Автор: Попков В.А. Бабков А.В.
Теги: химия общая и неорганическая химия медицина коллоидная химия
ISBN: 5-06-003836-Х
Год: 2001
Текст
ПРАКТИКУМ
ПО ОБЩЕЙ ХИМИИ
Биофизическая химия
Химия
биогенных элементов
Под редакцией профессора В.А. Попкова,
А.В. Бабкова
Издание второе,
переработанное и дополненное
Рекомендовано
Министерством образования
Российской Федерации
в качестве учебного пособия для студентов
высших учебных заведений, обучающихся
по медицинским, биологическим,
агрономическим, ветеринарным,
экологическим специальностям
Москва
“Высшая школа”
2001
ДК 54
БК 24.1
П69
Авторы:
А.В. Бабков, В.А. Попков, С.А. Пузаков, Л.И. Трофимова
Рецензент — профессор А. С. Берлянд
(Московский медицинский стоматологический Университет)
Практикум по общей химии. Биофизическая химия. Химия
П69 биогенных элементов. Учеб, пособие для вузов/ А.В. Бабков,
В.А. Попков, С.А. Пузаков, Л.И. Трофимова; Под. ред. В.А. Поп-
кова, А.В. Бабкова. 2-е изд., перераб. и доп. — М.: Высш,
шк., 2001.— 237 с.: ил.
ISBN 5-06-003836-Х
В практикуме описаны методики выполнения лабораторных работ, а
также физико-химические принципы проведения эксперимента и обработки
результатов измерений. Содержание работ отражает методы, используемые
в клинических и санитарно-гигиенических исследованиях. В конце книги
приведены необходимые справочные материалы. Практикум вместе с учеб-
ником «Общая химия» составляет единый комплекс.
Во втором издании (1-е — 1993) заново написаны теоретические вве-
дения. дополнительно включена глава «Основные типы равновесий и про-
цессов», а также заменены некоторые лабораторные работы.
Для студентов высших учебных заведений, обучающихся по меди-
цинским, биологическим, агрономическим, ветеринарным, экологическим
специальностям.
УДК 54
ББК 24.1
ISBN 5-06-003836-Х
© ГУП «Издательство «Высшая школа». 2001
Предисловие
В конце 70-х годов в преподавании химии в медицинских вузах про-
изошли значительные изменения: разработаны новые программы, усиле-
на целевая направленность. Предмет стал называться «Общая химия». В
его разделы входят биофизическая химия и химия биогенных элементов.
Изменились и требования к лабораторному практикуму по химии. В
настоящее время практикуму, как специфической и важнейшей форме
учебной работы, уделяется особое внимание, так как усвоение изучаемо-
го материала может происходить только в ходе активной деятельности
самого учащегося. Эта деятельность реализуется на практике и лабора-
торных занятиях в процессе решения различных ситуационных задач. В
этом смысле практикум является формой учебной работы, которая позво-
ляет реализовать задачи обучения.
В данном руководстве описаны лабораторные работы, помогающие
освоению теоретических основ химии и экспериментальных методов,
непосредственно применяемых в медицине.
Лабораторные работы построены так, чтобы обеспечить их осмыс-
ленное поэтапное выполнение. Каждой работе поставлена цель. Подроб-
ное изложение теории дано в разделах учебника.
Эксперимент предполагает выработать у студентов определенные
навыки научной организации исследований. В каждой работе приведены
вопросы, ответив на которые студент сможет более глубоко разобраться в
существе проведенного эксперимента и связанных с ним разделов тео-
рии. Руководство содержит также типовые задачи и необходимый спра-
вочный материал.
Второе издание практикума (1-е — 1993) переработано с учетом
действующей «Программы курса общей химии». Во втором издании из-
менена последовательность нескольких глав. В первой главе добавлен
параграф «Стехиометрические понятия и правила», которые недостаточ-
но полно изложены в учебниках и пособиях. Лабораторно-практические
работы начинаются с раздела «Количественный анализ», так как началь-
ное освоение принципов химического анализа студентами медицинских
специальностей не связано с обширной теоретической подготовкой.
Главной задачей здесь является приобретение навыков выполнения экс-
перимента. Далее идут главы по темам «Термодинамика и кинетика био-
химических процессов». Помимо описаний лабораторных работ, в эти
главы включены некоторые элементы теории, связанные непосредствен-
3
но с выполняемыми работами. В практикум включена гл. 6 «Основные
типы равновесий и процессов», в которой содержатся лабораторные ра-
боты по всем типам биохимических процессов с участием молекул и ио-
нов: протолитические процессы, гетерогенные процессы, редокс-про-
цессы, процессы комплексообразования и замещения лигандов.
Главы 1—3 написаны А. В. Бабковым; гл. 4 и 5 — совместно
А. В. Бабковым и В. А. Попковым; гл. 6 и 7 — С.А. Пузаковык-; гл. 8 и 9 —
совместно С. А. Пузаковым и В. А. Попковым; гл. 10 и 11 — совместно
Л. И. Трофимовой и В. А. Попковым.
Авторы выражают благодарность рецензенту проф. А. С. Берлянду
за критические замечания и полезные советы, а также всему коллективу
кафедры общей химии, педагогический опыт которого, безусловно, отра-
зился в содержании практикума.
Авторы
Глава 1
Общие вопросы выполнения
лабораторных работ
1.1. ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
В химической лаборатории необходимо соблюдать правила поведе-
ния и работы, обеспечивающие безопасность людей. Поэтому на первом
же занятии студент должен ознакомиться с правилами безопасной работы
и расписаться в специальном журнале.
На время занятия в лаборатории назначается дежурный, который от-
вечает за соблюдение правил работы и поддержание порядка и чистоты.
Все это необходимо не только для безопасности, но и успешного выпол-
нения лабораторной работы. На рабочих столах не должно быть посто-
ронних предметов, сумок, портфелей. Рассыпанные на столе реактивы и
разлитые растворы необходимо немедленно удалять. В лаборатории кате-
горически запрещается принимать пищу.
На склянках с реактивами и растворами должны быть отчетливые
надписи. Запрещается использовать вещества, находящиеся в склянках
без этикеток.
Лабораторную работу можно начинать только после тщательного
изучения методики и ознакомления с правилами работы на соответст-
вующих приборах. Работать можно только с исправным оборудованием и
приборами.
Неумелое и небрежное обращение с кислотами и щелочами может
привести к несчастным случаям: повреждениям глаз, кожи рук и лица,
дыхательных путей. Для защиты глаз при работе с концентрированными
кислотами и щелочами необходимо надевать защитные очки. При раз-
бавлении концентрированных кислот необходимо соблюдать порядок
смешивания: кислоту постепенно вливают в воду.
Опыты с едкими, ядовитыми или сильно пахнущими веществами
разрешается проводить только в вытяжном шкафу.
Особой осторожности требует работа с соединениями мышьяка, рту-
ти и другими ядами. Остатки, содержащие ядовитые вещества, нельзя
бросать в раковины или корзины. Их собирают в особые склянки. После
окончания опытов необходимо тщательно вымыть руки.
Со стеклянной посудой и приборами (в том числе термометрами)
следует обращаться бережно, не класть на край стола, не задевать локтя-
ми. Осколки разбитой посуды немедленно убирать.
5
По окончании занятия необходимо привести в порядок рабочее ме-
сто, закрыть все газовые и водопроводные краны, выключить электро-
приборы и уведомить лаборанта.
1.2. ЛАБОРАТОРНЫЙ ЖУРНАЛ
Результаты лабораторного эксперимента оформляют в виде прото-
кола в лабораторном журнале. Для ведения журнала наиболее подходит
тетрадь объемом 96 листов, которые следует сразу же пронумеровать. Не
рекомендуется вести запись лабораторных работ на отдельных листах
или в черновых тетрадях. Протокол каждой работы начинают с новой
страницы, указывая, в первую очередь, дату и название работы. Далее в
виде отдельных пунктов излагают цель работы, конкретное задание, тео-
ретические основы применяемого метода, предварительные расчеты, ход
работы, результаты измерений, обработка результатов, выводы. В прото-
кол могут быть внесены рисунки приборов, таблицы с эксперименталь-
ными данными и последующими расчетами, графики полученных зави-
симостей. Первичные экспериментальные данные (результаты взвешива-
ния, измерения объемов, отсчеты по шкалам приборов) вносят непосред-
ственно в протокол, и последующие исправления в этих записях недопус-
тимы. Если результаты измерений оказались ошибочны, преподаватель
может потребовать повторения всей работы или ее части. При этом все
сделанные ранее записи остаются в протоколе.
1.3. ВЕСЫ И ПРАВИЛА ВЗВЕШИВАНИЯ
Взвешивание, т. е. определение массы, является одной из наиболее
обычных и необходимых операций в химии. В зависимости от характера
Рис. 1.1. Технохимические весы
выполняемого эксперимента взвешива-
ние производят с различной степенью
точности, используя соответствующие
весы. В работах по общей химии приме-
няют технохимические весы (рис. 1.1),
обеспечивающие точность взвешивания
±0,01 г. Весы состоят из равноплечего ко-
ромысла 1, к которому на призмах под-
вешены чашки 3. В середине коромысла
укреплена призма, через которую оно
опирается на колонку 4. Весы снабжены
специальным устройством арретиром 5,
позволяющим слегка приподнимать ко-
6
ромысло, разгружая этим опорную призму и предохраняя ее от износа. В
нерабочем состоянии, а также при каждом изменении нагрузки весы
должны быть арретированы. После помещения образца и разновесок на
чашки, весы переводят в рабочее положение плавным поворотом рукоят-
ки арретира 5, и наблюдают качание коромысла по показаниям стрелки 6.
Весы снабжены также регулировочными винтами 7 для горизонтальной
установки по отвесу 8 и для настройки нуля при ненагруженных чашках.
К весам прилагается коробка с пинцетом и разновесами (гирями)
следующего достоинства: 100; 50; 20; 20; 10; 5; 2; 2; 1; 0,5; 0,2; 0,2; 0,1;
0,05; 0,02; 0,02; 0,01 г.
Правила взвешивания на технохимических весах. При взвешива-
нии на технохимических весах следует соблюдать следующие правила.
1. Приготовьте лабораторный журнал для записи результатов взве-
шивания и положите его около весов.
2. Убедитесь, что весы установлены горизонтально и на чашках нет
никаких предметов и разновесов.
3. Проверьте нулевую точку весов. Для этого плавно поверните ру-
коятку арретира и наблюдайте качание коромысла. Если стрелка откло-
няется вправо и влево на одинаковое число делений, то нулевая точка
весов совпадает с нулем шкалы. Если совпадения нет, то требуется регу-
лировка весов (она производится лаборантом).
4. На левую чашку весов помещают взвешиваемый предмет, а на
правую — разновесы. Нельзя взвешивать загрязненные, мокрые или го-
рячие предметы и насыпать вещества непосредственно на чашку весов. В
качестве тары можно использовать бюксы, часовые стекла, химические
стаканы. Летучие вещества взвешивают только в закрытой таре.
5. Класть на весы и снимать предметы и разновесы можно только в
арретированном положении весов.
6. Разновески ставят на чашку весов и снимают пинцетом. Каждый
раз после установки или замены разновесов рукоятку арретира поворачи-
вают и наблюдают отклонение стрелки. Если стрелка отклоняется вправо,
то это значит, что масса разновесов меньше массы взвешиваемого пред-
мета («мало»), если влево, то масса разновесов больше массы предмета
(«много»).
7. Признаком уравновешенности нагруженных весов являются рав-
ные отклонения стрелки весов вправо и влево при свободном качании.
8. Для быстрого уравновешивания подбор разновесов начинают с
больших и кончают наименьшими. Пусть, например, требуется взвесить
предмет массой 33,18 г (заранее это не известно). Взвешивание следует
начать с разновеса, который несколько превышает массу предмета, на-
пример 50 г. Убедившись, что этот разновес велик, его снимают и заме-
няют следующим в порядке уменьшения массы. Весь процесс взвешива-
ния будет выглядеть так:
7
Набор разновесов, г. 50 20
Общая масса, г....... 50 20
Показание стрелки
весов................ Много Мало
20+20 20+10 20+10+ 20+10+ 20+10+ 20+10+
J +5 +2 +2+2 +2+1
40 30 35 32 34 33
Много Мало Много Мало Много Мало
Аналогичным образом подбирают миллиграммовые разновесы до
достижения равновесия.
9. Определив набор разновесов, при котором достигается равнове-
сие, подсчитывают их массу и записывают полученное значение в лабо-
раторный журнал. Запись можно проверить, подсчитав массу разновесок
по пустым гнездам в коробке.
10. Запрещается использовать разновесы из других наборов и отхо-
дить от весов во время взвешивания.
11. Если необходимо приготовить навеску, т. е. порцию вещества за-
данной массы, то сначала уравновешивают тару. Затем добавляют на
чашку весов разновесы, по массе равные навеске. Тару снимают с весов и
помещают в нее порцию вещества. Далее ставят тару на весы, проверяют
показание стрелки, снова снимают ее и, добавляя или удаляя небольшие
порции вещества, доводят весы до состояния равновесия.
12. После окончания взвешивания разновесы убирают в коробку и
снимают с чашки взвешиваемый предмет. Проверяют, сохранилось ли
состояние равновесия у ненагруженных весов.
В химическом анализе требуется повышенная точность взвешивания —
до ±0,0001 г. Она достигается применением аналитических весов различ-
ной конструкции. В каждом конкретном случае с устройством весов и
правилами работы можно ознакомиться в прилагаемых к ним инструкци-
ях по эксплуатации.
1.4. ОШИБКИ ИЗМЕРЕНИЙ
Физическая величина, полученная прямым или косвенным измере-
нием, характеризуется точностью, т. е. числом надежно определенных
цифр в выражении, представляющем собой отношение данной величины
к единице измерения. Если, например, термометр, погруженный в рас-
твор, показывает 23 °C, то это не значит, что в истинном значении темпе-
ратуры не может содержаться еще сколько-то десятых, сотых, тысячных
и т. д. долей градуса. Цена деления термометра реальной величины около
1 мм на шкале не позволяет определить температуру точнее, чем 0,2 °C
(«на глаз»). Если, например, мы, внимательно глядя на термометр, сни-
мем показание 23,4 °C, то первая цифра после запятой не вполне надеж-
на, а последующие цифры с этим термометром определить вообще не-
возможно. Мы должны записать результат измерения как 23,4±0,2 °C.
8
Слагаемое ±0,2 °C характеризует точ-
ность измерения. Для повышения точно-
сти измерения температуры потребова-
лось бы применить более точный термо-
метр. Однако измеренная температура
может отличаться от истинной и более
чем на десятые доли градуса, если термо-
метр плохо настроен при изготовлении
или испорчен в процессе использования
(сдвинулась шкала). Поэтому следует
различать понятия точность и правиль-
ность измерения.
Правильность измерения — это сов-
падение измеренного значения физиче-
ской величины с ее истинным значением
в пределах точности измерения.
А‘ 4
ь' I ь ! с с'
_1J___: L I J I .
2» 25 251%
Рис. 1.2. Точность и правиль-
ность измерений (а) и гауссо-
во распределение случайных
ошибок (б)
Чтобы нагляднее представить себе различие между точностью и
правильностью результатов измерения, проведем ось, на которой будем
откладывать какую-то переменную величину (рис. 1.2, а). Измерение все-
гда дает не точку, лежащую на этой оси, а некоторый отрезок, соответст-
вующий точности измерения. Длина отрезка, на котором мож'ет лежать
истинное значение величины (Ьс или Ь'с', рис. 1.2, а), характеризует точ-
ность измерения. Чем меньше этот отрезок, тем выше точность. В приме-
ре с термометром истинная температура может отличаться от измеренной
на 0,2 °C в большую или меньшую сторону, а это значит, что мы опреде-
ляем не точку 23,4 °C, а отрезок 23,2—23,6 °C. Если истинное значение
величины (точка А) попадет в найденный при измерении отрезок Ьс, то
результат является правильным. Если истинная величина лежит вне ука-
занного отрезка (точка Ато результат неправильный.
Отклонение результата отдельного измерения от истинного значения
величины называется абсолютной ошибкой определения, или просто
ошибкой. Отношение абсолютной ошибки к измеряемой величине назы-
вается относительной ошибкой.
В зависимости от причин возникновения и числового значения
ошибки измерений делят на три вида.
Систематические ошибки. Эти ошибки связаны главным образом с
особенностями применяемого метода измерений или с недостатками ис-
пользуемого оборудования. При наличии систематической ошибки ре-
зультаты измерений отклоняются от истинного значения величины в од-
ну сторону: они оказываются или завышенными, или заниженными. Сис-
тематические ошибки могут возникнуть, например, из-за смещения шка-
лы термометра относительно капилляра с ртутью, несоответствия массы
9
разновески номинальному значению, изменения концентрации раствора
при хранении и т. д.
Совершенствование метода измерения, тщательная настройка и
калибровка приборов позволяют сводить систематические ошибки к
минимуму.
Промахи или грубые ошибки. Они возникают в результате из-
мерений, сильно отличающихся от истинного значения определяемой
величины. Промахи могут возникать из-за неправильного отсчета по-
казания прибора, ошибки при подсчете массы разновесок, поломки
прибора и т. д. Такие результаты нередко обнаруживаются своей не-
правдоподобностью. Промахи также выявляются при проведении па-
раллельных измерений. Резкое несовпадение одного из результатов с
другими, полученными в таких же условиях, означает, что это промах.
При обработке результатов измерений промахи исключают из полу-
ченной совокупности данных.
Случайные ошибки. Данные ошибки характеризуются неопреде-
ленностью величины и знака. Они сопровождают любое измерение и свя-
заны с теми отклонениями условий наблюдения от стандартных, которые
уже не поддаются контролю. Из-за наличия случайных ошибок результа-
ты параллельных измерений не совпадают между собой и образуют сово-
купность значений, лежащих на некотором отрезке. Случайные ошибки
ограничивают точность измерений. Есть способы уменьшения случайных
ошибок, но совершенно устранить их невозможно. Вероятность появле-
ния случайной ошибки тем больше, чем меньше эта ошибка по абсолют-
ному значению, что выражается законом нормального распределения
Гаусса. Сущность его показана на рис. 1.2, б. По горизонтальной оси от-
кладывают измеряемую величину х, а по вертикальной оси — вероят-
ность Р получения каждого данного значения х„ отличающегося от сред-
него значения х на Ах = х, -х. График показывает, что чем больше от-
клонение Дх, тем меньше вероятность получения соответствующего х,.
Отклонения от среднего значения в положительную и отрицательную
стороны равновероятны.
Вычисления ошибок эксперимента. Отклонения результатов изме-
рений от истинных значений соответствующих величин неизбежны. По-
этому составной частью каждой работы должно быть вычисление оши-
бок. Результат эксперимента, для которого неизвестна величина ошибки,
является неполным, и практическое значение его сильно снижено. Для
вычисления ошибки необходимо получить не менее 4—5 результатов
параллельных измерений. Среднее арифметическое этих измерений явля-
ется наилучшим приближением к истинному значению х измеряемой ве-
личины. Рекомендуется следующая последовательность вычисления
ошибок эксперимента:
ю
а) среднее арифметическое
х=-£\,, (1.1)
п )
где п — число измерений; х, — результаты отдельных измерений;
б) отклонения результатов отдельных измерений от среднего
d, =х( -х; (1.2)
в) стандартное отклонение (средняя квадратическая ошибка)
где/= п — 1 — число степеней свободы (число контрольных измерений);
г) стандартное отклонение среднего результата
s-x=~. (1.3)
Vn
Затем вычисляют доверительный интервал результата, определения
среднего. Сущность его состоит в том, что с некоторой заданной вероят-
ностью Р, например 0,95, при данном числе степеней свободы f результат
отдельного измерения х, попадает в интервал х ± 2s:
х, ±Дх = х, ±Z(P,/)s?. (1.5)
Коэффициент Г(Р, У) — это так называемый критерий Стьюдента. Он бе-
рется из таблиц в зависимости от Р и f (см. приложение, табл. 4). На ос-
новании уравнения (1.5) можно записать
x±\x = x±t^-,ps. (1.6)
•Jn
Это уравнение означает, что,
х- Дх < х < х + Дх. (1.7)
Пример 1.1. При определении молярной массы М белка в 6-и параллельных
опытах были получены следующие значения М (кгмоль-1): 44,7; 44,3; 43,9; 44,5;
43,4; 43,9. Требуется вычислить доверительный интервал для истинного значения
молярной массы.
Решение. Вычисляем среднее по результатам 6-и имеющихся измерений:
_ 44,7 + 44,3 + 43,9 + 44,5 + 43,4 + 43,9 лл,
6
Находим отклонения и вычисляем стандартное отклонение, учитывая, что
/ = 6-1 = 5:
11
1 ...... X, 1 44,7 2 44,3 3 43,9 4 44,5 5 43,4 6 43,9
Ф 0,6 0,2 -0,2 0,4 -0,7 -0,2
0,62 + 0,22 + 0,22 + 0,42 + о,72 + 0,22 „ ло
s = а------------------------------------------- 0,48,
V 5
По табл. 4 приложения при Р = 0,95 и f = 5 t(P, f) = 2,57. Отсюда
Ax = 2,57 0,196 = 0,5. Следовательно, М = 44,1 ±0,5, или искомая величина мо-
лярной массы заключена между 43,6 и 44,6 кг моль'1.
1.5. СТЕХИОМЕТРИЧЕСКИЕ ПОНЯТИЯ И ПРАВИЛА
Стехиометрией называют раздел химии, задачей которого является
установление правил расчета масс, объемов, количества веществ при
проведении реакций, приготовлении растворов и смесей, обработке ре-
зультатов химических анализов.
Структурные единицы вещества — это наименьшие реальные
(молекулы, атомы) или условные (формульные единицы) частицы, дос-
таточное число которых образует порцию данного вещества. Элемент-
ный состав структурной единицы совпадает с составом вещества в целом.
Число структурных единиц вещества X обозначают N(X). Молекула яв-
ляется структурной единицей вещества с молекулярной структурой. Для
воды это молекула Н2О, газа этана — молекула С2Н6, для кислорода как
вещества — молекула О2. Атом является структурной единицей простых
веществ с атомной структурой. Структурная единица алмаза — атом С.
У сложных веществ с атомными и ионными структурами условная час-
тица — формульная единица — это набор атомов или ионов, соответст-
вующий составу вещества. У оксида кремния структурная единица SiO2 —
это атом кремния и два атома кислорода, условно выделенные в кристал-
лической структуре. На самом деле кремний соединен с четырьмя атома-
ми кислорода, а кислород с двумя атомами кремния, и в структуре нет
реальных молекул SiO2.
Количество вещества п — это мера числа структурных единиц в
любой порции вещества, определяемая тождеством
„(Х>2УИ2, (1.8)
где N(X) — число структурных единиц вещества X в реально или мыс-
ленно взятой порции вещества, TVA = 6,02 • 1023 — постоянная (число)
12
Авогадро. За единицу количества вещества принят 1 моль — порция ве-
щества, содержащая 6,02-1023 структурных единиц.
В химии рассматриваются также специальные структурные единицы,
упрощающие некоторые расчеты и формулировки.
Эквивалент химический — реальная или условная частица ве-
щества, обменивающая (присоединяющая) 1 однозарядный ион, или
1/2 двухзарядного иона, или 1/3 трехзарядного иона и т. д., или участ-
вующая в переносе 1 электрона. Эквивалент обозначается формулой
J/x, где 1/z — фактор эквивалентности, а число z равно суммарному
заряду ионов одного знака, обмениваемых структурной единицей ве-
щества, или числу электронов, принимаемых или отдаваемых струк-
турной единицей.
В обменной реакции типа
A12(SO4)3 + ЗВаС12 = 2 А1С1} + 3BaSO4
эквивалент сульфата алюминия — это частица 1/6A12(SO4)э, а в реакции
нейтрализации
КОН + Н3РО4 = КН2РО4 + Н2О
эквивалент фосфорной кислоты совпадает с обычной структурной еди-
ницей. Однако фосфорная кислота имеет и другие эквиваленты:
1/2Н3РО4 и 1/ЗН3РО4. В реакции окисления—восстановления
2КМпО4 + 10KBr + 8H2SO4 = 2MnSO4 + 5Br2 + 8Н2О + 6K2SO4
+7 _ +2
эквивалент перманганата калия 1/5КМпО4 (Мп + 5е = Мп ), а эк-
вивалент бромида калия совпадает с формульной единицей
КВг(ВГ -е~ = Вг°).
Смысл введения понятия эквивалент состоит в том, что, по опреде-
лению, в реакции участвует равное число эквивалентов кислоты и осно-
вания, окислителя и восстановителя и т. д. Так, в последнем примере две
структурные единицы КМпО4, составляющие 10 эквивалентов, прини-
мают 10е~. Для этого необходимы 10 эквивалентов восстановителя КВт,
что мы и видим в уравнении реакции.
Структурная единица реакции — обобщенная структурная еди-
ница, включающая все структурные единицы веществ с их стехиомет-
рическими коэффициентами в уравнении реакции.
Оборот реакции («моль реакции») — 6,02-1023 структурных единиц
реакции. Иначе можно сказать, что оборот реакции — это превращение, в
котором участвует количество вещества, численно равное стехиометри-
ческим коэффициентам.
13
Число оборотов реакции («количество вещества реакции») £ —
численно равно отношению количества любого из веществ в уравнении
реакции к его стехиометрическому коэффициенту.
Пусть в результате реакции
2Н2+О2 = 2Н2О
образовалось 12,6 моль воды. Тогда ^ = 12,6:2 = 6,3, т. е. осуществлено
6,3 оборота реакции.
J Молярная масса вещества Л/(г/моль) — это отношение массы к
количеству вещества:
(1.9)
м(Х) =-----
«(X)
Благодаря специально выбранному значению постоянной Авогадро,
молярная масса численно совпадает с молекулярной массой. Последняя,
как известно, получается суммированием атомных масс согласно форму-
ле вещества. Поэтому уравнение (1.9) редко используют для расчета мо-
лярной массы, и обычно преобразуют для расчета количества вещества:
„(Х) = ^22.
Л/(Х)
(1.Ю)
Молярная масса зависит от подразумеваемой структурной единицы.
Поэтому совершенно необходимо каждый раз указывать формулу струк-
турной единицы в скобках. Если мы говорим «молярная масса перманга-
ната калия», то это может быть и Л/(КМпО4) = 158 г/моль, и
Л/(1/5КМпО4) = 31,6 г/моль, и Л/(1/3 КМпО4) = 52,7 г/моль. Для уточ-
нения характера структурной единицы к соответствующему термину ре-
комендуется добавлять определение «эквивалента». Например, M(\/z X) —
молярная масса эквивалента, «(l/z X) — количество вещества эквива-
лента, 1 моль 1/zX — один моль эквивалента. Использованием определе-
ния «эквивалента» полная определенность данной величины не достига-
ется, так как у веществ бывают переменные факторы эквивалентности, и
записью формулы в скобках пренебрегать нельзя.
Закон эквивалентов — в химической реакции участвует равное ко-
личество вещества эквивалента веществ:
»(l/z,X,) = n(l/z2X2). (1.11)
Это вытекает из рассмотренного выше понятия химического эквива-
лента. Уравнение закона эквивалентов применимо для расчета по уравне-
нию любой реакции, но практически применяется только в титриметри-
ческом анализе (см. гл. 2). В обычных расчетах по уравнениям химиче-
ских реакций используют уравнение
14
и(Х,) _ л(Х2) _ n(X3) _
1. 1Z)
V! V2 V3
где индексами 1, 2, 3 и т. д. обозначены вещества в уравнении реакции.
Концентрация — относительное содержание данного вещества в
растворе или смеси. Для различных целей удобно использовать опреде-
ленные способы выражения концентрации.
Массовая доля со — отношение массы данного вещества к общей
массе раствора'.
со, ==?<-100%. (1.13)
Масса раствора ^_mj складывается из массы растворителя и масс
всех растворенных веществ. Растворитель также может представлять со-
бой смесь веществ. Если раствор состоит только из растворенного веще-
ства 1 и растворителя 2, то формула принимает вид
со, = —; со, = —— 100%.
тх + т2 тх+т2
Можно вычислять также массовую долю растворителя:
(1-14)
w2
со2 =-----2—
т} + т2
Следует учитывать, что со, + со2 = 1; со, + со2 = 100%. Кроме того, при
массе раствора 100 г, массы веществ численно равны массовым долям,
выраженным в %. Массовая доля со (%) широко применяется во всевоз-
можных рецептурах.
Молярная доля х — это отношение количества вещества данного
вещества к суммарному количеству вещества всех веществ в растворе'.
Xi = ; х, % = J?,' 100%.
Ln> Ъп<
Пример 1.2. Рассчитайте молярные доли веществ в 40%-ном по массе вод-
ном растворе этанола.
Решение. Молярные массы компонентов: Л/(С2Н5ОН) = 46 г/моль (1),
М(Н2О) = 18 г/моль (2). Найдем молярные доли, взяв для простоты расчета 100 г
раствора:
(1-15)
40/46
-------------------= 0,207 (20,7%),
40/46 + (100-40)/18
- ...ILOO-WIS- =0,793(79,3%).
40 / 46 + (100 — 40) /18
Молярная доля этанола оказалась меньше, чем массовая доля, так как его
молекулы тяжелее, чем молекулы воды.
Молярная концентрация с — отношение количества вещества к
объему раствора:
с(х) = ^ (1.16)
Разновидность молярной концентрации — молярная концентрация экви-
валента’.
c(\lzX)=n^^-. (1.17)
Основной единицей измерения молярной концентрации является
моль/л. Для разбавленных растворов применяются дольные единицы —
ммоль/л и мкмоль/л. При известном объеме раствора и молярной концен-
трации количество вещества рассчитывают по формуле
п(Х) = с(Х)Г (1.18)
Молярную концентрацию широко применяют в химическом экспе-
рименте, аналитической химии, научной литературе по химии, биологии
и медицине.
В разделах 2 и 5 встретятся и некоторые другие способы выражения
концентрации.
Глава 2
Элементы количественного анализа
2.1. МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
ХИМИЧЕСКОГО АНАЛИЗА
Среди химических наук особое место занимает аналитическая хи-
мия, проникающая во все области человеческой деятельности. Задачей
аналитической химии является разработка методов определения состава
всевозможных объектов, встречающихся в природе или изготовленных
искусственным путем. Методы химического анализа применяются в гео-
логии (состав минералов и горных пород), в контроле за состоянием ок-
ружающей среды (количество кислорода и примесей в воздухе, качество
воды, состав поверхностных загрязнений), в сельском хозяйстве, во всех
отраслях промышленного производства, в криминологии, археологии и
т. д. С особенно большим комплексом как относительно простых, так и
чрезвычайно сложных веществ имеет дело биохимия, а также все другие
биологические и медицинские науки, прямо или косвенно связанные с
биохимией. Соответственно здесь возрастает и значение химического
анализа. Диагностика множества заболеваний основана на сравнении ре-
зультатов анализа крови, мочи, желудочного сока, спинномозговой жид-
кости и др., взятых у конкретного больного, с нормальным содержанием
определенных компонентов в различных жидкостях и тканях организма.
Поэтому в образовании врача необходимо ознакомление с основными
принципами и методами аналитической химии. Рассмотрим некоторые
разновидности химического анализа.
Качественный и количественный анализ. Под качественным ана-
лизом подразумевается определение или доказательство присутствия в
изучаемом объекте отдельных химических элементов или химических
соединений. Количественный анализ проводится для определения коли-
чественного состава изучаемого объекта, т. е. доли или концентрации
интересующих химических элементов и соединений.
Качественный анализ, в принципе, предшествует количественному,
так как для выполнения количественного анализа требуется знать качест-
венный состав. Однако непосредственно проводить качественный анализ
приходится относительно редко, так как вещества, имеющиеся в изучае-
мом объекте, могут быть известны заранее. Например, в крови содержит-
17
ся гемоглобин. При анализе крови требуется определять количественное
содержание гемоглобина. Результат такого анализа может выявить нали-
чие патологии. То же самое относится и к содержанию в организме чело-
века многих химических элементов — железа, цинка, меди, кобальта и др.
Один из важнейших методов анализа спектральный анализ позволя-
ет одновременно определять качественный и количественный состав. По
характерным линиям в спектре поглощения или излучения анализируе-
мой пробы устанавливают наличие определенных элементов, а по интен-
сивности этих линий — их количественное содержание.
Анализ индивидуальных веществ и смесей (растворов). Путем
анализа индивидуального вещества определяют количественное содер-
жание отдельных химических элементов и устанавливают его формулу.
Если формула вещества известна, то по результатам анализа судят о его
чистоте. Отклонение данных анализа от теоретического состава бывает
обусловлено наличием примесей в образце вещества, а также случайны-
ми ошибками анализа.
Анализом смесей устанавливают количественное содержание в них
индивидуальных веществ. Например, в молоке определяют содержание
белка, жира, сахара, витаминов. Особенно большое практическое значе-
ние имеет анализ растворов, целью которого является определение кон-
центрации растворенных веществ. Анализ растворов настолько удобен в
экспериментальном отношении, что очень часто изучаемый образец пе-
реводят в растворенное состояние и анализируют полученный раствор.
2.2. КЛАССИФИКАЦИЯ МЕТОДОВ
КОЛИЧЕСТВЕННОГО АНАЛИЗА
Химические методы основаны на проведении реакций между изу-
чаемым образцом и специально подобранными и приготовленными реак-
тивами. По количеству затраченных реактивов или по количеству полу-
ченных продуктов реакции рассчитывают состав анализируемого образ-
ца. Различают гравиметрический и титриметрический анализы.
Гравиметрический анализ основан на полном (количественном) вы-
делении какого-либо компонента из анализируемого образца в виде стро-
го определенного вещества и последующем точном взвешивании его.
Этот вид анализа сыграл огромную роль в развитии науки. Он дает точ-
ные результаты, но он очень трудоемок и длителен, и поэтому все более
вытесняется другими методами анализа.
Титриметрический анализ заключается в точном определении объе-
ма раствора химического реактива с известной концентрацией, который
необходим для полного протекания реакции с данным объемом анализи-
руемого раствора. Титриметрический анализ широко применяют в кли-
18
нических и санитарно-гигиенических лабораториях для анализа крови,
желудочного сока, мочи, пищевых продуктов, питьевых и сточных вод.
Физико-химические методы анализа основаны на количественном
изучении зависимости состав — физические свойства объекта. Физико-
химические методы анализа связаны с применением сложной и чувстви-
тельной аппаратуры. Достоинствами этих методов являются их объек-
тивность, возможность автоматизации и быстрота получения результа-
тов, что дает существенное повышение производительности труда и рас-
ширяет возможности исследования.
Примером физико-химического метода анализа является потенцио-
метрическое определение pH раствора с помощью измерительных прибо-
ров потенциометров. Этот метод позволяет не только измерять, но и не-
прерывно следить за изменением pH при протекании в растворах каких-
либо процессов.
В количественном анализе используют также различные оптические
методы. Измеряют поглощение видимых, ультрафиолетовых, инфракрас-
ных лучей, и по интенсивности поглощения определяют концентрацию
соответствующего вещества. Каждый человек непосредственно во время
взятия анализа крови может проследить, как аналитик определяет гемо-
глобин. Пробу крови из пипетки разбавляют жидкостью до получения
окраски, совпадающей с эталоном. Объем полученного раствора пропор-
ционален содержанию гемоглобина.
Химические и физико-химические методы анализа классифицируют
в зависимости от массы и объема анализируемых проб (табл. 2.1). В
практикуме работы проводят по полумикрометоду.
Таблица 2.1. Классификация методов анализа в зависимости от массы
и объема анализируемых образцов
Метод анализа
Макро-
Полумикро-
Микро-
Ультрамикро-
Субмикро-
Субультрамикро-
Масса проб, г
0,140
0,01-0,1
0,001-0,01
0,00001-0,001
Ю-’-Ю"6
10-,|-10’|°
Реакционный объем, мл
10-100
1-10
0,1-1
0,0001-0,001
ю-’-ю-6
10'9-10"8
2.3. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
Применение закона эквивалентов. В разделе 1.5 введено понятие
химический эквивалент, и другие связанные с ним понятия. На их основе
сформулирован закон эквивалентов. Он является главной теоретической
основой титриметрического (объемного) анализа. Пусть смешивают рас-
19
творы двух реагирующих веществ Xj и Х2 с молярными концентрациями
эквивалента c(l/z]X]) и c(l/z2X2). Вещества прореагировали полно-
стью при использованных объемах растворов И и К2. По закону эквива-
лентов, их количества вещества эквивалента одинаковы:
c(l/z] Xj)K] = c(l/z2 Х2)К2. (2.1)
При этом факторы эквивалентности должны соответствовать урав-
нению осуществляемой реакции. Если при проведении реакции были оп-
ределены объемы растворов и была известна концентрация одного из
веществ, то по уравнению 2.1 рассчитывают концентрацию второго ве-
щества. Этим и достигается цель анализа.
Объемы должны быть выражены в литрах. Однако, когда берется
отношение объемов, они могут быть выражены и в других, но одинако-
вых, единицах. Формула в скобках после обозначения концентрации и
количества вещества эквивалента должна сопровождаться фактором эк-
вивалентности, но при обозначении массы и объема фактор эквивалент-
ности не нужен, так как эти величины не зависят от выбранных струк-
турных единиц.
Пример 2.1. Для нейтрализации 5,00 мл раствора серной кислоты потребо-
валось добавить 4,78 мл раствора гидроксида натрия с концентрацией c(NaOH) =
= 0,1012 моль/л. Рассчитайте концентрацию серной кислоты.
Решение. Для определения факторов эквивалентности напишем уравнение
реакции
H2SO4 + 2NaOH = Na2SO4 + 2Н2О
Гидроксид натрия обменивает один ион Na+, следовательно, фактор эквивалент-
ности равен 1. Серная кислота обменивает два иона Н+, и ее фактор эквивалент-
ности равен 1/2. Согласно уравнению 2.1,
' „11СЛЧ c(NaOH)K(NaOH) 0,1012мольл-'-4,78мл _по.л
с(1 /2H,SO4) = —----— ------- = —-------------:-----= 0,0967 моль/л.
24 r(H2SO4) 5,00 мл
z Основные понятия титриметрического анализа. Титриметриче-
ское определение вещества проводится титрованием — добавлением
одного из растворов к другому небольшими порциями и отдельными кап-
лями при постоянном наблюдении (контроле) результата. Один из двух
растворов содержит вещество в неизвестной концентрации и представля-
ет собой анализируемый раствор. Второй раствор содержит реагент с
точно известной концентрацией и называется рабочим раствором, стан-
дартным раствором или титрантом.
В процессе титрования достигается точка эквивалентности, т. е. со-
стояние системы, в котором количество вещества эквивалента опреде-
ляемого вещества равно количеству вещества эквивалента реагента в до-
бавленном объеме титранта. При достижении точки эквивалентности
20
титрование обычно закан-
чивают и делают отсчет за-
траченного объема титран-
та. Как узнать, что точка
эквивалентности достигну-
та? Она обнаруживается
резким изменением какого-
либо свойства раствора.
Наиболее широко использу-
ется наблюдение за окра-
ской раствора. Если одно из
реагирующих веществ ок-
рашено, а продукты реакции
бесцветны или имеют дру-
Рис. 2.1. Кривые титрования со скачком (7) и
перегибом (2)
гую окраску, то в точке эквивалентности происходит изменение окраски.
Очень часто титриметрические реакции проводят в присутствии индика-
торов — веществ, способных изменять свою окраску в зависимости от
среды. В настоящее время широко применяются аппаратурные методы
определения точки эквивалентности. По мере добавления титранта к ана-
лизируемому раствору ведется непрерывная запись изменения некоторо-
го физического свойства раствора: температуры, электрической прово-
димости, потенциала индикаторного электрода. На полученной зависи-
мости «объем—свойство», называемой кривой титрования, обнаружива-
ется скачок или перегиб в точке эквивалентности (рис. 2.1).
'Требования к титриметрическим реакциям. Химическая реакция
между определяемым веществом и реагентом, содержащимся в титранте,
называется титриметрической. Такая реакция удовлетворяет ряду усло-
вий. 1. Она идет достаточно быстро — реагент, содержащийся в добав-
ляемой порции титранта, исчезает за несколько секунд. 2. Титриметриче-
ская реакция должна быть практически необратимой и не сопровождать-
ся побочными реакциями. 3. В ходе титриметрической реакции происхо-
дят изменения, которые можно наблюдать визуально или с применением
соответствующих приборов. Это позволяет фиксировать момент наступ-
ления точки эквивалентности.
Некоторые титриметрические реакции оказываются настолько цен-
ными в химическом анализе, что на их основе разрабатываются методы
определения десятков веществ.
v Классификация методов титриметрнческого анализа. Разнооб-
разные методы титриметрнческого анализа можно классифицировать в
зависимости от характера химической реакции, лежащей в их основе, и
по способу проведения анализа. Используют следующие основные типы
химических реакций: а) кислотно-основные (реакции с переносом прото-
на); б) окислительно-восстановительные (реакции с переносом электро-
21
на); в) осаждения; г) комплексообразования. Этим типам реакций соот-
ветствуют методы: а) ацидиметрии и алкалиметрии; б) оксидиметрии
(редоксиметрии); в) аргентометрии и меркурометрии; г) комплексомет-
рии И комплексонометрии. В лабораторных работах этого раздела будут
применены методы ацидиметрии — определение веществ с применением
стандартных растворов кислот, и оксидиметрии — определение веществ
со стандартными растворами окислителей или восстановителей.
По способу проведения анализа различают прямое, обратное и за-
местительное титрование.
При прямом титровании к раствору определяемого вещества непо-
средственно добавляют титрант. При работе по этому методу для опреде-
ления щелочи необходим стандартный раствор кислоты, для определения
восстановителя — стандартный раствор окислителя и т. д.
При обратном титровании вещество сначала реагирует с точно из-
вестным количеством некоторого реагента, взятого в избытке. Не всту-
пивший в реакцию избыток реагента титруют, и результатом титрования
определяется количество реагента, прореагировавшего с анализируемым
веществом. Формула закона эквивалентов для обратного титрования
принимает следующий вид:
л(1Д, XJ + nQ/z, Х2) = n(l/z3 Х3), (2.2)
где X! — анализируемое вещество; Х2 — титрант; Х3 — реагент, взятый в
контролируемом избытке.
Пример 2.2. Для определения массовой доли карбоната кальция в известня-
ке к образцу массой 0,1658 г добавили 20,0 мл соляной кислоты с концентрацией
с(НС1) = 0,203 моль/л. После окончания реакции
СаСО3 + 2НС1 = СаС12 + СО2 Т
к раствору добавили фенолфталеин и титровали щелочью до появления розовой
окраски. Затрачено 10,8 мл раствора с концентрацией c(NaOH) = 0,0938 моль/л.
Рассчитайте массовую долю карбоната кальция в образце известняка.
Решение. В реакции HCl + NaOH = NaCl + H2O при титровании участвовал
избыток хлороводорода, оставшийся после реакции с известняком. У хлороводо-
рода и гидроксида натрия химические эквиваленты совпадают с обычными фор-
мульными единицами НС1 и NaOH, а эквивалентом карбоната кальция является
частица 1/2СаСО3. Исходя из данных условия, преобразуем уравнение 2.2:
от(СаСО3) +c(Na0H)K(Na0H) = С(НС1)Г(НС1);
Л/(1/2СаСО3)
ти(СаСО3) = (0,203 • 0,020 - 0,0938 • 0,0108) • 50 = 0,1524 г.
Вычисляем массовую долю карбоната кальция:
со= 0Д524 = 2 (91,92%).
0,1658
22
В заместительном титровании проводят реакцию определяемого вещества с
некоторым реагентом, взятым в не контролируемом избытке, и затем титруют
продукт реакции, который «заместил» анализируемое вещество. Обычно это де-
лают с целью применения хорошей титриметрической реакции. Расчеты в замес-
тительном титровании проводят по обычной формуле закона эквивалентов.
Пример 2.3. Для определения перекиси водорода к 10,0 мл раствора добави-
ли иодид калия в избытке в кислой среде:
Н2О2 + 2KI + H2SO4 = 12 + 2Н2О + K2SO4
Выделившийся иод реагировал с титрантом тиосульфатом натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
На титрование затрачено 7,65 мл раствора с концентрацией c(Na2S2O3) =
= 0,01986 моль/л. Рассчитайте молярную концентрацию эквивалента Н2О2.
Решение. В первой реакции перекись водорода принимает два электрона, а
во второй реакции тиосульфат натрия отдает один электрон, поэтому
c(l/2H2O2)r(H2O2) = c(Na2S2O3)r(Na2S2O3);
7,65 мл-0,01986 моль/л ,
с(1 / 2Н2О2) =-------------------= 0,01519 моль/л.
10,0 мл
2.4. ОБОРУДОВАНИЕ ТИТРИМЕТРИЧЕСКОГО
АНАЛИЗА
Основным оборудованием в титриметрическом анализе являются
бюретки, мерные пипетки, конические колбы и мерные колбы.
Бюретки представляют собой градуированные по объему стек-
лянные трубки с нулевым делением наверху, предназначенные для
отмеривания растворов небольшими порциями и отдельными капля-
ми. К нижнему, слегка суженному, концу бюретки припаян стеклян-
ный кран, или присоединен резиновый шланг с шариковым затвором и
стеклянным носиком (рис. 2.2, а). Иногда вместо затвора ставят пру-
жинный зажим. Бюретки укрепляют вертикально в штативах. Объем
бюретки может составлять от 1 до 50 мл. Для работы выбирают бю-
ретку в зависимости от объема раствора, применяемого в анализе. В
полумикроанализе удобны бюретки вместимостью 3—6 мл («микро-
бюретки»), В зависимости от объема бюретки цена деления на ней
составляет от 0,01 до 0,1 мл. Для проведения наиболее ответственных
анализов бюретки калибруют, определяя взвешиванием массу воды
или ртути, помещающейся в отдельных участках градуированной
трубки. В титриметрическом анализе бюретки используются для на-
полнения титрантом и проведения титрования.
23
Рис. 2.2. Оборудование для титриметрического
анализа:
а — бюретки; б — пипетки; в — коническая колба;
г —мерная колба
Бюретку можно напол-
нять, заливая раствор сверху
через воронку. В аналити-
ческих лабораториях име-
ются бюретки, снабженные
различными устройствами
для наполнения.
Мерные пипетки —
специальные стеклянные
трубки, предназначенные для
отмеривания и переноса
заданного объема раствора
из одного сосуда в другой.
Часто применяемые разно-
видности пипеток показаны
на рис. 2.2, б. Пипетка Мо-
ра 1 имеет в средней части
шаровое или цилиндриче-
ское расширение, выше
которого нанесена кольце-
вая метка (риска). На рас-
ширенной части пипетки
указывают объем и темпе-
ратуру, при которой производилась калибровка. При выливании раствора
из пипетки, наполненной до метки, объем раствора в точности соответст-
вует маркировке. Используют также градуированные пипетки без расши-
рения в средней части 2. С их помощью можно набирать различные объ-
емы раствора. Пипетки Мора изготавливают вместимостью от 5,00 до
50,0 мл, градуированные пипетки — от 0,10 до 10,0 мл. Хранят пипетки в
специальных подставках в вертикальном положении.
Конические колбы служат непосредственно для проведения титри-
метрических реакций (рис. 2.2, в). В зависимости от объемов титруемых
растворов берут колбы вместимостью от 25 до 250 мл. При работе колба
не должна наполняться раствором более чем на 1/3 высоты.
Мерные колбы характеризуются наличием длинного узкого горлыш-
ка, на котором нанесена кольцевая метка (рис. 2.2, г). Они предназначены
для приготовления растворов точно заданной концентрации. На колбе
указана ее вместимость (10, 25, 50, 100, 200, 250, 500, 1000, 2000 мл), ко-
торая реализуется при наполнении жидкостью до метки при 20 °C.
Мерные цилиндры в титриметриЧеском анализе имеют второсте-
пенное значение. Их используют для приблизительного измерения объе-
мов некоторых вспомогательных растворов или воды.
24
2.5. ПРИГОТОВЛЕНИЕ СТАНДАРТНЫХ РАСТВОРОВ
Раствор с точно известной концентрацией может быть получен рас-
творением навески вещества в известном объеме, или установлением
концентрации по другому раствору, который заранее стандартизирован.
В первом случае получается раствор с приготовленным титром, во вто-
ром — с установленным титром.
Навеска — порция вещества, точно взвешенная на весах.
Титр — способ выражения концентрации, означающий массу опре-
деляемого вещества, соответствующую 1 мл титранта. Титр применя-
ется, как правило, при массовом проведении анализов.
Концентрация стандартных растворов должна быть определена с точно-
стью до трех или четырех значащих цифр. Наиболее надежны растворы с
приготовленным титром. Однако это возможно не для всех веществ. Напри-
мер, растворы обычно применяемых кислот соляной, серной, азотной нельзя
приготовить из точных навесок, так как исходные растворы кислот содержат
переменное количество воды. Едкие щелочи поглощают из воздуха воду и
углекислый газ, и точные навески их взять невозможно.
Для получения растворов с приготовленным титром пригодны лишь та-
кие вещества, которые могут быть хорошо очищены от примесей, имеют
постоянный состав, не изменяются на воздухе и при хранении. Вещества,
удовлетворяющие перечисленным требованиям, называются исходными или
стандартными. К ним относятся многие соли (тетраборат натрия, оксалат
натрия, хлорид натрия, дихромат калия), щавелевая кислота и ряд других.
Если в работе используются стандартные растворы веществ, которые не
удовлетворяют перечисленным требованиям, то их стандартизируют титро-
ванием. Тщательно приготовленные и проверенные стандартные растворы
хранят в условиях, исключающих изменение концентрации за счет испаре-
ния, разложения вещества или попадания примесей из окружающей среды.
Концентрацию стандартных растворов периодически проверяют.
Стандартные растворы можно готовить также из имеющихся в продаже
стандарт-титров (фиксаналов). Это стеклянные ампулы, содержащие точ-
но определенные количества различных твердых или растворенных веществ.
Вскрыв ампулу, вещество количественно (без остатка) переносят в мерную
колбу, после чего растворяют его и добавляют воду до метки.
2.6. МЕТОДИКА ВЫПОЛНЕНИЯ
ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
Для получения правильных и точных результатов все операции в
тигриметрическом анализе необходимо выполнять очень тщательно.
Приступая к работе, следует убедиться в чистоте рабочего места, нали-
25
чии всей необходимой посуды и ее пригодности к работе, внимательно
ознакомиться с методикой анализа, произвести расчеты и приготовить
лабораторный журнал для записи результатов.
Наполнение бюретки титрантом. Бюретку ополаскивают сначала
дистиллированной водой, а затем раствором, которым предполагается ее
заполнять. Жидкости заливают через воронку приблизительно на 1/3 вы-
соты бюретки, а сливают через носик. После этого титрант наливают не-
много выше нулевого деления. Пузырек воздуха из носика бюретки уда-
ляют, отогнув слегка носик вверх и приоткрывая затвор. Вынимают во-
ронку и устанавливают уровень раствора на нулевом делении, снова при-
открывая затвор или кран. Правильная установка на «ноль» и последую-
щий отсчет делений производится по центру мениска (часто не точно
говорят: по нижнему мениску). Отсчет показаний бюретки следует про-
изводить с точностью не менее 0,5 от наименьшего деления. Для повы-
шения точности отсчета целесообразно за бюреткой помещать бумажный
квадрат, наполовину закрашенный черной тушью. На его фоне резче вы-
деляется мениск. Используются также усовершенствованные бюретки с
впаянной цветной полосой позади шкалы. Преломление света в мениске
вызывает появление разрыва полосы, точно указывающего уровень рас-
твора. Каждый опыт по титрованию начинают с нулевого деления, чем
обеспечивается работа в одной и той же области шкалы.
При титровании полезно заранее определить объем одной капли, па-
дающей с носика бюретки. Для этого отмеривают 10 или 20 капель и,
сделав отсчет по шкале, делят найденный объем на число капель. В сред-
S)
Рис. 2.3. Правильное (а) и
неправильное (б) положения
пальцев при отборе пробы
пипеткой
нем на 1 мл приходится 20 капель раствора
(1 капля составляет 0,05 мл).
Отмеривание растворов пипетками.
Один из растворов при титровании (чаще
анализируемый раствор) берут с помощью
пипетки, которую опускают в склянку с рас-
твором почти до дна. Наполнение пипетки
производится всасыванием раствора рези-
новой грушей, плотно приставленной к ее
верхнему концу. В первый раз набирают
раствор для ополаскивания пипетки. Пере-
неся эту порцию в сливную склянку, наби-
рают раствор снова немного выше метки.
Верхний конец пипетки быстро зажимают
указательным пальцем (рис. 2.3). Ослабляя
нажим пальца, дают раствору медленно вы-
текать до установки мениска точно на мет-
ке. Снимают каплю раствора с носика пи-
петки, коснувшись им горлышка склянки.
и а)
26
Осторожно, следя за тем, чтобы раствор не капал, подносят пипетку к
колбе, куда намечено перенести данный объем раствора. Открывают
верхний конец пипетки и свободно переливают раствор. Если на пипетке
нет нижней метки, то сливают весь раствор, касаясь кончиком стенки
колбы. Выжидают 10 с для стекания жидкости со стенок. Если на пипетке
имеются деления, то плотно зажимают верхний конец в момент прохож-
дения мениска у требуемого деления. Отмеренную порцию раствора на-
зывают аликвотной долей. Остаток раствора можно перенести обратно в
склянку.
Раствор, подлежащий титрованию, во многих случаях должен со-
держать какие-либо добавочные компоненты, которые создают необхо-
димую среду или реагируют с определяемым веществом, переводя его в
форму, участвующую в титриметрической реакции. Растворы этих ком-
понентов отмеривают цилиндрами или добавляют из отдельных бюреток.
Проведение титрования. Коническую колбу с раствором, приго-
товленным для титрования, помещают под наконечником бюретки на
листе белой бумаги. Наконечник должен находиться на уровне горлышка
колбы. Приоткрывая затвор, добавляют титрант в колбу небольшими
порциями. Одновременно с добавлением титранта правой рукой осто-
рожно встряхивают колбу для перемешивания растворов. Вблизи точки
эквивалентности раствор в месте попадания капли титранта на короткое
время приобретает окраску, характерную для точки эквивалентности. Это
служит признаком приближающегося конца титрования. Титрант начи-
нают добавлять по одной капле, каждый раз полностью перемешивая
раствор. Как только произошло стойкое изменение окраски раствора,
титрование прекращают и записывают показание бюретки. Первое титро-
вание служит для ориентировочного установления объема, и его резуль-
тат не входит в число контрольных измерений. Затем проводят титрова-
ние еще не менее четырех раз. Проведение второго и последующих опы-
тов ускоряется одноразовым добавлением титранта в объеме, лишь на
доли миллилитра меньшем результата первого титрования. После этого
добавляют титрант по каплям до точки эквивалентности.
Приготовление исследуемого раствора для титрования. Если
анализируемый образец — твердое вещество, то навеску его растворяют
в мерной колбе, доводят водой до метки, перемешивают и берут аликвот-
ные доли для титрования. Если определяемое вещество находится в рас-
творе, то точный объем его разбавляют в мерной колбе дистиллирован-
ной водой, и далее действуют так же.
Иногда отдельные точные навески вещества растворяют в некотором
объеме воды непосредственно в колбе для титрования и проводят титро-
вание. Для каждого титрования в этом случае приходится брать отдель-
ную навеску, что требует большей затраты времени. Однако при этом
уменьшаются ошибки, связанные с приготовлением растворов. Поэтому
27
следует оценить, насколько повышение трудоемкости оправдывается
увеличением точности анализа.
2.7. ОБРАБОТКА РЕЗУЛЬТАТОВ АНАЛИЗА
В результаты химических анализов могут вкрадываться те же самые
виды ошибок, которые сопровождают и любые другие измерения. При
выполнении анализа всегда проводят несколько параллельных определе-
ний. Это позволяет исключить промахи и произвести статистическую
обработку результатов.
Систематические ошибки в титриметрическом анализе могут воз-
никнуть из-за неправильного определения концентрации стандартных
растворов, изменения концентрации при хранении, неточности мерной
посуды, неправильного выбора индикатора, субъективных особенностей
восприятия окраски индикаторов, отсчета объемов и др. Тщательная раз-
работка и проверка методики, калибровка мерной посуды, а также мас-
терство аналитика позволяют довести до минимума систематическую
ошибку.
Источником случайных ошибок в титриметрическом анализе явля-
ются неизбежные отклонения в установке нулевого уровня, неточность
отсчета объема по шкале, неопределенность избытка реагента после до-
бавления последней капли титранта.
Получив результаты нескольких титрований, определяют среднее ариф-
метическое, которое и используют в дальнейших расчетах. Явно ошибочные
результаты (промахи) при определении среднего не учитывают.
2.8. КИСЛОТНО-ОСНОВНЫЕ РЕАКЦИИ
В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
Обменные кислотно-основные реакции применяются в титриметри-
ческом анализе для определения кислот, оснований и солей. При опреде-
лении кислот и оснований проводится реакция нейтрализации. При опре-
делении солей идет реакция вытеснения слабой кислоты (основания)
сильной кислотой (щелочью), находящейся в титранте. Соли, образован-
ные сильными кислотами и основаниями, кислотно-основным титровани-
ем не определяются.
Определение веществ с применением стандартных растворов кислот
называется ацидиметрией. Определение веществ с применением стан-
дартных растворов щелочей называется алкалиметрией. В ацидиметрии и
алкалиметрии применяются стандартные растворы сильных кислот и ос-
нований.
28
При кислотно-основных реакциях изменяется pH растворов, и на
этом основано определение точки эквивалентности. Величина pH в точке
эквивалентности зависит от силы определяемых кислот и оснований.
Можно рассуждать и иначе: pH в точке эквивалентности определяется
свойствами веществ, образующихся в ходе титриметрической реакции. В
общем виде это представлено в табл. 2.2.
Таблица 2.2. pH точки эквивалентности при кислотно-основном титровании
Метод анализа Определяемое ве- щество Продукты реакции Ход изменения рн pH в точке эквива- лентности
Ацидиметрия Щелочь Соль и вода Понижение 7
Ацидиметрия Слабое основание Соль слабого основания и вода Понижение <7
Ацидиметрия Соль слабой ки- слоты Слабая кислота Понижение <7
Алкалиметрия Сильная кислота Соль и вода Повышение 7
Алкалиметрия Слабая кислота Соль елабой кислоты и вода Повышение >7
Алкалиметрия Соль слабого ос- нования Слабое основа- ние Повышение >7
В тех случаях, когда в точке эквивалентности имеется кислая или
щелочная среда, конкретное значение pH определяется реальной силой
слабой кислоты или основания. Это связано с константами кислотности
КЛ и основности Къ, вместо которых удобно использовать силовые пока-
затели рА"а и рА'ь. Чем меньше значения КЛ и Кь (соответственно, чем
больше значения р/Са и рА"ь), тем больше отличается pH в точке эквива-
лентности от 7. Этим определяется выбор индикатора для титрования.
Индикаторы представляют собой органические кислоты и основания
сложного строения, характеризующиеся разной окраской молекулярной и
ионизированной формы вещества. Различают одноцветные и двухцвет-
ные индикаторы. У первых окрашена только одна из форм, у вторых —
обе. Одноцветным индикатором является фенолфталеин — бесцветный в
кислой и нейтральной среде, где находится в молекулярной форме. В
щелочной среде фенолфталеин теряет протон и переходит в малиновую
анионную форму. К двухцветным индикаторам относится метиловый
оранжевый, принимающий в кислой среде розовую окраску, а в ней-
тральной и щелочной — желтую. У двухцветных индикаторов наблюда-
ется и промежуточная окраска, возникающая при одновременном при-
сутствии молекулярной и ионизированной формы.
Чтобы понять действие вещества в качестве индикатора, следует
учитывать, что индикатор добавляется в очень малом количестве и не
29
может повлиять на pH раствора. Само состояние индикатора определяет-
ся средой, куда он внесен. Равновесие ионизации индикатора
Hind = Н+ + Ind" (2.3)
смещается по мере изменения концентрации Н+ в ходе титрования. При
концентрации ионов водорода, создающей равные концентрации молеку-
лярной Hind и ионной Ind” форм индикатора, возникает промежуточная
окраска. В целом, переход окраски охватывает изменение pH на 2 едини-
цы. Выясним, при каком именно pH индикатор изменяет окраску. К рав-
новесию (2.3) применим закон действующих масс:
c(H*)-c(Ind~) _ к
c(HInd)
При c(Ind ) = c(HInd) получаем
с(Н+) = А; и рН = р/Са.
(2.4)
Таким образом, изменение окраски индикатора происходит вблизи
pH, равного силовому показателю индикатора. Это табличная величина.
Отсюда получаем правило: для кислотно-основного титрования следует
выбирать индикатор, силовой показатель которого близок к pH в точке
эквивалентности. Весь интервал изменения окраски находится в области
р*а±1.
Для каждого индикатора можно определить значение pH, называе-
мое показателем титрования рТ, при котором происходит наиболее от-
четливое изменение окраски. На практике, титрование заканчивается
вблизи этого значения pH. Например, для метилового оранжевого р7’= 4,0.
Это значение находится внутри интервала перехода окраски данного ин-
РН
(1)13 -
(2)12 -
(3)11 -
120 160 200
(4)10 -
(5)9 -
(6) 8
7
(8)6 -
(9)5 -
(Ю) 4 ~
(11)3 -
(12)2 ~
(13) 1 -
~ 40 80
V(NaOH), %
Метиловый
оранжевый
Рис. 2.4. Кривая титрования сильной ки-
слоты сильным основанием
дикатора, но не совпадает с
p/Ca = 3,34. Свойства некоторых
распространенных индикаторов
приведены в табл. 6 приложения.
Кривые титрования. Вы-
числения показывают, что из-
менение pH в процессе титро-
вания идет неравномерно. В
табл. 2.3 приведен пример для
случая нейтрализации соляной
кислоты гидроксидом натрия.
На рис. 2.4 зависимость pH от
объема добавленного титранта
представлена в виде графика.
Это конкретный пример кривой
зо
титрования, которая показана на рис 2.1. Из этого графика мы видим,
что сначала при нейтрализации кислоты на 99,9% pH уменьшается на 3,3
единицы. Затем при прохождении точки эквивалентности количество
добавленной щелочи увеличивается еще на 0,2%, а pH увеличивается на
5,4 единицы. Такое быстрое изменение pH называют скачком pH при
титровании. При исходном объеме кислоты 10 мл скачок был бы вызван
добавлением 0,02 мл щелочи — половиной капли при том, что добавить
менее одной капли мы не можем. Учитывая, что изменение окраски ин-
дикатора происходит в интервале двух единиц pH, можно понять, почему
при титровании это изменение вызывает одна последняя капля титранта.
На рис. 2.4 кроме кривой титрования нанесены области изменения
окраски двух индикаторов — фенолфталеина и метилового оранжевого.
Эти области существенно сдвинуты относительно pH 7 в точке эквива-
лентности, но, тем не менее, находятся в области скачка pH. При титро-
вании оба индикатора изменили бы окраску одновременно. Таким обра-
зом, благодаря наличию скачка pH существенно расширяется возмож-
ность выбора индикатора.
Для проведения кислотно-основной титриметрической реакции при-
годны те индикаторы, интервал изменения окраски которых находится
в области скачка pH, возникающего при титровании.
Таблица 2.3. Изменение pH при титровании соляной кислоты раствором
гидроксида натрия. Концентрации обоих растворов 0,1 моль/л
T(NaOH) в % от необходимого для нейтрализации Относительное увеличение объема с(Н+), моль/л с(ОН’), моль/л рн
0 1 110"' 110’13 1
90 1,9 5,3 10‘3 1,9 10 12 2,28
99 1,99 5 10-4 21 О’" 3,3
99,9 1,999 5 10 s 21O-10 4,3
100 2 110’7 110’7 7
100,1 2,001 2-Ю'10 510’5 9,7
101 2,01 210’11 5 10^ 10,7
ПО 2,1 1,2-1 О*12 4,8-10’3 11,68
200 3 ЗЮ'1’ 3,3-10'2 12,52
При титровании слабых кислот и оснований величина скачка pH
уменьшается, а середина его смещается относительно точки нейтрально-
сти (pH 7). В этих случаях выбор индикатора становится более ограни-
ченным. Так, при определении слабой кислоты pH в точке эквивалентно-
сти больше 7 (см. табл. 2.2); для титрования был бы пригоден фенолфта-
леин, но метиловый оранжевый изменил бы окраску слишком рано — до
31
Рис. 2.5. Кривая титрования сла-
бой кислоты (К, = 110“5) сильным
основанием
достижения точки эквивалентности.
Это видно из кривой титрования уксус-
ной кислоты (рис. 2.5).
Пример 2.3. На различии pH в точке
эквивалентности при титровании сильных и
слабых кислот основано их определение в
смесях. Так, в желудочном соке содержится
сильная соляная кислота и целый ряд сла-
бых кислот. Важное диагностическое зна-
чение имеет раздельное определение соля-
ной кислоты и общей кислотности. Первая
практически полностью титруется по мети-
ловому оранжевому до pH 4. Общее содер-
жание кислот определяется титрованием по
фенолфталеину до pH 9. Пусть при титро-
вании 10 мл желудочного сока с метиловым
оранжевым было затрачено 3,1 мл титранта с концентрацией c(NaOH) - 0,0983
моль/л, а с фенолфталеином — 6,0 мл того же титранта. Рассчитайте содержание
соляной кислоты и общую кислотность в ммоль/л.
Решение. Для расчета концентраций кислот используем формулу закона эк-
вивалентов:
с(НС1) = 210983—3,1 • 1000 = 30,5 ммоль/л,
10
Сикя o6„ = °!0983'6’0. 1000 = 59,0 ммоль/л.
КЖЛ.ОЯЛЦ |0 7
Стандартные растворы в методах кислотно-основного титрова-
ния. В ацидиметрии в качестве титранта обычно используют соляную
кислоту с концентрацией НС1 около 0,1 моль/л. Соответственно в алка-
лиметрии применяют раствор гидроксида натрия с концентрацией также
около 0,1 моль/л.
Непосредственно приготовить растворы этих веществ точной
концентрации невозможно. Гидроксид натрия гигроскопичен и кроме
того всегда содержит примесь карбоната натрия. Соляная кислота —
это раствор, содержащий переменные количества хлороводорода.
Предварительно готовят растворы НС1 и NaOH с концентрацией,
близкой к заданной, а затем определяют точную концентрацию по
первичным стандартам. Например, для стандартизации соляной ки-
слоты применяют раствор тетрабората натрия, приготовленный из
точной навески кристаллического декагидрата Na2B4O710H2O (см.
работу 5.2). Это вещество хорошо очищается перекристаллизацией и
не изменяется при хранении.
32
Работа 2.1. Приготовление соляной кислоты
заданной концентрации
Цель. Научиться готовить растворы для титриметрического анализа
методом разбавления на примере раствора соляной кислоты
Задание. Приготовить 250 мл раствора HCI с молярной концентра-
цией около 0,1 моль/л.
Оборудование. Мерные цилиндры вместимостью 10 и 250 мл; склянка с
пробкой вместимостью 250 мл; воронка; ареометр.
Реактивы. Соляная кислота концентрированная; вода дистиллированная.
Сущность работы. Разбавление исходной концентрированной ки-
слоты водой для получения раствора заданной концентрации в соответ-
ствии с предварительным расчетом.
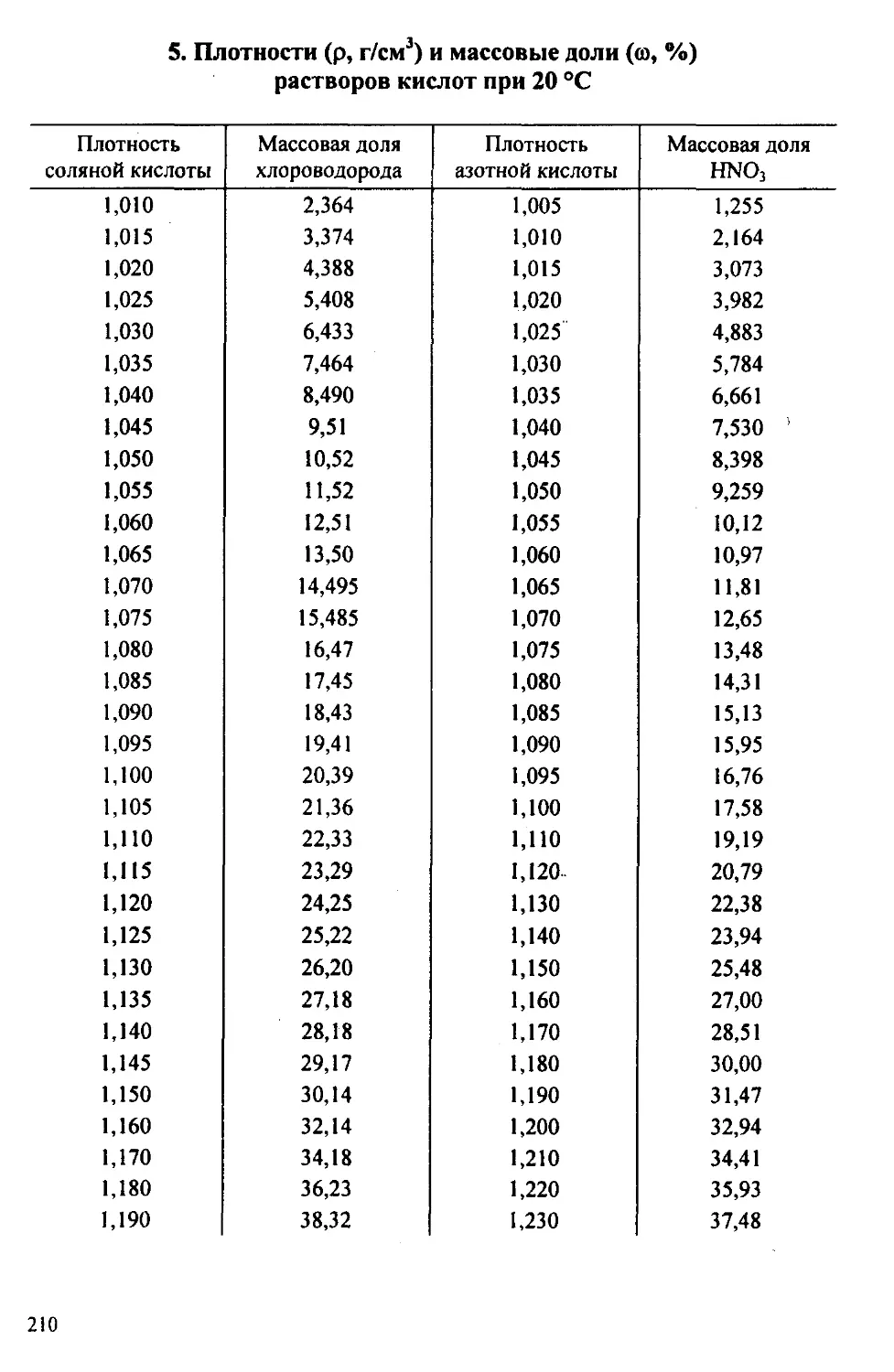
Выполнение эксперимента. Измеряют ареометром плотность кон-
центрированной соляной кислоты и по табл. 5 приложения находят ее
концентрацию. Затем рассчитывают объем этой кислоты, необходимый
для приготовления заданного раствора.
При разбавлении раствора водой количество растворенного вещест-
ва не изменяется. Следовательно,
c.CHCl)^ = с2(НС1)К2.
Из этого уравнения рассчитывают неизвестную величину К(.
Рассчитанный объем кислоты И, отмеривают небольшим мерным
цилиндром и переливают в чистую склянку с пробкой. Мерным цилин-
дром большего объема берут дистиллированной воды столько, чтобы
общий объем воды и кислоты составил 250 мл. Воду переливают в ту же
склянку и полученный раствор перемешивают. Если склянка для хране-
ния раствора имеет деления, то воду наливают прямо в нее до объема 250
мл. На склянку наклеивают этикетку с названием раствора и своей фами-
лией. Раствор сохраняется для дальнейшей работы.
Вопросы к защите работы
1. Меняются ли при разбавлении раствора количество вещества и концентра-
ция кислоты?
2. Можно ли приготовленный раствор соляной кислоты непосредственно ис-
пользовать в качестве титранта?
3. С какой точностью следует рассчитывать объем концентрированной соляной
кислоты для отмеривания мерным цилиндром?
2-366
33
Работа 2.2. Приготовление стандартного раствора
тетрабората натрия
Цель. Приобрести навыки приготовления растворов точной концен-
трации и взвешивания на аналитических весах.
Задание. Приготовить 100 мл раствора тетрабората натрия с моляр-
ной концентрацией эквивалента 0,1 моль/л с точностью до трех значащих
цифр.
Оборудование. Аналитические весы с разновесами; бюкс; мерная колба
вместимостью 100 мл; воронка; шпатель; промывалка.
Реактивы. Декагидрат тетрабората натрия (х.ч.); вода дистиллированная.
Сущность работы. Растворение точно взвешенной навески вещест-
ва в объеме раствора, определяемом вместимостью мерной колбы.
Выполнение эксперимента. Перед началом работы необходимо оз-
накомиться с устройством технохимических и аналитических весов и с
инструкциями по их эксплуатации (см. разд. 1.3). Готовят для работы мер-
ную колбу и сухую воронку. Рассчитывают массу навески Na2B4O7-10H2O,
необходимую для приготовления заданного раствора по формуле
т = c(l/2Na2B4O7 • 10Н2О)• И • A/(l/2Na2B4O7 • ЮН2О).
Рассчитанную навеску тетрабората натрия взвешивают на техниче-
ских весах (см. разд. 1.3). В качестве тары используют бюкс. Затем пере-
носят бюкс на аналитические весы и взвешивают его точно, сразу уста-
новив разновесы по массе, как на технохимических весах. Результаты
взвешивания на аналитических весах записывают в лабораторном журнале:
Масса бюкса с Na2B4O710H2O...
Масса бюкса с остатками вещества..
Масса навески Na2B4O710H2O...
Сняв бюкс с чашки аналитических весов, осторожно пересыпают на-
веску через сухую воронку в мерную колбу. Бюкс медленно наклоняют
над воронкой и не допускают рассыпания и распыления вещества. Бюкс с
остатками вещества на стенках тотчас снова взвешивают. После этого
снимают с весов всю нагрузку.
С помощью промывалки с подогретой дистиллированной водой
смывают вещество со стенок воронки в колбу и вынимают воронку. Кол-
бу наполняют дистиллированной водой приблизительно на 2/3 объема,
растворяют все вещество, охлаждают раствор до комнатной температуры
и добавляют воду до метки. Перемешивают раствор в колбе, переворачи-
вая ее несколько раз вверх дном, и переливают раствор в чистую сухую
склянку для хранения. Склянку закрывают пробкой и наклеивают этикет-
ку с названием раствора и своей фамилией.
34
Обработка результатов эксперимента. По разности двух взвеши-
ваний на аналитических весах находят массу вещества, перенесенного из
бюкса в мерную колбу. Рассчитывают молярную концентрацию эквива-
лента приготовленного раствора тетрабората натрия с точностью до трех
значащих цифр.
Вопросы к защите работы
1. Почему тетраборат натрия следует растворять в подогретой воде?
2. Почему колбу с раствором перед доведением объема до метки следует охла-
дить до комнатной температуры?
3. Почему фактор эквивалентности тетрабората натрия равен 1/2?
4. Как влияет на результат работы остаток вещества в бюксе после перенесения
в мерную колбу?
Работа 2.3. Стандартизация соляной кислоты по раствору
тетрабората натрия
Цель. Получить навыки приготовления рабочего раствора, проведе-
ния титрования и обработки результатов анализа. Установить точную
концентрацию приготовлений ранее соляной кислоты по стандартному
раствору тетрабората натрия.
Задание. Провести ацидиметрическое титрование раствора тетрабо-
рата натрия.
Оборудование. Бюретка вместимостью 25 мл на штативе; мерная пипетка
вместимостью 5 мл; конические колбы вместимостью 50—100 мл — 5 шт.
Реактивы. Рабочий раствор соляной кислоты; стандартный раствор тетра-
бората натрия; раствор индикатора метилового оранжевого; вода дистиллированная.
Сущность работы. Тетраборат натрия в качестве соли слабой ки-
слоты реагирует с соляной кислотой:
Na2B4O7 + 2НС1 + 5Н2О = 4Н3ВО3 + 2NaCl
Это третий вариант ацидиметрического титрования в соответствии с
табл. 2.2. Образующаяся борная кислота создает слабокислую среду —
pH в точке эквивалентности около 5. Поэтому титрование проводится с
индикатором метиловым оранжевым.
Выполнение эксперимента. В лабораторный журнал вносят ис-
ходные данные и подготавливают страницу для записи результатов
титрования.
35
Аликвотная доля стандартного раствора Na2B4O7 —5 мл
Концентрация c(l/2Na2B4O7) моль/л
Результаты титрования (И(НС1)): 1. ...
2. ...
и т. д.
Среднее значение И(НС1) =
Бюретку заполняют приготовленным ранее раствором НС1. В 5 колб
для титрования вносят пипеткой по 5 мл стандартного раствора тетрабо-
рата натрия. В каждую колбу добавляют 1 каплю индикатора. Отмечают
окраску полученных растворов. Титруют растворы в колбах по очереди
до перехода окраски в розово-оранжевую. Перед каждым следующим
титрованием доливают титрант до нулевого деления. Если сходимость
результатов в пределах 0,2 мл не получилась, проводят от 2 до 4 допол-
нительных титрований. После получения сходящихся результатов титро-
вания, кислоту из бюретки сливают и заполняют ее дистиллированной
водой. Возможно также продолжение работы (при наличии времени) —
выполнение контрольно-аналитической задачи с тем же раствором НС1 в
качестве титранта. Кислоту в склянке сохраняют для дальнейшей работы.
Обработка результатов эксперимента. Вычисляют среднее значе-
ние И(НС1), и по нему рассчитывают молярную концентрацию НО:
_ c(l/2Na2B4O7)K(Na2B4O7)
К(НС1)
В выводе указывают точное значение концентрации соляной кислоты.
Вопросы к защите работы
1. Чем обусловлено несовпадение результатов отдельных титрований?
2. Какой физический смысл произведения с V в расчетной формуле?
3. Почему в точке эквивалентности так резко изменяется окраска индикатора?
4. Наблюдалось ли различие в окраске растворов после окончания титрования?
Чем это можно объяснить?
5. Имеет ли значение для правильности результатов последующих работ от-
клонение концентрации приготовленной кислоты от заданной 0,1 моль/л?
Работа 2.4. Определение массы гидроксида натрия в растворе
(контрольно-аналитическая задача)
Цель. Закрепить навыки выполнения титриметрического анализа.
Задание. Определить массу гидроксида натрия в контрольном рас-
творе.
36
Оборудование. Бюретка вместимостью 25 мл на штативе; мерная пипетка
вместимостью 5 мл; мерная колба вместимостью 100 мл; коническая колба вме-
стимостью 250 мл; конические колбы вместимостью 50—100 мл — 5 шт.
Реактивы. Рабочий раствор соляной кислоты; контрольный раствор гидро-
ксида натрия; раствор индикатора метилового оранжевого; вода дистиллированная.
Сущность работы. Ацидиметрическое определение концентрации
гидроксида натрия по реакции
NaOH + НС1 = NaCl + Н2О
Масса вещества в растворе рассчитывается по формуле
/n(NaOH) = c(NaOH) • K(NaOH) • A/(NaOH).
Выполнение эксперимента. По характеру выполнения работа близ-
ка к предыдущей, но теперь титрование проводится не с целью стандар-
тизации кислоты, а с целью определения содержания щелочи в растворе с
предварительно стандартизированной кислотой.
Получают у преподавателя пробирку с контрольным раствором
кислоты, записывают номер задачи. В лабораторный журнал вносят
исходные данные и подготавливают страницу для записи результатов
титрования:
Концентрация титранта с(НС1) = ...
Объем анализируемого раствора после разбавления —...
Аликвотная доля анализируемого раствора NaOH — 5 мл
Результаты титрования (И(НС1)): 1....
2....
ИТ. д.
Среднее значение И(НС1) = ...
Бюретку заполняют стандартизированным раствором НО, сохра-
ненным после предыдущей работы. Контрольный раствор количественно
переносят из пробирки в мерную колбу; пробирку дважды ополаскивают
дистиллированной водой, которую также переливают в эту колбу. Объем
раствора доводят до метки водой. Последнюю порцию воды добавляют
по каплям из глазной пипетки, чтобы не допустить превышения объема.
Раствор в колбе перемешивают и переливают в сухую коническую колбу
вместимостью 250 мл, из которой берут аликвотные доли по 5 мл в 5
колб для титрования. В каждую колбу добавляют 1 каплю индикатора.
Отмечают окраску полученных растворов. Титруют растворы в колбах по
очереди до перехода окраски в розовую. Перед каждым следующим тит-
рованием доливают титрант до нулевого деления. Если сходимость ре-
зультатов в пределах 0,2 мл не получилась, проводят от 2 до 4 дополни-
тельных титрований. После получения сходящихся результатов титрова-
ния, кислоту из бюретки сливают и заполняют ее дистиллированной
водой.
37
Обработка результатов эксперимента. Вычисляют среднее значе-
ние И(НС1), и по нему рассчитывают концентрацию щелочи в контроль-
ном растворе, разбавленном до объема 100 мл:
c(NaOH) =
с(НС1)К(НС1)
K(NaOH)
Рассчитывают массу щелочи во всем объеме контрольного раствора:
zw(NaOH) = c(NaOH) • A/(NaOH) • 0,1.
Делают вывод, в котором указывают полученный результат, а также
массу гидроксида натрия по данным преподавателя.
Вопросы к защите работы
1. Чем обусловлено несовпадение результатов отдельных титрований?
2. В какой среде изменяет окраску метиловый оранжевый? Соответствует ли
это pH в точке эквивалентности в данном титровании? Не следовало ли взять
другой индикатор?
3. Как велико относительное отклонение вашего результата от данных, имею-
щихся у преподавателя?
Работа 2.5. Определение массы гидроксида натрия
и карбоната натрия при их совместном присутствии
в растворе (контрольно-аналитическая задача)
Цель. Закрепить навыки титриметрического определения веществ в
растворах. Ознакомиться с принципом проведения двухиндикаторного
титрования.
Оборудование. Мерная колба вместимостью 100 мл; воронка; промывалка;
бюретка вместимостью 25 мл; мерная пипетка вместимостью 10 мл; конические
колбы для титрования вместимостью 50—100 мл.
Реактивы. Рабочий раствор соляной кислоты; растворы индикаторов мети-
лового оранжевого и фенолфталеина; вода дистиллированная.
Сущность работы. Растворы щелочей, как правило, содержат при-
месь карбоната вследствие поглощения углекислого газа из воздуха.
Концентрации щелочи и карбоната в одном растворе можно определить
титриметрически, проводя последовательное титрование с двумя индика-
торами. Ион СО,- представляет собой слабое основание, присоединяю-
щее два иона водорода:
38
C03" + H+=HCO3"
HCO* +H+ =H2CO3
(1)
(2)
Первая образующаяся кислота НСО3 особенно слабая, и реакция прак-
тически заканчивается при pH 8,34, т. е. в щелочной среде. В этой облас-
ти происходит изменение окраски фенолфталеина (розовая -> бесцвет-
ная). При титровании одновременно с этой реакцией происходит и прак-
тически полная нейтрализация щелочи:
ОН+Н+=Н2О (3)
Обе реакции дают один скачок титрования. После обесцвечивания
фенолфталеина получается раствор гидрокарбоната, в котором при про-
должении титрования пойдет реакция 2, и точка эквивалентности ока-
жется в середине второго скачка титрования. Образующаяся угольная
кислота создает pH около 3,8—4,0. При этом значении pH изменяется
окраска метилового оранжевого. Итак, аликвотную долю анализируемого
раствора титруют сначала по фенолфталеину. При его обесцвечивании
записывают первый отсчет по шкале бюретки И|. Продолжая титрование
по метиловому оранжевому, при появлении розовой окраски записывают
второй отсчет К2. Разность отсчетов И2 - Vx дает объем, содержащий ко-
личество вещества НС1, эквивалентное гидрокарбонату. Всему имевше-
муся в растворе карбонату соответствует объем кислоты V’, равный уд-
военной разности:
V' = 1(V2-VX),
так как ион СО3" два раза присоединял равное число протонов. Осталь-
ной объем кислоты
V" = И2 - V = V2 - 2(И2 - Vx) = 2VX - V2
содержит количество вещества НС1, эквивалентное имевшейся щелочи.
Выполнение эксперимента. Получают у преподавателя пробирку с
контрольным раствором смеси гидроксида натрия и карбоната натрия
(могут быть и соединения калия), записывают номер задачи. В лабора-
торный журнал вносят исходные данные и подготавливают страницу для
записи результатов титрования:
Концентрация титранта с(НС1) = ...
Объем анализируемого раствора после разбавления ...
Аликвотная доля анализируемого раствора NaOH +Na2CO3 — 10 мл.
39
Опыт Отсчеты по шкале бюретки
И h
1
2
3
Среднее
Бюретку заполняют стандартизированным раствором HCI, сохра-
ненным после предыдущей работы. Контрольный раствор количественно
переносят из пробирки в мерную колбу; пробирку дважды ополаскивают
дистиллированной водой, которую также переливают в эту колбу. Объем
раствора доводят до метки водой. Последнюю порцию воды добавляют
по каплям из глазной пипетки, чтобы не допустить превышения объема.
Раствор в колбе перемешивают и переливают в сухую коническую колбу
вместимостью 250 мл, из которой берут аликвотные доли по 10 мл в 5
колб для титрования. Во все колбы добавляют по 2 капли раствора фе-
нолфталеина. Берут первую колбу и титруют кислотой до исчезновения
окраски. Делают отсчет по шкале бюретки И, и записывают его в прото-
кол работы. Вносят в ту же колбу 1 каплю метилового оранжевого и, не
добавляя кислоту в бюретку, продолжают титрование до перехода окра-
ски из желто-оранжевой в розовую. Записывают отсчет по шкале бюрет-
ки Уг. Таким же образом титруют растворы в остальных колбах, наполняя
предварительно бюретку до нулевого деления. После получения сходя-
щихся результатов титрования, кислоту из бюретки сливают и заполняют
ее дистиллированной водой.
Обработка результатов эксперимента. Рассчитывают средние зна-
чения И и Vz, и по ним находят объемы кислоты, эквивалентные карбо-
нату V', и щелочи V'. рассчитывают концентрации веществ в
контрольном растворе c(l/2Na2CO3) и c(NaOH) и массы этих веществ,
руководствуясь формулами в работе 2.4.
Делают вывод, в котором указывают полученный результат, а также
массы гидроксида натрия и карбоната натрия по данным преподавателя.
Вопросы к защите работы
1. Почему карбонат натрия в растворе реагирует с кислотой?
2. Какой объем кислоты был бы затрачен на титрование, если сразу начинать
титрование с метиловым оранжевым?
3. Почему карбонат натрия титруется в две ступени?
4. В каком направлении смещено равновесие гидролиза карбоната натрия в
анализируемом растворе по сравнению с раствором карбоната натрия без
щелочи?
40
2.9. РЕАКЦИИ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ
В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
На реакциях окисления—восстановления (редокс реакциях) основа-
но много методов титриметрического анализа. В целом эти методы назы-
вают оксидиметрией. В качестве титрантов в оксидиметрии применяют
растворы окислителей (КМпО4, К2Сг2О7, КВгО3,12 и др.) и восстановите-
лей (Na2S2O3, SnCl2, NaAsO2, и др.). Отдельным направлениям оксиди-
метрии даны названия по применяемым стандартным растворам: перман-
ганатометрия, иодометрия, броматометрия и др. Методы оксидиметрии
широко применяются в биохимии и клиническом анализе. Например,
перманганатометрия применяется, для определения содержания мочевой
кислоты в моче, кальция в сыворотке крови, сахара в крови. Йодометри-
ческие методы применяют при определении в крови сахара и фермента
пероксидазы, в санитарно-гигиеническом анализе для определения ак-
тивного хлора в хлорной извести, остаточного хлора в хозяйственно-
питьевой воде и других анализах. Методом иодометрии анализируют
многие органические и неорганические лекарственные вещества: иод,
перманганат калия, арсенат калия, сульфат меди, формалин, антипирин,
витамин С и др.
2.9.1. ПЕРМАНГАНАТОМЕТРИЯ
Метод перманганатометрии основан на реакциях окисления различ-
ных веществ перманганатом калия. Окисление проводят в кислой среде, в
которой ион MnOj проявляет наиболее сильные окислительные свойства
(Е° = 1,51 В) и имеет наименьший эквивалент l/5MnOv Продуктом вос-
становления интенсивно окрашенного перманганат-иона является почти
бесцветный ион Мп2+:
МпО; +5е~ +8Н+ = Мп2+ +4Н2О
В процессе титрования окраска добавляемого перманганата калия
исчезает. Точка эквивалентности фиксируется по едва заметной, не исче-
зающей в течение нескольких секунд розовой окраске титруемого рас-
твора, означающей появление минимального избытка КМпО4. В отстав-
ленной после титрования колбе розовая окраска вскоре исчезает вследст-
вие синпропорционирования марганца:
2МпО; + ЗМп2+ + 2Н2О = 5МпО2 I+4Н+
В титриметрическом анализе применяют растворы КМпО4 с моляр-
ной концентрацией эквивалента 0,02—0,05 моль/л. При растворении
41
перманганата калия в воде происходит окисление примесей восстанови-
телей и появляется нерастворимый в воде оксид марганца(1У). Поэтому
раствор КМпО4 должен несколько дней отстояться, после чего устанав-
ливается его точная концентрация по первичному стандарту — оксалату
натрия Na2C2O4:
2КМпО4 + 5Na2C2O4 + 8H2SO4 = 2MnSO4 +10СО2 + 5Na2SO4 + K2SO4 + 8H2O
В перманганатометрии широко применяется как прямое, так и об-
ратное титрование, что позволяет определять как восстановители, так и
окислители.
Работа 2.6. Определение содержания железа (II) в растворе
(контрольно-аналитическая задача)
Цель. Ознакомиться с особенностями перманганатометрического
титрования и закрепить навыки титриметрического определения веществ
в растворах.
Задание. Определить массу сульфата железа (II) в контрольном рас-
творе.
Оборудование. Мерная колба вместимостью 100 мл; воронка; бюретка вме-
стимостью 25 мл в штативе; мерная пипетка вместимостью 5 мл; конические кол-
бы для титрования вместимостью 50—100 мл — 5 шт.; колба вместимостью 250 мл;
мерная пробирка.
Реактивы. Стандартный раствор КМпО4, с(1/5КМпО4) = 0,05 моль/л; серная
кислота, c(H2SO4) = 1 моль/л; дистиллированная вода; контрольный раствор соли
железа(П) (FeSO4, FeSO4 (NH4)2SO4).
Сущность работы. Ионы Fe2+ окисляются перманганатом в кислой
среде:
MnO4 + 5Fe2+ +8Н+ = Mn2+ +5Fe3+ +4Н2О
Ион Fe2+ отдает один электрон, и фактор эквивалентности FeSO4 ра-
вен 1. Концентрация определяемого вещества будет рассчитываться по
формуле
ego ) = с(1/5КМпО4)-К(КМпО4)
4 F(FeSO4)
где F(FeSO4) — аликвотная доля анализируемого раствора; К(КМпО4) —
средний объем титранта.
Выполнение эксперимента. Получают у преподавателя пробирку с
контрольным раствором соли железа(П), записывают номер задачи. В
лабораторный журнал вносят исходные данные и подготавливают стра-
ницу для записи результатов титрования:
42
Концентрация титранта с(1/5КМпО4) = ...
Объем анализируемого раствора после разбавления —...
Аликвотная доля анализируемого раствора FeSO4 — 5 мл
Результаты титрования (И(КМпО4)): 1....
2. ...
ИТ. д.
Среднее значение 1/(КМпО4) = ...
Бюретку- ополаскивают и заполняют титрантом КМпО4. Нулевой
уровень титранта устанавливают по верхнему краю мениска из-за глубо-
кой окраски раствора. Так же делают в дальнейшем отсчеты по шкале
бюретки. Контрольный раствор количественно переносят из пробирки в
мерную колбу, как описано в работах по ацидиметрии. В 5 колб для тит-
рования переносят пипеткой аликвотные доли по 5 мл. В каждую колбу
добавляют из мерной пробирки по 2 мл серной кислоты. Титруют первый
раствор до появления не исчезающей минимальной розовой окраски. Де-
лают отсчет по шкале бюретки. Остальные растворы титруют по очереди
каждый раз от нулевого уровня титранта, начиная с добавления объема
на 0,5 мл меньшего, чем первый отсчет по шкале. Получив удовлетвори-
тельные результаты титрования, титрант сливают из бюретки в специ-
альную склянку и заполняют бюретку дистиллированной водой.
Обработка результатов эксперимента. По результатам анализа на-
ходят средний объем титранта. Вычисляют концентрацию соли железа, а
также массу FeSO4 во всем объеме контрольного раствора.
Делают вывод, в котором указывают полученный результат, а также
массу сульфата железа(П) по данным преподавателя. Вычисляют относи-
тельное отклонение.
Вопросы к защите работы
1. Какие ионы или вещества, помимо FeSO4, можно количественно определять
в растворе с помощью рабочего раствора КМпО4?
2. Для чего в колбу для титрования добавляли серную кислоту?
3. Всегда ли молярная масса эквивалента железа(П) равна его молярной массе?
4. Можно ли использовать для работы только что приготовленный раствор КМпО4?
5. Для раствора, с которым вы работали, рассчитайте титр по сульфату железа(П).
Работа 2.7. Определение содержания перекиси водорода
в растворе
Цель. Ознакомиться с особенностями перманганатометрического
титрования и закрепить навыки титриметрнческого определения веществ
в растворах.
43
Задание. Определить массу перекиси водорода в контрольном рас-
творе.
Оборудование. Мерная колба вместимостью 100 мл; воронка; бюретка вме-
стимостью 25 мл в штативе; мерная пипетка вместимостью 5 мл; конические кол-
бы для титрования вместимостью 50—100 мл — 5 шт.; колба вместимостью 250 мл;
мерная пробирка.
Реактивы. Стандартный раствор КМпО4, с(1/5КМпО4) = 0,05 моль/л; серная
кислота, c(H2SO4) = 1 моль/л; дистиллированная вода; контрольный раствор пере-
киси водорода.
Сущность работы. Перекись водорода окисляется перманганатом в
кислой среде:
2МпО4 + 5Н2О2 + 6Н+ = 2Мп2+ + 5О2 + 8Н2О
Молекула Н2О2 теряет два электрона, и фактор эквивалентности
Н2О2 равен 1/2. Концентрация определяемого вещества будет рассчиты-
ваться по формуле
„пи а у- с(1/5КМпО4)К(КМпО4)
2 2 И(Н2О2)
где И(Н2О2) — аликвотная доля анализируемого раствора, И(КМпО4) —
средний объем титранта.
Выполнение эксперимента. Получают у преподавателя пробирку с
контрольным раствором перекиси водорода, записывают номер задачи. В
лабораторный журнал вносят исходные данные и подготавливают стра-
ницу для записи результатов титрования:
Концентрация титранта с(1/5КМпО4) =...
Объем анализируемого раствора после разбавления —...
Аликвотная доля анализируемого раствора Н2О2 — 5 мл
Результаты титрования (И(К.МпО4)): 1....
2....
ит. д.
Среднее значение И(КМпО4) = ...
Бюретку ополаскивают и заполняют титрантом КМпО4. Нулевой
уровень титранта устанавливают по верхнему краю мениска из-за глубо-
кой окраски раствора. Так же делают в дальнейшем отсчеты по шкале
бюретки. Контрольный раствор количественно переносят из пробирки в
мерную колбу, как описано в работах по ацидиметрии. В 5 колб для тит-
рования переносят пипеткой аликвотные доли по 5 мл. В каждую колбу
добавляют из мерной пробирки по 2 мл серной кислоты. Титруют первый
раствор до появления не исчезающей минимальной розовой окраски. Де-
лают отсчет по шкале бюретки. Остальные пробы раствора титруют по
очереди каждый раз от нулевого уровня титранта, начиная с добавления
44
объема на 0,5 мл меньшего, чем первый отсчет по шкале. Получив удов-
летворительные результаты титрования, титрант сливают из бюретки в
специальную склянку и заполняют бюретку дистиллированной водой.
Обработка результатов эксперимента. По результатам анализа на-
ходят средний объем титранта. Вычисляют концентрацию перекиси во-
дорода, а также ее массу во всем объеме контрольного раствора.
Делают вывод, в котором указывают полученный результат, а также
массу перекиси водорода по данным преподавателя. Вычисляют относи-
тельное отклонение.
Вопросы к защите работы
1. Всегда ли перекись водорода проявляет свойства восстановителя? Приведите
примеры реакций, в которых Н2О2 является окислителем.
2. Какие задачи можно решать с использованием рабочего раствора КМпО4?
3. Найдите факторы эквивалентности Fe2+ и Н2О2 в реакции
Fe2++ Н2О2 + Н+-> ...
Работа 2.8. Определение содержания дихромата калия
в растворе
Цель. Ознакомиться с особенностями обратного перманганатомет-
рического титрования и закрепить навыки титриметрнческого определе-
ния веществ в растворах.
Задание. Определить массу дихромата калия в контрольном растворе.
Оборудование. Мерная колба вместимостью 100 мл; воронка; бюретки вме-
стимостью 25 мл в штативе — 2 шт.; мерная пипетка вместимостью 5 мл; кониче-
ские колбы для титрования вместимостью 50—100 мл — 5 шт.; колба вместимо-
стью 250 мл; мерная пробирка.
Реактивы. Стандартный раствор КМпО4, с(1/5КМпО4) = 0,05 моль/л, рас-
твор соли Мора вместе с серной кислотой; дистиллированная вода; контрольный
раствор дихромата калия.
Сущность работы. Дихромат калия является сильным окислителем
и не может реагировать с перманганатом калия. Титриметрическое опре-
деление его может быть осуществлено обратным перманганатометриче-
ским титрованием. Для этого в качестве восстановителя берут раствор
соли железа(П). Наиболее часто применяют для этой цели соль Мора
FeSO4 (NH4)2SO4-6H2O. Последовательно проводят реакции восстановления
дихромата контролируемым избытком соли Мора и окисления остатка соли
Мора в процессе титрования перманганатом калия:
45
K2Cr2O7 + 6FeSO4 + 7H2SO„ = Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O + K2SO4
2KMnO4 + 10FeSO4 +8H2SO4 = 2MnSO4 +5Fe2(SO4)3 +8H2O + K2SO4
Формула закона эквивалентов для данного обратного титрования:
с(1/6К2Сг2О7) - К(К2Сг2О7) + с(1/5КМпО4 ) • Г(КМлО4) = c(FeSO4) • F(FeSO4)
где К(К2Сг2О7) — аликвотная доля определяемого вещества; K(FeSO4) —
точно отмеренный объем восстановителя, взятого в избытке; К(КМпО4) —
объем титранта, затраченного на окисление избытка восстановителя.
Концентрацию соли Мора заранее обычно не определяют, так как при
хранении раствора кислород из воздуха постепенно окисляет ионы желе-
за. Вместо этого в ходе анализа раствора дихромата калия проводят холо-
стые опыты, в которых отмеривают такие же объемы раствора соли Мо-
ра и титруют их без добавления аликвотной доли раствора К2Сг2О7. В
этом случае
c(FeSO4) • K(FeSO4) = с(1/5КМпО4) - Г(КМпО4),
где К'(КМпО4) — объем титранта, затраченного в холостом опыте. Сде-
лав подстановку, получаем окончательную формулу
с(1/6К2Сг2О7) К(К2Сг2О7) + с(1/5КМпО4) • К(КМпО4) =
= с(1 /5КМпО4 ) V '(КМпО4)
по которой вычисляется неизвестная концентрация раствора дихромата
калия.
Выполнение эксперимента. Получают у преподавателя пробирку с
контрольным раствором дихромата калия, записывают номер задачи. В
лабораторный журнал вносят исходные данные и подготавливают стра-
ницу для записи результатов титрования:
Концентрация титранта с(1/5КМпО4) =...
Объем анализируемого раствора после разбавления —...
Аликвотная доля анализируемого раствора К2Сг2О7 — 5 мл
Точно отмеренный объем подкисленного раствора соли Мора — 5 мл
Результаты титрования:
Опыт Основное титрование С(КМпО4) Холостой опыт К'(КМпО4)
1 2 3 Среднее
Бюретку ополаскивают и заполняют титрантом КМпО4. Нулевой
уровень титранта устанавливают по верхнему краю мениска из-за глубо-
46
кой окраски раствора. Также делают в дальнейшем отсчеты по шкале
бюретки. Контрольный раствор количественно переносят из пробирки в
мерную колбу, как описано в работах по ацидиметрии. В 5 колб для тит-
рования переносят пипеткой аликвотные доли по 5 мл. Из отдельной бю-
ретки аккуратно добавляют в каждую колбу по 5 мл подкисленного рас-
твора соли Мора. Окраска раствора в колбах переходит из желтой в зеле-
новато-фиолетовую. После этого можно сразу приступать к титрованию.
Окраска добавляемого титранта исчезает на фоне имеющегося раствора
сульфата хрома(Ш). В точке эквивалентности при самом минимальном
избытке титранта происходит наложение зеленовато-фиолетовой и розо-
вой окраски, и раствор становится почти бесцветным. Делают отсчет по
шкале бюретки. Остальные пробы раствора титруют по очереди каждый
раз от нулевого уровня титранта, начиная с добавления объема на 0,5 мл
меньшего, чем первый отсчет по шкале. Затем готовят пробы для прове-
дения холостого опыта. В колбы для титрования отмеривают из бюретки
по 5 мл раствора соли Мора и титруют по очереди до появления неисче-
зающей минимальной розовой окраски. Получив удовлетворительные
результаты титрования, титрант сливают из бюретки в специальную
склянку и заполняют бюретку дистиллированной водой.
Обработка результатов эксперимента. По результатам анализа на-
ходят средние объемы титранта И(КМпО4) и Р(КМпО4). Вычисляют кон-
центрацию дихромата калия, используя формулу в разделе сущность ра-
боты. Рассчитывают также массу К2Сг2О7 во всем объеме контрольного
раствора.
Делают вывод, в котором указывают полученный результат, а также
массу дихромата калия по данным преподавателя. Вычисляют относи-
тельное отклонение.
Вопросы к защите работы
1. Почему для титриметрического определения дихромата калия выбрано об-
ратное титрование?
2. Можно ли по полученным данным титрования рассчитать концентрацию
раствора соли Мора?
3. Почему в колбе, оставленной после титрования, происходит изменение окра-
ски раствора?
2.9.2. ИОДОМЕТРИЯ
Широко распространенным методом титриметрического анализа яв-
ляется иодометрия, основанная на титриметрической реакции иода с тио-
47
сульфатом натрия (табл. 2.4). Для определения точки эквивалентности в
этой реакции служит превосходный индикатор крахмал, образующий с
иодом синее соединение. При полном исчезновении иода в процессе ре-
акции наблюдается очень четкий переход от синего раствора к бесцвет-
ному. Особенность применения крахмала заключается в том, что его до-
бавляют в конце титрования, а до этого ведут титрование по окраске ио-
да, доводя ее до бледно-желтой. После этого добавляют крахмал. Наи-
большее значение иодометрия имеет в вариантах заместительного и об-
ратного титрования (см. табл. 2.4) для определения многих окислителей и
восстановителей.
Таблица 2.4. Йодометрические методы анализа
Титриметрическая реакция I, + 2Na2S2O3 = 2NaI + Na2S4O6
Растворы: тиосульфат натрия Na2S2O3 (титрант), иод 12 совместно с иодидом
калия (стандартизированный), иодцд калия, серная кислота (не стандартизиро-
ванные)
Заместительное титрование Прямое титрование Обратное титрование
Определение окислите- лей (Ох), окисляющих ион Г. Добавляют KI в избытке в кислой среде Определение концен- трации иода или тио- сульфатов Определение восстановителей (Red), окисляющихся иодом. Добавляют иод в контролируе- мом избытке
20x + 2zI" = 2Red + zI2 -> I2 + 2S2O3“ = 2Г + S40* <- 2Red + zl2 = 20х + 2zl~
nf —Oxi = w(Na2S2O3) kz / n(ji2) = n(Na2S2O3) п(- Red'] + zi(Na2S2O3) = п(-121 \z ) \2 )
Стандартный раствор иода для иодометрии готовят растворением
точной навески кристаллического иода в водном растворе иодида калия.
В чистой воде растворимость иода очень мала, но с KI он образует свое-
образное, хорошо растворимое комплексное соединение К13 красновато-
бурого цвета:
12+Г=13
Образование этого вещества не мешает протеканию титриметриче-
ской реакции.
Работа 2.9. Определение концентрации перекиси водорода
в водном растворе
Цель. Ознакомиться с особенностями йодометрического титрования
и закрепить навыки титриметрнческого определения веществ в растворах.
48
Задание. Определить массовую долю перекиси водорода в кон-
трольном растворе.
Оборудование. Бюретка в штативе вместимостью 25 мл; пипетка вместимо-
стью 5 мл; мерная пробирка; мерная колба вместимостью 100 мл; колбы для тит-
рования вместимостью 100 мл — 5 шт.; коническая колба вместимостью 250 мл.
PeaicniBbi. Стандартный раствор тиосульфата натрия, c(Na2S2O3) = 0,05
моль/л; раствор иодида калия с массовой долей 5%, серная кислота, c(H2SO4) = 1
моль/л; раствор крахмала, раствор молибдата аммония (МН4)бМо7О24 с массовой
долей 25%.
Сущность работы. Перекись водорода окисляет ионы Г в кислой
среде до простого вещества 12 (пример 2.2). Реакция идет довольно мед-
ленно, и ее проводят с добавлением молибдата аммония в качестве ката-
лизатора. После завершения реакции количество вещества иода эквива-
лентно имевшемуся количеству вещества перекиси водорода. Иод тит-
руют стандартным раствором тиосульфата натрия.
Выполнение эксперимента. Получают у преподавателя пробирку с
контрольным раствором перекиси водорода, записывают номер задачи. В
лабораторный журнал вносят исходные данные и подготавливают стра-
ницу для записи результатов титрования:
Концентрация титранта c(Na2S2O3) = ...
Объем анализируемого раствора после разбавления —...
Аликвотная доля анализируемого раствора Н2О2 — 5 мл
Результаты титрования (l/(Na2S2O3)) 1....
2....
ит. д.
Среднее значение K(Na2S2O3) =...
Бюретку ополаскивают и заполняют титрантом Na2S2O3. Кон-
трольный раствор количественно переносят из пробирки в мерную
колбу, как описано в работах по ацидиметрии. В 5 колб для титрова-
ния переносят пипеткой аликвотные доли по 5 мл. В каждую колбу
добавляют из мерной пробирки по 1 мл серной кислоты, 1 мл раствора
иодида калия и 1 капле молибдата аммония. Смеси выдерживают 5
мин для завершения реакции. Титруют первый раствор до слабо-
желтой окраски. Добавляют 3 капли крахмала и продолжают титрова-
ние до исчезновения голубой окраски. Выжидают 2—4 мин, чтобы
убедиться, что окраска не появляется. В противном случае добавляют
по каплям титрант. Делают отсчет по шкале бюретки. Остальные рас-
творы титруют по очереди каждый раз от нулевого уровня титранта,
начиная с добавления объема на 0,5 мл меньшего, чем первый отсчет
по шкале. Получив удовлетворительные результаты титрования, тит-
рант сливают из бюретки в специальную склянку и заполняют бюрет-
ку дистиллированной водой.
49
Обработка результатов эксперимента. По результатам анализа на-
ходят средний объем титранта. Вычисляют концентрацию перекиси во-
дорода, а также ее массу во всем объеме контрольного раствора.
Делают вывод, в котором указывают полученный результат, а также
массу перекиси водорода по данным преподавателя. Вычисляют относи-
тельное отклонение.
Вопросы к защите работы
1. Почему в конце титрования может повторно возникать синяя окраска рас-
твора?
2. Какой вариант титрования был применен в данной работе?
3. Предложите способ проведения титрования для стандартизации раствора
тиосульфата натрия по стандартному раствору перманганата калия.
Работа 2.10. Определение массовой доли формальдегида
в водном растворе
Цель. Ознакомиться с особенностями йодометрического титрования
и закрепить навыки титриметрического определения веществ в растворах.
Задание. Определить массовую долю формальдегида в контрольном
растворе.
Оборудование. Бюретки в штативе вместимостью 25 мл — 2 шт.; пипетки
градуированные вместимостью 5 и 10 мл; мерная пробирка; мерная колба вме-
стимостью 100 мл; колбы для титрования вместимостью 100 мл; коническая кол-
ба вместимостью 250 мл.
Реактивы. Стандартный раствор тиосульфата натрия, c(Na2S2O3) = 0,05
моль/л; стандартный раствор иода, с(1/212) = 0,02 моль/л; раствор гидроксида
натрия, c(NaOH) = 2 моль/л; раствор крахмала; соляная кислота, с(НС1) = 2
моль/л.
Сущность работы. Формальдегид окисляется иодом в щелочной
среде:
СН2О + I2 + 3NaOH = HCOONa + 2NaI + 2Н2О
и поэтому для его определения можно применить обратное йодометриче-
ское титрование. Несмотря на добавленный иод в контролируемом из-
бытке, раствор практически бесцветен вследствие диспропорционирова-
ния иода в щелочной среде. После окончания реакции окисления фор-
мальдегида к смеси добавляют соляную кислоту, в результате чего снова
образуется иод:
50
I2 + 2NaOH = Nal + NalO
Nal + NalO + 2HC1 = I2 + 2NaCl + H2O
Его титруют стандартным раствором тиосульфата натрия.
Выполнение эксперимента. Получают у преподавателя пробирку с
контрольным раствором формальдегида (формалином), записывают но-
мер задачи. В лабораторный журнал вносят исходные данные и подго-
тавливают страницу для записи результатов титрования:
Концентрация титранта c(Na2S2O3) = ...
Концентрация стандартного раствора иода с(12) = ...
Объем раствора иода — 10 мл
Объем анализируемого раствора после разбавления —...
Аликвотная доля анализируемого раствора Н2О2 — 5 мл
Результаты титрования (K(Na2S2O3)): 1....
2. ...
ит. д.
Среднее значение Р(Ыа282О3) = ...
Контрольный раствор количественно переносят из пробирки в мер-
ную колбу, как описано в работах по ацидиметрии. В 5 колб для титрова-
ния переносят пипеткой аликвотные доли по 5 мл. В каждую колбу до-
бавляют пипеткой 10,0 мл раствора иода и по каплям из бюретки раствор
гидроксида натрия до светло-желтого окрашивания раствора. Смеси в
колбах выдерживают в темноте (в столе) 4—5 мин. После этого к раство-
рам добавляют мерной пробиркой по 2 мл соляной кислоты. Что наблю-
дается? Титруют первый раствор тиосульфатом натрия до слабо-желтой
окраски. Добавляют 3 капли крахмала и продолжают титрование до ис-
чезновения голубой окраски. Делают отсчет по шкале бюретки. Осталь-
ные растворы титруют по очереди каждый раз от нулевого уровня тит-
ранта, начиная с добавления объема на 0,5 мл меньшего, чем первый от-
счет по шкале. Получив удовлетворительные результаты титрования,
Титрант сливают из бюретки в специальную склянку и заполняют бюрет-
ку дистиллированной водой.
Обработка результатов эксперимента. По результатам анализа на-
ходят средний объем титранта. Рассчитывают концентрацию формальде-
гида на основе формулы для обратного титрования:
; c(1/2CH2O)- K(CH2O) + c(Na2S2O3)- K(Na2S2O3) = c(l/2I2) - И(Т2)
Вычисляют массу формальдегида во всем объеме контрольного рас-
твора. Узнают у преподавателя массу раствора в выданной пробирке и
вычисляют массовую долю формалина.
Делают вывод, в котором указывают полученный результат, а также
кассовую долю формалина по данным преподавателя. Вычисляют отно-
сительное отклонение.
Вопросы к защите работы
1. Что вам известно о применении формалина?
2. Как сказалось бы на результатах анализа использование в расчетах завышен-
ной концентрации тиосульфата натрия?
3. Можно ли определять бромид калия йодометрическим методом?
Работа 2.11. Определение содержания активного хлора
в хлорной (белильной) извести
Цель. Ознакомиться с особенностями йодометрического титрования
и закрепить навыки титриметрического определения веществ в растворах.
Задание. Определить массовую долю активного хлора в образце
хлорной извести.
Оборудование. Бюретка в штативе вместимостью 25 мл; пипетка вместимо-
стью 5 мл; мерная пробирка; мерная колба вместимостью 100 мл; колбы для тит-
рования вместимостью 100 мл; коническая колба вместимостью 250 мл.
Реактивы. Стандартный раствор тиосульфата натрия, c(Na2S2O3) = 0,05
моль/л; раствор иодида калия с массовой долей 5%; соляная кислота, с(НС1) = 4
моль/л; раствор крахмала.
Сущность работы. Хлорная известь, широко применяемая в сани-
тарных целях, не является стехиометрическим по составу продуктом.
Считается, что действующее вещество в ней хлорид гипохлорит кальция
СаС1(ОС1). Активным хлором называют хлор, проявляющий окислитель-
+i
ное действие, т. е. в данном случае С1. В кислой среде он в реакции с
ионом СГ образует молекулы хлора:
CaCl(OCl) + 2НС1 = СаС12 + С12 + Н2О
Хлор выделяет из иодида калия иод, который определяется йодомет-
рическим титрованием.
Выполнение эксперимента. Получают у преподавателя пробирку с
контрольным раствором хлорной извести, записывают номер задачи. В
лабораторный журнал вносят исходные данные и подготавливают стра-
ницу для записи результатов титрования:
Концентрация титранта c(Na2S2O3) = ...
Объем анализируемого раствора после разбавления — ...
Аликвотная доля анализируемого раствора СаС1(ОС1) — 5 мл
Результаты титрования (K(Na2S2O3)): 1....
2. ...
ИТ. д.
Среднее значение lz(Na2S2O3) = ...
52
Бюретку ополаскивают и заполняют титрантом Na2S2O3. Контроль-
ный раствор количественно переносят из пробирки в мерную колбу, как
описано в работах по ацидиметрии. В 5 колб для титрования переносят
пипеткой аликвотные доли по 5 мл. В каждую колбу добавляют из мер-
ной пробирки по 2 мл соляной кислоты и 1 мл раствора иодида калия.
Смеси выдерживают 5 мин для завершения реакции. Титруют первый
раствор до слабо-желтой окраски. Добавляют 3 капли крахмала и про-
должают титрование до исчезновения голубой окраски. Выжидают 2—4
мин, чтобы убедиться, что окраска не появляется. В противном случае
добавляют по каплям титрант. Делают отсчет по шкале бюретки. Осталь-
ные растворы титруют по очереди каждый раз от нулевого уровня тит-
ранта, начиная с добавления объема на 0,5 мл меньшего, чем первый от-
счет по шкале. Получив удовлетворительные результаты титрования,
титрант сливают из бюретки в специальную склянку и заполняют бюрет-
ку дистиллированной водой.
Обработка результатов эксперимента. По результатам анализа на-
ходят средний объем титранта. Вычисляют концентрацию хлора С12, а
также его массу во всем объеме контрольного раствора. По данным пре-
подавателя о массе хлорной извести, вошедшей в состав контрольной
пробы раствора, рассчитывают массовую долю активного хлора.
Делают вывод, в котором указывают полученный результат, а также
массовую долю активного хлора по данным преподавателя. Вычисляют
относительное отклонение.
Вопросы к защите работы
1. Какой вариант титрования применен для определения активного хлора?
2. Можно ли определить активный хлор перманганатометрическим титрованием?
3. Какие наиболее значительные примеси может содержать хлорная известь?
Вопросы и задачи к гл. 2
1. К 10 мл раствора с концентрацией хлороводорода 0,12 моль/л добавили 5 мл
раствора с концентрацией гидроксида натрия 0,22 моль/л. Вычислите pH по-
лученного раствора.
2. Навеска гидроксида калия 1,2046 г растворена в мерной колбе вместимостью
250 мл. На титрование 20 мл полученного раствора израсходовано 14,82 мл
соляной кислоты с концентрацией НС1 0,105 моль/л. Определите массовую
долю КОН в образце.
3. Для определения кислотности желудочного сока оттитровали 5 мл сока рас-
твором щелочи с концентрацией 0,095 моль/л в присутствии фенолфталеина.
53
На реакцию израсходовано 2,8 мл раствора щелочи. Рассчитайте кислотность
анализируемого сока.
4. Рассчитайте массу навески перманганата калия, необходимую для приготов-
ления 0,5 л раствора с молярной концентрацией эквивалента 0,05 моль/л для
перманганатометрии.
5. Важное санитарное значение имеет окисляемость воды, которая выражается
числом миллиграммов кислорода, необходимого для окисления органиче-
ских веществ в 1 л воды. Для определения окисляемости воды к 10,0 мл ана-
лизируемой воды прибавили 8,0 мл раствора КМпО4 с концентрацией
с(1/5КМпО4) 0,0926 моль/л, раствор подкислили серной кислотой и проки-
пятили. Затем добавили 10,0 мл раствора щавелевой кислоты с концентраци-
ей с(Н2С2О4) = 0,10 моль/л; на титрование избытка кислоты затрачено 4,6 мл
того же раствора перманганата калия. Определите окисляемость воды.
6. Для определения кальция в сыворотке крови его осаждают в виде СаС2О4,
добавляя к 0,5 мл сыворотки оксалат аммония в избытке. Осадок отфильтро-
вывают, промывают и растворяют в серной кислоте. Раствор титруют пер-
манганатом калия с молярной концентрацией эквивалента 0,01 моль/л до по-
явления розовой окраски. Вычислите содержание кальция в сыворотке (в
ммоль/л), если на титрование израсходовано 0,25 мл титранта.
Глава 3
Элементы химической
термодинамики
3.1. ТЕПЛОТЫ ХИМИЧЕСКИХ ПРОЦЕССОВ
Энергетические явления, сопровождающие химические реакции,
имеют очень большое практическое значение. Так, реакции сгорания уг-
леводородов, угля, водорода, магния, реакции в гальванических элемен-
тах, взрывные реакции — производятся специально для получения энер-
гии. Все энергетические потребности организмов, начиная от простей-
ших и до человека, также обеспечиваются химическими реакциями. Зе-
леные растения запасают энергию солнечного излучения в молекулах
! глюкозы, а все остальные организмы ее тратят, окисляя глюкозу и вре-
менно храня порции энергии в специальных веществах типа АТФ. Для
«этого клетки снабжены особыми органами — митохондриями. Для более
[длительного хранения запасов энергии организмы превращают глюкозу в
(.жиры. Эксперименты показывают, что превращения веществ in vivo и in
‘vitro сопровождаются одинаковыми суммарными энергетическими эф-
фектами. Поэтому положения химической термодинамики справедливы
фак для реакций в лабораторных и производственных условиях, так и в
[живых организмах. Человек за сутки затрачивает в среднем при массе 70 кг
[.11,3 МДж энергии (в медицине не вышла из употребления и более старая
единица измерения — килокалория-, 11,3 МДж = 2700 ккал). Фактические
затраты зависят от возраста, пола, состояния здоровья, климатических
(условий, характера труда. С учетом всего этого рассчитываются и плани-
руются нормы потребления пищевых продуктов, необходимые их запасы
[И т. д.
Для практических и научных целей возможно экспериментальное и
(расчетное определение энергетических эффектов — теплоты и макси-
мальной работы реакций.
\ Ознакомление на первом курсе с методами измерения и расчета теп-
лоты (АЯ) и максимальной работы (AG) химических реакций необходимо
для последующего изучения биохимии, физиологии, терапии, гигиены.
55
3.2. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ТЕПЛОТ
ХИМИЧЕСКИХ ПРОЦЕССОВ
Все разновидности химических и физико-химических процессов —
химические реакции, растворение и кристаллизация, фазовые переходы,
ионизация — сопровождаются различными энергетическими эффектами:
выделением теплоты, излучением, возникновением электрического тока,
совершением механической работы. Различные виды энергии в конечном
счете переходят в тепловую энергию. Поэтому для общей энергетической
характеристики химических процессов целесообразно измерять или рас-
считывать теплоты процессов, равные изменению энтальпии ДЯ в изо-
барно-изотермических условиях.
Для определения теплоты процесса служит калориметр. Этот при-
бор состоит из сосуда для проведения химической реакции, погруженно-
го в емкость с водой, которой передается большая часть выделяющейся
при реакции теплоты. По изменению температуры воды, ее массе ..
удельной теплоемкости вычисляют общее количество переданной тепло-
ты Q. Затем количество теплоты пересчитывают на 1 г реагирующего
вещества (удельная теплота) или на молярное количество вещества, соот-
ветствующее уравнению реакции.
Рис. 3.1. Схема
калориметра
Для веществ, способных сгорать в кислороде, хо-
рошо отработано определение теплоты сгорания ДСЯ *.
Для этого применяют калориметр, в котором для про-
ведения реакции служит толстостенный, герметически
закрывающийся металлический сосуд — калориметри-
ческая бомба. В сосуд помещают пробу вещества и ки-
слород под давлением в избытке. Реакция в смеси ини-
циируется искрой, создаваемой электрическим разря-
дом. Этим методом, в частности, определяют калорий-
ность или теплотворную способность различных пище-
вых продуктов.
Несколько другие типы калориметров (рис. 3.1)
применяют для измерения теплот реакций, протекаю-
щих в водных растворах. В этом случае теплота реак-
ции передается в основном воде (или, наоборот, заби-
рается у воды) как растворителя. Потери теплоты в ка-
лориметре по возможности уменьшают, помещая сосуд
с раствором 1 во внешнюю оболочку 2. Целесообразно
* Здесь и далее в обозначениях термодинамических функций используются сле-
дующие индексы: с — сгорание, г — реакция, f — образование (от англ, com-
bustion, reaction, formation).
56
применение в качестве калориметра сосуда Дьюара. Калориметр снабжа-
ется точным термометром 3, мешалкой 4 для быстрого достижения одно-
родности раствора и воронкой 5 для внесения в сосуд реагирующих ве-
ществ. Теплоту, выделяющуюся в калориметре, рассчитывают по общей
теплоемкости Ст всех частей калориметра и изменению температуры:
Q = Ст\Т. Массу реагирующих веществ и воды подбирают таким обра-
зом, чтобы изменение температуры было невелико, и процесс был близок
к изотермическому.
Общим методом определения максимальной работы химических
процессов является измерение электродвижущей силы гальванических
элементов (см. гл. 7).
33. РАСЧЕТЫ ТЕПЛОТЫ И МАКСИМАЛЬНОЙ РАБОТЫ
ХИМИЧЕСКИХ РЕАКЦИЙ
Теплоту и максимальную работу реакций можно рассчитывать при
наличии необходимых табличных данных по термодинамическим свой-
ствам веществ и некоторых характерных химических реакций. Основные
термодинамические характеристики реакций:
Стандартная теплота реакции \ГН' — это теплота одного оборо-
та реакции при определенных условиях. Наиболее часто стандартную
теплоту относят к стандартным условиям: р = 101,3 кПа, Т= 298,15 К.
Однако стандартные величины могут быть отнесены и к другим услови-
ям, что должно быть указано. В биохимии и физиологии стандартные
величины обычно относят к физиологическим условиям: р = 101,3 кПа, Т=
= 310,15 К(37 °C). Обычной единицей измерения ЛГН° является кДж/моль.
Теплота практически осуществляемой реакции при любом количест-
ве вещества вступивших в реакцию веществ рассчитывается по уравнению
АГЯ = А,/Г£. (3.1)
Стандартное изменение энергии Гиббса (максимальная работа ре-
акции) A,G° — это изменение энергии Гиббса при одном обороте реак-
ции в системе с концентрациями всех реагирующих веществ и продуктов,
равными 1 моль/л, и при прочих условиях, указанных для стандартной
теплоты реакции. Обычная единица измерения ArG° — кДж/моль.
Стандартное изменение энтропии химической реакции Аг5° —
это изменение энтропии при одном обороте химической реакции и при
прочих условиях, указанных для стандартной теплоты реакции. Основная
единица измерения — Дж/(моль К).
57
Стандартная теплота образования вещества \fH' — это изме-
нение энтальпии при образовании 1 моль сложного вещества из простых
веществ, находящихся в стандартном состоянии. Для последних теплота
образования принимается равной нулю. Обычная единица измерения
Ду//° — кДж/моль.
Практически осуществимы термохимические исследования лишь для
реакций образования бинарных соединений. Поэтому для большинства
других веществ величины hfH' найдены расчетным путем.
Стандартная теплота сгорания вещества &СН° — это изменение
энтальпии при сгорании 1 моль вещества в кислороде при стандартных
условиях с образованием высших оксидов всех элементов, кроме азота,
хлора и брома. Последние переходят в простые вещества. Для веществ,
которые не горят, &СН° = 0. Обычная единица измерения АСН" —
кДж/моль.
Стандартное изменение энергии Гиббса образования вещества
Дуб" — это изменение энергии Гиббса при образовании 1 моль сложно-
го вещества из простых веществ, находящихся в стандартном состоянии.
Для последних &fG° = 0. Обычная единица измерения Дуб" — кДж/моль.
Стандартная энтропия вещества S‘ — это энтропия 1 моль веще-
ства при стандартных условиях. Основная единица измерения 5° —
Дж/(моль К). По измерениям зависимости теплоемкости веществ от тем-
пературы рассчитываются абсолютные величины энтропии (а не AS).
Расчет стандартной теплоты реакции на основе следствий из закона
Г есса:
= (3-2)
прол исх
= (3.3)
исх прод
где v, — стехиометрические коэффициенты веществ в уравнении реак-
ции; прод — продукты реакции (вещества, записанные в уравнении спра-
ва); исх — исходные вещества (реагенты).
По аналогичным формулам рассчитываются стандартные величины
Дгб° и &rS°:
дгб° = £v,azg; -£у,Дуб;, (3.4)
прод исх
Дг5” = £v,5; -£v,s;. (3.4')
прод исх
58
Пример 3.1. Рассчитайте &rH°, &rG° и Дг5° для реакции образования ме-
тана из углекислого газа и водорода:
СО2+4Н2 = СН4+2Н2О
используя разные доступные способы расчета.
Решение. Выпишем из табл. 7 и 8 приложения термодинамические данные
для веществ в уравнении реакции:
СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж)
&fH°, кДж/моль.. -394 0 -85 -286
&СН°. кДж/моль.. 0 -286 -882 0
Д fG°, кДж/моль .. -394 0 -51 -238
5°, Дж/(моль К).. 214 131 186 70
Рассчитываем стандартную теплоту реакции по уравнениям (3.2) и (3.3):
Д,/Г = -85 + 2(-286)-(-394) = -263 кДж/моль;
Дг/Г = 4(-286) - (-882) = -262 кДж/моль.
Небольшое расхождение результатов объясняется тем, что табличные дан-
ные содержат случайные ошибки эксперимента.
Рассчитаем ДГС” и Дг5° по уравнениям (3.4) и (3.4'):
Д/Г =-51+2(-238)-(-394) = -133 кДж/моль;
Дг5° = 186 + 2 • 70 - (214 + 4 • 131) = -416 Дж/(моль К).
Величину Д/Г можно вычислить и другим способом:
Дгб" = Д,Н’ - Т • &rS° = -253 - 298(—416) /1 000 = -129 кДж/моль.
Совпадение результатов хорошее.
Работа 3.1. Определение теплоты реакции нейтрализации
Цель. Приобрести навыки калориметрического определения теплот
химических реакций и обработки данных эксперимента. Проверить зави-
симость теплот реакций нейтрализации от природы реагирующих кислот
и оснований.
Оборудование. Калориметр, состоящий из двух стаканов различного объема
(например, 0,1 и 0,5 л), вставленных один в другой, пробки с отверстиями для
термометра; мешалки и воронки; мерные цилиндры — 2 шт.; термометр с ценой
деления 0,1°; воронка; мешалка с мотором.
59
Реактивы. Кислоты: соляная, азотная, уксусная; растворы гидроксидов, на-
трия и калия; раствор аммиака. Все растворы с концентрацией в пределах 0,5—1
моль/л.
Сущность работы. Изучается выделение теплоты при реакции ней-
трализации по повышению температуры раствора. Для всех сильных ки-
слот и щелочей реакция нейтрализации оказывается одним и тем же про-
цессом
Н++ОН=Н2О
Для них теплота нейтрализации &пН° одинакова с небольшими от-
клонениями из-за влияния теплоемкостей разных катионов и анионов. По
данным справочников, &пН° = -57,3 кДж/моль. При участии в реакции
слабого электролита, нейтрализация сопровождается его диссоциацией
(процесс эндотермический), и измеренная теплота оказывается меньше.
Выполнение эксперимента. Получают у преподавателя задание для
выполнения лабораторной работы — конкретные пары реагентов кисло-
та—основание. Например, определяют теплоту реакции нейтрализации
соляной кислоты растворами гидроксидов калия и натрия и раствором
аммиака.
Подготавливают для работы калориметр: осматривают его, чтобы
убедиться в исправности всех деталей; ополаскивают дистиллированной
водой внутренний стакан; проверяют работу мешалки и настраивают ее
на небольшую скорость вращения. Возможно проведение опыта и без
мешалки. Записывают в лабораторном журнале исходные данные:
Масса внутреннего стакана калориметра т, г....
Объемы растворов реагирующих веществ И, мл....
Концентрация растворов с, моль/л.......
Плотность растворов р, г/мл..........
Удельная теплоемкость растворов (воды) С„(Н2О) — 4,184 Дж/(г К)
Удельная теплоемкость стекла Сю(ст) — 0,753 Дж/(гК).
Мерными цилиндрами отмеривают равные объемы растворов кисло-
ты и основания (0,025—0,05 л, по указанию преподавателя). Температуру
одного из растворов, например основания, измеряют непосредственно в
цилиндре термометром, вынутым из калориметра. После этого термометр
ополаскивают дистиллированной водой и снова вставляют в калориметр.
Раствор кислоты переливают через воронку во внутренний стакан кало-
риметра и также записывают его температуру. Раствор щелочи быстро
вливают в калориметр к раствору кислоты, перемешивают в течение не-
скольких секунд и наблюдают за столбиком ртути термометра. Записы-
вают самое высокое показание. Повторяют опыт с этой же парой кислоты
и основания. Затем проводят по два параллельных опыта с другими за-
60
данными парами кислот и оснований. Полученные экспериментальные
данные записывают в таблицу по форме:
Измеренные и вычисленные ве- ЛИЧИНЫ Реагирующие вещества (как например)
НС1 + NaOH НС1 + кон НС1 + NH3
Концентрация растворов, моль/л
Температура раствора, Тк, Тщ
Начальная температура опыта 7, = (ГК+ 7щ)/2
Самая высокая температура после нейтрализации, Т2
ДТ
п(кислота) = и(щелочь), моль
6, кДж
Л„Н°, кДж/моль
Обработка результатов эксперимента. Для вычисления по экспе-
риментальным данным теплоты реакций нейтрализации сначала рассчи-
тывают общую теплоемкость калориметра Ст, учитывая теплоемкость
раствора и теплоемкость внутреннего стакана:
Са = ст (н2°) • «(раствор) + С„ (ст) • т(стакан),
где т(раствор) — масса раствора в калориметре, вычисляемая по объему
взятых растворов и их плотности. Плотность может быть принята равной
1 г/мл. Затем вычисляют выделившуюся в калориметре теплоту:
Q=c„&t.
Эта теплота постепенно, по мере выравнивания температуры переда-
ется в окружающую среду и может быть принята равной по абсолютной
величине изменению энтальпии системы (калориметра):
Для расчета стандартной теплоты реакции нейтрализации найденное
значение теплоты необходимо пересчитать на 1 моль реагирующей ки-
слоты или основания, что соответствует 1 моль образующейся воды:
ЬпН’=ЬпН1п,
где и — количество одного из веществ, участвующих в реакции, которое
требуется рассчитать по исходным данным.
Рассчитывают стандартные энтальпии изученных реакций, исполь-
зуя термодинамические свойства веществ (см. приложение, табл. 7), и
сравнивают с полученными значениями. Находят отклонения найденных
61
значений от расчетных. Объясняют вероятные причины отклонений. Де-
лают вывод о зависимости стандартной теплоты реакции от природы реа-
гирующих кислот и оснований.
Вопросы к защите работы
1. Каковы основные источники ошибок в проведенном эксперименте?
2. На какие промежуточные стадии можно разделить процесс нейтрализации
слабой кислоты сильным основанием?
3. Чем объясняется постоянство стандартных теплот реакций нейтрализации
для разных сильных кислот и оснований?
4. Какие результаты опыта по определению теплоты реакции нейтрализации
можно ожидать при замене соляной кислоты таким же объемом серной ки-
слоты с равной молярной концентрацией эквивалента?
5. Как повлияет на точность определения теплоты реакции нейтрализации
уменьшение концентрации растворов кислоты и щелочи?
3.4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
При нагревании стеклянного сосуда с газообразным оксидом азота(1У) в
пределах 20—30 °C бурая окраска газа усиливается, а при охлаждении блед-
неет. Это следствие смещения равновесия в обратимой реакции
2NO, # N2O4, Д,Я<0.
бурый бесцветный
При повышении температуры равновесие смещается в сторону об-
ратной эндотермической реакции, а при понижении — в сторону прямой
экзотермической. В сосуде с желто-зеленым хлором в тех же условиях
окраска не изменяется, но при нагревании хлора до -1200 °C и в этом
газе возникает обратимая реакция.
С12 # 2С1
Обратимость разных реакций проявляется в разных температурных
интервалах. Практически обратимой считается такая реакция, в которой
смещение равновесия можно наблюдать при изменении общей концен-
трации вещества и/или при небольшом изменении температуры. Для ре-
акций в газовой фазе к этим факторам добавляется изменение давления.
Обратимые реакции имеют большое значение в процессах жизнедея-
тельности организмов. Необратимые процессы, осуществляющиеся в
клетках, как например экзоэргоническое окисление глюкозы или эндоэр-
гонический синтез белков, протекают на фоне быстро устанавливающих-
ся равновесий ионизации кислот и оснований, образования и распада ок-
сигемоглобина, гидратации и дегидратации СО2. Эти равновесия создают
необходимые условия для необратимых реакций метаболизма.
62
Конкретное состояние равновесия обратимой реакции, выражающее-
ся в величинах равновесных концентраций с(Х;) всех компонентов — реа-
гентов и продуктов, определяется константой равновесия К. Для химиче-
ской реакции, записанной в общем виде
Xv,x, = Ev-x< <3-5)
исх пред
константа равновесия связана с равновесными концентрациями уравне-
нием закона действующих масс (ЗДМ):
Гру'(х,)
Отметим некоторые свойства констант равновесия: 1. Константа
равновесия является характерной величиной для каждой обратимой реак-
ции, зависящей только от температуры, а равновесные концентрации ве-
ществ зависят от величины К. 2. Числовое значение К зависит от способа
выражения концентрации. Наиболее часто используют молярные концен-
трации. Для газов вместо концентраций можно использовать пропорцио-
нальные им парциальные давления. 3. Для гетерогенной реакции концен-
трации индивидуальных твердых и жидких веществ выражают через мо-
лярные доли х, в результате чего они оказываются равными 1. Поэтому
концентрации этих веществ в уравнение ЗДМ не входят. 4. Для прямой и
обратной реакции константы равновесия взаимно-обратные величины:
К =—.
Пр КЛ
**обр
5. Для обратимой реакции, состоящей из последовательно проте-
кающих реакций,
где — константа равновесия суммарного процесса, a К, — константы
равновесия отдельных стадий.
Такое же выражение, как в левой части уравнения (3.6), если в него
подставлены наличные (текущие) или начальные концентрации компо-
нентов, не является постоянной величиной. Его сокращенно называют
произведением концентраций и обозначают Пс.
Пример 3.2. Для реакции
2NO2 # N2O4
константа равновесия К = 9,0 л/моль (23 °C). Находится ли система в равновесии
при c(NO2) = c(N2O4) = 0,05 моль/л? Если нет, то в каком направлении идет
реакция и какие установятся равновесные концентрации?
63
Решение. 1. Вычислим Пс:
Пс = Г^2°4) = 0,05/0,052 = 20.
c2(NO2)
Произведение концентраций не равно константе равновесия, следовательно,
равновесия в системе нет, идет химическая реакция.
2. Согласно закону действующих масс, реакция пойдет так, что Пс будет
приближаться и станет равным К. Это произойдет при одновременном уменьше-
нии числителя и увеличении знаменателя в полном выражении величины Пс.
Следовательно, продукта (вещества справа в уравнении реакции и в числителе
Пс) будет становиться меньше, реакция будет идти справа налево.
Для вычисления равновесных концентраций обозначим изменения концен-
траций веществ при достижении состояния равновесия:
2NO2 = N2O4
Со, моль/л................. 0,05 0,05
Ас, моль/л................. 2х —х
с, моль/л.................. 0,05 + 2х 0,05 -х
Составляем и решаем уравнение:
——^-тг = 9,0; х = 0,0088 моль/л.
(0,05+ 2т)2
Равновесные концентрации веществ будут: с (NO2) = 0,0676 моль/г
c(N2O4) = 0,0412 моль/л.
Для отдельных классов реакций в растворах наиболее часто исполь
зуются следующие разновидности констант равновесия: 1
• для реакций ионизации кислот и оснований — константы кислотнс
сти Kt и константы основности Къ;
• для реакций растворения и осаждения малорастворимых электрод!
тов (солей и оснований) — константы растворимости Ks; *
• для реакций распада и образования комплексных соединений — koi
станты нестойкости К„ и константы устойчивости р.
Для удобства записи, сравнения и расчетов часто применяются покс
затели констант рК — это десятичные логарифмы констант, взятые
обратным знаком. Например, рЛ"а — показатель константы кислотности
или силовой показатель кислоты.
Работа 3.2. Исследование смещения химического равновесия
Цель. Изучить влияние изменения концентраций и температуры н
состояние химического равновесия. Сравнить результаты наблюдений
прогнозом на основе принципа Ле Шателье.
64 :
Оборудование. Химические стаканы вместимостью 100 и 250 мл; штатив с
пробирками; пипетки глазные или капельницы; газовая горелка.
Реактивы. Насыщенные растворы FeClj, KNCS; раствор KF, c(KF) = l
моль/л; раствор 12, с(/2) = 0,05 моль/л; раствор крахмала.
Сущность работы. Проводится визуальное наблюдение за измене-
нием интенсивности окраски раствора, содержащего хлорид железа (III) и
тиоцианат калия. В растворе образуются комплексные соединения крас-
ного цвета:
Fe3+ + nNCS # [Fe(NCS)„]3" (н=Ь6)
Смещение равновесия ожидается при добавлении по отдельности
исходных веществ и фторида калия, образующего с ионом железа не ок-
рашенный комплекс:
[Fe(NCS)„]3 "+HF-# [FeF„]3 "+nNCS“
Аналогичные наблюдения ведутся за раствором, содержащим крах-
мал и иод, при нагревании и охлаждении:
12+(С6Н10О5)„ <=> 12(С6Н10О5)„
желтый бесцветный синий
1 Выполнение эксперимента. Опыт 1. Смещение химического
равновесия при изменении концентрации реагентов. В химический
стакан вносят 10 мл воды и по 1 капле насыщенных растворов FeCl3
и KNCS. Полученный раствор распределяют по четырем пробиркам.
Первая пробирка остается для сравнения, В остальные пробирки по
очереди добавляют; 1 каплю раствора FeCl3; 1 каплю раствора KNCS;
1—3 капли раздельно раствора KF. Каждый раз после добавления ре-
актива раствор в пробирке перемешивают и наблюдают изменение
интенсивности окраски.
Результаты наблюдений вносят в таблицу или записывают иным об-
разом по своему усмотрению.
к Пробирка Добавленный реактив Наблюдение интенсивности окраски Направление смещения равновесия (влево или вправо)
1 «Свидетель»
2 FeClj
3 KNCS
4 KF
Делают вывод о соответствии наблюдений принципу Ле Шателье.
Записывают выражение ЗДМ для наблюдаемого равновесия.
1-366
65
Опыт 2. Смещение химического равновесия при изменении темпе-
ратуры. В стакане вместимостью 250 мл нагревают воду почти до кипе-
ния. В две пробирки вносят по 2 мл раствора крахмала и добавляют туда
же по 1 мл раствора иода. Наблюдают цвет образовавшегося раствора.
Одну из пробирок опускают на несколько минут в горячую воду. Вторую
пробирку оставляют для сравнения. Наблюдают изменение окраски. Ох-
лаждают нагретую пробирку, опустив ее в холодную воду, продолжая
наблюдение за окраской раствора. Делают вывод о наличии равновесия и
о его смещении при изменении температуры, а также о знаке ДГЯ.
Вопросы к защите работы
1. В каком направлении будет смещаться равновесие при разбавлении раствора
водой в первом опыте?
2. Сформулируйте принцип Ле Шателье.
3. Какие термодинамические данные необходимы для расчета константы рав-
новесия?
4. При увеличении температуры увеличиваются скорости как прямой, так и
обратной реакций, тогда почему происходит смещение равновесия? Изменя-
ется ли при этом константа равновесия?
5. Напишите реакцию иона железа с тиоцианатом при п = 3.
Вопросы и задачи к гл. 3
1. Приведите примеры реакций, при которых внутренняя энергия вещества
переходит в механическую, электрическую, световую, тепловую энергию.
2. Известно, что конечными продуктами превращения белков в организме яв-
ляются вода, углекислый газ и мочевина. Отличается ли теплота превраще-
ния белка в организме от теплоты сгорания белка?
3. Рассчитайте Дг//° для реакции 2NO(r) + O2(r) = 2NO2(r), используя таб-
личные данные по теплотам образования веществ.
4. Рассчитайте &ГН° гидратации хлорида кальция до гексагидрата, используя
табличные данные по теплотам растворения веществ.
5. Рассчитайте ДГЯ° биохимического брожения глюкозы
С6Н|2О6(к) = 2С2Н5ОН(г) + 2СО2(г)
используя табличные данные по теплотам сгорания веществ.
6. Рассчитайте Ду//° формальдегида, используя табличные данные по тепло-
там сгорания веществ.
7. Теплота плавления льда при 273 К составляет 6,03 кДж/моль. Рассчитайте
Д5“ плавления льда.
66
8. Рассчитайте ArG° реакции NH3+ H2O = NH4+0Н , используя табличные
данные.
9. Рассчитайте А//° и AG” растворения нитрата калия, используя табличные
данные по &fH° и A;G" гидратированных ионов (см. приложение 7). Какой
фактор — энергетический или энтропийный — определяет направление про-
цесса при стандартных условиях? Превышает ли растворимость калия нитра-
та 1 моль/л?
10. От каких факторов зависит числовое значение константы равновесия?
11. Влияет ли катализатор на положение равновесия? Зависит ли числовое зна-
чение константы равновесия от катализатора?
12. В каком направлении идут реакции при указанных концентрациях (моль/л):
а) Ва2+ + SO2~ = BaSO4 I;
1,05-Ю-5 1,05-Ю’5
б) [ZnBr4]2’ = Zn2+ + 4Br2’
0,1 0,1 0,1
Глава 4
Скорость химических реакций
4.1. ХИМИЧЕСКАЯ КИНЕТИКА В БИОЛОГИИ
И МЕДИЦИНЕ
Роль химической кинетики в существовании жизни наиболее отчет-
ливо выявляется в сравнении с термодинамикой. Рассмотрим несколько
химических реакций:
С6Н12О6(к) = 6Н2О(ж) + бС(графит); &rG° = -517 кДж/моль (1)
С6Н|2О6(к) + 6О2(г) = 6Н2О(ж) + 6СО2; ArG° =-2881 кДж/моль (2)
2Н2О2(ж) = 2Н2О(ж) + О2(г); ArG° =-240 кДж/моль (3)
2ОН(г) = 2Н2О2(ж); ArG° =-188 кДж/моль (4)
Все они имеют большие отрицательные значения ArG°, и следова-
тельно, протекают самопроизвольно. Но действительно ли они протека-
ют? Реакция (1) может служить упрощенной моделью разложения рас-
тительных остатков с образованием угля. Она протекает в течение тысяч
или миллионов лет. Реакция (2) при обычной температуре практически не
идет. При хранении глюкозы или сахара не требуется защиты от кисло-
рода воздуха. Но при высокой температуре, а также в растворенном со-
стоянии в клетках с участием ферментов глюкоза достаточно быстро
окисляется. В организме человека за сутки окисляется около 150 г глюко-
зы. Перекись водорода непрерывно разлагается по реакции (3), но в рас-
творах без примесей соединений металлов и без воздействия света она
сохраняется довольно долго. Наконец, реакция (4), в которой участвуют
так называемые свободные радикалы, протекает настолько быстро, что
соединение ОН невозможно получить в виде индивидуального вещества.
В приведенных примерах выявляется сущность кинетического факто-
ра химических процессов. Под ним подразумевается возможность сущест-
вования систем в термодинамически неустойчивых состояниях скорость
протекающих в них процессов и методы их ускорения или замедления.
Всем, как правило, понятно большое значение факторов воздействия
на скорости реакций в деятельности человека: ускорение химических
процессов в промышленности с применением катализаторов, высоких
давлений и температур; замедление процессов разложения пищевых про-
68
дуктов, лекарств, красителей при хранении и использовании и т. д. Одна-
ко наибольшее значение кинетический фактор имеет в самом существо-
вании жизни. В основу живой материи положены термодинамически не-
устойчивые органические вещества типа глюкозы: в силу неустойчивости
они способны к множеству различных превращений, но сами по себе эти
превращения протекают медленно и осуществляются только под контро-
лем ферментов с целесообразной для поддержания жизни скоростью. В
биологических процессах достигается согласованное протекание сотен
реакций (точно не подсчитано), а нарушение здоровья (как производного
от этих процессов) может быть результатом недостатка или избытка ка-
кого-нибудь одного фермента. Непосредственно медицинское значение
кинетического фактора состоит в обоснованном использовании различ-
ных средств, позволяющих поддерживать нормальную скорость биохи-
мических процессов, в понимании сущности многих видов патологии как
нарушения скоростей даже единичных из всего комплекса реакций, под-
держивающих жизнедеятельность.
4.2. ОПРЕДЕЛЕНИЕ КОНСТАНТ СКОРОСТИ
И КИНЕТИЧЕСКОГО ПОРЯДКА РЕАКЦИЙ
Кинетические характеристики реакций могут быть установлены
только экспериментальным путем, так как расчетные теоретические ме-
тоды слишком сложны и требуют огромной затраты времени даже для
тех простейших реакций, когда их можно осуществить. В то время как в
химической термодинамике используются табличные данные по энерге-
тике реакций образования и сгорания, позволяющие проводить расчеты д ля
всех остальных реакций, в химической кинетике нет и такой возможности.
Протекание химической реакции во времени может быть охаракте-
ризовано скоростью и периодом (временем) полупревращения.
Скорость реакции v определяется как производная концентрации по
времени:
Скорость, определенную таким образом, называют мгновенной, т. е. соот-
ветствующей данной концентрации в данный момент времени. Для уп-
рощения расчетов применяют также среднюю скорость:
_ Ас с, - с. ,.
и=±— = ±—-------L. (4.2)
Д/ t2-t}
Знак «+» берут при расчете по возрастающей концентрации продукта
реакции, а знак «-» — по убывающей концентрации исходного вещества.
Обычная единица измерения скорости — моль л ' с1.
69
Период полупревращения — это время, за которое концентрация ве-
щества уменьшается в 2 раза или вступает в реакцию половина исходного
количества вещества.
Для всякой химической реакции зависимость скорости от концен-
траций может быть представлена кинетическим уравнением типа:
и = *Пс"'(ХД (4-3)
где k — константа скорости', л, — порядок реакции по концентрации
/-компонента.
Константа скорости является характеристикой каждой реакции, за-
висящей от температуры и не зависящей от концентраций. Порядок реак-
ции, как видно из уравнения (4.3), это показатель степени, характери-
зующий наблюдаемую зависимость скорости от концентрации данного
вещества. Порядок реакции в элементарной (одностадийной) реакции
равен стехиометрическому коэффициенту. Сумма всех показателей сте-
пени называется порядком кинетического уравнения. Компоненты X,—
это вещества, участвующие в реакции. В их число могут входить и ката-
лизаторы. При этом следует иметь в виду, что концентрации реагентов в
ходе реакции убывают, а концентрация катализатора остается постоянной.
Экспериментальное определение кинетических характеристик реак-
ций основано на получении кинетических кривых (рис. 4.1), т. е. зависи-
мостей концентраций реагирующих веществ или продуктов реакции от
времени. Для этого применяются всевозможные прямые и косвенные
методы определения концентраций: химический анализ (только для мед-
ленных реакций), электрическая проводимость, поглощение света и дру-
гих видов электромагнитного излучения, изменение давления (для газо-
вых реакций) и пр. Для последующих расчетов необходим материал, со-
держащий кинетические кривые при разных начальных концентрациях
реагирующих веществ.
Рис. 4.1. Кинетические кривые:
1 — исходное вещество; 2 — продукт реакции; 3 —
промежуточное вещество
Одним из основных
принципов при изучении все-
возможных зависимостей яв-
ляется создание таких условий
эксперимента, при которых
так или иначе стабилизируют-
ся прочие переменные вели-
чины. Например, если изуча-
ется зависимость скорости
реакции от концентрации, то
при этом должна поддержи-
ваться постоянная температу-
ра. Но в химической реакции
одновременно изменяются во
70
времени концентрации двух или нескольких исходных веществ. Их кон-
центрации, кроме одной, намеченной для изучения, также должны быть
стабилизированы. Это достигается применением значительного избытка
всех веществ, кроме одного. Тогда их концентрации в ходе реакции из-
менятся незначительно, а вещество, взятое в недостатке, прореагирует
полностью. В результате опыта будет определен порядок реакции по
этому веществу.
Пример 4.1. Для изучения кинетики разложения перекиси водорода в при-
сутствии соли меди в растворе объемом 0,1 л измеряли объем выделившегося
кислорода:
/, с............. 0 90 180 270 360 оо
И(О2), мл (н. у.)... 0 28,9 44,7 57,9 67,2 89,6
Определите порядок реакции и рассчитайте константу скорости.
Решение. Согласно реакции разложения Н2О2 (с. 68), количество вещества
разложившейся Н2О2 равно удвоенному количеству вещества образовавшегося
кислорода, а начальное количество равно удвоенному общему количеству кисло-
рода. Исходя из этого проводим вычисления и записываем результаты следую-
щим образом:
Г, С 0 90 180 270 360 ОО
И(О2), мл (н. у.)... 0 28,9 44,7 57,9 67,2 89,6
и(О2)-103, моль ... 0 1,29 2,00 2,58 3,00 4,00
Ди(Н2О2)-Ю3, моль
(прореагировало). 0 -2,58 -4,00 -5,17 -5,99 -8,00
и(Н2О2)Ю3, моль
(остаток)........ 8,00 5,66 4,00 2,83 2,01 0
с(Н2О2), моль/л... 0,080 0,0566 0,0400 0,0283 0,0201 0
Эти данные показывают, что за первые 180 с и за следующие 180 с концен-
трация перекиси водорода уменьшалась в 2 раза. Отсюда следует вывод, что пе-
риод полупревращения не зависит от концентрации, и что это реакция 1-го по-
рядка. Вычисляем константу скорости:
* = 1!!?. = 1111 = 3,8510’3 с1.
/1/2 180
Кинетические уравнения сложных реакций — последовательных,
параллельных, последовательно-параллельных и др. — могут быть очень
разнообразны, но при экспериментальном изучении в условиях избытка
одного или двух из реагирующих веществ, реакция наиболее часто идет
по уравнению 1-, 2- и 0-го порядка. В табл. 4.1 приведены основные све-
дения об этих реакциях.
71
Таблица 4.1. Кинетические уравнения 1-, 2- и 0-го порядка
О Обычная Зависимость Зависимость Функция кон-
* X 3 О единица концентрации периода центрации,
S о U С о. у <и х X н ® и Св X сх X >• измерения константы скорости от времени полупревращения от начальной концентрации линейно зависящая от времени (см. колонку 4)
1 v = кс с-' 1п с = In с0 - kt In 2 /|/2“ к Inc
2 v = kc2 л-моль^с"1 11, с со 1 '1/2=-7— кс0 2 с
0 v=k моль-л^’с”1 с = с0 - kt tv2=^k с
На основе уравнений, приведенных в табл. 4.2, решаются различные
расчетные задачи. Рассмотрение данных табл. 4.1 помогает также понять
общий подход к определению порядка реакции. Получив эксперимен-
тальным путем зависимости концентрации от времени, следует построить
ее график; если это оказалась не прямая линия (рис. 4.2, а), то данная ре-
акция не нулевого порядка. Тогда следует построить график зависимости
In с от времени. Если получена прямая линия (рис. 4.2, б), то реакция
идет по 1-му порядку, если нет, то строят график зависимости 1/с от вре-
мени. Зависимость в виде прямой линии будет означать, что это реакция
2-го порядка. По тем же графикам определяются константы скорости.
Константы скорости и сами скорости практически всех реакций,
кроме ферментативных, увеличиваются при повышении температуры.
Это важный фактор, позволяющий выбирать для проведения реакции
оптимальную скорость. Количественными характеристиками зависимо-
сти скорости от температуры являются температурный коэффициент ско-
Рис. 4.2. Графическое определение порядка реакции:
а — 0-й порядок; б — 1-й порядок; в — 2-й порядок
72
роста у (приближенная, ориентировочная характеристика) и энергия ак-
тивации Еа (более точная характеристика).
Температурный коэффициент следующим образом связан со скоро-
стями реакции г । v2, при температурах Tt и Т2:
v
— = у 10 . (4.4)
V.
Энергия активации входит в уравнение Аррениуса и определяется в
простейшем варианте по константам скорости при двух разных темпера-
турах:
Я1п^-
= Р (4-5)
ITT" W
Связь между температурным коэффициентом скорости при темпера-
туре Т и энергией активации выражается уравнением
1пУг=^- (4.6)
Работа 4.1. Определение кинетических характеристик реакции
окисления ионов Г перекисью водорода
Цель работы. Ознакомиться в ходе самостоятельной учебно-иссле-
довательской работы с определением константы скорости, порядка и
энергии активации химической реакции.
Задание. Исследовать кинетику реакции окисления Г перекисью
водорода при двух температурах.
Оборудование. Секундомер; термометр; бюретка в штативе вместимостью
25 мл; воронка для заполнения бюретки; мерный цилиндр вместимостью 50 мл;
мерная пробирка вместимостью 10 мл; коническая колба вместимостью 250 мл;
водяная баня. На 4 рабочих места ставятся еще 2 бюретки вместимостью 25 мл.
Реактивы. Раствор иодида калия, с(К1) = 0,03 моль/л; серная кислота,
c(H2SO4) = 1 моль/л; раствор тиосульфата натрия, c(Na2S2O3) = 0,05 моль/л; рас-
твор перекиси водорода, с(Н2О2) = 0,15 моль/л; раствор молибдата аммония в
капельницах, (NH4)6Mo7O24, насыщенный и с концентрацией c((NH4)6Mo7O24) =
= 0,005 моль/л; раствор крахмала в капельницах.
Сущность работы. Перекись водорода в кислой среде медленно
окисляет ионы иода;
73
2Г + Н2О2 + 2Н+ -> 12 + 2Н2О
В реакции участвуют 3 вида частиц, и в реакционной смеси могут
изменяться концентрации всех этих частиц. Но кислота добавляется в
смесь в большом избытке, и поэтому с(Н+) может считаться постоянной.
Кроме того, в ходе опыта к смеси периодически добавляют тиосульфат
натрия, который реагирует с образующимся иодом, возвращая ионы Г в
исходное состояние:
I2+2S2O32~ = 2Г+84О2’
Поэтому концентрация Г также сохраняется практически постоян-
ной. Таким образом, переменными величинами остаются время t и кон-
центрация перекиси водорода. Подбирая далее кинетическое уравнение
для расчета константы скорости, определяем частный порядок реакции
по перекиси водорода и константу скорости. Эта константа зависит от
концентрации иодида калия и называется экспериментальной констан-
той скорости /с,КП. Для определения зависимости ^ксп от концентрации
Г следует поставить опыты при разных начальных концентрациях KI.
Это может быть сделано другими студентами по конкретному заданию
преподавателя. После этого обобщение данных, полученных всеми сту-
дентами группы, позволит вычислить истинную константу скорости.
Для определения энергии активации проводится опыт с тем же по
составу раствором при температуре на 10—12 градусов выше.
Реакция катализируется молибдатом аммония. Это используется для
быстрого доведения реакции до конца после проведения заданного числа
измерений. Если катализатор добавляют в смесь в очень малом количест-
ве, то можно количественно изучить его влияние на скорость реакции.
Выполнение эксперимента. Приготовление реакционной смеси.
Бюретку, стоящую в штативе на рабочем месте, заполняют раствором
тиосульфата натрия. Эта бюретка и коническая колба со смесью реаги-
рующих веществ являются основными инструментами работы. В мерный
цилиндр наливают от 20 до 50 мл раствора иодида калия (по указанию
преподавателя) и добавляют дистиллированную воду до общего объема
50 мл (если взято 50 мл раствора KI, то воду не добавляют). Раствор пе-
реносят в тщательно вымытую коническую колбу. Туда же добавляют
5 мл серной кислоты из мерной пробирки, 4—5 капель крахмала и ровно
1 мл тиосульфата натрия из бюретки. Проверяют работу секундомера.
Для начала реакции остается добавить только перекись водорода.
Проведение измерений. Из отдельной бюретки к содержимому колбы
добавляют 5 мл раствора перекиси водорода, энергично перемешивают и
ставят под бюреткой с тиосульфатом натрия. Реакция началась. Однако
для точного определения нулевого времени реакции секундомер вклю-
чают в момент окрашивания раствора в синий цвет. В этот момент пол-
74
ностью прореагировал с иодом тиосульфат натрия, содержавшийся в 1 мл
добавленного из бюретки раствора. Не теряя времени, из бюретки добав-
ляют еще 1,0 мл раствора тиосульфата натрия и перемешивают. Окраска
исчезает. Продолжают наблюдение за раствором и записывают показание
секундомера в момент следующего появления окраски. Секундомер при
этом рекомендуется не держать в руках, чтобы от неожиданности его не
выключить. Опять добавляют 1,0 мл раствора и повторяют все действия.
Следует произвести не менее 5 отсчетов по секундомеру. После этого
добавляют 3—5 капель концентрированного раствора катализатора и до-
титровывают содержимое колбы тиосульфатом натрия до прекращения
появления синей окраски. Записывают окончательное показание бюрет-
ки, обозначаемое как Ко. От начала опыта и до последнего отсчета
раствор в бюретку не подливают!
По ходу опыта результаты измерений вносят в таблицу по форме:
Объем раствора И, NajSjOj, вступившего в реакцию к моменту времени t, мл Моменты появления окраски, t, 3 t Приме- чание
По секундо- меру Перевод в секунды
1 2 3 ит. д. Го 0 0
Условия проведения опыта: t °C = ..., с(К1) = ..., с^Н4) = ..., сьСНгОг) =
Проведение опыта при повышенной температуре. Изучение зави-
симости скорости реакции от температуры сводится к проведению опыта
не менее, чем при двух разных температурах. В соответствии с правилом
Вант-Гоффа, достаточное изменение скорости реакции происходит при
повышении температуры на -10 градусов.
Готовят такую же смесь веществ, как в первом опыте. Перед добав-
лением перекиси водорода колбу помещают в водяную баню, нагретую
до температуры на 2—3 градуса выше, чем намечено для проведения
опыта. Нагреватель включают и выключают, не давая водяной бане силь-
но нагреваться. В колбу опускают термометр, и когда он покажет задан-
ную температуру, добавляют перекись водорода. Измерения проводят так
же, как в первом опыте. Не допускают сильного отклонения температуры
от заданной величины, периодически вынимая колбу из бани. Результаты
записывают в таблицу, как показано выше.
75
Проведение опыта в присутствии катализатора. В смесь реаги-
рующих веществ до начала реакции добавляют от 1 до 4 капель разбав-
ленного раствора молибдата аммония в качестве катализатора. Измере-
ния проводят так же, как в первом опыте, однако следует учитывать, что
реакция идет быстрее, и надо успевать с добавлением 1 мл тиосульфата
натрия до выделения такого количества иода, которое не полностью про-
реагирует с этим тиосульфатом. Тогда синяя окраска не исчезнет. Резуль-
таты отсчетов вносят в таблицу, указав в условиях опыта, сколько добав-
лено катализатора.
Обработка результатов эксперимента. Экспериментальную кон-
станту скорости рассчитывают по кинетическому уравнению 1-го поряд-
ка. Для упрощения вычислений отношение концентраций под знаком
логарифма заменяют отношением объемов, получая формулу, приведен-
ную в таблице результатов эксперимента. Соответствие использованного
уравнения реальному порядку реакции обнаруживается постоянством
рассчитанных значений константы скорости с учетом неизбежного в экс-
перименте разброса результатов. Рассчитывают среднее значение кон-
станты скорости. Постоянную концентрацию Г, при которой проведен
опыт, рассчитывают по уравнению
eV
*Г)=17’
где с и V — концентрация и объем исходного раствора KI.
Для дальнейшей обработки результатов берут значения ^KCn, полу-
ченные другими студентами группы при других начальных условиях. Эти
данные вносят в таблицу по форме:
Опыт с(К1), моль/л Температура, К Концентрация катализатора, с((НН4)бМо7О24), моль/л ^ЭКСП» С
По данным таблицы строят график зависимости к,К1:п от концентра-
ции иодида калия. Если получается прямая линия, то определяют тангенс
угла наклона к оси с. Он равен константе скорости 2-го порядка:
к
L _ ЭКСП
~с(Г)’
Энергию активации рассчитывают по уравнению (4.5).
Зависимость Аэксп от концентрации катализатора также представляют
в виде графика. Концентрацию катализатора рассчитывают по формуле
76
Рис. 4.3. Характер зависимости константы
скорости от концентрации катализатора
V пс
c((NH4)6Mo7O24) = -Jy,
где Ик — объем одной капли
раствора катализатора; п —
число капель катализатора
с — концентрация исходного
раствора молибдата аммония;
V — общий объем приго-
товленной смеси.
При удовлетворитель-
ных результатах определения
Лэке,, получается прямая ли-
ния, показанная на рис 4.3.
Пересечение же с вертикальной осью дает отрезок, равный константе
скорости реакции без участия катализатора. Тангенс угла наклона прямой
равен константе скорости реакции с участием катализатора. Имевшаяся в
эксперименте концентрация катализатора очень мала, и кк оказывается
очень большой величиной. Из графика следует также, что одновременно
протекают каталитическая и не каталитическая реакции.
Делают вывод о порядке реакции по концентрациям реагирующих
веществ. Записывают окончательное кинетическое уравнение.
Вопросы к защите работы
1. По какому порядку протекала изученная вами реакция?
2. Каков период полупревращения в вашем опыте без катализатора?
3. Как вы поставили бы опыт для определения зависимости скорости реакции
от концентрации ионов водорода?
4. Совпадает ли порядок реакции по концентрации со стехиометрическим ко-
эффициентом в уравнении? Какой можно сделать вывод о механизме реакции?
5. Рассчитайте температурный коэффициент скорости при температуре опыта.
Работа -4.2. Определение порядка и константы скорости реакции
разложения перекиси водорода в присутствии
комплексоната железа(Ш)
Цель. Приобрести навыки определения кинетических характеристик
реакций.
Задание. Исследовать кинетику разложения перекиси водорода в
присутствии комплексоната железа(Ш).
77
Оборудование. Бюретка вместимостью 50 мл — 1 шт.; бюретки вместимо-
стью 25 мл — 2 шт.; микробюретка вместимостью 5 мл — 1 шт.; мерный цилиндр
вместимостью 50 мл — 1 шт.; мерные пробирки — 3 шт.; стакан вместимостью
250 мл — 1 шт.; колбочки для титрования вместимостью 50 мл — 6 шт.; стеклян-
ная палочка — 1 шт.; секундомер — 1 шт.
Реактивы. Раствор Н2О2, с(Н2О2) = 0,013 моль/л; раствор комплексоната
железа(Ш) (смесь равных объемов FeNH4(SO4)2 с концентрацией 0,025 моль/л,
этилендиаминтетраацетата натрия с концентрацией 0,05 моль/л и аммиака, до-
бавляемого до pH 8—9); 5%-й раствор KI; серная кислота, e(H2SO4) = 0,8 моль/л;
10%-й раствор (NH4)6Mo7O24; раствор Na2S2O3 c(Na2S2O3) = 0,05 моль/л; раствор
крахмала, аммиачно-аммонийный буферный раствор (смесь, содержащая 3,2
моль/л аммиака и 0,8 моль/л NH4CI); вода дистиллированная.
Сущность работы. Перекись водорода — термодинамически неус-
тойчивое вещество, медленно разлагающееся на воду и кислород (см.
выше). Реакция разложения ускоряется различными гомогенными и гете-
рогенными катализаторами: ионами многих металлов, оксидом мар-
ганца(1У), ферментом каталазой в клетках. В активном центре каталазы
имеется атом железа. Поэтому интересно изучить разложение перекиси
водорода, используя в качестве модели каталазы комплексное соедине-
ние железа. Например, каталитической активностью обладает этилендиа-
минтетраацетат железа (Ш), имеющий в щелочном растворе состав
[FeY(OH)]2', где Y4 — остаток этилендиаминтетрауксусной кислоты
(OOCCH2)2NCH2CH2N(CH2COO)2‘. Механизм разложения Н2О2 с уча-
стием этого катализатора включает присоединение пероксидной группы
НОО к железу с образованием аналога фермент-субстратного комплек-
-I
са. Железо, перенося электрон от одного атома О к другому, поперемен-
но окисляется и восстанавливается. Скорость реакции пропорциональна
как концентрации перекиси водорода, так и концентрации катализатора.
При повышении концентрации ионов Н* катализатор постепенно пере-
ходит в неактивную форму, вследствие чего скорость реакции обратно
пропорциональна концентрации Н+. Получается кинетическое уравнение
v = _dcQb9A = ic(H2O2)c(FeY(OH)2-)/c(H+),
d/
справедливость которого требуется подтвердить в ходе эксперимента. В
ходе отдельного опыта концентрации ионов водорода и катализатора не
изменяются, благодаря чему можно установить порядок реакции по Н2О2.
В опытах при разных концентрациях катализатора определяется зависи-
мость от последней. Измерения в ходе опыта основаны на периодическом
отборе проб и йодометрическом определении имеющейся перекиси водо-
рода (с. 71).
78
Выполнение эксперимента. В лабораторном журнале заготавлива-
ют таблицу для записи результатов опытов:
Проба Время взятия пробы, t Результат тит- рования, K(Na2S2O3), мл *эксп =-1п —, С'1 t V
ПО секундомеру перевод в секунды
0 1 2 0 0
Бюретки вместимостью 25 мл заполняют буферным раствором и рас-
твором комплексоната железа(Ш). Микробюретку вместимостью 5 мл за-
полняют раствором тиосульфата натрия. В шесть колб для титрования мер-
ными пробирками вносят по 2 мл серной кислоты и 1 мл раствора иодида
калия; из капельницы добавляют по 2 капли раствора молибдата аммония.
Для проведения кинетического исследования в стакан вносят 40 мл
раствора перекиси водорода из мерного цилиндра, 6,0 мл буферного рас-
твора и 4,0 мл раствора комплексоната железа (III) из бюреток. Могут
быть взяты и другие объемы катализатора от 3 до 8 мл по указанию пре-
подавателя. Раствор быстро перемешивают. Отмечают наблюдаемое из-
менение окраски. Переливают раствор в бюретку вместимостью 50 мл и
устанавливают уровень раствора на целое число миллилитров. После это-
го отмеривают в приготовленную колбу для титрования нулевую пробу
объемом 5,0 мл и включают секундомер. Далее с интервалом 5—7 мин в
остальные пять колб отмеривают такие же пробы, каждый раз записывая
время взятия пробы по секундомеру.
Во взятых пробах раствора выделившийся иод титруют раствором
тиосульфата натрия как в иодометрии (с. 47). Записывают затраченный
объем титранта в таблицу.
Обработка результатов эксперимента. Затраченный объем титран-
та пропорционален концентрации перекиси водорода в пробах. Его под-
ставляют в уравнение для расчета константы скорости 1-го порядка (по-
следняя колонка таблицы). Вычисляют среднее значение константы ско-
рости. Если другие студенты проводили опыт с разными объемами до-
бавленного катализатора, то можно построить график зависимости кон-
станты скорости от концентрации катализатора и вычислить константу
при с(катализатор) = 1 моль/л.
Вопросы к защите работы
1. Почему для разложения перекиси водорода необходим катализатор?
2. Какие наблюдения подтверждают участие комплексоната железа (III) в раз-
ложении перекиси водорода?
79
3. В чем смысл проведения реакции в буферной среде?
4. Как вы поставили бы эксперимент для выявления зависимости скорости раз-
ложения перекиси водорода от концентрации ионов Н+? От температуры?
5. Почему найденный на опыте порядок реакции не совпадает с коэффициен-
том в уравнении реакции разложения перекиси водорода?
Работа 4.3. Определение константы скорости и порядка
реакции гидролиза сахарозы
Цель работы. Приобрести навыки применения физико-химических
методов исследования для изучения кинетики реакций.
Задание. Изучить кинетику реакции гидролиза сахарозы поляримет-
рическим методом.
Оборудование. Поляриметр; электрическая водяная баня; термометр со
шкалой до 100 °C; коническая колба вместимостью 250 мл.
Реактивы. Растворы сахарозы разной концентрации; соляная кислота,
с(НС1) = 4 моль/л.
Сущность работы. Сахароза является природным оптически актив-
ным веществом (энантиомером), вращающим плоскость поляризации
луча света, проходящего через раствор. Продукты реакции гидролиза
Сахароза + Н2О = Глюкоза + Фруктоза
катализируемой ионами Н+, также являются энантоимерами, но с дру-
гими удельными углами вращения плоскости поляризации луча. Поэто-
му, измеряя углы вращения луча в процессе реакции, можно определить
изменение концентрации сахарозы и кинетические характеристики реак-
ции — константу скорости и порядок по сахарозе.
Поляриметр (рис. 4.4) представляет собой оптический прибор, в ко-
Рис. 4.4. Принципиальная схема поляриметра и изменения поляризации луча
при прохождении через него
80
тором не поляризованный луч (а) от источника 7 проходит через поляри-
зующую призму Николя 2 и на выходе из нее оказывается плоско поля-
ризованным (б). Далее при прохождении через кювету с раствором 3
плоскость поляризации может повернуться при наличии в растворе энан-
тиомера. На схеме (в) новая плоскость поляризации показана наклонной
стрелкой, а установка призмы вертикальной стрелкой. Из поля зрения луч
исчез. Чтобы он появился, надо повернуть вторую призму Николя (ана-
лизатор) 4 (схема г). Отсчет по шкале 5 укажет угол вращения плоскости
поляризации. Этот угол а пропорционален длине кюветы I и концентра-
ции раствора энантиомера с:
а = [а]/с,
где [а] — удельное вращение, характеризующее оптическую активность
энантиомера.
Выполнение эксперимента. В лабораторном журнале подготавли-
вают таблицу для записи экспериментальных данных:
Экспериментальные данные Результаты расчета
Время от начала реакции Д/ Угол вращения плоскости поля- ризации света а,, градусы -а„ lg(a, -а») 1 а,-«<г.
5 10 15 00 0 5 10
Проверяют нулевое положение поляриметра. Для этого (см. рис. 4.4)
выдвигают окуляр 6 и установкой лампы 1 на определенной высоте и
расстоянии от поляризатора добиваются максимальной резкости изобра-
жения в поляриметре. Затем осторожно, над столом, отвинчивают шту-
цер, прижимающий стекло к торцу поляриметрической кюветы, и спо-
ласкивают ее 2—3 раза водой. Устанавливают трубку вертикально и за-
полняют ее дистиллированной водой до образования выпуклого мениска
над торцом трубки. Сбоку надвигают покровное стекло так, чтобы в
трубке не появилось пузырьков воздуха. Завинчивают штуцер и фильтро-
вальной бумагой удаляют остатки жидкости снаружи. Заполненную
трубку устанавливают в ближайшее к окуляру положение и закрывают
кожух. Вращением анализатора совмещают нули шкалы и нониуса. Если
при этом наблюдается равномерное освещение всех трех полей зрения и
небольшой поворот анализатора вправо или влево вызывает неравномер-
81
Рис. 4.5. Поле зрения в поляриметре:
а — нулевое положение; б — крайнее левое положение; в — крайнее правое положение
ность освещения полей (рис 4.5), то прибор настроен на нуль и готов к
измерению углов вращения плоскости поляризации.
Приступают к проведению реакции гидролиза. В коническую колбу
отмеривают 15 мл раствора сахарозы, указанного преподавателем, и 15 мл
соляной кислоты. В момент смешивания растворов включают секундо-
мер. Кювету поляриметра (трубку) заполняют приготовленной смесью,
устанавливают в поляриметр и закрывают кожух. Колбу с оставшейся
смесью помещают в водяную баню и выдерживают при температуре не
выше 70 °C. Через 5 мин от начала реакции делают первый отсчет. Вра-
щением анализатора 4 добиваются равномерного освещения всех трех
полей и производят отсчет по шкале прибора и нониусу. Число целых
градусов считывают со шкалы против нуля нониуса. Затем по штриху
нониуса, совпадающего с градусным штрихом шкалы, отсчитывают с
нониуса доли градуса. Аналогичные отсчеты проводят через 10, 15, 25,
35, 45 мин от начала реакции.
Сделав запланированные отсчеты, измеряют угол вращения плоско-
сти поляризации после окончания реакции. Выдержанную в водяной бане
реакционную смесь охлаждают до комнатной температуры, заполняют
ею кювету и измеряют угол вращения ах, учитывая, что знак а, —
отрицательный. После окончания эксперимента кювету промывают во-
дой и обсушивают снаружи фильтровальной бумагой. Осветитель отклю-
чают от сети.
Обработка результатов эксперимента. Вычисляют функции, ука-
занные в трех колонках таблицы. Разность а, - а„ пропорциональна
концентрации сахарозы в данный момент времени. Поэтому данные
функции совпадают с функциями, приведенными в табл. 4.1. Построив
графики зависимости функций от времени, выявляют линейную функ-
цию, которая и соответствует порядку реакции. Тангенс угла наклона
прямой линии к оси времени равен константе скорости. Определяют кон-
станту скорости, произвольно взяв две точки на прямой линии:
z... Ж)-ДО
^2 — А
82
Делают вывод о порядке реакции гидролиза сахарозы и приводят
полученное значение константы скорости.
Вопросы к защите работы
1. Удельное вращение растворов сахарозы, глюкозы и фруктозы равно +65,55°,
+52,60°, -91,90°. Можно ли по этим цифрам ожидать, что в результате гид-
ролиза сахарозы изменится знак вращения?
2. Зачем часть приготовленной реакционной смеси выдерживали в водяной бане?
3. Как могла бы измениться скорость реакции при изменении концентрации
хлороводорода в приготовленной смеси?
4. Как изменилась бы скорость реакции при замене соляной кислоты на уксус-
ную той же концентрации?
5. Напишите полное кинетическое уравнение реакции, предполагая, что ско-
рость ее прямо пропорциональна концентрации ионов водорода.
Вопросы и задачи к гл. 4
1. Соответствует ли уравнение С2Н6 +ЗО2 = 2СО2 + ЗН2О механизму горения
этана? Ответ поясните.
2. Гомогенная реакция 2NO + Cl2 = 2NOCI протекает по простому механизму.
Как изменится скорость данной реакции, когда концентрация оксида азо-
та(П) уменьшится в 2 раза?
3. Скорость каких реакций сильнее зависит от температуры — тех, у которых
энергия активации небольшая, или наоборот?
4. В каком случае скорость одной и той же реакции в большей степени зависит
от температуры: при проведении ее с катализатором или без катализатора?
5. Рассчитайте скорость простой реакции
Реакция.................. А +В -> Продукты
Со, моль/л............ 0,03 0,02
в момент, когда концентрация вещества В уменьшится в 2 раза. Константа
скорости к = 0,0017 л/(моль с).
6. При температуре 20 °C две реакции имеют следующие кинетические харак-
теристики: 1) к = 0,0027 л/(моль с), Еа = 46 кДж/моль; 2) к = 0,0023 л/(моль с),
Еа = 49 кДж/моль. При определенном изменении температуры скорости ре-
акций оказались одинаковы (при прочих равных условиях). Были ли реаги-
рующие вещества нагреты или охлаждены?
7. Для реакции а-глюкоза -> Р-глюкоза, параметры уравнения Аррениуса сле-
дующие: А = 3,67-1014 с’1, Еа = 79,5 кДж/моль. Рассчитайте период полупре-
вращения при 0 °C.
8. Реакция второго порядка 2А -> Продукты протекала в эксперименте со ско-
ростью v = 0,0016 моль/(л с). Рассчитайте скорость реакции по истечении
двух периодов полупревращения.
Глава 5
Растворы
5.1. ЗНАЧЕНИЕ РАСТВОРОВ
Растворы представляют собой универсальные по распространенно-
сти в природе системы. Кроме растворов нет ничего. Не повторяя извест-
ного утверждения о том, что любой образец природной воды содержит
растворенные вещества, можно отметить, и что любые твердые минералы
содержат примеси, атомы и ионы которых распределены в массе минера-
ла как в среде, т. е. растворителе. Живые организмы состоят из раство-
ров, заключенных в клетках, и межклеточных растворов. Искусственно
приготовленные растворы применяют в лабораториях, в промышленном
производстве, в медицине. На чем основано такое широкое применение
растворов?
1. В жидких растворах химические реакции протекают в объеме рас-
твора, и поэтому все имеющееся вещество доступно для химического
превращения без дополнительного воздействия на систему. Для сравне-
ния отметим, что смесь твердых веществ для проведения реакции при-
шлось бы перетирать, смесь жидкости и твердого вещества — перемеши-
вать. В растворе частицы веществ (молекулы, ионы) достаточно свободно
движутся и, сталкиваясь, превращаются в частицы продуктов реакции.
Еще более свободно движутся частицы в газовых смесях. Однако боль-
шинство твердых веществ и многие жидкости гораздо легче перевести в
раствор, чем в газообразное состояние.
2. Растворы имеют собственные физические свойства, отличающие-
ся от свойств индивидуальных веществ, и зависящие от концентрации.
Например, температуры замерзания водных растворов понижены относи-
тельно температуры замерзания воды; растворы электролитов проводят
электрический ток, тогда как исходные вещества не проводят и т. д. На-
личие особых свойств у растворов известно и на множестве примеров
металлических сплавов.
3. Активность растворенного вещества можно контролировать, из-
меняя его концентрацию. Кислоты и щелочи, окислители (КМпО4) дейст-
вуют как на металлы, так и на кожные покровы в концентрированных
растворах сильнее, чем в разбавленных. Строгая дозировка необходима
при лекарственном лечении, так как терапевтический эффект достигается
при определенной концентрации лекарственной субстанции в организме.
84
4. Применение веществ в растворах удобно при отборе их в задан-
ных количествах для практического применения. Быстрее приготовить
100 порций раствора, содержащих по 1 г вещества, отмеривая одинако-
вые объемы раствора, чем взвесить на весах 100 навесок по 1 г.
5.2. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Некоторые физико-химические свойства растворов зависят от кон-
центрации кинетически независимых частиц растворенных веществ в
данном растворителе (среде) и не зависят от вида самих частиц. Такие
свойства называют коллигативными.
При рассмотрении коллигативных свойств растворов часто исполь-
зуется моляльная концентрация Ь (моль/кг), представляющая собой от-
ношение количества растворенного вещества X к массе растворителя S,
выраженной в кг:
Преимущество моляльной концентрации состоит в том, что она не
зависит от температуры. У разбавленных водных растворов молярная и
моляльная концентрации практически совпадают.
К коллигативным свойствам растворов относятся:
1. Пониженное давление р пара растворителя S над раствором неле-
тучего вещества X по сравнению с давлением пара р° над чистым раство-
рителем при данной температуре.
Ap(S) = p°(S)x(X), (5.1)
где Ap(S) — понижение давления пара растворителя; х(Х) — молярная
доля растворенного вещества.
2. Пониженная температура замерзания раствора Т, по сравнению с
чистым растворителем:
ДГ3 = TJS) - Т3(р - р) = К^Ь^. (5.2)
3. Повышенная температура кипения Тк раствора по сравнению с
чистым растворителем:
A?;=T,(p-p)-7;(S) = £(S)d0CM. (5.3)
Уравнения (5.1)—(5.3) выражают закон Рауля. Коэффициенты X(S) и
£(S) являются постоянными величинами данного растворителя — крио-
скопическая и эбулиоскопическая постоянные (см. табл. 13 приложения).
Концентрация Ьжы носит название осмоляльность. Для разбавленного
раствора неэлектролита X осмоляльность равна моляльности: = Ь(Х).
85
Рис. 5.1. Изменение химического потен-
циала вещества S (линия /) и S как рас-
творителя (линия 2) при повышении
температуры
Для разбавленного раствора элек-
тролита осмоляльность равна
произведению моляльной кон-
центрации на изотонический ко-
эффициент /, показывающий, во
сколько раз истинное число час-
тиц вещества больше, чем число
структурных единиц X вследст-
вие диссоциации: bxtt = ib(X).
Для раствора сложного состава,
как например плазма крови, ос-
моляльность вычисляют на осно-
ве измерения физико-химических
свойств. Так, определив пониже-
ние температуры замерзания плазмы, находят
^осм
по формуле
b
X(S)
Она является суммой вкладов всех видов кинетически независимых
частиц в растворе.
Перечисленные свойства являются следствием второго начала тер-
модинамики. Рассмотрим изменение химического потенциала ц (энергия
Гиббса 1 моль вещества) растворителя S при повышении температуры
(рис. 5.1). В соответствии с тождеством
G = //-7S(Sip)
химический потенциал уменьшается до точки плавления. При переходе в
жидкость увеличивается энтропия вещества. Поэтому при дальнейшем
нагревании жидкости уменьшение химического потенциала характеризу-
ется большей крутизной:
G = Н-TS(SX), S(S,)>S(S4>).
При достижении нормальной температуры кипения (р = 101,3 кПа) жид-
кость превращается в пар, и энтропия снова резко увеличивается. Дальней-
шее уменьшение химического потенциала идет с еще большей крутизной:
G = H - TS(ST), S(Sr) > S(SM).
Если жидкость S содержит растворенные вещества, то ее молярная доля
меньше 1, и химический потенциал понижен в соответствии с уравнением
ц = ц° + RT In x(S).
Химический потенциал жидкости в растворе изображается линией 2,
которая пересекается с отрезками для кристаллического и газообразного
86
вещества в точках, соответствующих более низкой и более высокой тем-
пературе. Следовательно, температура замерзания раствора понижена, а
температура кипения повышена по сравнению с чистой жидкостью. С
повышением концентрации растворенных веществ химический потенци-
ал растворителя S продолжал бы понижаться, а АГ, и ДГК увеличиваться.
Понижение химического потенциала растворителя в растворе влечет за
собой также и понижение давления насыщенного пара растворителя S
над раствором.
К коллигативным свойствам растворов относится и осмотическое дав-
ление, которое устанавливается при достижении осмотического равновесия
между раствором и чистым растворителем, разделенными полупроницаемой
мембраной. Для осмотического давления разбавленного раствора расчетная
формула аналогична уравнению состояния идеального газа:
л = ^29.RT = c(X)RT. (5.4)
Под веществом X в формуле (5.4) подразумевается неэлектролит. В об-
щем случае в формулу для осмотического давления входит осмолярность
с0СМ, которая в случае электролита равна произведению концентрации на
изотонический коэффициент:
= /с(Х).
В случае раствора сложного состава осмолярность вычисляют по резуль-
татам определения осмотического давления или других коллигативных
свойств:
я
с =-----
осм *
Пример 5.1. Плазма крови начинает замерзать при температуре 272,41 К
(-0,59 °C), т. е. ДГ3 = 0,59 К. Какова осмоляльность плазмы и каково ее осмотиче-
ское давление при температуре 310 К (37 °C)?
Решение. Из формулы (5.2) получаем:
Сосм = АГ3/Х(Н2О) = 0,59 К/ 1,86 К кг моль’1 = 0,32 моль/кг.
Учитывая, что для разбавленных водных растворов молярная и моляльная
концентрации численно почти совпадают, будем считать, что сж<1 ® Ьжи.
п = cXMRT = 8,31—Па—310 КО,32 моль/л = 820 кПа.
моль-К
Работа 5.1. Определение температуры замерзания раствора
неизвестного вещества и расчет его молярной массы
Цель. Научиться проводить криометрические измерения на раство-
рах не электролитов и электролитов.
87
Задание 1. Определить температуру замерзания раствора неизвест-
ного вещества, но с известной массовой долей, по указанию преподавателя.
2. Определить изотонический коэффициент раствора соли натрия (также
по указанию преподавателя).
Оборудование. Криометр; дифференциальный термометр Бекмана; химиче-
ский термометр.
Реактивы. Исследуемые растворы глюкозы, мочевины, хлорида натрия и
сульфата натрия с разными массовыми долями; хлорид натрия технический; вода
дистиллированная, лед или снег.
Сущность работы. Производится охлаждение заданных растворов
до начала образования кристаллов воды (льда). Соответствующая темпе-
ратура называется температурой замерзания. Измерение температуры
производится термометром Беркмана, показания которого зависят от
предварительной настройки. Поэтому кроме измерения температуры за-
мерзания раствора необходимо определить и температуру замерзания
чистой воды при той же настройке термометра. По полученным данным
вычисляется понижение температуры замерзания
дт3 =т;(н2о)-7;(р-р),
где Тэ — условная температура замерзания при данной настройке термо-
метра. При этом ДГ, от настройки термометра не зависит. По полученному
значению рассчитывают моляльную концентрацию (осмоляльность) и дру-
гие величины, которые с ней связаны: осмотическое давление, молярную
массу растворенного вещества, изотонический коэффициент электролита.
Выполнение эксперимента. Получают у преподавателя задание на
определение температуры замерзания одного из имеющихся в лаборато-
рии растворов с указанной на этикетке массовой долей. Лабораторный
журнал подготавливают для записи результатов измерений:
Измерения Температура замерзания — отсчеты по шкале дифференциального термометра
Вода* Раствор с массовой долей...
1 2 3 Среднее
* Криометрическая постоянная...
Внутренний сосуд криометра 1 (рис. 5.2) ополаскивают и заполняют
дистиллированной водой приблизительно на 1/3 высоты. Важно, чтобы
при установке дифференциального термометра с большим резервуаром
ртути, он весь был погружен в воду. Внешний сосуд криостата 4
88
заполняют толченым льдом, добавляют 40—50 г
технической соли, доливают воду до всплывания
льда и перемешивают. Температура смеси
должна быть около -5---6 °C. Сосуд с дистил-
лированной водой помещают в криостат и неко-
торое время охлаждают его, но не до замерза-
ния. Теперь можно установить термометр Бек-
мана. Это точный измерительный прибор с
большим резервуаром ртути, благодаря чему по
шкале можно отсчитывать сотые доли градуса.
При этом на шкале термометра укладывается
интервал лишь в 6°. Поэтому предусмотрена
настройка термометра на рабочий интервал пу-
тем переливания ртути из нижнего резервуара в
небольшой верхний резервуар. В нашем случае в
пределах шкалы должен оказаться интервал от 0
до -6 °C. Термометр уже заранее настроен. Его
необходимо переносить без сотрясения и не на-
клоняя, чтобы из капилляра в верхний резервуар
Рис. 5.2. Схема прибора
для криометрических из-
мерений
не упала капелька ртути. Это может произойти, когда термометр еще не
охлажден. Устанавливая термометр, убеждаются в правильности погру-
жения резервуара в воду: он не должен выступать из воды и касаться сте-
нок сосуда. Начинают непрерывное перемешивание жидкости проволоч-
ной мешалкой и наблюдают за показаниями термометра. Сначала в ка-
пилляр уходит вся капелька ртути. Потом столбик ртути быстро опуска-
ется, верх его доходит до шкалы и движется вдоль нее. Вода в сосуде
неизбежно переохлаждается ниже 0 °C. В момент начала образования
льда происходит резкий скачок температуры, после чего она стабилизи-
руется (рис. 5.3).
Идет процесс замерзания воды при постоянной температуре. Запи-
сывают показание термометра. Сосуд осторожно приподнимают и слегка
Время
Рис. 5.3. Кривые охлаждения воды (7) и
раствора (2)
нагревают рукой до исчезно-
вения льда. Повторяют опре-
деление температуры замер-
зания 2 раза. После этого вы-
нимают термометр, выливают
воду, ополаскивают сосуд
заданным раствором и нали-
вают раствора столько же,
сколько было воды. Жела-
тельно, чтобы раствор заранее
был охлажден во льду. По-
вторяют определение темпе-
89
ратуры замерзания. При работе с раствором особенно важно непрерывное
интенсивное перемешивание, препятствующее сильному переохлажде-
нию жидкости. Дело в том, что по мере вымерзания воды из раствора,
концентрация последнего увеличивается, а температура замерзания до-
полнительно понижается (см. рис. 5.3). Поэтому наиболее точный ре-
зультат определения температуры замерзания получается при минималь-
ном количестве выделившегося льда. Увидев, что начался резкий скачок
температуры, записывают самое высокое показание по шкале термомет-
ра. Измерение повторяют еще 2 раза. После этого вынимают термометр
из криостата и сдают его лаборанту. В другом варианте задания проводят
определение температуры замерзания раствора электролита по такой же
методике.
Обработка результатов эксперимента. Вычисляют среднее значе-
ние ДГ,. Рассчитывают осмоляльность, которая в данном случае (одно
растворенное вещество) равна моляльной концентрации
*осм=й(Х) = дт;/х(н2о).
Далее вычисляют молярную массу вещества:
6(Х)(100-со)'
Делают вывод, какое вещество содержалось в растворе — мочевина
или глюкоза. Вычисляют относительную ошибку опыта.
Если было проведено определение ДГ, раствора электролита с из-
вестной концентрацией, то осмоляльность раствора
где i — изотонический коэффициент. Зная 6(Х), вычисляют изотониче-
ский коэффициент и сравнивают его с ожидаемым предельным значени-
ем для данного электролита.
Вопросы к защите работы
1. Рассчитайте осмотическое давление исследованного раствора при 37 °C,
считая cxb.
2. Приведите примеры растворов, для которых изотонический коэффициент
может иметь максимальное значение, равное 2 и 3.
3. При какой концентрации раствор глюкозы был бы изотоничен исследован-
ному раствору электролита?
4. Почему разброс результатов параллельных определений ДГ3 раствора ока-
зался больше, чем разброс определений для воды?
5. Почему при замерзании переохлажденной воды наблюдается скачок темпе-
ратуры?
90
Работа 5.2. Наблюдение явлений плазмолиза и гемолиза
эритроцитов
Цель. Изучить влияние концентрации веществ в окружающей среде на
состояние эритроцитов и объяснить его на основе осмотического давления.
Задание. Изучить состояние эритроцитов в разбавленном растворе,
изотоническом растворе и 4%-м растворе хлорида натрия.
Оборудование. Микроскоп; штатив с пробирками; микропипетки вместимо-
стью 5 и 1 мл; предметные и покровные стекла.
Реактивы. Донорская кровь; водные растворы хлорида натрия с массовыми
долями 0,25,0,9 и 4%.
Сущность работы. Мембраны клеток обладают избирательной про-
ницаемостью. В солевых растворах мембрана эритроцита проницаема в
основном только для молекул воды и не проницаема для ионов солей.
Если эритроцит поместить в раствор соли, где концентрация ионов
меньше, чем концентрация содержимого эритроцита (гипотонический
раствор), то вода будет в большей степени проникать в эритроцит. Эрит-
роцит разбухнет, а при значительной разнице концентраций мембрана
лопнет. Это явление называется гемолизом эритроцитов. В гипертониче-
ских растворах происходит обратный процесс — сжатие эритроцитов за
счет потери ими воды. Это явление называется плазмолизом. В изотони-
ческих растворах изменения формы эритроцитов не происходит. Изото-
ническим раствором по отношению к плазме крови является 0,9%-й рас-
твор хлорида натрия.
Выполнение эксперимента. В 3 пробирки вносят пипеткой по 3 мл
трех растворов хлорида натрия разных концентраций. В каждую пробирку
добавляют микропипеткой по 0,5 мл крови. Перемешивают стеклянной па-
лочкой. По одной капле каждой смеси наносят палочкой на предметные
стекла, закрывают покровными стеклами и изучают препараты под микро-
скопом. Зарисовывают форму эритроцитов в каждом случае. Если эритроци-
ты не наблюдаются, то это также отмечают в протоколе работы.
Обработка результатов эксперимента. Рассчитывают осмотиче-
ское давление примененных в работе растворов хлорида натрия при тем-
пературе опыта, и объясняют на этой основе наблюдаемые явления плаз-
молиза и гемолиза эритроцитов.
Делают вывод о значении явления осмоса для состояния клеток.
Вопросы к защите работы
1. В каком растворе наблюдалось осмотическое равновесие между эритроцита-
ми и средой?
2. Зависит ли осмотическое давление от природы растворенного вещества?
91
3. Приведите примеры природных осмотических явлений.
4. Можно ли оценить осмотическое давление раствора по температуре его за-
мерзания (кипения)?
5. Почему в 4 %-м растворе хлорида натрия эритроциты не наблюдались?
Вопросы и задачи к гл. 5
1. Рассчитайте молярную концентрацию изотонического раствора хлорида на-
трия, приняв для плазмы крови с0СМ = 0,32 моль/л и i = 1,92.
2. Какое из трех утверждений верно: 5 %-й раствор глюкозы по отношению к
5%-му раствору сахарозы является: а) изотоническим; б) гипотоническим; в)
гипертоническим?
3. Какое из четырех утверждений верно: при одинаковой концентрации и тем-
пературе максимальное осмотическое давление имеет разбавленный раствор:
а) хлорида натрия; б) хлорида калия; в) хлорида кальция; г) глюкозы?
4. В физиологических экспериментах и клинической практике широко исполь-
зуют физиологический раствор Тироде, который имеет состав (в г/л раство-
ра): хлорида натрия 8,0; хлорида калия 0,2; хлорида кальция 0,2; гидрокарбо-
ната натрия 0,1; хлорида магния 0,1; гидрофосфата натрия 0,05; глюкозы 1,0.
Рассчитайте осмотическое давление этого раствора при 37 °C (310 К). Плот-
ность раствора -1 г/мл.
5. Концентрация хлорида натрия в среде, окружающей клетку, при которой
начинается гемолиз, является мерой осмотической стойкости (резистентно-
сти) эритроцитов. У эритроцитов человека гемолиз начинается в 0,4%-ом
растворе хлорида натрия, а в 0,34%-ом растворе разрушаются все эритроци-
ты. Каково осмотическое давление этих растворов при 37 °C?
Глава 6
Основные типы равновесий
и процессов
Изменение химической природы реагирующих веществ в ходе хи-
мической реакции происходит в результате перераспределения электро-
нов внешних оболочек атомов, т. е. за счет переноса частиц от одного
реагента к другому. Такие частицы могут быть простейшими (электрон,
протон) или более сложными (атомно-молекулярными). В соответствии с
видом переносимых частиц рассматривают следующие основные типы
реакций в растворах:
1) протолитические реакции, суть которых заключается в переносе
протона от одних частиц к другим;
2) редокс-реакции, в ходе которых от одной частицы к другой пере-
носятся электроны, что вызывает изменение окислительно-восстанови-
тельных свойств реагирующих веществ;
3) реакции замещения лигандов, сопровождающиеся переносом
электронных пар и приводящие к образованию или разрушению ком-
плексных соединений;
4) гетерогенные реакции в растворах электролитов, т. е. реакции об-
разования осадков или их растворения.
6.1. ПРОТОЛИТИЧЕСКИЕ РАВНОВЕСИЯ И ПРОЦЕССЫ
Для описания реакций, сопровождающихся изменением кислотно-
основных свойств реагирующих веществ, пользуются преимущественно
протолитической теорией. В соответствии с положениями протолитиче-
ской теории, кислота—молекула или ион—донор протонов (НВ); основа-
ние—молекула или ион — акцептор протонов (В). Молекула и ион (или
два иона), отличающиеся по составу на один протон, называются сопря-
женной кислотно-основной парой. В водных растворах кислот и основа-
ний всегда имеются две сопряженные пары, одну из которых образует
растворитель. Равновесия, устанавливающиеся в растворах между кисло-
тами и сопряженными основаниями, называют протолитическими (ки-
слотно-основными). Понятия «кислота» и «основание» являются относи-
тельными, так как одни и те же объекты могут проявлять как кислотные,
так и основные свойства в зависимости от партнера по равновесию.
93
В дальнейшем любую кислоту будем обозначать буквой «а», а осно-
вание — «Ь». Кислотам «а» и основаниям «Ь» приписывают индекс «1»
или «2», при этом у основания и кислоты одной протолитической пары
индекс одинаковый. Если одну из протолитических пар образует вода, то
ей дается индекс «2»; в остальных случаях нумерация произвольная.
Рассмотрим примеры наиболее распространенных протолитических
реакций:
1) реакция ионизации кислоты в водном растворе:
СН3СООН + Н2О СН3СОО +Н3О+
Э| 62 Ь| Я2
2) реакция ионизации основания в водном растворе:
NH3+H2O # NH4++OH’
bl Я] 63
3) реакция автопротолиза (самоионизации) воды:
Н2О + Н2О # Н3О++ОН’
Ь| аг Э| Ь2
4) реакция нейтрализации между слабыми электролитами:
nh3+ch3cooh # nh;+ch,coo
b] а2 а, Ь2
5) реакция нейтрализации между сильными электролитами:
Н3О++ОН ->Н2О + Н2О
Э) Ьг Ь, аг
Частицы, способные к взаимодействию как с кислотами, так и с ос-
нованиями, называются амфолитами. Примеры реакций с участием ам-
фолитов:
NH2CH2COOH + OH“ # NH2CH2COO +Н2О
Hi Ь3 Ь| а3
NH2CH2COOH + H3O+ # +NH3CH2COOH + H2O
bi аг а, Ьг
Сила кислот определяется их способностью отдавать протон, а осно-
ваний — принимать его. Мерой этой способности служат, соответствен-
но, константа кислотности К, и константа основности Кь.
В водном растворе для произвольной кислоты НВ функцию основа-
ния выполняет вода:
НВ + Н2О->Н3О++В
Константа равновесия в этом случае будет иметь следующий вид:
94
С(В-)с(Н3ОЭ
‘ с(НВ)
Для многоосновных кислот Кл определяется по каждой ступени ио-
низации.
Для произвольного основания В в водном растворе функцию кисло-
ты выполняет вода:
В + Н2О-»НВ+ +ОН’
Выражение для константы основности Кь:
с(ОН”)с(НВ+)
Л. =--------------. (0.2)
ь с(В)
Константы кислотности и основности в сопряженной паре для водного
раствора связаны между собой:
(6.3)
Следовательно, чем сильнее кислота, тем слабее сопряженное ей ос-
нование, и наоборот. Для удобства расчетов и записи часто пользуются
не самими константами, а их показателями, т. е. десятичными логариф-
мами, взятыми со знаком минус:
р*а =-igKa; pKb =-ig*b.
Таким образом,
рА\ + рА\ = 14 (при 298 К) (6.4)
рА), и рА'ь называют силовыми показателями.
Протолитические равновесия смещены в сторону образования более
слабых кислот и оснований. Протолитическое равновесие можно рас-
сматривать как конкуренцию различных по силе оснований за протон.
Несколько одновременно существующих равновесий можно рассматри-
вать как простые (изолированные), если они независимы друг от друга,
т. е. не имеют общих частиц. Смещение положения равновесия одного из
них не влечет за собой изменения положения равновесия другого. Если
же в одновременно существующих равновесиях имеется одна частица
или несколько общих, то говорят о совмещенных (сопряженных, конку-
рирующих) равновесиях. Поскольку эти частицы могут принимать уча-
стие в нескольких равновесиях, ясно, что изолированность каждого из
них утрачивается. Изменение положения равновесия в одном из них вле-
чет за собой изменения и в других. В этом случае можно говорить об об-
щем равновесии и частных равновесиях. Процессы, развивающиеся в
системах, которые содержат одну или несколько общих частиц, конкури-
руют между собой. Так, в частности, более сильные электролиты подав-
ляют ионизацию более слабых электролитов.
95
Расчет pH водных растворов кислот, оснований и солей. Для
сильных кислот можно считать, что степень ионизации их в разбавлен
ных растворах равна 1, и тогда для одноосновных кислот
с(Н3О+) = с(НВ); pH = -lgc(HB) (6.5
Для сильных однокислотных оснований в разбавленных раствора:
рОН = - 1g с(В), следовательно:
pH = 14 + lgc(B) (6.6)
При расчете pH растворов слабых кислот и оснований необходимо
учитывать степень их ионизации.
Для раствора слабой кислоты:
c(H3O+) = -fc(HB). (6.7)
pH = 0,5(pKt - 1g с(НВ)). (6.8)
Для раствора слабого основания:
с(он) = 7адзУ; (6.9)
рОН = О,5(рЛ'ь - 1g с(В)).
или
pH = 14-0,5(p£b-lgc(B)). (6.10)
Водные растворы солей, образованных только сильными электроли-
тами, имеют pH 7. Водные растворы солей, образованных слабыми ки-
слотами и сильными основаниями, имеют щелочную среду. Расчет pH
раствора соли, гидролизующейся по аниону, проводят по формуле
pH = 7 + 0,5рХ, + 0,5 lgc(B' ), (6.11)
где с(В ) — концентрация аниона, численно равная или кратная концен-
трации соли.
Водные растворы солей, образованных сильными кислотами и сла-
быми основаниями, имеют кислую среду. Расчет pH раствора соли, гид-
ролизующейся по катиону, проводят по формуле
pH = 7-0,5pKb-0,51gc(HB+), (6.12)
где с(НВ+) — концентрация катиона, в том числе и гидратированного
иона металла.
Буферные системы. Буферная система — это равновесная система,
способная поддерживать примерно на постоянном уровне какой-либо
параметр при определенных внешних воздействиях. Протолитические
буферные системы поддерживают постоянство pH при добавлении не-
больших количеств кислот и оснований. Протолитические буферные сис-
96
темы состоят из слабой кислоты и сопряженного с ней основания (1-й
тип, например, ацетатная буферная система, состоящая из уксусной ки-
слоты и ацетата щелочного металла) или слабого основания и сопряжен-
ной с ним кислоты (2-й тип, например, аммиачная буферная система, со-
• стоящая из аммиака и соли аммония с сильной кислотой).
* Раствор, содержащий одну или несколько буферных систем, называ-
ется буферным раствором. Буферные растворы можно приготовить двумя
способами:
I 1) частичной нейтрализацией слабого электролита сильным:
СН3СООН (избыток) + NaOH; NH3 (избыток) + НС1
2) смешиванием растворов слабых электролитов с их солями (или
двух солей):
СНзСООН и NaCH3COO; NH3 и NH4C1; NaH2PO4 и Na2HPO4
Буферные растворы имеют две главные количественные характери-
стики — pH и буферную емкость 0. При выборе буферного раствора для
проведения анализа или эксперимента руководствуются необходимым
значением pH среды и способностью сохранять это значение pH при вне-
сении кислот или оснований. Если раствор содержит только одну буфер-
ную систему, то для расчета pH и 0 следует использовать отношение а и
сумму с концентраций компонентов буферной системы НВ/В (знаки за-
рядов частиц НВ и В для разных типов систем разные):
а = --б(--; с = с(В) + с(НВ).
с(НВ)
Тогда pH раствора, содержащего буферную систему, определяется
уравнением
PH=^+,gs <6,3)
или
pH = рХа + 1g а. (6.14)
Для ацетатного буфера с(В) = c(NaCH3COO); с(НВ) = с(СН3СООН);
для аммиачного буфера с(В) = c(NH3); с(НВ) = c(NH4C1). Для фосфатного
буфера, состоящего из кислых солей фосфорной кислоты, с(В) =
= с(НРО4 ); с(НВ) = с(Н2РО4).
Буферная емкость определяется как производная количества вещест-
ва сильной кислоты или щелочи, добавленных к 1 л буферного раствора,
по изменению pH:
4-366
97
Понятно, что чем больше количество кислоты или щелочи, вызы-
вающих одно и то же изменение pH, тем больше буферная емкость. Бу-
ферная емкость зависит не только от отношения концентраций компо-
нентов буферной системы, но и от их общей концентрации:
Р = 2,303с—(6.16)
(а + 1)2
Буферная емкость максимальна при а - 1 и будет тем больше,чем
больше суммарная концентрация компонентов буферного раствора при
постоянном соотношении их концентраций. При одинаковой суммарной
концентрации буферная емкость больше у того раствора, у которого
соотношение концентраций приближается к 1. При малых значениях п
буферная емкость одинакова как при добавлении кислоты, так и щелочи.
Практически к тем или иным растворам могут добавляться значительные
количества кислоты или щелочи. Тогда буферную емкость следует счи-
тать количеством вещества кислоты (емкость по кислоте ра) или щелочи
(емкость по основанию рь), вызывающее понижение/повышение pH на
единицу. Буферные емкости ра и рь — не равные друг другу величины,
определяются уравнениями
п 9а
Ра = С-3--------;
а2 + 11а + 10
(6.17)
(6.18)
(6.19)
„ - _____9а
Рь С10а2 +11а + 1
Если а превышает 1, то ра еще продолжает возрастать до а = 3,16.
Если а меньше 1, то рь продолжает возрастать до а = 0,316. Если величина
а меньше 0,1 или больше 10, то величины р, ра и рь быстро уменьшаются, и
раствор практически утрачивает буферное действие. Этим определяется
зона буферного действия. Для растворов неизвестного состава буферные
емкости ра и Рь определяют титрованием и проводят расчет по формуле
КДрН
где с(/Т) — молярная концентрация эквивалента титранта (НС1 или
КОН); И(Т) — объем титранта; ДрН — изменение pH буферного раствора в
процессе титрования; V — объем буферного раствора, взятый для анализа.
Главными буферными системами организма являются гидрокарбо-
натная (СО2 + H2CO3/NaHCO3 ), гемоглобиновая (протонированные и
депротонированные формы гемоглобина и оксигемоглобина), прочие
белковые системы, действующие преимущественно в плазме, фосфатные
системы (Н2РО4 /НРО4", а также включающие и органические фосфаты).
98
Работа 6.1. Определение pH раствора
фотоэлектроколориметрическим методом
Цель. Научиться определять pH растворов с помощью фотоэлектро-
колориметрического метода.
Оборудование. Фотоэлектроколориметры КФК-2 с набором кювет; пробирки;
стеклянные палочки; бюретки вместимостью 25 мл; воронки диаметром 30 мм;
мерные пипетки вместимостью 10 мл; мерные цилиндры.
Реактивы. Набор индикаторов по Михаэлису (а-динитрофенол, у-динитро-
фенол, и-нитрофенол, м-нитрофенол, фенолфталеин, ализариновый красный);
универсальная индикаторная бумага; раствор карбоната натрия с концентрацией
0,1 моль/л; исследуемые растворы; фильтровальная бумага.
Сущность работы. Сущность колориметрического метода заключа-
ется в использовании кислотно-основных индикаторов, представляющих
собой слабые кислоты или основания, изменяющие характер или интен-
сивность окраски в обратимых реакциях протонирования — депротони-
рования. У одноцветных индикаторов молекулярная форма бесцветна, а
ионная — окрашена. Пример одноцветного индикатора — л-нитрофенол:
ОН О
При прибавлении к водному раствору л-нитрофенола небольшого
количества сильной кислоты сопряженное основание (Ind ) переходит в
соответствующую бесцветную кислоту (Hind); интенсивность окраски
уменьшается или она исчезает вовсе. Наоборот, прибавление небольшого
количества сильного основания вызывает смещение равновесия в проти-
воположном направлении: концентрация окрашенной формы индикатора
(Ind“) возрастает, интенсивность окраски усиливается. Изменение соот-
ношения Hind и Ind“ сопровождается визуальными изменениями в опре-
деленном диапазоне значений pH, что позволяет судить о положении
равновесия и, следовательно, определять pH:
PH = pKa+lg-^l, (6.20)
c(HInd)
где р/^а — силовой показатель индикатора.
Отчетливые визуальные наблюдения и точные измерения pH воз-
можны только в том случае, если концентрация одной формы индикатора
99
превышает концентрацию другой формы не более, чем в 10 раз. Интервал
pH = рК, ± 1 называется зоной перехода окраски индикатора.
Сущность фотоэлектроколориметрического метода определения pH
заключается в измерении оптической плотности Ах испытуемого раство-
ра, в который добавлен индикатор, и оптической плотности щелочного
раствора Лтах, в котором индикатор полностью ионизирован и имеет мак-
симальную интенсивность окраски.
В соответствии с законом Бера:
А = кс1, (6.21)
где А — оптическая плотность раствора; с — молярная концентрация
окрашенного вещества; / — толщина поглощающего слоя (при использо-
вании одинаковых кювет 7 = const).
Выполнение эксперимента. Получают у преподавателя пробирку с
исследуемым раствором. На полоску универсальной индикаторной бума-
ги стеклянной палочкой наносят 1 каплю исследуемого раствора. Окра-
ску индикаторной бумаги сравнивают со стандартной шкалой pH. Ориен-
тировочное значение pH записывают в лабораторный журнал. Восполь-
зовавшись данными таблицы 6 приложения выбирают одноцветный ин-
дикатор из серии Михаэлиса, зона перехода окраски которого включает
ориентировочное значение pH.
За 15 мин до начала измерений фотоколориметр (см. рис 6.1) под-
ключают к электросети, открывают крышку кюветного отделения 7 и,
нажимая кнопку «Сеть» 8, включают прибор, при этом загорается инди-
каторная лампа 2. Поворотом ручки «Светофильтры» 7 устанавливают
необходимый светофильтр. Ручку чувствительности 5 устанавливают в
положение «7», отмеченное черным цветом. Ручку «Установка 100 гру-
бо» 4 переводят в крайнее левое положение.
После включения прибора готовят растворы для фотоколориметриро-
вания. Пробирки и кюветы перед проведением анализа тщательно моют и
Рис. 6.1. Общий вид колориметра КФК-2
ополаскивают дистилли-
рованной водой. Кюветы
можно брать только за те
грани, через которые при
работе фотометра не про-
ходит луч света.
В первую пробирку
с помощью пипетки от-
меривают 9,0 мл иссле-
дуемого раствора, а во
вторую пробирку добав-
ляют из бюретки 9,0 мл
раствора карбоната на-
100
трия. В обе пробирки добавляют точно (из бюретки) по 1,0 мл раствора
выбранного индикатора. Содержимое пробирок хорошо перемешивают
стеклянной палочкой.
Одну из кювет заполняют раствором из первой пробирки, предвари-
тельно ополоснув ее этим раствором, а другую кювету — дистиллиро-
ванной водой. Жидкости в кюветы наливают до метки. При необходимо-
сти внешние стенки кювет осушают фильтровальной бумагой.
Кювету с дистиллированной водой помещают в дальнее отделение
кюветодержателя, а кювету с исследуемым раствором — в ближнее отде-
ление. Рычаг смены кювет 6 должен находиться в положении «1». Крыш-
ку кюветного отделения закрывают и вращением ручек «Чувствитель-
ность», «Установка 100 грубо» и «Установка 100 точно» 3 устанавливают
стрелку микроамперметра 9 положение «0» по нижней шкале «Д». Пере-
мещают рычаг смены кювет 6 в положение «2» и записывают полученное
по нижней шкале значение оптической плотности в лабораторный жур-
нал. Измерение повторяют.
После окончания измерения оптической плотности исследуемого
раствора кювету с этим раствором извлекают из прибора, раствор выли-
вают, кювету промывают дистиллированной водой, ополаскивают рас-
твором из второй пробирки и заполняют этим же раствором. Кювету ста-
вят в ближнее отделение и измеряют оптическую плотность щелочного
раствора индикатора аналогично тому, как было описано выше.
По окончании измерений обе кюветы вынимают из прибора и моют
дистиллированной водой. Прибор выключают.
Обработка результатов эксперимента. Рассчитывают степень ио-
низации индикатора а в исследуемом растворе, для чего используют со-
отношение:
л
а = (6.22)
^макс
Для расчета pH используют следующее выражение:
pH = рК, + 1g—. (6.23)
1-а
У преподавателя узнают точное значение pH исследуемого раствора
и рассчитывают относительную ошибку эксперимента. В лабораторном
журнале отмечают возможные источники ошибок эксперимента.
Вопросы к защите работы
1. Объясните механизм действия одноцветного индикатора с позиций конку-
ренции протолитических процессов.
2. Объясните, почему для определения pH колориметрическим методом необходи-
мо измерять оптическую плотность двух растворов, содержащих индикатор.
101
Работа 6.2. Изучение простых и совмещенных
протолитических равновесий
Цель. Приобрести навыки химического эксперимента на примере
качественных опытов по равновесиям гидролиза и ионизации.
Оборудование. Набор пробирок в штативе; капельницы с растворами; пи-
петки глазные.
Реактивы. Растворы сульфита натрия, гидросульфита натрия, карбоната на-
трия, гидрокарбоната натрия, хлорида натрия, сульфата алюминия, ацетата аммо-
ния, уксусной кислоты, растворы метилового оранжевого и фенолфталеина; аце-
тат натрия кристаллический; универсальная индикаторная бумага.
Выполнение эксперимента. Опыт 1. Гидролитические равнове-
сия в растворах солей. С помощью универсальной индикаторной бумаги
определяют pH водных растворов Na2SO3, Na2CO3, NaHSO3, NaHCO3,
A12(SO4)3, NH4CH3COO, NaCl (концентрация каждого раствора равна
0,1 моль/л). Объясняют результаты наблюдений. Сравнивают степень
гидролиза карбонат- и сульфит-ионов; гидрокарбонат- и гидросульфит-
ионов; карбонат- и гидрокарбонат-ионов. Составляют ионные уравнения
гидролиза, рассчитывают степень гидролиза и pH растворов.
Опыт 2. Совместный гидролиз. В пробирку наливают 2 мл раство-
ра сульфата алюминия, после чего прибавляют по каплям раствор карбо-
ната натрия. В лабораторный журнал записывают наблюдения и объясне-
ния, сопровождая их уравнением реакции (в ионной форме).
Опыт 3. Влияние температуры на смещение равновесия гидролиза.
В пробирку наливают 2 мл раствора ацетата натрия, после чего прибав-
ляют 2 капли раствора фенолфталеина. Отмечают характер и интенсив-
ность окраски. Затем пробирку помещают в стакан с кипящей водой. От-
мечают изменение интенсивности окраски. В лабораторный журнал запи-
сывают наблюдения и объяснения, сопровождая их уравнением реакции
(в ионной форме).Указывают, экзо- или эндотермической является реак-
ция гидролиза ацетат-иона.
Опыт 4. Совмещенные протолитические равновесия в растворах
слабых кислот. В одну пробирку наливают 2 мл раствора карбоната на-
трия, а в другую — 2 мл раствора сульфита натрия. В каждую пробирку
добавляют по каплям по 1 мл уксусной кислоты. В лабораторный журнал
записывают наблюдения и объяснения, а также уравнения реакции в ион-
ной форме, принимая во внимание значения констант кислотности ук-
сусной кислоты, сернистой кислоты (по обеим ступеням) и угольной ки-
слоты (по обеим ступеням). Рассчитывают общую константу протолити-
ческого равновесия для каждого случая.
Опыт 5. Равновесие гидролиза и ионизации. В две пробирки нали-
вают по 5 мл раствора уксусной кислоты, затем в каждую пробирку до-
102
бавляют по 3 капли раствора метилового оранжевого. Отмечают интен-
сивность и характер окраски растворов. В одну из пробирок добавляют
кристаллический ацетат натрия, содержимое пробирки перемешивают
стеклянной палочкой до полного растворения добавленной соли. Отме-
чают изменение окраски. В лабораторный журнал записывают наблюде-
ния и объяснения, сопровождая их уравнением реакции (в ионной форме).
Вопросы к защите работы
1. Приведите по одному примеру простого и совмещенного протолитического
равновесия, укажите конкурирующие между собой частицы.
2. Какие из перечисленных солей будут подвергаться гидролизу: сульфат ка-
лия, сульфит калия, сульфид калия, сульфат аммония, сульфит аммония? На
одном из примеров покажите подробно причину протекания процесса.
3. Какая из солей будет подвергаться гидролизу в большей степени (при прочих
равных условиях): а) цианид калия или ацетат калия; б) хлорид аммония или
хлорид алюминия? Ответ поясните
Работа 6.3. Свойства буферных растворов
Цель. Научиться готовить буферные растворы и исследовать зави-
симость pH буферного раствора от концентраций и соотношения концен-
траций компонентов буферной системы.
Оборудование. Набор пробирок в штативе; бюретки вместимостью 25 мл;
воронки диаметром 30 мм; пипетки вместимостью 1 мл; стеклянные палочки;
капельницы с растворами; пипетки глазные.
Реактивы. Соляная кислота; растворы уксусной кислоты, гидроксида на-
трия, ацетата натрия (все по 0,1 моль/л); хлорида натрия 0,9 %-й, раствор лакмои-
да в этаноле.
Выполнение эксперимента. Опыт 1. Приготовление буферных
растворов с различным значением pH. Готовят серию буферных раство-
ров с разными соотношениями концентраций компонентов. Рассчитыва-
ют, какие объемы исходных растворов требуются для приготовления бу-
ферных растворов объемом по 10,0 мл с соотношением концентраций
соли (NaCHjCOO) и кислоты (СН3СООН): в пробирке 1 — 1:9; в пробир-
ке 2 — 1:1; в пробирке 3 — 9:1. Точные объемы растворов уксусной ки-
слоты и ацетата натрия отмеривают в пробирки из бюреток; содержимое
пробирок тщательно перемешивают стеклянной палочкой.
Затем готовят серию буферных растворов с тем же соотношением
концентраций соли и,кислоты, но с меньшей суммарной концентрацией
компонентов. Для этого пипеткой отбирают по 1,0 мл приготовленных
103
ранее растворов и к каждому добавляют по 8,0 мл дистиллированной во-
ды, после чего содержимое пробирок перемешивают. Таким образом, в
пробирках 1 и 4, 2 и 5, 3 и 6 находятся растворы с одинаковыми соотно-
шениями концентраций соли и кислоты, но растворы в пробирках 4, 5 и 6
являются разбавленными по сравнению с растворами в пробирках 1,2 и 3.
Во все пробирки добавляют по 5 капель раствора лакмоида, после
чего содержимое пробирок перемешивают. На белом фоне сравнивают
окраску растворов между собой: в пробирках 1—3; 1 и 4; 2 и 5; 3 и 6.
Рассчитывают pH приготовленных буферных растворов.
Результаты наблюдений и расчетов записывают по форме.
Пробирка с исходным буферным раство-
ром .................................... 1 2 3
c(NaCH3COO):c(CH3COOH).............
Цвет буферного раствора после добавле-
ния лакмоида.......................
pH исходного буферного раствора....
Пробирки с разбавленным буферным рас-
твором ............................ 4 5 6
c(CH3COONa):c(CH3COOH).............
Цвет разбавленного буферного раствора
после добавления лакмоида..........
pH разбавленного буферного раствора....
Опыт 2. Выяснение влияния добавления небольших количеств
сильных кислот и оснований на pH буферного раствора. В пробирках
1 и 2 готовят по 10 мл буферного раствора с соотношением концентрации
ацетата натрия и уксусной кислоты, равным 2:3, для чего предварительно
рассчитанные объемы растворов наливают из бюреток. В пробирки 3 и 4
отбирают с помощью пипетки по 10 мл физиологического раствора
(0,9 %-го раствора хлорида натрия). Ко всем растворам добавляют по 5
капель раствора лакмоида и содержимое пробирок перемешивают. На-
блюдаемую окраску записывают в таблицу. При необходимости окра-
ску физиологических растворов выравнивают, добавляя в пробирки 3
и 4 по каплям разбавленную соляную кислоту (с = 0,01 моль/л). После
каждой добавленной капли кислоты раствор перемешивают стеклян-
ной палочкой.
В пробирки 1 и 3 добавляют по 5 капель раствора гидроксида натрия
с концентрацией 0,1 моль/л. В пробирки 2 и 4 добавляют по 5 капель со-
ляной кислоты с концентрацией 0,1 моль/л. Все растворы перемешивают
и наблюдаемую окраску записывают в таблицу по форме:
104
Про- бирка Объект изучения Окраска рас- творов после добавления лакмоида +5 капель НС1, с = 0,1 моль/л +5 капель NaOH, с = 0,1 моль/л
1 Буферный раствор —
2 Буферный раствор —
3 Физиологический раствор • —
4 Физиологический раствор —
Выводы из опытов формулируют на основании наблюдений.
Вопросы к защите работы
1. Что называется буферной системой?
2. В чем заключается буферное действие?
3. Какие существуют способы приготовления буферных растворов?
4. Разберите на примере фосфатного буфера механизм его действия при добав-
лении небольших количеств НС1 и КОН.
5. Приведите примеры буферных систем, имеющих pH > 7 и pH < 7. Укажите
сопряженные протолитические пары.
6. Приведите три способа приготовления фосфатного буфера, содержащего
дигидрофосфат- и гидрофосфат-ионы.
Работа 6.4. Буферная емкость растворов
Цель. Научиться исследовать зависимость буферной емкости рас-
твора от разбавления и экспериментально определять буферную емкость
раствора по кислоте и основанию.
Оборудование. Набор пробирок в штативе; бюретки вместимостью 25 мл;
воронки диаметром 30 мл; цилиндры мерные; колбы конические вместимостью
50 мл; пипетки вместимостью 1 мл; стеклянные палочки; капельницы с раствора-
ми; пипетки глазные.
Реактивы. Соляная кислота, растворы уксусной кислоты, гидроксида на-
трия, ацетата натрия (все по 0,1 моль/л); раствор метилового оранжевого в этано-
ле; раствор метилового красного в этаноле.
Выполнение эксперимента. Опыт 1. Установление зависимости
буферной емкости раствора от разбавления. Готовят два буферных рас-
твора с одинаковым соотношением концентраций составляющих его
компонентов, но с разной суммарной концентрацией. Для этого в про-
105
бирке 1 готовят 10,0 мл буферного раствора с соотношением концентра-
ций ацетата натрия и уксусной кислоты, равным 1:9. Рассчитанные объе-
мы растворов отмеривают из бюреток. В пробирку 2 отбирают пипеткой
1,0 мл раствора из пробирки 1 и добавляют 8,0 мл дистиллированной во-
ды (точно), после чего раствор перемешивают. В обе пробирки добавля-
ют по 2 капли раствора метилового оранжевого. Наблюдаемую окраску
записывают в таблицу.
В обе пробирки добавляют по 5 капель раствора гидроксида натрия с
концентрацией 0,1 моль/л. Растворы перемешивают, наблюдаемую окра-
ску записывают в таблицу по форме:
Пробирка Объект исследования Окраска после добавления мети- лового оранжевого Окраска после добав- ления 5 капель рас- твора NaOH, (с = 0,1 моль/л)
1 Исходный бу- ферный раствор
2 Разбавленный буферный раствор
На основании наблюдений формулируют вывод.
Опыт 2. Определение буферной емкости раствора по кислоте и
основанию. В колбах 1 и 2 готовят по 10 мл испытуемого ацетатного бу-
ферного раствора с равными молярными концентрациями компонентов.
В колбах 3 и 4 готовят буферные растворы-свидетели с соотношением
концентраций соли и кислоты, равными 1:9 (в колбе 3) и 9:1 (в колбе 4).
Определяют буферную емкость по кислоте. В колбы 1 и 3 добавляют
по 5 капель раствора метилового оранжевого, растворы перемешивают.
Испытуемый раствор в колбе 1 титруют соляной кислотой до получения
окраски, одинаковой с окраской раствора-свидетеля (в колбе 3). Резуль-
таты титрования записывают в таблицу. Буферную емкость по кислоте
(Р„ моль/л) рассчитывают по формуле
К(НС1)с(НС1)
Р‘" ^₽.pAPH ’
где с(НС1) — молярная концентрация хлороводорода в титранте, моль/л;
И(НС1) — результат титрования, мл; Ибуфр.р — объем испытуемого бу-
ферного раствора, мл; ДрН — изменение pH испытуемого буферного рас-
твора в процессе добавления соляной кислоты; ДрН = ДрНиспр.р - ДрНсвид.
(Расчет pH см. в опыте 1 работы 6.3.)
Определяют буферную емкость по основанию. В колбы 2 и 4 добав-
ляют по 5 капель раствора метилового красного, растворы перемешива-
ют. Испытуемый раствор в колбе 2 титруют раствором гидроксида на-
106
трия до получения окраски, одинаковой с окраской раствора-свидетеля (в
колбе 4). Результаты титрования записывают в таблицу по форме:
Колба Содержи- мое колбы c(NaCH3COO) с(СН3СООН) pH до титро- вания Г тит- ранта pH после титрова- ния Р
1 Испытуе- мый раствор По кислоз 1:1 е (с метиле вым оранж евым)
2 Раствор- свидетель 1:9 — —
3 Испытуе- мый раствор По основа 1:1 нию (с мет ИЛОВЫМ кр£ юным)
4 Раствор- свидетель 9:1 — —
Буферную емкость по основанию рь рассчитывают по формуле
K(NaOH)c(NaOH)
^.„„ДрН
оуф р-р г
где c(NaOH) — молярная концентрация щелочи в титранте, моль/л;
K(NaOH) — результат титрования, мл; Кбуф.р-р — объем испытуемого
буферного раствора, мл; ДрН — изменение pH испытуемого буферно-
го раствора в процессе добавления раствора гидроксида натрия;
ЛрН = ДрН„.и„ - ДрН_Для исследуемого раствора рассчитывают
также буферную емкость по формулам (6.17) и (6.18).
Вопросы к защите работы
1. Что называют буферной емкостью раствора? От каких факторов она зависит?
2. Как экспериментально определяют буферную емкость?
3. Охарактеризуйте буферную емкость систем, функционирующих в живых
организмах.
6.2. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ И ПРОЦЕССЫ
При контакте малорастворимого вещества ионного типа (МХАУ) с во-
дой часть ионов переходит в жидкую фазу и наступает состояние равно-
107
весия (кинетическое условие: скорость растворения равна скорости оса-
ждения; термодинамическое условие: AG = 0). Раствор, находящийся в
равновесии с твердой фазой, состоящей из МхАу, называют насыщенным
относительно МХАГ
Процесс можно представить следующим образом:
МхАу(т) xM-’’+(aq) + yAx“(aq)
Константа равновесия этого процесса, называющаяся константой
растворимости Ks, имеет следующий вид:
*Х(МХА,) = а'(М'У(А-’)
(активности а твердых веществ, по определению, равны 1). Для разбав-
ленных растворов (а именно такими являются насыщенные растворы ма-
лорастворимых электролитов) можно считать, что ионная сила их на-
столько мала, что коэффициенты активности ионов равны 1, т. е. актив-
ности ионов равны их концентрациям, и константы растворимости можно
представить следующим образом:
KJ(MxA>,) = cx(M-y+)c>'(Ax'). (6.24)
Константы растворимости — справочные величины, табулируются
они обычно при температуре 298 К.
Пользуясь уравнением (6.24) можно рассчитать равновесную кон-
центрацию ионов в насыщенном растворе малорастворимого электроли-
та, например бинарного электролита МА:
с(М+) = с(А") = 7^7- (6.25)
Константы растворимости используются также для определения ус-
ловий образования и растворения осадков. Рассмотрим возможность об-
разования осадка МхАу ходе следующей реакции:
хМ?+(водн) + уАх~(водн) МхАу(т)
Обозначим, как это принято в термодинамике, произведение произ-
вольно выбранных активностей веществ, входящих в выражение кон-
станты равновесия, как Пс:
Пс= ах(М'+)аЧАх-).
Условием образования в системе осадка является неравенство
Пс>Л'„ (6.26)
т. е. осадок выпадает в том случае, если произведение концентраций ио-
нов электролита, в степенях, равных стехиометрическим коэффициентам,
108
будет больше константы растворимости. При Пс < Ks осадок в системе не
образуется, если же подобное выражение описывает состояние надоса-
дочной жидкости, то произойдет частичное растворение осадка. При Пс = Кг
система находится в равновесии (раствор насыщенный). Если в равно-
весную систему, содержащую в растворе ионы М^, А*~ и твердую фазу
MjAy, ввести электролит, имеющий в составе либо М^, либо А’'-, то это в
соответствии с принципом Ле Шателье приведет к образованию допол-
нительного количества осадка. Следовательно, присутствие одноименно-
го иона понижает растворимость малорастворимого электролита. Напри-
мер, если к насыщенному раствору BaSO4 добавить K2SO4, то раствор
становится пересыщенным (со временем некоторое количество сульфата
бария перейдет в состав твердой фазы).
В реальных системах редко встречаются простые гетерогенные
равновесия: присутствие в биологических жидкостях большого числа
ионов приводит к тому, что одновременно могут образовываться не-
сколько малорастворимых электролитов. Например, в системе присут-
ствуют анионы А“ и В“, которые с катионом М+ образуют малораство-
римые электролиты. Если электролиты однотипны и имеют примерно
одинаковые константы растворимости, то при равных концентрациях
А” и В” преобладания какого-либо одного процесса (образование МА
или МВ) не наблюдается. Если соединения различаются константами
растворимости, Ks (МА) > А\(МВ), то при равных концентрациях А" и
В' преимущественно будет образовываться менее растворимое соеди-
нение (МВ). Таким образом, конкуренцию за общий катион выигрыва-
ет тот анион, который с этим катионом образует менее растворимое
соединение. Аналогично протекают конкурирующие процессы за об-
щий анион.
Пример 6.1. Если в растворе присутствуют в равных концентрациях суль-
фат-ионы и карбонат-ионы, то при введении в него ионов кальция в осадок пере-
ходит в первую очередь карбонат кальция, так как /Сл(СаСО3) < K,(CaSO4).
Следовательно, в конкуренции за катион выигрывает карбонат-ион.
Пример 6.2. При введении фосфат-ионов в раствор, содержащий в равных
концентрациях ионы стронция и кальция, в первую очередь образуется твердая
фаза, состоящая из фосфата стронция, так как это соединение имеет меньшую
константу растворимости. Следовательно, в конкуренции за анион выигрывает
ион стронция.
Многие реакции, сопровождающиеся образованием осадка, исполь-
зуются в качественном анализе для разделения катионов и анионов на
аналитические группы и идентификации отдельных ионов.
109
Работа 6.5. Гетерогенные равновесия в растворах
электролитов
Цель. Получить системные знания по теории гетерогенных процес-
сов в приложении к биологическим системам; установить термодинами-
ческие условия образования и растворения твердой фазы.
Оборудование. Бюретки вместимостью 25 мл; измерительные пробирки;
штатив с пробирками; стеклянные палочки.
Реактивы. Растворы хлорида кальция (0,01 моль/л и 1 моль/л); сульфата на-
трия (0,01 моль/л и 1 моль/л); оксалата натрия (0,01 моль/л); нитрата свинца
(0,2 моль/л); хлорида натрия (0,2 моль/л и насыщенный); хлорида стронция
(0,5 моль/л); сульфата кальция (насыщенный); хлорида калия (0,5 моль/л); хлори-
да магния (0,5 моль/л); хлорида аммония (насыщенный); хлорида бария
(0,5 моль/л); сульфита натрия (0,5 моль/л); карбоната натрия (0,5 моль/л); гидро-
фосфата натрия (0,5 моль/л); тиосульфата натрия (0,5 моль/л); тетрабората натрия
(0,1 моль/л); 10%-й раствор аммиака; этанол; гексанитрокобальтат натрия.
Выполнение эксперимента. Опыт 1. Условия образования осад-
ков. В две пробирки наливают по 2 мл из бюретки раствора хлорида
кальция с концентрацией 0,01 моль/л. Из бюретки добавляют в одну из
пробирок 2 мл раствора оксалата натрия, в другую — сульфата натрия.
Концентрации обоих растворов равны также 0,01 моль/л. Наблюдения
записывают в таблицу по образцу:
Исходная концентрация
Са2+, моль/л
Исходная концентрация
аниона, моль/л
с2о2- -
SO2- —
Наблюдения
Опыт 2. Изучение влияния одноименного иона на растворимость
малорастворимого электролита. В пробирку вносят 3—4 капли раствора
нитрата свинца (с = 0,2 моль/л), добавляют несколько капель раствора
хлорида натрия (с = 0,2 моль/л) до образования осадка. К содержимому
пробирки приливают 1—2 мл дистиллированной воды до растворения
осадка, после чего прибавляют несколько капель насыщенного раствора
хлорида натрия.
Отмечают и объясняют изменения, происшедшие в пробирке.
Опыт 3. Изучение конкурирующих гетерогенных процессов. В
пробирку наливают 2 мл раствора хлорида стронция (с = 0,5 моль/л) и
2 мл насыщенного раствора сульфата кальция. Содержимое пробирки
нагревают почти до кипения, а затем оставляют на 10—15 мин, после
чего описывают происшедшие изменения. Наблюдения подтверждают
ПО
расчетами с использованием констант растворимости сульфатов строн-
ция и кальция.
Опыт 4. Условия смещения гетерогенных равновесий. Первона-
чально определяют отношение сульфата и карбоната бария к уксусной
кислоте. В две пробирки вносят по 5—6 капель раствора хлорида бария,
затем добавляют в одну пробирку раствор сульфата натрия, а в другую —
раствор карбоната натрия до образования осадков. К каждому из образо-
вавшихся осадков добавляют по 10—12 капель раствора уксусной кисло-
ты. Отмечают разницу в поведении образовавшихся малорастворимых
соединений бария по отношению к уксусной кислоте.
Осуществляют попытку перевода одного малорастворимого соеди-
нения в другое. В фарфоровой чашке получают осадок сульфата бария
смешиванием по 1 мл растворов сульфата натрия и хлорида бария (кон-
центрации обоих растворов равны примерно по 1 моль/л). Жидкость с
осадка осторожно сливают, а к осадку добавляют примерно 3—4 мл рас-
твора карбоната натрия с концентрацией 3 моль/л. Фарфоровую чашку
помещают на асбестовую сетку и содержимое чашки кипятят в течение 5
мин. После прекращения нагревания дают осесть твердой фазе, после
чего жидкость вновь сливают с осадка, а к нему добавляют опять 3—4 мл
раствора карбоната натрия. Описанную последовательность операций
повторяют не менее 4 раз. В последней порции сливаемой с осадка жид-
кости проверяют присутствие сульфат-ионов реакцией с хлоридом бария
в присутствии уксусной кислоты (белый осадок). Оставшийся в фарфо-
ровой чашке осадок проверяют на растворимость в уксусной кислоте.
Делают вывод о полноте перевода сульфата бария в карбонат бария. Объ-
ясняют, почему такой перевод стал возможным (приводят уравнение об-
менной реакции, сравнивают константы растворимости, поясняют влия-
ние условий опыта).
Опыт 5. Изучение зависимости последовательности выпадения
осадков от их констант растворимости. В пробирку вносят по 10 ка-
пель растворов сульфата натрия и хромата натрия; после перемешивания
к содержимому пробирки добавляют по каплям раствор нитрата свинца.
Отмечают изменения, происходящие в пробирке. Последовательность
выпадения осадков объясняют с помощью термодинамических данных.
Опыт 6. Изучение влияния природы растворителя на раствори-
мость осадка. В две пробирки вносят по 3—4 капли раствора хлорида
кальция (с - 1 моль/л), в одну из пробирок добавляют 4 капли этанола, а в
другую — 4 капли дистиллированной воды, после чего в каждую про-
бирку добавляют по 2—3 капли раствора сульфата натрия (с = 1 моль/л).
Отмечают изменения, происходящие в пробирках, и объясняют их.
Опыт 7. Изучение некоторых осадочных реакций, используемых
для обнаружения ионов. 7а. Аналитическая реакция на ион калия. В про-
бирку вносят 4—5 капель раствора хлорида калия, затем 1—2 капли рас-
111
твора гексанитрокобальтата(Ш) натрия. Наблюдают выпадение осадка и
записывают уравнение реакции
2К+ + Na3[CO(NO2)6] -+ K2Na[Co(NO2)6] 1 +2Na+
Отмечают цвет осадка.
76. Аналитическая реакция на ион магния. В пробирку вносят 3—4
капли раствора хлорида магния, прибавляют 3 капли раствора хлорида
аммония и несколько капель раствора аммиака, после чего добавляют
раствор гидрофосфата натрия. Наблюдают образование осадка и записы-
вают уравнение реакции
Mg2+ + НРО2 + NH3 -> MgNH4PO„1
Отмечают цвет осадка.
7в. Групповая реакция на анионы с хлоридом бария. В пять проби-
рок помещают по 3—4 капли растворов солей, содержащих следующие
анионы: сульфит, карбонат, фосфат, тиосульфат, тетраборат. Затем в ка-
ждую пробирку добавляют по 3—4 капли раствора хлорида бария. На-
блюдают образование осадков, отмечают их цвет. Записывают уравнения
реакций. Перечисляют, какие еще анионы могут образовывать нераство-
римые соединения с солями бария.
Вопросы к защите работы
1. Укажите термодинамические и кинетические условия равновесия в системе
твердое вещество ионного типа — водный раствор этого вещества.
2. Приведите по одному примеру малорастворимых электролитов состава МА2,
М2А, М3А, М2А3. Запишите для каждого из них математическое выражение
константы растворимости.
3. Приведите пример конкуренции катионов за анион S2".
4. Приведите пример конкуренции анионов за катион Ag+.
5. Как влияет присутствие общего иона на растворимость малорастворимого
электролита? Приведите по одному примеру совмещенных гетерогенных
равновесий, в которых общим ионом является а) Т1+; б) С<12+; в) SO2".
6. К раствору, содержащему сульфат- и оксалат-ионы в равных концентрациях,
добавляют по каплям раствор соли кальция. Какой из осадков образуется в
первую очередь? Объясните, почему.
7. В растворе имеются ионы свинца и бария. При введении какого аниона в
системе будет наблюдаться: а) простое гетерогенное равновесие: б) совме-
щенное гетерогенное равновесие? Какой из двух конкурирующих процессов
будет преобладать ?
6.3. РЕАКЦИИ ЗАМЕЩЕНИЯ ЛИГАНДОВ
В ходе реакций замещения лигандов (реакций комплексообразова-
ния) происходит перенос электронной пары, т. е. образование ковалент-
ной связи по донорно-акцепторному механизму:
Mz+ + м
акцептор донор комплексная частица
электронной электронной
пары пары
Комплексные соединения состоят из сложных молекулярных частиц,
образованных центральным атомом (ионом) и лигандами — заряженны-
ми или незаряженными частицами, донорами неподеленных электронных
пар. Лиганды могут быть как нейтральными частицами (х = 0; молекулы
воды, аммиака, аминов и др.), так и анионами (х < 0; гидроксид-, цианид-,
галогенид-ионы и др.). Если в составе лиганда находится один донорный
атом, т. е. атом, способный предоставить для образования ковалентной
связи по донорно-акцепторному механизму неподеленную пару элек-
тронов, то такой лиганд называется монодентатным. Все перечислен-
ные выше лиганды являются монодентатными. Бидентатные лиганды
имеют в своем составе два донорных атома, например этандиамин
NH2—СН2—СН2—NH2 (два атома азота).
Строго говоря, дентатность лиганда определяется числом донорных
атомов, доступных для координации (некоторые донорные атомы в ли-
ганде могут быть экранированы близко расположенными атомами и не
принимать участия в комплексообразовании из-за пространственных
препятствий).
Координационное число характеризует суммарное число связей цен-
трального атома (иона) с донорными атомами лиганда (лигандов). Цен-
тральный атом и связанные с ним лиганды образуют внутреннюю коор-
динационную сферу (в формулах ее заключают в квадратные скобки). В
том случае, если заряд внутренней координационной сферы [M(L)„]Z “
больше 0, т. е. z - их > 0, комплексная частица представляет собой ком-
плексный катион. Ионы, компенсирующие заряд внутренней координа-
ционннои сферы, находятся во внешней координационной сфере. Напри-
мер, в хлориде диамминсеребра(1) [Ag(NH3)2]Cl имеется комплексный
катион [Ag(NH3)2]+, а внешняя координационная сфера представлена
хлорид-ионом. В том случае, если заряд внутренней координационной
сферы [M(L)n]z~'“ меньше 0, т. е. z - пх < 0, комплексная частица пред-
ставляет собой анион. В составе гексацианоферрата(Ш) калия
K3[Fe(CN)6] имеется комплексный анион [Fe(CN)6]3-, а внешняя коорди-
национная сфера представлена ионами калия. Комплексные соединения,
в состав которых входят комплексные ионы, называются комплексными
из
электролитами. Диссоциация по внешней координационной сфере проте-
кает практически полностью, например:
[Ag(NH3 )2 ]С1 -> [Ag(NH3 )2 Г + СГ
K3[Fe(CN)6] -> ЗК+ +[Fe(CN)6]3-
У комплексных неэлектролитов (z - пх = 0) внешняя координацион-
ная сфера отсутствует. Пример комплексного неэлектролита — ди-
хлородиамминоплатина [Pt(NH3)2Cl2],
Диссоциация комплексной частицы по внутренней координационной
сфере протекает всегда частично; чем в меньшей степени это происходит,
тем прочнее комплекс. Количественно прочность (устойчивость) ком-
плекса характеризуется константой устойчивости. Для представленной
выше в общем виде реакции комплексообразования константа устойчи-
вости р принимает следующий вид:
с([МЬ/-та])
с(Мг+)с"(1Г)'
(6.27)
Комплексные частицы, имеющие в составе несколько лигандов, дис-
социируют ступенчато, подобно многоосновным кислотам. Чем больше
значение константы устойчивости (6.27), тем прочнее комплекс.
С практическими целями часто пользуются величиной, обратной
константе устойчивости — константой нестойкости К„.
" с([МЬ„]г“)
(6.28)
Чем меньше константа нестойкости, тем прочнее комплекс. Кон-
станты нестойкости позволяют прогнозировать направление процессов
комплексообразования. В водном растворе в отсутствие лигандов, спо-
собных конкурировать с молекулами воды, ион металла существует в
виде аквакомплекса. Например, комплекса, в котором вокруг центрального
иона координированы [Си(Н2О)4]2+ — тетрааквамедь(П); [Fe(H2O)6]3+ —
гексаакважелезо(Ш). Образование в водном растворе комплекса между
ионом металла и каким-либо лигандом можно рассматривать как реак-
цию замещения молекул воды во внутренней координационной сфере
этим лигандом, например:
[Zn(H2O)J2++4NH3 [Zn(NH3)J2++4H2O
[Cr(H2O)6]3+ +4ОН’ # [Cr(OH)4(H2O)2]’+4H2O
Прочность образующихся комплексных соединений зависит от мно-
гих факторов. Помимо природы реагирующих веществ, влияние оказы-
вают и условия проведения реакции. В большинстве случаев в малопо-
114
лярных растворителях прочность комплексных соединений выше, чем в
полярных, так как в них взаимодействие между ионами комплексообра-
зователями и молекулами растворителя ослаблено. На устойчивость ком-
плексных ионов влияет pH среды.
При наличии в растворе нескольких лигандов, способных к образо-
ванию комплексного соединения с ионом металла, наблюдается совме-
щенное лигандообменное равновесие. Процессы образования комплекс-
ных соединений иона металла с каждым из лигандов оказываются конку-
рирующими: преобладающим будет процесс, который приводит к обра-
зованию наиболее прочного комплексного соединения. Заключение о
сравнительной прочности комплексных соединений на основании кон-
стант нестойкости можно делать только для соединений с одинаковым
координационным числом.
Пример 6.3. Пусть в водном растворе присутствуют ионы цинка Zn2+, CN" и
молекулы NH3. Поскольку ион цинка способен образовывать комплексы
[Zn(H2O)4], [Zn(NH3)4]2+ и [Zn(CN4)]2~ с к. ч. 4, то устойчивость их можно срав-
нивать непосредственно по константам. Более прочным является цианидный
комплекс, образование которого и будет преобладать в данной системе. Следова-
тельно, в конкуренции за Zn2+ выигрывает CN“.
Существуют и такие совмещенные лигандообменные равновесия, в
которых объектом конкуренции является лиганд, а конкурирующими час-
тицами — ионы металла.
В настоящее время для комплексообразования с различными ионами
металлов используется этилендиаминтетрауксусная кислота (ЭДТА)
НООС — СН2\ /сн2— СООН
N — СН2— СН2 — N
НООС — сн2 сн2— СООН
или ее динатриевая соль 1Ча2ЭДТА.
Для написания формулы ЭДТА и ее анионов часто используют обо-
значения H4Y, H3Y“, H2Y2- и т. д. 1Ча2ЭДТА можно записать как Na2H2Y.
ЭДТА и ее соли образуют прочные комплексы почти со всеми металлами
(кроме щелочных). Особенностью их взаимодействия является независи-
мость молярного соотношения металл/ЭДТА от заряда иона металла, ко-
торое всегда равно 1:1.
Пример 6.4. Допустим, в растворе имеются ионы магния, меди(П),
железа(Ш), хрома(Ш), марганца (II). При введении в такой раствор ЭДТА в не-
достатке происходит связывание того иона, который образует наиболее прочный
комплекс, т. е. FeJ+. По мере добавления новых порций ЭДТА будет происходить
связывание и других ионов в следующей последовательности: Cr3*, Си2+, Со2+,
Mn2+, Mg2+.
115
Работа 6.6. Изучение реакций комплексообразования
с неорганическими лигандами
Цель. Изучить реакции ионов-биометаллов и ионов-токсикантов с
неорганическими лигандами на примере образования аммино- и гидро-
ксокомплексов.
Оборудование. Штатив с пробирками.
Реактивы. Растворы нитрата железа (III), нитрата кобальта (II), нитрата ни-
келя (II), нитрата меди (II), нитрата цинка, нитрата алюминия (перечисленные
выше нитраты могут быть заменены на сульфаты или хлориды), нитрата или аце-
тата свинца(11) (все с концентрацией приблизительно 0,2 моль/л); растворы гид-
роксида натрия с концентрацией 0,1 моль/л и концентрированный; раствор ам-
миака концентрированный.
Выполнение эксперимента. Опыт 1. Образование гидроксоком-
плексов d- и p-металлов. Предварительно получают нерастворимые гид-
роксиды металлов. Для этого в семь пробирок наливают по 1 мл раствора
соли, придерживаясь следующего порядка: в первую пробирку — раствор
соли железа(Ш); во вторую — раствор соли цинка, затем соли меди(П), соли
кобальта, соли никеля, соли свинца(П) и соли алюминия. В каждую из
пробирок добавляют по каплям разбавленный раствор щелочи (с концен-
трацией 0,1 моль/л) до отчетливого образования осадка. Надо помнить,
что некоторые осадки могут раствориться в избытке щелочи, поэтому
добавление избытка щелочи на этом этапе недопустимо. Цвет образо-
вавшихся осадков отмечают в таблице по форме:
Катион Цвет осадка при до- бавлении разбавленно- го раствора щелочи Изменения, произо- шедшие при добавле- нии концентрирован- ного раствора щелочи Изменения, произо- шедшие при добавле- нии аммиака
Fe3+ Zn2+ Cu2+ Со2+ Ni2+ Pb2+ Al3+
Затем переходят к изучению возможности образования гидроксо-
комплексов. Для этого в каждую из пробирок добавляют по 1—2 мл
концентрированного раствора щелочи. Изменения, происшедшие в
пробирках, отмечают в таблице. Записывают уравнения реакций в
ионном виде.
116
Опыт 2. Образование амминокомплексов d- и p-металлов. В шесть
пробирок наливают по 1 мл раствора соли, придерживаясь следующего
порядка: в первую пробирку — раствор соли железа(Ш); во вторую —
раствор соли цинка, затем соли меди(П), соли никеля, соли свинца(П) и
соли алюминия. В каждую из пробирок добавляют по 2 мл концентриро-
ванного раствора аммиака. Содержимое пробирок взбалтывают. Измене-
ния, происшедшие в пробирках, отмечают в таблице. Записывают урав-
нения реакций в ионном виде.
Опыт 3. Образование амминокомплексов кобальта. В пробирку
наливают 1 мл раствора соли кобальта и добавляют 3 мл концентриро-
ванного раствора аммиака. Содержимое пробирки взбалтывают. В лабо-
раторном журнале отмечают происшедшие изменения. Пробирку остав-
ляют в штативе на 30 мин, не перемешивая ее содержимое.
Наблюдения и уравнения реакций записывают в лабораторный журнал.
При формулировании выводов имеют в виду, что образование проч-
ных гидроксо- и амминокомплексов сопровождается полным растворени-
ем первоначально выпавшего осадка. Образование мутной жидкости оз-
начает не растворение, а пептизацию осадка.
Выводы можно оформить в виде перечисления:
• Ионы, образующие прочные и аммино- и гидроксокомплексы...
• Ионы, образующие прочные только амминокомплексы...
. • Ионы, образующие прочные только гидроксокомплексы...
• Ионы, не образующие прочные ни аммино-, ни гидроксокомплексы...
Вопросы к защите работы
1. Воспользовавшись справочными данными, установите, какой из аммино-
комплексов — [Cu(NH3)6]2+ или [Zn(NH3)4]2+ является более прочным.
2. Воспользовавшись справочными данными, установите, какой из гидроксо-
комплексов — [А1(ОН)4]~ или [Сг(ОН)4]* является более прочным.
3. Составьте формулы следующих комплексных соединений: дитиоцианатоди-
цианокупрат(П) бария; триамминтринитрокобальт; нитрат пентаамминтио-
ционатокобальта(Ш).
4. Для перечисленных в предыдущем вопросе комплексных соединений укажи-
те центральный атом, лиганды, внутреннюю координационную сферу и
внешнюю координационную сферу.
5. Назовите следующие соединения: K2[HgI4]; [Hg(NH3)6](NO3)2; K6[Pb(S2O3)4];
(NH4)2[Pb(CH3COO)4]. Напишите для этих соединений уравнения электроли-
тической диссоциации по внешней координационной сфере.
Работа 6.7. Простые и совмещенные лигандообменные
равновесия
Цель. Изучить реакции ионов биометаллов и ионов токсикантов с
органическими лигандами, а также совмещенные лигандообменные рав-
новесия, моделирующие конкуренцию реакций комплексообразования в
живых системах в норме и при патологии.
Оборудование. Штатив с пробирками; стеклянные палочки; пипетки;
фильтровальная бумага.
Реактивы. Растворы нитрата алюминия, нитрата меди(П), нитрата кобаль-
та(П), нитрата никеля(П), нитрата цинка, нитрата железа(Ш) (перечисленные вы-
ше нитраты могут быть заменены на сульфаты или хлориды), нитрата или хлори-
да кальция (все растворы с концентрацией приблизительно 0,2 моль/л); раствор
ЭДТА натрия (0,01 моль/л); раствор глицина (0,2 моль/л); насыщенные водные
растворы фторида калия, тартрата калия, тиоцианата калия, салицилата натрия,
ализарина; раствор аммиака концентрированный; 0,01%-й раствор дитизона в
тетрахлориде углерода; 0,5%-й раствор купрона (бензоиноксима) в 50%-м этано-
ле; 0,2%-й раствор 1-нитрозо-2-нафтола в 50%-й уксусной кислоте; 1%-й раствор
диметилглиоксима в этаноле. Буферные растворы со значениями pH 1; 2,5; 7,4.
Аммиачный буферный раствор (pH 9). Эриохром черный Т (сухая смесь с хлори-
дом натрия в соотношении 1:200). Индикаторная бумага.
Выполнение эксперимента. Опыт 1. Изучение образования внут-
рикомплексных соединений ионов металлов с органическими лигандами.
1а. Взаимодействие ионов алюминия с ализарином. На фильтровальную
бумагу капилляром наносят 1—2 капли раствора соли алюминия и дер-
жат бумагу в течение 1—2 мин над склянкой с концентрированным рас-
твором аммиака. На полученное влажное пятно капилляром наносят кап-
лю раствора ализарина, снова выдерживают в парах аммиака. После ок-
рашивания бумаги в фиолетовый цвет ее подсушивают, смачивают ук-
сусной кислотой и высушивают над пламенем горелки. В лабораторном
журнале отмечают цвет образовавшегося соединения. Формула ком-
плексного соединения алюминия с ализарином:
118
16. Взаимодействие ионов цинка с дитизоном, В пробирку вносят 10
капель раствора соли цинка, добавляют 5 капель раствора дитизона в тет-
рахлориде углерода. Дитизон не является специфическим лигандом для
цинка; комплексные соединения с ним образуют многие ионы металлов
(например, свинец, олово, кадмий и др.). Отмечают происходящие изме-
нения. Формула комплексного соединения цинка с дитизоном:
S /s \
Сбн5—N = N—С ZnZ С — N=N—С6Н5
N—NH HN—N
сбн5 с6н5
1в. Взаимодействие ионов кобальта с 1-нитрозо-2-нафтолом. На по-
лоску фильтровальной бумаги наносят каплю слабокислого раствора со-
ли кобальта(П) и каплю раствора 1-нитрозо-2-нафтола. В лабораторном
журнале отмечают цвет образовавшегося соединения. Следует иметь в виду,
что в процессе комплексообразования происходит окисление Со(П) —>
->Со(Ш). Формула комплексного соединения кобальта с 1-нитрозо-2-
нафтолом:
1г. Взаимодействие ионов меди с купроном. На полоску фильтро-
вальной бумаги помещают капилляром 1 каплю подкисленного раствора
соли меди и добавляют по 1 капле растворы купрона (бензоиноксима) и
аммиака. Цвет образовавшегося соединения отмечают в журнале. Фор-
мула комплексного соединения меди с купроном:
С6Н5 —НС—О \ N = С — С6Н5
I / Cu\ ।
С6Н5 — С = N ХО — СН—С6Н5
ОН
1д. Взаимодействие ионов меди с глицином. В пробирку вносят 2
капли раствора соли меди(П), 10—15 капель раствора глицина, добавля-
ют 4—5 капель раствора щелочи. Цвет образовавшегося соединения от-
119
сн2
мечают в лабораторном журнале. Формула комплексного соединения
меди с глицином:
О
II
С — Ох /NH2-
Cu
CH—Хо —
О
1е. Взаимодействие ионов никеля с диметилглиоксимом. На полоску
фильтровальной бумаги помещают капилляром 1 каплю раствора соли
никеля, затем 1 каплю раствора диметилглиоксима. Бумагу выдерживают
некоторое время в парах аммиака. Отмечают цвет образовавшегося со-
единения. Формула комплексного соединения никеля с диметилглиоксимом:
О— ОН
CH—C = N\ /N = C—СН3
,Ni I
СН—С = ЬГ XN = C—снз
ОН О —
Опыт 2. Изучение влияния природы растворителя на устойчи-
вость комплексного иона. В пробирку наливают 1 мл раствора соли ко-
бальта(П), добавляют 2—3 мл насыщенного раствора тиоцианата калия.
Отмечают цвет образовавшегося соединения. Раствор делят поровну в
две пробирки. В одну из них добавляют равный объем дистиллированной
воды, а в другую — равный объем изоамилового спирта. Отмечают изме-
нение цвета в каждом случае, после чего формулируют вывод.
Опыт 3. Изучение конкурирующих реакций комплексообразования.
За. Конкуренция за ион железаНП). В три пробирки наливают по 1 мл
раствора хлорида железа(Ш). В одну из пробирок добавляют 1 мл дис-
тиллированной воды, в другую — 1 мл раствора фторида калия, в третью —
1 мл раствора тартрата калия. Содержимое пробирок перемешивают и в
каждую из них добавляют по 5 капель раствора тиоцианата калия. Запись
наблюдений оформляют в виде таблицы:
Про- бирка Добавленный реа- гент Цвет содержимого пробирки Формула образовавшегося соединения
1 Вода
2 Фторид калия
3 Тартрат калия
120
Тартрат калия является двухзарядным анионом винной кислоты
НООС—СН(ОН)—СН(ОН)—СООН; в данных условиях ведет себя как
тридентатный лиганд. При составлении формул образующихся соедине-
ний принимают, что координационное число железа равно 6.
36. Конкуренция за ион кальция. В пробирку вносят 10 капель рас-
твора хлорида кальция, добавляют 1,5 мл аммиачного буферного раство-
ра и несколько крупинок эриохрома черного Т. Содержимое пробирки
перемешивают и отмечают цвет образовавшегося соединения. Раствор
делят на две части: одну из них оставляют для сравнения, а к другой до-
бавляют по каплям раствор ЭДТА натрия до изменения цвета. Наблюде-
ния записывают в лабораторный журнал.
Эриохром черный Т относится к числу так называемых металлинди-
каторов, способных образовывать окрашенные комплексные соединения
со многими металлами. Структурный фрагмент этого соединения, при-
нимающий участие в образовании хелатного комплекса, можно предста-
вить следующим образом:
Схематично взаимодействие иона металла с металлиндикатором и с
ЭДТА можно представить следующим образом:
С металлиндикатором: Ме2+ + Н2Х МеХ + 2Н+
где X3" анион, в состав которого входит приведенная выше группировка
атомов.
С ЭДТА натрия: Me2++H2Y2' # MeY2 +2Н+
где Y4- — анион ЭДТА.
Объясняют наблюдения с позиций теории совмещенных равновесий
и конкурирующих процессов. В описаниях опытов обоих заданий отме-
чают: а) объект конкуренции; б) конкурирующие между собой частицы;
в) конкурирующие между собой процессы (записи уравнений химиче-
ских реакций; г) вывод о преобладающем направлении протекания про-
цесса.
Опыт 4. Изучение влияния pH на состав комплексного соединения.
В три пробирки наливают по 3 мл буферных растворов с pH 1,0; 2,5; 7,4.
К каждому раствору добавляют по 3 капли раствора соли железа(Ш) и по
2 капли раствора салицилата натрия. Отмечают цвет образовавшихся со-
121
единений. Записывают формулы образовавшихся комплексных соедине-
ний с указанием констант нестойкости. Делают вывод о влиянии pH сре-
ды на состав комплексного соединения.
Вопросы к защите работы
1. Какие факторы, помимо природы реагирующих веществ, влияют на состав и
прочность комплекса?
2. Приведите пример конкуренции реакций комплексообразования за лиганд на
примере цианидов.
3. Приведите пример конкуренции реакций комплексообразования за ион се-
ребра.
4. Приведите для трисульфитоаргентат(1)-иона по одному примеру реакций:
а) замещения лиганда; б) замещения центрального атома.
6.4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ И ПРОЦЕССЫ
Окислителями называются вещества или частицы, принимающие
электроны от других веществ или частиц — восстановителей. Окислен-
ную и восстановленную форму одного и того же вещества называют ре-
докс-системой (редокс-парой). Для протекания окислительно-восстанови-
тельной реакции (редокс-реакции) необходимо наличие как минимум
двух веществ, относящихся к разным редокс-системам. В общем виде
реакции такого типа можно представить уравнением:
Ox,+Red2 Redj+Oxj
Характерным признаком редокс-реакций является изменение степе-
ней окисления: степень окисления одного из атомов, входящих в состав
окислителя, уменьшается, а одного из атомов, входящих в состав восста-
новителя, увеличивается. Например, в реакции, протекающей по уравнению
2KNO2 + 2KI + 2H2SO4 -> 2NO +12 + 2Na2SO4 + 2H2O
окислителем является нитрит калия (N + е~ —> 14), а восстановителем —
иодид калия (Г -> 1° + е”). Таким образом, в этом редокс-процессе уча-
ствуют две редокс-системы: NO2/NO и 12/Г. Приведенное уравнение —
пример межмолекулярных редокс-реакций, отличительной чертой кото-
рых является то, что атом-окислитель и атом-восстановитель находятся в
составе разных реагентов. Разновидностями редокс-реакции являются
реакции диспропорционирования:
122
C12+2OFT СГ+С10 + H20
и внутримолекулярного окисления — восстановления:
NH4NO3 NjO + 2H2O
В реакциях диспропорционирования одна часть атомов одного и то-
го же вещества выступает в роли окислителя, а другая — в роли восста-
новителя. В реакциях внутримолекулярного окисления — восстановле-
ния атом-окислитель и атом-восстановитель находятся в составе одной
формульной единицы.
Атомы в максимальной степени окисления могут проявлять только
окислительные свойства, а в минимальной — только восстановительные.
Вещества, в которых имеются атомы в промежуточных степенях окисле-
ния, обладают редокс-амфотерностью, т. е. способностью вступать в ре-
акции как с окислителями, так и с восстановителями (например, пероксид
водорода).
Количественной характеристикой редокс-систем является редокс-
потенциал, возникающий на границе раздела фаз платина — водный рас-
твор, содержащий редокс-систему. Величина редокс-потенциала в еди-
ницах СИ измеряется в вольтах (В) и рассчитывается по уравнению
Нернста:
о RT, о(Ох) т.,т+.
<Р = Ф +—In 'а"(И ),
nF a(Red)
(6.29)
где а(Ох) и a(Red) — активности окисленной и восстановленной форм
соответственно; R — универсальная газовая постоянная; Т — термодина-
мическая температура. К; F— постоянная Фарадея (96 500 Кл/моль); п —
число электронов, принимающих участие в элементарном редокс-
процессе; a(H*) — активность ионов гидроксония; m — стехиометриче-
ский коэффициент перед ионом водорода в полуреакции.
Величина <р° — стандартный редокс-потенциал, т. е. потенциал, из-
меренный при условии а(Ох) = a(Red) = а(Н+) = 1 и данной температуре.
Стандартный редокс-потенциал системы 2Н+/Н2 принят равным 0 В.
Стандартные редокс-потенциалы являются справочными величинами,
табулируются при температуре 298 К. Сильнокислая среда не характерна
для биологических сред (за исключением желудочного содержимого),
поэтому для характеристики процессов, протекающих в живых системах,
чаще используют формальный потенциал (или мидпойнт потенциал) <р°,
т. е. потенциал, определяемый при условии а(Ох) = a(Red), pH 7,4 и тем-
пературе 310 К (физиологический уровень). Выше указывалось, что ре-
докс-потенциал характеризует не какое-то вещество, а систему, т. е. со-
пряженную окислительно-восстановительную пару. При записи потен-
циала химическая природа системы указывается в виде дроби, причем
123
окислитель обязательно записывается в числителе, а восстановитель — в
знаменателе. Например, для систем, содержащих железо в различных
степенях окисления, правильными будут следующие записи:
<p(Fe3+/Fe2+) и <p(Fe2+/Fe).
Чем больше редокс-потенциал, тем сильнее окислитель и слабее со-
пряженный ему восстановитель. Сильный окислитель вступает в реакции
с большим числом восстановителей, чем слабый, и (или) вызывает более
глубокое окисление восстановителей.
Сравним окислительные свойства хлора и иода. Оба вещества окис-
ляют сульфит- и тиосульфат-ионы, металлическое железо. Однако хлор
как более сильный окислитель реагирует с большим числом восстанови-
телей: например, окисляет бромид-ионы. Иод бромид-ионы не окисляет.
Хлор окисляет железо до степени окисления +3, в то время как иод —
только до степени окисления +2.
Направление редокс-процессов. Вопрос о возможности самопроиз-
вольного протекания редокс-процесса можно решить, рассчитывая AG по
стандартным термодинамическим функциям, пользуясь уравнением (3.4).
Существует и более простой способ решения этого вопроса: вместо рас-
чета AG следует сравнить редокс-потенциалы редокс-систем, принимаю-
щих участие в процессе, т. е. рассчитывать электродвижущую силу
(ЭДС) мысленно составляемого гальванического элемента.
Сущность способа заключается в следующем. Поскольку в любом
редокс-процессе должны принимать участие, как минимум, две редокс-
системы, сначала делается предположение о том, какая из них является
окислителем, а какая — восстановителем. Затем мысленно обособляют
процессы окисления и восстановления, т. е. составляют гальванический
элемент. Если элемент составлен правильно (т. е. верно выбраны окисли-
тель и восстановитель), то в нем за счет протекания химической реакции
будет совершаться электрическая работа №зл.
И;л = nFE°, (6.30)
где Е° — стандартная ЭДС, В.
Стандартная ЭДС равна разности стандартных редокс-потенциалов
(редокс-система с реальной или предполагаемой функцией окислителя
обозначена 1, с функцией восстановителя — 2):
5° = ФГ-(р°. (6.31)
Константу равновесия редокс-процесса можно рассчитать, используя
следующее уравнение:
In Г nFE° ТЭ'!
In л =-----. (6.32)
RT
124
Работа 6.8. Окислительно-восстановительные свойства веществ.
Определение направления редокс-процессов
Цель. Научиться оценивать условия протекания окислительно-
восстановительных реакций.
Оборудование. Штатив с пробирками.
Реактивы. Растворы пероксида водорода, перманганата калия, иодида калия
(или натрия), нитрита калия (или натрия), серной кислоты (разб), гидроксида
калия (конц), бромида калия (или натрия), хлорида железа(Ш); иод кристал-
лический.
Выполнение эксперимента. Опыт 1. Окислительно-восстанови-
тельная двойственность пероксида водорода и нитритов. В пробирки 1
и 2 вносят по 2—3 капли раствора перманганата калия. В пробирки 3 и 4
наливают по 2—3 капли раствора иодида калия. В каждую из четырех
пробирок добавляют по 3—4 капли разбавленного раствора серной ки-
слоты. В пробирки 1 и 3 добавляют по каплям раствор пероксида водоро-
да, а в пробирки 2 и 4 — раствор нитрита натрия.
В лабораторном журнале отмечают изменения, происходящие в про-
бирках в каждом случае (выделение газа, изменение цвета). Записывают
уравнения реакций в ионной форме.
Опыт 2. Реакция диспропорционирования иода. В пробирку вносят
5—8 капель раствора гидроксида калия, затем добавляют 1 кристаллик
иода, после чего содержимое пробирки слегка нагревают.
В лабораторный журнал записывают наблюдения и уравнение реак-
ции в ионной форме.
Опыт 3. Зависимость характера продуктов окислительно-вос-
становительной реакции от pH среды. В пробирку 1 вносят 2—3 капли
раствора перманганата калия, 2—3 капли разбавленного раствора серной
кислоты и затем добавляют 3—4 капли раствора сульфита натрия. В про-
бирку 2 вносят 2—3 капли раствора перманганата калия и затем добав-
ляют 3—4 капли раствора сульфита натрия. При отсутствии видимых
изменений в пробирках 1 и 2 объем раствора сульфита натрия увеличи-
вают. В пробирку 3 вносят 3—4 капли концентрированного раствора
гидроксида калия, 3—4 капли раствора сульфита натрия и затем добав-
ляют 2—3 капли раствора перманганата калия.
В лабораторном журнале в каждом случае отмечают характер изме-
нений в пробирках после добавления последнего реактива и указывают
степень окисления марганца в продуктах реакций. Составляют уравнения
реакций в ионной форме.
Опыт 4. Определение направления редокс-процесса. Пользуясь зна-
чениями стандартных редокс-потенциалов, прогнозируют возможность
протекания процессов:
125
2Fe3++2Г -> 2Fe2++12
2Fe3* + 2Br -> 2Fe2++ Br2
Правильность проведенных расчетов проверяют экспериментально,
для чего в две пробирки наливают по 1—2 мл раствора хлорида
железа(П1). В одну из них добавляют 1 мл раствора иодида калия, в дру-
гую — 1 мл раствора бромида калия. В лабораторном журнале отмечают
изменения, происшедшие в пробирках.
Вопросы к защите работы
1. Каким образом можно прогнозировать направление самопроизвольного про-
текания редокс-процесса?
2. Какие из перечисленных веществ — перманганат калия, иодид калия, нитрит
калия, пероксид водорода — могут проявлять окислительно-восстановитель-
ную двойственность в водной среде? Объясните, почему.
3. Приведите примеры реакций диспропорционирования с участием следую-
щих веществ: а) пероксида водорода; б) хлора; в) нитрита натрия.
4. Приведите по одному примеру реакций, в которых пероксид водорода играет
роль восстановителя в кислой и щелочной среде. Напишите уравнения реак-
ций в ионной форме.
5. По отношению к воде некоторые вещества ведут себя как окислители, другие
как восстановители. Приведите по два примера таких веществ и напишите
уравнения реакций в ионной форме.
Работа 6.9. Изучение зависимости редокс-потенциала
от соотношения концентраций окисленной
и восстановленной формы
Цель. Приобрести навыки потенциометрических измерений.
Оборудование. Иономер ЭВ-74; электроды платиновый и хлорсеребряный;
химический стакан вместимостью 25 мл; колбы конические вместимостью 50 мл;
стеклянная палочка.
Реактивы. Раствор хлорида калия хлорида, с(КС1) = 2 моль/л; растворы гек-
сацианоферрата(11) калия и гексацианоферрата (III) калия, каждый с концентра-
цией 0,01 моль/л.
Сущность работы. Эксперимент проводится на примере редокс-
системы K3[Fe(CN6)]/K4[Fe(CN)6]. Платиновая проволочка, опущенная в
водный раствор, содержащий смесь этих двух веществ, образует редокс-
электрод. Поскольку измерить абсолютную величину редокс-потенциала
отдельно взятого электрода невозможно, собирают гальваническую цепь,
126
Рис. 6.2. Вид передней панели иономера универсального ЭВ-74
состоящую из хлорсеребряного электрода с известным потенциалом и
редокс-электрода, потенциал которого зависит от соотношения концен-
траций [Fe(CN)6]3" (окисленной формы) и [Fe(CN)6]4~ (восстановленной
формы).
Условная запись гальванической цепи:
Ag, AgCl | КС11| K3[Fe(CN)6], K4[Fe(CN)6] | Pt
Электродвижущую силу (ЭДС) гальванических элементов, разли-
чающихся соотношением окисленной и восстановленной форм, измеряют
-с помощью высокоомного вольтметра, шкала которого проградуирована
в милливольтах и единицах pH. На рис. 6.2 показана передняя панель
одного из таких приборов — иономера ЭВ-74.
Перед снятием показаний прибор включают в сеть и прогревают в
течение 30 мин. Устанавливают температуру исследуемого раствора, для
чего нажимают клавишу одного из узких диапазонов измерения: «-14-4»,
«44-9», «9-J-14» или «14-И 9»; нажимают клавишу «/» и ручкой «Темпера-
тура раствора» по шкале № 1 устанавливают стрелку прибора на значе-
нии, соответствующем температуре раствора. Для измерения ЭДС нажи-
мают клавишу «mV». Знак ЭДС (направление тока в цепи) определяется
величиной измеряемого потенциала по сравнению с потенциалом элек-
трода сравнения: если потенциал измерительного электрода больше по-
тенциала электрода сравнения, то знак ЭДС положителен (клавиша «±»
не нажата), и наоборот. Нажимают клавишу «-14-19» и с нижней шкалы
снимают приблизительное значение ЭДС (мВ), которое равно показанию
стрелки, умноженному на 100. Для определения точного значения ЭДС
127
нажимают клавишу того диапазона измерений, в который входит прибли-
зительное значение ЭДС. По одной из шкал № 2 или № 3 снимают пока-
зания прибора. При использовании узких диапазонов «4-ь9», «9-ь 14»,
«14-ь 19» к показанию стрелки прибавляют значение нижнего предела
диапазона (4, 9 или 14). Эта величина, умноженная на 100, дает точное
значение ЭДС (в мВ). После окончания измерения все клавиши выводят в
свободное (ненажатое) положение, кроме клавиш «/» и «—1-ь 19».
По измеренным величинам ЭДС рассчитывают редокс-потенциалы
по формуле
Фг = £ + Фср, (б.зз)
где Е — измеренная величина ЭДС; (рср — потенциал электрода сравне-
ния, в данном случае хлорсеребряного электрода, зависящая от концен-
трации хлорида калия и температуры (находят в справочнике).
Выполнение эксперимента. Подготавливают иономер ЭВ-74 к ра-
боте (см. рис. 6.2). Рассчитывают, какие требуются объемы растворов
K3[Fe(CN)6] и K4[Fe(CN)6] с концентрациями 0,01 моль/л для приготовле-
ния трех систем объемом по 11 мл с соотношением окисленной и восста-
новленной форм, равным: 1) 10:1, 2) 1:10, 3) 1:1. Найденные значения
записывают в таблицу по форме:
Редокс- 1 ' система Объем, мл £, мВ 1 ф„ мВ
K4fFe(CN)6]. с = 0,01 моль/л K3[Fe(CN)6], с = 0,01 моль/л КС1, с = 2 моль/л Рассчитанное на основе измерения Е Рассчитанное из справочных данных
1 5
2 5
3 5
4
В конические колбы вместимостью 50 мл наливают из бюреток по
5 мл раствора хлорида калия с концентрацией 2 моль/л и рассчитанные
объемы растворов K3[Fe(CN)6] и K4[Fe(CN)6], В химический стакан вме-
стимостью 50 мл переносят из конической колбы одну из приготовлен-
ных редокс-систем, опускают в него платиновый и хлорсеребряный элек-
троды, подсоединенные к иономеру. Измеряют ЭДС гальванического
элемента. Аналогичные измерения проводят с двумя другими редокс-
системами. Полученные результаты записывают в таблицу.
Одну из трех редокс-систем разбавляют вдвое дистиллированной водой,
дня чего в один из приготовленных растворов (например, в третий) добавля-
ют 16 мл воды. Измеряют ЭДС этого гальванического элемента.
128
По окончании работы прибор выключают, а электроды помещают в
стакан с дистиллированной водой.
Обработка результатов эксперимента. Значения редокс-потенциа-
лов рассчитывают по уравнению (6.33), после чего записывают в табли-
цу. Рассчитывают значения редокс-потенциалов для изученных систем по
уравнению Нернста. Значение (р° (см. табл. 20 приложения). Учитывая,
что в уравнении (6.29) R nF— постоянные, а п = 1, для расчетов при 298 К
можно применить более простое уравнение:
<рг=Ф° +0,05911g
a(Red)
В выводах отмечают зависимость редокс-потенциала от отношения
концентраций окисленной и восстановленной форм и от разведения ре-
докс-системы. Объясняют причины отклонений экспериментально най-
денных значений потенциалов от рассчитанных.
Вопросы к защите работы
1. В чем заключается механизм образования редокс-потенциала?
2. Что называют стандартным и формальным редокс-потенциалом?
3. Какие факторы влияют на величину редокс-потенциала?
4. Объясните, почему редокс-потенциал зависит от суммарной концентрации
окисленной и восстановленной форм редокс-системы?
5. Как между собой связаны ЭДС гальванического элемента и константа равно-
весия редокс-процесса?
Работа 6.10. Изучение влияния лигандного окружения
на редокс-потенциал
Цель. Изучить зависимость редокс-потенциала от лигандного окру-
жения центрального атома. Закрепить навыки потенциометрических из-
мерений.
Оборудование. Иономер ЭВ-74; электроды платиновый и хлорсеребряный;
химический стакан вместимостью 50 мл; колбы конические вместимостью 50 мл;
стеклянная палочка.
Реактивы. Раствор хлорида калия, с(КС1) = 2 моль/л; растворы гексациано-
феррата(П) калия и гексацианоферрата(Ш) калия, хлорида железа(П), хлорида
железа(1П), гидрофосфата натрия, каждый с концентрацией 0,01 моль/л.
Сущность работы. Лигандное окружение атома металла в комплек-
сах существенно влияет на редокс-потенциал пары, образуемой окислен-
5-366 129
ной и восстановленной формами комплексного соединения. В случае свя-
зывания ионов окисленной и восстановленной форм в прочные ком-
плексные соединения происходит снижение их активностей, при этом
возможны два варианта.
1. Константа устойчивости комплексного соединения с восстанов-
ленной формой будет больше аналогичной величины для окисленной
формы. Редокс-потенциал в этом случае увеличивается.
2. Константа устойчивости комплексного соединения с окисленной
формой будет больше аналогичной величины с восстановленной формой.
Редокс-потенциал в этом случае уменьшается.
Эксперимент проводится на примере редокс-системы Fe3+/Fe2+. Для
изучения влияния лигандного окружения центрального атома на редокс-
потенциал проводится сравнение трех значений редокс-потенциала: для
системы в отсутствие комплексообразователей (в растворе присутствуют
аквакомплексы), в присутствии гидрофосфат- и цианид-ионов. Редокс-
потенциалы рассчитываются по измеренным значениям ЭДС гальваниче-
ских элементов, в качестве электрода сравнения используется хлорсереб-
ряный электрод.
Выполнение эксперимента. Готовят иономер ЭВ-74 к работе (см.
работу 6.9).
В конические колбы 1 и 2 наливают из бюреток по 5,0 мл раствора
хлорида калия с концентрацией 2 моль/л, в коническую колбу 3 — рас-
твор гидрофосфата натрия. В колбы 1 и 3 наливают из бюреток по 5,5 мл
растворов хлорида железа(Ш) и хлорида железа(П), в колбу 2 наливают
по 5,5 мл растворов гексацианоферрата(П) калия и гексацианоферра-
та(Ш) калия.
В химический стакан из колбы 1 переносят приготовленную редокс-
систему, содержащую аквакомплексы железа в молярном соотношении
1:1, опускают в стакан платиновый и хлорсеребряный электроды, кото-
рые подсоединяют к иономеру. Измеряют ЭДС гальванического элемента
(см. рис. 6.2). Аналогичные измерения проводят с редокс-системами, со-
держащими цианидные комплексы железа (колба 2) и гидрофосфатные
комплексы железа (колба 3). Полученные результаты записывают в таб-
лицу по форме:
Колба Редокс-система pK„ ДрКн E, мВ <pr, мВ Д<рг, мВ
Ox Red
1 2 3 [Fe(H2O)6]'7 [Fe(H2O)6]2+ [Fe(HPO4)(H2O)4]7 [Fe(HPO4)(H2O)4] [Fe(CN)6]37 [Fe(CN)6]^
130
По окончании работы прибор выключают, а электроды помещают в
стакан с дистиллированной водой.
Обработка результатов эксперимента. Значения редокс-потен-
циалов рассчитывают по уравнению (6.33), после чего записывают в таб-
лицу.
В выводах отмечают зависимость редокс-потенциала системы
Fe37Fe2+ от лигандного окружения. Выявленную зависимость теоретиче-
ски обосновывают, используя значения констант нестойкости цианидных
и гидрофосфатных комплексов с окисленной и восстановленной формой
изучаемой редокс-системы. Объясняют причины отклонений экспери-
ментально найденных значений потенциалов от справочных.
Вопросы к защите работы
1. Каким образом изменится редокс-потенциал, если в систему ввести лиганд,
более полно связывающий восстановленную форму редокс-системы?
2. Приведите условную запись гальванических цепей, ЭДС которых измерялась
в ходе лабораторной работы.
3. С какой целью в редокс-системы добавляют раствор хлорида калия?
4. Как изменится потенциал редокс-системы FeJ7Fe2+ при добавлении к ней
ЭДТА? Ответ поясните.
5. Какое значение имеет феномен влияния лигандного окружения цен-
трального атома на редокс-потенциал для функционирования живых
систем?
Работа 6.11. Изучение влияния pH на редокс-потенциал
Цель. Изучить зависимость редокс-потенциала от pH среды на при-
мере системы хинон — гидрохинон; определить значение стандартного и
формального редокс-потенциала для этой системы. Закрепить навыки
потенциометрических измерений.
Оборудование. Иономер ЭВ-74; электроды платиновый и хлорсеребряный;
химический стакан вместимостью 25 мл; колбы конические вместимостью 50 мл;
стеклянная палочка.
Реактивы. Раствор хингидрона насыщенный в этаноле; буферные растворы
со значениями pH 4, pH 5, pH 6, pH 7.
Сущность работы. При растворении в воде хингидрона (соединение
и-бензохинона и гидрохинона) быстро устанавливается равновесие
131
о он
о он
хинон гидрохинон
Увеличение в растворе концентрации ионов водорода приводит к
смещению равновесия влево, а ее уменьшение — вправо. Таким образом,
изменение pH раствора приводит к изменению концентраций окисленной
и восстановленной форм, т. е. к изменению редокс-потенциала.
Выполнение эксперимента. Готовят иономер ЭВ-74 к работе (см.
работу 6.9, рис. 6.2).
Готовят растворы, содержащие изучаемые редокс-системы. В хими-
ческий стакан вместимостью 50 мл наливают 25 мл буферного раствора с
pH 7. В этот раствор добавляют при перемешивании стеклянной палоч-
кой несколько капель спиртового раствора хингидрона. В стакан опуска-
ют платиновый и хлорсеребряный электроды, которые подсоединяют к
иономеру. Измерение ЭДС составленного гальванического элемента про-
водят, как описано в работе 6.9. После измерения ЭДС стакан моют, опо-
ласкивают буферным раствором с pH 6, после чего в стакан наливают 25
мл этого буферного раствора. Так же, как и в предыдущем случае, добав-
ляют при перемешивании стеклянной палочкой несколько капель спир-
тового раствора хингидрона, после чего измеряют ЭДС. Описанную про-
цедуру повторяют для растворов с pH 5 и 4. Измеренные значения ЭДС
заносят в таблицу по форме:
pH 4 • 5 6 7
ЭДС, мВ
<р, мВ
Обработка результатов эксперимента. Значения редокс-
потенциалов рассчитывают по уравнению (6.33), после чего записывают
в таблицу.
По полученным данным строят график зависимости <рхг = /(pH).
Прямую, характеризующую зависимость, продолжают до пересечения с
осью ординат (pH = 0) и определяют значение стандартного редокс-
потенциала изучаемой системы. Из точки 7,4 на оси абсцисс восстанав-
ливают перпендикуляр, прямую продолжают до пересечения с этим пер-
132
пендикуляром и определяют значение формального редокс-потенциала
изучаемой системы.
В выводах отмечают зависимость редокс-потенциала системы от pH
и приводят определенные графическим способом значения стандартного
и формального редокс-потенциала системы хинон-гидрохинон.
Вопросы к защите работы
1. Приведите примеры биологических редокс-систем 1-го и 2-го типов.
2. Почему для биологических редокс-систем чаще пользуются формальным, а
не стандартным редокс-потенциалом?
3. Как будет изменяться редокс-потенциал для редокс-системы 2-го типа по
мере увеличения pH?
4. Приведите условную запись гальванической цепи, ЭДС которой измерялась
в ходе работы.
5. Можно ли использовать хингидронный электрод для определения pH? Пред-
ложите схему опыта.
6.5. Совмещенные равновесия и конкурирующие
процессы разных типов
Более сложным случаем совмещения равновесий является такой, при
котором конкурирующие между собой частицы могут принимать участие
в разнотипных процессах. Основные типы совмещенных равновесий и
процессов: а) протолитические — гетерогенные; б) окислительно-
восстановительные — протолитические; в) протолитические — замеще-
ния лигандов; г) окислительно-восстановительные — гетерогенные;
д) окислительно-восстановительные — замещения лигандов; е) гетеро-
генные — замещения лигандов.
Некоторые из них уже встречались в предыдущих разделах. Напри-
мер, в результате конкуренции за ион «/-элемента между лигандами и
электроном возникает такое явление, как влияние лигандного окружения
на редокс-потенциал (см. работу 6.10). В результате конкуренции за
окислитель между электроном и протоном образуются редокс-системы 2-го
типа, являющиеся, по сути, совмещенными редокс-протолитическими
системами (см. работу 6.11).
Константа общего (совмещенного) равновесия зависит от констант
частных равновесий. Общая константа равновесия будет равна отноше-
нию произведения частных констант диссоциативного типа (т. е. кон-
станты растворимости, константы ионизации, константы нестойкости
комплекса) веществ, стоящих в левой части уравнения, к произведению
частных констант диссоциативного типа веществ, стоящих в правой час-
133
ти уравнения. В случае совмещения равновесий с редокс-процессом в
выражение общей константы равновесия подставляют константу по на-
правлению окислительно-восстановительного процесса. При наличии
стехиометрических коэффициентов, отличающихся от единицы, частные
константы возводятся в степени, равные этим коэффициентам.
Например, для реакции:
[Ag(NH3)2]OH+ ЗНС1 # AgCl + 2NH4Cl + H2O
в которой совмещаются гетерогенный процесс AgCl # Ag+ + СГ, два
протолитических процесса Н2О # Н+ + ОН ; NH4 # NH3 + Н+ и про-
цесс замещения лигандов [Ag(NH3)2]+ Ag++2NH3 (все процессы
представлены в диссоциативном виде) выражение для общей константы
равновесия имеет вид:
к K„([Ag(NH3)2r)
^(AgCl)/fa(H2O)/f2(NH;)'
Необходимо обратить внимание, что соответствующая константа для
воды не равна константе воды Kw, и рассчитывается по формуле
К. (Н2О) = К* = 1 • 10 м : 55,6 = 1,8 • Ю’16.
* 2 с(Н2О)
Работа 6.12. Изучение совмещенных равновесий
и конкурирующих процессов разного типа
Цель. Научиться прогнозировать направление конкурирующих про-
цессов различных типов и характеризовать состояние равновесия в виде
общей константы равновесия, рассчитанной по частным константам рав-
новесия.
Оборудование. Штатив с пробирками; бюретки вместимостью 25 мл; стек-
лянные палочки.
Реактивы. Растворы хлорида бария, хлорида магния, иодида калия, нитрата
свинца(11), оксалата натрия, хлорида железа(Ш), тартрата калия, сульфата ме-
ди(П), тиосульфата натрия, хлорида кальция, карбоната натрия, сульфата
железа(П), гидрофосфата натрия, дигидрофосфата натрия (все с концентрацией
0,1 моль/л), соляной кислоты (0,1 моль/л), серной кислоты (0,2 моль/л), гидрокси-
да натрия (2 моль/л, 6 моль/л), ЭДТА натрия (0,01 моль/л), гексацианоферрата(П)
калия (0,5 моль/л), иодида калия насыщенный, перманганата калия (0,05 моль/л);
хлорид аммония (кристаллический).
134
Выполнение эксперимента. Опыт 1. Изучение совмещенных
протолитических и гетерогенных равновесий. В две пробирки вносят по
4—5 капель раствора хлорида магния и добавляют по каплям раствор
гидроксида натрия до образования осадка. В одну из пробирок добавляют
по каплям соляную кислоту, в другую — несколько кристаллов хлорида
аммония. Наблюдения записывают в лабораторный журнал.
Опыт 2. Изучение совмещенных гетерогенных и лигандообменных
равновесий. 2а. В две пробирки помещают по 3—4 капли раствора иоди-
да калия, после чего добавляют по каплям раствор нитрата свинца(П) до
образования осадка. В одну из пробирок добавляют по каплям насыщен-
ный раствор иодида калия, другую пробирку оставляют для контроля.
Наблюдения записывают в лабораторный журнал.
26. В две пробирки вносят по 3—4 капли раствора нитрата свин-
ца(П), в две другие — такой же объем раствора хлорида бария. В каждую
пробирку добавляют по каплям раствор оксалата натрия до образования
осадка. К двум осадкам оксалатов добавляют по каплям концентрирован-
ный раствор щелочи (пробирки 1 и 3), к двум другим — раствор ЭДТА
натрия (пробирки 2 и 4). Наблюдения заносят в таблицу по форме:
Пробирка Осадок Наблюдения при добавлении
КОН Ыа2ЭДТА
1 2 РЬС2О4 ВаС2О4
2в. В две пробирки вносят по 3—4 капли раствора хлорида
железа(Ш), в одну из пробирок добавляют раствор тартрата калия до об-
разования комплексного соединения (определяют по цвету), после чего в
обе пробирки — по каплям раствор гексацианоферрата(П) калия. Наблю-
дения записывают в лабораторный журнал.
Опыт 3. Совмещение нескольких типов равновесий. В пробирку
вносят 3—4 капли раствора сульфата меди, затем добавляют примерно
такой же объем раствора иодида калия. Отмечают характер наблюдаемых
изменений, после чего в пробирку добавляют по каплям раствор тио-
сульфата натрия, периодически встряхивая содержимое пробирки. На-
блюдения записывают в лабораторный журнал.
Опыт 4. Изучение условий образования фосфатов кальция. В три
пробирки отмеривают по 1 мл (точно, с помощью градуированной пипет-
ки или из бюретки) раствора хлорида кальция. В пробирки 1 и 2 добав-
ляют по 1 мл (точно) дистиллированной воды, в пробирку 3 добавляют 1 мл
(точно) раствора цитрата натрия. После этого в пробирки 1 и 3 отмери-
вают по 1 мл (точно) раствора гидрофосфата натрия, а в пробирку 2 — 1 мл
(точно) раствора дигидрофосфата натрия. Содержимое пробирок пере-
135
мешивают с помощью стеклянной палочки. Наблюдения записывают в
таблицу по форме:
Пробирка Содержимое пробирки Пс К, Наблю- дения Добавленный протолит Наблю- дения
1 2 3
На следующем этапе эксперимента в пробирку 1 прибавляют по кап-
лям соляную кислоту (с = 0,1 моль/л), а в пробирку 2 — по каплям рас-
твор гидроксида натрия (с = 0,1 моль/л). Содержимое пробирок при не-
обходимости перемешивают с помощью стеклянной палочки. Наблюде-
ния записывают в таблицу.
В лабораторный журнал записывают уравнения реакций (по всем
опытам). В выводах для каждого опыта указывают объект конкуренции,
конкурирующие между собой частицы и преобладающее направление
процесса. Для процессов, протекающих в опытах 1 и 2 (б и в), рассчиты-
вают с использованием справочных данных общую константу равновесия.
Вопросы к защите работы
1. Приведите примеры совмещенных равновесий и конкурирующих процессов,
характерных для живых систем (не менее двух).
2. Как pH влияет на растворимость осадков?
3. Объясните, почему осадок оксалата кальция растворяется в соляной кислоте,
но не растворяется в уксусной кислоте.
4. Объясните, почему осадок хлорида серебра растворяется в избытке аммиака,
а осадок иодида серебра — нет.
5. Выведите выражение для общей константы равновесия процесса растворе-
ния карбоната железа(П) в подкисленном растворе перманганата калия в
присутствии фторида калия.
Глава 7
Химия биогенных элементов.
Принципы качественного анализа
7.1. ДРОБНЫЙ И СИСТЕМАТИЧЕСКИЙ ХОД АНАЛИЗА
Основной задачей качественного анализа является обнаружение ве-
ществ, находящихся в интересующем нас объекте (биологические мате-
риалы, лекарственные препараты, продукты питания, объекты окружаю-
щей среды). В данном курсе рассматривается качественный анализ неор-
ганических веществ, являющихся электролитами, т. е. по сути качествен-
ный анализ ионов. Из всей совокупности встречающихся ионов выбраны
наиболее важные в медико-биологическом отношении: ионы биогенных
элементов (Fe3+, Fe2+, Zn2+, Са2+, Na+, К+, Mg2+, СГ, РО3", СО2" и др.),
ионы-токсиканты окружающей среды (Pb2+, NO,, NOj). Многие из этих
ионов входят в состав различных лекарственных препаратов и продуктов
питания.
В качественном анализе используются не все реакции, возможные
между теми или иными ионами, а только те, которые сопровождаются
отчетливым аналитическим эффектом.
Наиболее часто встречающиеся аналитические эффекты: появление
новой окраски, выделение газа, образование осадка.
Существуют два принципиально разных подхода к качественному
анализу: дробный и систематический.
В систематическом анализе обязательно используют групповые реа-
генты, позволяющие разделить присутствующие ионы на отдельные
группы, а в некоторых случаях и на подгруппы. Для этого часть ионов
переводят в состав нерастворимых соединений, а часть ионов оставляют
в растворе. После отделения осадка от раствора анализ их проводят раз-
дельно. Например, в растворе имеются ионы Al3+, Fe3+ и Ni2+. Если на
этот раствор подействовать избытком щелочи, выпадает осадок Fe(OH)3
и Ni(OH)2, а в растворе остаются ионы [А1(ОН)4]'. Осадок, содержащий
гидроксиды железа и никеля, при обработке аммиаком частично раство-
ряется за счет перехода в раствор [Ni(NH3)6]2+. Таким образом, с помо-
щью двух реагентов — щелочи и аммиака были получены два раствора [в
одном содержались ионы [А1(ОН)4]", в другом — ионы [Ni(NH3)4]2+ и
137
осадок Fe(OH)3], С помощью характерных реакций затем доказывается
наличие тех или иных ионов в растворах и в осадке, который предвари-
тельно нужно растворить. Щелочь и аммиак являются в данном случае
групповыми реагентами, потому что аналогично этим ионам в реакциях с
аммиаком и щелочью ведут себя и другие ионы (см. работу 6.6).
Существует несколько разновидностей систематического хода ана-
лиза: сероводородный, кислотно-основный, аммиачно-фосфатный. Оче-
видно, что деление ионов на группы зависит от набора выбранных груп-
повых реагентов и является относительным.
Систематический анализ используют в основном для обнаружения
ионов в сложных многокомпонентных смесях. Он очень трудоемок, од-
нако преимущество его заключается в легкой формализации всех дейст-
вий, укладывающихся в четкую схему (методику).
Для проведения дробного анализа используют только характерные
реакции. Очевидно, что присутствие других ионов может значительно
искажать результаты реакции (наложение окрасок друг на друга, выпаде-
ние нежелательных осадков и т. д.). Во избежание этого в дробном ана-
лизе используют в основном высокоспецифические реакции, дающие
аналитический эффект с наименее возможным числом ионов. Для успеш-
ного проведения реакций очень важно поддерживать определенные усло-
вия, в частности, pH. Очень часто в дробном анализе приходится прибе-
гать к маскировке, т. е. к переводу ионов в соединения, не способные да-
вать аналитический эффект с выбранным реактивом. Например, для об-
наружения иона никеля используется диметилглиоксим. Сходный анали-
тический эффект с этим реагентом дает и ион Fe2+. Для обнаружения Ni2+
ион Fe2+ переводят в прочный фторидный комплекс [FeF6]4 или же окис-
ляют до Fe3+, например, пероксидом водорода.
Систематический метод анализа со временем утрачивает свое значе-
ние. Это связано с появлением новых, специфических реактивов и разви-
тием физико-химических методов анализа.
Дробный анализ используют для обнаружения ионов в более про-
стых смесях. Время анализа значительно сокращается, однако при этом
от экспериментатора требуется более глубокое знание закономерностей
протекания химических реакций, так как учесть в одной конкретной ме-
тодике все возможные случаи взаимного влияния ионов на характер на-
блюдаемых аналитических эффектов достаточно сложно.
В аналитической практике часто применяют так называемый дроб-
но-систематический метод. При таком подходе используется минималь-
ное число групповых реактивов, что позволяет наметить тактику анализа
в общих чертах, который затем осуществляется дробным методом.
Одним из требований, которые предъявляются к аналитическим ре-
акциям, является высокая чувствительность, которую характеризуют от-
крываемым минимумом и предельным разбавлением. Открываемый ми-
138
нимум — это наименьшая масса (в микрограммах) вещества или иона,
которую можно обнаружить данной реакцией. Предельное разбавление
показывает, до какого максимального объема (в миллилитрах) можно
разбавить раствор, содержащий 1 г открываемого вещества или иона при
условии сохранения аналитического эффекта. Например, открываемый
минимум для ионов Си2+ реакцией с раствором аммиака составляет 0,2 мкг.
Предельное разбавление для Си2+ при реакции с аммиаком равно 250000.
Это означает, что для того, чтобы аналитический эффект данной реакции
был еще заметен, 0,2 мкг ионов меди(П) должно содержаться в объеме не
большем, чем 0,05 мл.
По технике проведения аналитических реакций различают реакции:
осадочные; микрокристаллоскопические; сопровождающиеся выделени-
ем газообразных продуктов; проводимые на бумаге; экстракционные;
цветные в растворах; окрашивания пламени.
При проведении осадочных реакций обязательно отмечают цвет и
характер осадка (кристаллический, аморфный), при необходимости про-
водят дополнительные испытания: проверяют осадок на растворимость в
сильных и слабых кислотах, щелочах и аммиаке, избытке реактива. Если
такие испытания не позволяют точно идентифицировать осадок, реакцию
проводят в микрокристаллоскопическом варианте. Осадок получают на
стеклянной пластинке и под микроскопом изучают форму его кристал-
лов. Следует иметь в виду, что в зависимости от концентрации веществ и
времени экспозиции (от момента получения осадка до наблюдения фор-
мы его кристаллов) могут получаться разные результаты.
При проведении реакций, сопровождающихся выделением газа,
отмечают его цвет и запах. В некоторых случаях проводят дополни-
тельные испытания. Например, если предполагают, что выделяющий-
ся газ — оксид углерода(1У), его пропускают через избыток известко-
вой воды.
В дробном и систематическом анализах широко используются реак-
ции, в ходе которых появляется новая окраска, чаще всего это реакции
комплексообразования (см. работу 6.7, опыт 1) или окислительно-восста-
новительные реакции.
В отдельных случаях такие реакции удобно проводить на бумаге
(капельные реакции). Реактивы, не подвергающиеся разложению в обыч-
ных условиях, наносят на бумагу заранее. Так, для обнаружения серово-
дорода или сульфид-ионов применяют бумагу, пропитанную нитратом
свинца [происходит почернение за счет образования сульфида свин-
ца(П)]. Многие окислители обнаруживают с помощью иод-крахмальной
бумаги, т. е. бумаги, пропитанной растворами иодида калия и крахмала.
В присутствии окислителя, например, нитрит-иона, выявляется синее
окрашивание. В большинстве же случаев необходимые реактивы наносят
на бумагу во время проведения реакции, например, ализарин на ион А13+,
139
купрон на ион Си2+ и др. Для усиления окраски иногда применяют экс-
тракцию в органический растворитель.
Для предварительных испытаний используют реакции окрашивания
пламени.
7.2. ГРУППОВЫЕ РЕАКЦИИ КАТИОНОВ И АНИОНОВ
В основе деления катионов на группы лежат реакции с кислотами и
основаниями. При последовательной обработке испытуемой смеси соля-
ной кислотой; серной кислотой; избытком щелочи в присутствии перок-
сида водорода; раствором аммиака выделяют следующие группы:
1. Ионы, не образующие осадки ни с одним из перечисленных реак-
тивов (Na+, К+, NH<).
2. Ионы, образующие нерастворимые хлориды (Pb2+, Ag+).
3. Ионы, образующие нерастворимые сульфаты (Pb2+, Са2+, Sr2*, Ва2+).
4. Ионы, образующие гидроксиды, растворимые в избытке щелочи
(Al3+, Cr3+, Zn2+).
5. Ионы, образующие гидроксиды, нерастворимые ни в избытке ще-
лочи, ни в аммиаке (Fe3+, Fe2+, Mn2+, Mg2+).
6. Ионы, образующие гидроксиды, растворимые в аммиаке (Со2+,
Cu2+, Ni2+, Hg2+, Cd2+).
Анионы делят на группы двумя способами: а) с использованием ре-
акций осаждения; б) с использованием окислительно-восстановительных
реакций.
При протекании реакций осаждения выделяют:
1) ионы, образующие осадки с нитратом серебра в присутствии
NOJ : СГ, Вг', Г, SCN", S2', S2O2’;
2) ионы, образующие осадки с хлоридом бария в нейтральной среде:
SO2', SO2', S2O2', РО3', В4О2', СО2';
3) ионы, не образующие осадки ни с одним из перечисленных реак-
тивов: сн3соо', no;, no;.
Анионы некоторых кислот при обработке сильными кислотами вы-
деляют газообразные продукты: NO; (образует бурый газ NO2), СО2",
S2', SO2', S2O2' (одновременно выпадает в осадок сера).
По возможности протекания окислительно-восстановительных реак-
ций выделяют:
1) анионы-окислители, реагирующие в кислой среде с иодидом ка-
лия с образованием иода (NO;, NO;);
140
2) анионы-восстановители, реагирующие с подкисленным раствором
перманганата калия (SO|", S2", S2O2", NO2, SCN", СГ, Br", Г).
Серосодержащие ионы (SO2", S2“, S2O2") являются более сильными
восстановителями по сравнению с остальными,, поэтому они способны
вступать в реакцию с иодом, менее сильным, чем перманганат калия,
окислителем;
3) анионы, не проявляющие окислительно-восстановительные свой-
ства в водных растворах, т. е. не вступающие в реакции ни с пермангана-
том калия, ни с иодидом калия (СО2-, РО4“, SO4", В4О2", СН3СОО~).
Работа 7.1. Качественные и групповые реакции ионов
Цель. Освоить технику проведения качественных и групповых реак-
ций на ионы биогенных элементов и элементов-токсикантов.
Оборудование. Штатив с пробирками; микроскоп; предметные стекла; изо-
гнутые стеклянные трубки, вставленные в пробки; стеклянные палочки; нихро-
мовая проволока; фильтровальная бумага; лакмусовая бумага синяя и красная;
универсальный индикатор.
Реактивы. Растворы сульфата натрия, сульфата калия, сульфата аммония,
сульфата алюминия, хлорида бария, хлорида кальция, хлорида магния, хлорида
цинка, хлорида хрома(Ш), хлорида кобальта(П), хлорида марганца(П), хлорида
железа(Ш), нитрита натрия, тиосульфата натрия, оксалата аммония, бромида ка-
лия, иодида калия, нитрата натрия, ацетата кальция, дихромата калия, дихромата
аммония, гексацианоферрата(111) калия, гексацианоферрата(П) калия (все — с
концентрацией 0,5 моль/л); нитрата свинца(П) (с = 0,2 моль/л); сульфата меди(П)
(с = 0,2 моль/л); ацетата натрия (с = 1 моль/л); перманганата калия (с = 0,05
моль/л); карбоната калия (с = 2 моль/л); пероксида водорода (с = 0,15 моль/л);
иодида калия (с = 0,1 моль/л); серной кислоты (с = 2 моль/л); азотной кислоты
(с = 2 моль/л); гидроксида натрия (с = 6 моль/л и с = 2 моль/л); аммиака (концен-
трированный и с = 2 моль/л); нитрата серебра (о = 0,1%); гидроксида кальция
(насыщенный); иода (1,3 г иода в 1 л воды); тиоцианата калия (насыщенный);
хлорная вода.
Выполнение эксперимента. Опыт 1. Изучение классификации
анионов, основанной на окислительно-восстановительных свойствах.
Раствор сульфита натрия наливают в три пробирки. В первую пробир-
ку добавляют раствор иодида калия и разбавленный раствор серной
кислоты, во вторую — водный раствор иода, в третью — раствор пер-
манганата калия слабо-розового цвета и разбавленный раствор серной
кислоты. Аналогично поступают с растворами бромида натрия, ацета-
та натрия и нитрита натрия. Результаты наблюдений записывают в
таблицу по форме:
141
Изучаемый анион Наблюдения при добавлении реактива
Г, Н+ МпО4, н+
SOj" Вг" СН3СОО" NOj
Опыт 2. Изучение действия сильных кислот на анионы. В три про-
бирки наливают по 1 мл растворов: а) нитрита натрия; б) тиосульфата
натрия; в) карбоната натрия. В каждую пробирку добавляют по несколь-
ко капель разбавленного раствора серной кислоты. Наблюдаемые изме-
нения записывают в лабораторный журнал.
Опыт 3. Использование осадочных реакций для обнаружения ионов
щелочно-земельных металлов и галогенид-ионов. За. Обнаружение иона
Ва2+. В пробирку помещают 3—4 капли раствора хлорида бария, 2—3
капли раствора ацетата натрия, после чего по каплям добавляют раствор
дихромата калия.
36. Обнаружение иона Са2+. В пробирку помещают 3—4 капли рас-
твора хлорида кальция и затем по каплям прибавляют раствор оксалата
аммония. Образовавшийся осадок испытывают на растворимость в ук-
сусной кислоте. Для этого к осадку добавляют 2—3 капли раствора ук-
сусной кислоты, содержимое пробирки нагревают и взбалтывают.
Зв. Обнаружение ионов СГ и Вг. В одну пробирку помещают 3—4
капли раствора хлорида калия, в другую — такой же объем бромида ка-
лия. В каждую пробирку добавляют по 1—2 капли раствора нитрата се-
ребра, до образования осадка. Осадки проверяют на растворимость в рас-
творе карбоната аммония. Для этого к полученным осадкам прибавляют
по 10—15 капель 15%-го раствора карбоната аммония и энергично взбал-
тывают в течение 1—2 мин.
В лабораторном журнале записывают уравнения реакций и наблю-
дения. Некоторые другие осадочные реакции изучались ранее (см. работу
6.5, опыт 7).
Опыт 4. Использование микрокристаллоскопических реакций для
обнаружения ионов s-элементов. На предметное стекло наносят 1 каплю
раствора соли, содержащей испытуемый ион. Стекло осторожно прогре-
вают в пламени газовой горелки, выпаривая досуха раствор. К сухому
остатку соли после охлаждения стекла на воздухе добавляют 1 каплю
раствора реактива. Образующиеся кристаллы рассматривают под микро-
скопом.
Для обнаружения иона К+ используют гексанитрокупрат(П) натрия
свинца:
142
2К+ + Na2Pb[Cu(NO2)6] -» K2Pb[Cu(NO2)6] + 2Na+
(черные кубические кристаллы)
Для обнаружение иона Na+ используют ацетат уранила-цинка
Na+ + Zn(UO2)3(CH3COO)g + СН3СОО^ NaZn(UO2),(CH3COO)9
(желтые тетраэдрические кристаллы)
Для обнаружения иона Са2+ используют серную кислоту (с = 2 моль/л)
(форма кристаллов сульфата кальция зависит от концентрации ионов Са2+).
В лабораторном журнале записывают уравнения реакций и зарисо-
вывают форму образовавшихся кристаллов.
Опыт 5. Использование реакций, сопровождающихся выделением
газа, для обнаружения ионов летучих кислот и оснований. 5а. Обнаруже-
ние ионов NHi. В пробирку помещают 3—4 капли раствора хлорида ам-
мония и добавляют 2—3 капли концентрированного раствора щелочи
(NaOH или КОН). Пробирку слегка нагревают и к ее отверстию подносят
влажную красную лакмусовую бумажку.
2- 2-
56. Обнаружение ионов СОч и SO3 . В пробирку, снабженную газо-
вой трубкой, помещают несколько кристалликов сульфита натрия, после
чего добавляют несколько капель раствора серной кислоты (с = 2 моль/л).
Отверстие пробирки быстро закрывают пробкой с отводной трубкой, ко-
торую опускают сначала в пробирку с насыщенным раствором гидрокси-
да кальция (известковой водой), а затем — в пробирку с подкисленным
раствором перманганата калия (слабо-розового цвета).
Опыт повторяют, помещая в пробирку, снабженную газовой трубкой
раствор карбоната натрия.
Уравнения реакций и наблюдения записывают в таблицу по форме:
Испытуемая соль Изменения, происходящие при пропускании выде- лившегося газа через раствор
Са(ОН)2 (насыщ) КМпО, (подкисленн)
Na2SO3 (к) Na2CO3 (р-р)
Опыт 6. Использование реакций, проводимых на бумаге, для обна-
ружения ионов железа. На фильтровальную бумагу на некотором удале-
нии друг от друга наносят по одной капле растворов сульфата железа(П)
и хлорида железа(Ш). В центр пятна, содержащего соль железа(П), до-
бавляют 1 каплю раствора гексацианоферрата(Ш) калия. Пятно, содер-
жащее соль железа(Ш), обрабатывают одной каплей раствора гексациа-
ноферрата(П) калия. Наблюдения и уравнения реакций записывают в ла-
бораторный журнал.
143
Опыт 7. Использование экстракционных реакций для обнаружения
ионов ВГ и Г. В одну пробирку помещают 10—15 капель раствора бро-
мида калия, в другую — такой же объем раствора иодида калия, В каж-
дую пробирку добавляют по 3—4 капли хлорной воды и разбавленного
раствора серной кислоты. Содержимое пробирок встряхивают, после чего
наблюдают изменение окраски. Затем в каждую пробирку прибавляют
примерно по 1 мл хлороформа. Содержимое пробирок вновь встряхивают
и после разделения слоев наблюдают за изменением цвета. Наблюдения и
уравнения реакций записывают в лабораторный журнал. Другая экстрак-
ционной реакция описана в работе 6.7 (опыт 2).
Опыт 8. Использование цветных реакций, проводимых в пробирке
для обнаружения ионов d-элементов. 8а. Обнаружение ионов Мп2+. В
пробирку помещают примерно по 15 капель раствора сульфата
марганца(П) и разбавленного раствора азотной кислоты, добавляют не-
сколько крупинок висмутата натрия NaBiO3. Содержимое пробирки
встряхивают и после отстаивания не вступившего в реакцию висмутата
натрия наблюдают окраску раствора.
В лабораторный журнал записывают наблюдения и уравнение реак-
ции (в ходе реакции образуются ионы Bi3+ и МпО4).
86. Обнаружение ионов Сг3*. В пробирку помещают примерно 15 ка-
пель раствора хлорида хрома(Ш), добавляют по каплям концентрирован-
ный раствор гидроксида натрия до полного растворения первоначально
выпавшего осадка и затем — 5—6 капель раствора пероксида водорода.
Содержимое пробирки осторожно нагревают. Наблюдают цвет раствора,
обусловленный возникновением хромат-ионов. Пробирку с полученным
раствором охлаждают под струей холодной воды, добавляют еще 2—3
капли раствора пероксида водорода, затем — 10—15 капель амилового
спирта и сразу подкисляют раствором серной кислоты (2—3 капли). На-
блюдают окраску органического слоя, обусловленную образованием ок-
сид-дипероксида хрома СгО5. В лабораторный журнал записывают на-
блюдения и уравнения реакций.
Опыт 9. Использование окрашивания пламени для обнаружения
ионов s-элементов. Кончик нихромовой проволочки погружают в про-
бирку с соляной кислотой, после чего прокаливают его в несветящейся
части пламени горелки до исчезновения окраски пламени.
Охлажденную проволочку смачивают исследуемым раствором или
же захватывают ею несколько мелких кристаллов исследуемой соли, по-
сле чего вносят в верхнюю часть пламени горелки. Наблюдают окраску
пламени. При проведении опыта с солью калия окраску пламени наблю-
дают через сине-зеленый светофильтр, поглощающий желтые лучи (соли
натрия, почти всегда присутствующие в виде примеси, маскируют окра-
шивание пламени). Наблюдения записывают в таблицу по форме:
144
Исследуемый катион Окраска пламени
Li+
К+
Na+
Са*+
Sr*+
Ва*+
Вопросы к защите работы
1. Приведите примеры катионов и анионов, которые могут быть обнаружены с
помощью окислительно-восстановительных реакций.
2. Присутствие каких ионов может быть обнаружено по образованию летучих
веществ: SO*", РО^", SO32', СО*", Na+, NHJ ?
3. Какие ионы образуют окрашенные комплексные соединения: Cu+, Cu*+, Fe*+,
Fe3+, Ag+, Zn*+, Co3+?
4. Как доказать наличие ионов Cu*+ и Ag+ в одном растворе?
Работа 7.2. Анализ неизвестного вещества
Цель. Освоить методику дробно-систематического анализа неиз-
вестной соли. Установить, какие ионы входят в состав соли, водный рас-
твор которой выдан преподавателем в качестве контрольно-аналитичес-
кой задачи.
Оборудование. См. работу 7.1.
Реактивы См. работу 7.1.
Выполнение эксперимента. В состав анализируемой соли могут
входить следующие ионы: Na+, К+, NH*, Са*+, Ва2+, Mg2+, Fe2+, Fe3+, Со2+,
Cu2+, Mn2+, Zn2+, Al3+, Cr3+, Pb2+, СГ, Вг", Г, SO*", SO2’, CO2’, NO3",
NO’, S2O*’, PO3", CH3COO’.
1. Предварительные испытания включают описание цвета и опреде-
ление pH раствора.
1а. Обращают внимание на цвет анализируемого раствора. Некото-
рые аква-ионы имеют окраску: Си2+ — голубую; Fe3+ — желтую; Сг3+ —
фиолетово-зеленую; Со2+ — розовую. Вывод о наличие или отсутствии
тех или иных ионов по окраске раствора носит ориентировочный харак-
тер, он не позволяет полностью исключить из дальнейших исследований
какие-либо ионы.
145
16. Определяют pH раствора. С помощью универсальной индикатор-
ной бумаги определяют pH водного раствора анализируемой соли и pH
дистиллированной воды, находящейся в равновесии с воздухом. Одина-
ковые значения pH указывают на то, что анализируемая соль гидролизу
не подвергается. Сдвиг pH в кислую область указывает на то, что соль
образована слабым основанием, т. е. в растворе могут быть катионы
NH4, Fe2+, Fe3+, Со2+, Mn2+, Zn2+, Al3+, Cr3+, Pb2+. В том случае, если pH
водного раствора анализируемой соли больше pH и дистиллированной
воды, можно предположить наличие в контрольной задаче анионов сла-
бых кислот: SO2', СО2', РО4~, СН.СОО". Характер вывода на этом
этапе исследования только ориентировочный.
2. Проводят групповые реакции катионов.
2а. Обнаружение катионов, образующих нерастворимые карбонаты.
К 5 каплям анализируемого раствора добавляют 3—4 капли раствора
карбоната калия и отмечают, образовался ли осадок. Нерастворимые кар-
бонаты или гидроксиды образуют все катионы, кроме К+, Na+, NH4. Ха-
рактер вывода — однозначный, т. е. образование осадка позволяет ис-
ключить дальнейшие испытания на К+, Na+, NH4, а отсутствие осадка
указывает на то, что в анализируемом растворе может быть только один
из перечисленных ионов (К+, Na+ или NH4). Остальные ионы в схему
дальнейших исследований не включаются.
26. Обнаружение катионов, образующих нерастворимые гидроксиды,
проводят только при положительном результате испытания. К 10 — 15 кап-
лям анализируемого раствора добавляют по каплям раствор гидроксида
натрия, с = 2 моль/л. Наблюдают, образуется ли осадок, отмечают его
цвет. Многие гидроксиды образуют гелеобразные осадки. Гидроксиды
магния, свинца, алюминия и цинка — белого цвета. Гидроксид марганца
(И) — белый, постепенно темнеющий на воздухе. Гидроксид железа(П)
— белый, на воздухе мгновенно становится зеленоватым, а затем, спустя
некоторое время, — бурым. Гидроксид хрома(Ш) выделяется в виде
хлопьев от серо-зеленого до фиолетового цвета. Гидроксид меди(П) — сине-
го цвета. При большой концентрации соли в контрольной задаче возмож-
но образование также осадка Са(ОН)2 и даже Ва(ОН)2. Характер вывода:
при положительной пробе (образовался осадок) — ориентировочный
(возможно неправильное заключение из-за ионов кальция и бария), при
отрицательной пробе (осадок отсутствует) — однозначный.
2в. Обнаружение катионов, образующих прочные гидроксокомплек-
сы. Осадок, полученный при проведении испытания 26, делят на две час-
ти. К одной части осадка добавляют концентрированный раствор гидро-
ксида натрия. Растворение осадка происходит за счет образования рас-
146
творимых гидроксомплексов [Zn(OH)4]2', [РЬ(ОН)4]2’, [А1(ОН)4]“ (все —
бесцветные), [Сг(ОН)4]~ (сине-фиолетовый). При недостатке щелочи
осадки могут раствориться не полностью. В избытке концентрированного
раствора щелочи возможно частичное или полное растворение осадка
Си(ОН)2 с образованием темно-синего раствора. Гидроксид железа (III) в
этих условиях может образовывать высокодисперсный коллоидный рас-
твор, который необходимо отличить от истинного раствора. Характер
вывода: при положительной и отрицательной пробе — ориентировочный.
2г. Обнаружение катионов, образующих прочные амминокомплек-
сы. Ко второй части осадка гидроксидов (испытание 26) добавляют кон-
центрированный раствор аммиака. Наблюдают, растворяется ли осадок,
отмечают цвет образующегося раствора.
Растворы амминокомплексов: [Zn(NH3)4]2+ — бесцветный,
[Cu(NH3)4]2+ — темно-синий, [Co(NH3)4]2+ — грязно-желтый, постепенно
переходящий в вишневый за счет окисления Со2+ до Со3+. Характер вы-
вода: при положительной пробе (осадок растворился) однозначный для
Си2+ (темно-синий цвет), ориентировочный для других катионов.
3. Характерные реакции катионов.
Характерные реакции проводят только на те катионы, которые отве-
чают аналитическим эффектам, наблюдавшимся при проведении предва-
рительных испытаний и групповых реакций, т. е. не были исключены в
результате проведения предшествующих испытаний.
Характерные реакции рекомендуется проводить «со свидетелем»:
одним и тем же реактивом действовать и на анализируемый раствор, и на
раствор соли, содержащей ион, наличие которого предполагается .
Для обнаружения ионов используются реакции, описанные в неко-
торых работах гл. 6 и в работе 7.1:
Na+ — работа 7.1, опыт 4 (с. 142);
К+ — работа 6.5, опыт 7а (с. 111); работа 7.1, опыт 4 (с. 142);
NHJ — работа 6.5, опыт 76 (с. 112);
Са2+ — работа 7.1, опыт 3 и 4 (с. 142);
Ва2+ — работа 7.1, опыт 3 (с. 142);
Fe2+ и Fe3+ — работа 7.1, опыт 6 (с. 143);
Со2+ — работа 6.7. опыты 1в и 2 (с. 119, 120);
Мп2+ — работа 7.1, опыт 8 (с. 144);
Zn2+ — работа 6.7, опыт 16 (с. 119);
А13+ — работа 6.7, опыт 1а (с. 118);
РЬ2+ — работа 6.12, опыт 26 (с. 135).
147
Ион Cu2+ открывается при проведении групповой реакции с аммиа-
ком. Порядок проведения реакций произвольный, однако перед обнару-
жением иона К+ следует проверить наличие иона NH^.
По результатам предварительных испытаний, групповых и характер-
ных реакций делают вывод относительно того, какой катион присутству-
ет в анализируемом растворе.
4. Ограничение круга анионов, которые могут присутствовать в ана-
лизируемом растворе. Из схемы дальнейших исследований исключают те
анионы, которые образуют нерастворимые соли с катионом, наличие ко-
торого установлено в растворе. Например, если в растворе обнаружен
ион РЬ2+, то в растворе не могут присутствовать анионы СГ, SO2-, SO2',
СО2', РО3'.
5. Групповые реакции анионов.
5а. Обнаружение анионов, образующих нерастворимые соли бария.
К 10—15 каплям анализируемого раствора (если исходный раствор кис-
лый, его нейтрализуют аммиаком) добавляют 6—8 капель раствора хло-
рида бария. Наблюдают, образуется ли осадок. Проверяют его раствори-
мость в соляной кислоте. Нерастворимые соли бария, растворимые в НО:
сульфит бария, тиосульфат бария, карбонат бария, фосфат бария. Нерас-
творимая соль бария, нерастворимая в НО — сульфат бария. Все осадки
белого цвета. Характер вывода: однозначный в случае сульфат-иона, ори-
ентировочный во всех остальных случаях.
56. Обнаружение катионов, образующих нерастворимые соли сереб-
ра. К 2—3 каплям анализируемого раствора добавляют 1 каплю раствора
нитрата серебра и 1 каплю раствора азотной кислоты. Наблюдают, обра-
зуется ли осадок, отмечают его цвет. В осадок переходят галогенид-ионы
(AgCl — белый, AgBr и Agl — желтые). Характер вывода: ориентиро-
вочный, так как желтый цвет не всегда отчетливо наблюдается.
5в. Обнаружение анионов, обладающих восстановительными свой-
ствами. Испытание не проводят, если в растворе обнаружены катионы
Fe2+ (окисляется перманганатом калия), Fe3+, Со, Cr3+, Си2+ (маскируют
окраску).
К 10—15 каплям анализируемого раствора добавляют 2—3 капли
разбавленного раствора серной кислоты и 1 каплю раствора перманганата
калия. Наблюдают, происходит ли ослабление розовой окраски. Перман-
ганат калия обесцвечивается анионами-восстановителями: сульфитом,
тиосульфатом, бромидом, иодидом, нитритом. Хлорид-ион реагирует
медленно. Характер вывода: при положительной пробе (обесцвечивание
розового раствора) — ориентировочный, при отрицательной пробе —
однозначный для всех ионов, кроме СГ.
148
5г. Обнаружение анионов летучих кислот. К 10—15 каплям анализи-
руемого раствора добавляют 2—3 капли раствора серной кислоты. На-
блюдают, выделяются ли газообразные продукты, отмечают цвет и запах
газа. Наблюдают, образуется ли осадок. Анионы летучих кислот и газо-
образные продукты, выделяющиеся при подкислении:
карбонат — СО2 (бесцветный, без запаха);
сульфит — SO2 (бесцветный, резкий запах);
тиосульфат — SO2, одновременно происходит помутнение раствора;
нитрит — NO2 (бурый, запах не проверяют — ядовит).
Характер вывода при положительной пробе — однозначный для
NOj, SjOj-, для остальных — ориентировочный.
6. Характерные реакции анионов.
6а. Обнаружение SO4", S2O2 проводится при действии групповых
реактивов.
66. Обнаружение NO2 проводится надежно в ходе действия группо-
вых реактивов. На его присутствие указывают: окислительно-
восстановительная двойственность (положительные результаты при дей-
ствии иодида калия в кислой среде и перманганата калия в кислой среде)
и выделение бурого газа при подкислении раствора.
6в. Обнаружение СО,’ и SO*" описано в работе 7.1 (опыт 56).
6г. Обнаружение РО^’. К 10—15 каплям анализируемого раствора
добавляют по каплям магнезиальную смесь, содержащую хлорид аммо-
ния, хлорид магния и аммиак. При наличии фосфат-ионов образуется
белый осадок MgNH4PO4, растворимый в соляной кислоте.
6д. Обнаружение NOJ. К 3—4 каплям раствора дифениламина в
концентрированной серной кислоте добавляют 1—2 капли предваритель-
но разбавленного в 5 раз дистиллированной водой анализируемого рас-
твора. В присутствии NO, появляется интенсивно-синяя окраска раство-
ра вследствие окисления дифениламина. Аналогичную реакцию дает NO2.
Реакцию можно проводить и в пробирке, и на предметном стекле.
При работе с указанным реактивом соблюдают особую осторожность.
бе. Обнаружение галогенид-ионов. При положительном результате
групповой реакции с нитратом серебра (пункт 56) с небольшой пробой
анализируемого раствора проводится экстракционная реакция с хлорной
водой; Вг’ и Г идентифицируются по цвету слоя хлороформа (см. работу
7.1, опыт 7). Отрицательный результат в этой реакции позволяет методом
исключения установить наличие СГ в растворе. Хлорид серебра раство-
ряется в 15%-ом растворе карбоната аммония.
149
6ж. Обнаружение СН3СОО . В пробирку помещают 5—6 капель
анализируемого раствора, добавляют 2 капли концентрированной серной
кислоты и осторожно нагревают. В присутствии ацетат-ионов ощущается
характерный запах уксуса.
По результатам групповых и характерных реакций делают вывод о
наличии анионов в анализируемом растворе.
В лабораторном журнале описывают этапы выполнения работы.
Обязательно отмечают, какие операции проводились (реактивы, условия,
оборудование); что при этом наблюдалось; какие из этого были сделаны
выводы. Формулируют вывод по работе в целом. Приводят уравнения
реакций, давших положительный результат.
Вопросы и задачи к гл. 7
1. Как распределены биогенные элементы по s-, р-, d- и /-блокам?
2. Как распределены биогенные элементы по периодам периодической системы
элементов?
3. Какие ионы могут замещать кальций в костной ткани: Fe2+, Fe3+, Pb2+, СО2",
S2+, Cs+, Br", F?
4. Рассчитайте массу осадка, получаемого при действии 1,03 г бромида натрия
на раствор, содержащий 1,8 г нитрата серебра и 2,6 г нитрата свинца?
Глава 8
Электрохимия
Электрохимические методы анализа, в частности кондуктометрию,
потенциометрию и вольтамперометрию, широко применяют в медико-
биологоческих исследованиях.
8.1. КОНДУКТОМЕТРИЯ
Кондуктометрией называют электрохимический метод анализа, ос-
нованный на изучении электрической проводимости проводников ионно-
го типа, т. е. проводников электричества II рода.
Биожидкости организма, внутри- и межклеточная жидкость содер-
жат сильные и слабые электролиты, играющие большую роль в функцио-
нировании живых систем. Ключевые биохимические процессы в орга-
низме протекают при непосредственном участии электролитов: они от-
ветственны за проведение нервных импульсов; проницаемость биологи-
ческих мембран во многом определяется концентрацией электролитов.
Определение содержания электролитов в тканях и жидкостях позволяет
проводить диагностику патологических состояний, определять константы
важных биохимических процессов.
В кондуктометрических исследованиях основной эксперименталь-
ной величиной, получаемой при прямых измерениях, является сопротив-
ление раствора электролита. Величину, обратную сопротивлению, назы-
вают электрической проводимостью: L = MR. Электрическая проводи-
мость проводников II рода, так же как и I рода, зависит от геометриче-
ских параметров:
L = - = x-, (8.1)
R Г
где х — удельная электрическая проводимость; S — площадь электродов;
/ — расстояние между двумя параллельными электродами.
В СИ удельную электрическую проводимость выражают в См-м-1,
допускается также использование дольной единицы Ом^'-см-1.
Во многих случаях для сравнения различных электролитов с точки
зрения их способности проводить электрический ток используют понятие
молярной электрической проводимости, которую находят по соотноше-
нию
151
(8.2)
Х = ——,
с(ХХ)’
где с(/Х) — молярная концентрация эквивалента электролита.
Молярную электрическую проводимость выражают в Смм^моль'1,
допускается также использование дольной единицы Ом"*-см2-моль ’.
Удельная и молярная электрическая проводимости зависят от при-
роды электролитов, свойств растворителя (диэлектрической проницаемо-
сти, вязкости), температуры, концентрации (или разведения 1/с). Моляр-
ная электрическая проводимость возрастает с увеличением 1/с, достигая
предельного значения Х...^. Эту величину принято называть молярной
электрической проводимостью при бесконечном разведении. Согласно
закону независимого движения ионов (Кольрауш, 1879), молярная элек-
трическая проводимость слабых электролитов представляет собой сумму
предельной молярной электрической проводимости катиона /(/Kt+) и
аниона /(/Ап"):
^=((XKt+) + /(XAn-). (8.3)
Предельные молярные электрические проводимости ионов приведе-
ны в справочниках (см. приложение, табл. 24).
Степень ионизации слабых электролитов а рассчитывают по урав-
нению Аррениуса:
(8.5)
а = Х/Хмю- (8-4)
Используя закон разведения Оствальда и уравнение Аррениуса,
можно выразить константу ионизации слабого электролита через данные
кондуктометрического исследования:
к*с
Кондуктометрический метод широко применяют для определения
концентрации электролитов в растворах. При прямых кондуктометриче-
ских измерениях предварительно строят градуировочный график, выра-
жающий зависимость электрической проводимости от концентрации
£ =/(с), по которому затем проводят определение концентрации электро-
литов в исследуемых растворах. В косвенных кондуктометрических ме-
тодах измерение электрической проводимости используют в качестве
вспомогательного метода, например, для обнаружения точки эквивалент-
ности в титриметрических методах (кондуктометрическое титрование).
В кондуктометрическом титровании чаще всего используют реакции
между кислотами и основаниями и реакции осаждения. Кислотно-
основное кондуктометрическое титрование основано на аномально высо-
152
Рис. 8.1. Кривые кондуктометрического титрования:
а — сильной кислоты сильным основанием; б — слабой кислоты сильным основанием;
в — смеси сильной и слабой кислот сильным основанием
ких значениях предельной молярной электрической проводимости ионов
Н3О+ и ОРГ. На рис. 8.1 приведены кривые кондуктометрического титро-
вания различных кислот сильным основанием.
При титровании сильной кислоты сильным основанием (рис 8.1, а)
уменьшение электрической проводимости на участке ab связано с тем,
что в растворе убывает концентрация ионов Н3О+. Несмотря на то что
общая концентрация ионов в растворе остается примерно постоянной (за
счет поступления катионов основания), электрическая проводимость
снижается, так как электрическая подвижность ионов Н3О+ значительно
выше электрической подвижности других катионов. После достижения
точки эквивалентности электрическая проводимость начинает резко воз-
растать (Ьс) за счет увеличения концентрации ОНГ-ионов, отличающихся
также большой электрической подвижностью.
При титровании слабой кислоты сильным основанием (рис.8.1, 6)
электрическая проводимость до достижения точки эквивалентности воз-
растает (ab), так как по мере прибавления титранта уменьшается концен-
трация неионизированных молекул кислоты за счет увеличения концен-
трации аниона этой кислоты. После достижения точки эквивалентности
электрическая проводимость продолжает возрастать более резко, так как
в системе накапливается избыток ОН*-ионов, значительно более подвиж-
ных, чем другие анионы (Ьс).
При титровании смеси сильной и слабой кислот (рис. 8.1, в) (или
двухосновной кислоты) первоначальное падение электрической прово-
димости объясняется аналогично тому, как падение электрической про-
водимости при титровании сильной кислоты (ab). Возрастание электри-
ческой проводимости на участке Ьс объясняется так же, как ее увеличе-
ние при титровании до точки эквивалентности слабой кислоты. После-
153
Рис. 8.2. Установка Кольрауша для измере-
ния сопротивления растворов электролитов:
АС — реохорд; D — подвижный контакт; / —
ячейка; 2 — телефонная трубка; « — генератор
переменного тока
дующее более резкое возраста-
ние электрической проводимо-
сти (cd) объясняется, как и в
двух предыдущих случаях.
Кондуктометрическое тит-
рование находит широкое при-
менение при определении кон-
центрации электролитов в раз-
бавленных растворах, в окра-
шенных и мутных средах, в ча-
стности в биожидкостях, а также
в растворах, содержащих силь-
ные окислители и восстановите-
ли, когда затруднено использо-
вание обычных индикаторов.
Преимуществом кондуктомет-
рического титрования является возможность автоматизации процесса.
В основе экспериментального определения сопротивления провод-
ников II рода лежит мостик Уитстона, модернизированный Кольраушем
для измерения сопротивления растворов электролитов (рис. 8.2). Отличие
установки Кольрауша заключается, во-первых, в использовании пере-
менного тока низкой частоты (до 1000 Гц) вместо постоянного, и, как
следствие, применение в качестве нуль-инструмента низкоомной теле-
фонной трубки. Переменный ток звуковой частоты используют для све-
дения к минимуму явлений электролиза и поляризации электродов, ис-
кажающих результаты измерений.
Установка Кольрауша содержит четыре сопротивления: RM — под-
бираемое экспериментально сопротивление на магазине сопротивлений;
Ri ий; — сопротивления участков реохорда, которые меняются пере-
движением скользящего контакта D для уравновешивания сопротивления
плеча, содержащего известное сопротивление /?м, и плеча, содержащего
измеряемое сопротивление Rx. При компенсации моста соблюдается условие
D
(8.6)
В этом случае через диагональ моста BD ток не протекает, что фик-
сируется по исчезновению звука в телефонной трубке.
Для кондуктометрических измерений используют платиновые элек-
троды, покрытые платиновой чернью для уменьшения поляризации элек-
тродов. Так как площадь платинированных электродов не может быть
определена геометрически, величину 1/S кондуктометрической ячейки,
необходимую для расчета удельной электрической проводимости, нахо-
дят экспериментально, измеряя сопротивление стандартного раствора.
154
Чаще всего используют раствор хлорида калия с концентрацией 0,02
моль/л, удельная электрическая проводимость которого при различных
температурах приведена в справочниках. Величину 1/5 называют посто-
янной кондуктометрической ячейки.
Работа 8.1. Определение степени и константы ионизации
слабого электролита
Цель. Приобрести навыки измерения сопротивлений проводников II
рода. Определить степень ионизации уксусной кислоты в растворах трех
концентраций и ее константу ионизации по данным кондуктометриче-
ских измерений.
Оборудование. Установка Кольрауша; пипетка вместимостью 20 мл; тер-
мометр до 50 °C, колба коническая вместимостью 20 мл.
Реактивы. Раствор хлорида калия (с = 0,02 моль/л); растворы уксусной ки-
слоты трех концентраций (0,025 моль/л, 0,05 моль/л, 0,1 моль/л).
Выполнение эксперимента. Предварительно определяют электри-
ческую проводимость раствора хлорида калия. Готовят к работе установ-
ку Кольрауша, проверяя правильность соединений частей установки.
Промывают сосуд и электроды дистиллированной водой, затем сполас-
кивают их раствором хлорида калия (с = 0,02 моль/л), после чего запол-
няют сосуд таким объемом раствора хлорида калия, чтобы электроды
были полностью погружены в исследуемый раствор.
Во избежание частичного удаления слоя платиновой черни не следу-
ет касаться поверхности электродов. В течение всей работы следят, что-
бы положение электродов друг относительно друга не изменялось. Со-
единяют зачищенные концы проводов, идущих от левой клеммы реохор-
да и от магазина сопротивлений, с электродами, погруженными в сосуд,
содержащий раствор хлорида калия.
Включают генератор переменного тока. Подвижный контакт D ста-
вят точно на середину реохорда. Убеждаются в наличии в телефоне дос-
таточно высокого и ровного звука. На магазине сопротивлений подбира-
ют такое сопротивление RM, при котором звук в телефонной трубке исче-
зает или становится минимальным. Контролируют правильность подоб-
ранного сопротивления RM на магазине перемещением подвижного кон-
такта D вправо и влево от середины реохорда, при этом звук в телефон-
ной трубке должен в каждом случае усиливаться.
Измеряемое сопротивление Rx будет равно подобранному сопротив-
лению магазина, если движок D стоит точно на середине реохорда. В том
случае, если это условие не соблюдается, Rx рассчитывают по уравнению,
полученному на основе закона Кирхгофа для разветвленной цепи:
155
(8.7)
Л =ЯМ------->
1000-а
где а — отрезок реохорда AD с сопротивлением (см. рис. 8.2).
Измерения проводят не менее трех раз. Результаты измерений запи-
сывают в лабораторный журнал.
Окончив измерения, выливают из сосуда раствор хлорида калия,
ополаскивают сосуд и электроды дистиллированной водой. После это-
го сосуд промывают раствором уксусной кислоты с наименьшей кон-
центрацией, заполняют сосуд этим раствором и проводят измерения
сопротивления раствора уксусной кислоты так же, как измеряли со-
противление раствора хлорида калия. Аналогичные измерения прово-
дят для растворов двух других концентраций, при этом каждый раз
электроды и сосуд обязательно ополаскивают тем раствором, сопро-
тивление которого будут измерять. Результаты всех измерений запи-
сывают в лабораторный журнал.
После окончания всех измерений генератор переменного тока вы-
ключают, электроды отсоединяют, раствор из сосуда выливают. Элек-
троды промывают дистиллированной водой и оставляют их погружен-
ными в дистиллированную воду.
Обработка результатов эксперимента. Рассчитывают средние зна-
чения сопротивлений исследованных растворов. Постоянную кондукто-
метрической ячейки 1/S вычисляют по уравнению (8.1). Удельную элек-
трическую проводимость раствора хлорида калия находят в справочнике.
По рассчитанным средним значениям сопротивлений растворов ук-
сусной кислоты и найденной постоянной кондуктометрической ячейки
вычисляют значения удельной электрической проводимости х растворов
уксусной кислоты.
Молярную электрическую проводимость X уксусной кислоты при
данной концентрации рассчитывают по уравнению (8.2). По уравне-
нию (8.3) рассчитывают Хмакс (СН3СООН). Затем вычисляют степень и
константу ионизации уксусной кислоты [уравнения (8.4) и (8.5)].
Строят графики зависимости х =Дс) и X = Д1/с). Рассчитывают отно-
сительную ошибку определенной константы ионизации уксусной ки-
слоты:
Относительная ошибка = —^та6л 100%,
Кта6л
где Кжп — среднее значение константы ионизации из трех определений;
Х^табл — табличное значение константы ионизации уксусной кислоты (см.
приложение 17).
156
Вопросы к защите работы
1. Каким образом можно измерить сопротивление раствора электролита?
2. Какие растворы можно использовать для определения постоянной кондукто-
метрической ячейки?
3. С какой целью поверхность платиновых электродов покрывают платиновой
чернью?
4. Почему в установке Кольрауша используют ток звуковой частоты?
5. Объясните изменение удельной электрической проводимости с уменьшени-
ем концентрации для сильных и слабых электролитов.
6. Объясните изменение молярной электрической проводимости с уменьшени-
ем концентрации для сильных и слабых электролитов.
7. Сформулируйте закон Кольрауша о независимой подвижности ионов. Запи-
шите математическое выражение этого закона и укажите его практическое
значение.
8. Сформулируйте закон разведения Оствальда и запишите математическое
выражение этого закона.
Работа 8.2. Кондуктометрическое титрование
Цель. Приобрести навыки кондуктометрического титрования. Опре-
делить концентрацию раствора кислоты титрованием щелочью с кондук-
тометрической индикацией точки эквивалентности.
Оборудование. Установка Кольрауша; бюретка вместимостью 25 мл; пи-
петка вместимостью 10 мл; стеклянная палочка.
Реактивы. Раствор гидроксида натрия (титрованный, с = -0,1 моль/л), ис-
следуемый раствор кислоты (смеси кислот).
Выполнение эксперимента. В лабораторном журнале записывают
концентрацию титранта — раствора NaOH.
Установку Кольрауша готовят к работе, проверяя правильность со-
единения отдельных частей установки (см. рис 8.2). В сосуд для измере-
ния сопротивления наливают пипеткой 10,0 мл исследуемого раствора
электролита неизвестной концентрации. Если электроды не полностью
погружены в раствор, в сосуд добавляют дистиллированную воду. Со-
единяют зачищенные концы проводов, идущих от левой клеммы реохор-
да и от магазина сопротивлений, с электродами.
Включают генератор переменного тока, подвижный контакт ставят
либо на отметку реохорда 300 мм (при титровании сильной кислоты или
ее смеси со слабой кислотой), либо на отметку 700 мм (при титровании
слабой кислоты). Убеждаются в наличии в телефонной трубке достаточ-
но высокого и ровного звука. На магазине сопротивлений подбирают та-
кое сопротивление, при котором звук в телефонной трубке исчезает или
157
становится минимальным. Сопротивление магазина сопротивлений ос-
тавляют постоянным до конца титрования.
Из бюретки к исследуемому раствору прибавляют 1,00 мл (или 0,50 мл)
стандартного раствора щелочи. После добавления раствора щелочи со-
держимое сосуда тщательно перемешивают стеклянной палочкой и нахо-
дят положение движка, соответствующее минимуму звука в телефонной
трубке. Измеряют отрезок а (длина отрезка реохорда от его начала до
движка в положении, соответствующем минимуму звука в телефонной
трубке) и результат записывают в лабораторный журнал. Добавление
раствора щелочи по 1,00 мл (или по 0,50 мл) и все последующие опера-
ции повторяют несколько раз до тех пор, пока не получатся три убываю-
щих значения отрезка а при титровании сильной кислоты или до получе-
ния резко убывающих значений величины отрезка а при титровании рас-
твора слабой кислоты (или смеси сильной и слабой кислот). Результаты
всех измерений записывают в лабораторный журнал. Окончив измерения,
отключают ток и приводят в порядок рабочее место (см. работу 8.1).
Обработка результатов эксперимента. По полученным данным
строят кривую кондуктометрического титрования, откладывая по оси
абсцисс суммарный объем прилитой щелочи, а по оси ординат — соот-
ветствующую длину отрезка а. Определяют точку эквивалентности,
опустив из точки пересечения двух прямых перпендикуляр на ось абс-
цисс. При титровании смеси слабой и сильной кислот определяют две
точки эквивалентности и, следовательно, два значения эквивалентного
объема. Объем, соответствующий второй точке эквивалентности, находят
как разность между объемом, затраченным на достижение второй точки
эквивалентности, и объемом, соответствующим первой точке эквива-
лентности. Записывают значение эквивалентного объема щелочи и рас-
считывают концентрацию исследуемого раствора кислоты по уравнению
(2.1), подставляя соответствующий объем щелочи. Для одноосновных
кислот и однокислотных оснований молярная концентрация эквивалента
равна молярной концентрации.
Вопросы к защите работы
1. Почему при построении кривой кондуктометрического титрования на оси
ординат вместо электрической проводимости можно откладывать значение
отрезка а?
2. Когда заканчивают кондуктометрическое титрование?
3. Изобразите кривую кондуктометрического титрования раствора пропионовой
кислоты раствором щелочи. Объясните ход кривой.
4. Изобразите схематично кривую титрования смеси NH3 и КОН раствором
сильной кислоты.
5. Почему нельзя проводить измерения сопротивления раствора, если электро-
ды не полностью погружены в раствор?
158
8.2. ПОТЕНЦИОМЕТРИЯ
Потенциометрией называют совокупность методов исследования и
определения различного рода величин, основанных на измерении элек-
тродвижущих сил гальванических элементов.
Потенциометрия — незаменимый во многих случаях метод опреде-
ления концентрации физиологически активных ионов (Н3СГ, К+, Na+,
Са2+, NH^, СГ, Вг , Г и др.) в биологических жидкостях (крови,
спинномозговой жидкости и др.) и тканях организма.
Измерение биопотенциалов лежит в основе таких ценных диагности-
ческих методов, как электрокардиография, электроэнцефалография и др.
Потенциал, возникающий на границе раздела металл — раствор соли
этого металла, называют электродным. Его величина ф определяется
уравнением Нернста:
Ф = ф° + -^-ln at, (8.8)
zF
где ф° — стандартный потенциал электродной реакции (при температуре
Т = 298 К и активности иона металла а, = 1); z — число электронов, те-
ряемых атомом металла при образовании катиона; R — универсальная
газовая постоянная; F— постоянная Фарадея (96 500 Кл/моль).
Если инертный металл (например, платина) опущен в раствор, со-
держащий окисленную и восстановленную форму одного или нескольких
веществ, на границе раздела фаз возникает потенциал, который называют
окислительно-восстановительным или редокс-потенциалом. Его величи-
на рассчитывается по уравнению Нернста (6.29).
Если границей раздела фаз служит мембрана, способная избиратель-
но обменивать ионы, входящие в ее состав, с электролитом, возникаю-
щий потенциал принято называть мембранным.
Потенциометрические методы основаны на измерении потенциалов
электродов, являющихся функцией активности ионов в растворе. По-
скольку измерить абсолютное значение потенциала отдельно взятого
электрода невозможно, для практических целей измеряют разницу между
потенциалом измерительного электрода, который зависит от активности
определяемого иона, и электрода сравнения, потенциал которого извес-
тен и практически постоянен. Наиболее употребительными электродами
сравнения являются каломельный и хлорсеребряный. Потенциалы этих
электродов при разных значениях концентрации внутреннего электроли-
та (0,1 моль/л, 1 моль/л, насыщенный раствор) приводятся в справочни-
ках (см. приложение, табл. 22).
Основной задачей в потенциометрии является правильный выбор
измерительного электрода, который воспроизводимо бы отражал свойст-
ва раствора (в частности, активность ионов). По механизму возникнове-
159
ния потенциала различают ионно-металлические (сюда же относят и га-
зовые) электроды, редокс-электроды, мембранные электроды.
Ионно-металлический электрод, представляющий собой металл,
опущенный в раствор соли этого металла, функционирует как электрод I
рода, если его потенциал зависит от активности катиона в растворе. Если
же металлический электрод покрыт слоем, нанесенным электролитиче-
ским способом малорастворимой соли этого металла, то он функциони-
рует как электрод II рода, так как отражает активность аниона, образую-
щего эту малорастворимую соль.
В силу многих причин не все металлы могут быть использованы для
изготовления электродов, измеряющих активность их катионов. В этом
случае часто используют мембранные электроды, способные давать по-
тенциалы, зависящие от активности ограниченного числа ионов, а в неко-
торых случаях — только одного типа ионов. Такие электроды называют
ионоселективными электродами. Примером ионоселективного электрода
является стеклянный электрод, потенциал которого зависит от активно-
сти ионов Н3О\ В настоящее время разработаны электроды с жидкими
мембранами, позволяющими определять ионы Са2+ и К+ и др., и нашли
широкое применение в медицине.
Различают прямые и косвенные потенциометрические методы.
Прямые потенциометрические методы определения концентрации
тех или иных ионов требуют предварительного построения градуировоч-
ного графика.
Косвенные потенциометрические методы чаще всего используют
для обнаружения точки эквивалентности в титриметрических методах,
когда применение обычных индикаторов затруднено. В основе потен-
циометрического титрования обычно лежат те же реакции, что и в клас-
сических методах: кислотно-основные, окислительно-восстановительные,
осадительные, комплексообразования. Точку эквивалентности определя-
ют по резкому скачку потенциала измерительного электрода, более точно —
по максимуму первой производной ДЕ/ДИ или по изменению знака вто-
рой производной Д2Е/ДИ2 (рис 8.3).
Рис. 8.3. Определение точки эквивалентности в потенциометрии
160
Для измерения разности потенциалов электродов (ЭДС) составляют
гальваническую цепь, состоящую из измерительного электрода, электро-
да сравнения и раствора электролита, в который помещают электроды.
ЭДС гальванического элемента измеряют с помощью высокоомного
вольтметра, шкала которого проградуирована в милливольтах и единицах
pH. Порядок работы на одном из таких приборов -— иономере ЭВ-74
описан в разделе 6.4.
Работа 8.3. Измерение pH раствора с помощью
стеклянного электрода
Цель. Научиться определять pH жидкостей потенциометрическим
методом.
Оборудование. Иономер ЭВ-74; электроды стеклянный и хлорсеребряный;
химический стакан вместимостью 50 мл.
Реактивы. Буферные растворы с известными значениями pH; исследуемые
растворы с неизвестными значениями pH.
Выполнение эксперимента. Включают иономер ЭВ-74 в сеть (см.
рис. 6.2). После прогревания прибора в течение 20 мин приступают к ка-
либровке стеклянного электрода по раствору с известным значением pH.
Для этого в химический стакан вместимостью 50 мл наливают буферный
раствор с известным значением pH, опускают в стакан стеклянный и
хлорсеребряный электроды, которые подсоединяют к иономеру. Нажи-
мают клавишу «рХ» и клавишу интервала «-14-19». Поворачивая ручку
«Калибровка», подводят стрелку иономера по нижней шкале (№ 4) к то-
му значению pH, которое соответствует значению pH используемого для
калибровки буферного раствора. При использовании буферного раствора
с pH меньше 4 нажимают клавишу «-1ч-4» и стрелку вновь подводят к
значению pH буферного раствора, но уже по средней из трех верхних
шкал (№ 2). Если же значение pH используемого буферного раствора
больше 4, определяют узкий диапазон, в который попадает это значение,
нажимают нужную клавишу «4-?9» или «94-14» и стрелку подводят к зна-
чению pH 4 или pH 9 по нижней шкале из трех верхних шкал (№ 3).
Закончив калибровку электрода, переходят к измерению pH иссле-
дуемых растворов. В таблицу записывают шифр раствора, которым за-
полняют химический стакан. В стакан опускают электроды, после чего
измеряют приблизительное значение pH. Для этого нажимают клавиши
«рХ» и «-14-19». Приблизительное значение pH испытуемого раствора
определяют по шкале № 4, результат записывают в таблицу. Для более
точного определения значения pH нажимают клавишу того узкого диапа-
зона измерений, в который входит приблизительное значение pH, и сни-
6-366 161
мают показание по шкапе № 2 или шкале № 3. При этом учитывают, что
для диапазона «-1+4» (шкала № 2) показание стрелки уже соответствует
значению pH. Шкала № 3 используется для двух остальных узких диапа-
зонов («4+9») и («9+14»), Для определения pH по этой шкале к начально-
му значению диапазона (4 или 9) прибавляют показание стрелки. Записы-
вают в лабораторный журнал точное (до двух знаков после запятой) зна-
чение pH раствора.
По окончании работы прибор выключают, электроды опускают в
стакан с дистиллированной водой.
У преподавателя узнают точные значения pH исследуемых раство-
ров. Находят отклонения экспериментально определенных значений от
истинных. Объясняют вероятные причины отклонений.
Шифр исследуемого раствора Приблизительное значение pH по шкале «-1+19» Интервал измерений Показания по шкале выбранного интервала Точное значение pH
Вопросы к защите работы
1. Какие измерительные электроды можно использовать для измерения pH?
2. На какой границе раздела в стеклянном электроде возникает потенциал, за-
висящий от pH раствора?
3. В связи с чем перед измерением pH электрод приходится настраивать по
стандартному буферному раствору?
4. Запишите в виде схемы гальваническую цепь, использованную в работе.
5. Почему стеклянный электрод должен обязательно находиться в воде?
6. Почему перед измерением pH прибор необходимо настроить на определен-
ную температуру?
Работа 8.4. Измерение концентрации бромид-ионов в растворе
прямым потенциометрическим методом
Цель. Приобрести навыки определения концентрации ионов в рас-
творах с помощью ионоселективных электродов.
Оборудование. Иономер ЭВ-74; бромид-селективный и хлорсеребряный элек-
троды; мерные колбы вместимостью 100 мл; бюретка вместимостью 25 мл; пипетки
вместимостью 1 и 10 мл; химический стакан вместимостью 50 мл; воронка.
Реактивы. Стандартный раствор бромида калия (с = 0,1 моль/л); исследуе-
мый раствор.
162
Выполнение эксперимента. Включают иономер ЭВ-74 (см. рис. 6.2)
за 20 мин до начала измерения.
Для построения градуировочного графика готовят растворы 1—3 по-
следовательным разведением стандартного раствора, используя мерные
колбы, бюретку и пипетки вместимостью 1 и 10 мл. Минимальный отме-
риваемый объем должен быть равным 1 мл.
В химический стакан вместимостью 50 мл наливают около 20 мл
раствора с наименьшей концентрацией бромид-ионов. Опускают в него
электроды: бромид-селективный (измерительный) и хлорсеребряный
(сравнения), которые подсоединяют к иономеру. Измерения ЭДС гальва-
нического элемента проводят для растворов всех четырех концентраций,
как описано в работе 6.9. Измерения начинают с раствора наименьшей
концентрации. Результаты измерений записывают в таблицу по образцу:
Раствор Концентрация Вг, моль/л ЭДС, мВ
1 0,0001
2 0,001
3 0,01
4 0,1
Исследуемый
Затем таким же образом измеряют ЭДС гальванического элемента
для исследуемого раствора с неизвестной концентрацией бромид-иона.
Этот результат также записывают в таблицу.
Обработка результатов эксперимента. По четырем значениям
ЭДС гальванических элементов, электролитами которых являлись эта-
лонные растворы бромида калия, строят график зависимости Е = fie).
Концентрацию бромид-иона в исследуемом растворе определяют по гра-
дуировочному графику. Узнают у преподавателя истинную концентра-
цию бромид-иона в исследуемом растворе и рассчитывают ошибку экс-
перимента. Объясняют вероятные причины ошибки.
Вопросы к защите работы
1. Запишите условную схему гальванического элемента для определения кон-
центрации бромид-ионов с помощью ионоселективного электрода.
2. Как изменится потенциал ионоселективного электрода при увеличении кон-
центрации бромид-ионов в растворе?
3. Что называют электродом в потенциометрии?
4. Какие требования предъявляются к электродам сравнения? Какие электроды
чаще всего используются в потенциометрии в качестве электродов сравнения?
5. Приведите примеры ионоселективных электродов, применяемых в медицине
и биологии.
163
Работа 8.5. Потенциометрическое титрование
Цель. Научиться проводить титриметрический анализ с потенцио-
метрическим определением точки эквивалентности.
Оборудование. Иономер ЭВ-74; электроды: серебряный, хлорсеребряный и
платиновый; химический стакан вместимостью 50 мл; бюретка вместимостью 25 мл;
воронка; мензурка.
Реактивы. Растворы: перманганата калия (титрованный, с('/5КМпО4) = 0,05
моль/л), хлорида калия (титрованный, с(КС1) - 0,05 моль/л), серной кислоты
(c(H2SO4) = 1 моль/л), нитрата бария (c(Ba(NO3)2) = I моль/л), иодида калия (ис-
следуемый), нитрата серебра (исследуемый).
Выполнение эксперимента. Готовят иономер ЭВ-74 к работе (см.
рис 6.2). Выполняют один из описанных ниже опытов.
Опыт 1. Определение концентрации иодида калия. В химический
стакан вместимостью 50 мл отбирают пипеткой 10,0 мл анализируемого
раствора иодида калия, добавляют мерным цилиндром 5,0 мл раствора
серной кислоты с концентрацией 1 моль/л. После перемешивания содер-
жимого стакана стеклянной палочкой в него погружают платиновый и
хлорсеребряный электроды, которые подключают к иономеру. Измеряют
значение ЭДС составленного гальванического элемента. Нажимают кла-
виши «mV» и «-14-19» и по нижней шкале (№ 4) определяют значение
ЭДС (в мВ), которое равно показанию стрелки, умноженному на 100. К
анализируемому раствору добавляют из бюретки порциями по 1,0 мл
стандартный раствор КМпО4. После добавления каждой порции тит-
ранта раствор перемешивают и измеряют значение ЭДС. В таблицу запи-
сывают объем титранта (показание бюретки) и ЭДС. Титрование закан-
чивают после того, как при добавлении трех последовательных порций
титранта получаются мало различающиеся между собой значения ЭДС
при условии, что ранее наблюдалось резкое изменение значений ЭДС
(скачок титрования).
Опыт 2. Определение концентрации нитрата серебра. В хими-
ческий стакан вместимостью 50 мл отбирают пипеткой 10,0 мл анали-
зируемого раствора нитрата серебра, добавляют мерным цилиндром
5,0 мл раствора нитрата бария с концентрацией 1 моль/л, перемеши-
вают содержимое стакана стеклянной палочкой. В раствор погружают
серебряный и хлорсеребряный электроды. Оба электрода подключают
к иономеру. Измеряют ЭДС составленного гальванического элемента
в процессе титрования исследуемого раствора, для чего все операции
проводят аналогично описанным при определении концентрации ио-
дида калия, с той лишь разницей, что титрант — стандартный раствор
хлорида калия — добавляют порциями по 0,50 мл. Результаты изме-
рений записывают в таблицу.
164
Обработка результатов эксперимента. Для определения эквива-
лентного объема титранта строят обычную (интегральную) кривую тит-
рования Е =/(Ктитранта) и дифференциальную по первой производной
ДЕ/А И = /(Итнл)аята). Точка эквивалентности на первой кривой определя-
ется как середина вертикального участка (скачка титрования), на второй —
как максимум (см. рис. 8.3). Концентрацию исследуемого раствора иоди-
да калия (или нитрата серебра) рассчитывают по формулам титриметри-
ческого анализа. Узнают у преподавателя истинную концентрацию ис-
следуемых растворов и рассчитывают ошибки эксперимента.
Вопросы к защите работы
1. Напишите уравнение реакции, лежащей в основе определения иодида калия
методом окислительно-восстановительного титрования.
2. Какой индикаторный электрод используют при определении иодида калия
перманганатометрическим методом?
3. Как обычно фиксируется точка эквивалентности в перманганатометрии?
Почему ее нельзя определить традиционным методом при титровании иоди-
да калия?
4. Какой измерительный электрод используют при определении содержания
ионов серебра?
5. Приведите условные схемы записи гальванических элементов, использован-
ных в лабораторной работе.
6. Почему при потенциометрическом титровании пользуются грубым диапазо-
ном измерений ЭДС иономера ЭВ-74?
Вопросы к гл. 8
1. Какие электрохимические методы исследования применяют в медицине и
биологии?
2. Как можно экспериментально определить сопротивление проводников вто-
рого ряда?
3. От каких факторов зависит удельная электрическая проводимость?
4. Приведите график зависимости молярной электрической проводимости от
концентрации электролита.
5. Сформулируйте закон Кольрауша.
6. Какие требования предъявляются в потенциометрии к измерительным элек-
тродам и электродам сравнения?
7. Что называют редокс-системой и редокс-электродом?
8. Как экспериментально определяется точка эквивалентности в потенциомет-
рическом титровании?
Глава 9
Физическая химия
поверхностных явлений
К поверхностным явлениям относят процессы, протекающие на гра-
ницах раздела фаз и обусловленные особенностями состава и структуры
поверхностей. Клетки, являющиеся основой строения любого организма,
отличаются сильно развитой поверхностью раздела (биологические мем-
браны), на которой и осуществляются многие жизненно важные процес-
сы. Особое значение для понимания механизма функционирования раз-
личных биологических структур имеет такое явление, как адсорбция.
Адсорбция — самопроизвольное изменение концентрации компо-
нента системы в поверхностном слое. С процесса адсорбции начинается
взаимодействие любых веществ с клетками и тканями организма (пита-
тельных и токсических веществ, лекарств и т. д.).
Взаимодействие ферментов с субстратами, антител с антигенами,
поляризация и деполяризация биологических мембран — все эти явления
не могут быть объяснены без применения закономерностей протекания
адсорбционных процессов.
В медицине весьма широко применяется адсорбционная терапия,
простейшие примеры которой — использование некоторых веществ, на-
зываемых адсорбентами (активированный уголь, гидроксид алюминия в
составе препарата «альмагель» и др.), для связывания токсинов, нежела-
тельных веществ, попадающих в желудочно-кишечный тракт. Одним из
средств интенсивной детоксикации организма является гемосорбция —
удаление из крови чужеродных организму веществ.
Наконец, в основе существующей в настоящее время системы реге-
нерации воздуха и воды в закрытых циклах (подводная лодка, космиче-
ский корабль, не загрязняющие среду производства) также лежат адсорб-
ционные процессы.
При образовании новой поверхности раздела в поверхностном слое
накапливается избыток энергии, который количественно может быть
охарактеризован поверхностным натяжением. Поверхностное натяжение
можно характеризовать как силу (отнесенную к единице длины), дейст-
вующую по касательной к поверхности и препятствующую ее увеличе-
нию (силовая трактовка). Однако поверхностное натяжение можно ха-
рактеризовать и как работу (отнесенную к единице площади), которую
необходимо затратить на увеличение поверхности (энергетическая трак-
166
товка). Единицы измерения поверхностного
натяжения в СИ: Нм’1 (предпочтительней)
и Джм"2.
Уменьшение избытка энергии в по-
верхностном слое (а именно оно может быть
движущей силой самопроизвольного про-
цесса) в однокомпонентных системах воз-
можно только за счет уменьшения поверх-
ности. В многокомпонентных системах
уменьшение избытка энергии происходит
также за счет перераспределения молекул
между объемом фазы и поверхностным сло-
ем, которое и реализуется в таком явлении,
как адсорбция.
Рис. 9.1. Изотермы поверх-
ностного натяжения:
I — поверхностно-активные
вещества (ПАВ); 2 — поверхно-
стно-неактивные вещества (ПНВ)
Рассмотрим только адсорбционные процессы в водных растворах, на
которых должно быть сосредоточено в основном внимание будущих ме-
диков.
Вещества, понижающие поверхностное натяжение воды, адсорби-
руются положительно (т. е. их концентрация в поверхностном слое
больше концентрации в объеме фазы) и называются поверхностно-
активными веществами (ПАВ). Наоборот, вещества, повышающие по-
верхностное натяжение, адсорбируются отрицательно и называются по-
верхностно-неактивными веществами. К этой же группе веществ относят
и такие вещества, которые не влияют на поверхностное натяжение. Зави-
симость поверхностного натяжения а от концентрации растворенного
вещества иллюстрируется изотермами (рис. 9.1).
Адсорбция на подвижных поверхностях раздела (газ — жидкость, жид-
кость — жидкость), где изменение поверхностного натяжения легко устано-
вить экспериментально, количественно определяется уравнением Гиббса:
Г = -——, (9.1)
RT de
где -(do/dc) = g —поверхностная активность.
Адсорбция таким образом так же, как и поверхностное натяжение,
Рис. 9.2. Изотерма адсорбции
зависит от природы соприкасающихся фаз и
от концентрации растворенного вещества
(рис. 9.2).
По теории Лэнгмюра предельной ад-
сорбции Гма1К соответствует образование на-
сыщенного (мономолекулярного) адсорбци-
онного слоя, что позволяет рассчитать пло-
щадь S поперечного сечения, занимаемую
одной молекулой (9.2), и ее длину / (9.3):
167
s =-----------,
г W
1 макс7* A
Г N
I = макс А
р
(9-2)
(9-3)
где Л\ — постоянная Авогадро; р — плотность растворенного вещества.
Интересной является закономерность изменения поверхностной ак-
тивности g в разбавленных водных растворах ПАВ некоторых гомологи-
ческих ядов (карбоновые кислоты, одноатомные спирты и др.). Согласно
эмпирическому правилу Траубе, поверхностная активность разбавленных
растворов таких веществ увеличивается примерно в 3,2 раза при удлине-
нии углеводородного радикала на одну —СН2-группу.
Адсорбция на неподвижных поверхностях раздела (твердое тело—
жидкость, газ—жидкость), где изменение количественной характеристи-
ки поверхностного явления трудно поддается экспериментальному опре-
делению, описывается иными уравнениями. Чаще всего пользуются эм-
пирическим уравнением Фрейндлиха (9.4) или уравнением Лэнгмюра (9.5):
а = Кс", (9.4)
где а — адсорбция на неподвижной поверхности раздела; п и К — кон-
станты;
(95)
а + с
где ана1К — предельная адсорбция (аналогично Гмакс, см. рис. 9.2.); а —
константа.
Константы в уравнениях Лэнгмюра и Фрейндлиха определяются
экспериментально (см. работу 9.2).
Если адсорбция на твердом теле (адсорбенте) происходит из раство-
ра, необходимо учитывать, что кроме молекул растворенного вещества
могут адсорбироваться и молекулы растворителя. Конкуренция за актив-
ные центры адсорбента уменьшает адсорбцию. Чем лучше вещество рас-
творяется в данном растворителе, тем хуже оно из этого растворителя
адсорбируется. В более общем виде эту закономерность можно сформу-
лировать так: полярные адсорбенты лучше адсорбируют полярные ад-
сорбтивы из неполярных растворителей, а неполярные адсорбенты —
неполярные адсорбтивы из полярных растворителей.
Явление адсорбции лежит в основе такого ценного метода анализа
многокомпонентных смесей, как хроматография. В общем случае под
хроматографией понимают физико-химический метод анализа, основан-
ный на различии в скорости движения разделяемых веществ относитель-
но неподвижной фазы под действием подвижной.
168
Различие в скорости движения связано с разной интенсивностью
процессов сорбции и десорбции в системе подвижная фаза — неподвиж-
ная фаза. По технике эксперимента различают колоночную хроматогра-
фию (разновидность — капиллярная хроматография), тонкослойную
хроматографию и хроматографию на бумаге.
Особенно большое значение для медицины имеет молекулярно-
ситовая хроматография, позволяющая разделить на фракции биомакро-
молекулы (например, белки).
Работа 9.1. Построение изотермы поверхностного натяжения
и изотермы адсорбции на поверхности
раздела газ—жидкость
Цель. Приобрести навыки определения поверхностного натяжения и
адсорбции на подвижной поверхности раздела.
Оборудование. Прибор Ребиндера для определения поверхностного натя-
жения; химический стакан вместимостью 50 мл; склянка вместимостью 200 мл;
фильтровальная бумага.
Реактивы. Растворы изоамилового спирта четырех концентраций: 0,025,
0,050, 0,100 и 150 моль/л.
Сущность работы. Адсорбция на подвижной поверхности раздела
определяют по изменению поверхностного натяжения. Для измерения
поверхностного натяжения используют метод, основанный на измерении
максимального давления образования пузырька на конце капилляра, по-
груженного в жидкость. Ис-
пользуемый для этого прибор
Ребиндера изображен на рис. 9.3.
Если открыть кран 4 аспи-
ратора, из него начнет вытекать
вода и в пробирке 1 в простран-
стве над исследуемым раство-
ром возникнет разряжение. В
результате избыточного давле-
ния извне через капилляр в ис-
следуемый раствор будет про-
давливаться пузырек воздуха.
Сравнивая максимальный пе-
репад давления при продавли-
вании пузырька воздуха в ис-
следуемую жидкость (Др,) и в
дистиллированную воду (Др0) с
Рис. 9.3. Прибор Ребиндера для измерения
поверхностного натяжения:
1 — пробирка с исследуемым раствором; 2 —
капилляр; 3 — аспиратор; 4 — кран аспиратора;
5 — манометр
169
известным значением поверхностного натяжения ао, рассчитывают по-
верхностное натяжение о( по уравнению
о,. =о0-^-. (9-6)
Адсорбцию определяют расчетным путем по уравнению Гиббса (9.1).
Выполнение эксперимента. Готовят к работе прибор Ребиндера,
проверяя правильность соединения всех частей прибора по рис. 9.3. От-
мечают нулевое положение жидкости в манометре (толуола) при откры-
той пробке. Аспиратор заполняют на 3/4 объема водопроводной водой,
сосуд и капилляр промывают дистиллированной водой. Проверяют, что-
бы все соединительные трубки были сухими внутри.
Измеряют температуру дистиллированной воды. Затем определяют
давление, предшествующее проскоку пузырька воздуха для дистиллиро-
ванной воды, поверхностное натяжение которой при измеренной темпе-
ратуре находят в справочнике. В пробирку прибора наливают дистилли-
рованную воду так, чтобы при плотно закрытой пробке капилляр только
касался поверхности жидкости. Постепенно открывая кран аспиратора,
регулируют истечение из него воды так, чтобы скорость образования пу-
зырьков воздуха в капиллярной пробирке не превышала 1—2 пузырьков
в 1 с. Отмечают и записывают в лабораторный журнал давление, соответ-
ствующее отрыву пузырька воздуха от конца капилляра (максималь-
ный подъем столба толуола в манометре). Опыт повторяют еще не
менее двух раз.
Затем аналогичные измерения проводят для четырех растворов изоами-
лового спирта в порядке возрастания концентраций. Перед заполнением
пробирку каждый раз аккуратно ополаскивают исследуемым раствором,
следя за тем, чтобы жидкость не попадала в боковой отросток пробирки.
Результаты всех измерений (не менее трех для раствора каждой кон-
центрации и дистиллированной воды) записывают в лабораторный журнал.
Обработка результатов эксперимента. По средним значениям из-
меренного давления рассчитывают поверхностное натяжение растворов
изо-амилового спирта для всех четырех концентраций [см. уравнение
(9.6)]. Полученные значения записывают в таблицу по форме:
Опыт Концен- трация с, моль/л Давление, предшествующее проскоку пузырька воздуха р, мм столба толуола Поверхностное натяжение, Нм’1
1 0,000
2 0,025
3 0,050
4 0,100
5 0,150
170
Строят график зависимости поверхностного натяжения от концен-
трации раствора (изотерму поверхностного натяжения): о =у(с).
Рассчитывают адсорбцию изоамилового спирта Г для каждого из че-
тырех значений по формуле
Г _ Сср <т2 ст,
RT с2 - с.
Полученные данные записывают в таблицу по форме:
Сер, моль/л Да, Н м 1 Дс, моль/л Г, моль/м2
Строят график зависимости адсорбции от концентрации спирта сср
(изотерму адсорбции). В выводах отражают, как зависят поверхностное
натяжение и адсорбция от концентрации.
Вопросы к защите работы
1. По какому признаку классифицируются границы раздела фаз?
2. Что такое поверхностное натяжение?
3. Какими методами измеряют поверхностное натяжение жидкостей?
4. Что такое поверхностно-активные вещества? Приведите примеры.
5. Какое минимальное значение поверхностного натяжения может иметь вод-
ный раствор изоамилового спирта?
6. Каким образом в приборе Ребиндера создается перепад давления?
7. Почему в приборе Ребиндера капилляр должен только касаться поверхности
исследуемой жидкости, а не быть погруженным в нее?
8. Почему нельзя допускать попадания жидкости в соединительные трубки
прибора?
9. Почему определение поверхностного натяжения исследуемых растворов
проводят в порядке возрастания концентраций?
Работа 9.2. Измерение адсорбции уксусной кислоты
на активированном угле
Цель. Научиться количественно измерять адсорбцию из растворов
на твердых адсорбентах.
Оборудование. Бюретка вместимостью 25 мл; конические колбы вместимостью
500 мл; воронки; цилиндры мерные; колбы для титрования; фильтровальная бумага.
Реактивы. Уголь активированный; растворы уксусной кислоты четырех
разных концентраций (от 50 до 400 ммоль/л); раствор гидроксида натрия (стан-
дартизированный, с = ~0,1 моль/л); раствор фенолфталеина в этаноле (индикатор).
171
Сущность работы. Адсорбцию на твердых адсорбентах определя-
ют, как правило, по разности концентраций адсорбтива в растворе до и
после проведения адсорбции. Для определения концентрации подбирают
подходящий метод (титриметрический, кондуктометрический, колори-
метрический и т. д.).
Выполнение эксперимента. С помощью мерных цилиндров в четы-
ре сухие пронумерованные колбы наливают по 50 мл раствора уксусной
кислоты следующих концентраций: 50 ммоль/л; 100 ммоль/л; 200 ммоль/л;
400 ммоль/л. В каждую колбу вносят одновременно по 1,0 г предваритель-
но измельченного активированного угля. Содержимое колб перемешива-
ют в течение 20 мин, после чего фильтруют через сухие складчатые
фильтры. Первую порцию фильтрата объемом 5 мл в каждом случае от-
брасывают. Из каждого фильтрата пипеткой отбирают пробу для титро-
вания; для растворов с исходными концентрациями 50 и 100 ммоль/л
объем пробы должен быть равен 10,0 мл, для двух других растворов —
5,0 мл. Во все четыре пробы добавляют по 3—4 капли фенолфталеина,
после чего титруют раствором гидроксида натрия до появления устойчи-
вого слабо-розового окрашивания. Результаты титровании записывают в
таблицу.
Обработка результатов эксперимента. По данным титрования рас-
считывают равновесную концентрацию уксусной кислоты с(СНзСООН) в
каждом фильтрате:
с(СН3СООН) =
c(NaOH)K(NaOH)
И(СН3СООН)
где И(СН3СООН) — объем взятой для титрования пробы фильтрата
(5 или 10 мл); c(NaOH) — молярная концентрация титранта; K(NaOH) —
объем титранта.
Адсорбцию рассчитывают по формуле
д 0,05(со-с)
т
где с0 — исходная концентрация уксусной кислоты; ммоль/л; с — равно-
весная концентрация уксусной кислоты, ммоль/л; 0,050 — объем уксус-
ной кислоты, взятой для адсорбции, л; т — масса адсорбента, г.
Полученные данные записывают в таблицу по форме:
Колба с0(СН3СООН), ммоль/л И(СН3СООН), мл K(NaOH), мл с(СН3СООН), ммоль/л а, ммоль/г
1 50 10,0
2 100 10,0
3 200 5,0
4 400 5,0
172
Строят график зависимости адсорбции от равновесной концентрации
уксусной кислоты (изотерму адсорбции): a
Для нахождения констант в уравнении изотермы Фрейндлиха (9.4)
его преобразуют в линейное уравнение логарифмированием:
lg а = lg X + и 1g с.
Для определения констант в уравнении Лэнгмюра (9.5) его преобра-
зуют в уравнение прямой линии путем деления 1 на обе части уравнения:
11 al
— —-------------------------------1------,
а амакс ^макс С
Рассчитывают 1g a, 1g с, 1/а и 1/с, данные расчета записывают в
таблицу по форме:
а с lg a Igc 1/a 1/с
По данным таблицы строят график зависимости lg а = /(1g с). Зна-
чения констант уравнения Фрейндлиха Кип находят графически: 1g К, как
отрезок, отсекаемый на оси 1g а; п, как тангенс угла наклона прямой к оси.
Строят также график зависимости \!а = /1/с). Величине 1/амакс соот-
ветствует отрезок отсекаемой прямой на оси ординат. Тангенс угла на-
клона прямой к оси абсцисс равен величине а/аыа1ге.
Вопросы к защите работы
1. Как экспериментально можно обнаружить адсорбцию из растворов на твер-
дом теле?
2. В каких единицах выражается адсорбция на неподвижных границах раздела?
3. Приведите примеры наиболее часто использующихся в практике адсорбентов.
4. Как определяют равновесную концентрацию уксусной кислоты?
5. Чем объясняется разный объем аликвот при определении равновесной кон-
центрации уксусной кислоты (5 и 10 мл)?
6. Почему первую порцию фильтрата отбрасывают?
7. Как можно доказать, что в проведенных опытах адсорбционное равновесие
устанавливалось примерно через 20 мин?
Работа 9.3. Влияние различных факторов на адсорбцию
из растворов
Цель. Определить влияние удельной поверхности адсорбента, при-
роды адсорбента, адсорбтива и растворителя на адсорбцию красителей из
растворов.
173
Оборудование. Пробирки; штатив для пробирок; воронки.
Реактивы. Водные растворы метиленового синего, фуксина, эозина; рас-
твор метиленового синего в этаноле; уголь активированный; каолин; кремниевая
кислота; фильтровальная бумага.
Выполнение эксперимента. Перед проведением основных опытов
устанавливают, к каким классам (кислотным или основным красителям)
относятся объекты анализа — метиленовый синий, фуксин, эозин. Для
этого на листок фильтровальной бумаги наносят по 1 капле водных рас-
творов указанных красителей, а также 1 каплю смеси фуксина и метиле-
нового синего. Наблюдают степень растекания капель во всех пробах.
Имея в виду, что поверхность волокон фильтровальной бумаги при сма-
чивании ее водой приобретает отрицательный заряд, определяют, какие
по знаку заряды несут окрашенные ионы. Результаты определения запи-
сывают в лабораторном журнале по форме:
Классы красителей
Метиленовый синий.......
Эозин ..................
Фуксин..................
Опыт 1. Влияние природы адсорбента и адсорбтива на адсорб-
цию. В одну пробирку помещают немного каолина, в другую — немного
активированного угля. В каждую пробирку добавляют примерно по 5 мл
водного раствора смеси эозина и метиленового синего. Содержимое про-
бирок взбалтывают 2—3 мин, а затем отфильтровывают. Окраску фильт-
ратов записывают в таблицу.
Опыт 2. Влияние природы растворителя на адсорбцию. В одну
пробирку наливают 10 мл водного раствора метиленового синего, в дру-
гую — такой же объем спиртового раствора метиленового синего (кон-
центрации растворов равны между собой). В каждую пробирку на кончи-
ке шпателя вносят приблизительно равную массу активированного угля.
Содержимое пробирок взбалтывают и отфильтровывают, после чего
сравнивают интенсивность окраски фильтратов. Наблюдения записывают
в таблицу.
Опыт 3. Влияние удельной поверхности адсорбента на адсорбцию.
Пробирку примерно на ‘/6 высоты заполняют полидисперсным порошком
кремниевой кислоты, после чего приливают водный раствор метиленово-
го синего (на 3/4 пробирки). Содержимое пробирки интенсивно взбалты-
вают и затем оставляют на 10—15 мин отстаиваться. Наблюдают измене-
ние интенсивности окраски кремниевой кислоты по высоте столба. Ре-
зультаты наблюдений записывают в таблицу по форме:
174
1
2
3
Опыт
Изучаемый фактор Адсор- бент Адсор- бтив Раствори- тель Наблюдения
Вывод по каждому опыту формулируют отдельно.
Вопросы к защите работы
1. Как влияет на адсорбцию удельная поверхность адсорбента?
2. Как можно экспериментально установить влияние на адсорбцию удельной
поверхности адсорбента?
3. Приведите примеры полярных и неполярных адсорбентов.
4. Почему природа растворителя оказывает влияние на адсорбцию?
5. Как экспериментально можно определить влияние на адсорбцию природы
растворителя?
6. Почему в качестве объектов исследования во всех заданиях использовались
красители?
Работа 9.4. Определение обменной емкости ионитов
Цель. Научиться экспериментально определять рабочую обменную
емкость ионитов в динамических условиях на примере сильнокислотного
катионита КУ-1.
Оборудование. Хроматографическая колонка (бюретка вместимостью 25 мл
с винтовым зажимом); мерный цилиндр вместимостью 10 мл; склянка вместимо-
стью 250 мл; предметное стекло; пипетка глазная; капельницы.
Реактивы. Раствор сульфата меди(П) (с = 0,025 моль/л); гексацианофер-
рат(П) калия (кристаллический); катионит КУ-1.
Выполнение эксперимента. В лабораторном журнале записывают
название катионита, концентрацию вытесняющего раствора сульфата
меди(П), моль/л.
В нижнюю часть хроматографической колонки, представляющую
собой бюретку вместимостью 25 мл с винтовым зажимом, помещают до
первой отметки кусочек стеклянной ваты, а затем — навеску набухшего
сильнокислотного катионита в Н+-форме. Объем катионита должен быть
в пределах 10—15 мл (отмечают в лабораторном журнале). Катионит за-
ливают водой и встряхивают до удаления пузырьков воздуха. Колонку с
помощью резинового шланга соединяют со склянкой, содержащей рас-
твор сульфата меди. Открывают винтовой зажим бюретки и пропускают
175
через колонку вытесняющий раствор, отбирая фильтрат в мерный ци-
линдр вместимостью 10 мл. Скорость пропускания раствора устанавли-
вают равной 3—4 мл/мин. Отобранные фракции (объемом по 10 мл) сли-
вают в общую емкость — колбу вместимостью 250 мл. Для определения
момента проскока ионов Си2+ периодически (через 2—3 мл) отбирают на
предметное стекло по 1 —2 капли фильтрата, после чего проводят качест-
венную реакцию на ион меди с гексацианоферратом(П) калия, добавляя
1—2 кристаллика реактива. При появлении красно-коричневого окраши-
вания (осадка) пропускание вытесняющего раствора прекращают.
Обработка результатов эксперимента. Вычисляют общий объем
вытесняющего раствора V(CuSO4) (мл), суммируя все фракции по 10 мл и
последнюю, которая может быть меньше 10 мл.
Количество вещества ионов меди (ммоль), поглощенных ионитом,
рассчитывают по формуле л(Си2+) = c(CuSO4)K(CuSO4).
Рабочую обменную емкость катионита (£) вычисляют, исходя из со-
отношения
р «(Си2+)
с —---------,
И(ионит)
где И(ионит) — объем набухшего ионита.
Если известна истинная плотность ионита в гидратированном со-
стоянии, рабочую обменную емкость можно рассчитать не на единицу
объема, а на единицу массы ионита.
Узнают у преподавателя истинное значение рабочей обменной емко-
сти и рассчитывают ошибку эксперимента. Оъясняют возможные причи-
ны ошибки.
Вопросы к защите работы
1. Приведите примеры катионитов и анионитов. Где их используют?
2. С какой целью в лабораторной работе применяли раствор сульфата меди?
3. Как определяется количество вещества ионов меди, поглощенных ионитом?
4. В каких единицах выражают обменную емкость ионитов?
5. С какой целью определяют обменную емкость ионитов?
Работа 9.5. Хроматография
Цель. Приобрести навыки разделения смеси веществ с помощью
тонкослойной и бумажной хроматографии.
176
Оборудование. Чашка Петри; цилиндры мерные вместимостью 10 мл; ка-
пилляры; пульверизаторы; химический стакан вместимостью 100 мл; стеклянные
палочки; колечки резиновые; пластинки для хроматографии «Силуфол»; хрома-
тографическая бумага.
Реактивы. Раствор гексацианоферрата(П) калия (с = 0,05 моль/л); насыщен-
ный раствор смеси нитрата меди(П) и нитрата железа(Ш); 5%-й раствор и-ди-
метиламинобензальдегида в этаноле, анестезина в этаноле и новокаина в этаноле
(насыщенные); хлороформ.
Выполнение эксперимента. Опыт 1. Разделение ионов меди и
железа. Из хроматографической бумаги аккуратно вырезают полоску
шириной 2—3 см и длиной 8—10 см. На расстоянии 1 см от нижнего
края карандашом по линейке проводят тонкую линию (так называемая
линия старта). В центр линии с помощью тонкого капилляра наносят рас-
твор, содержащий катионы Си2+ и Fe3+; диаметр пятна не должен превы-
шать 3—4 мм. Высушивают бумагу на воздухе.
Подготовленную таким образом полоску хроматографической бума-
ги закрепляют с помощью двух соединенных резиновыми колечками
стеклянных палочек и опускают в стакан с дистиллированной водой, как
это показано на рис. 9.4.
Слой воды в стакане должен быть равным 1—1,5 см, глубина погру-
жения полоски бумаги 2—3 мм. После поднятия воды на высоту 6—7 см
полоску вынимают из стакана и карандашом отмечают линию подъема
растворителя (так называемая линия фронта). Хроматограмму высуши-
вают на воздухе.
Для обнаружения разделенных зон катионов полоску смачивают из
пульверизатора раствором гексацианоферрата(П) калия. Отмечают число
и окраску зон. Измеряют расстояние от центра каждой зоны до линии
старта. Результаты записывают в лабораторном журнале.
Опыт 2. Разделение смеси новокаина и анестезина. Из пла-
стинки «Силуфол» аккуратно (чтобы не повредить сл^й сорбента)
вырезают прямоугольник размером 75x50
мм. Для поступления подвижной фазы у пла-
стинки загибают полоску шириной 10 мм
(«фитиль»). Линию старта наносят на рас-
стоянии 20 мм от края пластинки. С помо-
щью трех тонких капилляров на линию стар-
та наносят на расстоянии 10 мм друг от дру-
га по I капле растворов новокаина, анесте-
зина и их смеси.
В качестве хроматографических камер ис-
пользуют чашки Петри с плотно подогнанными
крышками. В камеру наливают подвижную фа-
зу (хлороформ).
Рис. 9.4. Камера для
хроматографирования на
бумаге
7-366
177
Рис. 9.5. Размещение хроматографиче-
ской пластинки в камере:
/ — чашка Петри с подвижной фазой; 2 —
крышка чашки Петри; 3 — хроматографи-
ческая пластинка; 4 — «фитиль»; 5 — упор
Рис. 9.6. Расчет Я/
/?ХА) = /(АУ/;ЯХБ) = /(БУ/
Хроматографическую пластинку с нанесенными растворами помещают
в камере под углом примерно 15°, для чего под верхнюю часть пластинки
ставят упор, который можно приготовить из металлической подложки ис-
пользованных ранее пластинок (рис. 9.5).
После того как подвижная фаза пройдет по пластинке 50 мм, отме-
чают карандашом линию фронта и вынутую из камеры пластинку высу-
шивают до полного удаления хлороформа. Для обнаружения зон пла-
стинку опрыскивают из пульверизатора раствором и-диметиламинобен-
зальдегида, при этом должны появиться желтые пятна.
Обработка результатов эксперимента. Для каждой зоны рассчи-
тывают значение Rf как отношение расстояния от ее центра до линии
старта к расстоянию от линии старта до линии фронта (рис. 9.6).
Результаты опытов суммируют в виде таблицы по форме:
Опыт Вид хроматографии Объект исследования Химическая природа под- вижной фазы Химическая природа неподвижной фазы Описание хроматограм- мы
по тех- нике выпол- нения по доми- нирующе- му меха- низму
1 Число зон (ок- раска и соот- ветствие ионам)
2 Число зон (окраска) ЯДанест.) ЯДновок.)
Приводят рисунки хроматограмм.
178
Вопросы к защите работы
1. Перечислите основные этапы методики хроматографии на бумаге и в тонком
слое.
2. Почему при хроматографии на бумаге при переходе к каждому новому этапу
методики следует высушивать полоску бумаги?
3. Почему полоску бумаги помещают в хроматографическую камеру таким
образом, чтобы пятна нанесенных проб не погружались в жидкость?
4. Под действием каких сил перемещается подвижная фаза в хроматографии на
бумаге?
5. Напишите уравнения реакций, лежащих в основе обнаружения ионов ме-
ди(П) и железд(Ш).
6. Какая реакция лежит в основе обнаружения новокаина и анестезина после
разделения их методом ТСХ?
7. Как рассчитывают величину Rj!
Вопросы к главе 9
1. Что называется границей раздела фаз? По какому принципу классифициру-
ются границы раздела фаз?
2. Какими методами можно измерить поверхностное натяжение водных рас-
творов?
3. В чем заключаются особенности строения молекул ПАВ? Приведите приме-
ры природных ПАВ.
4. Как можно определить адсорбцию на подвижных и неподвижных границах
раздела?
5. Представьте на одном графике изотермы адсорбции масляной, уксусной и
пропионовой кислот из водных растворов.
6. Одинаковы ли толщина насыщенного адсорбционного слоя и площадь, при-
ходящаяся на одну молекулу в нем, для пропанола и пентанола?.
7. Объясните характер влияния природы адсорбента и адсорбтива на адсорб-
цию.
8. Как можно экспериментально определить константы уравнения Лэнгмюра?
9. Почему природа растворителя оказывает влияние на адсорбцию?
10. Какие существуют разновидности адсорбции сильных электролитов?
11. В чем заключается сущность ионообменной хроматографии?
12. Приведите примеры использования хроматографических методов в медици-
не и биологии.
Глава 10
Физическая химия дисперсных систем.
Коллоидно-дисперсные системы
10.1. МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Дисперсные системы — системы, состоящие из двух или более фаз,
одна из которых является непрерывной (дисперсионная среда), а другая —
совокупность раздробленных частиц (дисперсная фаза). По размеру час-
тиц дисперсной фазы дисперсные системы делят на коллоидно-дисперс-
ные, или коллоидные, системы (размеры частиц 10~7—10'9 м) и грубо-
дисперсные системы (размеры частиц порядка 1(Г7 м и более).
Дисперсные системы, в частности коллоидные, широко распростра-
нены в природе. Дисперсными являются все живые системы. В крови,
лимфе, спинно-мозговой жидкости находятся в коллоидном состоянии
ряд веществ, например фосфаты, жиры, липиды. В настоящее время осо-
бый интерес представляет разработка моделей клеток, живых мембран,
нервных волокон, действующих по законам коллоидной химии. Приме-
ром сочетания диализа и ультрафильтрации является аппарат «искусст-
венная почка». Для биологов и медиков представляет большой интерес
изучение процессов коагуляции и пептизации. Коагуляция коллоидных
растворов фосфата кальция и холестерина в крови приводит к образова-
нию и отложению осадков на внутренней поверхности кровеносных со-
судов. Свертывание крови, слипание эритроцитов в так называемые «мо-
нетные столбики» представляют собой процессы, аналогичные коагуля-
ции. В основе процесса растворения тромбов лежит явление пептизации.
В гигиене и санитарии применяют коагуляцию для очистки питьевых и
сточных вод.
10.2. МЕТОДЫ ПОЛУЧЕНИЯ И ОЧИСТКИ
КОЛЛОИДНЫХ РАСТВОРОВ
Коллоидные растворы— это гетерогенные системы, состоящие из
частиц размером порядка КГ7—10"9 м, равномерно распределенных в
какой-либо жидкости. Коллоидные растворы называют золями, золи с
водной дисперсионной средой — гидрозолями, с органической — органо-
МО
золями. По размеру частиц коллоидные растворы занимают промежуточ-
ное положение между истинными растворами низкомолекулярных ве-
ществ (размеры частиц — молекул и ионов, — менее 10“9 м) и грубодис-
персными системами. Поэтому методы получения коллоидных растворов
делят на две основные группы: диспергирования и конденсации.
Для получения коллоидного раствора вещества необходимы сле-
дующие условия: 1) нерастворимость (или очень малая растворимость)
вещества в дисперсионной среде; 2) достижение коллоидных размеров
частиц вещества; 3) присутствие стабилизатора; стабилизаторами могут
быть как реагенты, из которых получен золь, так и примеси или специ-
ально вводимые вещества, ионы или молекулы которых могут адсорби-
роваться на поверхности частиц, придавая им устойчивость.
Методы диспергирования основаны на дроблении и измельчении
грубых частиц до частиц коллоидных размеров. К ним относятся механи-
ческие методы с использованием коллоидных и шаровых мельниц, методы с
применением электричества, ультразвука, вибрации, а также пептизация.
Сущность методов конденсации состоит в соединении отдельных
молекул, атомов или ионов вещества в агрегаты коллоидных размеров.
Методы конденсации делят на физические и химические. К физическим
конденсационным методам относятся, например, метод замены раствори-
теля, конденсация паров. Метод замены растворителя состоит в том, что
растворитель, в котором вещество растворяется, образуя истинный рас-
твор, заменяется растворителем, в котором это вещество нерастворимо.
Например, если истинный спиртовой раствор канифоли влить в воду, то
образуется коллоидный раствор канифоли в воде, так как канифоль не-
растворима в воде. Химические конденсационные методы делят на мето-
ды гидролиза, обмена, восстановления и т. д. по типу химической реак-
ции, приводящей к образованию плохо растворимых веществ. При этом
реакцию нужно проводить в разбавленных растворах.
Золи, полученные любым методом, могут содержать различные
примеси. Для очистки золей от примеси низкомолекулярных веществ
пользуются методами диализа, электродиализа и ультрафильтрации.
При диализе коллоидный раствор с содержащимися в нем примесями
отделен мембраной от растворителя. Применяют растительные, жи-
вотные и искусственные мембраны; их можно приготовить из белков,
пергамента, целлофана, коллодия и др. Диализационные мембраны
пропускают молекулы и ионы низкомолекулярных веществ и раство-
рителя и не пропускают частицы дисперсной фазы золей. В результате
диффузии через мембрану примеси удаляются в растворитель. За хо-
дом диализа можно следить, время от времени отбирая пробу из рас-
твора во внешнем сосуде и проверяя в растворе присутствие удаляе-
мых низкомолекулярных веществ. Ускорить диализ можно сменой
внешнего раствора и повышением температуры. Если низкомолеку-
181
лярные примеси в золе являются электролитами, диализ может быть
ускорен наложением электрического поля.
Ультрафильтрацией называют диализ, проводимый при повышенном
давлении во внутреннем сосуде диализатора или при разрежении во
внешнем сосуде. Очистить золь от примеси грубодисперсных частиц
можно, профильтровав его через бумажный фильтр.
10.3. СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ,
СТРУКТУРА КОЛЛОИДНЫХ ЧАСТИЦ
Коллоидные растворы бывают бесцветными или окрашенными. Золи
одного и того же вещества, приготовленные разными способами, могут
приобретать разную окраску в зависимости от размера частиц, их струк-
туры, формы и концентрации. Один и тот же золь часто имеет различную
окраску в зависимости от того, в проходящем или отраженном свете он
рассматривается. В проходящем свете золи, как правило, не отличаются
от истинных растворов, они прозрачны. При пропускании пучка света
через золь сбоку (перпендикулярно оси зрения наблюдателя) на темном
фоне виден путь проходящего луча в виде светлого конуса — эффект
Фарадея—Тиндаля. Это явление обусловлено рассеянием света в резуль-
тате дифракции. Так как в коллоидных системах размер частиц меньше
длины полуволны света, лучи света как бы огибают коллоидные частицы,
рассеиваясь во всех направлениях. Таким образом коллоидные растворы
можно отличить от истинных.
У коллоидных растворов молекулярно-кинетические свойства —
диффузия, броуновское движение, осмотическое давление — выражены
значительно слабее, чем у истинных, вследствие малых величин частич-
ной концентрации и относительно больших размеров коллоидных частиц.
Частицы гидрозолей обычно имеют сложную структуру, которая за-
висит от условий получения золей, стабилизатора и других факторов.
Рассмотрим строение коллоидных частиц гидрозоля гексацианофер-
рата(П) меди, полученного методом химической конденсации. При про-
ведении реакции обмена между сульфатом меди (избыток) и гексациано-
ферратом(П) калия образуются нерастворимые в воде частицы гексациа-
ноферрата(П) меди согласно уравнению
2CuSO4 + KJFe(CN)J = Cu2[Fe(CN)6] + K2SO4
Агрегат, состоящий из множества молекул меди(П) гексационоферра-
та(П), составляет основу коллоидной частицы: mCu2[Fe(CN)6], где т —
число структурных единиц, входящих в агрегат. Поверхность агрегата
заряжается благодаря избирательной адсорбции ионов из дисперсионной
среды. В соответствии с правилом Панета — Фаянса адсорбируются
182
преимущественно ионы, входящие в состав агрегата, изоморфные ионы
или образующие нерастворимые осадки с ионами агрегата. При рассмат-
риваемом в примере методе получения золя из присутствующих в дис-
персионной среде ионов К+, Cu2+, SO2- избирательно адсорбируются на
агрегате ионы Си2+, которые сообщают агрегату заряд и называются по-
тенциалопределяющими. Заряженный агрегат составляет ядро коллоид-
ной частицы 7wCu2[Fe(CN)6] nCu2+, где п — число адсорбированных ио-
нов. Заряд ядра компенсируется эквивалентным зарядом противоположно
заряженных ионов (противоионов), в данном случае ионов SO<~, причем
часть противоионов прочно связана с ядром и находится непосредствен-
но у поверхности ядра. Эти противоионы помимо электростатических
сил испытывают силы адсорбционного притяжения поверхности и назы-
ваются противоионами адсорбционного слоя, их число равно (п — х).
Остальная часть противоионов, число которых равно х, расположена
диффузно и составляет диффузный слой. Таким образом, формулу ми-
целлы гидрозоля гексацианоферрата(П) меди можно записать следующим
образом:
{wCu2[Fe(CN)6]~ иСи^ (w-x)SO2 }- xSO2'
Агрегат Потенциал- Противоиож! Противоиона
определяющие адсорбционного диффузного
ионы слоя слоя
Диффузный слой
Ядро
Гранула или коллоидная частица
Мицелла
Мицелла золя является электронейтральной. Заряженную часть ми-
целлы, обозначенную в формуле фигурными скобками, называют грану-
лой или коллоидной частицей. Потенциал, возникающий на поверхности
гранулы, называют электрокинетичёским или ^-потенциалом. Электро-
кинетический потенциал численно равен работе, которую нужно совер-
шить при переносе единицы заряда с поверхности гранулы в глубь дис-
персионной среды или наоборот.
Наличие и знак заряда у коллоидных частиц можно определить ме-
тодом капиллярного анализа или наблюдая явление электрофореза или
электроосмоса. Метод капиллярного анализа основан на том, что поверх-
ность волокон фильтровальной бумаги при смачивании водой и водными
растворами заряжается отрицательно. Поэтому, если капля золя на
фильтровальной бумаге образует окрашенное пятно небольшого диамет-
ра (компактное), значит коллоидные частицы заряжены положительно,
если пятно большого диаметра (расплывчатое) — коллоидные частицы
заряжены отрицательно.
183
Явление перемещения дисперсной фазы относительно дисперсион-
ной среды в электрическом поле называют электрофорезом, а перемеще-
ние дисперсионной среды относительно дисперсной фазы — электроос-
мосом. При электрофорезе коллоидные частицы (гранулы) движутся к
одному электроду, а диффузный слой противоионов перемещается к дру-
гому электроду. Знак заряда коллоидных частиц определяют по тому, к
какому из электродов они передвигаются. Измеряя скорость электрофо-
реза или электроосмоса, можно определить электрокинетический потен-
циал, так как скорость перемещения фаз зависит от ^-потенциала по
уравнению Гельмгольца—Смолуховского следующим образом:
где «о — скорость перемещения фаз; С, — электрокинетический потенци-
ал; Е — напряженность внешнего поля; г| — вязкость среды; £ — диэлек-
трическая проницаемость среды; е0 — электрическая постоянная (или
диэлектрическая проницаемость вакуума).
При электрофорезе скорость движения частиц и0 при напряженности
электрического поля Е, равной единице, называют электрофоретической
подвижностью и^, т. е.
^=-~ (Ю.2)
Е
Электрокинетический потенциал можно рассчитать по уравнениям
^ = -^- или ; = (10.3)
ег0Е ее0
Электрокинетический потенциал является важным фактором устой-
чивости коллоидных систем.
10.4. УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ СИСТЕМ.
КОАГУЛЯЦИЯ. ПЕПТИЗАЦИЯ
Различают два вида устойчивости коллоидно-дисперсных систем:
седиментационную (или кинетическую) и агрегативную. Седиментаци-
онная устойчивость — устойчивость коллоидных частиц к оседанию под
действием силы тяжести. Агрегативная устойчивость — способность зо-
ля сохранять размер частиц и их индивидуальность с течением времени.
Нарушение агрегативной устойчивости, при которой происходит
объединение коллоидных частиц в агрегаты, называют коагуляцией. Про-
дуктами коагуляции могут быть: золь с более крупными частицами, оса-
док (коагулят), гель (коагель). Внешне коагуляция проявляется в измене-
184
нии цвета раствора, помутнении или выпадении осадка (седиментации).
Едва ли существуют какие-либо внешние воздействия, которые при дос-
таточной интенсивности не вызывали бы коагуляцию. Коагуляцию золей
можно вызвать повышением концентрации золя, изменением температу-
ры, механическим воздействием, облучением, длительным диализом или
ультрафильтрацией, добавлением посторонних веществ: электролитов,
неэлектролитов, порошков, других золей и т. д. Наибольший интерес
представляет коагуляция под действием электролитов. Минимальная
концентрация электролита в золе, при которой начинается коагуляция,
называется порогом коагуляции. Порог коагуляции измеряется в милли-
молях электролита на литр золя (ммольл1). Коагулирующая способность
электролита определяется как величина, обратная порогу коагуляции.
Коагуляцию вызывают ионы, заряженные противоположно коллоидным
частицам (правило Гарди). Чем больше заряд иона, тем больше его коа-
гулирующая способность. Причем коагулирующая способность иона
пропорциональна приблизительно шестой степени заряда коагулирующе-
го иона (правило Шульце).
Процесс, обратный коагуляции, т. е. переход свежеобразованного
осадка или геля в коллоидный раствор, называется пептизацией. Вызвать
пептизацию можно промыванием коагулята растворителем, а также воз-
действием пептизаторов (электролитов, неэлектролитов, поверхностно-
активных веществ, высокомолекулярных соединений). Причем пептизи-
ровать можно только свежеполученные осадки, в которых не прошли
явления кристаллизации и частицы не потеряли своей индивидуальности.
Различают два вида пептизации электролитами: адсорбционную и хими-
ческую (или диссолюционную). При адсорбционной пептизации проис-
ходит адсорбция ионов пептизатора на частицах свежеполученного осад-
ка, заряд частиц повышается, в результате чего силы отталкивания стано-
вятся больше сил молекулярного притяжения, происходит коллоидное
растворение осадка. Например, при пептизации осадка гидроксида желе-
за(Ш) раствором хлорида железа(Ш) происходит адсорбция ионов Fe3+ на
частицах осадка (по правилу избирательной адсорбции Панета — Фаян-
са) и мицелла полученного золя может иметь следующее строение:
{тГе(ОН)3лГе3+ 3(и - х)СГ }3г+ • ЗхСГ
Механизм химической пептизации состоит в том, что при добавле-
нии электролита происходит его взаимодействие с частью осадка, в ре-
зультате чего образуется пептизатор, ионы которого адсорбируются на
частицах осадка, придавая им заряд. Примером химической пептизации
является пептизация осадка гидроксида железа (III) раствором хлорово-
дорода. Происходит химическая реакция НС1 с частью осадка
185
Fe(OH)3 + H+ = Fe(OH)2 + H2O
Fe(OH)j = FeO++H2O
а затем адсорбция ионов пептизатора на частицах осадка. Возможная
формула мицеллы полученного золя:
{wFe(OH)3 nFeO+ (л - х)СГ }х+ • хСГ
Ускорить процесс пептизации можно повышением температуры и пере-
мешиванием.
10.5. КОЛЛОИДНЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ
ВЕЩЕСТВА
К коллоидным поверхностно-активным веществам относятся такие
ПАВ, которые способны в растворах к самопроизвольному мицеллообра-
зованию. Способность к мицеллообразованию в сочетании с высокой
поверхностной активностью обусловливает целый комплекс важных
свойств коллоидных ПАВ: солюбилизирующую способность, высокую
эффективность их эмульгирующего, смачивающего и моющего действия.
В связи с этим коллоидные ПАВ используют в качестве диспергаторов и
стабилизаторов эмульсий и суспензий, для солюбилизации трудно рас-
творимых соединений, а также в качестве моющих средств. Явление со-
любилизации играет большую роль в жизнедеятельности организмов,
являясь одним из звеньев процесса обмена веществ.
В растворах коллоидных ПАВ возможно динамическое равновесие:
истинный раствор <5 золь или молекулы <5 ионы ±5 мицеллы. Мицел-
лы в растворах коллоидных ПАВ образуются в результате объединения
(ассоциации) дифильных молекул ПАВ. Как правило, способность к ми-
целлообразованию свойственна молекулам ПАВ с длиной углеводород-
ного радикала более 8—10 атомов углерода. При малых концентрациях
мицеллы имеют сферическую форму. С ростом концентрации образуются
более крупные мицеллы цилиндрической, пластинчатой, дискообразной,
палочкообразной формы. Затем могут формироваться жидкокристалли-
ческие структуры. При ассоциации лиофильные части молекул ПАВ
(имеющие большее сродство к растворителю) располагаются на перифе-
рии мицеллы, внутри ее находятся лиофобные части молекул. Так, в водных
растворах полярные части молекул обращены к воде, а неполярные — обра-
зуют ядро мицеллы. В неполярных растворителях внутри мицеллы распола-
гаются полярные группы, а к растворителю обращены — неполярные.
Минимальная концентрация коллоидного ПАВ, при которой начина-
ется образование мицелл, называется критической концентрацией мицел-
186
лообразования (ККМ). Она зависит от длины углеводородного радикала
ПАВ, температуры, введения посторонних веществ (электролитов и не-
электролитов).
Методы определения ККМ основаны на резком изменении физико-
химических свойств растворов ПАВ при переходе истинного раствора в
коллоидный, т. е. при мицеллообразовании. Для определения ККМ изу-
чают изменение какого-либо свойства раствора коллоидного ПАВ от
концентрации и строят график зависимости свойство — концентрация
раствора. ККМ можно определить, изучая поверхностное натяжение,
электрическую проводимость, показатель преломления, мутность, осмо-
тическое давление растворов ПАВ. При концентрации, соответствующей
ККМ, на графиках наблюдается излом, обусловленный образованием
мицелл.
В растворах коллоидных ПАВ при концентрациях выше ККМ резко
увеличивается растворимость веществ, плохо растворимых в данном рас-
творителе. Растворение происходит в результате внедрения молекул рас-
творенного вещества внутрь мицелл (внутримицеллярное растворение).
Это явление называют солюбилизацией. В водных растворах коллоидных
ПАВ солюбилизируются вещества, нерастворимые в воде, например жи-
ры, красители, бензол.
Работа 10.1. Получение, очистка и свойства коллоидных
растворов
Цель. Научиться получать коллоидные растворы различными мето-
дами, очищать их от примесей низкомолекулярных веществ и грубодис-
персных частиц, а также отличать коллоидные растворы от истинных
растворов низкомолекулярных веществ.
Оборудование. Проекционный фонарь; горелка газовая; пробирки; капель-
ницы; воронка; химический стакан вместимостью 150 мл; пипетки глазные, диа-
лизационные (например, коллодиевые); мембраны; фильтровальная бумага.
Реактивы. 2%-й раствор канифоли в этаноле; растворы FeCl3 с концентра-
цией 0,05 моль/л и массовой долей 2%; растворы гексацианоферрата(11) калия
(насыщенный и с = 0,001 моль/л); раствор щавелевой кислоты (с(1/2Н2С2О4) = 0,1
моль/л); 0,1%-й раствор нитрата серебра; 1%-й раствор танина и раствор сульфата
меди (с = 0,006 моль/л).
Выполнение эксперимента. Опыт 1. Получение гидрозоля кани-
фоли методом замены растворителя. В пробирку наливают приблизи-
тельно 10 мл (половина пробирки) дистиллированной воды и добавляют
5 капель раствора канифоли в этаноле. Смесь энергично перемешивают
и, зажав пробирку в держателе, нагревают до кипения для удаления из-
187
бытка этанола. При нагревании открытый конец пробирки должен быть
обращен в сторону от работающего и от соседей по столу. Чтобы очи-
стить полученный раствор от примеси грубодисперсных частиц, раствор
фильтруют через бумажный фильтр.
Для наблюдения эффекта Фарадея—Тиндаля пробирку с коллоид-
ным раствором помещают на пути луча света проекционного фонаря.
Рассматривают пробирку под углом 90° к направлению падающего луча.
Результаты наблюдения записывают в журнал.
Опыт 2. Получение гидрозоля берлинской лазури методом
пептизации. В пробирку наливают приблизительно 1 мл 0,05 моль/л рас-
твора хлорида железа(Ш) и 1 мл насыщенного раствора гексацианофер-
рата(П) калия, полученный осадок отфильтровывают и промывают на
фильтре дистиллированной водой до удаления избытка K4[Fe(CN)6].
К оставшемуся на фильтре промытому осадку берлинской лазури
добавляют 2—3 мл раствора щавелевой кислоты, фильтрат собирают в
пробирку. Наблюдают, образуется ли конус Фарадея—Тиндаля при про-
пускании пучка света через коллоидный раствор.
Опыт 3. Получение гидрозоля гидроксида железа(Н1) методом
гидролиза. В пробирку наливают приблизительно 10 мл (1/2 пробирки)
дистиллированной воды и нагревают до кипения; в кипящую воду добав-
ляют 5 капель 2%-го раствора хлорида железа(Ш) и продолжают нагре-
вание до появления красно-бурой окраски. Наблюдают, образуется ли
конус Фарадея—Тиндаля при пропускании пучка света через получен-
ный раствор.
Для очистки золя от примесей методом диализа горячий золь влива-
ют через воронку в коллодиевый мешочек (диализационная мембрана),
который осторожно опускают в стакан с теплой дистиллированной во-
дой. Время от времени отбирают пробы воды и проводят реакции на ио-
ны, перешедшие из золя в воду (на ионы СГ — с раствором AgNO3). Для
полной очистки золя от примесей ионов воду в стакане периодически
меняют до тех пор, пока в ней не перестанут обнаруживаться эти ионы.
Результаты эксперимента записывают в лабораторный журнал.
Опыт 4. Получение гидрозоля серебра методом восстановления. В
пробирку наливают приблизительно 10 мл дистиллированной воды и до-
бавляют 4—5 капель 0,1%-го раствора нитрата серебра; полученный рас-
твор нагревают до кипения и по каплям, с интервалами в 1 мин, добавля-
ют 1 %-й раствор танина до появления устойчивой желтой окраски.
Наблюдают, образуется ли конус Фарадея—Тиндаля при пропуска-
нии пучка света через полученный раствор. Результаты наблюдений за-
писывают в лабораторный журнал. Золь серебра выливают в специаль-
ную склянку.
Опыт 5. Получение гидрозоля гексацианоферрата(П) меди мето-
дом обмена. В пробирку отбирают равные объемы растворов сульфата
188
меди с концентрацией 0,006 моль/л и гексацианоферрата(П) калия с кон-
центрацией 0,001 моль/л. Наблюдают пробирку с золем в проходящем и
отраженном свете. Отмечают, образуется ли конус Фарадея—Тиндаля
при пропускании пучка света через полученный раствор. Результаты всех
опытов обобщают в таблицах по форме:
Опыт Золь Метод получения Внешний вид Наблюде- ние конуса рассеяния света Метод очистки
физиче- ский или хими- ческий дисперги- рование или конденса- ция в прохо- дящем свете в отра- женном свете
1
Опыт Химические реакции (полуреакции), лежащие в основе получения золей Схемы строения мицелл
Вопросы к защите работы
1. Как классифицируют дисперсные системы по размеру частиц дисперсной
фазы?
2. Какие системы называют коллоидными? Назовите две основные группы
методов получения коллоидных растворов, сформулируйте их сущность.
3. Перечислите разновидности методов диспергирования и конденсации. По
какому принципу классифицируют химические конденсационные методы?
Приведите примеры.
4. Назовите методы очистки коллоидных растворов от примесей: а) растворен-
ных низкомолекулярных веществ; б) грубодисперсных частиц.
5. Что такое диализ и для каких целей его применяют? Как устроен простей-
ший диализатор? От каких факторов зависит скорость диализа?
6. Опишите принцип работы ультрафильтра. С какими целями ультрафильтра-
цию применяют в медико-биологических исследованиях?
7. Напишите формулу мицеллы золя иодида серебра, полученного добавлением
40 мл раствора AgNO3 с концентрацией 0,02 моль/л к 50 мл раствора KI с
концентрацией 0,001 моль/л. Каким методом получен золь?
Работа 10.2. Определение знака заряда коллоидных частиц.
Измерение электрокинетического потенциала
методом электрофореза
Цель. Научиться определять знак заряда коллоидных частиц мето-
дами капиллярного анализа и электрофореза, а также электрокинетиче-
ский потенциал методом электрофореза.
Оборудование. Прибор для электрофореза (электрофоретическая трубка;
электроды; выпрямитель); пробирки; цилиндры мерные вместимостью 10 мл;
пипетки глазные; бумага фильтровальная.
Реактивы. Растворы: хлорида железа(Ш) (c(l/3FeCb) = 0,005 моль/л), гек-
сацианоферрата(11) калия (c(l/3K«[Fe(CN)6]) = 0,005 моль/л); гидрозоль гидрокси-
да железа(Ш); контактная жидкость (ультрафильтрат золя или электролит, элек-
трическая проводимость которого равна электрической проводимости золя).
Выполнение эксперимента. Опыт 1. Определение знака заряда
частиц золей капиллярным методом. В двух пробирках смешивают зара-
нее отмеренные цилиндрами растворы хлорида железа(Ш) и гексациано-
феррата(П) калия в следующих соотношениях:
Пробирка Объем раствора FeClj,
c(l/3FeClj) = 0,005 моль/л, мл
2 1
Объем раствора K4[Fe(CN)6],
c(l/3[Fe(CN)6]4'= 0,005 моль/л, мл
1
3
На фильтровальную бумагу наносят пипеткой 1 каплю раствора из
первой пробирки и рядом, на расстоянии приблизительно двух диаметров
пятна, — 1 каплю раствора из второй пробирки. Сравнивают степень рас-
текаемости окрашенных пятен золей. Определяют знак заряда коллоид-
ных частиц в первом и втором золе, имея в виду, что поверхность воло-
кон бумаги при смачивании водой и водными растворами заряжается
отрицательно. Результаты эксперимента записывают в таблицу по форме:
Пробирка Условия получения золя c(l/3Fe3+) c(l/3(Fe(CN)6]4*) Растекае- мость пят- на на бума- ге Знак заряда гранул Схема строения мицеллы
1 2
Записывают уравнение реакции, лежащей в основе получения золей
берлинской лазури.
190
Опыт 2. Определение
электрокинетического потен-
циала методом электрофоре-
за. Подготавливают к работе
прибор для электрофореза
(рис. 10.1), который представ-
ляет собой U-образную гра-
дуированную трубку с двумя
кранами, соединенную через
зажим с сосудом. В этот сосуд
при закрытых кранах наливают
исследуемый золь. Затем кра-
ны осторожно открывают так,
чтобы золь заполнил трубку до
кранов и просвет кранов был
без пузырьков воздуха. Краны
закрывают, и в оба колена U-
образной трубки наливают до
половины контактную жид-
кость, добиваясь равного уров-
ня ее в коленах трубки. Уста-
Рис. 10.1. Схема прибора для электрофореза:
1 — электрофоретическая трубка; 2 — электро-
ды; 3 — краны; 4 — зажим; 5 — сосуд
навливают электроды и измеряют расстояние между ними вдоль трубки.
Медленно и поочередно открывают оба крана, затем осторожно прикры-
вают зажим так, чтобы золь поступал в трубку медленно, и между золем
и контактной жидкостью образовалась четкая, без размывов, граница.
После того как электроды погрузятся в контактную жидкость, зажим за-
крывают. Измеряют скорость перемещения границы раздела золь—кон-
тактная жидкость (скорость электрофореза).
Отмечают положение границы раздела в обоих коленах трубки.
Подключают прибор к источнику постоянного тока с напряжением 100 В
и включают секундомер. Определяют время, в течение которого граница
раздела золь—контактная жидкость передвинется на определенное рас-
стояние. Записывают исходные и экспериментальные данные электрофо-
реза золя гидроксида железа(Ш):
Расстояние между электродами /, м
Напряжение (разность потенциалов) Дф, В
Вязкость среды г], Па-с
Диэлектрическая проницаемость среды £
Электрическая постоянная (диэлектрическая проницаемость вакуума)
е0 = 8,851(Г12 Ф-м~'
191
Результаты измерений оформляют в виде таблицы:
Поло: границь конга жидко началь- ное кение I золь— ктная сть, см конеч- ное Сдвиг границы раздела Л, м Время переме- щения границы г, с Ско- рость элек- трофо- реза «о, м/с Электро- форетиче- ская под- вижность ^эф Потенци- ал/;, В Знак заряда частиц
Обработка результатов эксперимента. Рассчитывают: 1) скорость
электрофоза w0 по уравнению и0 = h/t, где h — сдвиг границы раздела
золь—контактная жидкость, м; t — время сдвига, с; 2) напряженность
электрического поля Е (В/м) по уравнению Е = &р/1, где А<р — разность
потенциалов, В; / — расстояние между электродами, м; 3) электрофоре-
тическую подвижность «эф (м2-с'-В-') по уравнению = м0/Е; 4) элек-
трокинетический потенциал Q (В) по уравнению
ЕЕ0 ’
Вопросы к защите работы
1. Что называют электрокинетическим потенциалом?
2. От каких факторов и как зависит скорость перемещения коллоидных частиц
в электрическом поле ?
3. Что такое электрофоретическая подвижность?
4. В чем сущность электрофоретического метода определения электрокинети-
ческого потенциала коллоидных частиц?
S. Назовите методы определения знака заряда коллоидных частиц. В чем сущ-
ность капиллярного метода?
6. При электрофорезе гидрозоля сульфида мышьяка(Ш) к двум электродам,
находящимся на расстоянии 30 см, приложено напряжение в 100 В. При этом
за 15 мин наблюдалось перемещение частиц золя на 10 мм. Вычислите элек-
трокинетический потенциал частиц, если относительная диэлектрическая
проницаемость среды равна 81, а вязкость — 10 3 Па-с.
Работа 10.3. Коагуляция золей электролитами.
Определение порогов коагуляции. Пептизация
Цель. Приобрести навыки измерения порогов коагуляции золей и
коагулирующей способности электролитов. Научиться пептизировать
осадки электролитами.
192
Оборудование. Бюретки вместимостью 25 мл; пробирки; стеклянная палоч-
ка; капельницы.
Реактивы. Гидрозоль гидроксида железа(П1); раствор сульфата натрия
(c(l/2Na2SO4) = 0,0025 моль/л); раствор гексацианоферрата(П) калия
(c(l/3K3[Fe(CN)6]) = 0,0025 моль/л); растворы хлорида железа(1П) (c(FeCl3) = 0,5
моль/л и насыщенный); 10%-й раствор аммиака и соляная кислота, (с(НС1) = 0,1
моль/л).
Выполнение эксперимента. Опыт 1. Определение порогов коа-
гуляции. Проводят последовательно два опыта с растворами электро-
литов Na2SO4 и K3[Fe(CN)6], Готовят исходные растворы электролита
различных концентраций, смешивая в пяти пробирках отмеренные с
помощью бюреток исходный раствор электролита и дистиллирован-
ную воду в соотношениях, указанных в таблице.
Пробирка Объем, мл Результаты наблюдений
Раствор электролита Вода Коагулирующий электролит
Na2SO4 K3[Fe(CN)6]
1 2,5 0,5
2 2,0 1,0
3 1,5 1,5
4 1,0 2,0
5 0,5 2,5
В 5 хорошо вымытых пробирок отмеривают из бюретки по 5,0 мл
гидрозоля гидроксида железа(Ш). Во всё пробирки с золем приливают по
возможности одновременно приготовленные растворы электролита и
тотчас же перемешивают. Наблюдают за изменениями в пробирках. Че-
рез 10 мин отмечают, в каких пробирках наблюдается помутнение или
седиментация. Результаты наблюдений записывают в таблицу: знаком
«+» отмечают наличие коагуляции, знаком «-» — отсутствие.
Опыт 2. Пептизация осадка Fe(OH)3 электролитами. В пробирку
наливают приблизительно 5 мл (1/4 пробирки) раствора 0,5 моль/л хло-
рида железа(1П) и прибавляют по каплям раствор аммиака до полного
осаждения гидроксида железа(Ш). Полученный осадок Fe(OH)3 заливают
дистиллированной водой, перемешивают стеклянной палочкой и дают
ему отстояться. Жидкость над осадком осторожно сливают так, чтобы
осадок оставался в пробирке. К оставшемуся осадку снова приливают
воду и декантацию повторяют до полного удаления аммиака. К промы-
тому осадку прибавляют приблизительно 10 мл (1/4 пробирки) дистилли-
рованной воды и перемешивают до получения взвеси, которую разлива-
ют поровну в три пробирки. В первую пробирку добавляют 5—10 капель
193
насыщенного раствора хлорида железа(Ш), во вторую — 10—15 капель
0,1 моль/л раствора НС1. Третью пробирку оставляют для сравнения. Со-
держимое каждой пробирки тщательно перемешивают и через 10 мин
проводят наблюдения. Результаты наблюдений записывают в таблицу по
форме:
Пробир- ка Внешний вид содержимого пробирки Добавленный электролит Наблюдае- мые изме- нения Вид пептизации Формулы мицелл
1 2 3
Обработка результатов эксперимента. Рассчитывают пороги коа-
гуляции золя (сп) и коагулирующую способность (К.С.) для каждого
электролита, используя уравнения:
c(l/zX)—Гмин-1000
сп(Х) =--------Z----------
г сум
к.с.=
1
сп(Х)’
где c(l/zX) — молярная концентрация эквивалента раствора электролита,
моль/л; Киин — наименьший объем исходного раствора электролита, вы-
зывающий коагуляцию данного объема золя, мл; — — фактор эквива-
z
лентности; У^ — суммарный объем золя, исходного раствора электро-
лита и воды, мл.
Наименьший объем исходного раствора электролита, вызывающий
коагуляцию золя, находят как среднее значение по уравнению
V + V
у = ' 1
Г МИН 2
где У, — объем исходного раствора электролита в пробирке, в которой
произошла коагуляция, мл; И,+| — объем исходного раствора электролита
в соседней пробирке, в которой коагуляция не произошла, мл.
Формулируют вывод, отмечая, соответствуют ли экспериментальные
данные правилам Гарди и Шульце.
194
Вопросы к защите работы
1. Что называется кинетической и агрегативной устойчивостью золей?
2. Какое явление называется коагуляцией? В чем выражаются видимые призна-
ки коагуляции?
3. Воздействием каких факторов можно вызвать коагуляцию лиофобных золей?
4. Что называется порогом коагуляции? В каких единицах выражается его ве-
личина?
5. Что такое коагулирующая способность электролита? От каких факторов за-
висит ее величина?
6. Какие ионы электролитов Na2SO4 и K3[Fe(CN)6] являются коагулирующими
для гидрозоля гидроксида железа(Ш), полученного методом гидролиза?
7. Коагуляция 10 мл гидрозоля гидроксида железа(Ш) наступила при добавле-
нии к нему 2 мл раствора Na2SO4 с молярной концентрацией 0,0025 моль-л"1.
Вычислите порог коагуляции и коагулирующую способность этого элек-
тролита.
8. Какой объем раствора К2Сг2О7 с концентрацией 0,01 моль-л"1 можно доба-
вить к 1 л золя, чтобы вызвать его коагуляцию, если известно, что порог коа-
гуляции равен 0,6 моль-л"1?
9. Определите знак заряда коллоидных частиц золя, если при его коагуляции
электролитами получены следующие пороги коагуляции (в ммоль/л):
cn(KNO3) = 300; c„(MgCl2) = 320; c„(Na3PO4) = 0,6.
10. Какой из электролитов Na2SO4 или MgCl2 будет обладать большей коагули-
рующей способностью для золя иодида серебра, полученного смешением
равных объемов раствора иодида калия с концентрацией 0,01 моль-л"1 и рас-
твора нитрата серебра с концентрацией 0,015 моль-л"1?
11. Какое явление называют пептизацией? По каким признакам можно судить о
пептизации?
12. Чем отличается химическая пептизация от адсорбционной?
13. Напишите формулу мицеллы золя гидроксида алюминия, полученного из
осадка, пептизацией раствором гидроксида натрия.
Работа 10.4. Определение критической концентрации
мицеллообразования олеата калия
Цель. Приобрести навыки определения критической концентрации
мицеллообразования коллоидных ПАВ кондуктометрическим методом.
Оборудование. Прибор для измерения электрической проводимости рас-
творов; кондуктометрическая ячейка с платиновыми электродами; пипетки.
Реактивы. Раствор олеата калия (с = 0,01 моль/л).
Выполнение эксперимента. Кондуктометрическую ячейку промы-
вают дистиллированной водой, затем споласкивают 0,01 моль/л раство-
ром олеата калия. В ячейку наливают такой объем того же раствора олеа-
195
та калия, чтобы электроды были полностью погружены в него. Подклю-
чают электроды к кондуктометру и измеряют сопротивление раствора. Из
исходного раствора ПАВ последовательным разбавлением дистиллиро-
ванной водой готовят растворы с концентрациями, указанными в табли-
це, и измеряют их сопротивление. Растворы готовят непосредственно
перед измерениями электрической проводимости для предотвращения
гидролиза ПАВ. Результаты кондуктометрических измерений записыва-
ют по форме:
Концентрация раствора олеата калия, моль/л Сопротивление раствора R, Ом
110~2
7.5 10-3
5,6-10’3
2,8-10'3
1,4 103
0,7-1 (Г3
0,35-10'3
0,175-Ю-3
Обработка результатов эксперимента. Строят график зависимости
Rx = У(с). Определяют величину ККМ: проводят касательные к прямоли-
нейным участкам кривой до их пересечения и из точки пересечения
опускают перпендикуляр на ось абсцисс. Найденное значение ККМ ука-
зывают в выводе.
Вопросы к защите работы
1. Чем отличаются коллоидные ПАВ от истинно растворимых?
2. Какую концентрацию коллоидных ПАВ называют критической концентра-
цией мицеллообразования?
3. В виде каких частиц находятся коллоидные ПАВ в растворах, концентрация
которых: а) меньше ККМ; б) равна или больше ККМ?
4. По изменению каких свойств раствора коллоидного ПАВ можно судить о
возникновении мицелл?
5. Как можно объяснить наблюдаемое в работе изменение сопротивления рас-
твора олеата калия с изменением его концентрации?
6. Нарисуйте схемы строения сферических мицелл ионогенных коллоидных
ПАВ: а) в полярных растворителях; б) в неполярных растворителях.
7. Какое явление называют солюбилизацией? Приведите примеры.
196
Вопросы к гл. 10
1. Сравните свойства коллоидных и истинных растворов.
2. Какие условия необходимы для образования коллоидного раствора?
3. От каких примесей можно очистить коллоидные растворы посредством элек-
тродиализа?
4. Назовите электрокинетические явления в золях и объясните, чем они обу-
словлены.
5. Как определяют порог коагуляции и коагулирующую способность электро-
лита?
6. Какими воздействиями можно вызвать пептизацию осадка?
7. От каких основных факторов и как зависит солюбилизирующая способность
коллоидных ПАВ?
8. Перечислите основные применения коллоидных ПАВ.
Глава 11
Физическая химия
высокомолекулярных соединений
и их растворов
11.1. МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Применение высокомолекулярных соединений (ВМС) в самых раз-
личных областях техники, в быту ширится с каждым годом. Современная
жизнь практически невозможна без материалов на основе ВМС. Велико
их значение и в медицине, где их применяют для создания искусствен-
ных сосудов, разнообразных протезов, при изготовлении специальных, в
том числе хирургических, клеев. Белки, являющиеся основой процессов
жизнедеятельности всех известных организмов, — высокомолекулярные
соединения. Из биополимеров построены клетки всех живых организмов.
Изучение физико-химических свойств ВМС важно для понимания меха-
низмов биохимических реакций, взаимодействия лекарственных и токси-
ческих веществ с биополимерными структурами организма. Некоторые
лекарственные вещества представляют собой ВМС или их растворы.
Высокомолекулярные соединения состоят из очень больших моле-
кул, называемых макромолекулами-, их размеры соизмеримы с размерами
коллоидных частиц. Поэтому растворы ВМС проявляют ряд свойств, ха-
рактерных для коллоидных растворов. Это малая скорость диффузии рас-
творенных частиц, неспособность их проникать через диализационные
мембраны, эффект Фарадея—Тиндаля и др. Однако растворы ВМС явля-
ются истинными. Они удовлетворяют основным критериям истинных
растворов, которыми являются: самопроизвольность образования, гомо-
генность, термодинамическая устойчивость, равновесность и обрати-
мость. Равновесие в растворах ВМС устанавливается медленнее, чем в
истинных растворах, и растворению ВМС обычно предшествует набухание.
Набухание — процесс увеличения объема и массы ВМС в результате
поглощения высокомолекулярным соединением низкомолекулярной
жидкости. Набухание тканей организма наблюдается при образовании
отеков, очагов воспаления, ожогах, укусах насекомых, аллергических
реакциях, что связано в первую очередь с изменением pH среды и кон-
центраций поступающих в ткани веществ.
198
Способность полимера набухать характеризуется степенью набуха-
ния а:
V - V
(HD
'о
где Ио и К — объем образца полимера до и после набухания.
Величина набухания ВМС зависит от природы ВМС и растворителя,
температуры, давления, присутствия посторонних веществ, особенно
электролитов, pH среды, формы и степени измельченности образца. По-
вышение температуры ускоряет набухание, но уменьшает степень набу-
хания. Увеличение внешнего давления вызывает увеличение степени на-
бухания.
Влияние pH среды на набухание особенно значительно для амфотер-
ных полиэлектролитов (к ним относятся важнейшие биополимеры —
белки и нуклеиновые кислоты).
Состояние макромолекул, при котором число ионизированных ки-
слотных групп равно числу ионизированных основных групп и, следова-
тельно, средний суммарный заряд макромолекул равен нулю, называют
изоэлектрическим состоянием. Значение pH раствора, при котором мо-
лекулы полиамфолита находятся в изоэлектрическом состоянии, называ-
ют изоэлектрической точкой (ИЭТ). Изоэлектрическая точка является
важнейшей характеристикой белка, определяющей его свойства в той или
иной среде. Зная ИЭТ, можно подобрать оптимальные условия выделе-
ния и очистки белков при получении лекарственных форм на основе сы-
рья животного и растительного происхождения (ферменты, гормоны и
др.). Выбор адекватных методов окрашивания клеток при гистохимиче-
ских исследованиях также часто основан на знании значения ИЭТ. Изо-
электрическая точка большинства белков меньше 7: для желатина ИЭТ
равна 4,7, для казеина — 4,6, для глобулина — 5,4.
Ряд свойств белков в ИЭТ резко меняется. Белки в изоэлектрическом
состоянии имеют минимальные значения степени гидратации, набухания,
растворимости. Их растворы обладают минимальной устойчивостью,
вязкостью, осмотическим давлением, электрической проводимостью,
максимальной оптической плотностью и степенью желатинирования.
Методы определения ИЭТ делят на прямые и косвенные. К прямым ме-
тодам относят электрокинетические методы, например электрофорез.
При этом определяют pH раствора белка, при котором электрофоретиче-
ская подвижность частиц минимальна. Косвенные методы основаны на
определении изменения какого-либо свойства раствора белка в зависимо-
сти от pH среды. Зависимость степени набухания белка от pH среды вы-
ражается кривой с двумя максимумами и одним минимумом, положение
которого соответствует изоэлектрической точке.
199
Добавление определенных количеств ВМС к золям повышает агре-
гативную устойчивость золей по отношению к электролитам. Это явле-
ние называется коллоидной защитой. Объясняется оно тем, что молекулы
ВМС адсорбируются на поверхности коллоидных частиц, сольватируют-
ся, защищая коллоидные частицы от агрегации (коагуляции). Для коли-
чественной оценки защитной способности ВМС используют различные
«защитные» числа. Например, золотое число, железное и др. Название
защитного числа зависит от того, по отношению к какому золю оно изме-
рено. Золотым числом называют минимальную массу (мг) сухого высо-
комолекулярного вещества, способного защитить 10 мл красного золя
золота от коагуляции под действием 1 мл 10%-го раствора NaCl. Чем
меньше защитное число, тем выше защитная способность ВМС. Защит-
ные свойства ВМС зависят от природы ВМС и природы коллоидного
раствора. Для защиты коллоидных растворов подбирают определенные
ВМС, обладающие наибольшими защитными свойствами.
В организме многие гидрофобные частицы находятся в защищенной
белками форме. Нарушение явления коллоидной защиты способствует
развитию патологических процессов: отложению солей, образованию
камней, развитию атеросклероза.
Многие свойства ВМС, в частности способность к набуханию и рас-
творению, прочность и эластичность зависят от молекулярной массы
ВМС. Высокомолекулярные соединения часто состоят из макромолекул с
различной молекулярной массой (представляют собой смесь полимерго-
мологов). Поэтому говорят о средней молекулярной массе ВМС. Найден-
ное среднее значение молекулярной массы зависит от того, какой экспе-
риментальный метод был применен для его определения. Основными
методами измерения молекулярной массы ВМС являются методы осмо-
метрии, вискозиметрии, диффузии, светорассеяния, ультрацентрифуги-
рования. Одним из наиболее распространенных методов определения
молекулярной массы ВМС является вискозиметрический метод, основан-
ный на измерении вязкости растворов ВМС различных концентраций.
Вязкость растворов ВМС обычно выше вязкости растворов низкомолеку-
лярных веществ и коллоидных растворов тех же концентраций. Растворы
ВМС обладают аномально высокой вязкостью, которая не подчиняется
законам Ньютона, Пуазейля, Эйнштейна. Это объясняется тем, что моле-
кулы ВМС имеют большие размеры, асимметричную удлиненную форму,
повышенную гибкость, различную ориентацию в растворе (ориентацион-
ная вязкость), способны в растворах к образованию внутренних структур
в результате межмолекулярных взаимодействий (структурная вязкость).
Для измерения вязкости растворов ВМС можно использовать мето-
ды капиллярного истечения жидкости, падающего шарика и вращающих-
ся цилиндров. Определение вязкости с помощью капиллярных вискози-
метров основано на законе Пуазейля, согласно которому объем V жидко-
200
сти, перетекающей через капиллярную трубку, прямо пропорционален
времени перетекания /, давлению столба жидкости р и четвертой степени
радиуса капилляра г. Кроме того, объем перетекающей жидкости обратно
пропорционален длине капилляра I и вязкости жидкости q:
(11.2)
8/т|
Отсюда абсолютная вязкость равна
яг4 pt
п =----—
8Г/
(П-3)
Относительная вязкость q0TH равна отношению абсолютной вязкости
раствора г) к вязкости растворителя q0. Для определения относительной
вязкости измеряют время истечения t0 через капилляр вискозиметра рас-
творителя (с плотностью ро) и раствора t (с плотностью р). При условии,
что значения V, 1 и р постоянны для данного вискозиметра, относитель-
ную вязкость рассчитывают по уравнению
„ _ П _ 'Р
Пота
По ^оРо
(Н.4)
Если плотность раствора и растворителя приблизительно одинаковы, то
уравнение (11.4) можно упростить:
1)^=7-. (П-5)
‘о
Удельную вязкость определяют по уравнению
Пуд =Л22к = Пэт„-1 =^--1. (П-6)
По Ч
Отношение удельной вязкости к концентрации раствора называют приве-
денной вязкостью:
CUT)
В этом уравнении концентрация раствора
(Ь) ВМС выражена числом основных мо-
лей (молей мономера) на 1 кг растворите-
ля. Приведенная вязкость увеличивается
при увеличении концентрации раствора
ВМС. График этой зависимости представ-
лен на рис. 11.1. Приведенная вязкость
бесконечно разбавленного раствора назы-
приведенной вязкости от кон-
центрации ВМС
201
вается характеристической вязкостью [г|]:
[г|] = limr]np, с->0.
Характеристическую вязкость можно определить методом графической
экстраполяции значений приведенной вязкости при разных концентраци-
ях к концентрации, равной нулю.
По данным вискозиметрических измерений молярную массу ВМС
рассчитывают по модифицированному уравнению Штаудингера:
[п] = ХЛ/а, (11.8)
где К — константа, характерная для полимеров одного гомологического
ряда; а — константа, характеризующая гибкость макромолекул и их
взаимодействие с молекулами растворителя; а и К — эмпирические кон-
станты. Для некоторых ВМС и растворителей они найдены и приводятся
в справочниках и монографиях.
Работа 11.1. Набухание ВМС.
Определение ИЭТ желатина по набуханию.
Коллоидная защита
Цель. Приобрести навыки экспериментального определения вели-
чины набухания полимеров и ИЭТ белков, изучить влияние различных
факторов на величину набухания полимеров. Познакомиться с явлением
коллоидной защиты.
Оборудование. Штатив для пробирок; пробирки одинакового диаметра или
градуированные; бюретки; штативы Бунзена; палочки стеклянные.
Реактивы. Желатин порошкообразный; кусочки резины; толуол; растворы
сульфата натрия (c(l/2Na2SO4) = 1 моль/л и c(l/2Na2SO4) = 0,0025 моль/л); рас-
твор иодида натрия (c(Nal) = 0,1 моль/л); буферные растворы с pH от 1 до 12;
гидрозоль гидроксида железа(Ш); 0,1%-й раствор желатина.
Выполнение эксперимента. Опыт 1. Изучение влияния природы
среды на набухание. Берут четыре сухие пробирки одинакового диаметра
и нумеруют их. В пробирки 1 и 2 помещают примерно одинаковое коли-
чество порошкообразного желатина (0,5 см по высоте пробирки), в про-
бирки 3 и 4 — по одинаковому кусочку резины. В пробирки 1 и 3 отме-
ривают из бюретки по 5,0 мл дистиллированной воды, в пробирки 2 и 4
приливают толуол в таком же объеме. Через 20 мин измеряют высоту
слоя набухшего желатина и сравнивают размеры кусочков резины. Ре-
зультаты наблюдений записывают в таблицу по форме:
202
Пробирка Исследуемое ВМС Среда Результаты наблюдений
1 Желатин Вода
2 Желатин Толуол
3 Резина Вода
4 Резина Толуол
По окончании работы толуол выливают в специальную склянку для
слива органических растворителей.
Опыт 2. Изучение влияния электролитов на величину набухания
ВМС. В три сухие пронумерованные пробирки одинакового диаметра
помещают примерно одинаковое количество желатина (0,5 см по высоте
пробирки). С помощью полоски миллиметровой бумаги измеряют высоту
слоя сухого желатина до набухания (Ло); результаты записывают в табли-
цу. Пробирки примерно до середины заполняют из бюреток: 1 — дистил-
лированной водой, 2 — раствором сульфата натрия с концентрацией 1,0
моль/л, 3 — раствором иодида натрия с концентрацией 1,0 моль/л. Через
1—2 мин после заполнения пробирок содержимое их осторожно переме-
шивают стеклянной палочкой, чтобы набухшие частицы верхнего слоя
желатина не затрудняли доступ жидкости к частицам нижнего слоя.
Примерно через 20 мин осторожным постукиванием по верхней части
пробирки добиваются осаждения всплывших частиц желатина и измеря-
ют высоту слоя набухшего желатина (Л). Рассчитывают степень набуха-
ния желатина в воде и растворах электролитов. Результаты измерений и
расчетов записывают в таблицу по форме:
Про- бирка Среда Высота слоя сухо- го желатина Ло, мм Высота слоя набухше- го желатина h^, мм Степень набухания
1 Вода
2 Раствор Na2SO4
3 Раствор Nal
Опыт 3. Определение изоэлектрической точки желатина. В шесть
сухих пронумерованных пробирок (одинакового диаметра или градуиро-
ванные) помещают примерно одинаковое количество желатина (0,5 мл по
высоте пробирки); с помощью полоски миллиметровой бумаги измеряют
высоту сухого желатина в каждой пробирке (Ло) и результаты измерений
записывают в таблицу. В каждую из пробирок осторожно по стенке на-
ливают из бюреток по 7,0 мл растворов с различными значениями pH.
Через 1—2 мин содержимое пробирок осторожно перемешивают, а через
20 мин осаждают всплывшие частицы желатина (как в опыте 2) и изме-
ряют высоту слоя набухшего желатина (Л); результаты измерений запи-
сывают в таблицу по форме:
203
Пробирка pH раствора Л, мм h0, мм АЛ, мм
Опыт 4. Наблюдение коллоидной защиты. В три пронумерованные
пробирки отмеряют из бюретки по 5,0 мл золя гидроксида железа(Ш). В
пробирки 1 и 2 из бюретки добавляют по 1,0 мл 0,1%-го раствора жела-
тина. В контрольную пробирку 3 отмеривают 1 мл дистиллированной
воды. Содержимое пробирок перемешивают. Через 1—2 мин в пробирки
1 и 3 добавляют по 3,0 мл раствора натрия сульфата с концентрацией
c(l/2Na2SO4) = 0,0025 моль/л. В пробирку 2 добавляют такой же объем
сульфата натрия с концентрацией c(l/2Na2SO4) =1,0 моль/л. Содержимое
пробирок сразу же перемешивают и наблюдают за происшедшими изме-
нениями, сравнивая между собой содержимое пробирок 1, 3 и 1, 2. Ре-
зультаты наблюдений записывают в таблицу по форме:
Пробирка ВМС Концентрация электролита c(l/2Na2SO4) Наблюдения
1 Желатин 0,0025
2 Желатин 1,0
3 — 0,0025
Обработка результатов эксперимента. Для определения ИЭТ же-
латина (опыт 3) строят график зависимости ДЛ = /(pH). ИЭТ находят,
опустив из точки минимума на кривой перпендикуляр на ось абсцисс.
В выводах отмечают влияние природы среды, электролитов и pH на
набухание желатина.
Вопросы к защите работы
1. Каковы особенности растворения ВМС? Какой процесс называют набу-
ханием?
2. Какие факторы и как влияют на набухание ВМС? Влияние каких факторов
изучают в лабораторной работе?
3. Как определяют степень набухания? Назовите основные этапы эксперимента.
4. Что называют изоэлектрической точкой белка? Приведите схематическую
формулу макромолекулы белка находящегося в изоэлектрическом состоя-
нии. Какие свойства белка резко меняются в изоэлектрическом состоянии?
5. Назовите прямые и косвенные методы определения ИЭТ. Каким методом
определена ИЭТ желатина в лабораторной работе?
6. В каком из растворителей — вода, спирт, толуол, физиологический раствор —
желатин будет набухать, а в каком — нет? Объясните причину.
204
7. Изоэлектрическая точка миозина мышц равна 5. При каких значениях pH: 2,
4, 5, или 7 набухание будет наименьшим. С чем это связано?
8. При pH 6 инсулин остается на старте при электрофорезе. К какому электроду
инсулин будет перемещаться в растворе хлороводорода с концентрацией 0,1
моль/л?
9. В чем проявляется и как объясняется коллоидная защита?
Работа 11.2. Определение молярной массы ВМС
вискозиметрическим методом
Цель. Приобрести навыки определения молярной массы полимеров
вискозиметрическим методом.
Оборудование. Вискозиметр Оствальда; секундомер; цилиндры вместимо-
стью 25 мл.
Реактивы. Водные растворы карбоксиметилцеллюлозы четырех концентраций.
Выполнение эксперимента. Для определения вязкости применяют
вискозиметр Оствальда, который представляет собой U-образную трубку
с двумя расширениями (резервуарами): в нижней части широкого колена
/ив верхней части узкого колена 2 (рис. 11.2). Резервуар узкого колена
переходит в капилляр. Выше и ниже этого резервуара нанесены метки 3.
Вискозиметр тщательно промывают. Для этого наливают раствори-
тель в широкое колено и затем, переводя его с помощью резиновой гру-
ши в узкое колено (на 1—2 см выше верхней метки), дают жидкости сво-
бодно перейти в широкое колено. Операцию повторяют, затем раствори-
тель выливают. Закрепляют вискозиметр в штатив строго вертикально.
Перегиб вискозиметра, защищенный резиновой прокладкой, должен на-
ходиться на основании штатива. Определяют время г ,
истечения растворителя через капилляр вискозиметра П Г
(т0). Для этого в широкое колено наливают мерным j-h-
цилиндром такой объем растворителя, чтобы резерву- П
ар широкого колена был заполнен наполовину. С по- Г )
мощью резиновой груши переводят растворитель в J
узкое колено вискозиметра так, чтобы нижний край
мениска был на 1—2 см выше верхней метки, дают
жидкости свободно перетекать в широкое колено. Как
только нижний край мениска коснется верхней метки г д
узкого колена вискозиметра, включают секундомер, а ( j
когда мениск коснется нижней метки — выключают \ (
его. Проводят не менее трех измерений.
Описанным способом измеряют время истечения рис y j. Виско-
через капилляр вискозиметра растворов, начиная с зиметр Оствальда
205
раствора наименьшей концентрации. Объем растворов должен быть та-
ким же, как и объем растворителя. Переходя к раствору более высокой
концентрации, нужно тщательно удалить из вискозиметра прежний рас-
твор и сполоснуть вискозиметр новым раствором. После окончания рабо-
ты вискозиметр 2—3 раза промывают растворителем.
Исходные и экспериментальные данные вискозиметрического опре-
деления молярной массы ВМС запишите по форме:
Температура опыта...................................
Растворитель........................................
Исследуемое ВМС.....................................
Массовая доля ВМС в растворе <о, %..................
Л/(мономер), г/моль.................................
Концентрация в основных молях Ь, моль-кг’1..........
Время перетекания т, с................... ..........
Обработка результатов эксперимента. Рассчитывают моляльную
концентрацию растворов в основных молях: количество вещества моно-
мера в 1 кг растворителя. Рассчитывают относительную, удельную и
приведенную вязкость для растворов каждой концентрации по средним
значениям времени перетекания [уравнения (10.5), (10.6), (10.7)]. Строят
график зависимости =Цс). Отрезок, отсекаемый прямой на оси орди-
нат, отвечает характеристической вязкости. Рассчитывают относитель-
ную молярную массу полимера, подставляя найденное значение характе-
ристической вязкости в модифицированное уравнение Штаудингера (11.8).
Вопросы к защите работы
1. В чем заключается сущность вискозиметрического метода' определения мо-
лярной массы полимера?
2. Какое уравнение лежит в основе вискозиметрического метода определения
молярной массы полимеров? Проанализируйте это уравнение.
3. Время истечения из вискозиметра для 0,8%-го раствора полимера (C5H5CI—)„
равно 53 с, а время истечения растворителя 40 с. Рассчитайте относитель-
ную, удельную и приведенную вязкости.
4. Определите молярную массу полимера по следующим данным:
Концентрация ВМС в ос- новных молях на л 0,015 0,025 Приведенная вязкость 1,8 2,0 0,050 2,5
Константы в уравнении Штаудингера: К = 4,21 10"4, а = 0,67.
206
Вопросы к гл. 11
1. Сравните свойства растворов ВМС и коллоидных растворов.
2. Направление движения макромолекул белка при электрофорезе в растворах с
pH 5,2 и 6,7 разное. Определите диапазон значения pH, в котором может на-
ходиться ИЭТ белка, и направление движения макромолекул в обоих случа-
ях. Ответ объясните.
3. Определите ИЭТ сывороточного альбумина исходя из следующих данных:
pH 4,03 4,36 5,67 5,86 6,52 7,0
Электрофорети-
ческая подвиж-
ность, мкм/с.... 0,064 0,356 -0,487 -0,750 -1,00 -1,230
4. Что является количественной мерой защитной способности ВМС?
5. Каково биологическое значение коллоидной защиты?
6. Чем объясняется аномальная вязкость растворов ВМС?
7. Назовите методы определения молярной массы полимеров.
Приложение
1. Некоторые физические постоянные
Постоянная Авогадро = 6,02-1023 моль*1.
Универсальная газовая постоянная Л = 8,31 Дж/(моль-К) или кПал-К^моль*1.
Постоянная Больцмана к - R/NA = 1,38-10‘2! Дж/К.
Нормальный молярный объем газа Ко = 22,4 л/моль.
Постоянная Планка h = 6,63-1 О*34 Дж-с.
Заряд электрона е* = 1,60-10*” Кл.
Постоянная Фарадея F= 9,65-104 Кл/моль.
2. Множители и приставки для образования десятичных кратных
и дольных единиц и их обозначения
Множитель, на который умножается основная единица Наименова- ние Обозначе- ние Множитель, на который умножается основная единица Наименова- ние Обозначе- ние
1012 тера т 0,1 деци д
10’ гига г ю*2 сайта с
106 мега м ю*3 милли м
103 кило к ю*6 микро мк
102 гекто г ю*9 нано н
10 дека да ю*12 ПИКО п
3. Основные единицы Международной системы измерений (СИ)
Величина Единица
Наименование Обозначение
Основные величины
Длина метр м
Время секунда с
Масса килограмм кг
208
Продолжение табл. 3
Величина Единица
Наименование Обозначение
Сила электрического тока ампер А
Термодинамическая температура кельвин К
Количество вещества моль МОЛЬ
Производные величины пространства и времени
Площадь Объем квадратный метр кубический метр м2 м3
Скорость метр в секунду м/с
Производные механические и тепловые величины
Плотность килограмм на кубиче- ский метр кг/м3
Сила, вес ньютон Н
Давление паскаль Па
Энергия, работа, количество теплоты, термодинамический потенциал джоуль Дж
Энтропия джоуль на кельвин Дж/К
Производные электрические и магнитные величины
Количество электричества, элек- трический заряд кулон Кл
Электрическое напряжение, электрический потенциал, вольт В
электродвижущая сила
Электрическое сопротивление ом Ом
4. Коэффициенты Стьюдента t(P, J) при различных значениях
заданной вероятности р и числа определений (и)
/=л-1 Р /=л-1 Р
0,9 0,95 0,99 0,9 0,95 0,99
1 6,31 12,71 63,66 9 1,83 2,26 3,25
2 2,92 4,30 9,92 10 1,81 2,23 3,17
3 2,35 3,18 5,84 20 1,72 2,09 2,84
4 2,13 2,78 4,60 30 1,70 2,04 2,75
5 2,01 2,57 4,03 60 1,67 2,00 2,66
6 1,94 2,45 3,71 120 1,66 1,98 2,62
7 1,89 2,36 3,50 >120 1,64 1,96 2,58
8 1,86 2,31 3,35
8-366
209
5. Плотности (р, г/см3) и массовые доли (<о, %)
растворов кислот при 20 °C
Плотность соляной кислоты Массовая доля хлороводорода Плотность азотной кислоты Массовая доля HNO3
1,010 2,364 1,005 1,255
1,015 3,374 1,010 2,164
1,020 4,388 1,015 3,073
1,025 5,408 1,020 3,982
1,030 6,433 1,025 4,883
1,035 7,464 1,030 5,784
1,040 8,490 1,035 6,661
1,045 9,51 1,040 7,530 ’
1,050 10,52 1,045 8,398
1,055 11,52 1,050 9,259
1,060 12,51 1,055 10,12
1,065 13,50 1,060 10,97
1,070 14,495 1,065 11,81
1,075 15,485 1,070 12,65
1,080 16,47 1,075 13,48
1,085 17,45 1,080 14,31
1,090 18,43 1,085 15,13
1,095 19,41 1,090 15,95
1,100 20,39 1,095 16,76
1,105 21,36 1,100 17,58
1,110 22,33 1,110 19,19
1,115 23,29 1,120 20,79
1,120 24,25 1,130 22,38
1,125 25,22 1,140 23,94
1,130 26,20 1,150 25,48
1,135 27,18 1,160 27,00
1,140 28,18 1,170 28,51
1,145 29,17 1,180 30,00
1,150 30,14 1,190 31,47
1,160 32,14 1,200 32,94
1,170 34,18 1,210 34,41
1,180 36,23 1,220 35,93
1,190 38,32 1,230 37,48
210
6. Свойства важнейших кислотно-основных индикаторов
Двухцветные индикаторы
Индикатор
Метиловый оранжевый
Лакмоид
Метиловый красный
Бромтимоловый
Переход окраски
Красная —» оранжевая
Красная —> синяя
Красная —> желтая
Желтая -> синяя
Интервал pH
3,1^1,0
4,0—6,4
4,2—6,2
6,0—7,6
Одноцветные индикаторы (серия Михаэлиса)
Индикатор Цвет (при верхней границе pH) рК Интервал pH
а-Динитрофенол Желтый 4,05 (293 К) 2,8—4,5
у-Динитрофенол Желтый 5,15 (293 К) 4,0—5,6
«-Нитрофенол Желтый 7,16(293 К) 5,2 —7,0
м-Нитрофенол Желтый 8,31(293 К) 6,7—8,4
Фенолфталеин Малиновый 9,37 (291 К) 8,3—10,5
Ализариновый Фиолетовый -» 11,16(291 К) 10,0—12,0
красный желтый
7. Термодинамические свойства некоторых веществ,
применяемых в медицине
— стандартная теплота образования вещества, кДж/моль; Дуб^ —
стандартное изменение энергии Гиббса при образовании сложного вещества из
простых веществ, кДж/моль; 5^, — стандартная энтропия вещества,
Дж/(моль-К); к — кристаллическое состояние; ж — жидкое состояние; г — газо-
образное состояние; aq — вещество (ион) в водном растворе.
Вещество или ион Состояние Д/^29» с° ° 298
AgCl К -127 -109,7 96,1
AgNOj к -123 -32,2 141
AfcO к -30,6 -10,8 122
Al к 0 0 28,3
A1J+ aq -525 -481 -313
AljOj корунд -1670 -1576 51
211
Продолжение табл. 7
Вещество или ион Состояние A ^/^298 °298
А12О3-ЗН2О К -2568 -2292 140
В2О3 к -1264 -1184 54
Н3ВО3 к -1089 -963 89,6
нэво3 aq -1068 -963 160
Ва2+ aq -538 -561 12,6
ВаС12 К -860 -811 126
ВаС12-2Н2О к -1462 -1296 203
BaSO4 к -1465 -1353 132
Вг2 ж 0 0 152
Вг2 г 30,7 3,1 245
С графит 0 0 5,7
с алмаз 1,9 2,9 2,4
со г -111 -137 198
со2 г -393,5 -394,4 214
со2 aq -413 -386 121
Н2СО3 aq -700 -623 187
нсо3 aq -691 -587 95
СО^’ aq -676 -528 -53
Са2+ aq -543 -553 -55
СаО К -636 -603 40
Са(ОН)2 к -987 -897 76
CaSO4 к -1432 -1320 107
CaSO4-2H2O к -1762 -1565 194
СаС12 к -795 -750 114
СаС12 aq -878 -815 55
СаС12-6Н2О К -2607
СаСО3 к -1207 -1129 93
С12 г 0 0 223
С12О г 76 94 266
НС1 г -92,3 -95,3 186,7
HCI aq -167 -131 55
СгО2* aq -863 -706 38,5
Сг2О2' aq -1461 -1257 214
Си2+ aq 64,4 65 99
CuCl К -136 -118 84,5
CuCl2 к -206
CuSO4 к -770 -662 113
CuSO4-5H2O к -2278 -1880 305
212
Продолжение табл. 7
Вещество или ион Состояние д/я2°98 ^/^298 ° 298
F" aq -329 -276 -9,6
HF Г -269 -271 174
Fe к 0 0 27,2
Fe2+ aq -88 -85 -113
Fe3+ aq -48 -11 -293
Fe(OH)3 К -824
FeCOj к -753 -680 96
FeCl3 к -405
FeCl36H2O к -2226
FeSO4 к -923 -820 108
FeSO4-7H2O к -3007'
H2 г 0 0 131
H+ aq 0 0 0
OH’ aq -230 -157 -10,5
H2O Ж -286 -237 70
H2O г -242 -229 189
H2O2 ж -188 -118
H2o2 aq -191
Hg Ж 0 0 77
Hg г 61 32 175
Hg2+ aq -165
Hgci2 К -230 -177
Hg2ci2 к -265 -211 196
HgO к -90 -58,4 73
K+ aq -251 -282 103
KOH aq --477 —441 92
KA1(SO4)212H2O к -6057 -5137 687
KBr к -392 -379 96
KBr aq -372 -385 183
KC1 К -436 -408 83
KCi г -216 -235 239,5
KC1 aq -419 -413 158
KC1O3 К -391 -290 143
KI к -328 -322 104
KI aq -307 -334 212
KNO3 к -493 -393 133
KNO3 aq -458 -393 291
KMnO4 К -813 -714 172
K2SO4 к -1438 -1320 176
213
Продолжение табл. 7
Вещество или ион Состояние Д/Я2°98 Д/^298 с° ° 298
Li+ aq -278 -294 14
LiOH К -487 -444 50
LijCOj к -1215 -ИЗО 90
Mg2+ aq -462 -156 -118
MgCO3 К -1113 -1029 66
MgCl2 к -642 -592 89,5
MgCl26H2O к -2500 -1279 366
MgO к -602 -570 27
Mg(OH)2 к -925 -834 63
MgSO4 к -1278 -1174 91,6
MgSO4-7H2O к -3384
Mn2+ aq -219 -223 -84
MnSO4 К -1064 -956 112
N2 г 0 0 191,5
NH3 г -46,2 -16,6 192,5
NHj aq -80,8 -26,6 НО
nh; aq -133 -79,5 113
nh4ci К -315 -204 94,6
(NH4)2SO4 к -1179 -900 220
n2o г 81,5 103,6 220
NO т 90,4 86,7 210,6
no2 г 33,8 51,8 240,5
n2o4 г 9,7 98,3 304,3
hno2 aq -119 -56 153
HNO3 Ж -173 -80 155
NO3 aq -207 -114 146
Na к 0 0 51
Na+ aq -240 -262 60
Na2CO3 к -1131 -1048 136
Na2C0310H20 к -4082 -3906
NaHCO, к -948 -852 102
NaF к -569 -541 59
NaCl к -411 -384 72
NaNO2 к -359
NaNOj к -425 -366 116
NaOH к -427 -380 60
Na2SO3 к -1117 -1043 146
Na2SO4 к -1384 -1267 149
Na2SO410H2O к -4324 -3644 593
214
Продолжение табл. 7
Вещество или ион Состояние Д/^298 Д/О294 V0 ° 29$
Na2S2O3-5H2O К -2602
о2 г 0 0 205
О3 г 142 163 238
Р4 белый 0 0 44,4
Р4 красный -18,4
РС13 Г -306 -286 312
РС15 г -399 -325 353
н2ро; aq -1302 -1135 89
HPOJ* aq -1299 -1094 -36
РО’ aq -1284 -1026 -218
р2ог aq -2276
РЬ2+ aq 1,6 -24,3 21,3
РЬО К -218 -188 69
РЬО2 к -277 -219 77
РЬ(СН3СОО)2 к -964
РЬ(СН3СОО)2- к -1854
•зн2о
S ромбич. 0 0 32
S монокл. 0,3 0,1 32,6
so2 г -297 -300 249
SOj г -395 -370 256
H2S г -20 -33 206
H2SO4 aq -907 -742 17
hso; aq -886 -753 127
SO2' aq -907 -742 17,2
SiO2 кварц -859 -805 42
Zn2+ aq -152 -147 -106
ZnO К -348 -318 44
ZnCl2 к -416 -369 108
ZnSO4 к -979 -872 125
ZnSO4-7H2O к -3076 -2560 387
Органические вещества
СН4 Г -85 -51 186
С2Н2 г 227 209 201
QH, г 52 68 219
с2н6 г -107 -33 229
215
Продолжение табл. 7
Вещество или ион Состояние ^/^29» ° 298
с6н6 Ж 49 125 173
СН3С1 г -82 -59 234
СН2С12 г -88 -59 271
СНС13 г -100 -67 296
ссц г -107 -64 309
СН,Вг г -35,6 -26 246
СН2Вг2 г -4,2 -5,9 294
СНВгз г 25 16 331
СВг4 г 50 36 358
CHjOH ж -239 -166 127
С2Н5ОН ж -278 -175 161
Глицерин ж -671 -479 205
Формальдегид г -116 -ПО 219
Ацетальдегид г -166 -134 265
Ацетон ж -247 -154 199
НСООН ж -410 -346 129
НСОО aq -410 -335 92
CHjCOOH ж -487 -392 160
CHjCOO’ aq 489 -404 205
С3Н7СООН Ж -535 -376 226
CjHtCOO’ к -536 -372 202
Глюкозе-1-фос- форная кислота aq -1789,5
Нитробензол Ж 16 146 224
Анилин ж 31 149 191
Глицин к -537 -378 103,5
Глицин aq -523 -380 158,6
Цистеин к -532,6 -342,7 169,9
L-лейцин aq -643,4 -352,3 207,5
D.L-лейцилгли- aq -464
цин
Глицилглицин aq -734,3 492,1 231,4
Пируват-ион aq -596,2 -472,4 171,5
L-молочная кис- aq -686 -539 222
лота
Сахароза К -2222 -1545 360
D-глюкоза aq -1263,8 -917,0 269,5
D-глюкоза К -1274,5 -910,6 212,1
216
8. Теплоты сгорания ( ДСЯ°, кДж/моль) некоторых
органических веществ
Вещество Состояние дс//° Вещество Состояние дся°
СН4 Г -882 с2н2 Г -1305
СН3Вг г -770 С2Н5ОН ж -1371
СН3С1 г -687 С2Н5ОС2Н5 ж -2727
CH3I ж -815 NH2CH2COOH к -981
CHjNH2 -1071 СО(СНз)2 ж -1786
СН3ОН ж -715 С6н6 ж -3273
СН2О г -561 С6Н|2 ж -3920
НСООН ж -263 c6h5nh2 ж -3396
CO(NH2)2 к -634 c6h5no2 ж -3093
сись ж -373 С6Н5ОН -3064
CHI3 к -677 Глюкоза к -2810
С2н6 г -1541 Фруктоза к -2827
с2н, г -1387 СН3СООН ж -876
9. Средняя удельная теплота полного окисления
основных компонентов пищевых продуктов
Вещества Q, кДж/г
Белки 17
Жиры 39
Углеводы 17
10. Теплоты растворения в воде (Д,//°, кДж/моль) некоторых
неорганических веществ, применяемых в медицине
Вещество Д,Я° Вещество д,я°
AgNOj 22,9 MgCl2-6H2O -12,3
Al2(SO4)318H20 -33,9 MgSO4 -84,9
ВаС12 -8,7 MgSO47H2O 16,2
ВаС122Н2О 20,6 MnSO4 -57,7
Ва(ОН)2 -47,7 MnSO4-5H2O -0,2
217
Продолжение табл. 10
Вещество Д,Я° Вещество Д5Я°
Ва(ОН)2-8Н2О 60,7 NH3 -35,4
СаС12 -75,3 NH(C1 16,3
СаС12-6Н2О 19,1 NH4NO3 26,5
CuSO4 -66,5 NaBr 0,8
CuSO4-5H2O 11,7 NaCl 5,4
FeSO4 -62,3 N82B4O7 -43,0
FeSO4-7H2O 18,1 Na2B4O710H2O 108,2
FeCl3 -133 Na2CO3 -23,6
FeCl3-6H2O -24 Na2CO310H2O 67,6
KBr 21,2 NaNO2 14,7
KC1 8,6 Na2SO4 -2,3
KI 21,4 Na2SO410H2O 79,1
KNO3 35,4 Pb(CH3COO)2 -5,9
L12SO4 -26,7 Pb(CH3COO)2-3H2O 23,0
Li2SO4H2O -14,3 ZnSO4 -77,6
MgCl2 -150,5 ZnSO4-7H2O 17,9
,11. Периоды полураспада некоторых радионуклидов,
применяемых в медицине
Нуклид <1/2 Нуклид <1/2
14C 5,71103лет 226Ra 1600 лет
l44Ce 284,4 сут 22*Ra 5,76 года
51Cr 27,703 сут 222Rn 3,824 сут
,37Cs 30,17 года ,06Ru 367 сут
131I 8,054 сут ’«Sr 28,7 года
,92Ir 74,08 сут 95Zr 64 сут
12. Молярная активность некоторых ферментов
Фермент Молярная активность, с-1 Фермент Молярная активность, с“'
Карбоангидраза 600000 Химотрипсин 100
3 -Оксистероидизоме- 280000 ДНК-полимераза-1 15
раза
Ацетилхолинэстераза 25000 Триптофансинтаза 2
Пенициллиназа 2000 Лизоцим 0,5
Лактитдегцдрогеназа 1000
218
13. Константы некоторых жидкостей,
применяемых в качестве растворителей
Вещество /зам, °C Криометриче- ская постоян- ная, К-кг/моль t °C *кип» ч- Эбулиометри- ческая постоян- ная, К-кг/моль
Вода 0,00 1,86 100,0 0,52
Бензол 5,45 5,07 80,2 2,57
Нитробензол 5,85 6,9 211,03 5,27
Циклогексан 6,2 20,2 81,5 2,75
Диоксан 12,34 4,72 100,8 3,2
Диэтиловый эфир -177,0 1,79 34,6 2,02
Этанол -114,0 78,0 1,15
Уксусная кислота 16,64 3,9 117,8 3,1
Камфора 178,4 39,8 204,0 6,09
14. Коэффициенты активности f ионов в водных растворах
Ионы Ионная сила ц раствора
0,0005 0,001 0,01 0,02 0,1 0,2 0,3 0,5 1,0
Н+ 0,98 0,97 0,91 0,90 0,87 0,81 0,80 0,79 0,85
NHj, Ag*,K*, Li*, СГ, Вг“, Г, no;, no; 0,98 0,96 0,90 0,87 0,75 0,67 0,62 0,55 0,44
он“, г, сю; 0,98 0,96 0,90 0,87 0,76 0,68 0,63 0,56 0,46
Na*, Н2РО; 0,98 0,96 0,90 0,87 0,77 0,73 0,70 0,67 0,63
Pb2+, SOJ’, SjO2-, СгО2’, СО2’, SO?’, НРО2’ 0,90 0,87 0,66 0,62 0,36 0,29 0,25 0,22 0,18
Sr2*, Ва2*, Hg2*, S2’ 0,90 0,87 0,67 0,63 0,38 0,30 0,26 0,24 0,20
Са2*, Си2*, Zn2*, Fe2* 0,90 0,87 0,68 0,64 0,41 0,33 0,28 0,25 0,21
Mg2*, Be2* 0,91 0,87 0,69 0,65 0,45 0,37 0,34 0,28 0,23
PO3 0,80 0,73 0,40 0,10
Al3*, Fe3*, Cr3* 0,80 0,74 0,45 0,18
219
15. Средние значения водородного показателя (pH)
биологических жидкостей
Объект pH
Дистиллированная вода в контакте с воздухом Морская вода Сыворотка крови Артериальная кровь Венозная кровь Спинномозговая жидкость Водянистая влага глаза Слезная жидкость Слюна Чистый желудочный сок Желудочное содержимое через 45 мин после пробного завтрака Сок поджелудочной железы Молоко Кожа (внутриклеточная жидкость) Печень (внутриклеточная жидкость): 5,6 8,0 7,35—7,45 7,36—7,42 7,26—7,36 7,35—7,45 7,4 7,4 6,35—6,85 0,9 1,5—2,0 7,5—8,0 6,6—6,9 6,6—6,9
купфферовские клетки клетки по периферии долек клетки в центре долек Желчь в протоках Желчь в пузыре Моча Содержимое тонкого кишечника Кал 6,4—6,5 7,1—7,4 6,7—6,9 7,4—8,5 5,4—6,9 4,8—7,5 7,0—8,0 7,0—7,5
16. Ионное произведение воды Kw при различных температурах
Л °C А>1014 t, °C Х^-1014 /,°С ХГж-Ю14
0 0,11 30 1,48 60 9,55
5 0,17 35 2,09 70 15,8
10 0,30 37 2,4 80 25,8
15 0,46 40 2,95 90 38,8
20 0,69 50 5,50' 100 55,0
25 1,0
220
17. Силовые показатели и константы ионизации кислот по реакции
НВ1+Н2О = В1’1+Н3О+
Кислота pK, K.
Ag+-aq 11,99 1,02-10'12
Al3+-aq 5,02 9,55-IO-6
Н3ВО3 9,14 7,24 1O10
Ba2+-aq 13,36 4,36-1 O’14
HBr -9 10’
CO2 + Н2О 6,37 4,26-10“7
HCO3 10,33 4,68-10""
HCOOH 3,75 1,79-10"*
CH3COOH 4,76 1,74-10"5
H2C2O4 1,19 6,46-10“2
hc2o; 4,21 6,16 10 s
C2H5COOH 4,87 1,35-10 "5
C2HSOH >15 <10“15
CH2OHCHOHCOOH (глицериновая) 3,52 3,0-10"*
CH3CHOHCOOH (молочная) 3,83 1,48 10"*
H6C4O6 (винная) 3,04 9,12-10"*
Аскорбиновая 4,04 9,12-10"5
Глюконовая 3,86. 1,38-Ю-4
Бензойная 4,20 6,31 -10"5
С6Н5ОН (фенол) 10,0 IO'10
ННЬ (гемоглобин) 8,20 6,31-10-’
ННЬ-О2 (оксигемоглобин) 6,95 l,12-10"7
Ca2+-aq 12,77 1,70-10"13
НС1 -7 107
нею 7,55 2,82-10-’
НСЮз 0 1
НсЮ4 -10 10'°
Co2+-aq 8,90 1,26-IO*9
Cr3+-aq 3,95 1,12-Ю-4
Н2СГ2О7 1,64 2,29- IO"2
Cu2+aq 7,34 4,57-IO"8
Fe3+-aq 2,17 6,76-Ю-3
Fe2+aq 6,74 l,82-10-7
HF 3,18 6,61-10"*
HI -10 Ю'°
K+aq 14,46 3,47-Ю-'5
Li+-aq 13,64 2,29-Ю'4
221
Продолжение табл. 17
Кислота pK. K,
Mg2+-aq 11,42 3,80 10”
Mn2+-aq 10,59 2,57-10’"
HMnO4 -3 103
nh; 9,24 5,75-1 O'10
ch3nh; 10,66 2,1910"
HCN 9,0 IO’9
hno2 3,29 5,13-Ю-4
HNO3 -1,32 21
H2O 15,74 1,82-Ю-16
HjO+ -1,74 55
H2O2 11,62 2,40-10’12
H3PO4 2,14 7,24-10’3
h2po; 7,21 6,16-io-*
HPOj- 12,34 4,57-10’13
Pb2+-aq 6,15 7,08-10’7
H2S 6,98 1,05-10’7
HS 13 10”
SO2 + H2O 1,78 l,66-10’2
HSO, 7,20 6,31 10’’
H2SO4 -3 103
hso; 1,95 l,12-10’2
Sr^-aq 13,17 6,76-10’14
Zn2+-aq 7,69 2,04-10-*
18. Константы растворимости некоторых малорастворимых
солей и гидроксидов (25 °C)
Вещество K, Вещество K,
AgBr 5,3-10” FeCzO^ 2,0-10’7
AgCl 1,78-IO’10 FetOHfe 1,0-10”
Agl 8,3 10” Fe(OH)3 3,2-10’”
Ag2COj 1,2-10” FePO4 l,3-10’22
Ag2C2O4 3,5-10’" FeS 5,0-10’”
Ag2CrO4 1,1-10” Hg2Cl2 1,3-10”
Ag2Cr20y 1,0-1 O’10 HgS 4,0-10”
AgCN 1,4-1 O’16 Hg2SO4 6,8-1 O’7
AgSCN 1,1-10” LijCOj 3,98-1 O’3
222
Продолжение табл. 18
Вещество к. Вещество
AgNO2 1,6-Ю-4 LiF 3,8-10-’
Ag3PO4 1,3- IO-20 Li3PO4 3,2-10-’
Ag2S 6,3 1(T50 MgCO3 4,0-10-’
Ag2SO3 1,5-lCr'4 MgC2O4 8,6-10’
Ag2SO4 1,6 IO-’ Mg(OH)2 6,01 O’10
A1(OH)3 1,0-1 O'52 Mg3(PO4)2 1,010-”
AlPO, 5,7-10” MnCO3 1,8-10-"
AuBr 5,010-” Mn(OH)2 4,510-”
AuCl 2,0- IO13 MnS 2,5-10-'°
Aul 1,6-IO-2’ PbBr2 9,1-Ю-6
BaCO3 4,0-IO-10 PbCl2 1,6 10’
BaC2O4 l,l-10“7 Pbl2 1,1-Ю"9
BaCrO4 1,2-1 O’10 PbCO3 7,5-Ю-14
BaF2 1,1-ю-6 PbC2O4 4,8-Ю-10
Ba(OH)2 5,0-10-’ PbCrO4 l,810-14
Ba3(PO4)2 6,0- io-’9 Pb(OH)2 1,1-Ю-20
BaSO3 8,0-10-’ Pb3(PO4)2 7,9-10"”
BaSO4 i,iio-10 PbS 2,5-IO-2’
CaCO3 3,8-Ю-9 PbSO4 1,6-10’
CaC2O4 2,3-Ю-9 SrCOj l,110-,<)
CaC4H4O6 7,7-10-’ SrC2O4 1,6-10’
CaF2 4,0-1 O’" Sr3(PO4)2 1,0-Ю-”
Ca(OH)2 5,5-Ю-6 SrSO3 4,0- IO-’
Ca(H2PO4)2 1,0-10-’ SrSO4 3,2-IO-7
CaHPO4 2,7-10-’ TIBr 3,9-Ю-6
Ca3(PO4)2 2,0- 10-29 T1C1 1,7-ю"1
CaSO3 3,2-10-’ TH 5,75-10-8
CaSO4 2,5-10-’ T12CO3 4,0-10-’
CdCO3 1.010-12 T12C2O4 2,0-10"*
CdC2O4 1,5-10-* T13PO4 6,7-10-’
CdS 1.010-29 T12S 5,0-10-21
Cr(OH)3 6,310-” T12SO3 6,3-Ю-4
Cu(OH)2 5,0- IO-20 T12SO4 4,0-Ю-’
CuS 6,3-ю-’6 Zn(OH)2 7,1-Ю-”
Cu2S 2,5-10"” ZnS 1,6-Ю-24
223
19. Константы нестойкости комплексных ионов
в водных растворах (25 °C)
М"* Лиганд Константа M"* Лиганд Константа
Ag* NH3 K|.2 = 5,9 KT* Ag* no; К,.2=1,5Ю-3
Cd2* NH3 KM = 2,810-7 Cd2* no; К,_3 = 1,5-10”
Со2* NH3 KM = 8.5 10” Al3* c2o2- К1.3 = 5,0-Ю17
Со2* NH3 Км = 4,HO-’ Cr3* c2o2- К|.3 = 3,610”
Со3* NHj Km = 6,2-IO36 Fe3* c2o2- К1.3 = 6,ЗЮ-21
Си2* NH3 KM =l,ItO12 Mn3* c2o2- К|.3 = 3,8-Ю"20
Hg2* NH3 KM = 5,01 O'20 Co2* Салицилат-ион К|.2 = 3,8Ю-12
Ni2* NH3 Km = 3,4-IO11 Ni2* Салицилат-ион К|.2= 1,810-12
Zn2* NH3 KM = 8,31O'12 Cu2* Салицилат-ион К,_2 = 2,0-Ю-21
Bi3* Br" Km = 3,0-IO’10 Fe3* Салицилат-ион К|.3 = 5,4Ю"37
Hg2+ ВГ Km =1,0-10’21 Ca2* Тартрат-ион К1.2 = 9,810-|°
Pt2* Br“ KM = 3,21 O'21 Fe3* Тартрат-ион К1.2=1,4-Ю-12
Bi3* СГ Km = 3,8-IO'7 Ca2* Цитрат-ион К] =2,1-Ю-5
Pt2* СГ KM= HO-16 Mg2* Циграт-ион К, = 1,1-10”
Bi3* r Km = 7,98 IO’20 Cu2* Цитрат-ион Kt = 1,3-Ю-6
Hg2* г Km =1,5-IO'30 Hg2* Цитрат-ион К, = 1,3-10”’
Pb2* r Км = 1,2-Ю-4 Al3* ЭДТА*--ион K, = 3,210-17
Ag* CN" K1.2=l,4-10-20 Ba2* ЭДТА*-ион Kt = 1,7-Ю-8
Au* CN" K|_2 = 5,0-10-30 Bi3* ЭДТА^-ион К|=4,0-10'28
Cd2* CN- Km = 7,8-10” Ca2* ЭДТА4--ион ^=2,6-10"
Co2* CN’ Km = 8,1-IO-20 Cd2* ЭДТА^-ион К^З.ЗЮ-17
Co3* CN" Км=1-Ю“64 Co2* ЭДТА4--ион К|=4,9-10-17
Cu* CN" Km = 2,ОЮ-30 Co3* ЭДТА“--ион К, =2,5-Ю-41
Fe2* CN- Km= 1,3 Ю-37 Cr3* ЭДТА4-ион К| =4,0-10'21
Fe3* CN" Km = 1,310” Cu2* ЭДТА4-ион К| = 1,6-10'”
Ni2* CN" Км= 1,0-Ю'31 Fe2* ЭДТА^-ион ^=6,310”
Zn2* CN* Км = 2,4- IO-20 Fe3* ЭДТА^-ион К| = 5,9-Ю-25
Al3* F" Km = 2,1-10-21 Hg2* ЭДТА^-ион К| = 1,6-Ю-22
Fe3* F" Km = 7,9-IO-17 Mg2* ЭДТА^-ион Ki = 7,6-Ю-10
Ag* SCN- K|.2 = 5,910-’ Mn2* ЭДТА*--ион К, =9,НО”
Bi3* SCN- Km = 5,9-10-5 Pb2* ЭДТА^-ион К, =9,НО-19
Co2* SCN" K,.3 = 1,61O-2 Tl* ЭДТА^-ион Kt = 2,9l0'7
Cu2* SCN- K1.j = 3,0-10-7 Tl3* ЭДТА4--ион ^ = 1,6-10”
Fe3* SCN’ Km = 5.910-4 Zn2* ЭДТА^-ион K, = 5,5-10-17
224
Продолжение табл. 19
М"* Лиганд Константа M"* Лиганд Константа
Hg2+ SCN" £M = 6,3-10"22 Mg2+ Глицинат-ион К,.2 = 3,5-10~7
Ag+ S2O2' £,_3 = 7,l-10"15 Ca2* Глицинат-ион £, =4,2-10"2
Cd2+ s2o2- £,.3 = 6,3-10"’ Mn2+ Г лицинат-ион Kt =3,6-10"4
Cu+ s2o2- Kt.}= l,9-10"14 Fe2+ Г лицинат-ион Kt.2= 1,6-10"8
Pb2+ s2o2- £M = 6,3-10"8 Co2+ Глицинат-ион £,.2 = 5,6-10"10
Hg2+ s2o2- KM = 2,4-10"M Ni2+ Глицинат-ион £,.2 = 2,7-10""
Ag+ SO?" £,.3=1-10"’ Cu2+ Глицинат-ион Ку.2 = 2,6-10’16
Cu+ so2 £|.з = 4,410’,° Zn2+ Глицинат-ион £,.2=1,1-Ю’10
Hg2+ SO2" £,.з = l,l-10"25 Zn2+ Цистеинат-ион £,.2 = 2,0-10"”
20. Стандартные окислительно-восстановительные
потенциалы (25 °C)
Полуреакция <P°,B Полуреакция <p°,B
Ag+ + е" Ag 4- +0,80 Mn3++e" Mn2+ +1,51
[Ag(NHj)2]++е" Ag 4- +2NH3 +0,373 [Mn(CN)6]3"+e" [Mn(CN)6]4" -0,24
AgCI + e" Ag 4- +СГ +0,283 MnO^+e" MnO<" +0,56
AiT+e" Au 4- +1,68 MnO4 +8H* + 5e Mn2++4H2O +1,51
Au3+ + 2e~ Au+ +1,41 MnO; +2H2O + 3e" MnO2+4OH" +0,60
Au3+ +3e~ Au 4- +1,50 [Mo(CN)6]3" +e' ±> [Mo(CN)6]4- +0,73
Br2 + 2e" 2Br" +1,09 N2+8H++6e' 2NH4 +0,26
HBrO+H++2e" Br" + H2O + 1,34 NOj +HjO + (? NO2+2OH' +0,01
BrO,+5H++4e" HBrO + 2H2O + 1,45 NOJ+3H++2e“ HNO2 + HjO +0,94
225
Продолжение табл. 20
Полуреакция <p°, В Полуреакция <p°, В
С12+2е' 2СГ +1,36 NO3+2H+ + e~ £> NO2+H2O +0,80
Со3++е~ Со2+ +1,95 NO3+H2O + e" +? NOj+2OH’ -0,86
Со2++2е' Со 4- -0,29 NO3+4H++3e~ NO + 2H2O +0,96
Со3+ + Зе' Со 4- +0,46 NO3+2H2O + 3e" NO + 4OH’ -0,14
[Co(NH3)6]3+ +е- U [Co(NH3)6]2+ +0,1 O2+4H++4e’ 2H2O +1,23
Cr3++e' Сг2+ -0,41 O2+4H++4e* 2H2O (pH = 7) +0,82
Сг2О2-+ 14Н++ 6е~ 2Сг3++ 7Н2О +1,33 O2+2H2O + 4e~ 4OH“ +0,40
[Cr(CN)6]3-+e- [CKCNJJ4- -1,28 O2+2H++2e H2O2 +0,68
Cu++e" Си 4- +0,53 O2 + H2O + 2e HO2+OH" -0,08
Cu2+ + 2e' Си 4- +0,35 H2O2+2H++2e* 2H2O +1,77
Cu2++e* Cu+ +0,16 HO2+H2O + 2e“ ЗОН' +0,88
Си2+ + Г+е’ Cui +0,86 O3 + 2H+ + 2e O2+H2O +2,07
F2 + 2e~ 2F' +2,77 O3 + H2O + 2e O2 + 2OH“ +1,24
Fe3++e“ Fe2+ +0,77 S + 2H++2e~ H2S +0,17
[Fe(CN)6]3~+e“ [Fe(CN)6]4- +0,36 СЧ CO it CM + GO -0,48
2H++2e" £> H2 0,00 SO2'+4H++2e’ t; SO2 + 2H2O +0,17
2H+ + 2e~ ±> H2 (pH = 7) -0,414 S4O2'+2e" 2S2O3‘ +0,09
226
Продолжение табл. 20
Полуреакция Ф°, В Полуреакция Ф°,В
2Hg2++2e" Hg2+ +0,91 Sn2++2e~ Sn -I -0,14
Hg2++2e“ Hgl +0,85 Sn4++2e“ Sn2+ +0,15
Hgj++2e" 2Hg +0,80 ТГ+е" < Tli -0,357
I2+2e~ 2Г +0,54 Tl3++2e" ТГ +1,25
IO3+5H++4e~ +1,14 Zn2++2e~ t Zni -0,76
HIO + 2HjO HIO + H++2e~ £> Г+Н2О +0,99 [Zn(NH3)J2+ + 2e~ Zn I+4NH3 -1,04
21. Формальные (мид-пойнт) потенциалы биологических
окислительно-восстановительных пар (25 °C, pH = 7)
Окислительно- восстановительная пара <р'°,В Окислительно- восстановительная пара ф'°,В
О2+4Н+/2Н2О +0,82 Метиленовый синий +0,01
Цитохром a3 Fe3+/Fe2+ +0,55 Оксалоацетат + 2Н+/малат -0,17
Гемоцианин Cu2+/Cu+ +0,54 Пируват + 2Н+/лактат -0,19
no3+3h7hno2 + h2o +0,42 Ацетальдегид + 2Н+/этанол -0,20
Цитохром f Fe3+/Fe2+ +0,37 ФАД + 2Н+/ФАД-Н2 -0,22
Цитохром a Fe3+/Fe2+ +0,29 НАД+ + Н7НАД-Н -0,32
Цитохром c Fe3+/Fe2+ +0,254 НАДФ+ + Н+/НАДФ-Н -0,324
Цитохром C| Fe3+/Fe2+ +0,21 СО2 + 21Г/НСОО -0,42
Гемоглобин/метгемоглобин +0,17 2Н7Н2 -0,42
Миоглобин +0,04 Ферредоксин -0,43
Фумарат + 2Н7сукцинат +0,03 Ацетат + СО2 +2Н+/пируват -0,70
22. Потенциалы электродов сравнения
Электрод с(КС1) моль/л Потенциалы (В) при различных температурах (°C)
18 20 25 30 37
0,1 0,337 0,337 0,337 0,336 0,336
Каломельный 1,0 0,285 0,284 0,283 0,282 0,280
насыщ. 0,248 0,447 0,244 0,241 0,236
227
Продолжение табл. 22
Электрод с(КС1) моль/л Потенциалы (В) при различных температурах (°C)
18 20 25 30 37
0,1 — 0,290 0,290 — —
Хлорсеребряный 1,0 — 0,237 0,238 — —
насыщ. 0,199 0,200 0,201 0,202 0,204
23. Удельная электрическая проводимость (х, Ом-1-см *)
водных растворов КС1
Температура, °C с(КС1), моль/л
0,1 0,02 0,01
15 0,01048 0,002243 0,001147
16 0,01072 0,002294 0,001173
17 0,01095 0,002345 0,001199
18 0,01119 0,002397 0,001225
19 0,01143 0,002449 0,001251
20 0,01167 0,002501 0,001278
21 0,01191 0,002553 0,001305
22 0,01215 0,002606 0,001332
23 0,01239 0,002659 0,001359
24 0,01264 0,002712 0,001386
25 0,01288 0,002765 0,001417
24. Предельная молярная электрическая проводимость ионов
(Лщ, см2-Ом’1-моль“|)
Ион Ион
291 К 298 К 291 К 298 К
Н+ 315,0 349,8 ОН“ 171,0 198,3
Na+ 42,8 50,1 сг 66,0 76,35
К* 63,9 73,5 no; 62,3 71,46
nh; 63,9 73,5 НСОО’ 47,0 54,6
Ag+ 53,5 61,9 СН3СОО~ 34,0 40,9
l/2Mg2+ 44,9 53,0 С2Н5СОО’ — 35,8
1/2Са2+ — 60,0 С3Н7С00‘ — 32,6
1/2Ва2+ 54,6 63,6 1/2СО3” 60,5 69,3
1/2РЬ2+ 60,5 70,0 1/2SO2" 68,4 80,0
228
25. Поверхностное натяжение жидкостей при 293 К
Вещество аЮ’.НЛк Вещество аЮ’.Н/м
Ацетон 23,70 Муравьиная кислота 37,58
Бензол 28,88 Уксусная кислота 27,80
Вода 72,75 Пентан 16,00
Гексен 18,42 Пиридин 38,00
Глицерин 59,40 Этиленгликоль 46,1
Диэтиловый эфир 17,00 Этанол 22,03
Метанол 22,61
26. Поверхностное натяжение воды при различных температурах
Z, °C а-Ю’.Н/м Л °C a l О3, Н/м t, °C a l О3, Н/м
10 77,22 17 73,19 24 72,13
11 74,07 18 73,05 25 71,97
12 73,93 19 72,90 26 71,82
13 73,78 20 72,75 27 71,66
14 73,64 21 72,59 28 71,50
15 73,49 22 72,44 29 71,35
16 73,34 23 72,28 30 71,18
27. Золотые числа некоторых биосоединений — масса (мг),
защищающая 10 мл золя золота с массовой долей 0,0006% от
коагуляции при добавлении 1 мл 10%-го раствора NaCI
Вещество Золотое число Вещество Золотое число
Желатина 0,01 Декстрин 20
Казеинат натрия 0,01 Картофельный 20
крахмал
Гемоглобин 0,03—0,07 Сапонин 115
Яичный 2,5 Олеат натрия 0,4—1,0
альбумин
Гуммиарабик 0,5
229
28. Содержание химических элементов в организме человека
в расчете на условную массу 70 кг
Элемент Масса, г % по массе Кол-во элемента, моль Атомная моля, %
Водород 7000 10 7000 62,5
Литий 6,7-10^* 1,0-1 О*6 1,0-10"* 1,0-1 О*6
Бериллий 3,6-10“5 5,0-1 О*8 4,0-1 О*6 3,6 10*’
Бор 0,02 3,0-1 О*5 1,8-10*’ 1,610'5
Углерод 16000 22,8 1300 11,6
Азот 1800 2,6 130 1,16
Кислород 43000 61,5 2700 24,2
Фтор 2,6 3,7-10*’ 0,14 !,2-10*’
Натрий 100 0,14 4,4 0,039
Магний 19 0,027 0,8 7,2-10*’
Алюминий 0,061 8,7-1 О*5 2,3-10*’ 2,0-1 О*5
Кремний 0,14 2,0-10"* 5,0-10*’ 4,5-10*5
Фосфор 780 1,1 25 0,22
Сера 140 0,2 4,4 0,039
Хлор 95 0,14 2,7 0,024
Аргон 0,01 1,4-1 О*5 2,5-1 О*4 2,2-1 О*6
Калий 140 0,2 3,6 0,032
Кальций 1000 1,4 25 0,22
Скандий 0,013 2,0-10 s 2,9-1 О*4 2,6-1 О*6
Титан 9,0-10*’ 1,3-1О'5 1,8-10"* 1,6-1 О*6
Ванадий 0,018 2,6-1 О*5 3,5-10"* 3,1 10**
Хром 6,610*’ 9,4-1 О*6 1,3-10"* 1,2-1 О*6
Марганец 0,012 1,7 1 О*5 2,2-10"* 2,0-10**
Железо 4,2 6,0-10*’ 0,075 6,7-10"*
Кобальт 1,5-10*’ 2,110** 2,5-1 О*5 2,2-1 О*7
Никель 0,01 1,4-1 О*5 1,7-1 О*4 1,5-1 О*6
Медь 0,072 1,0-10"* 1,1 10*’ 1,0-1 О*5
Цинк 2,3 3,3-10*’ 0,035 3,1-10"*
Галлий 1,6-1 О*5 2,3-10*8 2,3-10’7 2,0- Ю4
Германий 4,3-1 О*6 6,2 10*’ 6,0-104 5,4-10’10
Мышьяк 0,018 2,6-1 О*5 2,4-1 О*4 2,2-10*6
Селен 0,013 1,9-1 О*5 1,6-10"* 1,4-1 О*6
Бром 0,2 2,910"* 2,5-10*’ 2,2-1 О*5
Рубидий 0,68 9,7-10"* 8,0-10*’ 7,1 10'5
230
Продолжение табл. 28
Элемент Масса, г % по массе Кол-во элемента, моль Атомная моля, %
Стронций 0,32 4,110м 3,710м 3,3 10м
Цирконий 0,42 7,010м 4,610м 4,110м
Ниобий' 0,11 1,610м 1,2-10-’ 1,110м
Молибден 9,5-10м 1,410м 1,0-10м 9,0-10 м
Серебро 7,910м 1,110м 7,310м 6,5-10-*
Кадмий 0,05 4,1 10м 4,510м 4,0-10м
Олово 0,017 2,4-10-’ 1,4-10м 1,2 10м
Сурьма 0,32 4,1 10м 2,6-10-’ 2,310м
Теллур 8,210м 1,2-Ю-’ 6,4-10-’ 5,7-10м
Иод 0,013 1,910м 1,010м 9,0-10м
Цезий 1,5-10м 2,110м 1,110 м 1,0-10'7
Барий 0,022 3,1 10м 1,610м 1,410м
Золото 9,8 10м 1,4-10-’ 5,0-10м 4,5-10м
Ртуть 0,013 1,9-10-’ 6,5 10м 5,8-10м
Свинец 0,12 1,710м 5,8-10м 5,210м
Висмут 2,3-10м 3,3-10м 1,110м 1,010м
Радий 3,110м1 4,4-10м4 1,4-10-” 1,2-10-'’
Уран 9.010-5 1,310м 3,8-10м 3,4-10м
Список литературы
Захарченко В. Н. Коллоидная химия. —М., Высш, школа, 1989.
Общая химия. Биофизическая химия. Химия биогенных элементов. Под ред.
Ю. А. Ершова. — М., Высш, школа, 2000.
Пузаков С. А. Химия. —М., Медицина, 1995.
Слесарев В. И. Химия. Основы химии живого. —С.-Пб., Химиздат, 2000.
Суворов А.В., Никольский А. Б. Общая химия. —С.-Пб., Химия, 1995.
Оглавление
Предисловие............................................................3
Глава 1. Общие вопросы выполнения лабораторных работ...................5
1.1. Правила работы в химической лаборатории.........................5
1.2. Лабораторный журнал.............................................6
1.3. Весы и правила взвешивания..................................... 6
1.4. Ошибки измерений................................................8
1.5. Стехиометрические понятия и правила............................12
Глава 2. Элементы количественного анализа.............................17
2.1. Медико-биологическое значение химического анализа..............17
2.2. Классификация методов количественного анализа..................18
2.3. Теоретические основы титриметрического анализа.................19
2.4. Оборудование титриметрического анализа.........................23
2.5. Приготовление стандартных растворов........................... 25
2.6. Методика выполнения титриметрического анализа..................25
2.7. Обработка результатов анализа..................................28
2.8. Кислотно-основные реакции в титриметрическом анализе...........28
Работа 2.1. Приготовление соляной кислоты заданной концентрации.33
Работа 2.2. Приготовление стандартного раствора тетрабората натрия...34
Работа 2.3. Стандартизация соляной кислоты по раствору тетрабората
натрия.......................................................35
Работа 2.4. Определение массы гидроксида натрия в растворе
(контрольно-аналитическая задача)............................36
Работа 2.5. Определение массы гидроксида натрия и карбоната натрия
при их совместном присутствии в растворе (контрольно-
аналитическая задача)........................................38
2.9. Реакции окисления-восстановления в титриметрическом анализе....41
2.9.1. Перманганатометрия.......................................41
Работа 2.6. Определение содержания железа (II) в растворе
(контрольно-аналитическая задача)............................42
Работа 2.7. Определение содержания перекиси водорода в растворе.43
Работа 2.8. Определение содержания дихромата калия в растворе...45
2.9.2. Иодометрия...............................................47
Работа 2.9. Определение концентрации перекиси водорода в водном
растворе.....................................................48
Работа 2.10. Определение массовой доли формальдегидов в водном
растворе......................™..............................50
Работа 2.11. Определение содержания активного хлора в хлорной
(белильной) извести..........................................52
233
Глава 3. Элементы химической термодинамики..........................55
3.1. Теплоты химических процессов.. ..............................55
3.2. Экспериментальное определение теплот химических процессов.....56
3.3. Расчеты теплоты и максимальной работы химических реакций......57
Работа 3.1. Определение теплоты реакции нейтрализации..........59
3.4. Химическое равновесие.........................................62
Работа 3.2. Исследование смещения химического равновесия......64
Глава 4. Скорость химических реакций............................... 68
4.1. Химическая кинетика в биологии и медицине....................68
4.2. Определение констант скорости и кинетического порядка реакций.69
Работа 4.1. Определение кинетических характеристик реакции
окисления ионов Г перекисью водорода........................73
Работа 4.2. Определение порядка и константы скорости реакции
.разложения перекиси водорода в присутствии комплексоната
железа(Ш)................................................. 77
Работа 4.3. Определение константы скорости и порядка реакции
гидролиза сахарозы..........................................80
Глава 5. Растворы...................................................84
5.1. Значение растворов...........................................84
5.2. Коллигативные свойства растворов.............................85
Работа 5.1. Определение температуры замерзания раствора
неизвестного вещества и расчет его молярной массы...........87
Работа 5.2. Наблюдение явлений плазмолиза и гемолиза эритроцитов.91
Глава 6. Основные типы равновесий и процессов.......................93
6.1. Протолитические равновесия и процессы........................93
Работа 6.1. Определение pH раствора фотоэлектроколориметрическим
методом.....................................................99
Работа 6.2. Изучение простых и совмещенных протолитических
равновесий.................................................102
Работа 6.3. Свойства буферных растворов......................103
Работа 6.4. Буферная емкость растворов.......................105
6.2. Гетерогенные равновесия и процессы......................... 107
Работа 6.5. Гетерогенные равновесия в растворах электролитов.110
6.3. Реакции замещения лигандов................................. 113
Работа 6.6. Изучение реакций комплексообразования с
неорганическими лигандами......................................116
Работа 6.7. Простые и совмещенные лигандообменные равновесия...118
6.4. Окислительно-восстановительные реакции и процессы.............122
Работа 6.8. Окислительно-восстановительные свойства веществ.
Определение направления редокс-процессов...................125
Работа 6.9. Изучение зависимости редокс-потенциала от соотношения
концентраций окисленной и восстановленной формы............126
Работа 6.10. Изучение влияния лигандного окружения на редокс-
потенциал .................................................129
234
Работа 6.11. Изучение влияния pH на редокс-потенциал............131
6.5. Совмещенные равновесия и конкурирующие процессы разных типов... 133
Работа 6.12. Изучение совмещенных равновесий и конкурирующих
процессов разного типа.....................................134
Глава 7. Химия биогенных элементов. Принципы качественного
анализа............................................................137
7.1. Дробный и систематический ход анализа.......................137
7.2. Групповые реакции катионов и анионов........................140
Работа 7.1. Качественные и групповые реакции ионов...........141
Работа 7.2. Анализ неизвестного вещества.....................145
Глава 8. Электрохимия.................................................151
8.1. Кондуктометрия..............................................151
Работа 8.1. Определение степени и константы ионизации слабого
электролита................................................155
Работа 8.2. Кондуктометрическое титрование...................157
8.2. Потенциометрия..............................................159
Работа 8.3. Измерение pH раствора с помощью стеклянного электрода 161
Работа 8.4. Измерение концентрации бромид-ионов в растворе
прямым потенциометрическим методом.........................162
Работа 8.5. Потенциометрическое титрование...................164
Глава 9. Физическая химия поверхностных явлений....................166
Работа 9.1. Построение изотермы поверхностного натяжения и
изотермы адсорбции на поверхности раздела газ—жидкость.....169
Работа 9.2. Измерение адсорбции уксусной кислоты на
активированном угле........................................171
Работа 9.3. Влияние различных факторов на адсорбцию из растворов.. 173
Работа 9.4. Определение обменной емкости ионитов.............175
Работа 9.5. Хроматография....................................176
Глава 10. Физическая химия дисперсных систем. Коллоидно-
дисперсные системы.................................................180
10.1. Медико-биологическое значение..............................180
10.2. Методы получения и очистки коллоидных растворов............180
10.3. Свойства коллоидных растворов, структура коллоидных частиц.182
10.4. Устойчивость коллоидных систем. Коагуляция. Пептизация.....184
10.5. Коллоидные поверхностно-активные вещества..................186
Работа 10.1. Получение, очистка и свойства коллоидных растворов.187
Работа 10.2. Определение знака заряда коллоидных частиц. Измерение
элекгрокинетического потенциала методом электрофореза......190
Работа 10.3. Коагуляция золей электролитами. Определение порогов
коагуляции. Пептизация.....................................192
Работа 10.4. Определение критической концентрации
мицеллообразования олеата калия............................195
235
Глава 11. Физическая химия высокомолекулярных соединений
и их растворов...................................................198
11.1. Медико-биологическое значение............................198
Работа 11.1. Набухание ВМС. Определение ИЭТ желатина по
набуханию. Коллоидная защита...............................202
Работа 11.2. Определение молярной массы ВМС вискозиметрическим
методом.................................................. 205
Приложение...................................................... 208
1. Некоторые физические постоянные........................ 208
2. Множители и приставки для образования десятичных кратных
и дольных единиц и их обозначения..........................208
3. Основные единицы Международной системы измерений (СИ)...208
4. Коэффициенты Стьюдента при различных значениях
заданной вероятности р и числа определений (и)..............209
5. Плотности (р, г/см3) и массовые доли (<о, %) растворов кислот
при 20 °C..................................................210
6. Свойства важнейших кислотно-основных индикаторов........211
7. Термодинамические свойства некоторых веществ, применяемых в
медицине...................................................211
8. Теплоты сгорания (ДСЯ°, кДж/моль) некоторых органических
веществ.....................................................217
9. Средняя удельная теплота полного окисления основных
компонентов пищевых продуктов...............................217
10. Теплоты растворения в воде (&,Н°, кДж/моль) некоторых
неорганических веществ, применяемых в медицине.............217
11. Периоды полураспада некоторых радионуклидов, применяемых в
медицине...................................................218
12. Молярная активность некоторых ферментов................218
13. Константы некоторых жидкостей, применяемых в качестве
растворителей..............................................219
14. Коэффициенты активности f ионов в водных растворах.....219
15. Средние значения водородного показателя (pH) биологических
жидкостей................................................ 220
16. Ионное произведение воды Ку при различных температурах..220
17. Силовые показатели и константы ионизации кислот по реакции
НВ* + Н2О = В1'|+Н3О*......................................221
18. Константы растворимости некоторых малорастворимых солей и
гидроксидов (25 °C).........................................222
19. Константы нестойкости комплексных ионов в водных растворах
(25 °C).....................................................224
20. Стандартные окислительно-восстановительные потенциалы
(25 °C)....................................................225
21. Формальные (мцд-пойнт) потенциалы биологических
окислительно-восстановительных пар (25 °C, pH = 7).........227
22. Потенциалы электродов сравнения........................227
236
23. Удельная электрическая проводимость (х, Ом см j водных
растворов КС1...............................................228
24. Предельная молярная электрическая проводимость ионов
(Лш, см2 Ом", моль*1).......................................228
25. Поверхностное натяжение жидкостей при 293 К.............229
26. Поверхностное натяжение воды при различных температурах.229
27. Золотые числа некоторых биосоединений — масса(мг),
защищающая 10 мл золя золота с массовой долей 0,0006% от
коагуляции при добавлении 1 мл 10%-го раствора NaCl.........229
28. Содержание химических элементов в организме человека в
расчете на условную массу 70 кг.............................230
Список литературы.................................................232
Учебное издание
Бабков Александр Васильевич
Попков Владимир Андреевич
Пузаков Сергей Аркадьевич
Трофимова Людмила Ивановна
Практикум
по общей химии.
Биофизическая химия.
Химия биогенных элементов
Редактор В. Н. Бораненкова
Художник К. Э. Семенов
Художественный редактор Ю. Э. Иванова
Технический редактор Л. А. Овчинникова
Набор и компьютерная верстка С. Ч. Соколовского
ЛР № 010146 от 25.12.96. Изд. № ХЕ-241. Сдано в набор 22.01.01. Подл, в печать
27.08.01. Формат 60x88'/)6. Бум. газета. Гарнитура «Таймс». Печать офсетная.
Объем 14,70 усл. печ. л. 14,95 усл. кр.-отт. 14,70 уч.-изд. л.
Тираж 8000 экз. Заказ №366.
ГУП «Издательство «Высшая школа», 127994, Москва, ГСП-4, Неглинная ул., д 29/14.
Факс: 200-03-01,200-06-87 E-mail: V-Shkola@g23.relcom.ru http://www.v-shkola.ru
Отпечатано в ОАО «Оригинал», Ю1990, Москва, Хохловский пер., д. 7.