Текст
Relata Refero
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ТЕХНОЛОГИЙ И УПРАВЛЕНИЯ
В. Ю. Воскресенский
ОБ ОСНОВАНИЯХ
ЭНТРОПИИ
S
URSS
МОСКВА
ББК 22.317
Воскресенский Всеволод Юрьевич
Об основаниях энтропии. —
М.: КРАСАНД, 2010. —
104 с. (Relata Refero.)
В настоящей книге высказывается идея о том, что основания термодинамики подлежат
исправлению. Два курса высшей школы приводят к парадоксально несовместимым выводам:
термодинамика утверждает, что энтропия является следствием второго закона термодинамики;
статистическая физика определяет энтропию как следствие первого закона. В книге установ
лена и устранена причина этой несовместимости. Доказано, что если поливариантное уравне
ние состояния не сводится к бивариантному, то оно неадекватно реально существующим
термодинамическим системам из-за несовместимости с флуктуациями и из-за помех, вызы
ваемых теоремой Фробениуса. Доказано, что все остальные структуры уравнений состояния
бивариантны и приводят к существованию энтропии как следствию первого закона термоди
намики. Доказано, что согласно нулевому закону термодинамики не существует нулевой
теплоемкости. Соответственно принципы Клаузиуса и Томсона в отношении равновесных
процессов также становятся следствиями первого закона, а действие второго закона ограни
чено только неравновесными процессами с возрастанием энтропии. Энтропия и термодина
мическая температура существуют во Вселенной везде, где существует их основание —
первый закон термодинамики, независимо от сферы действия второго закона. Установлено
неизвестное ранее свойство сложных термодинамических систем, состоящее в том, что они
представляют собой совокупность простых подсистем.
Книга адресована исследователям, изучающим и трактующим проблемы мироздания;
некоторым изобретателям, напрасно верящим в создание вечных двигателей второго рода; пре
подавателям, излагающим термодинамику, и студентам, совершенствующимся в ее изучении.
Рецензент:
зав. кафедрой теоретической и промышленной теплотехники МГОУ,
заслуженный изобретатель РФ, д -р тсхн. наук, проф. В. П. Проценко
Издательство «КРАСАНД». 121096, М осква, ул. 2 -я Ф илевская, 7, корп. 6.
Формат 60x90/16. Печ. л . 6,5. Зак. No 3667.
Отпечатано в ООО «ЛЕНАНД».
117312, Москва, пр-т Шестидесятилетия Октября, 11А, стр. II .
КВ1Ч 978-5 -396 -00163-3
© В. Ю. Воскресенский, 2010
© КРАСАНД, 2010
8703 Ю 111501
9
Все права защищены. Никакая часть настоящей книги не может быть воспроизведена или пере
дана в какой бы то ни было форме и какими бы то ни было средствами, будь то электронные или
механические, включая фотокопирование и запись на магнитный носитель, а также размещение в
Интернете, если на то нет письменного разрешения владельцев.
785396 001 633
НАУЧНАЯ И УЧЕБНАЯ ЛИТЕРАТУРА
URSS
E-mail: URSS@URSS.ru
Каталог изданий в Интернете:
http://URSS.ru
Тел./факс: 7 (499) 135-42 -16
I Тел./факс: 7 (499) 135-42 -46
Оглавление
От издательства..............................................................................................
5
Предисло вие...................................................................................................
6
В в е д е н и е ..................................................................................................
8
Глава первая. Определения и соотнош ен ия..................................... 17
1.1. Простые и сложные гомогенные термодинамические системы .... 17
1.2. Бивариантные уравнения со сто я н и я .................................................. 18
1.3. Версии поливариантных структур уравнения сос т о я н и я ............... 19
1.4. Пфаффова форма в дифференциальном уравнении I закона......... 24
1.5. Голономность пфаффовой форм ы ...................................................... 25
Теорема Фробениуса............................................................................. 26
Голономность по определен ию .......................................................... 27
Глава вторая. Классический и аксиоматический подходы
к проблем е э н т р о п и и .......................................................................... 29
2.1. Классический подход к проблеме существования э н тр о п ии ........ 29
2.2. Аксиоматическая структура и зл о ж ен и я ............................................ 30
Аксиоматика К .Каратеодори ............................................................... 30
Аксиоматика Т.А .Афанасьевой-Эренфест........................................ 35
Гипотеза А.А .Гух м ана.......................................................................... 37
И.И .Новиков об основаниях э н тр о п ии .............................................. 39
Альтернатива Г.В .Скорня кова............................................................ 40
М.Планк об энтропии простых с и с т е м .............................................. 43
Глава третья. Голономность пфаффовых ф орм ................................ 48
3.1. Голономность пфаффовых форм с бивариантными слагаемыми .. 48
3.2. Принцип Каратеодори и теорема Фробениуса................................. 52
3.3. Ограничения в структуре поливариантных
уравнений со сто я н и я ............................................................................ 58
4
Оглавление
Глава четвертая. Сложная система как совокупность
пр осты х п о д с и с т е м ...................................................................................... 60
4.1. Структура сложных термодинамических с ис т е м ............................ 60
4.2 . Классификация простых подсистем ................................................... 61
4.3. О расчленении поливариантных уравнений состояния
на бивариантные. Примеры .................................................................. 64
Молекулярный кислород...................................................................... 69
Магнетики с эффектом магнитострикции и
м агн итоупругости ................................................................................. 70
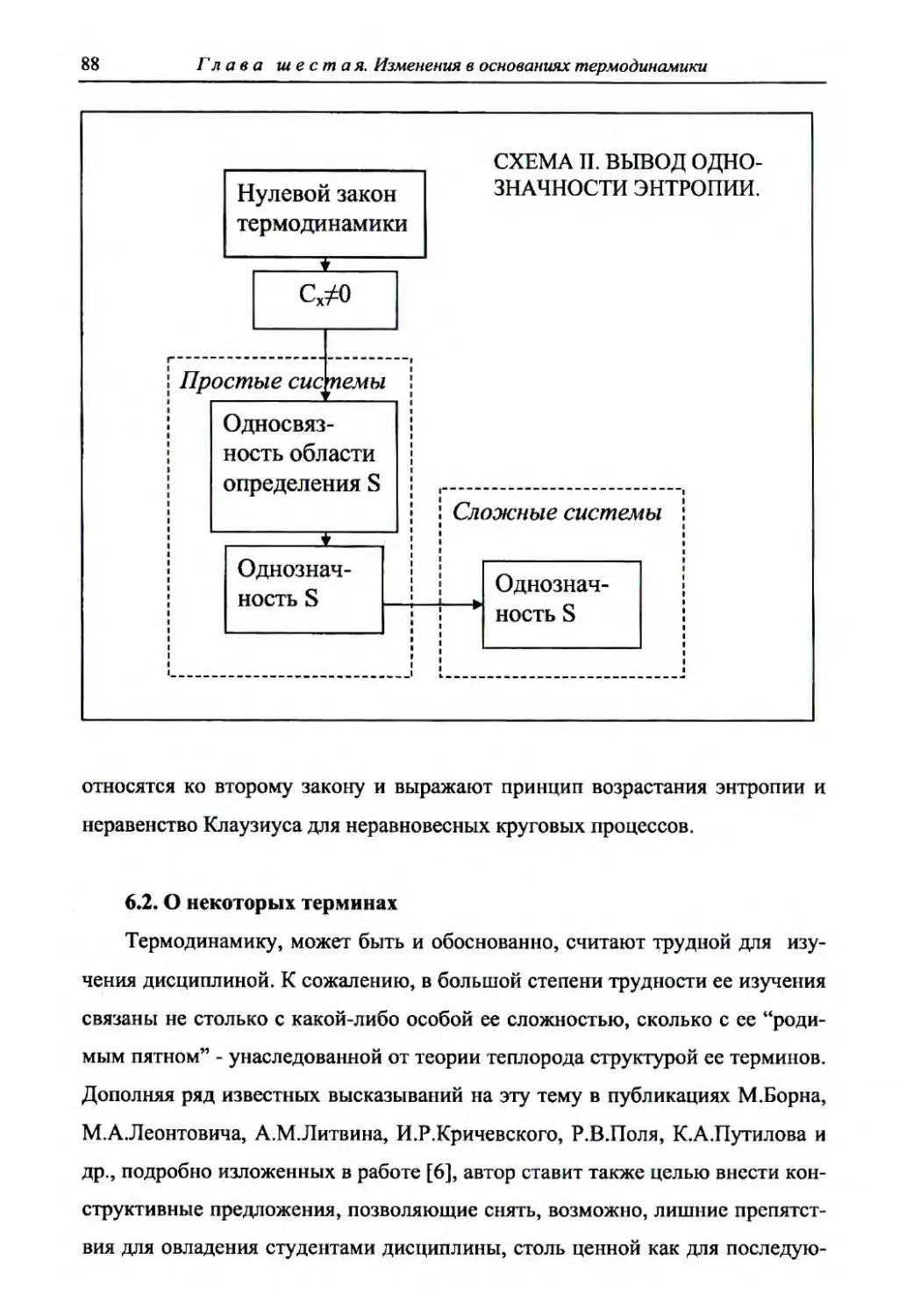
Глава п я т а я. Однозначность энтропии............................................
73
5.1. Постановка проблемы ........................................................................... 73
5.2. Нулевой закон термодинам ики............................................................ 76
5.3. Об отсутствии систем с нулевой тепло ем костью ............................ 79
5.4. Односвязность области определения энтропии и
однозначность энтропии....................................................................... 82
Глава шестая. Изменение оснований термодинамики.................... 85
6.1. О содержании первого и второго за ко но в ........................................ 85
6.2. О некоторых те р м и н а х ......................................................................... 88
З А К Л Ю Ч Е Н И Е ................................................................................................... 97
Список литературы...................................................................................... 101
От издательства
Эта книга продолжает серию «Relata Refero» (дословный перевод — рас
сказываю рассказанное).
Под этим грифом издательство предоставляет трибуну авторам, чтобы
высказать публично новые идеи в науке, обосновать новую точку зрения, до
нести до общества новую интерпретацию известных экспериментальных
данных, etc.
В споре разных точек зрения только решение Великого судьи — Време
ни — может стать решающим и окончательным. Сам же процесс поиска Ис
тины хорошо характеризуется известным высказыванием Аристотеля, выне
сенным на обложку настоящей серии: авторитет учителя не должен довлеть
над учеником и препятствовать поиску новых путей.
Мы надеемся, что публикуемые в этой серии тексты внесут, несмотря
на свое отклонение от установившихся канонов, свой вклад в познание Ис
тины.
Предисловие
В 1986 г. А.А .Гухман выпустил в свет книгу «Об основаниях термодина
мики». В книге изложены основные сложившиеся к тому времени концепции
феноменологической термодинамики, в том числе собственная концепция
Гухмана. В частной беседе Александр Адольфович заметил, что существование
универсальной аддитивной тепловой функции состояния, которую Р.Клаузиус
назвал энтропией, никогда не рассматривалось как проблема в отношении про
стых термодинамических систем. Проблемой являлась энтропия сложных сис
тем, и Клаузиус представил в качестве второго закона решение проблемы су
ществования интегрирующего делителя Т и энтропии, имея ввиду именно
сложные системы. Некоторые из последующих исследований (аксиоматика
Каратеодори и Афанасьевой-Эренфест) «подтвердили» вывод Клаузиуса об
энтропии как следствии второго закона. В то же время статистическая физика
пришла к противоположному результату: существование энтропии не зависит
от второго закона. Феноменологическая термодинамика также «частично»
пришла к этому выводу: М.Планк доказал, что существование энтропии про
стых термодинамических систем является следствием только первого закона.
До настоящего времени сохранился парадокс: выводы феноменологиче
ской и статистической термодинамик относительно оснований к существова
нию энтропии не совпадают, даже противоположны. Это несовпадание оце
нивается неоднозначно. П .Ш амбадаль [40] (перевод с фр. 1967 г.) в книге
«Развитие и приложение понятия энтропии», например, отдает предпочтение
феноменологической термодинамике как концепции с более твердыми осно
ваниями. Он полагает, что « ...м о ж н о только сожалеть, что современная тео
ретическая физика обнаруживает часто тенденцию полностью завладеть по
нятием энтропии, как если бы ее микроскопический аспект был единствен
ным имеющим смысл. Эта тенденция тем менее оправдана, что макроскопи
ческий эффект имеет более твердые основания: он был открыт в эпоху, когда
связь между энтропией и беспорядком была еще неизвестна, и сохраняется
даже в том случае, если по каким-либо причинам нам придется отказаться от
этой связи». Сомнения в отношении выводов, определяющих существование
Предисловие
1
энтропии, высказал автор книги «The Tragicomical History o f Thermodynam
ics» К.Трусделл [43, 1982 г.]: «Семь раз за последние тридцать лет я старался
проследить аргументацию Клаузиуса, пытавшегося доказать, что интегри
рующий множитель существует в общем случае и есть функция только тем
пературы, одинаковая для всех тел, и семь раз это совершенно обескуражи
вало меня... Я не могу даже объяснить, чего именно я не понимаю».
Термодинамика, отталкиваясь от теории теплорода, сначала сделала зиг
заг, обходя препятствие, которое являлось придуманным: сложную систему
описывали поливариантными уравнениями состояния, не видя в ней совокуп
ности простых термодинамических систем. На этом обходном пути было уга
дано существование энтропии, ее однозначность, был установлен второй закон
термодинамики. В пего вместе с принципом возрастания энтропии были вклю
чены без достаточных на то оснований принципы существования и однознач
ности энтропии. В результате существование энтропии при феноменологиче
ском изложении термодинамики оказалось отнесенным ко второму закону (и
частично к первому), при статистическом изложении - к первому закону тер
модинамики. Исследованию и устранению этого противоречия посвящена дан
ная книга. В ней приводятся сведения о противоречиях феноменологической
термодинамики при традиционном ее изложении, представлено найденное ав
тором решение проблемы как существования, так и однозначности энтропии.
Теорема Карно, постулаты Клаузиуса и Томсона, постулат о неосуществимости
вечного двигателя второго рода в отношении равновесных процессов относятся
к следствиям первого закона. Действие второго закона ограничивается нерав
новесными процессами. Ограничена и необратимость «стрелы времени» Эд
дингтона. Энтропия и термодинамическая температура существуют во Вселен
ной везде там, где существует их основание - первый закон термодинамики,
независимо от сферы действия второго закона термодинамики.
Исследованиям, изложенным в книге, содействовали серьезные критические
замечания со стороны термодинамической школы МЭИ - кафедр Инженерной
теплофизики и Теоретических основ теплотехники, в частности, профессоров
А.А .Александрова и А.М.Семенова; без книги профессора В.В.Сычева «Слож
ные термодинамические системы» настоящая работа не была бы закончена.
Автор
Памяти профессора
Д Л . Тимрота
Введение
Сложными называют термодинамические системы (магнетики, диэлек
трики, упругие твердые тела и др.) , которые в отличие от простых систем мо
гут совершать более одного вида работы с и л 1.
Аксиоматическая формулировка II закона, определяющая существова
ние энтропии, была представлена Р.Клаузиусом (1865г.[21]): дифференци
альное выражение первого закона термодинамики всегда имеет одинаковый
интегрирующий множитель, причем, равный обратной температуре 1/Т.
К.Каратеодори (1909г.[20]) обосновал эту формулировку как следствие
принципа адиабатической недостижимости. Таким образом, по Клаузиусу-
Каратеодори существование интегрирующего множителя и энтропии выво
дится из II закона, представляется неотделимым от II закона и тем самым от
возрастания энтропии: энтропия или возрастает (не убывает), или не суще
ствует. Здесь важно напомнить, что в ходе дискуссии с Каратеодори Планк
[32] представил доказательство, согласно которому простые термодеформа-
ционные системы имеют интегрирующий множитель и энтропию как пря
мое следствие первого закона термодинамики, вне связи со вторым законом.
Такая энтропия по свойствам отличается от энтропии, выведенной с привле
чением второго закона. Отличие в том, что существованию такой энтропии
не противоречит возможность ее убывания. К сожалению, этому выводу не
придали должного значения. Неопределенности, умолчания следуют в тер
модинамике одна за другой. Привлечение второго закона к выводу сущест
вования энтропии по-прежнему рассматривается как необходимое положе
ние; по умолчанию оно распространяется и на простые термодеформацион
ные системы.
' Известно о сложных системах (упругие кристаллы), совершающих 21 вид работы [22]
Введение
9
После публикации статьи К.Каратеодори и последующей почти столет
ней дискуссии в классической термодинамике установилось представление о
неразрывности трех положений - о существовании энтропии, о ее однознач
ности и о возрастании ее суммы в неравновесных процессах. Представление
0 принципе существования энтропии как составной части второго закона ос
тается общепринятым 1. Представление довольно противоестественное: суще
ствующее (энтропии в равновесных системах) ставится в зависимость от ее
свойства (ее возрастание при неравновесных процессах). Свойство оказыва
ется первичным, а носитель свойства, то есть существующее, вторично. Само
существования энтропии исключается в случае предположения об ее убыва
нии. В то же время существуют флуктуации - периодическое отклонение
(возрастание и убывание) параметров системы от их значений в равновесном
состоянии. Энтропия - функция этих параметров, и она должна вместе с ни
ми периодически отклоняться от равновесного значения, то есть возрастать и
убывать. Но в силу зависимости от второго закона (от принципа адиабатиче
ской недостижимости) энтропия существует только потому, что она не может
убывать. Тогда очевидным становится заключение: поскольку энтропия су
ществует как следствие второго закона, то она не может убывать и тогда
не существует флуктуаций. Если же флуктуации существуют, то энтро
пия должна убывать и тогда не существует энтропии. Этой формуле нель
зя противопоставить никаких возражений, основанных на фактах. Феномено
логическая термодинамика вынужденно последовала первой части формулы
и исключила из рассмотрения явление флуктуации, чтобы сохранить сущест
вование энтропии.
Здание термодинамики оказалось недостаточно устойчивым, оно про
должает провоцировать проведение исследований в ош ибочном направлении.
До сих пор в печати появляются проекты и теоретические «обоснования»,
направленные на создание вечных двигателей второго рода2. Оказались не-
1Возможность существования энтропии простых систем как составной части первого за
кона обычно опускается по умолчанию.
2 См. публикации Г.В .Скорнякова [35, 37].
10
Введение
адекватными понятия об энтропии, формируемые при феноменологическом и
статистическом подходах: один и тот же объект - энтропия - наделяется раз
ными качествами. В термодинамике сложных систем понятия существования
и возрастания энтропии оказались неразрывно связанными; само предполо
жение об убывании энтропии невозможно, поскольку тогда исчезает и поня
тие энтропии. Но в термодинамике простых систем, как и в статистической
физике, такое предположение в принципе не исключается. Оно, в частности,
рассматривается в «Теореме возврата» А.Пуанкаре в связи с воспроизведени
ем исходного неравновесного состояния после достижения системой равно
весного состояния. При этом в статистической термодинамике не существует
доказательств, запрещающих убывание энтропии.
Таким образом, как утверждал И.Пригожин в Нобелевской лекции,
« ...ч ер ез 150 лет после того, как второе начало было сформулировано, оно
все еще представляет собой скорее программу, чем четко очерченную тео
рию ...» . Почти 100-летняя дискуссия по второму закону термодинамики не
привела стороны к согласованному ответу на вопрос: является ли принцип
существования неубывающей энтропии аксиомой или гипотезой.
Тем не менее, в феноменологической термодинамике установилась неко
торая согласованная позиция в отношении ее оснований.
Нулевой закон в форме принципа транзитивности теплового равновесия
вводит в термодинамику понятие функции состояния - эмпирической темпе
ратуры /, измеряемой эмпирическими шкалами.
Первым законом вводится понятие о термодинамической системе, пред
ставленной объемом V, который ограничен контрольной поверхностью У7. В
пределах V содержится внутренняя энергия и у - однозначная функция пара
метров состояния данной системы . и у изменяется, если и только если через
F переносятся потоки энергии. Если У7 непроницаема для потока массы, то
сквозь У7 проникают потоки энергии только двух форм - в форме работы Ьу и
в форме теплопереноса ()у,
Аиу—/,/.•+й ,,
Введение
11
или в дифференциальной форме для системы массой 1 кг
ди-
-
61+ Sq.
Удельная внутренняя энергия и однозначно зависит от удельного объема
V, температуры / и других параметров состояния системы и представлена
полным дифференциалом функции, зависящей от параметров системы:
ди
ди,
с1и=с1и(у, /, ...) = — (к+— Ж+
Потоки энергии через Т7 зависят не от параметров состояния системы, а
от их изменения, поэтому не являются полными дифференциалами функции
состояния системы. Соответственно элементарные потоки энергии через Т7
имеют специфические обозначения: 61, 6q.
Для равновесных процессов в сложных термодинамических системах
элементарный теплоприток определен дифференциальным уравнением
Sq =cdt +У£
ди
\дХ;
+Х (к,
с=ди/д( - теплоемкость, Хх- / -ая обобщенная сила, в частности, давление, х, -
обобщенная координата, в частности, объем, сопряженная с обобщенной си
лой Хх,
т-1, где т - число независимых переменных. Термодинамиче
ские системы с одной парой сопряженных переменных называют простыми,
при двух и более парах - сложными.
За вторым законом закрепились выводы и суждения о существовании
функции состояния энтропии Л”-
Sq/T = ¿/у,
соответственно о существовании термодинамической температуры Т и ее аб
солютной шкалы, об однозначности энтропии (равенство Клаузиуса),
<^=0,
и о возрастании энтропии в неравновесных процессах -
6q/T < сЬ.
Эти выводы и суждения нуждаются в формальном уточнении, поскольку
в них опущено упоминание первого закона как необходимого основания
12
Введение
принципа существования энтропии. Первый закон не является согласно
Клиузиусу-Каратеодори достаточным основанием для этого принципа. Но и
принцип не мог бы существовать без формулировок первого закона. Ясно,
что вывод существования энтропии по Клиузиусу-Каратеодори основан на
двух законах - и первом, и втором, в отличие от принципа возрастания эн
тропии, опирающегося, действительно, только на второй закон. В то же вре
мя М.Планк [32] показал, что все простые системы (например, газы) имеют
энтропию на основании только первого закона, без ссылок на второй закон.
Это замечание существенно в том отношении, что феноменологическая тер
модинамика вполне располагает методом доказательств, исключающим вто
рой закон из оснований принципа существования энтропии, по крайней мере,
для некоторых реально существующих в природе тел. Первый же закон в лю
бом случае не может быть исключен из оснований энтропии.
Сферу действия II закона ограничивают пределами лабораторных мас
штабов, то есть не распространяют на всю Вселенную. Тем самым прихо
дится искусственным образом сокращать объем понятия «термодинамиче
ская система». Действительно, в астрофизике термодинамика черных дыр
обратила внимание на то, что «в рамках классической теории тяготения уже
сам факт существования черной дыры противоречит закону возрастания эн
тропии» [29]. Как следствие, существование таких систем «иного рода» ис
ключают из числа термодинамических систем, а энтропию исключают из фи
зики черных д ы р 1. Это объясняют «тем обстоятельством, что системы суще
ственно больших масштабов, чем лабораторные, то есть системы макрокос-
мических масштабов (Вселенная и ее части), не имеют равновесного со
стояния и поэтому (есть и другие причины) в целом термодинамическими
системами не являются» [17]. Такое сужение сферы применения термодина
мики выглядит не только вынужденным, но и неопределенным. Никак не оп
ределена граница между масштабами систем, имеющих и не имеющих рав
новесного состояния, соответственно между пределами существования во
1И при этом сохраняют понятие абсолютной температуры, не существующее без понятия
энтропия.
Введение
13
Вселенной термодинамических систем с их вторым законом, их энтропией и
термодинамической температурой и систем «не совсем термодинамических»,
подчиняющихся только первому закону термодинамики.
В то же время первый и нулевой законы явно не ограничиваются лабора
торными масштабами. Следовательно, объектом ограничений может быть не
вся феноменологическая термодинамика, а только ее второй закон и его вы
воды, точнее, общепринятые представления, объединяющие во втором зако
ном происхождение понятий о термодинамической температуре и о принци
пах существования, однозначности и возрастания энтропии.
Имеется еще одна неопределенность - в отношении оснований для выво
да существования
термодинамической
температуры и
энтропии.
К.Каратеодори [20] при построении оснований термодинамики рассматривал
исключительно произвольную структуру поливариантных (при более двух
независимых переменных) уравнений состояния сложных систем. Следуя
второму закону, Каратеодори обосновал принцип (аксиому) адиабатической
недостижимости. Тем самым он установил голономность1 пфаффовой фор
мы2 в уравнении первого закона как следствие второго закона. На основании
а) голономиости и б)произвольной структуры уравнений состояния сложных
термодинамических систем Каратеодори вывел существование энтропии
сложных систем как следствие второго закона.
В то же время существуют простые системы, описываемые бивариант-
ными (при двух независимых переменных) уравнениями состояния. Сущест
вование энтропии простых, в частности, термодеформационных систем рас-
1Голономность дифференциального выражения означает существование интегрирующего
делителя, после деления на который дифференциальное выражение обращается в интег
рируемое выражение - в полный дифференциал новой функции состояния, в данном слу
чае дифференциал энтропии ск. Интегрирующим делителем в данном случае служит
функция одной только температуры, названная термодинамической температурой Т.
2 Пфаффовой формой называют линейную дифференциальную форму в полных диффе
ренциалах независимых переменных, в данном случае правую часть уравнения первого
закона термодинамики для равновесных процессов.
14
Введение
сматривал М.Планк и обосновал существование энтропии таких систем без
ссылки на второй закон. В результате в состав оснований энтропии сложной
системы должен, согласно Каратеодори, входить второй закон, а достаточ
ным основанием энтропии простых термодеформационных систем должен
являться, согласно Планку, первый закон. Эта двойственность оснований
приводит к еще одной неопределенности в приложениях термодинамики.
Однако принимают, что вывод Каратеодори носит более общий характер, чем
вывод Планка. Поэтому всем, и простым, и сложным системам приписывают
энтропию, основанную на втором законе, и тем самым неопределенность
устраняется по умолчанию.
Однако неопределенность, на которую следует обратить особое внима
ние, сохраняется и в отношении голономности пфаффовой формы. Требова
ние ее голономности предъявлено вторым законом термодинамике в форму
лировке принципа адиабатической недостижимости Каратеодори. Но извест
но, что голономность пфаффовой формы, если ее коэффициенты имеют по-
ливариантную структуру, возможна только при условии, что эти коэффици
енты удовлетворяют тождественным равенствам теоремы Фробениуса. Тем
самым множество равенств Фробениуса становится дополнительным множе
ством уравнений состояния, связывающих переменные, входящие в состав
термических и калорических уравнений состояния.
На неопределенность, возникающей в связи с голономностью пфаффо
вой формы и с включением множества тождественных равенств Фробениуса
в состав уравнений состояния первым, по-видимому, обратил внимание
Г.В .Скорняков [35-37], а именно: термодинамические свойства реально су
ществующих тел могут быть несовместимыми со множеством дополнитель
ных уравнений состояния, вносимых теоремой Фробениуса. Скорняков пола
гает, что привлечение теоремы Фробениуса является следствием неопреде
ленности, которая вызвана недостаточной универсальностью принципа Кара
теодори (или второго закона) и тем самым допускает возможную неголоном-
ность пфаффовой формы первого закона.
Введение
15
Наконец, вывод феноменологической термодинамики по Каратеодори в
отношении оснований энтропии не совпадает с выводами статистической фи
зики. В изложении термодинамики сохраняются два подхода - феноменоло
гический и статистический. Их слиянию препятствуют не только методоло
гические проблемы. Очевидно несовпадение их выводов в отношении проис
хождения и содержания важнейшего понятия термодинамики - энтропии. В
феноменологической термодинамике существование энтропии, согласно
Клаузиусу-Каратеодори, опирается на второй закон. Поэтому существование
энтропии ограничивают пределами действия второго закона, то есть систе
мами лабораторного масштаба [17] («II начало не является всеобщим зако
ном природы»[2]). Второй закон наделяет энтропию неотъемлемым свойст
вом - необратимостью ее возрастания. Без этого свойства невозможно само
существование энтропии. Тем самым эта необратимость однозначно опреде
ляет энтропию как «стрелу времени» [15]. Но такая однозначность несовмес
тима с «Теоремой возврата» Пуанкаре. Эта теорема не вписывается в фено
менологическую термодинамику (или последняя не вписывается в первую).
Флуктуации, поскольку они сопровождаются не только временным, спонтан
ным увеличением энтропии, но и ее уменьшением, также несовместимы с не
обратимостью возрастания энтропии и «исключаются» аксиоматикой Клау-
зиуса-Каратеодори из феноменологической термодинамики.
В статистической термодинамике существование энтропии определяется
исключительно законом сохранения энергии и квантово-механическими
представлениями (принципом квантования энергии) [22], без привлечения II
закона. Соответственно существование энтропии распространяется, вместе с
существованием энергии и ее квантованием, на системы макрокосмических
масштабов (Вселенная и ее части), то есть за пределы лабораторных масшта
бов. Возрастание энтропии здесь вторично по отношению к ее существова
нию, не является неотъемлемым свойством, влияющим на существование эн
тропии и заранее определяющим ее существование. Поэтому энтропия здесь
не является a priori однозначно направленной «стрелой времени». «Теорема
16
Введение
возврата» Пуанкаре и флуктуации совместимы с основаниями статистиче
ской термодинамики.
Таким образом, выводы феноменологической и статистической термо
динамик не совпадают по принципиальным проблемам. Это несовпадание
оценивается неоднозначно. П.Шамбадаль [40], например, отдает приоритет
термодинамике как концепции с более твердыми основаниями.
Несогласованность выводов феноменологической и статистической тер
модинамик остается проблемой, требующей решения. Совместить два несов
падающих основания энтропии невозможно, и против этого утверждения
нельзя привести никаких фактических возражений. Аксиоматика по крайней
мере одного из подходов к изложению термодинамики не идеальна. Как бы
ни признавалась аксиоматика феноменологической термодинамики за про
шедшие полтораста лет обговоренной и продуманной, как бы ни казались ав
торитетными высказывания об отсутствии в этой аксиоматике «малейшей
бреши» (А.Пуанкаре), такая «брешь» имеется или в феноменологической,
или в статистической термодинамике (или в обеих).
Целью настоящего изложения является показать, во-первых, что «брешь»
имеется именно в феноменологической термодинамике и именно она ответст
венна за несовместимость выводов феноменологической и статистической
термодинамик в отношении оснований для существования энтропии, за неоп
ределенность в отношении сферы действия законов термодинамики, за «уст
ранение» явления флуктуации, за сомнительный результат в виде двух разных
оснований, определяющих существование энтропии - первого закона для
простых систем и второго закона для сложных систем, за произвол при выборе
и анализе возможно не существующих структур поливариантных уравнений
состояния, за множество бесполезных дополнительных уравнений состояния,
вносимых теоремой Фробениуса в аксиоматику Каратеодори. Во-вторых, сле
дует показать, что эта «брешь» устранима и что выводы феноменологической
и статистической термодинамик вполне совпадают, поскольку основание для
существования и однозначности энтропии едино: таким необходимым и дос
таточным основанием является первый закон термодинамики.
глава первая
Определения и соотношения
1.1. Простые и сложные гомогенные термодинамические системы
В соответствии с первым законом термодинамики термодинамическую
систему определяют как тело, имеющее объем, ограниченный замкнутой
контрольной поверхностью. Через контрольную поверхность переносятся
потоки энергии и массы. Далее рассматриваются только закрытые гомоген
ные системы с контрольной поверхностью, не проницаемой для массы. Ис
ключаются также изменения кинетической и потенциальной энергии систе
мы. Внутренняя энергия системы изменяется только при переносе через
контрольную поверхность полож ительных или отрицательных потоков
энергии в форме работы сил различной природы и в форме теплопритока.
Элементарная работа сил /-ой природы определяется произведением /-ой
обобщенной силы на элементарное изм енение сопряженной /-ой обобщен
ной координаты,
Системы, способные совершать один вид работы, называют простыми.
Сложными являются системы, совершающие более одного вида работ. Сис
тема в неравновесном состоянии при отсутствии потоков энергии через кон
трольную поверхность эволюционирует, переходя в равновесное состоянии.
Если возможное число потоков работы разной природы равно т-1, то, есте
ственно, равновесное состояние характеризуется постоянством т-1 обоб
щенных координат и, конечно, постоянством температуры. Равновесное со
стояние термодинамической системы определяется постоянством т пере
менных,
хт.и /, называемых независимыми переменными. Ими
определяются внутренняя энергия системы и, отнесенная к единице массы
системы, и обобщенные силы Х х в равновесном состоянии системы. Зависи
мость внутренней энергии или обобщенной силы от независимых перемен-
18
Глава первая. Определения и соотношения
ных в равновесном состоянии называют уравнением состояния, калориче
ским или термическим.
Непрерывную последовательность равновесных состояний называют
равновесным (квазистатическим) процессом. В таких процессах зависи
мость между элементарными количествами теплопритока и работы через
поверхность системы и изменением внутренней энергии в объеме системы
связывается дифференциальным уравнением первого закона термодина
мики.
Различают закрытые гомогенные1 равновесные термодинамические
системы - простые, с числом независимых переменных т=2, и сложные, с
т>2. Сложные системы характеризуются т-1 обобщенными силами X¡, Х2,
Хз,..., внутренней энергией и, температурой2 1 и т-1 обобщенными коор
динатами х и х2, хз,..., сопряженными каждая с соответствующей обобщен
ной силой. У такой системы при любом числе фаз, компонентов и химиче
ских реакций, если начальное число молей всех компонентов задано, ее
равновесное состоянии полностью определяется совокупностью ее обоб
щенных координат и температурой, то есть независимыми переменными3
XI, х2,..., t.
1.2. Бивариантные уравнения состояния
Состояние системы определяется термическими и калорическими урав
нениями состояния. Термическими уравнениями определяются обобщенные
силы, например, давление. Калорическим уравнением определяется внутрен
няя энергия термодинамической системы.
1Гомогенной называют систему, химический состав и физические свойства которой во
всех ее частях одинаковы.
2Здесь употребляется эмпирическая температура, введенная нулевым законом термоди
намики. Употребление термодинамической температуры возможно одновременно с вве
дения понятия энтропии.
5Аналогичное определение простой системы в химической термодинамике называют тео
ремой Дюгема [23]
Глава первая. Определения и соотношения
19
Различают две основные структуры уравнений состояния - бивариант-
ную и поливариантную.
Бивариантные уравнения состояния содержат по две независимые пере
менные (п=т=2) - обобщенную координату и температуру.
Простые системы описываются двумя бивариантными уравнениями со
стояния - термическим и калорическим. Термическое уравнение определяет
обобщенную силу X в зависимости от обобщенной координаты х и темпера
туры/,
Х=Х(х, 0,
(1-1)
например, давление р в зависимости от удельного объема Vи температуры /:
р=р(\,о.
Калорическое уравнение состояния определяет внутреннюю энергию
простой системы,
и=и(х, 0 ,
(1-2)
например,
и=и(ч, 0.
1.3. Версии би- и поливариантных структур уравнения состояния
Поливариантные уравнения состояния содержат более двух независи
мых переменных п\ т>п>2.
Современные руководства по термодинамике, следуя теоретической ме
ханике, выражают уравнения состояния сложных систем исключительно в
поливариантной структуре, включающей все п=т независимых переменных
данной сложной системы. При этом сложные системы описывают совокуп
ностью поливариантных уравнений состояния, термических -
Х^Х,
хт./ .....О,
(1-3)
и калорического -
и=и(х1,...,х1,...,хт.1 ,.... О
-
(1-4)
Но структура поливариантных уравнений состояния сложных систем
нуждается в уточнении и классификации.
20
Глава первая. Определения и соотношения
Если данная обобщенная сила Х1сложной системы зависит от сопряжен
ной /-ой обобщенной координаты и от температуры, то не обязательно, чтобы
Х1 зависела также и от какой-либо другой, у-ой обобщенной координаты или
от всех других независимых переменных данной сложной системы. Пусть
сложная система описывается совокупностью
хь..., х т.{ ,..., / независи
мых переменных. Здесь обобщенная сила X I , зависящая от
/, может или
зависеть оту-ой обобщенной координаты -
или не зависеть ни от какой у Ф/ -
V'Ухи
Неравенство (1 -5а) указывает или на собственно поливариантную струк
туру данного уравнения состояния, или на структуру, похожую на поливари
антную1. Равенство (1-56) свидетельствует о бивариантной структуре урав
нения состояния сложной системы.
Следующей ступенью анализа поливариантной структуры является вы
деление двух возможностей, связанных с неравенством (1-5а). Если уравне
ния состояния определяются по опытным данным, то заранее неизвестно, яв
ляется ли Х{ одной из обобщенных сил данной системы, или X¡ является
суммой двух или более одноименных аддитивных обобщенных сил данной
сложной системы. В последнем случае поливариантное на вид уравнение со
стояния является лишь композицией из первичных бивариантных уравнений
состояния, их совокупностью. Некоторые предположения и примеры не ис
ключают возможности такого вывода2.
Пусть, например, в эксперименте исследуется сложная система, которая
1По данным экспериментов, например, с магнетиками такими представляются уравнения
состояния, если в их состав входят бивариантные уравнения состояния, выражающие од
ноименные обобщенные силы.
2Заранее не исключен и далеко идущий вывод, что все иоливариантные уравнения с о
стояния представляю! собой совокупность бивариантных уравнений состояния.
'М-
\ дхи
*0
Г8ХЛ
дх,
=0.
(1-5а)
(1-56)
Глава первая. Определения и соотношения
2!
a priori описывается двумя бивариантными уравнениями состояния, имею
щими в своем составе одноименные обобщенные силы, обладающие свойст
вом аддитивности, например, давления:
При таких уравнениях состояния заведомо равны нулю (согласно (1-56)) ча
стные производные
Но по показаниям приборов в опыте определяется только общее внешнее
давление
Уравнение состояния, содержащее р* вместо /?/ или рг, приобретает вид по-
ливариантного уравнения состояния,
в которой частные производные согласно опытным данным будут отличать
ся от нуля, поскольку р*^ р 1, р*^ р2:
Ясно, что такая поливариантная зависимость является условно полива-
риантной. Она содержит в скрытом виде первичные бивариантных зависимо
стей и в принципе может быть расчленена на эти первичные бивариантные
зависимости.
Калорическое уравнение состояния (1 -4) сложной системы выражено в
поливариантном виде, но свойство заведомой аддитивности внутренней энер-
Pi=Pi ( у. О,
Р2=Р20.0.
Р*=Р1+Р2-
ftp*, y.j. 0=0,
22
Глава первая. Определения и соотношения
гии легко допускает его расчленение на сумму бивариантных слагаемых. А
priori не исключено, что это поливариантное на вид уравнение (1 -4) является
суммой бивариантных слагаемых,
п1
ы
соответственно оно расчленяется на совокупность бивариантных калориче
ских уравнений состояния
Ui=Ui(х и t).
Таким образом, если сложную систему описывают поливариантным
уравнением состояния, то из этого заранее не следует, что такое уравнение
действительно поливариантно и не является поливариантной композицией,
составленной из совокупности бивариантных уравнений состояния.
A priori возможны три версии уравнений состояния сложной системы:
A. Бивариантное уравнение состояния:
X^Xifat).
(1-6)
Ui=Uj(хь t).
Б. Поливариантная совокупность бивариантных уравнений состояния
(условная, кажущаяся поливариантность),
Х г Xu (xih t)+ Xl2(xi2,t)+...,
(1-7)
Ы1=ии(Хц, t)+ Uj2 (xi2, t)+...,
я-1
И=ZX
1=1
выраженная суммой первичных бивариантных уравнений состояния и в
принципе расчленяемая на совокупность первичных бивариантных уравнений
состояния.
B. Собственно поливариантное уравнение состояния,1
Xi=Xi(xi,...,xh...,x n.1>t),
(1-8)
u=u(x,, .. .t
xn.h t),
1В дальнейшем доказывается, что таких струкзур в природе не существует и что их суще
ствование является некорректным, принятым по умолчанию допущением Каратеодори.
Г л а в а первая. Определения и соотношения
23
не расчленяемое на совокупность бивариантных уравнений состояния.
Существование сложных систем с уравнениями состояния по версиям А
и Б не вызывает сомнения и подтверждается множеством опытных фактов.
При внимательном рассмотрении источников, определяющих, описывается
ли данная сложная система поли вариантной суммой Б бивариантных уравне
ний состояния или, напротив, собственно поливариантным уравнением со
стояния В, можно придти к предварительному выводу, что убедительных ар
гументов за или против существования собственно поливариантной струк
туры В нет. Поэтому как существование, так и отсутствие в природе
сложных систем по версии В требует обоснования.
К.Каратеодори применил принцип адиабатической недостижимости
(второй закон) к доказательству существования энтропии сложных систем,
имея в виду собственно поливариантные уравнения состояния (относимые к
версии В). Существование систем с уравнениями состояния по версии В Ка
ратеодори не обосновывал. Существование версии Б Каратеодори не прини
мал во внимание, так же как он не учитывал особенностей пфаффовых форм
уравнения первого закона, отвечающих версиям А и Б .
В то же время М .Планк обосновал существование энтропии простых (в
частности, термодеформациониых) систем без привлечения ссылок на второй
закон. Обычно полагают, что вывод Каратеодори имеет более общий харак
тер и покрывает собою вывод Планка как частный случай (хотя при этом ни
как не устраняется, но только замалчивается несовпадение оснований к су
ществованию энтропии). Но исходные позиции доказательств опирается на
разные основания: у Каратеодори - на первый1 и второй законы термодина
мики, у Планка - только на первый. Поэтому не исключено и обратное, пока
осторожное предположение, а именно, что вывод Планка об энтропии про
стых систем, не нуждающийся в привлечении второго закона, имеет более
общий характер, покрывающий собою или отрицающий результаты вывода
Каратеодори.
1Первый закон в любом случае входит в состав необходимых оснований для существова
ния энтропии, вместе со вторым законом или без него.
24
Глава первая. Определения и соотношения
1.4. Пфаффова форма в дифференциальном уравнении I закона
Общепринято выражать уравнение первого закона термодинамики, оп
ределяющее элементарный теплоприток в равновесном процессе, в виде
дц=(1и(хь ..., XI,.... х т
_
1,0+X",'Х1(^1>-,*,•хт_„>)сЬс,.
Математическое выражение в правой части уравнения представляет со
бой линейную дифференциальную форму в полных дифференциалах незави
симых переменных, называемую пфаффовой формой. В общем случае
пфаффова форма при т независимых переменных 7, имеет вид
1т)= 11Л21+...+1Д21+ ..Л 1 т(1гт,
где коэффициенты пфаффовой формы являются функциями независимых пе
ременных,
г,-,...,
Таким образом, первый закон выражен в общем случае поливариантной
пфаффовой формой
дц=П(х,,..., хь...,хт.},/>,
которая при поливариантных коэффициентах сводится к сумме
от-1
6ц=
.
/-1
а при бивариантных коэффициентах сводится к сумме бивариантных пфаф
фовых форм:
<5<?=
.
/=1
В случае простой системы уравнение первого закона, определяющее эле
ментарный равновесный теплоприток 5#, выражается бивариантной пфаффо
вой формой:
Зд=с1и(х>0+Х(х, 0с1х
(1-9)
Коэффициенты при дифференциалах определены уравнениями состоя
ния. В (1-9) они выражены, естественно, в бивариантной структуре, согласно
Глава первая. Определения и соотношения
25
бивариантной структуре уравнений состояния (1-1, 1-2). Слагаемые пфаффо
вой формы также бивариантны (содержат не более двух переменных).
В случае сложной системы, как отмечалось, возможны три версии урав
нений состояния - А, Б и В. Соответственно возможны три принципиально
отличающиеся структуры коэффициентов пфаффовой формы сложных сис
тем.
Версии А отвечают бивариантные коэффициенты и бивариаптные сла
гаемые пфаффовой формы сложной системы:
Сложная система, описываемая несколькими поли вариантными урав
нениями состояния по версии Б , после их расчленения на бивариантные
уравнения также описывается общим количеством т-1 бивариантных уравне
ний состояния. Соответственно уравнение первого закона также имеет
пфаффову форму, совпадающую с (1-Ю). Все слагаемые пфаффовой формы
имеют также бивариантную структуру.
Версии В, если она существует, отвечают поливариантные коэффициен
ты и поливариантные слагаемые пфаффовой формы первого закона:
Таким образом, версиям А и Б отвечают пфаффовы формы с бивариант-
ными слагаемыми, а версии В - с поливариантными слагаемыми, не своди
мым и к бивариантным.
1.5. Голономность пфаффовой формы
В зависимости от коэффициентов
пфаффовы формы могут быть голо-
номными или неголономными. Голономными являются те пфаффовы формы,
для которых может быть подобрана функция независимых переменных, на
зываемая интегрирующим множителем (делителем). После умножения на
интегрирующий множитель голономная пфаффова форма обращается в ин
тегрируемое выражение, представляющее собой полный дифференциал но-
(1-10)
26
Глава первая. Определения и соотношения
вой функции состояния. В математике нет общего метода для отыскания ин
тегрирующего множителя. Однако если пфаффова форма с тремя и более не
зависимыми переменными имеет интегрирующий множитель, то ее коэффи
циенты должны удовлетворять тождественным равенствам теоремы Фробе-
ниуса. Но бивариаптпая пфаффова форма (при двух независимых перемен
ных) всегда голопомпа по определению, вне связи с теоремой Фробепиуса.
Теорема Фробениуса
Отличие поливариантной пфаффовой формы от бивариантиой состоит в
том, что первая может быть и неголономной. При этом она голономна тогда
и только тогда, когда удовлетворяет требованиям теоремы Фробениуса. Тео
рема Фробениуса выражена равенством
(Z, rot Z)=0,
где Z - вектор, компонентами которого являются поочередно сочетания каж
дых трех коэффициентов Zit Zjf Z* пфаффовой формы - функций независимых
переменных zi,...,zm.
При числе независимых переменных сложной системы п>3 теорема
Фробениуса выражается множеством тождественных равенств, которые за
писываются для сочетания каждых трех коэффициентов пфаффовой формы,
Z„ Zj, Zk с их сопряженными обобщенными координатами z„ zj, z*:
dZ,.
07
dz
+Z
j/
dZk dZi
dz. dZ.
+Zi
f dz, dZj'
Kdzi dz,
=0.
(1-11)
'J
В общем случае число таких тождественных равенств Фробениуса зави
сит от числа т независимых переменных, определяется числом сочетаний
Ст3=т!/(6(т-3)!) и быстро растет с ростом числа переменных. При т=3, 4, 5,
б,..., 22,... число тождественных равенств Фробениуса равно соответственно
С3т.2=1,4, 10,20,..., 1540,...
При бивариантиой пфаффовой форме тождественное равенство (1-11)
обращается в тривиальное 0=0, указывающее на заведомую голономность
(голономность по определению) пфаффовой формы.
Г л а в а первая. Определения и соотношения
27
В случае простейшей из сложных систем - сложной системы с п=3, ком
понентами единственного равенства Фробениуса являются коэффициенты
Ъ \ ^ 2уЪ3 при дифференциалах независимых переменных Ъ\уг2, г 3 :
2,
дг2 82,
&3
дг2
'82, 82, "
+1,
'82, 822'
V
д2) )
3
дг, у
=о.
(Ы2)
Согласно равенству коэффициенты
Ъ2, Ъ3 пфаффовой формы зависи
мы не только от независимых переменных, но и друг от друга. Как необхо
димое (и достаточное) условие голономности пфаффовой формы, теорема
Фробениуса имеет отношение только к поливариантной пфаффовой форме,
поскольку бивариантная пфаффова форма заведомо голономна (по определе
нию).
Голономность по определению
Пфаффовы формы при двух независимых переменных
П(х1, х 2)=Х ,(х!, Х2)с1х1+ Х2(х1, х2)(Ьс2
(бивариантиые пфаффовы формы) заведомо голономны. В отличие от поли-
вариантных пфаффовых форм они всегда имеют интегрирующий множитель
/(*/,
обращающий их в полный дифференциал:
Щхп х2) ^ ( х 1>х2) = [Х,(х!, Х2)(к/+ Х2(хи х2)ск2]*/(х1, Х2)=(1Р(хи х& (1-13)
Действительно, из соответствующего уравнения Пфаффа
Х^хи х2)(1х,+ Х2(хи х^сЬс^О
следует дифференциальное уравнение
^1=_А
Л,
х2'
В соответствии с теоремой существования и единственности и при усло
вии, что Х\ и Х2 - непрерывные и однозначные функции независимых пере
менных X/, х 2 и Х2 Ф 0 во всей области изменения этих переменных, всегда
существует решение такого дифференциального уравнения:
Р(хи х2) =0.
При его дифференцировании имеем
28
Глава первая. Определения и соотношения
л
дР
л
—
с1х, + ----- с1Х, = О
аг7
Из сравнения полученного равенства с уравнением Пфаффа следует, что
коэффициенты при ¿¿х/ и ¿/х2 должны быть пропорциональны, то есть
дГ^
дх]
ар
-
^ - = /(дС|,ДГ2).
Л2
Отсюда
^- =Л^,х2)Х>у ^ - =/(хх,х2)Х2
дх?
дх.
откуда следует подтверждение голономности исходной бивариантной пфаф
фовой формы П(х\, х2): всегда существует такой интегрирующий множитель
/(*/, х?), что
П(х\,х2)*/(х\,х2)= —
с!хх +
= с1р(х], дг2).
дх.
дх,
(1-14)
Необходимость в подтверждении голономности со стороны теоремы Фробе-
ниуса исключается.
глава вторая
Классический и аксиоматический подходы к проблеме
энтропии
2.1 . Классический подход к проблеме существования энтропии
Классическая система обоснования понятия энтропии изложена в рабо
тах Р.Клаузиуса и В.Томсона и в значительной мере основана на теории Сади
Карно, изложенной в «Размышлениях о движущей силе огня». По Клаузиусу
«теплота не может переходить сама собой от более холодного тела к более
теплому» - постулат, называемый вторым началом термодинамики. Постулат
дает новое обоснование теоремы Карно о независимости КПД его равновес
ного цикла от физических свойств рабочего тела (преобразующей системы).
Вполне обоснован вывод соотношения для цикла Карно: в интервале темпе
ратур Т\..Т ”
Однако для определения вида функции / и зависимости КПД цикла Кар
но от температур и тем самым для вывода о существовании энтропии необ
ходимо привлечение свойств какого-либо одного рабочего тела. Таким рабо
чим телом послужил идеальный газ - «придуманная система» по выражению
Т.А .Афанасьевой-Эренфест. В связи с этим возникает неопределенность. Не
обходимость включения «придуманной системы» в вывод нарушает безу
пречность логической структуры классического вывода уравнения Зд=Тс18,
определяющего существование энтропии.
В то же время, как заметил Гельмгольц [12], для определения абсолют
ной температуры и энтропии не требуется ни рассмотрения круговых про
цессов, ни допущения существования идеальных газов. Среди всех различ
ных интегрирующих делителей дифференциала Зд имеется такой, который
30 Г л а в а вторая. Классический и аксиоматический подходы к проблеме энтропии
зависит только от температуры, и он является абсолютной температурой лю
бого тела.
Классическому изложению основ термодинамики Каратеодори противо
поставил аксиоматическое изложение, которое не зависит от круговых про
цессов и в котором отсутствует необходимость ссылки на свойства «приду
манного» идеального газа.
2.2. Аксиоматическая структура изложения
Аксиоматика Каратеодори
К.Каратеодори ([20], 1909 г.) рассматривал сложные системы, опи
сывая их собственно поливариантными уравнениями состояния (версия
В). То, что такие системы существуют в природе, было принято по умол
чанию. Корректность выбора собственно поливариантных уравнений со
стояния не обсуждалась. Для таких систем было представлено доказа
тельство существование интегрирующего множителя 1/Т у пфаффовой
формы дифференциального уравнения первого закона. Задача решается
в два этапа: а)доказывается голономность поливариантной пфаффовой
формы в уравнении первого закона для сложных систем с поливариаит-
ными уравнениями состояния, б)показано, что если а) доказано, то интег
рирующим множителем является температурная функция 1/Т, превра
щающая пфаффову форму в полный дифференциал новой функции со
стояния - энтропии.
Решая первую часть задачи, К.Каратеодори расчленил исходные законы
термодинамики на аксиомы. В качестве первой он привлек аксиому о тепло
вом равновесии1, в качестве второй - установил, что второй закон термоди
намики может быть выражен в виде принципа адиабатической недостижи
мости. Этот принцип Каратеодори обоснован математической теоремой и
«аксиомой И».
1В курсах термодинамики ее рассматривают как нулевой закон термодинамики, устанав
ливающий существование эмпирической температуры
Глава вторая. Классический и аксиоматический подходы к проблеме энтропии 31
Пусть для дифференциального уравнения, в том числе для уравнения
равновесной адиабаты
а*+£
Ы
ди
дх.
+ Х, С1Х;=0
У
решением является некоторая функция
0=0.
Если эта функции проходит через некоторые точки в системе координат
XI,..., х{,..., х п.!, /, и если вблизи каждой из этих точек существуют такие дру
гие точки, через которые данная функция не проходит (недостижимые точ
ки), то уравнение адиабаты, соответственно пфаффова форма в уравнении
первого закона голономна, имеет интегрирующий множ итель. Эта матема
тическая теорема доказана К.Каратеодори. Она дополняется доказательст
вом, что такие недостижимые точки существуют. Существование таких
точек К.Каратеодори обосновал «аксиомой И». Эту аксиому обычно назы
вают принципом (аксиомой) адиабатической недостижимости, или принци
пом Каратеодори. Этот принцип рассматривается как одна из равносильных
формулировок второго закона термодинамики и доказывается с помощью
второго закона термодинамики. Такое доказательство возможно, например,
исходя из «простейшей и точнейшей» формулировке второго закона, сфор
мулированной М.П ланком [32], а именно: «образование тепла путем трения
необратимо». Путем трения, действительно, можно вывести газ или другое
тело из данного исходного равновесного состояния и перевести в другое
равновесное состояние. Можно и вернуть его в исходное состояния, отводя
тепло. Но его нельзя вернуть адиабатно, без теплообмена. Адиабатные спо
собы возврата, согласно первому закону термодинамики, ограничиваются
только возможностью совершить положительную или отрицательную, рав
новесную или неравновесную работы. Ни один из них не способен вернуть
систему в исходное состояние после процесса трения, что и определено «ак
сиомой И».
32 Гла в а вторая. Классический и аксиоматический подходы к проблеме энтропии
Но тогда согласно теореме, доказанной Каратеодори, и принципу адиа
батической недостижимости, установленному Каратеодори, на дифференци
альное уравнение первого закона для равновесных процессов налагается ог
раничение: все существующие в природе термодинамические системы име
ют голономную пфаффову форму Sq.
Для пфаффовой формы в первом законе, из факта ее голономности Кара
теодори выводит существование интегрирующего делителя, равного термо
динамической температуре Т.
Рассматриваются1 две произвольные термодинамические системы в рав
новесном процесс с теплопритоками <50/ и SQ2 . Так как уже доказано, что
обе соответствующие пфаффовы формы голономны, то
<50/=М/<7/, <502 =N(¡02,
где М и (71- функции параметров состояния первой системы, а N и о2 - функ
ции параметров состояния второй системы.
Системы приводятся в термический контакт, обеспечивающий равенство
их температур в равновесном процессе. За независимые параметры первой и
второй системы выбраны:
*/=/, Х2= 0 1 , х3,...,хт,
У1=1, У2=<*2,
Уп-
Тогда независимыми параметрами составной системы будут
I аио2,х3,..., хт,у3,...,уп.
Общий теплоприток к составной системе
3()=Мс1о1 +Шо2.
Но полученная пфаффова форма <50 также голономна по доказанному,
поэтому и для нее также существует и интегрирующий делитель Я, и полный
дифференциал с11¥:
Я
+—аа . =с1\¥.
Вывод приводится в изложении Т.А .Афанасьевой-Эренфест [ 1].
Глава вторая. Классический и аксиоматический подходы к проблеме энтропии 33
В полном дифференциале частные производные каждых двух коэффици
ентов при дифференциалах двух независимых переменных, взятые накрест,
равны между собой. Отсюда, так как коэффициенты при dt, dbcj,..., dxm, dyit...,
dyn равны нулю, то и
д—
д—
——
=о,
——
=о
dt
dt
Это значит: если в выражения функций М, N, Я входит параметр t, то
только в одной и той же функции f(t)yявляющейся общим множителем.
Затем, из
аТ
«7
ду,
ÖXj
и из того, что М не зависит от y h а N не зависит от xjy можно заключить, что
М, N, Я не могут зависеть ни от каких параметров, кроме /, <г1г а2. Тогда
SQ{= f(t)<p(cг,) = f(t)dS,; 5, = JV(S, ]dS,
SQ2 = f(t)<p{a2) = f{t)d S2; 5 2 = \<p2{S2)dS2
откуда
¿Q=M d S t +dS2)=f(t)dS.
Здесь множитель f(t) универсален для всех возможных систем. Как из
вестно, одна и та же пфаффова форма или вовсе не имеет интегрирующего
делителя, или имеет их бесчисленное множество. Но все они будут содер
жать в данном случае один и тот же множитель f(t). В этом легко убедиться,
предположив противное и взяв для первой системы прежний интегрирующий
делитель, а для второй новый
N ' = / ’(t)<p *(S2).
Так как N7X не должно содержать t, то, очевидно, f ( t ) =f(t).
Именно этот вывод Каратеодори о голономности SQ приводит к необхо
димому следствию: выражения, определяющие коэффициенты пфаффовой
формы, должны, в силу ее голономности, удовлетворять условиям теоремы
34 Глава вторая. Классический и аксиоматический подходы к проблеме энтропии
Фробениуса как необходимому следствию голономпости пфаффовой формы.
Соответственно условиям теоремы Фробениуса должны удовлетворять и пе
ременные в составе уравнений состояния, поскольку именно уравнения со
стояния определяют коэффициенты пфаффовой формы первого закона. Тем
самым множество равенств теоремы Фробениуса долж но рассматриваться
как дополнительное множество уравнений состояния термодинамической
системы, но только в случае сложных систем с собственно поливариантными
уравнениями состояния (версия В). В случае простых термодинамических
систем голономность их пфаффовой формы первого закона устанавливается
по определению и множество равенств Фробениуса к уравнениям состояния
не привлекается.
Аксиоматический метод изложения термодинамики по Каратеодори
встретил возражения со стороны М.Планка [32]. Он отмечает достоинства
метода - независимость от круговых процессов и идеальных газов. Но ис
ходный пункт доказательства у Каратеодори («в любой близости всякого со
стояния системы тел существуют смежные состояния, которые из первого
состояния не могут быть достигнуты адиабатическим путем») хотя и вполне
убедителен, но уступает классическому методу, потому что лишен непосред
ственной экспериментальной основы, такой, какую имеет невозможность
вечного двигателя второго рода. «Никто еще никогда не ставил опытов с це
лью достижения всех смежных состояний какого-либо определенного со
стояния адиабатическим путем». Кроме того, второй закон лиш ается у Кара
теодори своего принципиального толкования, относящегося именно к двига
телю. Вместо этого он ставит систему тел в зависимость от числа степеней
свободы, то есть от отклонения отдельных значений от средних значений. В
частности он не может быть применен в случае газа, состоящего всего лишь
из десяти молекул.
В этой же публикации М.Планк воспроизводит вывод существования
интегрирующего множителя 1/Т как температурной функции, определяющей
существование энтропии. Но вывод Планка относится исключительно к про-
Г л а в а вторая. Классический и аксиоматический подходы к проблеме энтропии 35
стым системам, имеющим бивариантные уравнения состояния и бивариант
ные пфаффовы формы <?<?.
В связи с исключительной важностью этого вывода для обоснования
существования энтропии не только простых, но и сложных систем, изложе
ние данного вывода переносится в заключительную часть данной главы.
Аксиоматика Т.А.Афанасьевой-Эренфест
Существенный вклад в развитие аксиоматического направления в тер
модинамике, связанного с выводами Каратеодори, внесла Т.А .Афанасьева-
Эренфест [1]. Она определила, что при выводе принципа существования эн
тропии по Каратеодори нет необходимости представлять во всем объеме со
держание постулата Клаузиуса. Вместо невозможности произвольного, в том
числе неравновесного адиабатного процесса, возвращающего систему в ис
ходное состояние после элементарного процесса с теплообменом, достаточно
указать на невозможность только равновесного адиабатного обратного, в том
числе обходного обратного процесса. Соответственно постулат Каратеодори
заменяется аксиомой, предложенной Афанасьевой-Эренфест. «Аксиома I (эн
тропии): если на бесконечно малом пути, соединяющем два бесконечно близ
кие состояния термически однородной системы, ЗдФО, то между этими со
стояниями невозможен никакой обходный чисто адиабатический квазистати-
ческий путь». Тем самым голономность пфаффовой формы основана на од
ной только равновесной адиабатической недостижимости. Предположение о
возможности обратного адиабатического процесса, сопровождаемого какой-
либо неравновесностью, не нарушает вывода о голономности пфаффовой
формы и вывода о существовании энтропии.
Т.А .Афанасьева-Эренфест обратила также внимание на то, что одной
только голономности пфаффовой формы ¿><7 недостаточно для определения
того, что Клаузиус назвал энтропией. Имеется в виду принцип однозначности
энтропии, выраженный равенством Клаузиуса и проявляющийся, например,
в непересекаемости адиабат. Принцип однозначности энтропии является не-
36 Г л а в а вторая. Классический и аксиоматический подходы к проблеме энтропии
обходимой составной частью второго закона термодинамики. В связи с этим
было высказано критическое замечание в адрес М.Планка, который не при
влек ссылку на второй закон при выводе существования энтропии, рассмат
ривая совмещенные (для идеального газа и для произвольной равновесной
системы) круговые процессы, и который «весь вес второго начала полагает в
свойстве энтропии возрастать»1.
Аксиому I (энтропии) Афанасьева-Эренфест дополняет еще тремя ак
сиомами, в частности аксиомой III (однозначности энтропии)2: интеграл
взятый по замкнутому пути, всегда равняется нулю. Без этой аксио
мы можно было бы при помощи периодически действующей машины полу
чать работу из тепловой энергии, пользуясь одним только резервуаром тепла:
§dQ =§TdS =T§dS*Q ,
если аксиома III (однозначности энтропии) не выполняется и <jdS * о .
Четыре аксиомы являются основанием позиции Афанасьевой-Эренфест
относительно значения «квазистатических» (равновесных) процессов в изло
жении второго начала. Совокупность ее четырех аксиом рассматривается как
«второе начало для квазистатических процессов», согласно которому невоз
можны: 3
1. Превращение тепла в работу без того, чтобы некоторое соответст
вующее количество тепла не перешло от тела более нагретого к телу менее
нагретому.
2. Перенос тепла от тела менее нагретого к телу более нагретому без
того, чтобы соответствующее количество работы не было превращено в теп
ловую энергию.
1Ранее уже отмечалось, что, действительно, М.Планк в своем учебнике «Термодинами
ка», возможно, не без основания, сначала излагает принцип существования энтропии, а
затем переходит к изложению второго начала.
2 Вопрос об однозначности энтропии рассматривается ниже.
3Дальнейшее изложение настоящего исследования приводит к выводу, что все эти четыре
формулировки, относящиеся к равновесным процессам, вместе с принципом существова
ния энтропии переходят в первое начала термодинамики как его составные части.
Г л а в а вторая. Классический и аксиоматический подходы к проблеме энтропии 37
3. Превращение работы в тепло без того, чтобы соответствующее ко
личество тепла не было перенесено от тела менее нагретого к телу более на
гретому.
4. Перенос тепла от тела более нагретого к телу менее нагретому без
того, чтобы соответствующее количество тепла не было превращено в рабо
ту.
Тем самым второй закон термодинамики был разделен на две части:
второе начало для квазистатических (равновесных) процессов и второе нача
ло для нестатических (неравновесных) процессов.
Гипотеза Гухмана
По оценке А.А .Гухмана замена Афанасьевой-Эренфест постулата адиа
батической недостижимости Каратеодори на аксиому I (энтропии) «внесла
исчерпывающую ясность в этот вопрос». При этом А.А .Гухман [13,14]также
обращает внимание на недостаточную обоснованность вывода о существова
нии энтропии по Клаузиусу-Каратеодори. Он считает большим достоинст
вом аксиоматического метода в его окончательном виде, данном Афанасье
вой-Эренфест, последовательное, тщательно выдержанное расчленение его
на две по существу разнородные части, насильственно объединенные в нем
при классическом изложении. В структуре построения второго закона ею ус
танавливаются два самостоятельных принципа, относящихся к энтропии -
принцип существования энтропии и принцип ее одностороннего изменения
при неравновесном взаимодействии. Соответственно второй закон наполня
ется не одним, а двумя принципами - существованием и возрастанием энтро
пии.
В то же время Гухман убежден, следуя здесь Планку, что постулат
адиабатической недостижимости неприемлем в качестве исходного универ
сального физического принципа. Только последующая апробация теории в
целом на основе сопоставления с данными опыта ее конечного вывода о су
ществовании энтропии (с ее бесчисленными экспериментально проверяемы-
38 Г лава вторая. Классический и аксиоматический подходы к проблеме энтропии
ми следствиями) дает достаточные основания для утверждения физической
достоверности постулата. Но тогда постулат «приходится оценить как гипо
тезу, подтверждаемую апостериори». Причем, с опытом сопоставляется не
сам обосновываемый результат - существование энтропии, а теоретическое
следствие этого результата. «Сомнение в рациональности всего этого по
строения» приводит Гухмана к выводу о возможности принять в качестве ис
ходного положения гипотезу существования термодинамической температу
ры Т. В частности, Гухман, исходя из безосновательного, по его мнению,
применения постулатов второго закона к равновесным процессам, заменяет
их в качестве исходного положения гипотезой, непосредственно устанавли
вающей принцип существования и однозначности энтропии. Иными словами,
здесь опытные данные рассматриваются лежащими не в основании принципа
существования энтропии, а в его следствиях. Вводится гипотеза существова
ния энтропии, подтверждаемая всеми следствиями и приложениями термо
динамики. При такой трактовке вопрос о голономности пфаффовой формы
дифференциального уравнения первого закона, обсуждаемый здесь, вообще
выпадает из рассмотрения. Соответственно игнорируется, исключается из
рассмотрения неопределенность, возникающая в отношении голономности
и связанная с включением в аксиоматику теоремы Фробениуса.
Гухман подчеркивает существенное отличие предложенной им системы
построения термодинамики от классической. Он допускает возможность су
ществования процессов, приводящих не к возрастанию, а к убыванию энтро
пии, хотя «для классической системы нарушение принципа возрастания эн
тропии означает научную катастрофу».1 Факт убывания энтропии был бы
воспринят как свидетельство реализуемости таких условий, в которых тер
модинамика вообще не действительна. В системе термодинамики по Гухма-
ну, равно как и при аксиоматическом изложении по Афанасьевой-Эренфест
Что касается возможной по Гухману «научной катастрофы» в классической термодина
мике в случае возможного обнаружения ф а т а убывания энтропии, то «катастрофы» не
будет, но только в случае если и существование энтропии, и ее однозначность определены
не вторым, а первым законом термодинамики.
Глава вторая. Классический и аксиоматический подходы к проблеме энтропии 39
факт убывания энтропии не внес бы никаких изменений в основные пред
ставления о равновесных процессах, а в неравновесных процессах исправле
ния свелись бы лишь к изменению знака неравенств на противоположный.
Предложенная Гухманом система изложения термодинамики, так же
как и при классическом изложении по Клаузиусу или аксиоматическом по
Каратеодори и Афанасьевой-Эренфест, ограничивается рассмотрением слож
ных термодинамических систем с поливариантными уравнениями состояния
и поливариантными коэффициентами пфаффовых форм в первом законе. Во
зм ожность существования таких уравнений состояния не обсуждается.
И.И .Новиков об основаниях энтропии
Оригинальный вывод существования энтропии, исходя из второго за
кона термодинамики, приводит И.И .Новиков [28]. Обобщенные силы
Х1( х 1 , . . . , х п, 0 в уравнении первого закона равновесной многопараметриче
ской системы он рассматривает как частные производные от некоторой
функции - У(х1, . . . , хп, 0 . Это следует из второго начала термодинамики для
обратимого изотермического процесса, в котором работа равна
а подынтегральное выражение И.И .Новиков рассматривает как полный диф
ференциал некоторой однозначной функции от Х 1 , . . . , х п, обозначенной через
- У , при этом температура входит в У в качестве параметра. Соответственно
и
ех1 =дх1
дх] дх1
Последнее равенство указывает, что, как и К.Каратеодори,
И.И .Новиков исходит в своем выводе из структур сложных систем с произ
вольной структурой поливариантных уравнений состояния, без анализа их
40 Глава вторая. Классический и аксиоматический подходы к проблеме энтропии
структуры, ее совместимости с требованиями теоремы Фробениуса и ее сво
димости к сумме бивариантных уравнений.
Альтернатива Г.В .Скорнякова
Г.В .Скорняков [35-37], по-видимому, первый, кто выступил с критиче
ской оценкой роли теоремы Фробениуса, привлекая ее непосредственно к
анализу голономности пфаффовой формы первого закона. Каратеодори и
Афанасьева-Эренфест только упоминали о связи между голономностыо
пфаффовой формы Зц и теоремой Фробениуса как необходимым и достаточ
ным условием интегрируемости пфаффовой формы. Скорняков же обратил
внимание на последствия этой связи: «Второе начало термодинамики по сути
дела сводится к утверждению: для всех термически однородных термодина
мических систем условие Фробениуса выполнено, хотя этот вопрос никогда
не был предметом тщательного анализа и прямой экспериментальной про
верки». Он исходит из положения, что голономная пфаффова форма <5#, как и
пфаффова форма вообще, долж на удовлетворять тождественным равенствам
теоремы Фробениуса как необходимому следствию голономности пфаффо
вой формы.
Сопоставляя термодинамические свойства сложных систем с условием
Фробениуса, Г.В .Скорняков обращает внимание на то, что «с ростом числа
независимых термодинамических переменных число условий интегрируе
мости пфаффовой формы быстро растет». В результате Скорняковым вы
сказано сомнение в том, что поливариантные пфаффовы формы Зд всегда
могут быть совместимы с условиями теоремы Фробениуса. Причем, не
смотря на систематическое упоминание в литературе сведений об условиях
теоремы Фробениуса, «на выполнение этих условий в реальных случаях
многопараметрических термодинамических систем никогда не обращалось
внимания». В соответствии с теоремой Фробениуса с ростом числа незави
симых переменных число тождеств Фробениуса быстро растет и «наклады
вает весьма жесткие ограничения» на уравнения состояния. При этом, «на-
Глава вторая. Классический и аксиоматический подходы к проблеме энтропии 41
пример, в случае анизотропного упругого твердого тела число независимых
коэффициентов упругости может достигать шести. Ситуация в случае ани
зотропных магнетиков и сегнетоэлектриков аналогична. Сама возможность
удовлетворения набором п функций значительно большему, чем л, количе
ству условий более чем проблематична». В итоге Скорняков приходит к
выводу, что условия теоремы Фробениуса неприемлемы для поливариант-
ных пфаффовых форм и, соответственно, для поливариантных уравнений
состояния термодинамической системы с большим числом независимых пе
ременных.
Одновременно предлагается разрешение противоречия, существующе
го в термодинамике Каратеодори в связи с поливариантными структурами
уравнений состояния. Исходя из своего вывода о частичной неприемлемости
теоремы Фробениуса, Скорняков приходит к заключениям, приводящим к
отрицанию универсальности второго закона термодинамики. По Скорнякову
«в общем случае многопараметрических термодинамических систем интег
рирующий делитель пфаффовой формы вообще не существует». Тем самым
пфаффова форма 5д может не быть голономной вопреки принципу Каратео
дори, соответственно принцип адиабатической недостижимости не является
универсальным принципом. Отсюда вывод: могут существовать сложные
системы, не подчиняющиеся второму закону термодинамики, с поливариант
ными (многопараметрическими) уравнениями состояния и, соответственно,
поливариантными коэффициентами пфаффовых форм. В отношении второго
закона термодинамики «нет абсолютно никаких оснований распространять
его на любые тепловые процессы, а тем более придавать ему значение уни
версального закона природы». «Получившая широкое распространение трак
товка начал термодинамики как обобщения опытных данных лиш ена серьез
ных оснований».
В отношении однопараметрических (бивариантных) термодинамических
систем Скорняков замечает, что их пфаффовы формы дц хотя имеют интег
рирующий делитель, но интегрирующие делители могут не совпадать у раз-
42 Глава вторая. Классический и аксиоматический подходы к проблеме энтропии
ных систем, и нс обязательно равны идеально-газовой температуре. В под
тверждение указывается на свойства потенциальных термодинамических
систем, интегрирующий делитель которых «оказывается равным нс темпера
туре, а теплоемкости системы, причем, роль «энтропии» таких систем играет
температура». Однако такое «подтверждение» иллюзорно: и интегрирующий
делитель, и теплоемкость потенциальной системы, и ее энтропия являются
функциями только температуры, и изменение их названия не нарушает выво
да М.Планка о существовании энтропии простых систем, который будет при
веден ниже.
Действительно, I закон термодинамики определяет элементарный равно
весный теплоприток 8 0 к простой системе с температурой /, объемом V,
внутренней энергией 6 Д Р ), давлением р(ь V) и изохорной теплоемкостью
С^У)=Л(иУ)/дУ *0 равенством
где /(I, V) )?Ю - отличный от нуля интегрирующий делитель дифференци
альной формы 80, о=о((,У) - сопряженная с интегрирующим делителем
функция состояния.
В случае простых потенциальных систем, для которых
соответственно
с1сг=[Су(1 У)//0, У)]Ж+0*8У
Полученное равенство требует, чтобы по свойству полного дифферен
циала
8<2=Д/,К)Лт=Су(/,У)Л+
+ р(и У))8У,
СУ
Я]/дУ+р=0,
имеем
/о , У)8а= С Д У)Ж+0*с1У,
Глава вторая. Классический и аксиоматический подходы к проблеме энтропии 43
Тогда С\(и V) и /(?, V) или не зависят от V, или имеют одинаковые множи
тели г(У), выражающие их зависимость от V:
САЮ= м(0-г(Ю.
Ж V) = Щ.Г<У),
где р(() и Л(0 отличаются размерностью и поэтому не равны друг другу.
Отсюда
с1а=[ц(()/Щ]Ж,
то есть энтропия является функцией только температуры,
(Т=аО).
Тогда
У=У(1,о) = У[г, о(0] = У(0.
Соответственно и интегрирующий делитель для 8() оказывается функци
ей только температуры,
МУ)=ЖУ(0)=Т(0,
что и требовалось установить. Функцией только температуры является и теп
лоемкость простой потенциальной системы,
С^,У)=САУ(0)= с м .
Никаких особенностей, выражающих неоднозначность интегрирующего
множителя, в потенциальных системах не имеется.
М.Планк об энтропии простых систем
Как отмечалось выше, теорема Фробениуса относится только к полива-
риантным пфаффовым формам - формам с тремя и более независимыми пе
ременными. В случае простых систем, с двумя независимыми переменными,
их бивариантные пфаффовы формы уравнения первого закона заведомо го-
лономны (голономны по определению). Такие пфаффовы формы являются
инвариантом теоремы Фробениуса.
Вывод существования энтропии для простых голономных систем без
привлечения ссылок на второй закон приводится М.Планком в фрагменте
44 Глава вторая. Классический и аксиоматический подходы к проблеме энтропии
статьи [32]. Учитывая исключительную важность этого вывода для опреде
ления основ существования энтропии, здесь приводится подробное изложе
ние этого замечательного фрагмента.
Планк рассматривает «какую-нибудь систему тел» в точно определенном
ее состоянии. Частным случаем такой системы является простая термодина
мическая система - «одно единственное гомогенное тело», например газ, со
вершающее обратимый процесс. Его внутренняя энергия U определяется
двумя параметрами - объемом V и температурой t . Правая часть уравнения
первого закона для простых систем,
SQ=dU(V, í) + p(V, t)dV,
как любая бивариантной пфаффова форма, имеет отличный от нуля интегри
рующий делитель f(v, t),
SQ=f(V,t)da,
(2-1)
которому можно придать положительное значение:
f(V,t)>0.
Тем самым вводится и сопряженный с интегрирующим делителем пол
ный дифференциал конечной функции обоих независимых переменных
а=о(К í).
(2-2)
Эту функцию а, как и внутреннюю энергию U, можно рассматривать как оп
ределенное свойство тела и назвать ее энтропией вещества в состоянии, оп
ределяемом через V и /. Такое определение энтропии еще не является одно
значным, так как существует не одна величина, а бесконечное множество ве
личин / (V\ t), обращающих da в (2-1) в полный дифференциал. Тогда каждо
му / (V, t) соответствует другой дифференциал da. Поэтому в величине / (V,
t) можно произвольно взять лишь множитель, зависящий от сг, и для полноты
определения энтропии еще требуется установление этого множителя.
Существование функции а позволяет заменить в (2-1) независимые пе
ременныеV,tнаa,í:
SQ =0(а, t)da,
(2-3)
с интегрирующим делителем
Г л а в а вторая. Классический и аксиоматический подходы к проблеме энтропии 45
0(о, $>0 .
Далее рассматривается система, окруженная адиабатной изоляцией и со
стоящая из двух термически однородных тел - подсистем 1 и 2, допускаю
щих теплообмен между собой (разделенный диатермической перегородкой.
Их тепловой баланс
<5£/ +
=0,
согласно первому закону термодинамики имеет вид
¿Я/у+ р ,(/У^ (Ш2+р2с1У2 =0
(2-4)
или, с учетом разложения теплопритоков на сомножители согласно равенству
(2-3),
&]((Т], $€¡01+ @2(02, $€¡02=0 .
(2-5)
В этой алгебраической сумме каждое слагаемое, очевидно, означает сооб
щенную соответствующему телу извне теплоту, отнятую у другого тела. В
силу уравнения (2-4) дифференциалы трех переменных У!г У2 и / подчинены
некоторому условию, следовательно, лишь два из них могут быть взяты про
извольно, в то время как третье тогда определено. Поэтому если вместо неза
висимых переменных К/, У2 и / ввести в уравнение (2-4) независимые пере
менные 0 1 , 02 и /, то / выпадает из уравнения и последнее будет приведено к
уравнению вида1
Щои О2)=0.
Последнее представляется в дифференциальной форме:
ЭУ,
дУ.
-
€¡<7. + ------а<71 = 0
да.
да,
(2-6)
Чтобы полученное уравнение (2-6) было совместимо с уравнением (2-5),
необходимо и достаточно, чтобы дифференциальные выражения в обоих
уравнениях отличались лишь конечным множителем:
1Геометрически в координатах сгг, а2, / дифференциальное уравнение (2-5) выражает ци
линдрические поверхности, параллельные оси /, соответственно температура выпадает (по
выражению М.Планка) из числа независимых переменных. Действительно, в дифферен
циальном уравнении (2-5) с тремя переменными о/, о2, * каждая из двух переменных, <т/
и а21 изменяется, если и только если изменяется другая переменная. Тем самым перемен
ная / выпадает из уравнения (2-5) и оно сводится к зависимости (2-6).
46 Глава вторая. Классический и аксиоматический подходы к проблеме энтропии
ЛФ
0,((Трt)dax+ ®2(a2,t)da2 = N(----d a x+^—d<J2)
да.
да.
или
&¥
в,(0,,О-N
—
и 02(c2,,)=N —
-
следовательно
©^ар/) _ дШ/дах
©2(0 *2 ,/) д'¥/да2
Здесь частное от деления 0i(af ,t) на 0 2(a2,t) зависит лишь от о> и о>, но
не от /.Но так как 0i(aj, t)зависитлишь от а>и/, а 02(a2>t)лишь от а2и/, то
0/(ai,t) и 0 2(a2,t) имеют вид
0,(ah t) =х (t).(p¡(ai),
@2 ( 0 2 Л) =r (t).(р2(а^).
(2-7)
Тем самым температурные функции т(t) входят в состав интегрирующих
делителей только как сомножители, причем, значения этих функций в под
системах 1 и 2 равны
Tl(t)= r2(t)=T.
(2-8;
В величине Т произвольным является постоянный множитель. При выборе по
ложительного множителя Т может быть названа абсолютной температурой.1
При этом теплопритоки к подсистемам системы 1+2 представятся в виде
ôq,= T çj(ai)daIf
(2-9)
Sq2= Тф 2(a2)da2y
а тепловой баланс (2-4) после сокращения на Т выразится равенством
ф{(а^а, +ф2(а^а2=0,
(2-10)
слагаемые которого определяют дифференциал функции состояния -
ф/fadd a! = dSi(ai)= dSj(xlt t)
ф2 (a2)da2 = dS2(ai)~ dS2(x2t t)
' Кроме того, из (2-7) следует, что в силу неравенства 0(1, а) # 0 и независимости <р/ и
<р2 от /, тождественно выполняются неравенства Т*0, (р ¡(сг])^0, <Р2(<У2)^0 .
Глава вторая. Классический и аксиоматический подходы к проблеме энтропии 47
называемой энтропией подсистем 1 и 2 .Равенства (2-9) принимают вид
¿Вг-Пф,
(2-11)
из которого определяется энтропия каждой простой подсистемы1:
,=
(2- 12)
Таким образом, согласно представленному выводу Планк доказал:
1.Каждое простое гомогенное тело в равновесном состоянии с независимыми
переменными обобщенной координатой х и температурой / имеет энтропию
Б=5(х, I).
Вывод существования энтропии не зависит от выбора обобщенных перемен
ных простой системы; вместо давления и объема ими могла бы служить лю
бая другая пара сопряженных обобщенных переменных Х{ и х1 гомогенного
тела. 2. Существование энтропии получено без привлечения второго закона
термодинамики. Существование энтропии простой системы является пря
мым следствием одного только первого закона термодинамики.
3. Энтропия - аддитивная функция равновесного состояния. Сложная систе
ма, состоящая из двух простых гомогенных тел (подсистем) в равновесном
состоянии, разделенных диатермической перегородкой, имеет энтропию
8(Х1Х2,0 =51(Х1. 0 + 8 2(х2. 0.
Не имеет значения форма диатермической поверхности, разделяющей под
системы. Это может быть и гиперповерхность, разделяющая гомогенные
подсистемы, находящиеся в едином объеме, например, термодеформацион
ная подсистема с переменными р, V, / и термомагнитная подсистема с пере
менными - напряженностью магнитного поля Я , намагниченностью у и той
же температурой /.
1Фрагмент статьи М.Планка [32] с изложением данного вывода без ссылки на второй за
кон, к сожалению, иногда считают неактуальным или даже ошибочным, исходя из извест
ных критических замечаний в отношении совершенно другого вывода в другой его пуб
ликации - в учебнике по термодинамике. Тем не менее изложение фрагмента воспроизво
дится в учебной литературе ([16 ], [41]). Анализ названного фрагмента приведен в статье
автора [9,10]. Отсутствие проблем с выводом существования энтропии при двух незави
симых переменных подтверждается рядом авторов, в частности, И.А .Квасниковым [17].
глава третья
Голономность пфаффовых форм
3.1. Голономность пфаффовых форм с бивариантными слагаемыми
Как отмечалось выше, для пфаффовой формы с поливариантными коэф
фициентами и поливариантными слагаемыми голономность по определению
исключена. Так, вывод Планка относится к энтропии простых систем с пфаф
фовыми формами, состоящими только из бивариантных слагаемых. Такими
являются пфаффовы формы (1-10) в случаях, когда уравнения состояния бива-
риантны (по версии А). Вывод Планка может быть распространен и на поли-
вариантную совокупность бивариантных уравнений состояния (по версии Б).
Согласно изложенному выше, Планк рассматривал простые гомогенные
равновесные подсистемы с бивариантной пфаффовой формой <5#, разделен
ные диатермической перегородкой и допускающие адиабатную изоляцию от
внешней среды. Энтропия этих простых систем согласно выводу Планка яв
ляется следствием только первого закона. Этот вывод может быть дополнен и
распространен на сложные систем с бивариантными слагаемыми пфаффовой
формы, то есть на системы с уравнениями состояния по версии А и Б и с
пфаффовыми формами, состоящими из бавариантных слагаемых. Тем са
мым приводится доказательство, согласно которому пфаффовы формы урав
нения первого закона, состоящие из бивариантных слагаемых, являются го-
лономными по определению, без привлечения теоремы Фробениуса.
Каждое слагаемое такой пфаффовой формы бивариантно -
и описывает отдельную структуру сложной системы, с ее обобщенными пе
ременными Xh и xir температурой t, внутренней энергией Uh работой Xj dxit и
теплопритоком
/71-1
(3-1)
dQi=dUi(xit t)+Xj(xh t)dxv
(3-la)
Глава третья. Голономность пфаффовых форм
49
Тем самым эта структура имеет все признаки подсистемы, отделенной от
других аналогичных подсистем диатермическими перегородками. Через пе
регородки подсистемы вступают между собой в теплообмен. В соответствии
с выводом Планка, не обязательно иметь подсистемы, размещенные каждая в
своем отдельном объеме. Гомогенные термически однородные подсистемы,
например, термодеформационная и термомагнитная, могут размещаться в
едином общем объеме и вступать в теплообмен через разделяющую их ги
перповерхность. Наконец, подсистема, описанная равенствами 6Qi , как и
система в целом, может быть адиабатно изолирована от внешней среды.
Последующая часть приводимого здесь вывода воспроизводит приве
денный выше вывод Планка для двух подсистем, но дополнен рассуждения
ми, относящимися к сложным системам, имеющим более двух подсистем.
Каждая из таких подсистем имеет бивариантную пфаффову форму, сле
довательно, голономна: как любая бивариантной пфаффова форма, она имеет
отличный от нуля интегрирующий делитель/(х ь 0,
(3-16)
которому можно придать положительное значение:
/(хь 0 >0.
Тем самым вводится и сопряженный с интегрирующим делителем пол
ный дифференциал конечной функции обеих независимых переменных
аг<*х(хь 0.
(3-2)
Эту функцию <7/, как и внутреннюю энергию
можно рассматривать как оп
ределенное свойство /-ой подсистемы и назвать ее энтропией подсистемы в
состоянии, определяемом через х, и /. Такое определение энтропии еще не
является однозначным, так как существует не одна величина, а бесконечное
множество величин /¡(хь 0, обращающих
в (3-16) в полный дифференци
ал. Тогда каждому / ( х и 0 соответствует другой дифференциал с1<у,. Поэтому
в величине / ( х ь /)можно произвольно взять лишь множитель, зависящий от
о;-, и для полноты определения энтропии еще требуется установление этого
множителя.
50
Г л а в а третья. Голономность пфаффовых форм
Существование функции сг, позволяет заменить в (3-16) независимые пе
ременные хь / на аи /:
SQi =0i(ab t)dob
(3-3)
с интегрирующим делителем
Qi(ab t)>0.
Далее рассматривается сложная система, окруженная адиабатной изоля
цией и состоящая из термически однородных подсистем 1, 2, 3 , . . . , имеющих
возможность теплообмена между собой (разделенных диатермическими пе
регородками). Их тепловой баланс,
öQi + SQ2+SQ3+ ...=0,
согласно первому закону термодинамики имеет вид
dUj+ X,dx!+ dU2+X2 dx2+dU2+ X3dx3+ .. = 0
(3-4)
или, с учетом разложения теплопритоков на сомножители согласно равенству
(3-3),
0/(бТу, t)dG¡+ 0 2(а2, No о2+@3(о3, t)d(J3+... = 0 .
(3-5)
В этой алгебраической сумме каждое слагаемое, очевидно, означает сооб
щенный соответствующей подсистеме извне теплоприток, отведенный от
других подсистем. В силу уравнения (3-4) дифференциалы переменных X], х 2,
х3>... и t подчинены некоторому условию, следовательно, все, кроме одного
из них, могут быть взяты произвольно, в то время как оставшееся тогда опре
делено. Поэтому если вместо независимых переменных */, х2, х 3, ... и / ввести
в уравнение (3-4) независимые переменные ¿7/, а2, а3, . . . и /, то / выпадает из
уравнения и последнее будет приведено к уравнению вида
Щаи 02, а3,...)=0.
Последнее представляется в дифференциальной форме:
дЧ* ,
дЧ* ,
дЧ* ,
-da,+-----da,+------da,+...= 0
да]
да?
да.
(3-6)
Чтобы полученное уравнение (3-6) было совместимо с уравнением (3-5),
необходимо и достаточно, чтобы дифференциальные выражения в обоих
уравнениях отличались лишь конечным множителем:
Г л а в а третья. Голономиость пфаффовых форм
51
0,(сгрОАт, +®2(о2^)(1о2 ©з(^"з, /)^/сг3+
ИЛИ
дЧ*
дЧ
дЧ
@1(0 1 , 0 =м~д^~> @2(°2>0=М
@з(0з, 0=Ы-д^-,...
(3-ба)
Из первой пары равенств (3-ба) следует
©,(<7^/) _ дЧуЭсг,
0 2(<т2,/) дх¥/до1
Здесь частное от деления @1(0 1 ,/)на @2(0 2 ,0 зависит лишь от 0 1 и сг2, но не от
/. Но так как <9/сг/, /) зависит лишь от а> и /, а Э2(о2,0 лишь от сг2 и /, то
@1 (0 -1 ,У и @2(о2,1) имеют вид
Тем самым температурные функции г(0 входят в состав интегрирующих
делителей только как сомножители, причем, значения этих функций в под
системах 1 и 2 равны
В величине Т произвольным является постоянный множитель. При выборе
положительного множителя температурная функция Т может быть названа
абсолютной температурой.
Аналогичное значение термодинамической температуры Т будет полу
чено для любой пары равенств (3-ба)
При этом теплопритоки к подсистемам данной сложной системы пред
ставятся в виде
@1(0 1 , 0 =т(0.<р¡(о¡),
@2(о2 ,0 =т(0.<р2(О2).
(3-7)
п(0=т2(0=Т.
(3-8;
&}1=Т<р 1(00(101,
&}2= Тф 2(00(102,
Т<рз(о3)с1оз,
(3-9)
52
Глава третья. Голономность пфаффовых форм
а тепловой баланс (3-4) после сокращения на Т выразится равенством
ф1(сг1No<Т1 + (р2 ((Г2)с1ст2+<Рз(сг3)с1аз ...=0,
(3-10)
слагаемые которого определяют дифференциал функции состояния -
<Р1(ст,)с1а1 = (1Б](&!)= <1Б/(х1, О,
(р2(сг^< у2= ЛБ2(<Т1)= с1Б2(х2, О,
(р3(а3)с1<Уз = с1Б3(стз)= с1Б3(х3, /),
называемой энтропией подсистем 1, 2, 3 , . . . . Равенства (3-9) принимают вид
¿2/=7ВД,
^2=7Ж2,
(3-11)
&2з=Т(1Бз,
из которого определяется энтропия каждой простой подсистемы:
<1Б = ¿е,
Т
*2з
т
(3-12)
Получен результат, из которого следует, что сложные системы с урав
нениями состояния - бивариантными (версия А) и поливариантной совокуп
ностью бивариантных уравнений (версия Б) - имеют энтропию, существо
вание которой определено первым законом термодинамики, без привлечения
второго закона.
Остается пока нерешенной проблема существования энтропии в случае
сложных систем с собственно поливариантными уравнениями состояния (по
версии В).
3.2 . Принцип Каратеодори и теорема Фробениуса
Согласно аксиоматике Каратеодори голономность пфаффовой формы
задана принципом адиабатической недостижимости. При этом требуемая
структура и аналитические выражения коэффициентов пфаффовой формы
долж ны удовлетворять условиям теоремы Фробениуса. Однако имеется ис
ключение (см. п.1.5): если пфаффова форма имеет бивариантную структуру
или сводима к бивариантной структуре, то она голономна заведомо, по опре-
Глава третья. Голономность пфаффовых форм
53
делению, без согласования с условиями теоремы Фробениуса (левая часть
тождеств обращается в нуль). Такая голономность устанавливается незави
симо от принципа Каратеодори, но и не противоречит ему.
Это исключение в аксиоматике Каратеодори не рассматривается. Оно
бесполезно при рассмотрении пфаффовых форм с поливариантными коэф
фициентами и слагаемыми. Если хотя бы один коэффициент пфаффовой
формы имеет поливариантную структуру, голономность не устанавливается
по определению и долж на подтверждаться теоремой Фробениуса. Существо
вание поливариантного коэффициента пфаффовой формы обусловлено суще
ствованием собственно поливариантного уравнения состояния по версии В.
Тем самым, если существует хотя бы одно поливариантное уравнение со
стояния, не сводимое к бивариантной структуре, голономность пфаффовой
формы первого закона определяется только принципом Каратеодори и тогда
в аксиоматику включается теорема Фробениуса. Теорема Фробениуса явля
ется необходимым следствием аксиоматики Каратеодори, которая ограничи
вается рассмотрением собственно поливариантных уравнений состояния и
соответственно пфаффовых форм с поливариантными коэффициентами.
Полагая, что собственно поливариантные уравнения состояния сущест
вуют и им отвечают пфаффовы формы первого закона термодинамики, голо-
номные в силу второго закона, Каратеодори далее вычисляет интегрирующий
делитель пфаффовой формы Зс] с поливариантными коэффициентами и уста
навливает, что он равен термодинамической температуре Т, а энтропия явля
ется функцией состояния, определяемой, следовательно, вторым законом
термодинамики. «Подтверждается» классический вывод Клаузиуса о втором
законе как основании принципа существования энтропии. Но одновременно
выбранная версия - версия В поливариантных уравнений состояния - приво
дит к подчинению термодинамических свойств веществ множеству уравнений
состояния, выраженных тождественными равенствами теоремы Фробениуса.
Условие теоремы Фробениуса приводят многие руководства по термо
динамике. Согласно этой теореме необходимое и достаточное условие голо-
54
Глава третья. Голономность пфаффовых форм
номности пфаффовой формы с поливариантными коэффициентами выража
ется равенством в векторной форме
(Х,г<лХ )=0,
где X - вектор с компонентами Х ь Хр Хк, состоящими из поливариантных ко
эффициентов пфаффовой формы первого закона. Тем самым теорема Фробе-
ниуса дополняет уравнения состояния множеством уравнений состояния, вы
раженных равенствами Фробениуса. Они связывают поливариантные коэф
фициенты пфаффовой формы в уравнении первого закона не только с неза
висимыми переменными, но и между собой.
Например, простейшая из сложных систем имеет три независимых пере
менных, и ее термодинамическое состояние описывают тремя поливариант
ными уравнениями состояния - двумя термическими и одним калорическим:
Х^Х^Хи х2,О,
Х2=Х2(х1, х2, О,
и=и(х¡, х 2, 0.
(3-13)
Но появляются и другие, дополнительные уравнения состояния. Действи
тельно, уравнение первого закона содержит пфаффову форму с тремя поли
вариантными коэффициентами:
<^= с(*|,х2,/)сй+
+ Х1(х1,х2,1) Ц +
.
^2
+Х.
(3-14)
Теорема Фробениуса связывает поливариантные коэффициенты пфаф
фовой формы в уравнении (3-14) дополнительным равенством:
8
+Хх
дх2 ^1 >хг4
д_
дх{
дил
у дх2
+Х,
*2*
+
+
(ди^
+Х1
8
]дЫ) +х2
9С)
хг4
81
КдХ2; .Т| ,/
*|.*2
1^2;
Глава третья. Голономность пфаффовых форм
55
ди
\дху) ,
V ^/х,/
+Х7
де
Удхи Х2<1
—
I +*.
V1
Х2>*
Х\>Х2
= 0 (3-15)
После очевидных упрощений равенство приводится к виду
дХ} дХ,
дх2 дхх
дХ,
а/
?0-+х,
аг,
а/
а«
4^*2
+^
=0
(3-16)
Равенство (3-16) представляет собой дополнительное уравнение состоя
ния равновесной термодинамической системы, содержащее девять перемен
ных и связывающее обобщенные силы Хи Х2 и теплоемкость с= дм/дг не
только с различными частными производными, но и между собой:
дидиди
дХх дХх дХ, дХ,
_
уу
112
-
’о.
/-ч»/V>Л»
дt дхх дх2
д1дх2 дг дхх
=0
(3-17)
Таким образом, в случае собственно поливариантных уравнений состоя
ния при трех независимых переменных Ху, х2, / данная сложная систем опи
сывается взаимозависимыми уравнениями состояния - двумя термическими,
одним калорическим и одним, вытекающим из голономности пфаффовой
формы, то есть 2+1+1 =4 уравнениями состояния.
В общем случае сложных термодинамических систем, при т независи
мых переменных, поливариантные коэффициенты пфаффовой форма I закона
являются функциями независимых переменныхХу, х2,.. ., хт _/,
Я(х,,х2,...,/)=</и + Х хсЬсх+ Х2с1х2+... ,
(3-18)
или
П(х„хг,...,{)=^-Л +
(Н
+Х , (кх+
ди
дх,
+Х, Л2+...
(3-19)
Здесь обобщенные силы и внутренняя энергия определены уравнениями
состояния - термическими и калорическим. Кроме того они дополнительно
связаны тождественными равенствами теоремы Фробениуса. Ч исленность
равенств Фробениуса, как отмечалось, определяется числом сочетаний
Ст3=т!/(6(т-3)!). Выше приводился пример сложных систем (упругие кристал
лы), совершающих 21 вид работы [22] и имеющих соответственно т - 22 пере-
56
Глава третья. Голономностъ пфаффовых форм
менных и, соответственно, т = 22 коэффициентов пфаффовой формы первого
закона. Если бы все 22 переменные были независимыми, то у такой системы
число тождественных равенств теоремы Фробениуса было бы равно С223=1540.
Таким образом, для реально существующих сложных систем с числом
обобщенных координат от трех и более численность обычных уравнений со
стояния изменяется от четырех (три термических и одно калорическое)и бо
лее. Соответственно увеличивается численность равенств теоремы Фробе
ниуса и, соответственно, дополнительных уравнений состояния. Очевидно,
что, по крайней мере, верхние значения численности дополнительных урав
нений состояния представляются абсурдными, не имеющими физического
содержания: рациональное описание физико-химических связей между
структурами сложной системы при таком множестве уравнений состояния
представляется невозможным. Более того, оно представляется бесполезным,
не имеющим смысла. Причем, как и термические и калорическое уравнения
состояния, каждое из равенств Фробениуса долж но удовлетворяться при из
менении агрегатного состояния, при фазовых переходах и аномалиях. Сама
возможность описания физической природы тел, адекватной требованиям
теоремы Фробениуса, по крайней мере, недоказуема.
Отсюда следует вывод, что множество уравнений состояния, формируе
мых теоремой Фробениуса, возможно, лишено рационального физического
содержания.
Но и в случае сложной системы только с тремя независимыми перемен
ными возможность реального существования единственного дополнительного
уравнения состояния вызывает сомнения. Действительно, такая дополнитель
ная зависимость, предоставляемая теоремой Фробениуса, могла бы быть ис
пользованы для углубленного исследования и описания термодинамических
свойств тел. Но, по свидетельству Скорнякова [35,36], никто не стал ее рас
сматривать, учитывать и применять: все эти уравнения состояния оказались
практически бесполезными. При описаниях и исследованиях термодинамиче
ских свойств веществ воспринимают ту часть выводов из принципа Каратео
дори, которая подтверждает существование энтропии как производной второ-
Глава третья. Голономность пфаффовых форм
57
го закона. Но при этом пренебрегают той частью выводов, которая содержит
дополнительное уравнение состояния по Фробениусу. Это указывает на воз
можную бессодержательность этого уравнения. Такой результат может свиде
тельствовать о некорректных, переизбыточных исходных данных.
Вывод о сомнительной полезности равенств Фробениуса в аксиоматике
практически подтверждают создатели аксиоматического направления в тер
модинамике, Каратеодори и Афанасьева-Эренфест. Теорема Фробениуса ими
упоминается без комментариев. Ни слова о возможности ее применения при
анализе свойств термодинамических систем.
Если исходить из предположения о некорректном выборе исходных дан
ных в аксиоматике Каратеодори, то такое предположение может относиться к
двум пунктам. Это а)ссылка на принцип адиабатической недостижимости,
которая неизбежно включает теорему Фробениуса в структуру аксиоматики,
и б)существование в природе сложных систем, которое допустил по умолча
нию Каратеодори и которые описываются собственно поливариантными
уравнениями состояния (версия В), также требующими привлечения в струк
туру аксиоматики теоремы Фробениуса как необходимого следствия голо-
номности пфаффовой формы с поливариантными слагаемыми.
Г.В .Скорняков исходит из предположения, что некорректным основани
ем аксиоматики является принцип адиабатической недостижимости. Соглас
но его предположению голономность пфаффовой формы не обязательна, по
этому не обязательно и включение теоремы Фробениуса в аксиоматику. Но
если не обязательна голономность пфаффовой формы, то может не сущест
вовать и энтропии. Предположение Скорнякова приводит к осуществимости
вечного двигателя второго рода. Поэтому предположение, что принцип Кара
теодори не универсален, неприемлемо.
Вторым исходным положением в аксиоматике Каратеодори, связанным с
привлечением теоремы Фробениуса, является положение о существовании
собственно поливариантных уравнений состояния (версия В). Включение
теоремы Фробениуса в аксиоматику Каратеодори является необходимым
следствием этого исходного положения.
58
Гл ава третья. Гопономностъ пфаффовых форм
33. Ограничения в структуре поливариантных уравнений
состояния
Исключив теорему Фробениуса из аксиоматики, можно удалить данную
неопределенность из феноменологической термодинамики. Достаточно убе
диться, что в природе не существует термодинамических систем с собст
венно поливариантными (версия В ) уравнениями состояния.
Ранее отмечалось, что энтропия как следствие второго закона не может
убывать и это ее качество несовместимо с явлением флуктуации. Отсюда выте
кает дилемма: или существуют флуктуации, или существует энтропия как
следствие второго закона. Решения этой дилеммы исключают друг друга. Ни
каких фактических возражений против дилеммы не может быть. Но поскольку
флуктуация, бесспорно, существует, постольку энтропия не может быть следст
вием второго закона. Тогда не может быть и условий для существования эн
тропии как следствия второго закона. Но именно таким условием является су
ществование термодинамических систем с собственно поливариантными (вер
сия В) уравнениями состояния. Только это условие из трех возможных (А, Б и
В) ведет к существованию энтропии как следствию второго закона. Следова
тельно, сложных систем с собственно поливариантными уравнениями (по вер
сии В) в природе не существует. Не существует и энтропии, которая была бы
следствием второго закона термодинамики. В природе существуют только про
стые термодинамические системы и системы сложные с уравнениями состояния
или бивариантной структуры, или структуры, выраженной поливариантной со
вокупностью бивариантных уравнений состояния.1 Энтропия таких систем, как
было установлено выше (3-12), является прямым следствием первого закона.
Полученный результат диаметрально противоположен тому, что до сих
пор утверждалось классической термодинамикой Клаузиуса и аксиоматиче
ской термодинамикой Каратеодори2, но вполне совпадает с выводом стати-
1Тем самым теорема Фробениуса с ее бесполезными тождественными равенствами устра
няется из аксиоматики.
2По свидетельству И.А .Квасникова [ 17, с .59] первым, кто сделал вывод о том, что
отношение дд/Т представляет собой полный дифференциал однозначной функции состоя
ния, был Ренкин, который не хотел вкладывать в этот результат смысла новой аксиомы и в
Глава третья. Голономность пфаффовых форм
59
стической физики: существование энтропии является составной частью пер
вого закона термодинамики.
Выводы:
1. В природе существуют только термодинамические системы с бива-
риаптными уравнениями состояния или поливариантные композиции бива-
риантных уравнений состояния.
2. Все дифференциальные уравнения первого закона термодинамики для
равновесных процессов имеют пфаффову форму, состоягцую из бивариант-
ных слагаемых.
3. Необходимым и достаточным основанием энтропии и термодинами
ческой температуры является первый закон термодинамики
4. Устранены неопределенности в аксиоматике термодинамики, свя
занные 1)с флуктуаций как реально существующим, но исключенным из
термодинамики явлением, 2)с бездоказательным включением сложных тер
модинамических систем с произвольной поливариантной структурой урав
нений состояния в состав реально существующих систем, 3) с неоднознач
ностью оснований для существования энтропии простых и сложных сис
тем, 4)с неоднозначностью оснований для существования энтропии в фено
менологической и статистической термодинамике, 5)с необоснованным
включением теоремы Фробениуса в аксиоматику термодинамики.
своих работах пытался его обосновать с помощью первого закона термодинамики и ори
гинальной вихревой молекулярно-кинетической теории.
глава четвертая
Сложная система как совокупность простых подсистем
4.1. Структура сложных термодинамических систем
При обсуждении вопроса о несовместимости теоремы Фробениуса с
флуктуацией и с аксиоматикой термодинамики получены данные, относя
щиеся к структуре пфаффовой формы дц сложной системы. Они состоят в
том, что коэффициенты пфаффовой формы X\ имеют бивариантную структу
ру и тем самым определены бивариантными уравнениями состояния:
ХгХ х(хь0.
Бивариантными уравнениями состояния определены также калориче
ские уравнения состояния, выражающие внутреннюю энергию и энтропию:
м,= щ(хь О,
^¡( X¡у ().
Сами уравнения первого закона термодинамики с пфаффовой формой,
выраженной суммой бивариантных слагаемых,
я—I
зч =Е [Л/(х>>■0'+ (*,No],
/=1
я—1
дЧ=Т
1=1
дают основания для представления их теплопритоков
также в виде суммы
слагаемых
дц=Еддь
Sq¡ = еН4((хь 0+Хх(хь ОсЬси
Sqi=TdSi(Xi, / /
Эти выводы указывают на существование ранее не известного свойства
сложных термодинамических систем:
Глава четвертая. Сложная система как совокупность простых подсистем 61
каждая сложная гомогенная система является термически однородной со
вокупностью простых подсистем, совмещенных в едином объеме. Каждая
простая подсистема имеет две степени свободы и описывается бивариант-
ными уравнениями состояния. В противном случае, при существовании хотя
бы одной не бивариантной подсистемы, хотя бы одно из слагаемых пфаф
фовой формы было бы не бивариантным, что, по доказанному, невозможно.
Установленное свойство сложных систем как совокупности простых
термодинамических подсистем является прямым следствием вывода об от
сутствии систем с поливариантными уравнениями состояния.
В силу равновесности и однородности термодинамической системы ни
какая ее простая подсистема не может иметь температуру и объем, отличаю
щиеся от температуры и объема данной сложной систем ы 1. Две независимые
переменные х, и / определяют внутреннюю энергию подсистемы щ(х» 0, ее
энтропию
0, теплоемкость с(х1,0, обобщенную силу
, (). Соответ
ственно определяется, что /-ая подсистема имеет контрольную поверхность,
через которую совершаются работа <5/, = Х ^Х 1 и теплоприток дq¡=Tdsi.
Контрольная оболочка каждой подсистемы представляет собой поверх
ность, отделяющую подсистему от внешней среды, а также гиперповерх
ность, отделяющую подсистему от других гомогенных подсистем сложной
системы. Каждая подсистема, имеющая температуру, со своей внутренней
энергией, энтропией, обобщенной силой, обобщенной координатой и темпе
ратурой совершает работу над внешней средой и вступает в теплообмен <5^, с
внешней средой и с другими подсистемами сложной системы.
4.2. Классификация простых подсистем
Рассматриваются равновесные термически однородные гомогенные под
системы с двумя независимыми переменными каждая. В силу термической
однородности системы ее подсистемы имеют одинаковую температуру. В
1При этом, например, занимаемое подсистемой пространство, то есть ее объем не обяза
тельно входит в состав переменных, определяющих ее состояние и влияющих на другие
переменные.
62 Глава четвертая Сложная система как совокупность простых подсистем
силу гомогенности системы ее подсистемы также гомогенны и заполняют все
пространство системы, то есть имеют одинаковый объем.
Процессы в каждой единице объема системы и ее подсистем воспроиз
водят в масштабе все процессы системы в целом и поэтому могут описы
ваться уравнениями состояния, выраженными объемными удельными вели
чинами.
Одной из простых подсистем каждой сложной системы является термо
деформационная подсистема, или «р\Гподсистема» с независимыми пере
менными объемом Vи температурой / и совершающая работу сил давления р.
Уравнением первого закона термодеформационной подсистемы является
дЦтд = Алтд(у, 0+р(у,
При этом все ру/-подсистемы в составе сложной системы имеют по два сов
падающих параметра - один и тот же объем и одинаковую температуру. В
частности, все, например, газовые смеси можно рассматривать как сложные
системы, состоящие из /?у/-подсистем.
Все /?у/-подсистемы данной системы взаимозависимы: изменение Vили
/ одной подсистемы сопровождается изменением не только ее давления,
внутренней энергии и энтропии, но и однозначны ми изменениям в других
подсистемах. Как следствие, пфаффова форма уравнения первого закона для
совокупности /п^-подсистем имеет те же две независимых переменных при
любом числе термодеформационных подсистем с разными давлениями в
подсистемах, составляющих систему. Уравнение состояния такой системы
бивариантно. Ее пфаффова форма бивариантна, поэтому голономна по опре
делению, соответственно энтропия системы, состоящей из взаимозависимых
подсистем, определена первым законом:
дчктд -Т<Ьх
0+1р(у„ 1)<Ь>.
Но тогда все остальные, независимые подсистемы могут иметь не боль
ше одной одинаковой переменной - или только температуры, или только объ
ема (иначе они становятся взаимозависимыми /?у/-подсистемами). В каждой
сложной системе хотя бы одна из подсистем является термодеформационной
Глава четвертая Сложная система как совокупность простых подсистем 63
(зависит от температуры и объема). Любая другая независимая от нее под
система данной системы может зависеть только от одной из этих перемен
ных.
Действительно, в случае, например, магнетика одна его подсистема яв
ляется />у/-подсистемой и совершает работу сил давления р(у,
Работу
магнитных сил - Щ , г)ф совершает термомагнитная подсистема магнетика. В
ее уравнение первого закона объем не входит:
<>Ят=тж1т= ^ ма, о -но , 0<9-
Термомагнитные, термоэлектрические подсистемы, содержащие темпе
ратуру, но не реагирующие на изменение объема, можно назвать термиче
скими подсистемами.
V
р)
Нр*
Н
Рис. 1. Модели подсистем в системе «магнетик»
1- термодеформационная подсистема.
2- термомагнитна подсистема.
3- магнитодеформационнаяы подсистема
Наконец, предусматривается непротиворечивая гипотеза, согласно ко
торой существует третий вид подсистемы - подсистемы, реагирующей на из
менение объема, но не реагирующие на изменение температуры, то есть не
термическая подсистема. Не имея температуры, она не имеет внутренней
энергии и энтропии, соответственно не вступает в теплообмен:
3Я*=0.
Поэтому совершаемая ею работа не входит в уравнение первого закона. Пе
ременными этих не-термических подсистем являются объем V, давление /?,
64 Глава четвертая Сложная система как совокупность простых подсистем
намагниченность и напряженность магнитного поля у, Я, поляризация и на
пряженность электрического поля Р, Е. Для магнетиков - это магнитодефор
мационная не-термодинамическая подсистема с переменными V, Я , у* р.
Подсистемой совершаются виды работы
31р*=р*(],у)сЕ,
<5/,*= -
Модель структуры каждой такой термодинамической подсистемы, ко
торые могут входить в состав сложной системы, может быть представлена в
виде, изображенном схемой рис. 1.
4 3 . 0 расчленении поливариантных уравнений состояния
на бивариантные. Примеры
Ставится задача рассмотреть на примерах вывод о том, что сложные сис
темы, например, магнетики состоят из совокупности независимых простых
подсистем трех типов: термодеформационная, термомагнитная и магнитоде-
фомационная (см. рис. 1) и что поливариантные уравнения состояния являют
ся структурами, состоящими из совокупности первичных бивариантиых
уравнений состояния, каждое из которых описывает свою простую подсис
тему.
Согласно экспериментальным данным магнетики (молекулярный кисло
род, никель, инвар и др.) описываются в общем случае поливариантными
уравнениями состояния с тремя независимыми переменными. Например,
магнетик может описываться поливариантными уравнениями состояния1,
Р=р(ч>], О,
Я=#(V,у, 0,
(4- 1)
соответственно
и=и(у, у , 0,
1В связи с гомогенностью рассматриваемых сложных систем в расчетных формулах д о
пускается употребление объемных удельных значений экстенсивных переменных.
Глава четвертая. Сложная система как совокупность простых подсистем 65
определяющими его давление р , напряженность магнитного поля Н и внут
реннюю энергию и в зависимости от объема V, намагниченности у и темпера
туры /. При этом из опытных данных не следует, являются ли измеряемые в
опыте давление и намагниченность давлением или намагниченностью одной
подсистемы или, напротив, измеряются суммарные значения одноименных
переменных в составе нескольких подсистем.
Голономность пфаффовых форм Sq, устанавливаемая по определению,
имеет своим следствием то, что поливариантные уравнения состояния фор
мируются только путем сложения (совмещения) первичных бивариантных
уравнений состояния и именно поэтому могут быть расчленяемы обратно на
первичные бивариантные уравнения состояния.1
Формирование полученного в опытах поливариантного уравнения со
стояния из суммы бивариантных имеет следующие основания. В составе
сложной системы имеются подсистемы с одноименными параметрами, на
пример, обобщенными силами. Поэтому в состав наблюдаемого поливари
антного уравнения состояния будут входить бивариантные слагаемые с од
ноименными аддитивными обобщенными силами
Х^Х^Хи $+Х2(хи 0+Х3(х,,ч)+...,
где Хи Х2, ...
-
одноименные аддитивные обобщенные силы (в частности,
это могут быть аддитивные составляющие давленияр ), х и х2, ... - обобщенные
координаты системы (в частности, намагниченность у, поляризация Р и др.).
Если в бивариантные уравнения состояния разных простых подсистем
данной сложной системы входят одноименные аддитивные переменные -
давлениер ]г р 2, .. . намагниченностьу'/,у'2 , ..., то в опытах они воспринимаются
приборами (наблюдателем) в виде суммарных значений, скалярных или век
торных:
Рх=Р1+Р2+--
У2Г=У1+ У2+.»
1Технология расчленения поливариантного уравнения состояния, составленного по дан
ным опыта, на первичные бивариантные уравнения в принципе не является целью данно
го изложения.
66 Глава четвертая. Сложная система как совокупность простых подсистем
Поэтому в опытных данных содержатся только суммарное значение таких
одноименных переменных. Каждое из слагаемых этих величин не всегда мо
жет быть доступно непосредственным измерениям. При этом каждая из од
ноименных аддитивных величин зависит от разных переменных. Например,
давление термодеформационной подсистемы зависит от объема,
Р1=Р/&, о,
а давление магнитодеформационной подсистемы зависит от намагниченно
сти у:
р*=р*0,у).
Соответственно сложная система, содержащая две такие подсистемы с р!
и р*, имеет внешнее давление в виде суммы бивариантных зависимостей
Р£=Р1(у, О +Р*0> V),
а результаты наблюдений представляются в виде поливариантной зависимо
сти
Р1ГNo>1 О.
содержащей сумму исходных бивариантных уравнений состояния и все пе
ременные этих уравнений. Аналогично, в силу аддитивности внутренней
энергии очевидна принципиальная возможность построения поливариантно-
го калорического уравнения состояния из суммы бивариантных составляю
щих и последующего его расчленения на бивариантные составляющие:
Ф,],0 =щ(у,/;+ и$,I).
К дальнейшему рассмотрению предлагаются структуры двух сложных
термодинамических систем - магнетиков типа «молекулярный кислород» и
магнетиков т ипа «никель», состоящих из двух или трех подсистем.
Работа термодеформационной подсистемы равна
311=р1 (у,Т)сЬ>,
работа термомагнитной магнитной подсистемы, не имеющей объема в каче
стве переменных, выражена работой магнитных сил,
312= -Н0.Т)ф\
Глава четвертая. Сложная система как совокупность простых подсистем 67
Тем самым рассматриваются магнетики, состоящие из двух или трех
подсистем - двух термических -термодеформационной (1) и термомагнитной
(2), и третьей, не-термической (не-термодинамической) - магнитодеформа
ционной (*).
Уравнение первого закона принимает вид:
для термодеформационной подсистемы
дд1=Тс181(у,Т)=с1и1^ ,Т)+ р 1(у,Т) ¿/у,
для термомагнитной подсистемы
6д2=ТЖ20, Т) =аи20, Т)-Щ , Т) <$2 ,
для магнитодеформационной подсистемы уравнения первого закона не су
ществует. Сумма выражает уравнение первого закона для системы «магне
тик» в целом:
6ди=ТсЬ1.2(у,],1)=<1и1'20>,],Т)+ Р1(у,Т) (¡V - Щ 2,Т) ф2 .
(4-2)
Здесь 5/ 2 , м/ 2 , - суммарные значения аддитивных одноименных переменных -
энтропии, внутренней энергии, /?/,
-
давление и намагниченность термоди
намических (термических) подсистем 1 и 2, Т, у, Н - одинаковые для всех
подсистем значения температуры, объема и напряженности магнитного поля.
Переменные магнитодеформационной подсистемы в уравнение первого за-*
кона на входят.
Соответствующий уравнению (4-2) потенциал Гиббса равен
dg= - 5/2с1Т+Vф/ -]2<Ш.
(4-3)
Согласно свойству полного дифференциала dg из выражений для потен
циала Гиббса следует равенство
дН)
ГдМН,Т)Л
др
= <р=О
1 /н,т
(4-4)
Здесь /?/, Т, Я - измеряемые в опыте значения, полученные для магнетика, со
стоящего из только термических подсистем. При любом числе одних только
термических подсистем условие (р=0 не нарушается.
68 Глава четвертая. Сложная система как совокупность простых подсистем
Но известно [38], что по опытным данным обе частные производные
обращаются в нуль (<р=0) для одних магнетиков, и отличаются от нуля (ср^О)
для других.
Различие в опытных данных (ср=0 или ф #)) объясняется различием в
составе подсистем, входящих в сложную систему.
Если подсистемами являются только термодеформационные и терми
ческие подсистемы, ф=0. Но если, кроме того, в состав подсистем входит не
термическая подсистема, то фУО.
Действительно, во втором случае в составе сложной системы имеется не
термическая подсистема (*) с переменными ]* и р*. Совершаемая ею работа
не входит в уравнение первого закона и в потенциал Гиббса. Но изменяются
измеренные в опыте суммарные значения давления и намагниченности:
Ршм=Р1(*.т)+р*No),
Ую«=М>2. Т)+]*(\,Н).
Соответственно в опытах наблюдается не нулевой эффект магнитострикции
при /7у=со т/, описанный потенциалом Гиббса только для термических под
систем, а реальный процесс магнетика с магнитодеформационной подсисте
мой при /7/+р*=соя5/, и не нулевой эффект магнитоупругости при ] 2 =сол5/, а
процесс при у2 +У*=со/и/:
ду(р„Т)
дН
|
*0,
Р\
гцг(н,т)+р{н,у)'
д(р{+р*)
,
И,Т
*0.
(4-4)
Вывод: при наличии в составе магнетика магнитодеформационной (не
термической) подсистемы, имеющей в качестве переменных намагничен
нос ть]* и давление р*, исходное условие Гиббса нарушается: частные произ
водные принимают по результатам измерений вид, отличный от нуля:
гМр„т)Л
( ауи
дН
*0,
Фи,
*0.
(4-4)
Причем, ни откуда не следует, что частные производные равны.
Глава четвертая Сложная система как совокупность простых подсистем 69
Молекулярный кислород
Экспериментальные данные по некоторым магнетикам (молекулярный
кислород) непосредственно указывают на равенство (р=0\
Отсюда давление р определяется только термодеформационной подсис
темой, а намагниченность - только термомагнитной подсистемой (не зависит
от объема). Не-термодинамическая подсистема в состав магнетика не вхо
ди т1. Действительно, свойства молекулярного кислорода могут быть, как из
вестно [38], выражены термическими уравнениями состояния идеального га
за (термодеформационная подсистема) и идеального парамагнетика (термо
магнитная подсистема):
(/? - газовая постоянная, Т - газовая температура, V- объем, у - намагничен
ность, А - постоянная Кюри).
Тем самым термические и калорическое уравнения состояния данной
сложной системы легко приводятся к бивариантной структуре. Исходя из ад
дитивности внутренней энергии, калорическое уравнение можно предста
вить в виде суммы бивариантных составляющих,
и получить совокупность калорических бивариантных уравнений состояния,
Таким образом, три исходные, условно поливариантные уравнения со
стояния (4-1) в случае молекулярного кислорода могут быть представлены
двумя парами бивариантных структур двух простых подсистем: для термо
деформационной подсистемы -
р=ят, Н^Т/А,
Ф ,1 0=иф, О+цО, /Л
Щ=иу(у, 0, и} =ц0, 0.
Р =Р& г),
иу =м/у, г),
и для термомагнитной -
По крайней мерс в первом приближении
70 Глава четвертая. Сложная система как совокупность простых подсистем
н=но,0,
Му =Му0', О-
V
рj
Н
Рис.2. Модель структуры магнетика «молекулярный
кислород»
1-термодеформационная подсистема.
2-термомагнитна подсистема.
Непосредственно ясно, что такая сложная система состоит из двух про
стых термодинамических подсистем - термодеформационной с переменными
р, V, / и термомагнитной с переменными Н, у, /. Уравнениями первого закона
этих подсистем определяются теплопритоки к каждой подсистеме,
Sqv=Tdsv=duv+pdv>
дqj-Tdsj-dur Hdjt
и к системе в целом,
Sqv+j=Td(sv+Sj)=d(uv+Uj)+pdv-Hdj.
Пфаффова форма легко приводится к заведомо глолономной структуре с
двумя бивариантными слагаемыми:
дqv+J=Td(sv+Sj)={duv(v, /)+р(у, ОсЬ}+{сЫ^, />#(/,/МУ-
Схематическое изображение связей между переменными в сложной сис
теме типа «молекулярный кислород» приведено на рис.2
Магнетики с эффектом магнитострикции и магнитоупругости
Магнитотермодеформационные явления выражаются в том, что магне
тик при усилении магнитного поля при постоянстве внешнего давления или
увеличивается в объеме (ср>0), или уменьшается (ср<0), а с повышением
Г л а в а четвертая. Сложная система как совокупность простых подсистем 71
внешнего давления при постоянном магнитном поле намагниченность или
падает (<р>0), или, соответственно, растет (ср<0).
Переменными сложной системы «никель» являются температура Т, ее
внешнее давление р & напряженность магнитного поля Н, объем Vи намагни
ченность у2 г- Первые три переменные могут быть выбраны в качестве незави
симых. Согласно экспериментальным данным отличны от нуля частные про
изводные
(Я;
Вг
\ дР*;
=<Ррх*о.
(4-5)
Следовательно, в состав сложной системы входит не-термодинамическая
подсистема.
V
Рj
Нр*
Н
3
ж
*ж
+
в
ив!
11] V
}*
Рис.З. Модель структуры магнетика «никель»
1- термодеформационная подсистема.
2- термомагнитна подсистема.
3- магнитодеформационнаяы подсистема
Соответственно в целом магнетик состоит из трех подсистем - термоде
формационной 1, термомагнитной 2 и магнитодеформационной 3 (см. рис.З).
Внешнее давление равно сумме давлений подсистем
Рг=Р+Р*.
намагниченность определяется суммой
объемы обеих подсистем равны.
Результатом проведенного анализа магнетиков представляется вывод о
существовании в составе магнетиков подсистем, не являющихся термодина-
72 Глава четвертая Сложная система как совокупность простых подсистем
мическими, не имеющих температуры, энтропии, внутренней энергии, не
вступающих в теплообмен с другими подсистемами магнитика и внешней
средой. Аналогичные выводы могут быть получены в отношении бивариант-
ных уравнений состояния и структуры простых подсистем в составе сложных
систем диэлектриков с электрострикционным и пьезоэлектрическим эффек
тами.
Но не исключено, что могут быть найдены и другие сочетания простых
подсистем в составе сложной системы магнетиков и диэлектриков.
глава пятая
Однозначность энтропии
5.1. Постановка проблемы
В аксиоматике Афанасьевой-Эренфест однозначность энтропии рас
сматривается как следствие принципа второго закона, указывающего на не
возможность равновесных циклов вечного двигателя второго рода. Но после
того, как существование энтропии включено в состав первого закона, подле
жат пересмотру и основания к однозначности энтропии.
Однозначность функции, в данном случае энтропии как функции со
стояния термодинамической системы, выражается в следующем: в данном
равновесном состоянии с независимыми переменными xj, * 2 ,. .., t энтропия
может принимать только одно единственное значение независимо от процес
сов в системе, предшествующих данному состоянию1. Но однозначность эн
тропии требует обоснования.
В случае простой системы уравнением равновесной адиабаты Sq=0 или
равновесной изоэнтропы ds=0, является приравненная нулю правая часть
уравнения первого закона,
Cxdt+(ди/дх +X)dx=0.
В таком дифференциальном уравнении пфаффова форма с двумя пере
менными также голономна и определяет существование энтропии s, но одно
значность функции s не определена. Примеров, позволяющих сомневаться в
однозначности энтропии, достаточно. Так, можно предположить, что изотер
ма DEF (рис. 6) может дважды пересекаться с одной адиабатой АВС. Пусть в
состоянии D энтропия однозначна и равна Sq. Тогда в состоянии F энтропия
принимает по крайней мере два значения. Так, если процесс идет по равно
весной адиабате DBF, то энтропия Sy принимает значение, равное SD.. А если
1Аналогично однозначности внутренней энергии. Ее однозначность принимается в каче
стве первого закона термодинамики.
74
Г л а в а пятая. Однозначность энтропии
процесс идет по изотерме DEF, то энтропия SF отличается от SD на величину
Qdef/Tdef , где Q def^O-
Рис.6. Версии пересечения адиабат и изотерм, нарушаю
щие однозначность энтропии
Традиционно неоднозначность энтропии в точке F устраняется путем при
влечения постулата второго закона о невозможности вечного двигателя второ
го рода. Рассматривается контур DBFE. В круговом процессе по этому контуру
совершается работа
равная, как известно, площади pv-диаграммы, ограни
ченной контуром, и получено количество тепла, равное этой работе,
Q=<$TdS=T jdS =T(SF-SD)*0
DEF
При этом теплоприток Q получен только на изотерме DEF, следователь
но, от источника с постоянной температурой Т. В круговом процессе этот те
плоприток полностью превращен в работу. Таким образом, неоднозначность
энтропии в точке F вследствие двукратного пересечения изотермы с адиаба
той приводит к вечному двигателю второго рода.
Как указала Т.А .Афанасьева-Эренфест [1], одной только голономности
пфаффовой формы ôq недостаточно для установления однозначности энтро
пии. Следующий пример [34] позволяет в этом убедиться. Примером служат
бивариантная пфаффова форма с известными коэффициентами
П(х, y)=-ycbc+xdy.
Глава пятая. Однозначность энтропии
75
Она не является полным дифференциалом, но, как всякая бивариантная
пфаффова форма, она голономна. Ее интегрирующий множитель является
аналогом температуры Т в пфаффовой форме первого закона. Этот интегри-
рующий множитель в данном случае известен и равен
1
х2+у29
тем самым
определен и полный дифференциал, равный
ydx
xdy
х2+у2 X2+у2
= d(p,
где (р - угол между радиус-вектором и осью х (см. рис.4).
Здесь пространство состояний образуют все точки плоскости х, у , за ис
ключением малой окрестности вблизи начала координат (точка 0). Прямоли
нейные лучи, сходящиеся к началу координат, являются решением уравнения
адиабаты
- ydx+xdy=0
и представляют собою семейство адиабат. Изотермами являются кривые
х2+у2= const,
то есть окружности, сходящиеся к началу координат. Здесь выполнены все
условия, обеспечивающие голономность исходной пфаффовой формы. Вбли
зи каждой точки имеются адиабатически недостижимые состояния.
У
Рис.4. Существование осо
бой точки - точки пересече
ния адиабат
76
Глава пятая. Однозначность энтропии
Вместе с тем функция ф здесь неоднозначна. Если произвольный кру
говой процесс не огибает начало координат, то <fd<p = 0 , и однозначность ф
не нарушается. Но она нарушается, если круговой процесс огибает начало
координат - точку, к которой сходятся лучи ф = const. Действительно, в этом
случае для любого кругового процесса §d<p = 2к . Тем самым значение ф до
начала кругового процесса принимает по завершении кругового процесса но
вое значение, отличающееся от начального на 2п.
Неоднозначность функции ф вызвана двусвязностью пространства со
стояний, существованием в нем особых точек, или «дыр».
Особыми являются точки в пространстве состояния, в том числе и в
пространстве состояния термодинамических систем, в которых существовало
бы множество решений (пересечение адиабат) или, напротив, решение бы от
сутствовало (все адиабаты огибают точку). Отсутствие особых точек в об
ласти определения термодинамических состояний, или односвязность этой
области равносильна однозначности энтропии. Если, следовательно, уста
новлена односвязность области определения термодинамических состояний,
то будет установлена и однозначность энтропии.
5.2. Нулевой закон термодинамики
Термодинамическими являются те системы, состояние которых зависит
от их температуры. В то же время известное выражение «гораздо легче про
изводить измерения, чем точно знать, что измеряется» относится прежде все
го к определению температуры, причем, к определению температуры именно
в феноменологической термодинамике.
Состояние термодинамической системы может нарушаться не только
при механическом контакте. Взаимодействие, не являющееся механическим,
но способное вызывать нарушение равновесия, называют тепловым, или тер
мическим контактом.
Г л а в а пятая. Однозначность энтропии
77
К.Каратеодори привлек тепловое равновесие к определению температу
ры с помощью принципа транзитивности теплового равновесия. Пусть А, В,
С - три тела, находящиеся в равновесном состоянии до наступления теплово
го контакта. И пусть при осуществлении теплового контакта тел А+В на
чальное равновесное состояние каждого из них не нарушится.. И пусть, кро
ме того, при осуществлении теплового контакта тел А+С начальное равно
весное состояние каждого из них также не нарушится. Тогда все известные
опытные данные подтвердят, что при тепловом контакте В+С начальное рав
новесное состояние каждого из тел также не нарушится. Тепловое равновесие
транзитивно.
Принцип транзитивности теплового равновесия приводит к существова
нию параметра состояния тела - температуры, однозначно определяющей
способность или неспособность тела к тепловому равновесию с другими те
лами. Среди множества тел имеются тела, способные и не способные к со
хранению теплового равновесия при термическом контакте с данным телом.
Соответственно температура таких тел одинакова или неодинакова с темпе
ратурой данного тела. Если тела способны к тепловому равновесию друг с
другом, их температура долж на быть одинаковой и иметь одинаковое число
вое значение. В противном случае телам приписывается разное значение
температуры.
Таким образом, температура определена как функция состояния, равные
значения которой служат необходимым и достаточным условием теплово
го равновесия систем.
В соответствии с публикациями [20, 26] и др. принято считать, что свой
ство транзитивности теплового равновесия в качестве нулевого начала тер
модинамики равносильно утверждению о существовании эмпирической тем
пературы. Однако с появлением публикаций [30] выяснилась иная логическая
связь между свойством транзитивности и определением температуры, а
именно, было доказано, что первое само по себе недостаточно для строгого
вывода второго. В подтверждение приведен простой контрпример. Пусть Рь
78
Глава пятая. Однозначность энтропии
Pjt — координаты состояния систем, и пусть условия равновесия систем / и j
имеют вид
Ъ/Рь Pj)
-
tj(Pj )]2 + Ьи[т; (Pi) - T/Pj )]2 = О,
где ciij и bij — константы, а /, и г, — функции состояния Р, соответствующей
системы. Очевидно, что при /д,-, = idem для всех /, j любые два из уравне
ний равновесия обусловливают третье. Но при этом существуют не одна, а
две ’’температуры” / и х , так как эти условия равновесия эквивалентны урав
нениям
ti(Pi) =/, T,<Pi) = т,
где / и т — функции состояния, например, термометрического тела. Таким
образом, было установлено, что одним только свойством транзитивности не
исключается существование наряду с температурой / другой функции х, не
зависящей однозначно от температуры, но принимающей также равные зна
чения при тепловом равновесии систем. Тем самым допускается равенство
температур и при отсутствии теплового равновесия систем.
На основании этих результатов был сделан вывод о существовании в
классической термодинамике дополнительного постулата,_по которому сте
пень свободы к диатермической термически однородной системы равна еди
нице. Этим устраняется неопределенность в численности х независимых друг
от друга функций теплового равновесия, поскольку х < к.
В то же время устранение указанной неопределенности представляется
возможным без привлечения дополнительных постулатов [7].
Действительно, поскольку 1пр и н ц и п о м транзитивности устанавливает
ся одинаковая совокупность х > 1 функций теплового равновесия всех систем
без адиабатных перегородок и поскольку 2) численность этих функций как
независимых друг от друга величин не может быть больше числа к координат
состояния диатермической системы, то есть х < к, то достаточно установить
хотя бы один опытный факт, по которому диатермическая система имеет к =
/, чтобы убедиться в равенстве х = / .
Глава пятая. Однозначность энтропии
79
Таким опытным фактом является, например, зависимость состояния га
зового объема Vвдиатермической оболочке (V=const)от единственной ко
ординаты — давления.
Темсамым условие х= 1доказано,т.е .доказана единственность эмпи
рической температуры как функции,равные значения которой служат необ
ходимым и достаточным условием теплового равновесия систем, причем до
казана без привлечения постулата, дополняющего нулевое начало термоди
намики.
5.3. Об отсутствии систем с нулевой теплоемкостью
Можно
показать, что односвязность области определения энтропии в
случаепо крайней мерепростыхсистем следуетизисходного положения,что
теплоемкость системы
Схпри постоянных значениях внешних параметров
{х}неможет равняться нулю,
Сх = (SQ/dt)x * 0.
(5-1)
Согласно Н.Н
.Шиллеру [39], отсутствие систем с нулевой теплоемко
стью обосновывается тем,что
«изменение толькотемпературы тела,прине
изменныхвсех его другихпараметрах,может быть понимаемо лишь в смысле
получения или потери телом тепла, иборабота внешних сил исключается ус
ловием неизменности всех остальных параметров».
Согласно М.А
.Леонтовичу [26], монотонная в строгом смысле зависи
мость внутренней энергии от температуры также позволяет утверждать, что
теплоемкость системы Схпри постоянных значениях внешних параметров {х}
не может равняться нулю. Основанием для монотонной зависимости внут
ренней энергии от температуры
являются вытекающие из опыта единствен
ность распределения энергии равновесной системы по ее частям и одновре
менныйростэнергии этих частей приувеличении общей энергии системы.
В.А .Кириллин,В.В .Сычев,А.Е .Шейндлин [18]определяютусловие Cv>0
какусловиетермическойустойчивости.
80
Глава пятая. Однозначность энтропии
Согласно И.И .Новикову1, заведомо положительное значение теплоемко
сти является необходимым условием устойчивости для всех состояний тела
за исключением критической точки.
Неравенство (5-1) можно обосновать и в связи с изложением нулевого
закона. Известно, что понятие температуры вводят непосредственно нулевым
законом, используя принцип транзитивности теплового равновесия. Остается
обратить внимание на то, что принцип транзитивности не применим к систе
мам с нулевой теплоемкостью Сх [8].
Действительно, понятие теплового равновесия не может быть определе
но без понятия теплового взаимодействия при тепловом контакте термоди
намических систем. Тепловое взаимодействие термодинамических систем
осуществляется через теплопроводящую границу между ними, оно может со
вершаться при неизменных значениях внешних параметров {х }, соответст
венно его нельзя объяснить ничем другим, кроме как существованием на гра
нице тела потоков не-механической природы, или тепловых потоков. По
следние имеют иную природу, нежели потоки энергии при совершении ра
боты сил, но также однозначно связаны с изменением состояния системы.
Употребление терминов «теплопроводящая стенка» [6], «теплопроводящая
граница» лишь скрывает и в то же время подчеркивает проявление теплового
потока как необходимого и достаточного условия теплового взаимодействия
систем. Соответственно отсутствие теплового потока есть необходимое и
достаточное условие сохранения теплового равновесия при тепловом контак
те систем, в частности, систем А, В и С при обсуждении транзитивности их
теплового равновесия.
Кроме того, изложению принципа транзитивности предшествует, хотя и
в неявном виде, деление множества равновесных систем на подмножества -
по их способности к сохранению или нарушению исходного равновесного
состояния в случае теплового контакта между собой. Само выделение прин-
1Новиков И.И . Термодинамика. М.: Машиностроение, 1984
Глава пятая. Однозначность энтропии
81
ципом транзитивности систем А, В и С, сохраняющих тепловое равновесие
между собой при тепловом контакте, указывает на существование других
равновесных систем, тепловой контакт которых с выделенными системами
нарушил бы их равновесное состояние. Определив существование эмпириче
ской температуры, принцип транзитивности приписывает всем другим сис
темам, не состоящим в тепловом равновесии с системами А, В и С, иные зна
чения температуры. Тем самым понятие об эмпирической температуре /
формируется на основе принципа транзитивности теплового равновесия.
Этот принцип транзитивности формулируется на основе деления систем по
способности и неспособности к тепловому равновесию при тепловом контак
те между собой, то есть на основе представления об отсутствии или наличии
теплового потока через теплопроводящую границу между системами.
Из понятия теплового потока и существования температуры равновесной
термически однородной системы определяется понятие теплоемкости Сх сис
темы в процессах при постоянстве внешних параметров.
В отношении теплоемкости Сх и температуры можно доказать теорему,
обосновывающую неравенство (5-1) [8]:
принципом транзитивности теплового равновесия устанавливается
существование температуры у термодинамической системы тогда и толь
ко тогда, когда теплоемкость Сх этой системы в процессе при постоянных
значениях внешних параметров отлична от нуля.
Действительно, в противном случае принцип транзитивности теплового
равновесия не выполняется, в чем легко убедиться. Пусть имеются два тела с
теплоемкостью, отличной от нуля, и известной температурой: тело В с тем
пературой / и тело С с температурой /+<#, - а также тело А с теплоемкостью
Сх =0. В случае теплового контакта тела А при постоянстве значений его
внешних параметров {х} с телами В или С тепловые потоки не возникают:
д(2лв ~
—
СаЖ-0.
82
Глава пятая. Однозначность энтропии
Но из вышеизложенного следует, что отсутствие теплового потока
должно рассматриваться как свидетельство сохранения теплового равновесия
в случае тепловых контактов А с В или А с С. Тогда в соответствии с принци
пом транзитивности теплового равновесия должно иметь место тепловое
равновесие и при тепловом контакте В с С. Однако по условию эти тела име
ют разную температуру и их тепловое равновесие невозможно, поскольку
возникнут ненулевые тепловые потоки. Следовательно, принцип транзитив
ности теплового равновесия, действительно, не выполняется. Соответственно
нет оснований к выводу о существовании температуры системы А .
Очевидно, что равенство Сх = 0 не совместимо с принципом транзитив
ности теплового равновесия. При нулевом значении теплоемкости лишаются
смысла понятия температуры, следовательно, и самой теплоемкости. Нера
венство (5-1) доказано.
5.4.
Односвязность области определения энтропии и однозначность
энтропии
Следствием неравенства (5-1) является односвязность пространства со
стояний простых термодинамических систем, то есть систем с двумя незави
симыми переменными - одной обобщенной координатой х и температурой Г.
Действительно, уравнение первого закона для такой системы имеет бивари
антную, соответственно заведомо голономную пфаффову форму, опреде
ляющую дц:
где сх=(ди/д$х- теплоемкость системы при постоянстве обобщенной координа
ты, и=и(х,0 - внутренняя энергия, Х=Х(х,1) - обобщенная сила. Коэффициенты
пфаффовой формы суть непрерывные дифференцируемые и однозначные
функции, определяемые уравнениями состояния. Возможная неоднозначность
(5-2)
Глава пятая. Однозначность энтропии
83
энтропии является, как известно, следствием предположения, что область из
менения независимых переменных данной системы может быть неодносвяз
ной, то есть иметь особые точки (дыры), где решения уравнения адиабаты
схск+(ди/дх+Х)с!х=0
не существует, или решение существует, но не единственно.
В то же время в случае простых систем односвязность области опреде
ления может быть установлена на основании теории обыкновенных диффе
ренциальных уравнений. Известно [42], что необходимое и достаточное ус
ловие отсутствия особых точек состоит в том, что, по крайней мере, один из
коэффициентов пфаффовой формы дц в уравнении (5-2) не должен быть ра
вен нулю. В данном случае таким коэффициентом, как было установлено, яв
ляется теплоемкость сх, и она не равна нулю. Отсюда непосредственно следу
ет вывод об односвязности пространств состояний простых систем.
Таким образом, из отсутствия систем с нулевой теплоемкостью вытекает
односвязность пространства состояния простых систем, а из односвязности
пространства - однозначность энтропии простых систем. Представляется
существенным и то, что тем самым подтверждается отсутствие тех особых
точек, через которые не проходит ни одна из адиабат, то есть точек, в кото
рых не могла бы существовать энтропия. Последнее замечание можно рас
сматривать как дополнение к выводу М.Планком [32] существования энтро
пии простой системы без ссылки на второй закон. Согласно этому дополне
нию принцип существования энтропии распространяется на всю без ограни
чений область существования простых систем.
Самим определением однозначности энтропии указывается на невоз
можность предполагаемого двойного пересечения адиабаты с изотермой.
Действительно, в этом случае однозначность энтропии должна была бы быть
нарушенной. Следовательно, двойного пересечения адиабаты и изотермы
быть не может.
Таким образом, вывод о том, что теплоемкость всех термодинамических
систем всегда отличается от нуля, служит основанием для утверждения, что
84
Глава пятая. Однозначность энтропии
существуют системы, по крайней мере простые системы, однозначность эн
тропии которых не связана со вторым законом. Но выше было представлено
доказательство, что сложная система является совокупностью простых под
систем. Поскольку по доказанному область определения энтропии простых
систем, следовательно, и простых подсистем односвязна, не имеет особых
точек, постольку энтропия простых подсистем однозначна. Соответственно
однозначна и сумма энтропий простых подсистем, определяющая энтропию
сложной подсистемы.
Равенство Клаузиуса
4?-0 ,
(5-3)
выражающее принцип однозначности энтропии, исторически было установ
лено на основании постулатов второго закона. Однако, как теперь выясни
лось, однозначность энтропии вполне определена первым законом термоди
намики. Таким образом, первым законом термодинамики, без привлечения
второго закона, установлены как существование, так и однозначность энтро
пии. Соответственно равенство Клаузиуса (5-3) подчиняется первому закону.
Второму закону подчиняется соответствующее неравенство Клаузауса.
глава шестая.
Изменения в основаниях термодинамики
6.1. О содержании первого и второго законов
Полученные результаты существенно изменяют структуру основ тер
модинамики. Изменяется содержание и первого, и второго ее законов.
Принципы существования и однозначности энтропии переносятся из под
чинения второму закону в подчинение первому. Второму закону следуют
только неравновесные процессы и, соответственно, принцип возрастания
энтропии. Свойства равновесных процессов подчиняются только первому
закону, прежде всего это принципы существования и однозначности эн
тропии. К первому закону относятся также все известные формулировки,
которые Афанасьева-Эренфест рассматривала как «второе начало для ква-
зистатических процессов» и согласно которым, в частности, «невозможно
превращение тепла в работу без того, чтобы некоторое соответствующее
количество тепла не перешло от тела, более нагретого, к телу менее нагре
тому».
Последовательность заключений, приводящих к первому закону как ос
нованию существования энтропии, представлена графически на прилагаемой
схеме I .
1.В качестве исходных данных на схеме указаны два типа термодина
мических систем - простые с числом независимых переменных т=2 и слож
ные с т>2.
2.
Им отвечают четыре в принципе возможные структуры уравнений
состояния: 1)бивариантная структура с т=п= 2 простой системы,
2)бивариантная структура с т>п=2 сложной системы (версия А), 3) полива-
риантная структура с т>п=2 сложной системы (версия Б), 4) поливариантная
структура с т>2, п>2 сложной системы (версия В).
86
Глава шестая. Изменения в основаниях термодинамики
3.
Три первые структуры имеют в уравнении первого закона пфаффовы
формы, голономные по определению, пфаффова форма четвертой структуры
голономна по принципу адиабатической недостижимости. Соответственно
три первые структуры следуют аксиоматике Планка и приводят к существо
ванию энтропии в рамках первого закона.
4.Четвертая структура следует аксиоматике Каратеодори и приводит
к энтропии, которая должна бы подчиняться второму закону, соответствен
но убыль энтропии не допускается. Но этот результат неприемлем, по
скольку он противоречит факту возможного периодического (спонтанного)
убывания энтропия при флуктуациях. Следовательно, и подчинение эн тро
пии второму закону, и исходное предположение о существовании сложных
систем с поливариантной структурой уравнений состояния по версии В не
приемлемы1.
5.Все существующие сложные системы имеют бивариантную структу
ру и поэтому являются совокупностью простых термодинамических подсис
тем. Последовательность заключений, приводящих к первому закону как ос
нованию однозначности энтропии, представлена графически на прилагаемой
схеме II.
Равенства
5(3=Тс18,
определяющие существование и однозначность энтропии, являются ос
новными равенствами в составе первого закона. Соответствующие нера
венства
50<Тс18,
1Согласно Клаузиусу и Каратеодори за решение проблемы принимался вывод о сущест
вование энтропии, связанный со вторым законом термодинамики. При отсутствии других
решений непризнание флуктуаций представлялось вынужденным.
Глава шестая. Изменения в основаниях термодинамики
87
СХЕМАI.ВЫВОДСУЩЕСТВОВАНИЯЭНТРОПИИ
88
Г л а в а шестая. Изменения в основаниях термодинамики
относятся ко второму закону и выражают принцип возрастания энтропии и
неравенство Клаузиусадля неравновесных круговых процессов.
6.2 .0 некоторых терминах
Термодинамику,может быть и обоснованно,считают труднойдля изу
чения дисциплиной.К сожалению,вбольшой степени трудности ее изучения
связаны не столько с какой-либо особой ее сложностью, сколько с се “роди
мым пятном” - унаследованной оттеории теплорода структурой еетерминов.
Дополняя ряд известных высказываний на эту тему в публикацияхМ.Борна,
М.А
.Леонтовича,А.М
.Литвина,И.Р .Кричевского, Р.В .Поля, К.А .Путилова и
др., подробно изложенных вработе [6],автор ставиттакжецелью внести кон
структивные предложения,позволяющие снять,возможно,лишние препятст
вия для овладения студентами дисциплины, столь ценной как для последую-
Г л а в а шестая. Изменения в основаниях термодинамики
89
щего изучения ряда специальных дисциплин, так и для формирования их ми
ровоззрения. Для преподавателя, научного работника, выработавших стерео
тип в отношении различных вариантов, например, термина «теплота», со
держание этого понятия заранее известно. Но для изучающих термодинамику
содержание термина может представлять проблему.
Как известно, первый закон термодинамики вводит внутреннюю энер
гию в качестве первичного, исходного понятия, после чего определяется ве
личина Q, обозначающая разность между работой, совершенной термодина
мической системой, и убылью внутренней энергии системы. Эту разность
определяют как особую, сопряженную с процессом теплообмена и не рас
сматриваемую в механике форму переноса энергии к системе,.
Несмотря на существенное различие в содержании термодинамическо
го понятия величины Q и понятия теплоты Q как субстанции в теории тепло
рода, измерения этих величин осуществлялись и осуществляются традицион
ными методами калориметрии, сформировавшейся еще в рамках теории теп
лорода (calorique, фр.
-
теплород). В результате термины, обозначающие ве
личину Q и производные от нее величины, были перенесены из отжившей
теории в новую - термодинамику - почти без изменений: тепло (или холод),
теплота, количество тепла, количество теплоты (русск.), die Warme (нем.),
the heat (англ.) , la chaleur (фр.)- Характерно, что во всех перечисленных ев
ропейских языках этот же термин обозначает общепринятые бытовые, при
вычные с детства понятия - тепло, жар, жара, зной, связанные с ощущением
теплого, горячего, т.е . нагретого до температуры выше температуры тела.
Так что выбор этих терминов в теории теплорода для обозначения субстан
ции Q вполне естественный. Даже термометры, по свидетельству
И.Р .Кричевского [19], иногда называли тепломерами.
Напротив, сопоставление бытовых понятий о тепле с точным термоди
намическим определением величины Q, приведенным выше, указывает, что
это существенно разные, мало совместимые понятия, не смотря на кажу
щуюся их схожесть.
90
Глава шестая. Изменения в основаниях термодинамики
В то же время, по справедливому замечанию Е.С .Вентцель [5], “живое
содержание понятия формируется обычно не его определением, а всем опы
том общественной жизни и практической деятельности людей, всей системой
ассоциаций, образов, аналогий и даже эмоций, связанных с понятием. Кратко
всю эту систему можно назвать “ассоциативной базой” понятия. Скорее все
го, ассоциативная база терминов “тепло” , “теплота” сыграла в термодинами
ке не положительную роль. Недобрую службу здесь могло сослужить даже
кажущееся сходство величины £ с ассоциативной базой термина “теплота”,
ее обозначающего. Не этим ли объясняется, почему термодинамика с ее ба
зовой величиной £? слишком для многих остается невоспринимаемой учеб
ной дисциплиной. Еще в XIX веке Гельмгольц отмечал, что его студенты
воспринимают термодинамику только пройдя школу математической физи
ки. По признанию И.Р .Кричевского, он сначала научился пользоваться тер
модинамикой, и лишь потом стал ее понимать. И не случайно Томсон (лорд
Кельвин) заимствовал для новой термодинамической функции-невидимки -
энтропии - название из мертвого латинского языка, тем самым исключив
возможность связи с какой-либо ассоциативной базой. По той же причине
повсеместно термин “теплосодержание” был заменен на “энтальпию” .
И второе обстоятельство, помимо неблагоприятной связи терминов
“тепло”, “теплота” с их ассоциативной базой, осложняет освоение термоди
намики. А именно, в самой термодинамике, в разных ее руководствах, а ино
гда и в одном авторы применяют этот термин для обозначения понятий, дос
таточно отличающихся по содержанию и даже имеющих разные обозначе
ния. Этими понятиями являются, во-первых, внутренняя энергия и , в частно
сти, кинетическая энергия молекулярного, или теплового движения (Екин). С
точки зрения математической физики она является функцией параметров со
стояния (температуры, объема или давления), ее элементарное изменение
является полным дифференциалом. С точки зрения родовых понятий она яв
ляется энергией, аккумулируемой термодинамической системой в пределах,
ограниченных оболочкой, или контрольной поверхностью. Согласно закону
Глава шестая. Изменения в основаниях термодинамики
91
сохранения энергии изменение с1и внутренней энергии возможно только в
виде потоков энергии, проходящих сквозь оболочку термодинамической сис
темы. Эти потоки не могут принадлежать объему системы, но только ее обо
лочке. Они имеют, согласно первому закону для закрытой системы, только
две формы - работы и теплового потока, обозначаются через 6Ь и 3<2 и яв
ляются с точки зрения математической физики функциями процесса и отнюдь
не полными дифференциалами.
Немаловаж ную роль в таком двойственном, по существу эклектичном
применении термина “теплота” сыграла гипотеза теплорода. Она не имела
недостатка в моделях, объясняющих взаимодействие теплорода с молекула
ми. Однако употребление термина “теплота” в теории теплорода было устой
чиво в одном: теплота как субстанция (скрытая, свободная, полная, неунич
тожимая) рассматривалась как функция состояния системы. Причем это и то,
что содержится в системе, и то, что проходит сквозь границу системы (сим
метрично понятию работы силы и механической энергии в механике). В ме
ханической теории теплоты термин теплота был сохранен, но, по-видимому,
актуальным на рубеже Х1Х-ХХ веков являлось прежде всего обоснование
теплоты как вообще формы энергии в противоположность отжившему пред
ставлению о теплоте как субстанции. Впоследствии выявившаяся в термоди
намике двойственность употребления “теплоты” как энергии, содержащейся
как запас в термодинамической системе (функция состояния), и теплоты как
энергии, переходящей как поток через границу системы (функция процесса),
не могла остаться без внимания. Определенные, не всегда совпадающие, а в
некоторых случаях противоположные точки зрения относительно содержа
ния и употребления термина “теплота” были высказаны в публикациях
М.Борна, М .А .Леонтовича, К.А .Путилова с одной стороны, с другой -
А.М .Литвина, Р.В.Поля, И.Р .Кричевского. Каждая из этих позиций обосно
вана достаточно убедительными аргументами, но ни одна из них не считает
ся окончательно общепризнанной. Не случайно определение, рекомендован
ное Комитетом научно-технической терминологии АН СССР (1973г.), не
92
Г л а в а шестая. Изменения в основаниях термодинамики
внесло ясности в обсуждаемый вопрос. Согласно этому определению “тепло
та процесса (теплота) - энергия, передаваемая одним телом другому при их
взаимодействии, зависящая только от температуры этих тел и не связанная с
переносом вещества от одного тела к другому” . Это определение дает воз
можность толковать его так, что термин “теплота процесса” относится к
“энергии, передаваемой одним телом другому” (тем самым он сопрягается с
функцией процесса, что согласуется с позицией, например, Путилова [33]), а
термин “теплота” относится к “энергии..., зависящей только от температуры
этих тел” (тем самым он сопрягается с функцией состояния, что согласуется с
противоположной позицией). По-видимому, в современных руководствах по
термодинамике предпочтение отдается позиции Путилова, согласно которой
теплота есть функция процесса (“теплота процесса”). Тогда к техническому
жаргону, косноязычным оборотам или ошибкам относятся такие термины,
как “тепло содержащееся в теле”, “тепловая энергия” , “запас теплоты” , “по
тери тепла”, “запас тепла”, ’’производство тепла” , “потребление тепла”, “ про
изводство холода” и многие другие. Некоторые из этих терминов широко
применяются в производственной , практической деятельности инженеров,
механиков, технологов, экономистов. К сожалению, эти же термины приме
няются и в некоторых прикладных вузовских курсах, что разрушает в созна
нии учащихся формируемую термодинамикой структуру понятий, незаметно
трансформируя ее обратно в концепцию теплорода. К недостаткам некото
рых таких курсов относится, в частности, подмена термина “энтальпия” Я
термином “теплота” и обозначением 0 при рассмотрении энергии теплоно
сителя на входе в открытую систему (теплообменные аппараты в курсе “Теп
лопередача”, парогенераторы в “Котельных установках”, ректификационные
колонны, сушилки в “Процессах и аппаратах” и др.) . Характерно, что не
смотря на ошибочный термин и обозначение, сами вычисления при этом вы
полняются именно так, как и должна вычисляется энтальпия Я , например,
через произведение СРг , но не как теплота £9, вычисляемая через СРА /. На
исключение возможных ошибок именно в таком употреблении термина “те-
Глава шестая. Изменения в основаниях термодинамики
93
плота” указывается в третьей части вышеприведенного определения Комите
та по терминологии.
Таким образом, и ассоциативная база термина “теплота”, и зачастую
двойственный подход к употреблению этого термина в самой термодинами
ке, и технический жаргон - все это не способствует формированию у учащих
ся устойчивой структуры термодинамических понятий и представлений.
Представляется, что обсуждаемая проблема в большой степени опреде
ляется выбором термина, обозначающего величину 0 в первом законе тер
модинамики. При выборе и обосновании термина для величины () важно
учитывать, что законом устанавливается существование и взаимосвязан
ность двух симметричных форм переноса энергии - при совершении работы и
при теплообмене. Было бы целесообразным, чтобы и выбор терминов для
обозначения этих двух форм переноса энергии подчеркивал их симметрич
ность. Причем, нетрудно заметить, что термином работа силы может обо
значаться и явление, когда приложенная сила вызывает перемещение точки
приложения силы, и количество энергии, передаваемой при этом явлении.
Термином теплообмен, очевидно, можно обозначить только явление перено
са энергии, отличное от работы сил. Количество же энергии, переносимой
при теплообмене, обозначают в руководствах по термодинамике различными
терминами - количество теплоты, тепло, теплота, количество тепла, подве
денное к системе, теплота процесса, теплоприток. Первый из перечисленных
терминов - “количество теплоты”, пожалуй, наиболее распространен. Его не
достатки - это неблагоприятная ассоциативная база и известная неоднознач
ность применения, о которых говорилось выше.
Особое внимание привлекает к себе последний из перечисленных тер
минов - “теплоприток”, употребляемый наряду с другими, например, в двух
томнике “Механика сплошных сред” Л.И .Седова. Ассоциативная база этого
термина, как и термина “теплота процесса”, рекомендуемого Комитетом по
терминологии, наиболее точно, притом, одним словом отображает сущность
величины 0 как функции процесса. Следовательно, термин “теплоприток”
94
Г л а в а шестая. Изменения в основаниях термодинамики
более краток, вполне симметричен термину “работа силы”, определяет и яв
ление, и количество и к тому же он органично содержит информацию об об
щепринятом положительном направлении теплопереноса через границу тер
модинамической системы.
Также достаточно полно отображал бы содержание величины 0 термин
“тепловой поток” , тем более, что адекватное понятие потока через поверх
ность используется в курсах математического анализа при рассмотрении
формул Остроградского-Гаусса и Стокса. То, что этот термин уже использо
ван и устойчиво применяется в теории теплообмена , имея там размерность
мощности, а не энергии, приведет к взаимному уточнению этих понятий и в
термодинамике, и в теории теплообмена.
Наряду с “теплопритоком” может быть рассмотрен и такой термин для
величины 0 , как “термоприток” . Во всяком случае он в большей степени
адаптирован к области отрицательных температур, что важно при изучении
холодильной техники. Но такой термин почти совсем теряет ассоциативную
базу и поэтому был бы уж слишком непривычен. Все-таки именно “тепло-
приток” представляется наиболее перспективным для величины 2 термином,
позволяющим и облегчить усвоение курса термодинамики, и сохранить в
сознании структуру ее понятий и представлений.
Естественно, облегчение процесса изучения вовсе не означает облегче
ние и процесса преподавания курса. Употреблению термина “теплоприток”, о
чем автору известно по собственному опыту, сопротивляется неизбежный,
годами выработанный стереотип преподавания термодинамики, и тепло- и
хладотехники. Тем не менее корректное и достаточно комфортное употреб
ление этого термина вполне достижимо. Полная симметричность с употреб
лением термина “работа” достигается, например, в следующих словосочета
ниях:
•
совершение работы Ь системой -
получение теплопритока 0 к
системе, или теплообмен (формулировки, относящиеся к явлению);
•
работа системы равна Ь ...- теплоприток к системе равен Q...;
Г л а в а шестая. Изменения в основаниях термодинамики
95
•
система совершает над средой работу в количестве Ь... -
-среда совершает теплоприток к системе в количестве ()...
или система получает от среды теплоприток в количестве ()... (фор
мулировки в действительном залоге);
•
работа в количестве Ь совершается системой над средой...
-
- теплоприток в количестве 2 воспринимается системой от среды...
(формулировки в страдательном залоге).
Что касается термина “теплота процесса”, то его употребление в пол
ном виде ведет к значительному усложнению лексических конструкций и
при формулировании, например, постулатов второго закона, и при описании
многих обыденных явлений, таких, например, как действия комнатных ото
пительных систем или охлаждающих приборов в холодильных камерах.
Употребление же этого термина в сокращенном виде -“теплота”- сразу же
восстанавливает и двойственность, и связь с неблагоприятной ассоциативной
базой. Напротив, употребление термина “теплоприток” придает классиче
ским формулировкам вполне приемлемый вид. Например, приведенным вы
ше формулировкам постулата Клаузиуса можно придать следующую форму.
Во всяком равновесном круговом процессе
1) невозможно превращение теплопритока в работу без соответствую
щего теплопритока к телу менее нагретому от тела более нагретого;
2) невозможен теплоприток от тела менее нагретого к телу более нагре
тому без превращения некоторого соответствующего количество работы в
теплоприток.
Для изучающих термодинамику усвоение формулировок в таком виде
по крайней мере не менее доступно, чем в классическом виде. Вполне прием
лемы и выражения типа “теплоприток от отопительных батарей“ или “тепло
приток от ограждений и содержимого холодильной камеры к охлаждающим
приборам” и т.д.
Возможно, в солидных руководствах по термодинамике для физиче
ских, теплофизических или теплоэнергетических специальностей, там, где
96
Глава шестая. Изменениявоснованияхтермодинамики
изучение термодинамики подкреплено курсом математической физики, было
бы целесообразно сохранить исторически сложившуюся терминологию. Од
нако для многих механических и технологических специальностей, в кото
рых изучение термодинамики ограничивается разделом в курсах “Физика”
“Теплотехника”, “Процессы и аппараты” , “Холодильная техника и техноло
гия и др. уточнение одного из основных ее терминов представляется на
зревшей необходимостью, в противном случае мощная познавательная и ми
ровоззренческая роль термодинамики остается недоиспользованной.
Заключение
При традиционном феноменологическом (макроскопическом) и стати
стическом (микроскопическом) подходах к изложению термодинамики ее
выводы относительно содержания и сферы применения понятия «энтропия»
парадоксальным образом не совпадают. В феноменологической термодина
мике существование и однозначность энтропии определены вторым зако
ном. Отсюда ее свойство - быть «стрелой времени»: возможность убывания
энтропии и возврата «стрелы времени» исключается тем, что тогда исключа
ется и само существование энтропии. В статистической термодинамике су
ществование энтропии определено первым законом, и свойство энтропии
изменяется: возможность ее убывания в принципе не исключается.
Согласно феноменологической термодинамике сфера существования эн
тропии, как и второго закона, ограничена пределами лабораторных масш та
бов. Согласно статистической термодинамике сфера существования энтро
пии, как и первого закона, неограниченна. Несовпадение, даже противопо
ложность выводов фундаментальных курсов высшей школы - феноменологи
ческой термодинамики и статистической физики свидетельствуют, что, по
крайней мере, один из курсов содержит принципиальную ошибку: подлинное
свойство природы, выраженное в энтропии, не может зависеть от метода его
исследования. В данном случае ошибка обнаружена в феноменологическом
методе исследования термодинамических свойств веществ и процессов.
Последовательность и результаты представленного исследования состо
ят в следующем. Вслед за аксиоматикой Каратеодори рассматривается поли-
вариантная пфаффова форма теплопритока Зц в первом законе термодинами
ки. Голономность этой пфаффовой формы определена принципом адиабати
ческой недостижимости Каратеодори. Голономность поливариантной пфаф
фовой формы предусматривает включение в состав уравнений состояния
98
Заключение
сложной термодинамической системы множества дополнительных уравне
ний состояния, выраженных равенствами теоремы Фробениуса. Содержа
тельная сторона этих равенств сомнительна: они представляются бесполез
ными, лишенными физического содержания. Они никем и никак не учиты
ваются в практике исследования термодинамических свойств веществ. В то
же время включение теоремы Фробениуса в аксиоматику неизбежно, если
существуют сложные системы с поливариантными уравнениями состояния1.
Но ниоткуда не следует, что такие системы существуют: существование та
ких систем a priori является только некорректным допущением, принятым в
аксиоматике Каратеодори по умолчанию. Следуя этому допущению, Карате
одори пришел к результату, противоположному выводам статистической фи
зики, но «успешно» повторяющему вывод Клаузиуса о зависимости сущест
вования и однозначности энтропии от второго закона термодинамики.
В то же время феноменологическая термодинамика располагает аксио
матикой М.Планка, согласно которой существование энтропии простых сис
тем определено первым законом2. Противоположность выводов аксиоматики
Каратеодори и Планка требует объяснений. Путь к объяснениям проходит
через классификацию структур уравнения состояния и пфаффовых форм
сложных систем.
Установлена возможность в принципе трех версий структуры сложных
термодинамических систем: А - с бивариантными уравнениями состояния и
бивариантными слагаемыми пфаффовой формы уравнения первого закона; Б
-
с поливариантной совокупностью бивариантных уравнений состояния и
бивариантными слагаемыми пфаффовой формы, и В - с сугубо поливариант
ными уравнениями состояния, не расчленяемыми на бивариантные уравне
ния, и с поливариантными слагаемыми пфаффовой формы.
Аксиоматика Планка, примененная к исследованию простых систем, бы
ла дополнена и применена к исследованию сложных систем. Это позволило
доказать, что пфаффовы формы при бивариантных слагаемых по версии А и
1Имеются в виду собственно поливариантные уравнения состояния, не делимые на бива
риантные уравнения.
2Содержание этого вывода обычно игнорируется
Заключение
99
Б голономны по определению, то есть голономны независимо от принципа
Каратеодори. Тем самым существование энтропии таких систем определя
ется первым законом термодинамики.
Далее доказывается, что собственно поливариантных уравнений состоя
ния (по версии В) не существует. Их существование определяется голоном-
ностью пфаффовой формы первого закона, определяемой только принципом
адиабатической недостижимости Каратеодори, то есть вторым законом. Но
тогда энтропия таких систем определяется вторым законом и соответственно
не может убывать. Такой результат, хотя он и совпадает с выводами Клау
зиуса или Каратеодори, неприемлем. Он вступает в противоречие (несовмес
тим) с существованием флуктуаций. Решение дилеммы «или существование
флуктуаций, или существование собственно поливариантных уравнений» в
пользу второго было бы абсурдным.
Все уравнения состояния существующих в природе систем имеют или
бивариантную структуру, или поливариантную композицию бивариантных
структур. Бивариантные слагаемые пфаффовой формы имеют общий интег
рирующий делитель без ссылки на принцип Каратеодори и без привлечения
теоремы Фробениуса. Соответственно из аксиоматики устраняется теорема
Фробениуса. Устраняется и зависимость последующих выводов от второго
закона термодинамики.
Выводы
1. Термодинамическая температура Т определяется согласно уравнению
первого закона термодинамики как интегрирующий делитель пфаффовой
формы с бивариантными слагаемыми в этом уравнении.
2. Энтропия сложной термодинамической системы определена как прямое
следствие первого закона термодинамики; тем самым достигнуто совпадение
выводов при макро- и микроскопическом изложении термодинамики относи
тельно основания к существованию энтропии и относительно свойств энтропии.
3. Все термические и калорические уравнения состояния сложных тер
модинамических систем имеют бивариантную структуру, а поливариантные
структуры всегда являются композицией бивариантных структур. Отсюда ус-
100
Заключение
тановлено неизвестное ранее свойство сложных термодинамических систем:
каждая сложная система является термически однородной совокупностью
простых подсистем. Каждая простая подсистема имеет две степени свободы
и описывается бивариантными уравнениями состояния.
4.
Из нулевого закона термодинамики выведено положение: систем с
нулевой теплоемкостью в природе не существует. На основе этого положе
ния доказана односвязность области определения состояния сложной тер
модинамической системы. Отсюда доказана однозначность энтропии как
прямое следствие первого закона термодинамики.
В результате изложенных выводов и доказательств смещается граница,
разделяющая сферы действия первого и второго законов термодинамики. Из
второго закона термодинамики в состав первого закона, в дополнение к
принципу существования и однозначности внутренней энергии, переносится
принцип существования и однозначности энтропии. Первым законом опре
деляется термодинамическая температура. В первый закон переходят все по
ложения (постулаты) второго закона, относящиеся к равновесным процессам.
В составе второго закона остаются только его постулаты, относящиеся к
неравновесным процессам, и принцип возрастания энтропии в неравновес
ных процессах.
Первый закон термодинамики, в отличие от второго закона, является
всеобщим законом природы. Его действие распространяется за пределы дей
ствия второго закона. Соответственно следствия первого закона - существо
вание энтропии и термодинамической температуры, как и его внутренняя
энергия - сохраняют свое значение во всей Вселенной, в частности, в черных
дырах. С определением энтропии как составной части первого закона термо
динамики совместима «Теорема возврата» А.Пуанкаре. Положение Эддинг
тона об энтропии как однонаправленной стреле времени ограничено преде
лами действия второго закона. Существование и однозначность энтропии в
качестве составных частей первого закона термодинамики устраняют почву
для фантазий в отношении вечных двигателей второго рода.
Список литературы
1.
Афанасьева-Эренфест Т.А . Необратимость, односторонность и второе
начало термодинамики.- Журн. прикл, физики, 1928, т.5, вып.3 -4, с. 3-30.
2. Базаров И.П.Термодинамика. Гос.издат. физ.- мат. литературы, М.: 1961.
3.
Белов К.П. Упругие, тепловые и электрические явления в ферромагне
тиках, 2 изд., М.- Л., 1957.
4. Вогп М. //Phys. Z. 1921. В. 22. S. 218, 249, 282.
5.
Вентцель Е.С. Спор “Машина и творчество” - В сб. Методологические
проблемы кибернетики (Материалы к Всесоюзной конференции), т. II, АН
СССР, 1970.
6.
Воскресенский В.Ю. ”3а” и “против” при выборе из двух противопо
ложных значений термина “теплота” - Сб. научно-методических статей по
теплотехнике, вып. 2 - М.: Высшая школа, 1977.
7.
Воскресенский В.Ю. К вопросу об определении эмпирической темпе
ратуры. ЖФХ, No9, 1994.
8.
Воскресенский В.Ю. О некоторых следствиях принципа транзитивно
сти теплового равновесия. ЖФХ, 2007, в .81, с .2 1 10-2112. (См.также:
V.Yu.Voskresenskii. Some Corollaries to the Principle o f Transitivity o f Thermal
Equilibrium. ISSN 0036-0244, Russian Journal o f Physical Chemistry A,
2007,Vol. 81, No 11, pp. 1894-1895.)
9.
Воскресенский В.Ю. Об уравнениях состояния сложных термодинами
ческих систем.-
Научные труды ХШ международной научно-методической
конференции. Выпуск 11, том 3, МГУТУ, Москва, 2007, с.74-82.
10..Воскресенский В.Ю. Флуктуация и структура сложных термодина
мических систем. Научные труды XIV Международной научно-методической
конференции. Том 3.// Тематическое приложение к журналу «Открытое об
разование»- М.: МГУТУ, 2008. -
с.335-344.
102
Список литературы
11 .Воскресенский В.Ю . Особенность структуры сложных термодинами
ческих систем. Санкт-Петербургский государственный ун-т низкотемпера
турных технологий. IV Международная научно-техническая конференция
«Низкотемпературные и пищевые технологии в XXI веке » СПб, 25-27.
11.2009 г. Материалы конференции, с. 177-179
12.Гельмгольц Г. Berl. Вег. (1884)
П.Гухм ан А.А. Об основаниях термодинамики.
- М .: Энергоатомиздат,
1986. Изд. 2. М.: Издательство ЛКИ/URSS, 2010.
14. Гухман А.А. Об основаниях термодинамики. Алма-Ата, 1947 г.
15.
Eddington A.S. The Nature o f the Physical World, Cambridge University
Press, 1929, гл.5 .
16.
Казавчинский Я.3. Лекции по технической термодинамике. М.: Транс
порт, 1970.
П.Квасников И.А. Термодинамика и статистическая физика. Т.1: Теория
равновесных систем: Термодинамика - М.: URSS, 2002
18.
Кириллин В.А ., Сычев В.В ., Шейндлин А.Е .. Техническая термоди
намика. -
М.: Энергоатомиздат, 1983.
19.
Кричевский И.Р. Понятия и основы термодинамики.
-
Изд. «Химия»,
1970.
20.
Caratheodory С.// Math. Annal., 1909,LXVII, No3, S. 355-386. (См. также
Каратеодори К. Об основаниях термодинамики. В сб.”Развитие современной
физики” . М.: Наука, 1964.)
21.
Clausius R., Die mechanische Warmetheorie, Bd.I, Braunschweig, 1876;
Bd.II, Braunschweig, 1894. (См. также Клаузиус P. «Второе начало термоди
намики», Гостехтеоретиздат, 1934. Статья - «Механическая теория теплоты.
Математическое введение»)
22. Китгель Ч.Статистическая термодинамика. Пер.с англ. М.: «Наука», 1977.
23.
Kondepudi D., Prigoginc I. Modem Thermodynamics. John Wiley end Sons
(См. также Пригожин И., Кондепуди Д. Современная термодинамика. М.:
Мир, 2002)
Список литературы
103
24.
Lande L. Axiomatische Begründung des zweiten Hauptsatzes der Thermo
dynamik durch Karatheodory. Handbuch Physik, 1926, Bd.9, S .281-300.
25. Landsberg P.T . // Pure and Appl. Chem. 1970. V. 22. P. 215.
26.
Леонтович M.A. Введение в термодинамику - М .- Л .:Гос.изд.техн.-
теор.лит. 1952.
27. Математическая энциклопедия. Т.4. М.: СЭ, 1984.
28. Новиков И.И. Термодинамика - М.: Машиностроение, 1984.
29. Новиков И.Д., Фролов В.П.. Физика черных дыр.-М .:Наука, 1986, с.251.
30.
Петров Н., Бранков Й. Современные проблемы термодинамики: Пер.
с. болг. М.: Мир, 1986. 288 с.
31 .Петровский И.Г. Лекции по теории обыкновенных дифференциаль
ных уравнений - М .:Наука, 1970. Изд. 7. М.: Книжный дом «Либроком»/
URSS, 2009.
32.
Plank М. Uber die Begründung des zweiten Hauptsätzen der Thermody
namik // Sitzungsberichte der preuss. Acad. der Wissenschaften, Phys.-Math.
Klasse, 31, 453-463,1926. (См.также Планк М.Об обосновании второго закона
термодинамики. В кн.: Ван- дер-Ваальс И.Д ., Констамм Ф. Курс термостати
ки. 4 .1 . М.: Гостехиздат, 1936.)
33. Путилов К.А. Термодинамика - М.: Наука, 1971.
34.
Самойлович А.Г. Термодинамика и статистическая физика - М.:
Энергия, 1970.
35.
Скорняков Г.В. О неинтегрируемых термодинамических системах.
ЖТФ, т.66, в.1, с.3-14. См.также:
36.Silbergleit A.S ., Skomyakov G.V. Non-Integrable Thermodynamic Sys
tems and Intelligent Ways for the Conversion o f Heat into Work. In ”Using Energy
in an Intelligent Way” . Proc. o f the III* WE-Heraeus Seminar. EPS, Ge-
neva. 1993, P .7 1-84.
37.3ильберглейт А.С .Скорняков Г.В. Преобразование тепла в работу с
помощью потенциальных систем //ЖТФ. 1992. Т .62, вып.2 . С. 190
38.Сычев В.В. Сложные термодинамические системы - М . .Э нергия, 1970.
104
Список литературы
39.
Шиллер Н.Н. О втором законе термодинамики и об одной новой его
формулировке.
-
Отчет и протоколы физико-математического общества при
императорском университете за 1897 г. Киев: Типография Университета,
1898, с. 1-12.
40.
Chambadal Р. Evolution et Applications du Concept d ’Entropie. DUNOD,
Paris, 1963. Русский пер.: П.Шамбадал. Развитие и приложения понятия эн
тропии.- М.: Наука, Главное издательство физ. - мат. Литературы, 1967.
41.Schmidt Е. Einführung in die technische Thermodynamik und die Grund
lagen der chemischen Thermodynamik. Springer, 1962. (Русск.пер. Ш мидт Э.
Введение в техническую термодинамику. М.- Л.: Энергия, 1965.)
42.Эльсгольц Л.Э. Дифференциальные уравнения и вариационное исчис
ление. - М .: Наука, 1969. Изд. 7. М.: Издательство ЛКИ/URSS, 2008 (в 2 кн.).
43.Truesdell С. Tragicomical History o f Thermodynamics. New York: Springer-
Verlag, 1982.
Другие книги нашего издательства:
URSS
Серия «Relata Refero»
Опарин Е. Г. Физические основы бестопливной энергетики.
Зверев Г. Я. Физика без механики Ньютона.
Шевелев А. К. Структура ядер, элементарных частиц, вакуума.
Шевелев А. К. Структурное единство физического вакуума и фотона.
Андронов Г. Ф. Сложность элементарных частиц.
Бойко С. В. Основы механизма физических процессов.
Плохотников К. Э. и др. Основы психорезонансной электронной технологии.
Моисеев Б. М. Теория относительности и физическая природа света.
Федулаев Л. Е. Физическая форма гравитации: Диалектика природы.
Федулаев Л. Е. Философия гравитации. Глазами Гегеля на проблемы
современной физики.
Билик А. С. Атомная физика, изложенная на языке физики свойств.
Низовцев В. В. Время и место физики XX века.
Стельмахович Е. М. Пространственная (топологическая) структура материи.
Ацюковский В. А. Физические основы электромагнетизма и электромагнитных явлений.
Брусин Л .Д . , Брусин С.Д . Иллюзия Эйнштейна и реальность Ньютона.
Долгушин М. Д. Эвристические методы квантовой химии или о смысле научных занятий.
Терлецкий Н.А. О пользе и вреде излучения для жизни.
Кириллов А. И., Пятницкая Н. Н. Квант-силовая физика. Пшотеза.
Харченко К. Я . , Сухарев В. Н. «Электромагнитная волна», лучистая энергия — поток
реальных фотонов.
Бернштейн В. М. Перспективы «возрождения» и развития электродинамики
и теории гравитации Вебера.
Михеев С. В. Темная энергия и темная материя — проявление нулевых колебаний
электромагнитного поля.
Галавкин В. В. Дорогой Декарта, или физика глазами системотехника.
Галавкин В. В. Аристотель против Ньютона, или экономика глазами системотехника.
Федосин С. Г. Современные проблемы физики. В поисках новых принципов.
Федосин С. Г. Основы синкретики. Философия носителей.
Демин А. И. Парадигма дуализма: пространство — время, информация — энергия.
Иванов М. Г. Безопорные двигатели космических аппаратов.
Иванов М. Г. Антигравитационные двигатели «летающих тарелок». Теория гравитации.
Смольяков Э. Р. Теоретическое обоснование межзвездных полетов.
Хохлов Ю. Н. О нас и нашем мире.
Васильев В. И. Повторяется ли история?
Тел./факс:
(499) 135-42 -46,
(499) 135-42 -16,
E-mail:
URSS9URSS.ru
http://URSS.ru
Наши книги можно приобрести в магазинах:
«Библио-Глобус» (и. Лубянка, ул. Мясницкая, 6. Тел. (495) 625-2457)
«Московский дои книги» (и. Арбатская, ул. Новый Арбат, 8. Тел. (495) 203-8242)
«Молодая гвардия» (и. Полянка, ул. Б. Полянка, 28. Тел. (495) 238-5001, 780-3370)
«Дои научно-технической книги» (Ленинский пр-т, 40. Тел. (495) 137-6019)
«Дои нюни на Ладожской» (и. Бауманская, ул. Ладожская, 8, стр. 1. Тел. 267-0302)
«Гноме» (и. Университет, 1 гуи. корпус МГУ, коми. 141. Тел. (495) 939-4713)
«У Кентавра» (РГГУ) (и. Новослободская, ул. Чаянова, 15. Тел. (499) 973-4301)
«СПб. дои книги» (Невский пр., 28. Тел. (812) 448-2355)
Уважаемые читатели! Уважаемые авторы!
Наше издательство специализируется на выпуске научной и учебной
литературы, в том числе монографий, журналов, трудов ученых Россий
ской академии наук, научно-исследовательских институтов и учебных
заведений. Мы предлагаем авторам свои услуги на выгодных эконом и
ческих условиях. При этом мы берем на себя всю работу по подготовке
издания — от набора, редактирования и верстки д о тиражирования
и распространении.
URSS
Среди вышедших и готовящихся к изданию книг мы предлагаем Вам следующие:
Серия «Relata Refero»
Петров Ю. И. Парадоксы фундаментальных представлений физики.
Петров Ю. И. Некоторые фундаментальные представления физики: критика и анализ.
Зукакишвили Л. М. Физика сплошной среды: Единая теория поля.
Сазанов А. А. Преодоление классического мировоззрения. Кн. 1,2.
Демин В. // . , Селезнев В. П. Загадки света и гравитации.
Янчилин В. Л. Квантовая теория гравитации.
Янчилин В. Л. Квантовая нелокальность.
Янчилин В. Л. Неопределенность, гравитация, космос.
Лесков Л. В. Неизвестная Вселенная.
Шадрин А. А. Структура Мироздания Вселенной.
Переверзев В. Ф. Циклическая эволюция галактик.
Цимерманис Л.-Х . Вселенная д о и после Большого взрыва.
Цимерманис Л.-Х. Вселенная во Вселенной.
Лучин А. А. О ключевых вопросах физики в электронике (с философским подтекстом).
Лучин А. А., Шапиро А. Л. Природа полей.
Колесников А. А. Гравитация и самоорганизация.
Штепа В. И. Единая теория Поля и Вещества с точки зрения Логики.
Сосунов Г. И. Основы корпускулярно-волновой квантовой механики.
Бунин В. А. Биоподобие техногенных систем: Математический код метагармонии.
Шевелев А. К. Структура ядер, элементарных частиц, вакуума.
Шевелев А. К. Структурное единство физического вакуума и фотона.
Кубышкин Е. И. Нелинейная алгебра пространства-времени.
Агафонов К. II. Единство физической картины мира (неоклассическая концепция).
Артеха С. Н. Критика основ теории относительности.
Попов //. А. Сущность времени и относительности.
Сирис А. 3. Теоретические основы геометрической физики и физической геометрии.
Кирьянов В. И. Описание фазовых состояний Вселенной через фундамент, постоянные.
Матосов М. В. Теория относительности Эйнштейна: Реальная и виртуальная физика.
Матосов М. В. Контактная разность потенциалов: Миф и реальность.
Матосов М. В. Термоны — носители энергии.
Ильин В. Н. Термодинамика и социология.
Ильин В. И. Негуманитарная социология. Новый взгляд на обществоведение.
Томсон Дж., Планк М. и др. Эфир и материя.
По всем вопросам Вы можете обратиться к нам:
тел./факс(499) 135-42 -16, 135-42 -46
или электронной почтой URSS@URSS.ru
Полный каталог изданий представлен
в интернет-магазине: http://URSS.ni
Научная и учебная
литература
Всеволод Юрьевич
ВОСКРЕСЕНСКИЙ
Профессор кафедры холодильных систем
и технологий Московского государственного
университета технологий иуправления.
Наше издательство предлагает следующие книги:
9785396
8703 ID 111501
001633
НАУЧНАЯ И УЧЕБНАЯ ЛИТЕРАТУРА
Тел./факс: 7 (499) 135-42 -16
Тел./факс: 7 (499) 135-42 ^6
URSS
E-mail:
URSS@URSS.ru
Каталогизданий
вИнтернете:
http://URSS.ru
Любые отзывы о настоящем издании, а также обнаруженные опечатки присылайте
по адресу URSS@URSS.ru. Ваши замечания и предложения будут учтены
и отражены на \л/еЬ-странице этой книги в нашем интернет-магазине http://UR SS.ru
1996
ЖУРНАЛ ТЕХНИЧЕСКОЙ ФИЗИКИ
JOURNAL OF TECHNICAL PHYSICS
Том66,в.1
Vol66,N1
1996
01
О НЕИНТЕГРИРУЕМЫХ
ТЕРМОДИНАМИЧЕСКИХ СИСТЕМАХ
© Г, В. Скорняков
Физико-технический институт им. А .Ф .Иоффе РАН,
194021 Санкт-Петербург, Россия
(Поступило в Редакцию 1 ноября 1995 г.)
Проведен анализ основных понятий термодинамики.
Обсуждены вопросы
определения тепловых характеристик термодинамических систем.
1, Введение
Термодинамика пользуется репутацией теории, с логической точки
зрения построенной наиболее строго. В этом отношении ее часто срав
нивают с геометрией. Но в отличие от геометрии, да и от математики
в целом логическая непротиворечивость — необходимое, но отнюдь
не достаточное условие, которому должна удовлетворять физическая
теория. Важнейшее требование к ней — соответствие данным опыта.
По широте охвата явлений термодинамика не имеет себе равных
среди физических теорий. В этой связи А.Эйнштейн писал [1]: “Те
ория производит тем большее впечатление, чем проще ее предпосыл
ки, чем разнообразнее предметы, которые она связывает, и чем шире
область ее применения. Отсюда глубокое впечатление, которое про
извела на меня классическая термодинамика. Это единственная физи
ческая теория общего содержания, относительно которой я убежден,
что в рамках применимости ее основных понятий она никогда не будет
опровергнута (к особому сведению принципиальных скептиков)” .
В чем же усматривал А.Эйнштейн наиболее привлекательные чер
ты термодинамики: Вспоминая о создании теории относительности,
он подчеркивал [1]: “Только открытие общего формального принципа
может привести нас к надежным результатам. Образцом представля
лась мне термодинамика. Там общий принцип был дан в предложении:
законы природы таковы, что построить вечный двигатель (первого и
второго рода) невозможно... Общий принцип специальной теории от
носительности содержится в постулате: законы физики инвариантны
относительно преобразований Лоренца... Это есть ограничительный
принцип для законов природы, который можно сравнить с лежащим в
основе термодинамики ограничительным принципом несуществования
вечного двигателя.”
1
з
История термодинамики как науки насчитывает немногим более по
лутора веков. Не будет преувеличением сказать, что ее основы зало
жены Сади Карно, опиравшимся на господствовавшие тогда предста
вления о теплороде.
Современный характер изложения термодинамика приобрела бла
годаряработам Р.Клаузиуса и В.Томсона [2,э]. Математически строй
ную форму придал термодинамике К.Каратеодори [4], положивший в
основу ее построения два постулата, утверждающих невозможность
создания вечного двигателя первого или второго рода, незыблемость
которых почти полвека спустя подчеркивал А.Эйнштейн. Строго го
воря, в качестве второго постулата К.Каратеодори принял принцип
адиабатической недостижимости, который, как справедливо отмечал
М.Планк [5], никогда не был даже предметом экспериментального ис
следования. Но связь этого принципа с утверждением о невозможно
сти создания вечного двигателя второго рода столь непосредственна,
что их можно считать двумя из многих эквивалентных формулировок
второго начала термодинамики.
Молекулярно-кинетическая теория, в создании которой исключи
тельную роль сыграли Л.Больцман и Лж.В .Гиббс [6>7], согласно об
щепринятой точке зрения, подвела теоретическую базу под основные
положения термодинамики.
Именно термодинамика, точнее — созданная М.Планком термоди
намика излучения [8], явилась первым мостом из классической физики
в квантовую. Только непоколебимая уверенность в безусловной спра
ведливости термодинамики могла стать предпосылкой коренного изме
нения основных физических представлений, которого с самого начала
потребовала квантовая теория. С созданием квантовой теории постро
ение стройного здания термодинамики, опирающегося на, казалось бы,
незыблемый фундамент опытных данных, было завершено.
И тем не менее неоднократно отмечалось, что последовательное
проведение точки зрения, основанной на законах термодинамики, при
водит к разительным противоречиям с наблюдаемой картиной мира
и даже с самим фактом нашего существования. Если первое начало
термодинамики, являющееся выражением закона сохранения энергии
в тепловых процессах, практически никогда не было предметом специ
ального обсуждения, второму началу посвящены труды неисчислимого
множества авторов [9]. Сам по себе этот факт знаменателен. Каждый
автор стремился внести свою лепту в разъяснение смысла второго
начала, но по мнению адептов термодинамики сомнения в его спра
ведливости лежат за рамками науки. Более того, бытует мнение, что
второе начало не только составляет квинтэссенцию термодинамики,
но и занимает совершенно исключительное, высшее положение в ряду
основных законов природы [10,11].
Если продолжить параллель между термодинамикой и геометрией,
можно сказать, что второму началу посвящено кудабольше работ, чем
в свое время пятому постулату Евклида. Характерно, однако, что всем
им присущи не столько глубина анализа опытных данных или общей
структуры теории, сколько хлесткость фраз и образность выражений.
Действительно, достойно удивления, что второе начало, по существу
впервые сформулированное С.Карно, исходившим из заведомо ложных
предпосылок, получило полное подтверждение в дальнешем развитии
4
термодинамики. Приписываемое обычно Р.Клаузиусу введение в тер
модинамику,да и в физику вообще, понятия энтропии, неразрывно свя
занного со вторым началом, не обладает той степенью общности, на
какую претендует термодинамика в описании явлений природы. По
этому поводу К.Трусделл писал [12]: “Семь раз за последние тридцать
лет я старался проследить аргументацию Клаузиуса, пытавшегося до
казать, что интегрирующий множитель существует в общем случае, и
есть функция только температуры, одинаковая для всех тел, и семь раз
это совершенно обескураживало меня... Я не могу даже объяснить, че
го именно я не понимаю.”
Сама манера изложения теории тепловых процессов, берущая нача
ло в трудах основоположников термодинамики и сохранившаяся до на
ших дней, дала основание К.Трусделлу назвать термодинамику затх
лым болотом обскурантизма [12]. «Я избегаю в своей книге, —
писал
Трусделл, —
этого термина (“энтропия” —
Г.С .) и сопровождающих
его терминов “состояние”, “первое начало термодинамики”, “второе
начало термодинамики”, “обратимый”, “кипятильник”, “Вселенная” и
т.д . ad nauseam,1чтобы избавить читателя от путаницы, которая обыч
но проистекает от их использования» [13]. Но в попытке построить те
орию тепловых процессов не традиционным путем, а с использовани
ем логически строгих категорий современной теории множеств Трус-
делл по существу ограничился лишь терминологическими изменения
ми, сохранив в качестве одной из основных предпосылок неравенство
Клаузиуса-Дюгема, являющееся выражением второго начала в меха
нике сплошных сред.
Получившая широкое распространение трактовка начал термоди
намики как обобщения опытных данных лишена серьезных оснований.
Достаточно упомянуть, что в середине прошлого века относительная
точность определения механического эквивалента тепла составляла
десятки процентов [2]. В этих условиях говорить даже о первом нача
ле как об опытном факте было по меньшей мере преждевременно. По
существу, однако, первое начало — прямое следствие независимости
физических законов от времени. Поэтому степень точности определе
ния механического эквивалента тепла роли не играет.
Высказывания Р.Клаузиуса и В.Томсона по поводу второго нача
ла термодинамики [3]только на первый взгляд соответствуют данным
опыта, а в действительности имеют в своей основе лишь глубокое убе
ждение в невозможности осуществления вечного двигателя второго ро
да, сколько-нибудь серьезных попыток создания которого и не могло
быть тогда предпринято. В этой связи лишено какого бы то ни бы
ло основания утверждение Э.Ферми [14]: “Экспериментальное доказа
тельство справедливости второго начала состоит главным образом в
неудаче всех попыток сконструировать perpetuum mobile второго ро
да” . Даже если бы такие попытки и предпринимались (о чем у нас нет
определенных сведений), их неудача не может быть доказательством
столь далеко идущего утверждения.
Что же касается теории, то лежащая в ее основе пфаффова фор
ма, выражающая закон сохранения энергии в термодинамических пе
ременных системы, в случае полиморфизма вообще не имеет однознач
ного определения. Но и отсутствие полиморфизма немногим облегчает
до отвращения (лат.)
5
положение. Пфаффовы формы однопараметрических термодинамиче
ских систем любой природы, не обладающих метастабильными состо
яниями, однозначны и заведомо имеют интегрирующий делитель. Но
эти делители для различных систем отнюдь не обязаны совпадать и
быть равными абсолютной газовой температуре [15]. Упоминавшиеся
выше сомнения Трусделла йа этот счет имеют под собой вполне ре
альную почву. К тому же по самой своей природе интегрирующий
делитель заведомо не определяется однозначно, и нет никаких осно
ваний отдать предпочтение какому-либо из множества возможных его
определений.
Ситуация осложняется еще более в случае многопараметрических
систем. Необходимое и достаточное условие полной интегрируемости
дифференциального уравнения Пфаффа любого порядка п установле
но Г.Фробениусом после создания термодинамики, но для ть= 3 оно
было известно еще Л.Эйлеру. С ростом числа независимых термоди
намических переменных число условий интегрируемости пфаффовой
формы быстро растет [16,17]. На выполнение этих условий вреальных
случаях многопараметрических термодинамических систем никогда не
обращалось внимания.
В дальнейшем, с развитием статистической физики, все более ста
ло утверждаться убеждение в статистической природе второго начала.
Но далеко не все процессы в природе имеют вероятностный характер,
и несмотря на то, что законы теории вероятностей накладывают свой
отпечаток на многие явления природы, даже в рамках тепловых про
цессов он не является неизгладимым. Хотя хаотизация — характерный
признак поведения замкнутых стохастических систем, близких к состо
янию статистического равновесия, самоорганизация в природе не ме
нее естественна, чем хаотизация. К тому же в рамках статистической
теории возникают свои проблемы, убедительного решения которых до
сих пор не найдено. Так что второе начало, в отличие от первого, ни
из каких общих принципов не вытекает.
2. Характер термодинамического описания.
Внешние параметры, внутренняя энергия, температура
В ряду физических дисциплин термодинамика действительно зани
мает особое место. Характер термодинамического описания коренным
образом отличается с?т характера других физических теорий — меха
ники, электродинамики (в той мере, в какой в них можно пренебречь
тепловыми процессами).
Воснове любойфизической теории лежит понятие состояния изуча
емого объекта. Предметом теории является определение состояния и
изучение процесса его изменения во времени. Совершенно иначе ста
вится вопрос в термодинамике. По сути дела предметом термодинами
ки является изучение поведения макроскопических тел в предельном
случае медленного изменения определяющих их состояние перемен
ных. По удачному выражению ван-дер-Ваальса то, что принято назы
вать термодинамикой, в действительности представляет собой термо
статику. При этом определяющие термодинамическое состояние си
стемы переменные есть усредненные за более или менее значительный
промежуток времени характеристики сложной статистической систе
мы и потому заданы не точно, а подвержены флуктуациям.
б
Уже поэтому само состояние термодинамической системы нераз
рывно связано с процессом установления и поддержания статистиче
ского равновесия в ней. И именно в этом, а не в практически неиз
бежной необратимости любых реальных термодинамических процес
сов, связанных с изменением термодинамических переменных системы,
заключена природа определения будущего (истрелы времени”)[18], ибо
.всякое становление несет в себе изначальный признак направления
(необратимости)”[19]. По сути дела само состояние термодинамиче
ской системы есть результат установившегося процесса,определяюще
го характеристики этого состояния.
Термодинамика не формулирует уравнений, определяющих эво
люцию состояния термодинамической системы во времени, подобных
уравнениям Максвелла в электродинамике или уравнениям Гамильто
на в механике. Она устанавливает лишь общие принципы {начала тер
модинамики), в рамках которых эта эволюция может происходить. Та
кой характер термодинамики создавал чувство неудовлетворенности
у многих исследователей. В своей Нобелевской лекции И.Пригожин,
отнюдь не подвергая сомнению начала термодинамики по существу,
подчеркивал, что “через 150лет после того, как второе начало было
сформулировано, оно все еще представляет собой скорее программу,
чем четко очерченную теорию в обычном смысле этого понятия” [18].
В термодинамике оказываются тесно переплетенными физические
величины различной природы. Среди величин, определяющих состо
яние термодинамической системы, некоторые имеют отчетливо вы
раженную механическую или электродинамическую природу (объем,
плотность, давление, напряженности электрического и магнитного по
лей и т.п .) . Среди них важную роль играют внешние параметры а*
[20] , изменение которых непосредственно связано с совершаемой систе
мой (или над ней)работой. Производство работы термодинамической
системой, вообще говоря, сопровождается изменением ее внутренней
анергииЕ. Совокупностью внешних параметров и внутренней энергии
задано состояние системы в термодинамике.
К числу важнейших термодинамических величин относится темпе
ратураТ. Существует множество различных подходов к определению
этой величины, в том числе “строгое термодинамическое определение”
[21] . В действительности, однако, никакой строгости в этом определе
нии нет. Достаточно ещераз упомянуть, что интегрирующийделитель
любого уравнения в принципе не есть однозначная функция его пере
менных. Определение любого физического понятия и характеризую
щей его величины неразрывно связаны с возможностью ее измерения.
В основе определения понятия температуры лежит тот факт, что лю
бая равновесная термодинамическая система, не разделенная термо
изолирующими перегородками, характеризуется одинаковой для всех
ее частей величиной — температурой (так называемое нулевое начало
термодинамики). Для измерения температуры служит прибор (напри
мер, газовый термометр), показания которого определяют температу
ру во всех частях системы. Ввиду зависимости свойств системы (раз
меров, давления, электрической и магнитной проницаемостей и т.п .)
от температуры измерения этих характеристик могут быть использо
ваны для измерения температуры.
7
Другой важнейшей термодинамической величиной является количе
ствотепла(¿.Его поступление и отток в общем случае связаны сизме
нением температуры Т и внутренней энергии системы Е. Внутренняя
энергия служит столь же однозначной характеристикой равновесного
состояния системы, как и температура. Это утверждение справедливо,
однако, лишь в случае отсутствия метастабильных состояний. И хотя
внутренняя энергия и в этом случае однозначно определяет состояние
термодинамической системы, наряду с внешними параметрами, тем
пература является более удобной характеристикой, чем внутренняя
энергия, поскольку с ее помощью может быть описано не только состо
яние самой термодинамической системы, но и заданы характеристики
внешней среды, с которой она вступает в тепловой контакт. Взаимо
действие термодинамической системы с внешней средой, теплообмен
с нею и производство работы — одна из основных проблем термоди
намики.
3, Энтропия
Закон сохранения энергии в квазистатических тепловых процес
сах (первое начало термодинамики) выражается линейной дифферен
циальной формой (пфаффовой формой)
к
б(}=¿е + ^2^Маг,
(1)
1=1
где 6(£— переданное системе количество тепла, (1Е— изменение ее
внутренней энергии, ¿а* — изменения внешних параметров системы,
А{— соответствующие им обобщенные силы, к — число независимых
внешних параметров [20].
Однозначная связь внутренней энергии и температуры системы,
измеренной газовым термометром, при заданных внешних параме
трах существует лишь в случае отсутствия метастабильных состояний.
Структуры стабильных и метастабильных состояний и их спектры су
щественно отличаются, но метастабильные состояния, как и стабиль
ные, обладают вполне определенной температурой и другими термо
динамическими переменными. Характер их взаимодействия с внешней
средой ничем не отличается от характера взаимодействия стабильной
системы, обладающей теми же термодинамическими свойствами, но
уравнения состояния одной и той же системы, находящейся в стабиль
ном или метастабильном состояниях, различны. Не совпадают и их
пфаффовы формы. Для каждого метастабильного состояния функцио
нальная зависимость температуры от внутренней энергии и внешних
параметров, а следовательно и пфаффова форма, своя. Поэтому пер
вое начало термодинамики может быть однозначно сформулировано
лишь по отношению к системам, не обладающим метастабильными со
стояниями. Естественно, этим ограничением никак не затрагивается
закон сохранения энергии.
Принято считать, что для обратимого термодинамического процес
са величина
<«= -§■
<2>
есть изменение энтропии системы 5. Никакого иного, Глубокого”,
смысла термодинамическая, энтропия не имеет.
8
Даже если игнорировать возможную неоднозначность пфаффовой
формы (1)и ограничиться только рассмотрением систем, не обладаю
щих полиморфизмом, само определение термодинамической энтропии
(2)постулирует существование интегрирующего делителя пфаффовой
формы любой термодинамической системы, причем этот делитель оди
наков для всех термодинамических систем и равен абсолютной газовой
температуре.
Действительно, пфаффова форма любой термодинамической систе
мы с одним внешним параметром х заведомо имеет интегрирующий
делитель. Но для того чтобы им была именно температура Г, необхо
димо выполнение условия
ЗА 1(ЭЕ Л
дТ~Т\дх+А)'
^
Хотя это условие выполняется не только в случае идеального, но и
ван-дер-ваальсова газа, рассчитывать на его выполнение даже в слу
чае плотных газовых смесей не приходится. Экспериментально этот
вопрос никогда не был исследован. Более того, для потенциальных
систем [15]интегрирующий делитель оказывается равным не темпера
туре, а теплоемкости системы, причем роль “энтропии” таких систем
играет температура.
Но в общем случае многопараметрических термодинамических си
стем интегрирующий делитель пфаффовой формы (1)вообще не суще
ствует. При к> 1форма (1)имеет интегрирующий делитель лишь при
выполнении условия Фробениуса [16], накладывающего весьма жесткие
ограничения на функции А{.
Для произвольной пфаффовой формы и>п
п
U3n=^^
*2»•••,xn)dXi,
,'=1
условие Фробениуса имеет вид
<ко„ Ашп=О,
(4)
(5)
где du>n — внешний дифференциал пфаффовой формы, А — знак внеш
него произведения.
По отношению к коэффициентам у, пфаффовой формы (4) условие
Фробениуса (5) есть совокупность п\/[{п —3)!3!] = [п(га — 1)(п —2)]/6
условий, накладываемых на каждую тройку коэффициентов [17>22]
Уа
( дУч
\дхр
ду-у
дха
+Уч
'дур
дха
дУа\
дхр)
=0,
«,/3,7= 1 , 2 , афРф^фа.
(6)
Если рассматривать ха,х^,х7 как декартовы координаты в трех
мерном пространстве, а Уа^У/з^У'у как соответствующие компонен
ты вектора у, условия (6) могут быть компактно записаны в виде
(уrotу)=0.
9
Поскольку коэффициент при <1Ев(1) тождественно равен единице,
а& = 7г—1,тов приложении к термодинамике условия Фробениуса (6)
имеют вид
(7)
дА{дА3_дЛ,А^
дaj
да,
А’НЕ АгдЕ’
1.
.¿=1,2,
к-
...,л,
к>1.
Количество условий (7)к(к—1)/2 = (га—1)(п - 2)/2, хотя и несколь
ко меньше, чем в общем случае (4), но все же слишком велико при до
статочно больших к для к функций А{(Е,<&!,а2,..., а^). Заметим, что,
например, в случае анизотропного упругого тела число независимых
коэффициентов упругости может достигать шести. Ситуация в случае
анизотропных магнетиков и сеГнетоэлектриков аналогична. Сама воз
можность удовлетворения набором к функций значительно большему,
чем куколичеству условий более чем проблематична.
Второе начало термодинамики по сути дела сводится к утвержде
нию: для всех термически однородных термодинамических систем
условие Фробениуса выполнено, хотя вопрос этот никогда не был пред
метом тщательного анализа и прямой экспериментальной проверки. В
действительности же многопараметрические термодинамические си
стемы, не удовлетворяющие условию Фробениуса, не так уж трудно
создать [15,22]. Что же касается термически неоднородных систем, при
меры такого рода давно известны [23].
Невозможность создания вечного двигателя второго рода диктует
выполнение условий Фробениуса и существование интегрирующего де
лителя пфаффовой формы (1) при любых к. Однако само второе на
чало, как это подчеркивал К.Каратеодори, есть обобщение опытных
фактов, наблюдаемых при особенно простых обстоятельствах и по су
ществу относящихся к рассмотренным им простым системам. Нет аб
солютно никаких оснований распространять его на любые тепловые
процессы, а тем более придавать ему значение универсального закона
природы. И хотя необходимость выполнения условий типа (7)не оста
валась за пределами внимания [20], их реальное выполнение никогда
не было предметом экспериментальных исследований, а само число их
никого не смущало.
4. Преобразование тепла в работу
Хотя термодинамика охватывает необычайно широкий круг самых
разнообразных явлений природы, ее главное содержание, как это под
черкивал Э.Ферми [14], составляет анализ процессов преобразования
тепла в работу. Необходимой предпосылкой преобразования тепла
в работу принято считать наличие двух термостатов — нагревателя
и холодильника, причем сам процесс преобразования осуществляется
посредством циклического изменения термодинамических переменных
рабочего тела, в ходе которого оно вступает в тепловые контакты с
термостатами. Этот процесс сопровождается передачей тепла из на
гревателя в холодильник. Со времен Карно установилось убеждение в
том, что обратимый процесс — наиболее эффективный способ преобра
зования тепла в работу. Максимальным кпд преобразования тепла в
работу, определяемым исключительно температурами нагревателя и
холодильника, обладает цикл Карно. Все эти утверждения — непо
средственное следствие первого и второго начал термодинамики.
ю
Принципиально новые возможности преобразования тепла в рабо
ту открывает использование термически неоднородных систем в ка
честве промежуточного теплового резервуара [24]. Термически неод
нородным промежуточным тепловым резервуаром служит замкнутый
цилиндр, объем которого разделен на две части свободно скользящим
адиабатическим поршнем, наполнителями которых могут быть газы
или двухфазные системы газ-жидкость.
Термически неоднородную систему можно использовать как свое
го рода буфер между нагревателем и рабочим телом преобразователя.
Основная идея использования термически неоднородной системы в ка
честве промежуточного теплового резервуара заключается в том, что
при производстве работы она дает возможность рабочему телу чер
пать энергию из обеих частей буфера, находясь в тепловом контакте
лишь с одной из них. Врезультате производство работы за счет тепла,
поступающего из одной части буфера, сопровождается производством
холода и подготовкой холодильника, которым служит другая часть
буфера, используемая в этом качестве в дальнейших стадиях цикла.
Система преобразования тепла в работу содержит нагреватель,
имеющий температуру Го, промежуточный тепловой резервуар и дви
гатель, использующий в качестве рабочего тела, например, идеальный
газ. Двигатель и нагреватель могут быть приведены в тепловой кон
такт с промежуточным тепловым резервуаром. В исходном состоянии
обе части промежуточного теплового резервуара приводятся в тепло
вой контакт с нагревателем, а двигатель — с одной из них, заполненной
двухфазной системой. Все части системы находятся при температуре
Го. На первой стадии цикла тепловой контакт промежуточного тепло
вого резервуара с нагревателем прекращается и происходит расшире
ние рабочего тела двигателя при сохранении его теплового контакта с
одной из частей промежуточного теплового резервуара. Этот процесс
сопровождается охлаждением не только части резервуара, находящей
ся в тепловом контакте с двигателем, но и адиабатически отделенной
части в результате ее расширения. При уменьшении температуры Т\
части резервуара, находящейся в тепловом контакте с рабочим ве
ществом двигателя, температура Т2адиабатически отделенной части
убывает быстрее, чем Т\. Действительно, нетрудно показать, что в
силу уравнений Клапейрона и Клапейрона-Клаузиуса
<1Т2 72-1 дрГ2
,0ч
т-
72'п
’
^
где 72 — показатель адиабаты,
—
теплота фазового перехода. По
скольку (Тр/Гх > 1, при охлаждении двухфазной системы отделенный от
нее адиабатическим поршнем газ охлаждается быстрее. Характерно,
что этот результат не зависит от количеств вещества в газовой фазе
и в двухфазной системе. Поэтому теплоемкости частей промежуточ
ного теплового резервуара могут быть должным образом согласованы
между собой и с теплоемкостью рабочего вещества двигателя.
На второй стадии цикла прекращается тепловой контакт двигателя
с промежуточным тепловым резервуаром и происходят адиабатиче
ское расширение рабочего тела двигателя и его охлаждение до темпе
ратуры адиабатически расширившейся части резервуара. На третьей
стадии устанавливается тепловой контакт двигателя с этой частью ре
зервуара и рабочее вещество сжимается до исходного объема. При
п
достаточно большой теплоемкости частей резервуара по сравнению с
теплоемкостью рабочего вещества температуры рабочего вещества и
обеих частей резервуара оказываются при этом ниже исходной. Цикл
замыкается в результате установления теплового контакта обеих ча
стей промежуточного теплового резервуара с нагревателем и возвра
щения к исходному состоянию системы.
Последняя стадия цикла в
отличие от предыдущих заведомо необратима, но в результате ввиду
отсутствия холодильника тепло полностью преобразуется в работу.
Столь парадоксальный результат обусловлен тем, что термиче
ски неоднородная система является, вообще говоря, неинтегрируемой
р7,22-251(неголономной, по терминологии автора[23]). Более того, в хо
де теплового процесса термодинамические характеристики рабочего
вещества изменяются. Действительно, на первой стадии цикла проис
ходит по существу адиабатическое расширение идеального газа, нахо
дящегося в тепловом контакте с одной частью промежуточного тепло
вого резервуара, на третьей — адиабатическое сжатие того же газа,
но находящегося в тепловом контакте с другой его частью, а в про
межутке между ними — собственно адиабатическое расширение газа.
Приведение рабочего вещества по ходу процесса преобразования те
пла в работу в тепловой контакт с различными объектами можно рас
сматривать как один из способов управления его термодинамическими
характеристиками [26].
В результате само понятие термодинамической энтропии по отно
шению к системе в целом оказывается неприменимым. Для пояснения
этого вопроса рассмотрим (РУ)-диаграмму рабочего вещества двига
теля. По отношению к этой части системы применимы все обычные
термодинамические категории.
Первая стадия цикла отображается
на (РУ)-диаграмме кривой, промежуточной между изотермой и адиа
батой. Эта кривая тем ближе к изотерме, чем больше теплоемкость
двухфазной части промежуточного теплового резервуара. Термоди
намическая кривая, описывающая вторую стадию цикла, совпадает с
адиабатой идеального газа. Кривая, соответствующая третьей ста
дии, тем ближе к изотерме, чем больше теплоемкость газовой части
промежуточного теплового резервуара. В результате трех стадий ци
кла энтропия рабочего вещества двигателя оказывается меньше ис
ходной. Поскольку все они проходили в условиях термоизоляции от
нагревателя, казалось бы, энтропия промежуточного теплового резер-
12
вуара должна быть больше исходной, но на заключительной стадии
цикла все части системы нагреваются. Поэтому и энтропия системы
растет, а не возвращается к исходному значению. Решение этого пара
докса в том, что энтропия термически неоднородной системы вообще
не определена и не может “доопределяться” с помощью суммы энтро
пий составляющих ее частей, как это предложено в [23].
Неполное установление теплового равновесия между рабочим ве
ществом двигателя и частями термически неоднородной системы при
ведет к тому, что термодинамические кривые первой и третьей ста
дий цикла пойдут более круто, так что производимая за цикл работа
уменьшится, но преобразование тепла в работу не станет от этого ме
нее полным.
5* Заключение
Разумеется, все изложенное ни в коей мере не затрагивает извест
ные результаты, относящиеся к простым термодинамическим систе
мам. По существу только их и изучал Каратеодори. К ним принадле
жат не только все существующие системы теплоэнергетики, но и пода
вляющее большинство систем, используемых не только в технике, но и
в научных исследованиях.
Рассмотренный выше не столь уж и изощренный способ преобра
зования тепла в работу на практике трудно осуществить, как впрочем
и цикл Карно. По сути своей этот цикл хотя и необратим, но являет
ся квазистатическим, а следовательно, обладает нулевой мощностью.
Практический интерес могут представлять лишь процессы с интенсив
ными тепловыми потоками, не связанные с установлением теплового
равновесия между существенно разделенными частями системы.
Передача тепла рабочему веществу двигателя сопровождается ро
стом его энтропии, а его охлаждение — уменьшением энтропии.
Уменьшение энтропии обычно ассоциируется с ростом упорядочения
в стохастической системе.
Охлаждение с помощью внешнего холо
дильника, как это происходит в цикле Карно, можно рассматривать
как фактор организации системы. Тот же процесс, осуществляемый за
счет внутренних механизмов, можно относить к фактору самооргани
зации системы.
Эффективному преобразованию тепла в работу способствует, как
это вытекает из приведенного примера, сопутствующее производство
холода. Процесс интенсивного производства холода можно реализо
вать на основе эффекта Ранка [27_29].
Список литературы
[1] ЭйнштейнА.Автобиографические заметки. Собрание научных трудов. Т . IV.
М.: Наука, 1987. С . 259-293.
[2] ГелъферЯ.М. История и методология термодинамики и статистической фи
зики. М.: Высшая школа, 1981. 536с.
[3] Второе начало термодинамики. Сб. статей. М.;Л.: Гостехиздат, 1934. 310 с.
[4] Каратеодори К. Об основах термодинамики. В сб. “Развитие современной
физики”. М .: Наука, 1964. С . 188-222 . (Mathematische Annalen. 1909. Bd67.
S. 355-386).
[5] Планк M. Об обосновании второго закона термодинамики. В кн.: ван-дер-
Ваальс И.Д ., Констамм Ф. Курс термостатики. Ч . I. М.: Гостехиздат, 1936.
С. 438-452 . (Sitz. d. preus. Akad. d . Wiss., phys.-mathem. Klasse, 31 (1926), 453-463).
[6] Больцман Л. Избранные труды. M .: Наука, 1984. 590 с.
13
[7] Гиббс Дж.В. Термодинамика. Статистическая механика. М .: Наука, 1982.
584 с.
[8] Планк М. Избранные труды. М .: Наука, 1975. 788 с.
[9] Шамбадаль П. Развитие и приложения понятия энтропии. М .: Наука, 1967.
278 с. (Chambadal Р. Evolution et Applications du Concept d’Entropie. Paris: Dunod,
1963).
[10] Eddington A.S. The Nature of the Physical World. Cambr. Univer. Press, 1930. 361 p.
[11] Борн M. Критические замечания по поводу традиционного изложения термо
динамики. В сб. “Развитие современной физики”. М.: Наука, 1964. С. 223-256.
(Phys. Zeitschrift. 1921. Bd 22. S . 218-224, 249-254, 282-286).
[12] Truesdell C. The Tragicomical History of Thermodynamics. 1822-1854. New York:
Springer-Verlag, 1982. 339 p.
[13] Трусделл К. Первоначальный курс рациональной механики сплошных сред.
М.: М ир, 1975. 592 с. (Truesdell С. A First Course in Rational Continuum Mechanics.
The Johns Hopkins University, Baltimore, Maryland, 1972).
[14] Ферми Э. Термодинамика. Харьков: Изд. ХГУ, 1969. 139 с. (Fermi Е. Thermo
dynamics. London il Glasgow: Blackie Sz Son Ltd., 1938. 160 p.).
[15] ЗилъберглейтпA.C ., Скорняков Г.В. Преобразование тепла в работу с помощью
потенциальных систем. // ЖТФ. 1992. Т . 62. Вып. 2.С. 190.
[16] Математическая энциклопедия. Т . 4. Стб. 775-777. М.: СЭ, 1984. 1216 стб.
[17] Silbergîeit A.S ., Skornyakov G.V. The New Concept of Thermodynamics. Heat into
Work Conversion in Multiparameter Systems. In “Balances in the Atmosphere and
the Energy Problem” . Proc. of the 59th WE-Heraeus Seminar. EPS, Geneva, 1990.
P. 193-204.
[18] Пригожий И. Время, структура и флуктуации: Нобелевская лекция по химии
1977 г. // УФН. 1970. Т . 131. Вып. 2. С . 185-207. (Science. 1978. Vol. 201. N 4358.
P. 777 -785).
[19] Шпенглер О. Закат Европы. T . 1. М .: Мысль, 1993. 667 с. (Spengler О. Der
Untergang des Abendlandes. B dl).
[20] ЛеонтповичM.A. Введение в термодинамику. Статистическая физика. М .: На
ука, 1983. 416 с.
[21] Базаров И.П.Термодинамика. М .: Высшая школа, 1983. 344 с.
[22] Скорняков Г.В. О термодинамике анизотропных магнетиков // ЖТФ. 1986.
Т. 56. Вып. 3.С .579-581.
[23] Афанасьева-Эренфест Т.А . Необратимость, односторонность и второе начало
термодинамики // Журнал прикладной физики. 1928.Т .5.Вып. 3-4.С.3-30.
[24] Скорняков Г.В. Преобразование тепла в работу с помощью термически неод
нородных систем //ПисьмавЖТФ.1995.Т.21.Вып.23.С.1-4.
[25] Silbergîeit A.S .,
Skornyakov G.V . Non-Integrable Thermodynamic Systems and
Intelligent Ways for the Conversion of Heat into Work. In “Using Energy in an Intelligent
Way” . Proc. of the 111th WE-Heraeus Seminar. EPS, Geneva, 1993. P. 71 -84.
[26] Скорняков Г.В. Об управлении термодинамическими характеристиками тел
// ЖТФ. 1982.Т . 52.Вып. 6.С . 1259-1260.
[27] Ranque G. Expe’riences Sur la De’tente Giratoire Avec Productions Simultane’es d’un
Echappement d’Air Chaud et d’un Echappement d’Air Froid // Bull. Bi-Mensuel de la
Socie’te’ Française de Physique. 1933. N 342. P. 112S-115S.
[28] Скорняков Г.В. Новый принцип преобразования тепла в работу // Письма в
ЖТФ.1989.Т.15.Вып.22.С.12-14.
[29] Скорняков Г.В. Самоорганизация и преобразование тепла в работу //ЖТФ.
1995.Т.65.Вып.1.С.35-45.
14
Welcome to site
www.twirpx.com