Текст
А. В. Константинов
БИОЛОГИЯ
ИНДИВИДУАЛЬНОГО
РАЗВИТИЯ
Минск
Издательство БГУ им. В. И. Ленина
1978
57.022
К 65
УДК 577.95
Рецензент — доктор биологических наук А. Н. Палилова
Рекомендована кафедрой генетики и дарвинизма
Белорусского государственного университета
Биология индивидуального развития. Константинов А. В.
Мн., Изд-во БГУ им. В. И. Ленина, 1978.
Книга представляет краткий обзор основных вопросов биоло-
гии развития. Рассмотрены в сравнительном плане гаметогенез, эм-
бриогенез н особенности постэмбрионалыюго развития растений и
животных. Большое внимание уделяется генетическим и цитогене-
тическим основам развития (дифференциальной активности генов
и хромосом в ходе развития, обменным процессам между ядром и
цитоплазмой, межклеточным н межтканевым взаимодействиям). Рас-
сматриваются связи организмов со средой, бесполое размножение
н процесс регенерации.
Ил. 35, табл. 3, бнбл. 26 назв.
21001—054
КМ 317-78 22-78
© Издательство БГУ им. В. И. Ленина, 1978.
Оглавление
Введение ..................................................... 5
Глава 1. Спорогенез н саметогеиез........................17
Спорогенез н гаметогенез у растений .... 21
Гаметогенез у животных.............................31
Глава 2. Эмбриональное развитие растений.................45
Процесс оплодотворения..........................45
Эмбриогенез .......................................51
Г л а в а ’ 3. Эмбриональное развитие животных .... 60
Процесс оплодотворения.............................60
Дробление..........................................78
Гаструляция .......................................87
Органогенез.......................................108
Глава 4. Генетические и цитогенетические основы развития 121
Дифференциальная активность генов . . . . 121
Регуляция функционирования генов н их взаимо-
действие в ходе развития..........................141
Дифференциальная активность хромосом . . . 156
Глава 5. Взаимодействие ядра и цитоплазмы в развитии 163
Обменные процессы между ядром и цитоплазмой 163
Материнский эффект................................172
Межклеточные и межтканевые взаимодействия 177
3
Глава 6. Постэмбрионалыюе развитие растений и животных 189
Морфогенез растении.......................189
Морфогенетические процессы в иостэмбрноиальпып
период развития животных........................195
Формирование вторично-половых признаков . . 202
Особенности роста животных...............208
Глава 7. Среда н развитие организма.............215
Иммунологические реакции и ходе развития . . 216
Причины аномалий в развитии....................221
Глава 8. Бесполое размножение, соматический эмбриогенез
н регенерация.......................................224
Бесполое размножение у растений и животных . . 224
Регенерация у растений и животных .... 229
Заключение.................................................235
Рекомендуемая литера гура..................................238
Введение
Биология индивидуального развития изучает закономер-
ности, обусловливающие развитие особей с момента их
зарождения до естественной смерти. Это сравнительно
молодая отрасль биологии, хотя ее предыстория продол-
жалась несколько столетий. Длительное время индиви-
дуальное развитие растений и животных исследовалось
разными биологическими дисциплинами в различных
аспектах и независимо друг от друга, что способствовало
обособленности данных направлений и часто приводило
к односторонней оценке сложных процессов индивидуаль-
ного развития.
Ведущая роль в изучении индивидуального развития,
бесспорно, принадлежит эмбриологии, которая, исполь-
зовав первоначально только морфологические методы,
добыла важную информацию об основных этапах эм-
брионального развития различных организмов. Причин-
ный анализ индивидуального развития стал возможен с
появлением экспериментальной эмбриологии, которую в
разные времена называли по-разному: каузальной эм-
бриологией, динамикой развития, механикой развития,
экспериментальным морфогенезом, физиологией раз-
вития.
К 30-м гг. XX в. началось формирование генетики раз-
вития — широкой области, пересекающейся с экспери-
ментальной эмбриологией, цитогенетикой, иммунологией
и молекулярной биологией.
Предмет биологии развития очень сложен, и для его
изучения потребовалось объединение усилий биологов
различных специальностей и направлений. Реально та-
кое объединение стало возможным в 40—50-х гг. в связи
5
с развитием молекулярной биологии, которая явилась
связующим звеном между ранее обособленными направ-
лениями.
С момента синтеза различных направлений в изуче-
нии индивидуального развития под влиянием молекуляр-
ной биологии появился принципиально новый аспект в
понимании развития, дающий возможность на новой ос-
нове перейти к причинному анализу онтогенеза. Однако
этот переход был длительным и связан с преодолением
многих трудностей, возникавших в связи с различными
мировоззрениями и методологическими подходами. Для
лучшего понимания последних необходимо кратко рас-
смотреть узловые моменты в истории учений об индиви-
дуальном развитии животных и растений.
В XVII и XVIII вв. особое значение приобретает идея
преформации, по которой будущий организм в миниатюр-
ном виде уже имеется в половых клетках. Эта идея не
была повой, так как достаточно четко она была сформу-
лирована древнегреческим натурфилософом Анаксаго-
ром. Идея преформации возродилась на новой основе в
связи с развитием микроскопии, а также потому, что она
укрепляла позиции креационизма, по которому все
окружающее было создано творцом и существует в не-
изменном виде. Идею преформации разделяли многие
ученые того времени: А. Левенгук, Я- Сваммердам,
М. Мальпиги, Ш. Бонне, А. Галлер и др.
Следует отметить, что полностью свести идею пре-
формации к чисто фантастической было бы несправед-
ливо. Естественно, что исследователей того времени инте-
ресовал вопрос, каким же образом осуществляется пре-
емственность между поколения мн организмов. Однако
состояние биологии и мировоззрение того времени при-
вели к примитивному решению этой сложной проблемы.
К середине XVIII в. идея преформации в такой наив-
ной форме все чаще стала наталкиваться па трудности в
связи с возрастающим количеством противоречащих ей
фактов. Например, с позиций преформизма невозможно
было объяснить тератологические явления (уродства) у
растений и животных, а также, явление регенерации. Бо-
лее детальное изучение развития растений и животных,
их внешнего и внутреннего строения вскрывало факты
значительных различий между организмами в пределах
вида, а также между потомками и родителями. Изменчи-
6
поеть была совершенно не понятна преформистам. Еще
Ьольшие трудности появились, когда стали известны ре-
|ультаты опытов по гибридизации растений и животных,
(‘.лишком уж наивными оказывались, например, такие
объяснения, что у мула и лошака более длинные уши по
(-равнению с лошадью только по причине усиленного рос-
t ;i зачатков ушей лошади под влиянием соков осла-отца
пли матери. Не могли найти объяснения и факты сходст-
па па ранних этапах развития организмов, существенно
различающихся во взрослом состоянии. Кризис префор-
мизма отражал начавшийся в тот период общий кризис
метафизики.
В середине XVIII в. идее преформизма была противо-
поставлена идея эпигенеза, которая в различной интер-
претации высказывалась ранее Аристотелем, Гарвеем,
Декартом и другими учеными. Среди биологов эту идею
наиболее обоснованно высказал К. Ф. Вольф (1734—
1794). Он изложил ее в своей основной работе «Теория
зарождения» (1759)*. Вольф установил, что в эмбрио-
нальных тканях растений и животных нет будущих орга-
нов, они постепенно образуются из недифференцирован-
ной зародышевой массы. При этом он опирался на дан-
ные, полученные им при изучении точки роста у растений
п эмбрионального развития цыпленка.
Идеи преформации и эпигенеза в те времена были не-
совместимыми. Первая была ошибочной, метафизической
концепцией, а вторая была слишком односторонней.
Лишь значительно позже на принципиально новой осно-
ве стало ясно, что развитие представляет собой одновре-
менно преформацию (в виде генетической информации)
п эпигенез (формообразование на основе генетической
информации).
В первой половине XIX в. особое значение для разви-
тия эмбриологии имели работы К- М. Бэра (1792—1876),
которому удалось по-новому поставить и решить проб-
лему новообразования в зародышевом развитии. В своем
знаменитом труде «История развития животных» (1828)
он приходит к важным выводам об общих закономерно-
стях развития и строения животных. Например, уточнив
наблюдения русского эмбриолога X. И. Пандере (1794—
1865), Бэр показал, что зародыш на ранней стадии раз-
деляется на два слоя, или листка — серозный и слизис-
тый, между которыми затем закладывается средний, со-
7
судистый, листок. Основы учения о «зачатковых листках»
были затем развиты А. О. Ковалевским и И. И. Мечни-
ковым.
В середине XIX в. становится общепринятым пред-
ставление об универсальности клеточного деления как
процесса, лежащего в основе воспроизведения организ-
мов, что нашло свое выражение в известном афоризме
Р. Вирхова: «Каждая клетка из клетки». Это способст-
вовало сближению исследований репродукции клетки и
явлений наследственности, которая стала рассматривать-
ся как следствие генетической непрерывности, обуслов-
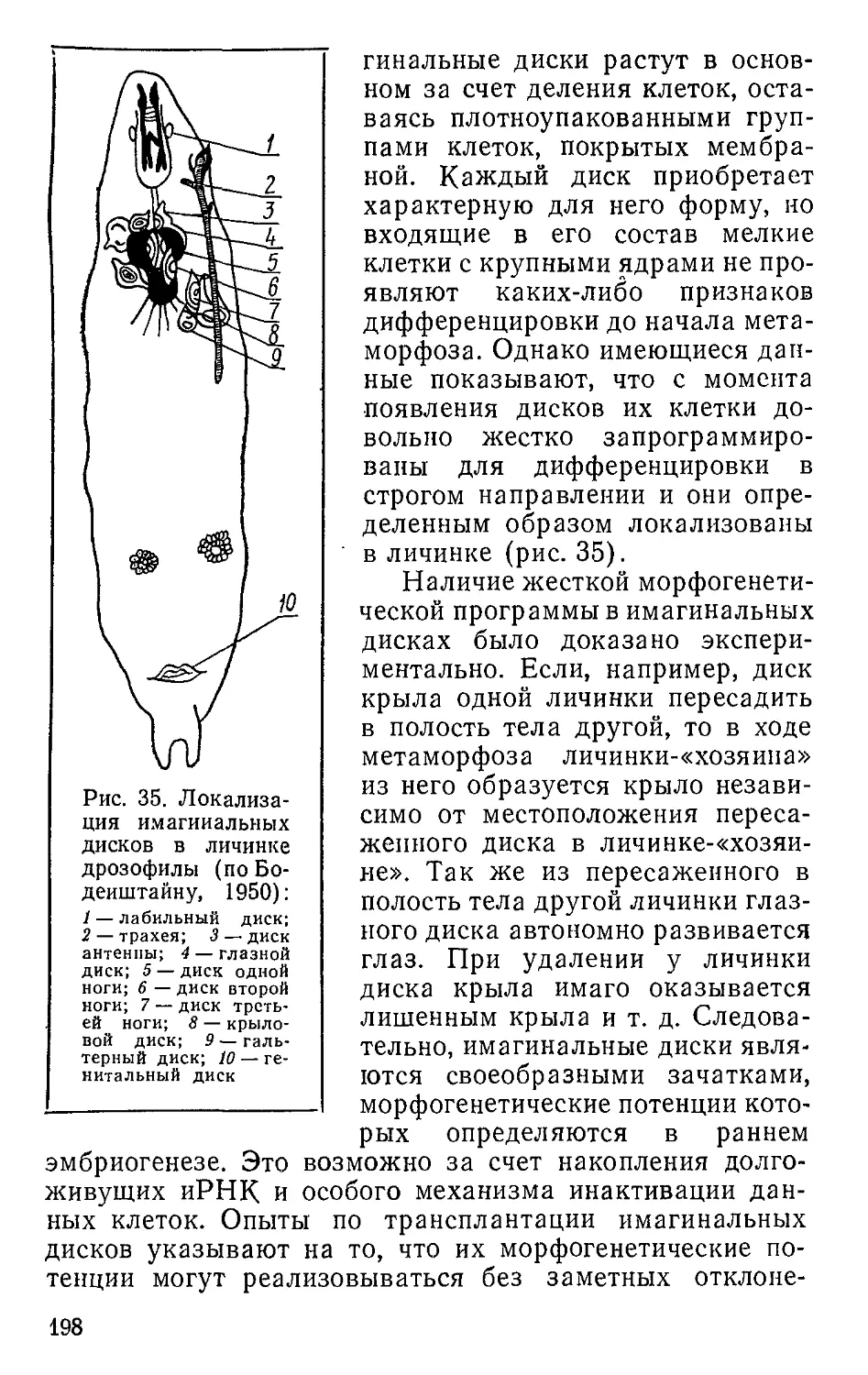
ленной делением клеток. Позже данную теорию развил
в своих трудах А. Вейсман, который в 1883 г. предложил
теорию непрерывности зародышевой плазмы и для объ-
яснения механизма передачи наследственных признаков
ввел представление о материальных частицах наследст-
венности. Эта теория нс была лишена ошибок, но она ока-
зала существенное влияние на становление новых пред-
ставлений о процессе оплодотворения и передаче поко-
лениям наследственных признаков и свойств.
Открытие оплодотворения у животных (Гертвиг, 1875;
Фоль, 1879) и растений (Горожанкин, 1883; Навашин,
1898; Гиньяр, 1899; Страсбургер, 1900) окончательно
укрепило мнение о клеточном ядре как носителе наслед-
ственности и имело большое значение для изучения пред-
зародышевого периода развития.
До конца прошлого века эмбриология в основном ос-
тавалась описательной, хотя с середины XVIII в. эпизоди-
чески использовались экспериментальные методы (на-
пример, опыты по опылению растений и осеменению
животных). Огромный описательный материал, накопив-
шийся к концу XIX в., требовал обобщения, и назрела
необходимость перехода к причинному анализу индиви-
дуального развития, а последнее было возможно при ши-
роком использовании экспериментальных методов.
Основателем экспериментальной эмбриологии (меха-
ники развития) явился немецкий исследователь Виль-
гельм Ру, который ввел в эмбриологию каузально-анали-
тический метод и впервые провел опыты по изучению раз-
вития изолированных бластомеров лягушки. В 1883 г.
В. Ру основал специальный журнал. Вокруг пего объеди-
нились эмбриологи экспериментального направления
многих стран. Среди первых исследователей эксперимен-
8
тального направления в эмбриологии необходимо на-
звать Е. Пфлюгера, Г. Шпемана, Г. Дриша, Ж. Лёба,
Ф. Лилли. Результаты экспериментального направления
в эмбриологии иногда трактовались ошибочно, но не-
смотря на это создавалась основа для перехода к при-
чинному анализу развития организмов на новой основе.
Использовав классическую клеточную теорию, которая
рассматривала организм как сумму равноценных биоло-
гических единиц (клеток), В. Ру предложил идею борь-
бы между всеми структурными единицами, входящими
в состав организма: более сильные клетки должны остав-
лять большее число потомков, чем более слабые клетки.
По его мнению, три условия определяют борьбу клеток
в пределах одного организма: 1) их размножение, когда
идет борьба за место; 2) накопление и усвоение питатель-
ных веществ; 3) освобождение клеток от ядовитых ве-
ществ, накопление которых приводит к их ослаблению.
Ошибочность такого механистического воззрения В. Ру
очевидна. Прежде всего не следовало непосредственно
переносить законы одного уровня организации на другой.
Кроме того, хорошо известно, что никакого хаоса в про-
цессе репродукции клеток нет и между ними не может
быть конкуренции за пространство, поскольку существу-
ют регуляторные механизмы их деления и коррелятив-
ные связи.
В 1891 г. Г?’Дриш развивает понятие о целостности
организма, но на виталистической основе. Положитель-
ным было то, что Дриш привел экспериментальные дока-
зательства, опровергавшие трактовку организма как аг-
регата клеток. Несколько позже этот взгляд был развит
А. Г. Гурвичем (1904), который ввел в понимание орга-
низма представление об индивидуализированности и ко-
ординированной системности. Таким образом, основной
заслугой Г. Дриша и А. Г. Гурвича было то, что при ис-
пользовании клеточной теории относительно многокле-
точных организмов они ввели понятие о системности.
Однако по мнению Г. Дриша, системность организмов
определялась энтелехией (чем-то несущим в себе цель),
что было явным витализмом.
Лишь к 1915 г. механистическая трактовка организма
как суммы клеток цачинает заменяться понятием орга-
низма как системы клеток, представляющей качественно
новую ступень организации. Само понятие системы неиз-
9
бежно влекло за собой признание появления нового ка-
чества на основе взаимодействия составляющих ее еди-
ниц. Позже это блестяще было развито в так называемой
организменной теории Л. Берталанфи (1932). Он считал,
что особая специфичность физико-химических процессов,
происходящих в организме, определяет качественное
своеобразие биологической системности. Л. Берталанфи
был одним из первых биологов, четко пояснившим несо-
стоятельность редукционизма — концепций, по которой
сложным явлениям можно дать исчерпывающее объясне-
ние, сведя все к особенностям составляющих их компонен-
тов. Он особо подчеркивал, что существует ряд структур-
ных ступеней (электроны и протоны, атомы, молекулы,
мицеллы, коацерваты, свободноживущие клетки, много-
клеточные организмы) и нужно исходить из наличия спе-
цифических закономерностей, действующих в пределах
каждой из этих ступеней. Значит, организм следует рас-
сматривать как своеобразную систему со специфически-
ми закономерностями. Такой подход непосредственно
примыкал к основным положениям материалистической
диалектики. Следует отметить, что элементы редукцио-
низма иногда проявляются и в наше время, например в
связи с развитием биофизики и молекулярной биологии.
Кстати, Л. Берталанфи по этому поводу отмечал, что
биологи в своем стремлении стать химиками и физиками
перестают, по существу, заниматься своей специально-
стью и пытаются рассматривать живое существо не как
организм, а как агрегат.
Повое представление об организмах как особых си-
стемах или уровне организации живого требовало и но-
вого методического подхода, который позволил бы охва-
тить все многообразие сложных и взаимосвязанных яв-
лений, обусловливающих индивидуальное развитие.
Поскольку каждый организм — это сложный уровень ин-
теграции живого, включающий молекулярный и клеточ-
ный уровни интеграции, при изучении закономерностей
индивидуального развития неизбежно приходится прово-
дить исследования в различных аспектах. В связи с этим
арсенал методов биологии индивидуального развития по-
стоянно пополнялся и продолжает пополняться.
В настоящее время можно выделить следующие ос-
новные методы исследования индивидуального развития:
описательные, экспериментально-эмбриологические, ци-
10
тологические, молекулярно-биологические, биохимиче-
ские, генетические, цитогенетические, иммунобиологиче-
ские и экологические. Одно лишь перечисление использу-
емых в биологии развития методов свидетельствует о
многостороннем подходе к изучению онтогенеза.
Особую значимость продолжают сохранять старые
описательные или морфологические методы, которые в
настоящее время иногда недооцениваются. Морфология
(термин Гёте) не случайно была названа Ч. Дарвином
душой естественной истории, а по справедливому замеча-
нию Э- Синнота, морфология остается основой для полно-
го познания живого организма и каждый биолог обяза-
тельно должен быть морфологом, прежде чем специализи-
роваться в какой-либо другой области. Хорошо известно,
что форма — это обязательный и наиболее характерный
признак, опираясь на который можно установить фило-
генетическое родство организмов и создать естественные
системы.
Форма (морфология) является видимым (внешним)
проявлением внутренних связей, характеризующих жизнь
на любом уровне ее организации и особенно на организ-
менном уровне. В связи с этим органическая форма ока-
зывается очевидным и вполне доступным для изучения
показателем основных черт живого, а следовательно,
доступным и для экспериментального исследования.
В настоящее в'ремя морфология располагает методами,
позволяющими изучать форму на уровне ультраструк-
туры (электронная микроскопия), клеток (цитологиче-
ские методы), тканей (гистологические методы) и ор-
ганизма.
Описательная эмбриология прошлого убедительно по-
казала, что в ходе развития организмов имеются опреде-
ленные коррелятивные связи и процессы в одной части
развивающегося организма должны определенным обра-
зом соответствовать процессам в любой другой части.
Иначе говоря, развитие любого организма в норме про-
исходит как бы по определенному плану. Нам еще мно-
гое неизвестно о причинах, обусловливающих законо-
мерную смену специфических форм в развитии ор-
ганизмов.
На современном этапе экспериментальная эмбриоло-
гия, занимающаяся динамикой развития и выяснением
причин формообразования в онтогенезе, отличается от
11
морфологии, физиологии и эмбриологии, хотя и тесно
связана с ними. По мнению многих исследователей, на-
звание экспериментальной эмбриологии не совсем соот-
ветствует ее содержанию, и в литературе все чаще употреб-
ляются названия «морфогенез», «развитие формы». Ино-
гда термин «морфогенез» рассматривают как синоним
морфологии развития, что соответствует его точному пе-
реводу. Однако в наше время его смысловая нагрузка
значительно увеличилась. Морфогенетические исследо-
вания включают не только чисто описательные данные о
возникновении формы, но и изучение экспериментально
контролируемого развития, а также анализ влияния
внешних и внутренних факторов па формообразование в
ходе онтогенеза. Следовательно, этот термин нужно по-
нимать в широком смысле.
Морфогенез с полным основанием можно считать
узловым пунктом, где сходятся почти все направления
биологических исследований. В этой области возможны
самые крупные открытия, которые будут иметь огром-
ное теоретическое и практическое значение не только
для биологии, по и для медицины, сельского хозяйства
и естествознания в целом.
Однако и термин «морфогенез», хотя он и очень ем-
кий, не охватывает все вопросы и проблемы, возникаю-
щие при изучении закономерностей индивидуального раз-
вития растений и животных. По-видимому, более соот-
ветствует содержанию данного направления термин
«биология развития».
Исторически сложилось так, что проблемы морфоге-
неза более интенсивно изучались на животных, а ботани-
ки несколько отставали в данной области. Частично это
было связано с особенностями воспроизведения у живот-
ных и растений, определяющими доступность изучения
ранних этапов развития. Так, многие животные с наруж-
ным и внутренним оплодотворением откладывают яйца в
воду или на сушу. Их сравнительно легко инкубировать
и наблюдать различные стадии эмбриогенеза в норме и
при экспериментальных воздействиях. У высших же рас-
тений ранние стадип эмбриогенеза проходят в семяпоч-
ках, окруженных многими слоями специальных тканей,
что делает их относительно недоступными для наблюде-
ния. Только у некоторых низших растений, например бу-
рых водорослей Fucus, яйцеклетки и первые этапы раз-
12
пития изучены так же хорошо, как и у некоторых живот-
ных. Правда, современные методы и прежде всего
культура клеток и тканей позволяют в известной мере
преодолевать ряд трудностей в экспериментальном изу-
чении эмбриогенеза у растений.
Однако в методическом отношении высшие растения
имеют ряд преимуществ по сравнению с животными.
I (режде всего у растений нет четкой грани между эмбри-
ональным и постэмбриональным развитием. На протяже-
нии всей жизни у них сохраняются эмбриональные тка-
ни — меристемы, что обеспечивает рост и органогенез на
любой стадии онтогенеза. Так, меристемы точки роста,
копчика корня и камбиальной зоны при наличии опреде-
ленных условий способны практически неограниченно
образовывать новые структуры, что позволяет экспери-
ментатору получать генотипически идентичный материал
для изучения роста и дифференцировки, которые у рас-
1епий являются непрерывными процессами, не ограни-
ченными только одним и часто коротким жизненным
никлом.
У растений имеются и органы с ограниченным ростом
(например, листья, цветки, плоды), что сходно с разви-
шем животных и позволяет изучать ряд общих вопросов
морфогенеза. В этом случае у исследователя в пределах
одного растения ^ожет быть много таких органов, что да-
ет ему возможность проводить сравнительный анализ ге-
нетически однородного материала при разнообразных
условиях среды.
Различно поведение отдельных клеток растений и жи-
вотных в ходе их развития. В период эмбрионального и
ппетэмбрионального развития животных ряд клеток мо-
нет свободно перемещаться, что обусловливает особенно-
> nt коррелятивных связей и способов регуляции морфо-
iмистических процессов. У растений же, за исключением
ряда низших, клетки обычно тесно связаны с соседними
п клеточные перемещения не имеют особого значения в
процессе морфогенеза. Морфогенетические изменения у
растений в основном определяются различиями в ло'кали-
1,щии и ориентации клеточного деления или в размере
и форме растущих клеток. В определенном смысле это
ныгодно отличает растения от животных, так как ход
p.i жития как бы запечатлевается в строении самой раз-
минающейся системы.
13
Следует также отметить, что большинство раститель-
ных клеток имеет более плотную оболочку, чем клетки
животных. В связи с этим их анатомическое строение ме-
нее изменчиво, а многие органы и части длительный пе-
риод сохраняют свою форму, что облегчает их изучение.
Например, стебли древесных и частично травянистых
растений, многие плоды с твердыми околоплодниками,
семена и даже листья ряда растений сохраняют свою
форму после смерти и высыхания и их можно длитель-
ный период изучать без какой-либо специальной об-
работки.
Во многих случаях растения значительно удобней при
проведении различных опытов. Например, в связи с при-
крепленным образом жизни они более чувствительны к
изменениям внешних условий, а последние исследова-
тель может разнообразить без особого труда и изучать
их влияние па морфогенетические процессы. Строение
растений значительно проще, чем строение животных,
и у них нет многих систем и органов, характерных для
животных, но общие закономерности развития сов-
падают.
Крупный вклад в развитие биологии индивидуального
развития растений сделали многие зарубежные и отече-
ственные ботаники (П. Ван-Тигем, Л. Пост, К. Сакс,
В.'Пфеффер, С. Швендер, Э. Страсбургер, С. Г. Навашин,
X. А. Аллард, Б. А. Келлер, В. Н. Любименко, Н. Г. Хо-
лодный, Э. Синнот, И. Г. Серебряков, М. X. Чайла-
хян и др.).
Одним из основных свойств жизни является дискрет-
ность, выражающаяся па любом уровне организации жи-
вого в наличии относительно обособленных систем.
Существование отдельных особей также отражает ди-
скретность. Каждая особь, хотя и входит в состав опре-
деленного вида (популяции), но обладает рядом
присущих только ей особенностей и в этом смысле ока-
зывается уникальным и неповторимым явлением. С ди-
скретностью жизни связано и другое очень важное ее
свойство — относительно идентичное самовоспроизведе-
ние, суть которого сводится к тому, что особи каждого
вида воспроизводят себе подобных, по при этом возника-
ют не копии, а организмы того же вида с новыми инди-
видуальными особенностями в связи с постоянной гено-
типической изменчивостью.
14
Совершенно очевидно, что особь (отдельный организм,
пли индивидуум) представляет собой целостную морфо-
функциональную систему, разделение которой на части
невозможно без утраты индивидуальности. Исходя из от-
меченных особенностей, иногда бывает трудно определить
понятие «особь». Например, трудно вычленить особь у
колониальных организмов (вольвокс, колонии коралло-
вых полипов, мшанок, сифонофор и др.), микроорганиз-
мов (колонии дрожжей), при симбиозах (лишайники).
Возникают затруднения и при определении особей в ряде
случаев вегетативного размножения у растений и раз-
множения почкованием у животных. По-видимому, поня-
тие «особь», или «индивидуум», может нести различную
смысловую нагрузку и ему следует придавать операцио-
нальное значение, т. е. необходимо указывать, к какой
области оно относится (морфологии, таксономии, генети-
ке, экологии или эволюционному процессу).
Так, с морфологической точки зрения колониальные
формы находятся на надындивидуальном уровне органи-
зации живого, а с эволюционной точки зрения их можно
рассматривать как одну особь, на уровне которой дей-
ствует естественный отбор. Если при вегетативном раз-
множении растений «потомки» остаются прикрепленны-
ми к родительскому растению, все это можно считать
одной особью. Если же произошло их отделение от роди-
тельского растения и «потомки» стали произрастать са-
мостоятельно, морфологически каждый из них представ-
ляет отдельную особь. Однако с генетической точки зре-
ния их и в этом случае можно считать одной особью, так
как они идентичны исходной форме.
Ранее мы определили, что предметом биологии инди-
видуального развития являются закономерности, обус-
ловливающие развитие особей с момента их зарождения
до естественной смерти. Понятие особи мы будем в ос-
новном использовать в морфологическом и морфогенети-
ческом аспектах. Поскольку онтогенез — последователь-
ный процесс реализации наследственной информации, в
ряде случаев нам потребуется и генетическая трактовка
понятия «индивидуум». Онтогенез — один из основных
феноменов жизни еще и потому, что историческое разви-
тие каждой группы организмов (филогенез) представля-
ет собой бесконечный (при наличии определенных усло-
вий) «поток» онтогенезов, постоянно обеспечивающий
15
процесс дивергенции и филогенетические дифференци-
ровки. Поэтому при рассмотрении основных закономер-
ностей индивидуального развития необходимо оцени-
вать значимость онтогенезов для эволюционного про-
цесса. ‘
‘—’Биология индивидуального развития — широкая об-
ласть исследований, тесно связанная с большинством
разделов биологии, что значительно затрудняет объеди-
нение огромного и разнообразного фактического матери-
ала в логически единую и стройную систему. Целостной
теории онтогенеза растений и животных пока не созда-
но, но в этом направлении достигнуты определенные ус-
пеха и многие фундаментальные вопросы проясняются.
На современном этапе продолжается познание основных
закономерностей индивидуального развития, но уже на-
чинает решаться и основная задача будущего — управ-
ление развитием организмов, в решении которой крайне
заинтересованы медицина, сельское хозяйство и т. д.
Глава 1 Спорогенез и гаметогенез
Способность к самовоспроизведению — одна из основных
особенностей живых систем. На молекулярном уровне
процесс репродукции определяется уникальной способ-
ностью нуклеиновых кислот к самоудвоению. На орга-
низменном уровне самовоспроизведение осуществляется
в разнообразных фор-мах: от простого деления однокле-
точных организмов до полового размножения растений
и животных, которое является чрезвычайно сложным
процессом в структурном и функциональном отношениях.
Хотя способы размножения в растительном и животном
мире очень разнообразны, их можно свести к двум ос-
новным типам: бесполое и половое. В бесполом размно-
жении участвует только одна родительская особь и в ре-
зультате ее деления или почкования образуется одна или
несколько новых особей, генотипически идентичные ис-
ходной родительской особи. В половом размножении
обычно участвуют две особи, и в результате слияния жен-
ских (яйцеклетки) и мужских (спермин, или спермато-
зоиды) гамет (от греч. gamos — брак) образуется зиго-
та (от греч. zygota — спаренная), которую можно рас-
сматривать как новый организм в самом начале его
развития.
При бесполом размножении обычно не образуется
каких-либо специальных клеток и новому организму дают
начало соматические (телесные) клетки. Половое раз-
множение обусловливается рядом сложных и взаимосвя-
занных цитогенетических, физиолого-биохимических и
морфологических явлений (половые различия клеток,
распределение генетической информации в ряду поколе-
ний организмов, различия между полами, развитие и
2 Зак. 918
17
строение копулятивных органов, физиологические особен-
ности женских и мужских организмов и т. д.). Некоторые
из этих явлений и процессов оказываются универсаль-
ными, т. е. характерными для полового размножения рас-
тений и животных любого уровня организации.
В ходе исторического развития живой природы поло-
вое размножение организмов в растительном и животном
мире стало доминирующим. Это не случайно, так как по-
ловое размножение по сравнению с бесполым имеет ряд
существенных преимуществ: 1) достигается более высо-
кий коэффициент размножения, т. е. возникает большее
количество зачатков новых особей; 2) происходит полное
обновление организмов в связи с объединением материн-
ской и отцовской генетической информации, что является
постоянным источником наследственной изменчивости,
имеющей особое значение для эволюционной пластично-
сти видов, а также расширяет адаптивные возможности
последних к абиотическим и биотическим условиям и га-
рантирует больший успех в борьбе за существование.
Пока мы не можем точно ответить на вопрос, как и
когда возникло половое размножение. Однако изучение
его в пределах некоторых типов и классов растений и жи-
вотных в известной мере позволяет говорить о том, каким
путем могла бы идти эволюция этого сложного способа
воспроизведения.
Прежде чем перейти к конкретному анализу гамето-
генеза у растений и животных, необходимо кратко рас-
смотреть мейоз — особый тип клеточного деления, кото-
рое происходит на определенных этапах жизненного цик-
ла организмов, размножающихся половым путем. Этот
исключительно важный процесс обеспечивает равномер-
ное распределение генетического материала в ряду поко-
лений организмов и через кроссинговер значительно уве-
личивает комбинативную наследственную изменчивость.
Как только стали известны основные черты полового
размножения, роль хромосом в наследственности и осо-
бенности митоза, биологическое значение которого за-
ключается в распределении генетического материала в
ряду клеточных поколений, многие исследователи пред-
сказывали, что происходящее при оплодотворении удвое-
ние числа хромосом должно в каждом поколении как-то
устраняться противоположным процессом. Если бы орга-
низмы производили гаметы с диплоидным числом хромо-
18
сом, при половом воспроизведении в каждом поколении
число хромосом удваивалось бы. При этом самовоспро-
изведение вида было бы невозможным, так как каждое
поколение было бы представлено совершенно новыми
формами. Однако этого не наблюдается, потому что об-
разуются гаметы с уменьшенным (редуцированным)
числом хромосом и после их слияния в процессе оплодо-
творения восстанавливается диплоидный набор хромо-
сом, характерный для данного вида. Следовательно, по-
ловое размножение могло возникнуть лишь при наличии
приспособления, позволяющего уменьшать количество
хромосом в гаметах. Таким приспособлением явился осо-
бый тип клеточного деления — мейоз.
Происходящий от зиготы организм, все клетки кото-
рого диплоидные, называют диплонтом, а развитие орга-
низма с момента оплодотворения до образования гамет —
диплофазой. У высших растений, например, диплофаза
представлена облиственным растением; на нем образу-
ются органы воспроизведения. Такое растение называют
спорофитом, поскольку оно образует споры (микроспоры
в пыльниках и макроспоры в нуцеллусе семяпочек). Спо-
рофитное (диплофазное) состояние обычно заканчивает-
ся образованием спор, возникающих в результате мейо-
.за, обусловливающего возврат к гаплоидному состоянию.
У животных мейоз происходит во время так называемых
делений созревания, предшествующих образованию га-
мет (в ооцитах у самок и сперматоцитах у самцов).
Таким образом, у организмов, размножающихся по-
ловым путем, при продуцировании гамет и оплодотворе-
нии происходит смена ядерных фаз (диплоидная — га-
плоидная—диплоидная). При рассмотрении смены
ядерных фаз в эволюционном плане оказывается, что в
цикле развития различных организмов соотношение про-
должительности диплоидной и гаплоидной фаз изме-
нялось.
Известны три типа мейоза, существующих в природе:
начальный, промежуточный и конечный. Начальный,
пли зиготный, мейоз происходит сразу после оплодотво-
рения, с первыми делениями зиготы. Он обнаружен у
многих водорослей и простейших. В цикле развития таких
организмов диплоидное состояние занимает небольшой
период (пока существует зигота). Производные зиготы
(соматические клетки) имеют гаплоидное число хромо-
Й* 19
сом, и сам организм оказывается гаплоидным. По-види-
мому, мейоз первоначально был зиготным и следовал за
сингамией (слиянием гамет) в качестве регуляторного
процесса, при помощи которого быстро восстанавлива-
лось гаплоидное состояние.
Промежуточный, или споровый, мейоз происходит в
процессе спорообразования, между стадиями спорофита
и гаметофита. Ои характерен для большинства растений.
В этом случае мейоз оказывается частью общего про-
цесса спорогенеза и сопровождается чередованием поко-
лений. Споры, являющиеся продуктом мейоза, получают
гаплоидное число хромосом и развиваются без оплодо-
творения в гаплоидное «половое» поколение (гамето-
фит). Гаметофит дает начало гаметам, после слияния
которых возникает зигота, развивающаяся затем в ди-
плоидный спорофит. Этот процесс называют антитети-
ческой сменой поколений, т. с. сменой, обеспечивающей
ритмичное чередование полового и бесполого поколений.
Гаметофит часто называют гаплонтом, а спорофит —
диплонтом, подчеркивая тем их различие по числу хро-
мосом.
Конечный, или гаметный, мейоз характерен для всех
многоклеточных животных, некоторых простейших и низ-
ших растений (например, для некоторых бурых водорос-
лей). Он происходит непосредственно во время гамето-
генеза (оогенеза и сперматогенеза), т. е. является частью
процесса образования женских и мужских гамет.
Мейотический цикл включает два последовательных
деления, из которых только одно сопровождается редук-
цией числа хромосом. Первое, деление обычно является
редукционным, а второе эквационным (уравнитель-
ным) и сходно с обычным митозом.
Общая схема мейоза, обеспечивающего переход от
диплоидного состояния к гаплоидному, сводится к следу-
ющему. За время двух последовательных делений мейоза
происходит лишь одна репродукция хромосом, а вторая
как бы «подменяется» конъюгацией гомологичных хро-
мосом. Гомологичными (парными, или аллеломорфны-
ми) называют хромосомы диплоидного набора, сходные
по морфологии и топкому строению. Одна из гомологич-
ных хромосом принадлежит женской, другая — мужской
гамете. Конъюгация гомологичных хромосом заключает-
ся в сближении их во время профазы первого деления
20
мейоза (профаза I) с образованием бивалентов. Это так
называемый синапсис. В анафазе гомологичные хромосо-
мы расходятся к полюсам и каждая дочерняя клетка по-
лучает уменьшенное вдвое число хромосом.
Морфологически фазы мейоза изучены хорошо. У рас-
тений и животных ход мейоза довольно однообразен.
Правда, есть и некоторые различия, не имеющие прин-
ципиального значения.
Спорогенез и гаметогенез
у растений
Можно выделить следующие основные тенденции в эво-
люции размножения растений при выходе их из водной
среды на сушу: 1) редукция гаметофитов с уменьшением
продолжительности гаплофазы в цикле развития; 2) по-
явление у спорофита приспособлений, облегчающих по-
ловое размножение (например, семяпочек); 3) почти пол-
ная утрата мужскими гаметами подвижности и меньшая
зависимость процесса оплодотворения от водной среды;
4) развитие зародыша внутри материнского орга-
низма.
Все эти крупные преобразования происходили в ис-
торическом развитии растений в связи с принципиально
новыми условиями существования, с которыми они встре-
тились при переходе от водного образа жизни к сухопут-
ному. При освоении водными растениями суши первона-
чально существовали растения-амфибии, часто затопля-
емые водой. Элементы их полового воспроизведения
(споры) развивались на суше и разносились ветром. Вы-
росшее из них половое .поколение, несущее архегонии и
антеридии с подвижными в воде сперматозоидами, дол-
жно было развиваться хотя бы временно в воде (мхи, па-
поротники, хвощи). По мере дальнейшего завоевания су-
ши растениями появляются приспособления, позволяю-
щие обходиться при оплодотворении без воды.
Макроспоры остаются на материнском растении и
здесь же прорастают в редуцированный гаметофит, жи-
вущий за счет спорофита и под защитой его частей (мак-
роспорангий, спорофиллы и т. д.). Микроспоры (пылин-
ки) начинают переноситься ветром. Развивающийся из
21
них мужской гаметофит небольшого размера и живет
также за счет спорофита. У примитивных групп голосе-
менных еще образуются сперматозоиды, а жидкость для
их движения выделяется женским спорофитом. В даль-
нейшем внутреннее оплодотворение совершенствовалось,
и важнейшим событием явилось развитие пыльцевой
трубочки, непосредственно доставляющей мужские га-
меты к женским.
Интересно, что переход от наружного оплодотворения
в воде к внутреннему на суше и в некоторых случаях в
воде, а также к развитию зародыша внутри материнского
организма имел место и в эволюции животных. Напри-
мер, оплодотворение и развитие зародыша у рыб и мно-
гих амфибий происходит вне организма, а у млекопита-
ющих то и другое совершается внутри тела женской
особи.
Высшим достижением исторического развития расте-
ний явились покрытосеменные, занявшие доминирующее
положение в мире растений. Общие признаки покрыто-
семенных следующие: 1) семена скрыты внутри плодов;
2) зародыши кроме покровов семени защищены еще и
стенкой плода, что полностью обеспечивает их вызрева-
ние; 3) имеются наиболее совершенные в анатомо-физио-
логическом отношении системы, обеспечивающие рацио-
нальное использование солнечного света, воздуха, воды
и почвенных растворов; 4) в связи с прогрессивными пре-
образованиями морфогенеза и воспроизведения покры-
тосеменные значительно расширили свои адаптивные
возможности по сравнению с другими растениями. Мы
ограничимся лишь кратким анализом спорогенеза и га-
метогенеза у покрытосеменных растений.
Для покрытосеменных характерно наличие цветка и
поэтому их часто называют просто цветковыми растени-
ями. Цветок — это укороченный неразветвленный побег с
ограниченным ростом, листья которого метаморфизиро-
ваны в связи с половым размножением, происходящим
здесь же в цветке и приводящим к образованию семени.
В большинстве случаев цветки являются гермафродит-
ными, т. е. имеют мужские (андроцей) и женские (гени-
цей) органы. Андроцей представлен совокупностью ты-
чинок (микроспорофиллов), количество которых сильно
варьирует (от одной до нескольких сотен). Тычинки про-
изошли из микроспорофиллов каких-то примитивных
22
предков покрытосеменных, но этот вопрос пока остается
спорным.
Обычная тычинка имеет четыре удлиненных пыльника
(микроспорангия), образующихся из клеток меристемы.
По мере развития пыльника на нем дифференцируется
ряд тканей: эпидермис, фиброзный слой,^тапетум (вы-
стилающий слой) и первичный археспории. Клетки пер-
вичного археспория на ранних этапах формирования
пыльников делятся митотически, увеличиваясь в числе, а
затем дифференцируются в мейоциты и переходят к мей-
озу. С этого момента их можно называть материнскими
клетками микроспор, или пыльцы.
Количество клеток археспория и мейоцитов в пыльни-
ках различных растений может варьировать. Мейотиче-
ское деление микроспороцитов завершается образовани-
ем тетрад микроспор, развивающихся затем в пыльцевые
зерна. Известны два основных типа мейоза микроспоро-
цитов: 1) сукцессивный, или последовательный, когда по-
сле первого деления мейоза образуется перегородка с
образованием диады; 2) симультанный, или одновремен-
ный, когда после первого мейотического деления перего-
родка не образуется, т. е. диад нет, а после второго за-
кладываются одновременно четыре перегородки (рис. 1).
Первый тип чаще встречается у однодольных, а второй —
у двудольных растений. Однако четкой таксономической
приуроченности этих типов пока доказать не удалось, так
как есть и промежуточный тип (см. рис. 1).
По форме тетрады микроспор разнообразны. Распо-
ложение микроспор в тетрадах может быть в виде тетра-
эдра, изобилатеральное, углом, крест-накрест, Т-образ-
ное, линейное. У изученных покрытосеменных чаще всего
встречаются тетрады микроспор в виде тетраэдра и изо-
билатеральные. Обнаружены и такие случаи, когда в
пределах вида имеются два-три типа расположения мик-
роспор в тетрадах (например, у банана, гнездовки, ага-
вы, лавра и др.).
Обычно тетрады микроспор распадаются перед нача-
лом формирования пыльцы и мужского гаметофита. Мик-
роспоры (молодые пыльцевые зерна) представляют собой
и первые клетки гаметофитной генерации. В начале фор-
мирования пыльцевого зерна завершается дифференци-
ровка интины (внутренней оболочки) и экзины (наружной
оболочки), которая приобретает характерную для данно-
23
Рис. 1. Типы образования тетрад микроспор (по Устиновой,
1965):
а — последовательный (сукцсссивный) тип: / — профаза I; 2 — метафа-
за I; 3 — метафаза II; 4 —анафаза II; 5 — тетрада микроспор; б —
промежуточный тип: / — профаза I; 2 — интеркинез; 3—аиафаза II;
4 — тетрада микроспор; в — одновременный (симультанный) тип: / —
профаза I; 2 — метафаза I; 3—метафаза II; 4— разделение протопла-
ста; 5 — тетрада микроспор
го вида скульптуру, что используется в качестве одного
из основных критериев при пыльцевом анализе. В дан-
ный период микроспора имеет одно ядро.
Развитие мужского гаметофита начинается с деления
ядра микроспоры. Первое деление ядра микроспоры ми-
тотическое, но особое, так как завершается образованием
двух ядер (вегетативного и генеративного), различаю-
щихся своими цитогенетическими и морфогенетическими
возможностями. Это один из немногих случаев, когда
митоз завершается образованием функционально различ-
ных ядер и клеток. Таким образом, первое деление ядра
микроспоры завершается образованием вегетативной и
генеративной клеток. На основе морфологических данных
эмбриологи растений давно пытались объяснить этот фе-
номен, исходя из частичной асимметричности митотиче-
ского веретена и особого его расположения в цитоплаз-
ме микроспоры.
24
Вегетативная клетка утрачивает способность делить-
ся, а генеративная делится, образуя два спермия. Деле-
ние генеративной клетки может произойти в пыльцевом
зерне или пыльцевой трубке во время ее активного роста.
Следовательно, пыльца может быть трех- и двухклеточ-
ной. В последнем случае мужской гаметофит завершает
свое развитие в период роста пыльцевой трубки, т. е. по-
сле опыления. Двухклеточная пыльца характерна для
двудольных, а трехклеточная — для однодольных расте-
ний (рис. 2), но бывают и исключения. Развитый муж-
ской гаметофит состоит из одной вегетативной клетки и
двух клеток-спермиев, которые существенно различаются
цитохимически. Например, ядро вегетативной клетки
почти не окрашивается по Фёльгену (специфическая
окраска ДНК), а ядра спермиев окрашиваются очень хо-
рошо. Первоначально даже думали, что вегетативное ядг
ро не имеет ДНК, но затем выяснилось, что последняя
находится в них в диффузном состоянии.
По многочисленным,данным, степень развитости муж-
ского гаметофита коррелирует с продолжительностью
жизнеспособности пыльцы. Так, двухклеточная пыльца
некоторых двудольных может храниться в течение не-
скольких лет, сохраняя свою жизнеспособность, а трех-
клеточная пыльца многих двудольных сохраняет свою
жизнеспособность от нескольких минут до нескольких
25
часов. Эту особенность пыльцы различных видов покры-
тосеменных необходимо знать экспериментаторам, зани-
мающимся скрещиваниями и гибридизацией растений.
Семяпочки, или макроспорангии, образуются в завязи
покрытосеменных в различных количествах. От одной
(например, у крапивоцветных, гречишных и злаков) до
нескольких тысяч (например, у орхидных). Семяпочки
начинают развиваться из меристемы, и развитая семя-
почка состоит из нуцеллуса, покрытого одним или двумя
интегументами. Форма семяпочек разнообразна (рис. 3).
Нуцеллус имеет микропилярную и халазальную зо-
ны, последняя находится у места прикрепления фонику-
луса. По степени развитости пуцеллусы различают крас-
синуцеллятные (массивпопуцсллярпые) и тенуинуцел-
лятные (тонкопуцеллярные). У семяпочек первого типа
хорошо развита париетальная (дополнительная, крою-
щая) ткань и материнская клетка макроспор отделена от
эпидермиса несколькими слоями клеток. У второго типа
париетальные клетки отсутствуют и материнская клетка
макроспор образуется непосредственно под эпидермисом.
В нуцеллусе семяпочек формируется археспориальная
(спорогенная) ткань. Различают четыре типа археспория:
1) одноклеточный с отделением выстилающей клетки;
2) одноклеточный без отделения выстилающей клетки;
3) многоклеточный с отделением выстилающих клеток;
4) многоклеточный без отделения выстилающих клеток.
Отделение выстилающих клеток происходит за счет ми-
тотических делений клеток первичного археспория.
26
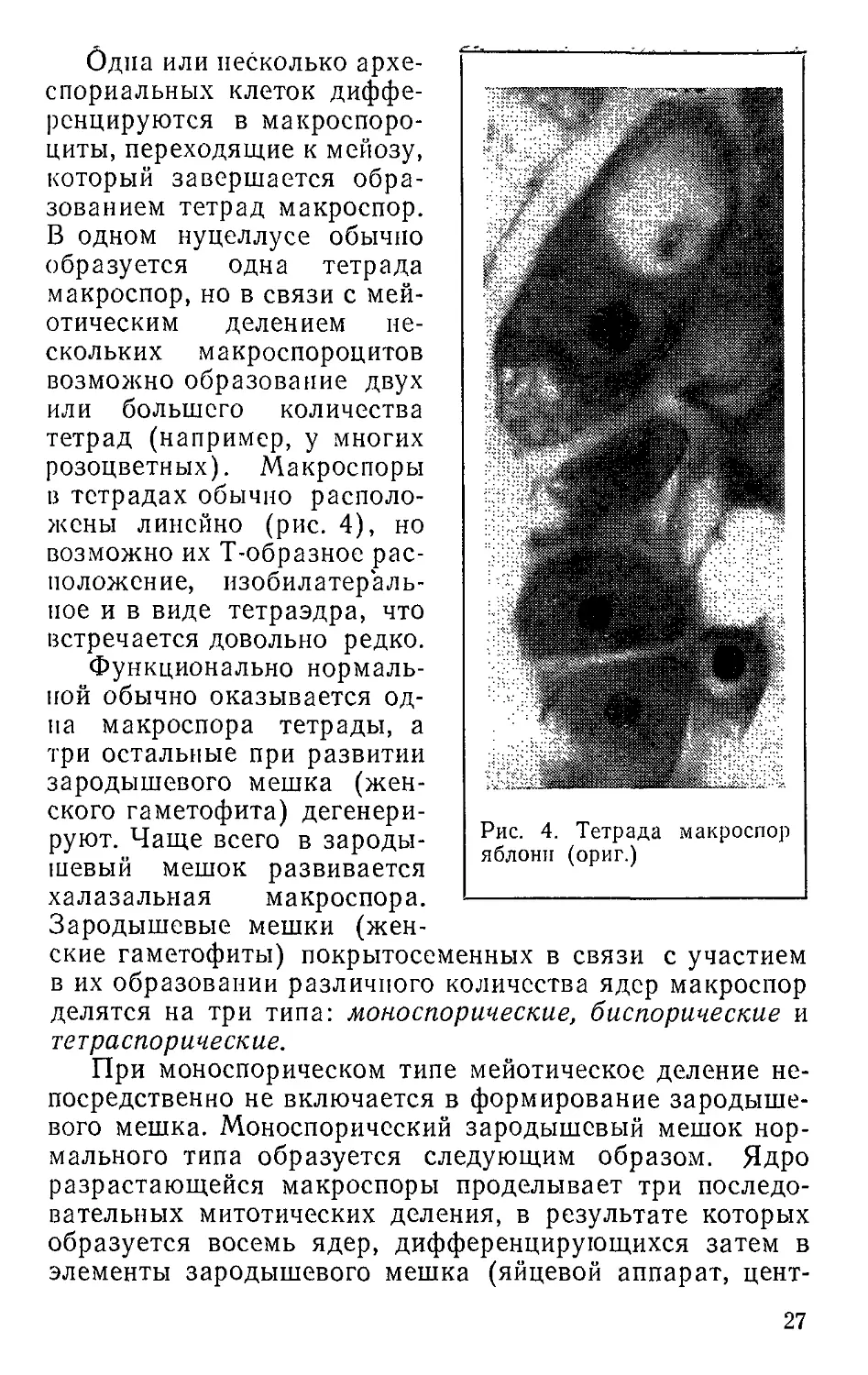
Одна или несколько архе-
спориальных клеток диффе-
ренцируются в макроспоро-
циты, переходящие к мейозу,
который завершается обра-
зованием тетрад макроспор.
В одном нуцеллусе обычно
образуется одна тетрада
макроспор, но в связи с мей-
отическим делением не-
скольких макроспороцитов
возможно образование двух
или большего количества
тетрад (например, у многих
розоцветных). Макроспоры
в тетрадах обычно располо-
жены линейно (рис. 4), но
возможно их Т-образное рас-
положение, изобилатераль-
пое и в виде тетраэдра, что
встречается довольно редко.
Функционально нормаль-
ной обычно оказывается од-
на макроспора тетрады, а
три остальные при развитии
зародышевого мешка (жен-
ского гаметофита) дегенери-
руют. Чаще всего в зароды-
шевый мешок развивается
халазальная макроспора.
Зародышевые мешки (жен-
ские гаметофиты) покрытосеменных в связи с участием
в их образовании различного количества ядер макроспор
делятся на три типа: моноспорические, биспорические и
тетраспорические.
При моноспорическом типе мейотическое деление не-
посредственно не включается в формирование зародыше-
вого мешка. Моноспорический зародышевый мешок нор-
мального типа образуется следующим образом. Ядро
разрастающейся макроспоры проделывает три последо-
вательных митотических деления, в результате которых
образуется восемь ядер, дифференцирующихся затем в
элементы зародышевого мешка (яйцевой аппарат, цент-
27
Тил зародышевого мешка Материн- ская кпетка макроспор Деление Зрепый зароды- шевый мешок
/ // /// /и и
Нормальный тип (Polygonum) 0 © © “(О 0
Oenothera-mun 0_ © (Г> 0 0
Altlum-mun 0 © © 0 1о 0 1 \£_0/
Weddeltlna-mun 0 © © ©
frltlltarla-mun 0 © © ©
Brusa-mun 0 © 0 ($) о© оо/ \о оо У
Pyrethrum-mun 0 © @ /ъооо 7S Г О ООО ОС\ kftfo °у i
Peperomla-mun 0 © 0 й © ж ©
Penaea-mun 0 0 © © /88\ IOOOOI loooo
Gunnera-mun 0 © © 0 Q @
Anthemls-mun 0 © 0 0 /6 с>\ оо L3
Plumbagella-mun 0 © 0 0 (D
Plumbago-mun 0 0 © @ /*ЕГ\ \f3jy
Adoxa-mun 0 © © 0 ©
Tullpa- tetrapliyllg-mun 0 0 © /ооо\ I 0 0
Tullpa- erlostemon-mun 0 0 /о"о\ и ©
ральные ядра и антиподы). Этот тип развития зародыше-
вого мешка называется еще Polygonum, поскольку пер-
вое его подробное описание было дано Э. Страсбургером
в 1879 г. на примере представителя данного рода. Нор-
мальным он называется потому, что обнаружен у боль-
шинства изученных покрытосеменных.
При развитии биспорических зародышевых мешков
после первого мейотического деления только одна клет-
ка диады делится дальше, а вторая дегенерирует. После
второго мейотического деления клеточная перегородка
не образуется и в результате имеется двухъядерный заро-
дышевый мешок. Происходит два митотических деления
его ядер и затем начинается дифференцировка его эле-
ментов как и у нормального типа.
В образование тетраспорических зародышевых меш-
ков подключаются оба мейотических деления, после ко-
торых не образуется клеточных стенок. Затем ядра могут
проделывать различное количество митотических делений
и возможны даже объединения ядер с увеличением пло-
идности. Тетраспорические зародышевые мешки доволь-
но разнообразны и могут быть 8- и 16-ядерными.
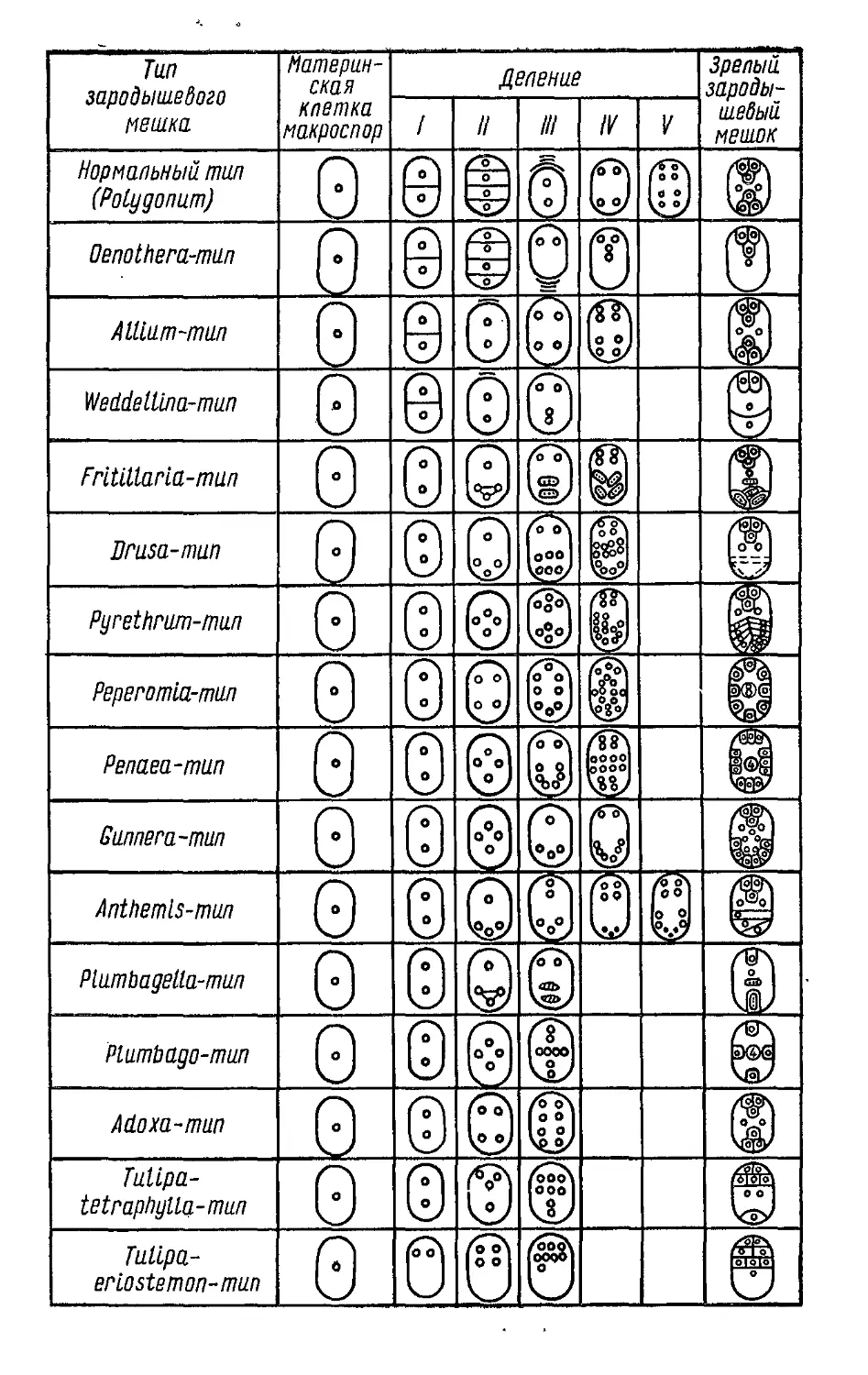
Классификации типов зародышевых мешков покры-
тосеменных обычно строились на основе следующих кри-
териев: количество ядерных делений, начиная от макро-
спороцита до зрелого зародышевого мешка; количество
макроспор, участвующих в образовании зародышевого
мешка; количество ядер и клеток, входящих в состав за-
родышевого мешка. Наиболее подробная классификация
типов зародышевых мешков покрытосеменных была
предложена И. Д. Романовым (1945) (рис. 5).
Зрелый зародышевый мешок нормального типа вклю-
чает: яйцевой аппарат, состоящий из яйцеклетки и двух
синергид; полярные ядра, находящиеся в центре полости
зародышевого мешка или ближе к яйцевому аппарату;
антиподы, которых обычно три, но у некоторых видов
растений в результате митотических делений клеток ан-
типод их количество может увеличиться до нескольких
десятков и даже сотен (например, у бамбука до 300).
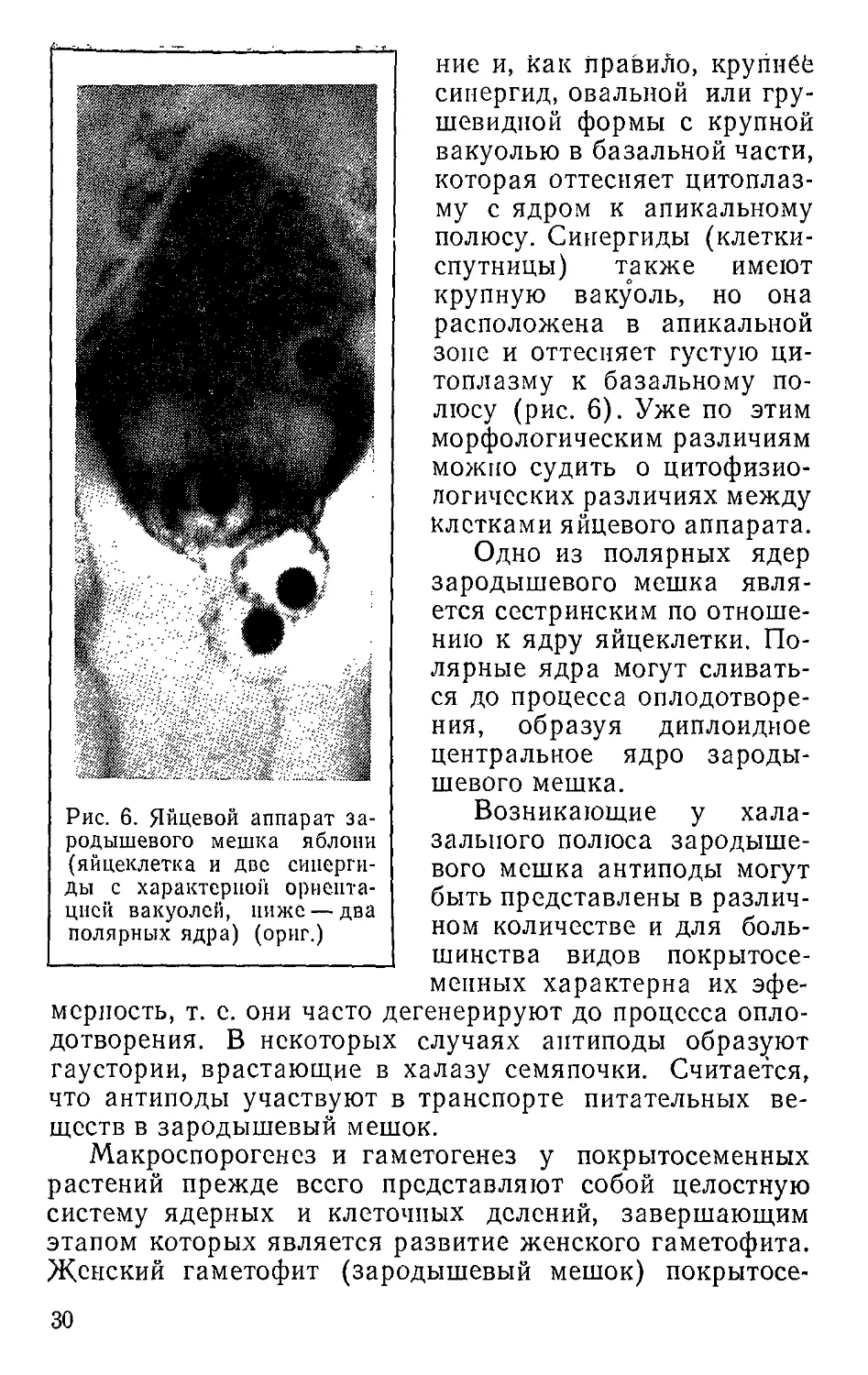
Клетки яйцевого аппарата имеют определенную мор-
фологию. Яйцеклетка обычно занимает среднее положе-
Рис. 5. Классификация типов зародышевых мешков (по Романову,
1945)
29
Рис. 6. Яйцевой аппарат за-
родышевого мешка яблони
(яйцеклетка и две сипергн-
ды с характерной ориента-
цией вакуолей, ниже — два
полярных ядра) (орнг.)
ние и, как правиЛо, крупнёб
синергид, овальной или гру-
шевидной формы с крупной
вакуолью в базальной части,
которая оттесняет цитоплаз-
му с ядром к апикальному
полюсу. Синергиды (клетки-
спутницы) также имеют
крупную вакуоль, но она
расположена в апикальной
зоне и оттесняет густую ци-
топлазму к базальному по-
люсу (рис. 6). Уже по этим
морфологическим различиям
можно судить о патофизио-
логических различиях между
клетками яйцевого аппарата.
Одно из полярных ядер
зародышевого мешка явля-
ется сестринским по отноше-
нию к ядру яйцеклетки. По-
лярные ядра могут сливать-
ся до процесса оплодотворе-
ния, образуя диплоидное
центральное ядро зароды-
шевого мешка.
Возникающие у хала-
залыюго полюса зародыше-
вого мешка антиподы могут
быть представлены в различ-
ном количестве и для боль-
шинства видов покрытосе-
менных характерна их эфе-
мерность, т. е. они часто дегенерируют до процесса опло-
дотворения. В некоторых случаях антиподы образуют
гаустории, врастающие в халазу семяпочки. Считается,
что антиподы участвуют в транспорте питательных ве-
ществ в зародышевый мешок.
Макроспорогенез и гаметогенез у покрытосеменных
растений прежде всего представляют собой целостную
систему ядерных и клеточных делений, завершающим
этапом которых является развитие женского гаметофита.
Женский гаметофит (зародышевый мешок) покрытосе-
30
менных полностью превратился во внутренний орган спо-
рофита и крайне редуцировался, сохранив лишь клетки и
ядра, обусловливающие процесс оплодотворения. Это бы-
ло принципиально новым в историческом развитии рас-
тений.
Гаметогенез у животных
У кишечнополостных и некоторых других животных че-
редуются половое и бесполое поколения, что внешне на-
поминает жизненный цикл растений. Большинство жи-
вотных размножается только половым путем и имеет
постоянные половые органы. Правда, некоторые низшие
животные являются гермафродитами, т. е. у одной и той
же особи одновременно есть семенники и яичники. В ряде
случаев такие особи способны к самооплодотворению, но
для большинства гермафродитных форм характерно не
самооплодотворение, а оплодотворение в результате ко-
пуляции двух особей (например, дождевые черви). Часто
самооплодотворение гермафродитных форм исключается
асинхронным развитием семенников и яичников. У жи-
вотных мужские половые клетки (гаметы) — сперматозо-
иды — формируются в семенниках, а женские гаметы —
яйцеклетки — образуются в яичниках.
У большинства позвоночных семенники состоят из се-
менных канальцев, окруженных соединительной тканью
и разделенных рыхлой интерстициальной тканью, клетки
которой, по-видимому, продуцируют гормоны, регулиру-
ющие развитие вторичных мужских половых признаков.
Семенные канальцы состоят из различных типов клеток
и в их внутренних стенках располагаются зачатковые по-
ловые клетки. Они в определенный момент начинают рас-
ти и перемещаться от периферии к центру канальцев,
переходя к митотическому делению, в результате чего
образуются клетки, называемые сперматогониями.
Сперматогонии растут и после многократных митоти-
ческих делений образуют сперматоциты, переходящие к
мейозу, два последовательных деления которого завер-
шаются образованием гаплоидных клеток — сперматид,
дифференцирующихся затем в сперматозоиды (рис. 7).
У животных два последовательных деления мейоза часто
называют делениями созревания. Таким образом, из
31
Рис. 7. Схема сперматогенеза:
/ — первое мейотичсское деление; 2— второе мейотнческое деление; 3 —
сперматозоиды
Рис. 8. Схема строения сперматозоида млекопитающих (из Боде-
мсра, 1971):
а —головка; б —шейка; в — средняя часть; г — хвост; д — нити; 1 — акро-
сома (активирующая функция); 2 — головной чехлик; 3 — ядро (генетиче-
ская функция); 4 — проксимальная центриоль; 5 — дистальная центриоль;
6—митохондриальная спираль (литаболическая функция); 7 — нити (дви-
гательная функция)
каждого диплоидного сперматоцита образуются четыре
гаплоидные сперматиды, каждая из которых превращает-
ся в сперматозоид. Гаметогенез осуществляется на про-
тяжении всего периода половой зрелости мужской особи.
Четкая последовательность стадий сперматогенеза
обеспечивается регуляторными механизмами, являющи-
мися внутренними и внешними относительно семенников.
Например, функционирование семенников у позвоночных
32
регулируется эндокринными железами и прежде всего
гипофизом.
Морфология сперматозоидов представителей различ-
ных классов животных очень разнообразна. Однако для
всех их характерны и общие черты, обеспечивающие их
способность к выживанию и оплодотворению. Общая ор-
ганизация сперматозоида сводится к следующему. Спер-
матозоид имеет четыре основные части: головку, шейку,
среднюю часть и хвост (рис. 8). Головка состоит из акро-
сомы и ядра. Акросома формируется из элементов комп-
лекса Гольджи сперматиды, представляет собой ком-
пактное тело, образующее двухслойную мембрану, час-
тично покрывающую ядро. Это так называемый головной
чехлик сперматозоида. Акросома обеспечивает проникно-
вение сперматозоида в яйцеклетку и активацию послед-
ней. В некоторых случаях, например у ряда морских бес-
позвоночных, в момент контакта сперматозоида с
яйцеклеткой акросома образует акросомную нить, фик-
сирующую сперматозоид на поверхности яйцеклетки.
Ядро сперматозоида содержит компактно упакован-
ные дезоксирибонуклеопротеиды за счет обезвоживания
и максимальной их спирализации. По-видимому, такая
компактная упаковка ДНП, а точнее, гаплоидного набо-
ра хромосом, связана с особой группой белков — прота-
минами и ее значение сводится почти к полной инактива-
ции генетического материала.
В шейке сперматозоида имеются проксимальная и ди-
стальная центриоли, расположенные под прямым углом
друг к другу. Проксимальная центриоль, по-видимому,
стимулирует к делению оплодотворенную яйцеклетку, а
из дистальной центриоли образуется осевая нить хвоста
сперматозоида.
В средней части сперматозоида сконцентрированы ми-
тохондрии, образующие компактные скопления, равно-
мерно распределяющиеся в средней части или окружаю-
щие плотной спиралью дистальную центриоль и прокси-
мальную часть осевой нити хвоста (митохондриальная
спираль). Как известно, митохондрии являются «энерге-
тическими станциями» клетки, поскольку в них осущест-
вляется освобождение и утилизация энергии химических
связей в виде макроэргических связей молекул АТФ за
счет процессов окислительного фосфорилирования. Сле-
довательно, средняя часть сперматозоида обеспечивает
3 Зак. 918
33
энергетическую и метаболическую активность спермато-
зоида.
Основой хвоста сперматозоида является осевая нить,
окруженная небольшим количеством цитоплазмы и кле-
точной мембраной. На поверхности хвоста (жгутика)
сперматозоидов млекопитающих есть спиральная нить
(кортикальная спираль), а сперматозоиды некоторых ам-
фибий имеют тонкую пластинку вроде плавника. Вообще,
морфология хвоста сперматозоидов довольно разнообраз-
на. Так, у рыб дополнительные тонкие нити, окружающие
осевую нить, сливаясь, образуют так называемую унду-
лирующую мембрану. Все отмеченные морфологические
особенности есть адаптации, обеспечивающие движение
сперматозоидов в различных средах и на различное рас-
стояние. Лишь сперматозоиды некоторых беспозвоночных
лишены хвоста.
Жизнеспособность сперматозоидов и продолжитель-
ность сохранения ими оплодотворяющей способности за-
висят от многих факторов, прежде всего от концентрации
спермы, которая в норме должна быть в виде густой взве-
си. При разбавлении последней сперматозоиды обычно
утрачивают свою оплодотворяющую способность. Важ-
ным фактором оказывается и концентрация водородных
ионов в среде. Например, в щелочной среде сперматозо-
иды становятся более активными, но довольно быстро
исчерпывают свой запас энергии и погибают. В практике
животноводства широко используется искусственное осе-
менение и в связи с этим исследуются цитофизиологиче-
ские особенности сперматозоидов с целью сохранения их
жизнеспособности. Было предложено много различных
сред для хранения семенной жидкости в течение длитель-
ного времени. Особое значение имеет температура. Даже
у теплокровных животных сперматозоиды дольше сохра-
няют активность при более низкой температуре. Сущест-
венное значение имеет и скорость охлаждения. Например,
при добавлении к сперме млекопитающих 10—20%-ного
глицерина и замораживании при —79°, —196° она сохра-
няла свою оплодотворяющую способность в течение дли-
тельного времени (в некоторых случаях до шести лет).
Оогенез происходит в яичниках и первоначальные его
стадии принципиально не отличаются от первоначальных
стадий сперматогенеза. Существенные различия появля-
ются в период развития яйцеклетки. Общая схема оогенеза
34
I
довольно проста. В Яичниках об-
разуются оогонии, количество ко-
торых увеличивается в результа-
те ряда митотических делений.
Оогонии дифференцируются в
ооциты первого порядка, образу-
ющие после первого мейотическо-
го деления ооциты второго поряд-
ка и полярные тельца. Два после-
довательных мейотических деле-
ния каждого ооцита первого по-
рядка завершаются образованием
лишь одной яйцеклетки и трех по-
лярных, или направительных, те-
лец, которые впоследствии деге-
нерируют (рис. 9). Интересно, что
у растений, как уже отмечалось,
макроспорогенез в норме завер-
шается образованием одной мак-
роспоры, дающей начало женско-
му гаметофиту, а три макроспоры
дегенерируют. По-видимому, это
обусловлено более рациональным
использованием питательных ве-
ществ, необходимых для развития
женского гаметофита и яйце-
клетки.
Рост яйцеклетки определяется
интенсивным биосинтезом различ-
ных соединений. В период роста
яйцеклетка значительно увеличи-
вается в размерах. Так, диаметр
большинства исходных половых
клеток составляет примерно
10 мкм, а зрелые яйцеклетки у не-
которых амфибий достигают
в диаметре 2000 мкм, у птиц —
40 000 мкм, а у млекопитающих — до 200 мкм. Увеличе-
ние размеров яйцеклеток прежде всего обусловлено ви-
теллогенезом, т. е. образованием желтка — обычной фор-
мы питательных веществ в яйце.
Желток накапливается в яйце в виде желточных гра-
нул и состоит в основном из белков, фосфолипидов и ней-
Рис. 9. Схема
оогенеза:
/ — ооцит первого по-
рядка; 2 — первое по-
лярное тельце; 3 —
ооцит второго поряд-
ка; 4 — вторая мета-
фаза митоза; 5—
вторичные полярные
тельца; 6 — яйце-
клетка
3*
35
тральных жиров. Например, в зрелом яйце амфибий бел-
ковая часть желтка составляет примерно 45% сухого
веса яйца, липиды —2% и гликоген — около 8%. Жел-
точные гранулы могут находиться в цитоплазме яйца (у
многих беспозвоночных, низших хордовых и амфибий)
или могут быть в различной степени обособлены от цито-
плазмы (например, у многих костистых рыб, пресмыка-
ющихся и птиц).
Неясным остается вопрос о том, какие клеточные
структуры принимают непосредственное участие в обра-
зовании желтка. По многочисленным данным, одна из
форм желточных гранул образуется при непосредствен-
ном участии модифицированных митохондрий ооцитов.
Некоторые компоненты желтка возникают вне ооцита и
поступают в него через кровь, формируясь затем в жел-
точные гранулы. Имеются данные, по которым часть бел-
ков и фосфолипидов яйца синтезируется в печени, а затем
переносится в ооцит. Количественными авторадиографи-
ческими исследованиями на птицах было показано, что
процесс роста и созревания яйца не является полностью
автономным и зависит от функционирования тканей ряда
органов. Подобное отмечалось и для беспозвоночных жи-
вотных. Например, в связи с наличием у насекомых двух
типов яйцевых трубок некоторые авторы (Дэвидсон,
1972) считают возможным выделить и два типа оогенеза,
исходя из характера связи ооцитов с окружающими их
клетками: 1) мероистический оогенез, когда ооциты по-
лучают различные соединения непосредственно через
систему специальных канальцев от так называемых пита-
ющих клеток, которые образуются из части первичных
оогониальных клеток; 2) паноистический оогенез, когда
биосинтетические процессы в период роста и созревания
ооцита почти полностью осуществляются им самим. По-
следний тип оогенеза отмечен и для большинства позво-
ночных животных.
Для животных характерны два способа питания яй-
цеклеток в яичниках: солитарный и алиментарный.
В первом случае питание яйцеклеток осуществляется
осмотическим путем, а во втором оно происходит за счет
особых клеток. Алиментарный тип наиболее распростра-
нен и включает нутриментарный и фолликулярный спо-
собы питания яйцеклеток. При нутриментарном способе
яйцеклетки поглощают питающие клетки, а при фолли-
36
кулярном — специальные фолликулярные клетки яични-
ка образуют эпителиальные покровы (фолликулярный
эпителий) отдельных ооцитов.
После завершения яйцом роста и накопления в нем
необходимого запаса желтка оно готово к овуляции, вре-
мя которой непосредственно связано с циклом размно-
жения каждого вида животных, а сам процесс контроли-
руется многими внешними и внутренними факторами.
У животных, цикл размножения которых в большей сте-
пени зависит от условий внешней среды (определенной
температуры, освещенности, пищи и т. д.), овуляция ин-
дуцируется в течение непродолжительного периода в
определенный сезон. У многих животных процесс овуля-
ции в меньшей степени зависит от внешних факторов и
определяется главным образом внутренними факторами,
обеспечивающими независимый от времени года ритм
овуляции (один раз в день, в пять дней, в месяц или дру-
гой промежуток времени). Правда, имеется много откло-
нений от такой ритмичной спонтанной овуляции, и у мно-
гих животных дозревание яйца и его выход из яичника
индуцируются спариванием и непосредственным присут-
ствием спермы в половых путях (например, у ряда птиц,
хорька, кошки, кролика и др.).
Общую схему овуляции рассмотрим на примере ам-
фибий и млекопитающих. Так, довольно крупный яичник
лягушки содержит около 2000 яиц, достигающих почти
2 мм в диаметре и окруженных фолликулярными оболоч-
ками. После завершения роста яйца освобождаются из
фолликулов и попадают в полость тела (целом), которая
выстлана тонким слоем перитонеальных клеток с рес-
ничками. Ритмичное движение ресничек «перегоняет»
яйца из яичника к воронке яйцевода. Проходя через яй-
цевод, яйцо покрывается несколькими слоями студени-
стой оболочки и затем попадает в расширенную часть
яйцевода, или матку. В матке собирается около 2000 яиц
и вся их масса откладывается самкой в момент выделе-
ния спермы самцом. После овуляции в яичнике начина-
ется деление и рост первичных половых клеток, которые
созревают в следующем году.
У млекопитающих каждое яйцо созревает в фоллику-
ле. В процессе роста фолликула в нем образуется по-
лость, куда затем попадает яйцо. После созревания ова-
риального фолликула определенные места его стенки
37
(стигмы) разрываются и яйцо, окруженное некоторым
количеством фолликулярных клеток, попадает в полость
тела. У млекопитающих воронка яйцевода (фаллопиевой
трубы) располагается около яичника. Реснички клеток
внутренней поверхности яйцевода обеспечивают передви-
жение яиц. Оплодотворение у млекопитающих происхо-
дит в яйцеводе. После овуляции разрушенный овариаль-
ный фолликул сокращается и в результате деления фол-
ликулярных клеток образуется так называемое желтое
тело. Желтое тело некоторое время увеличивается в раз-
мере, но если оплодотворение не происходит, оно доволь-
но быстро дегенерирует, а в другом участке яичника на-
чинает расти новый фолликул. При наступлении бере-
менности желтое тело сохраняется, и новые фолликулы
образуются лишь после родов.
Последовательность тесно взаимосвязанных стадий
оогенеза и овуляции находится под контролем внутрен-
них и внешних факторов. Из внутренних факторов особое
значение имеет гормональная регуляция. Так, у позво-
ночных животных функции яичника и процесс овуляции
во многом определяют гонадотропные гормоны, выделя-
емые гипофизом, а регулируемая секреция этих гормонов,
по-видимому, определяет особенности овариального цик-
ла и овуляции.
Для овариального цикла млекопитающих характерны
два четко обособленных процесса: рост фолликула, за-
вершающийся овуляцией, и образование желтого тела.
Эти процессы регулируются тремя гонадотропными гор-
монами, продуцируемыми гипофизом: 1) фолликулости-
мулирующим (ФСГ), индуцирующим рост овариальных
фолликулов; 2) лютеинизирующим (ЛГ), который сов:
местно с ФСГ определяет созревание фолликула, овуля-
цию и образование желтого тела; 3) лютеотропным
(ЛТГ), ответственным за секрецию молока и поддержа-
ние желтого тела в секретирующем состоянии.
Периодичность активности яичника нельзя объяснять
только влиянием гонадотропных гормонов гипофиза, так
как на гипофиз действуют два гормона яичника — эстро-
ген и прогестерон. Механизм этого совместного действия
двух гормонов яичника и трех гормонов гипофиза еще не
совсем ясен, но в общих чертах его представляют следу-
ющим образом. Гормон гипофиза ФСГ, действуя совмест-
но с небольшим количеством ЛГ, индуцирует рост фолли-
38
куда и образование эстрогена в яичнике. Эстроген дейст-
вует на гипофиз, стимулируя секрецию ЛГ и ЛТГ и
ингибируя секрецию ФСГ. При этом происходит овуляция
и образование желтого тела. Функционирование желтого
тела, продуцирующего прогестерон, стимулируется ЛТГ.
Если оплодотворение не состоялось и желтое тело деге-
нерирует, количество гормонов яичника резко уменьша-
ется, а в гипофизе усиливается образование ФСГ, что
приводит к повторению овариального цикла. При бере-
менности желтое тело сохраняется, рост новых фолли-
кулов и овуляция блокируются, а регуляторные функции
от гормонов яичника передаются плацентарным гор-
монам.
Как и сперматогенез, оогенез у некоторых животных
зависит от внешних факторов и прежде всего от светового
режима. Особенности фотопериодичности полового цикла
были хорошо изучены на примере многих видов живот-
ных. Различные отклонения в цикле размножения живот-
ных многократно описывались при их акклиматизации, и
интересная информация была получена в опытах по изу-
чению фотопериодизма. Например, при изменении свето-
вого режима в экспериментах у мышей и крыс изменя-
лось время овуляции. Непрерывное освещение животных
может привести к почти полному подавлению овуля-
ции. Знание особенностей реакции животных различных
видов на световой режим позволяет управлять половым
циклом, что бывает необходимо в животноводстве и зве-
роводстве. Световой режим имеет немаловажное значе-
ние и для человека. Например, высказывается предполо-
жение, что наблюдающийся в последние десятилетия
процесс акселерации, т. е. более раннее созревание, в
значительной степени обусловлен изменениями в свето-
вом режиме в связи с широким использованием электри-
ческого освещения.
Влияние света на половые циклы, по-видимому, обус-
ловлено не прямым его действием на семенники и яич-
ники, а действием через гипофиз. Экспериментально было
показано, что у животных с удаленным гипофизом не об-
наруживалось заметного влияния светового режима на
половые железы. Влияние света на организм начинается
с момента его восприятия органом зрения (глазом), пе-
редача световых раздражений другим органам и систе-
мам происходит при непосредственном участии зритель-
39
ного нерва. Так, при перерезке зрительного нерва дейст-
вие света на половой цикл прекращается. Результаты
многих наблюдений и опытов позволяют заключить, что
под действием света возникает рефлекс, дуга которого
проходит через глаз, зрительный нерв и мозговые центры,
а рефлекторное выделение гонадотропных гормонов при-
водит к повышению активности яичников или семенни-
ков. Следует отметить, что фотопериодичность полового
цикла не в одинаковой степени выражена у различных
представителей животного мира .и есть виды животных,
которые в меньшей степени или совсем не зависят от све-
тового режима. Обычно это связано с наличием дополни-
тельных механизмов внутренней регуляции сперматоге-
неза и оогенеза. Конечно, человек меньше зависит в этом
плане от светового режима, чем некоторые представители
животного мира.
У высших животных особое значение в регуляции
сперматогенеза и оогенеза имеет нервная система. Хоро-
шо, например, известно, что нервная система тесно связа-
на с регуляцией деятельности гипофиза. Нервные волок-
на идут от ядер гипоталамуса через ножку гипофиза к
особой его части — нейрогипофизу, который непосредст-
венно не связан с продуцированием гонадотропных гор-
монов. Доказано, что функциональная связь между эти-
ми двумя структурами устанавливается по венозной си-
стеме (воротной системе гипофиза), представляющей со-
бой структурную основу гуморальной регуляции функции
гипофиза.
Продуцирование ФСГ и ЛГ гипофизом и закономер-
ные изменения уровня их секреции в различные периоды
полового цикла, по-видимому, регулируются нейрогумо-
ральной активностью гипоталамуса, дифференцирован-
ного на центры, стимулирующие и подавляющие про-
дуцирование соответствующих гонадотропных гор-
монов.
Как отмечалось раньше, у некоторых животных ову-
ляция обычно начинается после спаривания. Было пока-
зано, что стимуляция центральной нервной системы в мо-
мент спаривания приводит к освобождению гипоталами-
ческого нейрогуморального фактора, вызывающего
секрецию Л Г в количестве, достаточном для индукции
овуляции. Например, при удалении гипофиза у кролика
через час после спаривания овуляция не подавлялась, а
40
при удалении его сразу же после спаривания овуляция
подавлялась. На кроликах и кошках было показано, что
>лсктрическая стимуляция гипоталамуса может вызвать
овуляцию.
Таким образом, сперматогенез и оогенез регулируют-
ся сложной системой внутренних и внешних факторов,
познание специфических особенностей действия которых
позволит разработать эффективные методы управления
ггими процессами.
Необходимо обратить внимание на то, что переход к
внутреннему оплодотворению и внутриутробному разви-
тию в ходе исторического развития животных сопровож-
дался появлением многих адаптаций, гарантирующих
снижение частоты аномалий в процессе гаметогенеза,
оплодотворения и эмбриогенеза.
Исключительно важным моментом в гаметогенезе яв-
ляются мейотические деления, обеспечивающие переход
к гаплоидному состоянию. При нарушении действия си-
наптических сил, обусловливающих конъюгацию гомоло-
гичных хромосом, а также при неравномерном расхожде-
нии гомологичных хромосом в анафазе I будут образо-
вываться аномальные гаметы, что исключает зарождение
или развитие нормального потомства. Следовательно,
подготовка к мейозу и его осуществление должны про-
исходить в относительно стабильных условиях, гаран-
тирующих наименьшую частоту возможных нарушений.
В ходе исторического развития у некоторых животных
возникли адаптации, обеспечивающие относительную
безопасность этого важного периода.
Вопрос о происхождении первичных половых клеток
еще не решен окончательно. Начиная с предложенной
А. Вейсманом во второй половине XIX в. гипотезы «не-
прерывности зародышевой плазмы», предполагалось су-
ществование двух плазм: соматической, участвующей в
развитии тела организма, и зародышевой, передающейся
непрерывно в ряду поколений организмов половыми
клетками, т. е. половые клетки противопоставлялись со-
матическим. А. Вейсману принадлежит и идея о сущест-
вовании материальных частиц наследственности, различ-
ную степень агрегации которых он называл детерминан-
тами, биофорами, идами, идантами и т. д., передающими-
ся из поколения в поколение половыми клетками. Во
время индивидуального развития при делении клеток
’ 41
происходит пересортировка детерминантов с утратой
многих из них соматическими клетками. По мнению
Вейсмана, именно это и определяет дифференцировку
клеток и тканей при развитии многоклеточных организ-
мов. Половые же клетки сохраняют полный набор детер-
минантов и поэтому они способны дать начало целому
организму. Многие эмбриологи того времени разделяли
гипотезу А. Вейсмана и были склонны противопоставлять
половые клетки соматическим. Например, В. Ру под вли-
янием этой гипотезы рассматривал зародыш как «мозаи-
ку бластомеров».
Согласно современным представлениям о половых
клетках, их нельзя противопоставлять соматическим
клеткам, хотя они и имеют некоторые цитогенетические
особенности, поскольку предназначены для передачи на-
следственной информации в ряду поколений организмов.
В ходе онтогенеза они появляются в результате диффе-
ренцировки, как и любые другие клетки.
Многочисленные данные по изучению дифференциров-
ки половых клеток у филогенетически различных групп
животных позволяют заключить, что они могут появлять-
ся в различные периоды эмбриогенеза. Например, у
некоторых животных (насекомые, аскариды, амфибии) на-
чало дифференцировки клеток зародышевого пути уда-
валось наблюдать, начиная с прегаструляционного пери-
ода (после первого деления дробления у аскариды и на
стадии восьми или большего количества клеток в других
случаях). У высших позвоночных первичные половые
клетки начинают дифференцироваться ко времени гаст-
руляции.
Таким образом, дифференцировка половых клеток
происходит в эмбриогенезе рано и они уже имеются к
стадии гаструлы. Дальнейшая их судьба у различных
групп организмов различна. Так, у первично- и вторично-
ротых (кроме некоторых иглокожих и хордовых) пер-
вичные половые клетки зародышей мигрируют к образу-
ющейся гонаде и можно сказать, что половые клетки го-
над являются их прямыми потомками.
У некоторых костистых рыб и амфибий деление оого-
ниев и образование новых ооцитов продолжаются и после
достижения половой зрелости, т. е. периодическое повто-
рение всего цикла оогенеза осуществляется на протяже-
нии всего периода половой зрелости.
42
Высшие позвоночные животные в этом отношении су-
щественно отличаются от низших. Все ооциты образуются
у них во время эмбриогенеза, и в постэмбриональный
период их дифференцировки не происходит, т. е. после
рождения животного исключается образование новых
оогониев и ооцитов. Интересно отметить, что подобное
происходит и с нервными клетками. Более того, у птиц
и млекопитающих во время эмбрионального развития все
ооциты первого порядка переходят к мейозу, который к
периоду рождения животного блокируется на стадии па-
хитены — диплотены. Следовательно, в течение ювениль-
ного и зрелого периодов онтогенеза ооциты в яичниках
высших позвоночных находятся в профазе I.
Период блокирования мейоза ооцитов в профазе I на-
зывают диктиатенной стадией, или диктиатой. Причины
его пока неизвестны. Диктиатенная стадия мейоза может
продолжаться от нескольких недель до нескольких десят-
ков лет. Этот блок профазы I периодически снимается с
некоторых ооцитов, тогда завершается оогенез и проис-
ходит овуляция в соответствии с периодами нереста, яй-
цекладки или цикла овуляции. Снятие блока, по-видимо-
му, обусловлено действием соответствующих гормонов и
механизмами нейрорегуляции.
Рядом авторов на птицах и млекопитающих было по-
казано, что к периоду диктиаты в ядрах ооцитов завер-
шается синтез ДНК, т. е. завершается основной процесс
репликации хромосом. К данному периоду завершается
также конъюгация гомологичных хромосом, которые на
долгое время остаются в спаренном состоянии, и, по-ви-
димому, при этом осуществляется кроссинговер.
Для ооцитов человека, вероятно, также характерна
стадия диктиаты, хотя в типичном виде ее пока не удава-
лось наблюдать. Диплотена профазы I наступает после
рождения и блокируется. Блокировка диплотены может
продолжаться более 40 лет. На этой стадии обнаружены
хромосомы типа «ламповых щеток», что указывает на их
особое функциональное состояние. У человека, как и у
большинства позвоночных животных, в течение продол-
жительного периода диплотенной стадии количество
ооцитов резко уменьшается. Так, по данным Т. Бекера
(1963), у девочек к семилетнему возрасту число ооцитов
в популяции снижается от 2 • 106 в конце пахитены Про-
фазы I, которая заканчивается в яичниках семимесячно-
43
го эмбриона, примерно до 0,3 • 106. Следовательно, коли-
чество ооцитов в популяции составляет всего около 5%
от максимального числа половых клеток (6,8- 105), со-
держащихся в яичнике зародыша на пятом месяце бере-
менности. За период половой зрелости женщины созре-
вает примерно 400—500 ооцитов и созревание происхо-
дит ежемесячно.
Блокировка профазы I в эмбриональный период раз-
вития высших позвоночных и человека явно имеет адап-
тивное значение. Как уже отмечалось, важнейшие явле-
ния мейоза — конъюгация гомологичных хромосом и
кроссинговер. Именно эти процессы оказываются под за-
щитой материнского организма, что гарантирует меньше
аномалий при образовании женских гамет (яйцеклеток).
В постэмбриональный период организм подвержен раз-
нообразным воздействиям постоянно изменяющихся ус-
ловий внешней среды, что явно увеличивает частоту об-
разования аномальных гамет. Обеспечив надежность
происхождения наиболее ответственных стадий мейоти-
ческого цикла, данное приспособление позволило сокра-
тить количество развивающихся ооцитов в период поло-
вой зрелости высших позвоночных, что всегда связано
с большими материальными и энергетическими затра-
тами.
По мужской линии у высших позвоночных и человека
подобного приспособления нет. Конечно, и в ходе спер-
матогенеза возможны различные аномалии, частота ко-
торых может быть значительной и находится в прямой
зависимости от характера воздействия на мужской орга-
низм различных факторов внутренней и внешней среды
(особенно от воздействия физических и химических фак-
торов). У мужских организмов особо важным в данном
случае является исключительная многочисленность про-
изводимых гамет. Например, за время половой зрелости
в семенниках мужчины производится не менее 500 млрд,
сперматозоидов, среди которых с большей или меньшей
частотой появляются цитофизиологически и кариологи-
чески аномальные сперматозоиды. Если учесть, что при
каждом половом акте выделяется несколько миллионов
сперматозоидов, становится понятным существование не-
ограниченных возможностей отбора генетически и функ-
ционально нормальных мужских гамет при оплодотворе-
нии.
44
Эмбриональное развитие
Глава 2 растений
Процесс оплодотворения
Процессу оплодотворения у покрытосеменных предшест-
вует опыление, т. е. попадание пыльцы на рыльце стол-
бика завязи. Известны два типа опыления: самоопыле-
ние и перекрестное. Каждый тип опыления связан с ком-
плексом своеобразных адаптаций, гарантирующих
попадание пыльцы на рыльце столбика.
Разнообразны способы переноса пыльцы при пере-
крестном опылении. Покрытосеменные в ходе историче-
ского развития, кажется, реализовали все возможные
способы переноса пыльцы, использовав ветер, воду, насе-
комых, птиц и других животных. Поэтому цветок и его
части имеют разнообразные морфологические особенно-
сти. Отметим, что ветроопыление у покрытосеменных бо-
лее позднего происхождения, чем опыление насекомыми,
и сопровождалось вторичными изменениями в строении
цветка, пестика и пыльцы. Основными тенденциями при
этом были: упрощение строения цветка, уменьшение ко-
личества семяпочек в завязи и быстрое развитие мужско-
го гаметофита.
Прорастание пыльцы на рыльце столбика в большин-
стве случаев стимулируется выделениями его клеток, од-
нако часто пыльца может прорастать на других частях
цветка (на поверхности столбика, завязи и даже вен-
чика).
Продвижение пыльцевой трубки в столбике пестика
может осуществляться по проводящим путям трех типов:
1) каналу, выстланному простым эпидермисом; 2) кана-
лу, окруженному специальной проводящей тканью;
3) сплошной проводящей ткани. Встречается и смешан-
ный тип.
Первыми признаками прорастания пыльцы являются
увеличение ее объема в результате поглощения жидкости
с влажной поверхности рыльца и начало выпячивания
интины из ростовой поры. Большинство пыльцевых зерен
моносифоничны, т. е. прорастают одной пыльцевой труб-
кой, но бывают и полисифоничные пыльцевые зерна (на-
4$
пример, у мальвовых, тыквенных и колокольчиковых).
Рост пыльцевой трубки в известной мере определяется
протяженностью пути и направлением, в котором она
продвигается, чтобы достигнуть зародышевого мешка.
В ряде случаев пыльцевой трубке приходится проделы-
вать длинный путь (до 20 см и более), и справедливо
мнение, что пыльцевое зерно само не может обеспечить
рост пыльцевой трубки. Так, на искусственных средах
при наличии различных веществ, включая" вытяжки из
рылец, еще не удалось получить нормальную длину пыль-
цевых трубок, а вот при подставлении срезанных столби-
ков того же вида удавалось даже удвоить длину пыль-
цевой трубки. Следовательно, для успешного роста
пыльцевой трубки необходим тесный контакт с тканью
столбика.
Путь пыльцевой трубки часто бывает сложным и его
направление от рыльца до верхушки нуцеллуса семяпоч-
ки может изменяться. При росте пыльцевой трубки четко
проявляется отрицательный аэротропизм и положитель-
ный хемотропизм. По-видимому, последний имеет боль-
шее значение для определения направления роста пыль-
цевой трубки, но его механизм остается неизвестным.
Интересно, что при искусственном самоопылении у неко-
торых перекрестников пыльцевая трубка начинает расти
нормально, но затем ее рост прекращается, все содержи-
мое скапливается в конце трубки. При опылении чуже-
родной пыльцой пыльцевые трубки первоначально могут
расти в тканях столбика, но затем рост прекращается или
изменяется его направление. В таких случаях пыльцевая
трубка иногда изгибается под углом 180° и продолжает
расти в противоположном направлении, проявляя отри-
цательный хемотропизм. Во всех случаях для роста пыль-
цевых трубок необходимы оптимальные внутренние и
внешние условия (особенно температура и влажность).
Скорость роста пыльцевых трубок варьирует в зави-
симости не только от вида растений, но и от погодных
условий. Например, при оптимальных условиях у лилии
пыльцевая трубка продвигается в столбике со скоростью
примерно 2 мкм/ч, а у ириса — до 9,5 мкм/ч. У некото-
рых растений (например, у представителей семейства га-
мамелидовых) опыление происходит поздно осенью. К на-
чалу зимы пыльцевые трубки достигают основания семя-
ножки (фоникулуса) и их рост прекращается до
46
наступления весеннего тепла, т. е. оплодотворение про-
исходит примерно через полгода после опыления.
Проникновение пыльцевых трубок в семяпочки обыч-
но происходит через микропиле (пыльцевход). Это про-
гамный способ оплодотворения. У немногих растений
пыльцевые трубки проникают в зародышевый мешок не
через микропиле, а окольным путем через халазу семя-
почки (халазогамия). У халазогамных растений микро-
пиле бывает заросшим. Обычно в зародышевый мешок
проникает одна пыльцевая трубка.
Эмбриологи растений подготовительный период к
оплодотворению разделяют на три этапа: 1) взаимодей-
ствие между пыльцой и пыльцевой трубкой, с одной сто-
роны, рыльцем и столбиком — с другой; 2) взаимодейст-
вие между пыльцевой трубкой и семяпочкой; 3) начало
взаимодействия мужского и женского гаметофитов и их
гамет. К сожалению, нам еще слишком мало известно о
специфических особенностях этих этапов и, по-видимо-
му, они еще более дифференцированы. Вполне справед-
ливой является и мысль о том, что значение пыльцевой
трубки и мужского гаметофита, возможно, не ограничи-
вается доставкой мужских гамет в зародышевый мешок
для их копуляции с яйцеклеткой и центральным ядром,
а гораздо многограннее и сложнее. В связи с этим само
слияние гамет следует рассматривать как завершающий
этап процесса оплодотворения, который начинается с
прорастания пыльцы на рыльце столбика.
Еще в конце XIX в. у ботаников существовало доволь-
но примитивное представление о процессе оплодотворе-
ния у растений. Например, считалось, что мужское ядро
пыльцевой трубки растворяется и ядерное вещество диф-
фундирует в яйцеклетку. Впервые ясность в этот вопрос
внес И. Н. Горожанкин (1883), который исследовал про-
цесс оплодотворения у голосеменных растений. Он по-
казал, что оплодотворение у хвойных совершается не
диффузным путем, а путем непосредственного слияния
ядра спермня с ядром яйцеклетки.
После работ И. Н. Горожанкина Э. Страсбургер пе-
ресмотрел свои представления о процессе оплодотворе-
ния у голосеменных и покрытосеменных. Дав правильное
описание генеративных и вегетативных клеток мужского
гаметофита, он пришел к выводу, что пыльцевая трубка
изливает все свое содержимое в полость зародышевого
47
мешка (ранее он считал, что оплодотворение происходит
вследствие диффузии клеточного сока трубки) и одно из
мужских ядер сливается с ядром яйцеклетки. В резуль-
тате Э. Страсбургер сделал следующие обобщения:
1) процесс оплодотворения включает слияние мужской
гаметы с ядром яйцеклетки; 2) цитоплазма гамет не име-
ет отношения к этому процессу.
Судьба второго спермия долго оставалась неизвест-
ной. Тайну его раскрыл С. Г. Навашин в 1898 г. Он дока-
зал, что второй спермий сливается с полярными ядрами
или центральным ядром зародышевого мешка. Так было
открыто двойное оплодотворение у покрытосеменных
растений, в результате которого возникает зародыш (из
оплодотворенной яйцеклетки) и трофическая ткань —
эндосперм (из оплодотворенного центрального ядра за-
родышевого мешка).
Познание сути двойного оплодотворения открыло но-
вые возможности в изучении процесса оплодотворения
и эмбриогенеза у покрытосеменных. С. Г. Навашин счи-
тал, что оба акта слияния при двойном оплодотворении
равноценны и в результате их начинают развиваться два
зародыша-близнеца: зародыш и эндосперм. Последний
является лишь видоизмененным зародышем. Это пред-
ставление разделяется многими эмбриологами. Однако
имеется и другая точка зрения, по которой лишь слияние
спермия с яйцеклеткой можно считать истинным оплодо-
творением, а слияние спермия с центральным ядром за-
родышевого мешка только имитирует оплодотворение и
развивающийся затем эндосперм принципиально иного
происхождения.
В зародышевый мешок обычно проникает (или вра-
стает) одна пыльцевля трубка. По-видимому, при этом
особое значение имеют синергиды, через одну из которых
и проникает пыльцевая трубка (рис. 10, а). Если ко вре-
мени достижения пыльцевой трубкой яйцевого аппарата
синергиды дегенерировали, рост пыльцевой трубки пре-
кращается или она изменяет его направление (рис. 10, б).
В литературе неоднократно описывались случаи проник-
новения в зародышевый мешок нескольких пыльцевых
трубок (до шести), а также отмечались случаи ди- и по-
лиспермии, т. е. слияние с яйцеклеткой нескольких спер-
миев. Однако пока нет общепризнанного цитогенетиче-
ского объяснения значения этого явления и большинство
48
Рис. 10. Проникновение пыльцевой трубки в зародышевый ме-
шок яблони (ориг.):
а — проникновение пыльцевой трубки через синергнду, которая затем
дегенерирует (вндна зигота и другая синергнда); б — прекращение ро-
ста и образование вздутия конца пыльцевой трубки перед дегенери-
ровавшей синергидой
из предложенных явно спекулятивны. Возможно, содер-
жимое дополнительных пыльцевых трубок может акти-
визировать метаболические процессы в полости зароды-
шевого мешка после оплодотворения.
Относительно возможности самостоятельного движе-
ния спермиев в пыльцевой трубке и полости зародыше-
вого мешка, а также механизма распределения спермиев
между яйцеклеткой и центральным ядром существуют
различные мнения. Одни авторы допускают возможность
активного движения спермиев, а другие считают, что
4 Зак. 918
49
спермин двигаются за счет токов цитоплазмы Пыльцевой
трубки.
Из гипотез, объясняющих движение спсрмиев в заро-
дышевом мешке, интересна митотическая гипотеза, пред-
ложенная Е. Н. Герасимовой-Навашиной (1947). По этой
гипотезе, к моменту оплодотворения в зародышевом меш-
ке сохраняется митотическая полярность между яйце-
клеткой и центральным ядром. В период проникновения
спермисв в зародышевый мешок они находятся в состоя-
нии незавершенного митоза (по-видимому, в телофазе)
и, попадая в митотическое поле, подобно группам сест-
ринских хромосом, распределяются между яйцеклеткой
и центральным ядром.
Сложным является и вопрос о способах слияния спер-
миев с яйцеклеткой и центральным ядром. Например, по
мнению Е. Н. Герасимовой-Навашиной, существуют два
типа слияния: премитотический и постмитотический.
В первом случае слияние ядер гамет (сингамия) проис-
ходит перед первым делением зиготы. После контакта с
ядром яйцеклетки спермий сразу проникает в него и начи-
нается деспирализация его хроматиновых нитей. Подоб-
ным образом происходит и слияние второго спермия с
центральным ядром. При постмитотическом типе слияние
ядер происходит в период первого деления зиготы.
Длительное время не было единого мнения о возмож-
ности проникновения в яйцеклетку цитоплазмы мужских
гамет. С. Г. Навашин, например, считал, что с мужской
стороны зигота получает только ядро. По мнению
В. Н. Финна, в яйцеклетку при оплодотворении проника-
ют также и элементы цитоплазмы спермия. Оба пред-
положения подтвердились. У покрытосеменных растений
в одних случаях потомство получает от отца только ядро,
а в других — ядро и цитоплазму. Это было показано и
при изучении цитоплазматической наследственности,
обусловленной пластидами. Так, при изучении наследо-
вания у ряда растений пестролистности, связанной с из-
менением пластид, было установлено, что в одних случа-
ях она передается только яйцеклетками, а в других —
яйцеклетками и мужскими половыми клетками.
После оплодотворения пыльцевая трубка обычно де-
генерирует, но в ряде случаев она может сохраняться
длительное время, а иногда даже выполняет роль гаусто-
риального органа (например, у некоторых тыквенных).
50
Это обычно связано со слабым развитием нуцеллуса се-
мяпочки и является приспособлением для питания заро-
дышевого мешка, а иногда и развивающегося зародыша.
Вообще после оплодотворения зародышевый мешок ста-
новится мощным физиологическим центром, который
привлекает к себе токи питательных веществ из окружа-
ющих тканей и прежде всего из нуцеллуса.
Если после оплодотворения вокруг зародышевого
мешка происходит дегенерация тканей, в самом зароды-
шевом мешке начинаются обратные процессы, т. е. начи-
нается деление первичного ядра эндосперма и зиготы.
Эмбриогенез
Первичное ядро эндосперма образуется в результате
слияния одного спермия с полярными ядрами зародыше-
вого мешка, которые перед этим могут слиться в цент-
ральное ядро. Следовательно, в зародышевых мешках
нормального типа первичное ядро эндосперма включает
три гаплоидных набора хромосом, т. е. является трипло-
идным. В других типах зародышевых мешков с большим
количеством полярных ядер первичное ядро эндосперма
может иметь 5, 7, 8, 9 и 15 гаплоидных наборов хромосом.
В оплодотворенном зародышевом мешке первичное
ядро эндосперма приступает к митотическим делениям
обычно раньше зиготы. По характеру деления ядер эндо-
сперма и образованию клеточных стенок выделяют три
основных типа эндосперма: 1) нуклеарный, когда первое
и несколько последующих делений не сопровождаются
образованием клеточных стенок, ядра остаются свобод-
ными и лишь на поздних стадиях развития эндосперма
могут разделяться перегородками; 2) целлюларный, ко-
гда после первого и последующих делений образуются
перегородки и полость зародышевого мешка разделяется
на несколько камер, часть которых может включать не-
сколько ядер эндосперма; 3) гелобиальный, занимаю-
щий промежуточное положение между нуклеарным и
целлюларным; после первого деления образуется попе-
речная перегородка, разделяющая полость зародышевого
мешка на микропилярную и халазальную камеры, а по-
следующие деления ядер обычно не сопровождаются об-
разованием перегородок.
4*
51
Первые митотические деления ядер эндосперма обыч-
но происходят синхронно, но по мере развития эндоспер-
ма наблюдается асинхронность деления. В большинстве
случаев в развивающемся эндосперме можно наблюдать
характерные волны делений, т. е. наличие всех фаз ми-
тотического цикла, последовательно сменяющих друг
друга в определенном направлении (обычно от халазаль-
ной к микропилярной зоне). Для митотического деления
ядер эндосперма характерны различные аномалии, ча-
стота которых возрастает по мере его развития. Возмож-
ны эндомитозы, блокирование митоза в различные пе-
риоды, аномалии в формировании и функционировании
веретена, объединение ядер в период деления и др. В ре-
зультате этих нарушений нарастает кариологическая ге-
терогенность эпдоспермальной ткани, что, по-видимому,
имеет определенное значение.
По мнению И. В. Цингер (1958), развитие эндоспер-
ма можно условно разделить на три этапа: 1) период
интенсивного роста; 2) интенсивный синтез и накопле-
ние запасных веществ, начинающих доминировать над
процессами роста; 3) ликвидация эндосперма в конце
развития зародыша или при прорастании семени. У дву-
дольных растений к периоду созревания семени эндо-
сперм практически перестает существовать и лишь в не-
которых случаях в зрелых семенах сохраняется его
периферический слой. У большинства однодольных, се-
мена которых имеют недоразвитый зародыш, эндосперм
сохраняется и расходуется в период формирования про-
ростка. По-видимому, существует корреляция между
типом развития эндосперма и темпом развития зароды-
ша. Отмечалось, что у растений с быстрым формирова-
нием зародыша эндосперм развивается по нуклеарному
типу. При медленном развитии зародыша и его недораз-
витости в семенах образуется целлюларный эндосперм.
Конечно, от этого правила имеются отклонения, но
именно особенности развития зародыша определяют пе-
риод потребления эндосперма.
Собственно эмбриогенез (развитие зародыша) изу-
чался многими эмбриологами и к настоящему времени
уже известны его основные особенности, хотя и остает-
ся еще много нерешенных вопросов. Особое значение
в изучении эмбриогенеза у двудольных и однодольных
растений имели работы А. С. Фаминцина, К. Шнарфа,
52
Д. Джохансена, Р. Суэжа и
многих других исследовате-
лей.
Возникшая после опло-
дотворения зигота некоторое
время находится в состоянии
относительного покоя, про-
должительность которого оп-
ределяется особенностями
вида и внешними факторами.
У одних видов растений пе-
риод с момента оплодотво-
рения до первого деления зи-
готы составляет от одного до
нескольких часов, а у дру-
гих — от нескольких дней до
нескольких месяцев (инжир,
липа, дуб, орешник, омела и
др.). У безвременника осен-
него (семейство лилейных),
например, оплодотворение
происходит осенью, а первое
деление зиготы — весной,
т. е. зигота находится в со-
стоянии относительного по-
коя четыре-пять месяцев.
Сложным является воп-
рос о причинах, обусловли-
вающих первое деление зи-
готы. Имеющиеся по этому
вопросу гипотезы не удовле-
творяют большинство эмбри-
ологов. Например, Г. Габер-
Рис. 11. Двухклеточный
предзародыш яблони
(ориг.).
Видны морфологические раз-
личия между базальной и апи-
кальной клетками
ландт считал, что первое деление зиготы вызывается не-
крогормонами, образующимися в ней в связи с травмой,
нанесенной проникновением в яйцеклетку мужской га-
меты. По другим предположениям, первое деление зиго-
ты стимулируется соединениями, попадающими в яйце-
клетку из пыльцевой трубки (Герасимова-Навашина),
или секретируемыми мужскими гаметами (Суэж).
Первое деление зиготы завершается образованием
двух клеток: апикальной и базальной, которые разделя-
ются поперечной перегородкой. В редких случаях пере-
53
городка закладывается в другом направлении и никогда
не бывает продольной. При дальнейших делениях кле-
точные перегородки закладываются в любых направле-
ниях.
Апикальная и базальная клетки в результате перво-
го митотического деления получают идентичные ядра,
но различное количество цитоплазмы в связи с наличи-
ем в базальной части яйцеклетки и зиготы крупной ва-
куоли (рис. 11). Это обусловливает различия в функцио-
нировании идентичных ядер с самого начала эмбриоге-
неза. В эмбриологии растений развивающийся зародыш
до начала дифференцировки семядолей обычно называ-
ют проэмбрио, или предзародышем, а затем зародышем.
Клетки предзародыша меристематического характе-
ра и без каких-либо морфологически заметных призна-
ков дифференцировки. Они активно делятся митотиче-
ски. Темп роста различных частей предзародыша и
зародыша в известной мере зависит от условий питания,
а последние прежде всего определяются характером
связи с развивающимся эндоспермом. Обычно наиболее
интенсивно осуществляется рост за счет делений клеток
в верхней части предзародыша, находящейся в более
тесном контакте с эндоспермом.
Различия по, цитоплазме апикальной и базальной
клеток определяют и различия их морфогенетических
возможностей. Иначе говоря, клеточные поколения, бе-
рущие начало от апикальной и базальной клеток, при-
нимают различное участие в дифференцировке основных
частей зародыша и будущего растения. Впервые на ос-
нове морфологических данных предварительная клас-
сификация морфогенетических возможностей апикаль-
ной и базальной линий клеток, т. е. клеток, являющихся
производными апикальной и базальной клеток, была
предложена Р. Суэжем в 30-х гг. При этом выяснилось,
что у покрытосеменных имеются существенные различия
по морфогенетическим возможностям апикальной и ба-
зальной линий клеток, что позволило Р. Суэжу выде-
лить шесть основных групп зародышей (табл. 1).
По классификации Р. Суэжа, для первой группы ха-
рактерна сосредоточенность почти всех морфогенетиче-
ских возможностей в базальной линии клеток, а по мере
перехода к VI группе наблюдается обратная картина.
К I группе относятся почти все однодольные. Таким об-
54
Таблица 1
Морфогенетические потенции апикальных и базальных клеток
зародыша
Группа Производные апикальной линии клеток Производные базальной линии клеток
I Семядоли Эпикотиль*, гипокотиль**, инициальные клетки*** цилиндра корня, инициальные клетки коры корня, корневой чехлик, под- весок
II Семядоли, эпикотиль Гипокотиль, инициальные клетки цилиндра корня, ини- циальные клетки коры корпя, корневой чехлик, подвесок
III Семядоли, эпикотиль, по- ловина гипокотиля Половина гипокотиля, ини- циальные клетки цилиндра кор- ня , инициальные клетки коры корпя, корневой чехлик, под- весок
IV Семядоли, эпикотиль, ини- циальные клетки цилиндра корпя Инициальные клетки коры корня, корневой чехлик, под- весок
V Семядоли, эпикотиль, ги- покотиль, инициальные клет- ки цилиндра корня, инициаль- ные клетки коры корпя Корневой чехлик, подвесок
VI Семядоли, эпикотиль, ги- покотиль, инициальные клет- ки цилиндра корня, инициаль- ные клетки коры корня, кор- невой чехлик Подвесок
* Эпикотиль — надсемядольное колено, участок стебля между се-
мядолями и почкой.
** Гипокотиль — подсемядольное колено, участок стебля между кор-
невой шейкой и местом прикрепления семядолей.
*** Инициальные клетки — меристемы, являющиеся исходными для каких-либо
тканей или органов.
разом, у различных видов покрытосеменных развитие
зародыша происходит по определенному типу с самого
начала. Рано проявляется и дифференцировка на кор-
невой и стеблевой полюсы. Зигота и первые клетки за-
родыша уже несут в себе возможности той организации,
которая характерна для взрослого растения. Эти воз-
можности детерминированы генотипически и реализу-
55
Рис. 12. Схема основных этапов развития зародыша двудоль-
ных растений (из Поддубной-Арнольди, 1964)
ются в ходе эмбриогенеза в зависимости от внутренних
и внешних условий. Здесь мы имеем дело с одним из
ярких примеров перехода возможности в действитель-
ность при наличии определенных условий. Каждая не-
специализированная клетка обладает генотипическими
возможностями для дифференцировки в любом направ-
лении, что доказывают результаты опытов по выращи-
ванию растений, например, из культивируемых изоли-
рованных клеток паренхимы. В ходе эмбриогенеза воз-
никают сложные цитогенетические коррелятивные связи,
обеспечивающие реализацию генетической информа-
ции в определенном направлении, т. е. имеются регу-
ляторные механизмы развития.
Основные этапы развития и морфологические осо-
бенности зародыша покрытосеменных довольно однооб-
разны, хотя степень развитости его отдельных частей
разнообразна (рис. 12, 13). Типичный развитый заро-
дыш покрытосеменных состоит из семядолей, эпикотиля
(надсемядольного колена), гипокотиля (подсемядоль-
ного колена), точки роста, располЪженной между семя-
долями, и их корешка с корневым чехликом. У некото-
рых двудольных и однодольных растений зародыш
в зрелых семенах остается на стадии проэмбрио, т. е.
не имеет дифференцированных органов (например,
у ряда лилейных, орхидных, лютиковых и др.). Диффе-
ренцировка зародышей в этих случаях происходит в пе-
риод прорастания семян. Наличие в семенах зародыша
на стадии проэмбрио в одних случаях, по-видимому, яв-
ляется примитивным признаком, а в других (у высоко-
организованных семейств) — результатом редукции.
Зародыши покрытосеменных разнообразны по форме
(прямые, изогнутые, подковообразные, кольцеобразные,
спиральные, винтообразные и т. д.). В большой степе-
ни варьирует форма семядолей (узкие и длинные, ли-
стоподобные и т. д.).
Ранние стадии развития зародыша у покрытосемен-
ных изучены значительно лучше, чем более поздние. Так,
еще недостаточно изучены морфогенетические особен-
ности первичных меристем (протодермы, прокамбия и
основной меристемы) и апикальной меристемы. Диффе-
ренцировка трех первичных меристем начинается па
стадии предзародыша. Протодерма закладывается пу-
тем периклинальных делений, начинающихся обычно
57
Рис. 13. Схема основных этапов развития заро-
дыша однодольных растений (из Поддубпой-
Лрнольди, 1964)
в дистальном ярусе и идущих в направлении к прокси-
мальному концу. Протодерма не распространяется на
подвесок зародыша, а сливается с апикальной меристе-
мой корня (рис. 14). Прокамбий становится различимым
перед заложением бугорков семядолей и по мере роста
последних дифференцируется в них. Прокамбиальная
система в гипокотилыю-корневой оси может быть раз-
личного строения в зависимости от того, какая часть
этой оси приобретает структуру корня. У злаков, напри-
мер, корнеподобную структуру имеет большая часть
оси, а у многих двудольных растений — менее чем одна
шестая часть оси.
58
Довольно часто у покрытосеменных растений встре-
чается полиэмбриония, т. е. развитие нескольких заро-
дышей. Эмбриологи растений обычно различают два
типа полиэмбрионии: истинную и ложную. К истинной
полиэмбрионии относят развитие нескольких зародышей
в одном или нескольких зародышевых мешках, образо-
вавшихся в одном нуцеллусе. Случаи же образования
одного или нескольких зародышей вне зародышевых
мешков из клеток нуцеллуса или интегументов относят
к ложной полиэмбрионии; это примеры бесполого раз-
множения.
Два или несколько зародышей могут образоваться
в результате продольного или поперечного разделения
предзародыша, т. е. своеобразного почкования предза-
родыша. При этом встречаются следующие варианты:
1) при аномальном делении зиготы может образоваться
Рис. 14. Развитие зародыша салата (из Эсау, 1969):
а — деление зиготы; б — ж — последовательные стадии развития
зародыша; э —н — стадии развития, на которых начинается
дифференцировка тканей; / — протодерма; 2 —подвесок; 3 —
центральный цилиндр зародыша; 4— инициали коры; 5 — инн-
циали протодермы; 6 — корневой чехлик
59
масса клеток, дифференцировка которых нарушается,
они разделяются па группы и дают начало многочислен-
ным зародышам, что довольно часто описывалось у ор-
хидных; 2) возможны разветвления нитевидного пред-
зародыша; 3) иногда происходит почкование предзаро-
дыша. Во всех этих случаях, по-видимому, имеет место
нарушение цитогенетической регуляции дифференци-
ровки предзародыша и зародыша.
Когда несколько зародышей развивается в пределах
одного зародышевого мешка предварительно, явно на-
рушается дифференцировка элементов женского гаме-
тофита. Чаще всего дополнительные зародыши могут
возникать из синергид, которые даже морфологически
становятся похожими на яйцеклетки и могут быть опло-
дотворены спермиями дополнительных пыльцевых тру-
бок или развиться партепогенетически. Значительно ре-
же наблюдалось образование зародышей из антипод,
морфологически сходных с яйцеклетками. Однако пока
не отмечалось образования жизнеспособных антипо-
дальных зародышей.
Имеющиеся данные о полиэмбрионии у покрытосе-
менных не позволяют сделать определенное заключение
о значении этого явления.
о Эмбриональное развитие
Глава О животных
Процесс оплодотворения
Процессу оплодотворения у животных, суть которого
заключается в слиянии ядер мужских и женских гамет,
предшествует осеменение. В ходе исторического разви-
тия различных групп животных возникло огромное раз-
нообразие приспособлений у половых клеток и организ-
мов, обеспечивающих осеменение, встречу мужских и
женских гамет и процесс оплодотворения.
Существуют два способа осеменения: наружное, или
внешнее, и внутреннее. При наружном осеменении спер-
матозоиды и яйца выделяются в окружающую среду,
что характерно для большинства водных животных.
60
Наиболее совершенным и надежным оказалось внутрен-
нее осеменение, которое осуществляется порой очень
сложно устроенными копулятивными органами и обу-
словлено системой безусловных и условных рефлексов,
а также согласованным поведением самок и самцов. Ре-
зультатом копуляции является выделение самцом семен-
ной жидкости со сперматозоидами (эйякуляция) непо-
средственно в половые пути самки, что гарантирует
встречу мужских и женских гамет в относительно кон-
стантных условиях.
В ходе эволюции животных, по-видимому, существо-
вало много переходных форм от наружного оплодотворе-
ния к внутреннему, некоторые из них известны и в на-
стоящее время. Например, у ряда немертин самки и сам-
цы одновременно выделяют яйца и сперму, образующие
после оплодотворения общую слизистую массу. У неко-
торых пиявок существует так называемое кожное осеме-
нение: во время спаривания сперматозоиды прикрепля-
ются к гиподерме тела (однослойная эпителиальная
ткань, находящаяся под кутикулой), а затем между
клетками гиподермы проникают в полость тела и матку
через ее стенки. У саламандр в результате сложного вза-
имного поведения самки и самца последний откладыва-
ет сперматофор (мешочек со сперматозоидами), который
самка помещает в свою клоаку, где он затем разруша-
ется и освободившиеся сперматозоиды оплодотворяют
яйцеклетки.
Интересные приспособления, повышающие надеж-
ность осеменения и оплодотворения, имеются у многих
водных беспозвоночных животных. Например, у передне-
жаберных моллюсков, актиний и иглокожих при наруж-
ном осеменении яйца и спермин выбрасываются в воду
только тогда, когда самка и самец находятся друг от
друга на определенном расстоянии. Обычно сначала са-
мец выделяет сперму, образуя так называемую спермо-
вую среду, стимулирующую выделение самкой яиц. По-
видимому, в этих случаях особое значение имеет хими-
ческое взаимодействие, природа которого остается не-
известной.
У актиний наблюдаются довольно сложные взаимо-
действия между самкой и самцом в период осеменения.
В ряде случаев половозрелые самки очень точно пере-
мещаются к половозрелому самцу. После сближения жи-
61
вотные образуют почти замкнутый свод, под которым
происходит осеменение. Затем самка и самец разъединя-
ются, а оплодотворенные яйца распространяются в воде.
В других случаях, возбуждая друг друга на расстоянии,
самец и самка сильно вытягиваются. Самец выделяет
сперматозоиды в воду, а самка, наклоняясь к их пото-
ку, выделяет яйца.
Эмбриологи уже давно догадывались о существова-
нии каких-то химических веществ, выделяемых женски-
ми и мужскими гаметами и обеспечивающих их взаимо-
действие на значительном расстоянии. Так, по наблюде-
ниям Ф. Лилли (1912—1921), морская вода, в которой
находились зрелые яйца морского ежа («яичная вода»),
активировала подвижность сперматозоидов и их агглю-
тинацию. Такие же свойства «яичной воды» были обна-
ружены и во многих других случаях (у морских звезд,
моллюсков, круглоротых, рыб и амфибий). Предполага-
емые химические вещества, продуцируемые яйцами,
Ф. Лилли назвал фертилизином. Основу фертилизина
составляют гликопротеины или мукополисахариды. По-
видимому, природа фертилизина разнообразна у различ-
ных видов животных.
Считается также, что и сперматозоиды продуцируют
и выделяют какие-то специфические соединения, назван-
ные антифертилизинами, в основу которых входят кис-
лые протеины. По мнению А. Тайлера (1958), систему
фертилизин—антифертилизин можно сравнить с систе-
мой антиген — антитело и они соответствуют друг другу
как «ключ замку». Специфические соединения, проду-
цируемые яйцами и сперматозоидами (природа их пока
не разгадана), по предложению М. Гартмана (1940),
стали называть гамонами (по аналогии с гормонами).
Яйцами продуцируются гиногамоны, а сперматозоида-
ми — андрогамоны. При этом, по-видимому, существует
несколько гино- и андрогамонов. Имеются гиногамоны,
активизирующие движение сперматозоидов и обеспечи-
вающие их контакт с яйцом, а также не менее двух ан-
дрогамонов, подавляющих подвижность сперматозоидов
в нужный момент и растворяющих оболочку яйца. В ли-
тературе их соответственно и обозначают гиногамоны I,
II и андрогамоны I, II.
Период жизнеспособности яиц и сперматозоидов,
а также продолжительность сохранения ими способности
62
к оплодотворению варьируют в зависимости от вида жи-
вотных. Так, у большинства водных беспозвоночных и
позвоночных яйца должны быть оплодотворены немед-
ленно после овуляции, а у млекопитающих этот период
может продолжаться от нескольких минут до 24 часов
и более. Продолжительность жизни сперматозоидов и
яйцеклеток и сохранение сперматозоидами оплодотворя-
ющей способности зависят от внутренних и внешних
факторов.
Жизнеспособность сперматозоидов обычно легко
определяется по их подвижности, но это далеко не всегда
является показателем их оплодотворяющей способности.
Например, сперматозоиды морского ежа живут в тече-
ние нескольких дней, но утрачивают оплодотворяющую
способность примерно через 12 часов. Сперматозоиды
млекопитающих сохраняют свою оплодотворяющую спо-
собность в половых путях самки также в течение не-
скольких часов. Довольно быстро утрачивают жизнеспо-
собность и зрелые яйцеклетки. В связи с этим сущест-
вуют разнообразные приспособления, обеспечивающие
надежное осеменение и быстрое оплодотворение. Стано-
вится понятным, почему в ряде случаев у морских жи-
вотных икрометание самки стимулирует выделение спер-
мы у самцов, а у других видов одновременное выделение
мужских и женских гамет стимулируется интенсив-
ностью освещенности, приливами, отливами и многими
другими внешними факторами. К внутренним же факто-
рам прежде всего относится действие гамонов. Напри-
мер, инактивация сперматозоидов их же собственными
андрогамонами, по-видимому, увеличивает продолжи-
тельность их жизни, сохраняя в неподвижном состоянии,
пока они не активируются соответствующими гиногамо-
нами. Вероятно, именно это обеспечивает выживание
сперматозоидов летучей мыши в половых путях самки
в течение зимы, а также длительное сохранение жизне-
способности сперматозоидов в мужских и женских поло-
вых путях у рыб и амфибий.
В норме у животных с внутренним оплодотворением
сперма должна быть в виде густой взвеси. После ее раз-
бавления сперматозоиды обычно утрачивают свою опло-
дотворяющую способность. В опытах А. И. Соколов-
ской (1947) на кроликах было, например, показано, что
если при осеменении самки вводится менее 1000 сперма-
63
тозоидов, оплодотворение не происходит. Оно не проис-
ходит и при избыточном количестве сперматозоидов (бо-
лее 1 млн.). В первом случае это, по-видимому, обуслов-
лено недостатком, а во втором — избытком гиалуронида-
зы (андрогамона II), растворяющей оболочку яйца. Сле-
дующим важным фактором, определяющим выживание
сперматозоидов, является концентрация водородных
ионов в среде. Так, в щелочной среде сперматозоиды
обычно становятся более активными, но довольно быстро
погибают.
Знание внутренних и внешних факторов, определяю-
щих жизнеспособность и оплодотворяющие возможно-
сти сперматозоидов, имеет и практическое значение, по-
скольку в животноводстве часто используется искусст-
венное осеменение. Ранее нами уже отмечалось (гл. I),
как сохраняют сперму при пониженных температурах.
В настоящее время довольно хорошо известны концен-
трации углекислого газа, концентрации самих сперма-
тозоидов для успешного хранения спермы, а также зна-
чение pH. В области искусственного осеменения выпол-
нено много исследований, результаты которых дают
значительный экономический эффект в рыбоводстве,
птицеводстве и животноводстве. Среди них нужно особо
отметить исследования наших отечественных ученых
В. П. Врасского и В. К. Милованова.
Совершенно ясно, что избыточное количество муж-
ских гамет прежде всего необходимо для увеличения ве-
роятности оплодотворения. Обычно значительная часть
сперматозоидов погибает в водной среде при наружном
осеменении или половых путях самки, в которых также
могут быть неблагоприятные физиологические условия.
Однако и при оптимальных условиях в половых путях
самки гибель сперматозоидов очень велика. Так, у кры-
сы при спаривании выделяется около 70 млн. спермато-
зоидов, но примерно через 12 ч в яйцеводе их число со-
ставляет около 50 и этого количества оказывается до-
статочно для нормального процесса оплодотворения.
Зрелые яйцеклетки имеют разнообразные поверхно-
стные структуры, через которые проникает сперматозо-
ид при оплодотворении. Яйцеклетки почти всех живот-
ных за редким исключением имеют три характерные
оболочки: первичную, вторичную и третичную. Первич-
ная оболочка продуцируется самим ооцитом или яйце-
04
«леткой п се обычно называют желточной. Это тонкая,
то очень плотная структура, находящаяся в непосредст-
венном контакте с цитоплазмой. Лишь в некоторых слу-
чаях (например, у ряда костистых рыб) первичная обо-^
почка может быть очень толстой. Вторичная оболочка;
которую часто называют хорионом, формируется как,
производное фолликулярных клеток, окружающих
ооцит. Третичные оболочки в большинстве случаев об-
разуются после оплодотворения за счет выделений же-
лез или слизистого эпителия половых путей самки или
выделений кожных желез. Третичные оболочки яиц раз-
нообразны по своей структуре (например, студенистые
оболочки яиц амфибий, белковые, подскорлуповые и
скорлуповые оболочки яиц птиц, оболочки яиц многих
моллюсков и червей).
В ходе оплодотворения сперматозоиду приходится
преодолевать вторичную и первичную оболочки. У не-
которых животных сперматозоиды имеют довольно
жесткую акросомную пить, которая как бы пробурав-
ливает -оболочки яйца, прокладывая путь сперматозои-
ду. В большинстве же случаев проникновение сперма-
тозоидов в яйцо связано с действием определенных га-
монов, растворяющих вторичную и первичную оболочки
яйца (андрогамон II или лизин).
Проникновение сперматозоидов в яйца ряда живот-
ных (например, у некоторых рыб) происходит только
через микропиле — участки первичной и вторичной обо-
лочек особой структуры, не являющиеся полыми кана-
лами. В момент контакта сперматозоида с наружной
оболочкой яйца начинается так называемая акросомная
реакция, в ходе которой изменяется структура акросомы
(например, начинается разрушение ее мембраны) и вы-
брасывается акросомная нить, если она имеется у дан-
ного типа сперматозоидов. Акросомная реакция — пер-
вичный механизм соединения гамет, и основной ее ре-
зультат заключается в выделении ферментов из акросо-
мы и образовании акросомного выроста. В месте кон-
такта сперматозоида (акросомы или акросомной нити)
с плазматической мембраной яйца образуется выпячи-
вание, или бугорок оплодотворения (рис. 15).
В принципе акросомная реакция сходна у различ-
ных животных. Они отличаются лишь количеством ак-
росомных выростов и их размерами. У некоторых насе-
5 Зак. 918
65
Рис. 15. Стадии соединения сперматозоида с яйцом (из Бо-
демера, 1971).
Интактный сперматозоид приближается к яйцу (а) и после контак-
та с оболочкой яйца кончик его головки раскрывается (б), затем
выворачивается акросомная мембрана (в), образуется бугорок опло-
дотворения (г, д) и ядро сперматозоида перемещается в цитоплаз-
му яйца (е); 1 — ядро; 2 — плазматическая мембрана сперматозои-
да; 5“ акросомные гранулы; 4 — акросомная мембрана; 5 —апи-
кальный пузырек; 6 — оболочка яйца; 7 — мембрана яйца; 8— ци-
топлазма яйца; 9 — акросомная нить; 10 — хвост сперматозоида;
11 — бугорок оплодотворения
комых, а также у осетровых рыб отмечена различная
степень редукции акросомы, а у сперматозоидов кости-
стых рыб акросомы вообще нет. Все это связано с осо-
бенностями строения оболочек яиц и наличием у них
микропиле.
Бугорок оплодотворения способствует втягиванию
сперматозоида внутрь яйца. Однако образование бугор-
ка оплодотворения наблюдается не у всех животных и,
возможно, в ряде случаев (например, у млекопитаю-
щих) сперматозоид проникает в яйцо без активного
участия бугорка оплодотворения,
66 .
По мнению ряда эмбриологов (Ж. Лёб, А. Тайлер
и др.), проникновение сперматозоида в яйцо можно
отождествить с явлениями пиноцитоза и фагоцитоза.
Однако это явно упрощенная трактовка вопроса и в
действительности дело обстоит значительно сложней.
Современные данные электронной микроскопии, цитохи-
мии и биохимической эмбриологии позволяют заклю-
чить, что проникновение сперматозоида в яйцо обуслов-
лено сложными взаимоотношениями между мембрана-
ми яйца и спермия, механизмы которых мало изучены.
В любых случаях конечным результатом проникно-
вения сперматозоида в яйцо, происходящего в течение
нескольких секунд или минут, является слияние гамет
в одну клетку. После проникновения в яйцо головки и
средней части, а у млекопитающих и хвоста спермато-
зоида ядра мужской и женской гаметы начинают сбли-
жаться. У одних животных ядра довольно быстро сли-
ваются, а у других — ядро сперматозоида утрачивает
свою мембрану и в ходе митотического деления хромо-
сомы мужской и женской гамет объединяются в единый
митотический аппарат, образованный с участием цен-
тросомы сперматозоида. Эти два варианта сингамии
очень сходны с премитотическим и постмитотическим ти-
пами слияния половых ядер при оплодотворении у по-
крытосеменных растений. Объединением ядерного ма-
териала мужской и женской гамет завершается процесс
оплодотворения.
В период оплодотворения и в оплодотворенном яйце
(зиготе) при взаимодействии структур мужской и жен-
ской гамет происходит ряд сложных процессов, совокуп-
ность которых называют активацией яйца. Различают
две основные фазы активации: импульс активации и
кортикальную реакцию. Экспериментально было показа-
но, что для активации яйца не обязательно проникнове-
ние в яйцб'сперматозоида. Уже сам контакт спермато-
зсшдГ с наружной оболочкой яйца является как бы им-
пульсом, активирующим яйцо и в некоторых случаях
даже обеспечивающим его дальнейшее развитие без
проникновения сперматозоида, т. е. без истинного опло-
дотворения. Это было доказано на опытах с удалением
сперматозоида микропипеткой сразу же после его кон-
такта с оболочкой яйца. После такой манипуляции на-
чиналось дробление яйца. Если же при помощи микро-
5*
67
пипетки сперматозоид вводился в яйцо и исключались
процессы, происходящие при контакте сперматозоида
с оболочками яйца, дробление яйца не начиналось.
Экспериментально кортикальная реакция была хо-
рошо изучена на яйцах иглокожих. Для кортикального
слоя яиц морского ежа, представленного перифериче-
ским слоем ооплазмы, характерно наличие гранул, ко-
торые начинают разрушаться при проникновении спер-
матозоида через яйцевую оболочку; этот процесс до-
вольно быстро распространяется во все стороны от
места проникновения сперматозоида. Происходит замет-
ное изменение цвета поверхности яйца. Затем вдоль
внутренней поверхности желточной оболочки интенсив-
но накапливается тонкий слой уплотненной структуры,
желточная оболочка отделяется от наружной поверхно-
сти ооплазмы, образуя перивителлиновое пространство.
В этот период желточная оболочка достигает толщины
около 90 нм и ее уже называют оболочкой оплодотворе-
ния. Наружная поверхность ооплазмы за счет части кор-
тикальных гранул покрывается гиалиновой мембраной
(рис. 16).
Кортикальная реакция, конечным результатом кото-
рой является образование оболочки оплодотворения и
перивителлинового пространства, распространяется по
всей поверхности яйца в течение 10—20 с, а оболочка
оплодотворения образуется в течение 1—3 мин после
осеменения. Эти процессы сопровождаются заметным
изменением двойного лучепреломления кортикального
слоя и оболочки оплодотворения, увеличением вязкости
кортикального слоя и его проницаемости для воды и
ионов калия. Происходит также изменение мембранного
потенциала клетки. Иначе говоря, в период кортикаль-
ной реакции происходит ряд сложных и взаимосвязан-
ных процессов, приводящих к глубоким изменениям ме-
таболизма яйца, т. е. к его активации. Имеющиеся дан-
ные не позволяют полностью оценить эти процессы.
После образования оболочки оплодотворения в боль-
шинстве случаев исключается проникновение в яйцо
других спермиев, и можно сказать, что одной из функ-
ций этой оболочки является защита от проникновения
в яйцо дополнительных сперматозоидов. Вообще для
оплодотворения яйца требуется только один спермато-
зоид, т. е. моноспермию можно считать нормой в цито-
68
I__________J__________I____________I___________I-----------1-----------1----------
0 20 ' 40 60 Время, c
Рис. 16. Кортикальная реакция и образование оболочки оплодо-
творения (из Бодемера, 1971).
Соотношение между кортикальными гранулами, клеточной мембраной и
желточной оболочкой в яйце до (а) и после (б) оплодотворения, латентная
стадия (s), кортикальная реакция (г, д) и отделение оболочки (е); 1 —
эндоплазма; 2 — кортикальный слой; 3 — желточная оболочка; 4 — клеточ-
ная мембрана; 5 — оболочка оплодотворения; 6—перивителлиновое про-
странство
генетическом смысле. Однако у некоторых моллюсков,
насекомых, пресмыкающихся, птиц и млекопитающих
и яйцо обычно проникает несколько сперматозоидов
(полиспермия).
Вопрос о значимости полиспермии остается спорным.
Многие эмбриологи считают, что полиспермия — это
аномальное явление для моноспермных животных, обу-
словленное в ряде случаев нарушениями структуры обо-
лочек яйца или нарушениями в ходе кортикальной ре-
акции. Например, по данным А. С. Гинзбург (1967),
оплодотворение у осетровых рыб в норме моноспермное,
но в экспериментальных условиях можно добиться по-
лиспермного оплодотворения. Последнее приводит
к аномальному развитию зародышей, большинство ко-
торых погибает. В работах А. С. Гинзбург было также
69
подтверждено существование тесной корреляций между
разрушением кортикальных гранул и блокированием
проникновения в яйцо дополнительных сперматозоидов.
Часто не наблюдается описанных выше изменений
кортикального слоя и оболочек яйца при оплодотворе-
нии (например, у некоторых насекомых и млекопитаю-
щих). Предполагается, что в этих случаях кортикаль-
ная реакция или совсем не происходит, или происходит
иначе и не завершается явными морфологическими пре-
образованиями кортикального слоя и оболочек яйца.
Высказывалось и сомнение относительно того, достаточ-
но ли велика скорость кортикальной реакции для бы-
строго блокирования полиспермии.
В работах А. С. Гинзбург и Т. А. Детлаф (1960—
1962) с использованием электронной микроскопии была
подробно изучена кортикальная реакция на яйцах осет-
ровых рыб. Было установлено, что уже через 5 с после
осеменения яиц начинаются преобразования кортикаль-
ных гранул, а весь процесс перестройки кортикальной
зоны происходит в течение 2 мин. По-видимому, это
вполне достаточная скорость для быстрого блокирова-
ния полиспермии.
Существует также мнение, что блокирование проник-
новения дополнительных сперматозоидов в яйцо опре-
деляется не собственно кортикальной реакцией, а обра-
зованием на поверхности ооплазмы гиалинового слоя.
Были попытки выделить определенные фазы в станов-
лении блокирования полиспермии.
Таким образом, по вопросу о механизмах защиты
яйца от проникновения дополнительных сперматозоидов
пока нет единого мнения, но, исходя из общих представ-
лений, этот механизм должен существовать. Дело
в том, что у растений и животных, размножающихся
половым путем, во время процесса оплодотворения осу-
ществляется переход к диплоидному состоянию, что
имеет исключительно важное значение в воспроизведе-
нии себе подобных. Переход к диплофазе достигается
слиянием ядра одного сперматозоида или спермия с га-
плоидным ядром яйцеклетки. По-видимому, при поли-
спермии увеличивается вероятность ошибок в процессе
восстановления диплоидного состояния и могут возни-
кать кариологически аномальные зиготы. С учетом это-
го обстоятельства полиспермия в цитогенетическом от-
70
ношении оказывается бессмысленной и должны суще-
ствовать адаптации, исключающие ее. Причины описан-
ных в литературе случаев полиспермии могут быть раз-
личными. Прежде всего полиспермия может быть
связана со структурными аномалиями оболочек яйца,
а иногда она может иметь цитофизиологическое значе-
ние, оказываясь своеобразным компенсирующим меха-
низмом в процессах активации яйца. Кроме того, не
следует забывать, что даже в пределах одного класса
организмы находятся на различных этапах историческо-
го развития и в ряде случаев именно это может опреде-
лять вариабильность структурных особенностей оболо-
чек яйцеклеток, а также изменчивость в проявлении
кортикальной реакции и других событий в момент опло-
дотворения.
Активация яйца после оплодотворения сопровожда-
ется глубокими изменениями его метаболизма. Иногда
в зиготе отмечаются резкое увеличение потребления
кислорода, фосфора, -гликогена, интенсификация вклю-
чения аминокислот в белки, активация синтеза иРНК и
многие другие процессы. Следует отметить, что измене-
ния метаболизма в зиготах различных животных прояв-
ляются по-разному. Например, при сравнении уровня
потребления кислорода зиготами морских ежей, некото-
рых рыб и аннелид через 60 мин после оплодотворения
наблюдаются существенные различия. Так, у морского
ежа в зиготе восстанавливается высокий уровень дыха-
ния, характерный для яйца в период созревания; у не-
которых амфибий и рыб уровень потребления кислоро-
да в зиготе практически не изменяется, а у аннелид —
резко снижается. По-видимому, существует зависимость
между потреблением кислорода после оплодотворения и
периодом созревания яйца. Так, во время оплодотворе-
ния яйца морского ежа завершили созревание, ооциты
некоторых рыб и амфибий находились во втором деле-
нии созревания, а яйца аннелид — в первом делении со-
зревания. Примерно также обстоит дело и с другими об-
менными процессами. Следовательно, активация яйца
после оплодотворения у различных представителей жи-
вотного мира проявляется разнообразно в зависимости
от особенностей оогенеза.
В подавляющем большинстве случаев стимуляция
яйца к развитию полностью определяется процессом
71
оплодотворения. Однако в естественных условиях и при
экспериментальных воздействиях возможно партеноге-
нетическое развитие, т. е. развитие яйца без оплодотво-
рения.
У ряда беспозвоночных животных (коловратки, тли,
пчелы, осы, муравьи) партеногенетическое развитие ока-
зывается нормальным явлением. Это так называемый
естественный партеногенез, который может быть обяза-
тельным (облигатным) или факультативным. Экспери-
ментально вызванную активацию неоплодотворенных
яиц обычно называют искусственным партеногенезом.
По нашему мнению, такое название не совсем удачно и
лучше данный тип партеногенеза называть индуциро-
ванным, или экспериментальным.
При естественном партеногенезе яйцо под влиянием
каких-либо внутренних или внешних факторов начина-
ет дробиться и развиваться в нормальный зародыш.
Партеногенетическое размножение в поколениях может
сменяться половым (циклический партеногенез). На-
пример, у коловраток в начале лета из отложенных яиц
развиваются только самки, которые в этот же сезон не-
сколько раз откладывают так называемые летние яйца,
развивающиеся партеногенетически в мужские и жен-
ские особи в определенном числовом соотношении. Сам-
ки партеногенетических поколений откладывают в кон-
це сезона зимние оплодотворенные яйца.
Своеобразным является факультативный партеноге-
нез у пчел, ос и муравьев. Пчелиная матка, имеющая
после осеменения в ссмеприемнике большое количество
спермы, откладывает яйца двух типов — оплодотворен-
ные и неоплодотворенные. Из оплодотворенных яиц раз-
виваются матки и рабочие пчелы, а из неоплодотворен-
ных партеногенетически развиваются только самцы-
трутни. В ходе онтогенеза последних в соматических
клетках восстанавливается диплоидный набор хромо-
сом главным образом в результате эндомитотических
делений. Естественный партеногенез встречается и у не-
которых беспозвоночных, способных размножаться на
личиночных стадиях развития (например, у сосальщи-
ков). Такое явление называют педогенезом.
При партеногенетическом развитии особо интерес-
ным является вопрос о смене ядерных фаз. В кариоло-
гическом отношении (по числу хромосом) существуют
72
дна типа партеногенеза: гаплоидный и диплоидный.
Гак, для пчел, ос и муравьев характерен гаплоидный
партеногенез, т. е. стимулируется развитие гаплоидной
яйцеклетки. Для коловраток, некоторых низших рако-
образных и тлей характерен диплоидный партеногенез,
г. е. начало зародышу дают клетки с нередуцированным
числом хромосом. Это может происходить разными спо-
собами. Образование диплоидных яйцеклеток возможно
при ряде отклонений в оогенезе, включая блокирова-
ние мейоза. В одних случаях в ходе оогенеза после пер-
вого мейотического деления полярное, или редукцион-
ное, тельце может слиться с ооцитом второго порядка.
В других случаях возможно нарушение второго деления
мейоза и исключение образования второго редукционно-
го тельца, которое как бы объединяется с яйцеклеткой.
Последнее наблюдалось в оогенезе у тлей. Кроме того,
может быть полное исключение конъюгации гомологич-
ных хромосом в мейозе и образование яйцеклеток с не-
рсдуцированным числом хромосом, что было описано
у некоторых орехотво'рок. Сходные формы естественно-
го партеногенеза имеются и у растений.
Индуцированный, или экспериментальный, партено-
генез у животных стал известен из работ зоолога
Л. А. Тихомирова, который в 1886 г. обнаружил, что
нсоплодотворепные яйца тутового шелкопряда активи-
руются и начинают развиваться после обработки их
серной кислотой, а также при изменении температуры
и после механического повреждения. Затем довольно
обстоятельные исследования были проведены Ж- Лёбом
(1913, 1916). Например, по его данным, выдерживание
яиц морского ежа в течение нескольких минут в масля-
ной кислоте и перенесение их затем в морскую воду сти-
мулирует образование оболочки оплодотворения. По-
добный эффект наблюдался и при действии другими
кислотами на неоплодотворенные яйцеклетки.
Относител'ьно возможности партеногенетического
развития у позвоночных животных имеется значительно
меньше данных. В свое время большой интерес вызвали
опыты Е. Батайона (1910), который индуцировал парте-
ногенетическое развитие яиц лягушки и жабы уколом
иглы и введением в яйца капли крови или кровяных
клеток взрослых животных. Имеются сообщения о воз-
можности индуцировать партеногенетическое развитие
73
у некоторых рыб при осеменении яиц сперматозоидами
других видов. При этом истинного оплодотворения не
происходит, но индуцируется активация яиц и в резуль-
тате партеногенетического развития появляются только
самки.
Была доказана возможность естественного партено-
генеза у птиц и даже на этой основе выведена порода
индеек. Естественный партеногенез описан у скальных
ящериц. В 1936 г. Ж. Пинкусу удалось, индуцировать
партеногенетическое развитие яиц у кролика. Высказы-
ваются предположения о возможности партеногенетиче-
ского развития у человека, но этот вопрос пока остается
спорным, хотя и описывались отдельные случаи начала
дробления яиц в яичниках женщины при отсутствии
осеменения и оплодотворения.
Много работ было по индукции партеногенеза у выс-
ших растений: для активации яйцеклетки использова-
лись различные физические и химические факторы.
Чаще всего для этой цели экспериментаторы применяли
следующие воздействия на пестик, завязь или непосред-
ственно на семяпочки: 1) воздействие высокими' или
низкими температурами; 2) облучение рентгеновскими
лучами; 3) действие различными химическими соедине-
ниями (например, индолуксусной, индолмасляной, наф-
таленуксусной, фенилуксуспой и другими кислотами);
4) опыление чужеродной пыльцой; 5) опыление пред-
варительно облученной пыльцой или обработанной хи-
мическими соединениями с целью убить спермин;
6) опыление нормальной пыльцой, но с последующим
срезанием столбиков с растущими в них пыльцевыми
трубками. Во многих случаях удавалось индуцировать
гаплоидный партеногенез (кукуруза, рожь, пшеница и
другие виды растений).
В опытах по индукции партеногенеза у различных
видов животных и растений используются самые разно-
образные воздействия, и создается впечатление, что не
существует специфичности партеногенетических аген-
тов. По-видимому, это не совсем так, и для выяснения
этого вопроса необходимо тщательно изучить особенно-
сти процессов, определяющих активацию яйца. Пока
лишь наиболее обстоятельные данные имеются об изме-
нениях кортикального слоя, с которых начинается про-
цесс активации. Затем необходимо идентифицировать
74
действие различных физических и химических факторов
па яйцеклетки разных видов животных и растений. По-
видимому, далеко не каждый физический или химиче-
ский агент может индуцировать партеногенез. Некото-
рые из них оказываются эффективными во многих
случаях, а некоторые — только при воздействии на яйца
определенных видов животных или растений.
Работы по индукции партеногенетического развития
имеют не только теоретическое, но и большое практи-
ческое значение. Особо интересны работы по индукции
гаплоидного партеногенеза. Дело в том, что у гаплоид-
ных организмов фенотипически проявляется весь гене-
тический багаж, поскольку каждый ген оказывается
без альтернативного аллеля. Следовательно, довольно
быстро можно оценить генотипические возможности
данных форм и на их основе получить чистолинейный
материал, что чрезвычайно важно для практической
селекции. Чистую линию можно получить при переводе
гаплоидной формы на диплоидный уровень с использо-
ванием колхицина или других агентов, исключающих
формирование митотического веретена.
В промышленных масштабах применение экспери-
ментального партеногенеза было осуществлено на осно-
ве работ Б. Л. Астаурова (1940—1960), который, ис-
пользуя особые методы обработки яиц тутового шелко-
пряда высокой температурой на определенных стадиях
развития, в большом количестве получал партеногене-
тических бабочек женского пола. Предполагается, что
решение проблемы партеногенеза в перспективе будет
иметь большое значение в животноводстве и растение-
водстве. Например, на основе партеногенеза возможно
разведение цепных пород животных и выведение новых
сортов растений, регуляция пола в потомстве и получе-
ние чистолинейного материала для селекционных целей.
Активация яйцеклеток и переход зигот к дроблению
осуществляются и другими способами, которые условно
можно определить как промежуточные между истинным
оплодотворением и партеногенезом. Например, у неко-
торых видов червей и рыб сперматозоид необходим
только для активации яйца, т. е. он проникает в цито-
плазму яйцеклетки, но его ядро не сливается с ядром
последней (псевдогамия — ложное оплодотворение).
Ядро сперматозоида дегенерирует, а развитие зароды-
75
ша осуществляется за счет ядра яйцеклетки. Это явле-
ние называется гиногенезом, который может быть есте-
ственным и индуцированным. Так, по наблюдениям
К. А. Головинской, в популяциях серебряного карася
подавляющее большинство особей представлено жен-
ским полом, что, по-видимому, обусловлено факторами
внешней среды. В самовоспроизведении таких популя-
ций большое значение приобретает гиногенез в особой
форме. При явной недостаточности сперма самцов сво-
его вида активацию яиц вызывает сперма самцов дру-
гих видов рыб (иногда даже представителей других
родов и семейств) по типу гипогенеза, что является свое-
образным приспособлением, гарантирующим воспроиз-
ведение популяции. Экспериментально гиногенез можно
получить при повреждении ядер мужских гамет физи-
ческими (облучение) или химическими факторами на
животных и растениях.
Существует и противоположное гиногенезу явле-
ние — андрогенез, т. е. развитие зиготы за счет ядер
мужских гамет при дегенерации ядер яйцеклеток. Ан-
дрогенез возможен при гибели ядра яйца перед оплодо-
творением, причин которой может быть очень много
в естественных и экспериментальных условиях. Экспе-
риментально андрогенетические особи в большом коли-
честве были получены у тутового шелкопряда Б. Л. Ас-
тауровым и другими исследователями на разных объ-
ектах. Такие особи обычно сходны с отцовскими орга-
низмами и всегда бывают только мужского пола
в случае его гомогаметичности. Андрогенетическое раз-
витие наблюдалось и у некоторых растений (табак, ку-
куруза и др.).
Рассмотренные нами явления партеногенеза, гино-
генеза и андрогенеза аналогичны для животных и рас-
тений, Они относятся к нерегулярным типам полового
размножения и в ходе исторического развития организ-
мов имели или имеют адаптивное значение. Наличие
партеногенетических форм размножения иллюстрирует
конвергентный путь возникновения сходных механизмов
размножения у растений и животных. По-видимому,
в ходе эволюции партеногенез оказался вторичным яв-
лением и произошел в результате упрощения полного
цикла полового воспроизведения. В этом упрощении ос-
новными событиями следует признать утрату слияния
76
гамет и их ядер, замену кариогамии делением ядра без
цитокинеза с последующим слиянием образовавшихся
ядер.
В процессе оплодотворения происходит одно очень
важное генетическое и, можно сказать, цитогенетиче-
ское событие, т. е. происходит определение пола буду-
щего организма. Давно было известно, что у растений,
животных и человека количественное соотношение по-
лов в потомстве относительно постоянно. Совершенно
очевидно, что определение пола и соотношение полов
в потомстве — важные обстоятельства для нормального
самовоспроизведения видов, т. е. для их существования.
В связи с этим в ходе исторического развития видов,
размножающихся половым путем, должны были по-
явиться механизмы определения пола, обеспечивающие
равное или необходимое количество самцов и самок
в потомстве. Ранее по данному вопросу было высказано
много различных предположений, большинство которых
не получило подтверждения. Только цитогенетические
исследования позволили найти правильное его решение.
Определение пола может происходить на разных
этапах размножения. Различают три типа определения
пола: 1) прогамный, когда пол будущего организма
определяется в ходе гаметогенеза у родительской осо-
би; 2) сингамный, когда пол дочерней особи определя-
ется в момент слияния гамет (это наиболее распростра-
ненный тип определения пола и его механизм довольно
хорошо изучен); 3) эпигамный, когда пол особи опреде-
ляется в процессе онтогенеза и в значительной степени
зависит от внешних факторов.
Следует различать процессы определения пола и
процессы его развития в онтогенезе, т. е. его дифферен-
цировку. При всех типах определения пола происходит
его дифференцировка в ходе индивидуального развития,
которая выражается в развитии первичных и вторичных
половых признаков. К первичным половым признакам
относят морфологические и физиологические особенно-
сти организма, обеспечивающие образование опреде-
ленного типа гамет и их соединение в процессе оплодо-
творения. Вторичные половые признаки — признаки
п свойства организма, непосредственно не обеспечиваю-
щие гаметогенез, спаривание и оплодотворение, но име-
ющие важное значение в половом размножении.
77
Определение пола связано с генотипическими осо-
бенностями, возникающими в ходе гаметогенеза и про-
цесса оплодотворения. Давно уже известен хромосом-
ный механизм определения пола.
Дробление
Процесс оплодотворения завершается образованием ди-
плоидной зиготы, а с переходом зиготы к дроблению
начинается сложный путь развития нового организма.
Вообще уже зиготу можно рассматривать как организм
на самой ранней стадии развития. Начало дробления
обусловлено рядом митотических делений, обычно про-
исходящих синхронно, в результате которых зигота де-
лится на большое количество клеток, или бластомеров,
образующих бластулу. Формированием бластулы завер-
шается первый этап эмбриогенеза.
Процесс дробления и образования бластулы у раз-
личных представителей животного мира происходит по-
разному, хотя в его основе лежат общие закономерно-
сти. Например, важной общей особенностью периода
дробления является отсутствие роста вновь образующих-
ся клеток (бластомеров) и относительно существенное
сокращение продолжительности митотического цикла.
Для бластомеров характерно почти полное выпадение
пресинтетического периода и в связи с избытком пула
предшественников очень быстро проходит синтез ДНК
(иногда в течение 10 мин). В ходе дробления обычно
существенно изменяется ядерно-плазмеиное отношение
у бластомеров за счет уменьшения объема цитоплазмы.
Для объяснения разнообразия дробления у различ-
ных животных О. Гертвиг высказал предположение, что
оно определяется количеством желтка и особенностями
его распределения в ооплазме. Позже по этому принци-
пу было выделено четыре основных типа яиц: алеци-
тальные, гомолецитальные, телолецитальные и центро-
лецитальные.
Для алецитальных яйцеклеток характерно наличие
небольшого количества желтка или почти полное его
отсутствие (например, яйцеклетки плоских червей и
млекопитающих).
Если небольшое количество желтка равномерно рас-
78
нределено в ооплазме, такие яйцеклетки называют гд-
молецитальными, или изолецитальными. Они являются
переходной формой к другому типу яиц. Гомолециталь-
пые яйцеклетки могут иметь значительное количество
желтка, который всегда равномерно распределяется
в ооплазме. Ядро яйцеклеток этого типа всегда занима-
ет центральное положение. Такие яйцеклетки характер-
цы для многих моллюсков, иглокожих, гидры, немертин,
ланцетника.
Телолецитальные яйцеклетки имеют значительное
количество желтка, неравномерно распределенного в
ооплазме. Морфологически довольно четко выражена
полярность. При этом у апимального полюса желтка
почти совсем нет и он сконцентрирован в вегетативном
полушарии. Ядро обычно смещено к анимальному по-
люсу. Такой тип яиц имеется у головоногих моллюсков,
амфибий и птиц.
Центролецитальные яйца также имеют большое ко-
личество желтка, равномерно расположенного в основ-
ной массе ооплазмы, и в связи с этим частично похожи
па гомолецитальные яйца. Однако в отличие от послед-
них у них нет желтка в тонком периферическом слое
ооплазмы, находящемся непосредственно у первичной
оболочки. Такой же слой ооплазмы окружает и ядро,
обычно занимающее центральное положение. Такие яй-
ца характерны для членистоногих.
По морфологическим признакам различают несколь-
ко типов дробления зигот животных, прежде всего пол-
ное и частичное. При полном, или голобластическом,
дроблении почти вся зигота или яйцеклетка дробится
па меньшие клетки и борозды дробления от поверхно-
сти яйца проникают до самых глубоких его частей, т. е.
разделяют его полностью. Полное дробление может
быть равномерным и неравномерным. При равномерном
дроблении образуются бластомеры почти одинакового
размера (рис. 17). Оно характерно для многих кишеч-
нополостных, немертин и других животных, имеющих
гомолецитальные яйцеклетки. Однако это более услов-
ное понятие относительно неравномерного дробления,
которое сопровождается образованием бластомеров
различной величины и встречается часто.
При частичном, или меробластическом, дроблении
борозды дробления не разделяют полностью яйцо и
79
Рис. 17. Развитие зародыша морского ежа (из Бодемера, 1971):
а — яйцо; б — д — стадии 2, 4, 8 и 16 бластомеров; е — бластула, в по-
лость которой проникают клетки вегетативного полюса; ж— гаструла
с первичной кншкой; з — плутеус (зародыш), в клетках кишечника ко-
торого находится пигментный поясок; /— ядро; 2 — эндоплазма; 3 —
пигментный поясок; 4 — кортикальный слой; 5—мезенхима; 6 — экто-
дерма; 7 — скелет; 8 — энтодерма; 9 — первичная кишка
большая его часть оказывается вне дробления. Это мо-
жет происходить различным образом; обычно выделяют
дискоидалыюе и меробластпческое (частичное) дроб-
ление. Так, у костистых рыб, пресмыкающихся и
птиц желток занимает значительную часть яйца и заро-
дыш начинает развиваться за счет небольшого количе-
ства цитоплазмы, расположенной у апимального полю-
са. В этих случаях делится только ядро и цитоплазма-
тический диск у анимального полюса и борозды дробле-
ния проходят по его поверхности или полностью разде-
ляют его (рис. 18).
Для некоторых беспозвоночных и особенно насеко-
мых, имеющих центролецитальные яйца, характерно так
называемое поверхностное дробление, при котором не-
сколько первых делений ядра, находящегося в центре
яйца, проходят без деления цитоплазмы. Затем, окру-
80
жоппые небольшим количеством цитоплазмы, ядра об-
разуют «островки» внутри недробящегося желтка, ко-
юрые перемещаются к периферии яйца, объединяясь
там с поверхностным слоем цитоплазмы, и в этой зоне
начинается формирование бластомеров (рис. 19),
а внутри остается неразделившийся желток.
Существование различных вариантов полного и ча-
стичного дробления, по-видимому, обусловлено количе-
ством и особенностями распределения желтка в ооплаз-
ме. Однако это не единственная причина. Если бы
только желток определял особенности дробления, следо-
пало бы ожидать во многих случаях равномерного и
синхронного дробления, но у ряда животных дробление
яйцеклеток явно не зависит от распределения желтка,
т. е. не всегда обнаруживается прямая корреляция ме-
жду содержанием желтка и типом дробления.
Имеется и другая классификация дробления, осно-
ванная на особенностях взаимного расположения бла-
стомеров. По этой классификации выделяют три основ-
ных типа дробления:‘радиальное, спиральное и билате-
Рис. 18. Схема меробластического (частичного) дробления (из
Бодемера, 1971);
а — г — стадии дробления яйца (вид с аиималыюго полюса); д, е —
зародыш на стадии ранней бластулы (видно, что делящиеся клетки обо-
соблены от желтка, между желтком и клетками находится бластоцель,
или полость дробления); 1 — бластоцель; 2 — пернбласт
О Зак. 918
81
a S 6
Рис. 19. Поверхностное дробление (из Бодемера,
1971).
Исходное ядро (а) делится много раз и при этом не про-
исходит деления цитоплазмы (б), затем ядра перемещаются
к периферии (в), где образуются отдельные клетки (г); 1 —
ядро; 2 — цитоплазма; J — желток
ральное. При радиальном дроблении два первых
деления являются меридиональными, т. е. происходят
в меридиональной плоскости яйца, а затем следуют
экваториальные деления, когда плоскость дробления на-
ходится под прямым углом к плоскостям первых двух
делений. В результате четыре бластомера анимального
полушария лежат непосредственно над четырьмя бла-
стомерами вегетативного полушария, что создает ради-
альную симметрию. Радиальное дробление характерно
для губок, иглокожих и многих позвоночных.
Для яиц немертин, кольчатых червей и большинст-
ва моллюсков характерно спиральное дробление
(рис. 20), при котором происходит смещение анималь-
пых клеток относительно оси яйца. Плоскость дробле-
ния в этих случаях проходит не через анимально-веге-
тативную ось яйца, а под углом к ней и экватору яйца.
Оси веретен образуют спирали или участки спиралей,
и бластомеры как бы чередуются друг с другом.
Образовавшиеся после двух первых дроблений че-
тыре бластомера обычно называют основным кварте-
том. Бластомеры основного квартета могут быть относи-
тельно равного размера, и тогда говорят о гомоквадрант-
ном дроблении. Если же бластомеры основного кварте-
та существенно различаются по своим размерам, такое
82
дробление называют гетероквадрантным. В зависимости
от направления смещения мелких бластомеров (микро-
меров) относительно крупных бластомеров (макроме-
ров) спиральное дробление разделяется на два типа:
дексиотропное и леотропное. В первом случае смещение
микромеров происходит по часовой стрелке, а во вто-
ром — против часовой стрелки.
Спиральное дробление происходит исключительно
упорядоченно, что позволяет проследить судьбу произ-
водных различных клеток. После первых двух дроблений
образуются четыре бластомера, которые обычно обозна-
чают А, В, С и D. При последующих делениях образуют-
ся бластомеры меньшего размера (микромеры) и их при-
нято обозначать \а, \b, 1с, \d. Следующие микромеры
обозначаются как 2а, 2Ь, 2с, 2d и т. д. Образование квар-
тетов микромеров сопровождается чередованием декси-
отропного и леотропного дроблений.
При спиральном дроблении обычно выделяются четы-
ре квартета микромеров, занимающих соответственно все
Рис. 20. Схема спирального дробления (из Бодемера,
1971).
В результате наклонного положения митотического веретена
(а, в) верхние клетки располагаются ие над нижними (б,
г), а между ними. Стрелки указывают направление сдвига
верхних клеток относительно более крупных мнжних кле-
ток; I — вид сверху; II — вид сбоку
6*
83
более удаленное от анимального полюса положение. Од-
новременно с делением макромеров делятся и бластоме-
ры первых квартетов микромеров, что обеспечивает к кон-
цу дробления образование значительного количества
клеток на анимальном полюсе, которые являются произ-
водными первого квартета микромеров. Однако при спи-
ральном дроблении образуется не такое уж большое
количество клеток, что позволяет проследить судьбу
практически каждого бластомера. Например, было уста-
новлено, что у брюхоногих моллюсков и кольчатых чер-
вей эктодерму образуют три квартета бластомеров, отде-
ляющихся от первых четырех бластомеров в ходе после-
довательных делений дробления.
Когда на ранних этапах дробления каждый бласто-
мер правой половины бластулы соответствует подобному
бластомеру левой половины, такое дробление называют
билатеральным, или двусторонне симметричным. Совер-
шенно очевидно, что строго упорядоченный характер
дробления яиц каждого вида животных обусловлен воз-
никшими в ходе исторического развития особыми морфо-
физиологическими и морфогенетическими механизмами,
многие из которых пока остаются нераскрытыми.
Однако из этого правила имеются исключения. На-
пример, у некоторых медуз было обнаружено так назы-
ваемое анархическое (беспорядочное, или хаотическое)
дробление, при котором сильно варьирует порядок вза-
имного расположения бластомеров. Правда, это понятие
чисто условное, так как и при таком дроблении осущест-
вляется развитие нормального организма. По мнению
Л. Н. Жинкина (1951), анархическое дробление эволю-
ционно более примитивно и от него произошли спираль-
ный и радиальный типы дробления.
Совершенно очевидно, что при различных типах
дробления должны существовать и различия в строении
бластул, хотя они имеют ряд общих особенностей, явля-
ющихся показателями общности происхождения живот-
ного мира. Наиболее простые по строению бластулы
представляют собой плотный шар, образованный тесно
сближенными бластомерами и не имеющий какой-либо
полости (например, у некоторых гидроидных полипов).
Такой тип бластулы называют морулой (от лат. morum—
тутовая ягода). Бластулы ряда животных на ранних ста-
диях развития очень сходны с морулой.
84
В большинстве случаев уже на стадии четырех
иластомеров последние слегка округляются и между ни-
ми образуется небольшая щель, которую называют по-
юстью дробления, или сегментационной полостью. В хо-
те дробления эта полость увеличивается и постепенно
превращается в полость бластулы, которая называется
оластоцелем, или первичной полостью зародыша. Стенка
бластулы (бластодерма) состоит из одного слоя бласто-
меров, которые в вегетативном полушарии несколько
крупнее (например, у морского ежа, яйцо которого мож-
но отнести к изолецитальному типу), т. е. бластула пред-
ставляет собой полый однослойный шар (см. рис. 16).
При дроблении телолецитальных яиц в конце разви-
тия бластулы обычно образуется многослойная бласто-
дерма, состоящая из различных по размеру бластомеров
н анимальной и вегетативной частях. Такая бластула ха-
рактерна для амфибий.
Однослойные бластулы с хорошо выраженным бла-
стоцелем называют цеыобластулами, а бластулы без чет-
ко выраженного бластоцеля — стерробластулами (от
греч. sterros — крепкий). В случаях с поверхностным
дроблением бластоцель заполнен желтком и продуктами
жизнедеятельности бластомеров, т. е. нет типичной поло-
сти дробления и бластоцеля. Такие бластулы называют
перибластулами. Бластодерма у них состоит из одного «
слоя клеток.
В результате дискоидального дробления формируются
дискобластулы, бластоцель у которых представлен узкой
щелью, находящейся под зародышевым диском. Цело-
бластулы с резко различающимися по размерам бласто-
мерами анимального и вегетативного полушарий часто
называют амфибластулами (например, у губок). Так, на
восьмом дроблении яйца некоторых губок передняя поло-
вина бластулы состоит из клеток с ресничками, а зад-
няя — из крупных зернистых клеток. Покинув тело мате-
ри, такая бластула плавает при помощи ресничек бласто-
меров верхней части, затем прикрепляется к субстрату и
развивается в губку.
У некоторых беспозвоночных животных (например,
наземных олигохет) имеется своеобразный тип бластулы,
которая представлена двухслойной пластинкой и назы-
вается плакулой. Образование плакулы обусловлено тем,
что при дроблении бластомеры располагаются только
85
Рис. 21. Типы бластул (из Токииа, 1970):
а — морула; б — бластула морского ежа; о — бла-
стула лягушки; г — бластула костистой рыбы;
д — бластула птицы; е — амфибластула в теле
губки; е' — плавающая бластула губки; ж — стер-
робластула; з, з' — плакула (вид с поверхности и
сбоку)
в двух параллельных плоскостях, образуя два сближен-
ных пласта. Такой тип бластулы определяет и своеобраз-
ные особенности гаструляции.
Таким образом, строение бластулы у различных пред-
ставителей животного мира довольно разнообразно
(рис. 21). Особенности строения бластул прежде всего за-
висят от количества и распределения желтка в ооплазме,
а также от свойств ооплазмы и типа дробления. У одних
животных бластула представляет собой полый шар, стен-
ка которого состоит из плотно соединенных между собой
бластомеров, а у других бластомеры располагаются до-
вольно рыхло. Форма бластулы зависит и от механиче-
ских факторов. Например, в ряде случаев особое значе-
ние имеет внеклеточный гиалиновый слой, при его удале-
нии исключается нормальное формирование бластулы.
Существует мнение, что поверхностный слой яиц иглоко-
жих и кортикальный слой яиц амфибий и костистых рыб
86
укрепляют связи между бластомерами. Для сохранения
оластула мп определенной формы имеют также значение
и юзмодесмы (межклеточные цитоплазматические мо-
стики), остатки митотических веретен и межклеточные
вещества.
Гаструляция
У некоторых животных со спиральным типом дробле-
ния рано происходит обособление бластомеров в морфо-
। енетическом отношении, т. е. появляются зачатки буду-
щих органов. В большинстве же случаев такого раннего
обособления зачатков органов не происходит и дифферен-
цировка начинается в следующей стадии эмбриогенеза —
еаструле (от греч. gastre— выпуклость, чрево сосуда).
Процесс образования гаструлы называется гаструляцией.
В период гаструляции происходит ряд сложных морфо-
। спетических движений, в результате которых зачатки
будущих тканей и органов перемещаются в строго опре-
деленные места и начинается дифференцировка органов
н систем согласно существующей генетической инфор-
мации.
Зародыш на стадии гаструлы состоит из четко разли-
чимых пластов клеток, так называемых зародышевых
пластов, или листков: наружного (эктодерма), внутрен-
него (энтодерма) и среднего (мезодерма).
Мезодерма у позвоночных животных формируется
в период гаструлы. Обычно она представлена совокуп-
ностью клеток, находящихся между эктодермой и энто-
дермой, а точнее, в бывшем бластоцсле. Следовательно,
в начале гаструлы зародыш является двухслойным, по-
скольку прежде всего четко дифференцируются эктодер-
ма и энтодерма, а по мере закладки и формирования ме-
зодермы зародыш становится трехслойным.
Пока хорошо известны лишь морфологические особен-
ности развития мезодермы. Не учитывая переходные спо-
собы образования мезодермы у различных представите-
лей животного мира, можно выделить два основных пути
се обособления: телобластиче ский и энтероцельный. Пер-
вый характерен для первичноротых, а второй — для вто-
ричноротых. При телобластическом способе образования
мезодермы в ходе гаструляции на границе между экто-
87
Рис. 22. Схема образования мезодермы у пер-
вичноротых (а) и вторичиоротых (б) (из Токи-
на, 1970):
1 — эктодерма; 2 — мезенхима; 3— энтодерма; 4 —
телобласт
дермой и энтодермой в районе бластопора дифференци-
руются две или большее количество крупных клеток (те-
лобластов), дающих в результате митотических делений
мелкие клетки, из которых формируется мезодерма.
Для энтероцельного способа образования мезодермы
характерно то, что клетки среднего зародышевого пласта
являются производными карманоподобных выступов пер-
вичного кишечника внутри бластоцеля. При этом группы
клеток обособляются от выступов первичного кишечника
и, объединяясь, дают начало мезодерме (рис. 22).
Морфологически период гаструляции хорошо изучен
у ланцетника. Гаструляция у ланцетника начинается при-
мерно после десятого дробления, когда бластула имеет
более 1000 бластомеров и в ней довольно ясно различим
эктодермальный слой и начинающий впячиваться веге-
тативный полюс. В результате впячивания формируется
первичная кишка, открываемая наружу бластопором. За-
тем первичная кишка достигает внутренней поверхности
клеток анимального полушария. Все это завершается об-
разованием чашеобразной гаструлы, состоящей из на-
ружного (эктодерма) и внутреннего (энтодерма) сло-
ев, т. е. первоначально образуется двухслойный заро-
дыш. Мезодермальные клетки и клетки будущей хорды
вначале находятся у края внутреннего слоя энтодермы и
в ходе гаструляции мигрируют, располагаясь у дорсаль-
ной стенки энтодермы (крыши первичной кишки). Затем
88
мезодерма обособляется, сегментируется и образует от-
дельные сомиты, на основе которых формируются мышеч-
ные сегменты. Зачаток же хорды выпячивается из крыши
первичной кишки в дорзальном направлении. Одновре-
менно наружный и внутренний листки боковых пластинок
образуют стенки полости тела (целома). К концу гастру-
ляции расположенная над хордой эктодерма видоизменя-
ется и дает начало нервной трубке. Таким образом,
в конце гаструляции довольно четко обозначается общий
план строения тела, характерный для хордовых (рис. 23).
Гаструляция у амфибий (лягушки, тритоны и др.) на-
чинается с появления вдавливания или щели в середине
серого серпа, что обусловливает появление бластопора.
Вдавливание у амфибий не может происходить как у лан-
цетника, поскольку у них вегетативное полушарие бла-
стулы перегружено желтком. Щель бластопора постепен-
но удлиняется по окружности, т. е. по границе краевой
зоны и вегетативной части зародыша, и затем замы-
кается в кольцо. Таким образом, формируется кольцевид-
ный бластопор, который ограничивает клеточный мате-
Рис. 23. Схема гаструляции у ланцетника (из Боде-
мера, 1971):
/ — бластоцель; 2— бластопор; 3 — эктодерма; 4 — энтодер-
ма; 5 — гастроцель; 6 — зачаток нервной трубки; 7 —хорда;
8 — сомит; 9 — первичная кишка
89
Рис. 24. Схема гаструляции у амфибий (по Шпеману из Токи-
па, 1970):
а — д — медиальные сагиттальные срезы; е — та же стадия, что и на
фиг. д, в поперечном разрезе; / — эктодерма; 2 — нервная пластинка;
3 — хордо-мезодерма; 4 — энтодерма; 5 — мезенхима
риал вегетативной части, приобретающий вид подушечки
и называемый желточной пробкой (рис. 24).
При формировании бластопора в процесс инвагина-
ции последовательно включается энтодермальный и ме-
зодермальный клеточный материал. Например, в полость
бластулы лягушки с поверхности перемещаются клетки,
находящиеся на границе пигментированного и светлого
полушарий. В связи с этим с одной стороны щели бласто-
пора оказываются пигментированные клетки, а с дру-
гой — светлые клетки. Желточная пробка выглядит свет-
лой, она как бы обрамлена темной рамкой. Гастральное
впячивание начинается около дорсальной губы бластопо-
ра в результате встречного движения в сторону бласто-
пора хордо-мезодермального материала со стороны ани-
мального полюса и растяжения эктодермального — со
стороны вегетативного полюса. Гастральное впячивание
постепенно углубляется и ко времени образования коль-
90
Э
ц> uii'iiKii(I loiiopii ifoirin догiin ner аппмалыкно шк
HOI
IImniinmiiiie в ходе гаструляции у амфибий и связан-
и>ц' е ним нарастание одних клеточных масс на другие
f uiuiiojliui) завершаются закрытием бластопора желточ-
ной (эитодермальной) пробкой, которая оказывается
ниу ipjj зародыша. Процесс впячивания, начинающийся
। одно у амфибий и ланцетника, существенно изменяется
«нем у амфибий. Истинное впячиванис сменяется свос-
чНразиым процессом перемещения в бластоцель клеточ-
ного материала будущих прехордальной пластинки, хор-
ил и мезодермы. По ходу гаструляции все новые и новые
<, чистки бластодермы заворачиваются внутрь, оказы-
ваясь в бластоцеле. Это не простое «перекатывание» но-
вых партий клеток по краю бластопора. Дело в том, что
।убы бластопора, особенно верхняя (дорсальная), непре-
рывно обновляют свой клеточный состав и вновь образу-
t мне клетки включаются в процесс гаструляции.
Топография презумптивных зачатков и органов бла-
। 1улы амфибий очень сходна с таковой у ланцетника. Как
и у ланцетника, определенные участки бластодермы
у амфибий, являющиеся исходными для формирования
мускулов, хорды, кишки и других органов, в результате
। аструляции оказываются внутри зародыша.
У костистых рыб наблюдается несколько иная морфо-
логическая картина гаструляции. В ходе дробления фор-
мируется бластодерма в виде шапочки, расположенной
на большой массе желтка, которая соединяется с желт-
ком при помощи перибласта, т. е. продолжения ее эпите-
лиального клеточного слоя. Следовательно, бластула
у костистых рыб состоит из бластодермы в виде апикаль-
ной шапочки и подстилающего ее перибласта, тесно свя-
юиного с желтком (рис. 25). В ходе гаструляции бласто-
диск становится тоньше, а его наружный край утолщается
и образуется краевое кольцо. По ходу роста бласто-
диска краевое кольцо распространяется в направлении от
апимального полюса. Утолщенная часть бластодиска на-
зывается зародышевым щитком, а его нижний слой —
гипобластом, который в начале гаструляции похож на
небольшой язычок, продвигающийся вперед между на-
ружным слоем бластодиска и перибластом. Затем крае-
вое кольцо и наружные внезародышевые участки бла-
гтодиска постепенно обрастают желток, покрывая всю
91
его массу. К концу гаструляции края обрастания смыка-
ются в хвостовой части тела зародыша, что соответст-
вует замыканию бластопора у амфибий.
Вопрос о морфогенетических передвижениях и об об-
разовании гипобласта в ходе гаструляции у костистых
рыб остается спорным. У них зачатки прехордальной пла-
стинки хорды и мезодермы в результате вворачивания
у края бластодиска перемещаются с поверхности внутрь
и занимают определенные места относительно оси заро-
дыша, т. е. этот процесс сходен с впячиванием хордо-ме-
зодермы у амфибий. Однако имеется и другая точка зре-
ния: гипобласт возникает в результате миграции внут-
ренних центральных клеток бластодиска, постоянно
нарастающих друг над другом (эпиболия). Образование
осевых структур зародыша обусловлено этой миграцией
и конвергенцией глубоких клеточных слоев. К такому
заключению, например, пришел В. Боллард в результате
изучения гаструляции у лососевых.
У рептилий и птиц яйцеклетки относятся к телолеци-
тальному типу, имеют большое количество желтка и
очень крупные. Желток яйца и является собственно яйце-
клеткой. Яйцо покрыто тонкой желточной оболочкой,
формирующейся из продуктов жизнедеятельности клеток
фолликулярного эпителия и производных ооплазмы. Жел-
92
ючная оболочка состоит из гомогенного слоя, перепле-
ниощихся белковых волокон и не имеет пор. У яйца
и । пц три слоя третичных оболочек: 1) белковая оболочка
(оелок), образующаяся за счет продуктов секреции верх-
ней, самой длинной части яйцевода; 2) двухслойная под-
। корлуповая оболочка, формирующаяся в коротком от-
деле яйцевода; 3) известковая скорлупа, образующаяся
и самой нижней части яйцевода. Это типичное строение
яйца птиц. Яйца черепах также имеют белковую оболоч-
ку, а у ящериц и змей она отсутствует или представлена
очень тонким слоем.
Для яиц птиц характерно дискоидальное дробление,
приводящее к образованию дискобластулы, крышей ко-
(орой является бластодиск, а дном — несегментирован-
пая масса желтка. На стадии 16 бластомеров нижняя по-
верхность клеток центральной части бластодиска начи-
нает отделяться от желтка и образуется щелевидная
полость, называемая предзародышевой полостью. Затем
на полость распространяется до внутренних границ кра-
евого перибласта, но‘не заходит под краевые клетки.
Крупные краевые клетки делятся, пополняя центральную
юпу, а горизонтальные борозды дробления проходят че-
рез центральную бластодерму; она становится много-
слойной и ее клетки полностью отделяются от желтка.
На более поздних стадиях дробления деление крае-
вых клеток замедляется, а часть ядер делящихся крае-
вых клеток мигрирует в перибласт, образуя многоядер-
пый слой, называемый зародышевым валиком. Некото-
рые ядра мигрируют в цитоплазму, прилегающую ко
дну предзародышевой полости, формируя центральный
перибласт. К этому времени краевой перибласт начинает
обрастать поверхность желтка, а у края бластодиска про-
должается образование новых клеток. Поверхностные
плетки, вероятно, позже дают начало части эктодермы, а
оолее глубоко расположенные клетки — части мезодер-
мы и энтодермы желточного мешка.
Яйцо птиц имеет важное приспособление, обеспечива-
ющее на начальных этапах развития зародыша опреде-
ленную ориентацию дробящегося участка, который при
любом положении яйца находится вверху. Это обеспечи-
вается различным удельным весом анимальной и вегета-
। пвной частей желтка, а также наличием халаз (тяжей
пруктурно видоизмененного белка), связанных с наруж-
93
йЫм белком у тупого и острого концов яйца, т. е. желток
как бы подвешен внутри белковой оболочки.
Гаструляции у птиц начинается до образования тре-
тичных оболочек яйца, т. е. в яйцеводах, а завершается
обычно в первые сутки инкубации (насиживания). До на-
чала инкубации в бластодиске яйца появляется разделе-
ние на центральное светлое поле (area pellucida) и окру-
жающее его более темное поле (area ораса). В area pellu-
cida затем формируются зачатки собственно зародыша, а
в area ораса эктодермальные клетки образуют плотные
слои, прижатые к желтку и дающие затем начало эпите-
лию желточного мешка.
Образование внутреннего эктодермального пласта
(гипобласта, или эндобласта) во врем& гаструляции раз-
лично у птиц, ланцетника, амфибий и рыб. По-видимому,
образование эндодермального пласта у птиц осуществля-
ется не путем подворачивания клеток заднего края бла-
стодиска, а расщеплением (деляминацией) клеточного
пласта на наружный и внутренний. Имеющиеся мнения
относительно особенностей образования кишечной энто-
дермы пока противоречивы, поскольку у различных ви-
дов птиц может доминировать либо подворачивание, ли-
бо деляминация.
Центральная часть бластодиска у птиц утолщается и
преобразуется в зародышевый щиток. После перемеще-
ния клеток зародышевого щитка по его средней линии
появляется утолщение, получившее название первичной
полоски. В свою очередь на переднем конце первичной
полоски в результате большой концентрации клеток об-
разуется утолщение, называемое гензеновским, или пер-
вичным, узелком. По всей длине первичной полоски появ-
ляется углубление — первичная бороздка, которая вблизи
гензеновского узелка заканчивается ямкой, дно кото-
рой направлено в сторону переднего края бластодиска.
Передний край ямки гензеновского узелка гомологи-
чен дорсальной губе бластопора амфибий, поскольку
в этом месте, так же как и около дорсальной губы бла-
стопора амфибий, перемещаются клетки, входящие за-
тем в состав дорсального эпителия переднего отдела пи-
щеварительного тракта, двух пар головных мезодермаль-
ных сомитов и хорды. В районе же первичной бороздки
• мигрируют под поверхностный эпителий клетки осевой и
боковой мезодермы, гомологичные тем, которые переме-
94
Рис. 26. Схема гаструляции у птиц (из Бодемера, 1971):
а — образование энтодермы в бластодерме куриного зародыша: 1 —
сплошной слой энтодермы; 2 — прерывистый слой энтодермы; 3 —
серповидная область, состоящая из разрозненных клеток энтодермы;
4— первичная полоска; б — карта зачатков бластодермы куриного за-
родыша: 1 — впезародышевая мезодерма; 2— впезародышевая эктодер-
ма; 3— мезодерма боковой «пластинки; 4 — сердце; 5 — сомиты; 6 — за-
чаток нервной пластинки; 7 — будущий эпидермис; 8 — вмезародыше-
вая эктодерма; 9 — зачаток хорды; 10 — граница миграции; 11— буду-
щая первичная полоска; /2 — энтодерма
щаются через боковые губы бластопора амфибий. Эпи-
(юлия при гаструляции у птиц выражается в том, что пе-
редняя часть гензеновского узелка постепенно перемеща-
егея в направлении заднего края бластодиска и хордаль-
ный отросток (зачаток хорды), постепенно удлиняясь,
соединяется с туловищной мезодермой. При этом первич-
ная полоска соответственно укорачивается. Часть экто-
термального пласта, находящегося впереди гензеновского
узелка над хордой, дифференцируется в нервную пла-
стинку, а остальная его часть используется затем для
образования кожного эпителия. Поскольку впереди ген-
leiioBCKoro узелка раньше возникают условия для появле-
ния зачатков осевых органов, в головном отделе зароды-
ша по мере перемещения гензеновского узелка к заднему
концу первичной полоски сначала проходит нейруляция,
и затем другие этапы эмбриогенеза (рис. 26).
Мезодерма у птиц появляется вблизи первичной по-
лоски и сначала находится около средней линии зароды-
ша, распространяясь затем в стороны и вперед, проникая
между эктодермой и желточной энтодермой в перифери-
95
ческие участки бластодиска. Края же бластодиска у птиц
являются и краями обрастания желтка с образованием
желточного мешка.
Гаструляция у птиц значительно усложняется по
сравнению с таковой у ланцетника, амфибий и костистых
рыб, хотя и сохраняются основные общие черты.
У высших млекопитающих и человека яйца почти не
имеют желтка, а также каких-либо других трофических
соединений в нужном количестве даже для начальных
стадий эмбриогенеза. Все необходимое для своего разви-
тия зародыш с самого начала получает от материнского
организма. Яйцеклетки плацентарных микроскопическо-
го размера (примерно 100—200 мкм в диаметре), алеци-
тального или изолецитального типа, дробление полное.
Вопрос о происхождении млекопитающих пока остается
нерешенным, хотя вполне очевидно, что их предками бы-
ли яйцекладущие рептилии.
Среди живущих в настоящее время примитивных мле-
копитающих имеются яйцекладущие животные. Так, у
утконоса яйцо развивается вне материнского организма,
а у ехидны — в кожной складке на брюшной стороне те-
ла, но зародыш не получает питания от матери. Яйца у
этих животных имеют большое количество желтка, отно-
сятся к меробластическим яйцам с частичным дробле-
нием и ранние этапы эмбриогенеза сходны с таковыми
у рептилий.
Своеобразными переходными формами являются и
сумчатые животные, зародыши которых почти нс полу-
чают питания от матери. У ряда сумчатых примитивная
плацента, функционирующая непродолжительное время.
Зародыши рождаются недоношенными и обычно очень
мелкими (1—2 см), а затем донашиваются матерью
в сумке, где устанавливается своеобразная связь пищево-
да зародыша с соском матери и молоко периодически
впрыскивается в пищевод. Яйца сумчатых животных со-
держат небольшое количество желтка. Вообще в ходе
эволюции имелась определенная тенденция относительно
содержания желтка в яйцах, т. е. чем больше развитие
зародыша зависит от материнского организма, тем мень-
ше содержится желтка в яйцах.
Обычно в результате дробления у млекопитающих об-
разуется морула и лишь у некоторых видов (землеройки
и прыгунчиковые) на стадии четырех бластомеров появ-
96
Рис. 27. Схема ранней
(а) и поздней (б) бла-
стоцисты и Дифференци-
рующегося эмбриобласта
(в) млекопитающих (по
Уоддингтону из Токина,
1970):
1 — трофобласт; 2 — эмбрио-
бласт; 3 — энтодерма; 4—
эктобласт; 5 — рауберов слой
трофобласта
ляется бластоцель. Имеются довольно четкие различия
между цитоплазмой внутренней и периферической мас-
сы бластомеров морулы. Внутренняя группа бластоме-
ров называется эмбриобластом и из него развиваются
сам зародыш, его амнион и желточный мешок. Перифери-
ческие бластомеры называют трофобластом (питающим
зачатком), и они обеспечивают установление связи меж-
ду зародышем и тканями матки.
После ряда дроблений морула млекопитающих прев-
ращается в бластоцисту (бластодермический, или заро-
дышевый, пузырек) и ее полость заполняется жидкостью,
включающей продукты жизнедеятельности клеток заро-
дыша. На одном из участков однослойной стенки бласто-
цисты образуется скопление клеток эмбриобласта (заро-
дышевого узелка), который затем развивается в зароды-
шевый щиток. Участок соприкосновения трофобласта
с эмбриобластом называется рауберовым слоем (рис. 27).
В начале гаструляции в зародышевом щитке обособ-
ляется энтодерма. Процесс гаструляции у сумчатых и
плацентарных млекопитающих сходен с таковым у реп-
тилий и птиц. Принципиально новым является то, что
в период гаструляции зародыш имплантируется в стенку
матки, что сопровождается рядом сложных морфофизио-
логических процессов. Как у рептилий и птиц, у млекопи-
тающих образуются амнион, аллантоис и желточный ме-
шок, хотя яйцеклетки млекопитающих практически лише-
ны желтка.
В ходе эмбриогенеза у млекопитающих и человека
между зародышем и материнским организмом возника-
ют определенные связи, обусловленные формированием
специального органа — плаценты (детского места). Пла-
7 Зак. 918
97
Центы в связи с особенностями строения разделяются на-
четыре типа. Эпителиохориальная плацента, или полу-
плацента, имеется у некоторых видов сумчатых, свиньи,
лошади и других млекопитающих. Ворсинки хориона это-
го типа плаценты проникают в углубления эпителия сли-
зистой оболочки матки, не разрушая его. Ворсинки хори-
она всасывают маточное молоко (эмбриотроф), секрети-
руемое маточными железами и обеспечивающее зародыш
питательными веществами и кислородом.’При родах эпи-
телий матки не разрушается.
Для жвачных животных характерна десмохориальная,
или соединительнотканная, плацента. При развитии пла-
центы этого типа ворсинки хориона внедряются в стенку
матки, разрушая эпителий ее слизистой оболочки, и ткани
зародыша оказываются в контакте с соединительной
тканью стенки матки, через которую он и получает все
необходимое от материнского организма. После родов
в стенке матки остаются участки, лишенные эпителия
слизистой оболочки, но он довольно быстро регенерирует.
Вазохориальная, или эндотелиохориальная, плацента
характерна для хищных млекопитающих. Плацентация
у них сопровождается не только разрушением эпителия
слизистой оболочки матки, но и нарушениями структуры
ее соединительной ткани, и трофобласт ворсинок хориона
оказывается в непосредственном контакте с эндотелием
сосудов. Этот тип плацентации обеспечивает более тес-
ную связь зародыша с материнским организмом и более
совершенное его снабжение питательными веществами.
У некоторых насекомоядных, летучих мышей, грызу-
нов, обезьян и человека развивается гемохориальная
плацента, обеспечивающая более тесную связь зароды-
ша с материнским организмом. При формировании пла-
центы данного типа разрушается эпителий слизистой
оболочки матки, участки соединительной ткани и часть
сосудов матки. В результате трофобласт непосредствен-
но соприкасается с кровью матери. Строение таких пла-
цент различно у разных видов животных. Например,
у обезьян и человека ворсинки хориона сильно ветвятся,
в результате чего увеличивается поверхность их сопри-
косновения с кровью. Это ворсинчатая гемохориальная
плацента. Иногда увеличение поверхности контакта
с кровью матери достигается путем разветвления выпя-
чиваний самого трофобласта (например, у грызунов)
98
е образованием сложного Лабиринта Каналов. Такую
плаценту называют лабиринтной гемохориальной. При
। емохориальной плаценте роды сопровождаются обиль-
ным кровотечением и отторжением эпителия слизистой
оболочки матки. Однако в норме стенка матки быстро
регенерирует.
Рассмотренные типы строения плаценты у различных
представителей млекопитающих и человека в известной
мере отражают пути эволюции внутриутробного разви-
тия, являющегося наиболее рациональным и надежным.
Известные типы плацент указывают на существование
мпоговариантной схемы формирования адаптаций, обес-
печивающих связь зародыша с материнским организмом,
среди которых есть более и менее совершенные.
Теперь рассмотрим типы гаструляции в связи с мор-
фогенетическими движениями, тем более что некоторые
из них или некоторые их особенности встречаются у всех
представителей животного мира. Различают четыре типа
। аструляции и морфогенетических движений: инвагина-
цию, эпиболию, иммиграцию и деляминацию.
При инвагинации части однослойной бластодермы
впячиваются внутрь бластоцеля и образуется двухслой-
ный мешок, наружная его стенка является эктодермой, а
внутренняя — энтодермой. Таким образом, возникает и
первичный кишечник (архентерон), а отверстие, которым
он сообщается с наружной средой, называют первичным
ртом, или бластопором. Судьба последнего различна у
разных животных. Во многих случаях первичный рот
дифференцируется в окончательный рот взрослого орга-
низма и таких животных называют первичноротыми
(черви, моллюски, членистоногие). У так называемых
вторичноротых бластопор может дифференцироваться
и анальное отверстие или нервно-кишечный канал, нахо-
дящийся в заднем конце эмбриона (щетинкочелюстные,
плеченогие, иглокожие, кишечнодышащие и хордовые).
Значение инвагинации и инвагинационной гаструлы оста-
ется неясным, хотя, казалось бы, это довольно простое
морфогенетическое движение.
Иммиграционная гаструла характерна для многих ки-
шечнополостных и ее развитие осуществляется за счет
активного вытеснения (иногда говорят—выселения) ча-
сти клеток стенки бластулы внутрь бластоцеля. Иммиг-
рация клеток может быть униполярной или мультипо-
7* 99
лярной. В первом случае вытесняются в бластоцель лишь
клетки с вегетативного полюса бластулы и затем такие
клетки дают начало энтодерме (например, у большинст-
ва гидромедуз). При мультиполярной иммиграции в бла-
стоцель вытесняются клетки из любых участков бласто-
дермы. Это редкое явление; впервые оно было описано
И. И. Мечниковым на одном из видов медуз. Следует от-
метить, что при иммиграционном типе гаструляции бла-
стоцель быстро заполняется плотной массой клеток и
полностью исчезает. У такой гаструлы нет бластопора и,
следовательно, нет общения гастроцеля с внешней сре-
дой.
У некоторых животных с телолецитальным типом яиц
имеется так называемая эпиболическая гаструла (напри-
мер, yBonnella). В таких случаях в ходе дробления четко
различимы макромеры и микромеры. Макромеры делят-
ся медленно и не проявляют каких-либо морфогенетиче-
ских движений; их обрастают быстроделящиеся микро-
меры. У таких зародышей отсутствует бластопор и на
ранних этапах гаструляции не появляется зачаток пер-
вичного кишечника, который закладывается значительно
позже, после нескольких делений макромер.
Образование деляминационной гаструлы встречается
у кишечнополостных; впервые было описано И. И. Меч-
никовым. Яйца таких животных можно отнести к центро-
лецитальному типу, только у них существенно различает-
ся структура эктоплазмы и эндоплазмы, в которую захо-
дит наружный эктоплазматический слой, содержащий
полужидкий желток. Примерно до 32 бластомеров наб-
людается довольно равномерное синхронное дробление,
бластомеры относительно одинакового размера. Дробле-
ния бластомеров происходят параллельно поверхности
зародыша. В результате наружный слой бластомеров яв-
ляется производным исходной эктоплазмы, а внутрен-
ний— эндоплазмы и частично эктоплазмы, т. е. видна
довольно четкая деляминация (расщепление) одного
слоя клеток на два. Затем делятся только внутренние
бластомеры параллельно поверхности зародыша и при
этом образуются четко различимые наружные (эктоплаз-
матические) и внутренние (эндоплазматические) бласто-
меры. При такой своеобразной гаструляции зародыш
оказывается шаром, состоящим из 64 плоских клеток
эктодермы и 32 клеток энтодермы. Один из вариантов
100
дсляминации был описал для животных, у которых при
дроблении развивается типичная морула (например,
у Clava squamata). При этом периферийные бластомеры
морфологически отличаются от остальных. Наружный
пласт клеток образует эктодерму, а внутренний —
энтодерму.
Встречаются смешанные типы гаструляции и морфо-
генетических движений. Вообще рассмотренные типы га-
струляции в известной мере условны и в большинстве
случаев правильней говорить, что инвагинация, эпиболия,
иммиграция и деляминация являются доминирующими
в характере морфогенетических движений и в процессе
гаструляции у многих животных могут иметь место одно-
временно несколько из этих движений. Кроме того, про-
цесс эпиболии иногда можно отождествить с некоторыми
вариантами инвагинации, деляминация иногда уподобля-
ется иммиграции и т. д. Например, у амфибий можно
выделить несколько вариантов гаструляции, назвав их
смешанными.
Ранее говорилось, что в некоторых случаях возможно
проследить судьбу отдельных бластомеров в ходе гастру-
ляции. Это чрезвычайно важно для познания механизмов
эмбриогенеза. Особое значение имеют методы выявления
презумптивных (предположительных или вероятных)
зачатков будущих органов на стадии бластулы и гастру-
лы. В развитии эмбриологии животных особую роль сы-
грала методика маркировки частей зародыша, предло-
женная в 1925 г. В. Фогтом. Суть ее заключается в сле-
дующем. Кусочки агара нужного размера помещаются
в растворы витальных красителей (нейтральный крас-
ный, метиленовый синий, коричневый Бисмарка и др.).
Окрасившиеся кусочки агара прикладывают к поверхно-
сти зародыша в местах, интересующих исследователя.
По мере диффузии красителя окрашивается определен-
ная группа клеток и эту метку можно проследить затем
при дальнейшем развитии зародыша.
Метод В. Фогта был успешно использован при изуче-
нии гаструляции у амфибий, в результате чего удалось
создать карту презумптивных зачатков органов. Напри-
мер, точно установлено, что обширная область анималь-
пого полюса зародыша дает начало эпидермису кожи, а
некоторые ее участки позже используются для построе-
ния органов обоняния и слуха, эктодермальной части
101
рта, линзы глаза и слизистых желез. Было также уста-
новлено, что некоторые клетки анимального полушария
оказываются исходными для формирования нервной си-
стемы, а часть промежуточной (маргинальной) зоны бла-
стулы является исходной для хорды и т. д.
Карта расположения презумптивных зачатков орга-
нов показала, что части будущей головы (глаза, органы
слуха и обоняния) находятся вблизи анимального полю-
са бластулы, соответствующего переднему "концу зароды-
ша. Часть промежуточной зоны, где находится материал
хорды, соответствует спине зародыша, а противополож-
ная часть — брюху. С помощью метода В. Фогта были
созданы карты презумптивных зачатков органов у заро-
дышей костистых рыб, рептилий и птиц. Этот метод не-
возможно применять при наличии очень мелких яиц и
зародышей. В последних случаях помогают гистологиче-
ские методы исследования.
Сложным остается вопрос о цитогенетических и физи-
ологических механизмах гаструляции. Совершенно оче-
видно, что пет единственной причины для всех случаев.
Однако не исключено существование каких-то общих тен-
денций даже при различных типах гаструляции и морфо-
генетических движений. Многие исследователи (С. Гер-
стадиус, Т. Густафсон, Ж. Руннстрем, Ж. Гольтфретер и
др.) тщательным образом изучали процесс гаструляции.
Правда, в большинстве случаев эти исследования были
проведены на морских ежах и амфибиях. Был предложен
ряд гипотез о причинах гаструляции, но пока нет обще-
принятой.
В ходе эмбриогенеза костистых рыб, рептилий, птиц
и млекопитающих появились провизорные (временные)
образования, имеющие большое значение для развития
зародыша. Это желточный мешок и зародышевые обо-
лочки. В образовании желточного мешка у рептилий и
птиц принимают участие все зародышевые пласты (лист-
ки), только мезодермальный пласт несколько отстает
в своем росте от эктодермального и энтодермального, по-
скольку он возникает позднее. Боковая мезодерма разде-
ляется на париетальный (наружный) и висцеральный
(внутренний) листки, которые продолжаются за преде-
лами тела зародыша, оказываясь в составе перифериче-
ских участков бластодиска. Собственно стенка желточ-
ного мешка образуется за счет желточной энтодермы и
102
висцерального листка мезодермы. В отличие от желточ-
ного мешка рыб желточный мешок рептилий и птиц дли-
тельное время остается незамкнутым и по мере расходо-
вания желтка становится складчатым. Перед вылуплива-
пнем зародыша из яйцевых оболочек желточный мешок
с остатками желтка перемещается в брюшную полость и
через месяц после вылупливания полностью дегенери-
рует.
На третий день развития куриного зародыша начи-
нает появляться сеть кровеносных сосудов в так называе-
мом сосудистом поле желточного мешка, который выпол-
няет функцию эмбрионального кроветворного органа.
В самом же зародыше кроветворные органы (печень, се-
лезенка, костный мозг) образуются значительно позже.
Связь сосудистой системы желточного мешка с сосуди-
стой системой собственно зародыша устанавливается
в результате развития правой и левой вен, соединяющих-
ся в непарный венозный проток, который в свою очередь
соединяется с венозным синусом развивающегося серд-
ца. С момента начала сокращения сердца (в конце вто-
рого дня развития зародыша) возникает кровоток, и
кровь поступает из желточного мешка в собственно за-
родыш.
Кроме того, клетки внутреннего листка желточного
мешка продуцируют специфические ферменты, преобра-
зующие желток, и всасывают продукты расщепления
желтка, проводя их к развивающемуся зародышу. Следо-
вательно, желточный мешок является мультифункцио-
пальным образованием, обеспечивающим реализацию
зародышем питательных веществ желтка, эмбриональное
кроветворение и дыхание эмбриона.
У зародышей рептилий и птиц кроме желточного меш-
ка имеются еще три провизорных органа, получивших
название зародышевых оболочек: амнион, хорион и ал-
лантоис. Они являются своеобразными адаптациями,
обеспечивающими защиту и частично питание эмбриона.
Амнион и хорион в своем формировании тесно взаи-
мосвязаны. Их зачатки появляются вблизи головного
конца зародыша в виде поперечных складок, которые за-
тем разрастаются, срастаются и полностью покрывают
зародыш. Таким образом, зародыш оказывается заклю-
ченным в амниотическую полость, вскоре заполняющую-
ся амниотической жидкостью. В результате зародыш
103
оказывается окруженным амниотической жидкостью со
всех сторон и остается связанным с внезародышевыми
частями только пупочным канатиком.
Амниотические складки развиваются из эктодермы и
париетального листка мезодермы. Мезодермальный кле-
точный материал проникает затем в переднюю часть
складки и в основном обеспечивает рост стенки амниона.
Из той же самой складки, образованной участком экто-
дермального листка и листка париетальнрй мезодермы,
формируется хорион (серозная оболочка, или сероза).
Такая исходная складка представляет собой четырех-
слойное образование, т. е. сочетание наружных и внут-
ренних слоев эктодермы и париетальной мезодермы. Ам-
нион развивается из внутреннего эктодермального и на-
ружного мезодермального слоев, а хорион наоборот — из
наружного эктодермального и внутреннего мезодермаль-
ного. Хорион разрастается под скорлупой по всей ее по-
верхности, над экзоцеломом.
Амнион и хорион являются своеобразными оболоч-
ками, защищающими зародыш от различных внешних
воздействий, предохраняющими его от высыхания, со-
трясения и прилипания к оболочкам яйца. Они, по-ви-
димому, имеют также определенное значение и для фор-
мообразовательных процессов. Амниотическая жидкость
имеет сложный химический состав, изменяющийся в хо-
де эмбриогенеза. По предварительным данным некото-
рых ученых, амниотическая жидкость необходима для
дифференцировки поверхностных слоев клеток зароды-
ша. Хорион принимает участие в дыхании и резорбции
остатков белковой оболочки и, по-видимому, для этого
он продуцирует специфические ферменты. Расщеплен-
ные такими ферментами белки поступают через сероз-
ную оболочку в кровеносные сосуды аллантоиса, а за-
тем в зародыш и утилизируются им.
Аллантоис начинает развиваться в виде вентрально-
го выроста энтодермы задней кишки (клоаки), в со-
став которого частично входит эпителий кишки и висце-
ральный листок мезодермы с сосудами. Вырост быстро
растет, проникая во внезародышевый целом, а точнее,
в пространство между желточным мешком, амнионом и
хорионом, продолжая быть связанным с собственно за-
родышем посредством узкого стебелька. К середине эм-
брионального развития рептилий и птиц аллантоис раз-
104
растается под хорионом по всей поверхности зародыша
г желточным мешком. Висцеральный листок мезодермы
аллантоиса срастается с париетальным листком хорио-
на и образуется так называемый хорио-аллантоис. В ре-
|ультате его сосуды выходят на поверхность и аллан-
юис может снабжать зародыш кислородом. Первона-
чально аллантоис выполняет функцию внезародышево-
ю мочевого пузыря и в нем скапливаются продукты
азотистого обмена зародыша.
В конце эмбриогенеза провизорные образования (ор-
ганы) зародыша прекращают функционировать и реду-
цируются. Перед вылупливанием эмбрион начинает ды-
шать воздухом, имеющимся в воздушной камере яйца,
штем пробивает скорлупу, освобождается от яйцевых
оболочек и переходит к постэмбриональному периоду
развития. Как уже отмечалось, у млекопитающих так-
же образуются желточный мешок, амнион и аллантоис,
ио они несколько видоизменены морфологически. Про-
являются и функциональные изменения, поскольку за-
родыш находится в контакте с плацентой. Провизорные
органы имеются также и у эмбрионов насекомых в виде
амниотической и серозной оболочек.
Зародышевые листки, или пласты, окончательно диф-
ференцирующиеся в период гаструляции, не обособлены
друг от друга, а взаимосвязаны. Зародышевые листки
представляют, собой совокупности клеток с пртенциаль-
цо одинаковыми морфогенетическими возможностями.
В пределах интегрированного зародыша они дифферен-
цируются в определенном направлении и каждый из
них дает начало различным органам и системам. Прав-
да, для правильного хода этих дифференцировок необ-
ходимы оптимальные внутренние и внешние условия,
существенные изменения которых могут привести к ано-
малиям или изменению направления дифференцировки.
У всех представителей животного мира определенные
органы берут начало от одного и того же зародышевого
листка. Это правило, как известно, хорошо иллюстриру-
ет гомологичность зародышевых листков и общность
псего животного мира.
Производными наружного зародышевого листка (эн-
тодермы) прежде всего являются покровы тела. Из него
развиваются: наружный эпителий, кожные железы, ро-
говые чешуи, поверхностный слой зубов и т. д. Иногда
105
в формировании покровов тела могут принимать уча-
стие и клеточные элементы других зародышевых лист-
ков. Например, у млекопитающих кожа формируется из
эктодермы и мезодермы. Обычно часть эктодермы в хо-
де морфогенеза опускается под наружный эпителий и
дает начало всей нервной системе. Во многих случаях
эктодерма на переднем и заднем концах тела зароды-
ша впячивается к развивающемуся из энтодермы ки-
шечнику и затем участвует в образовании передней и
задней кишок.
Производными внутреннего зародышевого листка
(энтодермы) являются: эпителий средней кишки и ее
пищеварительные железы, эпителий дыхательной систе-
мы (жабер и легких). В некоторых случаях в формиро-
вании этих видов эпителия частично принимают участие
и элементы других зародышевых листков.
Все мышечные, соединительные, хрящевые и кост-
ные ткани, а также каналы выделительных органов,
перитонеум полости тела, кровеносная система, часть
тканей яичников и семенников — производные средне-
го зародышевого листка (мезодермы). В большинстве
случаев средний зародышевый листок появляется не
только в виде компактной совокупности клеток, обра-
зующих эпителиеподобный слой, но и в виде разрознен-
ных амебоидных клеток. Такая часть мезодермы назы-
вается мезенхимой. Мезодерма и мезенхима не гомоло-
гичны, т. е. они различного происхождения. Мезодерма
энтодермального, а мезенхима большей частью экто-
дермального происхождения. Однако мезенхиму мож-
но рассматривать как часть среднего зародышевого
листка.
Сходство расположения зародышевых пластов у раз-
личных животных было отмечено биологами уже давно.
На это указывал К- Вольф (1759) и X. Пандер (1817);
основы теории зародышевых листков были заложены
К- М. Бэром (1828). Основателем же современной тео-
рии зародышевых листков явился А. О. Ковалевский
(1865—1871), а для ее развития особое значение имели
работы И. И. Мечникова и Э. Геккеля. Зародышевые
листки всех животных рассматривают как гомологич-
ные образования. Это важно для решения многих во-
просов.
Уже отмечалось, что образование мезодермы может
106
осуществляться различными путями в процессе гастру-
ляции, и нет оснований противопоставлять этот процесс
формированию эктодермы и энтодермы. Известны так-
же случаи, когда о зародышевых листках можно гово-
рить лишь условно. Например, у некоторых животных
(турбеллярии и сосальщики) образование презумптив-
пых зачатков происходит из однородной клеточной мас-
сы без каких-либо признаков дифференцировки на за-
родышевые листки. Относительность понятия о зароды-
шевых листках четко проявляется в случаях развития
зародышей у коловраток, скребней и аскарид, у кото-
рых на ранних этапах эмбриогенеза эмбриональный
клеточный материал непосредственно «распадается» па
отдельные зачатки органов либо дифференцируется пер-
воначально только эктодерма.
По классической теории зародышевых листков, хор-
да развивается из энтодермы, а нервная система из эк-
тодермы и т. д. Однако это не универсальное правило,
так как у некоторых животных (например, асцидий)
определенные группы бластомеров образуют и хорду,
и нервную систему, другие бластомеры дают начало ки-
шечнику, третьи — наружным покровам, четвертые —
мышечным и мезенхимным элементам. По справедливо-
му замечанию О. М. Ивановой и А. Г. Кнорре (1963),
подобные случаи являются примерами вторичных изме-
нений ранних стадий морфогенеза в ходе исторического
развития, принципиально такими же, как и любые дру-
гие изменения в ходе онтогенеза.
Данные экспериментальной эмбриологии, цитогене-
тики и генетики показали возможность изменить пути
дифференцировки всех трех зародышевых листков. Сле-
довательно, судьба каждого зародышевого листка не
предопределена изначально и зависит от ряда конкрет-
ных обстоятельств. Об этом же свидетельствуют и раз-
личные тератологические явления. При абсолютизации
основных положений теории зародышевых листков не-
возможно объяснить и понять развитие организмов в
результате бесполого размножения. Таким образом, тео-
рию зародышевых листков не следует воспринимать
как догму, и только в этом случае она оказывается эф-
фективной методологической основой для познания за-
конов индивидуального развития в морфогенетическом
н эволюционном планах.
107
Органогенез
Гаструляция является непосредственным переходом
к органогенезу. В ряде случаев в период гаструляции
закладываются органы и системы органов, постепенно
приобретающие затем дефинитивное значение. В других
случаях первоначально формируются органы, свойст-
венные личинке, а после метаморфоза происходит раз-
витие дефинитивных органов взрослого организма. По-
скольку мир беспозвоночных животных чрезвычайно
разнообразен, практически невозможно представить
основные особенности их органогенеза. Процессы орга-
ногенеза у позвоночных животных более однообразны,
и их можно представить в виде общей схемы.
Органогенез — очень сложный процесс. Он является
предметом исследования многих биологических дисци-
плин: эмбриологии, анатомии, гистологии, физиологии,
цитологии, цитогенетики, генетики, молекулярной био-
логии. Органогенез представляет собой совокупность
процессов дифференцировки и изменения формы частей
организма на основе реализации генетической инфор-
мации. В генетическом аспекте это цепь сложных собы-
тий — от функционирования генов до фенотипического
выражения признаков и свойств организма. Необходи-
мость комплексного изучения совокупности сложных
процессов органогенеза теперь ни у кого не вызывает
сомнений, и на современном этапе изучения закономер-
ностей индивидуального развития такой комплекс скла-
дывается и совершенствуется.
Эмбриологи, эволюционисты и другие биологи пре-
жде всего опираются на классификацию органов, осно-
ванную на их происхождении (генезисе), т. е. являют-
ся ли они производными эктодермы, энтодермы или ме-
зодермы. Такая классификация неизбежно вытекает из
теории зародышевых листков и в общем она вполне
оправдывает себя. Если учесть существование ряда от-
клонений от основного положения теории зародышевых
листков, разделение органов на эктодермальные, экто-
дермальные и мезодермальные следует считать услов-
ным. Однако мы будем придерживаться такого разде-
ления органов и систем, поскольку оно общепринято.
Гаструляция у позвоночных животных сменяется
нейруляцией (стадия нейрулы), в результате которой
108
вкладывается основа будущей нервной системы и орга-
нон чувств. В процессе гаструляции при образовании
первичной полоски мезодерма индуцирует образование
нервной пластинки из находящихся под ней клеток эк-
н «дермы. Затем первичная пластинка свертывается, об-
разуя нервную трубку. При этом по краям нервной пла-
нчики образуются два нервных, или медуллярных, ва-
'шка. Следует отметить, что после сближения нервных
валиков с обеих сторон обособляются полоски свободно
нежащих клеток, образующих нервный гребень. Клетки
нервного гребня могут мигрировать на значительное
расстояние и принимать участие в формировании разно-
образных структур: нейробластов спинальных и симпа-
псчсских ганглиев, клеток шванновской оболочки, моз-
।оного вещества надпочечников (хромаффинная ткань),
пигментных клеток различных тканей (например, ме-
ля побласты пера), оболочек мозга и др. Следовательно,
клетки нервного гребня очень подвижны и могут при-
нимать участие в различных морфогенетических про-
цессах. Это было доказано при использовании методов
.пггорадиографии.
Нервная трубка (рис. 28) первоначально однородна
но своей структуре и ее стенки состоят из клеток нерв-
ного эпителия, которые дают начало нейробластам,
гнопгиобластам и клеткам эпендимы. Затем начинается
детерминация ее отделов. Например, нервная трубка
четырехдневного куриного зародыша имеет три зоны:
I) массивный слой структурно недифференцированных
псйробластов, выстилающих канал; 2) мантийную зо-
ну, занимающую среднее положение; 3) наружную крае-
вую зону, где находятся дифференцирующиеся волокна.
I (средний конец нервной трубки имеет отверстие, кото-
рое называется нейропором (невропором), оно длитель-
ное время остается открытым. Задний конец нервной
трубки быстро закрывается и превращается в нервно-
кишечный канал. С обеих сторон внутренней поверхно-
сти нервной трубки образуются продольные борозды,
разделяющие ее дорсальный и вентральный отделы,—
соответственно крыловидную и базальную пластинки.
Крыловидные пластинки соединяются на спинной сторо-
не пластинкой крыши, а базальные — посредством дна
нервной трубки. Крыловидная пластинка представляет
собой зачаток будущей чувствительной части спинного
109
Рис. 28. Схема образования и развития нервной трубки (из
Бодемера, 1971):
а — зачаток спинного мозга и спинальных ганглиев в виде пластинки
удлиненных клеток; б — начало образования нервной трубки; в — нерв-
ная трубка с центральным каналом; г—два типа отростков от нейро-
бластов в спиином мозгу (одни из них идут к мышцам, а другие всту-
пают в контакт с промежуточными нейронами); / — хорда; 2—нервные
валики; 3— нервная пластинка; 4— нервная трубка; 5 — центральный
канал; 6 — нервный гребень; 7 — пигментные клетки; 8 — кожа; 9 —
спинальный ганглий; 10 — симпатический ганглий; 11 — надпочечники;
12 — висцеральные ганглии; 13 — промежуточный нейрон; 14 — дорсаль-
ный корешок; /5 —клетки, образующие оболочку; 16— ветви спиналь-
ного нерва; /7 — вентральный корешок; 18 — комиссура
мозга и ствола головного мозга, а из базальной пла-
стинки образуются двигательные элементы. В ходе
дальнейшего развития канал нервной трубки сужается,
но не исчезает полностью (у взрослого организма в нем
содержится спинномозговая жидкость).
Довольно рано (у куриного эмбриона на второй
день) в переднем отделе нервной трубки обозначаются
зачатки мозговых пузырей (переднего, среднего и задне-
го). Передний мозговой пузырь в дальнейшем разделя-
ется на зачатки большого и промежуточного мозга,
средний развивается в средний мозг, а задний разделя-
ется на зачатки мозжечка, моста и продолговатого моз-
Ш.
ГЛ, который переходит в спинной мозг. Затем начина-
ются сложные процессы дифференцировки отделов
головного и спинного мозга, черепномозговых нервов и
ганглиев, а также периферической и нервной системы.
Глаз и ухо тоже являются производными эктодер-
мы. Зачатки глаза появляются очень рано в виде боко-
вых выростов переднего мозга (глазных пузырей)
(рис. 29), которые активно растут до соприкосновения
с головной эктодермой. Глазные пузыри сохраняют
связь с передним мозгом при помощи глазных стебель-
ков. Дистальная поверхность глазного пузыря затем
впячивается, образуя чашеобразную структуру с двой-
ными стенками — глазной бокал. Около глазного сте-
белька края бокала не смыкаются и остается так на-
зываемая глазная щель, которая является входом для
зрительного нерва, мезенхимы и кровеносных сосудов.
Хрусталик располагается внутри бокала, а находящаяся
над ним эктодерма совместно с мезенхимой образует
прозрачную роговицу.
Рис. 29. Закладка и основные стадии развития глаза (из Бо-
демера, 1971):
а — закладка зрительных пузырей в виде боковых выростов первично-
го переднего мозга; б — толстый нервный н тонкий пигментный слои
в глазных бокалах; в — связь между нервными и фоторецепторными
клетками сетчатки; / — первичный задний мозг; 2 — средний мозг; 3 —
первичный передний мозг; 4— глазной пузырь; 5 — хрусталиковое поле;
6 — глазной стебелек; 7 — роговица; 8 — хрусталик; 9 — слой нервных
клеток; 10 — ганглиозная клетка; 11— глазная щель; 12 — нервное во-
локно; 13 — пигментный слой; 14— фоторецепторы зрительного слоя;
15— слой биполярных и ганглиозных клеток
ш
Рис. 30. Закладка и основные стадии развития внут-
реннего уха (из Бодемера, 1971):
а — слуховые плакоды образуют слуховые ямки в связи с
восьмым краниальным ганглием; б — развитие слухового пу-
зырька; / — первичный передний мозг; 2 — средний мозг;
3 — первичный задний мозг; 4 — слуховая ямка; 5 — ганглий
VIII пары; 6 — эндолимфатический проток; 7 — слуховой пу-
зырек
Глазной бокал состоит из двух слоев: толстого вну-
треннего (чувствительного, или нервного, слоя сетчатки)
и тонкого наружного (пигментного слоя сетчатки). Как
известно, в нервном слое сетчатки образуются зритель-
ные клетки (палочки и колбочки) и ряд других клеток,
с которыми они образуют синапсы (биполярные, гори-
зонтальные и ганглиозные клетки).
В развитии сетчатки глаза можно выделить три
основных периода: 1) активное деление клеток; 2) кле-
точную перестройку; 3) окончательную дифференциров-
ку. Зрительные клетки нервного слоя сетчатки, напри-
мер, куриного зародыша начинают дифференцировать-
ся на 12-й день, а начало их функционирования было
зарегистрировано на 18-й день развития зародыша.
В результате дальнейшей дифференцировки слоев
глазного бокала, роговицы и специальной мускулатуры
глаз полностью готов к нормальному функциониро-
ванию.
Ухо также в основном эктодермального происхожде-
ния. На уровне заднего мозга в эктодерме закладыва-
ются лабиринтные плакоды, которые затем инвагини-
руют и превращаются в слуховые пузырьки, дифферен-
112
цирующиеся во внутреннее ухо (рис. 30). Образование
слуховых пузырьков индуцируется влиянием первичного
заднего мозга и находящейся вблизи мезодермы. Слу-
ховой пузырек приобретает грушевидную форму в ре-
зультате появления на нем выроста, дающего начало
эндолимфатическому протоку. Поздние нервные волок-
на связывают внутреннее ухо с первичным задним моз-
гом. Нижний вырост слухового пузырька дает начало
улитковому протоку. Таким образом начинается форми-
рование лабиринта внутреннего уха, представляющего
собой одновременно орган слуха и равновесия. Чувст-
вительная часть внутреннего уха состоит из небольших
участков ресничного эпителия, находящихся в контакте
с нервными волокнами.
Перепончатый лабиринт, эпителий которого эктодер-
мального происхождения, возникает в результате диф-
ференцировки слухового пузырька, его окружают ме-
зенхимные клетки мезодермального происхождения.
Часть этих мезенхимных клеток разрушается, превра-
щаясь в жидкость, 'наполняющую перилимфатическое
пространство. Другие из этих клеток дают начало хря-
щевой слуховой капсуле, окружающей и защищающей
внутреннее ухо. Позднее происходит окостенение и об-
разуется костный лабиринт, морфологически почти со-
ответствующий перепончатому лабиринту. Исходным
материалом для барабанной полости является полость
первой внутренней жаберной щели. В конечном итоге
полость среднего уха отделяется от полости глотки, но
связь между ними сохраняется благодаря евстахиевой
трубе. Образовавшиеся вне барабанной полости слухо-
вые косточки (молоточек, наковальня, стремя) оказы-
ваются затем в ней, отделяясь от нее слизистой оболоч-
кой среднего уха. Наружное ухо у млекопитающих раз-
вивается из первой наружной глоточной щели. Часть
мезодермы, находящаяся между барабанной полостью
и полостью наружного уха, дифференцируется в бара-
банную перепонку. Вообще отдельные моменты разви-
тия внутреннего и среднего уха варьируют у различных
животных, но принцип развития этих отделов уха не из-
меняется.
Значительная часть эктодермы после стадии нейру-
ляции остается на поверхности зародыша и развивается
затем в эпидермис кожи. Производными кожного покро-
8 Зак. 918
из
ва являются чеШуй, йерйя, Волосы, потовые й сальйЫе
железы, млечные железы у млекопитающих.
На ранних этапах эмбриогенеза у птиц и млекопи-
тающих эпидермис состоит из одного слоя клеток. По-
том образуется внутренний листок, состоящий из актив-
ноделящихся клеток,— это так называемый мальпигиев
слой эпидермиса. В результате формируется эпителий, а
несколько позже соединительнотканная часть кожи —
дерма. Совместно они образуют кожу как» орган. Часть
мезенхимы, происходящей от мезодермального листка
и нервного гребня, развивается в соединительнотканную
часть кожи.
Большинство производных структур эпидермиса на-
чинает образовываться с утолщений эпидермального
эпителия, которые называются плакодами, имеющими
большое морфогенетическое значение. Например, в оп-
ределенных местах появляются парные плакоды, даю-
щие затем начало обонятельным мешкам, черепным
нервам, слуховым пузырькам и т. д.
Важнейшим производным энтодермы является пище-
варительный тракт, различные отделы которого в ходе
развития оказываются исходными для формирования
ряда важных органов. Замкнутая кишечная трубка фор-
мируется в результате образования передней и задней
туловищных складок и загибания краев исходного экто-
дермального зародышевого листка с участком прилега-
ющей к нему мезодермы. Сначала возникает передняя
кишка, затем задняя и боковые складки, соединяющие
края энтодермы. Пищеварительная полость долгое время
остается открытой в область средней кишки, где она
непосредственно соприкасается с желтком.
Производными передней и средней кишки являются
рот, язый, жаберные карманы, жаберные щели, легкие,
железы бронхиальной группы (щитовидная, паращито-
видная, зобная), печень и поджелудочная железа. Од-
нако в образовании каждого из этих органов участвует
не только энтодерма, но и соединительная ткань, крове-
носные сосуды и мышечная ткань — производные мезо-
дермы. Кроме того, все упомянутые органы снабжены
нервами, которые, как уже отмечалось, происходят из
эктодермы.
На ранних стадиях развития передней кишки обра-
зуется головная складка. Затем в определенной после-
114
Рис. 31. Производные передней кишки и некоторые связанные с
ними структуры (из Бодемера, 1971):
а — <Э — висцеральные карманы, представляющие эитодермальиые выросты
передней кншки (I—V — висцеральные дуги); / — вилочковая железа; 2—
гиоидная дуга; 3 — слуховой пузырек; 4— евстахиева труба; 5 — челюстная
дуга; 6 — передний участок, кишки; 7 — вороика (карман Ратке и воронка
вместе образуют гипофиз); <3—карман Ратке; 9 — ротовая пластинка;
10 — два выроста зачатков языка; // — парные зачатки щитовидной желе-
зы; 12 — голосовая щель; 13 — трахея; /4 —легкие; /5 — пищевод
довательности дифференцируются следующие зачатки:
висцеральные (глоточные) карманы, карман Ратке, из
которого позже образуются передняя и промежуточная
доли гипофиза, ротовая ямка, зачаток щитовидной же-
лезы, челюстной дуги и трахеи в виде ларинготрахеаль-
ной борозды, зачатки легких (рис. 31).
Печень — производная средней кишки, она развива-
ется из эктодермального эпителия брюшной стенки ки-
шечника. Зачаток печени появляется в области передних
кишечных ворот непосредственно позади участка, из ко-
торого образуется желудок. Между зачатком печени и
кровеносными сосудами рано возникает тесная связь,
что необходимо для становления сложной организации
печени. Энтодерма печени детерминируется в результате
взаимодействия с мезодермальным зачатком сердца,
что было доказано в опытах при раздельном и совмест-
ном культивировании этих тканей. Так, участок энто-
дермы, взятый из области передних кишечных ворот, пе-
ред появлением зачатка печени не дифференцируется в
культуре в гепатоциты. Однако если в эту же культуру
8*
115
поместить мезодермальный зачаток сердца, дифферен-
цировка гепатоцитов происходит.
Из проксимальной части зачатка печени развиваются
желчные протоки и желчный пузырь, который сообщает-
ся со всеми частями печени при помощи тонких каналь-
цев и остается соединенным с двенадцатиперстной киш-
кой. Три энтодермальных выроста (один дорсальный и
два вентральных) объединяются, образуя поджелудоч-
ную железу, соединенную с двенадцатиперстной киш-
кой тремя небольшими панкреатическими протоками.
У птиц на ранних стадиях развития печени и поджелу-
дочной железы средняя кишка остается открытой и со-
общается с желтком.
В заднем отделе зародыша на ранних стадиях раз-
вития закладывается из энтодермы и висцеральной мезо-
дермы задняя кишка в виде хвостовой складки. Задняя
часть кишки дифференцируется в клоаку, в которую
впадает проток первичной почки (вольфов канал), а
позднее мочеточник. Как уже отмечалось, брюшной вы-
рост энтодермы задней кишки образует аллантоис и его
наружный мезодермальный слой сливается с мезодер-
мальным слоем хориона, что завершается образованием
хорио-аллантоисной оболочки с густой сетью кровенос-
ных сосудов. При дальнейшей дифференцировке задней
кишки образуется анальная пластинка и постанальная
кишка. К этому периоду задняя кишка превращается в
хорошо развитую трубку, а задние кишечные ворота
смещаются далеко вперед.
Мезодерма обычно не представляет собой сплошного
слоя клеток, как эктодерма и энтодерма, ее клетки спо-
собны к миграции и образованию мезенхимы. Мезенхи-
ма может обрастать другие структуры, образуя опорную
и соединительную ткани, хрящи, кости и в некоторых
случаях мышцы. На ранних стадиях эмбриогенеза ме-
зенхима имеет лабильную организацию и при соответст-
вующих индукциях может дифференцироваться в раз-
личные структуры. Например, пересадка обонятельного
органа индуцирует образование вокруг него хрящевой-
капсулы из чужеродной мезенхимы, а имплантация ку-
сочков целлулоида может индуцировать образование
конечности из мезенхимы туловища и т. д.
На ранних этапах развития зародыша (например,
куриного) мезодерма разделена на три основных кле-
116
iочных агрегата: сомиты, нефротомы и боковые пластин-
ки. Сомиты — метамерно расположенные сегменты —
являются результатом дифференцировки мезодермаль-
ных клеточных скоплений, находящихся непосредствен-
но у хорды и нервной трубки. Обособление сомитов на-
чинается с головной части зародыша и распространяет-
ся в каудальном (хвостовом) направлении.
После образования сомита некоторые из его клеток
начинают мигрировать по направлению к хорде и нерв-
ной трубке, формируя скопление мезенхимы, называемое
склеротомом, который затем полностью окружает хор-
ду и нервную трубку. Позже из этой ткани дифференци-
руются клетки разных типов: фибробласты, хондробла-
сты, остеобласты. Поверхностная часть сомита образует
обособленный слой клеток — дерматом, прилегающий к
кожной эктодерме и дифференцирующийся затем в со-
единительнотканную часть кожи (дерму). Средний слой
клеток сомита является исходным для формирования
поперечнополосатых мышц, а внутренний участок соми-
та — склеротом — развивается в хрящевую и костную
ткани осевого скелета.
Остальная часть сомита называется миотомом и из
его клеток формируются мышечные волокна. Следует
отметить, что не все мышцы тела образуются из мио-
тома. Например, сердечная мышца формируется из вис-
церального листка боковой пластинки, а мышцы конеч-
ности— из мезенхимы, возникающей из париетального
листка боковой пластинки. Гладкая мускулатура пище-
варительного тракта формируется из висцерального
листка боковой пластинки, а мускулатура головного
отдела — из головной мезенхимы. Следовательно, мио-
том сомита главным образом дифференцируется в попе-
речнополосатые мышцы спины. У низших животных
миотомы представляют собой наиболее крупные участки
сомитов, а у высших позвоночных наиболее крупными
участками сомитов являются склеротомы (рис. 31).
Таким образом, сомиты — очень важные первичные
отделы мезодермы тела и в ходе дифференцировки их
частей осуществляются различные морфогенетические
процессы.
Следующим первичным отделом мезодермы тела яв-
ляется нефротом. Нефротомы дифференцируются из
относительно узких полосок мезодермальных клеток,
117
Рис. 32. Развитие сомитов (из
Бодемера, 1971):
а — поперечный срез куриного за-
родыша иа ранней стадии разви-
тия; видны три основных отдела
Л1езодермы: боковая пластинка —
париетальный (/) и висцеральный
(4) листки, нефротом (2) н сомит
(<?); б — более поздняя стадия раз-
вития; сомит подразделяется на три
группы клеток: рыхлое скопление
клеток — склеротом (9) перемеща-
ется вокруг нервной трубки и хор-
ды, остальная часть сомита разде-
ляется на два слоя: наружный —
дерматом (6) и внутренний — мио-
том (5); в нефротоме (5) образует-
ся проток первичной почки (7), зад-
ние его отделы еще не дифферен-
цированы; в — более поздняя ста-
дия развития; склеротом диффе-
ренцировался в хрящ вокруг хор-
ды (16) и спинного мозга и приоб-
рел форму позвонка (13—15), мио-
том дифференцировался в мышцы
спины (12), а дерматом — в дерму
(10) или мезодермальный компо-
нент кожи; И — эпидермис
связывающих сомиты с латеральным листком мезодер-
мы. Это своеобразные «стебельки» сомитов, дающие
начало выделительной системе. Клетки нефротома пре-
терпевают ряд сложных изменений, приводящих перво-
начально к формированию предпочки (пронефроса), за-
тем первичной почки (мезонефроса) и, наконец, вто-
ричной почки (метанефроса).
В ходе развития выделительной системы у позвоноч-
ных животных наблюдаются разнообразные тканевые
взаимодействия. Так, было показано, что образование
протока предпочки — необходимое условие для развития
почки. Нормальное развитие вторичной почки обу-
словлено взаимодействием ее мезенхимного и эпители-
ального компонентов. Если мезенхимные и эпителиаль-
ные компоненты культивируются совместно, собиратель-
ные трубочки и почечные канальцы развиваются
нормально. При раздельном же их культивировании ни-
какой дифференцировки не происходит.
118
Часть ткани первичной почки участвует в формиро-
вании придатка семенника, а ее проток — в формиро-
вании семявыносящего протока. С развитием почки тес-
но связано и развитие надпочечника, который, как из-
вестно, состоит из коры и мозгового слоя. Клетки коры
продуцируют гормоны, регулирующие функции почки,
а мозговой слой надпочечника выделяет андреналин,
действие которого аналогично действию симпатических
нервов.
Боковая пластинка — третий компонент мезодер-
мы— образует два хорошо различимых слоя клеток: на-
ружный (париетальный) и внутренний (висцеральный),
а пространство между ними представляет собой вторич-
ную полость тела (целом). Дифференцировка этих двух
слоев боковой пластинки зависит от контакта с эктодер-
мой и энтодермой. Из париетального слоя обычно обра-
зуется мускулатура (например, мышцы конечностей),
а из висцерального — гладкая мускулатура, соедини-
тельная ткань внутренних органов и брыжейка, поддер-
живающая внутренние органы. Через брыжейку прохо-
дят кровеносные сосуды и нервы. Оба слоя (листка)
боковой пластинки принимают участие в образовании
брюшины. Было установлено, что энтодерма индуцирует
дифференцировку висцерального слоя боковой пластин-
ки, а он дает начало ряду производных. У куриного за-
родыша из этого слоя развиваются кровяные островки,
дающие начало форменным элементам крови и эндоте-
лию сосудов. В ходе образования сердца висцеральный
слой боковой пластинки замыкается вокруг кровенос-
ных сосудов и дифференцируется в сердечную мышцу,
а значительно позже из него образуется селезенка. У за-
родышей птиц висцеральный и париетальный листки
связаны с формированием внезародышевых структур
(амниона и хориона).
Конечности амфибий, птиц и млекопитающих явля-
ются производными мезодермы и эктодермы, при этом
невозможно говорить о доминирующей роли мезодермы.
Исходным для появления зачатков конечностей оказы-
вается разрастание участков боковой мезодермы, а вер-
нее, миграция клеток и их скопление в мезенхимные
массы, находящиеся между боковой мезодермой и эпи-
дермисом. У зародышей амфибий такие скопления ме-
зенхимы возникают почти одновременно в местах буду-
119
Рис. 33. Схема происхо-
ждения мезодермальной
почки конечности заро-
дыша амфибий (по Ба-
лийскому из Токина,
1970):
а — начальный этап появле-
ния зачатка; б — почка;/ —
миотом; 2 — почечный ка-
нал; 3 — почка конечности;
4— париетальный листок ла-
теральной мезодермы; 5 —
висцеральный листок лате-
ральной мезодермы; 6 — эн-
тодерма; 7 — спинной мозг
щих передних и задних конечностей. У рептилий, птиц
и млекопитающих такие скопления мезенхимы возника-
ют по всей длине тела зародыша в виде гребней (воль-
фовы гребни), а затем большая часть их дегенерирует
и в дифференцировке конечностей принимают участие
скопления мезенхимы в определенных участках — «тер-
риториях конечностей». Покрывающий в этих участках
мезенхиму эпидермис несколько утолщается и выпячи-
вается. Таким образом возникает почка конечности
(рис. 33).
В ходе дифференцировки почки конечности два ее ос-
новных компонента (мезенхима и эпидермис) не равно-
значны морфогенетически. На первых этапах развития
конечности особое значение имеет мезенхима. Уже дав-
но (Балинский, 1931) экспериментально было показано,
что при трансплантации части боковой мезодермы под
эпидермис практически любой части зародыша образу-
ется добавочная конечность. Для развития конечности
большое значение имеет и эктодермальный гребень. По
данным А. Сондерса (1948), при удалении эктодермы
эпидермального гребня почки трехдневного куриного
зародыша не образуется дистальная часть крыла, хотя
мезодерма почки не повреждалась.
120
В ходе роста конечности она удлиняется и ее ди-
стальная часть оказывается более плоской и широкой.
Этот период развития конечности называют стадией
«лопатки», или «пластинки». Затем края лопатки стано-
вятся неровными и формируются зачатки пальцев.
Обычно у всех высших позвоночных с пятипалыми ко-
нечностями зачатки всех пяти пальцев появляются
одновременно. В процессе развития конечности происхо-
дят закономерные сгибания и вращения ее, что завер-
шается образованием трех ее отделов и закладкой су-
ставов. Развитие костного скелета конечности начина-
ется с дифференцировки части мезенхимы в хрящ.
Затем начинает формироваться единый скелетный
комплекс. Проксимальные части костного скелета, как
правило, закладываются раньше, чем дистальные.
На ранних стадиях развития конечности дифферен-
цируются кровеносные сосуды. Исходным материалом
для развития пояса конечностей является та же мезен-
хима, которая обусловливает появление конечности, но
только ее периферическая часть. Мышечная ткань ко-
нечностей в основном развивается из мезодермы ниж-
них краев миотомов.
Генетические
и цитогенетические основы
Глава 4 развития
Дифференциальная
активность генов
Вопрос о том, каким образом из одной зиготы или яйце-
клетки в ходе развития многоклеточного организма воз-
никает огромное количество клеток, существенно разли-
чающихся своими структурными и функциональными
особенностями, остается основным вопросом биологии
развития. В генетическом аспекте этот вопрос можно
сформулировать следующим образом: как на основе од-
ного генотипа возникает множество клеточных феноти-
пов. С появлением первых представлений о материаль-
121
ных основах наследственности выдвигался ряд гипотез
о причинах клеточной дифференцировки. Рассмотрим не-
которые из них.
Одна из первых гипотез (В. Ру) исходила из того,
что яйцеклетка имеет детерминанты всех типов клеток,
возникающих в ходе развития многоклеточного организ-
ма. В процессе деления клеток детерминанты распреде-
ляются таким образом, что каждая клетка получает
свой особый набор детерминантов, необходимый для ее
специализации. Эта гипотеза первоначально даже под-
тверждалась опытами по удалению части зародыша,
в результате чего наблюдались различные аномалии в
развитии при отсутствии нарушений в других частях за-
родыша. Затем выяснилось, что такие данные нельзя
распространять на зародыши всех животных, поскольку
бластомеры большинства животных имеют одинаковые
морфогенетические возможности, а направление их раз-
вития может изменяться при различных эксперименталь-
ных воздействиях. Этот тип развития стали называть ре-
гуляционным. Каждая клетка имеет потенциальные воз-
можности для дифференцировки в различных направле-
ниях, но во время нормального развития многоклеточно-
го организма она, как правило, дифференцируется лишь
в одном направлении.
Исходя из основных положений современной генети-
ки, можно заключить, что признаки и свойства любой
дифференцированной клетки в конечном итоге отражают
активность ее генов. Митотическое деление в норме обес-
печивает точное распределение идентичных наборов хро-
мосом между дочерними клетками, а следовательно, и
идентичных наборов генов. Однако в эмбриогенезе клет-
ки дифференцируются, приобретая различные фенотипы
(нервные, мышечные, пигментные, железистые и другие
клетки). Все фенотипически различающиеся клетки
в пределах многоклеточного организма, лишь за некото-
рым исключением (например, при изменении числа хро-
мосом), имеют один и тот же исходный генотип. Диффе-
ренцировка каждой клетки есть результат функциональ-
ной активности лишь части ее генов. Теперь хорошо изве-
стно, что основой клеточной дифференцировки являются
регуляторные механизмы, обеспечивающие дифферен-
циальную активность генов на определенных этапах ин-
дивидуального развития.
122
Становлению теории дифференциальной активности
генов предшествовал сложный период поисков и иссле-
дований. Важное значение имел ряд обобщений, сделан-
ных в 30-е гг. XX в. при непосредственном участии наших
отечественных исследователей Д. Д. Ромашова,
Л. Н. Промптова, Н. В. Тимофеева-Ресовского и др. На-
пример, было установлено, что каждый признак организ-
ма зависит от всех генов, а также от всей генотипической
и окружающей среды. Затем появились четкие представ-
ления о плейотропии, пенетрантности и экспрессивности.
Суть принципа плейотропии сводится к тому, что каж-
дый ген способен влиять на все признаки организма, хо-
тя и в различной степени. Пенетрантность — это частота
или вероятность фенотипического проявления гена. Пе-
нетрантность определяется количеством (в %) особей
популяции из числа особей, несущих ген, проявившийся
фенотипически. Например, пенетрантность в 25% слу-
чаев указывает на то, что лишь в 1/4 генотипов, несущих
определенный ген, посдедний проявляется фенотипичес-
ки. Под экспрессивностью понимается степень фенотипи-
ческого проявления гена как мера силы его действия, оп-
ределяемая степенью развития признака.
Такие представления имели особое значение для пре-
одоления упрощенных автогенетических и грубопрефор-
мистских схем, согласно которым организм считался
прямой проекцией генов на соответствующую мозаику
признаков. При этом окончательно решался старый воп-
рос о преформации и эпигенезе. Стало совершенно оче-
видно, что развитие любого организма одновременно
представляет собой и преформацию, и эпигенез. Фенотип
стал рассматриваться как результат реализации геноти-
па в ходе онтогенеза при определенных внутренних и
внешних условиях. Это было крупнейшим вкладом гене-
тики в биологию индивидуального развития и позволило
па новой основе пересмотреть имевшиеся данные.
Специфические свойства клеток определяются функ-
циональными и структурными особенностями ее белков,
синтез которых детерминирован генотипически. Возник-
ло предположение, что клеточная дифференцировка в ко-
нечном итоге зависит от транскрипции заложенной в ге-
номе информации.
После работ А. Мирского и X. Риса (1947—1948),
Л. Бовина и Р. Вендрели (1948) общепринятым стало
123
представление о постоянстве количества и состава ДНК
в большинстве клеток многоклеточного организма и воз-
можности обратимости дифференцировки. Правда, из
этого правила возможны исключения, но они обычно свя-
заны с какими-либо специфическими особенностями ор-
ганизмов или их отдельных тканей. Таким, например,
исключением является диминуция (утрата) части хромо-
сом у лошадиной аскариды в начале дробления, после
которой в онтогенезе лишь частично восстанавливается
генетический материал. В ходе дифференцировки клеток
некоторых тканей количество ДНК увеличивается за
счет эндомитозов (например, в ядрах с политенными хро-
мосомами). Имеются, примеры полной утраты ядерной
ДНК специализированными клетками (эритроциты мле-
копитающих и клетки эпителия хрусталика глаза).
Экспериментально было показано (Гердон, 1962), что
часть ядер (около 7%) из дифференцированных клеток
кишечника головастика лягушки после их пересадки
в энуклеированные яйцеклетки того же вида способны
обеспечить нормальное развитие организма. Эти и по-
добные им данные позволяют утверждать, что клеточную
дифференцировку нельзя объяснить избирательной утра-
той некоторых генов во время клеточных делений, а это,
скорее, связано с инактивацией части ДНК. Кроме того,
ядерные изменения при дифференцировках в большинст-
ве случаев следует считать обратимыми и опыты по де-
дифференцировке некоторых клеток показывают, что яд-
ро дифференцированной клетки содержит полный геном.
Б. Мак-Карти и Б. Хойер (1964) убедительно показа-
ли, что в каждой соматической клетке имеются все пос-
ледовательности нуклеотидов ДНК, их количественное
соотношение в различных клетках одного организма оди-
наково. ДНК, выделенные из ядер клеток зародышей,
мозга, почек, тимуса селезенки и печени мыши в экспе-
риментах по ДНК—ДНК гибридизации, не различаются
способностью конкурировать с меченой ДНК, выделен-
ной также из клеток мыши. По данным В. Олфри и
А. Мирского (1958—1962), в результате обработки ядер
клеток тимуса теленка ДНК-азой из них можно удалить
около 75% ДНК, существенно не затронув при этом син-
тез РНК. Последнее возможно при условии инактивации
освобождающихся гистонов и обеспечении синтеза необ-
ходимого количества АТФ.
124
Для определения функционирующей части генома
в дифференцированных клетках важными явились опы-
ты по гибридизации ДНК и РНК и изучению матричной
активности хроматина. Например, результаты опытов
многих исследователей по гибридизации ДНК и РНК по-
зволили заключить, что в дифференцированных клетках
в синтезе РНК участвует около 10% или даже еще мень-
шее количество ДНК генома. Принципиальная схема
экспериментов сводилась к следующему. Вновь синтези-
рованная меченая РНК выделялась из различных типов
дифференцированных клеток, а затем она инкубирова-
лась с гомологичной ДНК в условиях, благоприятных
для гибридизации РНК и комплементарных цепей моле-
кул ДНК. Сходные данные были получены и в опытах
на препаратах хроматина, выделенного из различных
дифференцированных клеток. Следовательно, в диффе-
ренцированных клетках только часть ядерной ДНК вы-
полняет роль матриц для синтеза РНК-
Авторадиографические исследования репродукции
хромосом растений, животных и человека показали, что
репликация ДНК в различных участках одной хромосо-
мы, как правило, происходит асинхронно. Обычно она
начинается с обоих концов хромосомы и завершается
вблизи центромеры. Асинхронность репликации ДНК в
разных хромосомах одного набора впервые была пока-
зана в работе В. Тэйлора (1960) на хромосомах китай-
ского хомячка. У части хромосом этого набора опреде-
ленные участки всегда реплицируются в конце синтети-
ческого периода, когда в других хромосомах репликация
ДНК уже завершена. Такое явление было установлено
и на многих других объектах. Стало общепринятым рас-
смотрение внутри- и межхромосомной асинхронности
репликации ДНК как показателя линейной генетической
и функциональной гетерогенности хромосом.
Особое значение для изучения клеточной дифферен-
цировки имеет непосредственный анализ изменений в ха-
рактере белкового синтеза на ранних стадиях развития,
который позволяет выявить ранние молекулярные приз-
наки дифференцировки. Известно, что для осуществления
синтеза специфических белков необходимо наличие трех
основных типов РНК: информационной (иРНК.), рибо-
сомной (рРНК) и транспортной (тРНК). Все эти виды
РНК синтезируются на определенных участках молекул
125
ядерной ДНК и их можно обозначить как первичные Ген-
ные продукты, от наличия и активности которых, а так-
же от их взаимодействия с соответствующими фермен-
тативными системами и макроэргическими соединения-
ми зависит синтез специфических белков. Следовательно,
количественная оценка генных продуктов и определение
периода их реализации на тех или иных этапах развития
являются важным источником информации о ранних мо-
лекулярных признаках дифференцировки. •
В настоящее время имеется ряд методов, позволяю-
щих анализировать первичные генные продукты и изме-
нения популяций белковых молекул. Например, при воз-
действии антибиотиком актиномицином D ингибируется
синтез иРНК, а значит, и синтез соответствующих спе-
цифических белков. Применяя актиномициновую блока-
ду на разных этапах развития зародышей, можно опре-
делять период синтеза иРНК. Так был установлен пе-
риод синтеза иРНК, необходимой для начала синтеза ке-
ратина пера птиц, который появляется на 13-й день раз-
вития зародыша. При актиномициновой блокаде в этот
период синтез данного белка полностью прекращается.
Воздействие актиномицина на 15-й день развития заро-
дыша не влияет на синтез кератина. Следовательно,
к 15-му дню синтез иРНК уже завершился и она некото-.
рое время хранится в ядре или цитоплазме. Опыты с ак-
тиномициновой блокадой показали, что на ранних ста-
диях развития она менее эффективна, чем на более позд-
них, т. е. на ранних этапах эмбриогенеза уже имеются
необходимые иРНК.
Для определения периода появления тканеспецифи-
ческих белков и ферментов широко используется метод
электрофореза. С помощью различных методов в ряде
случаев удалось установить время появления специфиче-
ских ферментов на определенных этапах эмбриогенеза:
например, ферментов, необходимых для синтеза мелани-
нов в дифференцирующихся клетках нервного гребня
амфибий (Уайлд, 1961), гемоглобина в кровяных остров-
ках, миозина в дифференцирующихся сомитах позвоноч-
ных и т. д. В результате сравнительного анализа актив-
ности различных гидролитических ферментов на разных
стадиях развития Дж. Моррил и Е. Норрис (1965)
пришли к заключению, что исследованные ими гидрола-
зы можно разделить на три группы: 1) ферменты, сох-
126
раняющие свою активность в различные периоды разви-
тия; 2) ферменты, проявляющие активность только на
ранних этапах эмбриогенеза и исчезающие к началу
дифференцировки; 3) ферменты, появляющиеся в нача-
ле дифференцировки. Следовательно, с началом видимой
дифференцировки происходят существенные изменения
биосинтетических процессов, что неизбежно связано с не-
обходимостью функционирования новых матриц генома.
В клетках различного типа большую часть РНК со-
ставляет рРНК. В период дробления общее количество
РНК относительно постоянно, а в некоторых случаях да-
же несколько уменьшается. По-видимому, почти вся
РНК, имеющаяся па ранних этапах эмбриогенеза, син-
тезируется во время оогенеза.. Особо интересными яви-
лись исследования РНК в ходе развития африканской
шпорцевой лягушки (Xenopus laevis), которая оказалась
удобным объектом для этой цели (Кутский, 1950; Браун
и Литн, 1964; Вудланд и Гердон, 1968; Илсдейл, 1958).
В 1958 г. у шпорцевой лягушки был обнаружен му-
тант, в диплоидных клетках которого имелось только од-
но ядрышко вместо положенных двух. Такая мутация
была обозначена как 1-пи. Утрата одного ядрышка не
приводила к аномалиям в развитии. В результате скре-
щивания таких мутантов (1-nuXl-nu) в потомстве име-
лось три генотипических варианта: гомозиготы дикого
типа (2-пи), гетерозиготы (1-пи) и мутантные гомозиго-
ты (0-пи) в соотношении 1:2:1. Мутантные гомозиготы
(безъядрышковые формы) погибали на ранних стадиях
эмбриогенеза. При исследовании летальных зародышей
оказалось, что их клетки содержат значительно меньше
РНК, чем нормальные зародыши, и в частности значи-
тельно меньше рРНК. Как известно, матрицами для син-
теза рРНК являются участки молекул ДНК ядрышковых
организаторов. Открытым оставался вопрос: синтезиро-
вались ли молекулы рРНК в начале эмбриогенеза или
они уже имелись в яйцеклетке до оплодотворения. Мето-
дом авторадиографии было установлено, что на ранних
этапах эмбриогенеза рРНК практически не синтезиру-
ется.
Дальнейшие исследования мутантных зародышей (0-
пи) показали, что у них отсутствуют гены рРНК (28S-
и 18 S-РНК). Это было доказано опытами по гибридиза-
ции ДНК—РНК. ДНК, выделенную из зародышей нор-
127
мального дикого типа и безъядрышковых мутантов, ин-
кубировали с очищенной радиоактивной рРНК (28 S и
18 S). В первом случае рРНК соединялись с комплемен-
тарными им участками молекул ДНК, образуя гибрид-
ные молекулы, а во втором гибридные молекулы не воз-
никали, так как отсутствовали комплементарные участки
молекул ДНК.
Метод молекулярной гибридизации позволил опреде-
лить и абсолютное число ДНК-матриц для" рРНК в дип-
лоидном наборе. Это было сделано с помощью так назы-
ваемой насыщающей гибридизации, т. е. когда опреде-
ленное количество ДНК инкубирует с возрастающим
количеством меченой рРНК, определяя количественное
соотноЩение ДНК:РНК, при котором прекращается обра-
зование новых гибридных молекул. Этот момент называ-
ется точкой насыщения, и он характеризует часть ДНК,
комплементарную определенным РНК. Методом насы-
щающей гибридизации было установлено, что в зароды-
шах африканской шпорцевой лягушки каждые 100 мкг
ДНК связывают около 0,07 мкг 28 S-pPHK, т. е. пример-
но 0,07% ДНК генома кодирует эту РНК. Диплоидное
ядро эритроцита данного вида лягушки содержит 3,6-1012
дальтон ДНК и 0,07% такой ДНК составляет 2,5-Ю9
дальтон. Разделив эту величину на молекулярную массу
28 S-pPHK, равную 1,7-10®, получим величину около
1600, указывающую на то, что диплоидный геном шпор-
цевой лягушки содержит примерно 1600 копий генов
рРНК. Поскольку у безъядрышковых мутантов не про-
исходит синтез рРНК, можно предположить, что все
множественные аллели, по-видимому, находятся в обла-
сти ядрышкового организатора.
Однако кроме двух видов рРНК (28 S и 18 S), состав-
ляющих основную массу РНК рибосом, имеется еще и
5 S-pPHK, гены которой непосредственно не связаны с ге-
нами двух предыдущих, но ее синтез координирован с их
синтезом. Хотя рРНК представляет значительную часть
всей РНК клетки (например, в животных клетках около
80%) и имеет большое значение в биосинтезе белка (на
уровне трансляции), но дифференцировку клеток в боль-
шей степени определяют иРНК, называемые часто мат-
ричными (мРНК), или ДНК-подобными РНК. Характе-
ристику иРНК дать очень трудно, так как иРНК чрез-
вычайно гетерогепна. Отметим только, что ее молекулы
128
обычно крупнее молекул рРНК. Поскольку у безъядрыш-
ковых мутантов не синтезируется рРНК, то вся выделен-
ная из этих зародышей тяжелая РНК, по-видимому, яв-
ляется иРНК- Поэтому особо интересны данные по изу-
чению синтеза различных РНК в эмбриогенезе. В ходе
развития классы РНК шпорцевой лягушки начинают
синтезироваться в определенное время и с разной ско-
ростью. Это указывает на дифференциальный синтез
РНК и является доказательством дифференциальной ак-
тивности генов. Подобные данные были получены и на
других объектах (например, на аскариде, некоторых на-
секомых, морских ежах, некоторых рыбах и млекопита-
ющих).
Представление о дифференциальной активности ге-
нов было подтверждено и при исследовании особенно-
стей синтеза белка в различные периоды эмбриогенеза.
Хотя процесс биосинтеза белков относительно далек от
первичного проявления активности генов, но он также
может быть использован как показатель генетического
контроля клеточной дифференцировки. Уже отмечалось,
что клетки различных типов всегда отличаются составом
популяций белковых молекул. Комплекс явлений, регули-
рующих количество белков в клетках эукариот, пока оп-
ределить трудно. Однако предварительную важную ин-
формацию об активности отдельных генов в ходе индиви-
дуального развития дают исследования особенностей
суммарного белкового синтеза па уровне всего зародыша.
Наиболее подробно особенности белкового синтеза
изучены в раннем эмбриогенезе у морских ежей. При ис-
пользовании меченых аминокислот с последующим анали-
зом различных фракций белков на определенных стадиях
развития было установлено, что в процессе развития орга-
низма изменяется скорость включения аминокислот в бел-
ки. До оплодотворения синтез белков практически не про-
исходит. После оплодотворения в течение первых четырех
часов наблюдается интенсивное включение меченых ами-
нокислот в белки. Затем темп синтеза белков несколько
снижается и вновь возрастает во время гаструляции, т. е.,
как и в случае с РНК, наблюдается дифференциальный
синтез (Уршпрунг, Смит, 1965).
Первоначально результаты таких экспериментов выз-
вали ряд возражений. Например, одни исследователи
(Эллис, 1966) считали, что отмеченные изменения скоро-
9 Зак. 918
129
сти включения аминокислот в молекулы белка могут быть
обусловлены различным поглощением меченых аминокис-
лот клетками зародыша. По мнению других (Сильвер,
Комб, 1966), в период развития могут происходить суще-
ственные количественные и качественные изменения фон-
да аминокислот, что неизбежно должно приводить и к из-
менению скорости их включения. Третьи (Гросс, 1967)
ставили под сомнение эти данные в связи с тем, что в хо-
де эмбриогенеза существенно меняется уровень метаболи-
ческой активности, что может изменять скорость белково-
го синтеза. Однако дальнейшие исследования показали
несостоятельность таких возражений. Например, при вве-
дении меченых аминокислот в яйцеклетки морского ежа
задолго до оплодотворения отмечалось лишь незначитель-
ное их включение в белки, даже при избыточном содер-
жании некоторых аминокислот. После оплодотворения
интенсивность включения меченых аминокислот резко
возрастала. Затем было проведено изучение фонда сво-
бодных аминокислот на различных стадиях развития мор-
ского ежа при помощи автоматического аминокислотного
анализатора. В результате выяснилось, что содержание
некоторых аминокислот, в том числе и метионина, изменя-
ется (незначительно) в первые 15 ч развития. Следова-
тельно, нет оснований считать, что изменение фонда сво-
бодных аминокислот является основной причиной измене-
ния интенсивности белкового синтеза.
До сих пор методически довольно сложно определить,
какие именно белки синтезируются на различных стадиях
развития, но можно предположить, что если бы измене-
ния интенсивности белкового синтеза были главным об-
разом обусловлены изменениями общей интенсивности
обменных процессов, то следовало бы ожидать примерно
одинаковых изменений скорости синтеза всех белков.
Опытами с использованием импульсной метки, т. е. крат-
ковременным введением меченых аминокислот на опреде-
ленных этапах развития организма, и последующим хро-
матографическим анализом фракций синтезированных
белков было установлено, что скорость синтеза белков
действительно изменяется во время развития. Однако на
разных стадиях эмбриогенеза синтезируются не только
различные количества белка, но и различные его виды.
Правда, пока сложно точно идентифицировать эти белки
и еще сложней установить их значимость на определен-
13Q
пых этапах развития. Последнее не умаляет значения ре-
зультатов рассмотренных выше опытов, явившихся до-
полнительным доказательством дифференциальной ак-
тивности генов в развитии.
Дифференциальный характер синтеза белка (диффе-
ренциальная трансляция) в развитии был доказан и опы-
тами по блокированию транскрипции генов на белковый
синтез. Экспериментально транскрипцию генов можно
блокировать различными способами. Прежде всего этого
можно достичь при удалении ядер из яйцеклеток извест-
ными методами микрургии. Можно также получить эну-
клеированные фрагменты яйцеклеток и затем изучить их
развитие.
При центрифугировании неоплодотворенных яиц мор-
ского ежа в определенной среде, плотность которой при-
мерно равна плотности яиц, они сильно вытягиваются и
их можно разделить на два фрагмента, один из которых
будет без ядра. Использовав различные химические аген-
ты (например, масляную кислоту), можно индуцировать
начало партеногенетического развития обоих фрагментов.
Безъядерные фрагменты в таких опытах обычно перехо-
дят к дроблению и образуют бластулу, похожую на нор-
мальную. При определении интенсивности включения ме-
ченых аминокислот в белки бластомеров такой бластулы
оказалось, что скорость их синтеза резко увеличивается
после активации, как и при нормальном развитии. Следо-
вательно, для белкового синтеза в начале развития орга-
низма нет необходимости в непосредственной ядерной
транскрипции. В этом случае может лишь возникнуть
сомнение в связи с тем, что ДНК имеется и в цито-
плазме (например, в митохондриях). Однако такие опыты
хорошо доказывают, что необходимые генные продук-
ты для синтеза большинства белков после оплодотворе-
ния уже имелись в яйцеклетке.
Транскрипцию генов можно блокировать при воздей-
ствии актиномицином D, который подавляет транскрип-
цию генетической информации в РНК, не действуя на
репликацию ДНК. Использование актиномицина с одно-
временным введением и определением включения в бел-
ки меченых аминокислот показало, что актиномицин не
подавляет скорости синтеза белка после оплодотворения,
однако и не увеличивает скорости синтеза белка перед
гаструляцией. Это позволило заключить, что синтез РНК
9*
131
не обязателен для белкового синтеза в период дробления,
но необходим для синтеза белка при переходе к гаструле,
т. е. генетическая информация зиготы начинает реализо-
вываться с началом гаструляции.
Убедительные данные, доказывающие дифферен-
циальную активность генов в ходе развития, были полу-
чены при изучении особенностей синтеза и распада раз-
личных ферментов. Таких исследований проводилось и
проводится много. Наиболее подробно, нагГример, в этом
плане были исследованы синтез и распад лактатдегидро-
геназы, ксантиндегидрогеназы, альдегидоксидазы и дру-
гих ферментов на различных объектах, включая растения.
Определение времени и скорости синтеза, а также рас-
пада различных ферментов на разных этапах эмбриогене-
за подтверждает предположение о том, что гены, детер-
минирующие синтез какого-либо белка, должны функци-
онировать перед началом синтеза данного белка в клетке
и их активность очень тонко регулируется в широких
пределах. Кроме того, сами продукты генной активности
могут распадаться с разной скоростью.
Представление о дифференциальной активности генов
позволило на новой основе подойти к решению вопроса о
цитоплазматической локализации морфогенетических по-
тенций, которая была известна давно, но оценивалась
с различных позиций. Суть этого явления в том, что диф-
ференцировку клеток какого-либо клона можно рассмат-
ривать как результат влияния отдельных участков цито-
плазмы, унаследованных клетками с начала дробления.
Участки цитоплазмы, определяющие дальнейшую судьбу
клеток, можно выявить в педробящемся яйце (ооплазма-
тическая сегрегация) и даже наблюдать за ними в период
дробления и гаструляции. Еще в 1905 г. Е. Конклин опуб-
ликовал результаты интересных наблюдений за разви-
тием асцидий. Яйца этих животных имеют пигментиро-
ванные участки ооплазмы, что позволяет проследить их
распределение между клетками развивающегося зароды-
ша. По характеру пигментации Конклин выделил пять
типов цитоплазмы в яйцах асцидии: 1) темно-желтая ци-
топлазма, которая затем включается в клетки мышечной
ткани хвоста личинки; 2) светло-желтая цитоплазма, уча-
ствующая в образовании целомической мезодермы личин-
ки; 3) светло-серый участок цитоплазмы, который затем
наследуется клетками хорды и нервной пластинки; 4) се-
132
рый непрозрачный участок, входящий в клетки энтодер-
мы; 5) прозрачная непигментированная цитоплазма,
встречающаяся только в эктодермальных клетках. Наб-
людения позволили сделать заключение, что цитоплазма-
тическая локализация является первичным механизмом,
обусловливающим клеточную дифференцировку в ходе
эмбриогенеза.
Открытие цитоплазматической локализации морфоге-
нетических потенций возродило на новой основе старый
конфликт между преформистами и эпигенетиками. В свя-
зи с этим стали появляться гипотезы, которые можно объ-
единить под общим названием «неопреформизм». Исполь-
зовав интересные экспериментальные данные, неопрефор-
мисты пришли к ложному убеждению, что зародыш
каким-то непонятным образом предопределен в яйце. При-
чины такой предопределенности они раскрыть не могли, а
факты, доказывающие наличие эпигенетических механиз-
мов развития, в большинстве случаев ими просто игнори-
ровались. В поисках объяснения причин цитоплазматиче-
ской локализации некоторые неопреформисты (В. Гис,
Е. Лэнкестер и др.) выдвинули в конце XIX в. так назы-
ваемую гипотезу молекулярной преформации, согласно
которой цитоплазма яйца изначально имеет разнообраз-
ные специфические молекулы, а их распределение между
бластомерами в ходе дробления является первопричиной
клеточной дифференцировки. В данной гипотезе, которую
иногда называют и гипотезой преждевременной сегрега-
ции, могло бы быть рациональное зерно при условии поз-
нания истинных причин появления в цитоплазме яйце-
клеток разнообразных популяций молекул. Однако с по-
зиций нсопреформизма этот вопрос был неразрешимым.
Тем временем продолжали накапливаться результаты
экспериментальных исследований цитоплазматической
локализации. Особое значение имели опыты по изучению
развития изолированных бластомеров и удалению отдель-
ных частей цитоплазмы яйцеклетки перед дроблением.
Результаты многочисленных опытов по изоляции бла-
стомеров позволили сделать ряд важных заключений.
Прежде всего стало очевидным, что, несмотря на начина-
ющуюся иногда в период дробления дифференцировку,
первые деления дробления равнонаследственные, т. е.
каждый бластомер содержит одинаковые хромосомы и ге-
ны. Это доказывало полную несостоятельность гипотез
133
В. Ру о «мозаичном» развитии и А. Вейсмана о детерми-
нантах и «зародышевом пути».
Затем выяснилось, что опыты по изоляции бластоме-
ров удаются не на всех объектах и в связи с этим эмбри-
ологи начали различать два типа яиц: мозаичные, или
с детерминированным характером дробления, и регуля-
тивные. К первому типу, например, относятся яйцеклетки
большинства моллюсков и червей, для которых характе-
рен спиральный тип дробления. При детерминированном
типе дробления изолированные бластомеры способны
к «самодифференцировке», а при регулятивном значи-
тельно реже удаются опыты по культивированию отдель-
ных бластомеров.
Следует отметить, что разделение яйцеклеток на де-
терминированный и регулятивный типы является услов-
ным, так как яйцеклетки первого типа на какой-либо ста-
дии развития проявляют способность к регуляции, напри-
мер яйцеклетки ланцетника с детерминированным типом
дробления, но они с первых же делений способны и к ре-
гуляции. Объяснение этого сложного явления, по-видимо-
му, возможно в двух аспектах. Прежде всего понятия «де-
терминация» и «дифференцировка» клеток нельзя связы-
вать только с самими клетками, а необходимо учитывать
и различные межклеточные взаимодействия в системе
развивающегося зародыша, которые могут быть очень
разнообразными в пределах животного мира. Результаты
опытов с изолированными бластомерами указывают на
то, что в последних имеются какие-то факторы, влияю-
щие на функционирование геномов в клонах клеток, про-
исходящих из данных бластомеров. Иначе говоря, перво-
причиной рассматриваемых явлений выступают регуля-
торные факторы, обусловливающие дифференциальную
активность генов на определенных этапах эмбриогенеза.
По своей природе такие факторы, вероятно, могут быть
разнообразными (внутренними или внешними относитель-
но отдельных бластомеров). Исходя из этих общих поло-
жений, по-видимому, и следует решать проблему клеточ-
ной дифференцировки.
Цитоплазматическая локализация морфогенетических
потенций — объективное явление, и весь вопрос заклю-
чается в выяснении его причин. Действительно, цитоплаз-
ма яйцеклеток гетерогенна по структурным и морфогене-
тическим особенностям. Еще Р. Хегнер в 1911 г. опубли-
134
ковал интересные данные о детерминирующей роли цито-
плазмы яйца, полученные на некоторых видах златок.
У данных видов поверхностный тип дробления и диффе-
ренцировка первичных половых клеток начинается
после того, как ядра дробления достигают периферии
яйца и начинается образование бластодермы. Достигшие
полярной области яйца ядра окружаются особым участ-
ком цитоплазмы, детерминирующим развитие первичных
половых клеток. Последнее Р. Хегнер доказал простым
опытом. Нагретой иглой он разрушал данный участок ци-
топлазмы. Такое повреждение компенсировалось в ходе
развития бластодермы, и эмбриогенез продолжался. В ко-
нечном итоге вылупливались взрослые особи, но они нс
имели половых клеток.
Исходя из современных данных, результаты опыта
Р. Хегнера можно объяснить следующим образом. Совер-
шенно очевидно, что в неразрушенных ядрах полярной об-
ласти дробящегося яйца имелась информация, необходи-
мая для дифференцировки зародышевых клеток, но после
разрушения цитоплазмы с определенными структурны-
ми особенностями были исключены факторы, необходи-
мые для реализации специфической информации, и диф-
ференцировка половых клеток была блокирована.
Данные Р. Хегнера позже были подтверждены многи-
ми другими исследователями. Например, облучение уль-
трафиолетовыми лучами полярного участка цитоплазмы
яйца дрозофилы до образования бластодермы блокирует
дифференцировку половых клеток, и взрослые мухи ока-
зываются лишенными гамет. Затем было установлено, что
цитоплазма, детерминирующая дифференцировку пер-
вичных половых клеток у дрозофилы и других организ-
мов, содержит специфические цитоплазматические гра-
нулы. Если при помощи центрифугирования эти гранулы
переместить в другую часть яйца, то первичные половые
клетки также не дифференцируются. Не следует думать,
что морфогенетические детерминанты локализованы ис-
ключительно в цитоплазматических гранулах, просто
в других участках цитоплазмы яйца они утратили свои
специфические особенности. Для дифференцировки пер-
вичных половых клеток необходимо не только наличие та-
ких гранул, но и определенное их расположение в цито-
плазме. Подобных данных к настоящему времени нако-
пилось много,
135
Цитоплазматическая локализация (ооплазматическая
сегрегация)—явление лабильное, что было доказано
многими экспериментами. Так, экспериментальные дан-
ные П. Ансель и П. Винтембергера (1948) наглядно пока-
зали, что полярность яиц лягушки легко изменить под
влиянием силы тяжести, что указывает на отсутствие пер-
воначальной поляризации структур цитоплазмы. Это бы-
ло показано и на яйцах других животных при воздейст-
вии на них механическими, физическими или химически-
ми факторами. Следовательно, по крайней мере в некото-
рых случаях, локализация морфогенетически значимых
структур ооплазмы и их функционирование могут изме-
няться под воздействием внешних факторов.
Правильное предположение о причинах цитоплазма-
тической локализации было выдвинуто Э. Вильсоном еще
в 1896 г., согласно которому специфическая структура
цитоплазмы яйца приобретается во время его созревания.
Позже, в 1925 г., Э. Вильсон отметил, что наследствен-
ность реализуется за счет ядерной информации, которая
в ходе развития находит свое выражение в процессе ци-
топлазматического эпигенеза. Эти мысли Вильсона в об-
щих чертах настолько правильны, что, бесспорно, яви;
лись основой для изучения явления локализации. Можно
сказать, что дальнейшее познание этого сложного вопро-
са было главным образом связано с детализацией этих
первоначально априорных доводов Вильсона.
Опираясь на современные представления, цитоплазма-
тическую локализацию, поскольку она влияет на ход
дифференцировки, можно объяснить, исходя из теории
дифференциальной активности генов, накопления и реа-
лизации генных продуктов в цитоплазме, а также регуля-
торных механизмов генной активности. В любом случае
попытка объяснить суть цитоплазматической локализа-
ции должна исходить из анализа синтезированных и хра-
нящихся в цитоплазме яйца генных продуктов, которые
в начале эмбриогенеза обеспечивают необходимые био-
синтезы, а позже — специфическую активность генома за-
родыша. Следовательно, в цитоплазме локализованы ка-
кие-то генные продукты, значение которых сводится к
избирательной и специфической активации генов в разви-
тии. Эти генные продукты синтезируются в ходе оогенеза
и сохраняются в яйце, а перед оплодотворением или сра-
зу после него происходит их распределение в цитоплазме.
136
Нисколько такое распределение закономерно, пока неиз-
вестно, так как неизвестны механизмы, обусловливаю-
щие его.
Различные типы генной активности при различных
чнфференцировках в ходе развития определяются взаи-
модействием хранившихся в ооплазме генных продуктов
г геномами бластомеров. Особое значение при этом имеет
чарактер их распределения между бластомерами во вре-
мя дробления. Таким образом, изучение продуктов ген-
ной активности в оогенезе, их окончательного распреде-
ления и функционирования в цитоплазме не только поз-
волит решить вопрос о механизмах цитоплазматической
локализации, но и поможет решить проблему клеточной
дифференцировки.
Согласно современным данным, в зрелом яйце уже
имеется значительный запас генных продуктов в виде мо-
лекул РНК, которые являются матрицами для синтеза
большинства белков, необходимых на начальных этапах
эмбриогенеза, а эти матрицы в свою очередь оказывают-
ся результатом активности генов в оогенезе. Ооциты, так
экс как и любые другие специализированные клетки, об-
разуются после дифференцировки, и механизмы актива-
ции их генома, по-видимому, принципиально не отлича-
ются от таковых в других клетках. Оогенез сопровожда-
ется синтезом иРНК и рРНК, но объем синтеза этих мо-
лекул часто оказывается в ооцитах очень большим по
сравнению с другими клетками. Кроме того, хромосомы
ооцитов в большинстве случаев изменяются морфологи-
чески и превращаются на определенное время в хромосо-
мы типа «ламповых щеток».
Промежуток времени между считыванием генетиче-
ской информации (транскрипция) и трансляцией данного
генного продукта в какой-либо фенотипический приз-
нак можно назвать латентным периодом реализации ге-
нетической информации. Продолжительность данного пе-
риода может быть различной. В связи с этим возникает
вопрос о продолжительности жизни генных продуктов
в цитоплазме. По продолжительности жизни иРНК обыч-
но разделяют на три группы: 1) долгоживущие; 2) со
средней продолжительностью жизни; 3) быстрораспада-
ющиеся.
РНК первой группы синтезируются в оогенезе и дли-
тельное время хранятся в яйцеклетках животных и рас-
137
тений. В Начале эмбриогенеза они активируются, обеспе-
чивая синтез белков, Необходимых на ранних этапах
развития. В инактивированном состоянии такая иРНК,
по-видимому, может храниться очень долго. Кстати, в
тканях зародышей зрелых семян растений иРНК может
храниться в течение нескольких лет или даже несколь-
ких сотен лет. Рядом исследований было показано, что
иРНК активируется при намачивании семян. Например,
в семенах пшеницы уже через час после намачивания
интенсивность синтеза белка составляет 28% от макси-
мально возможной, а через 3—5 ч после намачивания —
65%. Опыты с актиномициновой блокадой доказали, что
иРНК, участвующие в этот период в синтезе белка, уже
имелись в клетках зародыша. Известно, что семена неко-
торых видов растений могут длительное время сохранять
свою жизнеспособность. Так, по данным Ф. Вента (1963),
сохранившиеся в отложениях семена лотоса оказались
способными к прорастанию более чем через 1700 лет.
Естественно возникает вопрос: каким образом иРНК
может сохраняться длительное время в клетках. По мне-
нию А. С. Спирина (1966), иРНК может храниться: 1) в
пострибосомных информосомоподобных частицах, защи.-
щенных от клеточных нуклеаз; 2) в репрессированных
полисомах; 3) в тяжелых комплексах, содержащих ин-
формосомы и некоторое количество рибосом. Кроме того,
иРНК может быть защищена длительное время от распа-
да при связывании с какими-либо стабильными клеточ-
ными структурами, например мембранами.
Средняя продолжительность жизни иРНК — от не-
скольких часов до нескольких дней. При использовании
актиномициновой блокады удалось установить, что необ-
ходимая для синтеза кератина пера птиц иРНК на 15-м
дне развития зародыша синтезируется примерно за два
дня до этого. Подобное было обнаружено и при изучении
иРНК, являющейся матрицами для синтеза специфиче-
ских белков хрусталика глаза цыпленка. Так, по данным
Р. Скотта и Е. Белла (1965), изучавших контрольные и
обработанные актиномицином хрусталики 14-дневных за-
родышей, в данный период начинают функционировать
иРНК, синтезированные несколько дней раньше. По-ви-
димому, эти иРНК появились после 10 дней развития, по-
скольку у 10-дневных зародышей полисомы их еще не
имеют. Такие же данные были получены и при изучении
138
популяций молекул иРНК в период дифференцировки
хрусталика глаза у некоторых млекопитающих. Дело в
том, что позже, при образовании хрусталиковых волокон,
превращающихся затем в массу кристаллина, происходит
дегенерация ядер и элиминация ДНК в крайнеспециали-
зированных клетках. Однако к этому времени уже накап-
ливается необходимый запас тканеспецифических иРНК.
Это не единственный пример дегенерации ядер диф-
ференцированных клеток, накопивших заранее необходи-
мые иРНК со средней продолжительностью жизни. По-
жалуй, наиболее удачным примером являются безъядер-
ные эритроциты млекопитающих, которые, как известно,
имеют иРНК со средней продолжительностью жизни,
необходимой для синтеза гемоглобина. Было установле-
но (Витл, 1965, и др.), что иРНК со средней продолжи-
тельностью жизни начинает принимать участие в биосин-
тезе гемоглобина с момента появления этой тканеспеци-
фической функции. Примером подобной системы синтеза
белков у млекопитающих служит и система синтеза со-
кратительных белков в' тромбоцитах, являющихся участ-
ками цитоплазмы мегакариоцитов. Ф. Буйсом и М. Ра-
фельсоном (1967) было показано, что на интенсивность
синтеза сократительных белков тромбоцитов, составляю-
щих примерно 15% сухого веса клетки, in vitro в течение
длительного времени не влияет актиномицин. По их дан-
ным, запас иРНК, необходимых для синтеза сократи-
тельных белков, без заметного распада сохраняется при-
мерно 72 ч.
Огромный фактический материал позволяет заклю-
чить, что иРНК со средней продолжительностью жизни
прежде всего содержатся в активноделящихся и диффе-
ренцирующихся клетках зародыша, выполняя роль мат-
риц для синтеза тканеспецифических белков. После за-
вершения процессов дифференцировки синтез этих иРНК
прекращается.
Быстрораспадающиеся иРНК широко представлены у
всех организмов. Распад таких иРНК происходит сразу
же после их синтеза. Хорошо этот тип иРНК был изучен
у бактерий, у которых период жизни иРНК в среднем
составляет 2—5 мин. Интенсивность синтеза белка у них
тесно связана со скоростью распада и синтеза иРНК, т. е.
латентный период реализации генетической информации
у бактерий непродолжительный.
139
Быстрораспадающиеся иРНК имеются и в дифферен-
цированных клетках высших организмов, и кинетика их
распада принципиально сходна с кинетикой распада
иРНК в бактериальных клетках.
Вообще можно заключить, что продолжительность ла-
тентного периода реализации генетической информации,
по-видимому, непосредственно определяет скорость реак-
ции клетки на изменяющиеся условия внешней и внут-
ренней среды. В связи с этим определениеслатентного пе-
риода реализации генетической информации имеет осо-
бое значение.
Матрицы для систем, которые очень быстро подвер-
гаются геномному контролю, должны содержать быстро-
распадающиеся иРНК, поскольку активность таких
систем тесно связана с необходимостью постоянного син-
теза новых матричных молекул. Объем фонда матричных
молекул, а также активность внутриклеточных нуклеаз и
протеаз — важные факторы, определяющие особенности
кинетики реакции клетки на воздействие внешней среды
и регуляцию со стороны ядра. Эти факторы в известной
мере обусловливают и метаболическую активность кле-
ток, что позволяет им реагировать на изменения внеш-
них условий. Вероятно, клетки, в которых главным обра-
зом содержатся долгоживущие иРНК, не должны иметь
высокую реактивность, т. е. они в меньшей степени реа-
гируют на изменения внешней среды, например хорошо
защищенные от внешних воздействий клетки зародышей
семян растений или яйцеклетки животных, покрытые ма-
лопроницаемыми мембранами, а в ряде случаев плот-
ными третичными оболочками. В ходе развития много-
клеточного организма для клеток ряда крайнеспециали-
зированных тканей отпадает необходимость быстро
реагировать на факторы внешней среды, поскольку про-
грамма их дифференцировки завершена. В таких клетках
возможна дегенерация генетического аппарата и сохра-
няются только ранее синтезированные долгоживущие
иРНК (например, клетки хрусталика глаза, зрелые ре-
тикулоциты, эритроциты и т. д.).
Морфогенетические процессы в начале эмбриогенеза
в защищенной эмбриональной системе не контролируют-
ся непосредственно ядром зиготы, и ход этих явлений
запрограммирован в долгоживущих иРНК, синтезиро-
ванных до процесса оплодотворения. На определенных
140
этапах бластулы начинается транскрипция части генома
зиготы и в результате синтезируются иРНК со средней
продолжительностью жизни. Они сохраняются некото-
рое время и используются в процессах дифференцировки
во время гаструлы или позднее. На заключительных эта-
пах клеточной дифференцировки появляются быстрорас-
падающиеся иРНК. После трансляции их информации
завершается становление специфических особенностей
клеток специализированных тканей.
Таким образом, собственный геном зиготы, по-види-
мому, не предназначен для контроля за развитием заро-
дыша до начала дифференцировки и определяется мат-
рицами с длительным латентным периодом реализации
генетической информации (долгоживущими иРНК). На-
чало общей дифференцировки связано с началом функ-
ционирования собственно генома зиготы и обусловлено
генными продуктами с меньшим латентным периодом
(иРНК со средней продолжительностью жизни). Следую-
щие затем частные моменты дифференцировки обеспечи-
ваются генными продуктами с очень коротким латентным
периодом (быстрораспадающиеся иРНК). Последний тип
генных продуктов связан с процессами, которые постоян-
но изменяются в соответствии с изменениями геномной
регуляции, и именно эти генные продукты контролируют
становление новых специфических особенностей в ходе
дифференцировки. В большинстве случаев максимальное
сокращение латентного периода в реализации генетиче-
ской информации совпадает со временем, когда клетки
зародыша впервые вынуждены реагировать на изменения
окружающих условий, например на появление клеток
других тканей или воздействие на них продуктов жизне-
деятельности последних. Это и составляет суть эмбрио-
нальных индукций.
Регуляция функционирования
генов и их взаимодействие
в ходе развития
На первый взгляд кажется, что информационное содер-
жание организма любого вида должно быть непосредст-
венно связано с общим количеством информации, необ-
141
ходимой для его развития. Иначе говоря, следует ожи-
дать какую-то простую корреляцию между суммарным
количеством ДНК в ядрах клеток организмов и разно-
образием дифференцированных клеток, образующих их.
Было проведено много работ по определению суммарно-
го количества ДНК у различных организмов, и в некото-
рых случаях удавалось установить наличие корреляции
между уровнем организации и количеством ДНК. Однако
это отмечалось далеко не всегда, что существенно за-
трудняло понимание организации ДНК в хромосомах и
роль генов в определении конкретных признаков клеток
и организмов.
Для решения данного вопроса очень важна правиль-
ная оценка емкости нуклеотидного кода. По данным мо-
лекулярной и биохимической генетики, для кодирования
одной аминокислоты требуется три нуклеотида из четы-
рех имеющихся в ДНК, которые могут образовать 64 ко-
дона. При этом должны быть закодированы по крайней
мере 20 аминокислот и, по-видимому, сигналы пунктуа-
ции. Следовательно, для нуклеотидного кода характерна
высокая избыточность. Известно, что почти все аминоки-
слоты кодируются более чем одним триплетом нуклеоти-
дов каждая, т. е. код является вырожденным, или одна и
та же аминокислота может кодироваться различными по-
следовательностями нуклеотидов.
Предположим, что молекулярный вес белка в сред-
нем составляет около 30 000, в этом случае среднее коли-
чество аминокислотных остатков на молекулу белка
примерно будет равно 300, поскольку молекулярный вес
аминокислот в среднем составляет 100. Такое количество
аминокислот может быть закодировано 900 нуклеотида-
ми (округленно 1000). При рассмотрении данных по ко-
личеству ДНК у различных организмов возможны про-
тиворечивые заключения (табл. 2).
Исходя из приведенного выше расчета, ДНК бакте-
риофага Т2 может кодировать примерно 200 белков сред-
него размера, ДНК кишечной палочки — около 4500 бел-
ков, а ДНК млекопитающих — около 3 млн. белков, что
примерно соответствует сложности этих организмов. Од-
нако вывод о том, что имеется корреляция между уров-
нем организации и количеством ДНК, оказывается не-
справедливым относительно отдельных групп организ-
мов. Например, камбала имеет примерно в 5 раз меньше
142
Таблица 2
Количество ДНК в клетках различных организмов (по Маркерту и
Уршпрунгу, 1973)
Вид Содержание ДНК (1,00 = = 7-10—12 г ДНК) Вид Содержание ДНК (1,00 = = 7-10—12 г ДНК)
Бактериофаг ТГ 0,00006 Камбала 0,23
Кишечная палочка 0,0014 Форель 0,80
Губки 0,016 Мышь 1,00
Оболочники 0,0656 Лягушка 2,17
Кишечнополостные 0,096 Тритон 13,00
Ланцетник 0,167 Аксолотль 27,89
Иглокожие 0,26 Двоякодышащие рыбы 35,40
ДНК, чем млекопитающие, а двоякодышащие рыбы — в
150 раз больше ДНК, чем камбала. Некоторые амфибии
содержат в 27 раз больше ДНК, чем мышь, и т. д. Учи-
тывая правила кодирования или количество информации,
трудно представить, что для развития аксолотля необхо-
димо значительно больше информации, чем для разви-
тия мыши. Это первый трудный вопрос, требующий объ-
яснения.
Некоторые организмы (например, млекопитающие)
содержат большое количество ДНК, которого хватило бы
для кодирования белков, примерно в 1000 раз больше из-
вестных нам в настоящее время. Хотя нам известны еще
далеко не все белки, синтезируемые в клетках млекопи-
тающих или других организмов, однако можно с полной
уверенностью заключить, что для кодирования всех бел-
ков, с учетом еще неизвестных, не может понадобиться
такое огромное количество ДНК. Вопрос об избыточном
содержании ДНК У большинства эукариот также являет-
ся сложным.
Известно, что основное количество ДНК локализова-
но в хромосомах и лишь небольшое ее количество содер-
жится в цитоплазматических структурах (митохондрии,
пластиды растений, базальные тельца пелликулы инфу-
143
зорий). Суммарное количество ДНК цитоплазматических
структур существенно не влияет на сравнительную оценку
ее содержания в ядрах разных клеток. Относительное
варьирование количества ДНК У различных организмов,
иногда в значительных пределах, можно объяснить, ис-
ходя из числа и структурных особенностей хромосом. Од-
нако и при этом возникает ряд затруднений. Например,
хорошо известно, что у многих организмов встречается
полиплоидия и суммарное количество ДНК. в полиплоид-
ных клетках изменяется точно в соответствии со сте-
пенью плоидности. Но далеко не всегда наблюдаемые
различия в количестве ДНК можно объяснить за счет по-
липлоидии. Эти различия иногда можно связать с явле-
нием политении. Политепные хромосомы характерны, на-
пример, для клеток некоторых тканей ряда двукрылых
насекомых. Они образуются из обычных хромосом и мо-
гут состоять из более чем 1000 нитей ДНК, но, как пра-
вило, политенные хромосомы возникают лишь в некото-
рых крайнеспециализированных клетках. Политенпое
строение хромосом в гаметах представить невозможно
хотя бы потому, что это совершенно несовместимо с за-
кономерностями распределения мутантных генов в поко-
лениях. Таким образом, и явление политении не по-
зволяет дать исчерпывающий ответ на поставленный
вопрос.
Для объяснения различий в количестве ДНК исполь-
зуется и представление о линейной множественности ге-
нов: гены могут присутствовать во многих копиях, соеди-
ненных последовательно и образующих общую линейную
структуру хромосом. Множественность не обязательна
для всех генов данного генома, т. е. возможно различное
количество копий разных генов. Если существует диффе-
ренциальная множественность генов, то она, по-видимо-
му, может варьировать в клетках различных тканей од-
ного организма, что может иметь особое значение для
количественных различий активности генов в процессе
клеточной дифференцировки. Пока нет достоверных дан-
ных, показывающих дифференциальную множествен-
ность генов в различных клетках одного организма (за
исключением ооцитов), но справедливым является пред-
ставление о дифференциальной активации лишь части
повторяющихся генов в каждой клетке. В настоящее вре-
мя установлено, что в геномах высших организмов на-
144
ряду с одиночными генами имеются также гены, которые
повторяются в клетке до 1000 и более раз.
Представление о множественности генов выдвигает
несколько дополнительных вопросов. При наличии мно-
гих копий генов неизбежно должно увеличиваться коли-
чество синтезируемой иРНК и должен ускоряться синтез
соответствующих белков. Существование многих копий
одного гена в хромосоме создает условия для непрерыв-
ной дивергенции генов посредством мутаций, а по мере
увеличения числа копий значительно уменьшилось бы
давление отбора, направленное на элиминацию мутант-
ных генов. Наличие в клетках многочисленных изофер-
ментов в известной мере доказывает существование мно-
жественности генов, но нет данных, которые доказывали
бы наличие какой-либо связи между огромным разнооб-
разием белков и большим количеством ДНК.
Так, при сопоставлении различных белков, выделен-
ных из тканей двоякодышащей рыбы и камбалы, сущест-
венно различающихся по содержанию ДНК, были обна-
ружены лишь незначительные различия (Маркерт, Урш-
прунг, 1973). В связи с этим можно предположить, что
при линейной множественности, которая явно имеется у
двоякодышащей рыбы, существует механизм, обеспечи-
вающий передачу только одной копии гена следующему
поколению. Относительно того, каким образом это воз-
можно, было высказано ряд предположений.
Согласно одной из довольно распространенных гипо-.
тез, существует ген-«хозяин», контролирующий структу-
ру производных генов — генов-«рабов». При таком под-
ходе допускается существование механизма исправления
ошибок (или мутаций) во всех подчиненных генах. Дей-
ствительно, только один ген будет передавать информа-
цию от одного поколения к другому и множественность
генов не будет приводить к множественности белков.
В принципе эта гипотеза очень логична, но наличие осо-
бого механизма восстановления повреждений пока не до-
казано.
Другая гипотеза исходит из известных данных о по-
ведении цистронов рРНК, которые не только линейно по-
вторяются в хромосоме, но и реплицируются в ооцитах,
образуя многочисленные дополнительные копии, не пере-
дающиеся следующему поколению клеток. Значит, в слу-
чае мутаций этих экстракопий не было бы заметных из-
10 Зак. 918
145
Менений в новых поколениях клеток. Правда, пока Не-
возможно представить, какие особенности хромосом
определяют возможность такой амплификации генов, но
данное явление явно существует. Согласно этой гипоте-
зе, дополнительные копии генов не принимают участия в
клеточных делениях или по крайней мере в процессе га-
метогенеза. Иначе говоря, реплицируется только первич-
ный ген и только его мутации будут проявляться в по-
следующих поколениях. Данная гипотеза в большей сте-
пени подтверждается экспериментально, например
результатами опытов по гибридизации ДНК-
Познание упомянутых выше вопросов возможно при
изучении механизмов регуляции активности генов в ходе
онтогенеза. В последние десятилетия на биологию раз-
вития доминирующее влияние оказала концепция оперо-
на, разработанная на прокариотах. Оперон представляет
собой единицу транскрипции генома. Он состоит из не-
скольких компонентов: структурных генов, генов-регуля-
торов, локуса-оператора и, по-видимому, локуса-усилите-
ля. Структурные гены, каждый из которых кодирует один
фермент метаболического пути, расположены в хромосо-
ме рядом. Действие группы структурных генов коорди-
нированно контролируется взаимодействием продукта
гена-регулятора с локусом-оператором, расположенным
на одном конце этой группы. Сам же ген-регулятор мо-
жет находиться в другой части генома, не граничащей с
генами данного оперона. Такая генетическая система мо-
жет контролироваться низкомолекулярным соединением,
например субстратом метаболического пути. Молекула
такого субстрата, комплексируясь с веществом-репрессо-
ром, препятствует связыванию репрессора с оператором,
что делает возможной транскрипцию иРНК со структур-
ных генов.
Дискуссионным остается вопрос о приложении кон-
цепции оперона к высшим организмам. Для решения его
необходимо доказать: 1) имеются ли у высших организ-
мов случаи группировки структурных генов, как у бак-
терий; 2) имеется ли оператор в таких группах генов;
3) существуют ли гены-регуляторы; 4) имеются ли веще-
ства-репрессоры. Вероятно, у высших организмов в не-
которых случаях возможна группировка генов с образо-
ванием сложных локусов. Примером этого является
сложный локус рРНК у шпорцевой лягушки, а также
146
группировки функционально связанных генов, например,
у дрозофилы и других организмов. Однако эти морфоге-
нетические системы у эукариот пока недостаточно изу-
чены биохимически и еще нет оснований отождествлять
их с группировкой генов у бактерий.
Попытки выявить в группах структурных генов эука-
риот локус-оператор пока не имели успеха. Существует
сомнение относительно необходимости гена-оператора
для координированного синтеза, и даже необязательной
является группировка генов. У эукариот известно много
случаев синхронного повышения или понижения уровня
ряда ферментов, что считали доказательством координи-
рованного контроля на генном уровне. Однако к такому
заключению следует относиться осторожно по разным
причинам. Прежде всего у эукариот активность какого-
либо фермента контролируется скоростью транскрипции,
трансляции и деградации. Нужно также учитывать, что
у эукариот транскрипция и трансляция разделены терри-
ториально, т. е. транскрипция происходит в ядре, а тран-
сляция — в цитоплазме. Следовательно, координация
может осуществляться или нарушаться в совершенно раз-
личных частях клетки. Затем для доказательства коор-
динированного контроля на генном уровне (как у бакте-
рий) необходимо показать, что в ядре происходит синтез
полицистронной иРНК, кодирующей несколько функцио-
нально связанных ферментов, а это пока не удалось
сделать.
Согласно теории оперона, гены-регуляторы должны
непосредственно влиять на продуктивность структурных
локусов, не сказываясь, однако, на качестве их продук-
тов, а также должны находиться за пределами этих ло-
кусов. Некоторые системы синтеза у эукариот внешне
удовлетворяют таким требованиям. Например, система
синтеза ксантиндегидрогеназы (КДГ) у дрозофилы, ко-
торую можно отнести к типу «несколько генов — один
фермент». Данный фермент контролируется по крайней
мере тремя локусами. Этот случай изучен довольно хо-
рошо, но природа регуляторного действия различных ге-
нов, контролирующих КДГ, пока не выяснена, что не по-
зволяет дать окончательную сравнительную оценку дан-
ной модели со сходными у бактерий.
Дискуссионным остается и вопрос о природе веществ-
репрессоров. В последнее время наиболее распространено
10*
147
представление о том, что веществами-репрессорами в
хромосомах являются гистоны. Гистоны — гетерогенные
основные белки, образующие ионные комплексы с ДНК.
Экспериментально было показано, что такие комплексы
не функционируют как матрицы для синтеза РНК, т. е.
при насыщении гистонами молекул ДНК они инактиви-
руются. Представление о таком значении гистонов перво-
начально казалось единственно правильным. Однако по-
сле более подробных исследований гистонов оказалось,
что в клетках высших организмов можно идентифициро-
вать лишь несколько видов гистонов. Это первая серьез-
ная трудность, которая не позволяет представить гено-
специфическое репрсссорное действие гистонов. Нет
также доказательств, что гистоны программируются ло-
кусами-регуляторами, как следует из теории оперона.
Необходимо также помнить, что с ДНК хроматина ассо-
циированы не только гистоны, но и РНК и негистоновые
белки, которые могут быть геноспецифическими регуля-
торными соединениями. Таким образом, идентификация
веществ-репрессоров остается нерешенной задачей гене-
тики и биологии развития.
Следовательно, нет оснований для полного переноса
теории оперона на эукариоты и особенно многоклеточные
организмы, имеющие сложные системы регуляции актив-
ности генов. Правда, в ряде случаев регуляция активно-
сти генов у высших организмов, по-видимому, сходна с
таковой у бактерий, у которых субстракт обычно являет-
ся индуктором. Так, установлено, что многие наследст-
венные заболевания у человека (нарушения углеводного,
жирового и белкового обмена) обусловлены врожденны-
ми аномалиями метаболизма. Например, для нормально-
го обмена фенилаланина и тирозина необходимо опреде-
ленное количество аминокислот. Они обычно поступают
в организм с пищей, а тирозин дополнительно синтези-
руется из избытков фенилаланина. Тирозин является
предшественником для образования некоторых белков,
гормонов, пигмента меланина и других соединений. Био-
химические мутации могут блокировать определенные
звенья биосинтеза. Известна мутация, блокирующая син-
тез тирозина из фенилаланина, что приводит к избытку
фенилаланина. Это так называемая фенилкетонурия —
заболевание, вызывающее серьезные нарушения умствен-
ного развития. При ранней диагностике данного заболе-
148 /
вания удавалось исключить появление признаков умст-
венной отсталости удалением из пищи фенилаланина.
Здесь мы наблюдаем явное сходство с регуляторными
механизмами у микроорганизмов. Однако такие случаи
не являются правилом для высших организмов.
С учетом современных представлений о регуляции
генной активности у высших организмов геном можно
условно разделить на две системы: 1) локусы, контроли-
рующие процессы, необходимые только для данной клет-
ки; 2) специальные гены, детерминирующие многоклеточ-
ную дифференцированную систему в целом. Исходя из
этого, у высших организмов можно предположить суще-
ствование регулирующих механизмов трех типов: 1) обес-
печивающих стабильность основной жизнедеятельности
клетки в изменяющихся условиях (индукция и ингиби-
ция конечными продуктами, как и у прокариот); 2) обес-
печивающих постоянство дифференцировки по типу дли-
тельной репрессии или активации определенных групп
генов; 3) обеспечивающих последовательную реализацию
запрограммированных и морфогенетических специализа-
ций и дифференцировок при действии различных индук-
торов (например, гормонов и др.). Конечно, каждая из
этих систем имеет свой молекулярный механизм.
Примером длительной репрессии нс только опреде-
ленных групп генов, но и практически всех генов одной
хромосомы является случай с половыми хромосомами.
Известно, что у самок млекопитающих имеются две X-хро-
мосомы, а у самцов — одна X- и одна У-хромосомы. Сле-
довательно, все гены Х-хромосомы самок представлены
двойным набором, а самцов — одним. Однако локализо-
ванные в Х-хромосоме гены, т. е. сцепленные с полом,
функционируют в равной степени как у самок, так и у
самцов. Генетики давно предполагали, что у самок дол-
жен существовать механизм компенсации дозы гена,
обеспечивающий функциональную эквивалентность двой-
ной дозы генов Х-хромосомы самок одиночной дозе тех
же генов самцов. Первоначально это использовалось для
постулирования генов-модификаторов, что казалось
вполне логичным, но не подтверждалось эксперименталь-
ными данными. Сравнительно недавно было предложено
новое объяснение поведения Х-хромосомы у млекопитаю-
щих, которое имеет общее значение для понимания ре-
гуляции функции генов и хромосом в процессах диффе-
149
репцировки. Рассмотрим суть этой гипотезы, получившей
название гипотезы Лайон.
В 1949 г. М. Барр и Е. Бертрам установили, что ядра
клеток самок имеют глыбки гетеропикнотического хро-
матина. Эти так называемые тельца Барра отсутствуют в
ядрах клеток самцов. Затем было установлено (Лайон,
1962), что тельца Барра, или половой хроматин, пред-
ставляют собой одну из двух Х-хромосом, которая во
время интерфазы находится в гетеропикнотическом со-
стоянии, т. е. крайне спирализована. Это свидетельствует
о генетической инактивации одной из Х-хромосом жен-
ского набора, что было подтверждено экспериментальны-
ми данными. Например, мыши с генотипом ХО представ-
ляют собой нормальных плодовитых самок, т. е. для
нормального развития самки мыши необходима только
одна активная Х-хромосома.
Природа полового хроматина и поведение данных ло-
кусов, по М. Лайон (1968), объясняется следующим об-
разом. Гетеропикнотическая Х-хромосома генетически
неактивна, а активная Х-хромосома может быть получе-
на от любого из родителей. Инактивация одной изХ-хро-
мосом происходит на ранних стадиях эмбриогенеза и-
сохраняется во всех последующих клеточных поколениях.
Гипотеза Лайон, или гипотеза «одной активной Х-хромо-
сомы», была проверена на уровне ферментов. При этом
использовалось то обстоятельство, что фермент глюко-
зо-6-фосфатдегидрогеназа (Г-6-ФДГ) кодируется одним
из генов Х-хромосомы, существующим в двух аллельных
формах, которые контролируют синтез ферментов, разли-
чающихся электрофоретическими свойствами. Следова-
тельно, использовав обычную методику определения изо-
ферментов, можно выявить две области различной фер-
ментативной активности. У гетерозиготной самки по гену
Г-6-ФДГ синтезируются обе формы фермента, а у сам-
ца — только одна, поскольку он гемизиготен и не имеет
одновременно обоих аллелей этого гена. Если гипотеза
Лайон правильна, то одни клетки женских особей долж-
ны синтезировать одну форму фермента, а другие — вто-
рую, но синтез обеих форм фермента не должен происхо-
дить в одной клетке. Это было проверено при изучении
в культуре кусочков кожи женщин, гетерозиготных по
гену Г-6-ФДГ. Во время культивирования клетки разде-
лялись и клонировались, а затем на клонах был проведен
150
энзиМограмМный анализ. В результате в каждом клоне
выявлялась только одна форма фермента и ни в одном
случае не было обнаружено одновременно двух форм.
Иначе говоря, каждая клетка, дающая начало клону,
имела только одну активную Х-хромосому, что убеди-
тельно подтверждает гипотезу Лайон.
Из этих данных нельзя делать вывод, что одна из
Х-хромосом в клетках женских особей полностью инак-
тивирована. Имеются, например, данные, что женщины с
генотипом ХО аномальны, т. е. при отсутствии одной
Х-хромосомы сказывается какая-то генотипическая недо-
статочность. Однако все дополнительные Х-хромосомы в
значительной степени инактивированы, что делает воз-
можным существование женщин с четырьмя Х-хромосо-
мами. Подобных фактов накопилось много. Интересно,
что увеличение числа любой другой хромосомы обяза-
тельно вызывает изменения или аномалии в развитии.
По-видимому, Х-хромосома находится под особым регу-
ляторным контролем, неприложимым к другим хромосо-
мам. Это явно указывает на возможность существования
различных регуляторных механизмов активности хромо-
сом в пределах одного набора.
Цитологически инактивация Х-хромосомы выражает-
ся в том, что она становится гетерохроматиновой. Гете-
рохроматин в различных количествах встречается и в
других хромосомах, что, возможно, обусловлено сходны-
ми функциональными изменениями хромосом. Он уже
давно привлекает особое внимание цитогенетиков. На-
помним, что гетерохроматин — это хроматин, остающий-
ся компактным на протяжении интерфазы клеточного-»
цикла; остальная часть хроматина — эухроматин — дис-
пергируется в этот период. По-видимому, весь хроматин
при определенных условиях и определенном функцио-
нальном состоянии может находиться в какой-либо из
данных форм (гетерохроматиновой или эухроматиновой).
Многочисленные наблюдения привели к заключению, что
гетерохроматиновые участки хромосом генетически не-
активны. Считается, что активные гены редко локализо-
ваны в гетерохроматиновых участках, но абсолютизиро-
вать такое мнение не следует, хотя и было показано рез-
кое снижение меченых нуклеотидов в районах хромосом
(правильней говорить, что гстерохроматизация всегда
сопровождается прекращением транскрипции РНК).
151
Известны также примеры продолжительной гетеро-
хроматизации не отдельных хромосом, а целого генома.
Например, было обнаружено, что у самцов червецов (от-
ряд равнокрылых, подотряд кокцид) мужской геном ге-
нетически неактивен и данные хромосомы полностью ге-
терохром атичны.
В ходе сперматогенеза гетерохроматиновые хромосо-
мы дегенерируют и сперматозоиды имеют только нор-
мальные хромосомы. Гетерохроматизация» геномов сам-
цов происходит в ходе эмбриогенеза мужских особей. Это
поразительный случай длительной гетерохроматизации
целого генома в процессе индивидуального развития, и
его причины пока непонятны.
Несмотря на такие особенности, гетерохроматин реп-
лицируется, но значительно медленней, чем эухроматин.
Было высказано предположение, что гетерохроматин и
эухроматин — взаимообратимые биофизические состоя-
ния хроматина. Если это справедливо, то дифференци-
альную инактивацию генов можно представить как лока-
лизованное проявление более общего явления гетерохро-
матизации, наблюдающегося на уровне отдельных,
участков хромосом, целых хромосом (одна из Х-хромо-
сом самок млекопитающих) и даже на уровне отдельных
геномов (у самцов червецов). Следовательно, молекуляр-
ные механизмы, обусловливающие гетерохроматизацию,
контролируют и степень спирализации хромосом, в ре-
зультате которой молекулы ДНК становятся недоступны-
ми для транскрипции РНК и существенно снижается ско-
рость их репликации. В процессе спирализации хромосом
большое значение имеют гистоны.
На основе рассмотренных фактов вполне справедли-
вым представляется вывод о том, что гетерохроматизация
является регулирующим механизмом, обеспечивающим
постоянство дифференцировки по типу длительной реп-
рессии определенных групп генов, а эухроматизация —
активацию определенных групп генов в развитии орга-
низмов. Однако следует учитывать и существование дру-
гих регулирующих механизмов у многоклеточных орга-
низмов, которые обусловливают реализацию генетиче-
ской программы в ходе индивидуального развития
посредством различных индукций.
Особо показательными явились исследования гормо-
нальной индукции. Давно было известно, что гормоны
152
активируют ферменты. Затем выяснилось, что усиление
активности ферментов в ряде случаев обусловлено интен-
сификацией их синтеза. Активация молекул ингибиро-
ванного фермента без дополнительного синтеза также
приводит к усилению его активности. Это один из обыч-
ных метаболических механизмов регуляции активности
ферментов.
Интересными явились результаты ряда работ по изу-
чению синтеза триптофанпирролазы печени крыс. Этот
фермент разрывает индольное кольцо триптофана и при-
водит к синтезу витамина — никотинамида. Через опре-
деленные промежутки времени взрослым животным вну-
трибрюшинно вводились совместно и раздельно гидро-
кортизон и триптофан. Данные соединения приводили к
повышению активности фермента, а при совместном их
введении активность фермента возрастала значительно,
т. е. на много больше, чем можно было ожидать в случае
простой аддитивности действия этих соединений. Резуль-
таты дальнейших опытов позволили заключить, что гид-
рокортизон и триптофан индуцируют увеличение актив-
ности триптофанпирролазы различными путями. Гидро-
кортизон индуцирует синтез фермента, а триптофан пре-
пятствует его деградации. Поскольку введение гормона
приводит к усиленному синтезу фермента, он регулирует
активность генов.
Подобные данные были получены не только на живот-
ных, но и на растениях. Например, известно, что в про-
цессе прорастания семян резко возрастает удельная
активность ряда ферментов. При этом возникает вопрос:
имелся ли тот или иной фермент до прорастания семени
в клетках зародыша или его синтез был индуцирован в
начале прорастания. Экспериментально было доказано,
что в ряде случаев при прорастании семян синтез фер-
ментов индуцируется определенными гормонами.
Гены играют важную роль в определении путей кле-
точной дифференцировки и свойств клеток взрослого
организма. Основная функция отдельного гена, по-види-
мому, может быть очень простой, но механизмы совмест-
ной регуляции активности многих генов и времени нача-
ла их действия, от которых в конечном итоге зависит про-
цесс дифференцировки, очень сложны. Познание таких
взаимосвязей должно начинаться с последовательного
анализа появления какого-либо специфического генного
153
продукта в процессе дифференцировки определенного
типа клеток. В этом плане генетиками и эмбриологами
хорошо изучен, например, пигмент меланин, синтезируе-
мый только в меланоцитах. Меланин образуется в ре-
зультате ряда последовательных реакций, для которых
большое значение имеет фермент тирозиназа. У млеко-
питающих этот фермент детерминируется одним геном
локуса С (color), мутация которого исключает синтез
тирозиназы, и гомозиготные по мутантному гену особи
оказываются альбиносами, т. е. они не способны синтези-
ровать меланин. Давно было установлено, что кроме гена
тирозиназы на дифференцировку меланоцитов влияют и
многие другие гены.
На функционирование меланоцитов оказывают влия-
ние и негенетические факторы, что приводит к количест-
венному изменению пигмента. Известны примеры изме-
нения интенсивности пигментации кожи или волосяного
покрова при смене температуры, изменении интенсивно-
сти ультрафиолетового облучения, в зависимости от вре-
мени года, при действии гормонов и т. д. Все это указы-
вает на существование широких модификационных'
возможностей в рамках функционирования генов, детер-
минирующих пигментацию.
Относительная роль генотипа и клеточного окружения
меланоцита в ходе его дифференцировки была доказана
опытами по пересадке кожи у мышей с разным геноти-
пом. При пересадке небольшого участка кожи пигменти-
рованного животного альбиносу вскоре после его рожде-
ния меланобласты из пигментированной кожи мигрируют
в волосяные фолликулы альбиноса и образуют там пиг-
мент. Опыт с реципрокной трансплантацией дает обрат-
ный результат — меланоциты из черной кожи мигрируют
в волосяные фолликулы реципиента и образуют там жел-
тый пигмент. Меланоциты же донора, мигрирующие в
ткани реципиента, по не попадающие в волосяные фол-
ликулы, продолжают синтезировать черный пигмент, не-
смотря на то что они окружены клетками с другим гено-
типом. Следовательно, образование желтого пигмента
определяется не генами меланоцита, а генами клеток
волосяных фолликулов, т. е локусы, имеющие огромное
значение для дифференцировки меланоцитов, способны
нормально функционировать лишь в клетках волосяных
фолликулов,
154
Пока мы исходили из допущений, что гены могут быть
либо «включены», либо «выключены». Однако степень
фенотипического выражения генной активности может
варьировать в широких пределах — от едва обнаружи-
ваемой до резко выраженной. Следовательно, проблема
не исчерпывается познанием молекулярных механизмов,
избирательно активирующих одни гены и удерживающих
в состоянии покоя все остальные гены, а необходимо еще
вскрыть и механизмы, регулирующие интенсивность
функционирования гена. Рассмотренные нами лишь неко-
торые примеры, а их можно было бы привести больше,
указывают на сложность и топкость взаимодействия
между дифференцирующейся клеткой, се окружением и
генотипом.
В последнее время все расширяются методические
возможности получения новой информации об особенно-
стях функционирования генов в клеточной дифференци-
ровке. Особое значение, например, имеют опыты по
экспериментальному . получению аллофенных особей,
являющихся генетическими мозаиками, поскольку они
развиваются в результате комбинирования бластомеров
зародышей с различными генотипами. Впервые такие
особи были получены на мышах (Миптц и Сильвере,
1967, 1969). Методически это делается следующим обра-
зом. Из яйцеводов беременных мышей извлекают заро-
дыши примерно на стадии восьми бластомеров и разде-
ляют их на бластомеры с помощью протеолитического
фермента проназы. Затем при соответствующих условиях
отдельные бластомеры от двух или большего количества
зародышей можно рекомбинировать. После прочного
соединения бластомеров такая комбинированная бласту-
ла реимплантируется в специально подготовленную для
этого самку. При удачном проведении операций зародыш
переходит к гаструляции и его развитие завершается
рождением аллофенных особей, которые являются по-
томками четырех родительских особей, различающихся
генотипически.
Изучение аллофенных особей позволяет получить
важные данные, необходимые для ответа на многие
сложные вопросы. Рассмотрим один пример. Известно,
что клетки поперечнополосатых мышц являются много-
ядерными. Такие клетки могут возникать в результате
многократных делений ядер без цитокинеза миобластов
155
(эмбриональных мышечных клеток) или в результате
слияния одноядерных миобластов. Изучение аллофенных
мышей помогло ответить на этот вопрос. При исследова-
нии аллофенных мышей, исходные бластомеры которых
различались изоферментами изоцитратдегидрогеназы
(ИДГ), были выявлены особенности синтеза данных фер-
ментов. Этот фермент — полимер, и его субъединицы
кодируются аллельными формами соответствующего ге-
на. Субъединицы ИДГ различаются электрофоретически-
ми свойствами. У гетерозиготных особей образуются три
формы ИДГ, причем промежуточная форма является
гибридной молекулой и се субъединицы детерминирова-
ны двумя аллелями. Аллофенные особи, полученные в
результате комбинации бластомеров двух различных го-
мозиготных зародышей, обладают способностью к син-
тезу всех трех форм ИДГ. Гибридная ИДГ могла обра-
зоваться только в том случае, если в клетке имелись два
аллеля, функционирующих одновременно. В данном слу-
чае остается только предположить, что клетки обоих ге-
нотипов должны были слиться, образовав многоядерные
клетки, в которых и оказались два аллеля. Таким обра-
зом, взаимодействие генов может осуществляться и на
основе объединения нескольких ядер в одной клетке.
Дифференциальная активность
хромосом
Хромосомы можно определить как обязательные ком-
поненты ядра клеток, имеющие особую организацию,
индивидуальность в морфологическом и функциональном
отношениях, способные к самовоспроизведению и сохра-
нению своих свойств на протяжении многих клеточных
поколений. В процессе эволюции хромосомы эукариот
явились наиболее совершенной формой организации на-
следственных структур. Трудно назвать другую биологи-
ческую структуру, изучение строения и функций которой
производилось бы столь тщательно и интенсивно, с ис-
пользованием такого огромного количества разнообраз-
ных методов, как изучение строения и функционирования
хромосом. И хотя многие особенности этих сложно орга-
156
пнзованных структур уже известны, изучение хромосом
далеко не завершено.
Еще в 1892 г. И. Рюккерт при исследовании ооцитов
тритона обнаружил гигантские хромосомы с большим
количеством боковых ветвей, что придавало им вид лам-
повых щеток. Затем такие хромосомы были обнаружены
в развивающихся яйцеклетках амфибий, рептилий, рыб,
ракообразных, а также некоторых видов растений. Одна-
ко сравнительно недавно в общих чертах было расшиф-
ровано значение такого преобразования хромосом. Хро-
мосомы типа «ламповых щеток» являются примером
функционального преобразования хромосом, иллюстри-
рующим их дифференциальную активность во время раз-
вития яйцеклеток.
Стадия хромосом типа «ламповых щеток» к настоя-
щему времени обнаружена в ооцитах многих животных,
относящихся к различным систематическим группам
(брюхоногие и головоногие моллюски, некоторые щетин-
кочелюстные, иглокожие, прямокрылые насекомые, круг-
лоротые, акулы, костистые рыбы, амфибии, рептилии,
птицы и некоторые млекопитающие). Имеющиеся данные
позволяют предположить, что наличие или отсутствие
стадии хромосом типа «ламповых щеток» обусловлено
особенностями оогенеза. Животных, у которых не обна-
ружены хромосомы типа «ламповых щеток», можно раз-
делить по структурным особенностям хромосом в профа-
зе мейоза на две группы: 1) после короткой стадии
диплотены хромосомы становятся диффузными и насту-
пает длительная диктиатенная стадия; 2) на стадии дип-
лотены хромосомы сильноспирализованы. К первой груп-
пе относятся некоторые млекопитающие, а ко второй —
отдельные виды первичноротых. Правда, у ряда живот-
ных трудно обнаружить хромосомы типа «ламповых ще-
ток», поскольку они очень малы.
В связи с этим уместно напомнить, что у животных
известны по крайней мере два типа оогенеза: мероисти-
ческий, когда ооциты получают различные соединения из
окружающих их клеток, и паноистический, когда ооциты
сами синтезируют большинство необходимых соединений.
Стадия хромосом типа «ламповых щеток», как правило,
имеется у животных с паноистическим типом оогенеза.
Особенности мероистического оогенеза, который прежде
всего был описан у некоторых насекомых, позволяют
157
дать предварительное объяснение отсутствия хромосом
типа «ламповых щеток» у некоторых млекопитающих.
Например, электронно-микроскопическое исследование
мейотических ооцитов кролика (Замбани, Гондос, 1968)
показало наличие связи между ними посредством цито-
плазматических мостиков. Половые клетки образуют
своеобразные скопления, напоминающие синцитий. Меж-
ду такой системой и системой ооцита дрозофилы с при-
легающими к нему питающими клетками имеется сход-
ство. Известно также, что в ходе оогенеза многие ооциты
у грызунов дегенерируют. Эта дегенерация сходна с де-
генерацией питающих клеток у дрозофилы и других пер-
вичноротых. Часть образующих синцитиальное скопление
половых клеток у грызунов, вероятно, функционирует
как питающие клетки по отношению к развивающимся
ооцитам. Отсутствие стадии хромосом типа «ламповых
щеток», для которой характерна высокая синтетическая
активность, компенсируется так же, как и у насекомых
с мсроистическим типом оогенеза.
Стадия «ламповых щеток» уже давно рассматрива-
лась как проявление интенсивной генетической активно-
сти хромосом, однако доказательства этого появились
сравнительно недавно. По современным представлениям,
последовательное чередование различного размера пе-
тель и хромомер вдоль хромосом типа «ламповых щеток»
является своеобразным отражением линейного располо-
жения генов и дифференциальной активности хромосом.
Каждая петля, по-видимому, содержит один дуплекс
ДНК, а каждая пара петель — два таких дуплекса. На-
пример, по данным X. Каллана (1957), в хромосомном
наборе тритона насчитывается примерно 20 тыс. боковых
петель, часть из которых может достигать значительной
длины (более 50 мкм). Предполагалось, что каждая пет-
ля представляет собой один ген, но это маловероятно,
поскольку среднее содержание ДНК на одну петлю
слишком вел’ико. В 60-х гг. XX в. Л. Ллойд, X. Каллан и
другие ученые, пытаясь объяснить огромные различия в
содержании геномной ДНК У некоторых даже родствен-
ных организмов (например, шпорцевой лягушки и трито-
на), предлагали гипотезу, по которой каждая боковая
петля хромосом типа «ламповых щеток» представляет
собой набор реплик одного гена. Из этого следовало, что
для обслуживания большего объема цитоплазмы необхо-
158
дима и большая «генетическая сила». Последнее дости-
гается путем повторения одних и тех же генов, т. е. их
избыточностью, а не увеличением общего количества раз-
личных генов.
Спорным остается вопрос и о количестве ДНК в хро-
мосомах типа «ламповых щеток». По некоторым данным
(Изава, Мирский, Олфи, 1963), полученным в опытах с
тритоном, в хромосомах типа «ламповых щеток» содер-
жится примерно в 4 раза больше ДНК, чем в хромосомах
мейотической профазы (4G). Однако объяснить такой из-
быток генетического материала в хромосомах типа «лам-
повых щеток» пока не удается.
Многочисленными исследованиями было установлено,
что на петли хромосом типа «ламповых щеток» приходит-
ся около 5% общей длины геномной ДНК, а остальная
часть ДНК находится в плотно спирализованных хромо-
мерах. В опытах с авторадиографией метка включается
главным образом в боковые петли и лишь в небольших
количествах в хромомеры. Следовательно, на боковых
петлях происходит интенсивный синтез РНК. Первона-
чальное представление о лабильности петель хромосом
типа «ламповых щеток», по которому в период этой ста-
дии происходит передвижение ДНК-матриц и считывает-
ся значительно больше информации, чем 5%, оказалось
неправильным. По-видимому, боковые петли стабильны
на протяжении всей стадии «ламповых щеток» и в дан-
ный период транскрибируется не более 5% общей геном-
ной информации. Было также установлено, что вблизи
боковых петель увеличивается содержание белков, но
вопрос об их природе остается нерешенным.
Основываясь на многочисленных фактах, можно с
полной уверенностью утверждать, что на боковых петлях
хромосом типа «ламповых щеток» интенсивно синтезиру-
ются долгоживущие иРНК. Именно в это время они на-
капливаются и распределяются в ооплазме, обусловли-
вая ооплазматическую сегрегацию. Как уже отмечалось,
популяции таких иРНК реализуются в начале эмбриоге-
неза. Было установлено, что не менее 2/3 иРНК, синтези-
рованной на стадии «ламповых щеток», хранится в тече-
ние всего оогенеза до процесса оплодотворения и затем
наследуется зародышем в качестве основного запаса ма-
теринской иРНК. Следовательно, значение стадии «лам-
повых щеток» заключается в развертывании и активации
159
матриц для синтеза долгоживущих иРНК, что и выра-
жается в своеобразных морфологических преобразова-
ниях хромосом яйцеклеток. Поскольку расположение
боковых петель является строго определенным, такое
морфологическое преобразование хромосом доказывает
их дифференциальную активность.
По теории дифференциальной активности генов, ле-
жащей в основе клеточной дифференцировки, гены
«включаются» и «выключаются» в соответствии с потреб-
ностями клетки и организма на данном этапе развития.
На уровне хромосом это означает, что активные гены в
каком-либо участке хромосомы продуцируют РНК, а со-
седние гены в то же время могут быть неактивными.
Примером дифференциальной генетической активности
хромосом являются политеииые (гигантские) хромосомы
ядер некоторых специализированных клеток личинок
двукрылых насекомых. О существовании политенных
хромосом впервые сообщил Е. Бальбиани в 1881 г.
Политенные хромосомы образуются из обычных хро-
мосом в результате многократной репродукции хромо-
нем без репродукции самих хромосом. В некоторых слу-
чаях политенные хромосомы имеют более 1000 хромонем,
достигая 1 мм в длину и 50 мкм в диаметре. Политениза-
ция хромосом обычно сопровождается спариванием гомо-
логичных хромосом. В результате точного сближения го-
мологичных хромомерных и межхромомерных участков,
повторяющихся многократно, наблюдается исчерченность
гигантских хромосом, т. с. диски и междисковые про-
странства довольно четко обозначаются в виде полос.
Рапределение дисков в политенных хромосомах в конеч-
ном итоге стало рассматриваться как цитогенетическое
доказательство сцепления генов и их линейного располо-
жения в хромосомах, что было убедительно подтвержде-
но экспериментально.
Политенные хромосомы можно рассматривать как
модель интерфазпых хромосом, поскольку они способны
к редупликации ДНК и синтезу РНК. Поперечные диски
политенных хромосом — результат суммирования от-
дельных хромомеров, т. е. наиболее спирализованных
участков хромонем. Справедливым является представле-
ние о том, что диски политенных хромосом и хромомеры
обычных хромосом — не просто структурные элементы
хромосом, а особые функциональные участки. Размеры
160
дисков колеблются от 0,05 до 1 мкм, а размеры межди-
сковых участков почти одинаковы. По-видимому, величи-
на дисков отражает различия в содержании ДНК в этих
районах хромосом. Общее количество дисков политенных
хромосом дрозофилы около 1,5 тыс., а у хирономид их
насчитывается до 2,5 тыс. Первоначальное предположе-
ние о том, что каждый диск соответствует одному гену,
оказалось ошибочным. Неправильным является и отож-
дествление дисков с цистропами или операторами. Пока
лишь можно утверждать, что большинство генов локали-
зовано в дисках.
Морфологические, цитогенетические и цитохимические
исследования дисков политенных хромосом позволяют
рассматривать их как дискретные структурные единицы,
в которых локализовано большинство генов. Их функ-
ционирование обеспечивает дифференциальную редупли-
кацию и транскрипцию по длине хромосомы. Наиболее
же перспективной гипотезой, объясняющей регулирова-
ние функционирования.дисков в ходе онтогенеза, являет-
ся гипотеза гетерохроматизации.
В ходе дифференцировки клеток и метаморфоза дву-
крылых отдельные диски образуют вздутия, в которых
происходит интенсивный синтез иРНК. Эти вздутия рань-
ше называли кольцами Бальбиапи, по в современной
литературе используется термин «пуфы». Имеется много
убедительных доказательств, позволяющих рассматри-
вать пуфы как генетически активные локусы хромосомы.
Одни диски (хромомеры) в определенный период разви-
тия находятся в неактивном состоянии и не могут реали-
зовать заключенную в них генетическую информацию, а
другие активны и синтезируют иРНК. Активация диска
сопровождается деспирализацией хромонем, накопле-
нием кислых белков, активацией синтеза иРНК и появ-
лением вблизи пуфа гранул РНП. При введении меченых
предшественников РНК метка интенсивно включается в
пуфы. Это было показано и на изолированных политен-
ных хромосомах, т. е. хромосома, вероятно, содержит все
необходимое для синтеза РНК. Исследования распреде-
ления пуфов в клетках различных типов на определенных
этапах развития некоторых двукрылых убедительно по-
казывают, что образование пуфов отличается определен-
ной ткане- и стадиоспецифичностью, а это согласуется с
теорией дифференциальной активности генов.
11 Зак. 918
161
Определение особенностей распределения пуфов по
длине хромосом позволяет выявить степень активности
отдельных участков хромосом, а также оценить долю
активной и неактивной частей генома в данный момент
развития и составить физиологические (вернее, генетико-
физиологические) карты, отражающие функциональную
характеристику хромосом на той или иной стадии разви-
тия и смену состояния их отдельных участков в ходе
онтогенеза. Уже составлены такие карты для кариотипов
некоторых видов хирономид и дрозофилид. Правда, для
познания механизмов, обусловливающих дифференци-
альную активность хромосом, необходимо еще уточнить
многие вопросы.
Интересным является вопрос о возможности переноса
данных о функциональной организации политенных хро-
мосом на обычные интерфазные хромосомы. Представ-
ляется правильным, что принцип организации политен-
ных хромосом справедлив и для интерфазных хромосом
клеток разных типов. В начале своего развития политен-
ные хромосомы ничем не отличаются от хромосом других
видов. Во время формирования пуфов образуются боко-
вые петли, такие же как и у хромосом типа «ламповых
щеток». Анализ гетеро- и эухроматических участков ин-
терфазных хромосом растений и животных позволяет го-
ворить о наличии структурной и биохимической изменчи-
вости различных участков хромосом в интерфазе. Спира-
лизация хромосомы сопровождается инактивацией генов.
Кроме того, имеются убедительные доказательства обра-
тимости изменений отдельных участков хромосом и всего
генома при дифференцировке клеток. Например, при
трансплантации ядер из специализированных клеток в
безъядерную яйцеклетку удается получить новый орга-
низм. При этом для смены функционального состояния
генома особое значение имеет влияние цитоплазмы.
Также следует отметить, что пуфы не являются уни-
кальными образованиями политенных хромосом. Это
было показано на примере ядрышка. По современным
представлениям, ядрышко следует рассматривать как
специализированный пуф, основу которого составляет
ядрышковый организатор, т. е. участок хромосомы, ответ-
ственный за синтез всей рРНК клетки. В отличие от дру-
гих пуфов ядрышко — обязательная структура ядра всех
типов клеток. Ядрышковый организатор представляет со-
162
бой полигенную структуру. Для него также характерна
дифференциальная активность генов. Как и во всех
остальных случаях, активация ядрышкового организато-
ра начинается с деспирализации хромонем и образова-
ния боковых петель, что сопровождается развертыванием
в зоне ядрышка матриц для синтеза рРНК. В сформиро-
ванном ядрышке хромонемы активной части ядрышково-
го организатора пронизывают всю толщу ядрышка,
являясь его морфологической и функциональной основой.
Инактивацию ядрышкового организатора можно вызвать
экспериментально, использовав, например, актиномици-
новую блокаду.
Факторы, регулирующие дифференциальную актив-
ность хромосом, можно разделить на внутренние (гено-
типические) и внешние (средовые). К генотипическим
факторам относятся взаимодействия между нормальны-
ми и мутантными генами, изменения структуры хромосом
(различные хромосомные перестройки) и изменения на
уровне геномов (полиплоидия и анеуплоидия). Для ре-
гуляции функционирования отдельных участков хро-
мосом особое значение имеют следующие условия среды:
условия для нормального синтеза (пул предшественни-
ков, наличие необходимых ферментов, состояние матриц
ДНК и т. д.); все факторы, прямо или косвенно дейст-
вующие на синтез специфических белков; нервные
импульсы и гормональные индукции; температура, влия-
ющая на скорость биохимических реакций, и т. д.
Взаимодействие ядра
Глава О и цитоплазмы в развитии
Обменные процессы между ядром
и цитоплазмой
Ооплазма представляет собой гетерогенную смесь
различных соединений, организованных в различные спе-
цифические структуры и распределенные, по-видимому,
не случайным образом. Следовательно, ядра бластомеров
с начала дробления оказываются в различном цитоплаз-
11*
163
Определение особенностей распределения пуфов по
длине хромосом позволяет выявить степень активности
отдельных участков хромосом, а также оценить долю
активной и неактивной частей генома в данный момент
развития и составить физиологические (вернее, генетико-
физиологические) карты, отражающие функциональную
характеристику хромосом на той или иной стадии разви-
тия и смену состояния их отдельных участков в ходе
онтогенеза. Уже составлены такие карты для кариотипов
некоторых видов хирономид и дрозофилид. Правда, для
познания механизмов, обусловливающих дифференци-
альную активность хромосом, необходимо еще уточнить
многие вопросы.
Интересным является вопрос о возможности переноса
данных о функциональной организации политенных хро-
мосом на обычные интерфазные хромосомы. Представ-
ляется правильным, что принцип организации политен-
ных хромосом справедлив и для интерфазных хромосом
клеток разных типов. В начале своего развития политен-
ные хромосомы ничем не отличаются от хромосом других
видов. Во время формирования пуфов образуются боко-
вые петли, такие же как и у хромосом типа «ламповых
щеток». Анализ гетеро- и эухроматических участков ин-
терфазных хромосом растений и животных позволяет го-
ворить о наличии структурной и биохимической изменчи-
вости различных участков хромосом в интерфазе. Спира-
лизация хромосомы сопровождается инактивацией генов.
Кроме того, имеются убедительные доказательства обра-
тимости изменений отдельных участков хромосом и всего
генома при дифференцировке клеток. Например, при
трансплантации ядер из специализированных клеток в
безъядерную яйцеклетку удается получить новый орга-
низм. При этом для смены функционального состояния
генома особое значение имеет влияние цитоплазмы.
Также следует отметить, что пуфы не являются уни-
кальными образованиями политенных хромосом. Это
было показано на примере ядрышка. По современным
представлениям, ядрышко следует рассматривать как
специализированный пуф, основу которого составляет
ядрышковый организатор, т. е. участок хромосомы, ответ-
ственный за синтез всей рРНК клетки. В отличие от дру-
гих пуфов ядрышко — обязательная структура ядра всех
типов клеток. Ядрышковый организатор представляет со-
162
бой полигенную структуру. Для него также характерна
дифференциальная активность генов. Как и во всех
остальных случаях, активация ядрышкового организато-
ра начинается с деспирализации хромонем и образова-
ния боковых петель, что сопровождается развертыванием
в зоне ядрышка матриц для синтеза рРНК. В сформиро-
ванном ядрышке хромонемы активной части ядрышково-
го организатора пронизывают всю толщу ядрышка,
являясь его морфологической и функциональной основой.
Инактивацию ядрышкового организатора можно вызвать
экспериментально, использовав, например, актиномици-
новую блокаду.
Факторы, регулирующие дифференциальную актив-
ность хромосом, можно разделить на внутренние (гено-
типические) и внешние (средовые). К генотипическим
факторам относятся взаимодействия между нормальны-
ми и мутантными генами, изменения структуры хромосом
(различные хромосомные перестройки) и изменения на
уровне геномов (полиплоидия и анеуплоидия). Для ре-
гуляции функционирования отдельных участков хро-
мосом особое значение имеют следующие условия среды:
условия для нормального синтеза (пул предшественни-
ков, наличие необходимых ферментов, состояние матриц
ДНК и т. д.); все факторы, прямо или косвенно дейст-
вующие на синтез специфических белков; нервные
импульсы и гормональные индукции; температура, влия-
ющая на скорость биохимических реакций, и т. д.
Взаимодействие ядра
Глава О и цитоплазмы в развитии
Обменные процессы между ядром
и цитоплазмой
Ооплазма представляет собой гетерогенную смесь
различных соединений, организованных в различные спе-
цифические структуры и распределенные, по-видимому,
не случайным образом. Следовательно, ядра бластомеров
с начала дробления оказываются в различном цитоплаз-
11*
163
магическом окружении. Вероятно, именно это и является
первопричиной дифференциальной активности генов.
Функционирование определенных групп генов в свою
очередь порождает новое цитоплазматическое окруже-
ние, которое неизбежно действует на геном, обусловли-
вая избирательную активацию или инактивацию новых
групп генов. Так, с самого начала индивидуального раз-
вития осуществляется ряд последовательных реципрок-
ных взаимодействий между геномом и ^изменяющейся
цитоплазмой, в результате которых клетки дифференци-
руются в нужном направлении. В условиях эксперимента
можно изменить судьбу клеток, например, при их перено-
се на другую ткань. Нова,я тканевая среда первоначаль-
но изменяет состав цитоплазмы, а затем и активацию от-
дельных генов. В общих чертах эта схема предельно про-
ста, но еще слишком мало известно о молекулярных
событиях, обусловливающих специфику взаимодействия
между ядром и цитоплазмой в ходе развития. Познание
сути этих событий остается важной задачей биологии
индивидуального развития.
Еще в 1934 г. Г. Морган предположил, что региональ-
ные различия в цитоплазме возникают под влиянием
ядра, а измененная цитоплазма затем влияет на ядро.
Это предположение было обосновано, и теперь общепри-
знано, что дифференцировка определяется взаимодейст-
вием между ядром и цитоплазмой, для которого харак-
терен ряд особенностей, появляющихся уже в созреваю-
щей яйцеклетке.
Огромный экспериментальный материал последних
десятилетий убедительно показывает, что обмен между
ядром и ^цитоплазмой осуществляется частично за счет
различных видов РНК, транскрибируемой с ядерной
ДНК. Значительная часть молекул РНК различными
способами переходит из ядра в цитоплазму и участвует
в биосинтезе белков, информация о которых содержится
в активированных генах. Это в настоящее время сравни-
тельно просто обнаружить, например, использовав метод
авторадиографии. Значительно меньше известно о потоке
соединений из цитоплазмы в ядро, а он, вероятно, богат
информацией и имеет важное значение в регуляции ген-
ной активности. Можно считать, что лишь молекулы
нуклеиновых кислот и белков имеют достаточно инфор-
мации для выполнения такой роли. В связи с этим инте-
164
ресны исследования особенностей передвижения инфор-
мативных молекул между ядром и цитоплазмой.
В результате опытов по пересадке ядер у амеб был
обнаружен особый класс белков, которые перемещаются
взад и вперед между ядром и цитоплазмой. При пересад-
ке меченого 14С лизином ядра из одной клетки амебы в
другую (с немеченным ядром) довольно быстро происхо-
дил переход меченых белков из пересаженного ядра че-
рез цитоплазму в ядро клетки-«хозяина». Соотношение
количества меченого белка в обоих ядрах довольно бы-
стро становилось устойчивым и почти одинаковым. По-
скольку объем ядер значительно меньше объема цито-
плазмы, то концентрация меченых белков в ядрах при-
мерно в 50 раз превышала таковую в цитоплазме. Это
можно объяснить тем, что некоторые меченые белки
мигрировали из пересаженного ядра в цитоплазму, а за-
тем возвращались либо в пересаженное ядро, либо в
ядро клетки-«хозяина».
Не все ядерные белки столь подвижны. Примерно
около 60% суммарного меченого белка довольно прочно
фиксируется в ядре. Однако и этот белок постепенно по-
кидал ядро, но значительно медленнее, чем те 40%, ко-
торые непрерывно снуют между ядром н цитоплазмой.
К белкам, медленно покидающим ядро, относятся белки
ядерной мембраны, структурные белки ядрышка и раз-
личные хромосомные белки, например гистоны. Раз син-
тез практически всех белков осуществляется в цито-
плазме, то и такие белки должны возвращаться в ядро,
хотя и с меньшей скоростью. Следовательно, эти белки
вряд ли могут быть посредниками в цитоплазматическом
регулировании активности ядерных генов. Такими по-
средниками могут быть только быстромигрирующие
белки.
Пока не удалось доказать, что какие-либо белки, кро-
ме обратной транскриптазы, действительно регулируют
транскрипцию генов. Однако зависимость функции ядра
от особенностей цитоплазмы была показана в различных
опытах, прежде всего в опытах по пересадке ядер у мно-
гоклеточных организмов и гибридизации соматических
клеток высших организмов в культуре. Эти опыты по-
зволяют получить необычные сочетания цитоплазмы и
ядра на различных стадиях развития. Кроме того, четкая
зависимость функционирования ядер от цитоплазмы ино-
165
гда проявляется и при нормальной клеточной дифферен-
цировке, например инактивация одной из Х-хромосом в
клетках самок млекопитающих.
Известно, что ядра различных видов клеток можно
пересадить в энуклеированные яйцеклетки и получить
зародыш или даже взрослую особь. Это относится и к
пересадке ядер из части крайнеспециализированных кле-
ток. Много таких опытов было проведено на амфибиях.
При пересадке ядер различных соматических клеток
в яйцеклетки амфибий происходит увеличение объема пе-
ресаженных ядер. Ядра соматических клеток значитель-
но мельче ядер ооцитов. Даже довольно крупные ядра
клеток бластулы после пересадки в яйцеклетки увеличи-
ваются примерно в 3 раза. Мелкие ядра клеток эпителия
кишечника головастика шпорцевой лягушки при такой
пересадке увеличиваются примерно в 40 раз, а ядра кле-
ток головного мозга взрослой лягушки — в 60 раз. Кста-
ти, это относится и к ядрам сперматозоидов, которые че-
рез 30 мин после проникновения в яйцеклетку увеличива-
ются примерно в 50 раз. Причины такого увеличения
ядер пока неизвестны, но здесь явно сказывается влияние
цитоплазмы, предшествующее синтезу ядерной ДНК.
У позвоночных животных нервные клетки являются
крайнеспециализированными, и в норме у них блокиро-
вана митотическая активность. Так, при пересадке
ядер клеток головного мозга взрослой лягушки в
энуклеированные яйцеклетки с интактными зародышевы-
ми пузырьками синтез ДНК в этих ядрах не происходит
даже через несколько дней. При пересадке таких же ядер
в яйцеклетки в момент разрушения зародышевого пу-
зырька в них довольно скоро начинался синтез ДНК.
Следовательно, из зародышевого пузырька в цитоплазму
попадает какой-то фактор, который индуцирует синтез
ДНК даже в ядрах крайпеспециализированных клеток.
По некоторым данным, таким фактором может быть
ДНК-полимераза. Например, при инъекции очищенной
ДНК в цитоплазму ооцитов можно индуцировать синтез
ДНК, но только в том случае, если инъекция произво-
дится после разрушения зародышевого пузырька. Эти
реакции не специфичны, так как при пересадке ядер кле-
ток печени взрослой мыши в яйцеклетки лягушки наблю-
дается то же самое.
Цитоплазма контролирует и синтез различных видов
166
РНК. При пересадке ядер соматических клеток, активно
синтезирующих рРНК, в энуклеированные яйцеклетки
синтез прекращается. Это согласуется с ранее обсуждав-
шимися данными о периоде синтеза рРНК в эмбриогене-
зе. Напомним, что в начале эмбриогенеза рРНК не син-
тезируется и ее синтез начинается в предгаструлярный
период. Подобные данные были получены и для тРНК,
которая также не синтезируется в начале эмбриогенеза.
В ядрах клеток средней бластулы обычно синтезируется
небольшое количество РНК, но интенсивно происходит
синтез ДНК. При пересадке таких ядер в незрелые ооци-
ты с интактными зародышевыми пузырьками индуциро-
вался синтез РНК в больших количествах и блокировал-
ся синтез ДНК- Следовательно, метаболизм таких ядер
быстро перестроился в соответствии с особенностями ци-
топлазмы.
Имеются примеры крайнеспецифического взаимодей-
ствия цитоплазмы с хромосомами. Хромосомы отцовского
и материнского геномов в клетках зародышей червеца
женского пола ведут себя одинаково почти во всех слу-
чаях. У зародышей же мужского пола хромосомы отцов-
ского генома становятся гетерохроматическими и почти
полностью генетически неактивными. Хромосомы же ма-
теринского генома остаются эухроматиповымп и функ-
ционально активными. Справедливо предположить, что в
цитоплазме яйцеклеток или, вернее, зигот, из которых
должны развиваться самцы, имеются какие-то факторы,
избирательно действующие па хромосомы. Это и выра-
жается в гетерохроматизации хромосом отцовского гено-
ма и эухроматизации хромосом женского генома. У неко-
торых видов червецов в клетках ряда тканей самцов
гетерохроматизация хромосом отцовского генома оказы-
вается обратимой и все хромосомы становятся функцио-
нально активными. Следовательно, у хромосом отцовско-
го генома нет какой-либо присущей только им недоста-
точности, хотя они и должны несколько отличаться от
хромосом материнского набора. В связи с этим можно
предположить, что в цитоплазме яйцеклеток червецов
имеется какой-то исключительно чувствительны# и высо-
коспецифический молекулярный механизм, обеспечиваю-
щий четкую идентификацию гомологичных хромосом и
ограничение гетеросинтетичсской активности хромосом
Отцовского набора. Природа этого механизма пока неиз-
167
вестна, но ее познание было бы исключительно важным
для изучения специфических взаимодействий между хро-
мосомами и цитоплазмой, т. е. для изучения механизмов,
регулирующих функционирование хромосом в развитии.
Дополнительно к уже сказанному можно отметить, что
предварительные наблюдения показывают обратимость
процесса гетерохроматизации, находящегося под эффек-
тивным контролем со стороны цитоплазмы.
В связи с рассмотренными данными о влиянии цито-
плазмы на функционирование ядер встает вопрос: воз-
можны ли условия, при которых бы одновременно реали-
зовывалась вся генетическая информация ядра. При
таких условиях ядра любых соматических клеток должны
были бы находиться в одинаковом функциональном со-
стоянии. Теоретически это возможно, но практически ма-
ло вероятно.
В опытах по пересадке ядер у амфибий использова-
лись ядра различных клеток зародыша и взрослых осо-
бей. В энуклеированные яйцеклетки трансплантировались
ядра из клеток бластулы, гаструлы и ядра клеток раз-
личных тканей взрослого организма. В результате наме-
тилась общая тенденция: по мере использования в опы-
тах ядер клеток более поздних стадий развития организ-
ма уменьшается частота нормального развития таких
«синтетических» зародышей. Так, только в опытах с
яйцеклетками шпорцевой лягушки удалось получить от-
носительно нормальное развитие при пересадке ядер из
клеток кишечного эпителия головастиков. Однако по-
следние в известной мере еще близки к эмбриональным
клеткам. Развитие аномальных головастиков было полу-
чено при пересадке в яйцеклетки лягушки ядер клеток
карциномы почки (опухоль Люкке), взятых у взрослых
особей. Следует отметить, что одним из общих признаков
опухолевых клеток является блокирование их перехода
к дифференцировке в системе определенной ткани. Опу-
холевые клетки также можно сравнить с эмбриональны-
ми клетками, которые еще не перешли к дифференциров-
ке. Эти клетки еще содержат функционально нормальные
гены, обусловливающие дифференцировку в различных
направлениях.
Негативный результат опытов по пересадке в энукле-
ированные яйцеклетки ядер клеток крайнеспециализиро-
ванных тканей взрослых организмов можно объяснить
168
по-разному. Прежде всего возможны ошибки методиче-
ского порядка, однако это нс единственная причина.
В конце дифференцировки клеток многих тканей возмож-
но жесткое блокирование определенных групп генов и
цитоплазма яйцеклетки не в состоянии спять такой блок.
Иначе говоря, геном ядер крайнеспециализированных
клеток не доступен активирующему влиянию цитоплаз-
мы. Вероятно, в ходе эмбриогенеза происходит прогрес-
сивная дифференцировка ядер, которая становится все
менее обратимой. Теоретически она должна быть обра-
тимой, но экспериментально это удалось показать лишь
в единичных случаях.
Вернемся к поставленному рапсе вопросу о возмож-
ности создания таких условий для ядра, при которых бы
одновременно реализовывалась вся его генетическая ин-
формация. Экспериментально, возможно, и удастся со-
здать подобные условия. Однако в целостной системе
многоклеточного организма с многочисленными и разно-
характерными межклеточными и межтканевыми взаимо-
действиями и чрезвычайной лабильностью цитоплазма-
тических структур в связи с постоянно меняющимися
внутренними и внешними факторами такое состояние
полностью исключается.
В плане изучения взаимодействия ядра и цитоплазмы
интересны опыты и по межвидовой пересадке ядер. При
удачной пересадке ядер соматических клеток одного ви-
да организма в энуклеированные яйцеклетки другого
начинается дробление, но развитие происходит только до
гаструляции, затем развитие прекращается примерно на
той же стадии эмбриогенеза, как и у большинства истин-
ных отдаленных гибридов. Из погибающих на стадии га-
струлы зародышей можно выделить ядра и опять переса-
дить их в энуклеированные яйцеклетки первоначального
вида. При этом опять начинается дробление и вновь за-
родыш погибает в предгаструлярный период. Такую опе-
рацию можно повторять многократно с одинаковым ре-
зультатом.
Следовательно, ядра из клеток организма одного ви-
да могут какое-то время существовать и даже делиться
в цитоплазме другого вида, но не могут обеспечить пере-
ход к стадии гаструлы. Это можно объяснить следующим
образом. Образование бластулы связано с использова-
нием генных продуктов, накопленных и распределенных
169
в ооплазме в период оогенеза. В этот период нет необхо-
димости в функционировании генома зиготы. Переход же
к гаструляции связан с активацией определенных групп
генов генома зиготы. Следовательно, при межвидовой
пересадке ядер чужеродная цитоплазма не может акти-
вировать нужные для перехода к гаструляции гены или
они вообще отсутствуют в чужеродном ядре, что в боль-
шинстве случаев маловероятно.
Цитологический анализ погибающих зародышей по-
казал, что при межвидовой пересадке ядер часто появ-
ляются различные хромосомные аномалии: разрывы и
фрагментация хромосом, возникновение кольцеобразных
хромосом, делении и т. д. Таких аномалий вполне до-
статочно для прекращения нормального развития заро-
дыша, но их следует рассматривать как вторичные собы-
тия, а точнее, как следствие аномального взаимодействия
между хромосомами и цитоплазмой.
В единичных случаях при межвидовой пересадке ядер
можно получить гибридные организмы. Например, при
пересадке ядер соматических клеток Rana palustris в эну-
клеированные яйцеклетки R. pipiens удается получить
нормально развивающиеся гибридные особи, фенотипи-
чески оказывающиеся промежуточными между двумя
родительскими видами. Если же произвести пересадку в
обратном порядке, т. е. ядро соматической клетки R. pi-
piens пересадить в яйцеклетку R. palustris, то получить
взрослые особи невозможно, так как развитие прекра-
щается вскоре после вылупливания. При цитологическом
анализе такого гибридного зародыша не обнаруживаются
хромосомные аномалии и при пересадке ядер клеток это-
го зародыша обратно в яйцеклетки собственного вида
обеспечивается его нормальное развитие. Значит, в хро-
мосомах одного вида при перемещении их в цитоплазму
другого вида не возникает необратимых изменений.
Подобные результаты, но несколько иными методами,
были получены на морских ежах и дрозофиле. Различия
в развитии потомства от реципрокных межвидовых скре-
щиваний убедительно показывают, что функционирова-
ние хромосом в значительной степени зависит от цито-
плазмы. Это явление получило название материнского
эффекта.
При использовании метода культуры клеток и тканей
удалось получить своеобразные гибридные клетки в ре-
170
зультате слияния клеток разных организмов (крысы и
мыши, человека и мыши и т. д.). Например, по данным
М. Вейса и Б. Эфруси (1966), гибридные клетки, образо-
вавшиеся при слиянии соматических клеток мыши и кры-
сы, довольно хорошо размножаются в культуре и явля-
ются моделью для изучения ряда явлений. Энзимологи-
ческий анализ таких клеток показал, что в одной и той
же гибридной клетке одновременно могут функциониро-
вать некоторые гены обоих родителей. В этих опытах
подробно было изучено два фермента: лактат-дегидроге-
наза (ЛДГ) и 0-глюкуропндаза. Особо интересными
явились результаты по изучению ЛДГ. При изучении
гибридных клеток были выявлены наборы изофер-
ментов ЛДГ как мыши, так и крысы. Субъединицы ЛДГ,
детерминируемые геном А, различаются у мыши и кры-
сы. В гибридных клетках оба гена нормально функцио-
нируют и обеспечивают синтез субъединиц, которые за-
тем, случайно комбинируясь, образуют ожидаемые гиб-
ридные молекулы.
Исследователи располагали сравнительно небольшим
количеством гибридных клеток, образовавшихся спонтан-
но. Позже были разработаны методы, позволившие зна-
чительно увеличить частоту образования гибридных кле-
ток в культуре тканей при добавлении к совместно
инкубируемым клеткам различных линий инактивиро-
ванного вируса Сендай. Так, например, удалось получить
гибридные клетки между эротроцитами цыпленка и клет-
ками HeLa, в которых ядра эритроцитов начинали син-
тезировать ДНК и РНК, хотя до гибридизации они были
совершенно неактивными. Это перспективный метод гиб-
ридизации клеток организмов, принадлежащих к раз-
личным систематическим группам. Такие межвидовые
клеточные гибриды живут довольно длительное время, а
в ряде случаев способны делиться и давать начало но-
вым истинно гибридным клеткам.
Сравнив результаты опытов по межвидовой пересадке
ядер и межвидовой гибридизации клеток, можно отме-
тить, что первые оказываются менее удачными, чем вто-
рые. В связи с этим возникает предположение, что для
нормального развития зародыша необходимы не только
молекулярные механизмы «включения» и «выключения»
генов, но и надежное последовательное программирова-
ние активности генов. Самое незначительное отклонение
171
от нормальной продолжительности или уровня активно-
сти генов на любом этапе эмбриогенеза неизбежно нару-
шает необходимую последовательность реакций и исклю-
чает дальнейшее развитие. Иначе дело обстоит при куль-
тивировании клеток на каких-либо средах. В культуре
клеток должны лишь осуществляться основные процессы,
необходимые для поддержания жизни самих клеток, и
практически исключаются условия, обеспечивающие пе-
реход в альтернативное состояние. Поэтому в пределах
одной гибридной клетки могут функционировать одно-
временно различные механизмы активации генов. Дело в
том, что прекращение развития гибридного зародыша —
это блокирование развития многоклеточной системы, а нс
исключение возможности существования отдельных кле-
ток. Для развития зародыша как целостной системы не-
обходимы иные условия, чем для сохранения относитель-
ной жизнеспособности отдельными клетками. При этом
особое значение имеют межклеточные и межтканевые
взаимодействия.
Материнский эффект
Взаимодействие ядра и цитоплазмы особо четко прояв-
ляется при отдаленной гибридизации. Известно, что
межвидовые или даже межродовые гибриды у растений
и животных могут спонтанно возникать в природе и их
можно получить экспериментально. В большинстве слу-
чаев при отдаленной гибридизации развитие прекращает-
ся на ранних этапах эмбриогенеза. Иногда возможно по-
лучение взрослых гибридных особей, но они обычно ока-
зываются бесплодными. Однако интерес к отдаленной
гибридизации большой, что обусловливается не только
общетеоретическими, но и практическими задачами. Пер-
воначально считалось, что основной причиной гибели
гибридных зародышей (обычно на стадии гаструлы)
является несовместимость геномов родительских видов.
Однако в результате исследований с использованием
метода ядерной пересадки несостоятельность этого пред-
ставления стала очевидной.
Давно было замечено, что при реципрокных скрещи-
ваниях наблюдается несовпадение фенотипов у отдален-
ных гибридов. Например, потомство от скрещивания ло-
172
шади с ослом отличается размерами тела и экстерьером
от потомства, получаемого после реципрокного скрещи-
вания. В обоих случаях потомство больше похоже на
мать, чем на отца. Это явление получило название мате-
ринского эффекта, или материнской наследственности, а
его истинные причины стали известны сравнительно не-
давно. При реципрокных скрещиваниях двух видов дро-
зофилы (D. virilis и D. littoralis) было обнаружено, что
скрещивание хорошо удается, если в качестве матери бе-
рется D. littoralis, а если матерью является D. virilis, то
скрещивание осуществляется труднее и у гибридных осо-
бей обнаруживается большое количество различных
уродств (табл. 3).
Таблица 3
Количество аномальных гибридных особей при реципрокных
скрещиваниях (по Н. Н. Соколову, 1959)
Скрещивание Число гиб- ридных особей, Fi Отклонение от нормы, % Нормаль- ные особи. %
крылья, глаза, пло- тинки прочие
D. littoralis X D. virilis D. virilis X D. littoralis 1510 2297 35,9 0,6 62 99,4 2,1
Такие различия между реципрокными скрещиваниями
обусловлены действием цитоплазмы, поскольку структу-
ра ядра зиготы в обоих случаях одинакова. Отдаленный
гибрид развивается нормально, когда получает цитоплаз-
му от D. littoralis, и развитие его нарушается при полу-
чении цитоплазмы от D. virilis, т. е. при реципрокных
скрещиваниях этих двух видов наблюдается резко выра-
женный плазменный, или материнский, эффект.
Цитологический анализ митозов в период дробления
и политенных хромосом клеток слюнных желез личинок
гибридов, получивших цитоплазму от D. virilis, показал,
что в этом случае обнаруживается много различных ано-
малий в поведении хромосом и даже элиминация части
хромосом. Нарушения митоза в начале эмбриогенеза ока-
зываются причиной гибели части зародышей и появления
уродливых особей. Первопричиной же их является несов-
173
местимость цитоплазмы D. virilis с хромосомами D. litto-
ralis, которые не могут в таких условиях осуществить
нормальный митотический цикл. Цитологический же ана-
лиз гибридов от реципрокного скрещивания не выявил
каких-либо нарушений в митотическом делении, т. е. вли-
яние цитоплазмы D. littoralis существенно не сказывается
на поведении хромосом D. virilis.
Тщательные генетические и цитогенетические исследо-
вания гибридов первого и второго поколений, а также
гибридов от обратных скрещиваний между указанными
выше видами дрозофилы показали, что аномалии в ходе
эмбриогенеза могут быть вызваны не только материн-
ской цитоплазмой, ио и отцовскими хромосомами. Более
того, выяснилось, что чужеродные хромосомы со време-
нем могут изменить свойства исходной материнской ци-
топлазмы. Так, например, было доказано явное влияние
хромосом D. virilis на цитоплазму D. littoralis, в резуль-
тате чего она приобретала свойства, вызывающие элими-
нацию собственных же хромосом. Это было показано при
поглощающих обратных скрещиваниях.
Обратные скрещивания проводились до четвертого
поколения (FB4). Из этого поколения отбирались самки
и скрещивались с самцами D. littoralis для проверки спо-
собности их ооплазмы вызывать элиминацию хромосом.
Одновременно было сделано реципрокное скрещивание
гибридных самцов из того же поколения с самкой D. litto-
ralis. Оказалось, что ооплазма D. littoralis у самок F4 от
обратных скрещиваний полностью приобрела свойства
ооплазмы D. virilis под действием включенного в нее яд-
ра данного вида. Частота элиминации микрохромосом
в этом случае, например, составила 76%. Развитие гиб-
ридов было аномальным, так же как и при скрещивании
чистых видов. Такие же результаты были получены и при
замене хромосом D. virilis хромосомами D. littoralis при
поглощающих обратных скрещиваниях. Интересно, что
уже в первом гибридном поколении отмечались сущест-
венные изменения ооплазмы D. virilis под влиянием хро-
мосом D. littoralis.
Таким образом, цитоплазма оказывается чрезвычайно
важным фактором, контролирующим ранние стадии раз-
вития зародыша и регулирующим функционирование ге-
нов. Однако довольно быстро ее свойства могут изменять-
ся под воздействием чужеродных геномов, т. е. свойства
174
цитоплазмы являются менее автономными, и их становле-
ние в значительной мере зависит от ядерпых компонентов.
При изучении материнского эффекта следует, конеч-
но, учитывать и то, что цитоплазма имеет информацион-
ный материал, который может реплицироваться и переда-
ваться клеточным поколениям. Прежде всего это ДНК
митохондрий и пластид. Выяснение механизмов материн-
ского эффекта важно для познания регулирования дейст-
вия генов в онтогенезе. Сделаем, например, следующее
гипотетическое предположение. Если активация гена про-
исходит в начале развития зародыша, тогда оба аллеля
(женский и мужской) диплоидного организма будут ак-
тивными. Однако если один из аллелей активируется
в яйцеклетке до оплодотворения, т. е. в оогенезе, то в на-
чале эмбрионального развития будет активен только
один аллель, который получен от матери. Следовательно,
оба гена в одном ядре, подвергаясь одной и той же ин-
дукции или репрессии, будут находиться в разном функ-
циональном состоянии (активном или неактивном). Та-
кие примеры материнского наследования были бы несов-
местимы с представлением о том, что активность гена
определяется индуктором. Возможно, что его активность
связана с какими-то предшествующими событиями, влия-
ющими на функционирование, результат которых долго
сохраняется в клеточных поколениях. Этот тип материн-
ского наследования пока обнаружен в немногих случаях,
причем в зародышах активными являются оба аллеля
(материнский и отцовский).
Такой тип наследования был установлен у кукурузы,
которая для генетических исследований является очень
удобным объектом и ее даже называют растительной
«дрозофилой». Давно были известны особенности насле-
дования антоциановой пигментации алейронового слоя
эндосперма кукурузы (Эмерсон, 1918). При гомозиготно-
сти по рецессивным генам г 1г/г алейроновый слой не име-
ет антоциана и зерна не окрашены. При гомозиготности
по доминантным генам R/R/R и наличии других генов
окраски зерна интенсивно окрашены. Напомним, что ядра
эндосперма покрытосеменных обычно содержат три гено-
ма, один из которых отцовский, а два — материнских.
При скрещивании RR\rr образуется эндосперм геном-
ного состава RRr и у гибридов зерна сильно окрашены.
При реципрокном скрещивании rr\RR геномный состав
175
эндосперма rrR и образуются мозаичные зерна, у кото-
рых окрашены только отдельные участки. Данный случай
обычно приводился в качестве примера эффекта дозы
гена, когда одной дозы гена R недостаточно для развития
полностью окрашенных зерен, но затем выяснилось дру-
гое. Использовав индуцированные транслокации через
пыльцу, удалось ввести две дозы гена R в эндосперм.
Зерна, генетическая конституция эндосперма которых
была rrRR, опять оказались мозаичными. Значит, мозаич-
ность по исследуемому признаку не связана с дозой ал-
леля R, а зависит от того, был ли этот аллель получен от
матери или отца. Активация гена R происходит во время
гаметогенеза, т, е. во время развития яйцеклетки, а в ходе
сперматогенеза он активируется лишь частично. Унасле-
дованные от матери и отца гены сохраняют свою различ-
ную степень активации, хотя и находятся в одних ядрах.
Полная активация данного гена возможна только при
воздействии каких-то факторов цитоплазмы яйцеклетки.
Подобный случай материнского эффекта у кукурузы
был хорошо изучен и на ферментативном уровне. По-
скольку фермент непосредственно связан с первичными
генными продуктами, это позволяет исключить эффект
дозы и доминирования генов. Зерна кукурузы содержат
несколько отрицательно заряженных эстераз. Был обна-
ружен мутант, у которого при электрофоретическом ана-
лизе отсутствовала одна полоса, т. е. не синтезирова-
лась одна из эстераз, детерминируемая геном Е2. Мутант-
ный аллель обозначен е2. Были проведены реципрокные
скрещивания между нормальными и мутантными фор-
мами. При скрещивании Е2Е2\е2е2 у гибрида с генетиче-
ской структурой эндосперма Е2Е2е2 исследуемый фер-
мент синтезировался. Однако при скрещивании е2е2//.Е2Е2
у гибрида с эндоспермом е2е2Е2 фермент не синтезиро-
вался. Следовательно, ген Е2 функционирует в эндосперме
тогда, когда гибрид получает его от матери. Для про-
верки, не связано ли это с какой-либо формой цитоплаз-
матической наследственности, было проведено скрещива-
ние Е2е2 хЕ2Е2, т. е. эндосперм гибрида получал один ген
Е2 от матери, а другой — от отца (Е2е2Е2). Анализ эндо-
сперма зерен таких гибридов показал, что во всех слу-
чаях половина зерен имела фермент, а другая половина
не имела его, т. е. фермент синтезировался только тогда,
когда эндосперм получал активный ген от матери.
176
При дальнейшем изучении гибридов, у которых геи
был от матери, а ген Е2 от отца и в эндосперме не синте-
зировалась исследуемая эстераза, оказалось, что фермент
синтезируется в клетках зародыша. В ходе развития за-
родыша ген Е2, полученный от отца, активируется, т. е.
активными оказываются оба гена (материнский и отцов-
ский). В эндосперме же не происходит активации гена
Е2, полученного от отца, и в нем активны только гены, по-
лученные от матери в уже активной форме. Следователь-
но, для активации гена не обязательно присутствие ин-
дуктора и у диплоидов один ген может быть активным, а
его гомолог неактивным. Эта гипотеза может быть про-
верена только для генов, которые не активируются в зиго-
те и в самом начале эмбриогенеза.
Рассмотренные примеры позволяют сделать заключе-
ние о существовании двух типов активации генов: 1) пе-
реходящей активации, когда ген активируется индукто-
ром и остается активным до тех пор, пока присутствует
индуктор; 2) стойкой активации, которая должна быть
обусловлена наследуемым изменением структуры гена
или комплекса генов и изменением их взаимоотношения
с цитоплазматическим окружением. В последнем случае
ген будет оставаться активным до тех пор, пока какие-
либо процессы в онтогенезе нс обеспечат его переход в не-
активную форму.
Межклеточные и межтканевые
взаимодействия
Вопрос о межклеточных и межтканевых взаимодействиях
мы рассматриваем в связи с тем, что любые воздействия
внешней среды на ткани и клетки прежде всего оказы-
вают влияние на цитоплазму, а затем па ядро клеток.
Иначе говоря, данный вопрос непосредственно связан
с проблемой взаимодействия ядра и цитоплазмы в ходе
развития, а также с вопросами регуляции функцио-
нирования генов.
Поведение клетки в организме регулируется многооб-
разными внутренними и внешними сигналами. Изучение
природы этих сигналов стало значительно эффективней
при широком использовании метода культуры клеток и
12 Зак. 918
177
тканей, основы которого были разработаны в начале
XX в. Р. Гаррисоном. С использованием данного метода
стало возможным проведение модельных опытов по кле-
точной дифференцировке и морфогенезу первоначально
на животных, а затем и растительных объектах.
Прежде всего возникает вопрос: может ли одиночная
клетка самостоятельно дифференцироваться. Обычно при
культивировании клеток каких-либо тканей животного
в соответствующей среде на поверхности стекла довольно
быстро образуется сплошной монослой. Затем скорость
деления резко снижается и создается впечатление, что
клетки способны делиться только до тех пор, пока не
установился тесный контакт с другими клетками. Это яв-
ление получило название контактного угнетения. Причи-
ны его еще неизвестны, но совершенно очевидна целесо-
образность такого явления, обеспечивающего переход
к окончательной дифференцировке и ограничение роста
тканей. Кстати, при злокачественном росте подобного ог-
раничения не существует, что и делает его особенно опас-
ным. Для нормальной дифференцировки клеток необхо-
димы какие-то межклеточные взаимодействия.
Так, клетки мышц конечности 12-дневного куриного
зародыша, содержащиеся в суспензии, довольно быстро
прикрепляются ко дну камеры, растут и образуют непре-
рывный слой. После слияния клеток в один слой в нем
появляется много длинных лентовидных клеток, которые
через несколько дней начинают спонтанно сокращаться.
Последнее указывает на то, что завершилась дифференци-
ровка мышечных клеток. Таким образом, эмбриональные
мышечные клетки, растущие в культуре, сохраняют спо-
собность дифференцироваться. Вообще же клетки, куль-
тивируемые в диспергированном состоянии, довольно
быстро утрачивают способность синтезировать специфи-
ческие для них продукты и для стимулирования диффе-
ренцировки обычно культивируют плотные фрагменты
ткани в условиях, препятствующих миграции клеток
и разрастанию краев эксплантата. Дифференцировка же
мышечных клеток происходит в слое, образующемся из
отдельных диспергированных клеток, так же хорошо, как
и в плотном фрагменте. Можно предположить, что диффе-
ренцировка наступает в клеточном слое лишь после слия-
ния клеток, когда популяция достигает достаточно высо-
кой плотности.
178
Как известно, в состав мышечной ткани входят два
основных типа клеток: собственно-мышечные клетки и
фибробласты, лежащие в соединительнотканной основе
органа. Для проверки возможности роста и дифференци-
ровки одного из этих типов клеток в отсутствие другого
из клеточной суспензии выделяли отдельные клетки и по-
мещали их на питательную среду. Сохранившие жизне-
способность отдельные клетки давали начало колониям.
Через 10—14 дней примерно в одной из десяти таких ко-
лоний наблюдалось завершение дифференцировки мы-
шечных клеток. Естественно, возникает вопрос: позволяют
ли эти данные судить об относительном количестве мы-
шечных клеток в суспензии или указывают на то, что
только определенные миобласты в популяции способны
дифференцироваться в условиях культивирования. Пра-
вильным оказывается второе предположение, так как
в опытах с использованием более совершенной кондицио-
нированной среды частота колоний с дифференцирован-
ными мышечными клетками увеличивалась. Следователь-
но, окружающая клетку среда и поступающие из нее сиг-
налы имеют огромное значение для дифференцировки.
Если среда, на которой выращивалась монослойная
культура до дифференцировки мышечных клеток, исполь-
зуется вторично, клетки в ней дифференцируются пример-
но на 24 ч раньше, чем клетки, культивируемые в свеже-
приготовленной среде. Иначе говоря, среда изменяется
в результате метаболической активности самих клеток и
становится более подходящей для дифференцировки мы-
шечных клеток. Природа изменений среды под влиянием
дифференцирующихся клеток пока неизвестна. Имеются
лишь некоторые наблюдения, позволяющие понять отдель-
ные особенности взаимодействия клеток и среды. При
изучении пищевых потребностей различных линий клеток
было установлено, что большинство клеток способны
сами синтезировать многие необходимые для их жизнеде-
ятельности компоненты. Однако при культивировании они
растут только после внесения этих компонентов в среду.
Оказывается, что клетки в культуре быстро утрачивают
ряд соединений, которые уходят в среду, особенно если
клетки одиночные. Экзогенное введение ряда соединений
необходимо клеткам, культивирующимся в составе попу-
ляции низкой плотности, поскольку внутриклеточный
фонд довольно быстро истощается.
12*
179
Эти наблюдения позволяют на другой основе рассмот-
реть давно существующую концепцию о критической мас-
се ткани, необходимой для дифференцировки. Существует
определенный минимальный объем ткани, в которой ста-
новится возможной дифференцировка, и повышение плот-
ности клеток в культуре способствует этому процессу.
Данные об отсутствии дифференцировки при уменьшении
отношения поверхности ткани к ее объему (или массы
ткани к объему среды) вполне согласуются с представ-
лением о том, что дифференцировку можно стимулиро-
вать, компенсируя постоянную «утечку» соединений из
культивируемых клеток. В системе же целостного заро-
дыша такая компенсация происходит под влиянием
окружающих клеток. Значит, регулирование дифферен-
цировки осуществляется при обязательном взаимодей-
ствии между внутренними и внешними факторами.
В подавляющем большинстве случаев дифференциров-
ка не связана с необратимыми изменениями ДНК. У ра-
стений и животных при регенерациях иногда даже край-
неспециализированные клетки могут изменять свою диф-
ференцировку. Рассмотрим пример. Первоначально
Ф. Стыоард с сотрудниками, а затем и ряд других иссле-
дователей показали возможность дедифференцировки
клеток некоторых специализированных тканей растений и
получения из них нового растения. Например, при куль-
тивировании кусочков вторичной флоэмы корня моркови
на культуральной среде с добавлением кокосового моло-
ка (эндосперм кокосовой пальмы) они довольно быстро
растут. При отделении единичных клеток от этой ткани и
перенесении их на такую же среду они начинают диффе-
ренцироваться в разных направлениях. Одни из них обра-
зуют группы, напоминающие предзародыш растения, дру-
гие формируют корешки и т. д. На основе агрегации и
дифференцировки клеток возможно формирование рост-
ка, который может быть пересажен в почву и развиться
в зрелое растение моркови. Результаты опытов позволяют
предположить, что и клетки нормального зародыша бу-
дут вести себя сходным образом. Это было подтверждено
экспериментально. Изолированные зародыши моркови
культивировали таким образом, что на их поверхности
пролиферировали свободные клетки. Их переносили на
жидкую среду, где они делились, затем полученную сус-
пензию равномерно распределяли на агаре с добавле-
на
нием кокосового молока. Каждая такая клетка (или груп-
па клеток) делилась и давала начало зародышу моркови.
По данным Ф. Стыоарда, на агаровой пластинке, иноку-
лированной клеточной суспензией, приготовленной из од-
ного зародыша, появлялось до 100 тыс. «эмбриоидов».
Следовательно, для полной реализации потенциальных
возможностей к дифференцировке клетка моркови долж-
на быть освобождена от связей с другими клетками и по-
лучать ряд соединений из культуральной среды.
Приведенные данные указывают на то, что в ходе эм-
бриогенеза клеточная дифференцировка обусловливает-
ся определенными межклеточными взаимодействиями.
Вопрос состоит в том, каким образом осуществляются
контакты между клетками и какими соединениями они
обмениваются в конкретных случаях. В настоящее время
считается, что межклеточные взаимодействия могут осу-
ществляться следующими путями: 1) через щель между
мембранами клеток шириной 10—20 нм, обычно запол-
ненную веществом низкой электронной плотности; 2) при
наличии непосредственного контакта между мембранами
соседних клеток, когда смежные клеточные мембраны
сливаются и межклеточное пространство отсутствует; 3)
при наличии на соприкасающихся поверхностях соседних
клеток специализированных структур —- десмосом, пред-
ставляющих собой особые участки мембран; 4) через
плазмодесмы — цитоплазматические мостики, по кото-
рым плазматическая мембрана непрерывно переходит из
одной клетки в другую. Перечисленные способы контак-
тов между клетками, по-видимому, могут обеспечить по-
стоянную межклеточную циркуляцию самых разнообраз-
ных по молекулярной массе и физическим свойствам сое-
динений.
Расшифровка конкретных моментов межклеточных
взаимодействий позволит глубже разобраться в механиз-
мах, регулирующих развитие многоклеточных. К настоя-
щему времени на основе пока формального анализа кле-
точной дифференцировки, ее регулирования и морфо-
генеза было предложено много гипотез о механизмах
развития многоклеточных организмов.
В 50-х гг. XX в. Ж. Гольтфретер и другие исследовате-
ли развили концепцию об избирательном сродстве между
клетками и тканями эмбрионов, правильность которой
была убедительно доказана многочисленными опытами
181
культуры клеток и тканей. Результаты таких исследова-
ний позволяют вплотную подойти к решению вопроса о
тканеспецифичности и тканевом регулировании. Дело
в том, что для решения этих сложных вопросов прежде
всего необходимо различать специфические особенности
клеточного и тканевого уровней, что бывает не так про-
сто. Часто трудно ответить на вопрос: действует ли тот
или иной механизм на уровне клетки или на,уровне попу-
ляции клеток (ткани).
Проделано много опытов по совместному культивиро-
ванию клеток зародышей различных животных. Клетки
предварительно диспергировались или при удалении из
среды двухвалентных катионов, или при действии слабы-
ми растворами фермента (например, трипсина). Диспер-
гированные обычным механическим путем клетки двух
видов губок в морской воде довольно быстро реконструи-
ровались в ткани, а затем и в организмы, проявляя при
этом строгую видоспецифичпость. Возможно, клетки
различных видов губок продуцируют какой-то видо-
специфический продукт, действующий на клеточные
поверхности и обеспечивающий агрегацию родственных
клеток. Однако идентифицировать его — задача чрезвы-
чайно трудная.
Опыт по реконструкции тканей из диспергированных
клеток двух видов губок был проведен и в другом вариан-
те. Диспергирование и получение суспензии одиночных
клеток производились в морской воде, лишенной кальция
и магния, а культивирование смеси клеток для разделе-
ния их миграционных и адгезийных свойств проводилось
при постоянном вращении сосудов, в которых они находи-
лись. Диспергированные таким образом клетки при воз-
вращении их в обычную морскую воду при температуре
24° С образовывали видоспецифические агрегаты точно
так же, как и при диспергировании механическим спосо-
бом (продавливание через тонкое сито). Только при сни-
жении температуры морской воды до 5° реагрегация ис-
ключалась. При культивировании же такой смеси клеток
в морской воде, лишенной двухвалентных катионов, клет-
ки оставались диспергированными. Следовательно, для
агрегации клеток нужны двухвалентные катионы и опре-
деленные температурные условия, что является необходи-
мым для продуцирования видоспецифического фактора,
обусловливающего агрегацию клеток.
182
Опыты по совместному культивированию диспергиро-
ванных клеток зародышей птиц и млекопитающих показа-
ли, что клетки способны рассортировываться и реконстру-
ировать ткани, но при этом не проявляется так четко
видовая специфичность, как в опытах с губками. Так, на-
пример, клетки сходных тканей куриных и мышиных за-
родышей, взятые на близких стадиях развития, обладают
одинаковыми свойствами агрегации. Кроме того, смеси
клеток двух видов образуют мозаичную ткань. Из смеси
клеток сетчатки куриного и мышиного зародышей форми-
руется не сетчатка курицы и сетчатка мыши, а одна об-
щая структура. Подобным образом ведет себя и смесь
хрящевых клеток зародышей курицы и мыши. Правда, не
всегда бывает ясно, образуется ли при этом истинная хи-
мерная структура, в которой клетки обоих видов распре-
деляются равномерно, или в таком образовании имеются
лишь мелкие группы клеток каждого вида.
По-видимому, правилом является не видовая, а ткане-
вая специфичность, и уже имеется много данных, доказы-
вающих, что клетки тканей эмбрионов сортируются не по
видам зародышей, а по функциональным типам тканей.
Специфика же типа тканей возникает на определенных
этапах эмбриогенеза. Например, если приготавливается
смесь из диспергированных хрящевых клеток четырех-
дневного куриного зародыша и печеночных клеток пяти-
дневного зародыша, то клетки сортируются по их функци-
ональным свойствам: хрящевые клетки окажутся в цент-
ре, а печеночные — на периферии. М. Стейнберг ’ (1964)
исследовал 11 комбинаций по два из шести типов клеток
куриного зародыша. В агрегатах всегда хорошо разли-
чается наружный компонент, образующий непрерывный
слой, и внутренний, дискретный. Установлено, что изучен-
ные шесть типов клеток могут быть расположены
в «иерархический» ряд, в котором клетки каждого типа
ткани при комбинировании с клетками другого типа, на-
ходящегося ниже их в том же ряду, образуют внутрен-
ний компонент, а взятые в комбинации с клетками типа,
находящегося выше, образуют наружный компонент аг-
регата. По степени сложности такие структуры напомина-
ли структуры нормальных органов.
Объяснить эти явления пока не так просто. Возмож-
но, начальная агрегация не специфична, поскольку агре-
гаты первоначально состоят из различных, случайно пере-
183
мешанных клеток. Затем происходит перемещение и пе-
рераспределение клеток, которые сортируются по различ-
ным клеточным типам и постепенно группируются вме-
сте; каждый тип клеток сохраняет свою идентичность
в течение всего процесса. Авторадиографические исследо-
вания показали, что клетки одного типа не превращаются
в клетки другого. Правилом является то, что двигатель-
ные и адгезийные свойства клеток изменяются во вре-
мени.
Как же осуществляется переход от специфики клеточ-
ного уровня к специфике тканевого уровня? М. Стейнберг
в опыте с двухтканевой системой, образовавшейся из сме-
си диспергированных хрящевых и печеночных клеток, по-
казал, как из первоначально равномерной смеси форми-
руется такой агрегат. При этом печеночные клетки отдают
предпочтение связям с другими такими же клетками, а не
с хрящевыми. Если опыт начать с наложения шарика пе-
ченочных клеток на шарик хрящевых клеток, конечный
результат будет таким же, хотя и достигается он несколь-
ко иначе. Напомним, что в таком агрегате печеночные
клетки располагаются снаружи. Если хрящевые клетки
проникают сами в центр массы печеночных клеток, то не-
которые из них неизбежно должны устанавливать связи
с этими клетками. Если же печеночные клетки окружают
хрящевые, то некоторые из них устанавливают связь
с последними. Вполне логичным кажется предположение,
что обеспечивающий изменения положения клеток в пре-
делах клеточной массы механизм имеет клеточную осно-
ву. Однако при этом нс исключается и другое предполо-
жение, что на взаимодействия клеток влияет природа кле-
точной популяции как целого.
Имеющиеся данные позволяют предположить и суще-
ствование внеклеточного тканеепецифического продукта,
который обеспечивает ориентацию клеток и их связыва-
ние при гистогенезе, что пытаются объяснить изоляцией
определенных молекул, способных стимулировать ткане-
специфическую агрегацию, хотя их природа остается не-
известной. Вопрос этот пока нерешен, но явление ткане-
специфичности совершенно очевидно. Например, хорошо
известно, что во внеклеточной соединительной ткани
взрослых организмов в нормальных условиях кость ни-
когда не образуется, но остеогенные потенции есть. Осте-
огенез в соединительных тканях можно, например, инду-
184
цировать переходным эпителием слизистой оболочки мо-
чевого пузыря с большой частотой (до 100%). Последний
индуцируется только при трансплантации переходного
эпителия на соединительные ткани, что можно объяснить
следующим образом: 1) соединительная ткань может не
реагировать на индукцию; 2) неразрушенный переходный
эпителий может быть неактивен как индуктор; 3) индук-
тор не достигает цели. Кстати, в самой слизистой оболоч-
ке мочевыводящих путей можно вызвать остеогенез при
сокращении ее кровоснабжения, что приводит к разру-
шению клеток эпителия. Все это позволяет заключить, что
клетки эпителия выделяют какой-то индуктор в виде оп-
ределенных соединений. По предварительным гистохими-
ческим данным, ими могут быть полисахариды, не фер-
ментирующиеся амилазой.
Взаимодействие между тканями, в результате которо-
го осуществляются гисто- и морфогенетические процессы,
или иначе тканевая регуляция,— явление более высокого
порядка, чем регуляция функционирования отдельных
клеток. По-видимому, тканевая регуляция — наиболее
мощная система регуляции эмбрионального и особенно
постэмбрионального формообразования, включающая
процессы физиологической и репаративной регенерации
и иммунологической защиты.
Обычно выделяют три типа тканевой регуляции:
1) индукционную (воздействие одной ткани па другую);
2) нервнотрофическую (действие нерва, вызывающее спе-
цифическую дифференцировку ткани); 3) иммунобиоло-
гическую (контроль со стороны лимфоидной ткани).
Имеются экспериментальные модели, иллюстрирующие
некоторые из этих типов тканевой регуляции. Например,
образование трубчатой кости из хрящевого зачатка воз-
можно только при контакте с остеогенной периостальной
тканью. При изолировании зачатка хряща и трансплан-
тации его на другую ткань он развивается только как
хрящ и трубчатых костей не образует. В 1948 г. супруги
Оппенгеймер сообщили об интересном феномене, возни-
кающем при имплантации между тканями целлофановых
пластинок. При введении между тканями целлофановой
пластинки, лишенной канцерогенности, наблюдается опу-
холевая трансформация тканей. Это можно объяснить
тем, что при появлении такой преграды одна ткань вы-
ходит из-под контроля другой. Такой модельный опыт
185
подтверждает эпигенетический характер тканевых пре-
вращений в онтогенезе. Следует отметить, что подобные
модели хорошо иллюстрируют принципы дифференци-
ровки и морфогенеза и их поиски имеют большое значе-
ние. Пока их не так много, но они чрезвычайно важны для
решения ряда вопросов. Следует отметить, что понятие
«модель» в данном случае условно, поскольку практиче-
ски всякую структуру можно рассматривать как модель.
Биологические модели, позволяющие изучать морфо-
генез животных, Ч. Уоддингтон (1964) разделяет на три
основные группы: 1) общие, или текстуры; 2) пространст-
венные, или объемные; 3) модели пятен. Проиллюстри-
руем каждую из этих групп хотя бы одним примером.
Если для поверхности биологической системы характерна
какая-то упорядоченность, то такая система может быть
использована для изучения морфогенеза. Например, ку-
тикула брюшка клопа Rhodnius prolixus довольно хоро-
шо изучена в этом отношении. Каждый сегмент брюшка
личинок имеет большое количество волосков, которые
у взрослых особей заменяются рядами поперечных греб-
ней. М. Локке (1959) проводил опыты по трансплантации
участков кутикулы личинок в различные места тела, раз-
лично их ориентируя и наблюдая, как это сказывается па
характере гребней у взрослых особей. Оказалось, что
гребни одного сегмента разнозначны и обладают четко
выраженной индивидуальностью. Если при пересадке по-
ложение трансплантата не изменяется относительно пе-
редне-задней оси тела, формируются нормальные гребни,
а при изменении положения трансплантата изменяется и
характер гребней. Так, гребень развивается нормально,
если пересадить участок из одного сегмента в другой,
сместив его вперед или назад, не изменив относительного
расположения в пределах данного сегмента. Нормальное
развитие гребня наблюдается и при пересадке участка,
взятого с правой стороны от средней линии и пересажен-
ного на такое же расстояние от этой линии слева, или на-
оборот. Однако при изменении расположения трансплан-
тата относительно передне-задней оси тела у взрослой
особи линии, образующие гребень, будут огибать тран-
сплантат, т. е. он выпадает из упорядоченной системы
данной поверхности. Следовательно, для гребней имеется
совершенно определенный передне-задний градиент, из-
под контроля которого освобождаются неправильно ори-
186
Оптированные трансплантаты. Это пример того, что внеш-
не совершенно одинаковым структурам присуща индиви-
дуальность и в ряде случаев такие текстуры можно
использовать в исследованиях.
Пространственной, или объемной, моделью может, на-
пример, служить окраска крыльев амбарной огневки. Так,
центральная полоса, проходящая поперек переднего кры-
ла огневки, возникает из двух «потоков» какого-то мате-
риала, явно детерминированного генетически. Данные
«потоки» начинаются в определенных точках посередине
переднего и заднего краев верхней поверхности крыла,а
затем расходятся в стороны. Если в начале образования
«потоков» на их пути слегка прижечь небольшие участки
крыла нагретой иглой, «поток» огибает поврежденное ме-
сто. Если прижигание сделать на более поздних этапах
продвижения «потока», он останавливается. Таким обра-
зом, можно получить ряд взрослых особей, у которых пиг-
ментация поперечных полос крыльев остановилась на раз-
ных стадиях. Сходные изменения можно получить и при
воздействии повышенными температурами. Если для
крыльев характерно несколько таких «потоков», то,
используя взаимодействие между «потоками», можно по-
лучать экспериментально много типов окраски различной
степени сложности. Генетическими исследованиями было
доказано, что имеется ряд генов, ускоряющих или замед-
ляющих распространение «потоков» пигментации
крыльев.
Самая простая модель пятен состоит из редкой рос-
сыпи небольших участков различных размеров свойств,
которые могли возникнуть в результате простых стоха-
стических изменений. Однако в более сложных случаях
расположение пятен становится закономерным и это уже
приобретает особый смысл для морфогенетических иссле-
дований. Рассмотрим один пример такого рода взаимо-
действия между отдельными участками в пятнистой мо-
дели — особенности развития волосяных фолликулов
в коже овцы. Большое экономическое значение настрига
шерсти стимулировало тщательное изучение этой систе-
мы. Объяснение ее развития на основе представления о
конкуренции между фолликулами за приток различных
соединений впервые предложил А. Фрезер (1952), а поз-
же оно было развито им и рядом австралийских исследо-
вателей.
187
Волосяные фолликулы в коже овцы расположены
группами, каждая из которых состоит из нескольких пер-
вичных фолликулов (обычно трех) и грозди связанных
с ними вторичных фолликулов. Количество вторичных
фолликулов, приходящееся на один первичный, является
важным показателем качества шерсти. У простых жест-
кошерстных пород овец это соотношение в среднем равно
4, у выведенных длинношерстных и тонкорунных пород —
5—6, а у мериносовых пород может достигать 20. Соотно-
шение между первичными и вторичными фолликулами во
многом зависит от конкуренции между ними во время раз-
вития. Образно говоря, они конкурируют за «фолликуляр-
ный субстрат». Конкурентные отношения между фолли-
кулами осложняются тем, что онн появляются асинхрон-
но и растут с различной скоростью. В развитии группы
фолликулов обычно выделяют четыре стадии: 1) заклад-
ку центрального первичного фолликула; 2) появление бо-
ковых первичных фолликулов (обычно по одному с каж-
дой стороны); 3) появление ряда вторичных фолликулов,
образующих к концу эмбрионального развития кератини-
зированные волокна; 4) появление другой группы вторич-
ных фолликулов, которые образуют кератинизированные
волокна в постэмбриональный период. Следовательно,
количество конкурирующих фолликулов с течением вре-
мени возрастает. Время заложения фолликулов, скорость
их роста и созревания детерминированы определенными
генами.
Распределение фолликулов по поверхности кожи упо-
рядочено лишь до некоторой степени, и причины данного
расположения еще неизвестны. Однако совершенно ясно,
что образование такой сложной и лабильной системы обу-
словлено межклеточными и межтканевыми взаимодейст-
виями. Даже неполное знание особенностей развития этой
системы позволило селекционерам значительно повысить
эффективность искусственного отбора. Примеров подоб-
ных моделей много и основной задачей при их изучении
является познание непосредственных причин разделения
первоначально однородных участков ткани на отдельные
элементы, расположенные в определенном порядке.
При анализе межклеточных и межтканевых взаимо-
действий необходимо учитывать, что каждая дифференци-
рующаяся клетка имеет свою внутриклеточную систему
регуляции, но, будучи частью целого в процессе развития,
188
она неизбежно должна реагировать и на внешние регули-
рующие факторы, идентификация которых остается важ-
нейшей задачей биологии развития. При изучении же спе-
цифики межтканевых взаимодействий необходимо прежде
всего исходить из наличия тесной связи между клетками.
Однако это не простой механический контакт, а разнооб-
разные связи между клетками, находящимися в одном и
том же микроокружении. Гистогенез сопровождается ста-
новлением новых систем регуляции на основе межткане-
вых взаимодействий.
Постэмбрионалыюе развитие
Глава О растений и животных
Морфогенез растений
Морфогенез растений и'животных принципиально сходен,
по в связи с существенными генетико-физиологическими
различиями между растениями и животными имеются и
специфические особенности этого процесса. Прежде всего
большие различия наблюдаются в характере роста. На
протяжении всего онтогенеза у растений сохраняется эм-
бриональная ткань — меристема (от греч. meristos — де-
лящийся), которая является центром клеточного деления
и растяжения. Продольная ось растения увеличивается
благодаря росту меристем, расположенных на верхушке
стебля и кончике корня, а поперечная — при помощи
кольца боковой меристемы, или камбия.
Однако растения имеют и органы с ограниченным ро-
стом (например, листья), которые, как и органы живот-
ных, достигая определенного размера, дифференцируются
и прекращают рост. Можно сказать, что меристемы обес-
печивают «длительное эмбриональное состояние расте-
ний», что во многом определяет особенности морфогене-
за. Поэтому в отличие от животных у растений сложнее
провести грань между эмбриональным и постэмбриональ-
ным развитием и началом последнего приходится в изве-
стной степени условно считать прорастание семени.
Растения, за исключением некоторых низших, в связи
с их способностью синтезировать пищу из неорганических
189
веществ имеют прикрепленное к почве или другому суб-
страту тело. В отличие от животных им нет необходимо-
сти передвигаться в поисках пищи. Клетки растений
с прочными вторичными оболочками обычно больше не
делятся, а если и делятся, то дочерние клетки не могут
растягиваться и постоянные ткани растений, как правило,
не растут. У животных же почти в любой части тела
с клетками, имеющими эластичные клеточные стенки,
рост происходит не только во время развития, но и во
время обновления и регенерации тканей в течение всей
жизни организма. Следует, однако, помнить, что при опре-
деленных условиях растительные клетки или группы кле-
ток, даже крайнедифференцированиые, снова могут стать
эмбриональными, переходить к делению и образовывать
растущие области. Деление ограничивается ие механиче-
ским препятствием в виде уплотненных оболочек, а кор-
релятивными факторами, которые обусловливают разви-
тие каждой клетки в соответствии с ее положением в це-
лостной системе организма.
Наиболее распространенная классификация меристем
основана на их положении в теле растения и, согласно
этой классификации, они подразделяются на апикальные
(верхушечные) и латеральные (боковые). Первые распо-
ложены на верхушках главных и боковых побегов, а так-
же в кончиках корней, вторые — параллельно боковой
поверхности того органа, в котором они находятся. К ла-
теральным меристемам относятся камбий и филлоген. По
классификации, в зависимости от природы клеток, явля-
ющихся исходными для меристем, их подразделяют на
первичные и вторичные. Если меристематические клетки
являются прямыми потомками эмбриональных клеток,
которые всегда были связаны с процессом роста, такие
меристемы называют первичными. Если же меристемати-
ческие клетки образуются в результате дедифференциров-
ки клеток каких-либо тканей, такие меристемы называют
вторичными. Смысл второй классификации в ботаниче-
ской литературе иногда трактуется различно. Понятие
«вторичная меристема» чаще всего употребляется тогда,
когда необходимо определить относительное время появ-
ления меристем в данном растении или органе.
Понятие об апикальной меристеме довольно емкое, и
в него часто включают производные эмбриональной тка-
ни. Пожалуй, вполне справедливо это понятие отождест-
вить с терминами «апекс побега» и «апекс корня», что
190
правильней, чем употреблять термин «точка роста», по-
скольку рост, определяемый делением клеток, интенсивно
происходит и на значительном расстоянии от апикальной
меристемы. В действительности апекс побега или корня
представляет собой округлую, куполообразную массу кле-
ток, вокруг основания которой последовательно заклады-
ваются зачатки листьев (рис. 34). Многие исследования
указывают на то, что в апексе имеется инициальная клет-
ка (инициаль), делящаяся на две сестринские клетки: од-
на остается в меристеме, а другая добавляется к мери-
стематическим тканям, дифференцирующимся затем
в различные ткаии растения. Количество инициалей
в апексах побега и корня может сильно варьировать.
Кстати, первоначально считалось, что существует только
одна апикальная клетка как постоянная структурная и
функциональная единица апикальных меристем, управля-
ющая всем процессом роста. Дальнейшие исследования
опровергли представление о всеобщем распространении
единственной апикальной клетки и заменили его концеп-
цией независимого происхождения различных частей тела
растения. Теория апикальной клетки сменилась теорией
гистогецов,
191
Следующим важным моментом в развитии представле-
ний об апикальной меристеме были попытки разработать
единую концепцию ее роста, начатые школой Р, Бюва
примерно с 1955 г. При этом основное внимание обраща-
лось на меристематическую активность. Была предложена
гипотеза, согласно которой дистальная зона апикальной
меристемы во время вегетативного роста относитель-
но инертна, а действительно инициальной является пери-
ферическая зона, где возникают листовые примордии.
Данная гипотеза опиралась на результаты подсчета чис-
ла митозов, а также на цитологические, гистохимические
и ультраструктурные исследования. В связи с этим ди-
стальная зона апекса получила название меристемы ожи-
дания, поскольку перед возобновлением меристематиче-
ской активности она как бы ожидает перехода от вегета-
тивной стадии к репродуктивной. Периферическую же
зону стали называть инициальным кольцом, а внутрен-
нюю — сердцевинной меристемой.
Позднее эта гипотеза была несколько видоизменена
в связи с тем, что было доказано варьирование степени
неактивности дистальной зоны в зависимости от размера
апекса и стадии его развития. По мнению большинства
исследователей, относительно низкая частота деления
клеток дистальной зоны не указывает на то, что ее клет-
ки не принимают участия в формировании побегов. Раз-
личными методами, включая авторадиографию, было по-
казано, что именно такие клетки оказываются исходными
для всех остальных клеток побегов и их можно рассмат-
ривать как ипициали. Следовательно, представление о
меристеме ожидания относительное. Неактивные участки
меристемы апексов корней выражены несколько четче, и
в связи с этим Ф. Клоусон (1961) предложил концепцию
покоящегося центра. Обычно такой центр описывается
как немеристематическая группа клеток, напоминающая
форму полушария, окруженная активноделящимися клет-
ками— инициалями, или промеристемой. Центр стано-
вится покоящимся в процессе развития корня, после за-
вершения формирования апекса. Покоящийся центр сох-
раняет способность к возобновлению меристематической
активности и степень его развитости варьирует в широких
пределах.
Краткий обзор становления представлений об органи-
зации и морфогенетических потенциях апикальной мери-
стемы указывает на сложность изучения, казалось бы, до-
192
вольно просто организованной эмбриональной ткани ра-
стений. Для решения этих трудных вопросов особое зна-
чение имеют экспериментальные исследования верхушеч-
ных меристем. Огромное количество описательных работ,
которые продолжаются и в настоящее время, главным об-
разом посвящались и посвящаются изучению верхушеч-
ных клеток, плоскостей делений, происхождения клеток,
образования слоев и зоп клеток и соотношения меристе-
мы, дифференцировки и образования органов. Такие ра-
боты явились существенным вкладом в изучение морфо-
генеза у растений, поскольку благодаря им была полу-
чена основная информация о строении и активности
апикальных меристем, определяющих рост, по они не по-
зволяют глубже познать меристемы как живые и функ-
ционирующие центры морфогенетической активности.
Примерно с 30-х гг. XX в. исследователи все чаще на-
чинают использовать экспериментальные методы для ре-
шения вопросов, возникающих при изучении меристемы,
заимствуя методики, подобные тем, которые оказались
эффективными в экспериментальной эмбриологии живот-
ных. Меристема — эмбриональная ткань, и это очень
удобно для экспериментаторов. Правда, в большинстве
случаев размеры верхушечных меристем малы и они у
стеблей настолько плотно окружены листьями, что экспе-
риментальная работа с ними требует специальной техни-
ки. К настоящему времени уже разработано много рацио-
нальных методов прямого оперативного вмешательства
в меристему, а также значительно усовершенствованы ме-
тоды культуры растительных клеток и тканей, что позво-
ляет получать ценную информацию.
Экспериментальные исследования меристемы апекса
стебля были начаты с простого опыта М. Пилкингтона
(1929), который расщепил точку роста люпина вдоль и
установил, что каждая половина регенерирует нормаль-
ную меристему и в результате первичная ось разделяется
на две ветви. Другие исследователи (Болл, 1952) пошли
дальше и расщепили меристему на шесть полос. Каждая
из них, если она не была меньше критического размера,
восстанавливала новую меристему и побег, хотя образо-
вание листьев несколько замедлялось, а проводящая
ткань была слабодифференцирована до тех пор, пока не
развивались листья.
Ученые пришли к заключению, что апекс побега тоти-
13 Зак. 918
193
потентен и не зависит от остальных частей растения. Поз-
же данное представление укрепилось в связи с результа-
тами опытов по выращиванию целого растения из исход-
ных одиночных клеток. Каждая клетка имеет одинаковую
генетическую информацию и разнообразные потен-
циальные возможности для дифференцировок. Однако
нет оснований для абсолютизации автономности апекса,
хотя бы потому, что сюда поступают не только вода и тро-
фические соединения, но и специфические соединения,
обусловливающие регулирование морфогенеза. Напри-
мер, появление зачатков генеративных органов явно
индуцируется гормонами. Согласно современным пред-
ставлениям, растительный организм, как и животный,—
это морфологически и физиологически целостная систе-
ма, у растений также имеются определенные структур-
ные и физиологические основы для координации и взаи-
модействия частей. Следовательно, только с выявлением
и учетом таких взаимосвязей можно правильно решать
вопросы морфогенеза.
Верхушечная меристема побега играет важную мор-
фогенетическую роль при регенерации, оказывает сильное
влияние на дифференцировку тканей и органов в примы-
кающих к ней областях. Много опытов было, например,
проведено по изоляции зачатков листьев путем микрур-
гической операции. В культуре апекс развивался чаще,
чем зачаток листа. По-видимому, точка роста влияет не
только иа заложение, но и на развитие листа. Затем (Кут-
тер, 1956) было установлено, что в культуре молодые и
более старые зачатки листьев ведут себя различно. Са-
мые молодые примордиальные участки при изолировании
и выращивании в культуре образуют почки и могут затем
дать начало взрослым растениям, а более старые выра-
стают в обычные листья. Таким образом, филлотаксис
тесно связан с состоянием меристемы, т. е. апекс сильно
влияет на дифференцировку зачатков листьев. Как осу-
ществляется эта индукция, пока не совсем ясно.
Дифференцировка сосудистой ткани определяется ин-
дукцией, распространяющейся в базипетальном направле-
нии от апекса. Многими экспериментами было доказано
влияние почки на образование сосудистой ткани. На-
пример, если в эпидермисе вызвать закладку и рост при-
даточной почки, в паренхиме под ней обычно дифферен-
цируется сосудистый тяж. Такой же результат был полу-
194
чен и при трансплантации почек на культуру корневого
каллюса. В этих опытах добавление ауксина стимулиро-
вало дифференцировку сосудистой ткани под почкой. Ме-
тод культуры тканей оказался плодотворным для изуче-
ния меристемы, но при его использовании эксперимента-
торы сталкиваются с рядом трудностей. Сложным оста-
ется подбор среды, обеспечивающей нормальный рост и
развитие апекальных меристем и почек в целом.
Морфогенетические процессы
в постэмбриональпый период
развития животных
Метаморфоз и периодические морфогенезы. Постэмбрио-
нальный период развития животных начинается после ос-
вобождения молодого животного от яйцевых оболочек
или выхода из тела матери. Как известно, развитие у жи-
вотных может сопровождаться метаморфозом или быть
прямым. При непрямом развитии (метаморфоз) из яйца
вылупливается личинка, чаще всего организованная зна-
чительно проще взрослого организма, по обычно имею-
щая специальные личиночные органы. При прямом раз-
витии новорожденное животное принципиально не отлича-
ется от взрослой особи: у него есть все органы и системы,
но только значительно меньшего размера. У новорож-
денных недоразвитыми являются лишь половые железы.
В этих случаях постэмбриональное развитие главным об-
разом сводится к росту и частичному развитию половых
желез. Прямое развитие следует рассматривать как более
совершенное и менее древнее в эволюционном плане по
сравнению с непрямым. Оно характерно для животных
разных систематических групп (пресноводная гидра, мно-
гие нематоды, головоногие моллюски, большинство позво-
ночных).
Развитие с метаморфозом сопровождается рядом
сложных морфогенетических процессов, обусловливаю-
щих переход личинки во взрослое состояние. В личиноч-
ный период обычно быстро происходят подчас порази-
тельные морфогенетические преобразования, которые соп-
ровождаются утратой личиночных органов и появлением
структур взрослого организма. В этот период интенсивно
13*
195
осуществляются два противоположных процесса: редук-
ция одних органов и формирование других. Личинка —
это самостоятельно существующий в определенных усло-
виях организм. В свое время П. П. Иванов (1937) удачно
определил личинку как «организм, вынужденный на более
или менее ранних стадиях развития приспособиться к ус-
ловиям свободного существования путем ранней диффе-
ренцировки необходимых для этого специально личиноч-
ных органов».
При постепенной перестройке личиночной формы (у
кольчатых червей или ракообразных) метаморфоз назы-
вают эволютивным, а при быстрой перестройке — ката-
строфическим. В некоторых случаях в ходе преобразова-
ний личиночной формы дегенеративные процессы преоб-
ладают над морфогенетическими (например, у асцидий
и паразитического ракообразного саккулины), такой ме-
таморфоз называют некробиотическим.
Обычно метаморфоз связан с переменой условий су-
ществования (переход от планктонного образа жизни
к сидячему, от свободного существования к паразитизму
и т. д.) или со сменой среды обитания (переход из воды
на сушу). Смена экологических условий в ходе онтогене-
за часто хорошо отражает историческое развитие данной
группы животных (например, у паразитических раков,
асцидий, амфибий). У животных, ведущих прикреплен-
ный образ жизни, и у паразитических форм наличие сво-
бодноживущей личинки имеет большое значение для рас-
селения популяции.
В некоторых группах животных можно довольно хоро-
шо проследить переход от непрямого развития к прямому
(у гидроидов, брюхоногих моллюсков, ракообразных и
др.). Этот переход сопровождается накоплением больше-
го количества желтка в яйцах, что обеспечивает более
длительный период развития животного под защитой яй-
цевых оболочек и личинка из свободноживущей превра-
щается в одну из стадий эмбрионального развития. При
этом существовавшие ранее специальные личиночные ор-
ганы утрачивают свое значение и не закладываются. Уп-
рощается и весь ход развития, так как выпадают сложные
морфогенетические перестройки, характерные для мета-
морфозов.
Некоторые исследователи предполагают возможность
и вторичного происхождения непрямого развития. Счи-
тается, что оно началось у насекомых. Рост тела насеко-
196
мых в постэмбриональный период связан с периодически-
ми линьками. Обычно выделяют два основных типа пост-'
эмбрионального развития насекомых: с неполным и пол-
ным превращением. При неполном превращении из яиц!
вылупливаются молодые животные, очень похожие на'
взрослых особей (имаго), только для них характерна
диспропорция частей тела и недоразвитость крыльев.,
После нескольких линек в связи с интенсивным ростом
достигается нормальное соотношение размеров различ-
ных частей тела, а после, последней линьки завершается
развитие крыльев и гонад. Поскольку при неполном прев-
ращении развитие осуществляется постепенно и не про-
исходит существенных дегенеративных и морфогенетиче-
ских преобразований, такое постэмбриональное развитие
в известной мере условно можно отнести к метаморфозу.
При метаморфозе у насекомых с полным превраще-
нием наблюдаются существенные морфологические изме-
нения. Из яиц вылупливаются личинки, совершенно не по-
хожие на имаго. Они проделывают ряд линек, значитель-
но увеличиваются в размерах и переходят в стадию ку-
колки, которая внешне иногда напоминает имаго. Для
куколки характерна пассивность, т. е. она не двигается и
не питается. Внутри куколки интенсивно проходят морфо-
генетические процессы, которые сопровождаются дегене-
рацией личиночных органов и заменой их имагипальны-
ми. Рассмотрим это подробней на примере дрозофилы.
У дрозофилы относительно сложный жизненный цикл.'
Примерно через сутки после оплодотворения вылуплива-;
ется личинка первого возраста. Через сутки происходит
линька и появляется личинка второго возраста, еще через:.
сутки вторая линька завершается образованием личинки
третьего возраста. Затем через 2 дня активного питания
личинка окукливается. Ее кутикула уплотняется и обра-
зует оболочку куколки, или пупарий. Внутри пупария на-
чинается метаморфоз. В течение примерно 4 дней боль-
шинство личиночных органов и тканей дегенерирует и
формируется имаго.
В процессе метаморфоза в основном все имагинальные
структуры образуются из так называемых имагннальных
дисков, или зачатков. Имагинальные диски закладыва-
ются в определенных районах гиподермы и состоят из до-
вольно однородных эпителиальных клеток с крупными яд-
рами и небольшим количеством цитоплазмы. До начала
метаморфоза (конец третьего личиночного возраста) има-
197
Рис. 35. Локализа-
ция имагинальных
дисков в личинке
дрозофилы (по Бо-
деиштайну, 1950):
1 — лабильный диск;
2 — трахея; 3 — диск
антенны; 4 — глазной
диск; 5 — диск одной
ноги; 6 — диск второй
ноги; 7 — диск треть-
ей ноги; 8 — крыло-
вой диск; 9 — галь-
терный диск; 10 — ге-
нитальный диск
гинальные диски растут в основ-
ном за счет деления клеток, оста-
ваясь плотноупакованными груп-
пами клеток, покрытых мембра-
ной. Каждый диск приобретает
характерную для него форму, но
входящие в его состав мелкие
клетки с крупными ядрами не про-
являют каких-либо признаков
дифференцировки до начала мета-
морфоза. Однако имеющиеся дан-
ные показывают, что с момента
появления дисков их клетки до-
вольно жестко запрограммиро-
ваны для дифференцировки в
строгом направлении и они опре-
деленным образом локализованы
в личинке (рис. 35).
Наличие жесткой морфогенети-
ческой программы в имагинальных
дисках было доказано экспери-
ментально. Если, например, диск
крыла одной личинки пересадить
в полость тела другой, то в ходе
метаморфоза личинки-«хозяииа»
из него образуется крыло незави-
симо от местоположения переса-
женного диска в личинке-«хозяи-
не». Так же из пересаженного в
полость тела другой личинки глаз-
ного диска автономно развивается
глаз. При удалении у личинки
диска крыла имаго оказывается
лишенным крыла и т. д. Следова-
тельно, имагинальные диски явля-
ются своеобразными зачатками,
морфогенетические потенции кото-
рых определяются в раннем
эмбриогенезе. Это возможно за счет накопления долго-
живущих иРНК и особого механизма инактивации дан-
ных клеток. Опыты по трансплантации имагинальных
дисков указывают на то, что их морфогенетические по-
тенции могут реализовываться без заметных отклоне-
198
ний в чужеродном окружении, а это своеобразное ис-
ключение из рассмотренных выше особенностей взаи-
модействия ядра, цитоплазмы и клеток различных
тканей.
В чрезвычайно жесткой детерминации имагинальных
дисков убеждают и следующие наблюдения. Так, из ге-
нитального диска образуется несколько частей гениталей:
два семепровода, соединяющихся с семенниками, две при-
даточные половые железы и сократимый проток, проводя-
щий сперму в семеизвергательпый канал, который в свою
очередь транспортирует се в наружные половые органы.
Последние состоят из хитиновых частей, в том числе пе-
ниса и нескольких пластинок, имеющих шипы, сцепляю-
щиеся при спаривании с аналогичными структурами сам-
ки. Особо выделяются две анальные пластинки, окружаю-
щие анальное отверстие, и два половых придатка. Экспе-
риментально было доказано, что каждый из этих органов
детерминирован в имагинальном диске уже на ранних
стадиях развития. Прежде всего при раздельном культи-
вировании в личинках участков генитального диска каж-
дый из них формирует только одну структуру. Облучение
небольших участков этого диска микропучком ультрафио-
лета предупреждает развитие отдельных органов при пос-
ледующей трансплантации диска другой личинке. Резуль-
таты таких опытов позволили составить карты зачатков
для нескольких имагинальных дисков, в том числе для
генитального диска и диска крыла.
Предопределенность морфогенетических потенций
имагинальных дисков, конечно, не абсолютна, и на это
указывают так называемые гомойтические мутации (раз-
витие одного сегмента происходит по типу другого). У
дрозофилы уже известно несколько таких мутаций. На-
пример, при воздействии эфиром и высокими температу-
рами на ранние стадии развития дрозофилы были получе-
ны мутанты tetraptera, для которых характерно появление
четырех крыльев (два из них образуются па среднегруди,
а два — на самом заднем грудном сегменте, представля-
ющем не заднегрудь, а вторую среднегрудь). Известны и
другие гомойтические мутации у дрозофилы (развитие че-
тырех жужжалец, превращение антенн в ноги, формиро-
вание ноги из щупика и т. д.). Следовательно, под влия-
нием различных факторов морфогенетические потенции
имагинальных дисков могут изменяться.
Мы уже рассматривали исключительное значение
199
межклеточных и межткалевых взаимодействий в ходе
индивидуального развития и возможную роль гормонов
в этих сложных процессах. Гены могут контролировать
образование и выделение гормона, необходимого для дан-
ного морфогенетического процесса (гормональный сиг-
нал) или могут определять способность клеток реагиро-
вать на гормональный стимул. Было установлено, что у
насекомых по крайней мере два гормона непосредственно
связаны с ростом и дифференцировкой. Один из них
контролирует клеточные деления и сообщает им спо-
собность к дифференцировке (гормон роста и дифферен-
цировки), другой — ювенильный — определяет переход
к метаморфозу. У дрозофилы эти гормоны образуются
в кольцевой железе, которую удалось обнаружить благо-
даря мутантному гену lethal giant larva, исключающему
переход личинок к метаморфозу, т. е. он контролирует
появление соответствующего гормонального стимула.
В поисках центра, продуцирующего ювенильный гормон,
мутантным личинкам пересаживали разные органы осо-
бей дикого типа. Только кольцевые железы дикого типа
индуцировали метаморфоз у мутантных личинок. Инте-
ресно, что ответственные за образование пупария клетки
гиподермы потенциально способны функционировать да-
же в дефектном фенотипе, но кольцевая железа мутанта
не продуцирует гормона, необходимого для индукции об-
разования пупария.
Реципрокные скрещивания показали, что клетки дру-
гих типов также сохраняют в мутантных личинках спо-
собность реагировать на нормальный гормональный сиг-
нал. Так, зачатки яичников, никогда не развивающиеся
у мутантных личинок, при пересадке их особям дикого
типа начинали развиваться, но дифференцировались толь-
ко соматические компоненты половых желез, а собствен-
но-половые клетки не завершали дифференцировки. Сле-
довательно, клетки кольцевой железы и половые клетки
находятся под непосредственным контролем мутантного
гена. Оказалось, что этот ген влияет и на клетки имаги-
нальных дисков, которые при наличии данной мутации
дегенерируют на ранних личиночных стадиях. При этом
кишечник, нервная система и мышцы мутантных личинок
остаются нормальными. Значит, появление гормонально-
го сигнала и способность клеток реагировать на данный
сигнал могут контролироваться генами.
200
Довольно хорошо изучен метаморфоз и у амфибий.
У различных групп амфибий метаморфоз имеет свои осо-
бенности. Так, у бесхвостых амфибий при метаморфозе
происходят более существенные перестройки, чем у хво-
статых. Внешние проявления превращения головастика
в лягушку хорошо известны. Перед метаморфозом голова-
стик растет несколько месяцев, и во время личиночного
развития осуществляется дальнейшая клеточная и ткане-
вая дифференцировка. Метаморфоз головастика лягушки
сопровождается резорбцией хвоста, появлением конечно-
стей, изменением формы головы, утратой жабер, разви-
тием легких с их сосудистой системой и т. д. Метаморфоз
контролируется функционированием щитовидной железы,
что было доказано многочисленными опытами. При до-
бавлении в воду даже незначительного количества ти-
роксина метаморфоз головастиков ускоряется. Голова-
стики лягушки с удаленной щитовидной железой сохра-
няют личиночное строение, значительно увеличиваясь
в размерах. При введении таким головастикам тиреоид-
ного гормона наступает метаморфоз. Было также уста-
новлено, что гормон гипофиза имеет большое значение
в метаморфозе амфибий. Он оказывает влияние на щито-
видную железу.
У хвостатых амфибий метаморфоз сопровождается
менее резкими преобразованиями, но и в этом случае на-
блюдается атрофия наружных жабер, резорбция части
хвостового плавника, а также изменения головы и струк-
туры кожи. Особый интерес представляет неотения — вы-
падение из цикла развития стадии взрослого организма.
Неотения встречается у ряда хвостатых амфибий. Она
выражается в частичном или полном выпадении метамор-
фоза. Факультативная неотения может быть обусловлена
недостаточным питанием личинки или низкой температу-
рой. Например, обыкновенный аксолотль на своей родине
в Мексике метаморфизирует и дает начало амблистоме,
но в аквариуме он размножается только в личиночном со-
стоянии. Аксолотль не утрачивает способность к метамор-
фозу при определенных условиях, особенно при введении
гормона щитовидной железы, и легко превращается в ам-
блистому. Ряд других хвостатых амфибий в ходе истори-
ческого развития полностью утратили способность к ме-
таморфозу (например, пещерный протей).
У многих видов различных групп беспозвоночных и
201
позвоночных животных в постэмбриональный период про-
исходят так называемые периодические формообразова-
тельные процессы (например, смена и перекраска покро-
вов), которые имеют адаптивное значение, т. е. обеспечи-
вают существование животных в изменяющихся условиях.
Известны линьки, выражающиеся в смене кутикул, эпи-
дермиса, кожи, перьев и волосяного покрова в соответст-
вии с сезонными изменениями условий существования.
Известна также и перекраска покрова у ряда беспозво-
ночных и позвоночных животных, имеющая приспособи-
тельное значение. Для этих периодических формообразо-
вательных процессов необходимы определенные регуля-
торные механизмы и конкретные условия. Чаще всего
такие формообразовательные процессы индуцируются
физическими факторами (температурой или световым ре-
жимом), а регулируются нейрогуморальными механиз-
мами, причем особую роль играет дифференциальная
чувствительность к гормонам. Знание механизмов перио-
дических формообразовательных процессов имеет не
только теоретическое, но и практическое значение (на-
пример, в животноводстве, звероводстве и даже меди-
цине).
Формирование вторично-
половых признаков
Развитие признаков пола, как и любых других, зависит
от генотипа и факторов внешней среды. За определением
пола следует его дифференцировка, т. е. становление по-
ловых признаков (первичных и вторичных).
На ранних этапах эмбриогенеза зачатки гонад (поло-
вых желез) образуются из клеток висцеральной мезодер-
мы и нефротома (первичного отдела мезодермы тела).
Зачатки гонад появляются в виде продольных полосок
(половых валиков, или складок); расположение струк-
турных элементов гонады обусловлено задолго до обра-
зования ее зачатка. Зачатки гонады появляются на ста-
дии головного отростка, когда первичные половые клетки
располагаются по периферии, образуя фигуру серпа. Ес-
ли из бластодермы удалить серп первичных половых кле-
ток и пересадить их в период стадии появления сомитов
202
на хорио-аллантоис, образуется стерильный семенник.
У мышей было произведено облучение первичных поло-
вых клеток, еще не достигших стадии половых складок,
при этом также образовывались стерильные гонады.
Первоначально зачатки гонад являются лабильными
и индифферентными в половом отношении. Они обычно
состоят из двух слоев: коркового (кортикального) и моз-
гового (медуллярного). Пол животного зависит от того,
какой из этих слоев будет развиваться. При разрастании
и дифференцировке коры образуется собственно ткань
яичника, а мозговой слой в этом случае дегенерирует. Ин-
тенсивный рост и дифференцировка мозгового слоя обус-
ловливают развитие семенника. Эта дифференцировка
индуцируется гормонами, продуцируемыми клетками го-
нады.
Согласно преобразованиям гонад, дифференцируются
и половые пути женского или мужского организма. Пер-
воначально в виде вольфовых и мюллеровых протоков, а
затем протоки противоположного пола дегенерируют или
остаются в зачаточном состоянии. В начале постэмбрио-
нального периода яичники и семенники еще недоразвиты,
и их развитие завершается под влиянием различных гор-
монов в период полового созревания особей.
Половые железы и непосредственно необходимые для
полового акта органы относятся к первичным половым
признакам. У этих признаков обоих полов хорошо выра-
жены все элементы взаимного приспособления. Половые
различия, непосредственно не связанные с половым актом
и процессом оплодотворения, но имеющие большое значе-
ние в воспроизведении популяции, относят к вторичным
половым признакам. Вторичные половые признаки чрез-
вычайно многообразны. Следуя И. И. Шмальгаузену
(1969), их можно классифицировать таким образом: 1)
средства пассивной защиты особей одного пола, обычно
самки и ее потомства (защитная окраска, мимикрия сам-
ки); 2) средства активной защиты особей одного пола,
обычно самцов (клыки, рога и т. д.); 3) органы заботы
о потомстве (различные сумки и камеры для выведения
молоди, млечные железы млекопитающих); 4) приспо-
собления, способствующие спариванию (органы, исполь-
зуемые самцами для удержания самки, например мозоли
на первом пальце некоторых лягушек); 5) органы, облег-
чающие нахождение особей другого пола (яркие окраски,
203
звуковые органы, пахучие железы, органы свечения, по-
вышение чувствительности органов зрения, слуха, обоня-
ния и т. д.); 6) приспособления, вызывающие половые
рефлексы у особей другого пола и наблюдаемые чаще у
самцов (яркие окраски, рисунки, отметины, часто появ-
ляющиеся только в брачный период, рога, бороды, хохлы,
кожные выросты, специализированные перья, особое по-
ведение в брачный период и т. д.).
Формирование вторичных половых признаков проис-
ходит при влиянии различных гормонов, которые под кон-
тролем специальных генов начинают продуцироваться
половыми железами в период полового созревания орга-
низма. У животных есть три группы половых гормонов:
андрогены (мужские гормоны), эстрогены (женские гор-
моны) и гормон желтого тела — прогестерон. Эти поло-
вые гормоны влияют не только на развитие вторичных
половых признаков, но и на развитие самих гонад. Андро-
генные гормоны вызывают маскулинизацию яичников,
т. е. образование в них мужских половых клеток, а эстро-
гены — феминизацию семенников, т. е. развитие в них
женских половых клеток. Действием гормонами противо-
положного пола на ранний период эмбриогенеза можно
переопределить пол в онтогенезе у рыб, птиц и амфибий.
Действие же ими в постэмбриональный период на взрос-
лое животное обычно вызывает частичное изменение
прежде всего вторичных половых признаков.
Еще в 20-х гг. XX в. опытами М. М. Завадовского бы-
ло показано, что при кастрации птиц даже во взрослом со-
стоянии у них появляются признаки противоположного
пола. Кастрированные петухи внешне начинают напоми-
нать куриц, а последние — петухов. Это наблюдается и
при кастрации млекопитающих до наступления половой
зрелости. Первопричиной таких изменений являются на-
рушения контроля функционирования генов, определяю-
щих гормональную секрецию. В настоящее время извест-
но много примеров спонтанного и индуцированного пере-
определения пола в онтогенезе.
Среди моллюсков (Crepidula), например, имеются ви-
ды, особи которых в норме проходят ряд сменяющихся
фаз развития: бесполую, мужскую переходную и жен-
скую. Находящиеся в мужской фазе особи после спарива-
ния с особями в женской фазе либо начинают прикреплен-
ный образ жизни, либо остаются свободноплавающими и
204
затем переходят к женской фазе. Интересный пример
спонтанного переопределения пола в онтогенезе был об-
наружен Ф. Лилли в 1916 г. у крупного рогатого скота.
Оказалось, что при рождении разнополой двойни у круп-
ного рогатого скота мужская особь оказывается нормаль-
ной, а женская — бесплодной и с признаками самца. Дело
в том, что эмбриональное развитие мужского пола не-
сколько опережает развитие женского пола, а поскольку
кровеносные системы близнецовых зародышей связаны,
то мужские гормоны влияют па дифференцировку пола
женской особи. Такие измеленные женские особи назы-
вают фримартинами.
Переопределение пола в онтогенезе при введении гор-
мональных препаратов удавалось получить эксперимен-
тально у многих видов животных (рыбы, амфибии, птицы,
млекопитающие). Эти наблюдения и эксперименты убе-
дительно доказывают генетическую бисексуальность ор-
ганизмов и возможность изменения дифференцировки по-
ла в онтогенезе, что может иметь особое значение в жи-
вотноводстве и звероводстве.
Внешне схема хромосомного определения пола очень
проста, но на самом деле это явление значительно слож-
нее. Прежде всего возникает ряд вопросов относительно
значения для определения и дифференцировки пола ауто-
сом (неполовых хромосом) и взаимодействия между хро-
мосомами и цитоплазмой. Например, известно, что при
реципрокных скрещиваниях различных географических
рас некоторых насекомых в потомстве возникают как два
противоположных пола, так и промежуточные по половым
признакам особи, которых называют интерсексами. Ин-
терсексуальность может быть выражена в различной сте-
пени, т. е. возможны различные переходы в отношении
первичных и вторичных половых признаков от мужского
пола к женскому. Эти факты наводили на мысль, что по-
ловые признаки, как и все другие, детерминированы мно-
гими генами, локализованными в половых хромосомах и
аутосомах, и их дифференцировка зависит от влияния
различных внутренних и внешних факторов. Следователь-
но, каждая зигота потенциально бисексуальна.
В 30-х гг. XIX в. К. Бриджес при изучении дрозофил
с аномальным количеством половых хромосом и аутосом
обнаружил интерсексуальность по ряду первичных и вто-
ричных половых признаков. Изучив хромосомные наборы
205
у этих аномальных форм, он установил зависимость меж-
ду признаками пола и отношением аутосом к половым
хромосомам и пришел к заключению, что пол особи не
столько определяется половыми хромосомами, сколько
отношением количества Х-хромосом к количеству ауто-
сом. Это и явилось сутью балансовой гипотезы определе-
ния пола, по которой развитие половых признаков
зависит от баланса генов, контролирующих их развитие.
Данная гипотеза в общей форме справедлива для всех
организмов с сингамным типом определения пола.
Исходя из того, что организмы являются генетически
бисексуальными, т. е. в их генотипах имеются гены обоих
полов, а характер их проявления у мужских и женских
особей различен, Р. Гольдшмидт в 1934 г. предложил фи-
зиологическую гипотезу определения пола. Она была ос-
нована на результатах исследований интерсексов, возни-
кающих при реципрокных скрещиваниях различных геог-
рафических рас непарного шелкопряда. В таких случаях
не происходит изменение в соотношении половых хромо-
сом и аутосом. Скрестив две расы непарного шелкопряда
(европейскую и японскую}, Р. Гольдшмидт заметил, что
они отличаются половой потенцией. Европейскую расу
в связи с этим можно было определить как «слабую», а
японскую — как «сильную». Если самки европейской ра-
сы скрещивались с самцами японской расы, в первом
поколении возникали интерсексы женского типа. Следова-
тельно, изменения формирования половых признаков мо-
гут происходить и без изменения количества половых хро-
мосом, а в результате взаимодействия факторов двух
типов, из которых одни сдвигают развитие в сторону жен-
ского пола, а другие — в сторону мужского. Особое зна-
чение здесь имеет взаимодействие между ядром и цито-
плазмой.
Балансовая гипотеза К. Бриджеса и физиологическая
гипотеза Р. Гольдшмидта являются не взаимоисключаю-
щими, а скорее дополняющими друг друга. К. Бриджес
рассматривал причины определения пола и интерсек-
суальности в связи с генным балансом, а Р. Гольдшмидт
исходил из соотношения функциональной активности ге-
нов в период индивидуального развития.
Нарушения гормонального регулирования дифферен-
цировки пола могут привести к гермафродитизму, когда
у одного и того же организма имеются признаки мужско-
206
го и женского полов. По сравнению с интерсексуаль-
ностью это явление иного порядка. У некоторых живот-
ных (например, дождевых червей) и многих растений
гермафродитизм является нормой. У высших позвоночных
в результате аномалий дифференцировки первичных и
вторичных половых признаков может появиться герма-
фродитизм двух типов: истинный и ложный. При истин-
ном гермафродитизме у одной особи есть как мужская,
так и женская половые железы, что приводит к чрезвы-
чайной изменчивости вторичных половых признаков
(морфология наружных половых органов, тип волосяного
покрова, молочные железы и этология), т. е. они могут
иметь чисто мужской или женский характер, могут быть
смешанными или неопределенными. В случаях ложного
гермафродитизма половые железы особи одного типа
(мужские или женские), но они не соответствуют наруж-
ным или внутренним частям половой системы. Разли-
чают наружный и внутренний ложный гермафродитизм.
Например, при наружном мужском ложном гермафроди-
тизме имеются мужские половые железы, но наружные
половые органы в различной степени сходны с женскими.
Вообще могут возникать самые разнообразные аномалии
в дифференцировке первичных и вторичных половых при-
знаков н степень выраженности гермафродитизма может
сильно варьировать.
Интересно явление гинандроморфизма. Гинандромор-
фы — организмы, представляющие собой мозаику из
женских и мужских половых признаков. Не следует пу-
тать гинандроморфизм с интерсексуальностью и герма-
фродитизмом, так как последние явления другого поряд-
ка. При гинандроморфизме наблюдается мозаичность
мужских и женских половых признаков в различных уча-
стках одного и того же организма. Это своеобразное про-
странственное выражение генетической мозаичности.
Различают три типа гинандроморфов: 1) латеральный,
когда одна половина тела имеет признаки женского по-
ла, а другая — мужского; 2) передне-задний, когда пе-
редняя часть тела имеет признаки одного пола, а зад-
няя — другого; 3) мозаичный, при котором большая часть
тела организма проявляет признаки одного пола, а не-
большие участки — признаки другого пола.
Гинандроморфы редко встречаются у организмов
с четко выраженным половым диморфизмом. Они обнару-
207
жены у дрозофилы и некоторых бабочек и довольно часты
у тутового шелкопряда и пчел. Трудно точно определить
гинандроморфизм у позвоночных животных, поскольку
его можно спутать с интерсексуальностью дисгормональ-
ного типа. Цитологические исследования гинандроморфов
у дрозофилы показали, что причина этого явления связа-
на с элиминацией одной из Х-хромосом при делении зиго-
ты или клеток зародыша на различных этапах эмбриоге-
неза. При латеральном гинандроморфизме в клетках
женской половины тела есть две Х-хромосомы, а муж-
ской — одна Х-хромосома. Элиминация одной Х-хромо-
сомы произошла при первом делении зиготы. Поскольку
каждая из этих клеток является исходной для тканей и
органов одной половины тела, они и будут развиваться
в соответствии с имеющимися половыми хромосомами.
Если же элиминация Х-хромосомы произойдет при вто-
ром делении дробления, только четверть тела женской
особи будет с признаками мужского пола. Следовательно,
чем позже в эмбриогенезе произойдет элиминация Х-хро-
мосомы, тем меньшим окажется участок тела самки
с признаками мужского пола.
Таким образом, определение и дифференцировка по-
ла — это разные явления. Если первое обусловлено нали-
чием определенных половых хромосом и выступает в ка-
честве возможности развития особи одного или другого
пола, то второе обусловлено многообразными факторами
(внутренними и внешними), необходимыми для реализа-
ции имеющейся генотипической возможности.
Особенности роста животных
Рост является комплексным процессом и его изучением
занимаются многие специалисты (морфологи, эмбриоло-
ги, генетики, экологи, биофизики, физики и математики),
которые рассматривают этот процесс со своих позиций.
Рост — поступательное увеличение массы (W) или ве-
са организма. Данный процесс сопровождается увеличе-
нием неорганической и органической массы. Накопление
органической массы может происходить по-разному и
в связи с этим выделяют ауксетичный рост (главным об-
разом у животных с постоянным клеточным составом) и
пролиферозный рост, обусловленный делением клеток.
208
Пролиферозный рост может быть мультипликатив-
ным, аккрационным и рекуррентным. В первом случае
каждая сестринская клетка оказывается способной к де-
лению и увеличение количества клеток происходит в гео-
метрической прогрессии (N = 2n). При аккрационном ро-
сте лишь одна из сестринских клеток способна делиться,
а другая дифференцируется относительно выполнения ка-
ких-либо специальных функций в системе данной ткани
(N=n).
Клетки, сохраняющие способность к делению, обра-
зуют ряд стволовых клеток. Для рекуррентного роста
характерно то, что в результате деления сестринских
клеток образуется их разнос количество, что соответст-
вует ряду Фибоначчи (2, 3, 5, 8, 13, ... , т. е. Nn = Nn-i +
+Л^п-2+ .. .).
Изучение роста обычно сводится к анализу изменений
во времени весовых и линейных показателей особи, а
также изменений соотношения между ними. Наиболее
удобным способом представления этих показателей яв-
ляется построение кривой роста в системе координат, где
по оси абсцисс откладывается время, а по оси ординат —
значение рассматриваемого показателя.
Имея пару чисел, определяющих значения анализиру-
емого показателя (W) в начале (в момент и конце
(в момент t2) временного интервала, можно вычислить об-
щий абсолютный прирост W за время Af = /2—6 как
А№е=№2—и средний абсолютный прирост в единицу
времени как AW7=f’U72—W\)/(t2—1\). Однако следует
учитывать, что абсолютные приросты крупного и мелкого
животных несопоставимы, поскольку представляют ре-
зультаты увеличения разновеликих растущих масс.
В связи с этим был введен показатель относительного
прироста: /? = А№/№1. Если же интервал /2—1\ велик, ве-
личину R можно не учитывать. Более точной оценкой от-
носительного прироста является отношение абсолютного
прироста в единицу времени к условной величине W
в середине интервала t2—1\'
„ АГ
Л 1/2^ + ^) ’
Еще более точной оценкой относительного прироста
выступает средняя удельная скорость роста (с), которую
14 Зак. 918
209
обычно рассчитывают по формуле И. И. Шмальгаузена
lgra-lgrx
(h — h) 0,4343 '
Предложено много уравнений роста, сущность некото-
рых из них остается спорной. Дело в том, что одни иссле-
дователи рассматривают уравнения роста как способ опи-
сания эмпирической кривой роста и получения формулы,
позволяющей с достаточной точностью определять значе-
ние веса или промера. По мнению других, уравнения ро-
ста должны выражать и физиологические закономерно-
сти. В связи с этим в уравнения включалось различное
количество констант и параметров в зависимости от зада-
чи исследования.
Например, исходя из того, что рост (увеличение ве-
са) — результат двух процессов: анаболизма и катабо-
лизма, Л. Берталанфи предложил уравнение
r\Wm— KWn,
at
где W — вес организма; т] — константа анаболизма; К —
константа катаболизма.
Поскольку потери веса при голодании пропорциональ-
ны весу тела, показатель степени п Л. Берталанфи счи-
тал возможным принять равным единице. Тогда
at
После интегрирования и преобразований в оконча-
тельном виде уравнение выглядит так:
Wt = W„ (1 — е-(1-пг)
где ^->оо; -m); — предельный вес;
= да)1/(1 ~т}.
В зависимости от величины т, отражающей пропор-
циональность объема поверхности, Л. Берталанфи выде-
лял «типы роста» (т = 2/3, т=\, 2/3<т<1), считая, что
«типы роста» нужно рассматривать не как неизменные
характеристики видов и групп видов, а как идеальные
случаи, различимые при стандартных условиях.
Смысл параметров уравнения Л. Берталанфи интер-
претировался другими авторами по-разному, но было до-
210
казано, Что оно может быть успешно использовано для
описания линейного роста (особенно у рыб).
А. Гомпертц предложил уравнение, описывающее
рост, удельная скорость которого уменьшается экспонен-
циально. Оно хорошо описывает рост в эмбриональный и
постэмбриональный периоды развития некоторых птиц и
млекопитающих.
Имеется уравнение логистической функции, основан-
ное на предположении, что скорость роста прямо пропор-
циональна размерам (весу) животного в данный момент
и разности предельного веса и веса в данный момент:
= KW (W„ — W).
Отмеченные уравнения описывают увеличение веса
или линейных размеров на протяжении всего периода ро-
ста и, как правило, не позволяют с достаточной точностью
описывать эмпирическую кривую роста на всем протяже-
нии временного интервала. Следовательно, необходимо
еще выделять этапы роста в ходе онтогенеза, для кото-
рых изменения размерных характеристик имеют свои
особенности. Уравнения, описывающие увеличение веса
или линейных размеров па отдельных этапах онтогенеза,
были предложены С. Броди и И. И. Шмальгаузепом, раз-
вившими представление о росте как прерывистом про-
цессе, отдельные этапы которого имеют свои закономер-
ности.
Рост в разных систематических группах животных и
даже у животных одной группы, живущих в разных эко-
логических условиях, происходит по-разному, поэтому
для описания роста необходимо использовать различные
уравнения.
Рост животных может прекращаться с достижением
предельных размеров («конечный» рост) или продол-
жаться в течение всей жизни особи, так и не достигаю-
щей предельных размеров («бесконечный» рост). Кстати,
данные типы роста описываются одними и теми же урав-
нениями. При анализе увеличения веса организма или его
линейных размеров в конечном итоге определяется сум-
марное значение массы и размеров частей тела. Часто же
необходимо знать особенности роста отдельных органов
или частей тела и учитывать согласованность их роста.
Это так называемый относительный, или аллометриче-
ский, рост.
14* 211
Следует отметить, что в литературе термины «орган»
и «часть тела» обычно отождествляются. По И. И. Шма-
льгаузепу, орган— это более или менее обособленная
часть организма, несущая определенную функцию. Хотя
такая формулировка не лишена условностей, на ее основе
можно утверждать, что не каждую часть тела следует
называть органом, но каждый орган является частью
тела.
Широкое исследование аллометрического роста нача-
лось с работы Дж. Гексли, опубликованной в 1932 г. Он
исходил из того, что обычно соотношение размера органа
или части тела (у) и размера организма в целом за вы-
четом размера органа (х) довольно точно описывается
уравнением степенной зависимости: у=Ьхк, где k — кон-
станта, равная значению tg угла а между кривыми роста
одного и другого органа или целого организма. В лите-
ратуре эта константа часто обозначается а. При £>1
часть растет быстрее целого, а при £<1 часть растет мед-
леннее целого. В первом случае говорят о положитель-
ной, а во втором — об отрицательной аллометрии.
Общий рост зародыша и организма, как отмечалось
выше, представляет собой сумму роста всех его органов.
Различные органы растут с разной и непостоянной ско-
ростью. На скорость роста каждого органа влияет его ме-
стоположение и среда, с которой он непосредственно свя-
зан. При трансплантации органа одного зародыша друго-
му скорость его роста может существенно изменяться.
Рост органа прежде всего связан с увеличением количе-
ства клеток. Однако это правило может изменяться с из-
менением плоидности клеток. Известно, что гаплоидные
клетки мельче, а полиплоидные крупнее, чем диплоидные.
Например, у полиплоидных жизнеспособных зародышей
амфибий размеры ядер и клеток увеличиваются пример-
но пропорционально числу наборов хромосом. В ходе
развития увеличение размеров полиплоидных клеток
компенсируется соответственным уменьшением их числа.
Это обеспечивает нормальные размеры органов незави-
симо от общего числа клеток, образующих их. Увеличе-
ние размеров клетки и ее деление регулируются различ-
ными механизмами. Например, при действии на клетки
аналогами иприта подавляется их деление, но продол-
жаются синтетические процессы в цитоплазме и рост
клеток.
212
Основными факторами, влияющими на рост клеток,
тканей и органов, являются: 1) концентрация трофиче-
ских соединений в среде, включая и предшественников
различных макромолекулярных соединений; 2) достаточ-
ная аэрация; 3) концентрация в среде продуктов метабо-
лизма, особенно токсичных.
Интересен вопрос о факторах, ограничивающих рост.
У многоклеточного организма нс все части растут с оди-
наковой скоростью и нс все они перестают расти в одно
и то же время. Некоторые ткани растут на протяжении
всей жизни организма, у других тканей непрерывно
расти могут лишь отдельные группы клеток, расположен-
ных в особом участке. Например, такой недетерминиро-
ванный рост характерен для волосяных фолликулов, у ко-
торых имеются зоны деления и зоны трансформации кле-
ток. Кстати, это характерно и для меристем растений.
Высокодифференцированные клетки обычно не делятся.
Некоторые крайпеспсциализированпые клетки могут со-
хранять способность .к росту. Так, при перерезании нерв-
ного волокна оно способно регенерировать за счет роста
клеток, но сами нервные клетки не делятся.
При культивировании тканей зародышей, взятых
в различные периоды эмбриогенеза, оказывается, что они
растут с разной скоростью. Чем старше зародыш, тем
медленнее растут его ткани в культуре, а ткани взрослых
особей растут очень медленно. Нервная ткань вообще не
растет в культуре.
Связь между ростом, дифференцировкой и старением
отмечалась уже давно. На это указывал Ч. Майнот еще
в 1891 г., а значительно позже И. И. Шмальгаузен пред-
ложил рассматривать данную связь только как внешнюю.
По его мнению, окончание роста непосредственно связа-
но не с возрастом животного, а со степенью дифференци-
ровки его частей. Так, высокоспсциализироваппыс ткани
нервной системы почти полностью утрачивают способ-
ность к росту, а для ткани кожи и пищеварительного
тракта характерен довольно быстрый рост на протяже-
нии всей жизни животного. В последних случаях проис-
ходит своеобразное обновление тканей за счет резервных
недифференцированных клеток, способных к быстрому
росту и делению. Это предположение частично подтверж-
дается и тем, что органы растут быстрее до наступления
гистологической дифференцировки.
213
На рост животных может влиять огромное количество
абиотических и биотических факторов. Среди абиотиче-
ских факторов особое значение имеют температура, свет,
влажность и концентрация солей. Например, влияние тем-
пературы на рост животных хорошо отражает правило
К. Бергмана и правило оптимума. Еще в 1847 г. К. Берг-
ман сформулировал правило, по которому размер тела
теплокровных животных в северном полушарии уменьша-
ется по направлению с севера на юг. Позже выяснилось,
что это правило лучше всего отражает внутривидовую из-
менчивость и сейчас его формулируют следующим обра-
зом: особи географических рас в более теплых частях
ареала какого-либо вида имеют более мелкие размеры, а
в более холодных — боле:е крупные размеры.
Правило оптимума было сформулировано Б. Реншем
в 1932 г. на основе изучения наземных моллюсков: у каж-
дого вида размеры особей увеличиваются по направлению
к определенному оптимуму температуры и влажности, а
за этим оптимумом вновь уменьшаются. Затем данное
правило было распространено практически на всех жи-
вотных (пойкило- и гомойотермальных). Некоторые ав-
торы считают, что правило К. Бергмана является част-
ным случаем правила оптимума.
По физиологической обоснованности и интерпретации
этих правил имеется много спорного, но в общих чертах
они хорошо отражают влияние температуры на рост жи-
вотных.
Рост — сложноритмический процесс, зависящий от
многих факторов среды. Существуют сезонные ритмы ро-
ста животных, обусловленные разнообразными внутрен-
ними и внешними факторами. Известны также ритмы ро-
ста животных, имеющие периоды, не равные сезону или
году (суточные ритмы, ритмы с периодом более суток и
более года). Конечно, ритмичность роста по-разному про-
является у различных групп беспозвоночных и позвоноч-
ных животных. Различны и причины ритмичности.
У каждого вида животных предельные, или критиче-
ские, размеры отдельной особи колеблются в определен-
ных пределах. Рост организмов детерминирован генетиче-
ски, а проявление количественных признаков, как извест-
но, зависит от взаимодействия многих пар генов.
Генетические исследования показали, что при полигенном
наследовании первое поколение обычно бывает промежу-
214
точным между родительскими формами и довольно одно-
типным. Второе же поколение очень изменчиво и состоит
из индивидуумов, распределяющихся по количественным
признакам по всему диапазону между исходными роди-
тельскими типами. Кроме того, действие групп генов, де-
терминирующих количественные признаки, модифициру-
ется внешними условиями, например количеством и каче-
ством пищи. По мере увеличения объема животного
соответственно возрастает потребность в питательных ве-
ществах и удалении потенциально токсичных продуктов
обмена. Все эти вещества должны проходить через поверх-
ность организма, а чем больше его объем, тем больше и
должна быть поверхность. Если соотношение между объ-
емом и площадью поверхности резко увеличивается, пос-
ледняя не может обеспечить удаление необходимого ко-
личества веществ и рост ограничивается. Таким образом,
общая площадь поверхности особи становится фактором,
ограничивающим дальнейшее увеличение ее объема. Раз-
личные модификации формы и размера тела у животных
часто являются адаптациями, позволяющими компенси-
ровать несоответствие между увеличивающимся объемом
и площадью поверхности в процессе роста.
Интенсивность роста животных в постэмбрнональный
период в известной мерс зависит и от уровня их организа-
ции. Чем выше уровень организации, тем обычно меньше
интенсивность постэмбрионального роста. Самый интен-
сивный уровень роста наблюдается у простейших живот-
ных, беспозвоночные растут быстрее позвоночных, у боль-
шинства птиц интенсивность роста выше, чем у млекопи-
тающих, и т. д.
Таким образом, хотя внешнее проявление роста орга-
низмов чрезвычайно просто,— это очень сложный и мно-
гогранный процесс, обусловленный разнообразными внут-
ренними й внешними факторами, уровнем организации.
Глава / Среда и развитие организма
Среди многочисленных физических, химических и биоце-
нологических факторов кроме необходимых для развития
организма имеются или появляются с различной частотой
такие, которые могут существенно повлиять на ход разви-
215
тия и даже вызвать патологические изменения. В связи
с этим особую роль играет изучение защитных механиз-
мов и приспособлений, обеспечивающих относительную
устойчивость организма, а также изменчивость отноше-
ний организма к среде в ходе развития и действия факто-
"ров, вызывающих аномалии в развитии.
Иммунологические реакции
в ходе развития
Все позвоночные, от примитивных рыб до человека, име-
ют определенные системы защиты от различных инфек-
ций. Опасность вторжения во внутреннюю среду организ-
ма микроорганизмов или чужеродных макромолекул су-
ществует постоянно, и в ходе исторического развития
должны были появиться приспособления, противодейст-
вующие их вредному влиянию. Вторгающиеся в организм
чужеродные макромолекулы называют антигенами. Если
антигены проникают в кровь или лимфу, они вызывают
образование особых защитных белков — антител. Анти-
тела образуются в лимфоцитах и плазматических клет-
ках. Они способны связываться с антигеном, индуциро-
вавшим их образование, и преципитировать или инакти-
вировать его. Возникшие в результате реакции антиген —
антитело агрегаты обычно удаляются фагоцитарными
клетками организма или разрушаются системой компле-
мента, состоящей по меньшей мере из девяти имеющихся
в крови компонентов. Особую роль играет способность
антител отличать антигенные макромолекулы от нормаль-
ных компонентов организма. Длительное время представ-
лялось загадочным то, что антитела, синтезированные
в ответ на введение различных антигенов, как будто бы
не отличаются физическими и химическими свойствами, а
различаются только способностью связываться со специ-
фическим антигеном. Лишь сравнительно недавно было
установлено, что молекулы разных антител различаются
аминокислотной последовательностью, и были получены
доказательства гипотезы «разные антитела — разные пос-
ледовательности». Если антитела представляют собой
специфические белки, большинство иммунологических ре-
акций детерминировано генетически, и задача состоит
216
в том, чтобы проследить функционирование этой системы
в ходе индивидуального развития.
Есть убедительные данные об иммунологическом зна-
чении яйцевых оболочек. Собственно говоря, давно было
известно, что куриное яйцо не загнивает и не плесневеет
при длительном хранении, хотя скорлупа и подскорлупо-
вая оболочка проницаемы для бактерий и грибов. Даже
выделенная из яйца белковая оболочка (белок) долгое
время не загнивает. Было доказано, что белковая оболоч-
ка имеет иммунологическое значение (Гирфанова, 1944—
1948; Короткова, 1950-1957; Мовчан, 1961—1964). При
этом был установлен широкий диапазон антибиотическо-
го действия натуральной белковой оболочки. Выяснилось,
что опа обладает бактерицидным, протистоцидным, фун-
гицидным и фунгистатическим действиями, которые оста-
ются эффективными и после 11 дней инкубации, когда
белок смешивается с амниотической жидкостью и загла-
тывается зародышем. Это же было установлено и для бел-
ковой оболочки яиц черепахи. Сранительный анализ анти-
биотических свойств белковой оболочки яиц различных
видов птиц выявил их значительную изменчивость, что
связано с особенностями эмбрионального развития и раз-
личными экологическими условиями. Все это позволяет
заключить, что яйцевые оболочки выполняют и иммуноло-
гическую функцию, которая является защитной по отно-
шению к зародышу.
Было много попыток увязать явления иммунологии и
эмбриологии. Например, предполагалось (Тайлер, 1955,
и др.), что взаимодействие между сперматозоидом и яйце-
клеткой при оплодотворении осуществляется по типу «ан-
. тиген — антитело». Высказывалось также мнение, что по
такому же типу осуществляется межклеточное и межтка-
невое взаимодействие в ходе дифференцировки тканей и
органов, поскольку в некоторых случаях были обнаруже-
ны специфические белки, способствующие автотестирова-
нию клеток в системе ткани.
Совершенно очевидно, что в ходе эмбриогенеза нара-
стает количество синтезируемых специфических белков,
но спорным остается вопрос: возникают ли между ними
отношения по типу «антиген — антитело». Антигенная ре-
активность не свойственна эмбрионам млекопитающих,
она возникает только на поздних стадиях эмбриогенеза,
проявляясь в полной мере после рождения организма. По
217
мнению некоторых исследователей, иммунологические ре-
акции в ходе эмбриогенеза проявляются не в форме вы-
работки антител, а в виде вновь синтезированных белков,
реагирующих как антитела с онтогенетически более ста-
рыми белками — антигенами, что и является первичной
иммунологической реактивностью. Предполагается, что
появление новых специфических белков в эмбриогенезе
оказывает ингибирующее влияние на биосинтез предыду-
щих белков, и это имеет особое значение для развития за-
родыша. Иначе говоря, появление новых специфических
белков в эмбриогенезе приравнивается к появлению анти-
генов и связывается со стимулами развития. Высказыва-
лась также мысль, что зародыш отвечает на действие воз-
никающих в ходе его развития антигенов не выработкой
антител и аллергическими реакциями, а изменением про-
цессов роста и развития (Вязов, 1952, 1961).
Последние представления находят частичное подтверж-
дение в опытах по трансплантации различных тканей
зародышей, а также взрослых особей зародышам. Напри-
мер, трансплантация селезенки взрослой курицы на вне-
зародышевые оболочки и в целомическую полость кури-
ных эмбрионов стимулирует рост селезенки, сердца и пе-
чени этих зародышей. Подобная стимуляция отмечалась
и при других трансплантациях в различных вариантах.
Предполагается, что стимуляция и дифференцировка ор-
ганов в этих случаях обусловлены реакцией эмбриона на
антигены трансплантата. По мнению некоторых авторов
(Аверкин, 1956; Конюхов, 1957), в ходе эмбрионального
развития должно быть по крайней мере три типа антиге-
нов: 1) видоспецифические антигены, имеющиеся на всех
стадиях развития и отражающие «видовую специфику
процесса развития»; 2) стадиоспецифические, появляю-
щиеся на определенных стадиях развития и исчезающие
при переходе к новым стадиям; 3) органоспецифические,
появляющиеся в период закладки и развития того или
иного органа. Используя серологические реакции,
Р. Ф. Аверкин и Б. В. Конюхов убедились в совпадении
изменений антигенной характеристики с морфогенетиче-
скими преобразованиями на определенных этапах разви-
тия органов и организма.
Рассмотренные нами представления интересны, но
они нуждаются в экспериментальной проверке, поскольку
в этом сложном вопросе есть еще много спорных момен-
218
тов. По имеющимся данным, рано делать заключение об
общих закономерностях становления иммунитета в ходе
развития. Дело в том, что антигенная реактивность, вы-
ражающаяся в образовании антител, четко выражена
в постэмбриональном периоде у птиц и млекопитающих,
но ее нет у эмбрионов этих животных. Возникает сомне-
ние относительно возможности признать антигенную ре-
активность фактором формообразования для эмбрионов
всех животных, особенно если нс будет доказано наличие
так называемой первичной иммунологической реактивно-
сти. По мнению Б. II. Токипа, проблема иммунитета эм-
брионов является частью сравнительной эмбриологии и
призвана решать следующие основные вопросы: 1) како-
вы защитные механизмы эмбрионов различных живот-
ных; 2) когда и как в ходе онтогенеза проявляются раз-
личные иммунологические свойства; 3) какова связь меж-
ду иммунологическими реакциями и морфогенетическими
процессами. Третий вопрос неизбежно вытекает из того,
что в индивидуальном развитии иммунологические свой-
ства появляются как необходимые факторы развития. Из-
вестно, что в ходе исторического развития иммунологиче-
ские свойства возникали па основе более общих функций
и адаптаций (так, фагоцитарные реакции образовались
на основе внутриклеточного пищеварения). Не исключе-
но, что и большинство иммунологических свойств, меняю-
щихся в ходе эмбриогенеза, являются различными сторо-
нами закономерностей самого эмбрионального развития и
необходимы для морфогенетических процессов. Все имму-
нологические свойства следует рассматривать как факто-
ры, поддерживающие определенные состояния интегра-
ции организма на разных стадиях его развития (Токин,
1959).
Рассмотрим некоторые примеры, иллюстрирующие
значение иммунологических реакций в морфогенезе. Еще
И. И. Мечников и А. О. Ковалевский при изучении мета-
морфоза у некоторых беспозвоночных и позвоночных жи-
вотных установили, что личиночные ткани дегенерируют
при непосредственном участии клеток с фагоцитарными
свойствами. Затем это было подтверждено и многими дру-
гими исследователями на различных объектах. Фагоци-
тарные реакции присутствуют и в процессах регенерации,
во время которых неизбежно происходит дегенерация
клеток и клеточных структур, «пожираемых» фагоцита-
219
ми. В данном случае функция фагоцитов выглядит как
«санитарная», но поскольку без нее невозможен процесс
регенерации, она имеет и формообразовательное значе-
ние. Морфогенетическое значение фагоцитарных и воспа-
лительных реакций было доказано при изучении процес-
сов нормального развития организмов, например при фор-
мировании органа слуха (Филатов, 1935) и выделительной
системы у позвоночных (Кричинская, 1965), яйцекле-
ток у гидр (Токин, 1954) и др.
Есть данные (Токин, Филатова, 1953, и др.) об антиби-
отических свойствах развивающихся яйцеклеток млекопи-
тающих. Бактерицидными свойствами обладает и жид-
кость полости бластоцисты. Такие свойства потенциально
явно иммунологические и имеют большое значение в про-
цессах имплантации. Продуцируемые бластоцистой анти-
биотические вещества действуют на сенсибилизирован-
ную гормонами матку, принимают участие в лизисе эпи-
телия и являются одним из факторов, вызывающих
децидуальную реакцию со стороны тканей стенки матки
(Токин, 1970).
Результаты ряда исследований позволяют в общих
чертах представить динамику иммунологических свойств
в ходе эмбриогенеза. Эти данные были получены на амфи-
биях, птицах и млекопитающих при введении в кровяное
русло и ткани эмбрионов в разные периоды их развития
инородных тел (тушь, кармин, кизельгур, целлоидиновые
иголочки) с последующим изучением фагоцитарных ре-
акций и возможности воспаления. Было установлено, что
воспалительная реакция в ответ на введение инородных
тел появляется у зародыша курицы примерно на второй
день инкубации. В связи с клеточной и тканевой диффе-
ренцировкой характер воспалительной реакции усложня-
ется. Неправильным оказалось мнение, что воспаление
свойственно только взрослым организмам. В результате
опытов с введением в вену желточного мешка эмбриона
курицы бактерий или взвеси туши (Кричинская, 1954)
с последующим гистологическим анализом было установ-
лено, что высокой фагоцитарной активностью обладают
клетки эндотелия сосудов печени, селезенки, сердца,
желточного мешка и аллантоиса. Значит, «защитный
фагоцитоз» как явление иммунитета возникает в онто-
генезе на основе «физиологического фагоцитоза» (Дон-
дуа, 1957).
220
Причины аномалий в развитии
В ходе развития организмы подвергаются действию раз-
личных внешних и внутренних факторов, которые могут
вызвать аномалии. В последние десятилетия успешно раз-
вивается тератология — наука, изучающая нарушения
в развитий, знание причин которых прежде всего необхо-
димо для медицины.
Причины аномалий в развитии очень разнообразны и
условно их можно разделить па три группы: 1) действие
на зародыши экзогенных (тератогенных) факторов; 2) ге-
нотипические изменения (мутационный процесс); 3) сов-
местное действие указанных факторов. Обычно на разви-
вающийся и взрослый организмы действует совокупность
разнообразных факторов и часто трудно выявить истин-
ную причину аномалий в развитии. Однако уже имеется
обширная информация о тератогенном действии различ-
ных факторов.
Относительно хорошо изучено действие ионизирующей
радиации. Можно сказать, что с изучения действия на
организмы этого физического фактора, который является
абсолютным тератогеном, началась современная терато-
логия. Все живое на Земле постоянно подвергается дей-
ствию различных излучений (космическое излучение, из-
лучение Солнца, Земли и атмосферы). Эти виды излуче-
ний в той или иной мере проникают в живую материю, от-
дают ей свою энергию, а при повышенных дозах могут
привести к изменениям или тяжелым повреждениям кле-
ток. Изучение действия излучений на живые клетки и ор-
ганизмы в настоящее время широко проводится биофизи-
ками, биохимиками, цитологами, генетиками, эмбриоло-
гами и медиками. Особое значение эти исследования
приобретают в связи с широким использованием атомной
энергии в науке и технике.
Лучевое поражение организма начинается на молеку-
лярном и клеточном уровнях. Прежде всего возможны
повреждения генетического аппарата клетки (генов, хро-
мосом, геномов), что значительно увеличивает частоту ле-
тальных и вредных мутаций. Клетки, находящиеся в'мито-
зе, наиболее чувствительны к облучению, а таких клеток
много в период эмбрионального развития. В постэмбрио-
нальный период у животных и человека митотическая ак-
тивность характерна для клеток кроветворных органов,
221
камбиальных клеток некоторых тканей, а также клеток
яичников и семенников. Следовательно, повышенные дозы
облучения являются опасными в любой период онтоге-
неза.
Тератологическое действие других физических факто-
ров на генетический аппарат клетки (вибрация, радиовол-
ны, ультразвук и др.) изучено недостаточно.
В современных условиях быстро увеличивается коли-
чество химических воздействий на организмы, среди ко-
торых могут быть абсолютные или потенциальные тера-
тогены. Прежде всего следует отметить фармакологиче-
ские вещества, все шире используемые в медицинской
практике. Введение новых лекарственных средств без
должной их проверки на тератогенность очень опасно.
Достаточно вспомнить печальную историю с толидамидом
(снотворное средство) в ФРГ в 1959 г., когда у прини-
мавших его во время беременности женщин рождались
уродливые дети.
С учетом возможной опасности действия новых фарма-
кологических средств и продуктов химической промыш-
ленности был принят международный закон, согласно ко-
торому все химические вещества, выпускаемые в продажу
или используемые в промышленности и сельском хозяйст- ,
ве, должны пройти предварительную проверку на терато-
генность по единой методике. Обычно новые препараты
испытываются на беременных животных (кролики, мор-
ские свинки и др.). Правда, еще имеется много трудностей
в разработке единых тестов для оценки тератогенности и
возможности переноса этих данных на человека.
В связи с этим появились такие специализированные
области, как фармакологическая эмбриология и генетика.
Последняя исследует не мутагенное действие разных пре-
паратов, а различия в индивидуальных реакциях на них,
обусловленные генетическим полиморфизмом. Было до-
казано, что необычные и даже токсичные реакции на пре-
параты являются наследственно обусловленными и их
можно предсказать.
Обязательной проверке на цитогенетическое и терато-
генное действие подлежат все промышленные химические
вещества и ядохимикаты, используемые в сельском хозяй-
стве. Например, широкое использование в сельском хо-
зяйстве в послевоенные годы ДДТ и других хлорирован-
ных соединений для борьбы с вредителями и сорняками
222 !
не только привело к нежелательным изменениям в био-
ценозах, но и сказалось в отдельных случаях на индиви-
дуальном развитии ряда растений и животных. Накапли-
ваясь в почве и растениях, ядохимикаты попадают в ор-
ганизм животных и человека. Это, например, нарушило
в организме многих хищных птиц кальциевый обмен,
в результате чего скорлупа яиц стала хрупкой и разла-
мывалась до вылупливания птенцов. Опасным является
и то, что концентрация ДДТ в женском молоке в США
превышает сейчас установленные пределы.
Тщательно должны проверяться па тератогенность и
токсичное действие многочисленные продукты бытовой
химии (например, моющие средства) и различные пище-
вые добавки (красители для напитков и кондитерских
изделий, цикломаты как заменители сахара и т. д.). На-
пример, было установлено, что добавление при приготов-
лении крема ЭДТА (версена) опасно, так как его дейст-
вие может привести к аномалиям в развитии уха и нерв-
ной системы. По биохимическим данным, ЭДТА
связывает магний и Цинк, необходимые для ряда фер-
ментов и других соединений. Его действие может также
увеличить частоту хромосомных перестроек.
Соответствующим международным соглашением пре-
дусмотрено, что вся информация о действии па организм
различных препаратов и химических продуктов должна
поступать в специальные центры и храниться там в памя-
ти ЭВМ.
Нарушать развитие могут и различные биогенные фак-
торы, среди которых наиболее опасными являются инфек-
ционные агенты. Так, вирус краснухи может индуциро-
вать аномалии в делении клеток и хромосомные пере-
стройки. По имеющимся данным, вирусы гепатита и
гриппа также могут оказывать тератогенное действие, а
микробные инфекции в этом отношении менее опасны.
Ряд заболеваний, вызванных простейшими, также опас-
ны для развития. Например, токсоплазмоз в некоторых
случаях приводит к нарушениям в развитии нервной си-
стемы и органов зрения.
Сложным является вопрос о критических стадиях
в развитии тератогенного и токсического действия различ-
ных абиотических и биотических факторов. Нет такой
стадии, чтобы зародыш не был устойчив к каким-либо
агентам, но эта устойчивость относительна. Должны быть
223
и критические стадии в развитии, но для различных аген-
тов они не совпадают по времени. В связи с этим действие
каждого агента необходимо испытывать на всех стадиях
развития зародыша.
Перед современной тератологией стоит очень много
сложных и важных задач, связанных с проблемой охраны
окружающей среды. Их решение необходимо для предуп-
реждения аномалий в развитии.
Бесполое размножение,
8 соматический эмбриогенез
и регенерация
Бесполое размножение
у растений и животных
Бесполое, или вегетативное, размножение — это размно-
жение без участия женских и мужских гамет, при кото-
ром новый организм развивается из соматических клеток.
Поскольку при бесполом размножении не происходит
слияния генетически разнородных гамет (амфимиксис),
новый организм оказывается генетически идентичным ис-
ходному материнскому организму. У ботаников и зооло-
гов имеются некоторые различия в трактовке бесполого
размножения. Например, ботаники собственно-бесполым
размножением иногда считают только случаи развития
организмов из спор, а термином «вегетативное размноже-
ние» обозначают только развитие новых организмов из
вегетативных почек, отводков, корневищ, клубней, черен-
ков, укоренившихся листьев и т. д. Часто все способы вос-
произведения растений без процесса оплодотворения объ-
единяются под общим названием апомиксис (от греч.
аро—без, mixis— смешение) в противоположность ам-
фимиксису. Апомиксис разделяют на четыре типа: 1) не-
регулярный, когда зародыш развивается из нормальной,
но неоплодотворенной яйцеклетки (гаплоидный партено-
генез) или из других клеток женского гаметофита (гапло-
идная апогамия); обычно образуются гаплоидные сте-
рильные растения и процесс апомиксиса не повторяется
224
в следующих поколениях; 2) регулярный, когда зародыш
развивается из клеток археспория, нс прошедших мейоз
(генеративная апоспория), из клеток нуцеллуса (сомати-
ческая апоспория), из клеток зародышевого мешка с не-
редуцированным числом хромосом (диплоидный партено-
генез при развитии зародыша из нередуцированной яйце-
клетки и диплоидная апогамия при развитии его из
других нередуцировапных клеток гаметофита); 3) адвен-
тивная эмбриония, или спорофитное почкование, когда не-
зависимо от способа образования зародышевого мешка и
числа хромосом зародыши развиваются не из клеток
гаметофита, а из клеток пуцеллуса или интегументов
семяпочки, т. е. из диплоидных клеток родительского
спорофита; 4) все случаи истинного вегетативного раз-
множения.
Такая широкая общая трактовка апомиксиса спра-
ведлива, если все связывать с отсутствием процесса опло-
дотворения при воспроизведении. Однако следует учиты-
вать, что споры, клетки археспория, а также клетки заро-
дышевого мешка, являются ли они гаплоидными или
диплоидными, нельзя полностью приравнивать к сомати-
ческим клеткам. Значит, говоря о вегетативном размноже-
нии, можно не включать в это понятие все случаи размно-
жения спорами, различные виды партеногенеза и апоспо-
рии, а если включать, то с известными оговорками. В ли-
тературе по ботанике можно встретить оба подхода, из
которых один более общий, а другой с учетом частных
особенностей воспроизведения у растений без процесса
оплодотворения.
У зоологов также имеются различные подходы к трак-
товке бесполого размножения. Например, некоторые эм-
бриологи животных развитие нового организма из сома-
тических клеток называют бластогенезом в отличие от
эмбриогенеза. В ряде случаев термин «бластогенез» упот-
ребляется в совершенно ином смысле: им обозначают на-
чальные стадии развития млекопитающих и человека.
Встречается также и термин «бластозооид», которым
обозначают организмы, развивающиеся в результате бес-
полого размножения. Существование различной термино-
логии с иногда меняющейся смысловой нагрузкой не-
сколько затрудняет понимание сути вопроса, но если
учитывать то обстоятельство, что бесполое размножение
всегда обеспечивается одной особью, а в половом воспро-
15 Зак. 918
225
изведении, как правило, принимают участие Две особи
(женская и мужская), то вполне можно разобраться в
этой разнообразной терминологии и конкретизировать
свое отношение к ней.
Бесполое размножение широко распространено в ра-
стительном мире и его даже можно считать одним из
важных признаков многих видов растений. В мире живот-
ных оно менее распространено. Этот способ размножения
растений и животных изучен гораздо хуже,- чем половое
воспроизведение. Прежде всего неясным остается вопрос:
каким образом соматические клетки переходят к форми-
рованию зародыша нового организма и какова степень
сходства морфогенетических процессов при бесполом и
половом воспроизведений.
Бесполое размножение у простейших обычно происхо-
дит путем деления (продольного или поперечного) и поч-
кования. Для некоторых видов амеб, инфузорий и споро-
виков характерна так называемая палинтомия — множе-
ственное повторное деление, которому предшествует
многократное деление ядер (синтомия), а затем материн-
ское тело расчленяется на ряд одноядерных клеток (не-
подвижных спор или подвижных зооспор).
Почкование может быть простым и множественным.
В первом случае образуется одна почка, а во втором от
материнского организма отделяется одновременно не-
сколько почек. У некоторых инфузорий отмечено «внут-
реннее почкование», «живорождение», при котором почки
появляются внутри особей и превращаются в самостоя-
тельный организм в теле материнской особи.
У многоклеточных животных обычно выделяют пять
способов бесполого размножения: 1) поперечное или про-
дольное разделение материнских особей; 2) лацерацию;
3) почкование; 4) внутреннее почкование; 5) образование
столонов. Известны два способа разделения многоклеточ-
ных организмов: 1) архитомия, когда разделение мате-
ринского организма происходит без предварительной
дифференцировки отделяющейся части в новую особь; 2)
паратомия, когда дочерние особи отделяются от материн-
ского организма вполне сформированными. Паратомия
встречается значительно чаще. Имеются и особые случаи
разделения. Например, у специфистом сцифомедуз раз-
деление материнской особи начинается в нескольких ме-
стах (множественное деление), при этом образуется стро-
226
била, расчленяющаяся затем на многие особи. Такой спо-
соб бесполого размножения называется стробиляцией.
При лацерации наблюдается отделение от материнского
организма бесформенных участков тканей (у некоторых
актиний и губок), которые развиваются в новый орга-
низм. Пожалуй, самый распространенный способ бесполо-
го размножения животных почкование, которое харак-
терно для губок, кишечнополостных, мшанок, некоторых
червей и других беспозвоночных. Проявление почко-
вания очень разнообразно, однако общим признаком яв-
ляется то, что формирование, новой особи всегда начина-
ется из относительно небольшой части материнской
особи.
У некоторых губок, мшанок и асцидий иногда проис-
ходит внутреннее почкование. Так, для губок характерны
дезинтеграция и распад части тела с образованием так
называемых геммул, представляющих совокупность одно-
родных клеток. Геммулы покрываются сложной много-
слойной оболочкой и перезимовывают в дегенерировав-
шем теле матери, покидают последнее весной и развива-
ются в новые губки. У морских губок образуются не
геммулы, а несколько отличающиеся от них сориты, даль-
нейшее развитие которых происходит сходно с геммула-
ми. Внутреннее почкование у мшанок связано с образова-
нием статобластов, которые благодаря наличию плотной
капсулы хорошо перезимовывают и весной дают начало
новым особям. Размножение столонами сводится к обра-
зованию особых выростов (столонов). На них формируют-
ся зачатки («почки») новых особей. От почкования этот
способ размножения отличается только образованием
столонов. Он характерен для некоторых гидроидов и ко-
лониальных асцидий.
Так же как и у растений, бесполое размножение у жи-
вотных сходно с явлением полиэмбрионии, которую мож-
но считать одной из форм бесполого размножения. Поли-
эмбрионию у животных впервые описал И. И. Мечников,
наблюдавший расщепление бластул у медузы. Затем по-
лиэмбриония в различных вариантах отмечалась у ряда
беспозвоночных и позвоночных животных. Возможность
полиэмбрионии у многих животных была доказана опы-
тами по изоляции бластомеров. У высших позвоночных и
человека примерами полиэмбрионии являются случаи
развития однояйцевых близнецов, образующихся в ре-
15*
227
зультате разделения бластулы на ранних стадиях раз-
вития.
Способность к бесполому размножению прежде всего
связана со степенью интеграции организмов. Для пере-
хода к бесполому размножению необходима хотя бы де-
дифференцировка части клеток каких-либо тканей и вы-
ход их из-под контроля на тканевом и организменном
уровнях. Эти явления могут обеспечить реализацию от-
дельными клетками их морфогенетических.потенций при
формировании нового организма. При бесполом размно-
жении у животных развитие новой особи происходит из
группы клеток, которую можно сравнить с зародышем на
стадии бластулы. Возможность развития целого организ-
ма у животных из одной соматической клетки, как это
было показано на растениях, еще не доказана.
Развитие целых организмов из отдельных соматиче-
ских клеток или из их комплексов в экспериментальных
условиях называют соматическим эмбриогенезом. Его не
следует отождествлять с явлением регенерации, т. е. вос-
становлением утраченного, а не развитием нового орга-
низма. Соматическому эмбриогенезу обязательно пред-
шествует дезынтеграция взаимосвязанных клеточных си-
стем, тканей, органов или всего организма. Соматический
эмбриогенез экспериментально легко вызвать у менее ин-
тегрированных организмов с хорошо выраженным беспо-
лым размножением.
Эксперименты по соматическому эмбриогенезу у жи-
вотных широко проводятся с начала XX в. Наиболее
удобными для этого объектами являются губки, кишечно-
полостные, различные черви и асцидии. Методически та-
кие эксперименты сводятся к обеспечению развития цело-
го организма из диссоциированных клеток или изолиро-
ванных отдельных частей организма. При интерпретации
результатов этих экспериментов часто возникают затруд-
нения в связи с расчленением явлений регенерации и со-
матического эмбриогенеза. Считать, что мы имеем делб
с соматическим эмбриогенезом, можно лишь тогда, когда
есть полная уверенность, что образованию новой особи
предшествовала дезынтеграция и дедифференцировка
клеток или группы клеток какой-либо ткани. Не исклю-
чена также возможность соматического эмбриогенеза и
близких к нему явлений и у более сложных организмов
в определенные периоды их развития. Сюда можно отне-
228
сти возможность развития целых организмов из изолиро-
ванных бластомеров, опыты по индукции полиэмбрионии
у амфибий и птиц различными воздействиями, эмбриомы
у млекопитающих (опухоли, часто состоящие из произ-
водных всех зародышевых листков) и т. д.
Регенерация у растений
и животных
Под регенерацией обычно понимают восстановление ор-
ганизмом утраченной части. Этот процесс можно опреде-
лить так же как повторное развитие, вызванное повреж-
дением. Регенерация сходна с двумя основными способа-
ми бесполого размножения (когда новый организм
развивается из части материнского организма или внутри
его). Соматический эмбриогенез тоже сходен с регенера-
цией, и некоторые авторы считают его одним из способов
этого процесса. Действительно, регенерацию можно
сравнить с эмбриональным развитием, но такое сходство
не полное, так как повторное развитие обычно происхо-
дит с отклонениями (например, конечность у тритона ре-
генерирует без восстановления нервной системы и т. д.).
Процессы регенерации в той или иной форме харак-
терны для всех организмов, поскольку в любом организме
постоянно наблюдается множество существенных измене-
ний. В ходе жизнедеятельности непрерывно распадаются
и вновь синтезируются различные химические соедине-
ния, многие клетки дегенерируют и заменяются новыми,
естественная гибель клеток компенсируется процессами
роста и т. д. Постоянно происходящие процессы обновле-
ния функционирующих тканей и органов называют физи-
ологической регенерацией, примеров которой имеется
очень много (замена дегенерирующих эритроцитов, заме-
на поверхностных слоев кожи, смена перьев или шерст-
ного покрова, регенерация эпителия матки в связи с мен-
струальным циклом и т. д.).
У животных выделяют три способа регенерации: 1)
эпиморфоз, когда частично происходит повторное разви-
тие утраченного органа (например, развитие культи ко-
нечности у амфибий); 2) морфаллаксис— развитие цело-
го организма из части тела, как при разделении тела пла-
нарии; 3) регенерационную гипертрофию, когда остав-
шаяся часть органа гипертрофируется, восстанавливая
229
массу, а не развивается повторно (этот способ регенера-
ции характерен для внутренних органов).
В литературе по ботанике в понятие регенерации
обычно включают различные процессы, начиная от за-
живления ран до образования адвентивных (придаточ-
ных) органов и вегетативного размножения с участием
различных органов и частей растения. Вопрос несколько
запутывается в связи с тем, что у растений на протяжении
всего онтогенеза сохраняются эмбриональные ткани —
меристемы, всегда способные к формообразованию. Так,
среди ботаников широко распространено мнение, что у
высших растений имеются три типа регенерации: 1) пере-
стройка, или собственно регенерация, т. е. реорганизация
эмбриональной ткани, при которой восстанавливается ее
первоначальное строение; обычно это связано с истинны-
ми эмбриональными участками (точки роста и молодые
зародыши); 2) восстановление — разнообразные случаи,
когда отсутствующие ткани замещаются за счет мери-
стем, возникающих в соседних участках (например, про-
буждение спящих почек и зачатков или формирование но-
.вых, как это наблюдается при образовании новых корней
и побегов); 3) репродуктивная регенерация, или вегета-
тивное размножение, включая отделение естественным
путем вегетативной части растения («почкование») с об-
разованием нового растения.
При таком подходе в понятие регенерации включают-
ся разнообразные явления. Все формообразовательные
процессы, непосредственно связанные с деятельностью
меристем, можно отнести к вторичному эмбриогенезу, а
случаи формообразования с предварительной дедиффе-
ренцировкой— к соматическому эмбриогенезу. Справед-
ливым следует признать мнение, что собственно регене-
рация у растений выражается в довольно примитивных по
сравнению с животными процессах, являющихся по своей
сути защитными (например, «заживление» раны, образо-
вание каллуса, формирование пробковой ткани и т. д.).
Собственно же восстановление какого-либо органа из не-
большой его части у растений не наблюдается.
Регенерация у беспозвоночных и позвоночных живот-
ных имеет ряд общих особенностей, очень сходных с неко-
торыми явлениями эмбрионального развития. Прежде
всего регенерация начинается под влиянием какого-либо
стимула, в процессе регенерации отмечаются миграции и
230
морфогенетические движения клеток, наблюдаются такие
же изменения динамики клеточных популяций и взаимо-
действия тканей, как и в эмбриогенезе, происходят прог-
рессивная детерминация, рост и дифференцировка. Прин-
ципиальным отличием процессов регенерации от зароды-
шевого развития является наличие дифференцированных
тканей взрослого организма, его гормональной и нервной
систем.
Репаративная регенерация встречается у многих
групп животных. Отсутствие способности регенерировать
у некоторых животных пока еще по объяснено, хотя эк-
спериментально регенерацию удавалось вызывать. Для
каждого морфогенетического процесса необходим опреде-
ленный стимул (индукция). Например, стимулом для раз-
вития яйцеклетки является сперматозоид, для развития
нервной системы необходим стимул, исходящий от хордо-
мезодермы, и т. д. Однако во многих случаях удавалось
в эксперименте заменить эти стимулы воздействием раз-
личных физических или химических факторов. В ряде слу-
чаев удавалось, например, вызвать регенерацию конечно-
сти лягушки, хотя в норме она нс регенерирует. После
ампутации конечности лягушки культя обычно заживает
и при этом не образуется бластема, необходимая для фор-
мообразования. Иначе говоря, обычного стимула рассече-
ния тканей в данном случае недостаточно для начала ре-
генерации. Коротко остановимся на особенностях регене-
рационной бластемы и происхождении клеток, участвую-
щих в регенерации.
В начале процесса регенерации у животных характер-
но накопление клеток в месте повреждения, совокупность
которых называют бластемой. Так, у плоского червя пла-
нарии имеется популяция недифференцированных клеток,
сохраняющихся в эмбриональном состоянии и являющих-
ся тотипотентными. Эти клетки называются необластами.
При удалении части тела плапарии необласты активно
делятся и мигрируют к месту повреждения, образуя там
регенерационные бластемы, на основе которых дифферен-
цируются утраченные органы. У гидроидных полипов
в эктодерме имеются интерстициальные клетки, ведущие
себя при регенерации так же, как и необласты у плана-
рий. При регенерации какого-либо органа у хвостатых ам-
фибий (например, конечности) фибробластоподобные
клетки бластемы возникают после дедифференцировки
231
клеток ткани культи. Следовательно, бластема образует-
ся либо за счет особых клеток (как у планарий и гидроид-
ных полипов), либо в результате частичной дедифферен-
цировки клеток тканей в зоне повреждения.
Вернемся к опыту с ампутацией конечности лягушки.
Мы уже отметили, что само рассечение ткани в данном
случае не является стимулом для регенерации, но если
раневую поверхность обрабатывать солевыми растворами
или периодически нагревать, образуется бластема, кото-
рая начинает дифференцироваться и замещает утрачен-
ную конечность. Отсутствие регенерации конечностей у
взрослых бесхвостных амфибий прежде всего зависит от
характера взаимодействий между тканями культи и ле-
жащими над ними слоями эпидермиса. Например, после
ампутации конечности у аксолотля ее регенерация всегда
происходит с образованием раневого эпителия. Если же
при ампутации сохранить кусочек кожи и натянуть ее на
ранку, регенерация конечности не происходит, т. е. она
блокируется, если ранка сразу покрывается кожей. У ля-
гушки при заживлении ранки эпидермис и дерма доволь-
но быстро смыкаются над раневой поверхностью, что и
блокирует регенерацию. Действие же солевыми раствора-
ми и периодическое нагревание препятствуют образова-
нию слоя дермы над раневой поверхностью, а также по-
вышают чувствительность тканей культи к нервному вли-
янию. Возможно, это и обеспечивает регенерационные
процессы. Влияние нервов на регенерацию конечностей
было показано в опытах с аксолотлем, у которого регене-
рация начинается после врастания в остаток конечности
порогового числа нервных волокон. Путем увеличения
числа нервных волокон удавалось индуцировать и регене-
рацию хвоста у ящерицы. Имеющиеся данные позволяют
предположить, что организмы не утрачивают полностью
способности к регенерации, а дедифференцировка и про-
лиферация клеток блокируются особыми условиями за-
живления повреждения, иннервации и действия гормонов
в зоне повреждения.
Вопрос о происхождении регенерационного материала,
особенно у высших животных, довольно сложный. Рань-
ше считалось, что поскольку при регенерации происходит
повторное развитие органа или части тела, то должны
быть эмбриональные клетки. Это либо эмбриональные
клетки, остающиеся с периода эмбриогенеза (гипотеза
232
резервных клеток), либо возникшие в результате дедиф-
ференцировки специализированных клеток до эмбрио-
нального состояния.
Гипотеза резервных клеток все больше утрачивает
своих сторонников, так как на многих опытах было пока-
зано, что эмбриональные клетки не сохраняются. Малове-
роятной представляется теперь и дедифференцировка спе-
циализированных клеток до полного эмбрионального со-
стояния. Регенерациоппым материалом могут быть и
специализированные клетки. Например, доказана воз-
можность перехода ряда специализированных клеток
(хрусталик, радужные клетки, сетчатка, пигментный
эпителий и др.) к другому типу клеток.
Обновление же клеток ряда тканей за счет камбиаль-
ных систем — это особые случаи, относящиеся к физиоло-
гической регенерации.
Изменилось также представление о том, что регенера-
ционная способность падает по мере повышения уровня
организации животных. У высокоорганизованных живот-
ных масштаб регенерации действительно уменьшается,
что не означает полной утраты данной способности. Су-
ществовало разногласие по этому вопросу между биоло-
гами и медиками. Последние считали, что восстановление
внутренних органов — принципиально иной вид регенера-
ции (тканевая регенерация). На самом же деле это реге-
нерационная гипертрофия, т. е. один из способов регене-
рации, свойственный в различной степени почти всем
внутренним органам высших животных и человека.
Опыты по регенерации позволяют убедиться, что ча-
сти организма имеют четко выраженную полярность. Так,
при поперечном рассечении гидроидного полипа, у кото-
рого есть подошва для прикрепления к субстрату, относи-
тельно длинное тело и венчик щупалец, можно наблю-
дать, как на апикальном конце образуются щупальца, а
на другом, базальном, подошва. Эта полярность очень
сходна с анимально-вегетативной полярностью яйца мор-
ского ежа и передне-задней полярностью конечности
амфибий. При экспериментальных воздействиях такую
полярность можно изменить. Например, если на разделен-
ные части тела гидроидного полипа подействовать раз-
личными концентрациями кислорода, полярность при ре-
генерации изменяется. Организация тканей у гидроидного
полипа лабильна, что проявляется при разделении части
233
его тела надвое с помощью лигатуры. При этом щупаль-
ца начинают образовываться на обоих концах и из одного
кусочка ткани можно получить две особи, подобно обра-
зованию двух зародышей при разделении надвое яйца
или двух конечностей в результате разделения надвое ее
зачатка.
Существует мнение, что термин «регенерация» не сле-
дует использовать по отношению к процессам, происходя-
щим после травмирования зародыша, ещё не имеющего
четко дифференцированных тканей, и в этом случае пра-
вильней пользоваться термином «эмбриональные регуля-
ции». Пожалуй, более справедливым является мнение о
том, что регенерация возможна на всех стадиях развития,
и нельзя утверждать, что с возрастом организма падает
регенерационная способность.
Появление способности к регенерации у растений и
животных справедливо рассматривают как результат
естественного отбора, хотя и кажется маловероятным, что
длительный процесс конкуренции и отбора обеспечили по-
явление адаптаций, позволяющих восстановить почти лю-
бой тип повреждений. Исторически первичной явилась
физиологическая регенерация, возникшая на основе об-
менных процессов у примитивных живых систем. По-ви-
димому, па основе физиологической регенерации появи-
лись примитивные формы репаративной регенерации,
дальнейшие преобразования которой были и остаются
тесно связанными с физиологической регенерацией, пре-
образованиями других защитных механизмов, способов
размножения, продолжительностью жизни особей и т. д.
Заключение
Методологической основой биологии индивидуального
развития, как и других биологических наук, выступает
эволюционная теория. Изучение оптогенезов различных
организмов может быть успешным, если они рассматри-
ваются как результат исторического развития. Первым
важным обобщением относительно связи между индиви-
дуальным и историческим развитием явился биогенетиче-
ский закон, по которому онтогенез есть краткое повторе-
ние основных этапов филогенеза.
Известные факты, отражающие повторение в онтоге-
незе основных этапов филогенеза, можно условно раз-
делить на две основные группы: 1) повторение в онтоге-
незе общего пути исторического развития живой природы
от простого к сложному; это выражается, например, в
том, что и в филогенезе, и в онтогенезе развитие обычно
начинается с одной клетки и завершается сложно диф-
ференцированным многоклеточным организмом; 2) по-
вторение в онтогенезе потомков строения далеких пред-
ков (например, все эмбрионы наземных позвоночных па
определенных этапах эмбриогенеза имеют жаберные
щели и другие сходные с далекими предками черты).
Таким образом, фактический материал доказывал, что
в ходе индивидуального развития наблюдается повторе
ние (рекапитуляция) не только общего поступательною
пути филогенеза от простого к сложному, но и некоторых
конкретных особенностей далеких предков.
Чисто описательные методы исследования дают воз-
можность накопить фактический материал, но не позво-
ляют в большинстве случаев выявить причины наблюдае-
мых явлений. Причинный анализ соотношения между
235
онтогенезом и филогенезом стал возможен только при
комплексных исследованиях с широким использованием
методов сравнительной анатомии, эмбриологии, генетики,
цитологии, молекулярной генетики и биохимии. Только
при таком комплексном подходе можно выявить причин-
ные взаимосвязи между онтогенетическими и филогене-
тическими дифференцировками.
Все эволюционные преобразования практически осу-
ществляются через онтогенетические дифференцировки
(от изменений генотипа и фенотипа к дифференцировкам
на уровне популяций). Часто бывает трудно провести
грань между онтогенетическими и филогенетическими
дифференцировками. Основное отличиефилогенетичсских
дифференцировок от онтогенетических заключается в том,
что они завершаются образованием изолированных форм,
приобретающих собственную эволюционную судьбу. Он-
тогенетические же дифференцировки — это расчленение
структур, органов, систем или индивидуального развития
в целом на отдельные соподчиненные части и стадии.
Изучение онтогенетических дифференцировок идет в двух
планах: 1) сравнительное изучение различных стадий раз-
вития одной особи; 2) сравнительное изучение индиви-
дуального развития генетически родственных форм.
Устойчивость индивидуального развития определяется
сложной системой взаимосвязей, носящих в основном ре-
гуляторный характер: 1) развитие по генетической прог-
рамме; 2) развитие соответственно определенным внеш-
ним условиям, т. е. в зависимости от внешних факторов;
3) регуляция в собственном смысле, т. е. корректировка
развития в пределах нормы при возможных нарушениях
по различным причинам. Такое регулирование характер-
но для самонастраивающихся систем.
Программное регулирование детерминировано геноти-
пической нормой реагирования в определенных условиях
существования. Оно осуществляется в пределах этой нор-
мы с некоторыми модификациями. Наиболее приемлемой
в настоящее время теорией, объясняющей последователь-
ные дифференцировки в ходе индивидуального развития,
является теория дифференциальной активности генов.
В ходе индивидуального развития особое значение
имеет эмбриональная индукция — постоянное организую-
щее действие формирующихся частей зародыша на 'зак-
ладку и развитие других частей. При этом судьба отдель-
236
ной клетки ограничена лктпнпиП чагнио er генетической
информации, а судьба нсего iMhpiiuiia и взрослого орга-
низма зависит от более сложной и iihiciiieii информации
взаимодействующих закладок и дифференцировок, а так-
же от их взаимосвязей и влияний па геномы и цитоплазму
отдельных клеток.
Все онтогенетические дифференцировки в пределах
исторически сложившейся нормы являются результатом
последовательной реалнаацнп генетической информации.
Они непосредственно связаны с адаптациями или явля-
ются исходными для будущих адаптаций. Па основе онто-
генетических дифференцировок осуществляются переходы
к филогенетическим дифференцировкам, завершающимся
образованием независимых групп организмов, и их биоло-
гический смысл сводится к более полному использованию
среды обитания. Направление филогенетических диффе-
ренцировок определяется следующими обстоятельствами:
1) изменением среды обитания, что неизбежно сказыва-
ется на ходе элементарных микроэволюционных процес-
сов; 2) особенностями существующих онтогенетических
дифференцировок, определяющих реакцию организмов
на изменение среды обитания и возможные перестройки
существующей организации. Основой же филогенетиче-
ских дифференцировок является генотипическая изменчи-
вость, фенотипическое выражение которой имеет адаптив-
ное значение в изменившихся условиях.
Онтогенетические и филогенетические дифференциров-
ки, а точнее их взаимосвязь, отражают один из основных
принципов развития органических форм, суть которого
сводится к разделению первоначально относительно одно-
родного па обособленные части. Следовательно, биология
индивидуального развития не только использует эволю-
ционную теорию как методологическую основу, но и обо-
гащает ее фактическим материалом.
Рекомендуемая литература
Астауров Б. Л. Цитогенетика развития тутового шелкопряда и
ее экспериментальный контроль. М., 1968.
Биология развития растений. Под ред. М. X. Чайлахяна. М., 1975.
Бодемер Ч. Современная эмбриология. М., 1971.
Воронцова М. А., Лиознер Л. Д. Бесполое размножение и реге-
нерация. М., 1959.
Гердон Дж. Регуляция функции генов в развитии животных. М.,
1977.
Дэвидсон Э. Действие генов в раннем развитии. М., 1972.
3 усман М. Биология развития. М., 1977.
Иберт Дж. Взаимодействующие системы в развитии. М., 1968.
Кикнадзе И. И. Функциональная организация хромосом. Л., 1972.
Комфорт А. Биология старения. М., 1967.
Корочкин Л. И. Взаимодействие генов в развитии. М., 1977.
Магешвари П. Эмбриология покрытосеменных. М., 1954.
Маркерт К., Уршпрунг Г. Генетика развития. М., 1973.
Методы биологии развития. Под ред. Т. А. Детлаф, В. Я- Брод-
ского, Г. Г. Гаузе. М., 1974.
Мина М. В., Клевезаль Г. А. Рост животных. М., 1976.
Нейфах А. А., Тимофеева М. Я. Молекулярная биология процес-
сов развития. М., 1977.
Объекты биологии развития. Под ред. Т. А. Детлаф. М., 1975.
Поддубная-Арнольди В. А. Общая эмбриология покрытосемен-
ных растений. М., 1964.
Равен X. Оогенез. М., 1964.
Синнот Э. Морфогенез растений. М., 1963.
Соколов Н. Н. Взаимодействие ядра и цитоплазмы при отдален-
ной гибридизации животных. М., 1959.
Токин Б. П. Регенерация и соматический эмбриогенез. Л., 1959.
Токин Б. П. Общая эмбриология. М., 1977.
Уоддингтон К- Морфогенез и генетика. М., 1964.
Харрис Г. Ядро и цитоплазма. М., 1973.
Эсау К- Анатомия растений. М., 1969.
Константиноп Л. В.
К65 Биология iiiDiiniii ।v.। ।|.и>и<> ]1111чи1П1 >Мп
Изд-во БГУ, 197Н “ЛИ) » . in
В книге расемн l pH ИЦ It)I« н •>< и--ши м )мц. • »< > м t •» 1Ы и Н ) . И |1н> I
эмбрионального Ш’рШННщ p.i (ПИ. и И .Mill..) itt • • и t I .нйП При
особое внимание удели»1 ни iMi.pi.. .. j ..•«»»• « .»им. • i нм
и цитогенетическим осипнпм |ы|ин»ин м»|ч )м») , ..и»• -о ин.» .мгниниг
биологии развит)! оГИППрИмИ И 1.... И.... | ч .кн>..|| и» и, м ...и
Может бЫТЬ lll'lhuih BH1HIIH • ) » «н И >|»I и . *»•»»»<! ИМ >> И It 'IpVHH
ВЫСШИХ учебных ЭПИсЛГИПН, Н н>>.»и пни | .. . |.НМ< • 1Н> И ннНрНИ!
МИ биологии ПВД1ПШДУПЛ1.|Ц1) »t ("11|'|1>нн
21001—054
К М 317—78
22 78
1./.0ЙЙ