Текст
Л. М. Я КИМ ЕН КО
И. Д МОДЫЛЕВСКАЯ
З.А.ТКАЧЕК
ЭЛЕКТРОЛИЗ воды
Ф4Ф
Л. М. ЯКИ МЕН ко
И.Д.МОДЫЛ ЕВСКАЯ
З.А.ТКАЧЕК
ЭЛЕКТРОЛИЗ ВОДЫ
ПОД РЕДАКЦИЕЙ
ДОКТ. ТЕХН.НАУК
п РОФЕССОРА
Л.М.ЯКИ МЕН КО
ИЗДАТЕЛЬСТВО „ХИ М ?И Й” 7
• МОСКВА • 19 7т©8Ь^ . х
УДК 621.357.1:546.212
Я"15
Л. М. Якименко, И. Д. Модылевская, 3. А. Ткачек,
Электролиз воды
Книга представляет собой производственно-техническую моно-
графию, в которой изложены основы теории процесса электролиза
воды и важнейшие принципы конструирования электролизеров для
получения водорода и кислорода; описаны наиболее распространен-
ные конструкции современных электролизеров, работающих при
атмосферном давлении и повышенном давлении; приведены их
основные технические показа гели, методы материального и тепло-
вого расчета электролизеров; рассмотрены вопросы автоматизации
контроля и управления процессом электролиза воды, а также кор-
розии деталей электролизеров.
В заключительном разделе кратко изложены сведения о про-
изводстве тяжелой воды с использованием процесса электролиза,
при этом рассмотрены чисто электрохимические схемы, а также
принципиальные схемы ее производства с использованием химиче-
ского и фазового обмена изотопов водорода.
Книга рассчитана на инженерно-технических и научных работ-
ников химической и ряда смежных отраслей промышленности и
может быть полезна преподавателям и студентам вузов, специали-
зирующимся в области прикладной электрохимии.
В книге содержится 264 стр., 102 рисунка, 26 таблиц и 284 би-
блиографические ссылки.
3-14-3
47-70
СОДЕРЖАНИЕ
Предисловие ............................................................. 5
Введение............................................................. . 7
Общий обзор областей применения и развития методов производства водо-
рода и кислорода ..................................................... 7
Глава I. Основные свойства продуктов электролиза воды и веществ, при-
меняемых при электролизе.................................................13
1. Газы .... 13
2. Вода и водяной пар....................................................21
3. Щелочи и их водные растворы...........................................24
Литература ..............................................................30
Глава II. Теоретические основы процесса электролиза воды.................31
1. Общие сведения о процессе электролиза.................................31
2. Энер1 етический баланс ячейки.........................................36
Теоретическое напряжение разложения...................................38
Перенапряжение выделения водорода и кислорода........................*39
Концентрационная поляризация и э. д. с. диффузионного элемента . . 45
Падение напряжения в электролите и диафрагме .........................46
3. Зависимость общего напряжения па ячейке от условий работы электро-
лизера ..................................................................59
4. Выход по току.........................................................65
5. Утечки тока.................................... .....................75
6. Количественные соотношения в процессе электролиза воды................80
7. Тепловой баланс электролизера ....................................... 83
8. Электролиз воды под давлением.........................................86
Литература .............................................................90
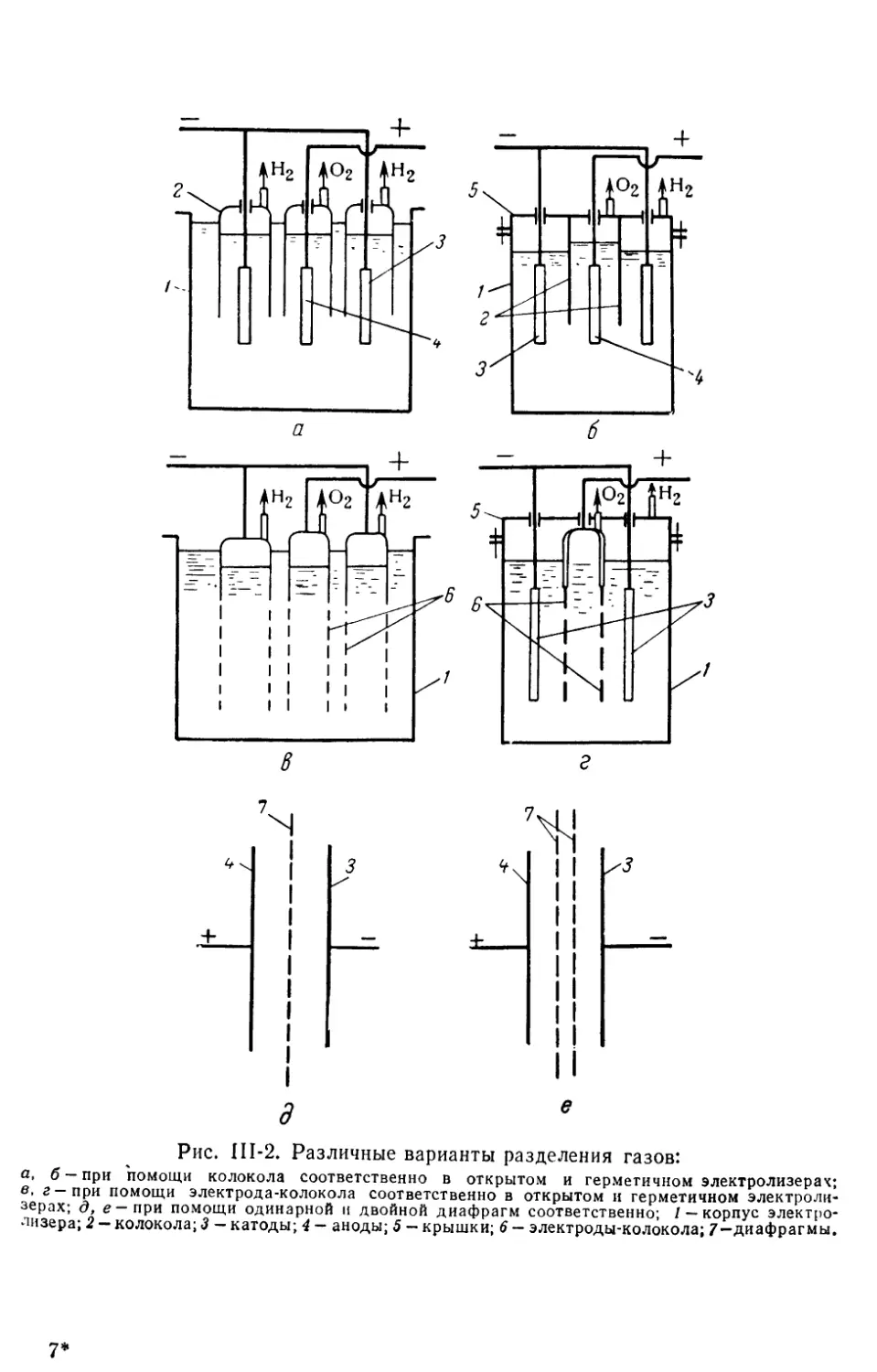
Глава III. Основные элементы конструкции электролизеров..................93
1. Электроды и их конструкции............................................93
2. Разделение газов электролиза..........................................98
3. Устройство корпуса электролизера ................................... 106
4. Регулирование уровня электролита и давления газов .................. 103
5. Циркуляция и охлаждение электролита..................................110
6. Охлаждение и промывка газов .........................................112
7. Уплотнение и электрическая изоляция..................................113
Литература..............................................................114
1* 3
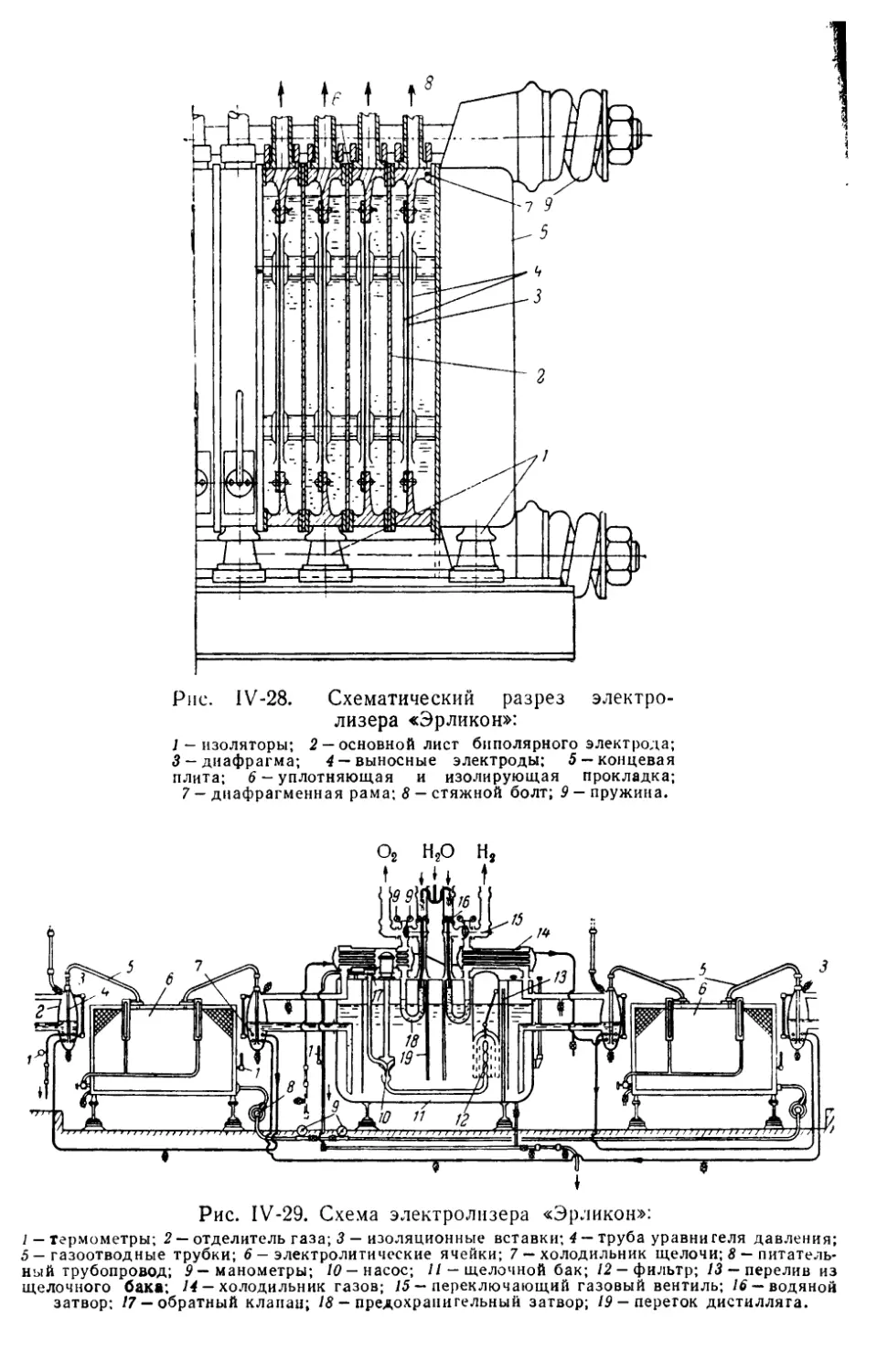
Глава IV. Конструкции промышленных электролизеров
1. Классификация электролизеров ......................................
2. Электролизеры с монополярным включением электродов.................
3. Фильтрпрессные электролизеры с биполярным включением электродов
для работы при атмосферном давлении ...................................
Электролизеры типа ФВ.............................................
Электролизеры «Бамаг» ............................................
Электролизеры «Де-Нора» ..........................................
Электролизеры «Демаг».............................................
Электролизеры «Эрликон» ..........................................
Электролизеры Пехкранца...........................................
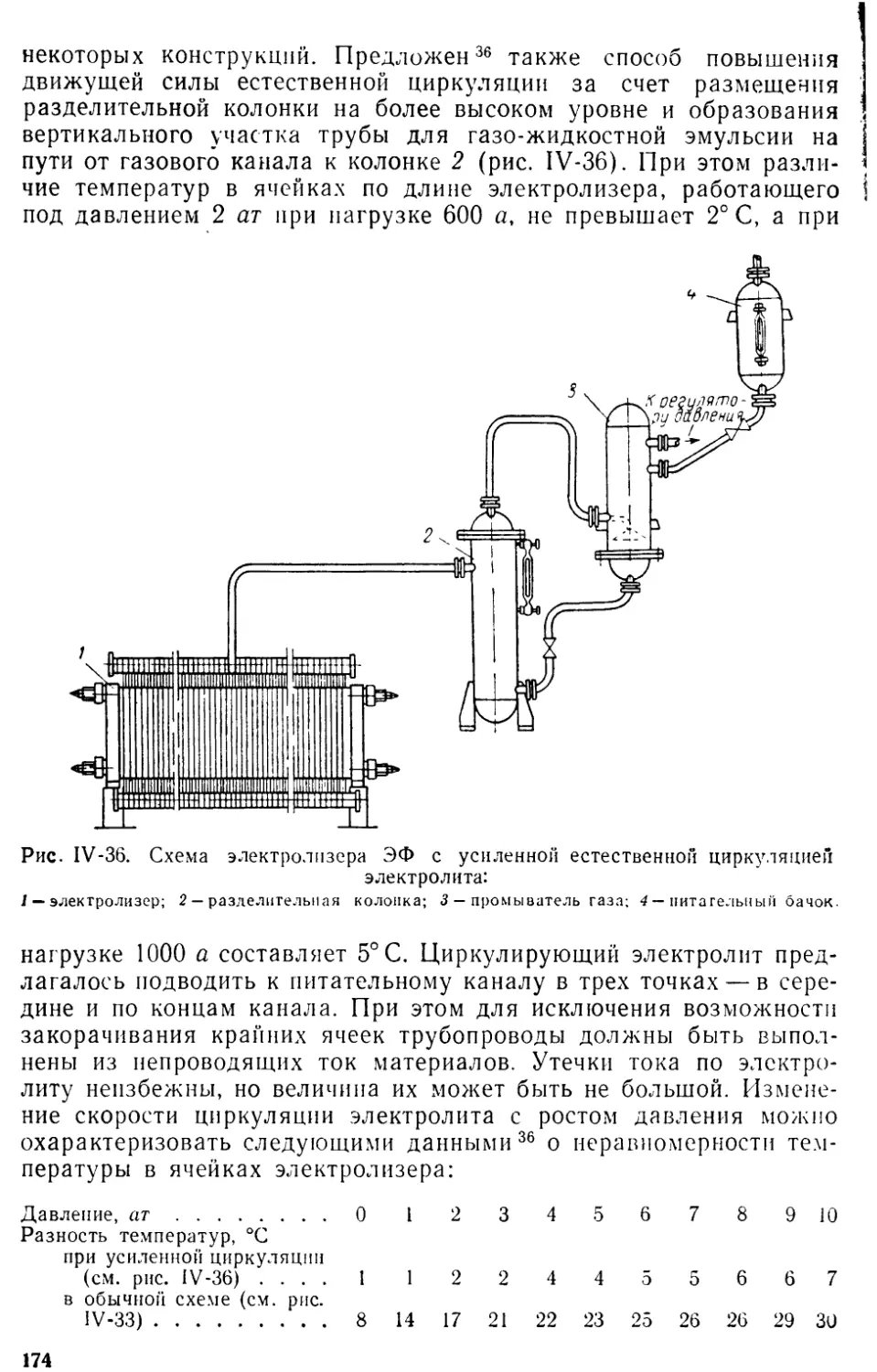
4. Электролизеры для работы под давлением.............................
Электролизеры типа ЭФ.............................................
Электролизеры типа СЭУ............................................
Электролизеры Зданского — Донца...................................
Прочие типы электролизеров для работы под давлением...............
115
115
119
126
126
152
154
157
159
165
166
167
177
180
186
Литература .........................................................189
Глава V. Эксплуатация установок электролиза воды.......................191
L Технологическая схема производства...................................191
2. Приготовление питающей воды........................................195
3. Приготовление и очистка электролита................................196
4. Очистка и осушка газов.............................................198
5. Контроль и автоматизация процесса электролиза воды.................202
6. Коррозия в электролизерах и ее устранение..........................205
Коррозионная стойкость железа и никеля в щелочных растворах . . 205
Коррозия деталей биполярных электролизеров ....................... 214
Литература ............................................................235
Глава VI. Производство тяжелой воды электролитическим методом , . . 236
1. Периодический метод электролитического концентрирования дейтерия . 240
2. Непрерывный метод электролитического концентрирования дейтерия . . 245
3. Комбинированные схемы концентрирования дейтерия....................255
Литература ............................................................260
ПРЕДИСЛОВИЕ
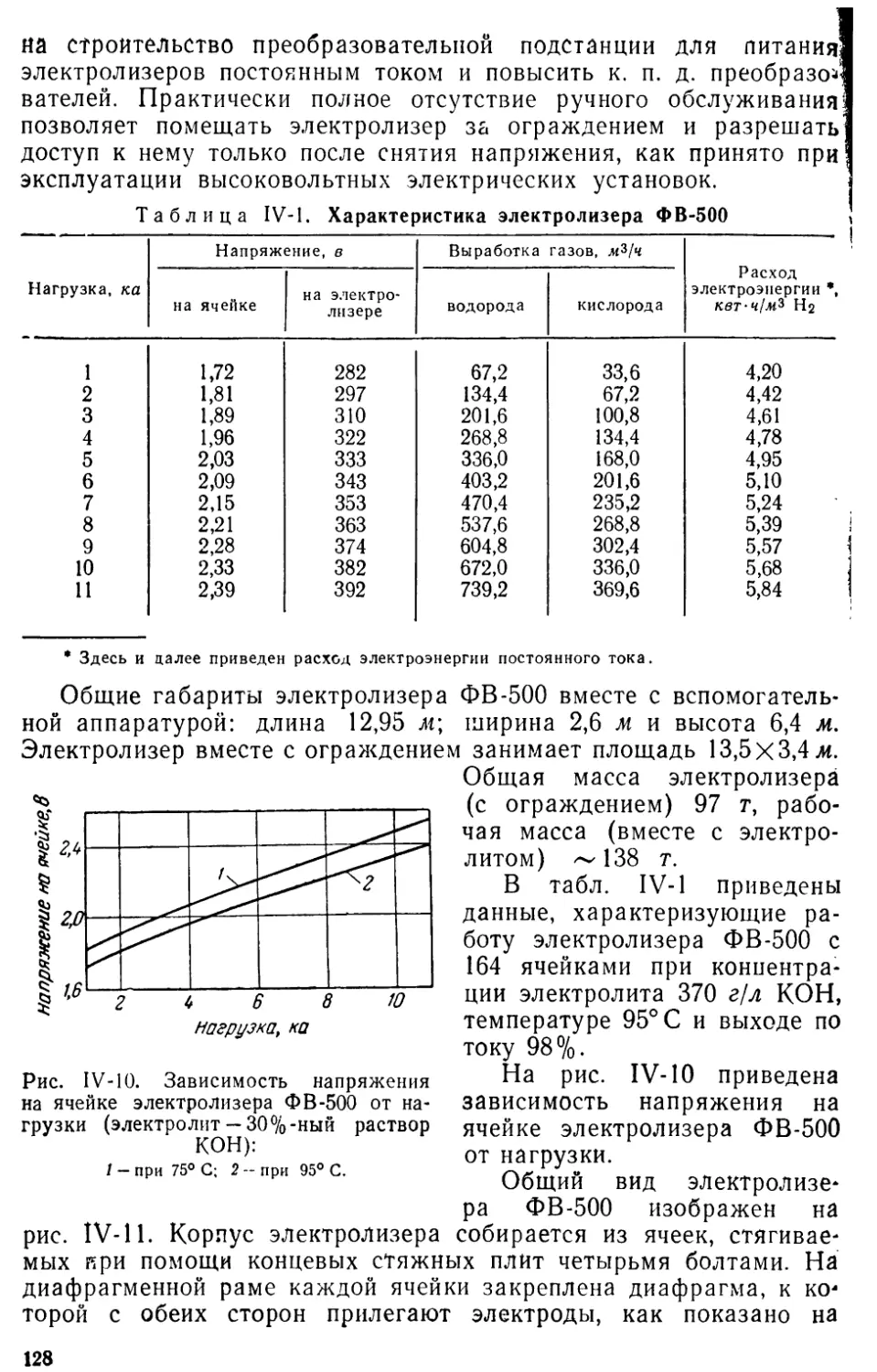
За последние десятилетия в СССР созданы сотни установок элек-
тролиза воды для получения водорода и кислорода, оборудованных
отечественными электролизерами, которые работают как при ат-
мосферном, так и при повышенном давлении. В настоящее время
только на электростанциях работает около тысячи электролизеров
различного типа.
Для удовлетворения нужд народного хозяйства в электролити-
ческом водороде в ближайшие годы дополнительно потребуется
значительное количество мощных электролизеров производитель-
ностью по 500—650 м3/ч водорода и более мелких электролизеров
для выработки небольших количеств водорода.
Литература по электролизу воды в течение последних лет не
издавалась. В связи с этим возникла необходимость в выпуске кни-
ги, необходимой работникам промышленности, проектных и науч-
но-исследовательских институтов, связанным с данной отраслью
химической технологии.
В предлагаемой вниманию читателей монографии рассмотрены
общие вопросы теории процесса электролиза и основные элементы
конструкции электролизеров, подробно освещены отечественные
конструкции мощных электролизеров типа ФВ для работы при
атмосферном давлении и типов ЭФ и СЭУ для работы под давле-
нием, менее подробно описаны электролизеры, применяемые за
рубежом.
Значительное внимание нами уделено вопросам эксплуатации
установок для электролиза воды, процессам коррозии деталей элек-
тролизеров и способам предотвращения коррозии.
Во многих странах электролизные установки использовались
для получения тяжелой воды в качестве побочного продукта. В по-
следующем были разработаны более эффективные методы ее про-
изводства, однако побочное получение тяжелой воды на крупных
5
электролизных установках в ряде случаев целесообразно. Поэтому
в книгу включена глава, посвященная основным закономерно-
стям электролитического концентрирования тяжелого изотопа во-
дорода.
Главы I, IV и VI подготовлены к печати И. Д. Модылевской,
главы II и III написаны Л. М. Якименко, введение и глава V —
3. А. Ткачек, которая участвовала также в подготовке к печати
главы II (в части технологического режима работы электроли-
зеров).
Авторы выражают глубокую благодарность Г. В. Палецкому,
Ф. 3. Серебрянскому, Ц. А. Аджемяну и В. В. Лосеву за ценные
советы, высказанные ими при просмотре и обсуждении рукописи.
Замечания и пожелания читателей по улучшению содержания
книги будут приняты нами с признательностью.
АВТОРЫ
ВВЕДЕНИЕ
ОБЩИЙ ОБЗОР ОБЛАСТЕЙ ПРИМЕНЕНИЯ
И РАЗВИТИЯ МЕТОДОВ ПРОИЗВОДСТВА
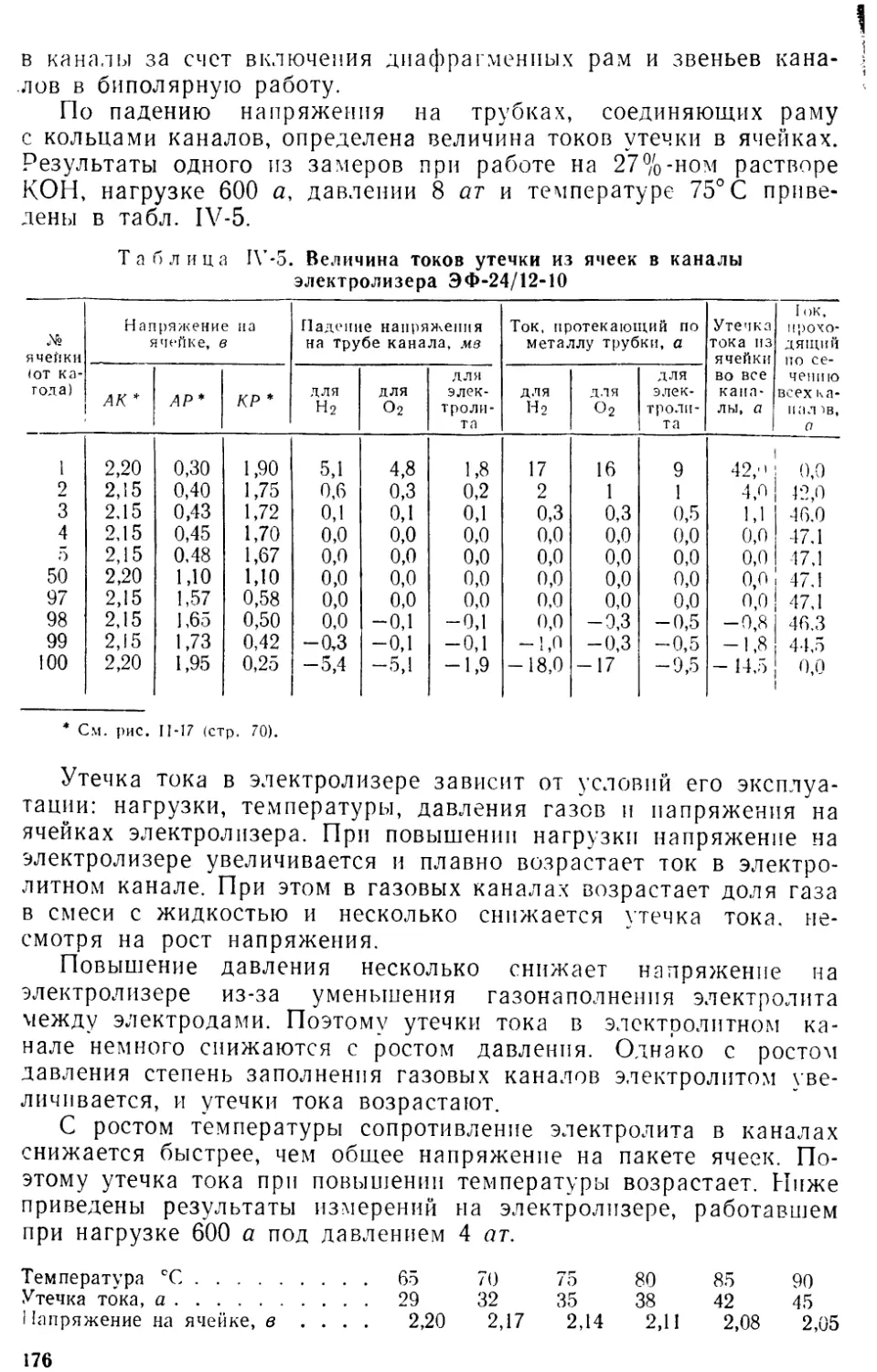
ВОДОРОДА И КИСЛОРОДА
По мере развития современной промышленности все большее чис-
ло ее отраслей и в возрастающем объеме используют для различ-
ных нужд водород и кислород. Еще 60 лет назад водород как
сырье имел весьма ограниченное значение, а в настоящее время
мировая потребность в нем составляет десятки миллионов кубо-
метров в час.
Практическое использование водорода началось с небольших
количеств, потреблявшихся главным образом для воздухоплавания,
освещения, гидрогенизации жиров и пайки свинца. В 20-х годах те-
кущего столетия промышленное производство водорода резко воз-
росло во всех странах мира, что было обусловлено разработкой и
широким внедрением в практику процесса синтеза аммиака из во-
дорода и азота. Этот процесс получил огромное развитие в связи
с непрерывным увеличением производства и потребления мине-
ральных удобрений. Большие количества водорода потребовались
для производства метилового спирта, а с 50-х годов и для синтеза
карбамида. В меньших количествах водород находит разнообраз-
ное применение во многих других отраслях народного хозяйства.
Значительно увеличилось использование водорода для гидрогени-
зации жиров, гидрирования угля, тяжелых масел, при синтезе спир-
тов, жирных кислот, получении углеводородов, перекиси водорода,
синильной и соляной кислот и других продуктов, а также для
сварки, резки и обработки металлов, в производстве электрических
ламп и аккумуляторов.
Водород имеет довольно важное значение в процессах произ-
водства редких металлов и твердых сплавов. Водород все шире на-
чинают применять в порошковой металлургии, для восстановления
металлических катализаторов, в производстве прозрачного (опти-
ческого) кварца и искусственных драгоценных камней, для охлаж-
дения мощных электрогенераторов. Некоторая доля водорода
может потребляться для заполнения аэростатов заграждения и
дирижаблей.
Количество потребителей водорода продолжает возрастать.
Так, в последние десятилетия его стали использовать для очистки
нефти. Весьма перспективен метод прямого восстановления
металлических руд водородом при высоких температурах, хотя
7
эта область потребления водорода находится еще в начальной ста-
дии развития. С успехом применяют водород в радиоэлектронике
для получения полупроводников, масштабы производства которых
непрерывно увеличиваются.
Известны десятки различных методов получения Н2. На первом
этапе развития производства водорода, когда его потребление ис-
числялось десятками кубометров в час, использовались главным
образом методы, основанные на способности многих металлов вы-
теснять водород из воды, разбавленных кислот или щелочей. К ним
относятся растворение цинка в разбавленной кислоте и алюминия
или кремния в едкой щелочи, действие натрия или гидрида кальция
на воду. В настоящее время эти методы применяют лишь в лабо-
раторной практике или для получения небольших количеств водо-
рода в полевых условиях.
В некоторых случаях водород можно получать термическим раз-
ложением аммиака или метанола в присутствии катализатора. Эти
методы очень просты и могут быть использованы при небольшой
потребности в водороде (не более 500 м3! сутки}.
Еще в 20-х годах для производства водорода довольно широко
применялся железо-паровой метод, основанный на взаимодей-
ствии железа с водяным паром при пропускании его над раскален-
ными железными стружками или опилками. Образующаяся при
этом окись железа восстанавливалась водяным газом. К настоя-
щему времени этот процесс утерял свое практическое значение
из-за малой производительности, громоздкости и большого рас-
хода тепла.
Современные промышленные методы получения водорода мож-
но подразделить на две группы: химические и электрохимические.
К химическим относятся методы переработки твердых и тяже-
лых жидких топлив и углеводородных газов (коксового, природ-
ного, газов нефтепереработки и др.).
В начальный период развития производства синтетического
аммиака широкое распространение приобрела газификация кокса,
антрацита и каменного угля для получения генераторных газов,
содержащих водород и окись углерода, далее подвергавшуюся
конверсии на катализаторе. В ряде случаев целесообразно полу-
чение водорода газификацией жидких топлив (мазут, тяжелые неф-
тяные остатки и др.).
Существенным источником водорода является коксовый газ,
образующийся в процессе коксования углей и содержащий 50—
60% Н2. Для выделения водорода из коксового газа его подвергают
глубокому охлаждению, при этом происходит фракционированная
конденсация всех компонентов газа, кроме водорода. Перед
поступлением на разделительную установку глубокого холода кок-
совый газ очищают от серы, двуокиси углерода и других нежела-
тельных примесей.
В настоящее время наибольшее распространение получило про-
изводство водорода каталитической конверсией природного газа,
8
состоящего преимущественно из метана. В результате неполного
окисления углеводородов природного газа водяным паром, кисло-
родом или двуокисью углерода при высокой температуре (до
1000°С и выше) в присутствии катализаторов получаются водород
и окись углерода, например по реакции паровой конверсии метана:
сн4 + н2о —> со + зн2
Далее полученную газовую смесь вместе с водяным паром
пропускают через слой катализатора для превращения СО и Н2О
в водород и двуокись углерода:
СО + Н2О —> СО2 + Н2
Значительные количества водорода получаются в качестве по-
бочного продукта производства ацетилена и этилена окислитель-
ным пиролизом природного или попутного газа.
Полученный химическими методами водород содержит различ-
ное количество таких примесей, как окись и двуокись углерода,
азот, кислород, метан, сероводород, инертные газы и др., которые,
как правило, должны быть удалены до поступления водорода на
дальнейшую переработку. Поэтому современная технологическая
схема производства водорода любым химическим методом вклю-
чает не менее четырех основных стадий: собственно получение во-
дорода, конверсию окиси углерода, удаление двуокиси углерода и
окончательную очистку газа от остальных примесей. Такие много-
ступенчатые схемы процесса довольно громоздки и требуют круп-
ных капиталовложений и больших эксплуатационных расходов.
К электрохимическим методам производства водорода
относится прежде всего электролиз воды, а также электролиз вод-
ных растворов NaCl для получения хлора и каустической соды;
одновременно в качестве побочного продукта электролиза NaCl
получается дешевый водород. Отметим, что в 1969 г. мировая хлор-
ная промышленность (без СССР) выработала около ^,§млрд. м3
водорода, который удалось использовать лишь в малой степени,
главным образом из-за отдаленности его потребителей.
-^"Существенные количества водорода побочно получаются также
при электрохимическом производстве хлората натрия, перекиси во-
дорода и некоторых других продуктов. • -----
При больших масштабах производства водорода химические
методы его получения, особенно из природных и попутных нефтя-
ных газов, более эффективны, чем электролиз воды, и являются
основными источниками обеспечения потребностей химической
промышленности в водороде. При малых масштабах производства
водорода преимущества химических методов уменьшаются, так
как расходы на многоступенчатую очистку газа заметно сказы-
ваются на себестоимости водорода.
В отличие от всех перечисленных методов производства водо-
рода при электролизе воды непосредственно получают и водород
и кислород высокой чистоты. В газах электролиза практически
9
отсутствуют посторонние примеси, кроме паров воды и взаимных
примесей одного газа в другом, что значительно упрощает очистку
водорода. Благодаря отсутствию трудноустранимых и отравляю-
щих катализаторы примесей электролитический водород можег
быть использован в любых производствах. Он обладает особыми
преимуществами в тех случаях, когда требуется высокая чистота
газа. Поэтому, например, для гидрогенизации жиров, каталитиче-
ских процессов гидрирования, производства перекиси водорода,
полупроводников и ряда других веществ применяют преимуще-
ственно электролитический водород.
Электролиз воды выгодно отличается от других методов получе-
ния водорода простотой технологической схемы, доступностью и
дешевизной сырья — воды, высокой надежностью в эксплуатации,
несложностью обслуживания установок. При электролизе воды под
давлением получаемые газы не требуют компримирования, что
очень важно для ряда их потребителей.
К достоинствам процесса электролиза воды относится также
одновременное получение кислорода, находящего разнообразное
применение в различных отраслях народного хозяйства — для ин-
тенсификации доменного процесса, для плавления платины, кварца
и других тугоплавких материалов, при автогенной сварке и резке
металлов, где необходимы температуры выше 2000° С. Кислород
широко используется также в химической промышленности: в про-
изводстве азотной, серной, уксусной кислот, метанола, формальде-
гида, в процессах газификации углей, конверсии метана и др. Жид-
кий кислород употребляется для достижения низких температур,
приготовления некоторых видов взрывчатых веществ. Чистый кис-
лород используется в медицине для улучшения затрудненного
дыхания, при отравлениях окисью углерода, углеводородными га-
зами и т. д. Важное значение приобрело обеспечение кислородом
людей, находящихся в герметичных помещениях, в космических ко-
раблях, выполняющих подводные и различные спасательные ра-
боты.
Кислород, потребляемый в больших количествах для техниче-
ских нужд, получают методом сжижения воздуха и ректификации
его компонентов в специальных воздухоразделительных агрегатах.
Особо чистый кислород получают электролизом воды.
Оборудованные ртутными или полупроводниковыми выпрямите-
лями простые компактные и дешевые установки для электролиза
воды под давлением, близким к атмосферному, и под давлением до
10 ат, почти не требующие обслуживания и ухода и обеспечиваю-
щие высокую чистоту газов, получили широкое распространение.
Современные электролизеры для разложения воды при нормаль-
ной эксплуатации работают в течение 5—10 лет без капитального
ремонта, затраты труда на их обслуживание невелики.
При техническом оформлении процесса электролиза воды воз-
никает меньше трудностей, чем в большинстве других электрохи-
мических процессов. При изготовлении аппаратов для электролиза
10
воды (с использованием щелочных электролитов) успешно приме-
няются такие доступные и дешевые материалы, как углеродистая
сталь и сталь, гальванически покрытая беспористым никелем, ас-
бестовые ткани, паронит, обладающие высокой устойчивостью
к коррозии в промышленных условиях электролиза. Поэтому для
электролиза воды ранее, чем для других электрохимических про-
цессов, разработаны и внедрены в промышленность фильтрпресс-
ные биполярные электролизеры большой мощности.
Разработка и усовершенствование конструкций электролизеров
в нашей стране шли по двум направлениям: по линии создания
крупных электролизеров производительностью до 500—650 м3/ч,
работающих под небольшим избыточным давлением, и по линии
конструирования более мелких электролизеров производитель-
ностью до 25 м3/ч, работающих под давлением от 1 до 10 ат. В са-
мые последние годы стали отдавать предпочтение электролизерам,
работающим при более высоком давлении.
Основным недостатком электрохимического метода получения
водорода является его большая энергоемкость. В электролизерах,
работающих при давлении, близком к атмосферному, расход элек-
троэнергии переменного тока составляет около 6300 кет • ч на
1000 м3 водорода. При работе под давлением около 40 ат удельный
расход электроэнергии заметно снижается. В отличие от химиче-
ских методов себестоимость электролитического водорода мало за-
висит от масштаба производства, так как основные затраты (около
70% себестоимости) приходятся на расходуемую электроэнергию.
Наибольшие преимущества электрохимический метод производ-
ства водорода имеет для потребителей, нуждающихся в сравни-
тельно небольших количествах его, но предъявляющих высокие
требования к чистоте газа. При высокой стоимости электроэнергии
крупное производство электролитического водорода неконкуренто-
способно с химическими методами. В определенных условиях, в слу-
чае значительной неравномерности годового и суточного графика
потребления электроэнергии, производство электролитического во-
дорода с использованием свободной электроэнергии (пиковых на-
грузок) может оказаться целесообразным даже при сравнительно
высокой стоимости электроэнергии. При наличии дешевой гидро-
электроэнергии и отсутствии углеводородного сырья электрохими-
ческий метод получения водорода в ряде случаев экономически
выгоден и для организации его производства в крупных масштабах.
В 20-х годах электролиз воды получил наибольшее распростра-
нение в странах, где быстро развивалась химическая промышлен-
ность, но были ограничены запасы углеродсодержащего сырья и
в то же время имелись большие ресурсы дешевой электроэнергии.
Так, в 1921 — 1929 гг. 18% водорода, использовавшегося в мировом
производстве аммиака, получалось электролизом воды. В 1936 г.
за рубежом насчитывалось шесть заводов синтетического аммиака
общей годовой производительностью около 200 000 т связанного
азота, работавших на электролитическом водороде. В 30-х годах
п
в Норвегии на заводе «Норкс-Гидро» была введена в эксплуатацию
самая крупная в то время в Европе установка электролиза воды
для производства водорода.
В свое время значительное развитие производство электролити-
ческого водорода получило в Корее и Японии; ряд крупных заводов
в Италии вырабатывал аммиак тоже из электролитического водо-
рода. В последние годы в Индии и ОАР построены крупные уста-
новки электролиза воды для обеспечения водородом заводов синте-
тического аммиака. В ряде других стран электрохимический метод
производства водорода используется для удовлетворения потреб-
ности в водороде и кислороде средних и мелких потребителей раз-
личных отраслей промышленности.
Однако в связи с развитием других более экономичных методов
производства доля электролитического водорода в общем объеме
его мирового производства за последние десятилетия неуклонно
снижается. В 1965 г. мировое производство водорода методом элек-
тролиза воды достигло 1,4 млрд, м? (без СССР), на что было за-
трачено свыше 9 млрд, кет * ч электроэнергии.
В 30-х годах XX в. в связи с открытием дейтерия и тяжелой во-
ды электролиз воды нашел еще одно важное применение, так как
тяжелая вода может получаться в качестве побочного продукта на
крупных электролизных установках. Получение тяжелой воды чисто
электрохимическим методом или комбинированием электролиза
воды с изотопным обменом дейтерия между водородом и парами
воды на катализаторе применялось и продолжает применяться
в ряде стран. Опубликованы данные о работе в США, Норвегии, Ин-
дии крупных установок для получения тяжелой воды с использова-
нием электрохимического метода, хотя к настоящему времени раз-
работаны и другие методы производства тяжелой воды, более эко-
номичные в определенных условиях.
ГЛАВА
I
ОСНОВНЫЕ СВОЙСТВА ПРОДУКТОВ
ЭЛЕКТРОЛИЗА ВОДЫ И ВЕЩЕСТВ,
ПРИМЕНЯЕМЫХ ПРИ ЭЛЕКТРОЛИЗЕ
1. ГАЗЫ
Основные физико-химические свойства продуктов электролиза во-
ды— водорода и кислорода, а также азота, применяемого для
продувки аппаратуры при остановках процесса, и воздуха приве-
дены в табл. 1-1.
Таблица 1-1. Основные физико-химические свойства газов1”4
Свойства n2 О2 н2 Воздух
Молекулярный вес Мольный объем (при 0°С и 28,013 31,999 2,016 1 28,95
760 мм рт. ст.), л Температура, °C 22,4 22,39 22,43 22,46
кипения -195,8 -182,97 -252,8 -192
плавления Критические константы -202,86 -218,8 -259,2 * -213
температура, °C -147,13 -118,82 -239,9 -140,7
давление, атм ...... 33,49 49,71 12,8 37,2
плотность, кг/л Плотность 0,311 0,439 0,031 0,35
при 0° С и 1 атм, кг/м3 . . при температуре кипе- 1,251 1,429 0,0099 1,293
ния, кг/л относительная (по воз- 0,808 1,14 0,0709 0,860
духу> Удельная газовая постоянная, 0,9673 1,1053 0,0695 1
калЦкг • град) Теплота, ккал!кг 70,93 62,12 986,96 68,61
плавления парообразования (при 6,1 3,3 14,0 —
1 атм) Объем жидкости, образую- щейся из 1 м3 газа ( при 47,58 51,5 108,5 49
15° С и 1 атм), л Удельная теплоемкость **, ккалЦкг ♦ град) 1,421 1,150 1,166 1,379
Ср ............ 0,251 0,218 3,408 0,241
0,178 0,156 2,42 0,172
Ср!cv ............ Теплопроводность **, 1,40 1,40 1,407 1,40
ккалЦм • ч • град) Коэффициент динамической 0,0196 0,2052 0,140 0,02945
вязкости **, мкпз . • . . . * При давлении 54 мм рт. ст. * * При 0° С и 760 мм рт. ст. 165 192 85 169,6
13
Таблица 1-2. Растворимость газов в воде при атмосферном давлении4
Температура, °C Азот + аргон (1,185% Аг) Кислород Вэдоро 1 Возд\ х, а-102
а-102 <7-103 а-102 <7-103 а-102 <7-104
0 2,354 2,942 4,889 6,945 2,148 1,922 2,885
5 2,086 2,600 4,287 6,072 2,044 1,824 2,547
10 1,861 2,312 3,802 5,368 1,955 1,749 2,268
15 1,685 2,085 3,415 4,802 1,883 1,668 2,048
20 1,545 1,901 3,103 4,340 1,819 1,603 1,871
25 1,431 1,751 2,831 3,931 1,754 1,535 1,727
39 1,342 1,624 2,608 3,588 1,699 1,474 1,607
35 1,255 1,501 2,440 3,315 1,666 1,425 1,504
40 1,184 1,391 2,30(3 3,082 1,644 1,384 1,415
45 1,130 1,300 2,187 2,858 1,624 1,341 1,352
50 1,088 1,216 1,052 2,090 2,657 1,608 1,287 1,298
60 1,023 1,945 2,274 1,600 1,178 1,216
70 0,977 0,851 1,833 1,856 1,600 1,02 1,156
80 0,958 0,660 1,761 1,381 1,600 0,79 1,126
90 0,952 0,33 1,723 0,787 1,600 0,46 1,21
100 0,947 — 1,700 — 1,600 — 1,11
Обозначения: а — коэффициент растворимости, показывающий число объемов
газа (при 0° С и 769 мм рт. ст.), растворенного в 1 оэьеме воты при парциальном давлении
газа 760 мм рт. ст. и данной температуре; q — растворимость газа (при общем давлении
760 мм рт. ст.), г/100 г Н2О.
Таблица 1-3. Коэффициент а растворимости вэцорода в водных растворах
неорганичес<их веществ 5
Растворенное Концентрация раствора, г-эк.в!л
вещество 0,5 1 2 3 4 5 6
LiCl 0,0157 При 15° 0,0133 С 0,0112 0,0095
NaCl — 0,0148 0,0114 0,0088 0,0069 0,0057 —
NaNO3 .... — 0,0144 0,0120 0,0098 0,0081 0,0067 0,0054
Na2SO4 .... — 0,0137 0,0099 0,0071 — — —
Na2<70j .... — 0,0134 0,0097 0,0069 — — —
KC1 — 0,0150 0,0122 0,0099 0,0082 — —
K2CO3 .... — 0,0134 0,0097 0,0070 0,0051 0,0037 0,0027
CaCl2 .... — 0,0149 0,0119 0,0096 0,0078 0,0064 0,0051
KNO3 .... — 0,0152 0,0128 0,9108 — — —
AUI3 — 0,0151 0,0122 0,0099 0,0031 0,0067 0,0055
KOH 0,0153 0,0130 При 25° С
NaOH .... 0,0151 0,0127 0,0089 0,0066 0,0050 —
HC1 0,0170 0,0164 0,0154 0,0146 — — —
HNO3 .... 0,0172 0,0168 0,0159 0,0159 0,0147 — —
14
Водород и кислород малорастворимы в воде и в водных раство-
рах неорганических соединений (табл. 1-2—1-4). Однако в процес-
се электролиза растворение газов в воде и электролите может при-
водить к взаимному загрязнению вырабатываемых водорода и кис-
лорода.
Таблица 1-4. Коэффициент а растворимости кислорода
в водных растворах неорганических веществ 5
Растворенное вещество Концентрация раствора, г-экв/л
0,5 1 2 1 0,5. I 2
НС1 HNO3 NaCl NaOH кон K2SO< Г 0,0326 0,0330 0,0292 0,0273 0,0276 0,0279 Три 15° ( 0,0310 0,0319 0,(/246 0,0219 0,0222 0,0225 0,0283 0,0299 0,0173 0,0144 Г 0,0271 0,0277 0,0240 0,0229 0,0231 0,0232 Три 25° ( 0,0263 0,0270 0,0204 0,0187 0,0189 0,0190 0,0245 0,0260 0,0146 0,0122
Растворимость кислорода в водных растворах серной кислоты
характеризуется следующими значениями коэффициента а:
Температура, °C 15 0,5 0,0320 Концентрация H2SO4, г-экв!л 5 0,0202
1 0,0302 2 3 0,0243 4 0,0221
25 0,0264 0,0252 0,0230 0,0210 0,0191 0,0178
С ростом давления растворимость газов увеличивается. В табл.
1-5 приведена растворимость водорода в воде при давлении 25—
200 ат.
Таблица 1-5. Растворимость водорода в воде при повышенном давлении
(в см31г Н2О)
Давление, ат Температура, °C
0 20 30 40 50 60 70 80 93 100
25 0,536 0,450 0,426 0,413 0,407 0,405 0,409 0,420 0,439 0,462
50 1,068 0,895 0,848 0,822 0,809 0,810 0,817 0,839 0,872 0,912
75 1,601 1,341 1,271 1,232 1,212 1,211 1,224 1,254 1,298 1,355
100 2,130 1,785 1,689 1,638 1,612 1,610 1,628 1,667 1,727 1,805
150 3,168 2,649 2,508 2,432 2,395 2,393 2,422 2,485 2,576 2,681
200 4,187 3,499 3,311 3,210 3,165 3,168 3,208 3,286 3,402 3,544
15
Коэффициенты теплопроводности газов Х-105 приведены ниже
[в кал)(см • сек • град)]:
Газы Температура, °C
-191,4 -78,4 0 100 200 300
Азот................. 1,829 4,395 5,80 7,52 9,20 10,72
Водород.............. 3,22* 30,65 41,60 51,60 61,60 71,60
Воздух (сухой) . . . 1,800 4,256 5,83 7,60 9,40 10,98
Кислород..............1,721 4,292 5,89 7,86 9,71 11,47
* При -252,2° С.
Коэффициенты динамической вязкости газов 1 при 1 атм имеют
следующие значения (в мкпз):
Г азы Температура, °C
0 20 50 100 150 200 250 300
Азот............ 165 175 188 208 228 246 263 280
Водород....... 85 88 94 103 113 121 130 138
Кислород .... 192 202 218 244 267 290 310 330
Данные об удельной
дены в табл. 1-6 и 1-7.
теплоемкости водорода и кислорода приве-
Таблица 1-6. Удельная теплоемкость водорода1 ср
[в калЦг град)]
Температура, °C Избыточное давление, ат
0 1 10 25 50
-250 2,464 2,611 . —
-200 2,524 2,541 2,690 — —
-150 2,839 2,844 2,883 — —
-100 3,128 3,131 3,151 —• —
-50 3,300 3,302 3,315 3,34 3,37
0 3,393 3,394 3,401 3,42 3,43
50 3,437 3,438 3,442 3,45 3,46
100 3,455 3,456 3,458 3,47 3,48
200 3,467 3,468 3,470 3,48 3,48
300 3,475 3,475 3,477 3,48 3,49
Мольную теплоемкость водорода можно определить по форму-
лам 6
Ср = 6,86 + 0,0000667 + 0,000000279 Г2
Cv = 4,87 + 0,0005397 + 0,000000146 72
мольную теплоемкость кислорода — по формулам
Ср - 6,5 + 0,001077
Cv = 4,52 + 0,001077
где 7 — температура, °К.
16
Таблица 1-7. Удельная теплоемкость кислорода1 ср
[в кал/(г • град)]
Избыточное давление, ат
Температура, °C 0,1 0,4 0,7 1 4
-150 0,218 0,219 0,220 0,221
-100 0,218 0,218 0,218 0,219 0,223
-50 0,218 0,218 0,218 0,219 0,221
0 0,219 0,219 0,219 0,219 0,221
50 0,220 0,221 0,221 0,221 0,222
100 0,223 0,223 0,223 0,223 0,224
150 0,227 0,227 0,227 0,227 0,227
200 0,230 0,230 0,230 0,230 0,231
250 0,234 0,234 0,234 0,234 0,234
300 0,238 0,238 0,238 0,238 0,238
Температура, °C Давление, ат
7 10 40 70 100
-100 0,228 0,234 0,34
•. -50 0,223 0,226 0,255 0,295 0,348
0 0,222 0,223 0,239 0,255 0,271
‘ 50 0,223 0,224 0,233 0,243 0,252
4 100 0,225 0,225 0,232 0,239 0,245
150 0,228 0,228 0,233 0,238 0,243
> 200 0,231 0,231 0,235 0,239 0,242
250 0,235 0,235 0,238 0,241 0,244
300 0,238 0,239 0,241 0,244 0,246
Водород — один из наиболее распространенных в природе эле-
ментов и самый распространенный элемент во вселенной. Общее
количество водорода достигает 1 % массы всех трех оболочек зем-
ной коры — гидросферы, атмосферы и литосферы В составе сол-
нечной системы 84% приходится на долю водорода. В межзвездном
пространстве атомы водорода встречаются в 100 раз чаще атомов
всех остальных элементов, вместе взятых.
В природе водород находится преимущественно в виде различ-
ных соединений, главным образом с кислородом, углеродом, серой,
азотом. Вода содержит около И вес.% Н2. В виде углеводородов
водород входит в состав нефти и природных газов. В природе сво-
бодный водород образуется при разложении некоторых органиче-
ских веществ, он присутствует в свободном виде также в вулкани-
ческих и в природных газах некоторых месторождений. На уровне
моря атмосфера содержит 0,00005 объемн. % водорода, в верхних
слоях атмосферы его содержание возрастает2.
Водород — самый легкий из газов, не имеет цвета и запаха,
легко воспламеняется и горит синеватым, мало светящимся пламе-
нем. При охлаждении водорода ниже —240° С под давлением 17
2 Зак. 7J3
17
тгу гvrпилтгиж
около 13 атм он конденсируется в очень легкую (в 15 раз легче
воды) прозрачную, бесцветную, легкоподвижную жидкость, не про-
водящую электричество и обладающую небольшим поверхностным
натяжением. При охлаждении до —259° С образуется твердый во-
дород—белая пенообразная масса, плотность которой в 12 раз
меньше, чем воды.
Водород состоит из смеси молекул двух модификаций — ортоводорода и
параводорода, обладающих практически одинаковыми химическими, но не-
сколько различными оптическими и термическими свойствами. Молекулы пара-
водорода имеют антипараллельную ориентацию ядерных спинов и четные рота-
ционные квантовые числа, молекулы ортоводорода — параллельные ядерные
спины и нечетные ротационные квантовые числа. При комнатной температуре
водород состоит из 25% параводорода и 75% ортоводорода. По мере снижения
температуры относительное содержание параводорода возрастает.
Известны три изотопа водорода: протий Н, или *Н, с массовым числом 1,
дейтерий D, или 2Н, с массовым числом 2 и тритий Т, или 3Н, с массовым чис-
лом 3. Содержание протия в водороде 7-9 достигает 99,985—99,986%, дейтерия
0,015—0,014%, содержание атомов трития ничтожно: соотношение 3Н : !Н нахо-
дится в пределах 1 : 1017 — 1 : 1018.
Некоторые физические константы дейтерия и трития приведены ниже:
Г>2 Т 2
Молекулярный вес...................... 4,029 6,203
Температура, °C
кипения.............................. —249,6 —248,1
плавления....................... —254,6 —
Критическая температура, °C ... . —234,8 —232,6
Критическое давление, атм............. 16,3 18,1
Теплота плавления, ккал!кг .... 11,75 —
Водород может отдавать электрон с образованием положитель-
ного иона (в этом случае по свойствам он подобен ионам щелоч-
ных металлов) или присоединять один электрон, превращаясь в от-
рицательный ион (в этом случае он подобен ионам галоидов и
образует соединения типа LiH). Однако при соединении водорода
с типичным металлоидом образуются не ионные, а полярные связи.
При действии вольтовой дуги или пропускании водорода через
зону электрического разряда молекулярный водород диссоциирует
на атомы, которые при понижении температуры соединяются
в молекулы. Причем образование молекул быстрее происходит на
поверхности металлов, чем в объеме газа. Реакция диссоциации
молекулы водорода эндотермична и протекает с большим погло-
щением тепла:
Н2 + 102,6 ккал = 2Н (при 298,2 °К)
Заметная термическая диссоциация начинается при 2000°С и
усиливается с повышением температуры.
Зависимость степени диссоциации молекул Н2 от температуры
приведена ниже:
Температура, °К . . . . 2000 2500 3000 3500 4000 5000
Степень диссоциации
водорода (при 1 атм), % 0,081 1,25 7,83 28,2 62,1 95,4
>8
Явление термической диссоциации молекул водорода и преиму-
щественное соединение атомов в молекулу Н2 на поверхности ме-
таллов используется в процессе атомно-водородной сварки.
Водород отличается значительно большей скоростью диффузии
по сравнению с другими газами. Коэффициенты D взаимной диф-
фузии газов при 1 атм приведены 5 ниже:
Газы т, °к D, см?!сек Г азы т, °к D, см0-(сек
Водород — азот 273 0,647 Водород — водяной пар 307,1 1,020
288 0,743 328,4 1,121
293 0,83 352,2 1,200
373 1,25 365,4 1,179
435 1,61 Кислород — водяной пар 298 0,27
Водород — воздух 273 0.66 307,9 С,°82
289 0,596 328,8 0,318
291,5 0,700 352,2 0,381
Водород — кислород 273 300 0,697 0,824 500 1009 0,691 2,21
500 2,07 Кислород — азот 293 0,219
1000 7,02
При повышенных температурах и давлениях водород диффун-
дирует в металлы. Наибольшее количество водорода поглощает
палладий, который не только адсорбирует, но и растворяет Н2.
В палладий водород проникает уже при 240° С, диффузия водорода
в мягкое железо значительна при 40—50 ат и температуре около
400°С. Поглощение водорода многими металлами (Fe, Со, Ni и др.)
увеличивается с повышением температуры и давления. При охлаж-
дении металла и снижении давления большая часть поглощенного
водорода выделяется. При сверхвысоких давлениях сталь заметно
поглощает водород даже при комнатной температуре. Количество
адсорбируемого водорода зависит от структуры поверхности ме-
талла. Металлический порошок поглощает водорода больше, чем
сплавленный, вальцованный или кованый металл. При поглощении
водорода могут изменяться твердость, термическая стойкость, те-
кучесть, электропроводность, магнитные и другие свойства метал-
лов и сплавов. Для уменьшения диффузии водорода в металлы
при повышенных давлениях и температурах обычно применяют ле-
гированные стали, содержащие хром, молибден, ванадий, воль-
фрам и другие легирующие металлы.
В обычных условиях при комнатной температуре молекулы
водорода малоактивны. Реакционная способность водорода значи-
тельно возрастает при нагревании, под действием света (ультра-
фиолетовых лучей), электрической искры и электрического раз-
ряда, в момент выделения, в присутствии катализаторов, под
воздействием элементарных частиц атомного распада. Водород
вступает в химические соединения со многими элементами. На воз-
духе и в чистом кислороде водород сгорает, образуя воду. При от-
ношении Н2: 02 = 2:1 образуется гремучая смесь, взрывающаяся
при пропускании электрической искры или поджигании. В присут-
2
19
ствии катализаторов (платина, никель, железо и др.) водородо-
кислородная смесь взрывается при незначительном нагревании.
Медленное увеличение давления газов до 150 ат не вызывает
взрыва. Смеси водорода с кислородом и воздухом взрывоопас-
ны 5’10 в широком интервале концентраций Н2:
Смеси водорода Пределы взрываемости, % Н2 Температура самовоспла- менения, °C Максимальная скорость распро- странения пламени, см.!сек,
нижний верхний
С кислородом . 4,5 95 450 890
С воздухом . . 4,1 74,2 510 267
При горении водорода в воздухе и кислороде5 развиваются сле-
дующие максимальные температуры пламени /тах:
Смеси водорода
С воздухом . . .
С кислородом . .
То же............
» ............
Содержание {
Н2, % ‘max*
31,6 2045
73,0 2525
78 2660
82 2425
Скорость распространения взрывной волны в гремучей смеси
(2Н2 + О2)11, по опытным данным, составляет 2821 м/сек, по рас-
четным данным достигает 2864 м/сек.
Теплота сгорания водорода с кислородом 11 при 0° С по реак-
циям
Н2 + V2O2 = Н2о (жидк.) (1)
н2 + V2O2 = Н2О (пар) (2)
составляет соответственно:
По реакции (1) По реакции (2)
Теплота сгорания при 0° С
ккал/кмоль Н2 ............ 68 520 57 840
ккал/кг Н2 ............ 33 990 28 630
Кислород — наиболее распространенный в природе элемент.
В воде содержится 88,9 вес. % О2, в земной коре ~ 49%, в воздухе
23,2% (21 объемн.% О2), в человеческом организме 65% О2. В ат-
мосфере, литосфере и гидросфере на долю кислорода 1 приходится
50 вес.%. Свободный кислород находится только в атмосфере. Га-
зообразный кислород не имеет цвета и запаха, жидкий и твердый
имеют бледно-синюю окраску. Кислород обнаруживает магнитные
свойства (притягивается магнитом).
Кислород играет исключительно важную роль в жизнедеятель-
ности организмов. Без его участия невозможно дыхание, являю-
щееся источником необходимой для жизни энергии. Кислород яв-
ляется одним из самых активных химических элементов. Во избе-
жание возможности взрыва (особенно при повышенном давлении)
20
необходимо предотвращать контакт кислорода с органическими и
легкоокисляющимися веществами.
Под действием тихого электрического разряда или ультрафио-
летовых лучей кислород частично превращается в озон Оз. В не-
больших количествах озон образуется вместе с кислородом в не-
которых электрохимических производствах. При —112° С озон
конденсируется в синюю жидкость, которая при —251,4° С затвер-
девает. Жидкий озон легко взрывается. При обычной температуре
он довольно устойчив, но при нагревании легко разлагается, пре-
вращаясь в кислород по реакции
2О3 = ЗО2 + 68 ккал
Озон является более сильным окислителем, чем кислород. Он
уничтожает бактерии и потому применяется для обеззараживания
воды и дезинфекции воздуха.
При —120° С и давлении около 50 ат кислород сжижается.
Под атмосферным давлением жидкий кислород кипит при
— 182,97° С и затвердевает при —218,8° С.
Природный кислород состоит из смеси трех изотопов: 16О с атомным весом
16,0000, 17О с атомным весом 17,0045 и ,8О с атомным весом 18,00369. Соотно-
шение 1бО: 18О : 17О « 2667:5,5: 1.
Кроме трех устойчивых изотопов кислорода известны радиоактивные ко-
роткоживущие изотопы кислорода ,4О, 2 * * * * * * * * * * * * 15О и 19О, периоды полураспада которых
соответственно равны: 76,5; 118 и 29,5 сек (эти изотопы не имеют значения
в химических исследованиях). Кислород атмосферы содержит больше 18О, чем
кислород речной воды. В воде из снега и ледников содержание тяжелых изо-
гопов D и 18О несколько понижено, в морской воде повышено. Вода, получен-
ная из кислорода углекислоты, имеет плотность на 10,6 у больше, чем из кисло-
рода, находящегося в природной воде.
2. ВОДА И ВОДЯНОЙ ПАР
В процессе электролиза вода расходуется для разложения на во-
дород и кислород и применяется для охлаждения. Воду, подавае-
мую на питание электролизеров, очищают дистилляцией, электро-
осмосом или обессоливанием на ионитах.
Требования к воде для питания электролизеров приведены
в главе V, требования к охлаждающей воде обычные.
В табл. 1-8 приведены основные физико-химические свойства
воды, в табл. 1-9 и 1-10 — давление насыщенных паров над водой
и льдом.
При снижении температуры газа парциальное давление паров
воды снижается, что используется для осушки газов. Помимо
охлаждения осушка газов может производиться при помощи хими-
ческих поглотителей влаги или других сорбентов.
На стр. 24 дано содержание влаги, практически остающейся
в газах при осушке их различными методами (это влагосодер-
;1<ание численно равно давлению водяного пара в мм рт. ст, при
21
Таблица 1-8. Физико-химические свойства воды1, 3’ 7’ 8’ 10, 12
Свойства Н2О Г)2О
Состав, вес. %
водород 11,19 20,24
кислород 88,81 79,76
Молекулярный вес 18,01629 20,02948
Мольный объем, см3
при температуре максимальной плотности . 18,015 18,140
при 0° С 19,65 19,32
Температура (при 1 атм), °C
кипения 100,00 101,431
плавления 0,00 3,813
максимальной плотности 3,98 11,23
Плотность
льда при температуре плавления,г/см3 . . . 0,9176 1,0170
жидкой воды d2f 0,997075 1,104460
максимальная, г/мл ............ 1,000000 1,10597
насыщенного пара (100° С, 1 атм), г/л . . . 0,5974 —
Критические константы
температура. °C 374,2 371,5
давление, атм 218,5 218,6
плотность, кг/л 0,324 —
Теплота плавления
удельная, кал/г 79,7 75,5
мольная, ккал/моль 1,436 1,515
Теплота испарения, ккал/моль
при температуре кипения 9,719 9,927
» 25° С 10,519 10,850
Теплота образования, ккал/моль
жидкости при 25° С 68,317 70,414
пара 57,798 59,563
Теплопроводность жидкой воды, кал/(см • сек • град)
при 0° С 0,00120 —-
» 20° С 0,00143 —
» 75° С 0,00154 —
Теплопроводность водяного пара, кал/(см • сек • град)
при 46° С 0,0000458 —
» 100°С 0,0000551 —-
Теплоемкость, кал/моль
жидкости при 25° С 18,0 20,13
льда при температуре плавления 9,19 10,79
Вязкость при 25° С, мпз 8,93 11,01
Поверхностное натяжение при 25° С, дин/см . . 71,97 71,93
Криоскопическая константа 1,859 2,050
Эбулиоскопическая константа 0,516 —
Теплота электролитической диссоциации (при 13,650
20° С) Н2О -> Н+ + ОН", ккал/моль
22
П родолжение
Свойства н2о D2o
Диэлектрическая проницаемость при 0° С 88,2
» 10° с 84,3 —
» 20° С 80,4 —
» 25° С 78,54 78,26
» 30° с 76,8 —
» 40° С 73,4 —
» 60° С 66,5 —
» 80° С 60,5 —
» 100°с 55,1 —
Энергия диссоциации, ккал]моль Н2О->Н + О + Н 218,9
н2о->н + он 117,8 —
Подвижность ионов при 25° С н+ 349,8 250,1
он- 197,6 —
OD- — 119
Константа диссоциации при 25° С и 1 атм К=[Н+]-[ОН"] 1,008 -10"14
Удельная электропроводность при 26° С, ом'1 • см"1 6,70 • 10'8 —
Таблица 1-9. Давление насыщенного водяного пара над водой 1
(в мм рт. ст.)
Температура, °C 0 ' 1 2 3 4 5 6 7 8 9
0 4,579 4,926 5,294 5,685 6 101 6,543 7,013 7,513 8,045 8,609
10 9,209 9,844 10,518 11,231 11,987 12,788 13,634 14,530 15,477 16,477
20 17,535 18,650 19,827 21,068 22,377 23,756 25,209 26,739 28,349 30,043
30 31,824 33,695 35,663 37,729 39,898 42,175 44,563 47,067 49,692 52,442
40 55,324 58,34 61,50 64,80 68,26 71,88 75,65 79,60 83,71 88,02
50 92,51 97,20 102,09 107,20 112,51 118,04 123,80 129,82 136.08 142,60
60 149,38 156,43 163,77 171,38 179,31 187,54 196,09 204,96 214,17 223,73
70 233,7 243,9 254,6 265,7 277,2 289,1 301,4 314,1 327,3 341,0
80 355,1 369,7 384,9 400,6 416,8 433,6 450,9 468,7 487,1 506,1
90 525,76 546,05 566,99 588,60 610,90 633,90 657,62 682,07 707,27 733,24
100 760,0 787,6 815,9 845,1 875,1 906,1 937,9 970,6 1004,4 1038,9
110 1074,6 1111,2 1148,8 1187,5 1227,3 1268,0 1309,9 1352,9 1397,2 1442,6
120 1489,1 1536,7 1585,9 1636,1 1687,6 1740,6 1794,8 1850,4 1907,4 1965,8
130 2025,7 2087,1 2150,1 2214,4 2280,5 2347,0 2416,2 2488,0 2565,5 2634,8
140 2710,5 2788,2 2867,5 2948,9 3031,2 3116,6 3203,4 3292,2 3382,8 3475.6
Таблица 1-10. Давление насыщенного водяного пара нац льдом 1
в мм рт. ст.)
Температура, °C -9 —8 -7 -6 -5 —4 —3 —2 -1 0
-50 0,008 0,009 0,011 0,013 0.015 0,017 0,019 0,022 0,025 0,029
-40 0,033 0,037 0,042 0,047 0,052 0,058 0,066 0,074 0,083 0,093
-30 0,105 0,119 0,134 0,150 0,167 0,185 0,205 0,227 0,252 0,280
-20 0,311 0,345 0,383 0,425 0,471 0,521 0,576 0,636 0,701 0,772
-10 0,850 0,935 1,027 1,123 1,238 1,357 1,486 1,627 1,780 1,946
0 2,125 2,231 2,532 2,761 3,008 3,276 3,566 3,879 4,216 4,579
Продолжение
Осушающее средство Содержание водяного пара, г/.мЗ при 20° С Осушающее средство Содержание водяного пара, г/м$ при 20° С
Охлаждение до —194° С Р2О5 Mg(C104)2 Mg(C104)2 ЗН2О . . . КОН (плавленый) . . . А12О3 H2SO4 CaSO4 MgO СаВг2 при —72° С . . . Охлаждение до —72° С 1,6- ю~23 2- 10"5 5- 10"4 0,002 0,002 0,003 0,003 0,004 0,008 0,012 0,016 СаВг2 при —21° С .... Охлаждение до —21° С . . СаВг2 при 25° С NaOH (плавленый) .... СаО СаС12 H2SO4 (95,1 %-ная) .... СаС12 (плавленый) .... ZnCl2 ZnBr2 CuSO4 0,019 0,045 0,14 0,16 0,2 0,14-0,25 0,3 0,36 0,8 Ы 1,4
3. ЩЕЛОЧИ И ИХ ВОДНЫЕ РАСТВОРЫ
В качестве электролитов при электролизе воды применяются вод-
ные растворы щелочей. К чистоте щелочей, применяемых для при-
готовления электролита, предъявляются высокие требования.
Для приготовления электролита для электролиза воды приме-
няется едкое кали, получаемое электролизом водных растворов
КС1 по методу с ртутным катодом, которое должно соответство-
вать следующим требованиям;
Показатели Реактив химически чистый (ГОСТ 4203-65) Технический жидкий (проект ГОСТ) Импортный плавленый (примерный анализ)
Содержание КОН, %, не менее . . 85 45 85
Содержание примесей, %, не более
К2СО3 1,0 0,3 1,5
хлориды 0,004 0,001 0,004
сульфаты 0,002 0,0005 0,002
железо 0,0005 0,0005 0,0005
азот общий 0,001 0,001 0,001
кальций 0,006 * 0,0014 0,001
алюминий 0,002 0,00005 0,002 **
кремний (в пересчете на SiO2) . 0,004 0,0003 0,005
тяжелые металлы 0,001 0,002 0,002
фосфаты 0,0005 — 0,002
* Суммарное содержание Са и Mg в пересчете на Mg.
** Суммарное содержание Ц2Оз.
В качестве электролита можно также использовать растворы
едкого натра, получаемого электролизом растворов NaCl по ме-
тоду с ртутным катодом. Применяемый для этой цели жидкий
едкий натр должен удовлетворять следующим требованиям ГОСТ
11078—64:
24
Показатели Марка А1 Марка А2
Содержание NaOH, %, не менее Содержание примесей, %, не более 42 45
Na2CO3 0,6 0,3
NaCl 0,05 0,05
железо (в пересчете на Fe2O3) 0,0011 0,0011
so’- 0,02 0,02
Са2+ 0,0014 0,0014
SiO2 . . 0,008 0,008
хлориты (в пересчете на NaC103) 0,01 0,01
алюминий (в пересчете на А12О3) 0,01 0,003
Си 0,00005 0,00005
Ni 0,00004 0,00002
Мп 0,0001 0,00005
Ва 0,0001 0,0001
Mg 0,0001 0,0001
Pb Не нормируется 0,0002
к 0,1 0,03
Pig 0,00125 0,00125
Прозрачность, мм, не менее 700 900
Примечание. Допустимое содержание 'примесей в едком натре приве i,eno в пере-
счете на 100%-ный продукт.
Технические щелочи, полученные электролизом водных раство-
ров хлоридов щелочных металлов по методу с диафрагмой или хи-
мическими методами, непригодны для приготовления электролита
вследствие их недостаточной чистоты.
Рис. 1-1. Политерма растворимости
КОН в воде.
Рис. 1-2. Политерма растворимости
NaOH в воде.
Растворимость едких щелочей в воде показана на рис. 1-1 и 1-2.
Плотность растворов КОН и NaOH приведена в табл. 1-11
и 1-12.
25
Таблица 1-11. Плотность водных растворов КОН 6
(при 15° С)
Концентрация КОН Плотность, г/м3 Концентрация КОН Плотность, г/см3
вес. % г/л г-экв/л вес. % г/л г-экв/л
1 10,08 0,18 1,008 26 324,7 5,79 1,249
2 20,35 0,36 1,018 27 340,0 6,06 1,259
3 30,80 0,55 1,027 28 355,6 6,34 1,270
4 41,44 0,72 1,036 29 371,2 6,62 1,280
5 52,26 0,93 1,045 30 387,3 6,90 1,291
6 63,26 1,13 1,054 31 403,3 7,19 1,301
7 74,46 1,33 1,064 32 419,7 7,48 1,312
8 85,84 1,54 1,073 33 434,4 7,78 1,322
9 97,42 1,74 1,082 34 453,3 8,08 1,333
10 109,2 1,94 1,092 35 470,4 8,39 1,344
11 121,1 2,16 1,101 36 487,8 8,70 1,355
12 133,3 2,38 1,111 37 505,4 9,01 1,366
13 145,6 2,60 1,120 38 523,3 9,33 1,377
14 158,2 2,82 1,130 39 541,3 9,65 1,388
15 170,9 3,05 1,149 40 559,6 9,98 1,399
16 183,9 3,28 1,149 41 578,2 10,30 1,410
17 197,0 3,51 1,159 42 597,0 10,64 1,422
18 210,4 3,75 1,169 43 616,1 10,98 1,433 •
19 223,9 3,99 1,179 44 635,5 11,33 1,444
20 237,7 4,24 1,188 45 655,1 11,68 1,456
21 251,7 4,49 1,198 46 675,0 12,03 1,467
22 265,8 4,74 1,208 47 695,1 12,39 1,479
23 280,2 5,00 1,218 48 715,5 12,75 1,491
24 294,8 5,26 1,229 49 736,2 13,12 1,503
25 309,7 5,52 1,239 50 757,2 13,49 1,514
Таблица 1-12. Относительная плотность растворов NaOH
(по отношению к плотности воды при 4° С)
Температура, °C Концентрация NaOH, вес. %
5 10 20 30 40 50
0 1,0598 1,1171 1,2296 1,3400 1,4435 1,5400
10 1,0571 1,1132 1,2242 1,3340 1,4367 1,5326
15 1,0565 1,1111 1,2219 1,3312 1,4343 1,5303
20 1,0538 1,1089 1,2191 1,3279 1,4300 1,5253
30 1,0501 1,1043 1,2136 1,3217 1,4232 1,5181
50 1,0418 1,0995 1,2020 1,3090 1,4095 1,5038
100 1,0115 1,0643 1,1700 1,2755 1,3750 1,4690
Ниже приведена вязкость водных растворов КОН (в с/гз)5:
Концентрация, Температура, °C Концентрация, Температура, °C
вес. % 20 30 вес. % 20 30
5 1,10 0,90 20 1,63 1,33
10 1,23 1,02 25 2,05 -
15 1,40 1,15 30 2,60 -
26
Вязкость водных растворов NaOH показана на рис. 1-3.
Теплоемкость водных растворов КОН (при 16—20°С)5 харак-
теризуется следующими данными:
Концентрация, Теплоемкость, Плотность,
моль НгО/моль КОН кал/(г-град) г/см3
30 0,876 1,0887
50 0,916 1,0550
100 0,954 1,0284
200 0,975 1,0144
Теплоемкость водных растворов NaOH (при 16 —20°С)прИ’
ведена ниже:
Концентрация,
моль IfyOluoAb NaOH
7,5
15
30
50
100
200
Теплоемкость,
Плотность,
калЦг-град)
г/см3
0,847 1,2576
0,878 1,1450
0,919 1,0782
0,942 1,0486
0,968 1,0246
0,983 1,0124
Парциальное давление паров воды над растворами электроли-
тов ниже, чем над чистой водой. С увеличением концентрации
электролита соответственно возрастают температуры их кипения.
Рис. 1-3. Вязкость водных растворов NaOH:
/-при 10° С; 2 -при 20° С; 3 — при 30° С; 4 — при
40° С; 5 — при 50° С; 6 -при 60° С; 7-при 70° С;
8 - при 80° С; 9 — при 90° С; 10 — при 100° С. В
В табл. 1-13 приведены парциальные давления паров воды над
растворами КОН, наиболее часто применяемыми в качестве элек-
тролита при электролизе водьи
27
Таблица М3. Парциальное давление водяного пара над растворами КОН
(в мм рт. ст.)
Концентрация КОН, г/100 г Н2О Температура, °C
0 20 40 60 80 100
10 4,25 16,3 51,4 138,9 331 707
20 3,83 14,7 41,4 125,4 299 639
зэ 3,35 12,9 40,7 110,1 263 563
43 2,82 10,9 34,6 94,0 225 485
49 — 10,8 — — — —
Данные о парциальном давлении водяных паров над раство-
рами NaOH приведены на рис. 1-4, температуры кипения раство-
ров КОН и NaOH —на рис. 1-5 и 1-6.
Рис. 1-4. Парциальное давление водяных паров над растворами NaOH различ-
ной концентрации:
/-над водой; 2 —при 10% NaOH; 3-при 20% NaOH; 4 - при 30% NaOH; 5-при 40% NaOH;
6' - при 50% NaOH; 7-при 60% NaOH; 8 - при 70% NaOH; $-при 75% NaOH.
28
При растворении КОН и NaOH в воде выделяется тепло. Зна-
чения теплот растворения щелочей приведены в табл. 1-14.
Таблица 1-14. Теплота растворения NaOH и КОН в воде
(в ккал/кг гидроокиси)
Концентрация гидроокиси в растворе, вес. % Теплота растворения Концентрация гидроокиси в растворе, вес. % Теплота растворения
NaOH кон NaOH кон
5 298 268 55 175 201
10 296 268 60 155 178
15 294 266 65 136 156
20 288 264 70 116 134
25 280 260 75 96 112
30 268 256 80 78 90
35 252 250 85 58 68
40 234 242 90 38 46
45 215 232 95 20 23
50 194 218 — — —
Теплоту растворения твердой щелочи находят непосредственно
по таблице. Теплоты разбавления и концентрирования раствора
Концентрация КО\\,вес. %
Рис. 1-5. Температуры кипения рас-
творов КОН:
1 — при 0,1 атм\ 2 — при 0,5 атм;3 — при 1 атм.
4— при 2 атм\ 5 — при 4 атм.
Концентрация NaOH, вес.%
Рис. 1-6. Температуры кипения
растворов NaOH при атмосферном
давлении.
можно определить как разность теплот растворения, т. е. образо-
вания растворов начальной и конечной концентрации.
29
ЛИТЕРАТУРА
1. Справочник химика, т. I, Госхимиздат, 1962.
2. Ullmanns Encyklopedie der technischen Chemie, Ed. 3, т. 18, N. J. — London,
1969, p. 501
3. Справочник химика, т. II, Госхимиздат, 1963.
4. Гельперин И. И., Зеликсон Г. М., Рапопорт Л. Л., Справочник
по разделению газовых смесей, Госхимиздат, 1963.
5. Справочник химика, т. III, Изд. «Химия», 1964.
6. Иоффе В. Б., Основы производства водорода, Госхимиздат, 1960.
7. Б р о д с к и й А. И., Химия изотопов, Изд. АН СССР, 1957.
8. Шатен штейн А. И. и др., Изотопный анализ воды, Изд. АН СССР, 1957.
9. Киршенбаум И., Тяжелая вода, перев. с англ., Издатинлит, 1953.
10. Справочник химика, т. III, Госхимиздат, 1952.
11. Хютте, Справочник, т. I, Госмашгехиздат, 1934.
12. П а с м а н и к М. И., С а с с - Т и с о в с к и й Б. А., Якименко Л. М., Про-
изводство хлора и каустической соды, Справочник, Изд. «Химия», 1966.
ГЛАВА ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
II
ЭЛЕКТРОЛИЗА ВОДЫ
1. ОБЩИЕ СВЕДЕНИЯ О ПРОЦЕССЕ ЭЛЕКТРОЛИЗА
Как известно, при прохождении электрического тока через рас-
творы электролитов на электродах происходит разряд ионов и про-
текают связанные с этим химические реакции. Протекание про-
цесса электролиза определяется переносом электрического тока в
жидкости и условиями разряда присутствующих в растворе ионов
электролита. Общие вопросы теории электролиза освещены в ряде
работ 1”8.
Процесс электролиза воды с получением водорода и кисло-
рода описывается следующим суммарным уравнением:
Н2О = Н2 + 1/2О2 (П-1)
Чистую воду нельзя непосредственно подвергать электролизу,
так как ее электропроводность очень мала. Удельная электропро-
водность водопроводной воды близка к 10-3 ом~х • см~х, очень чистой
дистиллированной воды около 4 • 10"8 ом~х • см~х. Поэтому при элек-
тролизе применяют водные растворы электролитов — кислот, ще-
лочей, солей.
Кроме доступности, дешевизны и малой агрессивности, элек-
тролиты, применяемые для электролиза воды, должны иметь высо-
кую электропроводность, позволяющую снизить потери напряже-
ния на преодоление омического сопротивления электролита в ячей-
ке, и такой ионный состав, чтобы на катоде могли протекать только
процессы с образованием газообразного водорода, а на аноде —
с образованием кислорода. Для этого в электролите должны отсут-
ствовать ионы, которые могут выделяться на электродах с образо-
ванием других продуктов электролиза. Ниже приведены значения
стандартных потенциалов выделения некоторых ионов из 1 н. вод-
ных растворов:
Электродный процесс Потенциал, в Электродный процесс Потенциал,
Li+ + е —» ► Li -3,02 D+ + e —> ’/so2 -0,003
К+ + е — - К -2,922 Н+ + е —> 72Н2 4=0.00
Na+ + е — ► Na -2,7125 Cu2++ 2е —> Си +0,3448
А13+ + 3е —i » Al -1,67 Hg2++ 2е —> Hg V2O2 + Н2О + 0,7986
Zn2+ + 2е —: ► Zn -0,762 2OH~ —2e —> + 0,401
Сг’+ + Зе —s - Cr -0,71 Г — е —> 7Л + 0,54
Fe2+ + 2e —> - Fe -0,44 Вг~ — е —> /2Вг2 + 1,087
Ni2+ + 2е —5 ► Ni -0,25 СГ-е —> 72С12 +1,358
Pb2+ + 2е —i ► Pb -0,126 F’- е —> 72f2 + 2,85
31
Потенциал £, практически необходимый для разряда ионов, за-
висит от их концентрации в электролите (активности), перенапря-
жения выделения и других факторов:
Е=П + е0 + -^-Ina (П-2)
Пг
где т] — перенапряжение, в; е0 — стандартный потенциал разряда ионов при
активности их в растворе а — 1; R — универсальная газовая постоянная; Г —
температура, °К; п — валентность разряжающегося иона; F — число Фарадея;
а — активность иона в растворе.
Изменяя состав, концентрацию и температуру электролита и
подбирая условия, определяющие величину перенапряжения
(прежде всего материал электродов), можно изменять протекание
электродных процессов в желательном направлении.
В промышленных процессах электролиза воды в настоящее
время применяются только щелочные электролиты — едкое кали и
едкий натр. Если в качестве электролитов используются техниче-
ские щелочи, в их растворах присутствуют примеси ионов
СОз~, SOt, СГ, БЮз" и т. д. Возможно также присутствие в
электролите небольших количеств железа и других загрязнений.
При длительной эксплуатации установок электролиза воды
в растворе электролита накапливаются посторонние ионы, вноси-
мые с примесями, содержащимися в питательной воде. Если ка-
кая-либо примесь, например ионы С1~, постоянно поступает в рас-
твор электролита, то при достаточной продолжительности процесса
электролиза достигается предельная концентрация этой примеси,
которая определяется из равенства ее прихода и расхода в элек-
тролизере за единицу времени. Для этого случая уравнение ма-
териального баланса аппарата по данной примеси может быть
представлено в виде:
С0Р + ^- = ^- (П-З)
где Со — содержание примеси в питательной воде, г/л; Р — расход питательной
воды па единицу вырабатываемого газа, л; Ci — содержание примеси в свежем
растворе электролита, подаваемом в аппарат для пополнения потерь щелочи,
г/л; b — потери щелочи на единицу вырабатываемого газа, г; Ск — предельное
содержание примеси в растворе электролита, г/л; С — концентрация щелочи
в электролите, г/л.
Из выражения (П-З) легко определяется предельная концен-
трация примеси в электролите:
C^Cl + ^ (П-4)
При питании электролизера дистиллированной водой содержа-
ние посторонних ионов в электролите обычно очень невелико и в
сумме не превышает 1—5 г/л, исключая карбонаты, содержание
которых в 1 л раствора электролита может достигать десятков
граммов. В электролизерах с открытым зеркалом электролита, со-
32
прикасающимися с воздухом, концентрация карбонатов может быть
с1це больше. Для электролизеров некоторых конструкций электро-
лит приготовляют в герметичных баках с азотной подушкой, что
предотвращает загрязнение его карбонатами.
При электролизе воды на катоде выделяется водород, на ано-
де — кислород. В зависимости от условий ведения катодного про-
цесса возможны 9-13 два механизма его протекания. В кислых рас-
творах с высоким содержанием ионов водорода его выделение
происходит за счет разряда ионов Н+ с образованием атомарного
водорода, который адсорбируется на поверхности катода, что мо-
жет быть описано выражением:
Н+ + е + Me = (Н—Me) (П-5)
где Me — металл катода.
Поскольку ион водорода в растворе гидратирован, стадию его
разряда можно представить в виде:
Н3О+ + е + Me = Н2О + (Н-Ме) (П-6)
Следующая стадия катодного процесса — рекомбинация ато-
марного водорода в молекулярный
2(Н—Мё) = Н2 + 2Ме (П-7)
протекающая по каталитическому механизму.
В определенных условиях обе стадии катодного процесса —
разряд ионов Н+ и выделение молекулярного водорода — могут
протекать одновременно. При этом удаление водорода с поверх-
ности электрода может протекать по электрохимическому меха-
низму:
Н3О+ + е + (Н-Ме) = Н2 + Н2О + Me (П-8)
В щелочных растворах, где концентрация ионов водорода и
доля их в переносе тока по раствору очень мала, и в кислых рас-
творах при очень высоких плотностях тока недостаток ионов водо-
рода у катода восполняется за счет диссоциации молекул воды
или их прямого разряда с образованием атомов водорода и ионов
ОН~ и последующей рекомбинацией атомарного водорода в моле-
кулы по каталитическому или электрохимическому механизму:
2Н2О + 2е + Me = Н2 + 2ОН ' + Me (П-9)
Если в растворе присутствуют другие катионы, имеющие более
положительный потенциал выделения по сравнению с водородом,
они выделяются на катоде, образуя осадок. Это наблюдается, на-
пример, при наличии в электролите примесей соединений свинца,
олова, цинка, железа, хрома, молибдена и некоторых других ме-
таллов. В случае образования на катоде такого осадка могут из-
меняться потенциал выделения водорода и условия протекания
катодного процесса. В промышленных условиях электролит прак-
тически всегда содержит небольшое количество ионов железа из-за
постоянной коррозии стальных деталей электролизеров. Поэтому
3 Зак. 713
33
на катодной поверхности обычно образуется осадок в виде метал-
лической (железной) губки.
Выделение на аноде кислорода при электролизе воды происхо-
дит в результате разряда гидроксильных ионов или молекул во-
ды 9’10. Присутствующие в электролите небольшие количества (не
более 1—5 г/л) СГ, SOC, БЮз” и других ионов, а также ионы
СОз" при достаточно высокой концентрации щелочи в растворе
(200—300 г/л и более) не могут разряжаться, так как для этого
в данных условиях необходим более высокий потенциал, чем для
разряда ионов ОН- или молекул воды. В щелочных растворах при
умеренных плотностях тока подвод ионов гидроксила к аноду не
является лимитирующим процессом и они разряжаются на аноде
по реакции:
2ОН’ -2е = Н2О + V,O2 (II-10)
В кислых растворах при любых плотностях тока и в щелочных
растворах при высоких плотностях тока подвод ионов ОН’ яв-
ляется лимитирующей стадией и для разряда их предложен второй
механизм:
Н2О - 2е = VA + 2Н+ (II-11)
При электролизе в переносе тока принимают участие все нахо-
дящиеся в электролите ионы. Доля их участия определяется отно-
сительной концентрацией и подвижностью ионов. В щелочных
электролитах вследствие очень низкой концентрации ионов водо-
рода перенос тока осуществляется почти исключительно ионами К+
или Na+ и гидроксилами ОН’.
На катоде разряжаются практически только молекулы воды,
на аноде—ионы ОН’. При этом на каждую молекулу выделивше-
гося на катоде водорода распадается две молекулы воды с обра-
зованием двух ионов ОН". Ионы К+ й Na+, участвующие в пере-
носе тока к катоду, так же как СГ, SO?” и другие анионы, уча-
ствующие в переносе тока к аноду, на электродах не разряжаются.
При проведении электролиза в течение длительного времени
концентрация ионов К+ или Na+ в катодном пространстве возра-
стает, а в анодном понижается вследствие переноса этих катионов
из анодного в катодное пространство. Концентрация щелочи в
анодном пространстве должна дополнительно снижаться и в свя-
зи с образованием воды при разряде ионов ОН’ на аноде по реак-
ции (П-10). Благодаря участию ионов СГ, SO?", СОз” и других
примесей в переносе тока возле анода в ходе процесса электролиза
увеличивается концентрация анионов, присутствующих в электро-
лите, за счет снижения концентрации их в католите. Диффузия че-
рез диафрагму, разделяющую анодное и катодное пространства
ячейки, приводит к уменьшению разности концентраций этих иоибв
в анолите и католите.
Спустя некоторое время после начала электролиза разность
концентраций щелочи и различных примесей в анолите и католите
34
достигает постоянной величины, зависящей от плотности тока на
диафрагме, ее сопротивления диффузии и от интенсивности пере-
мешивания анолита и католита.
В большинстве промышленных электролизеров (ФВ-500, ЭФ,
«Вамаг», Пехкранца и др.) предусматривается естественная со-
вместная циркуляция анолита и католита для уменьшения раз-
ности их концентраций в анодном и катодном пространствах. При
этом различие содержания КОН в анолите и католите не превы-
шает 10—20 г/л при общей концентрации едкого кали 350—400 г/л.
В связи с тем, что в процессе электролиза воды на обоих элек-
тродах выделяются газы, прилегающий к электроду слой электро-
лита интенсивно перемешивается. Поэтому на поверхности анода
маловероятно образование локальных зон с сильно пониженной
концентрацией КОН и соответственно с повышенной концентра-
цией ионов СГ, SOt, СОз", SiOt и др. Однако в глубине узких
щелей между электродом и прилегающими к нему деталями или
под шламом у поверхности электрода возможно значительное из-
менение концентрации ионов по ранее рассмотренным причинам.
Такие концентрационные изменения, по-видимому, вызывают ме-
стную интенсивную электрохимическую коррозию некоторых дета-
лей электролизеров.
Изменение концентрации различных ионов в анолите и католите
в ходе процесса электролиза воды может быть использовано для
очистки щелочи от загрязняющих ее анионов. Если несколько элек-
тролитических ячеек соединить таким образом, чтобы электролит
циркулировал через катодное пространство каждой предыдущей
ячейки и анодное пространство каждой последующей ячейки, то
в катодном пространстве крайней ячейки повысится концентрация
щелочи и понизится содержание СГ, СОз", SOt и других загряз-
няющих анионов. При этом в анодном пространстве крайней
ячейки накапливаются примеси и снижается концентрация щелочи.
На одном из заводов около 10 лет работает промышленная
установка по очистке растворов щелочи от загрязнений. Очистке
подвергается раствор технического КОН (ГОСТ 9285—59) и за-
грязненный электролит, содержащий большие количества карбона-
тов и хлоридов. При нагрузке по току 7,5 ка на этой установке
получали 1 т/сутки чистого едкого кали (квалификации «ч»)
в виде раствора концентрацией 400 г/л КОН и около 10 тыс.
лг3/сутки водорода.
В современных промышленных электролизерах, работающих
при высоких плотностях тока, необходимы специальные меры для
перемешивания анолита и католита. В случае нарушения нормаль-
ного обмена и перемешивания жидкости в электролизере разность
концентраций анолита и католита иногда достигает очень большой
величины.
Влияние изменений концентрации на величину концентрацион-
ной поляризации будет рассмотрено ниже.
3:
35
Как и в других электрохимических процессах, затраты электри-1
ческой энергии при электролизе воды велики и часто определяют I
экономику этого процесса. Поэтому вопросам расхода энергии на j
электролиз и снижению величины напряжения на электролитиче-
ской ячейке всегда уделяется большое внимание.
2. ЭНЕРГЕТИЧЕСКИЙ БАЛАНС ЯЧЕЙКИ
Электролиз воды с выделением газообразных водорода и кисло-
рода всегда сопряжен с протеканием термодинамически необрати-
мых процессов. Напряжение разложения, т. е. минимальное на-
пряжение на ячейке, при котором возможен процесс электролиза
с выделением водорода и кислорода в виде газовых пузырьков,
зависит от состава и температуры электролита и от материала
электродов.
Напряжение разложения 1 н. растворов электролитов на пла-
тиновых электродах при комнатной температуре с образованием
газообразных Н2 и О2 в качестве продуктов электролиза приведено
ниже
Электролит Напряжение, в Электролит Напряжение, в
H2SO4 1,67 NaOH 1,69
НС1О4 1,65 КОН 1,67
HNO3 1,69 NH4OH 1,74
Н3РО3 1,70
Если состав электролита изменить так, чтобы анодным продук-
том был не кислород, а, например, галоид, или чтобы на катоде
вместо Н2 получался, например, Zn, то напряжение разложения
может существенно измениться, что иллюстрируется следующими
данными:
Электролит.......НС1 HBr ZnSO4 ZnBr2
Напряжение, в . . . 1,31 0,94 2,35 1,80
Различие между напряжением разложения и разностью термо-
динамически обратимых электродных потенциалов объясняется пе-
Рис. П-1. Зависимость тока, проходящего
через ячейку, от напряжения при электро-
лизе щелочного электролита.
ренапряжением на электро-
дах при плотности тока,
близкой к нулю.
На рис. П-1 приведена
зависимость силы тока, про-
ходящего через электролити-
ческую ячейку со щелочным
электролитом, от приложен-
ного к ней напряжения. Если
оно меньше напряжения раз-
ложения, наблюдается так
называемый остаточный ток
небольшой величины. Его
возникновение объясняется разрядом ионов Нь и ОН" без выделе-
ния газов. При этом выделившиеся на электродах веще-
ства переходят в раствор за счет их обратной диффузии без обра-
зе
зивания газовой фазы. Остаточный ток увеличивается с повыше-
нием температуры и при перемешивании электролита.
Присутствие в электролите даже следов таких веществ, кото-
рые могут участвовать в электродных процессах или взаимодей-
ствовать с водородом или же с кислородом, растворенными в элек-
тролите, приводит к увеличению остаточного тока. Так, растворен-
ный в электролите кислород может участвовать в катодном
процессе с образованием воды или перекиси водорода. Если количе-
ство веществ, которые могут реагировать с водородом и кислоро-
дом, восстанавливаться на катоде или
окисляться на аноде при прохождении
тока через электролит, значительно, то
остаточный ток достигает заметной ве-
тчины. В этом случае параллельно
с электролизом воды протекают про-
цессы электроокисления или электро-
восстановления с большим или мень-
шим выходом по току. Когда напряже-
ние на ячейке достигает величины на-
пряжения разложения, происходит пе-
региб кривой (см. рис. П-1) и далее
ток возрастает почти линейно по мере
повышения напряжения.
Для проведения процесса электро-
лиза с конечной силой тока, помимо
термодинамически обратимых элект-
родных потенциалов и перенапряже-
ния, необходимо преодолеть потери на-
Рис. П-2. Напряжение на ячей-
ке и его составляющие:
а-при плотности тока, близкой к
нулевой; б - при конечной плотности
тока.
пряжения из-за омических сопротивле-
ний по пути тока через ячейку и допол-
нительных явлений концентрационной
поляризации, возникающей вследствие
изменений концентрации электролита
в ходе электролиза.
Напряжение Е на ячейке в процессе электролиза воды можно
представить как сумму следующих составляющих (в в):
Е — Ш + Лк + Ла + ^кп + + //?э + + //?м (II-12)
I че и — термодинамические обратимые значения потенциала катода и
<шода; Лк и Ла — перенапряжение выделения водорода на катоде и кислорода
н<1 аноде; екп и ея— величины концентрационной и диффузионной поляриза-
ции; / — сила тока; /?□, /?д и /?м — сопротивление электролита, диафрагмы, ме-
1 зллических проводников и контактов в ячейке, ом.
На рис. П-2 показана схема составляющих общего напряже-
ния па ячейке. Левая часть рисунка характеризует процесс
'j 1ектролиза при плотности тока, близкой к нулевой. При этом поте-
рями напряжения на преодоление сопротивления электролита, диа-
фрагмы и металлических проводников, так же как электродвижу-
37
щей силой концентрационной и диффузионной поляризации, можно
пренебречь. Правая часть рисунка относится к процессу электрод
лиза, протекающему с определенной (конечной) плотностью тока.
В этих условиях следует учитывать все составляющие напряжения,
входящие в выражение (П-12). I
Обычно величина IR3 изменяется по высоте электрода вслед-
ствие различного газонаполнения электролита. Это приводит к не-
равномерной плотности тока по высоте электрода и к соответствую-
щему изменению других составляющих общего напряжения на
ячейке, которое, естественно, сохраняет постоянное значение.
Теоретическое напряжение разложения
Теоретическое напряжение разложения Ео определяется разностью
термодинамически обратимых потенциалов анода и катода:
Ео ~ £к (П-13)
Значения равновесных потенциалов для катодного и анодного
процессов ек и еа можно рассчитать на основании стандартных тер-
модинамических функций воды и ее составляющих, приведенных
ниже (при 25°С и 1 атм):
Функции
Свободная энергия Аб°, кал/моль . .
Энтальпия АН0, кал!моль..........
Энтропия S0, кал/(моль ♦ град) . . .
н2о Н+ ОН“ Н2 (газ) О2 (газ)
-56 690 0 -37 585 0 0
-68317 0 -54 660 0 0
-16,716 0 -2,49 31,208 49,003
процесса AG° = 0,00,
Из выражения
(П-14)
Изменение свободной энергии катодного
анодного процесса AGa ~ — 56690 кал!моль.
AG
0,239/iF
получаем значения стандартных потенциалов для анодного и ка-
тодного процессов: = 0, eQa = 1,23 в.
В выражении (И-14) п — количество вещества, участвующего в
электродной реакции, г-экв\ F — число Фарадея (96570 а-сек)\
0,239 — коэффициент пересчета джоулей в калории.
Равновесные потенциалы катода и анода в зависимости от кон-
центрации ионов водорода могут быть определены из выражений:
о , 2,3/?Г , 2,3/?7 г ... .тт _
ек ек 4" р 1g ан+ р ДрВ] (1Ы5)
о , 2,ЗТ?Г , , 2,3/?Г г ТТ1
еа =^а + —р— !gaH+= И23-----— [pH] (П-16)
С ростом pH электролита значения равновесных потенциалов
анода и катода становятся более отрицательными, при этом теоре-1
тическое напряжение сохраняется неизменным (рис. П-З). i
Общее изменение энергии системы AG равняется тепловому эф-
фекту реакции Q:
>\U=Q = A + q (П-17)'
где /1 — максимальная работа реакции; q— количество тепла, которое виде*;
ляется или поглощается в ходе процесса, !
38
При электролизе воды q > 0. Проведение этого процесса сопро-
вождается поглощением тепла даже в том случае, если его можно
0ь1ло бы проводить в термодинамически обратимых условиях. При
работе водородо-кислородного элемента q <0 и процесс должен
идти с выделением тепла, если прово-
дится в обратимых условиях. Теорети-
ческие напряжение разложения воды
может быть определено исходя из ве-
личины максимальной работы реакции
Ц2О = Н2 + 72О2 по выражению, ана-
логичному формуле (II-14):
р —
° nF -0,239
(П-14а)
При 25° С работа А = 56690 кал)моль
Н2 и £0= 1,23 в\ при 80° С величина
4 = 54437 кал!моль Н2 и Ео=1,18в.
Рис. П-З. Зависимость равно-
весного потенциала анода и ка-
Теоретическое напряжение разло-
жения может быть определено также
исходя из теплового эффекта реакции
тода от pH электролита:
/ — потенциал анода; 2 —потенциал
катода.
и температурного коэффициента. По уравнению Гиббса—Гельм-
гольца
al
Максимальная работа процесса
А = О,239пЕЕо
После преобразования этих выражений получаем:
р — Q д. т
0 0,239/zF dT
(П-18)
(П-19)
(П-20)
Температурный коэффициент теоретического напряжения разло-
жения воды = —0,0008 в)град.
При 25° С величина Q = 68317 кал!молъ Н2, значение EQ тоже
равно 1,23 в.
Перенапряжение выделения водорода и кислорода
Перенапряжение выделения водорода на катоде и кислорода на
аноде — значительные составляющие общего баланса напряжения
электролитической ячейки (см. рис. П-2). Поэтому всегда стре-
мятся по возможности снизить величину перенапряжения. Однако
интенсификация процесса электролиза всегда связана с повыше-
нием плотности тока и с ростом перенапряжения при прочих рав-
ных условиях.
Теоретические основы процессов, ответственных за перенапря-
жение при выделении водорода на катоде, изучали А. Н. Фрум-
39
кин и др.8=14. В зависимости от материала катода и условий веде-
ния электродного процесса его лимитирующей стадией может быть
разряд ионов водорода (теория замедленного разряда) или эвакуа-
ция атомарного водорода из электрода с образованием газа. Даже
при одинаковом материале катода в различных условиях электрод-
ного процесса может изменяться соотношение скоростей его стадий
и в связи с этим ответственность каждой из них за величину пере-
напряжения выделения водорода.
Перенапряжение выделения водорода на различных металлах
изучалось многими исследователями 15‘ 25. Перенапряжение выделе-
ния кислорода изучено менее подробно, хотя этому вопросу тоже
посвящено немало работ 26“31. Величины перенапряжения выделе-
ния водорода на катоде и кислорода на аноде зависят от многих
факторов: от материала электрода, состояния его поверхности,
плотности тока, температуры, состава и концентрации электролита,
наличия в нем различных примесей, длительности ведения процесса
электролиза. Это затрудняет установление точных зависимостей и
часто приводит к значительным расхождениям результатов различ-
ных исследователей.
На гладких поверхностях электродов перенапряжение выше,
чем на шероховатых. Образование металлического губчатого осад-
ка на катоде может снижать перенапряжение. Присутствие кол-
лоидов в электролите обычно повышает перенапряжение па тех
электродах, на которых могут осаждаться коллоидные частицы при
прохождении тока.
, На всех металлах перенапряжение возрастает с увеличением
плотности тока на электродах. Верхний предел перенапряжения
выделения водорода с ростом плотности тока около 1,3 в. Обычно
наибольшее повышение перенапряжения с увеличением плотности
тока наблюдается на электродных материалах с малой величиной
перенапряжения. На материалах же с высоким перенапряжением
оно возрастает с повышением плотности тока в меньшей степени.
При умеренных плотностях тока существует линейная зависимость
перенапряжения от логарифма плотности тока 32. Иногда наблю-
дается перегиб кривой этой зависимости, что свидетельствует об
изменении механизма протекания электродного процесса с увели-
чением плотности тока.
С повышением температуры перенапряжение выделения водо-
рода и кислорода обычно снижается примерно в одинаковой сте-
пени на различных металлах. Температурный коэффициент пере-
напряжения водорода на катоде и кислорода на аноде для многих
металлов 8 находится в интервале 2—4 мв/град. С повышением тем-
пературы от комнатной до 70—80° С в большинстве случаев пере-
напряжение снижается на 30—40%. Постоянное значение перена-
пряжения выделения водорода и кислорода устанавливается только
после проведения процесса электролиза в течение длительного вре-
мени (до 4—5 суток).
40
Зависимость перенапряжения водорода на различных электро-
дах от величины радиуса атома металла 33; 34 показана на рис. П-4.
Наиболее низкое перенапряжение выделения водорода характерно
для металлов с атомным радиусом около 1,38 А, близким к радиусу
молекулы воды. Перенапряжение водорода возрастает на металлах
как с большим, так и с меньшим атомным радиусом, чем указано
выше.
W
РЬО
ТЮ
£
А?
Be
о
Си
GgFe 0
°°йСо
°Ni
хь
о
АЮ
м То '
!О° W 0Ай
Pd ° °Аи
Re8 °Р<
oBI oln
> Son
oTa 0Cd
/,/ 1,2 1,3 J4 1,5
Атомный радиус, А
1,7
Рис. П-4. Зависимость величины перенапряжения выделения водорода
от атомнэго радиуса металла электрода.
Перенапряжение водорода на различных металлах зависит от
их места в периодической системе элементов. Примерные величины
перенапряжения водорода на элементах различных групп периоди-
ческой системы приведены ниже:
Группа........... I II III IV V VI VII VIII
Перенапряжение, в . 0,35 0,70 0,50 0,45 0,42 0,32 0,25 0,18
Зависимость величины перенапряжения от плотности тока I оп-
ределяется выражением Тафеля32:
= a + (П-21)
Коэффициент а в этом выражении зависит в первую очередь от
материала электрода и состояния его поверхности, которое также
изменяется в зависимости от наличия в электролите загрязнений и
добавок. Величина коэффициента b также зависит от материала
электрода. Для перенапряжения водорода на большинстве элек-
тродных материалов величина этого коэффициента колеблется
в пределах 0,10—0,12,’однако возможны существенные отклонения
от этих значений.
Выражение (П-21) непригодно при малых плотностях тока, так
как, если плотность тока приближается к нулю, перенапряжение,
определяемое по выражению (П-21), становится отрицательной ве-
личиной и стремится к бесконечности.
Сложная зависимость величины перенапряжения от ряда вза-
имосвязанных между собой факторов затрудняет теоретическое
определение этой величины для конкретных условий процесса элек-
тролиза. Поэтому для практических целей обычно пользуются экс-
периментально установленными значениями перенапряжения выде-
ления водорода и кислорода на разных электродных материалах
при различных условиях электролиза. '
В экспериментально найденную величину перенапряжения мо->
гут входить также электродвижущая сила концентрационной поля-
ризации и потери напряжения на преодоление сопротивления элек-
тролита в приэлектродном слое, если измерение выполняется без
выключения тока.
Приводимые в литературе величины перенапряжения выделения
водорода и кислорода зачастую имеют расхождения, вызванные,
по-видимому, различием условий, в которых определялось перена-
пряжение. В табл. П-1 приведены1 примерные величины перена-
пряжения выделения водорода и кислорода на электродах из раз-
личных материалов при малой плотности тока.
Таблица П-1. Перенапряжение выделения водорода и кислорода (в мв)
на различных электродах при низкой плотности тока
Материал электрода Водород Кислород Материал электрода Водород Кислород
Pt(платинированная) 0 250 Си 230 250
Pd 0 430 Cd 480 430
Au 20 530 Sn 530 —
Fe 80 250 Pb 640 310
Pt (гладкая) .... 90 450 Zn 700 —
Ag 150 410 Hg 780 —
Ni 210 60
В табл. П-2 приведены перенапряжения выделения водорода и
кислорода из щелочных растворов в условиях, близких к условиям
промышленного электролиза воды 2.
Выделение водорода происходит с малым перенапряжением на
платинированной платине, рении и вольфраме, однако эти металлы
мало доступны в качестве катодных материалов для электроли-
зеров. С очень малым перенапряжением водород выделяется также
на электродах из никеля Ренея35, получаемого выщелачиванием
легкорастворимого компонента, например алюминия из его сплава
с никелем. Такие активные электроды предложено использовать
в процессе электролиза воды36. При обычной температуре электро-
лиза (80—100° С) и плотности тока 1500 а/м2 перенапряжение вы-
деления водорода на электродах из никеля Ренея составило около
30 мв. В течение годового испытания напряжение на ячейке с та-
кими электродами возросло37 на 40 мв. Из технических материа-
лов сравнительно небольшим перенапряжением выделения водо-
42
Таблица П-2. Перенапряжение выделения водорода и кислорода (в лее)
из 16%-ного раствора NaOH при различной плотности тока I
Материал электрода При 18° С и / (в а!м2) При 80° С и i (в а!м2)
100 1009 2009 100 500 1000 2000
Для водорода
pt (платинированная) .... Гальванически осажденный Ni, 40 80 95 10 30 45 55
содержащий серу Никелистая сталь, обработан- НО 190 210 20 60 80 100
ная песком 210 360 400 НО 150 180 230
Ni (катаный) 370 510 550 300 390 430 470
Ге (обработанное песком) . . 260 390 450 120 180 220 270*
Fe (никелированное) 250 490 560 160 240 260 300
Fe (кобальтированное) .... — 420 470 200 — 360 420
Для кислорода
Гальванически осажденный Ni, содержащий серу Никелистая сталь, обработан- ная песком 320 350 385 440 420 480 180 250 220 275 240 290 265 310
Ni (катаный) 550 820 850 310 — 400 430
Fe (кобальтированное) .... 310 370 390 230 — 270 290
* 345 мв при 3509 а/м2.
** 340 мв при 3500 а)м2.
рода отличаются железо (сталь), никель, кобальт, медь. Наиболее
высоко перенапряжение выделения водорода на цинке, свинце,
ртути.
Изыскание путей снижения величин перенапряжения выделения
водорода привлекало внимание многих исследователей. Исследо-
вания возможности снижения потенциала катода проводились в
нескольких направлениях и заключались в подборе металла или
сплава для катода или способа нанесения электролитического по-
крытия на железную основу катода для образования его поверхно-
сти, работающей с пониженным перенапряжением выделения водо-
рода. Предлагалось покрытие катодов сернистым никелем20 с
содержанием 16—28% серы и гальваническое покрытие их вольфра-
моникелевым сплавом 16, предложено изготовлять катоды из стали,
легированной вольфрамом, ванадием и молибденом.
На металлокерамических электродах на основе железного
.порошка наблюдалось38 снижение катодного потенциала по сравне-
нию с потенциалом'стального катода. Предложены металлокера-
мические катоды39, изготовленные из железного порошка с добав-
ками 3—5% других металлов с пониженным значением перена-
пряжения водорода (молибден, вольфрам, кобальт).
43
Можно добиться тех же результатов введением в электролит!
каких-либо добавок, предполагая, что благодаря частичному оса-]
ждению их на катоде образуется рабочая поверхность с понижен-’
ным перенапряжением выделения водорода. Coi ласпо другому’
предложению40, введение 0,1 г!л молибдата натрия в электролит;
позволяет снизить напряжение с 2,21 до 1,98 в при плотности тока!
в ячейке 1000 а/.м2, 80° С и использовании в качестве электролита
20%-ного раствора NaOH. Для снижения напряжения предприни-
мались попытки 41 вводить в электролит мелкораздробленный гра-
фит или кизельгур.
В условиях промышленного процесса электролиза воды все эти
способы снижения перенапряжения выделения водорода в течение
длительного времени не давали предполагаемого эффекта. По-ви-
димому, в условиях промышленного процесса потенциал катода оп-
ределяется в основном свойствами металлической губки, осаждаю-
щейся на его поверхности в ходе процесса. Нанесение на катод по-
крытий, имеющих в равных условиях пониженное перенапряжение
выделения водорода по сравнению с перенапряжением его выделе-
ния на катоде, покрытом железной губкой, может соответственно
снизить потенциал катода лишь в том случае, если на нем не обра-
зуется железная губка. В противном случае снижение потенциала
катода, наблюдаемое при электролизе воды с чистым электроли-
том (не содержащим примесей железа), не может быть воспроиз-
ведено в промышленных условиях этого процесса.
Благодаря сильно развитой поверхности железной губки сни-
жается фактическая плотность тока на катоде, что обусловливает
относительно низкий катодный потенциал (по сравнению с потен-
циалом гладкого стального катода), как и при электролизе водных
растворов хлоридов щелочных металлов 42; 43.
Отметим, что осаждение никеля из электролитов, содержащих
роданиды, нитраты и некоторые другие примеси, позволяет 44 акти-
вировать поверхность электродов и на длительное время значи-
тельно снижать катодное и анодное перенапряжение в промыш-
ленных электролизерах для получения водорода и кислорода. Воз-
можна активация поверхности катодов осаждением на ней слоя
металлов платиновой группы. При этом необходимо исключить воз-
можность загрязнения электролита соединениями железа (за счет
коррозии стальных деталей) и примесями, содержащимися в пита-
тельной воде. Такой прием используют в электролизерах Здан-
ского — Лонца.
По данным Г. В. Палецкого, 3. А. Ткачек с сотр., осаждение на
аноде активированных никелевых покрытий из электролитов с ни-
тратными или сульфидными добавками снижает в течение 1 года
работы напряжение на ячейке на 2—3%. В дальнейшем эффект
применения активированного покрытия уменьшается и через 2—2,5
года практически исчезает. Для достижения длительного эффекта
необходима регенерация активного покрытия через 1—2 года. Прак-
тический интерес имеет также снижение на 4,5% напряжения на
44
ячейке путем введения в электролит около За/л хромовокислого
калия. Механизм действия хромовых добавок полностью не изучен,
однако в ряде опытов отмечено снижение анодного и катодного
потенциалов.
Концентрационная поляризация и э.д. с.
диффузионного элемента
Концентрационная поляризация возникает в связи с изменениями
концентрации электролита в ходе процесса электролиза. Концен-
трация щелочи Ci в катодном пространстве электролизера возра-
стает за счет снижения концентрации щелочи С2 в анодном про-
странстве. Работа А концентрационного элемента может быть опи-
сана уравнением:
рт р
Л = А-|п-Л = екпЛ (11-22)
П
Откуда
пт г»
eKn = ^-ln-^- (П-23)
Г1Г U 2
При 80° С после подстановки в формулу числовых значений н,
/?, Т и F и перехода к десятичным логарифмам получаем:
екп = 0,07 lg-£-
С2
При С\1С2 = 1,1 величина екп = 0,003 в.
Электродвижущая сила диффузионного элемента ед возникает
на границе раздела анолита и католита из-за различия чисел пере-
носа аниона /а и катиона
При разряде 1 г-экв вещества через границу раздела анолита и
католита переносится F к, в том числе tKF к катионами из анолита
с концентрацией С2 в католит с более высокой концентрацией С\ и
taF к переносится анионами в обратном направлении — из раствора
с концентрацией G в раствор с концентрацией С2. Работа переноса
F к через границу раздела:
A = ta — 1п-^ -Мк— 1п-^- = е1Г 41-24)
n Cj п С2
Отсюда получаем:
e, = (tK-ta) 4rInTL И’25)
ПГ С 2
Учитывая, что /а = 1 — бъ имеем:
ед = (2/к-1)-^-1п-р- (П-26)
• ИГ С 2
Если в качестве электролита применяется КОН, то при темпе-
ратуре электролиза 80° С число переноса катионов /к = 0,32. Под-
ставляя в формулу (П-26) числовые значения n, R, Т и F и
45
переходя к десятичным логарифмам, получим выражение для диф-
фузионного потенциала:
0,028 1g(П-27)
с2
Величина диффузионного потенциала невелика и при С\1С2 =
= 1,1 составляет примерно 0,001 в.
Падение напряжения в электролите и диафрагме
При прохождении тока через электролитическую ячейку наблю-
дается падение напряжения, связанное с преодолением сопротивле-
ния электролита и диафрагмы, отделяющей анодное пространство
ячейки от катодного. Падение напряжения, обусловленное преодо-
лением сопротивления электролита, зависит от плотности и длины
пути тока в электролите, от его удельного сопротивления. Если
электроды плоские и расположены параллельно друг другу, то при
одинаковых размерах анода и катода можно принять, что плот-
ность тока одинакова по всему сечению ячейки. При этом потеря
напряжения на преодоление сопротивления электролита может
быть определена из выражения:
//?э = (5-^- = /гг/ (II-28)
где /— ток па ячейке, a; i — плотность тока, а!см2; S — сечение ячейки, см2\
rv—удельное сопротивление электролита с учетом его увеличения за счет газо-
наполнения, ом • см; / — расстояние между работающими поверхностями элек-
тродов, см.
Если размеры анода и катода различны, плотность тока в элек-
тролите неодинакова во всем сечении ячейки. В этом случае за
плотность тока в электролите обычно принимают среднее арифме-
тическое между плотностями тока на электродах.
Удельное сопротивление электролита зависит от степени его
газонаполнения и может быть выражено как
rr = Kr (П-29)
где К — коэффициент увеличения удельного сопротивления электролита из-за
наличия в нем газовых пузырьков; г — удельное электрическое сопротивление
чистого электролита, ом • см.
С учетом формулы (П-29) потери напряжения на преодоление
сопротивления электролита составят (в в);
IR3 = Kirl (И-30)
Для концентрически расположенных электродов цилиндриче-
ской формы потерю напряжения в электролите (в в) можно опре-
делить по формуле3:
IR = -^- -2,3 1g А (П-31)
где /—плотность тока на внутреннем электроде, а/см2; Ri и /?2 — радиусы
внутреннего и наружного электродов, см.
46
Выражение (П-31) применимо, если расстояние между элек-
тродами соизмеримо с их диаметрами.
Для снижения потерь напряжения в электролите его удельное
сопротивление и газонаполнение, а также расстояние между рабо-
тающими поверхностями электродов должны быть возможно мень-
ши ми.
Удельное сопротивление электролита зависит ог его темпера-
туры и концентрации. Коэффициент увеличения сопротивления элек-
тролита от включения в пего газовых пузырьков зависит не только
от плотности тока и конструкции ячейки, но и от температуры и
вязкости электролита, определяемой его концентрацией, и от неко-
торых других факторов, которые более подробно будут рассмо-
трены ниже.
Возможности снижения потерь напряжения в электролите за
счет уменьшения плотности тока в растворе ограничены экономиче-
скими соображениями. Различные технологические и конструктив-
ные факторы по-разному могут влиять на отдельные составляющие
общих потерь напряжения в электролите. Так, уменьшение расстоя-
ния между электродами может привести к увеличению газонапол-
нения электролита и коэффициента К в выражении (П-29). С по-
вышением температуры и одновременным снижением удельного
сопротивления чистого электролита может наблюдаться (при темпе-
ратурах около 100° С) увеличение его удельного сопротивления из-
за роста газонаполнения. Эти взаимные связи между различными
составляющими, определяющими общую величину потерь напряже-
ния в электролите, необходимо учитывать при выборе оптимальной
конструкции ячейки и режима ее работы для достижения мини-
мальных потерь напряжения на ячейке.
В прошлом были попытки применения в качестве электролита
растворов серной кислоты, однако при этом необходимы свинцовые
электроды и изготовление корпуса и других деталей электролизера
из коррозионностойких материалов. Использование свинцовых элек-
тродов приводило к повышению напряжения на ячейке из-за боль-
шого перенапряжения выделения водорода на свинце и кислорода
на аноде из перекиси свинца. Применение в качестве электролитов
растворов солей (например, Na2SO4) также связано с рядом не-
удобств.
Для щелочных электролитов легче выбрать электродные мате-
риалы с низким перенапряжением водорода (сталь) и кислорода
(никель) и доступные и дешевые конструкционные материалы для
изготовления деталей электролизеров. Поэтому в промышленных
установках электролиза воды в качестве электролитов применяются
исключительно растворы щелочей. Водные растворы некоторых со-
лей и кислые электролиты иногда используют для проведения спе-
циальных процессов электролиза воды, например в лабораторной
или измерительной технике.
Электропроводность водных растворов электролитов зависит от
концентрации ионов в электролите, заряда и скорости движения
47
ионов при определенном градиенте напряжения в электролите. Ниже
приведены 1 абсолютные скорости движения некоторых катионов ук
и анионов (в см) сек) при градиенте напряжения в электролите
ДЕ = 1 в!см и 18° С:
Катионы
Н+ 0,003242
К+ 0,000665
Na+ 0,000456
VsFe3* 0,00046
Анионы %
он- 0,001802
'/2sof 0,000704
сг 0,000676
/гсог 0,000605
Подвижность, или эквивалентная проводимость, ионов пропор-
циональна скорости их движения:
Хк = vKF
Ха ~
где Хк и Ха — подвижность, или эквивалентная ионная проводи-
мость, катиона и аниона, ом~х -см~2/г-экв; F — число Фарадея.
Эквивалентная проводимость раствора X равна сумме подвиж-
ностей ионов:
X = Хк + Ха (II 32)
Значения подвижности большинства неорганических ионов близ-
ки друг к другу и являются величинами одного порядка. Существен-
но больше подвижность ионов ОН- и особенно ионов Н+. Для объ-
яснения этого предложен особый механизм участия данных ионов
в переносе тока. Если молекулы воды рассматривать как диполи,
ориентированные определенным образом в электрическом поле, то
при разряде на катоде иона Н+ освободившийся при этом ион ОН“
связывает водородный ион соседней молекулы воды. Этот процесс
передачи иона Н+ от одной молекулы воды к другой обусловли-
вает большую подвижность этих ионов по сравнению с другими
ионами, которые должны двигаться в водном растворе от одного
электрода к другому. Кроме того, объем иона водорода меньше
объема любого другого иона. Необходимо учитывать также, что
в водных растворах ионы гидратированы и сопротивление их дви-
жению зависит от объема гидратированного иона. Обычно ионы Н+
гидратированы в меньшей степени, чем другие. Степень гидратации
различных ионов характеризуется следующими цифрами:
Н : С1 : К : Na : Li = 1 : 4 : 5,4 : 8,4 : 13,9
Подвижность ионов возрастает с повышением температуры и
снижается с увеличением концентрации раствора.
Зависимость подвижности ионов от концентрации приведена в
табл. Н-З.
48
Таблица П-3. Подвижность ионов в водных растворах (в он"1 • сьС/г-экз)
при 18° С и температурный коэффициент их подвижности
Ионы Концентрация, г-экв/л Температурный коэффициент подвижности
0 * 0,0901 0,001 0,01 0,1
н+ 315 315 311 307 294 0,0154
Na+ 43,5 43,2 42,4 40,5 36,4 0,0244
К+ 64,6 64,1 63,3 60,7 55,1 0,0217
ОН 174 172 171 167 157 0,0180
СГ 65,5 64,9 64,0 61,5 55,8 0,0216
'/г SOJ" 68,3 66,6 63,8 55,5 40 0,0237
’/г СО*’ 60,5 — 60 55 38 0,0270
* При бесконечном разбавлении.
С ростом концентрации электролита подвижность ионов и его
эквивалентная электропроводность снижается, особенно в области
концентраций, применяемых в промышленных процессах электро-
лиза. Ниже приведено изменение эквивалентной электропроводно-
сти X щелочных электролитов с ростом концентрации (при 18°С):
Концентрация Л, ом 1 2 •см /г-экв Концентрация К, ом 1 •см2/г-экв
щелочи, г-экв/л кон NaOH щелочи, г-экв/л кон NaOH
0,001' 234 208 3 141,6 108,0
0,01 228 200 5 105,8 60,0
0,1 213 183 10 44,8 20,2
1 184 160
Доля участия отдельных ионов в переносе тока (числа пере-
носа) изменяется в зависимости от концентрации и температуры
электролита: с повышением температуры числа переносов аниона
и катиона сближаются.
Зависимость чисел переноса аниона ОН" в растворах щелочи от
температуры иллюстрируется следующими данными (при бесконеч-
ном разбавлении):
Электролит 18° С
NaOH ... 0,8
КОН . . . 0,73
25° С 50° С 100° с
0,8 — 0,75
0,73 0,71 0,69
С ростом концентрации щелочи в растворе его электропровод-
ность вначале быстро (почти линейно) повышается, затем рост
удельной электропроводности замедляется. По достижении опреде-
ленной концентрации щелочного раствора его удельная электропро-
водность достигает максимума и далее снижается по мере повыше-
ния’ концентрации щелочи (рис. П-5). Такой характер изменения
удельной электропроводности с ростом концентрации щелочи мож-
но объяснить снижением подвижности ионов в концентрирован-
ных растворах как из-за увеличения вязкости, так и вследствие
4 Зак. 713
49
взаимодействия заряженных ионов, приводящего к торможению
их движения.
Удельное электрическое сопротивление водных растворов NaOH
и КОН приведено в табл. 11-4.
Таблица П-4. Удельное электрическое сопротивление водных
растворов щелочей 45
(в ом • см)
Температура, СС Концентрация NaOH, вес. %
15 17,5 20 22,5 25 27,5 33 32,5 35
50 55 60 65 70 75 80 Температурный коэффициент 1,575 1,460 1,333 1,250 1,172 1,162 1,046 0,017 1,527 1,408 1,300 1,209 1,130 1,062 1,000 0,0175 1,508 1,381 1,272 1,170 1,088 1,018 0,956 0,0192 1,52) 1,385 1,266 1,164 1,081 1,007 0,943 0,0203 1,583 1,428 1,290 1,180 1,088 1,010 0,941 0,0226 1,692 1,566 1,346 1,220 1,117 1,030 0,955 0,0258 1,780 1,567 1,392 1,256 1,166 1,050 0,969 0,028 1,923 1,650 1,450 1,300 1,176 1,075 0,990 0,0313 1,950 1,695 1,506 1,342 1,200 1,103 1,011 0,0313
Температура, °C Концентрация КОН, нес. %
20 22,5 25 27,5 30 32,5 35 37,5 40
50 55 60 65 70 75 80 Температурный коэффициент 1,250 1,174 1,099 1,046 0,988 0,928 0,882 0,014 1,158 1,096 1,027 0,968 0,909 0,863 0,833 0,013 1,104 1,036 0,970 0,923 0,865 0,820 0,790 0,0133 1,061 0,999 0,933 0,901 0,833 0,788 0,751 0,0137 1,042 0,988 0,922 0,867 0,827 0,775 0,737 0,014 1,060 0,988 0,921 0,864 0,814 0,769 0,730 0,015 1,075 1,000 0,929 0,870 0,818 0,772 0,731 0,0156 1,100 1,020 0,945 0,883 0,828 0,779 0,736 0,0163 1,153 1,064 0,980 0,913 0,825 0,800 0,754 0,0177
При 80° С минимальное удельное сопротивление имеют 32,5—
35%-ные растворы КОН (0,730 ом • см) и примерно 25%-ные рас-
творы NaOH (0,941 ом-см). В области оптимальных концентраций
удельное сопротивление электролита незначительно изменяется при
изменении его концентрации, поэтому некоторые отклонения от оп-
тимума не вызывают заметного увеличения потерь напряжения на
преодоление омического сопротивления электролита. Концентра-
ция, при которой удельное сопротивление электролита минимально,
зависит от температуры: с ее повышением оптимальная концентра-
ция электролита возрастает. Данные для оптимальных концентра-
ций щелочных электролитов приведены на рис. П-6.
По данным Г. В. Палецкого, 3. А. Ткачек с сотр., минимальное
напряжение на ячейке электролизеров ФВ-500 при плотности тока
3300-3700 ф/2 достигается при различных температурах и кон-
центрациях щелочного электролита:
Температура, °C....................
95 100 103
Концентрация (КОН + К2СО3), г/л . 425 — 445 Более 445 Более 469
С повышением концентрации электролита на каждые 10 г/л ко-
эффициент изменения напряжения в среднем на ячейку составляет:
Концентрация, г/л.................... 290 — 330 330 — 38) 380 — 420
Коэффициент, % на 10 г/л . . 1 0,8 0,5
Предложено 45 повышать концентрацию щелочи до 40—50% для
увеличения до 100—110°С температуры электролиза воды, прово-
димого под атмосферным давлением. При выборе практической
Рис. П-5. Удельная электропровод-
ность водных растворов NaOH:
1 — при 0° С; 2—при 18° С; 3 — при 53° С;
4 — при 60° С; 5—при 70° С; 6— при 80° С;
7 - при 90° С; 8 — при 100° С.
Рис. П-6. Зависимость опти-
мальной концентрации водных
растворов КОН (/) и NaOH (2)
и удельного электрического
сопротивления оптимальных
растворов КОН (3) и NaOH (4)
от температуры.
концентрации щелочи в электролите следует учитывать также уве-
личение скорости коррозии деталей электролизера с повышением
концентрации щелочи.
Удельное сопротивление электролитов г снижается с ростом
температуры и может быть определено из выражения
Значение температурного коэффициента Л зависит45 от кон-
центрации электролита и для концентрированных растворов изме-
няется в пределах: 0,013—0,018 для КОН и 0,016—0,038 для NaOH.
4*
51
Сопротивление прохождению тока в электролите существенно ;
возрастает в присутствии посторонних включений — диэлектриков. ;
К таким включениям относятся прежде всего газовые пузырьки, об-
разующиеся на электродах и движущиеся в электролите вверх, а
также частицы материала, из которого выполнена диафрагма. По-
сторонние включения сужают сечение электролита (при этом по-
вышается фактическая плотность тока в электролите) и удлиняют
путь движения тока, делая его извилистым. Все это приводит к ро-
сту потерь напряжения на преодоление сопротивления электролита.
Под газонаполнением понимают отношение объема влажного
газа, распределенного в виде пузырьков в электролите, к общему
объему газонаполненного электролита
Ь = 17ж + 7г
(П-34)
где b — газонаполнение, доли; Vr — объем газовой фазы в электролите; V}K —
объем жидкой фазы в электролите.
Газонаполнение электролита определяется соотношением скоро-
стей двух процессов: образования газовых пузырьков в электро-
лите, заполняющем ячейку, и отвода и отделения их от электро-
лита. Величина газонаполнения электролитов при электролизе вод-
ных растворов щелочей, хлоридов щелочных металлов и некоторых
других электролитов, зависимость газонаполнения от различных
факторов и влияние газонаполнения на величину сопротивления
электролита изучались многими авторами 46~61. Установлено, что
газонаполнение электролитов возрастает с увеличением плотности
тока, высоты электродов, вязкости электролита и уменьшением рас-
стояния между электродами, т. е. с уменьшением объема электро-
лита в ячейке.
На рис. П-7 показано 46 изменение электрического сопротивле-
ния газонаполненных щелочных электролитов (растворы КОН и
NaOH), применяемых в процессе электролиза воды, в зависимости
от высоты электродов при различной плотности тока.
Зависимость газонаполнения от различных факторов наиболее подробно
изучена для процесса электролиза водных растворов хлоридов щелочных метал-
лов с получением хлора, водорода и каустической соды. Поскольку этот про-
цесс также протекает с выделением газов на аноде и катоде, установленные
для него зависимости могут быть использованы и для оценки величины газо-
наполнения в процессе электролиза воды.
По мере роста плотности тока при прочих одинаковых усло-
виях процесса электролиза увеличение газонаполнения отклоняется
от линейного характера. Для процесса анодного выделения хлора
из водных растворов NaCl эта зависимость приведена на рис. П-8.
Количество выделяющихся газов линейно увеличивается с повы-
шением плотности тока, а газонаполнение возрастает при этом в
меньшей степени. Это объясняется укрупнением размеров газовых
пузырьков при подъеме их в электролите вследствие слияния пу-
зырьков по мере увеличения пути движения в жидкости с ростом
52
высоты электрода и увеличения интенсивности образования пузырь-
ков газа с ростом плотности тока.
При уменьшении расстояния между электродами или между
электродом и диафрагмой и связанного с этим уменьшением об-
щего объема газонаполненного электролита его газонаполнение
возрастает (рис. П-9). Поэтому с уменьшением расстояния между
электродами сначала наблюдается снижение потерь напряжения на
преодоление омического сопротивления газонаполненного электро-
лита. При дальнейшем уменьшении расстояния между электро-
дами потери напряжения в электролите могут возрастать из-за
Рис. П-7. Зависимость удельного элек-
трического сопротивления газонапол-
ненного электролита от высоты электрода
при различной плотности тока:
/-при 28,7% NaOH и 1000 а/л«2; 2 - то же и
500 а/л<2; 3 -при 15,4% NaOH и 1000 а/м2; 4 - то
же и 500 а’м2; 5-при 28,2% КОН и 1000 а!м2.
Рис. П-8. Влияние плотности гока
на газонаполнение анолита при 80° С
(межэлектродное расстояние 12 мм):
/ — рабочая высота электродов 500 мм;
2-то же, 1003 мм; 3-то же, 1500 мм.
сильного увеличения газонаполнения и связанного с этим роста
удельного сопротивления газонаполненного электролита.
С повышением температуры вязкость электролита снижается,
что способствует увеличению скорости подъема газовых пузырьков,
т. е. уменьшению газонаполнения. Одновременно с ростом темпе-
ратуры увеличивается объем газов, как за счет их расширения, так
и вследствие повышения парциального давления паров воды, насы-
щающих газы. При температуре до 70—80° С газонаполнение мало
изменяется с ее ростом, а иногда даже снижается. Выше 70—80° С
влияние увеличения объема газов является определяющим и газо-
наполнение возрастает, особенно при 100—105° С. Для иллюстра-
ции этих положений на рис. II-10 показана зависимость газонапол-
нения анолита от температуры в процессе элек/ролиза водных рас-
творов NaCl.
53
Величина газонаполпения зависит от скорости подъема газовых
пузырьков в электролите. Кроме вязкости на скорость подъема
влияют размеры пузырьков. Раз-
меры пузырьков газа, отрывающих-
ся от электродов, зависят от поверх-
ностного натяжения электролита на
Температура, °C
Рис. П-9. Влияние толщины катодной
ячейки и высоты электрода на газо-
наполнение католита в процессе элек-
тролиза водных растворов NaCl (плот-
ность тока 635 а)м2у температура 80° С,
концентрация щелочи 107—120 г/л):
Рис. П-10. Влияние температуры и вы
соты электрода на газонаполнение ано-
лита (плотность тока 700 а/м2, межэлек-
тродное расстояние 17 мм):
1 - высота электродов 500 мм\ 2 — го же, ЮЭ0 мм\
3 — то же, 1500 мм.
1 - высота катода 1500 мм, 2 - то же, 1000 мм;
3 — то же, 500 мм.
для разных электродных материалов. Величина поверхностного
натяжения изменяется в зависимости от потенциала электрода.
а
Рис. П-11. Зависимость размера газовых пузырьков от потенциала электрода:
а — зависимость краевого угла смачивания от потенциала электрода; б — зависимость размера
пузырьков от краевого угла смачивания; / — серебряный электрод; 2— платиновый электрод;
3 — ртутный электрод.
Пузырьки наибольших размеров выделяются при потенциале
электрода, близком к потенциалу нулевого заряда.
При этом краевой угол смачивания имеет максимальную вели-
чину (рис. 11-11, а). Краевой угол и размеры газовых пузырьков
54
уменьшаются при более электроотрицательном или электроположи-
тельном потенциале электрода по сравнению с потенциалом нуле-
вого заряда. Зависимость объема газовых пузырьков от величины
краевого угла смачивания в момент отрыва пузырька на сереб-
ряном, платиновом и ртутном электродах 62 показана на рис. П-11, б.
На размеры газовых пузырьков и газонаполнение может сильно
влиять присутствие поверхностно-активных веществ в электролите
или в воде, поступающей на питание электролизеров.
Отделение газовых пузырьков от электролита облегчается при
создании организованной циркуляции электролита внутри ячейки
электролизера. Зависимость
степени газонаполнения от
условий, определяющих вну-
треннюю циркуляцию элек-
тролита, изучалась для про-
цесса электролиза водных
растворов хлористого нат-
рия; полученные результаты
представлены на рис. П-12.
При создании в ячейке пу-
тей внутренней циркуляции
электролита и увеличении
Рис. П-12. Влияние сечения циркуляцион-
ного канала на газонаполнение электролита
(межэлектродное расстояние 12 мм)'.
/ — при плотности тока 610 а/м2 и высоте электрода
1000 мм; 2 — то же, при 610 а/м2 и 1500 мм; 3 — то же,
при 1000 а/м2 и 1500 мм.
сечения циркуляционного
канала газонаполнение сни-
жается, особенно при малых
отношениях сечений цирку-
ляционного канала и меж-
электродного пространства.
Для уменьшения степени газонаполнения предложено удалять га-
зовые пузырьки из ячейки струей электролита, прокачиваемого
через нее с большой скоростью.
Газонаполнение электролита может быть уменьшено и путем
применения электродов рациональной конструкции. При замене го-
ризонтальных электродов наклонными и вертикальными облегчает-
ся отвод газов, снижаются газонаполнение и потери напряжения на
преодоление сопротивления газонаполненного электролита. В слу-
чае применения вертикальных электродов с выносными перфориро-
ванными листами основная масса газовых пузырьков отводится че-
рез отверстия перфорации на обратную сторону выносного элек-
трода в зону, где не проходят силовые линии тока.
Попадание в электролит масла, поверхностно-активных веществ
и вспенивающих добавок может сильно увеличивать газонаполне-
ние электролита. В связи с этим предъявляются высокие требова-
ния к обезжириванию деталей электролизеров при их монтаже, а
также к чистоте электролита и воды, подаваемой на питание элек-
тролизеров.
*Прп практическом определении величины газонаполнения элек-
тролита обычно получают его среднее значение. Наиболее простым
55
и надежным методом определения среднего газонаполнения элек-
тролита является замер изменения его объема (за счет выделения
газовых включений) в момент остановки электролизера. Измерен-
ное таким методом среднее газонаполнение при различных нагруз-
ках на электролизер ФВ-500 приведено ниже:
Нагрузка, ка....................... 1,5
Плотность тока, ка/м2.............. 0,5
Газонаполнение, %.................. 5,0
3,0 4,5 6,0 7,5 9,0 10,5
1,0 1,5 2,0 2,5 3,0 3,5
7,6 10,5 13,7 16,0 19,0 22,0
Эти данные относятся к работе электролизера при температуре
около 95° С и концентрации КОН и К2СО3 в электролите около
380 г/л. При нагрузке 10,5 ка и рабочей температуре 90° С газо-
наполнение электролита снижается до 17—19%, а при 110°С пре-
вышает 35%.
Температурный коэффициент газонаполнения kt в электролизе-
рах ФВ-500, согласно измерениям Г. В. Палецкого, 3. А. Ткачек с
сотр., составляет на 1°С:
Интервал температур, °C
Коэффициент kt, %
90-95 95-100 100-105 105-110
0,54 0,68 0,96 1,05
В межэлектродном пространстве газонаполнение электролита
больше ранее приведенных средних значений, а между основным
и выносным листами электрода,
в холодильниках электролита и
в других частях электролизера
меньше средних величин газона-
полнения. Рост газонаполнения в
верхней
странств
мерному
сти тока
дов. На
зависимость коэффициента повы-
шения удельного электрического
сопротивления электролита от его
газонаполнения. Близкие значе-
ния этого коэффициента К полу-
чены при изучении63 влияния га-
зонаполнения на удельное сопро-
тивление электролита на модели,
состоящей из стеклянных шари-
в растворе
Рис. II-13. Зависимость коэффициента
изменения удельного электрического
сопротивления электролита от его
газонаполнения:
J - экспериментальные данные; 2— расчет-
ные данные.
части электродных про-
приводит к неравно-
распределению плотно-
по поверхности электро-
рис. П-13 представлена
ков различного размера, равномерно распределенных
желатина с добавкой хлористого
Газонаполнение, % ..............
К.................................
калия:
о
1,0
15 30 45
1 26 1,64 2,23
60 75
3,25 5,5
По этим же данным 63, размер пузырьков практически не влияет
на величину К, Косвенное влияние размера пузырьков, опреде-
59
ляющего скорость процесса удаления газа из электролита, в цити-
рованной работе не изучалось. Значение коэффициента К измене-
ния удельного сопротивления электролита в ячейке за счет его га-
зонаполиенпя при различной плотности тока и высоте электродов
500 мм показано ниже:
Удельное Плотность сопротивление, К Плотность тока, а/м2 Удельное сопротивление, ом • см к
тока, а/м2 омсм
0 1,10 1,00 300 1,27 1,155
100 1,20 1,09 400 1,30 1,18
200 1,24 1,126 500 1,32 1,20
При изменении режима работы электролизера, т. е. плотности
тока и температуры, изменяется величина газонаполнения, что в
свою очередь приводит к изменению фактической концентрации
щелочи в электролите. С увеличением степени газонаполнения
объем электролита в электролизере уменьшается и концентрация
щелочи возрастает. При снижении степени газонаполнения увели-
чивается подача питательной воды в электролизер для поддержа-
ния в нем постоянного уровня жидкости и происходит разбавление
электролита. В электролизерах типа ФВ-500, работающих при
плотностях тока 2700—3700 а/м2, изменение плотности тока на
100 а/м2 приводит к изменению концентрации щелочи в электро-
лите на 6—7 г/л, изменение температуры на 1°С в интервале
95—100° С вызывает изменение концентрации щелочи на 4—5 г/л.
-Диафрагма, обычно применяемая для разделения газов, со-
здает дополнительное сопротивление на пути тока. Диафрагма
представляет собой мелкопористую перегородку, препятствующую
прониканию через нее газовых пузырьков; ток проходит через диа-
фрагму по электролиту, заполняющему ее поры. Сопротивление
диафрагмы /?д, отнесенное к единице ее площади, определяется
сопротивлением электролита в ее порах и толщиной диафрагмы и
зависит также от пористости и характера ее пор:
Яд = р/К (П-35)
где р — удельное сопротивление электролита, заполняющего поры диафрагмы,
ом-см; I — толщина диафрагмы, см\ К — коэффициент увеличения сопротивле-
ния диафрагмы по сравнению с сопротивлением чистого электролита, учитываю-
щий пористость диафрагмы и характер ее пор.
Часть пор диафрагмы во время работы электролизера может
заполняться пузырьками газа. При этом сечение электролита, уча-
ствующего в прохождении тока через поры диафрагмы, сужается
и коэффициент К возрастает, вследствие чего увеличивается со-
противление диафрагмы. К этому же приводит отложение различ-
ных осадков на диафрагме или набухание ее асбестовых воло-
кон при длительном воздействии щелочного электролита. При
э'Дом возможно как увеличение толщины диафрагмы, так и за-
бивка ее пор осадками, т. е. снижение пористости диафрагмы, что
57
увеличивает сопротивление и потери напряжения в ней. Необхо-
димо также учитывать, что увеличение толщины диафрагмы из-за
отложения осадков или ее набухания приводит к уменьшению сво-
бодного пространства между рабочей поверхностью электрода и
диафрагмой, что вызывает рост газонаполнения электролита и
потери напряжения в нем. При бетонной футеровке детален элек-
тролизера продукты ее разрушения могут отлагаться на диафрагме
и электродах, что приводит к повышению напряжения на ячейке.
Потери напряжения на преодоление сопротивления диа-
фрагмы пропорциональны плотности тока и определяются из вы-
ражения:
£д == Крд (П-35)
где i— плотность тока на диафрагме, а!см\
Ниже приведен сравнительный расчет потерь напряжения на
преодоление сопротивления электролита и диафрагмы при приме-
нении растворов NaOH и КОН оптимальной электропроводности,
т. е. 25%-ного раствора едкого натра (300 г/л), удельное сопро-
тивление которого при 80° С равно 0,941 ом • см, и 34%-ного
раствора едкого кали (442 г/л) с удельным сопротивлением
0,730 ом-см при той же температуре.
Определим потери напряжения в электролите для электроли-
зера, работающего с плотностью тока 0,25 а]см2 при расстоянии
1 см между работающими поверхностями электродов. Среднее
газонаполнение электролита при такой плотности тока может быть
принято 20% и средний коэффициент увеличения сопротивления
электролита 1,5 (от газонаполнения и наличия диафрагмы). По-
тери напряжения на преодоление сопротивления электролита и
диафрагмы в растворе КОН составят:
Еэ= 1,5-0,73- 1 - 0,25 = 0,274 в
В растворе NaOH они будут равны:
Еэ= 1,5-0,941 • 1-0,25 = 0,353 в
Если общее напряжение на ячейке электролизера составляет
около 2,3 в, потери напряжения в электролите и диафрагме равны
11 —12% этой величины при применении растворов КОН и
15—16% для растворов NaOH. Замена растворов КОН растворами
NaOH приводит к росту напряжения на ячейке примерно на 80 мв,
или на 3,5%. Поэтому, несмотря на более высокую стоимость
едкого кали по сравнению с каустической содой, для приготовле-
ния электролита обычно применяют растворы КОН. Увеличение
затрат на первоначальное заполнение электролизеров таким элек-
тролитом и пополнение его потерь в процессе эксплуатации с из-
бытком компенсируются снижением расхода электроэнергии.
Потери напряжения на преодоление омического сопротивления
металлических проводников в ячейке современных электролизеров
обычно невелики. В электролизерах биполярного типа благодаря
68
отсутствию соединительных шин между ячейками эти потери не
превышают единиц или десятков милливольт. Потери напряжения
в проводниках первого рода, как известно, определяются по за-
кону Ома.
3. ЗАВИСИМОСТЬ ОБЩЕГО НАПРЯЖЕНИЯ НА ЯЧЕЙКЕ
ОТ УСЛОВИЙ РАБОТЫ ЭЛЕКТРОЛИЗЕРА
Общее напряжение на ячейке зависит от суммарного влияния рас-
смотренных выше факторов. В зависимости от конструкции элек-
тролизера могут изменяться расстояние между электродами, усло-
вия отвода газовых пузырьков и газонаполнение электролита, по-
тери напряжения в металлических частях электролизера и другие
условия, влияющие на величину напряжения на ячейке. Для дан-
ной конструкции ячейки электролизера напряжение зависит от
плотности тока, температуры и длительности электролиза и свойств
применяемого электролита.
С увеличением плотности тока возрастают перенапряжение на
аноде и катоде, потери напряжения в электролите, диафрагме и
металлических проводниках. Так как с ростом плотности тока уве-
личивается газонаполнение электролита, потери напряжения в
электролите возрастают в большей мере, чем увеличивается плот-
ность тока. Потери напряжения в металлических деталях и диа-
фрагме пропорциональны плотности тока. Перенапряжение на элек-
тродах возрастает пропорционально логарифму плотности тока,
однако абсолютная величина роста перенапряжения невелика.
Основное значение для роста напряжения на ячейке с увеличением
плотности, тока имеют потери напряжения в электролите и диа-
фрагме. С ростом плотности тока возрастает разница концентраций
электролита у катода и анода и величина электродвижущей силы
концентрационной и диффузионной поляризации, однако абсолют-
ное значение этих величин тоже невелико.
Ниже показана зависимость напряжения на ячейке электро-
лизера ФВ-500 от плотности тока (электролит 30%-ный раствор
КОН):
Плотность тока, а/м2 .......... 500 750 1000 1250 1500 1750
Напряжение на ячейке, в
при 75° С................... 1,86 1,93 1,99 2,05 2,10 2,15
при 95° С................... 1,77 1,83 1.89 1,95 2,00 2,04
Плотность тока, а/м2 .......... 2000 2250 2500 3000 3333
Напряжение на ячейке, в
при 75° С................... 2,20 2,25 2,30 2,40 2,47
при 95° С................... 2,09 2,14 2,18 2,28 2,33
Зависимость напряжения на ячейке от плотности тока близка
к линейной в интервале применяемых на практике плотностей тока.
На рис. П-14, а приведена зависимость отдельных составляющих
напряжения на ячейке от плотности тока. Напряжение на ячейке
й большой степени зависит от температуры (рис. П-14, б). С ростом
температуры несколько снижается теоретическое напряжение
59
разложения. Температурный коэффициент dEJdT = —0,008 в!град.
При повышении температуры с 20 до 80° С теоретическое напряже-
ние разложения снижается от 1,23 до 1,18 в.
Гораздо большее значение имеет снижение величины перена-
пряжения на катоде и аноде с повышением температуры. Из дан-
ных, приведенных в табл. П-2, видно, что при повышении темпе-
ратуры от 20 до 80° С суммарное снижение величины перенапря-
жения на катоде и аноде может достигать нескольких сотен
милливольт. Сопротивление электролита, как любого проводника
второго рода, с ростом температуры снижается, что благоприятно
сказывается на величине напряжения на ячейке.
Рис. II-14. Зависимость напряжения на ячейке и его составляющих от плот-
ности тока при 80° С (а) и от температуры при плотности тока 2 ка/м2 (б):
/ — теоретическое напряжение разложения; 2 — перенапряжение на катоде; 3 — перенапряжение
на аноде; 4 — потери напряжения в электролите и диафрагме; 5 —прочие потери напряжения
(концентрационная и диффузионная поляризация, сопротивление проводников первого рода);
(У—общее напряжение на ячейке.
Зависимость сопротивления газонаполненного электролита от
температуры процесса более сложна. Как было указано (стр. 53),
вначале с ростом температуры газонаполнение электролита мало
изменяется, а иногда снижается в связи с уменьшением его вяз-
кости и облегчением подъема газовых пузырьков в электролите.
При дальнейшем повышении температуры газонаполнение элек-
тролита начинает возрастать, особенно сильно при температурах,
близких к 100° С. В электролизерах, работающих под атмосферным
давлением, потеря напряжения в электролите за счет большего
газонаполнения настолько увеличивается, что при температу-
рах около 105° С напряжение на электролизере возрастает с по-
вышением температуры, несмотря на снижение величины осталь-
ных составляющих общего напряжения на ячейке.
С ростом температуры ускоряются процессы диффузии, приво-
дящие к уменьшению различия концентраций анолита и католита,
60
и уменьшается величина э. д. с. концентрационной поляризации.
Поскольку с повышением температуры числа переноса анионов и
катионов становятся более близкими по величине, э. д. с. диффу-
зионной поляризации с ростом температуры также снижается.
Однако величины концентрационной и диффузионной поляриза-
ции в процессе электролиза воды невелики и мало влияют на об-
щую величину напряжения на ячейке.
Сопротивление металлических проводников и их контактов с
ростом температуры возрастает. При этом необходимо учитывать,
что металлические проводники и их контакты могут иметь более
высокую температуру, чем электролит в электролизере, вследствие
дополнительного нагрева металла за счет джоулева тепла. Пере-
грев металлических проводников и их контактов может быть осо-
бенно значительным, если конструкция электролизера не обеспечи-
вает хороших условий охлаждения электролитом внутренних про-
водников и контактов и (путем свободного омывания воздухом)
наружных проводников и контактов.
Для электролизеров, работающих под атмосферным давлением,
при плотности тока 2,5—3,0 ка/м2 общее напряжение на ячейке
снижается примерно на 0,25% с повышением температуры на ГС.
Напряжение на ячейке с изменением температуры (до 100° С)
может быть определено из выражения:
Et = Ei, [1 -0,0025 (/ — 75)] (П-37)
где Е75 — напряжение на ячейке при 75э С, в\ Et — напряжение на ячейке при
температуре t, в.
Ниже приведены значения температурного коэффициента /(из-
менения напряжения на ячейке, полученные Г. В. Палецким
и 3. А. Ткачек с сотр. для промышленных электролизеров ФВ-500
при различных температурах:
Интервал температур, °C . . . . 80 — 90 90 — 95 95—100 100—105 105—110
К, % на ГС................ -0,42 -0,27 -0,23 -0,07 +0,07
По мере повышения температуры значение температурного
коэффициента снижается и примерно около 105° С становится по-
чти равным нулю. При более высокой температуре напряжение не
снижается, а увеличивается с ростом температуры из-за быстрого
повышения степени газонаполнения и потерь напряжения в элек-
тролите.
Температурный коэффициент при данной величине напряжения
на ячейке изменяется в зависимости от применяемой плотности
тока. Это явление связано с тем, что различные составляющие
энергетического баланса напряжения по-разному изменяются
с повышением температуры. Так, термодинамически обратимое
значение потенциала разложения очень мало зависит от нее,
а перенапряжение выделения водорода на катоде и кислорода на
аноде и потери напряжения на преодоление сопротивления
61
электролита и диафрагмы, наоборот, сильно изменяются в зависи-
мости от температуры.
С ростом плотности тока напряжение на ячейке увеличивается
в основном за счет тех составляющих его баланса, которые сильно
зависят от температуры. Поэтому при высоких плотностях тока,
когда доля перенапряжения на электродах и потери напряжения
в электролите и диафрагме в общем балансе напряжения на ячей-
ке больше, чем при низких плотностях тока, значения темпера-
турного коэффициента напряжения на ячейке .выше. При очень
малых плотностях тока значения составляющих общего напряже-
ния на ячейке, сильно изменяющихся в зависимости от темпера-
туры, невелики и изменение напряжения на ячейке меньше зави-
сит от температуры.
Для снижения величины напряжения и сокращения расхода
электроэнергии на электролиз стремятся повысить температуру
электролита. Верхний предел его температуры ограничивается
быстрым ростом газонаполнения за счет повышения парциального
давления паров воды. При проведении электролиза воды под дав-
лением верхний предел допустимых температур электролита тем
больше, чем выше применяемое давление. Это обстоятельство яв-
ляется одной из причин, обусловливающих возможность суще-
ственного снижения напряжения на ячейке и расхода электроэнер-
гии при электролизе воды под повышенным давлением.
В табл. П-5 приведены результаты подсчета энергетического
баланса ячейки электролизера ФВ-500 для температур в интервале
90—110° С, проведенного Г. В. Палецким с сотр. Для упрощения
расчета принято, что потери напряжения в проводниках первого
рода, диафрагме и контактах не изменяются в исследуемом ин-
тервале температур. Температурный коэффициент газонаполнения
принят по данным, приведенным на стр. 56 (обозначения состав-
ляющих баланса см. стр. 37).
Таблица П-5. Баланс напряжения (в в) на ячейке электролизера ФВ-500
при различных температурах
(нагрузка па электролизер 10 ка; состав электролита:
27,22% КОН и 4,23% К2СО3)
t, °C Потенциалы ек + еа Перенапря- жение ’’a+’lK /Яэ Прочие составляющие Общее напряжение на ячейке
90 1,172 0,888 0,286 0,1 2,446
95 1,168 0,818 0,283 0,1 2,369
100 1,164 0,798 0,292 0,1 2,354
105 1,160 0,778 0,308 0,1 2,346
НО 1,156 0,758 0,335 0,1 2,349
Следует учитывать, что повышение температуры электролиза
связано с 62 ускорением процессов коррозии деталей электролизеров.
Если питание электролизеров производится чистой дистиллиро-
ванной или обессоленной водой, напряжение на электролизере в
течение всего тура его работы изменяется незначительно. Некото-
рое изменение напряжения на ячейках электролизера возможно
вследствие забивки пор диафрагмы осадками (продукты разруше-
ния деталей электролизера или загрязнения, вносимые с питатель-
ной водой). При одинаковых прочих условиях электролиза (темпе-
ратура, плотность тока, состав и концентрация электролита) на-
пряжение на ячейке в течение 4—5 суток с момента включения
электролизера возрастает на 90—120 мв, т. е. примерно на 4—5%
Рис. П-15. Примерная зависимость напряжения на ячейке от длительности
работы электролизера:
/-при непрерывной работе; 2 -при отключении для деполяризации I раз в сутки; 3 - то же,
через 12 ч.
его начальной величины. Наиболее быстро напряжение увеличи-
вается в течение первых 12—24 ч с момента включения тока и за-
тем постепенно повышается до определенной величины, которая
далее сохраняется в течение многих месяцев непрерывной работы
аппарата. Это явление следует связывать с изменением состояния
поверхности электродов во времени и, как следствие этого, вели-
чины перенапряжения. Кратковременное отключение электроли-
зера на несколько секунд не влияет на величину напряжения на
ячейке. После отключения и деполяризации ячеек электролизера
при последующем его включении напряжение снова приобретает
исходное низкое значение и опять медленно возрастает в течение
4—5 суток.
Для снижения среднего напряжения на ячейке и расхода элек-
троэнергии на электролиз допустимо отключать электролизеры
через определенный период времени с тем, чтобы вести процесс
электролиза не при максимальном (стационарном), а при более
низком напряжении на ячейке. Чем чаще прерывается процесс
электролиза для деполяризации ячеек, тем более приближается
среднее напряжение на ячейке к его минимальному значению
в момент включения ячейки под нагрузку.
На рис. П-15 показана примерная зависимость напряжения на
ячейке электролизера от режима его работы (непрерывный про-
цесс электролиза или с перерывами через I сутки и 12 ч для
63
деполяризации ячеек). При ведении процесса электролиза с пере- 1
рывами для деполяризации через 12—24 ч можно снизить среднее j
напряжение па ячейке на 2—3% ио сравнению с установившимся !
его значением при длительной непрерывной работе электролизера. ;
Однако, насколько нам известно, такой способ снижения среднего
напряжения на ячейке не нашел применения в промышленном
электролизе воды.
При выключении электролизера напряжение на ячейке сни-
жается до величины э. д. с. водородо-кислородного элемента и за-
тем (если полюса электролизера не замкнуты) медленно в течение
Рис. П-16. Примерный вид кривой изменения напряжения на ячейке после
выключения электролизера.
многих часов снижается до нуля. Примерная кривая спада напря-
жения на ячейке после выключения электролизера при его разом-
кнутых полюсах представлена на рис. П-16. Напряжение на вы-
ключенной ячейке в первые мгновения снижается до величины,
близкой к 1,23 в. Напряжение порядка десятых долей вольта со-
храняется на ячейке в течение многих часов. Деполяризация ячеек
происходит вследствие постепенного выделения адсорбированных
на электродах газов (водорода и кислорода) и разрядки водо-
родо-кислородного элемента токами утечки.
При закорачивании полюсов электролизера сразу после его
отключения возникает ток короткого замыкания, величина кото-
рого определяется внутренним сопротивлением электролитической
ячейки. Токи короткого замыкания, измеренные на электролизере
типа ФВ из 56 ячеек сразу же после его отключения, превышали
30 ка, т. е. были более чем в 4 раза больше номинальной нагрузки
электролизера. Ячейки электролизера в режиме короткого замы-
кания работали с плотностью тока более 10 ка1м2. Электрическая
емкость ячейки, как и любого водородо-кислородного элемента,
очень невелика и определяется количеством водорода и кислорода,
остающихся на электродах в момент отключения и образующих
водородо-кислородный элемент. Фиксируемые осциллографом токи
64
короткого замыкания уже через ничтожные доли секунды резко
уменьшаются до нескольких единиц или десятков ампер. В серии
электролизеров с большим количеством ячеек напряжение на вы-
ключенной серии длительное время сохраняется на уровне, небез-
опасном для обслуживающего персонала. Так, на полюсах серии
из четырех электролизеров ФВ-500, имеющих по 160—166 ячеек
каждый, сразу после выключения может сохраняться разность на-
пряжений до 750—775 в. Чтобы обеспечить безопасность обслужи-
вающего персонала, на сериях, отключаемых для проведения ре-
монтных работ, проводят деполяризацию электролизеров, разря-
жая их через сопротивление, ограничивающее токи короткого за-
мыкания. После деполяризации серию электролизеров дополни-
тельно заземляют, только после этого разрешается выполнять ре-
монтные работы.
В электролизерах некоторых конструкций для защиты их дета-
лей от коррозии применяли цементную или асбоцементную футе-
ровку. Напряжение на ячейке таких электролизеров на 90—140 мв
выше (на 4—6%), чем в электролизерах без футеровки деталей.
Предпринимались многочисленные попытки снизить напряже-
ние на ячейке путем введения в электролит различных добавок, из
которых практическое применение получили только соединения
хрома.
4. ВЫХОД ПО ТОКУ
Если электролиз протекает без побочных процессов и без потерь
газов электролиза, т. е. при 100%-ном использовании тока на по-
лучение целевых продуктов, то в соответствии с законом Фарадея
на каждые 96540 к, или 26,8 а • ч, пропущенного через ячейку по-
стоянного тока выделяется по 1 г-экв водорода (на катоде) и кис-
лорода (на аноде). В промышленных условиях процесса электро-
лиза коэффициент полезного использования тока или выход по
току меньше 100%. При этом выход по току снижается из-за про-
текания на электродах побочных процессов, приводящих к беспо-
лезному расходу тока, вследствие взаимного загрязнения водорода
кислородом (и наоборот), взаимного проникания водорода в анод-
ное пространство и кислорода в катодное через диафрагму или
в результате совместной циркуляции анолита и католита в ячейке,
а также из-за утечек тока (особенно в электролизерах фильтр-
прессного типа с биполярным включением электродов) и вслед-
ствие потерь водорода и кислорода через неплотности электроли-
зера и его коммуникаций.
Кроме того, возможны потери водорода и кислорода при ча-
стых выключениях электролизеров и связанных с этим продувках
аппаратов и коммуникаций инертным газом и потери в процессах
транспортирования и хранения газов. Однако эти потери не ха-
рактеризуют работу электролизеров, а, скорее, зависят от режима
работы производства в целом, поэтому они здесь не будут рас-
сматриваться.
5 Зак. ?13
вб
Отношение количества газа (водорода или кислорода), прак-
тически получаемого в ячейке электролизера в ходе процесса элек-
тролиза, к количеству газа, которое должно выделиться при пол-
ном использовании тока на протекание основного процесса, назы-
вают выходом по току:
17
п = <п-38)
где т) — выход по току, доли единицы; Vn — объем практически полученного
газа; VT — объем газа, теоретически рассчитанный в соответствии с законом
Фарадея.
Выход по току в процентах определяют из выражения:
1) = 4г-100 (П-39)
К т
В зависимости от конструкции и состояния электролизера и его
диафрагмы, режима работы и других условий выход по току
обычно колеблется в пределах 0,95—0,99. При нормальной работе
отечественных электролизеров выход по току близок к 0,98.
В процессе электролиза со щелочными электролитами побочные
процессы на электродах и вторичные реакции между продуктами
электролиза не имеют большого значения, поскольку в составе та-
ких электролитов отсутствуют ионы, которые могли бы в заметных
количествах разряжаться вместе с водородом на катоде или
с кислородом на аноде. Продукты электролиза — водород и кис-
лород— сравнительно мало растворимы в электролите и в обыч-
ных условиях обладают малой реакционной способностью.
Некоторые потери тока на побочные электродные процессы все
же происходят в процессе электролиза воды, что обусловлено на-
личием различных загрязнений в электролите и некоторой (не-
большой) растворимостью Н2 и О2 в электролите. При попадании
в электролит примесей, содержащих соединения железа, никеля
или других более электроположительных металлов, чем водород,
на катоде одновременно с выделением Н2 эти примеси восстанав-
ливаются с образованием ионов меньшей валентности или метал-
лической губки. На этот процесс расходуется некоторая часть тока,
проходящего через электролитическую ячейку.
Если в процессе электролиза происходит коррозия анодов, на
растворение их металла также затрачивается часть тока. Корро-
зия других деталей электролизера обычно связана с утечками тока
и, следовательно, косвенно также влияет на выход по току. Одна-
ко, хотя коррозия деталей электролизеров и осаждение металли-
ческой губки на катоде после длительной эксплуатации электро-
лизера протекают с заметной скоростью, доля тока, непосред-
ственно расходуемого на растворение металла и выделение его
на катоде, как правило, очень невелика.
Другой причиной протекания побочных процессов на электро-
дах является наличие в электролите растворенных водорода и кис-
66
лорода. Попадание водорода в анодное пространство и кислорода
в катодное пространство возможно вследствие совместной цирку-
ляции анолита и католита через общие холодильники электролита.
При этом в электродные пространства поступает электролит, содер-
жащий растворенные водород и кислород. При недостаточно пол-
ном удалении мелких пузырьков газа в отделителях и холодиль-
никах содержание Нг и О2 в циркулирующем электролите может
увеличиваться за счет уноса мелких пузырьков газа в процессе
ииркуляции электролита.
Водород, содержащийся в электролите, который поступает
в анодное пространство, частично отдувается выделяющимся на
аноде кислородом, загрязняя его. Часть водорода может окис-
ляться на аноде с образованием воды:
Н2 - 2е + 2ОН“ = 2Н2О (II-40)
Оба эти процесса, связанные с потерей полученного водорода,
приводят к снижению его выхода по току. Электрохимическое
окисление водорода на аноде приводит к соответствующему сни-
жению выхода кислорода по току. Загрязнение кислорода отдувае-
мым из электролита водородом также надо рассматривать как сни-
жение выхода О2 по току, так как при очистке кислорода от при-
месей водорода, обычно проводимой путем выжигания Н2, расхо-
дуется соответствующее количество кислорода.
Если электролиз проводится при атмосферном давлении, рас-
творимость газов в электролите невелика и роль этих побочных
процессов обычно незначительна. При электролизе под давлением
их значение может существенно возрасти.
Попадание водорода в анодное пространство возможно также
за счет диффузии Н2 и насыщенного водородом электролита через
диафрагму из катодного в анодное пространство. Потери газа
из-за его диффузии через диафрагму могут дополнительно увели-
читься вследствие проникания пузырьков газа через поры или от-
верстия диафрагмы из одного электродного пространства в другое.
Этому способствуют образование на электродах (особенно на ка-
тоде) пузырьков газа малых размеров и небольшие колебания
давления по обе стороны диафрагмы, связанные с некоторой не-
равномерностью газо-жидкостного потока, выходящего через от-
водные трубки из анодного и катодного пространства ячейки.
Процессы диффузии и взаимного проникания пузырьков газа
из одного электродного пространства в другое через поры и мест-
ные повреждения диафрагмы усиливаются с повышением темпера-
туры. Особенно значительное взаимное загрязнение газов воз-
можно при высоких температурах, когда вследствие высокого газо-
наполнения электролита создаются условия для неравномерного
отвода газо-жидкостной эмульсии из катодного и анодного про-
странства.
Рассмотренные выше положения, определяющие проникание
водорода из катодного в анодное пространство и снижение из-за
6е
67
этого выхода по току, могут быть полностью применены и при рас-
смотрении возможных путей попадания кислорода в катодное про-
странство. Кислород попадает в катодное пространство в виде рас- ?
твора в циркулирующем электролите или в виде увлекаемых им ;
мелких пузырьков, а также в результате диффузии через диаф-
рагму или проникания через ее поры и местные дефекты. В катод- 1
ном пространстве кислород частично восстанавливается на катоде ’
по суммарной реакции:
О2 + 4е + 4Н+ = 2Н2О (П-41) '
Часть кислорода отдувается из электролита выделяющимся
в катодном пространстве водородом, загрязняя его. Потери выхода
по току за счет растворимости водорода и кислорода в циркули-
рующем электролите могут быть рассчитаны, если известны ско- .
рость циркуляции электролита и температура, при которой элек- '
тролит поступает в ячейку из холодильника. В обычных промыш-
ленных условиях процесса электролиза эти потери очень невелики.
Потери выхода по току из-за диффузии растворенных газов, про-
никания газовых пузырьков через диафрагму и уноса газовых
пузырьков циркулирующим электролитом зависят от конструкции ;
и режима работы электролизера, а также от качества и состояния
диафрагмы.
В новых электролизерах, когда еще не происходит включения
рам в электрохимические процессы, взаимное загрязнение газов j
электролиза в основном обусловлено описанными выше причинами
и утечками тока в каналах. Степень загрязнения водорода кисло-
родом (и наоборот) в новых электролизерах может служить кри-
терием примерной количественной оценки рассмотренных выше
побочных процессов. При нормальной работе электролизеров в во-
дороде обычно присутствует около 0,2% Ог, что соответствует по-
тере выхода по току — 0,4%. Кислород более загрязнен водородом
(0,5—1% Н2), и потери выхода по току вследствие этого возра-
стают до 0,5%. Однако такой подсчет, с одной стороны, дает не-
сколько заниженные результаты, так как не учитывает затрат газа
и тока на электрохимическое восстановление кислорода на катоде
и окисление водорода на аноде. С другой стороны, подобная
оценка завышает роль перечисленных процессов, поскольку взаим-
ное загрязнение газов частично должно быть отнесено за счет про-
цессов, сопровождающих утечку тока в электролизере.
Утечки тока по каналам в электролизерах фильтрпресспого
типа могут достигать заметных величин и снижать выход по току
на 3—8%. Утечки тока зависят от ряда факторов, прежде всего от
сечения электролита в каналах и степени его газонаполнения.
В электролизерах, работающих под давлением, газонаполнение
электролита в газовых каналах невелико, что приводит к умень-
шению удельного сопротивления электролита и увеличению токов
утечки. Для их снижения в электролизерах типа ФВ принимаются
специальные меры по ограничению уровня электролита в газовых
68
каналах. Более подробно вопрос об утечках тока будет рассмот-
рен в следующем разделе.
При длительной работе электролизеров фильтрпрессного типа
с биполярным включением электродов часто значительно ухуд-
шается чистота получаемых газов. Такое ухудшение наступает бы-
стрее, если в электролизер подается вода, содержащая значи-
тельные количества примесей железа, как, например, при питании
электролизеров паровым конденсатом без специальной очистки его
от ионов железа. Большее взаимное загрязнение газов наблю-
дается и в тех случаях, когда усиливается коррозия деталей элек-
тролизера, т. е. электролит загрязняется продуктами коррозии
металлических деталей. Особенностью этого процесса является то,
что загрязняется только кислород, а чистота водорода при этом
сохраняется все время достаточно высокой. Таким образом, проте-
кающие в электролизере процессы приводят к выделению водо-
рода в анодном пространстве без изменения количества кислорода,
попадающего тем или иным путем в катодное пространство.
Наблюдения за электролизерами, вырабатывающими кислород,
загрязненный водородом, показали, что процессы, приводящие
к этому, сопровождаются изменением величины потенциала диаф-
рагменной рамы ячейки по отношению к потенциалам анода и ка-
тода. В нормально работающей ячейке значение потенциала рамы
обычно находится примерно посередине между потенциалами
анода и катода данной ячейки. Если общее напряжение на ячейке,
т. е. разность потенциалов анода и катода ЛК, составляет, напри-
мер, 2,3 в, то разность потенциалов между анодом и рамой АР
обычно находится в пределах 0,8—1,5 в, а разность потенциалов
между катодом и рамой КР колеблется в интервале 1,5—0,8 в.
Естественно, всегда сохраняется равенство:
АК = АР + КР (П-42)
Такое положение сохраняется до тех пор, пока поверхность
диафрагменной рамы не начнет участвовать в электрохимическом
процессе, потребляющем заметные количества тока. В нормально
работающем биполярном электролизере величина потенциала
рамы по отношению к потенциалам электродов этой же ячейки,
т. е. значения АР и КР, находится в указанных пределах, за ис-
ключением рам крайних ячеек, где наблюдается отклонение от
этого общего правила. Оно вызывается утечкой тока по каналам
электролизера, служащим для распределения циркулирующего
электролита и сбора газо-жидкостной эмульсии из катодных и
анодных пространств ячеек. Части крайних рам, обращенные к
катодной стороне электролизера, в этих условиях работают как
аноды, вследствие чего значение КР для этих рам становится
больше напряжения разложения. В зависимости от величины то-
ков утечки КР крайней рамы может достигать значения, близкого
к напряжению на ячейке. При этом величина АР становится очень
небольшой (десятые доли вольта). Величина АР крайних рам
«9
с анодной стороны, наоборот, больше обычной, а значение КР не-
велико. По мере перехода от крайних рам к средним АР и КР
принимают обычные для них значения. Типичный характер изме-
нения величин АР и КР в нормально работающем электролизере
показан на рис. П-17,б. За исключением самых крайних рам с
катодной стороны (обычно 1—2 рамы), значение КР на осталь-
ных рамах меньше напряжения разложения щелочных растворов
(не более 1,7 в). Поэтому поверхность диафрагменной рамы, об-
ращенной к катоду, не участвует в электрохимических процессах
Напряжение, в
Рис. П-17. Изменение значений раз-
ности потенциалов между катодом и
рамой (КР) и между анодом и ра-
мой (АР) по длине биполярного
электролизера:
а —схема электролизера; / — пакеты ячеек;
2 —средняя камера; б —кривые, характери-
зующие нормальную работу; в — кривые,
характеризующие работу на электролите,
загрязненном ионами железа.
в качестве анода. анодной сто-
роны за исключением 1—2 край-
них рам величйна АР на осталь-
ных рамах также меньше напря-
жения разложения. Эти рамы то-
же не включаются в электрохими-
ческие процессы со стороны, об-
ращенной к аноду. Таким обра-
зом, в нормально работающем
электролизере с биполярным
включением электродов диафраг-
менные рамы не участвуют в
электрохимических процессах,
кроме крайних рам с анодной и
катодной сторон электролизера.
При загрязнении электролита
в электролизерах ФВ соедине-
ниями железа, которые поступают
с питательной водой или обра-
зуются в результате коррозии де-
талей электролизера, происходит
постепенный сдвиг потенциала рам в катодную сторону. При этом
значение АР возрастает, а КР уменьшается в зависимости от сте-
пени загрязнения электролита в ячейке (рис. П-17,в).
До тех пор, пока величины АР на ячейках меньше напряже-
ния разложения, электрохимический процесс между анодом и
обращенной к нему частью рамы с выделением на поверхности
рамы водорода невозможен. Чистота кислорода в этих ячейках
и во всем электролизере остается высокой и не изменяется во
времени. Если на какой-либо ячейке АР достигает величины на-
пряжения разложения, рама может включаться в электрохимиче-
ские процессы с выделением водорода на поверхностях диафраг-
менной рамы, обращенных к аноду. При этом выделяющийся на
раме водород проникает в анодное пространство и загрязняет
кислород. Чем больше отличается величина АР от напряжения
разложения, тем с большей плотностью тока происходит разряд
водорода На поверхности рамы и тем больше кислород загрязня-
ется водородом. Исследования, проведенные на многих ячейках
электролизеров ФВ при загрязнении электролита железом, поз-
70
волили установить ясно выраженную зависимость между вели-
чиной КР ячейки (или взаимосвязанной с ней величиной АР) и
степенью загрязнения кислорода водородом в данной ячейке (рис.
П-18).
Если электролит загрязняется соединениями железа и не пред-
принимаются необходимые меры для предотвращения их вред-
ного действия, включение диафрагменных рам в электрохимиче-
ские процессы может быть причиной сильного загрязнения кис-
лорода водородом и соответственно значительного снижения вы-
хода Н2 по току. При этом во-
дород не загрязняется кисло-
родом.
В связи с большой важ-
ностью этого явления для про-
мышленного электролиза целе-
сообразно более подробно рас-
смотреть механизм включения
диафрагменной рамы в элек-
трохимические процессы и спо-
собы его предотвращения или
снижения интенсивности. Наи-
более обоснованным нам пред-
ставляется предположение о
монополярной работе диафраг-
менной рамы в качестве катода
в результате соединения ее
Рис. П-18. Зависимость степени загряз-
нения кислорода водородом от величи-
ны КР ячейки.
с катодом проводниками пер-
вого рода с большим или меньшим сопротивлением. Рама вклю-
чается в электрохимический процесс по следующей схеме. Присут-
ствующие в электролите соединения железа восстанавливаются на
катоде, образуя слой металлической губки на его поверхности.
Благодаря интенсивному выделению водорода на катоде частицы
металлической губки отрываются от него и, осаждаясь на нижней
полке рамы, образуют мостики, соединяющие электрически раму
с катодной стороной биполярного электрода. В ходе работы элек-
тролизера эти мостики увеличиваются в размерах и уплотняются,
а их сопротивление уменьшается, что приводит к сдвигу потен-
циала рамы в катодную сторону, тем большему, чем плотнее и
больше мостики губчатого железа.
Правильность описанного механизма включения диафрагмен-
ной рамы в электрохимические процессы подтверждается рядом
наблюдений. При вскрытии ячеек с малым значением КР (и боль-
шим АР) на нижней полке рамы обнаруживались металлические
мостики губчатого железа, соединяющие раму с катодной сторо-
ной биполярного электрода. Если из ячейки с низким КР и боль-
шим загрязнением кислорода водородом удалить металлические
осадки и мостики с нижней полки рамы, величина КР и чистота
кислорода возрастают. Механическая очистка нижней полки
71
рамы и промывка ее кислотой дают одинаковые результаты. Надо
иметь в виду, что ячейки необходимо промывать ингибированной
кислотой для уменьшения коррозии деталей ячейки. Если ячейку
тщательно отмыть водой от щелочи, можно окислить губчатое
железо, образующее соединительные мостики между рамой и
электродами. После промывки водой сопротивление мостиков
вследствие их частичного окисления возрастает, что приводит к
росту величины КР и чистоты кислорода. Однако при такой про-
мывке не достигается длительного эффекта, так как окисленные
частицы осадка, образующего электропроводные мостики, катод-
но поляризуются и быстро восстанавливаются после включения
электролизера.
Включение рамы в электрохимический процесс при образова-
нии электропроводных мостиков между рамой и катодной сторо-
ной биполярного электрода можно предотвратить, если через со-
ответствующее сопротивление соединить раму с противоположным
электродом ячейки — анодом. При этом через сопротивление бу-
дет проходить постоянный ток, сила которого в соответствии с за-
коном Ома определяется величиной напряжения на ячейке и сум-
марным сопротивлением электропроводных мостиков между ка-
тодом и рамой и дополнительно включенного сопротивления меж-
ду рамой и анодом ячейки. Однако в этом случае достигается
лишь временное улучшение работы электролизера с последую-
щим усилением электрохимических процессов, в которых участ-
вует рама.
Потенциал рамы относительно электродов, т. е. величины АР
и КР, определяется соотношением сопротивлений металлических
проводников между рамой и катодом, с одной стороны, и между
рамой и анодом, с другой стороны. Если подобрать сопротивление
проводника, соединяющего раму с анодом, так, чтобы каждое из
значений АР и КР находилось в пределах 0,8—1,5 в (при напря-
жении на ячейке 2,3 в), то рама не сможет участвовать в электро-
химическом процессе и на ее поверхности не будут выделяться
газообразные водород или кислород. Если же соединить раму с
анодом при помощи проводника малого сопротивления, потенциал
рамы может настолько сдвинуться в анодную сторону, что поверх-
ность рамы включится в электрохимическую работу в качестве
анода с выделением кислорода в катодное пространство и загряз-
нением водорода кислородом.
При загрязнении ячейки соединениями железа и образовании
мостиков между рамой и катодом часть тока от катода переходит
на раму без выделения водорода в катодном пространстве, что
приводит к снижению выхода по току. Включение рамы в электро-
химическую работу в качестве катода приводит также к загряз-
нению кислорода водородом. При значительном развитии этого
процесса смеси кислорода с водородом могут достигать взрыво-
опасных концентраций. При этом прямого снижения выхода кис-
лорода по току не наблюдается, но происходит косвенное сниже-
72
ние его выхода, так как при последующей очистке или примене-
нии кислорода часть его будет связываться с водородом.
Вследствие сдвига потенциала рамы в анодную сторону и уве-
личения КР сила тока, переходящего от катода на раму (при том
же сопротивлении между ними), увеличивается пропорционально
возрастанию КР. В такой же степени снижается выход водорода
по току. Поскольку при этом весь ток, поступающий на раму, от-
водится по металлическому проводнику на анод ячейки, на такую
же величину уменьшается и выход кислорода по току.
Приближенная оценка потерь выхода по току из-за включе-
ния рамы в электрохимическую работу в качестве катода может
быть сделана, исходя из степени загрязнения кислорода водородом,
по выражению:
LJ7 _ ГТ//
д”=ТСТ100 (П’43)
где Дт| — потеря выхода водорода по току из-за включения рамы в электро-
химическую работу, %; Н' и Н" — содержание водорода в кислороде соответ-
ственно в данной ячейке и в ячейке, где диафрагменная рама не включена
в электрохимическую работу, %.
Поскольку определять загрязненность кислорода в каждой
ячейке практически затруднительно, потери выхода по току могут
быть определены по величине КР для данной ячейки. По величине
КР в этой ячейке можно определить значение Н' по графику, при-
веденному на рис. П-18 (стр. 71). Значение Н" можно принять рав-
ным 0,2%.
Снижение выхода водорода по току и соответствующее загряз-
нение кислорода водородом может происходить при металлиза-
ции диафрагмы. Если слой металлической губки на катоде стано-
вится настолько толстым, что достигает диафрагмы и проникает
через нее, то на поверхности губки, проникающей через диафрагму
в анодное пространство, выделяется водород. Обычно оба процес-
са — металлизация диафрагмы и образование электропроводных
металлических мостиков между рамой и катодом протекают одно-
временно и сопровождают друг друга. При вскрывании ячейки
электролизера металлизация диафрагмы легко обнаруживается по
черному осадку губчатого железа на ее стороне, обращенной к
аноду.
Металлизация диафрагмы ускоряется, если ее асбестовая
ткань усилена никелевыми проволоками. В этом случае при об-
разовании контакта между катодом и никелевой проволокой на
ней осаждается губчатое железо, которое прорастает через асбе-
стовую ткань в сторону анода. Аналогичное явление возможно
при контакте проволок диафрагмы с металлом рамы, если ее по-
тенциал сдвинут в катодную сторону.
Одним из основных условий работы электролизеров с бипо-
лярным включением электродов при высоких выходах по току и
чистоте газов, особенно кислорода, является предотвращение
73
возможности включения диафрагменной рамы в электрохимический
процесс в качестве катода, а также предотвращение металлизации
диафрагмы. Для обеспечения этих условий необходимо в макси-
мальной степени исключить возможность загрязнения электролита
соединениями железа. Поэтому на питание электролизеров необ-
ходимо подавать только чистую воду (дистиллированную или обес-
соленную), а также принимать меры для подавления коррозии ме-
таллических деталей электролизера, чтобы уменьшить загрязнение
электролита продуктами их коррозии. Однако полностью предот-
вратить коррозию не удается, в связи с чем целесообразна по-
стоянная очистка электролита от соединений железа. Для этого
обычно пользуются непрерывной фильтрацией электролита, уста-
навливая на пути его циркуляции фильтр.
В результате перечисленных мероприятий удастся значительно
уменьшить скорость осаждения металлической губки на катоде и
частично устранить связанные с ним нарушения работы ячейки.
Однако полностью эти явления не исключаются. Для подавления
процесса образования металлических мостиков между катодом и
рамой ее поверхность иногда покрывают непроводящим материа-
лом, например бетоном или асбобетоном. Благодаря этому исклю-
чается возможность электрического соединения рамы и катода ме-
таллической губкой и включения поверхности рамы в электрохи-
мические процессы. Такая футеровка может быть полезна и для
защиты металлических поверхностей рамы и ее деталей от кор-
розии.
Иногда футеруют всю поверхность рамы, хотя для предотвра-
щения ее соединения с катодом (через металл) достаточна футе-
ровка только нижней полки и нижней части боковых полок рамы
с катодной стороны. Частичная футеровка рам в ряде случаев
применяется для обеспечения длительной надежной работы элек-
тролизеров с высокой чистотой получаемого кислорода. Недостат-
ком футеровки рам является некоторое повышение напряжения на
электролизере (на 4—6%) и необходимость дополнительных за-
трат на футеровку. Следует отметить, что футеровка верхней полки
рамы работает в жестких условиях, поэтому часты случаи ее нару-
шения через сравнительно короткий срок работы (2—4 года). Ча-
стичная футеровка рам свободна от этого недостатка.
Надежным приемом, предотвращающим включение диафраг-
менной рамы в электрохимический процесс в качестве катода и
сильно замедляющим этот процесс в ячейках, где он уже начался,
является введение в электролит хромовых солей. При добавлении
2,5—Зг/л хромата калия или натрия повышаются значения КР на
ячейках и улучшается чистота кислорода. Можно предположить,
что в присутствии хромовых солей в электролите на катодной по-
верхности образуется пленка продуктов их восстановления, затруд-
няющая восстановление примесей железа и образование электро-
проводных мостиков между рамой и катодом. Добавление хромо-
вых солей удобно в промышленной практике в том случае, если
74
процесс электролиза не используется для получения тяжелой воды.
Если же одновременно с водородом и кислородом требуется полу-
чить тяжелую воду, следует учитывать снижение коэффициента
разделения изотопов водорода при электролизе в присутствии хро-
мовых добавок.
Для большинства схем получения тяжелой воды с использова-
нием процесса электролиза воды величина коэффициента разделе-
ния изотопов водорода в этом процессе существенно влияет на
технологические показатели производства. Применение хромовых
добавок к электролиту для этих схем неэкономично. В схемах, для
которых величина коэффициента разделения при электролизе не
имеет большого значения, применение хромовых добавок может
быть целесообразным.
5. УТЕЧКИ ТОКА
В электролизерах с монополярным включением электродов наблю-
даются утечки тока по трубопроводам, подводящим питательную
воду и отводящим водород и кислород в сборные коллекторы се-
рии. Обычно на этих трубопроводах монтируют вставки из изоли-
рующего материала (стеклянные, резиновые или другие непрово-
дящие ток трубы), и утечки тока по ним могут быть ограничены.
Вода, применяемая для питания электролизеров, обычно имеет
очень высокое удельное сопротивление (105—10б ом* см), поэтому
при наличии изоляционной вставки на подающем трубопроводе
можно значительно снизить утечки тока. По трубопроводам, отво-
дящим водород и кислород, утечки тока могут быть значитель-
ными, если в местах установки изоляционных вставок в трубах
скапливается конденсат. Водород и кислород уносят из электроли-
зеров брызги щелочи, поэтому конденсат в трубопроводах обычно
имеет значительную щелочность, повышающую его электропровод-
ность по сравнению с питательной водой. Для уменьшения утечек
тока отводящие водород и кислород трубы прокладывают с укло-
ном, чтобы конденсат не скапливался в местах установки изоля-
ционных вставок.
Утечки тока в электролизерах как моиополярного, так и бипо-
лярного типа возможны, если изоляция электролизеров от земли
выполнена недостаточно тщательно и если изоляторы электроли-
зера загрязнены. Утечки тока происходят также по трубам для
подвода и отвода охлаждающей воды. Ее электрическое сопротив-
ление находится в пределах (1—5) • 103 ом* см, поэтому для сни-
жения утечек тока на водопроводных трубах применяют резино-
вые изоляционные вставки возможно большей длины.
Значительно большие утечки тока наблюдаются в электролизе-
рах фильтрпрессного типа с биполярным включением электродов.
В электролизерах этого типа основное значение имеют внутренние
утечки тока по каналам для подвода циркулирующего электролита
75
к ячейкам и для сбора газо-жидкостной эмульсии, образующейся в ;
катодной и анодной частях каждой ячейки. Питательный канал, по
которому циркулирующий электролит поступает в ячейки, запол-
нен электролитом, хорошо проводящим ток. Газовые каналы (во-
дородный и кислородный) обычно также частично заполнены элек-
тролитом. Удельное сопротивление электролита в каналах не- ]
сколько повышается из-за наличия в нем газовых пузырьков, но :
все же достаточно низко.
Каналы для циркулирующего электролита и для сбора водо-
рода и кислорода проходят вдоль фильтрпрессного электролизера,
что создает возможность утечки тока по ним от ячеек с анодного
конца к ячейкам на катодный конец аппарата. Обычно каналы
электролизера составляют из секций (по числу ячеек), отделенных
друг от друга изоляционными и уплотняющими прокладками. По-
этому утечка тока по стенкам каналов вдоль всего электролизера
как по проводнику первого рода невозможна. Секции каналов со-
общаются по жидкости с электролитом, заполняющим ячейки,
вследствие чего может происходить утечка тока из каждой ячейки
в канал по штуцерам, соединяющим ее с секциями.
Для утечки тока из ячеек по штуцерам и вдоль каналов
имеются два пути: по раствору и при включении диафрагменных
рам, штуцеров и секций каналов в биполярные электрохимические
процессы. Утечка тока по раствору может наблюдаться в тех слу-
чаях, когда рамы, штуцера, соединяющие рамы с секциями кана-
лов, и сами секции выполнены из диэлектрика или из металла,
тщательно футерованного диэлектриком, что исключает соприкос-
новение электролита с металлическими поверхностями рам, шту-
церов и секций. В этих условиях электродные процессы возникают
только на электродах в ячейках и утечка тока по каналам опреде-
ляется разностью потенциалов и сопротивлением электролита на
путях утечки. Следует учитывать только скачки потенциалов у
анода и катода на пути утечки тока.
При оценке предельной величины тока утечки по каналам для
рассматриваемого случая можно допустить, что средний градиент
потенциала в электролите (в в-см~[), заполняющем каналы, опре-
деляется выражением:
где Еяч — напряжение на ячейке, в\ b — ширина ячейки, см.
Максимальная плотность тока
ставит:
утечки по каналу при этом со-
dE 1 _ Еяч
(11-45)
где р — удельное сопротивление электролита, заполняющего капал, с учетом
увеличения сопротивления за счет газонаполнения, ом • см,
76
Величина тока утечки по каждому из каналов /ут определяется
удельным сопротивлением электролита, заполняющего канал, и се-
чением S жидкости в канале:
= (П‘46)
Для снижения утечки тока желательно максимальное уменьше-
ние сечения каналов. Общая величина тока утечки (для всех ка-
налов) определяется из выражения:
I = 2iS (1Ь47)
1
Реальная плотность тока утечки по электролиту в каналах прак-
тически всегда меньше, чем рассчитано по формуле (П-45), из-за
значительного сопротивления электролита в штуцерах, соединяю-
щих раму с каналами.
Сечение штуцеров значительно меньше сечения секций каналов,
а длина штуцеров в электролизерах многих конструкций значи-
тельно больше ширины ячеек. Поэтому сопротивление электролита
в штуцерах в зависимости от конструкции электролизера может
превышать сопротивление электролита в секциях каналов на
1—3 порядка. Иногда предусматривают свободный слив газо-жид-
костной эмульсии через газовые штуцера в секцию канала, что
создает своего рода прерыватель струи. Хотя он не обеспечивает
надежного разрыва струи, однако существенно увеличивает сред-
нее сопротивление электролита на пути тока из ячейки в канал.
При небольшом числе ячеек в фильтрпрессном электролизере сред-
ний градиент потенциала в электролите, заполняющем каналы, не-
сколько снижается за счет скачков электродных потенциалов на
концах путей утечки тока. При большом числе ячеек это снижение
невелико.
Пути утечки тока по каналам и сопровождающие ее процессы
усложняются в случае применения металлических нефутерованных
рам, секций газовых и питательного каналов и штуцеров, соеди-
няющих эти секции с электродными пространствами ячеек. При
этом кроме утечки тока по электролиту, заполняющему штуцера
и секции каналов, возникает возможность участия рам, штуцеров
и секций каналов в утечке тока в результате включения их в элек-
трохимический процесс.
Примером включения в эту работу рамы, штуцеров и секций
каналов может служить ранее упомянутое поведение рам край-
них ячеек электролизера: в крайней ячейке с анодной стороны
электролизера поверхность рамы, обращенная к аноду, работает
в качестве биполярно включенного электрода. Так как величина АР
больше напряжения разложения, на поверхности рамы выде-
ляется водород при тем большей плотности тока, чем выше зна-
чение АР. В качестве анода при этом работают поверхности сек-
ций каналов и частично поверхность штуцеров, соприкасающаяся
77
с электролитом. Металлические стенки штуцеров участвуют в про-
хождении токов утечки, передавая ток от рамы, работающей как
катод, к кольцу канала, работающему как анод биполярного элек-
трода. Утечка тока по штуцеру может быть определена по потере
в нем напряжения.
Аналогичные явления происходят также на катодной стороне
электролизера. В крайней с катодной стороны ячейке рама рабо-
тает в качестве анода, а кольца каналов — в качестве катода бипо-
лярного электрода. При этом утечки тока приводят не только
к снижению выхода по току (вследствие того что часть тока ми-
нует средние ячейки, не разлагая в них воду с выделением водо-
рода и кислорода), но и вызывают взаимное загрязнение газов
электролиза.
Рамы, участвующие в биполярной работе как катод (на анод-*
ной стороне электролизера), выделяют водород в анодные про-
странства ячеек, загрязняя кислород. Соответственно рамы, ра-
ботающие как анод (на катодной стороне электролизера), загряз-
няют водород кислородом. В этих случаях на анодной сто-
роне электролизера в каналах (на поверхности секций) выде-
ляется кислород, на катодной — соответственно водород. В водо-
родном газовом канале Н2 загрязняется кислородом, в кислород-
ном газовом канале О2 загрязняется водородом. В питательном
канале водород, выделяющийся на катодной стороне, и кислород,
выделяющийся на анодной стороне, смешиваются, образуя грему-
чую смесь. Обычно ее отводят в кислородную сторону ячейки элек-
тролизера, при этом загрязняется кислород.
Рассмотренный выше механизм включения рамы и ее частей
в электрохимический процесс на путях утечки тока обусловливает
сдвиг потенциала рамы на одном конце электролизера в сторону
катода, а на другом конце — в сторону анода. Этот сдвиг должен
быть таким, чтобы величина АР (или соответственно КР) ячеек
превышала напряжения разложения, т. е. была более 1,67—1,8 в.
Однако это необязательно для включения диафрагменной рамы и
ее частей (штуцеров и секций каналов) в электрохимический про-
цесс на путях утечки токов. Как известно, через ячейку может про-
текать ток даже в том случае, если к ней приложено напряжение
меньшее, чем напряжение разложения. При этом плотность тока
на электродах невелика и процесс протекает без выделения газов.
Такой ток, называемый остаточным, определяется скоростью диф-
фузии атомарного водорода (или соответственно кислорода) от
поверхности электрода в электролит и зависит от температуры
процесса и интенсивности перемешивания электролита в ячейке.
Рамы ячеек в анодной стороне электролизера, на которых ве-
личина АР меньше напряжения разложения, также могут вклю-
чаться в биполярную электрохимическую работу в качестве катода,
как описано выше. Разница заключается в том, что поверхность
рамы, обращенная к аноду, будет работать как катод с малой
плотностью тока без выделения водорода в анодное пространство
78
и без соответствующего загрязнения кислорода. Поверхность рамы
сравнительно велика, поэтому утечки тока за счет биполярного
включения рамы и ее деталей могут быть не настолько малы,
чтобы ими можно было пренебречь, особенно с учетом их возмож-
ного влияния на коррозию деталей электролизеров. При этом сек-
ции каналов включаются в биполярную работу со значительно
большей плотностью тока, чем на поверхности рамы, поскольку
рабочая поверхность секций меньше. Анодный процесс на секциях
каналов может протекать нормально с выделением О2. Аналогично
на катодной стороне электролизера в биполярную работу на пути
утечки тока могут включаться рамы ячеек, на которых КР меньше
напряжения разложения. В этих ячейках поверхность рамы может
включаться как анод, работающий на остаточном токе малой плот-
ности без выделения газообразного кислорода. Секции каналов
при этом могут работать как катоды с выделением газообразного
водорода.
При рассмотрении предыдущего материала мы предполагали,
что утечка тока в каналах происходит только по электролиту, пол-
ностью или частично заполняющему каналы. Это предположение
верно лишь в том случае, когда секции каналов выполнены из ди-
электрика или тщательно футерованы. Если же секции каналов
металлические, пути утечки тока по каналам усложняются вслед-
ствие включения в биполярную работу их секций. Изменение по-
тенциала электролита по длине одной секции канала в среднем
равно напряжению на ячейке. Поэтому утечка тока по каналу (по-
мимо утечек по электролиту) возможна также через металличе-
ские секции с включением их в биполярную работу.
Потенциал электролита в каналах изменяется вдоль секции,
вследствие чего различные точки внутренней поверхности секций
по-разному включаются в электрохимический процесс. На концах
секций должна быть максимальная плотность тока, которая к се-
редине кольца снижается до нулевой. При включении секций ка-
налов в биполярную работу утечка тока по каналу может превы-
шать /max, определенную ранее исходя из возможности утечки тока
в каналах только по электролиту. При включении секций каналов
в биполярную работу часть тока утечки разлагает воду с выделе-
нием Н2 и О2. Это приводит к соответствующему загрязнению во-
дорода и кислорода и к снижению выхода по току.
Если электролит загрязняется соединениями железа и со-
здаются токопроводные мостики между катодами и прилегающими
к ним рамами, то наблюдаемое при этом изменение потенциала
рамы и металлически соединенных с нею штуцеров и секций кана-
лов вызывает также изменения величины и механизма утечки тока
в отдельных ячейках и в целом по электролизеру. Общая утечка
тока внутри электролизеров фильтрпрессного типа в основном
определяется конструкцией каналов, их секций и соединительных
штуцеров. На утечку тока сильно влияют степень заполнения га-
зовых каналов жидкостью и состояние электролизера, в частности
79
загрязнение электролита железом. При футеровке рамы и ее де-
талей (секции, каналы, штуцера) изменяется величина и механизм
утечки тока.
6. КОЛИЧЕСТВЕННЫЕ СООТНОШЕНИЯ
В ПРОЦЕССЕ ЭЛЕКТРОЛИЗА ВОДЫ
При прохождении через ячейку количества электричества, равного
1 фарадею (96540 а-сек, или 26,8 а-ч), на электродах выделяется
по 1 г-экв водорода и кислорода при полном использовании тока
на основной процесс разложения воды. В современных электроли-
зерах типа ФВ для электролиза воды суммарные потери тока
обычно составляют около 2—3%, а выход по току близок к 98%.
В табл. П-6 приведены теоретические и практические коэффи-
циенты, связывающие количество электричества, прошедшего через
ячейку, с количеством разложенной воды и выделяющихся при
этом газов, измеренных в сухом состоянии и приведенных к нор-
мальным условиям (0°С и 760 мм рт. ст,).
Таблица 11-6. Количественные соотношения в процессе
электрохимического разложения воды
(Q -- количество электричества, т) — выход по току)
Q«1 а*ч Q=>1000 а-ч Q = 26,8 а-ч
Т|= I Т) = 0,98 П-1 П = 0,98 П = 1 Г] = 0,98
Разлагается воды, г 0,336 0,3293 336 329,3 9,0 8,82
Выделяется Н2 г 0,0373 0,0366 37,3 36,6 1,0 0,98
л 0,419 0,41 419 410 11,2 10,98
Выделяется О2 г 0,2987 0,2927 298,7 292,7 8,0 7,84
л 0,2095 0,205 209,5 205 5,6 5,49
Количество газов V, выделяющихся в электролизере, который
состоит из п ячеек, за время t ч при нагрузке /а и выходе по
току т), может быть определено по выражениям:
для водорода........^н2= 0,419 П55о~ (П-48)
для кислорода.......V02 = 0,2095 м3 (П-49)
Если принять г] = 0,98, эти выражения приобретают следующий
вид:
УН, = 0'4' !>•«’ (П-50)
^ = 0.205-^ Л13 (П-51)
80
Получаемые по формулам (П-50) и (П-51) значения относятся
к сухим газам, приведенным к нормальным условиям.
При прохождении через ячейку 1 фарадея электричества разла-
гается 9 г воды. Для получения 1 м3 Н2 и 0,5 м3 Ог необходимо
разложить 0,805 кг воды. Количество воды, уносимой из электро-
лизера с 1 м3 водорода и с 0,5 м3 кислорода, зависит от темпера-
туры, при которой газы отводятся из электролизера, и от пар-
циального давления паров воды в паро-газовой смеси. Если газы
отводятся из электролизера без предварительного охлаждения их
в холодильнике, парциальное давление паров воды зависит от тем-
пературы и концентрации щелочи в электролите. При наличии в
электролизере газового холодильника, в котором происходит ча-
стичная конденсация паров воды, их парциальное давление в газе,
выходящем из холодильника, однозначно определяется его темпе-
ратурой, так как в этом случае пары воды находятся в равновесии
не с электролитом, а с конденсатом, т. е. практически с чистой
водой.
Количество воды, уносимой с 1,5 м3 газа (на 1 м3 Н2 и 0,5 м3
О2), составляет:
gn= 1,5- 0,805
где ga — количество паров воды, содержащихся в 1,5 м3 газов электролиза, кг\
р — парциальное давление паров воды в паро-газовой смеси, мм рт. ст.\ Р —
общее давление паро-газовой смеси, мм рт. ст.\ 0,805 — плотность паров воды,
приведенных к нормальным условиям.
Общий расход воды на получение 1 м3 Нг и 0,5 м3 Ог склады-
вается из количества разложенной воды gp и уносимой с парами,
насыщающими водород и кислород:
g = £p + gn = 0,805 (1 + -^) кг
Парциальное давление паров воды над электролитом зависит
от его состава. С увеличением концентрации щелочи в электро-
лите парциальное давление паров воды над ним снижается
(стр. 27).
Испарение и унос влаги с газами из электролизера приобре-
тают важное зцачение при использовании процесса электролиза
для производства тяжелой воды. Предложено 64 использовать есте-
ственные процессы испарения и уноса воды с газами из электро-
литических ячеек для отбора из ячеек конденсата, обогащенного
тяжелым изотопом водорода, с целью создания непрерывной кас-
кадной схемы разделения изотопов водорода без дополнительных
затрат энергии на испарение воды из электролита. Более подроб-
но этот вопрос будет освещен в VI главе.
Из общего количества воды g кг, расходуемой на производство
1 м3 Нг и 0,5 м3 О2, можно получить при достаточно полном охлаж-
дении газов конденсат в количестве, близком к gn. Максимально
6 Зак, 713
81
возможный удельный отбор воды в виде конденсата определяется
отношением
gn _ 1,5р
g Р + 0,5р
С ростом парциального давления паров и снижением общего
давления паро-газовой смеси удельный отбор воды возрастает.
В практических условиях процесса электролиза удобно учиты-
вать расход электроэнергии на единицу объема получаемых газов.
Удельный расход электроэнергии постоянного тока (в квт-ч) на
1 м3 Н2 и 0,5 ж3 О2 определяется из выражения:
где w — расход электроэнергии постоянного тока на ячейку за t ч, равный
/Еяч/
w 1000 квт '4
Vn — объем выработанного за этот период в ячейке водорода, определяемый
по выражению (П-48).
После преобразования получим:
Для практических расчетов выход по току можно принимать
близким к 0,98, при этом выражение (П-52) приобретает вид:
0,41
Поскольку в промышленных электролизерах для получения во-
дорода и кислорода выход по току очень мало изменяется в про-
цессе работы, удельный расход электроэнергии постоянного тока
определяется напряжением на ячейке. С ростом плотности тока
напряжение на ячейке и соответственно удельный расход электро-
энергии постоянного тока увеличиваются. Ниже приведена зави-
симость удельного расхода W электроэнергии постоянного тока
(на 1 ж3 Н2 + 0,5 м3 О2) от плотности тока для электролизера типа
ФВ, работающего при 75° С, концентрации электролита (раствор
КОН), близкой к оптимальной по электропроводности, и q = 0,98:
Плотность тока, а/м2: . . . 500 1000 1500 2000 2500 3000 3330
Г, квт-ч........... 4,54 4,85 5,12 5,37 5,61 5,86 6,03
Примечание. Расход энергии отнесен к объемам газов, приведенным к нормаль-
ным условиям.
Иногда в рекламных сообщениях некоторых зарубежных фирм
приводятся данные об удельном расходе электроэнергии, отнесен-
ные к 1 м3 Н2 + 0,5 м3 О2, объемы которых не приведены к нор-
мальным условиям, а относятся к влажным газам при 15—25° С.
82
Естественно, удельные расходы электроэнергии при этом полу-
чаются меньше, чем в действительности.
В зависимости от парциального давления р паров воды, насы-
щающих газы, и температуры t газов удельный расход электро-
энергии, отнесенный к влажному газу, можно определить из выра-
жения (в кет • ч на 1 м3 Н2 и 0,5 м3 О2):
^=U7-76O(273 + /), = X (Ь53)
Зависимость коэффициента К в выражении (П-53) от темпера-
туры, при которой газ насыщается влагой, показана ниже:
Температура, °C . . 0 10 20 30 40
К.................... 0,994 0,955 0,91 0,86 0,81
Для определения удельного расхода электроэнергии перемен-
ного тока необходимо учитывать коэффициент полезного дей-
ствия т]пс преобразовательной подстанции:
На современных преобразовательных подстанциях, оборудован-
ных полупроводниковыми выпрямителями, т)пс достигает 0,95—-0,97,
при использовании ртутных выпрямительных агрегатов -цпс сни-
жается до 0,92—0,96 в зависимости от требуемого напряжения по-
стоянного тока. Если переменный ток преобразуется в постоянный
при помощи мотор-генераторов, коэффициент полезного действия
преобразовательной подстанции становится еще меньше.
7. ТЕПЛОВОЙ БАЛАНС ЭЛЕКТРОЛИЗЕРА
Как известно, только часть электрической энергии, затраченной
в процессе электролиза воды, используется на целевую реакцию
разложения воды на водород и кислород. Остальная часть энергии
в конечном счете выделяется в виде тепла. Наиболее распростра-
нено65 определение количества тепла, выделяющегося в процессе
электролиза, по разности между общей затратой электрической
энергии на электролиз и химической энергией полученных при
этом газов — водорода и кислорода. Такое представление осно-
вано на первом законе термодинамики. Высказывалось также мне-
ние, что количество тепла, выделяющегося в процессе электролиза,
определяется разностью между общим количеством электрической
энергии, затрачиваемой на электролиз, и максимальной работой
процесса 66“68. Однако при этом не учитывается количественное
различие значений максимальной работы и теплового эффекта
процесса.
Некоторые авторы учитывают как полезную затрату энергии на
процесс разложения воды, так и тепло, уносимое парами воды, на-
сыщающими кислород и водород, которые отбираются из ячеек.
6*
83
В дальнейшем мы будем рассматривать как полезную только за-
трату энергии на разложение воды с получением водорода и
кислорода. Часть энергии, которая превращается в тепло, выделяю-
щееся в процессе электролиза, может расходоваться на нагрева-
ние получаемых газов или на образование водяных паров, насы-
щающих водород и кислород. Расход тепла на эти нужды зависит
от конкретных условий ведения процесса в каждом отдельном слу-
чае и поэтому его удобнее учитывать как составляющую теплового
баланса электролитической ячейки.
Количество электрической энергии, полезно затраченной на раз-
ложение воды, должно быть равно химической энергии полученных
газов электролиза. При их сжигании с образованием жидкой воды
должно выделяться такое же количество энергии (стр. 39), кото-
рое было затрачено на разложение водЁ1 в процессе электролиза.
Исходя из этого, можно написать следующее уравнение энергети-
ческого баланса процесса электролиза:
Г - /Еяч* = + Ют (11-54)
где W — общее количество энергии, затрачиваемой на процесс электролиза
в ячейке, кет - ч\ t — время, ч\ wx — количество энергии, полезно используемой
на процесс разложения воды, кет • ч; wT — количество электрической энергии,
превращающейся в процессе электролиза в тепло, кет • ч.
Если через Ех обозначить напряжение на ячейке, при котором
вся электроэнергия, затрачиваемая на электролиз, превращается
в химическую энергию газов, образующихся при электролизе, то
выражение (П-54) можно написать в виде:
/Еяч/ = IExt + шт
Отсюда получаем:
шт = //(Еяч-^х) (П-55)
В результате сжигания 1 моль Н2 с образованием Н2О (жидк.)
при 25° С выделяется тепло Q в количестве 68,317 ккал:
Н2 4- V2O2 = Н2О (жидк.) + 68,317 ккал
Следовательно, Q = 68,317 = 0,239 п FEX. Откуда
£х= 0,239/iF = 1,48 в
Подставляя это значение Ех в уравнение (П-55), получаем:
шт = 0,86// (Еяч ~ 1 >48)
В выражении (П-55) допускается некоторая неточность в
связи с тем, что на разложение воды используется не 100% тока.
Часть тока, затраченная на утечку по каналам, на процессы вос-
становления кислорода и окисления водорода, не расходуется на
разложение воды и потому целиком превращается в тепло. Однако
эта часть тока гораздо меньше, чем общие потери выхода по току.
Та часть потерь тока, которая служит источником загрязнения во-
дорода кислородом (и наоборот), производит работу разложения
воды и учитывается выражением (П-55).
84
Если исходить из химической энергии газов, получаемых при
электролизе, то коэффициент полезного использования энергии Ai
при электролизе определится выражением:
Л,=-^-п (П-56)
-Сяч
где г| — выход по току, доли единицы.
Если учитывать максимальную работу реакции А2, то формула
(П-56) принимает вид:
где Ео — термодинамически обратимая э. д. с. водородо-кислородного эле-
мента, в.
При 80° С величина Ех = 1,48 в, Ео= 1,18 в. При общем напря-
жении на ячейке 2,3 в коэффициенты полезного использования
энергии на электролиз воды составят: Ai = 0,626 и А2 = 0,502.
Сила тока на ячейку, а
б
Рис. II-19. Примерная схема теплового баланса электролитической ячейки (а) и
схема его изменения с ростом нагрузки при постоянной температуре про-
цесса (б):
Е- общее напряжение на ячейке; ^-теоретическое напряжение разложения; wx-химиче-
ская энергия продуцируемых газов; wT — количество тепла, отводимого в теплообменниках;
wr — количество тепла, отводимого с газами; wc~ потери тепла через стенки ячейки.
Тепло, выделяющееся в процессе электролиза в количестве,
определяемом по выражению (П-55), отводится из ячейки газами,
продуцируемыми при электролизе, а также за счет потерь тепла
в окружающую атмосферу и отвода его в специальных холодиль-
никах. Если электролиз проводится при низких температурах, не
более 65—75° С, количество тепла, отводимого с газами, в общем
тепловом балансе невелико. При более высоких температурах уве-
личиваются влагосодержание газов и количество тепла, уносимого
с парами воды, насыщающими газы.
На рис. П-19, а приведена примерная схема теплового баланса
электролитической ячейки. Поскольку выход по току близок
к 100%, все составляющие теплового баланса без большой погреш-
ности можно выразить в электрических единицах,
85
С повышением температуры процесса электролиза доля потерь
тепла с газами и через стенки ячейки возрастает. При изменении
плотности тока изменяются также напряжение и тепловой баланс
ячейки. На рис. П-19, б показана схема изменения теплового ба-
ланса ячейки при изменении нагрузки на ячейку определенных
размеров и постоянной температуре. Химическая энергия продуци-
руемых газов wx и количество тепла, уносимого с газами wr, про-
порциональны нагрузке, поэтому значение этих величин в тепло-
вом балансе не изменяется с ростом нагрузки и плотности тока.
Потери тепла через стенки ячейки и количество тепла, которое
необходимо отвести в холодильниках, зависят от нагрузки электро-
литической ячейки. При нагрузке, соответствующей точке пересе-
чения кривой напряжения на ячейке с линией общего расхода
тепла (см. рис. П-19, б), приход и расход энергии при заданной
температуре процесса равны. При повышении нагрузки выделяется
излишнее тепло, и, чтобы предотвратить повышение температуры,
необходим отвод тепла в холодильниках. С понижением нагрузки
потери тепла могут превысить его приход, и для поддержания
требуемой температуры электролиза необходим дополнительный
подвод тепла к ячейке.
Тепловой баланс процесса электролиза будет рассмотрен более
подробно при описании электролизера ФВ-500.
8. ЭЛЕКТРОЛИЗ ВОДЫ ПОД ДАВЛЕНИЕМ
Объем газов, образующихся в процессе электролиза воды, больше
объема разложившейся Н2О примерно в 1868 раз. Поэтому, если
вести ее электролиз в герметичном аппарате, можно повысить
в нем давление примерно в такое же число раз. Использовать эту
возможность для получения водорода и кислорода при электро-
лизе воды под давлением было предложено еще в конце прошлого
века69.
Проведение процесса электролиза под давлением в ряде слу-
чаев представляется целесообразным. Получение газов электро-
лиза при необходимом давлении упрощает производственную
схему их использования, так как позволяет отказаться от уста-
новки газгольдеров и компримирования газов. При этом отпадает
необходимость в дополнительных затратах энергии на их сжатие.
Если учесть к. п. д. газовых компрессоров, экономия электроэнер-
гии на сжатие 1 м3 газа и эквивалентное этому снижение напря-
жения на ячейке при электролизе воды под давлением составят:
Давление, ат....................... 10
Экономия электроэнергии, кет • ч/м3
газа*.............................. 0,11
Эквивалентное снижение напряже-
ния на ячейке, в................... 0,075
100
0,21
0,142
200
0,23
0,156
* Считая на объем газа, приведенный к нормальным условиям.
86
Кроме того, экспериментально установлено, что в практических
условиях процесса электролиза с ростом давления несколько сни-
жается общее напряжение на ячейке, особенно при высоких плот-
ностях тока и малых давлениях 70 '76. На рис. П-20 представлена
зависимость напряжения на ячейке от давления при различных на-
грузках на опытном электролизере70’71.
Изменение напряжения на ячейке и его составляющих с ростом
давления изучалось многими исследователями, однако полной
ясности в этом вопросе пока еще
нет. Теоретическое напряжение
разложения должно возрастать с
ростом давления. Для газовых
электродов, согласно уравнению
Нернста, обратимый потенциал в
зависимости от давления соста-
вит:
для
водородного электрода
е0Н2“ Ih 2
nF Рн*
3,5
3,0
I § 2,5 2,0
45
ДЛЯ
кислородного электрода
RT
ео о2== 7Г 1п
nF
га-
1500а
ЮОО
500
ч 200
— 1ПП - ,
сг>
20а
Зависимость напряжения
от давления при различ-
токовых нагрузках.
50 100 150 200
Давление, ат
Рис. П-20,
на ячейке
ных
При изменении давления
зов от Pi до Р2 значение обрати-
мого электродного потенциала должно измениться для водород-
ного электрода на
к _ 1 р2
Т-Т — — 7Т” 1П —~
0 Нг nF Pi
рог
Pq2-
и для кислородного электрода на
Л _ 1 Р2
Ле°°‘ nF 1п рх
Для водородного электрода значение п = 2 (2Н+ + 2е = Н2),
для кислородного соответственно п = 4(4ОН“ — 4е = О2-Ь 2Н2О).
Изменение теоретического напряжения разложения воды в за-
висимости от давления приведено ниже:
ДЕ0=Део0г-Лс01| =з/4-^1п-^
Подставляя в это выражение числовые значения R = 8,316 в-к
(вольт • кулон) и F = 96 540 а • сек и переходя к десятичным лога-
рифмам, получим:
ДЕ0 = 0,00015Г 1g
87
Ниже приведены величины, характеризующие увеличение тео-
ретического напряжения разложения воды с ростом давления при
18 и 80° С:
Р2: Pi...................
ДЕ0> в
при 80° С................
» 18° С............
1 10 100 1000
0 0,052 0,104 0,156
0 0,044 0,087 0,131
По данным Фаузера77, увеличение потенциалов электродов
с ростом давления несколько выше, чем следует из расчета для
идеальных газов.
Зависимость потенциалов анода и катода от давления изуча-
лась многими исследователями 78-86. В некоторых работах 78-80 не
удалось установить зависимость потенциалов выделения водорода
от давления, в других работах было обнаружено увеличение по-
тенциала 83 с ростом давления.
По мере повышения давления увеличивается растворимость га-
зов (водорода и кислорода) в электролите, соответственно должны
усиливаться процессы деполяризации электродов растворенными
газами. Высказывались мнения 77’87, что снижение напряжения на
ячейке по мере роста давления связано с деполяризацией катода
и анода растворенными в электролите газами — кислородом и во-
дородом. Ниже приведены данные Фаузера об изменении выхода
по току с ростом давления электролиза:
Давление, ат....... 1 100 120 140
Выход по току, % . . . 100 95,5 94,7 94,4
С повышением давления, безусловно, должны усиливаться про-
цессы деполяризации электродов растворенными газами, однако их
количественное значение и влияние на выход по току зависит от
конструкции электролизеров, принятой схемы циркуляции элек-
тролита и условий проникания растворенного водорода в анодное
пространство и кислорода в катодное пространство.
Поскольку значение обратимого потенциала электродов с ро-
стом давления увеличивается, снижение напряжения на ячейке
в этих условиях может быть объяснено только уменьшением по-
терь напряжения на необратимые процессы, сопровождающие
электролиз. К ним прежде всего относится снижение перенапряже-
ния на аноде и катоде и потерь напряжения на преодоление оми-
ческого сопротивления электролита.
Повышение давления позволяет работать при более высокой
температуре электролиза, чем под атмосферным давлением. С ро-
стом давления возможен переход к работе при температуре, пре-
вышающей 100° С, что связано также со снижением перенапряже-
ния и омического сопротивления электролита.
По вопросу о влиянии давления на величину газонаполнения
электролита пока нет единой точки зрения. Представляется вероят-
ным, что с ростом давления газонаполнение электролита должно
88
снижаться из-за уменьшения фактического объема выделяющихся
газов. Возможно и некоторое уменьшение среднего размера газо-
вых пузырьков и замедление их подъема в жидкости с увеличе-
нием давления, однако условия слияния газовых пузырьков друг
с другом определяются рядом факторов, мало зависящих от дав-
ления. Поэтому можно ожидать суммарного снижения степени
газонаполнения электролита с ростом давления.
Потери напряжения в электролите с ростом давления могут
уменьшаться из-за снижения газонаполнения и подъема рабочей
температуры. Некоторое увеличение электропроводности чистого
электролита с ростом давления компенсируется снижением его
электропроводности из-за большей растворимости газов в электро-
лите.
При электролизе под повышенным давлением значительно воз-
растают требования к конструкции электролизеров и к материа-
лам для изготовления их деталей, увеличивается расход материа-
лов для изготовления корпуса и деталей электролизера, повы-
шаются требования к диафрагме и устройствам для поддержания
равенства давления водорода и кислорода по обе стороны диаф-
рагмы. Следует учитывать, что при работе под давлением 10 ат
различие давления газов в 1 % соответствует возникновению одно-^
стороннего давления на диафрагму в 1000 мм вод. ст., что может
привести к смешению газов и образованию взрывоопасных смесей.
Взрывы их под давлением отличаются большой разрушающей
силой.
Для использования преимуществ электролиза под давлением
целесообразно работать при температуре 100—120°С в зависи-
мости от применяемого давления. Однако при этом повышаются
требования к коррозионной стойкости электродов, рам, диафрагм,
уплотнительных прокладок и других деталей электролизеров.
Большими техническими трудностями осуществления процесса
электролиза под давлением объясняется то обстоятельство, что,
несмотря на многочисленные предложения, работы и патенты в об-
ласти электролиза под давлением, этот процесс долгое время не
находил практического применения в промышленности. Впервые
промышленные конструкции электролизеров для работы под дав-
лением были созданы и внедрены в производство в нашей стра-
не88»89 в 30-х годах XX в. В 50-х годах электролизеры для работы
под давлением были выпущены фирмой Лонца 90~92. В настоящее
время в промышленности применяются электролизеры, работаю-
щие под сравнительно небольшим давлением — до 30—40 ат. Све-
дений о применении промышленных электролизеров для работы
при более высоком давлении не опубликовано.
Наибольшие преимущества электролиз под давлением имеет
при переходе от атмосферного давления к давлениям порядка
10—40 ат. Многих потребителей электролизных газов удовлетво-
ряет такое давление. Если им требуется более высокое давление
(200—1000 ат), более удобно получать газы электролиза под
89
средним давлением и дополнительно компримировать их до необ-
ходимого давления.
Современные конструкции электролизеров и системы регули-
рования давления газов при 10—40 ат не требуют большего уве-
личения затрат металла и усложнения схемы регулировки
процесса. Для дальнейшего повышения рабочего давления в про-
мышленных электролизерах необходима разработка новых кон-
струкций и схем регулирования.
ЛИТЕРАТУРА
1. Антропов Л. И., Теоретическая электрохимия, Изд. «Высшая школа»,
1969; Основные вопросы современной теоретической электрохимии, под ред.
А. Н. Фрумкина, Изд. «Мир», 1965; Изгарышев Н. А., Горба-
чев С. В., Курс теоретической электрохимии, Госхимиздат, 1951; С кор-
че летти В. В., Теоретическая электрохимия, Госхимиздат, 1959; Фет-
тер Км Электрохимическая кинетика, Изд. «Химия», 1967.
2. Пфлейдерер Г., Электролиз воды, перев. с нем., Химтеорет, 1935.
3. Стендер В. В., Прикладная электрохимия, изд. Харьковск. гос. унив.»
1961.
4. Биллитер Ж., Промышленный электролиз водных растворов, перев.
с нем., Госхимиздат, 1959.
5. Биллитер Ж., Новейшие достижения технической электрохимии, перев.
с нем., Госхимтехиздат, 1934.
6. Reg пег A., Electrochemical Processes in chemical Industries, Prague, 1957.
7. Cha pm an E. A., Chem. Proc. Eng., 46, № 8, 387 (1965); Pichler A.,
Chem. Ing. Techn., 33, № 2, 95 (1961).
8. Ф p у м к и н A. H., Ба тонкий В. С., Ио фа 3. А., Кабанов Б. Н.,
Кинетика электродных процессов, изд. МГУ, 1952; Фрумкин А. И., Труды
4-го совещания по электрохимии, Изд. АН СССР, 1959, стр. 7.
9. Туров П. П., С кобец Е. М., ЖФХ, 24, 694 (1950).
10. Туров П. П., Труды совещания по электрохимии, Изд. АН СССР, 1953,
стр. 86.
11. Фрумкин А. Н., ЖФХ, 24, 244 (1950); ЖФХ, 31, 1875 (1957).
12. Луковцев П. Д., Левина С. Д., Фрумкин А. Н., ЖФХ, 13, 976
(1939).
13. Con vers М., Bull. Soc. Chim. France, № 6, 792 (1959).
14. Некоторые проблемы современной электрохимии, перев. с англ., Издатинлит,
1958.
15. Фрумкин А. Н. и др., ЖФХ, 10, 508 (1937); 13, 1435 (1939); 14, 907
(1940); 18, 298 (1944); 18, 491 (1944).
16. Печерская А. Г., Стендер В. В., ЖФХ, 24, 856 (1950); ЖПХ, 19, 12
(1946); ЖПХ, 20, 36 (1947).
17. Баграмян А. Т., ЖФХ, 11, 311 (1933).
18. Б а го цк ий В. С., Яблокова И. Е., Труды совещания по электрохимии,
Изд. АН СССР, 1953, стр. 57.
19. Р о з е н ц в е й г С. А., К а б а н о в Б. Н., ЖФХ, 22, 513 (1948).
20. Федотьев Н. П., Березина Н. Б., Круглова Е. Г., ЖПХ, 21, 317
(1948).
21. Лошкарев М. А., Озеров А. М., ЖПХ, 24, 537 (1951).
22. Легран А. Э., Левина С. Д., ЖФХ, 14, 211 (1940).
23. Кабанов Б. Н., ЖФХ, 13, 341 (1939).
24. Луковцев П. Д., ЖФХ, 27, 1245 (1953); Луковцев П. Д. и др., ЖФХ,
13, 916 (1939).
25. В е с е л о в с к а я И. Е., Кучинский Е. М., Труды 4-го совещания по
электрохимии, Изд. АН СССР, 1959, стр. 96; Буянова Н. Е., Цыга-
нов Г. А., там же, стр. 827.
90
26. Б о к р и с О. М., Труды 4-го совещания по электрохимии, Изд. АН СССР,
1959, стр. 53; Смяловский М. и др., там же, стр. 72; Ио фа 3. А.,
М а з и и и е н к о Э. А., там же, стр. 91.
27. Волчкова Л. М., Красильщиков А. И., ЖФХ, 23, 441 (1949);
Волчкова Л. М., Антонова А. И., Красильщиков А. И., ЖФХ,
23, 714 (1949); Красильщиков А. И., Анодная защита металлов, Изд.
«Машиностроение», 1964, стр. 73.
28. Фисейский В. И., Турьян Я. И., ЖФХ, 24, 567 (1950); Турьян Я. И.,
Гольдштейн И. С., ЖПХ, 29, 379 (1956).
29. Кабанов Б. Н., Труды 4-го совещания по электрохимии, Изд. АН СССР,
1959, стр. 252; Эрдей-Груз Т., Шафарик И., там же, стр. 263; Кра-
сильщиков А. И., там же, стр. 272.
30. Г а н т м а н С. А., Л у к о в ц е в П. Д., Труды совещания по электрохимии,
Изд. АН СССР, 1953, стр. 504; Красильщиков А. И, там же, стр. 71.
31. Елина Л. М., Борисова Т. И., Залкинд Ц. И., ЖФХ, 28, 785 (1954).
32. Tafel, Z. phys. Chem., 50, 641, 710 (1905).
33. Хомутов И. Е., ЖФХ, 24, 1201 (1950).
34. Хомутов И. Е., Труды совещания по электрохимии, Изд. АН СССР,
1953, стр. 97.
35. I u s t i Е., Naturwiss., 47, 289 (1960).
36. Герм. пат. 592130 (1932): пат. ФРГ 1065821 (1961); 1052370 (1965); 1183892
(1965); англ. пат. 884905 (1961).
37. Vi е 1 s t i с h W., Chem. Ing. Techn., 33, № 2, 75 (1961).
38. Кузьмин Л. А., По рой ко в а А. С., ЖПХ, 22, № 6, 572 (1949).
39. Воронин H. H. и др., Укр. хим. журн., 20, № 2, 182 (1954); Б о р ма-
ше н к о И. В. и др., ЖПХ, 38, 2827 (1965).
40. Швейц, пат. 181800 (1935).
41. Соколов П. И., Волчкова Л. М., авт. свид. СССР 43413 (1934).
42. Коханов Г. Н. и др., ЖФХ, 36, 481 (1962).
43. К о х а н о в Г. Н. и др., Вести, техн, и эконом, информ. НИИТЭХИМ, № 2,
36 (1959).
44. Митауэр Э. С. и др., авт. свид. СССР 170473 (1965); Бюлл. изобр., № 9
(1965).
45. Коротков П. М., Соколов П. И., ЖФХ, 3, 670 (1933); У с а н о-
вич М. И., С ушке вич Т. И., ЖФХ, 25, 590 (1951); Максимова И. Н.,
Юшкевич Ф. В., ЖФХ, 37, 903 (1963); франц, пат. 1379177 (1964).
46. К р а у з е А. Э., С о к о л о в П. И., ЖПХ, 7, 887 (1934).
47. Фа уз ер Г., Жури. хим. пром., № 19, 1237 (1930).
48. Коган В. Б., Софронов В. М., Хим. пром., № 2, 94 (1954).
49. Рот ин ян А. Л., Ал ойц В. М., ЖПХ, 30, 1781 (1957).
50. Машовец В. П., ЖПХ, 24, 353 (1951).
51. Колотухин А. Т., Мул ин Е. В., Хим. пром., № 5, 395 (1960); Му-
лин Е. В., Колотухин А. Т., Хим. пром., № 5, 313 (1961).
52. Якименко Л. М., Электролизеры с твердым катодом, Изд. «Химия», 1966.
53. Генин Л. С., Крон га уз Е. Л., Хим. пром., № 2, 116 (1961).
54. Изосенков Р. И., Электрохимия, № 3, 371 (1966).
55. Левич В. Г., Физико-химическая гидродинамика, Физматгиз, 1959.
56. Rue, de la, Tobias C. W., J. Electrochem. Soc., 106, № 9, 827 (1959).
57. Артемьев Б. И., Труды МИХМ, вып. 21, 1960, стр. 49.
58. Runge G. L., Techn. Phys., 25, № 6, 61 (1925); Maxwell W., Treatise on
Electriciti Magnetism, № 1, 440 (1904).
59. R а у 1 e i g h t L., Phys. Mag., 5, № 34, 481 (1892).
60. Fricke H., Phys. Rev., 24, 575 (1924); 25, 361 (1925).
61. Pion tell i R., Mazza B., Electrochem. Metallor., 2, № 3, 257 (1967);
Gias J. P., Westwater J. W., Int. J. Heat and Mass Transfer, 7, № 12
1427 (1964).
62. К а б а н о в Б. H., Ф р у м к и н А. Н., ЖФХ, 4, 539 (1933).
63. Таката К., Морисита X., Кихара Я., Дэнки Когаку, 32, 379 (1964);
Таката К. и др., Дэнки Когаку, 32, 301 (1964); 32, 376 (1964); Ко-
ган В. Б., О в с е н я н Р. Р., Хим. пром., № 8, 463 (1954),
91
64. Якименко Л. М., авт. свид. СССР 57968 (1940).
65. Хомяков В. Г., Машовец В. П., Кузьмин Л. Л., Технология элек-
трохимических производств, Госхимиздат, 1949.
66. Антропов Л. И., ЖПХ, 23, № 4, 375 (1950).
67. Стен дер В. В., Электролитическое производство хлора и щелочей, Хим-
теорет, 1935.
68. Sharm а М. М., Chem. Age India, 11, № 2, 193 (1960).
69. Герм. пат. 51998, 1888.
70. Noeggerath I. Е., Z. angew. Chem., 41, 139 (1928).
71. N о e g g e г a t h I. E., Z. Ver. deut. Ing., 72, 373 (1928).
72. Ипатьев И. В., Шишкин В. В., Юрьев С. И., Z. Electrochem., 40, 713
(1934).
73. Шишкин В. В., Дубков И. A., Z. Elektrochem., 40, 724 (1934).
74. И пат ье в И. В., Шишкин В. В., Юрьев С. И., Журн. хим. пром.,
№ 3, 27 (1932); № 4, 30 (1932).
75. Jenckel Е., Вег., 69, 1078 (1927).
76. S с h n u г m a n R., Z. angew. Chem., 42, 949 (1929).
77. Ф а у з е р Г., Химстрой, № 2, 426 (1930).
78. Holmboe С. F., Z. Elektrochem., 34, № 2, 67 (1928).
79. Ипатьев И. В., Шишкин В. В., Пол ев Г. А., Дубков И. А., ЖФХ,
5, 1114 (1934).
80. Шишкин В. В. и др., ЖФХ, 5, 126 (1934).
81. Шишкин В. В., К а р н а у х Е., Z. Elektrochem., 42, 693 (1935).
82. Та mm an G., Jenckel Е., Z. anorg. allg. Chem., 173, 337 (1928).
83. Т a m m а п G. u. a., Z. anorg. allg. Chem., 150, 129 (1926).
84. Волчкова Л. M. и др., Труды ГИАП, вып. 7, Госхимиздат, 1957, стр. 258.
85. Wulf Т., Z. Phys. Chem., 48, 87 (1904).
86. Cassel Н., Veigt J., Naturwis., 21, 331 (1933); Cassel H., Krum-
be in E., Z. phys. Chem., 171A, 70 (1934).
87. Cassel H., Todt F., Z. Electrochem., 36, 241 (1930).
88. Якименко Л. M., Колосков А. И., авт. свид. СССР 51206 (1937);
Бюлл. изобр., № 5—6 (1937).
89. Я к и м е н к о Л. М., Кислород, № 2, 30 (1945).
90. Z d a n s к у A., Weltkonferenz Jugoslavien — Bundesrepublik Deutschland,
XL Teiltagung, Abt., B. 5, Bericht 3, Belgrad, 1957.
91. Пат. США 2739936 (1956).
92. Пат. США 2786811 (1957).
ГЛАВА
Ill
ОСНОВНЫЕ ЭЛЕМЕНТЫ
КОНСТРУКЦИИ ЭЛЕКТРОЛИЗЕРОВ
В промышленности использовались и используются в настоящее
время разнообразные конструкции электролизеров. Еще большее
число их конструкций было предложено в разное время, но не на-
шло применения 1-6. Несмотря на разнообразие конструкций элек-
тролизеров, можно выделить и целесообразно рассмотреть некото-
рые общие закономерности, определяющие возможные технические
решения по основным конструкционным узлам, которые в различ-
ных вариантах применялись при создании многочисленных типов
электролитических аппаратов.
1. ЭЛЕКТРОДЫ И ИХ КОНСТРУКЦИИ
От устройства электродов зависят напряжение на ячейке и расход
электроэнергии. Поэтому тип и конструкция электродов во многом
определяют технологические и экономические показатели работы
электролизера. Для разработки рациональной конструкции элек-
тродов необходимо соблюдение ряда требований:
материал электродов должен быть дешевым, доступным, удоб-
ным для обработки и придания необходимых форм, иметь невы-
сокое перенапряжение выделения водорода на катоде и кислорода
на аноде и обладать коррозионной стойкостью в условиях про-
цесса электролиза;
конструкция электродов должна обеспечить возможность со*
здания максимально развитой рабочей поверхности для снижения
истинной плотности тока на рабочей поверхности электрода;
рабочие поверхности электродов должны быть по возможности
сближены для уменьшения потерь напряжения на преодоление
омического сопротивления электролита;
конструкцией электродов должен предусматриваться удобный
отвод пузырьков газа из рабочего (межэлектродного) простран-
ства с целью уменьшения степени газонаполнения электролита на
пути тока между электродами.
Электроды должны быть по возможности просты в изготов*
пении.
Некоторые из этих требований взаимно противоречат друг
другу. Так, стремление максимально развить рабочую поверхность
93
электрода часто приводит к необходимости усложнить его кон-
струкцию. Поэтому важно найти оптимальный в техническом и
экономическом отношении вариант конструкции электродов.
При использовании щелочных электролитов катоды электроли-
зеров практически всегда изготовляются из обычной углеродистой
стали. Она доступна по цене, хорошо обрабатывается, обладает
коррозионной стойкостью при катодной поляризации и достаточно
низким перенапряжением выделения водорода. Для очистки по-
верхности катода от окалины и возможных загрязнений ее подвер-
гают пескоструйной обработке. Считается, что при этом несколько
развивается рабочая поверхность электрода, что снижает действи-
тельную плотность тока и перенапряжение на катоде.
Осадок губчатого железа, обычно выделяющийся на катоде в
процессе работы электролизера, снижает потенциал выделения во-
дорода по сравнению с его величиной на гладкой стальной по-
верхности, но повышает потенциал выделения водорода в случае
применения катода с активированной поверхностью. Для предот-
вращения возможности образования осадка губчатого железа
в электролизерах некоторых конструкций (Зданского — Лонца)
стараются полностью устранить соприкосновение стальных поверх-
ностей с электролитом.
В последнее время разработаны и успешно применяются в про-
мышленности 7-10 различные способы активации электродов. Акти-
вация катода достигается в результате осаждения на его поверх-
ности слоя никеля, содержащего серу. Такие активированные
электроды работают длительное время с пониженным перенапряже-
нием. В промышленности используются также способы повторной
активации катодной поверхности без разборки электролизера.
Применяется также активация катодов металлами платиновой
группы. Для изготовления анодов обычно используют сталь, по-
крытую слоем никеля. В старых конструкциях электролизеров
Фаузера в начале XX в. применяли стальные (не никелированные)
аноды. Несмотря на значительную коррозию, стальные аноды при
малой плотности тока (400—500 а)м2) работали в течение несколь-
ких лет. При интенсификации процесса электролиза и работе
с плотностью тока 2500 ai/м2 при 70—80° С стальные электроды
толщиной 3 мм полностью разрушаются за 3—4 недели. Никели-
рованная сталь вполне устойчива в условиях анодной поляризации
в щелочных растворах достаточно высокой концентрации. Перена-
пряжение на блестящих покрытиях выше, чем на матовых, поэтому
применяется матовое никелевое покрытие толщиной не менее
80—100 мк. Такое покрытие обычно не может быть совершенно
беспористым. Допускается до 15 пор на 1 дм2. Отсутствие корро-
зии стального листа анода с пористым никелевым покрытием объ-
ясняется забивкой пор малорастворимыми в щелочном электро-
лите продуктами коррозии железа.
Активирование никелевого покрытия для снижения анодного
потенциала, так же как и катодного, может быть достигнуто 7*12
94
путем введения серосодержащих добавок в электролит никелиро-
вочной ванны. Исследовалось влияние других добавок к электро-
литу ванны для никелирования на активацию получаемого осадка
никеля. Эффект активации анодной поверхности сохраняется дли-
тельное время.
Указывалось 13, что покрытие анода слоем кобальта позволяет
значительно понизить потенциал выделения кислорода по сравне-
нию с потенциалом на никелированном аноде. Однако это пред-
положение не подтвердилось, и вследствие значительно более
высокой стоимости кобальта его не применяют для покрытия ано-
дов.
Конструктивные формы электродов показаны на рис. Ш-1.
Электроды в виде гладких плоских стальных листов применялись
в ряде электролизеров как ящичного типа (Ноуэлса14), так и
фильтрпрессного типа с биполярным включением электродов (Пех-
кранц15). В некоторых случаях такая форма электродов целесо-
образна и имеет преимущества перед электродами более сложной
формы. Так, в установках для получения тяжелой воды методом
многоступенчатого электролитического концентрирования на ста-
дии конечного концентрирования для получения гремучего газа
находили применение аппараты с электродами из гладких сталь-
ных листов, характеризующиеся очень малым удельным объемом
электролита (на единицу мощности электролизера). Применение
гладких электродов в связи с высокой степенью газонаполнения
электролита и повышенным расходом электроэнергии ограничивает
возможности повышения плотности тока.
Недостатки плоских гладких электродов частично устраняются
в конструкции двойных перфорированных электродов (рис. II1-1, б),
которые применялись в отечественных электролизерах6 типов
В-3 и В-4. Двойные электроды без интенсивной перфорации
(рис. Ш-1, в) применяли в электролизерах типа Фаузера 16»17 и не-
которых других. При интенсивной перфорации электродных ли-
стов рабочая поверхность электродов увеличивается, так как по-
мимо лобовой поверхности электрода в процессе участвуют также
боковые стенки отверстий и частично обратная сторона электрод-
ных листов. Применение двойных электродов позволяет сблизить
их рабочие поверхности и облегчает отвод газа из электролити-
ческой ячейки, поскольку значительная часть газовых пузырьков
отводится на обратную сторону электрода через отверстия перфо-
рации.
Снижению газонаполнения способствует также внутренняя цир-
куляция электролита в электролизере с двойными электродами.
В пространстве между листами электрода электролит имеет мень-
шее газонаполнение, т. е. большую плотность, чем в пространстве
между электродом и диафрагмой. Поэтому устанавливается по-
стоянная внутренняя циркуляция электролита, который подшь
мается в пространстве между электродом и диафрагмой и опуска-
ется внутри двойного электрода. Подвод тока к таким электродам
95
ж
Рис. Ш-1. Типы электро-
дов:
а - одинарный плоский;
б —двойной перфорирован-
ный; в —двойкой типа Фау
зера; а-сетчатый; д — пла-
стинчатый (/ — стальные пла-
стины* 2~ дистанционные
кольца; 3 — болты; 4— сталь-
ные стержни); е-жалюзий-
ный; ж — с выносными ли
стами.
осуществляется при помощи стержней, привариваемых между ли-
стами электрода через отверстия перфорации.
Попытки развить рабочую поверхность электродов привели
к созданию конструкции, состоящей из набора металлических се-
ток 18’19 (рис. Ш-1, г). Однако она не нашла применения в про-
мышленности, потому что сильно затруднен подвод тока к рабочей
поверхности проволочек сетчатых электродов. Помимо этого, выде-
ляющиеся на сетке пузырьки газов «запутываются» между метал-
лическими сетками электрода, что приводит к экранированию зна-
чительной части поверхности сеток и повышению напряжения на
ячейке. Такие электроды более сложны в изготовлении. В послед-
нее время металлические сетки стали использовать как элементы
электродов сложной конструкции, например, в электролизерах
Зданского — Лонца. Другой прием развития поверхности электро-
дов использован в конструкции пластинчатых электродов20’21
(рис. Ш-1, д). В электролизерах этого типа возможна внутренняя
циркуляция электролита, как и при двойных электродах. В пла-
стинчатых электродах усложнен подвод тока к большому коли-
честву пластин. Широкого применения в промышленности пластин-
чатые электроды не получили.
Конструкция жалюзийных электродов, изображенных на
рис. Ш-1, е, предусматривает возможность отвода газовых пузырь-
ков из зоны прохождения тока. Такие электроды предполагалось
использовать для разделения электродных пространств в электро-
лизерах без диафрагмы. Однако при электролизе щелочных элек-
тролитов газы, особенно водород, распространяются в электролите
в виде мелких пузырьков (облака), поэтому в бездиафрагменных
электролизерах с жалюзийными электродами не удается получать
чистые газы.
Для уменьшения величины газонаполнения электролита пред-
ложены электроды с промежуточными по высоте устройствами для
сбора и отвода пузырьков газа из пространства между электро-
дами. Такие устройства уменьшают путь пузырьков газа в элек-
тролите.
В различных конструкциях фильтрпрессных электролизеров
наибольшее распространение получили тройные биполярные элек-
троды с выносными перфорированными стальными листами — ано-
дом и катодом (рис. Ill-1, ж). В таких электродах средний сплош-
ной (основной) лист служит для разделения соседних ячеек и
крепления выносных электродов; анодные и катодные листы кре-
пятся к основному электроду на анкерах расклепкой или сваркой.
Анодную сторону основного листа и выносной электрод—анод с
обеих сторон никелируют.
Конструкция такого электрода дает возможность сблизить ра-
бочие поверхности выносных листов. Развитая перфорация анода
и катода позволяет почти вплотную приближать к ним диафрагму,
так как в этом случае газы, выделяющиеся при электролизе, отво-
дятся на обратную сторону выносных листов в промежутки между
7 Зак. 713 97
ними и основным листом электрода. В работе участвуют все по-
верхности такого электрода, но плотность тока на основном листе
и анкерах невелика по сравнению с плотностью тока на лобовой
стороне выносных электродов и на поверхности отверстий перфо-
рации. В электролизерах с такими электродами происходит внут-
ренняя циркуляция электролита в каждом из электродных про-
странств ячейки. Тройные биполярные электроды используют в
отечественных электролизерах типов ФВ и ЭФ и в широко рас-
пространенных за границей электролизерах фирм «Бамаг», «Де-
Нора», «Демаг» и др.
В биполярных электролизерах некоторых конструкций вынос-
ные катоды снабжали дополнительной металлической сеткой для
увеличения поверхности электрода и облегчения отвода водорода.
Дальнейшее развитие этот вариант получил в электролизерах
Зданского—Лонца, где диафрагма зажата между двумя металли-
ческими сетками, одна из которых прилегает к аноду, а другая —
к катоду. Такой электрод состоит из одного листа со сложной
(вафлеобразной) поверхностью, позволяющей сблизить рабочие
поверхности соседних электродов и отводить выделяющиеся газы
на обратную сторону сетки, несущей основную часть нагрузки
электрода.
2. РАЗДЕЛЕНИЕ ГАЗОВ ЭЛЕКТРОЛИЗА
Практически во всех промышленных электролизерах для получе-
ния водорода и кислорода стремятся к возможно более полному
и надежному разделению образующихся газов. Только в некото-
рых случаях электролиз воды ведут без разделения газов. При
этом получают гремучий газ (2/з водорода и 73 кислорода). Такие
установки не получили широкого применения, так как при нару-
шениях режима процесса иногда происходили взрывы газа в ап-
парате.
Все способы разделения газов в электролизерах для получения
водорода и кислорода можно разделить на три следующие группы:
без применения диафрагмы; при помощи одной пористой диафраг-
мы; с использованием двух пористых диафрагм.
В период разработки конструкции первых аппаратов для элек-
тролиза воды делались попытки разделять водород и кислород без
диафрагмы, при помощи колоколов (колпаков), размещаемых над
электродами, и с применением жалюзийных электродов. В коло-
кольных электролизерах электроды размещали под колоколами
для сбора газов22, как показано на рис. Ш-2, а. При электролизе
кислых электролитов образуются более крупные пузырьки газов;
при использовании щелочных электролитов преобладают пузырь-
ки малых размеров.
В электролизерах с герметичной крышкой колокола можно рас-
полагать только над одноименно заряженными электродами, на-
пример над анодами (рис. Ш-2, б). Газы, выделяющиеся на элек-
тродах с противоположным зарядом, собираются при этом под
98
Рис. Ш-2. Различные варианты разделения газов:
б — при помощи колокола соответственно в открытом и герметичном электролизерах;
в, г—при помощи электрода-колокола соответственно в открытом и герметичном электроли-
зерах; д, е — при помощи одинарной и двойной диафрагм соответственно; / — корпус электро-
лизера; 2 — колокола; 3 — катоды; 4 — аноды; 5 — крышки; 6 — электроды-колокола; 7—диафрагмы.
7*
крышкой в пространстве между колоколами. Пузырьки газов, вы-
деляющихся на электродах, при подъеме вверх отклоняются от
вертикального направления и в виде облака распространяются
в обе стороны от поверхности каждого электрода. Кроме того, при
электролизе возникают конвекционные потоки, которые также спо-
собствуют распространению газовых пузырьков в горизонтальном
направлении.
Поэтому для удовлетворительного разделения газов требуется
ограничивать высоту электродов, возможно больше опускать края
газосборных колоколов относительно электродов и увеличивать их
ширину. Однако уменьшение высоты электродов 'невыгодно, так
как приводит к необходимости расширения производственных пло-
щадей. Увеличение ширины колокола, как и опускание краев ко-
локола относительно электрода, вызывает удлинение пути тока
между электродами и рост потерь напряжения на преодоление
омического сопротивления электролита. Этот недостаток можег
быть частично устранен, если боковые стенки колокола, находя-
щиеся ниже верхнего края электрода, снабдить отверстиями для
прохода тока23. Такие колокола можно рассматривать как пере-
ходный этап к созданию пористой диафрагмы.
Колокола для сбора газов можно выполнять из металла или
диэлектриков. Металлические стенки колоколов не включаются в
биполярную электрохимическую работу до тех пор, пока напря-
жение на ячейке не станет вдвое больше напряжения разложения,
т. е. достигнет 3,2—3,4 в.
В других вариантах бездиафрагменных электролизеров элек-
троды предлагалось выполнять в виде колоколов24, боковые стен-
ки которых ниже уровня электролита перфорированы, а 'наружные
поверхности покрыты слоем диэлектрика (рис. Ш-2, в). В этом
случае процесс электролиза может происходить только на внут-
ренней поверхности колоколов-электродов, что облегчает сбор га-
зов внутри колоколов и их разделение. Такую конструкцию мож-
но использовать для одноименно заряженных электродов, а элек-
троды другого знака могут иметь обычную конструкцию.
Выделяющиеся на них газы собираются под крышкой в простран-
стве между колоколами25»26 (рис. Ш-2,г). Для разделения газов
без диафрагмы было предложено применять жалюзийные элек-
троды27 или располагать жалюзиобразные решетки28 между обыч-
ными электродами. Однако все эти способы не обеспечивали на-
дежного разделения газов в электролизерах промышленных кон-
струкций и потому имели ограниченное применение.
Наибольшее распространение находило и находит разделение
газов при помощи пористой диафрагмы. В большинстве электро-
лизеров используется одинарная пористая диафрагма (рис. Ш-2, д).
В некоторых конструкциях до настоящего времени применяется
двойная диафрагма (рис. Ш-2, е). В электролизерах с одинарной
диафрагмой, естественно, возможно большее сближение рабочих
поверхностей электродов, поэтому напряжение на ячейке может
100
быть ниже, чем в равных условиях при двойной диафрагме.
В то же время применение двойной диафрагмы позволяет полу-
чать более чистые газы.
В ячейке с одинарной диафрагмой взаимное проникание водо-
рода и кислорода через диафрагму приводит к снижению чистоты
продуцируемых газов. При двойной диафрагме проходящие через
ее поры или поврежденные участки пузырьки газов отделяются в
междиафрагменном пространстве, благодаря чему и исключается
взаимное загрязнение газов. Однако в пространстве между диа-
фрагмами может образовываться смесь водорода с кислородом
или воздухом, поэтому необходимо принимать меры для предот-
вращения возможности ее взрывов.
В процессе электролиза воды диафрагма должна устранять по-
падание газовых пузырьков из одного электродного пространства
ячейки в другое. Вследствие малой растворимости водорода и кис-
лорода в электролите взаимное загрязнение газов из-за диффузии
электролита и растворенных в нем газов при электролизе под
атмосферным давлением невелико. Поэтому для процесса элек-
тролиза воды при атмосферном давлении в качестве диафрагмы
могут применяться сравнительно крупнопористые материалы. Из-
вестно, что в ряде конструкций электролизеров (Пехкранца) при-
менялась диафрагма в виде металлических листов с большим ко-
личеством отверстий, но наиболее широкое применение получили
диафрагмы из асбестовой ткани.
Если электролиз воды проводится под повышенным давлением,
растворимость газов в электролите сильно возрастает и пренебре-
гать этим нельзя, вследствие чего требования к диафрагме для
электролиза под давлением возрастают. Такие диафрагмы долж-
ны иметь мелкопористую структуру и более высокое сопротивле-
ние диффузии жидкости. Подобным требованиям отвечает, напри-
мер, асбестовый картон.
Пористая диафрагма может препятствовать прониканию
пузырьков газа из одного электродного пространства в другое
лишь в том случае, если она полностью покрыта жидкостью, а пу-
зырьки газа в жидкости имеют большие размеры, чем поры диа-
фрагмы. Если же часть диафрагмы будет обнажена (т. е. не по-
крыта электролитом), происходит смешение газов через поры этой
части диафрагмы даже при очень небольшой разности давления
газов по обе ее стороны.
Диафрагма должна иметь по возможности малое сопротивле-
ние прохождению тока. Поскольку материал диафрагмы не при-
нимает участия в прохождении тока, ее электрическое сопротивле-
ние определяется сопротивлением электролита, заполняющего
поры диафрагмы. Сопротивление диафрагмы рд (в ом • см2) может
быть определено из выражения
Рд = -ЕУ- (ПН)
101
где р — удельное сопротивление чистого электролита, ом • см\ Ь — толщина диа-
фрагмы, см; р = 1/Ь — коэффициент извилистости пор. (/ — средняя длина пор
диафрагмы, см); d — пористость диафрагмы, доли единицы.
Во время работы сопротивление диафрагмы может возрастать
в связи с забивкой ее пор различными посторонними примесями,
не проводящими ток. Таксе же действие оказывает заполнение
части пор мелкими пузырьками газа. Материал диафрагмы дол-
жен хорошо смачиваться электролитом, иначе газовые пузырьки
будут накапливаться в ее порах. Набухание диафрагмы во время
работы электролизера и выделение на ее поверхности большого
количества осадков может приводить к увеличению толщины диа-
фрагмы, что также вызывает увеличение ее сопротивления.
Большинство диафрагм после погружения в электролит при-
обретает по отношению к нему определенный заряд. Асбестовые,
фарфоровые и керамические диафрагмы обычно заряжаются отри-
цательно, диафрагмы из шерстяной ткани, алунда, из окислов тя-
желых металлов — положительно. Диафрагмы из пергаментной
бумаги, карборунда, льняной ткани нейтральны. Заряд диафрагмы
может изменяться в зависимости от реакции среды — с увеличе-
нием щелочности электролита диафрагма приобретает более отри-
цательный заряд. Заряд диафрагмы может вызвать электроосмоти-
ческий перенос жидкости из одного электродного пространства в
другое, однако в процессе электролиза воды это явление не имеет
существенного значения.
К химической и механической прочности диафрагмы предъяв-
ляются высокие требования. Условия работы диафрагмы при вы-
соких температурах (80—100° С, а в случае электролиза под дав-
лением и выше 100° С) в растворах концентрированных щелочей
ограничивают выбор материалов, пригодных для изготовления диа-
фрагмы.
Для уменьшения механических нагрузок на диафрагму в ряде
конструкций (ФВ-500 и «Бамаг») по всей ее площади расположе-
ны дистанционные вставки, зажатые между электродами и диа-
фрагмой и фиксирующие ее положение относительно электродов.
Если эти вставки плотно зажаты, верхняя часть диафрагмы раз-
гружается от усилий, вызываемых ее массой и колебаниями дав-
ления в электродных пространствах. Однако под дистанционными
вставками наблюдается ускоренное разрушение асбестовой диа-
фрагмы.
Металлические пористые диафрагмы могут включаться в би-
полярную работу только в том случае, когда потеря напряжения
на преодоление сопротивления электролита в порах диафрагмы
равна напряжению разложения или больше него. Поэтому при
нормальных условиях пористая металлическая диафрагма не уча-
ствует в электрохимическом процессе в качестве биполярного элек-
трода. Если происходит загрязнение и забивка пор диафрагмы
осадками или пузырьками газа, возможно значительное падение
напряжения на диафрагме и включение ее в биполярную работу.
102
При падении напряжения на диафрагме, близком к напряжению
разложения, диафрагма может включаться в биполярную работу
при малой плотности тока (с гак называемым остаточным током)
без выделения пузырьков газа.
При использовании металлических диафрагм необходимо от-
сутствие электрического контакта между диафрагмой и электро-
дами, так как в случае контакта с одним из электродов поверх-
ность диафрагмы включается в работу как электрод такого же
знака и происходит загрязнение газов в рабочем пространстве
другого электрода. При одновременном контакте металлической
диафрагмы с обоими электродами происходит короткое замыка-
ние ячейки через диафрагму, обычно приводящее к ее выгоранию
в местах контакта с электродами. Чтобы избежать возможности
контакта металлической диафрагмы с каким-либо электродом, при-
ходится создавать относительно большие расстояния между ними
и применять дистанционные вставки для фиксации положения
диафрагмы между электродами.
Наиболее известным и практически единственным широко при-
менявшимся в промышленности типом пористых металлических
перегородок является диафрагма, длительное время работавшая
в электролизерах Пехкранца. Такую диафрагму в виде тонкой ни-
келевой фольги, перфорированной большим количеством мелких
отверстий, получали гальваническим методом29. На медную матри-
цу наносили систему мелких углублений, которые заполняли изо-
ляционным лаком. После специальной подготовки металлической
поверхности матрицы на нее наносили слой никеля, образующего
фольгу необходимой толщины. Диафрагмы из никелевой фольги
имели 800—1400 отверстий на 1 см2. Чтобы уменьшить вероятность
забивки газовыми пузырьками отверстий, им придавали непра-
вильную форму. Для лучшего разделения газов верхняя часть
диафрагмы выполнялась без отверстий.
Основным преимуществом металлических диафрагм является
их высокая механическая прочность. Из таких стойких в концен-
трированных растворах щелочей металлов, как никель, кобальт
или серебро, можно получить диафрагмы, пригодные для работы
в течение многих лет. Поэтому, несмотря на трудности, связанные
с применением металлических диафрагм, делались многочислен-
ные попытки их использования. В частности, предлагалось приме-
нять в качестве диафрагмы сетки и перфорированные листы из
никеля, кобальта, серебра и его сплавов, никелистой стали 30-33.
Диафрагма из никелевой сетки репсового плетения длительное
время испытывалась также в электролизерах типа ФВ-500. При
надежном предохранении диафрагмы от контакта с электродами
ячейки работали удовлетворительно, однако для этого приходилось
увеличивать расстояние между диафрагмой и электродами. При
соблюдении принятых в электролизере ФВ-500 малых расстояний
между рабочими поверхностями выносных электродов (около
10 мм) точная фиксация металлической диафрагмы между
103
электродами по всей ее площади не удавалась. Наблюдались кон- 1
такты диафрагмы с электродами и разрушения ее в местах корот- |
ких замыканий. По этим причинам металлические диафрагмы (по- |
мимо электролизеров Пехкранца) не получили распространения. 5
Попытки предотвратить электрический контакт с электродами
путем покрытия диафрагмы из металлической сетки или фольги
слоем токонепроводящего осадка34 не были доведены до широкого .
промышленного использования. *
Во всех современных электролизерах применяются различные I
варианты асбестовых диафрагм. Для изготовления диафрагм ис-
пользуются щелочестойкие сорта хризотилового асбеста пример- .
ного состава 3MgO • 2SiO2 • 2Н2О. Такой асбест обладает высокой
стойкостью в щелочных растворах. При длительной работе в кон-
центрированной горячей щелочи асбест набухает и постепенно •
выщелачивается, однако при нормальном режиме процесса элек- \
тролиза асбестовая диафрагма может работать без замены до
10 лет. ’
В большинстве электролизеров применяются диафрагмы из ас-
бестовой ткани, изготовляемой из длинноволокнистых дорогих
сортов асбестового волокна. Для облегчения процесса получения |
асбестовой пряжи к асбестовому пуху обычно добавляют 3—5%
хлопкового волокна, которое растворяется в горячей щелочи, за-
грязняя электролит. Поэтому стремятся по возможности сокра- ;
тить количество хлопкового волокна, добавляемого к асбесту при
изготовлении пряжи.
Асбестовые диафрагмы могут подвергаться также механиче-
ским разрушениям. Колебания давления в электродных простран-
ствах по обе стороны диафрагмы, вызываемые неравномерностью
отвода из ячеек газо-жидкостной смеси, приводят к возникнове-
нию переменных нагрузок на диафрагму. При этом она может
раскачиваться и истираться о поверхность электродов, особенно
в тех местах, где диафрагма касается их острых углов. Эти об-
стоятельства и постоянное воздействие поднимающихся пузырь-
ков газа могут приводить к вымыванию отдельных волокон асбеста
из диафрагмы и ее разреживанию. Вымывание асбестовых воло-
кон уменьшается, если для изготовления диафрагм применяется
длинноволокнистый асбест и обеспечивается достаточно высокая
крутка асбестовой пряжи.
Гидравлические удары, сопровождающие включение электро-
лизера в работу, могут приводить к повреждению диафрагмы,
особенно ее верхней части. Механическая прочность ткани по ос-
нове выше., чем по утку. Поэтому желательно, чтобы в электроли-
зере основа асбестовой диафрагмы располагалась вертикально и
принимала .на себя наибольшую механическую нагрузку. Для уве-
личения механической прочности асбестовых тканых диафрагм их (
предлагалось- усиливать металлической проволокой35, проволокой, j
защищенной асбестом36, или любым другим изолирующим мате- |
риалом37. При организации производства водорода электролизом ]
104 !
воды в нашей стране успешно применялась асбестовая ткань, в
которой нити утка были усилены металлическими проволоками.
Основа ткани состояла из тройной нити чистого асбеста, уток — из
двух свитых нитей. Каждая нить утка представляла собой никеле-
вую проволоку диаметром 0,16 мм (или проволоку из никелистой
стали), обвитую асбестовой ровницей. Такая ткань имела толщину
около 3,5 мм, масса 1 м2 ткани —3,7 кг, расход никелевой прово-
локи составлял примерно 0,2 кг)м2 ткани. Срок службы асбестовой
диафрагмы, армированной никелевой проволокой, достигал 10 лет
и более. В дальнейшем от усиления утка металлической проволо-
кой отказались, что позволило удешевить диафрагму, однако срок
ее службы сократился и создались предпосылки для более частых
разрушений диафрагмы, особенно в верхней части, испытывающей
максимальные нагрузки.
Требования к механической прочности диафрагмы изменяются,
если она непосредственно опирается на электроды или наносится
на катод, как, например, в электролизерах с осажденной диафраг-
мой для получения хлора и каустической соды. При этом диафраг-
ма непосредственно прилегает к металлической сетке катода, что
обеспечивает ее достаточную жесткость и механическую прочность.
В электролизерах Зданского — Лонца, например, применяется диа-
фрагма из асбестового картона, непосредственно опирающегося на
металлическую катодную сетку. Вносились также предложения38
о закреплении диафрагмы биполярного электролизера между пру-
жинящими частями соседних электродов специальной конструкции.
В монополярных электролизерах диафрагма обычно имеет вид
мешка, охватывающего электроды. Вверху диафрагма при помощи
проволоки или накладок с заклепками прикрепляется к краям ко-
локола для сбора газа. Для облегчения внутренней циркуляции
электролита нижние части диафрагменного мешка, как правило,
оставляют открытыми. В электролизерах некоторых конструкций
диафрагменные мешки внизу закрыты и снабжены несколькими
отверстиями.
В фильтрпрессных электролизерах с биполярным включением
электродов диафрагма крепится к специальной раме обычно при
помощи заклепок с накладками. В электролизерах Де-Нора при-
менена двойная диафрагма с отводом газа из пространства между
обеими диафрагмами. Имеются и другие предложения по конструк-
ции электролизеров с двойной диафрагмой39. Усложнение кон-
струкции электролизера, связанное с применением двойной диа-
фрагмы, не оправдывается достигаемыми при этом преимущества-
ми. Поэтому в большинстве современных моно- и биполярных
электролизеров применяется одинарная диафрагма.
Для облегчения отвода газов предложено40 наряду с установ-
кой асбестовой диафрагмы применить принцип центробежной се-
парации газов от электролита. Это достигается вращением цилин-
дрического электролизера вокруг его горизонтальной оси.
1Q5
3. УСТРОЙСТВО КОРПУСА ЭЛЕКТРОЛИЗЕРА
Корпус монополярных электролизеров представляет собой сталь-
ной сварной ящик. Он обычно изолирован от электродов и ничем
не защищен. В нормальных условиях корпус электролизера не мо-
жет включаться в электрохимическую работу как электрод. В элек-
тролизерах типа Фаузера с открытым зеркалом электролита на
стенки корпуса сверху опираются газосборные колокола. В боль-
шинстве герметичных электролизеров корпус закрыт крышкой,
уплотняемой прокладкой. Ток подводится к электродам при помо-
щи стержней, проходящих через отверстия в крышке и электри-
чески изолированных от нее вставками из эбонита или других ди-
электриков.
В некоторых маломощных монополяриых электролизерах внут-
ренняя поверхность сварного стального корпуса использовалась
в качестве одного из электродов (преимущественно катода). Вто-
рой электрод помещался посередине корпуса, и ток подводился к
нему через крышку электролизера. Применялись также электро-
лизеры с полностью сварным корпусом (без съемной крышки).
При этом катодный полюс подводился к корпусу электролизера,
а второй — анодный, пропускался через отверстие в корпусе,
снабженное изоляцией и уплотненное. Сварку корпуса такого
электролизера проводили после установки электродов и диафрагм.
Для ремонта таких электролизеров их приходилось разрезать, од-
нако необходимость в этом возникала не чаще одного раза в 8—
10 лет.
Корпус электролизеров с биполярным включением электродов
имел вид ящика только в их первоначальных конструкциях (на-
пример, Шуккерта). Применение в этом случае стального неза-
щищенного корпуса невозможно, так как его стенки включались
бы в биполярную работу как электроды. Поэтому корпуса элек-
тролизеров типа Шуккерта изготовляли из бетона.
Корпуса современных фильтрпрессных электролизеров с би-
полярным включением электродов образуются из набора электро-
литических ячеек, стягиваемых между концевыми плитами при по-
мощи мощных болтов.
4. РЕГУЛИРОВАНИЕ УРОВНЯ ЭЛЕКТРОЛИТА
И ДАВЛЕНИЯ ГАЗОВ
Если уровень электролита в ячейке понизится настолько, что верх-
няя часть диафрагмы обнажится, создаются условия для смешения
газов как за счет их взаимной диффузии, так и за счет протекания
через диафрагму при возникновении хотя бы небольшой разности
давления газа по обе ее стороны.
Разность давления по обе стороны диафрагмы может привести
также к обнажению диафрагмы с одной стороны. Поэтому во всех
электролизерах предусматриваются меры для поддержания в ячей-
100
ках постоянного уровня электролита и равенства давления газов
по обе стороны диафрагмы.
Для электролизеров, работающих под давлением, близким к
атмосферному, широко применяется гидравлическая схема регу-
лирования уровня жидкости в электродных пространствах и под-
держания равенства давления газов, изображенная на рис. III-3.
Схема состоит из электролизера (ячейки) и барботажных промы-
вателей водорода и кислорода, сообщающихся в жидкостной части
между собой и с жидкостью
в нижней части электродных
пространств. Питательная вода
поступает в промыватели га-
зов, поэтому при установив-
шемся режиме электролиза
промыватели всегда заполнены
почти чистой водой.
Давление газов в электрод-
ных пространствах равно
po=pi + ^iYo (Ш-2)
= + Ш (П1-3)
Ро2, Рн2 — давление кислорода и
водорода в электродных простран-
ствах ячейки; Р2— давление кис-
лорода и водорода на выходе из
про.мывателей; hi, h2— уровни жид-
кости над барботерами в кислород-
ном и водородном промывателях;
Уо — удельный вес жидкости в про-
мывателях газов.
По закону сообщающихся
сосудов
Р1 + Мо = Р2 + Мо (Ш-4)
При колебаниях давления
Р) и Р2 в цеховых коллекторах
Рис. III-3. Гидравлическая схема под-
держания постоянного уровня электро-
лита и равенства давления водорода и
кислорода в электролитической ячейке:
/ — электролитическая ячейка; 2 —диафрагма;
3 — катодное пространство; 4— анодное про-
странство; 5 — водородный холодильник; 6 — кис-
лородный холодильник; 7 — кислородный про-
мыватель; 8 — водородный промыватель.
водорода и кислорода всегда сохраняется равенство давления этих
газов по обе стороны диафрагмы в электродных пространствах.
Барботеры в обоих промывателях газов должны быть установлены
на одинаковой отметке, иначе создается постоянная разность дав-
ления газов в электродных пространствах.
Схема регулирования, изображенная на рис. Ш-З, работает до
тех пор, пока оба газовых барботера промывателей погружены
в жидкость. Если разность давления водорода и кислорода (Р{ и
Р2) в коллекторах возрастает настолько, что один из барботеров
обнажается, схема регулирования равенства давления нарушается.
Для предотвращения возможности смешения газов промыватели
обычно снабжают трубой аварийного выброса газов в атмосферу
107
при уменьшении уровня жидкости в каком-либо промывателе
ниже определенного предела.
Рассматривая электролитическую ячейку и промыватели газов
как сообщающиеся сосуды, запишем выражение, определяющее
уровень электролита в ячейке:
ЛэТэ + рн8 = Мо+А2¥о + р2 (III-5)
После преобразования с учетом уравнения (Ш-З) получим:
йэ = Ло— (III-6)
Уэ
где hQ, hQ — уровни электролита в электролизере и барботеров в промывателях
газов; уэ — удельный вес газонаполненного электролита в ячейках.
Уровень электролита в электродных пространствах определяет-
ся высотой установки барботеров в промывателях и зависит от
соотношения плотности жидкости в промывателях и трубопроводе
между ними и ячейками электролизера, с одной стороны, и плот-
ности газонаполненного электролита — с другой.
В установившемся режиме работы электролизера, когда пита-
ние его ячеек водой происходит через промыватели, удельный вес
жидкости в них уо ~ 1 и уровень электролита в ячейках зависит
только от плотности газонаполненного электролита. Величина у;)
зависит от концентрации щелочи в электролите и всех факторов,
влияющих на его газонаполнение, г. е. от плотности тока, темпера-
туры, наличия или отсутствия вспенивающих добавок и др. Пони-
жение концентрации щелочи в электролите и увеличение плотности
тока приводят к повышению уровня электролита в ячейках.
Изменение уровня жидкости в промывателях газов, как видно
из уравнения (Ш-6), не отражается на уровне электролита в ячей-
ках, поэтому гидравлическая схема регулирования обеспечивает
автоматическое поддержание в них уровня жидкости независимо
от способа подачи воды в промыватели. При выключении электро-
лизера и прекращении потока газов через барботеры промывате-
лей схема регулирования давления газов и уровня электролита в
ячейках прекращает свое действие. При этом пузырьки газов от-
деляются от электролита, а поступление жидкости из промывате-
лей компенсирует уменьшение объема электролита. Измерение
количества жидкости, необходимой для ее пополнения вследствие
выделения пузырьков газа из электролита при остановке электро-
лизера, может быть использовано для определения средней вели-
чины газонаполнения электролита.
При включении электролизера объем электролита возрастает
за счет газонаполнения и избыток жидкости передавливается в
промыватели газов. При этом в промыватели попадает часть элек-
тролита и плотность жидкости в них возрастает. По этой причине
в первое время после включения электролизера под нагрузку под-
держивается повышенный уровень электролита в ячейках. Посте-
пенно, в ходе работы, питательная вода, проходя промыватели
38
газа, вытесняет щелочной раствор в ячейки электролизера, а удель-
ный вес жидкости в промывателях у0 и уровень электролита в
ячейках /гэ принимают нормальные значения. Необходимо также
учитывать, что при остановке и последующем включении электро-
лизера концентрация щелочи в ячейках электролизера несколько
снижается, что также приводит к некоторому повышению уровня
электролита.
Гидравлическая схема поддержания равенства давления в элек-
тродных пространствах ячейки с увеличением возможных пределов
изменений давления в потребляющей сети становится громоздкой
Рис. Ш-4. Схема поддержания постоянного уровня электролита и равенства
давления обоих газов в электролизерах, работающих под давлением:
/ — регулятор давления водорода; 2 — промыватель водорода; 3 — холодильник католита;
4 - электролитическая ячейка; 5 —катодное пространство; 6 — питательный канал; 7 —диа-
фрагма; 8 -водородный газовый канал; 9 - кислородный газовый канал; 10 — анодное про-
странство; // — холодильник анолита; 12 — промыватель кислорода; 13 — регулятор давления
кислорода; 14, /5 —ресиверы.
и неудобной для практического применения. Максимальный уро-
вень жидкости над барботером газов в промывателе должен обес-
печивать возможность компенсации максимальных колебаний раз-
ности давления газов во внешней газовой сети. Если эта разность
повысится, например, до 1 ат, то высота промывателей газов долж-
на возрасти примерно до 10 м. Поэтому описанная схема регули-
рования применяется только в электролизерах, работающих под
избыточным давлением до 500—1000 мм вод. ст.
Для электролизеров, работающих под более высоким давле-
нием, предложена схема41 (рис. Ш-4), сочетающая гидравличе-
ский барботажный регулятор давления с использованием поплав-
ковых клапанов. Промыватели газов барботажного типа соедине-
ны с электродными пространствами ячеек аналогично тому, как в
описанной выше схеме, и обеспечивают постоянство уровня
109
Электролита в ячейках электролизера и компенсацию разности дав-
лений обоих газов, если она не превышает ~500 мм вод. ст. Для
поддержания равенства давлений водорода и кислорода в элек-
тродных пространствах при более высоких перепадах давления в
потребляющей газовой сети каждый промыватель газов снабжен
регулятором с поплавковым игольчатым клапаном. При возникно-
вении разности давления газов уровень жидкости в промывателе
и регуляторе одного из газов (имеющего большее давление) пони-
жается, а в другом — повышается. Игольчатый клапан открывает
выход в ресивер газа с большим давлением и закрывает выход
другого газа до тех пор, пока давление обоих газов в промывате-
лях и регуляторах не уравняется.
По схеме, изображенной на рис. Ш-4, давление в электроли-
зере поддерживается по газу, находящемуся в потребляющей сети
под большим давлением, и сброс его в атмосферу исключается.
Если регуляторы давления соединены с ресиверами, а поплавко-
вые клапана — с отводом в атмосферу, давление в электролизере
будет поддерживаться по газу, находящемуся в потребляющей
сети под меньшим давлением. Давление другого газа сохраняется
на этом минимальном уровне сбросом его излишка в атмосферу
через игольчатый поплавковый клапан. Такая схема может быть
дополнена устройством для автоматического регулирования по-
дачи питательной воды в промыватель. Делались также попытки
заменить регулирование давления газов при помощи поплавковых
клапанов регуляторами постоянства давления газов «до себя». Од-
нако достоинства принятой схемы состоят в простоте исполнения
и обслуживания и достаточной точности регулирования при очень
высоком коэффициенте надежности, что нелегко достижимо в слу-
чае применения более сложных схем с использованием регулято-
ров других типов.
5. ЦИРКУЛЯЦИЯ И ОХЛАЖДЕНИЕ ЭЛЕКТРОЛИТА
В современных электролизерах, работающих при высоких плот-
ностях тока, выделяются значительные количества избыточного
тепла. Тепловой баланс аппарата изменяется в зависимости от на-
грузки на электролизер. При малых нагрузках выделяющегося
тепла может быть недостаточно для поддержания оптимальной
температуры электролиза (до 95° С) и требуется подвод тепла
извне. Если установки элек!ролиза воды работают в режиме силь-
но изменяющейся нагрузки (например, при использовании пиковой
электроэнергии), в период низких нагрузок можно подогревать
электролит для поддержания оптимальной температуры электро-
лиза. С возрастанием нагрузки на электролизер приход тепла уве-
личивается быстрее его расхода, и при определенной темпера-
туре достигается тепловое равновесие. При дальнейшем повыше-
нии нагрузки появляется избыток тепла, который необходимо от-
водить от электролизера.
110
Большинство конструкций монополярных электролизеров не
имеет специальных устройств для отвода избыточного тепла. Не-
обходимость в этом возникает только при работе с высокими плот-
ностями тока. Так, в электролизерах типов Б-3 и В-4 внутри кор-
пуса помещались змеевики для охлаждения электролита. В элек-
тролизерах типа Фаузера ино-
гда применялось орошение на-
ружной поверхности кор-
пуса.
В биполярных электролизе-
рах избыточное тепло обычно
отводится путем охлаждения
электролита, циркулирующего
через теплообменники. Были
сделаны попытки установить
охлаждающие змеевики в ка-
ждой ячейке электролизера,
однако такой вариант неудобен
и не используется ни в одной
из современных конструкций
биполярных фильтрпрессных
электролизеров. В электроли-
зерах типа «Эрликон» неболь-
шой мощности пытались при-
менить воздушное охлаждение
корпуса, помещенного в ко-
жух. Такой прием исключает
необходимость организовывать
циркуляцию электролита, од-
Рис. Ш-5. Схема естественной цирку-
ляции элекролита в электролизерах
фильтрпрессного типа:
нако вряд ли пригоден для
электролизеров большой мощ-
ности.
Для регулирования темпе-
ратуры в электролизере необ-
ходима определенная скорость
внешней циркуляции электро-
лита через теплообменник.
В большинстве конструкций
естественная
циркуляция электролита
/ — диафрагменная рама; 2 -катодное про-
странство; 3 — анодное пространство; 4 — диа-
фрагма; 5-катод; 6 — анод; 7 — холодильник
католита; <8—штуцер питательного канала;
9 — звено питательного канала; 10 — холодильник
анолита; //—штуцер водородного канала;
/2 — штуцер кислородного канала: 13 — газовый
водородный канал; 14 — газовый кислородный
канал; /5 — уровень газонаполненного электро-
лита в ячейках; 16 — уровень электролита в хо-
лодильниках.
электролизеров осуществляется
(рис. Ш-5) через тепло-
обменник, происходящая благодаря разности плотностей горячего
газонаполненного электролита в ячейках электролизера и электро-
лита, освобожденного от пузырьков газа и охлажденного в тепло-
обменнике.
Движущая сила циркуляции ДР определяется разностью гидро-
статического напора со стороны ячеек электролизера и со стороны
теплообменника и составляет:
ДР = Лтут — ^э¥э
(Ш-7)
ш
где Лэ и Лт — уровни электролита в ячейках электролизера и выносном тепло-
обменнике; уэ и ут — удельный вес газонаполненного электролита в ячейках
электролизера и электролита в теплообменнике.
Скорость циркуляции электролита через электролизер и тепло-
обменник определяется величиной напора, вызывающего циркуля-
цию, и суммой гидравлических сопротивлений на пути циркуляции
электролита. Включение в цикл циркуляции фильтров для отделе-
ния твердых взвешенных частиц, присутствующих в электролите
вследствие коррозии деталей электролизеров или вносимых с пи-
тательной водой, может вызвать существенное снижение скорости
циркуляции электролита.
В электролизерах некоторых конструкций применяются устрой-
ства для принудительной циркуляции электролита. В аппаратах
типа «Эрликон» — это коловратные бессальниковые насосы2. Для
электролизеров фильтрпрессного типа предложена принудительная
циркуляция электролита42 при помощи паровых инжекторов с ис-
пользованием парового конденсата для питания электролизера.
При работе электролизера под давлением величина газонаполне-
ния электролита в ячейках снижается, движущая сила циркуляции
уменьшается, и при прочих равных условиях труднее обеспечить
необходимую скорость обмена электролита за счет естественной
циркуляции43. Поэтому электролизеры под давлением, например
Зданского — Лонца6 * * 9, часто работают с принудительной циркуля-
цией электролита.
6. ОХЛАЖДЕНИЕ И ПРОМЫВКА ГАЗОВ
Первичная обработка газов электролиза заключается в их охла-
ждении (при этом конденсируется основное количество паров, на-
сыщающих газы) и в промывке от брызг электролита, уносимых
газами из ячеек электролизера.
В большинстве конструкций монополярных электролизеров от-
сутствуют устройства для охлаждения и промывки газов, так как
устанавливаются общие холодильники и промыватели на одну или
несколько серий электролизеров. При этом с горячими газами из
электролизера уносится много паров воды и брызг электролита,
которые частично отделяются в сборных коллекторах водорода и
кислорода. Для возвращения конденсата и брызг электролита на
установках, оборудованных электролизерами Ноуэльса, применяли
сборные газовые коллекторы зигзагообразной формы. Это давало
возможность возврата накопившейся в коллекторе жидкости соот-
ветственно в каждый электролизер, расположенный под данным
звеном коллектора. В некоторых конструкциях предусматривались
отбойники брызг электролита. На каждом из электролизеров
Стюарта и В-4 были установлены холодильники и промыватели
газов.
В биполярных электролизерах обычно холодильники устанав-
ливаются в промывателях газов. По такой схеме образующийся
112
при охлаждении газов конденсат смешивается с жидкостью из
промыватели газов и возвращается на питание каждого электро-
лизера. При использовании процесса электролиза в производстве
тяжелой воды конденсат отбирают отдельно и направляют на пи-
тание последующих ступеней электролитической схемы концен-
трирования. Для этого газы охлаждаются в поверхностных холо-
дильниках-кондесаторах (см. рис. Ш-З) и затем поступают
в барботажные промыватели, где происходит их окончательное
охлаждение и промывка. Основная масса паров воды конденси-
руется в поверхностных холодильниках и может быть выведена
для использования. Для отделения брызг электролита перед хо-
лодильниками иногда устанавливают сепараторы.
7. УПЛОТНЕНИЕ И ЭЛЕКТРИЧЕСКАЯ ИЗОЛЯЦИЯ
Для предотвращения утечек тока через землю, минуя электроли-
тические ячейки, необходима надежная электроизоляция электро-
лизеров. Утечки тока в землю возможны через опоры электроли-
зеров на фундаменты и через трубы для подвода питательной
воды и электролита, подвода и отвода охлаждающей воды и отво-
да продуцируемых газов. Для изоляции от фундаментов электро-
лизеры обычно устанавливают на фарфоровых изоляторах, кото-
рые должны быть защищены от возможного попадания на них
растворов электролита. Количество и размеры изоляторов зависят
от массы и конструкции электролизеров.
На трубопроводах обычно делают изоляционные вставки из
резины, стекла или других непроводящих ток материалов. Вслед-
ствие высокой электропроводности электролита и трудности на-
дежного разрыва тока в резиновом шланге, смоченном электроли-
том, часто применяют разъемное соединение трубопровода для
подачи щелочи в электролизер только на время ввода или откачи-
вания электролита. Работающий электролизер отключается от ще-
лочных коллекторов, благодаря чему исключается возможность
утечки тока через них.
Детали электролизера необходимо изолировать друг от друга.
В монополярных ящичных электролизерах, как правило, анод и
катод должны быть изолированы не только друг от друга, но и от
корпуса и крышки электролизера. Лишь в электролизерах неко-
торых типов корпус используется как катод. В этом случае необ-
ходимо изолировать анод от крышки и корпуса электролизера.
Для крепления деталей электролизеров применяются болтовые со-
единения с изоляцией их втулками и шайбами из диэлектриков.
В биполярных электролизерах фильтрпрессного типа изоляция
электродов и рам друг от друга, а также звеньев газовых и пита-
тельных каналов обычно производится при помощи паронитовых
прокладок, которые одновременно служат для уплотнения мест
соединения. Стяжные концевые плиты изолируются от корпу-
са электролизера прокладками, стяжные болты снабжаются
3 Зак. 713
изоляционными втулками и шайбами, которые должны быть рас- I
считаны на полное напряжение всех ячеек электролизера. Устрой- !
ство изоляции будет изложено более подробно при описании кон- j
струкций электролизеров.
ЛИТЕРАТУРА
1. Пфлейдерер Г., Электролиз воды, Химтеорет, 1935.
2. Биллитер Ж., Промышленный электролиз водных растворов, Госхим-
издат, 1959.
3. Биллитер Ж., Новейшие достижения технической электрохимии, Госхим-
техиздат, 1934.
4. Regner A., Electrochemical Processes in chemical Industries, Prague, 1957.
5. Стендер В. В., Прикладная электрохимия, изд. Харьков, госуд. унив.,
1961.
6. X о м я к о в В. Г. и др., Технология электрохимических производств, Гос-
химиздат, 1949.
7. Митта у эр Э. С., авт. свид. СССР 170473; Бюлл. изобрет. и тов. знаков,
№ 9 (1965).
8. Р i с h 1 е г А. V., Demag Nachrichten, № 163, 24 (1961).
9. S с h а г 1 a u A., Fette— Seife Anstrichmittel, 62, № 3, 185 (1960)
10. Герм. пат. 411528 (1925).
11. Пат. США 1818579 (1931).
12. Герм. пат. 414969 (1925).
13. Пат. США 1214934 (1917).
14. Пат. США 1485461 (1924).
15. Герм. пат. 359299 (1922); 400375 (1924).
16. Франц, пат. 551302 (1923).
17. Франц, пат. 605125 (1926)’
18. Пат. США 1502708 (1924); 1508758 (1924); 1513728 (1924).
19. Голланд, пат. 388466 (1924).
20. Пат. США 1269128 (1918); 1303519 (1919).
21. Я к и м е н к о Л. М., Химстрой, № 6, 347; № 7, 403 (1937).
22. Герм. пат. 80504 (1896); 188900 (1907).
23. Герм. пат. 294909 (1916).
24. Герм. пат. 416541 (1926).
25. Пат. США 1035060 (1912).
26. Герм. пат. 461688 (1928).
27. Франц, пат. 553744 (1923).
28. Англ. пат. 14285 (1907).
29. Герм. пат. 370118 (1923); 396994 (1924).
30. Франц, пат. 562357 (1923).
31. Герм. пат. 83110 (1892); 157474 (1902).
32. Франц, пат. 608757 (1926); 608922 (1926).
33. Швейц, пат. 118709 (1927); 118710 (1927).
34. Франц, пат. 651998 (1929).
35. Англ. пат. 335151 (1930).
36. Герм. пат. 468452 (1931); швейц, пат. 388275 (1965).
37. Герм. пат. 369943 (1923).
38. Г о л ь д ш т е й н А. Б., Иванов В. С., Костромин Л. Н., Мака-
ров В. М., С ере брянский Ф. 3., авт. свид. СССР 137896; Бюлл.
изобрет., № 9, 21 (1961).
39. Турьян Я. И., авт. свид. СССР 66872; Бюлл. изобрет., № 8, 8 (1946).
40. Пат. США 3119759 (1964).
41. Якименко Л. М. и др., авт. свид. СССР 51206 (1938).
42. Т у р ь я н Я. И., авт. свид. СССР 66685; Бюлл. изобрет., № 7, 8 (1946).
43- Р i с h 1 е г А. V., Chem. Apparatus № 12, 13 (1940).
ГЛАВА
IV
конструкции
ПРОМЫШЛЕННЫХ ЭЛЕКТРОЛИЗЕРОВ
1. КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИЗЕРОВ
Все многочисленные типы конструкций электролизеров для раз-
ложения воды с получением водорода и кислорода по способу вклю-
чения электродов могут быть подразделены на две большие груп-
пы: электролизеры с монополярным (рис. IV-1, а, б) и электролизеры
с биполярным включением (рис. IV-1, в, г). По устройству корпуса
различают ящичные электролизеры, в которых комплект электро-
дов размещается в емкости без крышек (см. рис. IV-l,a) или
с герметичными крышками (см. рис. IV-1,6), и фильтрпрессные
электролизеры (рис. IV-1, г), ячейки которых собираются по типу
фильтрпресса. На первом этапе развития конструкций электроли-
зеров с биполярным включением электродов они выполнялись как
ящичного, так и фильтрпрессного типов. В дальнейшем развитие
получили только фильтрпрессные конструкции.
По способу разделения газов электролизеры можно подразде-
лить на бездиафрагменные (колокольные) и электролизеры с оди-
нарной (см. рис. IV-1,6) или с двойной диафрагмой (см.
рис. IV-1, а). Двойная диафрагма применялась в открытых ящич-
ных электролизерах типа Фаузера и некоторых других. Предлага-
лось использовать двойную диафрагму и в электролизерах с би-
полярным включением электродов; в последние годы двойная
диафрагма применена в фильтрпрессных электролизерах типа
Де-Нора.
По давлению продуцируемых газов различают электролизеры,
предназначенные для работы при давлении, близком к атмосфер-
ному, и электролизеры, рассчитанные на работу под повышенным
давлением.
В конце XIX и в начале XX в. преимущественное развитие по-
лучили простые и дешевые в изготовлении ящичные электролизеры
с монополярным включением электродов, которыми были обору-
дованы установки электролиза воды в Италии, Франции, Японии,
Корее, США и других странах. Многочисленные типы конструкций
таких электролизеров подробно описаны в литературе. Для них
характерны работа при низких плотностях тока и сравнительно
малая мощность, что приводило к необходимости применять на
крупных установках многие тысячи электролизеров, для чего тре-
бовались большие производственные площади. Хотя в ряде стран
8*
115
(США, Италия и др.) еще работают большие установки, а иногда
и строятся новые маленькие установки 1, оборудованные монопо-
лярными ящичными электролизерами, вряд ли можно ожидать их
использования для оснащения новых крупных установок.
Электролизеры с биполярным включением электродов приме-
нялись уже на самых ранних этапах развития электролиза воды,
но конструкции их были несовершенны и не могли конкурировать
а, б — соответственно открытый и закрытый ящичные электролизеры с моиополярным вклю-
чением электродов (/-корпус; 2 — колокол для сбора газов; 3 — диафрагма; 4— катоды;
5—анод; 6 — крышка); в, г — соответственно ящичный и фильтрпрессный электролизеры с би-
полярным включением электродов (/ - диафрагменная рама; 2 - монополярный электрод - анод;
3 — биполярный электрод; 4 — монополярный электрод — катод; 5 —диафрагма; 6 — корпус).
с монополярными электролизерами. В этот период широко при-
менялись ящичные электролизеры открытого типа с монополярным
включением электродов, в которых часть зеркала электролита
могла соприкасаться с атмосферным воздухом (электролизеры типа
Фаузера2’3, Казале4 и др.). Такими электролизерами были обору-
дованы десятки довольно крупных установок в Италии, Франции,
Корее и других странах. Недостатки этих конструкций, связанные
с частично открытым зеркалом электролита, — возможность его
карбонизации и загрязнения атмосферы рабочего помещения ще-
лочным туманом — привели к созданию ящичных электролизеров
закрытого типа. Примером их могут служить отечественные элек-
116
гролизеры5 типов В-3, В-4 и зарубежные («Электролабс»6,
«Стюарта»7 и др.).
Известны и некоторое время применялись ящичные электроли-
зеры с биполярным включением электродов, например Шуккерта8.
Однако в дальнейшем они не получили развития.
Основные принципы конструирования промышленных электро-
лизеров с биполярным включением электродов были успешно раз-
работаны в 20-х и начале 30-х годов текущего столетия. С этих пор
электролизеры с монополярным включением электродов стали
уступать место биполярным электролизерам фильтрпрессного типа.
Все современные электролизеры с биполярным включением элек-
тродов конструируются как аппараты фильтрпрессного типа. В их
конструкции предусматриваются каналы для сбора водорода и
кислорода из всех ячеек электролизера, а также каналы для подачи
в ячейки питательной воды и циркулирующего электролита. Эти
сборные каналы играют роль, аналогичную серийным коллекторам
па установках с монополярными электролизерами. В некоторых
конструкциях сборные каналы размещаются внутри аппарата (элек-
тролизеры Зданского — Лонца, СЭУ, Пехкранца), но в большин-
стве биполярных фильтрпрессных электролизеров сборные каналы
расположены вне корпуса (ФВ-500, «Бамаг», ЭФ и др.).
Разработаны многочисленные варианты фильтрпрессных элек-
тролизеров с биполярным включением электродов. Такие электро-
лизеры значительно сложнее по конструкции и в изготовлении по
сравнению с монополярными электролизерами. Несмотря на это,
в последние десятилетия в промышленности получают применение
практически только фильтрпрессные электролизеры биполярного
типа, в связи с рядом преимуществ перед электролизерами других
типов9-1
в электролизерах с биполярным включением электродов увели-
чение мощности может достигаться как за счет повышения нагруз-
ки, так и за счет увеличения количества последовательно включен-
ных ячеек;
мощность фильтрпрессных электролизеров значительно больше,
чем монополярных ящичных. Фильтрпрессные электролизеры типа
ФВ рассчитаны на нагрузку 7,5—11 ка при 160—170 последова-
тельно включенных ячейках, что соответствует эквивалентной на-
грузке 1200—1800 ка. Нагрузка ящичных монополярных электро-
лизеров достигает 20—25 ка, т. е. их мощность в 50—70 раз меньше
биполярных. Вследствие большой мощности единицы оборудования
потребность в производственных площадях при установке биполяр-
ных электролизеров сокращается в 3—5 раз;
в электролизерах фильтрпрессного типа с биполярным вклю-
чением электродов отпадает необходимость в шинах для передачи
тока от одной ячейки к другой. Это сильно упрощает и удешевляет
ошиновку цеха электролиза и сокращает потери напряжения на
преодоление сопротивления шин и контактов ошиновки электроли-
зеров. При оборудовании цехов электролиза воды фильтрпрессными
117
электролизерами упрощаются системы трубопроводов для сбора |
газов, подачи питательной воды, электролита, подвода и отвода
охлаждающей воды.
Сокращение числа устанавливаемых электролизеров облегчает
автоматизацию контроля и управления процессами, приводит;
к уменьшению затрат рабочей силы на обслуживание производства. ;
Применение современных конструкций биполярных электролизеров 1
фильтрпрессного типа позволяет практически полностью автома-
тизировать процесс обслуживания и контроля работы установок
для получения водорода и кислорода электролизом воды.
Недостатками биполярных электролизеров являются: сравни-
тельная сложность конструкций, что требует более высокой точности
изготовления деталей электролизеров; более высокие требования
к качеству конструкционных материалов, а также к квалификации
обслуживающего и ремонтного персонала; усложнение отдельных
деталей и ремонта электролизера.
Однако преимущества биполярных электролизеров настолько
существенны, что компенсируют дополнительные затраты, связан-
ные с большей сложностью оборудования и необходимостью при-
менения более качественных материалов для изготовления деталей
электролизеров.
В течение длительного времени в промышленности электролиз
воды проводился только при атмосферном давлении, хотя уже
давно разрабатывались многочисленные варианты электролизеров
для работы под повышенным давлением. Электролиз воды под
давлением освоен в промышленности нашей страны еще в 30-х го-
дах, когда были построены установки с электролизерами ЭФ для
работы под избыточным давлением до 10 ат. В настоящее время
за рубежом стали применяться электролизеры, рассчитанные на
давление до 30—40 ат, ведется разработка электролизеров на да-
вление до 200 ат.
Стоимость водорода и кислорода, получаемых электрохимиче-
ским методом, определяется в основном затратами на электроэнер-
гию, а также на амортизацию, содержание и ремонт оборудования
и сооружений. Поэтому основными требованиями, общими для всех
типов электролизеров, являются возможно более низкий удельный
расход электроэнергии и снижение затрат на амортизацию и ре-
монт оборудования, что может быть достигнуто в результате со-
кращения удельных капиталовложений, высокой степени надеж-
ности установок и длительного пробега электролизеров без ре-
монта. Конструкция электролизеров должна обеспечивать высокую
чистоту получаемых газов, удобство и простоту управления и об-
служивания, надежность работы.
Здесь будут описаны преимущественно новые типы электроли-
зеров и приведена краткая характеристика некоторых старых кон-
струкций, которые еще применяются в промышленности или пред-
ставляют интерес для рассмотрения общих тенденций развития кон-
струкций электролизеров для разложения воды.
118
2. ЭЛЕКТРОЛИЗЕРЫ С МОНОПОЛЯРНЫМ
ВКЛЮЧЕНИЕМ ЭЛЕКТРОДОВ
Электролизеры без пористых диафрагм. В конце XIX и в начале
XX в. в Италии довольно широкое распространение имели элек-
тролизеры Гаррути 12. В аппаратах этого типа для разделения газов
применялись стальные закрытые сверху короба, опущенные на
30—40 мм ниже нижнего края электрода и не доходящие до дна
корпуса электролизера на 50—60 мм. Под коробами размещались
электроды одного полюса, между коробами — другого полюса.
Рис. IV-2. Электролизер Казале с жалюзийными электродами:
/-крышка электролизера; 2 — изолирующие прокладки; 3 — пластинки электродов; 4 — трубы
для отвода газов; 5, 6 — сборные газовые коллекторы; 7 — газоразделительные перегородки;
8 — корпус; 9 — жалюзийные электроды.
В дальнейшем стенки коробов стали перфорировать на уровне элек-
тродов, что позволило увеличить плотность тока. Расстояние ме-
жду электродами составляло около 20 мм, высота электродов
140 мм, плотность тока 200 а!м2, напряжение на ячейке 2,45 в.
Чистота водорода достигала 98,5—98,9% Н2, чистота кислорода
была несколько ниже.
В свое время в промышленности применялись также бездиа-
фрагменные электролизеры Казале4 со сдвоенными жалюзийными
электродами (рис. IV-2). Электроды подвешивались к крышке,
установленной на корпусе электролизера. К внутренней стенке
крышки приваривались стальные перегородки, образующие газо-
вые колокола, погруженные в электролит. Электролизеры Казале
могли использоваться в малых установках при небольших нагруз-
ках и постоянстве давления газов. В более поздних конструкциях
Н9
электролизеров этого типа сохранились жалюзийные электроды, j
способствующие уменьшению газонаполнения электролита и раз- !
витию поверхности электродов, но для улучшения чистоты газов ।
стали применять диафрагмы из асбестовой ткани. j
Электролизеры с двойной пористой диафрагмой. Наиболее ха-
рактерным из них является электролизер Фаузера нз, открытого
типа с двойной асбестовой диафрагмой и сдвоенными электрода-
ми. Применение такой диафрагмы позволяло получать газы вы-
сокой степени чистоты даже при использовании не очень плотного
диафрагменного материала.
Рис. IV-3. Электролизер Фаузера:
/ — шина; 2, 4 — изоляторы; 3- стержень для подвески электрода; 5—ребра жесткости;
6 — электроды; 7 —корпус; $ —диафрагма; 9 — газосборный колокол; 10 — труба для отвода
газа из колокола; //-сборный колпак.
Общий вид электролизера представлен на рис. IV-3. В сталь-
ном корпусе установлены сдвоенные электроды, выполненные из
двух стальных перфорированных листов, расположенных на рас-
стоянии 6 мм друг от друга. Для большей жесткости электроды
снабжены штампованными ребрами. Аноды никелированы. Каж-
дый электрод размещен под отдельным газосборным колоколом,
к нижней части которого прикреплен открытый снизу асбестовый
диафрагменный мешок. Газы из колоколов собираются в сборные
колпаки для водорода и кислорода. Электроды подвешены на
стержнях, изолированных эбонитом. Ток к электродам подводится
по шинам. В месте прохода через электролит и колпак шина за-
щищена этернитовой втулкой и цементной футеровкой.
Электролизеры Фаузера разработаны3 для нагрузок от 6 до
14 ка. Электролизер на 14 ка имеет 11 анодов и 10 катодов. При
120
плотности тока от 400 до 600 а/м$ и температуре 60—70° С элек-
тролизеры работают при напряжении на ячейке 2,1—2,3 в.
Электролизеры с одинарной асбестовой диафрагмой. В разное
время было предложено большое количество конструкций элек-
тролизеров с одинарной асбестовой диафрагмой. Многие из них
Рис. IV-4. Электролизер В-3:
а —схема устройства; / — корпус; 2—холодильные змеевики; 3 — газосборные колокола;
4, 5 —сборные трубы для водорода и кислорода; 6 — серийные трубопроводы для водорода и
кислорода; 7 —отбойник брызг; 8 — змеевик; 9 — колонка для промывки газов; 10 — барботер;
// — трубки для охлаждающей воды; 12, /3 —краны для подачи охлаждающей воды; 14 — кол-
лектор для подвода охлаждающей воды; 15— коллектор для подачи питательной воды;
16 — сточный трубопровод;
б —крепление электродов и диафрагмы: / — токоприемники; 2 — токоподводящие медные
шпильки; 3 — изоляционная прокладка; 4 — изоляционная втулка: 5 —крышка; 6 — корпус;
7 — перфорированные электроды; 8- диафрагма.
длительное время эксплуатировались в промышленности. Здесь бу-
дут кратко описаны лишь наиболее интересные конструкции таких
аппаратов.
Электролизер В-3. Монополярный герметичный электролизер
ящичного типа В-3 (рис. IV-4), разработанный в Советском Союзе
в 30-х годах, рассчитан на нагрузку 14 ка и работу при плотности
тока 700—750 а/м2. Корпус электролизера из 5-миллиметрового
стального листа вверху снабжен фланцем, к которому на болтах
присоединяется герметичная крышка, уплотняемая паронитовой
121
прокладкой на битуме. К крышке электролизера крепится И ка-
тодов и 10 анодов. С внутренней стороны к ней приварены газо-
сборные колокола, в нижней части которых с помощью накладок
и болтиков прикреплена асбестовая диафрагма. Под колоколами
в диафрагменных мешках размещены аноды, между колоколами —
катоды. Каждый электролизер снабжен промывателями газов —
водорода и кислорода,оборудованными холодильными змеевиками,
Рис. IV-5. Электролизер В-4:
/ — корпус; 2 — крышка; 3 — токоприемники; 4 — токоподводящие шпильки; 5 —сепараторы газов;
6 -аноды; 7-катоды; 8 - холодильный змеевик; 9 -диафрагма.
барботером для газов и решеткой для разбивания пены. Газопро-
мыватели служат также для выравнивания давления водорода и
кислорода в электродных пространствах электролизера, поддержа-
ния в нем постоянного уровня электролита и для автоматического
питания электролизера водой. Давление газов в электролизере мо-
жет поддерживаться до 600—800 мм вод. ст.
Каждый электрод изготовлен из двух перфорированных сталь-
ных листов размерами 1000 X 1000 X 2 мм, расположенных на рас-
стоянии 30 мм друг от друга. Листы приварены к трем токоприем-
никам, в верхнюю часть которых ввинчены медные шпильки для
подвода тока и крепления электродов к крышке электролизера
(рис. IV-4, б). Уплотнение и изоляция крышки в местах прохода
токоприемников выполняется при помощи паронитовых прокладок
и фибровых втулок.
122
Электролизер В-4 (рис. IV-5) является дальнейшим развитием
конструкции электролизера В-3 и представляет собой аппарат
с герметичным корпусом, двойными перфорированными электро-
дами и одинарной асбестовой диафрагмой, охватывающей аноды.
Он рассчитан на работу при повышенной плотности тока — до
1500 а/м2, поэтому усилена конструкция токоподвода к электрод-
ным листам. На каждом токоприемнике установлено по две медные
гокоподводящие шпильки. Электролизер В-4 на нагрузку 15 ка
имеет 5 анодов и 6 катодов, снабжен змеевиками для охлаждения
электролита и сепараторами для отделения брызг электролита от
водорода и кислорода, но в нем отсутствуют индивидуальные хо-
лодильники и промыватели газов. Эти аппараты устанавливаются
на серийных коллекторах водорода и кислорода. Зависимость на-
пряжения на ячейке электролизера В-4 от нагрузки при работе на
30%-ном растворе КОН и температуре 70° С приведена на рис. IV-6.
Рис. IV-6. Зависимость напряжения на электролизере В-4 от нагрузки.
Электролизер Ноуэлса. Электролизеры этого типа (рис. IV-7)
довольно широко использовались в промышленности 13~15. Они пред-
ставляют собой открытый стальной корпус, на борта которого опи-
раются изолированные от него газосборные колокола. Одинарные
плоские электроды из 3—4-миллиметрового стального листа под-
вешены на стальных стержнях к газосборным колоколам. Аноды
никелированы. Изолированные от колоколов стержни одновре-
менно служат для подвода тока к электродам. К нижней части
колоколов одного полюса (например, к катодам) прикреплены от-
крытые снизу асбестовые мешки — диафрагмы, опущенные ниже
электродов. Благодаря зигзагообразной форме коллекторов уноси-
мые газом брызги щелочи и конденсирующиеся в трубопроводах
пары воды стекают в электролизер.
Электролизеры Ноуэлса разработаны для нагрузок от 1 до 10
ка. Они работали на 18—20%-ном растворе едкого натра при тем-
пературе около 65° С и напряжении на ячейке 2,25 в. Расход элек-
троэнергии на 1 м3 Н2 составляет 5,4 квт-ч. Чистота водорода до-
стигала 99,75%, кислорода — 99,5%. Электролизер на 10 ка имеет
41 электрод и заключен в корпус длиной 1240, шириной 2400 и вы-
сотой 1270 мм. Плотность тока около 350 а/м2. Срок службы
123
Рис. IV-7. Электролизер Ноуэлса:
/ — асбестовая диафрагма; 2 —электрод; 3 — газосборный колокол; 4 — стержень; 5 — сборная
труба; 6 —серийные трубопроводы.
Рис. IV-8. Электролизер Холмбо:
/-стяжные болты: 2-лапы для крепления анодов; 3- стержни для подвески катодов и под-
вода тока: 4 -катодная шина; 5-штуцера для отвода газов; 6 -крышка; 7 - соединительный
водородный канал; 3 - корпус; пластинчатые катоды; 10- аноды; //-диафрагма.
диафрагмы достигал 5—7 лет. Электролит в электролизерах Ноу-
элса постепенно карбонизовался, и его приходилось заменять све-
жим примерно 1 раз в 2—3 года.
Для повышения мощности электролизера и сокращения необ-
ходимой производственной площади была разработана конструк-
ция многоэтажного электролизера Ноуэлса.
Электролизер Холмбо^ (рис. IV-8) представляет собой ящич-
ный аппарат с крышкой, уплотненной при помощи гидравлического
/ — уровни электролита; 2, 4 — газосборные камеры для водорода и кислорода; 3 — перегородка:
5 —крышка; 6 — диафрагма; 7 — токоподводы; 8 — газосборный колокол; 9 — электроды.
затвора или фланцевого соединения. Электродами служат верти-
кально установленные узкие пластины, скрепленные стяжными бол-
тами. Катоды крепятся к крышке электролизера и размещаются
в диафрагменных мешках. Диафрагма крепится к газосборным ко-
локолам, приваренным к крышке электролизера. Аноды располо-
жены между диафрагменными мешками и крепятся к стенке кор-
пуса электролизера при помощи болтов и лап.
В другом варианте конструкции этого типа аноды и катоды под-
вешены к крышке электролизера.
Газы поступают в установленные на каждом электролизере
промыватели и холодильники, а образующийся конденсат водяных
125
паров по сифонным трубам раздельно стекает в анодное и катод-
ное пространство. Для улучшения циркуляции электролита электро-
лизер снабжен пустым диафрагменным мешком. После отделения
от кислорода электролит опускается по этому мешку в нижнюю
часть электролизера, вытесняя из межэлектродных пространств
более легкий электролит, содержащий пузырьки газа.
Электролизеры Холмбо были разработаны для нагрузок до
18 ка, при токе более 10 ка они снабжались теплообменниками для
охлаждения электролита. Напряжение на ячейке при нагрузке
10 ка составляло 2,19 в.
Электролизеры Трейля применялись в США, Канаде и неко-
торых других странах. В США в 1939 г. была введена в эксплуа-
тацию установка мощностью 75 000 кет, состоящая из 3000 элек-
тролизеров этого типа для производства водорода и кислорода.
В 1944 г. установка реконструирована для получения тяжелой воды
при электролизе 17.
Стальной корпус электролизера (рис. IV-9) снабжен герметич-
ной крышкой из армированного бетона. Перегородка под крыш-
кой образует две камеры для сбора водорода и кислорода. Катоды
выполнены в виде стальных листов, аноды стальные никелирован-
ные. Электроды расположены между асбестовыми диафрагмами,
весь комплект электродов дополнительно окружен асбестовым
чехлом. Асбестовые диафрагмы и чехол крепятся к крышке
электролизера. Под перегородкой расположены газосборные коло-
кола.
Нормальная нагрузка электролизера равна 10 ка и может быть
повышена до 15 ка. В электролизере можно устанавливать 21; 17
или 15 пар электродов. Длина электролизера 1,3 м, высота 1,4 м,
ширина 0,75—1 м в зависимости от количества электродов. Объем
электролизера 750—1200 л. Электролизеры работали на 28%-ном
растворе КОН или 20%-ном растворе NaOH при 60—70°С и на-
пряжении на электролизере 2,1 в.
3. ФИЛЬТРПРЕССНЫЕ ЭЛЕКТРОЛИЗЕРЫ
С БИПОЛЯРНЫМ ВКЛЮЧЕНИЕМ ЭЛЕКТРОДОВ
ДЛЯ РАБОТЫ ПРИ АТМОСФЕРНОМ ДАВЛЕНИИ
Электролизеры типа ФВ 18
Конструкция электролизеров типа ФВ была разработана в СССР
в 30-х годах в связи со строительством Чирчикского электрохими-
ческого комбината для производства азотных удобрений на базе
синтетического аммиака из электролитического водорода. Элек-
тролизеры этого типа были усовершенствованы в конце 40-х годов
и в настоящее время используются на многих электролитических
установках различной производительности.
126
Электролизеры ФВ представляют собой мощные фильтрпрес-
сные аппараты с биполярными электродами и одинарной асбесто-
вой диафрагмой. В зависимости от потребности в водороде и кис-
лороде применяются электролизеры с разным числом ячеек— от
20—25 до 160—170. Электролизеры рассчитаны на работу при атмо-
сферном давлении и могут производить газы только под небольшим
избыточным давлением (500—1000 мм вод. ст.).
Максимальная по мощности модель электролизера ФВ перво-
начально предусматривалась на 160 ячеек и при нагрузке 7,5 ка
имела производительность* около 500 м^ч водорода и 250 м^ч
кислорода. Эта модель известна под названием ФВ-500. Количество
ячеек в электролизере ФВ-500 без изменения длины стяжных бол-
тов может быть увеличено до 164 и при максимальной нагрузке
11 ка его часовая производительность достигает 750 м3/ч Н2 и
375 м3/ч О2.
Электролизер ФВ-500 выполнен в виде агрегата, включающего
всю вспомогательную аппаратуру для первичной обработки (охла-
ждения и промывки) газов, поддержания теплового, гидравличе-
ского и концентрационного режима работы электролизера. Непо-
средственно на аппарате или на специальном щитке устанавливают
приборы для контроля основных показателей его работы: ампер-
метр и вольтметр для определения нагрузки и общего напряжения
на электролизере; термометры для измерения температур электро-
лита, газов и охлаждающей воды в различных точках электроли-
зера; тягомеры, измеряющие давление газов; указатели уровня
жидкости в газосборниках и газовых каналах.
Так как выход по току мало изменяется во время работы, по
нагрузке на электролизере можно с достаточной точностью опре-
делять часовую производительность аппарата. Поэтому амперметр
часто снабжают шкалой выработки водорода и кислорода (в м3/ч).
Поддержание заданного уровня жидкости в электролизере, ра-
венства давления обоих газов в электродных пространствах, нор-
мального концентрационного и теплового режима в отдельных ячей-
ках электролизера производится автоматически. Обслуживание
агрегата сводится в основном к регулированию подачи питатель-
ной и охлаждающей воды, которое также легко автоматизировать.
Поэтому на многих установках, оборудованных электролизерами
типа ФВ, все операции по их текущему обслуживанию полностью
автоматизированы.
Напряжение на электролизере ФВ-500 изменяется в зависимо-
сти от условий его работы и при нормальной нагрузке составляет
примерно 350—375 в. Электролизеры могут включаться в сеть по-
стоянного тока по одному или последовательно сериями по 2—
4 аппарата с общим напряжением на серии от 375 до 1500 в. Воз-
можность безопасной эксплуатации серии таких электролизеров
при напряжении 1500 в позволяет снизить капитальные затраты
* Здесь и далее объем газов приведен к нормальным условиям.
127
на строительство преобразовательной подстанции для питания
электролизеров постоянным током и повысить к. п. д. преобразо^
вателей. Практически полное отсутствие ручного обслуживания
позволяет помещать электролизер за ограждением и разрешать
доступ к нему только после снятия напряжения, как принято при
эксплуатации высоковольтных электрических установок.
Таблица IV-1. Характеристика электролизера ФВ-500
Нагрузка, ка Напряжение, в Выработка газов, м3[ч Расход электроэнергии ♦, КвТ'Ч/М^ Н2
на ячейке на электро- лизере водорода кислорода
1 1,72 282 67,2 33,6 4,20
2 1,81 297 134,4 67,2 4,42
3 1,89 310 201,6 100,8 4,61
4 1,96 322 268,8 134,4 4,78
5 2,03 333 336,0 168,0 4,95
6 2,09 343 403,2 201,6 5,10
7 2,15 353 470,4 235,2 5,24
8 2,21 363 537,6 268,8 5,39
9 2,28 374 604,8 302,4 5,57
10 2,33 382 672,0 336,0 5,68
11 2,39 392 739,2 369,6 5,84
* Здесь и далее приведен
расход электроэнергии постоянного тока.
Общие габариты электролизера ФВ-500 вместе с
ной аппаратурой: длина 12,95 ширина 2,6 м и
Электролизер вместе с ограждением занимает площадь 13,5х3,4>и.
Общая масса электролизера
(с ограждением) 97 т, рабо-
чая масса (вместе с электро-
литом) ~ 138 т.
В табл. IV-1 приведены
данные, характеризующие ра-
боту электролизера ФВ-500 с
164 ячейками при концентра-
ции электролита^370 г/л КОН,
температуре
току 98%.
На рис.
зависимость
ячейке электролизера ФВ-500
от нагрузки.
Общий вид электролизе-
ра ФВ-500 изображен на
собирается из ячеек, стягивае-
Рис. IV-10. Зависимость напряжения
на ячейке электролизера ФВ-500 от на-
грузки (электролит — 30%-ный раствор
КОН):
/ — при 75° С; 2 — при 95° С.
вспомогатель-
высота 6,4 уи.
95° С и выходе по
IV-10 приведена
напряжения на
рис. IV-11. Корпус электролизера
мых кри помощи концевых стяжных плит четырьмя болтами. На
диафрагменной раме каждой ячейки закреплена диафрагма, к ко-
торой с обеих сторон прилегают электроды, как показано на
128
Рис. IV-11. Электролизер ФВ-500:
2 —стяжные плиты; 2 —корпус, составленный из ячеек; 3 — газосборники; 4 —ловушки брызг; 5 — холодильники-конденсаторы газов; 6 —линия
подвода охлаждающей воды в среднюю камеру; 7 —стяжные болты; 8 — ограждения; фильтр для электролита; 10 ~ средняя камера.
Рис. IV-12. Разрез
электролитической
ячейки:
/ — диафрагменная рама;
2 — биполярный электрод;
3 — паронитовая проклад-
ка; 4 — отверстие для вы-
хода газов; 5—диафрагма;
6—заклепка; 7 —накладка.
Постоянный ТОК
рис. IV-12. Каждый из биполярных электродов служит анодом од-1
ной ячейки и катодом соседней ячейки. К диафрагменной раме на!
штуцерах прикреплены звенья газовых и пи-1
тательных каналов. При сборке электролизера!
газовые звенья образуют водородный и кис-1
дородный газосборные каналы, куда посту-1
пают газы из всех ячеек. Аналогично обра-1
зуется из звеньев питательный канал, по ко-|
торому циркулирующий электролит и пита-;
тельная вода распределяются по всем ячейкам
электролизера.
Средняя камера электролизера предназна-;
чена для охлаждения циркулирующего элек- г
тролита. Под ней установлен фильтр для от-
деления механических примесей и загрязнений '
от электролита. Вспомогательная аппаратура
для охлаждения и промывки газов, а также
для регулирования уровня электролита и дав-<
ления газов в электродных пространствах i
ячеек расположена над электролизером. Здесь
устанавливаются ловушки для отделения !
брызг электролита от газов, холодильники-
конденсаторы для водорода и кислорода и га-
зосборники.
подводится к крайнему монополярному элек-
троду, последовательно проходит все ячейки электролизера и отво-
Рис. IV-13. Биполярный электрод:
/ — основной лист биполярного электрода; 2 — вы-
носной анод; 3 — выносной катод; 4 — анкера;
5 — отверстие в основном листе.
дится от противоположного
крайнего монополярного
электрода. Через среднюю
камеру ток не проходит,
а проводится шинами от
монополярного электрода с
одной стороны камеры к
другому, прилегающему к
ней с другой стороны.
Электроды. В электроли-
зерах типа ФВ применяют-
ся биполярные сближенные
перфорированные электро-
ды. Только два крайних
электрода и два электрода,
прилегающие к средней ка-
мере, работают монополяр-
но — соответственно как аноды или катоды. Биполярный электрод
электролизера типа ФВ (рис. IV-13) состоит из основного листа
толщиной 5 мм, к которому на 173 анкерах расклепкой крепятся
выносные электроды: с одной стороны анод, с другой — катод.
Анкера служат одновременно для передачи тока от одного вынос-
130
Пого листа электрода к другому. Выносные электроды толщиной
3 мм перфорированы 39 000 отверстий диаметром 5,8 мм, распо-
ложенных по 60°-ной сетке с шагом 8,8 мм. Площадь отверстий
перфорации составляет 34,4% общей площади выносного листа
электрода. Применялись также электроды, перфорированные от-
верстиями диаметром 5 мм.
Анодная сторона электрода — выносной анод и обращенная
к нему сторона основного листа вместе с анкерами никелируются.
Для снижения перенапряжения выделения кислорода никелиро-
ванный анод иногда дополнительно покрывают тонким слоем ни-
келя в ванне с активирующими добавками. При изготовлении но-
вых электродов анод никелируют в три приема. Сначала никелем
покрывается анодная сторона основного листа вместе с расклепан-
ными на нем анкерами, и отдельно обратная сторона выносного
листа анода, обращенная в собранном электроде к основному ли-
сту. Затем выносной анод крепится к основному листу при помощи
анкеров и производится заключительная операция никелирования
электрода. В последнее время никелировку новых электродов про-
изводят также в собранном виде. Ремонт электродов, бывших
в работе и нуждающихся в повторном никелировании, выполняют
без разборки и расклепки основного и выносных листов. Если ни-
келевый слой не отстает от электрода, новый слой никеля толщи-
ной 60—70 мк накладывается по старой никелировке после тща-
тельной обработки поверхности.
Никелевое покрытие на лицевой стороне выносного листа —
анода толщиной не менее 100 мк должно быть беспористым или
иметь не более 15 пор на 1 дм2. На основном листе допускается до
30 пор на 1 дм2. Пористость никелевого покрытия на обратной
стороне выносного электрода обычно больше, так как на острых
краях отверстий перфорации и на заусенцах не удается создать
плотное никелевое покрытие.
Катодная сторона электрода (выносной лист и обращенная к
нему часть основного листа) перед установкой в аппарат обраба-
тывается при помощи пескоструйного аппарата для удаления
ржавчины и других загрязнений и развития рабочей поверхности
электрода. С целью увеличения рабочей поверхности катода и со-
ответственного уменьшения фактической плотности тока иногда
к катодной поверхности выносного электрода крепят металличе-
скую сетку.
Расстояние между основным листом и выносным анодом со-
ставляет 17,5 мм, между основным листом и выносным катодом
27 мм; в собранном электролизере расстояние между выносным
анодом и катодом составляет 9,5 мм (при толщине прокладки ме-
жду рамой и электродом 6 мм). В нижней части основного листа
биполярного электрода имеется по 2 отверстия диаметром 15 мм,
необходимые для перетока электролита из одной ячейки в другую
и предотвращения возможности опорожнения ячейки в случае за-
бивки штуцера питательного канала,
Монополярный электрод представляет собой основной лист;
толщиной 20 мм, к которому только с одной стороны крепится на
анкерах перфорированный выносной лист, аналогичный выносным
листам биполярных электродов. Анкера монополярных электродов
имеют на одной стороне резьбу и ввертываются в основной лист
на глубину 10—12 мм. Другая сторона анкерного болта на вынос- |
ном листе расклепывается аналогично креплению анкеров на би- j
полярных электродах. Монополярные электроды одновременно яв- !
ляются торцевыми крышками средней камеры и корпуса электро-
лизера. В последнее время применяются также монополярные
электроды толщиной 12—16 мм без выносных листов.
Для подвода тока основные листы крайних монополярных элек-
тродов в нижней части имеют луженые выступы размерами 900 X
X 100 мм с отверстиями для болтовых соединений с шинами, под-
водящими постоянный ток к электролизеру. На монополярных
электродах, установленных у средней камеры, для улучшения об-
служивания контактов и наблюдения за ними контактные выступы
иногда переносят на боковые торцы электродов.
Принятая в электролизере ФВ конструкция электродов обла-
дает достаточной механической прочностью, удобна в изготовле-
нии и сборке и обеспечивает надежную равномерную разводку тока
по электродам. Перфорация создает благоприятные условия для
циркуляции электролита у выносных электродов, что приводит
к снижению степени газонаполнения электролита и величины по-
терь напряжения на преодоление его электрического сопротивле-
ния. Принятые диаметр отверстий электродов, шаг перфорации и
толщина выносных листов позволяют увеличить (по сравнению
с гладкими листами) общую рабочую поверхность электродов и
снизить действительную плотность тока.
Ниже приведены данные о фактической поверхности электро-
дов (площадь диафрагмы 3,135 м2, проекция выносного листа «а
диафрагму 2,995 м2):
Поверхность Катод, м% Анод, м2
Лобовая выносного листа за вычетом отверстий
перфорации................................. 1,965 1,965
Боковая отверстий перфорации............... 2,130 2,130
Обратная выносного листа за вычетом отвер-
стий перфорации и площади, закрытой анкерами 1,926 1,900
Боковая анкеров............................ 0,250 0,203
Основного листа за вычетом площади, занятой
анкерами................................. 3,461 3,435
Общая поверхность электрода............... 9,732 9,633
Плотность тока в отдельных узлах ячейки электролизеров ФВ
при различной нагрузке приведена ниже (в а):
Нагрузка, ка............................... 11 8
Плотность тока в расчете на 1 м2 диафрагмы . . 3510 2550
Плотность тока на 1 м2 проекции выносного
листа на диафрагму....................... 3670 2670
Нагрузка на 1 анкер........................ 63,6 46,3
Плотность тока на 1 мм2 минимального сече-
ния анкера............................. . 0,338 0,245
132
Рамы диафрагменные. Рамы электролизера ФВ (рис. IV-14)
сварены по углам из Т-образной профильной стали (высота про-
филя 75 мм) с полками шириной 50 и толщиной 20 мм. Боковые
стороны рамы имеют две уплотняющие канавки глубиной 1,37 мм.
К раме при помощи накладок шириной 22 мм и заклепок со сто-
роны, обращенной к аноду, крепится диафрагменное асбестовое
полотно размерами 2100 X 1530 мм (характеристика асбестовой
ткани приведена в главе III).
Рис. IV-14. Диафрагменная рама:
/ — рама; 2 —кольца газового канала; 3 — газоотводные штуцера; 4 — диафрагма; 5 —накладка
для крепления диафрагмы; 6— заклепки; 7 —трубка для отвода газов из кольца питательного
канала; в —кольцо питательного канала; 9 — штуцер питательного канала.
Боковые и внутренние стороны диафрагменной рамы, а также
внутренние поверхности колец и штуцеров газовых и питательного
каналов покрывают слоем никеля толщиной 100 .мк, их наружные
поверхности слоем 25 мк. В верхней части диафрагменной рамы
имеются отверстия, при помощи штуцеров соединенные со звенья-
ми газовых каналов: одно предназначено для отвода водорода и
соединено с катодной частью ячейки, второе — для выхода кисло-
рода и соединено с анодной ее частью. Отверстие в нижней части
боковой стороны рамы через штуцер соединяет катодную и анод-
ную стороны ячейки со звеном питательного канала. Звенья газо-
вых каналов представляют собой кольца диаметром 425/378 мм и
шириною 61 мм, питательный канал состоит из звеньев той же
ширины, но меньшего диаметра (180/134 мм).
В электролизерах последней конструкции штуцера газовых и
питательного каналов присоединяются к диафрагменной раме при
помощи овальных фланцев на двух шпильках, с уплотнением паро-
нитовыми прокладками. В более ранних конструкциях штуцера
приваривали к диафрагменным рамам.
133
1
Для предотвращения включения рам в электрохимическую ра-
боту и уменьшения коррозии деталей электролизера рамы и коль-
ца каналов футеруют цементной массой. Штуцера колец каналов)
изолируют этернитовыми трубками на цементной массе; иногда
этернитовыми вставками футеруют и кольца каналов. Практика |
эксплуатации показала нецелесообразность применения этернито- i
вых вставок в кольца питательного канала, так как коррозия их *
незначительна, а этернитовые вставки, уменьшая сечение канала, '
ухудшают циркуляцию электролита.
Футеровка обеспечивает длительное (6—7 лет) надежное со-
хранение чистоты газов, вырабатываемых электролизером. В боль-
шинстве случаев футеруют только нижнюю и боковые полки рамы.
От футеровки верхней полки отказались, поскольку это несколько
затрудняет вывод газов из ячейки и ухудшает циркуляцию элек-
тролита.
Для футеровки рам следует применять цементную массу из
портланд-цемента марки не ниже 500 и дробленого отмытого о г
пыли известняка фракции 0,5—1,2 мм. Поверхность рамы перед
футеровкой тщательно очищается от следов жира и прочих за-
грязнений, промывается водой и на нее наносится слой футеровоч-
ной массы с соотношением компонентов цемент: известковая
крошка : вода =1:1 :0,4. После схватывания футеровочной мас-
сы примерно в течение 20 ч поверхность футеровки подвергают
железнению, затем таким же способом футеруют другую сторону
рамы. Футеровка рамы должна затвердевать в течение 28 суток,
для чего ее все время поддерживают во влажном состоянии. При
несоблюдении этих условий футеровочная масса быстро разру-
шается в процессе работы электролизера.
Для футеровки колец каналов применяется аналогичная це-
ментная масса с той разницей, что известняк размалывают на ча-
стицы размером 0,075 мм и для получения более жидкой массы
добавляют около 35% воды от общего количества цемента и из-
вестняковой муки. Футеровку цементной массой или этернитовыми
деталями на цементной замазке необходимо выполнять очень
тщательно, чтобы исключить возможность образования узких ще-
лей или трещин и обнажения поверхности металлической детали,
так как в этих местах возможны значительные изменения концен-
трации электролита, способствующие быстрому развитию корро-
зионных процессов.
Футеровка трех полок рам (нижней и боковых) приводит
к увеличению напряжения на ячейке и расхода электроэнергии на
4—6% по сравнению с нефутерованными рамами. Для снижения
этого вредного эффекта в электролизерах ФВ-500 перешли на фу-
теровку одной нижней полки, что позволяет снизить напряжение
на 2—2,5% при сохранении в большинстве случаев высокой чисто-
ты газов.
Бетонная футеровка рам и колец каналов связана со значитель-
ными неудобствами и большой затратой труда. Продукты разру*
134
щения бетонной массы загрязняют диафрагму и теплопередающие
поверхности средней камеры. Поэтому делались попытки найти
фугие способы, предотвращающие включение диафрагменных рам
в электрохимическую работу. Это может быть, в частности, до-
стигнуто применением прокладок между электродом и рамой, вы-
ступающих внутрь ячеек. Такая прокладка па нижней полке рамы
затрудняет возможность образования электропроводных мостиков
из губчатого железа между катодной стороной электрода и рамой.
Вследствие утечки тока в питательном канале происходит вы-
деление газов. Поэтому 6—12 крайних рам электролизера снабже-
ны трубками диаметром 32 X 3,5 мм, соединяющими звенья пита-
тельных каналов с анодной частью соответствующей рамы. Сред-
нее звено питательного канала соединено газоотводной трубкой
такого же диаметра со средним звеном газового кислородного ка-
нала. Газовые кольца двух крайних диафрагменных рам имеют по
два штуцера диаметром 32 мм для продувки электролизера азотом
при остановках и перед пуском. Звенья газовых и питательного
каналов крепятся к штуцерам наверткой на резьбе с подмоткой
асбестовым шнуром или привариваются.
В некоторых электролизерах одно время применяли газовые
штуцера, выступающие внутрь звеньев газовых каналов. Однако
выступающие части штуцеров подвергаются сильной коррозии, по-
этому от удлиненных газовых штуцеров впоследствии отказались.
Средняя камера. В средней камере происходит охлаждение
циркулирующего электролита, перемешивание и выравнивание
концентрации щелочи в анолите и католите, окончательное отделе-
ние газов от электролита и смешение циркулирующего электролита
с питательной водой.
Средняя камера (рис. IV-15) представляет собой сварную ко-
робку, боковыми стенками которой при стяжке электролизера слу-
жат монополярные электроды, установленные с обеих сторон ка-
меры. В торцевые стенки средней камеры ввальцованы цельно-
тянутые трубки диаметром 32 мм, образующие 14-ходовой тепло-
обменник, в котором циркулирует охлаждающая вода. Общая
поверхность охлаждения в средней камере последней конструкции
составляет 89 м2. Торцевые стенки средней камеры закрыты водо-
распределительными крышками. Система перегородок в торцевых
крышках направляет поток циркулирующей охлаждающей воды
по многоходовому теплообменнику.
Охлаждаемый электролит проходит в межтрубном пространстве
средней камеры противотоком охлаждающей воде. Коробка сред-
ней камеры герметично разделена вертикальной перегородкой на
анодную и катодную части. Камера снабжена также горизонталь-
ными перегородками, удлиняющими путь электролита в ней, что
улучшает его охлаждение.
Верхняя стенка средней камеры имеет два отверстия размера-
ми 100 X 200 мм, расположенные по обе стороны вертикальной
перегородки, для присоединения средних звеньев газовых каналов,
135
которые при сборке электролизера соединяют обе половины газо-
вых каналов.
На верхней стенке средней камеры при помощи шпилек укреп-
лена распределительная коробка для подвода питательной воды
Рис. IV-15. Средняя камера электролизера ФВ:
/-водораспределительная крышка; 2 —трубная решетка; 3 - охлаждающие трубки; 4 - среднее
звеноводородного газового канала; 5 — патрубок для ввода охлаждающей воды; 6 — патру-
бок для ввода питательной воды; 7 —среднее звено кислородного газового канала; 8 — верхняя
стенка; 9 — среднее звено питательного канала; 10 — смесительная коробка; 11 — патрубок для
вывода охлаждающей воды; 12 -нижняя стенка; 13- задвижка; 14 - вертикальная перего-
родка; /5—горизонтальные перегородки.
из газосборника. Питательная вода по трубам подается в смеси-
тельную коробку средней камеры. Охлаждающая вода поступает
в нижнюю секцию многоходового теплообменника, а из верхней его
секции отводится во внешнюю сеть.
Средние звенья газовых каналов снабжены смотровыми стек-
лами для наблюдения за уровнем электролита в них. Средняя ка-
мера имеет штуцера для подключения манометрических термомет-
ров, измеряющих температуру электролита на входе в камеру,
а также температуру воды и электролита на выходе из нее.
136
На рис. IV-16 показана средняя камера электролизера ФВ
в процессе его пробной сборки. Камера установлена на изоляторах,
на нижних стяжных болтах; к ней присоединены средние секции
газовых и питательного каналов. Справа на рисунке виден штабель
диафрагменных рам с кольцами питательного и газовых каналов.
Фильтр для непрерывной очистки электролита представляет
собой стальной цилиндр диаметром 450 и длиной 1960 мм. В нем
размещен внутренний стакан, состоящий из трех перфорирован-
ных цилиндров, обтянутых фильтрующей репсовой сеткой из
Рис. VI-16. Средняя камера электролизера типа ФВ в процессе пробной сборки.
никеля или монель-металла. Общая поверхность фильтрации
в электролизере последней модели составляет 3,5 м2. Для регене-
рации фильтрующей поверхности фильтр при помощи задвижек
отключается от средней камеры, присоединяется к линии откачки
электролита и освобождается от жидкости. После этого откры-
вается крышка фильтра и внутренний стакан извлекается для
промывки сильной струей воды.
Система стяжки и изоляции электролизера. Ячейки электроли-
зера вместе со средней камерой, а также газовые и питательный
каналы стягиваются четырьмя болтами при помощи концевых
плит. Стяжка фильтрпрессного электролизера должна обеспечить
полную герметичность корпуса, питательного и газовых каналов
при полной взаимной электроизоляции деталей.
Стыки диафрагменных рам с электродами, колец каналов,
средней камеры с монополярными электродами уплотняются паро-
нитовыми прокладками, служащими одновременно для электро-
изоляции ячеек. Прокладки приклеиваются к металлу рам и колец
на битуме № 5 или на специальных лаковых клеях. Между
137
электродами и рамами устанавливаются паронитовые прокладки
толщиной 6 мм, между кольцами газовых каналов и питательного
канала — прокладки толщиною 7,5 мм. Применяются также паро-
нитовые рамные прокладки толщиной 5 мм. При этом расстояние
между электродами уменьшается до 7,5 мм, что обеспечивает сни-
жение расхода электроэнергии примерно на 2,7%.
Для равномерности затяжки и компенсации температурных на-
пряжений под гайки стяжных болтов введены компенсационные
тарельчатые пружины Бьельвиля диаметром 380 мм. На каждой
стороне стяжного болта установлено по две пары таких пружин,
которые при нагрузке 54 т должны сжиматься на 10—12 мм при
остаточной деформации не более 1%. Каждый комплект из двух
пружин маркируется и снабжается графиком зависимости их сжа-
тия от прилагаемой нагрузки, что облегчает определение величин
нагрузки на каждом стяжном болте. В электролизерах ФВ-500 на
концах стяжных болтов длиной 12 950 и диаметром 110 мм, вы-
полненных из стали марки Ст. 5, имеется трапециевидная нарезка
пружин маркируется и снабжается графиком зависимости их сжа-
марки Ст. 4. На двух нижних стяжных болтах имеются фаски, на
которые устанавливают специальной формы фарфоровые или ка-
проновые изоляторы под диафрагменные рамы, биполярные элек-
троды и среднюю камеру. Чтобы облегчить передвижение изолято-
ров вдоль болта при затяжке электролизера, под каждым из них
устанавливают стальную чашечку.
Стяжные болты изолированы от концевых плит фарфоровыми
или капроновыми втулками и шайбами. Втулки длиной 357 и диа-
метром 163/125 мм устанавливают в месте прохода стяжных бол-
тов через концевые плиты. ;Между плитой и тарельчатыми пружи-
нами на стяжных болтах помещают фарфоровые кольца диамет-
ром 290/176 и высотой 60 мм. Нижние стяжные болты уложены на
20 фарфоровых опорах, изолирующих весь агрегат электролизера
от земли. Эти изоляторы установлены между двумя чугунными
башмаками. Для удобства смены опорных фарфоровых изоляторов
верхний и нижний чугунные башмаки имеют специальные вырезы.
Изоляция электролизеров типа ФВ и их деталей показана на
рис. IV-17.
Вспомогательная аппаратура для охлаждения и промывки га-
зов (ловушки брызг электролита, конденсаторы и газосборни-
ки) устанавливается над электролизером после сборки его кор-
пуса.
Ловушки, предназначенные для улавливания и отвода щелочи,
уносимой газами, устанавливают на линиях отвода кислорода и
водорода из электролизера в конденсаторы. Ловушка представ-
ляет собой цилиндр диаметром 700 и высотой 800 мм, снабженный
приварными сферическими крышками и тремя внутренними пере-
городками для изменения направления движения газа. Если не
предполагается отбор конденсата на сторону, ловушки не уста-
навливают.
138
Конденсаторы (рис. IV-18) предназначены для предваритель-
ного охлаждения газов и конденсации основного количества па-
ров воды, уносимых с газами (см. стр. 81). Конденсатор пред-
ставляет собой кожухотрубный теплообменник диаметром 600 и
Рис. IV-17. Изоляция рам электролизеров и стяжных болтов:
а—установка рам и электродов на изоляторах;
/-нижний стяжной болт; 2 —изолятор с башмаком; 3- диафрагменная рама; 4 - электрод;
б —установка пружин и изоляторов на стяжных болтах: 1 — сТяжной болт; 2 —плита; 3 — изо-
ляционная втулка; 4 — изоляционное кольцо; 5—шайба; 6— пружины; 7 —стальная втулка
с шайбой; 8 — гайка;
в-установка опорных изоляторов: / — нижний стяжной болт; 2—верхний башмак изолятора;
3 — прокладка; 4 — изолятор; 5 —нижний башмак изолятора.
длиной 7000 мм, разделенный на две части — водородную (3795 мм)
и кислородную (2995 мм). Между этими частями размещается
среднее звено конденсатора, служащее для ввода, распределения
при помощи перегородок и отвода охлаждающей воды. На торцах
Рис. IV-18. Конденсатор:
/ — водораспределительная крышка; 2—патрубок для ввода водорода; 3 — корпус; 4 — охла-
ждающие трубки; 5 — патрубок для выхода водорода; 6 — штуцера для отвода конденсата;
7—штуцер для ввода охлаждающей воды; 8 - патрубок для вывода охлаждающей воды;
9 —средняя распределительная коробка для воды; 10— патрубок для ввода кислорода;
// — патрубок для отвода кислорода; /2—перегородки.
конденсатора имеются сферические крышки, тоже снабженные пе-
регородками для изменения направления потоков охлаждающей
воды. В каждой части аппарата между двумя трубными решетка-
ми развальцовано по 169 трубок диаметром 25 X 2,5 мм. Поверх-
ность охлаждения в водородной части конденсатора равна 49 м2,
в кислородной 39,0 м2.
139
Газы из ловушек для щелочи поступают в межтрубную часть |
конденсатора и после охлаждения отводятся из нижней его части. 1
Для повышения коэффициента теплопередачи холодильник выпол- I
нен многоходовым по газу, для чего в межтрубном пространстве 1
установлены горизонтальные перегородки, направляющие движе- 1
ние газовых потоков. При охлаждении газов пары воды конденси- 1
руются, и жидкость по U-образной трубке диаметром 25 мм отво- 1
дится в сборные баки конденсата или в газосборник электролизера. 1
При высоком уровне электролита в электролизере или забивке ;
линии отвода щелочи из ловушки с газами в конденсатор может
уноситься большое количество брызг электролита, что приводит
к повышению щелочности газа и конденсата. При этом увеличи- ;
ваются утечки тока по линии отвода конденсата из электролизера
и возможно отключение электролизера системой защиты. Для
обеспечения постоянного и полного стока жидкости из конденсато-
ра и полноты его промывки в случае чрезмерного увеличения ще-
лочности конденсата штуцера для отвода последнего из аппарата
должны быть приварены в нижней его части, почти вплотную
к средней перегородке. Для предотвращения возможности смеше-
ния газов через U-образную трубку, соединяющую жидкостные про-
странства обеих частей конденсатора, она должна быть размеще-
на на достаточно большой глубине. Высоту воздушника на затворе
(трубе для стока конденсата) выбирают с таким расчетом, чтобы
не происходил выброс конденсата из затвора при возможном по-
вышении давления в конденсаторе. Увеличение отвода жидкости
из конденсатора при эксплуатации установки свидетельствует о
нарушении герметичности трубчатки. Конденсатор устанавливает-
ся на газосборнике и имеет равный с ним электрический потен-
циал.
Газосборник в электролизере ФВ-500 служит для регулирова-
ния и выравнивания давления газов, их охлаждения и промывки,
автоматического поддержания постоянного уровня электролита
в электролизере, предотвращения возможности повышения давле-
ния газов в электролизере, подачи конденсата и щелочи для пи-
тания электролизера.
Газосборник (рис. IV-19) представляет собой стальной ци-
линдр диаметром 900 и длиною 12 000 мм, состоящий из двух ча-
стей: водородной (6984 мм) и кислородной (4984 мм), разделен-
ных сплошной стальной перегородкой. С торцов к газосборнику
болтами крепятся сферические крышки. Каждая часть газосборни-
ка снабжена трубчатым двухходовым теплообменником. Поверх-
ность охлаждения водородной части газосборника равна 19,1, кис-
лородной 13,4 ж2. Охлаждающая вода поступает в теплообменник
кислородной части газосборника, проходит по обводной трубе
в теплообменник водородной его части и затем отводится в холо-
дильники-конденсаторы.
В каждом газосборнике имеется барботер — стальной сфериче-
ский желоб, установленный на расстоянии 33 мм от нижней стенки
140
аппарата. В нижней части барботера нарезаны зубья высотою
10 мм и два ряда отверстий диаметром 6 мм, просверленных с ша-
гом 21 мм. Проходя между зубьями и через отверстия барботера,
газ равномерно распределяется в жидкости газосборника и, бар-
ботируя через ее слой, промывается и очищается от щелочи, а так-
же охлаждается водой, проходящей по трубкам теплообменников.
На концах каждой части газосборника вверху имеется по два шту-
цера диаметром 133 мм: крайние штуцера служат для отвода газов
потребителю, остальные — для выброса газов в атмосферу в ава-
рийных случаях.
Рис. IV-19. Газосборник:
/ — указатель уровня; 2 — крышка; 3 — патрубок для отвода водорода; 4 — трубы для аварий-
ного сброса газов в атмосферу; 5 — корпус; 6 — охлаждающие трубки; 7 —барботер; 8— па-
трубок для ввода водорода; 9 — перегородка; 10 — патрубок для ввода кислорода; // — патру-
бок для вывода кислорода; 12 — штуцер для вывода питательной воды; 13 — штуцер для ввода
охлаждающей воды; 14— соединительная труба; /5 — штуцер для вывода охлаждающей воды.
Штуцера для отвода газов из газосборника через стеклянные
фонари соединены с наружными коммуникациями при помощи
резиновых манжет. Вследствие утечек тока, неизбежных в произ-
водстве, возможно возгорание резиновых манжет на кислородных
фонарях. Для их защиты штуцера для отвода кислорода из газо-
сборника изолируют этернитовыми вставками и асбестовым кар-
тоном. Стеклянные фонари, резиновые манжеты и этернитовые
вставки изолируют газосборник электролизера от наружных ком-
муникаций. Так как в аварийном водородном фонаре, соединенном
с атмосферой, может накапливаться водород, в фонарь постоянно
подается небольшая струя азота для исключения возможности об-
разования взрывоопасной смеси.
В аварийные штуцера газосборника вставлена труба, которая
на 100 мм не доходит до его дна и через стеклянный фонарь соеди-
няет аппарат с трубопроводом для отвода газов в атмосферу. При
понижении уровня жидкости в газосборнике до 100 мм аварийная
труба обнажается и газы автоматически отводятся через нее
в атмосферу. Понижение уровня жидкости в газосборнике возмож-
но при нарушении питания электролизера или при повышении давле-
ния одного из газов. Автоматический отвод газов в атмосферу
141
предотвращает возможность смешения газов по линии перетока |
жидкости из одной части газосборника в другую (принципы, опре- 1
деляющие возможность автоматического поддержания уровня ]
жидкости в электролизере, регулирования и выравнивания давле- :
ния газов, изложены в главе III). ]
На трубопроводе для отвода газа потребителю за стеклянным •
фонарем установлен двухходовой клапан, при помощи которого
газ может направляться и в трубопровод, соединяющий аварий-
ный фонарь с атмосферой.
Конденсат для питания электролизера через аварийный фонарь
подается в водородную часть газосборника, щелочь для подпит-
ки — в кислородную часть.
Уровень жидкости контролируется по мерным стеклам, уста-
новленным на торцах каждой части газосборника. При уровне
около 500 мм запас жидкости в газосборнике равен 4 ж3, или око-
ло 12% количества электролита в электролизере. При отключении
агрегата жидкость из газосборника перетекает в электролизер,
при включении электролит передавливается из электролизера в
газосборник.
Первоначальная конструкция электролизера ФВ-500 не имела
холодильника-конденсатора, и газы охлаждались в газосборнике
с увеличенной поверхностью охлаждения (33,7 м2 в водородной
части и 22,9 м2 в кислородной).
Газосборник установлен на трех опорах: одна из них крепится
непосредственно к средней камере электролизера без изоляции,
две другие, установленные на концевых плитах, снабжены фарфо-
ровыми стойками-изоляторами (по две стойки на каждую опору).
Вся вспомогательная аппаратура электролизера — ловушки, кон-
денсатор, газосборник и фильтр имеют потенциал, равный потен-
циалу средней камеры. Все коммуникации для отвода газов, по-
дачи воды на питание и охлаждение электролизера, отвода кон-
денсата и охлаждающей воды присоединяются к газосборнику,
конденсатору или фильтру, т. е. к аппаратуре, находящейся под
напряжением, также равным потенциалу средней камеры. При
включении в серию одного электролизера с заземленной средней
камерой отпадает необходимость изоляции всех трубопроводов
для газов и жидкостей. При последовательном включении в серию
двух или четырех работающих электролизеров требуется специаль-
ная изоляция трубопроводов. Газовые линии электролизера
ФВ-500 изолируют установкой на газосборнике стеклянных фона-
рей. На трубопроводах для подвода и отвода воды установлены
резиновые шланги длиною не менее 2 м. Откачивание электролита
через съемный резиновый шланг производится при отключенном
электролизере.
Схема работы электролизера. Образующиеся при электролизе
воды газы раздельно поднимаются в верхнюю часть ячейки и че-
рез штуцера в раме вместе с электролитом отводятся в соответ-
ствующие газовые каналы электролизера.
142
В газовых каналах и в их средних звеньях происходит перво-
начальное (грубое) разделение газо-жидкостной эмульсии. Основ-
ная масса электролита, отделенная от крупных газовых включе-
ний, отводится в среднюю камеру для раздельного охлаждения
анолита и католита с 90—95 до 60—65°С. Уменьшение скорости
электролита в средней камере способствует достаточно полному
удалению из него пузырьков газа. После охлаждения и отделения
газов анолит и католит на выходе из средней камеры смешивают-
ся и поступают в фильтр для очистки от механических примесей.
Очищенный электролит направляется в смесительную коробку
средней камеры, куда подается также питательная вода из газо-
сборников. Из смесительной коробки электролит вместе с пита-
тельной водой через среднее звено питательного канала распре-
деляется по всем ячейкам в оба конца электролизера. Таким
образом осуществляется постоянная естественная циркуляция
электролита в ячейках электролизера.
Газы, выделившиеся из анолита и католита в средней камере,
возвращаются навстречу потоку электролита в средние звенья
газовых каналов и вместе с основными потоками водорода и кис-
лорода отводятся в соответствующие ловушки для щелочи. Вслед-
ствие изменений направления и скорости потока в ловушках про-
исходит дальнейшее отделение газов от брызг щелочи. Щелочь по
U-образной трубе отводится в средние звенья газовых каналов,
а газы из ловушек поступают в конденсаторы-холодильники, где
охлаждаются примерно до 40° С, и затем отводятся в соответ-
ствующие газосборники. Конденсат по U-образным трубкам на-
правляется в специальные сборники или в газосборник.
В газосборниках газы барботируют через слой жидкости, отмы-
ваются от щелочи, охлаждаются примерно до 35° С и через двух-
ходовые клапаны отводятся во внешнюю сеть потребителям. При
пуске электролизера до установления определенной чистоты газов
их сбрасывают в атмосферу. В случае понижения уровня жидкости
в газосборнике или чрезмерного повышения давления газ из газо-
сборника по аварийной трубе также отводится в атмосферу. Жид-
кость для питания электролизера подается через аварийный фо-
нарь в водородную часть газосборника, откуда перетекает в его
кислородную часть, а затем в коробку смешения средней камеры.
В электролизерах ФВ-500 потери электролита через неплотно-
сти корпуса незначительны и щелочь расходуется в основном на
компенсацию ее потерь в виде тумана, уносимого газами, особен-
но кислородом. При быстром подъеме нагрузки возможен переброс
щелочи из электролизера в конденсатор, приводящий к резкому
увеличению уноса щелочи с конденсатом и газами. Подпитка элек-
тролизера щелочью производится через аварийный кислородный
фонарь газосборника.
Система циркуляции электролита. При нагрузке 10 ка и тем-
пературе около 100°С газонаполнение электролита в электролизе-
рах ФВ-500 с нефутерованными рамами или с одной футерован-
143
ной полкой достигает 24%, а в аппаратах с тремя футерованными!
полками повышается до 32%. Это связано с уменьшением объема!
электролита в ячейке и загрязнением его продуктами разрушения]
футеровки. В пространстве между электродами газонаполнение!
электролита больше этих средних значений, а в верхней части |
электролизера — больше, чем в ячейке в целом. !
Система циркуляции электролита и конструкция электродов,
принятая в электролизерах ФВ, обеспечивают быстрый отвод вы-
деляющихся газов из рабочего пространства ячейки. Это дости-
гается созданием общей совместной циркуляции анолита и като-
лита через среднюю камеру и организацией местной циркуляции
в электродном элементе, обеспечиваемой конструкцией электрода.
Выделяющиеся в процессе электролиза пузырьки газа интенсивно
перемешивают электролит у поверхности электрода. Жидкость, на-
сыщенная выделяющимися пузырьками газа (газо-жидкостная
эмульсия), поднимается вверх между электродами. В верхней ча-
сти электролизера газы, увлекая с собой брызги и эмульсию (по
принципу мамут-насоса), поступают в газовые каналы. Некоторая
часть жидкости, менее насыщенная газом и имеющая большую
плотность, опускается в нижнюю часть электролизера по простран-
ству между основными и выносными листами электродов.
Скорость циркуляции электролита зависит от нагрузки, тем-
пературы, газонаполнения, концентрации щелочи, разности тем-
ператур электролита в средней камере и в ячейках, сечения путей
циркулирующих потоков, степени загрязнения фильтра, общего
уровня электролита в аппарате, длины трубок, отводящих газы из
ячеек, уровня установки газосборников и ряда других факторов.
С изменением нагрузки на электролизер значительно изменяется
газонаполнение электролита, в связи с этим изменяются плотность
газо-жидкостной смеси в ячейке и уровень электролита в аппарате.
Эти факторы влияют также на скорость циркуляции, которая ха-
рактеризуется отношением количества электролита, обмениваемо-
го за 1 ч, к его запасу в электролизере. Для повышения нижнего
предела нагрузки, при которой аппарат ФВ работает без большо-
го снижения скорости циркуляции электролита, применяют газо-
отводящие трубки сравнительно большой высоты.
При нагрузке 10 ка и температуре 90—95° С кратность цирку-
ляции в электролизере ФВ-500 последнего типа близка к 1, в элек-
тролизерах более старых моделей при таких же условиях она не-
сколько выше. При снижении нагрузки на 1000 а кратность
циркуляции уменьшается примерно .на 0,1. В нефутерованных ап-
паратах кратность циркуляции больше, чем в футерованных. Ин-
тенсивная циркуляция электролита в электролизерах типа ФВ
обеспечивает отвод избыточного тепла из ячейки и поддержание
нормального температурного режима по всей длине электролизе-
ра, а также выравнивание концентраций анолита и католита: при
нормальной циркуляции электролита максимальная разность тем-
ператур в отдельных ячейках не превышает 3°С, средняя концен-
144
трация щелочи в католите на 20—30 г/л выше, чем в анолите (об-
щая щелочность электролита 350—400 г/л). При нарушении
циркуляции электролита наблюдается повышение щелочности в
ячейках по направлению к катодному концу электролизера. Так,
по данным одного из заводов, после 5-часового прекращения цир-
куляции электролита щелочность в ячейках составляла:
№ ячейки с катодной стороны ... 1 45 77 120 131 150
Концентрация КОН в ячейке, г/л . . 453,2 452 410,5 388,1 394,8 230,1
Система питания электролизера и поддержания постоянного
уровня электролита. Уровень электролита поддерживается на
7з—V2 высоты газового канала и проверяется через смотровые
стекла, установленные в средних звеньях газовых каналов. При
чрезмерном повышении уровня электролита в газовых каналах
увеличиваются утечки тока и унос щелочи газами. Для поддержа-
ния постоянного уровня электролита в газовых каналах и ограни-
чения утечек тока устанавливают барботер в средних звеньях га-
зовых каналов на выходе газов в конденсаторы водорода и кисло-
рода. Это позволяет на 2—3% повысить выход по току. Система
питания и поддержания постоянного уровня (стр. 107) должна
автоматически компенсировать происходящие при остановках,
включениях электролизера и колебаниях его нагрузки изменения
объемов газо-жидкостной смеси в ячейках.
Давление газов в электролизере определяется давлением в
газгольдере, сопротивлением трубопроводов и контрольно-измери-
тельных приборов на трубопроводах от электролизера до газголь-
дера и обычно равно 500—1000 мм вод. ст.
При образовании большой разности давлений водорода и кисло-
рода во внешней сети и уменьшении уровня жидкости в одном из
газосборников ниже 100 мм обнажается выхлопная аварийная тру-
ба, и газ, имеющий повышенное давление, выходит в атмосферу.
Гидростатическое давление в средней камере независимо от
уровня жидкости в газосборнике остается постоянным до тех пор,
пока не изменится плотность жидкости в газосборниках и в них
сохранится хотя бы минимальный уровень жидкости, обеспечиваю-
щий барботаж газов.
Большая высота газоотводящих трубок компенсирует неизбеж-
ные изменения газонаполнения и плотности электролита, вызывае-
мые изменениями нагрузки на электролизере. Принятый метод под-
держания уровня в электролизерах ФВ-500 допускает значитель-
ную неравномерность питания электролизера водой и разности
давления газов в наружной сети. Минимальный гидравлический
напор со стороны газосборников, необходимый для нормальной
работы электролизера, определяется экспериментально и фикси-
руется установкой барботеров газосборников на требуемой высоте.
При включении электролизера объем электролита увеличивается
вследствие газонаполнения. Поскольку электролизер обычно вклю-
чается с ячейками, заполненными электролитом, при быстром
1Q Зак. 7И
145
увеличении нагрузки рост газонаполнения может вызывать пере-
полнение газовых каналов и переброс жидкости из электролизера
через ловушки в конденсаторы. Если в средних звеньях газовых
каналов установлены барботеры, уровень электролита в электро-
лизере автоматически поддерживается постоянным (примерно
7з высоты канала).
При подъеме нагрузки электролизера до 10 ка объем электро-
лита из-за газонаполнения увеличивается примерно на 6 м\ или
на 20% первоначального объема электролита. Это количество
жидкости во время пуска и подъема нагрузки должно быть пере-
дано в газосборники и частично в газовые каналы, где уровень
электролита повышается, если в электролизерах нет устройств,
ограничивающих его уровень.
В ходе дальнейшей работы электролизера объем жидкости
в нем постепенно уменьшается за счет разложения воды. При мед-
ленном подъеме нагрузки избыток электролита успевает перете-
кать в газосборник, благодаря чему не происходит переполнение
газовых каналов.
Система охлаждения электролизера. Значительное количество
электрической энергии, подводимой к электролизеру, преобразуется
в тепло. Незначительная часть этого избыточного тепла отводится
с вырабатываемыми газами и теряется через стенки электролизера
в окружающую среду, большая часть тепла отводится охлаждаю-
щей водой. Электролизер ФВ-500 снабжен водяными теплообмен-
никами трех типов, которые размещены в газосборниках, конден-
саторах и в средней камере. Для сокращения расхода охлаждаю-
щей воды ее подают последовательно во все теплообменники.
Свежая охлаждающая вода поступает в трубки кислородного,
затем водородного газосборника и охлаждает газы с 40 до 35° С,
после чего направляется в конденсаторы, где газы охлаждаются
с 95 до 40°С. Из конденсаторов охлаждающая вода поступает
в трубчатые теплообменники средней камеры, откуда отводится
при 60° С и может быть использована для нужд теплоснабжения.
При небольших нагрузках на электролизер количество воды,
требуемое для охлаждения газов в конденсаторе, больше, чем не-
обходимо для поддержания нормального температурного режима
средней камеры. В этих случаях избыток охлаждающей воды из
конденсаторов сбрасывается в канализацию. При высоких нагруз-
ках на электролизер для увеличения температурного перепада ме-
жду электролитом и охлаждающей водой дополнительно вводят
свежую водопроводную воду непосредственно в среднюю камеру.
Присутствие солей временной жесткости в охлаждающей воде
приводит к забивке теплообменных трубок, поскольку при 50—
60° С значительная часть карбонатов осаждается главным образом
в трубках теплообменника средней камеры. Трубки средней камеры
периодически прочищают и промывают холодной и теплой водой
или очищают 1—5%-ной ингибированной соляной кислотой. При
большом содержании солей в охлаждающей воде происходит уси-
146
денная коррозия охлаждающих трубок средней камеры, конден-
саторов и газосборников. Поэтому желательно охлаждать электро-
тзеры чистой водой, находящейся в замкнутом цикле и охлаждае-
мой вне электролизера в системе теплообменников или градирен.
Материальные и тепловые расчеты электролизера. Схема ма-
териального баланса дана в главе II (стр. 80). Ниже приведены
исходные данные для расчета материальных потоков и теплового
баланса электролизера ФВ-500 со 164 ячейками (п) при нагрузке
-1—11 ка (электролит — 30%-ный раствор КОН):
Выход по току.................................. 0,98
Температура *, °C
рабочая в электролизере /э.................... 95
после конденсаторов-холодильников /к ... 40
после газосборника /г........................ 35
питательной воды, поступающей в газо-
сборник ZnilT................................ 30
Энтальпия пара (принято), ккал/кг
при 95° С.................................. 637,2
» 40° С.................................... 614,7
» 35° С..................................... 612,6
Теплоемкость ср, ккал/(м3 • град)
водорода...................................... 0,306
кислорода.................................. 0,312
Парциальное давление паров воды, мм рт. ст,
над электролитом р3.......................... 400
в газах после конденсатора рк ............... 55
» » » газосборника рг.................. 39
Общее давление газов, мм рт, ст.
в электролизере Р3...................... 840
» конденсаторах ........................... 830
» газосборппках Рг........................ 800
* Принято, что температуры газов и жидкости в аппаратах равны.
Результаты расчета материальных потоков представлены в
табл. IV-2.
Расход питательной воды приведен в двух вариантах: 1) при
отборе всего конденсата, например на производство тяжелой воды;
2) при возвращении всего конденсата в электролизер. Небольшие
механические потери щелочи и жидкости в расчете не учиты-
ваются.
В электролизере типа ФВ-500 на полезную работу — разложе-
ние воды с получением водорода и кислорода расходуется только
60—65% затраченной энергии, а остальная ее часть, расходуемая
на преодоление необратимых процессов, сопровождающих электро-
лиз,— перенапряжения на электродах, сопротивления электролита,
электродов, контактов и т. д., превращается в тепло. Определенное
количество тепла отводится из электролизера с водородом, кисло-
родом и парами воды, насыщающими эти газы. Помимо этого тепло
теряется через стенки электролизера в окружающую среду. Избы-
ток тепла отводится в теплообменниках охлаждающей водой.
10’
147
Таблица IV-2. Материальные потоки в электролизере ФВ-500
(потоки газов в м3/ч, жидкости — в кг/ч)
Потоки Формула для расчета Нагрузка на электролизер, ка
4 6 8 10 11
Выработка водо- рода * _ 0,41/п 1000 268,8 403,2 537,6 672 739,2
Выработка кисло- рода* _ 0,205/п К°- “ 1000 134,4 201,6 268,8 336 369,6
Корпус электролизер а
Расход воды на разложение Унос воды в виде паров с водородом ^ = 0,805^ ^2(Н2) — °’805 рэ _рэГН2 216 196 324 294 432 392 540 490 594 539
» кислородом гжг’да,.'',/» 98 147 196 245 269,5
общий Общий расход воды ^2 = ^2(Нг) + Si (О2) g = gl + gi 294 510 441 765 588 1020 735 1275 808,5 1402,5
Конденсаторы
Унос воды в виде паров с водородом 15,3 23,0 30,6 38,3 42,1
» кислородом SsW’WSp/.'p/o, 7,7 11,5 15,3 19,2 21,1
общий Образование кон- денсата £з = йз(Нг) + (о2) §4 = Й2-§3 23,0 271,0 34,5 406,5 45,9 542,1 57,5 677,5 63,2 745,3
Газосборники
Унос воды в виде паров с водородом ^(Н2) = 0,805 рДргУН2 11,1 16,7 22,2 27,8 30,6
» кислородом 5,6 8,3 1U 13,9 15,3
общий Образование кон- денсата ^5 (Нг) ^5 (Ог) §5 ~ §3 — &5 16,7 6,3 25,0 9,5 33,3 12,6 41,7 15,8 45,9 17,3
Расход питательной воды
При полном отборе конденсата Без отбора кон- денсата £пит ^1+^4 + ^5 £пит - £1 + ^5 503,7 232,7 755,5 349,0 1007,4 465,3 1259,2 581,7 1385,2 639,9
* Объем продукционных газов приведен к нормальным условиям.
148
Таблица IV-3. Тепловой баланс электролизера ФВ-500
(в тыс. ккал/ч)
Статья прихода Формула для расчета Нагрузка на электролизер, ка
и расхода тепла 4 6 8 10 11
Корпус электролизера
Приход тепла
Джоулево тепло Qj = 0,86/п (£ — 1,48) 270 515 823 1200 1410
С питательной во- дой из газо- сборника Q2 = g/r 17,8 26,7 35,6 44,5 48,95
Общий приход Q — Qi + Q2 287,8 541,7 858,6 1244,5 1458,95
Расход тепла
С водородом ^1 ~ Ун,сН2*э 7,8 11,7 15,6 19,5 21,5
С кислородом ^О.со/э 4,0 6,0 8,0 10,0 11.0
Энтальпия паров воды, уносимых газами водородом (?з = 637,2§2 (нг) 125 187,5 250 312,5 343,8
кислородом Q4 = 637,2^ (о2) 62,5 93,75 125 156,25 171,9
Потери тепла че- рез стенки Отвод в холодиль- нике средней камеры Qe = Q-(Q(+ •• • + Qs) 40 48,5 40 202,75 40 420 40 706,25 40 870,75
Конденсатор водорода
Приход тепла
Общий приход 1 qu=q!+q‘ | 132,8| 199,2 | 265,6 1 332,0 1 365.3
Расход теп : л a
С водородом Q11 = ^Н2сН2^к 3,3 4,95 6,6 8,25 9,1
Энтальпия паров воды, уносимых водородом Q>' = 614,7^ 9,4 14,1 18,8 23,5 25‘,9
С конденсатом Q31 °* (£2 (Нг) ~ ёЗ( Н,)) Zk 7,25 10,9 14,5 18,15 19,95
С охлаждающей водой Qr = Qu- -(Q}4Q'' + Q^ 112,85 169,25 225,7 282,1 310,35
149
П родолжение
Статья прихода и расхода тепла Формула для расчета Hui рузка на элект ролизер, ка
4 6 8 10 11
Конденсатор кислорода
Приход тепла
Общий приход
66,5
99,75 133,0 166,25
Расход тепла
С кислородом Qi” = Ш 1,7 2,55
Энтальпия паров Q'11 - 6,4>7.?з(О2) 4,7 7,05
воды, уносимых кислородом
С конденсатом Q'" = (^2 (О2)“?3 (Ог) Zk 3,6 5,4
С охлаждающей водой QJ’1 = QIH- -(Q!" + Q’" + Q1") 56,5 84,75
7,2 9,0
113 141,25
155,35
QIU = Qi + Ql
Газосборник водорода
Приход тепла
Приход с пита- тельной водой Общий приход ^пит £цнтСгг q,v = q![+q"+Qn„T 15,1 27,8 22,65 41,7 30,2 55,6 37,75 69,5 41,5 76,5
Расход тепла
С водородом Ун/Wr 2,9 4,35 5,8 7,25 8,0
Энтальпия паров воды, уносимых водородом Q'v=61W5№) 6,8 10,2 13,6 17,0 18,7
С жидкостью в газосборник кислорода = Опит + + ^З(Нг) — ^5(Н,)) 17,8 26,7 35,6 44,5 49,0
С охлаждающей водой Qjv = QIV- -К+сГ+О 0,3 0,45 0,6 0,75 0,8
Газосборник кислорода
Приход тепла
Общий приход QV = QI1" +Q1II +Q1V 24,2 36,3 48,4 60,5 66,5
153
Продолжение
Статья прихода и расхода тепла Формула для расчета Нагрузка на электролизер, ка
4 6 8 10 п
Расход тепла
С кислородом = Vo/Wr 1,45 2,2 2,9 3,65 4,0
Энтальпия паров воды, уносимых кислородом = 612,6^5 (ад 3,4 5,1 6,8 85 9,35
С жидкостью в корпус электро- лизера qV = q2 17,8 26,7 35,6 44,5 48,95
С охлаждающей водой Q4v = Qv-(Qy + Qy + QD 1,55 2,3 3,1 3,85 4,20
Общее количество тепла, отводи- мого охлаждаю- щей водой от теплообменни- ков средней ка- меры, конден- саторов и газо- сборпиков Q7 = Ql + Ql1 +<?Г‘ + + Qf + Qt 219,7 459,5 762,4 1134,2 1341,45
Потеря тепла через корпус электролизера на основании расчета, про-
веренного специальными замерами, принята равной 40 000 ккал!ч
при температуре в электролизере 95° С и в помещении 20° С. По-
тери тепла через стенки конденсаторов-холодильников и газосбор-
ников в тепловом балансе не учитываются, так как температура
стенок этих аппаратов незначительно превышает температуру в от-
делении электролиза. Тепловой расчет приведен для случая пол-
ного отбора конденсата из холодильников газов.
В принятых условиях работы тепловая нагрузка на холодиль-
ники газосборников невелика. Основное количество избыточного
тепла отводится из электролизера через холодильники средней ка-
меры электролизера и через конденсаторы. При более точном рас-
чете необходимо учитывать нагрев газосборников теплом, теряе-
мым электролизером.
В табл. IV-3 приведены результаты теплового расчета электро-
лизера ФВ-500 при различных нагрузках /, которым соответствуют
следующие напряжения Е на ячейке:
/, ка........................ 4,0 6,0 8,0 10,0 11,0
Е, в........................ 1,96 2,09 2,21 2,33 2,39
Тепловой расчет по исходным данным (стр. 147) выполнен раз-
дельно для корпуса электролизера, конденсаторов-холодильников
151
и газосборников. В нем приняты те же условия, что для расчета
материальных потоков, поэтому величины и обозначения этих по-
токов соответствуют приведенным в табл. IV-2.
Электролизеры «Бамаг»5911
Биполярный электролизер фирмы «Бамаг» (рис. IV-20), сконструи-
рованный А. Зданским, нашел широкое применение в ряде стран;
Западной Европы. Электролизер производительностью 500 ж3/ч
водорода на нагрузку 7,5 ка состоит из 160 ячеек, стянутых бол-,
тами при помощи концевых плит. Электрод выполнен из основного’
(среднего) сплошного стального листа и двух выносных перфори-
рованных листов, укрепленных на основном листе при помощи ан-
керов. Анодная часть электрода никелируется. Между электрода-
ми установлены диафрагменные рамы из Т-образного стального
проката. Рама также никелируется. Диафрагмой служит плотная
асбестовая ткань, в асбестовую нить которой вплетена металличе-
ская проволока.
В верхней части рамы по обе стороны диафрагмы имеются от-
верстия для отвода газов, соединенные трубками с газовыми коль-
цами, образующими газовые каналы. Отверстие в нижней части :
рамы соединено с кольцом питательного канала.
Между диафрагменными рамами и электродами и между коль-
цами питательного и газовых каналов 1находятся паронитовые про-
кладки, служащие для изоляции деталей и уплотнения электроли-
зера и каналов при его стяжке. В середине электролизера разме-
щена камера, предназначенная для охлаждения электролита и
окончательного отделения от него газов. Электролитические ячей-
ки расположены по обе стороны средней камеры. На электроли-
зере размещены газосборники водорода и кислорода, необходимые
для промывки и охлаждения газов, отделения их от щелочи и вы-
равнивания давления газов в электролизере. Под газосборниками
установлен резервуар для компенсации увеличения объема элек-
тролита вследствие газонаполнения при пуске электролизера.
Газы из ячеек собираются в газовых каналах и поступают в
газосборники, а после промывки и охлаждения отводятся потре-
бителям. Отделившийся от газов электролит стекает в резервуар,
откуда поступает в среднюю камеру и после охлаждения возвра-
щается в ячейки электролизера через фильтр по питательному ка-
налу. Изоляция деталей электролизера аналогична их изоляции
в электролизерах ФВ.
Выход по току в электролизерах «Бамаг» достигает 98%, рас-
ход электроэнергии постоянного тока составляет 5,3—5,4 квт*ч!м3
водорода. Чистота газов: 99,95% водорода, 99,8% кислорода; плот-
ность тока 2500—3000 а!м\ температура электролита 75—80°С.
Помимо описанных аппаратов фирма «Бамаг» выпускает элек-
тролизеры с меньшим количеством ячеек для установок небольшой
152
Рис. IV-23. Электролизер «Бамаг»:
1 — токоподводящие шины; 2 —ячейки; 3 — каналы для сбора газа; 4— двухходовый клапан; 5 —стеклянные изоляционные фонари;
<5 —отвод газа в коллектор: 7 —отвод газа в атмосферу; 8 — стяжные болты; 9 — газосборник водорода; 10 — газосборник кислорода;
11 — стяжные плиты; /2—фильтр; 13 — средняя камера; 14— питательный канал; /5, 16 — средние звенья газовых каналов; 17 — емкость для
электролита.
производительности. Хара ктеристика этих электролизеров приве-
дена ниже:
Тип электролизера В-40 В-60 В-100 С-100 С-126 С-160
Производительность по водо- роду, М3}ч
при нормальной нагрузке 40 60 100 200 300 400
при повышенной нагрузке 50 75 125 300 400 550
Напряжение постоянного то-
ка, в Нагрузка, а 90 135 225 225 285 360
нормальная 2250 2250 2250 4500 5300 5600
максимальная 2800 2800 2800 6700 7100 7700
В Польской Народной республике выпускаются 19 фильтрпресс-
ные электролизеры типа ТЕ, по конструкции во многом аналогич-
ные электролизерам ФВ и «Бамаг». Электролизер ТЕ состоит из
комплекта прямоугольных биполярных электродов и диафрагмен-
ных рам, стянутых между двумя концевыми плитами при помощи
четырех болтов. Над электролизером размещено вспомогательное
оборудование (газосборник и промежуточный бак для щелочи).
Основная контрольно-измерительная аппаратура установлена на
газосборнике. Ниже приведена характеристика выпускаемых элек-
тролизеров ТЕ:
Тип электролизера.............................ТЕ 1-40
Нормальная производительность, м3/ч
по водороду............................... 40
» кислороду............................. 20
Максимальная производительность, м3/ч
по водороду............................... 53
» кислороду............................. 26,5
Расход электроэнергии * постоянного тока,
квт-ч1м3 Н2................................... 4,9
Лавление, мм' вод. ст......................... 200
Чистота, объем н. %
водорода...................................... 99,9
кислорода................................. 99,5
ТЕ2-60 ТЕЗ-80
60 80
30 40
78 104
39 52
4,84 4,80
2С0 200
99,9 99,9
99,5 99,5
* В расчете па влажные газы при 20° С.
Электролизеры работают при нагрузке 2,4—3 ка\ в качестве
электролита применяется раствор КОН концентрацией 250—280 г/л.
При 80—90° С напряжение на ячейке равно 2,1 в.
Электролизеры «Де-Нора»
Электролизеры фирмы «Де-Нора» (рис. IV-21) также представ-
ляют собой аппараты фильтрпрессного типа с биполярными элек-
тродами. Они могут выпускаться на нагрузку 1 —10 ка с числом
ячеек от 10 до 100. При температуре до 80°С и применении в ка-
честве электролита 29%-ного раствора КОН электролизер работает
с -напряжением на ячейке 2,0—2,1 в. Фирма гарантирует высокую
чистоту электролитических газов: 99,9% водорода и 99,7% кисло-
154
рода. Максимально допустимое давление газов в электролизерах
стандартной конструкции составляет 300 мм вод. ст., но в случае
необходимости можно предусмотреть работу и при более высоком
давлении. К Т-образной диафрагменной раме электролизера
(рис. IV-22) с двух сторон крепятся две асбестовые диафрагмы.
Каждый биполярный электрод состоит из основного листа и вы-
носных электродов, прикрепляемых к основному листу при помо-
щи контактных анкеров. При наличии двух диафрагм в каждой
ячейке образуются три камеры — анодная, катодная и промежу-
точная. Кислород, выделяющийся на анодной стороне биполярного
электрода, отводится из анодной камеры по трубопроводу в сепа-
ратор, отделяется от брызг электролита и по трубопроводу через
барботер поступает в кислородную часть газосборника, откуда от-
водится потребителю. Аналогично водород из катодного простран-
ства через сепаратор и барботер поступает в водородную часть
газосборника и затем отводится потребителю. Отделившийся от
газов электролит из сепараторов проходит через водяной теплооб-
менник и после охлаждения возвращается раздельно, соответ-
ственно в анодную и катодную части ячеек.
Незначительная часть электролитических газов, проникающих
через диафрагмы, поступает в промежуточную камеру, благодаря
чему предотвращается возможность взаимного загрязнения водо-
рода и кислорода. Из промежуточной камеры загрязненный газ
отводится в атмосферу.
155
Газосборник предназначен для охлаждения и промывки газов
и для поддержания равного давления в анодной и катодной частях
ячеек. В газосборнике установлены три не доходящие до дна пере-
городки, образующие четыре отделения: два крайних с барботе-
рами соответственно для кислорода и водорода и промежуточные
камеры, снабженные отверстиями для отвода газов в атмосферу.
Рис. IV-22. Схема устройства электролизера «Де-Нора» (продольный и попереч-
ный разрезы; поперечный разрез условно смещен по высоте):
/-диафрагменная рама; 2—промежуточная камера; 3 - анодная камера; 4 — катодная камера;
5 —выносные листы; 6 — анкера; 7 — холодильники электролита; 8 — диафрагма; 9 — основной
лист электрода; 10 — кислородный сепаратор; // — водородный сепаратор; /2 — вспомогательный
сборник; 13 — регулирующие клапаны; 14 — штуцер для отвода газов в атмосферу; 15 — кисло-
родный барботер; 16 — переливная трубка; /7 — водородный барботер; 18 — кислородная часть
газосборника; 19 — водородная часть газосборника; 20 — корпус газосборника; 2/, 22—проме-
жуточные камеры газосборника.
Питательная вода подается в электролизер через газосборник,
уровень жидкости в промежуточных камерах определяется высо-
той переливной трубы, уровень в барботажных частях газосбор- (
ника зависит от давления газов в коллекторах, подающих газы ’
потребителям. Однако независимо от давления в коллекторе дав-
ление газов в электролизере определяется атмосферным давлением '
и расстоянием от открытой верхней части переливной трубки до \
уровня барботеров. Если в одном из барботажных отделений газо- \
сборника давление газа чрезмерно повышается, часть его отводит-
ся в атмосферу через соответствующие промежуточные камеры.
Питательная вода из газосборника по переливной трубе ча-
стично направляется в промежуточный сборник и далее на пита-
ние электролитических ячеек. Часть питательной жидкости по
156
трубе поступает в электролизер, минуя промежуточный сборник,
распределение потоков жидкости из газосборника через промежу-
точный сборник и по отводной трубе регулируется клапанами,
установленными на трубопроводах.
Электролизерами «Де-Нора» оборудована крупная электроли-
тическая установка в Индии, предназначенная для получения водо-
рода и кислорода, а также для производства тяжелой воды.
Электролизеры «Демаг»20*24
Биполярный фильтрпрессный электролизер «Демаг» типа EV раз-
работан в конце 40-х годов. Электролизеры выпускаются на на-
грузку от 150 до 8500 а, их производительность от 0,05 до 380 м3/ч
Н2. В электролизерах одноблочной конструкции до 50 ячеек, в
двухблочной конструкции до 100. В двухблочном варианте холо-
дильник циркулирующего электролита вмонтирован в среднюю
часть электролизера.
В 1960 году в Асуане (ОАР) начал работать крупнейший в
мире цех электролиза воды 22’23, оборудованный этими электролизе-
рами. В цехе установлено 36 серий по 8 электролизеров в каждой.
Отдельные электролизеры серии
нием. Общая производительность
цеха при нагрузке 7500 а равна
40 000 м3/ч водорода. Блоки
электролитических ячеек, из ко-
торых монтируется серия элек-
тролизеров, подготовляют и со-
бирают на заводе-изготовителе и
в собранном виде доставляют к
месту монтажа. Каждый такой
блок включает 43—45 ячеек, со-
стоящих из диафрагменных рам
и биполярных электродов.
Электролизеры «Демаг» пока-
заны на рис. IV-23 и IV-24.
Водород и кислород вместе с
электролитом из ячеек посту-
могут отключаться шунтирова-
Рис. IV-23. Вариант схемы электро-
лизера «Демаг»:
/ — фильтр электролита; 2 — блоки электро-
литических ячеек; 3- средняя камера элек-
тролизера; 4 — сборник-холодильник элек-
тролита; 5 - холодильник газа; 6-уравни-
тель давления газов.
пают в горизонтальные газовые
каналы, а затем в газосборники,
где отделяются от брызг элек-
тролита, охлаждаются и через
изолированные участки труб от-
водятся в общесерийные газопро-
воды. Электролит из газосборни-
ка через теплообменник, фильтр и нижний питательный канал воз-
вращается в ячейки. Описанная схема циркуляции электролита
является важной особенностью электролизера24. Газы из каждой
серии электролизеров поступают в общецеховой газопровод через
157
Рис. IV-24. Электролизер (а) и серия электролизеров «Демаг» (б) на нагрузку
7,5 ка производительностью около 1150 м3/ч водорода.
серийный регулятор давления и гидрозатвор. В серийный гидро-
/.атвор подается дистиллированная вода для питания электролизе-
ров. Регулятор выравнивает разность давлений при возникновении
се в общецеховых газопроводах и в случае необходимости автома-
тически отключает серию от общего газопровода. Регулятор соеди-
нен с предохранителем, обеспечивающим отвод газов в атмосферу
при превышении нормального давления и в период пуска установки.
Цех электролиза в Асуане оборудован центральным пультом
управления, откуда контролируется режим работы: напряжение на
отдельных электролизерах и
сериях, состояние их изоляции
от земли, температура в ап-
паратах, чистота газов. Преду-
смотрена возможность уста-
новки автоматических регуля-
торов температуры на каждом
электролизере и автоматиче-
ская подача азота для продув-
ки аппаратов при остановке.
По рекламным данным фир-
мы, чистота продуцируемых
газов: 99,9% водорода и
99,7% кислорода.
Зависимость напряжения и
Рис. IV-25. Зависимость напряжения
на ячейке и удельного расхода электро-
энергии постояного тока от нагрузки
(электролит 30%-ный раствор КОН).
удельного расхода электро-
энергии от нагрузки на электролизерах асуанской установки при-
ведена на рис. IV-25 (по результатам работы 144 электролизе-
ров22, включающих 6192 электролитические ячейки).
Электролизеры прибывают на место установки в собранном
виде и на фундаментах устанавливаются при помощи передвиж-
ных кранов. Поэтому отпадает необходимость в оборудовании
цеха тяжелыми монтажными кранами и облегчается оформление
строительной части здания. Для монтажа вспомогательного обо-
рудования используются легкие передвижные монтажные краны.
На рис. IV-26 показан цех электролиза воды с электролизе-
рами «Демаг» в процессе монтажа. Хорошо выполненная венти-
ляция цеха обеспечивает приемлемую температуру23 в помеще-
нии, несмотря на большую теплоотдачу от стенок электролизеров,
работающих примерно при 80°С, и высокую температуру наруж-
ного воздуха, достигающей 48° С.
Электролизеры «Эрликон»
Электролизеры «Эрликон» фильтрпрессного типа (рис. IV-27 и
IV-28) для работы при атмосферном давлении выпускаются25 раз-
ной производительности — от 2 до 500 м3/ч водорода. В зависи-
мости от требуемой мощности кличество ячеек в электролизере
может изменяться от 5 до 140.
159
Рис. IV-26. Монтаж электролизера «Демаг» из блоков:
а — блок электролитических ячеек электролизера «Демаг» на нагрузку 7,5 ка.
производительностью 145 лс3/ч Нг; б — монтаж электролизера из блоков.
Электролизеры малой мощности работают без внешней цирку-
,1яшш электролита. Охлаждение электролизера осуществляется
за счет отдачи тепла его наружной поверхностью. Для повышения
коэффициента теплоотдачи от поверхности аппарата электроли-
зеры заключены в кожух, через который просасывается воздух.
В электролизерах большой мощности организована принудитель-
ная циркуляция электролита через холодильник при помощи на-
соса.
Рис. IV-27. Электролизер «Эрликон» малой мощности
В электролизере применяются биполярные электроды с вынос-
ными перфорированными листами, одинарная асбестовая диа-
фрагма и наружные газосборные каналы для водорода и кисло-
рода. Выносные электроды, перфорированные круглыми отвер-
стиями, попарно прикреплены металлическими анкерами к основ-
ному листу, служащему разделительной перегородкой. Электроды
изолированы от диафрагменной рамы уплотнительной проклад-
кой. Диафрагма из асбестовой ткани крепится к раме при по-
мощи накладок и заклепок. Все те части, с которыми соприкасается
диафрагменная ткань, округлены для уменьшения ее истирания.
Анодная сторона электродов и поверхность диафрагменной рамы
никелированы, заклепки для крепления диафрагмы изготовлены
из чистого никеля. Катодная поверхность электрода подвергается
специальной обработке для снижения перенапряжения выделения
водорода. Электролитические ячейки стягиваются в единый блок
электролизера между концевыми плитами при помощи стяжных
болтов с пружинами. Рамы электролизера через изоляторы опи-
раются на фундамент.
11 Зак. 713
161
Рис. IV-28. Схематический разрез электро-
лизера «Эрликон»:
1 — изоляторы; 2 — основной лист биполярного электрода;
3 — диафрагма; 4 —выносные электроды; 5— концевая
плита; 6 - уплотняющая и изолирующая прокладка;
7 — диафрагменная рама; 8 — стяжной болт; 9 — пружина.
о2 Н2О н2
t Ml f
Рис. IV-29. Схема электролизера «Эрликон»:
/ — термометры; 2 — отделитель газа; 3 — изоляционные вставки; 4 — труба уравнителя давления;
5 — газоотводные трубки; 6 — электролитические ячейки; 7 — холодильник щелочи; 8 — питатель-
ный трубопровод; манометры; /(/ — насос; 11 — щелочной бак; 12 — фильтр; 13 — перелив из
щелочного бака; /4 — холодильник газов; /5 — переключающий газовый вентиль; /6 —водяной
затвор; /7 —обратный клапан; 18 — предохранительный затвор; 19 — переток дистиллята.
В электролизерах большой мощности имеются средняя камера
для охлаждения электролита и устройства для его принудитель-
ной циркуляции и фильтрации. Схема, общий вид и узлы такого
электролизера представлены на рис. IV-29 и IV-30. В электроли-
зерах меньшей мощности камера для охлаждения электролита
может располагаться также на конце электролизера.
Из ячеек газы по наклонным трубкам отводятся в газоотдели-
1 ели, снабженные теплообменниками. Щелочь из газоотделителей
поступает в бак, откуда через фильтр при помощи насоса, выпол-
ненного без сальниковых уплотнений, по трубопроводу подается
в ячейки электролизера. Газоотделители служат также для вы-
равнивания давления газов в анодном и катодном отделениях
ячеек. В электролизере может поддерживаться избыточное дав-
ление до 500 мм вод. ст. Электролизер работает на 25%-ном рас-
творе КОН при 75° С, напряжение на ячейке равно 2,1—2,3 в, при
этом расход электроэнергии постоянного тока составляет 5,1—
5,6 кет • ч/м3 Н2.
Сообщалось26»27 о выпуске нескольких моделей биполярных
электролизеров «Эрликон» типа EBN на различную производи-
тельность. Эти модели характеризуются следующими показате-
лями:
Тип электролизера . . . . EBN-55 EBN-110 EBN-220 EBN-330
Максимальное число ячеек . . . . . 20 40 50 70
Нормальная нагрузка, а . . . . . . 1 100 2 200 4 400 6 600
Производительность. м3/ч рода * водо- . . . . 10 40 100 210
Габариты, мм длина . . . . 2 600 3 800 4 400 6600
ширина . . . . 1800 2 050 3 150 3 960
высота . . . . 2500 3 300 3 800 3 800
Масса (без электролита), кг . . . . 5 000 10 000 18 400 31400
* Объем газа приведен к нормальным условиям.
Нагрузка на электролизеры может быть повышена на 10% по
сравнению с номинальной. В зависимости от потребности в водо-
роде количество ячеек в электролизерах может быть изменено для
обеспечения производительности агрегата в пределах 2—
210 м3/ч Н2.
Комплект биполярных электродов, диафрагменных рам и про-
кладок при помощи концевых плит и болтов на месте изготовле-
ния стягивается в блок массой не более 30 т, ставится на опоры
и в готовом виде транспортируется к месту монтажа. Общий вид
такого блока показан на рис. IV-30, в. Присоединение трубок для
подвода щелочи и отвода газов из ячеек видно на рис. IV-30, г.
Для предотвращения коррозии все эти трубки выполняются из
чистого никеля (99,9% Ni), газоотделители — из хромоникельмо-
либденовой стали.
Катодная сторона биполярных электродов подвергается спе-
циальной активации по рецепту фирмы «Норск — Гидро», что
Л* 163
обеспечивает снижение напряжения на 10% по сравнению с обыч-
ными неактивированными катодами. С течением времени напря-
жение на электролизере повышается, но незначительно, поэтому
ювторную активацию катодов обычно проводят при капитальном
ремонте после 8—12 лет нормальной эксплуатации.
Охлаждение, промывка и частичная сушка газов проводятся
в колонне с насадкой, нижняя часть которой служит приемни-
ком питательной воды. Питательная вода при помощи насоса не-
прерывно циркулирует через колонны и холодильник, а часть ее,
регулируемая по показаниям ротаметра, подается на питание
электролизера. Охлаждающая вода из теплообменника поступает
на предварительное охлаждение газов в газоотделитель.
Электролизеры Пехкранца9-11 28
Электролизер Пехкранца был первым биполярным электролизе-
ром, получившим широкое промышленное применение в ряде за-
падноевропейских стран в 20—30-х годах. Такими электролизе-
рами был оборудован очень крупный цех электролиза воды
в Рыокане (Норвегия), потреблявший более 100 000 кет. Электро-
лизер монтируется по типу фильтрпресса из рам и электродов
круглого сечения, внутренние каналы для сбора газов и распре-
деления циркулирующего электролита и питательной воды также
имеют круглое сечение. Холодильники циркулирующего электро-
лита и вспомогательная аппаратура для первичной обработки
газов располагаются в торце электролизера.
Особенностью электролизеров этого типа является разделение
анодного и катодного пространств металлической диафрагмой из
никелевой фольги толщиной 0,1 мм, перфорированной отверсти-
ями размером менее 0,1 мм (800—1400 оте/см'2). Плоские одинар-
ные электроды выполнены из стального листа толщиной не-
сколько миллиметров, анодная сторона электрода никелирована.
Диафрагменная рама изготовлена из U-образпого стального про-
филя толщиною около 30 мм. Внутри рам при помощи цементной
массы закреплены диафрагмы. Во избежание смешения газов
часть диафрагмы, выступающая над уровнем электролита, не пер-
форирована. Эта верхняя часть диафрагмы имеет форму сег-
мента, наибольшая высота которого в электролизерах диаметром
1,8 м равна 25 см. Между электродами и рамами находится изо-
ляционное уплотнение — асбестовый шнур, пропитанный обычным
или окисленным битумом. Диафрагменные рамы, электроды и
уплотняющие прокладки между рамами и электродами имеют
отверстия, образующие при сборке электролизера газосборные
и питательный каналы электролизера.
Комплект электродов и рам стягивается болтами между двумя
стальными плитами, одна из которых неподвижно установлена на
фундаменте, а другая перемещается на роликах по направляю-
щим. Нижние стяжные болты электролизера уложены на изоля-
165
торах. Каждый десятый электрод при помощи двух приливов и
изолирующих прокладок опирается на болты. Остальные электро-
ды и рамы закрепляются в пакете только за счет сжатия. Схемы
работы электролизера, циркуляции и охлаждения электролита,
регулирования давления не отличаются от обычно применяемых
в большинстве биполярных электролизеров других типов.
Вследствие большого сопротивления диафрагмы (особенно
после забивки ее отверстий) и большого расстояния между рабо-
чими поверхностями электродов напряжение на ячейке находится
в пределах 2,3—2,5 в при низкой электродной плотности тока
(600—800 а/м2). Количество ячеек в электролизере достигало 115.
Электролизер из 88 ячеек имел длину 8 м, при диаметре электро-
лизера 1,8 м его высота от уровня пола достигала 2,5 м. Чистота
газов: 99,2—99,6% Н2 и 98,0—98,7% О2.
В настоящее время электролизеры Пехкранца уступили ме-
сто новым более совершенным аппаратам, работающим с мень-
шим удельным расходом электроэнергии и обеспечивающим более
высокую чистоту газов.
4. ЭЛЕКТРОЛИЗЕРЫ ДЛЯ РАБОТЫ ПОД ДАВЛЕНИЕМ
Проведение электролиза воды под давлением дает большие тех-
нические и экономические преимущества перед процессом при
обычном давлении: снижается напряжение на ячейке, исключается
необходимость в дополнительной затрате энергии на компримиро-
вание газов и упрощается технологическая схема электролитиче-
ской установки. Получаемые под давлением газы содержат зна-
чительно меньше паров воды, поэтому облегчается их оконча-
тельная осушка (если она необходима). Проведение процесса
электролиза под давлением связано с некоторым усложнением
конструкции электролизера и увеличением его стоимости и стоимо-
сти вспомогательной аппаратуры. В настоящее время разработаны
и используются в промышленности аппараты для электролиза
воды под давлением 10—40 ат.
Для таких крупных потребителей водорода, как синтез ам-
миака или метанола, необходим газ под давлением 300 ат и бо-
лее. В ряде стран ведутся работы по созданию электролизеров
для работы под давлением порядка сотен атмосфер, однако
сведений об их промышленном использовании пока не опублико-
вано. Большинство более мелких потребителей удовлетворяет срав-
нительно невысокое давление чистого водорода (10—40 ат). При
разработке электролизеров на такое давление найдены удовле-
творительные конструктивные решения, позволяющие избежать
слишком большого увеличения габаритов и удорожания аппа-
ратуры.
Для технического оформления промышленного электролиза
воды под давлением наиболее трудной проблемой является раз-
работка таких конструкций аппаратов, которые при достаточной
166
фостоте гарантировали бы их надежную работу, высокую чистоту
газов и хорошую герметичность. При этом необходимо также соз-
дание системы автоматического поддержания равенства давле-
ния обоих газов в ячейках электролизера, независимо от возмож-
ной разности их давления в наружной (потребляющей) сети.
Разность давлений по обе стороны диафрагмы в электролитиче-
ской ячейке не должна превышать нескольких десятков миллимет-
ров водяного столба, т. е. сотых или тысячных долей общего ра-
бочего давления.
Попытки осуществить промышленный электролиз воды под
давлением делались уже давно. Первый электролизер для разло-
жения воды под давлением был предложен русским ученым
Д. А. Лачиновым 29 в 1888 г. В 20—30-х годах XX в. проведено
много работ в области конструирования и испытания опытных
конструкций электролизеров для работы под давлением. Однако
эти работы 29-33 не были завершены и не нашли применения
в промышленности.
Впервые производственная конструкция электролизера для
работы под давлением создана и внедрена в промышленность на-
шей страны в 30-х годах 34’35, когда были разработаны электроли-
зеры типа ЭФ. Несколько позже созданы и внедрены электроли-
зеры типа СЭУ36. За рубежом первые промышленные электроли-
зеры для работы под давлением конструкции Зданского — Лонца
появились на 15—20 лет позже.
Ниже приведены показатели электролизеров для работы под
давлением до 10 ат, широко применяемых в СССР в настоящее
время:
Тип электролизера ЭФ-24/12-10 ЭФ-12/6-10 СЭУ-8м СЭУ-4м
Производительность *,м3/ч по водороду 24 12 8 4
» кислороду 12 6 4 2
Число ячеек 100 50 34 30
Нагрузка, а 610 610 610 330
Плотность тока, а/м2 .... 1560 1560 1560 2600
Напряжение на ячейке**, в 2,3 2,3 2,3 2,4
Расход электроэнергии *, кет •ч/м3 Н2 • • 5,6 5,6 5,6 5,8
Электрическая мощность, кет . 140 70 50 24
Габариты, мм длина 5100 3000 2050 1700
ширина 1200 1200 915 610
высота 1590 1590 1080 800
Масса (без электролита), кг . 7930 4850 3200 1270
* В расчете на объем газов, приведенный к нормальным условиям.
'* Практически напряжение на ячейке ниже на 0,1 —0,2 в.
Электролизеры типа ЭФ
Фильтрпрессные электролизеры типа ЭФ с биполярным включе-
нием электродов и одинарной диафрагмой рассчитаны на работу
под давлением до 10 ат. Они имеют раму круглого сечения и
167
выносные газовые и питательный каналы. В электролизерах Эф
принята раздельная система стяжки и уплотнения корпуса и кана-
лов34, облегчающая герметизацию фильтрпрессного электроли-
зера при работе под давлением. Для уменьшения жесткости со-
единения при четырех независимых системах стяжки одного аппа-
рата была увеличена длина газовых и питательных трубок, что
повысило их компенсирующую способность. Удлинение газовых
трубок способствовало также увеличению движущей силы цирку-
ляции электролита и повышению ее интенсивности.
Для регулирования давления газов и поддержания равенства
давлений водорода и кислорода в электролитических ячейках
Рис. IV-31. Электролизер ЭФ 12/6:
/ — корпус; 2 — газовый канал; 3 — трубки для отвода газов; 4— плита для стяжки каналов;
гачка для стяжки каналов; 6 — стяжной болт газовых и питательного каналов; 7 —стяжная
плита; Я-комплект пружин; 9 - штуцер газового канала; 10 — стяжной болт корпуса электро-
лизера; 11 — гайка; 12 — питательный канал; 13 — трубки питательного канала.
принята схема, комбинирующая гидравлический барботажный ре-
гулятор давления с системой двух игольчатых клапанов, связан-
ных с поплавками37. При этом поплавковый регулятор обеспечи-
вает грубое, а гидравлический барботер более точное регулиро-
вание давления газов.
Электролизеры типа ЭФ рассчитаны па нагрузку 610 а и выпу-
скаются двух типов. Электролизер ЭФ-24/12 состоит из 100 ячеек,
и при номинальной нагрузке его часовая производительность со-
ставляет 24 л/3 Н2 и 12 л/3 О2. Электролизер ЭФ-12/6 имеет 50 ячеек
и вдвое меньшую производительность. Эти электролизеры рассчи-
таны на работу при сравнительно небольшой плотности тока
(1560 a/ж2) и могут быть интенсифицированы при повышении на-
грузки до 1000 а. Для этого необходимо усиление токоподводящих
шин и увеличение скорости циркуляции электролита.
Схема электролизера ЭФ-12/6 приведена на рис. IV-31. Ячейки
сжаты между двумя стальными плитами при помощи четырех
168
Золгов. Для компенсации температурного расширения и усадки
прокладок в процессе работы стяжные болты снабжены комплек-
юм тарельчатых пружин.
Биполярный электрод состоит из сплошного основного листа
шаметром 870 мм (служащего также перегородкой между сосед-
шмп ячейками), к которому па анкерах при помощи электроза-
клепок крепятся выносные перфорированные листы диаметром
700 мм. Выносные листы электродов перфорированы отверстиями
чиа метром около 6 мм с шагом между ними около 9 мм. Анодная
сторона основного листа электрода и выносной анод с обеих сто-
лон покрыты гальваническим слоем никеля толщиной 100 мк.
Рис. IV-32. Сборка электролизера типа ЭФ.
К внутренней полке стальной диафрагменной рамы со стороны,
обращенной к аноду, прикреплена асбестовая диафрагма, анало-
гичная применяемой в электролизерах ФВ. В верхней части рамы
по обе стороны диафрагмы имеется два штуцера, соединенные с
кольцами газовых каналов; в нижней части рамы находится шту-
цер, соединяющий оба электродных пространства ячейки с кольцом
питательного канала. С наружной стороны рама снабжена двумя
фигурными лапками (па рисунке не показаны), которыми она че-
рез изоляторы опирается на стяжные болты. Внутренние поверх-
ности рамы и колец каналов, накладки и заклепки для крепления
диафрагмы никелированы слоем в 100 мк. На наружных поверх-
ностях деталей толщина никелевого покрытия должна быть не
менее 25 мк.
При стяжке рамы и биполярные электроды образуют цилинд-
рический корпус электролизера; звенья питательного и газовых
каналов имеют самостоятельную стяжку (для каждого канала) из
двух плит и четырех болтов. Сборка корпуса электролизера с обра-
зованием газовых и питательного каналов показана на рис. IV-32.
Уплотнение электролизера и электрическая изоляция электро-
дов от рам и стяжных плит, а также уплотнение и изоляция
169
звеньев каналов производятся паронитовыми прокладками. Элек-
тролизер опирается на фундамент концевыми плитами, между пли-
тами и фундаментом уложены изоляционные прокладки. Конст-
рукция электролизера предусматривает совместную циркуляцию
электролита, что обеспечивает охлаждение и выравнивание кон-
центрации анолита и католита.
Для предотвращения возможности обнажения диафрагмы при
резких колебаниях давления в газопотребляющей сети и возни-
кающей при этом некоторой разности давления газов по обе сто-
роны диафрагмы нормальный уровень электролита в электроли-
зере значительно выше верхнего края диафрагмы и поддержи-
вается на отметке оси газового канала.
В отличие от электролизеров типа ФВ, вся вспомогательная
аппаратура которых является непосредственной частью агрегата,
в электролизерах ЭФ операции регулирования и первичной об-
работки газов выполняются в отдельных аппаратах, которыми
комплектуется электролитическая установка. Схема типовой про-
мышленной установки для электролиза воды под давлением, обо-
рудованной электролизерами типа ЭФ, приведена на рис. 1V-33.
Образующиеся при электролизе водород и кислород соби-
раются в газовых каналах и вместе с уносимым ими электролитом
поступают в соответствующие разделительные колонки, служащие
для сепарации жидкости от газов и охлаждения циркулирующего
электролита.
Разделительная колонка представляет собой цилиндрический
сосуд со сферическими днищем и крышкой и снабжена змеевиком,
по которому подается охлаждающая вода. Электролит по выходе
из обеих разделительных колонок смешивается, проходит фильтр
и далее поступает в питательный канал электролизера. Газы после
отделения брызг электролита отводятся из разделительных коло-
нок в промыватели, где, барботируя через слой жидкости, охла-
ждаются и отмываются от унесенных ими брызг электролита. Из
промывателей газы раздельно направляются через соответствую-
щие регуляторы давления в ресиверы.
Промыватели газов служат также для тонкого регулирования
перепада давления газов и являются промежуточными емкостя-
ми для приема избытка электролита из ячеек, возникающего за
счет газонаполнения при подъеме нагрузки, и емкостью для за-
паса питательной воды. Цилиндрический промыватель газов со
сферическими крышками снабжен установленным на определен-
ной отметке барботером, через который поступает газ из разде-
лительной колонки, и змеевиком-холодильником. Через боковые
штуцера водородный и кислородный промыватели газов соеди-
няются с соответствующими уравнителями давления: через ниж-
ние штуцера оба промывателя соединены между собой, а также
с питательной линией электролизера и с питательным бачком.
Регуляторы давления газов обеспечивают стабилизацию дав-
ления в электролизере при его изменении в газопотребляющей
170
Рис. IV-33. Технологическая схема электролитической установки с электролизерами типа ЭФ:
/ — сборник питательной воды и электролита; 2 — питательный бачок; 3 — регулятор давления кислорода; 4 — промыватель кислорода; 5—кисло-
родная разделительная колонка: 6 — электролизер; 7 —водородная разделительная колонка; 8 — промыватель водорода: 9 — регулятор давления
водорода; 10, 11 — ресиверы; 12 - водопроводная линия; 13 — линия промышленной канализации.
Рис. IV-31. Регулятор давления
в электролизерах ЭФ:
/ — поплавок; 2 — корпус, 3 — шток кла-
пана; 4 — направляющая втулка; 5—
крышка; 5 —гнездо клапана.
сети. По газу и жидкости регулятор соединяется с соответствую-
щим промывателем газа. Общий вид регулятора давления газов
представлен на рис. IV-34. В вертикальном сварном сосуде со
съемной крышкой на штоке подвешен поплавок, скользящий в на-
правляющей втулке. К верхней части штока при помощи накид-
ной гайки шарнирно крепится клапан. Размеры регулирующих
клапанов выбирают в зависимости от производительности уста-
новки и режима ее работы. Для
электролизеров типа ЭФ приме-
няются клапаны диаметром 16 мм.
В верхней крышке регулятора уста-
новлен предохранительный клапан
для ограничения роста давления
выше допустимого.
Схема регулирования давления
газов описана в главе III. В зави-
симости от характера потребления
газов применяется схема с выбро-
сом избытка одного из газов в ат- .
мэсферу или схема работы элек-
тролизера под максимальным даг^-
лсписм со сбросом (в случае необ-
ходимости) избыточного газа через
предохранительные клапаны реси-
веров установки. По первой схеме
игольчатый клапан регулятора дав-
ления газа, имеющегося в избытке,
в случае превышения установлен-
ного давления периодически приот-
крывается и выпускает часть избы-
точного газа в атмосферу. По вто-
рой схеме подача газа из электро-
лизера в ресивер регулируется по
максимальному давлению газа з
ресивере и газопотребляющей сети.
Ресиверы и регуляторы давления снабжены предохранительными
клапанами.
Уровень жидкости в электролизере и разделительных колон-
ках фиксируется высотой установки барботеров в промывателях
газов и не зависит от уровня жидкости в промывателях до тех
пор, пока не прекращается барботаж газа через слой жидкости.
Питание ячеек электролизера жидкостью из промывателей газов
происходит автоматически. Промыватели и регуляторы давления
служат также жидкостными буферами для питания ячеек элек-
тролизера. Подача питательной воды в систему производится са-
мотеком, так как газовое пространство питательного бачка в ра-
бочем состоянии соединено с кислородной линией электролизера.
В питательный бачок вода может подаваться высоконапорным
172
или обычным насосом, если при заполнении бачок отключается от
системы электролизера, находящегося под давлением, и соеди-
няется с атмосферой.
Электролизеры ЭФ могут работать как при повышенном дав-
лении (до 10 а?), так и при атмосферном. Высокая чистота про-
дуцируемых газов (99,8—99,2% Н2 и 99,6—99,0% О2) сохраняется
даже при резких колебаниях давления в газопотребляющей сети.
При работе электролизеров типа ЭФ под повышенным давле-
нием уменьшается газонаполнение электролита, что способствует
снижению движущей силы циркуляции и может привести к на-
рушению температурного
режима работы ячеек элек-
тролизера.
Г азонаполнение элек-
тролита в аппаратах, рабо-
тающих под давлением, из-
меняется с ростом плотно-
сти тока и рабочего давле-
ния. На рис. IV-35 приве-
дена36 зависимость газона-
1/р
Рис. IV-35. Газонаполнение электролита
в ячейках электролизеров, работающих под
давлением (<рср — среднее газонаполнение;
z — плотность тока, а!м2\ Р — давление, ат):
/ — элетролизер ЭФ-24/12 12; 2 — электролизер
СЭУ-4-м.
волнения электролита от
величины отношения плот-
ности тока к давлению i: Р
для электролизеров типа
ЭФ-24/12 и СЭУ-4м.
Отвод газо-жидкостной
смеси из газовых каналов
в разделительные колонки и подача охлажденного электролита
в питательный канал производятся в средней части электролизера.
Поэтому наибольшая интенсивность циркуляции электролита на-
блюдается в средних ячейках. В крайних ячейках (с обеих сторон
электролизера) вследствие дополнительного сопротивления в кана-
лах циркуляция электролита менее интенсивна. Поэтому возникает
разница температур электролита в ячейках по длине электроли-
зера. Ниже приведены температуры электролита36 в ячейках
электролизера ЭФ-24/12, состоящего из 100 ячеек и работающего
при нагрузке 600 а под давлением 2 ат:
№ ячейки...................... 1 5
Температура, °C.............. 76 86
10 20 30 40 50 90 95 100
80 78 79 60 48 80 81 77
Наиболее интенсивно охлаждаются средние ячейки. Темпера-
тура электролита в крайних ячейках примерно па 35° С выше, чем
в средних. Несколько пониженная температура самых крайних
ячеек объясняется большой потерей тепла в окружающую среду.
С повышением давления неравномерность распределения темпе-
ратур по ячейкам может увеличиться.
Для улучшения циркуляции на циркуляционном контуре мо-
жет быть установлен насос; это практикуется в электролизерах
173
некоторых конструкций. Предложен36 также способ повышения
движущей силы естественной циркуляции за счет размещения
разделительной колонки на более высоком уровне и образования ‘
вертикального участка трубы для газо-жидкостной эмульсии на |
пути от газового канала к колонке 2 (рис. IV-36). При этом разли- i
чие температур в ячейках по длине электролизера, работающего j
под давлением 2 ат при нагрузке 600 а. не превышает 2° С, а при
Рис. IV-36. Схема электролизера ЭФ с усиленной естественной циркуляцией
электролита:
/ — электролизер; 2 — разделительная колонка; <3 — промыватель газа; 4 — питательный бачок.
нагрузке 1000 а составляет 5° С. Циркулирующий электролит пред-
лагалось подводить к питательному каналу в трех точках — в сере-
дине и по концам канала. При этом для исключения возможности
закорачивания крайних ячеек трубопроводы должны быть выпол-
нены из непроводящих ток материалов. Утечки тока по электро-
литу неизбежны, но величина их может быть не большой. Измене-
ние скорости циркуляции электролита с ростом давления можно
охарактеризовать следующими данными36 о неравномерности тем-
пературы в ячейках электролизера:
Давление, ат................... 0 1
Разность температур, °C
при усиленной циркуляции
(см. рис. IV-36) .... 1 1
в обычной схеме (см. рис.
IV-33)................... 8 14
23456789 10
224455667
17 21 22 23 25 26 26 29 30
174
В электролизерах с усиленной циркуляцией при небольшом
давлении различие температур в ячейках по длине электролизера
не превышает 1—2° С. С повышением давления до 10 ат это раз-
личие температур несколько возрастает, что свидетельствует о сни-
жении интенсивности циркуляции электролита. Однако разность
температур в отдельных ячейках невелика (до 6—7°С).
В электролизерах ЭФ (рис. 1V-37) в качестве электролита при-
меняется 30%-ный раствор КОН, возможно также применение
Рис. IV-37. Общий вид установки электролизера ЭФ.
20—25%-ного раствора NaOH, однако при этом несколько возра-
стает напряжение на электролитической ячейке. Для повышения
чистоты кислорода к электролиту добавляют 2—3 г!л хромовых
солей. В табл. IV-4 приведена характеристика электролизеров
типа ЭФ при работе на 30%-ном растворе КОН при 75° С.
Таблица IV-4. Характеристика электролизеров типа ЭФ
Нагрузка, а Плотность тока, а!м2 Напряжение на ячейке, в Производительность, Л(3/ч Н2 Расход электроэнергии, квт-ч/м^ Нг
ЭФ-24/12 ЭФ-12/6
100 260 1,80 4 2 4,40
200 520 1,87 8 4 4,57
300 780 1,94 12 6 4,74
400 1040 2,00 16 8 4,87
'500 1300 2,06 20 10 5,02
600 1560 2,11 24 12 5,15
По экспериментальным определениям, основные утечки тока в
электролизерах типа ЭФ-24/12 происходят из крайних 3—4 ячеек
175
в каналы за счет включения диафрагменных рам и звеньев кана-
лов в биполярную работу.
По падению напряжения на трубках, соединяющих раму
с кольцами каналов, определена величина токов утечки в ячейках.
Результаты одного из замеров при работе на 27%-ном растворе
КОН, нагрузке 600 а, давлении 8 ат и температуре 75° С приве-
дены в табл. IV-5.
Таблица IV-5. Величина токов утечки из ячеек в каналы
электролизера ЭФ-24/12-10
№ ячейки (от ка- тода) Напряжение на ячейке, в Падение напряжения на трубе канала, мз Ток, протекающий по металлу трубки, а Утечка тока из ячейки во все кана- лы, а I (Ж, прохо- дящий по се- чению всех ка- нал 1В, а
АК* | ЛР* КР * для н2 для о2 ДЛЯ элек- троли- та для н2 ДЛЯ О2 ДЛЯ элек- троли- 1 та
1 2,20 0,30 1,90 5,1 4,8 1,8 17 16 9 42," 1 i 0,0
9 2,15 0,40 1,75 0,6 0,3 0,2 2 1 1 4,0 1 -12,0
3 2,15 0,43 1,72 0,1 0,1 0,1 0,3 0,3 0,5 1,1 | 46.0
4 2,15 0,45 1,70 0,0 0,0 0,0 0,0 0,0 0,0 0,0 47.1
5 2,15 0,48 1,67 0,0 0,0 0,0 0,0 0,0 0,0 0,0 ! 47,1
50 2,20 1,10 1,10 0,0 0,0 0,0 0,0 0,0 0,0 о,о : 47.1
97 2,15 1,57 0,58 0,0 0,0 0,0 0,0 0,0 0,0 0,0 | 47,1
98 2,15 1,65 0,50 0,0 -0,1 -0,1 0,0 -э,3 -0,5 -0,8 46.3
99 2,15 1,73 0,42 -0,3 -0,1 -0,1 -1,0 -0,3 -0,5 -1,8 44,5
100 2,20 1,95 0,25 —5,4 -5,1 -1,9 -18,0 -17 -9,5 - 14,5 1 0,0
* См. рис. 11-17 (стр. 70).
Утечка тока в электролизере зависит от условий его эксплуа-
тации: нагрузки, температуры, давления газов и напряжения на
ячейках электролизера. При повышении нагрузки напряжение на
электролизере увеличивается и плавно возрастает ток в электро-
литном канале. При этом в газовых каналах возрастает доля газа
в смеси с жидкостью и несколько снижается утечка тока, не-
смотря на рост напряжения.
Повышение давления несколько снижает напряжение на
электролизере из-за уменьшения газонаполнения электролита
между электродами. Поэтому утечки тока в электролитном ка-
нале немного снижаются с ростом давления. Однако с ростом
давления степень заполнения газовых каналов электролитом уве-
личивается, и утечки тока возрастают.
С ростом температуры сопротивление электролита в каналах
снижается быстрее, чем общее напряжение на пакете ячеек. По-
этому утечка тока при повышении температуры возрастает. Ниже
приведены результаты измерений на электролизере, работавшем
при нагрузке 600 а под давлением 4 ат.
Температура СС..................
Утечка тока, а .................
I Напряжение на ячейке, в . . . .
65 70 75 80 85 90
29 32 35 38 42 45
2,20 2,17 2,14 2,11 2,08 2,05
176
При понижении уровня электролита и неполном заполнении
газовых каналов утечка тока в них резко снижается. Утечка тока
в питательном канале при этом остается неизменной. При мень-
шем напряжении на электролизере, чем необходимо для разложе-
ния воды в пакете ячеек, рост утечки тока с повышением напря-
жения совпадает с увеличением общего тока, проходящего через
электролизер, до перегиба кривой I — Е, соответствующего на-
чалу выделения газов в ячейках. Сравнительно небольшое (на
5—7%) снижение напряжения на ячейках в первые часы после
деполяризации приводит к уменьшению утечки тока на 20—25%.
Однако достигнутый эффект непродолжителен: в течение несколь-
ких суток по окончании опыта он снизился до нуля. Величина
токов утечки заметно влияет на выход по току, удельный расход
электроэнергии, тепловыделения в электролизере и на чистоту
продуцируемых газов.
Для каждой нагрузки на электролизер существует оптимум
давления, при котором удельный расход электроэнергии минима-
лен. В электролизере ЭФ, работающем с номинальной нагрузкой
(600 я), минимальный расход энергии отмечается при давлении
2—3 ат. С повышением нагрузки минимум кривой удельного рас-
хода энергии смещается в область более высоких давлений.
Сечение каналов в электролизерах каждого типа должно вы-
бираться в зависимости от того, для каких нагрузок и давлений
они предназначены. Уменьшение сечения каналов возможно при
использовании схемы с усиленной естественной циркуляцией или
с принудительной циркуляцией электролита. Уменьшение сечения
каналов должно обязательно сочетаться с существенным умень-
шением сечения трубок, связывающих ячейки с каналами.
Электролизеры типа СЭУ
В 50-х годах были разработаны 36 электролизеры СЭУ-4 и СЭУ-8.
Затем их конструкция была несколько усовершенствована, и эти
аппараты получили название СЭУ-4м и СЭУ-8м. Электролизеры
обеих марок аналогичны по конструкции и отличаются по коли-
честву ячеек, их габаритам и плотности тока. Электролизеры
СЭУ-4м широко применяются на электростанциях небольшой
мощности для питания водородом системы охлаждения генерато-
ров. На крупных электростанциях мощностью 1200—2400 Мет
используются электролизеры СЭУ-8м, ЭФ-12/6-10, а в отдельных
случаях ЭФ-24/12-10.
Электролизеры СЭУ фильтрпрессного типа с биполярным
включением электродов рассчитаны на работу под давлением до
10 ат. Электролизер СЭУ-8м (рис. IV-38) состоит из 34 ячеек,
устройство которых показано на рис. IV-39. К диафрагменной ра-
ме диаметром 850 X 810 мм на заклепках прикрепляется асбе-
стовое полотно. Качество асбестовой диафрагменной ткани
должно быть такое же, как и для электролизеров ФВ и ЭФ.
12 Зак. 713 177
Диафрагменные рамы и основные листы электродов снабжены со-
ответствующими фасонными приливами с отверстиями, образую-
щими при стяжке электролизера внутренние питательный и газо-
вые каналы. Диаметр питательного канала 50 мм, газовых по
75 мм. Электроды — тройные с выносными перфорированными
Рис. IV-38. Электролизер СЭУ-8ч:
1 — рамный изолятор; 2 — гайка; <3 — шипа для подвоза тока; 4 — втулка изоляционная; 5 — шайба
изоляционная; 6— шайба под пружину; / — тарельчатая пружина; 8 — диск; 9 — стяжной болт;
10 — кожух пружины; 11 — плита — монополярный электрод (анод); 12 — паронитовыс прокладки;
13 — диафрагменная рама; 14 — биполярные электроды; /5 — плита — монополярный электрод
(катод); 16 — изоляционная подставка; 17 — козырек; 18 — водородный газовый канал; 19 — кисло-
родный газовый канал; 20 — питательный канал.
листами, прикрепленными к основному листу на анкерах. Вынос-
ной электрод диаметром 700 мм выполнен из стального листа тол-
щиною 2 мм, перфорированного отверстиями диаметрогл 6 мм, ос-
новной— из 3-миллиметрового стального листа. Все основные де-
тали электролизера никелируются аналогично деталям электро-
лизеров ЭФ: диафрагменные рамы, выносные листы анодов с двух
сторон, основные листы биполярных анодов с анкерами только
с анодной стороны.
Электролизер стягивается при помощи концевых плит — мо-
нополярных электродов и четырех стяжных болтов диаметром
75 мм. Болты с одной стороны снабжены комплектами тарельча-
тых пружин. От концевых монополярных электродов стяжные
болты изолированы эбонитовыми или капроновыми втулками и
текстолитовыми или эбонитовыми шайбами; от фундамента
электролизер изолирован опорами из эбонита или капрона. Меж-
ду электродами и диафрагменными рамами установлены паро-
нитовые прокладки, между рамами и болтами — полиэтиленовые
изоляторы.
Электролизер СЭУ-4м (рис. IV-40) по конструкции аналоги-
чен СЭУ-8м и отличается от него только количеством ячеек и га-
баритами деталей. Он состоит из 30 ячеек, диаметр выносного
178
листа электрода равен 400 мм,
размеры стяжной плиты — основ-
ных монополярных электродов
□ 10 x 800 мм. Схема работы
установок с электролизерами
СЭУ аналогична схеме работы
с электролизерами ЭФ.
Габариты разделительных ко-
лонок и промывателей газов на
установках, оборудованных элек-
тролизерами СЭУ, несколько от-
личаются от аналогичных аппа-
ратов в установках с электроли-
зерами ЭФ. Разделительная ко-
лонка электролизеров СЭУ пред-
ставляет собой вертикальный ци-
линдрический аппарат высотой
910 мм, выполненный из трубы
диаметром 159 X 5 мм и снаб-
женный плоскими днищем и
крышкой толщиною 14 мм. Про-
мыватель газа высотою 1160 мм
выполнен из трубы диаметром
*273 X 8 мм, имеет сферическое
приварное днище и сферическую
крышку, присоединяемую на
фланцах к корпусу. Внутри про-
мывателя к крышке присоедине-
ны барботер для газа и змеевик
поверхностью 0,75 м2, по которо-
му подается охлаждающая вода.
Регулятор давления газов в
электролизерах СЭУ аналогичен
регулятору в электролизерах ЭФ.
Движущая сила циркуляции
электролита в электролизерах
СЭУ меньше, чем в электролизе-
рах ЭФ, из-за применения внут-
ренних газосборных каналов.
При работе под давлением, близ-
ким к максимальному, интенсив-
ность циркуляции может сни-
жаться, особенно в крайних
ячейках электролизера, что при-
водит к повышению температуры
электролита и усиленной корро-
зии деталей в этих ячейках. Для
обеспечения достаточной интен-
Рис. IV-39. Разрез по ячейкам электро-
лизера СЭУ-8м:
1 — газовый канал; 2— прокладка; 3 — диа-
фрагменная рама; 4 — монополярный элек-
трод — анод; 5 — выносные электроды; 6 — ос-
новной лист биполярного электрода; 7 — ан-
кера; 8 — диафрагма; 9 — заклепки для креп-
ления диафрагмы; 10 — питательный канал.
12
179
сивности циркуляции и поддержания нормальной температуры во
всех ячейках по длине электролизера на трубопроводе от газо-
сборных каналов к разделительной колонке предусматривают
вертикальные участки, аналогично тому, как показано на
рис. IV-36 для электролизеров ЭФ. Для более равномерного по-
ступления электролита во все ячейки по длине электролизера
СЭУ его вводят в питательный канал с обоих торцов электроли-
зера. Как и в электролизерах ЭФ, при такой схеме возвращения
электролита в электролизер для предотвращения короткого за-
мыкания или увеличения утечек тока трубопроводы должны вы-
полняться из токонепроводящего материала или внутри стального
трубопровода должны быть уложены изолирующие вставки.
Рис. 1V-4J. Электролизер СЭУ-4м:
/ — изолятор ячейки* 2 —комплект тарельчатых пружин; 3 — плита — монополярный электрод,
(ка год); 4 — биполярный электрод; 5 — диафрагменная рама; 6 — прокладки; 7 — гайка; 8 — плита —
монополярный электрод (анод); 9— стяжной болт; 10 — изоляционная подставка; // — кислород-
ный газовый канал; 12 — водородный газовый канал; 13 — питательный канал.
По данным работы36, усиление циркуляции позволяет повы-
сить на 50% нагрузку на электролизеры СЭУ-4м и почти вдвое на
СЭУ-8м. При этом рекомендуется, чтобы расстояние по верти-
кали между газовыми коллекторами электролизера и штуцерами
разделительных колонок для электролизеров СЭУ-8м и СЭУ-4м,
а также для ЭФ-12/6 составляло 800 мм. Для электролизеров
ЭФ-24/12 это расстояние рекомендуется увеличить примерно до
1000 мм. Расстояние по вертикали между входными газовыми
штуцерами разделительных колонок и зубцами барботеров в про-
мывателях на установках с усиленной циркуляцией электролита
в электролизерах СЭУ-4м и СЭУ-8м должно составлять 280 —
300 мм, а для электролизеров ЭФ находиться в пределах 250—
280 мм.
Электролизеры Зданского — Лонца 35 47
За рубежом первый промышленный электролизер для разложе-
ния воды под давлением был разработан в 50-х годах конструк-
тором Зданским и фирмой Лонца и внедрен в промышленность
180
фирмой Лурги 38’39. Электролизер рассчитан на работу под дав-
лением до 30—40 ат при нагрузке до 4 ка. Указывается 39-40, что
применение электролизеров такого типа особенно эффективно при
этом давлении, а при более высоком давлении конструкция элек-
тролизера настолько усложняется, что преимущества электролиза
воды под давлением снижаются.
Электролизер Зданского — Лонца фильтрпрессного типа с би-
полярным включением электродов имеет внутренние каналы для
сбора водорода и кислорода из ячеек и для распределения цир-
кулирующего электролита и питательной воды между ячейками.
Проведение процесса под давлением 30—40 ат позволяет повы-
сить рабочую температуру электролиза до ПО—120° С без чрез-
мерного увеличения количества воды, испаряемой и уносимой га-
зами. В электролизере поддерживается небольшая плотность тока
(1000—1500 «Ди2), что в сочетании с высокой рабочей температу-
рой и специальной активацией поверхности электродов позволяет
вести процесс при относительно низком напряжении на ячейке
(1J5—1,80 а) и невысоком удельном расходе электроэнергии.
Естественная циркуляция электролита в электролизерах Здан-
ского— Лонца была бы очень неинтенсивной из-за малого газо-
наполнения электролита и применения внутренних газосборных
каналов. Поэтому в таких электролизерах применяется принуди-
тельная внешняя циркуляция электролита. Схема промышлен-
ного электролизера Зданского — Лонца41-46 показана на
рис. IV-41.
Детали ячеек электролизеров на заводе-изготовителе соби-
раются в блоки и стягиваются при помощи болтов между плита-
ми. На место монтажа поступают полностью собранные блоки
ячеек. Количество ячеек в блоках определяют исходя из удобства
транспортирования и монтажа электролизера. При сборке ячеек
в каждом блоке образуются газовые каналы для сбора водорода
и кислорода и питательный канал для распределения циркули-
рующего электролита по ячейкам.
Корпус электролизера монтируется из нескольких блоков
ячеек. По длине электролизер разделяется на две равные по ко-
личеству ячеек части, параллельно включаемые для питания по-
стоянным током. К средней части электролизера подводятся
шины от одного полюса преобразовательной подстанции,
а к обоим концам — от другого полюса. Такое включение ячеек
может приводить к неравномерному распределению тока между
обеими параллельно включенными частями электролизера, если
по каким-либо причинам возникает разность напряжений на от-
дельных ячейках в пакетах.
Образующиеся в электролитических ячейках водород и кисло-
род собираются в газовых каналах и вместе с уносимым ими
электролитом отводятся в сепараторы. В жидкостной части водо-
родный и кислородный сепараторы соединены U-образными тру-
бами. После отделения от электролита газы из сепараторов
181
поступают в промывные колонки, в верхнюю часть которых по- ]
дается вода для питания электролизера. Отделяемый в сепарато- ;
рах электролит проходит через фильтр и по питательному каналу '
поступает в ячейки электролизера. ;
Для принудительной циркуляции электролита установлен на-
сос, обеспечивающий полный цикл циркуляции менее чем за 2 ч.
Скорость циркуляции контролируется измерительным устройст-
вом. На жидкостных трубопроводах и трубопроводах от электро-
лизера к сепараторам установлены обратные клапаны. В случае
Рис. IV-41. Схема устройства электролизера Зданского — Лонца:
1 — сепаратор; 2 — промывная колонка; 3 —клапан; 4 — газопроводы; <5 —стяжные пли гы элек-
тролизера; 6 — стяжные плиты пакетов; 7—газовый канал; 8 — пакет ячеек; 9 — соединительные
трубы сепараторов; 10 — стяжные болты пакетов; И — стяжные болты электролизера; /2 — обрат-
ные клапаны; 13 — сигнальное устройство; 14 — контактный манометр; 15 — измеритель расхода;
16 — линия слива электролита; 17 — фильтр; /8 - насос; /9 —труба для циркулирующего элек*
тролита; 20— подвод тока; 2/— питательный канал; 22 — опорные изоляторы.
падения давления в трубопроводе более чем на 0,5 ат по срав-
нению с давлением в электролизере все обратные клапаны одно-
временно закрываются, предотвращая смешение газов в электро-
лизере, установка автоматически отключается и срабатывает
сигнальное устройство. В электролизере создается совместная
циркуляция анолита и католита39, что обеспечивает выравнивание
концентрации щелочи в анодном и катодном пространствах, но
может приводить к загрязнению кислорода и водорода и к неко-
торому снижению выхода по току, особенно при работе под вы-
соким давлением и недостаточно полном отделении электролита
от газовых пузырьков в сепараторах.
Для регулирования давления в электродных пространствах
ячеек электролизера Зданского — Лонца, как и в других электро-
182
лизерах, работающих под давлением, используется гидравличе-
ский барботажный регулятор в сочетании с поплавковыми кла-
панами. Газовые и жидкостные пространства используются также
в качестве буферных емкостей, выравнивающих колебания дав-
ления во времени.
На рис. IV-42 приведен общий вид электролизера Здан-
ского — Лонца, на IV-43 — схема устройства его ячейки40. Для
разделения водорода и кислорода применяется диафрагма из ас-
бестового картона, зажатого между двумя электродными метал-
лическими сетками. Сплошной электрод сложной вафлеобразной
Рис. IV-42. Общий
вид электролизера Зданского — Лонца.
формы служит также разделительной стенкой между анодным и
катодным пространством ячейки. Электродные сетки плотно при-
жаты к электродам, и процесс электролиза происходит как на
поверхности основного электрода, так и на электродных сетках.
Электроду придана форма, облегчающая удаление газов из
ячейки. Размер отверстий электродной сетки должен быть 47 мень-
ше средней длины асбестовых волокон, чтобы предотвращалось
вымывание волокон и разрушение диафрагмы при эксплуатации
электролизера. Биполярные электроды диаметром около 1,5 м
выполнены из листовой стали с выступами, вершины которых
расположены попеременно по одну и другую сторону листа. Для
увеличения механической прочности диафрагма из асбестового
картона толщиной 3—4 мм зажата между двумя металлическими
сетками, сплетенными из проволоки диаметром 0,8 мм.
Газовые каналы состоят из отдельных втулок, которые с помо-
щью колец на резьбе крепятся к электродам, одновременно
уплотняя диафрагму по краям отверстий. Питательный канал
183
также состоит из втулок, в каждой из которых имеется по два
сверления, соединенных с водородной и кислородной частями
ячеек.
Чтобы снизить перенапряжение и предотвратить разрушение
катода в результате водородной коррозии, его поверхность акти-
Рис. IV-43. Схема
устройства ячейки
электролизера Здан-
ского — Лонца:
/ — газовый канал для
водорода и кислорода;
2 — асбестовая диафрагма;
3 - электродные сетки;
4 - основной электрод,
разделяющий электрод-
ные пространства: 5-пи-
тательный канал; 6 —
уплотняющая прокладка;
7 — рама.
жительной работы
вируется48 путем нанесения слоя платины,
палладия или другого металла платиновой
группы из водного раствора, содержащего не
более 5 г/л (в некоторых случаях 0,1 — 0.5 г/л)
соли одного или нескольких из этих метал-
лов. На основной слой наносится дополни-
тельный слой платиновой черни. Расход пла-
тины или палладия не превышает 10 г/л/2 по-
верхности катода. Потери активирующих ме-
таллов, расходуемых для покрытия, незначи-
тельны.
Утечки тока через отверстия для отвода
газов в электролизерах, работающих под дав-
лением, обычно наиболее высоки. Для умень-
шения утечек тока эти отверстия делают не-
большого диаметра. От усиленной коррозии
их защищают фторопластом. Для защиты
уплотняющих прокладок от действия щелочи
(25%-ный раствор КОН) при повышенной
температуре электролиза (120° С) предложе-
но45 обматывать прокладки тонкой фторопла-
стовой пленкой. Предполагается, что такие
прокладки можно повторно использовать
после ремонта электролизера.
Отходящие из электролизера горячие га-
зы охлаждаются в промывной колонке пита-
тельной водой примерно до 30° С, нагревая
при этом воду почти до рабочей температуры.
Если потребителю не нужен газ под давле-
нием, на выходе из электролизера можно
установить дросселирующие вентили.
При электролизе воды под давлением до
30—50 ат в аппаратах Зданского — Лонца
напряжение на ячейке даже после продол-
невелико и количество тепла, выделяющегося
в процессе электролиза, незначительно.
На рис. IV-44 приведены 49 другие варианты конструкций
ячеек с диафрагмой из асбестового картона, зажатого между
электродными сетками. В одном из них (рис. IV-44, а) применены
биполярные электроды обычной конструкции с выносными
электродами из перфорированных стальных листов, прикреплен-
ных к основному листу электрода на анкерах. По второму вари-
анту (рис. IV-44, б) выносные электроды выполняются в виде ди-
•184
сков из металлической сетки и зажимаются между основными
электродами и диафрагмой из асбестового картона. С обеих сто-
рон асбестовая диафрагма защищена металлической сеткой (из
тонкой проволоки) или перфорированной фольгой. Размеры
ячеек в сетках выносного электрода выбирают с таким расчетом,
чтобы облегчить удаление газов из зоны прохождения электри-
ческого тока. Уточные нити сетки расположены вертикально и
имеют большую толщину, чем нити основы. При этом внутри сет-
ки образуются вертикальные каналы
для выхода газов. Для дополнитель-
ного уплотнения ячеек и предотвра-
щения диффузии газов через диафраг-
му сетчатые покрытия ее в бортовой
зоне предложено дополнительно защи-
щать металлической фольгой.
Первый аппарат Зданского — Лоп-
ца диаметром 1600 мм из 25 ячеек
для работы под давлением 25 ат был
введен в эксплуатацию40 в 1951 г.
При нагрузке 2 ка и ширине ячейки
13 мм напряжение на ней составило
1,76 в и удельный расход электро-
энергии постоянного тока 4,3 кет • ч/м3
водорода. Чистота газов: 99,9% Нг и
99,6% Ог- В 1955 г. начал работать
под давлением 30 ат электролизер из
500 ячеек, включенных в две парал-
лельные группы по 250 ячеек, при на-
грузке 4 ка и напряжении на электро-
лизере 440 в (производительность
410 м3/ч водорода). Позднее появи-
лись сообщения о пуске электролизе-
ров такого типа (с 400—660 ячейка-
ми) в Швейцарии и ФРГ.
В настоящее время выпускаются
Рис. IV-44. Варианты устрой-
ства электродных ячеек:
а —с перфорированными выносными
электродами; б —с выносными сет-
чатыми электродами; 1 — кольцо;
2 —основной электрод; 3 —выносной
перфорированный электрод;4 — анкер;
5 —диафрагма; 6 — проволочная сет-
ка: 7 — выносной сетчатый электрод.
электролизеры на нагрузку до 6,6 ка
производительностью от 100 до 750 м3!ч водорода; количество
ячеек от 100 до 556.
Опубликованы50 результаты проектной проработки крупного
цеха электролиза воды, оборудованного электролизерами Здан-
ского—Лонца для получения водорода под давлением 30 пт.
Проектом предусматривалась установка 40 электролизеров произ-
водительностью до 550 м3!ч водорода каждый при нагрузке 4 ка.
В каждую серию включалось по два электролизера; напряжение
на серии предусматривалось до 600 в. Предполагалась передача
водорода на азотнотуковый завод по стальному трубопроводу диа-
метром 160 мм.
Технологическая схема электролитической установки, оборудо-
185
ванной электролизерами типа Зданского— Лонца, для работы под
давлением приведена на рис. IV-45.
Рис. IV-45. Принципиальная технологическая схема
электролитической установки, работающей под дав-
лением:
Рис. IV-46. Схема устрой-
ства электролитической
ячейки:
1 — глектролизер; 2 — узел приготовления электролита; 3 — си-
стема очистки питательной воды; 4 — кислородный ресивер;
5—водородный ресивер; 6 — выпрямитель; 7 — трансформатор.
/ — отвод водорода и католи-
та; 2 —отвод кислорода и
анолита; 3— биполярный
электрод; 4— анод; 5 — асбе-
стовая диафрагма; 6— моно-
полярный электрод; 7 —ка-
тод; 8 — аноцное простран-
ство; 9 — катодное простран-
ство; /0 - уплотнительная
прокладка: 11 — подвод элек-
тролита и питательной во-
ды; /2 — пластмассовая рама.
Прочие типы электролизеров для работы под давлением
Помимо описанных предложены многочисленные конструкции аппа-
ратов для электролиза воды под давлением. Здесь будут кратко
рассмотрены только некоторые из них, наиболее интересные, по
мнению авторов, хотя сообщений о промышленном использовании
этих электролизеров пока нет.
Опубликованы 51 результаты инженерной разработки конструк-
ции биполярного электролизера для процесса под давлением с элек-
тродами из пористого никеля. Схема ячейки такого электролизера
приведена на рис. IV-46. Его особенностью является очень высо-
кая плотность тока (до 17 200 а/м2). За счет применения пористых
никелевых анодов и катодов, непосредственно прилегающих к тон-
кой (около 0,8 мм) пористой диафрагме, предполагается обеспе-
чить отвод газов на обратную сторону электродов и вывод газо-
вых пузырьков из зоны прохождения тока. По мнению авторов51,
это должно обеспечить небольшое напряжение на ячейке, несмотря
на высокую плотность тока. На рис. IV-47 приведена предполагае-
те
мая зависимость напряжения на ячейке электролизера от плотно-
сти тока.
Электролизеры круглого сечения с электродами диаметром
750 мм разрабатывались в различных вариантах — для получения
водорода под давлением около 20 и 200 ат при плотности тока
8,6 и 17,2 ка/м2. Более экономичной была признана работа под
давлением 20 ат при максимальной плотности тока.
Рис. IV-47. Зависимость напряжения на
ячейке от плотности тока:
/ - при 93° С; 2- при 121° С.
Электролизер Нидеррайта. В отличие от многих других разра-
боток в области электролиза воды под давлением несколько со-
тен атмосфер, в этом электролизере принят принцип биполярного
включения электродов. Для облегчения требований к механиче-
ской прочности и улучшения герметичности ячеек корпус фильтр-
прессного электролизера помещают в сосуд, находящийся во
время работы под давлением, равным давлению газов. Электро-
лизер Нидеррайта выполнен 11 из набора отдельных ячеек с би-
полярными электродами, вмонтированных в общий сосуд — на-
клонную трубу, рассчитанную на работу под давлением. Блок
ячеек изолирован от наружного сосуда, который заполнен токо-
непроводящей жидкостью с плотностью, отличающейся от плот-
ности электролита.
Образующиеся в электролизере газы вместе с уносимым ими
электролитом по удлиненным трубкам поднимаются в газоотде-
лители, откуда электролит через холодильник возвращается
в электролизер. Дистиллированная вода для питания электроли-
зера непрерывно поступает в катодные пространства из бачка,
находящегося под давлением. Выравнивание давления газов про-
изводится при помощи ртутных регуляторов. Для крупных устано-
вок предлагалось применение регулирующих вентилей, приводи-
мых в действие электродвигателями. Небольшие различия давле-
ний водорода и кислорода регулируются гидравлическим уравни-
телем давления.
Опытная установка электролизеров Нидеррайта, состоящая из
четырех наклонных труб длиной 3,2 м, в каждой из которых на-
ходился электролизер из 80 ячеек, работала под давлением до
187
160 ат при плотности тока 1500 а!м2. Чистота газов: 99,8% Н2 и
98,5% О2.
При нормальной нагрузке опытный электролизер Нидеррайта
работал при следующих показателях и:
Температура, °C ... . 80
Напряжение, в .... 2,07
Расход электроэнергии,
квт-ч/м* Н2........... 4,97
90
2,00
4,80
100 ПО
1,95 1,90
4,68 4,56
120
1,80
4,44
Строительство опытной установки с электролизерами Нидер-
райта было начато в 1934 г., в январе 1938 г. она была введена
в эксплуатацию; позднее11 работы на этой установке бы ан при-
остановлены.
Электролизер Тредвелла. Опубликованы сообщения 39’52 о мо-
нополярной конструкции электролизера Тредвелла для работы
под высоким давлением. Указывается, что в США электролизер
предложен для снабжения кислородом подводных лодок с атом-
ными двигателями. Корпус электролизера служит анодом. К мед-
ному катоду, покрытому химически осажденным никелем, кре-
пится толстая асбестовая диафрагма. Уровень электролита уста-
навливается электрозондом, а вода для питания электролизера
подается автоматически при помощи соленоидных вентилей. Из-
быточное тепло из системы отводится обдувкой корпуса воздухом.
Это снимает проблему электроизоляции водопроводов, которая
возникает при водяном охлаждении электролизера. Недостатком
такой системы охлаждения является нагревание воздуха в лодке
и необходимость отвода от него избыточного тепла.
Стоимость газов, получаемых в электролизере этого типа39,
чрезвычайно высока, и маловероятно, что он будет применяться
в промышленности, за исключением тех случаев, когда стоимость
газа не является решающим фактором при выборе типа электро-
лизера.
В литературе описаны и другие конструкции электролизеров
для работы под давлением, созданных в течение последних лет.
Н. я. Даньков53 предложил конструкцию биполярного элек-
тролизера, корпус которого рассчитан на рабочее давление.
Циркуляция электролита осуществляется принудительно. Отличи-
тельной особенностью конструкции электролизера Раймана 54 яв-
ляется спиральное расположение анодов. Конструкция биполяр-
ного фильтрпрессного электролизера Бекона55 предусматривает
применение активных пористых электродов.
Электрод56 представляет собой никелевый или стальной нике-
лированный диск, на который с одной или с обеих сторон нано-
сится крупнопористый рабочий слой никелевого порошка. Сто-
рона диска, обращенная к электролиту, покрывается защитным
слоем непроводящего пористого вещества (окиси никеля, окиси
магния, порошкообразного титана и др.). В качестве катода пред-
ложен слой, напрессованный из медного порошка. При работе
электролизера газы будут выделяться в рабочем слое электрода,
188
обладающем большей проводимостью и меньшим перенапряже-
нием, чем запорный слой. Вследствие значительного поверхност-
ного натяжения жидкости в мелких порах запорного слоя газы не
могут проникать через него в электролит и отводятся через от-
верстия основного диска электрода в каналы для сбора газов.
Изготовление и устойчивая работа металлокерамических электро-
дов, естественно, связаны с большими затруднениями, вызывае-
мыми необходимостью прочного сцепления пористого покрытия
с основным металлическим листом. При использовании таких
электродов отпадает необходимость в диафрагме для разделения
газов. Благодаря развитой поверхности металлокерамического
электрода и отсутствию диафрагмы напряжение на ячейке со-
ставляет56 1,6 в при плотности тока 1000 а/м2 и 1,85 в при плот-
ности 2000 а/м2.
Предлагаются57 двухкаркасные активные пористые электро-
ды: для катода — никель Ренея, для анода — никель Ренея или
серебро. Применение таких активных электродов дает возмож-
ность проводить процесс электролиза при низком напряжении на
ячейке. Электролизеры с активными электродами могут быть ис-
пользованы в качестве топливных элементов.
Сообщалось о разработке электролизеров для работы в косми-
ческом пространстве в условиях невесомости с диафрагмой из
ионообменных материалов58 и бездиафрагменного аппарата
с диффузионным катодом из палладиевой и серебряной фольги59.
ЛИТЕРАТУРА
1. Chem. Age, 93, № 375, 126 (1965).
2. Фр пат. 551302 (1923); 605125 (1926); 654289 (1929).
3 J. Chem. Soc., 43, № 119 (1924).
4. Пат. США 1547362 (1923).
5. Хомяков В. Г., Машовец В. П., Кузьмин Л. Л., Технология элек-
трохимических производств, Госхпмиздат, 1949.
6. Пат. США 1199472 (1916); 1214934 (1917); 1219966 (1917).
7. Пат. США 1303519 (1919); 1597552 (1926); 1597553 (1926).
8 Герм. пат. 410772 (1925); 412217 (1925); 416494 (1925); 469328 (1928);
469329 (1928); 469330 (1928).
9. Пфлейдерер Г., Электролиз воды, перев. с нем., Химтеорет, 1935.
10 Биллитер Ж., Новейшие достижения технической электрохимии, перев.
с нем., Госхимтехиздат, 1934.
11 Биллитер Ж., Промышленный электролиз водных растворов, перев.
с нем., Госхимиздат, 1959.
12. Герм. пат. 83110 (1892); 106226 (1898); 153036 (1902); 157474 (1902).
13. Якименко Л. М., Химстрой, № 6, 347 (1934); № 7, 403 (1934).
14. Knowles A R., Chem. Ind., 44, 131 (1925); фр. пат. 463507 (1913).
15. Пат. США 1485461 (1922); 1821018 (1930).
16. Англ. пат. 221189 (1924); норв. пат. 40205 (1923); 44685 (1926); 45940 (1927);
46781 (1927).
17. Пат. США 2293594 (1939); Sei a k Р., Fink J., Chem. Eng. Progr., 50, 221
(1954); Технология производства тяжелой воды. Материалы Женевской кон-
ференции по использованию атомной энергии, вып. 7, изд. Глав. упр. по
использованию атомной энергии при Совете Министров СССР, 1957.
18 И о ф ф е В. Б., Основы производства водорода, Гостоптехиздат, 1960; Энер-
гетика СССР (сборник статей), Госэнергоиздат, 1961.
18»
19. S z a t n i с к i P., l\em. i Ind., Zagreb, 14, № 9, 725 (1965). •
20. Пат. ФРГ 816814 (1953).
21. P i c h 1 e r A. V., Demag Nachrichten. № 125. 11 (1951).
22. Pichler A. V., Demag Nachrichten, № 163, 24 (1961); Chem. Age India, 14„
№ 8,602 (1963). J
23. H a s s K. et al., Chem. Ing. Techn., 40, № 12, 557 (1968).
24. Пат. ФРГ 818849 (1953).
25. S t о г s a n d B., Bull. Oerlikon, № 357/358, 37 (1964).
26. Aeschlimann M., Bull. Oerlikon, № 382, 1 (1968).
27. T о b i s c h K., Bull. Oerlikon, № 382, 9 (1968). J
28. Sevin K., Le Four Electrique, 39, № 1, 8 (1930); Aubert A., Chem. A\et.
Eng., № 36, 481 (1929) Pincass H., Metallborse, № 17, 2665, 2721 (1927). •
29. Л ачинов Д. А., герм. пат. 51998 (1888).
30. Чекин П. А., Соколов П. И., Волчкова Л. М., Л и ловецкая А. И.„
авт. свид. СССР 46247 (1936). i
31. J u s t i Е., Electrotechn. Z., № 14, 377 (1961).
32. V e s s e у P., Chem. Age India, 11, № 2, 241 (1960). t
33. James G. R., Chem. Eng., 67, № 25, 161 (1960); Costa R., Grimes P.,
Chem. Eng. Progr., 63, № 4, 56 (1967).
34. Якименко Л. M., Колосков А. И., авт. свид. СССР 54309 (1938). <
35. Я к и м e н к о Л. М., Кислород, № 2. 30 (1945). ;
36. Иванов В. С., Серебря иск ий Ф. 3., Газо-масляное хозяйство генера- 1
торов с водородным охлаждением. Изд. «Энергия», 1965; Гольд-
штейн А. Б., С е р е б р я н с к и й Ф. Э., Эксплуатация электролизных уста-
новок для получения водорода и кислорода, Изд. «Энергия», 1969.
37. Якименко Л. М., Колосков А. И. и др., авт. свид. СССР 51206-
(1937).
38. Англ. пат. 679334 (1952); 681895 (1952).
39. С h а р m a n Е. A., Chem. Proc. Eng., 46, № 8, 387 (1965).
40. Scharlau A., Fette — Seifen — Anstrichmittel, 62, № 3, 185 (1960).
41. Л а п и н Я. С., Хим. пром., № 8, 40 (1963).
42. Пат. ФРГ 1006401 (1958).
43. Швейц, пат. 333904, 333905, 330814, 331200 (1958); 335049, 334613, 334614
(1959).
44. Фр. пат. 1144922 (1957).
45. Пат. ФРГ 1007746 (1957).
46. Пат. США 2786811 (1957); 2739936 (1956).
47. Пат. ФРГ 877749 (1953).
48. Швейц, пат. 331841 (1958); 340810 (1959).
49. Пат. ФРГ 879543 (1953).
50. Z d a n s к у A., Weltkonferenz Yugoslavien — Bundesrepublik, Deutschland,
XI Teiltagung Abt., B. 5, Bericht 3, Belgrad, 1957
51. Costa R., Grimes P., Chem. Eng. Progr., 63, № 4, 56 (1967); Chem. Eng.
Progr., Sympos. Ser., 63, № 71, 45 (1967).
52. Spitzep R., J. Electrochem. Soc.. 106, № 3, 70 (1959).
53 Даньков H. Я., авт. свид. СССР 74687; Бюлл. изобрет., № 7 (1949).
54 Пат. США 2494264 (1950).
55. Англ. пат. 864457 (1961).
56. Англ. пат. 871950 (1961).
57. Пат. ФРГ 1065821 (1961).
58. G1 a n f i е 1 d Е. J., Miller R. A., Rudok F. P., Chem. Eng. Progr.,
Sympos. Ser., 62, № 63, 24 (1966).
59. С 1 i f f о г d J. E., К о 1 i с E. C., Faust C. L., Chem. Eng. Progr., Sympos.
Ser., 62, № 63, 43 (1966).
ГЛАВА
V
ЭКСПЛУАТАЦИЯ УСТАНОВОК
ЭЛЕКТРОЛИЗА ВОДЫ
1. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА
Технологическая схема производства водорода и кислорода элек-
тролизом воды сравнительно проста. Кроме основной стадии раз-
ложения воды она включает несколько вспомогательных стадий,
необходимых для обеспечения питания электролизеров постоян-
ным током, для очистки питающей воды и приготовления элект-
ролита. При повышенных требованиях к чистоте газов электро-
лиза схема дополняется стадиями очистки водорода и кислорода
от щелочного тумана и взаимных примесей и осушки газов для
удаления паров воды, унесенных из электролизеров и образовав-
шихся при каталитической очистке. Ниже описаны два наиболее
характерных варианта технологической схемы электролиза воды:
примерная промышленная схема производства большой мощности
с использованием крупных фильтрпрессных электролизеров
ФВ-500 (на 500—650 м3/ч водорода), работающих при небольшом
избыточном давлении, и схема средних и малых установок
электролиза воды, обычно работающих под давлением 10 ат и,
как правило, снабженных оборудованием для каталитической
очистки и осушки газов. Однако первый вариант схемы не исклю-
чает возможности каталитической очистки и осушки газов.
И наоборот, во втором варианте схемы эти стадии могут отсут-
ствовать, если в них нет необходимости.
Принципиальная технологическая схема электролиза воды без
давления представлена на рис. V-1. Промышленная вода, очи-
щенная от механических примесей в песчаных фильтрах 4, под-
вергается ионообменной очистке от химических примесей в ани-
онитовом 7 и катионитовом 6 фильтрах и поступает в сборники 9
питающей воды. Иониты периодически регенерируют раствором
щелочи из емкости 8 и кислоты из емкости 5. Из сборников 9 во-
да перекачивается в питательный бак 10, расположенный обычно
выше уровня жидкости в электролизере 14. Отсюда вода самоте-
ком поступает через водородный газовый фонарь в газосборник
водорода 12 и далее через питательный канал 15 направляется
в каждую ячейку электролизера.
Подача питающей воды в электролизер обычно регулируется
автоматически по уровню электролита в аппарате или вручную,
с помощью вентилей. Приготовление электролита, необходимого
191
для заполнения и подпитки электролизеров, производится вымы-
ванием твердой щелочи из барабанов 1 в баке-растворителе 2,
откуда щелочь подается в баки 3 для хранения и разбавления
электролита. Указанные емкости могут быть использованы и для
Рис. V-1. Технологическая схема промышленного производства водорода боль-
шой мощности:
/-барабаны с твердой щелочью; 2—бак-растворитель щелочи; 3 — баки для хранения элек-
тролита; 4 -фильтр для очистки воды от механических примесей; 5 —емкость для кислотного
регенерационного раствора; 6, 7 — катионитовый и анионитовый фильтры для ионообменной
очистки воды; S—емкость для щелочного регенерационного раствора; 9- емкости для хране-
ния очищенной воды; /(/-напорный питательный бак; //, /2—кислородный и водородный
газосборники, одновременно служащие промывателями газов, буферной емкостью и уравниь
телем перепада давления газа; 13 — газовые каналы; 14 — электролизер; /5 — питательный
канал; 16 — баллоны с азотом для продувки электролизера; /7 — преобразователь тока; 18 — во-
дородный газгольдер; 19 - кислородный газгольдер.
приема рабочего электролита из электролизеров (на рисунке не
показано). После разбавления щелочи дистиллятом или очищен-
ной водой до заданной концентрации электролит из бака 3 через
кислородный газовый фонарь подается в электролизер 14. Преоб-
разование переменного тока сети в постоянный нужного напря-
жения осуществляется на подстанциях, оборудованных мощными
192
ртутными выпрямителями или преооразователями полупроводни-
кового типа.
Газы электролиза — водород и кислород, содержащие сравни-
тельно небольшие примеси щелочного тумана, взаимных загряз-
нений и паров воды, направляются соответственно в водородный
18 и кислородный 19 газгольдеры. Из газгольдеров газы отби-
раются на компримирование или непосредственно используются
по назначению. Чистота электролитического водорода находится
в пределах 99,9—99,7% Н2, электролитический кислород содер-
жит 99,8—99,0% О2.
Технологическая схема электролиза воды под давлением
представлена на рис. V-2. Дистиллят или вода, очищенная в ме-
ханическом 4 и ионообменных фильтрах 6, 7, поступает в емко-
сти 9, затем насосом подается в питательный бак 10, откуда через
промыватель газа 19 направляется в электролизер 21.
В рабочем состоянии газовое пространство питательного
бака 10 соединено с кислородной линией электролизера и вода
для его питания поступает самотеком по мере надобности. Для
закачки воды из баков 9 в питательный бак 10 он отключается от
системы электролизера, находящегося под давлением, и соеди-
няется с атмосферой.
Электролит приготовляется растворением твердой щелочи из
барабанов 1 в баке-растворителе 2 и поступает в емкость 3, где
производится корректировка концентрации щелочи. Готовый
электролит подается на заполнение электролизеров 21. Водород
и кислород, получаемые в электролизере, отделяются от электро-
лита в соответствующих колонках 20, поступают в промыватели и
регуляторы перепада давления газов 18, 19, где охлаждаются во-
дой и отмываются от щелочного тумана, а затем через клапан-
ные регуляторы давления 17 подаются в газовые линии для по-
следующего использования по назначению.
В случае необходимости водород и кислород подвергаются до-
полнительной очистке. От щелочного тумана газы освобождаются
в специальных самоочищающихся фильтрах 11 с насадкой из тон-
коволокнистой стеклянной ваты определенных сортов. Затем газы
подвергаются каталитической очистке: водород—от примеси
кислорода в контактном аппарате 12 на никельалюминпевом или
никельхромовом катализаторе, кислород — от примеси водорода
ь аппарате 13 на гопкалитовом, платиновом или палладиевом ка-
тализаторе. После охлаждения в теплообменниках 14 очищенные
газы поступают на осушку, для чего водород и кислород пропу-
скают через соответствующие осушительные колонки 15 с насад-
кой (чаще всего силикагель или алюмогель) или вымораживают
влагу из газов на специальных холодильных установках. Очи-
щенные сухие газы (водород и кислород) подают потребителям
через кислородный и водородный ресиверы 16.
При неравномерном потреблении электролитического водорода
(или кислорода) его выработка в электролизере может автомати-
13 Зак. 713
193
чески регулироваться изменением токовой нагрузки по импульсу
от датчика давления в газовой линии.
Рис. V-2. Технологическая схема электролиза воды под давлением:
1 — барабаны с твердой щелочью; 2 — бак-растворитель щелочи; 3 — баки для хранения элек-
тро лита; 4 — фильтр для очистки воды от механических примесей; 5 —емкость для кислотного
регенерационного раствора; 6, 7 — анионитовый и катионитовый фильтры для ионообменной
очистки воды; 8 — емкость для щелочного регенерационного раствора; 9 — баки для хранения
очищенной воды; 10— питательный бачок; //-фильтры для очистки газов от щелочного ту-
мана; /2 —аппарат каталитической очистки водорода; 13 — печь дожигания примеси водорода
в кислороде; 14 — холодильники газов; /5 —осушители газов; 16— ресиверы кислорода и водо-
рода; /7-клапанные регуляторы давления газов; 18, /9- кислородный и водородный промы-
ватели газа, служащие одновременно гидравлическими регуляторами перепада давления
газов; 20 — разделительные колонки; 2/ —электролизер; 22 —баллоны с азотом для продувки
электролизера; 23 — преобразователь тока.
Преобразователи тока 23 соответствующей мощности снаб-
жают электролитические установки постоянным током необходи-
мого напряжения.
Регенерация ионитов в фильтрах 6 и 7 производится периоди-
чески. По мере необходимости анионит обрабатывают 5—10%-
194
ним раствором щелочи из бака S, катионит — 5—10%-ной соля-
ной кислотой из бака 5. После отключения и перед пуском элект-
ролизная установка продувается азотом из баллонов 22.
2. ПРИГОТОВЛЕНИЕ ПИТАЮЩЕЙ ВОДЫ
В процессе электролиза вода расходуется непосредственно на
получение водорода и кислорода, а также уносится в виде паров
с вырабатываемыми газами. Расход воды на 1 м3 водорода и
0,5 м3 кислорода практически составляет 820—850 г.
В электролите с течением времени постепенно накапливаются
примеси, вносимые с питающей водой. Поэтому к чистоте воды,
используемой для питания электролизных установок, предъяв-
ляются высокие требования. При использовании недостаточно
чистой воды процесс электролиза вначале идет точно так же, как
при питании дистиллятом. Однако после более или менее длитель-
ного применения неочищенной воды работа электролизера резко
ухудшается. Этим в основном и объясняется то, что при работе
примерно в равных условиях (плотность тока, температура, кон-
центрация электролита) пробег электролизеров одной и той же
конструкции до капитального ремонта колеблется в пределах
5—15 лет. Для нормальной работы электролизных установок с вы-
сокими устойчивыми показателями в течение длительного времени
(10 лет и более) необходима тщательная очистка воды. В настоя-
щее время пригодной для электролиза считается вода с удельной
электропроводностью не выше 10“5 ом~х • см~\ содержащая не бо-
лее 10 мг/л сухого остатка, в том числе не более 6 мг/л хлоридов
и до Змг/л железа. Общая окисляемость воды должна быть не
более 30 мг/л. Однако для питания электролизеров рекомендуется
применять более чистую воду (электропроводность не выше
10-6 ом~1 • см~х и содержание не выше 1 мг/л железа, 2 мг/л хло-
ридов и 3 мг/л сухого остатка).
Для питания промышленных электролизеров можно применять
паровой конденсат, если его электропроводность не выше
10"5 ом~х • см~х и в нем отсутствуют примеси масла и других орга-
нических веществ, которые вызывают вспенивание электролита.
Пена создает большие, непрерывно изменяющиеся местные сопро-
тивления и служит причиной возникновения толчков и перепадов
давления газов, что в свою очередь приводит к взаимному загряз-
нению их, увеличению утечек тока и другим нежелательным явле-
ниям. В паровом конденсате часто содержится значительное коли-
чество железа. В таких случаях перед подачей на питание электро-
лизеров необходима специальная очистка конденсата от этой
примеси.
При отсутствии конденсата достаточной чистоты воду, исполь-
зуемую для питания электролизеров, необходимо подвергать очист-
ке дистилляцией, электроосмосом или обессоливанием на ионитах.
Очистка воды дистилляцией давно используется в промышлен-
13*
195
ности и производится в типовом оборудовании различной произво-
дительности. Дистилляционный метод прост, но требует значитель-
ных затрат энергии. Электроосмотический метод также известен
довольно давно, но более сложен по аппаратурному оформлению
и в промышленных масштабах применяется редко. Умягчение и
обессоливание воды ионообменным методом, промышленное освое-
ние которого было начато в 30-х годах, получило наиболее широ-
кое распространение благодаря простоте, экономичности и высокой
степени очистки воды. Разработаны типовые промышленные уста-
новки 1~3 очистки воды на ионитах.
Ступенчатое обессоливание воды с последовательным чередова-
нием ОН'-анионитовых и Н+-катионитовых фильтров позволяет
получать чистую воду, освобожденную практически от всех загряз-
няющих ее катионов и анионов, даже из морской воды, содержа-
ние солей в которой достигает 30—35 г/л. Регенерацию ионитовой
насадки проводят при повышении удельной электропроводности
очищаемой воды сверх 10-6 ом~х-см~}. Затраты на очистку воды
с избытком окупаются повышением надежности и длительности
работы электролизеров. С развитием и совершенствованием тех-
ники электролиза воды требования к чистоте питающей воды ста-
новятся все более жесткими.
Для предотвращения загрязнения воды продуктами коррозии
все промежуточные сборники, емкости для хранения очищенной
воды и трубопроводы для ее подачи следует выполнять из нержа-
веющей стали или алюминия либо тщательно защищать от корро-
зии и перед заполнением тщательно промывать. Хорошие резуль-
таты получены при хранении н транспортировании слабо подще-
лоченной воды в емкостях и трубопроводах из обычной углеро-
дистой стали. При этом не наблюдалось коррозии и загрязнения
питающей воды ионами железа. Однако в случае применения угле-
родистой стали необходимо строго следить за подщелачиванием
очищенной воды. Для большей гарантии от возможного попадания
гидроокиси железа в питающую воду на линии перед входом в
электролизер иногда устанавливают фильтры с войлочной насад-
кой или с плотной репсовой сеткой из никелевой проволоки.
3. ПРИГОТОВЛЕНИЕ И ОЧИСТКА ЭЛЕКТРОЛИТА
В качестве электролита для электролиза воды применяют преиму-
щественно растворы едкого кали и лишь в отдельных случаях рас-
творы едкого натра. Для приготовления электролита на промыш-
ленных установках используют только чистые щелочи, получаемые
при электролизе водных растворов хлоридов на ртутном катоде.
По данным В. С. Иванова и Ф. 3. Серебрянского 4, электролизеры,
работающие на электролите из химически чистой щелочи, имеют
в два раза большую длительность пробега между ремонтами, чем
такие же электролизеры, заполненные электролитом, приготовлен-
ным из технического едкого кали.
190
Твердое едкое кали в виде гранул или монолита обычно постав-
ляется в стальных барабанах емкостью по 100 и 200 кг, жидкая
щелочь — в стальных цистернах. Приготовление электролита на
крупных установках электролиза воды производится в отдельном
помещении вымыванием щелочи из барабанов водой. В баке для
растворения имеется несколько гнезд в виде корзины, куда вверх
дном устанавливают предварительно вскрытые барабаны со ще-
лочью. В каждом гнезде имеется штуцер, соединенный с насосом
для подачи дистиллята или раствора. Струя воды под напором
растворяет щелочь в барабане, свободно стекает в бак и снова по-
дается насосом в барабан до полного вымывания щелочи. Пустые
барабаны заменяют заполненными и продолжают растворение до
получения концентрированных растворов электролита. По оконча-
нии растворения щелочи в бак добавляют очищенную воду в ко-
личестве, необходимом для образования 32—35%-ного раствора,
используемого при электролизе воды, и тщательно перемешивают
при помощи циркуляционного насоса. Для удаления механических
примесей электролит фильтруют через плотную никелевую сетку
и перекачивают в хранилища, откуда по мере надобности заби-
рают для заполнения или подпитки электролизеров.
Электролит следует хранить в закрытых емкостях, чтобы по
возможности уменьшить его контакт с воздухом, всегда содержа-
щим двуокись углерода, которая с растворенной щелочью легко
образует карбонаты. Высокое содержание карбонатов в электро-
лите вредно, так как приводит к увеличению его омического сопро-
тивления и повышению перенапряжения выделения кислорода на
аноде. В присутствии карбонатов заметно усиливаются коррозион-
ные процессы.
Для устойчивой и более надежной работы электролизеров в
электролит вводят бихромат калия К2СГ2О7 (хромпик) в таком
количестве, чтобы содержание его в электролите составляло
2—3 г/л. Рассчитанное количество хромпика растворяют в горячем
конденсате или дистилляте, который затем подается в бак с элек-
тролитом, поступающим после перемешивания на заполнение
электролизеров. Раствор хромпика можно подавать и с питающей
водой непосредственно в работающий электролизер. Действие
хромпика длится обычно 1,5—2 года, после чего добавляют новую
порцию К2СГ2О7.
Растворение щелочи сопровождается выделением тепла и ще^
лочных паров, раздражающе действующих на дыхательные пути
и слизистые оболочки. Поэтому в помещениях для растворения
щелочи должна быть обеспечена хорошая вентиляция. Твердая ще-
лочь и ее концентрированные растворы, особенно в горячем со-
стоянии, при попадании на кожу вызывают сильные ожоги. Следо-
вательно, электролит необходимо приготовлять с соблюдением всех
мер предосторожности, исключающих возможность разбрызгива-
ния, перелива и утечки жидкости через неплотности коммуникаций,
во избежание ожогов щелочью.
14 Зак. 713
197
При длительной эксплуатации электролит загрязняется продук-
тами разрушения футеровочных материалов, деталей электролизе-
ров (диафрагмы, электродов и др.), а также примесями, содержа-
щимися в питающей воде и в воздухе (СОг). Поэтому периоди-
чески электролит заменяют свежим. Загрязненная щелочь может
быть очищена и возвращена в производство. Обычно электролит
очищают химическим методом — осаждением гидроокисью кальция
загрязняющих примесей, в основном карбонатов, содержание ко-
торых может достигать нескольких десятков граммов в 1 л. На-
ряду с карбонатом кальция в осадок частично выпадает также
сульфат кальция. После отстаивания и слива электролита оса-
док выбрасывают. Регенерированный электролит доводят до не-
обходимой концентрации и возвращают на заполнения электроли-
зеров.
Для очистки щелочи от примесей анионов можно также исполь-
зовать принцип совмещения электролиза воды с концентрирова-
нием катионов в катодном, а анионов в анодном пространстве
ячейки (стр. 35). Для этой цели из обычных деталей надо собрать
специальный электролизер, ячейки (или пакеты ячеек) которого по
жидкости соединены по каскадной схеме. Трех или четырех ступе-
ней в электролизере вполне достаточно для очистки щелочи прак-
тически от всех загрязняющих ее анионов. Ячейки (или пакеты
ячеек) электролизера собирают таким образом, чтобы электролит
циркулировал через катодное пространство каждой предыдущей и
анодное пространство каждой последующей ячейки. При работе
такого электролизера одновременно с обычным разложением воды
на водород и кислород в крайнем катодном пространстве и соеди-
ненной с ним емкости будет концентрироваться щелочь и пони-
жаться содержание загрязняющих анионов (СГ, СОз", SO?", . NO7
и др.), а в крайнем анодном пространстве и соединенной с ним
емкости будут постепенно накапливаться примеси и снижаться
концентрация щелочи. Питание очистного электролизера произво-
дится грязной щелочью. Периодически (или непрерывно) из ка-
тодной емкости отбирают очищенную концентрированную щелочь,
а из анодной емкости — загрязненный слабый раствор щелочи.
При электролизе воды с одновременным получением тяжелой
воды гораздо большую ценность, чем щелочь, представляет вода,
обогащенная дейтерием. Поэтому электролит первых ступеней
электролиза очищают химическим способом, а электролит более
высоких ступеней, с повышенным содержанием тяжелой воды,
нейтрализуют углекислым газом и затем выпаривают досуха с воз-
можно более полной конденсацией паров воды.
4. ОЧИСТКА И ОСУШКА ГАЗОВ
Обычно в производстве электролитического водорода и кислорода
получаются достаточно чистые газы (стр. 152). Основной примесью
в водороде является кислород, в кислороде — водород. В газах
198
практически отсутствуют какие-либо другие примеси, кроме паров
воды и тумана щелочи. Содержание щелочи в водороде обычно до
20 жг/ж3, в кислороде до 100 мг]м3. В соответствии с ГОСТ
3022—60 электролитический водород должен иметь следующий со-
став:
Водород, объемы. %, не менее........... 99,7
Кислород, объемн. %, не более........... 0,3
Влажность газа, г/д/3, не более
несжатого............................ 25
сжатого.............................. 1,0
Специально утвержденных норм качества электролитического
кислорода нет. Обычно при его использовании руководствуются
требованиями ГОСТ 5580—58 на технический газообразный кис-
лород:
Показатели
Содержание кислорода, объемн. %,
не менее..........................
Содержание влаги, г/л3, не более . .
Сорт
высший первый второй
99,5 99,2 98,5
0,07 0,07 0,07
Кислород, получаемый методом электролиза воды, должен со-
держать не более 0,7 объемн. % водорода. Неочищенный кислород
нельзя применять в медицине из-за присутствия в нем щелочного
тумана.
Современные электролизеры обеспечивают чистоту газов, до-
статочную для основных потребителей. Однако расширение обла-
стей применения водорода привело к необходимости снабжения
некоторых потребителей водородом очень высокой чистоты. Для
этих целей, а также при недостаточной чистоте получаемого водо-
рода его подвергают каталитической очистке от кислорода, а ино-
гда от примесей электролита В таком случае очистка от щелочи
обычно предшествует каталитическому дожиганию.
Газы очищают от щелочного тумана в насадочных фильтрах,
так плотно заполненных рядами стеклянной ваты, чтобы исключа-
лась возможность проскока газа вдоль стенок. Крышку фильтра
герметично уплотняют прокладкой и стяжными болтами. Мелкие
капли тумана щелочи осаждаются на вате и постепенно стекают
в нижнюю часть фильтра, откуда жидкость периодически отво-
дится. Благодаря такой самоочищающейся насадке фильтры могут
очень длительное время обеспечивать высокую степень очистки га-
зов. Однако в результате постепенного уплотнения стеклянной
ваты гидравлическое сопротивление фильтра может настолько воз-
расти, что затруднится выход газа. В этом случае насадку заме-
няют свежей. На небольших установках фильтры для очистки га-
зов от щелочного тумана для большей компактности размещают
на электролизере (на линии от промывателя газа к подогревателю
узла каталитической очистки). Содержание щелочи в газах после
14*
199
очистки очень мало. Даже в кислороде эта примесь не превышает
0,1 мг/л, что дает возможность использовать такой кислород в ме-
дицине.
Очистку водорода от примеси кислорода проводят в контакт-
ных аппаратах, где газы проходят слой подогретого катализатора.
При этом водород взаимодействует с содержащимся в нем кисло-
родом, образуя воду. В качестве катализатора ранее использовали
платинированный асбест, мелко раздробленную медь, серебро и
железо. Затем стали применять палладиевые катализаторы — пал-
ладий, нанесенный на пемзу, силикагель и другие носители. Такие
катализаторы обеспечивают высокую степень очистки, но довольно
дороги. Наиболее дешевы и эффективны для очистки водорода ни-
кельалюминиевый и еще более активный никельхромовый катали-
заторы, которые в основном и применяются в настоящее время.
Высокая степень очистки водорода от кислорода (порядка
тысячных долей процента О2 и менее) достигается на никельалю-
миниевом и никельхромовом катализаторах при 100—130° С и
объемной скорости около 1000 «г1. Для нагревания до заданной
температуры газ пропускают через электрический или паровой на-
греватель, установленный перед контактным аппаратом, или через
теплообменник, в котором свежие газы подогреваются отходящим
из контактного аппарата газом. При содержании в водороде более
0,5% Ог необходимое для протекания реакции тепло выделяется
в процессе дожигания (при дожигании 1% кислорода температура
в контактном аппарате повышается на 160° С). Поэтому подогрев
нужен только в начальный период очистки.
После контактного аппарата газ охлаждается в водяном тепло-
обменнике, при этом пары воды, образовавшиеся при каталитиче-
ской очистке, частично конденсируются, водород далее поступает
на осушку.
Очистка кислорода от примеси водорода необходима в тех слу-
чаях, когда нужен кислород высокой чистоты, а также при исполь-
зовании кислорода в процессах, протекающих без участия водо-
рода, который вследствие этого может накапливаться в неочи-
щенном газе до взрывоопасной концентрации. Категорически
запрещено компримирование кислорода, если содержание в нем во-
дорода превышает 0,7%. В этих случаях рекомендуется предвари-
тельная очистка кислорода дожиганием Н2 на катализаторе. Устой-
чивы и активны платиновые катализаторы (платинированный
асбест или платина, нанесенная на окись алюминия) и гопкалит,
состоящий из окиси меди и окиси марганца. При использовании
платиновых катализаторов, в частности платины, нанесенной на
окись алюминия, объемная скорость газа составляет 1250—1300 ч~\
Таким образом, 150—200 л катализатора, содержащих 3—5 кг пла-
тины, в течение длительного времени обеспечивают очистку
200—250 м3/ч кислорода. Достаточная скорость и полнота очистки
влажного газа достигается при 50° С. Такая температура в боль-
шинстве случаев развивается при дожигании примеси водорода,
200
поэтому предварительный подогрев газа необходим только в на-
чале процесса. В атмосфере сухого газа реакция дожигания во-
дорода на платине, нанесенной на окись алюминия, достаточно
интенсивно протекает даже при комнатной температуре.
При использовании более дешевого гопкалита требуются боль-
шие объемы катализатора (и, следовательно, увеличение габари-
тов контактного аппарата) и более высокие температуры дожи-
гания.
Для удаления образовавшихся паров воды и охлаждения газа
кислород после очистки пропускают через водяной теплообменник.
Иногда тепло очищенного газа используют для подогрева газа,
поступающего на очистку, но чаще всего предварительный нагрев
проводится при помощи электронагревателя, который автомати-
чески отключается по достижении необходимой температуры в
контактном аппарате и включается при ее снижении. После охлаж-
дения кислород направляют потребителям или на осушку.
Для большинства потребителей водорода и кислорода содер-
жащиеся в этих газах водяные пары (20—25 г/л*3) не являются
вредными примесями. Присутствие влаги нежелательно только при
транспортировании газов в зимнее время, так как конденсирую-
щаяся вода замерзает в трубопроводах. Поэтому на отдельных
участках газопровода предусматривают уклоны, а в нижних точ-
ках газовой трассы устанавливают сифонные спуски и влагоотде-
лители. В некоторых случаях во избежание конденсации влаги
применяют водяной или паровой обогрев газовых коммуникаций
небольшой протяженности. Однако более кардинальной мерой яв-
ляется осушка газов перед подачей их потребителю. Для осушки
газы иногда охлаждают до минус 5 — минус 10°С, пропуская их
через рассольные холодильники, в которых в качестве хладоаген-
тов используются, например, растворы хлористого кальция, или
применяют специальные холодильные машины7. В результате та-
кого охлаждения влагосодержание газов снижается примерно до
2—3 г/ж3.
Наибольшее распространение получила осушка газов сорбен-
тами5»6. В большинстве промышленных установок для этого ис-
пользуется силикагель — дешевый, эффективный, легко регенери-
руемый и достаточно прочный поглотитель влаги. В последние годы
широкое применение получил еще более эффективный поглотитель
влаги — алюмогель. Содержание влаги в газе после его сушки на
алюмогеле составляет 0,03—0,05 г/л*3, что соответствует точке росы
минус 50 — минус 40° С. Силикагель регенерируют обычно тем же
газом, нагретым до 200—250° С.
При компримировании не производят осушку газов, так как по-
чти все содержащиеся в них водяные пары выделяются при охлаж-
дении газов после их сжатия. Остаточное содержание влаги в газе
зависит от давления сжатия, температуры газа после охлаждения
и при конечном давлении сжатия 150 ат снижается примерно до
0,2 г/л*3. Следует отметить, что при компримировании вместе
201
с водой из газов с достаточной полнотой удаляется и щелочной ту-
ман. Поэтому баллонные водород и кислород являются сухими и
свободными от примесей щелочи газами.
5. КОНТРОЛЬ И АВТОМАТИЗАЦИЯ
ПРОЦЕССА ЭЛЕКТРОЛИЗА ВОДЫ
Технологический процесс электролиза воды очень устойчив, легко
контролируется и поддается автоматическому регулированию.
Сила тока (нагрузка) на электролизере устанавливается исходя
из необходимой производительности по газу; она не должна пре-
вышать нагрузки, предусмотренной для данного электролизера.
Сила тока регулируется подачей соответствующего напряжения на
электролизер и постоянно контролируется по показаниям ампер-
метра. Если заданное напряжение не меняется, то самопроизволь-
ные колебания нагрузки за счет незначительных при нормальной
работе изменений температуры или концентрации электролита не-
велики.
Напряжение на электролизере непрерывно контролируется
вольтметром, который показывает общее напряжение, как сумму
напряжений на всех ячейках. Рабочее напряжение на данном элек-
тролизере зависит от нагрузки, температуры и концентрации элек-
тролита. Резкое повышение или снижение напряжения на ванне
является признаком серьезных нарушений в работе ячеек.
Кроме контроля за общим напряжением на электролизере реко-
мендуется проверять баланс напряжений по ячейкам измерением
разности напряжения между их основными деталями. Суммарный
перепад напряжений между катодом и рамой (КР) и между ано-
дом и рамой (АР) равен напряжению между катодом и анодом
(АК), т. е. напряжению на ячейке. Баланс напряжения по ячей-
кам следует проверять сразу после включения электролизера в ра-
боту, а затем периодически 1 раз в 3—6 месяцев. Изменение ба-
ланса напряжения по ячейкам характеризует степень включения
рам в побочные электрохимические процессы вследствие замыка-
ний, утечек тока, коррозии и других причин, что имеет важное зна-
чение при выяснении причины понижения чистоты кислорода.
Измерение перепада напряжений КР, АР и АК производят при
помощи удлиненных металлических щупов, изолированных по всей
длине, включая рукоятку, до наконечников, и вольтметра со шка-
лой от 0 до 5 в. При проведении измерений должна быть обеспе-
чена надежная защита, изоляция человека и прибора от электро-
лизера и «земли».
Контроль за уровнем жидкости в электролизере ведут при по-
мощи водомерных стекол, установленных в газосборнике (с водо-
родной и с кислородной сторон) или в регуляторах давления. От-
носительно постоянный уровень жидкости в аппарате поддержи-
вают непрерывной или периодической подачей питающей воды.
В большинстве случаев применяют автоматическое регулирование
202
количества подаваемой воды по уровню жидкости в газосборнике.
Температуры электролита, газов (до и после их охлаждения) и
охлаждающей воды на входе в аппарат и выходе из него непре-
рывно измеряется дистанционными манометрическими термомет-
рами или термометрами сопротивления, обычно устанавливаемыми
на щите электролизера. Температуру поддерживают на заданном
уровне регулированием подачи охлаждающей воды. На автомати-
зированных установках электролиза воды, работающих практи-
чески без обслуживающего персонала, подачу охлаждающей воды
регулируют при помощи термосигнализаторов.
Давление газов на выходе из электролизеров (в коллекторе
каждого газа) контролируют по показаниям манометров, устанав-
ливаемых на щите электролизера. На электролизерах, работаю-
щих под давлением, дополнительно измеряют перепад давлений
между кислородом и водородом. Установленный прибор сигнали-
зирует о превышении установленной нормы перепада.
Чистота электролитического водорода и кислорода. Определе-
ние чистоты газов электролиза путем их анализа на содержание
взаимных примесей можно выполнять при помощи стационарных
газоанализаторов типов ТХГ-5А, ТХГ-5Б и ДПГ-5; для определен
ления водорода в кислороде и в воздухе применяют также пере-
носной газоанализатор ПГФ-1. Автоматические термохимические
газоанализаторы ТХГ-5 — промышленные приборы непрерывного
действия. Принцип их работы основан на измерении теплового
эффекта сжигания примеси водорода в кислороде или примеси
кислорода в водороде. Прибор ТХГ-5А для определения примеси
Н2 в кислороде имеет шкалу от 0 до 2%, с ценой деления 0,1% Н2,
прибор ТХГ-5Б для анализа примеси О2 в водороде — шкалу от
0—1% О2, с ценой деления 0,05% О2. Прибор ДПГ-5 — автомати-
ческий газоанализатор для непрерывного определения кислорода
в газе, основанного на электрохимическом действии кислорода как
деполяризатора; шкала прибора от 0 до 5% О2.
Аналитическое определение примесей одного газа в другом мо-
жет производиться также лабораторными методами. «Лаборатор-
ный анализ кислорода основан на определении в нем содержания
водорода выжиганием Н2 на платиновой проволоке в приборе Вин-
клера. Анализ водорода основан на поглощении содержащегося в
нем кислорода медноаммиачным раствором, толуолом или другим
активным поглотителем. Определение чистоты водорода произво-
дится на аппарате Орса.
Анализ азота (после продувки им аппарата) на содержание
примесей водорода, если проба отбирается из кислородного кол-
лектора и газосборника, или на содержание кислорода, если проба
отбирается из водородного коллектора и газосборника, следует вы-
полнять после отключения и перед пуском аппарата. Анализ азота
на содержание примеси кислорода производится по такой же ме-
тодике и на том же аппарате, что и анализ водорода на содержа-
ние в нем кислорода. После продувки кислородных коллекторов
203
азот анализируют на содержание водорода, который дожигают в
аппарате Винклера. Для обеспечения возможности горения водо-
рода к анализируемой пробе азота добавляют воздух (обычно
V4 часть от объема азота).
Если нужен особо чистый газ, определяют его влажность и при-
месь щелочного тумана. Влажность газов определяется с по-
мощью гигрометров или аналитически, с использованием поглоти-
телей влаги по их привесу при пропускании через сорбент опре-
деленного количества газа, а также вымораживанием влаги жид-
ким азотом.
Количество щелочного тумана, уносимого газами, определяется
периодически при помощи фильтров Петрянова. Через такой
фильтр, герметично зажатый в плексигласовом корпусе, состоящем
из двух фланцев, пропускают определенное количество газа, изме-
ренное газовыми часами. На фильтре практически полностью улав-
ливается содержащаяся в газе примесь щелочи. Затем фильтр сни-
мают, помещают в колбу и заливают дистиллированной водой.
Раствор вместе с фильтром титруют соляной кислотой. Найденное
по результатам титрования количество щелочи относят к общему
количеству пропущенного через фильтр газа и определяют содер-
жание щелочи в единице его объема (1 л или 1 м3).
Концентрацию электролита определяют реометром или анали-
тически— обычным титрованием кислотой. Периодически (1 раз
в год) в электролите определяют содержание примесей карбона-
тов и хлоридов, которые накапливаются в процессе работы в ос-
новном из питающего конденсата (воды) и из щелочи, а также
содержание железа, переходящего в электролит в результате кор-
розионных процессов. Хлориды, карбонаты и железо в электролите
определяют по общепринятым методикам.
Дистиллят или конденсат, подаваемые в электролизер, контро-
лируют на содержание хлор-иона, железа и органических примесей
(масел). Наиболее надежным показателем чистоты питающей воды
является ее удельное омическое сопротивление, которое значитель-
но изменяется в присутствии примесей любых ионов. Омическое
сопротивление определяется при помощи солемеров СО-1.
Питающий конденсат проверяют на содержание органических
примесей систематически, если он поступает с соответствующих
производств, или периодически, если присутствие таких примесей
маловероятно. Качественную проверку примеси масла в конден-
сате можно легко сделать при помощи кристаллика камфары8.
В чистой воде такой кристаллик совершает быстрое непрерывное
движение по поверхности, которое прекращается в присутствии
даже микроследов масла. Органические примеси в питающей воде
можно количественно определять по ее окисляемости. Это опре-
деление основано на окислении органических веществ марганцево-
кислым калием в кислой или щелочной среде. Остаток введенного
марганцевокислого калия восстанавливается щавелевой кислотой,
избыток которой оттитровывают марганцевокислым калием.
204
Высокое содержание хлоридов (по хлор-иону) влияет на точ-
ность определения окисляемости органических веществ в кислой
среде, так как в этих условиях происходит и частичное окисление
ионов С1~. Поэтому в водах, содержащих более 300 мг)л хлор-иона,
определение окисляемости проводят в щелочной среде.
Одним из преимуществ электрохимического производства водо-
рода является возможность его полной автоматизации. Сила тока
на электролизере не только поддерживается постоянной, но может
автоматически регулироваться в зависимости от необходимой
производительности. Нагрузки регулируются изменением напряже-
ния постоянного тока, подаваемого на питание электролизера от
выпрямителя, в зависимости от давления используемого газа в ли-
нии. Автоматическое питание электролизера водой из напорных
баков производится через регулирующие клапаны, в зависимости
от уровня жидкости в аппарате. При снижении или чрезмерном
повышении уровня электролита возможна автоматическая сигна-
лизация и отключение электролизера. С помощью автоматических
клапанов (по сигналу от контактных манометрических термомет-
ров) регулируют подачу охлаждающей воды в аппарат для под-
держания необходимой температуры электролита и газов.
Схема автоматического выравнивания давления обоих газов
описана в главе III (стр. 106 сл.). При разности давлений водо-
рода и кислорода, превышающей установленную норму, электро-
лизная установка может автоматически отключаться с помощью
сигнализатора перепада давления. Автоматическое отключение
установки возможно также при чрезмерном повышении давления
газов, увеличении температуры электролита и снижении чистоты
одного из газов (по сигналу от автоматических газоанализаторов,
непрерывно контролирующих чистоту водорода и кислорода). Кон-
троль и обслуживание электролизных установок могут быть пол-
ностью автоматизированы при оснащении их широко используе-
мыми в промышленности средствами автоматики.
6. КОРРОЗИЯ в ЭЛЕКТРОЛИЗЕРАХ И ЕЕ УСТРАНЕНИЕ
Коррозионная стойкость железа и никеля
в щелочных растворах
В зависимости от того, вступает ли металл в химическое взаимо-
действие с окружающей средой или нет, его классифицируют как
устойчивый или неустойчивый в данной среде. В ряде случаев ме-
талл не вступает в химическую реакцию, так как она термодина-
мически невозможна. Однако во многих случаях металл оказы-
вается устойчивым и тогда, когда его химическое взаимодействие
со средой с точки зрения термодинамики вполне возможно
(например, железо — в концентрированной серной кислоте,
205
алюминий — в концентрированной азотной кислоте и т. д.). Такое
состояние металла принято называть пассивным. Способность к
пассивации и к сохранению пассивного состояния во многом ха-
рактеризует коррозионную стойкость конструкционных металли-
ческих материалов. Перевод металла в пассивное состояние по-
зволяет использовать во многих агрессивных средах более дешевые
и доступные материалы. Разработан ряд методов перевода метал-
лов в пассивное состояние, как химических — воздействием пасси-
вирующих веществ (обычно окислителей), так и электрохимиче-
ских — путем анодной поляризации.
Очень удобным и эффективным методом пассивации металлов,
получившим широкое практическое применение, является введение
в агрессивную среду окислителей. В работах Я. М. Колотыр-
кина9’10 показано, что степень пассивности металла (или скорость
его растворения) определяется электродным потенциалом и не за-
висит от того, поддерживается данное значение потенциала за
счет поляризации металла внешним анодным током или за счет
одновременно протекающих реакций (например, выделение водо-
рода, восстановление молекулярного кислорода или других ве-
ществ).
Если при наложении положительного потенциала весь ток или
его большая часть расходуется на растворение металла (его пере-
ход в раствор в виде ионов), то металл находится в активном со-
стоянии и, следовательно, не может быть использован в этих усло-
виях в качестве анода. Если же при анодной поляризации ток
практически полностью расходуется на другой процесс, для про-
текания которого требуется более положительный потенциал, чем
для растворения металла (например, выделение кислорода на ни-
келе при электролизе воды), в этом случае металл пассивен и
может служить анодным материалом. Пассивация вызывает суще-
ственное изменение поверхностного слоя металла, благодаря чему
становится возможным протекание процесса, требующего большей
затраты энергии, тогда как растворение металла — более легкий
процесс в отношении затраты энергии — полностью прекращается
или протекает с очень малой скоростью. При этом нарушается за-
кон электрохимической кинетики, согласно которому скорость
анодного растворения металла должна возрастать при увеличении
потенциала электрода. При изменении условий, в которых нахо-
дится металл, состояние пассивности в ряде случаев может быть
нарушено. Поэтому изменения плотности тока (или потенциала
металла), концентрации электролита, температуры или других ус-
ловий поляризации, иногда совсем 1незначительные, могут слу-
жить причиной перехода металла из пассивного состояния в актив-
ное и наоборот.
Явление пассивации металлов было известно давно. Но только
в 30-х годах XX в. началось более широкое изучение механизма
пассивации и пассивного состояния металлов. При этом выявились
две основные точки зрения на теорию пассивации. Сторонники
206
фазовой теории объясняют торможение процесса растворения ме-
талла образованием на его поверхности фазовой окисной пленки,
изолирующей металл от электролита11-14. Другие считают пасси-
вацию результатом образования на металлической поверхности
химически адсорбированных слоев кислорода или кислородсодер-
жащих соединений 15-17. По-видимому, в зависимости от условий
и свойств металла возможна пассивация его поверхности вслед-
ствие образования фазовой окисной пленки или адсорбционных
слоев. Так, анодная пассивация железа в щелочном растворе об-
наруживается уже при появлении -на его поверхности слоя кисло-
рода толщиной менее чем в один атомный слой 18-2°, что подтвер-
ждает правильность адсорбционной теории. Пассивация же никеля
в щелочных средах связана в основном с образованием фазовой
пленки окиси никеля.
И железо и никель относятся к металлам, которые, находясь
под током в щелочной среде, могут в зависимости от условий на-
ходиться или в пассивном или в активном состоянии, т. е. быть
устойчивыми или растворяться. Поэтому результаты исследований
электрохимического поведения железа и никеля в растворах ще-
лочи при различных плотностях тока, температуре и концентрации
электролита представляют не только научный, но и большой прак-
тический интерес. Они позволили вначале в общем правильно вы-
брать материалы для электродов и для изготовления других де-
талей и аппаратов электролизных установок, а позднее помогли
выяснить и в большинстве случаев устранить причины коррозии
деталей фильтрпрессных электролизеров.
Железо и никель весьма склонны к пассивации, для них харак-
терно замедление ионизации металла уже при сравнительно низких
плотностях тока, при этом потенциал металла смещается в поло-
жительную сторону, т. е. наступает пассивация. Причиной пассив-
ного состояния никеля21 и железа22 является образование окисных
соединений. При этом, чем выше анодный потенциал металла, тем
прочнее связь кислорода с металлом, толще и плотнее поверхност-
ный окисный слой и, следовательно, полнее пассивация. Наиболее
устойчива пассивация при потенциале выделения кислорода. Ско-
рость и степень пассивации повышаются также с увеличением
плотности анодного тока, уменьшением концентрации щелочи (до
определенного предела) и снижением температуры.
Склонность металла к пассивации связана со способностью его
окислов растворяться в данной среде: чем легче растворимы окис-
лы, тем труднее пассивируется металл и наоборот. Валентность
металла в поверхностном окисле, обусловливающем пассивность,
почти всегда выше валентности его ионов, образующихся при анод-
ном процессе растворения металла, относительно которого насту-
пает пассивация. Пассивированный металл может быть возвра-
щен в активное состояние путем катодной поляризации, кипяче-
ния в щелочи (без действия тока) или механической зачистки
электрода.
207
В зависимости от назначения детали электролизера ее металл
может не участвовать в электрохимических процессах или подвер-
гаться катодной или анодной поляризации в широком интервале
плотностей тока, температур, концентраций электролита, скоро-
стей его циркуляции и других условий. Поэтому в первую очередь
необходимо знать, как должна вести себя при этом сталь.
Л. М. Волчкова23 показала, что наличие значительных примесей
в железе (опыты проводились со сталью 20, из которой в основном
изготовляют детали электролизеров) не оказывает существенного
влияния на его поведение в растворах щелочи. Поэтому резуль-
таты исследований, полученные в большинстве случаев для хими-
чески чистого железа, можно использовать и для объяснения элек-
трохимического поведения стали при электролизе в щелочных рас-
творах.
Известно, что в кислой среде железо неустойчиво. С повыше-
нием pH раствора скорость растворения железа заметно снижается,
и при pH = 7,5 растворение его практически прекращается. Раз-
рушение железа в нейтральной воде происходит в основном под
действием растворенного в ней кислорода с образованием ионов
трехвалентного железа, причем скорость коррозии зависит от кон-
центрации растворенного железа. Скорость растворения железа в
холодных концентрированных растворах щелочи очень мала, с
повышением температуры она заметно возрастает, но и в горячих
щелочах быстро падает по достижении определенной концентра-
ции ионов железа в растворе. По данным Р. Шольгера25, изучав-
шего химическое растворение порошкообразного железа в кипя-
щих растворах щелочей, его переход в раствор прекращается по
достижении определенной концентрации ионов железа, которая
(при соответствующих температурах кипения) составляет:
Концентрация NaOH, °/о....... 50 30 10
Концентрация ионов железа, г/л . . 4 0,51 0,02
Электродный (равновесный) потенциал чистого, неокисленного
железа в щелочных растворах составляет около —0,1 в, т. е. на
50 мв отрицательнее стационарного потенциала (в отсутствие
внешней поляризации), равного примерно —0,05 в. Это свидетель-
ствует о том, что чистое железо очень легко пассивируется, окис-
ляясь в растворе щелочи без наложения тока и даже при отрица-
тельном потенциале, особенно при низких температурах. При этом
скорость растворения железа уменьшается до ничтожно малых
величин. Следовательно, для приготовления, хранения и транспор-
тирования растворов щелочи или подщелоченной воды в промыш-
ленных условиях может быть использована стальная аппаратура.
Исследования анодной поляризации железа в щелочных рас-
творах показали, что протекающие при этом процессы довольно
сложны, так как до наступления полной пассивации на электроде
возможно протекание нескольких анодных процессов с участием
металла. Количество, характер и последовательность анодных про-
208
цессов зависят от плотности тока, температуры и концентрации
электролита, наличия в нем примесей, особенно железа, от ско-
рости перемешивания раствора и других факторов. При низких
температурах анодная поляризация железного электрода в щелоч-
ных средах характеризуется тремя анодными процессами, по по-
воду механизма которых пока нет единой точки зрения19’26-29.
Первый анодный процесс — растворение железа с образованием
ионов Fe2+ — происходит при анодном потенциале +0,04 в отно-
сительно потенциала нормального водородного электрода в этом
же растворе19. С повышением плотности анодного тока в интер-
вале потенциалов от +0,2 до +0,3 в протекает второй анодный
процесс — окисление ионов Fe2+ до Fe3+. При дальнейшем незна-
чительном увеличении плотности анодного тока потенциал резко
смещается в положительную сторону и начинается третий анодный
процесс — выделение кислорода. Основной реакцией, определяю-
щей скорость анодного растворения железа, является его взаимо-
действие с гидроксильными ионами, в результате чего железо пе-
реходит в раствор в виде анионов HFeO2, которые затем гидроли-
зуются до Fe(OH)2. Однако образование непрочного осадка
гидроокиси двухвалентного железа не может служить причиной
пассивации металла. По-видимому, наряду с растворением на его
поверхности образуется окисел железа более высокой валентности,
что подтверждается снижением выхода Fe(OH)2 с повышением
плотности тока, т. е. при более положительном потенциале.
Габер и Гольдшмидт28 объясняют пассивацию железа в щело-
чи образованием поверхностного окисла типа РезО4. Наличие в
пассивирующем слое окислов трехвалентного железа, количество
которых увеличивается с повышением потенциала анода, подтвер-
дилось результатами работ В. И. Веселовского29.
Анодные процессы на железном электроде в щелочной среде
при высоких температурах существенно отличаются от анодной
поляризации при низких температурах. С повышением темпера-
туры железный электрод растворяется в щелочи в течение более
длительного времени и в более широких интервалах плотностей
тока. Этому способствует то, что соединения, образующиеся в про-
цессе анодной поляризации, довольно хорошо растворяются в ще-
лочи при высокой температуре. При анодной поляризации железо
в этих условиях переходит в раствор обычно только в двухвалент-
ной форме. Образование трехвалентного железа, отмеченное20 при
анодной поляризации железного электрода в условиях низких тем-
ператур, не наблюдалось30 при высоких температурах. В горячих
концентрированных растворах щелочей при небольших плотностях
анодного тока железо может необратимо растворяться в течение
довольно длительного времени с постепенным образованием види-
мого слоя окиси, затрудняющего растворение.
При повышении плотности тока пассивация наступает довольно
быстро, хотя внешний вид поверхности железа не изменяется. Ряд
исследователей объясняет пассивацию металла в этих условиях
209
образованием пленки Fe3O4, которая блокирует поверхность и за-
трудняет растворение железа, что вызывает резкое повышение
анодного потенциала. Отсутствие видимых изменений поверхности
металла при высоких плотностях тока они объясняют малой тол-
щиной окисной пленки. Прекращение перехода железа в раствор
в двух- и трехвалентной форме, вызываемое его пассивацией от-
носительно этих процессов, носит обратимый характер, так как при
снижении анодной плотности тока растворение возобновляется.
Скорость растворения железа в растворе, не содержащем его
ионов, возрастает с повышением интенсивности перемешивания,
приводящего к уменьшению концентрации ионов железа вблизи
электрода. Однако в условиях промышленной эксплуатации элек-
тролизеров снижение скорости циркуляции электролита обычно
вызывает усиление коррозии стальных деталей, что объясняется
наличием большого количества примесей железа в технических
электролитах. Кроме того, усиление циркуляции электролита
уменьшает возможность обеднения его щелочью в отдельных зо-
нах электролитической ячейки, благодаря чему уменьшается кор-
розия анодно работающих деталей. Коррозию железа усиливают
примеси анионов в электролите, особенно Cl-ионы17’31, причем их
влияние тем сильнее, чем меньше концентрация щелочи16’32.
В опытах В. В. Лосева20, изучавшего поведение железа в щелоч-
ных растворах, в 10 н. растворе NaOH при 20, 40, 60 и 80° С, с по-
вышением температуры увеличилась скорость саморастворения
железа, повысилась величина критического анодного тока, при ко-
торой наступает пассивация металла (от 7- 10-5 а]см2 при 20°С до
2-Ю-3 а!см2 при 80°С), значительно облегчилась активация элек-
трода. В условиях промышленного электролиза воды не наблю-
дается такой четкой зависимости коррозии деталей электролизера
от температуры, хотя температура электролита в настоящее время
повышена с 75 до 95—100° С. По-видимому, это связано с приме-
нением никелированных деталей в промышленных электролизерах.
Катодная поляризация железного электрода в щелочных рас-
творах по существу не отличается от поляризации других метал-
лов, если не считать ранее отмеченной способности активирован-
ной поверхности железа окисляться даже при отрицательных по-
тенциалах. В чистом растворе щелочи, не содержащем ионов
железа, на железном катоде может протекать только один про-
цесс — выделение водорода. Если в электролите содержатся ионы
железа (или другого металла с более положительным потенциа-
лом осаждения, чем потенциал выделения водорода), то при ка-
тодной поляризации на электроде могут одновременно протекать
два катодных процесса — выделение водорода и разряд ионов же-
леза (или другого металла) с осаждением его в виде металличе-
ской губки. Растворение катодно заряженных поверхностей железа
в этих условиях происходить не должно. Однако при длительной
эксплуатации электролизеров была обнаружена массовая корро-
зия в верхней части основного листа электрода с катодной сторо-
210
ны. Высказаны предположения, что коррозия связана со способ-
ностью водорода растворяться в железе в довольно значительных
количествах. Внедрение в течение длительного времени водорода
в металл может нарушить его структуру, в результате чего меха-
ническая прочность поверхностного слоя настолько снизится, что
он будет постепенно разрушаться непрерывно пульсирующим по-
током газо-электролитной эмульсии.
Однако более вероятным нам представляется другое объясне-
ние: большая склонность железа к окислению в среде щелочи
даже при катодных потенциалах. Механизм такой коррозии может
быть описан следующим образом. Верхняя часть основного листа
(в отличие от остальной его части и выносного катода) в течение
значительного времени эксплуатации электролизера находится в
газовой фазе вследствие газонаполнения электролита и непрерыв-
ного колебания его уровня. Когда поверхность электрода пол-
ностью закрыта электролитом, она работает при сравнительно вы-
сокой плотности тока с выделением водорода, который в горячей
концентрированной щелочи интенсивно активирует металл. В мо-
мент снижения уровня электролита верхняя часть основного листа
электрода оказывается в газовой фазе, плотность катодного тока
на этом участке электрода резко снижается, вследствие чего его
потенциал сдвигается в более положительную сторону. В таких
условиях восстановленная поверхность железа может активно
окисляться за счет восстановления кислорода, всегда содержаще-
гося в водороде в качестве примеси (0,1 — 1%), а также за счет
восстановления ионов трехвалентного железа, накапливающихся
в растворе. Протекание таких процессов доказано в работах
В. В. Лосева 20 и Я- М. Колотыркина 10. Наиболее глубокую корро-
зию основного листа электрода напротив выходного водородного
отверстия можно объяснить большой скоростью и пульсацией вы-
ходящего газо-электролитного потока, что способствует быстрой
доставке ионов Fe3+ и кислорода к поверхности электрода и более
полному растворению и удалению окислов железа.
Выносной катодный лист и остальная часть основного листа
имеют постоянный контакт с водородом, но на них никогда не
наблюдается описанная выше коррозия. Обычно эти части элек-
трода погружены в электролит и работают при потенциале выде-
ления водорода, когда окисление невозможно. Кроме того, поверх-
ность этих частей электрода покрыта слоем губчатого железа,
которое в случае окисления электрода окислялось бы в первую оче-
редь, защищая его основную массу.
Окислением поверхности железа за счет восстановления кисло-
рода и ионов Fe3+ в горячем концентрированном электролите мож-
но объяснить так называемую водородную коррозию коммуника-
ций Н2, корпуса водородной ловушки, водородных штуцеров и
основного листа электрода с катодной стороны, около нижних пе-
реточных отверстий. Особенно интенсивная коррозия наблюдается
там, где велики скорости протока электролита или водорода, на
211
сгибах труб, на участках, где изменяется направление потока.
Около переточных отверстий в нижней части основного листа прак-
тически отсутствует газовая фаза, и металл может окисляться
кислородом, уносимым электролитом из анодного пространства
ячейки через отверстия. Поэтому необходима антикоррозионная
защита катодно работающих или временно включающихся в ка-
тодный процесс деталей, если возможна их работа при потенциале,
меньшем потенциала выделения водорода. В противном случае
может окисляться поверхность железа с последующим растворе-
нием образовавшегося окисла в горячей концентрированной ще-
лочи. Нанесение на железо гальванического слоя никеля, значи-
тельно более стойкого в таких условиях, устраняет поверхностную
коррозию указанных деталей. Если деталь электролизера не долж-
на подвергаться ни катодной, ни анодной поляризации, (надежной
защитой от коррозии служит покрьпие стойкими не проводящими
тока пленками.
Никель, как и железо, способен к пассивации. Его пассивность
в отличие от железа более устойчива и может возникать на воз-
духе, в водных растворах щелочи и при анодной поляризации. До-
бавка никеля к стали или чугуну обычно оказывает облагоражи-
вающее действие на черные металлы, их сплавы с никелем более
стойки к коррозии. Пассивность никеля обусловлена образованием
стойких окисных пленок, закрывающих поверхность металла и за-
трудняющих переход его ионов в раствор. В зависимости от спо-
соба пассивации строение и состав окисных пленок могут быть
различны. Пассивность никеля может вызываться хемосорбцией
гидроксильных или кислородных ионов на поверхности металла,
образованием его окислов и гидроокисей или других нераствори-
мых в данном растворе соединений. Пассивирование никеля при
анодной поляризации определяется свойствами анионов электро-
лита и сильно зависит от величины pH раствора: чем больше его
pH, тем скорее и полнее пассивируется металл33. Пассивации спо-
собствуют также повышение анодной плотности тока, снижение
температуры и наличие в растворе ионов никеля. Противополож-
ное влияние на пассивацию никеля оказывает присутствие в элек-
тролите хлор-иона, сульфатов, карбонатов и других кислотных
анионов15’31, а также наличие примесей в металле35. Агрессивное
действие ионов хлора и кислородсодержащих анионов проявляется
тем сильнее, чем меньше концентрация щелочи. В растворах кар-
бонатов никелевый анод нестоек.
Легче всего пассивируются чистые и малоуглеродистые сорта
никеля. Гальванически осажденный никель, используемый для
антикоррозионной защиты металлов, наиболее склонен к пассива-
ции, так как отличается очень малым содержанием примесей.
Обычно пассивная пленка состоит из окиси никеля (NiO), при ак-
тивировании никелевого электрода никель переходит в раствор в
виде двухвалентных ионов36.
Образование прочной окисной пленки при пассивации никеля
делает его практически нерастворимым во многих агрессивных
средах и широко используется в промышленности, в частности для
защиты анодно работающих поверхностей электродов и деталей
при электролизе воды.
Никель обладает исключительно высокой стойкостью к дей-
ствию едких щелочей, даже при высокой температуре, и потому
широко применяется при изготовлении аппаратов для выпарива-
ния щелочных растворов, емкостей для хранения и транспортиро-
вания щелочей. Скорость растворения никеля в процессе выпари-
вания едкого натра составляет24: менее 0,06 гЦм2 • сутки) в слабых
растворах; 0,06 е/(лт2• сутки) в растворах, содержащих до 50%
NaOH; 1,8 г! (м2 • сутки) в растворах, содержащих до 75% NaOH,
и в безводной щелочи 5,5 г/(л2 • сутки) при 400—410° С.
Никель характеризуется хорошей стойкостью в дистиллирован-
ной воде (скорость коррозии 0,06 г/(л2- сутки), в паровом конден-
сате и в атмосфере водяного пара24. Никель практически нерас-
творим при электрохимической поляризации в концентрированных
растворах едких щелочей в широком интервале температур. Это
объясняется тем, что при наложении анодного тока в указанных
условиях на поверхности никеля образуется прочная окисная
пленка 35-37'38, благодаря чему почти полностью прекращаются все
анодные процессы с участием металла. Поэтому потенциал нике-
левого электрода при анодной поляризации довольно быстро сдви-
гается в более положительную сторону и становится равным по-
тенциалу выделения кислорода. Выявлены полупроводниковые
свойства окисной пленки никеля и ее большая прочность на по-
верхности металла 36’39"42.
Предварительная катодная поляризация15 свежезачищенного
никелевого электрода замедляет наступление пассивации, анодная
поляризация заметно ускоряет ее. До начала выделения кислорода
протекает один анодный процесс с участием металла — растворе-
ние никеля с одновременным окислением его поверхности до обра-
зования фазового окисла. Этот процесс начинается в области по-
тенциалов от 4 0,1 в п выше, имеет максимальную скорость при
потенциале 4-0,2 в, а затем замедляется. С течением времени пере-
ход ионов никеля в раствор полностью прекращается и наступает
пассивация. При этом потенциал электрода быстро смещается в
положительную сторону и начинается выделение кислорода. Дли-
тельность и интенсивность растворения никеля в щелочи до на-
ступления пассивации зависят от условий анодной поляризации.
Как и для железа, повышение температуры и концентрации ще-
лочи тормозит пассивацию. В интервале температур 60—90°С
скорость растворения никеля до наступления пассивации почти в
2 раза больше, чем при 20—60° С, хотя абсолютное увеличение рас-
творимости никеля с повышением температуры невелико. При
130°С растворение никеля продолжается в течение 5 ч без замет-
ной пассивации.
15 Зак. 7Ц
213
Отмечена следующая зависимость скорости растворения никеля
в указанной выше области потенциалов ог концентрации щелочи:
чем выше концентрация, тем медленнее наступает пассивация, при-
чем с повышением температуры сильнее сказывается влияние кон-
центрации. По-видимому, растворение никеля связано с непосред-
ственным участием в реакции ионов ОН", которые облегчают
переход никеля в раствор. При малой концентрации щелочи (на-
пример, 0,2% КОН) и 1НИЗКИХ плотностях тока никель начинает
интенсивно разрушаться43. Это, вероятно, является причиной быст-
рой коррозии никелированных анодных поверхностей в тупико-
вых зонах и местах скопления шлама, где интенсивность цирку-
ляции электролита замедлена, в результате чего он обеднен иона-
ми ОН".
Большое влияние на пассивацию никеля оказывает плотность
поляризующего тока. При высоких плотностях никель пассиви-
руется практически сразу по наложении тока. Накопление на по-
верхности никеля пассивирующих окислов подтверждается увели-
чением его массы (за счет кислорода), соответствующим толщине
окисной пленки. При высоких температурах окисная пленка может
частично растворяться, но сохраняется определенный фазовый
слой, защищающий поверхность никеля.
Защитную окисную пленку на никеле можно получить окисле-
нием его поверхности газообразным кислородом при температурах
~800° С или введением в агрессивную среду окислителей15. Окис-
ление поверхности никеля с соответствующим пассивации смеще-
нием потенциала в положительную сторону наблюдается и при
насыщении щелочи газообразным кислородом. Следовательно, дей-
ствие растворенного в щелочи кислорода на никелевый электрод
аналогично анодной поляризации. Насыщение щелочи водородом,
наоборот, замедляет пассивацию никеля, так как при этом частич-
но восстанавливаются окисные пленки41.
Коррозия деталей биполярных электролизеров
Длительность работы электролизера определяется стойкостью
применяемых материалов и условиями эксплуатации. Надежность
работы аппарата в первую очередь зависит от правильного выбора
материалов для изготовления основных частей и деталей электро-
лизера. Стойкость материалов зависит также от конструкции элек-
тролизера или его отдельных узлов и условий процесса электро-
лиза. Практика эксплуатации электролизных установок показала,
что одни и те же материалы, длительное время используемые без
заметных разрушений в электролизерах одной конструкции (моно-
полярные ящичного типа), иногда довольно быстро изнашивались
в электролизерах другого типа (например, в биполярных фильтр-
прессных аппаратах). Более того, электролизеры одинаковой кон-
струкции, изготовленные из одних и тех же материалов, разли-
чаются по времени пробега до капитального ремонта на 5—10,
214
а иногда и на 15 лет. Это объясняется разным качеством изготов-
ления деталей и монтажа аппарата и условиями его эксплуатации.
При длительной работе электролизеров фильтрпрессного типа
коррозии в различной степени подвергаются почти все их детали.
Причины частичного или полного разрушения довольно разнооб-
разны и сложны. Понадобились длительные исследования, наблю-
дения за всеми видами коррозии в электролизере и обобщение
большого эксплуатационного опыта, чтобы установить зависимость
вида коррозии от конструктивных особенностей аппарата и режи-
ма его работы.
Целесообразность мероприятий по устранению коррозии мож-
но оценивать только после их длительной проверки в рабочих ус-
ловиях. Иногда наблюдались случаи, когда меры, принятые для
устранения одного вида коррозии, неожиданно вызывали возник-
новение коррозии другого вида. Так, применение фланцевого со-
единения газовых штуцеров с рамой в электролизерах типа ФВ
привело к коррозии кислородных отверстий рамы, которая никогда
не наблюдалась при сварном соединении. Нанесение футеровки
даже на одну нижнюю полку рамы почти полностью устраняет
коррозию рам. Поэтому при конструктивных изменениях того или
иного узла электролизера необходимо учитывать, как они могут
сказаться на коррозии других деталей.
Сведения о коррозии деталей электролизеров, приведенные в
данном разделе, основаны на богатом фактическом материале, со-
бранном и обобщенном в результате длительных наблюдений за
коррозионными процессами в электролизерах и осмотра десятков
тысяч их деталей. Здесь описаны коррозионные процессы в элек-
тролизерах ФВ-500, поскольку они наиболее широко используются
в крупных промышленных установках для производства водорода.
Почти все виды коррозии, отмеченные в электролизерах ФВ-500,
характерны и для других конструкций электролизеров фильтр-
прессного типа, особенно для аппаратов с большим количеством
ячеек. В биполярных электролизерах меньшей мощности с мень-
шим количеством последовательно включенных ячеек 1некоторые
виды коррозии обычно наблюдаются в меньшей степени, а другие
могут отсутствовать.
При длительной работе электролитических ячеек неблагоприят-
ные условия, вызывающие усиленную коррозию, могут создавать-
ся в результате заметных утечек тока между отдельными деталями
или узлами электролизера, местного обеднения электролита ще-
лочью, загрязнения его вредными примесями, нарушений темпера-
турного и концентрационного режимов работы электролизера
и т. д.
О недостаточной скорости общей циркуляции электролита в
аппарате, которая приводит к нарушению концентрационного и
температурного режима процесса электролиза, можно судить по
разности концентраций анолита и католита и по перепаду тем-
ператур на входе и выходе электролита из средней камеры.
151
215
О степени загрязнения электролита вредными примесями доста-
точно полное представление дают результаты его химического
анализа. С соблюдением определенных мер предосторожности на
работающем электролизере можно измерить также утечки тока на
землю. Утечки тока в питательном и газовых каналах довольно
легко определяются расчетом. Однако оценить степень включения
деталей электролизера в электрохимическую работу в связи
с утечками тока, возникающими между отдельными ячейками и
деталями внутри аппарата, затруднительно, так как точно рас-
считать или измерить утечки не представляется возможным. Кро-
ме того, направление и величина этих утечек тока могут изме-
няться в процессе работы аппарата в зависимости от многих слу-
чайных факторов (скопление шлама, замыкание через мостики
и т. д.).
Поэтому основные данные об интенсивности и характере кор-
розии деталей, позволяющие определить ее причины, получают при
осмотре электролизеров во время их разборки для капитального
ремонта после длительной эксплуатации. Изучение внешнего вида
деталей, подвергшихся коррозии, характера ее протекания, распо-
ложения разрушенного участка на детали, зависимость степени
коррозии от расположения детали в ячейке (или в электролизере)
и от длительности эксплуатации позволили установить определен-
ные закономерности коррозионных процессов в фильтрпрессных
электролизерах. Обобщение результатов исследований поведения
железа, никеля и других металлов под действием тока в растворах
щелочей при различных концентрациях и температурах электро-
лита и фактические данные, полученные при осмотре деталей элек-
тролизеров, помогли установить (или достаточно обоснованно
предположить) причины различных видов коррозии. Это в свою
очередь позволило разработать меры предотвращения или ослаб-
ления основных коррозионных процессов при эксплуатации элек-
тролизеров. Усовершенствованные конструкции современных элек-
тролизеров, изготовленных с учетом таких мероприятий, в условиях
нормального режима эксплуатации могут иметь пробег между ка-
питальными ремонтами не менее 10 лет.
В основу приведенных ниже данных о коррозии положены обоб-
щенные результаты осмотра первых промышленных электролизе-
ров ФВ-500 отечественной конструкции при разборке их для капи-
тального ремонта после длительной эксплуатации. Эти данные
дополнены результатами последующих наблюдений за коррозион-
ными процессами в аппаратах такого же типа, но с несколько из-
мененной конструкцией отдельных узлов и деталей. Отметим, что
в процессе освоения техники электролиза воды и эксплуатации
электролизных установок интенсивность коррозионных процессов
была значительно уменьшена, а многие виды коррозии совсем
устранены и могут наблюдаться лишь как исключение.
Коррозия электродов. Ее целесообразно рассматривать отдель-
но для каждой части электрода, так как основной лист и вынос-
216
ные (катодный и анодный) листы работают в электролитической
ячейке в принципиально различных условиях.
Коррозионная стойкость анодного выносного листа зависит
прежде всего от качества никелирования, определяемого толщи-
ной и пористостью никелевого покрытия. Его толщина имеет зна-
чение лишь потому, что не удается получить беспористый слой
никеля при малой толщине покрытия. Никелирование анодных
поверхностей ранее выполнялось раздельно: сначала никель нано-
сили на основной лист, затем после наклепки — на выносной лист.
Рис. V-3. Коррозия анодной стороны биполярного электрода:
/—основной лист электрода; 2 — переточные отверстия в основном листе; 3 — выносной элек-
трод (анод); 4 -анкера; 5-коррозия выносного анода у трех анкеров, используемых для
подвода тока при никелировании; 6 — шелушение никелировки по краям электрода; 7 — про-
жоги выносного листа; 8 — шелушение никелировки в отверстиях перфорации; 9—коррозия
основного листа у анкеров под паронитовыми «пятачками».
Электроды с никелевым покрытием толщиной 50 мк, имеющим
до 500 пор на 1 дм2, оказались недостаточно стойкими при экс-
плуатации. После 6—10 лет работы 70—80% таких электродов
имели значительные коррозионные разрушения с анодной стороны,
в остальных электродах сохранился неразрушенный стальной лист,
но было заметно ослаблено никелевое покрытие. Поэтому все элек-
троды нуждались в капитальном ремонте и повторном никелиро-
вании.
Коррозия анодов начиналась с растворения железа в порах
никелевого покрытия, что приводило к шелушению, а при плохом
сцеплении металлов и к отслаиванию никеля. Вследствие этого на
незащищенных участках электрода железо интенсивно растворя-
лось, иногда вплоть до полного разрушения стального выносного
листа. На лобовой поверхности анода в этих случаях оставалась
только полуразрушенная никелевая пленка, удерживаемая сильно
источенными коррозией анкерами.
Основные виды коррозии анодной стороны электрода показаны
на рис. V-3. Отмечалось шелушение никелевого покрытия в отвер-
стиях перфорации выносного электрода, где слой никеля тонок и
наименее качественен (из-за недостаточной рассеивающей спо-
217
собности никелировочных ванн). Особенно часто шелушение на-
блюдалось в верхней части перфорационных отверстий, что могло
объясняться оседанием на этих участках (при никелировании) не-
больших пузырьков водорода, которые закрывали поверхность и
затрудняли осаждение никеля.
Массовое распространение имела коррозия никелевого покры-
тия выносного листа под паронитовыми «пятачками», где образо-
вывались раковины и желобки, обрамляющие анкер. Наиболее
интенсивная коррозия отмечена на анкерных участках по границе
«пятачка», в местах расклепки анкеров, а также по краям элек-
трода, т. е. там, где качество никелевого покрытия хуже, чем на
остальной поверхности электрода. На 70% электродов наблюда-
лась совершенно однотипная сквозная коррозия у трех верхних
(или симметрично расположенных трех нижних) анкерных болтов
(см. рис. V-3). Она вызвана неравномерным распределением тока
при никелировании из-за неправильной подвески электродов, в ре-
зультате которой ток во время никелирования подавался только
через эти три анкера. Очень высокая плотность тока на данных
участках была причиной низкого качества защитного никелевого
покрытия. Степень разрушения анодов заметно зависела от про-
должительности эксплуатации электролизера: чем дольше он ра-
ботал, тем сильнее была коррозия и больше количество деталей,
пораженных коррозией.
При устранении дефектов никелирования анодов, увеличении
толщины никелевого слоя до 180—200 мк и резком уменьшении его
пористости (не более 20 пор на 1 дм2) все ранее наблюдавшиеся
коррозионные разрушения анодного выносного листа практически
прекратились. Позднее было установлено, что беспористое покры-
тие толщиной 125—135 мк также надежно и в течение длительного
времени защищает анод от разрушений. Устранение причин кор-
розии в первую очередь было связано с общим улучшением каче-
ства никелирования. Более тщательная предварительная подго-
товка детали (пескоструйная обработка, обезжиривание щелочью,
промывка водой), изменение способа подвески электродов, уточ-
нение режима никелирования (состав ванны, плотность тока, тем-
пература, продолжительность) и строгий контроль за качеством
никелевого покрытия позволили в дальнейшем практически пол-
ностью исключить коррозию анодов.
При недостаточно высоком качестве никелевого покрытия на
анодной стороне основного листа электрода раньше наблюдались
коррозионные разрушения никеля, аналогичные описанным. Про-
исходило шелушение, отслаивание и разрушение защитного нике-
левого слоя, преимущественно в верхней части основного листа,
не закрытой выносным электродом, вдоль паронитовой прокладки,
в местах скопления пены и накипи.
Таким образом, коррозионная стойкость всех анодно работаю-
щих поверхностей электрода определяется в основном качеством
никелевого покрытия. В связи с этим технология гальванического
218
покрытия электродов никелем была значительно усовершенство-
вана. Никелирование электродов стали производить в собранном
виде, т. е. одновременно наносить покрытие на анодный выносной
и основной листы. Это не только позволило существенно уменьшить
объем работ и затрату времени на никелирование, но и положи-
тельно отразилось на стойкости покрытия. При значительно меньшей
толщине слоя, чем на лобовой поверхности выносного электрода,
качество никелевого покрытия основного листа было удовлетво-
рительным. По-видимому, наличие большого количества перфо-
рационных отверстий в выносном листе и достаточно хорошая
рассеивающая способность никелировочной ванны обеспечивали
осаждение качественного никелевого покрытия на основном листе
электрода. В течение длительной эксплуатации никелированные
электроды показали высокую устойчивость. Представляет интерес
успешно проводимое на одном из заводов повторное ремонтное
никелирование электродов без удаления старого слоя никеля. При
повторном никелировании важно обеспечить хорошее сцепление
нового слоя никеля со старым, что достигается соответствующей
обработкой поверхности ранее нанесенного никелевого слоя.
Известны случаи сквозной, быстро протекающей локализован-
ной коррозии основного листа, начинающейся с анодной стороны.
Из-за внешнего сходства (форма, глубина, сравнительно небольшая
площадь пораженного участка) такая коррозия, наблюдаемая и на
других деталях электролизера, получила наименование «прожога».
Обычно прожоги возникают внизу, в местах скопления шлама, осо-
бенно на границе изолирующей прокладки с металлом, реже —
сбоку, совсем редко — в верхней части основного листа. В ячейках,
расположенных на концах электролизера, прожоги наблюдались
чаще, чем в ячейках, находящихся ближе к средней камере. Наи-
большее число прожогов зафиксировано на анодных монополяр-
ных электродах.
Прожоги тоже заметно сократились при улучшении качества
никелирования электродов.
Отметим, что при низком качестве никелевого покрытия в элек-
тролизерах, работавших на электролите с большим содержанием
хлор-ионов (до 8 г/л), карбонатов (до 70—80 г/л) и других анио-
нов, зафиксировано значительно больше прожогов, чем в электро-
лизерах, где содержание этих примесей было меньше (до 1—3 г/л
хлора и 30—40 г/л карбонатов). На тех установках, где поддер-
живают высокую чистоту электролита, периодически очищают его
от загрязняющих анионов, систематически добавляют в электролит
хромпик, прожоги электродов с хорошо никелированными анод-
ными поверхностями практически ликвидированы (известны лишь
единичные случаи).
Для образования прожогов, по-видимому, обязательны: анодная
поляризация основного листа электрода и скопление шлама, за-
трудняющее циркуляцию электролита на данном участке и приводя-
щее к сильному местному обеднению электролита гидроксильными
219
ионами. По степени анодной поляризации поверхности основного
листа электрода на этих участках они, вероятно, работают при
самых .неблагоприятных (в отношении коррозии) значениях
потенциала (~ +0,2 в). В этих условиях происходит наиболее
интенсивное растворение сначала никелевого покрытия, затем
стального листа. Значительная пористость никелевого покрытия,
ухудшение циркуляции электролита в ячейках, повышение темпе^
ратуры, плотности тока и увеличение количества нежелательных
примесей в электролите (особенно ионов железа) способствуют
Рис. V-4. Коррозия катодной стороны бипо-
лярного электрода:
/ — основной лист электрода; 2 - выносной катод;
3 — коррозия основного листа электрода с катодной
стороны; 4~ коррозия основного листа электрода
у переточных отверстий.
усилению данного вида
коррозии.
На участках, где воз-
можно обеднение элек-
тролита щелочью, следует
отметить особую нежела-
тельность присутствия ио-
нов хлора, которые кро-
ме увеличения общей
скорости растворения ме-
талла способствуют воз-
никновению питтинговой
(точечной) коррозии,
приводящей к более быс-
трому и глубокому раз-
рушению деталей. При
хорошем качестве нике-
левого покрытия, чистом
электролите и высокой
культуре эксплуатации
электролизеров исключаются условия образования прожогов, что
убедительно подтверждается производственным опытом.
Прожоги выносных листов были довольно редки и вызывались
коротким замыканием выносного электрода на соседнюю деталь.
В одних случаях это обусловливалось местными неровностями по-
верхности выносного листа (особенно по краям), в других — по-
степенным прорастанием железных мостиков через диафрагму (при
большом содержании ионов железа в электролите), в третьих —
соприкосновением электрода и металлической прокладки, закреп-
ляющей диафрагму (при разрушении заклепок).
С катодной стороны основного листа металл разрушается
только в верхней части. При этом поверхностный слой металла по-
степенно «размывается» ровной полосой по всей длине листа вдоль
паронитовой прокладки (рис. V-4). Более сильной коррозии под-
вергается участок листа напротив выхода водорода из ячейки.
Этот вид коррозии основного листа отмечен на всех без исключе-
ния электродах. Разрушение происходит с равномерной скоростью
на протяжении всего времени эксплуатации электролизера. Сте-
пень разрушения определяется в основном продолжительностью
220
работы электрода и не зависит от места его расположения в элек-
тролизере. После 5—6 лет работы аппарата часто наблюдается
сквозная коррозия электрода. Возможный механизм этого вида
коррозии рассмотрен ранее (стр. 211).
В несколько меньшей степени такая же коррозия наблюдается
с катодной стороны основного листа около переточных отверстий.
При этом края отверстия и участок вокруг него на расстоянии
5—6 мм обычно не разрушаются (см. рис. V-4).
Остальная часть катодной поверхности основного листа обычно
покрыта налетом мелкодисперсного пирофорного губчатого железа,
которое более интенсивно отлагается на участках, не закрытых
выносным электродом. Выносные катодные листы совершенно не
подвергаются коррозии, за 5—6 лет работы они покрываются
слоем рыхлого губчатого железа толщиной 3—4 мм. Промытый от
щелочи осадок пирофорного железа на катоде при соприкоснове-
нии с воздухом окисляется в первое время настолько активно, что
иногда раскаляется докрасна.
Электроды с коррозионными повреждениями верхней части
основного листа сначала использовали для повторного пробега в
электролизере. Для этого их устанавливали верхней частью вниз,
старые циркуляционные отверстия заваривали, а в соответствую-
щих участках нижней части электрода просверливали новые от-
верстия. Это позволяло увеличить срок годности электрода еще на
5—6 лет, после чего использование его становилось невозможным.
В качестве надежной защиты основного листа от коррозии ре-
комендуется покрытие верхнего участка, подвергающегося разру-
шению, слоем никеля толщиной 150—200 мк. По данным произ-
водственных испытаний, такая защита основного листа вполне
эффективна на протяжении длительного времени (через 5—6 лет
коррозии на никелированных участках не наблюдалось).
Коррозия рам. Протекание коррозионных процессов на рамах
в значительной степени зависит от типа соединений газовых и пи-
тательного штуцеров с рамой, наличия футеровки или других за-
щитных покрытий на полках рамы.
Для изготовления рам промышленных электролизеров обычно
используется углеродистая сталь марки Ст.З. Для повышения
коррозионной стойкости рамы вся ее поверхность покрывается
слоем гальванического никеля, металл полок таких рам, как пра-
вило, не подвергается коррозии. Отмечены отдельные случаи про-
жогов футерованных и нефутерованных рам, особенно в крайних
ячейках (рис. V-5), причем футерованные рамы крайних ячеек вы-
ходят из строя чаще нефутерованных, поэтому крайние рамы не
рекомендуется футеровать. Большее количество разрушений отме-
чается на нижней полке рамы, реже — на боковых и почти никогда
не обнаруживаются прожоги верхней полки. Разрушение обычно
начинается у прокладки со стороны, обращенной к катоду, и рас-
пространяется вглубь металла, вплоть до сквозного разрушения.
На этих участках футеровка вспучивается и отваливается от рамы.
221
На нефутерованных рамах, имеющих фланцевое соединение
с газовыми и питательными штуцерами, иногда наблюдается мас-
совая коррозия стенок в отверстиях для отвода газов (см. рис. V-5).
Стенки кислородных газовых отверстий подвергаются гораздо
большему разрушению, чем водородных отверстий. Коррозия при-
водит к образованию раковин и распространяется вглубь попереч-
ного сечения, в направлении к катоду. Размеры и глубина раковин
определяются в основном длительностью работы рам и не зави-
сят от места их расположения в аппарате. Отдельные случаи
сквозной коррозии стенок кислородных отверстий наблюдались
Рис V-5. Коррозия деталей диафрагменной рамы:
/ — рама; 2 —штуцера для отвода газов; 3 — отверстия в раме для отвода газов; 4— накладка
для крепления диафрагмы; 5 — места коррозии головки заклепки; 6 — прожоги нижней и боко-
вых полок диафрагменной рамы; 7 —коррозия отверстия в раме при фланцевом соединении
с нею штуцера.
уже через 1,5—2 года работы электролизеров. При более длитель-
ном пробеге (3,5—5 лет) количество рам со сквозной коррозией
стенок кислородного отверстия настолько увеличивается, что по-
является необходимость в отключении аппарата на ремонт из-за
резкого снижения чистоты электролитического кислорода.
На таких же нефутерованных рамах, но со сварным соедине-
нием их со штуцерами коррозия стенок кислородных отверстий не
наблюдалась, отмечалась только коррозия водородных отверстий,
которая протекала с меньшей скоростью и носила совсем иной
характер: поверхность стенок равномерно как бы размывалась
аналогично «размыванию» верхней части основного листа с катод-
ной стороны. Сквозных разрушений стенки в этих условиях обычно
не обнаруживалось. По-видимому, способ соединения газовых
штуцеров с рамой имеет принципиальное значение для коррозион-
ных процессов в стенках кислородных газовых отверстий. Наличие
уплотняющей и изолирующей прокладки во фланцевом соединении
создает перепад напряжения и способствует включению в электро-
химическую работу отверстий рам на путях утечки тока между
рамой и газовым штуцером. При этом стенки газовых отверстий
222
рамы подвергаются интенсивной коррозии. Сварное соединение
образует надежный электрический контакт металлической рамы со
штуцером, благодаря чему исключается возможность возникнове-
ния разности потенциалов на этом участке рамы. Создание надеж-
ного электрического контакта между рамой и штуцером канала
при фланцевом соединении их предотвращает возможность разви-
тия коррозии газовых отверстий. Коррозия стенок водородных от-
верстий в раме, как и в верхней части основного листа с катодной
стороны, практически полностью прекращается после тщательной
никелировки поверхностей.
В рамах с фланцевым соединением и футеровкой нижней и бо-
ковых полок кислородные газовые отверстия практически не под-
вергаются коррозии. После 5—6-летнего пробега электролизеров
ни в одном футерованном аппарате не было зафиксировано корро-
зионных разрушений таких отверстий. В аппаратах только с ниж-
ней футерованной полкой коррозия стенок кислородных отверстий
также не наблюдалась на протяжении 5—6 лет. Прожоги полок
в рамах с фланцевым соединением со штуцерами существенно не
отличаются от описанной выше коррозии рам со сварными соеди-
нениями.
Футеровка нижней и боковых полок предотвращает возникно-
вение побочных электрохимических процессов на раме и практи-
чески прекращает коррозию стенок газовых отверстий. Однако экс-
плуатация электролизеров, рамы которых футерованы цементной
массой, связана с повышением на 4—6% напряжения на ячейках.
Футеровка одной нижней полки рамы также приводит к некото-
рому повышению напряжения (на 2—3%). Поэтому лучшим ва-
риантом защиты рам от включения их в электрохимическую ра-
боту и защиты стенок газовых отверстий от коррозии следует счи-
тать применение неметаллических покрытий, стойких в горячих
концентрированных растворах щелочей и не повышающих напря-
жение на электролитической ячейке.
Разрушение металлических рам по уплотняющей поверхности
и с внешней стороны наблюдается только при попадании электро-
лита на эти участки, возможном вследствие недостаточного уплот-
нения.
Коррозия заклепок рамы со стороны, обращенной к катоду
(особенно в верхней части), приводит к отставанию металлической
накладки и диафрагмы от рамы, что может вызвать замыкание
и прожог катода, а также резкое ухудшение чистоты газов. При-
чиной большинства случаев коррозии заклепок было изготовление
их из некачественного металла. Хорошую стойкость показали за-
клепки из никеля.
Коррозия газовых колец. Коррозия нефутерованных газовых ко-
лец, изготовляемых из обычной углеродистой стали и покрытых
слоем гальванически осажденного никеля толщиной ~100 мк,
имеет массовый характер и не зависит от конструкции кольца,
типа его соединения со штуцером и места расположения колец по
223
На нефутерованных рамах, имеющих фланцевое соединение
с газовыми и питательными штуцерами, иногда наблюдается мас-
совая коррозия стенок в отверстиях для отвода газов (см. рис. V-5).
Стенки кислородных газовых отверстий подвергаются гораздо
большему разрушению, чем водородных отверстий. Коррозия при-
водит к образованию раковин и распространяется вглубь попереч-
ного сечения, в направлении к катоду. Размеры и глубина раковин
определяются в основном длительностью работы рам и не зави-
сят от места их расположения в аппарате. Отдельные случаи
сквозной коррозии стенок кислородных отверстий наблюдались
Узел У
Узел Б
Рис V-5. Коррозия деталей диафрагменной рамы:
/ — рама; 2 —штуцера для отвода газов; 3 — отверстия в раме для отвода газов; 4— накладка
для крепления диафрагмы; 5-места коррозии головки заклепки; 6 -прожоги нижней и боко-
вых полок диафрагменной рамы; 7—коррозия отверстия в раме при фланцевом соединении
с нею штуцера.
уже через 1,5—2 года работы электролизеров. При более длитель-
ном пробеге (3,5—5 лет) количество рам со сквозной коррозией
стенок кислородного отверстия настолько увеличивается, что по-
является необходимость в отключении аппарата на ремонт из-за
резкого снижения чистоты электролитического кислорода.
На таких же нефутерованных рамах, но со сварным соедине-
нием их со штуцерами коррозия стенок кислородных отверстий не
наблюдалась, отмечалась только коррозия водородных отверстий,
которая протекала с меньшей скоростью и носила совсем иной
характер: поверхность стенок равномерно как бы размывалась
аналогично «размыванию» верхней части основного листа с катод-
ной стороны. Сквозных разрушений стенки в этих условиях обычно
не обнаруживалось. По-видимому, способ соединения газовых
штуцеров с рамой имеет принципиальное значение для коррозион-
ных процессов в стенках кислородных газовых отверстий. Наличие
уплотняющей и изолирующей прокладки во фланцевом соединении
создает перепад напряжения и способствует включению в электро-
химическую работу отверстий рам на путях утечки тока между
рамой и газовым штуцером. При этом стенки газовых отверстий
222
рамы подвергаются интенсивной коррозии. Сварное соединение
образует надежный электрический контакт металлической рамы со
штуцером, благодаря чему исключается возможность возникнове-
ния разности потенциалов на этом участке рамы. Создание надеж-
ного электрического контакта между рамой и штуцером канала
при фланцевом соединении их предотвращает возможность разви-
тия коррозии газовых отверстий. Коррозия стенок водородных от-
верстий в раме, как и в верхней части основного листа с катодной
стороны, практически полностью прекращается после тщательной
никелировки поверхностей.
В рамах с фланцевым соединением и футеровкой нижней и бо-
ковых полок кислородные газовые отверстия практически не под-
вергаются коррозии. После 5—6-летнего пробега электролизеров
ни в одном футерованном аппарате не было зафиксировано корро-
зионных разрушений таких отверстий. В аппаратах только с ниж-
ней футерованной полкой коррозия стенок кислородных отверстий
также не наблюдалась на протяжении 5—6 лет. Прожоги полок
в рамах с фланцевым соединением со штуцерами существенно не
отличаются от описанной выше коррозии рам со сварными соеди-
нениями.
Футеровка нижней и боковых полок предотвращает возникно-
вение побочных электрохимических процессов на раме и практи-
чески прекращает коррозию стенок газовых отверстий. Однако экс-
плуатация электролизеров, рамы которых футерованы цементной
массой, связана с повышением на 4—6% напряжения на ячейках.
Футеровка одной нижней полки рамы также приводит к некото-
рому повышению напряжения (на 2—3%). Поэтому лучшим ва-
риантом защиты рам от включения их в электрохимическую ра-
боту и защиты стенок газовых отверстий от коррозии следует счи-
тать применение неметаллических покрытий, стойких в горячих
концентрированных растворах щелочей и не повышающих напря-
жение на электролитической ячейке.
Разрушение металлических рам по уплотняющей поверхности
и с внешней стороны наблюдается только при попадании электро-
лита на эти участки, возможном вследствие недостаточного уплот-
нения.
Коррозия заклепок рамы со стороны, обращенной к катоду
(особенно в верхней части), приводит к отставанию металлической
накладки и диафрагмы от рамы, что может вызвать замыкание
и прожог катода, а также резкое ухудшение чистоты газов. При-
чиной большинства случаев коррозии заклепок было изготовление
их из некачественного металла. Хорошую стойкость показали за-
клепки из никеля.
Коррозия газовых колец. Коррозия нефутерованных газовых ко-
лец, изготовляемых из обычной углеродистой стали и покрытых
слоем гальванически осажденного никеля толщиной — 100 мк,
имеет массовый характер и не зависит от конструкции кольца,
типа его соединения со штуцером и места расположения колец по
223
состоянии, и только участок,
/2
Рис. V-6. Коррозия газовых колец и шту-
церов:
/ — массовая коррозия кислородных и водородных
газовых колец; 2 —коррозия колец по уплотняю-
щей поверхности; 3 — коррозия водородных шту-
церов; 4 — коррозия кислородных штуцеров; 5 —кор-
розия выступающей в кольцо части штуцера.
длине электролизера. Разрушение водородных и кислородных га«
зовых колец по внешнему виду совершенно однотипно. Коррозии
подвергается внутренняя поверхность кольца, ближе к стороне,
обращенной к аноду.
Разрушение колец начинается в местах выхода газа из шту*
цера и распространяется в виде узкого глубокого желоба (при
длительной работе сквозного) вверх по кольцу на V4—Уз длины
его окружности (рис. V-6). Никелевое покрытие остальной части
внутренней поверхности кольца находится, как правило, в хоро-
близко лежащий к катоду,
обычно покрыт черным на-
летом железа. Это свиде-
тельствует о включении
кольца в биполярную элек-
трохимическую работу. Рас-
пространение коррозионных
разрушений на поверхности
кольца снизу вверх опреде-
ляется, по-видимому, на-
правлением выходящего из
штуцера потока газо-жид-
костной смеси. Степень кор-
розии газовых колец зави-
сит в основном от длитель-
ности их работы, но ско-
рость коррозии водородных
и кислородных колец в процессе эксплуатации различна и изме-
няется во времени. Коррозия водородных колец наиболее интен-
сивна в первое время после включения электролизера (уже после
2 лет работы образуется глубокий, иногда сквозной желоб), а за-
тем замедляется. Коррозия кислородных колец сначала идет мед-
ленно (через 2 года появляются малозаметные следы), но далее
существенно ускоряется. Следует отметить, что после 4—5 лет про-
бега электролизеров водородные газовые кольца в общем разру-
шаются гораздо больше, чем кислородные. Качество и толщина
никелевого покрытия при этом не имеют решающего значения.
Попытка защиты колец от коррозии путем удлинения металли-
ческого газового штуцера (чтобы он входил в кольцо примерно
на 150 мм) для устранения возможности обмывания газом разру-
шающегося участка не дала эффекта. Газовые кольца по-преж-
нему подвергались коррозии. Кроме того, входящая в кольцо часть
штуцера также разрушалась и на ней образовывались узкие глу-
бокие желоба (см. рис. V-6). Поскольку коррозия водородных
штуцеров протекала более интенсивно и через 4—5 лет большая
часть их разрушалась насквозь, а кислородные штуцера не имели
сквозных разрушений, возникала нежелательная разность давле-
ний водорода и кислорода на выходе из ячеек, приводившая к за*
грязнению кислорода.
224
Другим видом коррозии газовых колец, который встречается
значительно реже, чем описанный выше, является разрушение
уплотняющей поверхности кольца под паронитовой прокладкой со
стороны, обращенной к катоду. Такие разрушения имеют форму
неглубоких поверхностных раковин.
Коррозия футерованных газовых колец зависит от того, на-
сколько полно и плотно футеровка закрывает внутреннюю поверх-
ность металла. Для защиты от коррозии внутренней поверхности
газовых колец без выступающих бортиков в промышленных уста-
новках использовали этернитовые вставки; кольца с выступаю-
щими бортиками футеровали цементной массой, закрывающей коль-
цо на уровне бортика. Если такое защитное покрытие (футеровоч-
ная масса или этернитовые вставки) было выполнено тщательно
и плотно закрывало всю внутреннюю поверхность кольца, описан-
ной выше коррозии металлических колец не наблюдалось. Если же
часть выступающего бортика оставалась незащищенной, в про-
цессе эксплуатации электролизеров такие кольца подвергались
коррозии, как и нефутерованные, но разрушение (тоже в виде
узкого глубокого желоба) смещалось к самой кромке кольца на
стороне, обращенной к аноду. Коррозия колец, футерованных этер-
нитовыми вставками, наблюдалась лишь в тех случаях, когда
вставка была разрушена, «размыта» или неплотно заделана. Тща-
тельная футеровка колец позволяет полностью устранить коррозию
их внутренней поверхности. Однако этернитовые вставки (и осо-
бенно цементная футеровка) в условиях электролиза тоже разру-
шаются. Наиболее сильно выщелачивается футеровка водородных
газовых колец. Ее «размывание» происходит равномерно по всей
поверхности, и через 5—6 лет работы футеровка может быть пол-
ностью разрушена. Футеровка кислородных газовых колец сохра-
няется несколько лучше и только покрывается черным налетом.
В большинстве случаев она разрушается на отдельных участках,
особенно в верхней части против выхода газа из штуцера. В этих
условиях этернитовые вставки водородных и кислородных колец
более устойчивы, чем футеровка их цементной массой.
Коррозия футерованных колец по уплотняющей поверхности со
стороны, обращенной к катоду, обнаруживается значительно чаще
и имеет другой характер, чем для нефутерованных колец. Разру-
шение металла происходит по всей уплотняющей поверхности, на
которой образуется слой окалины толщиной до 1 мм и более, легко
отделяющийся от металла (особенно при ударе) с образованием
на его поверхности углубления. Электролизеры, рамы и кольца ко-
торых имеют битумную обмазку или защиту уплотняющей поверх-
ности лаком типа ВДУ-5, наиболее стойким в условиях электро-
лиза, подвергаются коррозионным разрушениям в значительно
меньшей степени.
Наружная коррозия металлической поверхности колец наблю-
дается довольно редко и только в местах уплотнения и близлежа-
щих участках при пропусках электролита.
225
Высокую коррозионную стойкость в условиях процесса элек-
тролиза показали газовые кольца, отлитые из чугуна с присадкой
2—5% никеля. Большая партия таких колец испытана в промыш-
ленных электролизерах. В результате осмотра колец после 4—5 лет
работы было установлено, что они находятся в хорошем состоянии.
Недостатком чугунных колец является хрупкость, что приводит
иногда к выходу их из строя при затяжке электролизера.
Коррозия газовых штуцеров. Нефутерованные газовые штуцера
после 2—3 лет эксплуатации подвергаются коррозии независимо
от типа их соединения с рамой и кольцом (сварное или фланцевое
соединение штуцера с рамой и резьбовое или сварное — с коль-
цом). Однако характер разрушения водородных и кислородных
штуцеров различен. Водородные штуцера корродируют почти во
всех ячейках, т. е. коррозия не локализуется на определенном
участке. Кислородные штуцера больше подвергаются коррозии в
ячейках, расположенных на концах электролизера и около средней
камеры. Коррозия кислородных штуцеров наблюдается, как пра-
вило, в нижней части, на входе в них газа, водородные штуцера
постепенно «размываются», но сильнее в верхней части, где штуцер
соединен с кольцом (см. рис. V-6). При одинаковой продолжитель-
ности эксплуатации водородные штуцера поражаются коррозией
в большей степени, чем кислородные. Футеровка газового кольца
не предохраняет штуцер от коррозии. Этернитовые вставки в газо-
вые штуцера полностью защищают их от коррозии, но вставки
тоже разрушаются, особенно та часть их, которая выступает в
кольцо.
Коррозия колец питательного канала наблюдается только
в 5—6 крайних ячейках, но создает большие затруднения при экс-
плуатации электролизеров, так как вызывает необходимость в
сравнительно частых остановках аппарата и сливе из него элек-
тролита для замены кольца. Коррозия остальных колец в ячейках
средней части электролизера обнаруживается довольно редко, но-
сит совершенно другой характер и обычно вызывается проника-
нием электролита через прокладку (из-за недостаточно тщатель-
ного уплотнения кольца) с образованием на этом участке наруж-
ного слоя карбонатов.
Крайние питательные кольца подвергаются очень интенсивной
коррозии, особенно на катодном конце электролизера. Наиболее
часто выходит из строя второе от крайнего монополярного катода
кольцо, причем первое кольцо питательного канала, как правило,
не разрушается. Коррозия начинается на уплотняющей поверх-
ности кольца, со стороны, обращенной к катоду (чаще всего в верх-
ней части), далее распространяется на внутреннюю поверхность и
заканчивается сквозным разрушением кольца (рис. V-7). Ни кон-
струкция питательного кольца, ни тип соединения его с рамой не
оказывают заметного влияния на этот вид коррозии. Защита пита-
тельных колец этернитовыми вставками нецелесообразна, так как
основное количество колец не подвергается коррозии и без футе-
226
ровки, а футеровка крайних колец не только не уменьшила их кор-
розию, а наоборот, случаи выхода из строя футерованных крайних
колец даже участились. Этернитовая вставка у питательного коль-
ца, имеющего коррозионные повреждения, обычно тоже разру-
шается.
По-видимому, коррозия питательных колец связана с особен-
ностью распределения потенциала на крайних ячейках, обуслов-
ленной значительными утечками тока по электролиту. Интенсивное
включение колец в электрохимическую работу приводит к анод-
ному растворению их отдельных участков. Коррозии способствует
обеднение электролита гид-
роксильными ионами (вслед-
ствие его замедленной цир-
куляции на концах электро-
лизера) и наличие газов и
пены в питательном канале.
Ускорению процесса рас-
творения металла способ-
ствует большое количество
выделяющегося водорода и
действие его в качестве де-
пассиватора. Введение в
крайние ячейки циркуляци-
онных трубок, отводящих
Рис. V-7. Коррозия крайних колец пита-
тельного канала:
/-диафрагменные рамы (1—5 — номера питатель-
ных колец с катодной стороны электролизера;
160—162 - то же, с анодной стороны); 2 — кольца пита-
тельных каналов; 3 — газоотводные трубки; 4 - кор-
розия питательных колец; 5—заглушки питатель-
ного канала; 6 — коррозия газоотводных трубок.
газ из питательного канала
в ячейку, резко сократило
скорость коррозии колец.
Характерным показателем
интенсивности коррозионно-
го процесса в питательном
кольце работающего элек-
тролизера является возникновение разности потенциалов между
кольцом и рамой. При нормальном состоянии кольца перепад на-
пряжения практически равен нулю, но чем больше эта разность
потенциалов, тем интенсивнее коррозионный процесс. Стойкость
крайних питательных колец заметно улучшилась в результате по-
крытия их поверхности беспористым слоем никеля.
Опытная замена стальных никелированных питательных колец
в крайних ячейках кольцами из чугуна с присадкой 2—5% Ni по-
зволила увеличить пробег этих деталей до 3—3,5 лет (при нали-
чии газоотводящих трубок), но не устранила полностью их корро-
зию. Замена всех стальных колец питательного канала чугунными
оказалась нецелесообразной из-за повышенной хрупкости чугуна.
Наиболее эффективной антикоррозионной защитой могло бы слу-
жить покрытие уплотняющей и внутренней поверхности крайних
колец неметаллическими пленками, устойчивыми к действию го-
рячей концентрированной щелочи. Хорошие результаты полу-
чены при плотной обмотке крайних питательных колец тонкой
227
фторопластовой пленкой, исключающей возможность соприкосно-
вения электролита с металлической поверхностью.
Газоотводные трубки на крайних кольцах питательного канала
обычно корродируют по сварным швам в местах соединения тру-
бок с рамой и кольцом питательного канала, а в случае фланце-
вого соединения разрушаются под фланцами и на сгибах трубок.
Коррозия средних звеньев газовых и питательного каналов.
Средние звенья газовых и питательного каналов обычно подвер-
гаются коррозии по краям. Коррозия начинается возле уплотняю-
щей поверхности и затем распространяется вглубь металла. По
внешнему виду характер разрушения металла на уплотняющей по-
верхности средних звеньев аналогичен разрушению уплотняющей
поверхности газовых колец (отслаивающаяся от металла окалина
и отдельные раковины). Этот коррозионный процесс вызывает на-
рушение плотности и приводит к утечкам электролита и газа, что
в свою очередь усиливает коррозию за счет образования карбона-
тов. Через 5—6 лет работы электролизеров среднее звено станови-
лось непригодным к дальнейшему использованию.
Применение «паразитных» колец, надежно закороченных на
средние звенья для защиты последних от разрушения, дало замет-
ный эффект в смысле сохранения поверхности звена без повреж-
дений, однако коррозия «паразитных» колец вызывает необходи-
мость их периодической замены новыми кольцами. По-видимому,
для устранения коррозии средних звеньев эффективны те же меро-
приятия, что и для предотвращения коррозии газовых колец по
уплотняющей поверхности.
Коррозия заглушек газовых и питательного каналов. Коррозия
торцевых заглушек газовых каналов приводит к образованию
углублений в металле, главным образом на границе раздела га-
зовой и жидкой фаз, а также по периметру (около уплотняющих
прокладок). Более интенсивной коррозии подвергаются заглушки
водородного газового канала с анодной стороны. Коррозия заглу-
шек с катодной стороны водородного газового канала менее ин-
тенсивна, здесь происходит постепенное «размывание» металла.
Кислородные заглушки подвергаются коррозии только с анодной
стороны электролизера, а с катодной обычно лишь покрываются
черным осадком железа, что указывает на включение их в элек-
трохимическую работу. Аналогична коррозия заглушек питатель-
ного канала. Концевые стаканы питательного канала изолируют
паронитовыми прокладками, что значительно уменьшает коррозию
втулок.
Для уменьшения коррозии торцевых заглушек газовых и пита-
тельного каналов необходима изоляция их от монополярного элек-
трода и применение высококачественной никелировки или покры-
тие поверхности заглушек стойкими изолирующими пленками.
Коррозия водородных трубопроводов, идущих от среднего зве-
на газового канала к ловушке, и корпуса водородной ловушки
(рис. V-8) аналогична коррозии основного листа электрода и во-
228
дородных штуцеров по виду разрушений (постепенное размывание
металла) и по характеру протекания. Наиболее интенсивная кор-
розия наблюдается в местах изгибов труб и на передней стенке
ловушки, где газо-электролитный поток изменяет направление и
усиленно омывает этот участок стенки. Степень коррозии значи-
тельно снижается при уменьшении общего уноса электролита в
коммуникации и конструктивном изменении узла соединения сред-
него звена газового канала с ловушкой, предусматривающем со-
кращение переброса электролита в коммуникации и ловушку
(см. рис. V-8).
По аналогии с защитой катодной стороны основного листа, по-
видимому, эффективно покрытие внутренней поверхности труб и
ловушки слоем никеля.
Коррозия кислородных коммуникаций и кислородной ловушки
не наблюдается.
Наружная коррозия деталей электролизера. Наружной корро-
зии могут подвергаться любые изолированные друг от друга де-
тали электролизера, на поверхность
которых через неплотности попа-
дает электролит. Просочившаяся
наружу жидкая щелочь под дей-
ствием двуокиси углерода, содер-
жащейся в воздухе, довольно быст-
ро превращается в твердый карбо-
нат, слой которого со временем уве-
личивается в объеме и перекрыва-
ет (через изолирующую прокладку)
соседние детали, работающие под
разным напряжением. В результате
этого между ними проходит ток че-
рез слой влажного карбоната, обла-
дающего достаточно высокой элек-
тропроводностью; причем детали,
имеющие более электроположи-
тельный потенциал, подвергаются довольно интенсивной коррозии.
Наиболее часто внешняя коррозия наблюдается на газовых и пи-
тательных кольцах, на штуцерах и рамах.
Этот вид коррозии здесь подробно не рассматривается, так как
опа легко устраняется при тщательном уплотнении электролизера
и периодической обмывке его поверхности водой.
Разрушение диафрагм. В качестве диафрагм в фильтрпрессных
электролизерах обычно используют плотные асбестовые ткани из
высококачественного длинноволокнистого асбеста. Иногда в асбе-
стовую нить включается тонкая никелевая проволока.
При длительной работе асбестовые диафрагмы изнашиваются.
Продолжительность эксплуатации диафрагм зависит в первую оче-
редь от качества асбестовой ткани (щелочестойкость, плотность,
прочность) и механических воздействий, которым диафрагмы
Рис. V-8. Кьррозия водородных
коммуникаций:
/—среднее звено газового канала;
2 —ловушка брызг электролита; 3-
участки трубопровода, подвергающиеся
коррозии; 4 — расположение трубопро-
вода, уменьшающее коррозию.
229
Рис. V-9. Раз-
рушение диа-
фрагменной
ткани под «пя-
тачками»:
1 — диафрагмен-
ная рама; 2 — вы-
носной электрод-
катод; 3 — «пятач-
ки»; 4 — диафраг-
ма; 5 — места раз-
рушения диафраг-
менной ткани; 6—
выносной элек-
трод — анод.
мыкаегся на
этом участке.
подвергаются в ячейках электролизера. Сильные гидравлические
удары при включении электролизера могут разорвать ткань. По-
этому при частых отключениях тока в электролизерах имелось
большое количество разрывов верхней части диафрагм, напротив
выхода газа из ячеек. Асбестовая ткань с никелевой нитью в этих
условиях получала значительно меньшие повреждения. При плав-
ном подъеме нагрузки в момент включения электролизера и отсут-
ствии ее резких колебаний в процессе эксплуатации разрывы диа-
фрагм не наблюдаются. Однако и в этих случаях нельзя избежать
колебаний давления в анодном и катодном пространствах ячейки,
которые по действию значительно слабее гидрав-
лических ударов, но наблюдаются гораздо чаще
и приводят к постепенному истиранию ткани (осо-
бенно у краев электродов) и ее вытягиванию.
При эксплуатации диафрагма подвергается вы-
щелачивающему воздействию горячего концентри-
рованного электролита, в результате асбестовая
ткань (особенно в верхней части диафрагмы) на-
столько разреживается, что ухудшается разделе-
ние газов электролиза и появляется необходимость
ее замены.
По-видимому, повышение температуры и кон-
центрации электролита приводит к сокращению
продолжительности работы диафрагмы, однако
практика эксплуатации показала, что эта зависи-
мость выражена не столь явно, как ранее предпо-
лагалось. При повышении температуры электро-
лиза с 65—70 до 80—90° С и концентрации элек-
тролита с 320—350 до 380—400 г/л КОН не отме-
чалось значительных ухудшений состояния диа-
фрагмы. Как показали лабораторные исследования,
резкое нарушение прочности асбестовой ткани
происходит только в кипящем электролите. После
длительной работы разрушение диафрагмы на-
блюдается у границы паронитовых «пятачков», осо-
бенно под анодным, если с катодной стороны он
не закрыт катодным «пятачком». На этом участке
диафрагма разрушается (рис. V-9) и вывали-
вается, что приводит к ухудшению чистоты полу-
чаемых газов.
Присутствующие в электролите примеси железа
забивают асбестовую ткань, вследствие чего она
включается в электрохимическую работу и за-
электроды с образованием прожога диафрагмы на
Для увеличения срока службы асбестовых диафрагм до 10 лет
и более необходимо в первую очередь исключить возможность гид-
равлических ударов и толчков давления в электролизере (путем
230
плавной регулировки токовой нагрузки) и увеличить механическую
прочность ткани, что может быть достигнуто вплетением в ее уток
тонкой никелевой проволоки. Подобное же повышение прочности
диафрагмы возможно при натягивании ткани на раму так, чтобы
механические нагрузки, возникающие при работе электролизера,
и масса ткани воспринимались бы не ее утком, а основой, почти
в 2 раза более прочной, чем уток. Для этого ширина выпускаемой
асбестовой ткани должна соответствовать ширине рамы. Удлине-
нию пробега диафрагм способствует также уменьшение содержа-
ния примесей в электролите, особенно железа. При соблюдении
перечисленных условий и нормального режима эксплуатации элек-
тролизеров обеспечивается бесперебойная работа диафрагм в те-
чение 10 и более лет.
Разрушение паронита. Паронит используется в фильтрпрессных
электролизерах в качестве уплотняющего и электроизолирующего
материала между деталями ячеек (рамами, электродами, газо-
выми и питательными кольцами и т. д.). Паронитовые прокладки
обеспечивают достаточные уплотнения и изоляцию деталей на про-
тяжении 5—6 лет, после чего начинают появляться признаки не-
плотности и пропуск электролита через прокладку паронита. Раз-
уплотнения аппаратов в более ранние сроки довольно редки и
вызываются дефектами сборки или нарушением уплотняющей по-
верхности деталей.
Обычно паронит разрушается в местах, выступающих за гра-
ницы уплотнения внутрь или снаружи аппарата. Наружные участки
паронита с течением времени высыхают, расслаиваются по тол-
щине и крошатся. Часть прокладки, выступающая внутрь аппа-
рата, постепенно разбухает в электролите, превращаясь в непроч-
ную раскисшую массу, которая размывается электролитом и
загрязняет его. На таких участках воздействию электролита начи-
нает подвергаться и основная часть паронита, зажатая между де-
талями, вследствие чего нарушается уплотнение и снижаются изо-
ляционные качества прокладки. Об этом свидетельствует корро-
зия деталей по уплотняющей поверхности (особенно газовых
колец). Паронитовые «пятачки», используемые для фиксирования
диафрагмы между электродами и снижения нагрузки от ее массы,
мало разрушаются, если они хорошо зажаты между электродами.
Но при большом количестве ячеек трудно обеспечить равномерное
сжатие всех пятачков в ячейках, в результате чего многие «пятач-
ки» отваливаются, разбухают и загрязняют нижнюю часть ячеек.
Кроме того, по границе «пятачков» часто наблюдалось разруше-
ние диафрагмы, поэтому в последние годы от их использования
отказались. Стойкость паронита заметно улучшается, если при
сборке электролизеров паронитовые прокладки покрывают битум-
ной обмазкой.
Чтобы тщательное уплотнение аппаратов сохранялось на про-
тяжении длительного времени (более 5—6 лет), необходимо при-
менять паронит, отвечающий повышенным требованиям к его од-
231
породности, расслаиванию, механической прочности и набухае-
мости.
Разрушение футеровки. Как указывалось, цементная футеров-
ка поверхности рам, газовых колец и штуцеров также разрушается.
Степень ее разрушения зависит от продолжительности работы и
условий электролиза. Однако стойкость футеровки в большой сте-
пени определяется ее качеством, зависящим в основном от марки
применяемого цемента. Хорошие эксплуатационные результаты по-
лучены при использовании футеровочной массы, приготовленной
на основе портланд-цемента марки 500 Вольского цементного за-
вода.
Важное значение имеет технология и тщательность нанесения
футеровки на деталь. При строгом соблюдении правил футерова-
ния защитный слой хорошо сохраняется в течение 5—6 лет и более.
При защите колец и штуцеров от коррозии лучшие результаты
дало применение этернитовых вставок. Однако и цементная футе-
ровка, и этернитовые вставки со временем выщелачиваются, что
приводит к заметному повышению напряжения па ячейке (на
4—6%). Поэтому на многих заводах отказались от футеровки рам,
на ряде заводов футеруют только нижнюю полку рамы.
Имеющиеся данные о коррозионных явлениях в фильтрпрес-
сных электролизерах ФВ-500 не позволяют предложить для их
объяснения какой-то единый механизм. Обнаруживаемые виды
коррозии довольно резко различаются по характеру, вызываются
разными причинами и должны протекать по различным меха-
низмам.
Проведенный анализ позволил выделить следующие три основ-
ных вида коррозии, каждый из которых, по нашему мнению, имеет
свои причины и протекает по-разному.
К первому виду следует отнести коррозию анодно рабо-
тающих деталей электролизера. Разрушение металла деталей (или
отдельного участка), вызываемое их анодным включением в элек-
трохимическую работу, является наиболее распространенным ти-
пом коррозии в электролизерах. При этом различают две группы
таких коррозионных разрушений: коррозию деталей, которые по
своему назначению должны работать в электролизере анодами,
и коррозию деталей, которые не должны включаться в электро-
химическую работу, но из-за побочных процессов и утечек тока
приобретают анодный потенциал.
К первой группе следует отнести разрушения анодных вынос-
ных листов и основного листа с анодной стороны (шелушение и от-
слаивание никелевого покрытия), сквозную коррозию около трех
анкеров, коррозию в стопках отверстий перфорации, растворение
никеля и основного металла электродов. Известно, что при элек-
тролизе воды никель в области потенциалов выделения кислорода
устойчиво пассивируется в концентрированных растворах щелочи
232
и практически не подвергается разрушению. Скорость растворения
никеля при концентрации щелочи 350 г/л КОП, температуре 90° С
и плотности тока — 0,25 а!см2 составляет примерно 1—2 мк/год.
В этих условиях железо растворяется довольно интенсивно. От-
сюда был сделан вывод, что наблюдавшаяся ранее коррозия анод-
ной стороны биполярных электродов вызывалась плохим качеством
никелевого покрытия и что при тщательном никелировании анод-
ной стороны электрода можно устранить указанную коррозию.
Опыт подтвердил, что при хорошем качестве никелирования (не
более 20 пор на 1 дм2) коррозия выносного листа и основного ли-
ста с анодной стороны практически отсутствует и встречается
только как исключение.
Вторую группу коррозионных разрушений первого вида состав-
ляет коррозия деталей ^или их участков), которые не должны на-
ходиться под электрохимической нагрузкой, но при соприкоснове-
нии с электролитом и вследствие утечек тока приобретают анод-
ный потенциал (см. выше). Присутствующие в электролите
примеси, особенно кислород и трехвалентное железо, электрохими-
чески восстанавливаются в данных условиях, вызывая протекание
вредного анодного процесса — растворение железа или никеля.
При этом металл приобретает более электроположительный потен-
циал, чем соседняя деталь или другой участок данной детали.
К этой (второй) группе можно отнести коррозию внутренней
поверхности газовых штуцеров и колец водородных и кислородных
каналов, а также стенок газовых отверстий в раме, разрушение
уплотняющей поверхности газовых колец и средних звеньев газо-
вых и питательного каналов, коррозию газоотводящих трубок и
других деталей. Включение их в электрохимическую работу, по-
видимому, происходит с анодным потенциалом, не достигающим
потенциала выделения кислорода. В результате на отдельных
участках детали не создаются условия для устойчивого пассиви-
рования никеля, который поэтому может подвергаться разруше-
нию. При этом улучшение качества никелевого покрытия и уве-
личение его толщины способствуют удлинению срока службы де-
тали, но не устраняют полностью ее коррозию, что подтверж-
дается заводскими данными о коррозии перечисленных деталей.
Следовательно, для эффективного предотвращения этого вида
коррозии необходимо в первую очередь значительно снизить со-
держание железа и кислорода в электролите и устранить причины
включения деталей в электрохимическую работу, т. е. утечки тока
между деталями или отдельными участками одной детали.
Утечки тока между соседними деталями, находящимися под раз-
личными потенциалами, могут происходить по скоплениям метал-
лического шлама, по электролиту или в результате снижения
омического сопротивления изолирующих паронитовых прокладок.
Известно, что паронит, применяемый в качестве прокладочно-
изолирующего материала в электролизерах, довольно значи-
тельно набухает в горячей щелочи (18—20% привеса). Это сни-
16 Зик. 713
233
жает электрическое сопротивление паронитовых прокладок и
приводит к увеличению утечек тока между деталями и к корро-
зии их на таких участках, что особенно заметно при значительном
износе паронита после длительной эксплуатации аппарата.
Можно полагать, что применение прокладочных материалов
с очень хорошими электроизоляционными свойствами и защита
поверхности деталей изолирующими покрытиями или пленками,
стойкими в горячих щелочах, устранит описанный вид коррозии
при использовании чистого электролита. Для предотвращения воз-
можности включения в электрохимическую работу колец газовых
и питательного каналов эффективна защита их поверхности стой-
кой футеровкой или пленками, а газовых штуцеров — вставками
или изолирующими покрытиями.
Ко второму виду коррозии относятся так называемые про-
жоги деталей, т. е. все быстро протекающие локальные разруше-
ния деталей до образования сквозных отверстий. Наиболее часты
прожоги на концевых рамах, в основном листе биполярного элек-
трода (особенно в отдаленных от средней камеры ячейках) и
крайних кольцах питательного канала. Для прожогов характерно
преимущественно случайное расположение очага коррозии на де-
тали и отсутствие явной зависимости от продолжительности ее
работы в аппарате. Прожоги некоторых участков возникают через
несколько месяцев работы, на других — отсутствуют после 5—
6 лет работы. Обычно этот вид коррозии наблюдается в тупиках
и в местах с ухудшенной циркуляцией электролита (в отдален-
ных от средней камеры ячейках, преимущественно около прокла-
док), в очагах скопления шлама и т. п. Вероятно, прожоги свя-
заны также с анодным включением таких участков детали из-за
местных утечек тока.
По-видимому, возникновение прожогов вызывается плохой
коррозионной стойкостью никеля при малых анодных потенциа-
лах (порядка 0,2 в) и низкой концентрации щелочи. Б. Н. Каба-
нов, Д. И. Лейкис и др.16’19’34 установили неустойчивость никеля
в слабых растворах щелочей, особенно в присутствии ионов С1~.
Для уменьшения прожогов эффективны мероприятия, предус-
матривающие улучшение циркуляции электролита в ячейках
(особенно в тупиковых местах), снижение содержания в электро-
лите вредных примесей (ионов хлора, сульфатов и др.) и исклю-
чение возможности образования шлама в нижней части ячеек.
К третьему виду относится коррозия в водородной среде.
Для данной группы коррозионных явлений характерна связь про-
текающей коррозии (обычно на значительном участке поверх-
ности металла) с омыванием этого участка потоком водорода и
электролита. Сюда можно отнести коррозию основных листов
электродов с катодной стороны, коррозию рам (старой конструк-
ции) на участке между двумя соседними отверстиями для вы-
хода водорода из ячейки, коррозию водородных коммуникаций (от
среднего звена газового канала до ловушки), водородных лову-
234
шек, водородных штуцеров и заглушек, а также заклепок на
верхней полке рамы со стороны, обращенной к катоду. По внеш-
нему виду всех перечисленных деталей их коррозия однотипна:
разрушение имеет характер постепенного поверхностного «размы-
вания» ровным слоем, без раковин. При этом соседние участки
детали, даже закрытые паронитовой прокладкой от омывания
электролитом и водородом, не подвергаются коррозии. Степень
коррозии определяется в основном продолжительностью работы
данной детали и не зависит от места ее расположения в аппа-
рате. Коррозия наиболее резко выражена на участках, интен-
сивно омываемых водородо-электролитной эмульсией: на элек-
троде — напротив выхода водорода с электролитом из ячейки,
в коммуникациях — на изгибах труб, где поток изменяет направ-
ление.
Причины таких разрушений, по-видимому, заключаются в пе-
риодически повторяющейся активации поверхности железа
(вследствие омывания водородо-электролитной эмульсией) при
кратковременном наложении катодного потенциала с последую-
щим активным окислением поверхности за счет восстановления
кислорода или ионов Fe3+.
Эффективной мерой устранения водородной коррозии основ-
ного листа и водородных заглушек может служить покрытие кор-
родирующих участков беспористым слоем никеля, который в этих
условиях вполне устойчив. В водородных коммуникациях и шту-
церах, где никелирование внутренних поверхностей труб затруд-
нено, можно рекомендовать защиту их лаками и полиэпоксид-
ными или фторопластовыми пленками и уменьшение возможности
попадания электролита в трубопроводы.
ЛИТЕРАТУРА
I. Апсльцип И. Э., Кляч ко В. А., Лурье Ю. IO., Смирнов А С.,
Ионигы и их применение, Стандартгиз, 1949.
2. Салдадзе К. Н., Пашков А. Б., Титов В. С., Ионообменные высоко-
молекулярные соединения, Госхимиздат, 1960.
3. Прохоров Ф. Г., Руководящие указания по химическому обессоливанию
воды ионитами, Госэпергиздат, 1957.
4. Иванов В. С., Серебря некий Ф. 3., Газо-масляное хозяйство генера-
торов с водородным охлаждением, Изд. «Энергия», 1965.
5. С е р п и о н о в а Е. Н., Промышленная адсорбция газов и паров, Госхим-
издат, 1956.
6. К а с а г к и н А. Г.. Основные процессы и аппараты химической технологии,
Госхимиздат, 1960.
7. Герш С. Я., Глубокое охлаждение, ч. II, Госэнсргоиздат, 1960.
8. Лурье Ю. 10., Рыбникова А. И., Химический анализ производственных
сточных вод, Изд. «Химия», 1966.
9. К о л о т ы р к и н Я. М., К ня ж ев а В. М., ЖФХ, 30, 1990 (1956).
10. Колотыркин Я. М., Z. Electrochem., 62, 664 (1958); Бунэ И. Я., Ко-
лотыркин Я. М., ДАН СССР, 111, 1050 (1956); Ф л о р и а п о в и ч Г. М.,
Колотыркин Я- М., Смирнова Н. К., ДАН СССР, 120, 845 (1958).
11. Кистяковский К. А., Электрохимические реакции и электродные потен-
циалы, ч. II, тнпо-литография Шредера, 1916.
16* 235
12, Изгарышев Н. А., Вести, прикл. химии и хим. технол., вып. 1, 2, 3
(1916).
13. ТронстедЛ., Усп. физ. наук, 14, 371 (1934).
14. Акимов Г. В., Кларк Г. Б., ДАН СССР, 30, 798 (1941).
15. К о л о т ы р к и н Я. М., Бунэ Н. Я., ЖФХ, 35, 1543 (1961); Колотыр-
к и н Я. М., Флорианович Г. М., Хим. наука и пром., 3, 483 (1958).
16. Попова Т. И., Кабанов Б. И., ЖФХ, 35, 1296 (1961).
17. Ванюков Л. В., Кабанов Б. Н., ДАН СССР, 59, 917 (1948).
18. Б у р ш т е й н Р. X., Ш у м и л о в а Н. А., ЖФХ, 20, 789 (1946).
19. К а б а н о в Б. Н., Л е й к и с Д. И., ЖФХ, 20, 995 (1946).
20. Л осев В. В., Кабанов Б. Н., ЖФХ, 28, 824, 914 (1954).
21. Колотыркин Я. М., в сб. «Проблемы физической химии», Госхимиздат,
1958, стр. 81.
22. Фрумкин А. Н., Труды второй конференции по коррозии металлов, т. I,
Изд. АН СССР, 1940, стр. 5.
23. Волчкова Л. И., Анодное поведение никеля и его сплавов в щелочных
растворах (канд. диссертация), 1947.
24. Тодт Ф., Коррозия и защита от коррозии, Изд. «Химия», 1966.
25. S h о 1 g е г R„ Z. angew. Chem., 49, 255 (1936).
26. Faust О., Z. Electrochem., 13, 161 (1907).
27. Foerster F., H e г о 1 d V., Z. Electrochem., 16, 461 (1910).
28. H a b e r F., G о 1 d s c h m i d t F., Z. Electrochem., 12, 49 (1906).
29. Веселовский В. И., ЖФХ, 23, 1095 (1949).
30. Grube G , G m e 1 i n H., Z. Electrochem., 26, 459 (1920).
31. E n g e 11 H. J., S t о 1 i c a N. D., Z. Electrochem., 63, 113 (1959).
32. К a 6 a n о в Б. H., Электрохимия металлов и адсорбция, Изд. «Наука».
1966.
33. Волчкова Л. И., Красильщиков А. И., ЖФХ, 23, 414 (1949).
34. Колотыркин Я. М., Усп. хим., 31, 322 (1962).
35. Розенталь К. И., Веселовский В. И., ЖФХ, 27, 1163 (1953).
36. Раков А. А., Борисова Т. И., Эр ш л ер Б. В., ЖФХ, 22, 1390 (1948).
37. Борисова Т. И., Веселовский В. И., ЖФХ, 27, 1195 (1953).
38. Гинсбург В. И., Веселовский В. И., ЖФХ, 24, 366 (1950).
39. Волчкова Л. И., Антонова А. И., Красильщиков А. И., ЖФХ,
23, 714 (1949).
40. К р а с и л ь щ и к о в А. И., Электрохимические реакции кислорода (докт.
диссертация), 1954; Хим. наука и пром., 3, № 4, 476 (1958).
41. Кучинский Е. М., Э р ш л е р Б. В., ЖФХ, 20, 539 (1946).
42. Елина Л. М., Борисова Т. И., Залкинд Ц. И., ЖФХ, 28, 5 (1954).
43. П ф л е й д е р е р Г., Электролиз воды, Химтеорет, 1935.
44. Волчкова Л. М., Плясунов В. Д., Анодная поляризация никеля в рас-
творах щелочей в присутствии водорода под давлением, Труды ГИАП,
вып. 7, Госхимиздат, 1957.
ГЛ А В А
VI
ПРОИЗВОДСТВО ТЯЖЕЛОЙ воды
ЭЛЕКТРОЛИТИЧЕСКИМ МЕТОДОМ
Существование тяжелого изотопа водорода — дейтерия впервые
доказано Юри1 в 1932 г. В 1933 г. Льюис и Макдональд2 выде-
лили 0,3 г тяжелой воды повторным электролизом длительно ра-
ботавшего электролита в электролизерах для разложения воды.
В Советском Союзе3’4 небольшие количества тяжелой воды
впервые получил А. И. Бродский в 1934 г. также электролизом
воды.
Тяжелую воду и тяжелый изотоп водорода выделяют из при-
родных соединений водорода, главным образом из воды. Содер-
жание дейтерия в природных соединениях водорода составляет
около 0,015 атомн.%. Содержание дейтерия в водах различных
источников и в других водородсодержащих соединениях не-
сколько колеблется вследствие фракционирования изотопов водо-
рода в ходе процессов, определяющих кругооборот воды в при-
роде. Однако в большинстве случаев эти отклонения не превы-
шают 0,001 атомн. %. Изучению изотопного состава природных
вод посвящено много работ как за рубежом5"7, так и в Совет-
ском Союзе8-14.
Тяжелая вода находит применение в качестве замедлителя
нейтронов в атомных реакторах и как исходный продукт для при-
готовления разнообразных соединений с меченым атомом водо-
рода, применяемых в научных исследованиях. При разрешении про-
блемы управляемого термоядерного синтеза дейтерий мог бы стать
источником огромных количеств энергии. Энергия 1 г дейтерия,
расходуемого в процессе термоядерного синтеза, эквивалентна
энергии 10 т угля.
Для концентрирования дейтерия используют различия физи-
ко-химических свойств изотопов водорода и их соединений, обус-
ловленные разными массами ядер атомов. Наибольшее приме-
нение получили три группы методов разделения изотопов во-
дорода:
1. Ректификация, основанная на различии парциальных дав-
лений изотопов и их соединений. Помимо низкотемпературной
ректификации жидкого водорода использовалась ректификация
воды, аммиака и других водородсодержащих соединений.
237
2. Методы, основанные на различии химических свойств изо-
топов водорода. Они используются в схемах изотопного обмена
между водой и водородом, двухтемпературного изотопного об-
мена между водой и сероводородом или другими аналогичными
соединениями.
3. Фракционирование изотопов водорода при электролизе, яв-
ляющееся основой электрохимических методов разделения.
Для разделения изотопов водорода в принципе могут быть
использованы также центрифугирование, диффузия через перего-
родки, термодиффузия, электромагнитная сепарация, ионный об-
мен и другие методы, однако практического применения они не
получили.
Промышленное производство тяжелой воды в значительных
количествах впервые было организовано в Норвегии на заводе
электролиза воды фирмы «Норск-Гидро» (в Рьюкане) 15 неза-
долго перед второй мировой войной. В связи с развитием работ
по использованию атомной энергии производство тяжелой воды
было организовано в ряде стран. На стадии начального концент-
рирования использовалась ректификация воды и сочетание элек-
тролиза с каталитическим и фазовым изотопным обменом; на
стадии конечного концентрирования применялся электролитиче-
ский метод 15’16. Затем в ряде стран были разработаны и внедре-
ны другие более экономичные методы 17’18. Однако, несмотря на
применение таких методов производства тяжелой воды, как низ-
котемпературная ректификация водорода и двухтемпературный
обмен между H2S и Н2О, электрохимические методы концентриро-
вания сохраняют практическую целесообразность в тех случаях,
когда, исходя из местных экономических условий, выгодно полу-
чение больших количеств водорода электролизом воды. При этом
тяжелая вода может являться побочным продуктом 19.
Электрохимические методы концентрирования тяжелого изо-
топа водорода основаны на том, что легкий изотоп водорода —
протий выделяется с большей скоростью, чем дейтерий. Поэтому
в водороде, полученном путем электролиза, содержание дейтерия
меньше, нежели в электролите, подвергаемом электролизу. При
электролизе воды дейтерий накапливается в электролите (до
определенного предела).
Процесс фракционирования изотопов водорода при электро-
лизе характеризуется величиной коэффициента разделения а:
с 1 — с
а = — (VI-1)
С 1 -С
где С и С — концентрация дейтерия соответственно в жидкости, подвергаемой
электролизу, и в сухом газе, мол. доли.
При С < 1 выражению (VI-1) можно придать вид:
а = -£- (Vl-la)
С
238
При электролитическом концентрировании дейтерия величина
а оказывает большое влияние на технологическую схему и эко-
номичность производства. Поэтому изучению факторов, влияю-
щих на коэффициент разделения, посвящено много работ.
Коэффициент электролитического разделения изотопов водо-
рода зависит от материала и состояния поверхности катода, его
потенциала, состава электролита, наличия в нем добавок, плот-
ности тока, температуры, длительности процесса электролиза и
некоторых других факторов. Многочисленные исследования зави-
симости величины а от условий процесса электролиза 20-30 дают
плохо воспроизводимые и зачастую противоречивые результаты,
что можно объяснить недостаточным учетом влияния всех фак-
торов, определяющих величину коэффициента разделения. Из них
наиболее важными в практическом отношении являются влияние
на коэффициент а материала катода, температуры процесса и
различных добавок к электролиту.
В зависимости от температуры и других условий процесса
электролиза на стальных катодах в промышленных установках
величина коэффициента разделения колеблется в широких преде-
лах. При 90—95° С значение а в производственных условиях
близко к 5 и с понижением температуры возрастает. Ниже при-
ведены данные30 о зависимости величины а от температуры t
в процессе электролиза в бездиафрагменном электролизере со
стальным катодом и раствором КОН в качестве электролита:
/, °C................. -19 1 6 15 25 50 75 97
а.................... 17,5 14,4 13,2 12,7 10,6 8,6 7,1 5,8
Получаемые в промышленных условиях значения а близки
к этим величинам. Особенно сильное уменьшение коэффициента
разделения было установлено авторами с сотрудниками при вве-
дении в электролит добавок хромовых солей.
При электролизе воды водород и кислород практически всегда
получаются влажными. Концентрация дейтерия во влажных га-
зах, отводимых из электролизера, всегда выше, чем в сухих, так
как концентрация тяжелого изотопа водорода в парах воды, на-
сыщающих газы, близка к концентрации дейтерия в электро-
лите. В зависимости от содержания паров воды в газах, отходя-
щих из электролизера, эффективная величина аЭф коэффициента
разделения изотопов водорода снижается по сравнению с его ве-
личиной, получаемой_из выражения (VI-1).
Если обозначить Р — общий расход воды на получение 1 м3
Н2 и 0,5 м3 О2 —влажных газов при данных условиях*; Р' —
расход воды на разложение; Р"— унос паров воды с 1 м3 Н2 и
* Здесь к далее объемы газов электролиза приведены к нормальным усло-
виям.
239
0,5 м* О2> то путем несложных преобразований выражения
получим:
аэф-Т~с’{
Р [а — С (а — 1)]
Р' + Р" [а-С (а — 1)]
(VI-1)
(V1-2)
При малых значениях С можно пользоваться упрощенным вы-
ражением аЭф = Ра!(Р' + Р"а). Для предотвращения значитель-
ного снижения величины аЭф необходимо охлаждать отходящие из
электролизеров газы до возможно более низкой температуры.
В промышленных схемах концентрирования тяжелой воды
обычно комбинируют электролиз с другими процессами (изотоп-
ным обменом, сжиганием обогащенного дейтерием водорода —
рекуперацией и др.). Электрохимический процесс концентрирова-
ния может осуществляться в двух вариантах — периодическом
и непрерывном.
1. ПЕРИОДИЧЕСКИЙ МЕТОД
ЭЛЕКТРОЛИТИЧЕСКОГО КОНЦЕНТРИРОВАНИЯ ДЕЙТЕРИЯ
Если подвергать воду исчерпывающему электролизу, т. е. прово-
дить электролиз исходного объема воды без пополнения ее коли-
Концентрация дейтерия 8 электролите С, %
Рис. VI-1. Концентрация дейтерия в га-
зах электролиза в процессе исчерпы-
вающего концентрирования при различ-
ных коэффициентах разделения а.
риального баланса по дейтерию
чества, израсходованного на
разложение, содержание дей-
терия в остатке неразложен-
ной воды будет непрерывно
возрастать. Соотношение кон-
центраций дейтерия в воде,
подвергаемой электролизу, и в
образующемся при этом водо-
роде в каждый данный мо-
мент определяется выраже-
нием (VI-1).
На рис. VI-1 показано из-
менение концентрации дейте-
рия С в газах с повышением
его концентрации в электро-
лите С от природного содержа-
ния до 100% при различ-
ных коэффициентах разделе-
ния а. Если электролизу под-
вергать объем жидкости V с
содержанием в нем дейтерия,
равным С, то уравнение мате-
может быть записано в виде:
CdV = d(VC) = VdC + CdV
(VI-3)
Для малых значений концентрации дейтерия в жидкости после
необходимых преобразований из уравнений (VI- 1а) и (VI-З) и ин-
тегрирования получим выражение, связывающее изменение объ-
240
ема жидкости в процессе электролиза с изменением концентрации
дейтерия в остатке неразложенной жидкости:
С \а (Уч \а~'
CJ V )
(VI-4)
где Vo и Со — начальные объемы жидкости и концентрация дейтерия в ней;
V и С — конечные объемы жидкости и концентрация дейтерия в ней.
Из уравнений (VI-1) и (VI-3) аналогичным путем можно по-
лучить выражение, пригодное для любых концентраций дейтерия:
Степень обогащения Q жидкости дейтерием в процессе элек-
тролиза и степень извлечения у дейтерия при этом составят со-
ответственно:
Г) б? 1 — С0 /ТГТ .
(Vb6>
V = 1T§- (VI-7)
v 0C0
Из формул (VI-5) — (VI-7) получаем:
Q=l/ya-1 или y= l/Q,/(a-,) (VI-8)
Обозначая через W степень изменения объема жидкости при
электролизе Vo/V, находим:
IV = .1 (VI-9)
Со Со У
Для получения 1 л раствора с содержанием в нем дейтерия,
равным С, при исходном содержании дейтерия в жидкости Со
в процессе электролиза необходимо разложить (№ — 1) л воды.
Для получения тяжелой воды с содержанием 0,998 мол. долей
дейтерия из природной воды, содержащей 0,00016 мол. долей
дейтерия, необходимая степень обогащения по выражению (VI-6)
составляет: Q = 3,12 • 106.
Теоретически за одну операцию исчерпывающего электролиза
с переменным во времени объемом электролита может быть до-
стигнута любая степень обогащения остатка жидкости дейтерием.
Однако в ходе процесса электролиза наряду с концентрирова-
нием дейтерия в остатке неразложенной воды повышается также
концентрация электролита в растворе. Поэтому наступает мо-
мент, когда концентрация электролита в растворе, подвергаемом
электролизу, становится настолько большой, что дальнейшее про-
ведение электролиза воды становится невозможным.
При использовании в качестве электролита раствора едкого
кали начальная концентрация КОН в растворе обычно не может
быть менее 15—30 г/л, поскольку при более низких концентра-
циях резко возрастает напряжение на ячейке электролизера и
241
происходит интенсивная коррозия анодов. Проведение электро-
лиза при концентрации электролита более 450—550 г/л КОН ста-
новится затруднительным из-за высокой вязкости и агрессивности
растворов. Поэтому максимально достижимая степень изменения
W объема жидкости на одной стадии (ступени) концентрирова-
ния по периодическому электролитическому методу без возвраще-
ния в цикл дейтерия, уносимого с водородом, определяется ука-
занными выше предельными концентрациями КОН в электро-
лите:
450 550
30-35
После проведения одной ступени процесса необходимо уда-
лить из раствора избыток щелочи и снизить ее концентрацию до
нижнего допустимого предела (15—30 г/л), затем можно провести
вторую ступень электролиза и т. д. Основную часть остатка
электролита (95—97%) по окончании электролиза обрабатывают
двуокисью углерода:
2КОН + СО2 = К2СО3 + Н2О
Вся вода полностью отгоняется из образовавшегося раствора
поташа. Конденсат, полученный при перегонке, смешивается с не-
обработанным СО2 остатком электролита (3—5%) и образует
раствор, содержащий 15—30 г/л КОН, для последующей ступени
электролитического концентрирования. Количество необходимых
ступеней концентрирования для повышения концентрации дейте-
рия от Со до С определяется из выражения
где W — общая степень изменения объема электролита в процессе концентриро-
вания; Wk — степень изменения объема электролита на любой k-й ступени
Для получения тяжелой воды из природной воды при коэф-
фициенте разделения а = 5 необходимо четыре последовательные
ступени концентрирования. При а = 7,5 концентрация D2O, равная
99,8%, может быть достигнута в трехступенчатом каскаде элек-
тролитического концентрирования.
В ходе электролитического концентрирования дейтерия возра-
стает также содержание дейтерия в водороде, выходящем из
электролизера. При периодическом методе концентрирования
всегда предусматривается возвращение в цикл дейтерия, уноси-
мого газами. Для этого газы электролиза после повышения в них
концентрации дейтерия по сравнению с содержанием его в при-
родной воде сжигают, а образующуюся в результате конденсации
паров воду— рекуперат возвращают на предыдущую или на дан-
ную ступень в последующем производственном цикле. Концентра-
ция дейтерия в электролите и в добавляемой к нему порции реку-
перата должна быть одинаковой или незначительно отличаться,
242
Возвращение рекуперата в цикл исключает возможность потерь
дейтерия с водородом и позволяет достигнуть на одной ступени
большего обогащения.
Периодический метод электролитического концентрирования
благодаря его простоте и сравнительной легкости реализации ис-
пользовался в начале организации производства тяжелой воды.
Однако ему присущи серьезные недостатки, главными из которых
являются следующие:
переменный объем электролита и изменение его состава в ходе
процесса, что усложняет аппаратуру, увеличивает ее коррозию и
приводит к увеличению расхода электроэнергии на электролиз;
периодичность процесса и необходимость карбонизации элек-
тролита для полной отгонки воды приводят к большому расходу
химикатов и затратам ручного труда и связаны со значительными
механическими потерями тяжелой воды в производстве.
Поэтому периодический метод электролитического концентри-
рования одно время находил широкое применение только на по-
следних стадиях процесса, для которых энергетические затраты
не имели существенного значения, а основная задача заключа-
лась в простой и быстрой организации производства высокопро-
центной тяжелой воды.
При практическом использовании периодического метода
электролиза для конечного концентрирования оказалось целесо-
образным применение биполярных фильтрпрессных электроли-
зеров для получения гремучего газа. Это позволило создать кон-
струкции аппаратов с малым запасом электролита на единицу
мощности электролизера.
Расчеты и опыт практической работы показали, что после про-
ведения нескольких операций, когда устанавливаются относи-
тельно стабильные потоки рекуператов, необходимая степень кон-
центрирования (от 3—5 до 99,8% D2O) может быть обеспечена
двумя ступенями конечного концентрирования 15.
Возможная схема такой двухступенчатой установки представ-
лена на рис. VI-2. В процессе электролиза осуществляется есте-
ственная интенсивная циркуляция электролита через фильтрпрес-
сный биполярный электролизер /, разделитель 3 и бак 4 для
электролита. Емкость бака в 20—30 раз превышает остаточный
объем электролита в электролизере и коммуникациях. В начале
операции бак и электролизер заполняются жидкостью. После
полного опорожнения бака остаток жидкости из электролизера и
коммуникаций сливается в нейтрализатор 10, где после карбони-
зации щелочи из нее отгоняется вода. Полученный конденсат
поступает на следующую ступень, аналогичную первой и отли-
чающуюся только размерами аппаратов.
Гремучий газ после отделения от жидкости в аппарате 3 по-
ступает в горелку печи 6. Образовавшиеся здесь пары воды кон-
денсируются в теплообменнике 7 и собираются в приемных ба-
ках 8 для последующего возврата в цикл.
243
Рис. VI-2. Двухступенчатая схема конечного концентрирования методом исчерпывающего электролиза с
рекуперацией:
/—электролизеры; 2 — холодильные элементы; 3 — разделители; 4— баки; 5 —указатели уровня; 6 — печи для сжигания газов;
7 — конденсаторы; 8 — приемные баки; Р—насосы; /0—нейтрализаторы; 11 — котлы; 12— тара для продукта.
Использовалась также и несколько иная схема установки ко-
нечного концентрирования 16, но которой электролиз проводился в
монополярных цилиндрических электролизерах, работавших при
нагрузке до 1000 а.
Периодический метод электролиза удобно использовать в ис-
следовательских работах и при выполнении отдельных задач
в области концентрирования дейтерия. Например, этот метод при-
менялся для приготовления образцов практически чистой тяже-
лой воды31. Исчерпывающим электролизом исходного продукта,
содержащего 99,6—99,7% D2O, была получена 99,999%-ная тяже-
лая вода. Исчерпывающий электролиз использовали также для
определения очень малого содержания
дейтерия в «нулевой стандартной воде»,
практически лишенной дейтерия и с
изотопным составом кислорода таким
же, как в воздухе. В результате исчер-
пывающего электролиза концентрация
дейтерия в образцах «нулевой стандарт-
ной воды» увеличилась во много раз32,
что позволило повысить точность оп-
ределения тяжелого изотопа водо-
рода D.
2. НЕПРЕРЫВНЫЙ МЕТОД
ЭЛЕКТРОЛИТИЧЕСКОГО
КОНЦЕНТРИРОВАНИЯ ДЕЙ-
ТЕРИЯ
Если проводить электролиз с непрерыв-
ной подачей воды, компенсирующей ее
расход на разложение, максимально
достижимая степень обогащения на од-
ной ступени ограничена. По мере уве-
личения концентрации дейтерия в элек-
тролите будет возрастать и концентра-
ция его в водороде. Когда концентрация
дейтерия в водороде достигнет его кон-
центрации в воде, поступающей на пи-
тание электролизера, приход дейтерия в
Рис. VI-З. Схема матери-
альных потоков одной сту-
пени k электролитического
каскада:
Pk — количество обогащенной
дейтерием воды, отбираемой
с &-й ступени; — концентра-
ция в ней дейтерия; Р^ — коли-
чество воды, разлагаемой на
fe-й ступени с учетом паров воды,
уносимых с газами (Нг и Ог);
Ck — концентрация дейтерия в га-
зах, уходящих из £-й ступени;
— количество обогащенной
дейтерием воды, подаваемой
на k-ю ступень из ступени k— 1;
- концентрация дейтерия
вводе, питающей k- ю ступень
электролизер становится равным его
расходу с газами электролиза и дальнейший рост концентра-
ции дейтерия в электролите прекращается. При непрерывном
электролизе максимальная степень обогащения электролита дейте-
рием на одной ступени численно равна коэффициенту разделения.
Для достижения более высокой степени обогащения необходимо
проводить обогащение в несколько ступеней, т. е. необходимо
применение каскада ступеней электролитического концентриро-
вания.
Рассмотрим закономерности, характеризующие работу одной
ступени электролитического концентрирования. На рис. VI-3
245
схематически изображены материальные потоки одной ступени
электролитического каскада. Согласно принятым обозначениям,
коэффициент разделения а, степень обогащения па ^-ступени qn,
степень извлечения y/f и удельный отбор богатой фракции тд для
любой k-й ступени могут быть выражены в следующем виде:
a _ Q 1 - с к 1 — Ch (VI-1)
Ch \-Ch-t <!к- Ck-, \-Ch (VI-11)
Ъ Pk-iCh-i (VI-12)
(VI-13)
Для любой ступени концентрирования можно написать урав-
нение материального баланса по жидкости
Pk-i = Pk + Pk (VI-14)
и по дейтерию
Pk-\^k-\ = Pi&k + PkCk (VI-15)
После преобразования уравнений (VI-12) — (VI-15) получим:
При малых значениях С\ выражение (VI-16) можно упро-
стить:
т.а
Зависимость величины у от удельного отбора т при различных
значениях а показана на рис. VI-4, а.
Преобразуя уравнения (VI-11) — (VI-15), получим:
a~mk <а“ *)с*
gk~ OTft[a-Cfe(a-l)-l] + l
Для малых значений Ck это выражение может быть
в виде приближенного уравнения:
a
“ mk (a — 1) -f- 1
Зависимость степени обогащения q от величины т
личных коэффициентах а представлена на рис. VI-4, б. При посто-
янных значениях а и т степень обогащения сильно возрастает
с увеличением концентрации дейтерия. Зависимость q и у от кон-
центрации дейтерия при a = 5 и т = 0,5 показана на
рис. VI-4, в.
(VI-18)
записано
при раз-
246
Из уравнения (VI-18) находим:
a-9fc 1
mk~ а-1 ‘ qk-ck(qk-\)
или для малых значений Ск
(V1-19)
Рис. VI-4. Основные закономерности работы одной ступени электролитического
концентрирования тяжелой воды:
извлечения дейтерия у от удельного отбора т при различных О:
обогащения q от удельного отбора т при различных а; в — завпси-
а — зависимость степени
мостьВстепеней обогащения”’/1» извлечения**/ от концентрации дейтерия в электролите при
а в 5 и лд = о 5- г — удельный отбор т, необходимый для степеней обогащения q - а * и q = а 2
при различных концентрациях дейтерия в электролите; д-зависимость степени извлечения
дейтерия у на ступени от степени обогащения q.
Зависимость удельного отбора т, необходимого, для работы
ступени с q = а1/2 и с q — а1'3, от концентрации дейтерия приве-
дена на рис. VI-4, г.
247
После пребразования уравнений (V1-I6) и (VI-19) получаем:
а — q.
= (VI-20)
На рис. VI-4, д изображена зависимость величины у от степени
обогащения q,
В зависимости от условий работы ступени электролитического
концентрирования степень обогащения жидкости дейтерием может
изменяться в пределах от 1 до а; для достижения более высокого
обогащения необходимо соединение ступеней в каскад. Про-
ходя п последовательно включенных ступеней концентриро-
вания жидкость обогащается на каждой ступени соответственно
В 9ь 92, 9з, • • •, 9п-1, 9п раз.
Общее обогащение в каскаде составляет:
Q = 9172 • • • Яп- 17л (VI-21)
Если при создании схемы выполнено условие t/i •= q2 = ...
... = qn_\ = qtl, выражение (VI-21) принимает вид Q = qn.
Число ступеней, необходимых для достижения степени обога-
щения Q, равно:
я=-^- (VI-22)
1g <7
Степень извлечения дейтерия в каскаде из п ступеней соста-
вит:
Г = Y1V2 • • • Yn-iYn (VI-23)
где Yi, Y2, •••> Yn-ь — степени извлечения дейтерия на ступенях от первой
до п-й.
При qi = q2 = ... = qn~i = qn из уравнения (VI-20) следует
Yi = Y2= •” =Yn-i = Yn
Тогда выражение (VI-23) принимает вид: Г = уп.
Если сжечь газы тех ступеней, где концентрация дейтерия
выше, чем в природных водах, и полученную при сжигании
воду—рекуперат—возвратить на питание каскада, степень из-
влечения дейтерия в нем возрастает и удельные затраты электро-
энергии на производство тяжелой воды сокращаются. Такая схе-
ма, получившая название непрерывной электролитической схемы
концентрирования с рекуперацией, использовалась в некоторых
странах на первом этапе развития крупнопромышленного произ-
водства тяжелой воды.
Впервые промышленное производство тяжелой воды по
электрохимическому методу было организовано в Норвегии
(в Рьюкане). Первоначальная установка состояла из девяти по-
следовательно соединенных ступеней электролитического кон-
центрирования, получаемый продукт содержал 15 атом. % дейте-
рия, удельный отбор на ступенях составлял 0,27; обогащенный
дейтерием водород не сжигали и не возвращали в цикл. Впослед-
248
ствии схема производства тяжелой воды в Рьюкане претерпела
ряд изменений.
Для увеличения объема ее производства была использована
рекуперация газов, затем ее заменили процессом изотопного об-
мена между парами воды и водородом. В 1942 г. производство
тяжелой воды в Рьюкане
достигло 1,54 т, затем уве-
личилось примерно до 6 т
в год. До 1943 г. установка
в Рьюкане была единствен-
ным в мире крупным произ-
водителем тяжелой воды.
Окончательное концентри-
рование от 15 примерно до
99% D проводилось по 9-сту-
пенчатой электролитической
схеме с рекуперацией газов.
Простейшая схема элек-
тролитического концентри-
рования с использованием
рекуперации газов изобра-
жена на рис. VI-5. По этой
схеме рекуперат из любой
ступени (£4-1) поступает
на питание предыдущей £-й
ступени концентрирования
вместе с обогащенной фрак-
цией - конденсатом из сту-
пени k— 1. Чтобы предот-
вратить нежелательное сме-
шение потоков с различной
концентрацией в них дейте-
рия, необходимо соблюдать
соотношение:
6*^+1 (VI-24)
де Сд+ 1 — содержание дейтерия
в рскуперате ступени £+1;
Си _| — тоже, в обогащенной
фракции ступени (k—1).
Соотношение (VI-24) вы-
Рис. VI-5. Простейшая схема электроли-
тического каскада с рекуперацией газов:
1, 2, 3...п — ступени электролиза; р— сгупен ।
рекуперации газов.
полняется при q = ос1/2. Для
обогащения, равного Q, потребуется число ступеней п = 21gQ/lgcc.
При этом концентрация дейтерия в газах первой ступени электро-
лиза должна быть в q раз меньше, чем в природной воде. Содержа-
ние дейтерия в водороде второй ступени должно равняться его со-
держанию в воде, поступающей па питание первой ступени. Поэтому
сжигание газов целесообразно только для третьей и последующих
ступеней. Вопрос о том, с какой ступени выгодно сжигать газы,
]7 Зак. 713
249
зависит от соотношения цен на водород и тяжелую воду, и его
следует решать на основе технико-экономических расчетов, вы-
полненных для конкретных условий производства.
Вместо сжигания водорода с кислородом предложено33 ис-
пользовать их в топливных элементах для получения электриче-
ской энергии, а образующуюся при этом воду возвращать в кас-
кад концентрирования дейтерия.
Рассмотрим общие зависимости, характеризующие работу
схемы концентрирования с рекуперацией. Для любой й-й ступени
такой схемы будет действительно соотношение:
Учитывая уравнение (VI-12), (VI-15) и (V1-20), получаем:
а = -^Д- (VI-26)
а — q
Величины материальных потоков на всех ступенях схемы для
равного единице количества дейтерия, отбираемого с богатой
фракцией на n-й (последней) ступени каскада, приведены на
рис. VI-5. При наиболее полном использовании процесса рекупе-
рации, т е. при сжигании водорода из третьей и последующих
ступеней, количество дейтерия, содержащегося в поступающей на
электролиз воде, должно составлять на единицу производимой
тяжелой воды
роСо= 1+2а + 2а2+ ••• + 2ап~'+ап
или после преобразования
(1—ал)(1+а)
Общая степень извлечения продукта составит:
г = п^п —________________________1 ~ а___
~ РцСэ ~ (1 +а)
(VI-27)
(VI-28)
Для рационально построенной схемы описываемого типа при
q = afi значение а равно
а-Аг (VI-29)
а'2
т. е. существенно меньше единицы.
Для каскада, состоящего из значительного числа ступеней
(п = 8 — 10), величиной ап можно пренебречь и выражение
(VI-28) представить в виде приближенной формулы
а’/2 _ |
Г = А----1 (VI-30)
а'2 + 1
Предельная степень извлечения Г для такой электролитиче-
ской схемы концентрирования с рекуперацией при различных
250
значениях коэффициента а (без учета снижения Г из-за механи-
ческих потерь дейтерия по ступеням) приведена ниже:
Коэффициент а............ 2,5 5 7,5 10
Г по выражению (VI-28) . . . 0,225 0,382 0,466 0,520
Можно построить каскады, отвечающие выражению q = aI/rt,
где п — любое целое число больше 2. Для достижения одинако-
вого обогащения по дейтерию в этих каскадах требуется большее
число ступеней, а именно:
п = 3 -у* ® при q =
1g Я
С увеличением числа ступеней п уменьшается протекание вред-
ных процессов смешения потоков с различной концентрацией дей-
терия при питании электролитической ступени, что приводит к
увеличению степени извлечения дейтерия и снижению удельных
затрат электроэнергии в производстве тяжелой воды.
Механические потери обычно пропорциональны величине пото-
ков, проходящих через данную ступень. Потерю жидкости л на
каждой из ступеней можно учитывать как долю b потока воды,
разлагаемой на этой ступени:
nk^=bPk (VI-31)
Величина коэффициента b зависит от состояния аппаратуры и
тщательности ее обслуживания. На ступенях начального концент-
рирования значение b обычно колеблется в пределах 0,01—0,015.
Среднее содержание дейтерия в теряемом на ступени потоке лк
должно быть промежуточным между концентрацией дейтерия
в электролите и в газе данной ступени: Ск > C^k > Ск. Для упро-
щения расчетов обычно принимают, что средняя концентрация
дейтерия в теряемом потоке равна концентрации его в электро-
лите данной ступени. При этом потери дейтерия на любой сту-
пени k могут быть выражены в виде произведения jtkCk и должны
рассматриваться как часть потока богатой фракции.
При высоких концентрациях дейтерия для сохранения задан-
ной степени обогащения (например, q = а,/2) необходимо резкое
повышение удельного отбора т до величин, неприемлемых в прак-
тических условиях. Поэтому при создании непрерывного каскада
электролитического концентрирования на стадиях конечного кон-
центрирования обычно допускаются отклонения от регулярного
построения схемы, что приводит к смешению потоков с различным
содержанием дейтерия при возвращении рекуперата в цикл.
В связи с малыми удельными затратами электроэнергии на ста-
дии конечного концентрирования создание более простой и удоб-
ной схемы более важно, чем достижение высокого коэффициента
использования энергии на этой конечной стадии.
17* 251
Даже при наиболее рациональном построении электролитиче-
ской непрерывной схемы концентрирования общие удельные за-
траты электроэнергии на получение 1 кг тяжелой воды вряд ли
будут значительно меньше 105 квт-ч. Поэтому электролитическое
концентрирование не может рассматриваться как самостоятель-
ный метод производства тяжелой воды в качестве основного про-
дукта. Однако в тех условиях, когда процесс электролиза воды
рентабелен для получения больших количеств водорода и кисло-
рода, направляемых на химическую переработку, одновременная
организация производства тяжелой воды может оказаться целе-
сообразной и экономичной. В этом случае главные энергетические
затраты относят на производство основных продуктов — водорода
и кислорода, а на производство тяжелой воды приходятся только
дополнительные затраты, связанные с приспособлением процесса
электролиза к побочному получению тяжелой воды.
В схемах с рекуперацией газов основные энергетические за-
траты определяются количеством сжигаемого водорода. В первых
ступенях электролитического каскада на переработку поступают
большие количества воды и требуются соответствующие затраты
энергии. На последних ступенях каскада концентрация дейтерия
очень высока, благодаря чему величины потоков и расход энергии
сокращаются в 15 000—20 000 раз. Даже на очень крупных про-
мышленных установках аппаратура в последних ступенях каскада
концентрирования невелика по размерам и напоминает скорее
лабораторное, чем производственное оборудование.
В связи с этим к аппаратуре и схеме первых и последних сту-
пеней концентрирования предъявляются различные требования.
На первых ступенях схемы основное требование заключается
в наиболее рациональном использовании энергоресурсов для сни-
жения удельного расхода энергии. Для последних ступеней глав-
ными требованиями являются минимальные потери продукта при
переработке, простота и надежность схемы, малый запас про-
дукта в аппаратуре.
На стадии начального концентрирования применяются обыч-
ные аппараты для электролиза воды. Наиболее удобны в этом
случае фильтрпрессные электролизеры, например, типов «Бамаг»,
«Де-Нора» и др. Мощные фильтрпрессные электролизеры легко
приспособить для концентрирования тяжелого изотопа водорода.
Негерметичные ящичные электролизеры мало пригодны для таких
целей из-за больших потерь продукта с испаряющейся водой.
На стадии конечного концентрирования применяются как
электролизеры с диафрагмой, так и электролизеры специальной
конструкции для получения гремучего газа. В обоих случаях
стремятся к снижению удельных объемов электролита на единицу
нагрузки на электролизер для сокращения запаса тяжелой воды
в аппаратуре конечного концентрирования. К электролизерам и
к вспомогательной аппаратуре конечной стадии обычно предъяв-
ляют повышенные требования в отношении их герметичности для
252
уменьшения механических потерь продукта в производственном
процессе.
Для отбора обогащенной фракции на питание последующей
ступени34 используются естественные процессы испарения и кон-
денсации влаги, уносимой газами из электролизера (см. главы
III и IV).
Сжигание газов электролиза происходит с выделением боль-
шого количества тепла. При сжигании водорода с кислородом,
подаваемым в стехиометрическом количестве, температура в фа-
келе горелки может достигать 2500—3000° С. Для сжигания газов
Рис. VI-6. Схема работы печи с рециркуляцией газов:
/ — печь; 2 —конденсатор; 3 — газгольдер кислорода; 4 - подающий гидрозатвор; 5 - сбрасы-
вающий гидрозатвор; hit hi — высота водяных затворов.
на ступенях начального концентрирования предлагалась конст-
рукция печи с использованием выделяющегося тепла для получе-
ния водяного пара. Однако установка таких котлов-утилизаторов
оказалась неэкономичной и не была реализована в промышлен-
ности.
Водород и кислород поступают из электролизеров в печи
в стехиометрических соотношениях, поэтому потери дейтерия
из-за неполноты сгорания водорода обычно невелики. Потери воз-
можны при утечке из аппаратуры одного газа или при неравно-
мерности (пульсации) потока газов.
На установках конечного концентрирования для уменьшения
потерь дейтерия из-за неполноты сгорания часто сжигают водо-
род в избытке кислорода. Удобна схема работы печи с рецирку-
ляцией кислорода, показанная на рис. VI-6. При утечках кисло-
рода через неплотности аппаратуры уменьшается его поступле-
ние в горелку печи из электролизера и, поскольку кислород
продолжает расходоваться на сжигание водорода, давление в печи
253
понижается. Когда оно снизится до величины Р\ Р2 — h\ (здесь
Р2 — давление кислорода в газгольдере), кислород из газголь-
дера начинает поступать в печь через подающий гидрозатвор для
пополнения недостающего количества О2. Если в системе прои-
зойдет утечка водорода, в горелку будет поступать избыточное
количество кислорода и давление в печи станет возрастать, пока
не достигнет величины давления столба жидкости в сбрасываю-
щем гидрозатворе (P\>h2). При этом избыток кислорода сбра-
сывается в атмосферу.
Работа электролитической схемы концентрирования с рекупе-
рацией осложняется кругооборотом соединений азота в каскаде.
Одновременно с обогащением
жидкости дейтерием происхо-
дит также (но в значительно
меньшей степени) обогащение
потоков азотсодержащими со-
единениями. Рекуператы всех
ступеней содержат небольшие
количества азотной и азоти-
стой кислот, причем кислот-
ность рекуператов возрастает
от следов на первых ступе-
нях до содержания порядка
100 мг!л на последних. В кон-
денсатах всех ступеней отме-
чено присутствие аммиака,
концентрация которого тоже
возрастет от следов на первых
мг/л в конденсате последних
воде. Кру-
М2+окислы азота
HNO3 + HNO2 I
На питание t___[_
предыдущей
HNO3 + HNO2 ступени
I // Л
4
NH3+N2‘
NH3 |
IN2+Z?WC77A/
^\1 азота
nh3+n2/*\
на питание последующей
ступени
Рис. VI-7. Кругооборот соединений азо-
та в ступени электролитической схемы
с рекуперацией газов:
/-электролизер; 2, 4 — конденсаторы; 3 - печь.
ступенях примерно до 100—200
ступеней и в отбираемом продукте — тяжелой
гооборот соединений азота схематично показан на рис. VI-7.
В электролизерах анионы азотной и азотистой кислот катодно
восстанавливаются до аммиака и частично до элементарного
азота, которые уносятся с газами. Концентрация ионов NO2 и
NO3 в электролите очень невелика даже при питании электро-
лизера рекуператором, в котором присутствует заметное
количество этих анионов, что свидетельствует о большой ско-
рости катодного восстановления анионов азотной и азотистой
кислот.
Часть аммиака, образовавшегося в электролизере, погло-
щается конденсатом и вместе с богатой фракцией подается на пи-
тание последующих ступеней. Остальной аммиак и некоторое
количество азота поступает вместе с газами в печь рекуперации,
где частично превращается в окислы азота с образованием азот-
ной и азотистой кислот. Вместе с рекуператором эти кислоты
направляются в электролизеры предыдущих ступеней.
254
Для предотвращения коррозии коммуникации и аппаратура
для рекуперации газов выполняются из нержавеющей стали.
Загрязнение тяжелой воды аммиаком вызывает необходи-
мость в специальной очистке ее от NH3.
3. КОМБИНИРОВАННЫЕ СХЕМЫ
КОНЦЕНТРИРОВАНИЯ ДЕЙТЕРИЯ
Для возвращения в схему дейтерия, уносимого с водородом из
ступеней электролитической схемы концентрирования, вместо
сжигания газов можно использовать реакцию изотопного обмена
между водородом и парами воды:
HD + Н2О = Н2 + HDO (VI-32)
Константа равновесия этого процесса
[HDO] [Н2]
Кр [HD] [Н2О] (VI-33)
зависит от температуры и концентрации дейтерия. Значения кон-
стант равновесия реакций изотопного обмена между водородом и
жидкой водой или ее парами при низких и высоких концентра-
циях дейтерия приведены ниже:
Реакции Константы равновесия при температурах, °C
0 25 50 75 100 125
Н2О(пар) -Ь HD = HDO(nap) 4- Н2 4,19 3,62 3,20 2,88 2,62 2,43
Н2О(жидк.) 4- HD = НОО(жидк.) 4- Н2 4,69 3,84 3,37 2,99 2,69 2,47
HDO(nap) 4- D2 = D2O(nap) 4- HD 3,54 3,11 2,78 2,53 2,33 2,17
При промежуточных концентрациях дейтерия значения кон-
стант равновесия находятся между приведенными в таблице ве-
личинами.
При низких концентрациях дейтерия константу равновесия ре-
акции изотопного обмена между парами воды и водородом для
различных температур можно определить из выражения:
KpSt~0’127 (VI’34)
Изотопный обмен между парами воды и водородом в обычных
условиях происходит очень медленно. Для ускорения процесс про-
водят на катализаторах и потому называют каталитическим изо-
топным обменом (КИО). Для этой цели применяются скелетные
никелевые катализаторы и катализаторы, в которых слой никеля
нанесен на основу из окислов алюминия или хрома.
255
Кинетика процесса КИО описывается выражением:
Z0,5 • 2,3 (Л + ак)(Кр-а„)
+ lg (Л + ан)(К„-ак)
(VI-35)
где г — время, сек\ X — отношение количества водорода к количеству паров
воды, моль/моль; К — коэффициент, характеризующий активность катализатора;
ан и а к — коэффициенты распределения дейтерия между па-
Рис. VI-8. Схе-
ма материаль-
ных потоков на
ступени катали-
тического изо-
топного обмена:
Р и Р — потоки
пара (или воды) и
водорода соответ-
ст ieнно; С и С —
концентрация дей-
терия в потоках
Р и Р на входе в
ступень КИО; С\
и Ci — то же, на
выходе из ступе-
ни; / — контакт-
ный аппарат; 2 —
конденсатор.
рами воды п водородом в начале и в конце процесса.
При изотопном обмене дейтерий концентри-
руется в парах воды. Схема материальных потоков
на ступени каталитического изотопного обмена
приведена на рис. VI-8.
Условия работы ступени обмена определяются
следующими выражениями:
л = -р- (VI-37)
PC 4- PC = PC. 4-PC. (VI-38)
Из (VI-36) — (VI-38) для смесей с низким содер-
жанием дейтерия получаем приближенные уравне-
бия его концентрации в паре и водороде после
процесса КИО:
С, = ‘^^Т(С + Л?) (VI’39)
С,=—^(С + ЛС) (VI-40)
«к 4~ Л
Величина схк зависит от условий проведения
процесса и может быть выражена уравнением:
= (VI-41)
Степень приближения к равновесию зависит от продолжи-
тельности контакта паро-газовой смеси с катализатором и его ак-
тивности, которая изменяется в зависимости от температуры про-
цесса. В промышленных условиях величина |3 обычно составляет
примерно 0,95.
На рис. VI-9 приведена принципиальная схема концентриро-
вания тяжелой воды, в которой электролитический каскад до-
полнен каскадом ступеней каталитического изотопного обмена,
заменяющим сжигание газов последних ступеней электролитиче-
ской схемы. Замена рекуперации газов каскадом КИО приводит
к снижению затрат электроэнергии и увеличению мощности элек-
тролитического каскада по производству тяжелой воды, но при
этом требуется дополнительный расход пара. Пци построении
схемы необходимо предотвращать вредные процессы смешения
256
потоков с различной концентрацией дейтерия. Поэтому для пита-
ния каждой из ступеней КИО обычно подают водород и пары
воды примерно с равным содержанием в них дейтерия.
Показанная на рис. VI-9 схема характеризуется степенью
обогащения на электролитической ступени q = а'Л. В этом случае
Рис. V1-9. Принципиальная
схема концентрирования тя-
желой воды с использованием
КИО вместо рекуперации:
/ — ступени электролитического кас-
када; 2—ступени КИО с конденса-
торами; 3 — испарители.
для питания паром /г-й ступени КИО
испаряется конденсат п — 2 ступени
электролиза. После обогащения дей-
терием конденсат подается на пита-
ние п—1 ступени электролиза. Водо-
род, обедненный дейтерием после /г-й
ступени КИО, последовательно сме-
шивается с водородом предыдущих
ступеней электролитического каскада
и проходит весь каскад ступеней КИО.
Для более полного извлечения дей-
терия из водорода на питание одной
или двух последних ступеней КИО
(по току газа) подается острый пар.
Схема, аналогичная приведенной
на рис. VI-9, была использована для
стадии начального концентрирования
на заводе в Рьюкане.
Извлечение дейтерия из водорода
на ступени КИО существенно зави-
Рис. VI-10. Зависимость удельного
расхода пара А (в т/кг тяжелой
воды) от величины 1/Х:
/ — на начальных ступенях схемы; 11 — на
средних ступенях; III — на последних сту-
пенях; IV — экономически выгодный
расход пара.
сит от величины X — соотношения потоков водорода и пара. С ро-
.сгом содержания водяного пара в смеси, т. е. с уменьшением Z,
увеличивается как расход пара, так и степень извлечения дейте-
рия из водорода, следовательно, повышается производительность
схемы в целом. Для конкретных условий производства необходимо
рассчитать оптимальное значение X на каждой ступени КИО.
257
На рис. VI-10 приведены кривые зависимости удельного рас-
хода пара на 1 кг тяжелой воды, дополнительно получаемой по
одной из промышленных схем за счет использования процесса
КИО, от величины X на первых, средних и последних ступенях на-
чальной стадии концентрирования тяжелой воды до содержания
4-5% D2O.
При изотопном обмене между жидкой водой и водородом воз-
можно создание противоточного агрегата, однако возникают
трудности с подбором катализатора и других условий, ускоряю-
щих процесс обмена. В процессе парофазного изотопного обмена
противоточная система на одной ступени неосуществима, так как
оба реагирующих компонента являются газами. Соединив ряд
ступеней КИО между парами воды и водородом, как показано на
рис. VI-11, можно создать противоточный каскад. В таком кас-
каде принципиально достижима какая-угодно высокая степень
концентрирования дейтерия, если имеется достаточно большое
количество последовательных ступеней изотопного обмена. Про-
цесс электролиза здесь играет чисто вспомогательную роль и
практически служит только для превращения фаз. Процесс кон-
центрирования происходит в основном за счет изотопного обмена
между паром и водородом. Для малых концентраций дейтерия
в исходной жидкости:
= (VI-42)
О]
Величина — C\/CQ зависит от количества ступеней изотопного
обмена и разности концентраций дейтерия на концах каскада.
При достаточно большом числе ступеней в каскаде pt прибли-
жается к единице. Возможная степень извлечения дейтерия в та-
ком каскаде:
(VI-43)
При высокой степени обогащения дейтерия в каскаде Ро » Рп
и величина X мало отличается от единицы, поэтому можно прибли-
женно записать
1
РРЛр
(VI-44)
Степень извлечения дейтерия тем больше, чем выше значение
КР, т. е. ниже температура процесса изотопного обмена. Однако
одновременно с увеличением КР по мере снижения температуры
уменьшается активность катализатора и сильно возрастает его
количество, необходимое для достижения заданной степени р.
Поэтому на первых по ходу жидкости ступенях целесообразно
поддерживать возможно более низкую температуру и повышать
ее на последующих ступенях. Нижний предел температуры опре-
деляется необходимостью предотвращения конденсации паров во-
258
ды в порах катализатора и зависит от величины X. Обычно тем-
пература должна превышать точку росы не менее чем на 7—10° С.
Следует учитывать, что в порах катализатора точка росы соот-
ветствует более высокой температуре, чем в газовом объеме. Для
увеличения степени извлечения дейтерия необходимо максималь-
ное приближение значения 01 к единице, т. е. большее количество
Рис. VI-11. Схема концентрирования
тяжелой воды в каскаде ступеней
КИО:
/ — ступень электролиза; 2 —ступени КИО;
3 — конденсаторы; 4 — испарители.
Рис. VI-12. Схема концентрирования
из трех каскадов ступеней КИО:
/—ступени электролиза; 2 —каскады сту»'
пеней КИО.
н2
ступеней изотопного обмена. При этом возрастает расход пара и
воды, так как на каждой ступени должно происходить испарение
всего потока жидкости, затем ее конденсация, а также перегрев
паро-газового потока во избежание конденсации паров в порах
катализатора.
Концентрирование дейтерия от природной до высокой конеч-
ной концентрации в одном каскаде по схеме, приведенной на
рис. VI-11, нецелесообразно из-за огромного запаса дейтерия
259
Гис. VI-13. Каскад ступеней
фазового и каталитического
изотопного обмена:
/ — ступень электролиза; 2 — ступени
КИО; 3 - ступени ФИО; 4 - испари-
тель; 5 — конденсатор; 6 — подогрева-
тели.
в жидкости, заполняющей аппаратуру, и очень большого расхода
пара. Поэтому применяют схемы концентрирования, состоящие
из нескольких последовательно включенных каскадов ступеней
изотопного обмена с уменьшающимися по ходу жидкости пото-
ками от каскада к каскаду. На рис. VI-12 показана схема из трех
каскадов. В промышленных схемах количество каскадов следует
определять исходя из заданной степе-
ни концентрирования дейтерия, стрем-
ления к возможно меньшему запасу
дейтерия в аппаратуре, из стоимости
пара и электроэнергии и других ус-
ловий. Применение схем концентриро-
вания с каскадами ступеней изотоп-
ного обмена связано с большим рас-
ходом пара, особенно на начальных
ступенях концентрирования, где
жидкостные потоки велики. На пос-
ледних стадиях концентрирования, где
потоки становятся небольшими, кас-
кадные схемы со ступенями изотопно-
го обмена очень удобны. Расход пара
в этом случае не имеет существенно-
го значения.
Для снижения расхода пара в кас-
каде ступеней КИО вместо конденса-
ции пара из паро-газовой смеси, вы-
ходящей из каждой ступени, и после-
дующего испарения полученного кон-
денсата применяют процесс фазового
изотопного обмена (ФИО) между
жидкой водой и ее парами, содержа-
щимися в паро-газовой смеси. При
контакте паро-газовой смеси, выхо-
дящей из ступени изотопного обмена,
с жидкой водой, в которой содержа-
ние дейтерия ниже, чем в парах,
происходит обмен дейтерия между
жидкой водой и ее парами. При до-
статочно развитой поверхности контакта распределение дейтерия
в обеих фазах будет приближаться к равновесному в процессе
испарения. Если применить процесс фазового обмена между
жидкой водой и ее паром, каскад ступеней КИО, изображенный
на рис. VI-11, может быть заменен каскадом ступеней фазового
и каталитического изотопного обмена (ФКИО), показанным на
рис. VI-13. При этом пар расходуется только на однократное испа-
рение жидкостного потока и затем на подогрев паро-газового по-
тока между ступенями фазового и каталитического изотопного
обмена.
260
Аналогично тому, как было рассмотрено для КИО, при пост-
роении схем концентрирования необходимо применять несколько
последовательно включенных каскадов ступеней ФКИО. На
рис. VI-14 приведена принципиальная схема установки началь-
ного концентрирования тяжелой воды с использованием ФКИО.
Рис. VI-14. Схема концентрирования тяжелой воды на заводе в г. Трайле:
/-ступени электролиза (/-/V); 2 - конденсаторы для водорода и кислорода; 3 - испарители;
4 — водорододувки; 5 —испарители при колоннах ФКИО; 6 — колонны ФКИО {I — IV ступени);
7 —колонна ФИО для кислорода; « — конденсаторы.
работавшая на заводе в г. Трайле (США). Для начального кон-
центрирования тяжелой воды до 2,3% D2O применялась схема
из четырех каскадов фазового и каталитического изотопного об-
мена по 13 ступеней каталитического обмена в каскаде. Электро-
лиз проводился в монополярных электролизерах.
Для осуществления процесса ФКИО использовались колонны
с колпачковыми тарелками, хотя возможно применение и наса-
дочных колонн. Основные энергетические затраты (пар, вода)
приходятся на первый по ходу жидкости каскад ФКИО. Поэтому
схему, изображенную на рис. VI-14, можно улучшить, если
261
жет быть использован для
Н2 на синтез
Вода QMMUQHQ.
Рис. VI-15. Схема комбиниро-
вания электролиза воды с низ-
котемпературной ректификаци-
ей жидкого водорода:
/ — первая ступень электролиза; 2 —
вторая ступень электролиза; 3 — низ-
котемпературная ректификация
жидкого водорода.
предусмотреть в ее начале ступень электролиза, не имеющую ко-
лонки ФКИО и работающую с высокими значениями удельного
отбора и коэффициента разделения. При этом можно сущест-
венно снизить затраты пара на процесс ФКИО без значительного
уменьшения степени извлечения дейтерия. Построение оптималь-
ной схемы с использованием ФКИО зависит от конкретных эко-
номических условий производства. Процесс фазового обмена мо-
извлечения дейтерия из паров воды,
насыщающих кислород, как показано
на рис. VI-14.
Очень экономичный метод концен-
трирования дейтерия — низкотемпера-
турная ректификация жидкого водо-
рода 17’18. При использовании этого
процесса серьезные трудности возни-
кают при очистке водорода от различ-
ных примесей (N2, СО и др.), которые
при температуре ректификации пере-
ходят в твердое состояние и забивают
аппаратуру. Если ректификации под-
вергается электролитический водород,
его очистка упрощается и состоит в
освобождении от кислорода выжига-
нием на катализаторах и в удалении
паров воды.
Поэтому представляет интерес
комбинирование электролитического
производства водорода и низкотемпе-
ратурной ректификации жидкого водорода для получения тяжелой
воды. При этом электролиз может использоваться только для
получения водорода, а также для первоначального концентриро-
вания дейтерия в водороде, например при двухступенчатой схеме
электролиза, как показано на рис. VI-15. При этом па первой
ступени электролиза желательно работать с максимально боль-
шими значениями удельного отбора и коэффициента разделения.
На второй ступени целесообразен возможно более низкий коэф-
фициент разделения для уменьшения концентрации дейтерия в
электролите и механических потерь D2O с электролитом.
ЛИТЕРАТУРА
1 Urey Н. С., Brickwedde F. G., Murphy С. М., Phys. Rev., 40, I,
(1932).
2. Lewis G. N., Macdonald R. T., J. Am Chem. Soc., 55, 3058 (1933),
J. Chem. Phys., 1, 341 (1933); Lewis G. N., J. Am. Chem. Soc., 55, 1297
(1933).
3 Бродский А. И., Александрович В. А., Слуцкая M. M., Ше-
л у дько М. К., ДАН СССР, 3, 615 (1934).
4. А л е к с а н д р о в и ч В. А., Шелудько М. К., ЖПХ, 13, 483 (1940).
5. Киршенбаум И. Тяжелая вода, перев. с англ., Издатинлит, 1953.
262
6. Kimball A. H., Bibliography of Research on Heavy Hydrogen Compounds,
N. J. — London, 1949.
7. Иютопы в геологии, Сборник, Издал ни,hit, 1954.
8. Бродский А И., Химия иююнов, Изд. ЛИ СССР, 1957.
9. Броде к и й А. И. и др., ЖФХ, 13, 1494 (1939); 10, 731 (1937).
10 Тейс Р. В., ДАН СССР, 24, 779 (1939); 53, 553 (1946); 62, 365 (1948).
11. Флоренский К. П. н др., ДАН СССР, 30, 816 (1941).
12. Дем идеи ко С. Г., ЖФХ, 14, 380 (1940).
13. Тейс Р. В.. Флоренский К. П., ДАН СССР, 47, 666 (1945); 27, 70
(1940).
14. Якименко Л. М. и др., ЖПХ, 32, № 6, 1244, 1251 (1959).
15. Технология производства тяжелой воды. Материалы Женевской конферен-
ции, вып. 7, изд. Глав. упр. по использованию атомной энергии при СМ
СССР 1957.
16. SelakP. I., Finkel., Chem. Eng. Progr., 50, № 5, 217 (1954).
17. С а коды некий К. П., Атом, энергия, № 1, 14 (1959).
18. Ж а в о р о и к о в Н. М., С а коды некий К. П., Хим. пром., № 3, 35
(1959)
19. Ramanna М. S., Chem. Age. of India, 15, № 14, 497 (1964); Raman-
na M. S. et al., ibid, 13, № 5, 343 (1962).
20. С о n w а у В. E., Transactions of the Symposium on Electrode Processes
(Philadelphia), 1959, N. Y. — London, 1961, p. 267.
21. Topi e у В., Eyreng H., Nature, 133, 292 (1934).
22. В e 11 R. P., W о 1 f e n d e n I. H„ Nature, 133, 25 (1934).
23. Eucken A. et al., Z. Phys. Chem., 174, 273 (1935).
24. Urey H. C., Rev. Mod. Phys., 7, № 1 (1935).
25. Walton H. F., Wolfenden I. H., Trans. Faraday Soc., 38, 436 (1938);
Farkas A., ibid, 33, 552 (1937).
26. Heyrovsky I., Chem. Rev., 24, 125 (1939).
27. Bowden P. F. et al., Nature, 135, 185 (1935); Walton H. F., et al., ibid,
133, 291 (1934).
28. Halperin I., J. Chem. Phys., 3, 452 (1935).
29. J о h n s t о n H. L. et al., J. Am. Chem. Soc., 64, 2613 (1942).
30. Brunn I. et al., Keg Norske Videnskal Selskabs Farhande, 26, № 6, 19
(1953).
31. Ill а т e н ш т e й н А. И., Якименко Л. M. и др., ЖНХ, 2, № 5, 985
(1957).
32. Якименко Л. М., Шатен штейн А. И. и др., ЖНХ, 2, № 11, 2507
(1957).
33. Пат. ФРГ 1051820 (1959).
34. Я к и м е н к о Л. М., авт. свид. СССР 57968 (1940).
ЛЕОНИД МАРКОВИЧ ЯКИМЕНКО,
ИТ А ДАВЫДОВНА МОДЫЛЕВСКАЯ,
ЗИНАИДА АЛЕКСАНДРОВНА ТКАЧЕК
ЭЛЕКТРОЛИЗ ВОДЫ
Издательство „Химия** М., 1970 г.
264 с. УДК 621.357.1: 546.212
Редакторы М. В. Миникс, Н. С. Аврамова
Технический редактор В. М. Скатана
Художник А. Ф. Ольшевский
Корректоры С. А. Губенко, Г. Н. Сидорова
Т 12 962. Подписано к печати 28/Х 1970 г. Формат бумаги б0Х90'/|б. Печ. л. 16,5.
Уч.-изд. л. 17,35. Тираж 4600 экз. Типогр. бум. № 1. Цена 1 р. 05 к.
Тем. пл. 1970 г., № 47. Зак. № 713.
Ордена Трудового Красного Знамени
Ленинградская типография № 2 имени Евгении Соколовой Главполиграфпрома
Комитета по печати при Совете Министров СССР. Измайловский проспект, 29