Автор: Клаус Дж.
Теги: кровообращение кровь молекулярная биология биохимия иммунология гематология
ISBN: 5-03-001332-6
Год: 1990
Текст
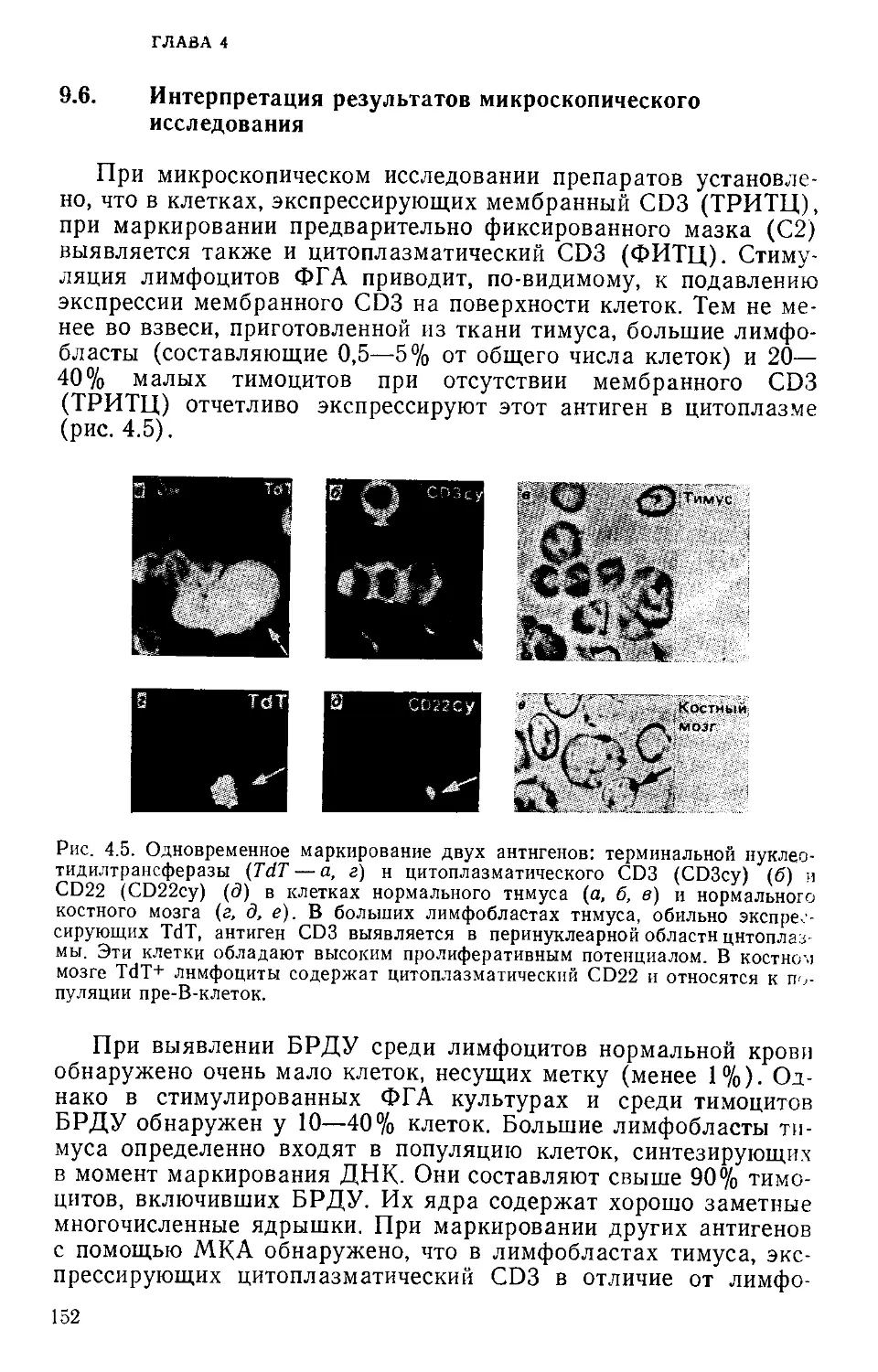
Лимфоциты
ЛАетоды
ИЗДАТЕЛЬСТВО «МИР»
Lymphocytes
A practical approach
Edited by
G. G. B. Klaus
NATIONAL INSTITUTE FOR MEDICAL
MILL HILL, LONDON NW7, 1AA, UK
IRL Press
Oxford, Washington DC
Лимфоциты. Методы
Под редакцией Дж. Клауса
Перевод с английского
А. Н. Маца и
А. А. Фельдшеровой
под редакцией
А. Н. Маца
МОСКВА «МИР» 1990
t>t>l\ Z6.U/U
Л58
УДК 612.112.94
Лимфоциты: Методы: Пер. с англ./Под ред. Дж. Клау-
Л58 са. — М.: Мир, 1990. — ООО с., ил.
ISBN 5-03-001332-6
Методическое пособие, написанное авюритетными хчспыми из Велцкобпи1.1
нии, Норвегии и Швейцарии. Подробно рассматривается выделение лимфоцит-»
из разных источников, методы очистки клеток и определение их жизнеспособно
сти, разделение на субпопуляции, культивирование, анализ функциональной а к
тивности (определение ряда лимфокинов), характеристика поверхностных белков.
Материал изложен продуманно, четко, с необходимым теоретическим обоснова-
нием.
Книга относится к зарекомендовавшей себя серии «Методы», издаваемой
«ИРЛ Пресс» (Англия).
Для иммунологов, гематологов, молекулярных биологов, биохимиков.
Л
1902000000—456
•--------------102—90
056(01)—90
ББК 28.070
Редакция литературы по биологии
ISBN 5-03-001332-6 (русск.)
ISBN 1-85221-018-4 (англ.)
© 1987 IRL Press
© перевод на русский язык.
Мац А. Н„ Фельдшерс-
ва А. А., 1990
ОТ РЕДАКТОРА ПЕРЕВОДА
Современная литература по иммунологии чрезвычайно раз-
нообразна и обильна. Это обусловлено не только очевидностью
серьезных успехов этой науки, но и тем, что иммунологические
подходы служат кратчайшим путем реализации достижений мо-
лекулярной биологии в решении сложнейших проблем практи-
ческой медицины. Методический раздел иммунологической лите-
ратуры также поражает своим разнообразием и избыточностью.
Поэтому современные требования к изданиям методического
плана весьма высоки и конкуренция довольно жестока. Тем не
менее данная книга — одно из методических руководств обшир-
ной серии «The Practical Approach» издательства IRL Press —
представляет собой насыщенное полезной информацией и очень
ценное в практическом отношении издание, предназначенное
для специалистов, профессиональные интересы которых связаны
с клинической и экспериментальной клеточной иммунологией,
иммунодиагностикой и гематологией. Ясно, лаконично и с вели-
чайшим вниманием к деталям описаны как традиционные, так
и новейшие оригинальные методы исследования лимфоцитов, их
иммуноморфологического и функционального разнообразия.
Пользуясь этими методами, действительно можно решать про-
блемы широкого диапазона — от постановки лабораторного ди-
агноза лимфопролиферативных заболеваний до выяснения прин-
ципиальных особенностей индукции и регуляции иммунного от-
вета на исследуемый антиген. На страницах этой сравнительно
небольшого объема книги соседствуют рядом методы работы с
лимфоцитами человека и лабораторных грызунов. В этом явное
ее преимущество. Она как бы формирует общее методическое
мышление экспериментаторов и клиницистов, позволяющее ин-
терпретировать полученные результаты в полном согласии с
современными иммунологическими концепциями. Обращает на
себя внимание весьма тщательный и экономный подбор иллюст-
ративного фактического материала и литературных ссылок,
особый акцент на сравнительных характеристиках методов с вы-
делением их достоинств и недостатков.
Книга написана 28 авторами—первоклассными специалиста-
ми в своих областях исследований. Отчетливо проявилось их
стремление уйти от традиционных методов к современным бо-
лее эффективным с широким использованием моноклональных
антител, иммуномагнптных микробус, проточной цитофлуори-
ОТ РЕДАКТОРА ПЕРЕВОДА
метрии, микрокапельного культивирования клеток, иммуноблот-
тинга, компьютерного анализа полученных данных и т. п. К со-
жалению, из-за ограниченного объема издания в него не вошли
методы молекулярной биологии лимфоцитов — применение тех-
нологии рекомбинантных ДНК, а ведь именно они формируют
современную методическую идеологию в области исследования
лимфоцитарных антигенов, интерлейкинов и антител. (Отечест-
венный читатель может познакомиться с данными методами из
предыдущих переводов издательства «Мир»: «Иммунологиче-
ские методы исследований» под ред. И. Лефковитса, Б. Перни-
са, М., 1988; «Иммунология» под ред. У. Пола, тт. 1, 2, 3, М.,
1987—1989). Стремясь максимально точно описать тот или иной
метод, авторы руководства очень часто указывают марки кон-
кретного лабораторного оборудования, реагентов, материалов и
принадлежностей определенных фирм-изготовителей. В связи
с этим на пути непосредственного воспроизведения методов со-
ветский читатель встретит ряд специфических трудностей и про-
блем— необходимость поиска аналогов, заменителей и вынуж-
денных разработок модификаций. В этом смысле книга адресо-
вана скорее к хорошо подготовленному, опытному, а не начи-
нающему специалисту в области лабораторных иммунологиче-
ских исследований.
Главы 1—4, 8 и 11 переведены А. Н. Мацем, а 5—7, 9, 10 —
А. А. Фельдшеровой.
А. Н. Мац
ПРЕДИСЛОВИЕ
Начало клеточной иммунологии было положено всего лишь
25 лет назад, когда Джеймс Гауанз (ныне возведен в достоинство
рыцаря) и сотрудники показали, что центральная клетка, осу-
ществляющая иммунный ответ — это лимфоцит.
До того функция лимфоцитов — этих многочисленных, рас-
пространенных по всем тканям, но морфологически весьма од-
нообразных клеток, — была неизвестна. Должно было пройти
еще несколько лет, прежде чем в полной мере стало понятным
разнообразие клеточных популяций, образующих лимфоидную
систему. За это время были получены доказательства «разделе-
ния труда» между Т- и В-клетками, а в последующем (благода-
ря объединенным усилиям быстро растущего Сообщества имму-
нологов) одна за другой были открыты функционально различ-
ные субпопуляцин этих клеток. По мере накопления знаний ста-
новилась все очевиднее важность межклеточных взаимодействий
в индукции и контроле иммунного ответа, в который, помимо
самих лимфоцитов, вовлекаются различные вспомогательные
клетки, необходимые для процессирования и презентации анти-
генов Т-клеткам как исполнителям главных ролей на иммуно-
логической арене.
Стремление расшифровать организацию сложной системы
взаимодействующих и дифференцирующихся клеток, вовлечен-
ных в местный и генерализованный иммунный ответ in vivo, не-
уклонно стимулировало создание новых методов анализа. В ре-
зультате для изучения роста и эффекторных функций Т- и
В-клеток in vitro стали применяться все более изощренные ме-
тоды очистки субпопуляций лимфоцитов и вспомогательных кле-
ток наряду со все более утонченными методами культивирова-
ния и оценки активности. Разработка методов идентификации
субпопуляционной принадлежности разнообразных лимфоидных
клеток по множеству маркерных молекул, которые экспрессиру-
ются на клеточной поверхности, было главным открытием, а по-
явление препаратов моноклональных антител к этим маркерам
существенно ускорило прогресс в данной области.
В одиннадцати главах этой книги затронуты различные ас-
пекты исследования лимфоцитов in vitro. В одних главах опи-
саны методы выделения лимфоцитов и вспомогательных клеток
из различных тканей, а также выявления их разных популяций
во взвесях или в тканевых срезах; в других — методы культиви-
7
ПРЕДИСЛОВИЕ
ровання, клонирования и оценки специфических эффекторных
функций лимфоцитов, будь то секреция антител или цитотокси-
ческая атака на инфицированные вирусами клетки-мишени.
Представленный в книге материал в основном касается биоло-
гии лимфоцитов. Однако в настоящее время имеются значитель-
ные успехи в изучении молекулярной биологии этих клеток.
Поэтому нам показалось вполне уместным познакомить читате-
ля с некоторыми из современных (и весьма оригинальных) ме-
тодов идентификации поверхностных молекул, которые обеспе-
чивают взаимодействие лимфоцитов с клетками микроокру-
жения.
Несмотря на впечатляющий прогресс наших знаний в обла-
сти изучения этих загадочных клеток за последнюю четверть
века, многие вопросы, касающиеся индукции и регуляции им-
мунного ответа, остаются пока без ответа. Есть надежда, что
книга окажется для читателя полезным сборником методиче-
ских подходов, которые можно применить для получения ответа
хотя бы на некоторые из этих вопросов.
Джерри Дж. Б. Клаус
СПИСОК АВТОРОВ
Р. L. Amlot
Department of Immunology, Royal Free Hospital, Pond Street,
London NW3 2QG, UK
M. H. Brown
Imperial Cancer Research Fund Laboratories, Lincolns Inn Fields,
London WC2A 3PX, UK
S. Cobbold
Department of Pathology, University of Cambridge, Tennis Court
Road, Cambridge CB2 1QP, UK
D. H. Crawford
Department of Virology, Royal Postgraduate Medical School, Du-
cane Road, London W12 OHS, UK
A. A. Davies
Imperial Cancer Research Fund Laboratories, Lincolns Inn Fields,
London WC2A 3PX, UK
D. W. Dresser
Division of Immunology, National Institute lor Medical Research,
Mill Hill, London NW7 1AA, UK
S. Funderud
The Norwegian Radium Hospital, Montebello, 0310 Oslo, Norway
G. Gaudernack
The National Hospital, Oslo, Norway
K- S. Gilbert
Division of Immunology, National Institute for Medical Research,
Mill Hill, London NW7 1AA, UK
A. S. Hamblin
Department of Immunology, St. Thomas' Hospital Medical School,
London SEI 7EH, UK
S. V. Hunt
Sir William Dunn School of Pathology, South Parks Road, Oxford
0X1 3RE, UK
G. Janossy
Department of Immunology, Roval Free Hospital, Pond Street,
London NW3 2QG, UK
S. C. Knight
Division of Rheumatology, Clinical Research Centre, Northwick
Park, Middlesex HA1 3UJ, UK
T. Lea
The National Hospital, Oslo, Norway
9
СПИСОК АВТОРОВ
/. Lefkowits
Basle Institute for Immunology, Grenzacherstrasse 487, Basle,
Switzerland
D. W. Mason
MRC Cellular Immunology Unit, Sir William Dunn School of Pa-
thology, South Parks Road, Oxford 0X1 3RE, UK
К. H. G. Mills
Division of Immunology, National Institute for Medical Research,
Mill Hill, London NW7 1AA, UK
A. -Nustad •
The Norwegian Radium Hospital, Montebello, 0310 Oslo, Norway
A. O’Garra
Division of Immunology, National Institute for Medical Research,
Mill Hill, London NW7 1AA, UK
W. J. Penhale
MRC Cellular Immunology Unit, Sir William Dunn School of Pa-
thology, South Parks Road, Oxford 0X1 3RE, UK
J. D. Sedgwick
MRC Cellular Immunology Unit, Sir William Dunn School of Pa-
thology, South Parks Road, Oxford 0X1 3RE, UK
P. Stenstad
SINTEF, NTH, Trondheim, Norway
P. M. Taylor
Division of Immunology, National Institute for Medical Research,
Mill Hill, London NW7 1AA, UK
D. B. Thomas
Division of Immunology, National Institute for Medical Research,
Mill Hill, London NW7 1AA, UK
/. Ugelstad
SINTEF, NTH, Trondheim, Norway
F. Vartdal
The Norwegian Radium Hospital, Montebello, 0310 Oslo, Norway
H. Waldmann
Department of Pathology, University of Cambridge, Tennis Court
Road, Cambridge CB2 1QP, UK
E. V. Walls
Department of Virology, Royal Postgraduate Medical School, Du-
cane Road, London W12 OHS, UK
СПИСОК СОКРАЩЕНИЙ
АЛК — активированные лимфокином киллеры
АМП —2-амино-2-метил-1-пропанол
АО — акридиновый оранжевый
АОК — антителообразующая клетка
АПК — антигенпрезентирующая клетка
АПР — анализ в предельном разведении
АЭТ — гидробромид бромистого 2-аминоэтилизотиурони
БВИ — блок визуальной индикации
БГЛ — большие гранулярные лимфоциты
БРДУ — бромдезокоиуридин
БХИФ — 5-бром-4-хлор-3-индолилфосфат
ВХЛЛ — В-клеточный хронический лимфолейкоз
БЭ — бычьи эритроциты
БЭТ — бромистый этидий
ВИЧ —вирус иммунодефицита человека
ВЭБ — вирус Эпштейна — Барр
ГАТ — L-глутаминовая кислота-Ь-аланин-Ь-тирозин
ГМФ — гемоцианин моллюска фиссуреллы
ГФ —гемоцианин фитолакки
ДАБ — З.З'-диаминобензидин
ДМСО — диметилсульфоксид
ДНФ — 2,4-динитрофенил
ДСН —додецилсульфат натрия
ДТТ — 1,4-дитио-ОГ-треитол
ИГХА — иммуногистохимический анализ
ИЛ — интерлейкин
ИФА —иммунофлуоресцентный анализ
ИЭФ — изоэлектрофокусирование
Кон А — конканавалин А
КСФ — колониестимулирующий фактор
ЛБ —лимфома Беркитта
ЛГИ —лимфоциты грудного протока
ЛИФА —локальный иммуноферментный анализ
ЛЛВК — линия лимфобластоидных В-клеток
ЛПК —лимфоциты периферической крови
ЛИС —липополисахарид
ЛЭМ —лейкоцитарный эндогенный медиатор
МАК — мононуклеары периферической крови
МКА — моноклональные антитела
СПИСОК СОКРАЩЕНИЙ
МСИ — минимальная среда Игла
МФ — митоген фитолакки
НИФ — 4-гидрокси-3-нитро-5-иодофенацетил
НК —натуральные киллеры
НМС — нормальная мышиная сыворотка
НП-40 — Нонидет П-40 (этилфенилполиэтиленгликоль)
НЭГрН —неравновесный электрофорез в градиенте pH
ОВА — овальбумин
ОЛМЛ — острый лейкемический миелобластный лейкоз
ООЛЛ —общий острый лимфолейкоз
ПАГЭ — электрофорез в полиакриламидном геле
ПАФ — полный адъювант Фрейнда
ПХ — пероксидаза хрена
РИА — радиоиммунологическнй анализ
СКЛ —смешанная культура лимфоцитов
СКСД — стрептокиназа/стрептодомаза
СНТ — сыворотка новорожденных телят
СО — стандартное отклонение
СПИД — синдром приобретенного иммунодефицита
СПК — сыворотка плода коровы
СЭБ — сукцинимидный эфир биотина
ТГ — тиогликолят
ТГАЛ — поли-Б-тирозин-поли-Б-глутаминовая кислота-поли-
ЦБ-аланин-поли-Б-лизин
ТЕМЭД — М,Кт,М',М'-тетраметилэтилендиамин
ТНБС — тринитробензолсульфоновая кислота
ТНФ —2,4,6-тринитрофенил
ТОЛЛ —Т-клеточный острый лимфолейкоз
ТРИТЦ — изотиоцианат тетраметилродамина
ТФА — 12-О-Тетрадеканоилфорбол-13-ацетат
Тх — Т-хелперы
ТХУ — трихлоруксусная кислота
ФГА — фитогемагглютинин
ФДК — фолл икулярные дендритные клетки
ФДЭ —фактор дифференцировки эозинофилов
ФЗТ —фактор, заменяющий Т-клетки
ФИТЦ — флуоресцеинизотиоцианат
ФМА — форболмиристатацетат
ФМСФ — фенилметилсульфонилфторид
ФРТК —фактор роста Т-клеток
ФРТуК —фактор роста тучных клеток
ФЭ —фикоэритрин
ЦТЛ —цитотоксические Т-лимфоциты
ЩФ — щелочная фосфатаза
[ДФ-АЩФ — комплекс щелочная фосфатаза — антитела к ще-
лочной фосфатазе
ЭБ —эритроциты барана
12
СПИСОК СОКРАЩЕНИИ
ЭДТА — этилендиаминтетраацетат
ЭДТУ — этилендиамин-Х.М.М'.М'-тетрауксусная кислота
Эндо F — эндо-р-М-ацетилглюкозаминидаза F
Эндо Н — эндо-р-Ы-ацетилглюкозаминидаза Н
' ЭП — эндогенный пироген
BCDF — фактор дифференцировки В-клеток (от англ. В-сс11
differentiation factor)
BCGF—фактор роста В-клеток (от англ. В-cell growth fac-
tor)
BSF—фактор, стимулирующий В-клетки (от англ. B-cell
stimulating factor)
BSS—сбалансированный солевой раствор (от англ, balan-
ced salt solution)
CD —дифференцировочный антиген лейкоцитов, выявляе-
мый группой моноклональных антител (от англ.
Cluster of differentiation)
CHAPS —3[ (3-холамидопропил) диметнламмонио] - 1 - пропан-
сульфонат (от англ. 3-[ (3-Cholamidopropyl)-dime-
thyl-ammonio] -1 -propanesulfonat)
CM —сухое молоко марки «Чудо Кадбури» (от англ. Cad-
burys Marvel)
ELISA — ферментзависимый иммуносорбентный анализ (от
англ, enzyme-linked immunosorbent assay)
Fab — фрагмент молекулы иммуноглобулина, несущий
один антигенсвязывающий центр (от англ, antigen-
binding fragment)
FACS—лазерный анализатор и сортировщик клеток по ин-
тенсивности флуоресценции (от англ, fluorescence-
activated cell sorter)
Fc — кристаллизующийся фрагмент молекулы иммуногло-
булина (от англ, fragment cristallizable)
HBSS — сбалансированный солевой раствор Хэнкса (пра-
вильнее Хэнка от англ. Hank’s balanced salt solu-
tion)
HEPES—N-2-гидроксиэтилпиперазин - Х/-2-этансульфоновая
кислота (от англ. N-2-hydroxyethylpiperazine-N'-2-
ethanesulphonic acid)
HPGF — ростовой фактор гибридом/плазмоцитом (от англ,
hybridoma/plasmacytoma growth factor)
MEM — минимальная основная среда (от англ, minimal es-
sential medium)
МНС—главный комплекс гистосовместимости (от англ,
major histocompatibility complex)
MOPS — 3-(N-морфолино) пропансульфоновая кислота (от
англ. 3-(N-morpholino)propanesulphonic acid)
OCT — орто-хлортолуол (от англ, o-chlorotoluen)
13
СПИСОК СОКРАЩЕНИЙ
PBS (А) —фосфатный буферный раствор Дюльбекко(А)беэ
ионов Са2+ и Mg2+ (от англ, phosphate buffered sa-
line)
PBSAB—фосфатный буферный раствор Дюльбекко АБ с
ионами Са2+ и Mg2+
PNA —лектин арахиса (от англ, peanut agglutinin)
POL — полимеризованный флагеллин сальмонелл (от англ,
polymerized flagellin)
PPD — очищенная белковая фракция туберкулина (от англ,
purified protein derivative)
SPF-статус—свободный от видоспецифических патогенных воз-
будителей (от англ, specific-pathogen-free)
TBS — забуференный трисом изотонический раствор хло-
ристого натрия (от англ. Tris-buffered saline)
TCR — Т-клеточный рецептор (от англ. T-cell receptor)
TdT — терминальная дезоксинуклеотидилтрансфераза (от
англ, terminal deoxynucleotidyl transferase)
ZIPP—зоны ингибиции размножения фага (от англ, zones
of inhibited phage plaques)
Глава 1
ВЫДЕЛЕНИЕ ЛИМФОЦИТОВ
И ВСПОМОГАТЕЛЬНЫХ КЛЕТОК
С. Хант
1. Общие предпосылки
1.1. Источники лимфоидных клеток
Эта глава начинается общими сведениями о различных попу-
ляциях лимфоцитов и вспомогательных А-клеток1 (разд. 1), вы-
делить которые сравнительно просто. Далее, в разд. 2 и 3 опи-
саны методы выделения клеток либо из естественных взвесей,
либо из тканей, которые необходимо разрушить, прежде чем по-
лучить клеточную взвесь. Затем в разд. 4 описаны наиболее про-
стые способы очистки клеточных взвесей (см. также в гл. 2
о розетнровании, пэннинге и т. п.). Разд. 5 посвящен способам
подсчета клеток, находящихся в суспензии. Описание многочис-
ленных методов работы с клетками иммунной системы читатель
найдет также в литературе [1—3].
1.1.1. Первичные лимфоидные органы
У взрослого индивидуума зарождение новых лимфоцитов
происходит главным образом в красном костном мозге и тимусе,
поэтому среди клеток в этих органах содержатся как зрелые,
так и незрелые клеточные элементы [4]. При этом зрелых кле-
точных элементов значительно меньше (примерно 5—10%). Не-
зрелые клетки либо достигают зрелости, либо погибают. Среди
подавляющего большинства мелких незрелых клеток можно об-
наружить крупные, делящиеся клетки («бласты»). Тимус и кост-
ный мозг стоят в стороне от основного пути рециркуляции ма-
лых периферических лимфоцитов, поэтому значительного воз-
врата зрелых клеток из циркуляции в эти органы не происхо-
дит. Однако в костном мозге все же содержится некоторое коли-
чество зрелых иммунокомпетентных малых лимфоцитов, вер-
нувшихся из циркуляции. При необходимости содержащиеся во
взвеси костного мозга Т-клеткп легко устраняются с помощью
специфических цитотоксических антител и комплемента (гл. 2).
Имеющиеся в литературе сообщения о присутствии в тимусе
В-клеток можно объяснить совершенно иначе. Вероятно, они
1 А-клетки от англ, accessory. — Прим. ред.
15
ГЛАВА I
попадают в цитологические препараты тимуса случайно из рас/
положенных в непосредственной близости паратимических лим-
фатических узлов. Данное обстоятельство следует особенно учи-
тывать при внутрибрюшинной иммунизации, поскольку из пе-
ритонеальной полости лимфа оттекает через паратимическпе
лимфоузлы. Разумеется, если предмет исследования — это Зре-
лые Т- или В-лимфоциты, то целесообразнее выделять их из
периферической лимфоидной ткани (т. е. из вторичных лимфо-
идных органов) с последующим отделением друг от друга. Пер-
вичные лимфоидные органы как правило используются в качест-
ве источника клеток при исследовании процессов созревания
или для решения иных специальных задач.
В период полового созревания, когда эти органы содержат
максимальное число клеток, красный костный мозг может на
30—50% состоять из лимфоцитов. У мышей зрелые В-клетки,
определяемые по поверхностным иммуноглобулинам, составля-
ют примерно 15% всех содержащих ядра клеток костного моз-
га. Примерно таково же содержание пре-В-клеток. Аналогичные
показатели для костного мозга крысы достигают примерно 5
и 25%. В гл. 2 описаны методы идентификации и избирательно-
го устранения пре-В-клеток из суспензии костного мозга мышц
и крысы с помощью моноклональных антител [5, 6].
Тимус молодых животных почти целиком состоит из лимфо-
идных клеток. Изредка среди ннх встречаются дендритные и
эпителиальные клетки, макрофаги и некоторые другие элемен-
ты, например, тимусные клетки-кормилицы [7—9]. Размеры ти-
муса зависят от возраста и линейной принадлежности живот-
ных. Уменьшение тимуса может быть вызвано стрессом. Врож-
денное отсутствие тимуса наблюдается у мышей, гомозиготных
по гену «nude» (голый). У молодых животных тимус содержит
не более 10% зрелых тимоцитов. Среди них примерно половина
несет антигенный маркер CD4 (фенотип Т-хелперов), а другая
половина — CD8 (фенотип Т-супрессоров и цитотоксических лим-
фоцитов, распознающих антигены главного комплекса гистосов-
местимости (МНС от англ, major histocompatibility complex)
класса I. Очень небольшая часть зрелых тимоцитов не обладает
ни одним из этих маркеров.
Большинство лимфоцитов тимуса несут либо один, либо оба
(CD4 и CD8) маркера. В коре преобладают двухмаркерные, а в
мозговой части — одномаркерные тимоциты. У старых животных
и у молодых, перенесших стресс или введение гидрокортизона,
кора тимуса уменьшается в размерах. Чтобы получить тимус
мыши и крысы, обогащенный зрелыми тимоцитами, животным
за 24—48 ч до аутопсии вводят ацетат гидрокортизона в дозе
0,1 мг на грамм массы. Кортизонрезистентные тимоциты, остав-
шиеся в тимусе, обладают многими свойствами зрелых перифе-
рических Т-лимфоцитов. Но не следует забывать, что они под-
16
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
^ерглись прямому воздействию высокой концентрации стероид-
ного гормона. Кроме того, кортизон избирательно разрушает и
некоторую часть зрелых клеток. Результаты недавних исследо-
ваний [10], ставят под сомнение ортодоксальную точку зрения,
отождествляющую кортизонрезистентные тимоциты с медулляр-
ными. Как и в случае красного костного мозга, истинно зрелые
клетки при необходимости следует выделять из ткани перифе-
рических лимфоидных органов.
Печень плода функционирует как первичный лимфоидный
орган. Она служит и центральным органом кроветворения в по-
следнюю пренатальную неделю у мышей и крыс, а также, начи-
ная с 6-й недели беременности у человека. В печени плода на-
ходится определенное количество пре-В-клеток, однако этот ор-
ган не может быть оптимальным источником пре-В-клеток, по-
скольку в нем преобладают клетки иных типов. Тем не менее
как источник плюрипотентных стволовых кроветворных клеток
печень плода незаменима [11, 12]. В отличие от костного мозга
на ранних сроках беременности печень не содержит зрелых
Т-лимфоцитов. Это особенно удобно для создания аллогенных
(не совместимых по МНС) радиационных химер, поскольку уда-
ется избежать реакции «трансплантат против хозяина».
1.1.2. Вторичные лимфоидные органы
Селезенка, лимфатические узлы, пейеровы бляшки и минда-
лины (вместе с другими участками лимфоидной ткани, ассоции-
рованной со слизистыми оболочками) —это все те лимфоидные
органы, в которых содержатся иммунокомпетентные лимфоциты.
Благодаря постоянной миграции большинства (а возможно и
всех) малых лимфоцитов, вторичные лимфоидные органы физио-
логически едины. Каждый рециркулирующий лимфоцит хотя бы
один раз в 24—48 ч может быть вынесен лимфой в грудной лим-
фатический проток. Однако небольшая часть лимфоцитов все
же уклоняется от лимфотока и надолго задерживается во вто-
ричных лимфоидных органах. Например, лимфобласты вообще
не рециркулируют, а в кровоток поступают развившиеся из них
малые лимфоциты [13].
Количество клеток, которое можно выделить из вторичных
лимфоидных органов, широко варьирует в зависимости от уров-
ня естественной и искусственной иммунизации. Так, например,
у животных, свободных от видоспецифических патогенных воз-
будителей (SPF-статус, от англ, specific-pathogen-free), по срав-
нению с обычными размеры вторичных лимфоидных органов
намного меньше. Сами эти лимфоидные органы специфически
различаются по относительному содержанию Т- п В-клеток.
В лимфатических узлах и в лимфе грудного протока преобла-
дают Т-клетки (55—80% всех лимфоцитов). В селезенке содер-
2—172 17
ГЛАВА 1
жится 40% Т-клеток, а в пейеровых бляшках их меньше всего,
примерно 30%. При выделении какой-либо одной субпопуляции
лимфоцитов лучше всего, разумеется, использовать наиболее бо-
гатый источник соответствующих клеток.
1.1.3. Линии лимфоидных клеток
Использование культивируемых in vitro линий лимфоидных
клеток имеет ряд общеизвестных преимуществ — высокую вос-
производимость результатов и возможность масштабирования —
особенно ценных при работе с клетками человека. Однако на
практике линии клеток требуют самого пристального внимания
для того, чтобы исключить нежелательные варианты или ла-
тентную контаминацию культур. Располагая панелью монокло-
нальных антител, можно сопоставить линии клеток и нормаль-
ные лимфоидные ткани по поверхностным антигенам. Во многих
случаях такой подход позволяет подобрать для данной линии
клеток лимфомы или лейкоза нормальный антигенный двойник
[14, 15]. Линии клеток представляют особую ценность для ис-
следований клеточного метаболизма и биохимического анализа
секретируемых, а также интегральных молекул, которые обыч-
но присутствуют в низкой концентрации, но могут быть полу-
чены в достаточном количестве, если удается отобрать гипер-
продуцирующие варианты. О линиях, полученных при культи-
вировании нормальных Т-клеток, сообщается в гл. 6.
1.2. Суспензии клеток, полученные из солидных
лимфоидных органов
Из большинства лимфоидных тканей можно без особого тру-
да получить суспензию, поскольку клеточные элементы, обра-
зующие эти ткани, прочно не связаны ни между собой, пи со
стромой. Простое измельчение или раздавливание лимфоидного
органа позволяет выделить довольно большое количество жиз-
неспособных лимфоцитов. Но среди них могут отсутствовать
минорные популяции клеток, которые нельзя выделить подоб-
ным образом. В то же время функциональная роль таких кле-
ток, несмотря на малочисленность, может быть весьма сущест-
венной, например, роль А-клеток (разд. 1.3) или некоторых
субпопуляций Т-лимфоцитов. Речь идет о более или менее хруп-
ких клетках, чувствительных к механической травме, например
о лимфобластах, которые теряют жизнеспособность гораздо
быстрее, чем малые лимфоциты.
Выделить лимфоциты из нелимфоидных тканей гораздо
сложнее, чем из лимфоидной. По-видимому, из-за этого при ис-
следовании иммунного ответа на клеточном уровне в поле зрения
18
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
Таблица 1.1. Методы выделения клеток иммунной системы
и» нелимфоидных органов
( Орган Выделяемые клетки Вид Литература
Почка Лимфоидные Человек 16
Почка Лимфоидные Крыса 17
Сердце Лимфоидные Крыса 18
Кожа Лангерганса Человек 19
Кожа Лангерганса Мышь 20, 21
Слюнная железа Лимфоидные Мышь 22
Кишечник Тучные Крыса 23
Кишечник Макрофаги Крыса 24
Спинной мозг Лимфоидные Крыса 25
оказывается центральное, а не афферентное или эфферентное
звено общего механизма. Вместе с тем в более подробном изу-
чении нуждаются лимфоидные клетки, обеспечивающие иммуно-
логическую защиту слизистых оболочек (органы пищеварения,
грудные железы, женские половые органы, слюнные железы,
бронхи), клетки, участвующие в отторжении трансплантатов
(кожа, почки, сердце) и в аутоиммунных процессах (нервная
система, эндокринные железы). В табл. 1 читатель найдет
ссылки на литературные источники, в которых описаны методы
выделения лимфоидных клеток из некоторых нелимфоидных
органов»
Не следует думать, что лимфоидные органы устроены подоб-
но простому мешку, заполненному лимфоцитами, которые высы-
пятся наружу как только мешок будет разрезан [см. 26, 27].
Анатомически каждый лимфоидный орган имеет:
1) капсулу;
2) образованную особыми клетками строму;
3) различного типа эндотелиальные клетки (в частности,
столбчатые клетки так называемых вен с высоким эндотелием
в паракортикальных областях лимфоузлов) и
4) А-клетки (разд. 1.3).
В селезенке помимо перечисленных клеточных элементов со-
держится красная пульпа, наполненная клетками крови. В крас-
ной пульпе плазматические клетки образуют антитела, а макро-
фаги разрушают захваченные чужеродные структуры. Поэтому
в суспензии клеток селезенки всегда содержатся эритроциты,
лейкоциты и многие разновидности лимфоцитов.
Выбирая ту или иную методику выделения клеток из лимфо-
идных органов, приходится искать компромиссы между просто-
той и быстротой процедуры, с одной стороны, и показателями
жизнеспособности и выхода клеток, с другой. Вначале следует
решить, стоит ли применять ферменты. Без ферментативного
гидролиза выделение клеток происходит быстрее, не нужна ин-
2* 19
ГЛАВА 1
кубация при 37 °C, можно использовать простые среды
(разд. 1.4.1). Кроме того, ферменты способны разрушить по-
верхностные структуры. В то же время, однако, применение
ферментов, например, одной коллагеназы или с добавлением
нейтральной протеиназы (диспазы), для диспергирования солид-
ных органов в течение 20—60 мин обеспечивает повышенный
выход лимфоцитов. Этот прием мы обычно используем при вы-
делении лимфоцитов из пейеровых бляшек, печени плода, тка-
ней облученных или очень старых животных. Применение
ДНКазы уменьшает потери живых клеток. В ее отсутствие зна-
чительное количество выделяемых клеток попадает в сгустки,
образованные нитями ДНК из погибших клеток. Особенно часто
это явление наблюдается при диспергировании тимуса и кост-
ного мозга молодых животных. Ферменты необходимы для вы-
деления дендритных клеток. Их длинные отростки слишком
хрупки, чтобы сохраниться при механической дезинтеграции
органа. Освобождение лимфоцитов из сети переплетающихся
отростков дендритных клеток следует проводить как можно де-
ликатнее. Наиболее щадящая процедура выделения фоллику-
лярных дендритных клеток (ФДК) начинается с внутривенного
введения коллагеназы за 30 мин до умерщвления животного
либо с перфузии изолированной селезенки раствором этого
фермента.
Чисто механическое разрушение органа также можно произ-
водить с разной степенью усердия. Самый деликатный подход —
это сначала разрезать орган на крупные фрагменты, а затем
терпеливо выщипывать из них глазным анатомическим пинце-
том более мелкие. При этом необходима известная тщатель-
ность, иначе интересующие исследователя клетки могут остаться
среди элементов соединительнотканной! стромы. Продавливание
органа через стальную или пластиковую сетку, растирание тка-
ни в стеклянном гомогенизаторе с неплотно пригнанным порш-
нем или раздавливание между двумя матовыми предметными
стеклами может дать намного больше клеток, но непременно
с утратой жизнеспособности. Методы, описанные в разд. 3 и
перечисленные в табл. 1.6, разработаны нами применительно к
тканям молодых крыс. В любой иной ситуации, которая отли-
чается от обычной, имеет смысл провести предварительные экс-
перименты, пользуясь другими методами выделения.
1.3. Гетерогенность А-клеток
Двадцать лет тому назад [29] впервые было установлено,
что для иммунного ответа in vitro лимфоцитам необходима по-
мощь нелимфоидных клеток. А-клетки отличаются от лимфоци-
тов по адгезивности, плавучей плотности, радиорезистентности,
20
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
а также по экспрессии некоторых поверхностных маркеров, та-
ких, как рецепторы Fc-фрагментов п антигены МНС класса II.
Эти' отличия используют для получения обогащенной суспензии
А-клеток. Если не обращать внимания на некоторые детали, все
вспомогательные клетки можно разделить на макрофаги и ден-
дритные клетки, а уже в пределах каждой из этих двух групп
выделить клетки, различающиеся физиологическим состоянием,
например степенью активации среди макрофагов, или тканевой
локализацией среди дендритных клеток. В частности, ФДК.
встречающиеся в первичных и вторичных фолликулах перифе-
рической лимфоидной ткани, следует отличать от других разно-
видностей дендритных клеток (разд. 1.3.3). В настоящее время
функциональные взаимосвязи между различными группами
вспомогательных клеток интенсивно и тщательно изучаются
[27, 30]. Накоплено много противоречивых данных, привести
которые в данном издании подробно не представляется воз-
можным.
Если обобщить известные факты, между фагоцитарной ак-
тивностью и адгезивными свойствами вспомогательных клеток
довольно часто наблюдается параллелизм. Однако ориентиро-
ваться на адгезивные свойства можно только в том случае, когда
для выделения клеток применяется достаточно щадящий метод.
Известно, например, что использование трипсина вызывает (по
крайней мере временно) нарушение клеточной физиологии. Ре-
шающее значение для способности к адгезии имеют свойства
поверхности, к которой прилипает клетка. Так, микроэкссудат,
оставляемый на поверхности пластика клетками почки хомячка
при сливном росте, служит подложкой для адгезивных клеток,
таких, как макрофаги человека. Чтобы элюировать распластав-
шиеся на микроэкссудате адгезивные клетки, достаточно обра-
ботать их раствором ЭДТА [31].
1.3.1. Макрофаги
Макрофаги разрушают чужеродные вещества, попавшие в ор-
ганизм. Презентация антигена (и теоретически, и вероятно, на
самом деле) является самостоятельным процессом, который ча-
сто осуществляют не макрофаги, а клетки других типов, напри-
мер дендритные или В-клетки. Кроме того, макрофаги секрети-
руют множество локально активных веществ [32], таких, как
цитокины, ферменты, простагландины, колониестимулирующие
факторы и др. Макрофаги обнаружены во всех тканях. Они раз-
виваются в костном мозге из миелоидных предшественников.
Одна из стадий их развития — это моноциты периферической
крови. Некоторое количество резидентных макрофагов в норме
находится в перитонеальной полости, легочных альвеолах, мо-
лозиве и молоке, откуда их можно выделить. Однако широко
21
ГЛАВА 1
используется другой подход, дающий значительно большее чис-
ло клеток. Это—получение макрофагов из стерильного воспа-
лительного экссудата, который образуется на 3—5 день после
введения в перитонеальную полость пептона или тиогликолятно-
го бульона по Бруэру. Внутрибрюшинное введение бактериаль-
ной вакцины (БЦЖ, Corynebacterium parvum) через 10—21 день
вызывает появление активированных макрофагов. При выделе-
нии макрофагов из воспалительного экссудата, прежде всего
следует освободиться от примеси гранулоцитов. Сделать это
сравнительно просто, поскольку макрофаги более прочно при-
липают к поверхности пластика, чем гранулоциты. Взвесь мак-
рофагов может быть контаминирована также тучными клетка-
ми, фибробластами и лимфоцитами. Тканевые макрофаги, на-
пример купферовские клетки печени, несмотря на их многочис-
ленность, в чистом виде выделить трудно, поскольку необходи-
мо диспергировать солидный орган до моноклеточной взвеси.
Субпопуляции макрофагов существенно отличаются друг от
друга. Например, макрофаги описанных выше типов различа-
ются по ряду свойств, в частности экспрессии антигенов глав-
ного комплекса гистосовместимости (класс II) после активации
[33], микробицидной активности [34] и секретируемым белкам
[35]. Степень активации резидентных, явно нестимулированных
макрофагов, тоже подвержена «естественным» вариациям в за-
висимости от тех условий, в которых содержатся эксперимен-
тальные животные. Перитонеальные макрофаги трудно назвать
типичными представителями макрофагов, поскольку они несут
особые маркеры, например антиген MRC 0X43 у крысы [36] и
ОКМ.5 у человека [37], отсутствующие на тканевых макрофа-
гах. Крысиные перитонеальные макрофаги имеют антиген CD4,
который отсутствует на макрофагах из бронхиального смыва
[38]. Между макрофагами, обитающими в различных участках
лимфоидной ткани, имеется и ряд более тонких различий. На-
пример, макрофаги, выстилающие мозговой синус, расположен-
ные под субкапсулярным синусом и находящиеся в зародыше-
вых центрах лимфатических узлов, различаются по морфологии.
Различия макрофагов по гистологическим свойствам и поверх-
ностным маркерам отражают, по-видимому, их функциональную
неоднородность [39]. Моноциты крови, наиболее доступные из
клеток макрофагального ряда человека, представляют собой
менее зрелые клетки, чем тканевые макрофаги. Перечисленные
выше данные необходимо учитывать при планировании экспе-
риментов.
1.3.2. Дендритные клетки
Объединение в одну группу всех вспомогательных клеток,
основная функция которых заключается в презентации (пред-
ставлении) антигена Т-лимфоцитам, вполне целесообразно.
22
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
В эту группу попадают «вуалевые» и другие нелимфоидные
клетки периферической лимфы, эпидермальные клетки Лангер-
ганса, «интердигитатные» клетки паракортикальной зоны лим-
фоузлов и клетки крови и пейеровых бляшек, называемые про-
сто дендритными. Однако неясно, в какой мере гистологические
особенности данных клеток коррелируют с их антигенпрезенти-
рующей активностью, связаны ли (и каким образом) они по
своему происхождению и каким образом в физиологических ус-
ловиях они «перерабатывают» антиген прежде, чем его презен-
тировать. Как и всем прочим объектам исследований в клеточ-
ной иммунологии, дендритным клеткам свойственна выражен-
ная гетерогенность.
Нефагоцитирующие дендритные клетки, обнаруженные Ста ft-
маном и сотр. [40, 41] в селезенке мыши, в ряде опытов по пре-
зентации антигена оказались довольно активными. Этих клеток
довольно мало, менее 1%. Поэтому их выделение основано на
последовательной очистке клеток одной популяции от клеток
других до такой степени, чтобы только дендритные клетки в
полученной взвеси проявляли себя как стимуляторы Т-лимфо-
цитов. Селезенка мыши — хороший источник дендритных кле-
ток. Примерно 40% их попадает во фракцию липких клеток при
разделении спленоцитов по адгезивности. В сущности, это —
наиболее простой способ получения неочищенной суспензии
дендритных клеток. Отметим, что в данном случае имеет место
исключение из правила — нефагоцитирующие дендритные клетки
обладают адгезивностью, хотя обычно адгезивные свойства кор-
релируют с фагоцитарной активностью. К дендритным клеткам
получены моноклональные антитела 33D1 [42], с их помощью
удается отличить дендритные клетки от макрофагов и ФДК в
реакции комплементзависимого цитолиза (но не иным методом,
поскольку 33D1—это слабоокрашивающие антитела). Известно
также, что на дендритных клетках отсутствует макрофагаль-
ный антиген F4/80 [43]. Поликлональную антисыворотку к ан-
тигену F4/80 (моноклональные антитела этой специфичности
могут быть нецитотоксичными) и антитела 33D1 можно приме-
нить в реакции комплементзависимого цитолиза, как описано в
гл. 2. По маркерам F4/80 и 33D1, а также с помощью фазово-
контрастной и интерференционной микроскопии (рис. 1.1) мож-
но следить за ходом очистки.
Дендритные клетки обнаружены и в лимфе, притекающей к
лимфоузлам, в частности, из кожи. Они задерживаются в лим-
фоузлах и в оттекающую лимфу не проникают. В связи с этим
существует гипотеза о происхождении дендритных клеток из
эпидермальных клеток Лангерганса, либо из несущих
антигены МНС класса II клеток слизистой пищевари-
тельного тракта (такие клетки встречаются в пейеровых бляш-
ках и на lamina propria). Предшественники дендритных клеток
23
ГЛАВА 1
Рис. 1.1. Лимфоциты и иелимфоидные вспомогательные клетки из лимфы
грудного протока, полученной у крысы после удаления брыжеечных лимфати-
ческих узлов. Живые клетки распластались на поверхности стекла (см. разд.
1.3.2). В отличие от округлых малых лимфоцитов (МЛ) и больших лимфобла-
стов (БЛ) дендритные клетки (ДК) имеют тонкие отростки (1300Х, интер-
ференционная оптическая система Номарского).
можно выделить, и подобно дендритным клеткам, они проявля-
ют антигенпрезентирующую активность. Легче получить ден-
дритные клетки из лимфы крупных животных (овец, свиней
и др.), у которых возможен прямой доступ к приносящим лим-
фатическим сосудам. Можно работать и на мелких животных.
Если удалить значительную часть лимфоузлов, то можно бу-
дет собирать не прошедшую фильтрацию лимфу с дендритны-
ми клетками, не задержанными лимфоидной тканью. Такую
лимфу, содержащую дендритные клетки, удавалось собирать у
крыс в течение нескольких недель после мезентериальной лим-
фаденэктомии [44]. Как источник А-клеток лимфа имеет одно
существенное преимущество — клетки выделяются в виде естест-
венной взвеси. Правда, их еще нужно очистить от примеси лим-
фоцитов. Да и сами они, судя по поверхностным маркерам, мо-
24
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
гут быть весьма гетерогенными; например, у крысы субпопуля-
ции вспомогательных клеток несут маркеры CD4, Thy-1 и
MRCOX2 [45].
1.3.3. Фолликулярные дендритные клетки (ФДК)
ФДК связывают и удерживают на своей поверхности комп-
лексы антиген — антитело. Связывание комплексов осуществля-
ется, по-впдимому, через молекулы СЗ (третьего компонента
комплемента), для которых на поверхности ФДК имеется доста-
точно СЗ-рецепторов (CR1 и CR2). ФДК не способны ни к фаго-
цитозу, ни к иному способу переноса антигена внутрь клетки.
Они не содержат лизосом. Подобно другим А-клеткам, ФДК
радиорезистентны (выдерживают дозы до 10 Гр). Однако дан-
ные об онтогенезе этих клеток весьма противоречивы. Не ясно,
происходят ли они из гемопоэтических предшественников или
из аутохтонных клеток. Вытянутые, тонкие отростки ФДК обра-
зуют сеть, оплетающую в основном В-клетки. Вполне убеди-
тельно доказано, что ФДК в зародышевых центрах лимфоуз-
лов мыши способны стимулировать В-клетки памяти '[46]. В то
же время роль ФДК в стимуляции первичного иммунного отве-
та изучена недостаточно. Спорным представляется и сам факт
экспрессии на поверхности ФДК антигенов МНС класса II
[28, 47]. Таким образом, ФДК с полной уверенностью нельзя
отнести к антигенпрезентирующим клеткам.
Из-за чрезвычайно тесного контакта с лимфоцитами ФДК
очень трудно выделить без повреждений. Существует предполо-
жение, что они, вообще, представляют собой оседлые, а не по-
движные клетки. Поэтому для их выделения следует осторожно
диспергировать целиком весь орган (лимфатический узел или
селезенку). За ходом очистки удобно следить, предварительно
пометив ФДК конъюгированными с флуоресцеином антителами
(или комплексами антиген — антитело). Метку вводят внутри-
венно за 3 дня до опыта. Агрегаты, захваченные макрофагами,
полностью гидролизуются через 48 ч, и флуоресцеин элимини-
руется. К 3-му дню метка остается лишь на ФДК [28]. От дру-
гих А-клеток ФДК отличаются по ряду маркеров — у мыши на
ФДК отсутствуют эпитопы для МКА 33D1, у человека ФДК не-
сут антиген R4/23 [49] и рецепторы CR1 и CR2 [28]. Выделение
ФДК из миндалин человека описано ранее [48].
1.3.4. Миеломоноцитарные линии клеток
Большинство линий макрофагоподобных клеток, например
WEHI-3 и J774, были получены при эксплантации опухолей от
мышей BALB/c. Фенотипические маркеры позволяют разграни-
чить клетки разных линий по степени дифференцировки (т. е.
25
ГЛАВА 1
одни более близки к моноцитам, другие — к макрофагам). Не-
которые линии получены в результате долговременного субкуль-
тивирования макрофагов или клеток костного мозга с периоди-
ческим добавлением фидерных клеток [50—52]. Проблема ста-
бильности фенотипа так же существенна при культивировании
миеломоноцитарных линий, как и лимфоидных. Например, су-
ществует несколько различных сублиний Р388, первоначально
полученных из клеток лимфомы; однако сублиния P388D1 об-
ладает свойствами макрофагальных клеток. В этом феномене,
по-видимому, выразилась свойственная некоторым клеткам спо-
собность к переключению фенотипа in vitro [53]. В связи с этим
необходимо тщательно собирать информацию о происхождении
той или иной линии и следить за возможными изменениями фе-
нотипа, постоянно сравнивая субкультуры с замороженными
образцами исходных клеток.
1.4. Условия выделения клеток
Согласно общепринятому мнению, для поддержания жизне-
способности клеток in vitro, необходимо создать те условия,
в которых они находились in vivo. Однако воспроизвести при
эксплантации буферные (в основном бикарбонатные) системы
живого организма и обеспечить клетки комплексом естествен-
ных факторов питания очень трудно. Правда, дело облегчается
тем, что, например, малые лимфоциты характеризуются отно-
сительно низким уровнем обмена веществ, особенно при 4 °C.
Они выживают, сохраняя функциональную активность, в тече-
ние суток в простых средах, забуференных фосфатами. Боль-
шие лимфоциты вследствие повышенного метаболизма более
привередливы. На этом основан простейший прием освобожде-
ния взвеси малых лимфоцитов от примеси больших [54]. Клет-
ки инкубируют в течение суток в относительно бедной культу-
ральной среде, которая обеспечивает избирательное выживание
только малых лимфоцитов. Клетки настолько различаются по
чувствительности к условиям выделения, что сформулировать
универсальные правила работы со всеми типами клеток не пред-
ставляется возможным. Целесообразно дать лишь самые общие
рекомендации.
1.4.1. Температура
Если процедура выделения продолжается не более несколь-
ких часов, то периферические лимфоциты, суспендированные в
сбалансированных солевых растворах, сохраняют жизнеспособ-
ность при комнатной температуре. Считают, что длительное вы-
деление, которое нельзя закончить в течение одного рабочего
дня, лучше проводить при 0—4 °C. Однако при исследовании
26
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
влияния температуры на миграционную активность (как на про-
явление функциональной активности) лимфоцитов грудного про-
тока было установлено, что охлажденные лимфоциты мигриро-
вали менее энергично, чем собранные в течение 4 ч при комнат-
ной температуре. Правда, эти различия в миграционной актив-
ности сохранялись не долго. Несмотря на явный неблагоприят-
ный эффект охлаждения, многие методы выделения лимфоид-
ных клеток предусматривают помещение удаленного из полости
тела органа в охлажденную на льду культуральную среду. Это
адекватно только для некоторых типов клеток, в частности кле-
ток костного мозга и тимуса, которые быстро теряют жизнеспо-
собность,- если их сразу же после выделения не поместить в ох-
лажденную среду. По-видимому, общепринятое мнение, что при-
чиной повреждения клеток служат перепады температуры,
справедливо. Поэтому в наиболее простых методиках работы с
клетками лучше исключить центрифугирование с охлаждением.
Если клетки необходимо инкубировать при 37 °C, то исполь-
зуемые среды должны быть соответствующим образом забуфе-
рены. Конкретный выбор среды зависит от видовой принадлеж-
ности и типа клеток. Мы, например, при культивировании кры-
синых лимфоцитов в течение 2—3 дней для исследования бласт-
трансформации используем среду RPMI 1640 с добавлением
5% сыворотки новорожденных телят, или, лучше, сыворотки
крыс DA.
1.4.2. Величина pH, осмотического давления
и содержание в среде питательных веществ,
необходимых клеткам
Нормальный pH крови — 7,4. Среды, используемые для вы-
деления клеток, можно забуферить фосфатами; при этом pH
среды не изменяется при контакте с воздухом. Однако, в средах,
предназначенных для культивирования клеток, высокого содер-
жания фосфатов следует избегать. Вместо фосфатного буфера
при культивировании клеток пользуются забуференными с по-
мощью бикарбонатов сбалансированными солевыми растворами
Хенкса или Эрла либо минимальной основной средой Игла
(МЕМ от англ, minimal essential medium), либо средой
RPMI 1640, либо МЕМ, модифицированной по Пскову с добав-
лением HEPES и бикарбоната. Все эти среды постепенно теря-
ют СО2, поэтому культивирование необходимо проводить в ат-
мосфере, содержащей 5% СО2. При культивировании макрофа-
гов можно воспользоваться свободной от бикарбонатов буфер-
ной системой на основе а-морфолинопропансульфоновой кисло-
ты (a-MOPS от англ, a-morpholinopropane sulphonic acid).
Осмотическое давление сывороток колеблется в довольно ши-
роких пределах. В растворе хлористого натрия (физиологиче-
ский раствор), осмотическое давление которого эквивалентно
давлению сыворотки крови человека и обезьяны, концентрация
27
ГЛАВА 1
соли составляет 147 ммоль/л [56]. Тот же показатель для сы-
воротки крысы равен 153, .мыши и цыпленка—168, а для сыво-
ротки плода коровы (СПК) — 170. Очевидно, что для культи-
вирования клеток указанных видов животных следует использо-
вать разные среды. Однако важность этой проблемы при прак-
тической работе с лимфоцитами еще никем систематически не
исследовалась. По крайней мере в одном случае осмотическое
давление среды имеет решающее значение — при изопикниче-
ском центрифугировании клеток. Даже небольшие изменения
осмотического давления среды могут существенно повлиять на
плавучую плотность клеток [56].
Как было сказано выше, выбор конкретной среды в значи-
тельной степени зависит от типа клеток и температуры, при ко-
торой производится выделение. Наиболее простая среда, напри-
мер, забуференный фосфатами раствор хлористого натрия и ка-
лия Дюльбекко A (PBSA, PBS см. приложение) содержит лишь
неорганические соли. В эту среду можно добавить раствор со-
лей Са2+ и Mg2+ (раствор Дюльбекко В, PBSB) и получить
раствор Дюльбекко АВ (PBSAB). Чтобы уменьшить неспецифп-
ческую адгезию клеток к поверхности культуральной посуды,
большинство исследователей добавляют в среду какой-либо ис-
точник белка или чистый белок, например 5% сыворотки ново-
рожденных телят (СНТ) пли 0,2% бычьего сывороточного аль-
бумина (БСА). В тех случаях, когда требуется подавить мета-
болитическую активность клеток, в частности для отмены кэп-
пинга при маркировании поверхности лимфоцитов с помощью
антител, как правило, в среду добавляют азид натрия (3—
10 мМ.) и проводят опыт на холоде (4 °C). Однако азид натрия
не применяют, если работа с клетками проводится при комнат-
ной температуре или при 37°C. PBSAB с 0,2% БСА и 3 мМ
NaNs — это наиболее распространенная в повседневной работе
среда. Сбалансированные солевые растворы имеют более слож-
ный состав — они содержат глюкозу и феноловый красный. Что-
бы обеспечить рост клеток, необходимы аминокислоты, витами-
ны и восстановители примерно в таких концентрациях, как в
МЕМ и ее различных модификациях.
Описывая в данной главе методы выделения клеток, мы ни-
сколько не рекомендуем отдавать предпочтение той или иной
среде. Мы просто указываем групповое название «питательная
среда», чтобы отделить культуральные среды от солевых раство-
ров. Рецептура сред указана в коммерческих каталогах фирм
Flow Laboratories Ltd, Gibco Europe Ltd (Великобритания)
и др. Иногда в среду необходимо добавить ростовые факторы.
В средах определенного химического состава — это конкретные
вещества. В остальных случаях источником ростовых факторов
служит сыворотка. При этом содержание ростовых факторов в
сыворотке может существенно варьировать от серии к серии.
28
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
1.4.3 Механическое повреждение клеток. Центрифугирование
Все клетки, особенно имеющие отростки (например, дендрит-
ные), довольно чувствительны к воздействию сил гидродинами-
ческой деструкции. Видимо, поэтому гомогенизация органа путем
растирания дает меньше жизнеспособных клеток, чем выщипы-
вание из него мелких фрагментов препаровальными иглами. Для
ресуспендирования осадка клеток используют пастеровскую пи-
петку. При этом объем осадка и добавленной к нему среды не
должен превышать объема пипетки, поскольку вся суспензия
должна пройти туда и обратно через ее суженную часть. После
этого объем суспензии доводят до конечного. При ресуспендиро-
вании важно не вспенивать взвесь пузырьками воздуха, так как
в тонкой пленке пены происходит гидродинамическая деструк-
ция клеток. Чтобы сохранить жизнеспособность адгезивных кле-
ток, при их отделении от поверхности пластика не следует поль-
зоваться резиновым скребком (раза. 4.4).
Обычно клетки осаждают центрифугированием при 300 g
в течение 7—10 мин в пробирках длиною 10 см. Для осаждения
клеток, суспендированных в среде с высокой плотностью, на-
пример после фракционирования в градиенте плотности
(разд. 4.3), может понадобиться более высокая скорость цент-
рифугирования. Сами по себе силы центробежного ускорения
даже при высоких значениях g не повреждают клетки. Во время
разделения в самоформирующемся градиенте плотности клетки
остаются жизнеспособными при нескольких тысячах g до тех
пор, пока находятся в суспензии. Повреждение наступает лишь
в результате сдавления, когда клетки оседают на дно центри-
фужной пробирки.
2. Выделение клеток из жидкостей организма
2.1. Кровь
Периферическая кровь, полученная в результате пункции
сердца у мышей и крыс, а также при пункции вен у крупных
животных и человека, представляет собой наиболее доступный
источник как лимфоцитов, так и А-клеток. Один мл крови че-
ловека содержит 5—10• 106 лейкоцитов и в 1000 раз больше
эритроцитов. Примерно 30% лейкоцитов — это лимфоциты, 1 —
3%—моноциты. Лимфоциты и моноциты объединяются общим
термином «мононуклеары периферической крови» (МПК). Ос-
тальные лейкоциты — это гранулоциты. Содержащиеся в крови
тромбоциты устраняются при дефибрпнпровании. Если кровь,
отбирают в пробирку с раствором цитрата или гепарина для
предотвращения свертывания, то тромбоциты остаются и могут
29’
ГЛАВА 1
Таблица 1.2. Выделение мононуклеаров периферической крови
1. Готовят градиент. В центрифужную пробирку (объем 10—15 мл) с проб-
кой вносят примерно 3 мл смеси метризоат — фиколл (см. приложение).
Пробирку оставляют на столе до тех пор, пока градиент не примет ком-
натную температуру. (При 4 °C работать не рекомендуется.)
2. Берут кровь. Переливают ее в коническую колбу, в которой находится
дюжина стеклянных бус диаметром 2 мм. Колбу осторожно вращают
кистью руки до тех пор, пока уже не будут слышны удары стеклянных
бус друг о друга и о стенку колбы, т. е. пока кровь не свернется. (Не сле-
дует забывать об инфекционной опасности, которую представляет кровь
человека.)
3. Разбавляют дефибрииироваииую кровь равным объемом среды (PBS или
BSS) при комнатной температуре.
4. С помощью пастеровской пипетки аккуратно наслаивают разбавленную де-
фибринироваииую кровь на градиент. Кончик пипетки загнут под углом 90°
и отрезан алмазным ножом вблизи изгиба, чтобы избежать при наслаи-
вании перемешивания градиента с кровью. (Можно поступить иначе.
Вначале поместить дефибрииированную кровь в чистую центрифужную про-
бирку, а затем подслоить под иее смесь метризоат — фиколл.)
5. Центрифугируют при 1500 g в течение 15 мни при комнатной температуре.
(Во избежание перемешивания для остановки ротора центрифуги не сле-
дует пользоваться тормозом.)
6. Эритроциты и гранулоциты оседают на дио пробирки, а на границе разде-
ла фаз находятся моиоиуклеариые клетки. Отсасывают прозрачный слой
среды, расположенный непосредственно над опалесцирующим слоем моио-
иуклеаров. Затем по всей площади сечеиия пробирки на границе раздела
фаз собирают слон мононуклеаров. Клетки, прилипшие к стенкам, можно
собрать кончиком пипетки. Моиоиуклеары переносят в чистую центрифуж-
ную пробирку.
7. Разбавляют взвесь мононуклеаров не менее чем четырехкратным избытком
среды и тщательно перемешивают. С этого момента обработку клеток мож-
но проводить при 4 °C. Чтобы сконцентрировать МПК, взвесь центрифуги-
руют при 300 g в течение 10 мин.
вызвать конгломерацию лейкоцитов. Бёйюм (Boyum, [57])
предложил широко используемую методику быстрого выделения
МПК путем центрифугирования цельной крови в градиенте
плотности (табл. 1.2). Эта методика дает хороший выход МПК,
примерно 50% от содержащихся в крови, т. е. более 106 из од-
ного мл крови. Разработанные ранее методы [58, 59] осажде-
ния эритроцитов желатиной или декстраном дают менее чистую
взвесь МПК. Добавление в среду высокомолекулярных полиме-
ров, таких как фиколл, декстран или желатина («плазмагель»),
способствует агрегации эритроцитов в «монетные столбики», ко-
торые вследствие более высокой плотности опускаются на дно
пробирки вместе с гранулоцитами (их плотность тоже высока
из-за значительного содержания гранул). При этом достигается
примерно 1000-кратная очистка МПК от других клеток.
Далее из МПК человека можно выделить дендритные клет-
ки, которые содержатся в крови в довольно низкой концентра-
ции (1—2-103/мл крови). Их выделяют по адгезивности к плас-
30
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
тику, культивируя МПК в течение суток, примерно так же, как
при получении дендритных клеток из селезенки мыши
(разд. 4.4.3), учитывая, однако, что клетки человека прилипают
к поверхности пластика несколько слабее. Затем с помощью
набора моноклональных антител к моноцитам, Т- и В-клеткам
очищают дендритные клетки в реакции цитолиза от соответст-
вующих примесей [41]. Чистота конечной взвеси может достичь
65—80%.
Среди МПК большинство составляют Т-клетки — примерно.
70%. Их содержание в суспензии можно еще повысить, если
профильтровать суспензию через найлоновую вату (разд. 4.4),
к которой прилипают В-клетки, или удалить В-клетки розети-
рованием. Т-лимфоциты, образующие розетки с эритроцитами
барана (Е+ клетки), можно сконцентрировать путем розетиро-
вания с эритроцитами барана, обработанными гидробромидом
бромистого 2-аминоэтилизотиурония (АЭТ) [60]. Для удаления
моноцитов используют также центрифугирование в ступенчатом
градиенте перколла [61], которое в отличие от фильтрования
через найлоновую вату не вызывает потери адгезивных Т-клеток.
2.2. Лимфа
Лимфа, которая притекает к лимфатическим узлам (аффе-
рентная), содержит лимфоциты, проникшие в ткани и органы
из крови. Таких лимфоцитов в 10—20 раз меньше, чем тех, ко-
торые проникают в лимфоузлы через столбчатые клетки так
называемых вен с высоким эндотелием. В афферентной лимфе
содержатся также макрофаги и дендритные клетки, которые
практически не обнаруживаются в эфферентной, оттекающей от
лимфоузлов. Лимфатические сосуды, по которым лимфа оттека-
ет от лимфоузлов, расположенных ниже диафрагмы, впадают
в цистерну (cisterna chyli). Из нее берет начало единственный
крупный лимфатический ствол, расположенный перед аортой
и впадающий в левую подключичную вену. Это и есть грудной
лимфатический проток. По нему в кровь поступает подавляю-
щее число лимфоидных клеток (как малых лимфоцитов, так и
лимфобластов). Среди малых лимфоцитов имеются неделящие-
ся Т- и В-клетки, образующие часть рециркулирующего пула.
За 3 или 4 дня из фистулы грудного протока можно получить
свыше 80% лимфоидных клеток рециркулирующего пула. Среди
них обычно 55—85% приходится на Т-клетки. Чем продолжи-
тельнее дренирование грудного протока, тем меньше становится
содержание Т-лимфоцитов, поскольку они имеют высокую ско-
рость рециркуляции. Лимфа, собранная, например, через 4 дня,
содержит в основном В-лимфоциты [63]. Одновременно нарас-
тает пропорция больших лимфоцитов от около 5 до 15—30%.
ЗЕ
ГЛАВА 1
Если канюлирование грудного протока выполнено аккуратно,
с минимальной кровопотерей, то в вытекающей лимфе клетки
какого-либо иного типа кроме перечисленных практически не
обнаруживаются. Изредка встречаются клетки фагоцитарного
ряда, появление которых, по всей вероятности, обусловлено вос-
палительной реакцией на оперативное вмешательство.
В течение первых суток из фистулы грудного лимфатическо-
го протока мыши можно получить примерно 100—150-106 [63],
крысы — 300—600-106, морской свинки — 300—400-106 [64] и
кролика — 2—3-109 [65] клеток. Детали оперативной техники
и выход клеток у собаки, овцы и человека читатель найдет в
.литературе (соответственно [66, 67, 68]). В целом выход клеток
при канюлировании грудного протока широко варьирует в зави-
симости от иммунологического и микробиологического (SPF
или обычный) статуса доноров.
Для получения лимфоцитов крысы с помощью описанной
выше процедуры лучше всего брать самцов весом около 250 г
с минимумом жировых отложений. Крыс линии Lewis по общему
мнению канюлировать трудно. Операцию следует производить
утром, когда легче найти грудной проток; он виден благодаря
молочно-белому оттенку хилуса после ночного кормления. Да и
времени для послеоперационного наблюдения в этом случае бу-
дет больше. Последнее весьма существенно, поскольку главная
причина неудачных операций — это свертывание лимфы в про-
свете канюли еще до того, как начнется ее истечение. Нужно
быстро удалить сгусток. Лучше всего его осторожно отсосать
шприцем или извлечь петлей из найлонового волокна. Канюля
для. внутривенных инъекций способна обеспечить достаточную
скорость потока лимфы, который сам по себе предотвращает
свертывание. В течение ночи из канюли можно собрать более
100 мл лимфы (хотя выход клеток не всегда прямо пропорцио-
нален объему лимфы). Накопив некоторый опыт, можно закон-
чить операцию за 25—30 мин и не пользоваться микроскопом.
Важно хорошо освещать операционное поле. Идеальным счита-
ется волоконно-оптический источник «холодного света». Кроме
того, желательно пользоваться подогреваемым операционным
столиком. При необходимости сбор лимфы можно проводить не-
прерывно в течение 5—7 дней, если животное кормить, поить,
содержать в тепле и тишине и дважды в день убирать экскре-
менты.
2.2.1. Канюлирование грудного лимфатического протока
у крысы
Для воспроизведения этой методики [58] в Великобритании
исследователь должен официально получить персональное раз-
решение в соответствии с законом о гуманном обращении с экс-
32
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
периментальными животными. Можно воспользоваться видео-
фильмом, который в свое время был отснят автором метода.
Цифрами в скобках отмечены инструменты и предметы, изобра-
женные на рис. 1.2.
1. Животному дают эфирный наркоз. Сбривают шерсть с ле-
вой половины живота и спины до позвоночника. В хвостовую
вену вводят канюлю (11, см. приложение), фиксируют положе-
ние. 1.2. Набор инструментов и принадлежностей для канюлирования груд-
ного лимфатического протока у крысы (см. разд. 2.1.1). (1) Скальпель.
(2) Тупоконечные ножницы. (3) Троакар (игла № 14). (4) Глазной ранорас-
ширитель с качающимися зеркалами (фирма Weiss J. and Son Ltd., Велико-
британия, № ВЗ по каталогу). (5) Марлевые салфетки. (6) Стеклянный
зонд (самодельный, изготовляют из стеклянной палочки, конец которой оплав-
ляют на пламени горелки). (7) Ватные тампоны. (8) Глазные хирургические
пинцеты. (9) Пружинные ножницы для иридэктомии (миниатюрные пружин-
ные ножницы фирмы Weiss, № В1048 по каталогу). (10) Изогнутые нож-
ницы (фирма Weiss, № В1048 по каталогу). (И) Канюля для внутри-
венных инъекций (см. приложение) со шприцем. (12) Канюля грудного лим-
фатического протока (см. приложение). Отдельно показан изгиб. (13) Шелк
хирургический для лигатур (№ 5/0), для швов (№ 3/0) и изогнутая лигатур-
ная игла с рукояткой. Масштаб указан в см.
нпе иглы на коже тремя отрезками 25-миллиметровой липкой
ленты (селлотейп). Медленно, в течение 25 с, вводят в вену че-
рез канюлю 3—4 мл раствора PBSAB 1 (см. приложение). После
этого канюлю пережимают для того, чтобы вернувшаяся обрат-
ным ходом кровь не свернулась в ней. Животное должно нахо-
диться в тепле.
2. Протирают кожу 70%-ным этанолом. По нижнему краю
реберной дуги слева с помощью скальпеля (1) делают разрез
3—172 33
ГЛАВА 1
брюшной стенки длиной примерно 3 см. Затем продолжают егс
вбок тупоконечными ножницами (2) до полного обнажения ле-
вой почки. Одновременно рассекают кожу и слой мышц. Осто-
рожно, пользуясь ватными тампонами (7), тупым путем разде-
ляют фасцию и обнажают левую почку на сосудистой ножке и
отводят ее от подлежащей поясничной мышцы. Постоянно уда-
ляют тампонами изливающуюся из мелких сосудов в операцион-
ную рану кровь.
3. В направлении спереди назад под острым углом прокалы-
вают поясничную мышцу троакаром (3) так, чтобы его кончик
выходил на коже спины на 3 см ближе к хвосту относительнс
места введения. В трубку троакара прямым концом вводят ка-
нюлю грудного, протока (12) (см. приложение). Затем троакар
немедленно извлекают, снимая с канюли таким образом, чтобы
не реформировать ее изгиб. Заполняют канюлю раствором
PBSAB 1. Следует проследить, чтобы канюля легла свободно,
не выгибаясь, параллельно и немного правее аорты, прямым
концом в направлении хвоста. В противном случае введение
троакара и канюли повторяют. ч
4. Задние лапы животного должны быть вытянуты. Чтобы
операционное поле было видно наилучшим образом, левую лапу
отводят вверх и вправо (относительно грудной клетки крысы).
Рану тампонируют марлевой салфеткой (5), смоченной в физио-
логическом растворе, и глазным ранорасширителем (4) оттес-
няют в сторону почку и кишечник.
5. Между поясничной мышцей и аортой тупым путем ват-
ными тампонами проделывают ложбинку длиной 10—15 мм, на
дне которой (благодаря молочно-белому оттенку содержимого)
можно легко найти грудной лимфатический проток. Его обна-
жают также тупым путем по направлению к диафрагме на
участке не менее 5 мм с помощью стеклянных зондов (6), вводя
их между аортой и протоком, осторожно раздвигая ткани.
На этом этапе операции не следует пунктировать грудной про-
ток. Поочередно зондируя с той и другой стороны протока, на-
ходят под ним слева от аорты продолговатую щель. Вставив в
нее тупоконечные ножницы и разведя бранши, расширяют эту
щель до 3—4 мм.
6. Лигатурной иглой подводят под проток шелковую нить
(№ 5/0), концы которой завязывают, пока не затягивая. Через
поясничную мышцу шелковой нитью № 3/0 делают два шва,
один вблизи выхода канюли, другой выше, захватив вершину ее
изгиба. Швы не должны, разумеется, захватывать нервов.
7. Необходимо сделать так, чтобы грудной проток был на-
полнен лимфой. Если требуется, его пережимают, осторожно на-
давив тампоном вблизи диафрагмы, а в это время другим там-
поном вытесняют лимфу из цистерны вниз. Пружинными нож-
ницами для иридэктомии (9) через переднюю стенку грудного
34
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
протока делают разрез длиной примерно в ’/з его ширины; При
этом из зияющего отверстия должна появиться лимфа. С ее по-
явлением стенки протока опадают. Если этого не происходит,
разрез необходимо удлинить. Он должен быть таким, чтобы, про-
макнув операционное поле, можно было бы без труда найти
отверстие в стенке грудного протока.
8. Захватив пинцетом (8) канюлю, заполненную раствором
PBSAB 1, вводят ее кончик без какого-либо усилия в отверстие
грудного протока. Конец канюли должен проникнуть в просвет
протока на 2—3 мм, располагаясь почти горизонтально. Если
при погружении кончика канюли ощущается сопротивление, не
дающее ему легко проскользнуть внутрь протока, то канюлю
следует извлечь и ввести снова. При слишком поверхностном
продвижении можно настолько расширить отверстие, что лимфа
будет течь мимо. В то же время, продвигаясь слишком глубоко,
можно просто-напросто разорвать проток поперек. Неудачно
начав, трудно исправить ошибки. Однако при достаточном опы-
те все должно получаться с первого раза. При неудачном пер-
вом разрезе можно попытаться сделать второй на 2 мм ниже,
хотя это и трудно из-за спадения протока. Если введение каню-
ли прошло удовлетворительно, ее осторожно подтягивают снару-
жи для того, чтобы она свободно, без напряжения, легла на свое
место. Канюля не должна пружинить. Наблюдают за вытекани-
ем лимфы (появление капель на конце канюли). В полость ка-
нюли не должен проникать воздух. Появление в ней воздуха
означает, что кончик канюли введен в просвет протока слишком
глубоко. Даже если все остальное выглядит нормально, попытку
введения канюли следует повторить.
9. Двойным узлом затягивают швы и лигатуру. Проверяют,
нет ли утечки лимфы мимо канюли и поддерживается ли ее по-
ток в канюле.
10. Из раны удаляют марлевую салфетку. Возвращают ор-
ганы на их естественное место. Проверяют, не перекручена
ли сосудистая ножка селезенки. В два слоя зашивают рану
(13).
11. Крысу переносят в клетку Боулмена [89]. Приходя в со-
знание, животное проявляет легкое возбуждение, но вскоре ус-
покаивается, особенно когда клетку накрывают крышкой и ос-
тавляют в тишине и покое. Сетка должна фиксировать крысу,
не сдавливая, но и не давая переворачиваться.
12. В первые 6 ч после операции животному внутривенно
вводят раствор PBSAB 1 (4 мл/ч), затем продолжают введение,
уменьшив скорость вдвое. Чтобы возбудить усиленное потреб-
ление жидкости, к первым 50 мл питьевой воды добавляют до
0,15 М концентрации NaCl, а затем дают водопроводную воду.
Корм дают животному без ограничений. Постоянно контролиру-
ют, не свернулась ли в канюле лимфа (см. текст).
3* 35
ГЛАВА ;
13. Когда установится постоянный поток лимфы (без свер-
тывания), ее начинают собирать в 100-миллилитровую кониче-
скую колбу со стерильным раствором PBSAB 20 (см. приложе-
ние). Вытеканию лимфы способствует перепад давления между
телом животного и концом канюли, расположенным примерно
на 15 см ниже.
2.2.2. Мезентериальная лимфаденэктомия
Если у крысы удалить мезентериальные лимфоузлы, а затем
выждать несколько недель, пока не произойдет воссоединение
приносящих п относящих лимфатических сосудов, то из груд-
ного протока можно получить лимфу, оттекающую от стенки
кишечника. Такая не прошедшая фильтрации через лимфоузлы
лимфа содержит дендритные клетки (рис. 1.1). Однако подав-
ляющее большинство клеточных элементов в ней составляют
лимфоциты, поскольку в грудной проток собирается лимфа не
только из кишечника, но и из других органов, да и в самой
кишечной лимфе 95—99% клеток приходится на лимфоциты.
Их число можно уменьшить, если крысу утром перед операцией
подвергнуть сублетальному облучению (5 Гр). Дендритные
клетки, по крайней мере у крыс, раднорезистентны, а малые
лимфоциты в значительной степени радиочувствительны. У об-
лученных и оперированных крыс относительное содержание
дендритных клеток в лимфе грудного протока может достигать
30%, но их абсолютное число будет таким же, как и у необлу-
ченных оперированных контрольных животных (0,15—2-106 кле-
ток в час) в первые три дня после операции. Впоследствии вы-
ход дендритных клеток у облученных крыс уменьшается. Техни-
ка мезентериальной лимфаденэктомии по Пью и сотр. (Pugh
et al. [44]) представлена в табл. 1.3. Послеоперационная смерт-
ность не должна превышать 10% и при благоприятных услови-
ях может быть менее 1 %.
2.3. Смыв из перитонеальной полости
В перитонеальной полости экспериментальных животных
можно обнаружить по меньшей мере четыре типа популяций
клеток, различающихся по составу и активности.
1. «Перитонеальный смыв», полученный от интактного жи-
вотного при промывании перитонеальной полости физиологиче-
ским раствором (табл. 1.4), содержит «резидентные», неактиви-
рованные макрофаги (разд. 1.3.1), полиморфноядерные грану-
лоциты и некоторые другие клетки. Из перитонеальной полости
обычной лабораторной мыши, например, линии РО, разводимой
в безбарьерных условиях, можно получить около 107 клеток,
36
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
Таблица 1.3. Мезентериальная лимфаденэктомия1*
1. Дают крысе наркоз, например эфирный.
2. Сбривают шерсть в области живота и протирают кожу 70%-ным этанолом.
Делают срединный разрез брюшной стенки. Находят место впадения тон-
кой кишки в толстую. Раскладывают эту часть кишечника на стерильной
салфетке (рис. 1.3). Хирургическим пинцетом захватывают конец цепочки
лимфоузлов и, мобилизуя их из брыжеечной жировой клетчатки, осторож-
но обрывают лимфатические сосуды. Стараются удалить всю лимфоидную
ткань в виде одной цепочки. Излившуюся кровь промокают ватными там-
понами.
3. Укладывают кишечник на свое место и зашивают рану в два слоя (от-
дельно мышцы и кожу). Следует избегать ущемления кишки. Особого
послеоперационного ухода обычно не требуется. Через 6 нед у животного
должно произойти восстановление лимфатических путей.
*) Для воспроизведения этой методики в Великобритании требуется официально по-
лучить персональное разрешение в соответствии с законом о гуманном обращении с экс-
периментальными ЖИВОТНЫМИ.
25—35% которых — макрофаги. От крыс и морских свинок по-
лучают столько же, но у морской свинки макрофаги могут со-
ставлять свыше 95% клеток.
2. «Привлеченные» перитонеальные клетки получают от жи-
вотных, которым за 16—24 ч до вскрытия в перитонеальную
полость ввели гидролизат казеина, тиогликолятный бульон, пеп-
тон или другие вещества, вызывающие стерильное воспаление.
Таким образом можно получить 2-Ю* 2 3 4 * * 7 клеток от мыши, 2-Ю8 —
от крысы и 5-Ю8 — от морской свинки. От 70 до 90% клеток
в таком экссудате составляют нейтрофилы; иными словами, его
нельзя считать хорошим источником макрофагов.
3. Клетки «воспалительного» перитонеального экссудата по-
лучают так же, как и в п. 2, но смыв делают через 3—4 дня
после внутрибрюшинной инъекции тиогликолятного бульона или
подобного раздражающего брюшину вещества. От мышеи
и крыс получают по 1—2-107 клеток, среди которых 65% макро-
фагов. От морской свинки в это время можно получить пример-
но 5-107 клеток.
4. Клетки «активированного» перитонеального экссудата по-
лучают после внутрибрюшинного введения бактериальных или
паразитарных вакцин. Например, вводят животному взвесь инак-
тивированных Corynebacterium parvutn (фирма Wellcome, Ве-
ликобритания) по 0,7 мг на 100 г веса тела и делают смыв на
Ю-й день. При этом от мыши или крысы можно получить 1—
2-107 клеток, из которых 70—95% — макрофаги.
Все перечисленные выше популяции, как правило, содержат
до 100% жизнеспособных клеток.
При внутрибрюшинных инъекциях следует избегать повреж-
дения иглой внутренних органов, в результате которого в экссу-
дат может попасть содержимое кишечника (с микроорганизма-
37
ГЛАВА I
Рис. 1.3. Цепочка лимфатических узлов в брыжейке крысы. Кишечник извле-
чен из брюшной полости для обнажения брыжейки перед лимфаденэктомией.
ми) или кровь. Начинающему экспериментатору полезно потре-
нироваться, вводя внутрибрюшинно небольшие объемы красите-
ля (например, туши). Живым экспериментальным животным,
особенно крупным, перед внутрибрюшинной инъекцией рекомен-
дуется дать эфирный наркоз для расслабления мышц передней
стенки живота. Когда животное находится под наркозом, экспе-
риментатор хорошо чувствует прохождение кончика иглы снача-
ла через кожу, а затем сквозь мышцы.
2.4. Смыв из бронхов и другие источники клеток
Зрелые макрофаги можно получить из смывов дыхательных
путей (табл. 1.5). Бронхиальный смыв мыши содержит 5-105,
а крысы — 1—5-106 клеток, 80—90% из которых — фагоциты,
обладающие высокой жизнеспособностью. Крысиные макрофаги
выделяют и из желудочно-кишечного тракта [24]. Макрофаги
человека могут быть выделены из грудного молока по адгезии
к поверхности пластика, покрытого ммкроэкссудатом (разд. 4.4).
В первые 10 дней после родов в грудном молоке содержится в
среднем 2-105 клеточных элементов на мл (эта величина может
существенно колебаться), из которых 40%—адгезивные клетки
[69]. Недавно предложен метод получения неограниченного ко-
личества макрофагов при эксплантации костного мозга [70].
38
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
Таблица 1.4. Получение перитонеального смыва1»
1. Умерщвляют животное цервикальной дислокацией либо дают ему наркоз
любым путем, кроме внутрибрюшинного. Фиксируют в горизонтальном
положении на спине с предельно разогнутыми конечностями. Протирают
кожу 70%-ным этанолом.
2. Вводят в брюшную полость PBS, содержащий 20 ед./мл гепарина (исполь-
зуют иглу № 23). Взрослой мыши вводят 5 мл, крысе— 10—15 мл, а мор-
ской свинке — 50 мл PBS.
3. В течение 1—2 мин массируют животному живот.
4. Далее методика имеет два варианта:
1) делают небольшой разрез кожи непосредственно под мечевидным отрез-
ком грудины для обнажения мышцы (но не затрагивая ее). Через
мышечный слой брюшной стенки косо вниз на небольшую глубину вво-
дят инъекционную иглу № 22. Приподнимая брюшную стенку, насколь-
ко это возможно, отсасывают из брюшинной полости жидкость;
2) с помощью ассистента приподнимают переднюю стенку живота, рас-
секают кожу и мышцы, делая отверстие, достаточное для того, чтобы
ввести тонкую полужесткую пластиковую трубку (например, из поли-
винилхлорида с внутренним диаметром 1,5—2 мм), надетую на конус
шприца. Отсасывают жидкость из различных отделов брюшинной поло-
сти. Иногда применяют трубку, имеющую отверстие не на самом конце,
а сбоку. Второй вариант методики позволяет извлекать из перитонеаль-
ной полости до 80—90% введенного PBS.
5. Если животному необходимо сохранять жизнь, накладывают два шва.
*) Для воспроизведения этой методики на живых экспериментальных животных в Be
ликобритании требуется официально получить персональное оазрешение в соответствии
с законом о гуманном обращении с экспериментальными животными. * У
3. Выделение клеток из солидных органов
3.1. Селезенка
У большинства видов позвоночных селезенка представляет
собой наиболее крупный солидный агрегат вторичной лимфоид-
ной ткани. У новорожденных млекопитающих первоначально
она функционирует как первичный гемопоэтический и лимфопо-
этический орган. Но даже у мышей и крыс, иммунную систему
которых в момент рождения можно считать еще незрелой, уже
«а третьей неделе жизни селезенка функционирует как вторич-
ный лимфоидный орган. На 8—10 нед жизни содержание лимфо-
идных элементов в селезенке достигает уровня взрослых живот-
ных. Ориентировочно из селезенки мыши можно получить 5—
10-107, а из селезенки крысы — 2—4-108 клеток, содержащих
ядра, т. е. примерно 2-105 клеток на мг веса свежевыделенного
органа (с жизнеспособностью 70—80%). Не существует такого
метода, который позволил бы выделить все имеющиеся в селе-
зенке клетки, как бы старательно ни проводилась дезинтегра-
ция. Об этом свидетельствуют еще не опубликованные результа-
39
ГЛАВА 1
Таблица 1.5. Получение бронхиального смыва
1. Примерно на 75 см выше рабочей поверхности закрепляют резервуар, на-
полненный 50 мл PBS. Через трехходовой кран с резервуаром соединяют
(а) шприц на 10 мл, (б) трубку с наружным диаметром 2—3 мм (для
крысы). Заполняют шприц и трубки PBS, не оставляя пузырьков воздуха.
2. Под эфириым или иным наркозом животное обескровливают. Для этого
у крысы обнажают аорту и, временно пережав ее, вставляют каиюлю
(трубку из полипропилена РР50); у мышей вскрывают нижнюю полую
вену. Эта процедура уменьшает примесь крови в бронхиальном смыве.
3. Удалив грудину и частично ребра, вскрывают грудную клетку. Обнажают
трахею. Фиксируют в ней трубку для промывания.
4. Под давлением заполняют легкие 5—10 мл PBS. Шприцем трижды направ-
ляют PBS в легкие и обратно. Сливают содержимое шприца в колбу. Еще
дважды заполняют легкие PBS и сливают смыв в колбу.
ты следующего опыта. Селезенка крысы была заселена лимфо-
цитами, меченными 51Сг. Затем ее дезинтегрировали без приме-
нения ферментов. При сравнении общей, ассоциированной с
клетками радиоактивности было обнаружено, что лишь */з мет-
ки, регистрируемой до дезинтеграции, попадает в конечную, от-
мытую после дезинтеграции суспензию спленоцитов. Остальная
метка, освободившаяся из разрушительных клеток, определяется
либо в надосадочной жидкости, либо в остатках стромы. В мы-
шиной селезенке содержится меньше, чем в крысиной, клеток
крови и соответственно больше лимфоидных клеток и меньше
гранулоцитов1.
3.2. Лимфатические узлы
Чем меньше размеры лимфатических узлов в данной области
тела, тем обычно больше их количество (рис. 1.4). В целом са-
мые крупные — это мезентериальные и шейные лимфоузлы. По-
верхностные шейные лимфоузлы, кроме того, наиболее доступ-
ны для биопсии. Достаточное количество клеток можно выде-
лить и из подмышечных, плечевых, паховых и подколенных лим-
фатических узлов. Чтобы при вскрытии можно было легко найти
лимфоузлы, за два дня до аутопсии животному подкожно вво-
дят немного туши либо за 10—14 дней внутрибрюшинно 5% -ный
раствор понтаминового небесно-голубого (1 мл на 100 г веса
тела). Подколенный лимфоузел служил, например, предметом
исследования при оценке местной реакции «трансплантат против
хозяина», возникающей после введения аллогенных клеток в
1 У мышей независимо от возраста селезенка является органом не только
лимфоидного, но и экстрамедуллярного миелоидного кроветворения. Поэтому
в ней закономерно обнаруживаются незрелые клетки эритроцитарного, грану-
лоцитарного и моноцитарного ряда.— Прим, перев.
40
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
Лимфоузлы--------
ворот печени
Верхние брыжеечные
лимфоузлы-----
Слепокишечный
лимфоузел
Наружные
поясничные
лимфоузлы
Ягодичный _
лимфоузел
Седалищный
нерв
Поверхностные____
шейные
лимфоузлы
Паратимические \
лимфоузлы —------
Подмышечные
(подкрыльцовые) _
лимфоузлы
Тимус
(зобная железа)
Рнс. 1.4. Лимфатические узлы крысы [88].
Подчелюстные
____ лимфоузлы
Внутренний шейный
(яремный) лимфоузел
Задний шейный узел
—-Трехглавая мышца
плеча
Плечевые
лимфоузлы
Задний средостенный
лимфоузел
- Задние желудочные
лимфоузлы
. Селезеночный
лимфоузел
Почечные лимфоузлы
Паховые лимфоузлы
Парааортальные
лимфоузлы
Нижний брыжеечный
лимфоузел
Подвздошные
лимфоузлы
Хвостовые
(каудальные)
лимфоузлы
Подколенный
лимфоузел
подушечку задней лапы крысы [71]. Чтобы найти этот лимфо-
узел, животное укладывают спиной вверх, предельно разгиба-
ют заднюю лапу в колене (поместив фалангу собственного паль-
ца позади сустава). Разрезают кожу от голеностопного сустава
до бедра и обнажают мышцы. Слегка надрезав фасцию между
группами мышц, раскрывают подколенную ямку. Надавливая
снизу пальцем на колено, вытесняют на поверхность подколен-
ный лимфатический узел. У взрослой молодой мыши в общей
сложности из лимфоузлов можно выделить 3—5-107 клеток,
у крысы — 1—1,5-108 (приблизительно 0,5—1-Ю6 клеток из од-
ного мг лимфоидной ткани с жизнеспособностью 80—85%).
3.3. Миндалины
Миндалины — довольно плотный лимфоидный орган. Поэто-
му для получения максимального количества клеток их лучше
обрабатывать ферментами (например, коллагеназой), а не пы-
таться сразу расщипывать (табл. 1.6).
41
ГЛАВА 1
Таблица 1.6. Диспергирование ткани для получения взвеси,
состоящей из отдельных клеток
1а и 16 представляют собой альтернативные варианты методики (см.
разд. 1.2).
1а. Расщипывание ткани на кусочки. Используют часовое стекло или чашку
Петри из пластика или стекла и часовые пинцеты (остроконечные,
с направляющим штифтом). Ткань измельчают, как описано в разд. 3.8.
Держа кусочек ткани одним пинцетом, выщипывают из него мелкие фраг-
менты другим. При этом клетки высвобождаются из стромы. С таким же
успехом можно воспользоваться изогнутыми тупоконечными пинцетами.
Ткань расщипывают до тех пор, пока это возможно.
16. Размельчение ткани продавливанием через сетку. Поршнем от шприца
или пестиком от стеклянного гомогенизатора кусочки ткани продавливают
через стальную сетку (14 нитей на 1 мм) или чайное ситечко из синте-
тического волокна. Можно воспользоваться и стальным цилиндром (диа-
метр около 20 мм), у которого вместо дна припаяна сетка. Вставив в ци-
линдр поршень, плотно прилегающий к его стенкам, продавливают фраг-
менты ткани; таким же образом промывают цилиндр и сетку. После про-
давливания с сетки в суспензию смывают гомогенат.
2. Ферментивный гидролиз ткани. (Для выделения лимфоцитов из нормаль-
ной селезенки, лимфатических узлов и тнмуса применение ферментов не-
обязательно. Однако оно настоятельно рекомендуется при работе с пейеро-
выми бляшками, печенью плода и всеми тканями облученных или старых
животных и необходимо для выделения ФДК.) Ткань измельчают скаль-
пелем или ножницами на кусочки размером около 2 мм3. Если клетки
выделяют из лимфатических узлов, то наиболее щадящим приемом будет
разрыв капсулы узла с одной стороны препаровальными иглами.
В пробирку с кусочками ткани добавляют приблизительно 1 мл питатель-
ной среды, содержащей коллагеназу (1—8 мг/мл), и, закрыв пробкой,
инкубируют при 37 °C в течение 30 мин. Во время инкубации (через 10
н 20 мин от начала) содержимое пробирки осторожно диспергируют пас-
теровской пипеткой с широким отверстием. К коллагеназе можно доба-
вить и нейтральную протеиназу, например диспазу, от 2 до 150 ед./мл
[73] и ДНКазу — 0,1 мг/мл.
3.4. Лимфоидная ткань кишечника
Пейеровы бляшки у мышей и крыс рассеяны по стенке тон-
кой кишки на всем ее протяжении. Их число может дости-
гать 30. Собрать эту лимфоидную ткань непросто, тем более что
перед ферментативным гидролизом ее необходимо тщательно
отделить от ткани кишечной стенки. Кроме того, из-за близости
кишечного содержимого довольно трудно сохранить стериль-
ность лимфоидной ткани. Тем не менее из каждой бляшки уда-
ется выделить примерно 106 клеток, жизнеспособность которых
достигает 95%. Изо всех источников вторичной лимфоидной
ткани именно в ткани кишечника содержится наибольшее ко-
личество В-клеток (около 70%). Травоядные животные имеют
довольно большой червеобразный отросток. Из его лимфоидной
ткани у кролика можно получить 3—5-109 клеток. Методом от-
42
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
слаивания (стриппинга) из лимфоидной ткани червеобразного
отростка довольно легко выделить фракцию, содержащую зна-
чительное количество клеток зародышевых центров [72].
3.5. Тимус
На 6-й нед жизни в тимусе мышей и крыс насчитывается до-
вольно много лимфоидных клеток, 2-Ю8 и 2-Ю9 соответственно,
за исключением линии крыс PVG. Однако к 16-й нед количество
клеток уменьшается примерно в четыре раза. Тимоциты доволь-
но хрупкие, поэтому даже легкое повреждение их при выделе-
нии приводит к образованию вязкого сгустка погибших клеток,
который, быстро увеличиваясь, захватывает и живые клетки.
Образование сгустка можно предотвратить, добавив к среде
ДНКазу, однако если он уже образовался, то его лучше удалить
из суспензии тимоцитов, а не пытаться разрушить. Соблюдая все
предосторожности, можно получить взвесь тимоцитов, жизне-
способность которых достигает 85—90%. Выделение тимусных
клеток-кормилиц требует наибольшей деликатности. Лучше об-
работать ткань ферментами, а не расщипывать.
Выделяя тимус при аутопсии, важно не захватить вместе с
ним паратимические лимфатические узлы. Они дренируют пери-
тонеальную полость, поэтому их легко выявить окрашиванием,
перед вскрытием внутрибрюшинно введя животному краситель
(например, тушь). Препарируя тимус, эти узлы следует оставить
на месте, поскольку на поверхности выделенного органа они
очень плохо различимы. Если вместе с тимусом будут случайно
выделены и паратимические лимфоузлы, то полученная взвесь
тимоцитов будет контаминирована периферическими В- и
Т-клетками.
3.6. Печень плода
Размеры и клеточный состав печени плода всецело опреде-
ляются сроком беременности. В момент закладки (10—11-й день
у мышей и 12-й — у крыс) печень функционирует как гемо-
поэтический орган, и в ней в высокой пропорции, но в малом
количестве (104) содержатся клетки, фенотипически подобные
плюрипотентным стволовым (30% этих клеток крысы имеют ан-
тиген Thy-1). Затем довольно быстро происходит увеличение
эритроидного ростка, который разбавляет стволовые клетки и
преобладает до поздних сроков внутриутробной жизни. Пре-В-
клетки появляются параллельно с миелоидными после 16-го дня
беременности. Печень 15-дневного плода легко отпрепариро-
вать даже без микроскопа. Печень, взятую именно на этой
43
ГЛАВА I
стадии, по-видимому, лучше всего использовать для выделения
стволовых гемопоэтических клеток, еще не контаминированных
Т-клетками.
Результаты опытов по заселению облученных реципиентов
стволовыми клетками из печени 15-дневного плода свидетельст-
вуют о том, что эти клетки качественно отличаются от стволо-
вых клеток костного мозга взрослых животных. Трансплантиро-
ванные клетки печени плода долгое время растут гораздо быст-
рее, чем стволовые клетки костного мозга. Из печени 16-дневно-
го плода крысы можно получить около 2-107 клеток, при этом
одна крыса вынашивает'от 8 до 14 крысят. Чтобы повысить вы-
ход и жизнеспособность клеток (которая может превысить и
90%), рекомендуется ферментативное разрушение ткани печени
коллагеназой.
2.7. Костный мозг
В костном мозге содержатся все клетки крови: как зрелые,
гак и их предшественники. В общей сложности этот орган со-
держит значительное количество диссеминированной по различ-
ным костям скелета ткани (примерно 1—3-107 клеток, содержа-
щих ядра, на 1 г веса тела у разных видов животных, включая
человека). У молодых животных, особенно при безбарьерномсо-
держании, в костном мозге преобладают миелоидные клетки.
Вообще, у конвенциональных животных в миелограмме выявля-
ется гораздо больше гранулоцитов, чем у животных, имеющих
SPF-статус. Подобно клеткам крови (разд. 2.1), клетки костно-
го мозга можно фракционировать в градиенте плотности мет-
ризоата — фиколла с невысокой степенью чистоты, отделяя лим-
фоциты от гранулоцитов и клеток эритроидного ряда. Более вы-
сокую степень очистки дают розетирование и цитотоксическая
реакция с применением моноклональных антител (гл. 2). В мак-
симальной пропорции лимфоциты обнаруживаются в костном
мозге молодых животных. У грызунов примерно на третьей не-
деле жизни среди клеток костного мозга может содержаться до
70% лимфоцитов. Абсолютное число лимфоцитов продолжает
нарастать до 6-й нед, однако относительное их содержание тем
временем падает. Пропорция стволовых клеток в костном моз-
ге всегда исчезающе мала (<С1%), поэтому их полной очистки
на сегодняшний день достигнуть не удается.
Выделение костного мозга из трубчатых костей (наиболее
доступного источника) далеко не исчерпывает всех возможно-
стей. Костный мозг, собранный из бедренных, большеберцовых
и плечевых костей, составляет лишь треть всего костного
мозга. Промывание трубчатой кости (разд. 3.9) позволяет вы-
делить лишь ту часть костномозговой ткани, которая располо-
жи
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
жена по центральной осп костп. Пристеночная же ткань оста-
ется. При этом вымытая и оставшаяся части костного мозга
могут существенно различаться по содержанию стволовых кле-
ток и, вероятно, других предшественников. Не удается вымыть
костномозговую ткань и из эпифизов трубчатых костей. В ре-
зультате общий выход костномозговых клеток у мыши составля-
ет 60—90%, а у крысы — 35—40% от имеющихся. Одним сло-
вом, по количественному и качественному составу вымытый
обычными приемами костный мозг может не полностью соответ-
ствовать костному мозгу in situ.
Лимфоциты костного мозга молодых животных, подобно ти-
моцитам, довольно чувствительны к повреждению. Поэтому в
суспензии клеток костного мозга при стоянии образуются кон-
гломераты. Чтобы предотвратить конгломерацию, мы суспенди-
руем костномозговые клетки в изопикнической 70%-ной взвеси
частиц перколла. В частности, это необходимо при фракциони-
ровании клеток в системе проточной цнтофлуориметрпи и сорти-
ровки FACS, которое может продолжаться в течение всего ра-
бочего дня.
Из одной бедренной кости молодого животного удается по-
лучить следующее количество клеток: у мыши — около 2—4-Ю7,
у крысы — 1—2-Ю8, у морской свинки 3—5-Ю8. При этом сле-
дует иметь в виду, что одна бедренная кость содержит лишь
6—8% всей костномозговой ткани. Жизнеспособность выделен-
ных клеток превышает 85%. Ее снижение прямо пропорцио-
нально продолжительности периода «теплой ишемии», т. е. вре-
мени, прошедшему от смерти животного до выделения клеток.
Этот период сократится до минимума, если препарировать жи-
вотное вдвоем с ассистентом.
3.8. Выделение клеток из лимфоидных органов
лабораторных грызунов
На рис. 1.5 представлен стандартный набор инструментов
для вскрытия и препарирования.
1. Животное умерщвляют цервикальной дислокацией или
передозировкой эфирного наркоза.
2. Шкурку обмывают 70%-ным раствором этанола.
3. Растянув за конечности, брюшком вверх, булавками при-
крепляют животное к столику для вскрытия.
4. Тупоконечными острозаточенными ножницами делают сре-
динный разрез от нижней челюсти до лобковой кости. При этом
кожу придерживают хирургическим пинцетом, затем оттягивают
пальцами по обе стороны разреза и прикалывают к поверхности
столика. Мышцы брюшной стенки на данном этапе вскрытия
рассекать не следует.
45
ГЛАВА I
5. Если выделяемые клетки в дальнейшем предполагается
культивировать, то все последующие этапы проводят асепти-
чески.
6. Шейные лимфатические узлы расположены симметрично
под кожей в виде цепочки из трех или четырех узлов (рис. 1.4).
Подобно большинству лимфоузлов, они почти со всех сторон
окружены жировой клетчаткой. Своим несколько желтоватым
цветом и капсулой они отличаются от более мягких и беловатых
комков жировой клетчатки, а также от лежащих глубже слегка
розоватых и намного более крупных слюнных желез. Тупым пу-
тем раздвигают ткани, непосредственно окружающие лимфо-
узел, обрывают его сосудистую ножку и немедленно переносят
в наполненную средой маленькую чашку Петри для отмывания.
Рис. 1.5. Набор инструментов для вскрытия лабораторных грызунов. Спра-
ва — два остроконечных часовых пинцета (для того, чтобы расщипывать ткань
лимфоидных органов на мелкие кусочки).
Стараются не повредить капсулу лимфоузла. Все отмытые узлы
собирают во второй чашке Петри.
7. Таким же образом выделяют глубокие («задние») шейные
лимфатические узлы — один или два с каждой стороны.
8. Для выделения брыжеечных (мезентериальных) лимфати-
ческих узлов, включая слепокишечный, срединным разрезом
рассекают и оттягивают по обе стороны мышечный слой перед-
ней брюшной стенки. Цепочка окруженных жировой клетчаткой
брыжеечных лимфоузлов начинается от подвздошно-слепокишеч-
ного угла и идет параллельно подвздошной кишке (рис. 1.3).
Их препарируют, как описано в п. 6, выделяя по возможности
целиком всю цепочку и стараясь не повредить заполненные
кровью крупные сосуды.
46
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
9. При выделении селезенки следует иметь в виду, что это —
небольшой орган ярко-красного цвета, расположенный в левом
подреберье позади желудка. Ее надо отличать от намного более
крупной, багрового цвета печени. Хирургическим пинцетом за-
хватывают и обрывают по всей длине фасцию и сосудистую
ножку, 'подходящую к воротам селезенки. Освобожденный орган
обмывают в среде, как рекомендовано в п. 6. Если нужно, взве-
шивают. Затем разрезают на 6—8 фрагментов (обычно только
селезенку крысы).
10. Для выделения пейеровых бляшек препарируют целиком
тонкий кишечник и разрезают па фрагменты длиной около
15 см. Содержимое кишечника вымывают ледяным изотониче-
ским раствором хлористого натрия. Бляшки выступают из стен-
ки кишки в виде беловатых утолщений, часто в них различимы
фолликулы. Бляшку вырезают скальпелем или остроконечными
ножницами, обмывают средой в чашке Петри и переносят в
пробирку, содержащую примерно 1 мл среды. Выделение кле-
ток лучше проводить с помощью ферментов (см. табл. 1.6). Рас-
щипывание лимфоидной ткани без обработки ферментами в
данном случае не проводят.
И. При выделении тимуса с обеих сторон рассекают диа-
фрагму и ребра, целиком удаляют грудину, за которой находят
беловатый, плоский, состоящий из двух долей орган. Это и есть
тимус. Тупым путем отслаивают паратимические лимфатические
узлы, расположенные в прилежащей к тимусу соединительной
ткани. Приподнимают тимус, захватив его пинцетом за задний
край, и ножницами отделяют от окружающих тканей, пока не
обнажится трахея. При этом стараются не повредить наполнен-
ные кровью крупные сосуды. Удаленный тимус обмывают сре-
дой в чашке Петри и переносят в другую.
12. При выделении печени плода шейку матки захватывают
пинцетом несколько ниже расхождения рогов, перерезают орган
под пинцетом и извлекают рога матки. Отрезают фаллопиевы
трубы. Обмывают рога средой в чашке Петри диаметром 9 см.
Определяют число плодов, отмечая недоразвитые. Остроконеч-
ными ножницами делают продольный разрез стенки матки. Ту-
пым путем отделяют плодные мешки от стенок матки и, не
вскрывая, переносят в другую чашку Петри. Вскрыв оболочки
плодных мешков, извлекают плоды, декапитируют, перерезают
пупочные сосуды, дают крови вытечь из них. После этого пере-
носят плоды в чашку Петри, обмывают средой и затем перено-
сят в следующую для препарирования. Для переноса плодов
используют пинцет или пастеровскую пипетку с широким носи-
ком, с краями, оплавленными на пламени горелки.
13. У каждого развитого плода находят печень, имеющую
темно-красный оттенок, а также сердце и селезенку (при сроке
беременности более 16 дней). Часовым пинцетом вскрывают
47
ГЛАВА 1
стенку живота и, оттеснив прилежащую закладку кишечника,
извлекают печень. Обмывают средой и переносят в пробирку,
содержащую примерно 1 мл среды, для обработки фермен-
тами.
3.9. Выделение клеток костного мозга
1. Животное умерщвляют цервикальной дислокацией. Обмы-
вают лапы в 70%-ном растворе этанола.
2. Положив животное брюшком вниз, перерезают скальпелем
ахиллово сухожилие, ножницами расчленяют голеностопный
сустав и отрезают стопу.
3. По задней поверхности лапы ог голеностопного до тазо-
бедренного сустава проводят разрез через кожу и пальцами
удаляют ее.
4. Скальпелем срезают мышцы, прикрепляющиеся в области
голеностопного сустава, отделяют малоберцовую кость и осво-
бождают от мышц большеберцовую.
5. Животное переворачивают на спину. Скальпелем делают
поперечный разрез через коленный сустав и расчленяют его. За-
хватив большеберцовую кость за край эпифиза костными щип-
цами, аккуратно выкручивают ее вместе с остатками прикреп-
ляющихся мышц, счищают с поверхности оставшиеся ткани и
помещают на лед до вымывания костного мозга.
6. Рассекают мышцы, окружающие бедренную кость, обна-
жают тазобедренный сустав и перерезают места прикрепления
мышц и связок в верхней части бедренной кости. Вскрывают
тазобедренный сустав и вычленяют из него головку бедренной
кости так, чтобы она осталась неповрежденной. Вновь восполь-
зовавшись костными щипцами, поднимают и выкручивают бед-
ренную кость, держа ее за дистальный эпифиз. Счищают с по-
верхности кости остатки тканей и хранят ее на льду до вымыва-
ния костного мозга.
7. Таким же образом выделяют большеберцовую и бедрен-
ную кости из другой задней лапы.
8. Для выделения плечевой кости проводят разрез кожи от
лопатки до локтевого сустава и ножницами вскрывают этот
сустав. Рассекают мышцы, окружающие плечевую кость, и пере-
резают лопатку. Отрезав эпифиз локтевой кости, освобождаются
от большинства мышц. Плечевую кость очищают от оставших-
ся тканей и хранят на льду до вымывания костного мозга. Та-
ким же образом выделяют плечевую кость с другой стороны.
9. Чтобы вскрыть полости костей, от большеберцовой кости
на голеностопном конце отрезают примерно двухмиллиметровый
фрагмент, а от бедренной и плечевой костей — головки. При
этом фиксируют кости костными щипцами. Кроме того, пункти-
48
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
руют каждую кость с обоих концов инъекционными иглами
(№ 23 для крыс и № 25 для мышей).
10. В место среза кости вкалывают иглу, надетую на 5-мил-
лилитровый шприц. Каждый раз используют чистую иглу. Ее
вводят по направлению противоположного эпифиза. Она долж-
на достаточно плотно удерживаться окружающей костной
тканью. Промываемую кость держат пинцетом над широкогор-
лым сосудом. Чтобы вытеснить костный мозг, в полость кости
под давлением вводят при помощи шприца примерно 1 мл сре-
ды (PBSAB или BSS, содержащие 5% СПК или 0,2% БСА). За-
тем кость переворачивают и делают инъекцию в противополож-
ном направлении. Вымывание костного мозга повторяют дваж-
ды, по возможности продвигая иглу вглубь по выстланной эндо-
остом полости. Остатки среды выдувают из костей воздухом.
11. Когда извлечены клетки из всех костей, необходимо по
возможности диспергировать естественные конгломераты. Для
этого используют шприц с иглой № 21.
3.10. Конечные этапы получения клеточных взвесей,
общие для всех методов
1. При выделении лимфоцитов быстрооседающую клеточную
взвесь тщательно ресуспендируют пастеровской пипеткой. Затем
фильтруют через один слой кисейной ткани, хлопковой марли
или небольшой комок гигроскопической хлопковой ваты, вло-
женные в воронку для фильтрования, закрепленную под про-
биркой. Чашку или пробирку, в которой находилась взвесь
лимфоцитов, ополаскивают средой и этот смыв также наносят
на фильтр.
2. Затем клеточную взвесь центрифугируют. Надосадочную
жидкость отсасывают под вакуумом. Для отсасывания слоя
жира, которого больше всего бывает при центрифугировании
только что вымытого костного мозга, конец пипетки постепенно
погружают сверху вниз, оставив над осадком лишь 2—3 мм
жидкости.
3. К осадку клеток добавляют примерно 1 мл среды. Затем
пипеткой разрушают видимые клеточные конгломераты. Далее
объем взвеси доводят средой до 10—15 мл и вновь пипетируют
для равномерного распределения клеток. Конгломераты, кото-
рые не удается диспергировать, устраняют. Описанное в пп. 2
и 3 однократное отмывание при необходимости можно повто-
рить 2—3 раза.
4. Для удаления конгломератов, образуемых А-клетками,
а также лимфоцитами, можно воспользоваться осаждением в
альбумине. Каждые 5 мл клеточной взвеси наслаивают на 0,5 мл
2%-ного раствора БСА или подслаивают БСА под взвесь клеток.
4—172
49
ГЛАВА 1
Таблица 1.7. Определение жизнеспособности клеток
Исключение трипанового синего
1. В лунку панели для микротитровання нли в маленькую пробирку вносят
10 мкл клеточной взвеси (около 107 клеток/мл) и 10 мкм раствора трипа-
нового синего (см. приложение). Ресуспендируют клетки пипетированием.
2. Без промедления вводят каплю клеточной взвеси в гемоцнтометрическую
камеру (табл. 1.8) и оставляют примерно на 1 мин, чтобы клетки осели
на дно.
3. В течение следующих 3 мин подсчитывают не менее 100 клеток, отмечая
голубые (погибшие) и неокрашенные (живые) и не обращая внимание
на эритроциты.
Окрашивание диацетатом флуоресцеина
1. Непосредственно перед опытом добавляют 10 мкл раствора диацетата
флуоресцеина в ацетоне (см. приложение) к 1 мл PBSAB.
2. К 50 мкл клеточной взвеси в PBSAB нли BSS (примерно 3-10° клеток/мл)
добавляют 5 мкл разбавленного диацетата флуоресцеина и тщательно пе-
ремешивают. Оставляют при комнатной температуре на 15 мнн. Затем
центрифугируют и аккуратно удаляют надосадочную жидкость.
3. При необходимости с окрашенными клетками ставят реакцию цитотоксич-
ности, например, в микромодификации под маслом (в лунку вносят 1 мкл
клеточной взвеси).
4. Подсчет живых и мертвых клеток производят в гемоцитометрнческой каме
ре или непосредственно на панели для микроцитотоксического теста (под
маслом). Используют люминесцентный микроскоп с фильтрами, позволяю-
щими наблюдать свечение флуоресцеина. Живые клетки выявляют по золо-
тистой флуоресценции.
Оставляют на 5 мин. Затем отсасывают верхний слой, свобод-
ный от конгломератов. Если цель эксперимента — сбор клеточ-
ных кластеров, например образованных ФДК, то пользуются
другой методикой (см. разд. 4.3 и 4.4).
5. Клетки вновь промывают.
4. Простые приемы очистки клеток
4.1. Погибшие клетки
4.1.1. Определение жизнеспособности клеток
Определить, погибла ли клетка или еще жива, не так про-
сто. Адекватный тест на жизнеспособность должен дифференци-
ровать погибшие клетки от тех, функция которых может вос-
становиться. Определение жизнеспособности по исключению
красителей (табл. 1.7) учитывает лишь состояние цитоплазма-
тической мембраны — интактна она или повреждена. Адекват-
ность такого подхода первоначально была доказана корреляци-
ей между процентом клеток, исключающих краситель, в суспен-
зии и эффективностью клонирования определенных клеточных
50
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
линий in vitro. Существует ли подобная корреляция в отноше-
нии функциональной активности нормальных лимфоцитов на
самом деле еще не доказано. Кроме того, разные субклассы кле-
ток в смешанной популяции могут быть по-разному чувствитель-
ны к повреждению. Поэтому высокие показатели жизнеспособ-
ности, определенные в нефракционированной клеточной популя-
ции, вовсе не гарантирует сохранность отдельных ее субфрак-
ций. Они отражают не точное соотношение живых и мертвых
клеток, а скорее некую обобщенную характеристику состояния
клеточной взвеси.
При постановке тестов исключения красителя регистрируют,
где он находится — внутри или вне клеток. Некоторые красите-
ли не проникают сквозь мембраны живых клеток, например
трипановый синий, эозин Y, нигрозин, но мертвые клетки ими
окрашиваются. Таким же образом ведет себя иодистый пропи-
дий (краситель для ДНК), применяемый для двуцветной им-
мунофлуоресценции при проточной цитофлуориметрии в системе
FACS [74]. Вероятно, чаще всего для определения жизнеспо-
собности клеток применяют трипановый синий. Определять чис-
ло живых и мертвых клеток необходимо сразу же после того,
как они осядут на дно гемоцитометрической камеры, поскольку
уже через 5 мин большинство лимфоцитов начинают активно
пиноцитировать краситель.
С другой стороны, известны красители, которые, наоборот,
окрашивают только живые клетки, например диацетат флуорес-
цеина. Сам он не флуоресцирует, но в живых клетках под дей-
ствием эстераз из него освобождается флуоресцеин, который не
может покинуть интактную клетку. На этом основано использо-
вание диацетата флуоресцеина в реакции лимфоцитотоксично-
сти при HLA-типировании.
4.1.2. Устранение погибших клеток
Погибшие клетки обладают большей адгезивностью, чем
живые. На этом основан способ их удаления в среде с низкой
ионной силой [75] для уменьшения электростатических взаимо-
действий (см. ниже). Клетки разделяются весьма быстро и эф-
фективно (жизнеспособность клеток в очищенной взвеси выше
95%) и с хорошим выходом (не менее 85%), но при этом не
удается освободиться от эритроцитов, а также от клеток, по-
гибших при культивировании.
1. Всю стеклянную посуду силиконируют, погружая в рас-
твор «силиклед» (см. приложение) или в 5%-ный раствор ди-
хлордиметилсилана в хлороформе. Силиконовую пленку фикси-
руют и тщательно промывают.
2. Силиконированную пастеровскую пипетку неплотно наби-
вают гигроскопической хлопковой ватой (высота слоя 5—
10 мм).
4* 5J
ГЛАВА 1
3. Взвесь разделяемых клеток (6-Ю8 клеток/мл) разбавляют
изоосмотическим раствором сорбита с глюкозой, взяв на каждые
0,75 объема взвеси 8 объемов 0,308 М. сорбита и 1,25 объема
0,308 М. глюкозы. Максимальная емкость ватной колонки, при-
готовленной как описано в п. 2, примерно 2-108 клеток.
4. Медленно, по каплям, пропускают клеточную взвесь через
колонку, которую затем промывают раствором сорбита с глю-
козой.
Помимо повышенной адгезивности погибшие клетки имеют
меньшую плотность, чем живые, и поэтому оседают медленнее
живых. Однако, если разделять клеточную взвесь в градиенте
плотности метризоата — фиколла (разд. 2.1) и БСА [76], по-
гибшие клетки по непонятным причинам оседают вместе с эрит-
роцитами на дно пробирки, а на границе раздела фаз процент
жизнеспособных клеток увеличивается (при некотором сниже-
нии выхода живых клеток).
Мертвые клетки по сравнению с живыми дают меньшие сиг-
налы переднего рассеяния света при проточной цитофлуорнмет-
рии в системе FACS (гл. 2) и благодаря этому могут быть вы-
явлены и отсортированы автоматически. Однако использовать
систему FACS просто для удаления мертвых клеток из взвеси
слишком расточительно и неэффективно.
4.2. Устранение эритроцитов при помощи гемолиза
Небольшая примесь эритроцитов в принципе не только не
вредит, но и может оказаться полезной, например, в качестве
маркера при центрифугировании небольшого количества лимфо-
цитов. Однако некоторые методы разделения лимитированы как
раз по общему числу фракционируемых клеток (например, сор-
тировка в системе FACS и седиментация при 1g). Кроме того,
эритроциты могут оказаться помехой при работе с меченными
(например, 51Сг) клетками, поэтому от них целесообразно из-
бавиться, особенно при исследовании взвеси костного мозга или
селезенки. Как завершающий этап устранение эритроцитов вхо-
дит в методику фракционирования клеток с помощью розетиро-
вания (гл. 2).
Обычно для удаления эритроцитов из взвеси клеток исполь-
зуют один из двух методов: центрифугирование взвеси в гради-
енте плотности метризоата — фиколла, как описано выше
(разд. 2.1), либо избирательное лизирование эритроцитов изо-
тоническим раствором хлористого аммония [77], как рекоменду-
ется ниже.
1. Готовят раствор NH4C1 в трис-буфере (см. приложение)
и доводят его до комнатной температуры.
2. Взвесь клеток осаждают центрифугированием при 20 °C и
ресуспендируют в растворе NH4C1 до концентрации 3- 10s кле-
52
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
ток/мл. Оставляют при комнатной температуре на 10 мин.
3. Разбавляют взвесь клеток не менее чем 5-кратным объ-
емом среды, тщательно перемешивают и центрифугируют.
4. Если гемолиз прошел не полностью, суспендирование кле-
ток в растворе NH4C1 повторяют.
Существует опасность, что интенсивный лизис под действием
ионов NH4+ может повредить клетки. Поэтому некоторые иссле-
дователи предпочитают метод гипотонического шока. Концен-
трированную взвесь клеток разбавляют 10 объемами воды, вы-
держивают 10 с и тотчас восстанавливают изотонию, добавив
10 объемов двухкратного концентрата среды.
4.3. Разделение клеток в градиенте плотности
Разделение в градиенте плотности используется в большин-
стве методов очистки дендритных клеток и поэтому описано
здесь. Более подробно усовершенствованная техника изопикни-
ческого фракционирования клеток обсуждается в литературе
[78]. Разделение клеток, различающихся по плотности и по
склонности к агломерации, с помощью метризоата — фиколла
описано выше (разд. 2.1). Градиент можно, кроме того, приго-
товить из метризамида, коллоидной взнеси частиц двуокиси
кремния и альбумина. Применяя любой из методов градиентно-
го фракционирования, необходимо ясно представлять себе раз-
личия между двумя принципами разделения при центрифугиро-
вании. Компоненты смеси могут разделиться, либо оседая с раз-
ными скоростями в однородной по плотности среде, либо дости-
гая того слоя в неоднородной по плотности среде, в котором их
собственная плотность равна плотности среды (при изопикниче-
ском центрифугировании). В первом случае все клетки, обла-
дающие большей плотностью, чем среда, будут быстрее или мед-
леннее оседать под действием центробежного ускорения. Во вто-
ром случае среда обладает достаточной плотностью, чтобы удер-
жать клетки на разных уровнях по мере того как они оседают.
Для разделения клетки наносят на градиент плотности (ступен-
чатый, линейный или другой произвольной формы), и они в ре-
зультате седиментации располагаются на тех уровнях градиен-
та, где плотность среды равна их собственной. Обычно градиент
готовят заранее либо он формируется непосредственно' во вре-
мя центрифугирования (как, например, градиент коллоидной
двуокиси кремния).
Метризамид1 — это хорошо растворимое в воде производное
метризоата натрия, которое без каких-либо проблем можно ис-
пользовать для создания ступенчатого градиента плотности.
1 2-(3-ацетамидо-5-Н-метилацетамидо-2,4,6-трииодбензамидо) -2-дезокси-D-
глюкоза.— Прим, перев.
53
ГЛАВА 1
С помощью 14,5%-ного раствора метризамида в культуральной
среде удается быстро, в один этап, выделить А-клетки из сус-
пензии клеток лимфатического узла мыши, а также дендритные
клетки из афферентной лимфы (разд. 2.2.2) [79]. Метризампд
сравнительно дорог (примерно в 5 раз дороже перколла или
БСА).
Перколл (Pharmacia, Fine Chemicals, Швеция) представляет
собой взвесь коллоидных частиц двуокиси кремния, покрытых
поливинилпирролидоном (и поэтому нетоксичных). Разбавляя
коммерческий препарат концентратом среды для сохранения
изотоничности, можно приготовить растворы высокой плотности
и очень низкой вязкости. Перколл достаточно прост в обраще-
нии, относительно дешев и имеет разнообразное применение.
Самоформирующиеся градиенты перколла использовались, на-
пример, для выделения антигенпрезентирующих клеток из крови
человека, а также кластеров, образуемых дендритными и Т-клет-
ками в пейеровых бляшках мыши [41].
По сравнению с перколлом сывороточный альбумин менее
удобен как реагент для формирования градиентов плотности.
Если он приобретен в виде порошка неочищенной «фракции V»,
то нуждается в медленном растворении, интенсивном диализе и
нейтрализации. Альбумин, купленный в виде 30—35%-кого рас-
твора, в подобной обработке не нуждается. Растворы альбуми-
на высокой концентрации обладают значительной вязкостью. По-
этому, пользуясь обычными смесителями, из него трудно приго-
товить непрерывные градиенты. Кроме того, из-за высокой вяз-
кости разделяемые клетки гораздо медленнее достигают своих
изопикнических точек при центрифугировании. Тем не менее
альбуминовые градиенты, особенно ступенчатые, применяют
весьма широко. Детальное описание методов изопикнического
центрифугирования читатель найдет в литературе [80, 81].
Ниже мы приводим фрагмент методики выделения дендрит-
ных клеток из селезенки мыши [41], предшествующий разделе-
нию по адгезивности. На этом этапе из 4-Ю8 спленоцитов мож-
но выделить 2—3-107 клеток, обладающих меньшей плотностью,
чем все остальные. В этой фракции концентрация дендритных
клеток возрастает в 10—15 раз. Каждый вид животных и каж-
дый тип исходной ткани требует подбора условий для оптималь-
ного разделения в градиенте плотности БСА. Например, для
выделения ФДК мыши рекомендуется следующая модифика-
ция [47]: нижний слой плотностью 1,060 г/мл и объемом 6 мл;
верхний слой плотностью 1,030 г/мл и объемом 3 мл; наслаи-
вают 2—-4-Ю8 клеток лимфатического узла, диспергированного
с применением ферментов; центрифугируют 60 мин при 8500 о'
и 4 °C; затем клетки собирают на границе раздела двух фаз.
54
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
4.3.1. Центрифугирование в ступенчатом градиенте
плотности альбумина (модифицировано Дж. Остиным
(1. Austyn) — личное сообщение)
1. Готовят раствор БСА плотностью 1,08 г/мл. Для этого рас-
творяют 10,0 г БСА (фракция V, Sigma, США) в 18,6 мл PBS,
2,9 мл 1 М. NaOH и 6,5 мл дистиллированной воды и оставляют
при 4 °C без перемешивания на 48 ч. Показатель преломления
раствора должен составлять 1,385. Готовы?! раствор стерилизу-
ют фильтрованием через префильтр и мембрану с размером пор
0,45 мкм. Разливают по флаконам и хранят при 4 °C.
2. Осадок клеток суспендируют в растворе альбумина до
концентрации 108 клеток/мл, переносят в центрифужную про-
бирку, которую помещают в ротор с подвесными стаканами.
Сверху наслаивают среду, содержащую 10% сыворотки ново-
рожденного теленка. Центрифугируют при 10 000 g и 4 °C
20 мин.
3. Собирают клетки, всплывшие на границе раздела фаз, над
слоем альбумина с плотностью 1,08 г/мл. Дважды промывают.
4. Осадок можно использовать как источник лимфоцитов, со-
держащий, кроме того, примесь А-клеток. Описание первона-
чального варианта метода читатель сможет найти в литерату-
ре [41].
4.4. Разделение клеток по адгезивности
Почему одни клетки прилипают к поверхности подложки,
а другие нет? Вероятно, в этом процессе принимают участие
ионные взаимодействия; действительно, при физиологических
значениях pH большинство клеток имеют суммарный отрица-
тельный заряд. Но наиболее распространенные подложки, о ко-
торых упоминается ниже, заряжены нейтрально (например, по-
перечносшитый декстран, названный сефадексом), тогда как
другие вообще гидрофобии (полистирол и силиконированное
стекло). Используемое в качестве классической подложки не-
обработанное стекло имеет кислую, а не щелочную реакцию п
теоретически должно отталкивать клетки; однако (парадоксаль-
ный факт!) клетки хорошо к нему прилипают. По всей вероят-
ности, благодаря высокой диэлектрической постоянной боль-
шинства культуральных сред электростатические взаимодейст-
вия сведены до минимума. Решающее значение в адгезии кле-
ток имеет их собственная метаболическая активность и в связи
с этим температура и состав культуральной среды. Шортман
(Shortman, [82]) предложил отличать «физическую» адгезив-
ность от «активной», для которой необходим нормальный кле-
точный метаболизм и которая поэтому проявляется при 37 °C.
55
ГЛАВА 1
В связи с этим все описанные здесь методы фракционирования
клеток по адгезивности осуществляются при 37 °C.
Сделать какие-либо обобщения относительно межклеточных
различий в адгезивности довольно трудно из-за выраженных
видовых особенностей (например, из-за существенных различий
дендритных клеток крысы и мыши). Однако в самых общих чер-
тах по мере снижения адгезивности клетки можно расположить
следующим образом: макрофаги>дендритные клетки = клетки,
образующие антител а > В-лимфоциты > Т-лимфоциты = эритро-
циты. Погибшие и поврежденные клетки обладают очень высо-
кой адгезивностью, вероятно, благодаря липким молекулам
ДНК, освободившимся из этих клеток.
4.4.1. Макрофаги
Благодаря своей способности быстро распластываться на по-
верхности подложки, макрофаги проявляют максимальную адге-
зивность. Их «активная» адгезивность позволяет без особого тру-
да избавиться от нежелательных неадгезивных клеток при по-
лучении обогащенной макрофагальной взвеси. Значительно
труднее собрать популяцию прилипших макрофагов, не повредив
клетки. Степень адгезивности мышиных макрофагов к гидрофоб-
ной поверхности, по-видимому, коррелирует с экспрессией анти-
гена Mac-1 (Crocker and Gordon, личное сообщение).
Методика, приведенная в разд. 4.4.3, предназначена для вы-
деления перитонеальных макрофагов (как резидентных, так и
«воспалительных»). С ее помощью можно выделять и Мас-1-
макрофаги селезенки и легких, моноциты костного мозга, но не
Мас-1_-макрофаги костного мозга и купферовские клетки. Ме-
тодика довольно проста. Для освобождения прилипших макро-
фагов снижают концентрацию двухвалентных катионов в среде.
Этот подход особенно ценен при работе с культивируемыми (до
7 дней) макрофагами, адгезивность которых слабее, чем свеже-
выделенных, и они легче отделяются от подложки. Перитоне-
альные клетки мыши и моноциты крови человека прочно прили-
пают к пластику панелей для культуры ткани в том случае,
если его поверхность покрыта «микроэкссудатом», оставленным
клетками линии ВНК [31] (такие панели под названием «ЕСМ
plates» продает фирма International Biotechnologies Inc., США).
Они позволяют получить хороший выход адгезивных клеток
(более 80%) с жизнеспособностью, превышающей 95%, и
90%-ной чистотой (если судить по способности к фагоцитозу и
спонтанной миграции). Кроме того, поверхность пластика мож-
но покрыть желатиной или коллагеном [83]. Прилипшие макро-
фаги снимают с поверхности подложки резиновым скребком
(стеклянной палочкой, на конец которой надета трубка из си-
ликоновой резины, свободно выступающая на 10—20 мм), три-
56
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
псином (без или с 0,1—0,3 мМ ЭДТА) или лигнокаином (10—
15 мМ.). Следует, однако, учесть, что все указанные приемы не-
избежно снижают как жизнеспособность, так и выход клеток.
В качестве подложки были испытаны и «нелипкие» поверхно-
сти (политетрафторэтилен, названный тефлоном [84] и «поли-
НЕМ.А» [85]). В последнем случае степень адгезивности макро-
фагов варьировала в зависимости от концентрации этанола, ко-
торым предварительно обрабатывали пластик.
Типичный выход макрофагов (адгезивных клеток) из перитонеального
смыва после инкубации на пластике в течение часа: Резидентные Клетки воспалительного экссудата клетки мыши крысы мыши Число нанесенных клеток (Ю6) 50 20 10 Число элюированных клеток (10s) 5 5 5
(Элюировано примерно 95% адгезивных клеток с жизнеспособностью более 95%).
4.4.2. Дендритные клетки
Дендритные клетки получают либо из солидных лимфоидных
органов с последующей очисткой, либо из лимфы грудного про-
тока животных, которым удалили мезентериальные лимфоузлы.
Преимущество второго подхода состоит в том, что дендритные
клетки выделяют в виде естественной взвеси, подвергавшейся
минимальным воздействиям in vitro. Этим преимуществом оку-
паются все сложности мезентериальной лимфаденэктомии и
канюлирования грудного протока. При выделении дендритных
клеток из селезенки и лимфатических узлов мыши и крови чело-
века [86] целесообразно воспользоваться методом Стейнмана
(Steinman R.). В основе метода лежит потеря адгезивности
дендритных клеток к пластику после культивирования клеточ-
ной взвеси в течение ночи. Из-за крайней малочисленности
дендритных клеток очистку проще всего начать с выделения
фракции клеток, обладающих низкой плотностью (р<1,08), в
градиенте плотности БСА (разд. 4.3). Эта фракция примерно
в 10 раз меньше исходной взвеси. Для ее разделения по адге-
зивности может быть достаточно лишь одной пластиковой
чашки. Дендритные клетки крысы, а также пейеровых бляшек
мыши сразу после выделения не проявляют адгезивности. Под-
робное описание методов выделения дендритных клеток крысы
можно найти в публикации Клинкерта и сотр. (Klinkert et al
Для удаления из клеточной взвеси макрофагов можно вос-
пользоваться весьма изящным приемом, основанным на их ад-
гезивной и фагоцитарной активности. Клеточную взвесь инкуби-
57
ГЛАВА 1
руют с частичками «карбонильного» железа (см. приложение),
а затем магнитом извлекают клетки, адсорбировавшие или пог-
лотившие эти частички. К 5-Ю7 клеток, суспендированных в
культуральной среде (разд. 1.4.2), добавляют примерно 200 мг
тщательно отмытого и автоклавированного порошка «карбо-
нильного» железа, инкубируют 45 мин, каждые 5 мин ресуспен-
дируя. После этого магнитным стержнем удаляют из взвеси
фагоцитирующие клетки. Для полного удаления мельчайших
частиц железа применяют более сильный подковообразный маг-
нит. При этом ожидаемый выход составляет 30—50% неадге-
зивных клеток селезенки мыши [3].
4.4.3. Выделение дендритных клеток с помощью
дифференциальной адгезии к полистироловой
поверхности
Чашки и панели должны быть изготовлены из полистирола,
который подходит для культивирования тканей. Макрофаги
прилипают к нему очень прочно и необратимо, а дендритные
клетки мыши, прилипнув вначале, потом отлипают от поверх-
ности пластика.
1. Клетки суспендируют в культуральной среде, содержащей
1 —10% СПК или 0,2% БСА (2,5-106 клеток/мл). В полистиро-
ловую чашку Петри диаметром 45 мм вносят 10 мл клеточной
взвеси (в чашку диаметром 85 мм — 40 мл, в лунку 24-луночной
панели—1 мл). Инкубируют 1—3 ч при 37°C (необязательно
в СОг-инкубаторе). Затем осторожно смывают неприлипшие
клетки пастеровской пипеткой с широким носиком. Под микро-
скопом следят за тем, чтобы неприлипшие клетки не скопились
в углу чашки вследствие менискового эффекта.
2. Прилипшие клетки 18 ч культивируют в среде с 5% СПК
во влажной атмосфере СОг-инкубатора. Осторожно (как реко-
мендуется в п. 1) смывают отлипшие дендритные клетки, утра-
тившие адгезивность. Их очищают от примеси макрофагов либо
Fc-розетированием, либо повторным разделением по адгезивно-
сти, суспендировав в свежей порции среды (см. п. 1).
3. Fc-розетирование. Подсчитывают клетки и доводят их кон-
центрацию до 5-Ю6 в 1 мл. Добавляют равный объем 1%-ной
взвеси эритроцитов барана, нагруженных антиэритроцитарными
антителами (см. приложение). Тщательно перемешивают. Осто-
рожно центрифугируют (150 g, 5 мин, 4°C). Оставляют на
20 мин при 4 °C. Ресуспендируют осадок легким покачиванием.
Центрифугируют, нанеся на слой метризоата — фиколла (разд.
2.1) или концентрированного БСА (р = 1,080, разд. 4.3). Отсасы-
вают слой всплывших клеток (дендритных, не имеющих рецеп-
торов к Fc).
58
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
4.4.4. Выделение макрофагов по адгезивности
Метод позволяет выделить адгезивную фракцию клеточной
суспензии. Используют пластик, к поверхности которого макро-
фаги прилипают менее прочно, чем к полистиролу, предназна-
ченному для культивирования клеток. Проще всего и дешевле
взять необработанный полистирол, который применяется для
бактериологических целей. Другие подложки были описаны в
разд. 4.4.1.
1. Клетки инкубируют, как описано выше в разд. 4.4.3, п. 1,
в течение 1 ч.
2. Осторожно отсасывают неприлипшие клетки, ополаскивая
чашку средой, содержащей Са2+.
3. Один или два раза быстрым и осторожным движением об-
мывают дно чашки PBS и, заполнив ее таким же PBS, содер-
жащим 5 мМ глюкозы, оставляют при 37 °C на 15 мин. В от-
сутствие Са2+ и Mg2+ часть макрофагов спонтанно отлипает от
пластика. Клетки, еще сохранившие адгезивность, можно снять
с поверхности пластика осторожным пипетированием. Следует
по возможности избегать применения скребка или ЭДТА.
4.4.5. Устранение из взвеси адгезивных
клеток на колонке
Колонку можно приготовить из стеклянных бус (см. прило-
жение), стеклянной ваты, сефадекса G-10 (Pharmacia Fine
Chemicals, Швеция) и ряда других носителей (разд. 4.4).
1. Цилиндр шприца (на конус которого надета эластичная
трубка с зажимом) наполовину заполняют носителем. Для раз-
деления 108—109 клеток используют цилиндр от шприца вмести-
мостью 50 мл, для меньшего числа клеток — вместимостью
10 мл. После заполнения колонку уравновешивают культураль-
ной средой, содержащей 10% СПК или 0,4% БСА, при 37°С.
Затем колонку герметизируют, иначе забуференная бикарбона-
том натрия среда быстро защелочится.
2. На колонку наносят разделяемую клеточную взвесь, со-
держащую примерно 1,5-108 клеток в 1 мл среды, состав кото-
рой указан в п. 1. Выжидают, пока взвесь полностью впитается
в носитель. Затем промывают колонку равным объемом пред-
варительно нагретой до 37 °C среды. Скорость потока среды
через колонку устанавливается таким образом, чтобы она вы-
текала по каплям и первые клетки появились в элюате пример-
но через 10 мин. Собирают элюат. Колонку промывают еще дву-
мя объемами нагретой среды при той же скорости потока.
59
ГЛАВА 1
4.4.6. Выделение Т-клеток на колонке
из найлоновой ваты
1. Кипятят или автоклавируют в четырех сменах дистилли-
рованной воды 0,6 г ваты, извлеченной из фильтра «лейко-пак».
Затем вату высушивают и набивают ею цилиндр от шприца
вместимостью 10 мл (на конус шприца надета эластичная труб-
ка с зажимом) до отметки 5 мл. Уравновешивают колонку
культуральной средой при 37 °C в течение 30 мин. Устраняют
пузырьки воздуха. Промывают вату двумя объемами среды.
2. Наносят клетки (108 клеток/мл среды, содержащей 5%
СПК- Выжидают, пока клеточная взвесь впитается в вату.
Затем на колонку наносят 0,5 мл среды, чтобы смыть клетки,
которые осели на стенки. После этого колонку герметизируют
и на 30—40 мин оставляют при 37 °C, потом элюируют 20 мил-
лилитрами подогретой среды со скоростью около 1 капли в се-
кунду.
5. Подсчет клеток
Клетки, суспендированные в среде, довольно быстро оседа-
ют. Непосредственно перед отбором образца для той или иной
процедуры, включая подсчет клеток, клеточную взвесь необхо-
димо осторожно перемешать пипетированием. Важно всегда
следовать этому общеизвестному правилу.
5.1. Гемоцитометр (счетная камера)
Использование гемоцитометра (табл. 1.8)—это простейший,
самый дешевый и наиболее информативный способ определения
числа клеток. Наблюдая непосредственно за клетками, а не за
их электронными отражениями на экране, можно определить
морфологию клеток, микробное загрязнение взвеси (если оно
обильно), присутствие клеточного детрита, долю эритроцитов в
препарате лимфоидных клеток и т. д. Применение гемоцитомет-
ра позволяет учитывать как живые, так и мертвые клетки по
исключению красителя (табл. 1.7). Недостаток подсчета клеток
в камере, обусловленный несколько меньшей воспроизводимо-
стью1 по сравнению с электронным подсчетом, вряд ли имеет
серьезное значение в большинстве случаев применения гемоци-
тометра в иммунологии.
1 При подсчете клеток в камере довольно высок коэффициент вариации,
±20% от показателя.— Прим, перев.
60
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
Рис. 1.6. Сетка стандар-
тного гемоцитометра (усо-
вершенствованной камеры
Нойбауера для подсчета
клеток крови), а. Вид в по-
ле зрения микроскопа под
объективом 40Х. Цифрами
обозначен порядок просмот-
ра. б. Увеличенное изобра-
жение квадрата 1 (длина
стороны 0,2 мм). Показана
рекомендуемая траектория
подсчета. Подсчитываются
клетки, схематически обоз-
наченные черными кружка-
ми. Глубина камеры обычно
составляет 0,1 мм (подроб-
ности в табл. 1.8).
Чаще всего клетки подсчитывают в той среде, в которой они
суспендированы. Эритроциты легко идентифицировать благода-
ря малым размерам, сильному преломлению света по перифе-
рии и рыжеватому оттенку (при соответствующем освещении).
Если требуется подсчитать только клетки, содержащие ядра, то
взвесь готовят в растворе Тюрка1, в котором эритроциты лизи-
руются уксусной кислотой, а ядра приобретают фиолетовый от-
тенок.
5.2. Определение числа клеток с помощью электронного
счетчика частиц
В счетчике фирмы Coulter Electronics Ltd. (Великобритания)
известный объем разбавленной клеточной взвеси (5—100-10®
клеток/мл, 10 мл или больше) протекает через отверстие (обыч-
но диаметром 50 мкм), по обе стороны которого поддерживается
1 3%-ный раствор уксусной кислоты, подкрашенный генцпановым фиолето-
вым.— Прим, перев.
61
ГЛАВА 1
Таблица 1.8. Определение числа клеток в гемоцитометре (счетной камере)
I. Промывают камеру средой, водой, затем этанолом или ацетоном.. Высу-
шивают. Увлажняют два параллельных края покровного стекла и тут же
плотно притирают к краям камеры. В местах соприкосновения покровного
стекла и камеры вследствие интерференции света должны появиться радуж-
ные кольца Ньютона. Благодаря силам сцепления покровное стекло долж-
но остаться неподвижным даже при переворачивании камеры.
2. Подсчет возможен в диапазоне концентраций от 2-Ю5 до 4-Ю7 клеток/мл,
но оптимальная концентрация—107 клеток/мл. Поэтому в зависимости от
цели эксперимента клеточную взвесь разбавляют средой, раствором Тюрка
нли трипанового синего до нужной концентрации и тщательно перемеши-
вают.
3. Каплю взвеси вносят в одну из двух половин камеры. Пространство меж-
ду дном камеры и покровным стеклом должно быть полностью заполнено,
но так, чтобы взвесь не вытекала.
4. Камеру примерно на минуту оставляют иа горизонтальной поверхности
для оседания клеток.
5. Под микроскопом с объективом Х10 или Х40 подсчитывают не менее
200 клеток. Траектория просмотра показана на рис. 1.66. Учитывают все
клетки, расположенные внутри большого квадрата, а также касающиеся
его левой и верхней сторон.
6. Рассчитывают концентрацию клеток во взвеси. Глубина стандартной ка-
меры— 0,1 мм. Площадь одного большого квадрата (см. рис. 1.66) со-
ставляет 0,04 мм2. Следовательно, объем расположенной над ним взвеси
равен 0,004 мм3. Если общее число клеток, подсчитанное в 25 таких квад-
ратах, умножить на 104, то мы получим число клеток, содержащееся в 1мл
взвеси, внесенной в камеру. Эту величину еще иужио умножить на фак-
тор разбавления исходной взвеси.
разность электрических потенциалов. Проходя через отверстие,
клетка вызывает увеличение электрического сопротивления в
цепи пропорционально своему объему. Возникший импульс на-
пряжения усиливается и автоматически учитывается, если пре-
восходит заданный порог. По величине импульса можно разли-
чать клетки разных размеров. Например, эритроциты (если их
концентрация не слишком велика) могут быть, вообще, исклю-
чены из электронного подсчета. Однако при работе со взвесями
клеток селезенки, костного мозга и крови, которые обычно со-
держат значительную примесь эритроцитов, непосредственно
перед подсчетом необходимо вызвать гемолиз добавлением кап-
ли раствора сапонина.
Порог подсчета определяют заранее при предварительной
калибровке прибора. Для подсчета общего числа эритроцитов
и лейкоцитов в негемолизированных суспензиях мы устанавли-
ваем объем учитываемой частицы более 30 мкм3, для подсчета
лимфоцитов — более 120 мкм3, для подсчета больших лимфоци-
тов (с определенными допущениями) — более 290 мкм3. После
лизиса эритроцитов сапонином клетки, содержащие ядра, под-
считываются при пороговом объеме более 30 мкм3. При опреде-
62
ЛИМФОЦИТЫ И ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
леннп всех этих величин за порог была принята точка, соответ-
ствующая краю плато на графике зависимости счета от нараста-
ющей величины учитываемого объема частиц для данной взвеси
клеток. Полученные таким образом данные целесообразно сопо-
ставить с результатами подсчета клеток в гемоцитометре.
Иногда в пределах времени срабатывания счетчика через
отверстие проходит одновременно несколько клеток. Частота
таких совпадений нарастает как квадратичная функция кон-
центрации клеток. В связи с этим в первоначальные данные
должна быть внесена поправка по таблицам, которые обычно
представляет изготовитель счетчика. Если получаемые показа-
тели низки (менее 5000), из них необходимо вычитать величину
фона. При использовании сапонина возможно дополнительное
повышение фона из-за появления мельчайших пузырьков возду-
ха при перемешивании. Прежде чем подсчитывать клетки, сле-
дует подождать, пока пузырьки воздуха не всплывут на поверх-
ность.
6. Благодарности
Я весьма признателен моим коллегам по Институту патоло-
гии, прежде всего Полу Крокеру (Paul Crocker), Джонанату
Остину (Jonathan Austyn), Гордону Макферсону (Gordon
Macpherson) и Дэйвиду Чао (David Chao) за ценные критиче-
ские замечания. Должен с благодарностью отметить, что изло-
жение некоторых разделов главы подкреплено результатами
ряда диссертационных работ, в том числе С. Хайнема (S. High-
nem), С. Хирша (S. Hirsch) и А. Робинсона (A. Robinson). Я вы-
ражаю особую признательность Кристу Пью (Chris Pugh), столь
щедро позволившему мне опубликовать рисунки 1 и 3. Рис. 4
воспроизведен из [88] с любезного разрешения Cambridge
University Press, а рис. 6 — с согласия Blackwell Scientific Pub-
lications.
7. Приложение
Реагенты и материалы
Бычий сывороточный
альбумин
Описание или приготовление
Растворяют примерно 200 г БСА (фракция V
сыворотки по Кону, Sigma Chemical Со, США)
в 25 мМ трис-буфере, pH 7,4 [3,03 г трис(гидро-
ксиметил) -аминометана и 8,2 г NaCl растворяют
в 1 л воды, подводят pH] и оставляют на 24—
48 ч при 4 °C. Вновь доводят pH до 7,4. Центри-
63.
Реагенты и материалы
Описание нли приготовление
Диацетат флуоресцеина
Фосфатный буферный
раствор,
фосфатный буферный
раствор
Дюльбекко A (PBS,
PBSA)
Канюля грудного про-
тока
Канюля'хвостовой вены
«Карбонильное» железо
Метризоат — фиколл,
изопак — фиколл,
гипак — фиколл
Фосфатный буферный
раствор Дюльбекко АБ
(PBSAB)
фугируют 45 мин при 14 000 об/мин. Осадок от-
брасывают. Разбавляют тем же трис-буфером до
получения 10%-ного БСА (вес на объем). При
разведении 1 : 100 ОП28о Должна составлять 0,66.
Если в опыте используют концентрированный
раствор БСА (выше 20%), то приготовление на-
чинают с диализа БСА против воды, а затем его
лиофилизируют.
Готовят раствор красителя в ацетоне (5 мг/мл),
разливают на небольшие порции и хранят в тем-
ноте при —20 °C. Размораживают непосредствен-
но перед опытом.
NaCl — 8,0 г/л, КС1 — 0,2 г/л, безводный
Na2HPO4—1,15 г/л, КН2РО4 —0,2 г/л. В прода-
жу поступают готовые таблетки (Oxoid Ltd, Ве-
ликобритания).
Используют полиэтиленовую трубку с внутренним
диаметром 0,58 мм (Portex). На конце делают
узкую петлю (не перекручивая) и для фиксации
изгиба быстро проносят через пламя горелки Бун-
зена (рис. 1.2). Трубка должна быть загнута точ-
но на 180°. Ее конец обрезают скальпелем под
углом 45° так, чтобы отверстие было обращено
наружу.
Расплавляют и отделяют пластиковую головку от
инъекционной иглы № 23 (Х11/4). На иглу наде-
вают полиэтиленовую трубку длиной около 40 см
и внутренним диаметром 0,58 мм (Portex).
Используют реагент квалификации «SF» со сред-
ним размером частиц 4,5—5,2 мкм. Отмывают
в воде и стерилизуют сухим жаром. Серии реа-
гента, окрашивающие воду, использовать не сле-
дует.
Концентрация используемого раствора фиколла
зависит от необходимой плотности градиента.
Например, для разделения клеток крови человека
в градиенте плотности используют 9%-ный
(вес/объем) раствор фиколла, чтобы приготовить
градиент с плотностью 1,078 г/мл. Для разделе-
ния клеток крысы готовят 14%-ный (вес/ объем)
раствор фиколла, чтобы окончательно градиент
имел плотность 1,087 г/мл. Фиколл растворяют
в дистиллированной воде при комнатной темпе-
ратуре и интенсивном перемешивании. К 24 объе-
мам растворенного фиколла добавляют 10 объемов
32,8%-ного (вес/объем) раствора метризоата нат-
рия (например, в виде препарата нзопак фирмы
Nyegaard and Со., Норвегия) и проверяют плот-
ность готовой смеси.
К 500 мл стерильного PBSA добавляют до ко-
нечной концентрации 0,1 г/л MgCl2 и СаС12
(Oxoid Ltd, Великобритания), содержащиеся
в 2.5 мл раствора В.
64
ЛИМФОЦИТЫ II ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
Раствор PBSAB +
+ 1 ед./мл гепарина
(PBSAB 1)
PBSAB + 20 ед./мл ге-
парина
(PBSAB 20)
Раствор хлористого ам-
мония
Силиклед (= сигмакоут)
Стеклянные бусы
Стеклянные зонды
Трипановый синий
Эритроциты барана, на-
груженные антпэритро-
цитарными антителами
К 500 мл стерильного PBSAB добавляют 500 ед.
гепарина, свободного от консерванта.
К 100 мл стерильного PBSAB добавляют 2000 ед.
гепарина, свободного от консерванта.
Смешивают 9 объемов 0,83%-ного раствора
NH4C1 (вес/объем, на воде) с одним объемом
грис (гндроксиметил) -аминометана (2,06 %,
вес/объем, на воде, pH доводят до 7,65). pH сме-
си должен составлять 7,2. Стерилизуют фильтро-
ванием через мембрану.
5%-иый раствор диметилдихлорсилана в СНС13.
Можно использовать неоднократно.
Используют бусы диаметром 450 мкм, например
стеклянные микробусы «баллотини» № 8 (Jencons
Scientifics Ltd., Великобритания). Отмывают кис-
лотой (коиц. НС1, конц. HNO3 и вода в соотно-
шении 4:4:1 по объему). Затем ополаскивают
водой, промывают раствором КОН в этаноле,
вновь ополаскивают водой, силикоиируют сили-
кледом, ополаскивают водой и высушивают. Для
повторного использования бусы отмывают изото-
ническим раствором хлористого натрия, кипятят
в растворе детергента, отмывают раствором КОН
в этаноле и вновь спликонируют.
Палочку из натриевого стекла диаметром 3 мм
сгибают на пламени горелки, как показано иа
рис. 1.2. Оплавляют копчик. Опытным путем оп-
ределяют необходимый диаметр кончика.
Готовят 0,2%-иый раствор красителя в PBS, со-
держащий 3 мМ NaN3, при продолжительном пе-
ремешивании. Перед использованием раствор
центрифугируют для удаления агломератов кра-
сителя.
Эритроциты барана трижды промывают изотопи-
ческим раствором хлористого натрия. Готовят
5%-ную взвесь и смешивают с гипериммуиной
кроличьей сывороткой к эритроцитам барана
в субагглютииирующен дозе. Инкубируют 20 мин
при 20 °C. Затем отмывают трижды в PBSAB
с О,2°/о БСА и 3 мМ NaN3. Ресуспендируют оса-
док эритроцитов до 10%-ной концентрации по
объему. Перед применением эритроциты еще раз
промывают.
Литература
1. Hudson L., Hay F. С. (1976). Practical Immunology. Blackwell’s Scientific
Publications, Oxford.
2. IV’eir D. M., Blackwell C„ Herzenberg L. A., Herzenberg L. A., eds. (1986).
Handbook of Experimental Immunology, 4th edition, Blackwell Scientific
Publications, Oxford.
5—172 65
1 ЛАВА 1
3. Mishell В. В., Shigi S. М. (1980). Selected Methods in Cellular Immunology.
W. H. Freeman, San Francisco.
4. Osmond D. G. (1985). J. Invest. Dermatol., 85, (Suppl. 1) 2s.
5. Coffman R. L. (1983). Immunol. Rev., 69, 5.
6. Opstelten D., Deenen G. J., Razing J., Hunt S. V. (1986). J. Immunol., 137,
76.
7. Wekerle H., Ketelsen U.-P-, Ernst M. (1980). J. Exp. Med., 151, 925.
8. Ritter Al. A., Sauvage C. A., Cotmore S. F. (1981). Immunology, 44, 439.
9. Kyewski B. A. (1986). Immunol. Today, 7, 374.
10. Reichert R. A., Weissman 1. L„ Butcher E. C. (1986). J. Ininiunol., 136, 3529.
11. Micklern H. S., Ford С. E., Evans E. P., Ogden D. A., Papworth D. (1972).
J. Cell Physiol., 79, 293.
12. Hunt S. V., Fowler M. H. (1981). Cell Tissue Kinet., 14, 445.
13. Ford W. L. (1975). Prog. Allergy, 19, 1.
14. Abbas A. K. (1982). Adv. Immunol., 32, 301.
15. Greaves M. F. (1986). Science, 234, 697.
16. von Willebrand E., Hayry P. (1978). Cell Immunol., 41, 358.
17. von Willebrand E., Soots A., Hayry P. (1979). Cell. Immunol., 46, 309.
18. Tilney N. L.. Strom T. R., Macpherson S. G„ Carpenter С. B. (1975). Trans-
plantation, 20, 323.
19. Morhenn V. B„ Wood G. S„ Engelman E. G„ Oseroff A. R. (1984), J. Invest.
Dermatol., 81, (Suppl. 1), 127s.
20. Sullivan S., Bergstresser P. R-, Tigelaar R. E„ Streilein J. IF. (1985). J. In-
vest. Dermatol., 84, 491.
21. Schuler G., Steinman R. M. (1985). J. Exp. Med., 161, 526.
22. Oudghiri M., Seguin J., Deslauriers N. (1986). Eur. J. Immunol., 16, 281.
23. Lee T. D. G., Shanahan F., Miller H. R. P., Bienestock J., Beftis A. D. (1983).
Immunology, 55, 721.
24. Sminia T„ Jeurissen S. H. Al. (1986). Immunobiology, 171. 72.
25. Burns J., Rozenzweig A., Zweiman B„ Moskowitz A., Lisak R. (1984). J. Im-
munol., 132, 2690.
26. Weiss L., Greep R. 0. (1983). Histology, 5tli edition. McGraw Hill.
27. Fossum S„ Ford IF. L. (1985). Histopathology, 9, 465.
28. Humphrey J. H., Grennan D., Sundaram V (1984). Eur. J. Immunol., 14.
859.
29. Mosier D. E„ Coppleson L. IP. (1968). Proc. Natl. Acad, Sci. USA, 61, 542.
30. Sorg C., Bowers IF. E. (1984). Immunobiology, 168, 133.
31. Ackerman S. K., Douglas S. D. (1978). J. Immunol., 120, 1372.
32. Werb Z., Banda M. J., Takemura R., Gordon S. (1986). In: Handbook of
Experimental Immunology. Weir D. M., Blackwell C., Herzenberg L. A. and
Herzenberg L. A. (eds. 7, Blackwell Scientific Publications. Oxford, p. 471.
33. Beller D. J., Kiely J.-M., Unanue E. R. (1980). J. Immunol., 124, 1426.
34. Nathan C F„ Root R. K. (1977). J. Exp. Med, 146, 1648.
35. Werb Z., Chin J. R. (1983). J. Exp. Med., 158, 1272.
36. Robinson A. P., White T. M., Mason D. IF. (1986). Immunology, 57, 231.
37. Talle. M. A., Rao E., Westberg E., Allegar N„ Makowski M., Mittler R. S..
Goldstein G. (1983). Ceii Immunol., 78, 83.
38. Robinson A. P.. White T. Л!.. Mason D. IF. (1986). Immunology, 57, 239.
39. Dijkstra C. D., Dopp E. A., doling P., Kraai G. (1985). Immunology, 54, 589.
40. Steinman R. M., Kaplan G., Witmer Al. G., Cohn Z. A. (1979). J. Exp. Med.,
149, 1.
41. Steinman R. M., Voorhis IF. C. van, Spalding D. M. (1986). In: Handbook
of Experimental Immunology. Weir D. M., Blackwell C„ Herzenberg L. A.
and Herzenberg L. A. (eds.), Blackwell Scientific Publishers, Oxford, p. 49. 1.
42. Steinman R. M., Wilmer Al. D., Nussenzweig M. C, Gutchinov B., Austyn J. M.
(1983). Transplant. Proc., 15, 299.
43. Austyn J. M., Gordon S. (1981). Eur. J. Immunol., 11, 805.
66
ЛИМФОЦИТЫ 11 ВСПОМОГАТЕЛЬНЫЕ КЛЕТКИ
44. Pugh С. W., MacPherson G. G„ Steer Н. IV7. (1983). J. Exp. Med., 157, 1758.
45. MacPherson G. G., Pugh C. IF. (1984). Immunobiology, 168, 338.
46. Klaus G. G. B., Humphrey J. H., Kunkel A., Dongworth D. W. (1980). Im-
munol. Rev., 53, 3.
47. Schnizlein С. T., Kosco M. H., Szakal A. K, Tew J. G. (1985). J. Immunol.,
134, 1360.
48. Lilet-Leclerq Q., Radoux D., Heinen E., Kinel-Denouel C., Defraigne Ad. P..
Houben-Defresne M. P., Simar L. J. (1984). J. Immunol. Methods, 66, 235.
49. Naiem M., Gerdes L, Abdulaziz H., Stein H., Mason D. У. (1983). J. Clin.
Pathol, 36, 167.
50. Ralph P. (1986). In: Handbook of Experimental Immunology. Weir D. M,
Blackwell C, Herzenberg L. A. and Herzenberg L. A. (eds.), Blackwell Sci-
entiffic Publishers, Oxford, p. 45. 1.
51. Minowada J., Tatsumi E., Sagawa K., Lok M. S., Sugimoto T., Minato K-,
Zgoda L., Prestine L., Kover L„ Gould D. (1984). In: Leukocyte Typing.
Bernard A, Boumsell L, Dausset J, Milstein C. and Schlossman S. F.
(eds.), Springer Verlag, p. 519.
52. Reinherz E. L., Haynes B. F., Nadler L. M., Bernstein I, D. (eds.). (1986).
Leukocyte Typing II. Springer Verlag, New York, Vol. 3, p. 1.
53. Bauer S. R., Holmes K. L., Morse H. C. III. Potter Al. (1986). J. Immunol,
136, 4695.
54. Gowans J. L„ Uhr J. W. (1966). J. Exp. Med, 124, 1017.
55. Smith M. E., Ford W. L. (1983). Immunology, 49, 83.
56. Williams N., Kraft N., Shortman K. (1972). Immunology, 22, 885.
57. Boyum A. (1968). Scan. J. Clin. Lab. Invest, 21, Suppl, 97, p. 77.
58. Ford W. L. (1978). In: Handbook of Experimental Immunology. Weir D. M.
(ed.), Blackwell Scientific Publications, Oxford, 3rd edition, p. 23.6.
59. Patrick С. C., Graber C. D„ Loadholt С. B. (1976). J. Immunol. Methods,
11, 321.
60. Beverley P. C. L. (1986). In: Handbook of Experimental Immunology.
Weir D. M, Blackwell C, Herzenberg L. A. and Herzenberg L. A. (eds.),
Blackwell Scientific Publishers, Oxford, p. 58.1.
61. Callard R. E., Smith C. Al. (1981). Eur. J. Immunol, 11, 206.
62. Smith J. B., McIntosh G. H., Morris B. (1970), J. Anat, 107, 87.
63, Sprent J. (1973). Cell. Immunol, 7, 10.
64. Dineen J. K., Adams D. B. (1970). Immunology, 19, 11.
65. Sanders A. G. Florey H. W. Barnes J. Al. (1940). Br. J. Exp. Pathol, 21,
254.
66. Grindlay J. H., Cain I. C., Bollman J, L., Mann F. L. (1950). Surgery, 27,
152.
67. Lascelles A. K.. Morris B. (1961). Q. J. Exp. Physiol, 46, 199.
68.. Tilney N. L., Murray J. E. (1968). Ann. Surgery, 167, 1.
69. Balkwill F. R., Hogg N. Al. (1979). J. Immunol., 123, 1451.
70. Hume D. A., Allan IF, Goldner J., Stephens R. IF, Doe IF. E., Warren H. S.
(1985). J. Leukocyte Biol, 38, 541.
71. Ford IF. L., Burr IF, Simonsen Al. (1970). Transplantation, 10, 258.
72. Waksman В. H.. Ozer H., Blythman H. (1973). Lab. Invest., 28, 614.
7'3 . Monfalcone A. P., Szakal A. K„ Tew J. G. (1968). J. Leukocyte Biol, 39,
617.
74. Parks D., Hardy R. R., Herzenberg L. A. (1983). Immunol. Today, 4, 145.
75. von Boehmer H., Shortman K. (1973). J. Immunol. Methods, 2, 293.
76. Shortman K. Williams N„ Adams P. (1972). J. Immunol. Methods, 1. 273.
77. Boyle W. (1968). Transplantation, 6, 761.
78. Miller R. G. (1986). In: Handbook of Experimental Immunologv. Weir D. M
Blackwell C, Herzenberg L. A. and Herzenberg L. A. (eds.), Blackwell Sci-
entific Publications, Oxford, p. 54.1.
79. Macatonia S. E.. Edwards A. J., Knight S. C. (1986). Immunology, 59, 509.
5'
67
ГЛАВА 1
80. Marbrook I. (1980). In: Selected Methods in Cellular Immunology. Mi-
shell В. B. and Shigi S. M. (eds.), W. H. Freeman, San Francisco, p. 188.
81. Raidt D. G. (1980). In: Selected Methods in Cellular Immunology. Mi-
shell В. B. and Shigi S. M. (eds.), W. H. Freeman, San Francisco, p. 193.
82. Shortman K., Williams .V., Jackson IL, Russel P., Byri P., Diener E. (1971).
J. Cell Biol., 48, 566.
83. Lin H.-S„ Gordon S. (1979). J. Exp. Med., 150, 231.
84. Van der Meer 1. W. AL. Bulterman D., van Zwet T. L., Elzenga-Claasen I.,
van Furth R. (1978). J. Exp. Med., 147, 271.
85. Folkman J., Moscona A. (1978). Nature, 273, 345.
86. van Voorhis IF. C., Hair L. S., Steinman R. M., Kaplan G. (1982). J. Exp.
Med., 155, 1172.
87. Klinkert IF. E. F„ LaBadie J. H„ Bowers Г. E. (1982). J. Exp. Med., 156, 1.
88. Tilney N. L. (1971) .J. Anat., 109, 371.
89. Waynforth H. B. (1980). Experimental Surgical Techniques in the Rat, Aca-
demic Press, London, p. 115.
Глава 2
ВЫДЕЛЕНИЕ РАЗЛИЧНЫХ СУБПОПУЛЯЦИЙ
ЛИМФОЦИТОВ
Д. Мейсон, Дж. Пенхейл, Дж. Седжуик
1. Введение
Давно известно, что в основе иммунного ответа лежит
взаимодействие между разнообразными клетками, составляю-
щими иммунную систему организма. Разработка методов выде-
ления практически чистых популяций Т-клеток из тимуса и
В-клеток из костного мозга позволила осуществить первые
классические эксперименты, доказавшие необходимость коопе-
рации между Т- и В-клетками при индукции образования анти-
тел. Когда же выяснилось, что в пределах одной популяции
лимфоидных клеток можно серологическим путем идентифици-
ровать множество субпопуляций,одним из главных направлений
иммунологии стало изучение функциональной гетерогенности
клеток иммунной системы. Работы в этом направлении почти
полностью зависят от получения моноклональных антител, рас-
познающих тканеспецифические антигены. Методы фракциони-
рования клеток, основанные на использовании таких антител,
значительно эффективнее любых других приемов выделения от-
дельных клеточных элементов иммунной системы.
В этой главе описаны серологические методы разделения
клеток, а именно:
I — сортировка клеток посредством проточной цитофлуорогра-
фии;
II — розетирование;
III — пэннинг;
IV — комплемент-опосредованнын лизис.
Из перечисленных II и IV представляют собой приемы уст-
ранения тех компонентов разнородной клеточной популяции,
которые „экспрессируют на своей поверхности определенный ан-
тигенный маркер. В то же время I и III — это методы выделе-
ния как имеющей, так и не имеющей данный антигенный мар-
кер клеточных субпопуляций. Дальнейшее обсуждение досто-
инств и недостатков различных методов разделения клеток мы
продолжим в конце главы.
69
ГЛАВА 2
2. Проточная цитофлуорография и сортировка
клеток
Оптико-электронные приборы, позволяющие определять раз-
меры клеток и выявлять связанные с клетками меченные флуо-
рохромом антитела, получили широкое распространение в пос-
ледние 10 лет. Можно считать убедительно доказанной эффек-
тивность этих приборов как инструмента для анализа гетеро-
генности лимфоцитов по фенотипу (антигенным маркерам) и
по функциональным особенностям. Ряд таких цитофлуорогра-
фов (цитофлуориметров) имеется в продаже, например прибо-
ры FACS (Becton Dickinson Immunocytometry Systems, CHIA),
EPICS (Coulter Electronics Ltd., Великобритания), цитофлуоро-
граф Ortho Diagnostic Systems Inc., CHIA. Приборы выпуска-
ются в двух вариантах — только для аналитической цели или с
дополнительным устройством для препаративного выделения
клеточных субпопуляций на основе определяемых характери-
стик. Именно приборы второго типа названы «клеточными сор-
терами».
Коммерческие приборы разных фирм отличаются друг от
друга, в частности, по принципу определения размеров (объе-
ма) клеток. Подробные описания приборов читатель найдет в
литературе, издаваемой фирмами-изготовителями, а мы рассмот-
рим в общих чертах принципы, преимущества и недостатки при-
менения клеточного сортера для разделения клеточных субпо-
пуляций.
2.1. Принципы фенотипического анализа клеток
Поверхностные клеточные антигены специфически маркиру-
ют антителами, конъюгированными с флуорохромом, и состоя-
щую из одиночных клеток взвесь вводят под давлением через
форсунку в оптическую систему прибора. Струя клеточной взве-
си занимает осевое положение в концентрически окружающем
ее потоке бесклеточной обтекающей жидкости. Клетки проходят
через сфокусированный на потоке лазерный луч. Свет лазера
рассеивается и отражается клетками, а также возбуждает флу-
оресценцию связанного с ними флуорохрома. Рассеянные и от-
раженные лучи света наряду с эмиссией флуорохрома воспри-
нимаются фотоэлектрическими детекторами, оснащенными
соответствующими линзами и оптическими фильтрами (рис. 2.1).
Возникающие электрические сигналы анализируются компью-
тером и могут либо преобразовываться немедленно, либо сох-
раняться для последующего изучения. На основе этих сигналов
в прочном цитофлуорографе для препаративного разделения
клеточных субпопуляций происходит сортировка клеток.
70
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
Луч лазера
Рис. 2.1. Оптическая система проточного цитофлуорографа, измеряющего че-
тыре параметра клетки. Схематически представлено расположение зеркал и
светофильтров прибора, позволяющего одновременно измерять «переднее рас-
сеяние света», «боковое рассеяние света» и яркость двухцветной флуоресцен-
ции. Форсунка, подающая струю клеточной взвеси, расположена как бы над
диаграммой. Струя пересекает луч лазера под прямым углом в точке А. Чер-
теж сделан без учета масштаба. Для регистрации сигналов флуоресценции
двух флуорохромов — флуоресцеина (зеленое свечение) и фикоэритрина (оран-
жевое свечение) в схему включены (под соответствующими номерами): (1) све-
тофильтр нейтральной плотности; (2) широкополосный интерференционный
светофильтр (максимум пропускания 520 нм) вместе с широкополосным стек-
лянным фильтром (максимум пропускания 530 нм); (3) фильтр с полосой про-
пускания 575/25 нм и (4) узкополосный интерференционный фильтр с макси-
мумом пропускания 560 нм. Дихроичное зеркало также имеет узкую полосу
пропускания с максимумом 560 нм. Следует отметить, что оптические харак-
теристики интерференционных светофильтров весьма нестандартны, поэтому
нх необходимо тщательно подбирать. В настоящее время изготовители распо-
лагаюу возможностью поставлять комплекты светофильтров с высокой спект-
ральной избирательностью.
Пользуясь приборами, в которых лазерный луч сфокусиро-
ван на свободной струе жидкости (т. е., выпущенной из фор-
сунки), как правило, можно получить четыре группы характе-
ристик анализируемых клеток.
1. Рассеяние света под малым углом. Это — часть лазерного
луча, рассеянная клетками под малым углом. По интенсивно-
71
ГЛАВА 2
сти сигнала малоуглового (или переднего) рассеяния опреде-
ляют размер клетки. В сравнении с живыми мертвые клетки
дают меньший сигнал переднего рассеяния — параметр, по кото-
рому удается различать эти два вида клеток. Таким же обра-
зом можно дифференцировать эритроциты млекопитающих от
клеток, содержащих ядра.
2. Рассеяние света под углом 90°. Рассеяние лазерного све-
та под большим углом в значительной степени зависит от струк-
турной гетерогенности клетки, а не от ее размеров. Так, клетки
с большим числом цитоплазматических гранул или других
органелл рассеивают больше света, чем эритроциты или лимфо-
циты.
Одновременное измерение переднего и 90-градусного рас-
сеяния (которое многие называют «боковым») позволяет
идентифицировать лимфоциты, моноциты и гранулоциты пери-
ферической крови [1] и довольно эффективно фракционировать
субпопуляции клеток костного мозга (см. ниже).
3. Эмиссия флуоресцеина. Как описано в разд. 2.5.1, флуо-
ресцеин легко присоединяется к антителам. Полученными
конъюгатами можно пометить клетки, несущие поверхностные
антигены, с которыми специфически связываются данные анти-
тела. Аргоновые лазеры имеют сильную линию испускания при
488 нм, близкую к максимуму возбуждения флуоресцеина.
Благодаря этому они чаще других используются как источники
света в клеточных сортерах. Лазерный луч, генерирующий сиг-
налы переднего и бокового рассеяния, а также возбуждающий
эмиссию флуоресцеина, может одновременно вызывать и второй
люминесцентный сигнал, если клетки будут маркированы новым,
недавно выделенным флуорохромом, В-фикоэритрином (см.
ниже).
4. Эмиссия фикоэритрина. Хромофор В-фикоэритрин — это
белок с мол. массой 250 000, выделенный из морских водорослей
(например, Porphyridium cruentum) и участвующий в фотосин-
тезе. Как и флуоресцеин, он эффективно возбуждается светом
с длиной волны 488 нм, но сам излучает с максимумом около
575 нм, превышающим примерно на 50 нм максимум эмиссии
флуоресцеина. Эти характеристики в сочетании с высоким кван-
товым выходом люминесценции (т. е., эффективность преобра-
зования флуорохромом энергии возбуждающего излучения в
энергию излучаемого света) делают фикоэритрин почти иде-
альным флуорохромом для проточной цитофлуорографии.
Подобрав соответствующие оптические фильтры, можно диф-
ференцировать эмиссии фикоэритрина и флуоресцеина и исполь-
зовать оба флуорохрома одновременно. В продаже имеется
фикоэритрин, ковалентно связанный с авидином (Serotec Ltd.,
Великобритания). Удобная методика маркирования клеток
двумя флуорохромами приведена в разд. 2.3.3. Отметим, что
72
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
100 200
ФП 1
'д ФЛ 1
Рис. 2.2. Преимущество логарифмического представления гистограмм флуорес-
ценции по сравнению с линейным. Лимфоциты грудного лимфатического про-
тока крысы были маркированы мышиными моноклональными антителами к кры-
синому антигену CD4, отмыты и проинкубированы с флуоресцеиновым конъю-
гатом F(ab')-фрагментов кроличьих антител к мышиным иммуноглобулинам.
Гистограммы флуоресценции, полученные при анализе лимфоцитов в цнто-
флуорографе FACS (Beckton Dickinson Immunocytometry Systems, США),
представлены (А) в линейном масштабе по шкале ординат (частота клеток)
н абсцисс (яркость флуоресценции), а также (Б) в логарифмическом масштабе
по шкале абсцисс. ФЛ 1 — яркость флуоресценции клеток, маркированных пер-
вым флуорохромом (в данном случае, единственным).
имеются и другие флуорохромы, способные заменить фикоэрит-
рин, но ни один из них не обладает такими хорошими характе-
ристиками флуоресценции в узком диапазоне длин волн, как
фикоэритрин.
Сигналы, поступающие от четырех детекторов, после соот-
ветствующего усиления различными способами выводятся на
экран дисплея (блок визуальной индикации, БВИ).
1. Первый способ — это простая гистограмма, отражающая,
например, соотношение частоты и размера (или интенсивности
флуоресценции) клеток. Большинство моделей клеточных сор-
теров представляют сигналы, полученные от клеток, маркиро-
ванных двумя флуорохромами, как в линейной, так и в лога-
рифмической форме; последней отдается большее предпочтение.
Так, арифметическая гистограмма соотношения частоты и ин-
тенсивности флуоресценции скрывает гетерогенность флуорес-
цирующих клеток и частоту тусклых клеток, значения которой
выходят за пределы шкалы ординат (рис. 2.2а). В данном случае
предпочтительнее гистограмма соотношения частоты и лога-
2^6^ интенсивности (ЯРКОСТИ) флуоресценции клеток (рис.
2. При второй форме представления данных на дисплей одно-
временно выводятся сигналы от двух разных детекторов. Каж-
дая пересекающая луч лазера клетка дает на экране БВИ одну
точку, положение которой зависит от амплитуды двух этих
73
ГЛАВА 2
Рнс. 2,3. «X—Y» — точечная цитограм-
ма костного мозга крысы на дисплее
цнтофлуорографа FACS. Клетки кост-
ного мозга крысы освобождали от
эритроцитов методом гипотоническо-
го шока н анализировали по сигналам
«переднего» рассеяния света (ПРС)
и «бокового» рассеяния света (БРС).
Построенная цитограмма свидетель-
ствует о присутствии трех типов кле-
ток: (1) малых мононуклеаров, (2)
больших мононуклеаров (бластов) и
(3) гранулоцитов.
1g фл 1 ig ФЛ 1
Рнс. 2.4. Сопоставление «X—Y» точечной н контурной цитограмм. А. «X—У»
точечная цнтограмма лимфоцитов грудного протока крысы, маркированных,
как описано в тексте, мышиными моноклональными антителами к крысиному
антигену CD8 (ФЛ 1 —яркость флуоресценции клеток, маркированных первым
флуорохромом, флуоресцеином) и к крысиному антигену CD5 (ФЛ2 — яркость
флуоресценции клеток, маркированных вторым флуорохромом, фикоэритри-
ном). Ясно видно, что CD8+ лимфоциты представляют собой субпопуляцию
CD5+ клеток. Б. Идентичные данные представлены в виде контурного графи-
ка. Обе шкалы имеют логарифмический масштаб. Мощность лазера 200 мВт
при длине волны излучения 488 нм.
сигналов. Такая «X — Y» точечная цитограмма представлена
на рис. 2.3 (координата X каждой точки соответствует амплиту-
де сигнала переднего рассеяния, а координата Y—амплитуде
сигнала бокового рассеяния).
3. При третьей форме представления данных, как и при вто-
рой, на дисплей одновременно выводятся сигналы от двух раз-
ных детекторов, но при этом строится контурный график, на
котором каждый контур соответствует заранее выбранной
частоте клеток данного типа в исследуемой взвеси (рис. 2.4).
В отличие от «X — Y» точечных цитограмм контурные графики
могут быть построены только после того, как в память компью-
74
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
\
-jjepa поступят все необходимые данные и реализуется соответ-
ствующая программа их обработки. Несмотря на то что контур-
ный график содержит больше количественной информации, для
решения многих задач достаточно воспользоваться первым спо-
собом представления данных.
Кроме описаннных, существует способ т. н. «изометрическо-
го» представления данных, т. е. придание контурному графику
видимости трехмерного изображения. В принципе этот подход
вносит мало ясности в представляемые данные, и мы не счи-
таем его эффективным.
2.2. Сортировка клеток
Для разделения поступающей в прибор через форсунку
клеточной взвеси на две субпопуляции, различающиеся по из-
меряемым параметрам, струя жидкости вначале дробится на
капли, проходя через расположенный в корпусе форсунки мик-
роскопический вибратор. Капли в момент отрыва от струи вос-
принимают подаваемые на нее импульсные заряды, полярность
которых задается программой разделения. Так, например, кап-
ли, содержащие ярко флуоресцирующие клетки, могут получить
положительный заряд, а капли с тусклосветящимися клетка-
ми— отрицательный. Возможен выбор и более сложных крите-
риев сортировки, учитывающих все четыре доступные для
измерения параметра клетки. Получив заряд, капли пересека-
ют электрическое поле, возникающее между двумя металли-
ческими электродами при разности потенциалов примерно 3 кВ.
Положительно заряженные капли отклоняются к катоду,
а отрицательно заряженные — к аноду. В результате этого
расходящиеся потоки капель собираются в разные пробирки, а
не отклоненная электрическим полем часть капель (в которых
либо нет клеток вовсе, либо содержатся клетки, не отвечающие
выбранным критериям сортировки), отбрасывается.
2.3. Практический подход к сортировке клеток
2.3.1. Работа с клеточной суспензией
Для успешной сортировки клеток необходимо соблюдать
ряд правил.
1. Следует добиться того, чтобы образец клеточной взвеси
не содержал детрита или агрегатов погибших клеток, которые
могут либо, закупорив отверстие форсунки, остановить сорти-
ровку, либо, частично заблокировав его, отклонить струю взвеси
от нужной траектории. Кроме того, некоторые препараты ан-
75
ГЛАВА 2
тител, применяемых для маркирования, могут вызвать агглюти-
нацию лейкоцитов. В результате прибор будет регистрировать
две и более клеток как одну. Для удаления агрегатов мертвых
клеток взвесь фильтруют через два слоя сетчатой ткани. Чтобы
диспергировать лейкоцитарные агглютинаты, взвесь энергично
пропускают через иглу № 25 для подкожных инъекций. Этот
способ диссоциации агглютинатов существенно не снижает жиз-
неспособности клеток.
2. Подбирают форсунку, размеры отверстия которой соот-
ветствуют размерам разделяемых клеток. Мы обычно применя-
ем 50-микронную форсунку для клеток диаметром около 15 мкм
и 100-микронную — для клеток большего размера.
3. Контролируют, является ли регистрируемый сигнал след-
ствием флуоресценции специфического маркера клеток. Для
этого сначала в прибор вводят взвесь немаркированных клеток,
чтобы определить уровень аутофлуоресценции, а затем взвесь
клеток, меченных неспецифическими антителами (отрицатель-
ный контроль). Например, при сортировке лимфоцитов крысы
мы инкубируем их (отрицательный контроль) с мышиными
моноклональными антителами к одному из компонентов ком-
племента человека, а затем с флуоресцеиновым конъюгатом
Р(аЬ')г-фрагментов кроличьих антител к мышиным 1g.
4. Для предотвращения «кэппинга» флуоресцентной метки
клеточную взвесь держат при 4°C и (или) добавляют в среду
10 мМ азида натрия. В процессе эксперимента все клеточные
суспензии находятся на холоду, поскольку имеются сообщения
о токсичности 10 мМ азида натрия для клеток при комнатной
температуре.
5. При выделении редко встречающихся клеток их собирают
в пробирку, заранее наполненную средой. Иначе отсортирован-
ные в малом объеме жидкости клетки могут высохнуть во вре-
мя разделения, которое нередко продолжается 6—7 ч. Из-за
небольшого числа клеток невелико и количество отклоненных
капель жидкости, и она не образует заметного при визуальном
контроле потока. В этом случае целесообразно автоматически
регистрировать поступление отклоненных капель в место сбора.
Для этой цели мы разработали и постоянно используем особое
электронное устройство [2].
6. В том случае, когда для сортировки клеток необходимо
центрифугировать пробирки с собранными фракциями, к суспен-
зии добавляют БСА (до 1%), который предотвращает адгезию
клеток к стенкам пробирки.
2.3.2. Сортировка клеток в стерильных условиях
Если разделяемые клетки предназначены для культивирова-
ния, то клеточный сортер стерилизуют. Для этого достаточно
вмонтировать в трубку подачи обтекающей жидкости мембран-
76
СУБП0ПУЛЯЦ1Ш ЛИМФОЦИТОВ
Цып фильтр с размером пор 0,2 мкм (например, фирмы Milli-
pore, США) п пропустить через него под давлением примерно
10 мл абсолютного этанола. На трубку, соединяющую резерву-
ар' обтекающей жидкости с фильтром, накладывают зажим и в
ее отвод, расположенный между фильтром и зажимом, вводят
при помощи шприца этанол. Он проходит через фильтр и, рас-
пространяясь далее по трубке для обтекающей жидкости, про-
никает в форсунку, а затем ретроградно через отверстие фор-
сунки в трубку, подающую клеточную взвесь. Через 20 мин
отвод пережимают и снимают зажим с трубки, подающей обте-
кающую жидкость. В течение 20 мин пропускают эту жидкость
через систему. В предварительной стерилизации фильтрованием
обтекающая жидкость не нуждается, но в нее всегда добавляют
10 мМ азида натрия.
2.3.3. Маркирование клеток антителами, связанными
с флуорохромом
Во многих случаях при маркировании клеток отдают пред-
почтение методу «сэндвича», поскольку в нем можно исполь-
зовать отцентрифугированную нативную культуральную жид-
кость, содержащую секретируемые гибридомой антитела. В тех
случаях, когда используются два разных флуорохрома, методи-
ка соответственно усложняется.
При маркировании одним флуорохромом выполняют пункты
2 и 3 описанной ниже методики. Полное ее воспроизведение
дает вполне удовлетворительные результаты двуцветного мар-
кирования (рис. 2.4).
1. Готовят взвесь исследуемых лимфоидных клеток (гл. 1).
2. Инкубируют клетки с мышиными моноклональными анти-
телами к поверхностному антигену А. На 107 клеток используют
25 мкл антител. После инкубации клетки дважды отмывают.
3. Инкубируют клетки с флуоресцеиновым конъюгатом
F (al/)2-фрагментов кроличьих антител к мышиным иммуногло-
булинам в концентрации 20 мкг/мл. После инкубации дважды
отмывают.
4. Для блокирования оставшихся свободными активных цент-
ров клетки инкубируют 20 мин в 1%-ной нормальной мышиной
сыворотке, инактивированной нагреванием.
5. Инкубируют клетки с биотиновым конъюгатом мышиных
моноклональных антител к поверхностному антигену Б (концен-
трация конъюгата — 20 мкг/мл). После инкубации клетки дваж-
ды отмывают.
6. В заключение инкубируют клетки с конъюгатом авидин —
фикоэритрин в концентрации примерно 20 мкг/мл, а затем
дважды отмывают.
77
ГЛАВА 2
I
На всех этапах маркирования клетки инкубируют при 4°Ц.
Время инкубации варьирует от 20 до 60 мин. Антиген А можно
маркировать неочищенной культуральной средой, содержа-
щей моноклональные антитела к этому антигену, разбавленной
в 3 раза и более. Для маркирования антигена Б используют
выделенные из асцитической жидкости мышиные моноклональ-
ные антитела, биотинированные, как описано ниже. Оптималь-
ные концентрации этих реагентов в каждом отдельном случае
подбирают в предварительных опытах. Выше указанные циф-
ры служат только для ориентировки. Вопреки общепринятому
суждению, кинетика связывания моноклональных антител с ан-
тигеном не отличается большими скоростями [3]. Разумеется,
время инкубации можно сократить, применяя повышенные кон-
центрации реагентов. Но концентрированные препараты моно-
клональных антител весьма дороги. В связи с этим приходится
искать компромисс между продолжительностью эксперимента и
его стоимостью.
При одновременном маркировании двумя разными флуоро-
хромами — ФИТЦ и ФЭ — необходимо иметь в виду следующее.
Обычно спектры эмиссии этих флуорохромов имеют круто очер-
ченные границы в коротковолновой области, но весьма постепен-
но сходят на нет в длинноволновой (с увеличением длины вол-
ны). Так, флуоресцеин, обладая максимумом эмиссии около
530 нм, излучает вплоть до 575 нм, т. е. в той области спектра,
на которую приходится пик эмиссии ФЭ. Поэтому нет такого
оптического фильтра, который пропустил бы свечение ФЭ, но
полностью задержал бы излучение флуоресцеина. Когда же тре-
буется, наоборот, определить эмиссию флуоресцеина, то искаже-
ния сигнала излучением ФЭ (сравнительно небольшим в обла-
сти 530 нм) не представляют для нас серьезной проблемы.
Проточные цитофлуорографы оснащены схемами электронной
компенсации, устраняющими искажения «красного» излучения
«зеленым», но компенсация эта имеет определенные ограниче-
ния. Поэтому при значительном перепаде интенсивности марки-
рования лучше, чтобы «зеленый» сигнал был слабее «красного».
Для аналитических целей достаточно маркировать 5-Ю6 кле-
ток. Чтобы загрузить клеточный сортер на весь рабочий день
препаративного фракционирования, необходимо маркировать
1—2-108 клеток.
2.4. Выход, чистота и производительность
сортировки клеток
Клеточные сортеры обычно обеспечивают 97—99%-ную чис-
тоту разделяемых субпопуляций клеток. Выход клеток, по на-
шим данным, никогда не превышает 40% от исходного количест-
ве
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
вг|. Примерно половина из потерянных 60%, т. е. 30% клеток
неводной взвеси, исчезает бесследно. По-видимому, они раз-
рушаются в процессе дробления взвеси на капли.
В типичном опыте по сортировке клеток, например, можно
получить следующие результаты:
число маркированных клеток
число выделенных клеток
чистота фракции «ярких» клеток
чистота фракции «тусклых» клеток
производительность сортировки
продолжительность сортировки
1.5-10s
5-107
97%
99%
5.5-103 клеток/с
7.5 ч
2.5. Приготовление конъюгированных антител
2.5.1. Конъюгация очищенных антител
с изотиоцианатом флуоресцеина
1. Буфер для конъюгации. Готовят следующие растворы на
дистиллированной воде:
A. Na2CO3 5,3%
Б. NaHCO3 4,2%
В. NaCl 0,85%
2. Смешивают 5,8 мл раствора А с 10 мл раствора Б. Один
объем этой смеси прибавляют к 9 объемам раствора В. Дово-
дят pH полученной смеси до 9,5, добавляя небольшой объем
раствора А (если pH ниже, чем требуется) или раствора Б
(если pH выше).
3. Уравновешивают буфером для конъюгации колонку сефа-
декса G-50 (Pharmacia Fine Chemicals, Швеция) и с ее помощью
переводят в этот же буфер очищенные антитела. Во всех реа-
гентах необходимо исключить присутствие азида натрия, так как
он мешает конъюгации.
4. Концентрацию антител доводят до 4—6 мг/мл. (Для этого
перед сменой буфера на колонке раствор антител должен иметь
концентрацию более 10 мг/мл.)
5. Растворяют в буфере для конъюгации 1 мг/мл ФИТЦ.
(Изомер 1, Nordic Laboratories, Финляндия.) Добавляют по
0,3 мл этого раствора на каждый мл раствора антител.
6. Инкубируют смесь антител с ФИТЦ 2 ч при комнатной
температуре в темноте.
7. Колонку сефадекса G-50 уравновешивают PBS (pH 7,4),
содержащим 10 мМ азида натрия, и отделяют на ней конъюга-
ты антител (которые выходят в первом пике) от свободного
ФИТЦ.
8. Измеряют ОП495 п ОП28о раствора конъюгированных анти-
тел. При оптимальной конъюгации соотношение ОП495/ОП280
79
ГЛАВА 2
приближается к 1. Рассчитывают концентрацию белка по фор-
муле:
_ОП?8о-.(ОП495ХО,35) мг/мл
1,4
9. Разливают мелкими порциями и хранят при —20 °C.
Пример-. 10,4 мг Р(аЬ')2-фрагментов кроличьих антител к
мышиным иммуноглобулинам в концентрации 6,1 мг/мл после
конъюгации и разбавления 1 : 10 дают ОП28о = 0,78; ОП495 = 0,89;
соотношение ОП495/ОП28о= 1,1. Концентрация антител = 3,36 мг/
/мл; суммарный выход 9,7 мг.
Приготовленный реагент в разведении 1 :200 (примерно
17 мкг/мл антител) хорошо маркировал крысиные лимфоциты,
преинкубированные с мышиными моноклональными антитела-
ми к поверхностным антигенам клеток.
2.5.2. Метод биотинирования очищенных антител
по Б. Роузе (В. Roser)
1. Используют N-гидроксисукцинимидный эфир биотина
(Pierce and Warriner Ltd., Великобритания).
2. Растворяют 2—5 мг/мл антител в 0,1 М натрий-бикарбо-
натном буфере, pH 8,4.
3. N-гидроксисукцинимидный эфир биотина (должен быть
сухим) отвешивают непосредственно перед использованием и
растворяют в концентрации 20—40 мг/мл в диметилсульфок-
сиде.
4. Добавляют 150—200 мкг эфира на 1 мг антител и 2 ч ин-
кубируют при комнатной температуре.
5. Отделяют конъюгат от несвязавшегося эфира на колонке
сефадекса G-25, уравновешенной PBS, содержащим азид нат-
рия. Хранят при —20 °C.
3. Розетирование
Здесь мы приводим усовершенствованный метод Париша и
Хейуарда (Parish and Hayward [4]), который был успешно
использован для субпопуляционного фракционирования различ-
ных моноклеточных взвесей, включая лимфоциты грудного про-
тока, тимоциты, спленоциты, клетки лимфатических узлов и
костного мозга.
Розетирование позволяет удалить из клеточной популяции
некоторую ее часть, реагирующую с антителами данной спе-
цифичности. Как правило, это — моноклональные антитела,
однако в ряде случаев можно использовать выделенные имму-
носорбцией из антисывороток поликлональные антитела.
80
СУБПОПУЛЯЦИН ЛИМФОЦИТОВ
3)1. Принцип
Эритроциты барана (ЭБ) нагружают антителами с помощью
хлорного хрома и смешивают с фракционируемой взвесью лей-
коцитов. Эритроциты связываются с клетками, экспрессирую-
щими на поверхности соответствующие антигены. В результате
образуются крупные агрегаты клеток, которые можно осадить
центрифугированием. При этом в надосадочной фракции оста-
ются только антиген-негативные клетки. Чистота этой фракции
по данным проточной цитофлуорографии в большинстве случа-
ев превышает 99%. Выход разделяемых клеток составляет
примерно 60% от теоретически возможного, но его можно по-
высить, если суспендировать осадок в свежей порции среды и
провести розетирование повторно. В результате суммарный
выход составляет 80% от теоретически возможного.
3.2. Приготовление раствора хлорного хрома
1. Растворяют 0,5 г хлорного хрома (СгОз-бНгО)1 в 500 мл
0,9% NaCl при комнатной температуре.
2. Прибавляя по каплям 1 М NaOH, доводят pH раствора
до 5,0.
3. Раствор оставляют на 3 недели. Еженедельно подводят pH
(который со временем снижается) до 5,0. После этого раствор
хлорного хрома готов для использования. Хранящийся при ком-
натной температуре, он пригоден для употребления не менее
двух лет. Добавление консервантов не требуется.
3.3. Приготовление взвеси эритроцитов барана,
нагруженных антителами
ЭБ для розетирования нагружают кроличьими антителами к
мышиным иммуноглобулинам.
1. ЭБ четыре раза отмывают 0,85%-ным NaCl. Если при от-
мывании наблюдается гемолиз, данная партия эритроцитов не
пригодна.
2. К Ю мл 5%-ной (по объему) взвеси отмытых ЭБ прибав-
ляют 800 мкг очищенных иммуносорбцией кроличьих антител к
мышиным иммуноглобулинам и, тщательно перемешивая, 400—
500 мкл 0,1%-ного раствора хлорного хрома (во всех случаях
растворителем служит 0,85%-ный NaCl).
1 Данный реагент называют также шестиводным треххлористым хромом.—
Прим, перев.
6—172 81
ГЛАВА 2
3. Смесь инкубируют при комнатной температуре 5 мин. За
это время большая часть эритроцитов, агглютинированная
хлорным хромом, оседает на дно пробирки.
4. Нагруженные антителами ЭБ дважды отмывают PBS и
один раз раствором PBSAB с добавлением БСА. При отмыва-
нии в PBS часто наблюдается легкий гемолиз, которым можно
пренебречь.
5. Нагруженные антителами ЭБ ресуспендируют в 10 мл
раствора PBSAB/БСА и используют в реакции розетирования.
Необходимо обратить внимание на следующее:
1. Кроличьи антитела к мышиным 1g, очищенные иммуно-
сорбцией на колонке с иммобилизованными иммуноглобули-
нами мыши, дают перекрестные реакции с 1g близких видов,
например крысы. Для устранения перекрестно-реагирующих
антител исходную кроличью антисыворотку истощают на колон-
ке с иммобилизованными иммуноглобулинами соответствующего
вида животного. Такое истощение, устраняя основную часть
нежелательных антител, все же оставляет их следовые количе-
ства. Благодаря этим антителам происходит образование розе-
ток, например, с крысиными В-клетками. Чтобы это предотвра-
тить, перед розетированием крысиных лимфоцитов ко взвеси
нагруженных антителами ЭБ добавляют 10% нормальной сыво-
ротки крысы. Однако если цель розетирования — удаление В-
клеток, то способствующие удалению перекрестно-реагирующие
антитела истощать, разумеется, не следует.
2. Присоединение с помощью хлорного хрома не происходит
при физиологических значениях pH. Поэтому очищенные имму-
носорбцией антитела к мышиным 1g перед опытом необходимо
либо диализовать против 0,85%-ного NaCl для удаления буфе-
ра, либо использовать в виде концентрированного раствора
(более 1 мг/мл по белку). В последнем случае объем буфера,
добавляемого вместе с антителами к эритроцитарной взвеси,
настолько мал, что не в состоянии помешать реакции присоеди-
нения.
3. Методика сенсибилизации эритроцитов антителами с по-
мощью хлорного хрома вполне надежна при условии, если ис-
пользуются ЭБ, при первоначальном отмывании которых не
произошел гемолиз. Мы обычно берем для сенсибилизации ЭБ,
взятые и выдержанные в растворе Олсвера при 4 °C в течение
2—3 нед.
3.4. Разделение клеток
3.4.1. Стандартный метод
Все этапы разделения проводят при 4 °C.
1. К Ю9 отмытых и осажденных центрифугированием лимфо-
идных клеток добавляют примерно 50 мкг моноклональных ан-
82
СУБПОПУЛЯЦИН ЛИМФОЦИТОВ
тител (здесь и ниже речь идет о мышиных моноклональных
антителах). Если антиген-позитивные клетки составляют лишь
малую часть разделяемой взвеси, можно взять пропорциональ-
но меньшее количество антител.
2. Инкубируют 1 ч.
3. Клетки отмывают дважды в PBSAB, содержащем 0,2%
БСА, либо в другой подходящей для этой цели среде.
4. Ресуспендируют клетки в 10 мл PBSAB/БСА. Несколько
миллионов маркированных клеток оставляют для последующе-
го анализа (см. ниже).
5. Основную часть клеточной взвеси вместе с 10 мл 5%-ной
суспензии ЭБ, нагруженных кроличьими антителами к мыши-
ным 1g (разд. 3.3), переносят во флакон объемом 20 мл с
завинчивающейся крышкой. Если для маркирования клеток на
первом этапе были использованы моноклональные антитела
животных другого вида (не мыши), то эритроциты должны быть
нагружены кроличьими антителами к иммуноглобулинам имен-
но этого вида животного.
6. Во флакон доливают PBSAB/БСА так, чтобы между уров-
нем жидкости и крышкой осталось воздушное пространство
объемом примерно 0,5 мл.
7. Содержимое флакона тщательно перемешивают, перевора-
чивая его вверх дном несколько раз в течение 20 мин в холод-
ной комнате при 4 °C.
8. Флаконы центрифугируют при 160g 45 с и собирают над-
осадочную фракцию, содержащую антиген-негативные клетки.
9. Если требуется увеличить выход антиген-негативных кле-
ток, то осадок осторожно ресуспендируют пастеровской пипет-
кой и заполняют флакон, как описано выше (п. 6). Содержимое
флакона вновь перемешивают, переворачивая его вверх дном в
течение 10 мин для восстановления тех агрегатов, которые
распались при пипетировании.
10. Центрифугируют флакон точно так же, как описано вы-
ше (п. 8), и собирают надосадочную фракцию.
11. Надосадочные фракции от двух центрифугирований объе-
диняют и центрифугируют вновь для осаждения антиген-нега-
тивных клеток. Примесь эритроцитов устраняют гемолизом в
растворе хлористого аммония или в дистиллированной воде
(гипотонический шок).
12. Выделенные клетки отмывают PBSAB/БСА и подсчиты-
вают. Одноступенчатое разделение дает выход 60%, двухступен-
чатое— 80%. Такой выход имеет место лишь в том случае, если
жизнеспособность исходной взвеси близка к 100%. При лизисе
с помощью гипотонического шока помимо эритроцитов устраня-
ются также погибшие и поврежденные клетки. В результате
при низкой жизнеспособности исходной клеточной взвеси про-
исходит пропорциональное падение выхода разделенных клеток:
6* 83
ГЛАВА 2
Рис. 2.5. Одновременное устранение из клеточной взвеси нескольких типов
клеток. Устранение В- и CD4+ Т-клеток из взвеси лимфоцитов грудного про-
тока крысы путем розетирования (разд. 3.4.1). Лимфоциты проинкубировали
в смеси моноклональных антител к х-цепям иммуноглобулинов (MRC ОХ-12)
и к CD4 (неконкурирующие МКА W3/25 и MRC ОХ-35) крысы. Образцы лим-
фоцитарной взвеси до и после разделения анализировали в цитофлуорографе
FACS (Becton Dickinson Immunocytometry Systems, CHIA). Результаты и де-
тали расчетов представлены в табл. 2.1. А. Гистограмма взвеси лимфоцитов
до разделения. После инкубации с МКА клетки обрабатывали конъюгатом
флуоресцеина с Р(аЬ')2-фрагментами кроличьих антител к иммуноглобулинам
мыши. По шкале ординат нанесена частота клеток, по шкале абсцисс — яр-
кость флуоресценции в логарифмическом масштабе. ФЛ1—яркость свечения
флуоресцеина. Яркость свечения 74,4% клеток превышает уровень, отмеченный
на графике вертикальной линией. Б. Гистограмма взвеси лимфоцитов после
разделения. Маркирование произведено теми же реагентами. Только 0,8% кле-
ток имеют яркость флуоресценции, превышающую отмеченный уровень. В. Ги-
стограмма взвеси лимфоцитов до разделения. Клетки маркировали МКА MRC
ОХ-8 к антигену CD8. Этот антиген выявлен у 23,3% клеток. Г. Гистограмма
взвеси лимфоцитов после разделения. Антигеи CD8 выявлен у 90,8% клеток.
Следует отметить, что в результате устранения В- и CD4+ Т-клеток произошло
и увеличение числа клеток «нулевой» популяции с 2,3 до 9,2%.
13. Для контроля чистоты выделенных клеток отобранный
образец клеточной взвеси инкубируют с флуоресцеиновым
конъюгатом F(ab') 2-фрагментов кроличьих антител к мышиным
Ig. Долю маркированных клеток определяют затем с помощью
84
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
Таблица 2.1. Цитофлуорографический анализ взвеси клеток грудного
лимфатического протока крысы после одновременного удаления В- и CD4-
Т-клеток методом розетирования
Исследуем ый образец Общее число клеюк ХЮ-7 Содержание клеток < J 11аблюдас,- МЫН выход клеток') ((\,)
или CD4+ CD8+ «11 . л 1 вые» 1)
До розети- рования 26,4 74.4 23,3 2.3
После розе- тирования 4,8 0.8 90,8 9.2-* 71
!) Содержание нулевых клеток рассчитывали как 100—(74,4-г 13..,) 2.5 ( ,)
2 зх 100
2) Расчетная величина, вычисленная как —----------=9,0 (%).
(ЮО—74.4)
3) Выражен, в % от теоретически максимального выхода, т. о. от ожидаемою вы^одл
без потерь, рассчитанного как 26.4Х Ю'Х ———1 ^6,76X107.
100
люминесцентной микроскопии или проточной цитофлуорогра-
фии.
14. Заранее оставленный образец исходной клеточной взвеси
маркируют одновременно с выделенными клетками и определя-
ют долю антиген-позитивных клеток.
15. Если нельзя провести проточную цитофлуорографию
сразу после разделения клеток, взвесь можно зафиксировать
1%-ным формалином и хранить несколько дней при 4 °C. Для
этого маркированные клетки ресуспендируют в 0,5 мл раствора
PBSAB/BCA с 10 мМ азида натрия и добавляют 0,5 мл 2%-ного
формалина в PBS. Перед использованием pH 2%-ного форма-
лина доводят до 7,2 несколькими каплями (на 100 мл) 1 М
НС1. Такой раствор формалина может храниться довольно
долго.
16. Инкубируя клеточную взвесь со смесью моноклональных
антител различной специфичности, можно розетированием уда-
лить одновременно несколько фенотипически различных кле-
точных субпопуляций. Результаты такого разделения представ-
лены на рис. 2.5 и в табл. 2.1.
3.4.2. Удаление из суспензии редко встречающихся
клеток
Если подлежащие удалению клетки составляют менее 20%,
то методика розетирования модифицируется, чтобы сделать бо-
лее адекватными условия агрегации.
1. Точно воспроизводят все этапы методики розетирования,
описанные выше, вплоть до 20-минутного перемешивания взвеси
85
ГЛАВА 2
клеток с эритроцитами (разд. 3.4.1, и. 7). На данном этапе
клетки, связавшие моноклональные антитела, образуют розет-
ки с сенсибилизированными ЭБ. Однако образовавшихся розе-
ток слишком мало для агрегации.
2. Половину содержимого 20-миллилитрового флакона пере-
носят в другой такой же флакон. В оба флакона добавляют
по 5 мл 5%-ной взвеси ЭБ, нагруженных мышиными иммуно-
глобулинами. Затем флаконы заполняют раствором PBSAB/
/БСА, оставив, как описано выше, примерно 0,5-миллилитровый
воздушный пузырь под крышкой.
3. Повторно перемешивают взвесь, переворачивая флакон
вверх дном в течение 20 мин. Розетки, образованные на первом
этапе, коагрегируют с ЭБ/ЭБ розетками. Возникшие коагрегаты
могут быть устранены дифференциальным центрифугированием
(160 g, 45 с), как описано в стандартном методе.
3.4.3. Прямое розетирование
Если исследователь располагает достаточным количеством
антител к поверхностным клеточным антигенам, то именно их
можно непосредственно присоединить к ЭБ. Это могут быть
моноклональные антитела из асцитической жидкости или очи-
щенные иммуносорбцией поликлональные антитела.
Метод прямого розетирования в точности повторяет стан-
дартный, но, разумеется, без этапа инкубации клеток с моно-
клональными или поликлональными антителами к поверхност-
ным антигенам клеток. Прямое розетирование в меньшей сте-
пени, чем стандартный метод, подходит для одновременного
удаления клеточных субпопуляций, относящихся к нескольким
различным фенотипам, и не может применяться для устранения
редко встречающихся клеток. Но во всех остальных случаях
прямое розетирование используется довольно успешно [5].
3.5. Разделение клеток розетированием
для последующей эксплантации
Метод образования розеток можно легко воспроизвести в
стерильных условиях, обычных для культивирования тканей.
Раствор хлорного хрома, обладающий собственными бактери-
цидными свойствами, не нуждается в стерилизующей фильтра-
ции.
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
4. Разделение лимфоцитов на поверхности
пластика, нагруженной антителами
к иммуноглобулинам («пэннинг»)
В основу метода положена обнаруженная ранее [6] способ-
ность поверхности полистирола адсорбировать белки, в частно-
сти антитела с частичным сохранением антигенсвязывающей
активности. В последующем этот феномен стал широко исполь-
зоваться для разделения субпопуляций лимфоцитов [7, 8].
4.1. Принцип
Разделяемую гетерогенную взвесь лимфоцитов вносят в пла-
стиковую чашку Петри и оставляют для оседания клеток на дно,
покрытое соответствующими антителами. В результате антиген-
позитивные клетки связываются с пластиком, а антиген-нега-
тивные легко удаляются путем слива клеточной взвеси (отри-
цательная селекция). Затем, осторожно смыв неприлипшие
клетки, энергичным пипетированием собирают антиген-позитив-
ные клетки (положительная селекция). Для облегчения элюции
прилипших клеток применяют некоторые реагенты (см. разд.
4.2.1).
Чаще всего лимфоциты вначале инкубируют со специфиче-
скими к субпопуляционным антигенам моноклональными анти-
телами (или смесью таких антител), а затем фракционируют
клетки на чашках Петри, дно которых покрыто очищенными
иммуносорбцией антителами к иммуноглобулинам соответствую-
щего вида. В результате лимфоциты, связавшие моноклональ-
ные антитела, прикрепляются к пластику через мостики, обра-
зованные моноклональными и антииммуноглобулиновыми анти-
телами (непрямой метод). При наличии высокоочищенных
поликлональных антител к субпопуляционным антигенам их
можно непосредственно адсорбировать на чашках Петри (пря-
мой метод).
4.2. Методы
В этом разделе излагаются примеры фракционирования
лимфоцитов путем отрицательной и положительной селекции.
4.2.1. Выделение В-клеток прямым методом путем
положительной селекции
Лучше использовать полистироловые чашки Петри 100Х
Х15 мм для бактериологических целей (Sterilin Ltd., Велико-
британия) , поскольку к пластику, предназначенному для куль-
87
ГЛАВА 2
туры тканей, клетки могут проявлять повышенную неспецифи-
ческую адгезивность.
1. В каждую чашку вносят по 8 мл PBS, содержащего
10 мкг/мл очищенных иммуносорбцией антител к иммуноглобу-
линам соответствующего вида, и оставляют на ночь при 4°С
для адсорбции.
2. Сливают раствор антител и дважды обмывают чашку.
3. В каждую чашку вносят по 5 мл PBS с 0,2% БСА и
оставляют на 30 мин при комнатной температуре. БСА насы-
щает оставшиеся свободными поверхностные структуры пласти-
ка, связывающие белки. Это необходимо для снижения неспеци-
фической адгезии клеток.
4. Однократно обмывают чашки 5—10 мл PBS и вносят в
каждую по 2—4-Ю7 клеток, суспендированных в 4 мл PBS
с 0,2% БСА. Инкубируют 45 мин при 4 °C. По истечении поло-
вины срока инкубации содержимое чашек осторожно перемеши-
вают круговым движением.
5. Неприлипшие клетки ресуспендируют легким круговым
движением чашки и сливают. В сливаемой взвеси содержатся
Т-клетки, для выделения которых ее сохраняют (см. разд. 4.2.3).
6. Клетки, прилипшие к пластику, трижды обмывают охлаж-
денным PBS с 0,2% БСА, осторожным движением заставляя
жидкость в чашке двигаться по кругу. Обмывающий р-аствор
вносят в чашку постепенно по боковой стенке, а затем сливают.
7. В каждую чашку добавляют по 4 мл подогретой 10%-ной
нормальной сыворотки в РВС и инкубируют 30 мин при 37 °C.
Видовая принадлежность сыворотки и разделяемых клеток дол-
жна быть одинакова. Содержащиеся в ней иммуноглобулины в
результате конкуренции уменьшают прочность связывания анти-
Ig с 1g клеточной поверхности.
8. Нормальную сыворотку сливают и в каждую чашку вно-
сят примерно по 40 мл охлажденного PBS с 0,2% БСА. Энер-
гично пипетируя параллельно поверхности пластика, стараются
механически (т. е. гидродинамическим усилием) нарушить
сцепление между ним и клетками.
9. Суспендированные клетки отмывают, подсчитывают и
анализируют на чистоту, как описано в разд. 2.1.
10. Отметим, что при положительной селекции выход элюи-
рованных клеток зависит от прочности адгезии клеток к пласти-
ку, которая в свою очередь определяется авидностью препарата
антител к иммуноглобулинам. В том случае, если наблюдаемый
выход низок (т. е. менее 50% от теоретически максимально
возможного), перед нанесением на чашки можно попытаться
разбавить анти-Ig неимунным 1g. Целесообразно, чтобы кон-
центрация нормального IgG в 10 и более раз превышала кон-
центрацию специфического IgG.
8S
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
11. Для увеличения выхода элюированных клеток рекомен-
дуется также проводить заключительную инкубацию с раство-
ром ксилокаина (4 мг/мл) в течение 15 мин при комнатной^
температуре [9].
Типичный пример положительной селекции крысиных В-кле-
ток представлен в табл. 2.2.
4.2.2. Выделение В-клеток непрямым методом путем
отрицательной селекции
По этой методике из смешанной клеточной популяции на
чашках, покрытых анти-Ig, устраняют Т-клетки. Для этого
необходимо сенсибилизировать Т-клетки специфическими поли-
клональными или моноклональными антителами.
1. Покрывают антителами чашки Петри, как описано выше
(разд. 4.2.1). При этом используют очищенные аффинной сорб-
цией антитела к иммуноглобулинам той видовой принадлежно-
сти, к которой относятся используемые антитела к Т-клеткам.
Анти-Ig необходимо тщательно абсорбировать для снижения
концентрации антител, перекрестно реагирующих с поверхност-
ными 1g В-клеток (см. разд. 3.3).
2. Клетки сенсибилизируют антителами к Т-лимфоцитам.
В каждую чашку вносят по 2—4-Ю7 клеток, суспендированных
в 4 мл PBS, содержащем 10% нормальной гомологичной сыво-
ротки, которая исчерпывающе блокирует остаточную перекрест-
ную анти-Ig активность.
3. Инкубируют при 4 °C в течение 45 мин, однократно пере-
мешивая взвесь легким круговым движением по истечении по-
ловины этого срока. Сливают неприлипшие клетки.
4. Для увеличения выхода В-клеток в чашки вносят по
20 мл охлажденного PBS с 0,2% БСА и обмывают их осторож-
ными круговыми движениями, дополнительно собирая остав-
шиеся неприлипшие В-клетки. Обе фракции В-клеток объеди-
няют.
5. Отмывают клетки в PBS с 0,2% БСА, подсчитывают и
анализируют на чистоту, как описано выше (см. табл. 2.2).
4.2.3. Очистка Т-клеток и их субпопуляций
путем последовательного пэннинга
Если при положительной селекции В-клеток (как описано в
разд. 4.2.1) собирать неприлипшие клетки, то такой подход
можно назвать методом негативной селекции Т-клеток и пред-
варительным этапом выделения субпопуляций Т-клеток. Дан-
ный метод довольно эффективен, поскольку удаление большей
части В-клеток повышает чистоту целевых клеточных фракций.
Для разделения Т-клеток на субпопуляции можно сначала про-
89
ГЛАВА 2
Таблица 2.2. Фракционирование лимфоцитарных суспензий путем адсорбции
на пластиковых чашках («пэииииг»)
Варианты метода Образец взвеси клеток, иссле- дуемый в си- стеме Общее чис- ло клеток ! ХЮ" 1 Содержание антиген-пези- тнввых клеюк'’) Паблюдае- чын выход клеток1)
ь А Q Д С и
А. Выделение В-кле- ток: ЛГП до разде- ления 8 46,8 54,7 н.о.-’ н.о.
1. Положительная селекция* 2 3' после адсорб- ции 1,9 96.9 3,3 Н .0. н.о. 50
2. Отрицательная селекция4 5' после адсорб- ции 2,9 94,5 5,6 н.о. н.о. С.9,4
Б. Выделение Т-кле- ток двухцикловой ЛГП до разде- ления 40 53,1 Я. О. 30,6 16,2
отрицательной се- лекцией: 1. Первый цикл (адсорбция В-клеток)6 7' после адсорб- ции 23 7.1 И.О. 58.6 34.8 1 (’8
2. Второй цикл (адсорбция суб- Г-клетки до разделения 10 7,1 н.о. 58,6 34.8
популяций Т-клеток)7) после адсорб- ции CD8 3,6 2,7 и. о. 94,1 3,2 58
после адсорб- ции CD4 2,4 10,0 н.о. 9,1 80,8 61
') В % от теоретически возможного (без потерь) выхода.
2) «Не определяли».
3) Лимфоциты грудного протока (ЛГП) крысы фракционировали на чашках Петри,
покрытых антителами к крысиным 1g. После инкубации взвесь неприлипших Т-клеток
сливали. Прилипшие В-клетки собирали энергичным пипетированием. Образцы взвеси
до и после адсорбции исследовали в системе FACS (Becton Dickinson, Immunocytometry
Systems. США).
4) Т-клетки, сенсибилизированные анти-CDS (MRC OX-8) моноклональными антите-
лами или смесью двух образцов неконкурирующих анти-СП4 моноклональных антител
(MRC ОХ-35 и W3/25), удаляли из суспензии пэннингом на чашках Петри, покрытых
кроличьими антителами к IgG мыши. В результате концентрация В-клеток в сливаемой
взвеси повышалась.
5) В % от общего числа Т- или В-клеток в соответствующих взвесях.
6) Первый цикл удаления В-клеток проводили путем адсорбции на чашках Петри, по-
крытых кроличьими антителами к крысиным 1g. как описано выше в примечании 3.
7) Т-клетки, выделенные, как описано выше в примечании 4. инкубировали со смесью
моноклональных антител либо MRC OX-8. MRC ОХ-12 и MRC ОХ-6 (для устранения
CD8+ и оставшихся В-клеток), либо W3/25, MR С ОХ-35 и MRC ОХ-6 (для устранения
CD4+- и оставшихся В-клеток), а затем адсорбировали сенсибилизированные клетки на
чашках Петри, покрытых кроличьими антителами к мышиным 1g. Эти антитела были
выделены иммуносорбцией на колонке иммобилизованных иммуноглобулинов крысы и
поэтому являются полностью перекрестно реагирующими, что и способствует одновре-
менному удалению крысиных В-клеток.
90
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
инкубировать взвесь с насыщающим количеством соответствую-
щих субпопуляционно-специфических моноклональных антител,
а затем фракционировать клетки на чашках, покрытых антите-
лами к 1g. Нужную субпопуляцию Т-клеток выделяют либо
положительной, либо отрицательной селекцией. Результаты ти-
пичного примера двухцикловой отрицательной селекции при
выделении субпопуляций Т-лимфоцитов крысы представлены в
габл. 2.2.
4.3. Общие замечания
Прямой метод менее универсален, чем непрямой, поскольку
гребует очистки используемых субпопуляционно-специфических
антител. Это чаще всего моноклональные антитела, и при по-
становке непрямого метода их можно применять в виде неочи-
щенной культуральной жидкости, в которой росла гибридома.
Кроме того, непрямой метод позволяет применять смесь антител
и одновременно маркировать, а также удалять из взвеси клетки
нескольких фенотипов. Но в некоторых случаях прямой метод
представляется более адекватным, например, для положитель-
ной селекции В-клеток на чашках, покрытых антителами к 1g.
С помощью пэннинга можно выделять из гетерогенной сме-
си как малые, так и большие клеточные популяции. При этом,
используя даже поликлональные антитела, удается добиться
чистоты 95% и выше [8]. В то же время применение монокло-
нальных антител в ряде случаев дает менее удовлетворительные
результаты [10]. Второй цикл адсорбции, как правило, увели-
чивает чистоту разделяемых фракций. В оптимальных условиях
фракционирования выход клеток приближается к теоретически
возможному, однако чаще всего составляет 50—70% от него.
5. Разделение субпопуляций лимфоцитов путем
комплемент-опосредованного цитолиза
Экспрессия на поверхности лимфоцитов субпопуляционно-
специфических антигенов лежит в основе данного метода от-
рицательной селекции, который часто применяется для выде-
ления различных субпопуляций лимфоцитов. Правда, компле-
мент-опосредованный цитолиз воспроизводится только с анти-
телами, которые связывают комплемент. Среди известных в
настоящее время моноклональных антител к поверхностным
антигенам крысиных лимфоцитов лишь небольшая часть связы-
вает комплемент. Следовательно, остальные моноклональные
антитела могут использоваться только в альтернативных мето-
дах фракционирования клеток. Однако, несмотря на это огра-
91
ГЛАВА 2
ничение, метод комплемент-опосредованного цитолиза имеет
ряд преимуществ. Он менее трудоемок и более прост, чем другие
методы разделения лимфоцитов, описанные в этой главе. На
других ограничениях комплемент-опосредованного цитолиза, на
которые следует обратить внимание перед его применением, мы
остановимся ниже (см. разд. 5.2).
5.1. Конкретное описание метода
5.1.1. Реагенты и оборудование
1. Разделяемая клеточная взвесь, приготовленная, как описа-
но в гл. 1.
2. Среды. Комплемент-опосредованный цитолиз можно прово-
дить в сбалансированных солевых растворах или минимальной
основной среде, но не в PBS, лишенном Са2+ и Mg2+. Для
отмывания клеток после цитолиза используют полные среды для
культуры тканей, содержащие 5% прогретой СПК или гомоло-
гичной сыворотки, либо 0,2% БСА.
3. Соответствующие клеточно-специфические антитела.
4. В качестве источника комплемента используют свежую
или лиофилизированную нормальную сыворотку кролика или
морской свинки. Нелиофилизированную сыворотку следует хра-
нить замороженной при —70°C.
5. Водяная баня на 37°C.
5.1.2. Одноэтапный вариант метода
1. Ресуспендируют клетки в подогретой до 37 °C среде, со-
держащей соответствующие разведения антител и комплемента.
Эти разведения устанавливают путем предварительного титро-
вания, взяв, например, надосадочную культуральную жидкость
с моноклональными антителами в разведении 1 :4, комплемент
в конечном разведении от 1 :4 до 1 : 10, а концентрацию разде-
ляемых клеток— 108 в мл.
2. Инкубируют при 37 °C в течение 45—60 мин, периодически
перемешивая осторожным встряхиванием.
3. Клетки осаждают центрифугированием и дважды отмыва-
ют полной культуральной средой, содержащей 5% инактивиро-
ванной нагреванием СПК или гомологичной сыворотки (либо
0,2% БСА).
4. Определяют жизнеспособность и чистоту полученной кле-
точной взвеси доступными методами.
5.1.3. Двухэтапный вариант метода
1. Ресуспендируют клетки до концентрации 5-Ю6—1 -107кле-
ток/мл в среде, содержащей соответствующее разведение анти-
тел. Для предотвращения кэппинга можно добавить в среду
92
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
азид натрия (см. разд. 5.2, п. 2), но это необязательно, если
клетки сохраняют при 4°C.
2. Инкубируют при 4 °C в течение 30 мин, периодически
осторожно встряхивая.
3. Клетки осаждают центрифугированием и, однократно от-
мыв охлажденной средой, ресуспендируют в первоначальном
объеме подогретой до 37 °C среды, содержащей комплемент в
соответствующем разведении.
4. Инкубируют при 37 °C в течение 45 мин, периодически ос-
торожно встряхивая.
5. Клетки осаждают центрифугированием, а затем дважды
отмывают полной культуральной средой, содержащей 5% сыво-
ротки или 0,2% БСА.
6. Определяют жизнеспособность и чистоту выделенных кле-
ток доступными методами.
5.2. Практические и теоретические соображения
1. С равным успехом можно воспользоваться как одноэтап-
ным, так и двухэтапным вариантом метода, но последний целе-
сообразнее использовать при антикомплементарности применяе-
мого препарата антител. (Большинству препаратов монокло-
нальных антител эта активность не свойственна.) Антиком-
плементарность выявляется при предварительном титровании
реагентов.
2. Присоединение антител к некоторым поверхностным кле-
точным антигенам вызывает кэппинг. Чтобы его предотвратить,
применяют двухэтапный вариант метода, при котором антите-
ла добавляют в клеточную взвесь при 4 °C без или вместе с
10 мМ азида натрия. Избыток антител и азид натрия затем
удаляют при отмывании до внесения комплемента и инкубации
при 37 °C. Поэтому они не должны влиять на жизнеспособность
нелизированных клеток. Отметим, что кэппинг не происходит
под действием моноклональных антител к мономерному антиге-
ну, поскольку при этом невозможно образование многочислен-
ных перекрестных связей между мембранными белками и анти-
телами.
3. В предварительном титровании необходимо определить оп-
тимальные (т. е. достаточно активные, но нетоксичные) рабочие
концентрации всех реагентов. Высокий уровень фоновой ток-
сичности комплемента может быть обусловлен натуральными
антителами. Его удается снизить, истощая комплемент агаром
[11] или соответствующей тканью (например, клетками селе-
зенки). Однако истощение, особенно тканью, приводит к паде-
нию активности комплемента, поэтому данный подход лучше
не использовать. Целесообразнее, испытав ряд серий компле-
93
ГЛАВА 2
мента, выбрать из них одну, наименее токсичную. Кроме того,
имеются коммерческие препараты заведомо нетоксичного
комплемента, например, фирмы Cedarlane Laboratories Ltd.,
Канада. В качестве источника комплемента свежая сыворотка
всегда лучше замороженной или лиофилизированной. Кроличья
сыворотка лучше сыворотки морской свинки для реакции ци-
толиза, который вызывается большинством препаратов мыши-
ных моноклональных антител к антигенам лейкоцитов человека.
4. Постановка опыта должна включать контрольные пробы,
содержащие неполный набор реагентов. Это — клетки, инкуби-
руемые с антителами, но без комплемента; клетки с комплемен-
том, но без антител и клетки без того и без другого.
5. Важно обратить внимание на ограничения метода. В част-
ности, чувствительность клеток к лизису, по-видимому, в значи-
тельной мере обусловлена плотностью антигенов-мишеней на
их поверхности. Клетки, незначительно экспрессирующие кон-
кретный антиген, могут не лизироваться [12, 13]. В этом случае
сохранившуюся после цитолиза часть популяции нельзя отне-
сти к клеткам, не имеющим данного поверхностного маркера.
Эта проблема в ряде случаев может быть решена применением
двух неконкурирующих образцов антител к одному и тому же
антигенному маркеру [13]. При этом молекулы IgG могут свя-
зываться с клеточными антигенами настолько стерически близ-
ко, что этого будет достаточно для активации комплемента и
лизиса клетки.
6. При оптимальных условиях комплемент-опосредованного
цитолиза чистота полученной клеточной взвеси может превы-
шать 95%. Однако, если требуется достичь чистоты 99% и вы-
ше, необходимо комбинировать цитолиз с методами положи-
тельной селекции, например с пэннингом. Этот комбинирован-
ный подход был с успехом использован для получения сверх-
чистых популяций Т-клеток [14]. Во всех случаях, когда это
возможно, мы рекомендуем оценивать чистоту клеточных взве-
сей с помощью проточной цитофлуорографии.
6. Сравнительная оценка различных методов
фракционирования клеток
Все четыре подхода к разделению клеток, описанные в дан-
ной главе, основаны на использовании антител. Однако во всем
остальном они существенно отличаются один от другого и каж-
дый имеет свои особые преимущества и ограничения. Совершен-
но очевидно, что наибольшей разрешающей способностью
обладают клеточные сортеры. С их помощью экспериментатор
может установить, какая именно клетка является антиген-
позитивной, не только по интенсивности флуоресценции, а од-
94
СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ
повременно на основе нескольких (обычно четырех) критериев
идентификации и фракционирования. Правда, клеточные сорте-
ры довольно дороги и имеют низкую препаративную произво-
дительность. Чтобы разделить 5-107 клеток, обычно требуется
затратить вместе с подготовкой клеток более 10 ч.
Розетирование и комплемент-опосредованный цитолиз осно-
ваны на одном и том же принципе — разделении клеток путем
отрицательной селекции. Для цитолиза требуются антитела,
связывающие комплемент, а клетка-мишень в свою очередь
должна быть чувствительна к его литическому действию. Если
эти условия не выполнены, возможны ошибочные результаты.
Например, по данным комплемент-опосредованного цитолиза
долгое время считалось, что CD5 антиген (Lyt 1 у мышей) слу-
жит маркером мышиных Т-хелперов. На самом деле, как теперь
известно, CD5 экспрессируется на всех Т-клетках. Преимущество
розетирования заключается как раз в том, что можно исполь-
зовать антитела, несвязывающие комплемент, а также обойти
проблему избирательной резистентности некоторых клеток к
комплемент-опосредованному цитолизу [12]. Оба этих метода
значительно превосходят проточную цитофлуорографию по пре-
паративной производительности. Розетированием можно раз-
делить до 1010 лимфоцитов крысы за несколько часов.
Иногда целесообразно комбинировать разные методы разде-
ления. Например, для получения максимального выхода суб-
популяций Т-клеток мы вначале розетированием удаляем В-
клетки, а затем проводим сортировку уже очищенных Т-клеток,
маркированных субпопуляционно-специфическимн моноклональ-
ными антителами. В других случаях оказывается эффективной
комбинация розетирования или комплемент-опосредованного
лизиса (для отрицательной селекции) с пэннингом (для поло-
жительной селекции).
Мощная аналитическая способность клеточных сортеров де-
лает метод проточной цитофлуорографии наиболее информа-
тивным для оценки чистоты клеточных популяций, выделенных
любым из известных методов. Мы настоятельно рекомендуем
применение аналитической сортировки клеток всем, кому до-
ступно это оборудование.
Литература
1. Loken М. R. (1986). In: Monoclonal Antibodies, Beverley P. C. L. (ed.),
Churchill Livingstone, Edinburgh, London, Melbourne and New York. p. 132.
2. Mason D. W., Rackley ]. P.t Smith D. T, (1985). In: Flow Cytometry: In-
strumentation and Data Analysis, Visser J. W. M. and Tanke H. J. (eds.),
Academic Press, London, p. 240.
3. Mason D. IV, Williams A. F. (1980). Biochem. J., 187, 1.
4. Parish C„ Hayward J. (1974). Proc. R. Soc. Loud. (Biol.), 187, 47
95-
ГЛАВА 2
5. Mason D. W. (1981). Transplantation, 32, 222.
6. Catt K., Tregear G. W. (1967). Scince, 158, 1570.
7. Mage M. G., McHugh L. L., Rothstein T. L. (1977). J. Immunol. Methods,
15, 47.
8. Wysocki L. J„ Sato V. L. (1978). Proc. Natl. Acad. Sci. USA, 75, 2844.
9. Lewis G. K., Karnin R. (1980). In: Selected Methods in Cellular Immunolo-
gy, Mishell В. B. and Shiigi S. M. (eds.), W. H. Freeman and Co., San
Francisco, p. 227.
10. Rosenberg J. S., Gilman S. C., Feldman J. D. (1982). J. Immunol., 129, 996.
11. Cohen A., Schlesinger M. (1970). Transplantation, 10, 130.
12. Ledbetter J. A., Rouse R. V., Micklem H. S„ Herzenberg L. A. (1980). J. Exp.
Med., 152, 280.
13. Howard J. C., Buther G. IF., Galfre G., Milstein C., Milstein С. P. (1979).
Immunol. Rev., 47, 139.
14. Sprent L, Schaefer M. (1985). J. Expl. Med., 162, 2068.
Глава 3
ФРАКЦИОНИРОВАНИЕ ЛИМФОЦИТОВ ПРИ
ПОМОЩИ ИММУНОМАГНИТНЫХ МИКРОБУС
С. Фундеруд, X. Нустад, Т. Ли, Ф. Вартдаль,
Г. Гейдернек, П. Стенстад, И. Угельстад
1. Введение
1.1. Полимерные магнитные микробусы стандартного
размера
Широкое использование магнитных частиц для разделения
клеток началось лишь недавно благодаря работам Угельстада
и сотр. (Ugelstad et al.) [1—3], которым удалось создать новое
поколение полимерных парамагнитных носителей. Свойства
этих новых магнитных микробус вполне позволяют использовать
их для фракционирования клеток.
Размеры микробус и содержание в них ферромагнетика
влияют самым непосредственным образом на эффективность им-
муномагнитного разделения клеток. Микробусы должны лег-
ко суспендироваться в воде, прочно и необратимо адсорбировать
на своей поверхности соответствующие избирательному фрак-
ционированию клеток антитела и не прилипать к клеткам не-
специфически.
Для успешного разделения клеток с помощью иммуномагнит-
ных микробус чрезвычайно важно, чтобы микробусы после
воздействия магнитного поля не проявляли остаточной намаг-
ниченности. На практике это означает, что они должны быть
суперпарамагнитными. В процессе присоединения антител к
поверхности полимера микробусы многократно осаждают маг-
нитом, отмывают и вновь суспендируют. Любая остаточная
намагниченность быстро приведет к утрате необходимой легко-
сти ресуспендирования.
Полимерные магнитные микробусы, полностью соот-
ветствующие перечисленным выше требованиям, были по-
лучены с помощью особой технологии, при которой оксид и гид-
роксид магнитного железа постепенно образуются прямо в по-
рах высокопористого полимера, из которого формуются шарики,
чрезвычайно сходные по размерам [2]. После заключительного
прогревания все микробусы не только имеют строго одинаковые
размеры, но и содержат идентичное количество маггемита
(д-РегОз). Благодаря тому что маггемит равномерно распреде-
ляется в виде мельчайших гранул по всему объему шарика,
микробусы обладают необходимыми суперпарамагнитными свой-
ствами.
7—172
£7
ГЛАВА 3
Put. 3.1. Микрофотография суперпарамагнитных микробус «Дюнабидс М-450»,
полученная с помощью сканирующей электронной микроскопии (2800Х).
После образования в порах микробус у-Ре20з значительная
часть высокопористой структуры полимера еще остается неза-
полненной, образуя поверхность около 100 м2/г. Именно в такой
форме микробусы использовались в первых исследованиях
[4]. Однако в дальнейшем для разделения клеток стали приме-
нять микробусы с порами, заполненными полимерным материа-
лом [5—7], который химически связывался с образующим
микробусы полимером, что значительно снизило свободную по-
верхность до 3—5 м2/г.
Электронно-микроскопическое изображение таких микробус
представлено на рис. 3.1.
1.2. Общие принципы разделения лимфоцитов
В последние 10 лет был разработан ряд новых методов из-
бирательного выделения лимфоцитов и их субпопуляций.
Некоторые из этих методов описаны в данной книге. В основе
выделения лежат два главных принципа.
98
ФРАКЦИОНИРОВАНИЕ НА ИММУПОМЛГП1П ПЫХ МПКРОБУСАХ
1. Разделение по физическим свойствам, например по размерам
или плотности.
2. Разделение по клеточно-специфическим рецепторам или по-
верхностным антигенам (см. гл. 2).
Лишь второй принцип разделения позволяет выделять относи-
тельно чистые субпопуляции лимфоцитов. При наличии моно-
клональных антител разной специфичности, применяя соответст-
вующий метод, можно получить максимально очищенные взвеси
клеток с удовлетворительным выходом. При этом следует обра-
тить внимание на следующие моменты. Прежде всего необхо-
димо выбрать тактику разделения — отрицательную или поло
жительную селекцию. Этот выбор имеет особое значение, если
после разделения исследуются функциональные свойства кле-
ток. В каждом отдельном случае он зависит, в частности, от
того, насколько хорошо нам известны функциональные свойства
тех рецепторов или антигенов, которые служат критерием раз-
деления. В этой главе описаны некоторые методы, основанные
на положительной селекции. Это — выделение субпопуляций
Т-клеток, несущих антигены CD8 и CD25, а также В-клеток,
несущих антигены CD19 и CD37. Показано, что выделенные
клетки вполне пригодны для функциональных исследований.
Кроме того, описаны методы выделения субпопуляций лимфо-
цитов путем отрицательной селекции. В качестве иммуномагнит-
ных носителей были использованы микробусы «Дюнабидс
М-450» фирмы Dynal А/S (Норвегия) из суперпарамагнитного
полимера, нагруженные при помощи адсорбции или ковалент-
ной связи моноклональными или поликлональными антителами.
Иммуномагнитные микробусы позволяют легко осуществить
либо положительную, либо отрицательную селекцию нужных
клеток как во взвеси лейкоцитов, так и непосредственно в цель-
ной крови. Оба типа селекции можно провести двумя способа-
ми:
1. Непрямой метод — клетки вначале инкубируют с мышины-
ми моноклональными антителами, а затем розетируют микро-
бусами, нагруженными антителами к мышиному IgG.
2. Прямой метод — клетки сразу инкубируют с микробусами,
нагруженными антителами к клеточным антигенам или рецеп-
торам.
Конкретные приложения прямого и непрямого методов обсуж-
даются в разд. 3.1 и 3.2.
Мы не приводим здесь микрофотографий розеток, которые
клетки образуют с микробусами. Читатель найдет их в лите-
ратуре [7].
Данная глава посвящена иммуномагнитному разделению
лимфоцитов человека, однако при помощи микробус «Дюнабидс
М-450» можно с тем же успехом фракционировать клетки дру-
гих типов.
7
99
ГЛАВА 3
2. Реагенты и приборы
2.1. Среды и посуда для культивирования клеток
Можно использовать обычные среды для культуры ткани,
сбалансированные солевые растворы, сыворотку плода коровы
(СПК) и пластиковую посуду любой из известных фирм.
2.1.1. Приборы
1. Магниты и специальные устройства. Постоянные магниты,
изготовленные из сплава кобальта и самария, можно приобре-
сти у многих поставщиков. В зависимости от диаметра исполь-
зуемых пробирок или флаконов выбирают отличающиеся по
размерам магниты: либо 10X10X3 мм, либо 10x30x6 мм.
Магнит следует поместить на пластинку мягкого железа, бла-
годаря которой усиливается магнитное поле и облегчаются
манипуляции с магнитом. Фирма Dynal А/S (Норвегия) пред-
лагает специальный штатив со встроенными магнитами для
одной или шести пробирок.
2. Смеситель «Рок-н-роллер» (фирма Labinco В. V., Гол-
ландия).
2.1.2. Микробусы «Дюнабидс М-450»
Описанные в разд. 1.1. полимерные частицы в настоящее
время продаются под маркой «Дюнабидс М-450» фирмой Dy-
nal А/S (Норвегия) в виде стерильной взвеси (30 мг/мл) во
флаконах по 2 и 10 мл. Взвесь не нагруженных антителами
микробус приготовлена на воде. Их свойства представлены в
табл. 3.1. В продаже имеются также микробусы «Дюнабидс
Таблица 3.1. Свойства микробус
«Дюнабидс М-450»
Диаметр частиц 4,5 мкм
Плотность 1,5 г/см3
Удельная поверхность 3—5 м2/г
Содержание железа 22% (по весу)
Число частиц на единицу массы 1,4- 1О‘°/г
М-450», нагруженные антителами овцы или козы ко всем под-
классам IgG мыши. Нагруженные микробусы содержат пример-
но 3 мкг антител на 1 мг веса и продаются в виде стерильной
взвеси (30 мг/мл) в забуференном фосфатами 0,15 М растворе
NaCl (PBS) с добавлением 0,1% бычьего сывороточного аль-
бумина (БСА) и 0,01% NaN3 во флаконах по 2 и 10 мл. Перед
присоединением антител поверхность микробус активируется
н-толуолсульфонилхлоридом.
100
ФРАКЦИОНИРОВАНИЕ НА 11ММУНОМАГНЦТНЫХ МИКРОБУСЛХ
2.2. Приготовление антител
2.2.1. Поликлональные антитела к IgG мыши
Целесообразно использовать препараты высокоавидных по-
ликлональных антител к IgG мыши, которые одинаково хорошо
связываются со всеми его подклассами. Предпочтение заслужи-
вают антитела, специфичные к Fc-фрагментам иммуноглобули-
нов. Они должны быть выделены и очищены аффинной сорбцией
на иммобилизованных специфических и перекрестно реагирую-
щих антигенах. Мы обычно устраняем антитела, перекрестно
реагирующие с IgG человека, пропуская исходную антисыворот-
ку через колонку сефарозы 4В, нагруженной этим антигеном с
помощью бромциана. Затем мы наносим антисыворотку на ко-
лонку сефарозы, нагруженной IgG мыши. После этого элюируем
связанную фракцию антител 4М гуанидином в PBS при pH 6,2.
Гуанидин удаляем диализом против PBS (0,15 М NaCl; 0,01 М
натрий-фосфатный буфер, pH 7,4). Раствор антител стерилизу-
ем фильтрованием и храним при 4 °C до присоединения к мик-
робусам.
Можно воспользоваться и коммерческими препаратами ан-
тител. Однако мы рекомендуем провести сравнение самостоя-
тельно нагруженных микробус с коммерческими образцами
«Дюнабидс М-450», нагруженными антителами овцы или козы
к IgG мышц.
2.2.2. Моноклональные IgM
Моноклональные IgM мыши выделяют из асцитической жид-
кости путем осаждения полиэтиленгликолем [8]. Данный ме-
тод представляется наиболее быстрым и простым, хотя и любой
другой метод выделения IgM может дать удовлетворительные
результаты. Осадок IgM растворяют в PBS, стерилизуют
фильтрованием и хранят при 4 °C.
Мы использовали моноклональные IgM к антигену CD8,
которые синтезирует клон ITI-5C2 и IgM к антигену CD 19,
которые синтезирует клон АВ1 [9 и 10].
2.2.3. Моноклональные IgG
Моноклональные IgG можно использовать в виде надосадка
культуральной среды, асцитической жидкости или очищенного
препарата IgG. Их либо присоединяют к поверхности микробус
через антитела к мышиным IgG, какописано в разд. 2.3.3, либо
применяют для сенсибилизации самих клеток, как описано в
разд. 3.1.2 и 3.2.2. Мы располагали следующими антителами:
1. Анти-СЭ37, синтезируемые клоном НН1 [11].
101
ГЛАВА 3
2. Ahth-CD25 (к рецептору интерлейкина-2) фирмы Becton
Dickinson Immunocytometry Systems, CHIA.
2.3. Адсорбция антител на микробусах «Дюнабидс М-450»
Микробусы «Дюнабидс М-450» имеют смешанную гидрофоб-
но/гидрофильную поверхность. Гидрофобные участки образуют-
ся главным образом ароматическими ядрами полимеров и
способствуют адсорбции антител. В то же время гидроксильные
группы полимеров могут быть использованы для ковалентного
присоединения антител. Как правило, для прочного связывания
антител на поверхности микробус достаточно одной лишь высо-
кой адсорбционной активности полимера. Следует отметить, что
в целом адсорбция белков — это зависящее от их структуры
многоточечное взаимодействие с гидрофобной поверхностью
полимера [12]. Мы обнаружили, например, что очищенные аф-
финной сорбцией антитела легче адсорбируются на микробусах,
чем нативный IgG, вероятно, благодаря происходящей во время
выделения частичной денатурации Fc-областей, которая обеспе-
чивает также благоприятную ориентацию антител на поверхно-
сти частиц [5].
Оптимальные результаты адсорбции антител обычно получают при сле-
дующих условиях.
Концентрация частиц 20—50 мг/мл
Концентрация антител 100—400 мкг/мл
Соотношение антител и частиц 2—10 мкг антител на 1 мг частиц
Раствор для адсорбции 0.05—0,1 М Трис-буфер, pH 9,5
Температура 2—8 °C
Время 2—24 ч
В литературе можно встретить описание многих других
вариантов адсорбции, условия которой эмпирически подобраны
для конкретных препаратов антител. Главные объекты варьиро-
вания— это состав буфера, его pH и ионная сила.
Присоединение антител к микробусам, активированным
сульфонилхлоридом, производят в тех же самых условиях. Ак-
тивация увеличивает поверхностную гидрофобность частиц.
В этом случае антитела связываются с полимером в два эта-
па— за адсорбцией следует их химическое присоединение [5].
Заслуживает внимания наша недавняя находка. Мы обнаружи-
ли, что некоторые моноклональные IgM гораздо лучше связы-
вают антиген, если их просто адсорбировать на микробусах,
а не присоединять с помощью н-толуолсульфонилхлорида. В то
же время поликлональные антитела достаточно активны и после
адсорбции, и после ковалентного присоединения. Хими-
ческое присоединение поликлональных IgG, даже нао-
борот, дает примерно на 30% большую емкость
102
ФРАКЦИОНИРОВАНИЕ ПА ИММУИОМАП1ИТНЫХ МИКРОБУСАХ
Таблица 3.2. Адсорбция поликлональных IgG антител
на микробусах «Дюнабидс М-450»
1. Флакон, содержащий 60 мг микробус в 2 мл воды, помещают на магнит
и стерильно шприцем отсасывают воду над слоем частиц.
2. Во флакон добавляют 2 мл 0,05 М трис-HCl буфера, pH 9,0, содержащего
150 мкг/мл поликлональных антител к IgG мыши (разд. 2.2.1), и тщатель-
но перемешивают на смесителе «Вортекс».
3. Помещают флакон в смеситель с вращением в вертикальной плоскости на
ночь при 4 °C.
4. Помещают флакон на магнит и стерильно шприцем удаляют надосадочную
жидкость.
5. Вносят во флакон 2 мл PBS с 0,5% (вес/объем) БСА и смешивают. Через
5 мин флакон помещают на магнит и отсасывают буфер, как указано
в п. 4.
6. Повторяют этап 5 четыре раза.
7. Повторяют этап 5, но перемешивают в течение ночи, используя смеситель
с вращением в вертикальной плоскости.
8. Удаляют последнюю порцию отмывающего буфера и к осадку микробус
добавляют 2 мл PBS с 0,1% БСА и 0.01% NaN3. Приготовленную взвесь
микробус хранят при 4 °C.
связывания растворимых антигенов, чем адсорбция, в
основном за счет увеличения количества антител, конъю-
гированных с микробусами.
Мышиные моноклональные IgG можно непосредственно
адсорбировать на поверхности микробус. Однако в большинст-
ве случаев, по нашим данным, лучшие результаты получаются
при иммуноадсорбции, описанной в разд. 2.3.3.
2.3.1. Адсорбция поликлональных IgG на микробусах
«Дюнабидс М-450»
Методика адсорбции поликлональных антител к IgG мыши
на микробусах изложена в табл. 3.2. Однако, как мы уже реко-
мендовали выше, самостоятельно нагруженные микробусы
следует сравнить с коммерческими образцами «Дюнабидс
М-450» фирмы Dynal А/S, Норвегия, которые нагружены анти-
телами овцы или козы к IgG мыши самим производителем
2.3.2. Адсорбция моноклональных IgG мыши
на микробусах «Дюнабидс М-450»
Моноклональные мышиные IgM следует очистить и адсорби-
ровать непосредственно на микробусах. Нам не удалось найти
такого образца поликлональных антител к IgM мыши, который
обеспечил бы удовлетворительное розетирование микробус вок-
руг клеток, связавших на своей поверхности моноклональные
IgM. В то же время эти моноклональные антитела были весьма
активны после адсорбции непосредственно на поверхности
103
ГЛАВА 3
Таблица 3.3. Иммуноадсорбция моноклональных IgG мыши
на микробусах «Дюнабидс М-450»
1. Помещают на магнит флакон, содержащий 60 мг микробус, нагруженных
антителами к IgG мыши, в 2 мл PBS с 0,1% БСА и 0,01% NaNj. Стериль-
но отсасывают шприцем буфер и добавляют 2 мл PBS.
2. Дважды отмывают микробусы PBS и ресуспендируют в 2 мл PBS.
3. Добавляют к микробусам 120 мкл раствора, содержащего 1 мг/мл моно-
клональных IgG мыши.
4. Инкубируют микробусы при 4 °C в течение ночи, поместив флакон в смеси-
тель с вращением в вертикальной плоскости.
5. Помещают флакон на магнит и удаляют надосадочную жидкость шпри-
цем.
6. Ресуспендируют микробусы в 2 мл PBS, помещают флакон на магнит и
удаляют надосадочную жидкость.
7. Повторяют этап 6 трижды.
8. Ресуспендируют микробусы в 2 мл PBS и хранят при 4 °C.
микробус, что свидетельствует об их достаточно высокой авид-
ности. Для адсорбции можно воспользоваться методикой, пред-
ставленной в табл. 3.2.
2.3.3. Иммуноадсорбция моноклональных IgG мыши
на микробусах «Дюнабидс М-450», нагруженных
антителами овцы или козы к IgG мыши
Методика иммуноадсорбции моноклональных IgG мыши на
микробусах, нагруженных антителами к IgG мыши, представле-
на в табл. 3.3. В качестве препарата моноклональных антител
можно использовать надосадок культуральной среды, асцитиче-
скую жидкость или очищенные антитела. В каждом конкретном
случае приготовления иммуномагнитных микробус необходимо
эмпирически установить оптимальную нагрузку антител на 1 мг
частиц. Для моноклональных IgG она обычно составляет от 0,2
до 3,0 мкг на 1 мг микробус. Время связывания можно сокра-
тить до 1 ч и инкубировать при комнатной температуре. Ко-
нечная взвесь микробус стабильна в течение нескольких меся-
цев при хранении в холодильнике. Со временем небольшая часть
связанных с микробусами антител переходит в раствор. Эти
антитела легко удаляются простым отмыванием микробус. Если
для текущих экспериментов требуется меньшее (чем указанное
в табл. 3.3) количество микробус. в этом случае целесообразно
перенести нужную часть микробус в стерильную пробирку и
провести в ней весь процесс иммуноадсорбции.
3. Разделение лимфоцитов
Выделение лимфоцитов определенной субпопуляции с целью
функционального анализа обычно производят путем последо-
вательного устранения клеток, относящихся к другим субпопу-
104
ФРАКЦИОНИРОВАНИЕ НА ИММУНОМАГНИТНЫХ МИКРОБУСАХ
ляциям. При таком подходе нужные для исследования клетки
не подвергаются воздействию примененных для разделения мо-
ноклональных антител, и вся методика направлена на то, чтобы
оставить их интактными. Согласно нашим данным, выделенные
клетки никогда не проявляют функциональных отклонений [ 11].
Однако даже самое тщательное иммуномагнитное фракциониро-
вание лимфоцитов путем отрицательной селекции не может
обеспечить нужную в определенных случаях гомогенность выде-
ляемой субпопуляции. Например, избирательным устранением
никому не удавалось достичь того уровня чистоты субпопуляций
В-клеток, который требуется для исследования факторов их
роста (см. ниже в разд. 3.1.2). А1етоды разделения лимфоцитов,
основанные на положительной селекции, становятся единственно
возможными в тех случаях, когда экспериментатор располагает
моноклональными антителами лишь к клеткам той субпопуля-
ции, которую нужно выделить. Примеры разделения клеток по
принципу положительной и отрицательной (устранение) селек-
ции описаны в разд. 3.1 и 3.2.
3.1. Методы положительной селекции лимфоцитов
По существу любую популяцию клеток, выявляемую с помо-
щью моноклональных антител определенной специфичности,
можно выделить путем положительной селекции с помощью мик-
робус «Дюнабидс М-450», если будут обеспечены следующие
условия:
1. Данные моноклональные антитела неспецифически не свя-
зываются с клетками других субпопуляций.
2. Аффинность или авидность антител достаточно высока.
3. Плотность соответствующего эпитопа на клетках выделяе-
мой популяции не слишком низка.
Благодаря той быстроте, с которой осуществляется имму-
номагнитное разделение путем положительной селекции, оно
может служить методом выбора для многих экспериментальных
систем. Но возможности методов, основанных на положитель-
ной селекции, ограничены не только необходимостью иметь в
распоряжении нужные моноклональные антитела, специфически
взаимодействующие с определенной популяцией лимфоцитов.
Дополнительное ограничение может быть обусловлено эпитоп-
ной специфичностью этих антител, а именно тем, насколько
вовлечен данный эпитоп в регуляцию различных функций вы-
деляемых клеток. В настоящее время известны многочисленные
структуры клеточной поверхности, так или иначе принимающие
участие в активации лимфоцитов, но, несмотря на вероятность
активации выделяемых клеток, положительная иммуномагнит-
105
ГЛАВА 3
Таблица 3.4. Прямой метод положительной селекции лимфоцитов
из цельной крови
1. Кровь берут в кислый цитратный гемостабнлизатор в 10-миллилитровую
вакуумированную пробирку «Вакутейнер».
2. Охлаждают взятую кровь до 2—8 °C.
3. Непосредственно в кровь добавляют мнкробусы «Дюнабидс М-450», нагру-
женные IgM клонов ITI — 5С2 или АВ1 (см. разд. 2.2.2). На каждый 1 мл
стабилизированной крови добавляют по 0,2 мг микробус.
4. Смесь крови н микробус на 5—10 мнн помещают в «Рок-н-роллер» при
2—8 °C.
5. К наружной стенке пробирки на 2 мин прикладывают кобальтово-самарие-
вый магнит, чтобы вызвать осаждение розетированных клеток.
6. Удерживая розетированные клетки магнитом, из пробирки выливают кровь.
7. Выделенные клетки четыре раза отмывают PBS. Первый раз используют
PBS с добавлением 0,6% цитрата натрия. Отмывание производят следую-
щим образом.
(I) В пробирку добавляют 5—10 мл PBS и ресуспендируют розетирован-
ные клетки.
(II) К наружной стенке пробирки на 30 с прикладывают магнит.
(III) Не отнимая магнит, выливают из пробирки PBS.
8. Выделенные клетки и несвязавшиеся микробусы ресуспендируют в среде
RPMI 1640, содержащей 10% СПК или 10% нормальной сыворотки чело-
века.
ная селекция все же может с успехом использоваться во многих
случаях. Ряд примеров такого использования представлен
ниже.
3.1.1. Выделение лимфоцитов прямыми методами
1. Выделение лимфоцитов из крови. С помощью данного
метода лимфоциты можно выделять непосредственно из крови
путем положительной селекции, применяя микробусы «Дюна-
бидс М-450», нагруженные моноклональными антителами к Т-
или В-клеткам (табл. 3.4). Метод предусматривает быстрое и
специфичное выделение лимфоцитов без предварительного гра-
диентного центрифугирования и отмывания.
Примерно за 15 мин можно получить взвесь функционально
интактных лимфоцитов с чистотой выше 99%. Чтобы освободить
выделенные клетки от прилипших к ним иммуномагнитных
микробус, используют приемы, описанные в табл. 3.6 (этапы
7—9). Основное условие успешного выделения различных суб-
популяций лимфоцитов — это применение специфических и
высокоаффинных моноклональных антител. Именно от аффин-
ности антител, нагруженных на микробусы, зависит необходи-
мая для завершения розетирования продолжительность инкуба-
ции. Количество микробус, добавляемых к образцу крови, долж-
но соответствовать предполагаемому числу клеток выделяемой
субпопуляции. Например, для выделения всех Т-лимфоцитов в
106
ФРАКЦИОНИРОВАНИЕ ИА ИММУНОМАГНИТНЫХ МИКРОБУСАХ
Таблица 3.5. Прямой метод положительной селекции лимфоцитов
из взвеси мононуклеаров
1. Клетки, выделенные из крови путем центрифугирования в градиенте плот-
ности нзопака — фнколла, ресуспендируют в сбалансированном солевом
растворе Хенкса (HBSS) с 1 % СПК, доведя концентрацию клеток до
20—40-106 на 1 мл.
2. Добавляют в суспензию клеток соответствующее количество нагруженных
моноклональными антителами микробус «Дюнабидс М-450». Взвесь микро-
бус вносят в суспензию в небольшом объеме PBS из расчета 1—2 микро-
бусинки на каждую клетку, которая, согласно предположению, несет инте-
ресующий исследователя маркер.
3. Смесь клеток с мнкробусами помещают на 20 мин при 4 °C в «Рок-н-рол-
лер».
4. Взвесь клеток разбавляют не менее чем в 5 раз охлажденным HBSS
с 1% СПК.
5. Сосуд, в котором находится клеточная взвесь, помещают на железную
пластинку с расположенными на ней кобальтово-самариевыми магнитами
и пипеткой отсасывают иерозетированные клетки.
6. Тщательно, не менее пяти раз, отмывают оставшиеся розетированные клет-
ки в HBSS с 1 °/о СПК, повторяя этапы 4 и 5, чтобы до проведения функ-
ционального анализа удалить все свободные от микробус клеточные эле-
менты.
целом требуется намного больше мнкробус, чем для выделения
какой-либо отдельной субпопуляции Т- или В-лимфоцитов.
2. Выделение лимфоцитов из взвеси мононуклеаров перифе-
рической крови. Прямой метод положительной селекции лимфо-
цитов из взвесей мононуклеарных клеток представлен в табл.
3.5. Ниже мы приводим один из примеров использования данно-
го метода для положительной селекции антигенспецифических
цитотоксических Т-лимфоцитов человека, несущих антиген CD8.
Как сообщалось ранее [9 и 13], были использованы микробусы
«Дюнабидс М-450», нагруженные антителами клона ITI-5C2
(IgM) к антигену CD8, для выделения цитотоксических Т-кле-
ток, специфичных к антигенам HLA класса I и обладающих
антигеном CD8. Объектом фракционирования служила сме-
шанная культура лимфоцитов. В типичных случаях выделенная
фракция лимфоцитов содержала 95—97% Т-клеток, несущих
CD8, и 2—4% Т-клеток, несущих CD4. Если количество добав-
ленных микробус не намного превышает число выделяемых
Т-клеток, то функциональная активность этих клеток полностью
сохраняется, несмотря на присутствие нагруженных антителами
микробус. Поэтому функциональные тесты с выделенными
клетками можно проводить сразу же после фракционирования
без предварительной инкубации для удаления прилипших к
клеткам микробус. Аналогично из культуры Т-клеток человека,
стимулированных высокой концентрацией ИЛ-2, можно выде-
лить СО8+-клетки, обладающие лимфокинактивированной кил-
лерной активностью. И в этом случае присутствие небольшого
107
ГЛАВА 3
Таблица 3.6. Непрямой метод положительной селекции лимфоцитов
из взвесей мононуклеаров
1. Из кровн нлн других жидкостей организма путем центрифугирования
в градиенте плотности изопака —• фнколла выделяют мононуклеары.
2. Выделенные клетки дважды отмывают в HBSS с 2% СПК.
3. Клеточную взвесь охлаждают на льду.
4. В клеточную взвесь вносят моноклональные антитела и инкубируют на
ледяной бане в течение 30 мин.
5. Клетки дважды отмывают в ледяном HBSS с 2% СПК.
6. Ресуспендируют клетки в ледяном HBSS с 2% СПК, доведя концентра-
цию клеток до 20—40-106 на 1 мл.
7. К клеточной взвеси добавляют соответствующее количество суспендиро-
ванных в малом объеме PBS мнкробус «Дюнабидс М-450», нагруженных
антителами к иммуноглобулинам. Необходимо добавить такое количество
микробус, чтобы на каждую клетку, предположительно экспрессирующую
интересующий нас маркер, пришлось примерно по две мнкробусннки.
8. Воспроизводят этапы 3—6 из табл. 3.5.
9. Если требуется получить клеточную взвесь, свободную от мнкробус, то
выделенные розетнрованием клетки ресуспендируют в культуральной сре-
де, доведя концентрацию клеток примерно до 106 на 1 мл и помещают
на ночь в СО2-инкубатор.
10. После инкубации, осторожно перемешав клетки, помещают сосуд, в кото-
ром они находятся, на магнит. Освободившуюся от мнкробус клеточную
взвесь сливают в другой сосуд. Если выход клеток окажется слишком
низким, его можно повысить, поместив взвесь клеток перед воздействием
магнита на смеситель «Вортекс» или пнпетируя ее пастеровской пипеткой
с узким отверстием.
11. Перед функциональным анализом клетки один раз отмывают культураль-
ной средой.
количества микробус, по-видимому, не нарушает эффективной
цитотоксической функции этих клеток.
3.1.2. Выделение лимфоцитов непрямым методом
Иногда, например в случае низкой авидности имеющихся
моноклональных антител, их лучше не нагружать на микробусы,
а использовать для сенсибилизации разделяемых клеток. Тех-
ника такой непрямой положительной селекции описана в табл.
3.6. Успешное разделение обычно происходит при минималь-
ном числе микробус, приходящихся на одну клетку, например
когда отношение микробус к клеткам составляет 2:1.
Мы получали вполне приемлемый выход неактивированных
В-лимфоцитов периферической крови человека, сенсибилизируя
их антителами к антигену CD37 (клон НН1) и применяя мик-
робусы «Дюнабидс М-450», нагруженные антителами к IgG
мыши [11]. По невыясненным причинам выход клеток колебал-
ся от 40 до 70%. По большинству критериев активности выде-
ленные В-клетки можно было отнести к покоящимся, статус
которых не изменился в процессе разделения. Благодаря этому
108
ФРАКЦИОНИРОВАНИЕ НА 11ММУ НОМЛГ1ИIT11ЫХ МПКРОБУСЛХ
у нас появилась возможность изучать параметры ранней фазы
активации В-лимфоцитов [И].
При получении стабильных Т-клеточных линий или клонов
для выделения активированных антигеном пли митогеном бла-
стов обычно используют центрифугирование в градиенте плот-
ности коллоидных частиц, подобных перколлу. По нашим дан-
ным, выход и чистота выделяемых с помощью перколла клеток
существенно варьируют. В качестве альтернативы мы с успехом
использовали положительную иммуномагнитную селекцию Т-
лпмфоцитов, имеющих рецепторы к ИЛ-2. Данные клетки мож-
но выделить из двухдневной культуры при помощи розетирова-
ния с микробусами, нагруженными антителами к рецептору
ИЛ-2, и затем инкубируя полученные клетки в культуральной
среде в течение ночи освободить их от прилипших микробус.
Метод позволяет выделить свыше 80% Т-клеток, которые имеют
рецепторы к ИЛ-2 и могут размножаться в среде, кондициони-
рованной ИЛ-2.
3.2. Удаление из взвеси определенных
клеточных популяций
Иммуномагнитную селекцию можно использовать для уда-
ления определенных клеточных популяций из крови или других
жидкостей организма, содержащих гетерогенную взвесь клеток.
Такой подход, в частности, позволяет определить, каким обра-
зом устранение той или иной клеточной субпопуляции отража-
ется на функциональных параметрах культивируемой взвеси
клеток [14]. С помощью иммуномагнитной селекции можно
устранить и Т-клетки из аллотрансплантата костного мозга,
предотвратив тем самым реакцию «трансплантат против хозяи-
на» [14], или очистить от опухолевых клеток аутологичный
костный мозг, используемый при лечении нейробластомы [4].
Для устранения клеток подходит как прямой (табл. 3.7), так
и непрямой (табл. 3.8) метод.
Эффективность обоих методов, например, при удалении Т-
клеток очень высока. Об этом можно судить по данным анализа
фенотипических маркеров (отмена образования розеток с эрит-
роцитами барана, отсутствие иммунофлуоресценции после обра-
ботки анти-Т-клеточными антителами) и функциональных
свойств очищенной клеточной взвеси (отмена ответа на фито-
гемагглютинин, митоген фитолакки и очищенный белковый де-
риват турберкулина, а также продукции ИЛ-2) [5, 6].
Количество микробус, необходимое для устранения данной
субпопуляции клеток, зависит от относительного содержания
последней среди других клеток разделяемой взвеси. Следует
учесть, что в целом для отрицательной селекции клеток тре-
109
ГЛАВА 3
Таблица 3.7. Прямое иммуномагнитное устранение определенных клеточных
популяций из гетерогенных взвесей клеток
1. Исходную клеточную взвесь выделяют из крови (или других жидкостей
и тканей организма) путем центрифугирования в градиенте плотности
нзопака — фиколла.
2. Клетки исходной взвеси дважды отмывают в HBSS с 2% СПК.
3. В клеточную взвесь вносят микробусы «Дюнабидс М-450», нагруженные
моноклональными антителами к той популяции клеток, которую необходи-
мо устранить.
4. Смесь клеток с микробусамн на 30 мин при 4 °C помещают в «Рок-н-рол-
лер».
5. Увеличивают объем смеси, добавляя HBSS с 2% СПК.
6. К сосуду, в котором содержится смесь клеток с микробусами, приклады-
вают снаружи кобальтово-самариевый магнит и примерно через 30 с, когда
все розетированные клетки и свободные микробусы соберутся в месте рас-
положения магнита, взвесь нерозетированных клеток сливают в другой
сосуд.
Таблица 3.8. Непрямое иммуномагнитное устранение определенных
популяций клеток из гетерогенных клеточных взвесей
1. Воспроизводят этапы 1—6 из табл. 3.6.
2. К сенсибилизированной моноклональными антителами клеточной взвеси
добавляют микробусы «Дюнабидс М-450», нагруженные антителами (на-
пример, бараньими) к IgG мыши.
3. Устраняют розетированные микробусами клетки, как описано в табл. 37
(этапы 4—6).
буется больше микробус в расчете на клетку, чем для положи-
тельной. Например, чтобы удалить Т-клетки из взвеси моно-
нуклеаров периферической крови (где их содержится 50—70%).
необходимо добавить 10—20 микробусинок на клетку. Для
одновременного устранения нескольких разных клеточных суб-
популяций можно сенсибилизировать клетки смесью монокло-
нальных антител (непрямой метод), либо применить микробусы,
нагруженные этой же смесью (прямой метод). В данном случае
прямой метод не менее эффективен, чем непрямой, и к тому
же проще и требует меньших временных затрат. Однако в
некоторых случаях, например при устранении гетерогенной по
поверхностным антигенным маркерам популяции опухолевых
клеток, преимущество может оказаться на стороне непрямого
метода, осуществление которого начинается с сенсибилизации
клеток смесью опухолеспецифических моноклональных антител.
Литература
1. Ugelstad J., Merk Р. С„ Kaggerud К. Н., Ellingsen Т., Berge А. (1980). Adv.
Colloid Interface Sci., 13, 101.
2. Ugelstad J., Mfutakamba H., Merk P. C., Ellingsen T., Berge A., Schmid R.,
Holm L., Jergedal A., Hansen F. K., Nustad K. (1985). J. Polym. Sci., 72,
225.
110
ФРАКЦИОНИРОВАНИЕ НА ИММУНОМАП1ИТПЫХ МИКРОБУСАХ
3. Ugelstad L, Berge A., Schmui\R., Ellingsen Т., Stenstad Р., Skjeltorp А.
(1986). In: Polymer Reaction Engineering, Reichert К. H. and Geiseler W.
(eds.), Hiithig and Wept, Basel, p. 77.
4. Treleaven J. B., Gibson F. M., Ugelstad J., Rembaum A., Philip T., Caine G. D.,
Kemshead J. T. (1984). Lancet, 1, 70. \
5. Nustad K.., Danielsen FL, Reith A., Funderud S., Lea T., Vartdal F., Ugel-
stad J. In: Microspheres: Medical and Biological Applications, Rembaum A.
(cd.), CRD Press Inc., Cat. No. 6571, in press.
6. Lea T., Vartdal F., Davies C., Ugelstad J. (1985). Scand. J. Immunol., 22.
207.
7. Danielsen FL, Funderud S„ Nustad K., Reith A., Ugelstad J. (1986). Scand.
J. Immunol., 24, 179.
8. Neoh S. FL, Gordon C., Potter A., Zola FL (1986). J. Immunol. Methods, 91,
231.
9. Gaudermack G., Leivestad T., Ugelstad J., Thorsby E. (1986). J. Immunol.
Methods, 90, 179.
10. Melsom H„ Funderud S., Lie S. O., Godal T. (1984). Scand. J. Haematol.,
33, 27.
11. Lea T„ Smeland E., Funderud S„ Vartdal F., Davies C., Beiske K., Ugel-
stad F. (1986). Scand. J. Immunol., 23, 509.
12. Norde U7. (1986). Adv. Colloid Interface Sci.. 25. 267.
13. Leivestad T., Gaudernack G., Ugelstad J., Thorsby E. (1986). Tissue Anti-
gens, 28, 46.
14. Vartdal F., Kvalheim G„ Lea T., Bosnes V.. Gaudernack G., Ugelstad J., Al-
brechtsen D. (1987). Transplantation, in press.
Глава 4
ИММУНОФЛУОРЕСЦЕНЦИЯ И
ИММУНОГИСТОХИМИЯ
Дж. Джаносси и П. Амлот
1. Введение
Нашей задачей было сжатое описание методов иммуно-
флуоресцентного и иммуногистохимического анализа (ИФА и
ИГХА соответственно), применяемых в клинической патологии
человека. Для иллюстрации мы воспользовались примерами
ИФА и ИГХА лимфоцитарных субпопуляций при клинических
исследованиях [I]1 таких проявлений инфекционной иммуно-
патологии, как синдром приобретенного иммунодефицита
(СПИД) и СПИД-подобные синдромы (СПС), а также [2]
лейкозов и лимфом.
Каждый из последовательно описанных здесь методов явля-
ется как бы ступенью к более полной оценке клеточных фено-
типов. По мере изложения нами описаны некоторые разрабо-
танные с помощью данных методов концепции, например пред-
ставление о корреляции между антигенным фенотипом клеток
и их функцией, а также об антигенных совпадениях между
злокачественными и нормальными клетками на определенных
стадиях лимфо- и миелопоэза.
В современном ИФА используются микроскопы с освещением
препарата сверху и комплекты селективных светофильтров для
регистрации зеленой флуоресценции изотиоцианат флуоресцеи-
на (ФИТЦ) и красной флуоресценции изотиоцианат тетраметил-
родамина (ТРИТЦ). Тот же комплект светофильтров позволяет
одновременно наблюдать оранжевое свечение предложенного
недавно нового флуорохрома, фикоэритрина (ФЭ) [1]. Флуо-
ресцентномикроскопическое исследование мембранных марке-
ров клетки, как правило, сочетается с морфологическим анали-
зом при помощи фазовоконтрастной оптики, позволяющей
экспериментатору отличить типичные лимфоциты от грануло-
цитов, моноцитов и больших гранулярных лимфоцитов [2].
Фазовоконтрастная микроскопия клеток может иметь самостоя-
тельное значение для цитологической диагностики, а флуорес-
центная микроскопия помимо визуального выявления флуорес-
цирующих мембранных маркеров может служить методом
предварительной оценки клеточных взвесей перед количествен-
ной протечной цитофлуориметрией.
112
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
ИГХА так же, как и ИФА, довольно часто используется в
патоморфологической диагностике и в исследовательской рабо-
те [3, 4]. Методы исследования на основе ИГХА и ИФА взаим-
но дополняют друг друга, однако каждый вид анализа имеет
свои особые преимущества и недостатки. ИФА чаще используют
иммунологи, а ИГХА — патанатомы, но, несмотря на это, во
многих лабораториях в зависимости от характера исследуемых
проблем применяются и те и другие методы.
ИФА имеет следующие преимущества:
1. Быстрота выполнения. Для прямого окрашивания суспен-
дированных клеток флуорохромированными антителами требу-
ется не более 10—15 мин, для непрямого — около 20—30 мин.
Если проводить маркирование в панелях для микротитрования
(микропанельный метод), можно довольно быстро исследовать
значительное число образцов.
2. Высокая аналитическая точность метода, которая прояв-
ляется при одновременном выявлении двух различных антиге-
нов антителами, конъюгированными с двумя разными флуоро-
хромами. Только при помощи такого двухцветного ИФА с ис-
пользованием сменных светофильтров удается выявлять слабо
экспрессирующиеся дифференцировочные антигены среди дру-
гих маркированных антигенов, обильно представленных на
мембране той же самой клетки.
3. Возможность одновременной морфологической оценки
клеток с помощью фазовоконтрастной микроскопии или после
окрашивания флуорохромированного препарата гематоксили-
ном, которое не вызывает гашения флуоресценции [5].
4. ИФА флуорохромированных клеток после микроскопии
может быть дополнен количественной проточной флуориметри-
ей.
К преимуществам ИГХА относятся следующие:
1. Возможность одновременного исследования классической
морфологии тканей и антигенного фенотипа клеток с помощью
меченных антител.
2. Для микроскопического выявления маркированных анти-
генов не требуется смены светофильтров или наблюдения в тем-
ном поле.
3. Для повышения чувствительности метода можно восполь-
зоваться препаратами меченых вторых и третьих антител, на-
пример обрабатывать срезы ткани моноклональными антитела-
ми к соответствующему антигену, затем поликлональными
антителами к иммуноглобулинам и в заключение — растворимы-
ми комплексами щелочная фосфатаза — моноклональные анти-
тела к щелочной фосфатазе [3].
В 70-х годах для анализа субпопуляций лимфоцитов и моно-
цитов, а также для дифференциальной диагностики лейкозов
использовались обычные антисыворотки [6]. Чтобы из гиперим-
8—172
113
ГЛАВА 4
мунной антисыворотки приготовить пригодный для диагностики
специфический реагент, ее необходимо полностью истощить
соответствующими клетками крови и костного мозга для удале-
ния нежелательных антител. В качестве примеров мы можем
перечислить 6 специфических ксеноиммунных антисывороток,
которые нашли диагностическое применение. Это — приготов-
ленные из антисывороток животных разных видов антиглобулп-
новые реагенты, содержащие антитела к иммуноглобулина у
человека, кроличья антисыворотка к Т-клеткам человека, на-
пример, анти-HuTLA [7] и предложенная недавно крысиная
антисыворотка к очищенному антигену ТЗ человека, выявляю-
щая Т-клетки на гистологических срезах [8], лошадиная анти-
сыворотка к супрессорным и цитотоксическим Т-лимфоцитам
(апти-ТНг) [9], кроличья антисыворотка к лимфобластам об-
щего острого лимфолейкоза (анти-ООЛЛ) [6] и кроличья
антисыворотка к терминальной дезоксинуклеотидилтрансферазе
(анти-TdT), обнаруживаемой в ядрах предшественников Т- и
В-лимфоцитов [10]. Некоторые из этих сывороток, например
антиглобулиновые реагенты и кроличья анти-TdT сыворотка,
до сих пор используются в лабораторной клинической диагно-
стике.
Развитие новых методов, в частности двухцветной проточной
цптофлуориметрии с одновременной регистрацией флуоресцен-
ции ФИТЦ и ФЭ в одном луче лазера, существенно повысило
диагностическую точность ИФА. Однако наиболее крупным
вкладом во все области иммунологических исследований и им-
мунодиагностики можно считать создание гибридомной техно-
логии для получения моноклональных антител (МКА), при
использовании которых отпадает необходимость в весьма тру-
доемких многократных процедурах истощения антисывороток,
столь характерных для их приготовления. Полученные в разных
лабораториях ряда стран препараты моноклональных антител
(CD)1, реагирующие с одними и теми же дифференцировочны-
1 CD (от англ. Cluster of Differentiation). На трех Международных рабо-
чих совещаниях по типированию лейкоцитов, состоявшихся в 1982 г. (Париж),
1984 г. (Бостон) и 1986 г. (Оксфорд) были представлены результаты опреде-
ления специфичности 1467 образцов МКА к лейкоцитарным антигенам чело-
века. Когда отдельные образцы МКА, реагирующие с одним и тем же диф-
ференцировочным лейкоцитарным антигеном, объединили в группы («класте-
ры»), получилось 48 кластеров, пронумерованных от 1 до 45 (некоторые кла-
стеры в пределах одного номера имеют разные буквенные обозначения). Ряд
авторов, в том числе авторы этой главы, используют обозначение «CD-f-иомер»
для классификации моноклональных антител, выявляющих определенный диф-
ференцировочнын антиген лейкоцитов человека. Однако в литературе послед-
него времени и в других главах настоящего издания обозначения «CD+номер»
используются как названия лейкоцитарных антигенов, т. е. обозначения кла-
стеров МКА стали названиями лейкоцитарных антигенов человека и живот-
ных, что и нашло отражение в тексте русского перевода.— Прим, перев.
114
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
ми антигенами лейкоцитов человека, были объединены на кон-
ференциях по лейкоцитарным дифференцировочным антигенам
в «кластеры» [12—14]. Большинство анти-CD моноклональных
антител относятся к IgM или различным подклассам IgG мыши.
Применяя в качестве антиглобулинового реагента конъюгиро-
ванные с ФИТЦ или ТРИТЦ козьи антитела к мышиным IgG
и IgM, можно без особых затруднений использовать анти-CD
МКА в ИФА в любых сочетаниях.
Еще одним важным шагом в развитии клинического ИФА
было постепенное сокращение числа образцов МКА в диагности-
ческих наборах, применяемых для идентификации лейкозов.
В течение последнего десятилетия сотни образцов МКА были
подвергнуты тщательному изучению. В центре внимания нахо-
дились два не связанных друг с другом вопроса. (1) Какие из
образцов МКА имеют наибольшее диагностическое значение п
(2) насколько верен диагноз, поставленный с помощью МКА?
В настоящее время имеется вполне определенный общепринятый
ответ на первый вопрос. Современная дифференциальная диаг-
ностика лейкозов базируется на применении лишь небольшого
набора образцов МКА с четко выраженным профилем реактив-
ности [15]. Все эти образцы МКА могут быть получены пз
коммерческих источников.
Заканчивая введение, следует отметить важность контроля
применяемых препаратов антител. Дело в том, что агрегиро-
ванные иммуноглобулины связываются Fc-рецепторами многих
типов клеток, включая лимфоидные и миелоидные. Кроме того,
клетки, выделенные из крови больного, содержащей циркули-
рующие иммунные комплексы, могут нести на своей поверхно-
сти пассивно связавшиеся через Fc-рецепторы иммуноглобули-
ны. Большую часть этих комплексов удается элюировать, отмы-
вая клетки ацетатным буфером [16]. Агрегаты иммуноглобули-
нов могут также адсорбироваться на клеточной поверхности в
ходе ИФА. Кроличьи иммуноглобулины, например, обладают
особо высокой аффинностью к Fc-рецепторам клеток человека.
Поэтому их лучше не применять вовсе либо использовать в виде
Р(аЬ')2-фрагментов. Козьи иммуноглобулины, напротив, не от-
личаются повышенной аффинностью к Fc-рецепторам клеток
человека и дают более четкие результаты при использовании
ИФА. Чтобы устранить агрегаты, препараты антител центрифу-
гируют при 100 000g в течение 30 мин, затем разливают мелкими
порциями и хранят замороженными при —30 °C. Перед исполь-
зованием каждую аликвоту следует еще раз отцентрифугиро-
вать при 1000g в течение 5 мин. В препаратах МКА, особенно
лиофилизированных, также могут содержаться агрегаты. Их
меньше всего в содержащей МКА культуральной среде с 10%
СПК- Такие препараты МКА можно хранить замороженными
при —30 °C. Моноциты и бласты при острых моноцитарных лей-
s’ 115
ГЛАВА 4
козах особенно эффективно неспецифически связывают имму-
ноглобулины. Поэтому для предотвращения связывания исполь-
зуемых МКА взвесь клеток необходимо предварительно
проинкубировать в нормальной кроличьей сыворотке для блоки-
рования Fc-рецепторов (разд. 6).
2. Выделение мононуклеарных клеток из крови
и костного мозга
2.1. Принцип
Известны два достаточно простых и эффективных метода
выделения мононуклеаров, каждый из которых имеет свою эк-
спресс-модификацию. Первый метод заключается в том, что
стабилизированную антикоагулянтами кровь или взвесь клеток
костного мозга наслаивают на смесь изопака — фиколла (эта
смесь может иметь и другие названия: «Фиколл — Гипак»,
«Лимфопреп», «Фиколл — Триосил», см. гл. 1) и центрифугиру-
ют при 20 °C. В результате эритроциты и полиморфноядерные
гранулоциты оседают на дно центрифужной пробирки, а лимфо-
циты, моноциты и тромбоциты из крови и мононуклеарные
клетки из костного мозга остаются на границе раздела плазмы
и смеси фиколла — изопака [17]. Во втором методе в качестве
разделяющей среды используют взвесь коллоидных частиц
двуокиси кремния «Сепрацелл-MN», которую вначале смеши-
вают с кровью, а затем центрифугируют. В результате моно-
нуклеарные клетки сосредоточиваются в верхнем слое [18].
2.2. Реагенты и посуда
1. Для приготовления разделяющей среды смешивают 10 ча-
стей изопака (32,8%-ный раствор метризоата натрия, плотность
1,20 г/мл) или триосила (Vestric Ltd., Великобритания) с 24 ча-
стями 9%-го раствора фиколла (фирма Pharmacia Fine Chemi-
cals, Швеция), чтобы получился раствор с конечной плотностью
1,077 г/мл; либо используют готовую патентованную смесь, на-
пример «Лимфопреп» (фирмы Nyegaard and Со., Норвегия).
2. В качестве альтернативной разделяющей среды можно
воспользоваться взвесью коллоидных частиц «Сепрацелл-MN»
(Sepratech Corp., США).
3. Кровь берут в специальные 10-миллилитровые флаконы,
содержащие литиевую соль гепарина, либо в другую посуду с
раствором гепарина без консервантов. Конечная концентрация
гепарина в крови должна составлять 10 МЕ/мл. Клетки костного
116
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
мозга берут во флаконы с литиевой солью гепарина, заполнен-
ные 2—4 мл культуральной среды.
4. Стерильный забуференный фосфатами изотонический
раствор хлористого натрия (PBS), содержащий 0,2% бычьего
сывороточного альбумина (PBS + БСА) и пробирки емкостью
15 мл.
2.3. Выделение мононуклеарных клеток
1. При концентрации лейкоцитов менее 20-109 клеток/л кровь
разбавляют PBS в два, а при концентрации выше указанной —
в четыре раза.
2. В пробирку вносят 4 мл смеси фиколла — изопака и осто-
рожно наслаивают на нее сверху 8 мл разбавленной крови.
Центрифугируют при 400g 25 мин. При выделении мононуклеа-
ров с помощью второго метода в пробирку, содержащую 6—
7 мл разделяющей среды «Сепрацелл-MN», вносят не более
6 мл крови и осторожно перемешивают. Продолжительность
центрифугирования при 2000g зависит от типа используемого
ротора: 10 мин в угловом и 20 мин в бакет-роторе.
3. Клетки, расположенные на границе раздела плазмы и
смеси фиколла — изопака или в верхнем слое «Сепрацелла-MN»,
собирают, переносят в другую пробирку и разбавляют в 5 раз
PBS + БСА. Выделенные клетки осаждают центрифугированием
при 40g 10 мин. При меньшей скорости центрифугирования воз-
можны значительные потери клеток, однако лишь такое низ-
коскоростное центрифугирование позволяет отделить мононук-
леары от тромбоцитов.
4. Выделенные клетки отмывают еще раз и, подсчитав их в
камере (см. гл. 1), доводят концентрацию взвеси до 1—2-Ю7
клеток/мл PBS + БСА.
5. Подсчитывают процент жизнеспособных клеток по исклю-
чению трипанового синего (гл. 1).
2.4. Примечания
В литературе описаны различные варианты разделения
клеток с помощью центрифугирования в градиенте плотности
смеси фиколла — изопака [17] (см. также гл. 1). И данный
метод, и альтернативный с использованием коллоидных частиц
«Сепрацелл-MN» дают одинаковый выход Т- и В-клеток, реак-
ция которых на Т- и В-клеточные митогены не зависит от выб-
ранного способа выделения [18]. Экспресс-модифркации данных
методов, позволяющие очень быстро выделить мононуклеарные
клетки из малых объемов крови или костного мозга, заключа-
ются в следующем.
117
ГЛАВА 4
1. Используют политеновые пробирки с колпачками (объе-
мом 1,5 мл, например, фирмы Sarstedt Inc., США) и микроцент-
рифугу с угловым ротором (например, фирмы Eppendorf CmbH.
ФРГ).
2. Наслаивают 1 мл клеточной взвеси на 0,5 мл смеси фи-
колла— изопака либо смешивают равные объемы среды «Сеп-
рацелл-MN» и разделяемой взвеси, например, неразбавленной
крови.
3. Пробирки центрифугируют при 600g (фиксированная ско-
рость в течение 1 мин).
4. Собирают клетки, скопившиеся на границе плазмы, и сме-
си фиколла — изопака или в верхнем слое при использовании
в качестве разделяющей среды коллоидных частиц «Сепрацелл-
MN». Количество мононуклеарных клеток, выделенных
каким-либо из ускоренных методов, вполне достаточно для
проведения микропанельиого ИФА с 12 образцами МКА (см.
ниже).
3. Иммунофлуоресцентное маркирование клеток
в панелях для микротитрования
(микропанельный ИФА)
3.1. Принцип
Специфические антитела связываются с мембранными анти-
генами живых клеток, находящихся в суспензии. Чтобы предот-
вратить кэппинг и шеддинг (слущивание) антигенов после
взаимодействия с антителами, к суспензии клеток добавляют
0,2% азида натрия [19]. В прямых методах ИФА используют
специфические к клеточным антигенам антитела, конъюгиро-
ванные с флуоресцентной меткой, и маркирование клеток произ-
водят как одноэтапную реакцию. В непрямых методах ИФА в
качестве первых антител используют немеченые антитела к
клеточным антигенам, а в качестве вторых—меченные флуоро-
хромом антитела к иммуноглобулинам. Маркирование клеток
производят в два этапа. Вторые антитела служат для выявле-
ния связанных с клеткой первых антител. Непрямые методы
обычно чувствительнее прямых.
Использование предназначенных для микротитрования пла-
стиковых панелей позволяет одновременно производить ИФА
значительного числа образцов клеток, применяя многочисленные
образцы МКА. Экономичность микропанельиого ИФА определя-
ется четырьмя моментами [15].
1. Для одновременного маркирования и отмывания 96 образ-
цов клеточной взвеси используется панель для микротитрования
с U-образными лунками.
118
ИММУНОФЛУОРЕСЦЕНЦИЯ и ИММУНОГИСТОХИМИЯ
2. Наборы применяемых МКА составляют из числа образ-
цов, кратного шести. Используют многоканальные автоматичес-
кие пипетки, позволяющие одновременно обрабатывать шесть
образцов клеточной взвеси шестью реагентами. Для микроско-
пии образцы клеточной взвеси переносят на предметные стекла,
имеющие два ряда по шесть лунок.
3. Перенесенные на каждое стекло 12 капель клеточных
взвесей фиксируют в парах формальдегида, накрывают покров-
ными стеклами и исследуют под микроскопом. Используют
фазовоконтрастный объектив с просветленной оптикой, увели-
чением 63Х и числовой апертурой 1,4, безупречно скорригиро-
ванный изготовителем.
4. В зависимости от результатов микроскопии микропанель-
ный ИФА позволяет:
(а) вновь провести маркирование оставшихся в лунках клеток
флуорохромпрованными антителами второй специфичности
(разд. 7);
(б) с помощью цитоцентрифуги получить препараты из остав-
шихся в определенных лунках клеток и провести их марки-
рование для выявления цитоплазматических «ли ядерных
антигенов (разд. 9);
(в) исследовать оставшиеся в выбранных лунках клетки в про-
точном цитофлуориметре (разд. 5).
Микропанельный ИФА специально предназначен для иссле-
дования антигенов лимфоцитарных мембран и диагностики лей-
козов. Однако в связи с тем, что он гораздо экономичнее дру-
гих модификаций ИФА по расходу реагентов, исследуемых
клеток и времени, его можно приспособить для решения других
экспериментальных задач особенно в тех случаях, когда требу-
ется исследовать одновременно много образцов суспензий,
содержащих ограниченное число клеток.
3.2. Реагенты и лабораторные принадлежности
из стекла и пластика
1. Наборы МКА для диагностики иммунопатологических со-
стояний и хронических лейкозов (табл. 4.1), а также острых
лейкозов (табл. 4.2). Нормальная сыворотка крови той же
видовой принадлежности, что и МКА. Меченные ФИТЦ козьи
антитела к мышиным иммуноглобулинам (например, фирмы
Sigma Chemical Со., США или Sera Lab Ltd., Великобритания),
2. PBS, содержащий 0,2% БСА и 0,2% NaN3.
3. Панели для микротитрования с U-образными лунками
(фирмы Sterelin Ltd., Великобритания).
4. Липкая пленка для герметизации микропанелей (фирма
Flow Laboratories Ltd., Великобритания).
119
ГЛАВА 4
Таблица 4.1. Образцы МКА, входящие в набор1) для диагностики
иммунопатологических состояний и хронических лимфолейкозов
с помощью иммунофлуоресцентного анализа («лимфоцитарный» набор)
Антигены, выявляемые с помощью МКА Экспрессия или функция антигенов Мол. масса антигенов (кДа) Часто используемые образцы МКА Литература
I Антигены 1 1. CD2 -клеток Е-рецептор 50 (ОК)ТН, 9—2, 31
2. CD3 Ассоциирован с 19, Leu5, RFT11 (ОК)ТЗ, UCHT1, 21
3. CD7 антнгенраспознаю- щим рецептором Т-клеток Рсц-рецептор 22, 28 40 Leu4 ЗА1, WT1, Leu9, 30
4. CD52) Все Т-клетки + 67 RFT2 Т101, (ОК)Т1, 21,
5. CD4 + клетки ХЛЛ Т-хелперы 55 RFT1 (OK)T4. Leu3 37, 55 21
6. CD8 Супрессорные и 32 (OK)T8, Leu2, 21
11 Антигены цитотоксические Т-лимфоциты больших гранулярн! ИХ лимфоцит! RFT8 )B
7. CD16 Низкоаффинный Leul 1 22
III Антигены 8. Антиге- Ес-рецептор В-клеток В-клетки + акти- 28, 32 (OK) la и другие, 7
ны HLA класса II 9. CD19 вированные Т-клет- ки + моноциты Пре-В и В-клетки 95 RFDR2 B4, Leu 12, SB4, 27
10. CD20 В-клетки 35 RFB9 Bl, Leul6, RFB7 29
И. Легкие цепи к и У» 52, 53
*) Для отрицательного контроля в набор включена также нормальная мышиная сы-
воротка.
2) CD5 выявляют одновременно с помощью IgM при двухцветном ИФА. используя
соответствующие антитела.
3) Легкие цепи иммуноглобулинов выявляют на мембранах В-клеток для определения
моноклональности злокачественного роста в прямом двухцветном ИФА, пользуясь соот-
ветствующими антиглобулиновыми реагентами.
5. Пластиковые пробки для индивидуальных лунок микро-
панелей (например, фирмы Pierce and Warriner Ltd., Велико-
британия).
6. Панели для микротитрования с U-образными лунками
(для размещения наборов МКА в стандартном порядке).
7. Тефлонизированные предметные стекла с 12-ю лунками
в тефлоновом покрытии (фирма Hendley Engineering Ltd., Ве-
ликобритания).
120
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
Таблица 4.2. Образцы МКА, входящие в набор1’ для диагностики
острых лейкозов2’
Выявляе.мые МКАТ анти- гены Экспрессия анти- генов Мол. мас- са антиге- нов (кДа) Часто используемые образцы МКА Литература
I Антигены, 1. CD34 выявляемые на стволовых Предшественники лимфо- клетках BI-3C5, МуЮ 23
2. HLA-DR идных и миелоидных клеток8 9’ Предшественники лимфо- 28, 32 анти-HLA-DR, 7
11 Антигены 3. CD13 идных и миелоидных клеток + В-клетки3> миелоидных клеток Миелобласты, гранулоци- 150 RFDR2 Му7; MCS2 24, 25
4. CD14 ты и моноциты3’ Моноциты3’ 55 UCHM1 26
III Антигены 5. CD194’ клеток ООЛЛ и В-клеточ Пре-В- и В-клетки ного ряда 95 В4, Leu 12, SB4, 27
6. CD10 Про-В-клеткн и клетки 100 RFB9 J5, VILA1, RFAL1 28
7. CD20 ООЛЛ В-клетки 35 Bl, Leul6, RFB7 29, 68
8. IgM В-клетки 75 (поликлональные 6
IV Антигены 9. CD7 тимоцитов и Т-клеточного Тимоциты и Т-клетки ряда 40 козьи антитела к IgM человека) ЗА1, WT1, Leu9, 30
10. CD2 Тимоциты, Т-клетки + 50 RFT2 (OK)Tll, Leu5, 31
11. C.D35’ натуральные киллеры Т-клетки 19, 22, 28 RFT11 (ОК)ТЗ, UCHT1 57, 62, 6i
’) Для отрицательного контроля в набор включена также нормальная мышиная сы-
воротка (НМС).
2) На клетках острых лейкозов выявляется много антигенных маркеров, присущих
незрелым клеткам лимфоидного и миелоидного ряда, а также терминальная дезоксннук-
леотндилтрансфераза (TdT) [10, 61].
3) См. рнс. 4.8.
4) CD19 неотчетливо выявляется МКА на гистологических срезах и в препаратах,
приготовленных с помощью цитоцентрифуги. Из других антигенов, присутствующих
(рис. 4.7) в цитоплазме клеток всего В-клеточиого ряда, можно назвать CD22, который
обозначают так же, как >р435, То15 или RFB4 [58, 59].
&) На гистологических срезах и препаратах, приготовленных с помощью цнтоцентри-
фугн. цитоплазматический CD3 выявляется уже в костномозговых претнмоцнтах (рнс. 4.6)
(62, 63].
8. Формалиновая камера (влажная камера с 40%-ным раст-
вором формальдегида).
9. Среда для долгосрочной заливки препаратов: 20 г поли-
винилового спирта растворяют в 80 мл PBS и добавляют 40 мл
глицерина, содержащего 3 г диазобициклооктана, pH 8,6 ;[20].
Среда для краткосрочной заливки препаратов: смесь равных
объемов PBS и глицерина.
121
ГЛАВА 4
3.3. Приборы
1. Центрифуга, например TJ-6 (фирмы Beckman Instruments,
США) или «Кентавр 2» (фирмы М. S. Е., Великобритания) с
бакет-ротором для микропанелей.
2. Микроскоп с освещением объекта сверху и снизу, комп-
лектами светофильтров для флуоресценции ФИТЦ и ТРИТЦ,
фазовоконтрастными конденсором и объективом, имеющим уве-
личение 63 X и числовую апертуру 1,3—1,4.
3. Встряхиватель для панелей (фирмы Dynatech Laborato-
ries Ltd., Великобритания).
4. Восьмиканальные автоматические пипетки «Титертек» с
регулируемым объемом на 5—50 мкл и 50—200 мкл (фирмы
Flow Laboratories Ltd., Великобритания), кюветами для раство-
ров и достаточным количеством наконечников (заменяемых пос-
ле каждой операции).
5. Дозаторы общим объемом 2 мл с поршнем из тефлона
для быстрого разлива клеточной взвеси равными порциями по
50 мкл (фирмы Jencons Scientific Ltd., Великобритания).
3.4. Постановка микропанельного ИФА
1. Пользуясь дозатором, в каждую лунку (с U-образным
дном) 12-луночного ряда микропанели вносят по 50 мкл клеточ-
ной взвеси, содержащей 1—2-105 клеток одного больного.
2. На другой микропанели, расположенной рядом и имею-
щей лунки с V-образным дном, готовят ряд исходных концент-
рированных растворов 12 образцов МКА на PBS + БСА. Затем,
используя шесть каналов восьмиканальной автоматической
пипетки, переносят по 50 мкл каждого из 11 образцов МКА и
НМС (дважды по 6, сменив наконечники) в лунки первой микро-
панели, содержащие по 50 мкл клеточной взвеси.
3. Всю первую микропанель герметизируют сверху липкой
пленкой, инкубируют 10 мин при 20 °C, периодически встря-
хивая.
4. В каждую лунку, содержащую клетки, вносят по 150 мкл
PBS-]-BCA-|-0,2% NaNs, закрепляют микропанель в роторе
центрифуги и доводят скорость вращения до 2000 об/мин, затем
останавливают ротор и удаляют из лунок иадосадочную жид-
кость острожным стряхиванием.
5. Поместив панель на встряхиватель, суспендируют клетки
в каплях жидкости, оставшихся в лунках. Затем вносят в каж-
дую лунку по 150 мкл PBS + BCA + 0,2% NaN3 и четыре раза
повторяют этапы 4 и 5.
6. В каждую лунку вносят по 30 мкл раствора, содержащего
меченные ФИТЦ козьи антитела к мышиным иммуноглобули-
122
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
нам, инкубируют 10 мин при 20°C, затем отмывают клетки, как
указано в пунктах 4 и 5.
7. После последнего отмывания в каждую лунку к клеточно-
му осадку многоканальной пипеткой добавляют по 5—6 мкл
PBS + BCA+0,2% NaN3, клетки ресуспендируют и по 2 мкл
взвеси переносят на тефлонизированные предметные стекла
(2 ряда по 6 капель на каждое стекло).
8. Каждое стекло с образцами клеток от одного больного,
обработанных 11-ю образцами МКА и НМС, помещают на 10 мин
в пары формальдегида, после этого высушивают при 20°C, на
высушенный препарат наносят смесь равных объемов глицерина
и PBS и накрывают покровным стеклом.
3.5. Примечания
Из азида натрия в кислых растворах образуется токсичная
азотоводородная кислота. Прежде чем сливать в канализацию,
растворы азидов следует разбавить водопроводной водой, в
противном случае в трубопроводах, изготовленных из меди,
могут образоваться взрывоопасные осадки.
Следует пунктуально воспроизводить рекомендуемую здесь
процедуру отмывания клеток (т. е. указанное число ресуспен-
дирований и осаждений), так как следовые количества МКА в
надосадочной жидкости могут прореагировать с антителами к
иммуноглобулинам с образованием растворимых комплексов,
которые будут связываться с Fc-рецепторами клеток, на самом
деле не экспрессирующих выявляемый антиген.
3.6. Интерпретация результатов
Распределение флуоресцентных меток на клеточной мембра-
не весьма тонко характеризует ее морфологию. Присутствие
азида предотвращает кэппинг и шеддинг антигенов, но движе-
ния мембраны, например образование пэтчей, все же происхо-
дят, и благодаря им удается идентифицировать клетки по мор-
фологическим различиям распределения маркера. Так, образо-
вание пэтчей отличается от появления «гранулярных» скоплений
метки в результате связывания иммунных комплексов с Fc-ре-
цепторами. Гомогенное же распределение метки по клеточной
мембране свойственно нефиксированным погибшим клеткам,
связывающим меченые антитела неспецифически.
Во многих лабораториях для первичной диагностики имму-
нопатологических состояний и хронических лимфолейкозов с
помощью микропанельного ИФА применяется почти один и тот
123
ГЛАВА 4
же набор образцов МКА (см. «лимфоцитарный набор» в табл.
4.1). Эти антитела выявляют три группы антигенов: антигены
Т-клеток, больших гранулярных лимфоцитов (БГЛ) и В-клеток.
В группу специфических Т-клеточных антигенов входят CD2,
CD3 и CD7, а также CD4 (маркер субпопуляции Т-клеток, вы-
полняющих преимущественно хелперные функции) и CD8 (мар-
кер Т-клеток, обладающих супрессорной и цитотоксической
активностью) [21]. В группе антигенов БГЛ имеется лишь один
маркер, CD16, который представляет собой молекулу Fc-рецеп-
тора низкой аффинности [22]. В группу В-клеточных включены
антигены HLA класса II, выявляемые МКА (которые с высокой
аффинностью связываются с нормальными В-клетками и сла-
бее— с моноцитами), а также антигены CD19 и CD20 (табл.
4.1).
Набор образцов МКА, предназначенный для диагностики
острых лейкозов (табл. 4.2), состоит из реагентов, специфич-
ных к дифференцировочным антигенам стволовых гемопоэти-
ческих клеток, клеток миелоидного ряда, клеток общего острого
лимфолейкоза и В-клеток, а также тимоцитов и Т-клеток.
Правда, указанная специфичность МКА соответствует лишь их
доминирующей активности (это сделано для удобства изложе-
ния). Примеры использования данного набора МКА при диаг-
ностике острых лейкозов представлены на рис. 4.2.
Вслед за проведением ИФА с помощью набора МКА «перво-
го ряда» может возникнуть необходимость в дальнейшей углуб-
ленной иммунодиагностике, возможность проведения которой
зависит от профиля диагностической лаборатории (т. е. отно-
сится ли она к центру лейкозов, общетерапевтическому стацио-
нару или группе педиатрической онкологии и т. п.). Можно,
например, одновременно с выявлением маркеров «первого ря-
да» определять в клетках терминальную дезоксинуклеотидил-
трансферазу TdT, используя МКА, меченные флуорохромом
другого цвета (разд. 9). К реагентам «второго ряда» относятся
МКА, синтезируемые, например, клоном Му9 и выявляющие
антиген CD33 незрелых миелоидных клеток. К ним же относят-
ся МКА к гликофорину эритроидных клеток, а также синтези-
руемые клоном AN51 или J15 (либо другими клонами анало-
гичной специфичности) МКА, соответственно выявляющие анти-
ген CDw42 или CD41 мегакариоцитов. Кроме того, к реагентам
«второго ряда» относят используемые для диагностики монокло-
нальности при В-клеточном злокачественном росте МКА к лег-
ким (анти-х и анти-Х) и тяжелым (анти-ц, анти-у и анти-а)
цепям иммуноглобулинов.
Результаты микропанельного ИФА можно учитывать визу-
ально под микроскопом, а также с помощью количественной
проточной цитофлуориметрии, используя клеточный сортер.
Примеры такого количественного ИФА лимфоцитов перифери-
124
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
ческой крови в норме, при СПИД и при хроническом В-лимфо-
лейкозе представлены ниже.
4. Иммунофлуоресцентный анализ суспензий
клеток лимфатических узлов
4.1. Принцип
Весьма эффективная при получении лимфоцитарных взвесей
механическая дезинтеграция лимфоидной ткани часто оказы-
вает повреждающее действие на более крупные лимфобласты и
разрушает все без исключения гистиоциты, стромальные и
дендритные клетки. Ограниченный ферментативный гидролиз
ткани позволяет приготовить более репрезентативную по соста-
ву клеточную взвесь, особенно в тех случаях, когда исследуемая
ткань подвержена склерозу либо инфильтрирована эпителиоид-
ными или гигантскими клетками (как это бывает при злока-
чественных лимфомах, саркоидозе и т. д.) (см. также гл. 1).
4.2. Реагенты и приборы
1. Ферменты: коллагеназа (тип I фирмы Hoechst, ФРГ);
нейтральная протеиназа (В. polymyxa, класс II фирмы Hoechst);
дезоксирибонуклеаза (тип IV фирмы Sigma Chemical Со.,
США).
2. Среда для культуры тканей (например, RPMI 1640) с
10% СПК-
3. Мешалка карусельного типа.
4.3. Приготовление взвеси клеток лимфоидной ткани
1. Полученную при биопсии лимфоидную ткань сразу же по-
мещают в среду, содержащую 10% СПК. Острой бритвой или
специальным ножом для трансплантации кожи (фирмы J. Weiss
and Со Ltd., Великобритания) разделяют ткань на фрагменты
размером 2—3 мм. На этом этапе никакого иного механического
разрушения ткани не производят.
2. Фрагменты лимфоидной ткани должны занимать не более
15% общего объема взвеси. Затем добавляют коллагеназу
(0,5 ед./мл), нейтральную протеазу (0,5—1,0 ед./мл) и инкуби-
руют взвесь при 37 °C 1 ч при постоянном медленном переме-
шивании на мешалке карусельного типа.
3. После инкубации ко взвеси добавляют ДНКазу (1 мкг/мл)
и диспергируют фрагменты ткани, энергично набирая и выпуская
125
ГЛАВА 4
их шприцем через пломбировочную трубку (с внутренним диа-
метром 2—3 мм).
4. Клеточную взвесь оставляют на 5—40 мин для отстаива-
ния при 20 °C, чтобы осели агрегаты клеток и детрит. Затем пе-
реносят надосадочную жидкость в центрифужную пробирку,
осаждают клетки и трижды отмывают их средой, содержащей
10% спк.
4.4. Примечания
1. Лейкоцитарные антигены CD4 (ОКТ4, ЬепЗ) и CD21
(C3dR), как правило, чувствительны к нейтральной протеазе.
2. Набор МКА, применяемый для ИФА взвеси клеток лимфа-
тического узла, почти ничем не отличается от «лимфоцитарного»
(представленного в табл. 4.1), но вместо RFT12 и RFT11 исполь-
зуют RFD9 и RFB5. RFD9 — это недавно стандартизованные
МКА, реагирующие с клетками лимфомы центробластического
типа, а также с малодифференцированными клетками эритроид-
ного ряда и некоторыми макрофагами [32], a RFB5 — это весьма
активные МКА, реагирующие с не включенным в CD-классифи-
кацию антигеном В-клеток [33].
3. При ферментативном гидролизе происходит одновремен-
ное устранение эритроцитов, поэтому взвесь клеток нуждается в
дальнейшей очистке лишь при значительной контаминации гра-
нулоцитами или другими нелимфоидными клетками (например,
гепатоцитами).
5. Количественная оценка интенсивности
флуоресценции клеток, маркированных
антителами, конъюгированными с ФИТЦ
5.1. Принцип
По сравнению с микроскопией, проточная цитофлуориметрия
имеет ряд преимуществ. Это — значительная скорость анализа
(более 500 клеток в секунду) и высокая точность количественной
оценки двух независимых параметров одной и той же клетки:
величины светорассеяния и интенсивности флуоресценции (см.
гл. 2). В новейших проточных цитометрах обычно регистрируют-
ся два параметра: (1) переднее светорассеяние, приблизительно
пропорциональное размерам клетки и (2) боковое (под углом
90°) светорассеяние (S), пропорциональное содержанию гранул
в ее цитоплазме. Автоматическая интегральная оценка этих па-
раметров позволяет вполне успешно дискриминировать в анали-
зируемой клеточной взвеси эритроциты, лимфоидные клетки, мо-
126
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
ноцпты, гранулоциты и погибшие клетки [34]. Среди лимфоид-
ных клеток на цитограммах можно дифференцировать клетки
хронического лимфолейкоза, а среди больших лимфоцитов и мо-
ноцитов— клетки острого лейкоза. На практике проточный ци-
тометр используется для подсчета клеток, связавших флуорес-
цирующие антитела, исключительно в пределах одной выбран-
ной клеточной популяции. Из анализа обычно исключаются зре-
лые моноциты и гранулоциты.
5.2. Реагенты и принадлежности
К реагентам и лабораторным принадлежностям, перечислен-
ным в разд. 3 и 4, добавляют
1) 8%-ный формалин или 4%-ный параформальдегид в 0,85;%-
ном растворе хлористого натрия (pH доводят до 7,4 с помощью
0,1 М NaOH или 0,1 М НС1) и
2) микробусы «Кейлибрайт», нагруженные ФИТЦ (зеленые),
фирмы Becton Dickinson Immunocytometry Systems, США.
5.3. Приборы и обеспечение
1. Проточная цитофлуориметрия может быть осуществлена
при использовании какого-либо из приборов, выпускаемых не-
сколькими фирмами. Наиболее распространены системы FACS
(фирмы Becton Dickinson Immunocytometry Systems, США) и
EPICS (фирмы Coulter Electronics Ltd., Великобритания), a
также цитофлуорографы фирмы Ortho Diagnostic Systems Inc.,
США.
2. Компьютерные программы для количественного анализа
клеток. В нашей лаборатории освоена компьютерная система
EASY.88, обслуживающая цитофлуориметры EPICS.
5.4. Количественный иммунофлуоресцентный анализ
1. Проточный цитометр калибруют в соответствии с инструк-
цией фирмы-изготовителя, используя нагруженные ФИТЦ мик-
робусы «Кейлибрайт».
2. Маркируют флуоресцирующими антителами и отмывают
клеточные взвеси (разд. 3 и 4). К каждому осадку клеток до-
бавляют по 100 мкл 8%-ного формалина и 4%-ного парафор-
мальдегида. Сразу же после добавления фиксатора клетки необ-
ходимо осторожно перемешать, используя смеситель «Вортекс».
Зафиксированные клетки можно месяцами хранить при 4 °C в
темноте и исследовать в тот момент, когда это удобно [35].
127
ГЛАВА 4
Нормальная кровь
Кровь больного СПИД
СПИД
Отриц. контроль
СПИД
CD4 (ОКТ4)
Кровь больного В-ХЛЛ
Интенсивность флуоресценции
Рис. 4.1. Типичный пример микропанельиого ИФА антигенного фенотипа лим-
фоцитов крови при использовании набора МКА и программы «КОМПОС» в
проточном цитофлуориметре EPICSV. Нормальная кровь содержит 10—15%
В-лимфоцитов (HLA класса II+, CD20+, CD22+, CD21+, IgM+); соотношение
х+ и Х+-клеток составляет 2 : 1. Соотношение Т-лимфоцитов, несущих антиге-
ны CD4 и CD8. тоже составляет 2:1. Среди лимфоцитов крови больного СПИД
отсутствуют СО4+-клетки. В крови больного В-клеточиым хроническим лим-
фолейкозом (В-ХЛЛ) преобладают злокачественные В-лимфоциты, экспресси-
рующие одновременно CD5 и IgM. В исследуемом образце лимфоцитов все
В-ХЛЛ клетки х+, но X-, т. е. моиоклональиы.
128
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
3. Для возбуждения флуоресценции ФИТЦ обычно исполь-
зуют монохроматический луч лазера с длиной волны 488 нм.
В этом же луче измеряется переднее и боковое (под углом 90°)
светорассеяние клеток анализируемой популяции. Детектор
флуоресценции ФИТЦ воспринимает излучение с длиной волны
более 515 нм, не реагируя благодаря фильтрам на отраженные
лучи лазера. Проточный цитометр, проанализировав 10 000 кле-
ток, выводит результаты на дисплей в виде гистограммы.
4. Компьютерные системы большинства цитофлуориметров
снабжены программами для расчета процентного содержания
маркированных клеток, характеризующего изучаемую популя-
цию. Цитофлуориметр EPICS V, оснащенный компьютерной си-
стемой EASY.88, имеет четыре программы построения графиков,
позволяющие, например, вывести на дисплей для сравнения ре-
зультаты микропанельного ИФА, выполненного с набором МКА.
Первая из этих программ, «КОМПОС», выстраивает гистограм-
мы результатов анализа клеток той же самой взвеси, но с раз-
ными МКА по горизонтали (рис. 4.1 и 4.2).
5. Вторая программа, «КОПЛОТ», строит гистограммы одной
серии результатов по вертикали, а третья программа, «НЮКО-
ПЛОТ», выстраивает их по диагонали. Все три программы пре-
дусматривают построение графиков в рамках (рис. 4.1 и 4.2)
или без них. Цвета изображений можно легко менять; при этом,
по желанию оператора, графики могут быть либо штриховыми,
либо сплошными. Программы «ИММУНО» и «КОПЛОТ» луч-
ше строят штриховые, а «НЮКОПЛОТ» — сплошные графики
без рамок.
6. Четвертая программа построения графиков, «ОВЕРЛЕЙ»,
одновременно выводит на всю площадь экрана одну или более
гистограмм (рис. 4.3). Этот способ изображения позволяет ви-
зуально сравнивать гистограммы. Анализ результатов тем са-
мым не облегчается, но рассчитанные предварительно с по-
мощью программ статистической обработки «ЙНТГРА» и
«ПММУНО» процентные отношения получают наглядное выра-
жение (см. ниже). Программа «ОВЕРЛЕИ» исключительно
удобна для построения графиков с использованием 15 имеющих-
ся оттенков окраски, однако малопригодна для печатания в
рамке.
7. Применение двух программ статистической обработки,
«ИНТГРА» и «ЙММУНО», существенно облегчает сравнитель-
ный анализ результатов проточной цитометрии. Кроме того, опе-
ративная компьютерная система EPICS MDADS цитофлуори-
метра EPICS сама интегрирует гистограммы для расчета про-
центных отношений результатов, полученных по отдельным ка-
налам. Достаточно выделить указателями (курсорами) нужную
область графика, чтобы получить ответ о том, какую часть она
составляет от всей гистограммы. Система EPICS MDADS одно-
9-172
129
ОбщийОЛЛ (ООЛЛ)
ООЛЛ CD34 i I (Bl - ЗС5) I Ж. I I ООЛЛ Класс 2 j 1 ,i(RFDR2) ! Ж
I i ООЛЛ i Д CD19 Л (RFB9) 1Ж J i i оолл j 1 ACDIO I (RFAL1I
оолл j CD7 (RFT2) оолл j CD2IRFT11) ' J L '!
оолл
CD13 (MCS2)
ООЛЛ
CD20 IRFB7)
ООЛЛ
СОЗ (UCHT1)
т-олл
; । оолл ;
I ' CD14 (UCHM1) :
•i; •;
J Ml___________'
ООЛЛ I
Отриц. контроль!
______________|
Т-ОЛЛ CD34 (BI-3C5) -u. Т-ОЛЛ 1 Класс 2 j (RFDR2) । т-олл ! CD13IMCS2) j I I Т-ОЛЛ CD14 (UCHM1)
Т-ОЛЛ i Т-ОЛЛ Т-ОЛЛ i Т-ОЛЛ ]
¥ о CD19 (RFB9) I CD1O(RFAL1) I CD20 (RFB7) I Ig M
CD ' c ; 1 j I L
it
О c j Т-олл j Т-ОЛЛ j Т-ОЛЛ i Т-ОЛЛ
£ 1 CD7 (RFT2) cd3(uchtd ;i i i 11 Отриц. контроль'
МКАТ "второго ряда"
Т-ОЛЛ
CD1 (NA134)
ТОЛЛ CD8 (RFT8) 1 Т-ОЛЛ i j 1 CD5IRFT1)
Ь 11— 1
олмл
Ж.
I олмл I I CD34 (BI-3C5) ] ilk ; ОЛМЛ Класс 2 j ; ji(RFDR2) 1j олмл Г'“си I олмл сосн“<
i| ОЛМЛ I CD19 (RFB9) олмл i CD10 (RFAL1) 1 k ; 1 олмл CD20 (RFB7) j олмл I IgM ;
I ОЛМЛ j I CD7 (РРТг^ j L i 1олмл j |CD2(RFT11I 1 L 1 I ОЛМЛ CD3 (UCHT1) ; L2U I олмл | | Отриц.контроль, к 1
Интенсивность флуоресценции
Рис. 4,2. Типичный пример микропанельного ИФА для определения антигенного фнноти-
па лимфоцитов больных острыми лейкозами при использовании набора МКА и про
граммы «КОМПОС» в проточном цитофлуориметре EPICS V. ООЛЛ—общий острый
лимфолейкоз (HLA класса П+, CD19+, CD10+). ТОЛЛ — Т-клегочиый острый лимфолей-
ков (HLA класса IICD7+, CD2+). Выявлены также дополнительные маркеры—СОТ
CD4 и CD8 — подтверждающие принадлежность злокачественных клеток к Т-лимфоцитам,
хотя некоторые из этих маркеров имеют на клетках ТОЛЛ слабую и нерегулярную экс-
прессию. ОЛМЛ — острый лейкемический миелолейкоз (HLA класса 1I+. MCS2+), В ис-
следуемом образце клетки ОЛМЛ в некоторой степени дифференцированы в направле-
нии моноиитов (UCHM1 + ).
Рис. 4.3. Миг^опанельныи ИФА лимфоцитов периферической крови здорового донора (контроль)
Программа «ОВЕРЛЕИ» позволяет непосредственно сопоставить содержание Т-хелперов (CD4+)
токсических лимфоцитов (CD8+). 1 '
и инфицированного СПИД,
и Т-супрессоров или пито-
ГЛАВА 4
временно обсчитывает лишь одну область графика. Для продол-
жения анализа необходимо вновь установить указатели. При
расчете процентных отношений по программе «ИНТГРА» на
компьютерной приставке EASY.88 воспроизводится тот же прин-
цип интегрирования гистограмм. Передвигая указатель по экра
ну (манипулятором типа «мышь»), можно установить до восьми
пределов оценки (заданные пределы) и получить на экране в
результате реализации программы одновременно до четырех
процентных показателей. Введя заданные пределы оценки в па-
мять компьютера, можно проводить обсчет гистограмм последо-
вательных образцов клеток и сравнивать между собой получен-
ные процентные показатели. Однако программа «ИНТГРА» не
производит вычитания показателей отрицательных контролен из
показателей опытных проб, которое возможно при использова-
нии программы «ИММУНО» (рис. 4.4).
8. Программа статистической обработки «ИММУНО» весь-
ма эффективна при анализе образцов клеточных взвесей, в кото-
ром распределение флуоресцирующих клеток накладывается на
распределение нефлуоресцирующих (или контрольных). Она по-
зволяет получить характеристики той и другой клеточной попу-
ляции. Об ограничениях этой программы можно узнать, позна-
комившись с буклетом «Immuno Program Notes» фирмы Coulter
Electronics Ltd., Великобритания.
5.5. Комментарии
На рис. 4.1 и 4.2 представлены результаты микропанельного
ИФА с помощью двух наборов МКА. Результаты применения
«лимфоцитарного» набора при анализе лимфоцитов перифериче-
ской крови больных СПИД и хроническим В-лимфолейкозом изо-
бражены на рис. 4.1. Среди лимфоцитов крови здорового инди-
видуума доминируют CD3+, CD2+, CD7+ Т-лимфоциты, пред-
ставляющие смесь CD4+ и CD8+ клеток. Указанные маркеры
имеют разную интенсивность флуоресценции. От 10 до 20% лим-
фоцитов относятся к В-клеткам. Они несут антигены CD 19, CD20
и мембранный IgM, в молекулах которого содержатся либо х.
либо X легкие цепи (в соотношении соответственно 2:1). В кро-
ви больного СПИД почти все CD3+ Т-клетки несут антиген
CD8, и наблюдается глубокая недостаточность CD4+ популяции
(см. рис. 4.3).
При сравнении крови больного В-клеточным хроническим
лимфолейкозом (В-ХЛЛ) с нормой можно отметить значитель-
ное увеличение числа В-лимфоцитов (несущих антигены МНС
класса II, CD19, CD20 и мембранный IgM) и снижение практи-
чески до нуля числа Т-лимфоцитов (CD7+, CD2+, CD3+). Не-
смотря на повышенное содержание В-лимфоцитов, интенсивность
132
2 4
1 2
6
e
Интервал
отрицательных
оценок
I Отрицательный
| контроль
Программа "ИММУНО"
\CD4
Образец: Т-хелперы
Процент отрицательных: 52,9
Процент положительных: 47,1
Средняя интенс. флуоресц.:85,7
a
20 25 30
24
18
1 2
б
0
, , 1 .... I
Интервал положительных оценок
Положительные
б
0 5 10 15 20 25 30
Номер канала х 10
24
1 8
1 2
6
0
Программа "ИММУНО"
ill' ।
III Интервал
отрицательных
| I оценок
Отрицательный
11|, контроль
JlL.
Ый CD4
в
Образец: Т-хелперы
Процент отрицательных 98,19
Процент положительных: 1,8
Средняя интенс. флуоресц.: 72,9
15 20
Э0
24
18
1 2
6
0
Интервал положительных оценок
Положительные
СПИД
М-Т-1
г
20 25 30
Номер канала х 10
Рис. 4.4. Статистическая обработка результатов микропанельиого ИФА в про-
точном цитофлуориметре EPICS V с использованием программы «ИММУНО».
Флуоресценция клеток, маркированных МКА к CD4, сопоставлена с флуорес-
ценцией клеток, маркированных мышиными антителами посторонней специфич-
ности (отрицательные контроли в айв). Во всех случаях метку выявляли
конъюгатом ФИТЦ с козьими антителами к иммуноглобулинам мышей. Поло-
жительные результаты представлены после вычитания данных отрицательных
контролей б и г. На панелях а и б анализированы лимфоциты здорового до-
нора, иа панелях в и г — лимфоциты больного СПИД. В крови больного
СПИД очень низкое (1,8%) содержание CD4+ Т-лимфоцитов.
ГЛАВА 4
флуоресценции В-клеточных маркеров при В-ХЛЛ существенно
ниже, чем в норме. Наблюдается также хорошо известный фе-
номен— слабая экспрессия В-лейкозными клетками антигена
CD5, который в норме считается маркером Т-клеток. Двойная
экспрессия одними и теми же клетками CD5 и IgM. а также
моноклональность IgM, определяемая по соотношению легких х-
и Х-цепей, имеют диагностическое значение и обсуждаются ниже
в разд. 7.
На рис. 4.2 представлены результаты микропанельного ИФА
лимфоцитов крови больного со злокачественным ростом ранних
пре-В-клеток. Диагноз общего острого лимфолейкоза (ООЛЛ)
в данном случае основывается на сильной экспрессии этими
клетками антигенов HLA класса II и CD10 (антиген ООЛЛ) и
слабой, но достаточно четкой экспрессии CD19. На ранних пре-
В-клетках выявлен и маркер стволовых клеток, CD34, но не об-
наружен характерный для зрелых В-лимфоцитов антиген CD20
[29].
Представленный далее на рис. 4.2 один из случаев острого
Т-лимфолейкоза (ОТЛЛ) характеризуется злокачественным рос-
том недифференцированных претимоцитов, сильно экспрессиру-
ющих CD7. Интенсивность флуоресценции этого маркера на
клетках ОТЛЛ часто бывает выше, чем на Т-лимфоцитах нор-
мальной периферической крови (см. рис. 4.1). Отметим, что клет-
ки ОТЛЛ несут антиген CD2, но не экспрессируют антигены HLA
класса II. На небольшой части бластов выявляется и CD10 (ан-
тиген ООЛЛ) [36]. Принадлежность клеток ОТЛЛ к претимоци-
там в данном случае стала очевидной при дополнительном ис-
пользовании набора МКА «второго ряда»: была выявлена [37]
коэкспрессия CD1, CD4, CD8 наряду с отсутствием мембранного
CD3. Целесообразно было бы исследовать экспрессию цитоплаз-
матического CD3 на препаратах, приготовленных с помощью ци-
тоцентрифуги (разд. 9) .
В случае острого лейкемического миелобластного лейкоза
(ОЛМЛ) наблюдалась более высокая, чем при ООЛЛ и ОТЛЛ,
фоновая флуоресценция отрицательного контроля, при постанов-
ке которого клетки сначала обрабатывали мышиными антите-
лами посторонней специфичности, а затем флуорохромированны-
ми антителами козы к мышиным иммуноглобулинам. Такую же
фоновую флуоресценцию, которая считается отрицательной ре-
акцией, дала обработка клеток ОЛМЛ целым рядом МКА к ан-
тигенам лимфоидных клеток. В то же время истинную положи-
тельную реакцию дали антитела к антигенам HLA класса II и
к CD13. Специфический маркер моноцитов, антиген CD14, вы-
явлен лишь на одной субпопуляции миелобластов.
Данные микропанельного ИФА лимфоцитов в проточном ци-
тофлуориметре EPICS V с применением МКА к характерному
для Т-хелперов антигену CD4 (Т4), представленные на рис. 4.1,
134
ИММУНОФЛУОРЕСЦЕНЦИЯ и ИММУНОГИСТОХИМИЯ
были подвергнуты статистической обработке по программе
«ИММУНО» (рис. 4.4). Проведено сопоставление реакции двух
образцов лимфоцитов — одного, полученного от здорового инди-
видуума, и другого, полученного от больного СПИД,— на анти-
тела к CD4 и на антитела посторонней специфичности (отрица-
тельный контроль). Показатели, полученные в отрицательных
контролях (рис. 4.4, айв), были вычтены из показателей опыта
для того, чтобы охарактеризовать истинную флуоресценцию,
обусловленную исключительно экспрессией CD4 (рис. 4.4, биг).
В результате было выяснено, что 47% мононуклеарных клеток
нормальной крови дают сильную положительную реакцию с ан-
тителами к CD4. Это и есть нормальные Т-лимфоциты, образую-
щие на гистограмме пик в интервале положительных оценок
(каналы 40—250). Другой пик, расположенный в интервале от-
рицательных оценок (каналы 2—40), образуют клетки, очень
слабо экспрессирующие CD4. В крови больного, инфицированно-
го вирусом иммунодефицита человека (ВИЧ), выявлено лишь
1,8% клеток, несущих CD4, что указывает на глубокое истоще-
ние этой субпопуляции Т-лимфоцитов. Такое низкое содержание
CD4+ лимфоцитов в крови наряду с клиническими симптомами
условнопатогенных инфекций свидетельствуют о том, что данный
больной, у которого образуются антитела к ВИЧ, страдает
СПИД.
При использовании чувствительных компьютерных программ
типа «ИММУНО» особое значение приобретает адекватность со-
ответствующих контролей. Например, в отрицательном контроле
первых антител вместо нормальной мышиной сыворотки реко-
мендуется использовать миеломные белки того же изотипа и в
той же концентрации, что и МКА, использованные в опытной
пробе.
5.6. Интерпретация результатов
Микропанельный ИФА позволяет применять для диагности-
ки лейкозов наиболее информативные иммуноспецифические реа-
генты— МКА. Чтобы установить принадлежность лейкозных кле-
ток к определенному гемопоэтическому ростку и идентифициро-
вать ту стадию дифференцировки, на которой прекратилось их
созревание, нужно располагать целым набором МКА, обеспечи-
вающих надежное фенотипирование клеточноспецифических ан-
тигенов. Вместе с тем, система идентификации клеток должна
обладать известной широтой, чтобы выявлять разнообразные от-
клонения исследуемых клеток от нормальной постадийной ди-
намики антигенного фенотипа. Результатом таких отклонений
иногда могут быть идиосинкратические фенотипы лейкозных кле-
ток, которые помимо этого имеют множественные хромосомные
135
ГЛАВА 4
аберрации. Поэтому именно микропанельный ИФА с одновре-
менным использованием целого набора МКА и быстрым получе-
нием разнообразной информации позволяет избежать ошибочных
оценок фенотипических данных, а также дает возможность про-
вести дополнительное типирование с любой новой комбинацией
реагентов. Примеры такого подхода, в частности, при диагно-
стике ОТЛЛ и ОЛМЛ представлены на рис. 4.2.
6. Блокада неспецифического присоединения
моноклональных антител к Fc-рецепторам
6.1. Принцип
На поверхностной мембране некоторых зрелых моноцитов и
лейкозных клеток моноцитарного происхождения нередко с вы-
сокой плотностью экспрессируются Рст-рецепторы. В этих слу-
чаях даже при использовании в качестве вторых антител F(ab')2-
фрагментов происходит создающее помехи неспецифическое свя-
зывание значительного количества МКА. Данный феномен про-
является высокой фоновой флуоресценцией в отрицательном кон-
троле с нормальной мышиной сывороткой. Характерно, что эта
флуоресценция после предварительного добавления нормальной
кроличьей сыворотки исчезает. Дело в том, что кроличьи имму-
ноглобулины, особенно агрегированные, обладают высокой аф-
финностью к Fc-рецепторам клеток человека, и, насыщая их, не
мешают специфическому связыванию МКА с соответствующими
лейкоцитарными антигенами.
6.2. Реагенты и лабораторные принадлежности
1. Все перечисленное в разд. 3 и, кроме того:
2. Нормальная кроличья сыворотка, содержащая агрегаты
иммуноглобулинов (для образования которых можно просто вы-
держать ее более месяца при 4 °C или трижды подвергнуть замо-
раживанию—оттаиванию). Сыворотку используют в разведении
1 : 10 без предварительного центрифугирования.
3. Меченные ФИТЦ козьи антитела к иммуноглобулинам
мыши, проверенные на отсутствие связывания с иммуноглобули-
нами кролика (должна быть отрицательная реакция с клетками,
инкубированными лишь в кроличьей сыворотке).
6.3. Описание метода
1. В каждую лунку микропанели, содержащую взвесь кле-
ток, вносят по 50 мкл кроличьей сыворотки, разбавленной в со-
отношении 1 : 10, и инкубируют 10 мин при 20 °C, а затем дважды
отмывают.
136
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
2. Проводят ИФА, результаты которого сравнивают с тако-
выми, полученными до блокады Fc-рецепторов.
6.4. Интерпретация результатов и примечания
Предварительная инкубация с нормальной кроличьей сыво-
роткой может привести к заметному снижению неспецифическо-
го связывания МКА, относящихся к IgG, и нормальных мыши-
ных иммуноглобулинов (в отрицательном контроле) с моноци-
тами и лейкозными клетками. Если при этом интенсивность вы-
явления антигенов HLA класса II и специфического антигена
моноцитов CD 14 остается высокой, можно утверждать, что ис-
следуемая популяция клеток экспрессирует Fc-рецепторы. Полу-
ченные данные позволяют идентифицировать диагностируемый
лейкоз как острый монобластный (ОМОЛ) или миеломонобласт-
ный (ОММЛ).
7. Двухцветный ИФА
7.1. Принцип
Эта простая модификация ИФА представляет значительную
ценность для специалистов в области иммунобиологии, глубоко
исследующих взаимосвязи между антигенным фенотипом и функ-
циями лимфоцитов. Принцип двухцветного маркирования заклю-
чается в следующем. Основной набор субпопуляционно-специ-
фических МКА позволяет выделить среди лимфоцитов четыре
главные категории клеток (табл. 4.3). Однако каждый из этих
образцов МКА маркирует клетки, функциональные особенности
которых весьма широко варьируют. Комбинируя МКА основного
набора с антителами к функционально-специфическим антиге-
нам, которые часто лишены клеточной специфичности, можно
разделить клетки на категории с более четко разграниченной
функциональной активностью. Как показано в табл. 4.3., в зави-
симости от сочетания выявленных мембранных маркеров каждая
основная категория лимфоцитов распадается на функционально
различные популяции. Так, с помощью МКА к Leu8 [38, 39],
CD45R (2Н4) [40] и CDw29 (4В4) [41] среди CD4+ лимфоци-
тов можно выделить субпопуляции Т-индукторов как с хелпер-
ной, так и с супрессорной активностью в отношении образования
антител. Однако антитела к Leu8 и к CD45R активно связы-
ваются не только с Т-лимфоцитами, но и с различными предста-
вителями В-клеточного ряда. Подобным образом МКА к CDw29
(4В4) с высокой аффинностью маркируют моноциты, макрофа-
137
Таблица 4.3. Взаимосвязи между антигенным фенотипом и функциональной активностью лимфоцитов
Т-хелперы1) Т-супрессоры и цитотоксические Т-лимфоциты1) Большие грануляр- ные лимфоциты (БГЛ) В-лим- фоциты Нелимфо- идные клетки
Антигены, выявляемые основным набором субпопуляционио-специфических МКА2>
CD3 CD4 CD8 CD166> CD 19 Антигены, вы + + являемые МКА «второго ряда» на клет + + <ах с разной функциональной ак -/+ + тивностью 1111 + Прим. 3 Прим. 4 Прим. 5 Прим. 7
Внутри суб- популяции CD4+ CD8+ CD166) Т-индукторы с хел- Т-индукторы ссуп- перной активно- рессорной актив- стью ностью Leu8- Leu8+ CDw294 CDw29- (4В4Ч CD45R- CD45R+ (2H4+) Т-супрессо- Цитотоксические ры9) Т-лимфоциты ? CD28+ Клетки с активно- стью нк,<>, HNK1 (Leu7)+/— клетки с не рестриктированной по МНС цитотоксичностью NKH1+ (Leul9) Прим. 8
') Имеются в виду только те Т-клетки. в которых генетические фрагменты. кодирующие антнгенсвязывающий рецептор (TCR), претерпели
соматическую перестройку; в БГЛ таких перестроек не происходит.
2) См. табл. 4.2.
3) Иногда анти-СОЗ МКА реагируют с клетками Пуркинье или цитоплазматическими филаментами всех клеток; во всех остальных случаях
экспрессия CD3 высокосиецифична.
4) Слабая экспрессия CD4 выявляется па моноцитах и купфсровских клетках; гетерогенной (от слабой до сильной) экспрессией CD4 обла-
дают разные субпопуляции макрофагов.
5) CD8 выявляется иа клетках, выстилающих синусы селезенки, на некоторых БГЛ, по во всех остальных случаях его экспрессия высоко-
специфична.
6) Fc-рецептор низкой аффинности (то же, что и Leull).
7) Слабо экспрессируется на В-клетках.
8) Эти антигены не являются клеточно-специфическими и обнаруживаются на многих нелимфоидиых клетках, перечень которых мы не приво-
дим из-за недостатка места [14].
9) Исчерпывающих данных об антигенном фенотипе Т-супрессоров еще не получено; цитотоксические Т-лимфоциты экспрессируют CD28 (9 3)
10) Leu7+, CD8- БГЛ обладают высокой активностью НК. по лишь 50—60% из них можно отнести к НК. Leu7+, CD8+ БГЛ и Leu7+, CD4t
БГЛ имеют меньшую активность НК. Большинство клеток, обладающих активностью НК. относятся к CD16+ (Leul 1+) популяции, лишенной CDS
и CD4. Другим специфичным маркером НК служит антиген NKH1 (Leu 19). В популяцию клеток, экспрессирующих данный антиген, входят неко-
торые CD3+ Т-лимфоциты, которые, по-видимому, экспрессируют v-цепь TCR и проявляют не рестриктироваииую по МНС цитотоксичность.
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
ги, полиморфноядерные гранулоциты и внеклеточные структуры
на срезах лимфоидной ткани. Еще один похожий (но имеющий
некоторые отличия) реагент с более тонкой специфичностью в
отношении лейкоцитов был совсем недавно предложен для ана-
лиза взаимосвязи между экспрессией данного антигена и опре-
деленной функцией клетки. Это — МКА к антигену UCHL1 [43].
Далее, популяция клеток, несущих CD8, также оказалась не-
однородной. В ней выделена субпопуляция, связывающая МКА
к антигену CD28 (9.3 и KOLT-2) и обладающая антигенспеци-
фической цитотоксичностью [44]. Окончательное представление
об антигенном фенотипе CD8+ Т-супрессоров до сих пор еще не
сформулировано.
Столь же загадочным представляется внутрипопуляционное
функциональное разнообразие больших гранулярных лимфоци-
тов (БГЛ) и их отношение к натуральным киллерам (НК). Лишь
50—60% БГЛ экспрессируют антиген Leu7 (HNK1). В такой же
пропорции Leu7+ (HNK1 н) клетки проявляют активность НК.
Высокая активность НК обнаружена у HNK1+, CD8", CD4~ кле-
ток, но антиген HNK1 строго не коррелирует с нею. Он обнару-
жен на некоторых CD8" клетках и на одной из популяций CD4+
лимфоцитов, которые не обладают активностью НК. По-видимо-
му, наиболее специфичным маркером БГЛ и НК является не
HNKL а антиген Fc-рецепторов низкой аффинности, CD16
(табл. 4.3). В самое последнее время получены МКА, выявляю-
щие новые маркеры НК, а именно NKH1 (Leul9) [46], но неко-
торые из несущих их клеток экспрессируют также CD3 и могут
быть отнесены к субпопуляции Т-лимфоцитов, обладающих не
рестриктированной по МНС цитотоксической активностью. Все
эти кратко упомянутые выше факты свидетельствуют о том, что
для определенного суждения о функциональной активности клет-
ки необходимо идентифицировать ее фенотип с помощью ИФА
по двум, а в некоторых случаях по трем антигенным маркерам.
Известны два варианта двухцветного ИФА. Во-первых, мож-
но одновременно маркировать клетки двумя флуорохромирован-
ными МКА разной специфичности. Мы настоятельно рекоменду-
ем данный прямой метод в тех случаях, когда требуется оценить
абсолютное количество того или иного антигена, экспрессирован-
ного на клетках. Применяют только первые (специфичные к лей-
коцитарным антигенам) антитела в концентрациях, достаточных
для полного насыщения всех антигенных детерминант. Препара-
ты необходимых меченых антител продаются многими фирмами
[47]. Один препарат из каждой пары обычно конъюгирован с
ФИТЦ, другой с ТРИТЦ или ФЭ. По сравнению с непрямым
методом, в котором применяются вторые, усиливающие положи-
тельную реакцию антитела, прямой метод требует относительно
большего расхода первых антител. Это расценивается как его
недостаток.
139
ГЛАВА 4
Таблица 4.4. Примеры образцов МКА идентичной специфичности,
но разного изотипа
Антигены, выявляемые МКА IgM IgG, IgG,
Антигены Т-клеток CD2 (Т11) на всех Т-клетках 9—2 (I)1’ OKTlla (2) RFT11 (3)
CD3 (ТЗ) на периферических Т-клет- Т10В9 (4) ОКТЗ (2) UCHT1 (5)
ках (аити-CDS МКА митогенны) CD4 (Т4) на Т-хелперах 66.1 (6) ОКТ4 (2) Leu 3a (7)
CD8 (Т8) на Т-супрессорах и пито- RFT8p. (3) ОКТ8 (2) RFT8y (3)
токсических Т-лимфоцитах Антигены клеток-предшествеиников CD 10 иа клетках ООЛЛ RFAL3 (3) RFAL2 (3) RFAL1 (3)
Антиген HLA класса II, неполиморф- ный Антигены В-клеток CD 19 иа пре-В-клетках и В-лимфоци- тах CD20 иа всех В-клетках RFDR1 (3) SB4 (8) RFB7 (3) RFDR (3) Bl (9) B4 (9)
’) В скобках указан порядковый номер учреждения-изготовителя или распространите-
ля МКА. (1) Naito and Dupont, США; (2) Ortho Diagnostic Systems Inc.. США; (3) Royal
Free Hospital. Лондон, Великобритания; (4) Thompson, США; (5) Beverley P. C. L..
University College Hospital, Лондон, Великобритания; (6) Hansen, США; (7) Becton
Dickinson Immunocytometry Systems, (США); (8) Sanofi, Франция; (9) Coulter, США.
Несмотря на то что непрямой метод неадекватно характери-
зует плотность экспрессии исследуемых антигенов на клеточной
мембране, его с успехом можно использовать для решения дру-
гих задач. По сравнению с прямым, он обладает тремя преиму-
ществами:
1) применение вторых флуорохромированных антител увели-
чивает количество связанной с антигеном метки и дает
яркую флуоресценцию даже при низкой плотности его экс-
прессии;
2) значительно сокращается расход дорогостоящих первых
антител;
3) для выявления первых антител любой специфичности при-
меняется один и тот же препарат флуорохромированных
вторых антител.
Когда первые МКА относятся к разным классам, например
к IgM и к IgG, их можно дифференцированно выявлять конъю-
гатами двух различных флуорохромов с козьими антителами к
соответствующим иммуноглобулинам мыши. В пределах каж-
дого стандартизованного CD-кластера МКА легко найдутся ан-
титела идентичной специфичности, но относящиеся к разным
классам иммуноглобулинов (табл. 4.4). Не менее успешно мож-
но использовать в непрямом двухцветном ИФА конъюгаты пер-
вых МКА с гаптенами, например биотином [48] (разд. 8) или с
140
\ ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
арсаниловой кислотой. Для выявления таких гаптенизированных
антител в качестве второго флуорохромнрованного реагента со-
ответственно применяют авидин (или стрептавидин) либо козьи
антитела к арсаниловой кислоте [49, 50].
И наконец, непрямой двухцветный ИФА можно проводить и
в том случае, когда оба препарата первых антител относятся к
одному классу иммуноглобулинов (например, IgG). Антитела
одной специфичности конъюгируют с биотином, тогда как анти-
тела второй специфичности (коммерчески доступные лишь в не-
большом количестве) используют пекопъюгированнымп (см.
разд. 8) [51].
7.2. Реагенты
1. В прямом ИФА применяют комплексные реагенты «Симул-
тест» фирмы Becton Dickinson Immunocytometry Systems (США),
например:
а) смесь меченных ФИТЦ антител к CD3 и меченных ФЭ
антител к CD19 (для выявления Т- и В-клеток);
б) смесь меченных ФИТЦ антител к CD4 и меченных ФЭ
антител к CD8 (для выявления Т-хелперов и Т-супрес-
соров);
в) смесь меченных ФИТЦ антител к CD5 и меченных ФЭ
антител к антигенам HLA класса II (для выявления
активированных Т- и В-клеток);
г) смесь меченных ФИТЦ антител к Leu7 и меченных ФЭ
антител к CD8 (для выявления цитотоксических Т-лим-
фоцитов и натуральных киллеров).
2. Для одновременного маркирования антигена CD5(Tl,p67)
и мембранного IgM используют мышиные МКА к CD5, конъюги-
рованные с ФИТЦ или ТРИТЦ козьи антитела к иммуноглобу-
линам мыши вместе с меченными ТРИТЦ козьими антителами к
IgM человека (к ц-цепи) фирмы Southern Biotechnology Associa-
tes (США) либо с меченными ФИТЦ р(аЬ')2-фрагментами кро-
личьих антител к IgM человека.
3. Для оценки моноклональностп В-клеточного злокачествен-
ного роста применяют меченные соответственно ТРИТЦ и ФИТЦ
козьи антитела к легким х- и Х-цепям иммуноглобулинов чело-
века (поставляются многими фирмами, в том числе Southern
Biotechnology Associates, США).
4. Парные образцы МКА разных изотипов для непрямого
двухцветного ИФА можно подобрать по табл. 4.4. Очищенные
иммуносорбцией изотипспецифические, меченные соответственно
ТРИТЦ и ФИТЦ козьи антитела к мышиному IgM и IgG (так
же, как и обратную комбинацию конъюгатов: aHTH-IgM-ФИТЦ
и aHTH-IgG-ТРИТЦ) поставляет фирма Southern Biotechnology
Associates, США.
141
ГЛАВА 4
5. Конъюгаты авидина и стрептавидина с ФИТЦ, ТРИТЦ и
ФЭ продает ряд фирм, например Becton Dickinson Immunocyto-
metry Systems, США; Serotec Ltd, Великобритания и Amershani
International pic, Великобритания.
6. Флуорохромированные МКА «второго ряда» (см. табл. 4.3)
можно приобрести у фирм Coulter Electronics Ltd, Великобрита-
ния, и Becton Dickinson Immunocytometry Systems, США.
7. Конъюгированные с ТРИТЦ МКА к антигену HLA клас-
са II (RFDR2) готовит Royal Free Hospital, Лондон, Великобри-
тания. От фирмы Becton Dickinson Immunocytometry Systems,
США, можно получить и меченные ФЭ антитела к антигенам
HLA-DR-класса II.
8. Нормальная мышиная сыворотка, разбавленная 1 : 10. Не-
обходимые приборы, перечисленные в разд. 3.
7.3. Прямой двухцветный ИФА с использованием антител,
флуорохромированных ФИТЦ и ФЭ
1. Как описано в разд. 3, в течение 10 мин инкубируют фрак-
цию мононуклеарных клеток крови с реагентом «Симултест» для
выявления Т-хелперов и Т-супрессоров либо с аналогичной, при-
готовленной самостоятельно смесью МКА анти-СЭ4 и анти-СЕ>8,
конъюгированных соответственно с ФИТЦ и ФЭ.
2. К отмытому осадку клеток добавляют 8%-ный формалин
нли 4%-ный параформальдегид и перемешивают.
3. Под микроскопом, не учитывая моноциты и тромбоциты,
подсчитывают 100—200 лимфоцитов. На моноцитах иногда вы-
является слабая экспрессия антигена CD. Вычисляют проценты
CD4+ (зеленое свечение) и CD8+ (оранжевое свечение) клеток
от общей популяции лимфоцитов.
4. Проводят проточную цитофлуориметрию клеток, обладаю-
щих параметрами светорассеяния, характерными для лимфоци-
тов. После анализа 10 000 клеток и построения гистограмм двух-
цветной флуоресценции выражают долю CD4+ (X) и CD8+ (Y)
клеток в процентах от общей популяции лимфоцитов.
5. Подсчитывают абсолютное число CD4+ и CD8+ клеток в
исследованном образце крови, исходя из процентного содержа-
ния этих клеток среди лимфоцитов, абсолютного содержания
лейкоцитов и лейкоцитарной формулы.
7.4. Примечание
Клетки, маркированные ФИТЦ и ФЭ, можно исследовать
под микроскопом одновременно без смены светофильтров. Для
этого пригоден стандартный комплект светофильтров, используе-
142
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
мый при микроскопии объектов, окрашенных ФИТЦ, из которо-
го удален дополнительный запирающий светофильтр с узкой
полосой пропускания. В таком виде комплект светофильтров по-
зволяет наблюдать оранжевое свечение ФЭ, при этом «выцвета-
ние» флуорохрома происходит очень медленно. В то же время
использование комплекта светофильтров, предназначенного для
наблюдения объектов, окрашенных ТРИТЦ, приводит к быстро-
му «выцветанию» ФЭ.
7.5. Дополнительное двухцветное (ФИТЦ и ТРИТЦ)
маркирование клеток при микропанельном ИФА
1. При обработке исследуемых клеток образцами МКА из
«лимфоцитарного» набора (см. разд. 3.4, табл. 4.1, рис. 4.1) в
11-ю лунку ряда вносят смесь меченных соответственно ТРИТЦ
и ФИТЦ козьих антител к легким х- и Х-цепям иммуноглобули-
нов человека. После четырехкратного отмывания производят
микроскопический учет ФИТЦ- и ТРИТЦ-окрашенных клеток,
пользуясь соответствующим комплектом светофильтров.
2. Клетки, находящиеся в 4-й лунке того же ряда, проинку-
бированные сначала с МКА к CD5 (Т1-типа), одновременно об-
рабатывают меченными ФИТЦ козьими антителами к иммуно-
глобулинам мыши и меченными ТРИТЦ козьими антителами к
IgM человека. После четырехкратного отмывания из осадка кле-
ток готовят препараты (в среде для заключения под покровны-
ми стеклами) и исследуют межклеточное распределение двух
маркеров — CD5 и IgM. В крови здорового донора наблюдается
раздельная экспрессия CD5 на Т-, a IgM на В-клетках. При
В-клеточном злокачественном росте CD5 коэкспрессируется на
IgM+ В-клетках.
3. При лейкозах популяции клеток крови и костного мозга
часто очень гетерогенны. Пропорция лейкозных клеток среди
нормальных элементов миелоидного и эритроидного ряда, а так-
же Т-лимфоцитов может в каждом случае широко варьировать.
Для оценки этой гетерогенности на клетках, оставшихся в лун-
ках после приготовления мазков, выявляют дополнительные мар-
керы, например антигены HLA класса II. В лунку добавляют
20 мкл мышиной сыворотки, которая связывает свободные козьи
антитела к мышиным иммуноглобулинам. Через 5 мин инкуба-
ции клетки один раз отмывают, добавляют конъюгированные с
ТРИТЦ МКА к антигенам HLA класса II, вновь инкубируют
10 мин, затем отмывают четыре раза и, микроскопируя с комп-
лектом светофильтров для ТРИТЦ, определяют на клетках экс-
прессию маркеров HLA-DR, параллельно оценивая экспрессию
других антигенов. В качестве других дополнительных маркеров
143
ГЛАВА 4
можно выбрать CD10 или групповые маркеры Т-лимфоцитов и
миелоидных клеток. Их выявляют в отдельных лунках, используя
комплект светофильтров для ФИТЦ.
7.6. Комментарии и интерпретация результатов
При микроскопии лимфоцитов нормальной крови, маркиро-
ванных антителами к х- и A-цепям иммуноглобулинов, можно
заметить, что на поверхности 10—15% клеток метка образует
скопление в виде пятен (пэтчей) и шапочек (кэпов). Так выгля-
дят х- и A-положительные В-клетки. Они соотносятся между со-
бой, как 2:1 (рис. 4.1). Редкое двойное окрашивание одной и
той же клетки объясняется присутствием на поверхности клетки
агрегированных иммуноглобулинов. Соотношение х/А-клеток
имеет значение для диагностики В-клеточных лейкозов и лим-
фом. О малигнизации свидетельствует превышение содержания
х-клеток над А-клетками более чем в 10 раз или превышение
А-клеток над х-клетками более чем в 5 раз [52, 53]. Если пато-
логические сдвиги цитограммы исследуемого образца выражены
нечетко (например, в случае В-лимфомы, поражающей костный
мозг), двухцветное маркирование может оказаться необходимым
для уточнения диагноза. Определяя частоту маркеров, выявляе-
мых антииммуноглобулиновыми реагентами, весьма важно учи-
тывать одновременно и другие антигены В-лимфоцитов, в част-
ности CD19, CD20 и антигены HLA класса II, поскольку некото-
рые злокачественные В-клетки отличаются низкой или вообще
нерегистрируемой экспрессией поверхностных иммуноглобули-
нов, проявляя при этом, однако, признаки «моноклональной» пе-
рестройки генов, кодирующих синтез иммуноглобулинов.
Одновременное выявление CD5 и IgM при двухцветном мар-
кировании позволяет подсчитать в крови здорового донора ко-
личество T(CD5+)- и В (IgM+)-клеток, а при лейкозах обнару-
жение этих маркеров на одной и той же клетке свидетельствует
о малигнизации. Такие клетки могут выявляться и в первичных
фолликулах лимфатических узлов и селезенки плода, их можно
найти в смывах из перитонеальной полости [54], но в норме они
быстро теряются среди подавляющего большинства CD5- В-кле-
ток и в лимфоидной ткани, крови и костном мозге взрослых встре-
чаются крайне редко [55].
Дополнительное выявление на клетках антигенов HLA-DR
весьма эффективно помогает и при диагностике лейкозов и лим-
фом со слабой диссеменацией, например, при лейкопеническом
ООЛЛ, когда в крови среди преобладающего числа нормальных
(HLA класса II)- Т-лимфоцитов появляются злокачественные
(slg)~ (HLA класса П)+ лимфобласты. Обнаружение последних
имеет диагностическое значение.
144
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
7.7. Контроль специфичности реагентов,
используемых в непрямом двухцветном ИФА
1. Контроль специфичности (стандартизацию) антиглобули-
иовых реагентов для двухцветного ИФА можно провести, ис-
пользуя два образца МКА, один из которых относится к IgM, а
другой к IgG. Мы, например, выбрали комбинацию Leu7 (HNK1,
IgM) и RFT8 (CD8, IgG). Для стандартизации готовят взвесь
лимфоцитов нормальной крови и по 50 мкл этой смеси помещают
в четыре пробирки.
2. В первую и вторую пробирки вносят RFT8 (IgG), а в
третью и четвертую — нормальную мышиную сыворотку (отри-
цательные контроли). Затем в первую и третью пробирки добав-
ляют Leu7 (IgM), а во вторую и четвертую — нормальную мы-
шиную сыворотку (отрицательные контроли). Клетки инкубиру-
ют 10 мин в присутствии 0,2% азида натрия, а затем четыре
раза отмывают.
3. В каждую пробирку вносят смесь соответствующих разве-
дений конъюгированных с ФИТЦ козьих антител к мышиному
IgG и конъюгированных с ТРИТЦ козьих антител к мышиному
IgM. Инкубируют 10 мин и вновь трижды отмывают.
4. Из осадков маркированных клеток готовят препараты «раз-
давленной» капли под герметизированным покровным стеклом.
Маркеры должны распределиться следующим образом: 25—30%
клеток CD8, 5—10% клеток HNK1+. В первой пробирке может
быть 3—6% клеток, несущих двойную метку. Однако наложение
двух маркеров вовсе не противоречит тому, что применяемые
МКА распознают два разных лимфоцитарных антигена и что
вторые (антиглобулииовые) антитела не дают перекрестных ре-
акций с указанными или другими классами мышиных иммуно-
глобулинов. Подтверждением специфичности реагентов может
служить выявление во второй пробирке клеток, окрашенных
только ФИТЦ, а в третьей — только ТРИТЦ. Хорошо стандарти-
зованный препарат вторых антител не должен маркировать клет-
ки в четвертой пробирке.
7.8. Примечания
Прошедшие контроль специфичности два препарата флуоро-
хромированных изотипспецифических антител к мышиным им-
муноглобулинам можно использовать в качестве вторых антител
с любой из множества комбинаций парных образцов МКА, от-
носящихся к IgG и IgM (табл. 4.4). Двухцветный микропанель-
ный ИФА — это весьма эффективный метод исследования гете-
рогенности лимфоцитарных популяций в крови и других орга-
нах (разд. 9), обладающий высокой точностью и пригодный для
10—172 145
ГЛАВА 4
повседневной практической работы, в частности для выявления
гемопоэтических клеток-предшественников, встречающихся с
крайне малой частотой.
8. Двухцветный ИФА, основанный на
взаимодействии биотин — авидин
8.1. Принцип
Известен достаточно простой метод присоединения биотина
к МКА. Биотинированные антитела в свою очередь можно вы-
являть с высокой чувствительностью в ИФА, используя коммер-
ческие препараты флуорохромированного авидина или стрепта-
видина. Сукцинимидный эфир биотина (СЭБ) для конъюгации
растворяют в диметилсульфоксиде (ДМСО) >и добавляют к ан-
тителам, с которыми он связывается при pH 8,6 [48].
8.2. Реагенты
1. Очищенные МКА, растворенные в 0,1 М ЫаНСОз (pH 8,6)
в концентрации 1 мг/мл, без азида натрия и других консерван-
тов. Конъюгацию антител с биотином тормозят посторонние ами-
ны, азид натрия и трис.
2. СЭБ хранят в эксикаторе и перед использованием раство-
ряют в ДМСО в концентрации 1 мг/мл.
3. PBS (pH 7,0) с 0,2% азида натрия.
4. Авидин (Sigma Chemical Со., США) конъюгируют с
ТРИТЦ, ФИТЦ или ФЭ самостоятельно либо используют пре-
параты стрептавидина, конъюгированные с техасским красным
или с ФИТЦ, поставляемые фирмой Amersham International pic,
Великобритания.
8.3. Описание метода
1. Раствор МКА разливают по 1 мл в три пробирки, добав-
ляют 30, 60 и 120 мкл СЭБ в ДМСО и, перемешав сразу же
после добавления, оставляют на 4 ч при 20°C.
2. Биотинированные антитела диализуют в течение ночи при
4 °C против PBS.
3. Исследуют каждый образец биотинированных МКА, чтобы
выбрать оптимальный конъюгат, дающий яркую флуоресценцию
после связывания с флуорохромированным авидином или стреп-
тавидином без потерь активности антител и неспецифического
свечения.
146
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
4. Исследуемые клетки инкубируют с препаратами антител
в следующей последовательности: небиотинированные МКА пер-
вой специфичности; конъюгированные с ФИТЦ козьи антитела
к мышиным иммуноглобулинам; мышиная сыворотка для исчер-
пывающего связывания остаточной активности предыдущего реа-
гента; биотинированные МКА второй специфичности и в послед-
нюю очередь препарат авидина или стрептавидина, конъюгиро-
ванный с ТРИТЦ или с ФЭ.
8.4. Примечание
Методом двухцветного ИФА, основанного на взаимодейст-
вии биотин-авидин, можно заменить двухцветное маркирование,
предусматривающее применение МКА разного изотипа. Окра-
шивание флуорохромированным авидином приводит к не менее
четким результатам, чем маркирование с применением антител
к иммуноглобулинам, но требует больше времени [51]. Боль-
шинство сред для культуры тканей содержит биотин. Если клет-
ки перед анализом не отмыть PBS или другим буферным рас-
твором, не содержащим биотина, то возможны ложноотрицатель-
ные результаты.
9. Исследование клеток в мазках и препаратах,
приготовленных с помощью
цитоцентрифуги
9.1. Принцип
Иммунофлуоресцентный анализ препаратов, полученных с
помощью цитоцентрифуги (т. е. осаждение клеток на предметном
стекле, которое служит дном центрифужной ячейки), позволяет
сделать следующие выводы.
1. Морфология клеток, маркированных во взвешенном со-
стоянии, выявляется лучше, чем при окрашивании мазков. Пре-
параты клеток, окрашенных во взвеси, не утрачивают способ-
ность к флуоресценции при хранении в темноте при 4°C свыше
месяца и, возможно, до года [56].
2. При маркировании антителами предварительно фиксиро-
ванных клеток выявляются преимущественно цитоплазматичес-
кие и ядерные антигены [57]. Окрашивая внутриклеточные ком-
поненты, многие образцы МКА могут проявлять иную реактив-
ность, чем при маркировании нефиксированных клеток во взвеси.
В препаратах фиксированных клеток выявляются также и мемб-
ранные антигены, имеющие высокий уровень экспрессии. На-
Ю* ]47
ГЛАВА 4
глядные примеры изменения реактивности МКА в зависимости
от условий маркирования можно наблюдать при исследовании
нормальных и злокачественных пре-В-клеток [58, 59], а также
плазматических клеток в ходе их доброкачественной и злокаче-
ственной пролиферации [60, 61], используя различные антигло-
булиновые реагенты.
3. Маркирование мембранных антигенов можно провести до
центрифугирования на клетках, находящихся во взвеси, а затем
окрасить цитоплазматические антигены на препаратах, приготов-
ленных с помощью цитоцентрифуги, т. е. после осаждения и
фиксации. Если при этом использовать различные флуорохромы,
можно одновременно выявить оба типа антигенов. Такой подход
был, например, воспроизведен при исследовании цитоплазмати-
ческого CD3, который у незрелых тимоцитов сначала экспресси-
руется в перинуклеарном пространстве, а затем в цитоплазме,
прежде чем встроиться в мембрану [57, 62, 63]. На препаратах,
приготовленных с помощью цитоцентрифуги, можно дополни-
тельно выявлять антигены, локализованные в ядрах клеток. Это
позволяет охарактеризовать мембранный фенотип тех клеток,
которые вступили в стадию синтеза ДНК и деления. О синтезе
ДНК судят по включению бромдезоксиуридина (БРДУ, аналога
тимидина), выявляемого с помощью МКА [64], или по появле-
нию в ядре ассоциированного с пролиферацией белка, который
тоже выявляют с помощью МКА (в данном случае МКА К167)
[65].
4. В заключение следует отметить, что выявляемая в ядрах
незрелых В-клеток и тимоцитов терминальная дезоксинуклеоти-
дилтрансфераза (TdT, уникальный фермент, участвующий в син-
тезе ДНК) вот уже несколько лет служит маркером при диаг-
ностике лейкозов. В физиологии лимфоцитов этот фермент рас-
сматривается как маркер стволовых клеток лимфоидного ряда
[10, 66].
Известны три способа приготовления препаратов клеточной
взвеси на предметном стекле.
1. Препарат готовят точно так же, как традиционный гема-
тологический мазок крови на предметном стекле. При этом оса-
док клеток должен быть суспендирован в равном объеме сыво-
ротки. Из мазков, приготовленных на основе таких 50%-ных
(«концентрированных») взвесей, быстро испаряется жидкость,
при этом клетки высыхают, не сморщиваясь, сохраняя первона-
чальную морфологию.
2. Препарат готовят с помощью цитоцентрифугп. Клетки сус-
пендируют в PBS, содержащей 0,2% БСА, до концентрации
106 клеток/мл и по 1—3 капли взвеси (это количество клеток
оптимально) вносят в лунки цитоцентрифуги.
3. Клеточную взвесь наслаивают на предметные стекла, по-
крытые поли-Ь-лпзином (ПЛЛ), оставляют примерно на 10 мин
148
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
для оседания и прилипания клеток, затем избыток жидкости
стряхивают.
В описанном ниже методе одновременного двухцветного мар-
кирования мембранных и цитоплазматических антигенов препа-
раты клеточных взвесей готовят с помощью цитоцентрифуги.
9.2. Реагенты и лабораторные принадлежности
1. Универсального фиксатора клеток, пригодного для анали-
за всех клеточных антигенов, разумеется, не существует. На-
пример, для выявления иммуноглобулинов в плазматических
клетках оптимальным фиксатором служит 5%-ная уксусная кис-
лота и 95°/о-ный этанол (совершенно не пригодные при марки-
ровании некоторых других антигенов). Чистый охлажденный эта-
нол — это лучший фиксатор при выявлении большинства цито-
плазматических антигенов и ядерной TdT [10]. Раствор NaOH
(0,01 М; см. ниже) необходим при выявлении БРДУ с помощью
МКА. При выявлении ряда других антигенов оптимально подхо-
дят такие фиксаторы, как ацетон или пары формальдегида.
2. Предметные стекла для микроскопии. Специальная фильт-
ровальная бумага для удаления жидкости при приготовлении
мазка с помощью цитоцентрифуги. Покровные стекла и среда,
в которую заключаются препараты, предназначенные для дли-
тельного хранения (описанная в разд. 3).
3. Стеклянные микропипетки объемом 2, 5 и 10 мкл для на-
несения растворов антител на препараты клеток.
4. Препараты антител для выявления мембранных, цитоплаз-
матических и ядерных антигенов, например, на тимоцитах чело-
века: МКА к СПЗ, такие, как Leu4 (Becton Dickinson Immunocy-
tometry Systems, США) или OKT3 (Ortho Diagnostic Systems
Inc., США) с меченными ТРИТЦ козьими антителами к имму-
ноглобулинам мыши (Southern Biotechnology Associates, США),
а также непосредственно конъюгированные с ФИТЦ антитела
к СОЗ. Меченные ФИТЦ МКА к БРДУ (Becton Dickinson) и сам
БРДУ (Sigma Chemical Со., США). Кроме того, необходим 0,1 М
раствор NaOH и 0,1 М раствор Na2B4O7.
5. Нормальная мышиная сыворотка (НМС), разбавленная в
соотношении 1 : 20.
6. Среда для культуры тканей с 10% СПК.
7. Фитогемагглютинин (ФГА) (Р, фирмы Wellcme Diagnos-
tics, Великобритания). Применяется для активации лимфоцитов
в конечной концентрации 2 мкг/мл.
9.3. Приборы
1. Настольная центрифуга для фракционирования клеток в
градиенте плотности фиколла—гипака (разд. 3).
149
ГЛАВА 4
2. Центрифуга («Цитоспин-2» фирмы Shandon Southern Pro-
ducts Ltd., Великобритания).
3. Влажная камера для препаратов, приготовленных с по-
мощью цитоцентрифуги.
4. Термостат на 37 °C с подачей СОг.
9.4. Метод двухцветного одновременного
маркирования мембранных
и цитоплазматических антигенов
1. Для маркирования готовят лимфоцитарные взвеси, содер-
жащие 5—10- 10s клеток в 1 мл. Источником может служить, на-
пример, нормальная кровь (К), ткань тимуса (Т) или четырех-
дневная культура лимфоцитов крови, стимулированных ФГА
(Ф). К лимфоцитарным взвесям добавляют БРДУ в конечной
концентрации 10 мкМ и инкубируют при 37 °C в атмосфере, со-
держащей 5% СОг, в течение 30 мин.
2. После инкубации из каждой лимфоцитарной взвеси (К, Т
и Ф) готовят по два образца, содержащих 4-105 клеток в 100 мкл
PBS-pO,2% БСА и 0,2% NaN3. Клеточные агломераты, имею-
щиеся во взвеси лимфоцитов, стимулированных ФГА (Ф) мож-
но разрушить пипетированием и инкубацией с N-ацетилгалактоз-
амином в концентрации 100 мкг/мл в течение 2—3 мин.
3. Образцы клеточных взвесей отмывают PBS, содержащем
0,2% БСА и 0,2% NaN3, затем один образец каждой взвеси ин-
кубируют 15 мин при 20°C с МКА к CD3, а второй — с НМС
(отрицательный контроль). После инкубации клетки трижды от-
мывают, затем добавляют меченные ТРИТЦ козьи антитела к
мышиным иммуноглобулинам (в качестве вторых антител) и
вновь трижды отмывают.
4. Из каждого опытного (маркированного МКА к СОЗ) и
контрольного образца каждой из взвесей (К, Т и Ф) в цитоцен-
трифуге готовят по три препарата (стекла Cl, С2 и СЗ). Обра-
зовавшиеся на предметных стеклах осадки клеток очерчивают
алмазной гравировальной иглой. По два препарата из каждой
серии (С1 и С2) фиксируют в ацетоне 10 мин при 20°С. Первое
стекло (С1) каждой серии предназначено для выявления мемб-
ранного CD3.
5. Второе стекло (С2) каждой серии регидратируют в PBS.
Затем на осадок клеток на 10 мин наносят НМС, разбавленную
PBS в соотношении 1 :20— 1:40. После этого препараты отмы-
вают тремя сменами PBS (каждая отмывка по 1—3 мин) в кю-
вете Коплина. Нельзя допускать высыхания препаратов, поэто-
му окрашивание проводят во влажной камере.
6. На отмытые препараты (С2) наносят раствор меченных
ФИТЦ антител к CD3 (коммерческий препарат, разбавленный в
150
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
соотношении 1 : 10), инкубируют 20 мин, затем трижды отмы-
вают.
7. Третье стекло (СЗ) из каждой серии, предназначенное для
выявления БРДУ, обрабатывают особым образом. Клетки фик-
сируют охлажденным метанолом при 4 °C 30 мин, затем на 10—
15 см погружают в 0,01 М. раствор NaOH и быстро переносят в
0,1 М. раствор Na2B4O7, имеющий pH 5,0.
8. После этого на клетки наносят НМ.С (разбавленную в со-
отношении 1:20— 1:40) и через 10 мин отмывают препараты,
как указано в п. 5.
9. На клетки наносят меченные ФИТЦ, МКА к БРДУ (титр
необходимо установить предварительно), инкубируют 20 мин,
затем трижды отмывают и заключают под покровным стеклом
(в одну из сред, описанных в разд. 3). Просматривая под микро-
скопом препарат СЗ следует обратить внимание на синтезирую-
щие ДНК и пролиферирующие клетки, которые несут одновре-
менно две метки — СПЗ (ТРИТЦ) на мембране и БРДУ в ядре.
В препарате С2 одновременно выявляются цитоплазматический
СПЗ (ФИТЦ) и мембранный СПЗ (ТРИТЦ). На стекле С1 окра-
шен только мембранный СПЗ (ТРИТЦ).
9.5. Примечания
Из приведенных выше примеров очевидно, что для выявления
различных антигенов необходимо использовать разные фиксато-
ры. Описанный метод позволяет проводить одновременное двух-
цветное маркирование мембранного и цитоплазматического СОЗ
(на стеклах С2), мембранного СПЗ и БРДУ (на стеклах СЗ) в
лимфоцитах нормальной крови, ткани тимуса и стимулированной
ФГА культуры. Можно было бы приготовить и по одному запас-
ному препарату (С4) из каждой серии для выявления ядерноп
TdT (см. ниже).
Одновременное маркирование мембранных или цитоплазма-
тических антигенов с помощью БРДУ требует особого внимания.
Попытки воспроизвести метод окрашивания БРДУ, рекомендуе-
мый в литературе, приводят к деструкции мембранных и цито-
плазматических антигенов из-за слишком высокой концентрации
используемого раствора NaOH. К тому же рекомендуемый фик-
сатор (70%-ный этанол) вызывает проникновение ядерных бел-
ков в цитоплазму и в результате приводит к размытому неудов-
летворительному маркированию антигенов (например, при выяв-
лении TdT соответствующими МКА). В связи с этим использова-
ние NaOH в более низкой концентрации представляется нам
важным условием сохранения нативной структуры мембранных,
цитоплазматических и ядерных антигенов; к тому же при этом
происходит необходимая для выявления БРДУ денатурация
ДНК [67].
151
ГЛАВА 4
9.6. Интерпретация результатов микроскопического
исследования
При микроскопическом исследовании препаратов установле-
но, что в клетках, экспрессирующих мембранный CD3 (ТРИТЦ),
при маркировании предварительно фиксированного мазка (С2)
выявляется также и цитоплазматический CD3 (ФИТЦ). Стиму-
ляция лимфоцитов ФГА приводит, по-видимому, к подавлению
экспрессии мембранного CD3 на поверхности клеток. Тем не ме-
нее во взвеси, приготовленной из ткани тимуса, большие лимфо-
бласты (составляющие 0,5—-5% от общего числа клеток) и 20—
40% малых тимоцитов при отсутствии мембранного CD3
(ТРИТЦ) отчетливо экспрессируют этот антиген в цитоплазме
(рис. 4.5).
Рис. 4.5. Одновременное маркирование двух антигенов: терминальной нуклео-
тидилтрансферазы (TdT— а, г) н цитоплазматического CD3 (CD3cy) (б) и
CD22 (CD22cy) (<Э) в клетках нормального тнмуса (а, б, в) и нормального
костного мозга (г, д, е). В больших лимфобластах тнмуса, обильно экспрес-
сирующих TdT, антиген CD3 выявляется в перинуклеарной области цитоплаз-
мы. Эти клетки обладают высоким пролиферативным потенциалом. В костном
мозге TdT+ лимфоциты содержат цитоплазматический CD22 и относятся к по-
пуляции пре-В-клеток.
При выявлении БРДУ среди лимфоцитов нормальной крови
обнаружено очень мало клеток, несущих метку (менее 1%). Од-
нако в стимулированных ФГА культурах и среди тимоцитов
БРДУ обнаружен у 10—40% клеток. Большие лимфобласты ти-
муса определенно входят в популяцию клеток, синтезирующих
в момент маркирования ДНК. Они составляют свыше 90% тимо-
цитов, включивших БРДУ. Их ядра содержат хорошо заметные
многочисленные ядрышки. При маркировании других антигенов
с помощью МКА обнаружено, что в лимфобластах тимуса, экс-
прессирующих цитоплазматический CD3 в отличие от лимфо-
152
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
бластов, полученных в стимулированной ФГА культуре лимфо-
цитов крови, выявляется TdT. Кроме того, лимфобласты тимуса
экспрессируют CD7, но лишены почти всех других Т-клеточных
антигенов (CD1~, CD2y CD4 \ CD9~ и слабая экспрессия CD5,
см. рис. 4.6). Подобным образом сопряженная экспрессия анти-
генов обнаружена и в системе В-клеток (известные данные по
этому вопросу обобщены на рис. 4.7).
Рис. 4.6. Экспрессия цитоплазматического CD3 (с CD3) мембранного CD3
(mCD3), терминальной нуклеотидилтрансферазы (TdT) и включение бром-
дезокснуриднна (БРДУ) в ходе дифференцировки тимоцитов. Большие лим-
фобласты тимуса (стадия 1 —• первая клетка на схеме под надписью «тимус»)
по фенотипическим характеристикам соответствуют клеткам Т-клеточного
острого лимфолейкоза (ТОЛЛ). Подобных клеток нет в костном мозге, где
все TdT+ клетки не имеют CD3. Числа 2, 4, 7 и 8 означают антигены Т-лим-
фоцитов CD2, CD4, CD7 и CD8, согласно номенклатуре, принятой на Первом
рабочем совещании по дифференцировочным антигенам лейкоцитов в Париже
в 1982 г. (Перепечатано из [63] с разрешения.)
10. Иммуноцитохимический анализ срезов тканей
10.1. Принципы
Основанные на реакциях антиген—антитело методы микро-
скопического выявления и идентификации молекулярных компо-
нентов клеток и тканей называют иммуноцитохимическими. В ка-
честве реагентов для выявления клеточных антигенов в боль-
шинстве случаев используют специфические антитела, тканевую
локализацию которых после связывания с антигенами устанав-
ливают прямым или непрямым методом по метке. Меткой слу-
жат конъюгированные с антителами ферменты, флуорохромы
или выявляемые при микроскопии частицы. Как уже обсужда-
лось выше, непрямой метод обнаружения клеточных антигенов,
основанный на использовании вторых антител, чувствительнее
прямого. Используя аффинные взаимодействия типа фермент —
153
ГЛАВА 4
Костный мозг и
лимфоидная ткань
Рис. 4.7. Экспрессия ядерной TdT, цитоплазматических (ср, — тяжелая цепь
IgM, CD22) и мембранных антигенов, а также включение бромдезоксиурпдпна
(БРДУ) в ходе дифференцировки В-лимфоцитов. Числа 10, 19, 20, 21 и 22
означают соответственно антигены CD 10, CD 19, CD20, CD21 и CD22, согласно
номенклатуре, принятой на Втором рабочем совещании по дифференцировоч-
ным антигенам лейкоцитов в Бостоне в 1984 г. cig-—цитоплазматические им-
муноглобулины; slgM п slgD — поверхностные IgM и IgD. RFD6(rer)—ци-
топлазматический антиген плазматических клеток.
антитела к нему или комплекс биотина, конъюгированного с
ферментом авидином, можно достичь еще большего увеличения
чувствительности. При постановке иммуноцитохимических мето-
дов требуется прежде всего так обрабатывать срезы исследуе-
мых тканей, чтобы в них сохранялась нативность выявляемых
антигенов. Однако этому всегда противостоит необходимость до-
биться адекватной морфологической картины исследуемых кле-
ток и тканей, которая позволила бы верно интерпретировать ре-
зультаты.
10.2. Реагенты
1. Фиксирующие жидкости: нейтральный забуференный рас-
твор формальдегида, жидкость Ценкера и т. п., рецептуру кото-
рых можно найти в руководстве по гистохимии Э. Пирса [72].
2. Поли-Ь-лизин (Sigma Chemical Со., США).
3. Протеаза VII (Sigma).
4. Водоотталкивающая смесь: смешивают 84 мл изопропано-
ла, 1 мл концентрированной серной кислоты и 15 мл диметилпо-
154
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
лисилоксана; смесь оставляют для уравновешивания до примене-
ния. Экономно наносят на предметные стекла с целью гидрофо-
бизации поверхности вокруг срезов.
10.3. Приготовление срезов из тканей
1. Для приготовления нефиксированных криостатных срезов
кусочки свежевыделенной ткани собирают в 0,85%-ный раствор
NaCl, в среду для культуры ткани или в транспортную среду
Мичела.
2. Блоки ткани толщиной 2—4 мм на пробковых колодках
заключают в OCT1 (Tissue Тек) и моментально замораживают
в охлажденном изопентане при —70 °C. Для охлаждения изо-
пентана наполненный им контейнер помещают над жидким азо-
том и оставляют до тех пор, пока изопентан на дне контейнера
не начнет загустевать.
3. Примерно через 5 мин полностью замороженный блок тка-
ни извлекают из изопентана и, удалив остатки последнего, хра-
нят при —70 °C до приготовления срезов. Замораживание ткани
непосредственно в жидком азоте может привести к растрески-
ванию блока при нарезании в криостате, поэтому и рекоменду-
ется сначала заморозить его в изопентане. Если блоки ткани за-
ключены в ОСТ, то в жидком азоте их можно хранить многие
годы, при —70 °C — примерно год, а при —20 °C — еще меньше.
Ткани наиболее чувствительны к повреждающему действию пе-
репадов температуры, которыми, по-видимому, и объясняется
сокращение сроков хранения при —20 °C и —70 °C.
4. Для приготовления срезов из предварительно фиксиро-
ванной ткани ее нарезают на блоки размером не более 0,5Х
Х1,5 см и на 18—24 ч помещают в нейтральный забуференный
формалин при 20 °C. Фиксированные блоки ткани заливают в
парафин, используя традиционные методы гистологических ис-
следований [72]. Метод парафиновых срезов обеспечивает хоро-
шую морфологическую картину, но при этом вызывает разруше-
ние большинства мембранных антигенов. Правда, некоторые ци-
топлазматические антигены полностью сохраняются или могут
быть выявлены после кратковременной обработки протеолитиче-
скими ферментами (трипсином или проназой). При использова-
нии других фиксаторов, например паров формальдегида [75],
смеси формалина с уксусной кислотой, жидкости Ценкера или
Буэна, сохраняются многие цитоплазматические антигены, но не-
обратимо разрушается большинство мембранных. После приме-
нения перечисленных фиксаторов обработка протеазами уже не
способствует выявлению цитоплазматических антигенов.
1 ОСТ — от англ, o-chlorotoluen (о-хлортолуол).— Прим, перев.
155
ГЛАВА 4
5. Фиксация ткани в смеси перйодат — лизин — параформ-
альдегид сохраняет неразрушенными гликопротеины и оставля-
ет нативными многие, но не все мембранные и цитоплазматиче-
ские антигены. Вместе с тем данный фиксатор обеспечивает хо-
рошую морфологическую картину [73].
6. Недавно был описан метод приготовления тканевых сре-
зов, весьма удобный для лабораторий, не располагающих моро-
зильными камерами достаточного объема. Блоки ткани толщи-
ной 3—4 мм высушивают из замороженного состояния в течение
ночи, а затем заливают в парафин. В таком виде их можно хра-
нить при комнатной температуре [74].
10.4. Приготовление срезов из замороженных тканей
1. После того как блок замороженной ткани воспримет тем-
пературу криостата (для лимфоидной ткани оптимальна темпе-
ратура от —20 до —28°C, для костного мозга от —30 до
—36°C), готовят срезы толщиной 5—8 мкм. Все требуемое ко-
личество срезов (с учетом запасных) необходимо нарезать одно-
временно из одного и того же блока. Качество блоков, заморо-
женных повторно после криотомии, быстро ухудшается, и они
часто становятся непригодными для приготовления срезов.
2. Охлажденной препаровальной иглой переносят по 2—3 сре-
за на поверхность каждого предметного стекла и оставляют для
полного высушивания при комнатной температуре на 2—24 ч.
Если качество замороженных блоков было недостаточно хоро-
шим или они были зафиксированы перед микротомией, то полу-
ченные срезы следует помещать на предметные стекла, покры-
тые ПЛЛ.
3. Затем можно зафиксировать срезы в течение 10 мин в лю-
бом из следующих фиксаторов: ацетоне; смеси равных объемов
ацетона и хлороформа; смеси равных объемов ацетона и мета-
нола, либо зафиксировать 10 мин в ацетоне, затем 10 мин в эта-
ноле, а в заключение быстро обмыть в ацетоне. Выбор фиксато-
ра зависит от того, какой именно антиген требуется выявить и
насколько важно получить хорошую морфологическую картину
(табл. 4.5).
4. Зафиксированные срезы оставляют для высушивания, за-
тем прикладывают тыльными сторонами предметных стекол друг
к другу, заворачивают в облегающую полиэтиленовую пленку
или алюминиевую фольгу и хранят при —20 °C, поместив в гер-
метизированный пластиковый пакет с влагопоглотителем (напри-
мер, силикагелем). В этих условиях срезы сохраняют способ-
ность к окрашиванию по меньшей мере в течение двух лет. Но
если срезы хранятся нефиксированными, их необходимо обрабо-
тать и окрасить в течение месяца.
156
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
Таблица 4.5. Выявление мембранных и цитоплазматических антигенов
в тканях с помощью различных фиксирующих средств
Фиксатор Мембранные антигены Цитоплазма- тические ан- тигены IgG IgA IgM1) Морфологи- ческая кар- тина
Срезы. приготовленные из свежезамороженной ткани
Ацетон — этанол +++ +++ -гН—F Плохо выра- женная
Ацетон-хлороформ +++ ++4- -г+-^ Еще хуже
Ацетон — метанол + ++ 4-++ Хорошая
Забуференный форма- лин Срезы, приготовленные из фиксированных бло- ков ткани + Отличная
Перйодат — лнзнн — параформальдегид ++ Н—г _!—L Отличная
Забуференный форма- лин, формалин на — -U -—— Отличная
0,85%-ном NaCl, жидкость Ценкера нли Буэна 1 1 1 1
*) Для выявления связанных с клеточными мембранами IgG нли IgA срезы, нзготов-
ленные из свежезамороженной ткани, после фиксации необходимо в течение 24—48 ч
отмывать 0,85'%-ным раствором NaCl, чтобы удалить сывороточные иммуноглобулины
того же нзотина. Морфологическая картина таких препаратов получается очень плюхой.
5. Срезы, извлеченные из морозильной камеры (—20 °C) не
разворачивают до тех пор, пока они не воспримут комнатную
температуру. Иначе их может повредить образующийся конден-
сат водяных паров. Области стекла, занимаемые срезами, очер-
чивают алмазной иглой. На поверхность стекла между срезами
наносят водоотталкивающую смесь. Благодаря этому наносимые
на срезы (когда их несколько) капли растворов первых антител
не будут растекаться по стеклу и не сольются друг с другом.
Теперь срезы подготовлены к нанесению первых и вторых анти-
тел (разд. 11 —13).
10.5. Обработка парафиновых срезов
1. Срезы депарафинируют в ксилоле или другом органичес-
ком растворителе.
2. Срезы регидратируют, проводя через ряд растворов этано-
ла убывающей концентрации до буферного раствора, в котором
наносят антитела.
3. Эффективность выявления антигенов в фиксированных
формальдегидом тканях с помощью антител можно повысить,
157
ГЛАВА 4
обработав срезы протеазой. Существует предположение, что про-
теаза освобождает перефиксированные антигенные детерминан-
ты [75]. Срезы погружают на 10——30 мин в 0,1%-ный раствор
трипсина в трис-буфере с pH 7,8 при 37 °C. Продолжительность
ферментативного гидролиза, как и его положительный эффект,
зависят от природы конкретных исследуемых антигенных детер-
минант и определяются в предварительных экспериментах (ме-
тодом проб и ошибок). В отдельных случаях, например, при
выявлении иммуноглобулинов, связанных с клеточными мембра-
нами, предпочтительнее использовать другие протеолитические
ферменты, такие как протеиназа VII, а не трипсин. Регидрати-
рованные срезы готовы для окрашивания (см. разд. 11 —12).
10.6. Обработка предметных стекол поли-Ь-лизином
Готовят 0,1%-ный (вес/объем) раствор ПЛЛ в дистиллиро-
ванной воде и погружают в него предметные стекла. Для боль-
шей экономии можно наносить ПЛЛ на поверхность стекла при-
мерно так, как делают мазок крови. Пятна ПЛЛ быстро высы-
хают (10—30 с) и становятся невидимыми, поэтому важно отме-
чать ту сторону стекла, где нанесен ПЛЛ. Покрытые ПЛЛ стек-
ла необходимо использовать в течение недели.
11. Иммунопероксидазный метод
11.1. Принципы
Пероксидаза хрена (ПХ) в присутствии небольшого количе-
ства перекиси водорода катализирует окисление 3,3'-диамино-
бензидина (ДАБ) с образованием нерастворимого золотисто-ко-
ричневого продукта. Если ПХ непосредственно или опосредован-
но присоединить к антителам, то эта реакция может происходить
лишь там, где меченные ферментом антитела связались с анти-
геном. Именно в этом месте образуется окрашенный продукт
окисления. Его контрастность можно усилить ионами металлов
[72]. При использовании других субстратов, вместо ДАБ, про-
дукты окисления имеют иную окраску [76], но обладают тем не-
достатком, что растворяются в смеси этанол-—ксилол, и, следо-
вательно, эти субстраты нельзя применять для приготовления
препаратов, предназначенных к долгосрочному хранению.
11.2. Реагенты и лабораторные принадлежности
1. ДАБ: готовят один из двух растворов—(а) непосредст-
венно перед применением растворяют тетрагидрохлорид 3,3'-диа-
минобензидина в концентрации 0,6 мг/мл в PBS, содержащем
0,01 % перекиси водорода [76] или (б) сначала растворяют сво-
158
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
бодное основание 3,3'-диаминобензиднна в монометиловом эфи-
ре этиленгликоля; приготовленный исходный раствор хранят при
—20°C (при этой температуре он не замерзает). Непосредствен-
но перед применением 0,1 мл исходного раствора добавляют к
10 мл 0,02 М фосфатного буфера, pH 7,2, содержащего 0,01 %
перекиси водорода. Рабочие растворы ДАБ должны быть бес-
цветными. При появлении коричневого оттенка их необходимо
профильтровать, иначе возрастет интенсивность фонового окра-
шивания. Рабочие растворы должны использоваться в течение
двух часов с момента приготовления. Их держат на холоду, за-
щитив от света. Внимание! ДАБ обладает канцерогенной актив-
ностью. Следует исключить его ингаляцию и попадание в орга-
низм иным путем.
2. 2%-ный (вес/объем) водный раствор железоаммонийных
квасцов.
3. Гематоксилин Майера. Растворяют в дистиллированной
воде 2,0 г гематоксилина, 0,2 г йодата натрия, 17,6 г персульфата
алюминия и 20 мл ледяной уксусной кислоты; объем доводят во-
дой до 1 л; перемешивают в течение нескольких часов до пол-
ного растворения и фильтруют перед использованием. Приго-
товленный по этой рецептуре гематоксилин не содержит стаби-
лизатора (полиэтиленгликоля) и поэтому должен быть исполь-
зован в течение месяца. Его преимущества заключаются в том,
что он не обладает собственной флуоресценцией [5] и, реагируя
при участии железоаммонийных квасцов с окисленным перокси-
дазой ДАБ, дает соединение, имеющее темно-коричневую или
черную окраску.
4. PBS: 0,15 М раствор хлористого натрия, забуференный.
фосфатами (0,01 М, pH 7,2).
5. PBSAA: 0,01 М PBS+0,2% БСА и 0,2% NaN3.
6. Кюветы Коплина, влажные камеры и штативы для окра-
шивания срезов.
11.3. Описание методов
После того, как срезы регидратированы, необходимо исклю-
чить их любое новое высушивание, которое может привести к
грубым изменениям тинкториальных свойств ткани.
1. Для блокирования эндогенной пероксидазы срезы, приго-
товленные из тканей, фиксированных формальдегидом, обраба-
тывают в течение 15—30 мин буфером или метанолом, содержа-
щим 1% Н2О2, либо нитроферрицианид [77], либо 1% NaN3. Кро-
ме того, можно поместить срезы на 5 мин в 2,5%-ную периодную
кислоту. К сожалению, однако, все эти способы блокирования в
той или иной степени вызывают денатурацию мембранных анти-
генов в криостатных срезах. В тех случаях, когда блокирование
пероксидазы слишком сильно нарушает морфологическую кар-
15»
ГЛАВА 4
тину или когда исследуемая ткань обладает повышенным содер-
жанием этого фермента, например из-за присутствия эозинофи-
лов, лучше использовать в качестве метки щелочную фосфатазу.
2. Без какой-либо предварительной гидратации на срезы на-
носят М.КА в соответствующем разведении на PBS+0,2% БСА+
+0,2% NaN3. Можно использовать неразбавленную или разбав-
ленную до 1 :50 надосадочную жидкость культуры гибридом.
Применяя асцитическую жидкость или обычные (поликлональ-
ные) антисыворотки, необходимо предварительно определить оп-
тимальный рабочий титр реагента. Он может быть весьма высо-
ким— от 1/500 до 1/1 000 000. Мы предпочитаем использовать при
иммуногистологическом анализе культуральную надосадочную
жидкость. На срез диаметром 6 мм достаточно нанести 30—
50 мкл препарата антител. Во избежание подсушивания инкуба-
цию срезов с антителами проводят во влажной камере при ком-
натной температуре в течение 30—60 мин.
3. Предметные стекла, на которых находятся срезы, перено-
сят в кюветы Коплина и отмывают в трех сменах PBS, оставляя
в каждой смене буфера на 1—3 мин.
4. В качестве вторых антител при использовании мышиных
или крысиных МКА применяют соответствующее разведение пре-
паратов конъюгированных с пероксидазой кроличьих или козьих
антител к мышиным иммуноглобулинам. Пероксидазные конъю-
гаты разводят в PBS (без азида натрия), содержащем 20% сы-
воротки того же вида, что и исследуемая ткань. Эта сыворотка
должна устранить неспецифическое связывание кроличьих анти-
тел и нейтрализовать перекрестную реактивность вторых антител
в отношении иммуноглобулинов, содержащихся в исследуемой
ткани. Конъюгаты кроличьих антител к мышиным иммуноглобу-
линам фирмы Dakopatts А/S, Дания, можно использовать в раз-
ведении 1/50. Срезы инкубируют с антителами во влажной каме-
ре в течение 30—60 мин и отмывают, как указано в п. 3.
5. Фиксируют срезы 5 мин в забуференном формалине и
5 мин промывают в воде.
6. На 2—10 мин погружают препараты в раствор ДАБ. Ре-
акцию можно усилить, добавив 10 мМ имидазола в фосфатном
буфере с pH 7,2. Затем 5 мин промывают препараты водопро-
водной водой.
7. На 1—2 мин погружают препараты в железоаммонийные
квасцы, затем, отмыв избыток квасцов водой, окрашивают в те-
чение 30 с гематоксилином и отмывают (дифференцируют) под
струей водопроводной воды. После этого проводят срезы через
растворы этанола восходящей концентрации для обезвоживания,
просветляют в ксилоле и заключают в DPX1 или стиролайт.
1 Нейтральный раствор полистирола и пластификатора в ксилоле.— Прим,
перев.
160
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
11.4. Комментарии
При воспроизведении любого из методов иммуноцитохимиче-
ского окрашивания крайне важно поставить положительные и
отрицательные контроли одновременно с исследованием опытно-
го образца. Один из отрицательных контролей предусматривает
использование первых антител посторонней специфичности, ко-
торые заведомо не реагируют с антигенами исследуемой ткани.
Положительный контроль следует поставить на срезах из ткани,
в которой выявляемый антиген обязательно экспрессируется.
Лишь на результатах контрольных экспериментов может быть
основана корректная интерпретация данных, полученных при
микроскопии срезов исследуемой ткани. Дело в том, что ни один
из методов иммуноферментного анализа не свободен от возмож-
ности неспецифического окрашивания, которое бывает либо диф-
фузным фоновым, либо локальным и необычно ярким. Причины
этих артефактов могут заключаться в следующем.
1. Связывание антител с Fc-рецепторами происходит при ис-
пользовании поликлональных антисывороток или содержащих
М.КА образцов асцитической жидкости. Для отмены такого не-
специфического связывания к препарату вторых антител добав-
ляют 5—20% нормальной сыворотки той же видовой принадлеж-
ности или используют F(ab')2-фрагменты антител.
2. Связывание антител в результате гидрофобных взаимодей-
ствий. Для его предотвращения необходимо работать с высоки-
ми разведениями антисывороток, инактивировать комплемент
(прогрев антисыворотку в течение 30 мин при 56°C, если арте-
факты обусловлены связыванием комплемента), а также приме-
нять для отмывания срезов и в качестве разводящей жидкости
буферные растворы высокой ионной силы (например, 2,5%-ный
раствор хлористого натрия или забуференный раствор ЭДТА).
3. Перекрестное взаимодействие вторых антител с иммуногло-
булинами исследуемой ткани. О нем мы уже упоминали выше.
Для его предотвращения к препарату вторых антител добавляют
20% нормальной сыворотки той же видовой принадлежности, что
и исследуемая ткань.
4. Ковалентное связывание антител с химически реактивны-
ми группами в тканях. В недостаточно отмытых после формаль-
дегидной фиксации тканях могут остаться реакционноспособные
альдегидные группы. Для их нейтрализации перед окрашивани-
ем можио обработать срезы боргидридом натрия.
И- 172
161
ГЛАВА 4
11.5. Интерпретация результатов микроскопического
исследования
При микроскопии окрашенных препаратов на фоне обычной
морфологической картины в тканях можно идентифицировать ко-
ричневый продукт ферментативной реакции, образовавшийся в
местах связывания использованных антител с выявляемыми ан-
тигенами. Кроме проблем, обусловленных неспецифическим окра-
шиванием и затемнением среза, которое в редких случаях вызы-
вает эндогенная пероксидаза, нммунопероксидазному методу,
как и другим методам иммуноферментного анализа, присуща
другая проблема, которую можно назвать главной. Это — необхо-
димость найти компромисс между стремлениями максимально
сохранить нативность выявляемых антигенов и при этом одно-
временно зафиксировать морфологическую картину ткани. До-
пустим, имеется срез ткани, содержащий 50% злокачественно
перерожденных лимфоцитов, у которых морфология ядер и яд-
рышек отличается от нормы. Если, добившись выявления опре-
деленного антигена, мы из-за плохой проработки морфологиче-
ской картины ядер не сможем с определенностью установить, в
какой из лимфоцитарных популяций — злокачественной или нор-
мальной— он локализуется, наша интерпретация будет слишком
умозрительной. Однако, с другой стороны, бессмысленно доби-
ваться хорошей морфологической картины, теряя при этом воз-
можность выявления антигенов.
Неудачные попытки найти этот компромисс послужили пово-
дом для интенсивных поисков МКА, способных выявлять клеточ-
но-специфические антигены в тканях, фиксированных формаль-
дегидом. Однако, как оказалось, значительная часть найденных
МКА не связывается с функционально-значимыми антигенами,
которые выявляются на живых клетках.
По нашим данным, наибольшее повреждение антигенов на
срезах, фиксированных в ацетоне или в смеси ацетона с этано-
лом, происходит в результате ферментативного протеолиза в мо-
мент окрашивания. Денатурацию антигенов можно уменьшить,
добавив ингибиторы протеаз (например, апротинин) в буфер, иа
котором приготовлены разведения реагентов, или зафиксировав
срезы забуференным формалином после нанесения первых анти-
тел. Иммуноглобулины относительно резистентны к формальде-
гиду, поэтому такая дополнительная обработка, инактивируя про-
теазы, не ослабляет связывания вторых антител, добавляемых на
следующем этапе.
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
12. Иммуноферментное маркирование
комплексами щелочная фосфатаза—антитела
к щелочной фосфатазе (ЩФ— АЩФ)
12.1. Принцип
Принцип маркирования тот же самый, что и при использова-
нии иммунопероксидазной метки, но на практике имеет свои пре-
имущества и недостатки. Среди преимуществ следует отметить
следующие.
1. Эндогенную ЩФ можно легко инактивировать во всех тка-
нях, исключая кишечник.
2. Конечный продукт ферментативной реакции имеет хорошо
заметный красивый красный цвет.
3. МКА к ЩФ, образуя многослойные комплексы ЩФ—АЩФ,
повышают чувствительность выявления первых антител.
Метод, основанный на применении ЩФ, имеет также и не-
достатки.
1. Большинство субстратов ЩФ дает продукт ферментатив-
ной реакции, который растворяется в этаноле и ксилоле. Это за-
трудняет приготовление препаратов, которые могли бы хранить-
ся долгое время.
2. Воспроизведение метода занимает больше времени, чем
маркирование иммунопероксидазой.
Легкость, с которой применение левомизола позволяет инак-
тивировать эндогенную ЩФ, делает данный метод особенно удоб-
ным для маркирования клеток крови и костного мозга [69].
Глюкозооксидаза и р-галактозидаза не имеют эндогенных ана-
логов в тканях млекопитающих и поэтому могли бы быть иде-
альными метками в иммуноферментном анализе. Однако для
этих ферментов все еще не найдены субстраты, дающие нерас-
творимые или ярко окрашенные продукты ферментативной ре-
акции.
12.2. Реагенты
1. Имеются два вида растворов субстрата для ЩФ. Субстрат-
ный раствор А дает весьма тонкое окрашивание, но может быть
использован только для приготовления препаратов, заключенных
в водную среду и хранимых недолго. Субстратный раствор Б
применяется при маркировании препаратов, предназначенных
для долгосрочного хранения.
2. Субстратный раствор А. В стеклянном флаконе растворя-
ют 2 мг фосфата нафтола AS-MX в 0,2 мл диметилформамида.
Добавляют 9,8 мл 0,1 М трис-HCl буфера, pH 8,2, и проверяют
pH. Раствор может храниться в течение нескольких недель при
и* 163
ГЛЛЗА 4
4 °C. Непосредственно перед применением в раствор А добавля-
ют левомизол до концентрации 1 мМ и диазоль красный ТР до
концентрации 1 мг/мл, затем наносят на срезы, покрытые филь-
тровальной бумагой. При необходимости вместо красного про-
дукта ферментативной реакции можно получить голубой, заме-
нив диазоль красный ТР на диазоль синий 2С в той же самой
концентрации.
3. Субстратный раствор Б. Растворяют 12 мг левомизола в
50 мл пропандиолового буфера (см. ниже), затем добавляют
2 мл раствора гексазотированного нового фуксина (см. ниже)
и 0,5 мл монометилового эфира этиленгликоля, содержащего
5 мг/мл фосфата нафтола AS-BI; смешивают и наносят на сре-
зы, покрытые фильтровальной бумагой. Известны также другие
способы приготовления препаратов для долгосрочного хранения
с использованием нового фуксина [78].
4. Водная среда для заключения препаратов. Растворяют
10 г желатины в 60 мл горячей дистиллированной воды, добав-
ляют 0,25 мл фенола и 70 мл глицерина. Тщательно перемеши-
вают стеклянной палочкой. Смесь загустевает при охлаждении,
поэтому перед использованием ее необходимо согреть в горячей
воде.
5. Гексазотирование. Смешивают равные объемы свежепри-
готовленного 4%-ного раствора нитрита натрия и раствор ново-
го фуксина. Через 1 мин смесь превращается в прозрачный рас-
твор соломенно-желтого цвета.
6. Новый фуксин. Растворяют 2 г нового фуксина в 25 мл
концентрированной НС1, добавив 200 мл дистиллированной воды.
Осторожно подогревая смесь, добавляют 2 г активированного
угля и перемешивают в течение 1 ч, затем охлаждают и фильт-
руют.
7. Пропандиоловый буфер. Готовят основной 0,2 М. раствор,
растворив 10,5 г пропандиола в 500 мл дистиллированной воды.
Для приготовления рабочего раствора к 25 мл основного добав-
ляют 5 мл 0,1 М. НС1 и 70 мл дистиллированной воды.
8. TBS. К девяти объемам 0,15 М. раствора хлористого натрия
добавляют один объем 0,5 М. трис-HCl буфера, pH 7,6. При мар-
кировании ЩФ необходимо использовать буферные растворы,
не содержащие фосфатов.
12.3. Описание метода
1. Все разведения реагентов готовят на TBS, а не PBS.
2. На срезы наносят первые антитела в соответствующем раз-
ведении и инкубируют в течение 30—60 мин при 20 °C. Отмыва-
ют тремя сменами PBS, оставляя препараты в каждой смене
буфера на 1—3 мин.
1С4
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
3. На срезы наносят немеченые, кроличьи антитела к мыши-
ным иммуноглобулинам в 20%-ной сыворотке той же видовой
принадлежности, что и исследуемая ткань. Оптимальное разве-
дение антиглобулиновых антител следует определить предвари-
тельно. Препарат кроличьих антител к мышиным иммуноглобу-
линам фирмы Dakopatts А/S, Дания, используют обычно в раз-
ведении от 1/20 до 1/50. Антитела должны быть в избытке, по-
этому реагент наносят на достаточно обширную область стекла.
Инкубируют срезы при комнатной температуре в течение 30 мин,
затем отмывают, как указано в п. 2.
4. На срезы наносят комплексы ЩФ—АЩФ (например, по-
лученные от фирмы Dakopatts, разведенные 1/50), инкубируют
в течение 30 мин, затем отмывают, как указано в п. 2.
5. Для усиления окрашивания вновь повторяют этапы 3 и 4,
увеличивая тем самым число последовательно формирующихся
слоев ЩФ—АЩФ. Если комплекс ЩФ—АЩФ предполагается
нанести более одного раза, то время инкубации можно сократить
до 15 мин.
6. В зависимости от типа приготовляемых препаратов на сре-
зы наносят субстратные растворы А или Б, инкубируют при 20°C,
периодически перемешивая, в течение 5—10 мин или 30 мин со-
ответственно. Если использовали раствор А, то последующее от-
мывание производят водопроводной водой, затем срезы докра-
шивают гематоксилином и заключают в водную среду. При ис-
пользовании раствора Б срезы отмывают водопроводной водой,
докрашивают гематоксилином, дифференцируют в воде, быстро
проводят через ряд растворов этанола восходящей концентра-
ции для обезвоживания и заключают в среду для долгосрочного
хранения.
12.4. Интерпретация результатов микроскопического
исследования
Результаты микроскопического исследования препаратов, мар-
кированных ЩФ, интерпретируют таким же образом, как и при
маркировании пероксидазой, с учетом тех преимуществ, о кото-
рых сообщалось выше. Использование комплексов ЩФ—АЩФ,
особенно при повторных циклах нанесения, повышает чувстви-
тельность иммуноферментного анализа до уровня иммунофлуо-
ресцентного и выше. Следует отметить, что можно достичь опти-
мального выявления различных клеточных антигенов, применяя
в одних случаях комплексы ЩФ—АЩФ, а в других ИФА. При-
чины слабого окрашивания определенных антигенов при исполь-
зовании того или другого иммуногистохимического метода не
всегда понятны. Преимущества и недостатки разных методов
выявления клеточных антигенов сопоставлены в табл. 4.6.
165
ГЛАВА 4
Таблица 4.6. Сравнительные характеристики различных методов
иммуногистохимического анализа с использованием флуоресцентных
и ферментных меток
Сравниваемые ха- рактеристики Флуоресцентные метки Пероксидаза Щелочная фос- фатаза
Вид микроскопии В УФ свете Обычная световая Обычная световая
Время проведения одного теста 75 мин 120 мин 180 мин
Срок сохранения препаратов 2—4 нед Неограниченный Продолжительный, но ограниченный
Окрашивание вы- явлиемых антиге- нов Яркое Тусклое Яркое
Контрастирующее Возможно Обязательная Обязательная
докрашивание часть метода часть метода
Исследование кле- точных взвесей Возможно Невозможно') Невозможно1'
Эндогенная имита- ция метки Неустранима Плохо устранима Устранима
Возможность ис- следования мазков крови и костного мозга Хорошая Плохая Хорошая
Э При использовании флуоресцентной метки можно различить поверхностную и ци-
топлазматическую локализацию выявляемых антигенов. Ферментные метки этого не поз-
воляют. В некоторых случаях суспендированные клетки можно проинкубировать с МКА.
конъюгированными с ферментом, приготовить из взвеси мазки и определить затем ло-
кализацию антител с помощью соответствующего субстрата. При этом возможно выяв-
ление некоторых поверхностных антигенов.
13. Система авидин — биотин
13.1. Принцип
Аффинность связывания авидина с биотином чрезвычайно
высока (Ка = 1013 * 15/М). Эта связь нековалентна и диссоциирует
лишь в экстремальных условиях, например, при pH 1,5. Авидин —
это гликопротеин с мол. массой около 60 кДа, выделяемый из
яичного белка. Он состоит из четырех субъединиц, каждая из
которых имеет по одному отдельному участку связывания био-
тина. К молекулам авидина можно присоединить флуорохромы,
ферменты и другие метки, что позволяет использовать его в ка-
честве маркера иммунохимических взаимодействий. Авидину,
однако, свойственны два недостатка, которые ограничивают его
использование в ИГХА. Во-первых, остатки его собственных
маннозы и глюкозамина могут связываться с лектиноподобными
эндогенными белками. Во-вторых, обладая очень высокой изо-
166
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
электрической точкой (pl 10,2), в условиях нейтрального pH
(которые обычно создаются при иммуногистохимическом окра-
шивании) он может связываться с отрицательно заряженными
клеточными структурами, такими, как мембраны и ядра. В ре-
зультате авидин проявляет весьма высокую аффинность при не-
специфическом связывании с тканями. Воспользовавшись вместо
авидина стрептавидином, который продуцирует Streptomyces
avidinii, можно в значительной степени преодолеть данный не-
достаток метода. Стрептавидин не относится к гликопротеинам
и имеет изоэлектрическую точку в области нейтрального pH. Мо-
лекулы авидина и стрептавидина могут служить «мостиками»,
соединяющими биотинированные первые антитела с биотиниро-
ванной меткой или биотинированными вторыми антителами.
Биотин (витамин Н)—это маленькая молекула (244 Да).
С помощью простого одноэтапного метода, активированный био-
тин можно присоединить к большому числу разнообразных бел-
ков.
13.2 . Реагенты
1. Биотинированные антитела получают самостоятельно, как
описано в разд. 7, или используют коммерческие препараты.
2. Стрептавидиновые конъюгаты получают из коммерческих
источников или самостоятельно, как описано ниже.
3. Комплекс авидин — биотинированная пероксидаза получа-
ют от фирмы Amersham International pic, Великобритания, или
приготовляют самостоятельно, смешав в соотношении 1 :25 (по
весу) авидин с биотинированной пероксидазой [10].
13.3 . Описание метода
Этапы 1, 2, 3 выполняют, как описано в разд. 11.3.
4. На срезы наносят вторые антитела в соответствующем раз-
ведении и инкубируют в течение 30—60 мин при комнатной тем-
пературе.
5. Отмывают препараты в PBS.
6. На срезы наносят заранее приготовленные комплексы ави-
дин—биотинированная пероксидаза, инкубируют в течение
30 мин при комнатной температуре. Оптимальное разведение
препарата комплексов необходимо определить предварительно.
Препарат фирмы Amersham можно использовать в разведении
1 : 200.
7. Срезы отмывают, как указано в п. 5, фиксируют в забуфе-
ренном фосфатами формалине и вновь отмывают в воде.
167
ГЛАВА 1
8. На 2—10 мин срезы погружают в раствор субстрата (ДАБ),
отмывают и затем окрашивают, как описано в п. 7 разд. 11.3.
13.4 . Интерпретация результатов микроскопического
исследования
Несмотря на то что авидин и биотин представляют собой на-
дежные универсальные реагенты, прямое и непрямое маркиро-
вание с помощью этой системы дает не лучшие результаты по
сравнению с применением высококачественных препаратов вто-
рых антител, меченных ферментами или флуорохромами. Объ-
ясняется это тем, что стрептавидин взаимодействует (а) с эндо-
генным биотином, который имеется, например, в тканях печени,
молочной железы, жировой клетчатки и почки, а также (б) с
тучными клетками. Эндогенный биотин отчасти можно заблоки-
ровать, если проинкубировать срезы сначала в течение 20 мин
в растворе, содержащем 1 мг/мл авидина, и столько же времени
в растворе, содержащем 0,1 мг/мл биотина с последующим от-
мыванием в PBS. Эта дополнительная процедура, однако, не
нужна при использовании комплекса авидин — биотинированная
пероксидаза, которое повышает чувствительность выявления ан-
тигенов, не вызывая слишком заметного неспецифического окра-
шивания. Правда, не совсем ясно, почему применение этого ком-
плекса по сравнению с другими методами, основанными на пря-
мом действии авидин — биотин, свободно от некоторых недостат-
ков. По всей вероятности, крупные агрегаты, из которых состоит
препарат комплекса, могут эффективно связываться лишь с био-
тином, экспонированным на молекулах первых антител. Если
биотин присоединить к антителам через спейсер1, то связывание
биотинированных таким образом антител с авидином на ткане-
вых срезах будет более прочным, так как существенно умень-
шатся стереохимические препятствия для этого межмолекуляр-
ного взаимодействия.
14. Двойное маркирование тканей
14.1. Принцип
Цель двойного маркирования, как отмечено в разд. 7,— это
выявление двух различных антигенов на одной клетке. Выявле-
ние двух и более разных антигенов на тканевых срезах позволя-
ет, кроме того, исследовать взаимосвязи между фенотипически
различными клетками. Совокупность локальных условий, в ко-
1 От англ, spacer — вставка.— Прим, перев.
168
ИММУНОФЛУОРЕСЦЕНЦИЯ П ИММУНОГИСТОХИМИЯ
торых находятся клетки разного типа в лимфоидной ткани, и
межклеточные взаимодействия обозначаются термином «микро-
окружение» и имеют весьма важное функциональное значение.
Для двойного маркирования можно использовать описанные
выше методы иммунофлуоресцентного и иммуноферментного
анализа. Иммуноферментный метод довольно эффективен, когда
требуется выявить разные антигены, принадлежащие различным
клеткам [3, 79]; разработаны также модификации, позволяю-
щие маркировать два разных антигена на одной и той же клетке
[3], но пока еще не ясно, какие варианты ИФА наиболее при-
годны для решения последней задачи.
14.2. Реагенты
В дополнение к реагентам, перечисленным в разд. 10—13,
используются следующие:
1. Препарат комплексов пероксидаза—кроличьи поликло-
нальные антитела к пероксидазе (ПАП) приобретают, например,
у фирмы Dakopatts А/S, Дания.
2. Препараты антител для наглядной демонстрации возмож-
ностей метода: МКА к CD21 (например, RFB6), МКА к антиге-
нам фолликулярных дендритных клеток (DAKO DRC IgM), по-
ликлональные козьи антитела к IgM и IgD человека (фирмы
Southern Biotechnology Associates, США).
14.3. Описание метода
Двойное маркирование с использованием различных флуоро-
хромов уже было описано в разд. 7, 8 и 9. Для его осуществления
можно воспользоваться (1) двумя образцами флуорохромирован-
ных первых антител, например конъюгированными с ФИТЦ
козьими антителами к х-цепям и конъюгированными с ТРИТЦ
козьими антителами к Z-цепям человека, или (2) двумя образца-
ми мышиных моноклональных антител разного изотипа, которые
затем выявляются вторыми класс- и субкласс-специфическими
антителами к мышиным иммуноглобулинам, конъюгированными
с разными флуорохромами.
Двойное маркирование с использованием иммуноферментных
меток по сравнению с иммунофлуоресцентными требует значи-
тельно больше времени и не дает столь четко дифференцируемо-
го окрашивания, но обеспечивает лучшую морфологическую
идентификацию клеток. Ниже описан один из методов двойного
иммуноферментного маркирования [см. также 3, 5, 80].
1. Готовят криостатные пли фиксированные формальдегидом
и заключенные в парафин срезы ткани, как описано в разд. 10.
169
ГЛАВА 4
2. На срезы наносят МКА к CD5 и кроличьи поликлональ-
ные антитела к IgM человека в соответствующих разведениях.
Инкубируют 30—60 мин при комнатной температуре.
3. Трижды отмывают срезы PBS, оставляя в каждой смене
буфера на 1—3 мин.
4. На срезы наносят барайьи антитела к мышиным и кро-
личьим иммуноглобулинам в соответствующих концентрациях.
Инкубируют в течение 30—60 мин при комнатной температуре,
затем отмывают, как указано в п. 2.
5. В течение 30 мин при комнатной температуре срезы инку-
бируют с двумя препаратами растворимых комплексов щелочная
фосфатаза — мышиные моноклональные антитела к щелочной
фосфатазе и пероксидаза — кроличьи поликлональные антитела
к пероксидазе, а затем отмывают, как описано в п. 2.
6. На срезах выявляют локализацию пероксидазы с помощью
раствора ДАБ, как описано в разд. 11.
7. На срезах выявляют локализацию щелочной фосфатазы с
помощью субстратного раствора А, как описано в разд. 12, ис-
пользуя диазоль синий 2С в концентрации 1 мг/мл вместо диа-
золя красного ТР.
8. Срезы отмывают, как указано в п. 2, и заключают в вод-
ную среду.
14.4. Интерпретация результатов микроскопического
исследования
Интерпретация результатов двойного иммунофлуоресцентно-
го маркирования не вызывает затруднений. Поочередно исполь-
зуя комплекты светофильтров для ФИТЦ и ТРИТЦ, можно
определить, маркирована ли данная клетка антителами одной
или двух специфичностей. В то же время интерпретация резуль-
татов двойного иммуноферментного маркирования не столь про-
ста. Клетки, меченные пероксидазой, приобретут золотисто-ко-
ричневую окраску, а меченные щелочной фосфатазой — голубую.
Обе метки одновременно окрашивают клетку в розовато-лиловый
цвет. Если, однако, срезы слишком толстые, то из-за наложения
клеток, маркированных по-разному, может возникнуть иллюзия
двойного окрашивания. При этом в отличие от ИФА не удается
сфокусировать микроскоп на разных уровнях такого толстого
среза. Кроме того, клетка, имеющая оба антигена, может быть
ошибочно отнесена к обладающим лишь одним антигеном из-за
того, что какой-либо из них экспрессирован с гораздо большей
плотностью, чем другой. С помощью описанного выше метода
двойного маркирования было установлено, что в нормальных
миндалинах человека клетки, несущие CD5 (т. е. Т-лимфоциты)
и клетки, несущие выявляемый кроличьими антителами IgM
170
ИММУНОФЛУОРЕСЦЕНЦИЯ И ИММУНОГИСТОХИМИЯ
ф Т4, HNK-1 (Leu 7|
д-ыпетк-^
Макрофаги с остатками д* RFD9++ (высокое
фагоцитированных содерж. в цитоплазме)
клеточных ядер Кислая фосфатаза +
Фолликулярные дендритные DAKO-DRC +, CD21+,
(ретикулярные) клетки । м +
Рис. 4.8. Схематичное изображение зародышевого центра лимфоидного фолли-
кула. Распределение иммуногистологических маркеров, выявляемых МКА к
лейкоцитарным антигенам, поликлональными антисыворотками к IgM и IgD,
лектином арахиса (PNA) и окрашиванием иа кислую фосфатазу. По этим мар-
керам удается идентифицировать различные популяции Т-, В- и вспомогатель-
ных клеток. Для этой цели особенно эффективно двойное маркирование с ис-
пользованием иммунофлуоресцентных и иммуногистохимических меток, так
как ни одним из маркеров, взятым отдельно, нельзя полностью охарактеризо-
вать ту или иную популяцию клеток.
(т. е. В-лимфоциты), явно относятся к различным популяциям.
Метка CD5 встречается на большинстве клеток паракортикаль-
ной области, тогда как IgM выявляется на большей части кле-
ток зародышевых центров. Клетки, маркированные одновремен-
но двумя метками — CD5 и IgM, крайне редки (рис. 4.8). Одна-
ко в ткани лимфатического узла, удаленного у больного с цент-
роцитарной1 лимфомой, можно обнаружить довольно много кле-
ток, имеющих промежуточный розовато-лиловый оттенок, так
как опухолевые клетки связывают одновременно антитела к CD5
и к IgM.
'Центроциты — В-лимфоциты зародышевых центров лимфатического
узла.— Прим, перев.
171
ГЛАВА 4
Схема, представленная на рис. 4.8,—это наглядный пример
реализации возможностей двойного маркирования. Так, окраши-
вание с помощью антител к IgM и к IgD показывает, что в зоне
мантии содержатся рециркулирующие В-клетки, которые обла-
дают одновременно двумя маркерами, тогда как на В-клетках
зародышевого центра IgD отсутствует. МКА к ФДК (препарат
DAKO-DRC фирмы Dakopatts А/S, Дания) и к CD21 (реаги-
рующие с рецепторами для C3d на ФДК и В-клетках) выявляют
характерную для зародышевых центров сеть ФДК, несущих обе
метки, и В-лимфоциты, обладающие только CD21. Благодаря
адсорбировавшимся на клеточной поверхности иммунным комп-
лексам, с ФДК связываются также антитела к IgM. Свои особые
маркеры имеет популяция Т-клеток. Большинство Т-лимфоцитов
несет CD4; примерно половина CD4+ Т-клеток связывает МКА
к HNK1 (Leu7), образуя субпопуляцию, которая редко (1°/о)
встречается в циркулирующей крови. И наконец, комбинируя
разные образцы МКА, в зародышевом центре можно выявить
захватившие так называемые «tingible body»1 макрофаги. Цито-
плазма макрофагов интенсивно связывает и МКА RFD9, но не
имеет, например, такого свойственного всем прочим макрофа-
гам маркера, как антиген, выявляемый МКА RFD7 [см. 80].
Подобные макрофаги можно найти и в тканевых гранулемах.
В заключение следует отметить, что двойное маркирование по-
зволяет выявлять уникальные фенотипические характеристики
клеток, зависящие от локальных условий микроокружения. Ре-
зультаты такого анализа можно использовать при выделении из
крови, лимфы или тканей, интересующих исследователя, редко
встречающихся клеток для функционального изучения in vitro,
которое будет способствовать раскрытию взаимосвязей между
функциями клеточных субпопуляций и их фенотипическими ха-
рактеристиками.
15. Благодарности
Мы выражаем свою признательность докторам Д. Компане и
М. Бофиллу за ценные советы и благодарим мисс Е. К остан-Смит
и мистера Тиммза за техническую помощь. Исследование фено-
типической гетерогенности лейкозных клеток получило финансо-
вую поддержку Британского Совета по медицинским исследова-
ниям (программа UKALL: грант № SPG 8417890) и Фонда изу-
чения лейкозов (грант № 84/15). Исследования крови больных,
инфицированных LAV/HTLV-III, финансировались концерном
Wellcome (грант № 14386).
1 Пикиотичные, сильно окрашенные гематоксилином остатки клеточных
ядер.— Прим, перев.
172
ИММУНОФЛУОРЕСЦЕНЦИЯ II ИММУНОГИСТОХИМИЯ
Литература
1. Oi V. Т„ Glazer А. М„ Stryer L. (1982). J. Cell Biol., 93, 981.
2. Schuitt H. R. E., Hijmans W. (1980). Clin. Exp. Immunol., 41, 567.
3. Mason D. У., Naiem M., Abdulaziz Z„ Nash J. R. G„ Gatter K. C„ Stein H.
(1982). In: Monoclonal Antibodies in Clinical Medicine, McMichael A. J.
and Fabre J. W. (eds.), Academic Press, London, p. 585.
4. De Mey J. (1986). In: Immunocytochemistry, Modern Methods and Applica-
tions, Polak J. M. and Van Noorden J. (eds.), John Wright and Sons Ltd.,
Bristol, p. 115.
5. Chilosi M., Pizzolo G., Vincenzi C. (1983), J. Clin. Pathol., 36, 114.
6. Greaves M. F. (1975). Prog. Haematol., 9, 255.
7. Janossy G., Hoffbrand A. V., Greaves M. F„ Ganeshaguru K., Pain C„ Brad-
stock K„ Prentice H. G., Kay H. E. M. (1980). Br. J. Haematol., 44, 221.
8. Christensen K., Mason D. У. (1987). Personal communications.
9. Evans R. L , Lazarus H., Penta A. C„ Schlossman S. F. (1978). J. Immunol.,
121, 1423.
10. Bollum F. J. (1979). Blood, 54, 1203.
11. Loken M. R. (1986). In: Monoclonal Antibodies, Beverley P. C. L. (ed.),
Churchill Livingstone, Edinburgh, London, Melbourne, New York, p. 132.
12. Bernard A„ Boumsell L., Dausset J., Milstein C„ Schlossman S. F., eds.
(1984). Leukocyte Typing 1, Springer Verlag, Berlin.
13. Reinherz E. L., Haynes B. F„ Nadler L. M., Bernstein I. D., eds. (1986).
Leukocyte Typing II, Springer Verlag, Berlin.
14. McMichael A., Beverley P. C. L., Hogg N., Horton M., eds. (1987). Leukocy-
te Typing III. Oxford University Press, Oxford.
15. Campana D„ Janossy G. (1986). Blood, 68, 1264.
16. Habeshaw J. A., Catley P. F., Stansfield A. G., Brearley R. L. (1979). Br. J.
Cancer, 40, 11.
17. Workshop W. H. O. (1974). Scand J. Immunol., 3, 521.
18. Dom A. R., Moriarty C. S., Osborne J. P., Schulz L. C., McCarthy J. P., Lis-
ter K. A., Horne L. A. (1986). American Clinical Product Review.
19. Taylor R. B., Duffus W. P. H., Raff M. C., De Petris S. (1979). Nature, New
Biol., 233, 225.
20. Johnson G. D„ Holborow E. J. (1986). In: Handbook of Experimental Im-
munology, Vol. I. Immunochemistry, Weir D. M., Herzenberg L. A., Black-
well C. and Herzenberg L. A. (eds.), Blackwell Scientific Publications, Ox-
ford, p. 2801.
21. Reinherz E. L., Schlossman S. F. (1980). Cell. 19, 821.
22. Lanier L. L., Le A. M., Phillips J. H., Warner N. L., Herzenberg L. A. (1983).
J. Immunol., 131, 1789.
23. Tindle R. W., Nichols R. A. B., Chan L„ Campana D., Catovsky D., Bir-
nie G. D. (1985). Leukemia Res., 9, 1.
24. Griffin J. D., Linch D., Sabbath K.. Larcotn P., Schlossman S. F. (1984).
Leukemia Res., 8, 521.
25. Drexler H, G., Sagawa K., Menon M., Minowada J. (1986). Leukemia Res.,
10, 17.
26. Linch D. C., Allen C., Beverley P. C. L., Bynoe A. G., Scott C. S, Hogg N.
(1984). Blood, 63, 566.
27. Nadler L. M., Korsmeyer S. J., Anderson К. C., Boyd A. IV'., Slaughenhoupt B.,
Park B., Jensen J., Coral F., Meyer R. J., Sallan S. E., Ritz J., Schloss-
man S. F. (1984). J. Clin. Invest., 74, 332.
28. Greaves M. F., Hariri G„ Newman R. A., Sutherland D. R., Ritter M. A.,
Ritz J. (1983). Blood, 61, 628.
29. Stashenko P„ Nadler L, M., Hardy R„ Schlossman S. F. (1980) J. Immunol.,
125, 1678.
30. Vodinelich L., Tax IV7., Bai Y., Pegram S„ Capel P., Greaves M (1982). Blood,
60, 742.
173
ГЛАВА 4
31. Verbi W., Greaves M. F., Koubek K-, Janossy G., Stein H., Kung P. C., Gold-
stein G. (1982). Eur. J.Immunol., 12, 81.
32. Amlot P. (1987). Unpublished data.
33. Bofill B., Campana D. (1987). Unpublished data.
34. Loken M. R., Lanier L. L. (1984). Cytometry, 5, 151.
35. Lanier L. L„ Warner N. L. (1981). J. Immunol. Methods, 47, 25.
36. Minowada J., Janossy G., Greaves M. F., Tsubota T., Sahai Srivastavia B. L,
Morkawa S., Tatsumi E. (1978). J. Natl. Cancer Inst., 60, 1269.
37. Reinherz E. L_, Kung P. C., Goldstein G., Levy R. H., Schlossman S. F.
(1980). Proc. Natl. Acad. Sci. USA, 77, 1588.
38. Gatenby P. A., Kansas G. S., Xian C. Y., Evans R. L., Engelman E. G.
(1982). J. Immunol., 129, 1997.
39. Darnle N. K, Mohagheghpour N., Kansas G. S., Fishwild D. M., Engel-
man E. G. (1985). J. Immunol., 135, 235.
40. Morimoto C„ Letvin N. L., Boyd A. IV, Hagan M., Brown H., Kornacki M. M.,
Schlossman S. F. (1985). J. Immunol., 134, 3762.
41. Morimoto C„ Letvin N L., Distaso J. A., Aldrich W. R., Schlossman S. F.
(1985). J. Immunol., 134, 1508.
42. Kansas G. S., Wood G. S., Fishwild D. M., Engleman E. G. (1985). J. Immu-
nol., 134, 2995.
43. Beverley P. C. L. (1987). Unpublished data.
44. Ledbetter J. A., Martin P. C„ Spooner С. E., Wofsy D., Tsu T. T., Beat-
ty P. G., Gladstone P. (1985). J. Immunol., 135, 2331.
45. Abo T„ Balch С. M. (1981). J. Immunol., 127, 1024.
46. Hercend T., Griffin J. D., Bensussan A., Schmidt R. E., Edson M. A., Bren-
nan A., Murray C., Daley J. F., Schlossman S. F., Ritz J. (1985). J. Clin.
Invest., 75, 932.
47. Becton-Dickinson (1985). Monoclonal Antibody Source Book, Becton-Dickin-
son, Mountain View, CA.
48. Guesdon J. L., Ternyuck T., Avrameas S. (1979). J. Histochem. Cytochem.,
27, 11’31.
49. Simmonds R. G., Smith W., Marsden H. (1982), J. Immunol. Methods, 54,
23.
50. Poulter L. W., Chilosi M., Seymour G. J., Hobbs S., Janossy G. (1983). In:
Immunocytochemistry, Practical Applications in Pathology and Biology, Po-
lak J. M. and Van Noorden S. (eds.), "Wright PSG, Bristol, p. 233.
51. Janossy G., Campana D., Coustan-Smith E., Timms A. (1987). In: Labora-
tory Haematology, Cawley J. C. (ed.), Churchill Livingstone, Edinburgh,
in press.
52. Galton D. A. G.. MacLennan J. С. M. (1982). Clin. Haematol., 11, 561.
53. Berliner N., Ault К E„ Martin P„ Weinberg D. S. (1986). Blood, 67, 80.
54. Bofill M., Janossy G., Janossa M., Burford G. D., Seymour G. J., Wernet P.,
Kelemen °. (1985). J. Immunol., 134, 1531.
55. Caligaris-Cappio F., Janossy G. (1985). Sem. Haematol., 22, 1.
56. Gathmgs W. E. (1984). In: Monoclonal Antobody Source Book, Becton-
Dickinson, Mountain View, CA.
57. Moir D. J., Ghosh A. K., Abdulaziz Z., Knight P. M„ Mason D. Y. (1983).
Br. J. Haematol., 55, 395.
58. Gathings II". E.. Lawton A. R., Cooper M. D. (1977). Eur. J. Immunol., 7,
804.
59. Campana D., Janossy G., Bofill M., Trejdosiewicz L. K, Ma D., Hof-
brand A. V., Mason D. Y., Lebacq A. M., Forster H. (1985). J. Immunol.,
114, 1524.
60. Bast E. J. E. G., Van Camp B., Boom S. E., Jaspers F. C. A., Ballieux R. E.
(1981). Clin, Exp. Immunol., 44, 375.
61. Caligaris-Cappio F., Bergui L. K., Tesio L., Pizzolo G.t Malavasi F., Chilo-
si M., Campana D., Van Camp B., Janossy G., (1985). J. Clin, Invest 76,
1243.
174
ИММУНОФЛУОРЕСЦЕНЦИЯ 11 ИММУНОГИСТОХИМИЯ
62. Furley A. J., Mizutani S„ Weilbaecher К., Dhaliwal H. S., Ford A. M.,
Chan L. C., Molgaard H. V., Toyonaga B., Mak T„ Van den Eisen P„ Gold D.,
Terhorst C„ Greaves M. F. (1986). Cell, 46, 75.
63. Campana D., Thompson J. S„ Amlot P., Brown S.. Janossy G. (1987). J. Im-
munol., 138, 648.
64. Gratzner H. G. (1982). Science, 218, 474.
65. Gerdes J., Lemke H., Baisch H„ Worker H. FL, Schwab U., Stein H. (1984).
J. Immunol., 133, 1710.
66. Janossy G., Bollum F. J., Bradstock K. F., Ashley J. (1980). Blood, 56. 430.
67 Badger M. P., Janossy G., Bollum F. J., Burford G. D., Hoffbrand A. V'.
(1983). Blood, 61, 1125.
68. Hokland P„ Resenthal P„ Griffin J., Nadler L., Daley J., Hokland M., Schlos-
sman S. F., Ritz J. (1983). J. Exp. Med., 157, 114.
69. Falini B., Martelli M. F., Tarallo F., Moir D., Cordell J, L., Gatter I\. C„ Lo-
reti G-, Stein H., Mason D. У. (1984). Br. J. Haematol., 56, 365.
70. Moldenhauer G., Darken B., Schwartz R„ Pezutto A., Hammerling G. J.
(1986). In: Leukocyte Typing II, Reinherz E. L., Haynes B. F„ Nadler L. M.
and Bernstein I. D. (eds.), Springer Verlag, Berlin, p. 97.
71. Campana D., Janossy G., Bofill M-, Trefdosiewicz L. K., Ma D., Hoff-
brand А. У-, Mason D. 1'., Lebacq A.-M., Forster H. K. (1985). J. Immunol.,
134, 1524.
72. Peurse A. G. E. (1985). Histochemistry, Theoretical and Applied, Churchill
Livingstone, Edinburgh.
73. Collings L. A., Poulter L. W., Janossy G. (1984). J. Immunol. Methods, 75,
227.
74. Stein H., Gatter K., Asbahr H.. Mason D. Y. (1985). J. Lab. Invest., 52, 676.
75. Huang S., Minassian H., More J. D, (1976). Lab. Invest., 35, 383.
76. Nakane P. K. (1968). J. Histochem. Cytochcm., 16, 557.
77. Graham R. C., Karnovsky M. J. (1966). J. Histochem. Cvtochem., 14, 291.
78. Malik D. Y„ Damon M. E. (1978). J. Clin. Pathol., 35, 1092.
79. Lin C. W., Fujime M., Kirley S. D., Prout G. J. (1984). J. Histochem. Cyto-
cheni., 32, 1339.
80. Janossy G., Bofill M., Poulter J.. IV’. (1986). In: Immunochemistry. Modern
Methods and Applications, Polak J. M. and Van Noorden J. (eds.), John
Wright and Sons Ltd, Bristol, p. 438.
Глава 5
ИНДУКЦИЯ И КОЛИЧЕСТВЕННОЕ
ОПРЕДЕЛЕНИЕ КЛЕТОК, ОБРАЗУЮЩИХ
АНТИТЕЛА IN VITRO
К- Гилберт и Д. Дрессер
1. Введение
Создание надежных методов культивирования и определе-
ния антителообразующих клеток in vitro в значительной мере
предопределило достигнутые за последние годы успехи в обла-
сти клеточной иммунологии. В этой главе будет описано несколь-
ко простых методов индукции образования специфических анти-
тел в культурах непримированных лимфоцитов человека и мыши.
Кроме того, изложены и проанализированы условия, необходи-
мые для иммунизации in vitro, в том числе роль лимфокинов и
других основных компонентов культуральной среды. Одним из
наиболее распространенных способов оценки индуцированного
образования антител служит локальный гемолиз. Поэтому здесь
мы подробно описали данный метод и его варианты — локальный
иммуноферментный анализ (ЛИФА) и обратный локальный ге-
молиз, который позволяет определить количество клеток, секре-
тирующих не антитела, а любые другие вещества, обладающие
антигенностью.
2. Индукция клеток, образующих антитела
in vitro
Разработка систем иммунизации in vitro внесла большой
вклад в анализ механизмов гуморального иммунного ответа.
В этих системах воспроизводится процесс образования антител,
моделирующий, как принято считать, нормальный иммунный от-
вет и в то же время допускающий манипуляции, невозможные in
vivo. Для воспроизведения in vitro тех условий, в которых В-
клетки существуют и синтезируют специфические антитела in
vivo, необходимы:
1) вспомогательные клетки;
2) среда, содержащая питательные компоненты для расту-
щих клеток;
3) сывороточные белки;
4' ’ ;5и визирующий буфер.
176
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
Таблица 5.1. Состав сред, исполмуемых при индукции образования антител
in vitro по Мишеллу и Даттону
Полная среда Мишелла— Даттона
RPM1 1640 или минимальная среда Игла без глутамина
2-Меркаптоэтанол
Пенициллин (104 Ед/мл) и стрептомицин (10 мг/мл)
L-Глутамнн (200 мМ раствор)
Пируват натрия (100 мМ раствор)
Заменимые аминокислоты (100-кратный концентрат)
Питательная смесь для подкормки [1]
Незаменимые аминокислоты (50-кратный концентрат)
Заменимые аминокислоты (100-кратный концентрат)
Глутамин (200 мМ)
Глюкоза
Модифицированная минимальная среда Игла без бикар-
боната натрия
Доводят pH до 7,2 1 н. NaOH
Добавляют 7,5 мл 7,5%-ного NaHCO3
Стерилизуют фильтрованием (мембранный фильтр фирмы
Millipore, США) и перед добавлением к культурам обо-
гащают СПК (33%)
5-10~5 М
5 мл
2,5 мл
2,5 мл
500 мг
35 мл
Роль каждого из этих факторов обсуждается более подробно
при описании систем, используемых для индукции антигеном об-
разования специфических антител в культурах лимфоцитов мыши
или человека.
2.1. Иммунизация спленоцитов мыши in vitro
Получившая широкое распространение культуральная систе-
ма, разработанная Мишеллом и Даттоном [1], позволяет инду-
цировать образование антител in vitro в суспензии спленоцитов
неиммунизированных мышей. Ниже описан метод Мишелла—
Даттона и некоторые его модификации.
2.1.1. Иммунизация спленоцитов мыши in vitro
эритроцитами барана (ЭБ)
1. Готовят суспензию спленоцитов (как описано в разд. 3.3
или гл. 1) и отмывают ее дважды средой RPMI 1640. Ресуспен-
дируют клетки до концентрации 5-106 в 1 мл в обогащенной
культуральной среде Мишелла — Даттона (табл. 5.1), содержа-
щей 5% (по объему) СПК-
2. Суспензию клеток разливают по 1 мл в культуральные
чашки Петри диаметром 35 мм.
3. Добавляют ЭБ до конечной концентрации 0,03% (5-Ю6
ЭБ в 1 мл).
12—172 177
ГЛАВА 5
4. Культуры инкубируют при 37°С в атмосфере 7% О2, 10%
СО2, 83% N2 при 100%-ной влажности. Замечено, что продукция
антител усиливается при вращении чашек со скоростью 7 об/мин
под углом ±1Г в течение всего периода культивирования. По-
этому культуры следует инкубировать на лотках в герметически
закрытом контейнере, который заполняют указанной газовой
смесью и помещают на вращающуюся платформу. Для этой цели
часто используют специально изготовленные из перспекса пена-
лы для системы Мишелла—Даттона. Возможен и другой до-
ступный вариант — в пластиковом воздухонепроницаемом кон-
тейнере для хранения замороженных образцов делают два отвер-
стия для подачи и выхода газовой смеси и вставляют в них под-
ходящие по размерам втулки с кусочками шланга.
5. В течение инкубации в каждую чашку ежедневно добавля-
ют по 0,05 мл питательной смеси (табл. 5.1) для восполнения
усвоенных клетками компонентов исходной питательной среды.
Количество клеток, образующих антитела (IgM) к ЭБ в прямом
варианте локального гемолиза (разд. 3.1.3), достигает пика меж-
ду 4 и 5 сут культивирования. Для определения их числа каж-
дую культуру переносят пастеровской пипеткой из чашки в цен-
трифужную пробирку и отмывают один раз сбалансированным
солевым раствором (BSS), ресуспендируют в 1 мл BSS [при
большом числе антителообразующих клеток (АОК) клеточную
взвесь необходимо разбавить] и проводят локальный гемолиз.
2.1.2. Дополнительные компоненты среды
или лимфокины
Для оптимальной пролиферации, дифференцировки и после-
дующей продукции антител В-клетки нуждаются в сигналах от
вспомогательных клеток — макрофагов и Т-хелперов. Роль вспо-
могательных клеток в культуре могут выполнять продуцируемые
ими растворимые факторы (лимфокины). Например, макрофаги
можно заменить интерлейкином-1 (ИЛ-1) [2, 3]. Активность
Т-хелперов более многогранна и реализуется рядом факторов,
в том числе ИЛ-2, фактором стимуляции В-клеток (BSF-1, ИЛ-4)
и фактором роста В-клеток II (BCGFII), названным также фак-
тором, заменяющим Т-клетки (ФЗТ) или ИЛ-5. В нашу задачу
не входило подробное описание роли лимфокинов в продукции
антител [4, 5] (см. гл. 10). Из практических соображений мы
отметим, что добавление лимфокинов в культуру нефракциони-
рованных клеток селезенки может усиливать происходящее и без
них образование антител, но совершенно необходимо для синте-
за антител в гомогенных популяциях В-клеток.
Лимфокины поступают в продажу в виде препаратов разной
степени очистки. Источником лимфокинов может быть и куль-
тура определенных клеточных линий (см. гл. 10). Кроме того,
178
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
надосадок культуры спленоцитов, стимулированных, конканава-
лином А (гл. 6) содержит разнообразные лимфокины и до на-
стоящего времени используется для стимуляции образования
антител in vitro [6, 7].
2.1.3. Образование антител в ответ
на различные иммуногены
При использовании в качестве антигена эритроцитов барана,
лошади или осла следует иметь в виду, что существуют внутри-
видовые различия этих клеток по иммуногенности и чувстви-
тельности к комплемент-зависимому иммунному гемолизу. Вна-
чале на пригодность для системы Мишелла—Даттона следует
проверить ряд образцов эритроцитов, полученных от нескольких
животных, и, выбрав одно из них, использовать в качестве посто-
янного донора, чтобы обеспечить воспроизводимость экспери-
ментов. Эритроциты можно несколько недель хранить при 4 °C
в стерильном растворе Олсвера.
Для индукции первичного образования антител in vitro поми-
мо эритроцитов успешно применяют и некоторые другие анти-
гены, в том числе:
1) микробные полисахариды, способные индуцировать Т-не-
зависимое образование антител;
2) природные или синтетические белки, некоторые из кото-
рых являются сильными иммуногенами и часто служат носите-
лями для менее иммуногенных молекул;
3) конъюгированные с носителем синтетические гаптены, ко-
торые без носителя обладают антигенностью, но из-за малых
молекулярных размеров лишены иммуногенности.
В табл. 5.2 эти антигены перечислены вместе со ссылками на
литературу по их использованию in vitro. Большую часть ука-
занных препаратов можно приобрести в готовом виде, но в таб-
лице приведены заодно и известные нам ссылки на методы их
получения (в том числе с использованием конъюгации).
Образование антител у мышей контролируется Ir-генами. Так,
величина ответа на конкретный антиген может существенно раз-
личаться у разных линий животных. Важно помнить, что не-
большое количество антиген-специфических АОК может свиде-
тельствовать об иммунореактивности на данный антиген у доно-
ров клеток, а не о дефектах культуральной системы.
2.1.4. Роль сывороточных факторов
Источником сывороточных факторов в культуральной систе-
ме Мишелла—Даттона чаще всего служит сыворотка плода ко-
ровы (СПК). Разные серии СПК существенно различаются по
способности поддерживать индуцированное антигеном образова-
12*
179
ГЛАВА 5
Таблица 5.2. Антигены, используемые для иммунизации in vitro
Антиген Литература
Прш отоп- ление Использо- вание для и ммуиизации
Полисахариды
Декстран 8 8, 9
Фиколл 10, 11 10
Леван 12 9
Sill (Pneumococcus тип III) 16 9
5. pneumoniae R36A 17, 18 17—20
Фосфорилхолин 21 22
Белки
Полимеризованный флагеллин (POL) сальмо- 13 14, 15
нелл
Бычнн сывороточный альбумин 22
Гемоцианин моллюска фиссуреллы 23
Яичный овальбумин 24, 25
Т-Глобулин 26 15, 25, 27
Инсулины 28
Туберкулин (PPD) 29
^-Галактозидаза 30 31
Синтетические полипептиды
ГАТ1» 32
ТГАЛ2) 33
Гаптены
2,4,6-Тринитрофенил 34, 35 23, 36, 37
2,6-Динитрофенил 10, И, 34 9, 38
Флуоресцеин 28 28
3,5-Динитро, 4-гидроксифенил 39 25
“) L-глутаминовая кислота60 — L-алаиин30 — L-тирозин1”.
2) Поли-Ь-тирозин — поли-Ь-глутаминовая кислота — поли-ЦЬ-аланин — поли-Ь-лизин.
ние антител и по собственной неспецифической поликлональной
активности. Поэтому, проверив ряд серий СПК, нужно выбрать
ту, которая эффективно способствует продукции антител in vitro,
не обладая митогенной активностью.
По сравнению с СПК сыворотки взрослых особей разных ви-
дов менее эффективны при индукции образования антител в
культуре мышиных клеток. Возможно, это связано с наличием
в них (но не в сыворотке плода) какой-то субстанции, подавля-
ющей высвобождение эндогенного ИЛ-1. Добавление ИЛ-1 к
мышиным спленоцитам, культивируемым в присутствии сыворо-
ток взрослых мышей, человека или кролика, усиливает образо-
вание антител к ЭБ до того же уровня, который достигается в
присутствии СПК [3].
Стремление избавиться от неспецифической стимулирующей
активности СПК привело к разработке бессывороточных сред,
(например, таких, как модифицированная Исковым среда Дюль-
180
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
бекко), пригодных для иммунизации лимфоидных клеток in vit-
ro. Обогащенная альбумином, трансферрином и соевыми ли-
пидами среда Искова поддерживает синтез антител в культуре
при первичном ответе на антигены, обладающие митогенной ак-
тивностью, и при вторичном ответе на антигены, лишенные ее
[40]. Аналогичный поддерживающий эффект оказывают и дру-
гие среды, в том числе модифицированная бессывороточная сре-
да Мишелла—Даттона с фетуином и 2-меркаптоэтанолом [41,
42]. Однако все эти среды менее эффективны при индукции пер-
вичного ответа in vitro на антигены, не обладающие митогенны-
ми свойствами [43]. Тем не менее недавно появилось сообщение,
что при ином составе добавок, включающем инсулин, прогесте-
рон, трансферрин, 2-меркаптоэтанол, БСА и определенные мик-
роэлементы (в том числе линолевую кислоту), среда Искова
сама по себе или в смеси со средой Хэма F-12 пригодна для
поддержания первичного образования антител к Т-зависимым и
Т-независимым антигенам В-клетками мышей [43, 44]. Указан-
ные среды и добавки имеются в продаже, а подробный состав
модифицированной среды Искова/Г-12 был опубликован [43].
2.1.5. Посуда для клеточных культур
Иммунизацию спленоцитов мыши эритроцитами барана in
vitro можно проводить и в плоскодонных 96-луночных пане-
лях для микротитрования или в панелях Терасаки. Для этого
готовят взвесь клеток селезенки и ЭБ таким же образом, как ука-
зано в разд. 2.1.1, и разливают обычно по 0,1 или 0,2 мл в лунки
панелей. Очень важно, чтобы поверхность посуды и приборов,
с которой контактируют клетки в процессе культивирования и
последующего анализа, была абсолютно чистой: даже малейшие
следы детергента могут оказать ингибирующее воздействие.
2.1.6. Использование камер Марбрука
Использование камер Марбрука (рис. 5.1) позволяет про-
длить культивирование клеток на срок свыше пяти дней (опти-
мальная продолжительность культивирования в системе Мишел-
ла—Даттона составляет 4—5 дней). В камерах Марбрука созда-
ются условия для тесного межклеточного контакта при относи-
тельно большом объеме среды, который обеспечивает долгосроч-
ный запас питательных компонентов и предотвращает накопле-
ние побочных продуктов жизнедеятельности клеток в токсиче-
ских концентрациях [45]. В такой культуральной системе мож-
но, например, исследовать достигающее максимума на 7—9-й
день образование IgG при первичном ответе клеток мышиной
селезенки. Методика заключается в следующем.
181
ГЛАВА 5
Рис. 5.1. Камера Марбрука (Hendley Engineering Ltd., Великобритания). Все
части тщательно моют и многократно ополаскивают, в последний раз кипя-
щей бидистиллироваиной водой. Наружное кольцо камеры Марбрука помеша-
ют поверх диска диализной мембраны на иижнюю часть камеры. Собранные
камеры хранят в чашках Петри с дистиллированной в стекле водой и стери-
лизуют автоклавированием при 105 °C. В особых случаях можно использовать
другие мембраны. Диализные мембраны, особенно целлюлозные, не рекомен-
дуется стерилизовать радиоактивным облучением, поскольку в собранные ка-
меры их помещают влажными после отмывания, а облучение воды приводит
к образованию токсичных перекисей. Если облучение неизбежно, после него
следует (по крайней мере трижды в течение 24 ч) ополоснуть камеры стериль-
ной средой.
1. В глубокую (50X18 мм) стерильную чашку Петри из по-
листирола наливают 10 мл полной культуральной среды Ми-
шелла—Даттона, содержащей 5% СПК (см. табл. 5.1).
2. В среду погружают стерильную камеру Марбрука в сборе
так, чтобы под мембраной не осталось пузырьков воздуха.
3. Внутрь камеры Марбрука пипеткой вносят 1 мл суспензии
спленоцитов (8—16-Ю6 клеток/мл).
4. В камеры добавляют по 50 мкл 0,1%-ной суспензии ЭБ.
5. Культуры инкубируют (подкормка питательной смесью
необязательна) и исследуют, как описано ниже. Максимальное
количество клеток, образующих IgM к ЭБ, появляется на 6-й,
a IgG — на 8—9-й день культивирования.
2.2. Иммунизация лимфоцитов человека in vitro
Образование антител in vitro можно индуцировать в куль-
турах лимфоцитов, выделенных из разных тканей человека. Чаще
всего в культуральных системах используются лимфоциты перп-
182
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
ферической крови (ЛПК), поскольку кровь — наиболее доступ-
ный источник иммунокомпетентных клеток человека. При стиму-
ляции примированных ЛПК in vitro гомологичным антигеном
(например, столбнячным анатоксином) образуются специфиче-
ские антитела по типу вторичного ответа [46, 47], а при стиму-
ляции поликлональными активаторами В-клеток (например, ми-
тогеном фитолакки — МФ) формируется антиген-неспецифичес-
кий ответ [48—50]. Разработка системы для воспроизводимой
индукции первичного антигенспецифического ответа в культу-
рах человека оказалась значительно более трудной задачей.
В результате экспериментов с различными системами было об-
наружено, что одна из модификаций метода Мишелла—Даттона
позволяет индуцировать слабый вариабельный, но все же анти-
генспецифический первичный ответ порядка 30—300 АОК на 106
ЛПК человека [51, 53]. Добавление к культурам ЛПК помимо
антигена небольшого количества неспецифического стимулятора
пролиферации может приводить к 10-кратному увеличению ко-
личества антигенспецифических АОК [54]. Еще большее уси-
ление ответа достигается внесением в культуру лимфокинов [55,
56]. Ниже описана модификация ранее предложенной Хоффма-
ном системы [56], в которой ЛПК человека дают первичный от-
вет на ЭБ. Затем обсуждается ряд параметров, по которым дру-
гие известные системы отличаются от системы Хоффмана.
2.2.1. Иммунизация ЛПК человека ЭБ in vitro
1. Из гепаринизированной венозной крови выделяют лимфо-
циты центрифугированием в градиенте плотности фиколла — ги-
пака (см.гл. 1).
2. Клетки дважды отмывают средой RPM.I 1640 и ресуспен-
дируют в полной среде Мишелла — Даттона (см. табл. 5.1), со-
держащей 5% инактивированной нагреванием (40 мин при
56 °C) сыворотки человека. Используя смесь сывороток не-
скольких здоровых доноров, группа крови которых, по-видимо-
му, не имеет значения, доводят концентрацию лимфоцитов от
1,25 до 5-106 в 1 мл.
3. К взвеси лимфоцитов добавляют ЭБ до конечной концент-
рации 0,03%, перемешивают и по 0,1 мл разливают в лунки
плоскодонной 96-луночной панели для микротитрования.
4. В культуры добавляют по 100 ед/мл ИЛ-1 и ИЛ-2 (ис-
пользуют коммерческие рекомбинантные препараты) и взвесь
инактивированных нагреванием клеток Staphylococcus aureus
(штамм Cowan I, American Type Culture Collection) до конеч-
ной концентрации 0,003% в качестве специального В-клеточного
митогена. Стафилококк выращивают по известной методике
[57]. В качестве источника ИЛ-1 можно использовать и над-
осадок стимулированных липополисахаридом адгезивных моно-
нуклеарных клеток человека [56].
183
ГЛАВА о
5. Культуры инкубируют 6—7 сут на вращающейся плат-
форме при 37 °C в атмосфере 7% О2, 10% СО2, 83% N2 при
100%-ной влажности с ежедневной подкормкой питательной
смесью (см. табл. 5.1).
6. После инкубации клетки дважды отмывают RPMI 1640,
содержащей 5% СПК, ресуспендируют в BBS и определяют в
суспензии число клеток, образующих IgM к ЭБ (см. разд. 3.1.3).
2.2.2. Иммунизация другими антигенами
Для индукции образования специфических антител в куль-
туре ЛПК человека в качестве антигенов использовали также
ДНФ-ГМФ [53], овальбумин [24, 58], гаптенизированные гра-
нулы полиакриламидного геля [51], иммуноглобулин кролика
[59], сывороточный альбумин собаки [59], экстракт клеток
карциномы почки [59] и Rh(d+) эритроциты человека [59].
2.2.3. Использование других неспецифических
стимуляторов образования антител
Помимо S. aureus (см. разд. 2.2.1) для неспецифической сти-
муляции ЛПК человека in vitro применялись вирус Эпштейна-
Барр (ВЭБ) [54], полиэтиленгликоль [54], С8-гуанинрибонук-
леозиды [55] и МФ [60, 61]. Дош и Гелфанд (Dosch and Gel-
fand) [58, 62] разработали систему, в которой образуется срав-
нительно много антигенспецифических АОК без добавления
поликлональных стимуляторов или лимфокинов. Однако эта
система не стала общепринятой в какой-то мере из-за техниче-
ски сложного определения АОК (монослой ЭБ создается с по-
мощью центрифугирования в лунках микропанели, покрытых
поли-Ь-лизином). Кроме того, резерв времени для проведения
теста и последующего подсчета зон гемолиза ограничивается
сравнительно быстрым разрушением монослоя эритроцитов.
2.2.4. Эффект лимфокинов, добавленных в среду
Эффект лимфокинов на антигенспецифический ответ В-кле-
ток человека in vitro изучен в значительно меньшей степени,
чем их действие в культурах клеток мышей. Добавление ИЛ-1
к культурам ЛПК человека усиливает образование АОК [56,
63, 64]. Кроме того, показано, что для стимуляции образова-
ния антител к ЭБ при отсутствии Т-клеток необходим ИЛ-2
[55, 66], рецептор которого был обнаружен на В-клетках чело-
века [65]. Установлено, что поликлональная продукция анти-
тел В-клетками человека может контролироваться BCGFII,
BSF-1 и BCDF [67, 68], но их влияние на антигенспецифиче-
ский синтез антител полностью не изучено.
184
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
2.2.5. Сывороточные факторы
Некоторые исследователи в качестве источника сывороточ-
ных факторов используют лошадиную сыворотку [66] или ау-
тологичную сыворотку человека [59]. По-видимому, СПК по
сравнению с сывороткой человека менее эффективна для под-
держания синтеза антител в культуре лимфоцитов человека,
а в некоторых случаях СПК может подавлять продукцию анти-
тел [52].
Использование плазмы человека иногда приводит к появле-
нию ложных зон гемолиза. Полагают, что их образование
обусловлено пассивно перенесенными специфическими или пе-
рекрестно-реагирующими антителами к данному иммуногену.
Для устранения этих антител сыворотку можно истощить дан-
ным антигеном (например, ЭБ). Однако Мисити и Валдман
(Misiti and Valdman) отмечали, что по сравнению с неистощен-
ной адсорбированная сыворотка способствует увеличению коли-
чества АО К в культуре. По их мнению, это обусловлено присут-
ствием в сыворотке некоторого количества эритроцитарного ан-
тигена, который элюируется при адсорбции [52], они рекомен-
дуют использовать неистощенную сыворотку, пренебрегая не-
которым количеством ложных зон локального гемолиза. Иногда
встречаются сыворотки с гемолитической активностью — их сле-
дует отбраковывать.
Фаррант с сотр. (Farrant et al.) [69] предложили метод
культивирования В-клеток в висячих каплях в микропанелях
Терасаки на бессывороточной среде; в этих условиях индуциру-
ется вторичный ответ на столбнячный анатоксин. Такая систе-
ма, хотя и сложна в техническом отношении, позволяет достиг-
нуть высокого уровня продукции антител при относительно не-
большом количестве клеток (см. гл. 9).
2.2.6. Дополнительные варианты условий культивирования
Первичное образование антител в культурах ЛПК вполне
успешно осуществляется также в чашках для культуры ткани
диаметром 35 мм [52], в пластиковых пробирках размером
17X100 мм с колпачками [58] и в микропанелях Терасаки
2.2.7. Дополнительные примечания
1. Индукция первичного образования антител в культуре
ЛПК человека происходит лишь в строго определенных опти-
мальных условиях. Вероятно, каждому исследователю для сво-
ей конкретной экспериментальной системы это условие, а имен-
но плотность клеточной суспензии, тип культуральной посуды,
185
ГЛАВА а
концентрацию антигена и продолжительность инкубации, необ-
ходимо определять заново.
2. При индукции образования антител в суспензиях нефрак-
ционированных ЛПК следует избегать стимуляции супрессор-
ных клеток. Супрессорные Т-клетки всегда присутствуют в сус-
пензии ЛПК и могут активироваться гистамином, выделяемым
при заборе крови и получении плазмы [55, 70], либо стимули-
роваться иммунными комплексами, ИЛ-2 или определенными
концентрациями поликлональных активаторов В-клеток [71,
72J. Необходимые для антигенспецифического ответа адгезив-
ные моноциты могут при определенных условиях подавлять ак-
тивацию В-клеток. Показано, что удаление моноцитов усилива-
ет продукцию антител в культурах ЛПК [64, 73]. Исследова-
тель может легко убедиться в том, что оптимальная продукция
антител происходит в дополненных лимфокинами культурах
ЛПК после удаления супрессорных Т-клеток и макрофагов.
Методы разделения клеток описаны в гл. 2.
3. При индукции антигенспецифического ответа важно уст-
ранить условия, благоприятствующие чрезмерной неспецифиче-
ской поликлональной активации. Ей способствуют круглодон-
ная культуральная посуда, низкие концентрации культивируе-
мых ЛПК и высокие концентрации антигена [47].
2.2.8. Иммунизация in vitro клеток селезенки
или миндалин человека
Клетки этих органов по сравнению с ЛПК дают более вос-
производимый ответ. Основные этапы работы при стимуляции
образования антител в культурах клеток селезенки или мин-
далин человека такие же, как при работе с ЛПК- Для опти-
мальной антигенспецифической продукции антител, очевидно,
требуется добавление поликлонального стимулятора В-клеток и
лимфокинов (особенно ИЛ-2) [66, 73—76]. И в этом случае
удаление супрессорных клеток из суспензий селезенки или мин-
далин усиливает синтез антител [73, 76].
2.3. Иммунизация in vitro лимфоцитов других
видов животных
Для иммунизации in vitro ЛПК других крупных животных,
в том числе телят [77], бесхвостых макак [78] и кроликов
[79] были описаны системы, аналогичные используемым при
культивировании лимфоцитов человека. Системы культивиро-
вания спленоцитов кролика [80] или морской свинки [81]
очень похожи на культуры мышиных спленоцитов (разд. 2.2.1).
186
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
3. Количественное определение клеток,
секретирующих антитела
3.1. Метод локального гемолиза
3.1.1. Общее описание
Суть метода заключается в том, что в слое индикаторных
эритроцитов вокруг единичной лимфоидной клетки, секретиру-
ющей антитела, образуется зона гемолиза, видимая невоору-
женным глазом. Для этого, например, суспензию спленоцитов
мыши, предварительно иммунизированной ЭБ, смешивают в
культуральной среде с ЭБ (индикаторные клетки) и источни-
ком комплемента, которым служит свежая сыворотка морской
свинки в соответствующем разведении. В процессе инкубации
при 37 °C некоторые лимфоциты (плазматические клетки) сек-
ретируют в среду антитела к ЭБ. Эти антитела свободно диф-
фундируют в среде до тех пор, пока не встретят на поверхности
эритроцита-мишени (ЭБ) незанятую антигенную детерминанту,
с которой образуют комплекс, активирующий комплемент. Про-
исходящий в результате этого гемолиз вокруг клеток, секрети-
рующих антитела, приводит к образованию отдельных, хорошо
различимых и легко подсчитываемых светлых зон, которые от-
четливо заметны при освещении на темном фоне.
Метод определения клеток, секретирующих антитела, осно-
ванный на этом принципе, представляется наиболее простым из
известных и позволяет выявлять в основном клетки, образую-
щие IgM к антигенным детерминантам ЭБ-мишеней. Продуци-
руемые этими клетками IgM могут непосредственно сами фик-
сировать комплемент и поэтому образуют так называемые пря-
мые зоны гемолиза. Мышиные антитела, относящиеся к другим
классам (изотипам) иммуноглобулинов, почти (или полностью)
не способны активировать комплемент морской свинки и нуж-
даются для осуществления гемолиза в комплексировании с
«проявляющими» (усиливающими) ксено- или аллогенными ан-
тиглобулиновыми антителами. Клетки, секретирующие такие
антитела, образуют непрямые зоны гемолиза. Преимущество
непрямой модификации — возможность раздельного визуально-
го учета клеток, образующих антитела разных изотипов, с по-
мощью антиглобулиновых реагентов, специфичных к разным
классам иммуноглобулинов.
Метод позволяет работать с широким набором антигенов,
поскольку всегда существует возможность пассивно нагрузить
ЭБ разнообразными белками или полисахаридами и использо-
вать их в качестве клеток-мишеней в прямом или непрямом ло-
кальном гемолизе. Все упомянутые выше варианты, в которых
187
ГЛАВА 5
ЭБ-мишени (ЭБ, нагруженные антигеном) служат для выявле-
ния антител, относятся к традиционному методу локального ге-
молиза. В отличие от этого ЭБ с присоединенными к их поверх-
ности антителами можно использовать для выявления клеток,
секретирующих антиген, при помощи метода обратного локаль-
ного гемолиза. Например, данный метод можно использовать
для идентификации клеток, секретирующих иммуноглобулины
независимо от специфичности образуемых молекул антител. Об-
ратный локальный гемолиз — это весьма эффективный метод
идентификации клеток, секретирующих не только иммуноглобу-
лины, но и другие разнообразные белки, например ферменты,
гормоны и компоненты комплемента.
Метод локального гемолиза достаточно четко воспроизво-
дится только в том случае, когда среда обеспечивает неподвиж-
ность АОК и клеток-мишеней при свободной диффузии секрети-
руемых молекул. Этого можно достичь в жидкой среде в пре-
дельно узких плоских стеклянных камерах, или в подходящем
геле. Примеры этих двух альтернативных решений приводятся
в последующих разделах. В работе Капплера (Kappler) [82]
описана микромодификация метода, используемая для анали-
за лимфоцитов непосредственно в лунках 96-луночных панелей
для культуры ткани. Определение зон гемолиза — очень чувст-
вительный метод. Например, обнаружение 50 АОК в лимфоуз-
ле, дренирующем область инъекции антигена, высоко достовер-
но с точки зрения статистики, хотя обнаружить циркулирующие
антитела, секретируемые этими клетками, едва ли возможно.
С другой стороны, данный метод при чрезвычайной чувствитель-
ности в оценке деятельности отдельных частей иммунной систе-
мы организма не подходит для определения ее совокупной
функциональной активности.
3.1.2. Определение клеток, образующих антитела
в жидкой среде
В плоскую камеру вносят смесь, содержащую эритроциты-
мишени, клетки, образующие антитела, разведенный соответст-
вующим образом комплемент и, если требуется, проявляющий
антиглобулиновый реагент в забуференном BSS. Затем камеры
помещают на установленную по уровню горизонтальную по-
верхность, чтобы клетки осели и образовали монослой. После
инкубации при 37 °C (более 30 мин) появляются зоны локаль-
ного гемолиза, которые можно подсчитать при небольшом уве-
личении на темном фоне.
1. Предварительно вымытые стандартные предметные стек-
ла для микроскопии 25x75 мм укладывают в ряд так, чтобы их
короткие стороны составили прямую линию. Сверху, как пока-
зано на рис. 5.2, наклеивают три параллельные полоски липкой
с двух сторон ленты («Скотч» № 410).
1-8
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
2. Снимают прокладку с тыльной стороны липкой ленты и
поверх первого слоя предметных стекол накладывают второй
(точно одно стекло на другое), осторожно прижимая их резино-
вым валиком. Ленту между отдельными камерами разрезают;
теперь камеры готовы для использования.
3. Объем всей камеры составляет примерно 180 мкл (по
90 мкл в каждом отделении), поэтому готовят 200 мкл смеси.
Для этого в маленькую пробирку (-~5Х4О мм) помещают не-
обходимое количество клеток в 150 мкл минимальной среды
Игла, содержащей HEPES (0,02 М), и желатину (0,5%; «Бак-
тожелатин» фирмы Difco Laboratories, Великобритания), а за-
тем туда же добавляют 20 мкл проявляющего антиглобулино-
вого реагента в соответствующем разведении, 20 мкл 16%-ной
(по объему осадка) суспензии ЭБ и 10 мкл свежей, истощенной
эритроцитами-мишенями сыворотки морской свинки. Для более
высокой Точности последующих расчетов можно ввести в каме-
ру 160 мкл приготовленной смеси, а оставшееся пространство'
заполнить средой.
Риг. 5.2. Приготовление камер Каннингема (см. описание в тексте). Каждая
камера легко отделяется от блока и готова к заполнению смесью среды, кле-
ток, проявляющего реагента и комплемента.
4. Попавшие в камеру пузырьки воздуха вызывают переме-
щение жидкости и последующую деформацию зон гемолиза.
Чтобы этого не произошло, поверхность стекол должна быть
чистой, незапыленной, а суспензию перед заполнением каме-
ры желательно нагреть до температуры окружающей среды.
5. Заполненную камеру герметизируют, обмакнув длинной
стороной в нагретую (70 °C) желеобразную смесь воска с ва-
зелином (см. рис. 5.3).
3.1.3. Дополнительные пояснения
Этот вариант метода локального гемолиза был впервые
предложен Каннингемом и Зенбергом (Cunningham and Szen-
berg) [83J, которые показали его удобство и чувствительность,
для выявления прямых (IgM) зон гемолиза. Есть данные, ука-
зывающие на то, что определение непрямых зон гемолиза по
Каннингему (в закрытой камере) менее чувствительно, чем опи-
санная в разд. 3.1.4 постановка реакции на поверхности стекол
189
ГЛАВА 5
(в открытом виде) [84]. При постановке реакции по Каннинге-
му клетки, секретирующие антитела, и эритроциты-мишени сме-
шивают с антиглобулиновым реагентом и комплементом перед
началом инкубации, тогда как в «открытой» постановке на стек-
лах комплемент обычно добавляют в конце инкубации. Сниже-
ние количества регистрируемых зон гемолиза, вероятно, обу-
словлено преждевременной активацией комплемента. Моди-
фикация Каннингема создает и другие, иногда существенные
неудобства, в частности: а) закрытый тип камеры препятству-
ет прямому доступу к АОК; б) броуновское движение и кон-
векция за несколько часов приводят к заполнению зон гемоли-
за эритроцитами. Поэтому необходимо подсчитывать зоны ге-
молиза тотчас после окончания инкубации. Очевидные преиму-
щества модификации Каннингема — это быстрота постановки,
Рис. 5.3. Открытые края камеры Каннингема после заполнения герметизи-
руют, погружая в расплавленную (70 °C) смесь воска с вазелином [равные
объемы прессованного пчелиного воска с темп, плавл. 56—57 °C (Gurr, Вели-
кобритания) и вазелина].
относительно высокая чувствительность и ненужность специаль-
ных приспособлений, таких, как лотки для стекол или термо-
статы с контролируемым составом атмосферы.
3.1.4. Локальный гемолиз в геле
Предлагаемый вариант — это модификация метода, впервые
предложенного Ерне с сотр. (Jerne et al.) [85]. Готовят смесь
клеток, секретирующих антитела, и эритроцитов-мишеней, как
указано в разд. 3.1.2, но с одним отличием — эта смесь при фи-
зиологических температурах должна образовывать гель, что
позволяет получить стабильный слой на стандартном предмет-
ном стекле. Поскольку этот слой открыт, можно (как обычно и
делают) на него наслаивать комплемент в конце инкубации.
1. Используют предварительно вымытые стандартные пред-
190
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
метные стекла (25X75 мм) с матовой поверхностью для над-
писи на одном из концов. Поверхность каждого стекла покры-
вают агарозной пленкой, погрузив его на короткое время в
0,5°/о-ный (вес/объем) расплавленный нагреванием (70—95 °C)
золь агарозы «Индубиоза» А37 или А45 фирмы L’Industrie Bio-
logique Francaise, приготовленный на дистиллированной воде,
а затем высушивают стекло. После высушивания обработан-
ные стекла можно хранить неопределенно долго.
2. Стекла надписывают на матовой поверхности мягким гра-
фитовым карандашом.
3. Готовят 0,75%-ный (вес/объем) золь агарозы «Сиплак»
фирмы FMC Bioproducts Europe, Дания (с низкой температу-
рой гелеобразования), на среде Игла, забуференной бикарбона-
том натрия (pH 7,2). Для этого помещают необходимую навес-
ку агарозы в коническую колбу, добавляют дистиллированную
воду (90% конечного объема) и доводят смесь до кипения при
постоянном перемешивании (на магнитной мешалке с подогре-
вом). Когда агароза полностью расплавится, добавляют 10% от
конечного объема 10-кратного концентрата минимальной среды
Игла с феноловым красным (Wellcome Diagnostics, Великобри-
тания). Затем по каплям добавляют 5,6%-ный (вес/объем)
раствор бикарбоната натрия до pH 7,2—7,4. Полученную сре-
ду держат при 35—37 СС и используют без промедления, так
как она нестерилизована.
4. В типичном случае расплавленную на водяной бане (35—
37 °C) агарозу разливают по 0,2 мл в маленькие стеклянные
пробирки (~7Х45 мм). Если нужно, в определенные пробирки
добавляют, кроме того, по 10 мкл антиглобулинового реагента
(см. разд. 3.4) в соответствующем разведении.
5. Тем временем на горизонтально установленной подогрев-
ной плите (30—35 °C) раскладывают заранее надписанные и
нагретые стекла с надписями и пастеровские пипетки. Подго-
тавливают также горизонтально установленную плиту для
охлаждения, поскольку агароза «Сиплак» не образует геля при
снижении температуры вплоть до 28 °C. Рядом помещают лот-
ки для инкубации стекол, необходимые на следующей стадии
(рис. 5.4).
6. В отобранные пробирки с агарозой добавляют суспензию
лимфоидных клеток (например, по 20 мкл) в нужном разведе-
нии с помощью автоматической пипетки типа «Эппендорф» или
«Оксфорд» и затем сразу же по 10 мкл 7—9%-ной суспензии
ЭБ-мишеней, которую удобно внести дозатором типа «Гамил-
тон». Содержимое пробирок перемешивают встряхиванием и на-
гретой пастеровской пипеткой переносят на подогретое предмет-
ное стекло.
7. Перенесенную взвесь распределяют кончиком пастеров-
ской пипетки по всей поверхности предметного стекла (кроме
191
ГЛАВА 5
матового участка) и оставляют на подогревной плите на 10 с
для выравнивания толщины слоя. Затем стекло переносят на
охлаждаемую плиту для образования геля. Еще через 60 с с
охлаждаемой плиты стекла переносят в специальные лоткн и
раскладывают слоем геля вниз.
8. Заполненные лотки помещают в термостат при 37 °C во
влажную атмосферу, содержащую 3% СО2 в воздухе, где инку-
бируют 2—3 ч до подслаивания комплемента.
9. Сыворотку морской свинки (свежую или хранившуюся
при —70 °C, либо лиофилизированную и хранившуюся при
—20 °C) истощают при 4 °C 5 мин эритроцитами-мишенями
(ЭБ), осадок которых добавляют в количестве 5—10% от объ-
ема сыворотки. Абсорбированный комплемент разводят в соот-
ношении 1 :20 раствором Хенкса с желатиной [BSS Хенкса+
Рис. 5.4. Перспексовые (метилметакрилатиые) лотки для локального гемолиза
на стеклах. Стекла помещают на лоток вниз гелем. Комплемент (5%-ную све-
жую сыворотку морской свинки) заливают в узкое пространство между слоем
геля и дном лотка.
-f-0,5% (вес/объем) желатины фирмы Difco Laboratories, Вели-
кобритания; либо PBS Дюльбекко] и заливают в пространство
между предметными стеклами и дном лотка; на каждое стекло
требуется примерно 1 мл разведенного комплемента.
10. Лотки помещают в термостат (37 °C) еще на 30—
35 мин. Затем стекла переносят в штатив, который погружают
на 3—5 мин для фиксации в 0,25%-ный раствор глутаральдеги-
да на 0,15 М NaCl. Фиксированные препараты отмывают про-
точной водопроводной, а затем дистиллированной водой в тече-
ние 20—30 мин, после чего для высушивания раскладывают на
гигроскопической бумаге гелем вверх.
Преимущества данного варианта по сравнению с «закрытой»
модификацией Каннингема заключаются в следующем:
1. Возможно использование авторадиографического анализа.
2. Возможны химические манипуляции, например восстанов-
ление и алкилирование иммуноглобулинов [86J.
'192
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
3. Возможно исследование роли раннего, позднего или мно-
гократного подслаивания антиглобулиновых реагентов.
4. Возможно исследование окрашенных клеток, образовав-
ших зоны гемолиза на фиксированных препаратах, обработан-
ных гистологическими методами.
Приведенное в этом разделе описание представляет собой
простой вариант определения клеток, образующих антитела к
ЭБ. Как уже отмечалось в разд. 3.1.2, возможности метода ло-
кального гемолиза в действительности гораздо шире. В качест-
ве мишеней можно использовать эритроциты других видов жи-
вотных, например осла, которые имеют предельно низкую пере-
крестную реактивность с ЭБ; можно и нагрузить ЭБ гаптена-
ми, белками или полисахаридами и, таким образом, конструи-
ровать мишени с широким спектром антигенной специфичности
(см. разд. 3.1.5). В разд. 3.4 мы кратко коснулись приготовле-
ния изотип- и аллотипспецифических антиглобулиновых реаген-
тов, которые позволяют подробно и многосторонне анализиро-
вать иммунный ответ на клеточном уровне.
3.1.5. Неэритроцитарные антигены
Локальный гемолиз позволяет количественно исследовать
на клеточном уровне гуморальный иммунный ответ на самые
различные антигены, если в качестве мишеней использовать
эритроциты, пассивно нагруженные белками, гликолипидами,
полисахаридами или гаптенами.
1. Белки. Хлорный хром — вероятно, самый простой и наи-
более. надежный из имеющихся реагентов для присоединения
белков, поэтому основанный на его применении метод заслу-
живает особых рекомендаций [87]. Известны две модификации
[88], в одной из которых используют «выдержанный», рас-
твор хлорного хрома, а в другой — свежеприготовленный. Хотя
первая модификация дает прекрасные результаты при изготовле-
нии индикаторных клеток для агглютинации или образования
розеток (см. гл. 2), для реакций гемолиза рекомендуют приме-
нять вторую.
а. Эритроциты барана отмывают (центрифугирование при
15Q0 g, в течение 5 мин) 4 или 5 раз 0,15 М NaCl при 20 °C.
На этом этапе следует исключить присутствие фосфатных
ионов. Следует также иметь в виду, что эритроциты некото-
рых животных непригодны для реакции из-за спонтанной аг-
глютинации при контакте с СгС1з, поэтому может возник-
нуть необходимость подбора донора. Установлено, что эрит-
роциты барана, отобранные по пригодности для культур по
Мишеллу — Даттону (разд. 2), успешно нагружаются бел-
ком с помощью хлорного хрома.
13—172
193
ГЛАВА 5
б. Непосредственно перед использованием разводят 10 мг хлор-
ного хрома (химически чистого) в 10 мл 0,15 М NaCl (полу-
чают примерно 4-10~5 М раствор хлорного хрома). Вся стек-
лянная посуда должна быть тщательно вымыта.
в. При 20 °C к 10 объемам раствора нагружаемого белка на
0,15 М NaCl добавляют один объем 50%-ной взвеси плотно-
го осадка в градуированной пластиковой центрифужной про-
бирке на 15 мл (Falcon 2095). Нужная концентрация каж-
дого конкретного белка подбирается экспериментально. На-
пример, эритроциты барана, лошади или козы вполне удов-
летворительно нагружаются бычьим или козьим IgG, взятым
в концентрации 1—2 мг/мл.
г. Поместив пробирку, содержащую взвесь ЭБ и белок на сме-
ситель «Вортекс», при интенсивном перемешивании быстро
добавляют 10 объемов раствора хлорного хрома.
д. Затем взвесь инкубируют 15—20 мин при комнатной темпе-
ратуре (20°C), и после этого останавливают реакцию добав-
лением BSS, например раствора Хенкса с желатиной.
е. Нагруженные эритроциты отмывают три или четыре раза
раствором Хенкса с желатиной. Их можно использовать сра-
зу же или хранить при 0 °C по крайней мере два дня.
Для экономии нагружаемого белка можно уменьшить объ-
емы используемых растворов, строго сохраняя, однако, указан-
ные выше концентрацию белка и абсолютное количество СгС13.
Их соотношение, оптимальное для пассивного гемолиза, может
оказаться неадекватным для гемагглютинации или розеткооб-
разования. С помощью данного метода к ЭБ можно присоеди-
нять и некоторые вирусные антигены [89].
2. Гликолипиды и полисахариды. Отмытые ЭБ легко адсор-
бируют липополисахариды (ЛПС) при простом смешивании их
с раствором ЛПС. Например, смешивают 1 мл PBS, содержа-
щий 1 мг ЛПС (феноловый экстракт из Escherichia coli фирмы
Sigma Chemical Со., США), с 0,5 мл осадка отмытых в PBS
ЭБ, тщательно перемешивают и инкубируют при 37 °C в тече-
ние 30 мин. Затем ЭБ многократно отмывают раствором Хенк-
са с желатиной непосредственно перед использованием в реак-
ции локального гемолиза.
Полисахарид Pneumococcus типа III (SIII) можно адсорби-
ровать на ЭБ, смешивая неочищенный диализованный (против
0,15 М NaCl) культуральный бульон с отмытыми эритроцита-
ми. Точное соотношение каждой партии бульона и эритроцитов
необходимо подбирать экспериментально. К сожалению, SIII и
другие полисахариды в очищенном виде слабо адсорбируются
на эритроцитах. Существует альтернативный вариант: углеводы
присоединяют к микробусам из латекса (диаметр 1,0—1,5 мкм;
Dow Diagnostics, США). Нагруженные микробусы затем сме-
шивают с ЭБ (50: 1) в среде для реакции локального гемолиза.
194
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
Связывание комплемента на микробусах приводит к лизису со-
седних ЭБ благодаря эффекту «свидетеля» [90].
3. Гаптены. Гаптены можно присоединить к ЭБ для образо-
вания мишеней двумя способами: 1) непосредственно химиче-
ской связью (что пригодно для ограниченного числа гаптенов)
и 2) опосредовано через белковый носитель: конъюгируют гап-
тен с белком, а затем конъюгат присоединяют к ЭБ одним из
известных способов. Этот прием, хотя и более сложен, но по
крайней мере в принципе может использоваться для всех гап-
тенов.
Непосредственно к ЭБ можно легко присоединить остаток
пикриновой кислоты (ТНФ, тринитрофенил). Методика заклю-
чается в следующем:
а. ЭБ отмывают 4 раза PBS.
б. Растворяют 10—20 мг тринитробензолсульфоновой кислоты
(ТНБС, Sigma, США) в 7 мл PBS, содержащего феноловый
красный, с помощью которого доводят pH раствора ТНБС до
7,0—7,2, добавляя 0,5 М NaOH. (Будьте внимательны! ТНБС
обладает сенсибилизирующими свойствами при контакте с
кожей.)
в. К раствору ТНБС добавляют 1 мл осадка ЭБ и осторожно
перемешивают 20 мин при 20 °C.
г. В реакционную смесь добавляют растворенный в PBS три-
глицин (Sigma, США) в количестве 1,1 мг на каждый 1 мг
ТНБС для блокирования всех непрореагировавших групп.
д. И наконец, нагруженные ЭБ отмывают 4—5 раз PBS или
раствором Хенкса с желатиной до исчезновения окраски. Пос-
ле каждого центрифугирования (1500 g, 5 мин) ЭБ осто-
рожно ресуспендируют с помощью пастеровской пипетки.
Используемый в гемолизе комплемент морской свинки необ-
ходимо абсорбировать непосредственно перед использованием
ТНФ (ДНФ)-лиз-сефарозой и ЭБ. Плотность присоединения гап-
тена может влиять на чувствительность эритроцитов-мишеней
к действию антител с различной аффинностью [91].
Высокая нагрузка (40—50 мг ТНБС в вышеизложенной про-
писи) способствует выявлению низкоаффинных антител, а низ-
кая— (5—10 мг ТНБС) оптимальна для антител с высокой аф-
финностью.
Для опосредованного присоединения к ЭБ гаптены конъюги-
руют с белками, например сывороточным альбумином, IgG или
ГМФ [39, 92], которые затем можно нагрузить на ЭБ одним из
известных методов. ДНФ можно присоединять и к полисахари-
ду, например SIH [93], хотя для локального гемолиза этот путь
менее пригоден, чем использование белка в качестве носителя.
Альтернативный способ присоединения гаптенов предусмат-
ривает использование в качестве носителя специфичных к ЭБ
антител. Из пшерпммунной кроличьей антисыворотки к ЭБ вы-
13* 195
ГЛАВА 5
деляют IgG [94], который расщепляют до Fab-фрагментов [95].
Затем к Fab-фрагментам присоединяют гаптен и в результате
получают гаптенпзированный реагент, обладающий естествен-
ной аффинностью к ЭБ, но не способный самостоятельно вызы-
вать гемолиз в присутствии комплемента. Определив оптималь-
ное соотношение, в котором следует нагружать ЭБ этим ре-
агентом, его разливают мелкими порциями и хранят заморожен-
ным до использования. Благодаря этому в повседневной работе
стандартизируется и упрощается приготовление эритроцитов-ми-
шеней.
Ниже изложен способ быстрого получения Fab-фрагментов
антител к ЭБ из сыворотки, содержащей антитела к ЭБ.
а. Антисыворотку подвергают хроматографии на колонке про-
теин А-сефарозы (Pharmacia Fine Chemicals, Швеция), кото-
рая связывает IgG.
б. Отмыв колонку от несвязывавшегося белка, элюируют IgG
0,2 М HCl-глициновым буфером (pH 2,4) и концентрируют,
диализуя под давлением против 0,2 М фосфатного буфера по
Серенсену, содержащего 0,008 М ЭДТА, pH 7,2. К концент-
рированному IgG добавляют суспензию меркурированного
папаина (Worthington, США), из расчета 10 мг ферментно-
го препарата на каждый грамм белка.
В смесь добавляют 2-меркаптоэтанол (до 0,01 М) и инкуби-
руют 8 ч при 37 °C.
Реакцию прекращают путем добавления 7з3 объема 0,5 М
иодацетамида в трис-буфере.
с. Диализуют против PBS (pH 7,2), а затем наносят на колон-
ку протеин А-сефарозы. При этом на колонке связываются
нерасщепленный IgG и Fc-фрагменты, но не задерживаются
Fab-фрагменты1. После концентрирования препарат Fab-
фрагментов готов для присоединения гаптенов.
Колонка, содержащая 1,5 г (около 5 мл) сефарозы-белка А.
связывает примерно 18 мг IgG кролика и выдерживает не ме-
нее 25 циклов элюции буфером с pH 2,4.
3.1.6. Обратный локальный гемолиз
Методом локального гемолиза можно выявлять клетки, сек-
ретирующие «антиген», если в качестве мишеней использовать
эритроциты, нагруженные антителами к этому антигену [96].
Метод, обычно применяемый для определения клеток, секрети-
рующих иммуноглобулины, был также адаптирован для выяв-
1 Известно слабое («альтернативное») связывание Fab-фрагментов IgG
многих видов животных со стафилококковым белком А. Поэтому в данном
случае необходимо подобрать условия элюции. — Прим. ред. перевода.
иг>
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
ления клеток, секретирующих гормон роста [97], тиреоглобу-
лин при аутоиммунном тиреоидите [98], а также для других
целей клинической иммунодиагностики [99]. Существуют две
широко распространенные методики, использующие: 1) эритро-
циты (обычно бараньи), нагруженные белком A (S. aureus Со
wan I), или 2) эритроциты-мишени, нагруженные непосредст-
венно антителами с помощью СгС13 (разд. 3.1.5).
В первом случае белок A (Sigma Chemical Со., США) при-
соединяют к ЭБ методом, изложенным в разд. 3.1.5, с незначи-
тельной модификацией для экономии этого дорогостоящего
реагента.
1. Смешивают 0,2 мл 50%-ной взвеси плотного осадка ЭБ,
отмытых 0,15 М NaCl, с 0,2 мл раствора (0,5 мг/мл) белка А в
0,15 М NaCl.
2. Поместив полученную взвесь на смеситель «Вортекс» для
интенсивного перемешивания, добавляют 2 мл свежеприготов-
ленного СгС13 (10 мг/100 мл; примерно 4-10~5 М) на физиологи-
ческом растворе. Дальнейшее описано в разд. 3.1.5.
Нагруженные белком А ЭБ используют в стандартном ме-
тоде локального гемолиза (в жидкой или гелеобразной среде),
добавляя «проявляющую» антисыворотку (кроличью) к секрети-
руемому белку. Комплексы секретируемого белка с антителами
проявляющего реагента связываются белком А, который обла-
дает высокой аффинностью к Fc-фрагментам 1g кролика. Ло-
кальный гемолиз происходит в тех зонах, где связанные комп-
лексы активируют комплемент. Проявляющая сыворотка имеет
максимальную эффективность в определенном разведении (т. е.
существует эффект прозоны), поэтому ее следует тщательно от-
титровать.
Если секретируемый «антиген» — это иммуноглобулин, то
целесообразно антиглобулиновые антитела присоединить непо-
средственно к эритроцитам-мишеням при помощи СгС13:
1. Выделяют IgG из сыворотки козы, гипериммунизирован-
ной, например, мышиным IgG, и диализуют против физиологи-
ческого раствора (см. разд. 3.4).
2. К ЭБ присоединяют IgG козы (обычно при концентрации
1—2 мг/мл) с помощью вышеизложенного стандартного метода
с использованием СгС13. Обычно препарат козьего иммуногло-
булина содержит в основном IgGi (которые не связывают комп-
лемент морской свинки), поэтому добавление комплемента не
вызывает спонтанного гемолиза. Локальный гемолиз с образо-
ванием зон происходит только в присутствии проявляющей сы-
воротки кролика против иммуноглобулинов мыши.
3. В обратном локальном гемолизе можно использовать ту
же самую проявляющую антисыворотку и в той же концентра-
ции, что и в непрямом варианте традиционного метода, изло-
женного ранее. Здесь, как и в описанном выше варианте обрат-
197
ГЛАВА 5
ного локального гемолиза, проявляющая антисыворотка дает
эффект прозоны, поэтому весьма существенное значение имеет
тщательное определение ее оптимального титра.
3.1.7. Комментарии общего характера
Одно из наиболее частых затруднений при постановке ло-
кального гемолиза —это гемолиз всех эритроцитов-мишеней.
Он-может возникать либо в том случае, когда эритроциты на-
гружены антигеном, самостоятельно активирующим комплемент
морской свинки, например IgG5, либо когда сливаются вместе
зоны гемолиза при слишком большом числе АОК- Иногда мож-
но работать с активирующим комплемент антигеном, нагружая
им ЭБ при более низкой концентрации. При этом спонтанного
гемолиза не происходит, а локальный гемолиз идет на достаточ-
ном для визуализации уровне. Интервал между оптимальной
концентрацией нагружаемого антигена и концентрацией, вызы-
вающей общий гемолиз, часто бывает очень узким. Поэтому не-
обходимо предварительное титрование каждой новой серии ан-
тигена. Число АОК, выявляемых на одном предметном стекле,
должно находиться между рационально выбранными миниму-
мом и максимумом, исключающим слияние зон гемолиза (см.
рис. 5.5). Оптимально, по-видимому, получить на стекле от 20
до 150 зон гемолиза. Если их количество заранее неизвестно,
исследуют ряд разведений клеточной взвеси.
Иногда на стекле зоны гемолиза вовсе отсутствуют, хотя,
предположительно, определенное количество их должно быть.
Возможно, это обусловлено неудачной нагрузкой эритроцитов,
например, при постановке пассивного или обратного локального
гемолиза из-за присутствия следовых примесей фосфатов в BSS
или детергента на недостаточно вымытой стеклянной посуде.
Низкую активность комплемента, по-видимому, не следует
считать причиной всех неудач, однако с нею иногда связано не-
четкое выявление зон гемолиза. Комплемент морской свинки в
виде лиофилизированной сыворотки можно хранить при —20 °C,
а в виде замороженной сыворотки — при температуре ниже
—50°C. Разводят комплемент непосредственно перед использова-
нием в BSS, содержащем Са2+ и Mg2+. В редких случаях об-
щий гемолиз может быть вызван присутствием антител к анти-
гену в комплементе. Во избежание этого комплемент абсорби-
руют эритроцитами-мишенями и антигеном, иммобилизован-
ным на сефарозе или на эритроцитах, при 4 °C в течение 10 мин
непосредственно перед разведением и добавлением в реакцию
локального гемолиза.
Артефакты, похожие на зоны гемолиза, могут возникать из-
за мелких пузырьков воздуха в среде или посторонних включе-
ний, секретирующих либо выделяющих гемолитические вещест-
198
6
Рнс. 5.5. Зоны локально-
го гемолиза, а. Фиксиро-
ванный н высушенный
гель с зонами гемолиза
при освещении на темном
фоне. б. Тот же препарат
при большем увеличении.
в. Прорастающие споры
плесенн в центре ложной
зоны гемолиза. Три не-
лизнрованных (бараньих)
эритроцита-мишени дают
представление о мас-
штабе.
ГЛАВА 5
ва. Пузырьки воздуха обычно хорошо различимы, т. к. имеют
крупные размеры и четко ограниченный край. Ложные зоны ге-
молиза вокруг клеточных агрегатов или прорастающих спор
плесени (рис. 5.5, в) идентифицировать не так легко, особенно,
если происходит увеличение их размеров в присутствии комп-
лемента. Если реакция проводится на стеклах (открытые куль-
туры), то для выяснения природы артефактов фиксированные
и высушенные препараты можно окрасить и исследовать под
микроскопом (при необходимости даже с большим увеличени-
ем). Еще одной причиной артефактов может быть временное
охлаждение среды ниже температуры гелеобразования. Это
приводит к появлению микрогранул геля, в которые не вклю-
чаются добавленные позже эритроциты-мишени. В тонком слое
эти микрогранулы на первый взгляд напоминают зоны гемоли-
за, но их легко исключить из подсчета при просмотре стекол до
начала инкубации.
Зоны гемолиза можно сфотографировать на темном фоне в
отраженном свете фотокамерой, снабженной зеркальным уст-
ройством для наведения на резкость и объективом для макро-
съемки. Кроме того, фиксированные и высушенные стекла мож-
но закрепить в рамке для фотопластинок или фотопленки обыч-
ного фотоувеличителя и, спроецировав изображение, печатать
непосредственно на высококонтрастной фотобумаге. Последний
способ съемки прямо на бумагу особенно удобен для измерения
размеров зон гемолиза.
3.2. Методы, основанные на формировании
негемолитических зон
3.2.1. Локальный лизис клеток-мишеней,
имеющих ядра
Количество клеток, секретирующих антитела к антигенам
клеток, содержащих ядра, можно определить методом, принцип
которого напоминает локальный гемолиз [100, 101]. Выращи-
вают монослой клеток-мишеней, культивируя их в соответст-
вующих условиях. В культуру сначала вносят антителообразу-
ющие клетки, дают им осесть на монослой и секретировать
антитела в течение определенного времени, а затем добавляют
комплемент кролика, вызывающий локальный цитолиз. Зоны
цитолиза становятся видимыми после фиксации и окрашивания
монослоя нелизированных клеток. При использовании в качестве
мишеней, например, клеток мастоцитомы для цитолиза после до-
бавления комплемента еще требуется длительный (24 ч) пери-
од культивирования.
200
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
Однако для выявления АОК не обязательно дожидаться
полного цитолиза мишеней. Зоны локальной секреции цитоток-
сических антител можно выявить путем окрашивания мишеней
на жизнеспособность (например, трипановым синим): живые
клетки исключают краситель, а мертвые — окрашиваются [102].
В качестве мишеней в методе локального бактериолиза исполь-
зовались также интактные бактерии [103].
3.2.2. Выявление зон ингибиции размножения фага
(метод ZIPP)
Клетки, секретирующие противовирусные антитела, во мно-
гих случаях можно определять стандартным методом локаль-
ного гемолиза ЭБ, нагруженных вирусными белками с по-
мощью СгОз [103]. Можно выявлять и зоны задержки размно-
жения фага в слое инфицированных им бактерий вокруг кле-
ток, секретирующих антифаговые антитела [Ю4]. Клетки, об-
разующие антитела, инкубируют при 37 °C в тонком слое ага-
розного геля, содержащего культуральную среду и фаг-мишень
(например, <рХ174 или Fd). На этот гель затем наносят сверху
тонкий слой питательного агара с бактериями соответствующе-
го штамма. После короткой инкубации при 24 °C активный ли-
зис бактерий останавливают, добавив избыток гипериммунной
сыворотки, содержащей антитела к фагу.
3.2.3. Метод иммуноферментных (ELISA) зон «Элиспот»
Метод твердофазного иммуноадсорбционного авторадиогра-
фического выявления АОК с применением радиоактивномечен-
ного антиглобулинового реагента был разработан около двух
десятилетий назад [105, 106]. Затем создание иммунофермент-
ной технологии [107, 108] привело к разработке метода имму-
коферментных зон («Элиспот») [109, 110]. При его воспроизве-
дении антиглобулиновый реагент, конъюгированный с фермен-
том (например, пероксидазой или щелочной фосфатазой), взаи-
модействует с антителом, связавшимся с антигеном, иммобили-
зованным на твердой фазе. Расположение молекул фермента
выявляют, добавив субстрат, который при взаимодействии с
ферментом образует нерастворимый окрашенный продукт. По
сравнению с авторадиографией метод «Элиспот» гораздо проще
и быстрее, а следовательно, более ценен в практическом отно-
шении. Приведенное ниже описание метода в основном взято из
статьи, которую опубликовали Седжуик и Холт (Sedgwick and
Holt) [111],
Субстрат и панели для проведения анализа можно пригото-
вить накануне.
201
ГЛАВА 5
1. Используют 24-луночные панели для культуры ткани
(Nunclon Linbro). В каждую лунку вносят по 1 мл раствора ан-
тигена, например IgG человека в концентрации 10 мкг/мл в
PBS или бикарбонатном буфере [107J. Инкубируют 1 ч при
37 °C и ночь при 4 °C.
2. Готовят буферный раствор для субстрата с 2-амино-2-ме-
тил-1 -пропанолом (АМИ), для чего растворяют 150 мг MgCl2-
•6Н2О, 0,2 мл тритона Х-405 и 1 г азида натрия в небольшом
объеме воды, и при перемешивании добавляют 95,8 мл основ-
ного раствора АМИ (Sigma Chemical Со., США). Доводят объ-
ем смеси водой до 900 мл и pH до 10,2—10,3 с помощью кон-
центрированной НС1. Оставляют буфер на ночь при 20 СС, а на
следующий день вновь доводят pH раствора до указанного зна-
чения, а объем-—до 1 л и хранят раствор при 4 °C до исполь-
зования.
3. Лимфоидные клет-ш тщательно отмывают от следовых ко-
личеств свободных антител и ресуспендируют при 4 JC в
RPM1 1640, содержащей 5% СПК.
4. Нагруженные антигеном панели отмывают несколько раз
PBS, содержащим 0,05% твин 20 (PBS-твин). Для этого в каж-
дую лунку вносят примерно 1 мл этого раствора и через три
минуты стряхивают содержимое-панели одним резким движе-
нием.
5. За 1 ч до внесения клеток в каждую лунку добавляют пэ
0,5 мл раствора БСА (1 мг/мл) в PBS-твине для блокирования
неспецифического связывания. (Некоторые авторы считают, что
в данной системе это необязательно.)
6. Удаляют раствор и в каждую лунку добавляют по 1 мл
суспензии клеток в соответствующей концентрации.
7. Панель инкубируют 1—3 ч в строго неподвижном состоя-
нии.
8. Вымывают клетки из лунок панели не менее чем тремя
порциями PBS-твина при 4 °C. Вымывание клеток должно быть
Весьма тщательным, поскольку они склонны прилипать к по-
верхности пластика.
9. Вносят в каждую лунку по 0,5 мл конъюгированного с
ферментом антиглобулинового реагента в нужном разведении
(1/200—1/2000) на PBS-твине (или на PBS-твине с 1% БСА).
10. Оставляют панель на 1 ч при 20 °C (или на ночь при
4 °C) и, перед тем как внести смесь субстрата с агарозой, от-
мывают лунки PBS-твином.
11. Накануне постановки реакции готовят раствор субстрата
для щелочной фосфатазы. Для этого 10 мг 5-бром-4-хлор-3-ин-
долилфосфата (БХИФ) (Sigma Chemical Со., США) растворят
в 10 мл буфера с АМП, оставляют на 1 ч при 20 °C, а затем
фильтруют и хранят в течение ночи при 4 °C.
12. Готовят основной 3%-ный (вес/объем) гель агарозы на
202
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
дистиллированной воде. В день опыта нужный его объем рас-
плавляют на кипящей водяной бане. После охлаждения до
70 °C один объем расплавленного золя агарозы смешивают с
четырьмя объемами буфера с БХИФ. Получается 0,6%-ный
(вес/объем) золь агарозы, который быстро разливают по 0,75 мл
в каждую лунку. Панель оставляют неподвижной, пока агаро-
за не застынет.
13. Панель инкубируют при 20 °C примерно 30 мин, пока не
проявятся голубые пятна, соответствующие бывшему располо-
жению АОК. Панель можно рассмотреть под микроскопом и
убедиться, что эти пятна не являются артефактами.
Если антиген успешно иммобилизуется на твердой фазе и в
наличии имеется подходящий конъюгат антиглобулинового ре-
агента с ферментом, то методу «Элиспот» всегда обеспечено
самое широкое применение.
3.3. Приготовление взвеси лимфоидных клеток
Селезенку и отдельные лимфоузлы мышей можно гомогени-
зировать с помощью тефлонового пестика, свободно входяще-
го в стеклянную пробирку. Такие гомогенизаторы можно изго-
товить из круглодонных центрифужных стеклянных пробирок
на 15 мл и пестиков, выточенных на токарном станке так, что-
бы зазор между стенками пробирки и пестика составлял 1—
2 мм.
1. Лимфоидный орган освобождают от фасций п оболочек
скальпелем или ножницами и помещают в небольшом количе-
стве раствора Хенкса с желатиной в центрифужную пробирку.
После гомогенизации пестик ополаскивают тем же раствором,
фильтруют клеточную суспензию через тонкое стальное сито
(30—35 меш).
2. Клетки центрифугируют при 600 g в течение 5 мин, ресус-
пендируют в соответствующем объеме раствора Хенкса с жела-
тиной и переносят на ледяную баню (0°С). До этого момента
все операции проводят при комнатной температуре (20 °C).
3. Обычно клетки исследуют в тот же день, но суспензию
можно хранить 1—2 дня при 0°С, хотя зоны локального гемо-
лиза при этом становятся менее четкими, а их количество умень-
шается (потери могут доходить до 25%). Довольно легко при-
готовить одновременно несколько разных суспензий в стериль-
ном виде, т. к. пестики, центрифужные пробирки и сита мож-
но автоклавировать. Методы получения взвеси лимфоидных
клеток из других источников, в том числе периферической кро-
ви, описаны в гл. 1.
203
ГЛАВА 5
3.4. Антииммуноглобулиновые сыворотки
(антиглобулиновые реагенты)
Антисыворотки к иммуноглобулинам используются для про-
явления или ингибиции зои гемолиза. В виде конъюгатов с фер-
ментами они в качестве специфических реагентов применяются
в методе «Элиспот». Многие сыворотки, необходимые для этих
целей, имеются в продаже, а те из них, которые предназначены
для иммуноферментного анализа, часто отличаются наиболее
высоким качеством. Образование прямых (IgM) зои гемолиза
можно специфически подавить с помощью анти-р, антител под-
класса IgGi, не связывающих комплемент морской свинки. Спе-
цифическое подавление не мешает образованию непрямых (не
IgM) зон гемолиза в присутствии изотипспецифической прояв-
ляющей антисыворотки, содержащей антитела подкласса IgG2
[112]. Поэтому имеется возможность выявлять очень неболь-
шое число непрямых зон на фоне высокого конкурирующего
IgM-ответа. Определенное практическое значение имеет тот
факт, что у коз, иммунизированных антигеном в полном адъю-
ванте Фрейнда, формируется в основном IgGi-ответ, а у кроли-
ков образуются антитела подкласса IgG2. Если в локальном
гемолизе в качестве проявляющего реагента используются ком-
мерческие антисыворотки, то иногда необходимо их дополни-
тельно истощать и контролировать на специфичность, посколь-
ку об изотипе, специфичности и активности антител, содержа-
щихся в этих препаратах, необходимо иметь полное представ-
ление. В двух недавно опубликованных сбзорах приводятся ме-
тоды получения и истощения антисывороток, которые исполь-
зуются в методе локального гемолиза [84, 94].
4. Благодарности
Мы благодарим Падди Хатчингз (отдел иммунологии, Ме-
дицинская школа при больнице в Миддлсексе, Лондон) и Анд-
желу Попем за весьма полезное обсуждение и практические со-
веты по поводу методов, приведенных в этой главе.
Литература
1. Mishell R. Dutton R. Г. (1967). J. Exp. Med., 126, 423.
2. Hoffmann M. K. (1980). J. Immunol., 125, 2076.
3. Hoffmann M. K„ Mizel S. B„ Hirst J. A. (1984). J. Immunol., 133, 2566.
4. Hamaoka T„ Ono S. (1986). Annu. Immunol., 4, 167.
5. Marrack P., Graham S. D., Kushnir E., Leibson H. J., Roehm N., Kapp-
ler J. W. (1982). Immunol. Rev., 63, 33.
6. Dutton R., Falkoff R., Hirst J., Hoffmann M., Kappler J., Kettman J., Les-
ley 1., Vann D. (1971). In: Progress in Immunology, Amos. B. (ed.), Aca-
demic Tress, Vol. I, p. 355.
2C4
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
7. Harwell L., Kappler J., Marrack P. (1976). J. Immunol., 116, 1379.
8. Coutinho A., Moller G., Richter W. (1974). Scand. J. Immunol,, 3, 321.
9. Desaymard C., Feldmann M. (1975). Eur. J. Immunol., 5, 537.
10. Imman J. K. (1975). J. Immunol., 114, 704.
11. Sharon R., McMaster P. R. B., Kask A. M., Owens J. D., Paul ll7. B. (1975).
J. Immunol., 114, 1585.
12. Hammerling U., Westphal O. (1967). Eur. J. Biochem., 1, 46.
13. Ada G. L., Nossal G. J. V., Pye J., Abbot A. (1964). Austr. J. Exp. Biol,
Med. Sci., 42, 267.
14. Feldmann M„ BasienJ. A. (1971). J. Exp. Med., 134, 103.
15. Schrader J. W7. (1974). Eur. J. Immunol., 4, 20.
16. Howard J. G., Zola H., Christie G. H., Courtenay В. M. (1971). Immuno-
logy, 21, 535.
17. Cosenza H„ Kohler H. (1972). Proc. Natl. Acad. Sci. USA, 69, 2701.
18. Du Clos T. W., Kim B. S. (1977). J. Immunol., 119, 1769.
19. Abruzzo L. V’., Mullen C. A, Rowley D. A. (1986). Cell. Immunol., 98, 266.
20. Stout J. T., Strickland F. M., Cerny J. (1985). J. Immunol., 134, 1926.
21. Chesebro B_, Metzger H. (1972). Biochemistry, 11, 766.
22. Imperiale M. J., Faherty D. A., Sproviero J. F., Zauderer M. (1982). J. Im-
munol., 129, 1843.
23. Feldmann M., Greaves M. F., Parker D. C.. Rittenberg M. B. (1974). Eur.
J. Immunol., 4, 591.
24. Balieux R. E., Hiejnen C. J., Uytdehaag F., Zegcrs B. J. Л1. (1979). Im-
munol. Rev., 45, 3.
25. Cheers C., Breitner J. C. S., Little M., Miller J. F. A. P. (1971). Nature,
New Biol., 232, 249.
26. Schimunkevitz R„ Kappler L, Marrack P.. Grau H. (1981). J. Exp. Med.,
158, 303.
27. Schrader J. W. (1973). J. Exp. Med., 138, 1466.
28. Jensen P. E„ Kapp J. A. (1984). Cell. Immunol., 87, 73.
29. Coutinho A., Moller G., Andersson J., Bullock ll7. II7. (1973). Eur. J. Immu-
nol., 3, 299.
30. Eardley D. D., Sercarz E. E. (1976). J. Immunol., 116, 600.
31. Eardley D. D., Sercarz E. E. (1977). J. Immunol., 118, 1306.
32. Kapp J. A., Pierce C. W„ Benacerraf B. (1973). J. Exp. Med., 138, 1107.
3>3. Hodes R. J., Singer A. (1977). Eur. J. Immunol., 7, 892.
34. Makela O., Seppala I. J. T. (1986). In: Handbook of Experimental Immu-
nology, Weir D. M., Herzenberg L. A., Blackwell C. and Herzenberg L. A.
(eds.), 4th edition, Blackwell, Vol. 1, p. 31.
35. Rittenberg M. B., Amkraut A. A. (1966). J. Immunol., 97, 421.
36. Jacobs D. M. (1975). J. Immunol., 114, 365.
37. Slowe A„ Waldmann H. (1975). Immunology, 29, 825.
38. Segal S., Globerson A., Feldmann M., Haimovich J., Sela M. (1970). J. Exp.
Med., 131, 93.
39. Brownstone A., Mitchison N. A., Pitt-Rivers R. (1966). Immunology, 10,
465.
40. Iscove N. N., Melchers F. (1978). J. Exp. Med., 147, 923.
41. Burger M. (1977). J. Immunol., 117, 906.
42. Tanno Y-, Aral S., Takishima T. (1982). J. Immunol. Methods, 52, 255.
43. Mosier D. E. (1981). J. Immunol., 127, 1490.
44. Tittle T. V., Mawle A., Cohn M. (1985). J. Immunol., 135, 2587.
45. Marbrook J. (1967). Lancet, 2, 1279.
46. Geha R. S. (1979). Immunol. Rev., 45, 275.
47. Lane H. C., Volkman D. J., Whalen G., Fauci A. S. (1981). J. Exp. Med.,
154, 1043.
48. Bird A. G., Britton S. (1979). Immunol. Rev., 41, 67.
49. Fauci A. S. (1979). Immunol. Rev., 45, 93.
205
ГЛАВА
50. Ringden О., Rynnel-Dagoo В., Kunori Т., Smith С. I. Е., Hammarstrom L.,
Freijd A., Moller E. (1979). Immunol. Rev., 45, 195.
51. Galanaud P., Delfraissy J. F., Dormont J. (1979). In: Antibody Production
in Man, Fauci A. S. and Ballieux R. (eds.), Academic Press, p. 159.
52. Misitt J., Waldmann T. A. (1981). J. Exp. Med., 154, 1069.
53. Morimoto C„ Reinherz E. L., Schlossmann S. F. (1981). J. Immunol., 127,
69.
54. Luzatti A. L. (1981). In: Immunological Methods, Lefkovits I. and Pernis B.
(eds.), Academic Press, Vol. II, p. 241.
55. Goodman M. G„ Weigle W. 0. (1985). J. Immunol., 135, 3284.
56. Hoffmann M. K. (1980). Proc. Natl. Acad. Sci. USA, 77, 1139.
57. Kessler S. IV. (1975). J. Immunol., 115, 1617.
58, Dosch H., Gelfand E. W. (1976). J. Immunol. Methods, 11, 107.
59. Cavagnaro J., Osband M. E. (1988). Biotechniques, 1983, 31.
60. Olsson L., Kronstrom H., Cambon-de Mouzon A„ Honsik C„ Brodin T.,
Jakobsen B. (1983). J. Imrnunol. Methods, 61, 17.
61. Sjoberg O., Karnick J. (1980). Scand. J. Immunol., 11, 47.
62. Dosch H., Gelfand E. IV. (1977), J. Immunol., 118, 302.
63. Lipsky P. E. (1985). Contemp. Top. Mol. Immunol., 10, 195.
64. Pollack S., Reisner Y., Koziner B., Good R. A., Hoffmann M. K. (1985).
Immunology, 54, 89.
65. Mittler R., Rao P., Olini G., Westberg E., Newman W., Hoffmann M. K-,
Goldstein G. (1985). J. Immunol., 134, 2393.
66. Tan L. J., Booth R. J., Prestidge R. L., Watson J. D., Dower S. K, Gil-
lis S. (1985). J. Immunol., 135, 2128.
67. Kehrl J. H., Muraguchi A., Battler J. L., Falkoff R. J. M., Fauci A. S.
(1984). Immunol. Rev., 78, 75.
68. Mayer L., Fu S. M., Kunkel H. G. (1984). Immunol. Rev., 78, 119.
69. Farrant J., Newton C. A., North M. E., Weyman C„ Brenner M. K. (1984).
J. Immunol. Methods, 68, 25.
70. Wang S. R„ Zwetman B. (1978). Cell. Immunol., 36, 28.
71. Lipsky P. E. (1980). J. Immunol,, 125, 155.
72. Pryjma J., Flad H. D.t Ernst M., Brandt E., Ulmer A. J. (1986). Immuno-
logy, 59, 485.
73. Chiorazzi N„ Fu S. M., Kunkel H. G, (1979). Immunol, Rev., 45, 219,
74. Booth R. J., Pang G. T. M., Watson J. D. (1984). J. Biol. Resp. Modifiers,
3, 205.
75. Ho M., Rand N., Marray J., Kato K, Rabin H. (1985). J. Immunol., 135,
3831.
76. Lagace J., Bradeur B. R. (1985). J. Immunol. Methods, 85, 127.
77. Filion L. G., Ohman H. B., Owen P. H., Babiuk L. A. (1984). Vet. Immu-
nol. Immunopathol., 7, 19.
78. Reed M. J., Borkow L, Staple P. H. (1981). J. Peridontol., 52, 111.
79. Luzatti A. L„ Ramoni C. (1981). J. Immunol. Methods, 47, 201.
80. Theis G. A., Thorbecke G. J. (1970). J. Exp. Med., 131, 970.
81. CohenS. A. (1981). Cell. Immunol., 60, 354.
82. Kappler J. W. (1974). J. Immunol., 112, 1271.
83. Cunningham A. J., Szenberg A. (1986). Immunology, 14, 599.
84. Dresser D. W. (1986). In: Handbook of Experimental Immunology, Weir
D. M., Herzenberg L. A., Blackwelll C. and Herzenberg L. A. (eds.), 4th
edition, Blackwell, Vol. 2, p. 64.1.
85. Jerne N. K, Nordin A. A., Henry C. (1963). Cell-bound Antibodies, Amos В
and Koprowski H. (eds.), Wistar Institute Press, p. 109.
86. Plotz P. H., Talal N„ Assovsky R. (1968). J. Immunol., 100, 744.
87. Gold E. R„ Eudenberg H. H. (1967). J. Immunol., 99, 859.
88. Goding J. IV. (1976). J. Immunol, Methods, 10, 61.
89. Steinmann J., Marzock H.-J. (1983). J. Immunol. Methods, 59, 221.
90. Bagasra 0., Damjanov I. (1982). J. Immunol. Methods, 49, 283.
206
ОБРАЗОВАНИЕ АНТИТЕЛ in vitro
91. Passanen V. J., Makela 0. (1969). Immunology, 16, 399.
92. Eisen Lt; (1964). Methods Med. Res., 10, 94.
93. Mitchell G F., Humphrey J. H., Williamson A. R. (1972). Eur. J. Immunol.,
2, 460.
94. Dresser D. IF. (1986). Handbook of Experimental Immunology, Weir D. M.,
Herzenberg L. A., Blackwell C. and Herzenberg L. A. (eds.j, 4th edition,
Blackwell, Vol. 1, p. 8.1.
95. Strausbanch P., Sulica A., Givol D. (1970). Nature, 227, 68.
96. Molinaro G. A., Dray S. (1974). Nature, 248, 515.
97. Frawley L. S„ Neill J. D. (1984). Neuroendocrinology, 39, 484
98. Row V. V., Voloe R. (1984). J. Clin. Lab. Immunol., 15, 219.
99. Tauris P. (1983). Scand J. Immunol., 18, 249.
100. Fuji H., Zaleski M., Milgrom F. (1971). Transplant. Proc.. 3. 852.
101. Nordin A. A., Cerottini J.-C., Brunner К. T. (1971). Eur. J linntuiiul. 1. 55.
102. Lake P. (1976). Nature, 262, 297.
103. Schwartz S. A., Braun W, (1965). Science, 159, 200.
104. Tao T.-W., Dresser D. IE. (1972). Eur. J. Immunol., 2, 262.
105. Pick E., Feldman J. D. (1967). Science, 156, 964.
106. Klinman N. R., Taylor R. B. (1969). Clin. Exp. Immunol., 4, 473.
107. Engvall E , Perlmann P (1971). Immunochemistry, 8, 871.
108. Van Weeman В. K., Schurs A. H. IV'. M. (1971). FEBS Lett., 15, 232.
109. Sedgwick J. D., Holt P. G. (1983). J. Immunol. Methods. 57. 301.
110. Czerkinski С. C., Nilsson L.-A., Nygren IL, Oiicliterlony ()., Tarkowski A.
(1983). J. Immunol. Methods, 65, 109.
111. Sedgwick J. D., Holt P. G. (1986). J. Immunol. Methods, 87, 37.
112. Dresser D. IV7., Popham A. M. (1980). Immunology, 41, 569.
Глава 6
КУЛЬТИВИРОВАНИЕ ЛИНИЙ и клонов
Т-КЛЕТОК IN VITRO
П. Тейлор, Д. Томас, К. Миллз
1. Введение
Достигнутые за последние годы успехи в разработке мето-
дов выращивания клонов антигенспецифических Т-клеток in
vitro существенным образом повлияли на развитие молекуляр-
ной и клеточной иммунологии [1]. Структурный анализ генов,
кодирующих рецепторы Т-клеток, позволил раскрыть механиз-
мы возникновения разнообразия рецепторного репертуара [2,
3] и способствовал быстрому развитию наших представлений
относительно роли продуктов генов иммунного ответа в презен-
тации антигена [4]. Более того, в перспективе методы эксплан-
тации клонов Т-клеток обладают чрезвычайной практической
ценностью для создания новых рекомбинантных и синтетических
вакцин. Для получения эффективной вакцины с помощью тех-
нологии рекомбинантных ДНК необходимо, чтобы сконструиро-
ванные пептиды или полипептиды содержали В- и Т-клеточ-
ные эпитопы. В настоящее время именно на клонах цитотокси-
ческих Т-лимфоцитов (ЦТЛ) и Т-хелперов (ТД установлены
основные закономерности иммунологического распознавания
естественных белков и синтетических пептидов Т-клетками [5—
9J; руководствуясь этой информацией, возможно, удастся скон-
струировать синтетические вакцины, индуцирующие Т-клеточ-
ный иммунитет, рестриктированнып по антигенам МНС класса 1
или II. Размножение Т-лимфоцитов in vitro целиком зависит от
интерлейкина 2 (ИЛ-2), тканеспецифического ростового факто-
ра, который продуцируют Т-хелперы при активации их антиге-
ном или поликлональными митогенами [10, 11]. Благодаря на-
личию адекватных источников экзогенного ИЛ-2 получение кло-
нов антигенспецифических Т-хелперов и ЦТЛ мыши и человека
превратилось в настоящее время в рутинную процедуру. Т-клет-
ки, сохраняющие супрессорную активность in vivo, обычно не
поддаются попытка,м добиться их размножения in vitro1 и здесь
не рассматриваются. В настоящей главе описаны методы разм-
ножения некоторых типов Т-клеток мышей.
1 Иммортализацию и размножение Т-супрессоров in vitro осуществляют
путем получения гибридом.—Прим. ред. перевода.
208
КУЛЬТИВИРОВАНИЕ ЛИНИИ И КЛОНОВ Т-КЛЕТОК ill vitro
Таблица 6.1. Фенотипические характеристики линий ЦТ Л и Т-хелперов мыши
\ \ МНС-рестрикция
Цитотоксические Т-лим- фоциты Класс I: К или D Т-хелперы Класс II: I—А или I—Г
Фенотип поверхностных антигенов Тканевая принадлеж- ность (Гримирование антигеном in vivo Зависимость от ИЛ-2 Lyt2+; L3T4- Покоящиеся спленоциты Необязательно Да Lyt2-; L3T4+ Активированные клетки лимфатического узла Необходимо Нет
Эксплантации клонов Т-клеток человека посвящена работа
Фатмана и Фитча (Fathman and Fitch) [1].
1.1. Различные стратегии получения линий
ЦТЛ и Т-хелперов
В табл. 6.1 приведены фенотипические характеристики ли-
ний ЦТЛ и Т-хелперов мыши. В этом разделе сопоставлены
лишь обязательные различия в условиях размножения этих
двух клеточных субпопуляций на начальных этапах культиви-
рования. Во-первых, линии ЦТЛ можно заложить из покоящих-
ся популяций либо неиммунных (аллореактивных), либо при-
мированных Т-клеток, обладающих иммунологической памятью
к какому-нибудь гаптену или вирусному антигену. В отличие
от этого линии Т-хелперов, специфичных к растворимым бел-
кам, могут быть получены только из предварительно активиро-
ванных in vivo лимфобластов, поскольку покоящиеся Т-хелпе-
ры in vitro не пролиферируют. Условия примирования Т-хелпе-
ров растворимыми белковыми антигенами известны с достаточ-
ной определенностью. Наиболее надежную методику опублико-
вали Коррейдин с сотр. (Corradin et al. [12]): для культивиро-
вания берут клетки регионарного лимфоузла на 8—10-й день
после подкожной инъекции антигена в полном адъюванте
Фрейнда. Поскольку предшественники ЦТЛ—покоящиеся лим-
фоциты, то для получения линии обычно используют клетки се-
лезенки, хотя клетки лимфатических узлов обладают не мень-
шей цитотоксической активностью в отношении аллогенных
стимуляторов.
Во-вторых, линии Т-хелперов продуцируют аутокринный
ИЛ-2 и для роста не нуждаются в экзогенном источнике данно-
го ростового фактора (кроме этапа клонирования), тогда как
для ЦТЛ экзогенный ИЛ-2 необходим после третьего или чет-
14—172
209
ГЛАВА 6
вертого цикла антигенной стимуляции. За исключением разли-
чий, касающихся активации, прочие условия культивирования
ЦТЛ и Т-хелперов весьма сходны: для стимуляции ЦТЛ в мас-
совую культуру спленоцитов добавляют облученные аллоген-
ные клетки, а для стимуляции Т-хелперов в массовые культуры
клеток лимфоузла вносят растворимый белковый антиген и оп-
ределяют эффекторные функции через 4—5 дней. Затем выжив-
шие клетки для формирования Т-клеточных линии многократно
стимулируют антигеном в присутствии антигенпрезентирующих
клеток (АПК) и после третьего цикла такой стимуляции отбира-
ют клоны. Методы клонирования ЦТЛ и Т-хелперов идентичны,
но различаются интервалы времени между циклами антигенной
стимуляции.
2. Приготовление суспензий лимфоидных клеток
Приготовление взвеси отвечающих Т-лимфоцитов, а также
клеток-мишеней и вспомогательных клеток (фидерных или
АПК) для долгосрочных культур требует строгого соблюдения
правил асептики. Все реагенты для культуры ткани следует
стерилизовать фильтрованием (мембраны фирмы Millipore.
США с размером пор 0,22 мкм). Стеклянную посуду и инстру-
менты необходимо автоклавировать при 121 СС в течение
20 мин.
2.1. Культуральная среда и условия культивирования
1. Клетки готовят и культивируют на среде RPMI 1640,
содержащей L-глутамин (2 мМ), 2-меркаптоэтанол (50 мкМ).
пенициллин (100 ед./мл), стрептомицин (100 мкг/мл) и 5—
10% инактивированной нагреванием СПК (полная среда).
2. Культуры инкубируют в термостате при 37 °C с увлажне-
нием при содержании в воздухе 5% СО2.
2.2. Приготовление клеточных взвесей селезенки
и лимфатических узлов
1. Помещают лимфоидный орган на стерильную стальную
сетку в чашке Петри с 10 мл полной среды и продавливают
его сквозь нее поршнем от пластикового шприца на 5 мл.
2. Переносят клеточную суспензию в центрифужную про-
бирку на 10 мл и дают осесть крупным агрегатам.
3. Переносят надосадочную часть взвеси в другую центри-
фужную пробирку и центрифугируют при 400 g в течение 5 мин.
4. Ресуспендируют осадок клеток в полной среде и опреде-
ляют их количество.
210
КУЛЬТИВИРОВАНИЕ ЛИНИЙ И КЛОНОВ Т-КЛЕТОК in vitro
2.3. Подсчет живых клеток
2.3.1. Окрашивание акридиновым оранжевым (АО)
и бромистым этидием (БЭТ)
Предостережение: реактивы канцерогенны, следует исключить
контакт с кожей
1. Готовят основной раствор красителей, добавив по 0,1 мг
АО и БЭТ (Sigma Chemical Со., США) к 100 мл PBS, содержа-
щего 0,1 мг азида натрия. Хранят в темноте при 3°С.
2. Смешивают 50—100 мкл суспензии, содержащей 105—10®
клеток в 1 мл, с равным объемом раствора красителей и вносят
в камеру гемоцитометра.
3. Подсчитывают количество зеленых (живых) и оранжевых
(нежизнеспособных) клеток, под флуоресцентным микроскопом
в ультрафиолетовой и видимой частях спектра.
2.3.2. Окрашивание динатриевой солью эозина
Преимущества данного метода в том, что достаточно обыч-
ного светового микроскопа, и используемый краситель неканце-
рогенен. Однако в отличие от АО и БЭТ на проникновение эо-
зина-натрия в клетки влияет присутствие сыворотки, поэтому
для подсчета клеток их необходимо ресуспендировать в среде,
не содержащей белка.
1. Готовят основной раствор красителя, содержащий 0,2 г
динатриевой соли эозина (фирма Gurr, Великобритания) в
100 мл PBS с добавлением 0,1 мг азида натрия. (Известны и
другие эозиновые красители, но они для окрашивания клеток
на жизнеспособность непригодны.)
2. Смешивают равные объемы суспензии клеток (105—
106 клеток/мл) и раствора эозина-натрия, а затем в гемоцитомет-
ре подсчитывают количество живых (неокрашенных) и погиб-
ших (красных) клеток. Подсчет клеток необходимо произво-
дить в течение 5—10 мин после добавления красителя.
2.4. Удаление погибших клеток с помощью
центрифугирования в градиенте плотности
метризамида 1 2 * *
1. Готовят основной 35,3%-ный (вес/объем) раствор анали-
тически чистого метризамида (фирмы Nyegaard and Со., Нор-
вегия) на дистиллированной воде. Стерилизуют фильтровани-
ем и хранят при 4 °C до трех месяцев.
2. Разводят основной раствор метризамида до 18% (но
объему), смешав 1,02 мл основного раствора, 0,94 мл PBS и
0,04 мл СПК. (Показатель преломления 1,3613.)
14* 211
ГЛАВА 6
3. Разливают 18%-ный раствор метризамида по 1 мл в две
пробирки размером 12x75 мм.
4. Осторожно наслаивают 1 мл среды, содержащей 107 кле-
ток.
5. Центрифугируют при 500 g в течение 15 мин.
6. Собирают живые клетки на границе раздела фаз и дваж-
ды отмывают полной средой (по 1 мл). Выход клеток превы-
шает 80%.
2.5. Приготовление клеток-мишеней для ЦТЛ
2.5.1. Получение клеток перитонеального экссудата,
индуцированного тиогликолятом (ТГ)
1. Готовят основной раствор 3%-ного (вес/объем) порошка
тиогликолятного бульона (фирма Difco Laboratories, Велико-
британия) на дистиллированной воде; разливают порциями,
стерилизуют автоклавированием и хранят при 4 °C.
2. Мышам внутрибрюшинно вводят по 1,5 мл ТГ, пользуясь
иглой № 23.
3. Животных умерщвляют через 3—5 дней (цервикальная
дислокация может вызвать кровоизлияние в брюшинную по-
лость).
4. Вводят внутрибрюшинно 5 мл PBS (иглой № 19) и шпри-
цем отсасывают жидкость. Повторяют эту операцию еще раз.
(Выход клеток составляет 0,5—1-107 от одной мыши.)
2.5.2. Получение В- или Т-лимфобластов
1. Готовят основной раствор конканавалина А (Кон A, Sig-
ma Chemical Со., США), содержащий 1 мг/мл PBSA или основ-
ной раствор липополисахарида (содержащий 1 мг/мл ЛПС,
Escherichia coli 055: B5W, Difco Labs, Великобритания). Стери-
лизуют раствор Кон А фильтрованием, а ЛПС — кипячением в
течение 30 мин.
2. Готовят суспензию, содержащую 106 клеток селезенки в
1 мл полной среды (разд. 2.2) и разливают по 10 мл в верти-
кально стоящие культуральные флаконы объемом 50 мл.
3. Для получения В-лимфобластов добавляют к культурам
ЛПС (до конечной концентрации 10 мкг/мл), а для образова-
ния Т-лимфобластов — Кон А (до конечной концентрации
2,5 мкг/мл).
4. Культивируют клетки в течение 48—72 ч. Выход клеток
должен составить 80—100% при содержании бластов свыше
50%.
212
КУЛЬТИВИРОВАНИЕ ЛИНИЙ И КЛОНОВ Т-КЛЕТОК in vitro
2.6. Облученные клетки селезенки
Облученная взвесь клеток сингенной селезенки служит наи-
более доступным источником значительного количества фидер-
ных клеток или АПК при повседневной работе с клонами и ли-
ниями Т-клеток.
1. Получают суспензию клеток селезенки (разд. 2.2) в PBS с
10% СПК и помещают в пластиковую центрифужную пробир-
ку объемом 10 мл.
2. Взвесь клеток во льду помещают в камеру источника гам-
ма-излучения с Со60 или рентгеновской установки и облучают в
дозе 1500—3000 рад. (Точную дозу, необходимую для подавле-
ния пролиферации лимфоцитов, следует установить для каж-
дого конкретного источника рентгеновского или ^-излучения.)
3. Отмывают клетки и ресуспендируют их в полной среде.
3. Продукция ИЛ-2
Для клонирования и размножения Т-клеток in vitro сущест-
вуют три основных источника ИЛ-2.
1. Надосадок стимулированных Кон А культур клеток кры-
синой селезенки (Кон А-надосадок).
2. Надосадок культур клеток мышиной тимомы EL4, стиму-
лированных форболмиристатацетатом (ФМА). (ЕЬ4-надоса-
док).
3. Аутокринный ИЛ-2 (Ауто-ИЛ-2), вырабатываемый ли-
ниями Т-хелперов при контакте с антигеном и АПК в течение
48 ч.
Для обычного поддержания клонов и линий ЦТЛ и Т-хелпе-
ров мы рекомендуем Кон А-надосадок, в то время как для из-
бирательной экспансии какого-либо из клонов ЦТЛ — ЕЬ4-над-
осадок. Ауто-ИЛ-2 предназначен для клонирования аутологич-
ных Т-хелперов.
3.1. Кон А-надосадок 1 2 3 *
1. Готовят суспензию клеток крысиной селезенки. Из каж-
дой селезенки можно получить 2—3-108 живых клеток.
2. Доведя концентрацию клеток до 2-Ю6 в 1 мл, культиви-
руют их в течение 48 ч в полной среде, содержащей 2,5 мкг/мл
Кон А, разлив взвесь по 250 мл в расположенные горизонталь-
но 500-миллилитровые флаконы.
3. Переносят культуры в пробирки на 50 мл и центрифуги-
руют при 400 g в течение 10 мин.
213
ГЛАВА 6
4. Надосадочную жидкость разливают равными порциями в
универсальные 20-мпллилитровые контейнеры, содержащие по
0,4 г а-метилманнозида (Sigma Chemical Со., США) и хранят
при —20°C (а-метилманнозид растворяют, нагревая до 37 °C).
5. Перед использованием стерилизуют фильтрованием.
6. В каждой серии надосадочной жидкости перед использо-
ванием определяют активность ИЛ-2.
3.2. Надосадок тимомы EL4
Тимома EL4 (Н-2Ь) [14] может быть получена из European
Collection of Animal Cell Cultures, Великобритания. Известен на-
дежный метод размножения клеток тимомы — взвесь размора-
живают, после отмывания внутрибрюшинно вводят мышам и
получают асцитный рост опухоли. В то же время частые пас-
сажи in vitro могут привести к отбору вариантов, не продуци-
рующих ИЛ-2.
1. Содержащиеся во флаконе 107 клеток тимомы EL4 быст-
ро размораживают при 37 °C. Отмывают один раз полной сре-
дой и один раз PBS.
2. Вводят внутрибрюшинно по 5-106 клеток двум мышам ли-
нии C57BL, используя иглу № 25.
3. Через 10—14 дн, когда у мышей заметно увеличится жи-
вот, асцитическую жидкость асептически извлекают из брю-
шинной полости. Сначала в нее через иглу № 19 вводят 5 мл
PBS, потом тем же шприцем отсасывают содержимое. Эту опе-
рацию повторяют дважды. От одной мыши получают примерно
5 -108 клеток тимомы.
4. Часть асцита на этой стадии замораживают про запас
(во флаконах по 1 • 107 клеток в RPMI 1640 с 20% СПК и 10%
диметилсульфоксида, ДМСО).
5. Готовят основной раствор ФМА (Sigma Chemical Со..
США). (Осторожно: это известный стимулятор опухолевого
роста, поэтому следует исключить его контакт с кожей.) Рас-
творяют в концентрации 1 мг/мл в ДМСО и хранят при —70 °C.
6. Клетки EL4 осаждают центрифугированием. Ресуспенди-
руют до концентрации 1-Ю6 клеток/мл в RPMI 1640 с 1% СПК
и 10 нг/мл ФМА. Инкубируют клеточную взвесь 48 ч при 37 °C,
разлив по 250 мл в расположенные горизонтально 500-миллн-
литровые флаконы.
7. Центрифугируют, собирают супернатант и стерилизуют
фильтрованием. Аликвоты хранят при —20 °C. Добавляют в
культуры 3—5% (по объему).
214
КУЛЬТИВИРОВАНИЕ ЛИНИЙ И КЛОНОВ Т-КЛЕТОК in vitro
3.3. Ауто-ИЛ-2
После культивирования в течение двух дней в присутствии
антигена линии Т-хелперов продуцируют большие количества
аутокринного ИЛ-2. Содержащие Ауто-ИЛ-2 надосадки куль-
тур рекомендуется использовать для обеспечения высокой эф-
фективности клонирования Т-хелперов.
1. Линии Т-хелперов (например, специфичных к овальбуми-
ну) выращивают в режиме чередования «стимуляция — покой —
стимуляция» (разд. 4.2) в культурах по 10 мл в 50-миллилит-
ровых флаконах в вертикальном положении.
2. «Стимулируют» Т-хелперы (2-Ю1 2 3 4 5 клеток/мл) овальбуми-
ном (100 мкг/мл) и АПК (2-106 клеток/мл) в течение двух дней.
3. Отсасывают из флаконов 50% культуральной среды (ауто-
ИЛ-2) и заменяют ее свежей порцией полной среды. Культи-
вируют еще два дня до стадии «покоя».
4. Разливают ауто-ИЛ-2 порциями и хранят при —20 °C.
Добавляют в культуры 5—20% (по объему) в зависимости от
содержания ИЛ-2.
4. Получение линий Т-хелперов
4.1. Примирование Т-хелперов in vivo растворимыми
белковыми антигенами [12]
1. Готовят эмульсию, смешивая равные объемы (1—2 мл)
полного адъюванта Фрейнда (Difco Labs, Великобритания) и
выбранного белкового антигена (например, овальбумина, Sig-
ma Chemical Со., США), растворенного в PBS в концентрации
4 мг/мл.
2. С помощью иглы для взятия крови приготовленную смесь
набирают в шприц на 1 мл; заменяют эту иглу на инъекцион-
ную (№ 27).
3. Вводят мышам подкожно в основание хвоста по 50 мкл
эмульсии. Эта процедура требует некоторого навыка: удобнее
всего посадить мышь на проволочную крышку клетки и тянуть
ее за кончик хвоста во время инъекции. Из инъекционного от-
верстия в коже обратно вытекает некоторое количество эмуль-
сии.
4. Через 8—9 дней (время — решающий фактор) мышей
умерщвляют цервикальной дислокацией и асептически извлека-
ют паховые и периаортальные лимфатические узлы.
5. Помещают их в чашку Петри с охлажденной средой
RPMI 1640. Тщательно удаляют жировую ткань. (Увеличенные
размеры лимфатических узлов свидетельствуют об удачном
примировании.)
215
ГЛАВА 6
4.2. Инициация и поддержание линий Т-хелперов
1. Готовят суспензию клеток лимфатических узлов в полной
среде, доводят их концентрацию до 4- 10б клеток в 1 мл и раз-
ливают по 20 мл в 50-миллилитровые флаконы для культивиро-
вания, расположенные вертикально.
2. Добавляют по 1 мл основного раствора антигена, напри-
мер овальбумина (2 мг/мл в PBS), и культивируют в течение
четырех дней.
3. Клетки собирают, определяют процент жизнеспособных и
ресуспендируют в полной среде (2-105 клеток/мл). Клеточную
суспензию разливают по 20 мл в 50-миллилитровые флаконы
для культивирования, находящиеся в вертикальном положе-
нии.
4. Получают АПК (разд. 2.6) и добавляют их во флаконы
до конечной концентрации 2-Ю6 клеток/мл.
5. Инкубируют в течение четырех дней. Клетки собирают и
определяют их жизнеспособность.
6. Рекультивируют Т-хелперы (2-105 клеток/мл) в течение
6—8 сут в присутствии АПК (2- 10е клеток/мл) без антигена
Это— период покоя.
7. После этого ведут линии Т-хелперов в режиме: «стимуля-
ция» (3—4 сут в присутствии антигена и АПК), «покой» (6—
8 сут в присутствии только АПК), «стимуляция».
8. Замораживают часть клеток через три дня после второй
стимуляции антигеном.
9. Через 8 дней «покоя» определяют пролиферативную ак-
тивность Т-хелперов или выработку в культуре ИЛ-2 (разд. 8).
10. Клонируют Т-хелперы через 3 дня после третьей (или
последующей) антигенной стимуляции.
5. Получение линий цитотоксических
Т-лимфоцитов
5.1. Получение примированных ЦТЛ
Существуют два разных подхода для получения примиро-
ванных ЦТЛ. Во-первых, можно провести примирование антиге-
ном in vivo. Для этого мышей иммунизируют нормальными ал-
логенными или опухолевыми клетками (107 клеток внутривен-
но или внутрибрюшинно) либо заражают живым вирусом, на-
пример вирусом гриппа [13]. Для успешного примирования
слабыми иммуногенами, например трансплантационным HY ан-
тигеном самцов, необходима их гаптенизация [15]. Через 1—
6 мес после иммунизации у мышей извлекают селезенки, содер-
216
КУЛЬТИВИРОВАНИИ ЛИНИЙ И КЛОНОВ Т-КЛЕТОК in vitro
Таблица 6.2. Типы клеток, обычно используемые как стимуляторы ЦТЛ
Тип клеток Источник Использование для сти- муляции
Спленоциты Нормальная мышь Массовых культур Линий Клонов
Индуцированные тногли- колятом клетки перито- неального экссудата Нормальная мышь Массовых культур
В- или Т-лнмфобласты Спленоциты, культивиро- ванные с ЛПС лнбо с Кон А (разд. 2.5.2) Массовых культур Линий
жащне ЦТЛ памяти. Эти клетки памяти необходимо повторно
стимулировать антигеном in vitro в массовых культурах.
Во-вторых, ЦТЛ, примированные в отношении антигенов
МНС можно получить in vitro. Для этого неиммунные сплено-
циты культивируют либо с аллогенными клетками селезенки,
либо с модифицированными гаптеном сингенными спленоцита-
ми [16].
5.2. Инициация линий цитотоксических Т-лимфоцитов
1. Готовят стерильную суспензию отвечающих клеток селе-
зенки (разд. 2.2) в стерильных условиях.
2. Доводят концентрацию отвечающих клеток до 1—2-Ю6
клеток в 1 мл. Разливают суспензию по 40 мл в 250-милл.илит-
ровые флаконы для культивирования, расположенные верти-
кально.
3. Получают облученные стимулирующие клетки, например
интактные аллогенные либо инфицированные вирусом или мо-
дифицированные гаптеном сингенные клетки (разд. 2.6). Для
этого обычно берут спленоциты, но можно использовать и дру-
гие типы клеток (табл. 6.2).
4. Добавляют стимулирующие клетки в культуры отвечаю-
щих клеток (в соотношении 1 : 5 или 1:10).
5. Инкубируют в течение 5 дн при 37 °C, а затем определяют
цитотоксическую активность отвечающих клеток в отношении
соответствующих клеток-мишеней (разд. 9).
6. После 10—12-дневной стимуляции in vitro отвечающие
клетки собирают. Выход обычно составляет 30—60% от исход-
ного количества отвечающих клеток.
7. Ресуспендируют живые клетки в полной среде (1—2-10‘!
жизнеспособных клеток в 1 мл).
217
ГЛАВА 6
8. Повторяют цикл стимуляции (в течение 10—12 дн с об-
лученными стимулирующими клетками) дважды.
9. На этой стадии жизнеспособность клеток снижается (ме-
нее 10%), и погибшие клетки желательно удалять (разд. 2.4).
10. Рестимулируют полученную линию ЦТЛ каждые 10—
12 дн. После четвертой стимуляции в культуры для поддержа-
ния роста добавляют ИЛ-2. Кроме того, можно увеличить коли-
чество стимулирующих клеток, сделав его равным количеству
отвечающих, а затем в 5—10 раз большим.
6. Клонирование Т-клеток
Условия клонирования и размножения Т-хелперов и ЦТЛ
идентичны: оптимальный срок — третьи пли четвертые сутки
после третьего или последующих циклов антигенной стимуля-
ции. Эффективность более раннего клонирования бывает пре-
дельно низкой, хотя оно и дает клоны с более широким репер-
туаром специфичностей [9J. Эффективность клонирования раз-
ных Т-клеточных линий сильно варьирует. Для полной уверен-
ности в моноклональном происхождении линии необходимо про-
вести по меньшей мере одно реклонирование, засевая из рас-
чета по 0,3 клетки на лунку.
6.1. Клонирование методом лимитирующих разведений
1. Готовят суспензию облученных клеток селезенки (3000 рад;
4—6-101 2 3 4 5 6 клеток/мл) в полной среде, содержащей 20% ИЛ-2,
Кон А-надосадок или ауто-ИЛ-2 и (для клонирования Т-хелпе-
ров) растворимый антиген (200 мкг/мл).
2. Разливают по 100 мкл в лунки плоскодонных 96-луночных
панелей для микротитрования. Следует использовать не менее
четырех микропанелей.
3. Определяют концентрацию клеток клонируемой линии.
Готовят серию из четырех последовательных разведений исход-
ной взвеси клеток в полной среде с добавлением 20% ИЛ-2
(например, 10, 50, 150, 500 клеток в 1 мл).
4. Каждое из разведений клеточной взвеси клонируемой ли-
нии вносят в одну целую микропанель с питающими клетками
по 100 мкл в лунку для того, чтобы в некоторых лунках оказа-
лось наименьшее число клеток, способных к росту.
5. На седьмые сутки во все лунки всех микропанелей добав-
ляют по 25 мкл неразбавленного источника ИЛ-2.
6. На 10—12-е сутки микроскопируют все микропанели для
выявления лунок, содержащих растущие клетки.
218
КУЛЬТИВИРОВАНИЕ ЛИНИЙ И КЛОНОВ Т-КЛЕТОК in vitro
Рис. 6.1. Типичные клоны Т-клеток иа 14-й день после клонирования. В отли-
чие от погибших питающих клеток, Т-клетки выглядят крупнее п светлее.
(Х250).
При отсутствии опыта часто бывает трудно идентифициро-
вать клоны Т-клеток среди большого количества питающих кле-
ток, устилающих дно лунки. Лучше всего просматривать лунки,
пользуясь фазовоконтрастным инвертированным микроскопом с
объективом 25X, постоянно наводя микровинтом на резкость.
Клонированные клетки обычно рассеяны по дну лунки (в слу-
чае Т-хелперов) или заполняют углы, образованные дном и ци-
линдрической стенкой лунки (вслучае ЦТЛ). Они отличаются от
питающих клеток более крупными размерами, иногда непра-
вильной формой и выглядят светлыми при фазовоконтрастной
микроскопии (рис. 6.1).
Если допустить, что количество засеянных в отдельные лун-
ки способных к росту клеток имеет пуассоновское распределе-
ние, то для получения изолированных клонов необходимо, что-
бы на всей микропанели было меньше 12 лунок с клеточным
ростом.
6.2. Размножение клонированных клеток
На данном этапе из панелей с наименьшим числом позитив-
ных лунок (менее 10 из 96) отбирают то количество клонов (не
более 30), которое можно вести одновременно.
219
ГЛАЗА 6
1. Готовят взвесь АПК (облученных 3000 рад в концентра-
ции 2—3-106 клеток/мл) в полной среде, содержащей 20% ИЛ-2
и (для клонов Т-хелперов) растворимый антиген (100 мкг/мл).
2. Разливают по 1,5 мл на лунку в 24-луночные панели «Кос-
тар» (фирмы Northumbria Biologicals Ltd, Великобритания).
3. В подготовленные лунки переносят растущие клоны.
4. Через 5—6 дн добавляют по 0,5 мл 20%-ного ИЛ-2.
5. Еще через 8—12 дн клетки образуют монослой. Вновь
стимулируют их антигеном в присутствии АПК и переносят ли-
бо в три лунки панели «Костар», либо по 10 мл взвеси в 50-мил-
лилитровые флаконы для культивирования, расположенные вер-
тикально, при том же соотношении Т-клеток и АПК.
6. Далее частота рассева и стимуляции размножаемых кло-
нов зависят от скорости их роста.
7. При пересеве во флаконы клоны Т-хелперов возвращают
в режим «стимуляция — покой — стимуляция», применявшийся
к исходной линии (разд. 4.2), и добавляют ИЛ-2 только в ста-
дии «покоя».
8. Как можно раньше определяют цитотоксическую актив-
ность или способность к пролиферативному ответу на антиген
у всех полученных клонов и образцы клеточных взвесей закла-
дывают на хранение в жидкий азот (лучше всего через 3—4 дн
после антигенной стимуляции).
9. Клоны ЦТЛ выращивают в присутствии ИЛ-2; при обиль-
ном росте клеток содержание ИЛ-2 снижают от 20 до 10%.
7. Селекция Т-хелперов путем
самоустранения клонов посторонней
специфичности
Линии Т-хелперов, полученные в ответ на примирование та-
кими сложными антигенными комплексами, как вирусы или па-
разиты, состоят из множества клонов, специфичных к спектру
антигенных белков. В связи с этим может возникнуть необходи-
мость в отборе клонов более узкой специфичности. Допустим,
исходным иммуногеном служил вирус, несущий антигены а, Ь, с
и имеющий минимальное количество перекрестно-реагирующих
детерминант с близкородственным вирусом, несущим антигены
а, Ь, х. Описанное здесь избирательное самоустранение [17]
обеспечивает положительный отбор клонов, специфичных в от-
ношении антигена с. Дело в том, что при отсутствии антигена
более 6 сут Т-хелперы задерживаются в Gi/G0 фазе клеточного
цикла. Однако данный подход неприменим для селекции кло-
нов ЦТЛ, поскольку эти клетки независимо от антигена по-
стоянно находятся в пролиферативном цикле, если в культуре
имеется ИЛ-2.
220
КУЛЬТИВИРОВАНИЕ ЛИНИЙ И КЛОНОВ Т-КЛЕТОК in vitro
Таблица 6.3. Избирательное самоустранение активированных клонов
бромдезоксиуридииом
1. Стимуляция клонов антигенами а, Ъ и с в присутствии АПК в течение
трех дней.
2. Период «покоя» в присутствии только АПК в течение 8 дней.
3. Перекрестная стимуляция антигенами а, b и х в присутствии АПК в тече-
ние 2 дней.
4. Самоустранение пролиферирующих клеток бромдезоксиуридином в течение
одного дня.
5. Воздействие ультрафиолетовым светом.
6. Повторный цикл: пп. 1—5
7. Клонирование.
В присутствии АПК Т-хелперы сохраняют жизнеспособность
в течение 8—12 дн культивирования без антигена. За это вре-
мя они из пролиферирующих лимфобластов превращаются в по-
коящиеся малые лимфоциты. Если в этот момент культуры рес-
тимулировать гетерологичным иммуногеном, несущим антиге-
ны а, b и х, то клоны Т-хелперов к антигенам а и Ь, вступят в
пролиферативный цикл и могут быть устранены специфичным
для S-фазы цитотоксическим препаратом. Применение для этой
цели бромдезоксиуридина описано в табл. 6.3.
1 и 2. Линию Т-хелперов вначале поддерживают в режиме
«стимуляция — покой» (разд. 4.2).
3. Затем ее рестимулируют гетерологичным антигеном в за-
ранее подобранной оптимальной для пролиферативного ответа
концентрации (разд. 8.1).
4. Через два дня добавляют бромдезоксиуридин (15 мкг/мл,
Sigma Chemical Со., США).
5. Через день собирают клетки, дважды отмывают полной
средой и ресуспендируют в 5 мл PBS. Клеточную взвесь пере-
ливают в чашку Петри и в течение 10 мин экспонируют под
ультрафиолетовым светом (365 нм) на расстоянии 8 см от
источника. Нельзя облучать ультрафиолетом клетки, суспен-
дированные в среде, так как в ней образуются токсичные сво-
бодные радикалы. Клетки отмывают и рекультивируют соглас-
но п. 1.
6. Повторяют стадии 1—4.
7. Клонируют.
8. Анализ Т-хелперов
Функциональную активность Т-хелперов определяют по про-
дукции ИЛ-2 (48 ч) или по пролиферации клеток (72 ч) после
рестимуляции антигеном и АПК. При этом исследуемые линии
или клоны Т-хелперов должны культивироваться без антигена
221
ГЛАВА 6
по крайней мере 6—8 сут до рестимуляции, иначе в контроль-
ных культурах возможны высокие «фоновые» показатели вклю-
чения метки.
8.1. Оценка пролиферативного ответа
1. Получают взвесь АПК (облученных 3000 рад) в полной
среде при концентрации клеток 4-10® в 1 мл.
2. Дважды отмывают Т-хелперы средой, чтобы удалить оста-
ток антигена или ИЛ-2. Ресуспендируют их (4-10s клеток/мл)
в суспензии АПК.
3. Разливают смесь клеток по 100 мкл в лунки 96-луночной
плоскодонной микропанели.
4. Готовят ряд разведений (от 1 до 300 мкг/мл) антигена в
полной среде из замороженного концентрата (10 мг/мл на фи-
зиологическом растворе). По 100 мкл из каждого разведения
антигена вносят не менее чем в три лунки. Культивируют при
37 °C.
5. Через 72 ч в лунки добавляют по 25 мкл метил-3Н-тими-
дина (20 мкКи/мл; уд. активность 5 Ки/ммоль, Amersham In-
ternational pic, Великобритания).
6. Через 6—8 ч клетки переносят на фильтры из стеклово-
локнистой бумаги (FG/A; Whatman Ltd, Великобритания), поль-
зуясь многоканальной пипеткой или автоматическим сборщиком
клеток.
7. Отмывают диски дистиллированной водой и высушивают.
8. Диски переносят во флаконы, содержащие сцинтилляци-
онную жидкость для неводных образцов и определяют радио-
активность.
9. Результаты выражают в виде средних арифметических ве-
личин радиоактивности (имп/мин) для параллельных культур
или в виде индекса стимуляции, т. е. величины включения мет-
ки (имп/мин) в культурах, получивших антиген и АПК, делен-
ной на величину включения метки в культурах, в которые до-
бавили только АПК. Типичная кривая зависимости включения
метки от концентрации антигена показана на рис. 6.2.
8.2. Определение ИЛ-2
1. Культивируют клетки в соответствии с пп. 1—4 разд. 8.1.
2. После культивирования в течение 48 ч из каждой лунки
многоканальной пипеткой отсасывают по 100 мкл надосадка и
переносят в пустую микропанель.
3. Готовят последовательные разведения надосадков (по
три параллельных серии) и определяют их способность поддер-
222
КУЛЬТИВИРОВАНИЕ ЛИНИИ И КЛОНОВ Т-КЛЕТОК in vitro
живать рост бластов, стимулированных Кон А или ИЛ-2-зави-
симой линии клеток CTLL, как описано в гл. 10.
9. Определение цитотоксической активности
Цитотоксическая активность клеток оценивается по осво-
бождению хромата натрия из меченных 51Сг клеток-мишеней.
Наилучшие мишени для ЦТЛ — это, по-видимому, линии опу-
холевых клеток; наиболее часто используют клетки мышиных
опухолей Р815 (H-2d), EL4 (Н-2Ь) и BW 5147 (Н-2к). Их мож-
но получить из European Collection of Animal Cell Cultures, Ве-
ликобритания. Для анализа рестрикции по МНС (разд. 11)
Аг АПК
Концентрация антигена, мкг/мл
Рис. 6.2. Включение 3Н-тимидина клетками специфичного к вирусу гриппа’
(Х31) клона Т-хелперов: кривая зависимости «доза — эффект». Точки на кри-
вой соответствуют радиоактивности (имп/мин) метки, включенной 2-104
Т-клетками, культивируемыми при разных концентрациях очищенного вируса
гриппа Х31 в присутствии АПК. Контрольные культуры, содержащие АПК
без антигена, антиген (Аг) без АПК или только среду, дают фоновое вклю-
чение. АПК — антигенпрезентирующие клетки.
нужны клетки-мишени, принадлежащие мышам рекомбинант-
ных линий; это могут быть, например, индуцированные тиогли-
колятом клетки перитонеального экссудата (разд. 2.5.1) либо
В- или Т-лимфобласты (разд. 2.5.2). Как правило, цитотоксиче-
скую активность массовых культур определяют через 4—6 дн,
а линий и клонов через 3—8 дн после добавления стимулирую-
щих клеток. На рис. 6.3 приведен типичный пример анализа ли-
тической активности клона ЦТЛ, специфичного к вирусу грип-
па. Показан лизис совместимых по МНС зараженных вирусом
223
ГЛАВА 6
гриппа клеток-мишеней при низком фоновом уровне лизиса не-
зараженных совместимых и зараженных несовместимых клеток-
мишеней.
9.1. Подготовка ЦТЛ
1. Центрифугируют взвесь ЦТЛ (5 мин, 200 g). Ресуспенди-
руют в 2 мл полной среды и определяют концентрацию клеток.
2. Разводят взвесь ЦТЛ полной средой до концентрации 1 •
• 103 * * 6 кл/мл (если это клон или линия) либо до 2—4-Ю6 (если
это массовая культура).
60 -]
50-
40-
30-
20-
10-
Рис. 6.3. Анализ литической активности клона специфичных к вирусу гриппа
ЦТЛ в отношении меченных 51Сг клеток-мишеней. Данный клон ЦТЛ был по-
лучен из суспензии спленоцитов мышей BALB/c, примироваииых интраназаль-
но вирусом гриппа типа А (А/Х31). В качестве стимулирующих клеток были
использованы зараженные А/Х31 и облученные спленоциты мышей BALB/c
(контакт ЦТЛ с клетками-мишенями продолжался в течение 6 ч). Определяли
освобождение slCr из следующих мишеней: клетки Р815 (H-2d), инфицирован-
ные А/Х31 (темные квадратики); индуцированные тиогликолятом клетки пе-
ритонеального экссудата мышей BALB/c (H-2d), инфицированные А/Х31 (тем-
ные кружки); клетки EL4 (Н-2Ь), инфицированные А/Х31 (светлые кружки);
неинфицироваиные клетки Р815 в качестве контроля (светлые квадратики).
Спонтанное освобождение slCr колебалось в пределах от 12,2 до 15,4%. К/М —
соотношение киллеры/мишеии, т. е. ЦТЛ и клетки-мишеии.
3. Готовят двукратные разведения ЦТЛ в полной среде. Чис-
ло ЦТЛ в отдельных лунках микропанели должно, таким обра-
зом снижаться при постоянном содержании клеток-мишеней,
чтобы получился ряд убывающих отношений киллеры/мишени
(К/М). Можно развести взвесь ЦТЛ в пробирках, а затем из
каждой пробирки перенести по 100 мкл в две-три лунки 96-лу-
224
КУЛЬТИВИРОВАНИЕ ЛИНИН И КЛОНОВ Т КЛЕТОК in vitro
ночной плоскодонной микропанели, либо приготовить разведе-
ния непосредственно в лунках микропанели многоканальной пи-
петкой.
4. Инкубируют культуры при 37 °C.
9.2. Приготовление и маркирование клеток-мишеней 51Сг
1. Центрифугируют взвесь, содержащую 5-106 клеток-мише-
ней (5 мин, 200 g), и ресуспендируют в 0,2—0,3 мл полной сре-
ды. (Малый объем весьма существен для эффективного мече-
ния с помощью 51Сг.) При маркировании стимулированных
тиогликолятом клеток перитонеального экссудата необходимо
брать 1 • 107 клеток, поскольку часть их может быть потеряна в
результате адгезии к пластику при 37 °C.
2. На 5-Ю6 клеток добавляют 50 мкКи 5,Сг (уд. активность
350—600 мкКи/мг хрома, Amersham International pic, Велико-
британия). Инкубируют 60 мин при 37 °C.
3. Добавляют 10 мл PBS, центрифугируют (5 мин, 200 g)
и сливают надосадок в контейнер для радиоактивных отходов.
Отмывание повторяют дважды.
4. Осадок клеток ресуспендируют в 0,5 мл полной среды и
определяют их жизнеспособность.
5. Ресуспендируют клетки до концентрации 2-10s в 1 мл и
сразу же разливают по 100 мкл взвеси на лунку в панель с при-
готовленными ЦТЛ.
6. Кроме того, клетки-мишени помещают в 8 лунок без ЦТЛ.
Четыре из них содержат по 100 мкл полной среды и служат
для оценки спонтанного освобождения 51Сг из клеток-мишеней.
Еще четыре лунки содержат по 100 мкл 2,5%-ного (по объему)
Тритона X—100, и предназначены для определения максималь-
ного освобождения 51Сг из клеток-мишеней.
7. Центрифугируют микропанель при 150 g в течение 1 мин,
пользуясь специальным держателем. Такое осторожное осаж-
дение клеток облегчает взаимодействие ЦТЛ с мишенями.
8. Инкубируют панели при 37 °C в течение 4—5 ч.
9.3. Оценка активности ЦТЛ
1. Центрифугируют микропанель при 250 g в течение 5 мин.
2. С помощью многоканальной пипетки сразу же извлекают
из лунок по 100 мкл надосадка, стараясь не нарушить слой кле-
ток. Переносят надосадки в пробирки LP2 (Luckham Ltd., Вели-
кобритания).
3. Определяют радиоактивность каждого надосадка с по-
мощью сцинтилляционного счетчика гамма-излучения.
15—172
225
ГЛАВА 6
4. Рассчитывают процент метки, освобожденной из клеток-
мишеней в результате активности ЦТЛ, по формуле:
(Освобождение 51Сг в присутствии ЦТЛ (имп/мин) — \
- Спонтанное освобождение 51Сг (имп/мин) | X 100
Полное освобождение 51Сг (имп/мин) — I
— Спонтанное освобождение 5,Сг (имп/мин) /
5. Для успешного проведения эксперимента необходимо, что-
бы спонтанное освобождение хрома из клеток-мншеней состав-
ляло менее 20% от полного.
9.4. Примечание
При оценке активности ЦТЛ, специфичных к вирусным анти-
генам, необходимо предусмотреть дополнительный этап зараже-
ния клеток-мншеней вирусом (инкубация в течение ночи), пос-
ле чего клетки метят 51Сг по вышеописанной методике. Можно
иначе: инфицировать клетки вирусом (например, вирусом грип-
па) на этапе маркирования 51Сг при использовании среды
RPMI 1640 без добавления сыворотки [13J.
10. Определение поверхностных антигенов
Т-клеток методом непрямого
розеткообразования
Как правило, рестриктированные по антигенам МНС клас-
са I ЦТЛ имеют фенотип L3T4", Lyt2+, тогда как рестриктиро-
ванные по антигенам МНС класса II Т-хелперы — фенотип
L3T4+, Lyt2 (табл. 6.1), хотя при активации Т-клеток in vivo
могут наблюдаться исключения из этого правила. При отсутст-
вии клеточного сортера типа FACS для фенотнпирования по по-
верхностным антигенам вполне пригоден требующий небольшо-
го количества клеток метод непрямого розеткообразования
[18].
Клоны Т-клеток следует фенотипировать не раньше, чем
пройдет 6 дн после последней стимуляции, чтобы в культуре
полностью погибли питающие клетки. Погибшие клетки удаля-
ют центрифугированием в градиенте плотности метризамида
(разд. 2.4).
Используют следующие реагенты:
1. Моноклональные антитела (МКА) к L3T4 или Lyt2 (Se-
ra Labs Ltd., Великобритания);
2. Антисыворотка барана или козы к иммуноглобулинам мы-
ши (гам'маглобулиновая фракция, Serotec Ltd., Великобритания,
или Nordic Laboratories, Финляндия);
226
КУЛЬТИВИРОВАНИЕ ЛИНИИ И КЛОНОВ Т-КЛЕТОК in vitro
3. Бычьи эритроциты (БЭ, Tissue Culture Services Ltd., Ве-
ликобритания).
10.1 . Присоединение антиглобулиновых антител
к бычьим эритроцитам
1. Трижды отмывают БЭ (хранящиеся в растворе Олсвера
до четырех нед) 0,85%-ным раствором NaCl.
2. Переносят 100 мкл суспензии БЭ в 5-миллилитровую стек-
лянную пробирку Бижу, содержащую 50 мкл гаммаглобу-
линовой фракции антисыворотки к иммуноглобулинам мыши
(5 мг/мл), предварительно диализованных против 0,85%-ного
раствора NaCl.
3. Поместив пробирку на смеситель «Вортекс», добавляют
по каплям 500 мкл раствора хлорного хрома (0,1 мг/мл), ко-
торый готовят непосредственно перед употреблением, разбав-
ляя основной раствор (1 мг/мл) 0,85%-ным раствором NaCl.
Применяют только «созревший» основной раствор хлорного
хрома. Его созревание продолжается свыше одного, но менее
12 мес при периодическом подведении pH до 5 с помощью 1 М
NaOH (см. также гл. 2).
4. На взвесь эритроцитов наслаивают 1 мл 0,85%-го раство-
ра NaCl и оставляют на ночь при 4 °C.
5. Трижды отмывают БЭ PBS и ресуспендируют в полной
среде до 5%-ной (по объему) концентрации.
10.2 . Связывание МКА с Т-клетками
1. Равные порции суспензии, содержащие по 1—2-Ю5 Т-кле-
ток, разливают в пластиковые центрифужные пробирки (LP3,
Luckham Ltd., Великобритания) и центрифугируют 5 мин при
200 g.
2. Ресуспендируют осадок клеток в 100 мкл МКА
(100 нг/мл) и инкубируют на льду в течение 30 мин.
3. Дважды отмывают клетки RPMI 1640 (по 2 мл).
10.3 . Образование и подсчет розеток
1. К Т-клеткам, обработанным МКА. добавляют 50 мкл
5%-ной суспензии БЭ, нагруженных антителами к иммуногло-
булинам мыши.
2. Центрифугируют 1 мин при 200 g и на 30 мин помещают
на лед.
3. После добавления 50 мкл раствора AO/БЭТ (разд. 2.3.1)
клетки осторожно ресуспендируют.
15* 227
ГЛАВА 6
Таблица 6.4. Анализ МНС-рестрикции четырех клонов Т-клеток
Линия мы- Аллели районов и локусов Реакция клона
шей — доно- ров АПК или
клегок-ми- июней к ла ЛГ> Е₽ D 1 2 3 4
СВА к к к к к к
B10.AQR q к к к к d — +
B10.A(4R) к к к к b b 1 - — — —
B10.A(5R) ь b b b к d .— — — ---
BALB/c d d d d d d — — н-
4. Под флуоресцентным микроскопом подсчитывают про-
центное содержание живых клеток (зеленых), образовавших ро-
зетки (т е. присоединивших четырех или более БЭ на каждый
лимфоцит).
11. Анализ МНС-рестрикции
Как правило, Т-хелперы распознают чужеродный антиген
только в комплексе с молекулами МНС класса II (у мышей это
продукты генов, расположенных в I—А- или I—Е-субрайонах),
тогда как ЦТЛ рестриктированы по продуктам МНС класса I
(К- или D-районов). Анализ рестрикции Т-хелперов проводят в
пролиферативной реакции (разд. 8.1), а ЦТЛ — в цитотоксиче-
ской (разд. 9) с использованием соответственно АПК или кле-
ток-мишеней от сингенных, аллогенных либо рекомбинантных ли-
ний мышей [19J. Положительная реакция будет происходить
только в присутствии АПК или клеток-мишеней, обладающих
соответствующим элементом рестрикции. В табл. 6.4 приведены
результаты анализа четырех клонов, которые рестриктированы
по аллелям субрайонов I-Ak и I-Ek, а также районов Kd и Dd.
12. Примечание, сделанное в корректуре
Проведенные недавно исследования показывают, что в зави-
симости от выделяемых после стимуляции лимфокинов клоны
Т-хелперов можно разделить на две популяции [20]. Т-хелпе-
ры 1 продуцируют ИЛ-2, ИЛ-3 и ^-интерферон, в то время как
Т-хелперы 2 секретируют ИЛ-3 и ИЛ-4 (фактор стимуляции
В-клеток I, см. гл. 10). Пролиферацию обычно используемых
«ИЛ-2-зависимых» линий клеток НТ2 и CTLL2 вызывают два
лимфокина — ИЛ-2 и ИЛ-4 [20—22]. Следовательно, и ту и
другую линию можно использовать для оценки активации обе-
228
КУЛЬТИВИРОВАНИЕ ЛИНИЙ И КЛОНОВ Т-КЛЕТОК in vitro
их субпопуляций Т-хелперов. Кроме того, в настоящее время в
ряде лабораторий уже получены линии клеток, избирательно
отвечающих либо на ИЛ-2 либо на ИЛ-4 [22].
Литература
1. Fathman G., Fitch F. IT. (1982). Isolation, Characterization and Utilization
of T Lymphocyte Clones, Academic Press, New York.
2. Arden B„ Klotz J. L_, Siu G., Hood L. E. (1985). Nature, 316, 783.
3. Fink P. J., Matis L. A., McElligott D. L., Bookman M., Hedrick S. AL (1986).
Nature, 321, 219.
4. Schwartz R. H. (1984). Annu. Rev. Immunol., 3, 237.
5. Hansburg D., Fairwell T., Schwartz R. H., Appela E. (1983). J. Immunol.,
131, 319.
6. Berkower Matis L. A., Buckenmeyer G. K., Gurd F. R. N., Longo D. L.,
Berzofsky J. A. (1984). J. Immunol., 132, 1370.
7. Manca F., Clarke J. A., Miller A., Sercarz E. E., Shastri E. (1984). J. Immu-
nol., 133, 2075.
8. Townsend A. R, AL, Gotch F. M„ Davey J. (1985). Cell, 42, 457.
9. Mills К. H. G., Skehel J. J., Thomas D. B. (1986). J. Exp. Med., 163, 1477.
10. Morgan D. A., Ruscetti F. W., Gallo R. (1976). Science, 193, 1007.
11. Smith K. A. (1989). Immunol. Rev., 51, 339.
12. Corradin G., Etlinger H. M., Chiller J. M. (1979). J. Immunol., 119, 1048.
13. Townsend A. R. M., Taylor P. A4., Melief C. J. M., Askonas B. A. (1983).
Immunogenetics, 17, 543.
14. Farrar J. J., Fuller-Farrar J., Simon P. L., Hifiker AL L., Stadler В. M.,
Farrar W. L. (1980). J. Immunol., 125, 2555.
15. Von Boehmer H., Haas W. (1985). In: Immunological Methods III, Lefko-
vitz I. and Pernis B. (eds.), Academic Press, New York, p. 245.
16. Shearer G. AL (1974). Eur. J. Immunol., 4, 527.
17. Thomas D. B., Skehel J. J., Mills К- H. G„ Graham С. M. (1986). Eur. J.
Immunol., 16, 789.
18. Mills К. H. G. (1986). In: Methods in Enzymology, Langone J. J. and Van
Vunakis H. (eds.), Academic Press, New York, Vol. 121, p. 726.
19. Klein J., Fiueroa F., David C. S. (1983). Immunogenetics, 17, 553.
20. Mosmann T. R., Clerwinski H., Bond M. W., Giedlin M. A., Coffman R. L.
(1986). J. Immunol., 136, 2348.
21. Lichtman A. H„ Kurt-Jones E. A., Abbas A. K. (1987) Proc Natl Acad
Sci. USA, 84, 824.
22. Muller W„ Vandenabeele P. (1987). Eur. J. Immunol., 17, 579.
Глава 7
ПОЛУЧЕНИЕ ЛИНИЙ ЛИМФОБЛАСТОИДНЫХ
В-КЛЕТОК ЧЕЛОВЕКА С ПОМОЩЬЮ ВИРУСА
ЭПШТЕЙНА —БАРР
Э. Уоллз и Д. Крофорд
1. Введение
1.1. Вирус Эпштейна — Барр
Вирус Эпштейна — Барр (ВЭБ) представляет собой В-лим-
фотропный герпесвирус человека, этиологически связанный с
инфекционным мононуклеозом [1] и двумя опухолями—-афри-
канской лимфомой Беркитта [2] и анапластической карцино-
мой носоглотки [3J.
Первичная инфекция ВЭБ может вызвать острый инфекци-
онный мононуклеоз у подростков и взрослых, но в детском воз-
расте обычно протекает бессимптомно. Большая часть населе-
ния земного шара (до 90%) содержит в сыворотке крови анти-
тела к ВЭБ [1]. Однако этот вирус после первичного инфици-
рования не исчезает из организма и может быть выделен в
биологически активной форме из слюны и смывов глотки от
серопозитивных индивидуумов. Репликация ВЭБ происходит в
эпителиальных клетках, выстилающих глотку, и небольшое ко-
личество инфицированных вирусом В-лимфоцитов циркулирует
в крови. При таком бессимптомном вирусоносительстве между
уровнем инфекции и контролирующими ее механизмами имму-
нитета как клеточного, так п гуморального поддерживается ба-
ланс.
В условиях in vitro ВЭБ может вызывать иммортализацию
В-лимфоцитов, что приводит к возникновению долгоживущих
линий, клетки которых содержат вирусный геном и экспрессиру-
ют продукты определенных вирусных генов, например ядерные
антигены [4, 5J. Инфицирование В-лимфоцитов ВЭБ может вы-
звать их поликлональную активацию, которая выражается про-
лиферацией нли продукцией иммуноглобулинов [6]. Поликло-
нальная активация и иммортализация В-лимфоцитов — Т-неза-
висимые процессы.
1.2. Линии лимфобластоидных В-клеток
Линии лимфобластоидных В-клеток (ЛЛВК), полученные
спонтанно или путем заражения лимфоцитов нормальных тка-
ней или крови, по своему происхождению обычно поликлональ-
230
ЛИНИИ ЛИМФОБЛЛСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
ны и ассоциированы с ВЭБ. Эти клетки имеют характерную
форму ручного зеркальца и часто растут в виде скоплений
(рис. 7.1, а). Как правило, они имеют диплоидный набор: хро-
мосом, а в их цитоплазме содержится много свободных поли-
рибосом при слабой выраженности шероховатого эндоплазма-
тического ретикулума и аппарата Гольджи. На В-клеткаХ| лим-
фобластоидных линий экспрессируются некоторые нормальные
В-клеточные маркеры, в том числе HLA класса I и класса II,
CD19, CD20 и поверхностные иммуноглобулины при наличии
или отсутствии цитоплазматических, а также секретируемых.
На ЛЛВК выявляются антигены, характерные для активиро-
ванных лимфоцитов (не только В-клеток), такие, как CD23
(BLAST-2), РСА-1, рецептор к ИЛ-2, аналогичный рецептору
на Т-клетках, и рецептор к трансферрину [7J. Из антигенов,
кодируемых геномом ВЭБ, на ЛЛВК экспрессируются латент-
ный мембранный белок и ядерные антигены ВЭБ; при литиче-
ской инфекции экспрессируются только ранний антиген и белки
оболочки вируса. В стандартных условиях культивирования ли-
тической инфекции подвергается не более 5% иммортализован-
ных ВЭБ В-клеток, поэтому в таких культурах вирус образует-
ся в небольших количествах.
Линии клеток лимфомы Беркитта (ЛБ), имеющие неоплас-
тическое происхождение, отличаются от ЛЛВК морфологически
(рис. 7.1,6) и способны расти в полужидком агаре и давать
опухолевый рост при инокуляции мышам nude. Линии клеток
ЛБ всегда моноклональны, экспрессируют поверхностные1 им-
муноглобулины (обычно IgM) одного изотипа тяжелой нелег-
кой цепи; они никогда не обладают нормальным диплоидным
кариотипом и, как правило, имеют одну из трех характерных
хромосомных транслокаций с участием с-тус-гена (18: 14 либо
варианты t8: 2 или t8:22) [8]. Геном ВЭБ содержится в клет-
ках тех линий, которые получены из ЛБ африканского типа,
но он нередко отсутствует у клеточных линий, полученных из
ЛБ, изредка встречающихся в других частях света. Клетки ЛБ,
как и лимфобластоидных линий, экспрессируют некоторые по-
верхностные антигены нормальных В-лимфоцитов, в том числе
HLA, антиген общего острого лимфобластного лейкоза, CD10,
CD19, CD20 и поверхностные иммуноглобулины. На клетках ЛБ
выявляются также антигены активированных лимфоцитов,
в том числе CD23, РСА-1, а также рецепторы к ИЛ-2 и транс-
феррину [7].
231
ГЛАВА 7
Рис. 7.1. Микрофотографии лимфобластоидных В-клеток и клеток лимфомы
Беркитта в суспензионных культурах. А. Лимфообластоидные В-клетки; линия
получена путем иммортализации лимфоцитов периферической крови от боль-
ного лимфомой Беркитта с помощью ВЭБ. Б. Содержащие ВЭБ клетки афри-
канской лимфомы Беркитта (линия Raji).
232
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
2. Принципы метода
2.1. Получение вируса
Инфекционный ВЭБ дикого типа обнаруживается у боль-
ных инфекционным мононуклеозом в слюне или смывах из гор-
тани [9]; его можно также периодически выделять из тех же
материалов от лиц, у которых обнаружены антитела к ВЭБ
[10]. Однако обычно в большинстве лабораторий источником
вируса служит линия клеток В95-8 [11]. Эта линия была полу-
чена из фракции неадгезивных к хлопковой вате мононуклеар-
ных клеток периферической крови игрунки (один из видов аме-
риканских тропических обезьян), зараженных in vitro ВЭБ ди-
кого типа, выделенным от больного инфекционным мононуклео-
зом. В стандартных культуральных условиях вирусная инфек-
ция вызывает лизис около 1 —10% клеток, но их количество
можно увеличить до 80% путем обработки индуцирующими
агентами, например форболовыми эфирами [12] или н-бутира-
том натрия [13]. Титр иммортализации надосадочной жидкости,
полученной в стационарной или приближающейся к ней фазе
роста культуры, обычно составляет около 1 : 1000 при титрова-
нии на мононуклеарах пуповинной крови (разд. 3.2). Однако
для некоторых целей может оказаться необходимым концент-
рирование вируса путем высокоскоростного центрифугирова-
ния, поскольку с увеличением дозы вируса нарастает число ин-
фицированных клеток (разд. 3.1.4) [14].
2.2. Правила работы с ВЭБ в лаборатории
В настоящее время мерам безопасности при работе с ВЭБ и
трансформированными с его помощью линиями клеток уделя-
ется повышенное внимание. Однако следует помнить, что взрос-
лое население уже на 90% заражено и в течение всей жизни
является носителем этого вируса, который не только инфици-
рует лимфоидные клетки, но и периодически высевается из по-
лости рта и глотки. Более того, ВЭБ имеет низкую инфекцион-
ность, и пока нет достоверных сообщений о случаях лаборатор-
ного заражения. В связи с этим целесообразно работать с ли-
ниями клеток, трансформированных ВЭБ (большинство их про-
дуцирует малые количества инфекционного вируса), соблюдая
меры безопасности, принятые в повседневной работе практи-
ческой микробиологической лаборатории, и использовать за-
щитный бокс только для манипуляций с концентрированными
препаратами вируса. ВЭБ относится к инфекционным возбу-
дителям второй категории, основные меры предосторожности
при работе с ним, а также иммортализованными линиями кле-
ток описаны в разд. 3.1.6.
233
ГЛАВА 7
2.3. Взаимодействие ВЭБ с В-лимфоцитами
Рецептором для ВЭБ служит гликопротеин с мол. массой
140 кДа (CD21), который также связывает компонент компле-
мента СЗЬ, хотя и другим своим участком [15]. Недавно с
помощью метода лимитирующих разведений было установлено,
что ВЭБ может инфицировать большинство В-лимфоцитов пе-
риферической крови, но только одна субпопуляция из них (от 1
до 20%) активируется или иммортализируется in vitro [16, 17].
Это, вероятно, обусловлено свойственной определенным субпо-
пуляциям В-лимфоцитов невосприимчивостью к иммортализа-
ции под действием ВЭБ либо появлением новых требований к
условиям роста у этих субпопуляций после заражения ВЭБ
[18, 19].
2.4. Необходимость вспомогательных и питающих клеток
Известно, что активация В-лимфоцитов ВЭБ с последующей
продукцией иммуноглобулинов — независимый от Т-клеток про-
цесс [6]. Однако для иммобилизации В-лимфоцитов с по-
мощью этого вируса необходимо присутствие питающих клеток
[20]. Ими служат моноциты, содержащиеся в препаратах мо-
нонуклеарных клеток периферической крови. Но при зараже-
нии ВЭБ очищенных популяций В-лимфоцитов для оптималь-
ного роста культуры питающие клетки необходимо добавлять.
Происходящие при этом межклеточные взаимодействия до сих
пор полностью не охарактеризованы; по-видимому наряду с про-
чим они включают продукцию ростового фактора. Эти взаимо-
действия не рестриктированы генетически, поскольку питаю-
щий эффект был обнаружен у многих типов аллогенных кле-
ток. Источником питающих клеток могут служить также эм-
бриональные фибробласты, аллогенные мононуклеарные клет-
ки периферической или пуповинной крови после предваритель-
ного облучения. Есть данные о том, что стабильная ЛЛВК про-
дуцирует свои собственные ростовые факторы [21].
2.5. Регуляция Т-лимфоцитами размножения В-лимфоцитов,
инфицированных ВЭБ
У лиц, имеющих в сыворотке крови антитела к ВЭБ (~90%
взрослого населения земного шара), в кровотоке циркулируют
Т-лимфоциты памяти, которые распознают аутологичные В-лим-
фоциты, инфицированные ВЭБ. Вероятно, в условиях in vivo эти
клетки контролируют рост инфицированных ВЭБ В-лимфоцитов,
а при стимуляции in vitro способствуют появлению специфиче-
234
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
ских цитотоксических клеток [22]. В результате при культиви-
ровании инфицированных ВЭБ мононуклеарных клеток крови,
высеянных с высокой плотностью (1—2-Ю6 клеток/мл), через
3—4 нед происходит обратное развитие очагов пролиферации
В-лимфоцитов и получить клеточную линию не удается.
Преодолеть это обратное развитие культуры можно одним
из четырех способов.
1. Культивировать клетки при более низкой плотности (1—.
5- 10s клеток/мл).
2. Удалить Т-лимфоциты из суспензии мононуклеарных кле-
ток путем розеткообразования с эритроцитами барана.
3. Подавить активацию Т-клеток циклоспорином А.
4. На начальном этапе культивирования добавить ФГА для
подавления специфической активации Т-лимфоцитов [23].
3. Описание методов
3.1. Получение вируса
3.1.1. Культуральная среда
Используют среду RPMI 1640, к которой добавляют пени-
циллин (100 МЕ/мл), стрептомицин (100 мкг/мл), L-глутамин
(2 мМ) и СПК (Ю°/о по объему), инактивированную нагрева-
нием и проверенную на отсутствие микоплазм.
3.1.2. Индуцирующие агенты
1. 12-О-тетрадеканоилфорбол-13-ацетат (ТФА). Готовят ос-
новной (200 мкг/мл) раствор ТФА (Sigma Chemical Со., США)
в ди метилсульфоксиде (ДМСО, квалификации I, Sigma, США).
Основной раствор ТФА хранят при —20 °C и используют в ко-
нечной концентрации 20 нг/мл.
2. н-Бутират натрия. Готовят свежий 3 М раствор н-бути-
рата натрия в воде и стерилизуют фильтрованием; используют
в конечной концентрации 3 мМ.
3.1.3. Культивирование клеток В95-8
Клетки В95-8 выращивают в пластиковых культуральных
флаконах (10s—106 клеток/мл) при 37 °C в термостате с влаж-
ной атмосферой, содержащей 5°/о СОг в воздухе. В нормальных
культурах В95-8 часть клеток образует плавающие скопления
при наличии слоя клеток, прилипших к поверхности пластика.
Поэтому флаконы располагают горизонтально, чтобы обеспе-
чить максимальную поверхность для адгезии. Если клетки на-
235
ГЛАВА I
ращивают для получения вируса, то объем культуры доводят до
250 мл во флаконе площадью 175 см1 2 3 * и после достижения
плотности суспензии 5-Ю5 клеток/мл культивируют 7—10 дн
без смены среды. На этой стадии для увеличения продукции
вируса в культуральную среду можно добавить ТФА или н-бу-
гират натрия. После этого пролиферация клеток продолжается.
Культуральную среду с вирусом собирают через 7 дн. При ис-
пользовании индуцирующих агентов в препаратах ВЭБ содер-
жатся ТФА или н-бутират натрия, что может помешать изуче-
нию опосредованной вирусом активации В-лимфоцитов.
3.1.4. Приготовление содержащих ВЭБ препаратов
из культуральной жидкости клеток В95-8
Для удаления основной массы клеток надосадок культу-
ральной жидкости центрифугируют 15 мин при 400 g (20 °C),
а затем фильтруют через мембрану с размером пор 0,45 мкм,
которая задерживает клетки и крупные частицы детрита, но
пропускает покрытые оболочкой частицы живого вируса. Очи-
щенные таким путем надосадки нормальных культур В95-8
(около 1—2-Ю6 клеток/мл) при титровании на клетках пупо-
винной крови человека должны иметь титр иммортализации
около 1: 1000. Препарат ВЭБ разливают мелкими порциями,
обычно по 1 мл, и хранят при —70 °C, поскольку инфекционная
активность вируса снижается в результате хранения при более
высокой температуре. Повторное замораживание и оттаивание
инактивирует вирус. ВЭБ, содержащийся в надосадке культуры
клеток В95-8, можно сконцентрировать в 50—100 раз центри-
фугированием при 27 000 g в течение 2 ч (4°C). Осадок ре-
суспендируют в культуральной среде, разливают порциями по
0,1 мл и хранят при —70 °C. Концентрированные препараты
ВЭБ перед заражением клеток обычно разводят в соотноше-
нии 1 : 10 свежей средой.
3.1.5. Титрование препаратов ВЭБ на мононуклеарных
клетках пуповинной крови
1. Из крови пупочного канатика выделяют мононуклеарные
клетки (разд. 3.2), по иммортализации которых оценивают титр
препарата ВЭБ; для оценки одной серии достаточно 107 клеток.
2. Готовят последовательные 10-кратные разведения исход-
ного культурального надосадка, содержащего вирус, до титра
1 : 106 в среде RPMI 1640 с 10% СПК (разд. 3.1.1).
3. Равные объемы взвеси, содержащей по 10е мононуклеар-
ных клеток пуповинной крови, помещают в пластиковые куль-
туральные пробирки (12x75 мм); осаждают клетки центрифу-
гированием при 400 g в течение 10 мин.
236
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
4. Удалив надосадочную жидкость, в каждую пробирку с
осадком клеток добавляют по 200 мкл соответствующего раз-
ведения содержащего вирус препарата; в одни контрольные
пробирки добавляют только культуральную среду, в другие —
препарат ВЭБ с известным титром иммортализации.
5. Клетки инкубируют при 37 °C 1 ч в термостате с контро-
лируемой атмосферой; пробирки периодически встряхивают,
чтобы не дать клеткам осесть на дно.
6. В каждую пробирку добавляют по 2 мл среды для отмы-
вания (RPMI 1640 с 2% СПК, разд. 3.2.1) п центрифугируют
при 400 g 10 мин.
7. Надосадки с избытком вируса удаляют, а осевшие клет-
ки ресуспендируют в культуральной среде RPMI 1640 с 10%
СПК (Ю6 клеток /мл).
8. Из каждой пробирки с соответствующим разведением ви-
руса разливают в пять лунок плоскодонной 96-луночной микро-
панели для культуры ткани по 200 мкл взвеси, содержащей 2-
• 101 2 3 4 5 клеток и инкубируют (37 °C, СОг-термостат) в течение 4-х
нед. Затем учитывают результаты иммортализации.
9. Один» раз в неделю культуры подкармливают, удаляя из
каждой лунки половину надосадка и заменяя его свежей сре-
дой. Важно не перенести клетки или содержащий вирус надоса-
док из одной лунки в другую.
Иммортализацию обычно оценивают визуально, просматри-
вая культуры под инвертированным микроскопом. Уже через
1—2 нед после заражения ВЭБ появляются очаги пролифери-
рующих В-лимфоцитов, а через 4 нед, как правило, и невоору-
женным глазом можно заметить крупные скопления клеток,
тогда как в контрольных культурах к этому времени остаются
только мертвые клетки и детрит (рис. 7.2). Эффективность им-
мортализации определяют как отрицательный десятичный лога-
рифм того разведения вирусного препарата, которое индуциру-
ет иммортализацию в 50% культур.
3.1.6. Предосторожности при работе с ВЭБ
и иммортализованными линиями клеток
1. При работе с препаратами ВЭБ и иммортализованными
линиями клеток надевают лабораторную одежду или однора-
зовый фартук. При уходе из лаборатории переодеваются и мо-
ют руки.
2. Можно надевать перчатки, желательно хирургические,
плотно прилегающие, но при аккуратной работе это делать не-
обязательно.
3. Никогда не следует набирать жидкость в пипетку ртом.
4. Все отходы перед выбросом обеззараживают либо, авто-
клавированием (126°C, 30 мин), либо обработкой растворами
237
ГЛАВА 7
7’2’ М1,кРоФот°гРафии трехиедельных культур мононуклеарных клеток
пуповинной крови. А — инфицированных ВЭБ, и Б — неинфицированных (кон-
1 Ь I »
238
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
гипохлорита, например препаратом «Хлорос» (гипохлорит нат-
рия, содержащий 11% свободного хлора, Durham Chemicals
Distributors Ltd., Великобритания).
5. Твердые отходы и небольшие количества жидких отходов,
например сыворотки крови человека и препараты ВЭБ, авто-
клавируют в закрытых контейнерах.
6. Жидкие отходы, например среды после отмывания или
культивирования, собирают аспиратором в емкость, содержа-
щую «Хлорос», и выдерживают 18 ч (конечная концентрация
раствора «Хлорос» не должна быть менее 10% по объему).
После деконтаминации жидкие отходы можно спускать в кана-
лизацию.
7. Стеклянную посуду обеззараживают, погружая полностью
в дезинфицирующий раствор («Хлорос», 5% по объему) и вы-
держивая в нем не менее 18 ч.
8. При выплескивании жидкости, содержащей вирус, поверх-
ность немедленно протирают и обрабатывают раствором «Хло-
рос» (10% по объему), а затем 70%-ным спиртом (по объему).
3.2. Приготовление клеток-мишеней для заражения
3.2.1. Среда для отмывания клеток
Используют RPMI 1640, к которой добавляют пенициллин
(100 МЕ/мл), стрептомицин (100 мкг/мл) и СПК (2% по объ-
ему), инактивированную нагреванием и проверенную на отсут-
ствие микоплазм.
3.2.2. Осаждение эритроцитов пуповинной крови декстраном
1. Готовят 6%-ный (вес/объем) раствор декстрана (мол.
масса 250 кДа, Sigma Chemical Со., США) в 0,15 М растворе
NaCl и стерилизуют автоклавированием при ПО °C в течение
30 мин.
2. Смешивают раствор декстрана с кровью, взятой в антико-
агулянт, в соотношении 1 : 4 (2,5 мл раствора декстрана добав-
ляют к 10 мл крови) и инкубируют в водяной бане при 37 °C в
течение 45 мин.
3. После оседания эритроцитов слой плазмы с лейкоцитами
отсасывают и фракционируют в градиенте плотности фиколла
для выделения мононуклеарных клеток.
3.2.3. Выделение мононуклеарных клеток
и удаление Т-лимфоцитов
Мононуклеарные клетки получают из гепаринизированной
крови или хирургического материала (миндалины и селезенка)
путем разделения в градиенте плотности фиколла (гл. 1). Т-лим-
239
ГЛАВА 7
фоциты можно удалить путем розеткообразования с эритроци-
тами барана, а затем осадить розетки в градиенте плотности фи-
колла (гл. 2). Для эффективной иммортализации В-клеток мин-
далин и селезенки хирургический материал должен быть обра-
ботан сразу же после операции.
3.3. Получение иммортализованных линий клеток
с помощью ВЭБ
3.3.1. Приготовление циклоспорина А
Циклоспорин А, используемый для работы с клеточными
культурами, поставляется фирмой Sandoz Ltd., Великобрита-
ния. Для приготовления основного раствора порошок растворя-
ют в фармакопейном этаноле (1 мг/мл) и разводят культураль-
ной средой до конечной концентрации 0,1—1 мкг/мл.
3.3.2. Заражение ВЭБ и культивирование
1. Осадок, содержащий до 107 клеток (в зависимости от тит-
ра вируса), ресуспендируют в 1 мл неразведенного надосадка
культуры клеток В95-8 и инкубируют 1 ч при 37 °C в СО2-термо-
стате, периодически перемешивая, чтобы клетки оставались в
суспензии. Период инкубации может быть и более длительным
(до 24 ч), хотя присутствие довольно густой суспензии клеток в
истощенной среде неминуемо ведет к падению их жизнеспособ-
ности.
2. После инкубации с ВЭБ клетки отмывают один раз сре-
дой RPMI 1640 с 2% СПК, ресуспендируют в культуральной
среде до концентрации 1—2-106 клеток/мл и разливают по 2 мл
в плоскодонные 24-луночные панели для культуры тканей. Если
клетки были получены от серопозитивного донора и Т-лимфоци-
ты из суспензии не были удалены, то в культуральную среду до-
бавляют циклоспорин А в конечной концентрации 0,1—1 мкг/мл.
3. Первоначально клетки подкармливают один раз в неделю,
для чего удаляют половину надосадка и заменяют его свежей
средой, стараясь не нарушать слой клеток. Через 1—2 нед пос-
ле заражения ВЭБ под микроскопом можно увидеть пролифе-
рирующие очаги В-клеток; эти клетки продолжают делиться
при субкультивировании.
3.3.3. Обратное развитие очагов пролиферации
В-лимфоцитов, демонстрирующее Т-клеточный
иммунитет в отношении ВЭБ
1. Готовят последовательные двукратные разведения взвеси
(от 2-Ю6 до 2,5-105 клеток/мл) инфицированных ВЭБ мононук-
леарных клеток от доноров, имеющих в сыворотке крови анти-
240
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
тела к ВЭБ, разливают по 200 мкл в лунки плоскодонной мик-
ропанели для культивирования.
2. Каждое разведение смеси разливают в десять параллель-
ных лунок; в пять из которых добавляют циклоспорин А.
3. Культивируют в течение 4-х нед с еженедельной под-
кормкой.
После 1—2 нед культивирования во всех лунках при микро-
скопии видны очаги пролиферирующих В-лимфоцитов, но в
лунках без циклоспорина, засеянных более густой клеточной
взвесью, эти скопления обычно подвергаются обратному разви-
тию через 3—4 нед после начала культивирования. Однако в
лунках, засеянных разбавленной клеточной взвесью (2,5—5-
• 105 клеток/мл), может сформироваться ЛЛВК. В то же время
при добавлении в среду циклоспорина в лунках с высокой и с
низкой плотностью клеток образуются ЛЛВК, которые затем
можно субкультивировать.
3.4. Наращивание клеток и криоконсервация
клеточных линий
3.4.1. Среда и ампулы для замораживания
Используют RPMI 1640, содержащую антибиотики (см.
разд. 3.1.1), ДМСО (10% по объему) и СПК (20—50% по объ-
ему). Ампулы — криопробирки фирмы Nunc, А/S, Дания.
3.4.2. Наращивание ЛЛВК.
Линии В-клеток, зараженных ВЭБ, хотя и различаются по
ростовым характеристикам, обычно растут в культуре при кон-
центрации 105—106 клеток/мл с периодом удвоения 24—72 ч.
После иммортализации 2-миллилитровые культуры пролифе-
рирующих В-клеток можно перенести из лунок 24-луночных па-
нелей в культуральные флаконы (25 см2), которые первона-
чально следует инкубировать в вертикальном положении. Впо-
следствии культуры можно переносить во флаконы большего
объема; при этом обычно клетки разводят в соотношении 1 : 2
каждые 3—7 дн в зависимости от скорости их роста.
3.4.3. Замораживание и оттаивание лимфобластоидных клеток
1. Клетки, собранные из нормально растущих культур, осаж-
дают центрифугированием при 400 g и ресуспендируют в охлаж-
денной среде для замораживания.
2. Суспензию клеток разливают в криопробирки порциями
по 1 мл и замораживают. Для этого ампулы выдерживают 24 ч
16—172 241
ГЛАВА 7
при —70 °C в пенопластовом блоке (толщина микропористого
полистирола вокруг каждой пробирки — около 2,5 см) либо ис-
пользуют более сложный метод контролируемого охлаждения.
Замороженные клетки хранят в парах жидкого азота.
3. При извлечении клеток содержание ампулы быстро от-
таивают на водяной бане при 37 °C.
4. Клеточную взвесь переносят в пластиковую универсаль-
ную пробирку, разбавляют подогретой средой, добавляя по кап-
лям при перемешивании 2 мл среды, а затем медленно еще
7 мл.
5. Клетки осаждают центрифугированием, ресуспендируют в
среде и подсчитывают.
6. Для получения хорошо растущих культур рекомендуется
засеять размороженные клетки в плоскодонную 24-луночную
панель в нескольких концентрациях (от 105 до 106 клеток/мл).
Для роста некоторых клеточных линий требуются питающие
клетки, в качестве которых, например, могут использоваться
облученные (2000 рад) мононуклеары периферической крови в
концентрации 0,5-106 клеток/мл.
3.5. Иммунофлуоресцентное выявление ядерных
антигенов ВЭБ в реакции связывания
комплемента
3.5.1. Реагенты.
1. Для отмывания клеток и предметных стекол готовят веро-
наловый буфер, pH 7,2, растворяя таблетки Барбитон (Oxoid
Ltd., Великобритания). Полученный раствор можно стерилизо-
вать автоклавированием (121 °C, 20 мин) и хранить при 4 °C.
Следует соблюдать осторожность: барбитон ядовит.
2. Готовят 0,95%-ный (вес/объем) раствор лимоннокислого
натрия и стерилизуют фильтрованием. Этот раствор используют
для приготовления мазков. Благодаря гипотоничности в нем
происходит некоторое увеличение размеров ядер.
3. Готовят смесь из равных объемов ацетона и метанола.
4. Стандартные донорские сыворотки, заведомо содержащие
и не содержащие антитела к ВЭБ, инактивируют нагреванием
и хранят при —20 °C.
5. От донора, заведомо не имеющего антител к ВЭБ, полу-
чают свежую сыворотку, которую используют как источник
комплемента, разливают порциями и хранят при —70 °C.
6. Для окрашивания клеток используют конъюгат козьих ан-
тител к СЗ человека с ФИТЦ (Cappel Labs, США), который
разводят вероналовым буфером в соотношении 1 : 30.
242
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
7. Для дополнительного окрашивания используют 0,1%-ный
(вес/объем) раствор синьки Эванса в дистиллированной воде.
Препараты заключают в смесь глицерина с вероналовым бу-
фером (1 : 1).
8. Необходимо также иметь отмытые спиртом предметные
стекла, штативы для стекол, кюветы Коплина для фиксации и
окрашивания препаратов, пластиковые коробки для влажной
камеры, кусочки мягкой хлопчатобумажной ткани и магнитные
мешалки.
3.5.2. Приготовление мазков из суспензии клеток
1. Клетки перед окрашиванием дважды отмывают веронало-
вым буфером и ресуспендируют в 0,95%-ном (вес/объем) рас-
творе лимоннокислого натрия до концентрации 5-106 клеток/мл.
Для приготовления каждого мазка требуется около 2,5-105 кле-
ток, следовательно, достаточно иметь 5-105 клеток, чтобы приго-
товить по одному положительному и отрицательному мазку.
В качестве положительного и отрицательного контролен при
выявлении ядерных антигенов ВЭБ используют соответственно
клетки линий Raji и Ramos, полученных из лимфомы Беркитта.
2. Готовят мазки вручную или с помощью цитоцентрифуги,
нанося на каждое стекло по 50 мкл клеточной взвеси; высуши-
вают на воздухе, обводят стеклорезом и надписывают нерас-
творимыми в спирте чернилами.
3. Перед фиксацией мазков смесь ацетон — метанол необхо-
димо охладить до —20 °C или ниже, иначе возможна потеря
ядерных антигенов. Для этого либо окружают кювету Коплина
с фиксирующей смесью сухим льдом, либо предварительно
охлаждают до —70 °C в низкотемпературном холодильнике.
Препараты фиксируют не менее 3 мин при —20 °C и высушива-
ют при комнатной температуре (20°C). До окрашивания их
можно некоторое время (24 ч) держать при 4 °C, а долгое вре-
мя хранить при —20 °C.
3.5.3. Иммунофлуоресцентное окрашивание антителами к С:
1. Готовят смеси, состоящие из одной части сыворотки, со-
держащей или несодержащей антитела к ВЭБ, одной части
сыворотки — источника комплемента и восьми частей веронало-
вого буфера, и помещают их на лед.
2. Препараты погружают в вероналовый буфер, затем по-
верхность стекла вокруг мазка осушают мягкой тканью. Сам
мазок не должен подсыхать на воздухе, поэтому каждое стек-
ло на этапах 3 и 5 обрабатывают индивидуально.
3. Нанеся на каждый мазок по 20 мкл смеси разведенной
сыворотки с комплементом, немедленно помещают мазки во
влажную камеру и инкубируют 1 ч при 37 °C.
16* 243
ГЛАВА 7
4. Стекла с мазками отмывают дважды по 10 мин веронало-
вым буфером на магнитной мешалке.
5. Поверхность стекла вокруг мазка осушают мягкой тканью,
на каждый мазок наносят по 20 мкл разведенного конъюгата
(меченные ФИТЦ козьи антитела к СЗ человека) и инкубиру-
ют во влажной камере 1 ч при комнатной температуре.
6. Стекла отмывают дважды по 10 мин вероналовым буфе-
ром при перемешивании.
7. Если требуется дополнительное окрашивание, мазки по-
гружают на некоторое время в дистиллированную воду, затем
инкубируют 15 мин в 0,1%-ном (вес/объем) растворе синьки
Эванса, после чего вновь отмывают вероналовым буфером.
8. Препараты заключают в смесь глицерина с вероналовым
буфером и хранят в темноте при 4 °C до флуоресцентной мик-
роскопии. Ядра клеток, содержащие антигены ВЭБ, флуорес-
цируют в виде пятен ярко-зеленого цвета (рис. 7.3).
3.6. Иммуноферментное выявление ядерных антигенов
ВЭБ в реакции связывания комплемента
3.6.1. Реагенты
1. Вероналовый буфер; лимоннокислый натрий; смесь аце-
тона с метанолом для фиксации; стандартная сыворотка чело-
века; комплемент человека и раствор для заключения препа-
ратов, приготовленный, как описано в разд. 3.5.1.
2. Конъюгированные с пероксидазой антитела кролика к СЗ
человека (Dakopatts А/S, Дания), разведенные в соотношении
1 : 30 вероналовым буфером.
3. Забуференный фосфатами физиологический раствор
(PBS), pH 7,2, для разведения субстрата и для отмывания сте-
кол перед инкубацией с субстратом.
4. Свежеприготовленный раствор тетрагидрохлорида 3,3-ди-
аминобензидина (ДАБ, Sigma, США) в концентрации 0,5 мг/мл
на PBS; к нему добавляют перекись водорода до конечной кон-
центрации 0,03% из расчета 1 мкл 30%-ной (вес/объем) пере-
киси водорода на 1 мл раствора субстрата.
5. Гематоксилин Майера для дополнительного окрашивания.
3.6.2. Выявление комплемента конъюгатом пероксидазы
с антителами к СЗ
1. Мазки клеток готовят и фиксируют, как описано в
разд. 3.5.2.
2. Препараты инкубируют с сыворотками, содержащими и
не содержащими антитела к ядерным антигенам ВЭБ (к сыво-
244
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
Рис. 7.3. Иммунофлуоресцентное выявление ядерных антигенов ВЭБ в реак-
ции связывания комплемента. Использование антител к СЗ, конъюгированных
с ФИТЦ.
роткам добавлен комплемент), а затем отмывают, как описано
в разд. 3.5.3 (этапы 1—4).
3. Осушив поверхность стекла вокруг мазка, на препараты
наносят по 20 мкл разведенного конъюгата пероксидазы с анти-
телами к компоненту СЗ человека и инкубируют во влажной
камере 30 мин при 37 °C.
4. Препараты однократно по 10 мин отмывают вероналовым
буфером и PBS.
5. Проявляют пероксидазную метку, погружая препараты на
5 мин при комнатной температуре в свежеприготовленный рас-
твор ДАБ с перекисью водорода.
6. Препараты отмывают несколько раз водопроводной во-
дой, а затем дополнительно окрашивают ядра в голубой цвет
гематоксилином Майера (3 мин).
7. После заключения препараты просматривают под свето-
вым микроскопом. Ядра, содержащие антигены ВЭБ, имеют ко-
ричневую окраску (рис. 7.4).
4. Проблемы
Метод получения ЛЛВК, описанный в разд. 3, в настоящее
время используется в повседневной работе ряда лабораторий.
245
ГЛАВА 7
Рис. 7.4. Иммуноферментное выявление ядерных антигенов ВЭБ в реакции
связывания комплемента. Использование антител к СЗ, конъюгированных с
пероксидазой.
Однако его освоение сопряжено с некоторыми проблемами, ко-
торые мы попытались здесь обсудить.
4.1. Проблемы, связанные с вирусом
Определяя титры иммортализации на мононуклеарах пупо-
винной крови (разд. 3.1.5), среди некоторых серий препаратов
вируса можно найти малоактивные. Низкий титр иммортализа-
ции может быть следствием преждевременного сбора надосад-
ка культуры В95-8, неправильного хранения вируса и даже кон-
таминации линии клеток В95-8 микоплазмами. Микоплазменная
контаминация клеток В95-8 и полученных при выращивании
таких клеток препаратов ВЭБ действительно оказывает отрица-
тельное влияние на эффективность иммортализации В-клеток
[24]. Присутствие микоплазмы в клетках миндалин, удаленных
хирургическим путем, может также снижать чувствительность
культуры к иммортализации под действием ВЭБ. Желательно
иметь проверенную на отсутствие микоплазм ЛЛВК и регуляр-
но дезинфицировать культуральные помещения формальде-
гидом.
246
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
4.2. Клетки-мишени
Свежие клетки-мишени с высоким процентным содержанием
живых клеток наиболее эффективно иммортализуются под дей-
ствием ВЭБ. Есть данные о том, что по сравнению с активиро-
ванными В-клетками покоящиеся более чувствительны к иммор-
тализации ВЭБ или менее требовательны к условиям культи-
вирования [18, 19]. Мононуклеарные клетки периферической
крови, как правило, легко иммортализуются под действием ВЭБ
даже после замораживания, но с хирургическим материалом
(миндалины и селезенка) могут возникать затруднения, осо-
бенно после криоконсервации. При использовании лимфоцитов
от сероположительных доноров из суспензии необходимо уда-
лять Т-клетки или добавлять к культурам циклоспорин, чтобы
предотвратить подавление роста В-клеток ВЭБ-специфичными
Т-клетками. Препараты циклоспорина предварительно должны
быть проверены на отсутствие токсичности.
4.3. Выявление ядерных антигенов ВЭБ в клеточных линиях
В некоторых случаях окрашивание на ядерные антигены ВЭБ
не дает удовлетворительных результатов. Причиной этого мо-
жет быть неправильная фиксация образцов, которую необходи-
мо проводить при —20 °C или более низкой температуре в сме-
си ацетон — метанол (разд. 3.5.1). Для контроля этапа фикса-
ции желательно параллельно окрасить клетки Raji и Ramos.
Из-за применения сывороток человека в качестве реагентов для
выявления антигенов ВЭБ на клетках человека можно получить
высокое неспецифическое фоновое окрашивание. У некоторых
клеток окрашивается мембрана, по-видимому, благодаря мемб-
ранным рецепторам к комплементу. Поэтому окрашивание всег-
да следует проводить и с контрольной, не содержащей антител
к В:ЭБ сывороткой. Кроме того, могут возникать сложности,
вызванные инактивацией комплемента при хранении или подсы-
ханием мазков перед добавлением различных реагентов.
4.4. Условия культивирования
Обычно для ЛЛВК пригодны среды и добавки, поддержива-
ющие активацию или рост лимфоидных клеток человека в крат-
косрочных культурах, но по возможности лучше проверить их
на культурах стабильных линий в условиях лимитирующих
разведений.
247
ГЛАВА 7
5. Возможности применения линий
лимфобластоидных В-клеток
Иммортализованные ВЭБ линии лимфобластоидных В-кле-
ток служат неисчерпаемым источником В-лимфоцитов, которые
можно использовать в различных целях [25]. Для биохимических
исследований антигенов клеточной поверхности требуются зна-
чительные количества относительно чистых клеток, идеальным
источником которых служат ЛЛВК, особенно после клонирова-
ния. Данные линии можно использовать и при иммунизации
грызунов для получения моноклональных антител к поверхност-
ным антигенам В-лимфоцитов человека, а при необходимости
получения антител к антигенам активированных В-клеток эти
линии представляют особую ценность. Поскольку ЛЛВК экспрес-
сируют HLA класса I и класса II, их можно применять при то-
нировании тканей как клетки-стимуляторы в смешанных куль-
турах лимфоцитов и как контрольные клетки в серологических
анализах.
Иммортализованные ВЭБ В-лимфоциты служат неограничен-
ным источником гистосовместимых питающих клеток для кло-
нов Т-лимфоцитов. С их помощью было также показано, что
В-лимфоцитЫ способны процессировать растворимые антигены
и презентировать их Т-лимфоцитам в соответствии с иммуноло-
гической специфичностью и МНС-рестрикцией [26].
Моноклональные антитела, которые синтезируются антиген-
специфическими В-лимфоцитами человека, иммортализованны-
ми ВЭБ, могут использоваться вместо антисывороток при изу-
чении иммунного ответа и, что более важно, в профилактике и
лечении ряда заболеваний. Это очень обширная область потен-
циального использования таких МКА, поскольку антисыворотки
человека в настоящее время применяются для предотвращения
гемолитической болезни новорожденных из-за резус-несовмести-
мости плода и матери, нейтрализации бактериальных токсинов
и змеиных ядов, элиминации циркулирующих лекарственных
препаратов при передозировке, пассивной иммунизации лиц при
повышенном риске заражения (например, гепатитом, герпесом,
ветряной оспой, краснухой и корью), а также для лечения цито-
мегаловирусной инфекции при иммунодефицитах.
Литература
1. Henle G., Henle W., Diehl V. (1968). Proc. Natl. Acad. Sci. USA, 59, 94.
2. Epstein M. A., Achong B. G. (1979). In: The Epstein-Barr Virus, Epstein M. A.
and Achong B. G. (eds.), Springer, Berlin, p. 321.
3. Epstein M. A. (1978). In: Nasopharyngeal Carcinoma: Aetiology and Con-
trol, de-The G., Ho Y. and Davis W. (eds.), IARC, Lyon, p. 333.
4. Reedman В. M„ Klein G. (1973). Int. J. Cancer, 2, 499.
248
ЛИНИИ ЛИМФОБЛАСТОИДНЫХ В-КЛЕТОК ЧЕЛОВЕКА
5. Pattengale Р. К., Smith R. W., Gerber Р. (1973). Lancet, II, 93.
6. Rosen A., Gergely P„ Jondal M„ Klein G., Britton S. (1977). Nature, 267, 52.
7. Crawford D. H., Ando 1. (1986). Immunology, 59, 405.
8. Zech L., Haglund LL, Nilsson K., Klein G. (1976). Int. J. Cancer, 17, 47.
9. Miller G., Niederman J. C„ Andrews L. L. (1973). N. Engl. J. Med., 288,
229.
10 Golden H. D., Chang R. S., Prescott IV., Simpson E., Cooper T. Y. (1973).
J. Infect. Dis., 127, 471.
11. Miller G., Shope T., Lisco H., Stitt D„ Lipman M. (1972). Proc. Natl. Acad.
Sci. USA, 69, 383.
12. zur Hausen H„ O’Neill F. J., Freese U. K, Hecker E. (1978). Nature, 272,
373.
13. Luka I., Kallin B., Klein G. (1979). Virology, 94, 228.
14. Zerbini M., Ernberg I. (1983). J. Gen. Virol., 64, 539.
15. Nemerow G. R., Slaw M. F. G., Cooper N. R. (1986). J. Virol., 58, 709.
16. Tosato G., Blaese R. M. (1985). Adv. Immunol., 37, 99.
17. Katsuki T., Hiruma Y., Yamamoto N., Abo T., Kumagi K. (1977). Virolo-
gy, 83, 287.
18. Aman P., Ehlin-Henriksson B., Klein G. (1984). J. Exp. Med., 159, 208.
19. Chan M. A., Stein L. D„ Dosch H.-М., Sigal N. H. (1986). J. Immunol., 136,
106.
20. Pope J. H., Scott IV., Moss D. J. (1974). Int. J. Cancer, 14, 122.
21. Blazar B. A., Sutton L. M., Strome M. (1983). Cancer Res., 43, 4562.
22. Rickinson A. B., Moss D. J., Pope J. H. (1979). Int. J. Cancer, 23, 610.
23. Crawford D. H. (1981). In: Transplantation and Clinical Immunology XIII,
Touraine J. T., Traeger J., Betuel H., Brochier J., Dubernard J. M., Revil-
lard J. P. and Triau R. (eds.), Excerpta Medica, Amsterdam, p. 48.
24. Doyle A., Jones T., Bidwell J., Bradley B. (1985). Hum. Immunol., 13, 199.
25. Crawford D. H. (1986). In: The Epstein—Barr Virus — Recent Advances,
Epstein M. A. and Achong B. G. (eds.), W. Heineman Medical Books, Lon-
don, p. 250.
26. Lanzaveccia A. (1985). Nature, 314, 537.
Глава 8
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИЙ
Г. Уолдман, С. Кобболд и И. Лефковитс
1. Введение
Иммунный ответ на любой антиген заключается прежде все-
го в-клональной экспансии прекоммитированных лимфоцитов,
а затем в дифференцировке их размножившихся потомков в эф-
фекторные клетки, например в клетки, способные синтезировать
антитела и проявлять цитотоксическую активность в отношении
специфических мишеней. Для оценки этого ответа во многих
случаях можно просто воспользоваться определением количест-
ва конечного продукта, т. е. образовавшихся специфических
антител или цитотоксических лимфоцитов. Однако задачей экс-
перимента может быть определение числа лимфоцитов-предше-
ственников, с активации которых начинается иммунный ответ
на данный антиген в покоящейся популяции. Иными словами,
необходим метод измерения частоты этих клеток-предшествен-
ников. В настоящее время не существует какого-либо метода,
позволяющего прямо идентифицировать клетки-родоначальники
будущих активных клонов среди других представителей лимфо-
цитарной популяции. Во-первых, они крайне редко встречаются
и, во-вторых, морфологически ничем не выделяются из однород-
ной подавляющей массы покоящихся лимфоцитов. Только ана-
лиз в предельном разведении (АПР) позволяет определить
частоту клеток-предшественников расчетным путем ретроспек-
тивно по числу активных клонов, образовавшихся в данной по-
пуляции лимфоцитов, исходя из того, что каждый активный
клон возникает из одной клетки-предшественника. Определение
этой частоты может быть конечной задачей АПР или же первой
необходимой ступенью в анализе многосторонних межклеточных
взаимодействий на уровне клонов (как это станет очевидным
ниже).
В настоящей главе в общих чертах изложены теоретические
основы АПР, приведены примеры его экспериментального ис-
пользования в различных областях клеточной иммунологии, вни-
манию читателя представлена также «дружелюбная» компью-
терная программа, в которую заложены ранее описанные мето-
ды расчета частот.
250
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
2. Теоретические предпосылки метода
2.1. Одноударные кривые и расчет частоты
Теория АПР подробно описана в ряде опубликованных ранее
обзоров [1—5]. Здесь мы лишь кратко коснемся основных прин-
ципов метода. В качестве первого примера рассмотрим анализ
популяции Т-лимфоцитов, полученных от животного, иммунизи-
рованного гемоцианином моллюска фиссуреллы (ГМФ). Допус-
тим, что одна из 20 000 Т-клеток относится к Т-клеткам, специ-
фичным в отношении ГМФ. Если мы возьмем, например, 106
Т-лимфоцитов и случайным образом рассеем их в 100 лунок с
культуральной средой, содержащей ГМФ, значительный избы-
ток В-лимфоцитов и необходимых вспомогательных клеток, то в
каждой из приготовленных микрокультур окажется в среднем
по 104 Т-клеток. Поскольку частота Т-хелперов в нашем приме-
ре составляет 1 на 2-Ю4 Т-клеток, в некоторые лунки, очевидно,
не попадает ни одного Т-хелпера. При определении антител в
конце периода культивирования эти микрокультуры будут'учте-
ны как неотвечающие. Исходя из предположения, что один Т-
хелпер может обеспечить синтез антител одним В-клеточным
клоном, мы можем рассчитать число клеток-предшественников
по пропорции (или доле) неответивших микрокультур, которая
служит ключевой величиной. Ее можно определить, воспользо-
вавшись выражением
Fo = е-“,
где Fo—доля неответивших микрокультур, е — основание нату-
рального логарифма, а и — среднее число клеток-предшествен-
ников (в данном случае Т-хелперов) на микрокультуру. Это вы-
ражение представляет собой нулевой член распределения Пуас-
сона. С полной формулой распределения Пуассона, ее выводом
и отношением к биноминальному распределению можно подроб-
но ознакомиться в литературе [1]. В рассматриваемом нами
примере, подставив в приведенное выше уравнение наблюдае-
мую пропорцию неответивших микрокультур, мы получим час-
тоту клеток-предшественников.
На практике ситуация выглядит несколько иначе. Требуется
определить частоту клеток-предшественников, которая вообще
неизвестна. Было бы рискованным ставить опыт, выбрав какую-
либо одну дозу исследуемых Т-клеток на лунку, как в описан-
ном выше примере, поскольку не известно, даст ли она подхо-
дящую для расчета долю неответивших микрокультур. По этой
и другим причинам при постановке опыта всегда приходится
титровать взвесь Т-клеток, т. е. высевать ряд групп микрокуль-
тур, с тем чтобы каждая группа имела свою отличную от других
дозу добавляемых Т-клеток. В результате получится серия ве-
251
ГЛАВА 8
личин Fo для различных концентраций Т-клеток. Для удобства
использования приведенное выше выражение целесообразно пе-
реписать в логарифмической форме:
и = — In Fo-
Это преобразование позволяет наглядно выразить экспери-
ментально измеряемую величину (и) и построить график зави-
симости величины и от дозы исследуемых клеток, который при
логарифмической шкале ординат должен иметь вид прямой ли-
нии. Другими словами, отрицательный натуральный логарифм
доли неответивших микрокультур прямо пропорционален сред-
нему числу клеток-предшественников, приходящихся на одну
микрокультуру. Прямолинейность зависимости, с одной стороны,
позволяет определять частоту клеток-предшественников разны-
ми методами (см. ниже), а с другой — служит внутренним
(контрольным) доказательством того, что учитываемый ответ
микрокультур определяется активностью одного-единственного
типа клеток. Прямолинейность графика означает одноударность
кривой, которая свидетельствует о том, что лишь один тип кле-
ток является лимитирующим. Отклонение от прямолинейности,
доказываемое соответствующими методами статистической об-
работки (см. разд. 4), ставит под сомнение исходные предпо-
сылки АПР, мешает определению частоты клеток-предшествен-
ников и исключает применение дополнительных приемов
анализа.
Для отклонения данного полулогарифмического графика от
прямолинейности может быть множество причин. Например,
недостаточно оптимальные условия культивирования клеток
или слишком низкая чувствительность метода определения про-
дуктов, синтезируемых одним клоном. При исследовании попу-
ляции Т-хелперов конечный результат зависит от наличия во
всех лунках избытка В-клеток. Если его нет, то кривые на
полулогарифмическом графике при высокой дозе Т-хелперов
приближаются к асимптоте, которую дают микрокультуры, не
содержащие антигенспецифических В-клеток. В радиобиологии
и вирусологии кривые подобной конфигурации называются так-
же «многоударными» или «многоцелевыми» (много разных кле-
ток-мишеней). Теоретически «многоцелевые» кривые свидетель-
ствуют о том, что во взаимодействии принимают участие клетки
двух или более разных типов. Однако практическое использо-
вание этих кривых в клеточной иммунологии затруднено из-за
сравнительной ограниченности выборок. В лучшем случае они
пригодны для нахождения оптимальных условий культивирова-
ния или для анализа сложных межклеточных взаимодействий.
Вернемся к нашему примеру. Построив полулогарифмиче-
ский график (рис. 8.1), мы можем, воспользовавшись критерием
«хи-квадрат» и определив доверительный интервал угла накло-
252
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
Рис. 8.1. Полулогарифмический график зависимости доли неответивших мик-
рокультур от дозы Т-клеток. Мышей примировали ГМФ; приготовили обога-
щенную Т-клетками взвесь спленоцитов и в нарастающих дозах добавили их
в микрокультуры В-клеток, полученных из селезенок мышей, примированиых
ТНФ-ОВА. Каждую дозу этих Т-клеток добавляли в 60 микрокультур, обра-
зующих одну группу. В микрокультуры всех групп добавили ТНФ-ГМФ, а
затем определяли антитела к ТНФ (в данном случае определяли число клеток,
образующих антитела, методом локального гемолиза). Полученная одноударная
кривая позволяет рассчитать частоту специфичных к ГМФ Т-хелперов, интер-
полируя от Fo=0,37. Вычисленная частота составляет примерно 1 : 20 000 Т-
клеток, т. е. 5-10~5.
на графика, статистически оценить согласие полученных точек
с одноударной моделью Пуассона (см. разд. 4). Предположим,
что имеется наилучшее согласие. Проводя интерполяцию на
уровне 37% неответивших микрокультур, мы теперь в состоянии
без труда определить частоту клеток-предшественников. Способ
расчета легче всего понять, подставив в формулу нулевого чле-
на пуассоновского распределения значение и, равное 1:
Fo = е-и;
Fo = е-1 = 1/е = 1/2,71828 ж 0,37 (37%).
253
ГЛАВА 8
Существует также более точный способ определения частоты
клеток-предшественников по углу наклона графиков, описанный
в другом издании [5].
В нашем примере интерполяция к Fo = O,37 дает частоту
клеток-предшественников порядка 1/20 000 или 5-10~5.
2.2. Анализ по распределению в предельном разведении
АПР чаще всего применяется для изучения функции какого-
либо одного типа активных клеток среди клеток большой гете-
рогенной популяции. С теми же основаниями его можно ис-
пользовать для исследования взаимодействия между клетками
разного типа анализируемой гетерогенной популяции. Чтобы
пояснить это положение, мь; приводим полулогарифмический
график одного из опытов, в котором исследовалась популяция
Т-хелперов, содержащая два различных типа редко встречаю-
щихся клеток с противоположным эффектом на В-клеточный
ответ. Эту популяцию мы получили, смешав Т-хелперы (Н-2к),
те же, что исследовались в опыте, представленном на рис. 8.1,
с полусовместимыми В-клетками (H-2kxH-2d). По отношению
к ним взвесь Т-хелперов содержала, как и в предыдущем опыте,
истинные Т-хелперы, а также естественные аллореактивные
(Н-2канти-Н-2а) Т-клетки. При низкой дозе рассева распреде-
ление каждого из этих двух типов Т-клеток по микрокультурам
должно быть независимым, а при высокой — обеспечивать по-
падание Т-клеток обоих типов в одну и ту же микрокультуру.
В результате такого распределения В-клетки должны испыты-
вать в одних микрокультурах стимулирующее, а в других —
подавляющее влияние Т-клеток. Данные опыта действительно
оказались неоднозначными. Полученная в этом опыте кривая
«обратного титрования» или кривая в виде «зуба пилы»
(рис. 8.2) была фактически первым доказательством отсутствия
кооперации между Т-хелперами и В-клетками, различающимися
по аллелям комплекса Н-2 (даже при совместимости по неко-
торым антигенам МНС класса II). Отсутствие кооперации было
обусловлено интерференцией со стороны аллореактивных Т-кле-
ток [6]. Анализировать такие кривые совсем не просто. Для
этого было предложено несколько моделей [1, 7, 8]. По мнению
Тасуэлла (Taswell) [5], пригодность этих моделей еще необхо-
димо доказать, однако имеются предпосылки для их успешного
применения. Для удобства изложения мы назвали этот более
сложный вид АПР анализом по распределению в предельном
разведении.
Мы полагаем, что пока преждевременно применять анализ
такого рода при изучении малопонятных явлений. Важно не
забыть, что по меньшей мере на двух этапах эксперимента мы
254
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
Число внесенных в лунку Т-клеток
примированных ГМФ (х 10~
Рис. 8.2. Отклонение графика зависимости от одноударной модели. Кривая в-
виде «зубца». Определяли хелперную активность Т-клеток (имеющих гаплотип
Н-2к и полученных так же, как в опыте, результаты которого представлены
на рис. 8.1) в микрокультурах В-клеток, выделенных из селезенки. гибридов
1д (H-2kXH-2d). При высокой дозе Т-клеток аллореактивность отменяла проявг-
ление хелперной активности. При снижении дозы Т-клеток происходило неза-
висимое распределение Т-хелперов и аллореактивных, подавляющих образо-
вание антител клеток по разным лункам. В результате в некоторых микро-
культурах (светлые кружки) проявлялась активность Т-хелперов.
исходно делаем весьма существенные допущения, которые при
определенных обстоятельствах могут не соответствовать дей-
ствительности. В частности, главное допущение мы делаем при
оценке конечного результата эксперимента, произвольно вводя
критерий, разграничивающий ответившие и неответившие мик-
рокультуры. Вполне возможно, что доля неответивших микро-
культур, полученная ранее при работе с одной определенной
дозой исследуемых клеток, вместо того, чтобы согласно допу-
щению уменьшаться при увеличении этой дозы, будет возрастать
из-за снижения чувствительности системы. Рассмотрим гипоте-
тический пример. Мы внесли разные дозы Т-клеток в лунки,,
содержащие клетки-кормилицы, стимулировали их поликлональ-
ным митогеном конканавалином А (Кон А), а затем, добавив
255.
ГЛАВА 8
через некоторое время В-клетки, определили число лунок, в ко-
торых образовались клоны Т-хелперов. И в этом случае вопреки
допущению вполне возможно, что в некоторых микрокультурах,
содержащих определенную дозу Т-клеток, произойдет активация
слишком большого их количества. В результате не будут созда-
ны биологические условия, нужные для нормального ответа
В-клеток, которые смогут, например, давать в этих микрокуль-
турах только мелкие клоны с трудновыявляемой продукцией
антител каждого из них. Эти микрокультуры из-за слишком
малого содержания антител будут оценены как неответившие.
Вместе с ответившими микрокультурами они дадут зубчатую
кривую. Вероятно, подобным образом можно объяснить стран-
ные результаты, которые содержатся в ряде публикаций Айхма-
на (Eichmann) [8] и его сотрудников. Все упомянутое выше
вовсе не отменяет значения переменных факторов, действующих
в конкретной экспериментальной системе. Ее особенности необ-
ходимо знать, она должна быть оптимизирована с тем, чтобы
давать воспроизводимые результаты при повторных тестирова-
ниях. Кривые необычной конфигурации следует использовать
только для качественной интерпретации тех биологических про-
цессов, которые происходят в микрокультурах. Получив такие
кривые, можно изменить схему эксперимента и проверить новую
гипотезу.
3. Описание метода АПР
3.1. Введение
АПР весьма широко используется во многих областях кле-
точной иммунологии. Наш собственный опыт применения АПР
связан главным образом с исследованием функций Т-хелперов
при вторичном гуморальном иммунном ответе. Поэтому мы ог-
раничимся здесь в основном описанием метода оценок именно
этой функции в экспериментах на клетках мышей. Принципы
применения АПР для исследования других функций лимфоци-
тов очень сходны. В связи с этим, чтобы избежать скучных по-
второв в тексте, мы будем просто отсылать читателя к серии
подобранных нами литературных источников, в которых исполь-
зование АПР хорошо документировано.
3.2. Анализ в предельном разведении Т-хелперов
3.2.1. Получение Т-хелперов
Мышам СВА/Са вводят внутрибрюшинно 200—500 мкг ГМФ
в полном адъюванте Фрейнда (ПАФ). В любое время спустя
4 нед после первой иммунизации животных можно повторно
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
стимулировать, введя 100 мкг ГМФ в PBS. Через неделю после
этой бустер-инъекции взвесь клеток селезенки содержит доволь-
но много Т-хелперов, способных осуществить когнатную (кон-
тактную) или некогнатную (дистантную) помощь В-клеткам в
образовании антител. Для обогащения взвеси спленоцитов Т-
клетками ее фильтруют через найлоновую вату [9], как описано
ниже.
1. Замачивают найлоновую вату в 0,85%-ном растворе NaCl,
оставляют на 2 ч при 37 °C, затем ополаскивают дистиллиро-
ванной водой, отмывают бидистпллированной водой при 37 °C
(3—4 смены в течение недели), выжимают и высушивают при
37 °C.
2. Для приготовления колонки в цилиндр пластикового
шприца на 12 мл помещают 0,6 г ваты.
3. Приготовленную колонку стерилизуют автоклавировани-
ем, перед использованием промывают сбалансированным соле-
вым раствором (BSS),содержащим 5% СПК, а затем выпускают
из колонки избыток этого раствора.
4. На колонку наслаивают примерно 1 —1,5-10® клеток селе-
зенки, суспендированных в 2 мл подогретого до 37 °C • BSS.
После того как взвесь клеток впитается в вату, сверху наносят
еще 1 мл подогретого (37 °C) BSS.
5. Инкубируют 45 мин при 37 °C, затем элюируют неприлип-
шие клетки BSS.
6. Собирают первые 25% элюата, который обычно содержит
не более 5% В-клеток.
7. В элюате содержатся также эритроциты. При АПР с ис-
пользованием высоких доз Т-клеток примесь эритроцитов может
тормозить образование антител. Эритроциты устраняют гемо-
лизом, инкубируя выделенные клетки на льду в течение 10 мин
в 2 мл BSS Гея, в котором хлористый натрий заменен на хло-
ристый аммоний. Сразу после инкубации к взвеси клеток до-
бавляют избыток BSS и удаляют хлористый аммоний отмыва-
нием и наслаиванием на СПК с последующим центрифугирова-
нием. В качестве BSS мы обычно применяем среду Игла без
бикарбоната, изотонизированную в отношении мышиных клеток
прибавлением хлористого натрия и забуференную 20 мМ
Н Е Р Е S.
8. Обогащенную Т-клетками взвесь спленоцитов инкубируют
при 37 °C в течение 20 мин в BSS, содержащем 40 мкг/мл ми-
томицина С (Sigma Chemical Со., США), затем отмывают и
удаляют остаток митомицина С, нанеся взвесь на СПК с после-
дующим центрифугированием. Это очень важный этап метода,
так как обработка митомицином С предотвращает деление Т- и
В-клеток и тем самым образование антител В-клетками, содер-
жащимися в качестве примеси во взвеси Т-клеток. Фоновый
уровень образования антител добавленными В-клетками без
17—172
257
ГЛАВА 8
прибавления антигена остается постоянным при любой дозе
Т-клеток. При этом ответ в микрокультурах зависит только ог
присутствия единичных исследуемых клеток.
При использовании чувствительных методов определения
антител, радиоиммунометрических или иммуноферментных, лю-
бое увеличение дозы Т-клеток непременно вызовет параллельное
увеличение фоновой продукции антител. Полученные данные в
этих случаях могут отклониться от одноударной модели, что
затруднит интерпретацию результатов.
3.2.2. Получение В-клеток памяти
Мышей иммунизируют 200—500 мг гаптенпзированного
овальбумина (ТНФ’-ОВА или НИФ1 2-ОВА) в ПАФ, затем через
1—2 мес делают бустер-инъекцию раствора антигена без адъ-
юванта. Среди спленоцитов, полученных на 7—17-й день после
бустер-инъекции, содержится много В-клеток памяти, готовых
к синтезу IgG. В микрокультурах без Т-клеток и антигена они
дают «фоновый» ответ, улавливаемый чувствительными метода-
ми обнаружения антител. Для снижения «фонового» ответа
взвесь, содержащую В-клетки памяти, обычно обрабатывают
антителами к Thy-1 и комплементом, чтобы устранить примесь
Т-клеток. Мы предполагаем, что in vitro происходит освобожде-
ние остатков депонированного в селезенке антигена (конъюгата
ОВА) и если из взвеси не удалить ОВА-специфические Т-клет-
ки, то они будут вступать в кооперацию с В-лимфоцитами и да-
вать «фоновый» ответ.
3.2.3. Культуральная среда
По нашим данным, оптимальной средой может быть ориги-
нальная среда Мишелла — Даттона [10]. На 100 мл минималь-
ной среды Игла (МСИ) мы добавляем глутамин, пируват, за-
менимые аминокислоты, антибиотики, 20 мМ HEPES, 5—10%
СПК и 5-10 5 М 2-меркаптоэтанола.
3.2.4. Культивирование клеток
Смеси клеток на каждую группу микрокультур готовят до
распределения по лункам. При стандартном титровании Т-хел-
перов поступают следующим образом.
1. В ряд стерильных пробирок вносят равные дозы В-клеток.
2. К В-клеткам в небольшом постоянном объеме добавляют
антиген (например, ТНФ-ГМФ до конечной концентрации
0,01—0,1 мкг/мл) и, наконец, непосредственно перед распреде-
лением по лункам в пробирки добавляют Т-клетки, суспендиро-
1 2,4,6-триннтрофеип.|.
2 4-гидрокси-3-нитро-5-иодофенацетил.
258
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
ванные в постоянном объеме, но в разной концентрации с уче-
том всего диапазона доз. Из-за различия доз Т-клеток общее
число лимфоцитов, содержащихся в каждой пробирке будет
разным, что, однако, не вызовет отклонения кривых от одно-
ударной модели. Но нельзя исключить ситуацию, когда разли-
чия в количестве клеток имеют существенное значение. В этих
случаях необходимо добавить нейтральные клетки-кормилицы
для нивелирования общей концентрации клеток во всех про-
бирках. При титровании Т-хелперов такими клетками могут
быть нормальные спленоциты, обработанные митомицином С,
в других случаях — непролиферирующие клетки-кормилицы из
иных источников.
3. Взвесь клеток из каждой пробирки распределяют по
15 мкл на 60—120 лунок (одна группа) панелей Терасаки для
мнкроцитотоксического теста (Falcon Plastics Microtest 3034).
4. Для предотвращения высыхания в периферические канав-
ки панелей Терасаки вносят по 4 мл стерильной дистиллирован-
ной воды. Панели закрывают крышками и инкубируют при 37 °C,
поместив в герметичный контейнер, заполненный воздухом с
10% СО2 или газовой! смесью: 10% СО2, 7% О2 и 83% N2.
5. Инкубацию продолжают 3 дня.
6. Затем, удалив из канавок воду, каждую панель заливают
10 миллилитрами свежей культуральной среды, добавляя ее у
края панели, чтобы не суспендировать осевшие клетки.
7. Осторожно перемешав среду, ее избыток отсасывают, ос-
тавив полные лунки и не до конца опорожненные канавки. Бла-
годаря такому приему можно не «подкармливать» микрокуль-
туры ежедневно. Кроме того, с избытком среды из микрокуль-
тур удаляются антитела, синтезированные на ранней стадии
культивирования клетками, образующими антитела в исходной
взвеси спленоцитов. Устранение этих ранних антител снижает
фоновый ответ, помогая тем самым решить, к какой катего-
рии— ответивших или неответивших — относится данная мик-
рокультура.
8. Панели инкубируют еще 3—4 дня.
9. Из каждой лунки отсасывают по 10 мкл культуральной
надосадочной жидкости и переносят в 100—200 мкл разбавляю-
щей смеси (1% БСА, 5 мМ ЭДТА, 0,1% азида натрия в PBS
pH 7,6) и хранят в герметизированной коробке при 4 °C до мо-
мента выявления антител. Эти образцы могут храниться многие
месяцы без потери активности.
3.2.5. Радиоиммунологический анализ образцов
культуральной надосадочной жидкости
Радиоиммунометрическое выявление секретированных анти-
тел (радиоиммунологический анализ, РИА)—это весьма удоб-
ный способ оценки ответа в микрокультурах [11]. Для этой
17’ 259
ГЛАВА 8
цели подходит и фермент-зависимый иммуносорбентный анализ
(ELISA, от англ, enzyme-linked immunosorbent assay).
1. Гибкие полистироловые панели (Linbro-SMRC-96) с U-об-
разными лунками нагружают антигеном, например конъюгата-
ми НИФ15-БСА или ТНФ13-БСА. Для этого в каждую лунку
вносят по 50 мкл выбранного конъюгата и оставляют на ночь.
2. Затем отсасывают раствор с несвязавшимся антигеном и
собирают его для повторного использования в следующих
опытах.
2Ы)
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
3. Тщательно отмывают панели, заполняя их PBS, а затем
блокируют оставшиеся свободными адсорбирующие группы
полистирола, заполнив лунки на 2 ч разбавляющей смесью
(разд. 3.2.4 п. 9).
4. Вновь отмывают панели, а затем вносят в лунки по 20 мкл
разбавленных образцов культуральной надосадочной жидкости
и инкубируют в течение 2 ч.
5. Панели отмывают, в каждую лунку добавляют 20 мкл ме-
ченных радиоактивным иодом антител к IgG мыши (около
12 000 имп/мин) и инкубируют в течение 3 ч.
6. В заключение панели шесть раз отмывают PBS, раскален-
ной проволокой отделяют лункн и определяют их радиоактив-
ность в гамма-счетчике.
Один и тот же разбавленный образец культуральной над-
осадочной жидкости можно повторно исследовать 5—10 раз.
Данные, представленные на рис. 8.3, свидетельствуют о высокой
воспроизводимости повторных определений, сделанных с месяч-
ным перерывом. В этом отдельном опыте были исследованы три
группы микрокультур; в первой — В-клетки культивировались
без Т-хелперов (график а), во второй — была добавлена проме-
жуточная (график б), а в третьей — высокая доза Т-хелперов
(график в). Хорошая воспроизводимость метода позволяет осу-
ществить двойной отбор образцов надосадочной жидкости для
исследования ответа тестируемых микрокультур на два разных
антигена с определенной степенью достоверности (см. разд.
3.2.7). Нельзя не отметить то значение, которое имеет в данном
случае качество антиглобулинового реагента. Один из лучших
способов приготовления антител к IgG мыши описан в Hand-
book of Experimental Immunology [11].
Рис. 8.3. Радиоиммунометрический анализ. Оценка воспроизводимости опреде-
ления антител. Приготовлены три группы микрокультур. В первой группе
(контрольной) Т-клетки отсутствовали (график а), во второй группе было
добавлено по 3• 104 Т-клеток на луику (график б), а в третьей группе — по
1 • 105 Т-клеток на лунку (график в). В образцах культуральной надосадочиой
жидкости определяли антитела к ТНФ. Сделано по два определения общей
радиоактивности с интервалом в несколько недель или месяцев. Каждая точ-
ка графиков соответствует двум независимым определениям антител в одном
и том же образце. Вертикальная и горизонтальная линии — это те значения
счета, ниже которых лежат результаты 95% микрокультур контрольной груп-
пы (график а). По этим линиям удобно сортировать микрокультуры на «от-
ветившие» и «иеответившие». При увеличении дозы Т-клеток с 3-104 до 1 • 105
на луику произошло увеличение числа ответивших микрокультур. Определение
антител имело высокую воспроизводимость, позволяющую засевать одновре-
менно большое число микрокультур с отбором многочисленных образцов иад-
осадочиой жидкости, исследовать которые можно в произвольно выбранный
момент времени. Ордината — радиоактивность (имп/мии) образцов при пер-
вом определении. Абсцисса — радиоактивность (имп/мии) образцов при втором
определении.
261
ГЛАВА
3.2: 6. Оценка надежности системы
Применяя АПР для исследования Т-хелперов, мы должны
быть уверены, что среди добавленных в каждую микрокультуру
В-клеток содержится определенное число В-клеток памяти.
Только в этом случае в микрокультурах, не ответивших при тит-
ровании Т-клеток, действительно, не содержится ни одного
55
45
35
25
15
5
О
•|тлтрттгрт»
0 1000 3000 5000 7000 9000
О 1000 3000 5000 7000 9000
262
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИЙ
активного Т-хелпера. Для оценки надежности системы парал-
лельно титрованию Т-клеток мы протитровали в том же самом
опыте В-клетки. Рассмотрим представленные на рис. 8.4 гисто-
граммы, построенные по исходным данным такого титрования.
Полученные величины счета радиоактивности мы сгруппировали
в блоки 0—99, 100—199, 200—299 и т. д. Каждая из 60 микро-
культур дала точку, попавшую в зависимости от уровня радио-
активности в один из таких блоков. По оси ординат мы откла-
дывали число микрокультур (лунок), давших счет, попадающий
в определенный блок величин. Судя по гистограмме а, можно
отметить, что среди микрокультур, не содержащих В-клеток,
при дозе Т-клеток 105 на лунку нет ни одной дающей счет выше
200 имп/мин. С нарастанием дозы В-клеток столбики гистограм-
мы продвигаются вправо (гистограмма б), и уже при внесении
в лунку 20 000 В-клеток (гистограмма в) только 18 из 60 микро-
культур попадают в блок, давший счет менее 200 имп/мин. При
внесении в лунку 1,5- 10s В-клеток (гистограмма г) уже нет ни
одной микрокультуры, которая бы давала счет меньше
1200 имп/мин. Исходя из формулы Пуассона, в этой дозе В-
клеток должно содержаться не менее пяти В-клеток памяти. На
гистограмме д представлен счет микрокультур, содержащих
высокую дозу В-клеток (1,5-105), но без Т-клеток. В этом слу-
чае лишь 8 микрокультур дали счет, превышающий 200 имп/мин.
Здесь мы сталкиваемся с первой проблемой, которая присуща
любой системе АПР. Какой уровень ответа должен расцени-
ваться как положительный? Может ли это быть ответ любой
микрокультуры, давшей счет выше 900 имп/мин (т. е. выше
самого счета двух «фоновых» лунок)? Следует ли прибавить к
этой средней 2—3 ее стандартные отклонения (СО)? В связи
с тем что величины фоновой радиоактивности обычно не дают
нормального распределения, прибавлять СО, вероятно, не нуж-
но. Можно было бы анализировать данные, приняв, например,
Рис. 8.4. Возможность насыщения системы Т- или В-клетками иммунологиче-
ской памяти, позволяющая проводить титрование каждого из этих типов кле-
ток. Гистограммы (а—г) построены по результатам определения антител в
микрокультурах, содержащих «избыток» Т-клеток (1-Ю5 на лунку) и нара-
стающие дозы В-клеток: а — 0; б — 5-103; в — 2-104 и г—1,5-105. В качестве
клеток-кормилнц добавлены облученные и очищенные от Т-клеток спленоцнты
неиммунизированных мышей. Гистограммы д—з построены аналогичным обра-
зом по результатам определения антител в микрокультурах, содержащих «из-
быток» В-клеток и нарастающие дозы Т-клеток: д — 0; е—1,25-Ю3; ж—2,5-
• 105 и з — 5-105. В добавлении клеток-кормилиц эти микрокультуры не нуж-
даются. Отвечающие мнкрокультуры были обнаружены даже при самых низ-
ких дозах В- и Т-клеток. Самые высокие дозы давали 100% отвечающих мик-
рокультур. Эти два факта свидетельствуют о том, что система может быть
«насыщенной» по обоим типам клеток. Следовательно, существует уверенность
в том, что число неотвечающих микрокультур обусловлено распределением
титруемых клеток, а не вызвано, например, недостатком отвечающих или вспо-
могательных клеток либо клеток-кормилиц.
263
ГЛАВА 8
в качестве «положительных» 0; 1,7; 5 или 10% фоновых микро-
культур. Если не учитывать выскакивающие значения, получен-
ные при этом результаты мало различаются между собой. По-
этому для простоты мы часто используем 5%-ный предел
исключения для фоновых микрокультур, когда решаем, положи-
тельной или отрицательной считать данную микрокультуру.
В других биологических системах, например, при оценке актив-
ности цитотоксических Т-лимфоцитов (ЦТЛ), довольно часто
положительной считается микрокультура, счет которой превы-
шает фоновое освобождение метки (радиоактивного хрома) на
2—3 его СО.
3.2.7. Применение АПР для доказательства моногамности
межклеточных взаимодействий отдельной Т-клетки
Получив одноударные кривые и рассчитав частоту активных
клеток, мы можем охарактеризовать поведение отдельного Т-
хелпера статистически изолированного в предельном разведении
клеточной взвеси. Например, в свое время часто обсуждался
такой простой вопрос: сколько В-клеток могут вступать в ко-
оперативное взаимодействие с одним Т-хелпером? Много, мало
или может быть одна? Сейчас нам удалось показать, что это
именно одна В-клетка. По не вполне понятной причине наше
открытие [6, 12—15] до сих пор существенным образом не по-
влияло на современные представления о межклеточной коопе-
рации в иммунном ответе. Вероятно, теперь уже устаревшая
идея о решающей роли диффундирующих антигенспецифических
факторов в этой кооперации все еще заставляет специалистов
рассматривать наши данные как чрезмерно искусственные или
слишком умозрительные. При этом отклоняется наиболее веро-
ятное предположение о том, что необходимость непосредствен-
ного клеточного контакта при кооперации делает моногамию
неизбежной. Лишь теперь, спустя несколько лет, это представ-
ление начинает получать поддержку из других источников.
Возможно также, что в то время АПР просто не вызвал боль-
шого интереса у исследователей и полученные с его помощью
данные так или иначе не были восприняты всерьез.
Воспользовавшись описанной выше системой, мы приготови-
ли микрокультуры, содержащие В-клетки двух популяций —
определенное количество В-лимфоцитов от мышей, примирован-
ных ТНФ-ОВА, и определенное количество — от примированных
НИФ-СВА. Задачей было определение числа микрокультур, от-
ветивших как на тот, так и на другой конъюгат образованием
антител к ТНФ и к НПФ при лимитировании количества Т-хел-
перов. Мы протитровали Т-клетки, определили антитела к ТНФ
и к НПФ в надосадочной жидкости из лунок и проанализирова-
ли распределение ответивших и неответивших микрокультур.
261
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
Разумеется, результат анализа в высшей степени зависит от
того, насколько четко различаются эти два типа микрокультур.
Поэтому мы, заранее не выбрав какой-либо один определенный
предел исключения, выполнили расчеты, принимая за ответив-
шие поочередно 0; 1,7%, 5% и 10% «фоновых» (т. е. не содер-
жащих Т-клетки совсем) микрокультур. На полулогарифмиче-
ских графиках (рис. 8.5) можно заметить, что использование
разных пределов исключения мало отражается на рассчитанной
частоте Т-хелперов. На графиках рис. 8.6 (а—е) представлены
результаты РИА образцов надосадочной жидкости, полученной
Рис. 8.5. Полулогарифмические гра-
фики зависимости доли иеотвечающих
микрокультур от дозы Т-хелперов.
Исследовали ответ примироваиных
ТНФ и НИФ В-клеток на НИФ-ГМФ
и ТНФ-ГМФ при построении графи-
ков, принимая за «ответившие» после-
довательно 0; 1,7; 5 и 10% «фо-
новых» микрокультур (т. е. содержа-
щих В-клетки без Т-клеток) ,[см. 14].
После того как была доказана стати-
стическая значимость согласия с од-
ноударной моделью, полученные дан-
ные использовались при анализе от-
вета мнкрокультур на два антигена
одновременно (см. табл. 8.1); ч. с. с.—
число степеней свободы; НД — недо-
стоверно.
Число внесенных в лунку Т-хеллеров,
лримированных ГМФ (х Ю"4)
из всех вариантов микрокультур, каждая из которых охаракте-
ризована по содержанию антител к ТНФ (абсцисса) и НИФ
(ордината). Можно видеть, что по мере уменьшения дозы вно-
симых Т-клеток (на графике а их больше всего, а на графике е
их нет вообще) происходит снижение счета радиоактивности и
по абсциссе, и по ординате. При высоких дозах Т-клеток фак-
тически все микрокультуры оцениваются как ответившие на оба
конъюгата. Однако при низких дозах Т-клеток большая часть
ответивших микрокультур содержит антитела либо к ТНФ; либо
к НИФ, но не к обоим гаптенам.
Предположим, что число Т-хелперов, попадающих в каждую
лунку, распределяется по Пуассону и что существует некая по-
стоянная вероятность (Pt) восприятия каждого акта помощи
ТНФ-специфической В-клеткой и комплементарная вероятность
(1—Pt) восприятия помощи НИФ-специфической В-клеткой.
265
3500
2500
1500
500
1500
1000
500
200 600 1000 1400 1800 2200 2600
I n 11 > IГ |! IГ Г |1 > г >ртг’|’| > 1111 <111| 11 пу I птр > 11111 > I p 111J >11 ip r>
б :
200 600 1000 1400 1800 2200 2600
Рис. 8.6. Анализ по распределению в предельном разведении. Образование антител к НИФ и ТНФ в зависимости от добавляемой
в микрокультуры дозы Т-клеток: а— I-105; б — 2-104; в—1 • 104; г — 5-Ю3; д — 2,5-103 и е — 0 на лунку. 'Вертикальные и горизон-
тальные линии На графиках соответствуют 0, 1,7-, 5- и 10%-ному пределу исключения. Для ответа на ТНФ—это вертикальные ли-
нии, соответственно проходящие через отложенные на абсциссе величины счета 180, 159, 123 и 114 имп. за 200 с. Для ответа на
НИФ—это горизонтальные линии, соответственно проходящие через отложенные на ординате величины счета 564, 559, 477 и
453 имп. за 200 с. Определение антител к ТНФ и НИФ в образцах культуральной надосадочной жидкости было сделано в разные
дни. См. оценку согласия наблюдаемых частот с двумя различными моделями межклеточной кооперации, представленную в табл. 8.1.
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
Таблица 8.1. Наблюдаемая и ожидаемая частота микрокультур,
образующих антитела к НИФ и к ТНФ
Наблюдаемая частота Ожидаемая частота
модель (1Т:1В) модель (1Т:2В)
анти-ТНФ всего анти-ТНФ анти-ТНФ
— всего — всего
+38 аити-НИФ —22 всего 60 43 17 60 81 39 120 +40,5 -19,5 всего 60 «хи-квадрат от наблюд< 0,95 при 'и свободы 1 40,5 19,5 60 » откл 1емых 1сле ст 81 39 120 онения частот епеней + 24,2 — 32,5 всего 56,7 «хи-квадрат» от наблюда< 29,8 при чи< свободы 1 57,8 5,6 63,4 откл шых :ле ст 82 38,1 120,1 оиеиия частот епеией
В каждой матрице представлены результаты определения в 120 микрокультурах
(лунках). Здесь приведена одна матрица для группы микрокультур, содержащих по
1-Ю7 Т-клеток (при учете 5%-ного предела исключения). Такие же сопоставимые матри-
цы были получены для всех других групп микрокультур. Оценку согласия наблюдаемых
н ожидаемых (по двум моделям) частот проводили с помощью критерия G. При оценке
результатов тех групп микрокультур, в которых согласно модели 1Т:1В, ожидался слиш-
ком низкий ответ, кроме кпитерия G, пользовались точным критерием Фишера для таб-
лиц взаимной сопряженности признаков 2X2 [14, 15].
Тогда ожидаемые величины частот для ТНФ-, НИФ-, ТНФ+,
НИФ-, ТНФ-НИФ+ и ТНФ+НИФ+ клеток можно вывести путем
математического моделирования последовательных ситуаций,
когда один Т-хелпер помогает одной, либо двум, либо трем
В-клеткам и т. д. Согласие наблюдаемых величин с этими мо-
делями можно статистически оценить по критерию G (критерий
отношения логарифмического правдоподобия) [16]. Результаты
такого анализа уже опубликованы [14, 15], но мы считаем целе-
сообразным для примера представить матрицу по группе микро-
культур, содержащих 1-Ю4 Т-клеток (учет результатов при
5%-ном пределе исключения) (табл. 8.1). Как это видно, на-
блюдаемая частота Т-хелперов достоверно не отличается от
ожидаемой согласно модели 1Т: 1В (один Т-хелпер помогает
одной В-клетке), но достоверно отличается от ожидаемой в со-
ответствии'1 с моделью 1Т:2В (один Т-хелпер помогает двум
В-клеткам). Рассмотрение моделей с большим числом В-клеток,
получающих помощь от одного Т-хелпера, тем более лишено
смысла.
Описанный здесь отдельный эксперимент был неоднократно
повторен с тем же самым результатом. Мы обсудили его более
подробно, поскольку он представляется нам наглядным приме-
ром стратегии анализа по двум (и более) признакам, который,
возможно, следует считать одним из основных приложений
АПР помимо известного метода определения частоты тех или
267
ГЛАВА 8
иных клеток. Именно эту разновидность АПР можно рассмат-
ривать как способ исследования функций и специфичности от-
дельных Т-клеток и их клонов.
3.3. Обзор систем, позволяющих исследовать
с помощью АПР другие функции лимфоцитов
Рамки настоящей главы не позволяют изложить методы при-
ложения АПР к исследованию всех прочих функций лимфоци-
тов. Поэтому мы просто перечислим примеры из уже опублико-
ванных работ, отослав читателя за детальной информацией к
подобранной нами литературе.
3.3.1. Созревание В-клеток (клональная дифференцировка)
Первая серьезная попытка использовать АПР в клеточной
иммунологии была сделана в работе Лефковитса, опубликован-
ной в 1972 г. [17]. Тогда же появилось большое число статей,
излагавших результаты применения АПР в изучении роста и
созревания В-клеток. Эти материалы были достаточно полно
обобщены в ранее опубликованных обзорах [1, 18, 19]. Применяя
ряд поликлональных активаторов, способных вовлечь в обра-
зование антител В-клетки, находящиеся на самых различных
стадиях созревания, удалось определить частоту клеток, пре-
коммитированных для ответа на любой конкретный антиген.
Когда были разработаны подходы к определению частоты анти-
генспецифических предшественников на разных стадиях диф-
ференцировки В-клеток, появилась возможность проследить ди-
намику этой частоты под действием антигенов и толерогенов
[20, 21], а также ряда ростовых и дифференцировочных факто-
ров [1. 22]. Стало возможным, наконец, применить анализ по
распределению в предельном разведении для изучения взаимо-
действий между В-лимфоцитами и вспомогательными клетка-
ми [23].
3.3.2. Т-хелперы
Самая первая попытка применить АПР для изучения функ-
ций Т-хелперов была предпринята при исследовании так назы-
ваемой некогнатной помощи [24, 25]. В последующих работах
удалось отделить Т-хелперы некогнатного типа от Т-хелперов,
оказывающих контактную или классическую помощь, ассоции-
рованную с иммунологическим распознаванием [26—28]. Когда
было обнаружено, что некогнатную помощь способны оказывать
Т-лимфоциты, стимулированные митогенами (Шоберг (Sjoberg),
неопубликованные данные [22]), АПР удалось провести на ак-
268
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
т^вированных Кон А Т-лимфоцитах с отбором большого числа
образцов культуральной надосадочной жидкости, которые были
тестированы на многочисленных образцах В-клеток [29]. В этих
исследованиях впервые было выявлено большое разнообразие
факторов, выделяемых Т-клетками, и реакций, которыми В-клет-
ки отвечают на них; тем самым в известной мере была предска-
зана современная концепция множественности и плейотропности
Т-клеточных факторов.
Особенно элегантным было применение АПР для исследова-
ния Т-хелперов, осуществляющих когнатное взаимодействие н
распознающих антигены в ассоциациях с различными продукта-
ми главного комплекса гистосовместимости [30]. В отличие от
экспериментов, описанных в разделе 3.2, при исследовании ког-
натных Т-хелперов необходимо было, чтобы сначала Т-клетки
памяти размножились с образованием клона, а затем их следо-
вало тестировать в микрокультурах, содержащих В-клетки. Вы-
зывает удивление, что до сих пор никто не воспользовался этим
методом, чтобы определить, способен ли Т-хелпер к пролифера-
ции после того, как он оказал помощь В-клетке.
3.3.3. Т-супрессоры
В обширной литературе, посвященной супрессорным клеткам,
как это ни удивительно, нет сообщений об использовании АПР
в исследовании Т-супрессоров. Подходящая для этого модель
супрессорного эффекта до сих пор не предложена, однако тео-
ретические предпосылки для приложения к ней АПР в общих
чертах (хотя бы отчасти) существуют уже сегодня. Моделями,
как нам кажется, могут быть экспериментальные системы, в ко-
торых выявляются отрицательные последствия аллогенного эф-
фекта. Отметим, что при анализе результатов такого рода ис-
следований имеет смысл строить полулогарифмические графики,
откладывая по оси ординат не Fo, a F+, т. е. долю ответивших
микрокультур [1, 7, 31].
3.3.4. Цитотоксические Т-лимфоциты и их предшественники
Исследование цитоксических Т-клеток с помощью АПР —
это, по-видимому, самое значительное приложение этого метода
в иммунологии. Чаще всего целью исследований было опреде-
ление частоты клеток, реактивных в отношении определенных
трансплантационных или обычных антигенов, для оценки репер-
туара иммунологической специфичности, его онтогенеза и кло-
нальной природы, а также для выявления утраты определенных
клонов иммунокомпетентных клеток при толерантности [21].
Читатель найдет в литературе подробные описания методов
АПР, применяемых для исследования клеток человека [38—41]
и мыши [2, 21, 32—37].
269
ГЛАВА 8
3.3.5. Наблюдение за динамикой Т-клеток в процессе ,
лечения (мониторинг)
В настоящее время в клинической практике появляется все
больше новых методов лечения, основанных на избирательном
устранении Т-клеток. Чтобы применять терапию такого типа,
необходимо располагать высокочувствительными методами не-
прерывного анализа этих клеток. Это особенно важно при транс-
плантации костного мозга; требуется постоянный контроль (мо-
ниторинг) остаточных Т-клеток в костном мозге реципиента и
в трансплантируемом костном мозге, так как с ними связаны
такие клинические осложнения, как реакция «трансплантат про-
тив хозяина», отсутствие приживления трансплантата и реци-
дивы лейкозов. Как было показано, АПР пролиферирующих
in vitro под действием митогенов Т-клеток позволяет объектив-
но и с высокой чувствительностью вести такой мониторинг
[42—44].
4. Методы статистической обработки
результатов АПР
При АПР, прежде чем рассчитать частоту тех или иных кле-
ток, необходимо доказать, что полученный график достоверно
не отличается от одноударной модели. Надежность различных
подходов к решению этой задачи уже была исчерпывающе об-
суждена в двух статьях Тасуэлла [5, 45], описывающих лучшие
из имеющихся в настоящее время способы статистической об-
работки результатов АПР. Широкое применение нашел ряд
основанных на формулах Тасуэлла [2] компьютерных программ.
К ним мы добавим еще одну особо «дружелюбную» к потреби-
телям программу, в которой использованы некоторые из этих
формул (приложение 1). Она представляет собой гибридную
программу, которую первоначально записал и любезно нам
предоставил доктор Клаус Хег (из Мюнхена) и в которую док-
тор Б. Ловланд и мы внесли свои изменения. Мы надеемся, что
она окажется весьма полезной для тех, кому доступны микро-
компьютеры ВВС (фирмы Acorn Computers, Кембридж, Вели-
кобритания) .
МЕТОД ЛИМИТ ЦРУЮЩИХ РАЗВЕДЕНИИ
5} Приложение 1
5. )- Полная распечатка программ для статистической
оценки результатов метода лимитирующих разведений
на микрокомпьютерах ВВС
Исполняемый файп^ назывется 1ВООТ (выполнение программы начинается
нажатием клавиши BREAK, на экране выводится следующее:
•BUILD IBOOT
M0DE7
CHAIN"».MENU’
Escape
•ОРТ 4,3
Ниже распечатаны программы на BBC-диалекте Бейсика.
Они сохраняются на диске и защищены ключом файла L.
10 ПРОГРАММА "МЕНЮ"
20 M0DE7
30«DJR D
40»FX15,l
50 I»=INKEY»(20):IF I»<>” THEN GOTO 50
60 PRINT”” CLIMITING DILUTION ANALYSIS)"
70 PRINT” STEVE COBBOLD APRIL 1S86"
60 PRINT”” ENTER/ANALYSE DATA -PRESS ’ D”
90 PRINT” PLOT DATA FROM DISC-PRESS ’P”
100 PRINT” CHECK DATA ON DISC -PRESS ’C”;
110 I»=GET»
120 IF I»="P" THEN CHAIN"».PLOT"
130 IF t»=”D" THEN CHAIN"».LIMIT”
140 IF I»=»C" THEN CHAIN"».CHECK"
150 GOTO 20
10 ПРОГРАММА "МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИЙ"
20 ТРЕБУЕТСЯ МИКРОКОМПЬЮТЕР ВВС МОДЕЛЬ >_ВС ГИБКИМ ДИСКОМ
И ДВУХСТОРОННЕЙ ЗАПИСЬЮ
30 В КОМПЛЕКТЕ С ПРИНТЕРОМ,СОВМЕСТИМЫМ С ПРИНТЕРАМИ ФИРМЫ EPSON
40»FX5,l
50»FX6,0
60 VDU3
70«DIR D
80 ON ERROR GOTO 1840
90»FX15,1
100 I»=INKEY»<20>:IF t»<>”” GOTO 100
110 МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИЙ
120 РАЗРАБОТАНА ГРУППОЙ ВАГНЕРА, МАЙНЦ, ФРГ
130 ПЕРЕПИСАНА НА BBC-ДИАЛЕКТЕ БЕЙСИКА В МАРТЕ 1986 Г С.КОББОЛДОМ
140 M0DE7
150 PRINT’"LIMITtNG DILUTION ANALYSIS"
160 PRINT”DO YOU WANT A PRINTOUT <Y/N)":X»-GET»:P1S'O:IF X» = "Y" OR X»="y"
THEN P1S=1:VDU2
170 ВВОД ДАННЫХ/ОТКРЫТИЕ ФАЙЛОВ
180 PRINT”LIMITING DILUTION ANALYSIS"
190 INPUT”FILE NAME TO STORE DATA",NF»
200 IF LEN(NF»)>7 THEN PRINT’MAX SEVEN LETTERS"‘.GOTO 190
210 NF=OPENOUT(NF»>
220 INPUT”HOU MANY REPLICATES (NO OF HELLS)"’"PER DILUTION ";N
230 PRINT”ARE THERE SERIAL (2-F0LD)"”DILUTI0N STEPS (Y/N) "isX»=GET»
240 IF X»="Y" OR X»="y" THEN GOTO 310
ГЛАВА 8
250 INPUT’”H0W MANY DILUTIONS ";P:IF P<3 THEN GOTO 250
260 X1«="HOW MANY RESPONDER CELLS (ABSOLUTE)"tCHR«C10)*CHR«C13)+"PER WEL
IN DILUTION "
270 Y1«="HOW MANY NEGATIVE WELLS "
280 DIM RE(P):DIM NE(P):FOR l*=l TO P
290 PR I NT’XU ; IX;: INPUT RECI*)
300 PRINT’Yl»;:INPUT NEC I*):NEXT:G0T0 370
310 INPUT’"HOW MANY DILUTION STEPS";P:IF P<3 THEN GOTO 310
320 INPUT’"HOW MANY RESPONDER CELLS (ABSOLUTE)"PER WELL IN FIRST
DILUTION";RE
330 X1«=’HOW MANY NEGATIVE WELLS IN DILUTION «
340 RE=2«RE:DIM RE(P):DIM NE(P)sFOR I«=l TO P
350 PRINT XI»;I*;:INPUT NEC I*)
360 RE(I*)=RE/2:RE=RE( I*)-.NEXT-.GOTO 370
370 PRINT’"DATA CHECK"” ;N;"-FOLD DETERMINATION WITH"’;P;" DILUTION
STEPS"
380 PRINT'"RESPONDERS";TAB(15);"NEG. WELLS"
390 FOR I*=l TO P
400 PRINT;TAB(3);RE(I*);TAB(18);NE(I«):IF NECIXXl THEN NE < I *) = 1
410 NEXT
420 PRINT’INPUT CORRECT (Y/N) ?";X«=GET»
430 IF X»="N" OR X»="n" THEN GOTO 220
440 PRINT’"EVALUATION OF INDIVIDUAL POINTS"
450 DIM WNCP),CLICP),F(P),NPCP),SCP):FOR I*=l TO P
460 WNCI*)=NE(l*)/N:NP(I*)=WN(I»)»100
470 W=WN(I*):W=W»(1-W):S(I*)=SQR(W»N)
480 CLI(I*)=1.96*S(I*):CLI(I*)=1♦INTCCLI(I*))
490 FCI*)=-LN(WN(I*)):F(I*)=F(l*)/RE(I*):NEXT
SOO PRINT’"RESP0NDERS";TABC12);"NEGS 95*CL";TABC30);"FREQ"
510 PRINT»NF,P,N
520 DIM E1CP),E2(P):FOR I«=l TO P-.El C I*)=NE( I*)-CLI (I*)
S30 IF EICIXXO THEN E1CI«)-O
S40 E2CIXXNECI«)+CLICl«):IF E2(I*)>N THEN E2(I*)=N
550 PRINT REC I*);TABC12);El(I*);" TO ";E2(I*);TAB(26);F(I*)
560 PRINTINF.RECl«),NE(I*)
570 NEXT
580 F=O:FOR I« = l TO P:F=F+F(l«):NEXT
590 PRINT’AVERAGE FREQUENCY F=";F/P
600 PRINT" OR F= 1/";P/F
610 Ql=10:DD=0.5:F1=F/P:PRINT'"PRESS ANY KEY":X«=GET»:VDU3
620 PRINT’EVALUATION BY CHI-SQUARE"
630 F=F1:Q=Q1
640 GOSUB 770
650 FR=F;CI=CH
660 GOSUB 820
670 IF CG>CI AND CK>CI THEN VDU3: PR I NT" ITERATION RUNNING" -.GOTO 690
680 GOTO 1050
690 QA=QiQ=Q-DD:C9=CG:Cl=CKtF4=FK:F5=FG
700 GOSUB 820
710 PRINT "CHI(1)=";CK
720 PRINT "CHI(F)=";CI
730 PRINT "CHI(2)=";CG
740 IF CG<C9 AND CK<C1 THEN GOTO 690
750 IF CG>C9 THEN F2=FS ELSE F2=F4
760 GOTO 890
770 CH=O
780 FOR K«=l TO P
790 MM=F»RE(K*):A1=EXPC-MM)
800 A3=N»A1!A2=(NECK*)-A3)A2:A4=1-Al:A5=A3«A4
810 A=A2/A5sCH=CH+A:NEXT:RETURN
820 F=FR»Q:FG=F
272
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
830 GOSUB 770
840 CG=CH
850 F=FR/Q:FK=F
860 GOSUB 770
870 СК=СН
880 RETURN
890 PRINT’"READY":IF P1S=1 THEN VDU2
900 PRINT’"CORRECTION FACTOR Q=";QA
910 IF C9=CI AND C1=CI THEN 930
920 GOTO 990
930 Dl=DD»100
940 PRINT’"FREQUENCY ERROR IS SMALLER THAN";D1;"X"
950 Q=1+1.2»DD
960 PRINT’"ITERATION HAS TO RUN AGAIN":VDU3
970 DD=DD/5:F=F2:G0T0 640
980 F2=FR«Q
990 PRINT’FREQUENCY F=";F2
1000 MM=INT(1/F2!
1010 PRINT"F=1/";MM;"+/-";DD»MM;"(ITERATION ERROR!!"
1020 PRINT’"DO YOU WANT THE FACTOR CALCULATED"’"5 TIMES MORE ACCURATELY
IY/N!?":X»=GET»
1030 IF X»O"Y" AND X»O"y" THEN GOTO 1100
1040 Q=ltDD»5:F=F2:DD=DD/5:G0T0 640
1050 PRINT’INPUT FREQUENCY IS >= FACTOR 10 TIMES"
1060 PRINT’DIFFERENT FROM THE REAL VALUE;"
1070 PRINT"- FURTHER ITERATION NOT POSSIBLE"
1080 PRINT’FURTHER ITERATION FROM THIS DATA"’"NOT POSSIBLE"
1090 PRINT’PRESS ANY KEY TO ANALYSE MORE DATA":X»=GET»:CLEAR:GOTO 140
1100 VDU3:CLS:IF P1S=1 THEN VDU2
1110 PRINT’EVALUATION ACCORDING TO CHI-SQUARE"
1120 PRINT’"CALCULATED FREQUENCY: F=";F2;”" OR 1/" ;MM;" + /-" ;DD»MM;
"(ITERATION ERROR!"
ИЗО PRINT’"THE CHI-SQUARE VALUE IS ";CI
1140 DIM H(10!:H(3!=3.8:H(4>=6:H(5>=7.8:H(6!=9.5:H(7!=11.1:H(8!=12.6:
H(9> = 14.1:H(10! = 15.5
1150 PRINT'"FOR ";P;" DILUTIONS & ";P-2j" DEGREES OF FREEDOM"
’"WITH P10.05, CHI-SQUARE MUST BE <";H(P!
1160 DF=P-2:G0SUB 1690
1170 PRINT’"PROBABILITY ESTIMATION (n-2!: P= ";PV
1180 H(2!=3.8:H(31=6:H(41=7.8:H(5!=9.5:H(61=11.1:H(7!=12.6:H(8!=14.1:
H(9>=15.5 .
1190 PR1NT’"FOR »;P;" DILUTIONS & ";P-1;" DEGREES OF FREEDOM"
’"WITH P>0.05, CHI-SQUARE MUST BE <";H(P!
1200 DF=P-1:GOSUB 1690
1210 PRINT’"PROBABILITY ESTIMATION (n-11: P=";PV
1220 IF CI<H(P! THEN GOTO 1250
1230 PRINT”"THE EXPERIMENT IS REJECTED!!!"
1240 GOTO 1270
1250 PRINT”"THE EXPERIMENT IS ACCEPTED»»»"
1260 GOTO 1270
1270 PRINT’"PRESS ANY KEY":Xt=GET»(PRINT” "EVALUATION BY MAXIMUM
LIKELI HOOD":VDU3
1280 F=F2:Q1=2:Q=Q1:DD=.O5:F1=F:GOSUB 1370
1290 GOSUB 1450:LL=L
1300 F1=F»Q:GOSUB 1450
1310 LG=L:IF LG<LL THEN VDU3:PR I NT"ITERATION RUNNING":GOTO 1330
1320 Q=Q»2:GOTO 1300
1330 L2=LG:Q=Q-DD:F1=F»Q:GOSUB 1450
1340 LG=L:PRINT"L=";LL,"LG=";LG
1350 IF LG>L2 THEN GOTO 1330
1360 GOTO 1510
272
ГЛАВА 8
1370 DIM А5(Р),А6(Р),А7(Р),А8(Р):FOR I*=l ТО Р
1380 А5(I*)=O:FOR J*=l ТО N
1390 А5(I*>=А5(Iк)+ LN(N):NEXT
1400 A6(I*)=0:F0R J*=l ТО NEC 1*1
1410 А6( I*) =А6(I*) + LN(J*) :NEXT
1420 A7(I*)=0:F0R J«=l TO N-NE(I*)
1430 A7(I*)=A7(I*)+LN(Jk):NEXT
1440 A8(I*)=A5(I*)-A6(I*)-A7(I*>:NEXT:RETURN
14S0 L=O:FOR I*=l TO P
1460 A1=EXP(-F1»RE(1*)):A1=1-A1
1470 A2=N-NE(I*):A3=A2»LN(A1)
1480 A4=NE(I*)»F1»RE(I*)
1490 A9=A8(I*>-A4+A3:L=L+A9
1500 NEXT:RETURN
1510 F2=F1:IF P1S=1 THEN VDU2
1520 PRINT'"CALCULATED FREQUENCY F=";F2;’" OR F=1Z";1ZF2
1530 PRINT’"ITERATION ERROR +Z-";2»DDZF2
1540 PRINT’"DO YOU WANT THE FACTOR 5 TIMES MORE ACCURATELY (YZN)?":X»=GET»
1550 IF X»="Y" OR X»="y" THEN F=F2:Q=l+4»DD:DD=DDZ5:G0T0 1290
1560 VDU3:CLS:IF P1S = 1 THEN VDU2
1570 PRINT’"EVALUATION BY MAXIMUM LIKELIHOOD"
1580 PRINT'"CALCULATED FREQUENCY: F=";F2;’" OR 1Z";1ZF2;" + /- 1/";
2«DDZF2;’"(ITERATION ERROR)'
1590 F=F2:L=0:F0R I*=l TO P
1600 A1=EXP(-F»RE(I*)):A2=N-NE(I*)
1610 A3=A2»RE(I*)*2:A4=-A1»A3
1620 A5=(-1-Al)*2:A6=A4/A5:L=L+A6:NEXT
1630 V=-1/L:CL=SQR(V):CL=1.96»CL
1640 PRINT’"FREQUENCY F=";F;" +/-"';CL;" (95* CONFIDENCE LIMIT)"
1650 F1=F-CL:F2=F+CL
1660 PRINT’”0R FREQUENCY F=1Z";INT(1ZF);’"WITH 95* CL FROM 1Z" ,• 1NT( 1ZF1);
TO 1Z";INTC1ZF2)
1670 PRINTINF,F,Fl,F2:CLOSEINF
1680 PRINT'"DO YOU WANT TO PLOT THE DATA (YZN)?":X»=GET«:IF X«="Y" OR X«="y"
THEN CHA IN"».PLOT":ELSE CLEAR:GOTO 140
1690 АЛГОРИТМ ОПРЕДЕЛЕНИЯ P МЕТОДОМ "ХИ-КВАДРАТ" ПУТЕМ АППРОКСИМАЦИИ
ПО ХОКСУ К КРАЯМ НОРМАЛЬНОГО РАСПРЕДЕЛЕНИЯ
1700 DEF FNPZG(X):IF Х>1 THEN=EE ELSE=(1-X»(X-LN(ЕЕ+Х)))Z((1-X)*21
1710 EE=10*-21
1720 IF DF=2 THEN PV=EXP(-0.5»CI):RETURN
1730 IF DF=1 THEN PZZ2=SQR(CI):GOSUB 1750:PV=P2TAIL:ELSE
PZZ2=(CI-DF+2Z3-.08ZDF)»SQR((1+FNPZG((DF-1)ZCI))Z(2»CI)):GOSUB 175O:B”=P1T
AIL
1740 RETURN
1750 PZZ=ABS(PZZ2)
1760 PZZ22=PZZ2*2
1770 IF PZZ>=2.2 THEN P2TAIL=.7978846»(1.184+PZZ)»EXP(-.5«PZZ22)Z
(1.209 + 1.176»PZZ+PZZ22):GOTO 1800
1780 PZHT=PZZ»(1+PZZ22»(-.0075166+PZZ22»(3.1737E-4-PZZ22»2.96S7E-6)))
1790 P2TAIL=(1-SQR(1-EXP(-.6366198»PZHT»PZHT)))
1800 P1TAIL=.5»P2TAIL
1810 IF PZZ2C0 THEN P1TAIL=1-P1TAIL
1820 RETURN
1830 END
1840 CLOSE#O:PRINT” "ERROR AT ";EPL:REPORT:PR I NT’"PRESS ANY KEY TO RESTART":
X»=GET«:RUN
10 ПРОГРАММА КОНТРОЛЯ
.20 РАСПЕЧАТКА ДАННЫХ, СОХРАНЯЕМЫХ В ФАЙЛЕ, НАЗВАННОМ "РЕЗУЛЬТАТЫ
МЕТОДА ЛИМИТИРУЮЩИХ РАЗВЕДЕНИЙ"
30 ВСЕ ФАЙЛЫ ДАННЫХ ХРАНЯТСЯ В ОГЛАВЛЕНИИ D
40 ЗНАЧЕНИЯ ЧАСТОТ ВЫЧИСЛЕНЫ МЕТОДОМ МАКСИМАЛЬНОГО ПРАВДОПОДОБИЯ
274
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
50 ON ERROR GOTO 250
60«DIR О
70«FX5,1
। 80«FX6,0
90 CLS:PRINT’" (PRINT LIMITING DILUTION FILE>"
100 PRINT”"DO YOU WANT A CATALOGUE (Y/N)?":I»=GET»:IF I« = "Y" THEN »CAT
110 INPUT'"CHECK WHICH FILE",NS
120 NF-OPENIN(NS>
130 INPUT»NF,P,N
140 PRINT’"DO YOU WANT A PRINTOUT (Y/N)?":IS=GETS:CLS:IF IS="Y" OR IS="y"
THEN VDU2
150 PRINT”"FILE : ”;NS
160 PRINT’;?;" DILUTIONS OF ";N;" WELLS"
170 PRINT*"RESPONDERS";TAB(12>;"NO. NEG WELLS";TAB(28);"PROP NEGS”
180 FOR M = 1 TO P
190 INPUTSNF,RE,NE:PR I NT;TAB(1);RE;TAB(15);NE;TAB(26);NE/N
200 NEXT
210 INPUT»NF,F,F1,F2
220 PRINT” "CALCULATED FREQUENCY BY"’"MAXIMUM LIKELIHOOD = 1/";I NTC1/F);
""WITH 95% CONFIDENCE LIMITS"’"FROM 1 /" ; I NT < 1 /F2); " TO 1/
"; I NT 11/F1>
230 CLOSESNF
240 VDU3:PRINT” "PRESS ANY KEY FOR MENU":IS=GETS(CHAIN'S.MENU"
250 IF ERR=222 THEN PRINT’"FILE NOT FOUND"
260 GOTO 230
10 ПРОГРАММА ПОСТРОЕНИЯ ГРАФИКОВ
20 ГРАФИЧЕСКИЙ ОБРАЗ РЕЗУЛЬТАТОВ МЕТОДА ЛИМИТИРУЮЩИХ РАЗВЕДЕНИЙ
ИЗ ФАЙЛОВ, СОХРАНЯЕМЫХ НА ДИСКЕ
30 СОПРЯЖЕНИЕ СОВМЕСТИМЫХ ЛИНЕЙНЫХ ГРАФИКОВ (ПАРАЛЛ. ИНТЕРФЕЙС 21) И
40 ВЫВОД ИЗОБРАЖЕНИЯ С ЭКРАНА НА ПРИНТЕРЫ EG FX-80/RX-80)
50 M0DE4
6Q«DIR D
70 ON ERROR GOTO 510
80 MF=O
90 VDU 28,0,1,39,0
100 PRINT’PLOT TO SCREEN OR PLOTHATE"’"PRESS ’P’ OR ’S'•;il»=GET»:PRINT I»:
IF I»-"P" OR IS="p" THEN POUT=1 ELSE POUT=O
110 INPUT’"MAX. NUMBER OF CELLS PER WELL",MC
120 HC1=HC:N=O:REPEAT N=N+1:MC1=MC1/1O:UNTIL HCl<=10
130 MC=-< (MC1<=2)»2+(HC1>2 AND MCl<=5)»5t(MCl>5 AND MC1< = 1O)»1O)»1O''N
140 VDU5
150 IF POUT’l THEN «RUN’S.PLOTON"(REM FILE S.PLOTON MUST CONTAIN PROGRAM
FOR ACTIVATING THE PLOTHATE INTERFACE (IF REQUIRED)
160 X=200:Y=700:IF POUT=1 THEN X=300
170 PLOT 4,X,Y:VDUS
180 FOR H=0 TO 1000 STEP 200
190 PLOT 5,X+M,YiPLOT 5,X+M,Y»20:PL0T 5,XtH,Y
200 PLOT 4.X+M-12,Y+60:PRINT;MC»M/((10AN)»1000):PL0T 4,X»H,Y
210 NEXT MsPLOT 5,X,Y:PL0T 5,X-20, Y:PLOT 5,X,Y
220 FOR M=10 TO 1 STEP -1sMl=(1-LOG(H))«600
230 PLOT 5,X,Y-M1:PLOT 5,X-20,Y-Hl:PL0T 5,X,Y-H1
240 PLOT 4,X-125,Y-Hltl2iPRINTsM/10:PL0T 4,X,Y-H1
250 NEXT H
260 PLOT 4,X+80,Ytl00sPRINT;"No. cells per well x 10";(PLOT 4.X+840,Y+110:
PRINT;"~";N
270 VDU 23,255,0,0,0,2,0,0,0,0
280 IF POUT’l THEN PLOT 4,100,85(PRINT;"Freq of negative wells"
290 VDU 23,255,0,0,0,1,0,0,0,0
300 VDU4:INPUT’NAME OF FILE TO PLOT",NS
310 DATA "0","X","»","0","#"
ГЛАВА в
320 NF=0PENIN(N«):INPUT#NF,P,N
330 READ XN»:VDU5:F0R M = 1 TO P:INPUTINF,RE,NE
340 PLOT 4,Xt(1000«RE/MC)-3,Y-(1-LOG(10»NE/N))«600*6:PRINTjXN»
350 NEXT M
360 INPUTINF,F,Fl,F2
370 PLOT 4,X,Y
380 PROCpIotlF.O)
390 VDU 23,255,0,0,0,0,0,0,MF«16,0
400 PROCplotlFl,16):PR0CpIot(F2,16):CLOSE#NF
410 PLOT 4,0,Y+2S0-MF»40:PRINT;" FILE: ";N»;" ( ";XN»;” )”
420 VDU4:1F MF<2:PRINT"PL0T ANOTHER FILE IY/N) ?” ;: I »=GET» : PRINT I»:
IF I»="Y" OR !»="y” THEN MF=HF+1:GOTO 300
430 VDU5:IF HF=O THEN PRINT" FREQUENCY^ 1/";INTI1/F);’" WITH 95* CL
FROM 1/";INTI1/F2)TO 1/";INTI1/F1)
440 VDU4:IF POUT=O THEN PRINT’DO YOU WANT A SCREEN-DUMP?":I»=GET»:
IF I»="Y" OR I»="y" THEN «RUN H.SDUMP:REM FILE H.SDUMP MUST CONT
AIN MACHINE CODE FOR SCREEN DUMP TO PRINTER
450 IF POUT=1 THEN CALL &C03
460 CHAIN"».MENU"
470 END
480 DEF PROCplotlFF,SO)
490 PLOT 4,X,Y:M=O:REPEAT M=M*5O:M1=Y-11-L0G13.7))»MC»FF»0.6»M:
PLOT 5+S0,X+H,Hl
500 UNTIL H>=1000 OR H1<=1OO:ENDPROC
510 PRINT’ERROR AT ";ERL;" ";:REPORT
520 IF ERR=222 THEN PRINT’FILE NOT FOUND"
530 PRINT'PRESS ANY KEY";:I3-GETS:RUN
Ниже приведен машинный код, выводимый в шестнадцатиричной форме
с дисплея не принтер FX/RX-80 фирмы EPSON или на совместимые с ним
принтеры. Файл назван М. SDUMP. Оператор, не имеющий опыта записи
машинного кода (например, через программу на Бейсике), может выбрать
одну из многочисленных коммерческих готовых обслуживающих программ
для микрокомпьютера ВВС.
0000 4С Е6 09
0008 00 00 00
0010 4Е 6F 74
0018 68 69 63
0020 1В 03 СО
0028 00 00 00
0030 04 26 3F
0038 89 6F FF
0040 03 2F 09
0048 00 00 00
0050.06 33 09
0058 9D 03 09
0060 20 ЕЕ FF
0068 А2 03 А9
0070 10 F8 А2
0078 FF BD 1Е
0080 10 F2 60
0088 98 8D 2А
0090 С9 03 F0
0098 BD ЗВ 09
ООАО 09 8D 2С
00А8 4В ОА BD
ООВО 18 60 АО
00В8 ЕЗ FF С8
00 00 FF 03
00 00 00 FF
20 67 72 61
73 0D 07 08
4С 1В 40 1В
00 00 00 FF
00 10 84 49
02 01 2D 09
08 06 33 09
04 03 2D 09
А2 03 BD ОС
СА 10 F7 А9
А9 1D 20 ЕЕ
00 20 ЕЕ FF
02 А9 01 20
09 20 ЕЕ FF
А9 87 20 F4
09 С9 06 10
1Е 18 2А 2А
8D 2В 09 8D
09 BD 3D 09
ЗЕ 09 8D 4С
00 В9 10 09
СО ОЕ DO F5
00 L.......
03 ........
70 Not grap
41 hies...A
04 ...L.8..
00 ........
66 .&?...If
04
00 . /. . .3. .
08.......-. .
09 .3......
1A ........
FF ........
CA.........
EE.........
CA...........
FF ..‘. . .
22 ..«...."
AA ««.
3C
8D......=. .
OA K..>..L.
20 . ‘.....
38.......8
276
ООСО 60 А2 01 А9 01 20 ЕЕ FF '.......
ооса'во 25 oa 20 ее ff ca 10 .x. ...
0000 F2 A2 18 A9 01 20 EE FF ......
0008 A9 OA 20 EE FF CA DO F3 ......
OOEO A9 03 20 EE FF 60 20 83 .. . . '
00E8 09 90 01 60 A9 02 20 EE ...'..
OOFO FF 20 S3 09 A2 03 A9 01 .6...
00F8 20 EE FF BD 21 09 20 EE ...!..
0100 FF CA 10 F2 A9 00 8D 28 .....(
0108 09 AD 2A 09 DO 08 AD 2C ..•..
0110 09 49 03 8D 2C 09 A9 04 . I.. ,. . .
0118 8D 27 09 A2 03 AO 09 A9 . ’..
0120 09 20 Fl FF AD 2A 09 ........
0128 02 FO OD C9 OS FO 09 AD .....
0130 07 09 8D 08 .09 4C 41 OA.....LA.
0138 A2 07 AO 09 A9 OB 20 Fl .....
0140 FF AC 08 09 AD 28 09 29 .....(.)
0148 03 AA B9 33 09 EO 00 FO . . . 3.. ..
0150 OS 6A 6A CA DO FB 6A 2E .JJ...J.
01S8 29 09 6A 2E 29 09 38 AD ). j. ) .8
0160 05 09 E9 04 8D 05 09 AD .....
0168 06 09 E9 00 8D 06 09 CE .....
0170 27 09 DO A7 A9 01 20 EE >.....
0178 FF AD 29 09 20 EE FF 18 .. ). ..
0180 AD 05 09 69 10 8D 05 09 .. . 1. . .
0188 AD 06 09 69 00 8D 06 09 ...1...
0190 EE 28 09 AD 28 09 CD 2C .(..(..
0198 09 FO 03 4C 16 OA 18 AD ...L...
01A0 03 09 6D 2B 09 8D 03 09 ..пн...
01A8 AD 04 09 69 00 8D 04 09 ...1...
01B0 C9 OS FO 03 4C 04 OA A9 ....L..
01B8 00 8D 04 09 A9 01 20 EE ........
01C0 FF A9 OA 20 EE FF 38 AD.........8
01C8 OS 09 E9 10 8D 05 09 AD ........
01D0 06 09 E9 00 8D 06 09 AD ........
01D8 06 09 C9 FF FO 03 4C F4 ........L
01E0 09 20 Cl 09 60 •• • « »• .
6. Приложение 2 (на английском и русском
языках)
6.1. Example output from running
the limiting dilution analysis program
(N. B. Responses required from the keyboard are shown in BOLD.)
(limiting dilution analysis)
STEVE COBBOLD APRIL 1986
ENTER/ANALYSE DATA -PRESS ’D’
PLOT DATA FROM DISC-PRESS ’P1
CHECK DATA ON DISC -PRESS •C
COMMENT: This is the main
menu screen
1 Совокупность записей информации в память компьютера под произволь-
ным названием.— Прим, перев.
2 Средство стандартного согласования,— Прим, перев.
ГЛАВА 8
LIMITING DILUTION ANALYSIS
DO YOU WANT A PRINTOUT (Y/N) Y
LIMITING DILUTION ANALYSIS
FILE NAME TO STORE DATA? TEST
HOW MANY REPLICATES (NO OF WELLS)
PER DILUTION ? 96
ARE THERE SERIAL (2-FOLD)
DILUTION STEPS (Y/N) N
HOW MANY DILUTIONS ? 5
HOW MANY RESPONDER CELLS (ABSOLUTE) PER WELL IN DILUTION 1? 100000
HOW MANY NEGATIVE WELLS ? 12
HOW MANY RESPONDER CELLS (ABSOLUTE)
PER WELL IN DILUTION 2? 30000
HOW MANY NEGATIVE WELLS ? 32
HOW MANY RESPONDER CELLS (ABSOLUTE)
PER WELL IN DILUTION 3? 10000
HOW MANY NEGATIVE' WELLS ? 56
HOW MANY RESPONDER CELLS (ABSOLUTE)
PER. WELL IN DILUTION 4? 3000
HOW MANY NEGATIVE WELLS ? 78
HOW MANY RESPONDER CELLS : (ABSOLUTE)
PER WELL IN DILUTION 5? 1000
HOW MANY NEGATIVE WELLS ? 90
DATA CHECK
COMMENT: This is the data
entry program
96-FOLD DETERMINATION WITH
5 DILUTION STEPS
RESPONDERS
1OOOOO
30000
10000
3000
1000
NEG. WELLS
12
32
58
78
90
INPUT CORRECT (Y/N) ? Y
EVALUATION OF INDIVIDUAL POINTS
RESPONDERS NEGS 95*CL FREQ
100000 5 TO 19 2.07944154E-5
278
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
30000
10000
3000
1000
22 ТО 42
48 ТО 68
70 ТО 86
85 ТО 95
3.66204096Е-5
5.03905181Е-5
6.92131216Е-5
6.45385211Е-5
AVERAGE FREQUENCY F=4.83113972Е-5
OR F = 1/20699.0495
COMMENT: This is simply
PRESS ANY KEY Z
the arithmetic mean
of the individual
points
EVALUATION BY CHI-SQUARE
ITERATION RUNNING
COMMENT: The iteration is
READY
repeatedly run until
the desired accuracy
has been achieve'’
CORRECTION FACTOR Q = 1.5
FREQUENCY F=3.22075981E-5
F=l/31048+/-15524(ITERATION ERROR!>
DO YOU WANT THE FACTOR CALCULATED
5 TIMES MORE ACCURATELY (Y/N)? Y
ITERATION RUNNING
READY
CORRECTION FACTOR Q=1
FREQUENCY F=3.22075983E-5
F=1/31048+/-3104.8(ITERATION ERROR!>
DO YOU WANT THE FACTOR CALCULATED
5 TIMES MORE ACCURATELY (Y/N)? Y
ITERATION RUNNING
READY
CORRECTION FACTOR QM.04
FREQUENCY F=3.09688445E-5
F=1/32290 + /-645.8( ITERATION ERROR!>
DO YOU WANT THE FACTOR CALCULATED
5 TIMES MORE ACCURATELY (Y/N)? N
EVALUATION ACCORDING TO CHI-SQUARE COMMENT: Output of results
CALCULATED FREQUENCY: F=3.09688445E-5
from evaluation
by minimum
chi-square
OR 1/32290+/-645.8(ITERATION ERROR)
THE CHI-SQUARE VALUE IS 39.4339097
FOR 5 DILUTIONS & 3 DEGREES OF FREEDOM
WITH P>0.05, CHI-SQUARE MUST BE <7.8
PROBABILITY ESTIMATION (n-2): P= 3.06344784E-9
FOR 5 DILUTIONS & 4 DEGREES OF FREEDOM COMMENT: Checking for
WITH P>0.05, CHI-SQUARE MUST BE <9.5 goodness of fit
PROBABILITY ESTIMATION (n-1): P=7.94134996E-9
279
ГЛАВА 8
THE EXPERIMENT IS REJECTED!!!
PRESS ANY KEY Z
COMMENT: This particular example
did not sit the single
hit model
NOTE THAT, ALTHOUGH THE EXPERIMENT HAS BE£N REJECTED ON THE BASIS OF
NOT FITTING THE SINGLE-HIT MODEL, THE PROGRAM DOES NOT ABORT, BUT
CONTINUES TO ESTIMATE FREQUENCIES BY MAXIMUM LIKELIHOOD. THESE MUST
THEN, OF COURSE, BE TREATED WITH EXTREME CAUTION.
EVALUATION BY MAXIMUM LIKELIHOOD
ITERATION RUNNING
CALCULATED FREQUENCY F=3.25172868E-5
OR F=l/30752.8732
ITERATION ERROR +/-3075.28732
DO YOU WANT THE FACTOR S TIMES MORE ACCURATELY (Y/N)? Y
ITERATION RUNNING
CALCULATED FREQUENCY F=3.31676327E-5
OR F=l/30149.8756
ITERATION ERROR +/-602.997512
DO YOU WANT THE FACTOR 5 TIMES MORE ACCURATELY (Y/N)? Y
ITERATION RUNNING
CALCULATED FREQUENCY F=3.33666386E-5
OR F=1/29970.0552
ITERATION ERROR +/-119.880221
DO YOU WANT THE FACTOR 5 TIMES MORE ACCURATELY (Y/N)? N
EVALUATION BY MAXIMUM LIKELIHOOD
CALCULATED FREQUENCY: F-3.33686386E-5
OR 1/29970.0552 ♦/- 1/119.880221
(ITERATION ERROR)
FREQUENCY F-3.33666386E-5 +/-
9.78333686E-8 (95* CONFIDENCE LIMIT) COMMENT: This is the data
which is stored
on disk and used
OR FREQUENCY F= 1/29970 in the plot.
WITH 95* CL FROM 1/42402 TO 1/23174
DO YOU WANT TO PLOT THE DATA (Y/N)? Y
THE EXAMPLE DATA IS SHOWN PLOTTED AND SCREEN-DUMPED IN THE FOLLOWING
FIGURE.
280
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
FILE: TEST < О >
FREOUEHCV= 1x29978
WITH 95Х CL FROM 1x23174
TO 1x42482
(NB. Ответы, запрошенные с клавиатуры, выделены жирным шрифтом.)
(Метод лимитирующих разведений)
Стив Кобболд, 1986
Ввод/Данные анализа. —Нажмите клавишу «D»
Построение графика по данным, записанным на
диске. — Нажмите клавишу «Р»
Проверка данных, записанных иа диск.— Нажми-
те клавишу «С»
Метод лимитирующих разведений
Нужен ли вывод на принтер (Да/Нет)? Да
Метод лимитирующих разведений
Как назван файл для хранения данных? Проба
Сколько повторных микрокультур (число лунок)
приготовлено на одно разведение? 96
Сделан ли двукратный шаг при приготовлении
серии разведений (Да/Нет)? Нет
Сколько сделано разведений? 5
Каково абсолютное число отвечающих клеток иа
каждую лунку в первом разведении? 100 000
Нужно ли расчитать в 5 раз точнее (Да/Нет)? Нет
Каково абсолютное число отвечающих клеток на
каждую луику во втором разведении? 30 000
Сколько неответивших лунок? 32
Каково абсолютное число отвечающих клеток на
каждую луику в третьем разведении? 10 000
Сколько неответнвших лунок? 58
Каково абсолютное число отвечающих клеток на
каждую лунку в четвертом разведении? 3000
Сколько иеответивших лунок? 78
Каково абсолютное число отвечающих клеток на
каждую луику в пятом разведении? 1000
Сколько неответивших лунок? 90
Проверка данных
96-кратиое повторное определение в 5 последова-
тельных разведениях
КОММЕНТАРИИ:
Это перечень основных
режимов, выведенный на
дисплей
КОММЕНТАРИИ:
Это ввод данных в па-
мять
281
ГЛАВА 8
Число отвечающих клеток на каждую лунку
100 000
30 000
10 000
3000
1000
Верно ли сделан ввод данных (Да/Нет) ? Да
Число неответивших лу-
нок
12
32
58
78
90
Расчет значений отдельных точек на графике
Число отвечающих кле- Число неответивших лу- Частота
ток нок (95%-ный довери-
тельный интервал)
100 000 от 5 до 19 2,07944154-10~5
30 000 от 22 до 42 3,66204096-10-5
10 000 от 48 до 68 5,03905181 -10-5
3000 от 70 до 86 6,92131216 -10-5
1000 от 85 до 95 6,45385211-Ю-5
Средняя частота 4=4,83113972-10 5
или 4=1/20699,0495
Нажмите клавишу «Z»
КОММЕНТАРИЙ:
Это просто средняя
арифметическая отдель-
ных точек
Расчет по критерию «хи-квадрат» путем
(повторного исполнения программы)
итераций КОММЕНТАРИЙ:
Итерация — это повтор-
ное исполнение програм-
мы, пока ие будет до-
стигнута нужная точ-
ность расчета
Расчет готов
Коэффициент коррекции Q=l,5
Частота 4=3,22075981 • 10~5
4=1/31048+15524 (итерационная ошибка!)
Нужно ли рассчитать в 5 раз точнее (Да/Нет)? Да
Повторное исполнение программы
Коэффициент коррекции Q=1
Частота 4= 3,22075983-10-5
4=1/31048+3104,8 (итерационная ошибка!)
Коэффициент коррекции Q=l,04
Частота 4=3,09688445-10"5
4= 1/32290 ±645,8 (итерационная ошибка!)
Нужно лн рассчитать в 5 раз точнее (Да/Нет) ? Нет
282
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
Расчет по критерию «хи-квадрат»
Вычисленная частота 4=3,09688445-10-5
или 1/32290±645,8 (итерационная ошибка)
Величина критерия «хи-квадрат» 39,433097
Для 5 разведений и 3 степеней свободы при
Р>0,05, «хи-квадрат» должен быть <7,8. Оценка
вероятности (п—2):
Р=3,06344784-10-9
Для 5 разведений и 4 степеней
свободы при Р>0,05 «хи-квадрат»
должен быть <9,5
Оценка вероятности (п—1):
Р = 7,94134996-10-9
Опыт не подлежит учету!!!
Нажмите клавишу «Z»
КОММЕНТАРИИ:
Вывод сделан на основе
расчета по минимальным
значениям критерия
«хи-квадрат»
КОММЕНТАРИИ:
Проверка степени согла-
сия
КОММЕНТАРИИ:
Получены данные, не со-
гласующиеся с моделью
одиоударной кинетики
Отметим, что несмотря на отказ от учета резуль-
татов данного опыта, которые не согласуются
с моделью одиоударной кинетики, исполнение
программы не следует прерывать. Целесообразно
продолжить обработку полученных данных с
целью вычисления частот методом максимального
правдоподобия. Разумеется, использовать резуль-
таты таких расчетов надо с известной осторож-
ностью
Оценка методом максимального правдоподобия
Повторное исполнение программы
Вычисленная частота 4=3,25172868-10-5 или
4=1/30752,8732
Итерационная ошибка ±3075,28732
Нужно ли рассчитать в 5 раз точнее (Да/Нет)?
Да
Повторное исполнение программы
Вычисленная частота 4=3,31676327-10~5
или 4=1/30149,8756
Итерационная ошибка ±602,997512
Нужно ли рассчитать в 5 раз точнее (Да!Нет)?
Да
Повторное исполнение программы
Вычисленная частота 4 =3,33666386-10~5
или 4=1/29970,0552
Итерационная ошибка ±119,880221
Нужно ли рассчитать в 5 раз точнее (Да/Нет)?
Нет
283
ГЛАВА ft
Оценка методом максимального правдоподобия
Вычисленная частота 4 = 3,33666386-105 нли 1/29970,0552 +1/119,880221 (итерационная ошибка) Частота 4=3,33666386-10~5+9,78333686-10~6 (95°/0-ный доверительный интервал) или частота 4=1/29970 с 95%-ным доверитель- ным интервалом от 1/42402 до 1/23174 Нужно ли представить эти данные графически (Да/Нет)? Да По полученным данным построен график, выведен- ный на экран в виде представленного ниже изображения: КОММЕНТАРИИ: Эти данные можно запи- сать на диск и использо- вать для построения гра- фика
Файл: проба (0)
Частота =1/29970
с 95%-ным доверительным интервалом
от 1/23174 до 1/42282
Литература
1. Lefkovits L, Waldmann Н. (1979). Limiting Dilution Analysis of the Immu-
ne System, Cambridge University Press.
2. Taswell C. (1981), J. Immunol., 126, 1614.
3. Lefkovits Waldmann H. (1984). Immunol. Today, 5, 265.
4. Waldmann H., Lefkovits I. (1984). Immunol. Today, 5, 295.
5. Taswell C. (1987). Cell Separation: Methods and Selected Applications,
Vol. 4, Academic Press, New York.
6. Waldmann H. (1977). Immunol. Rev., 35, 121.
284
МЕТОД ЛИМИТИРУЮЩИХ РАЗВЕДЕНИИ
7. Corley R. В., Kindred В., Lefkovits I. (1978). J. Immunol., 121, 1082.
8. Eichmann К. (1981). J. Exp. Med., 152, 477.
9. Julius M., Simpson E., Herzenberg L. A. (1973). Eur. J. Immunol., 3, 645.
10. Mishell R. J., Duiion R. IF. (1967). J. Exp. Med., 126, 432.
11. Newby C. J., Hayakawa K-, Herzenberg L. A. (1986). In: Handbook of
Experimental Immunology, Weir D. (ed.), Blackwells, Oxford, p. 34.1.
12. Waldmann H., Lefkovits J., Feinstein A. (1976). Immunology, 31, 353.
13. Phillips J., Waldmann H. (1977). Nature, 268, 641.
14. Waldmann H., Kenny G., Feinstein A., Brown D. (1978). In: Cell Biology
and Immunology of Leukocyte Function, Quastel M. (ed.), Academic Press,
New York, p. 403.
15. Waldmann H., Phillips J. (1980). Springer Seminars Immunopathol., 3, 129.
16. Sokal R. R., Rohlf F. J. (1969). Biometry: Principles and Practice of Sta-
tistics in Biological Research, 599, Freeman, San Francisco.
17. Lefkovits I. (1972). Eur. J. Immunol., 2, 360.
18. Quintans J., Lefkovits I. (1974). Eur. J. Immunol., 4, 617.
19. Quintans J., Lefkovits J. (1974). J. Immunol., 113, 1373.
20. Desaymard C., Waldmann H. (1976). Nature, 264, 780.
21. Good M. F., Nossal G. J. V. (1983). J. Immunol., 130, 78.
22. Waldmann H., Poulton P., Desaymard C. (1976). Immunology, 30, 723.
23- Ketitnan J. R., Soederberg A., Lefkovits L (1986). J. Immunol., 137, 114.
24. Waldmann H., Lefkovits I., Quintans J. (1975). Immunology, 28, 1135.
25. Lefkovits I., Quintans J., Munro A., Waldmann H. (1975). Immunology, 28,
1149.
26. Marrack P., Kappler J. IF. (1975). J. Immunol., 114, 1116.
27. Waldmann H., Pope H„ Lefkovits I. (1976). Immunology, 31, 343.
28. Waldmann H.. Pope H. (1977). Immunology, 33, 721.
29. Lefkovits I., Waldmann H. (1977). Immunology, 32, 915.
30. Spoviero J. F., Jmperiale M. J., Zauderer M. (1981). J. Exp. Med., 152, 920.
31. Waldmann H„ Pope H., Kenny G. (1977). Immunology, 33, 129.
32. Teh H.-S., Phillips R. A., Miller R. G. (1977). J. Exp. Med., 146, 1280.
33. Ryser J. E., MacDonald H. R. (1979). J. Immunol., 122, 1691.
34. Langhorne J., Fischer Lindahl K. (1979). In: Immunological Methods, Lef-
kovits I. and Pernis B. (eds.), Academic» Press, New York, Vol. II, p. 221.
35. Stockinger H., Bartlett R„ Pfizenmaier K„ Rollinghoff M„ Wagner H. (1981).
J. Exp. Med., 153, 1629.
36. Reimann J., Kabelitz D., Heeg K-, Wagner H. (1985). J. Exp. Med., 162,
592.
37. Mizuochi T., Munitz T. I., McCarthy S. A„ Andrysiak P. M., Kung J.,
Gress R. E„ Singer A. (1986). J. Immunol., 137, 2740.
38. Moretta A-, Pantaleo G., Moretta L., Mingari M. C., Cerrottini C. (1983).
J. Exp. Med., 158, 571.
39. Moretta A., Pantaleo G., Moretta L-, Cerottini J. C.. Mingair M. C. (1983).
J. Exp. Med., 157, 743.
40. Kabelitz D., Herzog IV. R., Zanker B., Wagner H. (1985). Scand. J. Immu-
nol., 22, 329.
41. Sharrock C. E„ Man S„ Wanachiwanawin W„ Batchelor J. R. (1987). Trans-
plantation, in press.
42. Martin P. J., Hansen J. A. (1985). Blood, 65, 1134.
43. Kernan N. A., Collins N. H., Juliano L., Cartagina T., DuPont B., O’Reil-
ly R. J. (1986). Blood, 68, 770.
44. Rozans M. K, Smith B. R., Emerson S„ Crimmins M., Laurent G„ Rei-
chert T„ Burakoff S. J., Miller R. A. (1986). Transplantation, 42, 380.
45. Taswell C. (1984). J. Immunol. Methods, 72, 29.
Глава 9
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
С. Найт
1. Введение
Методы оценки пролиферации лимфоцитов в культуре со
временем подверглись прогрессивной миниатюризации. После
разработки соответствующих приемов автоматического рассева
и сбора клеток вместо пробирочных культур, объем которых
достигал 1 мл, стали использовать пробы по 200 мкл в микро-
панелях [1, 2]. В настоящее время лимфоциты удается культи-
вировать уже в 20-мкл висячих каплях при стимуляции мито-
генами, антигенами или аллогенными лейкоцитами. Интенсив-
ность пролиферации определяют по включению [3Н]-тимидина
с помощью специального устройства, в котором капли радиоак-
тивномеченных культур сами впитываются в фильтровальные
диски; клетки затем отмывают и обрабатывают для сцинтилля-
ционного счета [3]. Культуральная система в таком миниатюр-
ном виде имеет два преимущества — в 5—10 раз уменьшается
расход клеток и значительно проще и быстрее происходит их
сбор. Метод запатентован Британской технологической группой
в Лондоне.
Объем настоящей главы, разумеется, не позволяет нам до-
статочно глубоко изложить теорию лимфоцитарных культур.
Однако, исходя из особенностей динамики пролиферации лим-
фоцитов, мы предлагаем определенный ход анализа, результаты
которого хорошо поддаются интерпретации. Например, зависи-
мость интенсивности пролиферации от нарастающего количест-
ва антигенпрезентирующих клеток, отвечающих лимфоцитов,
концентрации антигена или продолжительности культивирова-
ния можно описать колоколообразными кривыми [4]. Кроме то-
го, эти факторы вступают во взаимодействие между собой
(рис. 9.8), а также могут взаимодействовать с другими перемен-
ными, анализируемыми в эксперименте [5, 6]. В большинстве
работ, выполненных на культурах объемом 100—200 мкл, ин-
тенсивность пролиферации обычно оценивается в каком-то од-
ном «стандартизованном» варианте условий культивирования.
В результате констатируется «усиление» или «ослабление» про-
лиферации под действием исследуемых факторов. Эти колеба-
286
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
ния, однако, могут просто отражать изменившуюся динамику
ответа культуры. Может, например, измениться сама зависи-
мость пролиферации от числа отвечающих и антигенпрезенти-
рующих клеток, дозы антигена и длительности культивирования.
Метод капельных культур объемом 20 мкл как раз и был раз-
работан для того, чтобы всегда была возможность анализиро-
вать природу любых изменений пролиферации лимфоцитов в
многофакторных экспериментах.
В висячих капельных культурах объемом 20 мкл в панелях
Терасаки удается успешно выращивать лимфоциты людей и жи-
вотных. Данный метод по сравнению с традиционным требует
более тщательного поддержания нужного pH на всех этапах
обработки клеток и влажности в СОг-инкубаторе во время куль-
тивирования. Однако сбор клеток для счета радиоактивности из
культур такого малого объема чрезвычайно прост. Чтобы со-
брать клетки, 60 капельных культур одной панели одновремен-
но «промокают» фильтровальными дисками с последующим
отмыванием, и на все это уходит меньше двух минут. Метод
позволяет проводить многофакторные эксперименты по иссле-
дованию динамики роста лимфоцитов в различных эксперимен-
тальных системах. Он уже был успешно использован для коли-
чественной оценки пролиферации лимфоцитов, отвечающих на
неспецифические митогены, гомологичные антигены и аллоген-
ные лейкоциты.
Многофакторные эксперименты, ставшие возможными бла-
годаря методу капельных культур, требуют привлечения неор-
динарных приемов статистического анализа. Таким приемом
может служить дисперсионный анализ [6]. Поэтому к описанию
самого метода капельных культур и его использования для изу-
чения пролиферативного ответа лимфоцитов на различные аген-
ты, мы добавим дисперсионный анализ данных, полученных в.
динамике.
2. Исходный вариант метода культивирования
в висячих каплях
2.1. Культуральные среды и добавки
2.1.1. Среда
Рекомендуется использовать Dutch-модификацию среды
RPMI 1640 (Flow Laboratories Ltd., Великобритания), содержа-
щую бикарбонат натрия и HEPES. Для культивирования лим-
фоцитов человека и кролика пригодна минимальная или моди-
фицированная Дюльбекко среда Игла. Однако RPMI 1640
287'
ГЛАВА 9
специально предназначена для выращивания лимфоцитов боль-
шинства видов животных, в том числе мышей и крыс. Наименее
устойчивый компонент этой среды — глутамин; его желательно
добавлять незадолго до использования. Для. хорошего роста
мышиных лимфоцитов в среду необходимо прибавить 2-меркап-
тоэтанол (10-5 М), а для крысиных — достаточно внести его в
два раза меньше. Пенициллин (100 ед./мл) и стрептомицин
(100 мкг/мл) задерживают рост бактерий, но не препятствуют
стимуляции лимфоцитов. Бикарбонат натрия — это обязатель-
ный компонент сред для культивирования лимфоцитов. В прин-
ципе можно применять среды, забуференные только одним би-
карбонатом натрия. Это имело место, например, в некоторых из
опытов, представленных на рис. 9.1—9.5. Однако при внесении
клеточных взвесей объемом 5 или 10 мкл в 20-микролитровые
капельные культуры неизбежно происходит нарастание pH, ко-
торое трудно заметить в столь малом объеме по изменению
цвета индикатора. В связи с этим в среду целесообразно добав-
лять HEPES, способный стабилизировать pH на длительное
время. Поэтому Dutch-модификация RPM.I 1640 в большей сте-
пени соответствует условиям культивирования. Стимуляция
лимфоцитов в капельных культурах возможна и в бессывороточ-
ной среде Искова и Мелхерса, содержащей трансферрин, очи-
щенный от липидов альбумин и соевые липиды [7].
2.1.2. Добавление сыворотки
Как и при традиционном культивировании, для роста лим-
фоцитов в капельных культурах к среде RPM.I 1640 необходимо
добавлять сыворотку крови [4, 8]. При культивировании лим-
фоцитов человека можно добавить 10% аутологичной сыворот-
ки или сборной сыворотки от доноров группы крови АВ. В по-
следнем случае пул не должен содержать сыворотки тех доно-
ров, которым ранее переливали кровь, а также сыворотки
многорожавших женщин (в тех и других сыворотках
могут содержаться блокирующие или стимулирующие антите-
ла). Для культур лимфоцитов кролика пригодна кроличья сы-
воротка (10%), но для выращивания мышиных лимфоцитов не
следует применять мышиную сыворотку в концентрации выше
2%. Практически универсальное применение имеет СПК, под-
держивающая рост лимфоцитов в концентрации от 5 до 10%.
Необходимо заранее выбрать те серии СПК, которые обладают
низкой собственной стимулирующей активностью, но способст-
вуют размножению лимфоцитов в ответ на действие изучаемых
стимуляторов.
Высокая «фоновая» пролиферация лимфоцитов под действи-
ем СПК может быть обусловлена присутствием в ней ксеноан-
тигенов, которые в культуре адсорбируются антигенпрезенти-
288
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
Сыворотка плода коровы
СКСД 2.5 СКСД 25 СКСД 250 СКСД 2500
"j I---1----1 I I I
Л 10 20 40 10 20 40
с
I---------------1---------------1 I I I I I I
10 20 40 10 20. 40 10 20 40
Аутологичная сыворотка
10 20 40 Ю 20 40
10 20 40 10 20 40 10 20 40
_2
Число лимфоцитов, внесенных в лунку (х 10 )
Рис. 9.1. Пролиферативный ответ ЛПК человека на бактериальный антиген —
стрептокиназу/стрептодомазу (СКСД). Исследовали лимфоциты двух доноров,
выделенные из дефибринированной крови после осаждения эритроцитов в 1%-
ной желатине [4]. Засевали с одним повтором от 10-103 до 40-103 клеток в
забуференную бикарбонатом натрия среду (50% среды Дульбекко и 50% сре-
ды RPMI 1640), содержащую 10% СПК или 10% аутологичной сыворотки.
Культуры стимулировали разными дозами СКСД (в ед./мл), и на 3-й или
5-й день добавляли на 2 ч [3Н] -тимидин в объеме 1 мкл (конечная концен-
трация 1 мкг/мл при уд. активности 1 Ки/ммоль). Вертикальной линией пока-
зано различие, достоверное при Р=0,001. Светлые кружки — донор 1, 3-й день;
светлые квадратики — донор 1, 5-й день; черные кружки — донор 2, 3-й день;
черные квадратики — донор 2, 5-й день.
19—172
289
ГЛАВА 9
рующими клетками и затем презентируются лимфоцитам;
в этом случае кинетика пролиферации такая же, как при сти-
муляции митогенами и антигенами. Пример этого приведен на
рис. 9.1. Лимфоциты периферической крови человека культиви-
ровали в количестве 10 000—40 000 клеток на лунку в присутст-
вии СПК (Ю%) или аутологичной сыворотки человека (10%).
В культурах, содержащих 40 000 клеток, включение [3Н]-тими-
дина в присутствии СПК на 5-е сутки достигало 300 имп/мин,
а в присутствии аутологичной сыворотки никогда не превышало
30 имп/мин.
2.2. Культивирование в висячих каплях
2.2.1. Закладка капельных культур
1. Используют гамильтоновские микрошприцы-дозаторы на
1, 5 и 10 мкл. Культивирование проводят в 60-луночных микро-
панелях для культуры ткани (панели Терасаки) с лунками
вместимостью 10 мкл (например, Nunc А/S, Дания или Gibco
Europe Ltd, Великобритания).
2. В лунки панелей Терасаки вносят клеточную суспензию в
обогащенной среде при соответствующей концентрации клеток
(разной для различных стимуляторов, см. ниже) и добавляют
стимуляторы пролиферации, например, митогены (разд. 3.2),
антигены (разд. 3.3) или аллогенные клетки (разд. 3.4).
3. Несмотря на номинальную вместимость лунки 10 мкл,
конечный объем культуры должен достигать 15—23 мкл. Если
внести в лунку меньше 15 мкл клеточной взвеси, то капля этой
взвеси не будет провисать ниже края лунки при переворачива-
нии панели. При внесении более 23 мкл, любое случайное встря-
хивание панели может вызвать слияние капель. Некоторые
авторы считают, что из-за слияния капель нельзя вносить в
лунки более 15 мкл взвеси [9, 10], но у нас этой проблемы не
возникало, хотя объем культур обычно достигал 23 мкл.
4. Необходимо строго следить за тем, чтобы величина pH
не поднималась до повреждающего клетки уровня; в процессе
закладки культур между этапами внесения реагентов может
возникнуть необходимость в повторном насыщении культур СОг.
Работа в ламинарном боксе с сильным воздушным потоком мо-
жет усилить защелачивание среды и подсыхание культур. В свя-
зи с этим, для предотвращения высыхания стимулирующего
агента, если он распределяется порциями по 1 мкл, следует
сначала вносить в лунки несколько больший объем среды или
клеточной суспензии.
5. После добавления всех компонентов панели переворачи-
вают. Культивирование лимфоцитов в перевернутых панелях
290
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
Терасаки, когда клетки располагаются в образуемых каплями
менисках, обеспечивает более благоприятные условия по срав-
нению с обычными культурами на дне лунок [11, 12].
2.2.2. Культивирование
1. Используют термостат на 37 °C с контролируемой атмо-
сферой (5% СОз в насыщенном влагой воздухе). Пластмассовые
коробки с негерметичными крышками тщательно моют горячей
водой, ополаскивают этанолом и заливают стерильным 0,85%-
ным раствором NaCl. Коробки помещают в термостат, и после
внесения 0,85%-ного NaCl вкладывают в них панели с культу-
рами. Опорой для перевернутых панелей Терасаки может слу-
жить сетка или перевернутая чашка Петри, дно которой нахо-
дится несколько ниже уровня 0,85%-ного NaCl. Таким образом,
капельные культуры висят в насыщенной влагой атмосфере не-
посредственно над 0,85%-ным раствором NaCl (рис. 9.2). В тер-
мостате с надежно регулируемой влажностью можно обойтись
без 0,85%-ного NaCl.
Рис. 9.2. Культивирование в висячих каплях объемом 20 мкл. а. Капельные
культуры в" перевернутых панелях Терасаки с клетками, расположенными в
менисках; б. Подставка для панели Терасаки; в. Уровень 0,85%-ного раствора
NaCl, залитого для поддержания влажности; г. Коробка с неплотно прилегаю-
щей крышкой (5) для доступа газовой смеси к культурам.
2. При воспроизведении метода капельных культур поддер-
жание стерильности не представляет собой проблемы. Однако
в природных очагах повышенной активности грибной флоры це-
лесообразно прибегать к более строгим мерам предупреждения
контаминации. Коробки моют перед каждым опытом и до окон-
чания эксперимента их не открывают, чтобы не внести ин-
фекцию.
3. Чтобы определить степень испарения в культурах, в пус-
тые лунки вносят среду с [3Н]-тимидином и определяют радио-
активность до и после культивирования в пробах по 5 мкл.
Увеличение счета свидетельствует о подсыхании. Успешная сти-
19* 291
ГЛАВА 9
муляция пролиферативного ответа получалась даже при поте-
рях объема капель до 20% за 7 сут культивирования, а также
при увеличении его на 12%.
2.3. Использование [3Н]-тимидина
Клетки импульсно в течение 2 ч метили [3Н]-тимидином в
концентрации 1 мкг/мл (уд. радиоактивность 2 Ки/ммоль,
Amersham International pic, Великобритания) [8]. Импульсное
включение метки обеспечивает присутствие достаточного коли-
чества [3Н]-тимидина без чрезмерного радиационного повреж-
дения клеток и точно отражает интенсивность пролиферации
лимфоцитов. При любом отклонении от традиционного метода
маркирования следует учитывать два главных фактора — коли-
чество добавляемого тимидина и его удельную радиоактивность
[6, 13].
2.3.1. Количество добавляемого тимидина
Добавленный в культуру тимидин способен альтернативно
включаться в синтезируемую клетками ДНК- В обычных куль-
турах, по-видимому, нет существенного эндогенного источника
тимидина, поэтому эффективная утилизация будет определяться
только добавленным его количеством. Следовательно, [3Н]-ти-
мидина должно быть достаточно, иначе включение метки будет
отражать не только уровень синтеза ДНК, но и доступность
этого предшественника. Количество имеющегося в культурах
тимидина снижается по двум главным причинам. Первая при-
чина— это утилизация тимидина стимулированными клетками,
а вторая — его распад [13]. Распад до тимина значительно воз-
растает после 4—6 ч культивирования. Поэтому, максимальное
включение [3Н]-тимидина при непрерывном мечении в течении
24 ч значительно ниже того уровня, который достигается при
импульсном мечении каждые 6 ч. Если время импульсного вклю-
чения метки составляет 2 ч, достаточно добавлять тимидин в
количестве 0,5—1 мкг/мл; при этом в нем не возникает дефици-
та даже при интенсивной пролиферации клеток. Это в 10 раз
ниже той концентрации тимидина, которая вызывает значитель-
ное торможение синтеза ДНК.
2.3.2. Удельная активность [3Н] -тимидина
При удельной активности 2 Ки/ммоль [3Н]-тимидин интен-
сивно включается в ДНК, оказывая минимальное радиационное
поражение клеток. Благодаря короткой траектории излучения
трития повреждаются только те клетки, которые сами включают
[3Н]-тнмидин. В результате известное правило о соответствии
292
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
степени повреждения общей прибавленной радиоактивности не-
зависимо от удельной нельзя распространить на культуры,
в которых имеется достаточно [3Н]-тимидина. Наоборот, степень
повреждения прямо пропорциональна именно уд. радиоактивно-
сти [3Н]-тимидина, поскольку только от нее зависит количество
трития, попавшего в клетку при прочих равных условиях. До-
бавление к культурам избытка [3Н]-тимидина с высокой удель-
ной активностью (более 10 Ки/ммоль) можно использовать для
уничтожения делящихся клеток. При количественной оценке
синтеза ДНК по включению [3Н]-тимидина его уд. активность
должна быть по возможности более низкой, чтобы свести к ми-
нимуму радиоактивное поражение клеток.
К счастью, повреждение клеток, пропорциональное уд. ак-
тивности добавленного [3Н]-тимидина, не связано с каким-либо
из параметров культуры (ни с концентрацией клеток, ни с дозой
стимулятора пролиферации, ни с продолжительностью культи-
вирования) [6]. Когда [3Н]-тимидин добавлен в избытке, из-за
радиационного повреждения клеток в какой-то мере, безуслов-
но, снижается его включение, но тем не менее оно прежде всего
отражает биологические эффекты стимулятора, а не артефакты,
обусловленные недостатками метода оценки пролиферации.
2.3.3. Добавление [3}А]-тимидина в культуры
1. [3Н]-тимидин добавляют в культуры в дозе 1 мкл с по-
мощью гамильтоновского микрошприца-дозатора с иглой № 25.
2. Панель держат под очень небольшим углом так, чтобы
стала доступной большая поверхность мениска, и вводят тими-
дин, стараясь не коснуться осадка клеток.
3. Для этого каплю объемом 1 мкл выдавливают на кончик
иглы и подносят к каждой капельной культуре сбоку, пока кап-
ля не сольется с культурой (рис. 9.3).
Рис. 9.3. Добавление [3Н]-тимидина к культурам. Тимидин (1 мкл до конеч-
ной концентрации 1 мкг/мл при уд. активности 2 Ки/ммоль) добавляют шпри-
цем-дозатором. Легче всего это сделать, держа культуральную панель под не-
большим углом и не касаясь иглой осадка клеток. Можно видеть, как выдав-
ленная из кончика иглы (№ 25) капля раствора тимидина сливается с вися-
чей каплей.
293
ГЛАВА 9
2.4. Сбор клеток
2.4.1. Нарезание фильтровальных дисков
Панель устройства для сбора клеток имеет 60 воронкообраз-
ных лунок для фильтровальных дисков, причем каждая лунка
сообщается каналом с расположенной под панелью вакуумной
камерой (рис. 9.4). На эту панель сверху помещают кусок
фильтра из стекловолокна («Титертек», Flow Laboratories Ltd,
Великобритания) и одновременно вырезают из него 60 дисков.
В самом первом устройстве для сбора клеток, которое было
изготовлено в Clinical Research Centre, одновременное выреза-
ние 60 дисков производилось краями лунок (рис. 9.4) на пане-
Рис. 9.4. Вырезание фильтровальных дисков иа панели сборщика клеток. Эта
панель (а) представляет собой поликарбонатяый блок с каналами (б), откры-
вающимися в лунки (е) для фильтровальных дисков. Поверх луиок иа панель
устройства помещают фильтр из стекловолокна (а), и бортиками (5) луиок
панели Терасаки (е) вырезают 60 фильтровальных дисков.
лях Терасаки (Nunc А/S, Дания или Falcon, США). Потребо-
валась работа высокой точности, чтобы изготовить серию пане-
лей, каждая из которых позволяет вырезать диски на панелях
Терасаки строго определенной марки. Но для сбора клеток
столь строгого соответствия не требуется — их можно собрать
любой панелью устройства со стандартных панелей Терасаки
любой марки. Модель устройства, которое производится фирмой
Flow Laboratories Ltd, Великобритания, имеет панель для вы-
резания дисков, изготовленную из металла.
2.4.2. Сбор клеток
1. Панель устройства для сбора клеток, заполненную фильт-
ровальными дисками, помещают на камеру, в которой можно
создавать вакуум и герметизируют смазкой или с помощью
штыкового затвора.
294
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
2. Готовят промывалки, заполненные 0,85%-ным NaCl, 5%-
ной трихлоруксусной кислотой (ТХУ) и метанолом.
3. Фильтровальные диски смачивают 0,85%-ным NaCl и соз-
дают слабое разрежение в камере с помощью вакуумного насо-
са. Достаточный вакуум обеспечивается простым водоструйным
насосом. Если смочены все фильтры без исключения, поток
жидкости через них при сборе клеток будет равномерным.
4. Перевернутую панель Терасаки опускают на устройство
для сбора клеток таким образом, чтобы все 60 капель одновре-
менно впитались в фильтровальные диски (рис. 9.5). После на-
несения культур на диски вакуум можно усилить, поскольку
клетки не смоются с фильтров даже в том случае, если панель
устройства сверху полностью покрыть промывающей жидкостью.
Рис. 9.5. Сбор клеток. Панель сборщика клеток с фильтровальными дисками
(косая штриховка) герметично соединяют с вакуумной камерой, присоединен-
ной шлангом к обычному водоструйному насосу, и создают вакуум. Панель
Терасаки опускают на панель сборщика клеток так, чтобы содержимое каж-
дой висячей капли впиталось в фильтровальный диск. Панель Терасаки затем
снимают, а фильтры промывают 0,85°/о-ным раствором NaCl, 5%-ным раство-
ром ТХУ и метанолом (по 20 мл каждого) из промывалок. Фильтры можно
перенести иглой во флаконы для сцинтилляционного бета-счета.
5. Фильтры отмывают 0,85%-ным раствором NaCl, ТХУ и,
наконец, метанолом (по 10—20 мл каждого реагента на панель).
Известно, что при сборе клеток из традиционных культур объ-
емом 200 мкл для отмывания почти всегда используют только
дистиллированную воду. Однако использование 0,85%-ного раст-
вора NaCl, а затем ТХУ для отмывания клеток, собранных из
капельных культур, способствует значительному увеличению
счета, особенно в случае культивирования клеток в высокой
концентрации (более 20 000 клеток на лунку). Если в культурах
имелась примесь эритроцитов, то метанол обесцветит фильтры,
и тем самым будет предотвращено весьма существенное гаше-
ние сцинтилляций, которое имеет место при радиометрии окра-
шенных образцов. Кроме того, метанол подсушивает фильтры.
6. С помощью иглы фильтровальные диски переносят в плас-
295
ГЛАВА 9
тиковые флаконы для бета-счета, добавляют по 0,5 мл сцинтил-
лятора и считают в жидкостном сцинтилляционном счетчике
либо непосредственно, либо поместив в стеклянные флаконы.
2.5. Планирование эксперимента и анализ данных
Для одновременной оценки нескольких переменных факторов,
действующих в лимфоцитарных культурах, необходимо экспери-
ментально исследовать симметричные сочетания градаций каж-
дого фактора друг с другом и результаты подвергнуть диспер-
сионному анализу [6, 14—16]. Это позволит количественно изме-
рить индивидуальные и совокупные эффекты, а также силу
влияния различных технических и экспериментальных факторов
на пролиферацию лимфоцитов. Во многих экспериментах боль-
шинство переменных представляют собой факторы с заданными
(фиксированными) градациями (например, число засеянных
клеток, дозы стимуляторов, сроки культивирования, типы и до-
зы добавок) и только повторы дают случайную дисперсию от-
вета [16]. Исходные данные перед статистическим анализом
целесообразно представить в виде десятичных логарифмов [14],
тогда результаты больших многофакторных экспериментов да-
дут распределение, близкое к нормальному, и могут быть объ-
ектом дисперсионного анализа [6, 15, 16]. Все расчеты удобно
осуществить с помощью подпрограммы CRSTAT 14, записанной
М. Дж. Хили на ФОРТРАНе из общей библиотеки подпрограмм
Clinical Research Centre. Результаты расчета позволяют соста-
вить таблицу частных средних для градаций каждого фактора
и для сочетаний всех изучаемых факторов, а также сумм квад-
ратов отклонений частных средних от общей для этих факторов.
Разделив суммы квадратов на соответствующие им числа степе-
ней свободы, можно получить средние квадраты отклонений
(вариансы) для каждого фактора (см., например, табл. 9.2).
По отношению факториальных варианс, т. е. по преобразован-
ному критерию Фишера (F), определяют достоверность влияния
каждого из факторов. Комбинируя результаты повторных куль-
тур, вычисляют случайную дисперсию и, разделив ее на общее
число степеней свободы для повторов, получают случайную ва-
риансу, которую можно использовать в качестве знаменателя
при вычислении F, когда факториальное влияние существенно
превышает случайные. В опытах с большим числом изучаемых
факторов достоверность влияния лучше оценивать по дисперсии
повторов, при межфакториальных взаимодействиях давших са-
мые высокие показатели. Другая программа — BMDP8V (BMDP
Statistical Software Inc., Калифорнийский университет, США) —
позволяет осуществить полный дисперсионный анализ. В любом
эксперименте, вычислив случайную дисперсию, можно опреде-
Оле
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
частных средних по
числа степеней сво-
а также требуемого
лить достоверность различий любых двух
критерию t Стъюдента:
, Xi ---X?
t = —, , где
t — это значение t по Стъюденту с учетом
боды для разности случайных дисперсий,
уровня вероятности, Xi и х2 — две сравниваемые частные сред-
ние; б2 — остаточная дисперсия и п — число вариант, представ-
ляемых каждой средней.
В том случае, когда влияние исследуемых факторов недосто-
верно, данные можно сгруппировать иначе и по соответствую-
щим частным средним построить графики, демонстрирующие
достоверное влияние. Если представить результаты опыта в де-
сятичных логарифмах, как, например, сделано на рис. 9.1, то
вычисленное значение t позволяет на графике (тонкая верти-
кальная линия) определить, какие из результатов имеют досто-
верные различия при выбранном уровне вероятности.
3. Результаты
3.1. Воспроизводимость метода
В табл. 9.1 представлены результаты эксперимента, в кото-
ром повторы в ряде случаев дали значительный разброс. Мы
выбрали его, чтобы проиллюстрировать некоторые проблемы
метода. Цель эксперимента — это оценка вспомогательной функ-
ции дендритных клеток, добавленных к культурам мышиных
лимфоцитов, стимулированных низкими дозами конканавалина
А (Кон А). Ранее было установлено, что добавление дендритных
клеток в капельные культуры лимфоцитов периферической кро-
ви повышает чувствительность отвечающих клеток (даже при
снижении их числа) к стимуляции субоптимальными дозами
кон А [17]. Взвесь клеток мышиных лимфатических узлов в пяти
различных концентрациях стимулировали двумя разными доза-
ми митогена. Культуры засевали с повторами, а весь опыт,
уместившийся на одной панели, был к тому же воспроизведен
на другой панели. Это позволило оценить воспроизводимость
повторов на той же самой и на разных панелях.
Две капельные культуры, указанные в таблице, смешались
между собой в процессе постановки. Имеются также случаи раз-
броса повторов на той же самой панели (например, 230 и 474,
594 и 910) и на разных панелях (например, 130 и 138 на первой
и 470 и 304 на второй). Во многих других экспериментах мы
обычно не наблюдали существенных различий между панелями,
297
ГЛАВА 9
Таблица 9.1. Влияние дендритных клеток на пролиферативный ответ
мышиных лимфоидных клеток, стимулированных конкаиавалииом А
(включение [3Н]-тимидина, имп/мии)
Концентра- ция Кон А (мкг/мл) Количество клеток в культуре (ю-3> Без добавления дендрит- ных клеток Добавлено 1000 дендрит- ных клеток на культуру
панель 1 панель 2 панель 1 панель 2
0 0 32 24 36 54 26 28 48 20
20 50 58 58 50 56 48 56 42
40 82 86 90 90 82 78 72 74
80 142 96 152 162 130 118 176 154
160 158 180 230 474 192 160 256 246
0,1 0 30 46 44 48 36 26 32 68
20 96 78 92 74 142 138 150 120
40 114 128 158 158 202 216 192 216
80 180 150 184 194 424 312 482 454
160 294 208 346 482 630 980 818 662
1 0 26 28 32 38 28 34 26 202
20 116 124 136 138 372 338 388 108
40 130 138 470 304 796 878 794 762
80 323 319 414 294 290 274 420 344
160 646 697 594 910 134 156 222 244
Клетки лимфоузлов мышей СВА культивировали в RPM 1640 (Dutch-модификация)
с добавлением Кон А и дендритных клеток [17]. Каждая капельная культура имеет по-
втор на той же самой панели; кроме того, эксперимент полностью воспроизведен на
второй панели. Подчеркнуты культуры, которые смешались в процессе постановки.
но в этом уровни счета на панели 2 были выше, чем на панели 1.
Различие между панелями достоверно превышает разброс пар-
ных проб на той же панели (Р = 0,01 согласно дисперсионному
анализу). Пользуясь столь чувствительным методом статистиче-
ской обработки, можно выявить подобное расхождение резуль-
татов, полученных на разных панелях в традиционных культу-
рах объемом 200 мкл. Однако, несмотря на общее увеличение
счета на панели 2, все эффекты изменения концентрации отве-
чающих клеток, дозы митогена и добавления дендритных клеток
на ней достоверно воспроизвелись. С помощью дисперсионного
анализа установлено, что культивирование на разных панелях
не оказывает достоверного влияния на зависимость пролифера-
тивного ответа от изменения концентрации отвечающих клеток
(Р = 0,2), дозы митогена (Р = 0,27) и добавления дендритных
клеток (Р = 0,37). Влияние же большинства этих факторов на
пролиферацию клеток имеет высокую достоверность (Р<0,001),
поэтому разброс повторов на разных панелях можно не рас-
сматривать как серьезное затруднение. Целесообразно, однако,
все ответственные сопоставления по возможности проводить на
культурах той же самой панели. Если такой возможности нет,
то при исследовании слабых влияний мы рекомендуем парал-
лельную постановку повторов на разных панелях. Наблюдаемый
298
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
межпанельный разброс результатов, по всей вероятности, обус-
ловлен теми неизбежными небольшими расхождениями в сроках
добавления тимидина и сбора клеток, которые всегда происхо-
дят при постановке опыта одновременно на нескольких панелях
и имеют существенное значение, так как время импульсной мет-
ки составляет лишь два часа. Этот разброс можно сделать ми-
нимальным, обратив больше внимания на стандартизацию всех
условий эксперимента.
Другая проблема, как видно из табл. 9.1, — это включение
метки от 24 до 54 имп/мин в культурах, не содержащих ни от-
вечающих, ни дендритных клеток. Это весьма высокий счет,
который мы наблюдали лишь в одном из имеющихся у нас
сцинтилляционных счетчиков. При использовании других счет-
чиков счет в таких контрольных «культурах» был ниже
10 имп/мин. В этой миниатюризованной системе следует по воз-
можности избегать высокого счета в контролях.
В недавно проведенном опыте мы культивировали клетки
мышиных лимфоузлов, стимулированные Кон А, в висячих кап-
лях в панелях, помещенных в пяти термостатах разных типов
с микропроцессорным контролем поступления газа и влажности.
Удачные результаты были получены во всех пяти случаях.
В этом эксперименте каждая культура была повторена пять раз,
что позволило проанализировать дисперсию ответа между па-
нелями. Оказалось, что между ними нет достоверных различий,
как нет и эффекта «краевых» лунок, часто наблюдаемого в куль-
турах объемом 200 мкл.
3.2. Ответы на митоген
Митогены, стимулирующие В- или Т-лимфоциты, способны
вызывать пролиферацию лимфоидных клеток разных видов жи-
вотных. В предыдущем разделе уже описан подобный ответ на
низкие дозы Кон А клеток мышиных лимфоузлов (табл. 9.1).
Пример подобного ответа лимфоцитов периферической крови
человека на Кон А, фитогемагглютинин и митоген фитолакки
приведен на рис. 9.6, где представлены нелогарифмированные
данные. Первые два митогена в первую очередь стимулируют
Г-лимфоциты, хотя в культурах неразделенных клеток позднее
стимуляция захватывает и часть В-клеток. Митоген фитолакки
в большей степени действует на В-лимфоциты [4, 8]. Для опти-
мального ответа на МФ необходимо присутствие большего ко-
личества ЛПК в культуре: в опыте, показанном на рис. 9,6, нам
не удалось достичь пика ответа даже в культурах, содержащих
80 000 клеток. Необходимость большей концентрации ЛПК в
этом случае, вероятно, обусловлена тем, что В-лимфоцитов
в периферической крови содержится в процентном отношении
299
ГЛАВА 9
_о
Число лимфоцитов, внесенных в лунку (х10 )
Рис, 9.6. Пролиферативный ответ ЛПК человека на митогены. Лимфоциты
выделяли и культивировали, как указано в подписи к рисунку 9.1; в среду
добавляли 10% аутологичной сыворотки. Клетки в разных концентрациях
культивировали в течение 1—3 сут с Кон А (5 мкг/мл), ФГА (Wellcome Diag-
nostics, Великобритания, неочищенный препарат в конечном разведении 1 : 120)
или МФ (Difco Labs., США, 1 мгк/мл). Различия в 2,1 раза достоверны прн
Р=0,001.
меньше, чем Т-лимфоцитов. Подобная зависимость ответа от
количества потенциально отвечающих клеток наблюдалась в
культурах мышиных лимфоцитов различного происхождения
объемом 200 мкл [18]. Далее, на рис. 9.7 в десятичных логариф-
мах представлены результаты анализа динамики пролифератив-
ного ответа. Можно заметить, что при ответе на одну и ту же
дозу ФГА пик включения метки в культурах, засеянных 40—
80-Ю3 клеток, приходится на второй день культивирования.
В культурах, засеянных 10—20-Ю3 клеток, он приходится на
третий день, а в культурах, засеянных 5-103 клеток, — на чет-
вертый. Подобная зависимость ответа от количества клеток
при разных дозах ФГА представлена в нижней части рис. 9.7.
Как можно заметить, более высокие дозы митогена вызывали
максимальный ответ в культурах, засеянных меньшим числом
клеток. Аналогичные закономерности ранее были установлены
на культурах большего объема [4, 8]. Дисперсионный анализ
результатов многофакторного эксперимента, в котором исполь-
зуются разные концентрации клеток, дозы митогена и сроки
культивирования, выявил достоверность влияния каждого из
этих трех факторов на пролиферацию лимфоцитов (Р<0,001),
а также достоверность их взаимодействия (Р<0,001). В опытах
300
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
Рис. 9.7. Стимуляция ЛПК чело-
века фитогемагглютинииом. ЛПК
человека культивировали, как в
опыте иа рис. 9.6, и стимулировали
ФГА (Wellcome Diagnostics, Вели-
кобритания, неочищенный препа-
рат), который перед добавлением
разводили средой 1/12; 1/25 или
1/100 (отмечено иа рисунке) и до-
бавляли по 1 мкл в луику. Вверху
приведены результаты, полученные
с разведением ФГА 1/25 на 2-й,
3-й и 4-п дни культивирования,
а внизу — с тремя разведениями
ФГА на 3-й день. Вертикальными
линиями показано расстояние меж-
ду точками на графике для дан-
ных, различающихся достоверно
при Р = 0,001.
Число лимфоцитов, 3
внесенных в лунку (х 10 )
такого рода каждая культура имеет лишь один повтор. Верти-
кальными линиями на графиках показано, каковы должны быть
различия, достоверные при Р = 0,001 по критерию t Стъюдента.
Динамика пролиферативного ответа лимфоцитов более нагляд-
но иллюстрируется результатами опытов по антигенной стиму-
ляции (рис. 9.8 и 9.9), поскольку основные взаимодействия раз-
личных культуральных факторов наблюдаются при всех типах
пролиферативного ответа, описанных в этой главе.
301
ГЛАВА 9
День 3
8-1
День 4
5 х 103
День 5
День 6
Доза СКСД
Рис. 9.8. Динамика пролиферативного ответа ЛПК человека на стрептокиназу/
стрептодомазу (СКСД). Условия выделения и культивирования ЛПК указаны
в подписи к рис. 9.1 (к среде добавляли 10% аутологичной сыворотки). В куль-
туры засевали от 5-Ю3 до 160-103 клеток и добавляли разные дозы СКСД
(в ед./мл). На 3-й, 4-й, 5-й и 6-й день культивирования иа 2 ч вносили [3Н}-
тимидин. Каждая культура имела один повтор.
302
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
иа СКСД. Компьютером по-
строены трехмерные графики
данных, представленных на рис.
9.8. Рельеф «возвышенностей»
отражает величину ответа в
нмп/мин. При построении гра-
фиков в виде плавных поверх-
ностей использованы алгоритмы
подгонки путем двумерных ин-
терполяций [21] и пакет про-
грамм «Джиносеф» (Computer—
Aides Design Centre, Cam-
bridge).
3.3. Ответы на антиген
Лимфоциты примированных индивидуумов способны давать
пролиферативный ответ на гомологичный антиген в капельных
культурах. Выше (рис. 9.1) уже описан эффект различных сы-
вороток на пролиферативный ответ ЛПК человека при стимуля-
303
ГЛАВА 9
ции стрептокиназой/стрептодомазой (СКСД; Варидаза, Lederle
Labs., США). Данные рис. 9.1 наглядно свидетельствуют и о
том, что для ответа in vitro необходима сенсибилизация донора
лимфоцитов антигеном; у донора 2 не было ответа на антиген,
по-видимому, из-за отсутствия свежей сенсибилизации. На рис.
9.8 представлены результаты более детального изучения стиму-
ляции лимфоцитов человека СКСД. На графиках можно просле-
дить динамику ответа на разные дозы антигена при засеве в
культуры от 5 до 160-103 ЛПК и продолжительности культиви-
рования от 3 до 6 дней. С изменением каждого из этих парамет-
ров включение [3Н]-тимидина возрастает, достигает плато и
снижается. Уровень «фонового» включения в нестимулирован-
ных культурах становится выше при увеличении концентрации
клеток и продолжительности культивирования. Трехмерное изоб-
Число отвечающих
клеток (х 1сГ3)
Рис. 9.10. Пролиферативный ответ мышиных
лимфоцитов на аллогеииые дендритные
клетки (СКЛ). Лимфоциты лимфоузлов мы-
шей СВА культивировали в разных концен-
трациях иа среде RPMI 1640 (Dutch-моди-
фикация), содержащей СПК (10%) и 2-мер-
каптоэтанол (10~s М). В культуры добав-
ляли от 125 до 500 аллогенных дендритных
клеток, выделенных из лимфатических уз-
лов мышей В10, как описано ранее [19].
Добавленные в том же количестве сингенные
дендритные клетки от SPF-мышей СВА не
вызывали достоверной стимуляции (данные
не представлены).
ражение этих данных (рис. 9.9) еще нагляднее демонстрирует
динамику наблюдаемого ответа.
In vitro возможна первичная стимуляция ответа на некото-
рые антигены, в частности на те, которые вызывают контактную
сенсибилизацию; такого рода ответ дают клетки лимфатических
узлов мыши на пикрилхлорид или флуоресцеинизотиоцианат
[19].
3.4. Ответы в смешанных культурах лимфоцитов (СКЛ)
В первичной СКЛ аллогенные лимфоциты стимулируются
главным образом дендритными клетками. Пролиферативный от-
вет начинается после агломерации лимфоцитов вокруг дендрит-
ных клеток, и присутствие всего лишь одной дендритной клетки
304
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
Рис. 9.11. Вторичная реакция в смешанной
культуре лимфоцитов. ЛПК человека, вы-
деленные в градиенте плотности фиколла,
примировали в массовых культурах (см.
текст) обработанными митомицином В-клет-
ками гомозиготной по HLA-DW2 линии.
Примированные (вверху) н непримирован-
ные (внизу) ЛПК в разных концентрациях
культивировали в течение одного, двух или
трех дней в присутствии 80-103 тех же об-
работанных митомицином В-клеток. Дру-
гие условия эксперимента обсуждаются в
тексте.
Число лимфоцитов,
внесенных в лунку (х 10 F
на 3-103 аллогенных лимфоцитов может вызывать достоверную
стимуляцию включения [3Н]-тимидина. На рис. 9.10 показана
стимуляция клеток лимфоузлов мышей СВА при добавлении
125—500 аллогенных (В10) дендритных клеток. Такое же коли-
чество сингенных дендритных клеток не вызывает достоверного
ответа в сингенной СКЛ, если донорами клеток служат мыши
в SPF-статусе (свободные от специфических патогенных возбу-
дителей) [17]. В этой системе достоверную стимуляцию включе-
ния тимидина можно обнаруживать при добавлении всего лишь
25 аллогенных дендритных клеток к 50-103 или 100-103 клеток
лимфоузлов.
В капельных культурах, особенно в СКЛ, можно гораздо
раньше, чем в традиционных, выявить пролиферативный ответ.
На рис. 9.11 представлены первичный и вторичный ответы ЛПК
человека в культуре при стимуляции В-клетками перевиваемой
линии. Демонстрируется возможность раннего выявления ответа
и использование примированных лимфоцитов для типирования
по HLA. Для примирования использована линия клеток челове-
ка, гомозиготная по HLA DW2 (НОМ1). Эти клетки обрабаты-
вали в течение 25 мин митомицином С (Sigma, США) в кон-
центрации 50 мкг/мл и дважды отмывали перед использованием.
Лимфоциты примировали в массовой культуре, помещая 8-10&
обработанных митомицином стимулирующих клеток и 40-Ю6
305
ГЛАВА 9
Таблица 9.2. Дисперсионный анализ результатов оценки пролиферативного
ответа в смешанных культурах лимфоцитов
Факторы:
А. Повторение — каждая культура повторена один раз
Б. Концентрации отвечающих лимфоцитов (КОНЦ):
5, 10, 20, 40, 80, 160-103 клеток иа лунку
В. Источник стимулирующих клеток (СТИМ):
посторонние, материнские, отцовские, СИБС 1, СИБС 2
Г. Источник отвечающих лимфоцитов (СИБСЫ):
СИБС 1, СИБС 2
Д. Продолжительность культивирования (ДНИ):
3, 4 и 6 дней
Источник дисперсии Суммы квадратов отклонений Число сте- пеней сво- боды Средний квадрат от- клонений варианса) F Р
КОНЦ 11,0100 5 2,2020 210,82 <0,001
СТИМ 5,1853 4 1,2963 124,11 <0,001
СИБСЫ 2,3980 1 2,3980 229,59 <0,001
ДНИ 22,8130 2 11,4065 1092,07 <0,001
конц/стим 1,2937 20 0,0647 6,19 <0,001
КОНЦ/СИБСЫ 0,3807 5 0,0761 7,29 <0,001
КОНЦ/ДНИ 21,2319 10 2,1232 203,28 <0,001
СТИМ/СИБСЫ 0,0442 4 0,0111 1,06 >0,25*
СТИМ/ДНИ 0,1838 8 0,0230 2,20 <0,05
СИБС/ДНИ 0,1502 2 0,0751 7,19 <0,005
КОНЦ/СТИМ/СИБСЫ 0,3376 20 0,0169 1,62 >0,05*
конц/стим/дни 1,4601 40 0,0365 3,49 <0,001
КОНЦ/СИБСЫ/ДНИ 0,8576 10 0,0858 8,21 <0,001
СТИМ/СИБСЫ/ДНИ 0,0738 8 0,0042 <1,00 >0,25*
КОНЦ/СТИМ/СИБ- 0,5353 40 0,0134 1,28 >0,1*
сы/дни
Случайная дисперсия 1,8801 180 0,0104
* Не достоверно.
ЛПК в культуральные флаконы (25 см2) со средой Дюльбекко
(10 мл) и аутологичной сывороткой (15%)- Равное количество
лимфоцитов культивировали во флаконе без стимулирующих
клеток. Через 6 дней культуры подкармливали, добавляя 10 мл
среды, и через четыре дня клетки собирали, переносили в све-
жую среду и рестимулировали обработанными митомицином
стимулирующими клетками в висячих каплях. На рис. 9.11
представлены графики включения метки на 1-й, 2-й и 3-й день
культивирования примированных и непримированных ЛПК по-
сле рестимуляции клетками линии НОМ1, гомозиготной по DW2,
обработанными митомицином. После примирования клетки ста-
новятся более чувствительными к стимуляции, поскольку ответ
удается получить при меньшем количестве примированных кле-
306
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
Рис. 9.12. Смешанная культура лимфоцитов
человека. График построен по некоторым
данным из табл. 9.2. Лимфоциты выделяли
в градиенте плотности фиколла и культиви-
ровали в среде RPMI 1640 (Dutch-модифи-
кация), содержащей 10% СПК. Разные ко-
личества лимфоцитов культивировали без
добавления (светлые кружки) илн с добав-
лением 80-103 обработанных митомицином
стимулирующих клеток — аутологичных
(черные квадратики), HLA-идентичного сиб-
са (черные треугольники) или неродствен-
ного донора (черные кружки).
Число лимфоцитов, внесенных
в лунку ”'0 )
ток в культуре. Кроме того, ответ выявляется раньше при малых
количествах отвечающих клеток. В этом же опыте сходный
ответ был получен при рестимуляции клетками другой линии,
PGF, также гомозиготной по DW2. Для рестимуляции культур
использовались, кроме того, клетки третьей линии PRIESS, го-
мозиготной по DW4 (PRIESS). В этом случае стимуляция при-
мированных и непримированных ЛПК на третий день культиви-
рования достоверно не различалась (данные не представлены).
Описанный метод применялся также в СКЛ при использо-
вании в качестве стимулирующих клеток нормальных ЛПК [Ю,
20]. В табл. 9.2 и на рис. 9.12 приведены результаты опыта, в ко-
тором исследовали способность ЛПК двух детей из одной семьи
отвечать на обработанные митомицином клетки других членов
семьи и постороннего лица. Эти сибсы были идентичны по
HLA-A, В, С, и DR. Предполагалось, что благодаря этому про-
лиферативный ответ будет сходным.
В эксперименте была использована среда RPMI 1640, содер-
жащая бикарбонат натрия, HEPES и СПК (10%). СПК вызы-
вала небольшую «фоновую» стимуляцию, которая, однако, не
помешала выявить влияние генетических факторов. В табл. 9.2
описаны условия постановки опыта и подробно изложены ре-
зультаты дисперсионного анализа. ЛПК исследуемых сибсов
сходным образом отвечали на стимулирующие клетки других
членов семьи (СТИМ), поскольку не обнаружено достоверного
взаимодействия СТИМ/СИБСЫ. Это подтверждается также
отсутствием достоверного влияния изменения концентраций от-
вечающих клеток (КОНЦ), поскольку не выявлено достоверно-
го взаимодействия КОНЦ/СТИМ/СИБСЫ. Недостоверным ока-
307
ГЛАВА 9
залось и влияние продолжительности культивирования (ДНИ),
так как отсутствовало взаимодействие СТИМ/СИБСЫ/ДНИ.
Таким образом, «типирование» в СКЛ подтвердило сходство
между двумя исследованными популяциями отвечающих клеток.
Поскольку у этих двух сибсов наблюдались сходные реакции
на различные стимулирующие клетки, на рис. 9.12 приведены
результаты оценки пролиферации ЛПК одного из них, получен-
ные на 3-й день культивирования. Ответ этих ЛПК на стимуля-
цию ЛПК другого сибса достоверно не отличался от ответа на
•стимуляцию сингенными ЛПК- Наиболее высокий ответ наблю-
дался при стимуляции клетками постороннего индивидуума,
а клетки матери или отца стимулировали промежуточный уро-
вень пролиферации (эти данные не приведены).
Данный эксперимент дал важную дополнительную информа-
цию. Как и следовало ожидать, исходя из изложенного выше
(разд. 3.1 и 3.2), концентрация отвечающих лимфоцитов и про-
должительность культивирования не только влияют на проли-
ферацию, но и взаимозависимы: влияние факторов КОНЦ, ДНИ
и КОНЦ/ДНИ во всех случаях было достоверным (Р<0,001).
Ответ зависит от источника стимулирующих клеток, от которого
в свою очередь зависят необходимые для ответа количество от-
вечающих клеток и продолжительность культивирования (влия-
ние СТИМ, КОНЦ/СТИМ, КОНЦ/ДНИ, КОНЦ/СТИМ/ДНИ —
во всех случаях достоверно, Р<0,001). Вначале вызвал удивле-
ние тот факт, что у двух исследованных сибсов наблюдается
достоверное различие ответов (СИБСЫ, Р<0,001). Дальнейший
анализ показал, что в этом отразилось различие в требуемых
для оптимального ответа концентрации ЛПК и продолжитель-
ности культивирования (КОНЦ/СИБСЫ, Р<0,001; СИБСЫ/
/ДНИ, Р<0,005; КОНЦ/СИБСЫ/ДНИ, Р<0,001).
Таким образом, предлагаемый метод капельных культур объ-
емом 20 мкл может применяться для выявления генетических
различий между отвечающими и стимулирующими клетками в
СКЛ с ЛПК человека. В капельных культурах легче, чем в куль-
турах объемом 200 мкл получить ответ на более ранних стадиях
культивирования. Для идентификации разных источников вари-
абельности ответа в культурах лимфоцитов можно использовать
дисперсионный анализ. Например, исходя из данных представ-
ленных в табл. 9.2, можно идентифицировать отдельно от влия-
ния генов, кодирующих HLA-A, В, С и DR, влияние индивиду-
альных различий между сибсами, которые проявляются особен-
ностями пролиферативного ответа в СКЛ (т. е. необходимым
для стимуляции общим числом клеток и кинетикой).
308
АНАЛИЗ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ
4. Благодарности
Я хочу поблагодарить моих коллег за любезно предостав-
ленную возможность опубликовать данные нашей совместной
работы. Результаты, приведенные в табл. 9.2, а также на рис.
Q.11 и 9.12, взяты из диссертации д-ра Стивена Бермана (1981,
Council for National Academic Awards), в которой можно найти
дополнительные подробности этого исследования. Тканевое ти-
пирование для исследования, описанного в табл. 9.2 и на рис.
9.12, было выполнено Питером Холлом. Также я хочу поблаго-
дарить за предоставленные данные Стивена Макатония, Жаклин
О’Брайен и Пенелопи Бедфорд. Я высоко ценю помощь Отдела
медицинской иллюстрации при Clinical Research Centre и уча-
стие Кетлин Джеймсон в оформлении рукописи. Устройство для
сбора клеток запатентовано British Technology Group (Лондон).
Литература
1. Thurman G. В., Strong D. M., Ahmed A., Green S. S., Sell K. W., Hart-
man R. J., Bach F. H. (1973). Clin. Exp. Immunol., 15, 289.
2. Bondeuik H., Helgesen A., Thoresen A. B., Thorsby E. (1974). Tissue Anti-
gens, 4, 469.
3. O’Brien J., Knight S., Quick N. A„ Moore E. H., Platt A. S. (1979). J. Im-
munol. Methods, 27, 219.
4. Ling N. R., Kay J. E. (eds.) (1976). Lymphocyte Stimulation, North Hol-
land, Amsterdam.
5. Knight S. C. (1982). J. Immunol. Methods, 50, R51.
6. Farrant J.. Clark J. C., Lee H., Knight S. C. (1980). J. Immunol. Methods,
33, 301.
7. Farrant J., Newton C. A., North M. E., Weyman C., Brenner M. K. (1984).
J. Immunol. Methods, 68, 25.
®. Hume D. A„ Weidemann M. J. (eds.) (1980). Mitogenic Lymphocyte Trans-
formation, Elsevier/North Holland, Amsterdam.
9. Traill К- M., Chandler P., Krammer P. H. (1981). J. Immunol. Methods,
40, 17.
10. Taylor G. M., Jones H., Hughes G., Harris R., Dyer P. A. (1984). Tissue
Antigens, 24, 129.
11. Fainboim L., Festenstein H. (1979). Transplant Proc., 11, 700.
12. Pena-Martinez J., Festenstein N. H. (1975). Transplantation, 20, 26.
13. Cleaver J. E, (ed.) (1967). Thymidine Metabolism and Cell Kinetics, North
Holland, Amsterdam.
14. Dei R., Urbano P. (1977). J. Immunol. Methods, 15, 169.
15. Knight S. C„ Harding B., Burman S„ Mertin J. (1981). Clin. Exp Immu-
nol., 46, 61.
16. Felder M., Dore C. J., Knight S. C., Ansell В. M. (1985). Clin. Immunol
Immunopathol., 37, 253.
17. Knight S. C„ Balfour В. M., O’Brien J., Buttifant L-, Sumerska T., Clar-
ke J. (1982). Eur. J. Immunol., 12 1057
18. Thorpe P. E„ KnightS. C. (1974). J. Immunol. Methods, 5, 387.
19. Macatonia S., Edwards A., Knight S. C. (1986). Immunology 59 509
20. Khight S. C„ Burman S. (1981). Transplant. Proc., 13, 1637.
21. Akima H. (1974). Commun. ACM, 17, 26.
Глава 10
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ
ПОДОБНЫХ ИМ ФАКТОРОВ
А. Хамблин и А. О’Гарра
1. Введение
За последние 20 лет описано поразительно много растворимых
факторов, влияющих на лейкоциты, которые принимают участие
в иммунном ответе и воспалительной реакции. С тех пор как
был введен термин «лимфокины» (так стали называть белки и
гликопротеины, которые не относятся к антителам, образуются
при активации лимфоцитов и служат межклеточными медиато-
рами иммунных реакций [1, 2]), исследователи постоянно пы-
тались разработать классификацию множества разнообразных
растворимых факторов, объединенных под столь обобщенным
названием. В результате были введены дополнительные терми-
ны «цитокины», «монокины» [3] и «интерлейкины» [4], что сви-
детельствует, в частности, о существовании растворимых факто-
ров, источником которых не обязательно служат лимфоциты.
Многие факторы образуются другими лимфоидными или нелим-
фоидными клетками. Более того, уже первые работы показали,
что один и тот же фактор может синтезироваться разными ти-
пами клеток и действовать на множество различных клеток-ми-
шеней [5]. Технология рекомбинантных ДНК позволила опре-
делить первичную аминокислотную последовательность лимфо-
кинов и получить источник гомогенного материала для лабора-
торных исследований.
Первичная аминокислотная последовательность установлена
для ряда лимфокинов. Это интерлейкины: ИЛ-1, ИЛ-2, ИЛ-3,
ИЛ-51. Из них для стимуляции Т-клеток необходимы ИЛ-1 н
ИЛ-2, а для стимуляции В-клеток — ИЛ-4 и ИЛ-5. ИЛ-3 обес-
печивает дифференцировку и самообновление пула полипотент-
ных клеток-предшественников костномозгового происхождения.
В экспериментах с рекомбинантными интерлейкинами показано,
что помимо основных эффектов, они на самом деле проявляют
плейотропное действие на ряд клеток-мишеней, иногда совер-
шенно разных. Здесь мы изложим основные методы определения
интерлейкинов и интерлейкин-подобных факторов, активных в
1 Установлена также аминокислотная последовательность ИЛ-6 и ИЛ-7.—
Прим. ред. перевода
310
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
отношении Т- и В-лимфоцитов, а также кратко остановимся на
известных к настоящему времени их дополнительных функцио-
нальных свойствах. Кроме того, в эту главу включены методы
определения ИЛ-3, чтобы представить полностью весь ряд ин-
терлейкинов (известных к моменту подготовки настоящего из-
дания).
1.1. Интерлейкины, действующие на Т-лимфоциты
Стимуляция клональной экспансии Т-лимфоцитов под дейст-
вием антигена реализуется с помощью механизма, который
включает процессинг и презентацию антигена моноцитами и
макрофагами, а также образование ИЛ-1 моноцитами и ИЛ-2
Т-лимфоцитами. ИЛ-1 необходим для активации Т-лимфоцитов
антигенпрезентирующими клетками [6], способствует образова-
нию ИЛ-2 Т-лимфоцитами [7], а также экспрессии рецепторов
ИЛ-2 [8]. Получив активирующий сигнал, Т-лимфоциты в даль-
нейшем уже не нуждаются ни в антигене, ни в ИЛ-1. В резуль-
тате активации и последующего взаимодействия ИЛ-2 с соот-
ветствующим рецептором покоящийся лимфоцит проходит цикл
клеточного деления [9], и эта пролиферация продолжается, пока
присутствует ИЛ-2 и имеются отвечающие на него клетки [10,
11]. Биологическая роль ИЛ-1 и ИЛ-2 не ограничивается уча-
стием в активации Т-лимфоцитов под действием антигена. ИЛ-2
необходим также для пролиферации натуральных киллеров
(НК) [12] и активированных лимфокином киллеров (АЛК) [13],
а также для активации цитотоксических Т-лимфоцитов [14].
В настоящее время известно, что ИЛ-2 образуется только Т-
клетками и его биологическая активность, по-видимому, в ос-
новном направлена на Т-лимфоциты или близкие к ним клетки
(НК, АЛК); поэтому методы определения ИЛ-2 основаны на его
способности поддерживать рост Т-клеток. Круг клеток-мишеней
для ИЛ-1, напротив, чрезвычайно широк. ИЛ-1 вызывает кло-
нальную экспансию и созревание В-клеток, стимулирует выде-
ление белков острой фазы гепатоцитами и различных фермен-
тов хондроцитами, активирует резорбцию костной ткани остеок-
ластами и пролиферацию эндотелиальных клеток, а также,
воздействуя на соответствующие центры головного мозга, вы-
зывает лихорадку и сонливость. По-видимому, ИЛ-1 идентичен
лейкоцитарному эндогенному медиатору (ЛЭМ), катаболину и
эндогенному пирогену (ЭП) [15—17]. Следовательно, ИЛ-1
можно полностью охарактеризовать, основываясь на определе-
нии одной или нескольких перечисленных активностей в соче-
тании с результатами «основного, но неспецифического» [18]
теста на мышиных тимоцитах.
ЗИ
ГЛАВА 10
1.2. Интерлейкины, действующие на В-лимфоциты
Сейчас ясно, что Т-клетки осуществляют хелперную функцию,
в образовании антител, выделяя ростовые и дифференцировоч-
ные факторы, воздействующие на В-клетки. Эти растворимые
факторы по функциональным свойствам прежде делили на две
группы: факторы роста В-клеток (BCGF—В-cell growth factors),
которые, как считалось, участвуют в пролиферации В-клеток,
и факторы дифференцировки В-клеток (BCDF — В-cell differen-
tiation factors), ответственные за созревание активированных
В-клеток и превращение их в иммуноглобулин-секретирующие-
[19-22].
В настоящее время такая классификация нуждается в пере-
смотре с учетом последних данных. А именно, когда удалось
клонировать кДНК, которая кодирует фактор, стимулирующий
образование IgGi мыши (ИЛ-4) [24], обнаружилось, что реком-
бинантный ИЛ-4 обладает активностью BCGF и BCDF. Он дей-
ствует не только на В-, но и на Т-, а также на тучные клетки
[23, 24]. Другой, хорошо охарактеризованный В-клеточный фак-
тор (BCGF-II), первоначально был описан как фактор рост?
мышиной В-клеточной лимфомы (ВСЦ) [25]. Он также вызы-
вает синтез ДНК и секрецию антител (IgM и отчасти IgG)
в предварительно активированных нормальных В-клетках мыши
[26]. Когда удалось получить рекомбинантный BCGF-II мыши,
обнаружилось, что он дополнительно обладает активностью
фактора, заменяющего Т-клетки (ФЗТ), поэтому он получил
наименование ИЛ-5 [27]. Кроме того, было показано, что он
вызывает дифференцировку костномозговых предшественников
эозинофилов в зрелые клетки (ФДЭ — фактор дифференциров-
ки эозинофилов) [28].
Третий лимфокин, действующий на В-клетки — это BCDF
человека (мол. масса 20 кДа; сейчас его называют В-клеточный
стимулирующий фактор-2, или BSF-2—В cell-stimulating fac-
tor-2). Он индуцирует секрецию антител В-клетками человека,
предварительно активированными пли трансформированными
вирусом Эпштейна-Барр (ВЭБ). Однако до сих пор не показа-
но, что он способен стимулировать пролиферацию нормальных
В-клеток. В настоящее время кДНК, кодирующая BCDF чело-
века также клонирована [29], хотя ее мышиный гомолог еще не
идентифицирован. Недавно показано, что BSF-2 идентичен ин-
терферону-^ [30] и фактору роста гибридом/плазмоцитом
(HPGF — hybridoma/plasmocytoma growth factor) [31]. Это ве-
щество считается фактором роста и дифференцировки В-клеток1;
1 В настоящее время этот лимфокин назван интерлейкином-6; имеет мол.
массу от 19 до 54 кДа (по данным разных авторов), стимулирует также про-
лиферацию мышиных тимоцитов, активированных ФМА и ИЛ-4, продукцию
белков острой фазы клетками гепатомы мыши и гепатоцитами человека, экс-
прессию HLA класса I фибробластами человека.— Прим. ред. перевода
312
анализ интерлейкинов и других подобных им факторов
его противовирусная активность слабо выражена или отсутст-
вует, хотя вначале такое свойство предполагалось. Интересно,
что из перечисленных трех факторов данный лимфокин являет-
ся единственным, действующим, по-видимому, только на В-клет-
ки. В литературе описаны другие, менее охарактеризованные,
факторы, действующие на В-клетки, но они здесь обсуждаться
не будут.
2. Интерлейкин 1
Интерлейкин 1, прежде известный как фактор активации
лимфоцитов (LAF — lymphocyte activating factor), был впервые
обнаружен Гири с сотр. (Gery et al.) [32] в надосадочной жид-
кости культуры адгезивных лейкоцитов человека по способности
усиливать пролиферацию мышиных тимоцитов. В настоящее
время показано, что ИЛ-1 выделяется стимулированными моно-
цитами, клетками линий моноцитов и макрофагов, большими
гранулярными лимфоцитами (БГЛ), дендритными и эндотели-
альными клетками, а также нестимулированными линиями В-
клеток и линиями Т-клеток, полученных при лейкозе у взрослых
[16]. Действие ИЛ-1 обнаруживается при использовании разно-
образных клеток-мишеней (см. разд. 1).
При клонировании кДНК, кодирующей интерлейкин-1 чело-
века [33, 34] и мыши [35], были обнаружены две его формы,
•известные как ИЛ-1а и ИЛ-lfl. Обе они имеют мол. массу 17кДа,
но различаются по р! (ИЛ-la—р! 5,0; ИЛ-lfl—р! 7,0). Пока
еще полностью не установлено, в чем заключается различие био-
логических функций этих двух форм ИЛ-1.
«Основной, но неспецифический» тест для выявления ИЛ-1
базируется на оценке пролиферации мышиных тимоцитов in
vitro [18]. В этом тесте ИЛ-1 определяется по способности за-
менять интактные макрофаги, выполняющие вспомогательную
функцию в пролиферации Т-клеток. Другие методы определения
ИЛ-1 основаны на его способности стимулировать продукцию
ИЛ-2 в культурах клеточных линий [36] или пролиферацию
клеток ИЛ-1-зависимых линий [81. Сравнительно недавно по-
ступил в продажу набор для определения ИЛ-1 с помощью
радиоиммунологического анализа (РИА) (Cistron Biotechnology
Inc., США).
2.1. Источники
ИЛ-1 проще всего получить путем активации моноцитов и
макрофагов, выделенных из крови или других источников, липо-
полисахаридом, частицами типа кремнезема или форболовым
эфиром1 (ФМА). Ниже описан метод получения ИЛ-1 из моно-
1 Эфир миристиновой кислоты и форболового спирта, например 12-О-тет-
радеканоилфорбол-13-ацетат. — Прим. ред. перевода.
313
ГЛАВА 10
цитов крови человека [37], но в принципе, источником ИЛ-1
может служить любой из перечисленных в предыдущем разделе
типов клеток. Кроме того, ряд фирм выпускает для продажи
препараты натурального или рекомбинантного ИЛ-1 (например,
Cistron Biotechnology Inc., США; Genzyme Corp, США).
2.2. Получение ИЛ-1 из моноцитов периферической
крови человека
1. Путем центрифугирования в градиенте плотности смеси
метризоат—фиколл из периферической крови выделяют моно-
нуклеарные клетки (как описано в гл. 1). Клетки ресуспенди-
руют (10® клеток/мл) в среде RPMI 1640, содержащей 2-мер-
каптоэтанол (5-10~5М).
2. В каждую лунку 24-луночной панели (Nunclon Delta, Да-
ния; Gibco Europe Ltd., Великобритания) помещают 1 мл кле-
точной суспензии. В одни лунки добавляют растворенный в
RPMI 1640 ЛПС (Escherichia coli 055В5; Difco Labs., Велико-
британия) до конечной концентрации 10 мкг/мл, а в другие —
такой же объем среды RPMI 1640.
3. Инкубируют при 37°C в атмосфере с 5% СО2.
4. Через 24 ч культуры центрифугируют при 400 g в течение
8 мин при комнатной температуре, надосадочную жидкость со-
бирают, стерилизуют фильтрованием (0,2 мкм) и хранят при
—20 °C.
Серию полученного таким способом препарата можно ис-
пользовать как лабораторный стандарт. Данный метод можно
адаптировать для работы с моноцитами и макрофагами из дру-
гих тканей и от других видов животных.
2.3. Определение ИЛ-1 в культуре мышиных тимоцитов
В этом тесте определяют комитогенный эффект ряда разве-
дений исследуемого образца, содержащего ИЛ-1, добавленных
к мышиным тимоцитам, культивируемым при субоптимальной
концентрации митогенов, например ФГА или Кон А (комитоген-
ный тест). Можно исследовать и собственный стимулирующий
эффект содержащих ИЛ-2 образцов в культурах тимоцитов без
добавления митогенов (прямой тест), хотя таким способом уло-
вить ответ труднее [37]. Лимфоциты мыши отвечают на ИЛ-1
человека и животных. Проводя анализ, необходимо обратить
внимание на ряд деталей и контролей. Тимоциты многих линий
мышей способны отвечать на содержащиеся в препарате ИЛ-1
ЛПС, поэтому для определения ИЛ-1 обычно выбирают линию,
не дающую реакции на ЛПС (линия СЗН/HeJ). Кроме того,
314
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
тимоциты отвечают на ИЛ-2 и митогены, поэтому в препаратах,
тестируемых на ИЛ-1, следует определять также присутствие
ИЛ-2 и митогенов. Образцы надосадочной жидкости, приготов-
ленные как описано в разд. 2.2, не содержат ИЛ-2. Однако в
образцах, полученных из других источников, он может присут-
ствовать.
1. Готовят суспензию тимоцитов, как описано в гл. 1.
2. Концентрацию живых клеток в суспензии доводят до
12-10®/мл среды RPMI 1640, содержащей 10% СПК и 2-мер-
каптоэтанол (5-Ю-5 М) (полная среда).
3. Готовят ряд последовательных двукратных разведений
исследуемых и контрольных образцов. В качестве контрольных
используют образцы, полученные при инкубации мононуклеар-
ных клеток без ЛПС, и лабораторный стандартный ИЛ-1-содер-
жащий препарат. В 96-луночную круглодонную панель (напри-
мер, «Костар»; Northumbria Biologicals Ltd., Великобритания)
из каждого разведения переносят по 50 мкл в 6 лунок.
4. В три лунки каждого разведения добавляют по 50 мкл
растворенного в полной среде очищенного ФГА (Wellcome Di-
agnostics, Великобритания) в концентрации 3 мкг/мл, а в дру-
гие 3 лунки — по 50 мкл среды.
5. В каждую лунку добавляют по 50 мкл суспензии тимоци-
тов и инкубируют в течение 48 ч при 37 °C в воздухе, содержа-
щем 5% СО2.
6. Перед завершением культивирования в лунки вносят по
50 мкл раствора (1 мкКи/мл) [3Н]-тимидина (метил [3Н]-тими-
дин, уд. активность 185 ГБК/ммоль, Amersham International
pic., Великобритания) и инкубируют еще 20 ч.
7. Для определения уровня радиоактивности в клетках куль-
туры переносят на фильтровальную бумагу с помощью автомати-
ческого сборщика клеток (например, фирмы Skatron А/S Нор-
вегия), фильтры высушивают и определяют включение метки
жидкостным сцинтилляционным счетчиком.
8. Результаты выражают в виде индекса стимуляции:
включение тимидина в присутствии ИЛ-1 (имп/мин)_
включение тимидина при добавлении только среды (имп/мин)
Аналогичный индекс стимуляции определяют для культур, со-
держащих ФГА вместе с ИЛ-1 или только ИЛ-1. По этим ин-
дексам судят о прямой и комитогенной активности исследуемых
образцов. Если в данном опыте тимоциты отвечают на стиму-
ляцию стандартом ИЛ-1, то индекс стимуляции исследуемого
образца, превышающий 3,0, достоверно свидетельствует об
ИЛ-1-активностн.
315
ГЛАВА 10
3. Интерлейкин 2
Интерлейкин 2 (ИЛ-2), ранее называвшийся фактором рос-
та Т-клеток (TCGF), был впервые описан в 1976 г. [38] как
фактор, способствующий росту Т-лимфоцитов нормального кост-
ного мозга человека. Он представляет собой индуцибельный
гликопротеин с мол. массой 15 000, который синтезируется и се-
кретируется Т-лимфоцитами, активированными антигенами и
митогенами. Этот фактор необходим для размножения Т-клеток
после воздействия на них антигена, а также для длительного
культивирования Т-клеток (см. обзор [10] и гл. 6). При анали-
зе кДНК, полученных из трансформированных и нетрансформи-
рованных Т-клеток человека, была установлена аминокислотная
последовательность ИЛ-2: он состоит из 133 аминокислотных
остатков и имеет одну дисульфидную связь, которая необходи-
ма для реализации биологической активности [39].
Определение ИЛ-2 основано на его способности поддержи-
вать рост Т-клеточных линий человека (НТ-2) или мыши
(CTLL-2) (эти линии можно получить из American Type Culture
Collection, США), а также размножение Т-лимфоцитов при по-
ликлональной активации. Размножение клеток определяют по
включению [3Н]-тимидина [40] или с помощью модифицирован-
ного МТТ-метода1 [41]. Сравнительно недавно в продажу по-
ступил набор для определения ИЛ-2 человека иммунофермент-
ным методом (Genzyme Corporation, США). Ниже описан спо-
соб культивирования линии клеток CTLL-2 и применение их для
определения ИЛ-2, а также метод определения ИЛ-2 на лимфо-
бластах человека.
3.1. Источники
ИЛ-2 образуется наряду со многими другими лимфокинами
при стимуляции Т-лимфоцитов антигенами и митогенами [42].
Для этого мононуклеарные клетки, выделенные из перифериче-
ской крови или из лимфоидных органов (гл. 1), стимулируют
антигенами или митогенами в оптимальных концентрациях in
vitro (см. гл. 6). После культивирования в течение 24—48 ч
собирают надосадочную жидкость и хранят при —20 °C. В ней
можно определить ИЛ-2. Кроме того, ИЛ-2 продуцируют раз-
личные линии Т-клеток, Т-клеточные опухоли (например, EL 4,
гл. 6) и гибридомы [10, 11]. Препараты натурального или ре-
комбинантного ИЛ-2 производят несколько фирм (например,
Genzyme Corporation, США, Amgen Biologicals Inc., США).
1 Метод образования темно-синих кристаллов формазана из МТТ (т. е. из
бромида 3- (4,5-диметил-2-тиазолил) -2,5-дифенил-2Н-тетразолия). — Прим. ред.
перевода
316
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
3.2. Определение ИЛ-2 в культуре клеток CTLL
3.2.1. Культивирование клеток мышиной линии CTLL
1. Поддерживают непрерывную пролиферацию клеток CTLl
в полной среде, содержащей ИЛ-2 (рекомбинантный ИЛ-2 в
концентрации около 10 Е/мл или препарат ИЛ-2, получение
которого описано выше).
2. Клетки культивируют в объеме 2 мл в лунках 24-луноч-
ных панелей с неплотными пластиковыми крышками.
3. Пересев производят после того, как клеточная суспензия
достигает концентрации 1—3-105 клеток/мл (обычно каждые
3—4 дня).
4. Новые культуры закладывают при концентрации 5-103
живых клеток/мл в свежей среде.
5. Перед определением клетки отмывают дважды полной
средой для удаления следов ИЛ-2.
3.2.2. Определение
1. Готовят не менее пяти последовательных (2- или 4-крат-
ных) разведений каждого исследуемого препарата в полной сре-
де. Надосадочную жидкость культур лимфоцитов, полученную,
как описано выше, обычно используют в конечном разведении
1:4 и больше. Кроме того, готовят последовательные 2- или
4-кратные разведения лабораторного стандарта ИЛ-2.
2. Из каждого разведения переносят по 100 мкл в 3—4 лун-
ки круглодонной 96-луночной панели.
3. В каждую лунку добавляют по 100 мкл взвеси отмытых
клеток CTLL (2-104 живых клеток/мл) в полной среде и за-
крывают панель газопроницаемой пленкой или неплотной крыш-
кой. Инкубируют в течение 24 ч при 37 °C во влажной атмосфе-
ре, содержащей 5% СОг-
4. В каждую лунку добавляют по 50 мкл растворенного в
полной среде 3Н-тимидина (2 мкКи/мл) и инкубируют еще 20 ч.
5. Собирают культуры, как описано в разд. 2.3. Образцы,
содержащие ИЛ-2, должны стимулировать включение метки в
зависимости от дозы.
3.3. Определение ИЛ-2 на лимфобластах человека.
Модификация ранее описанного метода
3.3.1. Получение лимфобластов человека
1. Для выделения мононуклеарных клеток кровь центрифу-
гируют в градиенте плотности смеси метризоата—фиколла
(гл. 1).
2. Клетки ресуспендируют в среде RPMI 1640, содержащей
10% аутологичной плазмы, до концентрации 106 клеток/мл.
317
ГЛАВА 10
3. Суспензию клеток помещают в культуральные флаконы
на 260 мл с площадью поверхности 80 см2 (например, фирмы
Nunc А/S, Дания) и добавляют ФГА-R (20 мкг/мл, Wellcome
Diagnostics, Великобритания) или Кон А (20 мкг/мл Pharmacia
Fine Chemicals, Швеция). Флаконы с неплотно закрытыми
крышками инкубируют 3 дня в горизонтальном положении при
37 °C во влажной атмосфере, содержащей 5% СО2.
4. Клетки отмывают дважды средой RPMI 1640 и считают.
Первоначальный вариант метода описан ранее [43].
3.3.2. Выделение лимфобластов в градиенте плотности
перколла. Модификация ранее описанного метода
1. Перколл (Pharmacia) смешивают с 10-кратным концент-
ратом среды RPMI 1640 из расчета 9 частей перколла на 1 часть
среды. Эта смесь, имеющая плотность 1,1294 г/мл условно счи-
тается «100%-ным перколлом».
2. Из 100%-ного перколла на среде RPMI 1640 готовят ряд
растворов с концентрацией 70% (1,090 г/мл), 60% (1,077 г/мл),
50% (1,067 г/,мл), 40% (1,056 г/мл) и 30% (1,043 г/мл), учи-
тывая, что для одной пробирки с градиентом плотности требу-
ется 2 мл каждого разведения.
3. Клетки (не более 50-Ю6 на один градиент) ресуспендиру-
ют в 2 мл 30%-ного перколла.
4. В пробирках для культур (16X125 мм; Falcon) готовят
ступенчатый градиент плотности перколла, начиная со 100%-но-
го и заканчивая 30%-ным перколлом, в котором суспендирова-
ны клетки.
5. Пробирки центрифугируют при 450 g в течение 17 мин
при комнатной температуре.
6. После центрифугирования клетки располагаются на гра-
ницах раздела фаз. Фракция, содержащая наибольшее количе-
ство лимфобластов, располагается между слоями 40 и 50%-ного
перколла. Этот слой клеток переносят пастеровской пипеткой в
универсальный контейнер и разбавляют 20 мл RPMI 1640.
7. Выделенные лимфобласты центрифугируют при 200 g в
течение 10 мин. Затем отмывают их еще дважды.
8. Клетки ресуспендируют (106 клеток/мл) в среде RPMI
1640, содержащей 10% инактивированной нагреванием лошади-
ной сыворотки ( Gibco Europe Ltd., Великобритания) и помеща-
ют в культуральный флакон (80 см2/260 мл). Культивируют
4 дня при 37°C во влажной атмосфере, содержащей 5% СОг-
9. Клетки отмывают дважды и ресуспендируют в RPMI 1640,
содержащей 20% лошадиной сыворотки (2,5-105 живых лимфо-
бластов/мл). Первоначальный вариант метода описан ранее[44].
318
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
3.3.3. Определение ИЛ-2 на лимфобластах
1. Готовят серии последовательных двукратных разведений
исследуемых образцов и стандарта ИЛ-2 на полной среде.
2. В лунки 96-луночной плоскодонной панели для культур
помещают по 100 мкл клеточной суспензии и добавляют по
100 мкл приготовленных разведений. Каждое разведение иссле-
дуемых образцов и стандарта вносят в 3—4 лунки с клеточной
взвесью, оставив контрольные культуры без ИЛ-2.
3. Панель инкубируют в течение трех дней при 37 СС во
влажной атмосфере, содержащей 5% СОг- Затем в каждую лун-
ку добавляют по 20 мкл раствора [3Н]-тимидина (25 мкКи/мл;
74 ГБК/ммоль; Amersham International pic., Великобритания).
4. Определяют включение радиоактивной метки.
Если в препарате присутствует ИЛ-2, стимуляция включения
тимидина будет зависеть от дозы. Лимфобласты человека отве-
чают на митогены. Поэтому содержащие их препараты следует
тестировать на нечувствительных к митогенам линиях клеток,
таких, как CTLL-2.
4. Интерлейкин 3 (ИЛ-3)
Этот интерлейкин — один из множества колониестимулиру-
ющих факторов (КСФ), которые, как известно, регулируют ге-
мопоэз [45—47]. Его продуцируют Т-лимфоциты, активирован-
ные митогеном или антигеном, а также некоторые стабильные
линии клеток [48, 49]. ИЛ-3 принимает участие в регуляции
роста и дифференцировки полипотентных стволовых клеток,
дающих начало всем основным типам клеток крови. Рекомби-
нантный мышиный ИЛ-3 имеет активность фактора роста туч-
ных клеток (ФРТуК) и обеспечивает рост и дифференцировку
коммитированных предшественников моноцитов, гранулоцитов,
эритроидных клеток и мегакариоцитов, а также способствует
росту полипотентных клеток-предшественников [50]. В настоя-
щее время получена кДНК человека, кодирующая ИЛ-3, кото-
рый обладает мультипотентной колониестимулирующей актив-
ностью в отношении нормальных клеток костного мозга чело-
века [51]. Было выдвинуто предположение, что частично очи-
щенные факторы,такие, как фактор усиливающий пролиферацию
ранних эритроидных (бурстобразующих) предшественников;
фактор, стимулирующий размножение персистирующих («Р»,
похожих на тучные) клеток; мультилинейно-специфический КСФ
и тканеспецифический гемопоэтин, а также ФРТуК, возможно,
идентичны ИЛ-3 [52—54], хотя прямых доказательств этого по-
ка нет. До сих пор неизвестно, какое количество разных типов
молекул имеет сходные биологические свойства. Принадлеж-
ав
ГЛАВА 10
ность таких факторов к ИЛ-3 будет доказана, если выделить их
в очищенном виде из разных источников, определить амино-
кислотные последовательности и добиться экспрессии функцио-
нально активных продуктов при молекулярном клонировании.
Выполненное недавно клонирование мышиного фактора стиму-
ляции роста колоний гранулоцитов и макрофагов (КСФ Гр/Мф)
показало перспективность такого подхода [55].
Для определения ИЛ-3 можно использовать зависимые от
него линии клеток [49, 56, 57], которые при соответствующей
стимуляции in vitro дифференцируются в направлении эритро-
идных клеток, нейтрофильных гранулоцитов, а также базофилов
и тучных клеток. Ниже приведен один из таких стандартных
методов, а в дополнение к нему — метод выявления КСФ-актив-
ности интерлейкина-3 по росту колоний in vitro.
4.1. Источники
ИЛ-3 можно получить при стимуляции Т-клеток антигеном
или митогеном. Весьма удобным источником ИЛ-3 служит линия
клеток WEHI-3, которая конститутивно (т. е. без индукции)
продуцирует этот фактор [48]. Его можно выделить в очищен-
ном виде из среды, кондиционированной клетками WEHI-3 [58].
4.2. Определение ИЛ-3 по пролиферации клеточных линий
Линия 32-D была получена из популяции неадгезивных кле-
ток костного мозга мыши при длительном культивировании и
представляет собой линию гемопоэтических предшественников
[59].
1. Клетки линии 32-D выращивают на среде RPMI 1640, со-
держащей 10% СПК и 10% (по объему) среды, кондициониро-
ванной клетками WEHI-3 [48].
2. Исследуемые образцы надосадочной жидкости последова-
тельно разводят средой (RPMI 1640 + 5% СПК) и из каждого
разведения переносят по 50 мкл в лунки круглодонной панели
для микротитрования.
3. Клетки линии 32-D отмывают дважды, суспендируют в
RPMI 1640, содержащей 5% СПК, до концентрации 2-105/мл
и по 50 мкл клеточной взвеси вносят в лунки с разведениями
надосадочной жидкости.
4. Панель инкубируют 24 ч при 37 °C во влажной атмосфе-
ре, содержащей 5% СО2.
5. За 4 ч до окончания культивирования в каждую лунку
добавляют по 0,5 мкКи [3Н]-тимидина, а затем собирают клетки
и определяют включение метки, как описано в разд. 2.3.
320
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
4.3. Определение колониестимулирующей активности
1. Взвесь клеток костного мозга мыши готовят, как описано
Е 1Л. 1.
2. Для приготовления агаровой культуральной среды смеши-
вают равные объемы двукратного концентрата модифицирован-
ной Дюльбекко среды Игла (см. табл. 10.1) и расплавленного
0,6%-ного бакто-агара (Difco Labs, США) на воде и охлажда-
ют до 37 °C.
3. В чашки для культур (диаметром 35 мм) помещают по
100 мкл исследуемых образцов надосадочной жидкости.
4. Клетки костного мозга (7,5-104) ресуспендируют в 1 мл
агаровой среды для культивирования. Хорошо перемешивают и
выливают в чашки с образцами надосадочной жидкости; дают
агару застыть.
5. Культуры инкубируют при 37 °C во влажной атмосфере,
содержащей 10% СОг в течение 7 дней; за этот срок образуют-
ся визуально различимые колонии клеток.
6. Колонии (клоны, содержащие более 50 клеток) подсчи-
тывают под бинокулярным стереоскопическим микроскопом.
Метод описан ранее в литературе [60].
5. Иитергейкин 4
Интерлейкин 4, прежде известный как BSF-1 или BCGFI,
обладает разнообразной активностью. Первоначально этот фак-
тор был обнаружен благодаря комитогенной активности в ин-
дукции синтеза ДНК в покоящихся малых В-лимфоцитах, сти-
мулированных субмитогенными дозами антииммуноглобулино-
вых (анти-Ig) антител [63—66]. Этот фактор способен само-
стоятельно вызвать переход покоящихся В-клеток в состояние
временной активации, которое характеризуется резким усиле-
нием экспрессии антигенов МНС класса II (I-А и I-Е у мышей)
[67, 68]. Кроме того, ИЛ-4 может функционировать как весьма
избирательный фактор дифференцировки В-клеток, стимулиру-
ющий секрецию IgGi и IgE предварительно активированными
ЛПС В-клетками [3]. Показано, что рекомбинантный ИЛ-4 ин-
дуцирует и пролиферацию линий тучных и Т-клеток.
Мы приводим описание методов определения указанных ти-
пов биологической активности. С их помощью можно определить
активность мышиных ИЛ-4 и ИЛ-5, хотя в настоящее время уже
удалось получить рекомбинантные ИЛ-4 и ИЛ-5 человека [61,
621. Во. всех описанных ниже методах определения эффекта
ИЛ-4 и ИЛ-5 на В-клетки используется (кроме особо оговорен-
ных случаев) среда RPMI 1640, приготовленная на апирогенной
демонизированной или бидистиллированной в стекле воде;
321
ГЛАВА 10
Таблица 10.1. Состав двукратного концентрата минимальной среды (МЕМ)
Игла в модификации Дюльбекко
Компоненты Объем (мл)
Концентрат стандартного солевого раствора Эрла (десяти- 100
кратный)
NaHCO3 (2,8%) 80
Смесь витаминов для МЕМ Игла (100-кратный концентрат) 10
Смесь аминокислот (А) для МЕМ Игла (100-кратный кон- 10
центрат)
Смесь аминокислот (В) для МЕМ Игла (100-кратный кон- 10
центрат)
Раствор глутамина (200 мМ) 10
Пируват натрия (2,2%) 5
Сыворотка плода коровы 100
L-Серин (21 мг/мл) 1
Пенициллин (200 000 Е/мл) 0,58
Стрептомицин (200 мг/мл) 0,38
Феноловый красный (0,55%) 2
Бидистиллированная в стекле вода 135
в среду добавляют 2-меркаптоэтанол (5-Ю-5 М), глутамин
(2 мМ), пируват натрия (1 мМ), заменимые аминокислоты, пе-
нициллин, стрептомицин и СПК (5%). Для всех описанных про-
лиферативных тестов, а также для определения дифференциров-
ки В-лимфоцитов в клетки, секретирующие антитела, предвари-
тельно отбирают партии СПК, дающие низкую фоновую
стимуляцию.
5.1. Источники
ИЛ-4 образуют самые разные типы Т-клеток. Обычным ис-
точником этого фактора служат клетки тимомы EL4, культиви-
рование которых не вызывает особых трудностей. Эта линия
продуцирует значительные количества ИЛ-4 и ИЛ-5 при сти-
муляции ФМА (5 нг/мл) в течение 24 ч при 37°C (см. гл. 6).
Однако клетки EL4, подобно многим другим линиям Т-клеток,
продуцируют ряд лимфокинов, которые довольно трудно отде-
лить друг от друга, а также от присутствующего в надосадочной
жидкости ФМА (он оказывает влияние на В-клетки сам по се-
бе). В связи с этим используют и другой источник — Т-клеточ-
ные гибриды, среди которых благодаря нестабильности фено-
типа можно выбирать клоны, продуцирующие ограниченное
число факторов. Методы получения таких гибридов описаны
ранее [69].
322
анализ интерлейкинов и других подобных им факторов
5.2. Определение ИЛ-4, основанное на комитогенном эффекте
1. Готовят суспензию спленоцитов мыши, например гибридов
(CBAXC57BL) Fi, и удаляют из нее Т-клетки с помощью анти-
Thy-1 антител и комплемента (гл. 2).
2. Готовят градиент плотности перколла. Для этого смесь,,
называемую «100%-ным перколлом» (разд. 3.3.2), разводят
0,15 М NaCl или PBS А Дюльбекко для получения 85, 75 и
50%-ного перколла. В круглодонных центрифужных пробирках
создают градиент плотности, осторожно наслаивая друг на дру-
га 85, 75 и 50%-ный перколл (по 2,5 мл каждого). Необходима
исключить перемешивание слоев. !
3. Поверх градиента наслаивают 1 мл суспензии спленоци-
тов, освобожденной от Т-клеток (на один градиент не более
5-Ю7 клеток), и центрифугируют при 1300 g в течение 15 мин
при 4 °C с выключенным тормозом. Эти условия подобраны для
разделения на центрифуге J6-B фирмы Beckman Instruments
Inc., США. Для других центрифуг оптимальный режим следует
подбирать эмпирически. Обладающие высокой плотностью при.
малом объеме В-клетки собирают на границе раздела фаз 85 и
75%-ного перколла, отмывают один раз средой RPMI 1640, со-
держащей 5% СПК, и процедуру разделения в градиенте плот-
ности перколла повторяют еще раз.
4. Выделенные В-клетки трижды отмывают средой RPMI
1640 с 5% СПК для полного удаления примеси перколла, цент-
рифугируя первый раз при 800 g, и еще дважды при 400 g.
5. Для определенных экспериментов можно дополнительно
очистить В-клеточную взвесь от адгезивных клеток, последова-
тельно фракционируя на двух колонках сефадекса G-10 (гл. 1),
В полученной В-клеточной взвеси должно присутствовать более
90% 1§+-клеток при полном отсутствии ТЬу-1+-клеток.
6. В лунки плоскодонной 96-луночной панели для микротит-
рования вносят по 100 мкл ряда последовательных разведений
исследуемого образца.
7. Во все лунки, кроме контрольных, добавляют препарат
антииммуноглобулинов в субмитогенной дозе. Можно использо-
вать антитела кролика или козы к иммуноглобулинам мыши
(оба препарата имеются в продаже), либо моноклональные ан-
титела к IgM мыши, например Bet-2 [70]. В случае применения
кроличьих антител к иммуноглобулинам мыши желательно ис-
пользовать Р(аЬ)г/-фрагменты [71].
8. Концентрацию взвеси В-клеток доводят до 5-Ю5 кле-
ток/мл и разливают в лунки по 100 мкл.
9. Панель инкубируют в течение трех дней при 37 °C во
влажной атмосфере, содержащей 5% СОг, после чего в каждую
лунку добавляют по 0,5 мкКи 3[Н]-тимидина.
зга
10. Через 4 ч содержимое лунок переносят из фильтры и
определяют включение метки, как описано в разд. 2.3.
Сами :.о себе ни ИЛ-4, присутствующий в исследуемой на-
досадочной жидкости, ни антииммуноглобулнновые антитела
не индуцируют синтеза ДНК, но добавленные вместе в соот-
ветствующих концентрациях, вызывают по крайней мере 10-
кратное (по сравнению с контролем) усиление синтеза ДНК.
5.3. Определение ИЛ-4 по усилению экспрессии 1а-белксв
1. Обладающие высокой плотностью малые В-лимфоциты
выделяют, как описано в разд. 5.2 (например, от мышей
СВА/Са).
2. Полученные В-клетки культивируют в течение 24 ч в
лунках диаметром 16 мм с добавлением или без добавления
надосадочной жидкости либо в присутствии антииммуноглобу-
линов (10 мкг/мл) в качестве положительного контроля.
3. После культивирования клетки дважды отмывают PBS,
содержащим БСА (0,1%) и азид натрия (0,1%), и затем мар-
кируют при 4 °C соответствующими конъюгированными с флуо-
ресцеином моноклональными анти-I-A или анти-1-Е-антителами
(гибридомы можно получить из American Type Culture Collec-
tion, США).
4. В проточном цитофлуориметре анализируют флуоресцен-
цию маркированных клеток (гл. 2), получая гистограммы флу-
оресценции в логарифмическом масштабе. Об экспрессии ia-бел-
ков можно судить по изменению средней (медиана) интенсив-
ности флуоресценции клеток, выраженной в номерах каналов,
в стимулированных культурах по сравнению с контрольными.
5.4. Определение ИЛ-4 по индукции образования IgG;
1. Для каждого разведения исследуемой надосадочной жид-
кости готовят по три культуры, содержащие 10s спленоцитов,
освобожденных от Т-клеток, в 0,2 мл обогащенной среды
RPMI 1640 с добавлением СПК (15%) и ЛПС (50 мкг/мл) и
культивируют в течение суток при 37 °C во влажной атмосфере
(5% СО2).
2. Через сутки в культуры добавляют разведение исследуе-
мых образцов надосадочной жидкости.
3. На 6-ые или 7-ые сутки клетки из параллельных культур
объединяют и определяют среди них количество клеток, секре-
тирующих иммуноглобулины методом обратного локального
гемолиза с эритроцитами, нагруженными стафилококковым
белком А (гл. 5).
324
анализ интерлейкинов и других подобных им факторов
4. В качестве проявляющих реагентов используют коммер-
ческие кроличьи сыворотки против IgGi, IgG3 или lgG2b мыши.
С их помощью можно выявить индуцированное ИЛ-1 увеличе-
ние числа клеток, секретирующих IgGi, с одновременным умень-
шением числа клеток, секретирующих IgG3 и IgG2b в культу-
рах, стимулированных ЛПС.
5. Необходимо проверять специфичность используемых ан-
тиглобулиновых реагентов. Для этого можно использовать
клетки плазмоцитомы, секретирующие иммуноглобулины ука-
занных субклассов (имеются в American Type Culture Collec-
tion, США) [22]. Можно также собрать в соответствующий
срок из культур этих плазмоцитом образцы надосадочной жид-
кости (центрифугирование при 1500g), заморозить до исследо-
вания и затем иммуноферментным методом определить в них
иммуноглобулины известного изотипа, используя антиглобули-
новые сыворотки, как и в разд. 5.5.
Данный метод описан ранее [23J.
5.5. Определение ИЛ-4 по индукции образования IgE
1. Спленоциты (например, мышей BALB/c или C57BL.10),
освобожденные от Т-клеток, культивируют в лунках круглодон-
ной 96-луночной панели (5-10s клеток в 100 мкл) в обогащен-
ной среде RPMI 1640, содержащей СПК (10%) и ЛПС
(4 мкг/мл).
2. Исследуемые образцы надосадочной жидкости из куль-
тур Т-клеток разводят средой RPMI 1640 ( + 10% СПК) и до-
бавляют к культурам спленоцитов через сутки (по 100 мкл).
3. На 7-й день культивирования собирают надосадочную
жидкость из культур спленоцитов, замораживают до исследова-
ния и затем определяют в них IgE иммуноферментным мето-
дом, используя антисыворотку к мышиному IgE [72].
5.6. Определение ИЛ-4 по активности фактора роста
тучных клеток (ФРТуК)
1. Клон тучных клеток МС/9 [73, 74] получают из American
Type Culture Collection, США. Активность фактора роста мож-
но определить по включению 1 2 3 [Н]-тимидина [50] или колори-
метрическим методом [75], как описано ниже.
2. Клетки МС/9 (или другой линии тучных клеток) культи-
вируют в плоскодонной панели для мпкротитрования, помещая
в каждую лунку 104 клеток в 100 мкл обогащенной среды
RPM1 1640 (4% СПК), к которой добавлены разведения ис-
следуемых образцов надосадочной жидкости. Можно, например,
325
ГЛАВА 10
сначала приготовить в лунках панели серии разведений этих
образцов в объеме 50 мкл полной среды, а затем внести в
каждую лунку по 50 мкл взвеси, содержащей 2-105 клеток
МС/9 в 1 мл той же среды.
3. Панель инкубируют в течение 20 ч при 37 °C во влажной
атмосфере, содержащей 5% СО2, и далее:
а. добавляют в каждую лунку 0,5 мкКи 3[Н]-тимидина, инку-
бируют в течение 4 ч, а затем переносят клетки на фильтры
и определяют уровень включения метки, как описано в
разд. 2.3, или
б. в каждую лунку добавляют 50 мкг бромида 3-(4,5-диметил-
2-тиазолил)-2,5-дифенил-2Н-тетразолия (Sigma Chemical Со.,
США) в 10 мкл PBS. Через 4 ч в каждую лунку вносят по
0,1 мл 0,04 М раствора НС1 в изопропаноле для солюбили-
зации окрашенных продуктов реакции (кристаллов формаза-
на). Результаты реакции учитывают по поглощению при
570 нм в сравнении с поглощением при 630 нм в авторидере
М.К 580 фирмы Dynatech Diagnostics Inc., США, для имму-
ноферментного анализа на микропанелях.
5.7. Определение ИЛ-4 по активности фактора
роста Т-клеток
1. Активность фактора роста Т-клеток (ФРТК) определяют
на клетках линии НТ-2 [74] или CTLL-2 так же, как при ана-
лизе ИЛ-2, описанном в разд. 3.
2. Т-клетки культивируют в таких же условиях, как тучные,
помещая в лунку 5-103 клеток. Для определения активности
ФРТК используют те же методы, как при анализе ФРТуК.
6. Интерлейкин 5
Рекомбинантный ИЛ-5 был первоначально идентифициро-
ван по индукции пролиферации и секреции IgM В-клетками
лейкозной линии BCLi, а также по индукции вторичного IgG-
ответа на ДНФ в культурах спленоцитов, примированных ДНФ
и освобожденных от Т-клеток (определение ФЗТ-активности)
[27]. До этого было установлено, что очищенный до гомогенно-
го состояния ФЗТ имеет активность BCGF-II [76]. Кроме то-
го, как уже отмечалось, ИЛ-5 действует как фактор дифферен-
цировки эозинофилов (ФДЭ). Мы дополнительно даем описа-
ние методов, в которых мишенью действия ИЛ-5 служат нор-
мальные В-клетки. Для получения ИЛ-5 используют те же ис-
точники, что и для получения ИЛ-4.
326
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
6.1. Эффекты ИЛ-5 на клетки BCLi-лимфомы
6J.1. Выращивание ВСЬ\-лимфомы
Лимфому (скоро ее можно будет получать из European
Collection of Animal Cell Culture, Великобритания) поддержи-
вают, перевивая на мышах BALB/c. Для этого нормальной мы-
ши внутрибрюшинно вводят 5-Ю6 клеток BClj-лимфомы, полу-
ченной из селезенки мыши, инокулированной также внутрибрю-
шинно этой же опухолью 4—6 нед назад. Клетки для экспери-
мента можно брать в любое время в интервале от одной
недели после появления опухоли до гибели животных (6—8 нед
после инокуляции). Мышей нужно регулярно осматривать,
поскольку ухудшение состояния и гибель наступают внезапно.
6.1.2. Определение ИЛ-5 на клетках BCL\
1. У мышей с развитой опухолью удаляют селезенки и го-
товят из них суспензию клеток (гл. 1). От одной мыши удает-
ся получить от 8-108 до 1,3-109 спленоцитов.
2. Удаляют Т-лимфоциты. Для этого клетки из одной селе-
зенки ресуспендируют в 10 мл среды (RPMI 1640 + 5% СПК)
и добавляют 5 мл комплемента морской свинки в разведении
1 :3, а также 0,5 мл предварительно оттитрованных моноклона-
льных антител к Thy-1. Смесь инкубируют в течение 45 мин
при 37 °C.
3. Клетки трижды отмывают обогащенной средой и подсчи-
тывают их количество.
4. Для оценки пролиферативного ответа клетки ресуспенди-
руют в той же среде (2,5-105 клеток/мл) и помещают по
100 мкл суспензии в лунки 96-луночной панели для микротит-
рования.
5. Добавляют по 100 мкл среды (RPMI 1640 с 5% СПК),
содержащей разведения исследуемых образцов надосадочной
жидкости.
6. Инкубируют два дня при 37 °C, а затем определяют, идет
ли синтез ДНК, как описано в разд. 2.3.
7. Для определения продукции иммуноглобулинов культиви-
руют 2—4-Ю5 клеток BCL! в объеме 0,5 мл в 24-луночных па-
нелях «Костар» в присутствии исследуемых образцов надоса-
дочной жидкости и без них.
8. Панели инкубируют при 37 °C во влажной атмосфере, со-
держащей 5% СО2.
9. Спустя 2—5 сут клетки извлекают и определяют коли-
чество IgM-секретирующих клеток методом обратного локаль-
ного гемолиза [77] (гл. 5).
327
ГЛАВА 10
6.1.3. Стандартизация взвеси клеток BCL^
Для проведения экспериментов можно использовать порции
замороженных клеток BCL-.
1. Готовят суспензию клеток ВСЦ и удаляют из нее Т-клет-
ки, используя методы, описанные выше.
2. Клетки трижды отмывают, а затем ресуспендируют до
концентрации 107 клеток/мл в холодной смеси для заморажи-
вания (RPMI 1640, к которой добавлено 20% СПК и 10% дп-
метилсульфоксида) и разливают в ампулы.
3. Клетки замораживают в парах жидкого азота в камере,
обеспечивающей программированное охлаждение на 1 °C в
мин. При отсутствии такой камеры используют специальный
контейнер, который прилагается к большинству сосудов для
жидкого азота, и позволяет держать клетки над уровнем жид-
кого азота так, чтобы замораживание происходило с необходи-
мой скоростью.
4. Клетки могут храниться в сосуде с жидким азотом не-
ограниченное время.
5. Перед использованием ампулу с замороженными клетка-
ми быстро переносят из жидкого азота на водяную баню при
37 °C.
6. Размороженную суспензию клеток немедленно разводят,
добавляя 9 мл среды (RPMI 1640 с 5% СПК), и центрифуги-
руют в течение 7 мин при 400 g'.
7. Клетки ресуспендируют в 5 мл среды, подсчитывают их
количество и используют в приведенных выше методах.
6.2. Биологическое действие ИЛ-5 на нормальные
В-клетки
ИЛ-5 действует на предварительно активированные В-клет-
ки (вероятно, на поздней стадии Gi-фазы клеточного цикла),но
в отличие от ИЛ-4 не оказывает заметного влияния на покоя-
щиеся В-клетки (см. разд. 5 и ссылку [26J). Так, например,
ИЛ-5 вызывает пролиферацию больших В-лимфоцитов, естест-
венная активация которых произошла вероятно in vivo, и ин-
дуцирует их созревание в клетки, продуцирующие IgM и IgG
[261. Как уже упоминалось, этот фактор имеет активность
ФЗТ и стимулирует синтез специфических антител В-клетками
in vitro. Ниже приведено подробное описание эксперименталь-
ной системы определения ответа нормальных В-клеток на ИЛ-5.
6.2.1. Определение ИЛ-5 по биологическому действию
на большие В-лимфоциты
Определение пролиферативного ответа производят следую-
щим образом.
328
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
!. Готовят суспензии клеток селезенки, например мышей
(CBAXC57BL)Fi, удаляют из них Т-клетки с помощью антител
к Thy-1 и комплемента морской! свинки (разд. 6.1.2;.
2. Готовят взвеси 85, 80, 75, 70, 65, 50%-нсчо дер юлла
(разд. 5 2), из которых получают 6-ступенчатып градиент плот-
ности. На градиент наслаивают суспензию клеток и центрифу-
гируют, как описано в разд. 5.2.
3. Клетки собирают на Гранине раздела 65 и 50%-го пер-
колла. Для получения больших В-лимфоцитов достаточно од-
нократного фракционирования. В первоначальных опытах мож-
но исследовать клетки, собранные на границах раздела других
слоев градиента, и сравнить пролиферативное действие ИЛ-5
на клетки, имеющие различную плавучую плотность.
4. Не следует использовать для удаления адгезивных кле-
ток сефадекс G-10, поскольку при фракционировании на нем
теряются активированные В-клетки, в том числе и большие В-
лимфоциты.
5. Выделенные В-клетки трижды отмывают средой RPMI
1640 с 5% СПК; первый раз центрифугируют при 800 g, а затем
два раза при 400 g'. Осадок ресуспендируют в полной среде и
подсчитывают количество клеток.
6. Суспензию клеток доводят до концентрации 5-Ю5 кле-
ток/мл и разливают по 100. мкл в лунки плоскодонной 96-лу-
ночной панели для микротитрования.
7. В лунки добавляют по 100 мкл той же среды, содержа-
щей разведения исследуемых образцов надосадочноп жидкости.
Часто удобнее добавлять в лунки клеточную суспензию после
исследуемых образцов надосадочной жидкости, особенно если
необходимо готовить их разведения.
8. Панель инкубируют в течение трех дней, а затем опреде-
ляют, идет ли синтез ДНК, как указано в разд. 5.2.
Для определения секреции иммуноглобулинов поступают
следующим образом:
1. Большие В-лимфоциты культивируют в течение 5 дней в
тех же условиях, помещая в лунку 105 клеток.
2. Клетки собирают, определяют количество продуцирую-
щих IgM методом обратного локального гемолиза, описанным
в гл. 5.
3. Для определения количества клеток, секретирующих IgG,
большие В-лимфоцнты .культивируют в той же концентрации,
но в течение 7 дней на среде RPMI 1640, содержащей 15%
СПК.
4. На 4-й день инкубации пз лунок удаляют по 100 мкл на-
досадочной жидкости, вместо которой добавляют равное количе-
ство свежей среды, содержащей разведение образцов исследуе-
мой надосадочной жидкости.
5. На 7-й день клетки собирают и определяют количество
329
ГЛАВА 10
продуцирующих IgG методом обратного локального гемолиза.
При определении синтеза IgM и IgG положительными кон-
тролами могут служить культуры, к которым добавлен ЛПС
(10 мкг/мл). При наличии ИЛ-5 в исследуемых образцах надо-
садочной жидкости в культурах образуется значительное число
клеток, продуцирующих IgM, и меньшее, но воспроизводимое
количество клеток, секретирующих IgG. Количество клеток,
синтезирующих иммуноглобулины, может меняться от опыта к
опыту, но соотношение числа клеток, образующих IgM и IgG,
должно оставаться постоянным.
€.2.2. Определение фактора, заменяющего Т-клетки (ФЗТ)
Определение ФЗТ основано на его способности заменять
присутствие Т-клеток при Т-зависимом образовании антител.
В ряде систем показано, что ИЛ-5 имеет выраженную актив-
ность ФЗТ. Мы приводим описание двух методов, с помощью
которых можно выявить эту активность:
1) образование антител класса G к ДНФ в ответ на конъю-
гат этого гаптена с носителем в культуре В-клеток, примиро-
ванных ДНФ [78], и
2) образование IgM к эритроцитам барана (ЭБ) в культуре
непрпмированных В-клеток.
Ответ на ДНФ индуцируют следующим образом.
1. Мышам BALB/c вводят внутрибрюшинно 100 мкг ДНФ—
ГМФ (гемоцианин моллюска фиссуреллы, конъюгированный с
ДНФ), адсорбированного на геле гидроокиси алюминия (4 мг),
вместе с 109 бактерий BordetelLa pertussis и спустя 8—12 нед
повторно вводят ДНФ — ГМФ (20 мкг в 0,85%-ном NaCl).
2. Через 4—7 дней после реиммунизации у мышей извлека-
ют селезенки, готовят суспензию спленоцитов и удаляют из
нее Т-клетки, как было описано выше.
3. Смешивают 0,5 мл суспензии, освобожденной от Т-клеток
(5-Ю6 клеток/мл), в полной среде RPMI 1640 с 10% СПК и
0,5 мл исследуемых образцов надосадочной жидкости. К этой
смеси добавляют 10 мкл раствора ДНФ — ГМФ так, чтобы
конечная концентрация конъюгата составила 40 нг/мл.
4. По 300 мкл полученной смеси помещают в три лунки па-
нели для микротитрования и культивируют в течение 5 дней
при 37 °C во влажной атмосфере, содержащей 5% СО2.
5. Определяют количество клеток, образующих непрямые
зоны гемолиза в слое эритроцитов, нагруженных ДНФ (гл. 5).
Второй метод выявления ФЗТ — это минивариант метода
Мишелла — Даттона (гл. 5). Разведения исследуемых образцов
надосадочной жидкости добавляют к освобожденной от Т-кле-
ток взвеси спленоцитов неиммунизированных (или примирован-
330
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
ных ЭБ) мышей и культивируют в объеме 200 мкл при кон-
центрации 5-Ю6 клеток/мл. На 4-й день определяют число кле-
ток, образующих IgM методом локального гемолиза.
6.3. Активность фактора дифференцировки
эозинофилов (ФДЭ)
ИЛ-5 стимулирует дифференцировку эозинофилов из ком-
митированных клеток-предшественников. Наиболее чувствитель-
ный метод определения ФДЭ основан на феномене образова-
ния эозинофилов в массовых культурах клеток костного мозга
[79]. Следует отметить, что в норме у мышей имеется лишь
очень незначительное количество предшественников эозинофи-
лов. Поэтому для повышения чувствительности метода необхо-
димо использовать костный мозг мышей с индуцированной
эозинофилией. Для этого мышей обычно заражают тетрагидри-
диями (вторая личиночная стадия) цестоды Mesocestoid.es corti
[80]. Личиночная форма цестоды пассируется путем внутри-
брюшинных инъекций и в контролируемых лабораторных ус-
ловиях не может пройти свой полный жизненный цикл, поэтому
не заражает других мышей. Паразит как правило не поражает
человека.
6.3.1. Получение личинок М. corti
1. Мышам BALB/c вводят внутрибрюшинно примерно
100 мкл осадка тетрагидридий М. corti, используя иглу диа-
метром 0,8 мм. В течение нескольких месяцев происходит уве-
личение числа личинок, брюшко у мышей раздувается от пара-
зитов и асцита, но внешне у животных не заметны какие-либо
другие симптомы инфекции. Таких мышей можно содержать в
течение нескольких месяцев для получения личинок в любое
время.
2. Мышей умерщвляют и для извлечения личинок удаляют
кожу на животе, вскрывают перитонеальную полость таким
образом, чтобы можно было перенести ее содержимое в чаш-
ку Петри со стерильным PBS.
3. Из чашки Петри личинок переносят в стерильную про-
бирку, где их отмывают, давая осесть и удаляя надосадочную
жидкость. (В стерильном PBS при 4 °C личинки остаются жи-
выми на протяжении нескольких месяцев). Для проверки их
жизнеспособности каплю взвеси помещают на предметное стек-
ло и, когда она слегка согреется, просматривают под микро-
скопом при слабом увеличении, определяя подвижность личи-
нок.
331
ГЛАВА 10
6.3.2. Определение фактора дифференцировки эозинофилов
1. Мышь умерщвляют через 10—18 дней после заражения
(в этот период в костном мозге присутствует максимальное
количество предшественников эозинофилов).
2. Удаляют обе бедренные кости и готовят суспензию кле-
ток костного мозга, как описано в гл. 1.
3. Клетки осаждают и ресуспендируют в среде RPMI 1640,
к которой добавлены СПК (15%) и гидрокортизон (10 6 М),
доводя до коцентрацпи 106 клеток/мл.
4. В лунки круглодонной панели для микротитрования, со-
держащие разведения исследуемых образцов надосадочной
жидкости (по 10 мкл), добавляют по 100 мкл клеточной сус-
пензии, и панель инкубируют во влажной атмосфере (5% СО2)
при 37 °C в течение 5—7 дней.
5. Образование эозинофилов в культуре определяют либо
путем подсчета в гемоцитометре, либо по активности перокси-
дазы.
6.3.3. Подсчет эозинофилов
1. Клетки собирают из лунок и подсчитывают.
2. Из клеточной суспензии с помощью цптоцентрифуги на
предметном стекле готовят мазки и окрашивают их развешен-
ным красителем Романовского—Гимза (эозинофильные гра-
нулы должны быть отчетливо видны при слабо прокрашенном
ядре).
3. Определяют содержание эозинофилов в лунке, подсчиты-
вая их количество в присутствии исследуемых образцов надо-
садочной жидкости и в контроле.
6.3.4. Определение эозинофилов по пероксидазной
активности
1. Из культур клеток костного мозга удаляют большую
часть среды.
2. Добавляют по 100 мкл раствора субстрата для перокси-
дазы (табл. 10.2) п оставляют на 30 мин при комнатной тем-
пературе.
3. Реакцию останавливают, добавляя в лунки по 50 мкл
4М серной кислоты.
4. Определяют светоиоглощение в лунках с помощью авто-
матического спектрофотометра для микропанелей (прибор на-
страивают на вычитание фона контрольных лунок содержащих
только среду).
Между количеством эозинофилов в культуре и активностью
пероксидазы, определяемой данным методом, наблюдается лп-
332
АНАЛИЗ ПИТЕРЛЕИКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
Таблица 10.2. Реагенты для определения эозинофилов по пероксидазной
активности
Основные растворы
0,05 М трис-HCl буфер, pH 8,0
10%-ный (по объему) раствор тритона Х-100;
2%-ный раствор о-фенилендиамина, (ОФД, Sigma Chemical Со, США)
30%-ный (вес/объем) раствор пероксида водорода;
Раствор субстрата пероксидазы
(готовится непосредственно перед использованием)
50 мл трис-HCl буфера
0,5 мл основного раствора тритона Х-100
0,5 мл основного раствора ОФД
6 мкл раствора пероксида водорода
нейная зависимость [81J. В связи с большой вариабельностью
активности пероксидазы между клетками костного мозга от-
дельных мышей целесообразно проводить исследование на кост-
ном мозге, собранном от нескольких животных.
6.4. Заключительный комментарий
Ни активность BCGF-II, выявляемая на клетках BCLj, ни
активность ФДЭ не считаются строго специфичными для ИЛ-5.
Например, интерлейкин-4 тоже стимулирует синтез ДНК в
клетках BCLi, но с помощью методов, описанных в разд. 5,
его можно отличить от не обладающего аналогичными свойст-
вами ИЛ-5. Дифференцировку эозинофилов вызывает также
ИЛ-3, но его в отличие от ИЛ-5 можно выявить с помощью
ИЛ-З-зависнмых клеточных линий, как описано в разд. 4.
7. В-клеточный стимулирующий фактор-2 (BSF-2,
В cell-stimulating factor-2)
BSF-2 (BCDF) индуцирует секрецию IgG и IgM трансфор-
мированными ВЭБ В-клетками человека, не оказывая сущест-
венного влияния на их рост, а также индуцирует секрецию тех
же иммуноглобулинов нормальными В-клетками, активирован-
ными Staphylococcus aureus Cowan I [82J. Здесь мы приводим
описание стандартных методов оценки этой активности.
7.1. Источники
Для получения BSF-2 можно использовать плевральные ли-
мфоциты, стимулированные туберкулином (PPD) [83], или
мононуклеарные клетки миндалин, стимулированные ФГА
333
ГЛАВА 10
[84] . Были описаны Т-клеточные гибридомы человека, секре-
тирующие этот фактор, но как правило они нестабильны и не
продуцируют BSF-2 в количествах, достаточных для выделения
или структурного анализа [85]. Хорошим источником относи-
тельно больших количеств BSF-2 может служить линия Т-кле-
ток, трансформированная вирусом Т-клеточного лейкоза, TCL-
Nal [85]. Кроме того, линии клеток карциномы мочевого пу-
зыря Т24, Rt4 и 5637 секретируют вещества с активностью
BSF-2 без какой-либо индукции [29, 86].
7.2. Индукция синтеза иммуноглобулинов нормальными
В-клетками под действием BSF-2
1. Из периферической крови человека выделяют лимфоциты
центрифугированием в градиенте плотности метризоата — фи-
колла, либо готовят суспензию клеток миндалин, полученных
при тонзилэктомии (гл. 1).
2. Клетки трижды отмывают минимальной средой Игла, со-
держащей 5% СПК, и ресуспендируют в обогащенной среде
RPMI 1640 с 10% СПК-
3. Для отделения Т-лимфоцитов от В-клеток используют
розетирование с ЭБ, обработанными гидробромидом бромисто-
го 2-аминоэтилизотиурония (АЭТ), как описано в гл. 1 [87].
4. Фракцию В-клеток ресуспендируют в среде RPMI 1640.
В суспензии должно присутствовать 30—60% Ig-позитивных
клеток.
5. Для частичного удаления моноцитов суспензию фракцио-
нируют на колонке сефадекса G-10 (гл.1) либо по адгезивности
к пластику на чашках Петри. В полученном таким образом
препарате В-клеток должно содержаться менее 1% Т-клеток
(по образованию розеток с эритроцитами барана) н менее
1% моноцитов (по фагоцитозу частиц латекса).
6. В-клеточную суспензию (106 клеток/мл) культивируют в
присутствии убитых S. aureus Cowan I (0,0025% по объему) в
течение трех дней во флаконах.
7. В градиенте перколла на PBS (30:40:50:60%) выделя-
ют лимфобласты, обладающие низкой плавучей плотностью,
центрифугируя при 1280 g и 4 °C в течение 12 мин.
8. Лимфобласты собирают на границе раздела слоев 40 и
50%-ного перколла и культивируют в течение трех дней при
концентрации 5-Ю5 клеток/мл в объеме 200 мкл среды
RPMI 1640, содержащей 10% СПК и разведения исследуемых
образцов надосадочной жидкости.
9. Определяют концентрацию синтезированных иммуногло-
булинов в культуральной среде иммуноферментным методом
[88], или клетки, секретирующие иммуноглобулины, методом
обратного локального гемолиза, описанным в гл. 5.
334
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
7.3. Индукция синтеза иммуноглобулинов
В-клетками трансформированных ВЭБ линий
Для определения BSF-2 можно использовать ВЭБ-трансфор-
мированные линии клеток SKW6-CL4 [89] или CESS [90].
Получение трансформированных ВЭБ В-клеточных линий опи-
сано в гл. 7.
1. Клетки SKW6-CL4 (4-Ю3) или CESS (6-Ю3) культивиру-
ют в объеме 200 мкл в присутствии трехкратных разведений
исследуемых образцов надосадочной жидкости.
2. Через три дня в культуральной среде определяют кон-
центрацию IgM (для клеток SKW6-CL4) или IgE (для клеток
CESS) иммуноферментным методом [88].
8. Стандартизация методов определения
лимфокинов
Изложенные в этой главе методы определения интерлейки-
нов основаны на их биологическом действии на клетки. Такого
рода биологические эффекты отличаются высокой вариабель-
ностью при повторном воспроизведении. Поэтому условия оп-
ределения активности интерлейкинов должны быть максималь-
но стандартизованы для того, чтобы уменьшить источники не-
контролируемых вариаций в одном опыте и от опыта к опыту.
В каждое определение следует включать стандартный образец
интерлейкина, во-первых, для проверки способности клеток в
данном опыте отвечать на исследуемый фактор, а во-вторых,
для выражения активности неизвестного препарата в единицах
активности стандартного образца. Активность следует выра-
жать в принятых международных единицах. Только при этих
условиях можно сравнивать результаты, полученные одной ла-
бораторией в разное время или разными лабораториями.
Как в прошлом, так и в настоящее время многие исследо-
ватели предпринимают разнообразные попытки ввести между-
народные стандарты в определение активности ИЛ-2 [40, 91]
и других лимфокинов [92, 37]. Комитет по стандартизации
лимфокинов Международного союза иммунологических обществ
(IUIS) приступил к отбору имеющихся коммерческих продук-
тов, которые могли бы служить в качестве международных ре-
ференс-препаратов для оценки активности ИЛ-1, ИЛ-2, а в
дальнейшем и других лимфокинов [93]. Когда эта работа бу-
дет завершена, читатель получит возможность при воспроизве-
дении описанных здесь методов воспользоваться стандартными
препаратами интерлейкинов для положительного контроля в
каждом опыте и соответственно измерить активность лимфоки-
нов по этим стандартам.
ГЛАВА 10
литература
1. Dumonde D. С., Wolstencrojt R. A., Panayi G. S., Matthew M„ Morley J.,
Howson U . T. (1969). Nature, 224, 38.
2. Dumonde D. C„ Hamblin A, (1983). In: Immunology in Medicine, 2nd edi-
tion, Holoiow E. J. and Reeves W. G. (eds.), Academic Press, London and
New York, p, 121.
3. Cohen S. el al. (1977), Cell Immunol., 33, 233,
4. Aarden L. A., et al. (1979). J. Immunol., 123, 2928,
5. Cohen S., Pick E., Oppenheim J. J., eds. (1979). The Biology of The Lym-
phokines, Academic Press, London and New York.
6. Scala G., Oppenheim J. J. (1985). In: Lymphokines, Pick E. and Landy M.
(eds.), Academic Press, London and New York, Vol. 12, p. 39.
7, Smith K- A,, Lachman L. B,, Oppenheim J. J., Favata M. F. (1980). J. Exp.
Med., 151, 1551.
8. Kaye J., Gillis S., Mlzel S. B., Shevach E. M., Malek T. R., Dinarello C. A.,
Lachman L. B,, Janeway C. A. (1984). J. Immunol., 133, 1339.
9. Sekaly R. P., Macdonald H. R., Zaech P., Nabholz M. (1982). J. Immunol.,
129, 1407.
10. Smith K. A., Ruscetti F. W. (1981). Adv. Immunol., 31, 137.
11. Gillis S., Mochizuki D. Y., Conlon P. J., Hefeneider S. H., Ramthun C. A.,
Gillis A. E,, Frank M. В., Henney C. S., Watson J. D, (1982). Immunol.
Rev., 63, 167.
12. Henney C. S., Kuribayashi K-, Kern D. E., Gillis S, (1981), Nature, 291, 335.
13. Grimm E A., Ramsey К. M., Mazumder A,, Wilson D. J., Djeu J. У., Rosen-
berg S. A. (1983). J. Exp. Med., 157, 884.
14. Gillis S., Union N. A., Baker P. E„ Smith K- A. (1979). J. Exp. Med., 149,
1460.
15. Gery I., Lepe-Zuniga J. L. (1984). In: Lymphokines, Pick E. and Landy M.
(eds,), Academic Press, London and New York, Vol. 12, p. 109.'
16. Oppenheim J. J., Kovacs E. Matsushima K-, Duram S. K. (1986). Immu-
nol. Today, 7, 45.
17. Kluger M. J., Oppenheim I. !., Powanda N. C., eds. (1986). The Physiologie,
Metabolic and Immunologic Actions of Interleukin I. Alan R. Liss, New
York.
18. Oppenheim J. J., Gery J. (1982). Immunol. Today, 3, 113.
19. Howard M., Nankanlshi K-, Paul W. E. (1984). Immunol. Rev.. 78, 185,
20. Kishimoto T. A. (1985). Immunol. Rev,, 3, 133.
21. Isakson P. C., Pure E., Vltetta E. S,, Krammer P. H. (1982) J. Exp. Med.,
155, 734.
22. Bergstedt-Lindqvist S., Sideras P., MacDonald II. R., Severinson E. (1984).
Immunol. Rev., 78, 25.
23. Noma Y., Sideras P., Naito T., Bergstedt-Lindqvist S., Агата C., Severin-
son E., Tanabe T-, Kinashi T,, Matsuda F., Yaoita Y., Honjo 7. (1986), Na-
ture, 319, 640,
24. Lee F., Yokota T., Otsuka T., Meyerson P., Villar et D,, Colinian R., Mos-
mann T., Rennick D., Roehm N,, Smith C,. Zlotnik A.. Aral K.-I. (1986). Proc,
Natl. Acad. Sci. USA, 83, 2061.
25. Swain S. L., Dutton R. IV. (1982). J. Exp. Med., 156. 1821.
26. O’Garra A-, Warren D. J., Holman M., Popham A. M., Sanderson C. J., Kla-
us G. G. B. (1986). Proc. Natl. Acad. Sci. USA, 83, 5228.
27, Kinashi T., Harada N., Severinson E., Tanabe T„ Sideras P., Konishl AL,
Azuma C,. Toninaga T., Bergstedt-Lindqvist S., Takahashi M., Matsuda F.,
Yaoita Y„ Takatsu K-, Honjo T. (1986). Nature, 324, 70.
28. Sanderson C. J., O’Garra A., Warren D. J., Klaus G. G. B. (1986). Proc.
Natl, Acad. Sci. USA, 83, 437.
29. Hirano T„ Yasukawa K.. Harada H., Taga T„ Watanabe У.. Matsuda T.,
Kashlwamura S.-i., Nakajima K-, Koyama K., Iwamatsu A.. Tsunasc.wa S.,
336
АНАЛИЗ ИНТЕРЛЕЙКИНОВ И ДРУГИХ ПОДОБНЫХ ИМ ФАКТОРОВ
Sakiyama F., Matsui Н., Takahara У., Tatiiguchi Т., Rishimoto Т. (1986).
Nature, 324, 73.
30. Haegman G., Content J., Volckaert G„ Derynck R., Tavernier J., Fiers W7.
(1986). Eur. J. Biochem., 159, 625.
31. Van Damme J., Opdenakker G., Simpson R. J., Rubiro M. R„ Cayphas S.,
Vink A., Billiau A., van Snick J. (1987). J. Exp. Med., 165, 914.
32. Gery I., Gershon R. R., Waksam В. H. (1972). J. Exp. Med., 136, 128,
33. Auron P. E., Webb A C., Rosenwasser L. J., Mucci S. F., Rich A., Wolff
S. M., Dinarello C. A. (1984). Proc. Natl. Acad. Sci. USA, 81, 7907.
.34 . March C., Mosley B., Larsen A., Gerrelti D. P., Braedt G., Price V., Gil-
lis S., Henney C. S., Rronheim S. R„ Grobstein R., Conlon P. J., Hopp T. P.,
Cosman D. (1985). Nature, 315, 641.
35. Lomedico P. T., Gubler U„ Hellman С. P., Dukovich M., Giri J. G., Pan Y.-C.,
Collier R. S., Chua A. 0., Mizel S. B. (1984). Nature, 312, 458.
36. Gillis S„ Mizel S. B. (1981). Proc. Natl. Acad. Sci. USA, 78, 1133,
37. Satsangi J., Wolstencroft R. A., Cason J., Ainley С. C., Dumonde D. C.,
Thompson R. P. H. (1987). Clin. Exp. Immunol., 67, 594.
38. Morgan D. A., Ruscetti F. W., Gallo R. C. (1976). Science, 193, 1007.
39. Matsui H., Fujita T., Nishi-Takaoka C., Hamuro J., Taniguchi T. (1986). In:
Lymnphokines, Pick E. and Landy M. (eds.), Academic Press Inc., London
and New York, Vol. 12, p. 1.
40. Gillis S., Ferm M. M., Ou W., Smith R. A. (1978). J. Immunol., 120, 2027.
41. Tada H., Shiho O., Ruroshima R., Royama M., Tsukamoto R. (1986). J. Im-
munol. Methods, 93, 157.
42. Hambin A. (1981). In: Techniques in Clinical Immunology. Thompson R. A.
(ed.), Blackwell Scientific Publications, Oxford, p. 272.
43. Boylston A. W., Anderson R. L., Haworth A. (1981). Clin. Expl. Immunol.,
43, 329.
44. Harbeck R. J., Hoffman A. A., Redecker S., Biundo T., Rurnick J. (1982).
Ciin. Immunol. Immunopathol., 23, 682.
45. Burgess A. W., Camarkaris J., Metcalf D. (1977). J. Biol. Chem., 252, 1998.
46. Howard M., Burgess A. W., McPhee D„ Metcalf D. (1980). Cell, 18, 993.
47. Burgess A. W., Metcalf D., Russell S. H. M., Nicola N. A. (1980). Biochem,
J., 185, 301.
48. Lee J- C„ Hapel A. J., Ihle J. N. (1982). J. Immunol., 128, 2393.
49. Ihle J. N., Reller J., Greenberger J. S., Henderson L„ Yetter R. A., Mor-
se H. C. (1982). J. Immunol., 129, 1377.
50. Rennick D. M., Lee F. D., Yakota T., Arai R., Cantor H., Nabel G. J. (1985).
J. Immunol., 134, 910.
51. Yang Y. C., Ciarletta A. B., Temple P. A., Cheng M. P., Rovacic S., Witek-
Giannetti J. A. S„ Leary A. C., Rriz R., Donahue R. E., Wong G. G., Clark
S. C. (1986). Cell, 47, 3.
52. Nicola N. A., Vadas M. (1984). Immunol. Today, 5, 76.
53. Jscove N. N., Roitsch C-, Hirama M. (1984). Lymphokine Res., 3, 67.
54. Schrader J. W., Clark-Lewis J., Crapper R- M., Wong G. IV. (1983). Immu-
nol. Rev., 76, 79.
55. Gough N. M., Gough J., Metcalf D., Relso A., Grail D., Nicola N. A., Bur-
gess A. W„ Dunn A. R. (1984). Nature, 309, 763.
56. Greenberger J. S., Eckner R., Ostertag W., Colleta B., Bashettl S., Nagasawa
H., Rarpas A., Weicheselbaum R., Moloney W. (1980). Virology, 105, 425.
57. Dexter T. M-, Allen T. D., Teich N. M. (1980). In: Experimental Haemoto-
logy Today, Baum S. J., Ledney Q. D. and van Belckun D. W. (eds.), Kar-
ger, Basel, Switzerland, p. 145.
58. Ihle J. N., Reller J., Henderson L„ Rlein F„ Palaszynski E. (1982) J. Immu-
nol., 129, 2431.
59. Greenberger J. S., Sakakeeny M. A„ Humphries R. R., Eaves C. J., Eck-
ner R. J. (1983). Proc. Natl. Acad. Sci. USA, 80, 2931.
60. Metcalf D. (1970). J. Cell. Physiol., 76, 89.
22—172
337
ГЛАВА 10
61. Yokota Т., Otsuka Т„ Mosmann Т., Banchereau J., DeFrance T., Blanchard D„
De Vries J. E„ Lee F., Aral K. (1986). Proc. Natl. Acad. Sci. USA, 83, 5894.
62. Azums C., Tanabe T-, Konishi M-, Kinashi T., Noma T., Natsuda F., Yaoi-
ta Y., Takatsu K., Hammarstrom L„ Smith C. J. E., Severinson E., Honjo T.
(1986). Nucleic Acids Res., 14, 9149.
63. Howard M., Farrar J; Hifiker M., Johnson B„ Kiyoshi T., Takatsu K., Ha-
maoka T„ Paul W. E. (1982). J. Exp. Med., 155, 914.
64. Yoshizaki K., Nagagawa T., Fukunaga K-, Kaieda T„ Maruyama S., Kisimo-
to S., Yamamura Y., Hashimoto T. (1983). J. Immunol., 130, 1241.
65. Muraguchi A., Kasahara T., Oppenheim J., Fauci A. (1982). J. Immunol.,
129, 2486.
66. Maizel A. L., Morgan J. W., Mehta S. R„ Kouttab N. M., Bator N. M., Sa-
hasrabuddhe C. S. (1983). Proc. Natl. Acad. Sci. USA, 80, 5047.
67, Roehm N. W„ Leibson H. J., Zloinik A., Happier J., Marrack P., Cambier J. C.
(1984). J. Exp. Med., 160, 679.
68. Noelle R., Krammer P. H„ Ohara J., Uhr J. W., Vietta E. S. (1984). Proc
Natl. Acad. Sci. USA, 81, 6149.
69. O’Garra A.t Sanderson C. J. (1987). In: Lymphokines and Interferons —
A Practical Approach. Clemens M. J., Morris A. Q. and Gearing A. J. H.
(eds.). IRL Press, Oxford and Washington, DC, p. 323.
70. Hung J. T„ Sharrow S. O., Ahmed A., Habbersett R., Scher I., Paul W. E.
(1982). J. Immunol., 128, 2049.
71. Klaus G. G. B., Hawrylowicz С. M., Holman M-, Keeler K. D. (1984). Im-
munology, 53, 693.
72. Coffman R. L., Carty J. (1986). J. Immunol., 136, 949.
73. Nabel G., Galli S. J., Dvorak A. M., Dvorak H. F., Cantor H. (1981) Natu-
re, 291, 332.
74. Smith C. A., Rennick D. M. (1986). Proc. Natl. Acad. Sci. USA, 83, 1857.
75. Mossman T. R. (1983). J. Immunol. Methods, 65, 55.
76. Harada N„ Kikuchi Y., Tominaga A., Takaki S., Takatsu K. (1985). J. Immu-
nol., 134, 3944.
77. Gronowicz E,, Coutinho A., Melchers F. (1976). Eur. J. Immunol., 6, 588.
78. Takatsu K-, Tanaka K-, Tominaga A., Kumahara Y., Hamaoka T. (1980).
J. Immunol., 125, 2646.
79. Sanderson C. J., Warren D. J., Strath M (1985). J. Exp. Med., 162, 60
80. Strath M„ Sanderson C. J. (1985). J. Cell Sci., 74, 207.
81. StrathM., Warren D. J., Sanderson C. J. (1985). J. Immunol. Methods, 83, 209.
82. Hirano T., Taga T., Nakano N., Yasukawa K„ Kashiwamura S., Shimizu K.,
Nakajima K-, Pyun К- H., Kishimoto T. (1985). Proc. Natl. Acad. Sci USA,
82, 5490.
83. Hirano T., Teranishi T„ Toba H., Sakaguchi N., Fukukawa T., Tsuyuguchi I.
(1981). J. Immunol., 126, 517.
84. Hirano T., Teranishi T., Onoue K. (1984). J. Immunol., 132, 229.
85. Shimizu K-, Hirano T„ Ishibashi K., Nakano N., Taga T., Sugamura K-> Ya-
mamura Y., Kishimoto T. (1985). J. Immunol., 134, 1728.
86. Rawle F. C., Shields J., Smith S. H., Iliescu V., Merkenschlager M., Bever-
ley P. C. L., Callard R. E. (1986). Eur. J. Immunol., 16, 1017.
87. Kaplan M. E., Woodson M., Clark C. (1976). In: In Vitro Methods in Cell
Mediated and Tumor Immunity. Bloom. B. R. and David J. R. (eds.), Aca-
demic Press, New York, p. 83.
88. Goldsmith P. K. (1987). Anal. Biochem., 117, 53.
89. Saiki O., Ralph P. (1983). Eur. J. Immunol., 13, 31.
90. Muraguchi A., Kishimoto T., Miki Y„ Kuritani T., Kaieda T., Yoshizaki K-,
Yamamura Y. (1981). J. Immunol., 127, 412.
91. Dumonde D. C„ Papermaster B. W. (1984). Lymphokine Res., 3, 193.
92. Hamblin A. S., Zawisza B„ Shipton U., Dumonde D. C., den Hollander F. C.,
Verheul H. (1982). J. Immunol. Methods, 59, 317.
93. Dumonde D. C. (1986). Lymphokine Res., 5, Supplement 1, 1.
338
Глава 11
АНАЛИЗ БИОХИМИЧЕСКИХ СВОЙСТВ
АНТИГЕНОВ ЛИМФОЦИТАРНОЙ
ПОВЕРХНОСТИ
А. Дэйвис и М. Браун
1. Введение
Чтобы охарактеризовать какой-либо поверхностный лимфо-
цитарный антиген, в клеточной иммунологии обычно прежде
всего применяют соответствующие антитела. Для получения
этих антител продуцентов иммунизируют как правило целыми
клетками, чтобы вызвать иммунный ответ на нативные молеку-
лы клеточной поверхности. Однако, в качестве антигена при
такой иммунизации может быть использован и синтетический
пептид, например, в том случае, когда необходимо охарактери-
зовать лимфоцитарный антиген, исходя из известной нам по-
следовательности ДНК, которая его кодирует. Полученные при
этом антитела должны, по-видимому, отличаться по специфич-
ности от антител к целым клеткам, а именно, лучше распозна-
вать развернутую, чем нативную конформацию поверхностного
лимфоцитарного антигена.
Специалистов в области клеточной иммунологии интересу-
ют в первую очередь, следующие биохимические свойства ис-
следуемого лимфоцитарного антигена. Какова его молекуляр-
ная масса? Состоит ли он из одной или нескольких цепей,
связанных дисульфидными мостиками? Гликозилирован ли он?
Синтезирован ли он именно теми клетками, на которых его вы-
являют? Фосфорилирован ли он? Отличается ли он от других
антигенов, идентифицированных ранее?
Для ответа на эти вопросы используют два основные мето-
да, базирующиеся на применении антител соответствующей спе-
цифичности. Первый метод, в котором особенно эффективны
антитела к нативным белкам, заключается в иммунопреципи-
тации клеточных антигенов, меченных радиоактивными изото-
пами. Затем иммунопреципитаты анализируют с помощью
электрофореза, например, одно- или двумерного электрофореза
в полиакриламидном геле (ПАГЭ) в присутствии додецилсуль-
фата натрия (ДСН, т. е. ДСН-ПАГЭ), неравновесного электро-
фореза в градиенте pH (НЭГрН), двумерного ДСН-ПАГЭ сна-
чала без, а затем в присутствии восстановителя.
Другой метод, который применяют, в частности, при нали-
чии антител к синтетическому пептиду, позволяет идентифици-
22* 339
ГЛАВА 11
ровать антигены, цепи которых развернуты, например, в ре-
зультате денатурации ДСН и иммобилизации на микропорис-
той мембране. Данный метод представляет собой иммуноблот-
тинг после разделения антигена в ДСН-ПАГЭ. Идентификация
денатурированного антигена особенно важна в тех случаях,
когда требуется клонировать кодирующий его ген. Так, напри-
мер, специфичные к синтетическому пептиду антитела могут
быть использованы для скрининга продуктов экспрессии генов,
клонированных в векторе Xgtll.
В настоящей главе сделана попытка изложить приемы пря-
мого биохимического анализа антигенов лимфоцитарной по-
верхности. Особое внимание уделено использованию антител в
иммунопреципитации и иммуноблоттинге в комбинации с ДСН-
ПАГЭ при исследовании некоторых наиболее существенных
свойств этих весьма специфичных антигенов.
2. Иммунопреципитация
2.1. Введение
Иммунопреципитация — это широко используемый метод,
который в сочетании с радиоактивным маркированием позволя-
ет биохимически охарактеризовать тот или иной антиген, не
очищая его в большом количестве. Определяемые количества
антигена выделяют из сравнительно небольшого числа мечен-
ных изотопом клеток с помощью антител. Например, для имму-
нопреципитации антигена CD3, около 30 000 молекул которого
экспрессируются на каждой Т-клетке, вполне достаточно взять
всего 107 этих клеток. Чем в большей степени экспрессирован
антиген, тем меньше клеток необходимо использовать для им-
мунопреципитации. Ее можно осуществлять, используя антите-
ла к эпитопам как нативных, так и денатурированных антиге-
нов.
Первый этап метода — это маркирование антигена соответ-
ствующим радиоактивным изотопом. Избирательное примене-
ние разных изотопов позволяет более детально охарактеризо-
вать природу и локализацию того или иного антигена. Сущест-
вует два основных способа введения радиоактивной метки в
структуру антигена — биосинтетическое маркирование и присо-
единение метки к молекулам, расположенным на поверхности
клетки. Для биосинтетического маркирования чаще всего при-
меняют [35S]-метионин, так как он имеет высокую удельную ра-
диоактивность, интенсивно включается в большинство белков,
которые синтезируются клеткой в большом количестве (около
104 молекул на клетку) и с необходимой скоростью. Однако,
даже в том случае когда в структуре антигена имеется метио-
340
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
нин, маркирование может оказаться недостаточным (как напри-
мер, включение метки в CD2 на рис. 11.1). Трудно маркирует-
ся и «зрелая» форма (26 кДа) у-цепи антигена CD3, в то вре-
мя как ее предшественник (23 кДа) включает [35S]-метионин
с достаточной интенсивностью (рис. 11.1 и 11.2).
Если белок не удается пометить биосинтетически [35S]-ме-
тионином, например, из-за слишком малого содержания остат-
ков метионина, можно воспользоваться другими метками —
[35S] -цистеином, либо смесями [3Н] и [14С]-аминокислот. Для
определения таких свойств антигенов, как степень ацилирова-
ния или гликозилирования, рекомендуется маркировать их со-
ответственно тритированными жирными кислотами, например,,
пальмитиновой [1] или тритированными сахарами, в частности,
маннозой. Многие белковые поверхностные антигены лимфо-
цитов, в особенности выполняющие функцию рецепторов или
ассоциированные с ними, фосфорилированы. Благодаря этому
данные антигены можно маркировать с помощью 32Р и анали-
зировать действие на клетки всевозможных активаторов и ли-
гандов. Например, установлено [2], что форболовые эфиры, ак-
тивируя протеинкиназу С, инициируют фосфорилирование у-
цепи ТЗ, а также гиперфосфорилирование антигена МНС клас-
са I и рецептора трансферрина (рис. 11.3).
Белки, экспонированные на клеточной поверхности, изби-
рательно маркируются 1251 с помощью лактопероксидазы. Ре-
акция иодирования при этом хорошо контролируема. Наличие
метки в иммунопреципитате надежно свидетельствует о по-
верхностной локализации исследуемого антигена. Лактоперок-
сидазному иодированию подвергается лишь незначительный
процент общего количества клеточных белков. Поэтому внеш-
нее маркирование дает гораздо меньше меченных посторонних
антигенов, чем биосинтетическое. Посторонние антигены, неспе-
цифически попавшие в иммунопреципитат, способны повысить
фон на радиоавтографах, если с ними связалась метка, как
это часто бывает при иммунопреципитации биосинтетически ме-
ченных белков. Белки с низким включением биосинтетической
метки, например, антиген CD2 и у-цепь CD3 целесообразно
маркировать именно 1251 с помощью лактопероксидазы (рис.
11.3 и 11.4).
Для проведения иммунопреципитации маркированные клет-
ки необходимо лизировать, а клеточные мембраны солюбилизи-
ровать для того, чтобы поверхностные антигены могли избира-
тельно преципитироваться антителами. В связи с этим усло-
вия лизиса маркированных клеток имеют особое значение. Для
неденатурирующей солюбилизации и диспергирования антиге-
нов обычно используют неионные [например, нонидет П-401
- Этилтенилполиэтиленгликоль. — Прим, перев.
341
ГЛАВА 11
Рис. 11.1. Анализ иммунопреципитатов в
ДСН-ПАГЭ. Лейкозные Т-клетки линии J6
(треки 1 и 2) и Т-лимфобласты (треки 3
и 4) человека биосинтетически метили 3SfS]-
метионином в течение 4 ч, затем клеточные
лизаты иммунопреципитировали антителами
к CD3 (треки 1 и 3) и к CD2 (треки 2 и 4).
Стрелка указывает предполагаемую пози-
цию у-цепи CD3 (26 кДа), ниже которой
отчетливо выявляются б- и е-цепи. Фигур-
ная скобка указывает предполагаемую по-
зицию антигена CD2, который включил мало
метки, поэтому его полоса не отличается от
«фоновых» (сравните треки 3 и 4).
Рис. 11.2. Анализ иммунопреципитатов в
ДСН-ПАГЭ. Т-лимфобласты человека
биосинтетически метили [3SS]-метионином
в течение 10 мин, а затем инкубировали
с «холодным» метионином в течение
0 мин (трек 1), 15 мин (трек 2), 30 мин
(трек 3), 60 мин (трек 4) и 120 мин
(трек 5). Стрелкой показана «незрелая»
форма у-цепи CD3 (23 кДа), «зрелая»
форма не видна. Фигурной скобкой ука-
заны позиции 6- и е-цепей CD3 и их пред-
шественников.
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
12-5-
1 2 3 4 f 6 7 8 9 10 11 12
Рис. 11.3. Фосфорилирование поверхностных антигенов при стимуляции лим-
фоцитов человека форболовым эфиром [2]. Выделенные из периферической
крови клетки острого лимфолейкоза биосиитетически метили 32Р в течение Зч.
Стимуляция форболовым эфиром производилась за 0 мии (треки 1, 4, 7),
5 мин (треки 2, 5, 8) или 15 мин (треки 3, 6, 9) до иммунопреципитации, про-
веденной с антителами к HLA класса I (треки 1, 2, 3), к рецептору Т-лимфо-
цитов (треки 4, 5, 6) или к CD3 (треки 7, 8, 9). На треках 10, И, 12,
соответственно, представлены радиоавтографы иммуиопреципитатов, получен-
ных с теми же антителами из лизатов тех же самых клеток, меченных 1251 с
помощью лактопероксидазы. Использован вариант иммунопреципитации с при-
менением протеин А-сефарозы. По вертикали указана молекулярная масса.
(НП-40)] или слабоионные (например, дезоксихолат натрия)
детергенты. Неионные детергенты, подобные тритону-Х 114,
в разной степени солюбилизируют гидрофильные, ассоцииро-
ванные с клеточной мембраной белки, и амфифильные инте-
гральные мембранные белки [3]. Сильноионные детергенты,
например, ДСН, можно использовать для обнажения эпитопов,
скрытых в третичной структуре белковой молекулы.
Наряду с использованием иммунопреципитации непосредст-
венно для анализа специфического антигена, рациональный
выбор детергента позволяет применять ее для идентификации
других молекул, ассоциированных с антигеном. Солюбилизация
неденатурирующими детергентами, например, CHAPS2 [4] или
2 3 - [(3 - cholamidopropyl)-dimetyl-ammonio] -1 - propanesulfonate.— Прим,
перев.
343
ГЛАВА 11
25 —
Рис. 11.4. Дегликозилироваиие с по-
мощью Эндо F поверхностных CD2 и
HLA класса I, выделенных иммуно-
преципитацией из лизата меченных
1251 человеческих лейкозных Т-клеток
линии J6, солюбилизированных НП-40
[6]. Трек 1—не обработанный фер-
ментом CD2; трек 2 — CD2+1,8 ед.
Эидо F; трек 3 — CD2+0.18 ед. Эидо
F; трек 4 — неферментированный HLA
класса I; трек 5 — HLA класса 1+
+ 1,8 ед. Эндо F. ₽2-мнкроглобулнн
(12,5 кДа) не гликозилирован. По
вертикали указана молекулярная
масса.
дигитонином, не разрушает макромолекулярные комплексы, по-
этому молекулы, ассоциированные с антигеном, попадают в им-
мунопреципитат вместе с ним (рис. 11.5).
С помощью иммунопреципитации можно выяснить, содер-
жит ли антиген присоединенный связью N-типа «маннозобога-
тый» или гетеросахаридный углеводный компонент или присо-
единенные связью О-типа олигосахариды, либо то и другое.
Прежде чем анализировать в ДСН-ПАГЭ, иммунопреципитиро-
ванный антиген можно гидролизовать соответствующей глико-
344
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
Рис. 11.5 Одновременно с иммунопреципитацией
антигена CD3 (нижняя фигурная скобка) был ко-
преципитирован антигенраспознающий рецептор
Т-клеток (верхняя фигурная скобка). Клетки ост-
рого лимфолейкоза, выделенные из периферической
крови человека, метили 1251 с помощью лактопер-
оксидазы и иммунопреципитировали антителами
к CD3, иммобилизованными на гранулах сефаро-
зы. На треке 1 представлены иммунопреципитаты
до обработки Эндо F; на треке 2 — после трех-
кратной обработки 0,25 ед. Эндо F.
зидазой. При этом утрата углеводного компонента выявляется
по уменьшению молекулярной массы антигена. Изменения в
степени гликозилирования, которые претерпевает белок в ходе
посттранскрипционного процессинга, можно определить по ди-
намике его чувствительности к различным гликозидам. Дегли-
козилирование антигена позволяет определить молекулярную
массу его белкового каркаса, которая соответствует, например,
для CD2 приблизительно 40 кДа. Белковый каркас иммунопре-
ципитированного CD2 после обработки 0-эндогликозаминида-
зой F, которая отщепляет «незрелые» и «зрелые» олигосаха-
ридные цепи, представлен полосой именно в этой области мо-
лекулярных масс при ДСН-ПАГЭ (рис. 11.4) [6]. Последст-
вия воздействия этой же гликозаминидазы на антиген CD3 мож-
но видеть на рис. 11.5.
Подробное описание различных вариантов метода иммуно-
преципитации приведено ниже и схематически представлено на
рис. 11.6. Как это видно, иммунопреципитация может быть осу-
ществлена с помощью гранул сефарозы, нагруженных антите-
лами или стафилококковым белком А, либо взвесью клеток
стафилококка, обладающего белком А. Методу иммунопреци-
питации предшествует описание трех методов радиомаркирова-
ния клеток. В конце раздела описаны некоторые приложения
основного варианта метода иммунопреципитации.
345
ГЛАВА 11
Рздиоактивномеченные клетки
Лизируют клетки в растворе неионного или слабоионного детергента
Предварительно очищают лизат
Добавляют антитела
4
Добавляют кроличьи антитела к иммуноглобулинам мыши
Проводят иммунопреципитацию Проводят иммунопреципитацию Проводят преципитацию с помощью
антителами, фиксированными взвесью стафи/ококка, белка А, фиксированного на гранулах
на гранулах сефарозы содержащего белок А сефарозы
Отмывают
Элюируют комплексы антиген-
антитело из преципитатов
Анализируют путем электрофореза
в ПААГ с ДСН
Рис. 11.6. Последовательные этапы разных вариантов иммунопреципитации.
2.2. Радиомаркирование клеток
2.2.1. Иодирование белков клеточной поверхности
с помощью лактопероксидазы
Лактопероксидаза не проникает сквозь наружную мембрану
живых клеток, поэтому, если тщательно соблюдать указанные
ниже условия реакции, происходит иодирование исключитель-
но тех белков, которые экспонированы на клеточной поверхно-
сти. В связи с этим весьма важно брать для маркирования кле-
точную взвесь с высокой жизнеспособностью (выше 95%), ина-
че будут иодироваться внутриклеточные белки погибших лим-
фоцитов. Для сохранения высокой жизнеспособности следует
до предела сократить пребывание клеток в PBS и контроли-
ровать, не снизилась ли она в ходе эксперимента. Другой
важный параметр направленного маркирования — это концент-
рация радиоактивного иодида. Она в любом случае должна
быть ниже эквимолярной концентрации лактопероксидазы на-
столько, чтобы весь иодид был полностью связан с нею, и ни
одна из его молекул не смогла проникнуть через цитоплазма-
тическую мембрану и пометить внутриклеточные белки. В усло-
виях маркирования, которые указаны здесь, концентрация лак-
346
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
□пероксидазы примерно в 100 раз превышает концентрацию
одида. Поэтому, при необходимости, последняя может быть
величена без каких-либо осложнений.
Из соображений безопасности весьма важно, чтобы иодиро-
ание проводилось в хорошо функционирующем вытяжном
ткафу.
1. Необходимые реагенты,
PBS : 10 мМ натрий-фосфатный буфер, pH 7,2, содержащий
,17 М NaCl и 3 мМ КС1.
Иодируемые клетки суспендируют в этом PBS.
Лактопероксидаза (фирмы Sigma Chemical Со., США).
|,2 мг растворяют в PBS, получившийся раствор, содержащий
:0 ед./мл фермента, разливают мелкими порциями и хранят
[ри —70 °C.
Глюкозооксидаза (фирмы Sigma), растворяют в PBS до кон-
центрации 1 ед./мл.
Раствор Nal2SI без носителя (100 мКи/мл, фирмы Amers-
iam International pic, Великобритания). Первоначальный вари-
1нт метода описан в литературе [7].
2. Метод.
1) Клетки быстро отмывают PBS путем центрифугирова-
1ия, подсчитывают и доводят концентрацию клеточной взвеси
io 108 мл.
2) К 100 мл клеточной взвеси добавляют 10 мкл раствора
чактопероксидазы, 20 мкл раствора глюкозооксидазы, 10 мкл
эаствора глюкозы и 5 мкл раствора Na125I, содержащего
500 мкКи 1251.
3) Пробирку с клеточной взвесью закрывают пробкой, со-
держимое перемешивают и инкубируют 10 мин при 20 °C.
4) После инкубации клетки трижды отмывают PBS при
помощи центрифугирования.
2.2.2. Биосинтетическое маркирование белков
'^'[8]-метионином
Известны два варианта биосинтетического маркирования,
которые дифференцированно используются в зависимости от ко-
личества содержащихся в клетке молекул маркируемого белка
и скорости его метаболизма. Для многих белков достаточно
маркировать клетки 35[5]-метионином в течение 4 ч, но для
белков с низкой скоростью метаболизма может понадобиться
период 12—18 ч. Однако имеются исключения, например, "f-
цепь ТЗ метится только при краткосрочном маркировании и
теряет метку с продлением срока маркирования. Причина
этого нам не известна, но сам по себе этот феномен указыва-
ет на необходимость подбора условий маркирования каждого
конкретного белка путем эксперимента.
347
ГЛАВА 11
1. Необходимые реагенты
Среда для культуры ткани RPMI \ §40 без метионина.
Раствор 35 [SJ-метионина (15 мКи.’мл фирмы Amersham In-
ternational pic. Великобритания).
Сыворотка плода коровы (СПК), диализованная против
PBS.
Клетки, подлежащие биосинтетическому маркированию.
2. Метод
1) Клетки трижды отмывают средой RPMI 1640 без метио-
нина с помощью центрифугирования, подсчитывают и доводят
концентрацию клеточной взвеси до 2-106/мл той же средой, со-
держащей 10% СПК.
2) Инкубируют клетки 45 мин при 37 °C.
3) Проводят маркирование по одной из следующих методик:
(а) добавляют к клеточной взвеси 35[SJ-метионин до конечной
концентрации 20 мкКи/мл и оставляют на ночь при 37 °C, либо
(б) после инкубации в среде без метионина клеточную взвесь
центрифугируют, затем, ресуспендировав клетки в той же сре-
де до концентрации 108/мл, добавляют 35[SJ-метионин в конеч-
ной концентрации 1 мКи/мл и инкубируют в течение 4 ч при
37 °C.
2.2.3. Маркирование 32Р
Маркирование в течение 3 ч обеспечивает достаточный уро-
вень включения 32Р в большинство фосфопротеинов. Если не-
обходимо повысить включение метки в какой-либо конкретный
белок, увеличивают продолжительность маркирования или
используют более высокую концентрацию 32Pi (радиоактивного
неорганического фосфата), либо применяют то и другое одно-
временно. Однако, увеличение продолжительности маркирова-
ния клеток свыше 6 ч может дать высокий уровень фона на
радиоавтографах.
1. Необходимые реагенты
Минимальная среда Игла свободная от фосфатов
[32Р]-ортофосфат (10 мКи/мл, Amersham International
pic, Великобритания).
СПК, диализованная против PBS.
Клетки, которые необходимо маркировать.
2. Метод
1) Клетки трижды отмывают бесфосфатной культураль-
ной средой путем центрифугирования, подсчитывают и
суспендируют в той же среде, содержащей 10% СПК.
2) Инкубируют клетки в течение 45 мин при 37 °C, затем
348
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
Таблица 11.1. Состав растворов, используемых при иммунопреципитации
1. Литический буфер: 10 мМ трис-HCl буфер, pH 7,4, содержащий 1% НП-40
(вес/объем), 150 мМ NaCl, 1 мМ этилендиамиитетрауксусная кислота
(ЭДТУ).
2. Литический буфер, содержащий 1 мг/мл БСА.
3. Первый буфер для отмывания: литический буфер, содержащий дополни-
тельно 0,5 М NaCl.
Второй буфер для отмывания: литический буфер, содержащий дополнитель-
но 0,1% дсн.
Третий буфер для отмывания: 10 мМ трис-HCl буфер, pH 7,4, содержащий
0,1% НП-40.
4. 3,5 М раствор NaCl
5. 1 М раствор ФМСФ в ацетоне (Осторожно! Яд).
добавляют раствор 32Р( до конечной концентрации
40 мкКи/мл. Маркирование продолжается в течение
3—6 ч при 37 °C. Его необходимо продлить до следую-
щего утра, если маркируются неактивированные (по-
коящиеся) клетки.
2.3. Иммунопреципитация с помощью взвеси клеток
Staphylococcus aureus
2.3.1. Необходимые реагенты
Состав «литического буфера» и других используемых реа-
гентов представлен в табл. 11.1. Методы радиомаркирования
клеток описаны в разд. 2.2.
2.3.2. Получение клеточного лизата
1. Клетки дважды отмывают средой RPMI 1640 путем цент-
рифугирования.
2. Осадок клеток ресуспендируют в PBS так, чтобы в 50 мкл
содержалось 2-Ю7 клеток.
3. К клеточной взвеси на каждые 2-Ю7 клеток добавляют
по 1 мл литического буфера, содержащего БСА и 1 мкл ФМСФ
(фенилметилсульфонилфторида).
4. Осторожно перемешивают и оставляют на льду на 30 мин.
5. Клеточный лизат центрифугируют при 400 g- в течение
5 мин, чтобы осадить ядра клеток.
6. Собирают надосадочную жидкость и подвергают ультра-
центрифугированию при 100 000 g- и 4 °C в течение 60 мин.
При недостатке времени вполне допустимо вместо ультра-
центрифугирования осветлить надосадочную жидкость, полу-
ченную на этапе 5 в микроцентрифуге при 10 000 g- и 4 °C в те-
349
ГЛАВА 11
Таблица 11.2. Ингибиторы протеиназ
1. Иодоацетамид (20 мМ раствор)
2. Соевый ингибитор трипсина (50 мкг/мл)
3. Лейпептин1* (2 мкг/мл)
!) Полусульфат П-ацетил-Ь-лейцил-Ь-лейцил-аргиналя — пептидный ингибитор трипси-
на, плазмина, папаина и катепсина В из Streptomyces roseus. — Прим, перев.
чение 15 мин. Отделенный от осадка лизат, разлитый по 0,5 мл,
можно хранить при —70 °C. Каждая такая порция лизата соот-
ветствует 107 клеток исходной взвеси и вполне достаточна для
получения иммунопреципитата в реакции с одним образцом ан-
тител определенной специфичности.
Если ФМСФ не обеспечивает ингибирование протеиназ до
нужного уровня, и происходит деградация антигена, в литиче-
ский буфер целесообразно добавить другой ингибитор, напри-
мер, из перечисленных в табл. 11.2. По той же причине клеточ-
ный лизат необходимо всегда держать на холоде. При марки-
ровании 32Р в клеточный лизат следует добавить ингибиторы
фосфатаз — ванадат [8] для специфической инактивации тиро-
зиновых фосфатаз и фторид натрия (50 мМ) для ингибирова-
ния треониновых и сериновых фосфатаз.
В том случае, если антитела связываются только с эпито-
пами, экспонирующимися при развертывании молекулы анти-
гена, его следует перед иммунопреципитацией обработать ДСН.
1. К клеточной взвеси добавляют литический буфер, содер-
жащий БСА, из расчета 1 мл на 2-10* 1 2 3 4 s 6 клеток.
2. Осторожно перемешивают и на 30 мин оставляют на льду.
3. Клеточный лизат центрифугируют при 400 g- и 4 °C в те-
чение 5 мин для осаждения ядер клеток.
4. Собирают надосадочную жидкость и добавляют к ней
ДСН до конечной концентрации 1%.
5. В течение 5 мин лизат кипятят, затем разбавляют в
10 раз литическим буфером, содержащим БСА и 1 мкл/мл
ФМСФ. В результате 1 мл лизата становится эквивалентен
2-107 исходных клеток, при котором возможно взаимодействие
антигена с антителами.
6. Клеточный лизат ультрацентрифугируют при 100 000 g и
4 °C в течение 60 мин.
2.3.3. Предварительная очистка лизата
1. Взвесь убитых клеток Staphylococcus aureus, содержащих
белок А [9] дважды отмывают литическим буфером и ресус-
пендируют до 10 %-ной концентрации в этом же буфере с БСА.
Доводят концентрацию NaCl в полученной взвеси до 0,5 М (на
каждый 1 мл взвеси добавляют 0,1 мл 3,5 М раствора NaCl).
359
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
2. \На каждый 1 мл клеточного лизата (эквивалентный 2Х
ХЮЧклеток) добавляют по 100 мкл взвеси отмытого стафило-
кокками помещают в ротационный смеситель на 60 мин при
комнатной температуре или на ночь при 4 °C.
3. Центрифугируют клеточный лизат при 10 000 g и 4 °C в
течение 5 мин в микроцентрифуге, чтобы осадить стафилокок-
ки. На этом этапе происходит предварительная очистка клеточ-
ного лизата с удалением тех компонентов, которые неспецифи-
чески (т. е. без участия антител) связываются на поверхности
стафилококка.
4. Надосадочную жидкость декантируют и доводят в ней
концентрацию NaCl до 0,5 М (на каждый 1 мл очищенного ли-
зата добавляют 0,1 мл 3,5 М NaCl).
2.3.4. Иммунопреципитация
1. К 0,5 мл очищенного лизата (эквивалентным 107 клеток)
добавляют 10 мкг чистых антител, либо 10 мкл асцитной
жидкости или сыворотки, содержащих антитела.
2. Инкубируют в течение 60 мин при комнатной температу-
ре или, если антитела обладают низкой аффинностью, в течение
ночи при 4 °C. Чтобы получить оптимальные преципитаты, це-
лесообразно протитровать антитела в интервале доз от 3 до
30 мкг на 0,5 мл клеточного лизата. Если применяемые моно-
клональные антитела относятся к изотипу, не связывающемуся
со стафилококковым белком А [10], то после первоначальной
инкубации к лизату добавляют кроличьи антитела к мышиным
иммуноглобулинам (из расчета 2 мкг на 1 мкг моноклональных
антител) и инкубируют на льду в течение 45 мин.
3. К лизату добавляют 50 мкл взвеси отмытых стафилокок-
ков и помещают в ротационный смеситель на 60 мин при 4°C.
4. Лизат центрифугируют при 10 000 g и 4 °C в течение 5 мин
в микроцентрифуге. Надосадочную жидкость отделяют от осад-
ка стафилококка, нагруженного иммунопреципитатами. Ее
можно сохранить при —70°C и снова подвергнуть иммунопре-
ципитации с образцами антител другой специфичности.
2.3.5. Отмывание
1. К осадку стафилококка, нагруженного иммунопреципита-
том, добавляют 1 мл первого буфера для отмывания (см. табл.
11.1), тщательно ресуспендируют пипеткой или на смесителе
«Вортекс».
2. Полученную взвесь центрифугируют при 10 000 g и 4 °C в
течение 5 мин в микроцентрифуге.
3. Надосадочную жидкость устраняют, а осадок стафилокок-
ка, нагруженного иммунопреципитатом, отмывают вторым и
третьим буферами, как описано в пп. 1 и 2.
351
ГЛАВА 11
2.3.6. Подготовка иммунопреципитата к ДСН-ПАГЭ
1. Осадок стафилококка, нагруженного иммунопреципитатом,
ресуспендируют в 50—100 мкл буфера для образцов $ ДСН
(см. разд. 4.2).
2. Кипятят в течение 4 мин.
3. Центрифугируют по 10 000 g и 4 °C в течение 5 мин в
микроцентрифуге.
4. Собирают надосадочную жидкость и наносят на полиак-
риламидный гель с ДСН для разделения. Если важен количест-
венный выход антигена, то осадок стафилококка ресуспендиру-
ют в 50 мкл буфера для образцов с ДСН, повторно кипятят и
осаждают центрифугированием. Полученную при этом допол-
нительную порцию надосадочной жидкости объединяют с пре-
дыдущей. Таким образом элюированный антиген можно сохра-
нять при —20°C до ДСН-ПАГЭ. После размораживания перед
нанесением на гель образец антигена еще раз кипятят.
2.4. Иммунопреципитация с помощью гранул геля сефарозы,
нагруженных стафилококковым белком А
2.4.1. Приготовление взвеси гранул геля протеин
А — сефарозы (Pharmacia Fine Chemicals, Швеция)
Подготовленную по инструкции изготовителя взвесь гранул
сефарозы отмывают так же, как взвесь стафилококка (см. разд.
2.3.3) и ресуспендируют до 10%-ной концентрации.
2.4.2. Иммунопреципитация
1. Из клеток получают лизат, предварительно его очищают,
затем добавляют к нему антитела так же, как при осаждении
иммунопреципитата стафилококком (см. разд. 2.3.2, 2.3.3 и
2.3.4).
2. После инкубации с антителами к 0,5 мл лизата добавля-
ют 30 мкл отмытых гранул геля протеин А — сефарозы и на
60 мин помещают в ротационный смеситель при 4 °C.
2.4.3. Отмывание
1. Клеточный лизат центрифугируют при 10 000 g и 4°C в
течение 30 с в микроцентрифуге.
2. Пастеровской пипеткой осторожно отсасывают примерно
400 мкл надосадочной жидкости.
3. Оставшуюся часть надосадочной жидкости удаляют спе-
циальным гамильтоновским микрошприцем (на 100 мкл с очень
352
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
тонкий иглой типа 3, имеющей тупой конец и точечное отвер-
стие,! не пропускающее гранулы геля сефарозы). Сефарозные
грандты очень легко суспендируются, поэтому следует обере-
гать пЬобирку от сотрясений.
4. К осадку гранул сефарозы добавляют 100 мкл первого
буфер^ для отмывания и помещают на смеситель «Вортекс» на
5 с.
5. Центрифугируют и удаляют надосадочную жидкость га-
мильтоновским микрошприцем.
6. К осадку гранул сефарозы добавляют 100 мкл второго
буфера для отмывания, аккуратно смывая гранулы со стенок
пробирки на дно. Если часть гранул все же останется на стен-
ках, их осаждают центрифугированием в течение 30 с в микро-
центрифуге, затем помещают на смеситель «Вортекс».
7. Повторяют этапы 5 и 6 с третьим буфером для отмыва-
ния.
2.4.4. Подготовка иммунопреципитата к ДНС-ПАГЭ
1. К осадку гранул геля сефарозы, нагруженных иммуно-
преципитатом, добавляют 50—100 мкл буфера для образцов с
ДСН и кипятят в течение 4 мин.
2. Центрифугируют при 10 000 g в течение 30 с в микро-
центрифуге.
3. Надосадочную жидкость собирают га мильтоновским
микрошприцем и наносят на полиакриламидный гель с ДСН.
2.5. Иммунопреципитация с помощью антител,
непосредственно присоединенных к гранулам
геля сефарозы
В определенном смысле этот вариант иммунопреципитации
представляет собой дальнейшее усовершенствование описанно-
го выше метода. Антитела ковалентно присоединяют к грану-
лам активированной бромцианом сефарозы фирмы Pharmacia
Fine Chemicals, Швеция. К 1 мл гранул сефарозного геля мож-
но присоединить не менее 1 мг антител. Нагруженную антите-
лами сефарозу применяют точно так же, как протеин А — се-
фарозу. Иммунопреципитаты, представленные на рис. 11.1 и
11.2 были получены с помощью антител, присоединенных к гра-
нулам сефарозы.
2.6. Сравнение разных вариантов метода
иммунопреципитации между собой
Иммунопреципитация с помощью антител, присоединенных
непосредственно к гранулам сефарозы, дает наименьший уро-
вень фона на радиоавтографах и требует меньших временных
353
ГЛАВА 11
затрат, чем другие варианты метода. Однако, учитывая цитра-
ты времени на очистку и присоединение антител, этот вариант
иммунопреципитации целесообразен только при регулярном
использовании. Располагая препаратом антител низкого каче-
ства и планируя поставить лишь отдельные опыты иммунопре-
ципитации, лучше использовать протеин А-сефарозу. Правда,
она довольно дорога. Вполне адекватным может быть приме-
нение наиболее дешевого реагента — взвеси стафилококка, со-
держащего белок А, но только в том случае, если исследуемый
антиген обильно представлен на клетках и интенсивно вклю-
чает метку, и в распоряжении исследователя имеются высоко-
аффинные антитела. В ином случае этот вариант иммунопре-
ципитации может дать высокий уровень фона на радиоавто-
графах. Кроме того, он наиболее трудоемок, так как ресуспен-
дирование осевшего стафилококка при отмывании занимает
много времени.
2.7. Примеры использования иммунопреципитации
2.7.1. Анализ характера гликозилирования
Очищенные иммунопреципитацией антигены можно до
ДСН-ПАГЭ обработать различными ферментами, специфически
отщепляющими углеводные компоненты. Эндо-0-М-ацетил-
глюкозаминидаза F (Эндо F) отщепляет N-связанные «зрелые»
и «незрелые» углеводные цепи (см. рис. 11.4 и 11.5) от глико-
протеинов, а эндо-а-М-ацетилгалактозаминидаза (О-глюкана-
за) отщепляет от них «зрелые» О-связанные углеводные цепи.
Оба фермента можно использовать при определении молеку-
лярной массы белкового каркаса гликопротеинов. Эндо-p-N-
ацетилглюкозаминидаза Н (Эндо Н) катализирует гидролиз
«маннозобогатых» углеводных цепей и позволяет анализировать
процесс гликозилирования белка во время переноса его к ци-
топлазматической мембране. Сиаловые кислоты, присоединен-
ные к N- и О-связанным углеводным цепям гликопротеинов, от-
щепляются нейраминидазой. При этом уменьшается гетероген-
ность поверхностных зарядов молекулы антигена и тем самым
облегчается интерпретация «пятен», образующихся в геле при
двумерном ДСН-ПАГЭ.
В табл. 11.3 перечислены буферные растворы, в которых
проводят эндогликозидазный гидролиз. Ниже описаны последо-
вательные этапы обработки антигенов гликолитическими фер-
ментами. О-глюканазу, изготовленную фирмой Genzyme Corp.,
США, можно приобрести вместе с инструкцией по применению
у фирмы Koch-Light Ltd., Великобритания.
354
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
Таблица 11.3. Состав буферных растворов для эвдогликозидазного гидролиза,
гликопротеиновых антигенов
А. 100 «|М трис-HCl буфер, pH 7,4
1 % Ден
1% (>меркаптоэтанол
Б. 0,1 М иатрнй-фосфатный буфер, pH 6,1
50 мМ ЭДТА
1% НП-40
0,1% ДСН
1% р-меркаптоэтанол
В. 150 мМ натрнй-цнтратный буфер, pH 5,5
Г. 100 мМ натрнй-ацетатный буфер, pH 5,5
0,3 М НС1
0,2% СаС12
1) Очищенные иммунопреципитаты антигенов получают, как
описано в разд. 2.3, 2.4 или 2.5. Для получения каждого им-
мунопреципитата Ю'’ клеток растворяют в 0,5 мл литического
буфера.
2) Иммунопреципитат осаждают центрифугированием
после заключительного отмывания в третьем буфере; надоса-
дочную жидкость удаляют.
3) К осадку стафилококка или гранул геля, нагруженных,
иммунопреципитатом, добавляют 10 мкл буфера А (табл. 11.3),
кипятят в течение 5 мин, центрифугируют, а затем собирают
надосадочную жидкость.
4) К осадку добавляют еще 10 мкл буфера А и повторяют
этап 3.
1. Обработка иммунопреципитата Эндо F
1) Объединяют две порции (20 мкл) надосадочной жидкос-
ти, полученной на этапах 3 и 4 (см. выше) и добавляют 80 мкл
буфера Б.
2) Добавляют 1 мкл Эндо F (250 ед./мл, NEN Research
Products, США) и 1 мкл ФМСФ (1 М раствор в ацетоне), ин-
кубируют при 37 °C в течение 16 ч.
3) Через 16 и 24 ч ферментативного гидролиза добавляют'
еще по 1 мкл Эндо F и ФМСФ.
4) В заключение, через 40 ч ферментативного гидролиза,
добавляют 100 мкл охлажденного 25%-ного раствора трихлор-
уксусной кислоты (ТХУ) и оставляют на 30 с на льду.
5) Центрифугируют гидролизат при 10 000 g и 4 °C в тече-
ние 5 мин в мйкроцентрифуге.
6) Аккуратно удаляют надосадочную жидкость и отмывают
осадок 1 мл охлажденного ацетона. Центрифугируют при
10 000 g и 4 °C в течение 10 мин в микроцентрифуге и вновь-
отмывают осадок ацетоном.
355>
ГЛАВА 11
7) Удаляют из пробирки ацетон высушиванием.
8) Добавляют буфер для образцов с ДСН, кипятят в1 тече-
ние 4 мин, разделяют в ДСН-ПАГЭ и проводят авторадиогра-
фию пластинки геля.
После отмывания ацетоном осадок может стать невидимым.
Не беспокойтесь! Просто он очень уменьшился.
Некоторые антигены больше других резистентны к Эндо F,
поэтому для них требуется более продолжительный гидролиз.
2. Обработка иммунопреципитатов Эндо Н
1) Объединяют две порции надосадочной жидкости, полу-
ченной на этапах 3 и 4 (см. выше подготовку к ферментативно-
му гидролизу) и добавляют 80 мкл буфера В.
2) Добавляют 1 мкл Эндо Н (45—74 мкг/мл, NEN Research
Products) и инкубируют при 37 °C в течение 16 ч.
3) Затем добавляют 100 мкл охлажденного 25%-ного раст-
вора ТХУ для осаждения антигена. Осадок отмывают, как опи-
сано в разделе, посвященном использованию Эндо F.
3. Обработка иммунопреципитата нейраминидазой
1) Объединяют две порции надосадочной жидкости, получен-
ные на этапах 3 и 4 (см. выше подготовку к ферментативному
гидролизу), и добавляют 80 мкл буфера Г.
2) Добавляют 1 мкл нейраминидазы (100 ед./мл, Sigma
Chemical Со., США) и 1 мкл ФМСФ (1 М раствор в ацетоне),
инкубируют при 37 °C в течение 16 ч.
3) Добавляют 100 мкл охлажденного 25%-ного раствора
ТХУ для осаждения антигена, осадок отмывают, как описано
в разделе, посвященном использованию Эндо F.
2.7.2. Сравнение исследуемого антигена с известными
Модификации методов иммунопреципитации и иммуноблот-
тинга позволяют проводить сравнение любого неизвестного ан-
тигена с ранее охарактеризованными.
1. Последовательная иммунопреципитация. Принцип заклю-
чается в том, что при идентичности двух сравниваемых антиге-
нов иммунопреципитация одного из них исключает последую-
щую иммунопреципитацию другого. Необходимо только, чтобы
первая иммунопреципитация лизата меченых клеток была исчер-
пывающей. Для этого ее проводят несколькими повторными
циклами, и преципитаты, полученные после каждого цикла, от-
мывают и анализируют в ДСН-ПАГЭ. Полностью истощенный
клеточный лизат вновь подвергают иммунопреципитации для
выявления второго антигена. В качестве контроля параллель-
но анализируют порцию неистощенного лизата. Если в резуль-
тате добавления антител объем истощенного лизата увеличил-
356
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
ся, 4(о следует соответственно увеличить и объем контрольно-
го лйзата.
2. Иммуноблоттинг преципитатов. Последовательную имму-
нопреципитацию можно воспроизвести в модифицированном ва-
рианте. Сначала получают иммунопреципитат с антителами
одной специфичности и переносят его электрофоретически на
мембрану (разд. 3). Затем непосредственно на мембране ана-
лизируют перенесенный антиген с помощью препарата антител
другой специфичности.
3. Картирование пептидов по Кливленду. Метод пептидных
карт по Кливленду позволяет подтвердить идентичность неиз-
вестного белка известному или выявить различия между бел-
ками, имеющими одинаковую молекулярную массу [И]. Срав-
ниваемые антигены выделяют из радиоактивномеченных клеток
посредством иммунопреципитации и последующего ДСН-ПАГЭ.
Полоски геля вырезают и содержащиеся в них антигены под-
вергают ограниченному протеолизу под действием сайт-специ-
фической протеиназы и сравнивают полученные пептиды во
втором ДСН-ПАГЭ. Метод Кливленда был успешно использо-
ван для идентификации белка рЗб (основного субстрата для
pp60src), связывающего кальций и ассоциированного с цито-
плазматической мембраной лимфоцитов (рис. 11.7) [12]. Необ-
ходимые реагенты перечислены в табл. 11.4.
1) Быстро окрашивают и дифференцированно обесцвечивают
гель (разд. 4.3). Затем идентифицируют месторасположение
антигена в геле по молекулярной массе белков-калибрантов, вы-
резают содержащую его полоску геля и помещают в буфер А.
Возможен и другой порядок действий. Быстро окрашивают
и дифференцируют гель; определяют место расположения ан-
тигена с помощью радиоавтографищ вырезают полоску геля,
содержащую антиген; регидратируют гель в буфере А, удалив
фильтровальную бумагу, на которой он был высушен.
2) Оставляют полоску геля на 30 мин для полного насыще-
ния буфером А. После этого ее можно при необходимости хра-
нить при —20 °C.
3) Готовят смесь компонентов для 15 %-кого полиакрил-
амидного геля, содержащего ДСН. Заливают ее в электрофо-
ретическую камеру, при этом 4 см сверху предназначаются для
концентрирующего геля (разд. 4).
4) Содержащую антиген полоску первого геля вкладывают
шпателем в один из карманов, оставленных гребнем в концент-
рирующем геле.
5) Сверху наслаивают 20 мкл 20 %-кого глицерина в буфере
А.
6) Смешивают 5 мкл протеиназы Staphylococcus aureus V8
с 95 мкл буфера А и 100 мкл 20 %-кого глицерина в буфере А
(конечная концентрация фермента 25 мкг/мл).
357
ГЛАВА 11
Рис. 11.7. Пептидная карта белка р36, полученная по методу Кливленда. Био-
синтетически меченные f35S]-метионином человеческие лимфобластоидные
клетки BR1 8 (треки 1, 2) мышиные лимфоциты K2S (треки 3, 4) и мыши-
ные фибробласты ЗТЗ (треки 5, 6) были преципитированы кроличьей антисы-
вороткой к белку р36. Иммунопреципитаты ферментировали протеиназой
Staphylococcus aureus V8 в концентрации 1 мкг/мл (треки 1, 3, 5) или
10 мкг/мл (треки 2, 4, 6). Пептиды выявляли с помощью флюорографии. По
вертикали указана молекулярная масса.
7) Добавляют 50 мкл приготовленного раствора протеиназы
в карман концентрирующего геля, в котором находится полоска
первого геля, содержащая антиген.
8) В карманы концентрирующего геля, расположенные с
обеих сторон от кармана с анализируемым антигеном, вносят
буфер для образцов, содержащий бромфеноловый синий. Про-
водят электрофорез до тех пор, пока краситель не достигнет
границы раздела концентрирующего и разделяющего гелей.
9) Выключают электрический ток и на 30 мин оставляют
анализируемый антиген для ферментативного гидролиза.
10) Снова включают электрический ток и проводят ДСН-
ПАГЭ до конца.
11) С помощью радиоавтографии или окрашивания кислот-
ным (кумасси) ярко-синим выявляют в геле разделенные пеп-
тиды.
12) Сравнивают электрофореграммы гидролизатов исследуе-
мого и известных антигенов, оценивая их идентичность или
различия.
358
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
Таблица 11.4. Реагенты, используемые при картировании пептидов
по Кливленду
1. Буфер А: 0,125 М трнс-HCl буфер, pH 6,8, содержащий 0,1% ДСН и
1 мМ ЭДТА.
2. 20%-ный раствор глицерина в буфере А.
3. 0,125 М трис-HCl буфер, pH 6,8, содержащий протеиназу Staphylococcus
aureus штамм V8 (1 мг/мл, фирма Sigma Chemical Со., США).
4. 15%-ный полиакриламидный гель, содержащий 1 мМ ЭДТА, который до-
бавляют в буферные растворы при приготовлении концентрирующего и
разделяющего буфера (см. разд. 4 и табл. 11.6).
Протеиназу Staphylococcus aureus V8 добавляют в нес-
кольких различных концентрациях (в интервале от 1 до
25 мкг/мл) для проведения протеолиза разной степени глуби-
ны. Целесообразно использовать и другие протеиназы, среди
которых может оказаться фермент, позволяющий получить наи-
лучшие результаты при анализе данного антигена [12].
3. Иммуноблоттинг
3.1. Введение
Блоттингом называют перенос молекул на матрицу, способ-
ную их иммобилизовать. Первоначальный вариант метода был
описан Саузерном [13] для ДНК. Затем Таубин и сотр. [14]
разработали вариант электрофоретического переноса белков из
полиакриламидного геля на нитроцеллюлозную мембрану, ко-
торый называют электроблоттингом, «западным» блоттингом
или (при выявлении антигенов с помощью антител) иммуно-
блоттингом.
Принципы, методические детали и конкретные примеры ис-
пользования блоттинга белков из различного типа гелей были
описаны в ряде обзоров, опубликованных в последнее время
[15—17]. В этом разделе мы подробно остановились на имму-
ноблоттинге антигенов, разделенных в ДСН-ПАГЭ. В основе
лежит тот же самый принцип идентификации выделенного из
клеточного лизата антигена с помощью специфических антител,
на котором базируется иммунопреципитация. Когда иммуноблот-
тинг следует за ДСН-ПАГЭ, анализируемый антиген уже дена-
турирован ДСН, следовательно, антитела могут выявить лишь
те его эпитопы, которые не разрушились под действием ДСН.
С другой стороны, метод позволяет выявлять те эпитопы, ко-
торые не доступны антителам на нативной молекуле антигена,
но нередко экспонируются после воздействия ДСН. Иммуно-
блоттинг позволяет идентифицировать антигены, строго специ-
359
ГЛАВА 11
Фракционируют антигены путем
электрофореза в ПААГ с ДСН
I
Переносят антигены на нитроцеллюлозную
микропористую мембрану
Инкубируют 'мембрану
с блокирующим реагентом
для насыщения неспецифически
связывающих групп
I
Инкубируют мембрану со специфическими антителами
I
Инкубируют с антиглобулиновым реагентом
I 25.меЧенным
биотинированным
конъюгированным с ферментом
Выявляют антиген
методом авторадиографии
Инкубируют со смесью
авидина и биотинкрованного
фермента
Выявляют антиген,
добавляя субстрат;
при расщеплении субстрата
образуются окрашенные продукты
Рис. 11.8. Схема последовательных этапов иммуноблоттинга.
фически связавшие антитела, тогда как в иммунопреципитацию
как правило вовлекаются посторонние молекулы, ассоциирован-
ные с антигеном, и часто бывает трудно решить, принадлежит
ли данный эпитоп самому антигену или этим копреципитиро-
ванным молекулам.
3.2. Основной метод
Для идентификации антигена в иммуноблоттинге необходи-
мо, чтобы произошла иммобилизация антигена на мембране и
последующее выявление его с помощью специфических антител.
Неочищенные препараты антигена, например, нефракциониро-
ванный клеточный лизат, можно разделить в ДСН-ПАГЭ, и за-
тем перенести его отрицательно заряженные молекулы на нит-
роцеллюлозную мембрану с помощью электрического поля в
направлении от катода к аноду. После переноса мембрану об-
рабатывают специфическими антителами, места связывания ко-
торых затем выявляют антиглобулиновыми антителами, конъю-
гированными с радиоактивной или ферментной меткой. Такой
подход к анализу лимфоцитарных антигенов, поэтапная схема
которого представлена на рис. 11.8, описан нами в следующих
далее разделах главы. Существуют варианты основного мето-
360
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
да, в которых перенос производится из гелей иного состава,
например, из пластинки геля, в которой проведен двумерный
ДСН-ПАГЭ, или из агарозного, или из содержащего мочевину
геля. Чаще всего используют нитроцеллюлозные мембраны,
однако возможно применение найлоновых мембран, например,
«Хайбонд N» (фирма Amersham International pic, Великобри-
тания).
3.3. Исследуемый образец
Исследуемыми образцами могут служить содержащие анти-
ген цельные клеточные лизаты. Их готовят, как описано ниже,
непосредственно в буфере для образцов, содержащем ДСН.
1) Клетки отмывают в PBS, pH 7,4, чтобы удалить содер-
жащиеся в культуральной среде белки.
2) Осадок клеток для эффективной солюбилизации следует
хорошо диспергировать, добавив, если необходимо, немного
PBS (например, около 10% от конечного объема).
3) К диспергированному клеточному осадку добавляют буфер
для образцов, содержащий 4% ДСН (см. разд. 4.2) в таком
объеме, чтобы конечная концентрация клеток составляла 5—
10-107 в 1 мл, и кипятят в течение 10 мин. Для восстановитель-
ного расщепления дисульфидных связей в солюбилизированные
образцы до ДСН-ПАГЭ можно добавить (10% объема) 1 М
раствор дитиотреитола (ДТТ).
Другой вариант солюбилизации заключается в использова-
нии «литического буфера», который применяется при иммуно-
преципитации (см. разд. 2.3.2). В этом случае к уже готовому
клеточному лизату добавляют равный объем буфера для об-
разцов, содержащего 4% ДСН, и кипятят в течение 10 мин.
Чтобы представить себе, какое количество антигена целесооб-
разно нанести на гель при ДСН-ПАГЭ, воспользуемся следую-
щим примером. Для выявления антигена CD2, около 150 000
молекул которого экспрессировано на каждой Т-клетке, полос-
ку геля шириной 0,5 см нагружают объемом лизата, эквива-
лентным 5—10-105 клеток.
При низкой концентрации исследуемого антигена нефрак-
ционированный клеточный лизат как анализируемый материал
нередко вызывает ряд затруднений. В частности, количество
наносимых компонентов лизата может превысить разрешающую
способность геля и увеличить число посторонних белков, вызы-
вающих неспецифическое фоновое окрашивание. Если задача
состоит в идентификации именно мембранного антигена, то дан-
ное затруднение преодолевается использованием не цельного
лизата, а выделенных из него фракций микросомальных или
цитоплазматических мембран. Таким образом непосредственно
достигается увеличение концентрации исследуемого антигена до
361
ГЛАВА И
Рис. 11.9. Идентификация белка р36 как
компонента цитоплазматической мембраны
лимфоцитов [12]. Мембраны человеческих
лимфобластоидных В-клеток линии BRI 8
солюбилизировали 0,5% НП-40. «Несолюби-
лизированный» остаток анализировали с по-
мощью ДСН-ПАГЭ и иммуноблоттинга. Ле-
вую полоску мембраны окрасили кислотным
(кумасси) ярко-синим, а правую проявляли
кроличьей антисывороткой к белку р36. По
вертикали указана молекулярная масса.
того уровня, который обеспечивает высокую разрешающую спо-
собность геля при низком фоновом окрашивании. Например,
блоттинг фракции микросом (или нерастворимого остатка в
препаратах солюбилизированных детергентом микросом) поз-
воляет идентифицировать белок рЗб как компонент цитоплаз-
матических мембран лимфоцитов, тогда как при блоттинге не-
фракционированного клеточного лизата этот белок вообще не
выявляется (рис. 11.9) [12].
Второй пример блоттинга микросом, в котором был иден-
тифицирован антиген CD2 линии лейкозных Т-клеток челове-
ка, представлен на рис. 11.10. Каждая клетка этой линии экс-
прессирует около 150 000 молекул CD2.
3.4. Набор белков-калибрантов молекулярной массы
Набор предварительно окрашенных белков-калибрантов мо-
лекулярной массы (например, фирмы Amersham Internatio-
nal pic, Великобритания или Bio-Rad Laboratories Inc., США)
362
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
Рис. 11.10. Иммуноблоттинг антигена CD2 с использованием моноклональных
антител. Микросомы человеческих лейкозных Т-клеток линии J6 солюбилизи-
ровали в «литическом буфере», затем добавили равный объем буфера для об-
разцов, содержащего 4% ДСН, и фракционировали с помощью ДСН-ПАГЭ
в 12%-иом геле. Каждая полоска мембраны шириной 4 мм содержит количе-
ство антигена CD2, эквивалентное 2-106 клеток. Полоски были проявлены, как
описано в разделе 3.7. Перенос белков производился в камере «Транс-блот»
(Bio-Rad Laboratories Inc., США) в течение 16 ч при 4 °C и напряжении при-
мерно 50 В и силе тока около 150 мА. Полоски инкубировали в течение 16 ч
при 4 °C с различными образцами асцитной жидкости, содержащими раз-
ные моноклональные антитела к CD2. Первые три полоски слева инкубирова-
ли, соответственно, с очищенными антителами к CD2 (20 мкг/мл), очищенны-
ми антителами к CD3 (20 мкг/мл) и вовсе без первых антител. Несколько
образцов антител весьма интенсивно реагируют с антигеном CD2 на нитро-
целлюлозной мембране.
представляет собой идеальный реагент для иммуноблоттинга.
Для их выявления на нитроцеллюлозной мембране не требуется
окрашивание, которое само по себе могло бы изменить их мо-
лекулярную массу непредсказуемым образом. Перенос предва-
рительно окрашенных калибрантов позволяет непосредственно
судить об эффективности блоттинга. Ориентируясь по их рас-
положению, можно при необходимости разрезать нитроцеллю-
лозную мембрану на любое число полос и смонтировать их
вместе для сравнения. Наборы калибрантов, однако, весьма
363
ГЛАВА 11
дороги. Вместо них в качестве стандартов молекулярной массы
можно использовать чистые неокрашенные белки, выявляемые
после переноса с помощью амидочерного 10Б (см. ниже).
3.5. Гель
В основном методе иммуноблоттинга перенос белковых мо-
лекул из полиакриламидного геля, содержащего ДСН, проис-
ходит при pH 8,3, т. е.. в условиях, при которых они имеют
отрицательный заряд. Если один и тот же антиген необходимо
проанализировать с помощью ряда антител разной специфич-
ности, то при разделении белков с ДСН-ПАГЭ делают в геле
карман большего размера. При одновременном иммуноблоттин-
ге нескольких лизатов, содержащих разные антигены, образцы,
которые предполагается анализировать с помощью антител од-
ной специфичности, следует располагать один подле другого,
чтобы количество полосок мембраны было минимальным. Для
облегчения переноса на мембрану высокомолекулярных белков
используют менее концентрированные гели (см. разд. 4.1).
Например, миозин (200 кДа), в значительной степени удержи-
ваемый 12%-ным гелем, легко мигрирует из 5 %-кого.
3.6. Перенос белков
3.6.1. Приборы и принадлежности
Камера (аппарат) для блоттинга. Мягкие пористые проклад-
ки («Скотчбрайт»). Фильтровальная бумага Whatman 540. Нит-
роцеллюлозные мембраны (диаметр пор 0,1 мкм).
В продаже имеются разнообразные аппараты для блоттин-
га. Чаще всего это камера, вмещающая примерно 2,5 л буфе-
ра для электрофореза, с электродами из платины. Платиновая
проволока изогнута таким образом, чтобы обеспечить электри-
ческое поле равной плотности в пространстве между электро-
дами. Например, в камере «Транс-блот» фирмы Bio-Rad La-
boratories Inc., США, применяются платиновые электроды S-
образной формы, тогда как камера «Трансфор» фирмы Hoefer
Scientific Instruments, США, имеет сетчатые пластиковые элек-
тродные панели, в которых вертикально натянуты семь рядов
платиновой проволоки.
3.6.2. Буферные растворы
Чаще всего при переносе белков из гелей, содержащих
ДСН, используют буферы следующего состава: 25 мМ трис,
192 мМ глицин (pH 8,3) и 20% (по объему) метанола. В этом
буфере белки, связывающие ДСН, приобретают отрицательный
заряд, а метанол увеличивает адсорбционную активность нитро-
364
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
Электрод
Мягкая пористая прокладка
Фильтровальная бумага
Нитроцеллюлозная мембрана
Гель----------------------
Фильтровальная бумага-*- '/77//У///////////2//Л
Мягкая пористая прокладка
Электрод ..... *
Рис. 11.11. Схема «сэндвича», приготовленного для блоттинга.
целлюлозной мембраны. Перенос высокомолекулярных белков
(более 100 кДа) усиливается в присутствии 0,05—О.Р/о-ного-
ДСН. Следует, однако, отметить, что низкомолекулярные белки
(менее 50 кДа) лучше мигрируют из геля на мембрану в кар-
бонатном буфере с pH 9,9 [18J. Заполняющий камеру буферный
раствор можно использовать повторно 3—4 раза.
3.6.3. Приготовление «сэндвича»
1. В связи с тем, что метанол фиксирует белки, при приго-
товлении «сэндвича» (см. рис. 11.11) используют буфер для
переноса (25 мМ трис, 192 мМ глицин, pH 8,3) без спирта.
2. Вырезают лоскут нитроцеллюлозной мембраны, соответ-
ствующий по размерам пластинке геля, из которой предпола-
гается перенести белки. При этом, чтобы не загрязнить мембра-
ну, надевают перчатки. Затем вырезанную мембрану смачива-
ют, погрузив целиком в буфер и оставив там примерно на
20 мин.
3. Подготовленный к блоттингу гель также погружают в
буфер для насыщения им примерно на 20 мин.
4. Вырезают 2—4 листа фильтровальной бумаги Whatman
540 (пригодна также бумага Whatman ЗММ, но 540 лучше впи-
тывает влагу) по размеру или слегка больше пластинки геля.
5. Насыщают одну из пористых прокладок «Скотчбрайт»
буфером. На нее накладывают 1—2 смоченных буфером листа
фильтровальной бумаги.
365-
ГЛАВА 11
6. Сверху на фильтровальную бумагу помещают пластинку
теля.
7. На гель накладывают нитроцеллюлозную мембрану, тща-
тельно следя за тем, чтобы между гелем и мембраной не обра-
зовались пузырьки воздуха. Их можно удалить вместе с избыт-
ком буфера, осторожно проведя пипеткой, как катком, по всей
поверхности мембраны.
8. Поверх мембраны накладывают два листа фильтроваль-
ной бумаги и завершают приготовление «сэндвича» еще одной
пористой прокладкой «Скотчбрайт».
9. Проследив за тем, чтобы «сэндвич» был обильно смочен
•буфером, его помещают в кассету аппарата для блоттинга.
Кассета должна плотно охватывать «сэндвич», не допуская сме-
щения геля. Для устранения подвижности «сэндвича» на него
накладывают дополнительную пористую прокладку «Скотч-
брайт», смоченную буфером.
10. Кассету с «сэндвичем» погружают в камеру для блот-
тинга, наполненную буфером без метанола. При переносе из
геля, содержащего ДСН, в буфере с pH 8,3 молекулы белков
имеют отрицательный заряд и движутся к положительно заря-
женному аноду. Поэтому необходимо проследить, чтобы мембра-
на прилегала к гелю именно со стороны анода.
3.6.4. Условия переноса белков
Конкретные условия блоттинга зависят от молекулярной
массы белка: чем она выше, тем медленнее происходит пере-
нос. Блоттинг белков мол. массы менее 100 кДа при силе тока
350—500 мА требует 1—2 ч. Часто бывает удобнее оставить
аппарат для блоттинга включенным на ночь. При этом, разуме-
ется, используют меньшую силу тока и низкое напряжение.
Антиген CD2, имеющий мол. массу 50 кДа, вполне удовлетво-
рительно мигрирует на мембрану за 16 ч при напряжении 30—
60 В и силе тока примерно 150 мА в камере «Транс-блот»
(Bio-Rad Laboratories Inc., США). Результаты такого переноса
с хорошим разрешением полос можно видеть на рис. 11.10.
При более быстром переносе под высоким напряжением целе-
сообразно помещать аппарат для блоттинга в холодильник или
использовать систему водяного охлаждения. При этом лучше
поместить камеру на магнитную мешалку для усиления цир-
куляции буфера.
3.7. Выявление антигена, перенесенного на мембрану
Специфические антитела связываются с адсорбированным
на нитроцеллюлозной мембране антигеном, выявляя тем самым
его топографию. Обычно применяют метод «сэндвича», основан-
.366
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
ный на связывании вторых антител, несущих метку, с первыми
антигенспецифическими антителами. В первом варианте имму-
ноблоттинга Таубин и сотр. [14] использовали вторые антите-
ла, меченные )251, и радиоавтографию, но в настоящее время
для выявления антигена широко применяется иммунофермент-
ный анализ. Ферментная метка, например пероксидаза хрена,,
присоединяется ко вторым антителам непосредственно или
опосредованно (при взаимодействии авидина с биотином). Ло-
кализацию антигена на мембране выявляют при добавлении
субстрата, образующего нерастворимый продукт ферментатив-
ной реакции. Совсем недавно стали доступными коммерческие
препараты вторых антител, меченных коллоидальным золотом.
Чувствительность выявления антигена антителами, меченными
ферментом или коллоидальным золотом, можно повысить при
использовании усиливающих реагентов на основе лактата се-
ребра [19]. Тем не менее, особое внимание в этом разделе уде-
лено сравнительно давно известному взаимодействию авидина,
с биотином, которое позволяет с высокой чувствительностью и
без особых сложностей установить локализацию изучаемых ан-
тигенов на мембране. Биотин присоединяют ко вторым (анти-
глобулиновым) антителам и к ферменту. Добавляемый затем
авидин способен обеспечить высокоавидное связывание моле-
кул этих двух реагентов друг с другом.
На рис. 11.10 представлены результаты иммуноблоттинга
антигена CD2, 150 000 молекул которого экспрессируются на
поверхности каждого Т-лимфоцита. После переноса полоски
мембраны были проинкубированы с моноклональными антите-
лами к CD2. Связавшиеся антитела выявляли с помощью взаи-
модействия авидина с биотином. Аналогично можно выявить-
антиген CD3, 30 000 молекул которого тоже экспрессируется на
поверхности каждого Т-лимфоцита.
3.7.1. Выявление белков, перенесенных на мембрану
1) Закончив перенос, «сэндвич» раскладывают. Прежде чем.
отделить гель и мембрану друг от друга, фиксируют их взаим-
ную ориентацию и помечают обращенную к гелю «лицевую»-
сторону мембраны. Для этого можно отрезать один ее угол или
надписать карандашом.
2) Окрашивают гель кислотным (кумасси) ярко-синим, что-
бы прежде всего определить, насколько полно прошел перенос
белков.
3) Мембрану отмывают в PBS. При необходимости отреза-
ют отдельно полоски, содержащие белки-калибранты молеку-
лярной массы и разделенные антигены, для окрашивания кра-
сителем, выявляющим любой белок. Для разрезания мембрану
помещают на чистую стеклянную пластинку, используют острый:
367
ГЛАВА 11
скальпель, который рекомендуется направлять по металличес-
кой линейке.
4) Полоски мембраны окрашивают 0,55%-ным раствором
амидочерного в смеси метанол — уксусная кислота — вода
(1:5:1 по объему) в течение 3 мин. Затем отмывают в воде
также в течение 3 мин и обесцвечивают смесью метанол — ук-
сусная кислота — вода (9:2: 100 по объему). Можно восполь-
зоваться и другими красителями, в частности, кислотным (ку-
масси) ярко-синим, который, однако, дает высокое фоновое ок-
рашивание [17].
3.7.2. Выявление специфического антигена
Прежде чем инкубировать мембрану с препаратами специ-
фических антител, необходимо исчерпывающе заблокировать
все ее участки неспецифической адсорбции белка. Для этого
используют посторонний белок (например, БСА) вместе с де-
тергентом или только детергент (например, твин 20). Однако,
детергенты без добавления белка могут приводить к элюиро-
ванию из мембраны самого антигена. Чаще всего применяют
БСА и более дешевый продукт — порошок сухого снятого мо-
лока. Например, в Великобритании успешно применяется сухое
молоко под фирменным названием Cadbury’s Marvel («Чудо
Кадбури») (СМ).
1) Для блокирования неспецифической адсорбции нитро-
целлюлозную мембрану инкубируют на качалке в течение 2 ч
при комнатной температуре в PBS, содержащем 2% БСА, 5%
СМ и 0,1% NaNs, в который по желанию можно добавить
0,05% твина 20. Для блокирования найлоновых мембран требу-
ется более продолжительная инкубация, примерно 16 ч при
4°C. Блокирующий раствор не следует хранить, так как СМ
часто прорастает и выпадает в осадок.
2) Дважды ополаскивают мембрану PBS, содержащим
0,05% твина 20, для удаления избытка постороннего белка.
3) Мембрану разрезают на полоски в соответствии с про-
граммой эксперимента.
4) Антитела растворяют в PBS, содержащем 0,1% БСА
и 0,01% NaNg. Начинать лучше с концентрации очищенных ан-
тител порядка 10 мкг/мл или с разведения асцитной жид-
кости 1 : 100. Для инкубации одной полоски мембраны шириной
4 мм в пластиковом чехле, герметизированном с помощью тер-
мопайки, вполне достаточно приготовить 250 мкл такого раст-
вора, причем израсходовано будет даже меньше половины.
5) Полоски мембраны помещают между двумя листками
термоплавкой пленки и запаивают с трех сторон. Наполняют
сделанный таким образом чехол раствором антител, удаляют
пузырьки воздуха и запаивают сверху. Можно также инкубиро-
вать полоски мембраны, поместив каждую из них в отдельный
368
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
желобок кюветы для реагентов (например, в кювету с рифле-
ным дном для многоканальных пипеток Dynatech Labs. Inc.,
США). В таком желобке удобно помещается одна полоска
мембраны размером 4X60 мм; чтобы полностью ее покрыть,
вполне достаточно 250—500 мкл раствора антител.
6) Полоски мембраны инкубируют в растворе антител в те-
чение 1—2 ч при комнатной температуре. Инкубация при 4°C
дает меньшее фоновое окрашивание. Если, инкубируя в течение
1 ч при комнатной температуре, не удается получить нужных
результатов, то полоски мембраны оставляют на ночь при 4 °C.
Связывание антител с антигеном, разумеется, можно интенси-
фицировать, инкубируя мембрану при 37 °C, однако это вызы-
вает повышенное фоновое окрашивание и увеличение ее хруп-
кости, если она изготовлена из нитроцеллюлозы.
7) После инкубации полоски мембраны в течение 15—30 мин
промывают в 3—5 сменах PBS, содержащего 0,05% твина 20.
Можно отмывать каждую полоску в отдельном желобке кюве-
ты или все вместе, если обеспечить перемешивание, не позволя-
ющее им прилипать друг к другу.
8) После отмывания полоски мембраны инкубируют в рас-
творе вторых антител. В продаже имеются препараты биотини-
рованных антител к иммуноглобулинам различной видовой
принадлежности, а также к мышиным иммуноглобулинам раз-
ного изотипа, например, биотинированные лошадиные антитела
к мышиным иммуноглобулинам фирмы Dakopatts А/S, Дания.
Рабочий титр этих реагентов обычно указывается в инструкции
изготовителя. Перед тем как применить не описанный в инст-
рукции препарат вторых антител, рекомендуется его протитро-
вать и убедиться в том, что он непосредственно не взаимодейст-
вует с антигеном, адсорбированным на мембране. Для этого
служит контрольная полоска мембраны, не проинкубированная
в растворе первых антител, которую, вообще, необходимо вклю-
чать в каждый опыт.
9) Биотинированные антитела разводят обычно 1 :100 —
1 : 500 в PBS, содержащем 0,1% БСА и 0,01 % NaNs. Одного
мл этого раствора достаточно для обработки 10 см2 нитроцел-.
люлозной мембраны. Все полоски мембраны запаивают вместе
в одном пластиковом чехле. Чтобы они не накладывались од-
на на другую, конец чехла пережимают артериальным зажимом
типа «Бульдог». Наряду с биотинированными антителами, мож-
но использовать и антиглобулиновые реагенты, меченные 1251
(уд. активность примерно 1,5 мкКи/мкг IgG) в разведении
106 имп-мин/мл [14].
10) Полоски мембраны инкубируют в растворе биотиниро-
ванных антител в течение 1 ч при комнатной температуре.
Инкубацию с антителами, меченными 1251, рекомендуется про-
длить до 6—16 ч.
369
ГЛАВА И
И) Полоски мембраны отмывают так же, как после инку-
бации с первыми антителами. Если вторые антитела были по-
мечены 1251, то полоски мембраны после отмывания высушива-
ют. Лучше сушить их в потоке воздуха без нагревания, кото-
рое делает нитроцеллюлозную мембрану хрупкой. Высушенную
мембрану помещают на фильтровальную бумагу, накрывают
пленкой «Серан»1, затем рентгеновской пленкой и экспонируют.
12) Для выявления антигенов, связавших через первые ан-
титела вторые биотинированные антитела, полоски мембраны
инкубируют с биотинированным ферментом в присутствии ави-
дина или, как предложено недавно, стрептавидина, через мо-
лекулы которых фермент присоединяется к антителам. Биоти-
нированные ферменты и авидин можно приобрести в виде от-
дельных реагентов в наборе «Vector stain» (фирмы Vector La-
boratories, США) или в виде конъюгатов авидин-фермент
(фирмы Amersham International pic, Великобритания), приме-
нение которых повышает чувствительность реакции. Используя
набор «Vector stain», добавляют 10 мкл авидина (А) и 10 мкл
биотинированной пероксидазы хрена (В) к 1 мл PBS, содер-
жащему 0,1% БСА и 0,01% NaN3, вносят в пластиковый чехол
с полосками мембраны, запаивают его и инкубируют в течение
1 ч при 4 °C.
13) После инкубации полоски мембраны дважды отмывают
в PBS без твина 20, так как он мешает цветной реакции.
14) Отвешивают 25 мг диаминобензидина (необходимо
соблюдать аккуратность и использовать резиновые перчатки,
так как диаминобензидин — «потенциальный канцероген») и
растворяют в 50 мл 10 мМ триса, pH 7,4. Непосредственно
перед нанесением на полоски мембраны к раствору диамино-
бензидина добавляют 100 мкл 33%-ного раствора Н2Ог.
15) Дожидаются максимального развития цветной реакции.
Она может произойти немедленно, т. е. в пределах 1 мин после
добавления субстрата. Иногда необходимо ждать до 15 мин;
позже цветная реакция обычно не развивается. Для остановки
реакции полоски мембраны дважды отмывают в дистиллиро-
ванной воде и высушивают между двумя слоями фильтроваль*
ной бумаги.
16) Полоски мембраны следует защищать от света, иначе
возможно их выцветание.
1 От англ. Saran — торговая марка поливинилхлоридного оберточного ма-
териала.— Прим, перев.
370
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
4. Электрофорез в полиакриламидном геле,
содержащем додецилсульфат натрия
(ДСН-ПАГЭ)
4.1. Введение
ДСН-ПАГЭ весьма интенсивно используется в биохимичес-
ком анализе поверхностных лимфоцитарных антигенов. Ниже
мы вкратце остановимся на одномерном ДСН-ПАГЭ. Более
полное описание метода содержится в руководстве «Gel Elec-
trophoresis of Proteins» [20]. Описание методов двумерного
изоэлектрофокусирования (ИЭФ), неравновесного электрофоре-
за в градиенте pH (НЭГрН), а также двумерного электрофоре-
за в геле с восстановителем и без него читатель найдет соот-
ветственно в статьях [21, 22 и 23].
Концентрация акриламида в приготовленном геле зависит
от мол. массы исследуемых белков. Так, 12,5%-ный гель ис-
пользуется для разделения белков, имеющих мол. массу от 12
до 45 кДа, но не пригоден для анализа белков с большей мол.
массой. С другой стороны, 7,5%-ный гель идеально подходит
для белков от 50 до 150 кДа, но не дифференцирует белки с
низкой молекулярной массой. Смешивая 5%-ный раствор акрил-
амида с 15%-ным в приборе для формирования градиентов, мож-
но приготовить градиентные гели.
Проведя кипячение исследуемого белка в буфере для об-
разцов с добавлением восстановителя (ДТТ) и без него, мож-
но определить, состоит ли его молекула из одной цепи или не-
скольких, соединенных дисульфидными связями. Наличие внут-
рицепочечных дисульфидных связей также определяют с помо-
щью двумерного электрофореза в гелях, не содержащих и со-
держащих восстановители [23].
4.2. Необходимые реагенты и приборы
Состав растворов, используемых при постановке ДСН-ПАГЭ,
представлен в табл. 11.5. Требуются также стеклянные плас-
тинки, прокладки, «гребешки», верхний и нижний резервуары
для разделяющего буфера и источник электрического тока.
4.3. Описание метода
1) Смешивают компоненты разделяющего геля выбранной
концентрации (в соответствии с табл. 11.6) и проводят дегази-
рование.
24*
371
ГЛАВА 11
Таблица 11.5. Состав растворов, используемых при ДСН-ПАГЭ
1. Раствор акриламида:
2. Буферный раствор для
образцов, содержащий
2% ДСН»
3. Буферный раствор для
разделения
4. Раствор для окраши-
вания геля
5. Раствор для обесцве-
чивания геля
30 г акриламида и 0,8 г бисакриламида раство-
ряют в 100 мл воды и фильтруют. Отвешивание
следует производить в вытяжном шкафу н поль-
зоваться резиновыми перчатками.
1 мл 20% ДСН (конечная концентрация 2%)
1 мл глицерина (конечная концентрация 10%)
0,8 мл 1М трнс-HCl буфера, pH 6,8 (конечная
концентрация 0,08 М)
7 ,2 мл воды
0,01% бромфенолового синего
Смешивают и хранят при комнатной температуре.
Если необходимо вести разделение в присутствии
восстановителя, то к 100 мл буфера для образ-
цов добавляют 10 мкл 1 М раствора ДТТ или
0-меркаптоэтанола
0,025 М трнса I Проверяют pH, кото-
0,195 М глицина 1 рый должен быть pa-
о. 1 % ДСН I вен 8,3.
0,0125 г кислотного ярко-синего
52% воды
41% метанола
7% уксусной кислоты
40% метанола
7% уксусной кислоты
53% воды
’) Чтобы приготовить буфер для образцов, содержащий 4% ДСН, в этой же пропи-
си берут 2 мл 20%-иого ДСН и 6,2 мл воды.
2) В смесь добавляют 150 мкл 20%-ного ДСН, 100 мкл све-
жеприготовленного 10%-ного раствора персульфата аммония и
20 мкл М.М.М' М'-тетраметилэтилендиамина (ТЕМЭД).
3) Заполняют приготовленным раствором камеру для поли-
меризации геля, сверху наслаивают воду, насыщенную дибута-
нолом и выжидают примерно 30 мин. Верхняя часть камеры на
глубину около 2 см должна оставаться свободной.
4) Удаляют дибутанол и заливают в свободную часть каме-
ры смесь компонентов концентрирующего геля. Для его приго-
товления к 1,67 мл 30%-ного раствора акриламида, содержаще-
го 0,8% бисакриламида, добавляют 1,25 мл трис-HCl буфера
(pH 6,8) и 7,03 мл воды, дегазируют и добавляют 50 мкл 20%-
ного ДСН, 50 мкл 10%-ного персульфата аммония и 10 мкл
ТЕМЭД.
5) В смесь компонентов концентрирующего геля погружают
«гребешок», стараясь, чтобы вокруг него не осталось пузырь-
ков воздуха. Оставляют концентрирующий гель для полимери-
зации примерно на 15 мин.
6) Извлекают «гребешок» и промывают образовавшиеся в
геле карманы для образцов водой.
372
БИОХИМИЯ ЛИМФОЦИТАРНЫХ АНТИГЕНОВ
Таблица 11.6. Приготовление акриламидных гелей разной концентрации
Ингредиенты (мл) Концентрация акриламида (%)
5 7,5 10 12.5 15
30%-ный раствор акрилами- 5 7,5 10 12,5 15
да, содержащий 0,8% бисакриламида Вода 13,7 11,2 8,7 9,2 3,7
1 М трис-HCl буфер, pH 8,8 11,2 11,2 11,2 11,2 11,2
7) Помещают камеру с пластинкой геля в аппарат для эле-
ктрофореза, не забыв извлечь из нее нижнюю прокладку.
8) Заполняют разделяющим буфером верхний и нижний
резервуары аппарата для электрофореза, удалив пузырьки воз-
духа, которые образуются у нижнего края геля.
9) В зависимости от размеров в карманы концентрирующе-
го геля вносят по 50—150 мкл исследуемых образцов. Количе-
ство наносимого белка зависит от предполагаемого числа со-
держащихся в образце различных антигенов. Если это всего
лишь один белок, достаточно нанести около 5 мкг. При анали-
зе сложной смеси белков, например препарата клеточных мем-
бран или нефракционированного лизата, наносят до 200 мкг
белка. Образцы, подвергнутые кипячению в буфере с ДСН и
100 мМ ДТТ, содержат белки, утратившие внутри- и межце-
почечные дисульфидные связи.
10) Проводят электрофорез белков в направлении к аноду
до тех пор, пока фронт бромфенолового синего не достигнет
нижней кромки геля. При напряжении 35 В это происходит
через 16 ч, а при 140 В — через 4 ч. Напряжение можно под-
бирать произвольно, следя за тем, чтобы сила тока не превы-
сила 70 мА, иначе стеклянные пластинки могут растрескивать-
ся.
11) Пластинку геля окрашивают кислотным (кумасси) яр-
ко-синим в течение 2 ч (либо оставив на ночь в растворе для
окрашивания), затем проводят обесцвечивание. При этом долж-
ны остаться окрашенными белки-калибранты молекулярной
массы и разделенные антигены.
12) Гель высушивают и с помощью радиоавтографии иден-
тифицируют антигены, связавшие при иммунопреципитации ра-
диоактивно меченные антитела.
5. Благодарности
Мы весьма признательны Майку Крамптону за помощь в
подготовке текста этой главы, Нилу Керби за подбор литера-
турных ссылок и Дороти Флетчер за перепечатку рукописи.
373
ГЛАВА 11
Литература
1. Omary М. В., Trowbridge I. S. (1981). J. Biol. Chem., 256, 4715.
2. Cantrell D. A., Davies A. A., Crumpton M. J. (1985). Proc. Natl. Acad. Sci.
USA 82 8158
3. Bordier C. (1981). J. Biol. Chem., 256, 1604.
4. Samelson L. E„ Harford J., Schwartz R. H., Klausner R. D. (1985). Proc.
Natl. Acad. Sci. USA, 82, 1969.
5. Oettgen H. C.t Pettey C. L., Maloy W. F., Terhorst C. (1986). Nature, 320,
272.
6. Brown M. H., Krissansen G. W., Totty N. F., Sewell IT. A., Crumpton M. J.
(1987). Eur. J. Immunol., 17, 5.
7. Hubbard A. L„ Cohn Z. A. (1976). In: Biochemical Analysis of Membranes.
Maddy A. H. (ed.), Chapman and Hall, London, p. 427.
8. Swarup G., Cohen S., Garberts D. L. (1982). Biochem. Biophys. Res. Com-
mun„ 107, 1104.
9. Kessler S. IF. (1975). J. Immunol., 115, 1617.
10. Johnstone A., Thorpe R. (1982). Immunochemistry in Practice. Blackwell
Scientific Publications, Oxford, p. 210.
11. Cleveland D. W., Fisher S. G., Kirschner M. W., Laemmli U. K. (1977),
J. Biol. Chem., 252, 1102.
12. Davies A. A-, Crumpton Л1. J. (1985). Biochem. Biophys. Res. Commun.,
128, 571.
13. Southern E. M. (1975). J. Mol. Biol., 98, 503.
14. Towbin H., Staehelin T., Gordon J. (1979). Proc. Natl. Acad. Sci. USA, 76,
4350.
15. Towbin H., Gordon J. (1984). J. Immunol. Methods, 72, 313.
16. Gershoni J. M., Palade G. E. (1983). Anal. Biochem., 131, 1.
17. Beisiegel U. (1986). Electrophoresis, 7, 1.
18. Dunn S. C, (1986). Anal. Biochem,., 157, 144.
19. Moeremans M., Dancels G.t Van Dyck A., Langanger G., Derney J. (1984).
J. Immunol. Methods, 74, 253.
20. Hames B. D., Rickwood D., eds. (1981). Gel Electrophoresis of Proteins —
A Practical Approach. 1RL Press Ltd., Oxford and Washington, DC.
21. O’Farrell P. H. (1975). J. Biol. Chem., 250, 4007.
22. O’Farrell P. Z., Goodman H. M., O’Farrell P. H. (1977). Cell, 12, 1133.
23. Chilson О. P., Boylston A. IF., Crumpton M. J. (1984). EMBO J., 3, 3239.
Поставщики реактивов и оборудования
American Type Culture Collection, 12301 Parklawn Drive, Rock-
ville, MD 20852, USA
Amersham International pic, White Lion Road, Amersham, Bucks
HP7 9LL, UK
Amgen Biologicals Inc., 1900 Oak Terrace Lane, Thousand Oaks,
CA 91320, USA
Becton Dickinson Immunocytometry Systems, PO Box 7375, Moun-
tain, View, CA 94039, USA
Bio-Rad Laboratories Ltd, Caxton Wav, Watford Business Park,
Watford, Herts WD1 8RP, UK
Cappel Laboratories, 237 Lacey Street, PO Box 37, West Chester,
PA 19380, USA
Cedarlane Laboratories Ltd, 5516—8th Line, RR 2, Hornby ONT
LOP 1EO, Canada
Cistron Biotechnology Inc., Pine Brook, NJ, USA
Coulter Electronics Ltd, Northwell Drive, Luton, Beds LU3 3RH,
UK
Dakopatts A/S, Guldborgvei 22, DK-2000 F Copenhagen, Denmark
Difco Laboratories, PO Box 14B, Central Avenue, East Molesey,
Surrey KT8 08E, UK
Dynal A/S, PO Box 158, Skoyen, N-0212 Oslo 2, Norway
Dynatech Diagnostics Inc., Inland Farm Drive, South Windham,
ME 04082, USA
European Collection of Animal Cell Cultures, PHLS, Porton Down,
Wilts SP4 OJG, UK
Flow Laboratories Ltd, PO Box 17, Second Avenue Industrial Esta-
te, Irvine KA12 8NB, UK
FMC Bioproducts Europe, 1 Risingevej, DK-2665 Vallensbaek
Strand, Denmark
Genzyme Corp., 75 Kneeland Street, Boston, MA 02111, USA
Gibco Europe Ltd, PO Box 35, Trident House, Renfrew Road, Pais-
ley РАЗ 4EF, UK
Hendley Engineering Ltd, Loughton, Essex LG10 3TZ, UK
Hoechst UK Ltd, Hoechst House, Salisbury Road, Hounslow, Mddx
TW4 6JH, UK
International Biotechnologies Inc., 275 Winchester Avenue, PO
Box 1565, New Haven, CT 06505, USA
Jencons Scientific Ltd, Cherrycourt Way Industrial Estate, Stan-
bridge Road, Leighton Buzzard, Beds LU7 8UA, UK
375
ГЛАВА 11
L’Industrie Biologique Francaise, 35 Quai du Moulin de Cage, 92-
Gennevilliers, France
Nordic Laboratories, Tukimustre 1, SF-90460 Oulunsalo, Finland
Northumbria Biologicals Ltd, South Nelson Industrial Estate,
Cramlington, Northumberland NE23 9HL, UK
Nunclon {see Gibco Europe)
Nyegaard and Co., PO Box 4220, Torshov, Oslo 4, Norway
Ortho Diagnostic Systems Inc., Highway 202, Raritan, NJ 08869,
USA
Pierce and Warriner Ltd, 44 Upper Northgate Street, Chester CHI
4EF, UK
Pharmacia Fine Chemicals, PO Box 175, S-754 04 Uppsala, Sweden
Sepratech Corp., PO Box 61, Wakefield, RI 02879, USA
Sera Lab Ltd, Hophurst Lane, Crawley Down, W. Sussex RH10
4FF, UK
Serotec Ltd, Bankside, Station Field Industrial Estate, Kidlington,
Oxford OX5 1JD, UK
Sigma Chemical Co. Ltd, Fancy Road, Poole, Dorset BH17 7NH,
UK
Southern Biotechnology Associates, PO Box 26221, Birmingham,
AL 35226, USA
Sterilin Ltd, 43—45 Broad Street, Teddington, Mddx TW11 7NH,
. UK
Tissue Culture Services Ltd, 10 Henry Road, Slough, Berks SL1
2QL, UK
Vector Laboratories, 1429 Rollins Road, Burlingame, CA 94010,
USA
Wellcome Diagnostics, Temple Hill, Dartford, Kent DAI 5AH UK
J. Weiss and Son Ltd, 11 Wigmore Street, London Wl, UK
Worthington Diagnostic Systems Inc., PO Box 650, Halls Mill
Road Freehold, NJ 07728, USA
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Авидин 77, 142, 166, 167
Авидин — биотин, использование в им-
муноблоттииге 367
-------- на срезах 166—168
Авидин — фикоэритрин 77
Адгезия на колонке 59
----- из найлоновой ваты 60
----- полистироловой поверхности 58
А-клетки (вспомогательные), гетеро-
генность 20—21
Акридиновый оранжевый, использо-
вание для подсчета живых клеток
211
Альбумин, центрифугирование в сту-
пенчатом градиенте плотности 55
Антигены неэритроцитарные 193—196
— ВЭБ ядерные, иммунофлуоресцент-
ное выявление 242—244
Анализ в предельном разведении
(АПР), изучение Т-супрессоров 269
----------------Т-хелперов 268—
269
---------------- цитотоксических
Т-лимфоцитов 269
------------- культивирование кле-
ток 258—259
------------- культуральная среда
258
-----— — — методы статистиче-
ской обработки 270
------------описание метода 256—
268
— — --------- получение В-клеток
памяти 258
----------------Т-хелперов 256—
258
----------— радиоиммунологиче-
ский 259—261
------------- созревание В-клеток
268
Антигены для иммунизации in vitro
180
Антитела, конъюгация с биотином 80,
146
--------изотиоцианатом флуоресцеи-
на 79—80
— образование in vitro 176, 177
Аитителообразующие клетки 176
Биотин, конъюгация с антителами 80.
146
Бромдезокснуридин (БРДУ) 151, 152,
154
---- использование для селекции
Т-хелперов путем самоустраненп i
кланов 220
Бронхиальный смыв, получение 40
В-клетки, выделение непрямым мето-
дом путем отрицательной селекции
89
----прямым методом путем поло -
жительной селекции 87—88
— — с помощью микробус 106
— лнмфобластоидные, линии 230
— разделение на поверхности пласти-
ка (пэннинг) 87
В-клеточный стимулирующий фак-
тор-2, источники 333—334
В-лимфобласты, получение 212
В-лимфоцнты, дифференцировка 154
Гематоксилин Майера, приготовление
Гемоцитометр 60261, 62
Гнпак—фнколл 64
Грудной лимфатический проток 30
-------канюлирование 32—36
Двухцветный иммунофлуоресцентный
анализ 137—145
-------непрямой 139, 145
Дендритные клетки 22—25
выделение 20, 57
----; — с помощью дифференциаль-
ной адгезии 58
— — из мезентериальных лимфоуз-
лов 36
Диацетат флуоресцеина, определение
жизнеспособности клеток 50, 51
---- приготовление 64
Диспаза (нейтральная протеиназа)
для диспергирования солидных ор-
ганов 20, 42
Жизнеспособность клеток, определе-
ние, использование диацетата флуо-
ресцеина 50, 51
трипанового синего 50, 51
377
предметный указатель
Изопак—фиколл 64
----выделение мононуклеарных кле-
ток 116
Изотиоцианат тетраметилродамина
112
Изотиоцианат флуоресцеина 112
----конъюгация с антителами 79—
80
Иммуноблоттинг 359—370
— буферные растворы 364-—365
— выявление белков, перенесенных
на мембрану 367—368
----специфического антигена 368—
370
— основной метод 360—361
— подготовка образца 361
— преципитатов 357
— приборы 364
— приготовление «сэндвича» 365—366
— схема последовательных этапов 360
— условия переноса белков 366
Иммуноглобулины, индукция синтеза
нормальными В-клетками 334
----— трансформированными
В-клетками 335
Иммунопероксидазный (иммунофер-
ментный) метод 158, 244
-------описание 159—160
------- принципы 158
Иммунопреципитация 340—345
— анализ характера гликозилирова-
ния белков 354—356
— маркирование антигена 340
----белков 1251 341, 346—347
-------згр 348—349
-------[35S]-метионином 341, 347—
348
— последовательная 356
— радиомаркирование 346—349
— этапы разных вариантов 346
Иммуноферментное маркирование, ме-
тод, описание 164—165
---- принцип 163
---- реагенты 163—164
Иммуноферментный анализ локаль-
ный 176
Иммунофлуоресцентное маркирование
клеток, интерпретация результатов
123—125
— — — постановка 122—123
------- приборы 122
-------принципы 118—119, 163
------- реагенты 119—121
Иммунофлуоресцентное окрашивание
антителами СЗ 243—244
Иммунофлуоресцентный анализ коли-
чественный 127—132
Иммунофлуоресценция, принципы ис-
пользования 112
378
Иммуноцитохимический анализ, прин-
ципы 153
----фиксаторы 157
Интерлейкин 1, источники 313—314
--- определение 314
— 2 для использования в культуре
Т-клеток 213
----источники 213, 316
----определение 316, 319
— 3, источники 320
---- определение 320
— 4 источники 322
----• определение 323—326
— 5 источники 326
---- определение 327, 328—330
Интерлейкины 310
— действие на В-лимфоциты 312—313
-------Т-лимфоциты 311
Камера Каннингема 189, 190
— Марбрука для культуры лимфоци-
тов 181—182
Картирование пептидов по Кливленду
357
—----------- реагенты 359
Кишечник, лимфоидная ткань 42
«Кластеры» 115
Клетки вспомогательные (А-клетки)
20—21
— дендритные 22—25
----выделение 20
— живые, подсчет с помощью окра-
шивания акридиновым оранжевым
211
---------------бромистым этидием
211
---------- — — динатриевой солью
эозина 211
— лимфатических узлов, нммунофлуо-
ресцентный анализ суспензий 125—
126
— лимфоидные, приготовление взвеси
203
—• маркирование антителами, связан-
ными с флуорохромом 77—78
— -мишени, приготовление для за-
ражения ВЭБ 239—240
---------- определения цитотоксиче-
ской активности 225
— мононуклеарные, выделение из кро-
ви и костного мозга 116—118
— образующие антитела, индукция
in vitro 176, 182
— перитонеальные 37
— погибшие, удаление 51—53
— подсчет 60—63
— приготовление взвеси 42, 49—50
— разделение с помощью розетирова-
иия 82—85
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
— редко встречающиеся, удаление с
помощью модифицированной мето-
дики розетирования 85—86
— селезенки (спленоциты) 39—40
— сортировка 75—78
— условия выделения, величина pH 27
------- осмотическое давление 27—
28
------- температура 26—27
------- — центрифугирование 29
— фолликулярные дендритные 25
Клеточные сортеры 70
Клеточный лизат, получение 349
Коллагеназа для дяспергирования со-
лидных органов 20, 125
Колониестимулирующая активность,
определение 321
Комплекс щелочная фосфатаза — ан-
титела к щелочной фосфатазе 163,
165
Комплемеит-опосредованный цитолиз,
двухэтапный вариант 92—93
-------одноэтапный метод 92
Конканавалин А (Кон А) 212, 213
— — стимуляция лимфоидных клеток
297, 298
Костный мозг, выделение 48—49, 116
----содержание лимфоцитов 15, 16,
44
Кривые одноударные 251—254
Криоконсервация клеточных линий
241—242
Криостат, получение срезов 156
Кровь периферическая как источник
клеток 29—31
Культуральная система Мишелла —
Даттона 177
Лейкозы, дифференциальная диагно-
стика 113, 114, 115
Лимфа, содержание клеток 31—32
Лимфаденэктомия мезентериальная
36, 37
Лимфатические узлы, локализация у
крысы 40—41
— — шейные, выделение 46
Лимфоидная ткань кишечника 42—43
Лимфоидные органы вторичные 16,
----первичные 15, 16
Лимфокнны, влияние на синтез анти-
тел 178
—- определение 310
Лимфолейкоз острый, диагностика
132, 134
— хронический, диагностика 132, 134
Лимфома Беркитта, линии клеток
231
— BCLi 327
---- стандартизация клеток 328
Лимфоциты в культуре, ответы на ан-
тигены 303—304
----—--------митогены 299
----смешанных культурах в вися-
чих каплях 304—308
Лимфоциты, иммунизация in vitro
182—183
— культивирование в висячих кап-
лях 286
— — для образования антител 176,
182—183, 300
— крови, выделение непрямыми мето-
дами 108—109, 116
----— прямыми методами 106—107,
116
— — иммунизация in vitro 182, 183
— положительная селекция из цель-
ной крови, прямой метод 106
— разделение путем комплемент-опо-
средованного цитолиза 91, 94
Линии клеток лимфоидные 18
----миеломоноцитариые 25, 26
----цитотоксические Т-лимфоциты,
получение 209—210, 216—218
----CTLL 317
Макрофаги 21—22
— адгезивность 56
— выделение по адгезивности 59
— грудного молока 38
— из бронхиального смыва 38
----перитонеальной полости 36, 37
— удаление с помощью карбонильно-
го железа 58—59
Маркирование клеток иммунофлуо-
ресцентное, принцип 118—119
— тканей двойное, интерпретация ре-
зультатов 170—172
------- метод 169—170
------- принцип 168
-------реагенты 169
Мезентериальные (брыжеечные) лим-
фатические узлы, выделение 46
---------- удаление 36
Метод ДСН-ПАГЭ 371—373
— Кливленда для картирования пеп-
тидов 357
— культивирования в висячих каплях,
среда 287—288
290 ----— добавки к среде 288,
— лимитирующих разведений, прин-
цип 250
— локального гемолиза в геле 190—
193
предметный указатель
—-------— жидкой среде 188—189
--------использование белковых ан-
тигенов 193
—---------гаптенов 195
— — -----— гликолипидов н полисаха-
ридов 194
— — — комментарии общего харак-
тера 198—200
--------обратный 196—198
— — — общие принципы 187
— прямого розеткообразования 226
Методы, основанные на формирова-
нии негемолнтическнх зон 200—203
—. ------------выявление зон ин-
гибиции размножения фага (метод
ZIPP) 201
--------— — — локальный лизис
клеток-мншеней 200
----------------метод иммунофер-
ментных (ELISA) зон «Элнспот»
201—203
Метризамид 53—54
— использование для удаления мерт-
вых клеток 211—212
Метрнзоат-фиколл для разделения
лимфоцитов 30
---- приготовление 64
Мнкробусы, адсорбция антител 102—
104
— — моноклональных IgG 103—104
— — поликлональных IgG 103
— магнитные 97—98
---- использование для удаления
определенных клеточных популя-
ций 109—110
— нагруженные антителами овцы нли
козы к IgG мыши, нммуноадсорб-
ция моноклональных IgG мыши 104
Миндалины 41
Мнтоген фитолакки 299
Мишелла — Даттона культуральная
среда 177
Монокины 310
Мононуклеары периферической крови
29
Нейраминидаза 356
Нейтральная протеиназа 125
Непрямые зоны гемолиза 187
Пейровы бляшки, выделение 47
Пептиды, картирование по Кливленду
357
Перитонеальный смыв 36
— экссудат 37, 212
Перколл 54
-380
— использование для выделения лим-
фобластов 318
-------получения В-клеток 323
Пероксидаза, использование для вы-
явления ядериых антигенов ВЭБ
244—246
— хрена 158
— эндогенная, блокирование 159
Печень плода 17, 43—44
---выделение 47
---клеточный состав 43
Погибшие клетки, удаление 51—53
Пре-В-клетки 16, 17
Протеин А, использование в обратном
локальном гемолизе 197
-------для иммунопреципитации
352—353
Протеин А—сефароза для приготов-
ления IgG 196
Протеиназа, ингибиторы 350
Прямые зоны гемолиза 187
Пэннннг 87
— очистка Т-клеток и их субпопуля-
ций 89, 91
Розетирование, метод Париша и Хей-
уарда 80—86
— принцип 81
— прямое 86
— удаление В-клеток 31
— Fc- 58
Селезенка, выделение 47
— клеточный состав 39
Смыв из бронхов для получения мак-
рофагов 38
---перитонеальной полости 36, 39
Спленоциты (клетки селезенки), им-
мунизация 177, 186
Среда минимальная Игла, модифика-
ция Дюльбекко 322
Среды для культур в висячих кап-
лях 287—288
Срезы замороженные 156—157
--- приготовление 155
— парафиновые 157—158
Стрептавидин 142, 167
Счетчик частиц электронный, подсчет
числа клеток 61—63
Сыворотки антннммуноглобулнновые
204
Staphylococcus aureus, использование
для иммунопреципитации 349—352
Терминальная нуклеотидилтрансфера-
за 114, 148, 152, 153, 154
Тимидин, включение 222, 223, 292—
293
Тимоциты двухмаркерные 16
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
__ дифференцировка 153
— зрелые 16
__ кортизонрезистентные 16, 17
— одномаркерные 16
__ определение интерлейкина 1 314—
315
Тимус 15, 16, 17, 43
— выделение 47
Тиогликолятный бульон для получе-
ния макрофагов 37, 212
Т-клетки (Т-хелперы) 208, 209, 210,
215, 216, 218
----- анализ 221
— — — МНС-рестрикции 228
-----выделение с помощью микробус
106
-----инициация и поддержание ли-
ний 216
----- клонирование методом лимити-
рующих разведений 218—219
----- кооперативное взаимодействие
с В-клетками 264
— — очистка путем последовательно-
го пэннинга 89, 91
----получение 212
----- примирование 215
----- селекция путем самоустранения
клонов посторонней специфичности
220—221
Т-лимфобласты, использование для
выделения интерлейкина 2 317—318
— получение 212
Трипановый синий, использование для
определения жизнеспособности кле-
ток 50, 51
Фактор, заменяющий Т-клетки, опре-
деление 330
Фенотипический анализ клеток, рас-
сеяние света под малым углом 71
----------углом 90° 72
— — — эмиссия фикоэритрина 72
------------ флуоресцеина 72
Фикоэритрин, эмиссия 72
Фиксаторы для анализа клеточных ан-
тигенов 142
--- приготовления срезов 157
Фитогемагглютинин 149, 299, 301
Флуоресцеин, эмиссия 72
Фолликулярные дендритные клетки
(ФДК) 25
Фосфатаза щелочная 163, 165
— — использование в методе имму-
ноферментных зон 201
Fc-рецепторы 115, 137, 139, 161
Хром хлорный 193
----приготовление раствора для ро-
зетирования 81
— маркирование клеток-мишеней 224,
225
Центрифугирование в градиенте плот-
ности 30, 53—54
Циклоспорин А 240
Цитокины 310
Цитотоксическая активность, опреде-
ление 223
Цитотоксические Т-лимфоциты, ини-
циация линий 217
----- примирование 216
Цитофлуорограф, оптическая система
71
Цитофлуорография (цитофлуоримет-
рия) проточная 70—75
----- количественная оценка 126
Эндо-Р-Ц-ацетилглюкозаминидаза Н
(Эндо Н) 354, 355—356
Эозин, динатриевая соль, использова-
ние для подсчета живых клеток 211
Эозинофилия, индуцирование у мы-
шей 331
Эозинофилы, активность фактора диф-
ференцировки 331
— определение по пероксидазной ак-
тивности 332—333
-----фактора дифференцировки 332
— подсчет 332
Эпштейна—Барр вирус, получение
235—237
------- рост 231
------- свойства 230
------- титрование 236
Эритроциты барана, иммунизация
спленоцитов мыши in vitro 177, 178
-----нагруженные антителами, при-
готовление Взвеси 81—82
— удаление из взвеси клеток 52
Этидий бромистый, использование для
подсчета живых клеток 211
Оглавление
От редактора перевода ............................................ 5
Предисловие....................................................... 7
Список авторов ................................................... 9
Список сокращений.................................................11
Глава 1. Выделение лимфоцитов и вспомогательных клеток. С. Хант 15
1. Общие предпосылки.......................................15
1.1. Источники лимфоидных клеток..........................15
1.1.1. Первичные лимфоидные органы...................15
1.1.2. Вторичные лимфоидные органы...................17
1.1.3. Линии лимфоидных клеток.......................18
1.2. Суспензии клеток, полученные из солидных лимфоидных
органов.................................................18
1.3. Гетерогенность А-клеток..............................20
1.3.1. Макрофаги ....................................21
1.3.2. Дендритные клетки.............................22
1.3.3. Фолликулярные дендритные клетки (ФДК) . . 25
1.3.4. Миеломоноцитариые линии клеток................25
1.4. Условия выделения клеток.............................26
1.4.1. Температура...................................26
1.4.2. Величина pH, осмотического давления и содержа-
ние в среде питательных веществ, необходимых клет-
кам ................................................27
1.4.3. Механическое повреждение клеток. Центрифугиро-
вание ..............................................29
2. Выделение клеток из жидкостей организма.................29
2.1. Кровь ...............................................29
2.2. Лимфа................................................31
2.2.1. Канюлирование грудного лимфатического протока
у крысы.............................................32
2.2.2. Мезентериальная лимфаденэктомия .... 36
2.3. Смыв из перитонеальной полости..................... 36
2.4. Смыв из бронхов и другие источники клеток ... 38
3. Выделение клеток из солидных органов....................39
3.1. Селезенка............................................39
3.2. Лимфатические узлы ..................................40
3.3. Миндалины............................................41
3.4. Лимфоидная ткань кишечника...........................42
3.5. Тимус................................................43
3.6. Печень плода.........................................43
3.7. Костный мозг.........................................44
3.8. Выделение клеток из лимфоидных органов лабораторных
грызунов.............................................45
3.9. Выделение клеток костного мозга.........48
3.10. Конечные этапы получения клеточных взвесей, общие
для всех методов........................................49
382
ОГЛАВЛЕНИЕ
4. Простые приемы очистки клеток...............................50
4.1. Погибшие клетки ........................................50
4.1.1. Определение жизнеспособности клеток .... 50
4.1.2. Устранение погибших клеток........................51
4.2. Устранение эритроцитов при помощи гемолиза ... 52
4.3. Разделение клеток в градиенте плотности .... 53
4.3.1. Центрифугирование в ступенчатом градиенте плот-
ности альбумина (модифицировано Дж. Остиным
(J. Austyn) — личное сообщение).....................55
4.4. Разделение клеток по адгезивности.....................55
4.4.1. Макрофаги.......................................56
4.4.2. Дендритные клетки...............................57
4.4.3. Выделение дендритных клеток с помощью диффе-
ренциальной адгезии к полистироловой поверх-
ности ..............................................58
4.4.4. Выделение макрофагов по адгезивности ... 59
4.4.5. Устранение из взвеси адгезивных клеток на колонке 59
4.4.6. Выделение Т-клеток на колонке из найлоиовой ваты 60
5. Подсчет клеток...................................60
5.1. Гемоцитометр (счетная камера)................60
5.2. Определение числа клеток с помощью электронного счет-
чика частиц......................................61
6. Благодарности....................................63
7. Приложение.......................................63
Литература........................................65
Глава 2. Выделение различных субпопуляций лимфоцитов. Д. Мейсон,
Дж. Пенхейл, Дж. Седжуик......................................69
1. Введение.........................................69
2. Проточная цитофлуорография и се.ртировка клеток ... 70
2.1. Принципы фенотипического анализа клеток .... 70
2.2. Сортировка клеток............................75
2.3. Практический подход к сортировке клеток .... 75
2.3.1. Работа с клеточной суспензией..........75
2.3.2. Сортировка клеток в стерильных условиях . . 76
2.3.3. Маркирование клеток антителами, связанными с
флуоресцеина.................................77
2.4. Выход, чистота и производительность сортировки клеток 78
2.5. Приготовление конъюгированных антител .... 79
2.5.1. Конъюгация очищенных антител с изотиоцианатом
флуоресцеина ........................................79
2.5.2. Метод биотипирования очищенных антител по
Б. Роузе (В. Poser)................................80
3. Розетирование..............................................80
3.1. Принцип............................................81
3.2. Приготовление раствора хлорного хрома..............81
3.3. Приготовление взвеси эритроцитов барана, нагруженных
антителами................................................81
3.4. Разделение клеток......................................82
3.4.1. Стандартный метод.................................82
3.4.2. Удаление из суспензии редко встречающихся клеток 85
3.4.3. Прямое розетирование..............................86
3.5. Разделение клеток розетированием для последующей экс-
плантации ................................................86
4. Разделение лимфоцитов на поверхности пластика, нагружен-
ной антителами к иммуноглобулинам («пэининг») . . ., 87
383
ОГЛАВЛЕНИЕ
4.1. Принцип................................................87
4.2. Методы.................................................87
4.2.1. Выделение В-клеток прямым методом путем поло-
жительной селекции....................................87
4.2.2. Выделение В-клеток непрямым методом путем от-
рицательной селекции..................................89
4.2.3. Очистка Т-клеток и их субпопуляций путем после-
довательного пэннинга.................................89
4.3. Общие замечания........................................91
5. Разделение субпопуляций лимфоцитов путем комплемент-
опосредованного цитолиза .................................. 91
5.1. Конкретное описание метода.............................92
5.1.1. Реагенты и оборудование..........................92
5.1.2. Одноэтапный вариант метода.......................92
5.1.3. Двухэтапный вариант метода.......................92
5.2. Практические и теоретические соображения .... 93
6. Сравнительная оценка различных методов фракционирования
клеток......................................................94
Литература .................................................95
Глава 3. Фракционирование лимфоцитов при помощи иммуномагнитных
микробус. С. Фундеруд, X. Нустад, Т. Ли, Ф. Вартдаль, Г. Гей-
дернек, П. Стенстад, И. Угельстад........................97
1. Введение...................................................97
1.1. Полимерные магнитные микробусы стандартного размера 97
1.2. Общие принципы разделения лимфоцитов .... 98
2. Реагенты и приборы........................................100
2.1. Среды и посуда для культивирования клеток . . . 100
2.1.1. Приборы...................................100
2.1.2. Микробусы «Дюнабидс М-450»................100
2.2. Приготовление антител...........................101
2.2.1. Поликлональные антитела к IgG мыши ... 101
2.2.2. Моноклональные IgM........................101
2.2.3. Моноклональные IgG........................101
2.3. Адсорбция антител на микробусах «Дюнабидс М-450» . 102
2.3.1. Адсорбция поликлональных IgG на микробусах
«Дюнабидс М-450».................................103
2.3.2. Адсорбция моноклональных IgM мыши на микро-
бусах «Дюнабидс М-450»...........................103
2.3.3. Иммуноадсорбция моноклональных IgG мыши на
микробусах «Дюнабидс М-450», нагруженных анти-
телами овцы или козы к IgG мыши .... 104
3. Разделение лимфоцитов.....................................104
3.1. Методы положительной селекции лимфоцитов . . . 105
3.1.1. Выделение лимфоцитов прямыми методами . 106
3.1.2. Выделение лимфоцитов непрямым методом 108
3.2. Удаление из взвеси определенных клеточных популяций 109
Литература.................................................110
Глава 4. Иммунофлуоресценция и иммуногистохимия. Дж. Джаносси
и П. Амлот........................................................112
1. Введение..................................................112
2. Выделение мононуклеарных клеток нз кровн н костного мозга 116
2.1. Принцип...............................................116
2.2. Реагенты и посуда.....................................116
384
ОГЛАВЛЕНИЕ
2.3. Выделение мононуклеарных клеток....................117
2.4, Примечания.........................................117
3. Иммунофлуоресдентное маркирование клеток в панелях для
микротитрования (микропанельный ИФА)...................118
3.1. Принцип............................................118
3.2. Реагенты н лабораторные принадлежности из стекла
и пластика . .............................119
3.3. Приборы............................................122
3.4. Постановка микропанельного ИФА...................122
3.5. Примечания.........................................123
3.6. Интерпретация результатов ........ 123
4. Иммунофлуоресцентный анализ суспензий клеток лимфатиче-
ских узлов...........................................125
4.1. Принцип . 125
4.2. Реагенты и приборы .... 125
4.3. Приготовление взвеси клеток лимфоидной ткани . . 125
4.4. Примечания....................................126
5. Количественная оценка интенсивности флуоресценции клеток,
маркированных антителами, конъюгированными с ФИТЦ 126
5.1. Принцип ...........................................126
5.2. Реагенты и принадлежности..........................127
5.3. Приборы н обеспечение..............................127
5.4. Количественный иммунофлуоресцентный анализ . . 127
5.5. Комментарии........................................132
5.6. Интерпретация результатов..........................135
6. Блокада неспецифического присоединения моноклональных
антител к Fc-рецепторам...................................136
6.1. Принцип.......................................136
6.2. Реагенты и лабораторные принадлежности .... 136
6.3. Описание метода...............................136
6.4. Интерпретация результатов и примечания .... 137
7. Двухцветный ИФА........................................137
7.1. Принцип............................................137
7.2. Реагенты.........................................141
7.3. Прямой двухцветный ИФА с использованием антител, флуоро-
хромированных ФИТЦ и ФЭ.................................142
7.4. Примечание ........................................142
7.5. Дополнительное двухцветное (ФИТЦ и ТРИТЦ) маркиро-
вание клеток при микропанельном ИФА . . . 143
7.6. Комментарии и интерпретация результатов .... 144
7.7. Контроль специфичности реагентов, используемых в не-
прямом двухцветном ИФА..................................145
7.8. Примечания . 145
8 Двухцветный ИФА, основанный на взаимодействии биотин —
авидин ...................................................146
8.1. Принцип............................................146
8.2. Реагенты...........................................146
8.3. Описание метода ...................................146
8.4. Примечание ........................................147
9. Исследование клеток в мазках и препаратах, приготовленных
с помощью цитоцентрифуги..................................147
9.1. Принцип........................................... 147
9.2. Реагенты и лабораторные принадлежности . . 149
385
ОГЛАВЛЕНИЕ
9.3. Приборы............................................149
9.4. Метод двухцветного одновременного маркирования мем-
бранных и цитоплазматических антигенов .... 150
9.5. Примечания.........................................151
9.6. Интерпретация результатов микроскопического исследо-
вания .................................................152
10. Иммуноцитохимический анализ срезов тканей .... 153
10.1. Принципы......................................153
10.2. Реагенты . 154
10.3. Приготовление срезов из тканей................155
10.4. Приготовление срезов из замороженных тканей . . 156
10.5. Обработка парафиновых срезов..................157
10.6. Обработка парафиновых срезов..................157
10.6. Обработка предметных стекол поли-L-лизином . . 158
11. Иммуиопероксидазиый метод..............................158
11.1. Принципы..........................................158
11.2. Реагенты и лабораторные принадлежности .... 158
11.3. Описание методов..................................159
11.4. Комментарии ......................................161
11.5. Интерпретация результатов микроскопического исследо-
вания ... 162
12. Иммуиоферментное маркирование комплексами щелочная фос-
фатаза— антитела к щелочной фосфатазе (ЩФ — АЩФ) 163
12.1. Принцип...........................................163
12.2. Реагенты..........................................163
12.3. Описание метода...................................164
12.4. Интерпретация результатов микроскопического исследо-
вания ...................................................165
13. Система авидин — биотин................................166
13.1. Принцип . 166
13.2. Реагенты..........................................167
13.3. Описание метода...................................167
13.4. Интерпретация результатов микроскопического исследо-
вания . ......................................168
14. Двойное маркирование тканей............................168
14.1. Принцип . 168
14.2. Реагенты..........................................169
14.3. Описание метода...................................169
14.4. Интерпретация результатов микроскопического исследо-
вания ...................................................170
15. Благодарности..........................................172
Литература..............................................173
Глава 5. Индукция и количественное определение клеток, образующих
антитела in vitro. Д. Гилберт и Д. Дрессер..................176
1. Введение...............................................176
2. Индукция клеток, образующих антитела in vitro . . 176
2.1. Иммунизация спленоцитов мыши in vitro .... 177
2.1.1. Иммунизация спленоцитов мыши in vitro эритроци-
тами барана (ЭБ)....................................177
2.1.2. Дополнительные компоненты среды или лимфокины 178
2.1.3. Образование антител в ответ на различные иммуно-
гены ...............................................179
386
ОГЛАВЛЕНИЕ
2.1.4. Роль сывороточных факторов..................... . 179
2.1.5. Посуда для клеточных культур.......................181
2.1.6. Использование камер Марбрука.......................181
2.2. Иммунизация лимфоцитов человека in vitro .... 182
2.2.1. Иммунизация ЛПК человека ЭБ in vitro . 183
2.2.2. Иммунизация другими антигенами.....................184
2.2.3. Использование других неспецифических стимулято-
ров образования антител ........................... 184
2.2.4. Эффект лимфокинов, добавленных в среду . . 184
2.2.5. Сывороточные факторы..........................185
2.2.6. Дополнительные варианты условий культивирования 185
2.2.7. Дополнительные примечания.....................185
2.2.8. Иммунизация in vitro клеток селезенки или минда-
лин человека.........................................186
2.3. Иммунизация in vitro лимфоцитов других видов животных 186-
3. Количественное определение клеток, секретирующих антитела 187
3.1. Метод локального гемолиза...............................187
3.1.1. Общее описание.....................................187
3.1.2. Определение клеток, образующих антитела, в жид-
кой среде.................................................188
3.1.3. Дополнительные пояснения...........................189
3.1.4. Локальный гемолиз в геле...........................190
3.1.5. Неэритроцитариые антигены..........................193
3.1.6. Обратный локальный гемолиз.........................196
3.1.7. Комментарии общего характера......................198-
3.2. Методы, основанные на формировании негемолптических
зои.......................................................... 209
3.2.1. Локальный лизнс клеток-мишеней, имеющих ядра 200
3.2.2. Выявление зои ингибиции размножения фага (метод
ZIPP).....................................................201
3.2.3. Метод иммуноферментных (ELISA) зон «Элиспот» 201
3.3. Приготовление взвеси лимфоидных клеток .... 203
3.4. Антииммуноглобулиновые сыворотки (антиглобулиновые
реагенты) ...............................204
4. Благодарности ...............................204
Литература...................................................204
Глава 6. Культивирование линий и клонов Т-клеток in vitro. П. Тейлор,
Д. Томас, К. Миллз.............................203
1. Введение ...................................................208
1.1. Различные стратегии получения линий ЦТЛ и Т-хелперов 209
2. Приготовление суспензий лимфоидных клеток . . 210'
2.1. Культуральная среда и условия культивирования . 210
2.2. Приготовление клеточных взвесей селезенки и лимфатиче-
ских узлов . 210
2.3. Подсчет живых клеток....................................211
2.3.1. Окрашивание акридиновым оранжевым (АО) н бро-
мистым этидием (БЭТ)................................211
2.3.2. Окрашивание динатриевой солью эозина 211
2.4. Удаление погибших клеток с помощью центрифугирования
в градиенте плотности метризамида........................211
2.5. Приготовление клеток-мишеней для ЦТЛ .... 212
2.5.1. Получение клеток перитонеального экссудата, инду-
цированного тиогликолятом (ТГ)......................212
2.5.2. Получение В- или Т-лимфобластов....................212
2.6. Облученные клетки селезенки.............................213
387
ОГЛАВЛЕНИЕ
3. Продукция ИЛ-2 ..........................................213
3.1. Кон А-надосадок .....................................213
3.2. Надосадок тимомы EL4............................214
3.3. Ауто-ИЛ-2 ......................................215
4. Получение линий Т-хелперов..........................215
4.1. Примирование Т-хелперов in vivo растворимыми белко-
выми антигенами [12]................................215
4.2. Инициация и поддержание линий Т-хелперов . . . 216
5. Получение линий цитотоксических Т-лимфоцитов . . . 216
5.1. Получение примированных ЦТЛ.....................216
5.2. Инициация линий цитотоксических Т-лимфоцитов . 217
6. Клонирование Т-клеток....................................218
6.1. Клонирование методом лимитирующих разведений . . 218
6.2. Размножение клонированных клеток.....................219
7. Селекция Т-хелперов путем самоустранения клонов посторон-
ней специфичности . .............................220
8. Анализ Т-хелперов.....................................221
8.1. Оценка пролиферативного ответа....................222
8.2. Определение ИЛ-2..................................222
9. Определение цитотоксической активности...............223
9.1. Подготовка ЦТЛ.......................................224
9.2. Приготовление и маркирование клеток-мишеней 51Сг 225
9.3. Оценка активности ЦТЛ................................225
9.4. Примечание...........................................226
10. Определение поверхностных антигенов Т-клеток методом не-
прямого резеткообразования ................................ 226
10.1. Присоединение антнглобулиновых антител к бычьим
эритроцитам..............................................227
10.2. Связывание МКА с Т-клетками........................227
10.3. Образование и подсчет розеток......................227
11. Анализ МНС-рестрикции...................................228
12. Примечание, сделанное в корректуре......................228
Литература...............................................229
Глава 7. Получение линий лимфобластоидиых В-клеток человека с по-
мощью вируса Эпштейна — Барр. Э. Уоллз и Д. Крофорд 230
1. Введение................................................230
1.1. Вирус Эпштейна — Барр..............................230
1.2. Линии лимфобластоидиых В-клеток....................230
2. Принципы метода........................................233
2.1. Получение вируса...................................233
2.2. Правила работы с ВЭБ в лаборатории.................233
2.3. Взаимодействие ВЭБ с В-лимфоцитами..................234
2.4. Необходимость вспомогательных и питающих клеток . 234
2.5. Регуляция Т-лимфоцитами размножения В-лимфоцитов,
инфицированных ВЭБ.......................................234
3. Описание методов........................................235
3.1. Получение вируса...................................235
3.1.1. Культуральная среда..........................235
388
ОГЛАВЛЕНИЕ
3.1.2. Индуцирующие агенты...................... . 235
3.1.3. Культивирование клеток В95-8 .................. 235
3.1.4. Приготовление содержащих ВЭБ препаратов из
культуральной жидкости клеток В95-8 .... 236
3.1.5. Титрование препаратов ВЭБ на мононуклеарных
клетках пуповинной крови ........................... 236
3.1.6. Предосторожности при работе с ВЭБ и имморталн-
зованными линиями клеток.............................237
3.2. Приготовление клеток-мишеней для заражения . . . 239
3.2.1. Среда для отмывания клеток.......................239
3.2.2. Осаждение эритроцитов пуповинной кровн декстра-
ном .................................................239
3.2.3. Выделение мононуклеарных клеток и удаление
Т-лимфоцитов.........................................239
3.3. Получение иммортализованных линий клеток с помощью
ВЭБ.....................................................240
3.3.1. Приготовление циклоспорина А....................240
3.3.2. Заражение ВЭБ и культивирование .... 240
3.3.3. Обратное развитие очагов пролиферации В-лимфо-
цитов, демонстрирующее Т-клеточный иммунитет
в отношении ВЭБ......................................240
3.4. Наращивание клеток и криоконсервация клеточных линий 241
3.4.1. Среда и ампулы для замораживания .... 241
3.4.2. Наращивание ЛЛВК............................... 241
3.4.3. Замораживание н оттаивание лимфобластоидных
клеток...............................................241
3.5. Иммунофлуоресцентное выявление ядерных антигенов ВЭБ
в реакции связывания комплемента ...................... 242
3.5.1. Реагенты.........................................242
3.5.2. Приготовление мазков из суспензии клеток . . 243
3.5.3. Иммунофлуоресцентное окрашивание антителами
к СЗ . 243
3.6. Иммуноферментное выявление ядерных антигенов ВЭБ
в реакции связывания комплемента........................244
3.6.1. Реагенты.........................................244
3.6.2. Выявление комплемента конъюгатом пероксидазы
с антителами к СЗ....................................244
4. Проблемы.................................................245
4.1. Проблемы, связанные с вирусом.........................246
4.2. Клетки-мишени.........................................247
4.3. Выявление ядерных антигенов ВЭБ в клеточных линиях 247
4.4. Условия культивирования...............................247
5. Возможности применения линий лимфобластоидных В-клеток 248
Литература.................................................248
Глава 8. Метод лимитирующих разведений. Г. Уолдман, С. Кобболд
и И. Лефковитс...........................................250
1. Введение................................................250
2. Теоретические предпосылки метода........................251
2.1. Одноударные кривые и расчет частоты ..... 251
2.2. Анализ по распределению в предельном разведении
3. Описание метода АПР.........................• •
3.1. Введение................................
389
ОГЛАВЛЕНИЕ
3.2. Анализ в предельном разведении Т-хелперов . . . 256
3.2.1. Получение Т-хелперов....................256
3.2.2. Получение В-клеток памяти...............258
3.2.3. Культуральная среда ............................258
3.2.4. Культивирование клеток..................258
3.2.5. Радиоиммунологический анализ образцов культу-
ральной надосадочной жидкости ..... 259
3.2.6. Оценка надежности системы...............262
3.2.7. Применение АПР для доказательства моногамности
межклеточных взаимодействий отдельной Т-клетки 264
3.3. Обзор систем, позволяющих исследовать с помощью АПР
другие функции лимфоцитов.................................268
3.3.1. Созревание В-клеток (клональная дифференци-
ровка) ...........................................268
3.3.2. Т-хелперы.......................................268
3.3.3. Т-супрессоры....................................269
3.3.4. Цитотоксические Т-лимфоциты и их предшествен-
ники .................................................269
3.3.5. Наблюдение за динамикой Т-клеток в процессе лече-
ния (мониторинг)......................................270
4. Методы статистической обработки результатов АПР . . 270
5. Приложение 1 . . . .............................271
5.1. Полная распечатка программ для статистической оценки
результатов метода лимитирующих разведений на микро-
компьютерах ВВС...........................................271
6. Приложение 2 (на английском и русском языках) . . . 277
6.1. Example output from running the limiting dilution analysis
program...................................................277
Литература.................................................284
Глава 9. Анализ пролиферации лимфоцитов. С. Найт...............286
1. Введение .................................................286
2. Исходный вариант метода культивирования в висячих каплях 287
2.1. Культуральные среды и добавки....................287
2.1.1. Среда......................................287
2.1.2. Добавление сыворотки.......................288
2.2. Культивирование в висячих каплях.................290
2.2.1. Закладка капельных культур.................290
2.2.2. Культивирование............................291
2.3. Использование [3Н]-тимидина......................292
2.3.1. Количество добавляемого тимидина .... 292
2.3.2. Удельная активность [3Н]-тимидина .... 292
2.3.3. Добавление [3Н]-тимидина в культуры . . . 293
2.4. Сбор клеток......................................294
2.4.1. Нарезание фильтровальных дисков .... 294
2.4.2. Сбор клеток................................294
2.5. Планирование эксперимента и анализ данных . . . 296
3. Результаты . ...................................297
3.1. Воспроизводимость метода.........................297
3.2. Ответы на митоген................................299
3.3. Ответы иа антиген................................303
3.4. Ответы в смешанных культурах лимфоцитов (СКЛ) 304
390
ОГЛАВЛЕНИЕ
4. Благодарности........................................307
Литература............................................309
Глава 10. Анализ интерлейкинов и других подобных им факторов.
А. Хамблин и А. О’Гарра...............................310
1. Введение.............................................310
1.1. Интерлейкины, действующие на Т-лимфоциты . . . 311
1.2. Интерлейкины, действующие на В-лимфоциты . . . 312
2. Интерлейкин 1......................................313
2.1. Источники......................................313
2.2. Получение ИЛ-1 из моноцитов периферической крови
человека...........................................314
2.3. Определение ИЛ-1 в культуре мышиных тимоцитов 314
3. Интерлейкин 2......................................316
3.1. Источники ...........................................316
3.2. Определение ИЛ-2 в культуре клеток CTLL . . . 317
3.2.1. Культивирование клеток мышиной линии CTLL 317
3.2.2. Определение..............................317
3.3 . Определение ИЛ-2 на лимфобластах человека. Модифика-
ция ранее описанного метода ........................... 317
3.3.1. Получение лимфобластов человека . . . . 317
3.3.2. Выделение лимфобластов в градиенте плотности
перколла. Модификация ранее описанного метода 318
3.3.3. Определение ИЛ-2 на лимфобластах .... 319
4. Интерлейкин 3 (ИЛ-3)...............................319
4.1. Источники ...........................................320
4.2. Определение ИЛ-3 по пролиферации клеточных линий 320
4.3. Определение колониестимулирующей активности . . 321
5. Интерлейкин 4 321
5.1. Источники......................................322
5.2. Определение ИЛ-4, основанное на комитогенпом эффекте 323
5.3. Определение ИЛ-4 по усилению экспрессии 1а-белков 324
5.4. Определение ИЛ-4 по индукции образования Igj . . 324
5.5. Определение ИЛ-4 по индукции образования IgE . . 325
5.6. Определение ИЛ-4 по активности фактора роста тучных
клеток (ФРТуК)..........................................325
5.7. Определение ИЛ-4 по активности фактора роста Т-клеток 326
6. Интерлейкин 5 ...................................326
6.1. Эффекты ИЛ-5 на клетки BCLi-лимфомы .... 327
6.1.1. Выращивание BCL.-лимфомы.......................327
6.1.2. Определение ИЛ-5 на клетках BCL] .... 327
6.1.3. Стандартизация взвеси клеток BCL1 .... 328
6.2. Биологическое действие ИЛ-5 на нормальные В-клетки 328
6.2.1. Определение ИЛ-5 по биологическому действию иа
большие В-лимфоциты..................................328
6.2.2. Определение фактора, заменяющего Т-клетки
(ФЗТ)................................................330
6.3. Активность фактора дифференцировки эозинофилов
(ФДЭ).....................................................331
6.3.1. Получение личинок М. corti.....................331
6.3.2. Определение фактора дифференцировки эозинофи-
лов ...................................................332
391
ОГЛАВЛЕНИЕ
6.3,3. Подсчет эозинофилов...........................332
6.3.4. Определение эозинофилов по пероксидазной актив-
ности ..............................................332
6.4. Заключительный комментарий..........................333
7. В-клеточный стимулирующий фактор-2 (BSF-2, В cell-stimu-
lating factor-2)..........................................333
7.1. Источники ..........................................333
7.2. Индукция синтеза иммуноглобулинов нормальными
В-клеткамн под действием BSF-2..........................334
7.3. Индукция синтеза иммуноглобулинов В-клетками транс-
формированных ВЭБ линий.................................335
8. Стандартизация методов определения лимфокинов . . . 335
Литература...............................................336
Глава 11. Анализ биохимических свойств антигенов лимфоцитарной по-
верхности. А. Дейвис и М. Браун..........................339
1. Введение................................................339
2. Иммунопреципитация . . L.............................340
2.1. Введение ...........................................340
2.2. Радиомаркирование клеток . 346
2.2.1. Иодирование белков клеточной поверхности с по-
мощью лактопероксндазы..............................346
2.2.2. Биосинтетическое маркирование белков 35 [S]-метио-
нином ..............................................347
2.2.3. Маркирование 32Р..............................348
2.3. Иммунопреципитация с помощью взвеси клеток Staphy-
lococcus aureus.....................................349
2.3.1. Необходимые реагенты.....................349
2.3.2. Получение клеточного лизата..............349
2.3.3. Предварительная очистка лизата...........350
2.3.4. Иммунопреципитация.......................351
2.3.5. Отмывание . 351
2.3.6. Подготовка иммунопреципитата к ДСН-ПАГЭ 352
2.4. Иммунопреципитация с помощью гранул геля сефарозы,
нагруженных стафилококковым белком А 352
2.4.1. Приготовление взвеси гранул геля протеин А — се-
фарозы (Pharmacia Fine Chemicals, Швеция) . . 352
2.4.2. Иммунопреципитация.......................352
2.4.3. Отмывание ....................................352
2.4.4. Подготовка иммунопреципитата к ДСН-ПАГЭ 358
2.5. Иммунопреципитация с помощью антител, непосредствен-
но присоединенных к гранулам геля сефарозы . . . 353
2.6. Сравнение разных вариантов метода иммунопреципитации
между собой.........................................353
2.7. Примеры использования иммунопреципитации . . . 354
2.7.1. Анализ характера гликозилирования .... 354
2.7.2. Сравнение исследуемого антигена с известными 356
3. Иммуноблоттинг.....................................359
3.1. Введение.......................................359
392
ОГЛАВЛЕНИЕ
3.2. Основной метод...................................360
3.3. Исследуемый образец..............................361
3.4. Набор белков-калибрантов молекулярной массы . . 362
3.5. Гель............................................364
3.6. Перенос белков...................................364
3.6.1. Приборы н принадлежности...................364
3.6.2. Буферные растворы..........................364
3.6.3. Приготовление «сэндвича»...................365
3.6.4. Условия переноса белков....................366
3.7. Выявление антигена, перенесенного на мембрану . . 366
3.7.1. Выявление белков, перенесенных иа мембрану 367
3.7.2. Выявление специфического антигена .... 368
4. Электрофорез в полиакриламидном геле, содержащем доде-
цилсульфат натрия (ДСН-ПАГЭ)............................371
4.1. Введение.........................................371
4.2. Необходимые реагенты и приборы...................371
4.3. Описание метода..................................371
5. Благодарности . 373
Литература ...............................................374
Поставщики реактивов и оборудования...................375
Предметный указатель..................................377
ОПЕЧАТКИ
Напечатано
Следует читать
Стр. 100, 1-я строка снизу
н-толуолсульфонилхлоридом
Стр. 102, 5-я строка снизу
н-толуолсульфонилхлорида
п-толуолсульфоннлхлоридом
п -толуолсульфонилхлорида
Научное издание
Саймон Хант, Дон Мейсон, Джон Пенхейл и др.
ЛИМФОЦИТЫ. МЕТОДЫ
Под ред. Дж. Клауса
Заведующий редакцией чл.-корр. АН СССР Т. М. Турпаев
Зам. зав. редакцией М. Д. Гроздова
Научный редактор М. А. Серова
Мл. редактор М. С. Карнюшина
Художник А. В. Захаров
Художественный редактор А. Я. Мусин
Технический редактор Л. П. Бирюкова
Корректор В. И. Киселева
ИБ № 7125
Сдано в набор 20.03.90. Подписано к печати 12.07.90. Формат 60Х90'/15. Бумага типограф-
ская № 1. Печать высокая. Гарнитура Литературная. Объем 12,25 бум. л. Усл. печ. л.
25. Усл. кр.-отт. 25. Уч.-изд. л. 26,75. Изд. № 4/6532. Тираж 6500 экз. Зак. 172.
Цена 4 руб.
Издательство «Мир» В/О «Совэкспорткнига» Государственного комитета СССР по печати.
129820. ГСП, Москва, И-110, 1-й Рижский пер., 2.
Московская типография № 11 Государственного комитета СССР по печати. 113105,
Москва, Нагатинская ул., д. 1.
395