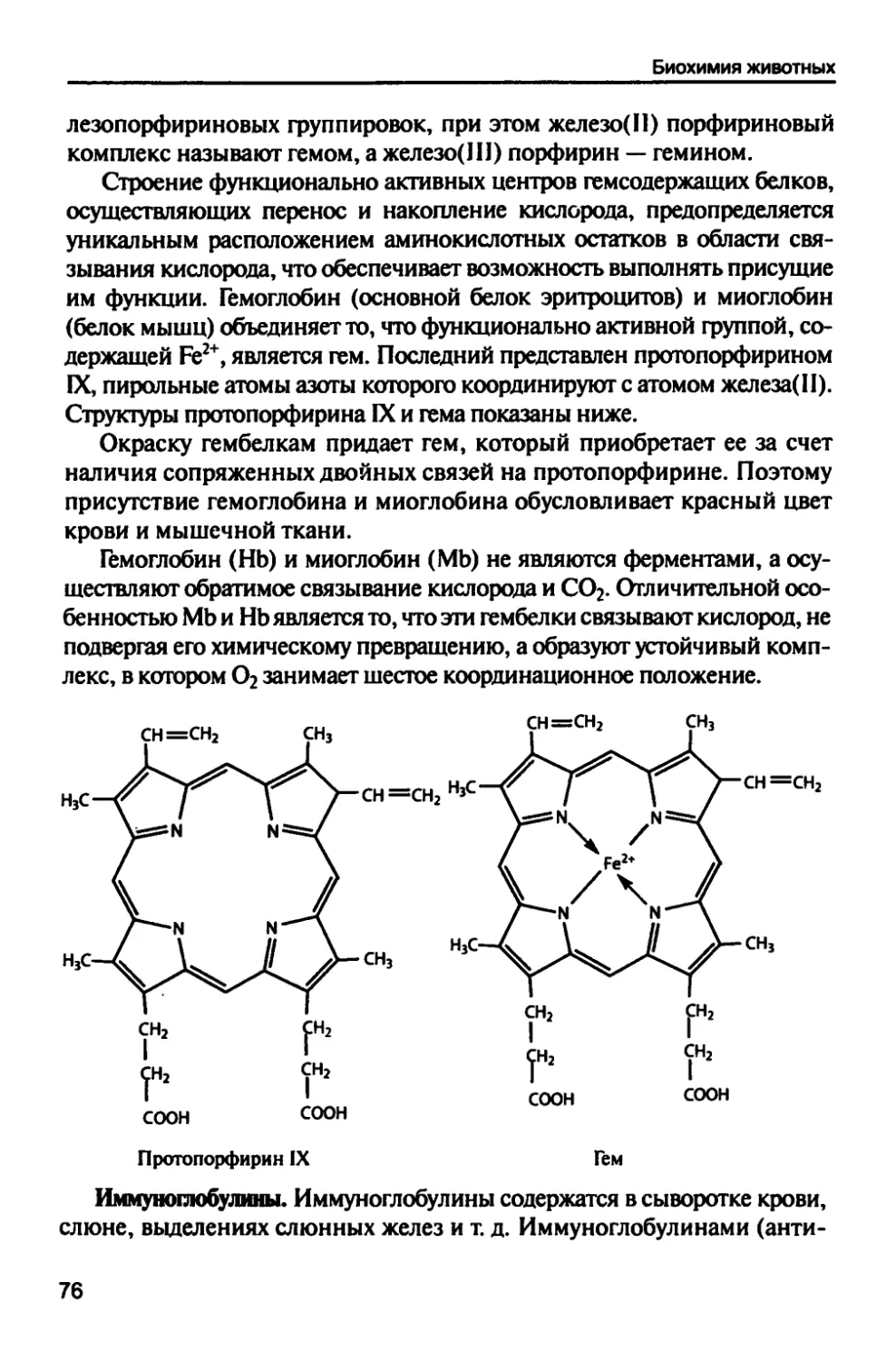
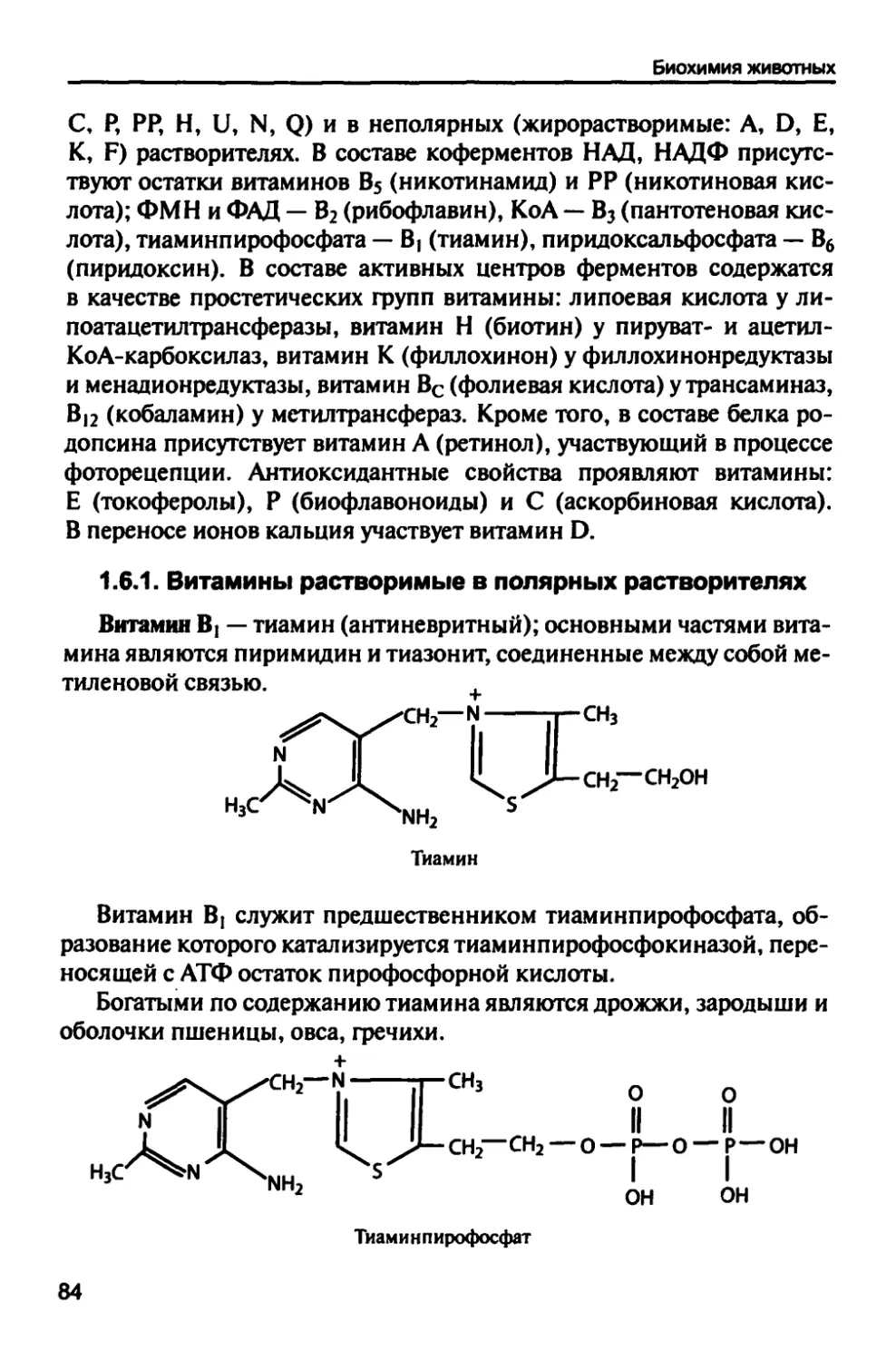
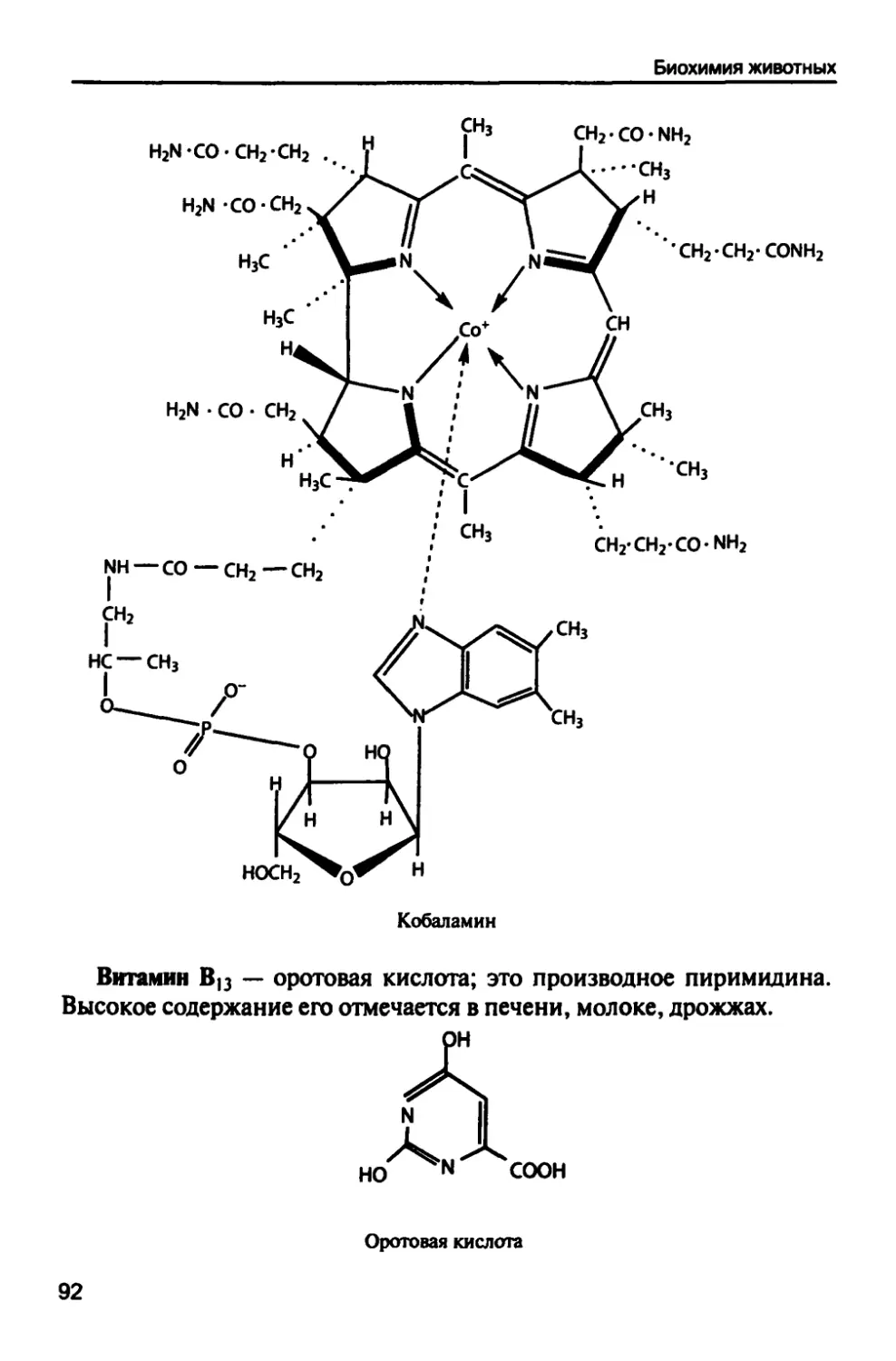
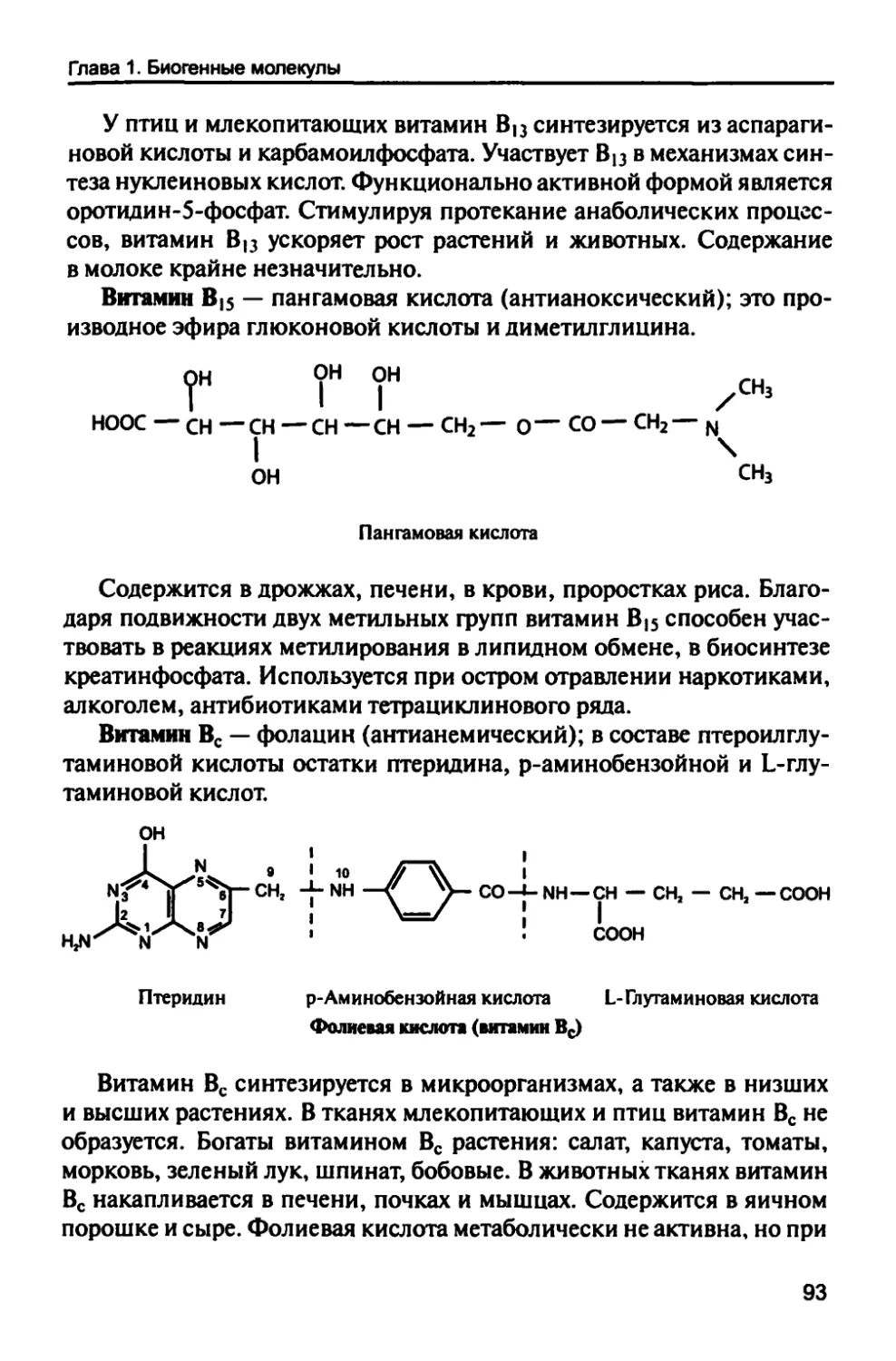
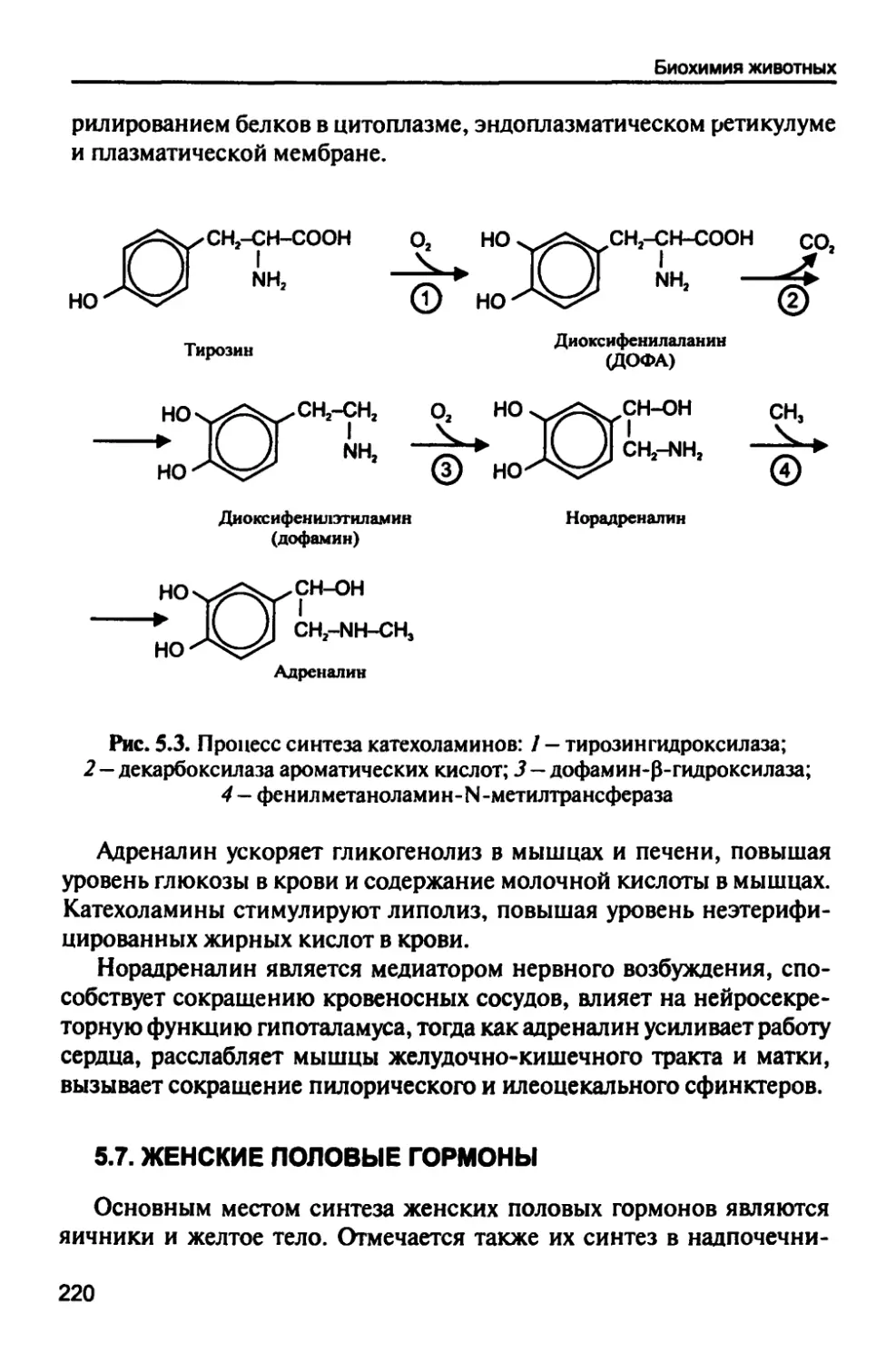
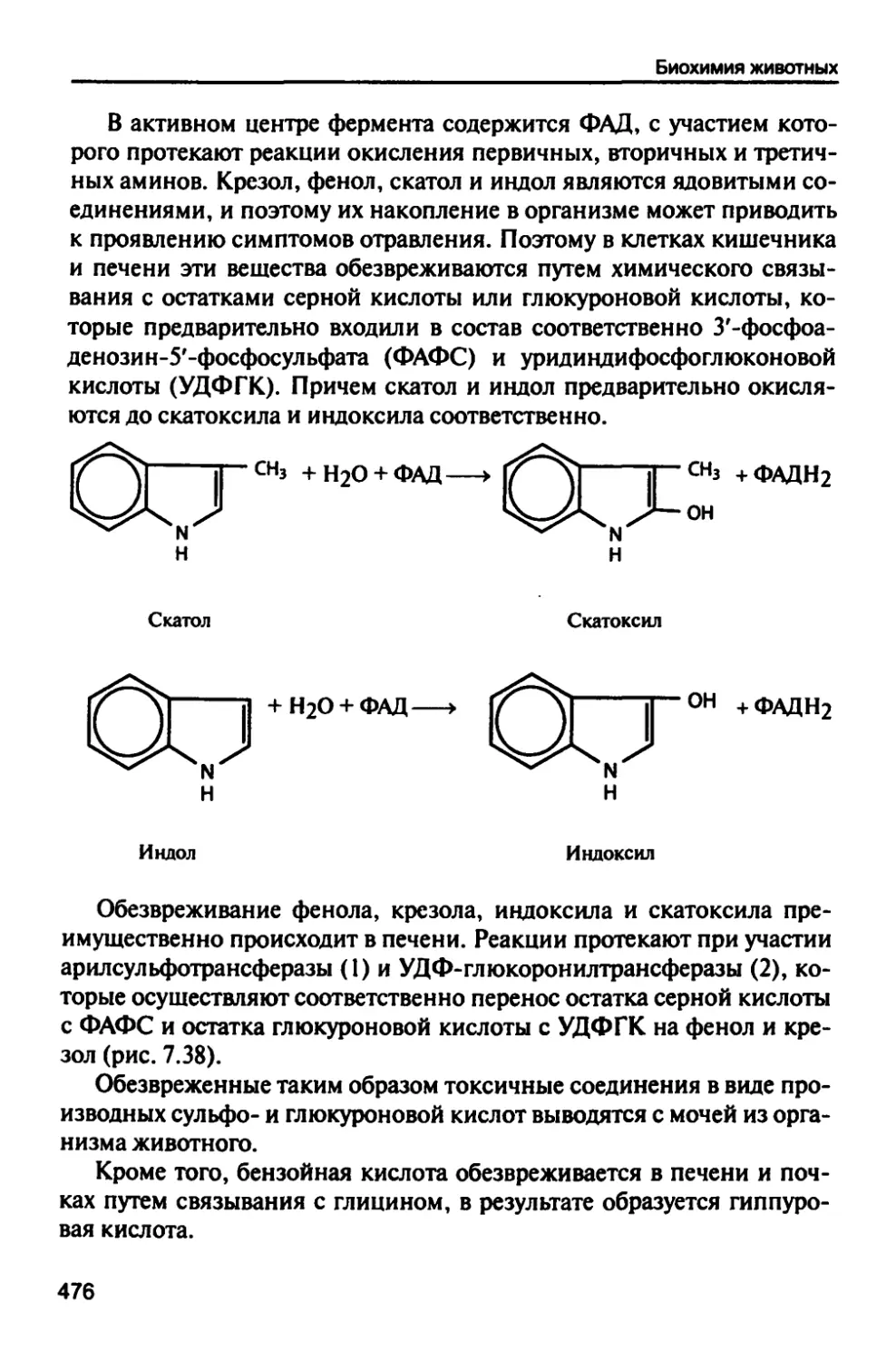
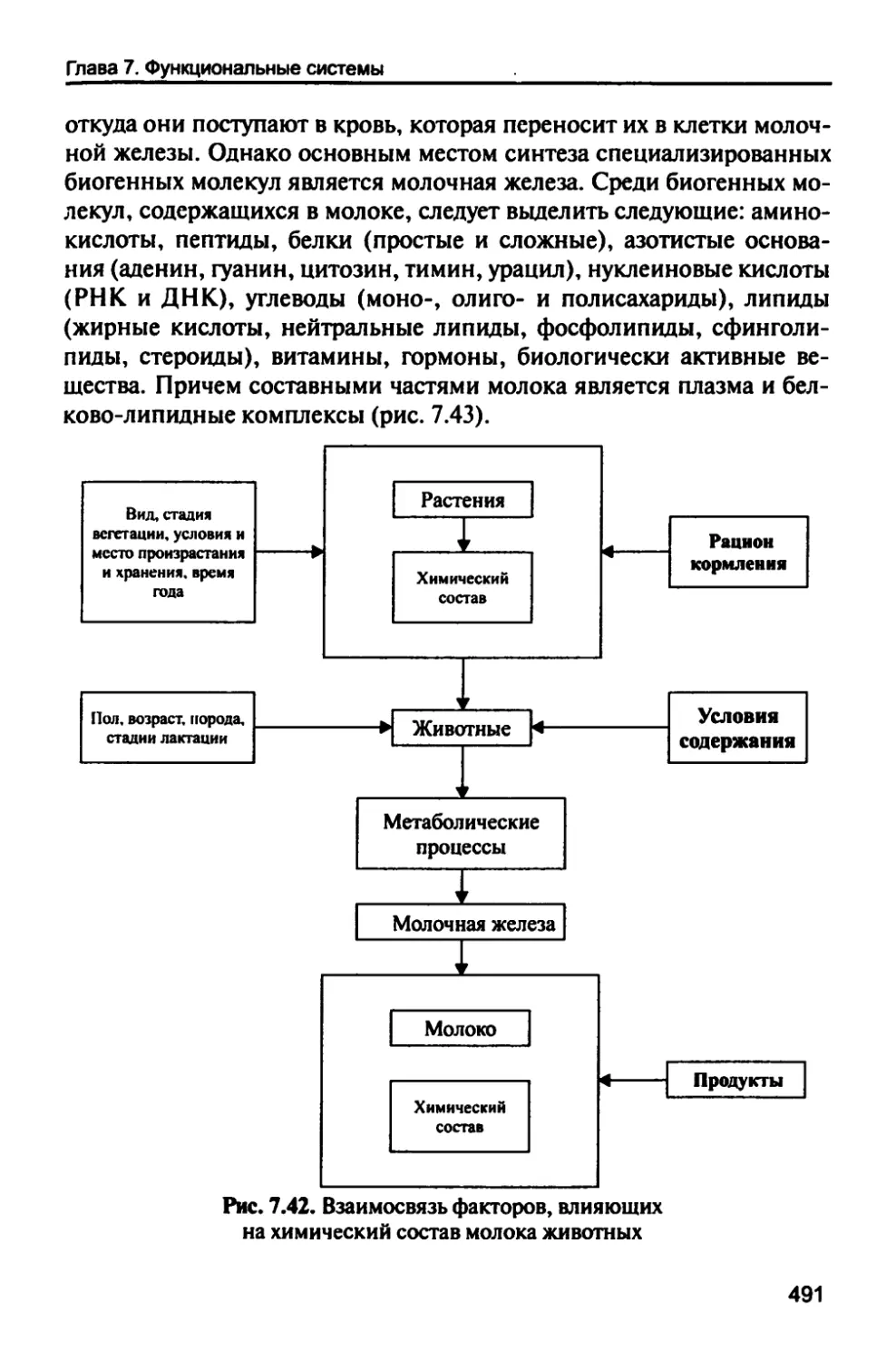
Автор: Рогожин В.В.
Теги: биологические основы животноводства химия биохимия молекулярные процессы
ISBN: 978-5-98879-074-7
Год: 2009
Текст
28.672 3329716
Р598
В. В. Рогожин
БИОХИМИЯ
животных
учебник
^г?щ$>д
В. В. Рогожин
БИОХИМИЯ
животных
учебник
Допущено Учебно-методическим объединением вузов Российской
Федерации по агрономическому образованию в качестве учебника
для студентов, обучающихся по специальности 110305
«Технология производства и переработки
сельскохозяйственной продукции»
^0*ю}>д
2009
Василий Васильевич Рогожин
Биохимия животных
Рецензенты:
Дранаева А. Г., кандидат химических наук, доцент, зав. кафедрой агробио-
химии Якутской государственной сельскохозяйственной академии;
Попов А. А., кандидат химических наук, доцент Института биологических
проблем криолитозоны СО РАН.
Директор издательства В. Фасульян
Руководитель направления Т. Казачкова
Выпускающий редактор М. Жданова
Литературный редактор ЕДудина
Корректоры Т. Петрова. Е. Дубина
Верстка М. Кеслер
Художник М. Соколинская
ББК45.2
Р598 Рогожин В. В.
Биохимия животных: Учебник. — СПб.: ГИОРД, 2009. — 552 с: ил.
15ВИ 978-5-98879-074-7
Данное издание посвящено биохимии животных — науке о молекулярных процессах,
протекающих в клетках живых организмов. Знание биохимии необходимо для выяснения причин
патологии различных болезней и изыскания путей их эффективного лечения. Учебник отвечает
задачам, стоящим перед дисциплиной «Биохимия»; рассматривает строение и свойства
основных биогенных молекул (нуклеиновые кислоты, белки, липиды, углеводы, витамины, гормоны
и др.), а также метаболические процессы, протекающие в клетках различных органов и тканей.
Допущено Учебно-методическим объединением вузов Российской Федерации по
агрономическому образованию в качестве учебника для студентов, обучающихся по
специальности 110305 «Технология производства и переработки сельскохозяйственной продукции».
18ВЫ 978-5-98879-074-7
© Рогожин В. В., 2009
© ООО «Издательство "ГИОРД"». 2009
Подписано в печать 13.11.08. Формат 60x90/16. Усл. п. л. 34,5. Тираж 1000. Заказ 201
ООО «Издательство "ГИОРД"»,
192148, Санкт-Петербург, а/я 8. Тел. (812) 449-92-20
Отпечатано с готовых диапозитивов в типографии
ОСЮ«ИПКБИОНТ»
199026, Санкт-Петербург, Средний пр., д. 86.
ОГЛАВЛЕНИЕ
Принятые сокращения 4
Введение 9
Глава 1. Биогенные молекулы 13
1.1. Спирты, альдегиды и карбоновые кислоты 13
1.1.1. Спирты 13
1.1.2. Альдегиды 15
1.1.3. Карбоновые кислоты 16
1.2. Липиды 17
1.2.1. Высшие жирные кислоты и эйкозаноиды 19
1.2.2. Ацилглицеролы (глицериды) 27
1.2.3. Фосфолипиды 29
1.2.4. Воска 34
1.2.5. Стероиды 35
1.2.6. Терпены (изопреноиды) 37
1.3. Углеводы 41
1.3.1. Моносахариды 44
1.3.2. Олигосахариды 52
1.3.3. Полисахариды 54
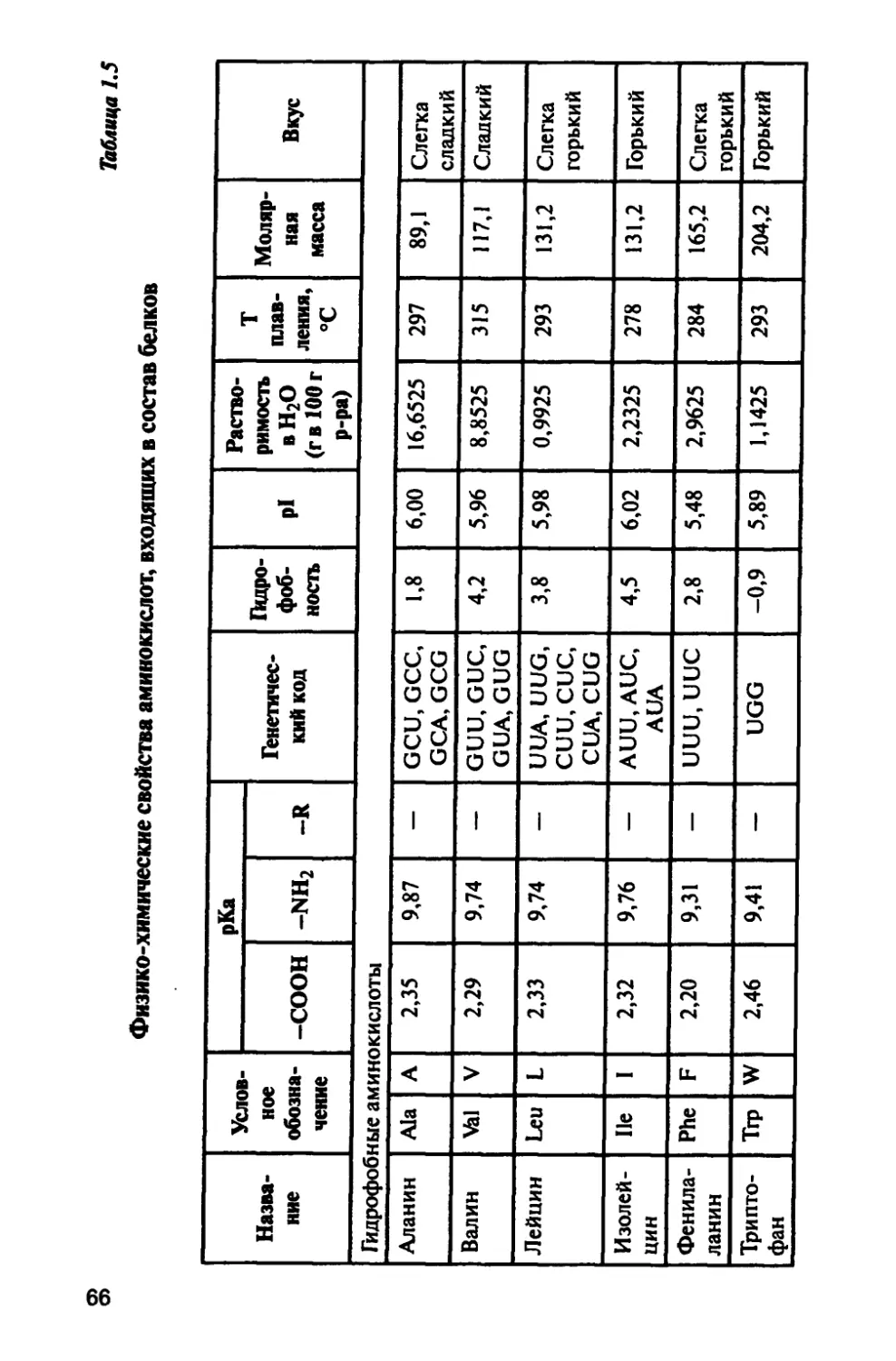
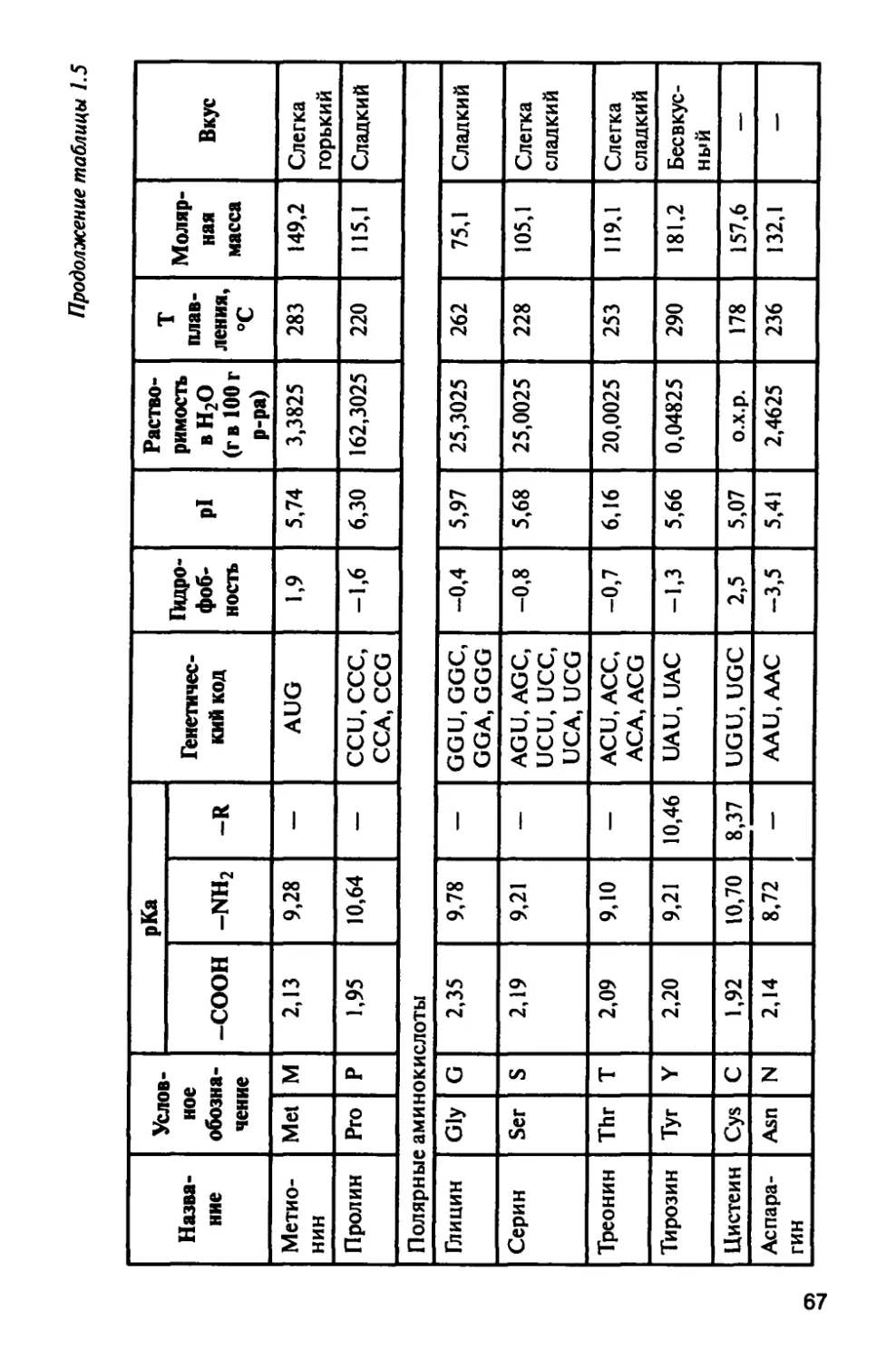
1.4. Аминокислоты 64
1.4.1. Физические свойства аминокислот 69
1.4.2. Химические свойства аминокислот 69
1.5. Белки 70
1.5.1. Структуры белков 70
1.5.2. Физические свойства белков 72
1.5.3. Простые и сложные белки 75
1.5.4. Формы белков 81
1.5.5. Функции белков 82
1.6. Витамины и коферменты 83
1.6.1. Витамины растворимые в полярных растворителях 84
1.6.2. Витамины растворимые в неполярных
растворителях 99
3
Оглавление
1.7. Элементы 103
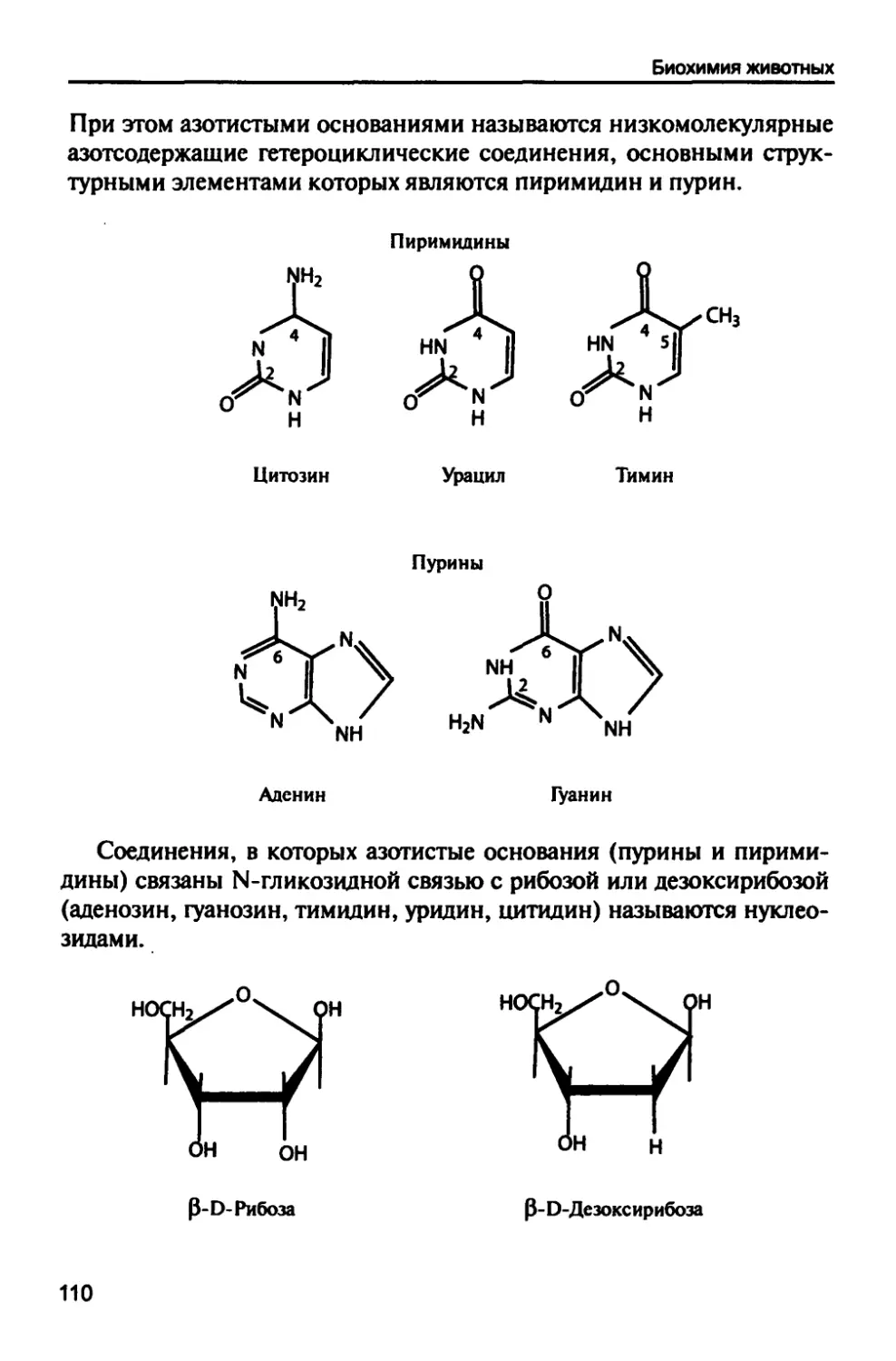
1.8. Азотистые основания 109
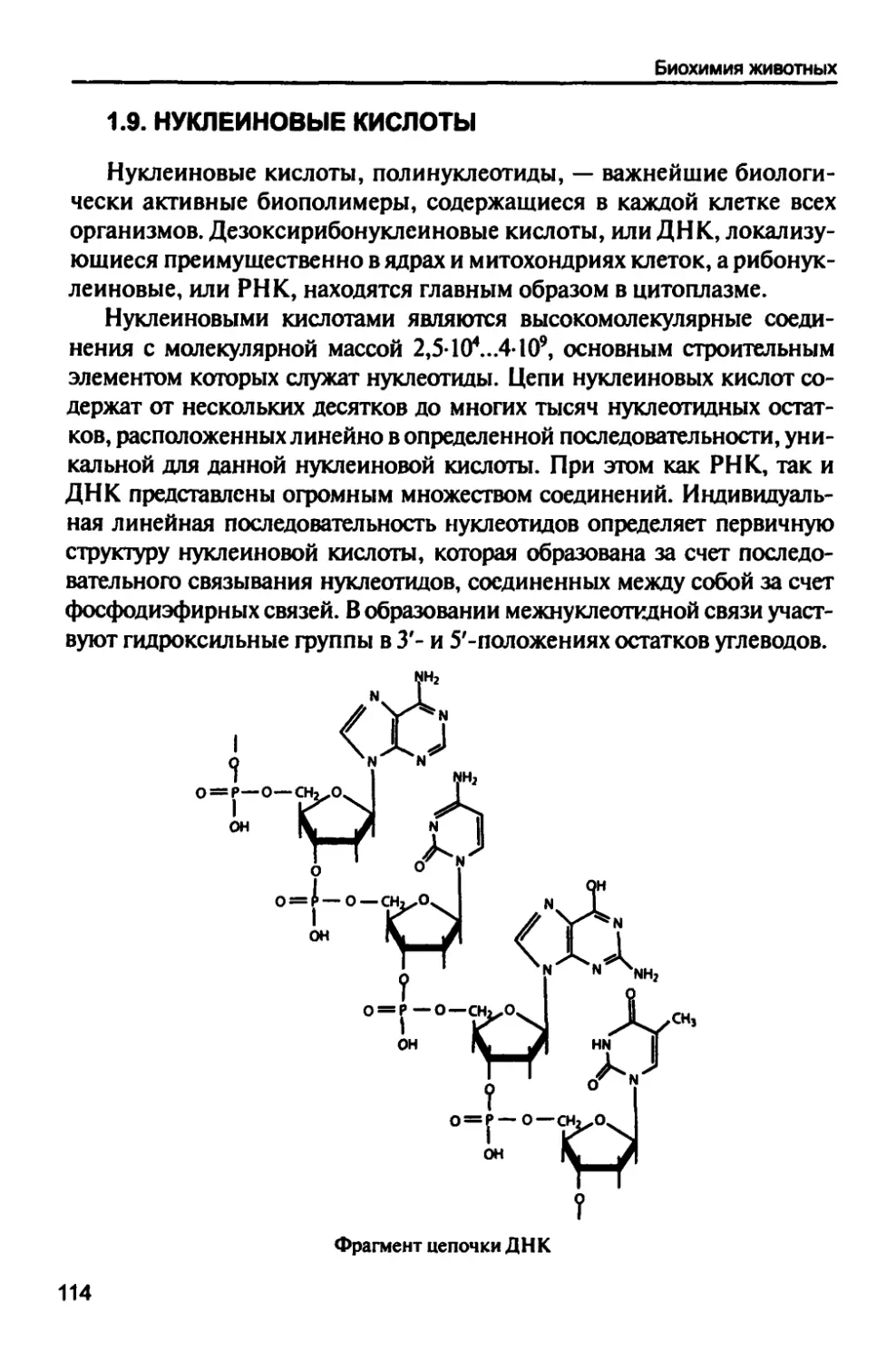
1.9. Нуклеиновые кислоты 114
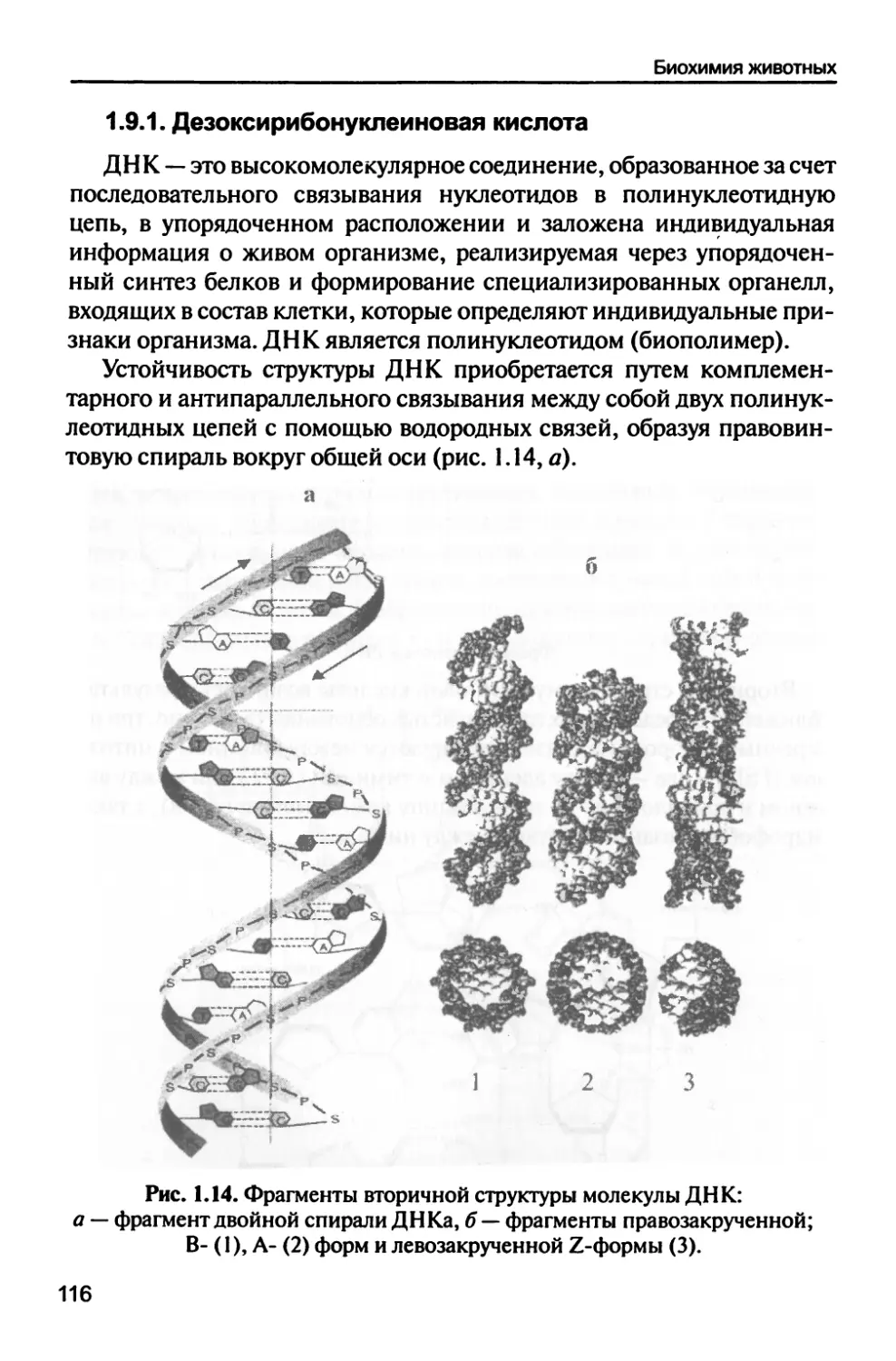
1.9.1. Дезоксирибонуклеиновая кислота 116
1.9.2. Рибонуклеиновые кислоты 122
1.10. Биогенные молекулы энергетических
процессов 126
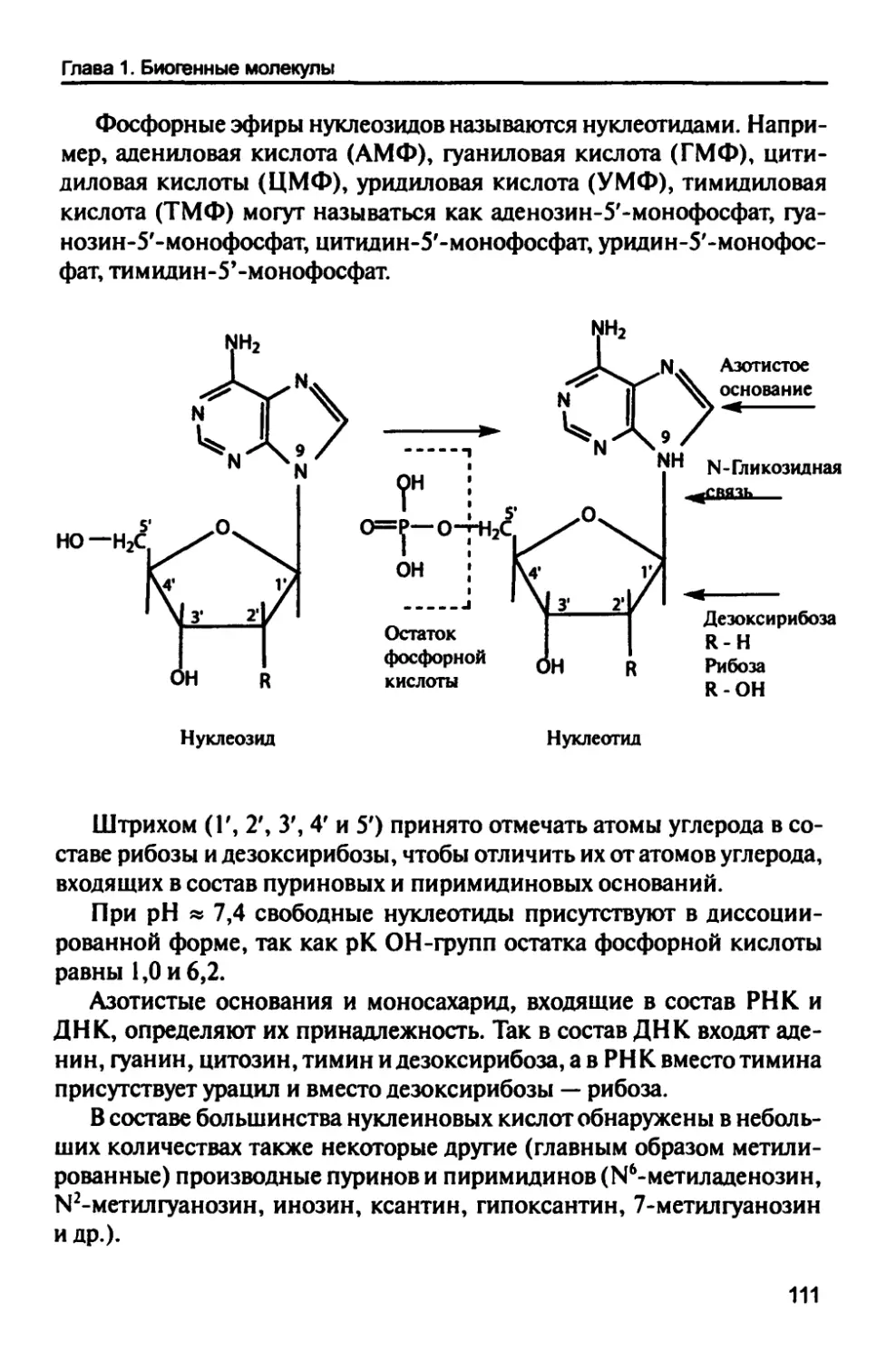
1.10.1. Нуклеозидфосфаты 130
1.10.2. Креатинфосфат 133
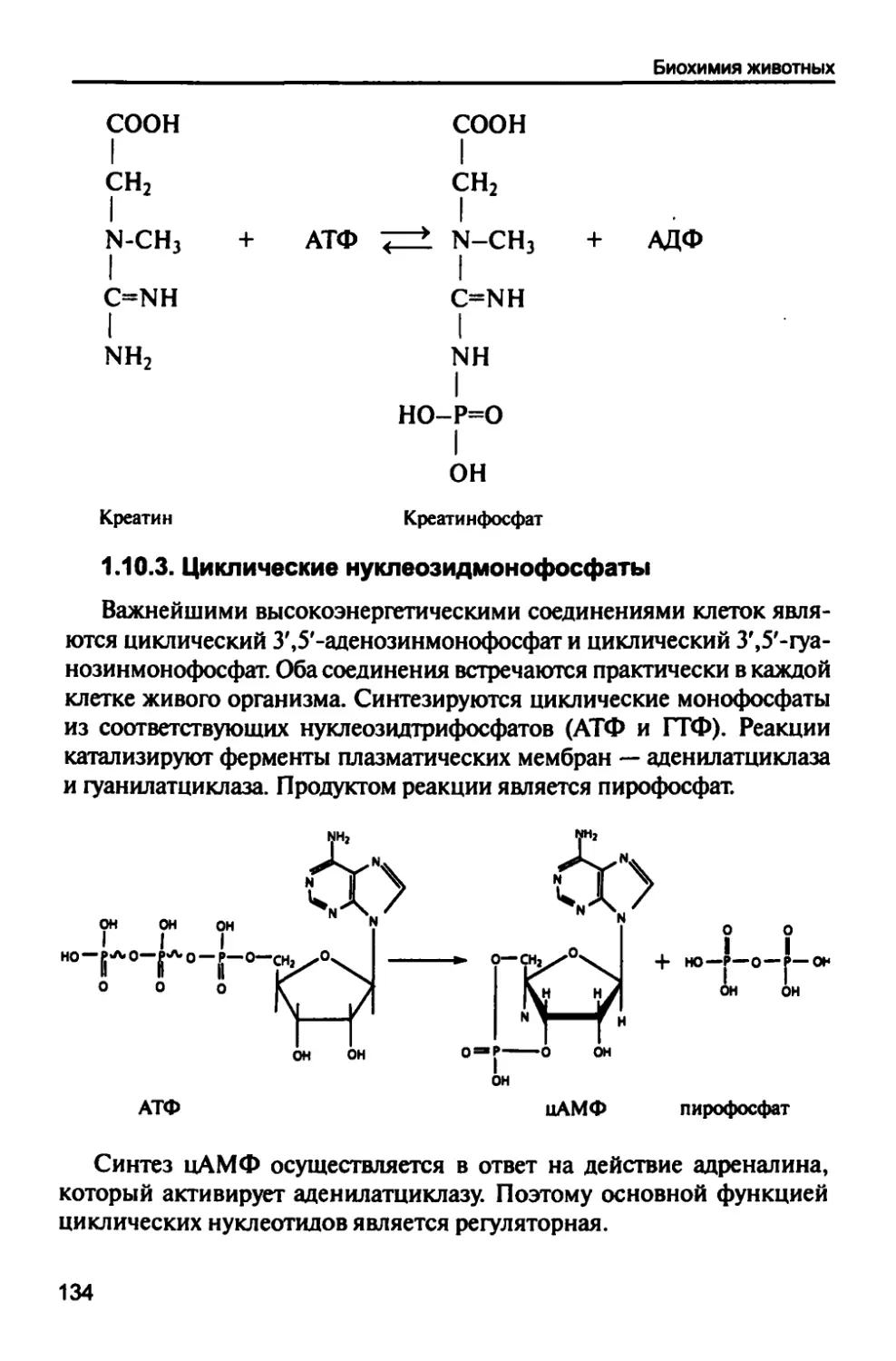
1.10.3. Циклические нуклеозидмонофосфаты 134
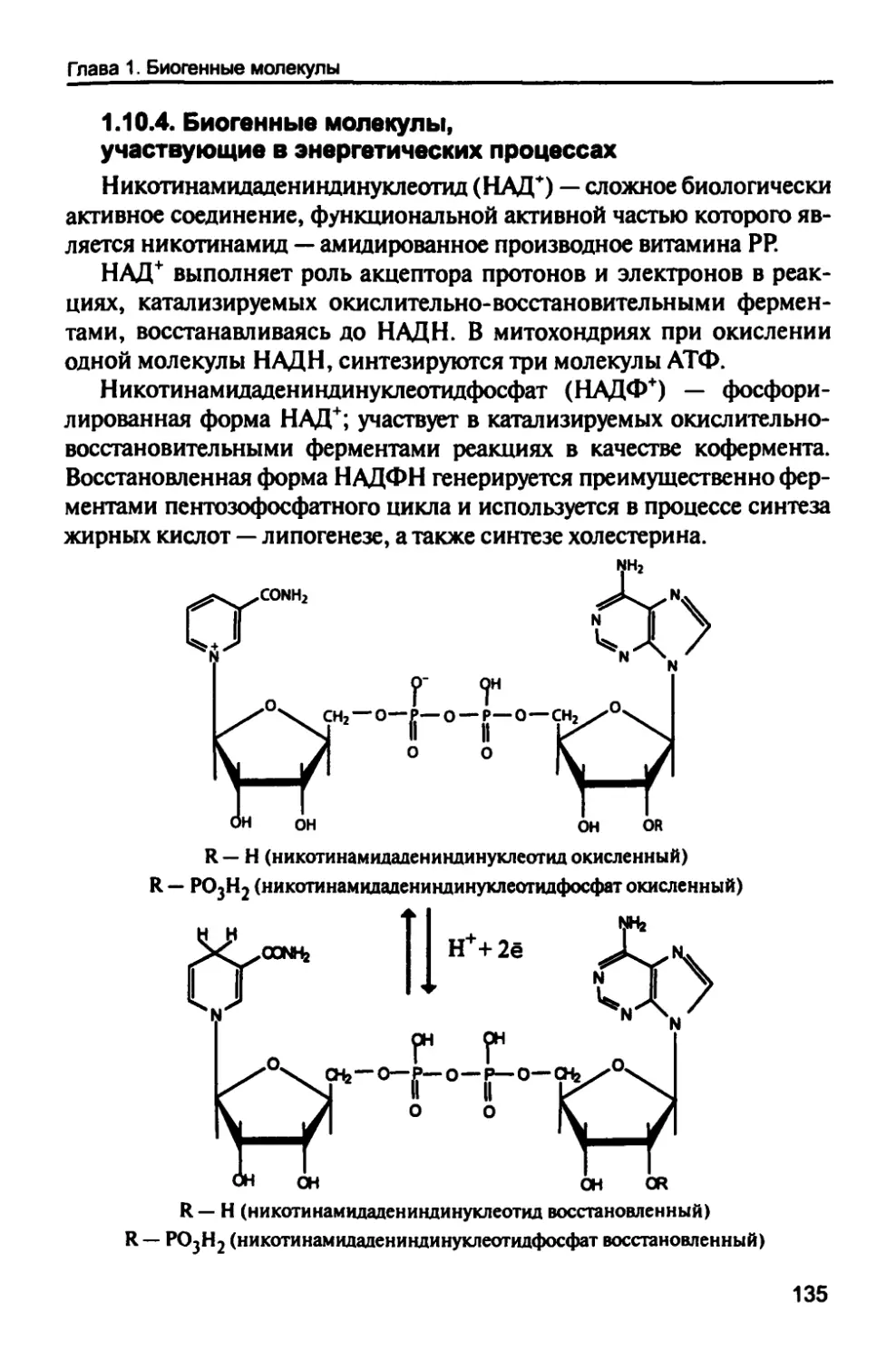
1.10.4. Биогенные молекулы, участвующие
в энергетических процессах 135
Пиша 2. Ферменты 140
2.1. Физико-химические свойства ферментов 140
2.2. Денатурация ферментов 144
2.3. Классификация и номенклатура ферментов 145
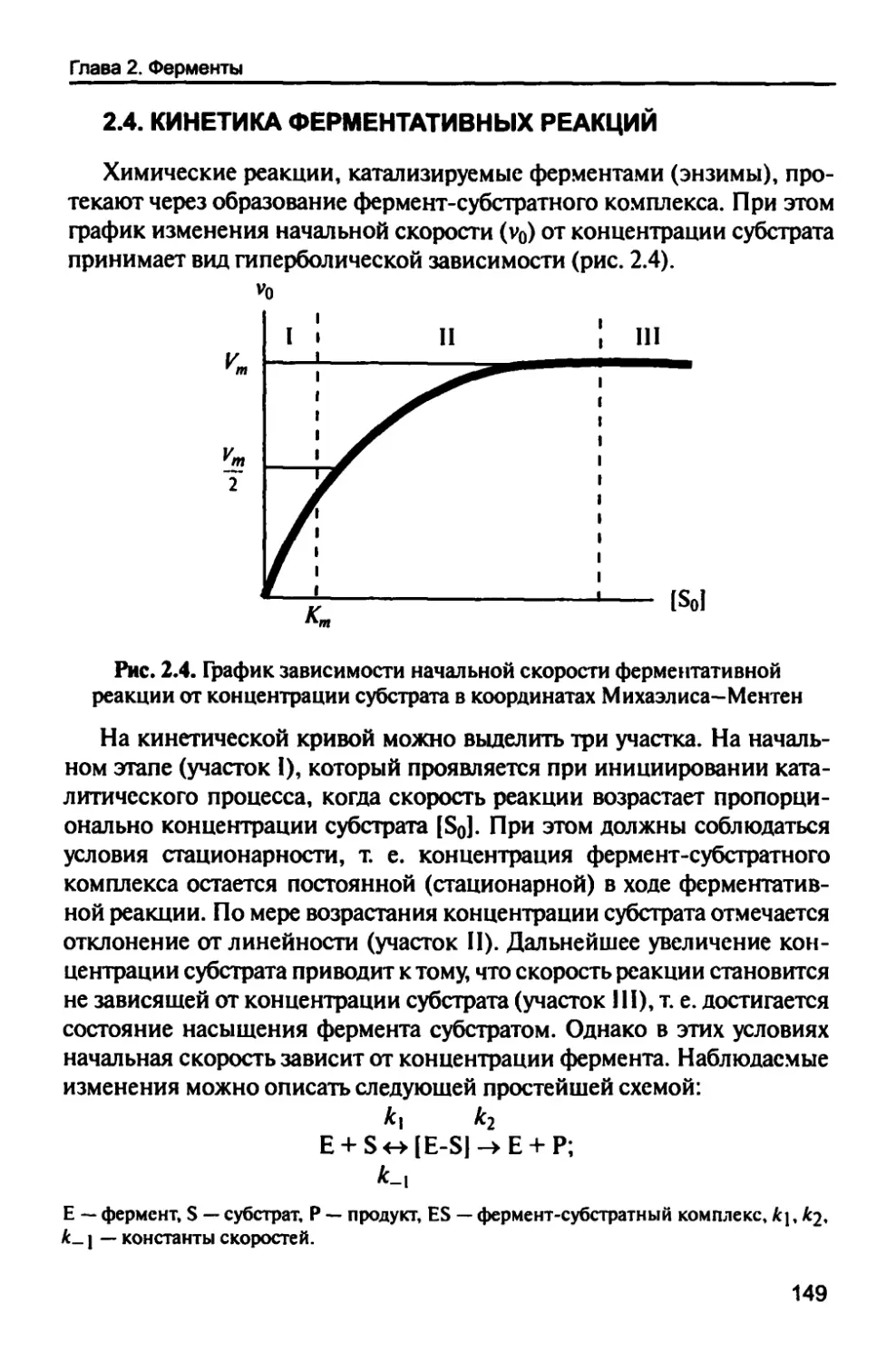
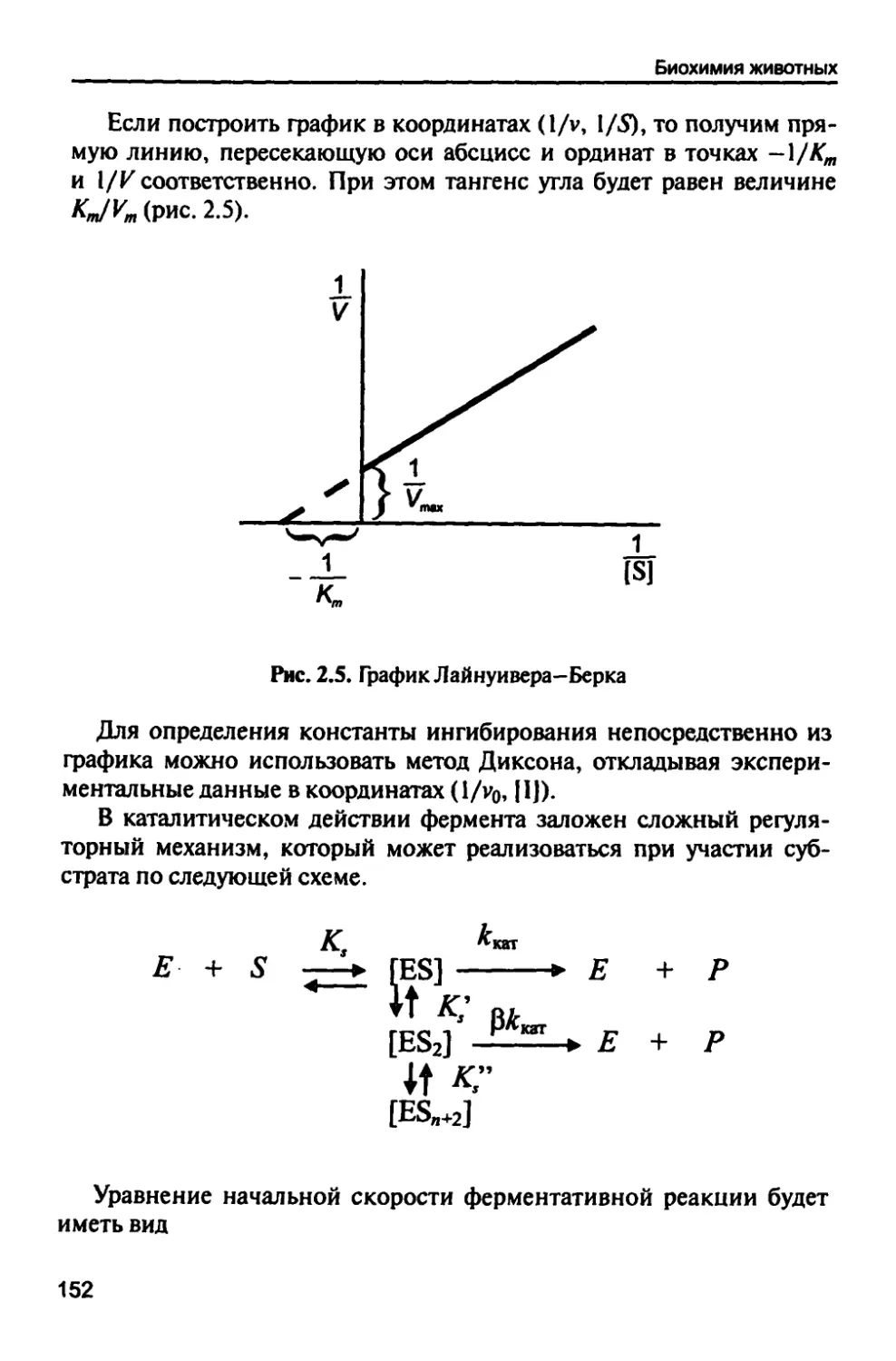
2.4. Кинетика ферментативных реакций 149
2.5. Регуляторное действие эффекторов
ферментативных реакций 153
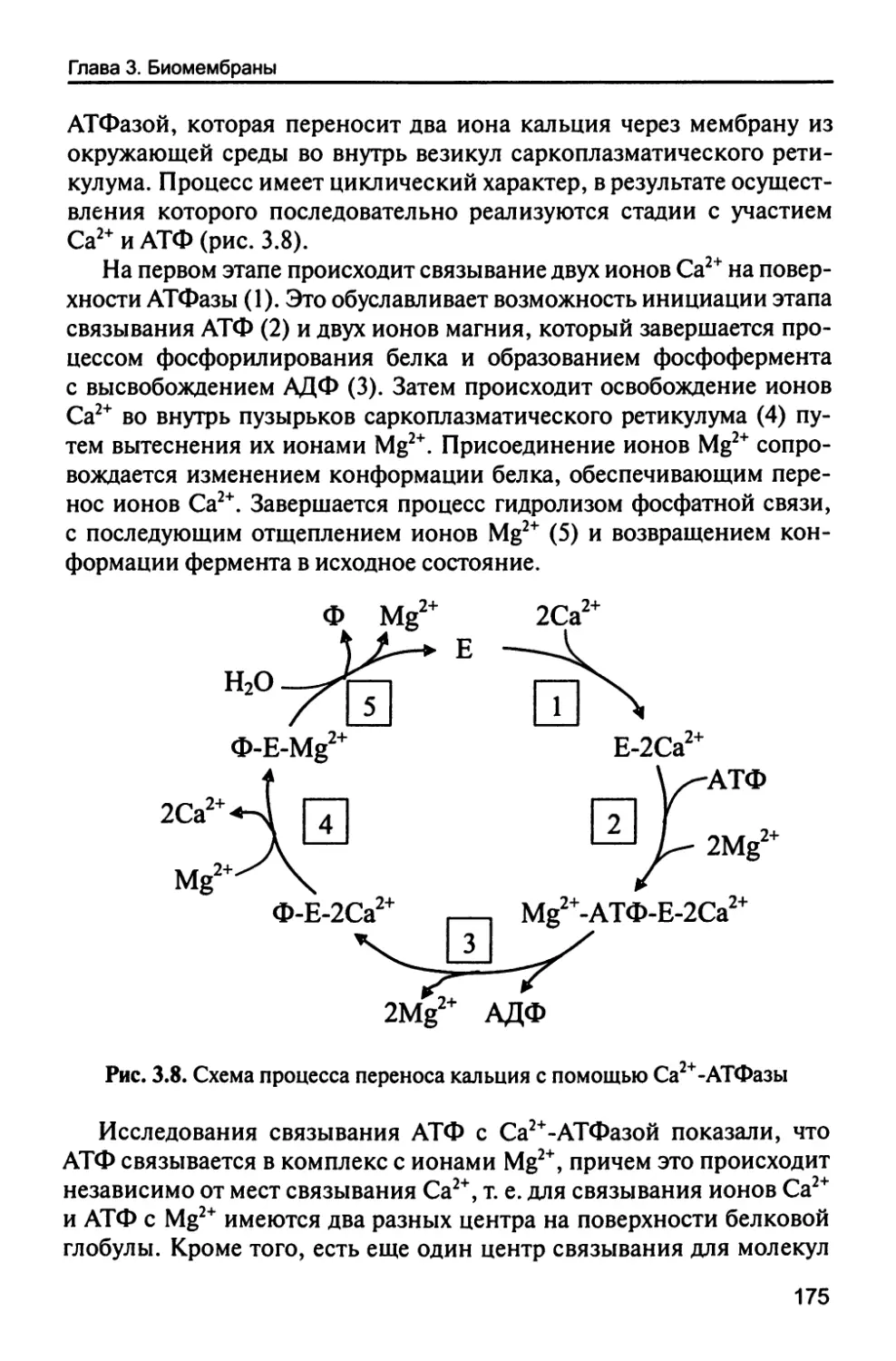
Глава 3. Биомембраны 159
3.1. Белково-липидные комплексы 159
3.2. Строение мембран 161
3.3. Транспортные системы 169
3.4. Вторичный активный транспорт 177
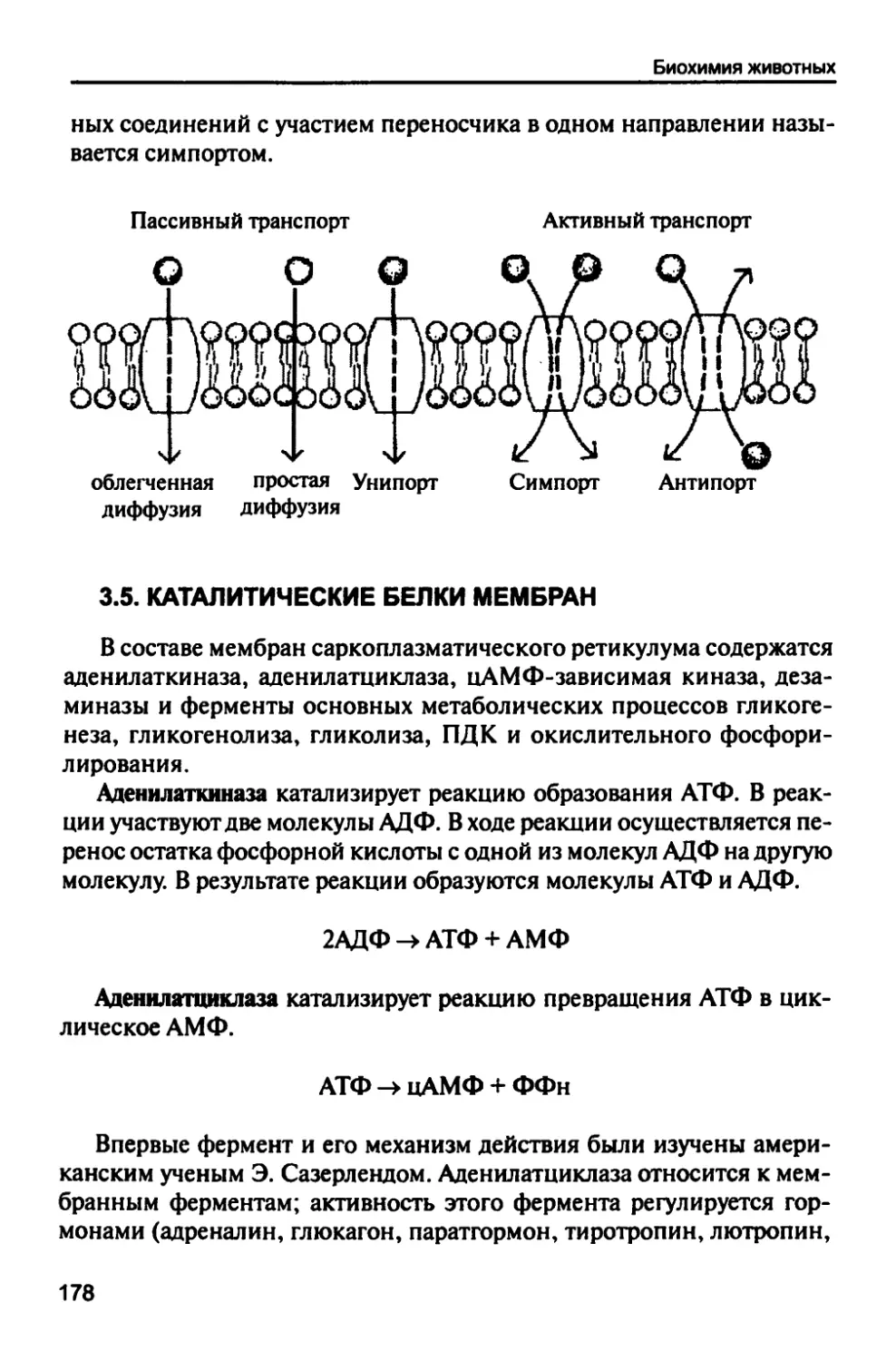
3.5. Каталитические белки мембран 178
3.6. Микросомальное окисление 179
1лава 4. Система управления живых организмов 183
4.1. Принципы структурной и функциональной
организации живых организмов 183
4.2. Основные принципы формирования биогенных
систем 185
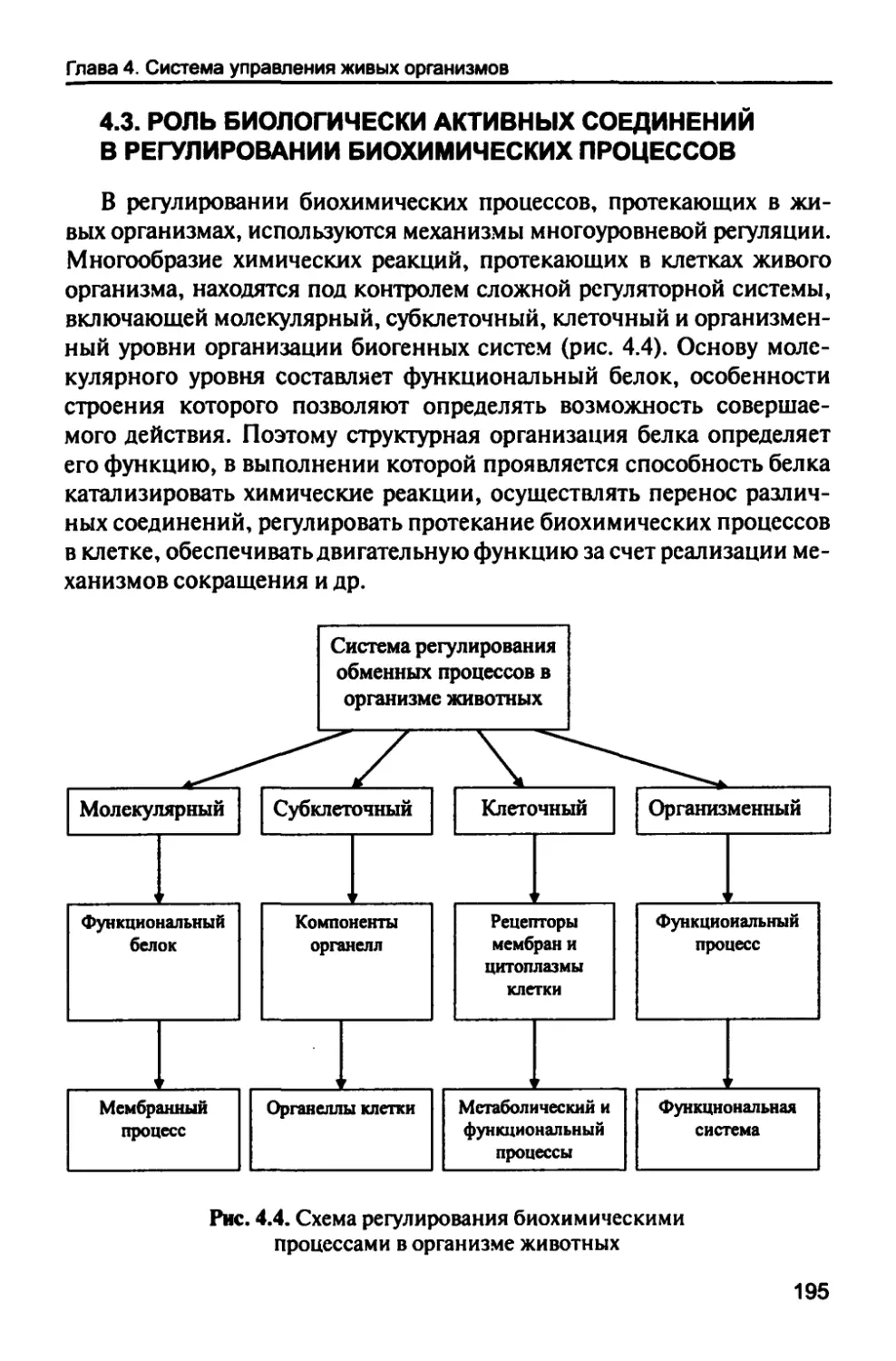
4.3. Роль биологически активных соединений
в регулировании биохимических процессов 195
4.4. Подвижные элементы ДНК 200
4.5. Альтернативный сплайсинг 201
4.6. РНК-переключатели 202
4.7. Обратная транскрипция 204
4.8. Нох-гены 204
4.9. Микро-РНК 205
Глава 5. Система регулирования живых организмов 207
5.1. Аденилатциклазная система 208
5.2. Гормоны гипоталамуса и гипофиза 211
5.3. Гормоны эпифиза 215
5.4. Гормоны щитовидной железы 215
5.5. Гормоны паращитовидной железы 217
5.6. Гормоны надпочечников 217
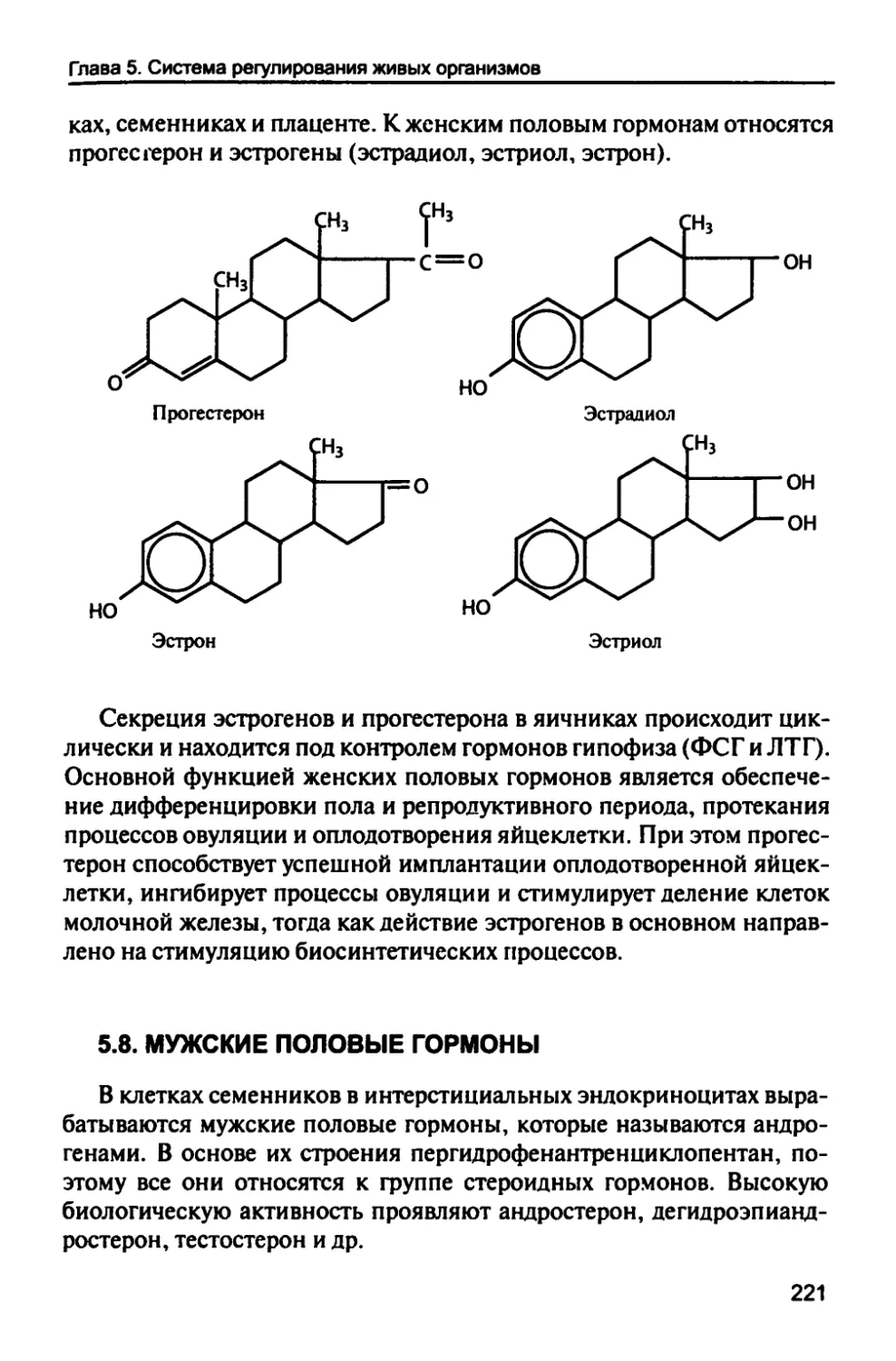
5.7. Женские половые гормоны 220
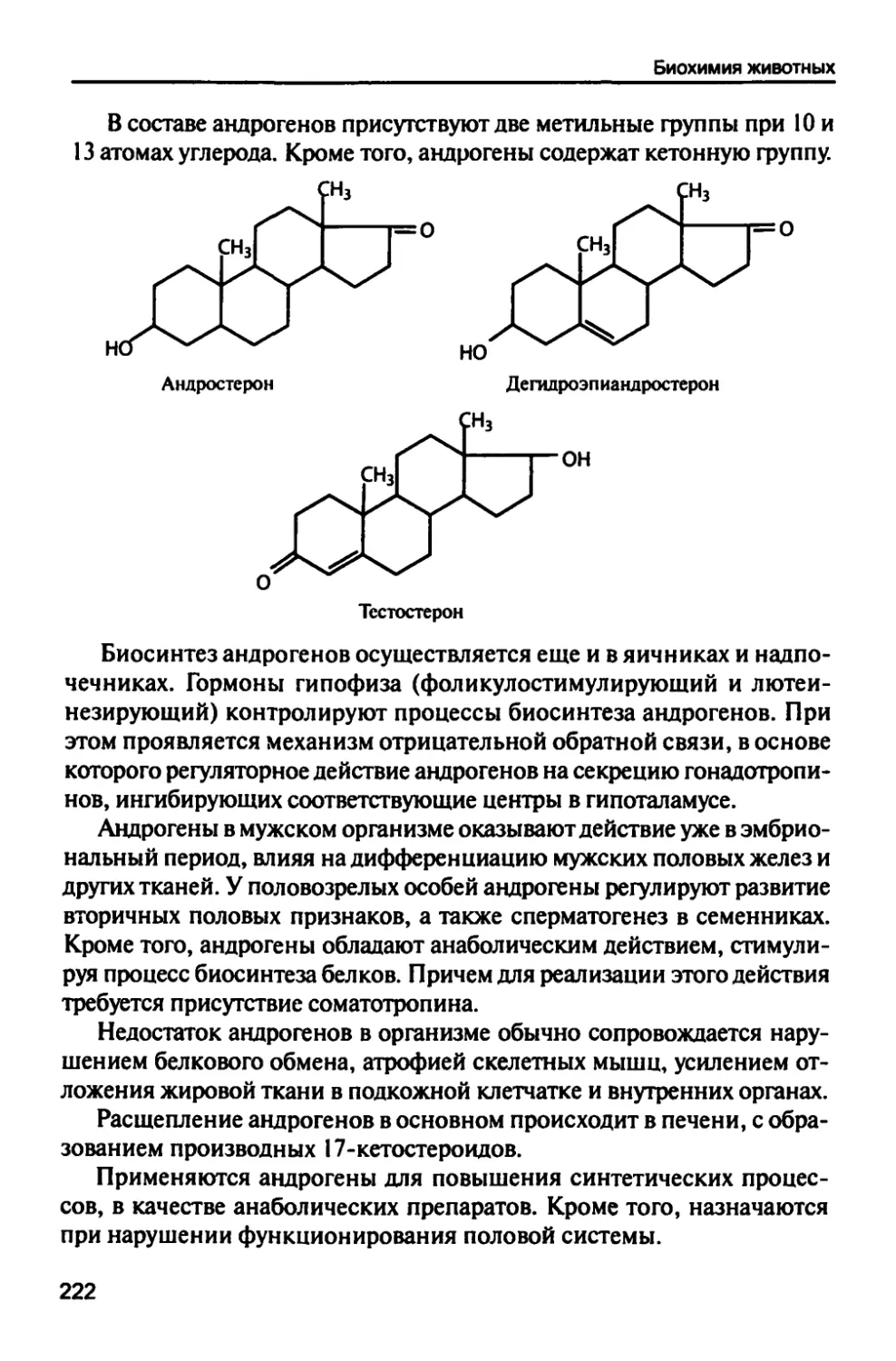
5.8. Мужские половые гормоны 221
5.9. Практическое использование гормонов
как стимуляторов обменных процессов 222
Глава б. Метаболические процессы 225
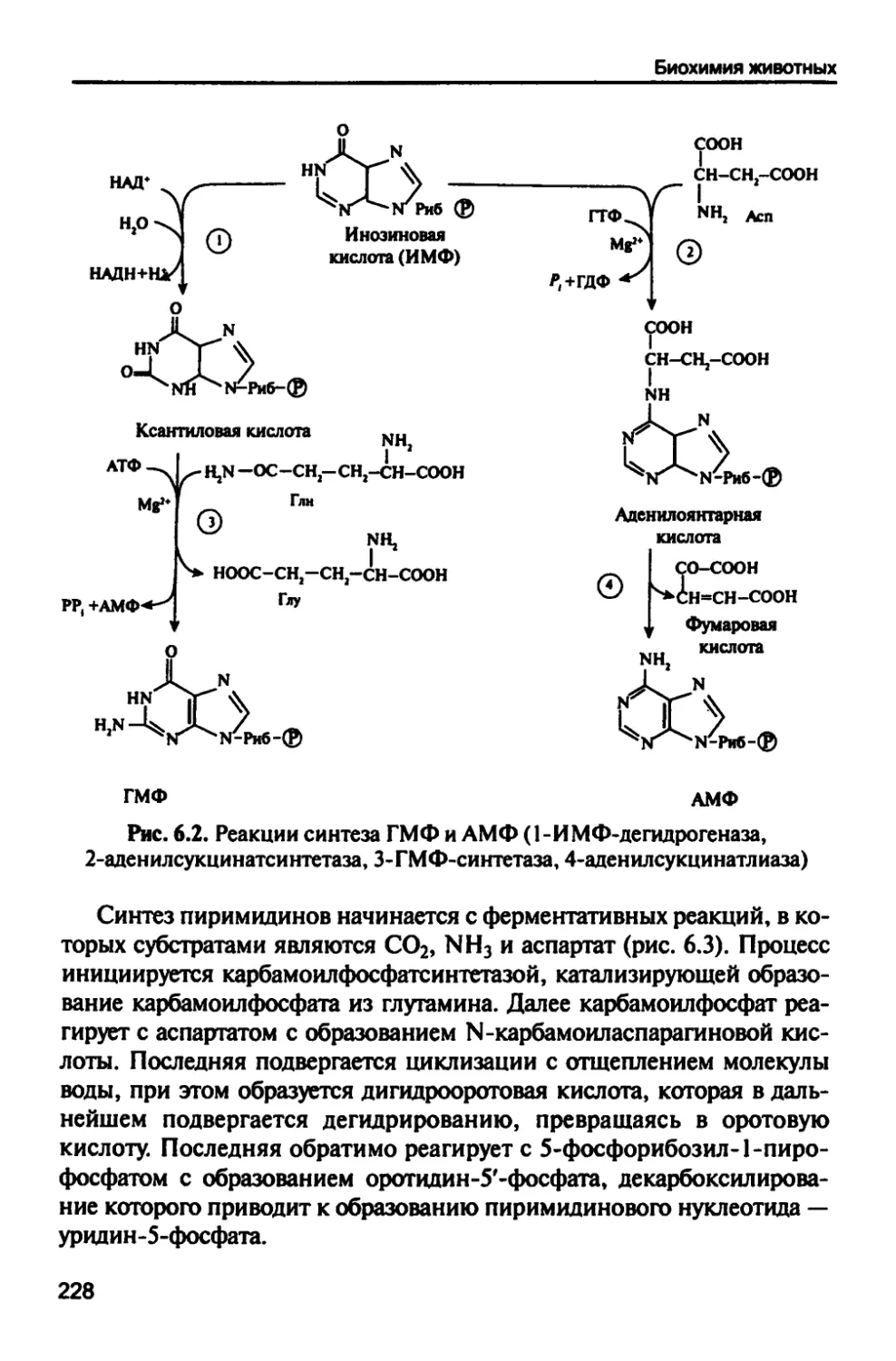
6.1. Метаболизм нуклеиновых кислот 225
6.1.1. Биосинтез пуриновых и пиримидиновых
нуклеотидов 225
6.1.2. Распад нуклеиновых кислот 230
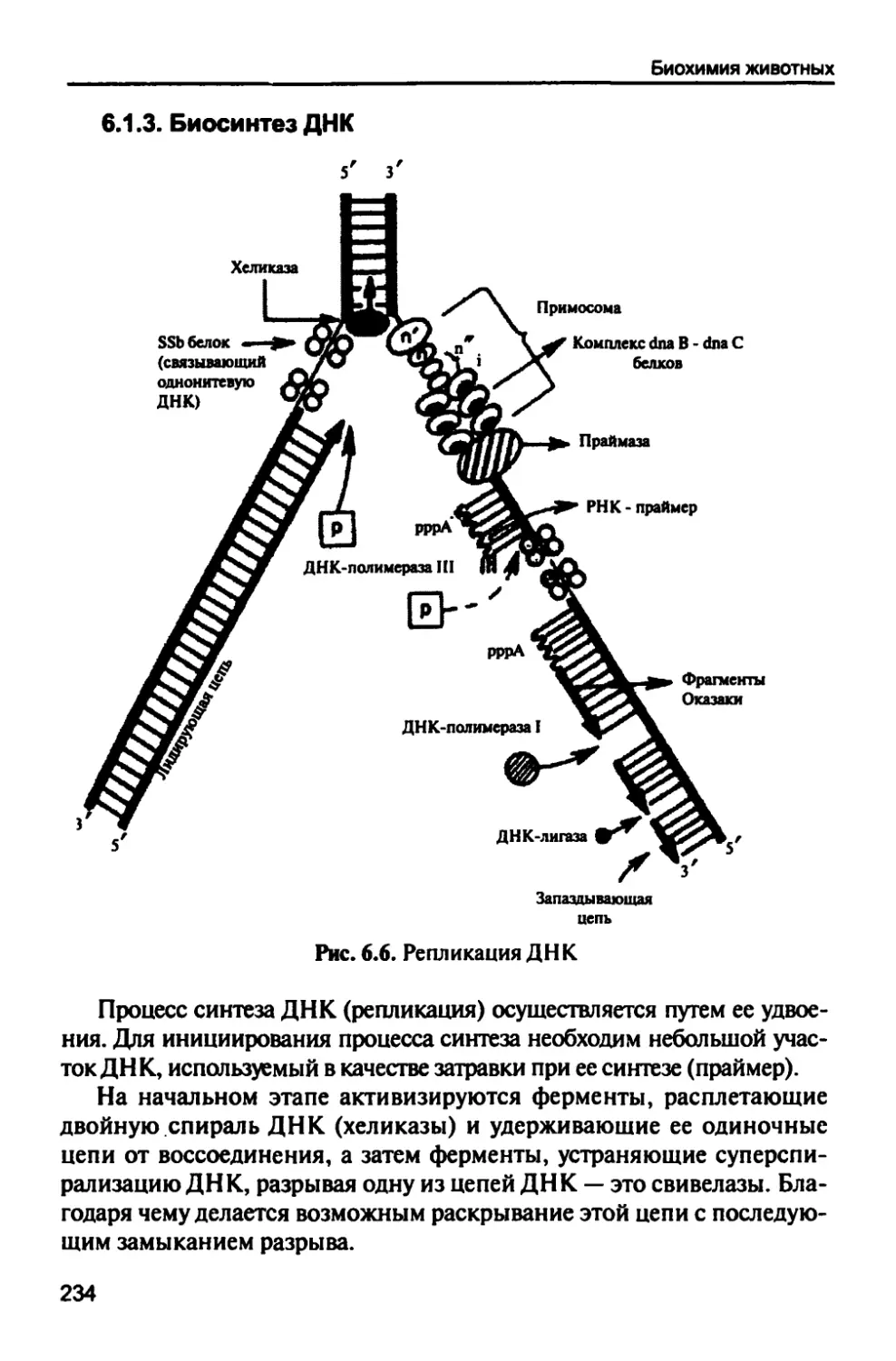
6.1.3. Биосинтез ДНК 234
6.1.4. Биосинтез РНК 235
6.1.5. Функции нуклеиновых кислот 237
6.2. Метаболизм белков 237
6.2.1. Биосинтез полипептидной цепочки белка
на рибосоме 237
6.2.2. Фолдинг 244
6.2.3. Протеолиз 246
6.2.4. Функции белков 247
6.3. Метаболизм аминокислот 248
6.3.1. Механизмы транспорта аминокислот
через мембраны 248
6.3.2. Участие аминокислот в реакциях транс-
и дезаминирования 250
6.3.3. Реакции восстановительного аминирования 254
6.3.4. Орнитиновый цикл 255
6.3.5. Функции аминокислот 257
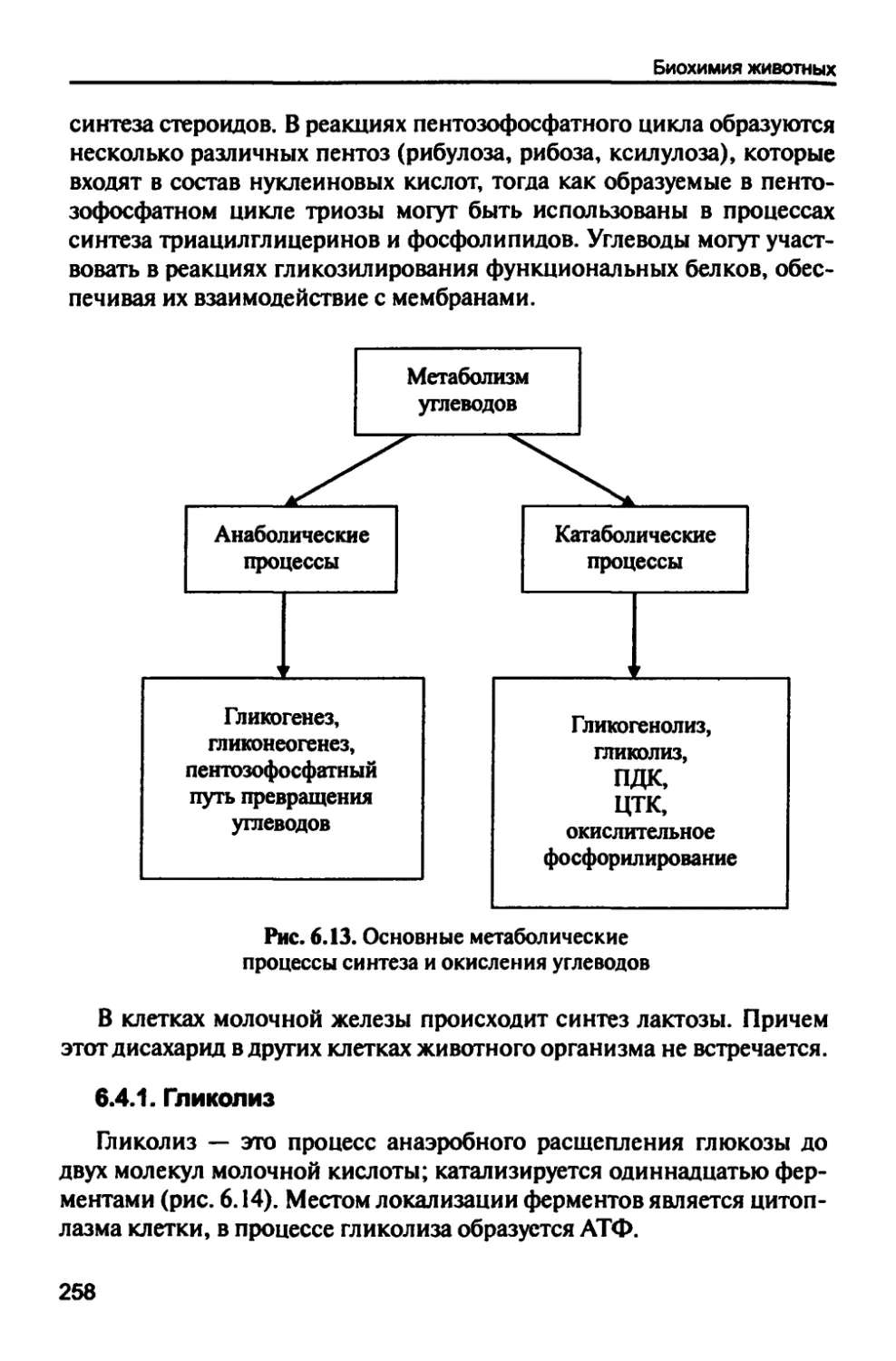
6.4. Метаболизм углеводов 257
6.4.1. Гликолиз 258
6.4.2. Синтез гликогена (гликогенез) 262
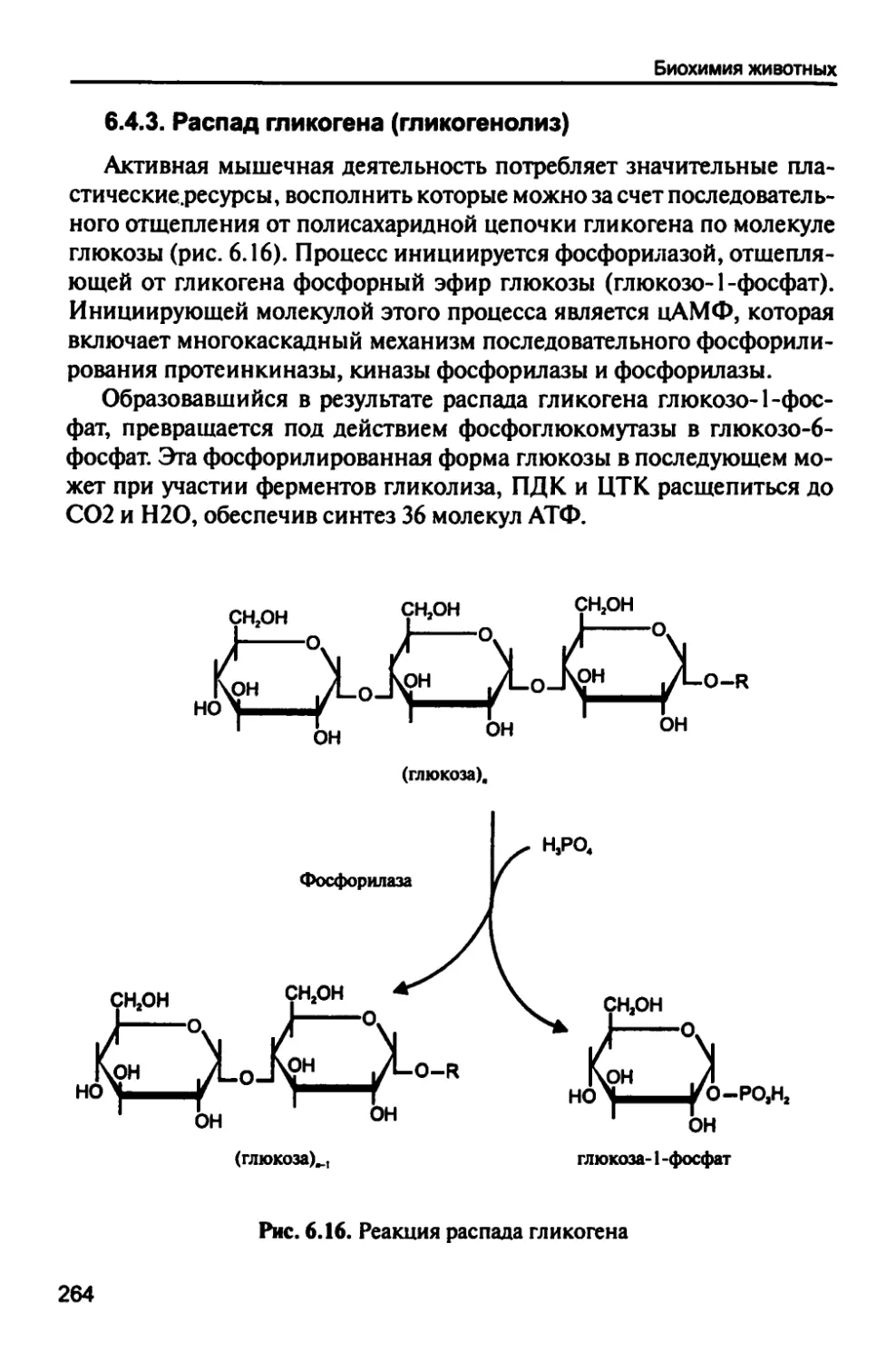
6.4.3. Распад гликогена (гликогенолиз) 264
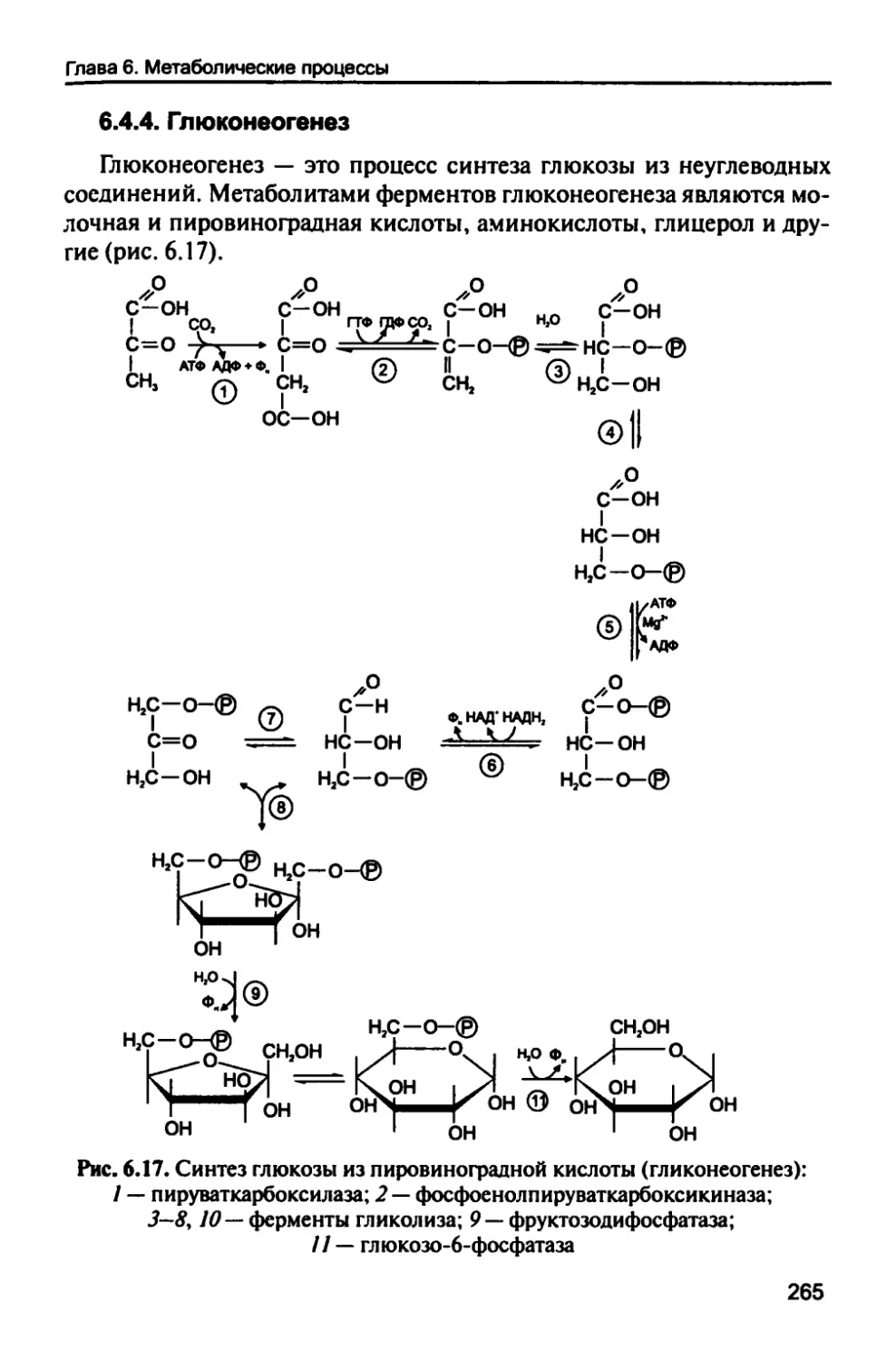
6.4.4. Глюконеогенез 265
6.4.5. Пентозофосфатный путь превращения углеводов 267
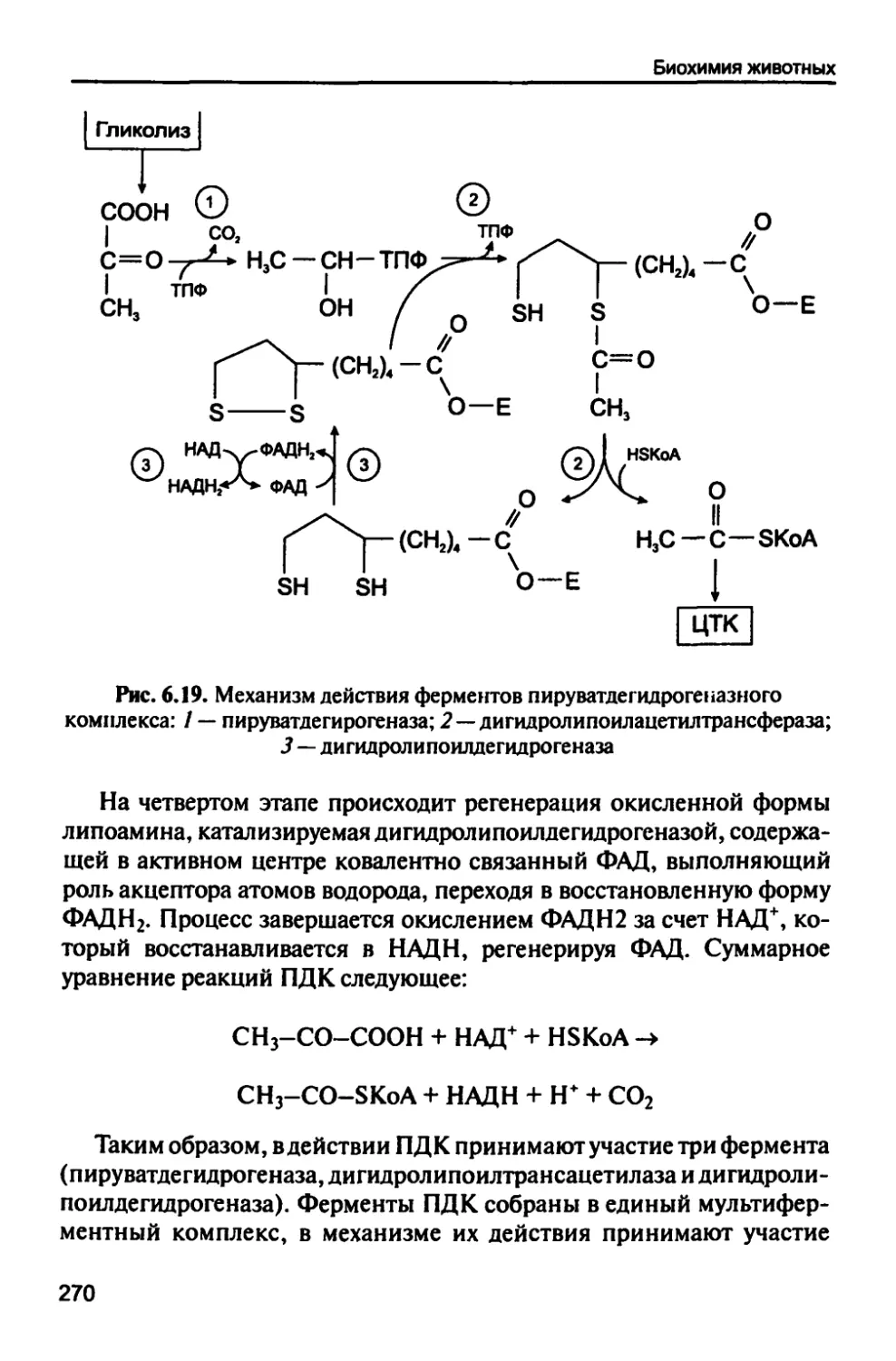
6.4.6. Пируватдегидрогеназный комплекс (ПДК) 269
6.4.7. Цикл трикарбоновых кислот 271
Оглавление
6.4.8. Окислительное фосфорилирование 274
6.4.9. Функции углеводов 278
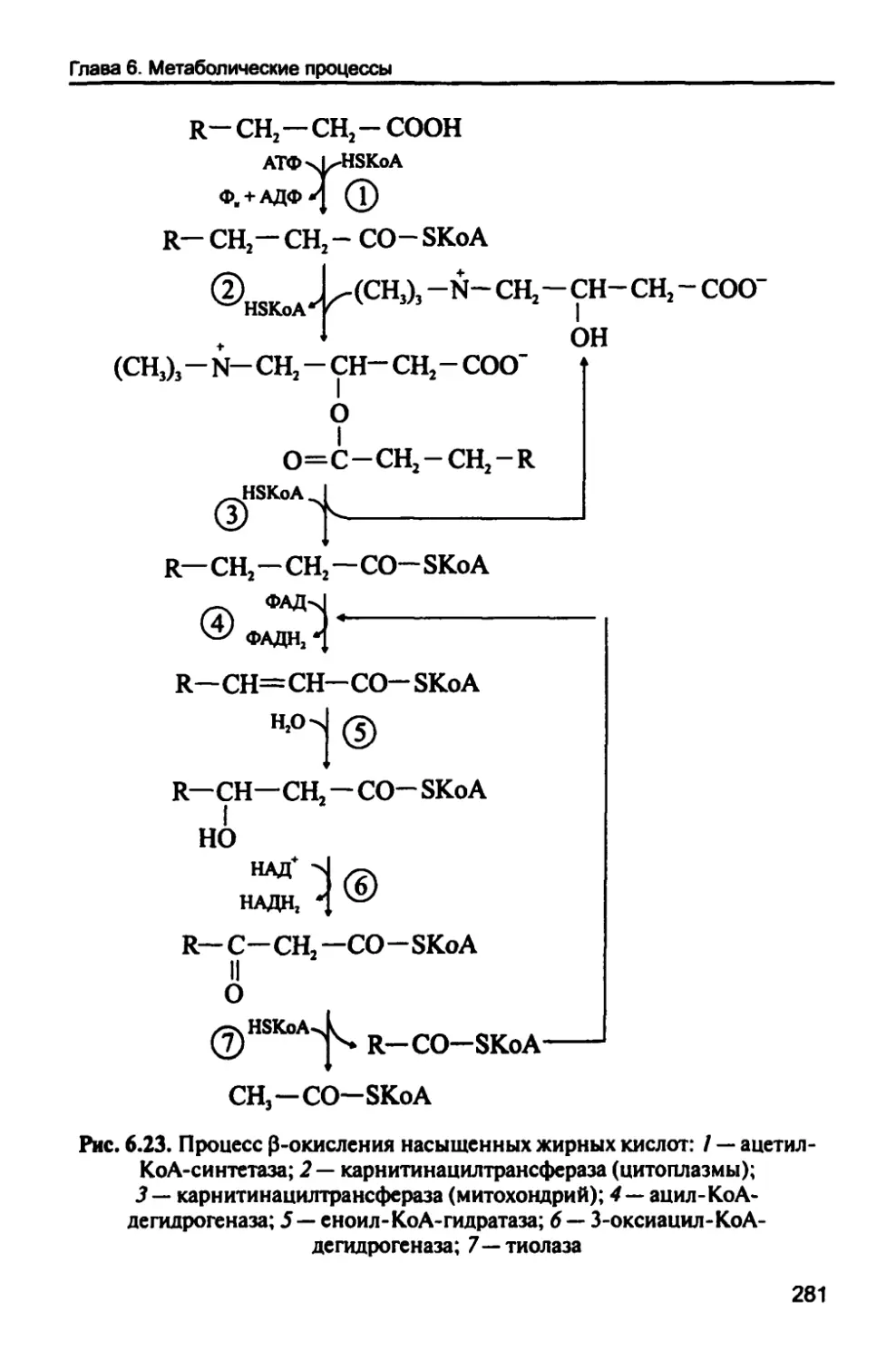
Метаболизм липидов 278
6.5.1. (З-Окисление насыщенных жирных кислот
(липолиз) 279
6.5.2. Синтез насыщенных жирных кислот (липогенез) 282
6.5.3. Синтез глицерина и нейтральных липидов 284
6.5.4. Биосинтез фосфолипидов 284
6.5.5. Биосинтез сфинголипидов 287
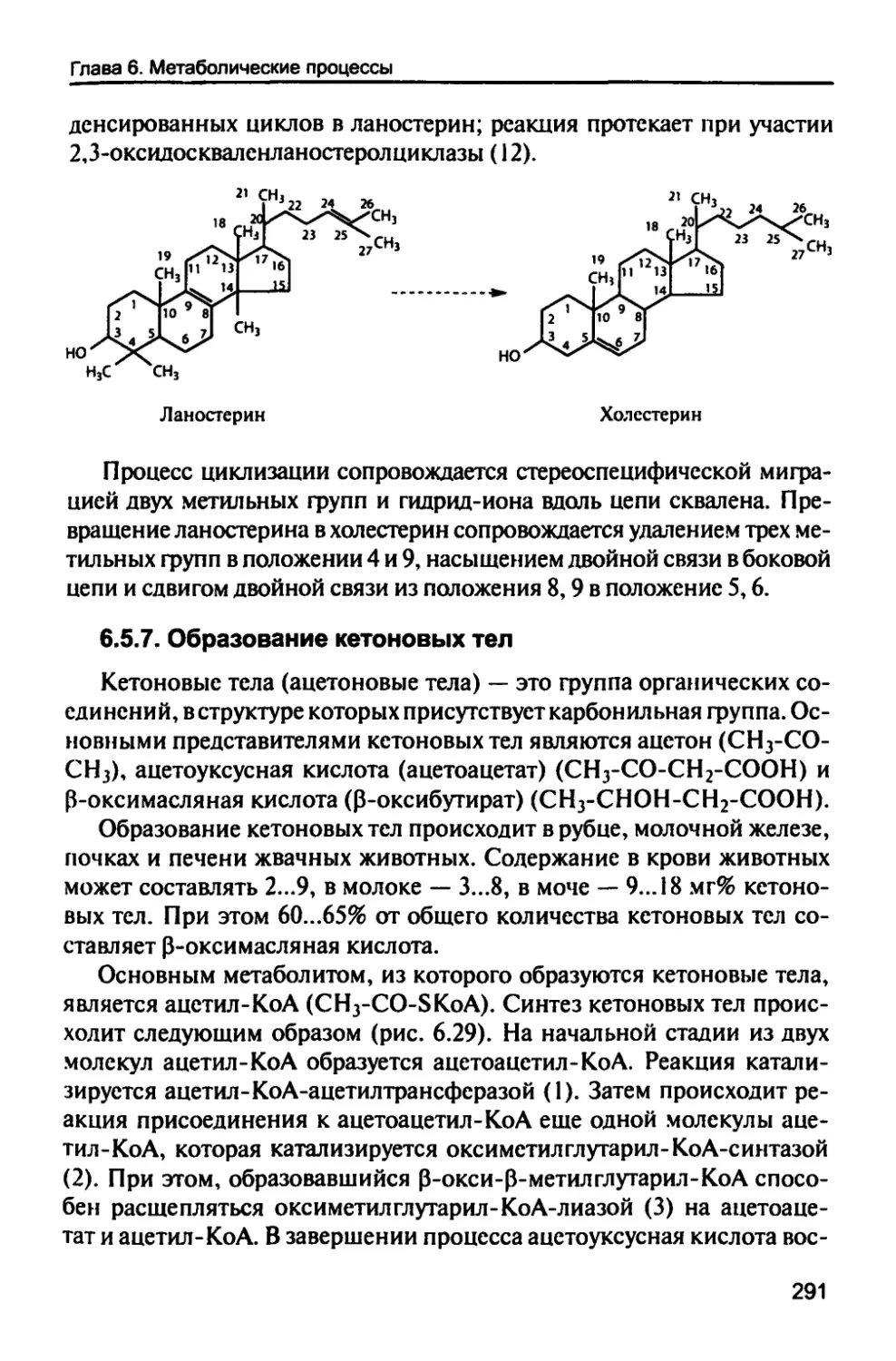
6.5.6. Биосинтез холестерина 289
6.5.7. Образование кетоновых тел 291
6.5.8. Функции липидов 293
Антиоксидантная система 294
6.6.1. Антиоксиданты 295
6.6.2. Перекисное окисление липидов 304
6.6.3. Автоокисление 308
6.6.4. Возможности использования антиоксидантов
в животноводстве 310
6.6.5. Некроз и апоптоз 313
Функциональные системы 323
Кровь 323
7.1.1. Химический состав крови 323
7.1.2. Форменные элементы крови 341
7.1.3. Лимфа 354
7.1.4. Система свертывания крови 354
7.1.5. Система фибринолиза 361
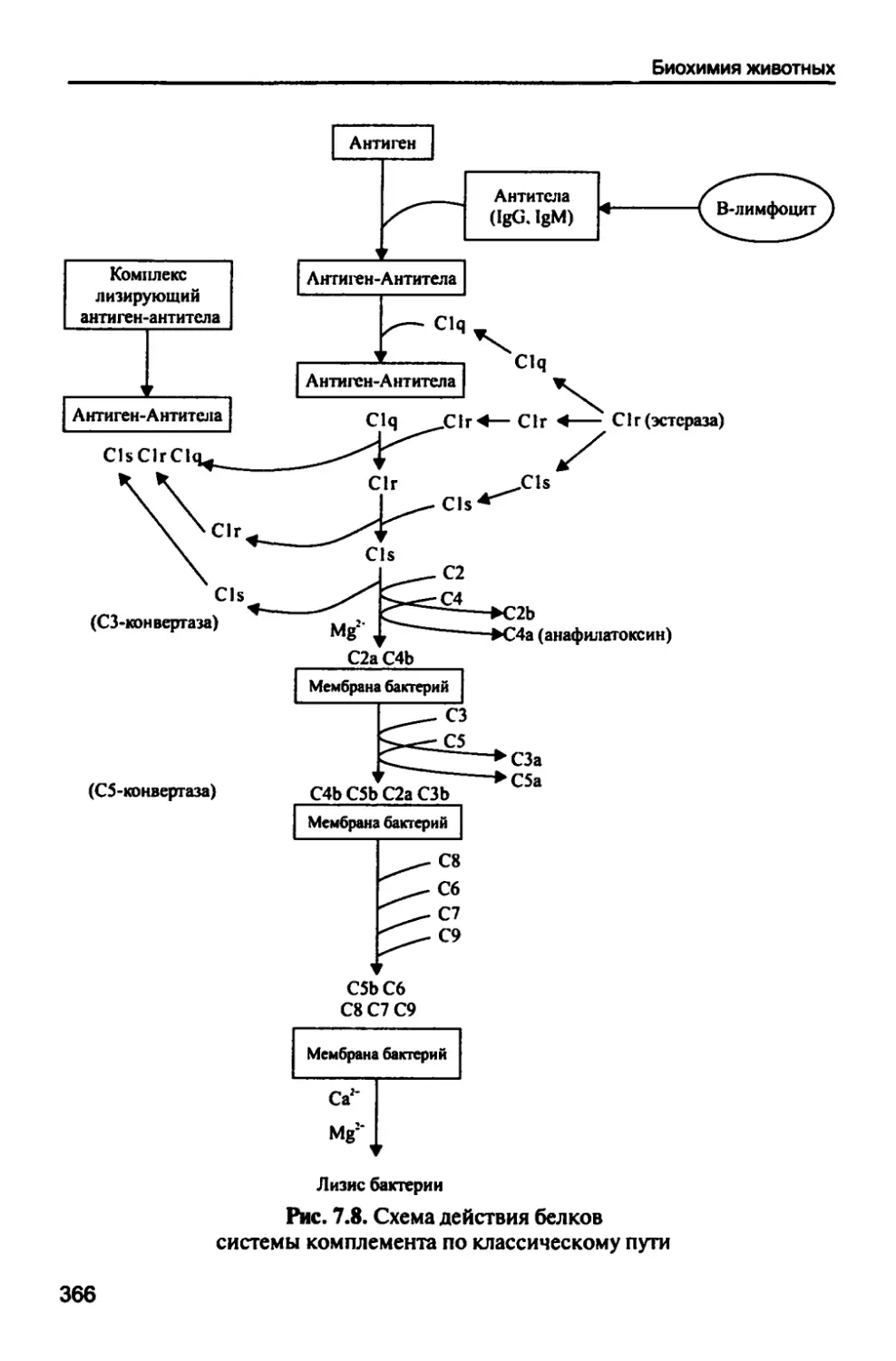
7.1.6. Система комплемента 364
7.1.7. Функции крови 372
7.1.8. Селезенка 374
Костная система 374
7.2.1. Соединительная ткань 376
7.2.2. Костная ткань 385
Нервная система 390
7.3.1. Химический состав нервной ткани 393
7.3.2. Метаболические процессы 397
Сенсорные системы 405
7.4.1. Система зрения 405
7.4.2. Молекулярные механизмы зрения 409
Мышечные ткани 410
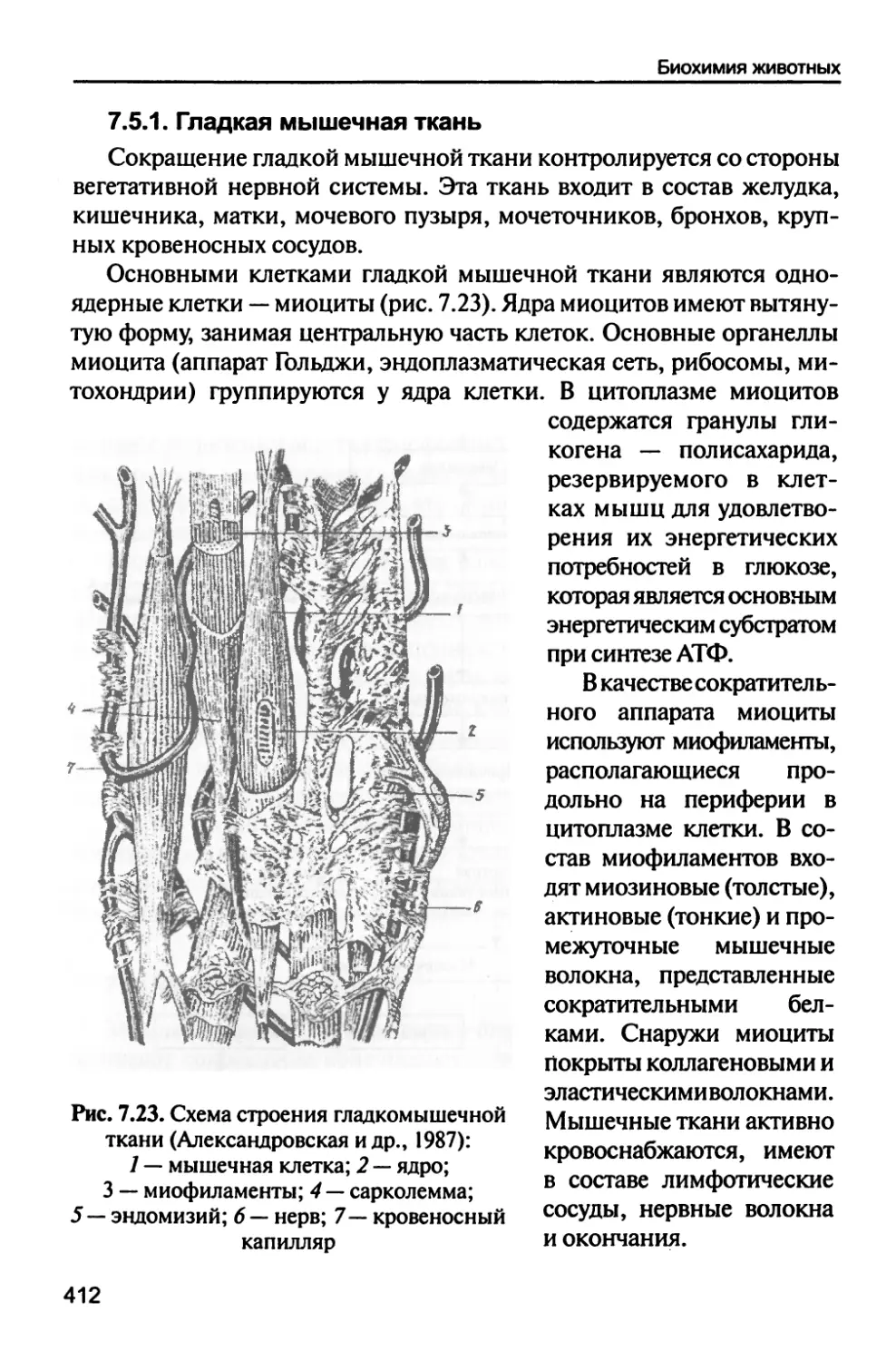
7.5.1. Гладкая мышечная ткань 412
7.5.2. Поперечнополосатая мышечная ткань 413
Оглавление
7.5.3. Химический состав мышечной ткани 415
7.5.4. Биохимические механизмы сокращения мыши 429
7.5.5. Механизмы послеубойного окоченения 434
7.6. Дыхательная система 435
7.6.1. Легкие 435
7.6.2. Биохимические механизмы газообмена 441
7.7. Пищеварительная система 444
7.7.1. Биохимические процессы в ротовой полости 444
7.7.2. Биохимические процессы в преджелудках
жвачных животных 445
7.7.3. Биохимические процессы в желудке
моногастрических и в сычуге жвачных животных 447
7.7.4. Биохимические процессы в печени 451
7.7.5. Химический состав желчи 461
7.7.6. Поджелудочная железа 466
7.7.7. Биохимические процессы
в тонком отделе кишечника 467
7.7.8. Биохимические процессы
в толстом отделе кишечника 474
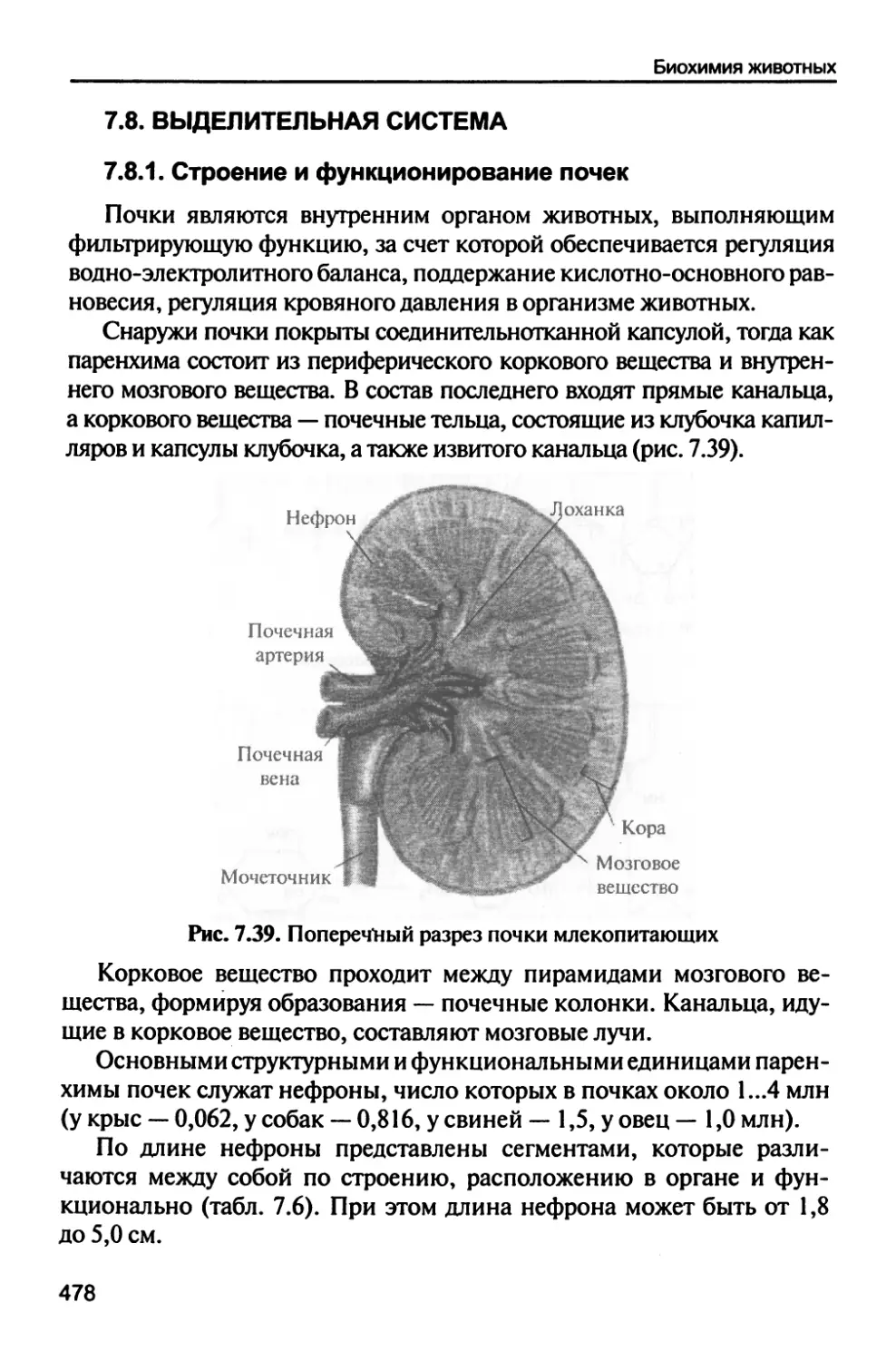
7.8. Выделительная система 478
7.8.1. Строение и функционирование почек 478
7.8.2. Механизм образования мочи 485
7.8.3. Химический состав мочи 488
7.8.4. Функции почек 490
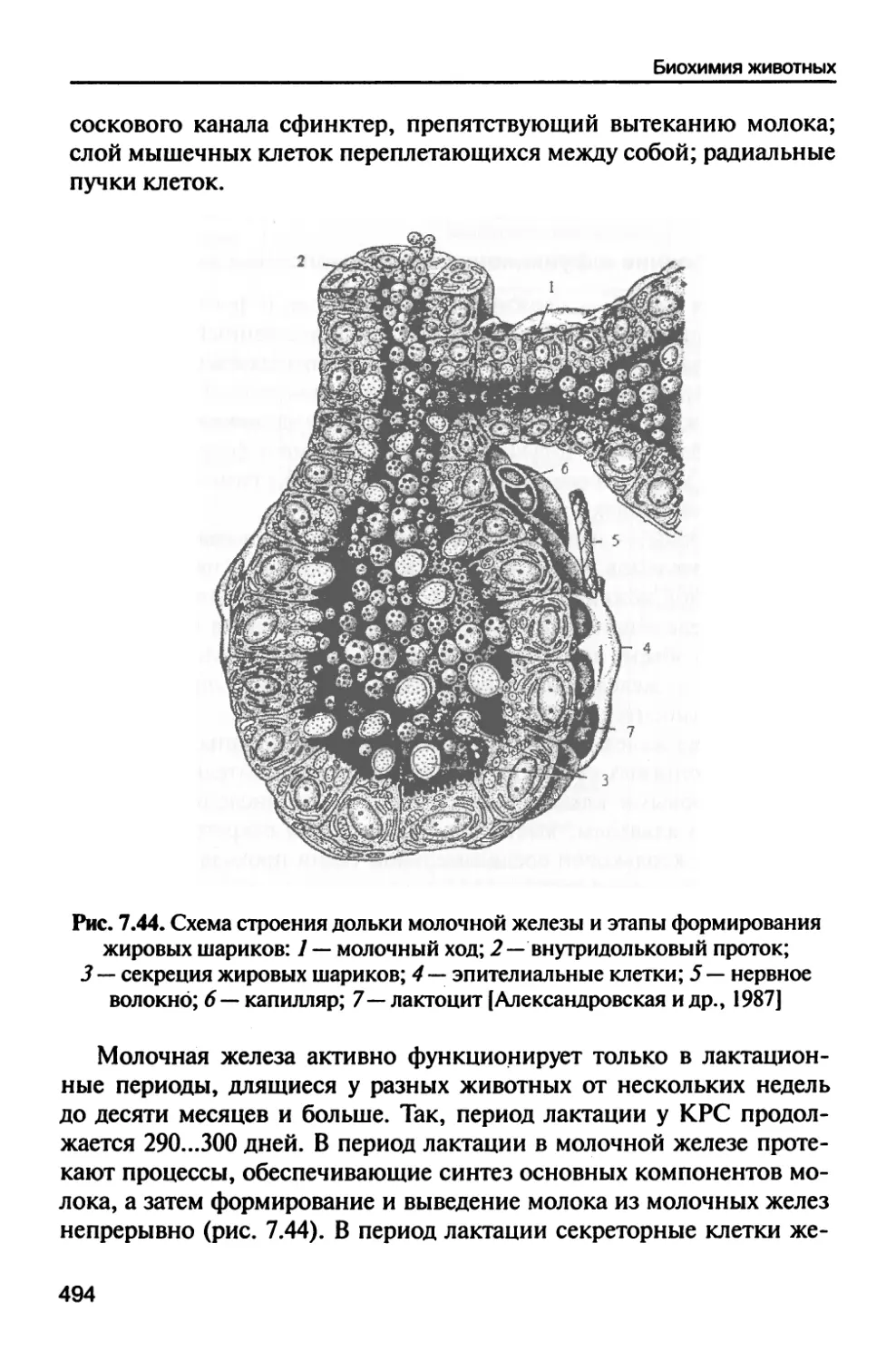
7.9. Система молочной продуктивности 490
7.9.1. Строение и функционирование
молочной железы 493
7.9.2. Химический состав молока 495
7.9.3. Действие гормонов на процесс
молокообразования 509
Словарь терминов 514
Использованная литература 550
7
ПРИНЯТЫЕ СОКРАЩЕНИЯ
АДГ — алкогольдегидрогеназа.
АКТГ — адренокортикотролный гормон.
АльЛГ — альдегиддегидрогеназа.
АМФ — аденозин монофосфат.
АсТ — аспартаттрансаминаза.
ГАМ К — у-аминомасляная кислота.
ГГТ — у-глутамилтрансфераза.
15-ГПЭТЕ — 15-гидроперокси-6,8,10,14-эЙкозатетраеновая кислота
15-ГЭТЕ — 15-гидрокси-6,8,10,14-эйкозатетраеновая кислота
ДНК — дезоксирибонуклеиновая кислота.
ИМФ — инозин монофосфат.
ИУК — индолил-3-уксусная кислота.
КФ — классификация ферментов.
КРС — крупный рогатый скот.
ЛТГ — лютеинизирующий гормон (лютропин).
ЛД Г — лактатдегидрогеназа.
ПДК — пируватдегидрогеназный комплекс.
ПДКа — пируватдекарбоксилаза.
ПО — пероксидаза.
ПОЛ — перскисное окисление липидов.
ПЦР — полимеразная цепная реакция.
ПФП — пентозофосфатный путь.
ПФПОУ — пентозофосфатный путь окисления углеводов.
РНК — рибонуклеиновая кислота.
СОД — супероксиддисмутаза.
СДГ — сукцинатдегидрогеназа.
СТГ — соматотропный гормон.
ТТГ — тиреотропный гормон.
Фн — фосфорная кислота (Н3РО4).
ФФн — пирофосфорная кислота (Н4Р2О7).
ФСГ — фолликулостимулирующий гормон (фоллитропин).
цАМФ — циклический аденозинмонофосфат.
ЦГМФ — циклический гуанозинмонофосфат.
ЦНС — центральная нервная система.
ЦТК — цикл трикарбоновых кислот.
'Ог — синглетный кислород.
02~ — супероксидный анион-радикал.
Н02~ — гидроперекисный радикал.
ОН" — гидроксильный радикал.
КО" — алкоксильный радикал.
Я02~ — перекисный радикал.
Тп — тролонин.
ТпТ — тролонин Т (тропом иозинсвязываюшая
субъединица тропой и на).
Тп! —тролонин I (ингибируюшая субъединицатропонина).
ТпС — тропой и н С (кальцийсвязывающая субъединица тропонина).
Тт — тропомиозин.
8
ВВЕДЕНИЕ
Биохимия — это наука, изучающая строение, метаболизм и
функционирование биогенных молекул. В настоящее время биохимия
бурно развивается и результатом этого является появление новых
направлений, таких как энзимология, иммунология, молекулярная
биология, генная инженерия, биотехнология и др.
Изучение биохимии позволяет студенту приобрести знания по
динамике различных метаболических процессов, участии в них
ферментов, кроме того, узнать закономерности регулирования
метаболических процессов, установить их взаимную зависимость.
Обусловленность общего происхождения всех эукариотических
клеток позволяет рассматривать взаимосвязь между живыми
организмами, в основе строения которых имеются одинаковые
низкомолекулярные биогенные молекулы. Единообразие в построении и
функционировании организмов позволяет формировать пути передачи
информации через сопряженную систему ДНК->РНК^белок.
Наличие единства в передаче информации дает возможность
рассматривать все многообразие живых организмов как общую
информационную базу, которая не только суммирует размер информации, но и
качественно индивидуализируется в каждом организме.
В целом, химические реакции управляются упорядоченными
клеточными структурами, в которых основным действующим элементом
является функциональный белок. Информация о всех белках клетки
хранится в ДНК, элементарной единицей которой служит ген. Через
управление деятельностью генного аппарата клетки осуществляется
избирательный синтез белков, от действия которых зависит
функционирование клетки и организма животного в целом. Упорядоченность
метаболических процессов осуществляется за счет внешнего
потребления энергетических и пластических ресурсов. Основными
источниками энергии являются углеводы и липиды, окисление которых
позволяет производить последовательное резервирование энергии в виде
специализированных биогенных энергозапасающих молекул (АТФ,
9
Биохимия животных
ГТФ, УТФ, креатинфосфат, цАМФ и др.). Содержание этих молекул и
будет определять активность и жизнеспособность живого организма,
а также возможности его противодействия неблагоприятным
факторам среды.
Знания, полученные при изучении биохимии, помогут студентам
освоить такие предметы, как физиология, фармакология,
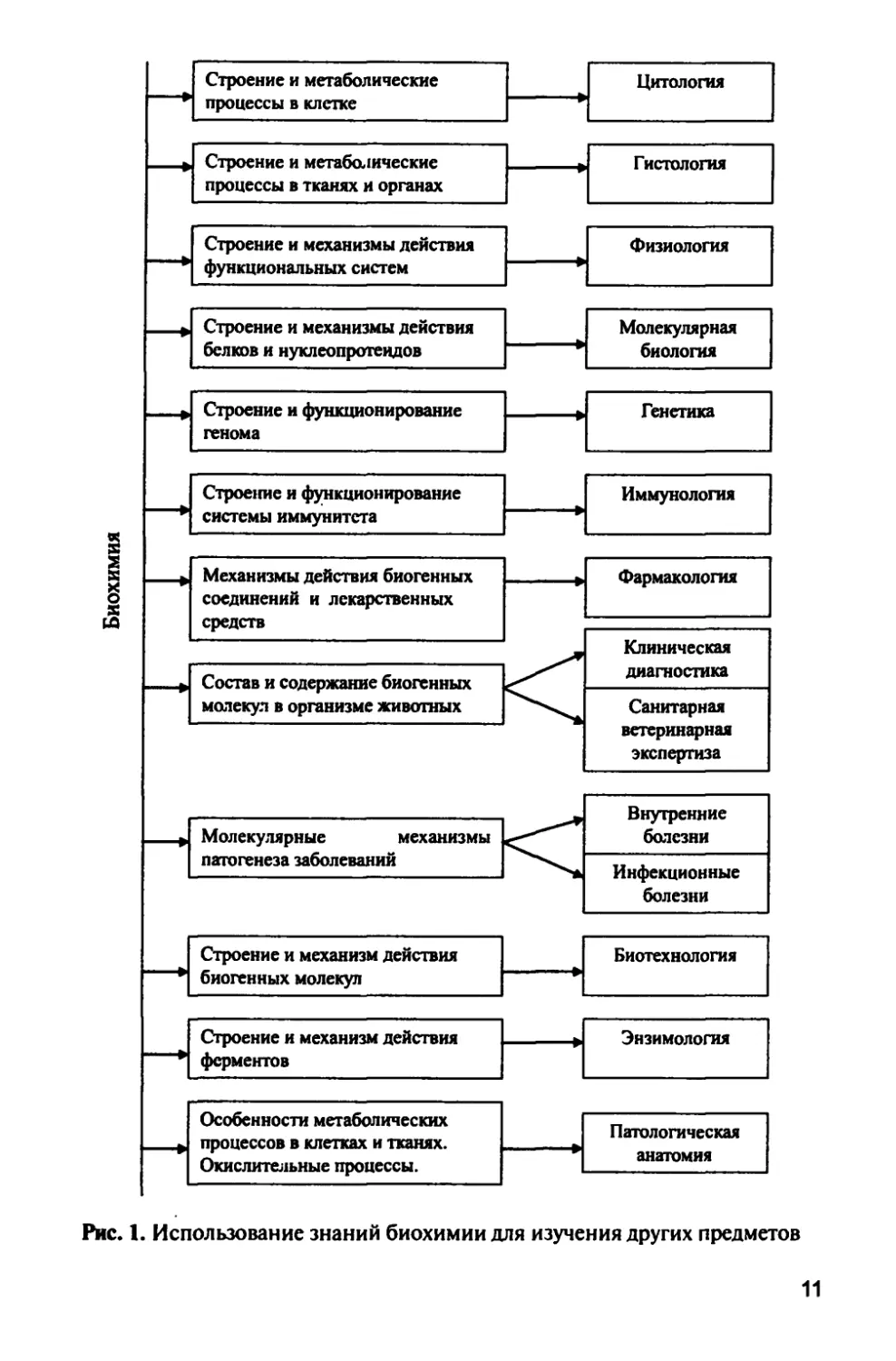
клиническая диагностика и др. (рис. 1).
Овладевая знаниями по биохимии, студенты формируют
представления о молекулярных механизмах патогенеза заболеваний, в
частности, развитии окислительного стресса, являющегося фактором
воспалительного процесса.
Достижения в области исследования генома позволяют выявить
детерминированность в развитии некоторых заболеваний.
Нарушения слаженности работы генного аппарата (механизмы
репликации, транскрипции, трансляции и др.) клетки приводят к
возникновению заболеваний. При этом инициаторами
воспалительного процесса являются первичные нарушения, происходящие на
молекулярном уровне и связанные с нарушением
функционирования белков.
Современные методы диагностики основываются на оценке
биохимических показателей, которые не только позволяют определить
локализацию патологического процесса и его интенсивность, но и
понять молекулярные механизмы процесса и уже на основании этих
данных правильно назначить лечение и осуществлять контроль за
протеканием воспалительного процесса.
Изучение биохимии необходимо будущему врачу для получения
знаний по обмену веществ в живых организмах в норме и патологии,
которые можно будет использовать для понимания действия
различных лекарственных средств и их превращений в организме, а также
для того, чтобы понять механизмы проявления устойчивости бактерий
к лекарствам и причины возникновения привыкания к ним у
больных животных и человека. Поэтому в курсе биохимии
предусматривается изучение строения биогенных молекул (аминокислот, белков,
нуклеиновых кислот, витаминов, гормонов и др.), закономерностей
проявления их функциональной активности, процессов их
биосинтеза, механизмов управления деятельностью сложных молекулярных
структур (мультиферментных комплексов, транспортных и регуля-
торных белков и др.), организации деятельности и
функционирования клетки, органа и ткани.
10
Строение и метаболические
процессы в клетке
Строение и метаболические
процессы в тканях и органах
1 Строение и механизмы действия
функциональных систем
Строение и механизмы действия
белков и нуклеопротеидов
Строение и функционирование
генома
Строение и функционирование
системы иммунитета
Механизмы действия биогенных
соединений и лекарственных
средств
Состав и содержание биогенных
молекул в организме животных
^<»
<.
Молекулярные механизмы
патогенеза заболеваний
Строение и механизм действия
биогенных молекул
Строение и механизм действия
ферментов
Особенности метаболических
процессов в клетках и тканях. \
Окислительные процессы.
<
Цитология
Гистология
Физиология
Молекулярная
биология
Генетика
Иммунология
Фармакология
Клиническая
диагностика
Санитарная
ветеринарная
экспертиза
Внутренние
болезни
Инфекционные
болезни
Биотехнология
Энзимология
Патологическая
анатомия
Рис. 1. Использование знаний биохимии для изучения других предметов
11
Биохимия животных
Знание биохимии позволяет врачу правильно назначать
лечебные препараты, основу которых составляют витамины, гормоны,
ферменты, АТФ, аминокислоты и др.
В учебнике описаны молекулярные механизмы действия
ферментов и принципы формирования мембран клетки и ее органелл. Кроме
того, рассмотрено функционирование различных систем
(пищеварительной, выделительной, регуляторной, иммунной, нервной,
сенсорной и др.). Показана их взаимосвязь и взаимная зависимость,
согласованность действия по обеспечению нормальной функциональной
активности организма.
Для выявления этих механизмов в биохимии активно
используются фотометрические, спектрофотометрические, флуорометриче-
ские, рентгеноструктурные методы анализа, а также хроматография,
электрофорез и др. Освоение этих методов является обязательным
условием подготовки современных высококвалифицированных
специалистов.
В учебнике рассматриваются сложные регуляторные механизмы,
обеспечивающие работу генов. В действии этих механизмов
участвуют РНК-переключатели, микро-РНК, ферменты,
обусловливающие протекание процессов, в результате которых образуются
мобильные фрагменты ДНК, осуществляются процессы альтернативного
сплайсинга и обратной транскрипции.
Учебник предназначен для студентов, обучающихся по
специальности «Зоотехния» и «Ветеринария» и по объему соответствует
программе курса биохимии. Кроме того, он может быть использован
студентами биологических и медицинских факультетов университетов,
а также других высших учебных заведений, где преподают биохимию.
ГЛАВА 1. БИОГЕННЫЕ МОЛЕКУЛЫ
1.1. СПИРТЫ, АЛЬДЕГИДЫ И КАРБОНОВЫЕ КИСЛОТЫ
В организме животных протекают разнообразные метаболические
процессы, продуктами которых могут быть спирты, альдегиды и кар-
боновые кислоты.
1.1.1. Спирты
К спиртам относят производные углеводородов, в составе которых
имеется гидроксильная группа (ОН-группа), тогда как в составе
альдегидов — альдегидная группа (-СНО), а карбоновых кислот —
карбоксильная группа (-СООН).
Высокое содержание спиртов в животных тканях обусловлено их
уникальными физико-химическими данными, способностью спиртов
с низкой молекулярной массой хорошо растворяться в полярной среде.
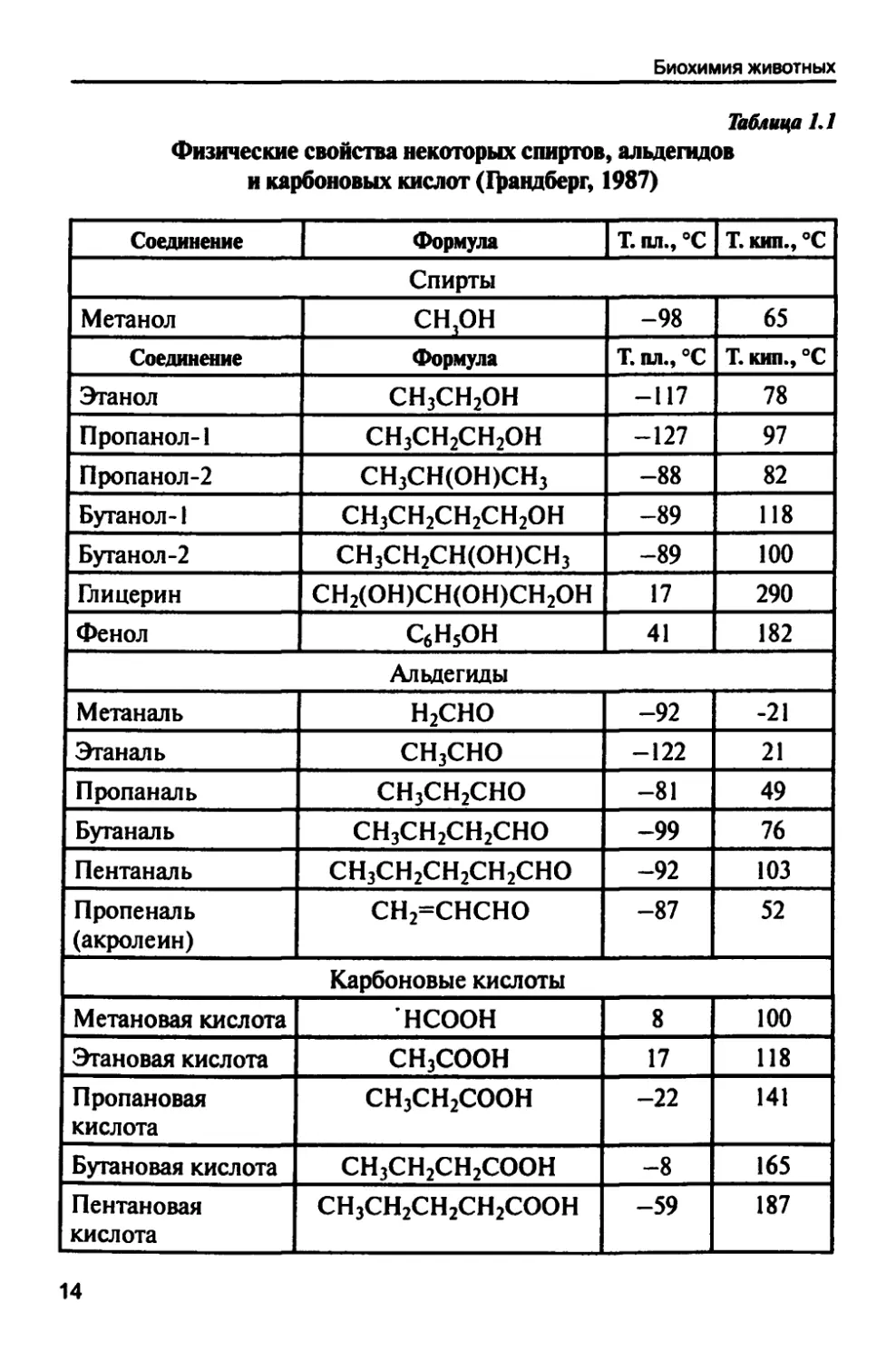
Для спиртов характерны низкие температуры плавления (табл. 1.1).
Разница в физических свойствах спиртов обусловлена высокой
полярностью ОН-группы, которая способствует ассоциации молекул за
счет водородных связей; по мере увеличения размера углеводородного
радикала в спирте влияние ОН-группы на свойства спирта
уменьшается, соответственно понижается растворимость спирта в воде и
увеличивается их растворимость в неполярных растворителях.
Спирты не обладают выраженными кислотными или основными
свойствами (рК* 18,0).
сн3-сн2-о<-н <+ сн3-сн2-сг + н*
Спирты вступают в реакции, идущие с участием только атома
водорода ОН-групп, а также в реакции, происходящие с замещением
или отщеплением ОН-группы. Кроме того, спирты участвуют в
реакциях окисления.
13
Биохимия животных
Таблица 1.1
Физические свойства некоторых спиртов, альдегидов
и карбоновых кислот (Цшндберг, 1987)
| Соединение Формула | Т. пл., °С | Т. кип., °С |
| Спирты |
| Метанол
1 Соединение
1 Этанол
1 Пропанол-1
1 Пропанол-2
1 Бутанол-2
1 Глицерин
| Фенол
I СН,ОН
| Формула
СН3СН2ОН
СН3СН2СН2ОН
СН3СН(ОН)СН3
СН3СН2СН2СН2ОН
СН3СН2СН(ОН)СН3
СН2(ОН)СН(ОН)СН2ОН
С6Н5ОН
1 -98
1 Т. пл., °С
-117
-127
-88
-89
-89
17
41
1 65 1
| Т. кип., °С |
78
97
82
118
100
290
182 |
1 Альдегиды |
1 Метаналь
1 Этаналь
| Пропаналь
1 Бутаналь
1 Пентаналь
1 Пропеналь
|(акролеин)
Н2СНО
СН3СНО
СН3СН2СНО
СН3СН2СН2СНО
СН3СН2СН2СН2СНО
сн2=снсно
-92
-122
-81
-99
-92
-87
-21 1
21
49
76
103
52
1 Карбоновые кислоты |
1 Метановая кислота
| Этановая кислота |
Пропановая
| кислота 1
| Бутановая кислота |
Пентановая
1 кислота
нсоон
СН3СООН
СН3СН2СООН
СН3СН2СН2СООН
СН3СН2СН2СН2СООН
8
17
-22
-8
-59
100 1
118
141
165
187
14
Глава 1. Биогенные молекулы
Особенно много в животных тканях этанола и глицерина. Этанол
при участии различных ферментов способен окисляться до ацетальде-
гида, реакции катализируют дегидрогеназы и оксидазы.
Алкогольдегидрогеназа
К-СН2ОН + НАД+ <->К-СО-Н + НАДН
Алкогольоксидаза
К-СН2ОН + 02 <-> К-СО-Н + Н202
В крови животных обнаруживается до 0,15...0,20 мМ этанола и
0,7... 1,2 мкМ ацетальдегида.
Аминослирты — соединения, в составе которых содержатся МН2-
и ОН-группы. В организме животных наиболее функционально
важными являются следующие аминослирты: этаноламин (НО-СН2-
СН2-1ЧН2) и холин (НО-СН2-СН2^+(СН3)3). Последний входит
в состав фосфолипидов — лецитинов, а также в состав нейромедиа-
тора ацетилхолина, участвующего в передаче возбуждения от нервных
рецепторов к мышцам.
1.1.2. Альдегиды
В отличие от спиртов альдегиды являются более реакционноспо-
собными соединениями, вступающими в реакции с различными
соединениями. Это обусловлено тем, что в молекуле альдегида в связи
с высокой электроотрицательностью атома кислорода по сравнению
с углеродным атомом подвижные электроны гс-связи в альдегидной
группе сдвинуты в сторону атома кислорода.
5-
к—сн2—с
\
При таком сдвиге появляется избыточная электронная плотность
у атома кислорода и уменьшается электронная плотность у
карбонильного атома углерода.
Однако, в отличие от спиртов, альдегиды не имеют подвижных
атомов водорода и поэтому их молекулы не ассоциированы, что
проявляется в более низких температурах кипения (табл. 1.1).
15
Биохимия животных
Проявление химических свойств альдегидов можно
продемонстрировать на следующих примерах.
К-СНО + 1ЧН2-К' -> К-СН=1Ч-К' + Н20
ОН
I
К-СНО + НО-К' -» КСН-О-К'
2Н*
К-СНО-»К-СН2-ОН
К-СНО ->К-СООН
Высокая реакционная способность альдегидов обусловливает их
участие в организме животных в реакциях с аминосодержащими
соединениями (аминокислоты, белки, нейропептиды и др.). Так,
модификация поверхностных аминогрупп белков ускоряет процессы
их автоокисления и последующего протеолиза. Модификации могут
подвергаться и нуклеиновые кислоты, что приводит к появлению
модифицированных форм РНК и ДНК.
Альдегиды утилизируются в организме животных с помощью
специализированных ферментов: альдегиддегидрогеназы и альдегидок-
сидазы.
Альдегиддегидрогеназа
К-СНО + НАД+ + Н20 <-> К-СООН + НАДН + Н+
Ал ьдегилоксидаза
к-сно + н2о + о2 <-> к-соон + н2о2
К соединениям, содержащим одновременно в своем составе гид-
роке ильные и альдегидные группы, относятся альдозы —
представители моносахаридов.
1.1.3. Карбоновые кислоты
Продуктами реакций окисления спиртов и альдегидов являются
карбоновые кислоты, которые отличаются от альдегидов тем, что
имеют более сильную поляризацию двойной связи за счет оттягива-
16
Глава 1. Биогенные молекулы
ния электронной плотности от атома кислорода ОН-группы, при этом
ослабевает энергия связи в гидроксиле (Ск-Н), способствуя легкому
отщеплению атома водорода в виде протона (Н*).
5-
5+ 8+(^
к-сн2—► с О
^ о ^— н
8+
Карбоновые кислоты по сравнению со спиртами и альдегидами
имеют более высокие температуры плавления и кипения (табл. 1.1).
Все карбоновые кислоты проявляют кислую реакцию и в водном
растворе способны диссоциировать, но в малой степени, являясь
слабыми кислотами с рК * 3,7...4,8 (рК — это отрицательный логарифм
константы диссоциации (-1§КД)).
а-соон о к-сосг + н*
Карбоновые кислоты образуют более прочные водородные связи,
чем спирты. Кроме того, карбоновые кислоты легко образуют соли
(СНзСООИа, СН3СООК, (СН3СОО)2Мб и др.).
СНзСООН + №ОН -> СНзСООИа + Н20
СН3СООН + №НС03 -> СНзСООИа + С02 + Н20
Реагируя со спиртами, карбоновые кислоты образуют сложные
эфиры.
а-соон + а'-он -> а-со~о-а' + н2о
1.2.ЛИПИДЫ
Липилы — это гетерогенная группа органических веществ, не
растворимых или плохо растворимых в полярных растворителях, но
хорошо растворимых в неполярных растворителях.
17
Биохимия животных
X
2
*
«г
X
ев
а
а
о
с
5
5
!
Ш
I
с
2
X
со
О
X
.1
Глава 1. Биогенные молекулы
Качественный и количественный состав липидов в органах и
тканях живых организмов зависит от вида, пола, породы, возраста,
функционального состояния, содержания и кормления животных.
Липиды являются в основном составными частями мембранных
структур клеток и их органелл (митохондрий, ядер, эндоплазматиче-
ского ретикулума, лизосом и др.), а также участвуют в энергетических
процессах, обеспечивая синтез АТФ. Кроме того, липиды регулируют
протекание метаболических процессов в клетках, управляют
экспрессией генов. Входя в состав углеводов и белков, липиды участвуют
в определении локализации их в структуре мембран и обеспечивают
их функциональную активность. В составе нуклеиновых кислот
липиды выполняют защитную функцию.
Различают следующие группы липидов: жирные кислоты, ацилг-
лицеролы, фосфолипиды, воска, стероиды, терпены (рис. 1.1). Кроме
того, липиды входят в состав белков (липопротеины) и углеводов
(гликолипиды), формируя сложные функционально активные
соединения.
1.2.1. Высшие жирные кислоты и эйкозаноиды
1.2.1.1. Высшие жирные кислоты
К группе высших жирных кислот относятся производные карбо-
новых кислот, в составе которых карбоксильная группа и
гидрофобный радикал, представленный насыщенными или ненасыщенными
углеводородами (К-СООН) (табл. 1.2).
Таблица 1.2
Физические свойства основных карбоновых кислот животных
Кислоты
Формула
°с
Т
•с
рКа
1 Насыщенные кислоты |
1 Капроновая
| Каприловая
1 Каприновая
1 Лауриновая
СН3(СН2)4СООН
СН3(СН2)6СООН
СНз(СН2)8СООН
СН3(СН2)шСООН
-2
16,7
31,6
44,2
205
237,5
269
225
— 1
4,85
— |
— |
19
Биохимия животных
Окончание таблицы 1.2
1 Кислоты
| Миристиновая
1 Пальмитиновая
| Стеариновая
1 Арахиновая
| Бегеновая
1 Янтарная
1 Глутаровая
1 Адипиновая
1 Формула
СНз(СН2),2СООН
СН3(СН2)14СООН
СНз(СН2)|6СООН
СН3(СН2)|8СООН
СНз^НгЬСООН
НООС(СН2)2СООН
НООС(СН2)3СООН
НООС(СН2)4СООН
1 Тцц,
°с
52,5
63,1
69,6
75,4
81,0
185
98
153
Гт
°с
249
211,5
213,0
[ —
_
рКа 1
1 ~~ 1
1 ~~ 1
1 ~~ 1
1 ~~ 1
~~ 1
4'2,-|
4у34\
4,41 1
1 Ненасыщенные кислоты |
1 Акриловая
1 Кротоновая
1 Изокротоновая
1 Пальмито-
1 олеиновая
1 Олеиновая
Элаидиновая
Линолсвая
Линоленовая
Арахидоновая
сн2=снсоон
/я/адйС-СН3СН=СНСООН
«ис-СН3СН=СНСООН
СНз(СН2)5СН=
=СН(СН2)7СООН
«ис-СН3(СН2)7СН=
=СН(СН2)7СООН
/я/ю//с-СН3(СН2)7СН=
=СН(СН2)7СООН
СН3(СН2)4СН=СНСН2СН=
=СН(СН2)7СООН
СН3СН2(СН=
=СН-СН2)3(СН2)6СООН
СНз(СН2)4(СН=
=СН-СН2)4(СН2)2СООН |
12
72
15
-0,5
14
52
-8,5
-16,5
-49,5
142
189
172
—
286
288
230
—
—
4,26 1
4,69
— 1
— 1
— 1
—
~~ 1
— 1
— 1
Карболовые кислоты в водных растворах могут присутствовать
в диссоциированном состоянии, являясь слабыми кислотами.
Для большинства одноосновных карбоновых кислот рК * 4,8,
что объясняется отсутствием электродонорного эффекта алкильных
20
Глава 1. Биогенные молекулы
групп. Карбоновые кислоты с числом атомов углерода от 1 до 4
смешиваются с водой во всех отношениях и называются летучими
жирными кислотами. Кислоты, в молекуле которых содержатся от пяти
до десяти и более атомов углерода, представляют собой
маслянистые жидкости со слабой растворимостью в воде (высшие жирные
кислоты). Среди карбоновых кислот муравьиная, уксусная и пропи-
оновая имеют резкий специфический запах, кислоты среднего ряда
обладают неприятным запахом, тогда как высшие жирные кислоты
запаха не имеют.
Карбоновые кислоты в живых организмах могут образовываться
в результате реакций последовательного превращения спиртов
(метанол, этанол, про па нол, бутанол и др.) и альдегидов (формальдегида,
ацетальдегида и др.), в частности, реакций, катализируемых при
участии алкоголь- и альдегидцегидрогеназ.
Алкогольдегидрогеназа способна катализировать реакцию
окисления этанола и восстановления ацетальдегида, а альдегиддегидроге-
наза участвует в реакциях окисления ацетальдегида. Обе реакции
протекают в присутствии окисленных и восстановленных форм НАД.
АДГ
НАД* НАДН АльДГ
СН3-СН2-ОН Г^- у» СНз-СНО /* -ч » СНз-СООН
НАД+ НАДН НАД+ НАДН
АДГ не очень специфична по отношению к субстрату и поэтому
способна катализировать реакции с участием первичных и вторичных
спиртов, альдегидов и кетонов. При этом спирты в клетках
животного организма, обеспечивают энергетические потребности живых
систем, тогда как альдегиды способны вступать в реакции с амино-
содержашими соединениями с образованием оснований шиффа, что
проявляется в провоцировании аутоиммунных реакций, а также в
модификации и нейтрализации активного действия соединений,
содержащих свободные МН2-группы (нейромедиаторы, пептиды,
аминокислоты и др.).
Основные представители карбоновых кислот в биогенных
системах образуются в реакциях анаэробного и аэробного окисления
углеводов (уксусная, пропионовая и масляная кислоты). Среди карбоновых
21
Биохимия животных
кислот встречаются соединения, содержащие кето-группы (пиро-
виноградная, шавелевоуксусная, а-кетоглутаровая кислоты). Кроме
того, карбоновые кислоты образуются в результате протекания
реакций дезаминирования аминокислот, а также в реакциях трансамини-
рования. Среди них встречаются соединения, относящиеся к высшим
жирным кислотам, которые входят в состав мембран клеток, образуют
мицеллярные структуры, формируют основу саркоплазматического
ретикулума.
Высшие жирные кислоты можно условно разделить на две группы:
насыщенные и ненасыщенные (в составе углеводородного радикала
одна, две и более двойных связей). Общая формула насыщенных
жирных кислот СН3-(СН2)л-СООН. Насыщенные жирные кислоты
животных тканей, как правило, содержат четное число углеродных
атомов, чаще всего 16 (пальмитиновая (С,6:0)) или 18 (стеариновая (С|8:0)).
Ненасыщенные жирные кислоты имеют в своем составе одну или
несколько двойных связей. Двойная связь в структуре углеводорода
обычно обозначается символом А*, где верхний индекс указывает на
местоположение двойных связей. Так, например, олеиновая (С18:1)
А9, линолевая (С|8:2) А912, линоленовая (С,8:3) А9-12»15, арахидоновая
(С2о:4) А5'81114. Двойные связи жирных кислот в основном находятся
в цис-конформации, обусловливая формирования изгибов
алифатической цепи. Цис-изомеры высших жирных кислот имеют более
низкую температуру плавления, чем транс-изомеры, и активно метаболи-
зируются. При комнатной температуре насыщенные жирные кислоты
с 12-ю и более углеродными атомами находятся в твердом состоянии,
а ненасыщенные жирные кислоты — в виде жидкости.
Среди насыщенных жирных кислот в организме животных
более всего преобладают пальмитиновая, миристиновая, стеариновая
и арахиновая, а среди ненасыщенных — олеиновая и линолевая.
Содержание жирных кислот в организме коров зависит от пола, возраста
и рациона кормления животных. Причем линолевая и линоленовая
кислоты не синтезируются в организме млекопитающих и должны
поступать с растительной пищей, поэтому эти кислоты называют
незаменимыми жирными кислотами.
Среди ненасыщенных жирных кислот следует выделить арахидо-
новую кислоту (С2о:4)> которая присутствует преимущественно в
составе эфиров фосфолипидов и триацилглицеролов, связана с белками
плазмы крови. Этерифицированная кислота освобождается при
участии фосфолипазы А2, которая отщепляет прикрепленную во 2-е по-
22
Глава 1. Биогенные молекулы
ложение жирную кислоту от фосфолипида. При этом предварительно
фосфолипид подвергается действию двух ферментов: фосфолипазы С
и диацилглицероллипазы. Фосфолипаза С превращает фосфолипид
в диацилглицерол, а диацилглицероллипаза отщепляет от него
жирную кислоту.
В полярных растворителях жирные кислоты способны
формировать мицеллярные структуры, в которых отрицательно заряженные
карбоксильные группы обращены в сторону полярных молекул, а
неполярные углеводородные радикалы формируют внутреннюю часть
мицеллы. Жирные кислоты молока могут частично синтезироваться
в молочной железе, а частично поступают из крови.
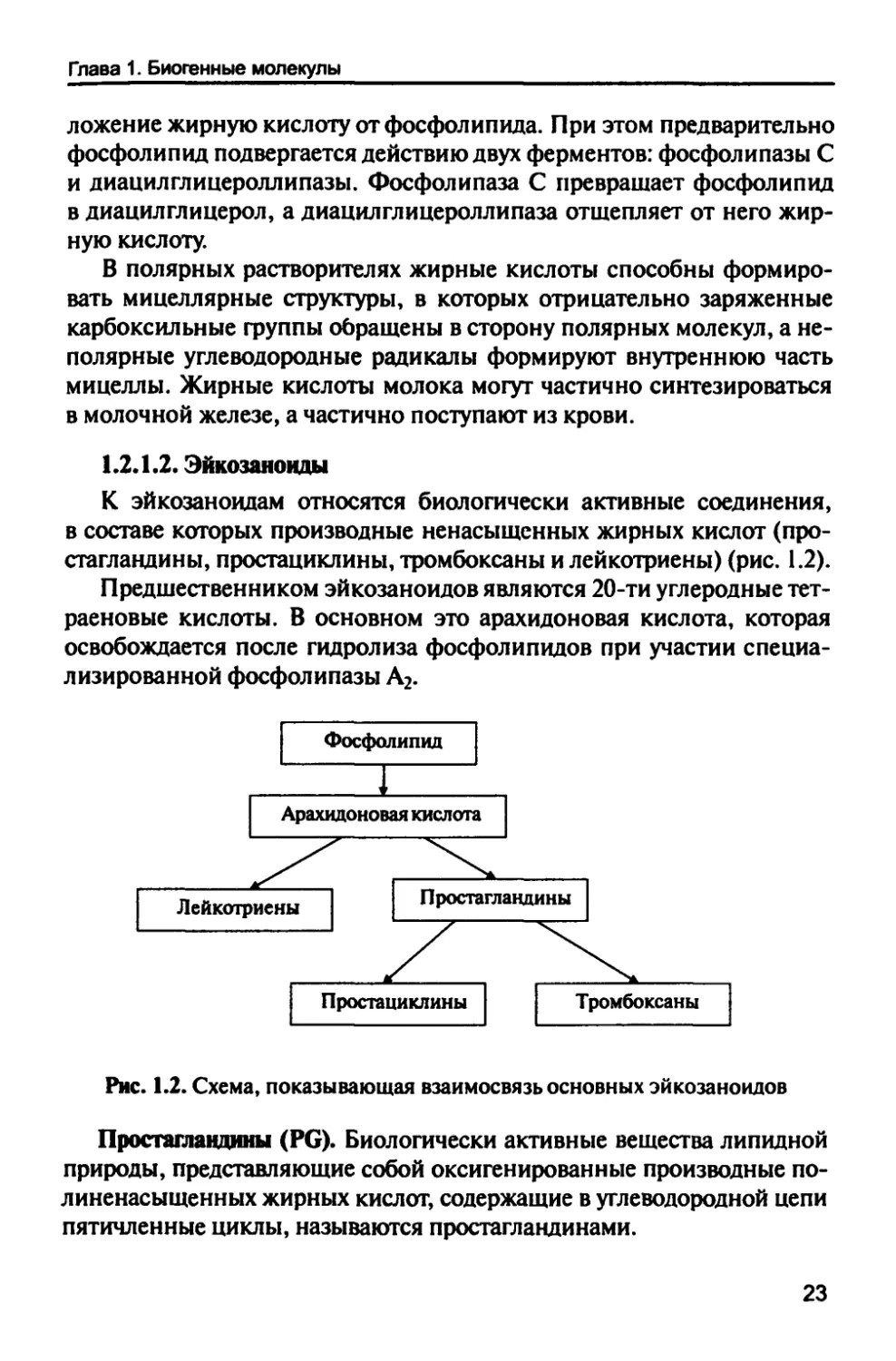
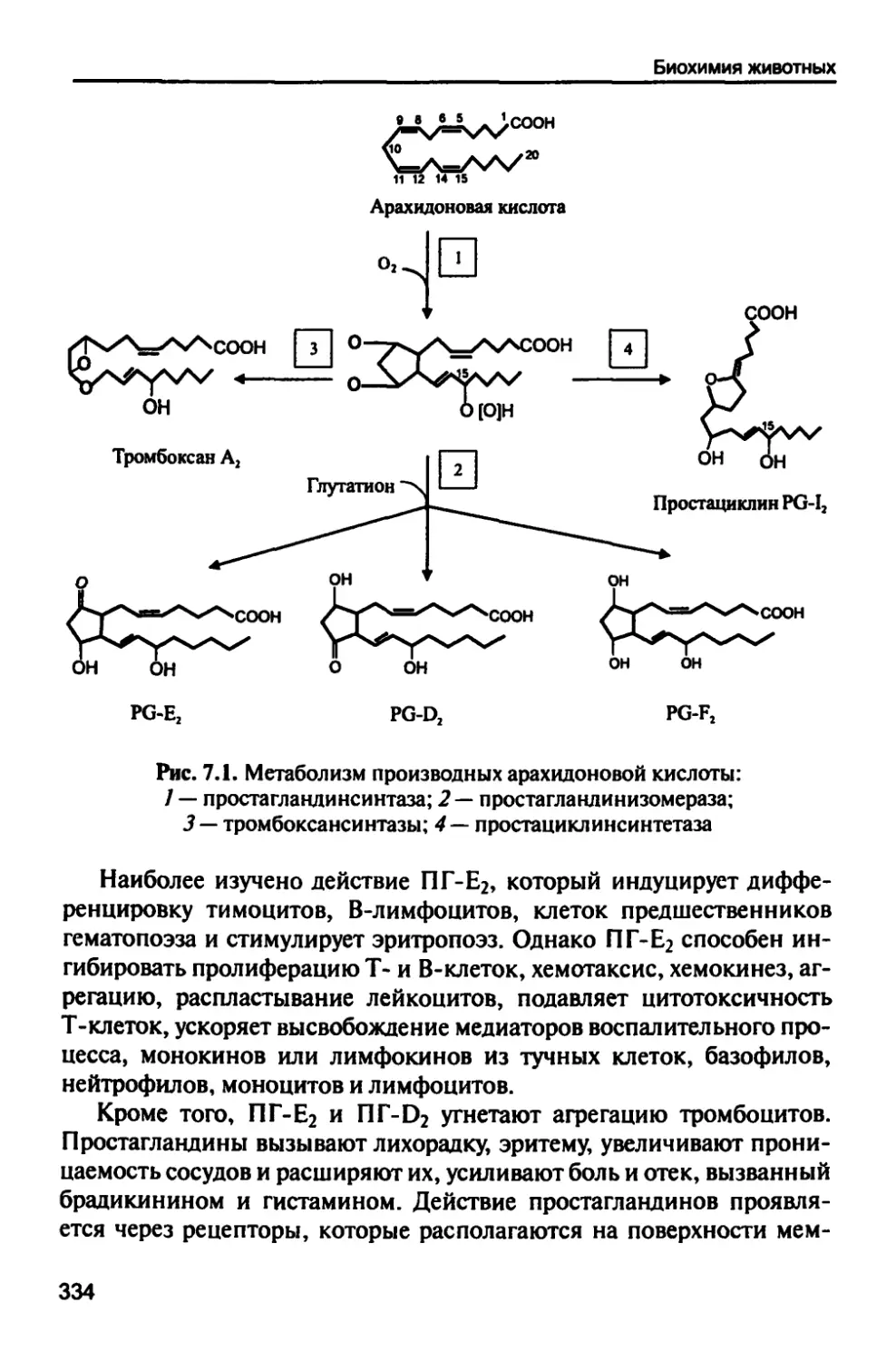
1.2 Л .2. Эйкозаноиды
К эйкозаноидам относятся биологически активные соединения,
в составе которых производные ненасыщенных жирных кислот (про-
стагландины, простациклины, тромбоксаны и лейкотриены) (рис. 1.2).
Предшественником эйкозаноидов являются 20-ти углеродные тет-
раеновые кислоты. В основном это арахидоновая кислота, которая
освобождается после гидролиза фосфолипидов при участии
специализированной фосфолипазы А2.
Фосфолипид
Арахидоновая кислота
Лейкотриены
Простагландины
Простациклины
Тромбоксаны
Рис. 1.2. Схема, показывающая взаимосвязь основных эйкозаноидов
Простагландины (РС). Биологически активные вещества липидной
природы, представляющие собой оксигенированные производные
полиненасыщенных жирных кислот, содержащие в углеводородной цепи
пятичленные циклы, называются простагландинами.
23
Биохимия животных
В зависимости от структуры пятичленного кольца выделяют до
10 типов простагландинов (РОА, РОВ, РСС, РСР, РСЕ, РСР, РСО,
РСН, РС1, РС.1). Дополнительно по числу двойных связей РС
подразделяются на серии, обозначаемые подстрочными индексами 1, 2 и
3 (РСА|, РСВ2, РСС2, РСЭ2 и др.). Кроме того, после цифровых
индексов могут присутствовать буквы аир, указывающие ориентацию
гидроксильной группы при 9 атоме углерода по отношению к
плоскости циклопентанового кольца.
В молекуле РСС2 циклопентановое кольцо имеет эндопероксидный
мостик (-0-0-), а боковая цепь — гидропероксндную фуппу (-ООН).
РСН2 содержит группу -О-О- и гкдроксильную группу (-ОН).
Условно простагландины можно разделить на моноциклические
(с кето-группой (РОА, РОВ, РОС, РШ), кетогидрокси-группами
(РОО, РОЕ), дигидрокси-группами (РСР)) и бициклические (эндо-
пероксиды (РОС2, РСН2)).
РОЕ. РСР„ РОО.
Простагландины не являются гормонами, но управляют их
действием. В основном функциональная активность РС осуществляется
в тех клетках, в которых они синтезируются. При этом проявляется их
специфичность действия по отношению к типу клеток.
24
Глава 1. Биогенные молекулы
Обнаружены простагландины почти во всех тканях
млекопитающих. Обладают простагландины исключительно высокой и
разносторонней физиологической активностью. Не накапливаются в тканях и
органах в свободном виде, а синтезируются внутриклеточными
ферментами в ответ на биологический стимул (циклооксигеназный путь).
Оказывают свое действие главным образом в непосредственной близи
от места образования, стимулируя протекание метаболических
процессов при супернизких концентрациях (10*|3...10-15 М). Простагландины
способствуют расширению сосудов, уменьшению кровяного давления,
увеличивают сердечный выброс. Являются ингибиторами тромбообра-
зования в сосудах, могут прерывать беременность практически на
любом сроке, оказывают седативное и транквилизирующее
(успокаивающее) действие, расслабляют мышцы бронхов и трахей. В медицине
простагландины применяются при лечении сердечно-сосудистых,
аллергических, воспалительных, гинекологических заболеваний.
Простациклины. Основным местом синтеза простациклинов
служат стенки кровеносных сосудов, где они вырабатываются с целью
ингибирования процессов агрегации тромбоцитов. Простациклины
содержат циклическую структуру между пятичленным циклом и
одной из боковых цепочек.
РС12
Простациклин Р012 увеличивает кровоток в сердце, легких,
почках и других органах. Понижает артериальное давление, оказывает
гастропротекторное действие, снижает реабсорбцию натрия и воды.
По механизму действия антагонистами простациклинов являются
тромбоксаны.
25
Биохимия животных
1]ромбоксаны (ТХ). Они отличаются в строении от простагландинов
тем, что имеют шестичленный цикл, в составе которого атом
кислорода. Известно два типа тромбоксанов (ТХА и ТХВ).
Основным местом синтеза тромбоксанов служат тромбоциты,
макрофаги и моноциты. После выхода в кровь тромбоксаны вызывают
сужение кровеносных сосудов, инициируя процессы агрегации
тромбоцитов. Повышают артериальное давление, способствуют сужению
сосудов бронхов. Баланс тромбоксанов и простациклинов
обеспечивает контроль за образованием тромба и прекращение кровотечения,
а также ограничивает тромбообразование, нарушение
микроциркуляции, поддерживает физиологически нормальное число тромбоцитов
в циркулирующей крови.
Лейкотриены (1Л). Относятся к производным 20-ти углеродных
полиненасыщенных кислот, содержащих четыре двойные связи, три из
которых сопряженные. Кроме того, в составе лейкотриенов имеется
гадрокси-группа в положении 5 или эпокси-группа в положении 5 и 6.
он
ЬТА ЬТВ
Известно 6 типов лейкотриенов: 1ХА, 1ХВ, 1ХС, 1Тй, 1ХЕ и 1ТР.
В составе лейкотриенов 1ТС...1ХР присутствуют остатки цистеина
или цистеинилпептида. Каждый тип имеет три серии лейкотриенов,
отличающихся числом двойных связей, обозначаемых цифрами 3, 4,
5 или 6 в нижнем индексе.
26
Глава 1. Биогенные молекулы
МН2— СН —С — ЫН — СН2— СООН
СН2 О
СООН
N42—СН —СООН
г н
СООН
ьто
НЕ
Синтезируются лейкотриены в лейкоцитах, тромбоцитах и
макрофагах, а также в легких, селезенке, мозге и сердце. Проявляют действие
как медиаторы воспалительных реакций, участвуют в аллергических
реакциях, регулируют направление движения лейкоцитов, регулируют
активность лимфоцитов, подавляют цитотоксичность N К-киллеров. Кроме
того, способны влиять на обмен кальция, повышают сосудистую
проницаемость, увеличивают секрецию слизи, способствуют сужению
бронхов за счет сокращения гладких мышц.
Липоксины. Производные эйкозаполиеновых кислот, близких по
строению к лейкотриенам, содержат в молекуле четыре сопряженные
связи и три гидроксильные группы.
он
соон
СООН
он
Липоксин А
он
Липоксин В
Синтез липоксинов осуществляется при участии липоксигеназ.
Они регулируют хемотаксис лейкоцитов и процессы агрегации
тромбоцитов.
1.2.2. Ацилглицеролы (глицериды)
К ацилглицеролам относятся сложные эфиры трехатомного спирта
глицерина и высших жирных кислот. Последние могут быть
представлены остатками насыщенных и ненасыщенных жирных кислот. Среди
жирных кислот наиболее часто встречаются в составе ацилглицеролов
пальмитиновая, стеариновая и олеиновая кислоты.
27
Биохимия животных
Трехатомный спирт глицерин может быть соединен сложноэфир-
ной связью с одной, двумя и тремя молекулами жирных кислот,
образуя мо но-, ди- и триацилглицеролы.
Г ? I
сн2 — о—с—к, о сн2 — о—с — к, о сн2 — о—с — «1
но—сн к2 — с — о— сн к?—с — о— сн р
сн2—-он сн2—он сн2—о—с—й3
Моноацилглицерол Диацилглицсрол Триацилглицирол
(К], К2 и Я3 — радикалы высших жирных кислот.)
Ацилглицеролы различаются природой остатков жирных кислот.
Так, если все три остатка представлены одной жирной кислотой, то
такие триацилглицеролы называются простыми и им присваивается
название по соответствующей жирной кислоте: тристеарат (тристеаро-
илглицерол),трипальмитин(трипальмитоилглицерол),триолеин(трио-
леилглицерол) и т. д.
Триацилглицеролы, содержащие разные остатки жирных кислот,
называются смешанными. Их названия образуются в зависимости от
природы остатков жирных кислот. При этом положение остатка
жирной кислоты указывается цифрами 1,2 и 3. Например, 1-олео-2-паль-
митостеарин, 1-олео-2,3-дипальмитин и т. д.
Жирные кислоты, входящие в состав ацилглицеролов, определяют
их физические и химические свойства. Так, например, чем больше
содержится остатков ненасыщенных жирных кислот и остатков жирных
кислот с короткой углеводородной цепью в молекуле триацилглице-
рола, тем ниже будут показатели температуры плавления этого
соединения.
В организме животных глицериды подвержены гидролитическому
расщеплению при участии специализированных ферментов — липаз.
Функциональная деятельность триацилглицеролов разнообразна.
Они могут откладываться в виде жировых отложений, обеспечивая
энергетические и пластические потребности клеток, а также являются
основными составляющими липопротеинов (хиломикронов),
основных транспортных систем организма. Кроме того, триацилглицеролы
резервируются в подкожно-жировом слое, обеспечивая тепловую и
физическую защиту органов.
28
Глава 1. Биогенные молекулы
1.2.3. Фосфолипиды
К группе фосфолипидов относятся сложные эфиры
многоатомного спирта глицерина или сфингозина с высшими жирными
кислотами, в составе которых еще имеется остаток фосфорной кислоты и
полярная группа.
Если фосфолипид содержит остаток глицерина, то он называется
глицерофосфолипидом, а если остаток сфингозина — то сфингофос-
фолипидом.
Полярная группа сфингофосфолипидов представлена только хо-
лином, тогда как глицерофосфолипиды могут содержать холин, эта-
ноламин, серии, инозит и др.
В полярной среде фосфолипиды легко образуют мицеллы. При
этом остатки жирных кислот фосфолипида ориентированы
вовнутрь мицеллы, а полярные группы обращены наружу, в сторону
растворителя.
1.2.3.1. Глицерофосфолипиды
Глицерофосфолипиды являются производными фосфатидной
кислоты, в составе которых полярная группа соединена эфирной связью
с остатком фосфорной кислоты. Фосфатидной кислотой является
остаток 1,2-диацилглицерина, этерифицированный по положению 3
фосфорной кислотой.
О О
о н2с-о—с—к,
к2-с-о—сн о
I II
н2с—о—р-он
он
о нх-о-с-к,
Ка-С-О—СН О
I II
н2с—о— р-о-Кз
О"
Фосфатидная кислота
Гл и церофосфол и п ид
В зависимости от строения полярной группы
глицерофосфолипиды представлены следующими соединениями: фосфатидилхолины,
фосфатидилэтаноламины, фосфатидилсерины, фосфатидилинозиты,
плазмалогены, кардиолипины и фосфатидилглицерины.
Фосфатидилхолин (лецитин). В основе лецитина — фосфатид-
ная кислота, остаток фосфорной кислоты которой соединен эфир-
29
Биохимия животных
ной связью с азотсодержащим соединением холином (НО-СН2-СН2-
1Ч+(СН3)з).
о
II
о н2с — о—с—«1
к2 — с — о— сн о
н2с—о— р—о—сн2—сн2—й(сн3)3
О"
Фосфатидилхолин
Высокое содержание лецитинов в организме животных отмечается
в мозге, сперме, надпочечниках, эритроцитах. Кроме того, богаты
лецитином и желтки яиц. У растений больше всего лецитинов
содержится в соевых бобах, семенах подсолнечника, зародышах пшеницы.
Фосфатидилхолины используются в пищевой промышленности
при производстве шоколада и маргарина. В медицине лецитины
применяются при лечении заболеваний нервной системы, а также в
качестве антиоксидантов.
Фосфатидилэтаноламин (кефалин). Это глицерофосфолипид,
содержащий в качестве полярной группы остаток этаноламина (НО-
СН2-СН2-ЫН2).
о н2с — о—с—*
к2 — с — о— сн о
Н2С — о— Р—О — СН2—СН2— 1ЧН3
0"
Фосфатидилэтаноламин
Высокое содержание лецитина и кефал ина в животных тканях,
определяется тем, что они служат основными компонентами мембран
клеток и клеточных органелл.
Гидролиз фосфатидилхолинов и фосфатидилэтаноламинов,
осуществляемый при участии фосфолипазы А2, которая катализирует
30
Глава 1. Биогенные молекулы
отщепление остатка ненасыщенной жирной кислоты в положении 2,
приводит к образованию лизофосфолипидов (лизофосфатидилхолины и
лизофосфатидилэтаноламины). Эти соединения обладают сильным
гемолитическим действием.
Фосфатидилхолины и фосфатидилэтаноламины являются
основными фосфолипидами молока, содержание которых составляет более
60% всех фосфолипидов. При этом основная часть фосфолипидов
молока входит в состав оболочек жировых шариков (60...70%).
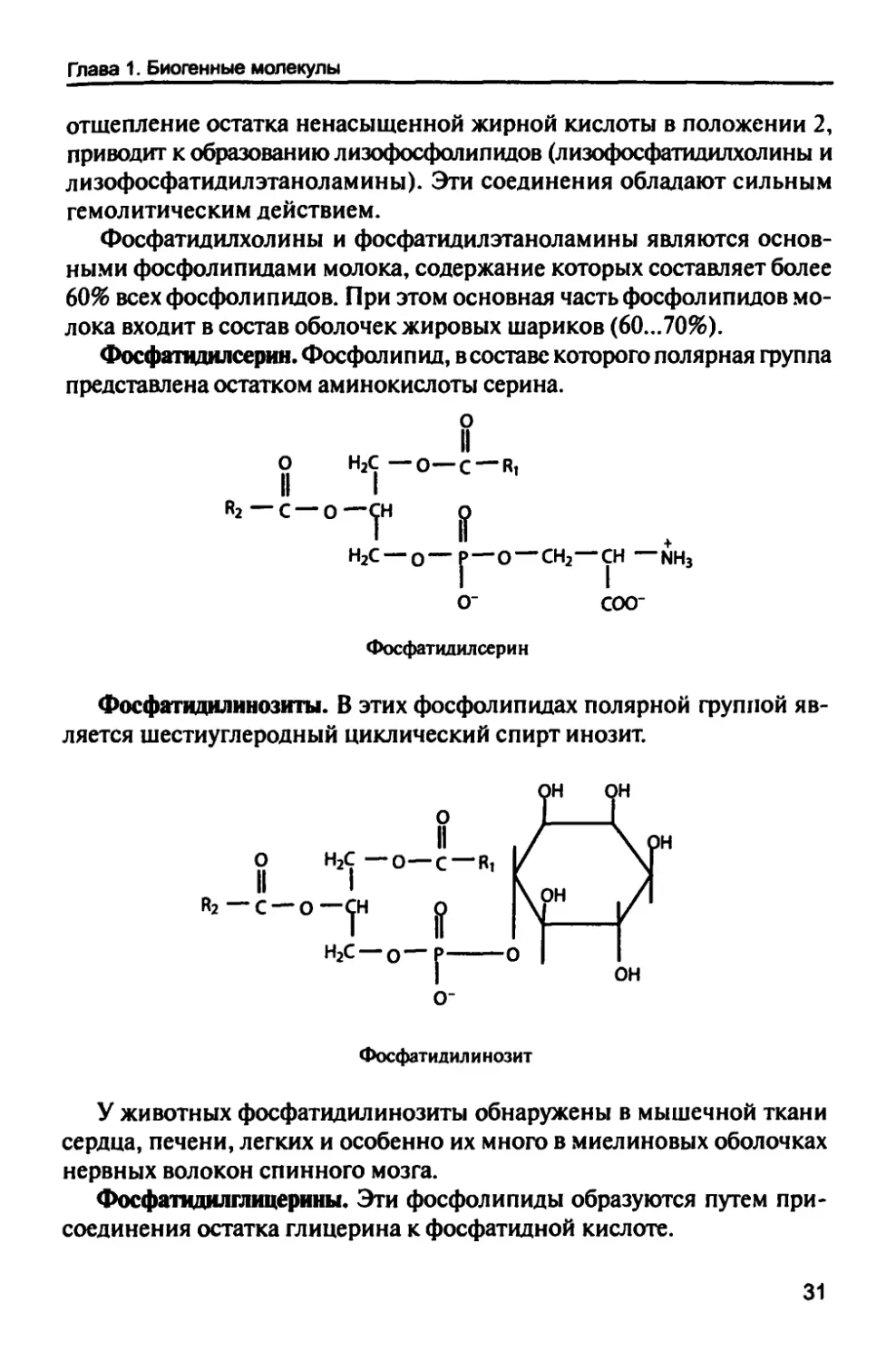
Фосфатцдилсерин. Фосфолипид, в составе которого полярная группа
представлена остатком аминокислоты серина.
о н2с — о—с — к,
к2—с —о-
т »
+
Н2С — о— Р — О — СН2—СН —ЫНз
О" СОО"
Фосфатид ил серии
Фосфатидилинозиты. В этих фосфолипидах полярной фуппой
является шестиуглеродный циклический спирт инозит.
Фосфатидил и нозит
У животных фосфатидилинозиты обнаружены в мышечной ткани
сердца, печени, легких и особенно их много в миелиновых оболочках
нервных волокон спинного мозга.
Фосфатндилглицернны. Эти фосфолипиды образуются путем
присоединения остатка глицерина к фосфатидной кислоте.
31
Биохимия животных
О СН2—О—С —«1
II I
«2 —С —О—СН
г
н2с—о— р — о — сн2—сн — сн3
о он он
Фосфатидилглицерин
Высокое содержание фосфатидилглицеринов отмечается в
некоторых бактериальных мембранах, где они представлены в форме
аминокислотных производных: Ь-лизилфосфатидилглицеринаили Ь-ала-
нилфосфатидилглицерина.
В растениях, фосфатидилглицерины содержатся в хлоропластах,
участвуя в формировании мембран и метаболических процессах.
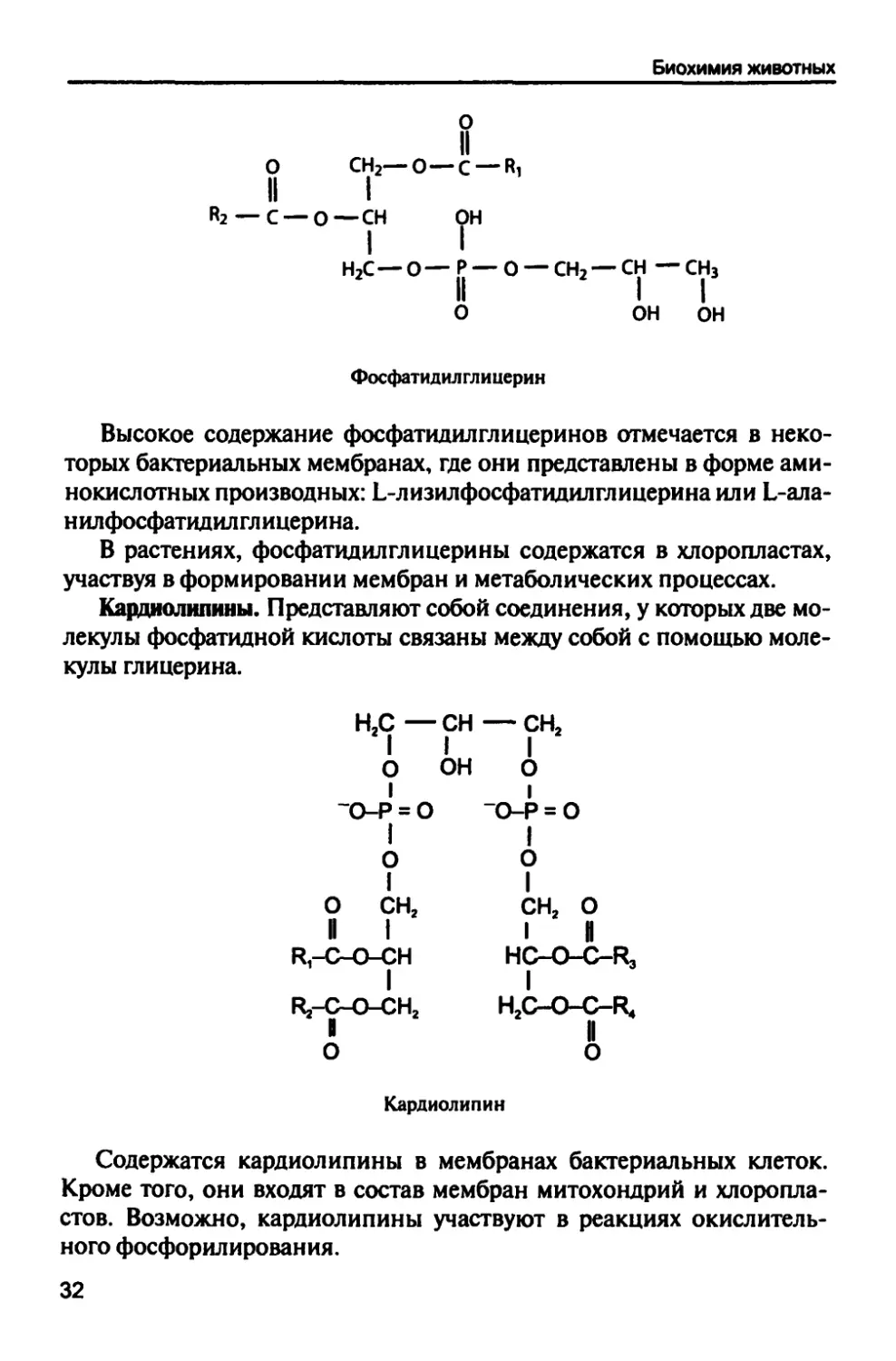
Карднолнлнны. Представляют собой соединения, у которых две
молекулы фосфатидной кислоты связаны между собой с помощью
молекулы глицерина.
Н2С —СН —СН2
I
О
I
~о-р = о
I
О
I
о сн2
II I
^-с-о-сн
I
Рг-С-О-СНг
он
I
о
_о-р = о
I
о
I
сн2 о
I И
НС-О-С-Кз
I
КС-О-С-Р*
II
о
Кардиолипин
Содержатся кардиолипины в мембранах бактериальных клеток.
Кроме того, они входят в состав мембран митохондрий и хлоропла-
стов. Возможно, кардиолипины участвуют в реакциях
окислительного фосфорилирования.
32
Глава 1. Биогенные молекулы
Плазмалогены. В составе данных фосфолипидов содержится оста-
ток ненасыщенного спирта (НО-СН=СН-К), который связан с гид-
роксильной группой глицерина простой эфирной связью.
0 Н2С-0—СН»СН—К,
1 I
к2—с-о-сн о
I 1
Н2С—О - Р - О - СН2- СН2- N (СН3),
0~
Фосфатилал ьхолин
Основными представителями плазмалогенов являются фосфати-
дальхолины, фосфатидапьэтаноламины, фосфатидальсерины. При
кислотном гидролизе плазмалогенов образуются альдегиды, называемые
плазмалями.
Плазмалогены входят в состав мембран мышц, нервных клеток и
эритроцитов.
1.23.2. Сфннгофосфолипиды
Липиды, содержащие в своем составе ненасыщенный аминоспирт
сфингозин или его восстановленную форму — дигидросфингозин.
СН3—<СН2)12—СН=СН—СН—СН—СН2ОН
ОН N4,
Сфингозин
СН3—(СН2)М—СН—СН—СН2ОН
он щ
Дигидросфингозин
Двойная связь в молекуле сфингозина находится в
транс-положении, а расположение заместителей у хиральных атомов углерода
соответствуют О-конфигурации.
В составе сфингозина присутствуют в основном от 16 до 20
углеродных атомов. Сфингозины, у которых аминогруппа ацилирована
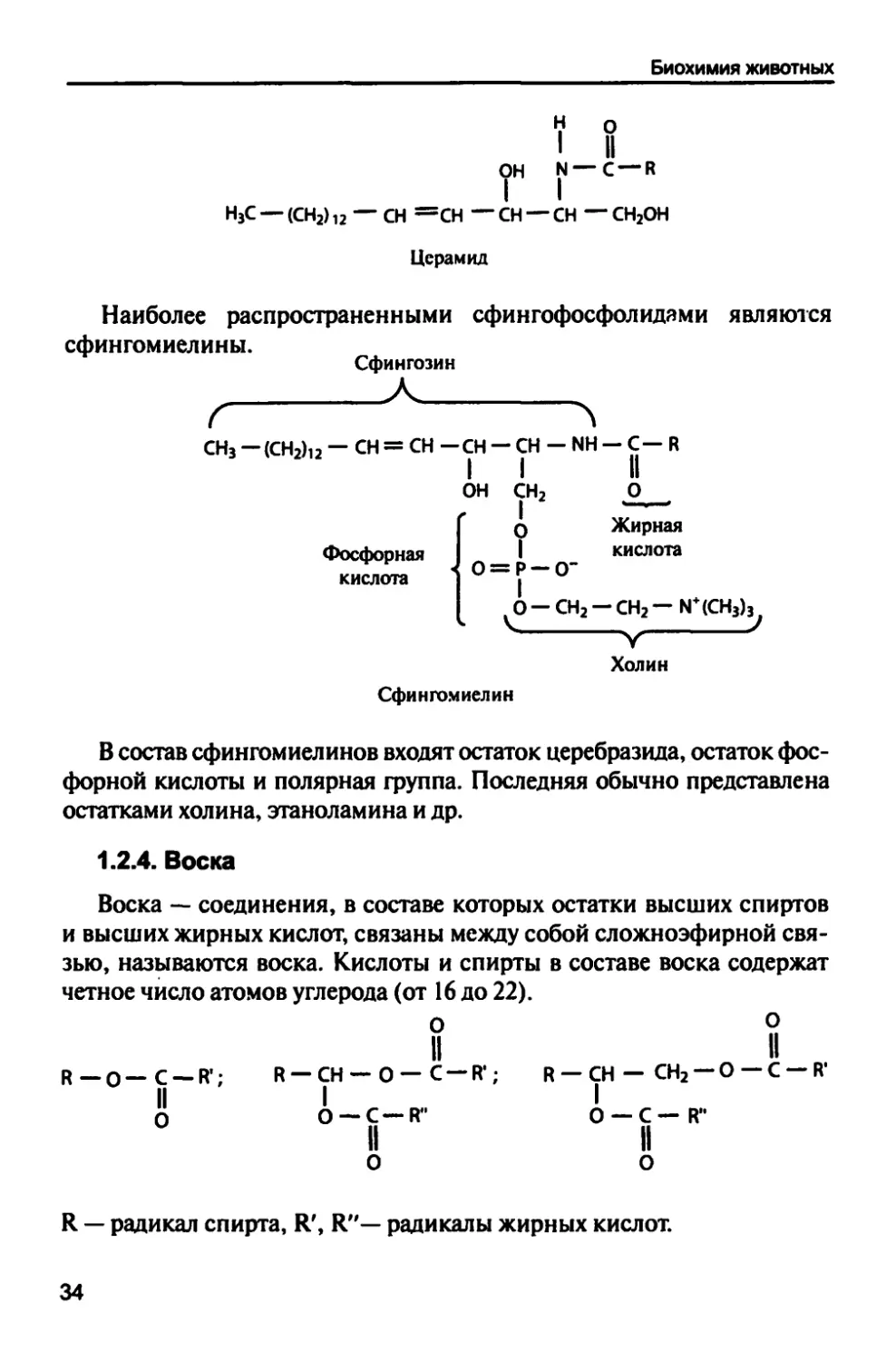
жирной кислотой, называются церамидами.
33
Биохимия животных
н о
I II
он р — с—к
Н3С — (СН2) 12 — СН =СН — СН — СН — СН2ОН
Церамид
Наиболее распространенными сфингофосфолидами являются
сфингомиелины.
Сфингозин
, А ч
СН3 -<СН2)12 - СН = СН -СН - СН - ЫН - С- К
он сн2 о
О Жирная
| кислота
0 = Р — О"
Фосфорная
кислота
0-СН2-СН2-М+(СН3)3
Холин
Сфингомиелин
В состав сфингомиелинов входят остаток церебразида, остаток
фосфорной кислоты и полярная группа. Последняя обычно представлена
остатками холина, этаноламина и др.
1.2.4. Воска
Воска — соединения, в составе которых остатки высших спиртов
и высших жирных кислот, связаны между собой сложноэфирной
связью, называются воска. Кислоты и спирты в составе воска содержат
четное число атомов углерода (от 16 до 22).
О О
II II
р_0_С-Р'; К —СН —О —С —К; Р-СН- СН2-0-С-К'
О О —С—Р" о —С—1Г
II II
О О
Я — радикал спирта, К', Я"— радикалы жирных кислот.
34
Глава 1. Биогенные молекулы
Воска обнаружены у животных, растений и микроорганизмов, в
основном они выполняют защитную функцию. Так, у животных воска
входят в состав секретов желез, которые используются для смазывания
кожи, шерсти и перьев. Растения покрывают восками листья, стебли,
плоды, семена. Насекомые применяют воска для формирования
кутикулы наружного скелета.
В состав воска могут входить высокомолекулярные спирты: цети-
ловый (СН3-(СН2)15-ОН), мирициловый (СН3-(СН2)3(ГОН), л-гекса-
козанол (СН3-(СН2)25-ОН) и др.
СН3-(СН2)30Ч)-СО-(СН2)14-СН3
Мирицилпальмитат
Особое практическое значение приобрели воска животных:
спермацет, ланолин и пчелиный воск.
Спермацет выделяют из черепной полости кашелота. В его составе
преимущественно содержится цетиловый эфир пальмитиновой кислоты
(С15Н31-СОО-С]6Н33). Спермацет хорошо всасывается через кожу и
поэтому применяется в парфюмерии при изготовлении кремов и мазей.
В состав ланолина входят два эфира стерина (ланостерин и агно-
стерин) с остатками жирных кислот (миристиновая, пальмитиновая,
стеариновая и др.).
Пчелиный воск является продуктом функциональной деятельности
желез рабочих пчел. В его состав входят сложные эфиры, свободные
жирные кислоты, свободные высшие спирты, углеводороды и
минеральные соединения. Благодаря такому набору соединений пчелиный
воск обладает пластичностью, кислотоустойчивостью,
водоотталкивающими и электроизоляционными свойствами.
Воска устойчивы к действию света, окислителей и нагреванию.
В медицине они используются для приготовления пластырей, мазей,
кремов и масок для лица.
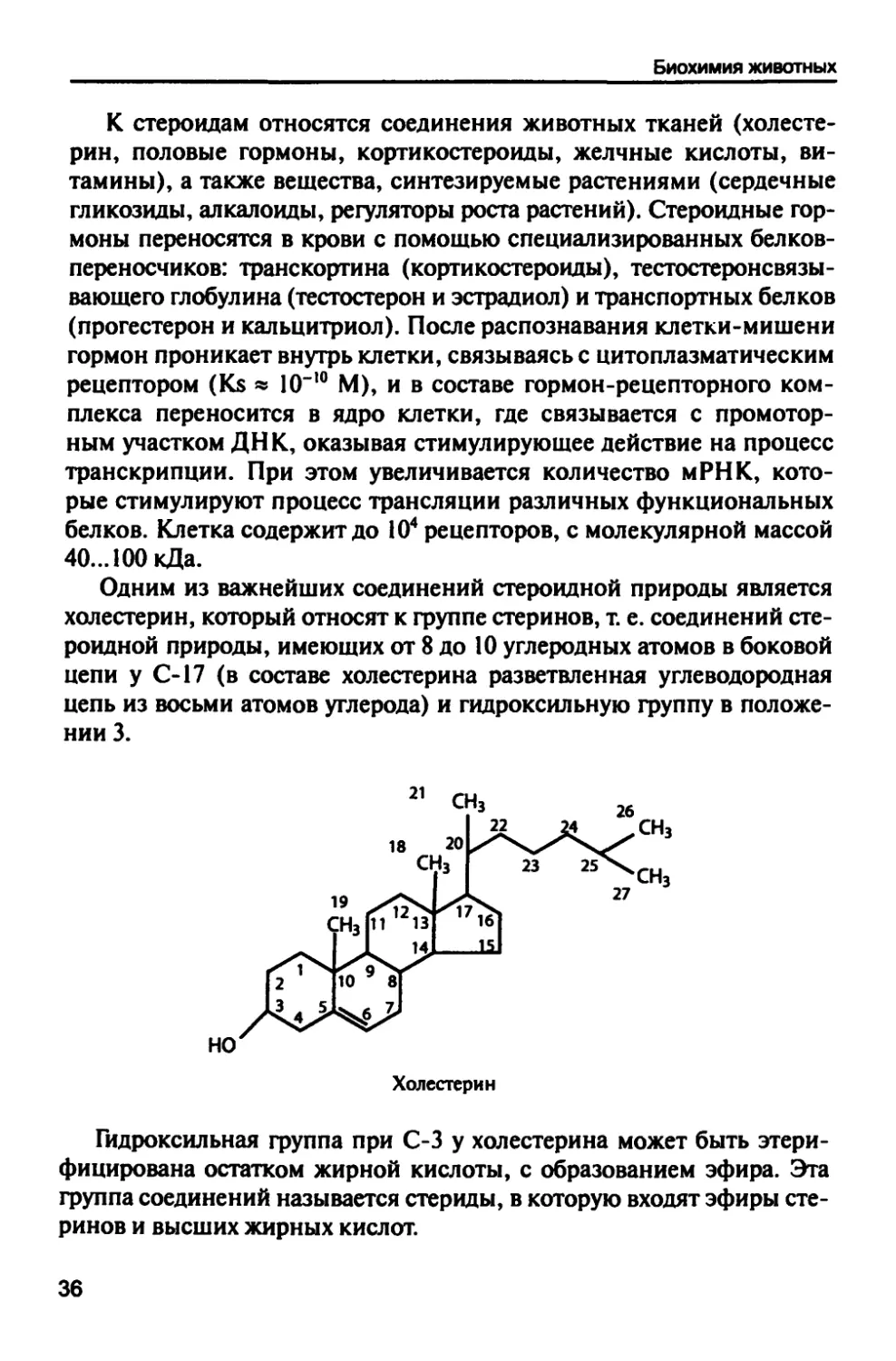
1.2.5. Стероиды
Это группа функционально активных соединений, основным
компонентом которых является пергидрофенантренциклопентан.
35
Биохимия животных
К стероидам относятся соединения животных тканей
(холестерин, половые гормоны, кортикостероиды, желчные кислоты,
витамины), а также вещества, синтезируемые растениями (сердечные
гликозиды, алкалоиды, регуляторы роста растений). Стероидные
гормоны переносятся в крови с помощью специализированных белков-
переносчиков: транскортина (кортикостероиды), тестостеронсвязы-
вающего глобулина (тестостерон и эстрадиол) и транспортных белков
(прогестерон и кальцитриол). После распознавания клетки-мишени
гормон проникает внутрь клетки, связываясь с цитоплазматическим
рецептором (К$ * Ю"!0 М), и в составе гормон-рецепторного
комплекса переносится в ядро клетки, где связывается с промотор-
ным участком ДНК, оказывая стимулирующее действие на процесс
транскрипции. При этом увеличивается количество мРНК,
которые стимулируют процесс трансляции различных функциональных
белков. Клетка содержит до 104 рецепторов, с молекулярной массой
40...100кДа.
Одним из важнейших соединений стероидной природы является
холестерин, который относят к группе стеринов, т. е. соединений
стероидной природы, имеющих от 8 до 10 углеродных атомов в боковой
цепи у С-17 (в составе холестерина разветвленная углеводородная
цепь из восьми атомов углерода) и гидроксильную группу в
положении 3.
Холестерин
Гидроксильная группа при С-3 у холестерина может быть этери-
фицирована остатком жирной кислоты, с образованием эфира. Эта
группа соединений называется стер иды, в которую входят эфиры
стеринов и высших жирных кислот.
36
Глава 1. Биогенные молекулы
Остаток жирной кислоты
Эфир холестерина
Холестерин входит в состав липопротеинов плазмы крови, а в
клетках печени, корковом веществе надпочечников и половых железах
подвергается превращениям в различные соединения стероидной природы.
Кроме того, холестерин может входить в состав мембран клеток и
клеточных органелл, придавая им большую жесткость.
Основным стерином молока является холестерин, который входит
в состав жировых шариков. Содержание стеринов в молоке может
достигать 0,010...0,014 % и обычно составляет 0,2...0,4 % от общего
количества липидов.
1.2.6. Терпены (изопреноиды)
Соединения, в состав которых входит остаток изопрена,
называются терпенами.
СН3
I
н2с = с— сн —сн2
Изопрен
В зависимости от числа изопреновых структур в составе
соединения, терпены подразделяются на следующие группы: гемитерпены
(С5), монотерпены (Сю), секвитерпены (С|5), дитерпены (С2о), сес-
тертерпены (С25>, тритерпены (С3о), тетратерпены (Сад) и
политерпены (С5о и более).
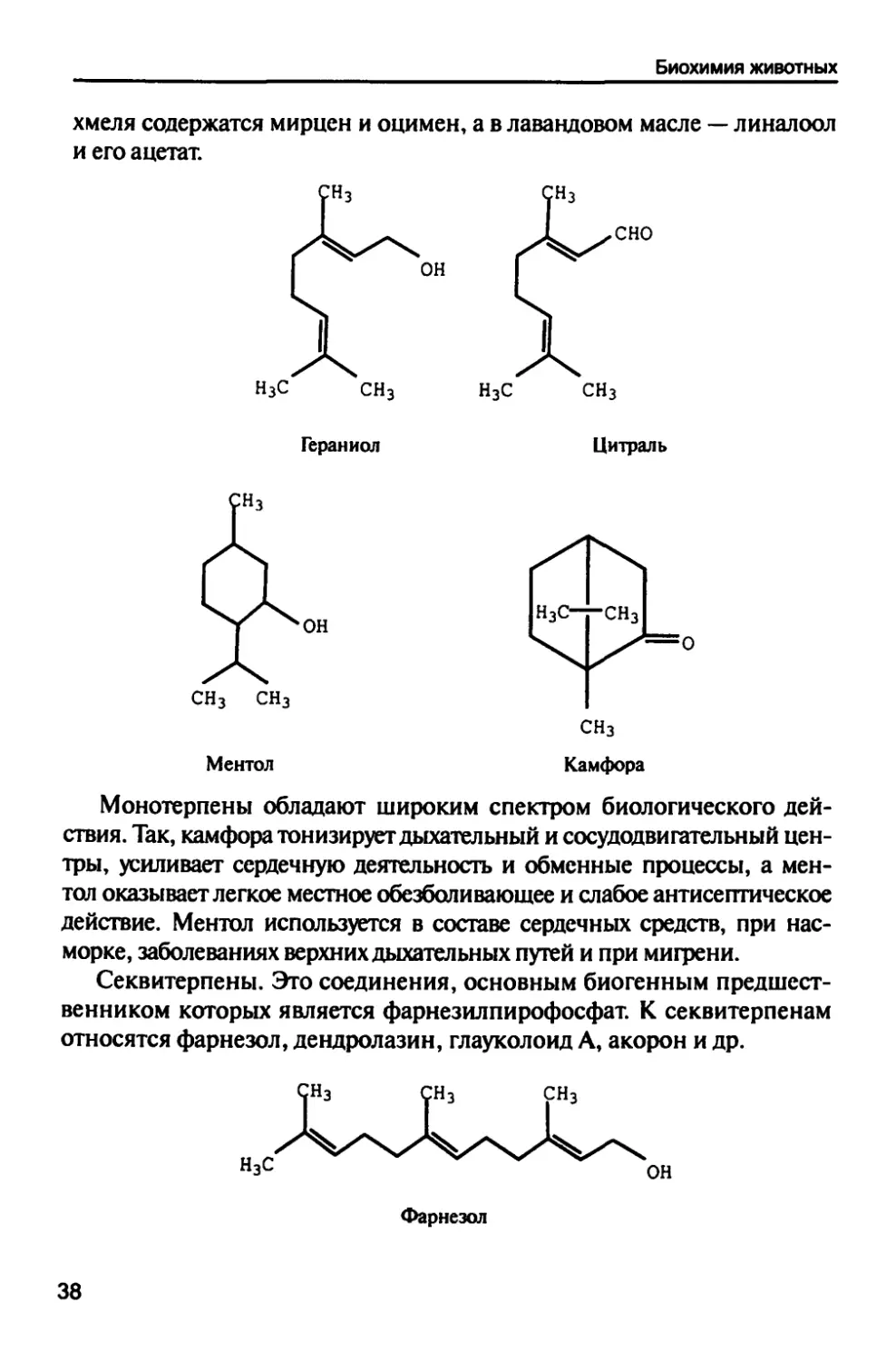
Монотерпены. К монотерпенам относятся: ментол (компонент
мятного масла), гераниол (компонент розового и лавандового масел), цит-
раль (компонент цитрусового масла), камфора (камфорное дерево),
(З)-цитронеллол (компонент эфирных масел розы и герани). В масле
37
Биохимия животных
хмеля содержатся мирцен и оцимен, а в лавандовом масле — линалоол
и его ацетат.
Ментол
Монотерпены обладают широким спектром биологического
действия. Так, камфора тонизирует дыхательный и сосудодвигательный
центры, усиливает сердечную деятельность и обменные процессы, а
ментол оказывает легкое местное обезболивающее и слабое антисептическое
действие. Ментол используется в составе сердечных средств, при
насморке, заболеваниях верхних дыхательных путей и при мигрени.
Секвитерпены. Это соединения, основным биогенным
предшественником которых является фарнезилпирофосфат. К секвитерпенам
относятся фарнезол, дендролазин, глауколоид А, акорон и др.
С.
н3с
;н3
Ч
Фарнезол
сн3
ОН
38
Глава 1. Биогенные молекулы
Дендролазин
Акорон
Кроме того, в состав секвитерпенов входят ювенильные гормоны,
влияющие на метаморфоз насекомых, а также душистые вещества.
Среди секвитерпенов имеются соединения защищающие растения от
болезней.
Дитерпены. К дитерпенам относятся: фитол (входит в состав
хлорофилла и токоферолов), витамин А, абиетиновая кислота, гибберел-
ловые кислоты, цис-озовая кислота и др.
НООС
Абиетиновая кислота
цис-Оэовая кислота
Дитерпены обладают лечебным действием. Так, маноол
используется как противовирусный препарат, а аконитин и атизин проявляют
болеутоляющее и сосудорасширяющее действие.
39
Биохимия животных
Атизин
Т^нтерпены. Сложные по строению природные терпены, в составе
которых 6 остатков изопренов. К производным тритерпенов,
присутствующих в организме животных, относятся сквален и ланостерин.
Тритерпены в значительных количествах содержатся и в растениях.
Так, гликозиды амиринов входят в состав биологически активных
веществ женьшеня и лимонника китайского.
Тетратерпены. В основном являются компонентами желтых и
красных пигментов растений и животных. К ним относятся каротины,
ксантофиллы, ликопины и ксантины.
Политерпены. Они представлены такими природными
соединениями, как каучук (цис-\ ,4-полиизопрен), гуттаперча (трансЛ ,4-полии-
зопрен) и полипренолы. Основным источником каучука является
каучуконосное дерево гевея (Яеуеа Ьга$Шеп$15), а гуттаперчу добывают из
Ра1адшит$ипа.
40
СН3
Каучук
П
Глава 1. Биогенные молекулы
Гуттаперча
Полимерные цепочки каучука отличаются от цепочек гуттаперчи
тем, что в составе каучука от 103 до 104 остатков изопрена, а
гуттаперча содержит всего 102. Кроме того, полиизопреновые цепочки
каучука и гуттаперчи имеют разную конфигурацию. У каучука это
реконфигурация, а у гуттаперчи — транс-конфигурация. Эти различия
обуславливают проявление индивидуальных физических свойств
политерпенов.
1.3. УГЛЕВОДЫ
Углеводами называются вещества органической природы,
основными компонентами которых являются альдегиды и кетоны
многоатомных спиртов, а также полимеры этих соединений. Основными
организмами синтезирующими углеводы являются растения, которые
из С02 и Н20 вырабатывают их в процессе фотосинтеза. В составе
углеводов присутствуют атомы углерода, водорода и кислорода, но
некоторые из них содержат также атомы азота, фосфора и серы.
Основными источниками моносахаридов для жвачных животных
служат полисахариды (крахмал, целлюлоза и клетчатка), которые
образуются из моносахаридов путем их последовательного связывания
в процессах биосинтеза, протекающих в клетках растений.
Расщепление и всасывание полисахаридов происходит в желудочно-кишечном
тракте животных с участием ферментов, обладающих
гидролитической активностью.
В организме животных углеводы служат основными источниками
энергии. Расщепление углеводов в клетках обеспечивает основные
энергетические потребности организма. Входя в состав белков (гликопроте-
ины) и липидов (гликолипиды), углеводы участвуют в формировании
упорядоченных структур мембран клеток, а также выполняют защитную
(иммуноглобулины) и регуляторную (рецепторы мембран клеток)
функции в организме. Кроме того, моносахариды (рибоза и дезоксирибоза)
являются компонентами нуклеиновых кислот (РНК и ДНК),
которые служат основными информационными молекулами живых орга-
41
Биохимия животных
низмов. В комплексе с белками углеводы входят в состав соединительной
ткани. Полисахарид (гликоген) резервируется в печени и мышцах с
целью обеспечения запасного питательного вещества. Гликопротеины, на
поверхности белковой глобулы которых имеются моносахариды,
обладают высокой термоустойчивостью, а также с помощью углеводов белки
защищены от разрушительного действия свободных радикалов.
Поверхностные углеводы способны обеспечивать фиксацию белков в
структурах клеточных мембран. Некоторые углеводсодержащие соединения
являются рецепторами для связывания различных токсинов,
бактериальных клеток, вирусов, гормонов, метаболитов. Гликопротеины
мембран нервных окончаний участвуют в проведении нервного импульса,
а также в связывании некоторых фармакологически активных
соединений. Поверхностные углеводсодержащие биополимеры клеток
участвуют в механизмах межклеточной адгезии, агрегации и морфогенезе.
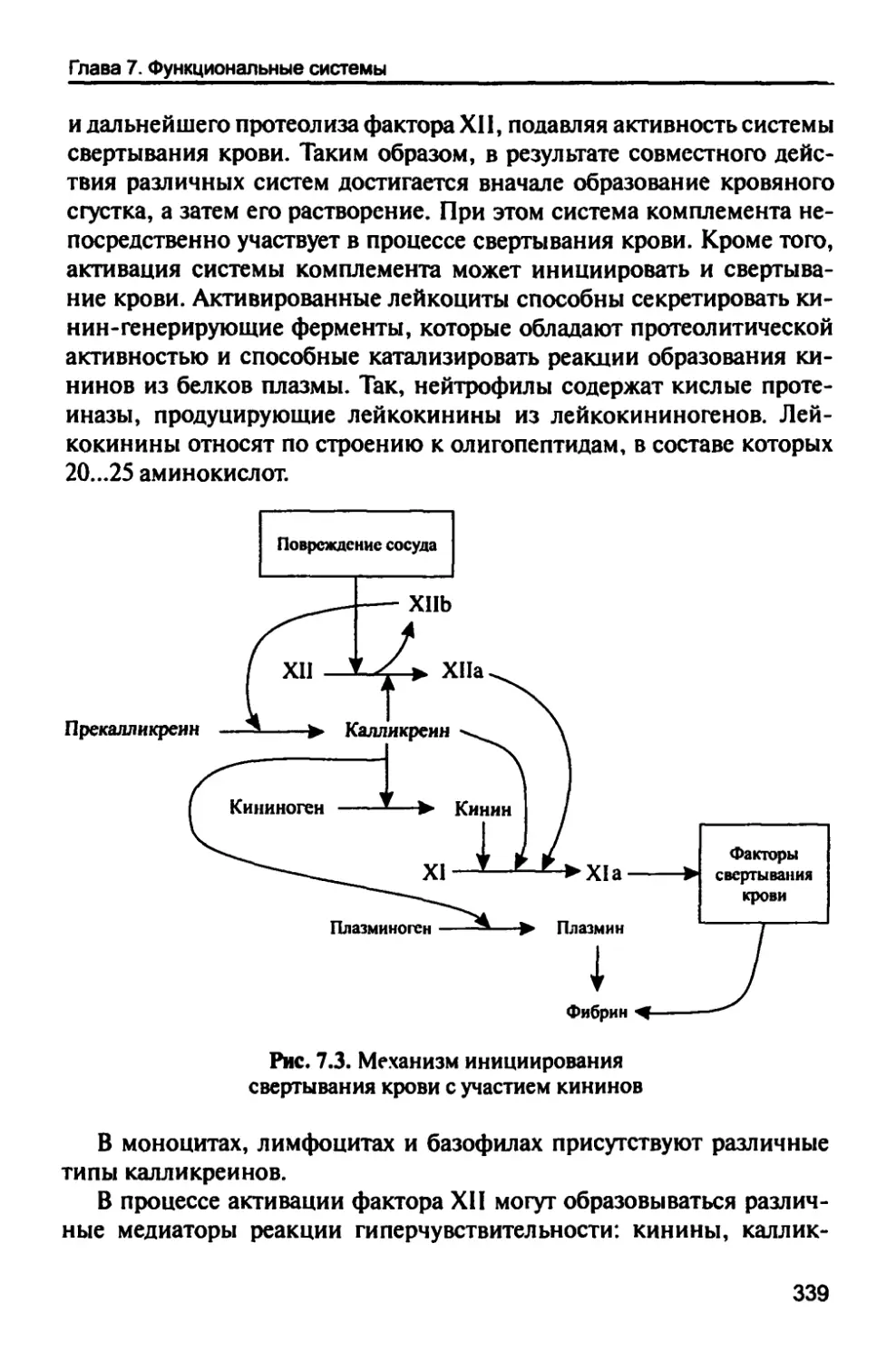
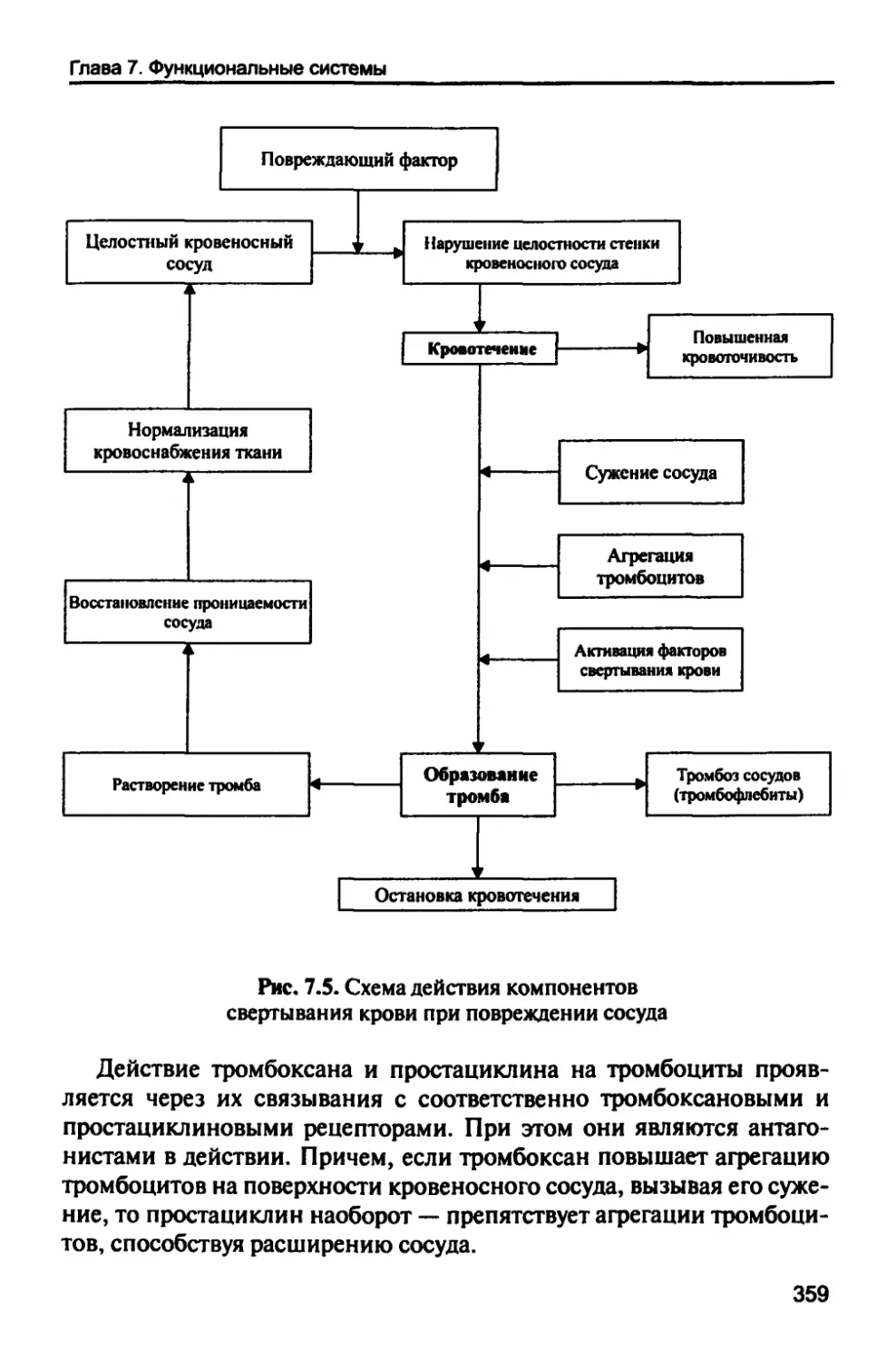
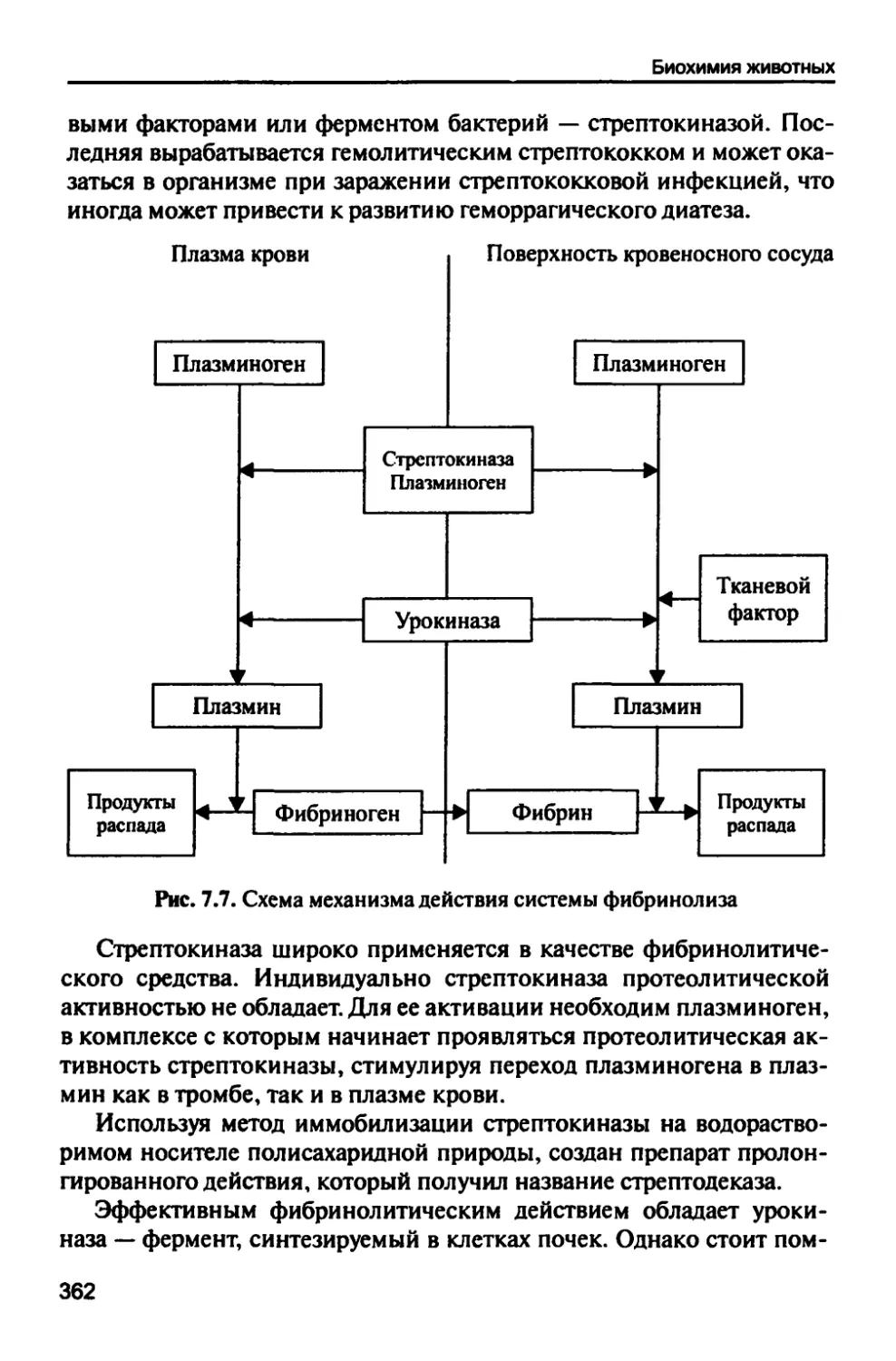
Так, например, гепарин обладает антикоагулянтным действием,
стимулирует фибринолитические системы, выполняет роль антиагреганта.
Гепарин способен нарушать кооперацию Т- и В-лимфоцитов, а
следовательно, препятствовать образованию иммуноглобулинов, ингибировать
систему комплемента, активировать липопротеиновую липазу и
понижать синтез альдостерона, связывать гистамин и активировать гистами-
назу. Полисахариды (целлюлоза, клетчатка), присутствующие в составе
кормов животных, повышают моторику кишечника, способствуют
перемещению пищевого комка по желудочно-кишечному тракту.
Окисление глюкозы и фруктозы в метаболических процессах,
обеспечивает энергетические потребности мышц, предназначенных для
выполнения сократительной деятельности.
Превращение моносахаридов осуществляется в нескольких
метаболических процессах, среди которых наибольшую значимость имеют
гликолиз, пентозофосфатный путь превращение углеводов, а также
гликогенез и гликогенолиз.
Промежуточными продуктами превращения глюкозы в
метаболических процессах могут быть фосфорил ированные производные
моносахаридов (глюкозо-6-фосфат, глюкозо-1 -фосфат, фруктозо-6-фосфат,
фруктозо-1,6-дифосфат, фосфоглицериновый альдегид, фосфодиок-
сиацетон, 3-фосфоглицерат, 1,3-дифосфоглицерат и др.).
Продуктами окисления глюкозы могут быть альдегиды, кетоны и
карбоновые кислоты.
Углеводы условно делят на три группы: моносахариды, олигосаха-
риды и полисахариды (рис. 1.3).
42
Глава 1. Биогенные молекулы
2
*
5
§•
х
ее
°
5
5
с
►
ютных
X
*
►
коген
и
зх
X
Растен
о*
*
§§д
Крахм
Целлюл
етчатка
(кл
§
5
X
в
I
о.
с
X
2
X
оа
о
X
о
о
к
X
я
X
•е-
X
о
о
2
к
о.
I ее
!Р
8
I X
I °
Р
I
^
ьдозы
4
2
м
4>
Н
2
м
НТО
а>
С
Я
л
КСО
и
и
т
<2
43
Биохимия животных
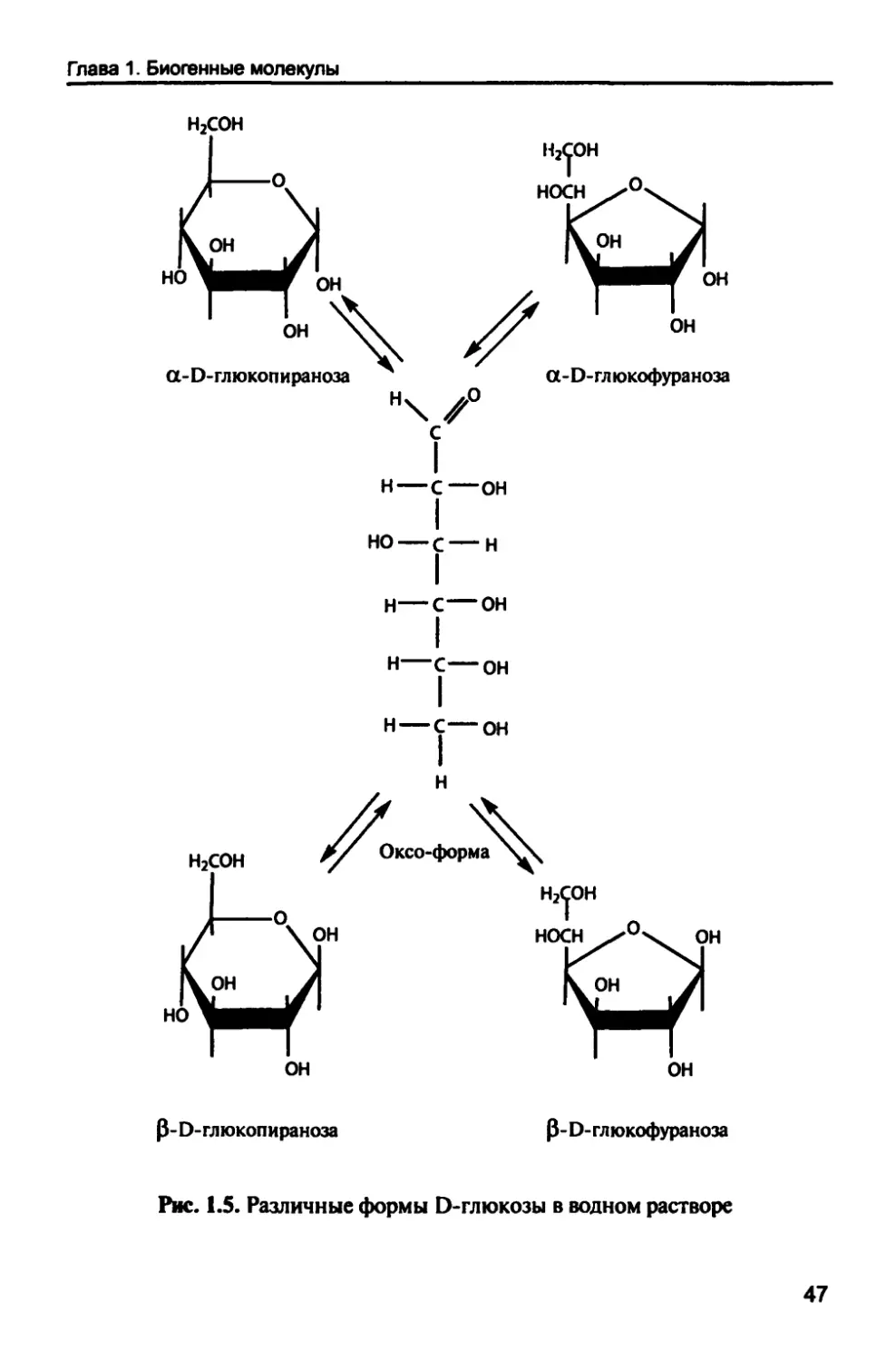
1.3.1. Моносахариды
К группе моносахаридов относят многоатомные спирты,
имеющие в составе альдегидную (К-СНО) или кетонную (К-С=Ю) группу,
которые подразделяются соответственно на альдозы (рис. 1.4, а) и
кетозы (рис. 1.4, б). Большинство моносахаридов имеют
эмпирическую формулу (СН20)я, где п равно или больше трех. В зависимости
от количества в структуре углеродных атомов они делятся на триозы,
тетрозы (С4), пентозы (С5), гексозы (С$) и т. д. Альдозы, в составе
которых 4...7 атомов углерода, имеют 2...5 хиральных атома углерода и
поэтому могут быть представлены в виде нескольких оптически
активных стереоизомеров. Количество стереоизомеров можно
рассчитать следующим обазом: 2л, где п — число хиральных
(асимметрических) атомов углерода.
Все моносахариды существуют в виде двух энантиомерных форм
(О- и Ь-формы), принадлежность к которым определяют по
расположению ОН-групп у последнего хирального атома углерода,
максимально удаленного от атома углерода карбонильной группы.
При этом если ОН-группа располагается при записи справа от
углеродной цепи, то моносахарид относится к Э-ряду, если слева —
к Ь-ряду. В живых организмах в основном встречаются Э-формы
стереоизомеров.
Наличие в составе моносахаридов карбонильной и гидроксильных
групп обуславливает их взаимодействие с образованием циклов фу-
рана или пирана.
с о
Фуран Пи ран
Таким образом, в результате реакции внутримолекулярной
конденсации происходит образование полуацеталя или ацеталя. Так,
например, О-глюкопираноза образуется при взаимодействии
свободной гидроксильной группы при пятом атоме углерода с первым
углеродным атомом, который в результате становится
асимметричным, способным проявить существование двух стереоизомеров (а- и
р-формы). При этом а-О-глюкопираноза и р-Э-глюкопираноза,
называются аномерами, а атом углерода карбонильной группы — ано-
мерным углеродным атомом. Каждая гексоза способна присутство-
44
"§!
о ? ? Т ''
5 5 ^
0 I О I О О «
*-Н-Н-*1-
О X О I '
4Н41!-
■в! т? I
* 4 * '
I I
III
4 йз
5
О
I § I ? 2-1
I I ± О
1
III!
2 Т ? ? '
О—О—О—6—1
*8
-о •
5 5 5 х х
о о о о о о
111111
°1ТГГ,
^515 и
I
О 4
I
0-Л-А-С1--.6-.0 1
XII
и и н ^
- о—о —о—о—о • ^
О I I О
Е
I
О
I
!
|_о—о—о—о *<<■
± ± О
45
Биохимия животных
СН2ОН
С=0
I
неон
неон
сн2он
О-рибулоза
/ \
СН2ОН
I
с=о
I
СН2ОН
Диоксиацетон
I
СН2ОН
I
с=о
I
неон
I
сн2он
О-эрит
СН2ОН
I
с=о
I
носн
I
неон
I
СН2ОН
й-ксилулоза
/ \
СН2ОН
I
с=о
I
неон
I
неон
I
неон
I
СН2ОН
СН2ОН
I
с=о
I
НОСН
I
неон
I
неон
I
скон
сн2он
I
с=о
I
неон
I
носн
I
неон
I
сн2он
сн2он
с=о
I
носн
I
носн
I
неон
I
сн2он
0-псикоза ЕЭ-фруктоза ЕЭ-сорбоза Отагатоза
Рис. 1.4, б. Основные представители кетоз
вать в растворе в виде четырех циклических форм (а- и Р-фураноза
и а- и р-пираноза), которые находятся в динамическом равновесии
с ациклической формой (рис. 1.5).
46
Глава 1. Биогенные молекулы
Н2СОН
Н2СОН
НОСН
ОН
а-О-глюкопираноза
\ /
ОН
а-Э-глюкофураноза
Н2СОН
С
I
н—с—он
I
но—с—н
I
н—с—он
I
н—с—он
I
н—с—он
р/ Оксо-форма \Л^
Н2СОН
Р- О-гл кжопираноза
НОСН.^ч. ОН
он
Р- О- гл кжофураноза
Рис. 1.5. Различные формы Э-глюкозы в водном растворе
47
Биохимия животных
Обычно при написании циклических форм углеводов пользуются
проекционными формулами, предложенными Хеуорсом. Где атомы
углерода в цикле не пишутся, край кольца, расположенный ближе к
читателю, отмечается жирной линией. При этом в действительности шести-
членное пиранозное кольцо не является плоским и вследствие изгибов
его плоскости возникают большое число конфигураций. Однако
стабильными из них являются восемь: 2 типа кресла и 6 типов лодки.
а 0сь
| а Ось а
э • '.
" * ; а \ а
а
Кресло Лодка
Форма кресла обладает значительно более устойчивой конформа-
цией, тогда как форма лодки более подвижна, что обуславливает
существование большего числа вариантов.
Фуранозный цикл может существовать в конформации конверта.
Четыре атома находятся в одной плоскости, а один выступает из нее.
Кроме того, фуранозный цикл может находиться в твист (скрученной)
форме, когда три атома располагаются в одной плоскости, а два
выступают из нее.
Пмкозвды. Образующийся при формировании циклической формы
моносахарида гндроксил, обладает более высокой химической
активностью, чем остальные гидроксильные группы. Участие гликозидного гид-
роксила в химических реакциях сопровождается замещением его атома
водорода на какие-либо радикалы, в результате получаются соединения,
называемые гликозидами, тогда как присоединенный радикал — агли-
коном. Гликозиды относятся к группе биологически активных
соединений, регулирующих обменные процессы в организме животных.
Образование гликозидов может осуществляться при реакции
метилового спирта с глюкозой, результатом которой является
образование метил-Р-О-глюкопиранозид.
48
Глава 1. Биогенные молекулы
При действии уксусной кислоты на р-О-глюкопиранозу,
образуется ацетил-Р-О-глюкопиранозид
сн2он сн2он
0 сн3он н2о
он
±и
ОСНз
р-О-глюкопираноза
СН2ОН
0 СН3СООН Н20
ОН
А^>
Метил-Р-й-глюкопиранозид
СН2ОН
ОСОСНз
Р-Э-глюкопираноза
Ацетил - р- О-глюкопиранозид
Таким образом, в реакциях ацетилирования и метилирования могут
участвовать различные моносахариды. Реакции, протекающие в
присутствии спиртов, фенолов или карбоновых кислот, сопровождаются
образованием О-гликозидов, так как в образовании связи участвует
кислород. Однако существует группа гликозидов, у которых глико-
зидная связь осуществляется через азот, такие соединения относятся
к классу 1М-пшкозидов.
сн2он сн2он
н
I—р
Т^-гликозид (а-форма)
М-гликозид (р-форма)
49
Биохимия животных
Они регулируют процессы расщепления нуклеиновых кислот, нук-
леопротеинов, АТФ, НАД, НАДФ и др.
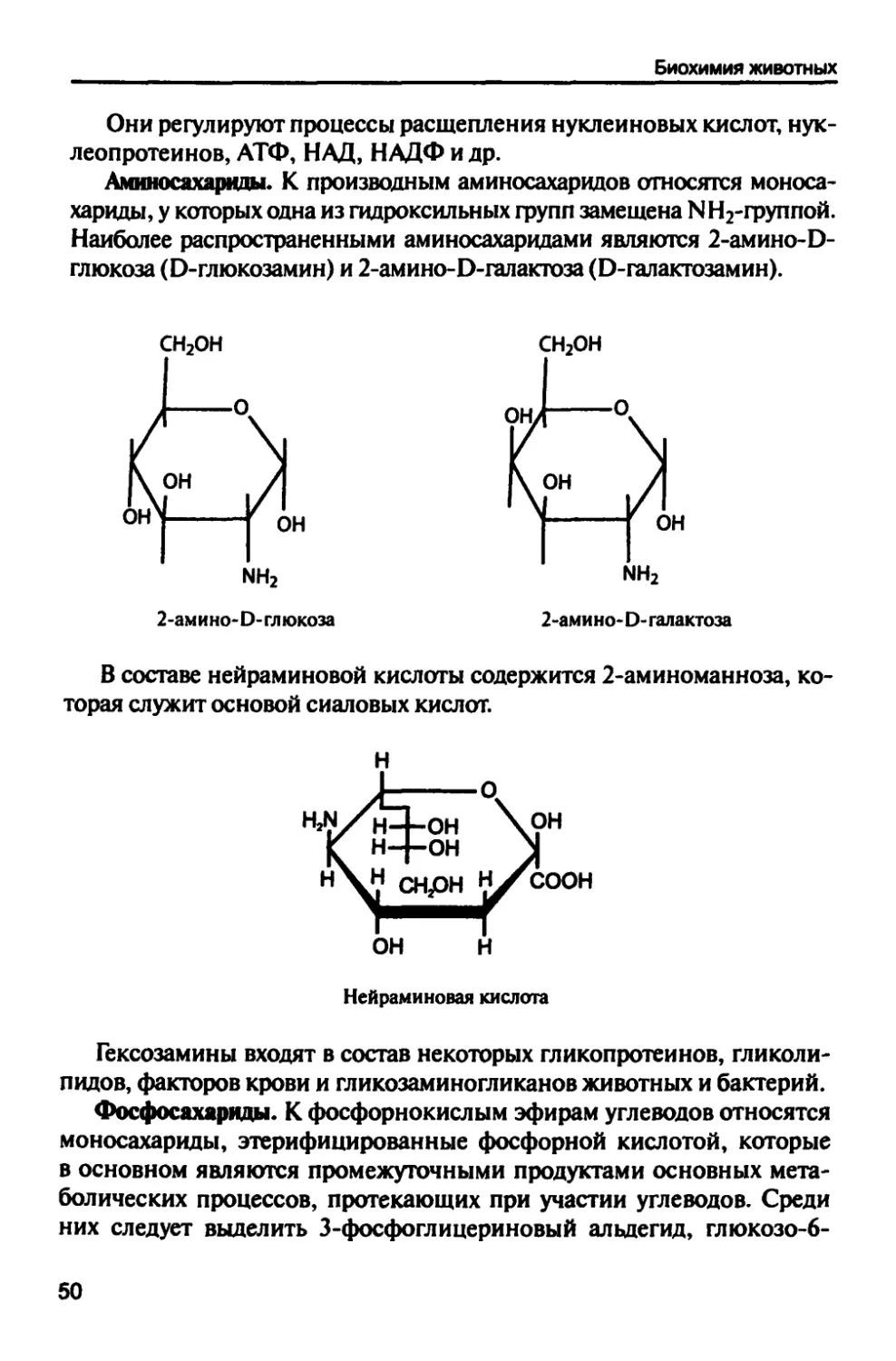
Аминосахарнды. К производным аминосахаридов относятся
моносахариды, у которых одна из гидроксильных фупп замещена NН2-ФУПпой.
Наиболее распространенными аминосахаридами являются 2-амино-Э-
глюкоза (Ь-глюкозамин) и 2-амино-О-галактоза (О-галактозамин).
СН2ОН
СН2ОН
мн2
2-амино- О- глюкоза
ЫН2
2-амино- О- галактоза
В составе нейраминовой кислоты содержится 2-аминоманноза,
которая служит основой сиаловых кислот.
ОН Н
Нейраминовая кислота
Гексозамины входят в состав некоторых гликопротеинов, гликоли-
пидов, факторов крови и гликозаминогликанов животных и бактерий.
Фосфосахариды. К фосфорнокислым эфирам углеводов относятся
моносахариды, этерифицированные фосфорной кислотой, которые
в основном являются промежуточными продуктами основных
метаболических процессов, протекающих при участии углеводов. Среди
них следует выделить 3-фосфоглицериновый альдегид, глюкозо-6-
50
Глава 1. Биогенные молекулы
фосфат, глюкозо-1-фосфат, фруктозо-6-фосфат, фрукгозо-1,6-дифосфат,
рибозо-5-фосфат, фрукгозо-2,6-дифосфат и др.
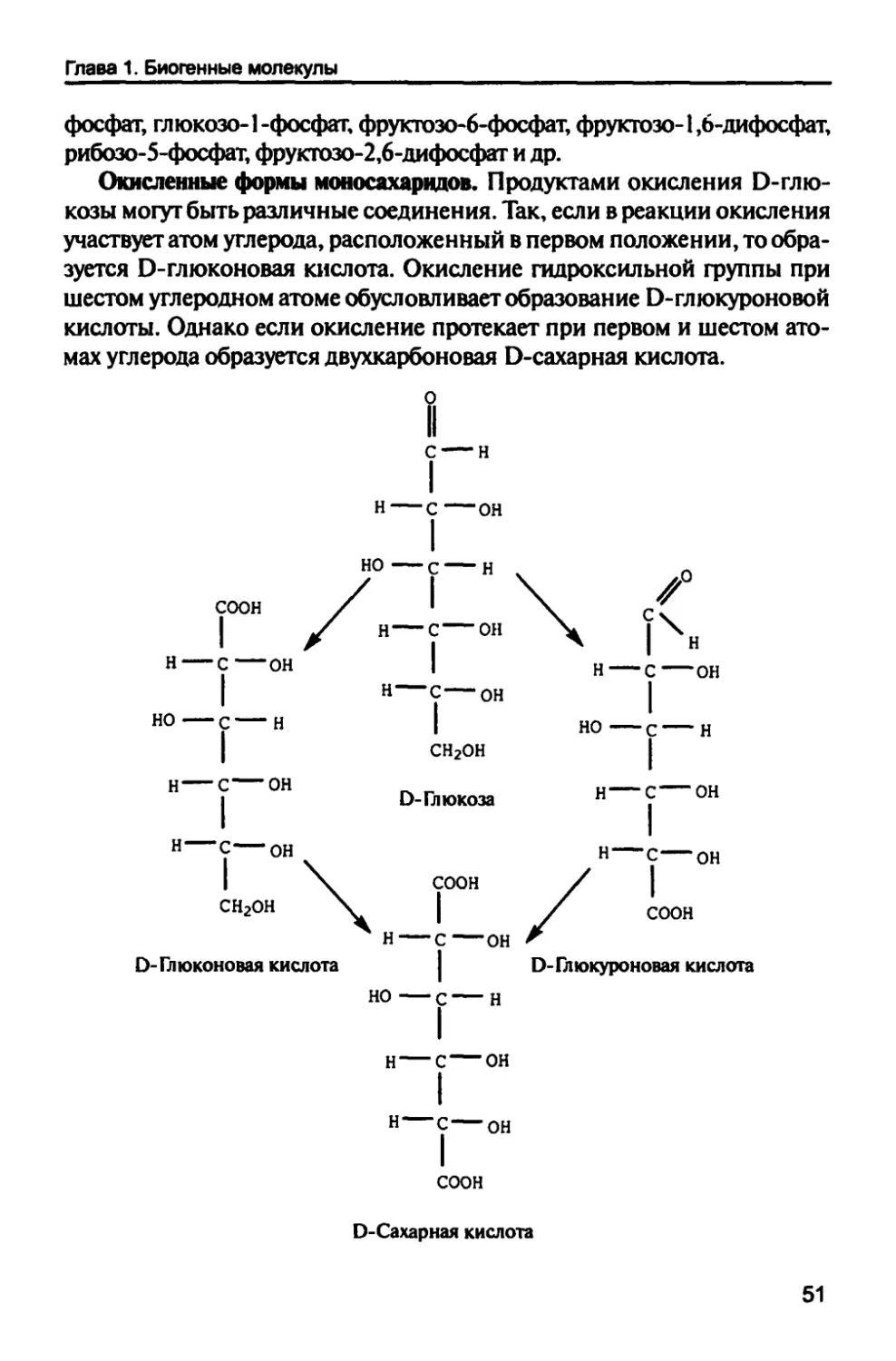
Окисленные формы моносахаридов. Продуктами окисления Э-глю-
козы могут быть различные соединения. Так, если в реакции окисления
участвует атом углерода, расположенный в первом положении, то
образуется О-глюконовая кислота. Окисление гидроксильной группы при
шестом углеродном атоме обусловливает образование Э-глюкуроновой
кислоты. Однако если окисление протекает при первом и шестом
атомах углерода образуется двухкарбоновая Э-сахарная кислота.
о
II
с — н
I
н—с—он
но—с — н
соон / I \ с
[ \ у
■с—он Ч |Чн
н — с—он I н — с—он
| н—с—он |
но—с — н | но—с —н
| сн2он I
Н — С— ОН 0_Гл10КОЗа Н—С—ОН
«—с—он
соон
СН2ОН \ |
■с—он
I
соон
н — с—он
О-Глюконовая кислота Э-Глюкуроновая кислота
но—с—н
I
н—с—он
I
н—с—он
соон
Э-Сахарная кислота
51
Биохимия животных
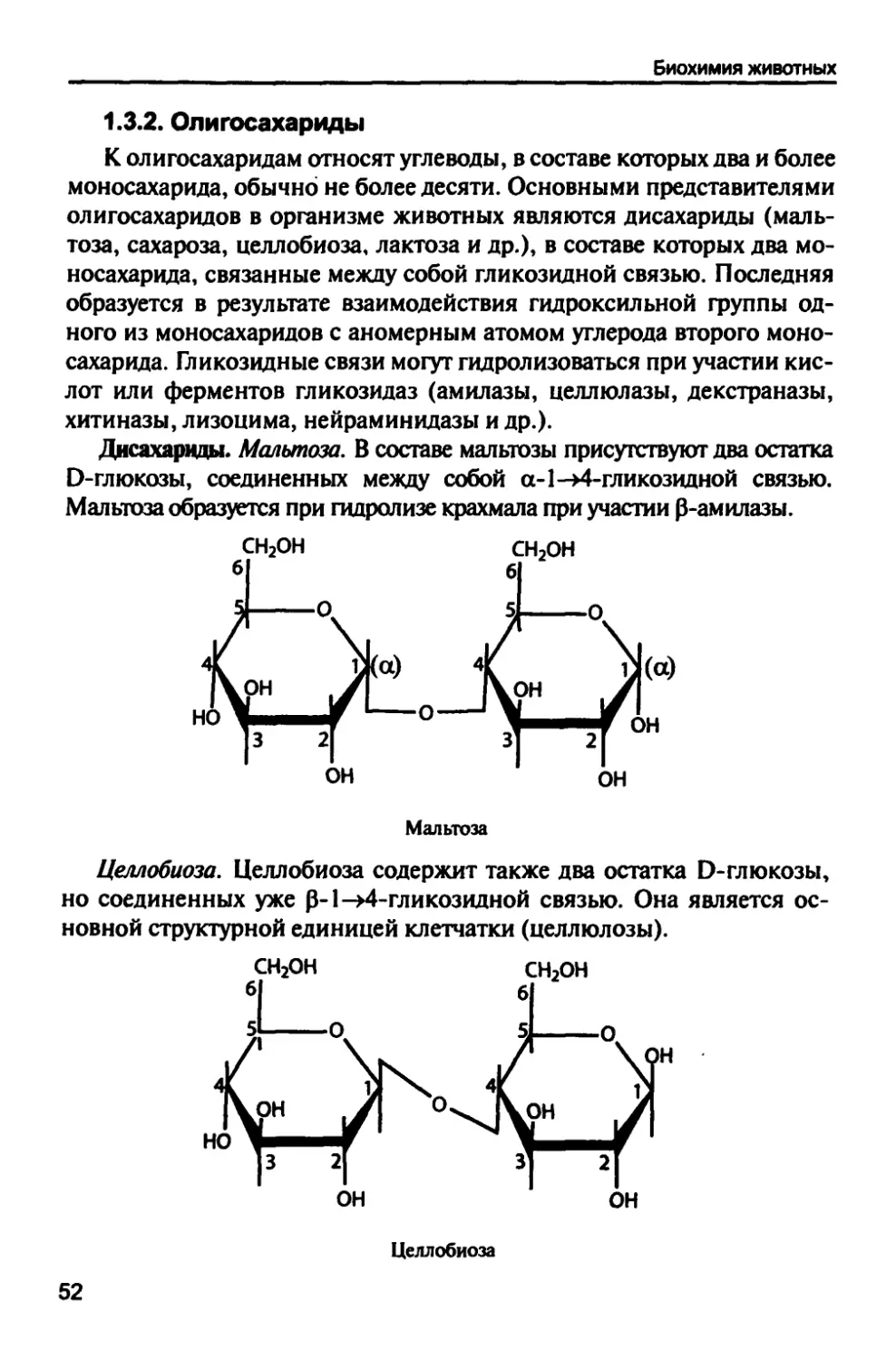
1.3.2. Олигосахариды
К олигосахаридам относят углеводы, в составе которых два и более
моносахарида, обычно не более десяти. Основными представителями
олигосахаридов в организме животных являются дисахариды
(мальтоза, сахароза, целлобиоза, лактоза и др.), в составе которых два
моносахарида, связанные между собой гликозидной связью. Последняя
образуется в результате взаимодействия гидроксильной группы
одного из моносахаридов с аномерным атомом углерода второго
моносахарида. Гликозидные связи могут гидролизоваться при участии
кислот или ферментов гликозидаз (амилазы, целлюлазы, декстраназы,
хитиназы, лизоцима, нейраминидазы и др.).
Дисахариды. Мальтоза, В составе мальтозы присутствуют два остатка
Э-глюкозы, соединенных между собой а-1->4-гликозидной связью.
Мальтоза образуется при гидролизе крахмала при участии р-амилазы.
Мальтоза
Целлобиоза. Целлобиоза содержит также два остатка О-глюкозы,
но соединенных уже р-1->4-гликозидной связью. Она является
основной структурной единицей клетчатки (целлюлозы).
СН2ОН СН2ОН
он он
Целлобиоза
52
Глава 1. Биогенные молекулы
Сахароза. В составе молекулы сахарозы содержатся остатки двух
гексоз: О-глюкозы и О-фруктозы. Гидролитическое расщепление
сахарозы катализирует сахараза (инвертаза), локализующаяся в
эпителиальных клетках тонкого кишечника.
сн2он
он он
Сахароза
О-Фруктоза почти в 2,5 раза слаще, чем О-глюкоза. Используя
методы колоночной хроматографии, во многих странах организовано
промышленное производство фруктозы, которое основано на
использовании глюкозоизомеразы (фермент иммобилизуется на
нерастворимом носителе, катализирует обратимую реакцию изомеризации).
О-глюкоза <-> О-фруктоза
Полученный продукт (О-фруктоза) может быть использован в
пищевой промышленности при производстве безалкогольных напитков
и мороженого.
Лактоза. Основным углеводом молока является дисахарид
лактоза, которая вырабатывается клетками молочной железы
млекопитающих. В коровьем молоке содержится 4...5,5% лактозы. В составе
лактозы молекулы а-О-глюкозы и р-О-галактозы связаны между
собой р-1,4-гликозидной связью
сн2он сн2он
1—Г"
он он
Лактоза
53
Биохимия животных
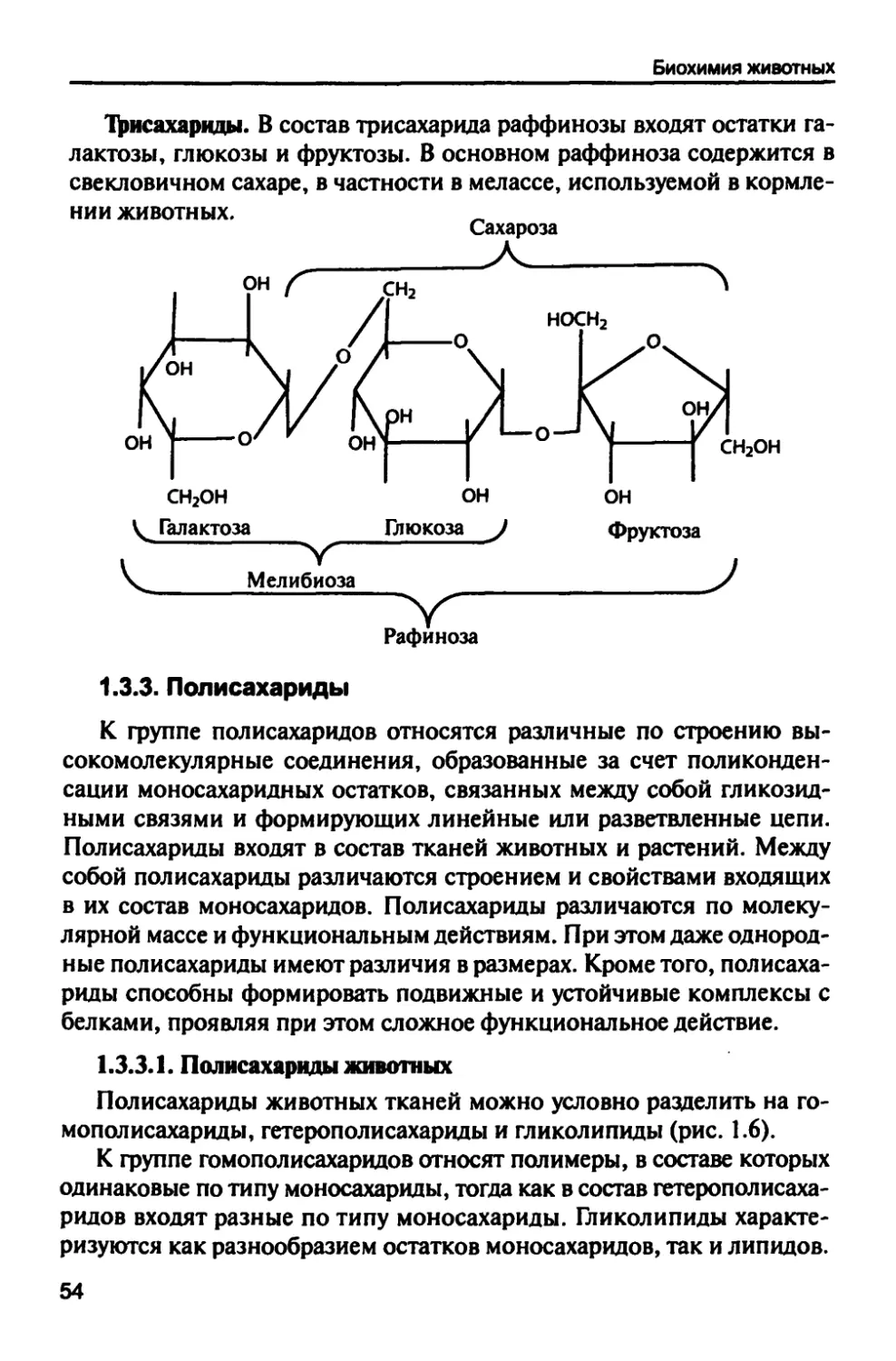
Т^исахариды. В состав трисахарида раффинозы входят остатки
галактозы, глюкозы и фруктозы. В основном раффиноза содержится в
свекловичном сахаре, в частности в мелассе, используемой в
кормлении животных. Л
Сахароза
носн2
сн2он
Рафиноза
1.3.3. Полисахариды
К группе полисахаридов относятся различные по строению
высокомолекулярные соединения, образованные за счет
поликонденсации моносахаридных остатков, связанных между собой гликозид-
ными связями и формирующих линейные или разветвленные цепи.
Полисахариды входят в состав тканей животных и растений. Между
собой полисахариды различаются строением и свойствами входящих
в их состав моносахаридов. Полисахариды различаются по
молекулярной массе и функциональным действиям. При этом даже
однородные полисахариды имеют различия в размерах. Кроме того,
полисахариды способны формировать подвижные и устойчивые комплексы с
белками, проявляя при этом сложное функциональное действие.
1.3.3.1. Полисахариды животных
Полисахариды животных тканей можно условно разделить на го-
мополисахариды, гетерополисахариды и гликолипиды (рис. 1.6).
К группе гомополисахаридов относят полимеры, в составе которых
одинаковые по типу моносахариды, тогда как в состав гетерополисаха-
ридов входят разные по типу моносахариды. Гликолипиды
характеризуются как разнообразием остатков моносахаридов, так и липидов.
54
2
я
§
си
о
§
С
К
5
а
■е-
55
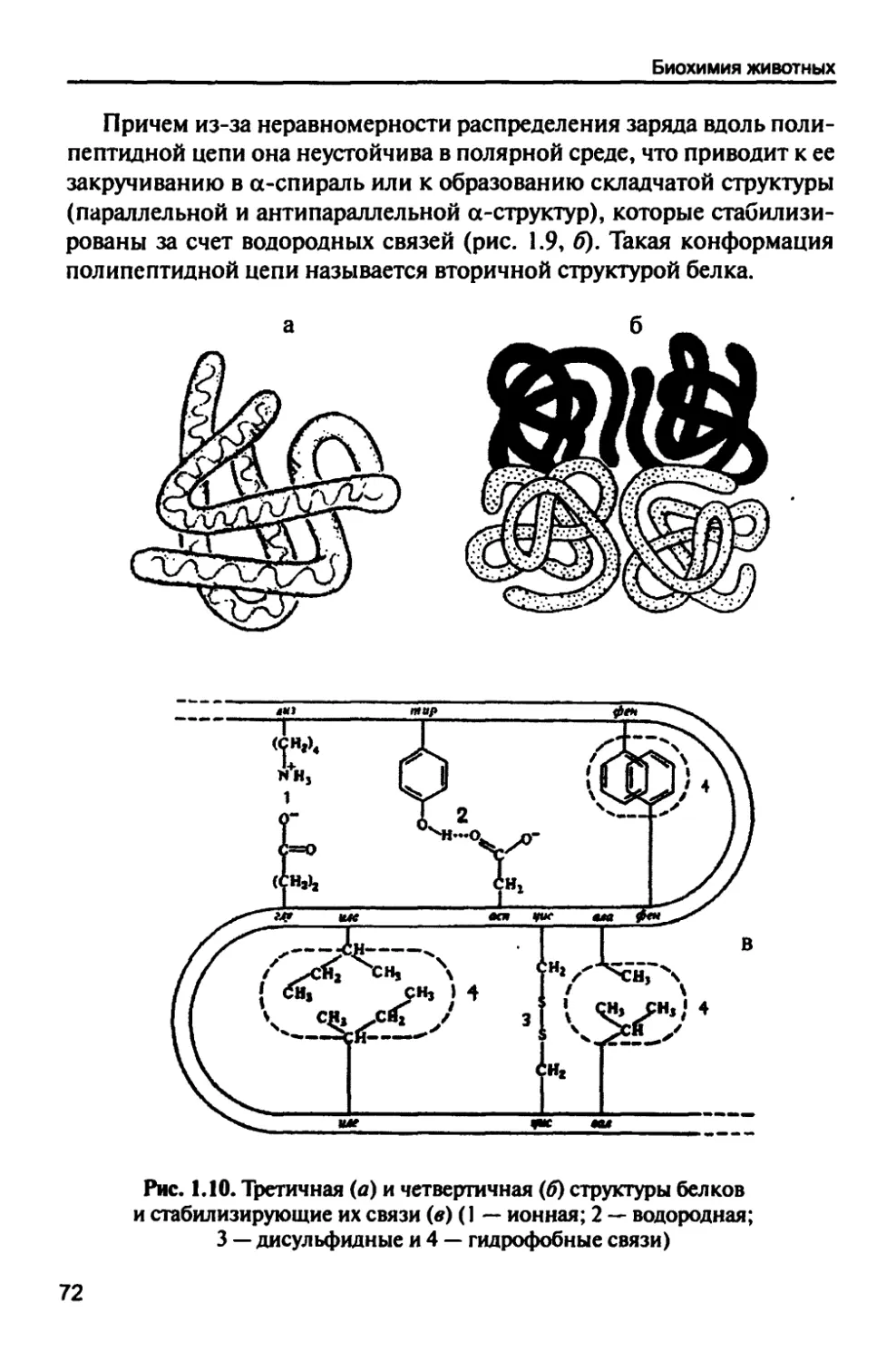
Биохимия животных
1.3.3.1.1. Гомополисахариды
Сшкоген. Основной полисахарид животных, резервируется в
клетках печени и мышцах, однако содержание гликогена у разных видов
животных может сильно различаться. Гликоген представляет собой
полисахарид с разветвленной структурой, состоящей из последовательно
связанных между собой в линейные структуры остатков О-глюкопира-
нозы (за счет а-1,4-гликозидных связей, а также в точках ветвления —
<х-1,6-связей). У гликогена одна связь <х-1,6-типа приходится на 8... 12
остатков Э-глюкопиранозы (рис. 1.7). Молекулярная масса гликогена
может достигать до 108 Да. При кислотном гидролизе выявляются в
основном а-О-глюкоза, а-мальтоза и а-изомальтоза.
6 а-1,6-Свяэь
СН,
] СН, СН,ОН
1ы °Н Св^ь °"
Внутренние
ветви
Рис. 1.7. Строение молекулы гликогена
Хитин. Полисахарид, встречающийся в организме беспозвоночных
животных, в основном у членистоногих, а также в грибах. Хитин
служит основой для построения наружного скелета ракообразных и
насекомых. Первичная структура полисахарида формируется из
последовательно связанных между собой р-1 -> 4-гликозидными связями
остатков N-ацетил-Б-глюкозамина.
56
Глава 1. Биогенные молекулы
N -ацетилглюкозами н N -ацетил глюкозами н
Фрагмент молекулы хитина
1.3.3 Л .2. Гетерополисахариды
К этой группе полисахаридов относятся представители гликозами-
ногликанов, которые подразделяются на две группы: кислые и
нейтральные (рис. 1.6).
В состав кислых гликозаминогликанов входят остатки глюкозамина
или галактозамина. В организме животных гликозаминогликаны
образуют комплексы с белками, формируя высокомолекулярные
структуры, называемые протеогликаны, которые входят в состав
межклеточного матрикса соединительной ткани.
Нейтральные гликозаминогликаны содержат в своем составе глю-
козамин, галактозу, маннозу и Ь-фукозу, а также нейраминовую
кислоту, в виде Т^-ацетилнейраминовой кислоты, называемой сиаловой
кислотой.
Н
СИз-СО-Ш
ОН Н
Сиаловая кислота
Сиаловая кислота участвует в механизме действия компонентов
иммунитета и в функционировании клеточных мембран,
определяется в плазме и клетках крови.
57
Биохимия животных
Нейтральные гликозаминогликаны входят в состав клеток
слюнных и пищеварительных желез, а также клеток покровного эпителия
полости носа, трахеи, шейки матки.
1.3.3.1.3. Гликолипиды
К группе гликолипидов относятся различающиеся по строению и
свойствам соединения, в составе которых один или несколько
остатков моносахаридов соединены (3-гликозидной связью с гидрофобной
частью остатка липидной молекулы. В качестве углевода могут быть
преимущественно остатки глюкозы и галактозы, их сульфатирован-
ные производные (галактозилсульфат, глюкозилсульфат), аминосахара
(галактозамин, глюкозамин и их 14-ацетильные производные) и сиало-
вые кислоты (Ы-ацетилнейраминовая кислота). Липидный компонент
гликолипидов в основном представлен остатками диацилглицерина или
церамида, которые содержат остатки жирных кислот с 16...22
углеродными атомами. Гликолипиды являются компонентами плазматических
мембран клеток, но их состав индивидуален для каждой функциональной
системы. При этом гидрофобный остаток липида в составе гликолипидов
определяет локализацию соединения в структуре плазматической
мембраны, а гидрофильный остаток углевода — его функциональную
принадлежность. Гликолипиды участвуют в формировании антигенных
химических маркеров клетки и в процессах клеточной дифференциации.
Кроме того, они способны регулировать процессы роста нормальных
клеток, а также обеспечивать и проявлять действие биологически
активных соединений (токсинов, гормонов, интерферонов и др.) и вирусов.
Гликолипиды, в составе которых остаток диацилглицерина связан
гликозидной связью с остатком моно-, ди- и трисахарида, называются
гликоглицеролипиды. о
—(/ЧЛЛААЛЛА
Моногалактозиллиацилглицерин
(3-0-галактопиранозил-1-пальмитоил-2-олеоил-5п-глицерин)
58
Глава 1. Биогенные молекулы
СН2503Н
/ЧЛЛЛЛЛЛЛЛЛ
Г П ги_
■сн2
Сульфохиновозилдиацилглицерин
(6-сульфо-сс-0-хиновопиранозил-( Г-*3')-!', -стеароил-2'-олеоил-8п-глицерин)
Гликоглицеролипиды содержатся преимущественно в листьях
растений, являясь основными липидами хлоропластов.
В составе гликолипида могут быть остатки фосфорной кислоты.
Такие соединения называются гликоглицерофосфолипиды.
/\ЛЛЛ=/ЧАЛА/
сн2 сн2он
о—сн о не—о
I II I
» н2с — о—р— о— сн2
он
Фосфатидилглюкозаминилглицерин
(3-8п-фосфатил-Г-(2-0-глюкозаминил)-8п-глицерин)
Фосфоросодержащие гликолипиды обнаружены в основном в
бактериальных клетках.
Среди гликолипидов определяется группа соединений,
называемых гликосфинголипидами, в составе которых остаток углевода
соединен р-гликозидной связью с концевой гидроксиметильной
группой церамида.
Простейшими представителями гликосфинголипидов являются
моногексозилцерамиды (церебразиды), содержащие только один
остаток моносахарида (глюкоза или галактоза). Основным моногексо-
зилцеребразидом мозга животных служит галактоцеребразид.
59
Биохимия животных
но-сн'^Ч/Ч/ЧА/Ч/Ч/
Галактоцеребразид
(I -р-О-галастозилпиранозил-Ы-нервоноилсфингозин)
Церебразиды можно обнаружить в тканях животных, растений и
в микроорганизмах.
Более сложное строение имеют гликосфинголипиды с олигосаха-
ридной цепью, в составе которой О-галактоза, О-глюкоза, й-галак-
тозамин, О-глюкозамин, Ь-фукоза (6-дезокси-Ь-галактоза) и сиало-
вая кислота. Гликосфинголипиды, имеющие такой состав углеводов,
называются гликозилцерамидами. Они встречаются в плазматических
мембранах клеток мозга, селезенки, эритроцитов, почек и печени.
Наиболее сложными по строению гликосфинголипидами являются
соединения, содержащие один или несколько остатков сиаловой
кислоты в составе олиго- или полисахаридных цепей. Они называются
ганглиозидами. В углеводный фрагмент ганглиозидов входят гексозы
(глюкоза и галактоза) и гексозамины, преимущественно М-ацетилга-
лактозамин.
Основным местом локализации ганглиозидов являются
плазматические мембраны клеток животных. При этом церебразиды и ганглиозиды
обычно располагаются на внешней поверхности плазмалеммы.
Ганглиозиды способны связывать токсины, функционально активные вещества,
участвуют в формировании упорядоченных клеточных структур,
выполняют роль рецепторов, обеспечивают работу транспортных систем
мембран клеток. Больше всего ганглиозидов содержится в сером веществе
мозга млекопитающих, а также в почках, селезенке, печени, легких.
Содержание нейраминовых кислот в крови возрастает при опухолях
головного мозга, инфаркте миокарда, туберкулезе, лейкемии,
лимфогранулематозе, нефрозе, остеомиелите. Кроме того, увеличение
концентрации свободной нейраминовой кислоты в организме отмечается при
поражении паренхимы печени и деструкции соединительной ткани.
60
Глава 1. Биогенные молекулы
Галактоза
Глюкоза
сн,он
^"^^ о—сн?—сн—сн-
Сфиигозин
NN ОН
I
С =0
I
N-ацетил нейрам и новая кислота
Гематозид (ганглиозид)
1.3.3.2. Полисахариды растений
В листьях растений содержатся хлоропласты, обладающие
фотосинтетической активностью, в результате которой при участии света
из С02 и Н20 происходит синтез углеводов. В ферментативных
реакциях трансгликозилирования в растениях синтезируются различные
полисахариды (крахмал, инулин, целлюлоза). Полисахариды
растений важны не только для растительного организма, но и являются
основными компонентами кормов животных.
Крахмал. В растениях крахмал присутствует в виде крахмальных
зерен, различающихся по химическому составу и свойствам. В
основном крахмал накапливается в семенах пшеницы, овса, гречихи, риса,
кукурузы, а также в клубнях картофеля.
Крахмал гетерогенен по составу полисахаридов, которые
различаются по физико-химическим свойствам и представлены двумя типами:
амилоза и амилопектин. В составе амилозы остатки а- Э-глюкопираноз
связаны между собой <х-1->4-гликозидными связями в линейную
полимерную цепь. Амилоза легко растворяется в теплой воде, образуя слегка
вязкий раствор. Молекулярная масса амилозы равна 3-105... 106 Да.
СНзОН СН20Н СН20Н
он он
Участок полисахаридной цели амилозы
_]у Д_0_
61
Биохимия животных
Амилопектин при растворении в горячей воде образует вязкий
коллоидный раствор. Остатки Ь-глюкозы связаны в линейные структуры
не только за счет формирования а-1,4-гликозидных связей (в точках
ветвления образуются а-1,6-связи).
сн2он
сн2он
н2с—о—'
_]у уь0-]у И—о—
он он
Фрагмент структуры амилопектина
Инулин. Полисахарид, содержащийся в клубнях земляной груши
и георгина, в корнях одуванчика, цикория, артишоков. Полимерная
цепочка инулина формируется из остатков Э-фруктозы, которые
связаны между собой 2-И -связями через метиленовую (-СН2) группу.
Полифруктозид может содержать в небольших количествах
остатки глюкопираноз и способен легко гидролизоваться под действием
разбавленных кислот.
I
носн2
носн2
Фрагмент структуры инулина
62
Глава 1. Биогенные молекулы
Целлюлоза (клетчатка). Полисахарид, служащий основным
компонентом клеточных стенок растений. Полимерная цепочка целлюлозы
формируется из последовательно связанных за счет гликозидных (5-1->4-связей
остатков (З-О-глюкопираноз. Молекулярная масса целлюлозы из разных
растений сильно варьируется и в максимуме может достигать « 2-106 Да.
Участок полисахаридной цепи целлюлозы
По данным рентгеноструктурного анализа молекулы клетчатки
имеют нитевидную форму, образующую структуры в виде фибрилл,
в составе которых 40...60 молекул. Прочность структуры
обеспечивается за счет водородных связей, в образовании которых участвуют
атомы водорода гидроксильных групп клетчатки, а также
адсорбированные клетчаткой молекулы воды (рис. 1.8).
У
Н*
ноЧ
ноЧ
.*
/
г-
У-о:
у
ХН
^°\
*
-он ноЧ
Кон ноЧ
■он но-| У *^о-и
I 2* *
I ' >Г
У^*Н
- #
Нон
Нон
Нон
А Б
Рис. 1.8. Структура обезвоженной (А) и увлажненной {В) клетчатки
63
Биохимия животных
Расщепление целлюлозы в желудочно-кишечном тракте
травоядных животных происходит при участии ферментов целлюлаз,
вырабатываемых преимущественно микроорганизмами рубца.
В организме других млекопитающих целлюлоза не расщепляется
и в основном выполняет функцию стимулятора моторики
кишечника.
1.4. АМИНОКИСЛОТЫ
Аминокислотами являются низкомолекулярные органические
соединения, относящиеся к группе карбоновых кислот (К-СООН),
в составе которых присутствует аминогруппа (-Ы Н2). Общая формула
а-Ь-аминокислот следующая
К-СН(ЫН2)-СООН
В природе встречается около 300 различных по строению
аминокислот. В состав белков входят 20 разновидностей аминокислотных
остатков. Все они относятся к а-Ь-формам аминокислот, у которых
в а-положении располагается аминогруппа (табл. 1.4). Согласно
строению эти аминокислоты можно условно разделить на три группы:
гидрофобные (аланин, валин, лейцин, изолейцин, фенилаланин, ме-
тионин, триптофан, пролин), полярные незаряженные (глицин,
серии, треонин, тирозин, цистеин, аспарагин, глутамин) и заряженные
(лизин, гистидин, аргинин, аспарагиновая и глутаминовая кислоты)
(табл. 1.5). Из них восемь аминокислот не синтезируются в организме
некоторых животных и человека и поэтому называются
незаменимыми (валин, лейцин, изолейцин, фенилаланин, триптофан, мети-
онин, треонин, лизин), две аминокислоты хотя и образуются в
организме, но в недостаточном количестве (аргинин, гистидин). Для
животных состав незаменимых аминокислот может варьироваться
в зависимости от вида.
64
I
3
сч
X
и
см
X
и
1
о\
о\
о
^^
сч
X
г
х
и
СЧ
X
и
сч
X
и
ел
X
о
8
X
и
\
/
21
и
х
х
8
и
I
I I
I
<Г
I
X
X
ее
•е-
о
н
С
5
5 1
е I
х
я
3
и
х
о
о
о
I
сч
X
2
сч
X
о
I
и
о
о
х
\
//
ОХ
сч
X
2
X
и
сч
X
и
гч
X
и
'гч
X
и о
II О
о о
х
о
о
и
гч
X
2
X
и
сч
X
и
сч
X
и
8
з.
*
о?
о
X
00
X
X
г*
2 *
б 2
65
&
1 т
1 1
1 & *
1 к к о
§2|
5 *
1 ч
8 Бо§о
1 с х ^5 2
|<21-ъ&
1 *■*
1 е*
Гидро-
фоб-
ность
1 •
8 9
енетич
кийке
1
№
1 °*
1
<**
X
1
1
5
о
о
1
Условное
обозначение
Название
"Я
*:
°
5
5
*
-1
2
ев
8
ю
1
л
1 «
Слегка
сладки
сС
^
Сч
гм
гм
40
^2
8
чО
оо
оо
оо
<->,ч
о о
1
***
оо
°^
»п
ГО
гм*
< 1
ее
3
X
X
ее
1 1
1*
1 ^
1 *
3
Г
1 ~~
г*Г
*/">
го
гм
00
оо*
ЧО
оч
»гГ
гм
ОО
Э^
оо
=>4
^Ч
оо
1
Ч"
г^
оС
еэч
гм
гХ
> 1
2
X
5
со
К я
1 Я ^
1 & *
<ч
со
ГО
о\
см
гм
о
04
о*
! оо
04
»п
оо
го"
о о о
э 2 э
Г) ОО
< э 4
^^г^
эо^
1
Ч"
г*
о\
со
го
см*
и
к
я
3
>х
1 5
1 *
1 -°
г
гч
го
оо
^
гм
гм
го
гм
гм*
гм
о
чО*
о
2 ^
э
<
1
чО
г^
оС
гм
СО
гм"
—
—
5
2 х
1 с*
1 *
0>
о
гч
ЧО
^
00
гм
гм
чО
оч
гм"
00
"*
**">
гм"
о
и
~>
э
1
щшЛ
го
С5Ч
о
гм
гм
п.
1
(
се
в;
X
X
е
«с
X
о.
в
X
!^ 1
X
ее
ем
1 я
к ^
1 *
I
ГМ
з
гм 1
ГО 1
о\
гм
9
*ИЧ1 1
""* 1
оч 1
оо 1
«Л 1
1
о
1
*"* 1
** 1
оС 1
^ 1
"*
гм" 1
^
■*
1 1
5 5
«о
2Г
табли
ние1
«
1
«г
&
м
5-к 3
5 * о
|«1
• к
н I ву
§ 1°
и 2 X й 1
« 8 й ? а
Ри о. >Ь
нн
о»
И1
Генетический код
3
О.
*
1
ГЧ
X
1
к
о
о
1
Условное
обозначение
2 з
X
«1
Слег
горь
°!
оС
2
ГО
оо
гм
«л
гм
00
1 ГО
го
<*•
г^
»Л>
Оч
о
<
1
оо
гм
о\
го
"^
гм"
5
1
О
Мет*
| НИН
*
к
*
Г
м
<гГ
~
о
гм
гм
1П
гм
о
го
ЧО
1 О
ГО
ЧО
^
1
и о
о о
э*
о и
1
1
ЧО^
о
ич
о\
си
1
X
X
о.
с: |
3
рные аминокислот
эХ
*
3
1 ^^
г^
ГМ
ЧО
гм
гм
о
го^
гм
г^
Оч
»о
та-
о
1
ио
о о
О О
=* и"
1
1
00
оС
*л
го
гм'
о
>>
о
х
3
|5
>Х
Л X
* *
3|
__
*лГ
о
00
гм
гм
1Л>
гм
гм
00
ЧО
<п
00
о
1
о и о
ээК
1
гм
оС
Оч
"™1
гм'
00
X
5
о.
и |
>Х
ее 5
\б 5
~~
о\
ГО
*п
гм
1Л>
гм
о
о
о
гм
ЧО
ЧО
г^
о
1
и о
^
=>\<
**
1
1
о
оС
о\
°-
гм'
ь |
-С
X
х
1 1
Беев
НЫЙ
гм
1 —
00
о
о\
гм
0,04825
ЧО
ЧО
»г>
| го^
т
и
3
о
3
чО
о
гм
о\
о
*ч
гм'
>- 1
*
X
со
1 1
1
°*
*-*"
ш
00
г^
о.
><
о
г-*
■ о
ш
1Л>
гм'
и
о
•э
ГО
оо
о
гм
°ч
и
2
1
—
гм'
ГО
ЧО
го 1
гм 1
1П 1
гм 1
гм' 1
~
^ 1
"^ 1
^ 1
го 1
!
и
*
5
3
1 1
гм 1
г-» 1
00 1
тГ 1
—^ 1
гм' 1
г 1
с 1
1
8
Ас па
| ГИН
67
I
1
1
I
&
Об
К а. я
1 ее ее о
§ 3 8
1 5 *
т
плавления,
°С
1 ^9.§?
с §я- ?•
|<2&-ъа
1 *■*
1 ®*
1идро-
фоб-
ность
Генетический код
и
1 ^
*
1
гм
X
г
1 1
а: 1
о
о
^
1
Условное
обозначение
Название
1
1 ^
1 ^
1 ***
1 *■
1 °°
1 1Л>
1 <^
1 ^
гм
^
«л
чо
»тГ
го*
1
о
б
1
1
г*
""*!. 1
гм" 1
О |
с: 1
О
2 1
5 1|
Ц
х|
5 1
51
я 1
2
X 1
1
го 1
1 ~ •
1 >5 О I
1 Л О Р Ж
1 ^
1 ^
°
*^
гм
гм
гм
оо
о"
^
г^
гм"
"1
го"
1
у
<
о
04
го"
8
вч
°1
™" 1
О 1
1
1 1
X ь- 1
з& 1
1 1
1Н
1 00 Ж с;
1 ^
1 *"
^
*"
гм
«О
гм
вЧ
оо
о*
гм
гм
го"
"1
го"
1
о
<
о
о
5
^
5
в"
о
"^ 1
гм 1
ш 1
3 1
о |
ь 1
Л 1
2 1
15 |
КИЙ
1 -в
г
1 вЧ
1 ^-"
1 гч
*■
гм
гм
а
X
6
*•
г^
вч
°1
го"
1
о
1
о"
8.
чо
^1
гм"|
*
л1
X 1
х 1
о 1
х 1
^1
Ё 3
1 ^
1 °~
1 ^
I оо
1 ^
ГМ
ГМ
о
о
«гГ
чО
о
«о
1
ооа
< и и
00
гм"
вч
оо"
гм
оо^
~^ 1
с* 1
< 1
х
х 1
х 1
х 1
* [
КИЙ
1 А
1 Си
1 гм
1 «Л 1
1 *° 1
го К
00 1
гм 1
«л 1
гм 1
40 1
«*■* 1
вч 1
«О 1
г>" 1
гм 1
го" 1
1
ч
<
и
б
*• 1
о 1
\о" 1
го 1
ГО^ 1
в\ 1
о 1
оо 1
~" 1
X 1
(Л 1
X
1 1
х 1
г ||
Глава 1. Биогенные молекулы
1.4.1. Физические свойства аминокислот
Большинство аминокислот хорошо растворимы в полярных
растворителях, в частности, в воде, что обусловлено наличием в составе
аминокислот карбоксильных и аминогрупп, которые способны
находиться в протонированном и депротонированном состоянии в
зависимости от рН среды (табл. 1.5). Состояние аминокислоты
определяется величинами констант диссоциации (Кд) СООН- и ЫН2-групп,
отрицательный логарифм которых равен рКа (-1§КД = рКа).
Для большинства аминокислот рКа| карбоксильных групп равно
- 2,0, а рКа2 аминогрупп - 9,0. В изоэлектрической точке
суммарный заряд аминокислоты равен нулю. Это может быть при значениях
рН = р! аминокислоты, которое определяют как среднее
арифметическое обеих рКа.
р1 = (рКа1+рКа2)/2.
Таким образом, в интервале рН от 2,0 до 9,0 почти все аминокислоты
будут находиться преимущественно в виде цвиттерионов с протониро-
ванной аминогруппой и диссоциированной карбоксильной группой.
* К-СН-СОСГ+ Н+
1ЧН2
К-СН-СОО*
Цвиттерион
Присутствующие в среде аминокислоты при значениях рН 1,8...3,3 и
8,5... 10,8 будут обеспечивать создание ее буферной емкости. Это
характерно для всех аминокислот за исключением гистидина, который
обладает буферной емкостью при рН близких к нейтральным (рН 6,8...7,6).
1.4.2. Химические свойства аминокислот
Аминокислоты входят в состав пептидов и белков, образование
которых основано на проявлении реакционной способности их
карбоксильных и аминогрупп. Перераспределение электронной
плотности между атомами, входящими в состав карбоксильной группы
(-СООН), обусловливает образование на атоме кислорода
избыточного отрицательного заряда, а на атоме углерода — избыточного
положительного заряда.
К-СН-СООН
Ан'1Г
К-СН-СООН
N4^
69
Биохимия животных
Я'ЧГН-С-ОН + Я-СН-С-ОН
I
ин2^
ш2
.О X)
1 Т '
о о ^ ^
Ш2-СН-С--ЫН--СН-С-ОН -> КН2-€Н-С -г ЫН—СН-€-ОН + Н20
1111 •
Я' 0-Н Я
Пептидная связь
В образовавшемся переходном комплексе происходит
перераспределение электронной плотности, сопровождаемое образованием ди-
пептида и отщеплением молекулы воды. Амидная связь в дипептиде,
образованная карбоксилом одной молекулы аминокислоты и
аминогруппой другой называется пептидной связью.
В зависимости от числа аминокислотных остатков, входящих в
молекулу пептида, различают дипептиды, трипептиды, тетрапептвды и т. д.
1.5. БЕЛКИ
Белками называются высокомолекулярные соединения, в состав
которых входят только а-Ь-аминокислоты и иминокислота — пролин,
последовательно связанные между собой в полипептидную цепь,
имеющие функционально активную третичную или четвертичную структуру.
Информация о природе аминокислот, последовательности их
связывания в полипептидной цепи и их количестве передается по следующей
цепи: ДНК -> пре-РНК -» мРНК -» полипептидная цепь -»
функциональный белок и реализуется в индивидуальном признаке организма.
1.5.1. Структуры белков
Последовательное соединение в полипептидную цепь а-Ь-амино-
кислот, связанных между собой за счет пептидной связи, согласно
генетической информации, заложенной в ДНК, называется первичной
структурой белка. При этом пептидная связь по природе является ко-
валентной полярной связью, которая образована между углеродом
одной аминокислоты и азотом другой, обеспечивая, таким образом,
связывание двух аминокислотных остатков между собой и проявляя
стабильность первичной структуры белка (К->Ш~СО-К~) (рис. 1.9, а).
70
Глава 1. Биогенные молекулы
(н)
*ф
©
®
/с)
(н)
Цепь
вращается
здесь
а*)
^-ч1етидвая
^сиоь
ГРУ0™ /ф\
Х*у
(и)
Смешение! *--. 4
вдоль оси 11,5/1 с"
на остаток/ 4
6 „ ^Н^^-Н^
с к,'\с *--\.
1 <с>К-«-<>Я-
с ,.о-< Н 0#с/ -«
ШагспираяиЬЛА ~^С %Н г^ \ы
(3,6 остатка) .-*** "Ч .О^Ч
нч>-н-^^н-
' к*' \: к>>
Рис. 1.9. Фрагменты первичной (а) и вторичной (б) структуры белка
(а-спираль (1), параллельная (2) и антипараллельная (3) ^-структуры)
71
Биохимия животных
Причем из-за неравномерности распределения заряда вдоль
полипептидной цепи она неустойчива в полярной среде, что приводит к ее
закручиванию в ос-спираль или к образованию складчатой структуры
(параллельной и антипараллельной ос-структур), которые
стабилизированы за счет водородных связей (рис. 1.9, б). Такая конформация
полипептидной цепи называется вторичной структурой белка.
Рис. 1.10. Третичная (а) и четвертичная (б) структуры белков
и стабилизирующие их связи (в) (1 — ионная; 2 — водородная;
3 — дисульфидные и 4 — гидрофобные связи)
72
Глава 1. Биогенные молекулы
Наличие гидрофобных радикалов в составе аминокислот
обусловливают дальнейшее сворачивание полипептидной цепи в устойчивую
глобулярную структуру, которая стабилизирована в основном за счет
слабых связей (гидрофобных и гидрофильных взаимодействий,
ионных и водородных связей), а также нескольких ковалентных дисуль-
фидных (-5-5-) связей — третичная структура белка (рис. 1.10, а). При
этом на поверхность отдельных белковых глобул могут выходить
гидрофобные радикалы аминокислотных остатков, которые способны
сформировать из двух и более субъединиц (мономерных
полипептидных цепей, имеющих третичную структуру) единое структурное
образование, обладающее функциональной активностью и
стабилизированное за счет слабых нековалентных связей, которое называется
четвертичной структурой белка (рис. 1.10, 6).
1.5.2. Физические свойства белков
Белки способны набухать, поглощая воду обладают оптической
активностью, могут перемещаться под действием электрического поля,
поглощают УФ-излучение при 280 нм.
1.5.2.1. Поведение белков в растворах
Растворимость белков, определяется природой тех групп, которые
располагаются на поверхности белковой глобулы. Растворимость
белков в воде возрастает при добавлении небольших концентраций
солей (N32504, М§504, N301 и др.). Эти соли в малых концентрациях
увеличивают степень диссоциации ионизированных групп белка, что
создает условия для экранирования заряженных групп белковых
молекул, уменьшая, таким образом, белок-белковые взаимодействия,
тогда как высокие концентрации солей способствуют осаждению
белков из водных растворов.
Растворимость белков зависит от рН растворителя, его состава и
температуры среды. В присутствии органических растворителей
(ацетон, хлороформ, этилацетат и др.) понижается растворимость белков,
что способствует выпадению их в осадок. Понижение температуры
среды также способствует осаждению белков, причем чем ниже
температура среды, тем больше белков будет в осадке.
Имея на поверхности белковой молекулы заряженные
аминокислотные остатки, белки могут приобретать положительный или
отрицательный заряд, а также иметь нулевой заряд. Последнее
наблюдается в случае равенства положительно и отрицательно заряженных
73
Биохимия животных
групп, расположенных на поверхности белковой глобулы. Такое
состояние определяется величиной р1 и зависит от рН среды.
Так, например, если р1 белка равна 4,5, то при рН > 4,5 белок будет
иметь отрицательный заряд, а при рН < 4,5 — положительный. В
случае, если р! белка равна 8,5, то при рН > 8,5 белок приобретает
отрицательный заряд, а при рН < 8,5 — положительный.
р1=4,5
рН>4,5
ОрН>8,5
О
р1=8,5
^—^\ рН<8,5 ^ ^
•(Э
Таким образом, суммарный заряд белковой молекулы при рН < р!
положительный, а при рН > р1 — отрицательный.
В изоэлектрической точке суммарный заряд белков равен нулю.
При этом они утрачивают способность к перемещению в
электрическом поле. В изоэлектрической точке белки малоустойчивы в
растворе и легко выпадают в осадок, что обычно обусловлено
перераспределением зарядов на поверхности белка, приводящих к изменению
его пространственной структуры.
Диссоциирующие на поверхности белковой глобулы
функциональные группы способны связывать различные ионы металлов, что
обусловливает избирательное их поведение в среде. Так, например, ионы
кальция способствуют формированию ассоциированных ансамблей
белков в молоке, которые образуют устойчивые белковые мицеллы,
основу структуры которых составляют казенны, являющиеся белками
молока.
1.5.2.2. Денатурация белков
Процесс денатурации представляет собой внутримолекулярное
изменение пространственного расположения по отношению друг к другу
74
Глава 1. Биогенные молекулы
отдельных пептидных фрагментов в белковой макромолекуле без
разрыва ковалентных связей, в результате действия химических или
физических факторов (ионы тяжелых металлов, органические
растворители, кислоты, щелочи, температура, ионизирующее излучение и др.),
приводящих к изменению ее физико-химических свойств и к утрате
функциональной активности. Так, например, белки под действием
высокой температуры (50...60 °С) и кислотности среды (4,0 > рН > 10,0)
начинают изменять свою пространственную структуру, что приводит
к нарушению их нативной (природной) конформации.
Разворачивание глобулы белка делает доступными для воды гидрофобные остатки
аминокислот, которые в нативном состоянии формировали
преимущественно ядро белка, взаимодействие их радикалов может приводить
к образованию крупных ассоциатов денатурированных белков, о чем
будет свидетельствовать степень помутнения раствора или
образование осадка. При проведении центрифугирования или длительном
отстаивании растворов денатурированных белков, в особенности при
низких температурах (0...+4 °С), агрегированные полипептидные
цепочки белков оседают на дно сосуда.
1.5.3. Простые и сложные белки
Условно белки можно разделить на две группы: простые и
сложные. Простыми называются белки, в основе структуры которых
полипептидная цепь, состоящая из аминокислотных остатков. В состав
сложных белков кроме полипептидной цепи могут входить углеводы
(гликопротеины), липиды (липопротеины), нуклеиновые кислоты
(нуклеопротеины) или различные неорганические и
низкомолекулярные органические соединения (остатки фосфорной кислоты, гем, фла-
винмононуклеотид, флавинадениндинуклеотид, липоевая кислота, ти-
аминпирофосфат и др.).
Гемопротеины. Гембелки представляют собой группу белков и
ферментов. Эти белки обладают различными функциями и механизмом
действия. Одни из них способны обратимо связывать кислород,
транспортируя его к различным органам и тканям организма (гемоглобин,
миоглобин), другие используют кислород в качестве субстрата.
Последние катализируют окисление или переокисление различных
соединений кислородом (цитохром Р.450 и пероксидазы), участвуют в
процессах переноса электронов (цитохромы в и с), катализируют разложение
гидроперекисей (каталаза), восстановление кислорода до воды (ци-
тохромоксидаза). Приставки геми- и гемо- происходят от названий же-
75
Биохимия животных
лезопорфириновых группировок, при этом железо(П) порфириновый
комплекс называют гемом, а железо(Ш) порфирин — гемином.
Строение функционально активных центров гемсодержащих белков,
осуществляющих перенос и накопление кислорода, предопределяется
уникальным расположением аминокислотных остатков в области
связывания кислорода, что обеспечивает возможность выполнять присущие
им функции. Гемоглобин (основной белок эритроцитов) и миоглобин
(белок мышц) объединяет то, что функционально активной группой,
содержащей Ре2+, является гем. Последний представлен протопорфирином
IX, пирольные атомы азоты которого координируют с атомом железа(Н).
Структуры протопорфирина IX и гема показаны ниже.
Окраску гембелкам придает тем, который приобретает ее за счет
наличия сопряженных двойных связей на протопорфирине. Поэтому
присутствие гемоглобина и миоглобина обусловливает красный цвет
крови и мышечной ткани.
Гемоглобин (НЬ) и миоглобин (МЬ) не являются ферментами, а
осуществляют обратимое связывание кислорода и С02. Отличительной
особенностью МЬ и НЬ является то, что эти гембелки связывают кислород, не
подвергая его химическому превращению, а образуют устойчивый
комплекс, в котором 02 занимает шестое координационное положение.
Протопорфирин IX Гем
Иммуноглобулины. Иммуноглобулины содержатся в сыворотке крови,
слюне, выделениях слюнных желез и т. д. Иммуноглобулинами (анти-
76
Глава 1. Биогенные молекулы
телами) называются сложные белки гликопротеины, вырабатываемые
в В-лимфоцитах. Основной функцией иммуноглобулинов считается
участие в распознавании и специфическом связывании чужеродных
молекул (антигенов) с целью нейтрализации их деятельности, с
последующей инактивацией и удалением из организма.
Иммуноглобулины представляют собой молекулы, состоящие из
четырех полипептидных цепей (две тяжелые (Н) и две легкие (Ь)),
соединенных ковалентно дисульфидными связями. В каждой из цепей
имеются вариабельные (V) и константные (С) участки. В составе
иммуноглобулинов можно выделить три фрагмента. Два из них
обозначаются как РаЬ и имеют в своем составе константные участки и
вариабельные участки. Последние участвуют в распознавании и связывании
антигенов. Третий фрагмент, обозначаемый Рс, имеющий только
константные участки, участвует в связывании компонентов комплемента
и в реакциях с рецепторами лейкоцитов (рис. 1.11).
Рис. 1.11. Строение молекулы иммуноглобулина (Овчинников, 1987)
В составе легких цепей определяются два домена (вариабельный
и константный), а в тяжелых их четыре или пять, в зависимости от
класса тяжелых полипептидных цепей.
77
Биохимия животных
Каждый домен имеет специфичную укладку третичной структуры
полипептидной цепи. В составе домена два слоя с р-складчатой
структурой, один из которых построен из четырех антипараллельных
сегментов цепи, тогда как другой — из трех сегментов. Стабильность
структуры поддерживается за счет дисульфидной связи,
располагающейся в середине домена. У млекопитающих выявлено пять классов
антител: 1^0,1§А, 1&М, № и 1&Е, тяжелых цепей: а, у, ц, е, 8, каждый
из которых содержит свой класс соответственно. При этом два из них
(а и у) подразделяются на подклассы.
Кроме того, имеются два типа легких цепей (% и у) с молекулярной
массой 23 кДа. В составе легкой полипептидной цепи 214
аминокислотных остатка. Причем первые 110 аминокислотных остатков сильно
изменчивы, тогда как остальные всегда одинаковы.
Гены тяжелых цепей, %- и у-цепей локализуются в разных
хромосомах. Так, например, у человека гены тяжелых цепей располагаются
в 14 хромосоме, %-цепей — в 2, а у-цепей — в 22, тогда как у мыши эти
гены расположены соответственно в 12, 6 и 16 хромосомах.
Строение и механизм действия антигенсвязывающих участков
иммуноглобулинов. В составе Ь- и Н-цепей иммуноглобулинов имеются
образования, ответственные за связывание антигенов. Участок
представлен аминокислотными остатками Ь- и Н-цепей. Поэтому каждая
молекула 1& имеет два таких участка. Причем молекулы 1&
предназначены для распознавания различных антигенов, имеют сходство в
строении общей структуры, но различаются строением
антигенсвязывающих участков, называемых вариабельными — У-доменами. Последние
в составе Н-цепи содержат четыре небольших гипервариабельных
компонента, а в Ь-цепи -- три гипервариабельных компонента. Эти
компоненты формируют антигенсвязывающий участок 1§. Причем остальные
компоненты У-домена, а их около 85%, практически не подвержены
изменениям. Поэтому основная роль константных компонентов
заключается в единообразии пространственной ориентации
гипервариабельных компонентов в составе антигенсвязывающего центра,
расположенного в составе N-конца полипептидной цепи 1§.
Общее количество антигенсвязывающих центров в организме
животного может составлять 106, что достигается как варьированием
аминокислотных остатков в гипервариабельных компонентах Ь- и
Н-цепей, так и их комбинациями.
Расположение 1§ в мембране В-лимфоцита таково, что антисвя-
зывающие центры ориентированы во внеклеточную среду, тогда как
78
Глава 1. Биогенные молекулы
С-концевые аминокислотные остатки полипептидных Н-цепей
погружены в липидный слой мембраны и прочно удерживаются в нем.
На поверхности В-лимфоцита равномерно располагается до 105
молекул 1§, идентичных по антигенной специфичности. Причем
количество лимфоцитов может достигать 106 клонов В-клеток. При этом
каждый клон В-клеток участвует в распознавании только одного
конкретного антигена.
В антигенсвязывающих центрах могут связываться как небольшие
молекулы антигенов, называемые гаптенами, так и крупные молекулы —
антигены. Участки, с помощью которых они связываются с антителами,
называются антигенными детерминантами. Так, на молекуле полиса-
харидного антигена детерминанта представлена 5...6 остатками
моносахаридов, а на молекуле глобулярных белков детерминанта имеет в своем
составе 4...6 аминокислотных остатков, расположенных на
поверхности белковой глобулы.
Высокая специфичность связывания антигена с антителом
определяется пространственным соответствием антигенной детерминанты к
антигенсвязывающему центру 1§. Причем на каждый антиген имеется
около 102 рецепторов, способных его связывать.
Липопротеины. Основную транспортную функцию в крови человека
и животных выполняют сложные высокомолекулярные бел ково-л ипид-
ные структурные образования, которые называются липопротеинами.
В составе липопротеинов присутствуют белки, триацилглицеролы,
фосфолипиды, холестерол и его эфиры, жирные кислоты,
жирорастворимые витамины (рис. 1.12).
Белок Липиды
Рис. 1.12. Модель липопротеина плазмы крови (Овчинников, 1987)
79
Биохимия животных
Липопротеины предназначены для связывания и транспорта
различных нерастворимых в воде соединений, в том числе и липидов.
Кроме того, липопротеины входят в состав мембран митохондрий,
ядра клетки, микросом и клеточной мембраны. Синтез липопротеи-
нов происходит в печени и в слизистой оболочке кишечника. Все
липопротеины имеют гидрофобное ядро, в состав которого входят ли-
пиды, окруженные полярными липидами и оболочной из белков.
Различают 8 типов апобелков: апо-А-1, АН, В, С1, СП, СШ, О и Е.
В составе липопротеинов могут быть различные углеводы (глюкоза,
галактоза, гексозамины, фукоза, сиаловая кислота).
В современной классификации липопротеины подразделяются на
классы в зависимости от электрофоретической подвижности,
обусловленной различным зарядом белков, или от их плотности при
ультрацентрифугировании. Поэтому к липопротеинам можно отнести
хиломикроны (ХМ), липопротеины низкой плотности (ЛПНП),
липопротеины очень низкой плотности (Л ПОНП) и липопротеины
высокой плотности (ЛПВП) (табл. 1.6).
Таблица 1.6
Состав липопротеинов (%) в крови крысы (Алимова и др., 1975)
| Показатели
| Триацилглицеролы
| Холестерол
| Эфиры холестеролл
| Фосфолипиды
| Белок
Средний размер, нм
ХМ
81...97
0,9...3,0
1,8...4,0
2...9
0Д..2.5
150...200
\ лпонп
52...58
6...8
12...16
18...20
7...10
30...90
1 ЛПНП
12...14
8...12
44...49
26...28
20...22
го..^^
лпвп-1
15...17
9...11
30...32
42...44
32...34
10...20 |
Транспортные белки. Переносчиками ионов Са2+ служат кальсекве-
стрин и Са2+-связывающий белок. Оба белка локализуются во
внутреннем объеме саркоплазматического ретикулума. Кальсеквестрин имеет
молекулярную массу 45 кДа, а Са2+-связывающий белок — 55 кДа.
Кальсеквестрин служит основным белком внутри терминальных
цистерн саркоплазматического ретикулума и поэтому связывает большую
часть ионов Са2+, поступающих в цистерны при работе Са2*-АТФазы.
80
Глава 1. Биогенные молекулы
Кальсеквестрин является кислым гликопротеином, полипептидная
цепочка которого на 40% состоит из остатков аспарагиновой и глутами-
новой кислот. Причем содержание кальсеквестрина в терминальных
цистернах скелетных мышц может составлять до 20% от общего количества
белков. Одна молекула кальсеквестрина способна связывать до 43 моль
ионов Са2+ на моль белка, располагаясь непосредственно вблизи к риа-
нодин-чувствительному Са2+-каналу. Кальсеквестрин выполняет
функцию по резервированию ионов Са2+ внутри терминальных цистерн и
обеспечивает его концентрирование около Са24-каналов, создавая
условия для его направленного транспорта за счет пассивной диффузии
в саркоплазму. Вторым белком является Са2+-связываюший белок,
способный связывать 25 молей ионов Са2+ на моль белка, выполняя
аналогично кальсеквестрину роль в саркоплазматическом ретикулуме.
1.5.4. Формы белков
Различают несколько форм белков: нативная, денатурированная,
модифицированная и рекомбинантная. Нативным, или природным
считается белок, синтезированный в клетке живого организма и
обладающий функциональной активностью или который способен ее
приобрести в случае необходимости.
Денатурированным является белок, подвергшийся физическому
воздействию (высокие и низкие температуры, УФ облучение и др.),
в результате которого он частично или полностью утратил
функциональную активность, вследствие изменения конформации нативной
структуры или расположения аминокислотных остатков, входящих
в состав активного центра фермента.
Модифицированная форма может образовываться вследствие
химического воздействия на нативный белок, которое
сопровождается изменением структуры и природы аминокислотных
остатков полипептидной цепи, модификацией функциональных групп
активного центра фермента. Модифицирующей способностью
обладают свободные радикалы, а также альдегиды, реагирующие
с ЫН2-группами аминокислотных остатков с образованием
основания Шиффа.
В эндоплазматическом ретикулуме происходит постгрансляцион-
ная модификация белков. Процесс необходим белкам для
приобретения функционально активной структуры. Белки подвергаются процессу
фосфорилирования, ацетилирования, гликозилирования, сульфатиро-
вания, полимеризации. Кроме того, поверхностные 5Н-группы белков
81
Биохимия животных
окисляются кислородом и другими окислителями с образованием ди-
сульфидных (8-8) связей. Нарушение этих процессов препятствует
выходу белков из эндоплазматического ретикулума. Необходимость этих
процессов продемонстрирована на белках лизосомальных мембран,
которые синтезируются в эндоплазматическом ретикулуме, а затем
переносятся в комплекс Гольджи для гликозилирования.
Модифицированные таким образом белки приобретают способность меньше
разрушаться, обеспечивая стабильность мембран и функционирование этих
органелл в клетке.
Рекомбинантным считается белок, полученный искусственным
путем, в состав полипептидной цепи которого введены чужеродные
аминокислоты. Рекомбинатный белок получают путем встраивания
в процессе транскрипции в первичную структуру белка новых
аминокислот, искажающих его естественную аминокислотную
последовательность. Так, например, методами генной инженерии был получен
рекомбинантный белок вируса ЛХМ путем экспрессии
консервативного и иммунодоминантного по В-сайту небольшого участка гена,
кодирующего белок нуклеокапсида НР в составе плазмиды р.1С40.
Одной из особенностей этой плазмиды является экспрессия белка
с включением в его состав 10 гистидиновых аминокислотных остатков.
В качестве матрицы для синтеза ДНК-копии интересующего В-сайта
был использован концентрированный и очищенный препарат вируса
ЛХМ. При расчете и синтезе праймеров для цепной полимеразной
реакции (ЦПР) применялись общепринятые компьютерные программы
и ДНК-синтезатор. После получения ДНК-амплификата в ЦПР
последний был клонирован в плазмиду р.1С40 под Т7 РНК-полимераз-
ный промотор между Жпё III и Ват Н1-сайтами рестрикции. Полу-
ченный экспрессией плазмиды в Е. соП рекомбинантный белок был
проанализирован с помощью электрофореза в ПААГ. Его
молекулярная масса составляла 9...11 кДа. В зависимости от полученного клона
выход рекомбинантного белка от тотального клеточного синтеза
колебался в диапазоне от 3 до 10%.
1.5.5. Функции белков
Белки в организме животных способны выполнять следующие
функции:
1. Каталитическая, осуществляется ферментами, ускоряющими
протекание химических реакций.
82
Глава 1. Биогенные молекулы
2. Транспортная, переносит нерастворимые в воде гидрофобные
соединения (липопротеины) или кислород (миоглобин и
гемоглобин) и др.
3. Структурно-механическая, выполняется белками, входящими
в состав мембран клеток (протеогликаны).
4. Регуляторная, выполняется гормонами, которые регулируют
протекание различных метаболических процессов.
5. Сократительная, способность к механическим действиям (белки
мышц).
6. Защитная, обеспечивается белками, входящими в состав ДНК
(нуклеопротеиды) и иммуноглобулинами.
Кроме того, белки участвуют в процессе свертывания крови,
обеспечивают активный трансмембранный потенциал, входят в состав
костной и соединительной ткани — структурные белки.
Разнообразие в структуре белков различных организмов
обусловлено их различной функциональной деятельностью, тогда как
различие в структуре функционально однородных белков — видовой
специфичностью. При этом белки обуславливают индивидуальные
особенности в строении каждого вида животного организма,
информация о которых записана в структуре ДНК.
Кроме того, индивидуальность белков каждого вида животных
обуславливает специфичность работы иммунной системы животного
организма, основанной на распознавании в организме чужеродных
белков, а также собственных белков, подвергнутых модификации.
1.6. ВИТАМИНЫ И КОФЕРМЕНТЫ
Витамины — это группа биологически активных веществ, синтез
которых преимущественно происходит в бактериях и растениях,
являющихся предшественниками коферментов или простетических групп,
имеющих буквенное обозначение. Недостаток витаминов в организме
вызывает у животных и человека развитие гипо- или авитаминозов.
Витамины были впервые открыты русским ученым Н. И. Луниным
в 1880 г.
В организме животных содержится более 23 витаминов. Основным
источником витаминов являются растения и часть из них
синтезируется у жвачных животных микрофлорой рубца.
Витамины условно можно разделить на растворимые в
полярных (водорастворимые: В,, В2, В3, В4, В5, В6, В7, В8, В,2, В,3, В,5, Вс,
83
Биохимия животных
С, Р, РР, Н, II, №, ()) и в неполярных (жирорастворимые: А, Оу Е,
К, Р) растворителях. В составе коферментов НАД, НАДФ
присутствуют остатки витаминов В5 (никотинамид) и РР (никотиновая
кислота); ФМН и ФАД — В2 (рибофлавин), КоА — В3 (пантотеновая
кислота), тиаминпирофосфата — В] (тиамин), пиридоксальфосфата — В6
(пиридоксин). В составе активных центров ферментов содержатся
в качестве простатических групп витамины: липоевая кислота у ли-
поатацетилтрансферазы, витамин Н (биотин) у пируват- и ацетил-
КоА-карбоксилаз, витамин К (филлохинон) у филлохинонредуктазы
и менадионредуктазы, витамин Вс (фолиевая кислота) у трансаминаз,
В|2 (кобаламин) у метилтрансфераз. Кроме того, в составе белка
родопсина присутствует витамин А (ретинол), участвующий в процессе
фоторецепции. Антиоксидантные свойства проявляют витамины:
Е (токоферолы), Р (биофлавоноиды) и С (аскорбиновая кислота).
В переносе ионов кальция участвует витамин О.
1.6.1. Витамины растворимые в полярных растворителях
Витамин В, — тиамин (антиневритный); основными частями
витамина являются пиримидин и тиазонит, соединенные между собой ме-
тиленовой связью.
Н3С N \МНг 5
Тиамин
Витамин В| служит предшественником тиаминпирофосфата,
образование которого катализируется тиаминпирофосфокиназой,
переносящей с АТФ остаток пирофосфорной кислоты.
Богатыми по содержанию тиамина являются дрожжи, зародыши и
оболочки пшеницы, овса, гречихи.
«Г"? Л-СНз о 0
II
_ ^ -сн2—о—р—о —р—он
дГгт:-.
м"2 он он
Тиаминпирофосфат
84
Глава 1. Биогенные молекулы
Больше всего в организме животных витамина В] определяется в
клетках печени и мозга. В молоке содержание витамина В, может доходить
до 0,8...1,2 мг/кг. Роль витамина В, в метаболических процессах
проявляется через действие кофермента, который участвует в
каталитических реакциях декарбоксилирования сс-аминокислот, а также
расщепления и синтеза а-оксикетонов. Ферментами, в механизме действия
которых участвует ТПФ, являются пируватдекарбоксилаза, транске-
талаза, а-кетоглутаратдегидрогеназа, дегидрогеназа у-оксиглутаровой
кислоты.
При авитаминозах витамина В| развивается заболевание
полиневрит («бери-бери»). Тиамин назначается к лечебному применению при
невритах, при атонии кишечника, заболеваниях печени, дистрофии
миокарда, спазмах периферических сосудов, экземе псориазе.
Витамин В2 — рибофлавин (витамин роста); в основе молекулы
витамина лежит гетероциклическое соединение — изоаллоксазин, к
которому в положении 9 присоединен пятиатомный спирт рибитол.
он он он
I I I
сн2—сн — сн — сн — сн2он
Рибофлавин
Содержится в дрожжах, молочной сыворотке, яичном белке, мясе,
рыбе, печени, горохе, зародышах и оболочках злаковых культур и др.
Витамин В2 чувствителен действию УФ излучения, под действием
которого витамин В2 окисляется в бесцветную лейкоформу
Свойство витамина В2 легко окисляться и восстанавливаться лежит в
основе его участия в метаболических процессах. Витамин В2 является
предшественником рибофлавина-5'-фосфата (ФМН) и флавинаде-
ниндинуклеотида (ФАД), действие которых проявляются в
окислительно-восстановительных процессах, катализируемых следующими
ферментами: оксидазы Ь и Ь-аминокислот, глициноксидаза, альде-
гидоксидаза, ксантиноксидаза, глюкозооксидаза, лактатдегидроге-
85
Биохимия животных
наза, алкогольоксидаза, ретинальдегидрогенеза, оротатредуктаза, сук-
цинатдегидрогеназа, глутарил-КоА-дегидрогеназа, аспартатоксидаза,
аминоксидаза, пиридоксаминфосфатоксидаза, тираминоксидаза и др.
ОН
он он он .
III I
сн2—с—с—с —сн2—о—р=0
н н н
о
I
он
Флавинмононуклеотид (ФМН)
ОН ОН ОН
I I I
СНг —С—С—С—СНг —О
Н Н Н НО—р=0
нч* о
он он
Флавинадениндинуклеотид (ФДД)
В ходе ферментативного процесса восстановленные ФМН и ФАД
способны обратимо окисляться, донируя атомы водорода от атомов
азота в положении N1' и 1Ч10.
Образование ФМН катализируется рибофлавинкиназой с участием
АТФ
86
Глава 1. Биогенные молекулы
М§2+
Рибофлавин + АТФ -> ФМН + АДФ,
а ФАД — АТФ-зависимой ФМН-аденинтрансферазой из ФМН
М82+
ФМН + АТФ -» ФАД +ФФн.
Содержание витамина В| в молоке зависит от времени года и
может колебаться в пределах 1,0...2,9 мг/кг.
Применяется при коньюнктивитах, кератитах, катаракте, ранах,
язвах, спру, циррозах и др.
Витамин В3 — пантотеновая кислота (антидерматитный); в составе
витамина остатки 0-а,у-диокси-Р,р-диметилмасляной кислоты и р-ала-
нина, связанные между собой амид ной связью.
СН3 ОН
I I
но— сн2— с— сн— со — м—сн2— сн2—соон
СНз
Пантотеновая кислота
Витамин В3 распространен в растениях (цветная капуста, картофель,
томаты), пивных дрожжах, бактериях, в том числе в кишечной
микрофлоре животных и человека, грибах. Высоко содержание витамина В3
в печени животных, почках, мышцах, яичном желтке, икре. В молоке
его содержится 2,0...3,8 мг/кг. Синтезируется витамин В3 в растениях
путем последовательного превращения следующих соединений:
а-кетоизовалериановая кислота -> кетопантоевая кислота ->
-* пантотеновая кислота.
Витамин В3 входит в состав коэнзима А, который участвует в
реакциях превращения пировиноградной кислоты, катализируемых
ферментами пируватдегидрогеназного (ПДК) и а-кетоглутаратдегидроге-
назного (а-КГДК) комплексов, синтезе жирных кислот — в составе
ацилпереносяшего белка.
87
Биохимия животных
н$— сн,—сн2—мн-Н: —сн2—сн2—N
о он сн3 о
II I I II
- с —сн—с—сн2—о—р—о ■
сн, он
КоэнзимА
В3 участвует в углеводном и липидном обменах и в синтезе аце-
тилхолина. Улучшает сократительные функции миокарда и усиливает
действие сердечных гликозидов. Применяется при невритах, экземе,
аллергических реакциях, язвах, ожогах, заболеваниях печени.
Витамин В4 — холин (капилляроукрепляющий); представляет
собой аминоэтиловый спирт, содержащий у атома азота три метальные
группы. Донорами метальных групп являются 8-аденозилметионин,
серии и глицин. Витамин В4 имеет следующее строение:
+
(СН3)з^-СН2-СН2ОН
Холин
В организме животных витамин В4 встречается в составе фосфо-
липидов. Основными источниками витамина В4 являются печень,
почки, мясо, рыбные продукты, капуста. Содержание в молоке может
достигать 0,2...0,6 мг/кг. Функционально активным витамин В4
становится в составе нейромедиатора ацетилхолина, принимая участие
в реакциях трансметилирования при биосинтезе метионина, пурино-
вых и пиримидиновых оснований, фосфолипидов. При недостатке
витамина В4 наблюдаются жировая инфильтрация печени,
геморрагическая дистрофия почек, нарушение свертываемости крови.
Витамин В5 — ниацин, никотинамид (антипеллагрический);
является амидом пиридин-3-карбоновой кислоты (никотиновая кислота).
Никотинамид
88
Глава 1, Биогенные молекулы
Входит в состав окисленных и восстановленных коферментов
НАД и НАДФ. Участвует в составе коферментов в механизме действия
окислительно-восстановительных ферментов дегидрогеназ.
Синтезируется витамин В5 микрофлорой рубца животных. Содержание
витамина В5 в молоке может составлять 1,0... 1,2 мг/кг.
Витамин В6— пиридоксол (антидерматитный); синтезируется
микроорганизмами кишечника жвачных животных и человека, а также
растениями из продуктов гликолиза: глицеральдегид-3-фосфата, гид-
роксиацетонфосфата и пирувата.
СН2ОН
СН2ОН
Высокое содержание витамина В6 отмечается в пивных дрожжах,
мясе, рыбе, зерновках злаков. У животных витамин В6 накапливается
в тканях печени, сердце, почках. В молоке содержится 0,18...0,24 мг/кг.
Функциональная активность витамина В6 проявляется в составе ко-
фермента пиридоксальфосфата.
9ю он
>^7г-сн2он—р=о
но
^" |1—\-п2ип — г
НзС" - ^
I I
П иридоксал ьфосфат
Участвует в процессе активного переноса аминокислот через
клеточные мембраны, в реакциях трансаминирования, декарбоксилиро-
вания, рацемизации аминокислот.
Применяется при анемиях, невритах, невралгии, лишае,
нейродермитах, псориазе, эксудативных диатезах.
Биохимия животных
Витамин В7 — каротин; известны три изомера каротина (а-, 0- и
у-каротины), с преобладанием в растениях (3~формы.
=сн-ё=юн)г- сн + сн-(сн=с-сн=сн)гЧХ
*СН)2-СН>
I
сна
р-Каротин
Больше всего содержится каротина в моркови, перце, плодах
томатов и шиповника, зеленых листьях, цветках растений. Содержание
каротиноидов в листьях зависит от условий произрастания и стадии
вегетации. К осени в листьях их содержание понижается, тогда как
в плодах наоборот возрастает. Богаты каротином и животные ткани,
в особенности печень, а также масло, яйца. В молоке содержится до
0,3 мг/кг витамина В7. Высокое содержание каротина в растении
проявляется наличием желтой и красной окраски. В основе строения
каротинов последовательно связанные восемь остатков изопрена,
способные находиться в цис- и трансформах. Функционально активными
являются трансизомеры. Витамин В7 в растениях принимает участие
в процессе фотосинтеза, размножении и в реакциях окислительно-
восстановительных ферментов.
Содержание каротина в молоке зависит от рациона питания,
времени года, вида и породы животного. При этом в летний период, когда
в кормлении животных преобладает зеленая растительная масса,
содержание каротина в молоке составляет 0,5...0,95 мг/кг, а зимой —
0,03...0,18 мг/кг. Высокое содержание каротина оказывает влияние
на окраску масла. Физические воздействия (пастеризация,
стерилизация, УФ и видимый свет) могут разрушать каротин, понижая его
содержание в молоке и молочных продуктах.
Витамин В8 — инозит; представляет собой циклический
шестиатомный спирт циклогексана. Образуется в результате циклизации
глюкозы, накапливается в виде эфира с фосфорной кислотой — фитина.
У животных накапливается в нервных клетках, особенно его много
в составе липидов мозга, в печени, мышцах, сердце, яичном желтке.
Богаты витамином В8 продукты: молоко, хлеб, а также овоши
(картофель, зеленый горох) и фрукты (яблоки, дыни). Участвует витамин
90
Глава 1. Биогенные молекулы
В8 в обмене липидов. Входит в состав фосфоацилглицеринов в виде
фосфатидилинозита. При недостатке витамина В8 отмечается
замедление роста животного, потеря шерстного покрова, анемии, жировая
инфильтрация печени с отложением холестерина.
он он
НО
Инозит
Витамин В|2 — кобаламин (антианемический); основу структуры
витамина составляют 4 восстановленных пиррольных кольца, атомы
азота которых координируют с кобальтом, связанным еще и с
атомом азота 5,6-диметилбензимидазола. Кроме того, в структуре
витамина В,2 имеется молекула рибозы с остатком фосфора у 3-го атома
углерода.
Витамин В|2 синтезируется только в микроорганизмах (бактерии,
актиномицеты и синезеленые водоросли). Богатым источником
витамина В|2 служат говяжья печень и почки. В молоке витамина В,2
может содержаться до 3...5 мг/кг.
Коферментные функции выполняют производные витамина В12 ме-
тилкобаламин и 5'-дезоксиаденозилкобаламин, участвующие в
каталитических реакциях переноса метальных групп и изомеризации.
Этот витамин необходим для нормального кроветворения и
созревания эритроцитов, участвует в синтезе лабильных метильных групп
и в образовании холина, метионина, креатина, нуклеиновых кислот.
Кобаламин активирует свертывание крови, повышает тромбопласти-
ческую активность и активность протромбина.
Недостаток витамина В,2 у животных приводит к развитию
злокачественной макроцитарной, мегалобластической анемии.
Применяется при малокровии, анемиях, заболеваниях печени, полиневритах,
при кожных заболеваниях.
91
Биохимия животных
•сн2-сн2-соын2
НС — СН3
Кобаламин
Витамин В)3 — оротовая кислота; это производное пиримидина.
Высокое содержание его отмечается в печени, молоке, дрожжах.
)Н
НО м СООН
Оротовая кислота
92
Глава 1. Биогенные молекулы
У птиц и млекопитающих витамин В|3 синтезируется из аспараги-
новой кислоты и карбамоилфосфата. Участвует В,3 в механизмах
синтеза нуклеиновых кислот. Функционально активной формой является
оротидин-5-фосфат. Стимулируя протекание анаболических
процессов, витамин В|з ускоряет рост растений и животных. Содержание
в молоке крайне незначительно.
Витамин В|5 — пангамовая кислота (антианоксический); это
производное эфира глюконовой кислоты и диметилглицина.
г
НООС — СН —СН —СН —СН — СН2— О— СО— СН2— м
ОН СН3
Пангамовая кислота
Содержится в дрожжах, печени, в крови, проростках риса.
Благодаря подвижности двух метальных групп витамин В!5 способен
участвовать в реакциях метилирования в липидном обмене, в биосинтезе
креатинфосфата. Используется при остром отравлении наркотиками,
алкоголем, антибиотиками тетрациклинового ряда.
Витамин Вс — фолацин (антианемический); в составе птероилглу-
таминовой кислоты остатки птеридина, р-аминобензойной и Ь-глу-
таминовой кислот
1 10 // XV ■
-[- N4 —Г Ч- СО-«- ЫН—СН — СН2 — СН2 —СООН
I Чггг/ [ |
| . СООН
Птеридин р-Аминобензойная кислота Ь-Глутаминовая кислота
Фолиевая кислота (витамин В^
Витамин Вс синтезируется в микроорганизмах, а также в низших
и высших растениях. В тканях млекопитающих и птиц витамин Вс не
образуется. Богаты витамином Вс растения: салат, капуста, томаты,
морковь, зеленый лук, шпинат, бобовые. В животных тканях витамин
Вс накапливается в печени, почках и мышцах. Содержится в яичном
порошке и сыре. Фолиевая кислота метаболически не активна, но при
93
Биохимия животных
восстановлении способна присоединять четыре атома водорода,
превращаясь в активный кофермент 5,6,7,8-тетрагидрофолиевую
кислоту (ТГФК).
МХ^Н 10 /~\
I |Г 6р СН2~"ЫН—^ >-СО—N4—СН— СН2 — СН2 — СООН
Н2М^ЧМ^&Г СООН
5,6,7,8-тстрагкдрофолиевая кислота (ТГФК)
Процесс в животных тканях протекает в две ферментативные
стадии, катализируемые последовательно НАДФ-зависимыми фолатре-
дуктазой и дигидрофолатредуктазой. Участие в ферментативных
реакциях ТГФК проявляется наличием в ее структуре в положениях 5
и 10 активных атомов азота, способных присоединять одноуглерод-
ные радикалы. В механизме действия трансфераз ТГФК осуществляет
перенос одноуглеродных остатков: -СН3 (метальная), -СНО (фор-
мильная), -СН2ОН (оксиметильная), -СН2 (метиленовая), -СН1МН
(формиминофуппа), -СН=К (метенильная). При биосинтезе метио-
нина и тимина переносится метальная фуппа, серина —
оксиметильная группа, пуриновых нуклеотидов — формильная группа.
Вс стимулирует эритропоэз, участвует в синтезе аминокислот,
выявлена роль витамина Вс в биосинтезе нуклеиновых кислот, пуринов,
пиримидинов и делении клетки, в обмене холина. Основная
функция витамина Вс в организме животных и человека проявляется в
качестве противоанемического фактора в гемопоэзе. Применяется при
анемиях, спру и др.
Витамин С — аскорбиновая кислота (антиоксидантный); относится
к углеводам, представляет собой лактон гексоновой кислоты (2,3-ди-
дегидротрео-гексоно-1,4-лактон), содержащий диенольную группу.
СН2ОН
Н. I
но он
Ь-Аскорби новая кислота
94
Глава 1. Биогенные молекулы
Наличие двух асимметричных атомов углерода в положениях 4 и
5 позволяет образовать четыре оптических изомера и два рацемата.
Природные изомеры, обладающие витаминной активностью,
относятся к Ь-ряду. В щелочной среде при рН > 7,6 происходит ее
самоокисление. Витамин С способен обратимо окисляться, донируя
протоны и электроны, кислородом воздуха, перекисью водорода, йодом,
2,6-дихлорфенолиндофенолом, перманганатом калия в водной среде.
Продуктом окисления витамина С является Ь-дегидроаскорбиновая
кислота. СН2ОН
о о
Ь-Дс гидроаскорбиновая кислота
В присутствии хинонов и некоторых антибиотиков процесс
окисления витамина С ускоряется, но флавоноиды, РНК, кислые
полисахариды, белки и тиоловые соединения (глутатион, тиомочевина,
тиосульфат, тиамин, ксантин, мочевая кислота, теофеллин, креатинин,
аминокислоты) подавляют этот процесс. Витамин С не синтезируется
только в организме человека, обезьяны и морских свинок. Витамин
С активно синтезируется у остальных животных и в растениях.
Богаты витамином С плоды шиповника, черной смородины, картофель,
капуста. В молоке витамина С может содержаться 4...25 мг/кг.
Витамин С очень чувствителен к действию УФ излучения и может быстро
окисляться в присутствии кислорода. Окисление витамина С в
растительных и животных тканях катализируют аскорбатоксидаза, церу-
лоплазмин, цитохромоксидаза, фенолоксидаза, пероксидаза.
Восстановление дегидроаскорбиновой кислоты до аскорбиновой кислоты
катализирует НАДФН2-зависимая дегидроаскорбинредуктаза или это
может происходить при участии восстановленного глутатиона, не эн-
зиматическим путем. Витамин С участвует в реакциях гидроксили-
рования пролина, лизина, коллагена, гормонов коры
надпочечников, триптофана. Гидроксилирование проколлагена осуществляется
с участием протоколлаген-гидроксилазы, использующего в качестве
кофактора аскорбиновую кислоту. Витамин принимает участие в ре-
95
Биохимия животных
гулировании окислительно-восстановительных процессах,
свертывании крови, регенерации тканей, образовании стероидных гормонов,
в синтезе проколлагена и коллагена, нормализует проницаемость
капилляров.
Симптомы недостатка витамина С в организме проявляются в виде
повышенной ломкости кровеносных капилляров, общей слабости,
апатии, утомляемости, снижении аппетита, задержки роста, болезненности
десен, их отечности и кровоточивости; комплекс симптомов
заболевания цинги (скорбут).
Применяется при геморрагических диатезах, кровотечениях,
интоксикациях, заболеваниях печени, ранах, переломах костей,
дистрофиях.
Витамин Н — биотин (антисеборейный); в составе молекулы
витамина имидазольное и тиофеновое кольца. Наличие трех
асимметрических атомов углерода, обусловливает существование восьми сте-
реоизомеров.
Н2<^§^Н-(СН2)4-СООН
Биотин
Образуется витамин Н из олеиновой кислоты в результате р-окис-
ления в пимелоил-КоА, а присоединение аланина сопровождается
замыканием цикла. В активных центрах карбонильная группа
витамина Н соединяется амидной связью с е-аминогруппой лизина,
становясь при этом простетической группой фермента. Витамин Н
синтезируется в микроорганизмах (бактерии кишечника) и
растениях (горох, соя, капуста, картофель, лук, томат, шпинат). Высокое
содержание витамина Н у животных отмечается в печени, почках,
молоке, желтке яиц. Содержание его в молоке может составлять
0,03...0,05 мг/кг. Витамин Н участвует в следующих
каталитических процессах: а) карбоксилирования с расщеплением АТФ,
катализируемого пируваткарбоксилазой, ацетил-КоА-карбоксилазой,
96
Глава 1. Биогенные молекулы
пропионил-КоА-карбоксилазой, метилкротоноил-КоА-карбоксила-
зой, гераноил-КоА-карбоксилазой; б) транскарбоксилировании без
расхода АТФ, катализируемые метилмалонил-КоА-карбоксилтранс-
феразой. Авитаминоз у животных проявляется прекращением роста,
снижением массы, покраснением и шелушением кожи, выпадением
шерсти, образованием красного отечного ободка вокруг глаз.
Витамин N — это а-липоевая (1,2-дитиолан-З-валериановая)
кислота. Существует в окисленной и восстановленной формах.
Н2С СН —(СН2)4—СООН +2Н^ Н2С СН —(СН2)4—СООН
I I ^ 7" I I
5 5 ~2Н 5Н Н5
Липоевая кислота Дигилролипоевая кислота
Липоевая кислота служит простетической группой ферментов пи-
руват- (ПДК) и а-кетоглутаратдегидрогеназного (а-КГДК)
комплексов, участвуя в реакциях окислительного декарбоксилирования а-ке-
токислот (пировиноградной и а-кетоглутаровой) и переносе ацильных
групп. В молоке ее содержится 0,02...0,05 мг/кг.
Витамин Р — биофлавоноиды (антиоксидантный); это
гетерогенная группа низкомолекулярных фенольных соединений, в составе
которой катехины, лейкоантоцианы, флаваноны, флавонолы, анто-
цианы, флавоны. Предшественником всех этих фенолов является ши-
кимовая кислота. Некоторые производные витамина Р (дигидроквер-
цетин, кверцетин) обладают антиоксидантным действием.
Дигидрокверцетин
97
Биохимия животных
Недостаток витамина Р сопровождается потерей устойчивости и
проницаемости капилляров, повышенной ломкостью кровеносных
сосудов, приводящей к мелкоточечным кровоизлияниям.
Применяется при нарушении проницаемости сосудов, капилляро-
токсикозах, септическом эндокардите.
Витамин РР — никотиновая кислота (антипеллагрический);
является пиридин-3-карбоновой кислотой.
соон
Никотиновая кислота
В организме животных и человека витамин РР образуется из
триптофана, а в растениях — из аспартата и производных триоз.
Основными источниками витамина РРдля человека являются рис, пшеница,
картофель, мясо, печень, почки, морковь и др. Богаты витамином РР
пивные дрожжи. В молоке его содержится 0,8...1,8 мг/кг. Витамин РР
входит в состав НАД и НАДФ, участвующих в
окислительно-восстановительных реакциях, катализируемых дегидрогеназами. В
окислительной реакции НАД и НАДФ выполняют роль переносчиков
электронов и протонов с окисляемых субстратов. При недостатке витамина
в организме развивается заболевание пеллагра (кожа краснеет,
становится шершавой, покрывается пузырями, трещинами, на местах
лопающихся пузырей остаются изъязвления). Используется при
заболеваниях печени, сердца, ранах и язвах.
Витамин 1} — 8-метилметионин (антигистаминный); является
предшественником метионина. Витамин V имеет следующее строение:
Глава 1. Биогенные молекулы
НООС — гн — СН2—СН2— 5 ^ IС1
' СН3
МН2
5-метилметионин
Много витамина II в овощах (свежая капуста, зелень петрушки, лук,
перец), фруктах (бананы). Особенно высокое содержание его в
капустном соке. Богаты витамином V молоко и животные ткани (печень).
Витамин V используется при лечении язвенной болезни в качестве
антигистаминного препарата.
1.6.2. Витамины растворимые
в неполярных растворителях
Витамин А — трансформы Аь А2-ретинолы и цисформа Агрети-
нол (неовитамин А) (антиксерофтальмический); в составе витамина
шестичленное р-иононовое кольцо, два остатка изопрена и спиртовая
группа. Витамин А2 отличается от А] наличием дополнительной
двойной связи в кольце р-ионона.
г
^ СН СН
Ретинол, транс-изомер
Предшественниками витамина являются а-, Р-, у-каротины,
которые способны в организме животных и человека, превращаться в
функционально активные витамины группы А. Высокое содержание
витамина А отмечается в печени КРС и свиней, яичном желтке, сметане,
сливках. В молоке витамина А может содержаться от 0,08 до 1,0 мг/кг,
а в молозиве — от 0,6 до 12 мг/кг. Особенно богаты витамином
зеленый лук, шпинат, петрушка, салат, щавель, крыжовник, черная
смородина, а также овоши (морковь, томаты, перец). Предшественниками
витамина являются каротины (а-, р-, у-каротины). Витамин участвует
в процессе фоторецепции сумеречного зрения. При недостатке
витамина развивается сухость роговой оболочки глаза (ксерофтальмия),
а дальнейшее развитие этого процесса может привести к воспалению
99
Биохимия животных
конъюнктивы, отеку, изъязвлению и размягчению роговой оболочки
глаза (кератомаляция). Фоточувствительным пигментом палочек
сетчатки является родопсин — хромопротеин, состоящий из окисленной
формы витамина А (цкс-ретиналь) и белка опсина. Цис-ретиналь
связывается своей альдегидной группой со свободной ЫН2-группой белка
с образованием основания Шиффа. Под действием света цис-ретиналь
отщепляется от родопсина, переходя в устойчивую транс-форму. В
темноте происходит обратный процесс — синтез родопсина. Образование
родопсина возможно только при наличии цде-ретиналя, который
может синтезироваться из цис-ретинола или транс-ретиналя в реакциях
изомеризации (/я/юнс-ретиналь -> цде-ретиналь) или дегидрирования
(цнс-ретинол + НАД -» цис-ретиналь + НАДН), катализируемых
соответственно ретинальизомеразой и алкогольдегидрогеназой.
<р3 <[Нз
**снхЧн'
'СН^ /С^ /СИ0
сн сн
Рстиналь, транс-изомер
Показаниями к лечебному применению витамина являются ксе-
рофтальмия, кератомаляция, экзематозные повреждения век,
обморожения, ожоги, раны, фолликулярный дискератоз, некоторые формы
экземы, острые и хронические заболевания, цирроз печени и др.
Витамин и — кальциферолы (В2 — эргокальциферол, Оз — холе-
кальциферол и04~ дигидроэргокальциферол) (антирахитический).
Предшественником витамина Э2 является эргостерин,
представляющий собой одноатомный ненасыщенный циклический спирт, в основе
структуры которого пергидрофенантренциклопентан. Под действием
УФ-излучения происходит разрыв между 9-м и 10-м углеродными
атомами кольца В эргостерина, превращающие его в витамин 02.
Эргостерин
СН3
Э2-эргокальциферол
СН3
СН3
100
Глава 1. Биогенные молекулы
Витамин Р3 образуется под действием УФ-облучения из
холестерина или 7-дегидрохолестерина.
В тканях животных витамин накапливается в почках, мозге,
поджелудочной железе, гипофизе, молочной железе. В молоке
содержится от 0,5 до 1,5 мкг/кп Высокое содержание витамина отмечается
в сливочном масле, желтке яиц, печени трески, в рыбьем жире, икре.
В растениях витамины группы Р не синтезируется, однако они
являются поставщиками 7-дегидрохолестерина.
7-дегидрохолестерин Дз-холскальциферол
Витамин О в организме животного может связываться со
специализированным рецепторным белком. Витамин участвует в регуляции
процессов всасывания ионов кальция и фосфора в кишечнике,
резорбции костной ткани и реабсорбции Са2+ и фосфора в почечных
канальцах. Кроме того, витамин О регулирует процессы остеогенеза и
ремоделирования костной ткани. Таким образом, основная функция
витамина Б заключается в поддержании оптимальной концентрации
ионов кальция к фосфора в плазме крови. Недостаток витамина О в
рационе питания животных и человека может приводить к
возникновению заболеваний костной ткани (остеомоляция — размягчение костей
или остеопороза — хрупкости костей). Прием очень больших доз
витамина О может вызвать смертельный исход.
Витамин Е — а-, р-, у-, 8-токоферолы (антиоксидантный) —
производные 2-метил-2(4',8г,12'-триметилтридецил)-хроман-6-ола, или
токолы.
СН3 СН3 СН3
(СН2)3 — СН — (СН2)3 — СН — (СН2)3 — СН— СН3
СН3
СН3
а-Токоферол
101
Биохимия животных
Витамины отличаются друг от друга числом и расположением ме-
тильных групп в бензольном кольце. Все они нерастворимы в воде, но
растворимы в неполярных растворителях. Устойчивы к нагреванию,
но быстро окисляются под действием УФ-излучения. Высоко
содержание витамина Е в растительных маслах (подсолнечное, хлопковое,
соевое, кукурузное и др.). Много витамина в капусте, салате,
семенах злаков, проростках пшеницы. Витамин Е может накапливаться
в животных тканях (мышцы, поджелудочная железа, жировая ткань).
В молоке содержание витамина Е может доходить до 0,7...1,9 мг/кг.
Основной функцией витамина Е является антиокислительная. Он
способен защищать от окисления полиненасыщенные жирные
кислоты, входящие в состав биомембран, жировых шариков молока.
Витамин К — производные нафтохинона К| и К2
(антигеморрагический). К1 является производным 2-метил-1,4-нафтохинона, в
положении 3 у которого фитильный радикал с 20-ю атомами углерода.
СН3 СН3 СН3 СНз СН3
СН2—СН =С—(СН2)3 —СН — (СН2)3 — СН— (СН2)3 — СН— СНз
о
Витамин К] (филлохинон)
Витамин К2 содержит в боковой цепи от 6 до 9 изопреновых
единиц.
Т г г
^^ сн2—сн = с — (сн2— сн2—сн=с) п— сн3
о
Витамин К2
Витамины фуппы К нерастворимы в воде, но хорошо растворимы
в бензоле, хлороформе, ацетоне, гексане и др. Витамин К быстро
окисляется в щелочной среде и при облучении. Богаты витамином К
листья каштана, крапивы, люцерны. Среди овощей больше всего ви-
102
Глава 1. Биогенные молекулы
тамина К накапливается в капусте, шпинате, тыкве, зеленых томатах.
В животных тканях витамина К содержится очень мало. Основным
источником витамина К в детском возрасте является молоко.
Витамин К принимает участие в реакциях окислительного фосфорилиро-
вания, выполняя коэнзимные функции в реакциях, катализируемых
филлохинонредуктазой и менадионредуктазой. Вовлечен в реакции
синтеза ферментов свертывания крови (фактор II, VII, IX, X),
активируя биосинтез мРНК. Выполняет роль кофактора в реакциях у-кар-
боксилирования остатка глутаминовой кислоты в составе факторов
свертываемости крови, катализируемые микросомальной у-глутамил-
карбоксилазой. При недостатке витамина К возникают
самопроизвольные паренхиматозные и капиллярные кровотечения, снижается
скорость свертывания крови. Проявления недостатка витамина К
могут быть связаны с перенесенными заболеваниями печени, обтураци-
онной желтухи, хроническими заболеваниями кишечника и др.
1.7. ЭЛЕМЕНТЫ
В организме животного содержится более 30 элементов, которые
присутствуют в свободном виде или в составе белков и биологически
активных соединений. Условно все элементы подразделяют на две группы —
макро- и микроэлементы.
Макроэлементы в основном представлены ионами N3% К*, Са2+,
С1 \ М^2+, а также 8 и Р.
Они присутствуют в живых организмах в высоких концентрациях
(более I мМ), обладают индивидуальным или входящим в состав
биогенных молекул действием.
Микроэлементы содержатся в живых организмах в низких
концентрациях (менее I мМ); они проявляют свое действие в составе
функциональных белков или низкомолекулярных соединений (витаминов,
гормонов и субстратов ферментативных реакций). К микроэлементам
относятся ионы 2п2+, Ре3*, А13+, Р", 8п2+, Вг, Си2+, Мп2+, Мо2+, РЬ2+, Г,
А*3\ 8е2+, Сг3*, №*\ <И2\ Н82+, Со2+.
Таким образом, все эти элементы можно отнести к регуляторам
локального действия, в присутствии которых проявляется активность
функциональных белков и низкомолекулярных биогенных молекул.
Натрий. Концентрация ионов №* в плазме крови животных
130...150 мМ. В костной системе содержится от 30 до 40% общего
количества натрия в организме. Транспорт ионов №+ осуществляет №\
103
Биохимия животных
К+-АТФаза, которая одновременно переносит через мембрану три
иона №+ из клетки во внешнюю среду и два иона Ю из внешней
среды в клетку. Ионы №+ участвуют в поддержании
кислотно-щелочного баланса в организме. Кроме того, натрий регулирует
осмотическое давление. Ионы N3+ активируют проведение импульсов по
нервным волокнам, обусловливая сократительную деятельность мышц.
Совместно с ионами К+ и СГ ионы Ыа+ принимают участие в
поддержании трансмембранного потенциала.
Кортикостероиды, в частности, дезоксикортикостерон способствует
накоплению ионов №* в организме. При гипофункции коры
надпочечников, уремии, расстройствах желудочно-кишечного тракта
наблюдается понижение концентрации натрия в крови.
Калий. В плазме крови животных содержится 2...6 мМ ионов К\
Основным местом накопления калия служит цитоплазма клетки.
Ионы К+ совместно с ионами №* поддерживают кислотно-щелочной
баланс в организме животных, а также осмотическое давление.
Содержание ионов К+ регулируется гормонами коры
надпочечников — алыюстероном, дезоксикортикостероном, кортизоном и др.
Недостаток калия в организме вызывает нарушения в деятельности
сердца, мышечную гиподинамию, задерживает рост животных.
Кальций. Ионы Са2+ являются основными элементами костной
ткани (содержание Са может доходить до 98%). В плазме крови
животных концентрация кальция равна 2,2...2,8 мМ. Кальций участвует
в процессе свертывания крови, сокращении мышц, передаче нервного
импульса. Ионы кальция стимулируют фагоцитарную функцию
лейкоцитов, повышая противовоспалительные реакции организма.
Присутствие ионов Са2+ в составе белков повышает их
стабильность к высоким температурам. Ионы кальция активируют протеин-
киназу, ускоряя протекание процесса фосфорилирования, а также
липазу и фосфолипазу.
Основное количество Са2+ поступает в организм животных в виде
солей фосфорной кислоты. Наиболее растворимые среди них: Са3(Р04)2,
СаНР04, Са(Н2Р04)2.
Всасывание ионов Са2* происходит главным образом в
проксимальных участках тонкого отдела кишечника, причем наиболее
активно этот процесс наблюдается у растущего организма, а также при
беременности и лактации.
На процесс всасывания кальция оказывает влияние присутствие
витамина О. Активной формой витамина О служит 1,25-диоксихоле-
104
Глава 1. Биогенные молекулы
кальцеферол, образование которого происходит в печени и почках путем
последовательного гидроксилирования. Превращение холекальцифе-
рола происходит в печени при участии НАДН-зависимых ферментов и
кислорода в митохондриях в 25-оксихолекальциферол, дальнейшее гид-
роксилирование которого в почках приводит к образованию 1,25-диок-
сихолекальциферола.
1,25-Диоксихолекальциферол стимулирует образование в стенке
кишечника специфичного Са2+-связывающего белка, который совместно
с Са2+-зависимой АТФазой участвует в переносе иона через
полупроницаемые мембраны. Часть кальция, проникшего в кровь, переносится по
кровеносным сосудам в составе альбумина и кальмодулина. Последний
широко представлен в тканях организма, способен связывать и
накапливать кальций в составе комплекса Са2+-кальмодулин. Причем количество
Са2+, связанного с белками, может увеличиваться с возрастанием рН.
Местом локализации ионов кальция является костная ткань, куда
Са2+ может откладываться и откуда может извлекаться. В норме
кальций выводится из организма через кишечный тракт, где главным
переносчиком ионов Са2+ служат компоненты желчи.
Гормоны щитовидной и паращитовидной желез (паратгормон и каль-
цитонин) регулируют концентрацию ионов Са2+ в крови.
Содержание кальция в молоке составляет 114... 130 мг%. Около
20% всего количества ионов кальция принимают участие в
формировании мицелл казеина. Остальная часть ионов кальция находится в
растворе в виде солей фосфорной и лимонной кислот.
Понижение содержания ионов Са2+ в организме сопровождается
проявлением следующих заболеваний: рахит, остеомоляция, гломеру-
лонефрит, механическая желтуха.
Магний. В крови животных содержится 1...2 мМ ионов магния.
Ионы магния связываются с АТФ с образованием комплексов М§2+-
АТФ. В составе таких комплексов ионы магния участвуют в
ферментативных реакциях, катализируемых киназами и дегидрогеназами
(гексокиназа, фосфофруктокиназа, енолаза, пируваткиназа, глюкозо-
6-фосфатдегидрогеназа, изоцитратдегидрогеназа и др.).
Ионы магния активируют ДНК- и РНК-полимеразу, полинуклео-
тидфосфорилазу, нуклеотидазу, рибонуклеазу, дезоксирибонуклеазу и
другие ферменты нуклеинового обмена. Кроме того, ионы магния
принимают участие в процессе синтеза ацетил-КоА, фосфохолина, холин-
фосфатидов. Ионы магния и кальция активируют синтетазу ацетил-
КоА и АТФазу.
105
Биохимия животных
Ионы магния участвуют в активации компонентов системы
комплемента. Магний необходим для сокращения мышц. При
понижении содержания ионов магния в организме отмечается слабость,
сердечная аритмия.
Марганец. Ионы Мп2+ входит в состав пируваткарбоксилазы и окса-
латдекарбоксилазы. Активирует аргиназу, которая катализирует
реакцию образования мочевины из аргинина. Ионы марганца активируют
синтез гликозаминогликанов, формирующих основу межклеточного
матрикса соединительной ткани. Марганец участвует в катализе глю-
козо-6-фосфатдегидрогеназы, аминоацилтрансферазы, изоцитратде-
гидрогеназы, фосфодиэстеразы и др.). Ионы марганца активируют
тиаминкиназу, аргиназу, дезоксирибонуклеазу, енолазу и др.
Ионы марганца и магния участвуют в каталитических реакциях
биосинтеза белка. Ионы марганца активируют ферменты цикла три-
карбоновых кислот, синтеза жирных кислот и холестерина, синтеза
гликогена и предшественников протеогликанов.
Недостаток ионов марганца в организме животных может
способствовать развитию аномалий в формировании костной ткани,
снижению оплодотворяемое™ и удлинению сроков стельности коров,
повышению частоты выкидышей и др.
Железо. В организме животных железо может находиться в
восстановленной Ре24 или окисленной Ре3+ формах. Кислородсвязывающие
белки гемоглобин и миоглобин функционально активны, если в их
составе находится восстановленная форма железа. Однако
каталитические белки (пероксидаза, каталаза, цитохром-с-пероксидаза и др.)
проявляют действие при наличии окисленной формы. Причем все
гемсодержашие белки обладают пероксидазной активностью.
Основным переносчиком железа в организме животных служит ферритин
или трансферрин. Эти белки способны связывать железо в
нетоксичной и легко доступной форме. Так, ферритин селезенки лошади
может содержать до 23% от его сухой массы. Молекулярная масса ферри-
тина около 430...480 кДа. Максимально ферритин способен связывать
до 4500 атомов железа на молекулу белка. В составе белкового
комплекса до 24 субъединиц с молекулярной массой 18...20 кДа каждая.
Железо, связанное с белком, образует комплексы гидратированного
оксида железа с фосфат-ионом [(РеООН)8(РеО-ОР03Н2)].
Недостаток железа в организме животных может способствовать
развитию анемии. Особенно чувствительны к недостатку железа
поросята, вследствие низкого содержания железа в молоке свиноматок.
106
Глава 1. Биогенные молекулы
Фосфор. Встречается в составе многих биогенных соединений
живого организма. В частности, фосфоросодержащими
соединениями являются низкомолекулярные вещества (АМФ, АДФ, АТФ,
цАМФ, креатинфосфат и др.), а также промежуточные метаболиты
(глюкозо-6-фосфат, фруктозо-6-фосфат, 3-фосфоглицериновый
альдегид и др.). Кроме того, фосфор обнаруживается в коферментах
(НАД+, ФАД, НАДФ+, Н8-КоА, ТПФ, ФП и др.). Фосфорилирован-
ные формы белков связываются с ионами Са2\ образуя мультибел-
ковые комплексы или мицеллы. Фосфор входит в состав
структурной части РНК и ДНК.
Фосфор совместно с кальцием образует костную ткань. Содержание
фосфора в организме животных регулируется паратгормоном,
тироксином и эстрогеноми. Особенно активно фосфор используется в
функционировании мозга, печени и мышц.
Недостаток фосфора в организме животных приводит к развитию
рахита, остеомаляции, остеопороза и других заболеваний.
Сера. Входит в состав серосодержащих аминокислот (метионина,
цистеина). Сера является компонентом витаминов В, (тиамин) и
Н (биотина), а также обнаруживается в составе Н5-КоА, таурина,
хондроитинсерной кислоты, гепарина. Серосодержащие
соединения ФАФС и серная кислота участвуют в механизмах
дезинтоксикации организма животных от действия индола, скатола,
индоксила, крезола и фенола.
Хлор. Анионы СГ совместно с ионами №+ и К+ поддерживают
осмотическое давление плазмы. Ионы хлора обеспечивают
формирование трансмембранного потенциала. Кроме того, ионы СГ секретиру-
ются слизистой желудка для образования соляной кислоты.
Цинк. Ион 2п2+ входит в состав ключевых ферментов
метаболических процессов карбоангидразы, фосфоглицеринальдегиддегидроге-
назы, лактатдегидрогеназы, глутаматдегидрогеназы, алкогольдегидро-
геназы, тимидинкиназы, РНК- и ДНК-полимераз и др. Ионы цинка
участвуют в формировании структур инсулина и глюкагона,
активируют половые гормоны и гормоны передней доли гипофиза. Кроме
того, цинк понижает свертываемость крови.
При недостатке цинка понижается поедаемость кормов,
замедляется рост животных, снижается плодовитость самок, нарушается
сперматогенез у самцов.
Медь. Функциональное действие меди проявляется в составе ци-
тохромоксидазы, тирозин азы, уратоксидазы, полифенолоксидазы и
107
Биохимия животных
других оксидоредуктаз. При дефиците меди понижается связывание
трансферрином железа, которое необходимо для образования
гемоглобина. Кроме того, медь влияет на рост костных и
соединительных тканей. Медьсодержащими белками являются церулоплазмин,
эритрокупреин и гематокупреин. Последний содержится в печени,
обеспечивая накопление меди в организме.
Недостаток меди сопровождается нарушением развития головного
мозга, наступлением преждевременных родов, ухудшением качества
волосяного покрова.
Избыток меди в организме животных может приводить к некрозу
клеток печени, гемолизу эритроцитов, метгемоглобинемии, гиперби-
лирубинемии.
Йод. Активное поглощение йода происходит щитовидной
железой, где он используется в процессе синтеза тироксина и его
производных, входя в состав этих гормонов. Регулирует эти процессы ти-
реотропин, гормон передней доли гипофиза.
Недостаток йода в организме проявляется возникновением
заболевания эндемический зоб, задержкой роста и продуктивности
животных, снижением устойчивости к инфекционным заболеваниям.
У птиц снижается яйценоскость.
Кобальт. В организм животных кобальт преимущественно
поступает в составе витамина В12. Цианокобаламин является
продуктом микробного синтеза в кишечнике у моногастральных
животных и рубце у жвачных. Накапливается кобальт в печени, почках
и селезенке. Участвует в процессе кроветворения, образовании гем-
содержащих белков (гемоглобина, миоглобина, каталазы, цитохрома
и др.), в синтезе пуриновых и пиримидиновых оснований, холина,
метионина. Кроме того, обеспечивает образование миелиновой
оболочки.
Кобальт входит в состав трансфераз, изомераз и дипептидаз.
Ускоряет протекание ферментативной реакции с участием пируваткар-
боксилазы, рибофлавинкиназы, щелочной фосфатазы, аргиназы,
каталазы, альдолазы и др.
Недостаток кобальта приводит к развитию у животных анемии,
сопровождаемой понижением содержания эритроцитов и
концентрации в них гемоглобина.
Селен. В организме животных селен действует как антиоксидант,
т. е. подавляет образование свободных радикалов. Входит в состав глу-
татионредуктазы и глутатионпероксидазы.
108
Глава 1. Биогенные молекулы
Селен способен регулировать накопление гидроперокси- и гидрок-
сипроизводных ненасыщенных жирных кислот (КН) и фосфол ипидов,
образование которых сопровождается следующей реакцией:
КН + 02->КООН
Восстановление гидропероксидов (КООН) может протекать при
участии глутатиона (Г-5Н) в присутствии глутатионтрансферазы (1).
Регенерация глутатиона осуществляется НАДФН и катализируется
глутатионредуктазой (2).
Ш
КООН + Г-8Н -► КОН + Г8-8Г + Н20
ш
НАДФН + Н+ + Г5-5Г -► НАДФ+ + 2Г-5Н
Недостаток селена может проявиться в виде эксудативного диатеза,
мышечной дистрофии, нарушением воспроизводительной функции,
сердечной деятельности и дыхания. В тяжелых случаях отмечается
некроз кончиков ушей и хвоста, а также некроз клеток печени и мышц.
Молибден. Входит в состав ксантиноксидазы и альдегидоксидазы.
Ксантиноксидаза участвует в метаболизме пурина и его производных,
тогда как альдегидоксидаза относится к флавогемопротеинам,
катализирует реакции окисления альдегидов и производных хинолина и
пиридина.
Кроме того, молибден у жвачных животных активирует рост
бактерий рубца и за счет этого улучшает поедание и усвоение кормов.
Фтор. В организме животного фтор накапливается в основном
в зубах и костях. Образование фторапатитов способствует
повышению прочности костей, дентина и эмали зубов.
Недостаток фтора сопровождается проявлением кариеса зубов и
остеопорозом.
1.8. АЗОТИСТЫЕ ОСНОВАНИЯ
В состав нуклеиновых кислот (ДНК и РНК) входят пять различных
остатков азотистых оснований: аденин, гуанин, цитозин, тимин, ура-
цил, имеющих соответственно буквенное обозначение А, Г, Ц, Т и У.
109
Биохимия животных
При этом азотистыми основаниями называются низкомолекулярные
азотсодержащие гетероциклические соединения, основными
структурными элементами которых являются пиримидин и пурин.
Пиримидины
О м
Н
Тимин
Пурины
1ЧН2
Лдснин
Гуанин
Соединения, в которых азотистые основания (пурины и
пиримидины) связаны 1\1-гликозидной связью с рибозой или дезоксирибозой
(аденозин, гуанозин, тимидин, уридин, цитидин) называются нуклео-
зидами.
110
Глава 1. Биогенные молекулы
Фосфорные эфиры нуклеозидов называются нуклеотидами.
Например, адениловая кислота (АМФ), гуаниловая кислота (ГМФ), цити-
диловая кислоты (ЦМФ), уридиловая кислота (УМФ), тимидиловая
кислота (ТМФ) могут называться как аденозин-5'-монофосфат, гуа-
нозин-5'-монофосфат, цитидин-5'-монофосфат, уридин-5'-монофос-
фат, тимидин-5'-монофосфат.
N ч Азотистое
^, основание
./~
**" ]Ч-Гликозидная
Дезоксирибоза
К-Н
Рибоза
К-ОН
Нуклеотид
Штрихом (Г, 2\ 3', 4' и 5') принято отмечать атомы углерода в
составе рибозы и дезоксирибозы, чтобы отличить их от атомов углерода,
входящих в состав пуриновых и пиримидиновых оснований.
При рН » 7,4 свободные нуклеотиды присутствуют в
диссоциированной форме, так как рК ОН-групп остатка фосфорной кислоты
равны 1,0 и 6,2.
Азотистые основания и моносахарид, входящие в состав РНК и
ДНК, определяют их принадлежность. Так в состав ДНК входят аде-
нин, гуанин, цитозин, тимин и дезоксирибоза, а в РН К вместо тимина
присутствует урацил и вместо дезоксирибозы — рибоза.
В составе большинства нуклеиновых кислот обнаружены в
небольших количествах также некоторые другие (главным образом
метилированные) производные пуринов и пиримидинов(1Ч6-метиладенозин,
1Ч2-метилгуанозин, инозин, ксантин, гипоксантин, 7-метилгуанозин
и др.).
111
Биохимия животных
•чХ*>
N
I
Рибоза
Инозин
МН—СН3
\Л / НзС-ны^м^Ч,
тХ^»
Рибоза
Х1б
N -метиладенозим
N
I
Рибоза
N 2-метил гуанози н
В ферментативных реакциях в качестве коферментов могут
участвовать нуклеотиды, в составе которых — еще один или два остатка
фосфата. Эти соединения называются нуклеозиддифосфаты (АДФ,
ГДФ, УДФ, ЦЦФ и ТДФ) или нуклеозидтрифосфаты (АТФ, ГТФ,
УТФ, ЦТФиТТФ).
1чк
он
I
он он
&
м^
НО-Р- О-Р- 0-Р-0-СН2
II II II
о о о
ОН ОН
Аденозин-5'-монофосфат (АМФ)
Аденозин-5'-дифосфат АДФ)
Аденозин-5'-трифосфат (АТФ)
Реакции дезаминирования нуклеотидов катализируют различные
дезаминазы. Так, например, АМФ-дезаминаза катализирует
следующую реакцию:
АМФ + Н20 -> ИМФ + NНз
Восстановление АМФ возможно в ходе реакций, использующих
аспартат и катализируемые аденилсукцинатсинтетазой и аденилсук-
циназой.
112
Глава 1. Биогенные молекулы
Аминирование ИМФ протекает через стадию образования
аденилосукцината, промежуточного соединения аспартата и инозиновой
кислотой (рис. 1.13). Образование аденилосукцината катализируется
аденилосукцинатсинтетазой (1). Реакция протекает в присутствии
ГТФ и ионов магния. Отщепление фумарата от аденилосукцината
осуществляется при участии аденилосукциназы (2). В результате
образуется адениловая кислота.
-оос-с-с-соо- -оос-с-с-соо- ^
1 м Н|мн/ н,о '^н м -оос-с=с-соо- м".
1 I I
Рибозо-5-фосфат Рибозо-5-фосфат Рибозо-5-фосфат
Инозинмонофосфат Аленилосукиинат Аленозинмонофосфат
НАД*
НАДН
+Н*
Ж
Н,0
нм
Глутамин Глутамат и
Н | 1
Рибозо-5-фосфат Рибозо-5-фосфат
Ксантозинмонофосфат Гуанозин монофосфат
Рис. 1.13. Превращение ИМФ в АМФ и ГМФ:
/ — аденилосукиинатсинтетаза; 2 — аденилосукциназа;
3— ИМФ-дегидрогеназа; 4— ксантозинмонофосфатаминаза
Аналогично образуется гуанозинмонофосфат. При этом образуется
промежуточное соединение ксантозинмонофосфат. В реакции
участвует НАД и Н20. На следующей стадии ксантозинмонофосфат ами-
нируется аминофуппой глутамина (рис. 1.14). Для протекания
реакции необходим АТФ.
Азотистые основания поглощают свет в ультрафиолетовой области
спектра с длиной волн 200...300 нм и максимумом около 260 нм. В
организме животных продуктами ферментативного разложения
пуринов является мочевая кислота, а пиримидинов — С02, N43,
мочевина, (3-аланин и р-аминоизомасляная кислота.
113
Биохимия животных
1.9. НУКЛЕИНОВЫЕ КИСЛОТЫ
Нуклеиновые кислоты, полинуклеотиды, — важнейшие
биологически активные биополимеры, содержащиеся в каждой клетке всех
организмов. Дезоксирибонуклеиновые кислоты, или ДНК,
локализующиеся преимущественно в ядрах и митохондриях клеток, а
рибонуклеиновые, или РНК, находятся главным образом в цитоплазме.
Нуклеиновыми кислотами являются высокомолекулярные
соединения с молекулярной массой 2,5-Ю4...^ 10?, основным строительным
элементом которых служат нуклеотиды. Цепи нуклеиновых кислот
содержат от нескольких десятков до многих тысяч нуклеотидных
остатков, расположенных линейно в определенной последовательности,
уникальной для данной нуклеиновой кислоты. При этом как РНК, так и
ДНК представлены огромным множеством соединений.
Индивидуальная линейная последовательность нуклеотидов определяет первичную
структуру нуклеиновой кислоты, которая образована за счет
последовательного связывания нуклеотидов, соединенных между собой за счет
фосфодиэфирных связей. В образовании межнуклеотидной связи
участвуют гидроксильные группы в 3'- и 5'-положениях остатков углеводов.
?
Фрагмент цепочки ДНК
114
Глава 1. Биогенные молекулы
&
^
О г
1
;—р
/у
* 1
он
" 1
он
0 1
он
1 1
5*0Н
-о —р=^р
"0—Р = о
-о—р=о
ЗЧ)Н
0 г-
I!
-Р+-
I:
о-:
Н/4 V
Р4- 0—СН,
Фрагмент цепочки РНК
Вторичная структура нуклеиновой кислоты возникает в результате
сближения определенных пар азотистых оснований (а именно: три
поперечные водородные связи формируются между гуанином и цитози-
ном (Г^Ц) и две — между аденином и тимином (А=Т) или между аде-
нином и урацилом (А=У) по принципу комплементарное™), а также
гидрофобных взаимодействий между ними.
он "зЧ^Р--^\
но—р=о { \мн—
0=Р—ОН
?
но—р=о
о=р—он
0=Р— ОН
I
он
115
Биохимия животных
1.9.1. Дезоксирибонуклеиновая кислота
ДНК — это высокомолекулярное соединение, образованное за счет
последовательного связывания нуклеотидов в полинуклеотидную
цепь, в упорядоченном расположении и заложена индивидуальная
информация о живом организме, реализируемая через
упорядоченный синтез белков и формирование специализированных органелл,
входящих в состав клетки, которые определяют индивидуальные
признаки организма. ДНК является полинуклеотидом (биополимер).
Устойчивость структуры ДНК приобретается путем
комплементарного и антипараллельного связывания между собой двух полинук-
леотидных цепей с помощью водородных связей, образуя правовин-
товую спираль вокруг общей оси (рис. 1.14, а).
Рис. 1.14. Фрагменты вторичной структуры молекулы ДНК:
а — фрагмент двойной спирали ДНКа, б— фрагменты правозакрученной;
В- (1), А- (2) форм и левозакрученной 2-формы (3).
116
Глава 1. Биогенные молекулы
ДНК может находиться в А-; В- и 2-формах (рис. 1.14, б), В
структуре ДН К записана информация о всех белках, синтезируемых в клетке,
а также индивидуальные (видовые) свойства, форма и поведение
живого организма.
Таким образом, ДНК представляет собой правильно
ориентированную в пространстве спираль, образованную за счет комплементарного
расположения двух полинуклеотидных цепей, закрученных друг
относительно друга и вокруг общей оси. Диаметр спирали равен 1,8 нм,
а длина витка спирали составляет 3,4 нм. Один виток спирали
представлен 10 нуклеотидными остатками. Спираль — правозакрученная,
а полинуклеотидные цепи в ней антипараллельны, т. е. в одной поли-
нуклеотидной цепи фосфодиэфирные связи имеют направление 3'->5',
а в другой противоположное — 5'->3'. При этом на каждом из концов
молекулы ДНК будут располагаться 5'-конец одной и З'-конец другой
полинуклеотидной цепи. Углеводно-фосфатные последовательности
обращены наружу, а азотистые основания во внутрь структуры ДНК.
При этом определенное пространственное расположение двух
полинуклеотидных цепей ДНК, комплементарно связанных между
собой за счет водородных связей, приобретающих устойчивую структуру,
стабилизированную нековалентными связями с белками (гистонами),
формируют третичную структуру ДНК.
Неоднородность структуры ДНК определяется наличием в ее
составе генов, каждый ген имеет два участка: регуляторный и
структурный. В состав регуляторного участка входят ген-регулятор,
ген-оператор, ген-промотор (рис. 1.15). При этом ген-регулятор является
участком в структуре ДНК, регулирующим активность
структурных генов (экспрессию), содержащим и передающим информацию
о белке-репрессоре, который выполняет посреднические функции
в регулировании активности гена. Белок-репрессор имеет сродство
к гену-оператору и обратимо связывается с ним в комплекс,
образование которого блокирует процесс синтеза пре-РНК. Таким образом,
функция белка-репрессора заключается в том, что он регулирует
активность структурных генов, ответственных за синтез пре-РНК. При
этом на поверхности белковой глобулы белка-репрессора имеется
участок, в котором специфически могут связываться
низкомолекулярные регуляторные молекулы-индукторы.
Рядом с ген-оператором располагается ген-промотор, который
служит местом связывания ДНК-зависимой РНК-полимеразы и
участвующий в регуляции синтеза пре-РНК.
117
Биохимия животных
и
Регулярный Про7"0,Ъператоо- Структурные
ген _ * <
"Мо( г "
гены
Щ
I
(а)
Р
Транс- |
крипция ф
у
1ас - оперон
мРНК
Трансляция!
Релрессор
►О САР - цАМФ комплекс
/5р<Л РНК - полимераза
И1 ' 1 Ир Го~1
(б)
Г^Г
Запрет на транскрипцию
цАМФ| у^~^ Индуктор
ЦАМФ ,^-
ж - САР- ♦
Активный релрессор ^ок
Чг (активатор)
Ж
И
I
■ч-*>
(а)
I Транскрипция
1ас-мРНК
I Трансляция
Галактозидаза Трансацетилаза
Пермеаза
Рис. 1.15. Структура 1ас-оператора Е. соН (а) и механизмы регуляции его
транскрипции: репрессии (б) и индукции (в) (Овчинников, 1987)
Ген неоднороден по своей структуре и в его составе выделяют
оперон (транскриптон), который является элементарной единицей
транскрипции, ограниченный промотором и терминатором и участвующий
118
Глава 1. Биогенные молекулы
в процессе биосинтеза молекулы пре-РНК у прокариот и эукариот.
В структуре оперона различают два участка: информативный и
неинформативный.
Совокупность генов, входящих в состав ДНК, называется
геномом, а суммарная генетическая информация, содержащаяся в
хромосомах, которая получена организмом от предыдущих поколений —
генотипом. При этом в структуре ДНК имеется участок, отделяющий
один ген от другого (он называется спейсер (от англ. зрасег —
промежуток)). Спейсер не кодирует белки.
Участки клеточного генома, в которых закодированы обратные транс-
криптазы, получили название ретротранспозоны, а гены, представленные
в ДНК в виде нескольких копий и перемещающиеся (мигрирующие
элементы ДНК) из одной части генома в другие, называются мобильными
диспергированными генами (МДГ) или транспозонами.
Последовательности ДНК, усиливающие транскрипцию при
взаимодействии со специфическими белками, называются энхансеры.
Сумма всех генов данного вида (заключенных в хромосомах),
обеспечивающая возможность выживание вида в данных условиях
обитания, проявляет специфичность генофонда животного.
ДНК способно к самовосстановлению поврежденных участков и
этот процесс называется репарация.
Информация об аминокислотных остатках, включенных в первичную
структуру белка, закодирована в виде триплетов в первичной структуре
ДНК. При этом триплет представлен тремя последовательно
соединенными между собой нуклеотидами.
Современные аналитические методы позволяют найти в
исследуемом биологическом материале небольшой участок генетической
информации любого организма среди огромного количества других
участков и многократно размножить его — метод полимеразной цепной
реакции (ПЦР). Метод ПЦР основан на принципе естественной
репликации ДНК, включающем расплетение двойной спирали ДНК,
расхождение нитей ДНК и комплиментарное дополнение обеих.
Репликация ДНК может начаться не в любой точке, а только в определенных
стартовых блоках — коротких двунитевых участках. Суть метода
заключается в том, что, маркировав такими блоками специфический только
для данного вида (но не для других видов) участок ДНК, можно
многократно воспроизвести (амплифицировать) именно этот участок.
Биологическая роль нуклеиновой кислоты заключается в
хранении, реализации и передаче наследственной информации, «записан-
119
биохимия животных
ДНК(новая)
Биосинтез ДНК
Биосинтез РНК
Биосинтез белка
Функциональный белок
Рис. 1.16. Схема метаболических процессов
белков и нуклеиновых кислот в клетке
120
Глава 1. Биогенные молекулы
ной» в молекулах нуклеиновой кислоты в виде последовательности
нухлеотидов (генетический код). При этом ДНК является
высокомолекулярным соединением живых организмов, выполняющим роль
матрицы, хранящей информацию обо всех белках, которые
синтезируются в клетках. Кроме того, в ДНК содержится информация о
структуре мембран клеток и ее органеллах, а также информация о поведении
живых организмов в окружающей среде, реализуемая посредством
действия регуляторной системы.
Удвоение ДНК и передача информации (транскрипция, процес-
синг, трансляция, фолдинг) осуществляется специализированными
ферментативными системами (ДНК-полимераза, ДНК-зависимая
РНК-полимераза, нуклеаза и др.), основной целью которых является
синтез функционально активного белка (см. рис. 1.16).
При делении клеток (митозе) происходит самовоспроизводство
ДНК — процесс, который называется репликацией. При этом каждая
дочерняя клетка получает равное количество ДНК, содержащей
программу развития всех признаков соматической клетки. Реализация
этой генетической информации в определенные признаки живого
организма осуществляется путем биосинтеза молекул РНК на молекуле
ДНК и последующего биосинтеза белков с их участием.
1.9.2. Рибонуклеиновые кислоты
В клетках эукариот функционируют несколько типов РНК:
транспортная (тРНК), матричная (мРНК), рибосомальная (рРНК) и малые
РНК. Молекулы РНК представлены преимущественно из одной по-
линуклеотидной цепи, которая может закручиваться, образуя
небольшие участки, в которых азотистые основания формируют
комплементарные пары.
Матричная РНК. мРНК представляет собой копию структурного
участка ДНК, содержащего индивидуальные характеристики
функционального белка. Элементарной составляющей первичной
структуры мРНК служит кодон. мРНК инициирует процесс формирования
и деятельность рибосомы из субчастиц, управляет процессом
биосинтеза белка. При этом мРНК определяет качественно-количественный
состав аминокислот и последовательность их включения в
полипептидную цепочку.
В эукариотических клетках мРНК образуется из пре-РНК в
результате процессинга. мРНК представляет собой полинуклеотидную
цепь, в последовательности нуклеотидов которой закодирована ин-
121
Биохимия животных
формация о первичной структуре белка. При этом концы молекулы
содержат нетранслируемые участки. На 5'-конце мРНК
располагается кэп (сар) участок, в головной части которого присутствует 7-ме-
тилгуанозин. Далее, за последовательностью из 3...15 нуклеотидов,
располагается участок из нуклеотидов, ответственных за связывание
мРНК с рибосомой. Этот участок комплементарен участку рРНК и
необходим для образования и стабилизации комплекса мРНК-рибо-
сома. За этим участком следует триплет АУГ, выполняющий роль
инициирующего кодона процесса биосинтеза белка, за которым
располагаются кодоны аминокислот. Концевой участок мРНК содержит
кодоны УАА, УАГ или УГА, служащие сигнальными триплетами
завершения процесса биосинтеза белка. Кроме того, на З'-конце мРНК
располагается полиаденилат (поли(А)), представляющий
последовательность из 150...200 аденозинмонофосфатов, которая стабилизирует
и предохраняет мРНК от действия РНКаз. Это подтверждается тем,
что мРНК, лишенная поли(А), способна находиться в цитоплазме
всего несколько минут, тогда как мРНК, имеющая поли(А),
разрушается через несколько часов или даже дней.
Таким образом, размер поли(А) определяет продолжительность
функциональной активности и время нахождения мРНК в клетке.
Транспортная РНК. тРНК используется как посредник и
предназначена для специфического связывания аминокислот, которые затем
переносятся к месту синтеза белка на рибосому и за счет своего ан-
тикодона распознает кодон в структуре мРНК. После этого участвует
в избирательном включении аминокислоты в состав первичной
структуры белка.
В составе полинуклеотидной цепи тРНК содержится от 73 до 93
нуклеотидов; она составляет 10...20% суммарной РНК клетки.
Поэтому тРНК представляет собой малые по размеру молекулы с
молекулярной массой 23...30 кДа. Для каждой из 20 аминокислот в клетке
имеется своя тРНК. При этом для некоторых аминокислот
известно несколько тРНК. В пространстве молекула тРНК имеет
упорядоченное расположение полинуклеотидной цепи в виде «клеверного
листа» (рис. 1.17). При этом компактность и стабильность структуры
определяется максимальным числом водородных связей между
азотистыми основаниями. Спирализация молекулы тРНК
обусловливает формирование вторичной структуры полинуклеотида. В
центре молекулы располагается неспирализованная область. В структуре
тРНК выявляются пять ответвлений, в составе которых имеются
122
Глава 1. Биогенные молекулы
одно- и двухцепочные участки. Кроме того, полинуклеотидная цепь
имеет два функционально важных для тРНК конца: 3'- и 5'-концы.
К З'-концу присоединяется аминокислота своей СООН-группой,
образуя аминоацил-тРНК. Присоединение аминокислот к тРНК,
осуществляет специализированный фермент — аминоацил-тРНК-синтетаза.
3'
ОН
Акцепторный
стебель
Вариабельная
петля
Антикодоновая
петля
Рис. 1.17. Структура «клеверного листа» + РНК (Овчинников, 1987)
В головной части тРНК располагается антикодоновая петля,
состоящая из 7 нуклеотидов, в состав которой входит триплет — антикодон.
Последний представлен тремя последовательно связанными нуклеоти-
дами, комплементарными кодону данной аминокислоты в мРНК, и за
счет которого обеспечивается специфичность распознавания кодона
мРНК антикодоном тРНК. В структуре тРНК выявляется Т-петля,
содержащая фрагмент, в составе которого псевдоуридин(рис. 1.18).
123
Биохимия животных
3 -коней
Антикодоновая
петля
Рис. 1.18. Пространственная структура РНК
Этот участок тРНК отвечает за взаимодействие с рибосомой. Э-учас-
ток тРНК имеет петлю, содержащую дигидроуридин. В целом участок
обеспечивает взаимодействие тРНК с ферментом аминоацил-тРНК-син-
тетазой.
И\1
V
Рибоза
Псевдоуридин
А
Рибоза
Дигидроуридин
124
Глава 1. Биогенные молекулы
Рибосомальные РНК и рибосома. Рибосомальные РНК имеют
разнообразную форму. Они служат стрежнем, вокруг которого
происходит упорядоченное связывание и расположение белков,
формирующих рибосому (рис. 1.19).
Борозда ^т :г' Легкая субчастица
1 М*
Тяжелая субчастица
Рис, 1.19. Модель рибосомы (по В. Д. Васильеву)
В эукариотической клетке может содержаться от 104 до 106
рибосом, в зависимости от интенсивности биохимических процессов.
В состав рибосомы эукариот входят две разные по форме и составу
субчастицы (легкая и тяжелая).
Рибосомы и их субчастицы принято обозначать в соответствии
с их коэффициентами седиментации, выражаемые в единицах Свед-
берга (3).
Легкая 405-субчастица содержит 183 РНК и 30 белков, а тяжелая
605-субчастица - 283 РНК, 55 РНК, 5,83 РНК и 41 белок. При этом
рибосомальные РНК сопоставимы по размерам с белками, входящими
в состав рибосомы. Каждая субчастица рибосомы содержит по одной
молекуле рРНК, которая составляет по массе от половины до двух
третей всей субчастицы. В составе 288 РНК животных присутствует
4700...4800 нуклеотидов, а в 185 РНК — около 1900 нуклеотидов. При
этом рРНК служит структурообразующей частью рибосомной
субчастицы, определяя ее форму, а также природу и порядок расположения
рибосомальных белков. Молекулярные массы рибосомальных белков
равны 5...50 кДа. В процессе синтеза белка рибосомы могут
прикрепляться к молекулам мРНК, образуя полирибосомы.
Малая субчастица разделена глубокой бороздой на две части. В
борозде размещается участок, в котором происходит связывание и
последующее протягивание полинуклеотидной цепочки. В борозде
большой субчастицы размещается каталитический центр рибосомы, где
протекает процесс синтеза полипептида.
125
Биохимия животных
Взаимное расположение субчастиц определяет места
локализации антикодона тРНК относительно кодона мРНК, а также
концевой части тРНК с аминокислотой, ориентируя их в области активного
центра.
Палочкообразный отросток большой субчастицы участвует во
взаимодействии с фактором элонгации 1 (ЕР1), а также в ориентации и
связывании фактора элонгации 2 (ЕР2).
Таким образом, рибосома является нуклеопротеином,
выполняющим в клетке белоксинтезирующую функцию, продуктами
которой служат различные белки, определяющие в дальнейшем свойства,
форму и функции клеток. Действие рибосомы основано на том, что
она протягивает вдоль себя мРНК, считывая при этом генетическую
информацию, закодированную в виде триплетов, осуществляет
синтез полипептидной цепочки белка. В процессе биосинтеза белка
происходит расход ГТФ.
Белки рибосомы участвуют как в связывании субстратов, так и
в каталитическом их превращении. Кроме того, беЗпси могут служить
стабилизаторами или модификаторами определенных структур рРНК,
выполняя роль переключателя функциональных состояний рибосомы.
Белки, располагающиеся на границе двух субчастиц, формируют
«карман», котором связываются субстраты (пептидил-тРНК и аминоа-
цил-тРНК), участвующие в образовании первичной структуры белка.
1.10. БИОГЕННЫЕ МОЛЕКУЛЫ
ЭНЕРГЕТИЧЕСКИХ ПРОЦЕССОВ
В составе клеток живых организмов можно определить
соединения органической природы, участвующие в энергетических
процессах или обеспечивающие их протекание. Разнообразие молекул
повышает информационный потенциал биогенной системы, увеличивает
запас внутренней энергии, способствует проявлению многообразия
межмолекулярных взаимодействий.
К энергетическим биогенным соединениям относятся в первую
очередь высокоэнергетические фосфаты, в составе которых
присутствует один или несколько остатков фосфорной кислоты ~РО(ОН)2.
Связь, образованная между остатками органической молекулы и фос-
форильной группы, принято называть макроэргической связью. В
зависимости от природы соединения энергия связи, определяется
запасом стандартной свободной энергии, величина которой выражается
126
Глава 1. Биогенные молекулы
в значениях -ДС°. Вычислить изменение стандартной свободной
энергии можно, если известна величина константы равновесия для
химической реакции при заданной температуре.
В случае если имеется равновесная химическая реакция
яА + АВосС + <Ю,
(где а, Ь, с и й — величины стехиометрических коэффициентов,
участвующих в реакции молекул А, В, С и Э, то
ЛС = ЛС° + К - Т - 1п{[С]с [0]7([А]° [В]*)}.
При этом [А|, [В], [С] и [О] — это молярные концентрации
реагирующих веществ, К — газовая постоянная, Т — абсолютная
температура, ЛО° — изменение стандартной свободной энергии.
В состоянии равновесия значение свободной энергии минимально
и дальнейшее ее изменение не происходит, т. е.АС = 0.
Поэтому уравнение стандартной свободной энергии принимает
следующий вид:
АС° = -К - Т. 1п{[С]с [0]'/(1А]в [В]%
Поскольку величина константы равновесия химической реакции
равна
Кр = [СГ[0|7([АПВП,
то уравнение значения свободной энергии принимает следующее
выражение
ЛО° = -К ■ Т • 1пКр
или
ЛС° = -2,ЗЯ-Т1ёКр.
Зная значение константы равновесия химической реакции при
данной температуре можно всегда вычислить изменение стандартной
свободной энергии исследуемой химической реакции.
Таким образом, определенная величина стандартной свободной
энергии для любого соединения есть количественный показатель свободной
127
Биохимия животных
энергии связи, которая может высвободиться при ее разрушении.
Знание этой величины позволяет определить изменение стандартной
свободной энергии химической реакции, протекающей с участием
соединений, вступающих в реакцию.
Особое значение в живых организмах имеют биогенные
соединения, в состав которых входит остаток фосфорной кислоты. Все они
имеют разные значения ДС°.
ОН ОН
К~Р=0 + Н20 -> КН + НО-Р=0
I I
он он
Фосфорсодержащее соединение Фосфорная кислота
В табл. 1.7 приведены величины свободной энергии (АС°)
гидролиза фосфорсодержащих биогенных соединений.
Таблица 1.7
Величины стандартной свободной энергии гидролиза
фосфорсодержащих соединений при рН 7,0 (25°С) и рК
функциональных групп
1 Название
| Фосфоенолпируват
| 1,3-Дифосфоглицерат
| Креатинфосфат
| Ацетилфосфат
Аргининфосфат
1 Уридиндифосфатглкжоза
АТФ
| Неорганический пирофосфат
АДФ
ДС°, кДж/моль
-53,50
-49,32
-43,05
-42,22
-33,44
-31,77
-29,26
-27,59
-26,75
** 1
7,5 и 8,0 1
2,7 и 4,58
1,2 и 4,8
2,0,4,5,9,4,
11,2
4,1и6,0...7,0
3,9и6,1-6,7 1
128
Глава 1. Биогенные молекулы
| Глюкозо-1-фосфат
12-Фосфоглицерат
1 Фруктозо-6-фосфат
1 Глюкозо-6-фосфат
| Фруктозо-1 -фосфат
|3-Фосфоглицерат
[ Глицерол-1-фосфат
-20,90
-17,14
-15,88
-13,79
-12,96
-12,54
-9,61
Окончание таблицы 1.7
1,11 и 6,13 I
0,97 и 6,11
0,94 и 6,11
При этом соединения с величинами больших отрицательных
значений АС° расположенные в верхней части табл. 1.7 в условиях
равновесия гидролизованы более полно, чем соединения расположенные
ниже. Таким образом, соединения расположенные в верхней части
таблицы, легко отдают свои фосфорильные группы, тогда как
соединения расположенные ниже стремятся их удержать. К группе
высокоэнергетических доноров фосфата относятся 2-фосфоенолпируват
и 1,3-дифосфоглицерат, а к низкоэнергетическим акцепторам
фосфата — глюкозо-1-фосфат, фруктозо-6-фосфат, глкжозо-6-фосфат,
глицерол-3-фосфат, фруктозо-1 -фосфат и др.
^О СООН
[^О^Р03Н2 Г — 0^Р03Н2
неон И
I сн2
СН2ОР03Н2
1,3-Дифосфоглицерат
2-Фосфоенолпируват
СН2ОН
СН20-РОзН2
-О
ОН
Гл юкозо-6-фосфат
129
Биохимия животных
О СН2ОР03Н2
НОрЬ/и\ СН2ОР03Н2 | *
\_/он \ но/
.3 г >—-г*
он
Фруктозо-1 -фосфат Фруктозо-6-фосфат
Как видно из табл. 1.7, промежуточное положение среди фосфоро-
органических биогенных соединений занимает АТФ, которое
выполняет роль посредника, участвуя в переносе фосфатных групп от
высокоэнергетических соединений к акцепторным молекулам.
Высокоэнергетические соединения способны выполнять в клетке
роль накопителей и переносчиков энергии в различные участки
клетки и организма в целом. Более подробно об этом описано в
учебнике «Биохимия» (Ленинджер, 1974).
В организме животного высокоэнергетические фосфаты способны
проявлять регуляторное действие гормонов, участвуя в пусковых
механизмах аденилатциклазной системы (АТФ, ГТФ, цАМФ). Кроме
того, они способны инициировать протекание и определять
направленность некоторых метаболических процессов в клетке, Определять
протекание индивидуальных химических реакций, делая их
практически необратимыми, вследствие высоких энергетических затрат, что
характерно для реакций, катализируемых гексокиназой, фосфофрук-
токиназой, пируваткиназой и других, одним из субстратов которых
служит АТФ. Высокоэнергетические соединения способны
накапливать и переносить энергию в форме макроэргических связей (АТФ и
креатинфосфат), обеспечивая энергетический потенциал
двигательной активности живых организмов.
1.10.1. Нуклеозидфосфаты
К высокоэнергетическим фосфатсодержашим соединениям
относятся нуклеозидмоно-, нуклеозидди- и нуклеозидтрифосфаты. В их
состав входят азотистые основания (аденин, гуанин, цитозин и урацил),
остаток рибозы и один, два или три остатка фосфорной кислоты.
Поэтому основными энергетическими соединениями считаются: АТФ
(аденозин-5'-трифосфат), ГТФ (гуанозин-5'-трифосфат), УТФ (ури-
дин-5'-трифосфат), ЦТФ (цитидин-5'-трифосфат), АДФ (аденозин-
130
Глава 1. Биогенные молекулы
5'-дифосфат), ГДФ (гуанозин-5'-дифосфат), УДФ (уридин-5'-дифос-
фат), ЦТФ (цитидин-5'-дифосфат) и др.
Нуклеозидтрифосфаты относятся к соединениям, способным
запасать, переносить и отдавать энергию макроэргических связей,
участвуя в различных химических реакциях. Причем основными
переносчиками химической энергии в клетке служат АТФ, ГТФ, ЦТФ и УТФ,
которые присутствуют в каждой клетке живого организма в
значительных количествах. При этом АТФ-зависимые реакции определяют
направленность реакций как синтеза, так и распада в клетках живых
организмов.
Все нуклеозидтрифосфаты хорошо растворимы в полярных
растворителях.
Аденозинтрифосфат (АТФ) — сложное соединение, образованное
из азотистого основания аденина, рибозы и последовательно
соединенных трех остатков фосфорной кислоты.
Основным местом синтеза АТФ служат митохондрии, где в
результате реакций окислительного фосфорилирования образуется
высокоэнергетическая молекула. Для протекания этих реакций необходимы
НАДН и ФАДН2.
АТФ содержит макроэргические связи, гидролиз которых
обеспечивает энергетические потребности, необходимые для протекания
метаболических процессов в живых организмах.
Продуктами расщепления АТФ в каталитических реакциях
являются аденозиндифосфат (АДФ) и аденозинмонофосфат (АМФ).
Полярность молекулы АТФ обеспечивается за счет четырех ОН-
групп, способных к ионизации. Три из них имеют значение рК * 2...3
и при физиологических рН * 7,4 находятся полностью в
диссоциированном состоянии.
АДФ содержит три ОН-группы, способные к ионизации, две из
которых полностью диссоциированы при рН 7,0. В клетках АТФ и АДФ
присутствуют в виде комплексов с ионами М%2+.
АТФ2" + М§2+ -> АТФ2"-М82*
Кроме ионов магния с АТФ могут образовывать комплекс и ионы Мп2"\
Величины стандартной свободной энергии гидролиза двух
высокоэнергетических связей АТФ равны -34,5 кДжмоль-1.
АТФ + Н20 -► АДФ + Н3Р04
131
Биохимия животных
он он он
но—р о—|р о — р—о—сн, ^°
0 0 0
он он
-о—ро-р^о-р-о-сн,, -°
0 0 0
Мд'
1 7 1
0 0 0
В ходе гидролиза АТФ остаток фосфорной кислоты переносится
на гидроксид-ион. Гидролиз концевой фосфорильной группы АДФ
практически имеет такую же величину свободной энергии, тогда как
энергия фосфоэфирной связи у нуклеозидмонофосфата в -4 раза
меньше и поэтому она практически не используется в химических
реакциях биогенных систем.
Другие нуклеозидтрифосфаты (УТФ, ГТФ и ЦТФ) выполняют
в клетках узкоспециализированные функции, обеспечивая энергией
только определенные химические реакции. Так, например, УТФ
служит поставщиком энергии при синтезе гликогена, ЦТФ — при
синтезе липидов, ГТФ ускоряет образование пептидной связи при
биосинтезе белков.
В клетках живых организмов синтез АТФ может осуществляться
в результате окисления органического субстрата метаболического
процесса (гликолиз), в реакциях субстратного фосфорилирования.
При этом происходит перенос остатка фосфорной кислоты с продукта
окисления на АДФ. Такие реакции катализируют фосфоглицератки-
наза (1) и пируваткиназа (2).
132
Глава 1. Биогенные молекулы
|^О^Р03Н2 + АДФ \Т\ |^О^Р03Н2 +АТФ
неон —> неон
СН2ОР03Н2 СН2ОР03Н2
1,3-дифосфоглицират 3-фосфоглицират
СООН ?°°Н
Г—О^Р03Н2 + АДФ \Т\ ?=0 + АТФ
СН2 снз
2-фосфое нол пиру ват пируват
Кроме того, образование АТФ может протекать при участии
ферментов, расположенных на внутренней мембране митохондрий,
осуществляющих процесс окислительного фосфорилирования.
1.10.2. Креатинфосфат
Креатинфосфат является макроэргическим фосфорным эфиром
креатина и служит основной формой накопления энергии в мышцах.
Основу креатинфосфата составляет метилированный остаток
глицина, гуанидиновая группа и остаток фосфорной кислоты. В реакциях
синтеза креатинфосфата принимает участие аргинин, гуанидиновая
группа которого переносится на глицин. Конечная стадия синтеза
креатинфосфата протекает при участии креатинфосфокиназы,
которая катализирует реакцию переноса фосфорильной группы с АТФ на
креатин. Реакция легко обратима.
В энергетических процессах, протекающих в мышцах,
креатинфосфат донирует остаток фосфорной кислоты на АДФ, реализуя
обратимое действие фермента. В результате происходит синтез АТФ,
который впоследствии участвует в сокращении и расслаблении
мышечных волокон.
Величина стандартной свободной энергии гидролиза
высокоэнергетической связи в креатинфосфате в -1,5 раза выше, чем в АТФ и
равна-43,1 кДжмоль"1.
Содержание креатина и креатинфосфата в мышцах составляет
0,20...0,55%.
133
Биохимия животных
соон
I
сн2
М-СН3
ОМ
АТФ
СООН
I
сн2
I
N-€N3
I
с=ын
АДФ
ын,
NN
I
НО-Р=0
I
он
Креатин Креатинфосфат
1.10.3. Циклические нуклеозидмонофосфаты
Важнейшими высокоэнергетическими соединениями клеток
являются циклический 3',5'-аденозинмонофосфат и циклический 3',5'-гуа-
нозинмонофосфат. Оба соединения встречаются практически в каждой
клетке живого организма. Синтезируются циклические монофосфаты
из соответствующих нуклеозидтрифосфатов (АТФ и ГТФ). Реакции
катализируют ферменты плазматических мембран — аденилатциклаза
и гуанилатциклаза. Продуктом реакции является пирофосфат.
он он он
I I I
5—РЛО—рл0 —Р—О—сн,
ООО
АТФ
цАМФ
+ НО— Р—О—Р— ОС
т—г
он он
пирофосфат
Синтез цАМФ осуществляется в ответ на действие адреналина,
который активирует аденилатциклазу. Поэтому основной функцией
циклических нуклеотидов является регуляторная.
134
Глава 1. Биогенные молекулы
1.10.4. Биогенные молекулы,
участвующие в энергетических процессах
Никотинамидадениндинуклеотид (НАД*) — сложное биологически
активное соединение, функциональной активной частью которого
является никотинамид — амидированное производное витамина РР
НАД+ выполняет роль акцептора протонов и электронов в
реакциях, катализируемых окислительно-восстановительными
ферментами, восстанавливаясь до НАДН. В митохондриях при окислении
одной молекулы НАДН, синтезируются три молекулы АТФ.
Никотинамидадениндинуклеотидфосфат (НАДФ+) — фосфори-
лированная форма НАД+; участвует в катализируемых окислительно-
восстановительными ферментами реакциях в качестве кофермента.
Восстановленная форма НАДФН генерируется преимущественно
ферментами пентозофосфатного цикла и используется в процессе синтеза
жирных кислот — липогенезе, а также синтезе холестерина.
асомн2
мн2
чХ">
Г Т I
^о _0_^_0_^_0_ о..
он он он ок
К — Н (никотинамидадениндинуклеотид окисленный)
Я — Р03Н2 (никотинамидадениндинуклеотидфосфат окисленный)
Щг Ин*+28 &>
г!
г г
т
О О
°^ СНг-О-Р-О-Р-О-СНг '°
^
ОН ОН (К
К— Н (никотинамидадениндинуклеотид восстановленный)
К — Р03Н2 (никотинамидадениндинуклеотидфосфат восстановленный)
135
Биохимия животных
Флавинадениноинуклеотил (ФАД) — сложное биологическое
соединение, предшественником которого является витамин В2 (рибофлавин).
ФАД выполняет роль донора и акцептора электронов и протонов
в окислительно-восстановительных реакциях, катализируемых
специфичными дегидрогеназами. Восстановленной формой ФАД
является ФАДН2, которая в основном генерируется в цикле трикарбоно-
вых кислот (цикле Кребса) и в процессе липогенеза.
ОН ОН ОН
СН2-С-С-С-СН2-0
III |
н н н Но-Р=о
Н'+б
нче
он он
ФАД
он он он
сн2-с-с-с-сн2-о
III I
н н н но-р=о
н
н о
он он
ФАДН2
136
Глава 1. Биогенные молекулы
При окислении в митохондриях одной молекулы ФАДН2
синтезируется две молекулы АТФ.
Ечугатион (Г-5Н) — трипептид, в состав которого входят три
последовательно соединенных аминокислотных остатка (глутаминовая
кислота, цистеин, глицин).
Глутаминовая кислота Цистеин
ноос— сн— сн2 — сн2—со-гын —сн — сч —зн
ЫН.
СО'
N4—СН2—СООН
Глицин
Глугатион
Глутатион служит донором водорода в
окислительно-восстановительных процессах. В организме животных глутатион является
субстратом глутатионпероксидазы, окисление которого сопровождается
образованием окисленной формы (Г-5-8-Г). Количество
восстановленного глутатиона может служить критерием жизнеспособности
живых организмов.
8-Аденозилметионин является основной формой метионина,
участвующей в реакциях метилирования. Синтез 5-аденозилметионина
катализируется метионинаденозилтрансферазой, которая осуществляет
присоединение Ь-метионина к АТФ.
СОО"
+ ффн + Фн
Ь-Метионин
Н ОН
$-Аденозилметионин
137
Биохимия животных
5-аденознлметионин является донором метильных групп, которые
специализированными метилтрансферазами могут быть перенесены
на гуанидиноуксусную кислоту с образованием креатина.
ЫН2
I
5-аденозилметионин + НЫ=С-ЫН-СН2-СООН ->
Гуанидиноуксусная кислота
ын2
I
->5-аденозилгомоцистеин + НЫ=С-Г*4-СН2-СООН
I
СН3
Креатин
Кроме того, 5-аденозилметионин может донировать метильную
фуппу на фосфатидилэтаноламин с образованием фосфатидилхолина.
сн2-о~со-я, сн2-о~со-я,
я2-со~о-сн о -► к2-соасн о
СН2Ю~Р-0-СН2-СН2-КН2 СН2-0-Р-0-СН2-СН2-М+(СН3)з
он он
Фосфатидилэтаноламин Фосфатидилхолин
5-аденозилметионин может участвовать в метилировании амида
никотиновой кислоты с образованием Ы'-метилникотинамида и др.
/°
СУ СТ
СН3
Никотинамид Ы'-метилникотинамид
138
Глава 1. Биогенные молекулы
Вопросы и задания для самоконтроля
1. Опишите физико-химические свойства спиртов. 2. Напишите
основные реакции с участием альдегидов. 3. Перечислите основные
представители карбоновых кислот. 4. Напишите структурные
формулы основных липидов. 5. Опишите физико-химические свойства
липидов. 6. Расскажите о биологической роли липидов в организме
животных. 7. Перечислите основные представители альдоз и кетоз.
8. Напишите структурную формулу глюкозы в проекции Фишера и
Хеуорса. 9. Опишите физико-химические свойства глюкозы. 10.
Расскажите о функциональной роли основных представителей пентоз и
гексоз в организме животных. 11. Напишите структурные формулы
основных дисахаридов (мальтозы, целлобиозы, сахарозы, лактозы).
12. Опишите физические свойства полисахаридов. 13. Расскажите
о биологической роли углеводов. 14. Напишите формулы
аминокислот, входящих в состав белков. 15. Перечислите основные функции
аминокислот. 16. Дайте определение первичной, вторичной,
третичной и четвертичной структурам белков. 17. Укажите различия в
строении простых и сложных белков. 18. Укажите основные условия
денатурации белков. 19. Напишите структурные формулы витаминов,
растворимых в полярных растворителях, и расскажите об их
биологической роли. 20. Расскажите о витаминах, являющихся
предшественниками кофакторов. 21. Укажите особенности строения и опишите
механизмы действия витаминов, растворимых в неполярных
растворителях. 22. Назовите основных представителей макро- и
микроэлементов животных. 23. Раскройте биологическую роль натрия и калия.
24. Расскажите о роли ионов М§2+ и Мп2+ в метаболических процессах.
25. Опишите значение кальция для роста и развития животных.
26. Расскажите об участии ионов Г, Вг, СГ в метаболических
процессах. 27. Перечислите азотные основания, входящие в состав РНК и
ДН К. 28. Напишите структурные формулы азотистых оснований, нук-
леозидов и нуклеотидов. 29. Опишите строение РНК и ДНК и укажите
на принципиальные различия в их строении. 30. Раскройте роль
нуклеиновых кислот в хранении и передаче генетической информации.
31. Назовите основные биогенные молекулы энергетических
процессов и расскажите об их биологической роли. 32. Раскройте роль АТФ
и его производных в энергетике живых организмов. 33. Расскажите о
строении креатинфосфата. 34. Напишите структурные формулы нук-
леозидфосфатов. 35. Назовите и расскажите о циклических нуклео-
зидмонофосфатах.
139
ГЛАВА 2. ФЕРМЕНТЫ
2.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ФЕРМЕНТОВ
Ферментами (энзимами) являются белки, имеющие функционально
активную третичную или четвертичную структуру, обладающие
каталитической активностью, способные ускорять протекание химических
реакций.
Химические реакции сопровождаются затратами энергии, запас
которой обусловливает действие молекул, вступающих во
взаимодействие. Суммарный запас энергии, необходимый для протекания
химической реакции, называется энергией активации (АЕ) и может быть
выражен следующим уравнением:
ДЕ = (Е, + Е2) + (Е3 + Е4)
или
ДЕ = ДЕ, + ДЕ2
Затраты энергии необходимы для ориентации молекул в пространстве
(Е1), сближения их относительно друг друга (Е2); также необходимы
энергетические затраты, используемые для разрыва старых связей (Е3)
и образования новых связей (Е4).
Запас энергии ДЕ) реализуется в движении молекул и
определяется величиной энтропии, тогда как ДЕ2 является энергией,
запасаемой в связях, определяемой величиной энтальпии.
При протекании ферментативной реакции ДЕ( служит энергией,
обеспечивающей связывание субстрата в области активного центра
фермента, тогда как ДЕ2 — энергия, обуславливающая превращение
субстрата в активном центре.
Величина энергетического барьера определяет возможность
осуществления химической реакции. Чем выше это значение, тем
медленнее протекает химический процесс.
140
Глава 2. Ферменты
Рис. 2.1. Пространственная структура (а) [Савицкий и др., 1998]
и модель активного центра (б) [\ЬКсп е( а]., 1992] пероксидазы
От обычных функциональных белков ферменты отличаются тем, что
на поверхности белковой глобулы у них располагается активный центр
(рис. 2.1). Это участок, образованный из различных аминокислотных
остатков, собранных из различных областей полипептидной цепи, где
происходит связывание и превращение субстрата. При этом субстратом
называется химическое соединение, претерпевающее изменение в ходе
каталитического процесса. Кроме активного центра у некоторых
ферментов имеется еще и регуляторный участок (рис. 2.2). В этом участке
связываются молекулы, оказывающие влияние на связывание и
превращение субстрата в ферментативном процессе, хотя сами регуляторы
не претерпевают изменений. Все биокатализаторы являются белками
еще и потому, что через упорядоченный синтез белков, информация
о которых заложена в геноме клетки, может осуществляться
управление химическими реакциями, протекающими в клетке.
По размерам белковая глобула фермента превышает в несколько
раз размеры субстрата. Это, возможно, обусловлено тем, что
поверхностные аминокислотные остатки апобелка картируют поверхность
клетки, определяя место связывания фермента на поверхности ее
мембраны. При этом связывание поверхностных групп белка с
функциональными группами мембранных структур определяет не только
глубину его погружения в структуру мембраны, но и силу связывания
белковой глобулы с поверхностными молекулами мембраны.
141
Биохимия животных
нон
Рис. 2.2. Активный центр и регуляторный
участок на поверхности белковой глобулы
В активном центре фермента могут располагаться
аминокислотные остатки, содержащие различные функциональные группы,
которые принимают участие в каталитическом процессе (табл. 2.1).
Условно активный центр фермента можно разделить на два участка:
сорбционный, функциональные группы которого отвечают за
связывание субстрата в активном центре фермента, и каталитический, в
котором происходит превращение субстрата. Размер активного центра
фермента определяется размером субстрата. Геометрия
расположения функциональных групп активного центра соответствует природе
субстрата, определяя эффективность его связывания и превращение
в ходе химической реакции. Константа, характеризующая
эффективность превращения субстрата в активном центре фермента,
называется каталитической (&«,,), а константа, определяющая сродство
субстрата к ферменту — константой связывания (К$ * Кт). Действие
эффекторов (активаторов и ингибиторов) определяют с помощью
константы активирования (Ка) и ингибирования (А)), которые
фактически являются равновесными константами.
142
Глава 2. Ферменты
Таблица 2,1
Функциональные группы ферментов и их рКа
(Березин И. В. и др., 1976)
1 Функциональные группы
а-СООН
0-СООН
у-СООН
а-МН2
е-1ЧН2
-5Н I
-ОН
1 мнч
/с_мн"
Н2Ы Х
| -он ]
[ Аминокислотные остатки
1 С-конец
1 А$р
С1и
Н15
N-конец
Ьу8
Су8
Туг
Аге
5ег, ТЬг |
р^~ 1
3,0...3,2
3,0...4,7
4,4
5.6...7.0
7,6...8,4
9,4... 10,6
9,1...10,8
9,8... 10,4
11.6...12.6
>14!0 |
Активность фермента зависит от проявления действия факторов
среды и от свойств фермента. К факторам внешней среды можно
отнести следующие:
• природа субстрата (субстратов) и их концентрации;
• природа среды раствора;
• природа микросреды активного центра;
• температура, УФ-облучение, давление;
• рН среды;
• присутствие активаторов и ингибиторов;
• ионная сила раствора.
Действие факторов могут проявить наличие в среде
активированных, ингибированных, денатурированных, модифицированных и ре-
комбинантных форм фермента.
143
Биохимия животных
К проявлению свойств фермента можно отнести следующие:
• природа и концентрация фермента;
• природа функциональных групп активного центра фермента,
подвижность этих групп и их расположение;
• конформация белковой глобулы;
• межсубъединичные взаимодействия;
• наличие простатических групп и кофакторов;
• количество сульфгидрильных групп;
• количество изоферментов;
• наличие пассивной формы фермента (зимоген);
• рекомбинантные формы фермента;
• модифицированные формы фермента.
С повышением температуры активность ферментов возрастает,
однако при температуре выше 40...60°С наблюдается понижение
активности фермента из-за разрушения нативной структуры белка.
Возрастание температуры сопровождается увеличением подвижности
функциональных групп в области активного центра и изменением
конформации белковой глобулы, денатурацией фермента.
Влияние рН на активность фермента проявляется через величины
рК ионизирующих групп активного центра и функциональных групп
субстрата. На активность фермента может также повлиять ионизация
групп, входящих в состав белковой глобулы, преимущественно
поверхностных аминокислотных остатков, приводящих к изменению
конформации апобелка.
2.2. ДЕНАТУРАЦИЯ ФЕРМЕНТОВ
Ферменты в клетках живых организмов выполняют роль
биологических катализаторов. В каталитическом действии фермента
принимают участие аминокислотные остатки, содержащие -СООН, -Г^Н2,
-5Н, -ОН и другие группы, входящие в состав активного центра, про-
тонирование и депротонирование которых может влиять на его
каталитические свойства!. Поэтому активность ферментов зависит от рН
среды, изменение которой может приводить к нарушению нативной
структуры апобелка и конформации активного центра, что
проявляется в утрате специфических каталитических свойств. Аналогично
белкам, ферменты при повышении температуры изменяют свою кон-
формацию, теряя способность катализировать превращения
различных соединений. Так, например, пероксидаза катализирует реакцию
144
Глава 2. Ферменты
окисления о-дианизидина перекисью водорода, однако длительное
воздействие температурой выше 60°С может приводить к денатурации
фермента, уменьшению или к полной утрате его каталитической
активности. Стабильность ферментов может возрастать в присутствии
ионов Са2+, субстратов и белков, например, альбумина.
2.3. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
В настоящее время, в соответствии с типом катализируемой
реакции, ферменты сгруппированы в 6 классов (рис. 2.3).
1 класс. Оксидоредуктазы — это ферменты, катализирующие
реакции окисления и восстановления. Оксидоредуктазы подразделяются
на 17 подклассов. Субстраты оксидоредуктаз являются донорами
атомов водорода и электронов и поэтому ферменты этого класса
называются дегидрогеназами или редуктазами (алкогольдегидрогеназа,
лактатдегидрогеназа, малатдегидрогеназа, сукцинатдегидрогеназа,
глиоксилатредуктаза, гидроксипируватредуктаза и др.). Кофермен-
тами оксидоредуктаз могут быть НАД, НАДФ, ФАД, ФМН. К классу
оксидоредуктаз принадлежат и оксидазы, в реакциях которых
участвует кислород (альдегидоксидаза, ксантиноксидаза, пируватоксидаза,
оксалатоксидаза, оксидаза Ь-аминокислот, аминооксидаза и др.).
2 класс. Трансферазы — это ферменты, катализирующие реакции
переноса различных групп (метильные, гидроксиметильные, форм
ильные, карбоксильные, карбамоильные, альдегидные, ацильные, алкиль-
ные, аминные и др.) от одного субстрата (донор) к другому (акцептор).
В реакциях катализируемых трансферазами принимают участие
5-аденозил-Ь-метионин, 5-метилметионин, пиридоксальфосфат,
биотин, тиаминпирофосфат, 2-аминоаденозин, 5Н-КоА. Название
фермента формируется по принципу: акцептор-группа-трансфе-
раза или донор-группа-трансфераза (метионин-метил-трансфераза,
тиол-метил-трансфераза, серин-гидроксиметил-трансфераза, глу-
тамат-формил-трансфераза, холин-ацил-трансфераза, транскетолаза,
трансальдолаза и др.). К этому классу принадлежат ферменты,
переносящие гликозильные группы (фосфорилаза, амилосахараза, декстран-
сахараза и др.). Трансферазы представлены 8 подклассами.
3 класс. Гидролазы — это ферменты, катализирующие разрыв связи
в молекуле субстрата, осуществляемый с участием молекулы воды.
В название фермента включается слово «гидролаза» (5-аденозилме-
тионин-гидролаза, формил-КоА-гидролаза, ацилфосфоаденозин-гид-
145
3
I
I
■ • II ИМ
.!.
2 г*2§ з|г г>2 | |
! I
М
5 5 §*!•?
I
а
•&
3
о
о
ее
С
из
3
3
*
во
о
X
о
О
СО
ж
(XI
146
1ЩП I1 И!
I ер I 2 «ф.« 1111118-1-1II Ш!
112 82 |2 |2 12 Г: §2 Р5 1^11=1^ 82 1\1 \\^ \21
Глава 2. Ферменты
ролаза, ацетил-КоА-гидролаза и др.) или название фермента
формируется из названия субстрата присоединением суффикса «-аза»
(целлюлаза, фосфолипаза, ацетилэстераза, тиаминаза, глутатионти-
олэстераза и др.) или ферменты имеют тривиальное название (хи-
мотрипсин, пепсин, химозин, трипсин, субтилизин, тромбин, плаз-
мин и др). Гидролазы подразделяются на 11 подклассов.
4 класс. Лиазы — это ферменты, катализирующие реакции
разрыва С-С, С-О, С^ и других связей в субстрате без присоединения
молекулы воды или окисления. Лиазы отличаются от других
ферментов тем, что в катализируемых реакциях в одном направлении
участвуют два субстрата, а в обратной реакции только один. В названии
фермента присутствуют слова «декарбоксилаза» или «альдолаза» или
«лиаза» (пируват-декарбоксилаза, оксалат-декарбоксилаза, оксало-
ацетат-декарбоксилаза, треонин-альдолаза, фенилсерин-альдолаза,
изоцитрат-лиаза, аланин-лиаза, АТФ-цитрат-лиаза и др.), а для
ферментов, катализирующих реакции отщепления воды от субстрата —
«дегидратаза» (карбонат-дегидратаза, цитрат-дегидратаза, серин-де-
гидратаза и др.). В тех случаях, когда обнаружена только обратная
реакция, или это направление в реакции более существенно, в
названии ферментов присутствует слово «синтаза» (малат-синтаза, 2-изо-
пропилмалат-синтаза, цитрат-синтаза, гидроксиметилглутарил-КоА-
синтаза и др.). Лиазы подразделяются на 6 подклассов.
5 класс. Изомеразы — это ферменты, катализирующие
внутримолекулярные превращения (рацемизация или эпимеризация). В названии
фермента присутствует слово «рацемаза» (аланин-рацемаза, метионин-
рацемаза, гидроксипролин-рацемаза, лактат-рацемаза и др.), «эпиме-
раза» (альдоза-1-эпимераза, рибулозофосфат-4-эпимераза, УДФ-глю-
куронат-4-эпимераза и др.), «изомераза» (рибозофосфат-изомераза,
ксилозоизомераза, глюкозаминфосфат-изомераза и др.), «таутомераза»
(фенил пируват-таутомераза, оксалоацетат-таутомераза), «мутаза» (фос-
фоглицерат-мутаза, метиласпартат-мутаза и др.). Подразделяются они
на 5 подклассов.
6 класс. Лигазы или синтетазы — это ферменты, катализирующие
реакции соединения двух и более молекул, используя АТФ. В названии
фермента присутствует слово «синтетаза» (тирозил-тРНК-синтетаза,
треонин-тРНК-синтетаза, ацетил-КоА-синтетаза, аспарагинсинтетаза,
карбамоилфосфат-синтетаза, аргениносукцинат-синтетаза и др.), «кар-
боксилаза» (пируваткарбоксилаза, ацетил-КоА-карбоксилаза, пропио-
нил-КоА-карбоксил аза и др.). Подразделяются они на 5 подклассов.
147
Биохимия животных
Ферменты, входящие в один класс, в соответствии с
особенностями катализируемых реакций, группируются в подкласс и под-
подкласс. При этом приобретают систематическое название и
кодовую нумерацию (шифр). Первое число шифра означает класс,
второе и третье — подкласс и подподкласс соответственно, а четвертое
число — порядковый номер фермента в подподклассе. Например, ал-
когольдегидрогеназа имеет шифр (КФ 1.1.1.1), это означает, что она
относится к классу оксидоредуктаз (КФ 1.), подклассу ферментов,
действующих на СН-ОН группу доноров (КФ 1.1.), к подподклассу
ферментов, акцепторами которых служат НАД и НАДФ (КФ 1.1.1),
с порядковым номером в подподклассе — 1; глюкозо-6-фосфатаза
(КФ 3.1.3.9), относится к классу гидролаз (КФ 3.), подклассу
ферментов, действующих на сложноэфирные связи (КФ 3.1), к
подподклассу ферментов, гидролизующих моноэфиры фосфорной кислоты
(КФ 3.1.3), с порядковым номером фермента в подподклассе — 9; пи-
руваткарбоксилаза (КФ 6.4.1.1), относится к классу лигаз (синтетаз)
(КФ 6.), подклассу ферментов, образующих С-С-связи (КФ 6.4.),
к подподклассу ферментов, присоединяющих С02 к различным
соединениям (КФ 6.4.1), с порядковым номером фермента в
подподклассе — 1.
Ферменты, выделенные из тканей различных животных и растений,
но катализирующих одну и ту же реакцию, различающиеся между
собой по строению и физико-химическим свойствам, а также имеющие
генетически обусловленные различия в первичной структуре,
называются изоферментами.
Кроме того, существуют еще и неактивные формы ферментов
(проферменты), относящихся к группе протеиназ (сериновые, тиоловые,
кислые), которые называются зимогенами. Синтез зимогенов
осуществляется на рибосомах эндоплазматического ретикулума особыми
секреторными клетками в виде зимогенных гранул, которые после
завершения процесса мигрируют к поверхности клеток и затем секретируются
в окружающую среду; достигнув места действия, они превращаются
в активные формы ферментов. К ним относятся пепсиноген,
активной формой которого является пепсин (основной протеолитический
фермент желудочного сока), трипсиноген — трипсин, химотрипси-
ноген — химотрипсин, прокарбоксипептидазы — карбоксипептидазы
(ферменты поджелудочной железы) и др. К зимогенам также относятся
ферменты свертывания крови (факторы свертывания крови),
компоненты и факторы системы комплемента и др.
148
Глава 2. Ферменты
2.4. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Химические реакции, катализируемые ферментами (энзимы),
протекают через образование фермент-субстратного комплекса. При этом
график изменения начальной скорости (у0) от концентрации субстрата
принимает вид гиперболической зависимости (рис. 2.4).
1 1 • II " 111
ц/' ^
к_1„
ли
2
Рис. 2.4. График зависимости начальной скорости ферментативной
реакции от концентрации субстрата в координатах Михаэлиса—Ментен
На кинетической кривой можно выделить три участка. На
начальном этапе (участок I), который проявляется при инициировании
каталитического процесса, когда скорость реакции возрастает
пропорционально концентрации субстрата [50]. При этом должны соблюдаться
условия стационарности, т. е. концентрация фермент-субстратного
комплекса остается постоянной (стационарной) в ходе
ферментативной реакции. По мере возрастания концентрации субстрата отмечается
отклонение от линейности (участок II). Дальнейшее увеличение
концентрации субстрата приводит к тому, что скорость реакции становится
не зависящей от концентрации субстрата (участок III), т. е. достигается
состояние насыщения фермента субстратом. Однако в этих условиях
начальная скорость зависит от концентрации фермента. Наблюдаемые
изменения можно описать следующей простейшей схемой:
*| кг
Е + 5<-ИЕ-51->Е + Р;
Е — фермент, $ — субстрат, Р — продукт, Е5 — фермент-субстратный комплекс, к\ч к^
к_ | — константы скоростей.
149
Биохимия животных
При этом Е0 = Е + [Е8| — общая концентрация фермента,
а 50 = 5+ [Е51 — общая концентрация субстрата. Реакция протекает
в условиях, когда концентрация субстрата во много раз превышает
концентрацию фермента (50 » Е0)у т. е. число молекул субстрата,
связанных с ферментом, пренебрежительно мало по сравнению с общим
числом молекул субстрата. Таким образом, 5* 50.
Протекание ферментативного процесса определяется
соотношением показателей скоростей образования и распада
фермент-субстратного комплекса. При этом скорость образования [Е8]
выражается уравнением второго порядка
у,= *,1ЕЦ8].
Тогда как скорость распада [Е8] можно записать в виде уравнений
первого порядка
у2 = *_,[Е8];
у,=*2[Е8].
Лимитирующей стадией ферментативного процесса, является
стадия продуктивного распада фермент-субстратного комплекса
-</[Е8]А/, = *2[Е8].
В условиях стационарности скорость образования
фермент-субстратного комплекса равна скорости его распада
*11Е]18] = *_,[Е8] + *2[Е8].
Решая это уравнение, можно найти выражение для концентрации
фермент-субстратного комплекса в стационарном состоянии
[Е8] = ЗД/<<<*_,+*2)/*,) + ^о},
где комбинация констант (*_, + к2)/к\ есть константа Михаэлиса
<*■>.
Таким образом, начальная скорость (у0) ферментативной реакции
при к2 - кКЛТ определяется следующим уравнением
150
Глава 2. Ферменты
Уо = *кат Е^/(Кт + 50).
Полученное уравнение называется уравнением Михаэлиса-Мен-
тен. При этом произведение к^ Е0 называется максимальной
скоростью ферментативной реакции (Ут).
у0=Кт5о/(/Гт + 50).
В случае, если к2« к_ь то
где АГ5 — константа диссоциации фермент-субстратного комплекса.
Значение Кт можно определить, если принять концентрацию
субстрата, при которой начальная скорость ферментативной реакции (у0)
составляет половину от максимальной скорости (Ут), т. е.
Уо=Ут/2=Ут5о/(Кт + Зо).
Решая это уравнение, можно получить:
Ут(Кт + 50) = 2Ут50;
Таким образом, константа Михаэлиса есть величина численно
равная концентрации субстрата при скорости ферментативной реакции,
составляющей половину максимальной.
Для нахождения кинетических констант уравнение Михаэлиса-
Ментен преобразуют в уравнение двойных обратных величин (метод
Лайнуивера-Берка)
\/Уь = (\/Ут) + (Кт/Ут)-(\/5<>)
или в уравнение Иди-Хофсти
151
Биохимия животных
Если построить график в координатах (1/у, 1/5), то получим
прямую линию, пересекающую оси абсцисс и ординат в точках —\/Кт
и 1/К соответственно. При этом тангенс угла будет равен величине
*т/К*(РИС.2.5).
Рис. 2.5. График Лайнуивера-Берка
Для определения константы ингибирования непосредственно из
графика можно использовать метод Диксона, откладывая
экспериментальные данные в координатах (1/% [I)).
В каталитическом действии фермента заложен сложный регуля-
торный механизм, который может реализоваться при участии
субстрата по следующей схеме.
Е + 8
К.
I
ЕЗ]
-► Е
[Е32] -^
И КГ
[Е8и+2]
-> Е + Р
Уравнение начальной скорости ферментативной реакции будет
иметь вид
152
Глава 2. Ферменты
у = ±->
О „2 о я+1 *
* ° К' К'К"
5 5 5
При этом реализуется следующий регуляторный механизм.
Низкие концентрации субстрата инициируют каталитическую активность
фермента, тогда как при связывании двух молекул субстрата
наблюдается активирование фермента (Р > 1). Связывание нескольких
молекул субстрата ингибирует фермент.
2.5. РЕГУЛЯТОРНОЕ ДЕЙСТВИЕ ЭФФЕКТОРОВ
ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Активность фермента регулируется с помощью различных
соединений, которые способны связываться в области активного центра
или регуляторного участка, расположенных на поверхности
белковой глобулы. При этом проявляется эффект понижения или
возрастания каталитической активности фермента. Эффекторы,
вызывающие снижение или полное подавление активности фермента,
называются ингибиторами, а повышающие активность энзима —
активаторами. При этом механизмы ингибирования и
активирования изучаются индивидуально для каждого фермента. Действие
эффекторов является одним из элементов регуляторных процессов,
осуществляющихся в биогенных системах. Подробный анализ
различных случаев ингибирования и активирования приводится в
монографиях [Березин, Клесов, 1976; Березин, Мартинек, 1977].
Единой классификации эффекторов в настоящее время не существует;
наиболее часто встречающиеся типы ингибирования и
активирования приведены ниже.
Конкурентный тип ингибирования проявляется в случае, если
субстрат и ингибитор конкурируют за область связывания в активном
центре фермента. При этом связывание ингибитора препятствует
связыванию субстрата, замедляя протекание ферментативного процесса. Это
наблюдается в том случае, когда ингибитор имеет схожее строение с
субстратом или является субстратом с меньшим сродством к месту
связывания, согласно следующей схеме.
153
Биохимия животных
[И]
к\ Лит
+ 5 ^Т±[Е5] >Е + Р
Начальная скорость ферментативной реакции при конкурентном
типе ингибирования определяется уравнением
у„=-
кжжтЕ0$0
Кт(\ + -»-) + 50
График этой зависимости в координатах Лайнуивера—Берка имеет
вид пучка прямых с точкой пересечения на оси ординат (рис. 2.6).
Константа конкурентного ингибирования определяется из уравнения
Кт{жяж) = Км "*" ~7Г~ 1/о ^
путем построения экспериментальных данных в координатах Кт (|саж), [/0].
Рис. 2.6. График зависимости обратных начальных скоростей
ферментативных реакций от концентрации субстрата в отсутствие (I)
и в присутствии (2) конкурентного ингибитора
Неконкурентный тип ингибирования проявляется в том случае, когда
ингибитор и субстрат связываются в разных участках активного центра
154
Глава 2. Ферменты
фермента. Однако при связывании ингибитора образуется фермент-
субстратный комплекс, превращение в котором субстрата становится
невозможным. Начальная скорость ферментативной реакции при
неконкурентном типе ингибирования определяется уравнением
уЛ=-
■Ювд
Кт+5п
В координатах Лайнуивера-Берка график имеет вид,
пересекающихся на оси абсцисс прямых (рис. 2.7). При этом константу
неконкурентного ингибирования определяют по уравнению
Лкм<1саж) Л/
путем построения экспериментальных данных в координатах (ккг1/
*кэт<каж)> 1А)1)- Определить константу неконкурентного ингибирования
можно и с помощью метода Диксона.
Рис» 2.7. График зависимости обратных начальных скоростей
ферментативных реакций от концентрации субстрата в отсутствие (1)
и в присутствии (2) неконкурентного ингибитора
Бесконкурентный тип ингибирования. При этом типе
ингибирования субстрат и ингибитор способны связываться в активном центре
фермента, имея разные участки связывания. В присутствии
ингибитора превращение субстрата несколько затрудняется, хотя его
связывание несколько улучшается, т. е. ингибитор улучшает связывание
субстрата, но ухудшает его превращение.
155
Биохимия животных
*1 *«г
Й+ $^=± [Е5] >Е + Р
[Е1] +5 ^* [Е13] + Е1 + Р
График в координатах Лайнуивера—Берка представлен
параллельными прямыми. Начальная скорость ферментативной реакции при
бесконкурентном типе ингибирования определяется уравнением
№ + [/<>])
(аК, + [10])
(*/ + [/(>])
Кт +50
(о/Г,+ [Л>])
Значения каталитических констант можно определить из уравнения
*т 1 а/Г, 1
+
Построение графика с использованием экспериментальных
данных в координатах (*1сат/(А:каТ(Каж) — Л^т), 1/[/о1) позволяет определить
значения а и К§.
Антиконкурентный тип ингибирования проявляется при
связывании ингибитора только с фермент-субстратным комплексом. При
связывании в активном центре фермента ингибитора
останавливается каталитический процесс. При этом типе ингибирования
начальная скорость ферментативной реакции определяется уравнением
№+М>
к,
к* + *.
№ + [/.]>
График в координатах Диксона имеет вид параллельных прямых,
из тангенса угла наклона которых (1/А)Кт) определяют константу
ингибирования.
Псевдоконкурентный тип ингибирования отличается тем, что график
в координатах Лайнуивера-Берка похож на график конкурентного ин-
156
Глава 2. Ферменты
гибирования. Однако уравнение Михаэлиса—Ментен начальной
скорости ферментативной реакции, имеет отличия от аналогичного
уравнения для конкурентного типа ингибирования.
ИЛ
*Д1 + —)
11 *| 1
Уо Ут [У0] 50
6 0 + — )
Тогда как в координатах Лайнуивера-Берка их уравнения
начальной скорости похожи.
Для идентификации типа ингибирования используют график в
координатах Диксона. При псевдоконкурентном типе ингибирования
отсутствует линеаризация экспериментальных данных, что позволяет
отличить этот тип ингибирования от конкурентного типа.
Смешанные типы ингибирования проявляются в случае
взаимного влияния субстрата и ингибитора как при их связывании, так и
при превращении субстрата. При этом графики в координатах Лай-
нуивера- Берка принимают вид семейства прямых с обшей точкой
пересечения в правом верхнем, левом верхнем или левом нижнем
квадранте. Постоянные аир характеризуют степень влияния
ингибитора на каталитический процесс. Возрастание значения а (а > 1)
свидетельствует об ухудшении связывания субстрата в активном
центре фермента, проявляемом в возрастании величин Кт{каж) и К;. Тогда
как понижение а (а > 1) может означать улучшение сродства субстрата
у ферменту, сопровождаемое понижением значений Кт{каж) и Кг
Возрастание величины каталитической константы возможно при р > 1,
а понижение — при значении р < 1.
Синергистическая активация наблюдается в том случае, если
связывание активатора в активном центре фермента увеличивает сродство
фермента к субстрату, проявляемое в понижении величины константы
связывания. При этом значение к^ не меняется, а уравнение
начальной скорости ферментативной реакции принимает следующий вид:
у0 = •
(*. + [Ао1)
аКт + 50
(оКа+[А0])
157
Биохимия животных
Величины аи Ка определяют по уравнению
Кт 1 аК& 1
= + х .
(*«-*«) (1-а) (1-а) [Ас]
График в координатах Л айну и вера-Берка имеет вид семейства
прямых с точкой пересечения на оси ординат.
Неконкурентная активация проявляется в случае, если субстрат и
активатор связываются независимо в различных участках активного
центра фермента. При этом образуется тройной комплекс, в составе
которого фермент-субстрат-активатор. Связывание активатора
ускоряет протекание каталитического процесса. Начальная скорость
ферментативного процесса можно выразить следующим уравнением
(*.+ р[\])
(*. + [\])
*•= •
*. + *.
График в координатах Лайнуивера-Берка представляет семейство
прямых, с точкой пересечения на оси абсцисс. Для определения
констант Р и АГа используют следующее уравнение
кт 1 Кл 1
С*.*-!-*-) (Э-1) (Р-1) [Ас]
Вопросы и задания для самоконтроля
1. Расскажите о ферментах как биокатализаторах химических
реакций живых организмов. 2. Опишите физические и химические свойства
ферментов. 3. Назовите основные классы ферментов и опишите их
участие в химических реакциях. 5. Опишите механизмы денатурации
ферментов. 6. Расскажите о строении активного центра фермента. 7. Дайте
определение основным каталитическим константам (ксаь Кту К5, Кау
А)). 8. Представьте способ выведения уравнения Михаэлиса-Ментен.
9. Представьте кинетические данные в виде графика Лайнуивера-Берка.
10. Раскройте роль регуляторных участков на поверхности апофермента
в регулировании активности ферментов. 11. Перечислите типы инги-
бирования и активирования ферментативных реакций. 12. Расскажите
о влиянии температуры и рН среды на активность ферментов.
158
ГЛАВА 3. БИОМЕМБРАНЫ
3.1. БЕЛКОВО-ЛИПИДНЫЕ КОМПЛЕКСЫ
Сложные комплексы белков и липидов могут формировать
упорядоченные структуры, построенные по типу мицелл, которые
представляют структуры гетерогенного состава, чаще всего шарообразной
формы и различных размеров, формирующиеся неполярными
молекулами в полярной среде. Стабилизированы мицеллы за счет слабых
связей, преимущественно гидрофобных, гидрофильных, ионных,
водородных и др. Компоненты, входящие в состав мицелл,
представляют собой ассоциированные образования, сформированные под
воздействием молекул растворителя и условий среды (температура,
рН, ионная сила и др.) (рис. 3.1).
Рис. 3.1. Структурные образования полярных и неполярных молекул:
а — поверхностные гидрофобно-полярные структуры; б— мицеллярные
образования; в — белково-липилные комплексы; г — жировые шарики
159
Биохимия животных
В полярных растворителях образование мицелл происходит путем
упорядоченного расположения липидов таким образом, что их
гидрофильные головки бывают обращены в сторону полярных молекул
воды (рис. 3.1, а), тогда как неполярные углеводородные радикалы
формируют гидрофобное ядро, изолированное от молекул
растворителя (рис. 3.1, б), К мицеллообразующим молекулам относятся жирные
кислоты, фосфолипиды, ганглиозиды, желчные кислоты. Устойчивые
мицеллы могут образовываться в смешанных белково-липидных
комплексах (рис. 3.1, в). При этом белки располагаются по периферии
мицеллы, контактируя с молекулами воды, а гидрофобные молекулы (ли-
пиды) занимают центральную часть молекулы.
Так как ядро мицеллы гидрофобно и на поверхности
располагаются заряженные молекулы, то такие структуры способны солюби-
лизировать неполярные вещества, обеспечивая их растворимость
в полярной среде. Этому подвергаются все соединения, которые
нерастворимы или плохо растворимы в воде. Стабильность мицеллы
определяется величиной критической константы мицеллообразова-
ния (ККМ) и числом агрегации. При этом значение ККМ определяет
концентрацию вещества, при которой начинают образовываться
мицеллы (табл. 3.1).
Таблица 3.1
Критические концентрации мицеллообразования
для некоторых соединений
1 Название
| Пальм итат калия
1 Стеарат калия
| Олеат калия
| Холат натрия
1 Дезоксихолат натрия
| Таурохолат натрия
| Тауродезоксихолат натрия
| Стеарат сахарозы ]
Температура, °С
50
| 50
25
25
25
25
25
20 |
Критическая
концентрация, мМ |
2,2
1 0,5
1,2
13,0
5,0
12,0
4,0
0,0046 1
160
Глава 3. Биомембраны
Мицеллы представляют из себя целостные структуры,
изолированные в пространстве друг от друга за счет наличия у каждой из мицелл
гидратной оболочки, которая формируется путем упорядоченного
расположения молекул воды, контактирующих с полярными
поверхностными молекулами мицеллы. Мелкие мицеллы способны к
агрегации, сливаясь в единые крупные структуры, которые из-за слабых
взаимодействий могут разрушаться при различных физических
воздействиях опять на более мелкие.
Солюбилизация неполярных соединений, таких как холестерин,
возможна за счет внедрения неполярных молекул в гидрофобное ядро
мицеллы, тогда как соединения содержащие полярные группы
(жирные кислоты, простые эфиры и др.) при солюбилизации располагаются
в поверхностных структурах мицеллы. Таким образом, обеспечивается
индивидуальность расположения молекулы на мицелле, когда их
полярная группа обращена наружу, а гидрофобная часть молекулы
погружена вовнутрь мицеллы. Соединения с несколькими полярными
группами (фосфолипиды, триацилглицеролы и др.) могут адсорбироваться
на поверхности мицеллы. Процесс солюбилизации зависит от
температуры, концентрации и природы соединений, входящих в состав
мицеллы. При этом насыщенные мицеллы образуют устойчивые
дисперсные системы, что характерно для различных компонентов молока,
в частности жировых шариков (рис. 3.1, г), у которых поверхностная
оболочка является фрагментом мембраны лактоцита.
3.2. СТРОЕНИЕ МЕМБРАН
Мембраны представляют собой упорядоченные структуры, состав,
размеры и форма которых обусловлены генетически и определяются
специфическим составом функциональных белков и
соответствующих липидов (рис. 3.2).
Мембраны способны осуществлять активный и пассивный
транспорт веществ из клетки в среду и обратно, определяют размер и форму
клетки, через действие рецепторов, расположенных на поверхности
мембраны и обладающих высоким сродством к определенным регуля-
торным молекулам, передают сигналы внутрь клетки, осуществляют
избирательную проницаемость различных соединений как внутрь
клетки, так и за ее пределы, посредством межклеточных контактов
обуславливают передачу сигналов от одной клетки к другой, а
являясь упорядоченной структурой — обеспечивают изоляцию
внутреннего содержимого клетки от внешней среды.
161
Биохимия животных
Белок с се-спиралью,
погруженный в мембрану
Рис. 3.2. Фрагмент плазматической мембраны клетки (Болдырев, 1997)
Кроме того, они осуществляют направленное движение веществ
внутри клетки, выполняют роль цитоскелета клетки, поддерживают
целостность клеточной структуры, создают условия для реализации
действия функциональных белков, в частности, каталитических
(ферментов), осуществляют и регулируют процессы апоптоза и
обусловливают протекание процессов секреции, эндоцитоза и экзоцитоза,
участвуют в деятельности рецепторных систем анализаторов,
поддерживая трансмембранный потенциал, обеспечивают работу
ферментов, синтезирующих АТФ.
Состав мембран соматических клеток индивидуален и зависит от
функциональной принадлежности, однако специфика действий
белков схожа. Так, рецепторные белки способны связывать регуляторные
молекулы, проявляя восприимчивость клеток к сигналам
эндокринных систем, а затем, после усиления этого сигнала, обеспечивать его
передачу внутрь клетки.
Кроме того, транспортные белки, встроенные в мембрану,
обусловливают направленный перенос веществ против градиента их
концентрации.
Мембраны органелл и плазмалеммы различаются по составу, а
поверхностные структуры мембран отличаются по составу от структур,
обращенных вовнутрь клетки.
162
Глава 3. Биомембраны
Состав мембраны постоянно обновляется. Белки располагаются
в структуре мембраны асимметрично и окружены липидами. Основу
мембраны составляют белки, подвергнутые полимеризации. Текучесть
мембраны зависит от количества и строения жирных кислот. При этом
увеличивается содержание ненасыщенных жирных кислот, повышающих
текучесть мембраны, а возрастание гидрофобного радикала ацильной
части жирной кислоты способствует понижению текучести мембран.
Движение молекул в упорядоченных структурах (эндоплазмати-
ческий ретикулум, аппарат Гольджи, митохондрии и др.) будет
определяться величиной константы связывания (К5), которая
характеризует степень взаимодействия между молекулами.
А + Б< *' >А-Б
При этом вектор движения молекул будет зависеть от значения К$
и направлен в сторону уменьшения сродства перемещающейся
молекулы к окружающим ее белкам и другим соединениям, входящим в
состав мембран. Скорость движения молекул в упорядоченных структурах
и их действие зависит от природы окружающих молекул, с которыми
они будут связаны ковалентными или не ковалентными связями.
Функционирование мембраны клетки зависит от величин
создаваемого трансмембранного потенциала, образование которого
обусловлено неравномерным распределением вдоль мембраны
заряженных ионов (№+, К+, Са2+, СГ).
Основными компонентами мембраны являются белки,
составляющие 20...70%, липиды — З0...60%, углеводы — 0,5... 10%.
В состав биологических мембран входят фосфолипиды, гликоли-
пиды и стероиды. Среди фосфолипидов следует выделить
производные фосфатидной кислоты: фосфатидилхолин, фосфатидилэтанола-
мин, фосфатидилсерин, фосфатидилинозит, а также сфинголипиды,
представленные производными церамида и сфингомиелина.
Индивидуальность структур и физико-химические свойства
сложных липидов обусловлены разнообразием высших жирных кислот,
которые входят в их состав. В состав гликолипидов входят углеводные
компоненты. Основным представителем стероидов служит холестерин.
Увеличение размера углеводородных цепей высших жирных
кислот происходит при участии ферментов эндоплазматического ре-
тикулума или в матриксе митохондрий. Образование двойных
связей осуществляют ферменты, относящиеся к группе десатураз. При
163
Биохимия животных
этом известно, что в тканях животных линолевая (С18:2), линоленовая
(С|8:з) и арахидоновая (С2о:4) кислоты не образуются и поэтому
являются для них незаменимыми.
В состав молекулы фосфатидилхолина могут входить
пальмитиновая и пальмитолеиновая кислоты, а у фосфатидилэтаноламина — еще
и арахидоновая кислота.
Расположение липидов в струетуре мембран имеет определенные
закономерности. Так, фосфаткдилсерин преимущественно располагается
на внутренней поверхности мембраны, обуславливая появление
отрицательного заряда. Аналогично локализуется в структуре мембраны фосфа-
тидилинозитол, участвующий в механизмах передачи внешнего сигнала
в цитоплазму клетки. Пгиколипиды (ганглиозиды и церебразиды)
располагаются на наружном слое мембраны, обращенной во внешнюю среду.
Состав основных липидов некоторых мембран животных и человека
представлен в табл. 3.2, из которой видно, что основными липидами
мембран животных являются холестерин, фосфатидилхолин и фосфа-
тидилэтаноламин. При этом в состав мембраны миелина в большом
количестве входят гликолипиды.
Таблица 3.2
Процентный состав липидов некоторых мембран животных и человека
(Болдырев, 1990)
1 Название
1 Фосфатидная кислота
| Фосфатидилхолин
| Фосфатидилэтаноламин
1 Фосфатидил и нозит
1 Фосфатидилсерин
| Кардиолипин
1 Сфингомиелин
| Гликолипиды
1 Холестерин |
Эритроциты
человека
1,5
19,0
18,0
1,0
8,5
0
17,5
10,0
25,0
Миелин
человека
0,5
10,0
20,0
1,0
8,5
0
8,5
26,0
26,0
Митохондрии
сердца быка
0
39,0
27,0
7,0
0,5
22,3
0
0
3,0 |
Изменение состава липидов пищи может проявляться в
изменении липидного состава мембранных структур.
164
Глава 3. Биомембраны
Лабильность липидного состава мембран может наблюдаться при
перемене условий среды обитания. Особенно резкие различия в составе
высших жирных кислот отмечаются при смене температуры среды.
Фосфолипиды в составе мембран выполняют в основном
структурообразующую роль, тогда как холестерин регулирует упаковку
мембраны и осуществляет контроль за подвижностью ее компонентов.
Мембранные белки способны легко встраиваться в фосфолипид-
ный бислой. При этом происходят изменения в конформации
белковой глобулы, индуцирующие возникновение гидрофобных контактов
между белком и ацильными фрагментами фосфолипидов. Глубина
погружения белка в бислой зависит от энергии гидрофобных
взаимодействий и от величины полярности поверхностных участков
белковой глобулы. Белок ориентирован в структуре мембраны таким
образом, чтобы полярные и заряженные поверхностные участки белка
были обращены к полярной среде по обе стороны мембраны.
В составе белков мембраны могут быть как остатки углеводов,
так и остатки липидов. Особенно богаты цитоплазматические
мембраны гликопротеинами. При этом их углеводные радикалы
обращены наружу с внешней стороны мембраны. Функциональная
активность белков зависит от окружения, что обусловлено лабильностью
их структуры, поэтому изменение в составе липидов может приводить
к угнетению функциональной активности белка.
Устойчивость мембранных белков может повышаться за счет пос-
ттрансляционной модификации. При этом белки подвергаются аце-
тилированию и гликозилированию. Процесс ацетилирования
сопровождается связыванием остатков высших жирных кислот (К-СООН) за
счет сложноэфирных связей с остатками серина, треонина и тирозина,
располагающихся на поверхности белковой глобулы. Таким образом,
формируются протеолипиды. Кроме того, к белкам могут быть
присоединены остатки диацилглицерина, который присоединяется к белку
тиоэфирной связью через 1М-концевой цистеин. Жирные кислоты еще
могут присоединяться к белку амидной связью к а-аминогруппам.
амидная связь 0=С-К сложноэфирная связь
165
Биохимия животных
Время жизни мембранных белков составляет от двух до пяти суток.
Синтез полипептидной цепи новых мембранных белков начинается
с Ы-конца и завершается образованием сигнального пептида,
основной целью которого является распознавание в структуре мембраны
рецептора, обеспечивающего встраивание белка в мембрану. Затем этот
участок полипептидной цепи отщепляется, а к гидрофильной части
молекулы присоединяются остатки углеводов. По завершению
синтеза белка рибосома покидает мембрану, а белок переносится к месту
функционирования.
В составе мембран содержится до 10% гликозилированных белков
(гликопротеины и протеогликаны) и до 26% гликозилированных ли-
пидов (гликолипиды). В основном углеводы представлены в
следующем составе: глюкоза, галактоза, нейраминовая кислота, фукоза и
манноза.
В соединительной ткани и межклеточном веществе определяют
протеогликаны, углеводные остатки которых сульфатированы (хонд-
роитинсульфат, дерматонсульфат и гепарансульфат).
Остатки углеводов связываются гликозидной связью с остатками
серина, треонина, аспарагиновой и глутаминово кислот.
Избирательное расположение белков в структуре мембран
обусловлено их строением. Так, фибринопектин локализуется на
наружной поверхности большинства клеток, тогда как спектрин
располагается на внутренней поверхности клеточных мембран. Транспортные
белки пронизывают мембрану насквозь (рис. 3.3). Представителем
таких белков является гликофорин А (28 кДа). В составе
полипептидной цепи белка имеется участок из 24 аминокислотных остатков,
содержащих гидрофобные радикалы. Последовательность начинается
и заканчивается остатками аргинина.
166
Глава 3. Биомембраны
Ионный
канал
Рис. 3.3. Фрагмент мембраны с элементами цитоскелета и углеводов
(Болдырев, 2001)
Некоторые мембранные белки, встроенные в мембрану, связаны
амидной связью с жирной кислотой. В образовании связи участвует
1М-концевой аминокислотный остаток и карбоксильная группа
жирной кислоты. В основном это миристиновая или пальмитиновая
жирные кислоты. Кроме того, часть белков могут образовывать тиоэфир-
ные связи между цистеином и изопреновой структурой (фарнезил,
геранилгераниол и др.).
Все клетки организма обладают сходством в основном наборе
внутриклеточных структур, обуславливающих ее функционирование. При
этом каждый тип органелл имеет высокоспецифичный белково-ли-
пидный состав, индивидуализирующий их и обуславливающий
взаимодействие между органеллами. Последние являются динамическими
структурами, они варьируются в размерах и способны формироваться
только при наличии исходной формы.
Расположение органелл в клетках не хаотично, а зависит от
выполняемых ими индивидуальных функций. В клетке существуют
определенные транспортные пути перемещения веществ как внутри клетки,
так и между клетками. Нарушение транспортных путей может
привести к возникновению заболевания.
167
Биохимия животных
Долихол. Процесс гликозилирования мембранных белков протекает
при участии долихола. Последний относится к семейству полиизопренов,
в составе углеродной цепи которых от 80 до 100 атомов углерода.
?нз
/Ч/ N
сн2 сн
т-
сн
/\ /
сн2 сн2
,СН2ОН
л = 19
Долихол входит в состав мембран клеток, оказывая влияние на их
структуру. В мембранах долихол присутствует в соединениях с
жирными кислотами и углеводородами (рис. 3.4).
Долихол
и—АТФ
^АДФ
Долихол-Р
Долихол-Р-Р
Гликопротеин /
у
Белок
Долихол-Р-Р-2МГА-
9манноза-Зглюкоза
УДФ-ЫАГА
УМФ
Долихол-Р-Р^АГА
УДФ-ЫАГА
УДФ
Долихол-Р-Р-2ЫАГА
5ГДФ-манноза
5ГДФ
Долихол-Р-Р-2ЫАГА-5манноза
4Долихол-Р-манноза
ЗДолихол-Р-глюкоза
Долихол-Р"-Р-2НАГА-9манноза
Рис. 3.4. Долихофосфатный цикл
Вначале долихол подвергается фосфорилированию (долихол-Р), а
затем к этой форме присоединяется М-ацетилглюкозамин ^АГА) с
образованием долихол-Р-Р-АГА (цолихол-пирофосфат-14-ацетилглюко-
замин) (1). Повторное присоединение ЫАГА позволяет удлинить
углеводный фрагмент (2). Затем происходит присоединение пяти
молекул маннозы с образованием долихол-Р-Р-2МГА-5манно-
зы (3). Данный комплекс способен участвовать в процессе глико-
168
Глава 3. Биомембраны
зилирования белка и для этого он переносится в эндоплазматичес-
кий ретикулум, где к нему присоединяется 4 остатка маннозы (4)
и 3 остатка глюкозы (5). Образовавшийся комплекс (долихол-Р-
Р-2ЫАГА-9манноза-Зглюкоза) переносится на Ы-конец гликози-
лированного белка (6). При этом освободившийся долихолфосфат
может быть использован в следующем цикле. В этом процессе
лимитирующей стадией является образование долихолфосфата, а
активность пирофосфатазы (7) регулирует процесс.
Основным местом образования долихола в тканях животных
служит печень, где в его синтезе принимают участие ферменты синтеза
холестерина. Долихол способен накапливаться в тканях, индуцируя
фазовые переходы в структуре мембран, что оказывает влияние на их
проницаемость.
Белки, подвергнутые гликозилированию, защищены от действия
протеаз в процессе синтеза, приобретают избирательность транспорта
к месту их локализации, распознавая в структуре мембран участок
специфичного расположения. После встраивания белка в структуру
мембраны от него отщепляется часть полипептидной цепи
мембранной гиалуронидазой.
Холестерин. Молекула холестерина после встраивания в мембраны
удерживается в их структуре за счет взаимодействия гидроксильной
группы с карбон о вы м кислородом ацильных цепей фосфолипидов,
а также за счет образования гидрофобных связей с радикалами
жирных кислот. Высокое содержание холестерина увеличивает
микровязкость мембраны.
Следует помнить, что холестерин очень важен для организма
животных, поскольку он является предшественником желчных кислот,
кортикостероидов, половых гормонов и витамина Р. Поэтому в
организме ежесуточно синтезируется холестерина значительно больше,
чем поглощается с пищей.
Связывание холестерина с мембранами зависит от активности
специфичных мембранных рецепторов и от соотношения в крови
отдельных групп липопротеинов, которые осуществляют его транспорт
в организме.
3.3. ТРАНСПОРТНЫЕ СИСТЕМЫ
Клетки живых организмов являются термодинамически
открытыми системами и поэтому могут обмениваться с окружающей средой
169
Биохимия животных
веществом и энергией. Транспорт веществ через биомембраны может
происходить с использованием пассивных или активных
транспортных систем.
Пассивный транспорт осуществляется с помощью диффузии,
протекает самопроизвольно и не связан с расходом энергии АТФ.
Различают несколько способов диффузионного переноса веществ: простая
и облегченная диффузия. Простая диффузия обеспечивает перенос по
градиенту концентрации переносимого вещества, имеет низкую
скорость и неизбирательна в действии. При облегченной диффузии
перенос веществ осуществляется в направлении концентрационного
градиента, с использованием специализированных
молекул-переносчиков или через ионные каналы. В случае облегченной диффузии
может наблюдаться конкуренция между переносимыми веществами за
переносчик, что обуславливает избирательность действия
переносчика по отношению транспортируемых веществ.
Активный транспорт осуществляется против градиента
концентрации веществ и протекает при участии специализированных
транспортных каталитических систем — АТФаз. В настоящее время известно
три типа АТФаз: №+/К+-АТФаза, Са2+-АТФаза и Н+-АТФаза.
№+, К+-АТФаза. В клетках живых организмов всегда
поддерживается асимметричное распределение ионов №+ и К+, которое
используется для генерации возбуждения в нервных и мышечных клетках,
обеспечивая транспорт в клетку жизненно важных биогенных
молекул (углеводов и аминокислот). Разная концентрация ионов №+ и К+
внутри и снаружи мембраны клетки, обеспечивает протекание
активного транспорта, который осуществляется с помощью
специализированного фермента — №+,К+-АТФазы. Причем поддерживается
градиент ионов таким образом, что внутри клетки концентрация ионов
К+ примерно в 30 раз выше, а ионов натрия в 10 раз ниже, чем в
окружающей среде.
Фермент располагается в структуре клеточной мембраны животных
тканей (рис. 3.5). Основной деятельностью фермента является
избирательный перенос ионов №+ и К+ через мембрану, используя для этого
энергию гидролиза АТФ. Возникающий в результате потенциал действия
системы используется для генерации возбуждения, водно-солевого
обмена, активизации клеточного метаболизма (синтез ацетилхолина,
биосинтезов белка и липидов, ДНК и РНК-полимеразных реакций и др.).
В составе фермента две полипептидные цепочки, которые
обозначаются а- и р-субъединицами; они имеют в первичной структуре по
170
Глава 3. Биомембраны
1016 и 302 аминокислотных остатка соответственно. Молекулярная
масса а-субъединицы 112, а р-субъединицы — 45 кДа. Причем малая
субъединица гликозилирована, т. е. содержит на поверхности
белковой молекулы несколько остатков углеводов (рис. 3.5).
Участки связывания
уабаина
а-субъединица
р-субъединица
Центр связывания
ионов
Гликозидные
радикалы
Центр связывания
АТФ
Участок фосфорилирования
Рис. 3.5. Схема расположения Ыа+,К+-АТФазы в клеточной мембране
(Болдырев, 1998)
В структуре а-субъединицы располагается активный центр,
осуществляющий гидролиз АТФ, а также имеются участки связывания
кардиостероидов, обращенные к наружной стороне мембраны. При
этом большая субъединица погружена в мембрану, пронизывая ее
насквозь. Центры связывания переносимых ионов располагаются
в петле между второй и третьей спиралями, что обеспечивает
работу а-субъединицы как транспортной системы мембран, р-субъ-
171
Биохимия животных
единица же локализуется на наружной стороне мембраны, с
обращенными в сторону цитоплазмы прикрепленными к ней остатками
углеводов.
Инициирующей молекулой №+,К+-АТФазы служит АТФ;
гидролиз ее обеспечивает энергией активный транспорт ионов, в котором
участвуют ионы натрия, калия и магния. Процесс протекает по циклу
(рис. 3.6).
Рис. 3.6. Схема цикла работы №\К+-АТФазы
В присутствии ионов натрия происходит активизация фермента
(Е|), сопровождаемая связыванием АТФ. В результате гидролиза
происходит отщепление остатка фосфорной кислоты от АТФ, с
последующим переносом на карбоксильную группу остатка аспарагиновой
кислоты активного центра белка, с формированием фосфорилйро-
ванной формы фермента (ЕГФ). Последняя переходит в состояние,
когда связанные с ферментом три иона натрия фиксируются в
области активного центра (Ф-ЕгЗЫа+). В связывании ионов
принимают участие карбоксильные группы остатков аспарагиновой и глута-
миновой аминокислот молекулы белка, кислород которых способен
осуществлять координационные взаимодействия с лигандами,
образуя решетку двух типов (Е1 и Е2).
При этом может образоваться в одном случае рыхлая и
доступная для молекул воды структура, а в другом атомы упакованы плотно.
172
Глава 3. Биомембраны
Возможности такого расположения ионов позволяют в первом случае
связывать три иона натрия, а во втором — два иона калия.
Переход в следующее состояние осуществляется в присутствии
ионов магния, которые способствуют переходу фермента из конформа-
ции Е, в Е2. Этот переход сопровождается переносом ионов натрия
через мембрану.
ш
т\
1 * * * 1
1
1 * > * 1
§
После высвобождения ионов №+ фермент переходит в
состояние Е2-Ф. Находясь в этом состоянии фермент способен уже с этой
стороны связывать два иона калия, перенося их через мембрану.
Фосфорилированная форма фермента подвергается дефосфори-
лированию молекулой воды, с высвобождением неорганического
фосфата. Процесс завершается переносом ионов калия через
мембрану, с последующим высвобождением во внутрь клетки. В
результате фермент возвращается к исходной форме (Е,) и вновь готов
к повторению цикла.
Активность фермента регулируется с помощью протеинкиназ,
осуществляющих фосфорилирование №\К+-АТФазы и фосфатаз,
катализирующих отщепление остатка фосфорной кислоты. Кроме того,
фермент находится под контролем гормональной системы. В
частности, альдостерон способен активировать синтез фермента.
Ингибитором фермента является строфантин С (уабаин),
имеющий на поверхности белка участок связывания.
Са2+-АТФаза. Кальциевые АТФазы входят в состав цитоплазмати-
ческих и внутриклеточных мембран. Фермент выполняет роль
кальциевого насоса. Все Са2+-АТФазы являются мономерными белками,
но различаются по молекулярной массе. При этом цитоплазматиче-
173
Биохимия животных
екая Са2+-АТФаза имеет молекулярную массу 120 кДа, а саркоплаз-
матического ретикулума — 108 кДа. Са2+-АТФаза обеспечивает обмен
ионов М§2+ на ионы Са2+, расходуя при этом АТФ. Перенос ионов Са2+
осуществляется против градиента его концентрации.
Схематическое изображение Са2+-АТФазы саркоплазматического
ретикулума скелетных мышц представлено на рис. 3.7. Белковая часть
молекулы фермента встроена в мембрану таким образом, что большая
ее часть сс-спиральных участков соединена снаружи короткими
полипептидными связями.
&Д7 V V V \11
соон
Рис. 3.7. Схема строения Са2+-АТФазы (Владимиров, 1998):
/ — полипептидная цепь Са2+-АТФазы саркоплазматического ретикулума;
2 — участки цепи Са2+-АТФазы цитоплазматической мембраны;
3 — а-спиральные участки, Са2+-ионы кальция, ФЛБ — фосфоламбан,
КМ — кальмодулин, Р — участок фосфорилирования
Са2+-АТФаза выполняет роль насоса, осуществляя связывание,
транспорт и высвобождение перенесенного кальция. Процесс
осуществляется за счет энергии гидролиза одной молекулы АТФ Са2+-
174
Глава 3. Биомембраны
АТФазой, которая переносит два иона кальция через мембрану из
окружающей среды во внутрь везикул саркоплазматического рети-
кулума. Процесс имеет циклический характер, в результате
осуществления которого последовательно реализуются стадии с участием
Са2+ и АТФ (рис. 3.8).
На первом этапе происходит связывание двух ионов Са2+ на
поверхности АТФазы (1). Это обуславливает возможность инициации этапа
связывания АТФ (2) и двух ионов магния, который завершается
процессом фосфорилирования белка и образованием фосфофермента
с высвобождением АДФ (3). Затем происходит освобождение ионов
Са2+ во внутрь пузырьков саркоплазматического ретикулума (4)
путем вытеснения их ионами М&2+. Присоединение ионов М&2+
сопровождается изменением конформации белка, обеспечивающим
перенос ионов Са2+. Завершается процесс гидролизом фосфатной связи,
с последующим отщеплением ионов М§2+ (5) и возвращением
конформации фермента в исходное состояние.
Ф М§2
2Са2
2+
Е-2Са
\^АТФ
2Са
01:
2М8*
Ф-Е-2Са2+ ,—. М§2+-АТФ-Е-2Са2+
Ш
2М§Г АДФ
Рис. 3.8. Схема процесса переноса кальция с помощью Са2+-АТФазы
Исследования связывания АТФ с Са2+-АТФазой показали, что
АТФ связывается в комплекс с ионами М§2+, причем это происходит
независимо от мест связывания Са2+, т. е. для связывания ионов Са2+
и АТФ с М§2+ имеются два разных центра на поверхности белковой
глобулы. Кроме того, есть еще один центр связывания для молекул
175
Биохимия животных
АТФ, который выполняет регуляторные функции. Фосфорилирова-
ние Са2*-АТФазы, осуществляется по карбоксильной группе остатка
аспарагиновой кислоты, расположенной в активном центре
фермента. Эта стадия обратима и обеспечивает возможность переноса
остатка фосфорной кислоты с белка на АДФ с образованием АТФ.
Вытеснение ионов Са2' из центров их связывания ионами М§2+
происходит в два этапа. Сначала отщепляется ион кальция,
который замещается на ионы М§2\ а затем происходит гидролиз
фосфатной связи.
Нефосфорилированная форма фермента (Е-форма) способна
связывать ионы кальция только с внешней стороны мембраны, а после
фосфорилирования фермента (Ф-Е-форма) Са2+-связывающие
центры становятся доступными с внутренней стороны мембраны и
недоступны с внешней.
Таким образом, фосфорилирование Са2+-АТФазы обеспечивает
этап переноса центров связывания ионов кальция через мембрану,
который завершается изменением сродства центров связывания к
ионам кальция и выход их наружу.
Деятельность Са2+-АТФазы регулируется специализированным
белком фосфоламбаном, который способен связываться на
поверхности белковой глобулы неподалеку от места фосфорилирования и
таким способом понижает активность фермента. Это происходит за
счет того, что связывание фосфоламбана сопровождается
уменьшением сродства участков связывания ионов Са2+ к этому иону. Ингиби-
рующий эффект снимается путем фосфорилирования фосфоламбана
протеинкиназами, фосфорилированная форма которого не способна
связываться с Са2+-АТФазой.
Кальмодулин. Другим регуляторным белком Са2^-АТФазы
является кальмодулин, действие которого основано на том, что он
препятствует реализации механизма самоингибирования Са2+-АТФазы,
которое осуществляется путем отклонения фрагмента
полипептидной цепи С-конца Са2+-АТФазы, закрывающего центры связывания
ионов кальция. Кальмодулин связывается в участке вблизи С-конца,
препятствуя его ингибирующему действию.
Белок был впервые обнаружен в тканях мозга американским
исследователем В. Ченгом. Кальмодулин определяется практически
во всех растительных и животных тканях. В молекуле кальмодулина
имеются центры связывания четырех ионов Са2+, которые обладают
высоким сродством к белкам (Кд = 10~9). Процесс регулируется кон-
176
Глава 3. Биомембраны
центрацией кальция. Высокие концентрации Са2+ внутри клетки
активируют кальмодулин, а в случае понижения содержания кальция
он становится функционально неактивным.
Кальмодулин — мономерный белок, в составе полипептидной
цепочки которого около 150 аминокислотных остатков, с
молекулярной массой 17 кДа. В первичной структуре кальмодулина
преобладают остатки аспарагиновой и глутаминовой кислот, составляющие
до 30% от общего числа аминокислотных остатков белка. Аллос-
терическая активация кальмодулина аналогична активации киназ
циклическим АМФ.
Взаимодействие Са2+ с кальмодулином изменяет активность около
100 ферментов. К их числу относятся Са2*-кальмодулин зависимые
протеинкиназы.
Связывание ионов Са2+ с кальмодулином инициирует конфор-
мационные изменения в глобулярной структуре белка, приводящие
к экспонированию гидрофобных участков терминальных и
центральных спиралей сопровождаемое разматыванием фрагментов а-спира-
лей, которые образуют петлю, позволяющую молекуле кальмодулина
обернуться вокруг белка-мишени. При этом N и С терминальные
области полипептидной цепочки кальмодулина сближаются друг с
другом и их гидрофобные участки связываются с белком-мишенью. Это
способствует тому, что спиральная последовательность белка-мишени
попадает в центр гидрофобного туннеля, проявляя сильные
изменения в конформации белка-мишени. При снижении концентрации
Са2+ комплекс кальмодулина с белком мишенью диссоциирует.
3.4. ВТОРИЧНЫЙ АКТИВНЫЙ ТРАНСПОРТ
В клетках живых организмов дополнительно транспортные системы
могут использовать градиент одного вещества для транспорта другого.
Этот вид транспорта осуществляет перенос в клетку углеводов,
аминокислот, а также выведение некоторых продуктов метаболизма. Изучены
три системы вторичного транспорта: унипорт, антипорт и симпорт.
Источником энергии вторичного активного транспорта служит
мембранный потенциал и градиент концентрации одного из ионов.
В механизме унипорта реализуется однонаправленный перенос
одного соединения через мембрану. В случае если транспорт вещества
сопряжен с переносом другого вещества в противоположном
направлении, то этот механизм называется антипортом. Перенос двух раз-
177
Биохимия животных
ных соединений с участием переносчика в одном направлении
называется симпортом.
Пассивный транспорт Активный транспорт
3.5. КАТАЛИТИЧЕСКИЕ БЕЛКИ МЕМБРАН
В составе мембран саркоплазматического ретикулума содержатся
аденилаткиназа, аденилатциклаза, цАМФ-зависимая киназа, деза-
миназы и ферменты основных метаболических процессов гликоге-
неза, гликогенолиза, гликолиза, ПДК и окислительного фосфори-
лирования.
Аденилаткиназа катализирует реакцию образования АТФ. В
реакции участвуют две молекулы АДФ. В ходе реакции осуществляется
перенос остатка фосфорной кислоты с одной из молекул АДФ на другую
молекулу. В результате реакции образуются молекулы АТФ и АДФ.
2АДФ->АТФ + АМФ
Аденилатциклаза катализирует реакцию превращения АТФ в
циклическое АМФ.
АТФ -► цАМФ + ФФн
Впервые фермент и его механизм действия были изучены
американским ученым Э. Сазерлендом. Аденилатциклаза относится к
мембранным ферментам; активность этого фермента регулируется
гормонами (адреналин, глюкагон, паратгормон, тиротропин, лютропин,
178
Глава 3. Биомембраны
фоллитропин, кальцитонин, кортикотропин, (3-меланотропин, серо-
тонин, вазопрессин и др.). В составе ферментативного комплекса три
компонента: рецептор, каталитический и регуляторный белки. При
взаимодействии гормона с рецептором запускаются механизмы,
регулирующие активность аденилатциклазы.
Циклический АМФ предназначен для выполнения роли
универсального внутриклеточного мессенджера, индуцирующего в клетке
цикл превращения, активируя работу цАМФ-зависимой протеинки-
назы. Эти ферменты переносят терминальный остаток фосфорной
кислоты с АТФ на остатки серина и треонина субстратных белков.
Протеинкиназы осуществляют фосфорилирование гистонов, белков
рибосом, ферментов гликогенолиза.
3.6. МИКРОСОМАЛЬНОЕ ОКИСЛЕНИЕ
Метаболизм ксенобиотиков (чужеродных соединений) в организме
животных и человека осуществляется в основном в клетках печени при
участии ферментов, локализованных в эндоплазматическом ретику-
луме (микросомах) и в митохондриях. При этом эцдоплазматический
ретикулум представляет собой липопротеиновую канальцевую сеть,
располагающуюся внутри клетки. При разрушении тканей эндоплаз-
матический ретикулум распадается на фрагменты, называемые
микросомами, в составе которых многочисленные ферменты,
катализирующие реакции окисления, восстановления, метилирования, гидролиза
и перекисного окисления липидов (рис. 3.9). Среди реакций микро-
сомального окисления особенно следует выделить реакции гвдрокси-
лирования, т. е. включение гидроксильной группы в состав молекулы
субстрата. В организме животных в реакциях гидроксилирования
участвуют ферменты (монооксигеназы и оксидазы), которые используют
в качестве окислителя кислород и протекают они в присутствии НДДН
и НДДФН.
АН + НАДФН + Н+ + 02 -> АОН + НАДФ* + Н20,
где АН — субстрат, АОН — продукт реакции.
Оксидазы представляют собой сложные мультиферментные
комплексы, содержащие в качестве терминальной оксидазы гемопро-
теин — цитохром Р-450.
179
Биохимия животных
АН-Р45о-Ре
АН
ё<-Цит. Ъ5<-ФП,«-НАДФН
Р450-Ре3'
АН-Р45о-Ре
2+
АОН
Ч"
Н20
АОН-Р45о-Ре3+-Н20 Ц
V
Оо
АН-Р45о-Ре"-02
еЧ-Цит. Ъ5<-ФП2«-НАДФН
Рис. 3.9. Схема механизма действия гидроксилируюшей системы микросом
(ФП1 — НАДФН-цитохром-Р-450-редуктаза, ФП2 — НАДН-цитохром-
Р-450-редуктаза, АН и АОН — субстрат и продукт реакции, Ре2* и Ре3+ —
восстановленная и окисленная формы железа)
В состав микросомальной гидроксилируюшей системы кроме ци-
тохрома Р-450 еще входят НАДФН-цитохром Р-450-редуктаза и фос-
фолипид — фосфотидилхолин.
Цитохром Р-450 является гемопротеином, в составе которого про-
топорферин IX с атомом железа.
Под воздействием ксенобиотиков мультифсрментный комплекс
способен индуцироваться, т. е. чужеродные соединения экспресси-
руют синтез основных компонентов комплекса, причем в
зависимости от природы индуктора вновь синтезируются разные формы ци-
тохрома Р-450. При этом каждая из форм цитохрома Р-450 способна
катализировать реакции определенного типа, например, гидроксили-
рование ароматических соединений до фенолов или окислительное
деаминирование многих лекарств или окисление ненасыщенных
соединений до спиртов и т. д. В механизме действия микросомальной
системы можно выделить пять стадий (рис. 3.9).
На первой стадии восстановленная форма субстрата (АН)
взаимодействуете окисленной формой цитохрома Р-450. Эта стадия характеризуется
высокими константами скорости. Поэтому исследования, проведенные
180
Глава 3. Биомембраны
с использованием метода быстрой кинетики, позволили установить,
что связывание субстрата с цитохромом Р-450 не только сдвигает
спиновое равновесие гемопротеина, но также существенно изменяет
окислительно-восстановительный потенциал цитохрома Р-450.
На второй стадии процесса происходит восстановление фермент-
субстратного комплекса АН-Ре3+ первым электроном до АН-Ре2+.
Донором электрона является НАДФН, который окисляется при участии
НАДФН-цитохром-Р-450-редуктазы.
На третьей стадии происходит быстрое присоединение
молекулярного кислорода к восстановленному ферментсубстратному
комплексу, с образованием тройного комплекса (АН-Ре2+-02).
На четвертой стадии тройной комплекс восстанавливается вторым
электроном, поступающим из НАДН-специфической цепи переноса,
в которой участвует цитохром В5. Между двумя цепями переноса
электронов существует сопряжение, сопровождаемое обменом
восстановленными эквивалентами НАДН- и НАДФН-спеиифических цепей.
Таким образом, в четвертой стадии осуществляется активация
молекулярного кислорода в координационной сфере гемового железа.
На пятой стадии, происходит внедрение активированного
кислорода в субстрат с последующим распадом тройного комплекса и
освобождением продуктов реакции и воды.
Кроме того, многие реакции микросомального окисления,
происходящие с участием НАДФН и 02, могут быть осуществлены в
присутствии органических гидроперекисей и только одного цитохрома
Р-450, находящегося в окисленной форме. В этом случае транспорт
первого и второго электронов на цитохроме Р-450 уже не нужен, так
как гидроперекиси содержат кислород, активированный двумя
электронами.
Цитохром Р-450 обнаружен в микросомах и митохондриях коры
надпочечников, где он участвует в ключевых стадиях биосинтеза
стероидных гормонов из холестерина. Однако цитохром Р-450 не
обнаружен в микросомах мозга и скелетной мускулатуре.
Цитохром Р-450 не проявляет специфичности к какому-либо
определенному субстрату, а специфичен к гидрофобности окисляемых
соединений.
Цитохром Р-450 крайне нестабильное соединение и может
быстро инактивироваться при выделении или действии радикалов,
образующихся при разложении комплекса гидроперекиси с цитохромом
Р-450.
181
Биохимия животных
Вопросы и задания для самоконтроля
I. Расскажите о механизмах формирования бел ково-липидных
комплексов. 2. Опишите строение мембран. 3. Расскажите о значении
мембран для живых организмов. 4. Раскройте роль мембран в транспорте
веществ. 5. Назовите основные компоненты мембран. 6. Раскройте
роль белков в формировании упорядоченных структур. 7. Расскажите
о строении сложных белков, входящих в состав мембран. 8. Расскажите
о роли долихола и холестерина в формировании мембран. 9. Назовите
основные транспортные системы мембран. 10. Расскажите о
функционировании вторичного транспорта. 11. Опишите действие
каталитических белков мембран. 12. Расскажите о значении микросомального
окисления.
ГЛАВА 4. СИСТЕМА УПРАВЛЕНИЯ
ЖИВЫХ ОРГАНИЗМОВ
4.1. ПРИНЦИПЫ СТРУКТУРНОЙ И ФУНКЦИОНАЛЬНОЙ
ОРГАНИЗАЦИИ ЖИВЫХ ОРГАНИЗМОВ
Система управления — это комплекс биогенных молекул,
которые предназначены для хранения и передачи информации о строении
и функционировании живого организма, а также для осуществления
контроля за деятельностью информационных молекул.
Все живые организмы на нашей планете имеют индивидуальные
проявления признаков, что позволяет отличаться им друг от друга.
При этом свойства организма и его биопотенциал ограничен
информативностью генома (рис. 4.1); реализация этой информации
позволяет создавать организмы с их индивидуальными свойствами,
проявляющими в то же время способности к интегрированию при
выполнении следующих функций:
1) самоуправления, т. е. способности сформировать действующую
систему управления; при этом самоорганизация клетки возможна
только при направленном действии внешних факторов, тогда как
самоуправление позволяет проявить имеющиеся
внутриклеточные механизмы, реализуя информацию, заложенную в ДНК, и
переписывая ее в виде специализированных молекул РНК (тРНК,
м РН К, рРН К), которые уже в свою очередь участвуют в процессах
синтеза на рибосомах функциональных белков;
2) самовосстановления, т. е. активизации процессов репараций как
на уровне генома клеток, так и на уровне молекулярных
структур; при этом активизируются механизмы восстановления
нарушенных действием патогенных внутренних и внешних
факторов систем управления (ДНК и РНК), функциональных
белков и регенерации мембран клеточных структур;
183
Биохимия животных
1
Вирусы
А
Грибы
Живые организмы
1
1
! Бактерии
1
Растения
*
Информационная система
Половые признаки
Время жизни
Рост и развитие
Поведение
Размеры и форма ;
<
г
ДНК
1„
|
^ 1
1
Животные
~~
\ Ы .„ ~ *-„„™
1 Индивидуальные особенности
строения
1 т
Тип питания
1 т '
Тип движения и активность
Сенсорная чувствительность \
1
Адаптация к условиям |
Рис. 4.1. Основные информационные свойства ДНК живых организмов
3) самовоспроизведенияу т. е. реализации возможности
воспроизводить организмы себе подобных; для этого используются
механизмы мейоза и митоза;
4) саморегуляции, т. е. имеются специализированные системы,
органы и молекулы, регулирующие протекание биохимических
процессов; эти механизмы проявляются на молекулярном,
субклеточном, клеточном и организменном уровне регуляции,
с участием заложенных в них регуляторных механизмов;
184
Глава 4. Система управления живых организмов
5) самоуничтожения, т. е. имеются системы, способные
распознавать возникшие в биогенной системе нарушения и посредством
активизации механизмов автоокисления, протеолиза и апоп-
тоза способны саморазрушаться.
4.2. ОСНОВНЫЕ ПРИНЦИПЫ
ФОРМИРОВАНИЯ БИОГЕННЫХ СИСТЕМ
Живой организм является термодинамической открытой системой,
в каждой из клеток которой протекают преимущественно
неравновесные биохимические процессы. Основным действующим элементом
живого организма является функциональный белок. В каждом живом
организме имеется специфичный набор биогенных молекул. При этом
каждая биогенная молекула индивидуальна в реализации
пластического, энергетического и информационного потенциала.
Пластический потенциал биогенных молекул проявляется в их упорядоченном
расположении в биологических структурах, тогда как энергетический
потенциал обуславливает возможности совершения направленности
действия, а информационный — в жизнеспособности и
жизнедеятельности организма.
За счет малых размеров в клетке понижается энергия
неупорядоченных процессов, но возрастает уровень упорядоченных процессов, что
способствует повышению устойчивости биогенных структур. Таким
образом, уменьшение объема клетки способствует возрастанию
энергии межмолекулярных взаимодействий, создавая условия для
проявления порядка и степени управления биохимическими процессами.
Высокая активность и избирательность действия ферментов,
позволяет малым количествам каталитического белка превращать
значительные концентрации субстрата. При этом неравновесность
биохимических процессов позволяет осуществлять последовательное
превращение веществ в клетке.
Градиент температуры и рН обеспечивают оптимальные условия
для действия функциональных белков. При этом рН может служить
регулятором направленности каталитических реакций.
Водный состав среды варьируется составом биогенных молекул.
Заряженные и полярные молекулы способствуют накоплению воды,
тогда как гидрофобные и неполярные молекулы — выталкивают воду
из среды.
185
Биохимия животных
Слабые взаимодействия между молекулами повышают
динамичность биогенной системы, а сильные взаимодействия увеличивают ее
стабильность.
В специализированных соматических клетках организма протекают
два вида процессов: во-первых, — процессы, поддерживающие
жизнеспособность клетки, присущие для всех клеток организма, во-вторых, —
процессы, проявляющие индивидуальные свойства каждого вида клеток.
Выявление этих специфичных для клеток процессов, а через них и
индивидуальных функциональных белков, может быть использовано в
диагностике патологических состояний, выявлении локализации
патологического процесса и оценки интенсивности его протекания.
Реакционная способность биогенных молекул зависит от
качественного и количественного состава атомов, их расположения в
молекуле, а также возможности проявить себя в составе различных
функциональных групп и взаимного влияния этих групп друг на друга,
с проявлением влияния условий среды. Движение молекул в
упорядоченных структурах (эндоплазматический ретикулум, аппарат Гольджи
и др.) будет определяться величиной константы связывания, которая
определяет степень взаимодействия между молекулами. В частности,
вектор движения молекул зависит от значения К5 и будет направлен
в сторону уменьшения сродства перемещающейся молекулы к
окружающим ее белкам и другим соединениям, входящим в состав
упорядоченной структуры. Таким образом, осуществляется управление
направленным движением биогенных молекул в клетке.
При нахождении соединений в биогенных структурах их
поведение и действие будет зависеть от окружающих молекул, с которыми
они будут взаимодействовать, участвуя в образовании ковалентных и
нековалентных связей. Причем низкомолекулярные соединения
могут вступать во взаимодействия как с низкомолекулярными, так и
высокомолекулярными соединениями.
Большинство химических реакций в клетках живых организмов
катализируются ферментами. Ферментативные реакции протекают
в квазистационарном состоянии, т. е. при постоянстве
концентрации фермент-субстратного комплекса. Химические реакции,
протекающие в биологических системах, синхронизированы во времени
и в пространстве. Все живые организмы состоят из одних и тех же
базовых биогенных молекул (аминокислоты, азотистые основания,
нуклеиновые кислоты, белки, углеводы, липиды и др.). Однако
качественный и количественный состав биогенных молекул индивидуален
186
Глава 4. Система управления живых организмов
для каждого организма. Кроме того, строение белков и нуклеиновых
кислот строго специфично видовому составу живого организма, хотя
многие из них могут выполнять схожие функции. В целом биогенные
молекулы живого организма обладают специализированной
функцией, необходимой для поддержания его высокой жизнедеятельности
и активного функционирования, но в случае необходимости способны
обеспечить поддержание жизнеспособности живой системы и в
состоянии покоя. Причем информация о всех молекулах живого организма
содержится в ДНК и определяется активностью его генов. В ДНК
заложен и алгоритм развития живых организмов. Присутствие в
биологической системе чужеродных молекул может привести к ее
гибели, поэтому высокая активность защитных механизмов организма
направлена на то, чтобы распознать посторонние молекулы и затем
их уничтожить. Для реализации этой функции в организме активно
действует система распознавания, способная с высокой
специфичностью связывать чужеродные молекулы. Действие функционального
белка определяется величиной константы связывания (К5).
А + Б^=^[АБ]
*-,
[А][Б] *, 1
[АБ] *, К„
где А — низкомолекулярная биогенная молекула, Б —
функциональный белок, К5 — константа связывания, Кр — константа равновесия,
к\ и к_\ — каталитические константы.
Если величина к\ » к_и то это свидетельствует о том, что
происходит образование комплекса. При этом скорость образования
комплекса (V) = *|[А][Б]) намного выше его распада {у_\ = Л_|[А][Б]), т. е.
у1 » у_|. В случае, если к„\ » кь то образуется крайне нестабильный
комплекс (у_| »у1).
Наиболее стабильной является система, в которой
устанавливается состояние равновесие. При этом проявляется равенство
скоростей образования и распада комплекса (V! = у2).
Процесс взаимодействия биогенных соединений обычно
завершается образованием стабильного при данных условиях комплекса,
концентрация которого зависит от условий среды и природы биоген-
187
Биохимия животных
ных соединений. Период образования комплекса обычно называется
пред стационаром, а время, в течение которого концентрация
комплекса [АБ] достигает максимального значения и в течение некоторого
промежутка времени практически не изменяется, называется
стационаром. Таким образом, в условиях стационарности
4АБ]
Л
= 0.
Установление режима стационарности обеспечивает протекание
процесса с участием функциональных белков.
Величина константы связывания определяет сродство биогенной
молекулы к функциональному белку и, возможно, с помощью этого
показателя регулирует количественный состав биогенных молекул в клетке.
По величине константы связывания можно определить
направленность процесса в сторону образования комплекса. При этом, чем
меньше величина К5, тем прочнее комплекс и выше сродство
соединений, участвующих в его образовании. Высоким сродством к
функциональным белкам в биологических системах обладают гормоны,
значения констант связывания которых могут быть равны 10"9...Ю"12 М.
Практически ковалентнос связывание проявляет гем при
связывании с апобелком у гемсодержащих белков. Так, например, константа
связывания гема с апобелком пероксидазы равна Ю"13 М, что
наблюдается при рН > 3,0. Однако при рН меньше 3,0 величина константы
связывания резко возрастает, понижая сродство гема к апобелку,
обусловливая пониженную стабильность комплекса гема с апобелком.
На стабильность комплекса белка с биогенной молекулой
оказывают влияние диффузионные процессы, протекающие в системе.
Упорядоченное расположение функциональных белков и других молекул
в структурах мембран клетки и ее органелл позволяет осуществлять
контроль за молекулярным составом мембран и вследствие этого
определять размер и форму клетки.
Образование комплекса биогенной молекулы с белком обычно
происходит при условии, что (А|0 » 1Б]0, а уравнение материального
баланса можно записать в виде (А]0 = [А| + [АБ] и [Б]0 = [Б| + [АБ].
Тогда[А]0 = [А].
Тогда уравнение для комплекса будет иметь следующий вид
[АБ]=[А],[Б]0
*,+[А],
188
Глава 4. Система управления живых организмов
Преобразуя уравнение получаем следующее
[АБ]
[АБИДо-ДГ,
[А] с
В случае, если есть возможность регистрировать образование
комплекса, например спектрофотометрически, то уравнение можно
представить в виде
АА=ААао-К-^->
* * [А]0
где ДА — величина изменения оптической плотности при добавлении
биогенного соединения; ААоо — величина, характеризующая переход
всего белка в связанное состояние.
Если молекула функционального белка имеет п идентичных, не
взаимодействующих друг с другом центров, то уравнение можно
преобразовать к виду:
N
'[А]/
где N — число молей биогенных молекул, связанных с одним молем
белка. Из графика, построенного в координатах (#/[А]0; /V), можно
найти стехиометрию (п) и определить величину константы
связывания (К5).
Поведение биогенных молекул, содержащих функциональные
группы, имеющих определенное рК, может быть охарактеризовано с
помощью уравнения Хендерсона—Хассельбаха. Вывод этого
уравнения сводится к следующему.
АН<=±А+Н\
_[Н»][А-]
я [АН]
Логарифмируя это уравнение, получаем следующее:
[А"]
1ёКд = 1ё[Н+]+1ё
[АН]"
189
Биохимия животных
Поменяем местами \&КЛ и 1§ [ЬГ] и получим
-1ё[Н']=-1§К = + 18-^Ц
61 ^ ^д *[АН]
Заменив -\% [Н+] на рН, а -1§КД на рКа, получим
рН = рКа+18-^.
Р к ш Б[АН]
В случае, если |АН] = [А-], то
рН = рК^ + 181,0 = р^ 4- 0, т. е. рН = рК.
Используя уравнение Хендерсона-Хассельбаха, можно:
1. вычислить величину рКа любой группы при данном рН, если
известно отношение молярных концентраций донора [АН] и
акцептора [А"];
2. определить значение рН сопряженных кислотно-основных пар
(СН3СООН/СН3СОО-, Н2Р047НР042" и др.) при данном
молярном соотношении в случае, если известно рК;
3. рассчитать соотношение между молярными концентрациями
донора и акцептора протонов при любом значении рН, если
известна величина рКа слабой кислоты.
Активное состояние биологической системы поддерживается за счет
запаса внутренней энергии системы, а протекание и направленность
химических процессов осуществляют при накоплении в клетке АТФ
и других фосфорорганических соединений. Резервирование энергии
в молекуле АТФ позволяет в дальнейшем персонифицировать запас
энергии в лимитирующих ферментативных реакциях метаболических
процессов, определяя их скорость протекания и направленность и
создавая условия, при которых эти реакции становятся необратимыми.
Ферменты, катализируют протекание химических реакций в
клетках живых организмов, используя для этого участок на поверхности
белковой глобулы, который называется активным центром.
Специфичность связывания и превращения субстрата в активном центре
определяется природой функциональных групп и геометрией их
расположения. Активность фермента регулируется с помощью различ-
190
Глава 4. Система управления живых организмов
ных молекул, которые могут понижать ее (ингибиторы) или повышать
(активаторы). По строению ферменты относятся к белкам, поэтому
их синтез определяется экспрессией соответствующего гена.
Строение управленческого аппарата живой клетки,
представленный высокомолекулярными соединениями (ДНК, РНК, белки),
способен выполнять следующие функции:
О хранить и передавать информацию о живом организме
(включая строение, функционирование, поведение клеток и живого
организма в целом);
□ информация, переданная от ДНК на РНК и белок, определяет
количество, качество и порядок связывания аминокислот в
полипептидной цепи, индивидуализируя, таким образом,
структуру белка; при этом поверхностные аминокислотные остатки
определяют место локализации белковой молекулы в
структурах клетки, выполняя роль структурообразующих составляющих
мембран как субклеточных структур, так и мембран клетки;
□ функциональные свойства белка зависят от природы
аминокислотных остатков и упорядоченности их расположения в местах
локализации на поверхности белковой глобулы, а также в
области активных или регуляторных центров;
С] поверхностные структуры клеточных мембран участвуют в
распознавании клеток, а также обеспечивают их взаимодействие
в сообществе клеток органов и тканей.
Несмотря на многообразие многоклеточных организмов, все они
имеют схожие проявления в формировании целостной структуры,
которые обусловлены тем, что каждая клетка живого организма содержит
один и тот же набор генов, т. е. наблюдается идентичность в строении
ДНК всех клеток многоклеточного организма. Однако сообщество
клеток организма, входящих в состав различных органов и тканей,
обладает определенной специализированностью в функционировании,
реализуя индивидуальную генетическую программу, которая
осуществляется за счет проявления активности определенных генов и инги-
бированием других.
Механизмы экспрессии и репрессии генов позволяют каждой клетке
реализовать индивидуальную программу действий, определяя их
структурные особенности в строении и специал изированность протекающих
в них метаболических процессов.
191
Биохимия животных
Рис. 4.2. Компоненты информационной системы биологических организмов
Дифференциация клеток животного организма происходит в
период его эмбрионального развития, однако механизмы этих
процессов пока мало изучены. Формируясь как целостная система, клетка
192
Глава 4. Система управления живых организмов
приобретает автоматизм в действии, проявляемый в делении
клеток и обусловленный запасом внутренней энергии системы, ее
способностью реализовать информационный потенциал генома клетки
(рис. 4.2). Наличие этих проявлений позволяет отличать живую клетку
от неживой.
Совокупность биохимических процессов, протекающих в организме
и обеспечивающих его жизнеспособность, называется метаболизмом,
тогда как вещества, участвующие в ферментативных реакциях
различных метаболических процессов, получили название метаболиты.
Метаболические процессы, протекающие в клетке живых
организмов, можно разделить на две группы: анаболические и катаболи-
ческие. В группу анаболических процессов входят процессы
ферментативного синтеза сложных биологических молекул (углеводов, нуклеиновых
кислот, аминокислот, белков, липидов и др.) из простых
предшественников, с потреблением свободной энергии, которая поставляется
в форме фосфатных связей АТФ (рис. 4.3). К катаболическим
процессам относят, процессы ферментативного расщепления биологических
молекул (углеводов, липидов, нуклеиновых кислот, белков и др.),
сопровождающиеся выделением свободной энергии и запасанием ее
в форме энергии фосфатных связей АТФ, ГТФ, ЦТФ и УТФ.
Посредниками в окислительно-восстановительных реакциях могут быть
окисленные и восстановленные формы НАД\ НАДФ* и ФАД.
Причем в живых организмах как анаболические, так и катаболические
процессы протекают с участием нуклеозидтрифосфатов. При этом
надмолекулярный комплекс ферментов, катализирующих
последовательные стадии метаболического пути и структурных элементов
клетки, называется метаболой, т. е. в состав метаболона включается
не только комплекс ферментов, выполняющих определенную
метаболическую функцию, но и опорный участок клеточной структуры
(участок мембраны, цитоскелет и т. п.), на котором комплекс
адсорбирован. Примером такого метаболона может служить комплекс
гликолитических ферментов вместе с белками в мембране
эритроцитов или актин в составе цитоскелета, ферменты пируватдегидро-
геназного и а-кетоглутаратдегидрогеназного комплексов.
В клетках многоклеточных живых организмов присутствуют все
те компоненты, которые свойственны для всех остальных клеток
организма животного. Имеется ядро, митохондрии, рибосомы,
гладкая и гранулярная эндоплазматическая сеть, аппарат Гольджи, ли-
зосомы и др.
193
Биохимия животных
3
2
5
о
X
о
о
т
5
10
ю
ю
о
о
о
X
о
т
X
X
о
с
2
194
Глава 4. Система управления живых организмов
4.3. РОЛЬ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ
В РЕГУЛИРОВАНИИ БИОХИМИЧЕСКИХ ПРОЦЕССОВ
В регулировании биохимических процессов, протекающих в
живых организмах, используются механизмы многоуровневой регуляции.
Многообразие химических реакций, протекающих в клетках живого
организма, находятся под контролем сложной регуляторной системы,
включающей молекулярный, субклеточный, клеточный и организмен-
ный уровни организации биогенных систем (рис. 4.4). Основу
молекулярного уровня составляет функциональный белок, особенности
строения которого позволяют определять возможность
совершаемого действия. Поэтому структурная организация белка определяет
его функцию, в выполнении которой проявляется способность белка
катализировать химические реакции, осуществлять перенос
различных соединений, регулировать протекание биохимических процессов
в клетке, обеспечивать двигательную функцию за счет реализации
механизмов сокращения и др.
Система регулирования
обменных процессов в
организме животных
Молекулярный
Субклеточный
Функциональный
белок
Компоненты
органелл
Мембранный
процесс
Органеллы клетки
X
Клеточный
Рецепторы
мембран и
цитоплазмы
клетки
Метаболический и
функциональный
процессы
Рис. 4.4. Схема регулирования биохимическими
процессами в организме животных
195
Биохимия животных
По своему строению белки можно разделить на простые и
сложные. Последние в своей структуре имеют различные
низкомолекулярные соединения небелковой природы (углеводы — гликопротеины,
липиды — липопротеины, гем — железопротеины и др.), а также ионы
металлов (железо, медь, кобальт, цинк, селен и др.). Присутствие этих
соединений в составе белка определяет его возможности к
функциональной деятельности.
Активность функционального белка во многом определяется кон-
формационной подвижностью белковой части. Так, например,
каталитическая активность фермента зависит от природы
превращающегося субстрата, возможности связываться в области активного центра
и затем превращаться за определенное время. Конформационные
изменения в субъединицах сложных ферментов проявляют их
кооперативные взаимодействия, ускоряющие протекание каталитического
процесса (положительная кооперация) или, наоборот, способны его
замедлять (отрицательная кооперация).
Различные факторы среды влияют на поведение белков в биогенных
системах (рис. 4.5). В частности, ионы тяжелых металлов ингибируют
ферменты, вызывают их денатурацию, адсорбируясь на поверхности
белковой глобулы, тогда как температура изменяет активность ферментов.
Возрастание температуры вначале приводит к увеличению скорости
ферментативных реакций, но сопровождается понижением их стабильности,
что в итоге проявляется в виде денатурации ферментов и утрате
каталитических свойств. С понижением температуры активность ферментов
уменьшается. Это вызвано тем, что понижается подвижность
функциональных групп в области активного центра и одновременно возрастают
энергетические затраты, необходимые для связывания субстратов.
Белки могут разрушаться под действием ультрафиолетового,
рентгеновского излучения, а также различных видов ионизирующего
излучения. Активность каждого фермента биогенных систем
оптимизируется в определенном диапазоне рН, выход за пределы которого
сопровождается понижением скорости ферментативной реакции.
В регулировании деятельности функциональных белков
принимают участие витамины и элементы (рис. 4.5). Последние могут
входить в состав белковой молекулы, участвуя в процессах стабилизации
белка или в активные центры ферментов, принимая участие в
каталитическом процессе. Роль витаминов обусловлена тем, что они
являются предшественниками кофакторов, в отсутствие которых
каталитический процесс невозможен.
196
Глава 4. Система управления живых организмов
Витамины
т
Кофакторы
Компоненты системы
регулирования
"/
Макро-и
микроэлементы
V
Функциональные
белки
\ /
Ферменты
V
Гормоны
т
Клетка
/ \
Аденилатцик-
лазная система
т
Метаболические
процессы
4
Факторы
среды
1
г
Температура,
рН-среды,
влажность,
давление и
ДР- |
Экспрессия
генов
1
'
Биосинтез
белка
Рис. 4.5. Схема действия компонентов системы регулирования
биохимических процессов в организме животного
Субклеточный уровень регулирования проявляется на уровне
организации сложных структурных образований клеток (метабо-
лоны, органеллы, элементы мембранных структур и др.). Основной
регуляторный механизм субклеточных структур реализуется в
регулировании процессов биосинтеза белков, фолдинга, протеолиза,
апоптоза и др.
При этом регуляторное действие проявляется на уровне
экспрессии генов и репрессии генома, которые осуществляются
соответственно субстратом и продуктом ферментативной реакции.
197
Биохимия животных
Процесс транскрипции находится под контролем стероидных
(анаболических) гормонов (рис. 4.5).
Образование сложных ферментативных комплексов определяется
структурой белка, расположением на поверхности белковой глобулы
аминокислотных остатков, собранных вместе в виде специфических
поверхностных сайтов, индивидуальных в составе у каждого белка.
Замена хотя бы одного аминокислотного остатка в первичной
структуре белка, приводит к искажению ее функционально активной
третичной структуры, проявляемой, вследствие этого, потерей
функциональной активности.
Кроме того, регуляторный механизм заложен и во взаимодействии
компонентов функционального процесса. Так, например, активность
фермента единого метаболического процесса регулируется действием
субстрата и продуктом реакции, реализуя механизм «обратной связи».
Когда субстрат первого фермента метаболического процесса
является инициатором процесса, т. е. выполняет роль «триггера» процесса,
тогда продукт конечной ферментативной реакции этого процесса
служит ингибитором первого фермента.
Кроме того, контроль за протеканием метаболического процесса,
осуществляется через наличие лимитирующей стадии ферментативной
реакции, скорость которой является самой малой величиной и, кроме
этого, фермент, катализирующий эту реакцию находится под контролем
метаболитов сопряженных процессов. Таким образом, устанавливается
регулирование ферментами лимитирующих стадий гликолиза (гексо-
киназа, фосфофруктокиназа и пируваткиназа) и продуктами
ферментативных реакций цикла трикарбоновых кислот. Метаболиты
последнего, в частности цитрат, ингибирует активность фосфофруктокиназы.
Кроме того, ферменты лимитирующих стадий гликолиза активируются
при накоплении АМФ и АДФ, а ингибируются избытком АТФ.
Активную роль в регуляторном действии на субклеточном уровне
проявляют активные формы кислорода, инициирующие протекание
свободнорадикальных реакций, действующим элементом которых
служит свободный радикал. Реакции радикалов с жирными кислотами,
входящими в состав мембран, характеризуются появлением перекисей
и разрушением структуры мембран органелл и клетки. Кроме того,
свободные радикалы способны модифицировать поверхностные
аминокислотные остатки белков, активировать процессы автолиза. Известно
регуляторное действие активных форм кислорода, проявляемое в
процессе окислительного фосфорилирования, когда изменения в составе
198
Глава 4. Система управления живых организмов
ненасыщенных жирных кислот мембран митохондрий может служить
условием разобщения процессов окисления и фосфорилирования. При
этом сохраняется активность процесса окисления, но угнетается
активность процесса, связанного с фосфорил ированием АТФ. Этот механизм
используется для создания условий нахождения живого организма в
состоянии гипобиоза, который характеризуется тем, что при сохранении
жизнеспособности угнетается его функциональная активность.
Уровень клеточной регуляции реализуется путем
регулирования метаболических процессов посредством воздействия на
рецепторы клеточных мембран через активизацию аденилатциклаз-
ной системы. Последняя осуществляет регулирование, активизируя
деятельность гормонально-рецепторной системы. При этом гормон
связывается с рецептором, расположенным на поверхности мембраны,
инициируя механизмы передачи сигнала через упорядоченное действие
компонентов аденилатциклазной системы.
Кроме того, регулирование транспортных потоков различных
биогенных соединений необходимо клеткам, которые в последующем
будут участвовать в энергетических и пластических процессах.
Своевременное удаление продуктов распада биогенных молекул
является условием защиты клетки от действия ненужных клетке веществ.
Процесс клеточной дифференциации является условием
формирования разнообразных по своей функциональной активности
клеток в многоклеточном организме. Причем объединение этих клеток
приводит к образованию отдельных органов и тканей, которые
приобретают специализированную функцию, обусловленную
активностью определенных генов.
Таким образом, многоклеточный организм, имеющий различные по
функциональной активности клетки, приобретает разнообразные
функциональные системы (пищеварительная, нервная, выделительная,
дыхательная, двигательная и др.), совместное действие которых
регулируется с помощью сигналов нейроэндокринной системы. Главным
инициатором этих сигналов является центральная нервная система,
принимающая и анализирующая действия, происходящие в
окружающей среде (изменение температуры, звуковые, световые и другие
раздражители). В ответ на их действие в гипоталамо-гипофизарной
системе вырабатываются различные регуляторные молекулы,
которые посредством связывания с рецепторами мембран могут изменять
скорость метаболических процессов и их направленность в клетках
живого организма.
199
Биохимия животных
4.4. ПОДВИЖНЫЕ ЭЛЕМЕНТЫ ДНК
Геном млекопитающих почти наполовину состоит из различных
повторяющихся последовательностей, которые могут перемещаться
в геноме как в пределах одной хромосомы, так и между хромосомами.
Эти фрагменты ДНК получили название мобильные генетические
элементы (МГЭ). Их содержание в геноме может составлять до 50% от
общего количества ДНК. Способность к перемещению обусловлено
структурными особенностями МГЭ и наличием специальных
ферментов (транспозазы и ревертазы), которые в составе белковых
компонентов осуществляют эти перемещения. Движение МГЭ может
осуществляться путем вырезанияфрагментаДНКизодногоместаи встраивания
его в другое (транспозоны), а также путем образования копии
подвижного элемента, с последующим перемещением этого фрагмента ДНК
на новое место (ретротранспозоны). Образование ретротранспозонов
сопровождается увеличением числа МГЭ в геноме.
Подвижные элементы, встраиваясь в геном, могут вызывать
мутации, а также повышать активность близлежащих генов.
Мобильные генетические элементы часто получают различные
названия (коЬо — бродяга, 8урзу — цыган,У7ед — блоха и т. д.).
Однако следует отметить, что перемещение МГЭ в геноме
совершаются достаточно редко. Только в случае сильных внешних
воздействий или мутаций генов или самих элементов число перемещений
может возрастать в сто и даже тысячу раз.
Транспозоны перемещаются при помощи комплекса белков, в составе
которых — фермент транспозаза, участвующая в распознавании МГЭ и
его транспортировке на новое место. Транспозон ограничен с двух
сторон инвертированными (направленными навстречу друг другу) повтор-
ностями, которые необходимы для перемещения фрагмента ДНК. Во
время движения они сближаются, обеспечивая распознавание транспо-
зона транспозазами. Узнавание ДНК белками основано на
специфичном нековалентном взаимодействии остатков аминокислот
полипептидной цепи с нуклеотидами. Затем транспозон встраивается в новое
место в структуре ДНК, которое создается транспозазой. По
завершении процесса фермент сшивает МГЭ с основной ДНК.
Таким образом, разрыв в структуре ДНК и сшивание фрагментов
осуществляется транспозазой и вспомогательными белками.
Образование ретротранспозонов основано на процессе обратной
транскрипции, которая осуществляется при участии фермента —
обратной транскриптазы. Фермент способен не только синтезировать
200
Глава 4. Система управления живых организмов
ДНК, но и осуществлять синтез второй (комплементарной) цепочки
ДНК. Затем ДНК перемещается в ядро и может встраиваться в
геном, образуя провирус. В составе хромосомы МГЭ наследуется как
обычный ген.
Провирус имеет концевые повторы, содержащие 250...700 нуклео-
тидных пар. Они необходимы для транскрипции и репликации про-
вируса. В составе одного из повторов присутствует промотор,
взаимодействующий с РНК-полимеразой, осуществляющей синтез РНК.
Иногда может образоваться зрелый вирус, содержащий упакованную
в белки РНК. Вирус может мигрировать в другие клетки, инфицируя
их. Ретротранспозоны широко распространены у эукариот.
В системе контроля мобильных элементов участвуют белки
семейства Ргт и особый класс малых РНК (пиРНК), которые
предназначены для распознавания нуклеотидных последовательностей.
пиРНК представляют собой короткие полинуклеотиды (24...29 нук-
леотидов), последовательности которых совпадают с различными
участками мобильных генетических элементов, пи РНК
присоединяются к РМ-белкам и обеспечивают участие в связывании и
уничтожении молекул РНК, считанных с мобильных элементов, подавляя
таким образом активность МГЭ. У млекопитающих РМ-белки
называются М1\У1 и МИЛ. Они синтезируются во время сперматогенеза, и
отключение генов РМ-белков приводит к резкому росту активности
МГЭ в зреющих сперматоцитах. Кроме того, пиРНК могут влиять на
активность МГЭ и через механизм метилирования ДНК. Причем, чем
сильнее метилирован ген, тем слабее он функционирует. В процессе
метилирования ДНК участвуют ДНК-метилтрансферазы, а
регулируют действие фермента пи РНК при помощи РМ-белков. Система
РМ-пиРНК действует по принципу обратной связи. При этом
фрагменты, считанные в результате действия РМ-белков с МГЭ в виде
молекул РНК, могут сами функционировать в качестве пиРНК,
приобретая способность связываться с РМ-белками и управлять их
деятельностью.
Таким образом, чем активнее МГЭ, тем больше в клетке образуется
пи РНК и тем активнее подавляется деятельность МГЭ.
4.5. АЛЬТЕРНАТИВНЫЙ СПЛАЙСИНГ
Известно, что только 2% генома высших организмов кодируют
белки. Эти участки подвергаются и транскрипции и трансляции. Од-
201
Биохимия животных
нако почти 80% остальной части генома может подвергаться
только транскрипции и присутствовать в клетке в виде транскриптов.
К этим фрагментам ДНК относятся гены функциональных РНК
(транспортные, рибосомальные и разнообразные регуляторные),
атакже интроны, вставки в структуре пре-РНК, вырезанные в
процессе сплайсинга.
Сплайсингом является процесс образования функционально
активной мРНК из пре-РНК. Последняя содержит в своей структуре
участки, кодирующие белки (экзоны) и вставленные между ними не-
кодируюшие сегменты (интроны). В процессе сплайсинга интроны
удаляются, а экзоны сшиваются между собой в единую структуру.
Однако процесс может быть изменен. При этом из структуры пре-РНК
могут вырезаться часть экзонов вместе с прилежащими к ним
нитронами. В результате таких действий образуется множество мРНК,
которые в дальнейшем могут служить матрицами для синтеза разных по
аминокислотному составу белков, представляющих семейство изо-
форм. Этот процесс получил название альтернативного сплайсинга.
Механизм альтернативного сплайсинга обуславливает возможность
реализации информации одного гена для кодирования нескольких
разных по структуре белков. Причем синтез белков зависит от
действия различных факторов и регуляторных систем.
Альтернативный сплайсинг может осуществляться при участии
специализированных белков ($р11ст§ ге§и1а1ог8) или при помощи
особых структур — РНК-переключателей. Так, например, активность
механизмов альтернативного сплайсинга проявляется в мышечной
ткани, обусловливая образование функционально различных белков.
Кроме того, альтернативный сплайсинг реализуется в нервной ткани,
обеспечивая разнообразие белков оболочки нервных волокон.
4.6. РНК-ПЕРЕКЛЮЧАТЕЛИ
В настоящее время установлено, что действие генов находится под
контролем специализированной системы, элементом которой
служат РНК-переключатели. Первые РНК-переключатели (пЬо5шксНе$)
были обнаружены в 2002 г. Рональдом Брейкером и его коллегами из
Йельского университета. Ими впервые было установлено, что
информация о РНК-переключателях записана в начальном участке
кодирующего белка области гена и представляет собой последовательность
нуклеотидов, которая после транскрипции образует функционально
202
Глава 4. Система управления живых организмов
активные структуры. Формирование этих структур обусловлено
определенными нуклеотидными последовательностями, которые
располагаются в различных концах полинуклеотидной цепи
РНК-переключателя в виде следующих повторов: -АААГГГ- и -ЦЦЦУУУ-.
Эти последовательности связываются между собой, формируя
следующие комплементарные структуры:
-АААГГТ-
-УУУЦЦЦ-
В целом РНК-переключатель имеет форму петли с ручкой. В
составе РНК-переключателя определяются два участка, один из
которых выполняет роль рецептора, избирательно связывая регуля-
торные молекулы (рис. 4.6). Второй участок предназначается для
распознавания в структуре молекулы ДНК положение
регулируемого гена. При этом РНК-переключатель может как активировать,
так и ингибировать активность гена. Последнее действие основано
на прекращении процесса транскрипции. Действие
РНК-переключателя специфично и осуществляется индивидуально без участия
белков. Причем один ген
может находиться под контролем
одного или двух РН К-переклю-
чателей.
Регуляторнымимолекулами,
связывающими и
регулирующими активность
РНК-переключателя, могут быть глицин,
5-аденозилметионин, адено-
зилкобаламин, тиаминпиро-
фосфат и др.
Трехмерная структура РНК-
переключателя, реагирующего
натиаминпирофосфат,
представлена на рис. 4.6.
Связывание регуляторной
молекулы с
РНК-переключателем обусловливает изменение
его пространственной структуры, Рис. 4.6. Модель
которая в дальнейшем проявляет РНК-переключателя
203
Биохимия животных
активность переключателя, приобретающего после этого высокое
сродство к структурному участку гена. При этом регулягорной
молекулой, приводящей в действие РНК-переключатель, обычно служит
соединение, образующееся или расходующееся в каталитической
реакции, протекающей при участии фермента, ген которого находится
под контролем этого РНК-переключателя.
Таким образом, осуществляется контроль за накоплением и
расходованием вещества в клетках. При этом избыточное накопление
продукта ферментативной реакции обуславливает его связывание
с РНК-переключателем, который блокирует ген, приостанавливая
синтез фермента. В случае избытка субстрата РНК-переключатель
активирует ген, инициируя процесс синтеза фермента на рибосоме.
Описанный механизм действует по принципу отрицательной
обратной связи, когда избыток продукта опосредованно (через действие
переключателя) понижает синтез фермента, катализирующего реакцию,
в которой он образуется.
4.7. ОБРАТНАЯ ТРАНСКРИПЦИЯ
Процесс переписывания информации с РНК на ДНК называется
обратной транскрипцией. Методы обратной транскрипции
используют для размножения ретровирусы и ретротранспозоны. Кроме того,
в процессе обратной транскрипции образуются ретропсеадогены и
происходит достройка кончиков хромосом, укорачивающихся при
каждом делении.
Механизмы обратной транскрипции могут быть использованы
при восстановлении повреждений ДНК в результате действия
химических соединений или УФ-излучения. При этом утраченная
информация может списываться с РНК. В процессе участвует
ДНК-зависимая РНК-полимераза, осуществляющая считывание информации
с РНК и синтезирующая утраченный фрагмент ДНК.
Таким образом, фермент ДНК-зависимая РНК-полимераза
способна катализировать процесс, который осуществляет обратная транс-
криптаза.
4.8. НОХ-ГЕНЫ
В середине XX в. Эдвард Льюис исследовал мутантную плодовую
мушку, у которой на голове вместо антенн выросли ноги. Мутация
204
Глава 4. Система управления живых организмов
возникла вследствие того, что в процессе эмбриогенеза гены,
ответственные за формирование грудных конечностей, располагались не
в том месте и возникли не в то время. Это семейство генов,
отвечающих за правильное формирование частей тела у млекопитающих,
было названо Нох-генами. Эти гены, как показали исследования,
отвечают за правильный порядок дифференциации тканей и органов
в процессе эмбриогенеза.
Нох-гены у дроздофилы располагаются в хромосоме в строгом
порядке, определяя процесс дифференциации основных частей тела
животного. Работа этих генов определяет последовательность
формирования органов на голове, затем на груди и в хвостовой части. Похожие
гены определены и у млекопитающих (мышь, человек и др.).
Нох-гены могут располагаться на хромосомах кластерами или
вразброс. Нох-гены млекопитающих подразделяются на 14
классов, у нематод — 5, у оболочников — 9, у ланцетника — 14.
Паразитические трематоды содержат 4 Нох-гена на двух хромосомах и между ними
располагаются другие гены не из Нох-семейства. Все Нох-гены
являются транскрипционными факторами, т. е. регулируют активность
других ферментов, запуская каскад реакций, приводящих к образованию
в клетке нужных функциональных белков. Так, например, у иглокожих
первые три гена располагаются перед последним (14-тым), а начинается
кластер с пятого гена. У нематод и оболочников Нох-гены не образуют
кластеров и располагаются в разных местах хромосомы. Такое
расположение Нох-генов свидетельствует о том, что для их функционирования
в клетке присутствуют еще какие-то дополнительные факторы.
Неоднородность структуры ДНК еще проявляется в том, что между
Нох-генами располагаются участки ДНК, которые кодируют короткие
молекулы регуляторных РНК. Некоторые из них непосредственно
оказывают влияние на экспрессию самих Нох-генов, а некоторые
проявляют опосредованное действие на работу транскрипционных
факторов. Эти микро-РНК могут регулировать активность как
близких, так и удаленных Нох-генов. Регуляторная роль микро-РНК в
настоящее время активно изучается.
4.9. МИКРО-РНК
Микро-РНК представляют из себя короткие цепочки
рибонуклеиновых кислот, предназначенные для нахождения матричных РНК,
содержащих комплементарный участок, с которым связывается микро-
205
Биохимия животных
РНК. Образование комплекса препятствует дальнейшему участию
матричной РНК в процессе синтеза белка, что проявляется в
подавлении экспрессии гена.
Таким образом, регуляция процесса экспрессии может
осуществляться как за счет наличия факторов транскрипции, так и с
участием микро-РНК. Причем эти два метода способны
взаимодействовать между собой. При этом содержание микро-РНК контролируется
регуляторными системами клетки.
Так, например, функционально активной микро-РНК (гшКЫА-
142), вырабатываемая в клетках кроветворных тканей, становится
после того как специализированный фермент ЭгозНа осуществит
обрезание концевых фрагментов из первичной цепочки РНК. Однако
если ферменты АЭАКЛ и АОАК2 вмешиваются в этот процесс и
предварительно заменяют один нуклеотид в первичной структуре РНК, то
ОгозЬа утрачивает способность вырезать микро-РНК из первичной
полинуклеотидной цепочки. При этом модифицированная РНК
утрачивает способность к дальнейшему функционированию и становится
бесполезной для клетки. В процесс утилизации такой РНК
включается еще один клеточный механизм (Тшк>г-5М), в результате действия
которого бесполезная РНК разрезается на две части, причем действие
происходит вблизи замещенного нуклеотида.
Таким образом, реализуется регуляторный механизм, с помошью
которого осуществляется блокирование действия микро-РНК и
создаются условия для экспрессии гена.
Вопросы и задания для самоконтроля
1. Чем отличаются живые организмы от неживых? 2. Расскажите
о принципах построения живых систем. 3. По каким критериям можно
определить жизнеспособность живого организма? 4. Расскажите об
основных принципах формирования биогенных систем. 5. Выведите
уравнение Хендерсона-Хассельбаха. 6. Опишите
функционирование основных систем управления клетки. 7. Расскажите о роли
биологически активных соединений в регулировании метаболических
процессов. 8. Расскажите о подвижных элементах ДНК. 9. Опишите
механизм альтернативного сплайсинга. 10. Расскажите о значении
РНК-переключателей. 11. Опишите механизм обратной
транскрипции. 12. Расскажите о Нох-генах. 13. Раскройте роль микро-РНК в
регулировании процесса биосинтеза белков.
206
ГЛАВА 5. СИСТЕМА РЕГУЛИРОВАНИЯ
ЖИВЫХ ОРГАНИЗМОВ
Система регулирования представляет собой сложный комплекс
биогенных соединений, осуществляющих контроль за протеканием
метаболических процессов в клетках различных органов и тканей
организма животных. В состав регуляторной системы входят гормоны
и другие биологически активные соединения, которые способны
специфически связываться с рецепторами мембранных структур и
внутриклеточными рецепторными комплексами. При этом действие
регуляторных молекул индивидуально и специфично, а задача ре-
цепторных комплексов — усилить принимаемый сигнал в десятки
или сотни раз и реализовать его в определенной направленности
метаболического процесса.
Функционирование различных органов и систем живого организма
находится под контролем центральной нервной системы, связанной
с деятельностью анализаторов чувств (слуховой, зрительный,
вкусовой, обоняния и тактильной чувствительности). При этом в рецептор-
ных элементах анализаторов происходит преобразование сигналов из
внешней среды в нервный импульс, который в дальнейшем
преобразуется в деятельность гормонов эндокринной системы. Поэтому в целом
работа нервной системы находится во взаимосвязи с эндокринной
системой, образуя единую регуляторную нейроэндокринную систему
В эндокринных железах вырабатываются функционально
активные вещества — гормоны, проявляющие свое действие через рецеп-
торную систему. При этом рецептор может располагаться на внешней
поверхности клеточной мембраны или в цитоплазме клетки.
Действие гормона проявляется посредством передачи сигнала рецептору
при образовании комплекса с ним. По своей природе рецептор
является гликопротеином. Гормон проявляет высокое сродство только
к определенному участку на поверхности белковой глобулы, что
обусловливает высокое его сродство к рецептору, позволяющее проявлять
207
Биохимия животных
свое действие в низких концентрациях. Непродолжительность
действия гормона вызвано тем, что он быстро разрушается в живом
организме ферментативными системами (оксидазы и пероксидазы).
По строению гормоны можно условно разделить на несколько
групп: производные аминокислот (адреналин, норадреналин,
тироксин, трийодтиронин и др.), пептиды (вазопрессин, окситоцин, МСГ,
тиреолиберин, соматостатин и др.), белки (инсулин, глюкагон, сома-
тотропин, пролактин, тиротропин, фоллитропин, кальцитонин, па-
ратгормон и др.) и стероиды (эстрон, эстриол, эстрадиол, андросте-
рон, тестостерон, кортизол, кортизон, альдостерон и др.).
Содержание гормона в крови животных крайне незначительно и
по времени нахождения непродолжительно, что свидетельствует о
непостоянстве в проявлении их действия на клетки-мишени.
Концентрация гормона в крови может колебаться в пределах 10"6...Ю"12 М.
Механизм действия гормона проявляется через мембранные,
внутриклеточные и внутриядерные рецепторные системы. При совместном
действии гормонов возможен синергизм (когда действие одного
гормона усиливается другим гормоном), антагонизм (действие двух
гормонов противоположно) или многоступенчатость (действие гормона
провоцирует последовательное проявление действия нескольких систем).
Высокие концентрации гормона способны разрегулировать
нормальную деятельность организма, привести к возникновению заболевания.
5.1. АДЕНИЛАТЦИКЛАЗНАЯ СИСТЕМА
Система, в составе которой несколько рецепторных и
функциональных белков, располагающихся на внешней стороне клеточной
мембраны называется аденилатциклазной системой (рис. 5.1).
Рецептором аденилатциклазной системы служит белок, относящийся
к группе гликопротеидов. Рецептор способен избирательно
связывать гормон, передавая затем сигнал на N-белок, который
располагается между рецептором и ферментом (аденилатциклаза).
Функционально М-белок представлен двумя типами: Ы5 белок, активирующий
аденилатциклазу и Ы4 белок — понижающий ее активность. В составе
Ы-белка потри субъединицы (а-, 0-, у-субъединицы). а-Субъединица
Ы5 белка имеет молекулярную массу 42...45 кДа, 0-субъединица —
35 кДа, а у-субъединица — 5 кДа, тогда как сс-субъединица Ь1§ белка
имеет молекулярную массу 41 кДа, а 0- и у-субъединицы такие же,
как у Ы5 белка. Первоначальное состояние у-субъединицы N5 белка
208
Глава 5. Система регулирования живых организмов
Внеклеточное пространство
ташггтт
цАМФ
тпСОтдттрищттт
фи
ш
Рис. 5.1. Механизм действия аденилатциклазы (Овчинников, 1987)
209
Биохимия животных
определяется присутствием в ее активном центре молекулы ГДФ,
которая при образовании гормон-рецепторного комплекса замещается
на ГТФ путем вытеснения последней. При этом аденилатциклаза
приобретает каталитически активную конформацию, что проявляется
в действии по превращению АТФ в цАМФ.
он он он
но—ро- р^о — р—о— сн2
0 0 0
АТФ
о—сн2
0 = Р
+ФФн
он
цАМФ
Возвращение Ы& белка в исходное состояние происходит только
после того, как а-субъединица Ы5 белка гидролитически расщепляет
ГТФ до ГДФ и последний оказывается связанным с этой субьедини-
цей, тогда как ингибирование аденилатциклазы происходит при
связывании ГТФ с N1 белком, инициируемое соответствующим гормоном.
При этом цАМФ выполняет роль мессенджера сигнальной системы.
Действие аденилатциклазы приводит к увеличению концентрации
внутриклеточного цАМФ. В результате увеличивается скорость
одного из метаболических процессов, в частности, процесса анаэробного
окисления глюкозы — гликолиза. При этом одновременно происходит
понижение скорости гликогенеза — процесса синтеза гликогена.
Действие цАМФ сопровождается активированием протеинкиназы,
которая, в свою очередь, способна активировать киназу фосфорилазы.
Многокаскадный механизм действия киназ сопровождается
реакциями фосфорилирования неактивных предшественников, путем
переноса остатка фосфорной кислоты с АТФ на функциональную группу
(серии или треонин) активного центра фермента. Аденилатциклазная
система способна проявить действие нескольких гормонов:
адреналина, глюкагона, паратгормона, тиреотропина, лютеинизирующего и
фоликулостимулирующего гормонов, кальцитонина, кортикотропина,
серотонина, вазопрессина и др.
210
Глава 5. Система регулирования живых организмов
Таким образом, цАМФ обеспечивает переключение с одного
метаболического процесса на другой, одновременно включая
многокаскадный регуляторный механизм, в котором участвует несколько
ферментов (рис. 5.2). Инициатором этого процесса служит цАМФ,
которая активизирует цАМФ-зависимую протеинкиназу.
Активация фермента является следствием связывания цАМФ с
неактивной олигомерной формой протеинкиназы, вызывая ее диссоциацию
на активные мономеры. При этом активная протеинкиназа
катализирует АТФ-зависимое фосфорилирование другой протеинкиназы
(киназы фосфорилазы), которая в свою очередь активизирует глико-
ген-фосфорилазу. После этого фосфорилированная форма фермента
способна расщеплять гликоген, высвобождая фосфорилированные
формы глюкозы (глюкозо-1 -фосфат), которые подвергаются
дальнейшему превращению с участием ферментов гликогенолиза и
гликолиза (рис. 5.2).
Превращение активной формы фосфорилазы в неактивную
осуществляется фосфатазой.
5.2. ГОРМОНЫ ГИПОТАЛАМУСА И ГИПОФИЗА
В подбугровой области промежуточного мозга (гипоталамус)
вырабатываются белки, обладающие гормональной активностью.
Нервные клетки серого вещества гипоталамуса формируют 32 пары ядер,
распределенные в трех зонах: передней, средней и задней.
Вырабатываемые в гипоталамусе вещества (рилизинг-факторы) регулируют
секрецию соответствующих гормонов гипофиза. Все гормоны
гипоталамуса подразделяются на либерины, которые активируют синтез
гормонов гипофиза, и статины — ингибирующие этот процесс. По
строению гормоны гипоталамуса являются пептидами. В группу ли-
беринов входят: тиреолиберин, люлиберин, соматолиберин, мелано-
либерин, кортиколиберин; статинами являются: соматостатин, мела-
ностатин.
Гормоны гипофиза. Компонентом единой гипоталамофизарной
системы организма являются гормоны гипофиза. Различают
переднюю, заднюю и промежуточную доли гипофиза. В передней доли
гипофиза вырабатывается соматотропин (гормон роста), кортикотропин
(АКТГ), тиреотропин (ТТ), пролактин (ПЛ), фолликулостимулиру-
ющий гормон (ФСГ), лютеинизирующий гормон (ЛТГ), липотроп-
ные гормоны (Л Г). Задняя доля гипофиза вырабатывает вазопрессин
211
Биохимия животных
Адреналин
Аденилатциклазная система
Протеинкиназа
(активная)
1?г
М84 1^-АТФ
Протеинкиназа
(неактивная)
Киназа фосфорилазы I
(неактивная) ""
Киназа фосфорилазы
(активная)
М8
,2+
-АТФ
Фосфорилаза I I
(активная) "" "" ""
I
Фосфорилаза
(неактивная)
Фосфатаза
Гликоген
г
Н3Р04
Гликоген
(укороченный на
фрагмент)
Глюкозо-1 фосфат
Гликогенолиз
Гликолиз
Рис. 5.2. Механизм регуляторного действия цАМФ
212
Глава 5. Система регулирования живых организмов
и окситонин. В промежуточной доли гипофиза синтезируется мелано-
цитстимулирующий гормон.
Соматотропный гормон (СТГ, гормон роста) синтезируется в
ацидофильных клетках передней доли гипофиза. В первичной
структуре СТГ 191 аминокислотный остаток и четыре цистеина формируют
две дисульфидные связи. Гормон способен усилить биосинтез белка,
ДНК, РНК. Проявляет стимулирующий эффект на процессы синтеза
гликогена, способствует мобилизации липидов из депо, оказывает
влияние на окисление высших жирных кислот и глюкозы в тканях.
Действие гормона ускоряет рост и развитие организма. Нарушения
в содержании СТГ выражаются в заболевании называемом
акромегалия, характеризующимся непропорционально интенсивным ростом
отдельных частей тела.
Адренокортикотропный гормон (АКТГ) вырабатывается базофиль-
ными клетками аденогипофиза. Оказывает стимулирующее действие
на надпочечники, обладает меланоцитстимулирующей активностью
и липидомобилизующей. В первичной структуре АКТГ 39
аминокислотных остатков. Стимулирующий эффект АКТГ реализуется через
аденилатциклазную систему, цАМФ которой активирует протеинки-
назу, осуществляющую фосфорилирование холинэстеразы,
катализирующей превращение эфиров холестерина в свободный холестерин.
Последний, в свою очередь, переносится в митохондрии
надпочечников, где превращается в кортикостероиды.
ТЪфеотропин (ТТГ) — гормон гипофиза; в составе нативной
структуры белка две субъединицы (а- и р-субъединицы). Белок активен
только в димерной форме. Состав а-субъединицы постоянен для всех
видов животных и представлен 96 аминокислотными остатками, тогда
как аминокислотный состав Р-субъединицы может варьироваться.
Так, например, у человека в составе р-субъединицы 112
аминокислотных остатков. ТТГ контролирует деятельность щитовидной железы,
регулируя биосинтез и секрецию в кровь тиреоидных гормонов.
В регулировании процессов, протекающих в молочной железе,
участвует гормон передней доли гипофиза — пролактин. Гормон по
химическому строению относится к белкам. Например, у овцы в
первичную структуру пролактина входили 198 аминокислотных остатков, из
которых шесть цистеинов участвуют в образовании трех дисульфид-
ных связей. При этом стабильность структуры гормона
поддерживается за счет трех дисульфидных связей. Пролактин стимулирует
развитие молочной железы и лактации. Кроме того, гормон активирует
213
Биохимия животных
рост внутренних органов, секрецию желтого тела, оказывает ренот-
ропное, эритропоэтическое и гипергликемическое действие, а также
регулирует водный и солевой обмен, определяет развитие вторичных
половых признаков.
Секреция пролактина находится под контролем гормонов
гипоталамуса, в частности, тиролиберина. Через действие на
метаболические процессы в молочной железе гормон способен стимулировать
биосинтез основных белков молока — казеинов, оказывать влияние
на процессы биосинтеза лактозы и липидов.
Фолликулостимулирующий гормон (ФСГ) относится к группе
сложных белков — гликопротеинов, стимулирует созревание фолликулов
в яичниках у самок и сперматогенез у самцов, проявляет
совместное действие с лютеинизирующим гормоном (ЛТГ), который тоже
относится к гликопротеинам; в составе нативной структуры ЛТГ две
субъединицы: а- и р-субъединицы. В организме самок ЛТГ
стимулирует секрецию эстрогенов и прогестерона, вызывает разрыв
фолликулов с образованием желтого тела, а у самцов — секрецию тестостерона
и развитие интерстициальной ткани.
Липотропные гормоны (ЛГ) — гормон передней доли гипофиза,
различают 0- и у-ЛТГ. 0-ЛТГ обладает кортикотропным, мелано-
цитстимулирующим, гипокальциемическим и инсулиноподобным
стимулирующими эффектами, способен повышать скорость
утилизации глюкозы и липидов в тканях. Липотропное действие гормона
проявляется через аденилатциклазную систему, цАМФ которой
активирует протеинкиназу. ЛТГ ускоряет фосфорилирование тригли-
церол-липазы, которая после этого активно начинает расщеплять
нейтральные липиды, с отщеплением диацилглицерола и высшей
жирной кислоты.
Меланоцитстимулирующий гормон (МСГ) — гормон промежуточной
доли гипофиза, по строению относится к пептидам. Различают а-МСГ
с 13 аминокислотными остатками в первичной структуре и|$-МСГ —
у которого 18 остатков аминокислот. МСГ стимулирует меланино-
генез у млекопитающих и увеличение пигментных клеток в кожных
покровах у земноводных.
Окситоцин и вазопрессин. В задней доле гипофиза вырабатываются
два гормона пептидной природы окситоцин и вазопрессин,
оказывающие влияние на секрецию молока путем действия на мышцы
молочной железы, которое проявляется в нейроэндокринном рефлексе при
кормлении детенышей или при доении животных.
214
Глава 5. Система регулирования живых организмов
Су5-ТуГ'11е-С1п-А$п-Су5-Рго-Ьеи'С1у-ЫН2
Окситоцин
Су5-Туг-РЬе-С1п-А5п-Су8-Рго-Аг8-С1у-ЫН2
Вазопрессин
Кроме того, вазопрессин стимулирует сокращение гладкой
мускулатуры сосудов, регулируя водный обмен в организме, осуществляя
контроль за осмотическим давлением плазмы крови. При атрофии задней
доли гипофиза развивается заболевание несахарный диабет,
характеризующееся выделением большого количества жидкости с мочой.
5.3. ГОРМОНЫ ЭПИФИЗА
Эпифиз, или шишковидное тело, располагается между
полушариями большого мозга и мозжечком. В основе состоит из долек,
паренхима которых построена из пинеалоцитов, глиоцитов, лимфоцитов,
тканевых базофилов, пигментных клеток и мозгового песка. Пине-
алоциты секретируют серотонин, мелатонин — гормон-антагонист
меланоцитсинтезируюшему гормону передней доли аденогипофиза.
Предшественником гормонов является триптофан. При гидрокси-
лировании и декарбоксилировании триптофана образуется
серотонин. После ацетилирования и метилирования серотонина
образуется мелатонин. Реакция протекает при участии аденилатциклазной
системы, цАМФ которой запускает механизм активации протеинки-
назы. Действие гормона проявляется в торможении половых функций
у молодых животных и понижает освобождение лютеинизирующего
гормона. Свет оказывает угнетающее действие на синтез мелатонина
в организме животных.
5.4. ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Щитовидная железа располагается в области шеи по обеим сторонам
трахеи, позади щитовидного хряща. Морфофункциональной
структурой щитовидной железы является фолликул, внутри которого различают
два типа клеток. Фолликулярные (тироциты) и околофолликулярные
(С-клетки) клетки. В тироцитах происходит синтез йодсодержаших
215
Биохимия животных
гормонов (тироксина и трийодтиронина). Основным поставщиком
тироксина в щитовидной железе является белок тиреоглобулин, в
составе которого остатки тирозина подвергаются йодированию до мо-
нойодтирозина, а затем в дийодтирозин. Два остатка дийодтирозина
взаимодействуют между собой с образованием тироксина, либо
остатки монойодтирозина и дийодтирозина — с образованием
трийодтиронина.
СООН
СООН
Тироксин
Трийодтиронин
Синтез тиреоидных гормонов катализируется тиреоид-перокси-
дазой с участием перекиси водорода. Рецепторы тиреоидных
гормонов располагаются в ядре клетки, в составе митохондриальной
мембраны и в цитоплазме клетки. Поэтому действие гормонов
щитовидной железы может проявляться на уровне экспрессии генов,
регулируя процесс транскрипции, обусловливая возрастание
активности ДНК-зависимой РНК-полимеразы, оказывая, таким образом,
влияние на процессы биосинтеза белка, деление клетки. Действие
через митохондриальный рецептор позволяет регулировать процессы
окислительного фосфорилирования, тогда как цитозольный
рецептор обеспечивает транспорт гормона в ядро клетки.
В околофолликулярных клетках щитовидной железы
вырабатывается гормон пептидной природы кальцитонин, в составе первич-
216
Глава 5. Система регулирования живых организмов
ной структуры которого 32 аминокислотных остатка и два цистеина,
связанных между собой дисульфидной связью. Кальцитонины
животных различаются между собой по структуре и концевым
аминокислотным остаткам; кальцитонин действует противоположно па-
ратгормону, понижая концентрацию кальция в крови, который,
проникая из крови в клетки молочной железы, участвует в
формировании мицелл казеина.
5.5. ГОРМОНЫ ПАРАЩИТОВИДНОЙ ЖЕЛЕЗЫ
Гормоны парашитовидной железы регулируют концентрацию
ионов кальция и фосфорной кислоты в крови. При этом кровь является
основным поставщиком кальция в клетки молочной железы.
Основным гормоном паращитовидной железы является паратгор-
мон. В составе первичной структуры белка 84 аминокислотных
остатка. В проявлении действия гормона участвуют компоненты аде-
нилатциклазной системы. Стабилизируя содержание ионов кальция
в крови гормон способствует реализации его действия в мышечном
сокращении, передаче нервно-мышечного возбуждения, в
механизмах свертывания крови, активности транспортных белков мембран,
стабилизации структуры ферментов и т. д., и таким образом
нормализует деятельность этих систем. Действие гормона на почки
способствует уменьшению реабсорбции фосфата в дистальных канальцах и
повышает канальцевую реабсорбцию кальция.
5.6. ГОРМОНЫ НАДПОЧЕЧНИКОВ
Надпочечники — это парные железы, имеющие овальную или
вытянутую форму и расположенные вблизи почек. Состоят из двух
структур: мозгового (эктодермальные клетки) и коркового (мезо-
дермальная железистая ткань) вещества. Корковое вещество
располагается снаружи мозгового вещества, расположенного в
центральной части надпочечников, в составе которого хромаффинные
клетки, симпатические нейроны, нервные окончания и синусо-
идные капилляры. Удаление надпочечников у животных приводит
к сгущению крови, снижению артериального давления, желудочно-
кишечным расстройствам, астении, понижению температуры тела,
развитию гипогликемии, снижению обмена веществ, а также потере
натрия и калия.
217
Биохимия животных
Из коркового слоя надпочечников выделено более 40 гормонов
под общим названием кортикостероиды (кортикоиды). Все корти-
коиды можно разделить на две группы: глюкокортикоиды
(оказывающие влияние на пластический обмен) и минералокортикоиды
(влияющие на водно-солевой обмен). В первую группу входят: корти-
костерон, кортизон, гидрокортизон, 11-дезоксикортилзол, 11-дигид-
рокортикотерон.
О О
СН2ОН
Кортикостерон
Гидрокортизон
О
СН2ОН
Кортизон
Ко второй группе относятся дезоксикортикостерон, альдостерон.
СН2ОН
Дезокси корти костерон
Альдостерон
218
Глава 5. Система регулирования живых организмов
В основе строения кортикоидов пергидроциклопентанофенан-
трен. Выработка кортикостероидов находится под контролем
гормона гипофиза (АКТГ). Кортикоиды легко проникают в клетку,
связываясь со специфическими рецепторами, которые переносят их
в ядро клетки. Таким образом, гормон способен оказывать
влияние на начальные этапы биосинтеза белка. При этом проявляется
избирательность действия кортикоидов. Так, например, они могут
стимулировать синтез РНК и белков в печени, но ингибируют их синтез
в мышцах и лимфоидной ткани. Могут действовать синергично с
инсулином. Кроме того, обладают противовоспалительным,
антиаллергическим, иммунодепрессивным, противошоковым и
антитоксическим действием.
В центральной части надпочечника располагается мозговое
вещество, в котором вырабатываются гормоны, получившие название кате-
холамины. В составе мозгового вещества различают две разновидности
хромаффинных клеток: норадреноциты и адреноциты, причем первые
из них вырабатывают норадреналин, а вторые — адреналин.
НО ч ^2>^ НО <
■ сн — он ТУ^чТ"" сн — он
сн2—ын —сн3 /^^У сн2—ын2
но но ^ 2
Адреналин Норадреналин
Предшественником катехоламинов является тирозин, который
подвергается ферментативному окислению до 3,4-диоксифенилала-
нина (ДОФА) (см. рис. 5.3), которое катализируется тирозингидрокси-
лазой (1). Затем при участии декарбоксилазы (2) ароматических кислот
ДОФА превращается в 3,4-диоксифенилэтиламин (дофамин), а
дофамин преобразуется в норадреналин дофамин-р-гидроксилазой (3).
Завершается процесс метилированием норадреналина, который
катализируется фенилметаноламин-М-метилтрансферазой (4) в присутствии
донора метальных групп 5—аденозилметионина, с образованием
адреналина. Действие гормонов проявляется через активирование адени-
латциклазной системы. При этом активация сопровождается фосфо-
219
Биохимия животных
рилированием белков в цитоплазме, эндоплазматическом ретикулуме
и плазматической мембране.
НО
СН2-СН-СООН
I
ын2
О но
о
сн2-сн-соон
I
1ЧН, —
со,
л
Тирозин
но-^^-сн2-сн2
ТоЛД ^ -
Диоксифенилэтиламин
(дофамин)
НОч^^ч^СН-ОН
но
® но
Диоксифенилаланин
(ДОФА)
СН-ОН
сннчн,
Норадреналин
©
сн,
шлД'ммн'
Адреналин
Рис. 53. Процесс синтеза катехоламинов: / — тирозингидроксилаза;
2 — декарбоксилаза ароматических кислот; 3 — дофамин-0-гидроксилаза;
4 - фенилметаноламин-М-метилтрансфераза
Адреналин ускоряет гликогенолиз в мышцах и печени, повышая
уровень глюкозы в крови и содержание молочной кислоты в мышцах.
Катехоламины стимулируют липолиз, повышая уровень неэтерифи-
цированных жирных кислот в крови.
Норадреналин является медиатором нервного возбуждения,
способствует сокращению кровеносных сосудов, влияет на нейросекре-
торную функцию гипоталамуса, тогда как адреналин усиливает работу
сердца, расслабляет мышцы желудочно-кишечного тракта и матки,
вызывает сокращение пилорического и илеоцекального сфинктеров.
5.7. ЖЕНСКИЕ ПОЛОВЫЕ ГОРМОНЫ
Основным местом синтеза женских половых гормонов являются
яичники и желтое тело. Отмечается также их синтез в надпочечни-
220
Глава 5. Система регулирования живых организмов
ках, семенниках и плаценте. К женским половым гормонам относятся
прогестерон и эстрогены (эстрадиол, эстриол, эстрон).
Эстрон
Эстриол
Секреция эстрогенов и прогестерона в яичниках происходит
циклически и находится под контролем гормонов гипофиза (ФСГ и ЛТГ).
Основной функцией женских половых гормонов является
обеспечение дифференцировки пола и репродуктивного периода, протекания
процессов овуляции и оплодотворения яйцеклетки. При этом
прогестерон способствует успешной имплантации оплодотворенной
яйцеклетки, ингибирует процессы овуляции и стимулирует деление клеток
молочной железы, тогда как действие эстрогенов в основном
направлено на стимуляцию биосинтетических процессов.
5.8. МУЖСКИЕ ПОЛОВЫЕ ГОРМОНЫ
В клетках семенников в интерстициальных эндокриноцитах
вырабатываются мужские половые гормоны, которые называются андро-
генами. В основе их строения пергидрофенантренциклопентан,
поэтому все они относятся к группе стероидных гормонов. Высокую
биологическую активность проявляют андростерон, дегидроэпианд-
ростерон, тестостерон и др.
221
Биохимия животных
В составе андрогенов присутствуют две метильные группы при 10 и
13 атомах углерода. Кроме того, андрогены содержат кетонную группу.
СН3 СН3
= 0
Андростерон
Дегидроэп иандростерон
Тестостерон
Биосинтез андрогенов осуществляется еще и в яичниках и
надпочечниках. Гормоны гипофиза (фоликулостимулирующий и лютеи-
незирующий) контролируют процессы биосинтеза андрогенов. При
этом проявляется механизм отрицательной обратной связи, в основе
которого регуляторное действие андрогенов на секрецию гонадотропи-
нов, ингибирующих соответствующие центры в гипоталамусе.
Андрогены в мужском организме оказывают действие уже в
эмбриональный период, влияя на дифференциацию мужских половых желез и
других тканей. У половозрелых особей андрогены регулируют развитие
вторичных половых признаков, а также сперматогенез в семенниках.
Кроме того, андрогены обладают анаболическим действием,
стимулируя процесс биосинтеза белков. Причем для реализации этого действия
требуется присутствие соматотропина.
Недостаток андрогенов в организме обычно сопровождается
нарушением белкового обмена, атрофией скелетных мышц, усилением
отложения жировой ткани в подкожной клетчатке и внутренних органах.
Расщепление андрогенов в основном происходит в печени, с
образованием производных 17-кетостероидов.
Применяются андрогены для повышения синтетических
процессов, в качестве анаболических препаратов. Кроме того, назначаются
при нарушении функционирования половой системы.
222
Глава 5. Система регулирования живых организмов
5.9. ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ ГОРМОНОВ
КАК СТИМУЛЯТОРОВ ОБМЕННЫХ ПРОЦЕССОВ
Гормоны как стимуляторы обменных процессов активно
используются в животноводстве. Их практическое применение основано на
том, что гормоны способны контролировать протекание
метаболических процессов в животном организме, обеспечивают нормальный
рост и дифференцировку тканей, в том числе и мышц. Действие
гормонов проявляется на клеточном, субклеточном и молекулярном
уровнях структурной организации живых систем. При этом особое
внимание уделяется действию гормонов на уровне генома клетки.
Определяющими моментами в действии гормонов являются:
• специфичность взаимодействия гормонов с рецепторами,
расположенными в структуре мембран клеток-мишеней;
• количественные показатели этого взаимодействия
(определяются концентрацией и природой гормона);
• эффективность проявляемого действия на уровне процессов
экспрессии генов с модуляцией ответа на уровне биосинтеза
белка;
• регуляция внутриклеточных метаболических процессов.
Направленно воздействуя на обмен веществ с помощью
гормональных препаратов можно повысить мясную продуктивность
животных.
С помощью методов генной инженерии удалось научиться
направленному воздействию на клетки живых организмов для активизации
выработки гормонов белковой природы. Кроме того, современные
способы позволяют усиливать экспрессию ферментов, участвующих
в синтезе гормонов щитовидной железы, надпочечников и др.
При применении гормональных препаратов необходимо
учитывать видовые особенности животных, их возраст, физиологическое
состояние.
В настоящее время используют стимулирующий эффект
анаболических гормонов на рост и развитие животных, вводя их в рацион
питания молодняка крупного рогатого скота и свиней. В эту группу
соединений входят андрогены, эстрогены, инсулин, соматотропин.
Гормоны анаболического действия стимулируют обменные
процессы, за счет активизации процессов экспрессии генов,
проявляемых в ускорении синтеза белков.
223
Биохимия животных
Использование эстрогенов и кортикостероидов позволяет
повысить естественную резистентность организма животных, стимулируя
протекание иммунных процессов.
Следует обратить внимание на то, что повторное частое
воздействие гормонов ведет к развитию избирательной чувствительности
клеток-мишеней к одному типу гормонов. При этом может
утрачиваться стимулирующий эффект гормонов, проявляемый в том, что
клетки перестают реагировать на действие гормона, т. е. утрачивают
специфичность связывания. Кроме того, усиливаются процессы их
инактивации.
Так, например, при длительном введении гидрокортизона
происходят изменения в состоянии генома клеток, препятствующие
усилению транскрипции. При этом отмечается нарушение механизма
специфического взаимодействия гормон-рецепторного комплекса
с ядерными акцепторами и в результате не происходит включение
ДНК-зависимого синтеза РНК в ядре.
Условием использования гормонов всельскохозяйственном
производстве должна быть их безвредность для здоровья животных, а также
людей, потребляющих продукты животноводства. Поэтому
применение гормонов допускается лишь при строгом соблюдении всех
санитарно-гигиенических норм.
Вопросы и задания для самоконтроля
1. Расскажите о функциональной роли нейроэндокринной системы.
2. Опишите механизм действия гормонов. 3. Приведите
классификацию гормонов. 4. Раскройте роль аденилатциклазной системы в
регулировании процессов углеводного обмена. 5. Проанализируйте
взаимное действие гормонов гипоталамуса и гипофиза. 6. Расскажите о роли
гормонов эпифиза. 7. Расскажите о роли гормонов щитовидной и пара-
щитовидной желез в регулировании обменных процессов. 8. Назовите
гормоны надпочечников и опишите механизм их действия. 9.
Расскажите о механизме действия катехоламинов. 10. Раскройте роль
половых гормонов в развитии и функционировании организма животных.
11. Расскажите об использовании гормонов в животноводстве.
ГЛАВА 6. МЕТАБОЛИЧЕСКИЕ ПРОЦЕССЫ
6.1. МЕТАБОЛИЗМ НУКЛЕИНОВЫХ КИСЛОТ
6.1.1. Биосинтез пуриновых и пиримидиновых нуклеотидов
Живые организмы способны синтезировать пуриновые и пири-
мидиновые нуклеотиды из простых соединений: глицина, аспартата,
глутамина, рибозы, С02 и NНз. При этом в клетках функционируют
два разных метаболических процесса.
В процессе синтеза пуринов реализуются действия 11
ферментативных реакций, которые протекают при участии коферментов и
энергетических молекул. Данные исследования были выполнены в
лабораториях Дж. Бьюкенена, Дж. Гринберга и А. Корнберга.
Установлено, что конечным результатом синтеза пуринов является
рибонуклеотид — инозиновая кислота (ИМФ), из которой
впоследствии синтезируются АМФ и ГМФ (рис. 6.1). Синтез инозиновой
кислоты начинается с реакции фосфорилирования О-рибозо-5-фосфата,
который образуется в пентозофосфатном цикле. Реакция протекает
при участии пирофосфорилазы и АТФ. Образовавшийся 5-фосфори-
бозил-1 -пирофосфат взаимодействует с глутамином, в результате чего
образуется р-5-фосфорибозил-амин. Причем в процессе реакции
наряду с освобождением пирофосфата и свободной глутаминовой
кислоты происходит изменение его конфигурации (из а- в 0-форму).
Данная реакция является лимитирующей в синтезе пуринов.
На следующей стадии происходит присоединение молекулы
глицина к свободной ЫН2-Фуппе р-5-фосфорибозил-амина с
образованием глицинамидрибонуклеотида. Для протекания реакции требуется
АТФ. Затем, на следующей стадии, происходит удлинение радикала за
счет присоединения формильной группы из Г^5, М,0-метенил-ТГФК
с образованием формилглицинамидрибонуклеотида. На форм ильную
группу последнего переносится амидная группа глутамина и
синтезируется формилглицинамидинрибонуклеотид. Реакция протекает также
в присутствии АТФ.
225
®-о-н,с,
ъ
АТФ
ГФ МЛФ ф-0-н,С,
0
и_
Рибозо-5-фосфат
5-фосфорибозил
1 -гшрофосфат (ФРПФ)
5-фосфорибозиламин
М*'*-^АТФ
ын,.
Гли
©
АДФ+Р,
сн, с^
1 н
^ГШ-Риб-ф
М-формилглицин
амидинрибонуклеотид
АТФч1
АДФ+Р, **|
N
нс^Ч
II СН
5-Аминоимидазол-
рибонуклеотид
5 ® ° ^хн-Рив-® © о*с-ш-
^>Ж-Ри6-®
М-формилглицин
амидинрибонуклеотид
О^ ^МН-Риб-®
Глицинамид-
рибонуклеотид
ноос
^
♦ II сн
Ь-Асл
СНу-СООН
^н-мн. +'
^ ^-*
сн,-соон
сн-н
I
-НИ
соон
-с^и кн
~>НРиб-® ^
Рибонуклеотид-5-амино-
имидазол-4-карбоновой
кислоты
I!
н.н'Ч/
сн
чРиб-©
5- Аминоимидазол-4- N -сукцино-
карбоксамидрибонуклеотид
^>, сн-соон
М
соон
о
•I
сн ■*■
н,о
о
II
Риб-®
Инозиновая
кислот (И МФ)
©
Фумаровая
/Сх N тгфк ^онр-тгФК^^ N кислота
н>
^Ы-Риб-®
5-Формамидоимидазол-
-4-карбоксамидрибонуклеотид
н^-" ^к-Риб-®
5-Аминоимидазол—4-кар-
боксамидрибонуклеотид
Рис. 6.1. Процесс синтеза инозиновой кислоты (7 — пирофосфокиназа;
2 — 5-фосфорибозил-1 -пирос|хюфатамидотрансфераза; 3 — фосфо-
рибозилглицин-амидсинтетаза; 4— глицинамидрибонуклеотидтрансформидаза;
5— формилглицинамидинрибонуклеотидамидолигаза; 6— амидоимидазол-
рибонуклеотидсинтетаза; 7— аминоимидазолрибонуклеотидкарбоксилаза;
5— аминоимидазол-Ы-су1щинокарбоксамидрибонуклео^
9—аденилосукдинатлиаза; /0—аминоимидазол-4-карбокса-
мидрибонуклеотид-трансформилаза; // —инозиниказа)
226
Глава 6. Метаболические процессы
На следующей стадии замыкается пятичленное имидазольное
кольцо и образуется 5-аминоимидазолрибонуклеотид, который
способен акцептировать С02 с образованием рибонуклеотида 5-аминои-
мидазол-4-карбоновой кислоты.
В последующем двухступенчатом процессе, в котором участвуют ас-
парагиновая кислота и АТФ, образуется 5-аминоимидазол-4-карбокса-
мид-рибонуклеотид и освобождается фумаровая кислота. В этих
реакциях азот аспарагиновой кислоты включается в I -е положение будущего
пуринового ядра. Последний углеродный атом пиримидинового остатка
кольца пурина вводится в виде формильного остатка, который
присоединяется к 5-ЫН2-фуппе. После этого отщепляется молекула воды и второе
кольцо замыкается. В результате образуется первый пуриновый нуклео-
тид — инозиновая кислота (ИМФ), которая является предшественником
пуриновых нуклеотидов в составе нуклеиновых кислот.
АМФ и ГМФ образуются из ИМФ, причем в синтезе обоих мононук-
леотидов участвуют по два фермента, отличающихся по механизму
действия. Образование ГМФ из ИМФ катализируют ИМФ-дегидрогеназа и
ГМФ-синтетаза, а образование АМФ из того же предшественника
катализируется последовательным действием аденилосукцинатсинтетазы и аде-
нилосукцинатлиазы. Механизм двухэтапного синтеза АМФ и ГМФ можно
представить в виде нескольких ферментативных реакций (рис. 6.2).
В ферментативном синтезе АМФ из ИМФ принимает участие аспа-
рагиновая кислота, являющаяся донором ЫН2-группы, и ГТФ в качестве
источника энергии. Промежуточным продуктом реакции является адени-
лоянтарная кислота. Биосинтез ГМФ, напротив, начинается с дегидроге-
назной реакции ИМФ с образованием ксантозиловой кислоты; в амини-
ровании последней используется только амидный азот глутамина.
Превращение АМФ и ГМФ в соответствующие нуклеозидди-
и нуклеозидтрифосфаты также протекает в 2 стадии при участии ки-
наз (нуклеозидмонофосфаткиназа и нуклеозиддифосфаткиназа).
В клетках синтез пуриновых нуклеотидов регулируется
конечными продуктами ферментативных реакций по принципу обратной
связи. Регуляторное действие оказывается на фермент,
катализирующий первую стадию процесса — перенос аминогруппы глутамина
на 5-фосфорибозил-1-пирофосфат. При этом проявляется аллосте-
рический механизм регуляции. Кроме того, избыток ГМФ в клетках
оказывает аллостерическое торможение только на свой собственный
синтез, не влияя на синтез АМФ, и, наоборот, накопление АМФ
подавляет свой синтез, не ингибируя синтеза ГМФ.
227
Биохимия животных
НАД*
н2о
нлдн+наИ
V
©
о
«ЛЛ\ _
^Г^г/риб ®
Инозиновая
кислота (ИМФ)
соон
СН-СН.-СООН
ГТФ^ I мна Асп
Мв^
Л+ГДФ
А
о
Ксантиловая кислота
АТФ
©
СООН
сн-сн,-соон
->^Ь- н,ы -ос-с^-с^-сн-соон
м«*
РР, +АМФ*->|
I 2
©
Глн
N.
КН,
НООС-СН,-СН2-СН-СООН
Глу
"'"^Л^б-®
ГМФ
Аденилоянтарная
кислота
I СО-СООН
® Г^йн-сн-соон
\ Фумаровая
кислота
\
Риб-®
АМФ
«^
Рис. 6.2. Реакции синтеза ГМФ и АМФ (1-ИМФ-дегидрогеназа,
2-аденилсукцинатсинтетаза, 3-ГМФ-синтетаза, 4-аденилсукцинатлиаза)
Синтез пиримидинов начинается с ферментативных реакций, в
которых субстратами являются С02,1^Н3 и аспартат (рис. 6.3). Процесс
инициируется карбамоилфосфатсинтетазой, катализирующей
образование карбамоилфосфата из глутамина. Далее карбамоилфосфат
реагирует с аспартатом с образованием М-карбамоиласпарагиновой
кислоты. Последняя подвергается циклизации с отщеплением молекулы
воды, при этом образуется дигидрооротовая кислота, которая в
дальнейшем подвергается дегидрированию, превращаясь в оротовую
кислоту. Последняя обратимо реагирует с 5-фосфорибозил-1-пиро-
фосфатом с образованием оротидин-5'-фосфата, декарбоксилирова-
ние которого приводит к образованию пиримидинового нуклеоткда —
уридин-5-фосфата.
228
Глава 6. Метаболические процессы
о
х .
2|
у
I?
^•6
?!
I
I I
Ю
О
о
I
5
С
5
и
5
* 5
ев ЕС
2<А
229
Биохимия животных
Превращение уридин-5-фосфата в УДФ и УТФ осуществляется
в фосфотрансферазных реакциях:
УМФ + АТФ -> УДФ + АДФ;
УДФ + АТФ-» УТФ + АДФ.
Предшественником цитидиловых нуклеотидов служит УТФ,
который превращается в ЦТФ:
м82+
УТФ + Глутамин + АТФ -> ЦТФ + Глутаминовая кислота + АДФ + Фн.
ЦТФ-синтетаза
Образовавшаяся ЦТФ может ингибировать активность аспартат-
карбамоилтрансферазы, проявляя аллостерический тип ингибирова-
ния, реализуя механизм ингибирования по типу обратной связи.
Таким образом, осуществляется контроль за активностью
фермента лимитирующей стадии процесса синтеза пиримидиновых
нуклеотидов.
6.1.2. Распад нуклеиновых кислот
Полимерные молекулы нуклеиновых кислот расщепляются в
тканях животных при участии специализированных ферментов — нуклеаз.
Различают эндо- и экзонуклеазы. Эндонуклеазы расщепляют
внутренние межнуклеотидные связи, а экзонуклеазы катализируют реакции
гидролиза, в результате которых отщепляются концевые нуклеотиды от
ДНК и РНК. В результате действия нуклеаз нуклеиновые кислоты
распадаются до рибо- и дезоксирибонуклеозид-3'- и 5'-фосфатов.
В дальнейшем пуриновые нуклеозиды (аденозин и гуанозин)
расщепляются ферментативными системами до молочной кислоты,
которая у большинства млекопитающих, птиц и некоторых рептилий
является конечным продуктом обмена пуринов и выводится из
организма с мочей (рис. 6.4).
Ключевым ферментом в превращении пуринов является ксанти-
ноксидаза, катализирующая реакции последовательного окисления
гипоксантина и ксантина до мочевой кислоты. В составе фермента —
ионы железа и молибдена. В качестве кофермента в реакциях
участвует ФАД.
Фермент содержит два независимых каталитических центра.
Молибден (Мо6+) входит в состав центра связывания восстановленных
230
Глава 6. Метаболические процессы
субстратов и в процессе ферментативной реакции восстанавливается
до Мо5+ и Мо4+. Электрон переносится на элекроннодонорный фла-
виновый центр непосредственно или при участии железосеросодер-
жащего фрагмента. При этом центром связывания кислорода служит
участок расположения ФАД.
Субстратами фермента могут быть различные пурины, птерины и
альдегиды.
Ксантин является продуктом расщепления аденозина и гуанозина,
которые образовались при гидролизе нуклеиновых кислот. Оба нук-
леозида подвергаются ферментативному распаду в организме
животных до мочевой кислоты. Расщепление аденозина до ксантина
вначале протекает при участии аденозиндезаминазы и нуклеозидазы,
которые последовательно катализируют реакции дезаминирования
и дегидратации. Продуктами этих реакций является инозин и гипок-
сантин. Последний окисляется до ксантина в реакции,
катализируемой ксантиноксидазой.
Превращение гуанозина осуществляется при участии нуклеозидазы,
гидролизующей его до гуанина. В результате реакции от нуклеозида
отщепляется остаток рибозы. Затем гуанин гидролизуется в ксантин в
реакции, катализируемой гуаниндезаминазой. Окисление ксантина до
мочевой кислоты протекает в присутствии ксантиноксидазы.
Таким образом, ксантиноксидаза является ферментом,
катализирующим процесс последовательного окисления гипоксантина до
мочевой кислоты, промежуточным продуктом которого служит ксантин.
У некоторых млекопитающих и рептилий мочевая кислота
расщепляется до аллантоина, а у рыб до аллантоиновой кислоты и
мочевины. Реакции катализируются специализированными ферментами
как показано на рис. 6.4.
Пиримидиновые нуклеотиды также расщепляются при участии
ферментативных систем. Конечными продуктами каталитических
реакций являются С02, ТМз, мочевина, р-аланин и р-аминомасляная
кислота (рис. 6.5).
Реакции протекают последовательно. Вначале цитозин после
дезаминирования превращается в уридин. Затем происходит
раскрытие кольца в продуктах ферментативных реакций урацила и тимина.
В результате образуется карбамоилпировиноградная кислота, гидро-
лизующаяся до С02,1ЧН3, р-аланина. Продукты разложения пирими-
динов могут выводиться из организма или повторно метаболизиро-
ваться в других метаболических процессах.
231
Биохимия животных
N4,
I
о=с соон
NN
'-^н-
Рибозо-1
ГМ-рибоза
рибоза
он н2о н,оа о
Пшоксантин
Ксантин
н2о+о, ^1
Н.О.И
©
NНI
I
-ын
Алантоиновая
кислота
©
о
N4 N4
СО, О,
©
ын
Н1Ч' ~ "
>°
Алантоин
Мочевая кислота
©
2Н,0
V0
NН2
!
2С= О
I
Глиоксиловая
Мочевина кислота
I
СООН
Рис. 6.4. Процесс распада аденозина и гуанозина: 7 — аденозиндезаминаза;
2 — нуклеозидфосфорилаза; 3 — гуаниндезаминаза; 4 — ксантиноксидаза;
5 — уриказа; б — аллантоиназа
232
Глава 6. Метаболические процессы
ын, о
Рибоза Рибоза
Цитидин
Уридин
Н,Р04 1 / н1(
Рибозо-1-ф " ч
Рибоза
О
И
I II
о*с% „сн
лн
Урадил
А
Н*+ НАДФ-^
НАДФ^И
©
О
. II
нм*С^
о=с ^сн,
ын
>
Дигидроураиил
соон
0^=С у
X»
*н
N -карбамоилпрол ионовая
кислота
О
НЛ^^-СН,
°</
Дезоксирибоза
Тимидин
Н^^Ц Н,Р04
® 1Г ®
2 -Дсзокси
рибоза
Л*.
-Дезокси-
рнбоэо-!-©
О
II
ш^^с-сн.
I II '
о=с хсн
?чн
Тимин
©
► НАДФ + Н*
*НАДФ*
Н1ч\^СН—СН,
О^ „СН,
Дигидротимин
0 I— н,о
соон
Н^ ЧСН-СН,
о^*.' сн,
Лн
М-карбамоилизомасляная
кислота
р-Аланин
Рис. 6.5. Процесс распада пиримидинов: / — цитидиндезаминаза;
2 — уридинфосфорилаза; 3 — уридиннуклеозидаза;
4 — тимидинфосфорилаза; 5 — дигидроурацилдегидрогеназа;
6 — дигидропиримидиназа
233
Биохимия животных
6.1.3. Биосинтез ДНК
5' 3'
Запаздывающая
цепь
Рис. 6.6. Репликация ДНК
Процесс синтеза ДНК (репликация) осуществляется путем ее
удвоения. Для инициирования процесса синтеза необходим небольшой
участок ДНК, используемый в качестве затравки при ее синтезе (праймер).
На начальном этапе активизируются ферменты, расплетающие
двойную спираль ДНК (хеликазы) и удерживающие ее одиночные
цепи от воссоединения, а затем ферменты, устраняющие суперспи-
рализацию ДНК, разрывая одну из цепей ДНК — это свивелазы.
Благодаря чему делается возможным раскрывание этой цепи с
последующим замыканием разрыва.
234
Глава 6. Метаболические процессы
После этого синтез одной дочерней цепи происходит в
направлении 5'->3' и осуществляется непрерывно, в то время как синтез
второй цепи в направлении 3'->5' происходит прерывисто путем
соединения коротких фрагментов, называемых фрагментами Оказаки,
синтезируемых в противоположном направлении (рис. 6.6).
Фрагменты Оказаки представляют собой небольшие участки нуклеоти-
дов, образующиеся на обеих цепях матричной ДНК в процессе ее
синтеза, размером в 1000...2000 нуклеотидов, которые с течением
времени укрупняются, образуя непрерывные дочерние цепи ДНК.
Наличие фрагментов Оказаки указывает на то, что синтез ДНК происходит
прерывисто, отдельными участками.
6.1.4. Биосинтез РНК
Транскрипция. Процесс синтеза пре-РНК путем переписывания
информации с ДН К называется транскрипцией (отангл. ггапзспргюп —
переписывание). Транскрипция, осуществляется с помощью различных
РНК-полимераз. В эукариотической клетке присутствуют четыре
вида РНК-полимераз: РНК-полимеразы I, II, III, которые
располагаются в ядре клетки, и одна — в митохондриях. РНК-полимераза I
отвечает за синтез рибосомных 183, 283 и 5,85 РНК. Рибосомальная
55 РНК и транспортные РНК синтезируются РНК-полимеразой III,
а РНК-пол имераза II осуществляет синтез предшественников м РНК.
В структуре ДНК выявляются особые регуляторные элементы,
названные энхансерамиу в присутствии которых резко возрастает
скорость транскрипции; при этом энхансеры проявляют активность
независимо от ориентации и положения относительно гена, т. е. они
могут быть перед геном, внутри или за ним. Индукция генов может
осуществляться с помощью гормонов (стероиды), которые в составе
комплекса с белком рецептором способны связываться с регулятор-
ной последовательностью ДНК, что сопровождается
активированием процесса транскрипции.
Ингибирование процесса транскрипции осуществляется белком-
репрессором за счет его специфического связывания с регуляторным
участком в структуре ДНК или РНК. Этот процесс называется
репрессией генов.
Процессингисплайсинг. Процессформированиязрелыхмолекул РНК
(транспортной (тРНК), матричной (мРНК), рибосомальной (рРНК))
из неактивного предшественника (пре-РНК) в эукариотической клетке
называется процессингом или посттранскрипционной модификацией.
235
Биохимия животных
В результате процессинга происходят следующие действия:
отрезание «лишних» концевых последовательностей, расщепление длинных
первичных транскриптов, вырезание их них участков,
транскрибированных с интронов, добавление нуклеозидов к З'-концу трачскрипта,
добавление нуклеотидов к 5'-концу транскрипта, модификация
оснований в транскрипте. При этом конечным этапом процессинга
является метилирование мРНК, в результате которого на каждые 400
остатков аденинов приходится один остаток 6-метиладенина. Процессинг
завершается тем, что функционально активная мРНК в виде нуклеоп-
ротеидного комплекса, в составе которого набор белков-информофе-
ров, покидает ядро клетки через поры в ядерной мембране, поступая в
цитоплазму для трансляции.
Конечным этапом процессинга является процесс, называемый
сплайсингом, в течение которого происходит формирование функционально
активной мРНК из пре-РНК. В процессе сплайсинга происходит
вырезание из первичного транскрипта пре-РНК интронных
(вставочных) участков, с последующим соединением участков, которые
называются экзонами.
При этом экзонами являются участки в структуре ДНК и пре-РНК,
несущие генетическую информацию о структуре белка и чередующиеся с
нитронами. В процессе сплайсинга интронные участки вырезаются, а эк-
зоны сшиваются между собой, образуя функционально активную мРНК.
Считывание информации с мРНК происходит на рибосоме, обеспечивая
упорядоченный синтез полинуклеотидной цепочки белка.
Сплайсинг протекает на сплайсосоме, которая является
специализированной внутриядерной многокомпонентной структурой,
включающей десятки белков и набор малых ядерных РНК.
Синтезированная в процессе транскрипции РНК называется
матричной (информационной) РНК и содержит точную копию
генетической информации, закодированной в определенном участке ДНК. При
этом информация в дальнейшем реализуется в упорядоченном
синтезе полипептидной цепочки, в которой определяется количественный
и качественный состав аминокислот, а также последовательность их
связывания в первичной структуре белка. Эта информация
закодирована в мРНК в виде кодонов (триплетов), которые представляют три
последовательно связанные между собой остатки нуклеотидов. Вся
совокупность триплетов, передающих информацию о 20 аминокислотных
остатках, которые будут упорядоченно включены в структуру
полипептидной цепи, называется генетическим кодом.
236
Глава 6. Метаболические процессы
6.1.5. Функции нуклеиновых кислот
Дезоксирнбонуклеиновая кислота. Основным местом нахождения ДНК
в клетках является ядро и митохондрии. На ДНК возлагаются следующие
функции: I) хранение и участие в передаче информации о всех белках,
которые должны быть синтезированы в клетке; 2) содержание
информации об индивидуальных свойствах и проявлениях признаков организма;
3) быть основным элементом в передаче информации при
воспроизводстве организмов; 4) участие в передаче информации во время деления
клеток; 5) определение индивидуальных свойств клеток различных органов и
тканей; 6) содержание информации о структуре клетки и клеточных орга-
неллах; 7) через управляемый синтез белков (ферментов) регулирование
протекания ферментативных реакций в клетке, метаболических и
функциональных процессов; 8) быть основным элементом управления клеток;
9) определять время жизни соматической клетки.
Рибонуклеиновые кислоты. тРНК выполняет следующие функции:
1) обеспечивает специфическое связывание с аминоацил-тРНК-син-
тетазой и последующее связывание аминокислот согласно
информации антикодона; 2) осуществляет перенос аминокислоты к месту
синтеза белка; 3) участвует в процессе распознавания кодона мРНК
и синтезе полипептидной цепочки на рибосомах, т. е. обеспечивает
специфическое присоединение каждой аминокислоты к растущей
полипептидной цепочке.
мРНК участвует в следующих процессах: I) инициирует
формирование функционально активной структуры рибосомы; 2) согласно
данных кодона производит избирательное связывание аминоацил-
тРНК в аминоацильном участке рибосомы; 3) обеспечивает
избирательное связывание аминокислот в полипептидной цепочке согласно
информации, записанной в кодоне.
рРНК осуществляет контроль за процессом синтеза
полипептидной цепочки на рибосоме.
6.2. МЕТАБОЛИЗМ БЕЛКОВ
6.2.1. Биосинтез полипептидной цепочки белка
на рибосоме
Процесс перевода информации, заложенной в
последовательности нуклеотидов мРНК, в последовательность
аминокислотных остатков полипептидной цепи называется трансляция (от англ.
(гапзШоп — перевод). На включение в белок каждой аминокислоты
237
Биохимия животных
расходуется энергия четырех высокоэнергетических связей (одной
молекулы АТФ на стадии синтеза аминоацил-тРНК и трех молекул
ГТФ — на стадиях связывания аминоацил-тРНК и трансляции). В
процессе трансляции принимают участие все три вида РНК. Причем,
если в матричной РНК информация записана в виде кодонов
(триплетов), т. е. трех последовательно связанных нуклеотидов, то для
считывания этой информации используется транспортная РНК.
Тогда как проверяет правильность считывания закодированной
информации рибосомальная РНК. При этом транспортная РНК
представляет из себя небольшие последовательности (75-90) мононук-
леотидов, содержащие антикодон из 3-х последовательно связанных
между собой нуклеотидов, комплиментарный кодонудля
аминокислоты в информационной РНК, расположенный в тРНК в месте
локализации антикодоновой петли, недалеко от вариабельной петли
(рис. 6.7). Функция тРНК состоит в том, чтобы транспортировать
аминокислоты к рибосоме и вставлять их в определенные участки
полипептидной цепи при ее биосинтезе, переводя
последовательность нуклеотидов в кодоне мРНК в последовательность
аминокислотных остатков первичной структуры белка (рис. 6.8).
Генетический код для аминокислот является вырожденным, так
как некоторые аминокислоты закодированы 2-6 кодонами (табл. 6.1).
Исключение представляют триптофан и метионин, имеющие по
одному кодону.
Всего имеется 64 кодона три из которых не кодируют никакой
аминокислоты; УАГ, УАА и УГА — обозначают конец матрицы: на этих
триплетах обрывается дальнейшее наращивание пептидной цепи —
терминирующие триплеты.
Терминирующие кодоны узнаются специфическими белками —
факторами терминации. Надежность распознавания этих триплетов
не высока и поэтому терминирующий триплет иногда может
прочитываться как кодон аминокислоты. Из-за этого терминирующие
кодоны обычно дублируются. При этом первым обычно располагается
кодон УАА, а уже за ним на близком расстоянии следует один из
запасных терминирующих триплетов (УАГ или УГА).
Код в основном одинаков у всех животных организмов от вирусов
до человека. В этом проявляется его универсальность,
свидетельствующая о древности его происхождения и консервативности. Сходство
кода у разных организмов является доказательством того, что все
живые организмы в процессе эволюции произошли от единого предка.
238
Глава 6. Метаболические процессы
3"
ОН
5р-
Участок
связывания
аминокислот
Акцепторный
стебель
Вариабельная
петля
Антикодоновая
петля
Антикодон
Рис. 6.7. Структура «клеверного листа» тРНК (Овчинников, 1987)
Процессы синтеза ДНК, РНК и белков практически одинаковы
у всех живых организмов. Поэтому в основе эволюции организмов
были заложены механизмы образования новых генов,
обусловливающих синтез различных функциональных белков, отличающихся по
структуре и функциям. Это способствовало появлению
разнообразных живых организмов на нашей планете.
Всего 20 разновидностей аминокислот могут быть включены в
первичную структуру белка. Радикалы этих аминокислот проявляют
гидрофобные, полярные незаряженные и заряженные (положительно и
239
Биохимия животных
отрицательно) свойства. В полярной среде белки приобретают
устойчивую структуру, при этом заряженные аминокислотные остатки
располагаются на поверхности белковой глобулы. Тогда как полярные и
гидрофобные аминокислотные остатки обращены преимущественно
во внутрь белка. Таким образом, сформированный белок приобретает
функциональную активность. Причем поверхностные
аминокислотные остатки несут информацию о клетке, реализация которой
обеспечивает их упорядоченное в ней расположение и функционирование.
&Ъ@Ъ0*&@Ъ@*Ъ0№@^ ДН|С
Рис. 6.8. Общая схема биосинтеза белка (Спирин, 1986)
Функционально активным белок становится в процессе фолдинга,
после завершения которого белки приобретают способность
выполнять специализированные функции. При этом только небольшая
группа аминокислот, расположенных на поверхности белковой
глобулы, способна участвовать в функциональном действии белка.
240
Глава 6. Метаболические процессы
Таблица 6.1
Генетический код
[
У
ц
А
Г
м
1 у
УУУ -ч
Фен
УУС ^
УУА Л
1 Лей
УУГ ^
ЦУУ >
ЦУЦ
ЦУА
ЦУГ ^
АУУ -
АУЦ
АУА ^
АУГ
ГУУ ч
ГУЦ
ГУА
ГУГ*-'
1
Лей
Иле
1
Мет
Вал
1 ц
УЦУ>
УВД
УЦА
УЦГ^
ЦЦУ>|
ЦВД
ЦЦА
ццгУ
АЦУЛ
АЦЦ
АЦА
АЦГУ
пщ
ГЦА
ГЦГ '
Сер
Про
Тре
Ала
1
А
УАУ ч
Тир
УАЦ ^
УАА Л
Терм
УАГ ^
ЦАУ Л
Гис
ЦАЦ^
ЦААЛ
Глн
ЦАТ-^
ААУ Л
Асн
ААЦ^
ААА Л
Лиз
ААГ ^
ГАУ >
Асп
ГАЦ ^
ГАА Л
Глу |
ГАГ ^ 1
Г
УГУ ч
Цис
УГЦ ^
УГА Терм
УГТ Три
ЦГУ ^
ЦГЦ
ЦГА
цгт ;
Арг
АГУ Л
Сер
АГЦ ^
АГАЛ
Арг
АГТ^
ГТУ ч
гтц
ГГА
ГГГ '
Гли
У
ц
А
Г
У
ц
А
Г
У
ц
А
Г
У
ц
А
Г 1
Биосинтез белка представляет собой циклический
энергозависимый многоступенчатый процесс, протекающий с участием мРНК,
тРНК, рибосомы и различных инициирующих факторов. Вначале
процесса происходит активирование аминокислот, а затем при
наличии мРНК формирование функционально активной рибосомы.
Процесс завершается образованием полипептидной цепочки, в составе
которой количественный и качественный состав аминокислот будет
определять индивидуальное строение будущего белка, его
функциональные возможности и место локализации в структуре клеток.
Активирование аминокислот. Этот этап сопровождается
присоединением аминокислоты, предназначенной для включения в состав
полипептидной цепочки, к соответствующей тРНК. Процесс ката-
241
Биохимия животных
лизируют специализированные ферменты — аминоацил-тРНК-син-
тетазы. Ферменты обладают высокой специфичностью как к
аминокислоте, так и к соответствующей тРНК.
Процесс ацилирования аминокислот протекает в цитоплазме клетки в
две стадии. Сначала происходит образование аминоациладенилата. При
этом карбоксильная группа аминокислоты связывается ангидридной
связью с 5'-фосфатной группой АМФ с выделением пирофосфата. Затем
происходит перенос аминоацильного остатка на специфическую тРНК,
с образованием сложноэфирной связи между карбоксильной группой
аминокислоты и З'-ОН-группой концевого аденозинового остатка тРН К.
Таким образом, результатом реакции этерификации является
образование соответствующих аминоацил-тРНК, способных участвовать
в процессе синтеза полипептидной цепочки.
Трансляция. Матричный синтез белка в протекает с участием
рибосомы. В результате этого процесса осуществляется перевод информации,
заложенной в последовательности нуклеотидов мРНК, в
последовательность аминокислотных остатков полипептидной цепи. Трансляция
протекает в три этапа: инициация (начало процесса), элонгация (развитие
процесса) и терминация (окончание процесса).
При наличии мРНК, которые поступают из ядра в цитоплазму
через ядерные поры, происходит сборка рибосом. Началом синтеза
белка является присутствие в составе мРНК концевых триплетов АУГ
или ГУ Г. Инициатором процесса служит метионил-тРНК, которая
реагирует с факторами инициации е1Р-5, е1Р-2, е1Р-3, с 405-субчас-
тица рибосом и мРНК.
Процесс инициации протекает следующим образом.
Инициирующий фактор е!Р-3 соединяется с малой субчастицей рибосомы (405),
а фактор е1Р-2 соединяется с ГТФ. Затем к комплексу е1Р-2-ГТФ
присоединяется метионил-тРНК. В дальнейшем к комплексу е1Р-2-ГТФ
присоединяется 405-субчастицас е1Р-3. В результате образуется
комплекс 408-е1Р-3-ГТФ- е!Р-2-метионил-тРНК. К этому комплексу
присоединяется мРНК своим 5'-концом при участии е1Р-5. Завершается
процесс сборки рибосомы присоединением большой субчастицы
рибосомы (603), что сопровождается высвобождением факторов
инициации, а также ГДФ и НзР(Х После этого факторы инициации могут
быть использованы для инициации синтеза новых рибосом.
Синтез пептидов в митохондриях и хлоропластах протекает с
участием формилметионил-тРНК. Начало элонгации характеризуется
тем, что в Р-участке рибосомы находится метионил-тРНК. При этом
242
Глава 6. Метаболические процессы
А-участок свободен и в нем находится следующий кодон мРНК.
Поэтому вновь поступающая аминоацил-тРНК имеет антикодон,
соответствующий кодону мРНК в А-участке. Для осуществления
распознавания и связывания аминоацил-тРНК в А-участке требуется ГТФ и
фактор элонгации (ЕР-1). Специфичность связывания очередной ами-
ноацил-тРНК в А-участке осуществляется благодаря соответствия ко-
дона мРНК к антикодону тРНК. После этого происходит образование
пептидной связи в пептидил-трансферазном центре большой
субчастицы рибосомы, которая формируется в результате взаимодействия
аминогруппы с вновь поступившей в рибосому аминокислоты с
карбоксилом предыдущей аминокислоты. Реакция катализируется пепти-
дилтрансферазой, входящей в состав большой субчастицы рибосомы.
После образования пептидной связи осуществляется передвижение
(транслокация) м РН К в рибосоме на один кодон. В этом действии
участвует фактор инициации (ЕР-2) и расходуется энергия молекулы ГТФ.
В результате транслокации мРНК перемещается на один триплет,
а дипептидил-тРНК поступает в Р-участок, вытесняя инициаторную
метионил-тРНК. При этом в А-участок встает следующий кодон.
Процесс повторяется при наличии следующей аминоацил-тРНК.
Считывание информации с мРНК идет в направлении 5'->3' полинуклео-
тидной цепочки, а полипептидная цепь растет от 1М-конца к С-концу.
Элонгация завершается при наличии в структуре мРНК одного
из терминальных кодонов (УАА, УАГ или УГА). В терминации
участвует белковый фактор (еКР), который присоединяется к
терминирующим ко до нам, блокируя дальнейший рост полипептидной цепи.
еЯР способен распознавать все три терминирующих кодона, которые
совместно с белковым фактором способны инициировать активность
пептидилтрансферазы. Фермент катализирует реакцию гидролиза,
прекращая рост полипептидной цепочки. В результате происходит
отделение полипептида от рибосомы и освобождение молекул тРНК и
мРНК. Последняя подвергается распаду до свободных нуклеотидов в
течение нескольких часов или суток. Свободная рибосома
диссоциирует на субчастицы, которые при наличии новой мРНК может быть
использованы для реассоциации новой рибосомы.
Матричная РНК может транслироваться одновременно
несколькими рибосомами, располагающихся близко друг к другу. Такая
ассоциация рибосом получила название полисома.
Следует рассмотреть некоторые особенности протекания процесса
биосинтеза белка. Прежде всего следует отметить, что начало трансля-
243
биохимия животных
ции мРНК (инициация) не совпадаете началом полинуклеотидной
цепочки МРНК. Это обусловлено наличием в структуре мРНК эукариот
5'-концевых нетранслируемых последовательностей. Трансляция
информации, закодированной в мРНК, начинается с первого 5'-конца ме-
тионинового кодона, которым является триплет АУГ. Однако это
происходит только в том случае, если этот триплет находится в окружении
двух нуклеотидов (А или Г), а непосредственно за ним должен
следовать нуклеотид Г. Кроме того, на процесс инициации могут оказывать
влияние также нуклеотиды, находящиеся в других положениях вблизи
инициирующего кодона. Если первый триплет (АУГ) мРНК находится
не в оптимальном контексте, то он пропускается и инициация
начинается со следующего триплета (АУГ). При этом на процесс инициации
оказывает влияние наличие кэп-структуры на 5'-конце мРНК и поли
(А)последовательности на противоположном конце полинуклеотида.
При этом кэп-структура и поли(А)последовательности должны быть
узнаваемы специфическими белками, участвующими в процессе
инициации. Поэтому инициация транскрипции может начинаться двумя
способами. Путем кэп-сканирования, когда мРНК просматривается с
начала для поиска кодона АУГ, находящегося в оптимальном контексте,
или за счет непосредственного узнавания в структуре мРНК
внутреннего кодона АУГ, называемой внутренней инициацией. Для
осуществления последнего механизма требуются особые клеточные белки.
Участие мРНК в процессе трансляции зависит еще и от присутствия
в составе полинуклеотида кэп-структуры или наличия в 5'-нетрансли-
руемой области кодонов АУГ, в контексте неоптимальном для
инициации. Кроме того, на активность мРНК в процессе трансляции могут
оказывать действие специфические регуляторные белки или регуля-
торные РНК (малые РНК). Эти белки и РНК способны связываться со
специфическими последовательностями или структурами в мРНК,
изменяя общую пространственную структуру мРНК и за счет этого,
препятствуя процессу инициации. Такие конформационные перестройки
структуры РНК могут создавать трудности в связывании
инициирующего кодона и 5'-конца мРНК с белоксинтезирующим аппаратом.
6.2.2. Фолдинг
Фолдинг — это процесс сворачивания полипептидной цепи в
функционально активный белок, формирование которого происходит после
завершения биосинтеза полипептида на рибосоме в
специализированных образованиях. В результате фолдинга в водных растворах у водора-
244
Глава 6. Метаболические процессы
створимого полипептида уменьшается свободная энергия,
гидрофобные остатки аминокислот упаковываются преимущественно вовнутрь
молекулы, а гидрофильные остатки располагаются на поверхности
белковой глобулы. Фолдинг в клетках эукариот обеспечивается
специфическими белками, называемыми шаперонами, которые необходимы
для эффективного формирования третичной структуры
полипептидных цепей других белков, но не входят в состав конечной белковой
структуры. Новосинтезированные белки после выхода с рибосом для
правильного функционирования должны укладываться в стабильные
трехмерные структуры и оставаться такими на протяжении всей
функциональной жизни клетки. При этом шаперонами являются белки
про- и эукариотических клеток, управляющие процессом правильной
нековалентной укладки полипептидной цепи или полипептидсодер-
жащих структур ш У1уо в упорядоченные третичные структуры. В
эукариотических клетках местом синтеза шаперонов являются строма
хлоропластов и матрикс митохондрий. Шапероны осуществляют
транспортировку полипептидов от эндоплазматического ретикулума
к субклеточным частицам, обеспечивая проход полипептида через
мембраны, а затем принимают участие в упорядоченной его укладке и
сборке. Шапероны обладают сродством к экспонированным
гидрофобным участкам полипептидной цепи. Связывание белка с шаперонами
препятствует его агрегации с другими белками и тем самым создает
условия для нормального сворачивания растущего полипептида. Действие
шаперона сопровождается гидролизом АТФ, т. е. энергетически
затратно. Количество шаперонов может резко возрастать под влиянием
стрессов, таких кактепловой шок, химические воздействия, УФ
облучение. В связи с этим шаперонами называют белки теплового шока
(Н$р — Ьеа18!ге88-рго1ет). При этом они выполняют функцию
защиты белков клетки от денатурации. Шапероны обнаружены у
различных бактерий, дрожжей, высших растений и животных.
Различают одну группу шаперонов с молекулярной массой от 70 до 100 кДа
(ЬзрбО, Н$р70, Ь5р90) и вторую группу шаперонов с 800 кДа, имеющих
сложную олигомерную (четвертичную) структуру и называемых ша-
перонинами. Белки — представители семейства Ь$р70 — связываются
на начальной фазе образования растущего пептида. Одни из них
контролируют процесс сворачивания белка в цитоплазме, другие участвуют
в переносе белков в митохондрии. Белки Ь$р60 охватывают
синтезированный полипептид наподобие бочонка, тем самым обеспечивая
условия для принятия правильной конформации.
245
Биохимия животных
Таким образом, в клетках живых организмов биосинтез белков
осуществляется на специализированных органеллах — рибосомах. При
этом носителем информации о качественном и количественном
составе аминокислот, а также последовательности их связывания в
первичной структуре белка является ДНК, с которой эта информация
передается на различные типы РНК (рРНК, тРНК и мРНК) и затем
реализуется в синтезе упорядоченной полипептидной цепочки,
сворачивание которой в глобулу происходит в специализированных
образованиях с затратой энергии. В результате фолдинга клетка
получает функционально активный белок.
6.2.3. Протеолиз
Процесс гидролитического разрушения нативной структуры белков
до аминокислот называется протеолизом. Большинство
внутриклеточных белков заканчивают существование в результате протеолитического
гидролиза, превращаются в небольшие пептиды и свободные
аминокислоты, которые утилизируются под действием ферментов митохондрий
или включаются в первичные структуры новых белков на рибосомах.
Многие протеолитические ферменты используют в качестве субстратов
индивидуальные белки. Имеется множество протеиназ широкой
субстратной специфичности, чья неразборчивость в субстратах
компенсируется их строгой компартментализацией. Они локализованы в лизосо-
мах и вакуолях, где гидролизуют любые белки после их попадания в эти
органеллы. Такая компартментализация протеолитических ферментов
является жизненно важным условием существования клетки. Система
протеолитической деградации внутриклеточных белков с участием про-
теосом и убиквитина отличается от вышеописанных систем тем, что,
обладая широкой субстратной специфичностью, она безопасна для
окружающих белков и реагирует на регуляторные воздействия. Протеолиз
является упорядоченным процессом, в реализации которого
принимают участие множество клеточных протеаз, в частности, убиквитин.
Убиквитин-зависимая система протеолиза проводит поиск
потенциальной мишени для протеолитической деградации среди
внутриклеточных белков. Белки несут специфические сигналы деградации
по аналогии с сигнальными последовательностями, которые
направляют вновь синтезируемые белки к определенным микрокомпартмен-
там клетки. Сигналы протеолитической деградации более сложные и
разнообразные, так как с их помощью не только маркируются белки,
удаляемые с помощью протеолиза, но и определяется время удаления
246
Глава 6. Метаболические процессы
и скорость их протеолитического расщепления. Для распознавания и
декодирования таких сигналов в клетках эукариот имеется убиквитин-
конъюгирующая система. Как в ядре, так и в цитоплазме эта система
отделена пространственно и функционально от протеолитических
ферментов, организованных в протеасомы. Распознанные данной
системой белки-субстраты маркируются путем ковалентного
присоединения к ним молекул стабильного 76-звенного белка — убиквитина.
Убиквитин соединяется С-концом с боковыми остатками лизина
в субстрате. Наличие такой метки в белке является первичным
сигналом сортировки, направляющей образовавшиеся конъюгаты к протеа-
сомам. В большинстве случаев к субстрату присоединяется несколько
молекул убиквитина, которые организованы в виде бусинок на нитке.
Молекулы белков, содержащие убиквитин, по-видимому, являются для
протеасом предпочтительными субстратами. Конъюгацию убиквитина
с субстратом можно представить следующим образом. Убиквитин-ак-
тивирующий фермент (Е]> связывает убиквитин, гидролизует АТФ и
образует тиоэфирную связь между АМФ и убиквитином с
последующим переносом молекулы убиквитина на один из своих остатков цис-
теина. Молекула активированного убиквитина далее соединяется с
одним из ферментов семейства убиквитин-коньюгирующих ферментов
(Е2) и часто вслед за этим — с убиквитин-лиазой (Е3). Процесс
конъюгации убиквитина с субстратом может катализироваться как самим
Е2, так и Е2 совместно с Е3. Белки Е2 и Е3 в клетках существуют в виде
больших семейств, члены которых различаются по свойствам и
внутриклеточной локализации. Мутации в генах семейства Е2 у дрожжей
показывают, что в ДНК-репарацию, прохождение клеточного цикла,
биогенез пероксисом, в обеспечение устойчивости к тепловому шоку
и ионам кадмия вовлечены разнообразные ферменты. Некоторые из
ферментов Е2 способны образовывать между собой гетеродимеры,
которые в сочетании с белками Е3 обеспечивают весь репертуар
субстратных специфичностей убиквитин-конъюгирующих комплексов.
6.2.4. Функции белков
Белки в организме животных способны выполнять следующие
функции: 1) каталитическая, осуществляется ферментами,
ускоряющими протекание химических реакций; 2) транспортная, переносит
нерастворимые в воде гидрофобные соединения (липопротеиды) или
кислород (миоглобин и гемоглобин); 3) структурно-механическая,
выполняется белками, входящими в состав мембран клеток (протеогли-
247
Биохимия животных
каны); 4) регуляторная, выполняется гормонами, которые регулируют
протекание различных метаболических процессов; 5) сократительная,
способность к механическим действиям (белки мышц); 6) защитная,
обеспечивается белками, входящими в состав ДНК (нуклеопротеиды),
и иммуноглобулинами. Кроме этого, белки участвуют в процессе
свертывания крови, обеспечивают активный трансмембранный потенциал,
входят в состав костной и соединительной ткани.
6.3. МЕТАБОЛИЗМ АМИНОКИСЛОТ
6.3.1. Механизмы транспорта аминокислот через мембраны
За счет активного кровоснабжения из крови через мембрану
эпителиальных клеток путем диффузии и активного транспорта
аминокислоты поступают в клетки различных органов и тканей. Основным
элементом этого активного транспорта является у-глутаминтрансфераза
(I) (рис. 6.9). Фермент локализуется в структуре мембраны,
осуществляя перенос аминокислот с внешней стороны мембраны в клетку.
Посредником в этом процессе служит глутатион, в составе которого
три аминокислотных остатка (глутаминовая кислота, цистеин и
глицин). ГГТ катализирует перенос аминокислоты через мембрану,
одновременно связывая ее с остатком глутаминовой кислоты, и, таким
образом, образуя два дипептида. В составе одного остаток
переносимой аминокислоты и остаток глутаминовой кислоты, а другим ди-
пептидом является цистеинил-глицин, в составе которого уже только
два аминокислотных остатка глутатиона. Цистеинил-глицин под
действием дипептидазы (2) расщепляется до глицина и цистеина, тогда
как дипептид с аминокислотой претерпевает следующие
превращения. у-Глутамилциклотрансфераза (3) расщепляет пептидную связь,
освобождая аминокислоту, а остаток глутаминовой кислоты
высвобождается в виде 5-оксипролина. После этого 5-оксопролиназа (4)
превращает 5-оксипролин в глутаминовую кислоту, расщепляя одну
из связей цикла. Для протекания этой реакции требуется молекула
АТФ. Затем у-глутамилцистеинсинтетаза (5) путем присоединения
к глутаминовой кислоте цистеина синтезирует дипептид у-глутамил-
цистеин. Реакция протекает с потреблением энергии АТФ. На
завершающем этапе глутатионсинтетаза (6) присоединяет глицин к у-глу-
тамил-цистеину, в результате вновь синтезируется глутатион, который
способен принять участие в транспорте новой аминокислоты.
248
Глава 6. Метаболические процессы
а
о
•е-
о
X
се
■§
о
2! « В
о &Е
Т X О
О Св -г
511
§ в р
X ^ 5
*-5
о
5** 5 с;
«и со
II.
8*
С
I
249
Биохимия животных
6.3.2. Участие аминокислот
в реакциях транс- и дезаминирования
Впервые процесс трансаминирования был открыт российским
ученым А. Е. Браунштейном, который показал, что реакции
катализируются трансаминазами (КФ 2.6.1), осуществляющими перенос
аминогруппы с аминокислоты на кетокислоту.
К-СН(Ш2)СООН + К'СОСООН -> КСОСООН + К'-СН(Ш2)СООН
Аминокислоты, превращающиеся в реакциях трансаминирования
в соответствующие кетокислоты, могут быть субстратами ферментов
цикла трикарбоновых кислот. Кроме того, процесс
трансаминирования играет роль в протекании цикла мочевины с участием аспартата.
Коферментом аминотрансфераз служит пиридоксаль-5'-фосфат.
Пиридоксалъ-5'-фосфат
Высокое содержание трансаминаз отмечается в тканях печени,
сердца, скелетных мышцах, почках животных. Реакции
трансаминирования играют ключевую роль в промежуточном метаболизме,
обеспечивая синтез и разрушение аминокислот в живых клетках.
Так, например, аминокислоты глутаминовая, аспарагиновая и ала-
нин превращаются в соответствующие а-кетокислоты, являются
компонентами цикла трикарбоновых кислот и могут служить
источниками энергии.
Наиболее изученными среди аминотрансфераз являются аспартат-
и аланинаминотрансферазы. Пространственное расположение
полипептидной цепи и аминокислотных остатков в области активного
центра аспартатаминотрансферазы показаны на рис. 6.10.
Полипептидная цепь белка содержит 412 аминокислотных остатков, а
молекулярная масса фермента равна 46 кДа.
250
Глава 6. Метаболические процессы
Большой домен
Малый домен
Большой домен
Рис. 6.10. Схема строения аспартатаминотрансферазы (Овчинников, 1987)
251
Биохимия животных
НООС -СН2-СН-СООН+НООС-СН2-СН2-С-СООН 5=*
Ш2 О
Аспарагиновая кислота а-Кетоглутаровая кислота
НООС-СН2-С-СООН+НООС-СН2-СН2-С-СООН
О NН2
Щавелевоуксусная кислота Глутаминовая кислота
Аланинаминотрансфераза способна обратимо катализировать
следующую реакцию:
СНз-СН-СООН+НООС -СН2-СН2-С-СООНг^
I I
ин2 о
Алании а-Кетоглутаровая кислота
СН з-С-СООШ-НООС-СН 2-СН 2-С-СООН
о ш2
Пировиноградная кислота Глутаминовая кислота
Процесс трансаминирования включает межмолекулярный
перенос аминофуппы с донорной а-аминокислоты на акцептор а-кето-
кислоту без промежуточного образования аммония.
Активность трансаминаз проявляется только тогда, когда
альдегидная группа пиридоксальфосфата образует связь с г-аминогруппой
остатка лизина-258 активного центра фермента (1), который
замещается аминокислотой, вступающей в реакцию (рис. 6.11). В результате
образуется промежуточное соединение (основание шиффа) (2),
подвергающееся внутримолекулярному превращению (3, 4),
завершающемуся освобождением а-кетокислоты и пиридоксаминфосфата (5).
Последний на втором этапе реагирует с другой а-кетокислотой и
через повторение тех же стадий, но только в обратном направлении,
завершает каталитический цикл реакций. Процесс трансаминирования
завершается синтезом новой аминокислоты и освобождением
пиридоксальфосфата.
252
Глава 6» Метаболические процессы
Ьуз-258
+
©
О-
(7><
О
I
(СН,)4
0
•Чс^"
о-пйс
о-
©
"ООС—С-Л
сн,
у—си,
н
N
СОО~
г5н,-с-н
® "ООС^С-Л
0-о^Ч>
о-ойс
о-
1ч" ^сн.
I '
н
Рис. 6.11. Процесс трансаминирования
253
Биохимия животных
В результате реакции образуются новые амино- и кетокислоты.
Катализировать протекание такого типа реакций могут следующие
ферменты: аспартатаминотрансфераза (КФ 2.6.1.1), аланинаминотран-
сфераза (КФ 2.6.1.2), цистеинаминотрансфераза (КФ 2.6.1.3), глицина-
минотрансфераза (КФ 2.6.1.4) и др.
Кроме того, аминокислоты способны вступать в реакции дезами-
нирования, которые протекают при участии ферментов,
отщепляющих от аминокислот аминогруппы:
1) восстановительное дезаминирование
К-СН(Г^Н2)СООН + Н+ -► К-СН2СООН + 1МН3;
2) гидролитические дезаминирование
К-СН(ЫН2)СООН + Н20 -► К-СН(ОН)СООН + NНз;
3) внутримолекулярное дезаминирование
К-СН2-СН(1\1Н2)СООН -> К-СН=СН-СООН + 1МН3;
4) окислительное дезаминирование
К-СН(ЫН2)СООН + 1/202 -► Л-СО-СООН + NN3.
Также аминокислоты способны превращаться в ферментативных
реакциях декарбоксилирования, сопровождающихся отщеплением
С02 от аминокислоты с последующим образованием аминов
К-СН(МН2)СООН -> К-СН2-]МН2 + С02
Реакции декарбоксилирования аминокислот катализируются
ферментами, относящимися к классу лиаз (КФ 4), подклассу углерод —
углерод лиазы (КФ 4.1), подподклассу карбокси-лиазы (КФ 4.1.1);
например, пируваткарбоксилаза, оксалатдекарбоксилаза, оксалоаце-
татдекарбоксилаза, ацетоацетатдекарбоксилаза и т. д.
6.3.3. Реакции восстановительного аминирования
Ключевыми реакциями в биосинтезе всех аминокислот служат
реакции восстановительного аминирования. Примером может служить
254
Глава 6. Метаболические процессы
реакция с участием глутаматдегидрогеназы, которая в качестве ко-
фермента может использовать НАДН или НАДФН.
НООС-СН2-СН2-СО-СООН + 1ЧН4+ + НАДН ->
НООС-СН2-СН2-СН(NН2)-СООН + Н20 + НАД'
Образовавшаяся глутаминовая кислота служит субстратом в
реакциях трансаминирования а-кетокислот. Кроме того, глутаминовая
кислота может быть использована для связывания еще одной
молекулы аммиака по следующей реакции (реакцию катализирует глута-
минсинтетаза):
НООС-СН2-СН2-СН(ЫН2)-СООН + ЫН3 + АТФ ->
Глутаминовая кислота
Ш2-СО-СН2-СН2-СН(ЫН2)-СООН + АДФ + Фн
Глутамин
В реакциях связывания молекулы аммиака может быть
использован глутамин, служащий донором аминогруппы в реакции
образования карбамоилфосфата, которую катализирует карбамоилфосфатсин-
таза (аммиак).
6.3.4. Орнитиновый цикл
Синтез мочевины в организме животных осуществляется в
основном в процессе, который называется орнитиновый цикл (рис. 6.12).
Продуктами цикла являются карбамоилфосфат, цитруллин, аргини-
носукцинат, аргинин, мочевина и орнитин. Наиболее активно
процесс протекает в печени. Основной стадией орнитинового цикла
является реакция образования карбамоилфосфата.
Наибольшее значение в синтезе карбамоилфосфата имеет
реакция, катализируемая карбамоилфосфатсинтетазой, которая является
лимитирующей в процессах синтеза мочевины.
1ЧН3 + С02 + АТФ -> NN2-00-0-0 + АДО
255
Биохимия животных
2 2 ,
а"*
СН-МН,
/боон
/ Орнитин
0=< V/
Мочевина
Н20 \
МН-СН--СН.
I '
НМ^С-Ш, 9Н1
СН-1ЧН
Аргинин
НООС-СН
сн-соон
Фумарат
НК-СН^СН,
сн2
СН-МН2
СООН
Цитруллин
Н^-СН-СООН
/ сн,-соон
АТФ
Чдф+р=
Аспартат
НМ-С-МН
нооЧн соон
ноос-сн2
Аргининосукиинат
Рис. 6.12. Реакции синтеза мочевины ворнитиновом цикле:
/ — орнитинкарбамоилтрансфераза; 2 — аргининосукцинатсинтетаза;
3 — аргининосукцинатлиаза; 4 — аргиназа
Карбамоилфосфат в основном синтезируется в митохондриях.
Процессы синтеза мочевины сопряжены с образованием аргинина
в орнитиновом цикле, который начинается с переноса карбамоиль-
ной группы с карбамоилфосфата на орнитин, в результате
образуется цитруллин. Реакция катализируется орнитинкарбамоилтранс-
феразой (1).
Затем в реакции с цитруллином участвует аспарагиновая кислота,
аминогруппа которой конденсируется с его карбамоильной группой.
Реакция протекает в присутствии АТФ и катализируется аргинино-
сукцинатсинтетазой (2). В результате реакции образуется
аргининосукиинат, который под действием аргининосукцинатлиазы (3)
обратимо расщепляется на аргинин и фумаровую кислоту. Последняя
служит промежуточным субстратом ферментов цикла три карбон о-
вых кислот.
256
Глава 6. Метаболические процессы
В случае активности аргиназы (4) аргинин расщепляется на орни-
тин и мочевину. При этом орнитин может вновь участвовать в
циклическом процессе.
Мочевина выводится с мочой, являясь главным конечным
продуктом белкового обмена в организме человека и животных.
6.3.5. Функции аминокислот
В организме животных аминокислоты используются в процессах
синтеза белков, пептидов. Аминокислоты входят в состав гормонов
белковой природы. Так, например, белками являются пепсин, глюка-
гон, паратгормон, а пептидами — окситоцин, вазопрессин, кальцито-
нин и др. Кроме того, глицин и аспарагиновая кислота входят в состав
пуриновых и пиримидиновых оснований соответственно. Из
аминокислот образуются функционально активные соединения. Так,
например, предшественником серотонина и мелатонина является
триптофан, гистамина — гистидин, катехоламинов (ДОФА, адреналин,
норадреналин) — фенилаланин, тироксина и трийодтиронина —
тирозин, креатинфосфата — глицин и т. д. Участие аминокислот в
процессах окисления в цикле трикарбоновых кислот обеспечивает
энергетические потребности организма.
В молоке КРС присутствуют аминокислоты, которые способны
поддерживать постоянство рН, придают вкусовые свойства молоку.
Так, например, слегка сладким вкусом обладают аланин, серии,
треонин, сладкий вкус присущ глицину, валину, пролину, слегка горький —
аргинину, метионину, лейцину, фенилаланину, горький — изолейцину,
триптофану, гистидину, лизину, вкус мясного бульона — у аспарагино-
вой и глутаминовой кислот.
6.4. МЕТАБОЛИЗМ УГЛЕВОДОВ
Активное кровоснабжение органов и тканей обеспечивает
поступление в клетки значительного количества углеводов, которые способны
быстро метаболизироваться, обеспечивая их пластические и
энергетические потребности. Так, окисление углеводов в клетках обеспечивает
накопление в них АТФ. Основными метаболическими процессами,
в которых происходит превращение углеводов, являются гликолиз,
ПДК, цикл трикарбоновых кислот, окислительное фосфорилирова-
ние, пентозофосфатный путь (рис. 6.13). Причем последний
обеспечивает клетки в НАДФН, который затем используется в процессе
257
Биохимия животных
синтеза стероидов. В реакциях пентозофосфатного цикла образуются
несколько различных пентоз (рибулоза, рибоза, ксилулоза), которые
входят в состав нуклеиновых кислот, тогда как образуемые в пенто-
зофосфатном цикле триозы могут быть использованы в процессах
синтеза триацилглицеринов и фосфолипидов. Углеводы могут
участвовать в реакциях гликозилирования функциональных белков,
обеспечивая их взаимодействие с мембранами.
Метаболизм
углеводов
Анаболические
процессы
Гликогенез,
гликонеогенез,
пентозофосфатный
путь превращения
углеводов
Катаболические
процессы
Гликогенолиз,
гликолиз,
ПДК,
ЦТК,
окислительное
фосфорилирование
Рис. 6.13. Основные метаболические
процессы синтеза и окисления углеводов
В клетках молочной железы происходит синтез лактозы. Причем
этот дисахарид в других клетках животного организма не встречается.
6.4.1. Гликолиз
Гликолиз — это процесс анаэробного расщепления глюкозы до
двух молекул молочной кислоты; катализируется одиннадцатью
ферментами (рис. 6.14). Местом локализации ферментов является
цитоплазма клетки, в процессе гликолиза образуется АТФ.
258
Глава 6. Метаболические процессы
Первой ферментативной реакцией гликолиза является фосфори-
лирование, сопровождаемое переносом остатка фосфорной кислоты
с АТФ на глюкозу. Реакция катализируется ферментом гексокиназой
(1) (Кт ~ I " Ю"5 М)- Реакция протекает в присутствии М§2+ или Мп2\
которые, связываясь с АТФ, образуют активные комплексы.
Ингибиторами фермента могут быть соединения, содержащие сульфидные
группы, глюкозо-6-фосфат.
Гексокиназа способна также катализировать фосфорилирование
Э-фруктозы, О-маннозы.
Второй реакцией гликолиза является изомеризация глюкозы-6-фос-
фата во фруктозу-6-фосфат, которая катализируется ферментом глюкозо-
6-фосфат-изомеразой (2). Эта реакция легко обратима, так как гл юкозо-6-
фосфат и фруктозо-6-фосфат обладают высоким сродстюм к ферменту.
Третья реакция катализируется ферментом фосфофруктокина-
зой (3), которая осуществляет фосфорилирование фруктозы-6-фос-
фата во фруктозу-1,6-дифосфат. Реакция практически необратима,
протекает в присутствии ионов магния и является лимитирующей
реакцией гликолиза. Кроме АТФ донорами остатков фосфорной
кислоты могут быть УТФ и ЦТФ.
Ингибиторами фосфофруктокиназы могут быть АТФ и цитрат,
а АДФ, АМФ и фруктозо-2,6-дифосфат — активаторы фермента.
Действие эффекторов позволяет регулировать скорость протекания
гликолиза, активируя процесс при недостатке АТФ в клетке,
сопровождаемые накоплением АДФ и АМФ. Последние активируют
гликолиз, ускоряя его протекание и обеспечивая накопление АТФ.
Четвертая реакция гликолиза катализируется ферментом альдо-
лазой (4), которая расщепляет фруктозу-1,6-дифосфат на две фос-
фотриозы — фосфодиоксиацетон и 3-фосфоглицериновый альдегид.
Реакция легко обратима при изменении температуры, повышение
которой сдвигает равновесие в сторону образования триозофосфатов.
Молекула фермента состоит из четырех субъединиц (150 кДа). В
активном центре фермента имеются 5Н-группы.
Пятую реакцию гликолиза катализирует триозофосфатизомераза
(5), осуществляющая превращение фосфодиоксиацетона в
3-фосфоглицериновый альдегид.
На этом заканчивается этап расщепления глюкозы до двух фос-
фотриоз, которые в дальнейшем превращаются с участием
окислительно-восстановительных ферментов, обеспечивающих протекание
реакций фосфорилирования АДФ, образование и накопление АТФ.
259
Биохимия животных
СНгОН
н2с-о-ф „гС_0_ф
А°
. он
он
А® ^°
„2с-0-<Е> -А. с-н ^.^ с-о-<Е>
с=о ^=^ нс—он ^ ч **■ нс-он
н2с—он ® н2с—о-ф ® н2с—о-ф
^АЛФ
®&
с-он
I
н—с-он
н,с-о-<Е>
©I
А°
Ао © ло ® /> ®
С—ОН над- надн, С—ОН АТФ ддф С—ОН н/>
н-^-°н н^нТ^- с«о ■* «И» ЗГ н-с-о-<В>
СНз СН, СН2 Н2С-ОН
Рис. 6.14. Расщепление молекулы глюкозы до молочной кислоты
ферментами гликолиза: / — гексокиназа; 2— глюкозо-6-фосфатизомераза;
3 — 6-фосфофруктокиназа; 4 — альдолаза; 5 — триозофосфатизомераза;
6 — глицеральдегидфосфатдегидрогеназа; 7— фосфоглицераткиназа;
8— фосфоглицератмутаза; 9 — енолаза; 10— пируваткиназа;
// — лактатдегидрогеназа
260
Глава 6. Метаболические процессы
В шестой реакции гликолиза 3-фосфоглицериновый альдегид
подвергается фосфорилированию и дегидрированию с участием 3-фос-
фоглицеральдегиддегидрогеназы (6). В реакции принимает участие
НАД и неорганический фосфат. В ходе каталитического процесса на
НАД переносятся атомы водорода, отщепляемые от 3-фосфоглице-
ринового альдегида, при этом образуется тиоэфир, в образовании
которого принимает участие сульфгидрильная группа фермента и
карбоксильная группа субстрата, с образованием производного,
которое называется ацилферментом. Затем ацильная группа
переносится на неорганический фосфат с образованием 1,3-дифосфогли-
церата.
В седьмой реакции, катализируемой фосфоглииераткиназой (7),
остаток фосфорной кислоты в положении 1 от 1,3-дифосфоглицерата
переносится на АДФ с образованием АТФ и 3-фосфоглицериновой
кислоты.
Таким образом, последовательное действие двух ферментов (3- фос-
фоглицеральдегиддегидрогеназы и фосфоглицераткиназы) позволяет
высвободившуюся энергию при окислении 3-фосфоглицеринового
альдегида трансформировать в АТФ.
В восьмой реакции, катализируемой фосфоглюкомутазой (8),
осуществляется перенос остатка фосфорной кислоты из положения 3
в положение 2. При этом 3-фосфоглицериновая кислота
превращается в 2-фосфоглицериновую кислоту. Реакция протекает в
присутствии М%2+ и 2,3-дифосфоглицериновой кислоты.
Девятая реакция катализируется енолазой (9). При этом от 2-фос-
фоглицериновой кислоты отщепляется молекула воды и образуется
2-фосфоенолпировиноградная кислота. Активаторами фермента
могут быть ионы М^2* и Мп2+, а ингибитором — фторид.
Десятая реакция катализируется ферментом пируваткиназой (10)
и сопровождается разрывом высокоэнергетической связи в 2-фосфо-
енолпировиноградной кислоте и переносом остатка фосфорной
кислоты на АДФ, с образованием АТФ и пировиноградной кислоты.
Реакция является практически необратимой. Для ее протекания требуются
ионы М^2* и Мп2+, а ион К+ активирует фермент.
В одиннадцатой реакции происходит восстановление
пировиноградной кислоты до молочной кислоты. Реакция катализируется лак-
татдегидрогеназой (11) с участием НАДН.
Суммарная реакция превращения глюкозы до молочной кислоты
имеет следующий вид:
261
Биохимия животных
Глюкоза (С6Н1206) + 2Фн + 2АДФ + 2НДД+ ->
2СН3-СН(ОН)-СООН + 2АТФ + 2НАДН + 2Н+ + 2Н20
Таким образом, гликолиз является направленным процессом,
в котором происходит расщепление молекулы глюкозы до двух
молекул молочной кислоты. Реакции, катализируемые гексокиназой,
фосфофруктокиназой и пируваткиназой, являются практически
необратимыми. Лимитирующей реакцией гликолиза является реакция,
катализируемая фосфофруктокиназой. Для инициирования
начальных стадий гликолиза расходуется две молекулы АТФ,
обеспечивающих фосфорилирование глюкозы и фруктозо-6-фосфата.
Положительным балансом гликолиза является синтез четырех молекул АТФ,
в реакциях, катализируемых фосфоглицераткиназой и
пируваткиназой. Энергетическая эффективность гликолизасоставляет 2 молекулы
АТФ при расщеплении одной молекулы глюкозы.
6.4.2. Синтез гликогена (гликогенез)
В процессе синтеза гликогена принимают участие несколько
ферментов, использующих энергию АТФ (рис. 6.15). На начальном этапе
глюкоза подвергается фосфорилированию. Реакция протекает с
участием гексокиназы (1). Затем, образовавшийся глюкозо-6-фосфат под
действием фосфоглюкомутазы (2) превращается в глюкозо-1-фосфат,
который вступает в реакцию с УТФ. В результате образуется уридин-
дифосфатглюкоза и пирофосфат. Реакция катализируется глюкозо-1-
фосфатуридилилтрансферазой (УДФ-пирофосфорилаза) (3).
Завершается процесс синтеза гликогена переносом глюкозного остатка
с УДФ-глюкозы на глюкозидную цепь гликогена. Реакция протекает
при участии гликогенсинтазы (4). Высвободившийся УДФ
восстанавливается до УТФ путем реакции фосфорилирования, которая
протекает при участии нуклеозиддифосфаткиназы (5), использующей для
этого молекулу АТФ.
Присоединение глюкозы с образованием а-1,6-связи,
катализируется специализированным гликогенветвящим ферментом (гликозил-
(4->6)-трансфераза).
Таким образом, обеспечивается резервирование углеводов в
мышечной ткани, которые при необходимости могут обеспечить их
энергозатратную работу.
262
Глава 6, Метаболические процессы
АДФ
АТФ
СН.ОРО.Н,
Г
НО\ь^_|/гОН
ОН
©
9н»он ^
Н(\ии^ро»н
ФФн
носн,
сн,он сн,он сн,он
X" Ло^н ^о^н )Хо-к ©
он он он -ч.
АДФ
сн,он сн,он сн,он
. &н Хо^ Хо-№н Хо
1 он он он
Рис. 6.15. Процесс синтеза гликогена: / — гексокиназа; 2— фосфоглюко-
мутаза; .? — УДФ-пирофосфорилаза, 4 — гликогенсинтаза;
5 — нуклеозиддифосфо-киназа
263
Биохимия животных
6.4.3. Распад гликогена (гликогенолиз)
Активная мышечная деятельность потребляет значительные пла-
стическиересурсы, восполнить которые можно за счет
последовательного отщепления от полисахаридной цепочки гликогена по молекуле
глюкозы (рис. 6.16). Процесс инициируется фосфорилазой,
отщепляющей от гликогена фосфорный эфир глюкозы (глюкозо-1 -фосфат).
Инициирующей молекулой этого процесса является цАМФ, которая
включает многокаскадный механизм последовательного фосфорили-
рования протеинкиназы, киназы фосфорилазы и фосфор ил азы.
Образовавшийся в результате распада гликогена
глюкозо-1-фосфат, превращается под действием фосфоглкжомутазы в глюкозо-6-
фосфат. Эта фосфорилированная форма глюкозы в последующем
может при участии ферментов гликолиза, ПДК и ЦТК расщепиться до
С02 и Н20, обеспечив синтез 36 молекул АТФ.
о-к
(глюкоза).
Фосфорилаза
(глюкоза)..,
Н,Р04
о-в
снаон
ГО-РО,Н2
он
глюкоза-1 -фосфат
Рис. 6.16. Реакция распада гликогена
264
Глава 6. Метаболические процессы
6.4.4. Глюконеогенез
Глкжонеогенез — это процесс синтеза глюкозы из неуглеводных
соединений. Метаболитами ферментов глюконеогенеза являются
молочная и пировиноградная кислоты, аминокислоты, глицерол и
другие (рис. 6.17).
с-он с-он
с=о -^—* с=о ^=
1 АТФ АДФ + Ф. |
сн2
ос—он
уР
Н,0
сн3
©
®
с-он
С—О-® ^=^ НС—0-©
(з) I
сн,
-он
©II
,0
с-он
I
НС—ОН
I
н,с
®
о-®
1/АТФ
1й1
н2с-о-® @
с=о =
I
КС-ОН
,р
с-н
I
НС-ОН
н2с-о-(!
Ф.НАД'НАДН,
®
®
о
С-0-®
I
НС—ОН
I ^
н,с—о-®
н2с-о-® Н2С_0_^
он
Н,0
он
ч®
н,с-о-®
о.
СН2ОН
Н,0 ф,
и>9-°^р сн,он
онЧ-—^^он © он
он ' он
Рис. 6.17. Синтез глюкозы из пировиноградной кислоты (гликонеогенез):
/ — пируваткарбоксилаза; 2— фосфоенолпируваткарбоксикиназа;
3—8,10— ферменты гликолиза; 9 — фруктозодифосфатаза;
// — глюкозо-6-фосфатаза
265
Биохимия животных
Ферменты, катализирующие обратимые стадии гликолиза, могут
принимать участие в реакциях глюконеогенсза, тогда как три
необратимые реакции гликолиза катализируются специализированными
ферментами глюконеогенеза.
Первая реакция глюконеогенеза катализируется пируваткарбок-
силазой (1), которая осуществляет присоединение С02 к пировиног-
радной кислоте с образованием оксалоацетата. В реакциях участвует
АТФ, активатором фермента служит ацетил-КоА.
В следующей реакции оксалоацетат подвергается декарбокси-
лированию и фосфорилированию, превращаясь в фосфоенолпиру-
ват. Реакция катализируется фосфоенолпируваткарбоксикиназой (2),
при этом донором фосфатного остатка служит гуанозинтрифосфат
(ГТФ).
При участии ферментов гликолиза фосфоенолпируват
превращается вофруктозо-1,6-дифосфат, который подвергается дефосфорили-
рованию. Эта реакция катализируется ферментом фруктозодифосфа-
тазой (9), при участии которой фруктозо-1,6-дифосфат преобразуется
во фруктозо-6-фосфат. Ингибитором фермента служит АМФ и фрук-
тозо-2,6-дифосфат. Фруктозо-6-фосфатизомераза (10) гликолиза
катализирует реакцию изомеризации, превращая фруктозо-6-фосфат
в глюкозо-6-фосфат. Последний подвергается дефосфорилированию
при участии глюкозо-6-фосфатазы (11) в глюкозу.
Суммарное уравнение реакций глюконеогенеза следующее:
2СН3СОСООН + 4АТФ + 2ГТФ + 2НАДН + 2Н+ + 6Н20 ->
Глюкоза (С6Н,206) + 2НАД+ + 4АДФ + 2ГДФ + 6Фн
Таким образом, в реакциях глюконеогенеза принимают участие
ферменты гликолиза, катализирующие обратимые стадии (енолаза,
глицератмутаза, глицераткиназа, 3-фосфоглицератдегидрогеназа, три-
озофосфатизомераза, альдолаза, глюкозо-6-фосфатизомераза).
Направленность глюконеогенеза определятся ферментами: пируваткар-
боксилазой, фосфоенолпируваткарбоксилазой, фруктодифосфатазой
и глюкозо-6-фосфатазой. Регуляторами глюконеогенеза являются АТФ
и АМФ, а также фруктозо-2,6-дифосфат. Высокие концентрации АТФ
при низком содержании АМФ стимулируют протекание
глюконеогенеза, тогда как повышение в клетке содержания фруктозо-2,6-ди-
фосфата ускоряет протекания гликолиза и понижает скорость глю-
266
Глава 6. Метаболические процессы
конеогенеза, а возрастание содержания фруктозо-2,6-дифосфата
способствует ускорению глюконеогенеза. Лимитирующей
реакцией глюконеогенеза является реакция, катализируемая пируват-
карбоксилазой.
6.4.5. Пентозофосфатный путь превращения
углеводов
Пентозофосфатный путь начинается с окисления глкозо-6-фос-
фата (рис. 6.18). Реакция катализируется ферментом глюкозо-6-фос-
фатдегидрогеназой (1) с участием НАДФ и ионов М§2+ и Мп2+. В
реакции глюкозо-6-фосфат подвергается дегидрированию, превращаясь
в 6-фосфоглюколактон, который гидролизуется при помощи 6-фос-
фоглюконолактоназы (2) в 6-фосфоглюконовую кислоту.
Затем 6-фосфоглюконовая кислота подвергается дегидрированию
и декарбоксилированию при участии фермента 6-фосфоглюконатде-
гидрогеназы (3), в рибулозо-5-фосфат. Реакция протекает при участии
НАДФ. В дальнейшем рибулозо-5-фосфат под действием фермента
фосфопентозоэпимеразы (5) превращается в ксилулозо-5-фосфат или
изомеризуется соответствующей фосфопентозоизомеразой (4) в ри-
бозо-5-фосфат.
На этом окислительные стадии в пентозофосфатном пути
превращения углеводов завершаются и начинается неокислительный этап
пентозофосфатного цикла, ферментами которого являются транске-
толаза и трансальдолаза, катализирующие превращение изомерных
пентозо-5-фосфатов.
Реакции, катализируемые транскетолазой, протекают при участии
тиаминпирофосфата, выполняющего роль переносчика гликоальде-
гидной группы. В реакции с участием ксилулозо-5-фосфата группа
переносится на рибозо-5-фосфат, с участием транскетолазы (6). В
результате ферментативной реакции образуется седогептулозо-7-фос-
фат и 3-фосфоглицериновый альдегид.
В реакции с ксилулозо-5-фосфатом группа переносится на эритрозо-
4-фосфат, с образованием фруктозо-6-фосфата и 3-фосфоглицерино-
вого альдегида.
Трансальдолаза (7) катализирует реакции переноса остатка ди-
оксиацетона от седогептулозо-7-фосфата на
3-фосфоглицериновый альдегид, с образованием эритрозо-4-фосфата и фруктозо-6-
фосфата.
267
Биохимия животных
© Н2С-0-ЧВ
НАДФ* НАДФНа 1 О
не—он
I
НС-ОН
н2с—о-®
н2с-он
с=о
I
НС—ОН НО-СН
I I
НС-ОН НС—ОН
н2с-о-® н2с-о-® нс—он
НС—ОН
I
Н2С-ОН
с=о с=о
тпй, НО-СН ® НС-ОН
у I +— I
^- НС—ОН НС—ОН
н2с-о-© н2с-о-©
нс*=о
I
НС—ОН
н2с-о-ЧВ н2с-о-©
НС—О
НС-ОН
I
НС-ОН
I
нс—он
I
Рис. 6.18. Пентозофосфатный путь окисления углеводов:
/ — глюкозо-6-фосфатдегидрогеназа; 2— 6-фосфоглюколактоназа;
3— 6-фосфоглюконатдегидрогеназа; 4 — пентозофосфатизомераза;
5 — пентозофосфатэпимераза; 6 — транскетолаза; 7—трансальдолаза;
8 — транскетолаза; 9 — триозофосфатизомераза; 10 — альдолаза;
/У — фруктозо-1,6-дифосфатаза; 12— глюкозофосфатизомераза
Суммарное уравнение пентозофосфатного пути окисления
углеводов можно представить в следующем виде:
6(Г-6-Ф) + 7(Н20) + 12(НАДФ+) -►
5(Г-6-Ф) +6(С02) + Фн+ 12(НАДФН2)
268
Глава 6. Метаболические процессы
Таким образом, реакции ПФП протекают в цитоплазме клетки.
Окислительный этап ПФП завершается восстановлением двух
молекул НАДФ+, которые в дальнейшем могут принять участие в
реакциях синтеза липидов (биосинтез жирных кислот, холестерина и
др.). Наличие схожих промежуточных продуктов ПФП и гликолиза
позволяет предположить, что эти процессы способны взаимно
дополнять друг друга и регулировать скорость протекания. Продукты
ПФП могут служить пластическим материалом при формировании
биогенных молекул (нуклеотидов). У животных активность
ферментов ПФП возрастает в печени, надпочечниках, эмбриональной ткани
и в молочной железе в период лактации. Лимитирующей
ферментативной реакцией ПФП является реакция, катализируемая глюкозо-
6-фосфатдегидрогеназой. Ферменты ПФП совместно с ферментами
гликолиза способствуют взаимному превращению трех-, четырех-,
пяти-, шести-, семиуглеродных углеводов путем обратимого
переноса двух- или трехуглеродных остатков (гликольальдегидных или
диоксиацетоновых групп), осуществляемого с участием транскето-
лазы и трансальдолазы.
6.4.6. Пируватдегидрогеназный комплекс (ПДК)
ПДК — это группа ферментов, катализирующих реакции
окисления пировиноградной кислоты до ацетил-КоА (рис. 6.19). В составе
мультиферментного комплекса пируватдегидрогеназа (1)
катализирует реакцию декарбоксилирования пирувата. В этой реакции из пи-
рувата образуется оксиэтильное (СНЗ-СНОН-) производное,
связанное с тиаминпирофосфатом (ТПФ), который в виде оксиэтил-ТПФ
связывается в активном центре фермента.
На втором этапе оксиэтильная группа переносится на один из
атомов серы циклической дисульфидной группы липоевой кислоты,
которая ковалентно связана в активном центре дигидролипоилтран-
сацетилазы (2). Перенос оксиэтильной группы от ТПФ на липоевую
кислоту сопровождается восстановлением липоевой кислоты. При
этом оксиэтильная группа превращается в ацетильную (СН3СО-)
с восстановлением одного из атомов серы липоевой кислоты в дити-
оловую форму.
На третьем этапе ацетильная группа переносится с липоиловой
группы дигидролипоилтрансацетилазы (3) ктиоловой группе ЗНКоА.
При этом, образовавшийся ацетил-КоА (СН3-СО-5КоА) отделяется
от ферментативного комплекса.
269
Биохимия животных
Гликолиз
т
соон О
I <?о,
С=0-?г-^ Н,С — СН-ТПФ
I ТПФ
сн3
з з и—ь снз
0 ^Г^^Ч© ©1*
зн зн
НЗКоА
// II
(СН2)4 — С Н3С—С—ЗКоА
I
цтк
Рис. 6.19. Механизм действия ферментов пируватдегидрогеназного
комплекса: / — пируватдегирогеназа; 2 — дигидролипоилацетилтрансфераза;
3 — дигидролипоилдегидрогеназа
На четвертом этапе происходит регенерация окисленной формы
липоамина, катализируемая дигидролипоилдегидрогеназой,
содержащей в активном центре ковалентно связанный ФАД, выполняющий
роль акцептора атомов водорода, переходя в восстановленную форму
ФАДН2- Процесс завершается окислением ФАДН2 за счет НАД+,
который восстанавливается в НАДН, регенерируя ФАД. Суммарное
уравнение реакций ПДК следующее:
СНз-СО-СООН + НАД+ + Н5КоА ->
СН3-СО-5КоА + НАДН + Н+ + С02
Таким образом, в действии ПДК принимают участие три фермента
(пируватдегидрогеназа, дигидролипоилтрансацетилаза и
дигидролипоилдегидрогеназа). Ферменты ПДК собраны в единый мультифер-
ментный комплекс, в механизме их действия принимают участие
270
Глава 6. Метаболические процессы
пять коферментов (ТПФ, липоевая кислота, Н8КоА, ФАД, НДЦ+),
в составе которых определяются остатки шести витаминов (В,, В2,
В3, РР, В5, Ы). Три кофермента (ТПФ, липоевая кислота, ФАД) кова-
лентно связаны в активных центрах ферментов, выполняя роль про-
стетических групп в каталитических процессах. Дигидролипоилтран-
саиетилаза состоит из 24 субъединиц, каждая субъединица — 36 кДа;
в активном центре фермента имеется ковалентно связанный остаток
липоевой кислоты. Дигидролипоилдегидрогеназа состоит из 12
субъединиц, каждая субъединица по 55 кДа. В активный центр входит
ФАД. Ингибиторами ферментов ПДК являются молекулы АТФ.
Превращение пирувата до ацетил-КоА позволяет обеспечить синтез трех
молекул АТФ (при окислении 1 молекулы НАДН2 в процессе
окислительного фосфорилирования образуется 3 молекулы АТФ).
6.4.7. Цикл трикарбоновых кислот
Ферменты ЦТК локализуются в матриксе митохондрий (рис. 6.20).
Инициирование процесса начинается с реакции, катализируемой цит-
рат-синтазой (1), которая осуществляет перенос ацильного радикала с
ацетила КоА на оксалоацетат, в результате образуется лимонная
кислота (цитрат).
При участии аконитазы (2) осуществляется последовательное
превращение цитрата вначале в цис-аконитовую кислоту, а затем — в изо-
лимонную (изоцитрат). В действии фермента принимает участие Ре2+.
В третьей реакции изоцитрат превращается в а-кетоглутаровую
кислоту. Реакция катализируется изоцитратдегидрогеназой (3), кофермен-
том которой служит НАД\ Для каталитического процесса необходимы
ионы М&2+ или Мп2+. Активность фермента возрастает в присутствии
АДФ и понижается при накоплении АТФ и НАДН.
Четвертую реакцию катализируют ферменты а-кетоглутаратде-
гидрогеназного комплекса (4), осуществляющие окислительное де-
карбоксилирование а-кетоглутаровой кислоты до янтарной кислоты
(сукцинат). а-Кетоглутаратдегидрогеназный комплекс имеет
структуру, аналогичную пируватдегидрогеназному комплексу. Конечным
продуктом реакции является сукцинил-КоА, представляющий
высокоэнергетический тиоэфир, у которого в образовании сложноэфир-
ной связи принимает участие одна из СООН-групп янтарной кислоты.
В действии комплекса принимают участие 5 коферментов (тиаминпи-
рофосфат, липоевая кислота, Н8КоА, НАД* и ФАД).
271
Биохимия животных
В пятой реакции сукцинил-КоА утрачивает свою КоА-группу, при
этом освобождающаяся энергия запасается в фосфатной связи нуклео-
зидтрифосфата. Реакция катализируется ферментом сукцинил-КоА-
синтетазой (5). Энергия запасенная в сукцинил-КоА, переносится на
ГТФ, который отдает фосфор ильную группу АДФ, в результате
синтезируется АТФ:
ф Н2С-СООН
/V ► НО-С-СООН
'* I
н,о нзкоА Н2С—СООН
®
соон
сн ©
II ^-зрг
|" фадн, фад |
СООН СООН
©
СООН
СН2 Н5МСОА
I «+5-Г-
сн, * ^
ГТФ ГТФ+ Ф.
н2с—соон
I
♦• НС—СООН
I
НО—СН-СООН
Г^НАД*
©со^надн,
СООН
I
С=0
I
сн2
сн2
I
СООН
СООН
I
СН
Н8КоА^
сн,
с:
НАД*
НАДН2
0
>о
'8КоА
Рис. 6.20. Превращение ацетил-КоА в матриксе митохондрий
(Цикл трикарбоновых кислот): / — цитратсинтаза; 2— аконитаза;
3— изоцитратлегидрогеназа; 4— а-кетоглутаратдегидрогеназный комплекс;
5—сукцинил-КоА-синтетаза; 6 — сукцинатдегидрогеназа; 7—фумараза;
8— малатдегидрогеназа
272
Глава 6, Метаболические процессы
ГТФ +АДФ -> ГДФ +АТФ
Реакцию катализирует нуклеозиддифосфаткиназа.
Сукцинатдегндрогеназа (6) катализирует шестую реакцию, в которой
осуществляется окисление янтарной кислоты до фумаровой кислоты
(фумарат). Фермент активен в присутствии ФАД, который выступает
в качестве акцептора атомов водорода. СДГ располагается в структуре
внутренней мембраны митохондрий, участвуя в работе дыхательной
цепи, в переносе протонов и электронов от ФАДН2 к кислороду
В седьмой реакции фумаровая кислота подвергается обратимой
гидратации, превращаясь в яблочную кислоту (малат). Реакция
катализируется фумаратгидратазой (7), в составе молекулы фермента
четыре субъединицы с молекулярной массой по 50 кДа, каждая из
которых в отдельности каталитической активностью не обладает.
В восьмой реакции при участии НАД-зависимой малатдегидроге-
назы (8) яблочная кислота подвергается дегидрированию,
превращаясь в щавелевоуксусную кислоту (оксалоацетат), которая может
вступать в новый цикл реакций.
Суммарная реакция цикла трикарбоновых кислот имеет
следующий вид:
СН3СО-КоА + ЗНДД+ + ФАД + ГДФ + Фн + Н20 ->
2С02 + ЗНАДН + ФАДН2 + ГТФ + 2Н+ + КоА
Таким образом, превращение ацетил-КоА в ЦТК начинается с
переноса остатка ацетила с ацетил-КоА на оксалоацетат с образованием
лимонной кислоты, последовательное превращение которой
сопровождается дегидрированием и декарбоксилированием. В результате
двууглеродное производное (ацетил) расщепляется до С02 и Н20.
Цикл завершается образованием четырехуглеродного соединения
(оксалоацетата), который способен участвовать в новом циклическом
процессе. ЦТК выполняет роль основного процесса, в котором
происходит окисление производных ацетил-КоА, конечного продукта
окисления углеводов, жирных кислот и аминокислот. Ферменты ЦТК
располагаются в матриксе митохондрий и катализируют протекание
восьми последовательных энзиматических реакций. Реакции
дегидрирования катализируются 4 ферментами ЦТК (ИЦДГ, аКГДГ, СДГ,
МДГ), в результате протекания этих реакций образуются 3 молекулы
НАДН и одна молекула ФАДН2. Цитрат-синтаза и изоцитратдегид-
273
Биохимия животных
рогеназа катализируют лимитирующие реакции ЦТК. За один цикл
Кребса возможен синтез 12 молекул АТФ. Одна молекула АТФ
синтезируется непосредственно в цикле Кребса (субстратное фосфори-
лирование), а окисление 3 молекул НАДН и одной молекулы ФАДН2
в дыхательной цепи обеспечивает синтез дополнительно 11 молекул
АТФ. Аллостерическим ингибитором цитрат-синтазы служит АТФ,
тогда как АДФ может являться активатором НАД-зависимой изоцит-
ратдегидрогеназы. Через действие нуклеозидфосфатов на ферменты
лимитирующих реакций осуществляется регуляция в целом
активности ферментов ЦТК. При этом накопление АТФ понижает, а
увеличение содержания АДФ активирует ферменты ЦТК.
6.4.8. Окислительное фосфорилирование
Все живые организмы для активного функционирования
нуждаются в энергии, которая накапливается в клетках в виде макроэрги-
ческих (богатых энергией) соединений. К числу таких соединений
относится молекула аденозинтрифосфорной кислоты. Молекулы АТФ
необходимы для протекания в клетках анаболических и катаболичес-
ких процессов. Основным местом синтеза АТФ являются
митохондрии. Процессу синтеза АТФ предшествуют процессы окисления
органических соединений. Энергия, высвобождающаяся в результате
химических реакций окисления, преобразуется в электрохимическую
и в дальнейшем используется для синтеза АТФ.
Процесс образования АТФ сопряжен с транспортом электронов
по цепи переносчиков от НАДН или ФАДН к 02. При этом вначале
происходит окисление восстановленных коферментов и создание
трансмембранного потенциала, обусловленного зарядом
биомембраны протонами (Н+), перенесенными из матрикса в
межмембранное пространство митохондрий. Затем электроны и протоны
переносятся на молекулу кислорода, восстанавливая его до молекулы воды.
Эти окислительно-восстановительные процессы обусловливают
протекание процесса фосфорилирования АДФ с образованием АТФ.
В реакциях окисления участвуют ферменты, располагающиеся во
внутренней мембране митохондрий, использующие в качестве
носителя заряда ион водорода. В результате окислительной реакции
происходит перенос электронов от молекулы-донора к молекуле-акцептору.
При этом совокупность оксидоредуктаз, катализирующих процесс
внутриклеточного дыхания, называют дыхательной цепью.
274
Глава 6. Метаболические процессы
Окислительное фосфорилирование катализируется четырьмя
ферментативными комплексами, расположенными на внутренней
мембране митохондрий (рис. 6.21), структура и механизм действия которых
еще недостаточно изучены. Комплекс I — НАДН: убихинон-оксидо-
редуктаза (ФМН, Ре8); комплекс II — сукцинат: убихинон-оксидо-
редуктаза (ФАД, РеЗ); комплекс III — убихинон: феррицитохром с-
оксидоредуктаза (цит Ь и с, РеЗ), комплекс IV — ферроцитохром
с-кислород-оксидоредуктаза (цит а и а3, Си2+). Цитохромы
располагаются в порядке возрастания окислительно-восстановительного
потенциала. Терминальный цитохром ааЗ (цитохромоксидаза) осуществляет
конечную стадию процесса — перенос восстановительных
эквивалентов на молекулярный кислород.
внутренняя мембрана
Рис. 6.21. Компоненты дыхательной цепи
В состав комплекса I могут входить от 13 до 46 субъединиц, с
общей молекулярной массой 700-980 кДа. Располагается комплекс I в
окружении фосфолипидов мембраны. Содержит в своем составе фла-
вин (ФМН) и более 20 атомов железа, связанных с атомами серы в
виде железо-серных кластеров.
Комплекс II содержит убихинон, гидрофобный хвост которого
погружен в липидный слой мембраны, полярная головка
располагается на поверхности мембраны. Убихинон осуществляет
ступенчатое присоединение электронов и протонов, его полувосстановленная
форма, называется убисемихинон.
275
Биохимия животных
СН,
СН ^ .СН2
си/ *С
+ . —
е
\-н + н +
/п
СН,
н,с-о.
н,с-о'
НзС-О^
н3с-о^
V-
он
1
л
он
•он
6
||
О
^СНз
^к
^сн,
+ Н+ + ё
Комплекс III содержит железо, связанное с атомами серы и про-
топорфирина.
В составе комплекса IV два различных гема и несколько атомов
меди, связанных прочно с белком.
Процесс окислительного фосфорилирования начинается с
присоединения НАДН к комплексу I. Два электрона отщепляются от ко-
фермента и переносятся на убихинон, который связывается с
другим активным центром, расположенным внутри мембраны. При этом
протоны остаются в водной среде межмембранного пространства
митохондрий, а электроны возвращаются на другую молекулу окисли-
276
Глава 6, Метаболические процессы
теля. В результате на мембране возникает трансмембранный
потенциал. При этом комплекс I осуществляет постоянную регенерацию
окисленной формы НАД+, которая необходима для протекания ката-
болических процессов углеводов, липидов, аминокислот и других
соединений.
Восстановленный убихинон отдает электроны на атом железа гема
цитохромас. Процесс катализируется комплексом III. В свою очередь
восстановленный цитохром с связывается с комплексом IV. В
завершающей стадии процесса участвует кислород, который акцептирует
электроны и протоны, восстанавливаясь до молекулы воды.
При окислении ФАДН, кофермент связывается с комплексом II,
компоненты которого передают далее электроны по электронтранс-
портному пути на кислород.
Некоторые белки комплексов могут выполнять роль протонных
насосов, приводимых в действие потоком электронов дыхательной
цепи. Энергия, выделяющаяся при переносе электронов, расходуется
на функционирование протонных насосов, обеспечивающих
транспорт протонов из матрикса в межмембранное пространство. В
результате наблюдается избыток протонов на наружной стороне мембраны,
которая приобретает положительный заряд. При этом в матриксе
образуется избыток ОН-, в результате этого внутренняя сторона
мембраны заряжается отрицательно. Такое распределение зарядов
обусловливает возникновение градиента электрического потенциала. При
этом обратный поток протонов по градиенту их концентрации в
сторону матрикса осуществляется АТФ-синтетазным комплексом,
инициируя процесс синтеза АТФ.
По цепи переноса электронов располагаются три протонных
насоса, инициирующих три реакции фосфорилирования, в результате
которых синтезируются три молекулы АТФ. Поэтому в результате
окисления одной молекулы НАДН синтезируется три молекулы АТФ,
а одной молекулы ФАДН — две молекулы АТФ. Уравнения реакций
окислительного фосфорилирования имеет следующий вид:
НАДН -> НАД+ + Н+ + 26
} окисление
ФАДН->ФАД + 2Н+ + 2б
02 + 4Н* + 4ё -> 2Н20} восстановление
АДФ + Фн -> АТФ } фосфорилирование
277
Биохимия животных
6.4.9. Функции углеводов
Углеводы в организме животных выполняют следующие функции:
I) обеспечивают энергетические потребности живых организмов за счет
окисления в различных метаболических процессах: гликолизе, ПДК,
ЦТК, окислительном фосфорилировании; 2) участвуют в протекании
процессов синтеза стероидов за счет образования в пентозофосфат-
ном пути НАДФН; кроме того, в результате реакций пснтозофосфат-
ного цикла превращения углеводов образуются несколько различных
пентоз (рибулоза, рибоза, ксилулоза), которые входят в состав нуклео-
зидов, нуклеотидов и нуклеиновых кислот; образуемые в пентозофос-
фатном цикле триозы могут быть использованы в процессах синтеза
триацилглицеринов, фосфолипидов или быть окисленными до С02 и
воды, обеспечивая энергетические потребности клетки; 3) отложение
углеводов в печени и мышцах в виде полисахарида гликогена
обеспечивает их резервирование в организме; 4) многие углеводы могут
входить в состав функциональных белков в результате реакций гликози-
лирования. Так, например, углеводы, входящие в состав пероксидазы,
способны защитить фермент от инактивируюшего действия свободных
радикалов, образующихся при протекании оксидазных и пероксидаз-
ных реакций, обеспечивают растворимость фермента в полярных
растворителях, обусловливают взаимодействие фермента с мембранами
и за счет этого способствуют встраиванию фермента в определенные
участки мембран органелл и клетки, защищают фермент от инактиви-
рующего действия высоких температур и растворителей; 5) в составе
мембран клеток и клеточных органелл углеводы способны
индивидуализировать их поверхностные структуры, т. е. определяют свойство
мембран и придают отличие внешней стороны мембраны от
внутренней; 6) в составе гормональных рецепторов (гликопротеидов)
обеспечивают избирательность их регуляторного действия; 7) в составе АТФ,
ГТФ, ЦТФ и др., углеводы участвуют в энергетических процессах,
обеспечивая их функциональное действие.
6.5. МЕТАБОЛИЗМ ЛИПИДОВ
В клетках различных органов и тканей осуществляется синтез и
окисление жирных кислот, синтез триацилглицеринов,
фосфолипидов, стероидов и др., которые представляют сумму метаболических
процессов с участием липидов (рис. 6.22). Окисление жирных
кислот в лактоцитах, так же как и углеводов, обеспечивает их энергети-
278
Глава 6, Метаболические процессы
ческие потребности и в первую очередь накопление в клетках АТФ.
Высокое содержание в клетках молочной железы
высокоэнергетических молекул обеспечивает протекание процессов биосинтеза
специализированных белков, в частности, казеина, а также протекание
других анаболических процессов, тогда как синтезированные в клетках
молочной железы жирные кислоты, нейтральные липиды, фосфоли-
пиды, сфинголипиды и стероиды входят в состав жировых шариков.
Метаболизм
липидов
Анаболические
процессы
Катаболические
процессы
Липогенез,
синтез холестерина,
синтез глицерина,
синтез нейтральных
липидов,
синтез фосфолипидов,
синтез сфинголипидов
Липолиз,
окисление нейтральных
липидов,
окисление глицерина,
окисление фосфолипидов,
окисление сфинголипидов,
образование кетоновых тел
Рис. 6.22. Основные метаболические процессы синтеза и окисления липидов
В составе биогенных тканей содержатся жирные кислоты с
четным числом углеродных атомов. Расщепление насыщенных жирных
кислот в организме происходит путем последовательного отщепления
двууглеродных радикалов.
Часть липидов могут откладываться в подкожно-жировом слое,
выполняя рольтеплоизоляторов.
6.5.1. р-Окисление насыщенных жирных кислот (липолиз)
Теория (3-окисления жирных кислот впервые предложена Ф. Кноо-
пом в 1904 году. Окисление насыщенных жирных кислот в клетках про-
279
Биохимия животных
исходит мультиферментным комплексом в матриксе митохондрий. На
начальном этапе осуществляется перенос насыщенной жирной
кислоты в матрикс митохондрии при помощи карнитина (рис. 6.23).
Вначале ацил-КоА-синтетаза (I) катализирует реакцию
присоединения Н5КоА к жирной кислоте, используя АТФ.
Дал ее ацил-КоА присоединяется к карнити ну с образованием ацил-
карнитина при участии цитоплазматической-карнитинацилтрансфе-
разы (2), который переносится через мембраны митохондрий.
В митохондриях митохондриальная карнитинацилтрансфераза (3)
расщепляет ацилкарнитин на составные части (карнитин и жирную
кислоту); реакция протекает при участии Н5КоА.
При этом карнитин переносится в цитоплазму клетки, а
образовавшийся ацил-ЗКоА подвергается окислению.
Вначале ацил-КоА-дегидрогеназа (4) при участии ФАД
катализирует реакцию дегидрирования, отщепляя два атома водорода во 2-ом
и 3-ем положениях от ацил-КоА, превращая его в КоА-эфир
ненасыщенной кислоты.
Затем енол-КоА-гидратаза (3-оксиацил-КоА-гидратаза) (5)
катализирует реакцию обратимой гидратации двойной связи в еноил-КоА,
с образованием 3-оксиацил-КоА, который дегидрируется при участии
3-оксиацил-КоА-дегидрогеназы (6) в 3-оксоацил-КоА.
Ацетил-КоА-ацилтрансфераза (тиолаза) (7) расщепляет 3-оксоа-
цил-КоА, с образованием ацил-КоА и ацетил-КоА. Последний
представляет двууглеродный остаток, производное уксусной кислоты; он
подвергается окислению ферментами цикла трикарбоновых кислот
(цикл Кребса), а образовавшийся новый ацил-КоА вновь способен к
дальнейшему окислению.
За один цикл превращений от ацил-КоА отщепляется по одному
ацетил-КоА, т. е. двууглеродному производному. Процесс
продолжается до тех пор, пока полностью не происходит расщепление ациль-
ного остатка до двууглеродных производных, которые окисляются
ферментами ЦТКдоС02 и Н20.
Таким образом, окисление жирных кислот катализируют ферменты
матрикса митохондрий. В переносе жирных кислот через мембраны
митохондрий участвует карнитин. Ферментативные реакции
окисления насыщенных жирных кислот протекают последовательно, за один
цикл от ацил-КоА отщепляется двууглеродный фрагмент,
расщепление которого до С02 и Н20 осуществляется в дальнейшем ферментами
цикла Кребса. Каждое отщепление двууглеродного фрагмента от жир-
280
Глава 6. Метаболические процессы
к-сн2—сн2-соон
АТФ>,Ь-НЗКоА
Ф. + АДФ-] ф
Я- СН,— СН, - СО- 8КоА
®НВКоА1^(СН>)г-Н-СН2-СН-С11г-СОО-
♦ ОН
(СН,)3-Ы-СН2- СН-СН2- СОО"
о
I
о=с-сн2-сн2-к
Я—СН,—СН,—СО—8КоА
0
фад-ц
ФАДН2*|
К—СН=СН—СО- 8КоА
Н'°Н(5)
К—СН—СН, - СО- 8КоА
I
НО
К— С—СН2— СО-8КоА
II
О
фНЗКоА^ к^со^8Код_
СН3-СО-8КоА
Рис. 6.23. Процесс р-окисления насыщенных жирных кислот: / — ацетил-
КоА-синтетаза; 2— карнитинацилтрансфераза (цитоплазмы);
3 — карнитинацилтрансфераза (митохондрий); 4 — ацил-КоА-
дегидрогеназа; 5— еноил-КоА-гидратаза; 5— 3-оксиаиил-КоА-
дегидрогеназа; 7— тиолаза
281
Биохимия животных
ном кислоты сопровождается синтезом по одной молекулы ФАДН и
НАДН, общее количество которых зависит от числа циклов. Так,
например, окисление молекулы пальмитиновой кислоты повторяется
7 циклов с образованием 8 молекул ацетил-КоА.
При этом, если после одного цикла синтезируется по молекуле ФАДНг
и НАДН, то всего за 7 циклов образуется 7 молекул ФАДН2 и 7 молекул
НАДН. Окисление по одной молекулы ФАДН2 и НАДН обеспечивают
синтез (ФАДН2 — 2 молекул АТФ, НАДН — 3 молекул АТФ) в сумме
35-ти молекул АТФ. В процессе Р-окисления 8 молекул ацетил-КоА
образуется 96 молекул АТФ. Таким образом, всего при окислении одной
молекулы пальмитиновой кислоты синтезируется 131 молекула АТФ.
6.5.2. Синтез насыщенных жирных кислот (липогенез)
Из жирных кислот в молоке больше всего содержатся олеиновая
и пальмитиновая кислоты. Консистенция липидов молока зависит от
состава жирных кислот и соотношения между его жидкими и
твердыми фракциями. В составе молока определено 147 жирных кислот.
Процесс синтеза насыщенных жирных кислот называется липогенез
(рис. 6.24). Это процесс протекает в цитоплазме животных клеток.
Пусковой стадией процесса является реакция, катализируемая ацетил-КоА-
карбоксилазой (1). Этот фермент содержит в качестве простатической
группы биотин. Реакция протекает в два этапа: на первом этапе
происходит карбоксилирование биотина, с образованием карбоксибиотина.
8 реакции участвует АТФ, обеспечивающий направленность процесса.
На втором этапе карбоксилируется ацетил-КоА, с образованием
малонил-КоА. Ацетил-КоА-карбоксилаза катализирует
лимитирующую стадию процесса синтеза жирных кислот. При этом аллостери-
ческим активатором фермента служит цитрат.
Затем при участии АПБ-ацилтрасферазы (2) и АПБ-малонилтранс-
феразы (3) ацильные группы с ацетил-КоА и малонил-КоА
переносятся на АПБ. В составе активных центров обоих ферментов имеются
Н5-группы. Образовавшиеся ацетил-АПБ и малонил-АПБ реагируют
между собой при участии Р-кетоацил-АПБ-синтетазы (4) с
образованием ацетоацетил-АПБ. В ходе реакции происходит декарбоксилиро-
вание малонильного остатка.
В реакции, катализируемой р-кетоацил-АПБ-редуктазой (5),
происходит восстановление ацетоацетил-АПБ, при участии НАДФН,
в р -оксибугирил-АПБ. р-Оксиацил-АПБ-дегидратаза (6) катализирует
реакцию дегидратации р-оксибутирил-АПБвкротонил-АПБ, который
282
Глава 6. Метаболические процессы
Е~ О
О
Л
ЮГ ЫН
А
-(СН2)Г5'
®
СО, Н,0
АТФФ. + АДФ
О
/
Е—О
О
С—(СН2)« 5
С —СН2 —С—ЗКоА
НО
О
\
/
НО
®(1
Н$-АПБ
Н$-КоА
О
Н3С— С—3— АПБ
-СН2—С—3—АПБ
^
Н8-АПБ4
Хсо2 0
* О
I
,-<
Н,С—С — СН2 — С— 3—АПБ
. НАДФН,
>НАДФ4
О
Н,С—СН —СН2 —С—3—АПБ
ОН
©
н2о-|
II
Н,С— СН = СН—С—8—АПБ
НАДФ-4 0 |
" )
Н,С— СН2— СН2 —С—3—АПБ*^
©I*
Н8-АПБ
О
II
к—с-он
Рис. 6.24. Процесс синтеза высших жирных кислот (липогенез):
/ — ацетил-КоА-карбоксилаза, 2 — АПБ-ацетилтрансфераза, 3 — АПБ-
малонилтрансфераза, 4— р-кетоацил-АПБ-синтетаза, 5— р-кетоацил-АПБ-
редуктаза, б — оксиацил-АПБ-дегидратаза, 7—еноил-АПБ-редуктаза,
8—деацилаза
283
Биохимия животных
НАДФН-зависимой еноил-АПБ-редуктазой (7) восстанавливается до
бутирил-АПБ. Цикл может многократно повторяться. Наиболее
вероятным конечным продуктом процесса синтеза жирных кислот может
быть пальмитиновая кислота, которая образуется в результате действия
гидролитической деацилазы (8) на пальмитил-5-АПБ.
Таким образом, синтез насыщенных жирных кислот
преимущественно протекает в цитоплазме клетки. Для синтеза жирных кислот
необходимы АПБ (ацилпереносящий белок) и НАДФН. Реакции синтеза
жирных кислот инициируются АТФ-зависимым ферментом (ацетил-
КоА-карбоксилаза), который катализирует лимитирующую стадию
процесса, используя в качестве простетической группы биотин.
Активаторами ацетил-КоА-карбоксилазы служат цитрат, изоцитрат и а-ке-
тоглутарат.
6.5.3. Синтез глицерина и нейтральных липидов
Процесс синтеза триацилглицеринов протекает в цитоплазме клетки
(рис. 6.25) и начинается реакцией фосфорилирования глицерина,
катализируемой глицеролкиназой (1), в результате которой образуется гли-
церолфосфат. В жировой ткани и в мышцах активность глицеролки-
назы очень низкая, поэтому глицеролфосфат образуется в гликолизе и
гликогенолизе с участием триозофосфатизомеразы (2) и глицеролфос-
фатдегидрогеназы (3), которые катализируют реакции изомеризации
3-фосфоглицеринового альдегида в фосфодиоксиацетон и
восстановление последнего с участием НАДН дофосфоглицерола. В дальнейшем
глицеролфосфат ацилируется двумя молекулами ацил-КоА
(активными формами жирных кислот) с образованием фосфатидной
кислоты. Реакция катализируется глицеролфосфатацилтрансферазой (4).
Фосфатидатфосфатаза (5) катализирует реакцию дефосфорилирования
фосфатидной кислоты, с образованием 1,2-диглицерида, к которому
диглицеридацилтрансфераза (6) присоединяет третий остаток жирной
кислоты. На этом синтез триацилглицеринов завершается.
6.5.4. Биосинтез фосфолипидов
Основные представители фосфолипидов синтезируются в печени,
почке, кишечнике, мышечной ткани и в мозге. К группе
фосфолипидов относятся фосфатидилэтаноламин (кефалин) и фосфатидилхолин
(лецитин), которые имеют схожие пути биосинтеза. Лецитина в
молоке около 1 г/л, а кефалина — 0,5 г/л. Оба фосфолипида входят в
состав жировых шариков.
284
Глава 6. Метаболические процессы
0
н2с-он ^ н2с-он
2 | АТФ АДФ |
нс-он -Ь1- нс-он о
I Мв I II
н,с—он^™"^^ н2с—о—р—он
нс-он о
НАДН,
©
н2с—он
с=о о
Тд)*.—С-5КоА^|
II
н2с-о-р-он
I
он
н2с-о-р-он ,н ]
I
он
2Н$КоЛ <
I
ОН
<3>
о
//
н2с—о-с—к,
I />
нс—о-с—к2
I //°
н,с-о-р-он
он
(I) н'°^ф.
о
К,-С-5Ко,
н2с—о-с—к,
I />
нс—о-с—а2
н2с-он
,А^{©
н2с-о-с—я,
I />
нс—о-с—к2
I ,р
н2с—о—с—к3
Рис. 6.25. Процесс биосинтеза триацилглицеринов: / — глицеролкиназа,
2 — триозофосфатизомераза, 3— глицеролфосфатдегидрогеназа,
4— глицеролфосфатацилтрансфераза, 5 — фосфотидатфосфатаза,
6 — диглииеролацилтрансфераза
285
Биохимия животных
Ж,-СН2-СН2-ОН
АТФО
Мдг* Д ©
АДФ Т О
ЫН3-СН2-СН2-0-Р-ОН
ЦТФ>| он
1 ®
фф„44
йн3-сн2-сн2-0-цдф
ЦМФ
(СН3)з-Ы-СН2-СН2-ОН
АТФМ ^
** Д ® .
АДФ/ 9
(СН,)3-Ы-СН2-СН2-0-Р-ОН
ЦТФч1 ОН
л ®
ффи<*4
(СН,)3-Й-СН2-СН2-0-ЦДФ
о
СН2-0-С-К,
I о
СН-О-С-К
сн2-о-Р-о-сн2-сн2-ын3
он
ык-сн2-сн,-он
сн,-сн-соон
-0-СН2-СН2-М-(СН3)з
он
о о
сн2-о-с-к, ® сн2-о-с-к,
. I ° ЦТФ I О
"7—сн-о-с-к2*7^— сн-о-с-к,
ЦМФ I фф„ I Р
СН2-0-Р-0-СН2-СН-СООН СН2-0-ЦДФ СН2-0-Р>-ОН
он йн2 он
Рис. 6.26. Процесс биосинтеза основных фосфолипидов:
/ — этаноламинкиназа; 2 — холинкиназа;
3 — этаноламинфосфатцитидилтрансфераза; 4 — холинфосфат-
цитидилтрансфераза; 5— этаноламинфосфаттрансфераза; 6—холинфосфат-
трансфсраза; 7— трансметелаза; 8—серинфосфоэтаноламинтрансфераза;
9—фосфатидатцитидилтрансфераза; 10— фосфатидилсеринсинтетаза
286
Глава 6. Метаболические процессы
Процесс синтеза фосфолипидов начинается с реакций фосфор и-
лирования этаноламина и холина (рис. 6.26), которые катализируются
этаноламинкиназой (I) и холинкиназой (2). В результате образуются
фосфоэтаноламин и фосфохолин. Затем при участии этаноламинфос-
фатцитидилтрансферазы (3) и холинфосфатцитидил-трансферазы (4)
осуществляется взаимодействие фосфоэтаноламина и фосфохолина с
цитидилтрифосфатом (ЦТФ) с образованием цитидилдифосфатэта-
ноламина (ЦДФ-этаноламин), цитидилдифосфатхолина (ЦДФ-хо-
лин) и освобождением пирофосфатов (ФФН). В дальнейшем ЦДФ-
этаноламин и ЦДФ-холин, взаимодействуют с 1,2-диглицеридом,
превращаясь в фосфатидилэтаноламин и фосфатидилхолин. Реакции
катализируются этаноламинфосфаттрансферазой (5) и холинфос-
фатрансферазой (6).
Кроме того, фосфатидилхолин может быть получен путем
метилирования фосфатидилэтаноламина. Реакции катализируются трансме-
телазами (7), которые осуществляют последовательный перенос трех
метильных групп с трех молекул 5-аденозилметионина.
Биосинтез фосфатидилсерина может протекать двумя путями.
Первый — в реакции обмена этаноламина на серии, которая
катализируется серинфосфоэтаноламинтрансферазой (8). Второй путь
образования фосфатидилсерина возможен при участии фосфатидной
кислоты, которая реагирует с ЦТФ при участии фосфатидатцитидил-
трансферазы (9) с образованием ЦДФ-диглицерида и пирофосфата.
Затем серии переносится на фосфатидильный остаток с образованием
фосфатидилсерина. Реакция катализируется фосфатидилсеринсин-
тетазой (10).
6.5.5. Биосинтез сфинголипидов
Биосинтез сфинголипидов протекает в цитоплазме клетки (рис. 6.27).
Начальной стадией образования сфинголипидов является реакция,
катализируемая дигидросфингозинсинтетазой (1). В качестве кофермента
принимает участие пиридоксальфосфат. В реакции участвует пальми-
тоил-КоА и серии. При этом в результате реакции остаток пальмитоила
переносится с пальмитоил-КоА на серии, в процессе реакции
происходит декарбоксилирование серина и высвобождение КоА с
образованием дигидросфингозина. На следующей стадии дигидросфингозин
подвергается дегидрированию, при этом с него протоны переносятся
на ФАД с образованием ФАДН2 и сфингозина. Реакция
катализируется дигидросфингозиндегидрогеназой (2).
287
Биохимия животных
но-снг-9н-соон
I мн2
\/^ СН3-(СН2)14-СО-ЗКоА
со^Г©
^-чНЗКоА
СН3-(СН2)14-С-СН-СН2-ОН
НАДФН2- ' " !
НАДФ^И
о ын2
СН3-(СН2)14-СН-9Н-СН2-ОН
|6н йн2
ФАД
ФАДН2
НЗКоА
Р-СО-ЗКоА
(3)
СН3-(СН2)12-СН=СН-СН-СН-СН2-ОН
■сн-сн-
6Н №г
(СН3)3-М-СН2-СН2-0-ЦДФ-ч1 ® Ф=0
Ь+ЦМФ
сн3-(сн2)12-сн=сн-9н-9Н-сн2-о-^-о-сн2-сн2-1У1-(сн3)з
г
он ун
Рис. 6.27. Основные стадии процесса биосинтеза сфинголипидов:
/ — дигидросфингозинсинтетаза; 2 — дигидросфингозиндегидрогеназа;
3— сфингозин-ацилтрансфераза; 4— церамидхолинтрансфераза
Затем сфингозинацилтрансфераза (3) переносит ацильный
радикал с ацил-5КоА на сфингозин. При этом в ходе реакции
аминогруппа сфингозина ацилируется остатком жирной кислоты с
образованием церамида.
В реакции, катализируемой церамидхолинтрансферазой (4),
происходит перенос холина с ЦЦФ-холина на церамид с образованием
сфингомиелина.
288
Глава 6. Метаболические процессы
Образования глкжоцеребразида и галактоцеребразида,
катализируются трансферазами, которые переносят остатки глюкозы и
галактозы с соответствующих УДФ-производных на церамид.
Существуют и альтернативные пути синтеза цереброзидов,
которые катализируют ферменты, способные переносить остатки
глюкозы и галактозы с УДФ-производных вначале на сфингозин, с
образованием психозина, который затем ацилируется в цереброзид.
6.5.6. Биосинтез холестерина
В синтезе холестерина выявляются последовательно протекаемые
три этапа (рис. 6.28): I) образование мевалоновой кислоты; 2)
превращение мевалоновой кислоты в сквален; 3) циклизация сквалена и
образование холестерина.
На первом этапе синтеза холестерина при участии ацетил-КоА-
ацетилтрансферазы (1) и З-окси-3-метилглутарилсинтетазы (2)
происходит последовательная конденсация трех молекул ацетил-8КоА
с образованием ацетоацетил-5КоА и 3-окси-3-метилглутарил-8КоА.
Последний при участии фермента оксиметилглутарилредуктазы (3)
восстанавливается до мевалоновой кислоты. Эта ферментативная
реакция является лимитирующей во всем процессе синтеза холестерина.
В реакции восстановления расходуется две молекулы НАДФНг.
На втором этапе мевалоновая кислота фосфорилируется при участии
киназ (4, 5), превращаясь в 5-пирофосфомевалоновую кислоту. Затем
пирофосфомевалонатдекарбоксилаза (6) осуществляет два
последовательных действия. Вначале катализирует реакции фосфорилирования
5-пирофосфомевалоната в З-фосфо-5-пирофосфомевалонат, который
на второй стадии подвергается декарбоксилированию и дефосфори-
лированию, превращаясь изопентилпирофосфат, который далее изо-
меризуется в диметилаллилпирофосфат при участии изопентилдифос-
фатизомеразы (7). В следующей реакции изомеры конденсируются
с высвобождением пирофосфорной кислоты и образованием геранил-
пирофосфата. Реакция катализируется диметилаллилтрансферазой (8).
Затем геранилпирофосфат конденсируется с еще одной молекулой
изопентилпирофосфата, превращаясь в фарнезилпирофосфат. Реакция
протекает при участии геранилтрансферазы (9). Далее фарнезилтранс-
фераза (10) конденсирует две молекулы фарнезилпирофосфата в
сквален, который окисляется кислородом до сквален-2,3-эпоксида при
участии скваленмонооксигеназы (11). Сквален-2,3-эпоксид
претерпевает внутримолекулярную циклизацию с образованием четырех кон-
289
Биохимия животных
СН,СО-8-ЦоА СН,СО-3-КоА
Ацетил-КоА\/^ Ацетил-КоА
°Ь*
НЗ-КоА
СН,СОСН2СО-3-КоА
Ацетоацетил-КоА
^СНзСО-б-КоА +н»°
Холестерин <4-
- Ланостерин
б?)
®и
V
НЗ-КоА
СН3
НООС-СН2-С-СН2-СО-3-КоА
I
ОН
3-окси-З-метилглутарил-КоА
н 0 г.зЮксидосквален
НАДО*
у~ 2НАДФН2
О Ь*2НАДФ*
^-►НЗ-КоА
НАДФ'^ уо)
НАДФН2>1
С1_1 Фарнезилпирофосфат ■
НООС-СН2-С-СН2-СН2ОН "
I
ОН
Мевалонат
АТФ
ФФ,
©1г
^*АДФ
5-Фосфомевалонат
Изолентенилпирофосфат
Фарнезилпирофосфат
(С„)
®
Диметилаллилпирофосфат <
^ЧЬАДФ АТф АДФ
5-Пирофосфомевапонат ^—2.
©Г*
со2
Геранилпирофосфат
(С10)
ФФ„
Изопентенилпирофосфа
©
-► З-Фосфо-5-пирофосфомевалонат
Рис. 6.28. Процесс биосинтеза холестерина: / — ацетил-Ко А-
ацетилтрансфераза; 2 — З-окси-3-метилглутарилсинтетаза;
3 — оксиметилглутарил-редуктаза; 4 — мевалонаткиназа;
5— 5-фосфомевалонаткиназа; 6 — пирофосфомевалонат-декарбоксилаза;
7— изопентилдифосфатизомераза; 8 — диметилаллилтрансфераза;
9 — геранилтрансфераза; 10 — фарнезилтрансфераза;
// — скваленмонооксигеназа; /2 — 2,3-оксидоскваленланостеролциклаза
290
Глава 6. Метаболические процессы
денсированных циклов в ланостерин; реакция протекает при участии
2,3-оксидоскваленланостеролциклазы (12).
Ланостерин Холестерин
Процесс циклизации сопровождается стереоспецифической
миграцией двух метальных групп и гидрид-иона вдоль цепи сквалена.
Превращение ланостерина в холестерин сопровождается удалением трех ме-
тильных групп в положении 4 и 9, насыщением двойной связи в боковой
цепи и сдвигом двойной связи из положения 8,9 в положение 5,6.
6.5.7. Образование кетоновых тел
Кетоновые тела (ацетоновые тела) — это группа органических
соединений, в структуре которых присутствует карбонильная группа.
Основными представителями кетоновых тел являются ацетон (СН3-СО-
СН3), ацетоуксусная кислота (ацетоацетат) (СН3-СО-СН2-СООН) и
р-оксимасляная кислота (Р-оксибутират) (СН3-СНОН-СН2-СООН).
Образование кетоновых тел происходит в рубце, молочной железе,
почках и печени жвачных животных. Содержание в крови животных
может составлять 2...9, в молоке — 3...8, в моче — 9... 18 мг%
кетоновых тел. При этом 60...65% от общего количества кетоновых тел
составляет р-оксимасляная кислота.
Основным метаболитом, из которого образуются кетоновые тела,
является ацетил-КоА (СН3-СО-8КоА). Синтез кетоновых тел
происходит следующим образом (рис. 6.29). На начальной стадии из двух
молекул ацетил-КоА образуется ацетоацетил-КоА. Реакция
катализируется ацетил-КоА-ацетилтрансферазой (1). Затем происходит
реакция присоединения к ацетоацетил-КоА еще одной молекулы аце-
тил-КоА, которая катализируется оксиметилглутарил-КоА-синтазой
(2). При этом, образовавшийся Р-окси-р-метилглутарил-КоА
способен расщепляться оксиметилглутарил-КоА-лиазой (3) на
ацетоацетат и ацетил-КоА. В завершении процесса ацетоуксусная кислота вос-
291
Биохимия животных
2СН3СО—8-КоА
Ацетил-КоА
1*НЗ-КоА
СН3—СО-СН2-СО-3-КоА
Ацетоацетил-КоА
|/СН3СО-8-КоА
©рн2о
Х*Н8-КоА
ОН
НООС-СН2-С-СН2-СО-8-КоА
I
СН3
3-Окси-З-метилглутарил-КоА
^* СНз-СО-8-КоА сн
СН3-СО-СН2-СООН -ф* СНз-СО-СНз
Ацетоацетат Ацетон
НАДН2
|*НАД*
ск-снон-сн,-соон
Рис. 6.29. Процесс образования кетоновых тел: / — ацетил-КоА-
ацетилтрансфераза; 2— оксиметилглутарил-КоА-синтаза;
3—оксиметилглутарил-КоА-лиаза; 4— р-оксибутиратдегидрогсназа;
5 — ацетоацетатдекарбоксилаза
Глава 6. Метаболические процессы
станавливается НАД-зависимой р-оксибутиратдегидрогеназой (4),
с образованием р-оксимасляной кислоты, а при участии ацетоацетат-
декарбоксилазы (5) ацетоацетат подвергается декарбоксилированию
с образованием ацетона.
Синтезированные кетоновые тела могут быть использованы в
энергетических процессах. Так, например, в митохондриях ацетоуксусная
кислота под действием ацетил-КоА-синтетазы превращается в ацето-
ацетил-КоА. В реакции используется АТФ и Н8КоА.
АТФ Н8КоА
СН3-СО-СН2-СООН -Чк—Ч^ » СН3-СО-СН2-СО-8КоА
АМФ ФФн
Затем ацетоацетил-КоА способен расщепляться тиолазой до двух
молекул ацетил-КоА, которые окисляются ферментами цикла три-
карбоновых кислот до С02 и Н20.
СН3-СО-СН2-СО-8КоА + Н8КоА -> 2СН3-СО-8КоА
6.5.8. Функции липидов
В организме животных липиды выполняют разнообразные
функции: 1) входят в состав мембран клеток и органелл (насыщенные и
ненасыщенные жирные кислоты, фосфолипиды, сфинголипиды и др.);
2) окисление липидов (жирных кислот) обеспечивает энергетические
потребности живого организма; 3) служат предшественниками
молекул, обладающих регуляторным действием, в частности,
ненасыщенные жирные кислоты входят в состав витамина Р, а из арахидоновой
кислоты синтезируются простагландины и тромбоксаны; 4)
предшественником кортикостероидов, женских и мужских половых гормонов,
желчных кислот и витамина О является холестерин; 5) кортикостеро-
иды могут стимулировать синтез РНК и белков, обладают
противовоспалительным, антиаллергическим, иммунодепрессивным,
противошоковым и антитоксическим действием; 6) в качестве женских и
мужских половых гормонов липиды отвечают за проявление
вторичных половых признаков, регулируют активность генома клеток; 7)
желчные кислоты в составе желчи принимают участие в процессе
переваривания и транспорте липидов по кишечнику; 8) витамин О участвует
в переносе ионов кальция; 9) в составе сложных белков липиды фор-
293
Биохимия животных
мируют комплексы (липопротеиды), обеспечивающие перенос
нерастворимых в воде соединений; 10) выполняют функции изоляторов
в составе липоидных слоев миэлиновых оболочек, защищая при этом
проводящие части нервного волокна от окружающей среды; 11)
отложение л ипидов в подкожно-жировом слое проявляет их
термоизоляционные свойства; 12) входя в состав жировых шариков молока, липиды
обеспечивают стабильность этих образований; 13) липиды придают
водоотталкивающие свойства кожным покровам животных.
6.6. АНТИОКСИДАНТНАЯ СИСТЕМА
Жизнеспособность организмов поддерживается за счет высокой
активности антиоксидантной системы. Антиоксиданты регулируют
процессы свободнорадикального окисления, создают оптимальные
условия для нормального метаболизма и функционирования клеток
и тканей, их основной функцией в животных клетках является
торможение развития свободнорадикальных процессов окисления.
В основном антиоксиданты по механизму действия можно
разделить надве группы: 1) высокомолекулярные соединения —ферменты
антиоксидантной защиты (супероксиддисмутаза, пероксидаза, ката-
лаза и др.), а также белки (альбумин, трансферрин, ферритин и т. д.),
способные связывать ионы Ре и Си, являющиеся катализаторами
свободнорадикальных процессов; 2) низкомолекулярные
соединения, к которым относятся стероиды, убихиноны, фосфолипиды,
некоторые аминокислоты, полиамины, мочевина, мочевая кислота,
глутатион, аскорбат, билирубин, токоферолы и др.
Общая антиокислительная активность липидов зависит как от
количества биоантиоксидантов и их взаимовлияния, так и от присутствия
веществ, которые сами не оказывают антиоксидантного или проокси-
дантного действия, но способны усилить или ослабить действие
биоантиоксидантов.
По механизму проявляемого действия низкомолекулярные
антиоксиданты подразделяются на соединения, обладающие
антирадикальной и антиоксидантной активностью. Однако их объединяет то,
что все они являются донорами атомов водорода и электронов и
поэтому участвуют в окислительно-восстановительных реакциях. Роль
антиоксидантов сводится к тому, что в низких концентрациях они
способны инициировать свободнорадикальные процессы, проявляя
при этом прооксидантные свойства, тогда как при избытке они по-
294
Глава 6. Метаболические процессы
давляют образование свободных радикалов в живых организмах,
проявляя антиоксидантные свойства.
Соединения, обладающие высокой прооксидантной активностью,
способны разрушать биогенные системы и поэтому являются
основным инструментом апоптоза — запрограммированной смертью
клеток живого организма.
В образовании свободных радикалов принимает участие кислород,
используемый в живых системах преимущественно в процессах
окислительного фосфорилирования. Основную роль в образовании
активных форм кислорода в живых организмах выполняют гемсодержащие
белки. Эти белки выполняют самую разнообразную функцию в
биогенных системах. Одни из них способны переносить и накапливать
кислород в тканях, другие катализируют
окислительно-восстановительные реакции. Ферменты, катализирующие
окислительно-восстановительные реакции, относятся к классу оксидоредуктаз. В
результате протекания этих реакций, катализируемых ксантиноксидазой,
альдегидоксидазой и многочисленными флавопротеидами, могут
образовываться активные формы кислорода
(супероксид-анион-радикал и перекись водорода). Аналогичные процессы протекают и при
самопроизвольном окислении гемоглобина, ферридоксинов,
адреналина и др.
В утилизации активных форм кислорода участвуют ферменты: су-
пероксиддисмутаза, каталаза, пероксидаза. Эти белки объединяет то,
что они способны осуществлять последовательное превращение АФК,
в результате происходит восстановление супероксид радикала до Н202
в реакции диспролорционирования, катализируемой супероксиддис-
мутазой, а затем перекись водорода разлагается до воды и кислорода
в реакции катализируемой каталазой, или восстанавливается до воды
в пероксидазных реакциях.
6.6.1. Антиоксиданты
6.6.1.1. Высокомолекулярные антиоксиданты
Супероксиддисмутаза (КФ 1.15.1.1). Еще в 1939 г. Манн и Кейлин
выделили из эритроцитов быка медьсодержащий белок, который они
назвали гемокупреином. Затем этот белок стали называть эритрокуп-
реином. Позднее сходные белки были выделены из других тканей (ге-
патокупреин, цереброкупреин). СОД относится к металлоферментам.
В активном центре содержатся ионы цинка (2п2+) и меди (Си2+), рас-
295
Биохимия животных
положенные близко друг к другу. В составе фермента две субъединицы
с молекулярной массой по 16 кДа.
Фермент катализирует реакцию дисмутации
супероксид-ион-радикалов.
02- + 02" + 2Н+ -* Н202 + 02
В механизме окислительно-восстановительной реакции
принимает участие ион Си2\ Основным местом локализации фермента
являются мембраны митохондрий. Активность Си,2п-СОД не зависит
от рН среды в области 5...9. В Си-связывающий центр фермента
входят четыре остатка Ню, а в 2п-связывающий центр — два остатка гис-
тидинов и один остаток аспарагиновой кислоты. В области активного
центра фермента присутствует также Аг§-141, существенный для
каталитической активности. Стабильность структуры каждой
субъединицы фермента поддерживается за счет дисульфидного мостика, в
образовании которого принимают участие Су$-58 и 160.
Каждая субъединица Си, 2п-СОД имеет структуру бочонка (бета-
барреля), образованного 8 антипараллельными бета-слоями, и
содержит 3 выступающие внешние петли. Димер представляет собой
удлиненный эллипсоид (33, 67, 36 А). Около 9% внешней поверхности
каждой субъединицы приходится на область контакта. В контакте
участвуют первая и последние пары бета-слоев бета-барреля и
области двух петель на участках 47...82 и 100... 112 остатков.
Бета-Баррель асимметричен: бета-слои с 5 по 8 более короткие и
с меньшим числом водородных связей, чем слои 1...4. Петли
различаются по размерам и структуре. Наибольшая петля содержит дисуль-
фидный мостик и область центра связывания цинка. Дисульфидная
связь ковалентно соединяет большую петлю с началом бета-слоя 8.
Вторая петля имеет небольшой альфа-спиральный участок. Самая
маленькая петля имеет форму греческого ключа.
Расстояние между атомами Си активных центров составляет 33,8 А.
Разделение двух активных центров в пространстве и их кажущаяся
идентичность позволяют предположить, что сильное димерное
взаимодействие обеспечивает скорее структурную стабильность СОД, а не
ферментативную функцию.
Си(И) и 2п(Н) расположены на дне глубокого, узкого канала на
расстоянии 6,3 А. При этом ион цинка погружен полностью, а ион
меди более открыт и доступен для растворителя. Боковая цепь Н18-61
образует мостик между ионами Си2+ и 2п2+. Лигандами иона Си2+
296
Глава 6. Метаболические процессы
являются Ж8-44, Ж8-46, Н15-61 и Н15-118, лигандами иона 7л\2' —
Н18-61, Нгс-69, Н18-78 и А8р-81. Положение металлсвязывающих
остатков стабилизировано сложной сетью водородных связей.
Молекулярная поверхность канала активного центра образована 18
аминокислотными остатками, 16 из которых повторяются для СОД из
различных источников. Е. Гетцофф с соавторами в 1992 г. получили
мутантную Си, 2п-СОД человека с заменой в канале активного центра
С1и-132 и С1и-133 на С1п-остатки. Нейтрализация отрицательных
зарядов С1и приводит к существенному увеличению скорости реакции
дисмутации, по-видимому, за счет снижения электростатического
барьера и увеличения скорости диффузии 02- к активному центру. На
дне узкой части канала имеются две ямы, в одной из которых
располагается ион Си24, в другой — молекула воды.
Молекулярный механизм действия Си,2п-СОД, основанный на
данных рентгеноструктурного анализа и биохимических данных,
предложен Д. Тэйнером и др. в 1983 г. Согласно этой модели радикал
02- связывается с Си-центром таким образом, что один атом
кислорода вытесняет молекулу воды из Си-центра, а второй атом кислорода
образует водородную связь с гуанидиновым азотом Аг§-141.
Связанный 02- восстанавливает Си(И) до Си(1) с одновременным
расщеплением связи между Н18-61 и Си. Кислород выделяется, один из
атомов азота имидазольного кольца Н18-61 протонируется, а другой
остается связанным с ионом 2п2\ Затем второй радикал 02-
связывается с Си(1) таким образом, что один атом кислорода образует
водородную связь с протонированным атомом азота имидазольного кольца
Н18-61, в то время как другой атом кислорода снова образует
водородную связь с Аге-141. Перенос электрона от Си(1), сопряженный с
переносом протона от Н18-61, приводит к образованию Си-гидроперок-
сида. Второй протон поступает от связанной в активном центре воды
и образуется нейтральная молекула Н202.
В ранних исследованиях иону 2п2+ в основном отводилась роль
стабилизатора структуры фермента. Однако в последнее время
высказываются предположения о его участии в катализе. В пользу этого
говорят следующие данные. Так, активность Си,2п-СОД не зависит от
рН среды в области 5...9, а активность СОД, лишенной цинка, зависит
от рН, причем величина кажущейся рК составляет - 6,9, что может
отражать рК Н18-61. Далее, в Си,2п-СОД редокс-потенииал Си равен
0,42 В, тогда как в водном растворе он составляет 0,17 В, а в Си(П)-
гистидиновых комплексах - 0,01 В. На первой стадии реакции про-
297
Биохимия животных
исходят изменения геометрии комплекса иона 2п2+ с лигандами. На
второй стадии 2п обеспечивает протонизацию №8-61, образующего
мостик между ионами меди и цинка, и направляет этот протон для
образования водородной связи и последующего переноса на второй
супероксид-радикал, завершая, таким образом, каталитический цикл.
2п(П), связанный с №$-61, увеличивает рК ЫЕ2 до ~ 13.
СОД характеризуется необычайной структурной стабильностью и
является одним из наиболее термостабильных глобулярных белков.
Фермент активен в 8 М мочевине; он не реагирует с дитионитробен-
зоатом (ДТНБ) в 8 М гуанидингидрохлориде при рН 11,4 в течение
2<* часов. При выдерживании в 86%-ном этаноле в течение трех часов
фермент теряет активность только на 10%.
Физиологическую функцию СОД связывают с защитой клеток от
свободно радикального повреждения. К настоящему времени
выяснены далеко не все биологические источники супероксидных
радикалов. Супероксидные радикалы могут продуцировать лейкоциты в
процессе фагоцитоза. Источниками супероксидных радикалов
являются цепи переноса электронов (митохондрии), некоторые флавин-
содержащие оксидоредуктазы, локализованные в цитозоле, такие как
ксантиноксидаза, альдегидоксидаза, дегидрооротатдегидрогеназа и др.
В цитозоле 02- могут образовываться также в процессах
автоокисления некоторых белков и низкомолекулярных метаболитов, таких как
катехоламины, гидрохиноны и др.
В условиях нормального обмена супероксиддисмутазы
поддерживают стационарную концентрацию супероксидных радикалов на
определенном уровне, защищая тем самым клеточные структуры от
повреждающего действия как самих радикалов 02-, так и от появления
гидроксильных радикалов.
Каталаза (КФ 1.11.1.6). Фермент катализирует реакции
разложения перекиси водорода на воду и кислород.
2Н202->2Н20 + 02
Относится к гемсодержащим ферментам. Состоит из четырех
субъединиц, каждая из которых содержит гем. Одна молекула фермента
способна разложить 44-Ю3 молекул Н202 в секунду.
На основании данных рентгенографических исследований было
показано, что в активном центре каталазы проксимальным лигандом
железа гема является Туг-367, а в дистальной области располагаются
298
Глава 6. Метаболические процессы
РНе-167, Н18-74 и Азп-147. Проксимальный лиганд каталазы может
находиться в депротонированном состоянии и за счет этого
стабилизировать ион железа гемина в ферриформе. Атом азота дистального ЬП$-74
расположен на расстоянии 4,5 А от атома железа, а его имидазольное
кольцо располагается почти параллельно плоскости гема на
расстоянии 3 А. Строение активного центра каталазы отличается от других
гембелков тем, что гемин очень глубоко погружен внутрь глобулы,
поэтому субстраты могут проникать к активному центру каталазы в
область координационного окружения гема только по каналу, имеющему
максимальную ширину у входного отверстия 15 А, где располагаются
гидрофильные аминокислотные остатки Азп-127, С1и-1б7 и и$-172.
Сам же канал имеет длину 30 А и выстлан гидрофобными
аминокислотными остатками (\Ы-73 и -115, А1а-116, С1у-Н7, Рго-128, РЬе-152,
-153, -160 и -163, Не-164, Ьей-148). Ограниченные размеры канала
каталазы создают стерические затруднения для ее некоторых субстратов,
что наглядно было показано еще Чансом, который, используя перекиси
с различными заместителями, заключил, что гем каталазы глубоко
погружен внутрь белка. Через канал вглубь молекулы каталазы могут
проникать кроме перекисей и достаточно большие молекулы, например,
аминотриазол, являющийся необратимым ингибитором фермента. Он
модифицирует Н13-74 и, встраиваясь в гемовый «карман», своим
атомом азота образует координационную связь с железом гема, поэтому
такая модификация приводит к полному ингибированию фермента.
Мономерная субъединица каталазы способна катализировать
процессы перокендазного окисления. Возможность выполнять некоторые
функции пероксидазы обусловлена общностью в строении активных
центров этих гембелков. Субъединицы каталазы реагируют с
перекисью с образованием трех соединений. Лишь одно из них, соединение
I, аналогичное соединению I пероксидазы с Н202, обладает высокой
каталитической активностью и участвует в окислении различных
органических соединений. Соединение II каталазы образуется только
при действии избытка перекиси; его каталитическая активность
приблизительно в 104 раз меньше, чем активность соединения I. Кейлин
и Харти обнаружили еще неактивное соединение III, образующееся
в присутствии высоких концентраций перекиси водорода. Реакция
каталазы с перекисью водорода отличается от аналогичной реакции
пероксидазы. Каталаза осуществляет реакцию диспропорциониро-
вания, т. е. расщепляет перекись водорода до воды и 02 в ходе
одностадийной двухэлектронной реакции по схеме:
299
Биохимия животных
КАТ + Н202 -> соединение I + Н20;
Соединение I +Н202 -> КАТ + Н20 +02
В настоящее время считается доказанным, что соединение Е, ка-
талазы и пероксидазы содержат по два окислительных эквивалента:
один на железе тема, имеющего электронную конфигурацию Ре(1У),
а другой в виде л-катион радикала на порфирине.
Вгутатионпероксидаза (КФ 1.11.1.9). Фермент представлен в
организме животных в нескольких формах. Глутатионпероксидаза (СРХ-1)
эукариот является селенсодержащим белком, катализирующим
следующую реакцию:
2Г-5Н + Н202 -> Г-5-5-Г + 2Н20,
где Г-8Н и Г-5-3-Г — восстановленная и окисленная форма глутатиона.
Основным местом локализации фермента служит эритроцит. Кроме
того, СРХ-1 обладает способностью катализировать окислительно
восстановительную реакцию, характерную для пероксинитритре-
дуктазы.
СРХ-1 состоит из четырех одинаковых субъединиц, каждая из
которых имеет молекулярную массу 23 кДа и организована в комплекс
квадратной формы. В состав субъединиц входит один атом селена,
связанного с Н5-группой цистеина. В полипептидной цепочке
фермента 201 аминокислотный остаток и цистеин, участвующий в
связывании селена и занимающий 41-е место от 1^-конца.
В активном центре фермента имеются три аминокислотных
остатка, участвующие в каталитическом процессе. Это остатки
цистеина, глицина и триптофана. В связывании субстрата (глутатиона)
принимают участие четыре остатка аргинина и остаток лизина.
Образование функционально активной формы фермента зависит
от присутствия в рационе питания животных селена. При
концентрации селена в 0,001...0,02 мг/кг рациона образование активной формы
фермента не происходит. По мере роста приема селена до 0,2 мг/кг
рациона отмечается появление активности фермента в тканях. При
ежедневном приеме селена 0,2...0,5 мг/кг полностью восстанавливается
нормальная активность фермента.
Другой формой глутатионпероксидазы служит СРХ-11. Это
тканевой фермент и его основным местом синтеза служат печень и сердце.
300
Глава 6. Метаболические процессы
СРХ-Н катализирует реакцию окисления глутатиона при участии
гидроперекисей липидов.
2Г-8Н + КООН -► Г-5-5-Г + КОН + Н20,
где К — алкильный радикал (обычно фосфолипид).
СРХ-Н является мономерным белком с молекулярной массой
в 22 кДа. В активном центре фермента атом селена связан с
остатком цистеина, как и у СРХ-1.
СРХ-Н участвует в реакциях перекисного окисления липидов,
понижая концентрацию гидроперекисей (КООН).
В плазме крови выявлена активность глутатионпероксидазы (СРХ-
III), которая состоит из четырех субъединиц, с молекулярной массой
по 23 кДа каждая. В отличие от СРХ-1, СРХ-Ш является гликопро-
теидом и также катализирует реакцию восстановления перекиси
водорода за счет окисления глутатиона. Местом синтеза СРХ-Ш
служит печень.
В последнее время в тканях позвоночных была обнаружена глута-
тионпероксидаза (СРХ-1У), по специфичности действия
тождественная СРХ-Н, но отличающаяся от нее строением первичной структуры
полипептидной цепочки.
Кроме того, в составе гранулоцитов недавно был определен селен-
содержащий белок с молекулярной массой 30 кДа, способный
катализировать реакцию, в которой участвует перекись водорода,
восстанавливающаяся при окислении органических соединений. В частности,
субстратом фермента в реакциях пероксидазного окисления может
быть о-дианизидин.
Фермент состоит из двух идентичных субъединиц по 15 кДа
каждая. В активном центре фермента имеется селен, связанный с
остатком цистеина. Этот фермент представляет собой селензависимую
тканевую пероксидазу, отличающуюся по специфичности действия от
остальных форм глутатионпероксидаз.
Глутатионредуктаза (КФ. 1.6.4.2) является ферментом, широко
распространен в тканях животных, особенно в печени, почках,
сердце, эритроцитах, мышечной ткани.
Фермент имеет молекулярную массу 44 кДа. Субстратами фермента
могут быть окисленная форма глутатиона и коферменты (НАФН2 и
НАДН2). Глутатионредуктаза катализирует реакцию восстановления
окисленного глутатиона за счет окисления коферментов.
301
Биохимия животных
Г-5-5-Г + НАД Н2 -► 2Г-5Н + НАДФ
Ингибиторами фермента могут быть ионы Н§2+ и Си2+.
6.6.1.2. Низкомолекулярные антиоксиданты
В фуппу низкомолекулярных антиоксидантов входят витамины С,
Р, Е, А, а также различные метаболиты биогенных систем (глутатион,
мочевая кислота, мочевина, билирубин).
Глутатион (Г-5Н) — трипептид, в состав которого входят три
последовательно соединенных аминокислотных остатка (глутаминовая
кислота, цистеин, глицин).
НООС-СН-СН2-СН2-ССК-МН-СН-СН2-8Н
I I .
N4, СО^Н-СН2-СООН
Глутатион
Глутатион служит донором водорода в
окислительно-восстановительных процессах. В организме животных глутатион является
субстратом глутатионпероксидазы, окисление которого сопровождается
образованием окисленной формы (Г-5-5-Г), тогда как
восстановление глутатиона катализирует глутатионредуктаза. Активность этих
двух ферментов обеспечивает баланс восстановленной и окисленной
форм глутатиона в организме животного.
ын/ о н
оосснсн.сн,смснсмсн,соо-
.'. I ■.
сн,
ын,* о н
I I I
-оосснсн2сн,смснсмсн,соо
и| о
сн,
I
5Н } супьфгидрильная
+2Н
~*П» ' I Групп*
5/
I
сн,
ын; о I н
I I I I
оосснсн2сн2смснсысн2соо-
II
н о
Восстановленная форма Г-5Н Окисленная форма Г-$Н
302
Глава 6. Метаболические процессы
Глутатион участвует в транспорте аминокислот через мембраны
клеток, нейтрализует действие токсичных соединений, защищая Н5-
группы белков от повреждения, обеспечивает поддержание
восстановленного состояния железа (Ре2+) гембелков, в частности, у мио-
глобина.
Синтез глутатиона осуществляется в 2 стадии. Вначале к глутаминовой
кислоте присоединяется цистеин с образованием дипептида (у-глутамил-
цистеин). Реакция катализируется у-глутамилцистеинсинтетазой.
Фермент проявляет активность в присутствии АТФ, а также ионов М&+ и К+.
СООН
СН-ЛН2
I
СН2 +
сн2
СООН
СООН
I
СН-Ш2 АТФ
I
СН2-
I
зн
СН2-СО-МН-СН-СООН
^г
I
сн2
сн-мн2
I
СООН
АДФ+Фн
I
сн2
8Н
Глутаминовая
кислота
Цистеин
Г-Глутамил цистеин
Затем глутатионсинтетаза присоединяет к у-глутамилцистеину
глицин.
СООН
I
СН2-СО-КН-СН
I
сн2
I
сн-гаъ
I
СООН
I
СН2
ЗН
Ш, АТФ
+ СН2
СООН
СН2-СО-Ш-СН-СО- 1МН
■л*
АДФ+Фн
I
СН2
СН-NН2
I
СООН
I
сн2
I
8Н
I
сн2
СООН
Глутатион
Реакция протекает с образованием промежуточного производного
глутаминилцистеинилацилфосфата, ацилфосфатная группа которого
замешается глицином.
303
Биохимия животных
Роль в действии антиоксидантной системы основана на том, что
глутатион является главным восстановителем клетки и напрямую
способен восстанавливать активные формы кислорода. Кроме того,
глутатион реализует свое действие в ферментативных реакциях с Н202
и КООН. Глутатион зависимые ферменты катализируют реакции во
всех органеллах клетки (ядро, митохондрии, эндоплазматическая сеть
и др.). Количество восстановленного глутатиона может служить
критерием жизнеспособности живых организмов, а также показателем
высокого адаптационного потенциала.
6.6.2. Перекисное окисление липидов
Животные могут существовать только в атмосфере, содержащей
кислород, который обеспечивает протекание аэробных
метаболических процессов в клетках, а также образование в них свободных
радикалов и перскисных соединений органической и
неорганической природы. При действии неблагоприятных факторов
интенсивность этих процессов может возрастать. Клетка располагает
несколькими специализированными механизмами защиты в составе
противоокислительной системы, в действии которых принимают
участие следующие соединения: глутатион, аскорбат, каротиноиды
и ферменты (супероксмддисмутаза, каталаза, глутатинпероксидаза).
За счет наличия баланса антиоксидантов и прооксидантов в тканях
поддерживается нормальный гомеостаз живых организмов, в
которых физиологически обусловлена генерация свободных
радикалов, т. е. активных форм кислорода: Ю2, 02~, Н202, НО. Генерация
супероксидного радикала в животных тканях может происходить
в результате активности НАДФН-цитохром-Ь5-редуктазы, мито-
хондриальной НАДН-дегидрогеназы, ксантиноксидазы и глутати-
онпероксидазы. Так, например, в образовании супероксид радикала
могут участвовать соединения, содержащие железо(И).
Ре2* + 02-> Ре3* + ОУ
Процесс начинается стадией инициирования, причем в роли
инициаторов в основном выступают супероксидный или гидроксильный
радикалы. Это наиболее реакционноспособные промежуточные
соединения кислорода, обладающие большим сродством к электрону,
способные модифицировать молекулы белков, нуклеиновых кислот,
разрушать липидные компоненты мембран клеток и т. д.
304
Глава 6, Метаболические процессы
о-2 + н *->но-2
но-2 + кн -> к- + н2о2
Образовавшиеся радикалы ненасыщенных жирных кислот (К)
далее взаимодействуют с кислородом, образуя перекисиые радикалы
(К02), а те в свою очередь вступают в реакцию с новой молекулой
жирной кислоты с образованием К и накоплением гидроперекисей
липидов (КООН).
К# + 02->КСГ2;
КО#2 + КН -+ К- + КООН
Процесс подавляется антиоксидантами, которые способны
реагировать со свободными радикалами, образуя малоактивные радикалы,
не способные вступать в реакцию с новыми молекулами
ненасыщенных жирных кислот.
КО-2 + ЬпН -> КООН + Ьп#
Свободнорадикальные процессы и перекисное окисление липи-
дов необходимы для регулирования липидного состава и
проницаемости мембран, а также синтетических и регуляторных процессов
в животных тканях, нормальный уровень которых поддерживается за
счет функционирования системы ингибиторов свободнорадикаль-
ного окисления. Срыв в функционировании защитных систем может
приводить к развитию окислительного повреждения тканей,
развитию окислительного стресса. Накопление активных форм кислорода
приводит к инициации перекисного окисления липидов в
биологических мембранах, следствием чего является частичная их
дезинтеграция, проявляемая в увеличении проницаемости ионов,
изменении степени гидрофильности и микровязкости мембранных липидов,
а также степени олигомеризации мембранных белков и их
взаимодействии с липидами. Следствием этих процессов может быть изменение
условий функционирования рецепторных комплексов,
ответственных за связь с гормональными веществами и нарушение
регулирования метаболических процессов.
305
Биохимия животных
Активные формы кислорода выполняют роль вторичных
посредников клеточной активации и пролиферации и служат
компонентами свободно-радикального механизма в регуляции размножения
клеток.
Для различных стрессов, возникающих под действием
неблагоприятных факторов среды (инфекции, различные ксенобиотики,
гербициды, тяжелые металлы, ультрафиолетовое излучение,
рентгеновское облучение и др.), является характерным повышение в тканях
содержания супероксидных радикалов и других активных форм
кислорода, активизация ПОЛ. Разнообразие факторов и
неспецифичность их действия проявляется в интегрировании механизмов
повреждения биогенных систем.
Ультрафиолетовое излучение вызывает повреждения в ДНК:
нарушаются процессы транскрипции и репликации вследствии
образования свободных радикалов и гидроперекисей азотистых
оснований, приводящие к сшивкам, с формированием пиримидиновых
димеров. УФ-облучение вызывает нарушение проницаемости
мембран эритроцитов, изменение физико-химических характеристик
липидного бислоя и вследствие этого потерю связывающей
активности мембранного опиоидного рецептора. Выявлена
положительная корреляция между скоростью УФ-индуцированного гемолиза
эритроцитов и перекисным фотоокислением липидов в мембране.
Показано, что фотоокисление лежит в основе обнаруженного ранее
нарушения функционирования различных ферментов и их
ансамблей, связанных с мембраной. Причем окисление липидов под
действием УФ-облучения протекает по цепному механизму и аналогично
автоокислению, где роль облучения сводится к генерации
свободных радикалов, инициирующих цепи окисления.
Супероксидный ион рад и кал, образующийся в УФ облученной
клетке, способен вызывать мутации как прокариотов, так и эукари-
отических клеток. Аналогичным действием могут обладать и другие
активные формы кислорода, регулирование активности которых
осуществляется с помощью функционально активных веществ,
относящихся к группе антиоксидантов. Возникающие свободные радикалы
инициируют перекисное окисление липидов — процесс, который в
значительной мере определяет их токсичность. Степень его развития будет
зависеть от уровня антиокислителей и их активности.
Неспецифичность реакции активных форм кислорода на
воздействующий фактор или проявление дефицита может свидетельствовать
306
Глава 6. Метаболические процессы
об их участии в активации регуляторных сил биологических систем
с целью компенсировать возникшие изменения. Реализация их
деятельности проявляется в активизации ПОЛ, изменении количества
антиоксидантов и т. д. Так, например, показано, что ответная реакция
биологических мембран на усиление ПОЛ молекулярным
кислородом выражается в активации каталазы, супероксиддисмутазы (СОД),
глутатионпероксидазы (ГП), в уменьшении окислительного индекса
и накоплении продуктов перекисного окисления липидов.
Наиболее эффективными регуляторами ПОЛ являются (в порядке
убывания эффективности) каталаза>СОД>ГП. Пероксидаза
обладает прооксидантными свойствами, переводя на более высокий
уровень регуляции систему ферментативных антиоксидантов за счет
образования в процессе пероксидазного катализа свободнорадикальных
форм фермента. Опосредованное действие ПОЛ показано на
регулировании активности протеинкиназы С (ПК-С)-Са2+ и фосфолипид-
зависимого фермента, который играет ключевую роль в регуляции
многих клеточных процессов. ПК-С рассматривается как важнейшее
звено в системе трансмембранной передаче сигнала при многих
кратковременных и долговременных клеточных ответах, включая
пролиферацию и трансформацию. Известно, что данные процессы наряду
со специфическими регуляторами контролируются работой системы
ПОЛ в биологических мембранах, компонентами которой являются
продукты ПОЛ и природные антиоксиданты.
Предложена гипотеза о роли свободнорадикальных процессов
(в частности, соотношения перекисей липидов и природных
антиоксидантов) в регуляции размножения нормальных и опухолевых клеток.
Причем система регуляции ПОЛ, основными параметрами которой
являются концентрация перекисей липидов, содержание природных
антиоксидантов, состав липидов и структура мембраны, тесно связана
с функционированием ПК-С, продукты ПОЛ в зависимости от
концентрации могут как активировать, так и ингибировать ПК-С.
При гипоксии и гипербарической оксигенации (ГБО)
наблюдается активация ПОЛ. Причем при гипоксии это происходит за счет
накопления восстановителей, а при ГБО — за счет возрастания
кислорода в тканях. Интенсификация ПОЛ способствует увеличению
вязкости мембран, появлению отрицательного заряда на
поверхности мембран, увеличению количества гидрофильных зон,
снижению доли липидов, находящихся в жидком состоянии. На
начальных этапах ПОЛ способствует «разрыхлению» мембран вследствие
307
Биохимия животных
окисления ненасыщенных двойных связей и выталкивания молекул,
содержащих гидрофильные кислородсодержащие перекисные группы
из гидрофобного окружения.
Действие антиоксидантов связано с обрывом цепной реакции,
в результате чего образуются гидропероксид субстрата и
обладающий низкой реакционной способностью свободный радикал
ингибитора. Антиоксидантный эффект а-токоферола в мембранах
усиливается аскорбатом. В присутствии аскорбата а-токоферол может
восстанавливать перекись липида до его исходной формы.
6.6.3. Автоокисление
Комплексы гемоглобина и миоглобина с кислородом достаточно
нестабильны и присутствующий в них кислород способен
инициировать реакции окисления.
Ре2+ + 02 -► Ре2 * 02 -> Ре3+ + 02-
Скорость автоокисления гемоглобина и миоглобина зависит от
природы белка, возрастает при повышении температуры, при подкис-
лении или увеличении концентрации солей.
Отмечается ускорение автоокисления у некоторых мутантных
форм гемоглобинов, например, в случае замещения гистидина в
активном центре гемоглобина на аргинин. Скорость автоокисления
линейно зависит от концентрации протонов в интервале рН 5...7 и
обратно пропорциональна величине парциального давления.
Изменение окислительно-восстановительных потенциалов одно-
и двухэлектронных реакций восстановления кислорода при рН 7,0
позволило выявить следующие их значения:
ё ё 2Н* ё ё 2Н+
02—Х^ > Ог • Ч-4»' ► Н202 ^ > НО • ^ ^—ЖгО
-0,45 +0,98
+0,38 +2,33
+0,27 +1,35
Из этих данных видно, что, хотя кислород и является сильным
окислителем, он проявляет лишь слабые окислительные свойства
в тех случаях, когда возможно присоединение только одного
электрона.
308
Глава 6. Метаболические процессы
Окислительно-восстановительный потенциал пары Ре2*/Ре3+ в
гемоглобине и миоглобине имеет значения в водном растворе при рН 7,0:
+0,2 и +0,1 В соответственно.
Кроме того, кислород способен к окислительной модификации
макромолекулы. Донорами электронов могут быть Ре2+, Си* и семихи-
ноны.
Образующиеся в клетках активные формы кислорода вызывают
получение органических гидропероксидов.
Ре2+ + 02 -* Ре3* + 0-2
Н+ + 0^2-»Н0'2
но-2+кн->н2о2 + к-
к- + о2-*ко-2
ко#2+кн->коон + к-
Процесс образования КООН называется перекисным окислением.
В случае, если КН — липид, то весь процесс называется перекисное
окисление липидов. Кроме того, перекисному окислению могут
подвергаться ДН К, белки, а также другие органические молекулы.
Чрезмерное накопление АФК в клетках может способствовать
возникновению патологических состояний, которые обуславливают
развитие окислительного стресса у живого организма.
Факторами, вызывающими окислительный стресс, могут быть
повышенное содержание кислорода в среде, избыток гема, Ре2+, Си\
ионизирующее и ультрафиолетовое излучение, большие дозы витамина
А и некоторых ксенобиотиков.
При развитии окислительного стресса повреждаются
нуклеиновые кислоты, белки и липиды. Результатом повреждения ДНК служат
окисления азотистых оснований, их модификация, разрыв полинук-
леотидной цепочки и повреждение хромосом.
Таким образом, АФК являются мутагенами, а возникающие в
результате их действия повреждения ДНК могут привести к гибели
клеток или их злокачественному перерождению.
Для предотвращения развития патологии от действия АФК в
организме функционирует антиоксидантная система, предназначенная
309
Биохимия животных
для подавления действия, вызванного присутствием в клетке избытка
активных форм кислорода. Компонентами АОС являются высоко-
и низкомолекулярные антиоксиданты. Описание их действия будет
рассмотрено ниже.
6.6.4. Возможности использования
антиоксидантов в животноводстве
Важным аспектом в исследовании регуляции клеточного
метаболизма является выяснение роли природных компонентов клетки
в процессах перекисного окисления липидов. Уровень ПОЛ в тканях
животных зависит от многих факторов, в частности от содержания
антиоксидантов в липидах биологических мембран и свойств самих
липидов как субстратов окисления. В ПОЛ участвуют
преимущественно высоконенасыщенные жирнокислотные остатки арахидоно-
вой, докозагексаеновой, линоленовой кислот, находящиеся в а-поло-
жении глицерольного остатка молекулы фосфолипидов. Способность
к окислению различных мембранных фосфолипидов не одинакова.
Легко окисляются фракции фосфатидилэтаноламина (ФЭ), фосфати-
дилинозита, фосфатидилсерина и кардиолипида.
В последнее время в основе патогенеза различных заболеваний
проявляются механизмы повреждения тканей животных
индуцированных патогеном, за счет активации свободнорадикальных
процессов, сопровождающиеся селективным повреждением
полиненасыщенных жирных кислот. Развитие поражения тканей сопровождается
изменениями относительного содержания полиненасыщенных
жирных кислот и в основном снижается содержание линолевой и
линоленовой кислот, с увеличением доли пальмитиновой кислоты.
Выявленные изменения в составе липидов мембран клеток проявляются уже на
ранних, досимптомных этапах патогенеза и сохраняются в процессе
развития болезни. Снижение доли полиненасыщенных жирных
кислот отражает деструктивные повреждения, обусловленные действием
патогена на мембранные структуры клеток животных. Этапы
повреждающего действия возбудителей заболеваний можно представить
следующим образом. Патоген вначале активирует в животных
клетках генерацию свободных радикалов кислорода. Последние,
непосредственно или через цепь реакций, инициируют процессы перекисного
окисления мембранных липидов, приводя к необратимым
деструктивным повреждениям мембран, включая и плазмалемму. В
результате нарушаются их барьерные функции, что обычно сопровождается
310
Глава 6. Метаболические процессы
увеличением скорости выхода внутриклеточных электролитов.
Следствием повреждения мембран является разрушение клеток и выход
токсичных соединений, в том числе и фенольной природы, а также
солюбилизация оксидазных ферментов из клеточных стенок. В
результате создаются благоприятные условия для активации системы
оксидазы — фенолы в диффузатах, приводящей к генерации
активных форм кислорода, для подавления образования которых
используются антиоксиданты.
Антиоксиданты регулируют процессы свободнорадикального
окисления, создают оптимальные условия для нормального метаболизма и
функционирования клеток и тканей, их основной функцией в
растительных и животных клетках является торможение развития свободно-
радикальных процессов окисления.
Сердечные гликозиды и аскорбиновая кислота относятся к группе
соединений, обладающих антиоксидантными свойствами. Оба ан-
тиоксиданта способны накапливаться в растениях в периоды их
активной вегетации, в особенности в период формирования семян, что
позволяет высказать некоторые предположения об участии этих
соединений в онтогенезе растений При этом заготовка растений в этот
период позволяет создавать запас кормов с высоким содержанием
естественных антиоксидантов.
В животных тканях стероидные гликозиды способствуют
увеличению проницаемости внутрь клеток кальция, а также
высвобождению внутриклеточного лабильного кальция из мембран митохондрий.
Анализ действия стероидных гликозидов позволяет определить, что
их основная функциональная роль заключается в способности
стимулировать проницаемость мембран как растительных, так и животных
клеток, активировать процессы деления и роста клеток. За счет
реактивной агликоновой части стероидные гликозиды способны
подавлять образование свободных радикалов, ингибировать ПОЛ, т. е.
выполнять в клетке роль антиоксидантов. Установленным является
и то, что антиоксиданты в зависимости от их концентрации в
питательной среде дифференцированно стимулируют рост, развитие
живого организма.
Для животных тканей показано, что АК может выступать в
качестве гидроксилирующего агента при образовании кортикостероидов
в гомогенатах надпочечников. При дефиците АК нарушается
биосинтез и превращения кортикостероидов. Экзогенное введение АК
животным повышает экскрецию 17-кетостероидов в моче и увеличивает
311
Биохимия животных
концентрацию в крови оксикортикостероидов. Участие АК в
образовании функционально активных гормональных соединений
стероидной природы не случайно, а является закономерным звеном в
сложившейся системе регулирования интенсивности и направленности
метаболических процессов в любом живом организме, хотя
экспериментально это показано пока только для животных. Понижение
содержания АК в организме животных приводит к возникновению у них
стресса, понижению реактивности. В этой связи очень интересны
исследования, выполненные Л. Полингом, который показал, что
введение больших доз АК резко повышает устойчивость организма, его
адаптационные способности к неблагоприятным воздействиям
внешней среды (инфекции, перегревание, охлаждение, недостаток
кислорода и др.), способствует процессам регенерации.
Функциональная роль АК в метаболических процессах в основном
была раскрыта в работе Ругге и Блюменфельда, которые показали, что
окисление аскорбиновой кислоты происходит с образованием
промежуточных продуктов ион-радикалов семихинонного типа. Ими же
было высказано предположение, что способность АК отдавать
электроны соответствующим акцепторам и образовывать ион-радикалы
лежит в основе ее участия в окислительно-восстановительных процессах,
причем АК может участвовать в транспорте электронов и окислении
пиридиновых коферментов.
Известно, что витамины-антиоксиданты оказывают синергичес-
кое действие. Аскорбиновая кислота восстанавливает продукт
окисления токоферола а-токофероксид в а-токоферол, витамины С и Р также
взаимно обратимо восстанавливаются. Аскорбиновая кислота более
стабильна в присутствии метилметионина, так как сульфгидрильные
группы способны восстанавливать дегидроаскорбиновую кислоту в
аскорбиновую. Метилметионин, поставляющий 5Н-группы,
обеспечивает функционирование глутатионного звена — одного из основных
механизмов антиокислительной системы. При этом, он участвует в
выведении из организма как активных радикалов, так и избытка
радикалов биоокислителей. Липоевая кислота, которая участвует в процессе
биологического окисления в липидном и углеводном обмене, коэнзим
А также обладают выраженными антиоксндантными свойствами. Под
их влиянием увеличивается фонд НАДН, что способ-ствует
восстановлению окисленного глутатиона.
Эффективность действия антиоксидантов обусловлена
предотвращением окисления ЗН-фупп белков, сохранением состава мембран,
312
Глава 6. Метаболические процессы
биологически активных веществ, информативных молекул и т. д.,
повреждение которых возникает в результате активации процесса перекис-
ного окисления липидов.
Высокое содержание сердечных гликозидов в листьях отмечается
у бадана толстолистного, гетеропаплуса щетинистоволосистого,
дриады восьмилепестной, змееголовника пальчатого, солонечника
даурского. Цветки горечавки бородатой, полыни монгольской и эстрагон
в период массового цветения накапливают в большом количестве
стероидные гликозиды. Богаты стероидными гликозидами и плоды
гетеропаплуса щетинистоволосистого, лабазника вязолистного и длане-
видного, льнянки остролопастной и солонечника даурского. Кроме
того, высокое содержание антиоксидантов отмечается и в растениях,
которые выращивает человек. Полезные свойства этих растений
могут быть реализованы, если их добавлять в корм животным в качестве
биологически активной пищевой добавки. Использование этих
растений в рационе питания позволит компенсировать некоторый
недостаток антиоксидантов в организме животных.
6.6.5. Некроз и апоптоз
Прекращение функционирования жизненно важных органов
(сердце, почки, печень, мозг и др.) сопровождается гибелью организма.
С наступлением смерти проявляются необратимые изменения в
жизнедеятельности организма, заканчивающиеся гибелью клеток. Если
эти процессы в живом организме происходят в результате
воздействия физико-химических и биологических факторов, то этот процесс
называются некрозом. В случае, если клетки погибают в результате
действия специализированных запрограммированных механизмов, то
этот процесс получил название апоптоз.
Некроз. Некроз может быть обусловлен физическими факторами
(высокой (ожог) и низкой (отморожение) температурами, радиацией
(лучевая болезнь), техническими повреждениями кожных покровов
(ссадины, раны и др.)), действием химических факторов
(концентрированные кислоты и щелочи, соли тяжелых металлов, лекарственные
средства и др.), а также биологическими факторами (бактерии,
вирусы, простейшие и др.).
Протекание некроза характеризуется морфологическими и
биохимическими изменениями в структуре клеток, которые зависят от
особенностей строения органов и тканей, скорости его протекания,
а также от причины его возникновения и условий развития.
313
Биохимия животных
Общими признаками некроза являются, прежде всего, набухание
митохондрий и разрушение мембран органелл, сопровождаемое
вакуолизацией цитоплазмы, а также лизисом структурных и
функциональных биогенных молекул (ДНК, РНК, белков, углеводов, липи-
дов и др.) собственными ферментами лизосом, проявляемое затем
процессом переваривания компонентов клетки. Кроме того,
отмечается разрыв цитоплазматической мембраны и возрастание размеров
клетки, т. е. происходит набухание клетки (рис. 6.30).
Вокруг омертвевших тканей возникает реактивное воспаление,
проявляемое специализированной зоной, ограничивающей
мертвую ткань. В этой зоне отмечается расширение кровеносных
сосудов, гиперемия, отек, увеличивается содержание лейкоцитов, секрети-
рующих гидролитические ферменты и расплавляющих некротические
массы, которые утилизируются макрофагами. После этого
активизируется размножение клеток соединительной ткани, которая замещает
участок некроза и на месте некроза образуется рубец. В случае
образования участка некроза вокруг него формируется капсула из
соединительной ткани. В мертвых зонах могут откладываться соли кальция
с образованием обызвествленных участков некроза. При рассасывании
некроза и формировании капсулы на месте некротического участка
появляется полость — киста. Кроме того, возможен и неблагоприятный
исход некроза при септическом расплавлении некротического участка,
проявляемый развитием сепсиса, т. е. общим заражением организма.
V-
ч €*■;•:>>. '
Нормальная
клетка
{ ... \.
~1%Ш\ -
Этап набухания
клетки
Набухание
митохондрий
1
• ||(
■ ^ V.
* -"'"•!?
Консервирование
ядра клетки
Этап необратимых
измене
НИИ
Нарушение целостности
мембраны клетки
-.0 1 /. "'■ • ■:
1 * У ' *
* )А
(1*
*
Этап разрушения
клетки
Рис. 6.30. Основные этапы некроза клетки
314
Глава 6. Метаболические процессы
Если некротический участок не подвергается аутолизу и не
замещается соединительной тканью, располагаясь свободно в
окружении живых клеток, то в этом случае формируются секвестры. Вокруг
секвестра образуется секвестральная капсула и полость, заполненная
гноем, который выходит из полости через свищи. Гной формируется
в основном из погибших лейкоцитов и остатков поврежденных
клеток, которые могут служить питательной средой для бактерий. В месте
локализации гноя протекают процессы распада и активного
размножения бактерий, которые способны вызывать интоксикацию
организма и способствуют развитию воспалительного процесса.
Таким образом, некроз является процессом, инициируемым
действием внешних факторов различной природы (химические,
физические и биологические). Он проявляется в нарушении структуры
мембран органелл и плазмалеммы, с последующим лизисом всех биогенных
структур и молекул ферментами лизосом и других образований клетки.
Заканчивается некроз формированием очага воспаления, с
последующим развитием воспалительного процесса и нарушением
функционирования различных органов и систем в организме животных.
Аноптоз. Процесс, в результате которого происходит
запрограммированная смерть клетки, называется апоптозом. Этот жизненно
важный процесс для животного организма может быть реализован
повседневно, так как все клетки организма находятся под
постоянным контролем специализированных сенсоров, проверяющих их
целостность.
У нормально функционирующих клеток компоненты апоптоза
участвуют в реализации программ индивидуального развития
организма, дифференциации клеток, поддержании тканевого гомеостаза
и защищают организм от инфекций. Поэтому апоптозу
подвергаются все клетки живых организмов в случае, если у них
происходят следующие изменения: нарушается целостность структур
мембран митохондрий и плазмалеммы, повышается содержание активных
форм кислорода, понижается содержание АТФ, возникают
нарушения в структуре ядерной ДНК, возрастает уровень денатурированных
белков и при этом происходит активное их связывание с Ьзр 70 (Ьеа1
$Ьоск рго1ет 70), отмечается появление фосфатадилсерина на
внешней поверхности плазмалеммы. Кроме того, апоптозу подвергаются
мигрирующие клетки, оторвавшиеся от своих групп, а также клетки
иммунной системы, образующие антитела к собственным белкам
организма. В апоптоз входят клетки организма, исчерпавшие свой жиз-
315
Биохимия животных
ненный потенциал (состарившиеся клетки), а также клетки,
подвергшиеся модификации (инфицированные вирусами или бактериями),
и переродившиеся клетки — раковые клетки.
Действие элементов механизма апоптоза основано на том, что на
начальном этапе реализуется взаимодействие рецептора с
сигнальной молекулой. По строению рецепторы являются белками,
встроенными в структуру клеточной мембраны таким образом, что его
наружная часть имеет участок, с которым может специфично
связываться сигнальная молекула. При этом, в образовавшемся комплексе
инициируются изменения в структуре рецептора и он приобретает
ферментативные свойства или становится посредником в запуске
каскада биохимических процессов, сопровождаемых экспрессией
отдельных генов. В результате активируются процессы биосинтеза
РНК и белков. Среди белков особую важность приобретают
ферменты, способные гидролизовать белки — протеазы и нуклеиновые
кислоты — нуклеазы. Совместное действие этих ферментов
разрушает ядро клетки и его органеллы, обуславливая в дальнейшем
утилизацию фрагментов клетки макрофагами.
Ведущее значение в механизмах апоптоза имеют каспазы, которые
по механизму действия относятся к классу ферментов гидролаз,
катализирующих избирательное расщепление белков. Синтезируются
ферменты в форме неактивных предшественников (зимогенов) — про-
каспаз. В настоящее время известно около 14 изоферментных форм:
каспаза-1, каспаза-2, каспаза-3, каспаза-4 и т. д.
Все каспазы содержат в активном центре остаток цистеина.
Механизм действия каспаз основан на том, что вначале они распознают
в структуре гидролизуемых белков определенные тетрапептидные
участки, а затем расщепляют пептидную связь по карбоксильному
концу остатка аспарагиновой кислоты. Все каспазы по субстратной
специфичности можно разделить на две группы: инициирующие
(каспазы-2, -8, -9 и -10) и эффекторные (прокаспазы-3, -6 и -7).
Ингибиторами каспаз служат белки семейства Вс1-2, а
активаторами — белки семейства Вах.
В активации инициирующих каспаз принимают участие
специальные белки — адапторы. Для связывания адаптеров на поверхности
белковой глобулы имеются специальные участки. Причем эти участки
разные у различных каспаз: ОЕО (с!еа1Ь ейес(ог с1отат — домен
эффектора смерти), САКЭ (сазразе гесшктеп! с1отат — домен
рекрутирования каспазы), ЭШ (с!еа1Ь тс!ист§ с!отат — домен, вызывающий
316
Глава 6. Метаболические процессы
смерть). Так, у прокаспазы-9 это СА1Ш, а у прокаспазы-8 два
последовательно соединенных участка ОЕЭ.
Молекулярная масса инициирующей прокаспазы может
достигать 50 кДа и в составе полипептидной цепочки содержать свыше 100
аминокислотных остатков. В составе белковой глобулы прокаспазы
проявляются три участка, два из которых после протеолиза образуют
большую (> 20 кДа) и малую (< 10 кДа) субъединицы. Каталитической
активностью обладает фермент, имеющий тетрамерную структуру, в
составе которого две малые и две большие субъединицы. В катализе
принимают участие два идентичных активных центра. В связывании ди-
мерных форм каспаз принимают участие малые субъединицы.
Полипептидная цепь эффекторных прокаспаз содержит менее
30 аминокислотных остатков. Группа эффекторных прокаспаз
выполняет функцию ингибиторов активации прокаспаз. Кроме того,
установлены белки 1АР, которые и блокируют процесс отщепления
участков эффекторных протеаз, подавляя их активацию и это, в свою
очередь, предотвращает развитие апоптоза.
При апоптозе отмечаются морфологические и биохимические
изменения в структуре клетки, которые сопровождаются вначале
уплотнением ядерного аппарата, а затем его распадом на фрагменты (рис. 6.31).
Процесс завершается дроблением клетки на отдельные кусочки,
которые утилизируют фагоцитирующие лейкоциты.
Консервация
митохондрий Фрагменты
Нормальная Начальный этап Этап образования Этап лизиса
клетка фрагментации клетки фрагментов клетки фрагментов клетки
Рис. 6.31. Основные этапы апоптоза клетки
317
Биохимия животных
Процесс апоптоза находится под контролем некоторых белков. Так,
белок Вах в составе двух субъединиц, способствует развитию апоптоза,
тогда как димерные формы другого белка Вс1-2 при присоединении
к белку Вах понижают его апоптозную активность.
Таким образом, высокие концентрации белка Вах способствуют
инициации механизмов апоптоза, а преобладание белка Вс1-2 инги-
бирует этот процесс, защищая клетку от гибели. Кроме того,
существуют еще и специализированные гены, ответственные за
профилактику раковых и других злокачественных новообразований. Среди
них следует выделить ген, кодирующий белок р53, который
осуществляет контроль за деятельностью ДНК, регулирующий процесс
деления клетки. В случае возникновения в клетке нарушений белок р53
инициирует процесс апоптоза, уничтожая поврежденную клетку.
Однако этот процесс находится под контролем и вначале при
возникновении повреждений в структуре ядерной ДНК р53 активирует гены,
кодирующие белки, обеспечивающие репарацию ДНК. Если
нарушения значительные, то р53 репрессирует синтез белков, участвующих
в делении клетки, и при этом инициирует программы апоптоза.
В целом апоптоз прежде всего предназначен для защиты животного
организма от действия возбудителей инфекционных заболеваний.
Вирусы вызывают нарушения в деятельности инфицированной клетки,
что обуславливает инициирование процессов ее гибели. Таким
образом, организм избавляется от поврежденной клетки, предотвращая
развитие инфекции. Однако в ряде случаев некоторые вирусы
содержат гены, которые обеспечивают синтез белков схожих по строению
с апоптозными белками, способствуя размножению вируса. Кроме
того, некоторые вирусы вырабатывают вещества, способные
стимулировать процессы синтеза клеткой ее собственных антиапоптозных
белков, обеспечивая беспрепятственное размножение вирусов.
Инструментом апоптоза могут быть активные формы кислорода.
Кислород участвует в процессе окислительного фосфорилирова-
ния, которое протекает в митохондриях. Основным потребителем
02 в митохондриях является цитохромоксидаза — фермент,
восстанавливающий кислород до молекулы воды, перенося на него четыре
электрона и четыре протона. Избыток кислорода может
восстанавливаться до супероксида (02), который супероксиддисмутазой
превращается в перекись водорода. 02- и Н202 являются
предшественниками радикала гидроксила (ОН), который проявляет себя как
сильнейший окислитель, разрушающий клеточные структуры (мемб-
318
Глава 6. Метаболические процессы
раны, органеллы, ДНК, РНК, белки и др.). АФК способны нарушить
деятельность АТФаз, делая их проницаемыми для различных
низкомолекулярных соединений. При этом во внутренней мембране
митохондрий появляются поры высокой проницаемости, возникновение
которых приводит к нарушению осмотического давления в матриксе
и межмембранном пространстве митохондрий, сопровождаемому
нарушением целостности структуры внешней мембраны митохондрий,
с последующим выходом белков в цитоплазму клетки. В составе белков
присутствуют цитохром с, фактор, инициирующий апоптоз (арор1о5ю-
1пйис1п§ ГасЮг, А1Р), второй митохондриальный фактор,
активирующий апоптоз (зесопй гт1осЬоп<1па1 арор1о$1$-ас1|уа1тё ГасЮг, 5тас)
и прокаспаза-9.
А1Р — белок межмембранного пространства митохондрий —
является флавопротеином. Из цитоплазмы клетки он переносится в ядро,
где активирует нуклеазу, расщепляющую ядерную ДНК на фрагменты
по 50 000 пар нуклеотидов. Апоптоз, вызванный действием А1Р, может
протекать и без участия каспаз.
8тас участвует в активации апоптоза за счет того, что, связываясь с
белками 1ар, снимает их ингибирующее действие на каспазы-9 и -3.
Таким образом, проявляется активирующий эффект Зтас на каспазы.
Процесс апоптоза инициируется комплексом, в образовании
которого участвуют цитохром с, белок АраГ-1 (первый фактор,
активирующий апоптоз), дезокси-АТФ (<1АТФ) и несколько молекул прокас-
пазы-9.
АраГ-1 является белком с молекулярной массой 130 кДа,
содержащим САКО-домен на Г^-конце и на С-конце — 12 повторяющихся
дипептидных (триптофан и аспартат) последовательностей. Такие
последовательности свойственны белкам, принимающим участие в
регуляции деления и дифференцирования клеток, транскрипции генов,
модификации мРНК, трансмембранной передаче сигналов.
После образования комплекса цитохрома с, АраГ-1 и <1АТФ от про-
каспазы-9 отщепляется небольшой пептид, не обладающий
каталитической активностью. Образовавшаяся после этого каспаза-9
активирует прокаспазу-3, превращая ее в каспазу-3. Последняя проявляет
протеолитическую активность в отношении ферментов ключевых
метаболических процессов, а также зимогенов нуклеаз и структурных
белков. В результате совместного действия протеаз и нуклеаз, в клетке
расщепляются белки и нуклеиновые кислоты и этот процесс
завершается гибелью клетки.
319
Биохимия животных
Активатором каспазы-3 может быть КСО-пептид, в составе
которого три последовательно связанных аминокислотных остатка (арги-
нин-глицин-аспартат). Такая же последовательность
аминокислотных остатков обнаруживается и вблизи активного центра каспазы-3.
Причем в молекуле прокаспазы-3 КСО-последовательность участвует
в формировании конформации фермента, при которой он не обладает
протеазной активностью, т. е. находится в неактивном состоянии.
Однако если КСО-пептид связывается с аналогичной
последовательностью в прокаспазе-3, то эти взаимодействия инициируют
изменения в конформации зимогена, олигомеризацию и аутопроцес-
синг прокаспазы-3 в каспазу-3.
В инициировании апоптоза могут участвовать окисленные формы
фосфатидилсерина и фосфатид ил этанол амина. В норме фосфоли-
пиды располагаются на внутренней поверхности плазмалеммы. Такое
расположение обусловлено действием специализированных
транспортных АТФаз, переносящих фосфолипиды из внешнего слоя
мембраны во внутренний. В случае окисления фосфатидилсерина
активными формами кислорода, его окисленная форма не распознается
транспортной АТФазой и он перемещается на внешнюю поверхность
мембраны. Такое расположение окисленного фосфолипида
инициирует фагоцитарную активность лейкоцитов, которые начинают
продуцировать в межклеточное пространство вблизи клетки ферменты
перфорины и фан зимы. Перфорины проделывают в мембране клетки
отверстия, а гранзимы, проникая в клетку, инициируют механизмы
апоптоза.
Особенно следует выделить гранзим В, который относится к сери-
новым протеазам. В активном центре этих протеаз содержится
остаток серина. Гранзим В катализирует превращение прокаспазы-3 в
каспазу-3. При этом его активность в 2 и 7 раз выше, чем соответственно
у каспазы-8 и -10.
Среди семейства каспаз следует выделить каспазу-12, проформа
которой активируется при нарушении внутриклеточного кальциевого
гомеостаза или накоплении белка в эндоплазматическом ретикулуме.
Каспаза-12 активирует каспазу-3, запуская механизм апоптоза.
Лейкоцит может атаковать клетку-мишень, продуцируя супероксид
и другие радикалы. Для этого на внешней поверхности мембраны
лейкоцита располагаются комплексы ферментов, окисляющих НАДФН и
другие соединения, с которых электроны переносятся на флавин и
далее на цитохром Ь. Последний способен окисляться кислородом с об-
320
Глава 6. Метаболические процессы
разованием супероксида, который модифицирует клетки-мишени,
инициируя процесс апоптоза. При этом АФК способны окислять
фосфатидилсерин плазмалеммы клетки-мишени, запуская в них
механизмы апоптоза.
Лейкоциты могут инициировать апоптоз клеток, секретируя в среду
фактор некроза опухолей (Штог песгоыз Гас1ог, ТЫР). Для этого на
поверхности клетки-мишени имеется рецептор, с которым связывается
ТЫР, после чего инициируется каскад лротеазных реакций. При этом
вначале происходит образование из прокаспазы-8 активной каспазы-8,
которая в свою очередь расщепляет белок Вк1, превращая его в
активную форму хВ'хй (1гапса1ес1 ВМ). 1Вк1 воздействует на мембранный белок
Вах, изменяя его конформацию. Это действие способствует появлению
на поверхности мембраны поры и нарушению осмотического
давления, вследствие этого клетка разрушается.
Вопросы и задания для самоконтроля
I. Опишите процессы биосинтеза пуриновых и пиримидиновых
нуклеотидов. 2. Расскажите о процессе распада нуклеиновых кислот.
3. Расскажите о биосинтезе ДНК. 4. Перечислите основные этапы
биосинтеза РНК. 5. Раскройте роль процессинга в формировании РНК.
6. Какие основные функции возложены на ДНК и РНК в клетке?
7. Расскажите о строении и функционировании рибосом. 8. Опишите
процесс фолдинга. 9. Раскройте роль процесса посттрансляционного
протеолиза белков. 10. Назовите функции белков. II. Опишите
механизм транспорта аминокислот через мембраны. 12. Приведите
примеры участия аминокислот в реакциях транс- и дезаминирования.
13. Расскажите об участии аминокислот в реакциях
восстановительного аминирования. 14. Назовите стадии процесса синтеза мочевины
в организме человека. 15. Перечислите основные функции
аминокислот. 16. Расскажите о процессе анаэробного расщепления глюкозы.
17. Опишите стадии синтеза и распада гликогена. 18. Назовите
стадии синтеза глюкозы из неуглеводных соединений. 19. Опишите
превращение углеводов по пентозофосфатному пути. 20. Назовите
витамины, которые являются предшественниками коферментов ПДК.
21. Раскройте значение цикла трикарбоновых кислот. 22. Опишите
ферментативные комплексы, участвующие в процессе
окислительного фосфорилирования. 23. Назовите функции углеводов. 24.
Опишите стадии процесса окисления высших жирных кислот. 25.
Опишите механизм синтеза высших жирных кислот. 26. Расскажите
321
Биохимия животных
о процессе синтеза триацилглицеринов. 27. Опишите этапы процесса
синтеза фосфолипидов. 28. Назовите стадии процесса биосинтеза
сфинголипидов. 29. Опишите стадии процесса синтеза холестерина.
30. Назовите причины образования кетоновых тел. 31. Перечислите
функции липидов. 32. Назовите причины появления активных форм
кислорода в клетках живых организмов. 33. Какие соединения можно
отнести к антиоксидантам? 34. Расскажите о механизме действия
высокомолекулярных антиоксидантов. 35. В чем проявляются
антирадикальная и антиоксидантная активность биогенных антиоксидантов?
36. Расскажите о значении ПОЛ для живых организмов. 37.
Расскажите о возможности использования антиоксидантов в
животноводстве. 38. Опишите процесс автоокисления. 39. Назовите
отличительные признаки некроза и апоптоза животных клеток. 40. Значение
апоптоза для живых организмов.
ГЛАВА 7. ФУНКЦИОНАЛЬНЫЕ СИСТЕМЫ
7.1. КРОВЬ
7.1.1. Химический состав крови
Кровьявляется подвижной тканевой системой, состоящей изплазмы и
форменных элементов. Характеристическими параметрами крови служат
химический состав и физические свойства (плотность — 1,050... 1,060,
вязкость — 4,7...6,0, осмотическое давление — 0,697...0,793 МПа и
др.), которые индивидуальны для каждого вида животных. С
помощью крови во все клетки организма доставляются необходимые для
их жизнедеятельности вещества и кислород, а конечные продукты их
метаболических процессов удаляются через почки.
Кровь животных имеет строго определенную величину рН (табл. 7.1),
колебания значений которого не должны превышать 0,05...0,07
единиц рН. При смещении величины рН крови на 0,3...0,5 единиц
может привести к гибели животного. Так, при септических заболеваниях
рН крови может возрастать до 7,7...7,9. Сильное защелачивание крови
свидетельствует о летальном прогнозе заболевания.
Плазма крови имеет светло-желтую окраску и получается с
помощью центрифугирования крови. Если кровь отстаивать при 4°С
в течение суток, то получается слегка желтоватая жидкость —
сыворотка крови. Желтая окраска плазмы и сыворотки обусловлена
присутствием в ней билирубина и каротиноидов, однако сыворотка
отличается от плазмы крови тем, что в ней нет фибриногена с компонентами
свертывания крови. Химический состав плазмы разнообразен и не
постоянен. Он зависит от вида животного, пола, возраста, условий
содержания, стрессирующих факторов, кормления, состояния
здоровья, физической нагрузки и др. (табл. 7.1).
323
I
$
3
СО
"Т.
о"
«Л I О
го
го
I О
©
оо*
о
СП
©I
00
©Ч
«о
оо
го
се
ю
I ^1
о
го
го
л 1
324
Глава 7. Функциональные системы
Основными компонентами плазмы крови являются аминокислоты,
гормоны, ферменты, витамины, липиды, углеводы, кроме того,
продукты обмена веществ: молочная, пировиноградная, ацетоуксусная, <х-
кетоглутаровая, лимонная, угольная и другие кислоты, мочевина,
мочевая кислота, С02, 02, и др. В составе плазмы крови присутствуют
ионы N8*, К\ Са2+, Ме2+, Си2+, Мп2+, Ре3+, 2п2*, Со3+, СГ, НС03-,
НР042"\ Н2Р04" и др. Одни из них находятся в свободном состоянии
(№+, К+, Са2\ М§2+, Мп2+), а другие входят в состав белков и
низкомолекулярных соединений.
Основным белком плазмы крови служит альбумин, который может
легко проникать через стенки сосудов в ткани и после гидролиза
обеспечивает клетки аминокислотами, которые впоследствии
используются в процессе синтеза функциональных белков. На поверхности
белковой глобулы альбумина могут адсорбироваться различные гормоны,
витамины, токсины, лекарственные соединения, ионы металлов,
которые с помощью альбумина разносятся по всему организму.
Поверхностные заряженные группы аминокислотных остатков белков
обеспечивают буферные свойства крови. Среди белков следует выделить группу
зимогенов, которые в норме находятся в неактивной форме, однако
при повреждении тканей участвуют в свертывании крови.
Транспорт ионов металлов осуществляет гаптоглобин — переносчик
железа, цинка, меди, тогда как церулоплазмин и лактоферрин являются
соответственно медь- и железосодержащими белками крови. Оба белка
предназначены для накопления и переноса ионов меди и железа,
адсорбируя их на поверхности белковой глобулы. Как
специализированные переносчики они способны обеспечить поступление ионов меди
и железа в организм детенышей, ликвидируя, таким образом,
недостаток этих ионов в растущем организме. Однако между собой
церулоплазмин и лактоферрин различаются по молекулярной массе — 151
и 76,5 кДа соответственно. Очищенный церулоплазмин имеет голубую
окраску за счет высокого содержания меди (8 атомов меди на молекулу
белка), катализирует реакции оксидазного окисления аскорбиновой
кислоты, гидрохинона, катехолов и р-фенилендиамина. Оптимум
активности церулоплазмина приходится на рН 5,6...6,0. Ингибиторами
фермента являются цианид и азид, а активаторами — Ре2+.
7.1.1 Л. Липопротеины
Липопротеины крови представляют собой сложные белково-ли-
пидные комплексы, выполняющие преимущественно транспортные
325
Биохимия животных
функции, т. е. переносят нерастворимые в полярной среде
соединения. Нарушение их количественного состава в крови может привести
к возникновению некоторых тяжелых заболеваний.
Липопротеины вырабатываются преимущественно клетками
тонкого отдела кишечника и печени. Основу структуры липопротеина
определяют белки мембран клеток, а их внутренний состав
образован из производных липидов и индивидуален для каждого типа
сложных белков, т. е. информация о структуре липопротеина должна
храниться в ДНК и экспрессироваться в специализированных клетках
организма.
Номенклатура липопротеинов плазмы крови основана на их
поведении при проведении электрофореза и аналитического
центрифугирования.
За счет высокого содержания липидов липопротеины имеют
низкую плотность. В составе липопротеинов определяются
индивидуальные белки, обозначаемые буквами А, В, С, О, Е, Р. Некоторые из них
представляют семейства и обозначаются еще и цифрами (А-1, А-П,
С-1,С-Пит.д.).
Каждый класс липопротеинов имеет несколько белков. Так,
например, 90% всех Л ПВП содержат А-1 и А-Н и только 10% — по-А-1.
Аналогичная гетерогенность определяется и для ЛПОНП. Кроме того, во
фракции Л ПОНП найдены апо-В и апо-С
Белки липопротеинов могут осуществлять связь с липидами,
выполняя структурообразующую функцию, а также участвуют в
реализации активности ферментативных систем. Наличие общих белков
в составе разных липопротеинов указывает на возможное участие их
в совместных действиях.
Основной функцией липопротеинов является транспорт
нерастворимых в воде липидов от места синтеза и всасывания, до места их
утилизации или резервирования. Липопротеины переносят
холестерин, стероидные гормоны, жирорастворимые витамины,
нейтральные липиды, высшие жирные кислоты, желчные кислоты и
пигменты. Участвуют в построении клеточных мембран и субклеточных
структур.
Взаимопревращения липопротеинов за счет перехода их
компонентов от одного типа к другому обуславливает реализацию единого
гомеостатического механизма, нарушение которого может
способствовать возникновению различных форм дислипопротеиндемий, т. е.
развитию заболеваний вызванных изменением концентрации в плазме
326
Глава 7. Функциональные системы
крови определенных классов липидов. Различают гипер-, гипо- и али-
попротеиндем и и.
Повышение в крови содержания ЛПНП и ЛПОНП
сопровождается возникновением атеросклероза. Проявлением заболевания
служит отложение липидов (холестерина и триацилглицеринов) на
поверхности стенок артерий и образование бляшек, что способствует
сужению просвета сосудов.
7.1.1.2. Интерфероны
К семейству белков, обладающих специфичностью в механизме
действия, относятся интерфероны. Эти белки способны проявлять
себя как противовирусные агенты. Причем они активны против
разных вирусов, но обладают видовой специфичностью. Поэтому
каждому виду животных свойственен свой специфичный в
строении интерферон. Различают три вида интерферонов: а-интерферон
(лейкоцитарный), (5-интерферон (фибробластный) и у-интерфе-
рон (иммунный). Интерфероны по строению белки с
молекулярной массой 17,5 кДа. Большинство а-интерферонов не содержат
на поверхности углеводов, тогда как (}- и у-интерфероны относятся
к гликозидам.
Первично в клетках синтезируется предшественник интерферона,
содержащий сигнальный пептид из 23-х аминокислотных остатков.
Этот пептид отщепляется от белка при его секреции.
Действие интерферона обусловлено его связыванием
клеточными рецепторами, расположенными на поверхности плазмалеммы.
При этом инициируется процесс синтеза в клетке двух ферментов:
2',5'-олигоаденилатсинтетазы и протеинкиназы, т. е. эффект действия
интерферона подобен гормону. Ферменты проявляют свою
активность в присутствии двухцепочечных РНК, которые могут быть
продуктами репликации вирусов или содержаться в его вирионах.
2',5'-Олигоаденилатсинтетаза инициирует реакции синтеза 2',5'-оли-
гоаденилатов из АТФ, которые в свою очередь активируют рибонук-
леазу I. Протеинкиназа осуществляет фосфорилирование фактора
инициации трансляции 1Р2. В результате этих действий наблюдается
ингибирование процессов биосинтеза белка и вследствие этого
подавление размножения вирусов в инфицированной клетке, с
последующим их лизисом.
Интерфероны используются в лечебной практике в малых дозах
путем местного или парентерального введения (внутривенно, внут-
327
Биохимия животных
римышечно, подкожно). Кроме противовирусного действия, интер-
фероны обладают антиклеточной, противоопухолевой и иммуномо-
дулирующей активностью.
7.1.1.3. Иммуноглобулины
В крови животных идентифицированы представители пяти
классов иммуноглобулинов — 1§А, 1^Е, 1^0,1&С, ]%М.
Иммуноглобулины 1§А (500 кДа) являются основными классами
антител в секретах (слизи, слезах, секретах дыхательных путей и
кишечника, молоке); содержат 10... 12% углеводов; могут находиться
в мономерной и димерной формах. В последней содержится .1-цепь,
которая образует комплекс с димерной формой, называемый
секреторным компонентом. Поступление в секреты комплекса
обусловлено механизмами клеточного эндоцитоза, переносящего его
через цитоплазму эндоплазматических клеток. При этом секреторный
компонент защищает 1§А от действия протеолитических ферментов
в секретах.
Иммуноглобулины \^0 (175 кДа) относятся к минорным
компонентам сыворотки крови. В основном они локализуются на
мембране В-лимфоцитов, выполняя роль рецепторов с высоким
содержанием связанных с белком углеводов, участвующих в распознавании
антигенов.
Иммуноглобулины \%Е (200 кДа) являются минорными
компонентами сыворотки крови. Способны осуществлять защитную функцию
в организме от действия паразитарных инфекций, обуславливают
многие аллергические реакции; механизм действия 1§Е проявляется
через связывание с высоким сродством (10~ш • М) с поверхностными
структурами тучных клеток, с последующим присоединением к ним
антигена, вызывая дегрануляцию и выброс в кровь высокоактивных
аминов (гистамина и серотонина — медиаторов воспаления).
Иммуноглобулины 1§С (150 кДа) являются основным классом
иммуноглобулинов крови. В составе \%0 2...3% углеводов. Два
антигенсвязывающих Рав-фрагментов и один РС. Рав-фрагмент
(50...52 кДа) состоит из целой Ь-цепи и Г^-концевой половины
Н-цепи, соединенных между собой дисульфидной связью, тогда как
в РС-фрагмент (48 кДа) входит только половина Н-цепей. Всего
в молекуле 1^0 12 доменов (участки, сформированные из Р-струк-
туры и а-спиралей полипептидных цепей \% в виде неупорядоченных
образований, связанных между собой дисульфидными мостиками
328
Глава 7. Функциональные системы
аминокислотных остатков внутри каждой цепи): по 4 на тяжелых и по
2 на легких цепях.
Иммуноглобулины 1§М (950 кДа) — класс антител, которые
продуцируются В-лимфоцитами в начале иммунного ответа. Содержат 10... 12%
углеводов. Образование 1§М происходит еще в пре-В-лимфоцитах,
в которых первично синтезируются из |д-цепи. Синтез легких цепей
в пре-В-клетках обеспечивает их связывание с ц-цеиями, в результате
образуются функционально активные 1§М, которые встраиваются в
поверхностные структуры плазматической мембраны, выполняя роль
антиген распознающего рецептора. С этого момента клетки ире-В-лим-
фоцитов становятся зрелыми и способны участвовать в иммунном
ответе. В секреторной форме 1§М представляют пентамеры,
состоящие из 5 мономерных иммуноглобулинов, в составе которых 10 анти-
генсвязывающих центров. При этом каждый пентамер содержит одну
копию полипептида с ^цепью (20 кДа), который синтезируется анти-
телообразующей клеткой и ковалентно связывается между двумя
соседними РС-фрагментами иммуноглобулина.
7.1.1.4. Медиаторы
Медиаторами являются молекулы, обладающие регуляторным
механизмом действия через рецепторную систему клеток-мишеней.
К группе медиаторов относятся гистамин, серотонин, гепарин, бра-
дикинин, простагландины, лейкотриены, лимфокины, цитокинины
и др.). Вырабатываются медиаторы в специализированных клетках
(нейтрофилы, эозинофилы, базофилы, тучные клетки и др.) в ответ
на воздействие и предназначены для инициирования
индивидуальной активности клеток-мишеней и побуждению их к действию. Для
проявления действия медиатора на поверхности мембраны клетки
располагается специфичный рецептор. В дальнейшем сигнал от
рецептора передается во внутрь клетки, инициируя каскад
биохимических реакций, конечной целью которых служит проявление
индивидуальной активности клетки.
Гистамин. Это аминосодержащее функционально активное
соединение, образующееся из гистидина в реакциях декарбоксили-
рования. Больше всего гистамина содержится в тучных клетках и
базофилах. Превращение гистидина в гистамин катализирует гисти-
диндекарбоксилаза (1), кофактором которой служит пиридоксаль-5-
фосфат. В структуре фермента одна полипептидная цепь (55 кДа).
329
Биохимия животных
□
СН2-СН2-СООН
I
ын2
Гистидин
|^со2
у=^-СН2-СН2-МН2
[СЫН
«гт-СК-СК-ЫН
12 ЧуП2 1^1 12
_► СНз-Мч^Ы
Гистамин
N4,
А
к^
=^-СН2-СООН
Имидазол-5-уксусная кислота
З-Метилгистамин
у*
у
/—^-СЦ-СООН
З-Метилимидазол-5-уксусная
кислота
Гистамин откладывается в крупных гранулах базофильных клеток,
откуда и высвобождается при их активации. Внутри гранул гистамин
находится в комплексе с протеогликаном, связываясь с его
карбоксильной группой. Секретируется гистамин из клеток через
специализированные каналы. Гистамин проявляет меньшую активность,
чем другие медиаторы реакции гиперчувствительности немедленного
типа (ЛТ-Э4, ЛТ-В4, С5а, ФАТ). За счет малых размеров гистамин
быстро распространяется в месте локализации, оказывая регулятор-
ное действие. В метаболизации гистамина участвует гистаминтранс-
фераза (2), присоединяющая к гистамину метильную группу в N-3
положении. Затем 3-метилгистамин окисляется с помощью моноами-
ноксидазы (3) до З-метилимидазол-5-уксусной кислоты. Кроме того,
часть гистамина окисляется диаминоксидазой (4) до имидазол-5-ук-
сусной кислоты.
Больше всего в моноцитах содержится ^метилтрансферазы, а к ней-
трофилах и эозинофилах преобладает активность гистаминазы.
Гистамин участвует в регулировании механизмов сокращения
гладких мышц трахеи, бронхов, кишечника и эндоэпителиальных желез,
а также повышает проницаемость сосудов кожи и других органов.
Увеличение проницаемости сосудов достигается расширением терми-
330
Глава 7. Функциональные системы
нальных артериол и сужением посткапиллярных венул. Эти действия
гистамина проявляются через Н1-рецепторы, которые специфичны
к этиламинной группе и угнетаются Н1-ингибиторами (пириламин
и хлорфениламин). Так, связывание гистамина с Н1-рецепторами
инициирует секрецию соляной кислоты в желудке, а также проявляет
влияние гистамина на сердце и индивидуальное действие на
лейкоциты. Кроме того, действие гистамина может ускорить синтез в
тканях простагландинов (ПГ-Е2 и ПГ-Р2а), являющихся сильными брон-
хоспазмогенами.
Гистамин способен угнетать вызванную лектинами или
аллергенами пролиферацию Т-лимфоцитов, активизировать
высвобождение лимфокинов из Т-клеток, индукцию цитотоксических Т-кле-
ток, цитолиз, способствовать цитолизу зрелыми цитотоксическими
Т-клетками, оказывать влияние на дифференцировку В-клеток,
увеличивать секрецию лизосомных ферментов нейтрофилами и
инициировать 1§Е-зависимое высвобождение гистамина из базофилов.
Кроме того, гистамин проявляет хемокинетическое и хемотаксиче-
ское действие на нейтрофилы и эозинофилы.
В тучных клетках гистамин связан с гепариноидами, поэтому
при разрушении тучных клеток в процессе анафилактической
реакции вместе с гистидином в среде появляются серотонин и гепарин.
При этом гепарин действует при анафилаксии как антикоагулянт.
Однако это проявляется не у всех животных. Секреция гистамина из
тучных клеток происходит через специализированные транспортные
каналы, работа которых находится под контролем аденилатаиклазной
системы. Инициатором механизма секреции гистамина является
антиген-антитело, которое взаимодействует с клеткой-мишенью. В
образовании комплекса антиген-антитело принимает участие
иммуноглобулины класса Е. Причем реакции инициируются только при
связывании с антигеном не менее двух молекул 1§Е, которые
ориентированы таким образом, что их Рс-фрагмент связан с клеткой, а РаЬ-
фрагмент — с антигеном. Комплекс антиген-антитело при
связывании с тучной клеткой инициирует активность аденилатциклазной
системы. В результате образуется цАМФ, который активизирует
последовательно деятельность следующих ферментов: протеинкиназы и
фосфолипаз. Последние, воздействуя на структуры клеточной
мембраны, способствуют образованию в ней каналов, через которые
гистамин и другие медиаторы выходят наружу. Высвобождению
медиаторов способствуют ионы кальция, которые участвуют в механизме
331
Биохимия животных
сокращения микрофиламентов и микротрубочек, перемещающих
гранулы клетки к ее мембране и обеспечивающие экзоцитоз.
Серотонин. Серотонин, или 5-гидрокситриптамин образуется при
участии декарбоксилазы ароматических аминокислот (1), которая не
обладает высокой субстратной специфичностью и способна
катализировать реакции декарбоксилирования триптофана и 5-окситриптофана
в соответственно триптамин и серотонин. Реакции гвдроксилирования
триптофана и триптамина катализирует триптофан-5-монооксигеназа
(2) в присутствии тетрагвдроптерина и кислорода с образованием
соответственно 5-окситриптофана и 5-окситриптамина (серотонин). В
дальнейшем серотонин может легко превращаться в 5-гидроксииндолацетат при
помощи монооксигеназ (3).
С®
-сн,—сн-соон о2
сю
ыи7
Н Триптофан
к,
>со2
-сн2—си,
ын2
н
Триптамин
ш
"ОТ"
■сн-соон
I
1ЧН2
н
в
со
5-Окситриптофан
СОа
СН2 —СН2
ЫН,
Н
Серотонин
И И'
мн3*/*
но>^ЧчЛ—я— сн2—соон
н
5-Гидроксииндол ацетат
Серотонин содержится в тромбоцитах, энтерохромаффинных клетках
пищеварительного тракта, тучных клетках, базофилах и других клетках
и тканях.
332
Глава 7. Функциональные системы
Серотонин способен вызывать сокращение гладкомышечных
волокон кровеносных сосудов, кишечника, бронхов и матки. Эти действия
сопровождаются повышением артериального давления, а в
результате спазма почечных сосудов может наступить некроз коркового
слоя почек, так как спазм мышц бронхов может привести к развитию
приступов бронхиальной астмы. Действие серотонина на мышцы
кишечника проявляется в усилении перистальтики и может
способствовать развитию симптомов непроходимости. В почках
серотонин оказывает антидеуретическое действие, способствуя задержке
натрия, калия и воды в организме. Освобождающийся из
тромбоцитов серотонин способствует остановке кровотечения, вызывая спазм
сосудов. При повышении давления серотонин может вызывать
фиброз клапанов или даже всего эндрокарда правой половины сердца.
В процессе развития воспаления серотонин способствует
расширению артериол, одновременно вызывая спазм венул, что приводит
к локальному отеку за счет повышения проницаемости плазмы крови
в ткани.
Простагландины (ПГ)* Эти соединения относятся к группе
низкомолекулярных функционально активных веществ, образующихся из
арахидоновой кислоты (С20:4), имеющих в составе циклопентановое
кольцо. Выявлено несколько групп простагландинов (Е, Р, Н, О и
др.), различающихся по положению и типу замещающих групп (гид-
рокси и оксо) в циклопентановом кольце. Синтез простагландинов
происходит во всех клетках (рис. 7.1). Вначале простагландинсин-
таза (1) включает две молекулы кислорода в структуру арахидоновой
кислоты с образованием промежуточных продуктов — простаглан-
динэндоперекисей (ПГ-С2 и ПГ-Н2). Последние под действием
простагландинизомеразы (2) превращаются в простагландины (ПГ-
Е2, ПГ-02, ПГ-Р2). В реакции донором атомов водорода служит глу-
татион.
Простагландины способны оказывать действие на гладкие мышцы
пищеварительного тракта, репродуктивные и респираторные ткани,
на мышцы сосудов, регулируют нервное возбуждение, процессы
воспаления, скорость почечного кровотока. В проявлении действия
простагландинов принимает участие аденилатциклазная система.
Лейкоциты способны продуцировать различные простагландины.
Так, макрофаги и моноциты вырабатывают ПГ-Е2 и ПГ-Р2а. В ней-
трофилах синтезируются в основном ПГ-Е2, а в тучных клетках —
ПГ-Э2.
333
Биохимия животных
^8 85 1 СООН
11 12 14 15
Арахидоновая кислота
- - 14 15
онова*
ш
ОН 6[0]Н
соон
Тромбоксан А2
Глутатион
ОН
Простациклин РС-12
Л^Чя^^^^Чсоон у^Г^ч=^ч^>чсоон >Ц^«^Ч^^соон
у-ч^у^^^ у^ч^хчхч^ У^у^ч^
он он
РС-Е2
о он
рс-о2
он он
РС-Р2
Рис. 7.1. Метаболизм производных арахидоновой кислоты:
/ — простагланлинсинтаза; 2 — простагланлинизомераза;
3 — тромбоксансинтазы; 4 — простациклинсинтетаза
Наиболее изучено действие ПГ-Е2, который индуцирует диффе-
ренцировку тимоцитов, В-лимфоцитов, клеток предшественников
гематопоэза и стимулирует эритропоэз. Однако ПГ-Е2 способен ин-
гибировать пролиферацию Т- и В-клеток, хемотаксис, хемокинез,
агрегацию, распластывание лейкоцитов, подавляет цитотоксичность
Т-клеток, ускоряет высвобождение медиаторов воспалительного
процесса, монокинов или лимфокинов из тучных клеток, базофилов,
нейтрофилов, моноцитов и лимфоцитов.
Кроме того, ПГ-Е2 и ПГ-02 угнетают агрегацию тромбоцитов.
Простагландины вызывают лихорадку, эритему, увеличивают
проницаемость сосудов и расширяют их, усиливают боль и отек, вызванный
брадикинином и гистамином. Действие простагландинов
проявляется через рецепторы, которые располагаются на поверхности мем-
334
Глава 7. Функциональные системы
браны клеток. Так, рецепторы гепатоцитов способны связывать про-
стагландин с Кд равной 1 • 10~9 и 2,5 • 10"8 М. При этом количество
рецептов составляет 200...300 на одну клетку.
Насинтез простагланди нов оказывают влияние эндотоксины,
комплекс антиген-антитело, ионофор А23187, колхицин, зимозан и лим-
фокины. При этом лимфокины, образующиеся при инкубации
сенсибилизированных лимфоцитов с антигеном, способны инициировать
образование простагландинов макрофагами. Однако
накапливающиеся простагландины способны ингибировать процессы синтеза лим-
фокинов и митогенез Т-клеток. Таким образом, в системе может
реализоваться регуляторный механизм отрицательной обратной связи,
когда возрастание концентрации одного из соединений, в частности,
простагландинов макрофагами подавляет ответное действие
лимфоцитов.
Тромбоксаны (1к). Тромбоксаны относятся к производным арах и-
доновой кислоты, в структуре которых — циклогексановое кольцо.
Синтез тромбоксанов происходит в тканях мозга, селезенке, легких,
почках, а также тромбоцитах из простагландинов ПГ-Н2 при участии
тромбоксансинтетазы. Ингибиторами фермента являются замещенные
производные имидазола. Антиоксиданты подавляют синтез
тромбоксанов.
Кроме того, синтез тромбоксанов ингибируется эндопероксидами
простагландинов. Основными источниками тромбоксанов у
млекопитающих являются тромбоциты, макрофаги и моноциты.
I он
он
Тромбоксан А2 Тромбоксан В2
Тромбоксан А2 инактивируется при участии 15-оксипростаглан-
диндегидрогеназы (1) до тромбоксана В2. В качестве кофермента
в ферментативной реакции используются НАД+ или НАДФ+.
Тромбоксаны способны вызывать агрегацию тромбоцитов,
инициируя процессы тромбообразования. Кроме того, они оказывают
сильное сокращение мышц, кровеносных сосудов. ТкА2 способен вызывать
335
Биохимия животных
сильное сокращение гладких мышц трахей и бронхов. В отличие от ПГ-
Е2 и ПГ-12, Тк-А2 понижает концентрацию цАМФ в тромбоцитах.
Простациклины (ПГ-1). Синтез простациклинов катализирует про-
стациклинсинтетаза, которая осуществляет циклизацию с включением
в структуру простагландина атома кислорода. После этого простацик-
лин может быстро разрушаться при участии 15-оксипростагландинде-
гидрогеназы (1) до6,15-дикето-РС-Р1а.
соон
соон
РС-12 6Л5-дикето-РС-Р,а
Простациклин синтезируется в эндотелии сосудов, макрофагах,
тучных клетках сердечной мышцы, матки и слизистой оболочки
желудка. Способен расширять кровеносные сосуды, увеличивать их
проницаемость, инициировать процессы разрушения тромбоцитов,
ингибировать процессы агрегации тромбоцитов, активировать фиб-
ринолиз. Ингибиторами простациклинсинтетазы являются гидропе-
роксиды — продукты липоксигеназы. Действие ПГ-12 проявляется
через аденилатциклазную систему, сопровождается увеличением
концентрации цАМФ. Кроме того, они повышают действие медиаторов
воспаления на проницаемость сосудов, усиливают болевой синдром.
Лейкотриены (ЛТ). Предшественником лейкотриенов является
арахидоновая кислота, имеющая в своей структуре 20 углеродных
атомов, четыре двойные связи, некоторые из них образуют пептидоли-
пидные комплексы с глутатионом (ЛТ-С) или цитеинилглицином
(ЛТ-О) или цистеином (ЛТ-Е). Синтез лейкотриенов катализирует
липоксигеназа, которая присоединяет кислород к цис-1,4-пентади-
енам углеводородной цепи жирных кислот, превращая их в гидро-
пероксиды и вызывая перераспределение двойных связей (рис. 7.2).
В механизме действия фермента принимает участие один атом железа
на молекулу. Субстратами липоксигеназы могут быть эфиры жирных
336
Глава 7. Функциональные системы
кислот и спирты. Активаторами фермента являются фосфолипиды
и диацилглицерины. Активность липоксигеназы регулируется анти-
оксидантами. Избирательное ингибирующее действие на липоксиге-
назу оказывают ацетиленовые аналоги С19...С22 ненасыщенных
жирных кислот, а также 15-ГПЭТЕи 15-ГЭТЕ.
Арахидоновая кислота
5-ГПЭТЕ Глугатион 5-ГЭТЕ
ш
соон
ын,-сн-сн1-сн,-с-мн-сн-с-нн-сн2-соон
о сн, о
3 ОН
,СООН
Лейкотриен В Лейкотриен С
К
КН.-СН-СООН Г—] КН,-СН-С-МН-СН,-СО0Н
сн, , , ,
I •< *- ■* 8 ОН
? он _Г_Х _ и . соон
К-Глу "'
у-Л/Ц^Ч/соон Глицин Н20 Гл)\/\/™
Лейкотриен Е Лейкотриен V
Рис. 7,2. Схема синтеза лейкотриенов: / — липоксигеназа;
2 — глутатион-5-трансфераза; 3 — у-глутамилтрансо>ераза;
4— цистеинилглииин дипептидаза; 5 — эпоксидгидролаза;
б — глутатионпероксидаза
337
Биохимия животных
Лейкотриены оказывают влияние на сокращение гладких мышц
легких, пищеварительной системы, кровеносных сосудов и
стимулируют сокращение коронарных артерий.
Источником лейкотриенов могут быть базофилы, перитониаль-
ные альвеолярные моноциты и моноциты крови, нейтрофилы, эози-
нофилы, тучные клетки кишечника.
Синтез лейкотриенов может индуцироваться ионофором А23187,
ядом кобры, иммунными комплексами и агрегированными
иммуноглобулинами (1&Е и 1§С-антителами).
Гидропероксиды жирных кислот активируют гуанилатциклазу,
стимулируя, таким образом, образование внутриклеточного цГМФ. Кроме
того, ТЭТЕ служат медиаторами воспалительного процесса.
Кинины. К группе кининов относятся низкомолекулярные белки
(олигопептиды), участвующие в реакциях немедленной
гиперчувствительности. Они образуются в плазме или в тканях в процессе
активации свертывания крови из белков — кининогенов. Реакции
превращения кининогенов в кинины катализируют ферменты — калликреины,
большая часть которых представлена аргининовыми эстеразами.
Кинины могут изменять тонус и проницаемость кровеносных сосудов,
снижают кровяное давление, повышают секрецию медиаторов
лейкоцитами. Наиболее изученным кинином является брадикинин, в
составе которого девять аминокислот (нонапептид). Брадикинин
повышает проницаемость сосудов, снижает артериальное давление и
вызывает боль. Низкие концентрации брадикинина стимулируют
сокращение гладких мышц кишечника, а высокие — сокращение мышц
матки. В активации калликреинов принимают участие фактор XII,
прекалликреин и высокомолекулярный кининоген (рис. 7.3). Все три
белка относятся к факторам свертывания крови и их действие
обусловливает инициирование процесса свертывания крови. Комплекс из
этих белков формируется на отрицательно заряженных поверхностях
в местах повреждения стенок кровеносных сосудов или тканей.
Механизм свертывания крови инициируется фактором XII, который
расщепляется на активированные факторы XI 1а и XI1Ь (28 кДа).
Последний активирует превращение прекалликреина в калликреин. Затем
фактор XI 1а вместе с калликреином и кинином превращают фактор
XI в активную форму Х1а. Кроме того, калликреин участвует в
образовании плазмина из плазминогена. Плазмин относится к
специфическим протеиназам, основной функцией которых является активация
фибринолизина за счет расщепления фибрина, системы комплемента
338
Глава 7. Функциональные системы
и дальнейшего протеолиза фактора XII, подавляя активность системы
свертывания крови. Таким образом, в результате совместного
действия различных систем достигается вначале образование кровяного
сгустка, а затем его растворение. При этом система комплемента
непосредственно участвует в процессе свертывания крови. Кроме того,
активация системы комплемента может инициировать и
свертывание крови. Активированные лейкоциты способны секретировать ки-
нин-генерирующие ферменты, которые обладают протеолитической
активностью и способные катализировать реакции образования ки-
нинов из белков плазмы. Так, нейтрофилы содержат кислые проте-
иназы, продуцирующие лейкокинины из лейкокининогенов. Лей-
кокинины относят по строению к олигопептидам, в составе которых
20...25 аминокислот.
Повреждение сосуда
Прекалликреин
>Х1а-
>• Плазмин
Факторы
свертывания
крови
Фибрин -4-
Рис. 7.3. Механизм инициирования
свертывания крови с участием кининов
В моноцитах, лимфоцитах и базофилах присутствуют различные
типы калликреинов.
В процессе активации фактора XII могут образовываться
различные медиаторы реакции гиперчувствительности: кинины, каллик-
339
Биохимия животных
реин, фибринопептиды, активатор плазминогена и плазмин.
Производные калл икре и на проявляют хемотаксическую активность для
базофилов, моноцитов и нейтрофилов. Кроме того, они вызывают
образование С5а, С1$ и СI г из предшественников, активируют
свертывание крови и нейтрофилы.
Фибринопептиды обладают хемотаксической активностью по
отношению к нейтрофилам, усиливают действие брадикинина, угнетают
лимфоцитарный бластогенез. Активатор плазминогена и плазмин
активируют хемотаксис лейкоцитов и действие системы комплемента,
а также усиливают секрецию ферментов из лейкоцитов и тромбоцитов.
Лимфокины. В защитной реакции организма принимают участие
лимфоциты, которые в активированном состоянии секретируют
комплекс белков, регулирующих рост и дифференцировку клеток
иммунной системы. Эти белки называются интерлейкины или лимфокины.
Среди них следует выделить интерлейкин 2 (1Ь2), который вызывает
пролиферацию активированных Т-лимфоцитов. Интерлейкин 2
продуцируется зрелыми Т-лимфоцитами (Т-хелперами) в результате их
стимуляции антигенами. По строению интерлейкин 2 относится к гли-
копротеинам, в его первичной структуре 133 аминокислотных остатка,
к треонину в положении 3 присоединен углеводный остаток, в составе
которого остатки 1М-ацетилнейраминовой кислоты, галактозы и 1М-аце-
тилгалактозамина. При этом, углеводы на биологическую активность
интерлейкина 2 не влияют. Активный центр интерлейкин 2
формируется аминокислотными остатками, расположенными на 14- и
Оконцах полипептидной цепи, в сближении которых принимают участие
два цистеина, связанных между собой за счет дисульфидной связи.
Действие 11-2 направлено на клетку-мишень и через соответствующий
рецептор инициируется биосинтетический процесс в клетке. При этом
константа связывания интерлейкина 2 с рецептором равна - 4-Ю*12 М,
что свидетельствует о высоком сродстве 1Ь2 к рецепторам клеток,
проявляя действие при низких концентрациях интерлейкина 2 в крови.
Интерлейкин 2 используется при лечении вирусных заболеваний,
иммунодефицитов, некоторых форм рака.
Интерлейкин I (11-1) продуцируется активированными
макрофагами, а также полиморфноядерными лейкоцитами,
эпителиальными клетками кожи и др. 1Ы инициирует пролиферацию фиброб-
ластов, синтез простагландинов. При этом основной мишенью 1Ь1
являются активированные Т-хелперы, которые в присутствии 1Ы
секретируют 1Ь2.
340
Глава 7. Функциональные системы
Интерлейкин 3 (ИЗ) проявляет свое действие не на зрелые клетки
иммунной системы, а на клетки-предшественники в концентрации
10",,...10"12 М, вызывая рост стволовых клеток и предшественников
Р-клеток. Источником 1ЬЗ являются активированные Т-хелперы. По
строению Ю относится к гликопротеинам, в составе полипептидной
цепочки которого 134 аминокислотных остатка.
Кроме интерлейкинов, клетками иммунной системы
продуцируются еще лимфотоксин и фактор некроза опухолей.
Лимфотоксин (ЬТ) вырабатывается лимфоцитами, обладает ци-
тостатической активностью. Его действие усиливается в присутствии
у-интерферона.
Фактор некроза опухолей (ТЫР) способен активировать процесс
лизиса некоторых опухолей. Вырабатывается активированными
макрофагами. В составе полипептидной цепи активной формы 157
аминокислотных остатка. Для активизации ТЫР от его предшественника
отщепляется пептид с 76 аминокислотными остатками.
Л имфокины и Т^ проявляют свое действие через одни и те же
рецепторы, расположенные на поверхности опухолевой клетки.
Гепарин. Гепарин — протеогликан, в составе которого сульфатные
группы, состоящие из остатков глюкуроновой и идуровой кислот и
2-глюкозамина. Особенно много гепарина содержится в тучных
клетках животных. Гепарин образует комплексы с антитромбином,
предотвращая коагуляционное действие тромбина, ингибируя активность
серинэстеразы. Подобным образом гепарин ингибирует действие
других белков, участвующих в свертывании крови (факторов XII, Х1а,
!Ха, калликреина и плазм и на). Кроме того, гепарин участвует в
клеточной пролиферации, стимулирует миграцию эндотелиальных
клеток в капиллярах, понижая активность компонентов комплемента,
регулирует реакции гиперчувствительности замедленного типа,
образует комплексы с главным щелочным белком эозинофилов,
усиливает действие эластазы, стимулирует пиноцитоз и фагоцитоз,
осуществляет контроль за связыванием фермента с мембраной клетки.
7.1.2. Форменные элементы крови
В состав форменных элементов крови входят эритроциты —
красные кровяные клетки, а также лейкоциты и тромбоциты.
Качественный и количественный состав форменных элементов индивидуален
у каждого вида животных и может изменяться в зависимости от воз-
341
Биохимия животных
раста, породы, воздействия различных факторов (физическая нагрузка,
содержание, кормление и др.), а также при болезнях.
Лейкоциты представлены несколькими формами,
различающимися по наличию или отсутствию зернистости в цитоплазме после
окраски мазка крови основными или кислыми красителями, они делятся
на соответственно гранулоциты (зернистые) и агранулоциты
(незернистые). К гранулоцитам относятся три вида клеток: нейтрофилы,
эозинофилы и базофилы, тогда как к агранулоцитам — лимфоциты
и моноциты. В ветеринарной практике при анализе крови животных
значение имеет индивидуальный подсчет лейкоцитов, который
выражается в процентах — лейкоцитарная формула (лейкограмма).
Эритроциты. У большинства млекопитающих эритроциты
являются безядерными клетками, тогда как у птиц в эритроците
содержится весь комплекс внутриклеточных орган ел л, в том числе и ядро,
обусловливая их способность к делению (митоз или амитоз).
У млекопитающих эритроцит теряет внутриклеточные органоиды
и ядро во время созревания, утрачивая способность к делению. При
этом он принимает форму двояковогнутого круглого диска, внутри
которого отсутствуют органеллы (митохондрии, ядро и др.).
Средний диаметр эритроцита 5...7 мкм. Форма эритроцитов изменяется
благодаря эластичности мембраны, что позволяет им проходить
через капилляры. Количество эритроцитов в крови КРС 5,0...7,5,
лошади 6,0...9,0, овцы 7,0... 12,0, козы 12,0... 18,0, свиньи 6,0...7,5, собаки
5,2...8,4, кошки 6,6...9,4, кролики 4,5...7,5 млн.
Эритроцит покрыт плазмалеммой, в составе которой 44% липидов
(холестерин, нейтральные липиды, лецитин), 47% белков, 7%
углеводов. Мембранные белки преимущественно являются гликопротеинами.
Один из белков мембраны — спектрин — располагается на ее
внутренней стороне, непосредственно над цитоплазмой, образуя структуру,
благодаря которой эритроцит проявляет пластичные свойства. Другим
белком является гликофорин, представляющий гликопротеин,
который пронизывает липидные слои мембраны, выходя наружу. К этому
фрагменту белка присоединены различные моносахариды, связанные с
молекулами сиаловой кислоты.
Внутри эритроцита содержание гемоглобина составляет 34%.
Эритроциты активно потребляют глюкозу, которая утилизируется
ферментами гликолиза, обеспечивающими в клетке синтез АТФ. Количество
эритроцитов возрастает в условиях недостатка кислорода (гипоксии),
после кровопотерь и при анемиях. Продолжительность жизни эрит-
342
Глава 7. Функциональные системы
роцита в крови около 120 суток. Эритроциты по мере старения
утилизируются лейкоцитами и макрофагами селезенки.
Основной функцией эритроцитов является транспорт
гемоглобина, который связывает Ог и С02, обеспечивая их поступление
соответственно в ткани и в легкие. Поверхностные олигосахариды
мембраны определяют групповые свойства крови. После фагоцитоза
макрофагами из остатков гемоглобина образуются пигменты желчи,
мочи и кала.
Лейкоциты. Предшественниками лейкоцитов являются
стволовые клетки красного костного мозга, из которых вначале образуются
миелобласты и лимфатические стволовые клетки. Из миелоблас-
тов развиваются нейтрофилы, эозинофилы, базофилы и моноциты.
Лимфатические стволовые клетки покидают красный костный мозг,
перемещаются в лимфоидные органы и ткани (селезенка, миндалины
и тимус), а также лимфатические узлы и кожу, где они преобразуются
в лимфоциты.
Лейкоциты свободно мигрируют из сосудов в ткани, выявляя и
уничтожая в них чужеродные белоксодержащие образования (вирусы,
бактерии и др.), а также поврежденные клетки собственных тканей.
Нейтрофилы. Нейтрофильные лейкоциты представлены
подвижными клетками, короткоживущими клетками, обладающими
высокой ферментативной активностью, способны к хемотаксису и
фагоцитозу. Подразделяются нейтрофилы на юные, палочкоядерные и
сегментоядерные. Если ядро лейкоцитов состоит из нескольких
сегментов, соединенных тонкими перемычками, то эти нейтрофилы
называются сегментоядерные, или зрелые. В случае, если ядро в виде
изогнутой палочки или в виде буквы 5 — палочкоядерные, тогда как
нейтрофилы, имеющие бобовидное ядро, называются юные. Высокая
подвижность нейтрофилов осуществляется за счет сокращения мик-
рофиламентов. Размер нейтрофилов может достигать 8... 15 мкм, а их
количество 25...70%. Нейтрофилы содержат небольшое количество
органелл, включения гликогена, тогда как в периферической зоне
содержатся микрофиламенты, обеспечивающие движение клеток. В
аппарате Гольджи на промежуточной стадии развития в костном мозге
образуются гранулы нейтрофилов и в дальнейшем не
восстанавливаются. В гранулах нейтрофилов содержатся следующие гидролазы:
катепсины А, Э и Е, а-фукозидаза, 5'-нуклеотидаза, р-галактози-
даза, арилсульфатаза, а-маннозидаза, Ы-ацетил-р-гл юкозоаминидаза,
Р-глюкуронидаза, кислая р-глицеролфосфатаза, нейтральные проте-
343
Биохимия животных
иназы (катепсин С, эластаза, коллагиназа), миелопероксидаза, лизо-
цим, лактоферрин, щелочная фосфатаза и др. Данный набор
ферментов способен обеспечить расщепление липидов, углеводов, белков и
нуклеиновых кислот бактерий. Причем эти ферменты действуют как
внутри клетки, так и снаружи. Циклические нуклеотиды (цАМФ и
цГМФ) стимулируют высвобождение ферментов из гранул.
Активные формы нейтральных и кислых протеиназ в совместном
действии разрушают эластин, коллаген и другие белки, активизируют
систему комплемента, превращая кининогены в кинины, а также
повышают проницаемость сосудов. Нейтрофилы продуцируют
производные арахидоновой кислоты: простагландин Е2, лейкотриен В4 и
С4, 5-ГЭТЕ, тромбоксан А2.
В воспалительном процессе участвуют СЗа, С5а, гистамин,
действующий опосредовано через СЗа и С5а, лейкотриены, тромбоксан А2,
кинины, ангиотензин II, влияющий на сосудистую проницаемость.
Влияние нейтрофилов на воспалительный процесс может
проявляться через действие ферментов, разрушающих медиаторы и
компоненты комплемента. Так, гистамин окисляется при участии гистами-
назы, а СЗа, С5а, С4, С18 — протеиназами. Ферменты нейтрофилов
могут влиять на свертывание крови, расщепляя фибриноген. Кроме
того, нейтрофилы содержат лизоцим, который способен расщеплять
компоненты клеточных мембран бактерий.
В гранулах нейтрофилов присутствует лактоферрин, который
совместно с миелопероксидазой принимает участие в генерации
активных форм кислорода.
Нейтрофилы обладают высокой фагоцитарной активностью,
которая реализуется последовательно в несколько стадий. Вначале
происходит прикрепление частицы к клеточной мембране нейтрофила, при
этом отмечается возрастание потребления кислорода и
сопровождаемое образованием активных форм. Одновременно повышается
активность фосфолипазы и 5-липоксигеназы, продукты этих ферментов
стимулируют агрегацию клеток и их миграцию. Затем происходит
инвагинация этой части поверхности. В завершении процесса
наблюдается захват и поглощение частицы нейтрофилом, с образованием
фагоцитарного пузырька (фагосомы), который перемещается вовнутрь
клетки. В результате слияния фагосомы с внутриклеточными
гранулами нейтрофила образуется фаголизосома, компоненты которой
гидролизуют составные части инородной частицы. Фагоцитоз
активируют ионы Са2* и М§2+. Однако некоторые бактерии имеют поверх-
344
Глава 7. Функциональные системы
ность, к которой лейкоциты не способны прикрепляться, что
проявляет их устойчивость к фагоцитозу, повышая их вирулентность. В таких
случаях на помощь приходит действие специализированных антител
и факторов комплемента (СЗЬ, СЗа, С5а, С4, С5), которые
адсорбируются на поверхности бактерии, способствуя прикреплению
лейкоцитов к этой поверхности и с последующей активацией фагоцитоза. Для
этих целей нейтрофилы имеют рецепторы к 1^0, СЗЬ, С5а, СЗа, ЛТ-В4,
регулирующие хемотаксис и агрегацию нейтрофилов.
Накапливаются в участке воспаления, очищают его от
микроорганизмов и продуктов клеточного и тканевого распада. В
процессе фагоцитоза нейтрофилы погибают, формируя продукты
воспаления — гной.
Эозинофилы. Эозинофильные лейкоциты подразделяются на юные,
палочковидные и зрелые. Имеют сегментированное ядро, которое
чаще состоит из двух сегментов. Проявляют малую подвижность.
Высокое содержание эозинофилов отмечается в рыхлой соединительной
ткани стенки кишечника. В диаметре эозинофилы имеют 12... 18 мкм,
а их количество в крови может достигать 2... 12%. Эозинофилы
участвуют в тканевых реакциях, оказывают цитотоксический эффект на
паразиты. В гранулах эозинофилов содержатся кислая фосфатаза, пе-
роксидаза, гистаминаза, арилсульфатаза В, полипептидазы, киназы,
лизофосфолипаза, а в лизосомах — гидролазы и пероксидаза. На
поверхности клеточной мембраны эозинофила содержатся рецепторы к
1§С, 1§Е и компонентам комплемента (СЗЬ, С4, С1з, СЗа, С5а),
которые регулируют активацию клеток и высвобождение содержимого
гранул. Эозинофилы секретируют простагландин Е2, лейкотриены О, В
и С, различные ГЭТЕ (15-ГЭТЕ, 5-ГЭТЕ, 11-ГЭТЕ и др.).
Основным белком гранул является главный щелочной белок (ГЩБ
имеет молекулярную массу 9,2 кДа) с высоким содержанием аргинина.
Действие эозинофилов основано на том, что они способны
прикрепляться к бактериям, секретируя содержимое гранул в окружающую
среду или частично вводят его во внутрь бактерии. При этом ГЩБ
участвует в связывании эозинофилов с бактериями, способен
нейтрализовать действие гепарина и ДНК, оказывает влияние на
свертываемость крови и регулирует фибринолиз. При этом цитотоксичность
эозинофилов находится под контролем 1§Е-рецепторов и 1§Е-антител.
При развитии воспалительного процесса отмечается совместное
действие эозинофилов с макрофагами и тучными клетками. При этом
пероксидаза эозинофилов связывается с гранулами тучных клеток.
345
Биохимия животных
Кроме того, действие эозинофилов прежде всего направлено на
подавление высвобождения гистамина. На поверхности клеточных
мембран эозинофилов содержится мезофосфолипаза, которая
катализирует реакции гидролиза фосфолипидов, содержащихся в мембранах
клеток бактерий. Основным субстратом фермента являются лизоле-
цитин, который совместно с лизофосфатидилсерином влияет на
процесс секреции гистамина из тучных клеток. Обладают эозинофилы
малой фагоцитарной активностью, но способны инактивировать
гнетами н и другие медиаторы воспаления, понижая уровень
воспалительного процесса в организме. Эозинофилы являются эффектор-
ными клетками в противопаразитарном иммунитете, скапливаясь
вокруг внедрившихся в организм паразитов.
Базофилы. Базофилы представляют собой клетки,
циркулирующие в крови и накапливающиеся в тканях только при особых
обстоятельствах. Базофильные лейкоциты имеют ядро в виде неправильно
изогнутой палочки, которое реже бывает сегментировано. Могут
достигать 10... 12 мкм, а их количество у животных составляет 0,5...2,
у птицы 3...4, у земноводных до 20%. Содержат гранулы с высоким
содержанием кислых протеогликанов, где синтезируются и
запасаются гистамин, гепарин, АТФ, протеиназы, оксидоредуктазы (перок-
сидазы) и другие ферменты, а также факторы хемотаксиса нейтрофи-
лов и эозинофилов. Высвобождающиеся из тучных клеток гранулы
активно поглощаются макрофагами, нейтрофилами и эозинофи-
лами. На поверхности клеточной мембраны базофила содержится
большое количество равномерно распределенных рецепторов к 1§Е,
обеспечивающих их активацию при 1§Е-ответе на антиген. В
ответной реакции на антиген базофилы секретируют из гранул гистамин
и другие медиаторы, инициируя реакции гиперчувствительности,
проявлением которой служит расширение сосудов, возрастание их
проницаемости, развитие отека и сокращение гладкой мускулатуры.
Кроме того, действие базофилов проявляется в ответ на появление
анафилотоксинов и лимфокинов. Участвуют базофилы в
присоединении антигенов (аллергенов) и образовании комплекса антиген-
антитело. В результате происходит дегрануляция базофилов и выход
из них гистамина и гепарина, т. е. базофилы участвуют в
иммунологических реакциях организма аллергического типа. Базофилы способны
секретировать активатор плазминогена, участвующего в регуляции
образования фибрина, который обычно присутствует в очаге
воспаления. Действие базофилов, секретирующих гистамин и серотонин,
346
Глава 7. Функциональные системы
способствует усилению инфильтрации в очаге воспаления. Особенно
это выражено при патологическом процессе, вдыхательных путях при
аллергии, а также в почках при хроническом интсрстициальном
нефрите и отторжении трансплантанта. При этом использование анти-
гистаминных и антисеротонических препаратов, предотвращает
аллергические повреждения тканей.
Точные клетки (тканевые базофилы) содержатся в подэпителиаль-
ной соединительной ткани кожи, пищеварительного тракта,
дыхательных путей, матки, а также в соединительнотканных прослойках
мелких кровеносных сосудов печени, почках, эндокринных органов,
молочной железе и других. Тучные клетки имеют овальную или
шаровидную форму, диаметром от 10 до 25 мкм. В структуре содержат
много крупных гранул, где накапливаются гепарин, гистамин, серо-
тонин, дофамин, а также ферменты (кисла и щелочная фосфатазы,
липаза, протеиназы). Как и базофилы, тучные клетки предназначены
для секреции медиаторов при анафилактической реакции
гиперчувствительности немедленного типа. Поэтому у человека тучные клетки
служат основным источником при отеке и покраснении кожи в ответ
на антиген среды, а также при аллергической астме. Аллергические
реакции в коже и бронхах могут продолжаться в течение нескольких
часов и протекают в две фазы. Вначале происходит секретирование
медиаторов в ответ на появление антигена и это может продолжаться
в течение 4...8 часов. Затем реакция приобретает адематозный
характер, т. е. сопровождается бронхиальным отеком. При этом эти
реакции могут быть инициированы 1§Е и другими формами.
Серотонин, секретируемый тучными клетками, может участвовать
в развитии кожной реакции гиперчувствительности замедленного
типа. Кроме того, тучные клетки способны участвовать в подостром
и хроническом ответе на паразитарные инфекции в кишечнике. На
поверхности тучных клеток имеются рецепторы к Ц$Е, 1§С, СЗЬ, С5а,
С4а и СЗа. На секрецию медиаторов базофилами и тучными клетками
оказывают влияние продукты Т-лимфоцитов (лимфокины), нейтро-
филов (катионные белки и протеиназы), моноцитов (факторы
комплемента, протеиназы, интерферон). Сильным стимулятором секреции
медиаторов являются АТФ, активированные компоненты
комплемента, факторы свертывания крови и функционально активные
вещества (интерферон, ГЭТЕ, аденозин и ацетилхолин). Особо следует
отметить инициирующее действие интерферона в развитии
аллергического процесса при острых вирусных инфекциях, затрагивающих
347
Биохимия животных
дыхательные пути, вызывающие обострение аллергических ренитов и
астмы. Кроме того, интерферон усиливает хемотаксический ответ ба-
зофилов, увеличивает количество рецепторов к 1§С и 1§Е на
поверхности Т-клеток, понижая экспрессию рецептора к 1§М. Располагаясь
вблизи мелких кровеносных сосудов, тучные клетки одни из первых
реагируют на проникновение антигенов из крови. Комплекс антиген-
антитело обусловливает появление местных и общих
воспалительных реакций. При этом секретируемый из тучных клеток гистамин
способствует повышению проницаемости сосудистых стенок
капилляров, стимулирует миграцию эозинофилов, активирует макрофаги.
Тучные клетки участвуют в развитии аллергических и
анафилактических реакций.
Моноциты. Моноциты — долгоживущие в тканях клетки,
обладающие способностью к локальной дифференцировке и к
взаимодействию с лимфоцитами. Имеют ядро бобовидной или лопастной
формы, достигают 18...20 мкм и более. В цитоплазме моноцитов
содержатся лизосомы, пиноцитозные пузырьки, комплекс Гольджи,
митохондрии. Количество моноцитов в крови варьируется в пределах
1...8%. Обладают высокой активностью кислых гидролаз, пероксидаз,
лизоцима. Продуцируют разные цитокины, действующие в
качестве сигнальных молекул на клетки других типов. Моноциты
проявляют высокую фагоцитарную активность, действуя в воспалительных
и противовоспалительных процессах. Моноциты взаимодействуют
с лимфоцитами и фибробластами, стимулируют созревание
предшественников лейкоцитов, действуют на систему комплемента,
свертывания крови, обмен кининов, служат основными источниками
метаболитов арахидоновой кислоты, оказывают токсическое действие на
опухолевые клетки и микроорганизмы. В процессе превращения
моноцитов в макрофаги у них исчезают азурофильные гранулы,
содержащие пероксидазу. При этом начинает проявляться высокая активность
лизосом, содержащих гидролазы. Моноциты стимулируют фиброб-
ластические процессы, образуют многоядерные клетки. Моноциты
содержат активный аппарат синтеза белков и их секреции. Обладают
высокоактивными органеллами, участвующими во внутриклеточном
пищеварении, дыхательной активностью (митохондрии) и микрофи-
ламентами. Последние обеспечивают их высокую подвижность и
способность к фагоцитозу. Моноциты проявляют противосвертывающую
активность, возрастающую в присутствии функционально активных
лимфоцитов и комплексов антиген-антитело, С5ф, лектинов.
348
Глава 7. Функциональные системы
Моноциты, вышедшие из сосудов и попавшие в соответствующее
микроокружение, адаптируются к новой среде, превращаются в
макрофаги, которые также способны к фагоцитозу и секреции
функционально активных веществ. В каждой ткани или органе макрофаги
приобретают специализированные свойства клеток окружающей среды.
Так, в костной ткани моноциты превращаются в остеоциты, в рыхлой
соединительной ткани — в гистиоциты, в нервной ткани — в клетки
микроглии, в печени — в гепатоциты и т. д. В составе клеточной
мембраны макрофагов присутствуют большое количество рецепторов для
иммуноглобулинов и факторов комплемента. Превращаясь в
макрофаги, моноциты увеличиваются в размере до 25...50 мкм. При этом
возрастает их амебоидная подвижность, а также фагоцитарная
активность. В действии макрофаги используют активные формы
кислорода и большой набор гидролитических ферментов. В отличие от
нейтрофилов макрофаги являются более долгоживущими формами,
способными дифференцироваться. Кроме того, макрофаги обладают
медленной и длительной реакцией на внешние стимулы, способны
повторно использовать фаголизосомы и секретировать нелизосомные
белки. Они также как нейтрофилы не способны вновь синтезировать
гранулы, но способны продуцировать и секретировать ферменты,
содержащиеся в гранулах. Макрофаги быстро реконструируют
плазматическую мембрану, используя мембраны фагосом.
Макрофаги синтезируют компоненты комплемента (С1, С2, СЗ, С4,
С5, факторы Вий, пропердин, инактиваторы СЗЬ Р1Н). В
воспалительных эксудатах макрофаги способны продуцировать интерлейкин 1,
лейкоцитарный пироген, а также фактор, активирующий фибробласты и
пролиферацию клеток гладких мышц. Кроме того, макрофаги
вырабатывают интерферон, факторы, стимулирующие пролиферацию
клеток капилляров, факторы, влияющие на образование копий грану-
лоцитов, эритроцитов, макрофагов и мегакариоцитов, фактор диффе-
ренцировки В-клеток, белки, убивающие опухолевые клетки.
Макрофаги секретируют ПГ-Е2, тромбоксан А2, лейкотриены В и С, а также
моногидроксиэйкозатетраеновые кислоты. Макрофаги содержат ли-
попротеинлипазы, расщепляющие триацилглицерины, которые
входят в состав липопротеинов. Антимикробное действие макрофагов
усиливается за счет продуцирования активных форм кислорода.
Вырабатываемая макрофагами ангиотензинконвертаза способна
катализировать реакцию превращения ангиотензина I в ангиотензин II,
а также реакцию инактивации брадикинина.
349
Биохимия животных
Макрофаги секретируют фибронектины (димерные белки с
молекулярной массой 440 кДа), которые участвуют в клеточной адгезии,
распластывании и движении клеток, обладают хемотаксической
активностью для фибробластов, стимулируя за счет этого процессы
восстановления поврежденных тканей и фагоцитарные реакции. В
очагах воспаления макрофаги способны сливаться в одну многоядерную
клетку или формировать скопление клеток. Поэтому основные
функции макрофагов: участие в защите организма от микроорганизмов,
уничтожение зараженных вирусом клеток и раковых клеток;
фагоцитоз старых и погибших клеток и межклеточного вещества; утилизация
клеток всех видов гранулоцитов, которые утратили свою
функциональную активность. Кроме того, макрофаги секретируют
разнообразные функционально активные вещества, обеспечивающие
регенерацию структур поврежденных тканей.
Лимфоциты. Лимфоциты (Т- и В-лимфоциты) в большом
количестве содержатся в лимфе и несколько меньше — в крови. Имеют
крупное ядро, чаще круглое с небольшим углублением. Способны
образовывать на клеточной мембране микроворсинки и псевдоподии. Они
защищают организм от чужеродных и собственных
модифицированных форм белков — антигенов. Их функция проявляется путем
непосредственного взаимодействия с антигенами или за счет выработки
антител. Поэтому их различают соответственно на Т- и В-лимфоциты.
Т-лимфоциты развиваются из костномозговых клеток в корковой
части долек тимуса. В-лимфоциты развиваются из миелоидной ткани
костного мозга, способны синтезировать иммуноглобулины.
В-лимфоциты осуществляют выработку антител в ответ на
проникающие в организм антигены. Достигают размеров 8... 11 мкм и их
количество может быть 20...65%. Для осуществления своей функции часть
их генов, отвечающих за синтез рецепторных белков, имеет сильную
изменчивость, что проявляется в синтезе различных по структуре
белков (антител), располагающихся на клеточной мембране и
ответственных за распознавание антигенов. Вариабельность
белков-антител может составлять около 109 вариантов. Поэтому морфологически
сходные клетки В-лимфоцитов различаются между собой составом
рецепторных белков, проявляющих в этом свою индивидуальность и
реализуя ее в случае попадания в организм какого-либо антигена.
В-лимфоциты становятся функционально активными при
образовании на их клеточной мембране комплекса антиген-распозна-
ющего рецептора с антителом. Это служит пусковым механизмом
350
Глава 7. Функциональные системы
деления В-лимфоцитов, образующих многочисленную группу
клеток, называемых клоном. При этом часть клеток клона превращаются
в долгоживущие клетки памяти, а остальные клетки клона становятся
плазматическими клетками. Клетки памяти обеспечивают длительное
хранение информации об антигене, тогда как плазматические клетки
мигрируют в различные ткани и слизистые оболочки, осуществляя там
синтез и секрецию антител. Последние формируют особую группу
белков гликопротеинов, которые называются иммуноглобулинами.
К Т-лимфоцитам относятся клетки иммунной системы,
распознающие и взаимодействующие с клетками организма, на мембране которых
они обнаруживают антигены. Т-лимфоциты способны синтезировать и
выделять лимфокины, которые изменяют поведение других клеток,
обладают противовирусной активностью (интерферон и лимфотоксин).
Т-лимфоциты способны разрушать чужеродные клетки — мишени или
изменившиеся собственные клетки при отторжении
трансплантантов, при реакции гиперчувствительности замедленного типа, при
разрушении опухолевых клеток и развитии аутоиммунных реакций. Они
созревают в тимусе и представлены четырьмя группами клеток: Т-хел-
перы, Т-киллеры, Т-супрессоры и Т-клетки памяти.
Т-хелперы (помощники) выделяют продукты, взаимодействующие
с В-лимфоцитами, превращая их в антителопродуцирующие
плазматические клетки. Относятся к группе регуляторных клеток,
осуществляющих поиск различных клеток иммунной системы, связывающих
антигены и затем утилизирующие их с участием ферментов лизосом.
Для этого макрофаги, нейтрофилы и другие клетки, взаимодействуя
с антигеном, осуществляют только частичное его расщепление с
помощью ферментов лизосом, оставляя фрагменты антигена на
наружной поверхности клеточной мембраны в окружении особых белковых
комплексов, сигнализирующих о появлении нового антигена. В
ответ на такой сигнал Т-хелперы выделяют особые вещества — цитоки-
нины, которые в свою очередь активируют другие клетки иммунной
системы (макрофаги, В-лимфоциты и др.).
Т-киллеры (убийцы) — цитотоксические клетки, основной
функцией которых является обследование поверхности всех клеток
организма с целью обнаружения у них антигенов, а затем при наличии
у них такой метки их уничтожают, разрушая эти клетки.
Механизм действия Т-киллеров состоит из нескольких этапов.
Вначале цитотоксическая клетка сближается с инфицированной
клеткой, секретируя особые ферменты, обладающие гидролитической ак-
351
Биохимия животных
тивностью — перфорины, которые после встраивания в мембрану ли-
зируемой клетки, образуют в ее структуре крупные отверстия. Затем,
в результате изменения осмотического давления внутри клетки,
наблюдается ее набухание, так как в клетку через отверстия начинает
поступать вода. После этого клетка разрушается (лизируется). Кроме
того, Т-клетки способны вырабатывать и секретировать токсические
вещества, которые проникают внутрь лизируемой клетки, ускоряя
процесс ее гибели.
Т-супрессоры (угнетающие) подавляют процессы деления В-кле-
ток и образование плазмоцитов, ингибируют механизмы антитело-
образования. Действуют Т-супрессоры как на Т-хелперы, так и на
Т-киллеры, В-лимфоциты и на макрофаги. Функциональная
активность Т-супрессоров проявляется путем выработки соединений,
замедляющих иммунные реакции. Кроме того, они защищают собственные
здоровые клетки от разрушительного действия В- и Т-лимфоцитов, т. е.
они подавляют в организме протекание аутоиммунных реакций.
Т-клетки памяти — это группа длительно живущих клеток,
хранящих информацию об уничтоженном антигене. Эти клетки
предназначены для ускорения реакций иммунной системы при вторичном
проникновении в организм антигена (вирусов, бактерий и др.) или на
повторное образование собственных модифицированных
(измененных) клеток.
Тромбоциты. Клетки крови, концентрирующиеся и инициирующие
процесс образования тромба в области повреждения и участвующие
в восстановлении целостности поверхностных структур. Тромбоциты
формируются из мегакариоцитов костного мозга в процессе цитогенеза.
Тромбоциты не имеют клеточного ядра. Клеточная мембрана
тромбоцита снаружи покрыта гликокаликсом, содержащим значительные
количества кислых гликозаминогликанов, которые являются
рецепторами для компонентов тригтерной системы активации тромбоцита и
субстратами для склеивания и агрегации тромбоцитов. Фосфолипиды
тромбоцитов участвуют в процессе коагуляции протеинов, выполняют
роль инициатора активности субстратов тромбоцитарных ферментов,
продуцирующих тромбоксан А2, который является важнейшим
элементом в механизме активации тромбоцитов и мощным тромбоцитар-
ным кофактором, инициирующим агрегацию тромбоцитов. Под
мембраной располагаются микротрубочки и активные микрофиламенты.
Продолжительность жизни тромбоцитов 3...8 суток, затем они
утилизируются ретикулоэндотелиальными клетками печени селе-
352
Глава 7. Функциональные системы
зенки. Тромбоциты способны достигать 2...5 мкм и присутствуют в 1 мл
крови в количестве 0,25...0,35 млн.
В составе тромбоцита определяются АТФ, АДФ, катехоламины,
серотонин, гистамин, гликоген, кальций, фибриноген, фактор Вил-
лебранда, тромбоспондин, витронектин, а также вещества,
способствующие росту клетки: клеточный гормон роста, тромботический фактор
IV и преобразующий гормон роста клетки. Кроме того, тромбоциты
содержат факторы коагуляции: кининоген, фактор XI и активатор плаз-
миногена. В тромбоцитах проявляет функциональную активность
система синтеза простагландинов. Выявлена активность 47 ферментов,
в том числе 13 из них принимают участие в свертывании крови.
Механизм тромбообразования можно разделить на четыре этапа:
адгезию, агрегацию, уплотнение и секрецию. Начальный этап
(адгезия) обусловлен тем, что при повреждении сосудистой стенки
происходит выброс субэндотелиальных продуктов, таких как коллаген.
Тромбоциты связываются с коллагеном, формируют основу для
образования тромба. Это взаимодействие может инициировать фактор
Виллебранда, имеющий тромбоцитарный рецептор 1Ь-1Х. Затем
происходит высвобождение кальция и тромбоцитарных факторов,
которые обусловливают протекания процессов агрегации и
уплотнения тромба. При этом происходит распад тромбоцитов на фрагменты,
с секрецией факторов свертывания крови. В результате суммарного
действия факторов свертывания, содержащихся в плазме крови и
тромбоцитах, на раневой поверхности протекает процесс фибриногенеза.
В завершении этого процесса образуется каркас, на котором
формируется тромб.
В процессе образования тромба тромбоциты выделяют вещества,
необходимые для уплотнения кровяного сгустка — ретрактозимы.
Эти соединения и тромбоцитарный фактор роста стимулируют
деление клеток, ускоряя заживление раны.
Условием остановки кровотечения является то, что тромбоциты
содержат вещества, суживающие кровеносный сосуд и
уменьшающие кровотечение. Кроме того, тромбоциты транспортируют
соединения, необходимые для сохранения и укрепления структуры
сосудистой стенки.
Многообразие функциональной деятельности тромбоцитов на этом
не ограничивается, так как кроме участия в процессе свертывании крови
они еще и сохраняют способность к фагоцитозу, т. е. поглощают и
переваривают чужеродные частицы, втом числе и вирусы.
353
Биохимия животных
7.1.3. Лимфа
Лимфой называется специализированная жидкость
лимфатических сосудов, межтканевых и межклеточных пространств.
Составными частями лимфы служат лимфоплазма и форменные элементы.
Плотность лимфы 1,012... 1,026, рН 7,6...7,7.
Лимфоплазма содержит фибриноген, белки фибриногенеза, ли-
пиды, углеводы и остальные белки как в плазме крови. Основными
форменными элементами лимфы являются лимфоциты, хотя могут
присутствовать и другие лейкоциты.
Состав лимфы зависит от вида сосудов. Поэтому выделяют
следующие разновидности лимфы: лимфа лимфатических капилляров и
сосудов и лимфатических узлов, постлимфатических сосудов и лимфа
грудного и правого лимфатического протоков.
7.1.4. Система свертывания крови
Система свертывания крови животных предназначена для защиты
организма от кровопотери. Действующими элементами системы
являются тромбоциты и комплекс ферментов, преимущественно
представленных протеиназами, которые до активации присутствуют в крови
в неактивной форме (зимогены) и называются факторами свертывания
крови. Причем принято обозначать факторы системы свертывания,
связанные с тромбоцитами, арабскими цифрами (1, 2, 3,4,5,6 и т. д.),
а факторы компоненты плазмы крови — римскими цифрами
(неактивные формы — 1, II, III, IV, V, VI, VII, VIII, IX, Хит. д., активные формы,
т. е. обладающие каталитической активностью — 1а, На, II 1а, 1Уа, Уа,
\Ла, М1а, МНа, 1Ха, Ха и т. д.).
7.1.4.1. Процесс образования фибрина (фибриногенез)
Система свертываемости крови инициируется вследствие
нарушения целостности ткани {внесосудистый путь) или при нарушении
целостности сосуда на его внутренней поверхности (внутрисосудистый
путь) (рис. 7.4). Свертывание крови по внутрисосудистому пути
протекает достаточно быстро (~ 12 с). Объединение обеих путей
происходит на уровне активации X фактора системы свертывания крови.
Активация компонентов свертывания крови представляет
каскад протеолитических реакций, в результате которых от неактивного
предшественника отщепляется пептид (фрагмент полипептидной
цепочки), превращая его в активированную сериновую протеазу.
354
Глава 7. Функциональные системы
Внутренняя поверхность поврежденного сосуда
Рис. 7.4. Схема действия компонентов свертывания крови
(сплошными стрелками показаны переходы факторов из неактивного
состояния в активное, а прерывистыми стрелками указаны объекты, на
которые действуют активные формы): а) внутрисосудистый путь,
б) внесосудистый путь (К — кинин, КК — калликреин,
КН — кининоген, ПК — прекалликреин,
ФП — фибрин полимер)
В механизме действия факторов свертываемости крови
принимают участие ион Са2+ и фосфолипиды. Внутрисосудистый путь
инициируется коллагеном, который входит в состав соединительной
ткани наружной оболочки сосудистой стенки. На начальном этапе
свертывания крови происходит адсорбция калл икре и на и кинино-
гена на поврежденной поверхности эндотелия сосуда. Калликреин
активирует превращение фактора XII в каталитически активный
фактор ХПа, отщепляя от фактора XII полипептид (XI1Ь) с молекулярной
355
Биохимия животных
массой в 28 кДа. Этот полипептид способен активировать
превращение прекалликреина в калликреин, который в свою очередь
превращает кининоген в кинин. Комплекс активированных ферментов
(XI 1а, калликреин, кинин) превращает фактор XI в активную форму
Х1а, которая после этого способна активировать фактор IX,
превращая его в фактор 1Ха. Последний активирует фактор VIII в VIПа.
Активированные факторы 1Ха и VI На, а также фЗ и фактор IV вызывают
активацию фактора X с образованием фактора Ха.
Внесосудистый путь активации механизма свертываемости крови
обусловлен освобождением тканевого фактора (III) из поврежденных
тканей, который вызывает активацию фактора VII и образование
активированной протеиназы VI 1а. Совместное действие тканевого
фактора (III) и фактора VI 1а ускоряет процесс свертывания крови. При
этом фактор Ха активирует фактор V, переводя его в активное
состояние У/а. Совместное действие трех факторов (Ха, \г и фЗ) может
в десять раз увеличивать скорость превращения протромбина
(фактора II) в тромбин (фактор На).
Протромбином является белок, у которого в составе
полипептидной цепи 582 аминокислотных остатков. Расщепление двух пептидных
связей между аминокислотными остатками аргинином 274 и
треонином 275, а также аргинином 323 и изолейцином 324,
сопровождается отщеплением 1М-концевого фрагмента и образованием двухсубъ-
единичного белка тромбина. Превращение протромбина в тромбин
происходит на поверхностях фосфолипидных комплексов мембран
тромбоцитов, скопление которых происходит в местах повреждения
сосудов. Активированный фактор На (тромбин) является сериновой
протеиназой, строение активного центра которой аналогично
трипсину, химотрипсину и эластазе.
В составе полипептидной цепи II, VII, IX и X факторов
присутствует остаток у-карбоксиглутаминовой кислоты, который образуется
в результате посттрансляционного карбоксилирования остатков глу-
таминовой кислоты и предназначен для связывания ионов Са2+.
Последние обеспечивают связывания активированного фактора с фосфо-
липидами на поверхности плазматической мембраны.
Ряд соединений, например цитрат, способны связываться с
ионами Са2+, предотвращая взаимодействие фактора с фосфолипи-
дами и таким образом замедляя процесс свертывания крови. Кроме
того, для синтеза остатков у-карбоксиглутаминовой кислоты
необходим витамин К.
356
Глава 7. Функциональные системы
С=0 О С02 С=Ю хСОСГ Са2+ С=Ю СОСГ
СН-СН2-СН2-С ^-*СН-СН2-СН ^^—►СН-СНг-СН Са2+
ЫН О" ЬГН СОО" NН СОО"
I I I
остаток глутаминовой остаток у-карбоксиглутаминовой
кислоты кислоты
Антагонисты витамина К (производные кумаринов) способны
ингибировать процесс синтеза факторов коагуляции, действуя как
ингибиторы свертывания крови. В активное состояние система
свертывания крови вводится за счет того, что каждый предыдущий
фактор является активатором последующего. Причем процесс
активирования обусловлен отщеплением от неактивного фактора
фрагмента полипептидной цепи, который закрывал доступ субстратов
к активному центру и после удаления этого фрагмента фермент
становился функционально активным, т. е. проявлял свойства
активной протеиназы.
Система свертывания крови находится под постоянным
контролем ингибиторов протеиназ. При этом сериновые протеиназы
свертывания крови могут инактивироваться антитромбином, действие
которого усиливается гепарином. Тогда как тромбомодулин,
расположенный на внутренней стенке кровеносных сосудов, инактивирует
тромбин (фактор На) за счет образования с ним стехиометрического
комплекса. Белок с активируемый тромбином способен расщепить
в плазме крови факторы V и VIII. Таким образом, осуществляется
деятельность компонентов системы, препятствующей активному
функционированию факторов свертывания крови.
Завершающим этапом в механизме свертывания крови является
превращение фибриногена (фактора I) тромбином в
фибрин-мономер (фактор 1а), полимеризация которого приводит к образованию
нерастворимого фибрин-полимера.
Сгусток крови, образовавшийся в результате полимеризации
фибрина, вначале имеет рыхлую структуру, а затем уплотняется за счет
образования дополнительных поперечных ко валентных связей в
структуре фибрина. Процесс протекает при участии фактора XIII, активной
формой которого служит фактор XI Па — трансамидаза. Фермент ка-
357
Биохимия животных
тализирует реакции трансамидирования с участием аминокислотных
остатков глутамина и лизина. В процессе участвует ф8 тромбоцитов,
который обладает АТФазной активностью.
7 Л .4.2. Тромбообразование. Механизм агрегации тромбоцитов
При повреждении кровеносных сосудов активируется система
тромбообразования, элементами которой являются процессы
агрегации тромбоцитов и активизация факторов свертывания крови
(рис. 7.5). Действие этих систем функционально взаимосвязано
с активностьютромболитической системы, основу которых
составляют компоненты системы фибринолиза. Причем эти две системы
находятся в состоянии взаимного влияния и зависимости. Так,
повреждение кровеносного сосуда сопровождается
кровотечением, которое инициирует процессы в гладких мышечных
клетках средней оболочки сосуда. Это действие в дальнейшем
проявляется в сокращении сосудистой стенки, на поверхности которой
происходит агрегация тромбоцитов и активизация факторов
свертывания крови. Процесс завершается образованием тромба.
Вследствие этого кровотечение останавливается. Однако, последующее
заживление раны активирует процесс фибринолиза, компоненты
которого обеспечивают постепенное растворение тромба,
сопровождаемое восстановлением проницаемости кровеносного сосуда
и нормализацией кровоснабжения ткани. В случае, если
нарушается взаимосвязь между свертывающей и противосвертывающей
системами крови, то могут развиться повышенная кровоточивость
или тромбоз сосудов.
Повреждение кровеносных сосудов сопровождается активацией
системы свертывания крови, элементом которой является
агрегация тромбоцитов на поверхности поврежденной сосудистой стенки.
Процесс агрегации тромбоцитов регулируется сложным комплексом
соединений, среди которых можно выделить тромбоксан и проста-
циклин (рис. 7.6). Предшественником этих соединений служит ара-
хидоновая кислота, превращающаяся при участии циклооксигеназы
в циклические эндопероксиды. Последние под действием
тромбоксан- и простациклинсинтетаз преобразуются соответственно в
тромбоксан и простациклин. Причем синтез промбоксана осуществляется
в тромбоцитах, а простациклина — в основном эндотелии сосуда.
Ингибиторами циклооксигеназы являются противовоспалительные
препараты (аспирин и индометацин).
358
Глава 7. Функциональные системы
Повреждающий фактор
Целостный кровеносный
сосуд
4
к
* ь
Нормализация
кровоснабжения ткани
4
^
Нарушение целостности стенки
кровеносного сосуда
1
г
Кровотечение
Восстановление проницаемости
сосуда
4
к
Растворение тромба
1
г
Образование
тромба
ч
г
Повышенная
кровоточивость
Сужение сосуда
Агрегация
тромбоцитов
Активация факторов
свертывания крови
Остановка кровотечения
Тромбоз сосудов
(тромбофлебиты)
Рис. 7.5. Схема действия компонентов
свертывания крови при повреждении сосуда
Действие тромбоксана и простациклина на тромбоциты
проявляется через их связывания с соответственно тромбоксановыми и
простациклиновыми рецепторами. При этом они являются
антагонистами в действии. Причем, если тромбоксан повышает агрегацию
тромбоцитов на поверхности кровеносного сосуда, вызывая его
сужение, то простациклин наоборот — препятствует агрегации
тромбоцитов, способствуя расширению сосуда.
359
360
Глава 7. Функциональные системы
Тромбоксан связывается с тромбоксановым рецептором, что
проявляется в стимулировании активности фосфолипазы С, действие
которой сопровождается повышением содержания диацилглицерина и
моноинозит- 1,4,5-трифосфата и таким образом способствует повышению
содержания в тромбоцитах ионов Са2+. Кроме того, стимуляторами
агрегации тромбоцитов могут быть коллаген сосудистой стенки,
тромбин, АДФ, серотонин, простагландин Е, катехоламины.
Действие простагландина проявляется через простациклиновый
рецептор, при связывании с которым активируется аденилатциклаза,
катализирующая реакцию превращения АТФ в цАМФ.
В ответ на это в тромбоцитах и в стенке сосуда понижается
содержание внутриклеточного кальция. Кроме простациклина процесс
агрегации тромбоцитов ингибируют простагландин Е1, гепарин, АМФ,
аденозин, метилксантин, антагонисты серотонина,
ацетилсалициловая кислота и др.
Ацетилсалициловая кислота является ингибитором циклооксиге-
назы и, как видно из рис. 7.6, это проявляется в понижении синтеза
циклических эндопероксидов. Причем ингибирующий эффект
более выражен в понижении активности циклооксигеназы
тромбоцитов, что обуславливает превышение концентрации простациклина
над тромбоксаном. В результате повышается антиагрегирующий
эффект сосудистой стенки, который может сохраняться в течение
нескольких дней.
7.1.5. Система фибринолиза
В организме животных в норме функционирует система
фибринолиза, которая препятствует свертыванию крови путем подавления
активности факторов свертывания крови, а также предназначена для ли-
зирования формирующихся кровяных сгустков — тромбина (рис. 7.7).
В состав антисвертываюшей системы входит группа ферментов,
обладающих протеазной активностью. Эти ферменты в нормальных
условиях находятся в неактивном состоянии — зимогены. К ним
относится плазминоген, который с помощью активаторов крови и тканей
превращается в активную форму — плазмин. Молекула плазминогена
представляет собой одну полипептидную цепь из 840
аминокислотных остатков и имеет молекулярную массу 92 кДа. Изменения
в структуре плазминогена сопровождается отщеплением от
полипептидной цепи фрагмента, составляющего 'Д его части. Такое действие
катализируется урокиназой, калликреином, специфическими ткане-
361
Биохимия животных
выми факторами или ферментом бактерий — стрептокиназой.
Последняя вырабатывается гемолитическим стрептококком и может
оказаться в организме при заражении стрептококковой инфекцией, что
иногда может привести к развитию геморрагического диатеза.
Плазма крови
Плазминоген
1
4
^
^
ч
г
Плазмин
Продукты
распада
4 1
^
• Поверхность кровеносного сосуда
Стрептокиназа
Плазминоген
Урокиназа
Ч Фибриноген
Плазминоген
ъ
р
ь
р
*
^
«—
г
Тканевой
фактор
Плазмин
Фибрин
^
' »
г
Продукты
распада 1
Рис. 7.7. Схема механизма действия системы фибринолиза
Стрептокиназа широко применяется в качестве фибринолитиче-
ского средства. Индивидуально стрептокиназа протеолитической
активностью не обладает. Для ее активации необходим плазминоген,
в комплексе с которым начинает проявляться протеолитическая
активность стрептокиназы, стимулируя переход плазминогена в
плазмин как в тромбе, так и в плазме крови.
Используя метод иммобилизации стрептокиназы на
водорастворимом носителе полисахаридной природы, создан препарат
пролонгированного действия, который получил название стрептодеказа.
Эффективным фибринолитическим действием обладает
урокиназа — фермент, синтезируемый в клетках почек. Однако стоит пом-
362
Глава 7. Функциональные системы
нить, что чрезмерное использование фибринолитиков может быть
причиной развития заболевания — системного фибринолиза,
которое характеризуется высокой кровоточивостью, вследствие снижения
в плазме крови содержания фибриногена, а2-антиплазмина, ряда
факторов свертывания крови (V и VIII).
7.1.5.1. Антикоагулянты
Активизация системы свертывания крови является нежелательной
для функционирования организма животных в норме и служит
показателем развития патологического процесса.
Вещества, обеспечивающие функционирование противосверты-
вающей системы крови, относятся к группе антикоагулянтов.
В состав антикоагулянтов входят антитромбопластины, антит-
ромбины, а также белки системы фибринолиза. Предполагается, что
в функционировании антисвертываюшей системы крови принимают
участие специфические ингибиторы факторов свертывания крови
(антитромбин, антифибрин, антиакцелерин, антиконвертин и др.),
а также вещества, ингибирующие процесс свертывания крови на
различных этапах. К последней группе антикоагулянтов относятся:
цитрат натрия, гепарин, дикумарин, неодикумарин, пелентон, син-
кумар и др. Понижение концентрации этих соединений в крови
может способствовать образованию тромбов.
В систему распознавания активности элементов свертывания крови
входят хеморецепторы, основной обязанностью которых служит
регулирование процессов образования антикоагулянтов. Действие хеморе-
цепторов соподчинено с деятельностью нейрогуморальной системы.
7.1.5.2. Антитромбины
К этой фуппе относятся белки плазмы крови, обладающие анти-
коагулянтным действием по отношению компонентов свертывания
крови. Одним из представителей антитромбинов является
антитромбин III. Активатором антитромбина III служит гепарин, который
способен связываться с катионным участком на поверхности белка,
вызывая конформационные перестройки в структуре антикоагулянта,
проявляемые в подавлении активности сериновых протеаз —
активных форм факторов свертывания крови. Избирательность действия
антитромбина III проявляется по отношению следующих факторов:
На, 1Ха, Ха, Х1а, XI 1а и калликреина.
363
Биохимия животных
Связывание гепарина в области активного центра антитромбина
происходит за счет олигосахаридного фрагмента, в составе которого
12 остатков. Наиболее прочно связываются те участки гепарина,
которые содержат сульфатные остатки.
Высокие концентрации гепарина оказывают влияние на
агрегацию тромбоцитов. Разрушение гепарина происходит при участии ге-
париназы в печени.
Гепарин способен понизить содержание липидов в крови, что
обусловлено его влиянием на освобождение липопротеинлипазы.
Фермент катализирует реакции гидролиза триацилглицеринов до
глицерина и жирных кислот, которые способны быстро утилизироваться
в тканях.
7.1.6. Система комплемента
Сложный комплекс протеолитических ферментов, активация
которых имеет каскадный механизм и запускается в организме
животного и человека при наличии бактерии или комплекса
антиген-антитело, называется комплементом. Основу комплемента составляют
взаимодействующие между собой группы белков и гл и коп роте и нов
крови, необходимые для защиты организма от различных
бактериальных и вирусных инфекций, предназначенные для уничтожения
чужеродных клеток и микроорганизмов.
Компоненты системы комплемента выполняют следующие
функции: 1) обеспечивают направленное движение лейкоцитов к очагу
инфекции или воспаления, т. е. являются факторами хемотаксиса;
2) вызывают сокращение гладкой мускулатуры, увеличивают
проницаемость кровеносных сосудов и агрегацию тромбоцитов,
способствуют развитию отека и деструкции тканей, стимулируют воспаление
и реакции гиперчувствительности, т. е. проявляют свойства анафи-
латоксинов; 3) активизируют лейкоцитоз, являясь медиаторами
иммунного ответа; 4) участвуют в активации макрофагов и
лимфоцитов; 5) регулируют продуцирование антител; 6) участвуют в процессе
разрушения (лизисе) клеток и чужеродных веществ; 7)
специфически реагируют с клетками-мишенями (опсонизация),
подготавливая их к фагоцитозу макрофагами; 8) активированные фрагменты
комплемента управляют биосинтезом и экскрецией интерлейкинов,
простагландинов и лейкотриенов.
Такими действиями достигается защита организма хозяина от
инфекций. В составе системы комплемента 21 разновидность сыво-
364
Глава 7. Функциональные системы
роточных белков и 8 рецепторов с молекулярной массой от 8 до
600 кДа, обозначаемых как компоненты С1, С2, СЗ до С9, факторы В
и О. Большая часть компонентов комплемента синтезируется гепато-
цитами и мононуклеарными фагоцитами. Активация системы
комплемента осуществляется двумя путями — классическим и
альтернативным. При этом активацию системы комплемента контролируют особые
факторы, которые циркулируют в крови (ингибитор С1-эстеразы, СЗЬ
инактиватор (СЗЫпН или фактор I), фактор Н (1Н)).
Все белки системы комплемента относятся к группе ферментов
группы зимогенов, которые в отсутствии инициирующих факторов
находятся в неактивном состоянии и свободно циркулируют в крови.
Различают два комплекса протеолитических ферментов: мембрано-лизи-
рующий и антиген-антитело лизирующий. В первом случае ответная
реакция организма сопровождается образованием антител (1§С или
1§М), активизирующих систему комплемента. Инициатором процесса
является комплекс антиген-антитело, который реализует действие
компонентов комплемента по классическому пути (рис. 7.8). При этом на
первом этапе участвует компонент С1 комплемента, в составе
которого три субъединицы (С1я, С1г, С1$), связанные между собой с
помощью ионов кальция. Для связывания и активации С1 антителами
необходимы две молекулы \%С Субъединица С 1ц по форме напоминает
букет нераскрытых тюльпанов, части которого могут прикрепляться
к СН2 домену Рс-фрагмента антител за счет ионных взаимодействий.
Молекула С 1я состоит из 18 полипептидных цепей, объединенных по
3 цепи в 6 субъединиц с общей молекулярной массой равной 459 кДа.
При этом каждая субъединица С1я связывается с комплексом
антиген-антитело, активизируя субъединицу С1г, которая в свою очередь
активирует субъединицу С18, превращая ее в сериновую протеиназу.
Процесс контролируется ингибитором СНпЬ, действующим на про-
теиназы С1г и С1$. При этом белковые ингибиторы трипсина и хи-
мотрипсина, содержащиеся в крови, не действуют на эти и другие
протеиназы комплемента.
Активная субъединица С1$ способна последовательно активировать
компонент С4 (201 кДа) и С2 (108 кДа), отщепляя от С4 полипептиды
С4а (8 кДа) и С2Ь (193 кДа), а от С2 — полипептиды С2а (74 кДа) и С2Ь
(34 кДа). С4а и С2Ь представляют собой небольшие фрагменты — ана-
филатоксины. Эти соединения вызывают сокращение гладкой
мускулатуры, способствуют увеличению сосудистой проницаемости, дегра-
нуляции тучных клеток и освобождению гистамина.
365
Биохимия животных
Антиген
Комплекс
лизирующий
антиген-антитела
(СЗ-конвертаза)
(С5-конвертаза)
Антитела
(ДО, \%М)
В-лимфоцит
Антиген-Антитела
сц
V.
Антиген-Антитела
С1г 4 С1г(эстераза)
4а (анафилатоксин)
С4ЬС5ЬС2аСЗЬ
Мембрана бактерий
С8
С6
С7
С9
С5ЬС6
С8 С7 С9
Мембрана бактерий
Са2-
Лизис бактерии
Рис. 7.8. Схема действия белков
системы комплемента по классическому пути
366
Глава 7. Функциональные системы
Образовавшиеся компоненты С2а и С4Ь переходят в активное
состояние, формируют в присутствии ионов магния ферментативный
комплекс (С2аС4Ь) под названием СЗ-конвертаза, в котором
катализатором реакций является С2а, а полипептид С4Ь связывается с
мембраной клетки-мишени, взаимодействуя своей (3-карбоксильной груп-
пой аспарагиновой кислоты с гидроксильной фуппой поверхностных
структур плазмалеммы. Этот комплекс активирует компонент СЗ (186
кДа), расщепляя его на полипептиды СЗа (9 кДа) и СЗЬ (177 кДа).
Меньший компонент СЗа принимает участие в развитии
воспалительного процесса, индуцируя хемотаксис лейкоцитов к очагу воспаления
(хемотаксис, воспалительные процессы). Более крупный компонент
СЗЬ связывается ковалентно на поверхности бактериальной клетки и
инициирует цепь реакций, приводящих к образованию мембраноата-
кующего комплекса С2аС4ЬСЗЬ, называемого С5-конвертазой. Этот
комплекс способен активировать пятый компонент комплемента С5
(181 кДа), расщепляя его на два полипептида — анафилатоксин С5а
(11 кДа), обладающий хемотоксической активностью по отношению
гранулоцитов, и С5Ь (170 кДа). После этого активированный
компонент С5Ь способен самостоятельно прикрепляться к клеточной
мембране, способствуя присоединению других компонентов комплимента
(С6 (128 кДа), С7 (120 кДа), С8 (150 кДа) и С9 (79 кДа)). Компонент
С9 по структуре и свойствам похож на перфорин — цитотоксичес-
кий белок естественных киллеров и цитотоксических лимфоцитов.
С9 присоединяется к комплексу мембранных ферментов, формируя
трансмембранный канал в мембране клетки (диаметр до 10 нм), через
который могут диффундировать небольшие молекулы, такие как вода
и ионы. При этом осмотические силы способствуют поступлению
воды внутрь бактериальной клетки, которая набухает и лопается, что
проявляется в лизировании бактериальной клетки. Процесс может
регулировать белок 5, связывающийся с комплексом С5ЬС6С7С8С9,
и препятствующий при этом формированию функционально
активного комплекса на поверхности мембраны. Кроме того, в
регуляции активации комплемента по классическому пути участвует С4-
связываюший белок (600 кДа), который способствует расщеплению
С4Ь под действием фактора I (88 кДа). При этом расщепление
полипептидов С4Ь и СЗЬ, способствует образованию нескольких
функционально активных пептидов, которые могут связываться с
рецепторами клеток иммунной системы или стимулировать лейкоцитоз,
как, например, СЗе.
367
Биохимия животных
Активность мембрано-лизирующего комплекса системы
комплемента инициируется полисахаридами мембран бактериальной клетки,
и этот путь активизации компонентов комплемента называется
альтернативным (рис. 7.9). При этом на начальных этапах
активизируется компонент СЗ комплемента, от которого отщепляются
полисахариды СЗа и СЗЬ. Фактор СЗЬ присутствует в плазме крови в низкой
концентрации и обладает способностью связываться на наружной
поверхности плазмалеммы бактериальной клетки. С мембранносвя-
занным СЗЬ в присутствии ионов М§2+ способен связываться
фактор В (90 кДа). Последний активизируется фактором О, который
является одноцепочсчным гликопротеином с молекулярной массой
23 кДа. Фактор О отщепляет от фактора В полипептиды Ва (30 кДа)
и ВЬ (60 кДа). Компонент СЗЬ и фактор ВЬ формирует
ферментативный комплекс СЗЬВЬ, называемый СЗ-конвертазой
альтернативного пути. Этот комплекс обладает протеолитическим действием на
СЗ, расщепляя его на СЗа и СЗЬ. Однако комплекс СЗЬВЬ крайне
нестабилен и поэтому для сохранения активности стабилизируется
пропердином Р, который является у-глобулином и состоит из
четырех одинаковых субъединиц, с общей молекулярной массой 150 кДа.
Кроме того, этот комплекс может стабилизироваться
полисахаридами, гликолипидами, гликопротеинами мембран микроорганизмов
и после этого начинает катализировать процесс образования в
больших количествах СЗЬ. Добавление к этому комплексу еще
нескольких компонентов СЗЬ обусловливает формирование активного
ферментативного комплекса — С5-конвертазы альтернативного пути
(РСЗЬВЬСЗЬ). Ферменты комплекса РСЗЬВЬСЗЬ способны
расщеплять белки мембран бактериальной клетки, активизируя процессы
ее лизиса.
Таким образом, завершается действие компонентов системы
комплемента по альтернативному пути. Как в классическом, так и в
альтернативном механизмах образуются ферменты, способные расщеплять
С5. Однако С5-конвертазой в классическом механизме служит
ферментативный комплекс С4ЬС2аСЗЬ, а в альтернативном — РСЗСЗЬВЬ.
Активный центр первого фермента расположен в молекуле С2а,
а у второго — в молекуле ВЬ. Обе конвертазы способны одинаково
расщеплять С5.
Активность ферментов системы комплемента возрастает в
присутствии ионов Са2+ и М§2+ и может регулироваться действием
белков-ингибиторов.
368
Глава 7. Функциональные системы
(СЗ-конвертаза)
(С5-конвертаза)
Р(пропердин)
СЗЬ Р ВЬ
СЗЬ
Мембрана бактерий
СЗЬСЗЬРВЬ С5
С5а
СЗЬСЗЬРВЬ
С5Ь
1
Лизис бактерий
Рис. 7.9, Схема действия белков
системы комплемента по альтернативному пути
369
Биохимия животных
Регуляция активации факторов комплемента осуществляется на
уровне образования комплекса СЗЬВЬ с фактором Н (150 кДа),
который совместно с СЗЬ инактиватором (фактором I или СЗЫпа)
способствует ферментативному расщеплению СЗЬ на неактивные
субъединицы. Ингибитор С1-эстеразы (СПпЬ) блокирует протеолиз С2
и С4 под действием С18. Фактор I способствует превращению СЗЬ в
ЮЗЬ, который, как и СЗЬ, может быть опсонином. Кроме того,
комплекс СЗЬВЬ способен активировать компоненты С4 и С2 с
образованием СЗ-конвертазы классического пути.
От действия факторов системы комплемента клетки могут быть
защищены некоторыми компонентами клеточных мембран. Так,
в составе клеточных мембран эритроцитов, лейкоцитов, тромбоцитов,
эпителиальных клеток присутствует фактор ЭАР (десау ассе1ега1тя
ГасЧог), который способен взаимодействовать с формирующимися
на поверхности клеток комплексами факторов комплемента,
способствуя их диссоциации. Эти же клетки имеют еще и фактор НЯР,
который связывает С8 и С9 и препятствует формированию литичес-
кого комплекса. В мембранах лейкоцитов и тромбоцитов
присутствует фактор МСР, связывающий СЗЬ и повышающий активность
фактора I.
^4еxанизм действия компонентов системы комплемента
проявляется за счет наличия специфических рецепторов для этих
компонентов на поверхности клеток. Так, опсонизация осуществляется
через рецептор СК1 (СЭ35), который присутствует на мембранах
эритроцитов, Т- и В-лимфоцитов, дендритных клеток. На плазма-
лемме нейтрофилов и тромбоцитов имеется рецептор СЯ5,
связывающий СЗй. На поверхности лейкоцитов имеются рецепторы СЯЗ
и СЯ4, способные связывать \СЗЪ и являющиеся адгезивными
молекулами лейкоцитов. СЗа и С5а имеют рецепторы на поверхности
клеточных мембран тучных клеток, нейтрофилов, эозинофилов,
лимфоцитов, моноцитов, эндотелиальных клеток, гладкомышеч-
ных клеток. Поэтому С5а обладает сильной хемотаксической
активностью по отношению к некоторым видам лейкоцитов (базофи-
лов, моноцитов, нейтрофилов и эозинофилов), вызывает агрегацию
клеток, высвобождение гранулярных ферментов и медиаторов,
активирует фагоцитоз. При участии С5а может происходить
сокращение гладких мышц трахеи, паренхимы легких, подвздошной кишки
и матки. Из-за своей высокой биологической активности С5а
быстрее всех фрагментов расщепляется протеазами. В понижении актив-
370
Глава 7. Функциональные системы
ности С5а принимает участие Г^-карбоксипептидаза, отщепляющая
от С-конца полипептидной цепи аргинин. При этом понижается хе-
мотаксическая активность С5а.
Активность СЗа и С5а проявляется через разные рецепторы,
индивидуализируя их активационные механизмы. Доказательством этого
является то, что при потере чувствительности с СЗа чувствительность
с С5а сохраняется. Кроме того, хемотаксическая активность СЗа
значительно ниже активности С5а. Действие СЗа подавляется антигиста-
минными препаратами, действующими на Нгрецепторы.
Действие системы комплемента связано с системой свертывания
крови, фибринолиза и кининовой системой. Иммунные комплексы
активируют механизмы коагуляции и внутрисосудистого
свертывания крови. Их действие опосредовано через различные медиаторы,
которыми служат компоненты комплемента. Нарушения в действии
системы комплемента могут приводить к угнетению фагоцитарной
активности лейкоцитов, развитию различных инфекций и
аллергических реакций, возникающих под воздействием иммунных
комплексов.
Кроме того, могут проявляться генетически детерминированные
дефекты факторов системы комплемента. Так, дефекты факторов С1...
С4 сопровождаются аутоиммунными заболеваниями, а дефекты
других факторов системы комплемента приводят к развитию
рецидивирующих бактериальных и грибковых инфекций. Дефект фактора СЗ
проявляется наличием рецидивирующих форм пневмоний, менингитами,
перитонитами, а дефекты факторов С5-С8, В и пропердина —
рецидивирующими бактериальными инфекциями. Дефекты ингибиторов
Н и I способствуют развитию повторных нагноительных процессов,
а дефект ингибитора С1-эстеразы проявляется наследственным ан-
гионевротическим отеком, что обусловлено протеолитическим
действием С 1з на факторы С2 и С4. Кроме того, С1 осуществляет контроль
за активностью калликреиновой системы, участвующей в
образовании брадикинина.
Следует отметить, что мелкие фрагменты от СЗ, С4 и С5, которыми
являются соответственно СЗа, С4а и С5а, синтезируемые при
активации комплемента или системы свертывания крови, обладают
анафилактической активностью в отношении тучных клеток и базофилов.
Эти фрагменты способны инициировать сокращение гладких мышц
и повышать проницаемость мелких кровеносных сосудов. СЗа, С4а и
С5а имеют одинаковую последовательность аминокислот и располо-
371
Биохимия животных
жение дисульфидных связей, схожи по механизму биосинтеза и
биологической активности, содержат на С-конце полипептидной цепи
аргинин, необходимый для проявления биологической активности.
Таким образом, система комплемента предназначена для
осуществления неспецифической защитной реакции живого организма на
проникновение единичных бактериальных клеток, с проявлением
активности факторов комплемента по альтернативному пути, тогда как
в результате специфического иммунного ответа на инфицирование
организма в плазме крови накапливаются антитела. При
взаимодействии этих антител с антигенами на поверхности плазмалеммы
бактериальных клеток формируются ферментативные комплексы по
классическому пути, обладающие протеиназной активностью. Результатом
действия этих комплексов является лизис бактерий. Однако действие
факторов комплемента может быть нивелировано за счет того, что
существуют микроорганизмы, которые способны понижать активность
факторов системы комплемента или имеют поверхностные
структуры, устойчивые к лизису, и таким образом избегают действия
факторов неспецифической защиты организма. Кроме того, некоторые
бактерии имеют специальные механизмы, понижающие процесс
активации факторов системы комплемента. Так, капсульные
полисахариды пневмококка ингибируют связывание фактора В с СЗЬ.
Бактерии (кишечная палочка, стрептококки, нейссерии, трепонема) имеют
сиаловые кислоты, которые способны усиливать связывание фактора
Н с СЗЬ, тогда как гликопротеины в составе вируса герписа повышают
нестабильность комплекса СЗЬВЬ.
7.1.7. Функции крови
Кровь осуществляет перенос питательных веществ, поступивших
из кишечника во все клетки организма (рис. 7.10). С помощью
гемоглобина, осуществляется аккумуляция газов (кислород и С02), а
эритроциты доставляют их к различным клеткам организма животного.
За счет высокого содержания белков, аминокислот, карбоновых
кислот, аминосодержащих (мочевина, мочевая кислота, креатинин,
азотистые основания) и других соединений поддерживается баланс рН и
осмотическое давление крови. Транспортируя гормоны и другие
функционально активные вещества, кровь осуществляет регулирование
клеточной активности. С помощью липопротеинов реализуется
транспорт нерастворимых в воде соединений (холестерина, кортикостеро-
идов, мужских и женских половых гормонов, высших жирных кислот,
372
Глава 7. Функциональные системы
нейтральных липидов, витаминов и др.). Компоненты крови
участвуют в остановке кровотечений при травмах, обеспечивают защиту
организма от бактерий и вирусов, предотвращая его инфицирование.
В этих механизмах проявляется активность тромбоцитов и
лейкоцитов. Белки крови осуществляют связывание токсичных соединений.
При этом кровь нейтрализует и выводит с мочей из организма
различные лекарственные и токсичные соединения. Направленное
движение крови обеспечивает терморегуляцию в организме животных, т. е.
постоянство температуры в различных участках тела.
Питательный
субстрат и вода
Пищеварительная
система
(н изкомолекул ярныс
вещества)
Костная система
(форменные элементы
крови)
/|
Дыхательная система
(кислород)
Кровь
(плазма и форменные
элементы)
Эндокринная система
(гормоны)
Система анализаторов!
(рецепторы)
Нервная система
(нейромедиаторы)
Продукты
жизнедсятел ьности
Выделительная
система
(моча)
Мышечная система
(миофибриллы)
Система размножения!
(половые клетки)
Система молочной
продуктивности
(молоко)
Рис. 7.10. Схема основных потоков веществ
и их регулирование в организме животных
373
Биохимия животных
Кровь имеет диагностическое значение, так как по качественным
и количественным показателям компонентов крови анализируется
состояние организма. При этом по ряду показателей можно
определить локализацию воспалительного процесса и его интенсивность.
7.1.8. Селезенка
Селезенка — многофункциональный орган, расположенный в
брюшной полости, основной функцией которого является депонирование
крови и участие в гуморальном и клеточном иммунитете.
Основными частями селезенки служат капсула, трабекулы и межтра-
бекулярная часть — пульпа. Различают белую и красную пульпу. При
этом белая пульпа включает комплекс лимфатических узлов селезенки,
выполняющих защитную функцию, продуцируя лимфоциты крови.
В селезенке лошади лимфатические узлы встречаются редко, мало их
и у свиньи. У КРС их много и они хорошо развиты. С возрастом их
число понижается. Красная пульпа располагается между
лимфатическими узлами и трабекулами. Приобретает окраску за счет содержания
большого количества эритроцитов. Состоит из ретикулярной ткани,
в составе которой клетки крови, плазматические клетки и макрофаги.
Красная пульпа активно кровоснабжается, поэтому имеет много ар-
териол, капилляров и винозные синусы, в которых депонируются
клеточные элементы. Фрагменты красной пульпы, расположенные
между синусами, называются пульпарными тяжами. Последние
содержат много лимфоцитов и участвуют в развитии зрелых
плазматических клеток. Макрофаги пульпарных тяжей осуществляют
фагоцитоз поврежденных эритроцитов.
Основная функция селезенки заключается в резервировании крови.
Больше всего эта функция проявляется у лошадей и жвачных
животных. Кроме того, селезенка является органом лимфообразования и
иммунитета, участвует в механизмах гуморального и клеточного
иммунитета. Может выполнять кроветворную функцию.
Селезенка способна выполнять роль макрофагического органа,
и при участии макрофагов в ней разрушаются клетки крови, в
особенности, эритроциты.
7.2. КОСТНАЯ СИСТЕМА
Костная система представляет собой сложно организованное
биогенное образование, в составе которой разные по строению и химиче-
374
Глава 7. Функциональные системы
скому составу клетки и межклеточные структуры. Различают три вида
тканей: соединительная, хрящевая и костная. Соединительная ткань
в свою очередь подразделяется на рыхлую, плотную и ретикулярную.
В составе рыхлой соединительной ткани клетки (фибробласты,
гистиоциты, тканевые базофилы, плазмоциты, липоциты, пигментоциты)
и межклеточное вещество (коллагеновые и эластические волокна
и основное вещество). Основное вещество заполняет все
межклеточное пространство, вырабатывается специализированными клетками
(фибробластами, гистиоцитами и частично тучными клетками),
продуктами деятельности которых служат гликозаминогликаны, прокол-
лаген и проэластин.
Гликозаминогликаны соединительной ткани представляют собой
неразветвленные полимеры, построенные из повторяющихся остатков
дисахаридов. В организме животных гликозаминогликаны образуют
комплексы с белками и в их составе обязательно присутствуют остатки
глюкозамина и галактозамина. Представителями гликозаминоглика-
нов являются гиалуроновая кислота, хондроитин-4-сульфат, хондрои-
тин-6-сульфат, дерматансульфат, кератансульфат, гепарин и др.
Основное вещество соединительной ткани представлено белками и
гликозаминогликанами. При этом около 30% белков образуют
комплекс с гиалуроновой кислотой. Состав основного вещества зависит от
вида тканей. В основном веществе располагаются
соединительнотканные волокна, состав которых зависит от функциональной
принадлежности тканей. Соединения, входящие в состав волокон, синтезируются
в клетках соединительной ткани. По своей природе волокна делят на
коллагеновые и эластические, принадлежность которых определяется
основными белками (коллаген и эластин), входящими в их состав.
Функциональная активность соединительной ткани обусловлена
различными клетками: фибробластами, гистиоцитами, тучными
клетками, плазмоцитами, липоцитами, пигментоцитами, клетками крови
(нейтрофилы, эозинофилы и др.). Этапом в развитии организма
является его старение, проявляющееся изменением состава
соединительной ткани, уменьшением содержания гликозаминогликанов и
увеличением содержания коллагена и эластина.
Патогенезсоединительнойткани отмечается при ревматизме,
склеродермии и др. При этом отмечается дегенерация коллагеновых
волокон, в составе которых коллаген заменяется фибриноидом. Кроме
того, разрушение гликозаминогликанов, особенно гиалуроновой
кислоты, сопровождается повышением активности гиалуронидазы.
375
Биохимия животных
7.2.1. Соединительная ткань
Соединительная ткань состоит из разнообразных клеток и
межклеточного вещества, представленного системой волокон,
выполняющих механические и формообразующие функции, в составе
которых фибриллярные белки и основное вещество.
Структурными белками волокон являются коллаген и эластин. Они
входят в состав перегородок, прослоек внутри органов,
многочисленных оболочек, формируют основу капсул, связок, фасций, сухожилий,
хрящей, кровеносных сосудов, кожу.
7.2.1.1. Коллаген
Относится к фибриллярным белкам, образуя длинные нити —
фибриллы. Каждое коллагеновое волокно состоит из фибрилл диаметром
до 100 нм, расположенных параллельно друг другу и погруженных
в межфибриллярное вещество, содержащее гликопротеиды, гликоза-
миногликаны и протеогликаны.
Коллагеновые нити формируются путем укладки молекул тропо-
коллагена, который является основной структурной единицей
коллагена с молекулярной массой 285 кДа. В составе тропоколлагена три
субъединицы — две (Х| и одна сс2. Переплетаясь, они формируют
единую спираль из трех полипептидных цепей, в составе которой
мономерные белки связаны между собой водородными связями.
ОН ОН 0Са1-С1с ОН ОН ОН
ОН О ОН ОН ОСа1-С1с ОН
Тропоколлаген
В аминокислотном составе цепей тропоколлагена преобладают
остатки глицина (до 30%), пролина, 4-гидроксипролина и 5-гидрокси-
лизин.
Генетически различают четыре типа коллагена: тип I [(а|1)2а2],
тип Н(а|11)з,тип III (а,Ш)з, тип 1У(а|1У)з- При этом коллаген типа I
входит в состав сухожилий, типа II — в состав хрящевой ткани, типа
III — в состав патологически измененных тканей, типа IV — в базаль-
ные мембраны.
376
Глава 7. Функциональные системы
ОН
ГЦ-
соон
1
4-гидроксипролин
ГЧН2
I
ЫН2СН2СНСН2СН2СНСООН
он
5-гидроксилизин
Прочность коллагеновых волокон обеспечивается за счет
дополнительных ковалентных связей между молекулами тропоколлагена.
В образовании межмолекулярных связей участвуют остатки лизина и
гидроксилизина, окисление которых аминоксидазой обусловливает
образование альдегидов, вступающих в реакции альдольной
конденсации или формирующих «шиффовы основания» (рис. 7.11).
сн,сн,сн,сн,мн,
он
СНДОРСН/М,
снрмх.сн.мн,
ндобсн.сн, -
9й
■ сн.смрсн.мн,
СН,СНр«^Н
^с-снсм.сн,.
<Г он
♦уюи/н.сн.сн.
^_
СНг
д*+*
«".си.
Ю**
,&»
ъ#*
Рис. 7.11. Ковалентные связи в коллагене (Овчинников, 1987)
Чистота формирующихся межмолекулярных связей зависит от
функции и возраста ткани. Так, например, коллагеновые волокна мягких
тканей (язык, хвост и др.) образованы за счет малого числа
межмолекулярных связей, тогда как коллагеновые волокна сухожилий
формируются путем установления большего числа связей, определяющих их
прочность.
В разложении коллагена принимают участие специфические
ферменты — коллагеназы.
377
Биохимия животных
При длительном воздействии высокой температуры в водной среде
коллагеновые волокна образуют гель.
Процесс синтеза коллагена происходит в фибробластах, на
рибосомах клеток. Вначале происходит синтез полипептидных цепей про-
коллагена. Затем пептидные цепи гидроксилируются и гликозилиру-
ются пострансляционно. Гидроксилирование проколлагена протекает
при участии протоколлаген-гидроксилазы, которая в качестве кофер-
мента использует аскорбиновую кислоту (рис. 7.12).
Рис. 7.12. Схема процесса биосинтеза коллагена (Овчинников, 1987)
378
Глава 7. Функциональные системы
7.2.1.2. Гликопротеины
Компонентом соединительной ткани служат гликопротеины. Они
относятся к группе сложных белков, в составе которых присутствуют
ковалентно связанные олигосахаридные цепи. В связывании углеводов
принимают участие аминокислотные остатки серина, треонина или ас-
парагина. В состав олигосахарида входят 10...20 остатков моносахаридов
(галактоза, манноза, Ы-ацетилглюкозамин, Ы-ацетилгалактозамин).
~Н2ОН
"V" '% • • \,
н-он
н-он
1ЧН — СОСНз
н-он
1ЧН — СОСНз
14- Ацетил глюкозамин
М-Ацетилгалактозамин
Заканчивается олигосахарид обычно Ы-ацетилнейраминовой
кислотой или фукозой. Гликопротеины обладают ферментативными,
гормональными и иммунными свойствами.
гнз
СНз-СОнм
СООН
М-Ацетилнейраминовая кислота
НОН
379
Биохимия животных
7.2.1.3. Протеогликаны
В состав протеогликанов основного вещества входят кислые муко-
полисахариды, ковалентно связанные с белками. В водном растворе
они гели, а в тканях заполняют пространство между клетками.
Протеогликаны сильно гидролизованы и содержат много ионов №+.
Углеводные компоненты протеогликанов называются гликозамино-
гликаны.
Бшкозаминогликаны. В состав гликозаминогликанов входят: гиалу-
роновая кислота, хондроитинсульфат, гепаринсульфат, дерматансуль-
фат и кератансульфат. По своей природе это линейные полимеры,
в образовании которых принимают участие уроновые кислоты (глкжу-
роновая, галактуроновая и идуроновая), N-ацетилгексозамины (1М-аце-
тилглюкозамин и М-ацетилгалактозамин) и моносахариды (галактоза,
манноза и ксилоза). Некоторые дисахариды могут быть
верифицированы серной кислотой.
он ОН
Глюкуроновая кислота Галактуроновая кислота
Гиалуроновая кислота является полимером, в основе которого
чередующиеся остатков О-глюкуроновой кислоты и N-ацетил-й-
глюкозамина. Молекулярная масса гиалуроновой кислоты может
составлять от 100 до 10000 кДа. Гиалуроновая кислота способна
активно связывать воду и, находясь в составе межклеточного
вещества, приобретает гелеобразную структуру, регулируя проницаемость
тканей.
При участии гиалуронидазы происходит гидролиз Р(1->4)-связи
гиалуроновой кислоты, сопровождающийся понижением вязкости
раствора.
Связь между мукополисахаридами и белками осуществляется
через трисахаридный остаток галактоза-галактоза-серин.
380
Глава 7. Функциональные системы
Э-глюкуроновая кислота 14-ацетил-О-глюкозамин
О
соон
н он
Н ЫНСОСНз
,1 п
Фрагмент гиалуроновой кислоты
Взаимодействие протеогликанов с коллагеном за счет ионных
связей приводит к формированию коллагеновых фибрилл.
Кислые мукополисахариды хорошо растворимы в воде, образуя ге-
леобразные структуры. Наибольшей вязкостью обладают растворы
гиалуроновой кислоты, имеющие молекулярную массу до 7-Ю3 кДа.
Хондроитинсульфат имеет молекулярную массу, равную 14... 18 кДа.
«ХГ -0, <^2ОН
I РО-3) I I 0(1-4)
ОН N4
0 = ССН3
0 = ССН3
Хонлроити н сульфат
Обладая низкой вязкостью, он не встречается в свободной форме.
Принимает участие в формировании сетчатой структуры хрящевой
ткани, сухожилий, роговицы глаз, в костной ткани и коже.
Различают хондроитинсульфат А и С, которые состоят из повторяющихся
звеньев дисахарида р-0-глюкуронозил-(1-->3)-р-0-1Ч-ацетилгалак-
тозамина, соединенных Р(1->4)-гликозидной связью.
Хондроитинсульфат А содержит сульфогруппу в С-4 положении N-ацетил галак-
тозамина, а хондроитинсульфат С сульфатирован при С-6.
381
Биохимия животных
В дерматансульфате вместо остатков О-глюкуроновой кислоты
присутствуют остатки Ь-идуроновой кислоты, связанные <х((1->3)-глико-
зидной связью с сульфатированным Ы-ацетилгалактозамином. Основная
биологическая роль дерматансульфатов заключается в стабилизации
волокон коллагена и антикоагулянтном действии.
нон
он
Ь-Идуроновая кислота
Кератансульфаты присутствуют в основном веществе хряща,
роговице глаз. Способны заполнять все свободное пространство,
вытесняя другие макромолекулы к периферии. Их цепи состоят из
чередующихся дисахаридных фрагментов, в составе которых остатки
О-галактозы и Ы-ацетилглюкозаминсульфат, соединенные р(1-И)-
связью. Дисахаридные остатки соединяются р(1->3)-связью. Остатки
галактозы могут быть сульфатированы. В молекуле могут
присутствовать остатки сиаловой кислоты, фу козы, маннозы.
Гепарин синтезируется тучными клетками, в его составе
определяются остатки О-глюкуронат-2-сульфата и Ы-ацетилглюкозамин-6-
сульфата. Особенно высокое содержание гепарина отмечается в печени
и легких. Молекулярная масса гепарина равна 15...20 кДа. Присутствие
остатков серной кислоты обуславливает его высокую кислотность.
В растворе гепарин имеет отрицательный заряд, что способствует его
взаимодействию с белками, участвующими в свертываемости крови.
Этим проявляется антикоагулянтное действие гепарина, который
выполняет роль кофактора антитромбина III, проявляющего анти-
свертывающее действие, нарушая активность факторов свертывания
крови (XI 1а, калекреин, Х1а, Ха, XI Па). В результате этих действий
гепарина в целом нарушается переход протромбина в тромбин. Кроме
того, ингибируется активность тромбина (Па).
Биосинтез протеогликанов. Процесс биосинтеза протеогликанов
начинается на рибосомах активных фибробластов. После завершения синтеза
полипептидной цепочки к аминокислотным остаткам серина через три-
382
Глава 7. Функциональные системы
сахарид-ксилоза-галактоза-галактоза присоединяется гликозаминог-
ликан. Процесс протекает при участии ксилозилтрансферазы и двух
различных галактозилтрансфераз, локализованных в эндоплазмати-
ческом ретикулуме. После этого осуществляется присоединение
первой молекулы глюкуроновой кислоты глюкуронозилтрансферазой.
Процесс продолжается при участии Ы-ацетилгалактозаминтрансфе-
разы и глюкуронозилтрансферазы 2, которые присоединяют 30...50
дисахаридных цепочек.
При образовании цепочки в 90 звеньев в процесс включаются суль-
фотрансферазы, которые вводят в состав молекулы сульфогруппы. Сфор-
мированные молекулы протеогликана концентрируются в форме
секреторных гранул, которые затем сливаются с цитоплазматической
мембраной с высвобождением содержимого во внеклеточное
пространство.
7.2.1.4. Эластин
Эластин — белок, близкий по структуре к коллагену, содержится
в стенке кровеносных сосудов, в связках.
В отличие от коллагеновых волокон эластические волокна не
объединяются в пучки, обладают высокой устойчивостью к действию
кислот и щелочей.
Образование эластических волокон в соединительной ткани
обусловлено синтетической и секреторной функциями фибробластов.
При этом вначале вблизи от фибробластов образуется каркас из ми-
офибрилл, а затем формируется предшественник эластина — проэ-
ластин. При участии специализированных ферментов
полипептидные цепи проэластина укорачиваются, превращаясь в сферические
молекулы тропоэластина, которые соединяются между собой с
помощью полифункциональных аминокислот десмозина и изодесмозина.
Это гетероциклические вещества, образованные при окислении ли-
зиновых остатков субъединиц эластина до а-полуацетальдегида ами-
ноадипиновой кислоты (аллизин). Молекулы десмозинов составляют
около 1% аминокислот, участвуя в образовании связей между
субъединицами эластина.
Прочность и гибкость эластина обусловлена свойствами его
субъединиц. Известен аминокислотный состав а-эластина, в первичной
структуре которого преобладают глицин, аланин, валин, пролин,
составляющие около 70%. Цистеин в составе полипептидной цепи белка
отсутствует. Из-за преобладания в мономерной молекуле белка гидро-
383
Биохимия животных
фобных аминокислотных остатков молекула эластина практически не-
полярна. Однако, несмотря на это, в водной среде субъединицы эластина
принимают форму глобулы. При этом гидрофобные аминокислотные
остатки полипептидной цепи образуют множество гидрофобных
связей, которые погружены во внутрь белковой глобулы, гидратированной
молекулами воды.
Н2Г1 .СООН
н2ы
\
сн—(сн2)2
ноос
(СН2)2 —СН
/
N142
\
соон
Десмозин
Н2Ы
\
/
СН —(СН2)2
ноос
1ЧН2
I
(СН2)2 —СН—СООН
(сн2)2 — сн—соон
ын2
н2ы соон
Изодесмозин
Характерной особенностью эластина является его способность
растягиваться. В первичной структуре эластина мало остатков гидрокси-
пролина и отсутствуют остатки гидроксилизина. Прочность эласти-
384
Глава 7. Функциональные системы
новых волокон достигается за счет большого числа межмолекулярных
и межкомпонентных связей.
Эластин подвергается гидролизу под действием пепсина при рН 2,0.
Коллаген и эластин практически нерастворимы в полярных
растворителях. В воде при температуре 100°С получается раствор желатина,
который при охлаждении образует гель.
7.2.2. Костная ткань
Костная ткань представляет собой специализированный вид
соединительной ткани. Развивается костная ткань из мезенхимы и
состоит из клеток и межклеточного вещества. Костная ткань составляет
основу костей скелета, черепа, грудной клетки, позвоночников,
обеспечивает функцию опоры, зашиты органов центральной нервной
системы (головной и спинной мозг) и фудной полости (легкие, сердце,
печень). Кроме того, красный костный мозг костей скелета участвует
в процессе кроветворения и дифференцировании клеток иммунной
защиты организма. В кости депонируются соли кальция и фосфора.
В состав костной ткани входят клетки (остеогенные клетки,
остеобласты, остеоциты и остеокласты) и межклеточное вещество,
которое имеет в своем составе коллагеновые волокна и компоненты
среды (гликопротеины, сульфатированные гликозаминогликаны,
фосфат кальция, гидроксил- и карбонатапатиты (ЗСа3(Р04)2 • Са(ОН)2
и ЗСа3(Р04)гСаСОз-Н20), ионы №+, К+, Си2+, 2п2', Ва2+, М&2\
СУ и др.
Различают грубоволокнистую и пластинчатую кость. Последняя
имеет коллагеновые волокна, которые располагаются параллельно,
формируя костные пластинки.
Грубоволокн истая кость представлена пучками, при этом
коллагеновые волокна располагаются беспорядочно.
Компоненты межклеточного вещества синтезируются в
остеобластах, которые по мере формирования костной ткани погружаются
в нее, превращаясь в остеоциты. Кроме того, в составе костной ткани
проявляют индивидуальную функциональную активность
остеокласты, ферменты лизосом которых способны разрушить кость.
В составе костной ткани животных 20...25% воды и 75...80%
твердых веществ. Последние на 60% представлены неорганическими и на
40% органическими соединениями. Их состав зависит от вида и
возраста животного, условий кормления и содержания, физического
состояния и вида кости.
385
Биохимия животных
В составе коллагеновой ткани высокое содержание остатков
глицина, оксипролина, оксилизина, мало остатков тирозина, гистидина,
метионина и нет триптофана и цистеина.
Неорганические соединения костной ткани образуют различные
кристаллы, структура и размер которых обуславливает взаимосвязь
между основным веществом и коллагеновыми волокнами. Основой
этих образований является фосфат кальция, большая часть которого
связана с остатками серина.
Основным представителем гликозаминогликанов костной ткани
служит хондроитин-4-сульфат, тогда как хондроитин-6-сульфат и ги-
алуроновая кислота присутствуют в незначительных количествах.
Клетки костной ткани богаты содержанием нуклеиновых кислот,
в особенности, РНК, что свидетельствует об их высокой
биосинтетической активности.
Значительное содержание цитрата в клетках позволяет
предположить, что в костной ткани он образует комплексные соединения с
солями кальция и фосфора, что обуславливает формирование кристаллов,
участвующих в образовании специфичной структуры костной ткани.
Активное кровоснабжение костной ткани обеспечивает
постоянное поступление в клетки питательных веществ, необходимых для их
функционирования.
Энергетические потребности обеспечиваются за счет протекания
процессов гликолиза и цикла трикарбоновых кислот, в которых
участвует АТФ. Образующиеся в процессе гликолиза фосфорорганиче
ские соединения расщепляются гидролазами с высвобождением ор-
тофосфорной кислоты, которая может взаимодействовать с хлоридом
кальция с образованием фосфата кальция. Кроме того, в остеобластах
синтезируется коллаген и гликозаминогликаны. Эти соединения
поступают в межклеточное пространство, где адсорбируют на своей
поверхности ионы Са2+ и фосфата, инициируя процессы
кристаллизации, завершающиеся формированием типичной костной ткани.
На поверхности кристаллов могут быть адсорбированы
разнообразные анионы (НС03~, ОН", С1", Р\ цитрат), катионы (№*, К+,
Си2+, 2п2+, Ва2+, М§2+) и молекулы воды. Костная ткань активно
снабжается кровью, с которой она получает как элементный, так и
органический материал кости. При этом кристаллы и волокна располагаются
параллельно, находясь в тесном контакте. В образовании кристаллов
кости принимают участие радикалы аминокислот и молекулы
гликозаминогликанов.
386
Глава 7. Функциональные системы
Процессы образования костной ткани регулируются со стороны
эндокринной системы и активностью ферментов. Образование
костной ткани зависит от элементного состава корма, содержания
витаминов (А, О, С и др.).
Недостаток витамина А проявляет замедление роста скелета, а также
рост и развитие мягких тканей. Эти изменения обусловлены
возникающими при авитаминозе и гиповитаминозе нарушениями в
синхронизации между скоростями минерализации кости и синтезом
коллагена. Кроме того, витамин А влияет на формирование костей,
регулируя функциональную активность остеобластов и
остеокластов в растущих костях. В результате этих изменений может
происходить утолщение и дисплазия костей. У А-витаминозных
животных кости становятся короче, толще и грубее костей нормальных
животных.
При недостатке витамина О в организме могут возникнуть
нарушения всасывания кальция и неорганического фосфора в
кишечнике, что подтверждает участие витамина О в осуществлении
активного транспорта кальция и фосфора через слизистую кишечника.
Кроме того, витамин О оказывает влияние и на пассивную
диффузию кальция через внешнюю мембрану клеток слизистой оболочки.
При О-авитаминозе проницаемость мембран клеток понижена, что
затрудняет поступление кальция в клетки слизистой оболочки и
проявляется в уменьшении количества кальция в плазме крови и других
жидкостях организма. Вследствие этого у животных могут развиться
нарушения в минерализации костной ткани, обусловливая
появление симптомов рахита, остеомоляции и остеопороза. Тогда как
введение витамина О рахитичным животным способствует повышению
всасывания как неорганического фосфора, так и кальция из просвета
кишечника в клетки слизистой оболочки. Под контролем витамина
О находится и процесс мобилизации кальция из костной ткани, что
обуславливает создание оптимальных условий роста костной ткани.
Кроме того, витамин О способен активировать процесс реабсорбции
кальция и фосфора в канальцах почек. Действие витамина О
проявляется за счет его избирательной локализации в эпителии тех
участков почечных канальцев, которые осуществляют обратное
всасывание фосфора. Кроме того, регуляторный эффект витамина О может
проявляться через действие гормонов. Так, снижение концентрации
кальция в крови вызывает гиперсекрецию гормона парашитовидной
железы (паратгормона), который тормозит реабсорбцию фосфора и
387
Биохимия животных
кальция. Повышение содержания витамина О способствует
возрастанию концентрации кальция в крови, снижает секрецию паратгор-
мона и процессы реабсорбции фосфора и кальция в почках
нормализуются.
Избыток витамина О в организме животных характеризуется
усиленным рассасыванием костной ткани, сопровождаемым
возрастанием содержания кальция и фосфора в плазме крови. Высокие
концентрации кальция и фосфора в крови способствуют увеличению
содержания их ионов в моче и образованию камней в почках. Таким
образом, избыток витамина О в организме может проявиться в
нарушении функции почек.
Недостаток в организме витамина С проявляется
заболеванием, при котором характерно уменьшение количества и
изменение свойств соединительной ткани в стенках кровеносных сосудов.
Основу соединительной ткани составляет коллаген, в составе
которого преобладает оксипролин. Поэтому действие аскорбиновой
кислоты обусловлено ее участием в реакциях гидроксилирования
пролина, для протекания которых требуется образование
свободных радикалов витамина С. При С-витаминной недостаточности
проявляется снижение образования оксипролина, что сказывается
на формировании коллагена, а также изменяет состав гликозами-
ногликанов. В несколько раз увеличивается содержание гиалуро-
новой кислоты и резко уменьшается включение серы в хондрои-
тинсульфат хрящей.
В регуляции метаболизма ионов кальция и фосфора принимает
участие гормон щитовидной железы кальцитонин, который
стимулирует перенос ионов из плазмы крови в клетки косной ткани,
способствуя отложению кальция в кости (рис. 7.13). На секрецию каль-
цитонина железой оказывает влияние содержание кальция в плазме
крови. Возрастание кальция в крови стимулирует выработку
гормона, действие которого способствует возрастанию его содержания
в клетках костной ткани. Таким образом, основной эффект действия
кал ьцито ни на ограничивается в угнетении процесса декальцифика-
ции костей. При этом на всасывание ионов кальция из кишечника
и выведение их почками из организма кальцитонин практически
не влияет. В лечебной практике используется синтетический
аналог кальцитонина — цибакальцин. Кроме того, кальцитонин
содержится в препарате кальцитрин, получаемом из щитовидной железы
свиней.
388
Глава 7. Функциональные системы
с
Щитовидная железа
Кальцитонин
Костная ткань
Са2* <«—
1 /
I /
\ /
\ /
V
Желудочно-
кишечный тракт
Паратгормон
Паращитовидная
железа
Рис. 7.13. Схема механизма действия гормонов на обмен кальция
На обмен кальция и фосфора оказывает влияние паратгормон,
синтезируемый в клетках паращитовидной железы. Действие па-
ратгормона вызывает декальцификацию костей и освобождение
ионов кальция в кровь. Кроме того, гормон способствует
всасыванию ионов кальция из желудочно-кишечного тракта. Причем
это действие проявляется через образование под влиянием парат-
гормона вначале кальцитриола, который является активным
метаболитом витамина Э3 (холекальциферола). Последний оказывает
389
Биохимия животных
стимулирующий эффект, обусловливая всасывание ионов Са2+
клетками слизистой оболочки кишечника. Паратгормон увеличивает
обратное всасывание ионов кальция в канальцах почек. Оба
действия паратгормона в итоге приводят к повышению содержания
ионов кальция в крови. При этом содержание в крови фосфатов
понижается, что обусловлено уменьшением их обратного всасывания
в канальцах почек. В практической медицине используется
препарат, получаемый из паращитовидных желез убойного скота — пара-
тиреоидин.
Простагландины ускоряют выход кальция из кости, способствуя
рассасыванию косной ткани. Аналогичное действие проявляется при
введении кортикостероидов, которые оказывают ингибирующее
действие на процесс синтеза гликопротеинов.
Накопление в клетках костной ткани молочной кислоты
понижает рН-среды, что приводит к деминерализации кости,
обусловленную растворением кристаллов гидроксилапатита. При этом
происходит расплавление органических структур кости с
высвобождением лимонной кислоты, концентрация которой возрастает
в крови.
7.3. НЕРВНАЯ СИСТЕМА
Нервная система животных предназначена для регулирования
процессов в функциональных системах организма, а также для
управления важнейшими функциональными системами организма животных
(рис. 7.14). При этом, нервная система хранит информацию об
окружающей среде, управляет двигательной активностью организма и
сократительной деятельностью гладких мышц, способна распознавать
повреждения и воздействия на организм, регулировать активность
эндокринной системы и реакций организма на токсичные вещества,
осуществлять мыслительную деятельность, участвовать в сенсорной
деятельности органов (слуха, зрения, обоняния, вкуса) и
контролировать сокращения мышц сердца и др. Благодаря нервной системе
проявляется стресс-реакция организма и активизируется адаптационный
потенциал животных.
Нервную систему условно можно разделить на центральную
(головной и спинной мозг) и периферическую (нервные волокна — аксоны
и нервные окончания). Основными элементами нервной системы
служат нейроны, нейроглии и микроглии (рис. 7.15).
390
Глава 7. Функциональные системы
Слукошй
Зрительный
Кровеносная система
Вкусовой
Г"*Е '*к ■ ^
Анализаторы
1
Головной мозг
Центральная нервная
система
Снннной мозг
▼
Нервные окончания
^ХХ^
Органы
1
Ткани
г
т
Функциональные
системы
Обонятельный |
1
Эндокринная система
Рис. 7.14. Схема действия нервной системы животных
Нейроглиальные клетки
Астроциты
Олигодендроциты
Клетки эпендимы
Микроглии
Рис. 7.15. Основные компоненты нервной системы
391
Биохимия животных
Нейрон является специализированной клеткой нервной системы,
который способен накапливать и передавать информацию в виде
нервных импульсов, проявляя действие всоставе сложных межнейрональ-
ных комплексов, дифференцирующихся по функциональному
признаку. Число нейронов в ЦНС высших животных составляет 10!2...Ю15.
Кроме нейронов в нервной ткани содержатся нейроглиальные
клетки — астроциты, олигодендроциты, клетки эпендимы и микроглии. При
этом только согласованная деятельность нейрональных и глиальных
клеток обеспечивает нормальное функционирование нервной ткани.
Кроме того, в организме животных присутствуют скопления
нервных клеток в различных частях тела (автономные ганглии),
действия которых независимы от контроля со стороны головного мозга.
Эти автономные ганглии обеспечивают автоматическую регуляцию
работы внутренних органов и кровообращения.
В состав нейрона входят тело клетки, многочисленные
ветвящиеся короткие отростки (дендриты) и один длинный отросток (аксон).
Аксон периферической нервной системы покрыт миелиновой и шва-
новской оболочками, тогда как аксон ЦНС не имеет миелина.
Последний представляет собой сложное белково-липидное образование,
в составе которого 78% липиды (фосфолипиды, цереброзиды и
холестерин) и 22% белки (гликопротеины, основные белки и белки с
большой молекулярной массой).
Миелиновая оболочка — это высокоорганизованное
структурное образование, располагающееся вокруг аксона; состоит из
компонентов плазматической мембраны олигодендроглиальной клетки.
Сформированная таким образом сложная мембранная структура
называется мезаксон, которая является элементарной единицей
миелина, представляя собой многослойные белково-липидные слои,
число которых может достигать до 250. Липидными компонентами
миелина служат цереброзиды и сульфоцереброзиды. В составе
миелина 20...25% холестерина и 40...45% фосфолипидов.
Однако аксон не полностью покрыт миелиновой оболочкой,
а только фрагментарно, длина — 1...2 мм. Открытые участки
поверхности нервных волокон называются перехватом Ранвье. Их основное
предназначение в генерации электрического возбуждения, которое
является проявлением активности нейрона и основано на протекании
биохимических, электрических и тепловых процессов.
Нейроны могут контактировать между собой. При этом место
контакта окончания аксона с телом клетки или с аксоном и дендритом
392
Глава 7. Функциональные системы
другой клетки называется синапсом. На одном нейроне может быть
до нескольких тысяч синапсов.
По функциональному признаку различают возбуждающие и
тормозящие синапсы. Причем возбуждающими в основном являются
синапсы, образованные с участием аксона и дендрита различных
нейронов и характеризующиеся широкой синаптической щелью, толстой
и плотной постсинаптической мембраной. Тормозные синапсы имеют
узкую синаптическую щель и более тонкую мембрану.
В передаче возбуждения в возбуждающих синапсах принимает
участие ацетилхолин, содержание которого находится под контролем двух
ферментов: ацетилхолинсинтетазы (1) и ацетилхолинэстеразы (2).
о Н о
СНз-С-ОН + НО-СН2-СН2-М+(СНз)з щ > СНз-С-0-СН2-СН2-Ы+(СНз)з + Н20
ацетат холин \2\ ацетилхолин
К медиаторам возбуждения ЦНС относятся глутаминовая и аспа-
рагиновая кислоты, а тормозным — у-аминомасляная кислота и
глицин. При этом медиаторная функция глицина ограничивается только
спинным мозгом.
К медиаторам, оказывающим как возбуждающее, так и
тормозящее действие на нейроны ЦНС, относят катехоламины (дофамин, но-
радреналин и адреналин) и серотонин. Предшественником катехола-
минов является фенилаланин, а серотонина — триптофан.
7.3.1. Химический состав нервной ткани
Углеводы. В головном мозге содержатся гетерополисахариды, в
основном, ганглиозиды, в составе которых остатки глюкозы, галактозы,
сфингомиелина, высших жирных кислот и нейраминовой кислоты.
Отмечается высокая активность нейраминидазы, которая
катализирует реакции гидролиза, 2,3-, 2,6- и 2,8-гликозидные связи,
соединяющие концевые нередуцирующиеся остатки 14- или
О-ацилнейраминовой кислоты, с остатками галактозы, Ы-ацетилгексозамина или
N1- или О-ацилнейраминовой кислоты вол игосахаридах, гл и ко
протеин ах, гликолипидах и в коломиновой кислоте. Кроме того, в составе
нервной ткани содержатся гликоген, глюкоза и пентозы.
393
Биохимия животных
В нервной ткани активно протекают энергетические процессы,
субстратами которых служат глюкоза и кислород. Причем потребление
глюкозы не может быть компенсировано другими соединениями.
Липнды. В состав нервной ткани входят специфические липиды,
которые определяют сложность и своеобразие мембран и
надмолекулярных образований, в частности, миелина. На долю липидов
приходится до 50% сухой массы нервной ткани, из которой одну половину
составляют фосфолипиды, а другую — холестерин и гликолипиды.
Кроме того, в составе нервной ткани определяются эфиры
холестерина, цереброзиды и небольшое количество глицеридов. К
специфическим липидам нервной ткани можно отнести ганглиозиды, галакто-
цереброзиды, полифосфоинозитиды.
Процентный состав липидов мозга крупного рогатого скота
представлен следующими соединениями: холестерин — 20,3,
цереброзиды — 16,7, кефалины — 16,5, лецитин — 11,0, сфингомиелин —
8,0, фосфатидилсерин — 7,2, сульфолипиды — 3,5, ганглиозиды — 2,8,
фосфатид ил инозин — 1,1, полиглицеролфосфолипиды — 2,4, фос-
фатидная кислота — 0,6, церамид — 0,4, трифосфоинозит — 0,3, не-
липидные фракции — 9,0.
Видно, что в составе липидов мозга преобладают фосфолипиды
и холестерин. При этом фосфолипиды нервной ткани составляют
до 70% от суммарного содержания липидов в сером веществе и до
45...50% в белом веществе мозга.
Нервная ткань особенно богата кефали ном, сфингомиелином.
Основная масса высших жирных кислот мозга составляют
пальмитиновая (С 16:0), стеариновая (С18:0), олеиновая (С18:1) и арахидоновая
(С20:4) кислоты. Всего в мозге выявлено около 40 жирных кислот.
Гетерогенность жирных кислот обуславливает структурную лабильность
мембран и определяет их физико-химические свойства.
Большинство холестерина в нервной ткани содержится в
свободном состоянии и увеличивается с возрастом. Липиды,
входящие в состав нервной ткани, участвуют в формировании мембран.
Причем наружная и внутренние поверхности мембран
характеризуются микрогетерогенностью, формируя их асимметричность. При
этом наружный слой мембраны образуется из молекул фосфати-
дилхолина, сфингомиелина, полифосфоинозитидов, холестерина,
цереброзидов и сульфатидов, а аминофосфолипиды (фосфатид и-
лэтаноламин и фосфатидилсерин) располагаются во внутреннем,
цитоплазматическом слое.
394
Глава 7. Функциональные системы
Белки. Упорядоченное расположение липидов в мембране создает
условие для оптимальной конформации и проявления
функциональной активности белков, выполняющих каталитические,
транспортные, иммунологические и другие функции.
Расположение белков в мембране определяет размещение
липидов, которые создают условия для их латерального перемещения и
через фазовые переходы регулируют активность белков.
Мембранные белки, погруженные в липидный слой, содержат
значительное количество гидрофобных аминокислот, что обеспечивает
устойчивость их связей с липидами и определяет их расположение
в мембране.
Активность генома клеток нервной системы характеризуется
разнообразием экспрессируемых специфичных генов, среди которых
есть гены, определяющие синтез большого числа нейроспецифич-
ных белков. Возможность регулирования механизмами экспрессии
генов обусловливает формирование элементов памяти и других
функций ЦНС.
Нейроспецифические белки в основном представляют собой
глико- или липопротеины, участвующие в формировании реиеп-
торных систем, расположенных на поверхности клеточной
мембраны. Кроме того, некоторые из нейроспецифических белков
участвуют в процессах генерации и проведения нервного импульса,
установлении межклеточных контактов нервной ткани, регуляции
проницаемости ионных каналов, в механизмах обучения и
формирования памяти.
Белки ЦНС способны взаимодействовать с ионами Са2*. Одним из
первых был открыт нейроспецифичный белок 5-100, в составе
которого две фракции: 5-100 А и 5-100 В, с субъединичным составом
соответственно аа и ар. Причем аминокислотная последовательность
(3-субъединицы близка по составу Са-связывающим белкам (кальмо-
дулин и тропонин С).
Следует отметить, что аминокислотный состав белка 5-100
характеризуется высоким содержанием кислых аминокислот (36% остатки
глутаминовой и 22% остатки аспарагиновой кислот), оставшиеся 42%
аминокислотных остатков относятся к гидрофобным алифатическим
аминокислотам (аланин, валин, лейцин, изолейцин). При этом 3...4%
от общего аминокислотного состава приходится на цистеин, 5Н-группы
которого способны взаимодействовать с ионами Са2+. В результате этих
взаимодействий происходят конформационные перестройки в струк-
395
Биохимия животных
туре белка 8-100, сопровождаемые изменением пространственного
расположения гидрофильных и гидрофобных поверхностных участков
белковой глобулы, что оказывает влияние на способность 8-100
мигрировать через мембраны клетки. Поэтому функциональная роль белка
8-100, по-видимому, связана с регуляцией проницаемости ионных
каналов за счет связывания ионов Са2*.
Кроме того, в клетках нервной ткани отмечено высокое
содержание кальмодулина, выполняющего роль переносчика ионов Са2+.
Молекулярная масса кальмодулина 17 кДа, он содержит четыре центра
связывания Са2\ Активность белка подавляют кальцинейрин, фос-
фомиристин и хлорпромазин. Последний относится к группе
нейролептиков, производных фенотиазинов.
Кальцинейрин состоит из двух субъединиц по 15 и 61 кДа,
обладает протеинфосфатазной активностью. Другой белок, фосфомири-
стин, относится к липопротеинам (27...32 кДа). В состав белка входит
миристиновая кислота (С14:о) и до 30% остатков аланина. Белок может
фосфорилироваться под действием протеинкиназы С. В дефосфори-
лированном состоянии фосфомиристин способен связывать кальмо-
дулин, а после фосфорилирования высвобождает его.
В составе фосфорилируемых белков плазматических мембран
синапсов присутствует нейроспецифический белок В-50,
локализованный преимущественно в пресинаптических мембранах. В-50 является
эндогенным субстратом диацилглициролзависимой и
Са2^-зависимой протеинкиназы С. Фосфорилирование белка В-50 способствует
изменению заряда мембраны, вследствие этого возрастает
проводимость транспортных каналов.
В процессе синаптической передачи принимают участие нейроспе-
цифические белки фодрин и фосфопротеин Р1-20, имеющие
молекулярные массы соответственно 230 и 190 кДа. Оба белка являются
субстратами Са2+-зависимой протеинкиназы калпеина, которая способна
их расщепить. В результате освобождаются активные рецепторы глута-
миновой кислоты, ранее закрытые этими белками, что проявляется в
повышении проводимости синапса.
Следует выделить группу нейроспецифичных белков, обладающих
сократительной функцией. К ним относятся нейротубулин, нейростенин,
кинезин и др. Эти белки обеспечивают ориентацию и подвижность
цитоплазматических структур (микротрубочек и нейрофиламентов)
нервной клетки, участвуют в активном транспорте компонентов
нейрона, а также в нейромедиаторных процессах в синапсах.
396
Глава 7. Функциональные системы
Нейроспецифические гликопротеины участвуют в формировании
миелина, в процессах клеточной адгезии, нейрорецепции и взаимном
узнавании нейронов в онтогенезе и в процессах регенерации.
В клетках нервной ткани, как и в других клетках организма,
проявляется активность ферментов гликолиза, глюконеогенеза, липолиза,
гликогенеза, окислительного декарбоксилирования кетокислот, ан-
тиоксидантной системы и др.
Функционально активные вещества. В составе азотистых веществ
определяются: креатин, креатинфосфат, АТФ, АДФ, холин, ацетилхо-
лин, серотонин, у-аминомасляная кислота, мочевая кислота, аспара-
гин, гистамин и др.
В составе безазотистых веществ: глюкоза, инозит, лактат, пируват,
триозо- и гексозофосфаты.
7.3.2. Метаболические процессы
Высокая активность нейронов обусловливает значительное
потребление кислорода, который инициирует окислительные процессы
в головном и спинном мозге. При этом потребление глюкозы
увеличивается в 2 раза, по сравнению с мышцами. Продуктом
окисления глюкозы является пировиноградная кислота, которая активно
используется в процессах синтеза аминокислот. Так, установлено,
что метаболизм глутаминовой кислоты в нервной ткани сопряжен
с активностью ферментативных систем гликолиза и цикла трикар-
боновых кислот, что было показано на примере превращения
меченной глюкозы, 70% которой приходилось на долю глутаминовой
кислоты и ее производных уже через 30 минут после инъекции
меченной глюкозы.
Определяющим этапом в синтезе глутаминовой кислоты служат
реакции восстановительного аминирования и переаминирования
(рис. 7.16).
Глутаматдегидрогеназа (3) присутствует в митохондриях, проявляет
активность в присутствии пиридиндинуклеотидов (НАДН, НАДФН)
и активируется АДФ. Кт для молекул аммония равна 8 мМ. Реакция
обратима, однако равновесие сдвинуто в сторону образования
глутаминовой кислоты.
Таким образом, основная роль глутаматдегидрогеназы — участие
в синтезе в клетках головного мозга глутаминовой кислоты из а-кето-
глутаровой, связывая в этой реакции молекулы свободного аммиака.
397
Биохимия животных
СН,-СН-СООН
I
ын2
СНз-С-СООН
ч И о/
соон
I
с=о
сн2
сн2
соон
'Шг-СНгСНг-СНг-СООН I 2 10=СН-СН2-СН2-СН2-СООН
1№ 1 3 |НАДд>н"
НООС-СН2-СН(КН2)-СООН
ноос-сн2-с-соон
(^ООН
сн-ш2
1
сн2
СНг
боон
НО—/ \-СН,—СН—(
1ЧН,
СООН
сн,—с—соон
о
Рис. 7.16. Реакции синтеза глутаминовой кислоты в клетках нервной ткани:
/ — аланинаминотрансфераза; 2 — трансаминаза ГАМ К;
5 — глутаматдегидрогеназа; 4 — аспартатаминотрансфераза;
5 — тирозинаминотрансвераза
В митохондриях клеток мозга до 90% глутаминовой кислоты
подвергаются переаминированию с образованием аспартата. Реакция
катализируется аспартатаминотрансферазой (4). Определены две изоформы,
которые присутствуют в митохондриях и цитоплазме.
Функционирование митохондриального фермента обусловлено деятельностью изофер-
ментов ЦТК, а цитоплазматической формы — глюконеогенеза.
В нормально функционирующих митохондриях активность тран-
саминаз выше, чем дегидрогеназ. Это обусловлено тем, что
протекание дегидрогеназных реакций приводит к снижению концентрации
восстановленных форм пиридиннуклеотидов.
Однако в случае разобщения окислительного фосфорилирования,
например, с помощью 2,4-динитрофенола, происходит переключение
типа реакций с трансаминазных на дегидрогеназные.
В клетках мозга выявлен активно действующий механизм
взаимного превращения аспартата и малата, который получил название ас-
партат-малатного шунта, используемый для транспорта
восстановленных соединений из цитоплазмы в митохондрии (рис. 7.17).
Таким образом, через митохондриальную мембрану активно
диффундируют восстановленные соединения, которые в последующем
398
Глава 7. Функциональные системы
х
о
о
X
я
а
X
I
Я
х
8
-В
X
о
о
X
ее
ее
•Ч
С
1
8
31
31
3
о
о
X
сч
2 -
т
X
о
о
X
X
X
о
о
X
^гнвйдп^щ
X
о
о
|-8 3
X
2
1^
X
о
о
X
3
8
X
о
о
о
о
х"
■2
в
X
2 *
II
1 с
о. о
й> ев
1М
т '*
II
2 1
X и
§ &
ев §
х
о-.
5
X
8
X
о
о
X
399
Биохимия животных
окисляются в матриксе митохондрий, обеспечивая функциональную
деятельность митохондрий по синтезу АТФ. Этому способствуют
высокие концентрации ферментов, участвующих в механизме действия
аспартат-малатного комплекса в нейронах мозга.
Глутаминовая, аспарагиновая и у-аминомасляная кислоты
повышают уровень энергетических процессов в клетках нервной системы,
участвуют в механизмах адаптации организма к гипотермии.
В нейронах протекают ферментативные реакции амидирования
глутаминовой и аспарагиновой кислот. Так, глутаминсинтетаза (КФ
6.3 Л .2) катализирует следующую реакцию:
НООС-СН2-СН2-СН -СООН + ЫН3 + АТФ
Щ
Глутаминовая кислота
0= С-СН2-СН2-СН-СООН + АДФ + Фн + Н20
ЫН2 1ЧН2
Глутамин
Активность фермента особенно высока в клетках головного мозга
животных, где его содержание составляет 0,2% от общего белка мозга.
Для протекания реакции требуется АТФ и ионы магния.
Ингибиторами фермента являются глицин и аланин.
Реакция синтеза глутамина обеспечивает связывание аммиака,
высокие концентрации которого губительны для клеток ЦНС. Так, при
повышении концентрации аммиака в мозге до 0,6 мМ отмечаются судороги
у животного. Введение аммиака в организм животного вызывает
конвульсии, сопровождаемые увеличением содержания глутамина в клетках
мозга. В случае повышения содержания аммиака и глутамата в
спинномозговой жидкости у животных может проявляться коматозное
состояние. Больше всего активность глутаминсинтетазы определяется в глиаль-
ных клетках и очень мало фермента в нервных окончаниях.
Реакции дезаминирования глутамина катализирует глутаминаза.
н2о
о=с — сн2—сн2—си—соон ^^ » ноос—сн2—сн2—сн — соон
Ан2 ын2 мнэ мн2
м82+
»
400
Глава 7. Функциональные системы
Наибольшая активность фермента проявляется в митохондриях
клеток. Ингибиторами фермента служат продукты реакции (глутами-
новая кислота и аммиак).
Таким образом, различия в локализации ферментов (глутаминсин-
тетаза и глутаминаза) обуславливают специализированное™» действия
глиальных клеток и нейронов. При этом глутаминовая кислота может
образоваться из глюкозы и у-кетоглутаровой кислоты, а также из ор-
нитина и аргинина.
Продуктом декарбоксилирования глугаминовой кислоты в клетках
головного мозга является у-аминомасляная кислота, в образовании
которой принимают участие три фермента (глутаматдекарбоксилаза, ГАМК-
трансаминаза, дегидрогеназа янтарного полуальдегида) (рис. 7.18).
ноос-сн2-сн2-сн-ссюн *—ч
щ
Глутаминовая кислота
ш^
СОг
ЫН2-СН2-СНг-СН2-СООН
у-Аминомасляная кислота
НООС-СН2-СНг-С-СООН
б
О
аКетоплутаровая кислота
га
0=ОСН2-СН2-СООН
Полуальдегид янтарной
кислоты
ЦТК
ш
НООС-СН2~СН2-СООН
Янтарная кислота
Рис. 7.18. Путь превращения у-аминомасляной кислоты:
/ — глутаматдекарбоксилаза; 2 — ГАМК-трансаминаза; 3 — дегидрогеназа
янтарного полуальдегида
Глутаматдекарбоксилаза (1) катализирует реакцию отщепления
СС>2 от глутаминовой кислоты с образованием у-аминомасляной
кислоты. Фермент присутствует только в ЦНС, в основном в сером
веществе. Коферментом ГДК служит пиридоксальфосфат, входящий
401
Биохимия животных
в состав активного центра фермента. Молекулярная масса фермента
85 кДа, Кт для глутамата 0,7 мМ, а для пиридоксальфосфата 0,05 М.
Основным субстратом фермента является глутаминовая кислота.
ГАМК-трансаминаза (2) находится в сером веществе мозга, но
определяется и в других тканях. Коферментом фермента служит пири-
доксальфосфат. Фермент катализирует реакцию переноса аминогруппы
с у-аминомасляной кислоты на у-кетоглутаровую кислоту. В результате
образуется глутаминовая кислота и полуальдегид янтарной кислоты.
Последний при участии соответствующей дегидрогеназы
восстанавливается до янтарной кислоты.
Аминомасляная кислота является медиатором торможения в
нервной системе, локализуется преимущественно в нервных
окончаниях тормозных нейронов ЦНС, подавляет биоэлектрическую
активность головного мозга позвоночных животных.
Мозг животных содержит разнообразные нейропептиды, которые
выполняют регуляторные функции, являясь участниками синапти-
ческой передачи сигналов и дистанционными регуляторами,
обеспечивая широкий круг функций ЦНС и психоматические взаимодействия.
Репликативный синтез ДНК в дифференцированных нейронах
отсутствует. Поэтому в мозге млекопитающих репликация ДНК, в
основном, протекает в глиальных клетках.
Ограниченность репликативных процессов ДНК компенсируется
активно функционирующей системой репарации, что обеспечивает
целостность и нормальное функционирование генетического аппарата.
Хроматин нервных клеток имеет типичную для эукариотических
клеток фрагментацию. При этом в составе нуклеосом присутствуют
различные виды гистонов, а также значительное число негистоновых
белков и высокая синтетическая активность генома, обусловленная
экспрессией нескольких десятков тысяч уникальных генов.
Системы активного транспорта аминокислот осуществляют их
движение как в клетки мозга, так и обратно. Причем оба процесса энерго-
зависимы и представлены специальными транспортными системами,
проявляя избирательность для отдельных аминокислот.
Высокоактивными являются системы транспорта нейротрансмиттеров (глицин,
у-аминомасляная кислота, таурин, глутаминовая кислота и др.).
Предшественниками основных нейромедиаторов служат
ароматические аминокислоты (триптофан и тирозин). Так, в результате
метаболизма триптофана в клетках нервной ткани может синтезироваться
серотонин и мелатонин (рис. 7.19).
402
Глава 7. Функциональные системы
сн, — сн—соон
I
МП,
сн. — сн—соон
I
От
н
Триптофан
то-
н
5-Окситриптофан
ось *уГг]
СНз-С-8КоА Се^Г
ПК"
со2
—^ I
СХт
. сн, — сн,
Триптамин
'Ш
ВЗКоА
сн, — сн,
I °
I II
ын-с-сн,
8-Аденозил-Ь-метионин
н,со
]Ч-Ацетилсеротонин
ш
5-Аденозил-Ь-гомоцистеин
—сн,—мн—с—
сщ-сн,
сн,
Мелатонин
Рис. 7.19. Метаболизм триптофана в клетках головного мозга:
У — триптофан гидрокс ил аза; 2— 5-окситриптофанлекарбоксилаза;
3 — ацетилтрансфераза; 4 — аиетилсеротонинметилтрансфераза,
5 — триптофандекарбоксилаза
Начальной стадией этого процесса является реакция гидроксили-
рования триптофана, катализируемая триптофангидроксилазой (1).
Реакция протекает в присутствии кислорода и тетрагидробиоптерина,
403
Биохимия животных
который выполняет роль кофактора. Активность фермента
определяется исключительно в серотонинергических нейронах мозга.
Ингибиторами фермента являются катехоламины.
В дальнейшем 5-окситриптофандекарбоксилаза (2) катализирует
реакцию декарбоксилирования 5-окситриптофана с образованием се-
ротонина.
В эпифизе серотонин при участии специфической ацетилтрансфе-
разы (3) ацетилируется с образованием Ы-ацетилсеротонина.
Последний подвергается О-метилированию с участием метилтрансферазы
(4), которая использует в качестве донора метильной фуппы 5-адено-
зилметионин. При этом образуется гормон эпифиза мелатонин.
Превращение тирозина в мозге протекает при участии тирозин-3-
гидроксилазы (1), активность которой лимитирует весь процесс. В
реакции участвует кислород, восстановленный птеридин и Ре2+.
Продуктами реакции являются 3,4-дигидроксифенилаланин (ДОФА), который
подвергается декарбоксилированию при участии ДОФА-декарбокси-
лазы (2). Фермент активен в присутствии пиридоксальфосфата и
способен участвовать в реакциях декарбоксилирования различных
ароматических аминокислот.
сн2 — сн —соон о2 нОх^С^^сн2—сн—соон СОг
-►
■сн—соон со-
I —«■"« »
©' НПА^ ^ ©
но
Тирозин Диоксифенилаланин
(ДОФЛ)
НОх^^ч^СН2—ГН2 02 НО^^Лх^СН2— ОН^СНз
" А-Д »* ©Г Х^ ^-нн, ©
но ^^ ч-^ но
Диоксифенилэтиламин Норадреналин
(дофамин)
."•ЙГ"0"
У<^М СН2 — М — СН3
но
Адреналин
В следующей реакции, катализируемой дофамин-р-гидроксила-
зой (3), дофамин превращается в норадреналин. Для протекания ре-
404
Глава 7. Функциональные системы
акции требуется кислород и аскорбиновая кислота. Активность
фермента возрастает в присутствии фумаровой кислоты.
Конечная стадия образования адреналина катализируется фени-
лэтаноламин-Т^-метилтрансферазой (4), которая осуществляет перенос
метильной группы от 5-аденозилметионина на аминогруппу норадре-
налина. Фермент ингибируется высокими концентрациями продукта
реакции — адреналина.
7.4. СЕНСОРНЫЕ СИСТЕМЫ
Поведение млекопитающих в окружающей среде во многом
определяется наличием у них высокоразвитой центральной нервной системы,
которая получает информацию о внешнем мире и о состоянии
организма от специализированных рецепторных систем. К ним относятся
зрительные, слуховые, обонятельные, вкусовые и осязательные
рецепторы, которые воспринимают раздражение из внешней среды.
В составе сенсорной системы три отдела: рецепторный,
проводящий и принимающий. Рецепторный отдел содержит компоненты,
в которых происходит преобразование сигналов в нервный импульс.
Он представлен специализированными органами.
7.4.1. Система зрения
Зрение — это результат функциональной деятельности зрительной
системы, основанный на восприятии электромагнитных излучений в
видимом диапазоне спектра. Процесс состоит из нескольких этапов.
Вначале происходит проектирование изображения на сетчатку глаза,
а затем возбуждение фоторецепторов и передача преобразованной
зрительной информации нейронными слоями зрительной системы
в отделы центральной нервной системы.
Свет проходит через прозрачные образования и среды
зрительной системы: роговицу, хрусталик, жидкость передней и задней камер
глаза, стекловидное тело (рис. 7.20).
Наружная оболочка глаза состоит из двух частей — роговицы и
склеры. Роговица располагается в передней части наружной оболочки
и состоит из плотной соединительной ткани, она лишена
кровеносных сосудов. Прозрачность роговицы обусловлена коллагеновыми
волокнами, которые имеют одинаковую толщину. Роговица меняет
свою структуру и переходит в склеру. Последняя еще называется
белочной оболочкой, окрашена в белый цвет, непрозрачна. В основном
состоит из коллагеновых фибрилл и глюкозаминогликанов.
405
Биохимия животных
Хрусталик имеет вид двояковыпуклой линзы с большой кривизной
задней поверхности. Прозрачность хрусталика обусловливают
эпителиальные клетки, которые составляют его основу. Эти клетки в
процессе дифференциации утрачивают свои органеллы, сохраняя только
продольно расположенные микротрубочки и скопления свободных
рибосом. Капсула хрусталика содержит коллаген, богатый оксилизином,
ОН-группа которого образует гликозидную связь с глюкозилгалакто-
зой. Основными белками хрусталика являются а-, р- и у-кристаллины.
Хрусталик быка содержит ос-кристаллин, в составе которого две
полипептидные цепи по 173 и 175 аминокислотных остатков.
Рис. 7.20. Схема горизонтального разреза глаза:
/ — передний полюс глаза; 2 — роговица; 3 — передняя камера;
4— радужная оболочка; 5— задняя камера; б — хрусталик; 7— стекловидное
тело; <? — экватор глаза; 9— склера; /0 — сосудистая оболочка;
11 — сетчатка; 12 — зрительная ось; 13 — ось глаза; 14 — фовеа;
15 — зрительный нерв
Осаждение а-кристаллина способствует развитию мутности в
центральной области хрусталика, что обусловлено протеолизом концевых
аминокислотных остатков полипептидных цепей и реакциями деза-
минирования. В хрусталике отмечается высокое содержание глутати-
она и аскорбиновой кислоты.
Сосудистая оболочка является задней частью средней оболочки
глаза, богата пигментами и активно снабжается кровью. Состоит из
406
Глава 7. Функциональные системы
соединительной ткани, представленной сетью эластических волокон
и многочисленными пигментными клетками.
Внутреннюю оболочку стенки глазного яблока, прилежащую к
стекловидному телу, представляет сетчатка. Это основной элемент
фоторецепции, составляет единое целое со зрительным нервом и своей
внутренней поверхностью граничит со стекловидным телом,
прилегая снаружи к сосудистой оболочке. В задней части сетчатки
содержатся фоторецепторные клетки, которые и обусловливают основное
свойство глаза — светочувствительность. Зрительная часть сетчатки
состоит из двух слоев: пигментного слоя, прилегающего к
внутренней поверхности сосудистой оболочки, и контактирующего со
стекловидным телом фоторецепторных, первичночувствительных клеток
нервного слоя сетчатки.
Клетки пигментного слоя получают питательные вещества из
кровеносных сосудов средней оболочки глаза. На поверхности этих
клеток присутствуют микроворсинки, прилегающие к фоторецепторным
клеткам и участвующие в обновлении наружных сегментов
фоторецепторных клеток, очищая их крайнюю в данный момент часть
фоторецептора путем эндоцитоза. Кроме того, клетки пигментного слоя
поглощают свет, который попал в глаз и пройдя через
светочувствительный слой сетчатки не был поглощен им. В отростках
пигментных клеток содержится пигмент меланин, который способен
перемещаться в цитоплазме в зависимости от освещенности.
Нервный слой сетчатки состоит из множества микроскопических
сегментов, отличающихся составными элементами. Основными
сегментами нервного слоя сетчатки являются фоторецепторные клетки
(колбочки и палочки) (рис. 7.21), которые представляют собой
высокоспециализированные нейроны, выполняющие в сетчатке глаза
сенсорную функцию. При этом палочки являются рецепторными
клетками, ответственными за черно-белое сумеречное зрение, а
колбочки — за цветное дневное зрение животных. Клетки
фоторецепторов состоят из наружного и внутреннего сегментов. У палочек
наружный сегмент тонкий, длинный, цилиндрической формы, тогда как
у колбочек — он короткий и конической формы. Различия наблюдаются
и во внутреннем содержании палочек и колбочек. Во внутреннем
сегменте палочек отмечается скопление митохондрий, полисом, эндоплаз-
матической сети, аппарата Гольджи, тогда как у колбочек — имеется
участок, состоящий из скопившихся митохондрий с расположенным в центре
этого скопления липидного образования в виде эллипсоида.
407
Биохимия животных
Рис. 7.21. Строение
рецепторных клеток:
А — палочки, Б — колбочки;
I — наружный сегмент;
II — внутренний сегмент;
III — ядросодержащая зона;
IV — синаптическая зона;
/ — фоторецепторные диски;
2 — реснички; 3 —
митохондрии; 4 — липидная капля;
5 — эндоплазматическая сеть;
б —ядро
Наружный сегмент палочки имеет
внешнюю клеточную мембрану, внутри
которой располагаются сотни или
тысячи, в зависимости от вида
животного, уплощенных замкнутых
структур, называемых фоторецепторными
дисками. Образование фоторецептор-
ных дисков происходит у основания
наружного сегмента палочки, и
представляются вначале выпуклыми
образованиями плазматической мембраны.
Затем они отпочковываются от
мембраны, превращаясь в замкнутые
структуры. В составе фоторецепторных
дисков 60% белков и 40% липидов.
Внутренний сегмент фоторецептора
соединен с наружным сегментом
модифицированной ресничкой, которая
содержит девять пар микротрубочек.
В составе внутреннего сегмента крупное
ядро, митохондрии и активно
работающий метаболический аппарат клетки.
Здесь происходит синтез и включение
молекул зрительного пигмента в фото-
рецепторную мембрану диска.
Основным фотопигментом
наружного сегмента палочки является
родопсин, в составе которого белок оп-
син и ретиналь (витамин А). Родопсин
участвует в рецепции кванта света,
осуществляя дальнейшую передачу
сигнала через специализированную
систему белков. Содержание родопсина
зависит от вида животного и может
находиться в пределах 0,1... 1,0 мМ.
При недостатке витамина А в
организме животного нарушается
зрительное восприятие, т. е. отсутствует
сумеречное зрение. Кроме родопсина
408
Глава 7. Функциональные системы
в составе наружного сегмента палочки содержатся фракции О-белкатран-
сдуцина, оррестина, фосфодиэстеразы циклического ГМФ, родопсинки-
назы, гуанилилциклазы, рековерина и активатор гуанилилциклазы.
7.4.2. Молекулярные механизмы зрения
В восприятии и передаче зрительного сигнала участвуют: родопсин,
трансдуцин и цГМФ-фосфодиэстераза. При этом родопсин выполняет
роль акцептора фотона, находясь в прочно связанном состоянии. Его
полипептидная цепь семь раз пересекает мембрану, располагаясь таким
образом, что гидрофильный 1Ч-конец обращен внутрь диска, а
полярный С-конец — в цитоплазму Три гидрофильных фрагмента обращены
как вовнутрь диска, так и в сторону цитоплазмы дисков. К седьмому
гидрофобному фрагменту, расположенному у С-конца, присоединен
11-цис-ретиналь. В механизме фоторецепции цис-ретиналь
присоединяет фотон. При этом изомеризуется в транс-ретиналь. Эти
структурные перестройки инициируют пространственные изменения в
структуре опсина, проявляемые в том, что его третья цитоплазматическая
петля приобретает способность взаимодействовать с трансдуцином.
Последний является белком, состоящим из трех субъединиц (а-, 0- и
у-субъединицы). На ос-субъединице располагается центр связывания и
превращения ГТФ в ГДФ, проявляет ГТФазную акгивность фермента.
После отщепления остатка фосфорной кислоты от ГТФ образуется
ГДФ, который остается в активном центре трансдуцина.
Каждая активированная молекула трансдуцина, имеющая в своем
составе ГДФ, активирует одну молекулу цГМФ-фосфодиэстеразы.
Фермент способен с высокой скоростью разрушать тысячи молекул
циклического гуанозинмонофосфата.
В составе цГМФ-фосфодиэстеразы три субъединицы (а-, Р-, у2).
При этом активный центр располагается на а- и р-субъединицах,
а у2-субъединица выполняет роль регулятора ферментативной
активности а- и р-субъединиц. Поэтому когда все субъединицы
фосфодиэстеразы собраны в единый комплекс, фермент не обладает
каталитической активностью. Функционально активным он становится после
удаления у2-субъединицы. При этом оставшиеся а- и р-субъединицы
начинают гидролизовать с высокой скоростью цАМФ до АМФ.
цАМФ + Н20->АМФ
Понижение концентрации цАМФ в цитоплазме наружного
сегмента рецептора приводит к закрытию ионных каналов в плазмати-
409
Биохимия животных
ческой мембране, которые были открыты в темноте и через которые
внутрь клетки поступали ионы №+ и Са2*. Уменьшение содержания
№+ приводит к гиперполяризации клеточной мембраны,
распространяясь вдоль клетки до ее пресинаптического окончания, способствуя
уменьшению выделения нейромедиатора — глутамата.
Восстановление исходного темнового состояния фоторецептора
должно сопровождаться открытием ионных каналов плазматической
мембраны и трансформацией активированных компонентов фосфо-
диэстеразного комплекса в исходное, неактивное состояние.
Нейтрализация родопсина достигается путем его фосфорилиро-
вания под действием родопсинкиназы, катализирующей
присоединение к родопсину остатка фосфорной кислоты от АТФ. Причем
эффективность этого процесса зависит от количества присоединенных
остатков фосфорной кислоты, что обусловливает постепенное
снижение деятельности родопсина.
В составе наружного сегмента палочки присутствует белок арре-
стин, который способен прочно связываться с фосфорилированной
формой родопсина. Образование этого комплекса полностью
прекращает передачу сигнала от родопсина к трансдуцину.
Действие трансдуцина и фосфодиэстеразы прекращается после
гидролиза ГТФ, который в составе комплекса трансдуцин-ГТФ при
передаче зрительного сигнала связывает у2-субъединицу
фосфодиэстеразы, а после гидролиза у2-субъединицы связывается с а- и р-субъ-
единицами фосфодиэстеразы, ингибируя активность фермента.
Синтез цАМФ катализирует гуанилилциклаза, активность которой
понижается в присутствии высоких концентраций ионов Са2+. Поэтому
в условиях отсутствия света вновь открываются ионные каналы в
плазматической мембране, но при этом скорость синтеза цАМФ понижается.
7.5. МЫШЕЧНЫЕ ТКАНИ
Мышцы являются частью опорно-двигательной системы. Они
обеспечивают сокращение конечностей, движение органов и систем и за
счет этого работу и функционирование организмов животных. Мышцы
поддерживают определенную ориентацию и перемещение тела в
пространстве, осуществляют дыхательные движения грудной клетки и
диафрагмы, глотание, движение глаз, работу внутренних органов (сердца,
кишечника, желудка и др.). В составе мышц белки: миозин, актин, тро-
помиозин, тропонин, №\К+-АТФазы, Са2+-АТФазы и др.
410
Глава 7. Функциональные системы
Основу мышц составляют мышечные ткани, которые относятся
к специализированным тканям, предназначенным для осуществления
двигательной активности, в основе действия которых используется
сократительная способность белков. Мышечные ткани подразделяют
на гладкие (неисчерченные), поперечнополосатые (исчерченные) и
специализированные сократительные ткани (рис. 7.22).
Поперечнополосатая мышечная ткань подразделяется на скелетную и сердечную.
К специализированным сократительным тканям относят миоэпители-
альные клетки молочной, потовой и слюнных желез.
Коллагеновые волокна
Сухожилия
Соединительные ткани
Кровеносные и
лимфатические сосуды
Мышцы
Гладкая мышечная
ткань
Нереиая ткань
Мышечные ткани
Миоциты
Специализированные
сократительные ткани
Поперечнополосатая
мышечная ткань
Стенки желудка,
кишечника, матки,
мочевого пузыря,
мочеточников,
бронхов, кровеносных
сосудов
Скелетная
мышечная ткань
мышечная ткань
Мышечное волокно
Сарколемма
Саркоплазма
Миофибриллы
Саркомер
Толстые
миофиламенты
Тонкие
миофиламенты
Рис. 7.22. Классификация мышечных тканей и их основные компоненты
411
Биохимия животных
7.5.1. Гладкая мышечная ткань
Сокращение гладкой мышечной ткани контролируется со стороны
вегетативной нервной системы. Эта ткань входит в состав желудка,
кишечника, матки, мочевого пузыря, мочеточников, бронхов,
крупных кровеносных сосудов.
Основными клетками гладкой мышечной ткани являются
одноядерные клетки — миоциты (рис. 7.23). Ядра миоцитов имеют
вытянутую форму, занимая центральную часть клеток. Основные органеллы
миоцита (аппарат Гольджи, эндоплазматическая сеть, рибосомы,
митохондрии) группируются у ядра клетки. В цитоплазме миоцитов
содержатся гранулы
гликогена — полисахарида,
резервируемого в
клетках мышц для
удовлетворения их энергетических
потребностей в глюкозе,
которая является основным
энергетическим субстратом
при синтезе АТФ.
В качестве
сократительного аппарата миоциты
используют миофиламенты,
располагающиеся
продольно на периферии в
цитоплазме клетки. В
состав миофиламентов
входят миозиновые (толстые),
актиновые (тонкие) и
промежуточные мышечные
волокна, представленные
сократительными
белками. Снаружи миоциты
покрыты коллагеновыми и
эластическими волокнами.
Рис. 7.23. Схема строения гладкомышечной Мышечные ткани активно
ткани (Александровская и др., 1987): кровоснабжаются, имеют
7 — мышечная клетка; 2 — ядро; ,
3 - миофиламенты; 4 - сарколемма; в составе лимфотические
5 — эндомизий; 6 — нерв; 7— кровеносный сосуды, нервные волокна
капилляр и окончания.
412
Глава 7. Функциональные системы
7.5.2. Поперечнополосатая мышечная ткань
7.5.2.1. Скелетная мышечная ткань
Скелетная мышечная ткань — это ткань, имеющая
поперечнополосатую исчерченность; она составляет основу туловища, головы,
конечности, глотки, гортани, верхней половины пищевода, языка,
жевательных мышц. У дифференцированной скелетной
мышечной ткани нет
клеточного строения, так как
основным структурным
образованием являются
мышечные волокна,
называемые миофибрил-
лами; они представлены в
виде длинных цитоплаз-
матических, продольно
ориентированных тяжей
с закругленными концами,
переходящими в сухожилие.
Оболочка,
покрывающая снаружи
мышечное волокно, называется
сарколеммой. В составе
сарколеммы внутренний
слой — это плазмалемма,
а наружный —
соединительнотканный слой,
состоящий из базальной
мембраны и прилегающих
к ней волокнистых
структур (рис. 7.24).
Миофибриллы
окружены саркоплазмой, в
состав которой входят
сократител ьн ые бел ки,
органеллы (ядра,
митохондрии), включения, ги-
алоплазма. Миофибриллы
состоят из чередующихся
Рис. 7.24. Схема строения
поперечнополосатой мышечной ткани
(Александровская и др., 1987):
/ — саркоплазматическая сеть;
2 — терминальные цистерны; 3 — Т-трубка;
4 — триада; 5 — саркалемма;
6— миофибриллы; 7—диск А; 8 — диск I;
9 — диск 2; 10 — митохондрии
413
Биохимия животных
темных и светлых полос (дисков). В поляризованном свете темные
полосы (диски) обнаруживают двойное лучепреломление — анизотропию,
поэтому их называют анизотропными (А-дисками). Светлые полосы
изотропны, их называют изотропными (1-дисками). В середине каждого
1-диска проходит темная зона (2-линия), а в середине А-диска светлая
зона (Н-линия) с темной линией посередине (М-линия). Образование,
заключенное между двумя 2-линиями, называется саркомером, а 2 и М
линии выполняют функцию его опорного аппарата (рис. 7.25).
-А-
Н
/н Гг
/ П I
ГЛЯЭНКЯ1
2, Саркомер X
/V
/ \
Миофибрилла
Гм1
111111 111111
/
/
г
НИМ »МН
111111 ИНН
НИИ Л11Ш
/
Толстые нити
(миозин)
" н
ШИН 111111
-А-
Н
1
111111 | НИИ
ШИП 111111
1111111 НИН
1лП
ИНН ИНН
НИИ НИН
НИН НИН
нмн-
•ШШ7
Толстые нити
(актин)
\ /
Вид в поперечной разрезе
(в указанных участках)
Рис. 7.25. Схема строения миофибрилл
414
Глава 7. Функциональные системы
А-диск состоит из толстых миофиламентов, а 1-диск из тонких ми-
офиламентов. Тонкие филаменты начинаются у 2-линии и кончаются
у Н-линии, тогда как толстые миофиламенты проходят по всей длине
А-диска.
В составе толстых миофиламентов белок миозин, а тонких — актин,
тропомиозин и тропонин.
7.5.2.2. Сердечная мышечная ткань
Клетками сердечной мышечной ткани являются кардиомицеты,
которые, соединяясь друг с другом концами, формируют мышечное
волокно. Соседствующие между собой миоциты ограничены
вставочными дисками (2-линии), обеспечивающими механическую
прочность мышечного пласта и проводную связь между кардиомицетами.
Каждый миоцит содержит одно или два ядра, расположенные в
центре клетки. Саркоплазма (цитоплазма) состоит из сократительных
нитей — миофибрилл, органелл, включений и гиалоплазмы. В мио-
цитах содержатся хорошо развитые митохондрии, комплекс Гольджи,
саркоплазматическая сеть и включения, которые представлены
гранулами гликогена и пигментами липофусцина.
Миофибриллы сердечной мышцы сходны по строению со
скелетной мышечной тканью. Имеют А-диски (анизотропные) и 1-диски
(изотропны).
7.5.3. Химический состав мышечной ткани
Основная функция мышц состоит в преобразовании химической
энергии в механическую энергию движения. Это может быть
вследствие движения живого организма относительно окружающего
пространства или результатом реализации движения его отдельных
компонентов относительно друг друга.
Химический состав мышц обусловлен их специализированной
деятельностью, в основе которой заложены механизмы сокращения.
В животном организме мышечная ткань составляет около 38...45%
от общей массы. При этом до 70% приходится на скелетные мышцы,
в которых содержание воды может составлять от 70 до 80%. Белки
в сухом остатке составляют 17...21% от общей массы мышц.
Основными компонентами мышечной ткани являются белки миофибрилл,
саркоплазмы и сарколеммы. Последняя содержит в своем составе
белки соединительной ткани: коллаген и эластин. Кроме того, в
состав мышечной ткани входят азотосодержащие соединения: креатин,
415
Биохимия животных
креатинфосфат, креатинин, мочевина, карнозин, анзерин, холин,
аминокислоты, нуклеозиды, нуклеотиды, нуклеиновые кислоты и др.
Соединения, не содержащие азот, в основном представлены углеводами
и липидами (гликоген, глюкоза, фруктоза, жирные кислоты,
холестерин, триацилглицерины, фосфолипиды и др.).
В составе мышечной ткани белки сарколеммы составляют 18...20,
саркоплазматические — 30...35, а миофибрилл — 40...45%.
Основными белками мышц служат миозин и актин, содержание которых
составляет 60...70% и 20...25% соответственно.
Химический состав мышц колеблется в зависимости от вида и
возраста животного, типа и функционального состояния мышц и ряда
других факторов. Основные вещества, входящие в состав
поперечнополосатых мышц животных, и их содержание (в % к сырой массе)
представлены в табл. 7.2.
Таблица 7.2
Химический состав мышечной ткани животных
| Компоненты мышц
1 Вода
| Сухой остаток
| Белки
| Гликоген
| Фосфолипиды
1 Холестерин
| Креатин + креатинфосфат
1 Креатинин
АТФ
| Карнозин
1 Карнитин
| Анзерин
1 Свободные аминокислоты
| Глутаминовая кислота
| Содержание, %
72,0...80,0
20,0.-28,0
16,5...20,9
0,3...4,0
0,2... 1,0
0,06...0,20
0,20...0,55
0,003...0,005
0,25...0,40
0,10...0,25
0,02...0,05
0,09...0,20
0,1...0,7
0,05...0,08 ^
416
Глава 7. Функциональные системы
Окончание таблицы 7.2
\ Компоненты мышц
| Глутамин
| Молочная кислота
1 Мочевина
| Инозит
Зольный остаток
Содержание, % |
0,08...0,10
0,01. ..0,02
0,04...0!4
около 0,001 |
1,0...1,5 |
Химический состав основных биогенных соединений зависит от типа
ткани, а состав мышечной ткани и от вида животного (табл. 7.3).
Среди азотсодержащих соединений в мышцах содержатся
креатин (0,2...0,5%), карнозин (0,1...0,25%), анзерин (0,09...0,20%), кар-
нитин (0,015...0,020%), глутаминовая кислота (0,05...0,08%), глутамин
(0,08...0,10%), мочевина (0,015...0,025%), аминокислоты (0,7...0,8%),
аденозинтрифосфорная кислота (0,12...0,15%).
Содержание холестерина в мышечной ткани может составлять до
0,2%. При этом основным местом накопления холестерина служат
клеточные мембраны. Общее содержание стероидов в мышечной ткани
колеблется в пределах от 0,03 до 0,23 %, фосфолипидов — 0,2... 1,0 %,
холестерина — 0,06...0,2 %.
Доля минеральных веществ в мышечной ткани может составлять
до 1,5% от общего состава. Среди ионов в мышечной ткани КРС
содержатся, мг%: К+ - 340, Ыа+ - 65, Мё2+ - 19, Са2+ - 10.
В мышечной ткани говядины, свинины и баранины содержится
одинаковое количество витаминов. Так, содержание рибофлавина
составляет 0,13...0,17, никотиновой кислоты — 3,9...6,7, фолиевой кислоты —
0,013...0,026, биотина — 3,4...4,6 мг%. В мышцах свинины содержится
тиамина 0,74...0,94, витамина В6 — 0,42...0,50, пантотеновой кислоты —
0,7...2,0мг%.
7.5.3.1. Карнитин
Карнитин (Ь-З-окси-4-триметиламмоний-бутират) выполняет роль
переносчика ацильных групп в матрикс митохондрий и наружу.
Предшественником карнитина служит лизин, который в результате
последовательных реакций дезаминирования, декарбоксилирования и
окисления, утрачивает атомы углерода, превращаясь в у-буриробетаин,
который подвергается гидроксилированию. Реакция протекает в при-
417
Биохимия животных
к'
I
1
I
Содержание элементов, мг %
иных молекул, %
шие биоге
1 и 1
1 о 1
железо 1
а
о
Г9,
+
Те
2
+
СЧ
се
и
+
+
се
2
се
§
со
ЛИПИДЫ
5
■=4
а>
ю
Вид
животного
1 °°-
1 Н*
1 ^Я
1 ^
1 °
К ^
1 об
1 °^
1 го
1 ™
1 гч
о
С7Ч
со
го
ГО
ЧО
О
чэ
СТч
о'
О
СО
о
гч* 1
°- 1
гч 1
«л 1
оо 1
V? 1
г«» 1
^ 1
осГ 1
«л 1
<->
си 1
1 "Я
1 со
Со
го
гч
СТч
00
о
чэ
«л
о
00
о
о
ГО
«о
сч*
гч 1
«О 1
69 1
з 1
ш 1
о
1 ГЯ
1 *ч
1 °1
1 ^
1 "*
1 ™
1 го'
1 г»
1 гч
1 ™
1 °°
Оч
г**
«л
о
чэ
чэ
о*
о
ГО
2
•л!
X 1
к 1
ш 1
и
2,7...3,0
1 °
1 ™
-
1 гч
1 <"1
сч
«л»
о
гч
•о
го
«л»
\©
го
о
о
сч
*">
гч*
о
оо
об
л 1
ж 1
а> 1
1 **?
1 °ъ
1 гч*
1 ^
1 оо
1 *>
1 «л
К со
1 ^
гч
со
о
|*"
го
о
чо
со
^ 1
в
о
о*
«п
гч" 1
1** 1
гч 1
"Ъ 1
гч 1
-* 1
«л 1
^ 1
об 1
§
3
° 1
1 ГЧ
***
с* 1
г** 1
00 1
«л 1
гч 1
сч 1
об 1
1
1
со 1
о 1
*я 1
-* 1
со^ 1
гч 1
чэ 1
°°* 1
62Д..75.4
2
I
418
Глава 7. Функциональные системы
сутствии 02, кетоглутарата, Ре2", аскорбиновой кислоты и
катализируется Содержание элементов, мгу-буриробетаингидроксилазой.
Ш2-СН2-СН2-СН2-СН2-СН-СООН
Ш2
лизин
1
(СН3)-М+-СН2-СН2-СН2-СН2-СН-СООН
ш2
е-М-триметиллизин
(СН3)-М+-СН2-СН2-СН2-СбО"
у-буриробетаин
НООС-СН2-СН2-СО-СООН
о.
аскорбиновая кислота
НООС-СН2-СН2-СООН
(СНзИ^-СНг СН-СН2-СОО"
он
Карнитин
Челночная функция карнитина обеспечивается участием двух ацил-
трансфераз. Одна из них — карнитин-ацилтрансфераза — катализирует
реакции, в которых карнитин присоединяется к жирным кислотам с
короткой цепью.
К-СО-8КоА + (СН3)-К+-СН2-СН-СН2-СОО_-
ОН
-► (СН3)->Г-СН2-СН-СН2-СОСГ+ Н8-КоА
I
О
о=с-к
419
Биохимия животных
Тогда как карнитин-пальмитоилтрансфераза катализирует ацили-
рование карнитина жирными кислотами с длинной цепью.
СН3-(СН2)14-СО-8КоА + (СН3)->Г-СН2-СН-СН2-СОО--->
I
ОН
-> (СН3)-Ы+-СН2-СН-СН2-СОО-+ НЗ-КоА
I
О
0=С-(СН2)14-СН3
Таким образом, карнитин выполняет роль переносчика остатков
высших жирных кислот через мембраны митохондрий. Процесс
инициируется в цитоплазме клетки и завершается в матриксе
митохондрий, где ацильные группы после переноса на Н8-КоА подвергаются
последовательному окислению.
7.5.3.2. Карнозин и анзерин
Карнозин (р-аланилгистидин) был открыт в конце XIX в. в России
русским ученым Владимиром Сергеевичем Гулевичем, который,
исследуя мясной фарш, обнаружил в нем превышающие общепринятые
показатели содержания органического азота. Анализируя полученные
данные, он пришел к заключению, что в исследуемом материале
находятся какие-то неизвестные ранее органические вещества,
содержащие азот, но не принадлежащие белкам.
Гулевич выделил три таких соединения — холин (исходное
соединение для образования фосфолипидов клеточных мембран),
карнитин (рассматривается сейчас как необходимый участник транспорта
и окисления жирных кислот) и карнозин — дипептид, состоящий из
двух аминокислот, гистидина и аланина. В отличие от холина,
открытого ранее, два последних соединения были открыты и изучены
Гулевичем впервые. Он же дал названия обоим соединениям,
используя латинское слово мясо (саго, саггнз). Несколько позже (в 1929 г.) его
ученица Наталья Толкачевская открыла в составе мышц гуся (Апзег
апзег) другое соединение, которое было названо анзерином ^ 1
-метил карнозин).
Эти д и пептиды (карнозин и анзерин) обнаруживаются только
в мышечной и нервной тканях позвоночных животных и человека.
Поэтому их функция связана с процессами возбуждения. Оба дипеп-
420
Глава 7. Функциональные системы
тида выполняют роль нейропептидных регуляторов обмена веществ в
возбудимых тканях.
О
-сн2—сн —соон
г
О =С — СН2—СН2— МН2
N !Г
о
сн
Карнозин
-СН2— СН — СООН
г
О = С — СН2—СН2— NН2
"з
Анзерин
Академик С. Е. Северин в 1954 г. впервые описал биологическую
функцию карнозина и анзерина. Им было установлено, что эти
соединения способны устранять мышечное утомление и обеспечивать
многократное увеличение работоспособности изолированной мышцы
в экспериментальных условиях.
Карнозин участвует в механизмах возбудимости и
функционировании мышечных клеток благодаря своей способности защищать их
от образующихся при экстремальных условиях токсинов. Эти
токсины носят название активные формы кислорода, поэтому карнозин
и его производные нужно признать природными
высокоэффективными антиоксидантами. Выявлена также протекторная способность
этих веществ и относительно нейронов головного мозга.
Установлена способность карнозина ускорять заживление
открытых ран. Поэтому он был рекомендован для дезинфекции ротовой
полости при ретракции зубов и как средство от парадонтоза.
Карнозин и анзерин содержатся в большом количестве в некоторых
пищевых продуктах (мясо птиц, некоторых рыб, например, тунца).
В настоящее время имеются сведения об использовании
карнозина (наряду с широко известными витаминами В, С и Е) в составе
421
Биохимия животных
тонизирующих коктейлей. В Японии производится лекарственное
средство, содержащее карнозин, эффективно излечивающее болезни
желудочно-кишечного тракта. Одновременно оно оказывается
полезным в качестве дополнительной терапии при борьбе с
онкологическими заболеваниями и нарушениями иммунной системы.
Систематический прием карнозина увеличивает длительность и качество
жизни лабораторных животных. Перспективным является
использование карнозина для спортсменов, для персонала, постоянно
работающего в условиях высокого радиационного фона, людей,
испытывающих повышенные эмоциональные и физические перегрузки.
Положительное действие карнозина и анзерина основано на
способности этих соединений служить буфером протонов,
способствуя удалению кислых продуктов, образующихся при
интенсивной мышечной нагрузке. Оба дипептида способны
связывать тяжелые металлы, устраняя токсические эффекты ионов
цинка, меди, свинца, железа и т. д., подавляют образование
активных форм кислорода, регулируя содержание свободных
радикалов в клетках, препятствуют окислению биомакромолекул (белков,
РНК, ДНК и др.). Такая способность более выражена у анзерина.
Поэтому его применение позволяет снимать мышечную усталость,
восстанавливать работоспособность организма, оптимизировать
метаболические процессы в клетках, замедлять дегенерацию
нейронов головного мозга при старческой или патологической (болезнь
Альцгеймера) деменции. Регулярный прием карнозина и анзерина с
пищей может замедлить нарастание возрастных или нейродегенера-
тивных изменений в организме, предохранить от инфаркта
сердечной мышцы, инсульта головного мозга. Опасности передозировки
при использовании этих дипептидов не существует, поскольку их
избыток включается в нормальные метаболические процессы,
участниками которых они являются. Добавки этих природных веществ
в ежедневный рацион питания повысит качество пищи и сделает
человечество в своей массе более устойчивым к вредным воздействиям
внешних факторов среды обитания.
Достижения современной биотехнологии позволяют разработать
способы получения карнозина как из природного сырья — телятина,
говядина, рыба ценных сортов (осетр, горбуша, семга, тунец), так и
из исходных аминокислот, гистидина и р-аланина. Это сделало
возможным производство различных форм карнозина, пригодных для
использования в качестве пищевых добавок.
422
Глава 7. Функциональные системы
Синтез Р-аланилгистидина катализируется карнозин-синтетазой.
Реакция протекает в две стадии. Вначале происходит активация
карбоксильной группы, с образованием ангидрида с АМФ и пирофосфата.
ИН2-СН2-СН2-СООН + АТФ -► ЫН2-СН2-СН2-СО-АМФ + ФФн
р-аланин
Затем осуществляется реакция присоединения гистидина,
заканчивающаяся образованием дипептида — карнозина.
Ш2-СН2-СН2-СО-АМФ + СН=СН-СН2-СН-Ш2->
1^1 ^к СООН
СН
-> СН==СН-СН2-СН-ЫН-СО-СН2-СН2-КН2
1^1 \ СООН
СН
Карнозин
Карнозинсинтетаза способна катализировать и синтез другого
дипептида — анзерина.
Впервые название анзерин (от лат. апзег— гусь) предложил в 1928 г.
Д. Аккерман (О. Аскегтапп) для обозначения гомолога карнозина —
метилкарнозина, выделенного им из скелетных мышц гуся.
уСН=ЧШ-СН2-СН-МН.СО-СН2-СН2^Н2
Н3С-К ^& СООН
СН
Анзерин
При этом вместо гистидина в реакции участвует Ы'-метилги-
стидин.
7.5.3.3. Креатин и креатинин
В мышечной ткани одним из активных высокоэнергетических
соединений служит креатинфосфат. Предшественником креатинфос-
423
Биохимия животных
фата является креатин, в составе которого остаток глицина и гуани-
диновая группа.
Креатин + АТФ <-> Креатинфосфат + АДФ
н2о ^>Х ^Сн,ро4
Креатинин
Превращение креатина в креатинфосфат катализируется креатин-
фосфокиназой, которая переносит остаток фосфорной кислоты с АТФ
на креатин. Реакция легко обратима. Продуктом гидролиза этих
соединений является креатинин.
СООН
I
сн2-со-ш-сн сн2-со-ш-сн-со-ш
II III
СН2 СН2 1МН2 АТФ СН2 СН2
I I I V, I I
СН-ЫН2 ЗН + СН2 ^—► СН-NН2 ЗН СООН
СООН СООН \ СООН
сн2
Таким образом, креатинфосфат и АТФ используются в мышцах
в качестве высокоэнергетических соединений. Однако их участие
в механизме сокращения разное. Так, например, АТФ используется
как в механизме сокращения мышечных волокон, так и в их
расслаблении. Тогда как креатинфосфат необходим для восстановления
АТФ путем фосфорилирования АДФ. Именно этим можно объяснить
то, что в покоящейся мышце содержание креатинфосфата в 3...8 раз
больше, чем содержание АТФ.
Однако при интенсивной работе концентрация АТФ в мышцах
понижается и для его восстановления на начальных этапах используется
креатинфосфат, обеспечивающий наиболее быстрый путь генерации
АТФ. Затем могут включаться и другие механизмы, в частности,
анаэробные процессы (гликогенолиз, гликолиз, окислительное фосфо-
рилирование).
Синтез креатинфосфата сопряжен с синтезом аргинина,
лимитирующей стадией которого служит образование карбамоилфосфата.
Этот процесс обычно называют орнитиновый цикл. Продуктом цикла
является мочевина. Наиболее активно процесс протекает в печени.
Однако в мышцах основные стадии процесса способствуют синтезу
424
Глава 7. Функциональные системы
не только аргинина, но и дальнейшему
переносу гуанидиновой группы
аргинина на глицин, с последующим
синтезом креатина и креатинфосфата.
Таким образом, основные стадии ор-
нитинового цикла являются и
начальными стадиями синтеза креатинфосфата,
когда гуанидиновая группа с аргинина
может быть перенесена на глицин с
помощью глицин-амидинотрансферазы.
В результате образуется гуанидинуксус-
ная кислота, которая подвергается
метилированию при участии гуанидинаце-
тат-метилтрансферазы, с образованием
креатина. В реакции участвует 3-аде-
нозил-Ь-метионин.Образовавшийсякреа-
тин подвергается фосфорилированию
креатинкиназой, которая переносит
остаток фосфорной кислоты с АТФ на
креатин.
Таким образом, процесс
завершается образованием креатинфосфата,
который используется в дальнейшем
в мышцах в качестве основного
энергетического соединения в механизмах
сокращения.
7.5.3.4. Сократительные белки мышц
7.5.3.4.1. Миозин
Миозин — это белок толстых фи-
ламентов поперечнополосатых мышц.
Имеет в составе две тяжелые (по 200 кДа)
и 2...4 легкие (по 15...27 кДа)
полипептидные цепочки. Тяжелые цепи
переплетаются, формируя вытянутые в длину
фибриллярные структуры, тогда как
легкие цепи закручиваются в клубок,
образуя головную часть белка (рис. 7.26).
Рис. 7.26. Строение
молекулы миозина
425
Биохимия животных
Около 400 молекул миозина могут связываться в структурное
образование, которое называется филаментом (рис. 7.27). При этом головки
миозина располагаются упорядочение по спирали таким образом, что
каждая головка четвертой пары располагается на одной линии с одной
из головок первой пары, формируя структуру, проявляемую в центре
зоны Н в виде М-линии, где происходит стык двух миозиновых нитей,
направленных в противоположные стороны. Причем каждый миози-
новый филамент находится в окружении шести актиновых, а каждый
актиновый филамент окружен тремя миозиновыми (рис. 7.28). Миозин
способен гидролизовать АТФ на АДФ и фосфат неорганический, не
освобождая продукты гидролиза. Однако высвободившаяся при этом
энергия расходуется на движение актиновых нитей. Этот процесс
протекает в присутствии ионов кальция.
Толстая
нить
42,9 нм
14,3 нм
Палочка
«Головки»
Молекула миозина 10 нм
Рис. 7.27. Строение толстого филамента молекул миозина (Овчинников, 1987)
Толстые
филаменты
Рис. 7.28. Упорядоченное расположение толстых и тонких нитей миофибрилл
426
Глава 7. Функциональные системы
7.5.3.4.2. Актин
Актин является белком тонких филаментов поперечнополосатых
мышц. Присутствует в двух формах: С-актин и Р-актин (рис. 7.29).
При этом С-актин — это моносубъединичный водорастворимый
глобулярный белок (43 кДа), в составе первичной структуры которого 376
аминокислотных остатка. Причем с каждой молекулой белка
связывается одна молекула АТФ. Однако в присутствии ионов магния С-актин
может полимеризоваться в многосубъединичный белок, который
называется Р-актин. В структуре Р-актина молекулы С-актина
последовательно связаны между собой за счет нековалентных связей, образуя
две закрученный в а-спираль нитевидные структуры. Для завершения
одного витка спирали Р-актина необходимо 13... 14 молекул О-актина.
1п уНго актин образует комплекс с миозином, называемый актомиози-
ном, который обладает АТФазной активностью, стимулируемой
ионами магния. Концы Р-актиновых молекул присоединяются к
белковой молекуле (а-актинин), проявляя образование, которое называется
2-линией.
36 им
5,5 нм
Рис. 7.29. Две закрученный в а-спираль нитевидные
структуры, в составе которых С- и Р-актины
7.5.3.4.3. Тропомиозин
Тропомиозин — это белок (70 кДа), в составе которого две разные
субъединицы, переплетающиеся между собой в а-спиралевидные
фибриллярные структуры. Тропомиозин связывается в единый
комплекс с Р-актином в области изгиба молекулы, обеспечивая его
стабильность. По длине тропомиозин равен 7 субъединицам С-актина.
При этом контактирует только с одной из нитевидных структур
Р-актина (рис. 7.30). Кроме того, тропомиозин совместно с тропонином
участвует в регуляции взаимодействия актина с миозином.
427
Биохимия животных
Тропомиозин
Рис. 7.30. Строение тонкого филамента, в составе
которого актин, тропомиозин и тропонин
7.5.3.4.4. Тропонин
Тропонин — белок поперечнополосатых мышц (76 кДа). Имеет вид
вытянутого в длину белка (76 кДа). Состоит из трех разных по
структуре и функциям субъединиц: тропомиозинсвязывающей (ТпТ), ин-
гибирующей (Тп1) и кальцийсвязывающей (ТпС)) (рис. 7.30).
Располагается на конце каждой молекулы тропомиозина. Тропонин способен
связываться как с актином, так и с тропомиозином. Тропомиозинсвя-
зывающая субъединица тропонина состоит из 259 аминокислотных
остатков (37 кДа), обеспечивает связывание тропонина с
тропомиозином. Ингибирующая субъединица тропонина состоит из 179
аминокислотных остатков и обеспечивает связывание белка с актином,
предотвращая при этом взаимодействие миозина с актином, подавляя
их АТФазную активность. Кальцийсвязывающая субъединица имеет
в составе 159 аминокислотных остатков (18 кДа), функциональная
активность субъединицы проявляется за счет того, что на поверхности
белковой молекулы располагаются шесть центров связывания ионов.
Причем в четырех центрах происходит специфичное связывание двух
ионов Са2+ и двух ионов М§2+, тогда как два других центра способны
связывать оба иона. Активный актин-тропомиозин-тропонин-мио-
зиновый комплекс проявляет Са2+/М§2+-АТФазную активность.
7.5.3.4.5. Акпгинины
а-Актинин и 0-актинин являются белками мышечной ткани, к
которым присоединяются концы Р-актиновых молекул тонких фила-
ментов. Располагаются в зоне 2-линии. Состоят из двух субъединиц,
каждая из которых имеет молекулярную массу по 90 кДа.
428
Глава 7. Функциональные системы
7.5.4. Биохимические механизмы сокращения мышц
7.5.4.1. Механизмы сокращения скелетных мышц
Механизм мышечного сокращения определяется сложным
последовательным действием, в осуществлении которого участвуют белки
и функционально активные вещества. В процессе сокращения
происходит преобразование химической энергии в механическую.
Инициирующим моментом в сокращении мышц служит
деполяризация мембраны под действием электрического импульса,
передаваемого на мышечную клетку двигательным нервом, с последующим
распространением через клеточную мембрану (сарколемму) на
пронизывающие ее поперечные трубочки Т-системы. Последняя связывает
все саркомеры мышечной клетки с саркоплазматическим ретикулумом.
Переход возбуждения с нервного волокна на иннервирующую
мышечную клетку осуществляется при участии синапсов
(нервно-мышечных), которые приспособлены для однонаправленной передачи
возбуждения. Компонентами синапса являются иресинаптическая
часть, постсинаптическая часть и разделяющая их синаптическая
щель.
Под действием нервного импульса происходит деполяризация
мембраны нервного окончания и ее слияние с синаптическими
пузырьками, с последующим выбросом их содержимого в синаптическую
щель (табл. 7.4). Передатчиками возбуждения служат ацетилхолин,
молекулы которого диффундируют через щель и достигают внешней
стороны постсинаптической мембраны, где связываются с ацетилхоли-
новым рецептором. Взаимодействие медиатора с рецепторным белком
вызывает изменение его конформации, сопровождаемое открытием
проводных ионных каналов. В результате активизируется перенос
ионов К+ вовнутрь клетки и ионов N3+ наружу, за счет активизации
№+,К+-АТФазы.
Активный транспорт ионов №+ и К+ приводит к деполяризации
постсинаптической мембраны, активируя пассивную диффузию
ионов Са2+ из цистерн саркоплазматического ретикулума в саркоплазму.
Концентрация ионов Са2+ возрастает до 10""5 М, что является
условием его взаимодействия с тропонином С, вызывающим конформа-
ционные перестройки в этом белке. В результате происходит
перемещение тропомиозина, который смещается в желобок между двумя
цепями актина. При этом становится возможным взаимодействие
актина с головками миозина. Конформационные изменения в миозине,
429
Биохимия животных
2
к
я
I
О
<а
о
в
о
2
I
5
о
ее
С [
1
з
•51
X
о
а
а>
X
О
X
о
| . . 8~
8 ^ * о Я
5 « <у У о
>% Ч И 1) 5
ю ^ о зг >
5? и я X Е
а
к А 8 я . с
2 2-11
5 5 « § Х^
8.8 * & Ё | сх
X *
х 5
сч
О V
Р 3 ~ <
се
ГО _
л се
Ё 2
X 2*
3°
X
о*
$ X
Iс
с: к
а> 5
>Х
о
у о.
се и
X 5
430
Глава 7. Функциональные системы
к
2
2Г
1
1
I
X р. -
22 Р X х
* I со
Л X О
. • п X
А о 5
Л X О
и 5 с
03
со I
есв о ' , ^
Й™ & О
, « ев 2 е
*« I * а *
се О
х о
и
2 X «
рд «
2 Й к
8 Е «
ф X С
* 5 *
V т. —
8й8й
а § §
■ 9 *>
т 8 5
и х
СО я) Н
во г и
О о О = и -
1 § 5 11 « к
а «и х * Е " о
О х х х 8 х 5
ю
X Ч
и О.
* °
Я х
ЧО
X
X
5 *;,
X X
о о
* X
5 8 5 ?
о.
С
хэ 1
х 5 *|
431
Биохимия животных
инициируют его АТФазную активность, отщепляя от АТФ фосфатную
группу, которая вместе с АДФ выделяется в среду. При этом их место
занимает другая молекула АТФ.
Энергия гидролиза АТФ приводит в действие Са2+-АТФазу,
которая уже «выкачивает» ионы Са2+ из саркоплазмы в саркоплазматиче-
ский ретикулум. В ответ на расщепление одной молекулы АТФ Са2+-
АТФаза переносит через мембрану два иона кальция, понижая его
содержание в саркоплазме до 10"7 М. В саркоплазматическом рети-
кулуме ионы Са2+ связываются специализированными белками каль-
секвестрином и Са2+-связывающим белком.
Понижение концентрации ионов Са2+ в саркоплазме понижает
АТФазную активность актомиозина, что приводит к разрушению
связей между актином и миозином, проявляемому в расслаблении и
удлинении мышц.
Механизмы сокращения и расслабления мышц, обеспечиваются
энергией АТФ, концентрация которого понижается при активной
мышечной деятельности. Восстановление содержания АТФ может
происходить за счет креатинфосфата, однако этот резерв
незначительный и может обеспечить мышечную активность только в течение
10... 12 с, поэтому основным поставщиком АТФ являются
метаболические процессы, в частности, гликогенез и гликолиз. Анаэробные
процессы достигают своего максимума через 40...50 с после начала
деятельности мышц, а уже через 60...70 с активизируется работа
аэробных процессов, сопровождаемая образованием АТФ в
митохондриях. Лимитирует этот процесс поступление кислорода, т. е. работа
транспортных систем, переносящих кислород (гемоглобин и миог-
лобин).
При высоких нагрузках возрастает скорость гликолиза, конечным
продуктом которого является молочная кислота. Накопление
молочной кислоты в мышцах вызывает понижение рН, в результате
угнетается активность основных гликолитических ферментов, что приводит
к понижению содержания АТФ, проявляемому в понижении
мышечной активности.
Восстановление активности мышечной системы происходит за счет
того, что молочная кислота кровью переносится в печень, где
превращается в глюкозу и гликоген, в соответствующих процессах глюконе-
огенеза и гликогенеза. Образовавшийся гликоген служит источником
глюкозы, которая кровью доставляется в мышцы, откладываясь уже в
виде гликогена мышц.
432
Глава 7. Функциональные системы •
7.5.4.2. Механизмы сокращения гладких мышц
Условием сокращения гладких мышц является возникновение
мембранного потенциала, при уменьшении которого мышцы
сокращаются, а при возрастании — расслабляются. Колебания мембранного
потенциала независимо от возбуждения нервов вызывают
нерегулярные сокращения, которые поддерживают гладкие мышцы в состоянии
постоянного частичного сокращения — тонуса.
Возникновение потенциала действия обеспечивают поступления
в цитоплазму миоцитов внеклеточного кальция, участвующего в
последующем в активизации механизмов сократительной деятельности
белков гладкомышечных клеток.
Инициаторами сокращения гладких мышц могут быть различные
функционально активные вещества: адреналин, норадреналин, аце-
тилхолин, гистамин и др. Действие этих соединений определяется
наличием специфических рецепторов на поверхности мембран гладко-
мышечных клеток, взаимодействие с которыми медиаторов приводит
к возникновению мембранного потенциала.
Так, например, норадреналин действует на а- и р-адренорецеп-
торы мембран гладкомышечных клеток. В результате взаимодействия
медиатора с рецептором активизируется аденилатциклаза,
катализирующая реакции образования цАМФ, с последующей активизацией
механизмов, понижающих содержание внутриклеточного кальция и
проявляемое в торможении механизмов сокращения мышц.
Противоположным действием обладает ацетилхолин. Он понижает
мембранный потенциал, увеличивая тонус и частоту ритмических
сокращений мышц. Действие ацетилхолина способствует деполяризации
мембраны, увеличивая ее проницаемость для ионов №+ и Са2+.
В механизмах сокращения гладких и скелетных мышц имеются
принципиальные отличия. Главным из них является то, что миозин
гладкой мышцы, проявляющий АТФазную активность, должен быть
фосфорилирован. Хотя процесс фосфорилирования и дефосфорили-
рования миозина происходит и в скелетных мышцах, но в отличии от
гладких мышц он не является условием активизации АТФазной
активности миозина.
Инициатором процесса фосфорилирования миозина гладких мышц
являются ионы Са2", связывание которых с кальмодулином
активизирует киназу легкой цепи миозина, катализирующей процесс
фосфорилирования миозина. Затем происходит скольжение актина по
отношению к миозину, обуславливая сокращение мышцы.
433
Биохимия животных
Таким образом, активатором сокращения гладких мышц служит
комплекс ионов Са2+ с кальмодулином. Тогда как в скелетной и
сердечной мышце сокращение инициируется присоединением ионов
Са2" к тропонину
7.5.5. Механизмы лослеубойного окоченения
После убоя животного прекращается поступление кислорода и
питательных веществ в клетки органов и тканей, вследствие
прекращения кровоснабжения. В клетках начинают накапливаться продукты
распада биогенных молекул. При этом утрачивается направленность
и упорядоченность метаболических процессов, активируются
процессы автолиза белков и нуклеиновых кислот. Вначале замедляются,
а затем останавливаются процессы деления клеток. Подавляется
активность митохондрий. В тканях происходят специфические
физические и химические изменения, протекание которых во времени
можно условно подразделить на стадии лослеубойного окоченения,
созревания и разложения.
Стадия окоченения наступает через 2...3 часа после убоя
животного. В этот период мышцы приобретают максимальную упругость,
содержание гликогена понижается в пять раз, происходит накопление
молочной кислоты. При этом реакция среды смещается в кислую
сторону. Белки мышц теряют ионы кальция, калия и магния.
Период наступления полного окоченения мышц зависит от вида
животных. Так, например, у кролика он наступает через 1,5...4,0,
курицы — 2Д..4Д свиньи —4,5... 18,0, КРС — 10,0...24,0 часов.
При сокращении живой мышцы изменение содержания ионов
Са2+ регулируется первичными импульсами, изменяющими работу
транспортных АТФаз, за счет действия которых происходит
энергозатратное сокращение и расслабление мышечных волокон. Тогда как
в состоянии окоченения в отсутствие деятельности нервной
системы отмечается необратимый выброс ионов кальция в саркоплазму,
в результате оказывается невозможным расслабление мышечного
волокна.
При наличии высоких запасов гликогена в мышечной ткани
могут протекать анаэробные метаболические процессы (гликогенолиз
и гликолиз), за счет которых еще некоторое время возможно
образование АТФ. Однако со временем содержание АТФ и креатинфосфата
начинает понижаться. Этот период может продолжаться от 1 до 10
часов. Причем содержание гликогена, АТФ, креатинфосфата в мышеч-
434
Глава 7. Функциональные системы
ной ткани зависит не только от вида животных, но и различно у
разных мышц одного и того же животного.
Окоченение характеризуется уплотнением мышечных волокон,
уменьшением их объема. Понижение содержания АТФ на 15...25% уже
является условием нарушения целостности структуры и нормального
функционирования мембран клеток. Эти нарушения затрагивают и
мембранные структуры саркоплазматического ретикулума,
сказываясь на работе транспортных АТФаз (№*,К+-АТФаза и Са2^-АТФаза).
Находящиеся в цистернах саркоплазматического ретикулума ионы
Са2+ проникают в саркоплазму и при наличии в мышечных клетках
необходимого количества АТФ способны производить сокращение.
При этом диффузия кальция в саркоплазму оказывается необратимой
и поэтому расслабление мышечного волокна невозможно.
7.6. ДЫХАТЕЛЬНАЯ СИСТЕМА
7.6.1. Легкие
Отличительной особенностью млекопитающих от других животных
является наличие у них специализированных органов дыхания —
легких. Последние обеспечивают поступление кислорода в организм и
выведение из него углекислого газа. При этом органы дыхания
участвуют в процессах терморегуляции, депонирования крови и
регулировании эндокринных механизмов. В состав системы органов дыхания
входят воздухоносные пути (полость носа, гортань, трахея, бронхи
и терминальные бронхиолы) и респираторный отдел (альвиолярные
бронхиолы, ходы и мешочки, альвеолы). Компоненты последнего,
совместно с кровеносными и лимфатическими сосудами,
соединительной тканью и нервами, являются функциональной единицей
легких — аценуса.
Легкие участвуют в процессе газообмена. При этом в легких кровь
обогащается кислородом и освобождается от избыточного количества
СО2, поступает в ткани, где происходит обратный процесс, т. е.
кислород крови поступает в ткани, а из них выводится С02. Процесс
протекает за счет разности парциального давления газов в альвеолярном
воздухе и давления газов крови.
Обмен газов в легких происходит через легочную мембрану,
состоящую из альвеолярных клеток, соприкасающихся с эндотелием
кровеносных капилляров.
435
Биохимия животных
Альвеолы легких представлены двумя видами клеток:
респираторными и большими альвеолоцитами. Свободная поверхность клеток
покрыта пленкой, в составе которой нерастворимый в воде сурфак-
тант, состоящий из фосфолипидов, белков и гликопротеинов. Пленка
предохраняет альвеолы от спадания и защищает организм от
внедрения микроорганизмов.
На растворимость газов влияет состав жидкости, температура
среды, объем и давление газа вне жидкости и физические свойства
газов. Основными переносчиками газов в крови служат эритроциты,
в составе которых гемсодержащий белок — гемоглобин. При этом
1 г гемоглобина может связать 1,34 мл кислорода. Основными
потребителями кислорода в клетках являются митохондрии. Поэтому
в зрелом эритроците отсутствует ядро и митохондрии. Потребление
кислорода особенно велико в мышечной ткани. Это обусловлено
двигательной активностью мышц. Поэтому в резервировании
кислорода в мышцах принимает участие специализированный
гемсодержащий белок — миоглобин.
Гемоглобин состоит из четырех субъединиц (двух а и двух Р) (рис.
7.31). Субъединицы НЬ имеют сходную с МЬ третичную структуру, но
различаются по сродству к кислороду, что, вероятно, связано с
различием в строении белковой части активных центров этих гембел-
ков. Атом железа в оксигемоглобине (НЬ02) расположен в плоскости
порфиринового кольца, а в высокоспиновом дезоксигемоглобине —
выступает на 0,8 А в направлении белкового лиганда, и
координационное число его равно пяти. Гем расположен внутри складки или
«кармана», образуемого белковой цепью. С проксимальной стороны,
в цепи гемоглобина, с железом гема координирован Н15-92, а в дис-
тальной области расположен ЬПз-бЗ. Наличие Уа1-67 и РЬе-42 вблизи
Н15-63 придает активному центру этого гембелка гидрофобный
характер. В гемоглобине связывание лигандов в области гема может
происходить как с проксимальной, так и с дистальной стороны. Однако
функционально активной является только дистальная область гема,
где происходит связывание 02, СО, С02 и других лигандов
небольшого размера. Связывание лигандов приводит к структурным
изменениям пространственного расположения цепей гемоглобина, что
подтверждено кристалл ографически.
На примере мутантных форм гемоглобина было показано, сколь
существенные изменения происходят в структуре белка и его сродстве
к 02 при замене только одного остатка аминокислоты в полипептид-
436
Глава 7. Функциональные системы
ной цепи. Так, замена Н15-87 а цепи, являющегося пятым лигандом
гема в МЬ и в каждой субъединице НЬ, на менее основный остаток
тирозина приводит к тому, что аномальные субъединицы утрачивают
способность обратимо связывать кислород и вместо этого
окисляются. Это обусловлено изменением положения гема по отношению
к плоскости порфиринового кольца и, следовательно,
свидетельствует об участии пятого лиганда в этом искажении. Замещение дис-
тальных Н13-58, 63 на тирозин в а цепи или в р цепи НЬ приводит
к тому, что кислород не связывается субъединицами, а окисляет Ре2+
до Ре3+. Окисленное состояние железа в гемоглобине может
стабилизироваться ионной связью между Ре3+ и введенным тирозином.
Рис. 7.31. Модель молекулы оксигемоглобина
(ар, (Х2-, рр и р2_сУбъединицы)
437
Биохимия животных
Замещение дистального Жз-бЗ на аргинин в р субъединице
гемоглобина в отличии от вышеприведенного случая увеличивает его
сродство к кислороду вследствие того, что аргинин больше по
объему, чем тирозин, и не может расположиться в лигандном
«кармане». Это тоже является важным обстоятельством, поскольку
расстояние между функциональными группами в области активного
центра белка определяется геометрией расположения всех
аминокислотных остатков полипептидной цепи, и поэтому замена даже
одной аминокислоты приводит к резкому нарушению
расположения функционально важных остатков относительно друг друга. Это,
в свою очередь, нарушает конформацию активного центра белка и
изменяет его субстратную специфичность. Замещение Уа1-67 в дис-
тальной области р субъединицы НЬ на глутаминовую или аспа-
рагиновую кислоту приводит к тому, что карбоксильные группы
этих аминокислот образуют солевые мостики и с железом гема, и
с дистальным ЬПз-бЗ. Солевой мостик с железом гема может
стабилизировать атом металла в окисленном состоянии и таким
образом предотвращает его связывание с кислородом. Солевой мостик
с гистидином стягивает гемовый «карман», существенно понижая
сродство НЬ к кислороду.
Миоглобин — аналог гемоглобина эритроцитов, основной
функцией которого является адсорбирование кислорода в мышцах.
Миоглобин относится к мономерным гемсодержащим белкам (рис. 7.32).
В составе миоглобина единичная полипептидная цепь с
молекулярной массой 17 кДа, содержащая 153 аминокислотных остатка.
В составе первичной структуры миоглобина определяются восемь
правых а-спиралей, содержащих от 7 до 20 аминокислотных остатков.
Принято спирали обозначать с Ы-конца буквами латинского алфавита
от А до Н, а участки, соединяющие спирали, обозначают двумя
буквами. Отдельным аминокислотным остаткам в полипептидной цепи
присваивают букву, указывающую спираль, в которой они находятся,
и порядковый номер, отсчитываемый с 1^-конца спирали. Например,
Н18 Р8 — восьмой остаток в спирали Р. Таким образом, обозначаются
гистидин Р8 (проксимальный) и Е7 (дистальный), которые участвуют
в координации гема. При этом гем располагается в щели между
спиралями Е и Р, а его пропионовокислые остатки ориентированы к
поверхности белковой глобулы. Аналогичное расположение гема
наблюдается у всех гемсодержащих белков (субъединицы гемоглобина,
цитохромы, каталаза, пероксидаза и др.).
438
Глава 7. Функциональные системы
Рис. 7.32. Модель молекулы миоглобина
В координации гема на белке принимают участие два атома
азота гистидинов, один из которых располагается с проксимальной
стороны (пятое координационное положение), а другой с дисталь-
ной (шестое координационное положение). Кислород может
обратимо связываться в шестом координационном положении, рядом
сдистальным гистидином, вытесняя из ближайшего окружения
молекулу воды.
Основная функция миоглобина заключается в накоплении
кислорода в мышечной ткани. Миоглобин может находиться в
нескольких формах. В отсутствие кислорода он называется дезоксимиогло-
439
Биохимия животных
бин (МЬ), а при связывании кислорода — оксимиоглобин (МЬ02),
С02 — карбоксимиоглобин (МЬС02).
Таким образом, гемсодержащие белки (гемоглобин и миоглобин)
служат накопителями кислорода, резервируя кислород в организме и
в дальнейшем обеспечивая равномерное его поступление в
митохондрии, где он участвует в реакциях окислительного фосфорилирования,
восстанавливаясь до воды. Роль переносчика кислорода в организме
животных выполняет эритроцит, который перемещается в организме
животных током крови. Кроме того, гемоглобин и миоглобин
способны участвовать в процессе обмена газов, замещая в тканях
кислород на С02.
Растворимость кислорода в водной среде очень низкая. Так, в 1 л
воды при 20°С и нормальном атмосферном давлении растворяется
6,59 см3 кислорода, что соответствует концентрации раствора в 3-Ю"-* М.
Однако в 1 л крови растворимость кислорода выше и составляет
при нормальных условиях около 200 см3, что соответствует
концентрации раствора в 9-10"3 М.
Таким образом, растворимость кислорода в крови превышает
почти в 30 раз его растворимость в чистой воде, что достигается за счет
использования специализированных гемсодержащих белков
(гемоглобин и миоглобин).
Связывание кислорода с миоглобином определяется
гиперболической зависимостью, которая соответствует уравнению
МЬ + Оут"» МЬОг
[МЬ02] к,
[мънод к2
V! =к,[МЬ][02] и у2 =к2[МЬ02]
Тогда как связывание С02 с миоглобином описывается следующим
уравнением
440
Глава 7. Функциональные системы
Кр2
МЬ + ССЬт"» МЬСОг
[МЬСОг] к',
[МЬ][С02] к'2
уг! = к'^МЪНСОг] и у'г = к'2[МЪС02]
где Кр|, Кр2 — константы равновесия, кь къ к'ъ к'2 — каталитические
константы, У|, у2, у'ь у'2 — скорости процессов образования
комплексов и их распада.
Возможность связывания молекул кислорода и С02 с молекулой
миоглобина определяется величинами констант равновесия (Кр,,
Кр2), значения которых зависят от концентрации веществ,
присутствия органических фосфатов, рН и температуры среды и др.
Константа скорости (&|) связывания кислорода с миоглобином при
20°С равна (1,0... 1,9) • 107 М~1 • с"1 (бимолекулярная константа
скорости). Тогда как константа скорости (к2) составляет 10...70 с"1, при
величине энергии активации равной 80...88 кДж/моль.
Однако при необходимости миоглобин легко отдает кислород,
инициируя протекание окислительно-восстановительных реакций
на внутренней мембране митохондрий, обеспечивая синтез АТФ,
который в дальнейшем обусловливает энергетику активных действий
мышц. Кроме того, кислород способен инициировать протекание
множество ферментативных оксидазных и оксигеназных реакций,
а также присутствовать в виде различных активных форм (02-, НО,
НОг, Н202).
7.6.2. Биохимические механизмы газообмена
В основе осуществления механизма транспорта кислорода в живом
организме заложены индивидуальные свойства гембелков
(гемоглобина и миоглобина), которые реализуются в направленном переносе
кислорода из легких в ткани и обратно (рис. 7.33), где кислород
используется в окислительно-восстановительных процессах,
протекающих в митохондриях, с последующим обменом кислорода на С02,
образующегося в результате расщепления углеводов (глюкозы, фрук-
441
Биохимия животных
Окружающая среда
02 С02
Мышечная ткань
02 С02
МЬО:
МЬС02
СН3-СО-8КоА
Ш:
СНз-СО-СООН <-► СНз-СНОН-СООН
ш
(СН20)„
Рис. 7.33. Схема транспортной системы переноса (>2 и С О 2:
1 — гликолиз; 2— ПДК; 3 — ЦТК
442
Глава 7. Функциональные системы
тозы, галактозы, рибозы и др.) и липидов (нейтральных липидов,
жирных кислот и др.). Перенос С02 осуществляется гемоглобином и ми-
оглобином, реализуя на начальных этапах процесса большее сродство
С02 к гембелкам, по сравнению с кислородом. Оптимальными
условиями связывания кислорода с гембелками являются условия среды,
определяемые величинами рН и температурой. Кислород лучше всего
связывается с гембелками при рН, близких к физиологическим (рН -
7,4), а при закислении и защелачивании среды происходит ухудшение
его связывания. Поэтому это может быть в клетках, где протекают
метаболические процессы, продуктами которых служат кислоты и С02.
Последний при участии карбоан гид разы, катализирующей реакции
гидратации, соединяется с молекулой воды, превращаясь в угольную
кислоту, которая присутствует в среде в виде ионов Н+ и НС03.
С02 + Н20 Т± Н2С03 5=^ Н* + НСОз".
Основная масса С02, поступающего из ткани в плазму крови
капилляров, сразу переносится в эритроциты, где при участии карбоан-
гидразы вновь происходит образование угольной кислоты и ее
диссоциация на ионы водорода и бикарбоната.
Образующийся избыток ионов водорода связывается с
гемоглобином, а ионы бикарбоната с ионами №+, образуя №НС03.
Восстановленная форма гемоглобина способна связывать большее
количество С02, чем окисленная, что облегчает транспорт двуокиси
углерода и кислорода. Тогда как мономерная субъединица гемоглобина
обладает способностью катализировать пероксидазные реакции.
Структуры активных центров гемоглобина, миоглобина являются
более высокоорганизованными по сравнению с пероксидазой, так как
их активные центры предназначены в основном для выполнения
специфических функций в организме человека. Однако, несмотря на
высокую структурную организацию, эти гемсодержащие белки сохранили
способность участвовать в реакциях окисления, что, возможно,
позволяет в ряде случаев использовать специализированные ферментные
системы в окислительных реакциях, реализуемых при включении
механизмов саморазрушения клеток, т. е. в механизмах апоптоза, участвуя в
активизации механизмов перекисного окисления липидов в биогенных
системах. Поэтому выявление общих закономерностей в строении
активных центров и механизмов действия гемсодержащих белков
поможет понять специфику их действия и, в частности, механизм действия
пероксидазы и других гембелков в составе антиоксидантной системы.
443
Биохимия животных
7.7. ПИЩЕВАРИТЕЛЬНАЯ СИСТЕМА
7.7.1. Биохимические процессы в ротовой полости
Процесс переваривания углеводов у многих видов животных (КРС,
лошади, собаки и др.) протекает очень медленно в ротовой полости
в связи с низким содержанием в слюне ам(политических ферментов.
В основном содержимое слюны богато гидрокарбонатами. За сутки
у крупного рогатого скота со слюной выделяется до 350 г
гидрокарбонатов, которые поступают в рубец и могут участвовать в
нейтрализации карболовых кислот, образующихся в процессе брожения.
Процесс секреции
Обогащение
питательного субстрата
у жвачных животных
продуктами
жизнедеятельности
микроорганизмов
Комплекс
гидролитических
ферментов
Процесс переваривания
сложных биогенных
молекул
Питательный
субстрат
Образ
эвание
I мономерныл фирм
биогенных молекул
1
г
Всасывание биогенных
молекул в тонком
отделе кишечника
1
г
Перенос кровью
биогенных молекул в
органы и ткани
■■■■■■ "^
Обезвреживание
токсичных
продуктов в
толстом отделе
кишечника
1
Формирование
каловых масс
Рис. 7.34. Схема превращений биогенных
молекул в пищеварительной системе животных
444
Глава 7. Функциональные системы
Частично углеводы могут перевариваться в желудке лошадей с
участием амилолитических ферментов желудочного секрета. При
этом крахмал может расщепляться до мальтозы. Однако основная
масса крахмала расщепляется в двенадцатиперстной кишке с
участием ферментов, вырабатываемых в поджелудочной железе.
Расщепление клетчатки у лошадей осуществляется ферментами
микрофлоры в толстом отделе кишечника и, в частности, в слепой кишке.
Переваривание компонентов корма начинается в ротовой
полости, где они подвергаются механическому воздействию,
результатом которого должно быть разрушение клеточных структур растений
(рис. 7.34).
Продуктом секреции слюнных желез служит слюна, которая
представляет вязкую жидкость слабо щелочной реакции с плотностью
1,002... 1,012, содержит 99,0...99,4% воды и до 1% сухих веществ.
В секрете слюны содержатся хлориды, сульфаты, карбонаты, соли
угольной кислоты, мочевина, СОг и др. В слюне присутствуют
комплексы ферментов: амилазы (а-, р- и у-амилазы), глюкозидазы (а- и
(3-глюкозидазы).
Ферменты слюны расщепляют крахмал до дисахарида мальтозы и
затем до глюкозы. Слюна способствует экстракции веществ из корма
и поддерживает активность ферментов за счет постоянства рН (рН
7,6...9,0), обладает бактерицидным действием (лизоцим), смачивает
корм, облегчает его проглатывание.
7.7.2. Биохимические процессы
в преджелудках жвачных животных
Желудок жвачных животных самый большой по объему и состоит
из четырех камер, расположенных в следующем порядке: рубец, сетка,
книжка и сычуг. Первые три отдела называются преджелудками,
а последний — сычуг — является истинным желудком. Четырехкамер-
ный желудок у КРС, овец, коз, оленей, тогда как у верблюдов — трех-
камерный (отсутствует книжка).
Рубец КРС может достигать объема в 100...300 л, у овец и коз —
13...23л.
Слизистая оболочка рубца не имеет желез, а выстлана плоским
ороговевшим многослойным эпителием, формирующим складки
величиной до 1 см. Процессы, протекающие в рубце, катализируются
ферментами микроорганизмов (простейшие, грибы и бактерии).
Оптимальными условиями для протекания микробиологического про-
445
Биохимия животных
цесса являются температура 38...40°С и рН среды, близкой к
нейтральной (рН 6,5...7,4).
Кроме того, на микробиологический процесс оказывает влияние
соотношение безазотистых веществ корма и азотистых
экстрактивных соединений в соотношении 1 : 8 и 1 : 10. При этом соотношение
белка и углеводов должно быть 1:0,8 и 1 : 1,5.
В рубце происходит расщепление клетчатки и целлюлозы при
участии ферментов целлюлазного комплекса (целлюлоза и целло-
биоза), которые вырабатываются микрофлорой рубца. В
растительных кормах содержится до 40...50% клетчатки и при участии
ферментов целлюлозолитических бактерий в преджелудках расщепляется до
60...70% клетчатки. Конечным продуктом гидролиза клетчатки
служит р-О-глюкоза. Кроме того, клетчатка участвует в активации
моторики преджелудков и кишечника.
Продуктами гидролиза клетчатки в рубце являются моно- и оли-
госахариды, окисление которых приводит к накоплению в рубце
летучих жирных кислот (уксусная, пропионовая и масляная). При этом
75% от всех летучих жирных кислот приходится на уксусную кислоту,
15% — на пропионовую и 10% — на масляную кислоты.
Продуктом окисления глюкозы служит пировиноградная кислота,
которая восстанавливается до глюкозы при участии ферментов глюко-
неогенеза. Кроме того, пировиноградная кислота может
восстанавливаться до молочной при участии лактатдегидрогеназы или подвергается
декарбоксилированию, превращаясь в ацетальдегид пируватдекарбок-
силазой.
Высокое содержание карбоновых кислот в рубце может понизить
рН среды. Поэтому нейтрализация кислот осуществляется с
помощью щелочных компонентов слюны (карбонатов и фосфатов). В
результате брожения в рубце образуются С02, СН4, Т^Нз, Н25. На долю
С02 приходится 65%, а метана — 30%.
Белки расщепляются в рубце до пептидов и аминокислот.
Последние могут быть использованы бактериями для синтеза собственных
белков, часть дезаминируется с образованием карбоновых кислот и
аммиака.
Микроорганизмы рубца содержат ферменты, способные
расщеплять мочевину до С02 и аммиака. Реакцию катализирует уреаза.
1ЧН2-СО-МН2 + Н20 -» С02 + 2ЫН3
Мочевина
446
Глава 7. Функциональные системы
Ферментативные системы микроорганизмов утилизируют продукты
расщепления углеводов, синтезирующие собственные белки, в состав
которых входят незаменимые аминокислоты.
Активная деятельность микрофлоры рубца способствует синтезу
витаминов: В,, В2, В3, РР, Вс, Н, В6, В,2, К.
У взрослых жвачных животных процессы гидролиза липидов пищи
осуществляются липазами микроорганизмов рубца. В связи с тем,
что липазы микроорганизмов присутствуют вне клетки, то они
способны полностью расщепить поступившие с кормом липиды.
Продукты гидролиза жирных кислот и глицерин активно всасываются
в тонком отделе кишечника, участвуя в процессах ресинтеза триаци-
лглицеринов, или окисляются в митохондриях клеток, обеспечивая
энергией организм.
Сетка осуществляет сортировочную функцию, пропуская в
нижележащие отделы желудка только измельченную и разжиженную массу,
а крупные частицы пищи остаются в рубце для дальнейшего
переваривания.
Книжка выполняет фильтрующую функцию. Сокращение мышц
книжки способствует дальнейшему измельчению частиц корма, в ней
переваривается до 20% клетчатки и всасывается до 70% карбоновых
кислот.
В преджелудках животных происходит интенсивное всасывание
воды, летучих жирных кислот, глюкозы, аминокислот и ионов.
7.7.3. Биохимические процессы в желудке
моногастрических и в сычуге жвачных животных
У животных с однокамерным желудком и в сычуге жвачных
животных различают главные, обкладочные и добавочные клетки желез
слизистой, которые имеют функциональную специализацию. При этом
главные клетки вырабатывают ферменты (гидролазы), обкладочные
клетки — соляную кислоту, а добавочные — слизь. Секрет клеток
желудка имеет кислую рН (1,5...2,5) и содержит неорганические и
органические вещества. Неорганические вещества представлены ионами
№+, К+, Са2+, Т^Н4+, М§2+, а также сульфатами и фосфатами. Высокое
содержание соляной кислоты обеспечивает низкое значение рН
желудка. В составе органических веществ в желудочном секрете
определяются белки (сывороточный альбумин, глобулины, муцин),
ферменты (пепсин, химозин, желатиназа, желудочная липаза), молочная
кислота, АТФ, аминокислоты, креатинин, мочевая кислота.
447
Биохимия животных
Железы желудка вырабатывают неактивные формы протеаз, кото-
рые под действием соляной кислоты становятся активными. Кроме
того, соляная кислота способна выполнять следующие функции:
1) денатурирует белки, нуклеопротеины и гликопротеины,
катализирует реакции неферментативного гидролиза белков; от
сложных белков отщепляются разнообразные пептиды, которые
затем подвергаются гидролизу до аминокислот;
2) активирует пепсиноген, переводя его в пепсин — активную
форму;
3) поддерживает рН среды желудка;
4) активирует гастрин, переводя его из неактивной формы (про-
гастрин) в активное состояние;
5) стимулирует выработку гастрона, который образуется в пило-
рической части желудка и обладает противоположным гаст-
рину действием;
6) способствует образованию энтерогастрона в слизистой
двенадцатиперстной кишки;
7) регулирует действие пилорического сфинктера желудка; при
продвижении пищи к пилорической части соляная кислота
стимулирует открытие пилорического сфинктера желудка,
в результате часть содержимого желудка поступает в
двенадцатиперстную кишку, понижая при этом рН среды в этом отделе
кишечника; в ответ на это происходит раздражение слизистой
оболочки двенадцатиперстной кишки, вызывая сокращение
мышц пилорического сфинктера; при этом пища
обогащенная углеводами эвакуируется из желудка быстрее, чем бел-
ково-липидная; гастрин стимулирует образование гистамина,
который влияет на секрецию обкладочных клеток,
вырабатывающих соляную кислоту; предшественником гистамина
служит гистидин;
8) ускоряет секрецию из клеток слизистой оболочки
двенадцатиперстной кишки просекретина, превращая его в секретин
(активная форма), который всасывается в кровь, стимулирует
образование секрета поджелудочной железы и одновременно
замедляет деятельность обкладочных клеток, подавляя
секрецию соляной кислоты в желудке; секретин относится к
гормонам пептидной природы, в составе первичной структуры
которого 27 аминокислотных остатков с молекулярной
массой в 5 кДа.
448
Глава 7. Функциональные системы
9) стимулирует содержимое желудка, останавливая бродильные
процессы, способствуя растворению фосфата кальция,
соединений железа и др.
Сокращение мускулатуры желудка находится под контролем гаст-
рина, гистамина, холина, ацетилхолина, ионов Са2*. Замедляют
двигательную активность желудка энтерогастрин, адреналин, норадреналин.
При синтезе соляной кислоты используется хлорид натрия, что
доказано экспериментами по варьированию содержания №С1 в составе
корма. Диссоциация хлорида натрия сопровождается образованием
ионов натрия и хлора. Последний диффундирует через клеточные
мембраны, соединяясь с ионами водорода, донорами которых служит
угольная кислота, образующаяся из СОг и Н20 при участии фермента
карбоангидразы.
N301 ^=*Ыа+ + СГ
карбоангидраза
СОг + НгО^: Н2С03т=* Н+ + НС03"
СГ + Н*;щ*НС1
Образовавшаяся соляная кислота экскретируется в составе секрета
обкладочных клеток желудка. Процесс образования соляной кислоты
протекает с участием АТФ.
Основным ферментом желудка является пепсин, который
синтезируется главными клетками фундальной части желудка и первично
вырабатывается в неактивной форме — пепсиногена.
Пепсин (КФ 3.4.23.1) имеет молекулярную массу, равную 32,7 кДа,
с изоэлектрической точкой при рН 3,7. Превращение пепсиногена
в функционально активную форму может происходить в кислой среде
при участии молекул воды (неэнзиматический путь), в качестве
катализаторов выступают ионы водорода, а также автокаталитически,
с участием уже самого пепсина (энзиматический путь).
НС1->ЬГ + СГ
Пепсиноген + Н20 -а ►пепсин + пептид
449
Биохимия животных
В составе полипептидной цепочки пепсина содержится 327
аминокислотных остатков. При активации от 1М-конца пепсиногена
отщепляется полипептид с молекулярной массой около 7 кДа, который
содержит в своем составе 42 аминокислотных остатка. При этом
активный центр освобождается и белок приобретает каталитические
свойства, с очень узким оптимумом каталитической активности при
рН 2Д..ЗД В активном центре фермента 3 карбоксильные группы
глутаминовой и аспарагиновой (А$р-32 и А$р-215) аминокислот.
Пепсин относится к группе эндопептидаз и под действием фермента
гидролизу подвергаются внутренние пептидные связи белков, поэтому
пепсин может катализировать реакции гидролиза только
денатурированных белков. Это обычно происходит за счет соляной кислоты,
которая вырабатывается в париетальных (обкладочных) клетках
слизистой оболочки желудка. Продуктами гидролиза белков являются
в основном пептиды и очень небольшое количество аминокислот.
Пепсин обладает высокой протеолитической активностью, но очень
низкой молокосвертывающей активностью.
В сычуге телят жвачных животных вырабатывается химозин (КФ
3.4.23.4), относящийся к группе гидролитических ферментов,
катализирующих гидролиз пептидной связи у казенное, что обуславливает
процесс свертывания молока. В механизме действия фермента
проявляется специфичность, обусловленная тем, что подвергается разрыву
всего лишь одна пептидная связь между фенилаланином (Фен-105)
и метионином (Мет-106) в молекуле х-казеина.
Фермент имеет молекулярную массу равную 30 кДа, с изоэлектри-
ческой точкой при рН 4,5. Активность фермента проявляется в
слабокислой среде (рН 5,0...5,3), в присутствии ионов кальция. В активном
центре фермента содержится карбоксильная группа аспарагиновой
кислоты. Химозин обладает низкой протеолитической активностью,
но высокой молокосвертывающей активностью. Химозин способен
гидролизовать казеин в составе мицелл. При этом казеин переходит
в казеинат кальция, образуя створоженный сгусток.
Ферменты (пепсин и химозин) входят в единый сычужный
ферментативный комплекс, в составе которого 60...70% химозина и 30...40%
пепсина. Активность этих ферментов зависит от температуры. С
возрастанием температуры активность ферментов увеличивается, достигая
максимума при 40°С. Дальнейшее повышение температуры
сопровождается денатурацией фермента и утратой ферментативной активности.
При 10°С сычужный ферментативный комплекс мало активен.
450
Глава 7. Функциональные системы
7.7.4. Биохимические процессы в печени
Печень является крупной железой пищеварительной системы,
представленной одним типом клеток печеночной паренхимы — гепатоци-
тами, сообщество которых формирует печеночную дольку. Последняя
является структурно-функциональной единицей печени, в которой
протекают важнейшие биохимические процессы (табл. 7.5).
Таблица 7.5
Основные биохимические процессы, протекающие в гепатоцитах
| Вид метаболизма
Метаболизм
белков
Метаболизм
углеводов
Метаболизм ли-
ПИДОВ |
| Характеристика биохимического процесса |
| Биосинтез белков плазмы крови |
Образование мочевины и мочевой кислоты |
Синтез холина и креатина |
Реакции переаминирования и дезаминирования
аминокислот |
Синтез гепарина |
Синтез гиппуровой кислоты |
Синтез глюкозы и гликогена |
Синтез пентозофосфатов |
Окисление глюкозы, фруктозы, галактозы |
Образование НАДФН |
Синтез глицерина |
Синтез АТФ |
Синтез высших жирных кислот |
Синтез триацилглииеринов, и фосфолипидов |
Синтез холестерина и его эфиров |
Синтез желчных кислот и их секреция |
Образованиелипопротеинов (ЛПОНП иЛПВП) |
Окисление жирных кислот |
Липолиз триацилглииеринов |
Образование кетоновых тел ]
451
Биохимия животных
Окончание таблицы 7.5
1 Вид метаболизма
Общие функции
Характеристика биохимического процесса
Обезвреживание токсичных продуктов |
Депонирование витаминов
Регуляция равновесия между свертывающей и
антисвертывающей системами крови
Снаружи печень покрыта соединительной капсулой и серозной
оболочкой. Кровоснабжение печени осуществляется печеночной
артерией и воротной веной. Через печень протекает кровь из желудка,
кишечника и селезенки по воротной вене и может депонировать до
20% крови организма. Поверхностные мембраны гепатоцитов с одной
стороны обращены в сторону внутридолькового желчного протока,
через который собирается желчь, поступающая в желчные
капилляры. С другой стороны они активно контактируют с кровеносными
сосудами, осуществляющими обмен биогенных соединений, одни из
которых необходимы для жизнедеятельности гепатоцитов, а другие
являются продуктами их деятельности, выделяемыми в кровь.
Таким образом, при функционировании гепатоцита должна
прослеживаться взаимная зависимость между процессами,
протекающими на поверхности мембраны с направленностью метаболических
процессов в цитоплазме клетки. За счет этого будет регулироваться
направление синтезируемых компонентов к той поверхности
мембраны, которая соприкасается с эндотелием синусоидов или с
желчными капиллярами. При этом компоненты желчи, синтезируемые
в гепатоците, должны быть ориентированы к той стороне клетки,
которая соприкасается с капилляром, отводящим желчь, тогда как
липопротеины должны быть перемещены в сторону кровеносных
сосудов.
В тканях печени содержится больше всего воды и четвертую часть
составляет сухой остаток, который в основном представлен органическими
соединениями. Количественный и качественный состав соединений
печени следующий, %: вода — 70...75, сухой остаток — 25...30, белки —
10...13, глобулины 8...10, альбумины — 1...2, гликоген — 1,5...2,0,
глюкоза — 0,08...0,1, липиды — 1,5...2,0, холестерин — 0,3...0,5, а также
ионы натрия — 0,1...0,2, калия — 0,2...0,3, хлора — 0,15...0,20, кальция —
0,012...0,014, магния - 0,023...0,025, железа — 0,01 ...0,015.
452
Глава 7. Функциональные системы
Метаболизм аминокислот и белков в печени. Активное
кровоснабжение печени способствует поступлению значительного количества
аминокислот, которые в гепатоцитах подвергаются декарбоксилирова-
нию, дезаминированию и трансаминированию. В печени происходит
обезвреживание ядовитых продуктов азотного обмена, в частности,
аммиака, который превращается в мочевину. Последняя
синтезируется в печени из аммиака, С02 и воды, в процессе синтеза мочевины,
в котором принимает участие орнитин. Синтез мочевины начинается
с образования карбамоилфосфата. Реакция катализируется карбамо-
илфосфатсинтетазой и протекает за счет гидролиза АТФ.
Реакции амидирования аспарагиновой и глутаминовой кислот,
используются для обезвреживания аммиака и катализируются
соответственно аспарагинсинтетазой (1) и глутаминсинтетазой (2). В
результате этих реакций образуется аспарагин и глутамин.
ноос-сн,-р+-соон +мнз+атф
0=С-СН,-^Н-СООН +АДФ + Н,Р04
ЫН2 N4, N4,
Аспарагиновая кислота Аспарагин
Глутаминовая кислота Глутамин
НООС^Н,^ННрН-СООН + Ш| + АТф Ш . 0«9-СН,-СН,-СН^СООН +АДФ + Н,ГО4
В печени активно протекают процессы биосинтеза. В
гепатоцитах происходит синтез основных белков крови, в частности, все
альбумины и 75...80% глобулинов. Кроме того, синтезируются основные
факторы свертывания крови (фибриноген, протромбин, проконвер-
тин и проакцелерин).
При патологических процессах в печени резко понижается
активность процессов синтеза белков, что проявляется в снижении в плазме
крови содержания альбуминов, вследствие этого может понизиться он-
котическое давление плазмы крови, способствуя развитию отеков и
затем проявлению асцита.
453
Биохимия животных
Развитию геморрагических явлений способствуют нарушения в
синтезе белков системы свертывания крови.
Кроме того, в печени происходит распад нуклеиновых кислот,
окисление пуриновых оснований аденина и гуанина до соответствующих
оксипуринов — гипоксантина и ксантина, которые при участии ксан-
тиноксидазы окисляются до мочевой кислоты. Следует отметить, что
в печени происходит синтез креатина, который затем переносится
током крови в мышечную ткань, где он подвергается фосфорилированию
с образованием креатинфосфата.
Синтез креатинфосфата. Синтез креатинфосфата сопряжен с
синтезом аргинина, лимитирующей стадией которого служит
образование карбамоилфосфата. Этот процесс обычно называют орнитино-
вый цикл. Продуктом цикла является мочевина. Наиболее активно
процесс протекает в печени. При этом основные стадии орнитино-
вого цикла являются и начальными стадиями синтеза
креатинфосфата. Карбамоилфосфат в основном синтезируется в митохондриях.
Процессы синтеза мочевины и креатина сопряжены с образованием
аргинина в орнитиновом цикле. Процесс завершается образованием
креатинфосфата, который используется в дальнейшем в мышцах
в качестве основного энергетического соединения в механизмах
сокращения.
Продуктом гидролиза креатина и креатинфосфата служит креа-
тинин, который образуется при отщеплении молекулы воды от
креатина или фосфорной кислоты от креатинфосфата
неферментативным путем.
Метаболизм углеводов в печени. Одной из основных функций
печени является регулирование концентраций глюкозы в крови. Гли-
колитическая функция печени обеспечивается активностью
ферментов и регулируется центральной нервной и гормональной системами.
Поступление глюкозы в клетки находится под контролем адреналина,
инсулина и глюкагона.
В гепатоцитах превращение глюкозы осуществляется в процессах
гликолиза, гликогенеза, гликогенолиза и глюконеогенеза.
Поступившая в гепатоциты глюкоза при участии глюкокиназы подвергается
фосфорилированию с образованием глюкозо-6-фосфата. Высокая
активность фермента обусловлена тем, что глюкокиназа, в отличие от
гексокиназы, не ингибируется глюкозо-6-фосфатом. Фермент имеет
более высокое сродство к субстрату и за счет этого почти в 10 раз
более активен, чем гексокиназа.
454
Глава 7. Функциональные системы
Основными продуктами расщепления глюкозы в печени являются
трехуглеродные соединения (фосфодиоксиацетон, трифосфоглице-
риновый альдегид, 1,3-дифосфоглицерат, 2-фосфоглицерат и др.),
которые в дальнейшем используются в реакциях синтеза триацилглице-
ринов и фосфолипилов.
В печени протекают активно процессы синтеза желчных кислот,
которые образуются из холестерина. Для процесса синтеза холестерина
требуется НАДФН, который образуется в реакциях пентозофосфатного
пути. Кроме того, НАДФН используется в реакциях синтеза жирных
кислот, входящих в состав мембран клеток и липопротеинов.
Образующиеся в пентозофосфатном процессе пентозофосфаты (ри-
боза-5-фосфат, рибулоза-5-фосфат, ксилулоза-5-фосфатидр.),
используются в реакциях синтеза нуклеиновых кислот.
В печени происходит не только расщепление глюкозы, но и ее
синтез. Основным источником глюкозы в гепатоцитах служит гликоген,
являющийся полисахаридом, синтез которого особенно активно
протекает в печени, мышцах и мозге.
Процесс расщепления гликогена находится под контролем аденилат-
циклазной системы, мессенджером которой является цАМФ.
Последний инициирует активность протеинкиназы, запуская каскад
ферментативных реакций, результатом которых служит повышение активности
фосфорилазы, катализирующей реакцию отщепления от гликогена
молекулы глюкозо-1-фосфата. Дальнейшее превращение
глюкозо-1-фосфата осуществляется при участии фосфоглюкомутазы и глюкозо-6-фос-
фатазы. Конечным продуктом этих реакция является глюкоза.
Кроме того, в гепатоцитах глюкоза может образоваться в процессе
глюконеогенеза, исходными субстратами которого являются лактат,
глицерин и аминокислоты.
Поступающая в гепатоциты фруктоза способна фосфорилиро-
ваться под действием гексокиназы до фруктозо-6-фосфата или при
участии фруктокиназы до фруктозо-1 -фосфата. Последний
расщепляется альдолазой до двух триоз (фосфодиоксиацетон и
глицериновый альдегид).
При участии триокиназы глицеральдегид подвергается фосфорили-
рованию до глицеральдегид-3-фосфата, который в последующем
может превращаться до образования пировиноградной кислоты или в
реакции, катализируемой триозофосфатизомеразой изомеризоваться до
фосфодиоксиацетона, с последующим включением в состав триацилг-
лицеринов.
455
Биохимия животных
Основной путь превращения фруктозы в гепатоцитах исключает
участие лимитирующего фермента гликолиза — фосфофруктокиназы.
Поэтому расщепление фруктозы в гепатоцитах до триоз позволяет
ускорять процессы синтеза жирных кислот, их эстерификацию и
секрецию липопротеинов очень низкой плотности.
Превращение галактозы в гепатоцитах инициируется галактокина-
зой, осуществляющей фосфорилирование галактозы с образованием
галактозо-1-фосфата. Большая часть галактозо-1-фосфата в
гепатоцитах превращается при участии гексозо-1-фосфат-уридилилтранс-
феразы, катализирующей следующую реакцию:
УДФ-глюкоза + галактоза-1 -фосфат ->
-> УДФ-галактоза + глюкозо-1 -фосфат
Метаболизм липидов в печени. В клетках печени осуществляется
множество реакций, в которых превращаются липиды. В частности,
в гепатоцитах протекают как процессы синтеза высших жирных
кислот, триацилглицеринов, фосфолипидов, холестерина и его эфиров,
желчных кислот, так и процессы окисления жирных кислот, липолиз
триацилглицеринов, образование кетоновых тел.
Печень выполняет функцию регулятора жирных кислот в плазме
крови. При возрастании их содержания в плазме жирные кислоты
начинают активно поступать в гепатоциты, стимулируя процесс синтеза
триацилглицеринов и окисление жирных кислот. В результате
происходит накопление ацетил-КоА, который используется для синтеза
кетоновых тел. Последние током крови разносятся в различные органы
и ткани, где они могут окисляться.
В гепатоцитах протекают как процессы синтеза, так и распада
фосфолипидов. В составе фосфолипидов остатки глицерина, жирных
кислот, фосфор ильная группа и полярная молекула (остаток холина, эта-
ноламина, инозина и др.). Недостаток азотистых соединений может
понизить содержание фосфолипидов, способствуя накоплению в
гепатоцитах нейтральных липидов, что проявляется в жировой
инфильтрации клеток печени.
В гепатоцитах протекают процессы биосинтеза холестерина,
которые находятся под контролем избыточных концентраций холестерина,
поступающего с пищей. Высокие концентрации экзогенного
холестерина подавляют процесс его синтеза в гепатоцитах. Кроме того, со-
456
Глава 7. Функциональные системы
держание холестерина в организме поддерживается на определенном
уровне за счет того, что часть синтезированного холестерина выводится
из организма в составе желчи, а часть превращается в желчные кислоты
или поступая в другие органы и ткани используется для синтеза
стероидных гормонов. Некоторое количество холестерина в виде эфиров
с жирными кислотами поступает в кровь и вместе со свободным
холестерином разносится по всему организму.
Кроме того, в гепатоцитах происходит образование липопроте-
инов очень низкой плотности (ЛПОНП) и липопротеинов высокой
плотности (ЛПВП).
Основным белком ЛПОНП является апопротеин В-100 (апо-В-100),
синтез которого происходит на рибосомах шероховатого эндоплаз-
матического ретикулума, тогда как сборка ЛПОНП осуществляется
в гладком эндоплазматическом ретикулуме, где синтезируются все
основные компоненты липопротеинов (неэстерифицированные
жирные кислоты (НЭЖК), холестерин, триацилглицерины, фосфоли-
пиды). Часть из этих компонентов может поступать в печень током
крови. По мере накопления НЭЖК и триацилглицсринов
инициируется процесс синтеза апо-В-100. Затем апопротеин В-100
внедряется в мембрану шероховатого ретикулума, инициируя процесссы,
сопровождаемые отделением от мембраны фрагмента, в составе
которого фосфолипиды и белки, являющиеся составными частями ли-
попротеина. После этого белковофосфолипидный комплекс
переносится в гладкий эндоплазматический ретикулум, где в его структуру
встраиваются триацилглицерины и эстерифицированный холестерин.
В результате формируются промежуточные частицы липопротеинов
(п-ЛПОНП). Процесс образования ЛПОНП завершается в аппарате
Гольджи, в составе секреторных везикул которого они доставляются
к поверхности клетки и затем путем экзоцитоза выделяются в периси-
нусоидальные пространства, откуда липопротеины поступают в
просвет кровяного синусоида. Процесс синтеза ЛПОНП завершается тем,
что апопротеины С из ЛПВП переносятся на п-ЛПОНП.
Механизм образования липопротеинов. Начальная стадия
синтеза липопротеинов протекает в полости шероховатого эндоплазма-
тического ретикулума, где на рибосомах синтезируются апобелки,
которые совместно с фосфолипидами будут формировать
липопротеины. Образование липопротеинов завершается в гладком
эндоплазматическом ретикулуме, который является основным местом синтеза
триацилглицеринов, фосфо- и сфинголипидов. Затем липопротеины
457
Биохимия животных
проходят через аппарат Гольджи, где подвергаются гликозилирова-
нию, накапливаясь в визикулах, т. е. происходит процесс
присоединения углеводных остатков к молекуле липопротеина.
Высвобождение хил омикронов и ЛПОНП из клеток слизистой
оболочки кишечника и печени происходит при слиянии секреторной
вакуоли с клеточной мембраной. Из клеток кишечника хиломикроны
поступают в межмембранное пространство, а затем через
лимфатическую систему и грудной лимфатический проток в кровь. Липопро-
теины, синтезируемые в гепатоцитах, вначале секретируются в
пространство Диссе, а затем в синусоидные капилляры печени.
Детоксикация веществ в печени. Одной из основных функций
печени является детоксикация вредных для организма веществ. При
выполнении этой функции в гепатоцитах проявляют активность
ферменты микросомального окисления и пероксисомального окисления.
Последние относятся к специализированным органеллам, в которых
содержатся различные оксидазы (лактатоксидаза, алкогольоксидаза,
оксидаза Д-аминокислот, супероксиддисмутаза, каталаза, перокси-
даза и др.).
В реакциях катализируемых оксидазами образуется перекись
водорода.
Глюкозооксидаза
Р-Б-глюкоза + 02 -► О-глюконо-8-лактон + Н202
Алкогольоксидаза
к-сн2-он + о2 -> к-сно + н2о2
Оксидаза- Ь-гидроксикислот
К-СН (ОН)-СООН + 02 -> К-СО-СООН + Н202
Альдегидоксидаза
К-СНО + 02 -► К-СООН + Н202
о о
;н\ +н2о+о2 Кса^=^ н7 ]ГМ>о +н2о2
Ксантин Мочевая кислота
458
Глава 7. Функциональные системы
В реакциях восстановления перекиси участвуют каталаза и перок-
сидаза.
Каталаза
2Н202 -> 2Н20 + 02
Пероксилаза
Н202 + АН2-
2Н20 + А
Причем действие пероксидазы проявляется при низких
концентрациях перекиси - 10-6 М, тогда как каталаза способна катализировать
реакции разложения перекиси при концентрации выше - 10—3 М.
Кроме того, в печени наблюдается обезвреживание
накопившегося в результате реакций дезаминирования аммиака, путем его
последовательного включения в состав различных органических
молекул, конечным продуктом которых является мочевина. Этот процесс
называют орнитиновый цикл.
Током крови в печень поступают токсичные продукты
расщепления ароматических аминокислот: тирозина — фенол и крезол,
триптофана — скатол и индол.
но-^^»-сн2-сн-
NN2
СН — СООН-
~о-*-*-о
Тирозин
сн2— сн —соон
ын2
Триптофан
Крезол
1
■СН3
Скатол
Фенол
Индол
Нейтрализация этих соединений достигается за счет их
взаимодействия с активными формами 3'-фосфоаденозин-5'-фосфосуль-
фата (ФАФС) и уридиндифосфоглюконовой кислотой (УДФГК).
Токсичность некоторых соединений в печени понижается путем
взаимодействия с глюкуроновой кислотой. Так, например,
свободный билирубин при взаимодействии с глюкуроновой кислотой
образует моно- и диглюкурониды билирубина.
459
8
ОН
I
НО—5 — 0 —Р—О—С
ОН
но—р—о
ФАФС
о —р—он
но о
НО — Р— О— С1
но он
УДФГК
Глава 7. Функциональные системы
Для обезвреживания бензойной кислоты в печени используется
глицин, продуктом этой реакции является гиппуровая кислота.
н— сн — соон
с°он + I —► (( )>-со-мн-сн2 +н2о
мн2
соон
Бензойная кислота Глицин Гиппуровая кислота
В печени высока активность ферментов, катализирующих реакции
метилирования. Так, амид никотиновой кислоты подвергается
метилированию с образованием М-метилникотинамида.
^° сн ^ ^°
Амид никотиновой кислоты Ы-метилникотинамид
Некоторые сульфаниламидные препараты в печени ацетилиру-
ются. Под действием микросомальной системы печени многие гор-
моны инактивируются. Так, с участием аминооксидаз в гепатоцитах
происходит окисление катехоламинов.
7.7.5. Химический состав желчи
Желчью называется биологическая жидкость, основные
компоненты которой вырабатываются в гапатоцитах и поступают через
желчный проток в желчный пузырь, где происходит формирование
ее индивидуального состава.
Желчеобразование происходит непрерывно, однако
интенсивность процесса на протяжении суток может колебаться. Желчь
скапливается в желчном пузыре, а из него поступает в кишечник
периодически по мере приема пиши.
Стенки желчного пузыря состоят из трех оболочек: слизистой,
мышечной и серозной. В образовании этих оболочек принимают участие
различные биогенные молекулы. Слизистая оболочка имеет
многослойные складки, а мышечная оболочка представлена
преимущественно циркулярно расположенными гладкомышечными клетками.
У однокопытных желчный пузырь отсутствует, поэтому выводные
протоки представлены большим числом складок.
461
Биохимия животных
В состав желчи входят желчные кислоты (холевая, дезоксихолевая,
хенодезоксихолевая, гликохолевая, таурохолевая кислоты). По
химической природе желчные кислоты являются производными холано-
вой кислоты.
н —сн2—сн2—соон
Холановая
Г'
но ^н — сн2—сн2— соон
СН3
но сн — сн2 —сн2— соон
' СН3У
Дезоксихолевая кислота
462
Глава 7. Функциональные системы
:н—сн2—сн2—соон
но- - - он
Хенодсзоксихолевая кислота
сн2—сн2— с— ын — сн2— соон
О
ОН
Гликохолевая кислота
СНз
Н — СН2—СН2— С— NН — СН2—СН2—503Н
О
Таурохолевая кислота
Кроме того, в желчи содержатся пигменты (билирубин, биливер-
дин), холестерин, муцин, лецитин, жирные кислоты, нейтральные
липиды, мочевина, мочевая кислота, аминокислоты, углеводы
(глюкоза, фруктоза), витамины (А, В и С), ионы (№\ К\ Са2\ СГ, Си2\
Ре3+,2п2+,Мп2\1-идр.).
463
Биохимия животных
В желчи присутствуют ферменты: амилазы, оксидазы, фосфатазы,
протеазы, каталаза. Соотношение между компонентами желчи могут
меняться в зависимости от состава пищи. Эмульгирующее действие
желчных кислот зависит от соотношения в желчи желчных кислот,
ненасыщенных жирных кислот и моноацилглицеринов. При этом соли
желчных кислот способны уменьшить поверхностное натяжение на
поверхности раздела липид/вода и при этом стабилизируют
образовавшуюся эмульсию.
Цвет желчи зависит от содержания желчных кислот и
пигментов. Присутствие билирубина придает свежей печеночной желчи
золотисто-желтый цвет, тогда как зеленой она становится из-за
окисления билирубина в биливердин. Со временем желчь
приобретает коричневую окраску, обусловленную окислением
пигментов. Окраска желчи у разных видов животных различается. Так,
у всеядных животных желчь имеет темный золотисто-желтый цвет,
у плотоядных — темно-красный с желтизной, у травоядных — темно-
зеленой окраски.
Во время прохождения по желчевыводящим путям и в желчном
пузыре состав желчи дополняется секретом эпителия — муцином.
Последний является гликопротеином, входит в состав секрета
эпителиальных клеток слизистых оболочек дыхательных,
пищеварительных, мочеполовых путей, а также подчелюстных и подъязычных
слюнных желез. Муцин слюны способствуют смачиванию и
склеиванию пищевого комка и его прохождению по пищеводу.
Обволакивая слизистую оболочку желудка и кишечника, муцины
предохраняют ее от воздействия протеолитических ферментов желудочного
и кишечного сока. Выполняют в организме защитную функцию,
например, подавляют слипание эритроцитов, вызываемое вирусом
гриппа.
В желчном пузыре происходит всасывание воды, которая
повышает плотность и вязкость желчи.
Плотность пузырной желчи сельскохозяйственных животных
колеблется в пределах от 1,026 до 1,048 и имеет рН 6,8.
Вода составляет 80...86%. Количественные показатели желчи
зависят от вида, возраста животного, типа питания, условий
содержания и др.
В течение суток при нормальном рационе питания у лошади
выделяется 5...6, у крупного рогатого скота — 2...6, у овец — 0,3...0,4, у
собак — 0,25...0,30 л желчи.
464
Глава 7. Функциональные системы
Желчеобразование возрастает при поступлении в организм
желчных кислот, при раздражении рецепторов желудка пищевыми
массами, при закислении кишечника содержимым желудка.
Основные компоненты желчи фосфолипиды, желчные пигменты
и желчные кислоты обуславливают растворимость холестерина за счет
образования мицеллярных структур. При понижении концентрации
желчных кислот в желчи холестерин выпадает в осадок, способствуя
образованию камней. Последние имеют внутреннее ядро, состоящее из
белка, окрашенного желчными пигментами. Активное формирование
камней наблюдается при застое желчи и наличии инфекции. В первом
случае в камнях содержание холестерина составляет 90...95%, а во
втором — образовавшиеся камни содержат билирубинат кальция.
Образование билирубина происходит вследствие возрастания
активности бактериальной р-глюкуронидазы, гидролизующей конью-
гаты билирубина. Наиболее часто встречаются камни, состоящие из
чередующихся слоев холестерина и билирубината кальция.
Роль желчи в пищеварительном процессе животных достаточно
многогранна и сложна. Однако можно выделить следующие функции
желчи:
1) компоненты желчи нейтрализуют кислое содержимое,
поступающее из желудка в кишечник, останавливая действие пепсина;
2) участвует в эмульгировании липидов, способствуя их
всасыванию за счет того, что нерастворимые в полярной среде жирные
кислоты переходят в растворимую форму;
3) способна активировать деятельность ферментов
поджелудочной железы и желез тонкого отдела кишечника;
4) участвует в процессе промежуточного обмена веществ, в
частности, в фосфорном обмене;
5) усиливает движение ворсинок кишечника, ускоряя всасывание
соединений из желудка;
6) повышает тонус и усиливает перистальтику кишечника,
способствуя быстрому всасыванию, переработке и эвакуации
питательных веществ;
7) проявляет бактериостатическое действие на микрофлору
кишечника;
8) стимулирует желчеобразование, оказывая действие на
рецепторы и нервные центры;
9) способствует выведению из организма продуктов обмена и
токсичных веществ.
465
Биохимия животных
7.7.6. Поджелудочная железа
Поджелудочная железа имеет сложное анатомо-функциональное
строение. Снаружи железа покрыта соединительнотканной капсулой,
от которой отходят перегородки, делящие железу на дольки.
Морфологически и функционально различают экзокринную (наружную) и
эндокринную (внутреннюю) части. Клетки экзокринной части (аци-
нусы) секретируют ферменты, поступающие по выводным протокам
в просвет двенадцатиперстной кишки, участвующие в расщеплении
белков, углеводов и липидов.
Тогда как клетки эндокринной части (инсулярные) синтезируют
гормоны, регулирующие углеводный, белковый и липидный обмены
в тканях.
Инсулярные клетки различаются по строению. Среди них
выделяют А-, В-, Э-, В1- и РР-клетки. Больше всего В-клеток. Они
занимают центральную часть железы, и в них синтезируется инсулин,
тогда как в клетках расположенных на периферии в А-клетках
вырабатывается глюкагон. В Р-клетках образуется гормон, который
тормозит секрецию как ацинозных клеток, так и А- и В-клеток.
Вырабатываемый гормон в 01-клетках снижает кровяное
давление, и усиливает секреторную деятельность поджелудочной железы.
В РР-клетках происходит синтез гормона, который усиливает
секрецию поджелудочной железы и желудка.
Секрет поджелудочной железы представляет прозрачную,
бесцветную жидкость, рН которой у лошадей 7,30...7,58, у КРС — около 8,0.
В составе секрета 90% воды и 10% белковых соединений,
преимущественно ферменты: трипсин, химотрипсин, карбоксипептидазы,
эластазы, амилазы, лактазы, инвертазы, липазы, нуклеазы. Кроме
того, в секрете содержатся соли: №НС03, №С1, СаС12, №Н2Р04 и
№2НР04.
Клетки слизистой оболочки двенадцатиперстной кишки
способны вырабатывать несколько гормонов, усиливающих секрецию
поджелудочной железы. К этим гормонам относятся секретин, пан-
креозимин.
Секреция поджелудочной железы возрастает под действием гаст-
рина, образующегося в пилорической части желудка, инсулина,
солей желчных кислот.
Угнетают секрецию поджелудочной железы нейропептиды: гаст-
роингибирующий, панкреатический, вазоактивный интестинальный
полипептиды и соматостатин.
466
Глава 7. Функциональные системы
7.7.7. Биохимические процессы в тонком отделе кишечника
После желудка пищевая масса поступает в кишечник, где при
участии ферментов секрета поджелудочной железы, желчного пузыря и
эпителия слизистой тонкого отдела кишечника подвергается
дальнейшему превращению. В секрете поджелудочной железы содержится
комплекс ферментов класса гидролаз, катализирующих реакции
гидролиза белков до аминокислот, углеводов до моносахаридов и
нейтральных липидов до жирных кислот и глицерина
Белки гидролизуются под действием трипсина, химотрипсина, кар-
боксипептидазы,аминопептидазы идипептидазы. Первоначально
ферменты (трипсин и химотрипсин) вырабатываются в неактивной
форме — зимогенов. Так, трипсин в виде трипсиногена, химотрипсин —
хим отри пси ноге на.
Трипсиноген
I Энтеропептидаза
^*— ТпмХ-
Трипсин
Химотрипсиноген —*•—► Химотрипсин
1с
Карбоксипептидаза т * Карбоксипептидаза
(неактивная форма) (активная форма)
Превращение трипсиногена в трипсин катализируется эндопепти-
дазой, которая относится к гликопротеинам с механизмом проявления
активности при рН 5,0...8,0. Активным фермент становится после того,
как энтеропептидаза отщепляет гексапептид, освобождая, таким
образом, активный центр фермента. В дальнейшем трипсин катализирует
превращение трипсиногена в активную форму, которая проявляет
максимальную активность при рН 7,8...8,2. При расщеплении пептидных
связей трипсин проявляет большую специфичность к тем пептидным
связям, в формировании которых участвуют карбоксильные группы
аргинина и лизина. Продуктами гидролиза белков, катализируемых
трипсином, являются низкомолекулярные полипептиды, дипептиды и
аминокислоты, так как трипсин способен катализировать реакции
гидролиза не только высокомолекулярных протеинов, но и тетропептиды,
в составе которых аминокислотные остатки лизина и аргинина.
467
Биохимия животных
Субстрат
Промежуточное
соединение
Ацилфермент
5ег-195
—сн, о
о снк-
с
СНР-М-Н
Н18-57
/
©6.
у
г-
А$р-102
©.
I
с- снк*
-сн,—о^ \
снк—гч—н
^*"»™
и
~ч^
/СН, н
1о о
у
он,
\/нк'
—сн,—о
:НК— М- Н
I
И
х>
/СН, н
V
к
Аминный
пролукт
♦ нр
8ег-195 о,
—сн,-с^
V
I
СНК'
/Н
Н18-57
/СН,
У
Промежуточное
тетраэлрическое соединение
:
0 I ,
Мэ снк'
с
сн, о' чон
Азр-102
н
&
,сн, м
н
I
сн2
-СН,-0
н
Ацильный
продукт
о. .снк'
V
I
он
/СН, н
V
I
сн,
I
Рис. 7.35. Схема механизма действия химотрипсина (Овчинников, 1987)
Активация химотрипсина происходит при участии трипсина из
неактивного предшественника химотрипсиногена. Химотрипсин
катализирует реакции гидролиза белков и пептидов, проявляет
специфичность по отношению пептидных связей, образованных
карбоксильными группами остатков тирозина, триптофана, фенилаланина
и метионина. Кроме того, химотрипсин гидролизует сложные эфиры
соответствующих аминокислот. Фермент имеет молекулярную массу
равную 25 кДа, в составе его полипептидной цепи 241 аминокислотный
468
Глава 7. Функциональные системы
остаток. Холофермент состоит из трех полипептидных цепей, которые
связаны между собой дисульфидными мостиками. В активном центре
фермента присутствуют 8ег-195, Н1?-57 и Азр-102, образующие систему
переноса заряда, участвуя в каталитическом процессе. При этом Н18-
57 принимает участие в качестве кислотно-основного катализатора,
а также повышает реакционную способность 5ег-195 как нуклеофила.
Впроцессекатализаосуществляетсяпереноспротонаот5ег-195кН18-57,
с последующей атакой атомом кислорода серина карбонильного
атома углерода субстрата с образованием вначале тетраэдрического
соединения (1), а затем ацилфермента (2). В дальнейшем молекула
воды замещает уходящий аминный продукт (3). Протон от молекулы
воды переносится на ЬП$-57, а ион гидроксила атакуется атомом
карбонильного углерода ацильной группы ацилфермента, образуя
промежуточное тетраэдрическое соединение (4), в образовании которого
участвует 8ег-195. Процесс завершается переносом протона с Н18-57
на атом кислорода Бег-195, в результате освобождается ацильный
продукт, который диффундирует в раствор как показано на рис. 7.35.
При участии пепсина, трипсина и химотрипсина белки
расщепляются до низкомолекулярных пептидов, дипептидов и
аминокислот.
Дальнейшее расщепление низкомолекулярных пептидов и
дипептидов осуществляют пептидазы, которые синтезируются в
поджелудочной железе (карбоксипептидазы) и эпителиальных клетках тонкого
отдела кишечника (аминопептидазы и дипептидазы) в неактивной
форме. В активации пептидаз принимает участие преимущественно
трипсин или химотрипсин. Специфичность действия
карбоксипептидазы определяется тем, что фермент катализирует последовательно
гидролиз концевых пептидных связей со стороны свободной
карбоксильной группы, т. е. с С-конца. Различают карбоксипептидазу А,
в составе полипептидной цепи которой 307 аминокислотных остатков,
с молекулярной массой 34,47 кДа. В активном центре фермента
располагается ион цинка, координирующий с остатком 01и-72, Н15-196, Шз-
69 и молекулой воды. В катализе фермента участвуют остатки Аг^-145,
С1и-270, Туг-248 (рис. 7.36).
Процесс катализа инициируется молекулой воды, которая дони-
рует протон карбоксильной группе О1и-270, а образующийся ион
гидроксила осуществляет нуклеофильную атаку на карбоксильный
углерод гидролизуемой пептидной связи. При этом гидроксильная группа
Туг-248, находящаяся вблизи атома азота расщепляемой пептидной
469
Биохимия животных
связи, донирует протон МН-группе. В результате происходит разрыв
пептидной связи, а образующийся продукт покидает активный центр
фермента (рис. 7.37).
/
Н18-69 .сн>
<^ ын Гидрофобный «карман»
Н18-196
нм-'Ч
он
/СН1 '(7г) Т у> мнч /сн» ян>
Ч_У«. сн, .<{0 ©*:с-мн \
О.и-72 ^о X 1„ Агд-1454
/Сн,—сн, I 7°~\ /СН,_
Й0 <мн»'' Туг"248
^СН,-СН, С|и.270
Рис. 7.36. Строение активного центра карбоксипептидазы А
и ее субстрата (глицилтирозин) (Овчинников, 1987)
Аминопептидазы катализируют реакции последовательного
гидролиза пептидной связи со стороны свободной ЫН2-группы пептида.
Ы-конец Аминокислоты Пептидные связи С-конец
' * III
NН2-0-0-0-0-0-0-0-0-0-0-0-0-0-0-03^-ОЮЮ*0-0-0-0-0-СООН
Аминопёптидаза КарбокСипептидаза
470
Глава 7. Функциональные системы
о*>
х
о
\
00
3
5
X
X
о
<
3
Н
С
С
ев
5
о
се
со
се
и
г*>
471
Биохимия животных
Таким образом, действие амино- и карбоксипептидаз позволяет
расщепить полипептид до аминокислот, тогда как ди- и трипептиды
расщепляются при участии дипептидаз. Последние проявляют
специфичность действия по отношению гидролизуемого субстрата.
Так, например, цистинил-аминопептидаза, пролин-аминопепти-
даза, аргинин-аминопептидаза, аспартат-аминопептидаза, амино-
ацилпролин-аминопептидаза и др.
Кроме того, в составе секрета поджелудочной железы проявляют
активность эластаза и коллагеназа, которые катализируют реакции
гидролиза соответственно эластина и коллагена.
В тонком отделе кишечника активно всасывается глюкоза и
галактоза, в то время как медленно — фруктоза и манноза. Это
свидетельствует о том, что в процессе всасывания преобладает избирательность
по отношению биогенных соединений, обусловленная действием
специализированных транспортных систем.
Под действием а-амилазы поджелудочной железы крахмал
(гликоген) расщепляется до мальтозы. Однако в молекулах амилопектина и
гликогена вточках ветвления существуюта(!->6)-гликозидные связи,
и их гидролиз протекает при участии амило-1,6-глюкозидазы и олиго-
1,6-глюкозидазы.
Дисахариды мальтоза и сахароза гидролизуются в кишечнике под
действием соответственно мальтозы и сахарозы до моносахаридов
(мальтоза — на две молекулы глюкозы, а сахароза — до фруктозы и глюкозы).
В составе секрета поджелудочной железы содержится липаза,
фермент катализирует реакции гидролиза сложноэфирных связей
нейтральных липидов и фосфолипидов. Активность фермента проявляется
только в мицеллярных структурах, в образовании которых участвуют
компоненты желчи. Панкреатическая липаза способна катализировать
реакции последовательного гидролиза триацилглицеринов до диаци-
лглицеринов и моноацилглицеринов. Конечными продуктами
гидролиза являются глицерин и жирные кислоты, которые вместе с моноа-
цилглицеринами входят в состав мицеллярных структур, образованных
из компонентов желчи. Поэтому в механизме всасывания жирных
кислот участвуют желчные кислоты. Сложные комплексы жирных кислот
с желчными кислотами, способны хорошо растворяться в воде, что
способствует их быстрому проникновению в эпителиальные клетки
ворсинок кишечника.
Глицерин хорошо растворим в воде, и поэтому он легко
всасывается в тонком отделе кишечника.
472
Глава 7. Функциональные системы
Фосфолипиды расщепляются в тонком отделе кишечника с
помощью специализированных фосфолипаз, которые
вырабатываются в виде неактивных форм ферментов, однако способны
активироваться трипсином. Специфичность действия фосфолипаз (А|, А2, С
и О) проявляется по отношению локализации гидролизуемых связей
в фосфолипилах.
А1
(^Нг-О-СО-К,
К2-СО-0-СН О Л>
I сн2-о-р-о-х
А2 /ОН
с'
Кроме того, в составе секрета поджелудочной железы
содержатся ферменты, способные катализировать реакции гидролиза
сфинголипидов, гликолипидов и эфиров холестерина,
поступающих с кормом.
Продукты гидролиза липидов после активного всасывания в
кишечнике включаются в состав новых сложных молекул, которые
структурируются в такие образования, как хиломикроны. Кроме того, в клетках
кишечника протекает процесс синтеза триацилглицеринов, которые
составляют основу хиломикронов. Последние аккумулируют
различные липиды, способные к выполнению транспортной функции,
переносу нерастворимых в воде соединений в составе крови в различные
органы и ткани.
В тонком отделе кишечника активно всасываются летучие жирные
кислоты, которые по скорости всасывания можно расположить в
следующем порядке: уксусная, масляная, пропионовая.
Распад нуклеиновых кислот в тонком отделе кишечника
катализируют рибонуклеазы (РНКазы) и дезоксирибонуклеазы (ДНКазы),
которые присутствуют в секрете поджелудочной железы и кишечнике.
Продуктами гидролиза РНКазы и ДНКазы являются олигонуклео-
тиды и нуклеотиды. Последние при участии фосфатаз расщепляются
до нуклеозидов и фосфорной кислоты.
Поступившие в кровь нуклеотиды, нуклеозиды и фосфорная
кислота могут быть использованы для синтеза нуклеиновых кислот
клеток или расщепляются до конечных продуктов обмена.
473
Биохимия животных
7.7.8. Биохимические процессы
в толстом отделе кишечника
В толстом отделе кишечника проявляется активность
микроорганизмов, которые осуществляют дальнейшее расщепление питательных
соединений. Так, углеводы (клетчатка, целлюлоза и др.) подвергаются
гидролизу и сбраживанию, тогда как белки и аминокислоты —
гниению. В результате разложения аминокислот могут образовываться
токсичные продукты, действие которых нейтрализуется в кишечнике
и печени. Причем у травоядных животных (лошадей, КРС, кроликов и
др.) в кишечнике преобладают процессы брожения, а у свиней, собак,
кошек — процессы гниения. В результате распада серосодержащих
аминокислот (цистеин, метионин, цистин) в кишечнике образуются
сероводород (Н28) и метилмеркаптан (СН3-5Н). Реакции декарбок-
силирования аминокислот сопровождаются выделением С02 и
образованием аминов и диаминов. Так, декарбоксилирование аланина,
орнитина и лизина сопровождается образованием соответствующих
аминов: этиламина, путресцина и кадаверина.
СН3 — гн —СООН ► С02 + СН3-СН2-1ЧН2
ЫН2
Алании Этиламин
МН2 — СН2— СН2— СИ — СООН ► СО2 + М2-СН2-СН2-СН2-1ЧН2
ЫН2
Орнитин Путресцин
Н2— СН2— СН2 —СН2— СИ — СООН -» С02 + ЫН2-СН2-СН2-СН2-СН2-ЫН2
МН2 МН2
Лизин Кадаверин
При декарбоксилировании ароматических аминокислот (фенила-
ланина, тирозина, триптофана и гистидина) образуются
соответствующие амины: фенилэтиламин, р-оксифенилэтиламин (тирамин), ин-
долилэтиламин (триптамин) и гистамин.
474
Глава 7. Функциональные системы
О—г-
МН2
СООН
С02
+ ^ ^— сн2—сн2 —
ж2
Фенил алан и н
Фенил этиламин
7
сн2—сн — соон.
мн2
->С02 +
сю
н
сн2
МН2
Триптофан
Триптамин
/^сн'_
нмч^м
Т
МН2
— СООН
С02+ НМ
У Ч СН2—СН2 — МН2
Гистилин
Гистамин
При этом ферменты бактерий способны разрушать ароматические
аминокислоты до токсичных форм. В частности, продуктами
деградации тирозина могут быть крезол и фенол, а триптофана — скатол и
индол.
В низких концентрациях, образующиеся в кишечнике амины и
диамины, при всасывании в кровь способны проявлять сильное
действие на кровеносные сосуды, повышая кровяное давление. Тогда как
высокие концентрации этих соединений могут приводить к
летальному исходу.
Поэтому в клетках животного организма функционирует система
зашиты от этих токсичных соединений в виде аминоксидазы (КФ
1.4.3.4). Фермент катализирует реакции окисления аминов до
соответствующих альдегидов.
К-СН2-1ЧН2 + Н20 + 02 -► К-СНО + 1ЧН3 + Н202
475
Биохимия животных
В активном центре фермента содержится ФАД, с участием
которого протекают реакции окисления первичных, вторичных и
третичных аминов. Крезол, фенол, скатол и индол являются ядовитыми
соединениями, и поэтому их накопление в организме может приводить
к проявлению симптомов отравления. Поэтому в клетках кишечника
и печени эти вещества обезвреживаются путем химического
связывания с остатками серной кислоты или глюкуроновой кислоты,
которые предварительно входили в состав соответственно З'-фосфоа-
денозин-5'-фосфосульфата (ФАФС) и уридиндифосфоглюконовой
кислоты (УДФГК). Причем скатол и индол предварительно
окисляются до скатоксила и индоксила соответственно.
+ Н2<Э + ФАД
СНз +ФАДН2
ОН
Скатол
Скатоксил
+ Н20 + ФАД-
+ ФАДН2
Индол
Индоксил
Обезвреживание фенола, крезола, индоксила и скатоксила
преимущественно происходит в печени. Реакции протекают при участии
арилсульфотрансферазы (1) и УДФ-глюкоронилтрансферазы (2),
которые осуществляют соответственно перенос остатка серной кислоты
с ФАФС и остатка глюкуроновой кислоты с УДФГК на фенол и
крезол (рис. 7.38).
Обезвреженные таким образом токсичные соединения в виде
производных сульфо- и глюкуроновой кислот выводятся с мочей из
организма животного.
Кроме того, бензойная кислота обезвреживается в печени и
почках путем связывания с глицином, в результате образуется гиппуро-
вая кислота.
476
Глава 7. Функциональные системы
мнг
о он
НО—в-О-Р-О-С^ Л
О
НО-Р-О ОН
N4,
СО
он
I 5-
НО —Р—О —СН,
I
он
НО — Р — О ОН
I
ОН
+ О-он — 0-+"
+
3\5'-дифосфо-
аденозин
ФАФС
Фенол
Фенолсерная
кислота
н6 ^^ 6-#—он
но 0
0*0
НО—Р-О-СН^
о ч'
к*
+ но-(3-сн, "Х"» Л-ГУсн, + АДФ
НО ОН
УДФГК
Крезол
он
Крезолглюкуроновая
кислота
Рис. 7.38. Реакции обезвреживания фенола и крезола с помощью ФАФС
УДФГК: / — арилсульфотрансфераза; 2— УДФ-глюкоронилтрансфераза
477
Биохимия животных
7.8. ВЫДЕЛИТЕЛЬНАЯ СИСТЕМА
7.8.1. Строение и функционирование почек
Почки являются внутренним органом животных, выполняющим
фильтрирующую функцию, за счет которой обеспечивается регуляция
водно-электролитного баланса, поддержание кислотно-основного
равновесия, регуляция кровяного давления в организме животных.
Снаружи почки покрыты соединительнотканной капсулой, тогда как
паренхима состоит из периферического коркового вещества и
внутреннего мозгового вещества. В состав последнего входят прямые канальца,
а коркового вещества — почечные тельца, состоящие из клубочка
капилляров и капсулы клубочка, а также извитого канальца (рис. 7.39).
Рис. 7.39. Поперечный разрез почки млекопитающих
Корковое вещество проходит между пирамидами мозгового
вещества, формируя образования — почечные колонки. Канальца,
идущие в корковое вещество, составляют мозговые лучи.
Основными структурными и функциональными единицами
паренхимы почек служат нефроны, число которых в почках около 1...4 млн
(у крыс — 0,062, у собак — 0,816, у свиней — 1,5, у овец — 1,0 млн).
По длине нефроны представлены сегментами, которые
различаются между собой по строению, расположению в органе и
функционально (табл. 7.6). При этом длина нефрона может быть от 1,8
до 5,0 см.
478
Глава 7. Функциональные системы
N0
1
■е-
4>
4>
5
X
О
о
§
е
5
X
О
X *
5 5 Р §
5 Ё X =
я г
*||!
5
93
5^&
у о
о 2
С е-
X Ю
3 2
5 ^
2 X
5
О. 5
2 «
С со
« 5
и с
5" ра
** ° §
ю 5 *
о. н ч
4) 0) 4)
с ю ю
К о п
о 2 *>
9> ° х
Я - *
«л 8 ^
ч? 8 >»
Л " И
2 СО 2
^1§
о 2 о
с:з2
з 5 == 5
§ о 9 х
« ^ О «Л
I ***
X »+, О
х 5 * х
8 9-х
8 &+ 8
2 с* со в
^2 6
: 2 5 &
I 8 ? о
а У о ё
с ? 8 8
4> Й 5 "
О Н х Л
э= о 3 х
И 2 СС Й
5 У °- 5
н о н о.
са и
х о
и Ю
479
Биохимия животных
к
аг
I
о
ОС
с
о.
О- Ю
о Я
О. I I
О <и сп
11 &* »
и X я л о
О- Ю X Ш о
ей х
ой О.
а з
•е- х
5
*
х
со
о.
с
С х
>> ю
п о
я Г.
а • 5
5 о о
1 * ё
3 5 &
со
т
5
ей
х _
Ь в
± п
8 5
& а
5 2
3 о
И
= «
го <и
л со
о. н
. X
А 00
я -
м
„ х
н
о. §
С 1=1
X -г
В 5
о и
х *о
Й О
I
* 1
2 в
л з:
со *
в>
х 3
ь °
ев о
° х
3 I
е §з
г
II
811
III
А
Н
О
ев
Г X О
И!
480
Глава
7. Функциональные системы
Вазопрес-
син
Реабсорбция,
натриевый
насос
Происходит активная реабсорбция
ионов хлора и натрия. Участок
непроницаем для молекул воды.
Осуществляется активное поступление
мочевины
Следует за нисходящей частью
петли Генле. Имеет два участка:
один тонкий, а другой толстый
Восходящая часть
петли
Генле
Альдосте-
рон, ва-
зопрессин,
дезокси-
кортико-
стерон
Секреция,
натриевый
насос
Реабсорбируются ионы натрия и
хлора, но мало проницаем для
молекул воды. Наблюдается пассивная
секреция ионов К+ и Н+. Активное
поступление мочевины
Состоит из прямой и извитой
частей. Прямой каналец имеет
диаметр 35 мкм. Длина канальца
составляет 4,6...5,2 мм и диаметр
20...50 мкм
Дисталь-
ный
каналец
Вазопрес-
син
Реабсорбция
Отмечается активная реабсорбция
ионов натрия и пассивная реабсорбция
молекул воды. Происходит секреция
ионов К и Н . Концентрации ионов
№ , К и мочевины равны соответс-
твенно 130,60 и 300 мМ
Состоит из кубического или
призматического эпителия
Собирательная
трубка
Биохимия животных
Различают два основных типов нефронов: кортикальный и юкста-
медуллярный. Последние располагаются на границе коркового и
мозгового слоев и по размеру они несколько крупнее, чем кортикальные.
Следует отметить, что канальцы нефрона располагаются строго по зонам.
В корковом веществе находятся мальпигиевы клубочки, проксимальные,
дистальные отделы канальца, а также связующие и начальные отделы
собирательных трубок. В мозговом веществе располагаются нисходящие и
восходящие отделы петель Генле и собирательные трубки (рис. 7.40).
а б
Юкстамедулярный нефорн Кортикальный нефорн
Рис. 7.40. Разные типы нефронов
482
Глава 7. Функциональные системы
Сосуды нефрона образуют две ветвящиеся сети. Одна из них
представляет капиллярную сеть мальпигиева клубочка, а другая состоит
из капилляров, оплетающих канальцы. Между нефронами
располагается интерстициальная соединительная ткань. Капилляры, по
которым кровь поступает в мальпигиевы клубочки, называются
приносящие (афферентные) и имеют диаметр больший, чем выносящие
(эфферентные) сосуды. Это позволяет создавать разное кровяное
давление в сосудах, обеспечивая процесс фильтрации крови в мальпигие-
вых клубочках.
Мальпигиев клубочек включает сеть переплетающихся
капилляров, окруженных капсулой Шумлянского-Боумена (рис. 7.41).
Афферентная Эфферентная
артериола артериола
Рис. 7.41. Схема строения мальпигиева клубочка
На границе между корковым и мозговым слоями почек имеются
клубочки, в месте расположения приносящих и выносящих артериол
которых находятся клетки миоэпителиального происхождения,
образующие юкстагломеруллярный комплекс, вырабатывающий ренин,
который накапливается в виде гранул, а затем поступает в ткань почки
или общий кровоток.
483
Биохимия животных
Ренин регулирует реакции синтеза ангиотензина, который влияет
на кровяное давление и реабсорбцию ионов натрия и воды в
почечных канальцах.
Механизм действия ренина обусловлен тем, что он является
термостабильной пептидазой и способен расщеплять сывороточный ан-
гиотензиноген, с образованием декапептида ангиотензина I. В плазме
крови содержится производное фосфатидилсерина, которое служит
сильнейшим ингибитором ренина.
При участии ангиотензин-конвертирующего фермента (ангиотен-
зинконвертаза) от ангиотензина I отщепляется С-концевой дипептид
и образуется ангиотензин II, действие которого проявляется через ан-
гиотензиновые рецепторы клеток. Различают два вида рецепторов:
АТ1 и АТ2. Причем действие ангиотензина на АТ| вызывает реакцию
сосудов и сердца.
Кроме того, ангиотензин II действует на гладкие мышцы
кровеносных сосудов и стимулирует секрецию альдостерона (гормона коры
надпочечников), который регулирует обмен ионов в организме.
При введении в организм ангиотензин II проявляет сильнейшее
сосудосуживающее действие (суживает артериолы), повышая
артериальное давление, участвуя в патогенезе артериальной
гипертонии. При этом происходит увеличение периферического сосудистого
сопротивления, сопровождаемого гипертрофией левого желудочка
сердца.
В регулировании действия ренин-ангиотензиновой системы
принимают участие гладкие мышцы артериол мальпигиевого клубочка,
сокращение которых приводит к сужению эфферентной артериолы,
способствуя высвобождению ренина, тогда как понижение его
содержания наблюдается при расширении артериолы.
Кроме того, на секрецию ренина оказывает влияние
концентрация ионов Ыа+ и СГ в области дистального отдела канальца. При этом
ионы №+ и СГ, не реабсорбирующиеся в восходящем отделе петли
Генле, могут стимулировать секрецию ренина, который в свою
очередь повышает содержание ангиотензина II. Последний изменяет
тонус сосудов афферентной артериолы или увеличивает канальцевую
реабсорбцию 1^а+, понижая, таким образом, потерю ионов натрия и
хлора организмом.
На секрецию ренина оказывают влияние компоненты симпато-ад-
реналовой системы и катехоламины (гормоны мозгового слоя
надпочечников). Так, повышение содержания норадреналина способствует
484
Глава 7. Функциональные системы
возрастанию секреции ренина, тогда как 0-блокаторы полностью ин-
гибируют этот процесс. Это свидетельствует о том, что секреция ренина
не зависит от изменения тонуса сосудов, а обусловлена воздействием
катехоламинов на р-адренорецепторы клеток, продуцирующих ренин.
7.8.2. Механизм образования мочи
Процесс образования мочи можно разделить на два этапа:
фильтрация и реабсорбция. На первом этапе осуществляется фильтрация
крови, поступающей в мальпигиевы клубочки. При этом
фильтруется плазма, а через клубочковый аппарат почки могут проходить
только белки с молекулярной массой меньше 65 кДа, а
образовавшийся при этом фильтрат называется первичной мочей.
Основными элементами фильтрации служат градиент давления,
возникающий в результате разного диаметра канальцев, и
осмотическое давление, обусловленное варьированием концентрации
вещества в фильтрационной жидкости, а также регуляторное действие
гормонов на тонус кровеносных сосудов.
Незначительное количество белка в первичной моче обратно
всасывается в стенки капсулы и в извитом проксимальном канальце. На
процесс фильтрации оказывает влияние давление в почечных
артериях и внутри капсулы. При этом повышение давления в почечных
артериях и понижение давления внутри капсулы способствуют
возрастанию фильтрации, тогда как в случае обратного действия
происходит снижение степени фильтрации.
Фильтрация крови осуществляется через эндотелий капилляров,
базальные мембраны и подоциты. Последние образуют капсулу
клубочка. Эндотелиальные клетки имеют толщину в 30... 100 нм и
пронизаны порами, диаметр которых составляет 50... 100 нм. Через эти поры
проходит основной поток жидкости с низкомолекулярными
веществами, но они не проницаемы для форменных элементов крови.
Базальная мембрана толщиной до 300 нм имеет сетчатую структуру
и образована тонкими фибриллярными нитями. Основной функцией
базальной мембраны является избирательная фильтрация молекул в
зависимости от их размера, формы и заряда. Базальная мембрана
проницаема для молекул размером меньше 3...4 нм и несущих
положительный заряд, так как сама мембрана заряжена отрицательно.
На конечном этапе фильтрации вещества проходят через щелевые
мембраны, образованные отростками подоцитов, ограничивающих
проницаемость белков плазмы крови с высокой молекулярной массой. Эф-
485
Биохимия животных
фективность улырафильтрации определяется разностью между
гидростатическим давления крови и суммой онкотического давления белков
плазмы и гидростатического давлением жидкости в капсуле мальпигие-
вого клубочка.
Химический состав ультрафильтрата практически идентичен
составу плазмы крови, за исключением белков. На процесс фильтрации
оказывают влияние различные биологически активные вещества
(ренин, ангиотензин, простагландины и др.).
На втором этапе происходит реабсорбция компонентов первичной
мочи: белки, аминокислоты, глюкоза, соли и часть воды. Под реаб-
сорбцией понимают процесс обратного всасывания необходимых
организму соединений, путем возвращения их обратно во внеклеточную
жидкость. Этот этап завершается образованием вторичной мочи, в
составе которой содержание сульфатов возрастает в 90, магния — в 40,
мочевой кислоты — в 25, кальция — в 2,4, мочевины — в 70 раз.
Процессу обратного всасывания способствует то, что поверхность
клеток эпителия покрыта микроворсинками, за счет которых
увеличивается всасывающая поверхность канальца. В верхней части
проксимального канальца активно всасываются белки, витамины, глюкоза,
часть воды и 80% ионов №+ и С1-. Практически полностью реабсор-
бируются ионы К*.
В нисходящем канальце петли Генле происходит активная
реабсорбция молекул воды, но в то же время эпителий проницаем для
ионов Ыа+, тогда как в восходящем канальце реабсорбируются ионы №+
и эпителий становится непроницаем для молекул воды.
Процесс реабсорбции различных веществ в канальцах нефрона
регулируется компонентами нервно-эндокринной системы,
которые регулируют тонус сосудов. Так, например, вазопрессин (гормон
нейрогипофиза) усиливает обратный процесс всасывания ионов №+
в клетках толстого восходящего отдела петли Генле и реабсорбцию
воды в д и стальных отделах нефрона, тогда как альдостерон (гормон
коры надпочечников) стимулирует реабсорбцию ионов №+ в дисталь-
ном канальце. Действие гормона может привести к полному
удалению ионов натрия из мочи.
В регуляции транспорта ионов Са2+ и фосфатов принимают
участие паратгормон и тиреокальцитонин.
В клетках почечных канальцев происходит синтез гиппуровой
кислоты из бензойной кислоты и глицина. Особенно много гиппуровой
кислоты содержится в моче травоядных животных.
486
Глава 7. Функциональные системы
В паренхиме почек происходит синтез аммиака, который
образуется в результате реакций дезаминирования аминокислот.
глуггами наза
Глутамин + Н20->Глутаминовая кислота + >Шз
ЫН3 + Н20-> МЬОН- ^Н/ + ОН"
Карбоангидраза клеток канальцев катализирует взаимодействие
углекислого газа с водой. При этом образуется угольная кислота, которая
диссоциирует на ионы Н+ и НСО3-.
карбоангидраза
С02 + Н20 ►Н2С03^=±Н+ + НСОз"
Клетки почечных канальцев способны к секреции неорганических
и органических соединений.
В извитой части проксимального канальца происходит секреция
органических оснований, а в его прямой части — органических кислот,
тогда как в дистальном канальце и собирательной трубке,
осуществляется секреция ионов К+ и Н+. В процессе секреции участвует
переносчик, который располагается в мембране и способен избирательно
связывать соединение, а затем после переноса его через мембрану,
высвободить в цитоплазму. В дальнейшем за счет пассивного транспорта
соединение переносится через апикальную мембрану в просвет
канальца. В работе переносчика затрачивается энергия АТФ. Причем
в механизме секреции органических кислот и оснований
преимущественно участвуют специализированные переносчики.
Так, секреция ионов К+ и обмен их на ионы №+ осуществляется
с помощью №+,К+-АТФазы, а ионов водорода и Са2+ соответственно
Н+- и Са2+-АТФазы.
Эпителий собирательных трубок обладает избирательной
проницаемостью и практически непроницаем для ионов натрия, но активно
проницаем для молекул воды и регулируется гормоном вазопресси-
ном. При отсутствии гормона эпителий становится непроницаем для
молекул воды, что сопровождается образованием сильно разбавленной
мочи. Гормон обладает регуляторным действием на аденилатциклазу,
регулируя образование цАМФ. Последняя способна влиять на прони-
487
Биохимия животных
цаемость эпителия по отношению молекул воды, повышая их
проницаемость. Кроме того, регуляторным действием на проницаемость
ионов натрия и воды обладают простагландины, которые вырабатываются
в почках. Возрастание содержания простагландинов способствует
увеличению выделения ионов натрия с мочей и повышению диуреза.
7.8.3. Химический состав мочи
Моча сельскохозяйственных животных является раствором, в
составе которого 93...95% воды и 5...7% минеральных и органических
соединений.
В составе мочи присутствуют ионы Ыа+, К+, М§2+, Мп2+, С1",
Р043~, 5042", НР042", НС03 , Н2Р04~ и др. В зависимости от состава
корма, возраста, физической нагрузки рН мочи животных может
принимать различные значения. Так, моча травоядных животных, в
частности, лошади имеет рН 7,1...8,7, КРС — 7,7...8,7, козы — 8,0...8,5, а у
плотоядных — 5,7...7,0, у свиньи — 6,5...7,8. При физической нагрузке
моча животных становится более кислой, в связи с накоплением в
организме С02 и молочной кислоты.
Плотность мочи может колебаться от 1,018 до 1,040, в зависимости
от поступления в организм животного жидкости. Избыточное
потребление жидкости понижает плотность мочи, тогда как понижение
потребления способствует ее возрастанию. Ежесуточно из крови в неф-
роны фильтруется около 180 л жидкости. Однако в среднем за сутки
у лошади выделяется мочи 3,0...5,5, у КРС — 6... 12, у овец — 1,0...1,5,
у свиней 2...4, у собак — 0,5... 1,0, у кролика — 0,04...0,1 л.
К основным органическим соединениям мочи можно отнести:
мочевину, мочевую кислоту, аденин, гуанин, ксантин, гипоксантин,
креатин, креатинин, гиппуровую кислоту, индол, скатол, фенол, крезол,
урохром, уробилин, витамины, лекарственные средства и др.
Желтую окраску мочи придает урохром, который служит
конечным продуктом распада гема и по строению очень близок уробилину.
Красноватая окраска мочи может быть обусловлена присутствием
уроэритрина. При малых концентрациях уроэритрина моча имеет
розовый цвет, а при высоких — огненно-красный.
При интенсивном распаде гемоглобина в моче повышается
содержание уробилина.
Одним из продуктов белкового обмена, содержание которого в моче
коррелирует с количеством белков в норме служит мочевина. За сутки
с мочей может выделиться мочевины у лошадей 75... 150, у КРС—60... 100,
488
Глава 7. Функциональные системы
у собак — 3...10 г. Содержание мочевины в моче может повышаться при
гиперфункции щитовидной железы, надпочечников, гипофиза,
лихорадочных состояниях, а понижается при церрозе и жировом перерождении
печени, при отравлении некоторыми ядами, при приеме богатого
углеводами корма.
К низкомолекулярным азотсодержащим соединениям относятся
аминокислоты, среди которых в моче больше всего присутствуют глу-
таминовая кислота, глутамин, гистидин и аспарагиновая кислота. За
сутки с мочей животных (КРС, лошади, свиньи) может выделиться до
1 г аминокислот. Причем 30% всех аминокислот составляют глутамин
и глутаминовая кислота.
В виде аммонийных солей в моче животных содержится аммиак.
У лошадей за сутки с мочей выделяется аммиака до 0,40, у КРС — 0,6,
у овец — 0,22, у собак — 0,44 г.
Продуктом окисления пуриновых оснований служит мочевая
кислота, которая накапливается в моче в виде калиевых и натриевых
солей (уратов).
Содержание гиппуровой кислоты в суточной моче лошади
достигает 160, КРС — 150, овцы — 30 г.
В механизмах мышечного сокращения принимает участие креатин-
фосфат, продуктом гидролиза которого является креатинин. В моче
животных может содержаться креатинина у лошадей до 0,32, КРС —
0,80, у свиней - 0,88, у собак — 0,77 мМ.
Кроме того, в моче животных содержатся щавелевая (НООС-
СООН), янтарная (НООС-СН2-СН2-СООН), уксусная (СН3-СООН),
пропионовая (СН3-СН2-СООН), валериановая (СН3-(СН2)3-СООН)
кислоты. Щавелевая кислота содержится в моче в виде кальциевых
солей, способных образовывать кристаллы, которые составляют
основу мочевых камней.
Анализ мочи может свидетельствовать об интенсивности процессов
разложения в толстом отделе кишечника. В частности, такая оценка
дается по содержанию в моче индоксилсерной, индоксилглюкуроновой
кислот, которые образуются из индола и являются продуктами
расщепления триптофана. Продукты расщепления ароматических
аминокислот присутствуют в моче в составе фенолсульфатов.
Фосфор в моче содержится в составе солей натрия (№2НР04 и
ЫаН2Р04).
Сера в составе серосодержащих аминокислот (цистеина, цистина
и метионина) и сульфатов.
489
Биохимия животных
7.8.4. Функции почек
В организме животных почки выполняют роль биологических
фильтров, пропуская через себя всю кровь, осуществляют ее фильтрацию,
отделяя при этом продукты распада (мочевина, мочевая кислота, креа-
тинин и др.) от функционально активных молекул (белки, глюкоза,
витамины, аминокислоты, ионы натрия, калия, хлора и др.) и
форменных элементов.
Почки способны регулировать общий объем жидкости в организме,
выводя избыток воды из организма, регулируют состав крови и
одновременно состав всех жидкостей организма животных,
способствуют выведению токсичных соединений и понижают
концентрацию функционально активных веществ, осуществляют поддержание
постоянства состава крови, межклеточной жидкости, осмотического
давления и рН крови.
Кроме того, почки поддерживают баланс ионов №+, К+, М§2+,
Мп2+, СГ и других соединений в организме животного. В почках
разрушаются некоторые гормоны и белки. Почки участвуют в регуляции
кислотно-основного гомеостаза организма, синтезируют некоторые
фосфолипиды, осуществляют синтез биологически активных веществ,
регулирующих артериальное давление в организме животных. Почки
участвуют в обмене Са2+ и эритропоэзе. Обладают эндокринной
функцией, осуществляемой системой ренин-ангиотензин, регулирующей
функцию почек и систему кровообращения.
7.9. СИСТЕМА МОЛОЧНОЙ ПРОДУКТИВНОСТИ
Молоко — это биологическая жидкость, вырабатываемая в
молочной железе, содержащая все компоненты (витамины, белки, липиды,
углеводы, макро-, микроэлементы и другие соединения),
необходимые для активного роста детенышей в постэмбриональный период.
Качество и количество молока зависит от вида и породы животного,
возраста, стадии лактации, условий кормления и содержания,
состояния здоровья.
Состав молока во многом определяется рационом кормления
животных, в котором в основном используются растения (рис. 7.42).
Поэтому в молоке могут присутствовать различные вещества,
синтезирующиеся в растениях и поступающие в организм животного с кормом.
Кроме того, в составе молока присутствуют биогенные молекулы,
синтез которых происходит в различных органах и тканях животных,
490
Глава 7. Функциональные системы
откуда они поступают в кровь, которая переносит их в клетки
молочной железы. Однако основным местом синтеза специализированных
биогенных молекул является молочная железа. Среди биогенных
молекул, содержащихся в молоке, следует выделить следующие:
аминокислоты, пептиды, белки (простые и сложные), азотистые
основания (аденин, гуанин, цитозин, тимин, урацил), нуклеиновые кислоты
(РНК и ДНК), углеводы (моно-, олиго- и полисахариды), липиды
(жирные кислоты, нейтральные липиды, фосфолипиды, сфинголи-
пиды, стероиды), витамины, гормоны, биологически активные
вещества. Причем составными частями молока является плазма и бел-
ково-липидные комплексы (рис. 7.43).
Вил, стадия
вегетации, условия и
местопроизрастания
и хранения, время
года
Пол. возраст, порода,
стадии лактации
.р
Растения
1
Химический
состав
1
г
Животные
1
Рацион
кормления
г
Метаболические
процессы
Условия
содержания
I
Молочная железа
^
г
Молоко
Химический
состав
Продукты
Рис. 7.42. Взаимосвязь факторов, влияющих
на химический состав молока животных
491
Биохимия животных
молоко
Плазма
Белково-липидные
комплексы
Вода,
сывороточные белки
(альбумины),
ферменты,
иммуноглобулины,
витамины,
аминокислоты,
пептиды,
гормоны,
лактоза,
фосфат кальция,
элементы
и др.
Жировые
шарики
2
Поверхностная
оболочка
5*
Липидное
ядро
Компоненты
плазмалеммы
Жирные кислоты
(насыщенные и
ненасыщенные),
нейтральные липнды
(моно-, ди-,
триацилглицериды),
сфингапипиды
(сфингомиелин),
фосфолипиды
(фосфатидихолин,
фосфатидилэтаноламин,
фосфатидилсерин,
фосфатидилинозит),
стероиды (холестерин,
эфиры холестерина,
кортикостероиды),
белки,
витамины,
углеводы (галактоза,
глюкоза,
Ы-ацетилгалактозамин,
М-ацетилглюкозамин,
сиаловые кислоты) и др.
Мицеллы
казеина
а.1 - Казеин,
а*2 - казеин,
р- казеин,
X - казеин,
кальций,
неорганический
фосфор,
магнии,
цитрат.
Рис. 7.43. Основные составные части молока КРС
Основными соединениями, которые синтезируются только в
клетках молочной железы, являются казеины, Р-лактоглобулин, а-лакталь-
бумин и лактоза, тогда как синтезируемые в лактоцитах липнды
отличаются по составу от липидов плазмы крови и тканей животного.
Таким образом, биосинтез основных составных частей молока
происходит в лактоцитах — специализированных клетках молочной
железы. При этом субстраты и метаболиты для синтеза биогенных мо-
492
Глава 7. Функциональные системы
лекул в лактоцитах поступают из крови в виде низкомолекулярных
соединений (аминокислоты, жирные кислоты, глюкоза, витамины, элементы
и др.), количественный и качественный состав которых определяет
молочную продуктивность животного.
7.9.1. Строение и функционирование молочной железы
Молочная железа — сложный по морфологии и функции орган,
секретирующий молоко. Качественный и количественный состав
молока определяется функционированием у животных следующих
систем: пищеварения, кровеносной, нервной, эндокринной и др.
У разных животных строение молочных желез одинаково. При этом
различия наблюдаются только в размерах (объеме и форме), а также
в количестве холмов и сосков на вымени, выработке разного по
химическому составу молока.
Вымя коровы — непарный орган; оно образовано за счет
слияния трех пар холмов. Снаружи вымя коровы покрыто нежной,
тонкой эластичной кожей с редким шерстным покровом. Это позволяет
молочной железе при накоплении большого количества молока
увеличиваться в объеме на 1/3 первоначальной величины. Молочная
железа состоит из железистой и соединительной ткани, а по
происхождению она относится к кожным железам.
Паренхима железы состоит из системы разветвленных выводных
протоков, концевых секреторных отделов и соединительной ткани,
богатой жировыми клетками (рис. 7.44). Многочисленные мелкие
(0,1...0,8 мм) альвеолы, выстланы однослойным секреторным
эпителием. В междольковой соединительной ткани проходят
кровеносные капилляры, лимфатические сосуды, нервы и междольковые
выводные протоки, заканчивающиеся в паренхиме долек концевыми
железистыми отделами альвеолярной или трубчатой формы. Клетки
наружного слоя альвеол и молочных протоков звездчатой формы и
способны быстро сокращаться под действием гормона окситоцина,
вырабатываемого в гипофизе и поступающего в молочную железу по
кровеносным капиллярам. Каждая альвеола выделяет молоко в
соответствующий проток. Сливаясь, они образуют средние и крупные
молочные протоки, открывающиеся в молочную цистерну. Из цистерны
молоко поступает в сосковый канал. Соединительная ткань соска
содержит гладкие мышечные клетки, формирующие четыре слоя.
Продольный, хорошо развитый в области молочной цистерны;
кольцевой, представленный кольцевой мышцей, образующей на вершине
493
Биохимия животных
соскового канала сфинктер, препятствующий вытеканию молока;
слой мышечных клеток переплетающихся между собой; радиальные
пучки клеток.
Рис. 7.44. Схема строения дольки молочной железы и этапы формирования
жировых шариков: 1 — молочный ход; 2— внутридольковый проток;
3 — секреция жировых шариков; 4— эпителиальные клетки; 5 — нервное
волокно; б— капилляр; 7— лактоцит [Александровская и др., 1987]
Молочная железа активно функционирует только в
лактационные периоды, длящиеся у разных животных от нескольких недель
до десяти месяцев и больше. Так, период лактации у КРС
продолжается 290...300 дней. В период лактации в молочной железе
протекают процессы, обеспечивающие синтез основных компонентов
молока, а затем формирование и выведение молока из молочных желез
непрерывно (рис. 7.44). В период лактации секреторные клетки же-
494
Глава 7. Функциональные системы
лезы приобретают кубическую или призматическую форму,
апикальная поверхность которых неровная за счет микроворсинок.
Цитоплазма клеток содержит гладкую и гранулярную эндоплазматическую
сеть, аппарат Гольджи, микротрубочки и микрофибриллы. В период
секреции на свободной поверхности клеток образуются скопления
липидов в виде жировых капель различной величины,
концентрирование которых в периферийной части лактоцита приводит к
формированию куполообразных выпячиваний, покрытых снаружи плазма-
леммой. Окончание созревания жирового шарика заканчивается его
отрывом в полость альвеол. В альвеолы секретируются и другие
соединения, являющиеся составными частями молока.
Молочная железа поглощает из крови глюкозу, аминокислоты,
неорганические вещества, альбумин сыворотки крови, ферменты,
пептиды, витамины, гормоны, нейтральные липиды, фосфолипиды,
стероиды, высшие жирные кислоты, ацетоуксусную кислоту, р-окси-
масляную кислоту, летучие жирные кислоты и вырабатывает
составные части молока — лактозу, казеины, р-лактальбумин, а-лактогло-
булин, лактоферрин, молочный жир. Для секреции 1 л молока через
молочную железу должно пройти от 400 до 500 л крови.
7.9.2. Химический состав молока
Молоко КРС представляет собой белую с желтоватым оттенком
непрозрачную жидкость сладковатого вкуса и своеобразного запаха.
Цельное молоко можно разделить на молочную плазму и белково-ли-
пидные комплексы (рис. 7.43). Последние представлены в молоке
небольшими частицами, называемыми молочными или жировыми
шариками. Размеры жировых шариков могут колебаться в пределах от
0,5 до 18 мкм (в среднем достигая 3 мкм). Молочная плазма —
многокомпонентная система, содержащая разной степени дисперсности
органические и минеральные вещества.
Химический состав молока животных очень сложный. В молоке
содержатся аминокислоты, белки, углеводы, липиды, фосфатиды,
стероиды, витамины, ферменты, соли, газы, вода, кальций.
Коровье молоко содержит 83...88% воды, 12... 17% сухого вещества,
в которое входит 3,8...6,0% липидов, 2,7...3,7% белков (2,2...2,9%
казеина), 2...5% азотистых оснований, 4...5% молочного сахара
(лактоза), 0,6...0,8% минеральных веществ, 0,1...0,2% лимонной кислоты
(табл. 7.7). Наиболее богато белково-липидными компонентами
молоко северного оленя, в котором поданным Подкорытова содержится
495
Биохимия животных
64% воды, 36% сухого вещества (19% липидов, 11% белков (8,7%
казеина), 1,5...2,0 азотистых оснований). Таким образом, молоко
северного оленя превосходит коровье по содержанию липидов в 3...5 раз,
белка в 3...4 раза. По консистенции молоко оленя близко к сливкам
коровьего молока. Однако уступает по количеству надоенного
молока, так как за 7...11 месяцев лактации общий объем надоенного
молока у подсосных важенок составляет всего 45...84 кг [Подкорытов,
1995]. При этом оленье молоко можно использовать для
производства молочных продуктов по технологиям принципиально не
отличающимся от общепринятых в молочном деле.
Таблица 7.7
Основной химический состав коровьего молока
Компоненты молока
1 Вода
Сухое вещество
СОМО
Липиды
1триацилглицерины
фософолипиды
1 стерины
1 Азотистые вещества
Белки
Казенны
а5|-казеин
а52-казеин
Р-казеин
1 х-казеин
1 р-Лактоглобулин
| а-Лактальбумин
Иммуноглобулины
А
М
С
Содержание, %
83Д..88.0
12.0...17.0
8,0... 10,0
2.9...7.0
2.5...4.0
0.03...0.05
0,012...0,013
2,5...4,0
2,7...3,6
2.1...2.8
1.3...1.8
0,3...0,5
0.7...1.1
0,15...0,25
0,2...0,4
0,07...0,2
1.2...2.5
0,05...0,15
0,1...0,2
0.3..Д6
Элементный
[ состав молока
Макроэлементы, мг %
! Са2+
а-
р+5
Ыа+
М&2>
Микроэлементы, мкг %
2п2+
Ре3+
А13+
Р
■ в+3
8п2+
Вг
Си2+
Мп2+
Мо2+
Содержание
148
122
ПО
92
60
13
400
200
70
30
18
18
15
15
12
6
5
496
Глава 7. Функциональные системы
Окончание таблицы 7.7
Небелковые
азотистые
1 соединения
Углеводы:
лактоза
глюкоза
| галактоза
Соли:
органических
кислот
неорганических
| кислот
0,02...0,08
4,5...5,0
0,01...0,1
0,2
0,1 .0,5
0,5...0,8
РЫ*
Г
| А53+
8е2+
Сг3*
VI "2+
N1
н82+
Со2+
5
4
4
4
2
2
1
0,3
0,08
Вода молока может находиться в свободном состоянии или в
составе мицелл. Полярность воды обеспечивает формирование
стабильных мицелл, в составе которых различные липиды расположены во
внутренней части, а по периферии локализуются белки и углеводы.
Кальций, присутствующий в молоке, образует связи с белками,
придавая молоку свойства коллоида. Различают молоко парное, цельное
и питьевое.
Парное молоко получается сразу после доения коров. Оно имеет
температуру близкую к температуре тела животного. Однако при
стоянии температура молока понижается, и на его поверхность
всплывают жировые шарики размером до 1,5 мкм, образуя слой сливок.
Жировые шарики с большим диаметром могут формировать отстой жира.
Такое молоко называют цельное.
Питьевое молоко получают путем гомогенизации цельного
молока, которое сопровождается раздроблением жировых шариков
молока, а также увеличением дисперсности белковых частиц.
Гомогенизацию молока проводят с целью улучшения его внешнего вида и
вкуса, а также повышения консистенции и снижения расходов сырья.
В гомогенизированном молоке не происходит агрегирования
жировых шариков, так как механизм агрегации обусловлен
возникновением слабых межмолекулярных взаимодействий между
аминокислотными остатками поверхностных белков жировых шариков, которые
при гомогенизации молока разрушаются.
497
Биохимия животных
После удаления из молока воды и липидов образуется сухой
обезжиренный молочный остаток (СОМО), который используется как
показатель качества молока. По госстандарту СОМО из молока КРС
должно быть не менее 8,0%. Для примера СОМО из молока северного
оленя равно 16%.
7.9.2.1. Основные белки молока
К основным белкам молока относят четыре электрофоретически
разделимые фракции казеинов, сывороточные белки (Р-лактогло-
булин, а-лактальбумин), альбумин сыворотки крови,
иммуноглобулины, Р-микроглобулин, лактоферрин, церулоплазмин. Казеина
содержится в молоке около 80% от общего количества белка, тогда как
Р-лактоглобулина — 7... 12%, а-лактальбумина — 2...5%,
сывороточного альбумина — 0,8... 1,4%.
Казеин. Казеин по структуре является фосфопротеидом, обладает
способностью к самопроизвольному формированию мицелл в
присутствии ионов кальция, цитратов и фосфатов. Известны четыре типа
казеина: Ол-, СЦ2-, Р-, х~казеин, которые присутствуют в молоке в
количестве соответственно 38,10,39 и 13% от суммарного количества казеинов.
Казенны отличаются между собой по молекулярной массе, количеству
фосфорной кислоты в них, а х-казеин еще и содержанием углеводов,
представленных глюкозамином и сиаловыми кислотами.
В молоке около 95% казеина образуют мицеллы глобулярной
формы, размер которых составляет 150...200 нм, и только 5% казеина
находится в виде мономерных форм, полимеров фракций казеина и
субмицелл. Каждая мицелла содержит в себе все виды казеина и
состоит из 7000...8000 полипептидных цепей, соединенных между собой
ионами Са2+. На периферии мицелл расположен х-казеин,
выполняющий роль защитного коллоида.
Особое внимание следует уделить строению х-казеина. Этот
белок состоит из нескольких компонентов, главный из которых не
содержит углеводы, тогда как в структуре других компонентов
содержатся олигосахариды. Сложность формирования вторичной
структуры х-казеина обусловлена наличием у него 32% а-спирали,
31% параллельной и 24% антипараллельной Р-структуры. Причем
спирализация полипептидной цепи х-казеина происходит вблизи
участка связывания химозина.
Фермент реннин (сычужный фермент), который добавляется к
молоку при изготовлении сыров, отщепляет от х-казеина гликопептид,
498
Глава 7. Функциональные системы
после чего нарушается структура мицелл и происходит
створаживание молока. Причиной створаживания является то, что х-казеин,
потеряв под действием фермента гидрофильный гликопротеид, образует
нерастворимые соли с ионами Са2* даже в нейтральной среде, чего не
происходит при нативном состоянии белка в молоке. Тогда как
растворимые а&г, а$2- и р-казеины подвергаются гидролитическому
расщеплению под действием плазмина молока.
Казеин характеризуется высокой биологической ценностью
благодаря содержанию в его составе полного набора аминокислот. В
казеине содержится от 0,1 до 1% фосфора, связанного сложноэфирной
связью с остатками серина, входящими в молекулу белка. С казеином
соединен кальций. Все это обусловливает высокие питательные
качества казеина для человека.
Синтез казеина осуществляется в молочной железе из
доставляемых в нее кровью аминокислот и фосфатов. Для этой же цели в
железе используются и сывороточные альбумины, которые вначале
гидролизуются до аминокислот, а потом вовлекаются в процессы
биосинтеза белка.
Р-Лактоглобулин. После осаждения казеина (при подкислении
молока или под действием реннина) остается сыворотка,
содержащая набор белков, среди которых содержится р-лактоглобулин. Он
относится к группе альбуминов, так как способен растворяться в
растворе (N144)2804 и характеризуется высоким содержанием 8Н-групп.
Р-Лактоглобулин состоит из двух полипептидных цепей с
молекулярной массой 18,3 кДа, которые при температуре выше 30°С способны
распадаться на мономерные формы. Дальнейшее нагревание
приводит к агрегации субъединиц, соединенных между собой дисульфид-
ными связями. В целом р-лактоглобулин имеет две дисульфидыые
связи между остатками цистеина в положении 66 и 160, 106 и 119,
и одну свободную сульфгидрильную группу в положении 121. При
нагревании молока до 70°С и выше часть сульфгидрильных групп
отщепляется в виде сероводорода, что придает кипяченному молоку
специфический запах. Нагревание молока также сопровождается
изменением пространственной структуры сывороточных белков,
в результате чего возникают дополнительные дисульфидные связи,
при этом молекулы белка денатурируют. р-Лактоглобулин придает
молоку определенные физико-химические свойства. Так, в
денатурированном состоянии этот белок адсорбируется на мицеллах
казеина, предохраняя молоко от свертывания при сгущении. В денатури-
499
Биохимия животных
рованном состоянии р-лактоглобулин препятствует створаживанию
молока, поэтому молоко, предназначенное для получения творога,
нельзя перегревать.
а-Лактальбумин. Белок относится к гликопротеидам, состоит из
одной полипептидной цепи с молекулярной массой 16,5 кДа и изо-
электрической точкой 5,1. Входит совместно с галактозилтрансфе-
разой в состав лактозосинтазы. В стабилизации третичной
структуры белковой молекулы а-лактальбумина принимают участие ионы
кальция, поэтому а-лактальбумин денатурирует только при
температурах выше 65°С
7.9.2.2. Основные ферменты молока
В молоке присутствуют ферменты: пероксидаза, каталаза, липаза,
щелочная фосфатаза, ксантиноксидаза и др.
Липаза (КФ 3.1.1.3) относится к классу гидролаз, катализирует
реакции гидролиза сложноэфирных связей, расщепляя триацилглице-
рины на глицерин и жирные кислоты.
рн2-о~со-я, <рн2-он я,-соон
рн-о~со-я2 + зн2о -> 9Н-°Н + я2-соон
СН2-0~СО-Я3 СН2-ОН Кз-СООН
триац ил глицерин глицерин жирные кислоты
Липаза обнаружена в молоке. Высокое содержание липазы
наблюдается в зимнем молоке, по сравнению с летним. Отмечается
возрастание активности липазы к концу лактации, что сказывается на
качестве молока (прогорклое молоко). Липаза может адсорбироваться
на поверхности жировых шариков, вызывая порчу масла,
подвергшегося плесневению. Под действием липаз сыры, созревающие при
участии плесени, приобретают специфичный вкус.
Щелочная фосфатаза (КФ 3.1.3.1) катализирует в щелочной
среде реакции гидролиза ортофосфорных эфиров, имеет
молекулярную массу равную ПО кДа. В действии фермента проявляются
свойства гидролазы, при отщеплении фосфата от субстрата и транс-
феразы, когда осуществляется перенос фосфата на молекулу
акцептора (глюкоза):
500
Глава 7. Функциональные системы
О" О"
1) К-0~Р=0 + Н20 -> К-ОН + НО-РО
6" О"
2" ?~
2) НО-РО + К'-ОН -» К'-0-Р=0 + Н20
О" 6"
Максимальная активность фермента проявляется при рН 9,0... 10,0.
Высокое содержание фермента отмечено в лактирующей молочной
железе. По своей природе щелочная фосфатаза относится к
мембранным ферментам и поэтому участвует в механизмах переноса фосфора
через клеточные мембраны, являясь компонентом системы активного
транспорта. Кроме того, фермент принимает активное участие в
процессах кальцификации костной ткани, поэтому его много в сыворотке
крови, откуда щелочная фосфатаза поступает при активном
кровоснабжении в молочную железу.
Активаторами фермента являются ионы М§2\ Мп2+ и Со2+, тогда
как активность фермента ингибируется ионами 2п2*, Си2+ Нб2\ Кроме
того, ингибиторами фермента могут быть желчные кислоты,
аминокислоты (аланин, гистидин и лизин), мочевина.
Ферменты попадают в молоко из крови или являются составными
частями отторгающихся клеток секреторного эпителия, поэтому
высокая активность щелочной фосфатазы в молоке может
свидетельствовать о заболеваниях печени и костной системы. Щелочная
фосфатаза в молоке может быть и микробного происхождения. Поэтому
высокая активность фермента может свидетельствовать о низком
санитарном качестве молока.
Ксантиноксндаза (КФ 1.2.3.2) относится к молибденсодержащим
ферментам. Фермент молока имеет молекулярную массу 275 кДа,
содержит по 2 атома Мо, 2 молекулы ФАД и 8 атомов Ре на каждой
молекуле белка. Ксантиноксндаза катализирует реакции оксидазного
окисления ксантина до мочевой кислоты. Субстратами фермента
могут быть альдегиды, которые окисляются до карбоновых кислот. В
молоке отмечается высокая активность фермента.
а-Амилаза (КФ 3.2.1.1) является специализированным
ферментом, который катализирует реакции гидролиза а-1,4-гликозидных
связей полисахаридов. Продуктами реакции могут быть мальтоза и
501
Биохимия животных
мальтотриоза. Молекулярная масса фермента 48 кДа. Активность
фермента возрастает в присутствии ионов хлора. Оптимум
каталитической активности а-амилазы приходится на диапазон рН 6,5...7,5.
В составе фермента один ион кальция, который участвует в
стабилизации белковой глобулы фермента.
7.9.2.3. Углеводы молока
Основным углеводом молока является дисахарид лактоза, или
молочный сахар, которого содержится 4,5...5,0%. Кроме того, в молоке
может быть до 0,02% галактозы и 0,01 ...0,1 % глюкозы. В составе
лактозы молекулы а-Э-глюкозы и Р-Э-галактозы связаны между собой
1,4-р-гликозидной связью.
В незначительных количествах в молоке присутствуют и другие оли-
госахариды: трисахариды, тетрасахариды, пентасахариды, гексасаха-
ридыидр.
Лактоза является основным углеводом молока и больше нигде не
обнаружена. Поэтому основным местом ее синтеза лактозы являются
лактоциты — клетки молочной железы. Лактоза относится к группе
дисахаридов, основным местом синтеза служат структуры аппарата
Гольджи. Лимитирующей стадией процесса синтеза лактозы является
образование лактозосинтазы. Компонентом фермента служит а-лак-
тальбумин, синтез которого происходит на мембранах гранулярного
эндоплазматического ретикулума. После этого а-лактальбумин
переносится в аппарат Гольджи, где образует комплекс с галактозилтранс-
феразой. Образовавшаяся в результате лактозосинтаза завершает
процесс синтеза лактозы, которая поступает в просвет альвеол в составе
белковых комплексов.
Синтез лактозы осуществляется путем превращения Э-гликозиль-
ного остатка в О-галакторильный остаток с участием пяти цитоплазма-
тических ферментов (гексокиназа, фосфоглюкомутаза, глюкозо-1-фос-
фатуридилилтрансфераза, УДФ-глюкозоэпимераза, лактозосинтаза)
(рис. 7.45).
На первой стадии гексокиназа (1) катализирует реакции фос-
форилирования глюкозы до глюкозо-6-фосфат. Далее глюкоза-6-
фосфат при участии фосфоглкжомутазы (2) превращается в глю-
козо-1-фосфат. Затем глюкозо-1-фосфат взаимодействует с УТФ,
с образованием уридиндифосфатглюкозы и пирофосфата. Реакцию
катализирует глюкозо-1-фосфатуридилилтрансфераза (УДФГ-пи-
рофосфорилаза) (3).
502
Глава 7. Функциональные системы
сн2он
Кон |у\ 7Т"
ШР1 р АТФ *"*
Н2С—О-®
СН2ОН
1 он
I он 'он
3®
СНгОН
УТФ-
СН2ОН
А О^ О-УДФ илш, наг , >/1~°\. О—УДФ
I пи
он
СН2ОН
окЛ——о о—удф
' ОН
СН2ОН
ОН>| [Г ОН
он
сн2он сн2он
I он 'он
Рис. 7.45. Процесс синтеза лактозы: / — гексокиназа;
2— фосфоглюкомутаза; 3— глюкозо-1-фосфатуридилтрансфераза;
4 — УДФ-глюкозоэпимераза; 5 —лактозосинтаза
Затем УДФ-глюкоза эпимеризуется в УДФ-галактозу УДФ-глюко-
зоэпимеразой (4), причем реакция протекает в две стадии с участием
НАД+.
503
Биохимия животных
УД Ф-глюкоза + НАД* -> УДФ-4-кетоглюкоза + НДД+
УДФ-4-кетоглюкоза + НАДН -> УДФ-галактоза + НАД+
При участии лактозосинтазы (5) осуществляется присоединение
глюкозы к УДФ-галактозе, в результате образуется лактоза.
7.9.2.4. Кальций и механизмы его транспорта
Са2+ в организме животных необходим для формирования костной
ткани, проведения нервного импульса, он активирует VIII фактор
свертываемости крови, участвует в мышечном сокращении, стабилизирует
белки. Содержание кальция в молоке составляет 114...130 мг%. Около
20% всего количества ионов кальция принимают участие в
формировании мицелл казеина. Остальная часть ионов кальция находится
в растворе в виде солей фосфорной и лимонной кислот.
Основное количество Са2+ поступает в организм животного в виде
солей фосфорной кислоты. Наиболее растворимыми среди них
являются: Са3(Р04)2, СаНР04, Са(Н2Р04)2.
Всасывание ионов Са2* происходит главным образом в
проксимальных участках тонкого отдела кишечника. Причем наиболее
активно процесс всасывания кальция наблюдается у растущего
организма, а также при беременности и лактации.
На процесс всасывания кальция оказывает влияние присутствие
витамина Э. Активной формой витамина О служит 1,25-диоксихо-
лекальцеферол, образование которого происходит в печени и
почках путем последовательного гидроксилирования. Превращение хо-
лекальциферола происходит в печени при участии НАДН-зависимых
ферментов и кислорода в митохондриях в 25-оксихолекальциферол,
дальнейшее гидроксилирование которого в почках приводит к
образованию 1,25-диоксихолекальциферола.
1,25-Диоксихолекальциферол стимулирует образование в стенке
кишечника специфичного Са2+-связывающего белка, который совместно
с Са2+-зависимой АТФазой участвует в переносе иона через
полупроницаемые мембраны. Часть кальция, проникшего в кровь, переносится
по кровеносным сосудам в составе альбумина. Причем количество Са2*",
связанного с белками, может увеличиваться с возрастанием рН.
Местом локализации ионов кальция является костная ткань, куда
Са2+ может откладываться и откуда может извлекаться. Контроль за
содержанием кальция в крови поддерживается с помощью двух гор-
504
Глава 7. Функциональные системы
монов — паратгормона и кальцитонина. В норме кальций выводится
из организма через кишечный тракт. Главным переносчиком ионов
Са2+ служат компоненты желчи.
Холестерин
но'
Холекалышферол
1,25-Диоксихолекальциферол
25-Оксихолекальцифсрол
7.9.2.5. Мицеллы казеина
Мицеллы казеина являются ассоциированными образованиями,
формирование которых протекает в вакуолях аппарата Гольджи.
Процесс протекает поэтапно. Вначале после завершения биосинтеза
полипептидных цепочек казеина на рибосомах клетки они поступают
в вакуоли аппарата Гольджи, где подвергаются гликозилированию, т. е.
осуществляется присоединение углеводов к поверхности белковой
глобулы, а также фосфорилированию.
505
Биохимия животных
он он
Белок-ОН + НО-|=0 -> Белок-О-^О + Н20
ОН ОН
В присутствии ионов кальция образуются субмицеллы казеина.
Затем по мере насыщения субмицелл ионами Са2+ и фосфатов
субмицеллы могут сливаться, образуя мицеллы. После слияния с
мембраной клетки мицеллы казеина выталкиваются в просвет альвеол.
Размер мицелл казеина может изменяться и зависит от времени
года, породы, кормления животных и др. В образовании устойчивых
мицелл казеина принимает участие находящийся в растворе фосфат
кальция, который образует казеинаткальцийфосфатный комплекс.
В молоке казеин присутствует в виде казеинатов кальция, в
образовании которых участвуют остатки аминокислот (аспарагино-
вая и глутаминовая кислоты), имеющие свободные карбоксильные
ГРУППЫ. 0
/^ *\ «
/ \С-Оч
\
.2+
Фосфорилированию подвергаются белки, на поверхности которых
располагаются аминокислотные остатки, содержащие гидроксильные
группы (серии, треонин, тирозин).
I Белок 1_(
он + но-р-он
он
0
-о-Цмэн +н2о
он
При этом кальций может присоединяться к гидроксильной группе
остатка фосфорной кислоты.
+ Са2+ -► 1 Бешж /О-Р-0 + 2Н4
\^_^ 6-Са
казеинаткальцийфосфатный комплекс
506
Глава 7. Функциональные системы
Кроме того, ион кальция способен образовать кальциевый мостик,
соединяя между собой два и более белков за счет образования связи
с расположенными на поверхности этих белков остатками
фосфорной кислоты.
( Белок ЬО-1
-РЧЭ-Са-0-|>-0-/ Белок 1
Эта способность кальция проявляется при формировании мицелл
казеина. Разнообразие мицелл, в образовании которых принимают
участие ионы кальция и фосфора, могут реализоваться в следующих
структурах:
I Белок ЬС
-О-Са-О-Р-О- Са-О-С-
>Н
[ Белок ]
или
( Белок )-0--Р--0-Са-0-^-0~Са-(>-Р
\^^У ОН ОН ОН
Белок
Таким образом, мицеллы казеина представляют упорядоченные
белковые структуры, в образовании которых принимают участие ионы
кальция и остатки фосфорной кислоты, формирующие кальций-фосфатные
мостики, связывающие между собой молекулы казеина. Поэтому казеин
в молоке присутствует в виде сложного казеинаткальцийфосфатного
комплекса, в состав которого могут входить и некоторые полярные
соединения (лимонная, уксусная кислоты, витамины и др.) и ионы
(№+, К+, М§2+, СГ и др.). В мицелле присутствует 65% кальция, 50%
неорганического фосфора, 25...30% магния и 8... 10% цитрата.
507
Биохимия животных
Увеличение в молоке содержания кальция, связанного с казеином,
может приводить к понижению термоустойчивости казеиновых
мицелл. Это необходимо учитывать при изучении свертывания молока
при нагревании и при установлении скорости сычужной
коагуляции. Стабильность казеиновых мицелл зависит от содержания в
молоке ионов кальция, фосфора, состава казенное, рН молока,
температуры среды.
Размеры мицелл казеина являются определяющими при
выявлении технологических свойств молока, в особенности, при
определении пригодности молока для производства сыров. При этом
проявляется способность молока к свертыванию под действием сычужного
фермента.
7.9.2.6. Жировые шарики
7.9.2.6.1. Механизмы формирования жировых шариков
Структурированные образования, сформированные в
результате пиноцитоза, имеющие наружную оболочку, представленную
белково-липидными комплексами мембран лактоцитов,
называются жировыми шариками. Размер ЖШМ может колебаться в
пределах 0,1...20 мкм, в среднем диаметр жирового шарика составляет
3...4 мкм.
[ ( ) -} поверхностная оболочка
V ^/""^липиды
Строение жирового шарика
В период лактации в секреторных клетках молочной железы (лак-
тоцитах) активизируются биосинтетические процессы, приводящие
к формированию на апикальной поверхности микроворсинок лак-
тоцита куполообразных выпячиваний (жировые капли), содержащих
различные липиды, которые по достижению определенных размеров
отрываются и вместе с покрывающей их плазмалеммой, поступают
в полость альвеол. В альвеолы выделяются и другие биогенные
молекулы секреторных клеток. Вместе с казеином, лактозой и другими
компонентами молока они формируют мицеллы.
508
Глава 7. Функциональные системы
7.9.2 6.2 />емс# оболочек жировых шариков
Идентифицировано более 40 белковых комплексов,
принимающих участие в формировании оболочки жировых шариков.
Основная масса этих белков — гликопротеиды, в составе которых углеводы
(галактоза, Ы-ацетилгалактозамин, 1Ч-ацетилглкжозамин и сиаловая
кислота) и ферменты (кислая и щелочная фосфатазы, ксантинокси-
даза, х-глутаминтрансфераза, нуклеозидаза и др.). Поверхность
жирового шарика сформирована из белков и фосфолипидов, которые
входили в структуру клеточной мембраны. В основном фосфолипиды
представлены лецитином (фосфатидилхолином) и кефалином (фос-
фатидилэтаноламином). Эти два фосфолипида являются основными
липидами мембран клеток животных.
Внутри жирового шарика содержатся триацилглицерины, жирные
кислоты и стероиды. Кроме того, в составе жирового шарика могут
присутствовать витамины (А, Э, Е), ионы металлов (Си2+, Ре3+, Са2+,
К+ и др.* и функциональные белки (казеин, сывороточные белки),
расположение которых определяется их природой. Гидрофобные
молекулы обычно бывают погружены во внутреннюю часть жирового
шарика, тогда как полярные и заряженные молекулы располагаются
в поверхностных структурах жирового шарика. Стабильность структуры
жирового шарика определяется в основном слабыми гидрофобными и
гидрофильными связями. Поэтому при гомогенизации,
сепарировании, транспортировке, низко- и высокотемпературной обработке
жировые шарики могут разрушаться. Размеры жировых шариков имеют
значение при определении технологической пригодности молока при
производстве сливок, масла, сыра, творога и др. Жировые шарики
способны слипаться, всплывая на поверхность молока, формируя слой
сливок.
7.9.3. Действие гормонов на процесс молокообразования
Образование молока в молочной железе представляется как
единый процесс, проявляемый согласованным действием ЦНС и
эндокринной системы, в сочетании с деятельностью различных
функциональных систем организма животного (пищеварительной, половой,
выделительной, нервной, эндокринной, мышечной и др.).
Регуляторное действие нейроэндокринной системы в молокообра-
зовании проявляется в том, что вырабатываемые в гипофизе соматот-
ропин, окситоцин и пролактин обладают стимулирующим действием
на лактогенез, тогда как их накопление в организме находится под кон-
509
Биохимия животных
тролем эстрогенов (рис. 7.46). Причем содержание пролактина в крови
может изменяться, увеличиваясь в начале доения и понижаясь к его
окончанию. Пролактин стимулирует синтез в лактоцитах белков
(казенное), а-лактальбуминов, липидов и углеводов (лактозы).
Анализаторы чувств
Центральная нервная система
Гипоталамус
Рилизинг-факторы
Гипофиз
Пролактин ТТГ СТГ ФСГ ЛТГ АКТГ Окситоцин
Тироксин,
трийодтиронин
Эстрон,
эстрадной,
эстриол и др.
Мозговое
вещество
Корковое
вещество
Катехол-
амины
Глюкокор-
тикоиды
М МОЛОЧНАЯ ЖЕЛЕЗА К
Молоко
Рис. 7.46. Схема регуляторного действия нейроэндокринной
системы на функционирование молочной железы
510
Глава 7. Функциональные системы
Соматотропин оказывает влияние на альвеолярный эпителий
вымени, воздействуя на белковый, углеводный и липидный обмен. При
этом в крови возрастает концентрация глюкозы, кетоновых тел,
жирных кислот, фосфолипидов и аминокислот.
Эстрогены стимулируют рост протоковой системы молочной
железы, а прогестерон совместно с эстрогенами — развитие дольчатой
альвеолярной структуры. При этом, кроме желтого тела, прогестерон
может вырабатываться также плацентой и надпочечниками.
Половые стероиды воздействуют как непосредственно на
молочную железу, так и на выработку гормонов аденогипофиза (АКТГ,
соматотропин и п рол актин).
При этом определяется направленность действия гормонов. Так,
например, эстрогены, прогестерон и инсулин оказывают
стимулирующий эффект на синтез ДНК и митоз клеток, тогда как под действием
кортикостероидов может формироваться эндоплазматический рети-
кулум, аппарат Гольджи, а пролактин ускоряет образование рибосом.
АКТГ и тиреотропные гормоны гипофиза оказывают влияние на
лактацию посредством воздействия на щитовидную железу и надпочечники.
Гормоны щитовидной железы также способны стимулировать
процесс лактации. В результате их действия увеличивается в молоке
содержание иммуноглобулинов, липидов, фосфорсодержащих
соединений и ионов кальция. При этом действие тироксина проявляется
через усиление активности ферментов окислительного фосфорилиро-
вания в митохондриях, возрастания синтеза белков. Тогда как
тироксин ускоряет синтез в тканях глюкозы, р-оксимасляной кислоты,
ацетата, способствуя поглощению их лактоцитами.
Действие гормонов мозгового вещества надпочечников,
проявляется за счет вырабатываемого адреналина, который усиливает
сокращение мышц стенок цистерн и протоков молочной железы, усиливает
процессы синтеза липидов и белков, содержание которых в молоке
возрастает. Гормон надпочечников кортизол, воздействуя на
лактацию, ускоряет синтез мРНК.
Гормон желтого тела прогестерон оказывает ингибирующее
действие на лактацию. Тогда как другие эстрогены, стимулирующие
процессы синтеза белков и липидов, угнетают выработку пролактина
в начальный период беременности. Однако после отела содержание в
крови эстрогенов и прогестерона резко может снижаться и за счет этого
снижается эффект их угнетающего действия на гипофиз. При этом
гипофиз начинает продуцировать пролактин, активирующий лактацию.
511
Биохимия животных
Вопросы и задания для самоконтроля
1. Расскажите о химическом составе крови. 2. Раскройте роль ли-
попротеинов как сложных транспортных белков. 3. Расскажите о
противовирусных белках крови и их механизмах действия. 4. Назовите
основные классы иммуноглобулинов и расскажите об их биологической
роли. 5. Назовите и опишите функциональные свойства медиаторов.
6. Опишите свойства форменных элементов крови. 7. Расскажите об
участии лейкоцитов в процессе фагоцитоза. 8. Какая роль отводится
тромбоцитам в механизме свертывания крови? 9. Расскажите о лимфе
и ее химическом составе. 10. Раскройте значение системы
свертывания крови для организма животных. 11. Опишите процесс
образования фибрина. 12. Расскажите о процессе агрегации тромбоцитов.
13. Раскройте механизм действия компонентов системы фибрино-
лиза. 14. Назовите антикоагулянты и опишите их механизм действия.
15. Расскажите о механизме действия компонентов системы
комплемента. 16. Перечислите основные функции крови. 17. Опишите
особенности строения тканей костной системы. 18. Расскажите о
строении и биологической роли коллагена. 19. Раскройте роль сложных
белков в формировании соединительной ткани. 20. Назовите
основных представителей протеогликанов и опишите их функции. 21.
Расскажите о строении и биологической роли эластина. 22. Опишите
особенности строения костной ткани. 23. Назовите химический
состав костной ткани. 24. Дайте описание строения и
функционирования нервной ткани. 25. Опишите химический состав нервной ткани.
26. Дайте описание основных метаболических процессов,
протекающих в нейронах. 27. Раскройте роль аминомасляной кислоты в
функционировании нервной ткани. 28. Расскажите о значении сенсорной
системы для животных. 29. Опишите строение и функционирование
системы зрения. 30. Расскажите о строении гладкой мышечной ткани.
31. Чем отличается в строении поперечнополосатая мышечная ткань
от гладкой мышечной ткани? 32. Опишите особенности строения
сердечной мышечной ткани. 33. Назовите химический состав мышечной
ткани. 34. Напишите структурные формулы карнитина и расскажите
о его биологической роли. 35. Напишите структурные формулы кар-
нозина и анзерина и расскажите об их свойствах. 36. Напишите
формулы креатина и креатинина и расскажите об их биологической роли.
37. Опишите механизм синтеза креатинфосфата. 38. Опишите
строение основных сократительных белков мышц. 39. Расскажите о роли
ионов Са2+ в механизме сокращения мышц. 40. Опишите процесс
512
Глава 7. Функциональные системы
инициации мышечного сокращения. 41. Какова роль тропомиозина
и тропой и на в механизме сокращения мышечных волокон? 42.
Расскажите о механизмах послеубойного окоченения. 43. Раскройте роль
дыхательной системы в функционировании организма животных.
44. Расскажите о гемсодержащих белках, участвующих в связывании
кислорода. 45. Опишите основные биохимические механизмы
газообмена в легких. 46. Расскажите о биохимических процессах,
протекающих в ротовой полости. 47. Раскройте роль амилаз в гидролизе
крахмала. 48. Какие биохимические процессы протекают в преджелудках
жвачных животных? 49. Опишите биохимические процессы,
протекающие в желудке моногастрических и в сычуге жвачных животных.
50. Расскажите о роли соляной кислоты и пепсина. 51. Объясните
влияние температуры и рН на активность химозина и пепсина. 52.
Опишите основные биохимические процессы, протекающие в печени
животных. 53. Дайте описание химического состава желчи. 54.
Расскажите о функционировании поджелудочной железы. 55. Опишите
механизм действия трипсина и химотрипсина. 56. Как нейтрализуются
токсичные продукты в толстом отделе кишечника? 57. Расскажите
о строении и функционировании почек. 58. Опишите механизмы
образования мочи. 59. Назовите основные компоненты мочи и укажите
особенности состава первичной и вторичной мочи. 60. Опишите
строение и функционирование молочной железы. 61. Расскажите об
основных макро- и микроэлементах молока. 62. Дайте характеристику
основным биохимическим процессам, протекающим в молочной
железе. 63. Назовите основные белки молока. 64. Расскажите о
строении казенное. 65. Опишите свойства основных сывороточных белков
молока. 66. Объясните проявления бактерицидных свойств молока.
67. Расскажите о ферментах, входящих в состав молока. 68.
Напишите структурные формулы основных представителей углеводов
молока. 69. Напишите структурную формулу лактозы и назовите стадии
ее биосинтеза. 70. Раскройте роль кальция в образовании мицелл
казеина. 71. Назовите основные компоненты мицелл казеина и жировых
шариков. 72. Расскажите об особенностях в строении мицелл казеина
и жировых шариков. 73. Опишите механизмы образования жировых
шариков. 74. Перечислите названия белков, входящих в состав
жировых шариков и опишите их функции. 75. Расскажите о действии
гормонов на процесс молокообразования.
513
СЛОВАРЬ ТЕРМИНОВ
А
АБЗИМЫ — новый класс каталитических белков, полученных методами белковой
инженерии, на основе иммуноглобулинов (антител), обладающих ферментативной
активностью; при катализе А. используют энергию сайт-специфического связывания
антител с молекулой-мишенью.
АВТОМАТИЗМ — это способ реализации информационного потенциала
биогенных молекул.
АВТОТРОФЫ (от греч. авто — само-, трофе — пища) — организмы, использующие
оксид угле рода (IV) С02 в качестве единственного источника углерода, из которого они
способны синтезировать все свои углеродсодержащие соединения. К автотрофам
относятся растения, а также фотосинтезирующие и хемосинтезирующие бактерии.
АДАПТАЦИЯ — форма проявления приспособительной способности живых
организмов к функционированию в новых условиях среды.
АДЕНИЛАТЦИКЛАЗНАЯ СИСТЕМА - это система, в составе которой
несколько рецепторных и функциональных белков, располагающихся на внешней
стороне клеточной мембраны, участвуют в процессе передачи сигнала регуляторных
молекул; рецептор способен избирательно связывать гормон, передавая затем сигнал на
N-белок, который располагается между рецептором и ферментом аденилатциклазой.
АДЕНОВИРУСЫ — ДНК-содержащие вирусы, которые были выделены из клеток
самых различных млекопитающих и птиц; А. поражают лимфоидную ткань и вызывают
у человека различные респираторные заболевания.
АДЕНОЗИНТРИФОСФАТ (АТФ) — сложное соединение, образованное из
азотистого основания аденина, рибозы и последовательно соединенных трех остатков
фосфорной кислоты; АТФ содержит макроэргические связи, гидролиз которых
обеспечивает энергетические потребности, необходимые для протекания метаболических
процессов в живых организмах; при расщеплении АТФ последовательно образуются
АДФиАМФ.
АЗОТИСТЫЕ ОСНОВАНИЯ — низкомолекулярные азотистые соединения,
основными структурными элементами которых являются пиримидин и пурин; А.о.
входят в состав РНК и ДНК, определяя их принадлежность; так в составе ДНК аденин,
гуанин, цитозин и тимин, а в РНК вместо тимина присутствует урацил; А.о.
поглощают свет ультрафиолетовой области спектра с длиной волн 200...300 нм и
максимумом около 260 нм; в организме животных продуктами ферментативного разложения
пуринов является мочевая кислота, а пиримидинов — С02, г^Н3, мочевина, р-аланин
и Р-аминоизомасляная кислота.
АККЛИМАТИЗАЦИЯ — форма проявления приспособительных признаков у
живых организмов к изменившимся климатическим (сезонным) условиям
существования.
514
Словарь тепминов
АКТИВАТОР — вещество, действие которого проявляется в возрастании скорости
ферментативной реакции; различаю*: неконкурентную (а = 1, 3 > I), синсргистическую
(а < 1, р = 1) и смешанные (а ф 1, р * 1) типы активирования.
АКТИВНЫЙ ЦЕНТР — участок, расположенный на поверхности белковой
глобулы, образованный из разных аминокислотных остатков, собранных из различных
участков полипептидной цепи, где происходит связывание и превращение субстрата;
аминокислотные остатки имеют определенное пространственное расположение в
активном центре, что обеспечивает специфичность (избирательность) механизма
действия фермента.
АКТИН — белок тонких филаментов поперечнополосатых мышц; присутствует
в двух формах: С-актин и Р-актин.
АЛЛЕЛЬНЫЕ ГЕНЫ — различные формы одного и того же гена в гомологичных
хромосомах; например, гены контролирующие окраску желтозерных и зеленозерных
сортов гороха или белую и красную окраску цветков роз и т. д.
АЛЬТЕРНАТИВНЫЙ СПЛАЙСИНГ наблюдается в разных тканях одного и того
же РНК-предшественника, приводит к образованию разных РНК, содержащих разные
наборы экзонов; в результате А.с. РНК, транскрибируемые с одного гена, будут
кодировать белки с разными свойствами; выбор путей сплайсинга РНК-предшественника —
это способ регуляции активности генов в разных клетках и тканях организма.
АМИНОКИСЛОТЫ — низкомолекулярные органические соединения,
относящиеся к группе карбоновых кислот, в составе которых присутствует аминогруппа (-1МН2);
в состав белков входят 20 А., у которых в а-положении аминогруппа (аланин, валин,
лейцин, изолейцин, фенилаланин, метионин, триптофан, пролин, глицин, серин,
треонин, тирозин, цистеин, аспарагин, глугамин, лизин, гистидин, аргинин,
аспарагиновая и плутами новая кислоты).
АНАБОЛИЗМ (анаболические пути) — процессы ферментативного синтеза
сложных биологических молекул (углеводов, нуклеиновых кислот, белков, жиров) из
простых предшественников, с потреблением свободной энергии, которая поставляется
в форме фосфатных связей АТФ.
АНТИКОНКУРЕНТНЫЙ ТИП ИНГИБИРОВАНИЯ - этот тип ингибирова-
ния проявляется при связывании ингибитора только с фермент-субстратным
комплексом; при связывании в активном центре фермента ингибитора
останавливается каталитический процесс.
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ — активность, проявляемая действием ан-
тиоксидантов в живых организмах, подавляющих протекание процессов свободноради-
кального окисления; эффект действия антиоксидантов часто используется в
производстве пищевых продуктов; так, например, антиоксиданты (дигидрокверцетин, кверцетин,
аскорбиновая кислота и др.) используются в качестве пищевых добавок или входят в
состав уже готовых пищевых продуктов: молока, масла, сливок, сметаны, сыров и др.
АНТИОКСИДАНТЫ — это соединения, действие которых связано с обрывом
цепной радикальной реакции, в результате чего образуются гидропероксид субстрата и
обладающий низкой реакционной способностью свободный радикал ингибитор А.
АНТИРАДИКАЛЬНАЯ АКТИВНОСТЬ - проявление реакционной способности
соединений подавлять активность свободных радикалов и, в частности, активных форм
кислородА
АНАЭРОБЫ — организмы, использующие в качестве акцепторов электронов не
кислород, а другие вещества; к ним относятся многие бактерии, различные инфузории,
некоторые черви и моллюски.
515
Биохимия животных
АНАЭРОБНЫЕ УСЛОВИЯ — условия жизнедеятельности организмов и
протекания биохимических процессов в отсутствие кислорода, при этом в качестве окислителя
используется не кислород, а другие вешествА.
АНТИГЕННАЯ ДЕТЕРМИНАНТА — участок на поверхности белковой глобулы
антигена, с которым специфично связываются антителА.
АНТИГЕНЫ — вещества, несущие признаки генетической чужеродности и
индуцирующие синтез антител.
АНТИКОДОН — триплет, содержащийся в составе молекулы тРНК,
комплементарный какому-нибудь кодону и РНК.
АНТИТЕЛА — вещества гл и коп роте ид ной природы, образующиеся в ответ на
введение в организм антигена и обладающие способностью к специфической реакции
с антигеном.
АПОПТОЗ — это запрограммированная смерть клетки, протекает лри участии
активных форм кислорода (АФК); условием развития А. являются нарушения,
возникшие в клетках в процессе жизнедеятельности организмА.
АПОФЕРМЕНТ — белковая часть холофермента.
АППАРАТ ГОЛЬДЖИ — структурные компоненты клетки, представляющие
собой стопку плоских мешочков — цистерн диаметром около 1 мкм и толщиной
0,02...0,025 мкм, ограниченных мембраной и расположенных параллельно друг другу;
число цистерн в диктиосоме 5...7.
АССИМИЛЯЦИЯ (реакции пластического обмена) — процессы направленного
синтеза биогенных молекул в живых организмах, протекающие с затратой энергии (АТФ и
др. высокоэнергетических молекул); к процессам А. можно отнести биосинтез белка,
глюконеогенез — синтез гликогена, липогенез — синтез жирных кислот и т. д.
АЦИДОЗ — накопление в организме кислых продуктов метаболизма (ацетоуксус-
ная кислота, 3-гидроксимасляная кислота, ацетон), которые могут накапливаться при
голодании, сахарном диабете, резкой смене диеты и т. л.
АЭРОБЫ — организмы, использующие в качестве акцептора электронов
молекулярный кислород; к аэробам относятся все животные и растения, а также многие
микроорганизмы.
АЭРОБНЫЕ УСЛОВИЯ — условия жизнедеятельности организмов и протекания
биохимических реакций в присутствии кислорода, использующие его в качестве
акцептора электронов.
Б
БАЗОФИЛЬНЫЕ ЛЕЙКОЦИТЫ являются форменными элементами крови, в
основе механизма действия которых лежат реакции повышенной чувствительности
немедленного типа; специфические рецепторы, расположенные на поверхности Бл.,
способны связывать иммуноглобулины Е, а также различные антигены с
формированием неустойчивых комплексов антиген-антитело, которые вызывают дегрануляцию
базофилов и выход из них биологически активных веществ — гистамина и гепарина;
т. о. базофилы участвуют в различных иммунологических и аллергических реакциях
организма, формируя значительную часть клеточного инфильтрата при различных
формах гиперчувствительности замедленного типа.
БАКТЕРИОФАГ — вирус, поражающий бактерии.
БЕЛОК — высокомолекулярное соединение, образованное за счет
последовательного соединения а-Ь-аминокислот в полипептидную цепь, связанных между
собой пептидной связью (-СО-ЫН-) (согласно генетической информации, хранящейся
516
Словарь терминов
в гене), и обладающее функционально активной третичной или четвертичной
структурой; информация о природе аминокислот, последовательности их связывания в
полипептидной цепи и количестве передается последующей цепи: ДНК -* пре-РНК -►
мРНК-> белок.
БЕЛО К-РЕП РЕССОР — белок, выполняющий посреднические функции в
регулировании активности гена; Б-р. имеет сродство к гену-оператору и обратимо
связывается с ним в комплекс, образование которого блокирует процесс синтеза пре-РНК;
т. е. функция Б-р. заключается в том, что он регулирует активность структурных
генов, ответственных за синтез пре-РНК; при этом на поверхности белковой глобулы
Б-р. имеется участок, в котором специфически могут связываться низкомолекуляр-
ные регуляторные молекулы-индукторы.
БЕСКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - при этом типе ингибирования
субстрат и ингибитор способны связываться в активном центре фермента, имея разные
участки связывания; в присутствии ингибитора превращение субстрата несколько
затрудняется, хотя его связывание несколько улучшается; т. е. ингибитор улучшает
связывание субстрата, но ухудшает его превращение.
БРОЖЕНИЕ — процесс анаэробного превращения углеводов в
микроорганизмах, конечными продуктами которых являются этанол, молочная кислота, глицерин.
В
ВЕКТОР — молекула ДНК, способная переносить в клетку чужеродную ДНК
любого происхождения и обеспечивать ее встраивание в ДНК клетки; ими могут быть
бактериофаги или плазм иды.
ВИД — группа особей, имеющих наследственное сходство генетических,
биохимических, морфологических и физиологических признаков, свободно скрещивающихся
между собой и дающих плодовитое потомство, имеющее единое происхождение,
обитающее на определенной территории, приспособленное к определенному типу
питания и образу жизни.
ВИТАМИНЫ — это группа биологически активных веществ, синтез которых
преимущественно происходит в бактериях и растениях, являющихся предшественниками
кофакторов или простетических групп; недостаток витаминов вызывает у животных
и человека развитие симптомов гипо- или авитаминозов, а их избыток — гипервита-
минозы.
ВОДОРОДНАЯ СВЯЗЬ — связь, образованная атомом водорода, находящегося
между двумя атомами электроотрицательных элементов; в образовании водородной
связи участвуют такие электроотрицательные атомы, как кислород, азот, фтор, хлор;
энергия водородной связи сравнительно мала (около 40 кДж/моль).
В ОС К И — сложные эфиры высших многоатомных спиртов и высших жирных
кислот.
ВТОРИЧНАЯ СТРУКТУРА БЕЛКА — упорядоченное пространственное
расположение отдельных участков полипептидной цепи, закрученных в форму а-спирали
или образующих складчатые слои ((3-структура), стабилизированных за счет
водородных связей.
ВТОРИЧНАЯ СТРУКТУРА ДНК — комплементарное расположение двух поли-
нуклеотидных цепей, связанных между собой водородными связями молекул пури-
новых и пиримидиновых оснований; пары (А=Т и Т=А) образуют по две водородные
связи, а пары (Г=Ц и Ц=Г) — три водородные связи.
517
Биохимия животных
г
ГАНГЛ ИОЗИДЫ — гл и кол и пилы, в состав которых входит сиаловая кислота.
ГАПТЕН — низкомолекулярное вещество, которое при связывании с белком,
полисахаридом и другими соединениями, способно инициировать развитие иммунных
реакций.
ГАПТЕННАЯ ДЕТЕРМИНАНТА — участок на поверхности макромолекулы, с
которым специфично связываются молекулы малого размера (гаптены); образовавшийся
комплекс способен вызывать синтез специфических антител (иммуноглобулинов);
в отсутствие акцептирующей макромолекулы гаптен не способен сам активизировать
иммунные реакции.
ГЕН — элементарная единица наследственности, в которой заключена информация о
всех белках и рибонуклеиновых кислотах, участвующих в метаболических процессах,
входящих в структуру мембран клеток.
ГЕН-РЕГУЛЯТОР — участок в структуре ДНК, регулирующий активность
структурных генов (экспрессию), содержащий и передающий информацию о белке-репрессоре.
ГЕНЕТИЧЕСКИЙ КОД — набор триплетов в ДНК, представленный тремя
последовательно соединенными мононуклеотидами, содержащими информацию о
первичной структуре белков, синтезируемых на рибосоме.
ГЕНОМ — совокупность генов, входящих в состав ДНК.
ГЕНОТИП — суммарная генетическая информация, содержащаяся в хромосомах,
которая получена организмом от предыдущих поколений.
ГЕНОФОНД — сумма всех генов данного вида (заключенных в хромосомах),
обеспечивающая возможность выживания вида в данных условиях обитания.
ГЕТЕРОТРОФЫ (от греч. гетерос — другой, трофе — пища) — организмы,
получающие углерод в виде готовых, достаточно сложных органических соединений (глюкоза,
жирные кислоты и т. д.). К ним относятся животные и большинство микроорганизмов.
ГИАЛОПЛАЗМА — жидкая часть цитоплазмы, представляющая собой водную
коллоидную систему с определенным рН и ионной силой, основными функциями которой
является обеспечение передвижения метаболитов клетки, регуляция основных
биохимических процессов и взаимосвязь с метаболическими процессами, протекающими
в органеллах и ядре клетке.
ГИДРОЛАЗЫ — класс ферментов, катализирующих расщеплен и г связей с
участием молекулы воды в качестве нуклеофила.
ГИДРОФИЛЬНОСТЬ (от греч. гилро — вода, филео — люблю, букв, любящий
воду) — свойства веществ, материалов интенсивно взаимодействовать с водой, хорошо
растворяться в воде.
ГИДРОФОБНОСТЬ (от греч. гидро — вода, фобос — страх, боязнь, букв, боящийся
воды) — свойства веществ, материалов слабо взаимодействовать с водой, плохо
растворяться в воде.
ГИДРОФОБНЫЕ ВЗАИМОДЕЙСТВИЯ — тип связей, устанавливаемый при
взаимодействии между неполярными группами; Гв. относятся к слабым связям;
в белках Гв. формируются между неполярными группами аминокислотных остатков,
которые чаще всего юкализуются внутри белковой глобулы, избегая контакта с
молекулами воды.
ГИСТОНЫ — небольшие щелочные белки (12-30 кДа), расположенные
преимущественно в ядре животных и растений и играющие важную роль в структуре
хроматина, участвуя в формировании третичной структуры ДНК; Г. подвергаются
модификации и в результате этого приобретают функциональную специализацию, определяя
518
Словарь терминов
начало сайтов транскрипции и других элементов генома; характер модификации
позволяет устанавливать даже наличие регуляторных элементов в структуре ДНК.
ГЛАДКАЯ МЫШЕЧНАЯ ТКАНЬ — это разновидность мышечной ткани,
сокращение которой контролируется со стороны вегетативной нервной системы; эта ткань
входит в состав желудка, кишечника, матки, мочевого пузыря, мочеточников, бронхов,
крупных кровеносных сосудов; основными клетками гладкой мышечной ткани
являются одноядерные клетки — миоциты.
ГЛИКОЛИЗ — анаэробный процесс расщепления одной молекулы глюкозы до двух
молекул молочной кислоты при участии ферментов цитоплазмы; в результате Г
синтезируются четыре молекулы АТФ, две из которых расходуются в реакциях фосфорили-
рования глюкозы — гексокиназой и фруктозы-6-фосфат — фосфофруктокиназой; три
стадии Г необратимы, они катализируются АТФ-зависимыми ферментами:
гексокиназой, фосфофруктокиназой и пируваткиназой; суммарная реакция превращения
глюкозы в пируват имеет следующий вид:
Глюкоза (С6Н ,206) + 2Фн + 2АДФ + 2Н АД'+ ->
-> 2СН3-СН(ОН)-СООН + 2АТФ + 2НАДН + 2Н+ + 2Н20
ОН
ГЛ И КОКАЛ И КС — структурное образование поверхностной мембраны клетки,
состоящее из гликолипидов, полярные головки которых вместе с углеводными
остатками белков (гликопротеинов) образуют наружное покрытие плазматической
мембраны.
ГЛИКОПРОТЕИНЫ — сложные белки, в состав которых входят углеводы; выполняют
Г функции рецепторов мембран, участвующих в процессах биологического распознавания
соединений и клеток (гормонов, бактерий и вирусов); ряд гликопротеинов, циркулирующих
в кровяном русле человека и животных, являются транспортными белками; каталитическая
функция выполняется такими белками, как пероксидаза, холинэстераза, глюкооксидаза,
энтерокиназа и др., содержащими углеводы в своем составе; входя в состав межклеточного
вещества соединительной ткани, Г. выполняют структурно-механическую функцию.
ГЛУТАТИОН (Г-5Н) — трипептид, в состав которого входят три последовательно
соединенных аминокислоты (глутаминовая кислота, цистеин, глицин); Г служит донором
водорода в окислительно-восстановительных процессах; в организме животных Г является
субстратом глутатионпероксидазы, окисление которой сопровождается образованием
окисленной формы (Г-5-5-Г); количество восстановленного глугатиона может служить
критерием жизнеспособности живых организмов.
ГЛЮКОНЕОГЕНЕЗ — процесс синтеза глюкозы из пировиноградной кислоты или
производных аминокислот при участии ферментов цитоплазмы; некоторые реакции Г
являются общими с реакциями гликолиза; для осуществления Г. требуются четыре
новые реакции — в обход необратимых, соответствующих реакциям гликолиза; эти
реакции катализируются пируваткарбоксилазой, фосфоенолпируваткарбоксикиназой,
фруктозо-1,6-дифосфотазой и глюкозо-6-фосфотазой; суммарное уравнение реакций
Г. следующее:
2СН3СОСООН + 4АТФ + 2ГТФ + 2НАДН + 2Н+ + 6Н20 ->
-> Глюкоза (С6Н1206) + 2НАД+ + 4АДФ + 2ГДФ + 6ФН
519
Биохимия животных
ГОМОЛОГИ Ч НЫ Е ОРГАН Ы — органы, соответствующие друг другу по строению и
происхождению независимо от выполняемых функций; например, рука человека,
передняя нога лошади, крыло птицы, лапа лягушки и т. д.; Го. развиваются из одних и тех
же зачатков и имеют единую основу строения.
ГОРМОНЫ — группа биологически активных веществ, синтез которых
осуществляется в специализированных эндокринных железах или в тканях, проявляющих
действие через рецепторную систему; при этом рецептор может располагаться на внешней
поверхности клеточной мембраны или в цитоплазме клетки; действие Г. проявляется
посредством передачи сигнала рецептору при образовании с ним комплекса; по своей
природе рецептор является гликопротеидом.
ГОРМОНЫ ГИПОТАЛАМУСА — вырабатываются в подбугровой области
промежуточного мозга (гипоталамусе); нервные клетки серого вещества гипоталамуса
формируют 32 пары ядер, распределенные в трех зонах: передней, средней и задней;
вырабатываемые в гипоталамусе вещества (рилизинг-факторы) регулируют секрецию
соответствующих гормонов гипофиза; все Г.г. подразделяются на либерины, которые
активируют синтез гормонов гипофиза, и статины — ингибируюшие этот процесс; по
строению Г.г. являются пептидами; в группу либеринов входят: тиреолиберин, люли-
берин, соматолиберин, меланолиберин, кортиколиберин; статинами являются сома-
тостатин, меланостатин.
ГОРМОНЫ ГИПОФИЗА — компонент единой гипоталамофизарной системы
организма; различают переднюю, заднюю и промежуточную доли гипофиза; в передней
доле гипофиза вырабатывается соматотропин (гормон роста), кортикотропин (АКТГ),
тиреотропин (ТТ), пролактин (ПЛ), фолликулостимулируюший гормон (ФСГ), люте-
инизирующий гормон (ЛТГ), липотропные гормоны (Л Г); задняя доля гипофиза
вырабатывает вазопрессин и окситоцин; в промежуточной доли гипофиза синтезируется ме-
ланоцитстимулирующий гормон.
ГОРМОНЫ КОРКОВОГО ВЕЩЕСТВА НАДПОЧЕЧНИКОВ - из коркового слоя
надпочечников выделено более 40 гормонов под общим названием кортикостероиды
(кортикоиды); все кортикоиды можно разделить на две группы: глюкокортикоиды
(оказывающие влияние на пластический обмен) и минералокортикоилы (влияющие
на водно-солевой обмен); в первую группу входят: кортикостерон, кортизон,
гидрокортизон, 11-дезоксикортилзол, 11-дигидрокортикостерон; ко второй группе
относятся альдостерон, дезокс и кортикостерон.
ГОРМОНЫ МОЗГОВОГО ВЕЩЕСТВА НАДПОЧЕЧНИКОВ - мозговое
вещество располагается в центральной части надпочечника; в их составе различают две
разновидности хромаффинных клеток: норадреноциты и адреноциты, причем первые из
них вырабатывают норадреналин, а вторые — адреналин; предшественником
гормонов является тирозин.
ГОРМОНЫ ПАРАЩИТОВИДНОЙ ЖЕЛЕЗЫ — регулируют концентрацию ионов
кальция и фосфорной кислоты в крови; основным Гп-ш.ж. является паратгормои; в
составе первичной структуры белка 84 аминокислотных остатка; в проявлении действия
гормона участвуют компоненты аленилатциклазной системы; стабилизируя
содержание ионов кальция в крови, гормон способствует реализации его действия в мышечном
сокращении, передаче нервно-мышечного возбуждения, в механизмах свертывания
крови, активности транспортных белков мембран, стабилизации структуры ферментов
и т. д., и таким образом нормализует деятельность этих систем; действие гормона на
почки способствует уменьшению реабсорбции фосфата в дметальных канальцах и
повышает канал ьцевую реабсорбиию кальция.
520
Словарь терминов
ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ располагаются в области шеи по обеим
сторонам трахеи, позади щитовидного хряща; морфофункциональной структурой
щитовидной железы является фолликул, внутри которого различают два типа
клеток: фолликулярные (тироциты) и околофолликулярные (С-клетки) клетки; в ти-
роцитах происходит синтез йодсодержащих гормонов (тироксина и трийодтиро-
нина); основным поставщиком тироксина в щитовидной железе является белок
тиреоглобулин, в составе которого остатки тирозина подвергаются йодированию
до монойодтирозина, а затем в дийодтирозин; два остатка дийодтирозина
взаимодействуют между собой с образованием тироксина, либо остатки монойодтирозина
с дийодтирозином с образованием трийодтиронина; синтез тиреоидных гормонов
катализируется тирсоид-пероксидазой с участием перекиси водорода.
ГОРМОНЫ ЭПИФИЗА (эпифиз, или шишковидное тело) располагаются между
полушариями большого мозга и мозжечком; в основе состоят из долек, паренхима которых
построена из пинеалоцитов, глиоцитов, лимфоцитов, тканевых базофилов, пигментных
клеток и мозгового песка; пинеалоциты секрстируют серотонин, мслатонин — гормон-
антагонист меланоиитсинтезирующему гормону передней доли аденогипофиза;
предшественником гормонов является триптофан; при гидроксилировании и декарбокси-
лировании триптофана образуется серотонин; после ацетилирования и метилирования
серотонина образуется мелатонин; реакция протекает при участии аденилатциклазной
системы, цАМФ которой запускает механизм активации протеинкиназы; действие
гормона проявляется в торможении половых функций у молодых живоыых и понижает
освобождение лютеинизируюшего гормона; свет оказывает угнетающее действие на
синтез мелатонина в организме животных.
Д
ДЕЗОКСИРИБОНУКЛЕИНОВАЯ КИСЛОТА (ДНК) - это высокомолекулярное
соединение, образованное за счет последовательного связывания нуклеотидов в полинук-
леотидную цепь, в упорядоченном расположении которых заложена индивидуальная
информация о живом организме, реализируемая через упорядоченный синтез белков и
формирование специализированных клеточных структур, определяющих индивидуальные
признаки организма; ДНК является полинуклеотилом (биополимер), в составе которого
азотистое основание (аденин, гуанин, цитозин и тимин), моносахарид (дезоксирибоза)
и остаток фосфорной кислоты; в полинуклеотидной цепи нуклсотиды последовательно
связаны между собой за счет фосфодиэфирной связи; устойчивость структуры ДНК
приобретается путем комплементарного и антипараллельного связывания между собой двух
полинуклеотидных цепей с помощью водородных связей, образуя правовинтовую
спираль вокруг обшей оси; две поперечные водородные связи формируются между А=Т и
три — Г=Ц,*ДНК может находиться в А-, В- и 2-формах; в структуре ДНК записана
информация о всех белках, синтезируемых в клетке, а также индивидуальные (видовые)
свойства и форма живого организма; удвоение ДНК (репликация) и передача
информации осуществляется специализированными ферментативными системами (ДНК-поли-
меразы, ДНК-зависимая РНК-полимераза, нуклеазы).
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ - реакции, катализируемые
ферментами, в которых от аминокислот отщепляется аминогруппа:
1) восстановительное дезами нирование
К-СН(1ЧН2)СООН + Н* -* К-СН2СООН + ЫН3;
521
Биохимия животных
2) гидролитические дезаминирование
К-СН(1МН2)СООН + Н20-> К-СН(ОН)СООН + NНз:
3) внутримолекулярное дезаминирование
К-СН2-СН(1ЧН2)СООН -► К-СН=СН-СООН + NN3;
4) окислительное дезаминирование
К-СН(1ЧН2)СООН + 1/2 02 -» Я-СО-СООН + NN3-
ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ -тип ферментативных реакций,
сопровождающихся отщеплением С02 от аминокислоты с последующим образованием
аминов
К-СН(Ш2)СООН -► К-СН2-1ЧН2 + С02
Реакции декарбоксилирования аминокислот катализируются ферментами,
относя щмися к классу лиаз (КФ 4), подклассу углерод — углерод лиазы (КФ 4.1), подпод-
классу карбокси — лиазы (КФ 4Л.1); например, пируваткарбоксилаза. оксалатдскар-
боксилаза, оксалоацетатдекарбоксилаза, ацетоацетатдекарбоксилаза и т. д.
ДЕНАТУРАЦИЯ представляет собой внутримолекулярное изменение
пространственного расположения по отношению друг к другу отдельных пептидных
фрагментов в белковой макромолекуле или ДНК без разрыва ковалентных связей в результате
действия химических или физических факторов (ионы тяжелых металлов,
органические растворители, кислоты, щелочи, температура, ионизирующее излучение и др.),
приводящих к изменению их физико-химических свойств и к утрате
функциональной активности.
ДЕНАТУРАЦИЯ БЕЛКОВ —белки под действием высокой температуры (50...60°С)
и кислотности среды (4,0 > рН > 10,0) начинают изменять свою пространственную
структуру, что приводит к нарушению их нативной (природной) кон формации;
разворачивание глобулы белка делает доступными для воды гидрофобные остатки
аминокислот, которые в нативном состоянии формировали преимущественно ядро белка,
взаимодействие их радикалов может приводить к образованию крупных ассоциатов
денатурированных белков, о чем свидетельствует степень помутнения раствора или
образование осадков. При проведении центрифугирования или длительном
отстаивании растворов денатурированных белков, в особенности при низких температурах
(0...+4°С), агрегированные полипептидные цепочки белков оседают на дно сосуда.
ДЕНАТУРАЦИЯ ФЕРМЕНТОВ — ферменты выполняют роль биологических
катализаторов; в каталитическом действии фермента принимают участие аминокислотные
остатки, содержащие -СООН, ->Ж2, -5Н и другие группы, входящие в состав
активного центра, протон ирование и де протон и рование которых может влиять на его
каталитические свойства; поэтому активность ферментов зависит от рН среды, изменение
которой может приводить к нарушению нативной структуры апобелка и конформации
активного центра, что проявляется в утрате специфических каталитических свойств;
аналогично белкам, ферменты при повышении температуры изменяют свою конфор-
мацию, теряя способность катализировать превращения различных соединений.
522
Словарь терминов
ДИССИМИЛЯЦИЯ (реакции энергетического обмена) — процессы
направленного распада веществ в клетках живых организмов; при этом накопившаяся в
результате распада рсщсств энергия генерируется в связях высокоэнергетических молекул
(АТФ, ГТФ, ЦТФ, УДФ и др.), используемых в дальнейшем для синтеза
пластических вешеств; к процессам Д. можно отнести гликолиз — распад глюкозы, лииогенез —
окисление жирных кислот, гликогенез — расшепление гликогена и др.
ДОМЕНЫ — локализованные участки белковой глобулы, структурно и
функционально обособленные и соединенные между собой короткими участками
полипептидной цепи.
Ж
ЖЕЛЧНЫЕ КИСЛОТЫ являются конечными продуктами обмена холестерина;
относятся к производным холановой кислоты, в составе которых холевая (3,7,12-три-
оксихолановая), лезоксихолевая (3,12-диоксихолановая) и хенодезоксихолевая (3,7-ди-
оксихолановая) кислоты; Ж.к. могут присутствовать в коньюгированной форме с
глицином (гликохолевая, гликодезоксихолевая, гликохенодезоксихолсвая кислоты) и
таурином (таурохолевая, тауродезоксихолевая, таурохенодезоксихолевая кислоты);
основным местом синтеза Ж.к. является печень; при этом только комплекс желчных
кислот с ненасыщенными жирными кислотами и моноацилглицеринами может создать
смесь для эмульгирования жиров; Ж.к. являются компонентами желчи, которая
необходима в процессе переваривания пиши, компонентами которой являются углеводы,
белки и липиды; эмульгированные жиры способны проникать через стенку кишечника
и попадать в лимфатическую систему; пройдя через мембраны клеток слизистой
оболочки кишечника, Ж.к. отделяются от липидов и по венам кишечника через
портальный кросоток возвращаются в печень, а затем с желчью вновь поступают в двенацати-
перстную кишку.
ЖЕЛЧЬ — биологическая жидкость, основными компонентами которой являются
желчные кислоты, жирные кислоты, триацилглицерины, фосфолипиды (фосфатидилхо-
л ин), билирубин и холестерин; кроме этого, вЖ. определяется активность некоторых
ферментов (щелочная фосфатаза, амилаза, кагал аза, протсазы и оксидазы); в Ж. содержатся
белки, аминокислоты, углеводы и микроэлементы (железо, магний, медь, цинк,
марганец); состав желчи зависит от вида, пола и возраста животного, типа питания и др.;
ежесуточно может вырабатываться у лошади 5...6 л, у крупного рогатого скота — 2...6 л, у овец —
0,3...0,4л, у собак — 0,25...0,30л желчи; вырабатывается Ж. непрерывно в клетках печени,
поступает по желчным канальцам в печеночный и пузырной проток и в желчный пузырь,
где накапливается; желчь способна выполнять следующие основные функции: 1) участие
в эмульгировании липидов; 2) транспорт липидов по желудочно-кишечному тракту;
3) участие в механизмах всасывания липидов в ЖКТ; 4) нейтрализация соляной кислоты
и повышение величины рН в тонком отделе кишечника; 5) активизация липаз,
катализирующих гидролизтриаиилглицеринов, фосфолипидов и стероидов.
ЖЕНСКИЕ ПОЛОВЫЕ ГОРМОНЫ — основным местом синтеза их яапяются
яичники и желтое тело; отмечается также их синтез в надпочечниках, семенниках и
плаценте; к Ж.п.г относятся прогестерон и эстрогены (эстрадиол, эстриол, эстрон);
секреция эстрогенов и прогестерона в яичниках происходит циклически и находится под
контролем гормонов гипофиза (ФСГ и ЛТГ); основной функцией Ж.п.г. является
обеспечение дифференцировки пола и репродуктивного периода, протекание процессов
овуляции и оплодотворения яйцеклетки, при этом прогестерон способствует успешной
имплантации оплодотворенной яйцеклетки, и н гиб и руст процессы овуляции и стиму-
523
Биохимия животных
лирует деление клеток молочной железы, тогда как действие эстрогенов в основном
направлено на стимуляцию биосинтетических процессов.
ЖИРЬ. — продукты животного, растительного и искусственного происхождения,
в составе которых смесь липидов; к Ж. относятся масло, сало, маргарин и др.
3
ЗИМОГЕНЫ — неактивные формы ферментов (проферменты), относящиеся
к группе протеиназ (сериновые, тиоловые, кислые); синтез 3. осуществляется на
рибосомах эндоплазматического ретикулума особыми секреторными клетками в виде
зимогенных гранул, которые после завершения процесса мигрируют к поверхности
клеток и затем секретируются в окружающую среду; достигнув места действия, они
превращаются в активные формы ферментов; к ним относятся пепсиноген, активной
формой которого является пепсин (основной протеолитический фермент
желудочного сока), трипсиноген — трипсин, химотрипсиноген — химотрипсин, прокарбок-
сипептидазы — карбоксипептидазы (ферменты поджелудочной железы) и др.; к 3.
относятся ферменты свертывания крови (факторы свертывания крови), компоненты и
факторы системы комплемента.
И
ИДИОДДАПТАЦИЯ (от греч. Шю$ — свой, особый и лат. айаршйо — прилаживание,
приспособление) — появление новых приспособительных признаков в организме в ответ
на специфические условия среды, полезные в борьбе за существование, но не изменяющие
уровня организации; например, разнообразные виды птиц, специфичные условия
обитания которых приводят к изменению клюва, размера и формы крыльев, конечностей и т. д.
(хотя уровень организации у всех одинаков).
ИЗОМЕРАЗЫ — это класс ферментов, катализирующих внутримолекулярные
превращения (рацемизация или эпимеризация); в названии фермента присутствует слово
«рацемаза» (аланин-рацемаза, метион и н-рацемаза, гидроксипролин-рацемаза, лак-
тат-рацемаза и др.), «эпимераза» (альдоза-1-эпимераза, рибулозофосфат-4-эпимераза,
Ы О Р-глюкуронат-4-эпимераза и др.), «изомераза» (рибозофосфат-изомераза, ксилозо-
фосфат-изомераза, глюкозаминфосфат-изомераза и др.), «таутомераза» (фенилпиру-
ват-таутомераза, оксалоацетат-таутомераза), «мутаза» (фосфоглицерат-мутаза, мети-
ласпартат-мутаза и др.): И. подразделяются на 5 подклассов.
ИЗОФЕРМЕНТЫ (изоэнзимы) — фуппа ферментов, выполняющих идентичную
каталитическую функцию у одного биологического вида, но отличающихся между
собой по структуре и ряду физико-химических свойств (элсктрофоретическая
подвижность, растворимость, каталитические константы), вследствие генетически
обусловленных небольших различий в первичной структуре, которые проявляются при
формировании нативной структуры ферментов.
ИЗОЭЛ ЕКТРИЧ ЕСКАЯ ТОЧКА—состояниезаряженностибелкаприопределенном
рН, при котором устанавливается равенство положительных и отрицательных зарядов в
молекулебелка;врастворесопределеннымрН,котороесовпадаетсвеличинойИ.э.т.,белок
в электрическом поле неподвижен.
ИММУНИТЕТ (от лат. ттипИаз — освобождение, избавление от чего-либо) —
защитная реакция организма, выражающаяся в невосприимчивости организма к
инфекционным агентам и чужеродным веществам; различают естественный или врожденный
И. (наследуемый организмом от родителей) и искусственный, или приобретенный И.
(вырабатываемый у человека после перенесенного инфекционного заболевания).
524
Словарь терминов
ИММУНОГЛОБУЛИНЫ (1&) — класс белков гликопротеинов, продуцируемых
В-лимфоцитами и обеспечивающих связывание, на начальных этапах иммунного
ответа, антигена; \& состоят из четырех полипептидных цепей (двух легких (Ь) и двух
тяжелых (Н) цепей), удерживаемых с помощью нековалентных взаимодействий и 5-
5-связей; можно выделить в составе 1& два Рав-фрагмента, каждый с антигенсвязываю-
шим центром, и один Рс-фрагмент; различают 5 классов антител: 1кС, 1я,М, 1§А, ДО,
1§Е, каждый 1& имеет свой тип тяжелых цепей — а, р, 8, у, и соответственно; 1&
образуются в ответ на введение в организм антигена; кроме сыворотки крови \% обнаружены
в молоке, слюне, выделениях слюнных желез и т. д.; действие 1& осуществляется через
образование комплекса с антигеном; если при этом проявляется образование осадка, то
это называется реакцией преципитации; если взаимодействие приводит к склеиванию
клеток, то их называют агглютининами, если происходит лизис лизинами.
ИММУНОГЛОБУЛИНЫ 1&А (500 кДа) являются основными классами антител
в секретах (молоке, слизи, слезах, секретах дыхательных путей и кишечника);
содержат 10... 12% углеводов; могут находиться в мономерной и димерной формах; в
последней содержится .1-цепь, которая образует комплекс с димерной формой,
называемой секреторным компонентом; поступление в секреты комплекса обусловлено
механизмами клеточного эндоцитоза, переносящими его через цитоплазму эндоплаз-
матических клеток; при этом секреторный компонент защищает 1&А от действия про-
теолитических ферментов в секретах.
ИММУНОГЛОБУЛИНЫ \&0 (175 кДа) являются минорными компонентами
сыворотки крови; выполняют функцию рецепторов, с высоким содержанием связанных
с белком углеводов.
ИММУНОГЛОБУЛИНЫ 1&Е (200 кДа) являются минорными компонентами
сыворотки крови; способны осуществлять защитную функцию в организме от действия
паразитарных инфекций, обуславливают многие аллергические реакции; механизм действия
1&Е проявляется через связывание с высоким сродством (10-10 М) с поверхностными
структурами тучных клеток, с последующим присоединением к ним антигена, вызывая
дегрануляцию и выброс в кровь высокоактивных аминов (гистамина и серотонина —
медиаторов воспаления).
ИММУНОГЛОБУЛИНЫ \%С (150 кДа) являются основным классом
иммуноглобулинов крови; в составе 1§С 2...3% углеводов; два антигенсвязывающих Рав-фрагментов и
один РС; Рав-фрагмент (50...52 кДа) состоит из целой 1_-цепи и М-концевой половины
Н-цепи, соединенных между собой дисульфид ной связью; тогда как в РС-фрагмент
(48 кДа) входит только половина Н-цепей; всего в молекуле 1&С 12 доменов (участки,
сформированные из р-структуры и а-спиралей полипептидных цепей 1& в виде
неупорядоченных образований, связанных между собой дисульфидными мостиками
аминокислотных остатков внутри каждой цепи): по 4 на тяжелых и по 2 на легких цепях.
ИММУНОГЛОБУЛИНЫ 1я,М (950 кДа) класс антител, которые продуцируются
В-лимфоцитами в начале иммунного ответа; содержат 10... 12% углеводов;
образование 1&М происходит еще в пре-В-лимфоцитах, в которых первично синтезируются из
ц-цепи; синтез легких цепей в пре-В-клетках обеспечивает их связывание с ц-цепями,
в результате образуются функционально активные 1&М, которые встраиваются в
поверхностные структуры плазматической мембраны, выполняя рольантигенраспознаюшего
рецептора; с этого момента клетки пре-В-лимфицитов становятся зрелыми и способны
участвовать в иммунном ответе; в секреторной форме \&М представляют пентамеры,
состоящие из 5 мономерных иммуноглобулинов, в составе которых 10
антигенсвязывающих центров; при этом каждый пентамер содержит одну копию полипептида с Л-цепью
525
Биохимия животных
(20 кДа), который синтезируется антителообразуюшсй клеткой и ковалентно
связывается между двумя соседними Р^-фрагментами иммуноглобулина.
ИНГИБИРОВАМИЕ — процесс, при котором ферментативная реакция в
присутствии ингибитора замедляется или полностью останавливается, в зависимости от типа
ингибирования.
ИНГИБИТОР — вещество, замедляющее или полностью останавливающее
скорость ферментативной реакции, которое по той или иной причине частично или
полностью препятствует образованию продуктивного фермент-субстратного комплекса;
ингибиторами могут быть лекарственные препараты, яды и другие вещества.
ИНТРОН (вставка) — участок в первичной последовательности ДНК и
транскрибируемый в структуру пре-РНК, информативность которого пока не установлена,
вырезаемый ферментами в процессе сплайсинга из пре-РНК.
ИОНЫ — это электрически заряженные частицы, образующиеся из нейтральных
атомов или молекул путем отдачи или приема электронов (N301 <-> №+ + С1~);
отрицательно заряженные ионы называются анионы, а положительно — катионы.
ИСКУССТВЕННЫЕ БИОГЕННЫЕ СИСТЕМЫ - это сконструированные
человеком искусственные микроорганизмы с минимальным количеством генетического
материала, достаточным для самостоятельной жизнедеятельности; создание И.б.с.
становится возможным благодаря крупномасштабным манипуляциям с ДНК, которые
позволили бы создать первую искусственную хромосому, а может быть, и целый
организм; идея создания первого искусственного микроорганизма была выдвинута
доктором Вентером еще в 1999 г.
К
КАРБОКС И ГЕМОГЛОБИН — гемоглобин, в котором атомы железа гемов связаны
с молекулами СО.
КАТАБОЛИЗМ (катаболические пути) — процессы ферментативного расщепления
биологических молекул (углеводов, жиров и белков), сопровождающиеся выделением
свободной энергии и запасанием ее в форме энергии фосфатных связей АТФ.
КАТАЛИТИЧЕСКАЯ КОНСТАНТА (кса1) - величина, показывающая
эффективность превращения субстрата в активном центре фермента; при этом, чем большие
значения принимает К.к., тем быстрее и эффективнее превращается субстрат в активном
центре фермента в ходе каталитического процесса.
КЕЙЛОНЫ — тканеслецифичные гормоны местного действия — представлены
белками или пептидами различной молекулярной массы.
КЕТОННЫЕ ТЕЛА — химические соединения (ацетоуксусная кислота, 3-гид-
роксимасляная кислота, ацетон), относящиеся к карбоновым кислотам (оксокисло-
там или кетокислотам), в составе которых кетонная группа; К.т. образуются
преимущественно в печени из ацетила-КоА при расщеплении жирных кислот и углеводов;
используются в периферических тканях и мозге в качестве основных энергетических
соединений, окисляясь в цикле трикарбоновых кислот; накопление К.т. в организме
наблюдается в результате голодания, при сахарном диабете, длительной физической
нагрузке, при резкой смене диеты и т. п.
КИНЕТОХОР — белковый комплекс, собирающийся на специализированной
последовательности хромосомной ДНК (центромера), к которому присоединяются
микротрубочки веретена, образующиеся во время деления клетки.
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ — в настоящее время, в соответствии с
типом катализируемой реакции, ферменты сгруппированы в 6 классов: 1 класс — окси-
526
Словарь терминов
доредуктазы; 2 класс — трансферазы; 3 класс — гидролазы; 4 класс — лиазы; 5 класс —
изомеразы; 6 класс — лигазы (синтстазы); неофициально к ферментам относят еше две
группы высокомолекулярных соединений: абзимы и рибозимы.
КЛЕТОЧНАЯ МЕМБРАНА (плазмалемма) — структурное образование,
изолирующее внутреннее содержание клетки от окружающей среды; К.м. состоит из
упорядочение расположенных молекул белков, липидов и углеводов; наружный и внутренний
слои элементарной мембраны образованы белковыми молекулами, а между ними
находятся два липидных слоя; белки располагаются как на поверхности К.м., так и
пронизывают ее насквозь, формируя проводные каналы транспортных систем метаболитов
клетки; поверхность К.м., обращенная наружу, отличается по химическому составу от
внутренней; К.м. обладает избирательной проницаемостью, регулируя, таким образом,
движение веществ в клетку и из клетки.
КЛЕТОЧНЫЙ ЦЕНТР — органоид, находящийся вблизи ядра клеток; состоит из
двух маленьких телец цилиндрической формы (центриолей), расположенных под
прямым углом друг к другу; К.ц. содержит ДНК и относится к самовоспроизводящимся
органоидам цитоплазмы; К.ц. участвует в делении клетки, с него начинается рост
микротрубочек, формирующих веретено деления.
КЛЕТОЧНЫЙ ЦИКЛ — промежуток времени между двумя делениями клетки; К.ц.
состоит из двух фаз — собственного деления клетки (митоза) и промежутка между
делениями — интерфазы; в период интерфазы происходят процессы синтеза биогенных
молекул, удвоение хромосом и рост клетки; деление клеток происходит у всех живых
организмов и является необходимым условием их существования.
КЛОНИРОВАНИЕ — процесс получения многочисленных копий чужеродного
гена, представляющего гомогенную популяцию молекул ДНК; клонирование ДНК
возможно благодаря способности бактериальных пластид и фагов продолжать
нормально функционировать после встраивания в их геном дополнительных
последовательностей ДНК.
КО ВАЛЕНТНАЯ СВЯЗЬ — связь, образованная между атомами за счет
обобществления их электронов, в электронных оболочках, в общую электронную пару; разная
электроотрицательность атомов, участвующих в образовании К.с, приводит к
возникновению поляризации этой связи; прочность ковалентной полярной связи меньше,
чем неполярной.
КОДОН — это три последовательно соединенных мононуклеотида в и РНК,
кодирующих определенную аминокислоту; генетический код для аминокислот является
вырожденным, т. К. некоторые аминокислоты закодированы 2...6 кодонами; всего
имеется 64 кодона три из которых не кодируют никакой аминокислоты; УАГ, УАА и УГА
обозначают конец матрицы: на этих триплетах обрывается дальнейшее наращивание
пептиЛной цепи — терминирующие триплеты.
КОМПАРТМЕНТЫ — отдельные специализированные элементы системы; так,
например, в клетках это органоиды, мультиферментные комплексы и т. д.
КОМПЛЕМЕНТАРНОСТЬ ДНК — специфическое расположение азотистых
оснований двух цепочек ДНК, избирательно соединенных между собой водородными
связями (А-Т, Г=Ц), обеспечивающее взаимную повторяемость нуклеотидов в цепях ДНК
в обратной последовательности.
КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - это тип ингибирования, когда
субстрат и ингибитор конкурируют за участок связывания в активном центре
фермента, причем связывание ингибитора препятствует последующему связыванию
субстрата и его превращению.
527
Биохимия животных
КОНКУРЕНТНЫЙ ИНГИБИТОР — соединение, структура которого сходна со
структурой субстрата; К.и. способен связываться в активном центре фермента,
занимая место субстрата, препятствуя его связыванию, что приводит к снижению
скорости ферментативной реакции.
КОНСТАНТА МИХАЭЛСА (Кт) — константа, по величине которой можно
определить сродство субстрата к ферменту, а также возможность образования фермент-
субстратного комплекса при протекании каталитического процесса в условиях
стационара; кроме этого, К.М. определяется как величина, численно равная концентрации
субстрата при скорости ферментативной реакции, составляющей половину
максимальной.
КОФАКТОР (кофермент) — низкомолекулярное соединение небелковой природы,
связанное с апобелком нековалентными связями в активном центре и участвующее в
каталитическом процессе; в отсутствие кофермента фермент не активен и
каталитическая реакция не протекает; к коферментам относятся: НАД, НАДФ, ФАД, ТПФ и др.;
предшественниками некоторых К. являются витамины (В, (тиамин) --> ТПФ (тиамин-
пи рофосфат), В2 (рибофлавин) -» ФАД (флавинадсниндинуклеотид), В3 (пантотеновая
кислота) ->ЗНКоА, В5 (никотиновая кислота)->ФП (фосфопиридоксин), В12 (цианоко-
баламин) -> МК (метилкобаламин), Вс (фолиевая кислота) -> ТГФК (тетрагидрофолие-
вая кислота), Н (биотин) -> КБ (карбоксибиотин).
КРОВЬ — подвижная тканевая система, составными частями которой являются
плазма (жидкость светло-желтого цвета, в составе которой белки, липопротеиды,
углеводы и др.) и форменные элементы (эритроциты, лейкоциты и тромбоциты).
КЭП — группировка в составе гена и и РНК, начинающаяся с 7-метилгуанозина;
К. необходим для стабилизации и РНК, предохраняя ее от расщепления 5-эндонукле-
азами.
Л
ЛЕЙКОПЛАСТЫ — бесцветные пластиды, по ультраструктуре ближе к проплас-
тидам, но более крупного размера; расположены Л. преимущественно в тканях и
органах растений, лишенных доступа света: спорах, гаметах, семенах, клубнях,
корневищах; Л. выполняют функцию по синтезу и накоплению запасных продуктов питания
(крахмала, белков, липидов).
ЛИАЗЫ — это класс ферментов, катализирующих реакции разрыва С-С, С-О, С^
и других связей в субстрате без присоединения молекулы воды или окисления; Л.
отличаются от других ферментов тем, что в катализируемых реакциях в одном
направлении участвуют два субстрата, а в обратной реакции только один; в названии фермента
присутствуют слова «декарбоксилаза», или «альдолаза», или «лиаза» (пируват-дека-
рбоксилаза, оксалат-декарбоксилаза, оксалоацетат-декарбоксилаза,
треонин-альдолаза, фенилсерин-альдолаза, изоцитрат-лиаза, аланин-лиаза, АТФ-цитрат-лиаза и др.),
а для ферментов, катализирующих реакции отщепления воды от субстрата — «дегид-
ратаза» (карбонат-дегидратаза, цитрат-дегидратаза, серин-дегидратаза и др.); в тех
случаях, когда обнаружена только обратная реакция, или это направление в реакции
более существенно, в названии ферментов присутствует слово «синтаза» (малат-синтаза,
2-изопропилмалат-синтаза,цитрат-синтазагидроксиметилглутарил-КоА-синтазаидр.);
Л. подразделяются на 6 подклассов.
ЛИ ГАЗЫ (синтетазы) — это класс ферментов, катализирующих реакции
соединения двух и более молекул, используя АТФ; в названии фермента присутствует слово
«синтетаза» (тирозил-тРНК-синтетаза, треонин-тРНК-синтетаза, ацетил-КоА-син-
528
Словарь терминов
тетаза, аспарагинсинтетаза, карбамоилфосфат-синтетаза, аргениносукцинат-синтетаза
и др), «карбоксил аза» (пируваткарбоксилаза, ацетил-КоА-карбоксил аза, пропионил-
КоА-карбоксилаза и др.); Л. подразделяются на 5 подклассов.
ЛИЗОСОМЫ (от греч. /уго — растворение, разложение и $ота — тело) —
органоиды, выполняющие лизируюшую, т. е. разрушающую функцию; размеры Л.
колеблются от 0,2 до 0,5 мкм; в Л. содержится набор гидролитических ферментов, гидроли-
зирующих белки, полисахариды, нуклеиновые кислоты, липиды и др. органические
соединения тфи внутриклеточном пищеварении; Л. обеспечивают постоянство
состава веществ в клетке; Л. участвуют в защите организма против вирусов, бактерий,
инородных тел, а также удаляют отжившие клетки и их части; таким образом, Л.
выполняют в клетке пищеварительную, защитную и выделительную функции.
ЛИМИТ ХЕЙФЛИКА — Леонид Хейфлик в начале 1960-х гг. установил, что в
клеточных культурах нормальные диплоидные (соматические) клетки человека способны
делиться лишь ограниченное число раз; при этом предельное число делений сильно
зависит от возраста индивидуума, которому эти клетки изначально принадлежали; так,
например, клетки новорожденных делятся в культуре 80...90 раз, а у 70-ти летнего
человека — только 20...30 раз; достигнув Л.X., клетки переходят в состояние одряхления,
вслед за которым наступает их гибель.
Л И МФА — прозрачная желтоватая жидкость, образующаяся из тканевой жидкости,
локализованная в лимфотических сосудах и капиллярах; Л. состоит из лимфоплазмы —
жидкой части, в составе которой белки и фибриноген, последний участвует в
свертываемости крови, и форменных элементов — лейкоцитов, среди которых больше всего
лимфоцитов, выполняющих фагоцитарную функцию.
ЛИМФОЦИТЫ — ядерные клетки крови, участвующие в иммунологических
реакциях организма; функционально различают два основных класса лимфоцитов: Т- и В-
лимфоциты; Т-лимфоциты, формируются в костномозговых клетках корковой части
долек тимуса, а В-лимфоциты, образуются из стволовых предшественников в фабри-
циевой сумке у птиц и миел овил ной ткани костного мозга у животных; механизм
действия Л. различается.
ЛИПИДЫ — это гетерогенная группа органических веществ, не растворимых или
плохо растворимых в полярных растворителях, но хорошо растворимых в неполярных
растворителях; различают следующие группы липидов: жирные кислоты, нейтральные
липиды, фосфолипиды, сфинголипиды, воска, стероиды.
ЛИПОГЕНЕЗ — процесс синтеза жирных кислот; протекает в цитоплазме клетки,
в качестве восстановителя при Л. используется НАДФН, образующийся в пентозо-
фосфатном цикле; синтез жирных кислот происходит при участии ацилпереносящего
белка.
Л И ПОЛ ИЗ — процесс окисления высших жирных кислот под действием
ферментов митохондриального матрикса; Л. протекает в митохондриях, кула жирные кислоты
доставляются с помощью переносчика — карнитина; в процессе Л. происходят
циклические превращения молекул жирных кислот с отщеплением от них лвууглеродиых
производных КоА (СН3-СО-$КоА) (Р-окисление жирных кислот) или одноуглсролных
производных КоА (а-окисление жирных кислот): протекание одного цикла окисления
жирной кислоты сопровождается синтезом по одной молекуле ФАДН и НАДН; Л.
является важнейшим энергетическим процессом в клетке, который обеспечивает синтез
самого большого количества АТФ; например, при окислении одной молекулы пальми-
тата (СН3(СН2)14СООН), образуется 131 молекула АТФ, две из которых используются
для активации пальмитата.
529
Биохимия животных
ЛИПОПРОТЕИНЫ — это сложные липопротеилные комплексы, в составе
которых белки (альбумин) и липиды (нейтральные ли пилы, фосфолипиды, холестерин
и его эфиры и др.); различают несколько классов Л.: Л. высокой плотности (ЛПВП),
Л. низкой плотности (ЛПНП), Л. очень низкой плотности (ЛПОНП) и хиломикроны
(ХМ).
М
МАКРОЭЛЕМЕНТЫ — это элементы биогенных систем, присутствующие в
организме животных и человека в миллимолярных (и выше) концетрациях; к этой группе
элементов можно отнести №+, К4", Са2+, Мв2"1", Ре2+, Ре3+, Р, С1", 5; при этом их
действие проявляется только в составе белков и биологически активных соединений или
биогенных структур; так, например, №* и 1С1" участвуют в создании трансмембранного
потенциала, активизации Ыа*/К*-АТФазы; Са2"*" необходим для формирования
костной ткани, проведения нервного импульса, он активирует VIII фактор свертываемости
крови, участвует в мышечном сокращении, стабилизирует белки; М§2+ активирует
АТФазу мышц, участвует в действии АТФ зависимых ферментов (глюкоза-6-фосфатде-
гидрогеназа, пируваткиназа, гексокиназа и др.); Ре2* участвует в действии гемоглобина,
миоглобина, трансферрина, ферритина; Ре3* входит в состав цитохромов и гемсодержа-
ших ферментов (пероксидаза, катал аза, цитохром с пероксидаза), белка молока лакто-
феррина; фосфор (Р) является составной частью костной ткани и зубов, компонентом
нуклеотидов (АТФ, ГТФ, ЦТФ) и нуклеиновых кислот (Д Н К, РН К), коферментов (НАД,
НАДФ, ФАД, ФМН, КоА); СГ обеспечивает поддержание трансмембранного
потенциала, используется слизистой кишечника для секреции соляной кислоты; сера (5) входит
в состав аминокислот (метионин, цистеин) и сульфатов, обезвреживающих некоторые
яды (индол, скатол).
МАТРИЧНАЯ (информационная) РНК синтезируется в процессе транскрипции
и содержит точную копию генетической информации, закодированной в
определенном участке ДНК; информация об аминокислотах, которые будут включены в
первичную структуру полипептидной цепи, передается с помощью кодонов (триплетов) в
составе иРНК.
МЕЙОЗ (от греч. те/ого — уменьшение) — процесс, в результате которого
образуются половые клетки (гаметы) — яйцеклетки и сперматозоиды (или спермин у
растений) — имеющие одинарный (гаплоидный) набор хромосом (/?); в процессе М.
происходит одно удвоение и два деления — редукционное и эквационное (равное); каждое
состоит из следующих фаз: интерфазы, профазы, метафазы, анафазы и телофазы;
первое деление (редукционное): в интерфазе I — удвоение (редупликация) хромосом (2л);
в профазе I — спаривание (конъюгация) удвоенных гомологичных хромосом (2л),
которые образуют биваленты, состоящие из четырех хроматид, и одновременно спира-
лизация, укорочение и утолшение хромосом; к концу профазы I исчезает ядерная
мембрана и ядрышко, формируется ахроматиновое веретено; в метафазе 1 — сбор
хромосом (2л) в экваториальной плоскости, к центромере присоединяется тянущая нить
ахроматинового веретена; в анафазе I — движение хромосом (2л) к полюсам клетки;
в телофазе 1 — деление клетки, в каждую клетку попадает только по одной удвоенной
хромосоме (л); второе деление: интерфаза II — короткая без удвоения хромосом (л);
профаза II — как в митозе (л); метафаза II — хромосомы (л) выстраиваются на
экваторе клетки; анафаза II — расхождение хроматид (л) к полюсам; телофаза И — деление
обеих клеток, в результате из двух гаплоидных клеток возникают четыре тоже
гаплоидные (л) клетки.
530
Словарь терминов
МЕМБРАНЫ (от лат. тетЬгапа — перепонка) — специализированные
структурные элементы клетки и ее органоидов, состоящие из липидов (фосфолипидов,
насыщенных и ненасыщенных жирных кислот), стеринов, гл и кол и п идо в и белков: М.
выполняют следующие основные функции: барьерную, транспортную, осмотическую,
электрическую, биосинтетическую, секреторную, пищеварительную, рецепторно ре-
гуляторную и др.
МЕТАБОЛИЗМ (обмен веществ) — совокупность биохимических процессов,
протекающих в организме и обеспечивающих его жизнеспособность.
МЕТАБОЛИТЫ — промежуточные продукты ферментативных реакций,
протекающих в клетке.
МЕТАБОЛОЙ — надмолекулярный комплекс ферментов, катализирующих
последовательные стадии метаболического пути и структурных элементов клетки, т. е. в
состав М. включается не тол:.ко комплекс ферментов, выполняющих определенную
метаболическую функцию, но и опорный участок клеточной структуры (участок мембраны,
цитоскелет и т. п.), на котором комплекс адсорбирован; примером такого М. может
служить комплекс гликолитических ферментов вместе с белками в мембране эритроцитов
или актин в составе цитоскелета.
МЕТГЕМОГЛОБИН — гемоглобин, атомы железа которого находятся в
окисленном состоянии Ре+3; метгемоглобин не присоединяет ни 02, ни СО; образование
такой формы гемоглобина в организме животного и человека, приводит к развитию у них
кислородного голодания.
МЕТОД МОНОКЛОНАЛ ЬНЫХ (ОДИНАКОВЫХ ПО СТРОЕНИЮ) АНТИТЕЛ -
метод, позволяющий с помощью дол гоживущих клеточных клонов получать
единообразные по всем признакам антитела заданной специфичности.
МИКРОЭЛЕМЕНТЫ — к группе микроэлементов относят Мп2\ Си2+, 2п2+,
Со2+, Мо2+, I *, Сг3"1". Р", Вг~; действие элементов проявляется только в составе
белков и биологически активных соединений; так, например, Мп2ь активирует АТФ
зависимые ферменты; Си2* входит в состав цитохромоксидазы, пластоцианина, ти-
розиназы, уратоксидазы, полифенолоксидазы и др., белка крови церулоплазмина,
участвует в процессе эритропоэза; 2п2+ входит в состав карбоангидразы, карбокси-
полипептидазы, лактатлегидрогеназы, глютаматлегидрогеназы; Со2+ активирует
витамин В12, входит в состав тра нефе раз, изомера:*, дипептидазы, активирует пируват-
карбоксилазу, рибофлавинкиназу, аргиназу, щелочную фосфатазу; Мо2+ присутствует
в составе ксантиноксидазы; I- содержится в составе гормонов щитовидной железы
(тироксина, трийодтиронина); Сг3+ активирует фосфоглюкомутазу и трипсин; Р-
накапливается в костной ткани зубов и скелетных костей; Вг принимает участие в
биосинтезе гормонов гипофиза.
МИОЗИН — белок толстых филаментов поперечнополосатых мышц; имеет в
составе две тяжелые (по 200 кДа) и 2...4 легкие (по 15...27 кДа) полипептидные цепочки;
тяжелые цепи переплетаются формируя вытянутые в длину фибриллярные структуры,
тогда как легкие цепи закручиваются в клубок, образуя головную часть белка; около
400 молекул М. могут связываться в структурное образование, которое называется фи-
ламентом; при этом головки миозина располагаются упорядочен но по спирали таким
образом, что каждая головка четвертой пары располагается на одной линии с одной из
головок первой пары, формируя структуры, проявляемую в центре зоны Н в виде М-ли-
нии, где происходит стык двух миозиновых нитей, направленных в противоположные
стороны, причем каждый миозиновый филамент находится в окружении шести акти-
новых, а каждый актиновый филамент окружен тремя миозиновыми; М. способен гид-
531
Биохимия животных
ролизовать АТФ на АДФ и фосфат неорганический, не освобождая продукты
гидролиза, однако высвободившаяся при этом энергия расходуется на движение актиновых
нитей; этот процесс протекает в присутствии ионов кальция.
МИТОХОНДРИИ (от греч. тИо$ — нить, сНопйпоп — зерно, гранула) — орга-
неллы, выполняющие энергетические функции в клетке; диаметр М. около 0,1...0,5
мкм, длина — от 1 до 10 мкм; М. состоят из двух мембран (наружной и
внутренней) и внутреннего пространства (матрикса); наружная мембрана М.
регулирует поступление и выделение веществ; внутренняя мембрана М. образует к
центру складки — кристы (ткани животных) и извилистые трубки в клетках растений,
увеличивающие рабочую поверхность, на которой расположены ферменты,
катализирующие окислительно-восстановительные реакции; в матриксе М.
находятся ферменты цикла трикарбоновых кислот и ферменты, окисляющие липиды
(жирные кислоты); основной функцией М. является синтез АТФ; в матриксе
М. находятся рибосомы и молекулы ДНК.
МИТОЗ (от греч. т'поз — нить) (кариокинез) — основной способ деления ядер
клеток, после которого обычно следует деление всей клетки — цитотомия, отсутствие
которой приводит к образованию двух- и многоядерных клеток; можно выделить
следующие стадии М. с кратким описанием протекающих в них процессов: профаза —
увеличение ядра в объеме, исчезновение ядерной оболочки, хромосомы приобретают вид
толстых нитей, формируется ахроматиновое веретено, делится клеточный центр и цен-
трьоли расходятся к полюсам клетки; метафаза — укорочение хромосом и
расположение их в экваториальной плоскости, соединение нитей веретена с центромерами,
расположенными на полюсах клетки; анафаза — деление центромеры, движение хромосом
к полюсам клетки; телофаза — деспирализация хромосом, образование ядерной
мембраны, восстановление ядрышек, формирование межклеточной мембраны,
возникновение двух новых клеток.
МИЦЕЛЛЫ — это упорядоченные структуры гетерогенного состава, чаще всего
шарообразной формы и различных размеров, формирующиеся неполярными
молекулами в полярной среде или полярными молекулами в неполярной среде (обращенные
мицеллы), стабилизированные за счет слабых связей (гидрофобных, гидрофильных,
ионных, водородных и др.) в ассоциированные образования под воздействием молекул
растворителя и условий среды (температура, рН, ионная сила и др.).
МИЭЛ ИН — гидрофобное вещество, входящее в состав нервных волокон и
состоящее в основном из сфингомиелина.
МОБИЛЬНЫЕ ДИСПЕРГИРОВАННЫЕ ГЕНЫ (МДГ) - гены, представленные
в ДНК в виде нескольких копий и перемешающиеся (мигрирующие элементы ДНК) из
одной части генома в другие.
МУЖСКИЕ ПОЛОВЫЕ ГОРМОНЫ — основным местом синтеза М.п.г. являются
семенники (и частично — яичники и надпочечники); предшественником стероидных
гормонов является холестерол, превращение которого в митохондриях приводит к
образованию основных половых гормонов (тестостерон, дигидротестостерон, андросте-
рон); андрогены стимулируют процесс сперматогенеза в семенниках, их активность
обусловливает дифференцировку пола, проявление половых рефлексов; действие ян-
дрогенов проявляется через стимуляцию процессов биосинтеза.
МУТАЦИИ (от лат. тШаИо — изменение) — случайные повреждения генного
аппарата клеток вследствие воздействия радиоактивного и ультрафиолетового излучения
или химических соединений (мутагенов), приводящих к изменению числа хромосом,
или нарушению последовательности генов внутри одной хромосомы (инверсия), или
532
Словарь терминов
потере части хромосомы (делеция), или присоединению хромосом друг к другу (транс-
локаиия) и т. д.; некоторые М. могут приводить к гибели организма или развитию
бесплодия, способствовать появлению различных заболеваний; М., возникшие в клетках
организма с диплоидным набором хромосом (соматических), не наследуются, кроме
случаев бесполого размножения или клонирования.
МУТАЦИОННАЯ ИЗМЕНЧИВОСТЬ — вид изменчивости, вызываемый
повреждением в генотипе.
МЫШЕЧНЫЕ ТКАНИ — это специализированные ткани, предназначенные для
осуществления двигательной активности, в основе действия которых — сократительная
способность белков; мышечные ткани подразделяют на гладкие (неисчерченные),
поперечнополосатые (исчерченные) и специализированные сократительные ткани;
поперечнополосатая мышечная ткань подразделяется на скелетную и сердечную; к
специализированным сократительным тканям относят миоэпителиальные клетки молочной,
лотовой и слюнных желез.
МЫШЦЫ — часть опорно-двигательной системы; обеспечивают сокращение
конечностей, движение органов и систем и за счет этого — работу и
функционирование животных организмов; М. поддерживают определенную ориентацию и
перемещение тела в пространстве, осуществляют дыхательные движения грудной клетки и
диафрагмы, глотание, движение глаз, работу внутренних органов (сердца, кишечника,
желудка и др.); в составе мышц белки: актин, миозин, актомиозин, тропомиозин.
Н
НАДПОЧЕЧНИКИ — это парные железы, имеющие овальную или вытянутую
форму и расположены вблизи почек; состоят из двух структур: мозгового (эктодермаль-
ные клетки) и коркового (мезодермальная железистая ткань) вещества; корковое
вещество располагается снаружи мозгового вещества, расположенного в центральной
части надпочечников, в составе которого хромаффинные клетки, симпатические
нейроны, нервные окончания и синусоидные капилляры; удаление Н. у животных
приводит к сгущению крови, снижению артериального давления, желудочно-кишечным
расстройствам, астении, понижению температуры тела, развитию гипогликемии,
снижению обмена веществ, потере натрия и калия.
НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ — кислоты, синтезирующиеся только в
растениях и микроорганизмах и не образующиеся в организме животных и человека; к Н.а.
относятся лизин, аргинин, гистидин, валин, лейцин, изолейцин, треонин, метионин,
фенил алан ин, триптофан.
НЕЙРОМЕДИАТОРЫ (нейротрансмиттеры) — вещества, осуществляющие
передачу нервных импульсов от одного нейрона к другому и на и нервируемые ими клетки,
ткани и органы; Н. секретируются нервными окончаниями и при передаче импульса
выделяются в синаптическую щель; в результате взаимодействия Н. со
специфическими рецепторами мишени трансформируется постсинаптическая мембрана и
изменяется ее ионная проницаемость, вследствие этого инициируются реакции,
заставляющие постсинаптическую нервную клетку или клетку и нервируемой ткани или органа
выполнять свои специфические функции; к Н. относятся адреналин, ацетилхолин, но-
радреналин, дофамин, серотонин, ГАМК, глицин и глутамат.
НЕКОНКУРЕНТНАЯ АКТИВАЦИЯ проявляется в случае, если субстрат и
активатор связываются независимо в различных участках активного центра фермента; при
этом образуется тройной комплекс, в составе которого фермент-субстрат-активатор;
связывание активатора ускоряет протекание каталитического процесса.
533
Биохимия животных
НЕКОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ - этот тип ингибирования
проявляется в том случае, когда ингибитор и субстрат связываются в разных участках активного
центра фермента-; однако при связывании ингибитора образуется
фермент-субстратный комплекс,- превращение в котором субстрата становится невозможным.
НИКИ — однонитевидные разрывы в структуре ДНК.
НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД (НАД+) - сложное биологически
активное соединение, функционально активной частью которого является н и коти на-
мил — амидированное производное витамина РР; НАД* выполняет роль акцептора
протонов и электронов в реакциях, катализируемых
окислительно-восстановительными ферментами, восстанавливаясь до НАДН; в митохондриях при окислении одной
молекулы НАДН синтезируются три молекулы АТФ.
НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ (НАДФФ) - фосфори-
лированная форма НАД+; участвует в катализируемых
окислительно-восстановительными ферментами реакциях в качестве кофермента; восстановленная форма НАДФН
генерируется преимущественно ферментами пентозофосфатного цикла и используется
в процессе синтеза жирных кислот — липогенезе.
НОМЕНКЛАТУРА ФЕРМЕНТОВ — ферменты, входящие в один класс, в
соответствии с особенностями катализируемых реакций, группируются в подкласс и под-
подкласс; при этом они приобретают систематическое название и кодовую нумерацию
(шифр); первое число шифра означает класс, второе и третье — подкласс и подподкласс
соответственно, а четвертое число — порядковый номер фермента в подподклаесс.
НОРМА РЕАКЦИИ (для модификационной изменчивости) — пределы, в рамках
которых может происходить модификационная изменчивость признака, определяемая
видовой специфичностью организма; Н.р. задает семенную продуктивность у растений
и величину живой массы у животных и т. д.
НУКЛЕИНОВАЯ КИСЛОТА (РНК и ДНК) — биополимер, в состав которого
входят пуриновые и пиримид и новые азотистые основания (аденин, гуанин, цитозин, ура-
пил, тимин), а также моносахариды пентоз (рибоза или дезоксирибоза), связанные
между собой остатками фосфорной кислоты.
НУКЛЕОЗИДЫ — соединения, в которых азотистые основания (пурины и пи-
римилины) связаны г^-гликозидной связью с рибозой или дезоксирибозой (адено-
зин, гуанозин, тимидин, уридин, цитидин).
НУКЛ ЕОТИДЫ — фосфорные эфиры нуклеозидов, например, адениловая кислота
(АМФ), гуаниловая кислота (ГМФ), цитидиловая кислоты (ЦМФ), уридиловая кислота
(УМФ), тимидиловая кислота (ТМФ) (а также они могут называться: аденозин-5'-фос-
фат, гуанозин-5'-фосфат, цитидин-5'-фосфат, уридин-5'-фосфат, тимидин-5'-фосфат).
О
ОБЛИГАТНЫЕ ПАРАЗИТЫ — организмы, которые способны воспроизводить
себя только внутри живой клетки, например вирусы, грибы.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛ ИРОВАНИЕ - процесс образования АТФ
(процесс фосфорилирования АДФ), сопряженного с транспортом электронов по цепи
переносчиков от НАДН или ФАДН к 02 (процесс окисления); О.ф. катализируется
четырьмя ферментативными комплексами, расположенными на внутренней мембране
митохондрий; комплекс 1 — НАДН: убихинон-оксидоредуктаза (ФМН, Ре$), комплекс
II — сукцинат: убихинон-оксидоредуктаза (ФАД, Ре5), комплекс III — убихинон: фер-
рицитохром с- оксидоредуктаза (цит Ь и с, Ре5), комплекс IV — ферроиитохром с-кис-
лород-оксидоредуктаза (цит а и а3, Си).
534
Словарь терминов
ОКИСЛИТЕЛЬНЫЙ СТРЕСС — стресс, возникающий у организмов под
воздействием свободных радикалов кислорода; живые организмы активно потребляют
кислород, который может вызывать окислительное повреждение тканей; в развитии
окислительного стресса играют роль активные формы кислорода (АФК).
ОКСИ ГЕМОГЛОБИН — гемоглобин, в котором атомы железа каждого из гемов
обратимо связаны с молекулой кислорода (02).
ОКСИДОРЕДУКТАЗЫ — это класс ферментов, катализирующих реакции
окисления и восстановления; оксидоредуктазы подразделяются на 17 подклассов; субстраты
оксидоредуктаз являются донорами атомов водорода и электронов и поэтому ферменты
этого класса называются дегидрогеназами, или редуктазами.
ОЛИГОСАХАРИДЫ — производные углеводов, содержащие от 2 до 10 остатков
моносахаридов, соединенных О-гликозидной связью; основными о. являются лактоза,
сахароза, мальтоза, целлобиоза, трегалоза.
ОПЕРАТОР — регуляторный участок ДНК, служащий местом связывания репрес-
соров — белков, контролирующих синтез пре-РНК.
ОПЕРОН (транскриптон) — это участок в структуре гена, являющийся
элементарной единицей транскрипции, ограниченный промотором и терминатором,
участвующий в процессе биосинтеза молекулы пре-РНК у прокариот и эукариот; в структуре
оперона различают два участка: информативный и неинформативный.
ОПИОИДНЫЕ ПЕПТИДЫ — группы нейропептидов (эндорфинов, энкефалинов
и др.), оказывающих регулирующее действие при передаче нервных импульсов в ряде
отделов центральной системы (ЦНС); взаимодействуя с рецепторами О.п.
обеспечивают восприятие боли, влияние гормонов на обмен веществ, воздействуют на
сердечнососудистую деятельность, стрессовые реакции и т. д.
ОСТЫВШЕЕ МЯСО — мясо, остывавшее после разделки туши в естественных
условиях или в охлажденных камерах не менее 6 часов; имеет поверхностную корочку
подсыхания и упругую консистенцию.
ОТВЕТНАЯ РЕАКЦИЯ — проявление действия функциональных систем в ответ
на внешний раздражитель или действующий фактор.
ОХЛАЖДЕННОЕ МЯСО — мясо, охлажденное до температуры 0...4'С, имеющее
плотную корочку подсыхания, полностью созревшее О.м. имеет самые высокие
питательные свойства.
V
п
ПАРАЗИТ — организм, живущий внутри другого организма (хозяина) или на нем;
организм-хозяин обеспечивает П. пищей и убежищем; хозяином может быть любой
организм, причем П., как правило, наносит вред своему хозяину, отравляя его продуктами
своей жизнедеятельности.
ПАРАЗИТИЗМ — форма сосуществования организмов, когда паразитирующий
организм (паразит) использует другой организм (хозяина) в качестве источника
питания; к П. относятся грибы, бактерии и вирусы, живущие на теле хозяина (вши, клещи,
грибы), в тканях или полости тела (бактерии, глисты), внутри клеток (вирусы).
ПАТОГЕНЫ — паразиты, вызывающие различные заболевания.
ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ОКИСЛЕНИЯ УГЛЕВОДОВ - процесс, в
котором происходит ступенчатый окислительный распад гексоз до пентоз и других Сахаров
с более короткой цепью; значение П.п.о.у. состоит в том, что он генерирует в
цитоплазме НАДФН, необходимый для синтеза жирных кислот и стероидов; активность пен-
тозофосфатного пути особенно высока в клетках печени, молочной железе, жировой
535
Биохимия животных
ткани и коре надпочечников; П.п.о.у. поставляет пентозофосфаты для синтеза
нуклеиновых кислот и нуклеотидов; суммарное уравнение реакций П.п.о.у. имеет
следующий вид:
6Глюкозо-6-фосфат + 7Н20 + 12НАДФ'+ -►
-► 5Глюкозо-6-фосфат + 6С02 + 12НАДФН + 12Н+ + Фн
в П.п.о.у. АТФ не синтезируется и не расходуется.
ПЕПТИДНАЯ СВЯЗЬ — ковалентная полярная связь, образованная между
углеродом одной аминокислоты и азотом другой, при соединении двух аминокислот между
собой; П.с. относится к ковалентной полярной связи, обеспечивает стабильность
первичной структуры белков (-1ЧН-СО-).
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ - последовательное
соединение а-аминокислот в полипептидную цепь, связанных между собой за счет
пептидной связи согласно генетической информации, заложенной в ДНК.
ПЕРВИЧНАЯ СТРУКТУРА ДНК — структура, образованная за счет
последовательного соединения мононуклеотидов в полинуклеотидную цепь, связанных между
собой сложноэфирной связью, образованной фосфатными остатками (3',5'-фосфодиэ-
фирная связь) одного мононуклеотида. .
ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ — процесс окисления
ненасыщенных жирных кислот продуктами свободнораликального окисления; активно протекает
в микросомальных системах печени и других тканях; генерация супероксидного
радикала может происходить в результате активности МОФН-цитохром-Ь5-редуктазы, ми-
тохондриальной ЫАОН-дегилрогеназы, ксантиноксидазы и пероксилазы, а также
фотодинамического действия света на хлорофилл, приводящего к образованию синглетного
кислорода или супероксид радикала; процесс начинается стадией инициирования,
причем в роли инициаторов в основном выступают супероксидный или гидроксильный
радикалы; это наиболее реакционноспособные промежуточные соединения кислорода,
обладающие большим сродством к электрону, способные модифицировать молекулы
белков, нуклеиновых кислот, разрушать липилные компоненты мембран клеток и т.д.
ПЕРОКСИДАЗА (КФ 1.11.1.7) — самый распространенный фермент растительных
и животных тканей; П. относится к группе двухкомлонентных ферментов (железогли-
копротеин), в составе которых гемин (протопорфирин IX в комплексе с трехвалентным
железом) и полипептидная цепь; П. катализирует реакции оксидазного, оксигеназного
и пероксидазного окисления субстратов.
ПИ РАН — шестичленный цикл, в состав которого входит атом кислорода.
ПИРЕНОИД — белковое образование в хлоропласта* водорослей, в составе
которого рибулозобифосфаткарбоксилаза, осуществляющая фиксацию двуокиси углерода и
таким образом участвующая в запасании углеводов, например, крахмала.
ПЛАЗМАЛЕММА - см. КЛЕТОЧНАЯ МЕМБРАНА.
ПЛАЗМ ИДЫ — добавочные маленькие кольцевые молекулы ДНК, присутствие
которых необязательно для жизни клетки; П., содержащиеся в цитоплазме многих
бактерий, способны автономно размножаться, стабильно наследоваться, т. е. сохраняться
без специфической селекции во внехромосомном состоянии; кроме бактерий П. иногда
содержат сине-зеленые водоросли, а из эукариотических организмов — дрожжи.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА — железа, секретирующая гормоны: инсулин,
глюка гон, соматостатин, секретин и панкреатический полипептид; гормоны П.ж. оказы-
536
Словарь терминов
вают антигипсргликемическое действие, активируют высвобождение липидов из
жировой ткани, влияют на секрецию желудочных и панкреатических ферментов, угнетают
перистальтику кишечника и желчного пузыря, действуют на клетки-мишени мышц,
печени, молочной железы и жировой ткани, а также на фибробласты и лимфоциты;
через действие на рецепторную систему мембраны клетки ускоряют процессы активного
транспорта глюкозы в клетку, понижая ее содержание в крови; кроме того, они
способны активировать деятельность аденилатциклазной системы, которая повышает
активность киназы фосфорилазы, ускоряя протекание гликогенолиза.
ПОЛИСАХАРИДЫ — высокомолекулярные полимерные производные углеводов,
образованные из последовательно соединенных моносахаридов, связанных между
собой О-гликозидной связью; основными представителями П. являются: крахмал,
гликоген, целлюлоза, хитин, агар-агар.
ПОЛИНДРОМЫ (перевертыши) — участки ДНК, содержащие
последовательности нуклеотидов, повторяющиеся в обратном порядке.
ПОПЕРЕЧНОПОЛОСАТАЯ МЫШЕЧНАЯ ТКАНЬ - это ткань, имеющая
поперечнополосатую исчерченность; составляет основу туловища, головы, конечности,
глотки, гортани, верхней половины пищевода, языка, жевательных мышц; у
дифференцированной скелетной мышечной ткани нет клеточного строения, так как
основным структурным образованием являются мышечные волокна (миофибриллы),
представленные в виде длинных цитоплазматических продольно ориентированных тяжей с
закругленными концами, переходящими в сухожилие.
ПРАЙМАЗА — фермент, синтезирующий затравки (праймеры).
ПРАЙМЕР — небольшой участок ДНК, используемый в качестве затравки при ее
синтезе.
ПРИЗНАК — это совокупность показателей живого организма, проявляющих его
индивидуальные свойства и особенности строения.
ПРИОНЫ — инфекционные агенты, идентифицированные как белковые
молекулы, обладающие устойчивостью к действию протеолитических ферментов; П.
человека переносят заболевания нервной системы (куру или смеющаяся смерть); П.
переносят также болезнь овец (скрэпи или почесуха), коз, оленей, мышей, хомяков и др.;
у крупного рогатого скота (сумасшествие коров).
ПРИСПОСОБИТЕЛЬНЫЙ МЕХАНИЗМ - это проявление возможности
метаболических систем и процессов, обеспечивающих выживание организма в определенных
условиях.
ПРОДУКТ — вещество, которое образуется из субстрата в результате химической
(ферментативной) реакции.
ПРОДУЦЕНТЫ — автотрофные организмы (производители), синтезирующие
органические вещества из неорганических; к П. относятся зеленые растения, водоросли.
ПРОМОТОР — участок ДНК, служащий местом связывания ДНК-зависимой
РНК-полимеразы, участвующий в регуляции синтеза пре-РНК.
ПРО ПЛАСТИДЫ — незрелые пластиды, содержащиеся в эмбриональных клетках
растений; П. имеют оболочку, состоящую из двух цитоплазматических мембран и
полость, заполненную бесструктурным матриксом; внутренняя мембранная структура П.
развита очень слабо, представлена обычно одиночными цистернами или трубочками и
пузырьками, расположенными без определенной ориентации; П. могут превращаться
в лейкопласты, хлоропласты и хромопласты.
ПРОСТАГЛАНДИНЫ — биологически активные вещества липидной природы,
представляющие собой оксигенированные производные полиненасыщенных жирных
537
Биохимия животных
кислот, содержащие в углеводородной цепи пятичленные циклы; обнаружены П. почти
во всех тканях млекопитающих; обладают П. исключительно высокой и разносторонней
физиологической активностью; не накапливаются в тканях и органах в свободном виде,
а синтезируются внутриклеточными ферментами в ответ на биологический стимул,
оказывают свое действие главным образом в непосредственной близи от места образования;
П. способствуют расширению сосудов, уменьшению кровяного давления, увеличивают
сердечный выброс; являются ингибиторами тромбообразования в сосудах, могут
прерывать беременность практически на любом сроке, оказывают седативное и
транквилизирующее (успокаивающее) действие, расслабляют мышцы бронхов и трахей; в медицине
П. применяются при лечении сердечно-сосудистых, аллергических, воспалительных,
гинекологических заболеваний.
ПРОСТЕТИЧЕСКАЯ ГРУППА— низкомолекулярное соединение небелковой
природы, прочно связанное с апобелком, выполняющая активную роль в ферментативном
катализе, при отсутствии которой фермент не активен; к П. г. относятся: гем в перокси-
дазе и каталазе, изоаллоксази новое кольцо в флавиновых ферментах и др.
ПРОТЕОЛИЗ — процесс гидролитического разрушения нативной структуры
белков; большинство внутриклеточных белков заканчивают существование в результате
протеолитического гидролиза, превращаются в небольшие пептиды и свободные
аминокислоты, которые утилизируются в синтезе новых белков; многие протеолитические
ферменты используют в качестве субстратов индивидуальные белки; имеется
множество протеиназ широкой субстратной специфичности, чья неразборчивость в
субстратах компенсируется их строгой компартментализацией; они локализованы в лизосомах
и вакуолях, где гидролизуют любые белки после их попадания в эти органеллы; такая
компартментализация протеолитических ферментов является жизненно важным
условием существования клетки; система протеолитической деградации внутриклеточных
белков с участием протеосом и убиквитина отличается от вышеописанных систем тем,
что, обладая широкой субстратной специфичностью, она безопасна для окружающих
белков и реагирует на регуляторные воздействия.
ПРОЦЕССИИ Г (посттранскрипционная модификация) — процесс формирования
зрелых молекул РНК (тРНК, иРНК, рРНК) из неактивного предшественника (пре-
РНК) в эукариотической клетке; в результате П. происходят следующие действия:
отрезание «лишних» концевых последовательностей; расщепление длинных первичных
транскриптов, вырезание их них участков, транскрибированных с интронов;
добавление нуклеозидов к З'-концу транскрипта; добавление нуклеотидов к 5'-концу
транскрипта; модификация оснований в транскрипте; при этом конечным этапом П.
является метилирование мРНК, в результате которого на каждые 400 остатков аде ни нов
приходится один остаток 6-метиладенина; П. завершается тем, что функционально
активная мРНК в виде нуклеопротеидного комплекса, в составе которого набор бел-
ков-информоферов, покидает ядро клетки через поры в ядерной мембране, поступая
в цитоплазму для трансляции.
ПЦР (полимеразная цепная реакция) — это метод, который позволяет найти в
исследуемом клиническом материале небольшой участок генетической информации
любого организма среди огромного количества других участков и многократно
размножить его; метод ПЦР основан на принципе естественной репликации ДНК,
включающем расплетение двойной спирали ДНК, расхождение нитей ДНК и
комплиментарное дополнение обеих; репликация ДНК может начаться не в любой точке, а только
в определенных стартовых блоках — коротких двунитевых участках; суть метода
заключается в том, что, маркировав такими блоками специфический только для данного вида
538
Словарь терминов
(но не для других видов) участок ДНК, можно многократно воспроизвести (амплифи-
цировать) именно этот участок.
Р
РЕАКЦИОННАЯ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ МОЛЕКУЛ - это
проявление их химических свойств, которые зависят от качественного и количественного
состава атомов, их расположения в молекуле, а также возможности проявить себя в
составе различных функциональных групп и взаимного влияния этих групп друг на друга,
с проявлением влияния условий среды.
РЕДУЦЕНТЫ — гетеротрофные организмы (бактерии, грибы), способные
расщепить остатки органических продуктов жизнедеятельности высших организмов; Р.
необходимы для разложения веществ и круговорота элементов в природе, они
формируют гумус из остатков животных и растений, а также из различных органических
веществ.
РЕКОМБИНАНТНЫЙ БЕЛОК — это белок, полученный искусственным путем,
в состав полипептидной цепи которого введены чужеродные аминокислоты; Рб.
получают путем встраивания в процессе транскрипции в первичную структуру белка
новых аминокислот, искажающих его естественную аминокислотную
последовательность.
РЕКОМБИНАНТНАЯ ДНК — это измененные, химерные молекулы ДНК,
составленные из фрагментов разного происхождения, или в структуру нагивной ДНК
введены чужеродные последовательности или новые гены.
РЕПАРАЦИЯ — процесс восстановления поврежденных участков ДНК.
РЕПЛИКАЦИЯ — процесс синтеза ДНК путем ее удвоения; синтез одной
дочерней цепи происходит в направлении 5'->3' осуществляется непрерывно, в то время как
синтез второй цепи в направлении 3'->5' происходит прерывисто путем соединения
коротких фрагментов, называемых фрагментами Оказаки, синтезируемых в
противоположном направлении.
РЕПРЕССИЯ ГЕНОВ — ингибированис процесса транскрипции (или трансляции)
белком-репрессором за счет его специфического связывания с регуляторным участком
в структуре ДНК или РНК.
РЕСПОНСИВНЫЙ ЭЛЕМЕНТ — последовательности энхансера (усилителя) или
промотора ДНК, к которым прикрепляются тканеспецифичные регуляторные
молекулы; так, Рэ. цАМФ состоит из последовательности -АЦГТЦА- и эту
последовательность узнают цАМФ, активируясь путем фосфорилирования с помощью цАМФ-зави-
симой протеинкиназы.
РЕТРОТРАНСПОЗОНЫ — это участки клеточного генома, в которых
закодированы обратные транскрилтазы.
РИБОСОМЫ — органеллы клетки (15...35 нм), синтезирующие белки из
аминокислот, последовательно соединяя их согласно информации, содержащейся в ДНК;
располагаются свободно в цитоплазме или фиксированы на эндоплазматической
сети; имеются и в составе ядра клетки; Р состоят из двух субъединиц (малой и
большой), образующих функционально активную димерную форму только при наличии
мРНК; несколько объединенных рибосом формируют цепочки — полисомы или
полирибосомы; рРНК обеспечивает контрольную функцию при считывании
информации с мРНК, а тРНК осуществляет распознавание, специфичное связывание и
транспортировку аминокислот к месту синтеза полипептидной цепочки на рибосоме; для
каждой из 20 аминокислот имеется своя тРНК, в структуре которой имеется антико-
539
Биохимия животных
дон; распознавая соответствующий у мРНК кодон тРНК способна связаться с
рибосомой, а затем обеспечить присоединение аминокислоты к растущей полипептидной
цепочке.
РИЛИЗИНГ-ФАКТОР (регуляторыый фактор) — низкомолекулярные
полипептиды, вырабатываемые в гипоталамусе, выполняющие роль мессенджеров
(посредников), посредством которых осуществляется передача нервных импульсов на
эндокринную систему; Р-ф., способствующие образованию гормонов гипофиза,
называются либерины, а ингибирующие — статины (например, кортиколиберины, про-
лактостатины).
С
САЙТ — короткая последовательность нуклеотидов в составе ДНК, РНК или
аминокислот в белке.
САПРОФИТЫ — организмы, которые извлекают питательные вещества из
мертвого и разрушающегося органического материала; С. секретируют ферменты в
органическое вещество, так что переваривание происходит вне организма; образующиеся при
этом растворимые продукты всасываются и усваиваются уже внутри тела сапрофита.
САТЕЛЛИТНАЯ ДНК (от лат. зшеИШз — спутник, сопровождающий) — ДНК эука-
риот, содержащая многократно повторяющиеся последовательности нуклеотидов.
СВИВЕЛАЗЫ — ферменты, устраняющие суперспирализацию ДНК, разрывая
одну из цепей ДНК, благодаря чему делается возможным раскрывание этой цепи с
последующим замыканием разрыва.
СВОБОДНАЯ ЭНЕРГИЯ — максимальная доля полной энергии, которая может
быть переведена в работу; определяется по формуле
<Ю = (Ш-Т415Ч
где йО — свободная энергия, ёН — энтальпия, Т— абсолютная температура, 45—
энтропия.
СВОБОДНЫЙ РАДИКАЛ — атом или молекула, содержащая неспаренный
электрон; Ср. обладают высокой реакционной способностью, ядовиты для живых
организмов, могут вызывать мутации; представителями Ср. являются: 02— супероксидради-
кал; ОН- — гидроксид радикал, Н02 — гидропероксидный радикал и др.
СЕЛЕКЦИЯ — отбор особей (животных или растений), производимый человеком.
СИГНАЛЬНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ АМИНОКИСЛОТНЫХ
ОСТАТКОВ — обеспечивают направленную доставку вновь синтезированных белков к
внутриклеточным органеллам и микрокомпартментам; они оказывают влияние на
характер фолдинга, посттрансляционные модификации и метаболическую стабильность;
существуют пять биохимических процессов с участием вновь синтезируемых
белков, контролируемых сигнальными последовательностями аминокислотных остатков:
транслокация белка через плоскость мембраны; внутриклеточный перенос белка без
пересечения плоскости мембраны: химические модификации белка без гидролиза
пептидных связей; расщепление некоторых пептидных связей в белке; конформаиионные
и иные пространственные изменения белков, включая фолдинг и олигомеризацию
полипептидных цепей.
СИНЕРГИСТИЧЕСКАЯ АКТИВАЦИЯ — наблюдается вюм случае, если
связывание активатора в активном центре фермента увеличивает сродство фермента к суб-
540
Словарь терминов
страту, проявляемое в понижении величины константы связывания (К5 или Кт)\ при
этом значение ккат не меняется, а график в координатах Лайнуивера-Берка имеет вил
семейства прямых с точкой пересечения на оси ординат.
СМЕШАННЫЕ ТИПЫ ИНГИБИРОВАНИЯ - проявляются в случае
взаимного влияния субстрата и ингибитора как при их связывании, так и при
превращении субстрата; при этом графики в координатах Лайнуивера-Берка
принимают вид семейства прямых, с обшей точкой пересечения в правом верхнем,
левом верхнем или левом нижнем квадранте; постоянные аир характеризуют
степень влияния ингибитора на каталитический процесс; возрастание значения
а (а > 1) свидетельствует об ухудшении связывания субстрата в активном центре
фермента, проявляемых в возрастании величин Кт{каж) и А}, тогда как понижение а (а <
1), может означать улучшение сродства субстрата у ферменту, сопровождаемое
понижением значений А^иик) и К,\ возрастание величины каталитической константы
возможно при р > I, а понижение — при значении р < 1.
СПЛАЙСОСОМА — специализированная внутриядерная многокомпонентная
структура, включающая десятки белков и набор малых ядерных РНК,
предназначенных для осуществления сплайсинга.
СТЕРИДЫ — эфиры стеринов и высших жирных кислот.
СТЕРИНЫ — стероиды, имеющие от 8 до 10 углеродных атомов в боковой цепи у
С-17 и свободную гидроксильную группу в положении 3; основным представителем С.
является холестерин.
СТЕРОИДЫ — это группа функционально активных соединений, основным
компонентом которых является пергидрофенантренциклопентан; к С. относятся
соединения животных тканей: половые гормоны, кортикостероиды, желчные кислоты,
витамины, а также вещества, синтезируемые растениями: сердечные гл и коз иды, алкалоиды,
регуляторы роста растений.
СТРУКТУРНЫЕ ГЕНЫ — гены, несущие информацию о структуре
специфических белков.
СПЕЙСЕР (от англ. храсег — промежуток) — участок ДНК, отделяющий один ген
от другого; С. не кодирует белки.
СПЛАЙСИНГ — конечный процесс формирования функционально активной
иРЙК из пре-РНК, путем вырезания из первичного транскрипта интронных
(вставочных) участков, с последующим соединением между собой экзонов.
СУБСТРАТ — вещество, которое претерпевает химические изменения в процессе
химической реакции, катализируемой ферментом; например, глюкоза является субстратом
фермента гексокиназы, пируват — пируватдекарбоксилазы, молочная кислота — лактат-
дегидрогеназы и т. д.
СФИНГОЛИПИДЫ — сложные эфиры, составными частями которых являются
ненасыщенный аминоспиртсфингозин или дигидросфингозин, жирные кислоты,
фосфат и полярная группировка в составе холи на или этанол амина, или серина и др.
Т
ТАНДЕМНЫЕ ПОВТОРЫ В ДНК (от англ. 1апйет — расположенные гуськом) —
многократно повторяющиеся гены, кодирующие транспортные тРНК, и гены,
кодирующие белки-гистоны и отдельные цепи иммуноглобулинов.
ТЕЛОМЕРАЗА (РНК-зависимая ДНК-полимераза, или обратная транскриптаза) —
фермент, синтезирующий тандем но повторяющиеся сегменты ДНК, из которых состоит
С-цепь теломерной ДНК.
541
Биохимия животных
ТЕЛОМ ЕРЫ (от греч. телос — коней и мерос — часть) — это специализированные
кониевые районы линейной хромосомной ДНК, состоящей из многократно
повторяющихся коротких нуклеотидных последовательностей; Т. построены издезоксинуклеоп-
ротеидов (комплексов ДНК с белком).
ТИАМИНПИРОФОСФАТ (кокарбоксилаза, ТПФ) — фосфорилированное
производное витамина В] (тиамина); участвует в реакциях декарбоксилирования а-кетокис-
лот, а также в расщеплении и синтезе оксикстонов; тиамин зависимыми ферментами
являются пируватдекарбоксилаза, фосфокетолаза, транскетолаза и др.
ТКАНЬ — система клеток и неклеточных структур, идентичных по
происхождению, строению и приспособленных к выполнению специфичной (определенной)
функции; в животном организме различают эпителиальную ткань, опорно-трофические
ткани (мезенхима, кровь, лимфа), соединительные ткани (рыхлая, плотная и
ретикулярная), хрящевая, костная, мышечная ткани (гладкая, поперечнополосатые и
специализированные сократительные ткани), нервная ткань; в растительных организмах
различают образовательные, покровные, механические, проводящие, основные и
выделительные Т.
ТРАНСАМИН ИРОВАН ИЕ (впервые процесс Т. был открыт российским ученым
А. Е. Бранштейном) — тип ферментативных реакций, катализируемых трансами
налами (КФ 2.6.1), которые осуществляют перенос аминогруппы с аминокислоты на ке-
токислоту.
К-СН (1ЧН2) СООН + КСОСООН ->
-> ЯСОСООН + К'-СН(1ЧН2)СООН
Кофермснтом трансаминаз служитфосфопиридоксаль, альдегидная группа которого
используется для переноса аминогруппы с аминокислоты на кетокислоту; реакция
протекает в два этапа: I этап — аминогруппа с аминокислоты переносится на фосфопи-
ридоксальфосфат, с образованием пиридоксамина, 2 этап — пиридоксамин образует
шиффово основание с кетокислотой, перенося на нее аминогруппу; в результате
реакции образуются новые амино- и кетокислоты; катализировать протекание такого типа
реакций могут следующие ферменты: аспартатаминотрансфераза (КФ 2.6.1.1.), алани-
наминотрансфераза (КФ 2.6.1.2), цистеинаминотрансфераза (КФ 2.6.1.3), глицинами-
нотрансфераза (КФ 2.6.1.4) и др.
ТРАНСГЕННЫЕ ЖИВОТНЫЕ — животные, в состав генома которых введены
чужеродные гены, их экспрессия позволяет проявлять новые свойства биогенных
систем.
ТРАНСКРИПЦИЯ (от англ. 1гапзспрпоп — переписывание) — процесс синтеза
пре-РНК, путем переписывания информации с ДНК; т. е. осуществляется с
помощью различных РНК-пол и мераз; в эукариотической клетке присутствует четыре вида
РНК-полимераз: РНК-полимсразы I, II, III — располагаются в ядре клетки и одна —
в митохондриях; РНК-пол и мераза I отвечает за синтез рибосомных 185, 285 и 5,85 РНК;
рибосомальная 5$ РНК и транспортные РНК синтезируются РНК-полимеразоЙ III,
а РНК-полимераза II осуществляет синтез предшественников мРНК; в структуре ДНК
выявляются особые регуляторные элементы, названные энхансерами, в присутствии
которых резко возрастает скорость транскрипции; при этом энхансеры проявляют
активность независимо от ориентации и положения относительно гена, т. е. они могут быть
перед геном, внутри или за ним; индукция генов может осуществляться с помощью
542
Словарь терминов
гормона (стероиды), который в составе комплекса с белком рецептором способен
связываться с регуляторной последовательностью ДНК, что сопровождается
активированием процесса транскрипции.
ТРАНСЛЯЦИЯ (от англ. (гапзШоп — перевод) — процесс перевода информации,
заложенной в последовательности нуклеотидов и РНК, в последовательность
аминокислотных остатков полипептидной цепи; процесс т. протекает в цитоплазме клетки
на рибосомах; на включение в белок каждой аминокислоты расходуется энергия
четырех высокоэнергетических связей (одной молекулы АТФ на стадии синтеза аминоацил-
тРНК и трех молекул ГТФ — на стадиях связывания аминоацил-тРНК и трансляции).
ТРАНСПОЗИЦИЯ — специализированный процесс, в результате которого
осуществляется перемещение фрагментов ДНК с помощью комплекса белков,
содержащих транспозазу; фермент участвует в распознавании и переносе фрагмента ДНК на
новое место, где они могут копироваться и образовавшиеся копии могут снова
переноситься на новое место.
ТРАНСПОЗОНЫ (Тп-элементы) — сегменты ДНК, содержащие гены, не
имеющие непосредственного отношения к транспозиции; Т. могут нести гены
устойчивости к антибиотикам, гены токсинов или гены дополнительных ферментов
клеточного метаболизма.
ТРАНСПОРТНАЯ РНК (тРНК) — небольшие последовательности (75...90) мо-
нонуклеотидов, содержащие антикодон из трех мононуклеотидов, комплиментарный
кодону для аминокислоты в информационной РНК, расположенный в тРНК в месте
локализации антикодоновой петли, недалеко от вариабельной петли; функция тРНК
состоит в том, чтобы транспортировать аминокислоты к рибосоме и вставлять их в
определенные участки полипептидной цепи при се биосинтезе (процесс трансляции),
переводя последовательность нуклеотидов в кодоне иРНК в последовательность
аминокислотных остатков первичной структуры белка.
ТРАНСФЕРАЗЫ — это класс ферментов, катализирующих реакции переноса
различных групп (метильные, гидроксиметильные, формальные, карбоксильные, карба-
моильные, альдегидные, ацильные, алкильные, аминные и др.) от одного субстрата
(донор) к другому (акцептор); в реакциях катализируемых трансферазами принимают
участие З-аденозил-Ь-метионин, $-метилметионин, пиридоксальфосфат, биотин, ти-
аминпирофосфат, 2-аминоаденозин, ЗН-КоА; название фермента формируется по
принципу: акцептор-группа-трансфераза или донор-группа-трансфераза (метионин-
метил-трансфераза. тиол-метил-трансфераза, серин-гидроксиметил-трансфераза, глу-
тамат-формил-трансфераза, холин-ацил-трансфераза, транс кетол аза, трансальдолаза и
др.); к этому классу принадлежат ферменты, переносящие гл и коз ильные группы (фос-
форилаза, амилосахараза, декстрансахараза и др.); трансферазы представлены 8
подклассами.
ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА — определенное расположение
полипептидной цепи в пространстве, стабилизированное в основном за счет слабых
(гидрофобных, гидрофильных и ионных), а также нескольких ковалентных дисульфидных (-5-
5-) связей.
ТРЕТИЧНАЯ СТРУКТУРА ДНК — определенное пространственное
расположение двух полинуклеотидных цепей ДНК, комплементарно связанных между собой за
счет водородных связей, приобретающих устойчивую структуру, стабилизированную
нсковалентными связями с белками (гистонами).
ТРИАЦИЛГЛИЦЕРИНЫ (нейтральныелипиды) — сложные эфиры трехатомного
спирта глицерина и высших жирных кислот.
543
Биохимия животных
ТРОПОМ ИОЗИН — белок (70 кДа), в составе которого две разные субъединицы,
переплетающиеся между собой в а-спиралевидные фибриллярные структуры; Т.
связывается в единый комплекс с Р-актином в области изгиба молекулы, обеспечивая его
стабильность; подлине Т. равен 7 субъединицам С-актина; при этом контактирует только с
одной из нитевидных структур Р-актина; кроме этого, Т. совместно с тропонином
участвует в регуляции взаимодействия актина с миозином.
ТРОПОНИН — белок поперечнополосатых мышц (76 кДа); имеет вид
вытянутого в длину белка (76 кДа); состоит из трех разных по структуре и функциям
субъединиц (тропомиозинсвязывающей (ТпТ), ингибируюшсй (Тп1) и кальцийсвязываюшсй
(ТпС)); располагается на конце каждой молекулы тропомиозина.
У
УГЛЕВОДЫ — вешества органической природы, основными компонентами
которых являются альдегиды и кетоны многоатомных спиртов, а также полимеры этих
соединений; у. условно делят натри группы: моносахариды, олигосахариды и полисахариды.
УРАВНЕНИЕ ИДИ — это один из способов алгебраического преобразования
уравнения Михаэлиса-Менте н
при построении графика экспериментальных данных в координатах Иди (у0, У(/5о),
полученная прямая линия пересекает ось ординат в точке Ут, с тангенсом угла
наклона -Кт.
УРАВНЕНИЕ ЛАЙНУИВЕРА-БЕРКА — это способ алгебраического
преобразования уравнения Михаэлиса-Ментен, с последующей линеаризацией
экспериментальных данных в двойных обратных величинах
1/П) - 1/Кш + (А^/Кш> (1/5Ь>:
график зависимости в координатах Лайнуивера-Берка (1/»0, 1/*?о) имеет вид прямой
линии, пересекающей ось абсцисс и ординат в точках —\/Кт и \/Ут соответственно.
УРАВНЕНИЕ МИХАЭЛИСА-МЕНТЕН — основное уравнение ферментативной
кинетики; впервые выведено в 1913 г.; описывает поведение субстрата в случае
простой односубстратной двухстадийной ферментативной реакции, анализируя начальную
скорость ферментативного процесса, при условии, что 5* К5 * Кт, по следующей
общепринятой схеме:
Е + 5<-НЕ-$1-»Е + Р;
^ = (ксшЕ050)/(Кт-^5о):
У.М.М. устанавливает зависимость скорости ферментативной реакции от
концентрации субстрата и фермента и проявляет величины каталитических констант (ксап Кт)
в случае преобразовании его в координатах Лайнуивера-Берка.
Ф
ФАТОМ ЕРА (/аШт — судьба) — это одна из структур эукариотического генома,
способная контролировать клеточные детерминации и, следовательно, дальнейшую
судьбу любой данной группы клеток, формирующих ту, или иную морфологическую
544
Словарь терминов
структуру; т. е. это участок генома, ответственный за проявление определенного
анатомического признака.
ФЕНОТИП — сумма всех развивающихся признаков и свойств организма в
конкретных условиях его онтогенеза; фенотип формируется на основе генотипа под
влиянием факторов внутренней и внешней среды.
ФЕРМЕНТЫ (энзимы, от англ. епгуте) — белки, обладающие каталитической
активностью, способные ускорять протекание химических реакций в живых организмах;
от обычных функциональных белков их отличает то, что на поверхности белковой
глобулы у них располагается активный центр; это участок, образованный из различных
аминокислотных остатков, собранных из различных областей полипептидной цепи, где
происходит связывание и превращение субстрата; кроме активного центра, у
некоторых ферментов имеется еще и регуляторный участок; в этом участке связываются
молекулы, оказывающие влияние на связывание и превращение субстрата в
ферментативном процессе; при этом сами регуляторы не претерпевают изменений.
ФЛАВИНАДЕНИНДИНУКЛЕОТИД (ФАД) — сложное биологическое
соединение, предшественником которого является витамин В2 (рибофлавин); ФАД выполняет
роль донора и акцептора электронов и протонов в окислительно-восстановительных
реакциях, катализируемых специфичными дегидрогеназами; восстановленной формой
ФАД является ФАДН, которая, в основном, генерируется в цикле трикарбоновых
кислот (цикле Крсбса) и в процессе липогенеза; при окислении в митохондриях одной
молекулы ФАДН синтезируется две молекулы АТФ.
ФОЛДИНГ — процесс сворачивания полипептидной цепи в пространственную
высокоспецифическую структуру, которая формируется полностью после завершения
биосинтеза полипептида на рибосоме; в результате фолдинга в водных растворах у
водорастворимого полипептида уменьшается свободная энергия, гидрофобные остатки
аминокислот упаковываются преимущественно внутрь молекулы, а гидрофильные
остатку располагаются на поверхности белковой глобулы; Ф. в клетках эукариот
обеспечивается специфическими белками, называемыми шаперонами, которые необходимы для
эффективного формирования третичной структуры полипептидных цепей других
белков, но не входят в состав конечной белковой структуры; новосинтезированные белки
после выхода с рибосом для правильного функционирования должны укладываться в
стабильные трехмерные структуры и оставаться такими на протяжении всей
функциональной жизни клетки.
ФОСФОЛИПИДЫ — сложные эфиры трехатомного спирта глицерина с высшими
жирными кислотами и фосфорной кислотой; последняя соединяется сложноэфирной
связью с полярной группировкой, в составе которой может быть холин, этанол а мин,
серии, инозит и др.
ФРАГМЕНТЫ О КАЗАК И — небольшие участки нуклеотидов, образующиеся на
обеих цепях матричной ДНК в процессе ее синтеза, размером в 1...2 тыс. нуклеотидов,
которые с течением времени укрупняются, образуя непрерывные дочерние цепи ДНК;
наличие фрагментов Оказаки указывает на то, что синтез ДНК происходит прерывисто,
отдельными фрагментами.
ФУНКЦИИ АМИНОКИСЛОТ — в организме животных и человека
аминокислоты используются в процессах синтеза белков, пептидов; аминокислоты входят в
состав гормонов белковой природы; так, например, белками являются пепсин, глюка-
гон, паратгормон, а пептидами — окситоцин, вазопрессин, кальцитонин и др.; кроме
этого глицин и аспарагиновая кислота входят в состав пуриновых и пиримидиновых
оснований соответственно; из аминокислот образуются функционально активные
545
Биохимия животных
соединения; так, например, предшественником ссротонина и мелатонина является
триптофан, гистамина — гистилин, катсхоламинов (ДОФА, адреналин, норадрсна-
лин) — фенилаланин, тироксина и трийолтиронина — тирозин, креатинфосфата —
глицин и т. д. Участие аминокислот в процессах окисления в цикле трикарбоновых
кислот обеспечивает энергетические потребности организма.
ФУНКЦИИ БЕЛКОВ — белки в организме растений и животных способны
выполнять следующие функции: I) каталитическая, осуществляется ферментами,
ускоряющими протекание химических реакций; 2) транспортная» белки переносят
нерастворимые в воде гидрофобные соединения (липопротеиды) или кислород (миоглобин и
гемоглобин); 3) структурно-механическая, выполняется белками, входящими в состав
мембран клеток (протсогликаны); 4) регуляторная, выполняется гормонами, которые
регулируют протекание различных метаболических процессов; 5) сократительная,
способность к механическим действиям (белки мышц); 6) защитная, обеспечивается
белками, входящими в состав ДНК (нуклеопротеиды) и иммуноглобулинами; кроме этого,
белки участвуют в процессе свертывания крови, обеспечивают активный
трансмембранный потенциал, входят в состав костной и соединительной ткани.
ФУНКЦИИ ЛИПИДОВ — в организме животных липиды выполняют
разнообразные функции: 1) входят в состав мембран клеток и органелл (насыщенные и
ненасыщенные жирные кислоты, фосфолипиды, сфинголипиды и др.); 2) окисление
липидов (жирных кислот) обеспечивает энергетические потребности живого
организма; 3) служат предшественниками молекул, обладающих регуляторным действием,
в частности, ненасыщенные жирные кислоты входят в состав витамина Р, а из ара-
хидоновой кислоты синтезируются простагландины и тромбоксаны; 4)
предшественником кортикостероидов, женских и мужских половых гормонов, желчных
кислот и витамина О является холестерин; 5) кортикостероиды могут стимулировать
синтез РНК и белков, обладают противовоспалительным, антиаллергическим, им-
мунодепрессивным, противошоковым и антитоксическим действием; 6) в
качестве женских и мужских половых гормонов, липиды отвечают за проявление
вторичных половых признаков, регулируют активность генома клеток; 7) желчные
кислоты в составе желчи принимают участие в процессе переваривания и
транспорте липидов по кишечнику; 8) витамин О участвует в переносе ионов кальция;
9) в составе сложных белков липиды формируют комплексы (липопротеиды),
обеспечивающие перенос нерастворимых в воде соединений; 10) выполняют функции
изоляторов в составе липоидных слоев миэлиновых оболочек, защищая при этом
проводящие части нервного волокна от окружающей среды; II) отложения липидов
в подкожно-жировом слое проявляют термоизоляционные свойства; 12) липиды
входят в состав жировых шариков молока, обеспечивают стабильность этих образований;
13) липиды придают водоотталкивающие свойства кожным покровам животных.
ФУНКЦИИ УГЛЕВОДОВ — в организме животных углеводы выполняют
следующие функции: 1) обеспечивают энергетические потребности живых организмов за
счет окисления в различных метаболических процессах: гликолизе, ПДК, ЦТК,
окислительном фосфорилировании; 2) участвуют в протекании процессов синтеза
стероидов за счет образования в пентозофосфатном пути НАДФН; кроме этого, в
результате реакций пентозофосфатного цикла превращения углеводов образуются несколько
различных пентоз (рибулоза, рибоза, ксилулоза), которые входят в состав нуклео-
зидов, нуклеотидов и нуклеиновых кислот; образуемые в пентозофосфатном цикле
триозы могут быть использованы в процессах синтеза триацилглицеринов, фосфо-
липидов или быть окисленными до С02 и воды, обеспечивая энергетические пот-
546
Словарь терминов
ребности клетки; 3) отложение углеводов в печени и мышцах в виде полисахарида
гликогена, обеспечивает их резервирование в организме; 4) многие углеводы
могут входить в состав функциональных белков; так, например, углеводы, входящие
в состав пероксидазы, способны защитить фермент от инактивирующего действия
свободных радикалов, образующихся при протекании оксидазных и пероксидазных
реакций, обеспечивают растворимость фермента в полярных растворителях, обусловливают
взаимодействие фермента с мембранами и за счет этого способствуют встраиванию
фермента в определенные участки мембран органелл и клетки, защищают фермент от
инактивирующего действия высоких температур и растворителей; 5) в составе мембран
клеток и клеточных органелл углеводы способны индивидуализировать их
поверхностные структуры, т. е. определяют свойства мембран и придают отличие внешней
стороны мембраны от внутренней; 6) в составе гормональных рецепторов (гликопротеи-
дов), углеводы обеспечивают избирательность их регуляторного действия; 7) в составе
биологически активных молекул (АТФ, ГТФ, ЦТФ и др.) углеводы обеспечивают их
функциональное действие.
ФУРАН — пятичленный углеводородный цикл, в состав которого входит атом
кислорода.
X
ХЕЛИКАЗЫ — ферменты, расплетающие двойную спираль ДНК и удерживающие
ее одиночные цепи от воссоединения.
ХИМУС — однородная жидкая масса, образующаяся в результате переваривания
компонентов корма ферментами пищеварительных секретов тонкого отдела кишечника.
ХИРАЛЬНЫЙ АТОМ УГЛЕРОДА — атом углерода, у которого все четыре
заместителя различаются между собой.
ХОЛОДОВОЕ СОКРАЩЕНИЕ — это проявление сокращения мышечных
волокон, в основном при быстром замораживании мяса, вследствие воздействия низкой
температуры, инициирующее выход ионов кальция из саркоплазматического ретику-
лума и реализации запаса энергии АТФ в послеубойном сокращении мышц, которое
обуславливает появление повышенной жесткости мяса.
ХОЛОФЕРМЕНТ — эта активная форма фермента, состоящая из кофермента и
белка (белковой части фермента).
ХРОМОПЛАСТЫ — не зеленые пигменты, окрашенные преимущественно в желто-
красный цвет; X. имеют двухслойную мембрану, в матриксе которой содержатся каро-
тиноиды и биологически активные вещества, придающие им характерную окраску и
функцию; содержание X. в лепестках и плодах придает им своеобразную окраску.
ХРОНОМЕРА — это концевая теломерная фатомера, не подвергающаяся
амплификации и ответственная за измерение биологического времени в ходе онтогенеза.
Ц
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (Цикл Кребса) - аэробный процесс
окисления биологических молекул (аминокислот, жирных кислот и углеводов) до С02 и Н20;
Ц.т.к. протекает в митохондриях, обеспечивая генерацию восстановленных кофермен-
тов (НАДН и ФАДН2); суммарная реакция Ц.т.к. имеет следующий вид:
СН3СО-КоА + ЗНАД* + ФАД + ГДФ + Фн + Н20 ->
-► 2С02 + ЗНАДН + ФАДН2 + ГТФ + 2Н+ + КоА
547
Биохимия животных
ЦИТОКИНИНЫ — биогенные молекулы (кинетин, зеатин и др.), стимулирующие
деление клеток (цитокенез), участвуют в процессах роста и дифференциации клеток,
осуществляют передачу сигнала от клетки к клетке; у растений Ц. ускоряют
прорастание семян, стимулируют рост почек и плодов, задерживают процессы увядания.
Ч
ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА — структура, сформированная из двух и
более субъединиц (мономерных полипептидных цепей, имеющих третичную структуру),
с образованием единого функционально активного комплекса, стабилизированного за
счет нековалентных связей (гидрофобных, гидрофильных и ионных), и выполняющая
специфичную функцию.
Ш
ШАПЕРОНЫ (отанл. сНарегопе) — белки про- и эукариотических клеток,
управляющие процессом правильной нековалентной укладки полипептидной цепи или полипеп-
тидсодержащих структур т у1уо в упорядоченные третичные структуры; в
эукариотических клетках местом синтеза Ш. являются строма хлоропластов и матрикс митохондрий;
Ш. осуществляют транспортировку полипептидов от эндоплазматического ретикулума к
субклеточным частицам, обеспечивая проход полипептида через мембраны, а затем
принимают участие в упорядоченной его укладке и сборке.
Э
ЭКЗЕРГОНИЧЕСКИЕ РЕАКЦИИ — реакции, протекающие самопроизвольно
с выделением свободной энергии, при этом величина сЮ имеет отрицательное
значение.
ЭКЗОНЫ — участки в структуре ДНК и пре-РНК, несущие генетическую
информацию о структуре белка и чередующиеся с нитронами; в процессе сплайсинга и
тройные участки вырезаются, а экзоны сшиваются между собой, образуя функционально
активную иРНК; считывание информации с иРНК происходит на рибосоме,
обеспечивая упорядоченный синтез полинуклеотидной цепочки белка.
ЭКОСИСТЕМА — сообщество организмов, обитающих в определенной среде и
связанных между собой в единое функциональное целое взаимозависимым
круговоротом веществ и энергии.
ЭКСПРЕССИЯ ГЕНОВ — активирование процессов транскрипции, т. е.
биосинтеза пре-РНК на одной из полинуклеотидной цепочки ДНК, и трансляции —
биосинтеза белка на м РНК.
ЭНДЕРГОНИЧЕСКИЕ РЕАКЦИИ — реакции, протекающие с поглощением
энергии, при этом 60 (свободная энергия) — положительная величина.
ЭНХАНСЕРЫ — последовательности ДНК, усиливающие транскрипцию при
взаимодействии со специфическими белками.
ЭОЗИНОФИЛЬНЫЕ ЛЕЙКОЦИТЫ — форменные элементы крови,
вырабатываются в красном костном мозге, обладают выраженной антигнетами новой функцией за
счет большого количества гидролитических и окислительно-восстановительных
ферментов; в их составе пероксидаза, кислая и щелочная фосфатаза, гистаминаза, арилсульфа-
таза и др.; Э.л. малоподвижны, способны осуществлять инактивацию гнетами на и других
медиаторов воспаления, таким образом предотвращая развитие воспалительного
процесса; отмечается наибольшее скопление Эл. в клетках рыхлой соединительной ткани
кишечника; различают палочковидные и юные формы эозинофилов; отмечают
увеличение Эл. при различных инфекционных заболеваниях.
548
Словарь терминов
ЭПИГЕНЕТИЧЕСКИЕ — обратимые изменения активности генов в процессе
индивидуального развития организма, не связанные с нарушением нуклеотидной
последовательности ДН К, но приводящие к сохранению неактивного или активного
состояния генов в ряду клеточных поколений.
ЭРИТРОЦИТЫ (от лат. егугИп>5 — красный) — красные кровяные безъядерные
клетки, основной функцией которых является транспорт кислорода и углекислого газа
в организме; функциональным белком Э. является гемоглобин; в структуре
гемоглобина четыре субъединицы (две а- и две р-субъединицы), каждая из которых содержит
гем с двухвалентным железом; в мономерной форме субъединица гемоглобина
обладает пероксидазной активностью; в зрелом Э. отсутствуют органеллы;
предшественником Э. является ретикулоцит, в котором сохраняются рибосомы, эндоплазматическая
сеть и рибосомы; подсчет ретикулоцитов используется с целью определения скорости
эритропоэза.
ЭНДОПЛАЗМАТИЧЕСКАЯ СЕТЬ (эндоплазматический ретикулум) — система
разветвленных каналов и цистерн, ограниченных мембранами, пронизывающих ги-
алоплазму; каналы Эх. заполнены бесструктурной жидкостью — матриксом;
различают два типа Э.с. гладкая (агранулярная) и шероховатая (гранулярная); на
мембранах гладкой Эх. находятся ферменты лип иди ого и углеводного обмена, производящие
синтез липидов и углеводов, а на мембранах шероховатой Эх. располагаются
рибосомы, обеспечивающие синтез белков; по каналам Э.с. вещества могут
транспортироваться из клетки в клетку.
ЭТЕРИФИЦИРОВАННЫЕ ЖИРНЫЕ КИСЛОТЫ - группа высших жирных
кислот, входящих в состав белков или фосфолипидов; особенно активно Э. ж. к.
связываются с помощью гидрофобных взаимодействий с молекулой альбумина.
ЭУКАРИОТЫ (от греч. ей — хорошо и кагуоп — ядро) — оргакизмы, клетки которых
имеют клеточное ядро, отделенное от цитоплазмы ядерной оболочкой; отличительной
особенностью Э. (от прокариот) является наличие у них в органоидах (митохондриях и
хлоропластах) небольших по размеру молекул ДНК, а также то, что все Э. размножаются
делением ядра с образованием настоящих хромосом; для большинства Э. характерен
половой процесс, при котором образуются ядра с уменьшенным вдвое (гомологичный
набор) числом хромосом (см. мейоз); в надцарство Э. входят разнообразные простейшие
(жгутиковые, инфузории, споровики), грибы, животные и растения.
Я
ЯДРО — органоид, обеспечивающий хранение и передачу генетической
(наследственной) информации; основными элементами Я. являются ДНК, РНК и белки,
комплекс которых обеспечивает протекание в ядре основных
трансинформационных процессов; в Я. протекают процессы, обеспечивающие удвоение ДНК —
репликация и процессы передачи генетической информации с ДНК -► пре-РНК->
иРНК — транскрипция и процессинг.
ЯЙЦЕКЛЕТКА — неподвижная женская половая клетка, образующаяся в
яичниках; состоит из ядра, большого количества цитоплазмы и оболочки.
549
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. Александровская 0. В., Радостина Т. //., Козлов Н. А. Цитология, гистология и
эмбриология. — М.: Агропромиздат, 1987. — 448 с.
2. Алимова Е. К, Аствацатуръян А. Т., Жаров Л. В. Липиды и жирные кислоты
в норме и при ряде патологических состояниях. — М.: Медицина, 1975. — 280 с.
3. АнисимовА. А., Леонтьев А. //., Александрова И. Ф., Каманина М, С, Бронштейн Л. М.
Основы биохимии/Пол ред. А. А. Анисимова. — М.: Высш. школа, 1986. — 551 с.
4. Березов Г. Г., Коровкин Б. Ф. Биологическая химия. — М.: Медицина, 2002. — 528 с.
5. Березин И. В., КлесовА. А. Практический курс химической и ферментативной
кинетики. - М.: Изд-во МГУ, 1976. - 320с.
6. Болдырев А. А. Введение в биохимию мембран. — М.: Высш. школа, 1986. — 112 с.
7. Бохински Р. Современные воззрения в биохимии. — М.: Мир, 1987. — 544 с.
8. Вилли К. Биология. - М.: Мир, 1968. — 808 с.
9. Гельфман М. И., Ковапевич О. В., Юстратов В. П. Коллоидная химия. — СПб.:
Лань, 2003. - 336 с.
10. Герасимов Я. //., Древинг В. //., Еремин Е. Н., Киселев А. В.,
Лебедев В. Я., Панченков Г Л/., Шлыгин А. И. Курс физической химии. Т. 1,2. — М.:
Химия, 1969.
11. Георгиевский А И. Физиология сельскохозяйственных животных. — М.:
Агропромиздат, 1990.— 511с.
12. Грин Н„ Стаут У., Тейлор Д. Биология. Т. 1-3. - М.: Мир, 1990.
13. Гусев М. В., МинееваЛ. А. Микробиология. — М.: Академия, 2003. — 464 с.
14. Гусев //. Б. Внутриклеточные Са-связываюшис белки. Ч. 1. Классификация
и структура//Соросовский Образовательный жур-нал. — 1998. — № 5. — С. 2-9.
15. Гусев Н. Б. Внутриклеточные Са-связываюшие белки. Ч. 2. Структура и механизм
функаионирования/Дам же. — С. 10—16.
16. Дубинин Н. //. Экспериментальное исследование интеграции наследственных систем
в процессах эволюции популяций//Журн. обш. биол. — 1948. — № 9. — С. 3-12.
17. Елисеев А. П., Сафонов И. А., Бойко В. И. Анатомия и физиология
сельскохозяйственных животных. — М.: Агропромиздат, 1991. — 493 с.
18. ЖученкоА. А, Экологическая генетика культурных растений (адаптация, рекомби-
ногенез, агробиоценоз). — Кишинев: Штиинца, 1980. — 230 с.
19. ЖученкоА. А. Адаптационный потенциал культурных растений (эколого-геиети-
ческис основы). — Кишинев: Штиинца, 1988. — 766 с.
20. Жученко А. А. Адаптивное растениеводство. — Кишинев: Штиинца, 1990. — 376 с.
550
Использованная литература
21. Жученко А. А Проблемы адаптации в современном сельском хозяЙстве//С.-х.
биол. - 1993. -№5.-С. 3-35.
22. Кнорре Д. Г., Мызина С. Д. Биологическая химия. — М.: Высш. школа, 1998. — 479 с.
23. Коморский А. И. Биохимия животных. — Киев: Виша школа, 1984. — 415 с.
24. Лавриненко В. А. Выделительная функция почек//Соросовский Образовательный
журнал. - 2001. - Т. 7. - N° 11. - С. 13-18.
25. Лебедев А. А. Система ренин — ангиотензин//Соросовский Образовательный
журнал. - 1998. - № 3. - С. 35-40.
26. Левицкий Л. О. Кальций и биологические мембраны. — М.: Высш. шк., 1990.
27. ЛенинджерА. Биохимия. — М.: Мир, 1976. — 957 с.
28. Льюин Б. Гены. - М: Мир, 1987. - 544 с.
29. МаистерА. Биохимия аминокислот. — М.: Иностранная л-ра, 1961. — 530 с.
30. Меерсон Ф. 3. Основные закономерности индивидуальной адаптации. — В сб.:
Физиология адаптационных процессов. — М.: Наука, 1986. — С. 10-76.
31. Метверцов Я. П. Гормональная регуляция экспрессии генов. — М.: Наука, 1986. —
207 с.
32. МецлерД. Биохимия. - М.: Мир, 1981. - Т. 1-3.
33. Николаев А. Я. Биологическая химия. — М.: Высш. школа, 1989. — 495 с.
34. Номенклатура ферментов/Под ред. А. Е. Браунштейна. — М.: ВИНИТИ, 1979. —
321с.
35. Овчинников Ю. А. Биоорганическая химия. — М.: Просвещение, 1987. — 815 с.
36. Основы биохимии/Под ред. А. А. Анисимова. — М.: Высш. школа, 1986. — 551 с.
37. Основы биохимии/Под ред. А. Уайт и др. — М.: Мир, 1981. — Т. 1-3.
38. Шященко С. //., Сидоров В, Т. Естественная резистентность организма
животных. -Л.: Колос, 1979. - 184 с.
39. Рогов И. А,, АнтиповаЛ. В., Дунченко Н. //., Жеребцов Н. А. Химия пиши. В 2 кн. —
М.: Колос, 2000. -384 с.
40. Рогожин В. В. Пороке ид аза как компонент антиоксидантной системы живых
организмов. - СПб.: ГИОРД, 2004. - 240 с.
41. Рогожин В. В. Биохимия молока и молочных продуктов. — СПб.: ГИОРД, 2006. —
320 с.
42. Рогожин В. В. Биохимия мышц и мяса. - СПб.: ГИОРД. 2006. - 240 с.
43. Рогожин В, В. Практикум по биологической химии. — СПб.: Лань, 2006. — 256 с.
44. Рогожин В. В., Верхотуров В. В., Рогожина Т. В. Псрокеидазный катализ
многокомпонентных систем. — Якутск: Сахаполиграфиздат, 2003. — 165 с.
45. Рогожин В. В., Верхотуров В. В.. Рогожина Т. В. Пероксилаза: строение и механизм
действия. - Иркутск: Изд-во ИГТУ, 2004. - 200 с.
46. Рубцов А. М., Батрукова М. А. Кальциевые каналы (рианолиновые рецепторы)
саркоплазматического ретикулума: Структура и свойства//Биохимия. — 1997. —
Т. 62.-№9.-С. 1091-1105.
551
Биохимия животных
47. Рубцов А. М. Роль саркоплазматического ретикулума в регуляции
сократительной активности мышц//Соросовский Образовательный журнал. — 2000. — Т. 6. —
№9.-С. 17-24.
48. Селье Г. Очерки об адаптационном синдроме. — М.: Медгиз, 1960. — 25 с.
49. Селье Г. Стресс без дистресса. — М.: Прогресс, 1979. — 123 с.
50. Симонов П. В. Эмоциональный мозг. — М.: Наука, 1981. — 215 с.
51. СтрайерЛ. Биохимия. Т. 1-3. — М.: Мир, 1984.
52. Строев Е. А. Биологическая химия. — М.: Высш. школа, 1986. — 479 с.
53. Стромберг А. Г., СемченкоД. П. Физическая химия. — М.: Высш. школа, 2001. —
527 с.
54. Теппер Е. 3., Шилышкова В. ДГ., Переверзева Г. И. Практикум по микробиологии. —
М.: Колос, 1979.-216 с.
55. Тигранян Р. А. Стресс и его значение для человека. — М.: Наука, 1988. — 176 с.
56. Тканук В. А. Мембранные рецепторы и внутриклеточный кальциЙ//СоросовскиЙ
Образовательный журнал. — 1998. — Т. 63. — № 1. — С. 47—56.
57. Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия.— М.: Медицина, — 815 с.
58. Хмельницкий Р А. Физическая и коллоидная химия. — М.: Высш. школа, 1988. —
400 с.
59. Уайт А., Хендлер Ф., Смит Э., Хилл Р, Лемач И, Основы биохимии. Т. 1-3. — М.:
Мир, 1981. - С. 1364-1371.
60. Уильяме В., Уильяме X. Физическая химия для биологов. — М.: Мир, 1976. — 600 с.
61. Фершт Э. Структура и механизм действия ферментов. — М.: Мир, 1980. — 432 с.
62. Чанг Р. Физическая химия с приложениями к биологическим системам. — М.:
Мир, 1980.-662 с.
63. Шаробайко В, И. Биохимия холодильного консервирования пищевых продуктов:
Учебное пособие. — Л.: Изд во Л ГУ, 1986. — 224 с.
64. Шлегель Г. Общая микробиология. — М.: Мир, 1987. — 567 с.
65. Шмальгоузен И. И. Факторы эволюции. — М.: Наука, 1968. — 451 с.
66. Шмальгоузен И. И, Организм как целое в индивидуальном и историческом
развитии. - М.: Наука, 1982. - 383 с.
552