Автор: Путилин Ф.Н.
Теги: общее школьное образование общеобразовательная школа общая и неорганическая химия органическая химия химия подготовка к экзаменам справочник
ISBN: 5-211-03840-1
Год: 1997
Текст
Ф.Н.Путилин
ХИМИЯ
для
абитуриентов
и
ШКОЛЬНИКОВ
Справочное руководство
Издательство Московского университета
Ф.Н. Путилин
ХИМИЯ
ДЛЯ
абитуриентов
и
ШКОЛЬНИКОВ
Справочное руководство
Издательство Московского университета
1997
УДК 37154
ЬБК 24.1+24 2
Г190
Путилин Ф.Н.
П90 Химия для абитуриентов и школьников: Справочное
руководство. - М/. Изд-во МГУ, 1997 - 144 с
ISBN 5-211-03840-1
В справочнике изложены основы химии в соответствии с программой
средней школы.
Справочник предназначен для учащихся средних школ любого про-
филя (гимназий, лицеев, специализированных классов), абитуриентов
химических и медико-биологических вузов, а также для преподавате-
лей химии
ББК 24.1+24.2
Справочное издание
Путилин Феликс Никифорович
Химия для абитуриентов и школьников.
Справочное руководство
Зав. редакцией И.И.Щехура
Редактор Г М.Полехова
Художественный редактор Ю.М.Добрянская
Технический редактор Г.Д.Колоскова
Изд. лиц. № 040414 от 1S.04.97
Подписано в печать 07.08.97. Формат 60x90/16.
Бумага кп.-журн. Печать офсетная. Усл. печ. л. 9,0.
Уч.-изд. л. 9,33. Тираж 5000 экз. Заказ 3549
Изд. № 6410.
Ордена “Знак Почета" Издательство Московского университета
103009, Москва, Б. Никитская 5/7.
Отпечатано в Производственно-издательском комбинате ВИНИТИ
140010, Люберцы, Октябрьский пр., 403. Тел. 554-21-86
ISBN 5-211-03840-1
© Ф.Н.Путилин, 1997
ЧАСТЬ 1. ТЕОРЕТИЧКСКИЕ ОСНОВЫ ХИМИИ
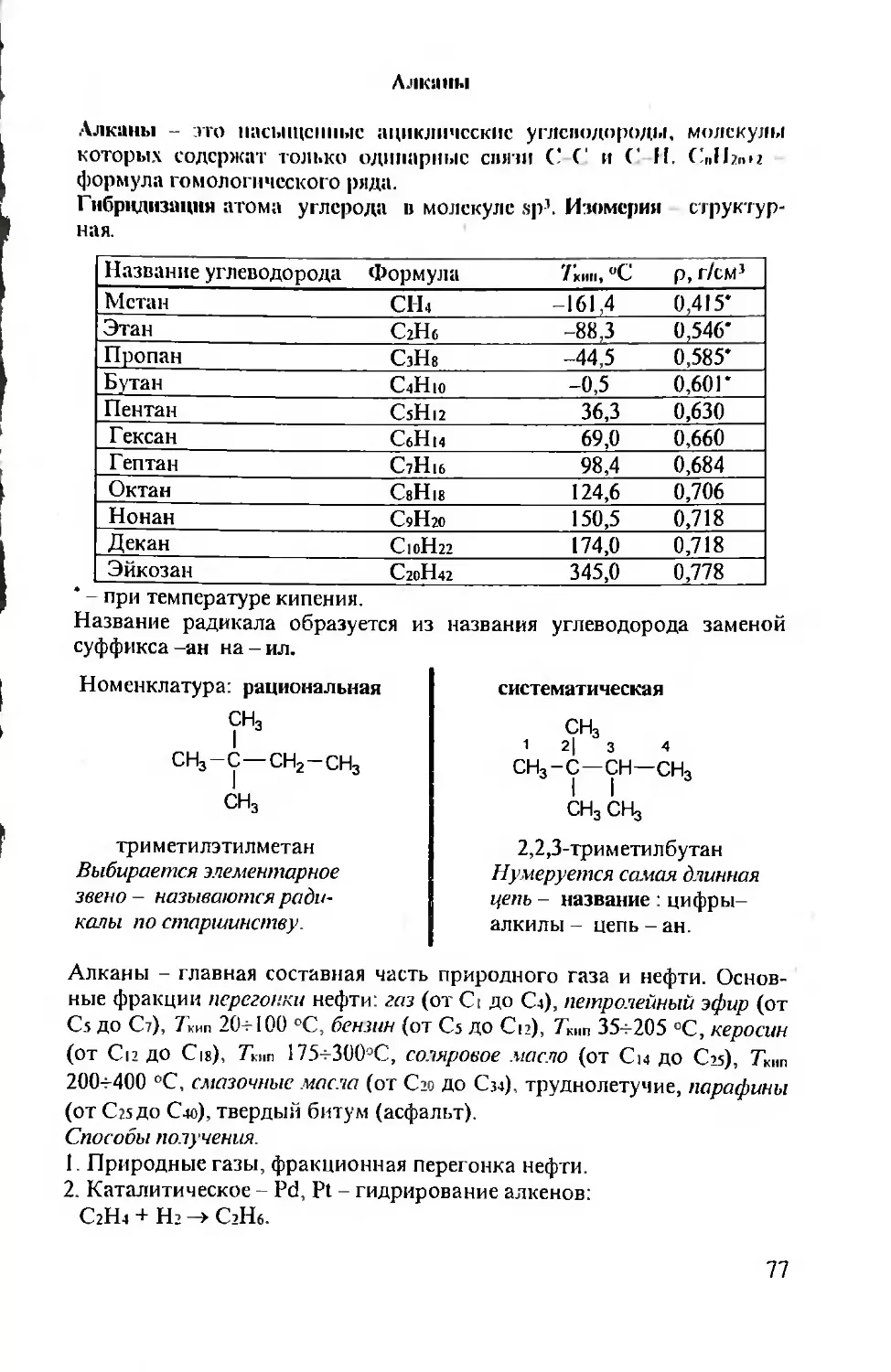
Основные определения и законы химии.
Химии -это пауки, изучающая состав, строение, свойства веществ, а
также процессы превращения одних веществ в другие.
Вещество - любая совокупность частиц, находящихся и твердом, жид-
ком или газообразном состоянии и имеющих массу и объем.
Смесь -состоит из частиц нескольких веществ.
Простое вещество -это вещество, состоящее из атомов одного хими-
ческого элемента.
Сложное вещество - вещество, молекулы которого состоят из атомов
различных элементов.
Аллотропия свойство химического элемента образовывать несколь-
ко простых веществ. Аллотропические модификации могут быть вы-
званы различным составом молекулы ( Ог-кислород, Оз - озон ) или
различиями в их строении ( углерод - алмаз, графит).
Химический элемент - вид атомов, характеризующихся определен-
ным зарядом ядра.
Атом - электронейтральная частица, состоящая из положительно за-
ряженного ядра и отрицательно заряженных электронов
Молекула - наименьшая частица вещества, способная к самостоятель-
ному существованию и обладающая химическими свойствами данно-
го вещества.
Атомный ион - частица, состоящая из ядра и электронов и имеющая
заряд.
Молекулярный ион - взаимосвязанная система атомов, имеющая за-
ряд.
Химический символ - форма записи химического элемента. Около
символа могут быть указаны следующие четыре величины:
массовое число 1 | заряд иона | и |
символ I N I N3+1 Nz.
число протонов число атомов * 7 ’ *
Физическое явление - любое изменение вещества, не приводящее к
изменению состава и строения молекул.
Химическими явлениями, или реакциями, называются такие явления,
при которых из одних веществ образуются другие вещества.
Химическая формула вещества показывает, из атомов каких химиче-
ских элементов состоит данное вещество и сколько атомов каждого
элемента входит в состав молекулы вещества.
1
3
I рафнческаи (структурная) формула ncincciiia показывает, из а гомон
каких химических элементов состоит данное вещество, сколько ато-
мов каждого элемента входи т в состав молекулы и в какой последова-
тельности атомы соединены в молекуле:
H2SO„ , CaOCI2 , AIР0„ .
А1~-О^>р—®
^0
Схема химической реакции дает возможность проследить, какие ве-
щества претерпевают изменения и какие продукты, один или несколь-
ко, образуются при этом:
Си + HjSQ, (конц) —► CuSO4 + S02
Уравнение химической реакции показывает, какие вещества и сколько
(в молях) вступают во взаимодействие и какие продукты и сколько (в
молях) получаются в результате взаимодействия:
Си + 2 H2SO4 (конц) ~ CuS04 + S02 + 2 Н2О.
Стехиометрические коэффициенты - числа перед формулами химиче-
ских веществ в уравнении химической реакции, которые показывают
количества реагирующих и образующихся веществ. В уравнении хи-
мической реакции число атомов каждого элемента в левой и правой
частях должны быть одинаковыми.
Масса - это свойство, характеризующее гравитационное притяжение
или инертность частицы при изменении ее состояния.
Атомная единица массы (а.е.м.), или углеродная единица, - это 1/12
массы изотопа углерода-12 : I а.е.м = 1,66057 1024 г. При проведении
практических расчетов в химии используют не абсолютные значения
масс, а относительные - в качестве единицы атомных масс выбрана
углеродная единица.
Относительная атомная масса - это число, показывающее, во сколько
раз масса атома конкретного элемента больше массы углеродной еди-
ницы. Элементы представляют собой смесь изотопов, поэтому атом-
ные массы элементов, приведенные в таблице Д.И.Менделеева, - это
средние значения атомных масс природного изотопного состава эле-
ментов.
Относительная молекулярная масса - это число, показывающее во
сколько раз масса молекулы больше массы углеродной единицы. Мо-
лекулярная масса вещества равна сумме атомных масс всех элементов,
входящих в состав молекулы.
4
Моль - это количество вещества, содержащее столько же структурных
единиц этого вещества, сколько имеется атомов в 12 г изотопа углеро-
да- 12.
Структурная единица вещества - это химическая частица (атом, моле-
кула, ион), а также любая совокупность частиц, передаваемая ее фор-
мулой.
Закон сохранения массы веществ (М.В.Ломоносов, 1748 , А.-Л. Лаву-
азье, 1789): масса веществ, вступивших в реакцию, равна массе ве-
ществ, получившихся в результате реакции.
Закон постоянства состава веществ (Ж.-Л.Пруст, 1799): каждое веще-
ство, каким бы способом оно ни было получено, всегда имеет один и
тот же состав (и свойства).
Закон Авогадро (А. Авогадро, 1811, С.Канницаро, 1858): в равных
объемах различных газов при одинаковых условиях (равных темпера-
туре и давлении) содержится одинаковое число молекул.
Следствия из закона Авогадро:
а) при одинаковых условиях равные количества различных газов за-
нимают равные объемы;
б) при нормальных условиях (н.у.) - температура Т = 273,15 К (0°С),
давление Р = 1,01325 Ю5 Па (или Р = 1 атм., или Р = 160 мм. рт. ст.) -
1 моль любого газа занимает объем (22,4 л)..
Относительная плотность (D) - это отношение массы данного объема
газа к массе такого же объема другого газа:
D = .
Учитывая, что v = т / М , где v - число молей вещества, т- масса ве-
щества, М - молярная масса вещества
Мг
Плотность газов: р = т/ V .
Средняя молярная масса газовой смеси, состоящей из п компонентов, -
отношение общей массы смеси к общему количеству вещества:
м т у,Л/,+-+у„Л/„ _ ViMt+-+V„M„
v v1+--+v„ Pl+. -+Г„
(Л7-молярная масса, К-объем газа).
Число Авогадро: в моле любого вещества содержится
Na = 6,02 1023 структурных единиц.
5
Объединенный газовый закон. 11 '-1 11
7" 71
1де I о- 7;,_ значения давления, объема и температуры при я.у.; /'i,
|< значения этих же величин при выбранных условиях
равнение Клапейрона - Менделеева для идеального гатя:
/'И = vRT,
где Р- давление, Т- температура, V - объем, v - число молей вещест-
ва, К - универсальная газовая постоянная:
R - 8,314 Дж / (моль К) = 0,082 л- атм / (моль К).
Закон эквивалентов (В.Рихтер, 1792): вещества вступают в химические
реакции в весовых количествах, пропорциональных их эквивалентам.
Химический эквивалент элемента - это такая масса его, которая сое-
диняется с единицей массы водорода или с 8 единицами массы кисло-
рода, или замещает эти количества в их соединениях.
Валентность - свойство атомов данного элемента присоединять или
замещать в соединении определенное число атомов другого элемента.
Э = А / В , где Э - эквивалент элемента, В - валентность атома элемен-
та в соединении, А - атомная масса элемента.
Закон кратных отношений (Д.Дальтон, 1803): если два элемента обра-
зуют между собой несколько соединений, то на одно и то же весовое
количество одного элемента приходятся такие количества другого
элемента, которые относятся между собой, как небольшие целые чис-
ла.
Массовая доля вещества в смеси (твердой, жидкой, газообразной)
равна отношению массы компоненты X к массе смеси:
го(х) = ; ш(х)% = 100%.
m m
Мольная доля вещества X в смеси равна отношению числа молей ком-
поненты X к сумме молей всех веществ смеси:
х(-г) = ^; х(х)% = ^-Ю0%.
Sv Sv
Объемная доля вещества X в смеси равна отношению объема, зани-
маемого компонентой X, к объему смеси:
Ф(х) = у; Ф(х) = ^юо%.
Выход продукта реакции показывает, какая доля продукта реакции
получилась практически по сравнению с вычисленной теоретически
(по уравнению реакции). Часто эту величину указывают в процентах:
Г) = Ш(лракт) / ш(теорет) 100%. КОЛИЧеСТВеННЫЙ ВЫХОД - ВЫХОД Продукта
реакции, когда г, = 100%.
6
Классификации химических соединений
Под классификацией понимают объединение химических соединений
в определенные группы или классы, обладающие сходными свойства-
ми. Многообразие соединений представлено в нижеследующей табли-
це:
7
Оксиды
Оксцды jfiio соединении, состоящие из двух jjieMciimoe, одним ш ко-
торых является кислород.
Нссолсобразующие оксиды - N2O, NO.
ерокснды - соединения, в которых осуществляется связь между дву-
мя атомами кислорода:
Н2О2: Н-О-О-Н ; К2О2: К-О-О- К.
Основные оксиды - это такие оксиды, которые образуют соли, вза-
имодействуя с кислотами и кислотными оксидами; им соответствуют
основания:
Na2O -> NaOH, CaO -> Са(ОН)2, ВаО -► Ва(ОН)2.
Основными оксидами являются оксиды типичных металлов.
Кислотные оксиды - это такие оксиды, которые образуют соли при
взаимодействии с основаниями или основными оксидами; им соответ-
ствуют кислоты:
SO3->H2SO4; Р2О5->НзРО4;
SO2, N2O3, СО2, NO2, SiO2, СтОз, В2О3, Р2О3, CI2O7.
Амфотерные оксиды - это такие оксиды металлов, которые проявляют
как свойства основных оксидов, так и свойства кислотных оксидов;
им соответствуют и кислоты, и основания.
ZnO -» H2ZnO2; ZnO -» Zn(OH)2:
AI2O3, СггОз, РегОз, ВеО.
Двойные оксиды - это оксиды, в которых атомы одного элемента на-
ходятся в разных степенях окисления:
РеОРе2Оз=РезО4.
Номенклатура. По международной номенклатуре название оксидов
образуется из слова “оксид” и названия элемента с указанием степени
окисления элемента римскими цифрами: SO2- оксид серы (IV), СггОз -
оксид хрома (III), FeO - оксид железа (II).
Способы получения.
1, Взаимодействие простых веществ с кислородом:
Са + 1 /2 Ог = CaO; S + Ог = SO2; 4А1 + ЗОг = 2АЬОз.
2. Термическое разложение оснований, кислот, солей:
Mg(OH)2 = MgO + Н2О ; 2НзВОз = В2О3 + 3 Н2О;
2Pb(NO3)2 = 2 PbO + 4 NO2 + O2.
З.Взаимодействие кислот-окислителей с простыми веществами:
С + 2H2SO4 (кони) = СОг + 280г + 2 НгО ;
Си + 4HNO3 (кони) - Cu(NO3)2 + 2 NO2 + 2 Н2О.
Химические свойства.
1. Взаимодействие основных оксидов с водой:
СаО + Н2О = Са(ОН)г; SO2 + Н2О = H2SO3.
2. Взаимодействие основных оксидов с кислотами; кислотных окси-
дов с основаниями:
MgO + H2SO4 = MgSO4 + НгО ;
SO2 + Са(ОН)2 = CaSO3 + Н2О.
8
3. Взаимодействие зкпопных оксидов с кислотными.
СаО + S02 - CaSOi,
СО’ I СаО = CaCOi
4. Амфотерные оксиды проявляют свойства и кислотных, и основных
оксидов:
ZnO + 2NaOH(,„) = Na.’ZnO.' + IhO (нагревание) ;
ZnO + 2HCI = ZnCh+H-O.
Основания
Основания - это соединения, в которых положительно заряженный
ион металла (а также Nil/ и нек. др.) связан с отрицательно заря-
женным гидроксид-ионом. Общая формула оснований - Ме(ОН)х.
Основания подразделяют на не растворимые в воде, растворимые в
воде (щелочи) и амфотерные.
Номенклатура: основания называют гидроксидами с указанием степе-
ни окисления металла: Сг(ОН)2 - гидроксид хрома (II), Сг(ОН)з - гид-
роксид хрома (III).
Способы получения.
1. Общим способом являются реакции ионного обмена:
C11SO4 + 2КОН = K2SO4 + Сп(ОН)21;
№’СОз+ Ва(ОН)2 = ВаСОз-1 + 2NaOH.
2. Щелочи получают взаимодействием щелочных, щелочноземельных
металлов с водой; растворением в воде основных оксидов:
2Na + 2Н’О = 2 NaOH + Н2Т; Са + 2Н2О = Са(ОН)2 + Н2Т;
СаО + Н2О = Са(ОН)2; LBO + Н2О = 2LI ОН.
3. Электролизом водных растворов галогенидов металлов:
2NaCl + 2Н2О -> НгТ + ChT + 2NaOH;
2 А1С1з + 6Н?О -> 3H2t + ЗС12Т + 2 А1(ОН)з.
Химические свойства.
1. Все основания реагируют с кислотами (реакция нейтрализации):
NaOH + НС1 = NaCl + Н2О; Са(ОН)2 + Н2 SO< = CaSO4 + 2Н2О.
2. Амфотерные основания взаимодействуют с кислотами и щелочами
2НС1 + Zn(OH)2 = ZnCh + 2Н2О;
Zn(OH)2 + 2NaOII = Na2[Zn(OH)4
3 Щелочи реагируют с кислотными и амфотерными оксидами’
2NaOH + SO2 = NazSOj + Н2О;
2NaOH (кош4гоР)+ А1зОз (™) + ЗН2О = 2Na[Al(OH)4].
4. Растворы щелочей взаимодействуют с растворами солей-
2NaOH + РЬ(СНзСОО)2= Pb(OH)2l+ 2CH3COONa.
5. Основания реагируют с кислыми солями:
Са(НСОз)2 + Ва(ОН)2 = ВаСОз>1-+ CaCOsU 2Н2О.
6. Не растворимые в воде основания при нагревании разлагаются на
основной оксид и воду:
2 Fe(OH)3 = Fe»O3 + ЗН2О;
Mg(OH)2 = MgO + НзО.
2-3549
9
7. Щелочи взаимодействуют в растворах c huioi снами белым фосфо
ром, кремнием, некоторыми металлами:
2NaOH + Ch = NaCt+ NaCIO + I hO; (на холоде)
3NaOH + ЗН2О + 41’ = РНзТ + 3 NalhPCh;
2КОН + 6И2О + 2А1 = 2K[A1(O1I)4] + ЗН2Т.
Теории кислот и оснований . Кислоты
Существует несколько теорий кислот и оснований.
Согласно теории электролитической диссоциации С.Аррениуса, кис-
лоты - это соединения, которые при диссоциации в водных растворах
образуют положительно заряженные ионы водорода (Н+).
Основания, в рамках этой же теории, - соединения, которые при дис-
социации образуют ионы ОН-
Протонная теория И.Бренстеда определяет кислоты как соединения,
отщепляющие в данной реакции протоны, а основания как вещества,
принимающие протоны:
НС1 + NH3 <------------> NHC + С1-.
кислота основание кислота основание
В рамках теории Льюиса - кислоты - это ионы или нейтральные моле-
кулы. способные принять одну или несколько электронных пар.
Основания - это ионы или нейтральные молекулы, способные отда-
вать электронные пары.
В классическом смысле кислоты подразделяются на бескислородные -
НС1, HBr, HCN (циановодородная) и кислородсодержащие - HNO3,
H2SO4, Н3РО4.
Количество атомов водорода, способных замещаться металлами с
образованием солей, определяет основность кислоты. В приведенных
примерах:
H2SO4 - двухосновная Н3РО4 - трехосновная кислота.
Номенклатура: названия кислородных кислот образуются из названия
неметалла с прибавлением окончания -пая,-вал, если степень окисле-
ния неметалла равна номеру группы. При понижении степени окисле-
ния суффиксы меняются в следующем порядке: -оватая, - истая, - ова-
тистая.
H2SO4 - серная кислота,
H2SO3 - сернистая,
НСЮ4-хлорная,
НСЮз - хлорноватая,
НСЮ2- хлористая,
НС1О - хлорноватистая.
Способы получения
1. Из простых веществ:
H2+S = H2S.
3. Взаимодействием солей с кислотами:
NaCl + H2SO4 = НС1 Т+ NaHSCh.
HNO3 - азотная кислота,
HNCh - азотистая,
НзРОд - фосфорная,
НзРОз- фосфористая,
Н3РО2 - фосфорноватистая,
2. Присоединением воды к оксидам:
Р2О5 + Н2О = 2 НРОз.
10
4. Окислением некоторых простых веществ:
31’ + 5HNO1 + 21ЬО = 31Ы’()4 । 5NO t.
Химические свойства кислот.
Общими свойствами кислот являются: действие на индикатор, взаимо-
действие с металлами, оксидами, основаниями, солями.
Специфические свойства кислот связаны со способностью ряда кислот
проявлять сильные окислительные свойства.
I. В растворах кислот изменяют цвет индикаторы: лакмус окраши-
вается в красный цвет, метилоранж в реповый, фенолфталеин остает-
ся бесцветным.
2. Металлы, стоящие в ряду напряжений до водорода, вытесняют по-
следний, взаимодействуя с кислотами - неокислителями:
Zn + 2НС1 = ZnCh + Hz ?;
Си + HzSOt (разе) не реагирует.
3. Кислоты образуют соли, взаимодействуя с основными, амфотерны-
ми оксидами и основаниями:
CaO + 2НС1 = CaClz + HzO ;
AlzCh + 6НС1 = 2A1CU + 3HzO;
2KOH + H2SO4 = K2SO4+ 2H2O.
4. Кислоты вступают в реакции с солями:
BaCh + H2SO4 = BaSChJ- + 2НС1;
H2SO4 (кокц) + 2KN0j(tb) = K2SO4 + 2HNChT.
5, При нагревании некоторые кислородсодержащие кислоты разлага-
ются:
2HNO3 = 2NOz + Н2О + 1/20,; HzSiOs = Н2О + SiO2.
Соли
Соли - это химические соединения, которые в водных растворах диссо-
циируют с образованием катионов металла (а также NH4+ и нек. др.) и
анионов кислотного остатка.
Соли - это продукты замещения атомов водорода в кислоте на металл
(а также NH4+ и нек. др.). Соли подразделяют на средние, кислые,
основные и комплексные.
Средние соли - продукты полного замещения атомов водорода на ме-
талл; BaS04, СаСОз, (NH4)zSO4.
Смешанные соли (средние)- соли двух кислот: Cl- Са-ОС1.
Двойные соли (средние) - атомы водорода многоосновной кислоты
замещены различными металлами: NaKSCU
Кислые соли - это продукт неполного замещения атомов водорода в
кислоте на металл: Ва(НСОз)г, MgHPCh, NaHSCh.
При электролитической диссоциации кислые соли дают отрицательно
заряженные ионы кислотных остатков и положительно заряженные
ионы двух видов - металла и водорода.
Основные соли помимо металла и кислотного остатка содержат гидро-
ксильные группы ОН-: Al(OH)Ch, Сг(ОН)гЫОз.
2
11
Кислоты. ( Lojiii. I loMCHKJiarypa
Название кислоты Формула Кислотный Соль остаток 1 кивание соли
Азотистая HNO2 NO2 KNO2 нитрит калия
Азотная HNOi NO3 KNO3 нитрат калия
Бром оводородиая НВг Вт КВг бромид калия
Иодоводородная Н1 I KI иодид калия
Кремниевая НгБЮз БЮз2 КгБЮз силикат калия
Марганцовая НМпО4 МпО4" КМпО4 перманганат калия
Марганцовистая Н2М11О4 МпО42- КгМпСД манганат калия
Серная H2SO4 SO42- HSO4- Кг SO4 KHSO4 сульфат калия гидросульфат калия
Сернистая H2SO3 БОз2- НБОз Кг БОз сульфит калия КНБОз гидросульфит калия
Сероводородная H2S Б2~ HS Кг Б сульфид калия KHS гидросульфид калия
Соляная НО С1 КС1 хлорид калия
Угольная H2CO3 СОз2 НСОз КгСОз КНСОз карбонат калия гидрокарбонат калия
Фосфорная (орто) H3PO4 РО43- НРО42- HJPO КзРО4 К2НРО4 КН2РО4 фосфат калия гидрофосфат калия ди гидрофосф ат калия
Фосфорная (мета) НРОз РОз КРОз метафосфат калия
Фтороводородная HF F- KF фторид калия
Хлорноватистая нею сю КСЮ гипохлорит калия
Хлористая НСЮг 002 КСЮг хлорит калия
Хлорноватая НСЮз СЮз- КСЮз хлорат калия
Хлорная НС1О4 С1О4 КС1О4 перхлорат калия
Хромовая НзСгО4 СгО42- КгСгО4 хромат калия
Двухромовая НгСггО? СггО?2- К2СГ2О7 AI(OH)Ch гидроксихлорид алюминия Cr(OH)2NCh дигидроксинитрат хрома Т1(ОН)зС1 тригидроксихлорид титана дихромат калия
Способы получения.
1. Взаимодействием металлов с кислотами и кислотами'- окислите-
лями:
Mg + 2НС1 = MgCh + Нг Т; Си + 2Н2БО4(конц) = CuSO4+ SO2T+ 2Н2О.
2. - основного оксида с кислотой:
ВаО + H2SO4 = BaSO4 + Н2О.
3. - основания с кислотой:
Са(ОН)2 + H2SO4 = CaSO4 + 2НгО.
12
4 - соли с кислотой:
BaCOi + 2HNO3 = Ba(NO.)j I- IbO + CO/T.
5. - основного оксида с кислотным оксидом:
Ag?O + SO3 = AgjSO-i
6. - кислотного или амфотерного оксида с основанием:
N2O5 + 2NaOH = 2 NaNOi + IbO.
7. - неметалла со щелочью:
ЗСЬ + 6 NaOH = NaClOs + 5 NaCl + ЗН2О. (кипячение)
8. - металла со щелочью:
2AI + 2NaOH + 2Н2О = 2 NaAlO2 + ЗН2?; (400-500"С)
2А1 + 6NaOH + 6Н2О = 2 №з[А1(ОН)6] + ЗНгТ.
9. - металла с неметаллом:
2Cr + 3Ch = 2 СгС1з.
10. - кислотного оксида с солью:
Na’COj + SiO2 = Na2SiO3 + СО2 Т. (> 1100°С)
11. - щелочи с солью:
Ге(ХОз)з + ЗКОН = Fe(OH)3l + 3KNO3.
12. - неметалла с солью:
С12 + 2 Nal = 2 NaCl + I2; S + Na2SO3 = Na2S2O3.
13. - соли с солью:
BaCh + K2SO4 = BaSO4 + 2KC1.
14. При нагревании ряда кислородсодержащих солей образуются но-
вые соли:
2NaNO3 = 2NaNO2 + О2; Са(Н2РО4)2 = Са(РОз)2 + 2Н2О.
Химические свойства.
Характерными свойствами солей является их способность участвовать
в реакциях ионного обмена с кислотами, щелочами, солями. Ионы
металлов могут быть восстановлены атомами более активных метал-
лов или путем электролиза:
BaCh + H2SO4 = BaSO41 + 2 НС1;
AI(NO3)3 + ЗКОН = Al(OH)3i + ЗКИОз;
(NH4)2HPO4 + 2КОН = К2НРО4 + 2NH3? + 2IW;
2AgF + Na2S - Ag2S4- + 2NaF;
Cu + 2AgNO3 = 2Ag + Cu(NO3)2;
2C11SO4 + 2H2O = 2H2SO4 + 2Cu + O2T (электролиз).
Большинство солей устойчиво при нагревании. Однако соли аммония,
малоактивных металлов, слабых кислот и кислот, в которых элементы
проявляют высшие или низшие степени окисления, а также нитраты
при нагревании разлагаются:
(NH4)2Cr2O7 = N2 + СггОз + 4Н2О;
4К2СГ2О7 = ЗО2 + 2Сг20з + 4К2С1О4;
Cu(NO3)2 = CuO + 2NO2 + I/2O2;
4КС10з = КС1 + ЗКСЮ4;
СаСОз = СаО + СО2;
4Na2SO3 = Na2S + 3Na2SO4;
13
2NaHSOj = NaiSCb + SO? + 1I?O.
Комплексные соединении
Комплексные соединении - сложные химические соединения, молекулы
которых в растворах диссоциируют на комплексные и простые ионы:
(Си ( NH3 )„ ] SO4 == [Cu(NH3)4]2++SO42’
лиганды
1 2
[Cu(NH3 )„] .
центральный
атом
Количество лигандов (координированных молекул или ионов), рас-
положенных вокруг центрального атома, определяется его координа-
ционным числом.
Центральный атом вместе с лигандами составляет внутреннюю сферу
комплексного соединения; молекулы или ионы, окружающие ком-
плексный ион, образуют внешнюю сферу. В комплексах с координаци-
онным числом 2 лиганды располагаются линейно; при координаци-
онном числе 4 комплексы имеют преимущественно тетраэдрическую
структуру (центральный ион располагается в центре, а лиганды - по
вершинам тетраэдра); для комплексов с координационным числом 6
характерно октаэдрическое строение с расположением лигандов по
вершинам октаэдра, а ионов металла - в центре октаэдра.
Важнейшими типами комплексных соединений являются: ацидоком-
плексы, аквакомплексы, аммиакаты, хелаты.
К ацидокомплексам относятся соединения, которые можно рассмат-
вать как двойные соли: KifHgL] , Кз[бе(СК)б], Na2[SnCk] ; комплекс-
ные кислоты - H JSiFr], HfAuCh]: гидроксокомплексы - К[А1(ОН)4].
В аквакомплексах лигандами служат молекулы воды; [Са(НзО)б]С12,
[Сг(Н2О)б]С1э. Координированные во внутренней сфере молекулы во-
ды удерживаются прочно и выделяются из растворов в виде кри-
сталлогидратов СаСИбНгО.
Аммиакаты содержат в качестве лигандов молекулы аммиака:
Со[(ЦНз)в]С1з , [Cu(NH3)4]SO4
Некоторые комплексы способны образовывать циклические структу-
ры с центральным атомом, образуемые при этом соединения назы-
ваются хелатными комплексами:
ацетилацетонат меди
Комплексные соединения образуются за счет донорно-акцепторных
связей. Чтобы атом мог служить донором электронов, у него должна
быть хотя бы одна неподеленная электронная пара. У акцептора во
14
внешней оболочке должна быть по крайней мере одна вакантная ор-
биталь. Акцептором может служить катион металла, или атом пере-
ходного металла, или один из атомов, входящих в состав молекулы.
В молекуле воды а том кислорода имеет две нснодслснные электрон-
ные пары, в молекуле аммиака имеется одна нсиодслспная пара элек-
тронов, которые используются для образования связей.
Строение атома
Атомистические теории 18 19 вв. предполагали, что атом - мельчай-
шая, неделимая частица материи. Исследования процессов прохожде-
ния электрического тока через жидкости и газы показали, что атом
состоит из положительно и отрицательно заряженных частиц. Наибо-
лее полно многообразие экспериментальных фактов объяснила
“планетарная1" теория строения атома, предложенная Э.Резерфордом
(1911) и усовершенствованная Н.Бором (1913).
Основные положения “планетарной" теории:
1. Атом состоит из положительно заряженного ядра, в котором сосре-
доточена основная часть массы атома, и отрицательно заряженных
электронов с зарядом е = 1,601 1019 Кл, тс (1/1840 у.е.
2. Атом в целом электронейтрален: заряд ядра равен суммарному за-
ряду электронов.
3. Электроны вращаются вокруг ядра, подобно планетам в поле при-
тяжения Солнца.
Постулаты Бора:
1. Электрон вращается вокруг ядра по строго определенным круго-
вым орбитам.
2. При движении по этим орбитам электрон не излучает и не погло-
щает энергию: энергия излучается и поглощается при переходе с орби-
ты на орбиту: ДЕ = Ei - Е2 = hv.
Справедливость постулатов Бор доказал, теоретически рассчитав
спектр энергетических переходов атома водорода. Энергия электрона
на орбите радиусом г, по Бору, равна:
Е - -1 In2- 2пте- е4/ h2,
где /; - постоянная Планка. Все величины, кроме п, в уравнении по-
стоянны, следовательно, энергия электрона в атоме определяется зна-
чением главного квантового числа п , которое принимает значения 1,2,
3,4 .... до +°о.
Бор рассматривал электрон как частицу. По современным представле-
ниям электрон проявляет свойства и частицы, и волны. Поведение
электронов в атоме описывается волновым уравнением. Следствием
решения волнового уравнения, кроме квантового числа п, являются
еще три квантовых числа: орбитальное, магнитное спиновое.
Орбитальное (побочное) квантовое число I характеризует форму орби-
тали. При заданном п, I может принимать значения: 0, 1,2 ...(и - 1).
15
Магнитное кваптонос число mt характеризует ориентацию орбитали
в пространстве и принимает значения: -/...,-1,0, 1,... /.
Спиновое квантовое число j характеризует собственный момент коли-
чества движения электрона и принимает значения ±1/2.
Форма электронной s орбитали в трехмерном пространстве с центром
координат, проходящим через ядро атома, - сфера; форма электрон-
ной р орбитали - “объемная восьмерка”. При заполнении электрон-
ных орбиталей атомов электронами выполняются три правила
(принципа): а) принцип Паули; б) правило Гуида; в) правило Клечко-
вского: а) в атоме не может быть двух электронов с одинаковым набо-
ром четырех квантовых чисел. Максимальное число электронов на
энергетическом уровне N= 2п2; б) устойчивому состоянию атома соот-
ветствует такое распределение электронов в пределах энергетического
подуровня, при котором абсолютное значение суммарного спина мак-
симально; в) электрон занимает в основном состоянии подуровень с
наименьшим значением суммы (и + /); если для двух подуровней сум-
мы (и+ /) равны, то сначала заполняется подуровень с меньшим значе-
нием п.
Электронные конфигурации атомов записывают в терминах двух (а)
или четырех (б) квантовых чисел.
?N a)ls22s22p;; б)
п ? т т
Химическая связь
Взаимодействие атомов в молекуле и молекул между собой осу-
ществляется с помощью химических связей. Различают внутримоле-
кулярные (ковалентная, полярная, ионная, донорно-акцепторная, ме-
таллическая) и межмолекулярные связи (водородная, ван-дер-вааль-
сова). Электроны внешних электронных слоев, принимающие участие
в образовании связи, называются валентными электронами. В ка-
честве валентных электронов, как правило, выступают неспаренные
электроны или свободные электронные пары.
Валентность - это количество связей, которое образует атом химиче-
ского элемента в молекуле.
Атомы металлов в наружном электронном слое в большинстве слу-
чаев имеют от одного до трех электронов. Чем легче металл теряет
электроны, тем он активнее. Одной из характеристик реакционной
способности металла является энергия ионизации - наименьшая энер-
гия, которая необходима для удаления электрона из атома на расстоя-
ние, равное бесконечности.
Атомы неметаллов имеют на внешнем уровне от 4 до 8 электронов.
Мерой проявления неметаллических свойств является сродство к элек-
трону - это энергия, выделяющаяся вследствие присоединения электрона
к атому (измеряют в эВ / атом).
16
Энергия связи но игсргпя, которая выделяется пли поглощается при
образовании пин разрыве связи ( кДж/ моль).
Длина связи - это расстояние между ядрами атомов, при котором
притяжение между атомами равно силам отталкивания.
Дипольный момент - мера полярности молекулы, представляющая
собой произведение величины заряда па расстояние между центрами
положительного и отрицательного зарядов в молекуле:
ц = qг (единица измерения - Дебай, D).
Правило октета - при образовании химической связи атомы, как пра-
вило, стремятся получить завершенную (двух - дублет или восьми
октет) электронную оболочку инертного газа.
Согласно современной теории связь между атомами А и В осу-
ществляется за счет образования электронной пары. При этом можно
рассмотреть следующие случаи:
а) в образовании связи участвуют одинаковые или близкие по свойствам
атомы, в этом случае электронная пара находится между атомами А и
В на одинаковом расстоянии от каждого их них - такой тип связи на-
зывается ковалентным, соединения с ковалентным типом связи - Hz,
N2, Ch, О,;
б) атомы А и В резко отличаются по своим свойствам (А - типичный
металл, В - типичный неметалл), электронная пара смещена к атому
В, и связь образуют положительно заряженный ион металла и отри-
цательно заряженный ион неметалла - такой тип связи называется
ионным, соединения с ионным типом связи - Nad, КВг;
в) атомы А и В отличаются по своим свойствам, что приводит к сме-
шению электронной пары к атому В и возникновению заряда 8+ на
атоме А и 8- на атоме В - такой тип связи называют полярным, соеди-
нения с полярным типом связи HCI, Н2О;
г) атом А имеет неподеленную электронную пару, а атом В имеет
свободную орбиталь, тогда атом А (донор) отда'ет электронную пару, а
атом В (акцептор) принимает электронную пару - такой тип связи
называется донорно-акцепторным, типичное соединение с донорно-
акцепторным типом связи - NH-rCl.
Металлическая связь - это связь, в которой электроны каждого от-
дельного атома принадлежат всем атомам, находящимся в металле.
Межмолекулярное взаимодействие обусловлено электростатическим
взаимодействием разноименных полюсов полярных молекул.
Водородная связь - это связь между положительно заряженным ато-
мом водорода одной молекулы и электроотрицательным атомом дру-
гой молекулы. Энергия водородной связи (2-10 ккал/ моль) значи-
тельно меньше энергии ковалентной связи (энергия ковалентной связи
кислорода с водородом равна НО ккал /моль)1. Несмотря на неболь-
шие величины энергии водородная связь приводит к ассоциации мо-
лекул. Проявляется, например, в спиртах ROH, воде HzO.
1 1 ккал - 4,1868 кДж.
3 3549
17
Нан-дср-ваальсопа спин. но pa iiioiiiuukk и. мсжмолскулярши' им
имо действия ia ciei наведенных дипольных momciiiob.
(ipmniie ядра атома. I'a.iiioan iiniiKK i i.
Я дро а дома часть атома. iapn.'icenna>i пою.житетпо. в которой ro-
средоточена основная масса атома. Ядро состош из нуклонов 'прото-
нои и нейтронов). ( умма числа прогонов Z и neiiipoiioi) N называв н:я
массовым 'шелом .-I: . 1 = Z + Л;.
Протоны - положительно заряженные частицы с условной единицей
наряда +1 и массой 1.00728 а.е.м. Порядковый номер элемента равен
числу прогонов в атоме и определяет общий положительный заряд
ядра, а также место элемента в периодической системе.
Нейтроны электрически нейтральные частицы с массой 1,00866 а.е.м
Число нейтронов в ядрах одного и того же химического элемента мо
жег быть разным.
Изотопы разновидности хи-
мических элементов, атомы ко-
торых имеют разные массы.но
один и тот же заряд ядер'.
Изобары - разновидности хи-
мических элементов, имеющих
одинаковую массу, но разные
заряды ядер.
1в it is <— массовое число ядра^- 54 54
0,0.0 Cr , Fe
888 «- порядковый номер атома-» 24 26
Ядерные реакции процессы перераспределения протонов и нейтронов
в порах ато мае с образованием новых эле ментов.
Радиоактивность - самопроизвольное испускание частиц пти волн ка-
ким-либо элементом, обусловленное распадом атомных ядер.
Изотоны подразделяются на устойчивые и неустойчивые. Устойчивые
изотопы не подвергаются радиоактивному распаду. Неустойчивые
изотопы радиоактивны.
Радиоактивные вещества испускают излучение трех типов:
а (альфа)-излучение поток ядер гелия с массой 4 и зарядом+2. спо-
собен пройти сквозь слой металла толщиной не более 0.01 мм;
Р (бета)-излучение - поток электронов, способен пройти сквозь слой
металла толщиной 0,01 м.
у (гамма)-излучение - электромагнитное излучение с высокой энерги-
ей, подобное рентгеновскому излучению, обладает высокой прони-
кающей способностью.
Период полураспада Tin неустойчивого изотопа - это время, за кото-
рое его радиоактивность уменьшается вдвое по сравнению с исход-
ной: (in = 0,693 / X. где X - постоянная распада.
Известны три естественных ряда радиоактивных элементов:
1 ряд урана начинается с 2^U, путем последовательных ядерных
превращений заканчивается изотопом свинца 2^РЬ;
18
2 ряд актиния начинается с ?,р II и заканчивается I’b;
а ряд тория начинается с ’,Л1 1 h п закапчивается R, I’b
Когда moron претерпеваета-раснад, сто атомный номер уменьшается
на 2, а массовое число па 4: при |)-расиадс атомный номер уиеличи
вается на 1. а массовое число не меняется:
а-распад
$Th + 2 Нс
0-раснад
2”Th-^Pa + '’е.
Искусственные ядерные превращения (ядерные реакции) , с цслыо полу-
чения устойчивых или неустойчивых изотопов, осуществляются при
бомбардировке ядер атомов частицами с высокой энергией (а-, Р-, у-
лучи, нейтроны, ядра дейтерия):
N + 2 Не->'gO + ) Н ; N + J Н О + у:
f3Al + (!n-> *Na+ 2 Не ; f3 Al + ? Не-> ??Р + о п.
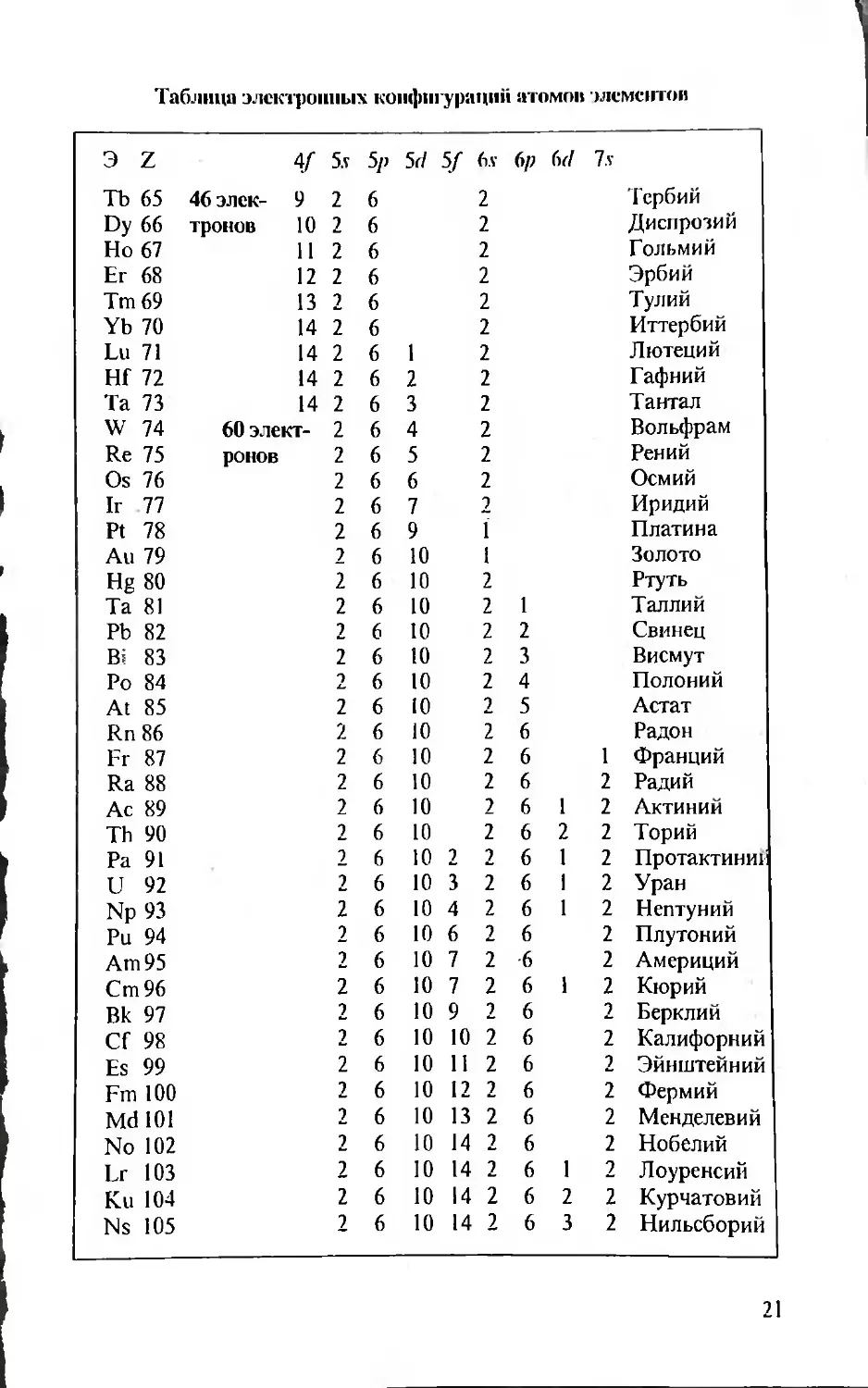
Таблица электронных конфигураций атомов элементов
э Z Is 2s 2p Э5 3p 3(1 4s 4p 4rf 4/
Н 1 Не 2 Li 3 Be 4 В 5 С 6 N 7 О 8 F 9 Ne 10 Na 11 Mg 12 Al 13 Si 14 P 15 S 16 Cl 17 Ar 18 К 19 1 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 1 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 1 2 3 4 5 6 6 6 6 6 6 6 6 6 6 1 2 2 2 2 2 2 2 2 1 2 4 5 6 6 1 Водород Гелий Литий Бериллий Бор Углерод Азот Кислород Фтор Неон Натрий Магний Алюминий Кремний Фосфор Сера Хлор Аргон Калий
Ca 20 2 2 6 2 6 2 Кальций
Sc 21 2 2 6 2 6 1 2 Скандий
Ti 22 2 2 6 2 6 2 2 Титан
V 23 2 2 6 2 6 3 2 Ванадий
Cr 24 2 2 6 2 6 5 1 Хром
з1
19
Таблица >лекг|и>|шых конфигурации а юмов злемсиюв
э / 3<Z 4.v 4p 4г/ 4/ 5.v 5p 5г/ 5/ 6.V
Мп 25 18 элск-5 2 Марганец
Ее 26 тропов 6 2 Железо
Со 27 7 2 Кобальт
Ni 28 8 2 Никель
Си 29 10 1 Медь
Zn 30 10 2 Цинк
Ga 31 10 2 1 Галлий
Ge 32 10 2 2 Германий
As 33 10 2 3 Мышьяк
Se 34 10 2 4 Селен
Br 35 10 2 5 Бром
Ki 36 10 2 6 Криптон
Rb 37 10 2 6 1 Рубидий
Sr 38 10 2 6 2 Стронций
Y 39 10 2 6 1 2 Иттрий
Zr 40 10 2 6 2 2 Цирконий
Nb 41 28 элект- 2 6 4 1 Ниобий
Mo 42 ронов 2 6 5 I Молибден
Tc 43 2 6 6 1 Технеций
Ru 44 2 6 7 I Рутений
Rh 45 2 6 8 1 Родий
Pd 46 2 6 10 Палладий
Ag 47 2 6 10 1 Серебро
Cd 48 2 6 10 2 Кадмий
In 49 2 6 10 2 1 Индий
Sn 50 2 6 10 2 2 Олово
Sb 51 2 6 10 2 3 Сурьма
Те 52 2 6 10 2 4 Теллур
I 53 2 6 10 2 5 Йод
Xe 54 2 6 10 2 6 Ксенон
Cs 55 2 6 10 2 6 1 Цезий
Ba 56 2 6 10 2 6 2 Барий
La 57 2 6 10 2 6 1 2 Лантан
Ce 58 2 6 10 2 2 6 2 Церий
Pr 59 2 6 10 3 2 6 2 Празеодим
Nd 60 2 6 10 4 2 6 2 Неодим
Pm 61 2 6 10 5 2 6 2 Прометий
Sm 62 2 6 10 6 2 6 2 Самарий
Eu 63 2 6 10 7 2 6 2 Европий
Gd 64 2 6 10 7 2 6 1 2 Гадолиний
20
Таблицы электронных конфигураций атомов элементов
Э Z 4F 5.v 5/> 5г/ 5f 6.V 6p M 7.v
ТЪ 65 46 элек- 9 2 6 2
Dy 66 тронов 10 2 6 2
Но 67 11 2 6 2
Ег 68 12 2 6 2
Тт 69 13 2 6 2
Yb 70 14 2 6 2
Lu 71 14 2 6 1 2
Hf 72 14 2 6 2 2
Та 73 14 2 6 3 2
W 74 60 элект- 2 6 4 2
Re 75 ронов 2 6 5 2
Os 76 2 6 6 2
Ir 77 2 6 7 э
Pt 78 2 6 9 1
Au 79 2 6 10 1
Hg 80 2 6 10 2
Ta 81 2 6 10 2 1
Pb 82 2 6 10 2 2
Bi 83 2 6 10 2 3
Po 84 э 6 10 2 4
At 85 2 6 10 2 5
Rn 86 2 6 10 2 6
Fr 87 2 6 10 2 6 1
Ra 88 2 6 10 2 6 2
Ac 89 2 6 10 2 6 1 2
Th 90 2 6 10 2 6 2 2
Pa 91 2 6 10 2 2 6 1 2
U 92 2 6 10 3 2 6 1 2
Np 93 2 6 10 4 2 6 1 2
Pu 94 2 6 10 6 2 6 2
Am 95 2 6 10 7 2 6 2
Cm 96 2 6 10 7 2 6 1 2
Bk 97 2 6 10 9 2 6 2
Cf 98 2 6 10 10 2 6 2
Es 99 2 6 10 11 2 6 2
Fm 100 2 6 10 12 2 6 2
MdlOl 2 6 10 13 2 6 2
No 102 2 6 10 14 2 6 2
Lr 103 2 6 10 14 2 6 1 2
Ku 104 2 6 10 14 2 6 2 2
Ns 105 2 6 10 14 2 6 3 2
Тербий
Диспрозий
Гольмий
Эрбий
Тулий
Иттербий
Лютеций
Гафний
Тантал
Вольфрам
Рений
Осмий
Иридий
Платина
Золото
Ртуть
Таллий
Свинец
Висмут
Полоний
Астат
Радон
Франций
Радий
Актиний
Торий
ПротактиниТ
Уран
Нептуний
Плутоний
Америций
Кюрий
Берклий
Калифорний
Эйнштейний
Фермий
Менделевий
Нобелий
Лоуренсий
Курчатовий
Нильсборий
21
Псрио пгнскаи ciicicM» viCMCinon Д.П.Менделеева
Периодический /икон ,'(JI.Mcnih”ici4iti (IKW/ t iioiicina прея n.iz i'-i
также формы и свойства соединений ijicmchiob иаходя1ся в периоди-
ческой зависимости oi i>ejiii*inii атомных масс ikcmciiiob.
Современная формстровка периодического /окопа спой' два просты/
тел. а также формы и свойства соединений ijicmchiob находятся в пе-
риодической зависимости от величины заряда ядра атома (порядково-
го номера) химического элемента.
Период - горизонтально расположенная последовательность элсмеи-
гов в периодической системе, в пределах которой закономерно изме-
няются свойства элементов от типичного металла до типичного неме-
талла.
Периоды 1 - 3 содержат по одному ряду элементов и называются ма-
лыми, 4-7 называются большими
Большие периоды состоят из четных и нечетных рядов В этих перио-
дах наблюдается двойная периодичность: помимо общего для всех
периодов изменения свойств от щелочного металла до инертного газа
отмечается изменение свойств отдельно в пределах четного и нечетно-
го ряда. У элементов четных рядов преобладают металлические свой-
ства, и их ослабление слева направо замедлено по сравнению с нечет-
ным рядом. В нечетных рядах происходит заметное ослабление ме-
таллических свойств и усиление неметаллических.
Особое положение занимают элементы лантан-57, актиний-89 и сле-
дующие за ними 14 элементов: по химическим свойствам они очень
сходны между собой, поэтому лантану и лантаноидам, актинию и
актиноидам выделено по одной клетке в периодической системе.
Сходные по своим свойствам элементы собраны в вертикальные ряды,
которые называются группами.
Подгруппы, которые содержат элементы 2- го и 3- го периодов, назы-
ваются главными-, элементы нечетных рядов составляют побочные под-
группы.
Элементы главных подгрупп по своим химическим свойствам значи-
тельно отличаются от элементов побочных подгрупп.
Номер группы, как правило, показывает высшую валентность элемен-
та по кислороду. Элементы главных подгрупп характеризуются также
валентностью по водороду, Летучие водородные соединения образу-
ют элементы IV, V, VI, VII групп. Некоторые исключения отмечаются
у элементов подгруппы меди и VIII группы. В VIII группе в каждой
клетке периодической системы находятся по три элемента: Fe, Со, Ni;
Ru, Ph, Rd; Os, Ir, Pt.
В группах с увеличением атомной массы элемента усиливаются его
металлические свойства.
Особенно четко это проявляется в главных подгруппах. Наиболее
сильно металлические свойства выражены у франция, неметалличе-
ские - у фтора.
22
Ai pci:iIнос coeioiiiiiic iieincciii:i
Агрегатное состояние ncmccrna »io форма сущее i кования iktiici iiih h
конкретных условиях. Различают: .•<иоо6/щщос, wz/P/wr, твердое
кристаллическое и аморфное ai pci а гныс состояния.
Газообразное состояние характертуется малыми силами мсжмолску
лярного взаимодействия и большими кинетическими iiicpi иями час
гни Частины газов находя гея на больших расстояниях друт оз друга
Газы приобретают объем и форму сосуда, в котором они находятся.
13 курсе средней школы при рассмотрении газообразно! о состояния
используется модель идеального газа (все частицы материальные
точки, не имеющие объема и не взаимодействующие друг с другом,
столкновение частиц происходит но законам упругих столкновений).
Жидкое состояние - промежуточное состояние между газами и твер-
дыми телами, которое характеризуется наличием сил взаимного при-
тяжения между отдельными молекулами жидкости. При увеличении
температуры свойства жидкости приближаются к свойствам газа, при
понижении температуры - к свойствам твердого тела. Жидкости не
имеют собственной формы (в небольших количествах жидкости спо-
собны сохранять форму капли), малосжимаемы.
Твердое состояние вещества характеризуется сильным взаимодействи-
ем между молекулами (атомами или ионами) и как следствие - нали-
чием определенного объема и формы
Твердые тела бывают кристаллическими и аморфными. В кристалличе-
ских веществах частицы, из которых построены кристаллы, размеще-
ны в пространстве в определенном порядке и образуют простран-
ственную решетку. В зависимости от природы частиц, находящихся в
узлах кристаллических решеток, различают молекулярные, атомные,
ионные и металлические решетки.
В узлах молекулярной решетки находятся полярные или неполярные
молекулы связанные слабыми силами притяжения. Такую решетку
имеют органические соединения, их температура плавления невысо-
кая.
Атомы, связанные общими шектроннымч парами, располагаются в
узлах атомной решетки: такие соединения имеют очень высокие тем
пературы плавления (алмаз ).
Положительные и отрицательные ионы, чередующиеся между собой,
расположены в узлах ионной решетки. Ионные кристаллические ре-
шетки характерны для большинства солей, оксидов, оснований.
В узлах металлической решетки наряду с нейтральными атомами раз-
мещаются положительные ионы данного металла, между ними сво-
бодно перемещаются электроны (так называемый электронный газ).
Металлические решетки характерны для металлов, и их специфика
строения объясняет особенности свойств металлов. Прочность связи
между частицами, из которых построена кристаллическая решетка.
23
определяется величиной, которая называется энергией кригтатш-
ческой решетки.
Кристаллическая решетка разрушается при плавлении, растворении,
испарении вещества. Она построена из повторяющихся одинаковых
структурных единиц, которые называются элементарной ячейкой Су-
ществует се.иь типов элементарных ячеек: простая кубическая, простая
тетрагональная, простая ромбическая, простая моноклинная, гексаго-
нальная, ромбическая, триклинная,
Кроме того, насчитывается еще семь типов вложенных решеток. 1а-
ким образом, всего существует 14 типов кристаллических решеток.
Например, в случае примитивной кубической решетки гранецентриро-
ванная кубическая решетка представляет собой систему вложенных
простых кубических ячеек, вершины одной из них совпадают с цен-
трами граней другой. Объемно-центрированная кубическая решетка
представляет собой систему вложенных простых кубических ячеек, в
которой вершина одной ячейки совпадает с пространственным цен-
тром другой ячейки.
Аморфное состояние вещества представляет собой совокупность агре-
гатов беспорядочно расположенных молекул. Аморфные тела, в отли-
чие от кристаллических тел, плавящихся при строго определенной
температуре, плавятся в широком интервале температур. Аморфные
вещества можно рассматривать как жидкости с очень большой вяз-
костью.
Типы химических реакций
Химическая система - совокупность частиц и существующих между
ними взаимодействий.
Система является изолированной (замкнутой), если между ней и приле-
гающими системами отсутствует обмен как веществами, так и энерги-
ей.
Гомогенные системы (реакции) - это системы (реакции), в которых
реагирующие частицы не отделены друг от друга какими-либо гра-
ничными поверхностями, а составляют единое целое:
Нэд+СЬ)= 2 HCId)
Гетерогенные системы (реакции) - это системы (реакции), в которых
реагирующие вещества разделены граничными поверхностями:
Sn(iB) + 2Ch(r>= SnChir)
По изменению числа исходных и образующихся после реакции ве-
ществ химические реакции подразделяются на несколько типов.
1. Реакции разложения
ЗКНСОз = КзСОз + СО? +Н?О; (100-400 °C)
2. Реакции соединения '.
2К + Нз = 2КН; (200-350 °C)
СаО + НзО = Са(ОН)2;
24
3. Реакции замещения:
Fc + C11SO.1 = FcSO.i । ( i
4. Реакции двойного обмена:
NaCl + AgNOi = AgCI + NaNOj.
По направлению протекания химических реакций они подразделя-
ютпея на необратимые, которые завершаются полным превращением
исходных веществ в конечные продукты, и обратимые, которые в за-
висимости от условий могут протекать как в прямом, так и в обрат-
ном направлении. Необратимость химической реакции подчеркивает-
ся знаком равенства, а обратимость - противоположно направленны-
ми стрелками:
28Ог + О2 2SQj .
Группу окислительно- восстановительных реакций выделяют по приз-
наку изменения степени окисления атомов элементов реагирующих ве-
ществ.
По тепловому эффекту химические реакции подразделяют на реакции,
идущие с поглощением тепла (эндотермические) и с выделением тепла
(экзотермические).
Скорость химической реакции
Скорость гомогенной реакции
измеряется количеством вещест-
ва, вступающего в реакцию или
образующегося за единицу вре-
времени в единице объема сис-
темы.
Скорость гетерогенной реакции
измеряется количеством вещест-
ва, вступающего в реакцию или
образующегося за единицу вре-
мени на единице поверхности
фазы.
Г(гом) = Д,г/(ГД0; Г(гет) = Д/г / (S At),
где Д/г - количество прореагировавшего или образовавшегося вещества,
V- объем системы, S - поверхность фазы, на которой идет реакция, At
- время. Так как п / V- концентрация, то Г(ГОм) - АС/ Al.
Важнейшими факторами, влияющими на скорость химической реак-
ции, являются: природа реагирующих веществ, концентрация, темпе-
ратура, давление, катализатор.
Закон действия масс: скорость реакции в гомогенных системах при
постоянной температуре прямо пропорциональна произведению кон-
центраций реагирующих веществ в степенях, равных их стехиометри-
ческим коэффициентам.
Для реакции mA + //D = С
F=/t[A]"W,
где к - константа скорости химической реакции, зависящая от свойств
реагирующих веществ и температуры.
4-3549
25
Правило Ванг-Гоффа: при iioiibiiiicnnii температуры на 10 "С скорость
химической реакции увеличивается в 2 4 раза. Математически прави-
ло Вапт-Гоффа записывается следующим образом:
I, г,
'W.Y 10 ,
где у-температурный коэффициент скорости, Т- температура.
Не всякое столкновение реагирующих веществ приводит к химической
реакции между ними. Избыточная энергия, которой должны обладать
молекулы для того, чтобы их столкновение могло привести к образо-
ванию нового вещества, называется энергией активации Молекулы,
обладающие такой энергией, называются активными.
Зависимость константы скорости химической реакции от температу-
ры выражается уравнением Аррениуса:
К = Ае Rr ,
где А - постоянный множитель, Еа - энергия активации.
Химическое равновесие. Принцип Ле-Шателье
Состояние, при котором скорость прямой реакции равна скорости об-
ратной реакции, называется химическим равновесием:
СН3СООН(Ж)+ С2Н5ОН()К) — CHjCOOCjHs^+H^j .
Состояние равновесия может быть достигнуто с любой стороны. Си-
стема находится в состоянии динамического равновесия, при котором
происходит непрерывное образование и разложение молекул до тех
пор, пока она остается изолированной.
Состояние равновесия характеризуется константой равновесия:
m А + пВ -—- рС + gD;
гл п
V, = К, [ а ] [ В ] скорость прямой реакции
р q _ _
V2 = Кг [ С ] [ D ] скорость обратной реакции
По условию равновесия Vi = Vj ,
m n P 9
Ki[A] [В] = K2 [C] [DI ,
p g
K| _ [C] [ D] _ константа
— - К =------m n > Кг равновесия •
K2 C [A][B]n
Для каждой обратимой реакции при данных условиях константа рав-
новесия К является величиной постоянной. Она не зависит от кон-
центраций реагирующих веществ и изменяется только с изменением
температуры. Зная концентрации исходных веществ и значение кон-
станты равновесия, можно вычислить равновесные концентрации, т.е.
концентрации всех веществ, находящихся в химическом равновесии.
26
И наоборот, по равновесным концентрациям легко вычислить кон-
станту равновесия и исходные концентрации взятых для реакции ве-
ществ.
Для реакций с участием газов константа равновесия выражается нс
через их концентрации, а через парциальные давления газов. В этом
случае константу равновесия обозначаю!' символом /Ср:
н2(г) + 12(г) == 2Н1(г> :
2
ftll
Константа равновесия гетерогенной реакции:
900 °C
СаСО3(тв) СаО(тв) + СО2 (г) ;
КР ” РСО2(г)
Химическое равновесие можно смещать в ту или иную сторону, изме-
няя условия: концентрации веществ, давление, температуру.
Принцип Ле-Шателье (1884) качественно оценивает воздействие внеш-
них факторов на равновесие.
Внешнее воздействие (изменение концентрации, давления, температу-
ры) на систему, находящуюся в состоянии равновесия, вызывает сдвиг
равновесия в том направлении, -при котором частично компенсируется
влияние этого воздействия.
Основные понятия химической термодинамики
Внутренняя энергия U - запас энергии (химической) системы в данном
состоянии, свойство состояния. Зависит только от того, в каком со-
стоянии находится система, и не зависит от пути, каким система
пришла в это состояние. Абсолютное значение U измерить нельзя, но
можно определить ее изменение &U при переходе системы в другое
состояние.
Теплота (0 и работа (А) - разные формы передачи энергии, свойства
процессов. Зависят от того, каким способом энергия передается.
Первый закон термодинамики - поглощенная системой теплота расхо-
дуется на увеличение внутренней энергии системы и на совершение ею
внешней работы: Q = &U + А.
Энтальпия Н определяется соотношением Н = U + РУ, где Р - давле-
ние, V- объем.
Если система совершает работу расширения против постоянного
внешнего давления, то А = РДИ, Qp = ДС/ + А = (U2 - UJ + Р(У2 - yj =
(Ц+РГУ “ (С/Г,'^’И) = Нг- = ^P- To есть, изменение энтальпии
численно равно количеству поглощенной системой теплоты или, для
химической реакции, протекающей при постоянном, например атмо-
сфсриом, даплснпн тепловому эффекту реакции (см. далее; с обрат-
ным знаком
Если отсутствует работа расширении (реакция протекает при посто-
янном объеме), то в соответствии с первым законом термодинамики
(Л = Д(/,., и изменение внутренней энергии равно тепловому аффекту
реакции при постоянном объеме.
Энтропия X- количественная мера “беспорядка" в системе. Значение Л'
может быть только рассчитано, Свойство состояния.
Второй закон термодинамики (одна из формулировок) энтропия изо-
лированной системы или увеличивается, или остается постоянной:
Д5>0.
Третий закон термодинамики - энтропия идеального кристалла чисто-
го вещества при абсолютном нуле равна нулю.
Свободная энергия Гиббса G определяется соотношением G = Н - TS.
Изменение энергии Гиббса в процессе при постоянных температуре и
давлении является критерием самопроизвольности протекания этого
процесса. В случае химической реакции:
Gnpou — Ghcx ~ //прол — //исх — Т(Хпроя~Хисх) ~ AGpeaxq — Д//реакц — ТЛХреаки-
Если &G < 0, то реакция идет самопроизвольно при заданных услови-
ях, если AG > 0, реакция не идет. Знак AG определяется алгебраи-
ческой суммой двух факторов: энергетического (энтальпийного, Д//)
и энтропийного (ГДХ).
Пример: при растворении в воде соли (например, тиосульфата натрия)
теплота поглощается (i\H > 0), но процесс все же идет самопроизволь-
но, поскольку произведение 7ДХ > Л// (энтропия сильно увеличивается,
т.к. упорядоченное расположение частиц в кристалле переходит в хао-
тическое движение ионов в растворе ), и, в результате,
процесса <
Тепловые эффекты химических реакций. Закон Гесса
Раздел химии, в котором рассматривают тепловые эффекты химиче-
ских процессов, называют термохимией.
Тепловым эффектом реакции называется количество выделяющейся
или поглощаемой во время реакции теплоты при стандартных усло-
виях. При этом, если теплота выделяется, тепловой эффект считается
положительным (в отличие от термодинамической системы знаков,
когда положительной считается теплота, поглощенная системой), т.е.
Q=-bH.
Химические реакции, протекающие при постоянном давлении, назы-
ваются изобарными. Химические реакции, протекающие при постоян-
ном объеме называются изохорными. Запись химической реакции с
указанием теплового эффекта и агрегатного состояния называют тер-
мохимическим уравнением. Тепловой эффект реакции зависит от агре-
гатного состояния реагентов, поэтому в термохимических уравнениях
около символов реагентов указывают их агрегатное состояние:
28
и । - газообразное, (ж) жидкое, ( hi) гпердос.
Закон Гесса (1840): тепловой эффект реакции кишсит только от со-
стояния исходных веществ и конечных продуктов, но не зависит от
пути перехода
Закон Гесса справедлив для любых химических процессов, происходя-
щих с изменением энергии, поэтому с его помощью можно рассчиты-
вать энергии химических связей, кристаллических решеток, теплоту
растворения и т.д.
Теплота образования (?об|> - это теплота которая выделяется или по-
глощается при образовании 1 моля сложного вещества из простых
веществ при стандартных условиях. Теплота образования простых
веществ равна нулю.
Стандартные условна - давление 1 атм или 1,013 105 Па. В таблицах
стандартные значения термодинамических величин приведены для
298 К.
Теплота сгорания QaQf, - это теплота, выделяющаяся при сгорании
моля вещества в кислороде при стандартных условиях с образованием
оксидов элементов в высщих степенях окисления.
Следствия из закона Гесса.
Тепловой эффект реакции равен сумме теплот образования продуктов
реакции за вычетом сумм теплот образования исходных веществ:
Среаки — (2обр проа — £2оСр. ИСХ ВСШ .
Тепловой эффект реакции равен сумме теплот сгорания продуктов
реакции за вычетом сумм теплот сгорания исходных веществ:
Срсакц — ^сгир. исх. пет - ()сгор. прод .
Аналогичные соотношения справедливы и для энтальпий реакций,
выраженных через энтальпии образования или сгорания (ДЯ°обР и
ДН0сгоР ), которые обычно и приводятся в справочных термодинами-
ческих таблицах при стандартных условиях.
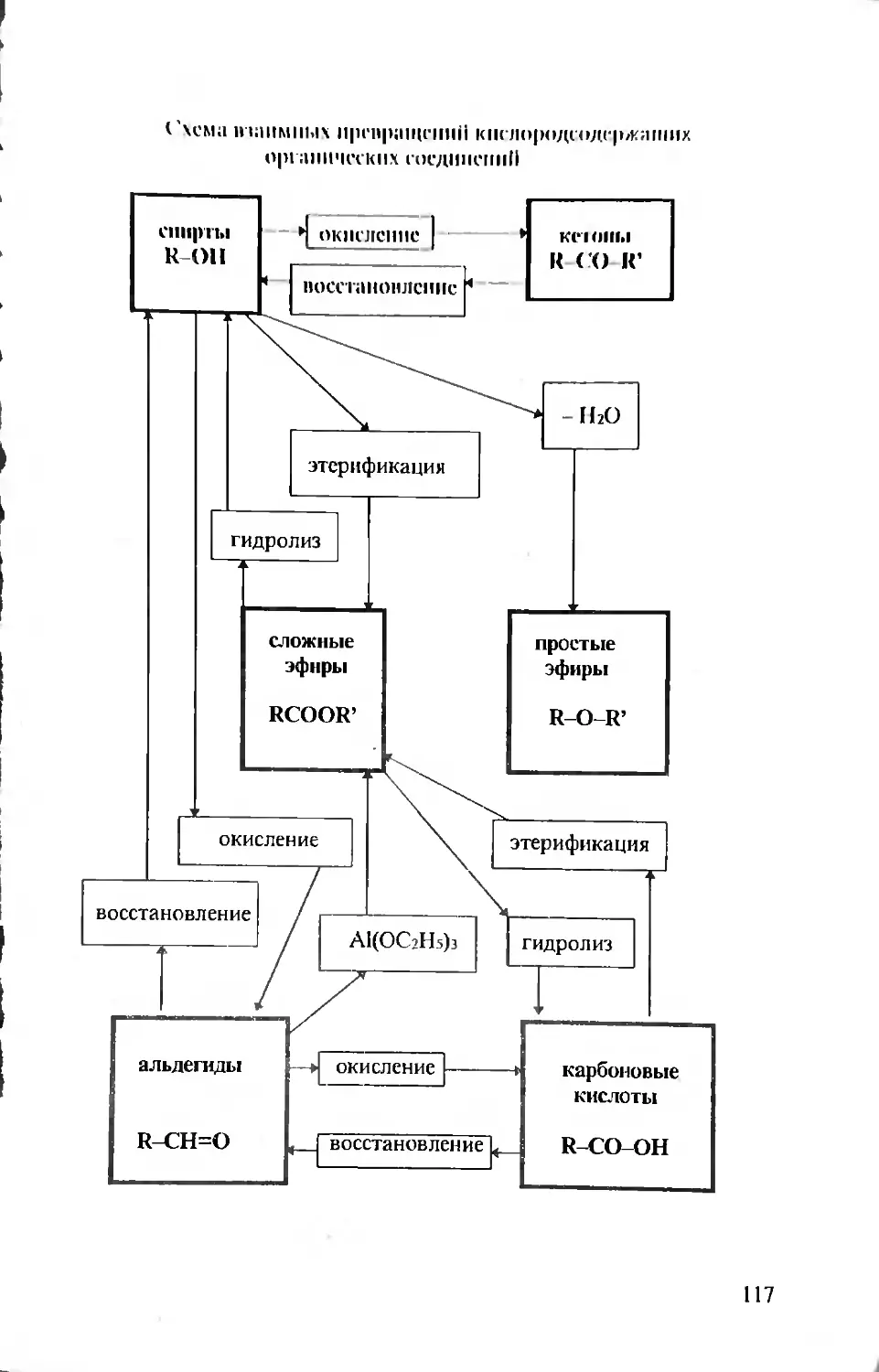
Растворы
Растворы - это гомогенные системы переменного состава, состоящие
из двух или более независимых компонентов
Один из компонентов является растворителем, а остальные - раство-
ренными веществами. Растворитель - вещество, количество которого
преобладает в данной системе.
Растворы однородны в различных частях объема, но отличаются от
химических соединений тем, что состав растворов может быть самым
разнообразным. В широком смысле под растворами понимают гомо-
генные смеси в любом агрегатном состоянии (твердое - твердое, твер-
дое - жидкое, газообразное - газообразное и т.д.)
29
Растворы подразделяются на истинные и коллоидные. Отдельно выде-
ляют суспензии. В истинных растворах размеры частик < I 10 ’ м, в
коллоидных I 10 9 — 5 10~7 м. Суспензии - системы с размерами частиц
>510-7м.
Тепловой эффект, сопровождающий растворение моля вещества, на-
зывается молярной теплотой растворения. Количество теплоты, ко-
торое выделяется при взаимодействии моля частиц растворен кого ве-
щества с молекулами растворителя определяет тепловой эффект соль-
ватации.
Растворение является примером типично обратимого процесса, когда
изменение условий, например увеличение температуры, приводит к
увеличению количества растворенного вещества в системе, а пониже-
ние температуры приводит к уменьшению количества растворенного
в системе вещества и выпадению осадка.
Насыщенный раствор - такой раствор, который находится в состоя-
нии динамического равновесия с твердой фазой растворенного ве-
щества и содержит максимально возможное при данных условиях
количество вещества.
Ненасыщенный раствор - это раствор, в котором количество раство-
ренного вещества меньше, чем в насыщенном растворе.
Пересыщенный раствор содержит растворенного вещества больше,
чем в состоянии насыщения; пересыщенные растворы крайне неста-
бильные, легко переходят в состояние насыщения путем кристаллиза-
ции.
Коэффициент растворимости (растворимость) - отношение массы ве-
щества, образующего насыщенный раствор при данной температуре,
к массе растворителя (или масса вещества растворенного в 100 г рас-
творителя).
Способы выражения концентрации растворов
Качественными характеристиками растворов являются понятия: кон-
центрированный раствор - большое (?) количество растворенного ве-
щества; разбавленный раствор - малое (?) количество вещества
Количественными характеристиками растворов служат понятия: мо-
лярная, процентная (или массовая доля) концентрация, моляльность.
Молярная концентрация (молярность) - число молей (М) растворенно-
го вещества в 1 л раствора.
Молярность раствора записывается числовым значением молярной
концентрации растворенного вещества, выраженной в моль/л с после-
дующей буквой М или словом “ молярный": 1 М - одномолярный рас-
твор, 0,1 М - децимолярный раствор.
Моляльность - число молей растворенного вещества в 1000 г раство-
рителя.
30
Процентная концентрация (%) - масса вещества в граммах, растворен-
ного в 100 г раствора.
Массовая доля вещества - это отношение массы растворенного ве-
щества к массе раствора (выражается в долях единицы или в процен-
тах ): 10% -и раствор NaCI - 10 г NaCI содержится в 100 1- раствора.
Электролиты. Электролитическая диссоциация
Электролиты - это вещества, растворы или расплавы которых прово-
дят электрический ток.
Неэлектролиты - вещества, растворы или расплавы которых не про-
водят электрический ток..
К электролитам относится большинство неорганических кислот,
оснований, солей; неэлектролиты - многие органические соединения:
спирты, углеводы и т.д. Растворы электролитов обладают более низ-
кими давлениями пара растворителя и температурами плавления и
более высокими температурами кипения по сравнению с соответству-
ющими значениями для чистого растворителя или для раствора не-
электролита в этом же растворителе.
Полученные экспериментальные факты объяснила теория электроли-
тической диссоциации (С.Аррениус, 1887), сущность которой сводится
к следующему:
вещества, растворы которых проводят электрический ток, при рас-
творении распадаются (диссоциируют) на ионы, несущие положитель-
ные и отрицательные заряды.
Процесс диссоциации во всех случаях является обратимым. В растворе
одновременно присутствуют как непродиссоциировавщие молекулы,
так и ионы. Различные электролиты диссоциируют на ионы в разной
степени. Степень диссоциации зависит от природы электролита, его
концентрации, природы растворителя, температуры. Уравнение элек-
тролитической диссоциации электролита КА можно записать в сле-
дующем виде:
КА - ~ К+ + А-.
Отношение числа молекул, распавшихся на ионы, к исходному числу
молекул электролита в растворе называют степенью электролити-
ческой диссоциации и обозначают буквой а:
а = ДГ / А = [К+] / [ ХЛ] = [Я ] / [КЛ],
где ТС- число продиссоциировавших молекул, N - общее число моле-
кул в исходном растворе, [А+], [Л ] , [АЛ] - молярные концентрации
заряженных ионов и исходного электролита. Степень диссоциации
выражается в долях единицы (0-1)или в процентах (0-100 %). Степень
диссоциации неэлектролитов равна нулю. Условно электролиты делят
на сильные (а > 30%), слабые (а < 3% ), средней силы 3% < а < 30 %).
31
Степень диссоциации как сильных, так и слабых электролитов тали
сит от концентрации раствора (а тем выше, чем более разбавлен рас-
твор)
Более точной характеристикой диссоциации электролита является
константа диссоциации, которая не зависит от концентрации раст во-
ра. Применяя закон действия масс к уравнению диссоциации электро-
лита, получим выражение для константы диссоциации, которая зави-
сит от температуры, природы растворителя и электролита, но не зави-
сит от концентрации электролита:
= [К41 [А~]
ЯИС [КА]
Ступенчатая диссоциация:
+ - Н+ [Н2РОГ1 з.
Н3РО4 Н + н2РО4 , К, =[ []НзРо71---------- = 7,5-10 ,
н2РО4- = н+ ♦ нро4- Л2=[^нр0НР^-= 6’3-10-8;
НРО42-^ н+ + РО43Т _ н4 [ РО43~1 _ 4 8.10-13
Аз 1 [ ,'нро^]
Фосфорная кислота по первой ступени диссоциации является средней,
по второй - слабой, а по третьей - очень слабой кислотой.
Ионные реакции - реакции между ионами, образующимися в резуль-
тате диссоциации электролитов, протекают до конца в случае образо-
вания осадка, газа, малодиссоциирующего соединения.
Ионное произведение воды. pH раствора. Произведение растворимости
Небольшая часть молекул воды (1 молекула из 550 млн) диссоциирует
на ионы водорода и гидроксид-ионы:
[Н+1(ОК] = Кравн I НгО]
Концентрация воды несравненно больше концентраций ионов водо-
рода и гидроксила, и поскольку она практически не меняется, то ее
считают постоянной. Тогда
[ Н+][ОН ] = К К = 110-14 моль2/л2 (при 25 °C)
П2О H2U
Произведение концентрации ионов водорода и гидроксид-ионов на-
зывается ионным произведением воды, оно постоянно для всех реак-
32
цнй, протекающих и водных растворах при постоянной icMiicpaiypc с
изменением температуры оно меняется.
Водородный показатель pH - отрицательный логарифм величины
концентрации ионов водорода, выраженной в молях на литр.
рН= 1g [П'|
pH < 7 - кислая среда [II ] > 10 7 моль /л;
pH = 7 нейтральная среда, [111J = 10 ' моль /л;
pH > 7 - щелочная среда , [II1 ] < 10 7 моль /л.
Произведение растворимости - это произведение концентраций ионов,
образующихся из труднорастворимого соединения, при постоянной
температуре (увеличивается с ростом температуры):
кх Ау х КУ++ удх ,
„ IК J [ A J г V. , Х X У
Аравн~ [КхАу] ' пр=кравн [КхАу 1 = [К ] [А ] ;
Са3(РО4)2 == ЗСа2++2РО43~ ПР=[Са2+]3 [РО43-]2.
Из выражения ПР видно, что если в насыщенном растворе соли уве-
личить концентрацию фосфат-ионов, например внесением NasPCh, то
концентрация ионов кальция понизится за счет выпадения осадка
Саз(РО4)г.
Гидролиз солей
Гидролиз солей - это реакция взаимодействия солей с водой, при ко-
торой часть растворенных катионов или анионов (или и те, и другие)
образуют недиссоциированные кислоты или недиссоциированные
основания. Как следствие подобного взаимодействия, такие растворы
не являются нейтральными.
Тип соли
Пример реакции гидролиза
Соль образована:
а) сильным осно-
ванием и слабой
кислотой
б) слабым осно-
ванием и силь-
ной кислотой
CHjCOONa + Н2О — NaOH + СНзСООН,
СНзСОО +Н2О ОН + СНзСООН;
реакция среды - щелочная (pH > 7)
NH4CI + Н2О ==* NH4OH + НС1,
nh4+ + h2o =NH4OH + H+:
реакция среды - кислая (pH < 7 )
33
5-3549
в) слабым осно-
ванием п слабой
кислотой
ClhCOONIhl 1ЬО NlhOIMCIht ООП
реакция среды п таком случае определяется
значениями констант диссоциации основания
(NlhOU, К - 6,3 I0-') и кислоты
(СПзСООП, К- 1,7510-’) н тгом случае
слабощелочная;
NaCl + lW -“Na'+CI + IhO
соли такого типа гидролизу не подвергаются,
реакция среды - нейтральная.
г) сильным осно-
ванием и силь-
ной кислотой
Гйдролиз солей усиливается: 1) при нагревании; 2) при разведении во-
дой.
При растворении в воде солей многоосновных кислот (многокислот-
ных оснований) гидролиз протекает ступенчато:
Na2S + Н2О NaHS + NaOH;
S2 + Н2О “ HS +ОН-;
HS +Н2О = H2S + OH .
Гидролиз - равновесный процесс, константа гидролиза является по-
стоянной величиной для данной температуры и характеризует спо-
собность соли гидролизоваться. Для случая а)
_[СНзСООН][ОН“] . _ [сн3соон][он~]
'равн " [CHjCOO-] [Н2О]' ^lH2°r гидр • [СН3СОО-]
Окислительно - восстановительные реакции
Степень окисления элемента - это формальный заряд, который рас-
считывается для атома химического элемента в предположении, что
все атомы в молекуле связаны ионными связями (кроме атомов одно-
го и того же элемента)
Валентность - это количество связей, которое образует атом химиче-
ского элемента в молекуле.
Окислительно-восстановительные реакции - реакции, протекающие с
изменением степеней окисления элементов, входящих в состав реаги-
рующих веществ:
восста-
новитель
восстановление
l[Z 2+ 1- I 0
+ 2НС1 —► ZnCI2 + Hj .
окисли- ,
тель
окисление
Окисление - процесс отдачи электронов атомом, ионом или молеку-
лой. Восстановление - процесс присоединения электронов атомом,
ионом или молекулой
34
Окислитель принимает электроны: восстановитель отдаст электроны.
Типы окислительно- восстановительных реакций.
Внутримолекулярные - окислитель н восстановитель входят в состав
одного вещества:
2КС10з = 2КС1 + ЗО2.
Диспропорционирование - окислителем и восстановителем являются
атомы одного и того же элемента:
3HNO2 = HNOs + 2NO + Н2О.
Межатомное и межмолекулярное окисление-восстановление, в кото-
рых окислитель и восстановитель разные вещества.
2HN01 + 2HI = 2NO + 12 + 2Н3О.
Составление уравнений окислительно- восстановительных
реакций методами:
а) электронного баланса:
Na + Ch -> NaCl
Na°-e->Na+ 12
Ch+2e-»2Cl |1
2Na + Ch = 2NaCl.
FejOj + Al —> АЬОз + Fe
Fe2+ + 2e -> Fe +8e 3
2Fe3+ + 6e -> 2Fe
A' - 3e -> AP* -3e 8
ЗРезОд + 8A1 = 4А12Оз + 9Fe.
IONH4CIO4 + 8P = 5N2 + 5Ch + 8H3PO4 + 8H2O.
2№ - 6e->N:
2Cl7++14e-> Ch +8e 5
P - 5e -» P5+ - 5e 8
б) электронно - ионного баланса:
MnCh + НВг -> МпВгг + Br2 + Н2О
МпО2 + 4Н+ + 2е-> Mn2+ + 2FhO 1
2Вг--2е->Вг2 1
МпО2 + 4Н+ + 2Вг - -> Мп2+ + 2Н2О + Вг2
МпО2 + 4НВг = МпВг2 + Вг2 + 2Н2О.
Cu2S + HNO3(ko„u) —> C11SO4 + Cu(NOs)2+ NO2 + H2O
NO3-+ 2H++ le-> NO2 + H2O 110
Cu2S + 4H2O - IQe -» 2Cu2+ + 8H+ + SO42 | 1
1ONO3 - + 20 H+ + C112S+ 4H2O -> I ONOj + 1OH2O + 2Cu2+ + 8H+ + SO42-
Cu2S + 12HNO3(kohu) = C11SO4 + Cu(NO3)2+ 10NO2 + 6H2O.
S'
35
Э.'1СК I po.llll I
Электролиз это окпслптслыю-посстанови1с/и.иыс реакции, которые
протекают и растворах или расплавах электролитов при пропускании
через них электрического тока.
Различают: а) электролиз с растворимым анодом;
б) электролиз с нерастворимым анодом.
Схе ма электролиза с растворимым электродом".
CuCl,
, 2 1
( - ) Катод Л— си ++ 2 CI —► Анод ( Си ) ( + )
2+ п о 24-
Си 4- 2е—* си си - 2е—► си
При электролизе с нерастворимым анодом (изготавливается из углеро-
да , платины)выполняются два правила.
1. Электролиз растворов солей металлов, стоящих в ряду напряжений
до А1 включительно, приводит к выделению на катоде водорода;
- солей металлов, стоящих в ряду напряжений после водорода,- к
выделению чистого металла;
- солей металлов, стоящих в ряду напряжений между А1 и водородом,
- как чистого металла, так и водорода:
(-)«— Си2+ + 2СГ— (+)
НгО Н++ ОН~
Cu2++2e^cu° 2сГ-2е—С12
2№С1
К | А
(-)«— 2 |\|а+ + 2СГ—-( +
2 Н2О =f==2H++ 2ОН-
2н+2е—Hj 2сГ-2е—ci2
2. Электролиз растворов солей кислородсодержащих кислот или са-
мих кислот приводит к выделению на аноде кислорода;
- солей бескислородных кислот или самих кислот приводит к выделе-
нию простых веществ, см. электролиз NaCl, CuCh:
Na2SO4
+ I 2
2 Na + SO4
( - ) Катод .— 4 HjO = 4 H+ + 4 он" —- Анод ( + )
4н++4е—»2нг 4он'-4е—►гнго + сс
Закон Фарадея: т - (Э / F) h ,
где т - масса образовавшегося при электролизе вещества (г ); Э - эк-
вивалентная масса вещества (г/моль), I- сила тока (Л), t - время (с), F-
постоянная Фарадея, равная 96500 Кл/моль.
Во всех перечисленных случаях электролиза растворов или расплавов
электролитов можно записывать суммарные уравнения реакций:
2НгО = 2Нг? + Ог? (электролиз раствора NazSOi),
CuCh = Си + Ch? (электролиз раствора CuCh).
36
ЧАСТЬ II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
I группа, главная подгруппа. (Цепочные металлы
Li, Na, К, Rb, Cs, Er очень реакционноспособны. Наиболее ак-
тивным является франций, л от элемент радиоактивен Высокая хими-
ческая активность объясняется малым значением эисрши, необходи-
мой для отрыва т-элсктрона. Cs теряет электрон при освещении. Хра-
нят в чистом виде под керосином или парафином.
Li отличается по своим свойствам от других щелочных металлов: при
сгорании на воздухе образует нормальный оксид, некоторые соли рас-
творяются в воде плохо (фосфат, карбонат, фторид), повторяет
свойства магния (правило диагонали).
Нахождение в природе. В свободном состоянии не встречаются. NaCI
каменная, или поваренная соль; NazSOaЮНгО - глауберова соль;
NaNOj - селитра; КС1 MgClz 6Н2О - карналлит.
Способы получения.
Вследствие высокой реакционной способности щелочные металлы
получают электролизом расплавов хлоридов и гидроксидов.
Физические свойства.
Щелочные металлы - очень мягкие серебристые вещества с характер-
ным блеском на свежесрезанной поверхности, имеют низкие темпера-
туры плавления. Li, Na, К легче воды. Хорошо растворяются в ртути,
образуя амальгамы.
э р, г/см3 7k.,°C Г«„„,°С Э р, г/см3 Тпл,°С Гк„„, °C
Li 0,53 181 1337 Rb 1,53 39 688
Na 0,97 98 883 Cs 1,87 28 708
К 0,86 64 774
Химические свойства.
Me - щелочной металл - Li, Na, К, Rb, Cs, Fr. Щелочные металлы реа-
гируют:
а) с неметаллами:
2Ме + Xz = 2МеХ, (Xz = Fz, Clz-20°C, Вг2, Ь Т^ц ,°С (150)
2Me+Hz = 2MeH; (>300)
2Me+S = MezS; (150-300)
6Li + Nz = 2LiaN; (200-250)
6Me + Nz = 2Me3Nz; (электрическая дуга)
ЗМе+Р=МезР; (200)
4Li + O2 = 2LizO (чистый кислород); (200)
1 OLi + Oz + Nz (воздух) = 2LijN + 2LizO; (200)
2Na + O2 = NazOz; (>200)
2K + 2Oz = K2O4; (>200)
2Me + 2C = Me 2C2; (>200)
б) с водой, кислотами (в водных растворах кислот реагируют как с
молекулами кислоты, так и с молекулами воды), NHj, HzS:
37
(7pt»„,.’’C 150 400)
(>100)
(1200)
(250-400)
(1200)
(>800)
2Me + 2HzO = 2McOIl + lb?;
2Mc+ 2HC1(,)= 2МсС1 + lb?;
2Мс+ 2NH.4,) = 2McNHz + Hz?;
2Ме + 2HzS(r> - 2MeHS + Hz?.
Оксиды щелочных металлов обладают ярко выраженными основными
свойствами Реагируют с водой, кислотами, кислотными и амфотер-
ными оксидами, кислородом:
MezO + HzO = 2МеОН;
MezO + HzSO4 = MezSO4 + HzO;
MezO + COz = MezCOz;
MezO + AizOj = 2MeAIOz;
2MezO + Oz = 2MezOz;
LizO + SiOz = LizSiOz;
LizO + Mg = 2Li + MgO.
Пероксиды щелочных металлов - желтовато-белые порошки, реаги-
руют с водой, неметаллами, кислотами, СО и COz, проявляют, в зави-
симости от условий, свойства окислителя и восстановителя:
MezOz + 2HzO = 2МеОН + HzOz; (на холоде)
2MezOz + S = MezSOz + MezO; (100)
2MezOz + С = МегСОз+MezO; (100)
2МегОг + 2COz = 2МегСОз + О2?;
MezOz + СО - Ме2СОз;
MezOz + 2MeI + 2HzSO4 — Iz + 2MezSO4 + 2HzO;
5NazOz + 2KMnO4 + 8HzSO4 = 5Oz + 2MnSO4+ 8HzO +
+ 5NazSO4 + KzSOi;
2MezOz + 2HzO = 4MeOH+ Ог?. (кипячение)
Надперекиси - соединения состава KOz (KzO4) - участвуют в реакциях,
характерных для перекисей; сильные окислители:
К2О4 + 6К = 4KzO;
2КгО4 + 2COz = 2КгСОз + 3Oz.
Гидроксиды щелочных металлов - твердые, белые, непрозрачные ве-
щества, хорошо растворимые в воде (щелочи). Реагируют с кислота-
ми, кислотными оксидами, неметаллами, металлами, амфотерными
оксидами и гидроксидами, а также с солями:
NaOH + НС1 = NaCl + HzO;
NaOH + SOz = NaHSOs;
2NaOH + SOz = NazSOz + HzO ;
6NaOH(pa36) + 4Fz = 6NaF + 3HzO + OFz + Oz?;
2NaOH + Xz = NaXO + NaX + HzO (хол. p-p, X=Clz,Brz,Iz);
6NaOH + 3Xz = NaXOz + 5NaX + ЗНгО (гор. p-p, X=Clz,Br2,I2);
2NaOH + 2HzO + 2A1 = 2 NaAlOz + 3Hz? ; (400- 500)
2NaOH(P.p) + 2A1 + 6H2O = 2Na[Al(OH)4] + 3H2?;
2NaOH+ AlzO3 = 2 NaAlOz + HzO; (1000)
2NaOH + ZnClz = 2NaCl + Zn(OH)z;
2NaOH(p-P) + Zn(OH)z= Naz[Zn(OH)4],
38
1 группа, побочна» подгруппа
Медь
Медь Си-довольно мягкий металл красного циста, 7м = 1083"С, об-
ладает высокой электро- и теплопроводностью, образует различные
сплавы.
Нахождение в природе.
CuzS - медный блеск, CuFeSz - медный колчедан (халькопирит),
CiijFeSa - борнит, СиСОзСи(ОН)г - малахит.
Способы получения.
Продувание О? через расплав сульфида меди (I):
2C.uzS + 30 2 = 2CuzO + 2S0z;
2Cu?0 + CuzS — 6Cu + SOz.
Химические свойства.
Малоактивный металл, под действием Ог покрывается защитной
пленкой, реагирует с неметаллами, кислотами- окислителями:
2Cu + Oz + HzO + COz = (СиОН)гСОз (пленка зеленого цвета);
2Cu + Oi= 2CuO (800°С); Си + S = CuS (350°С);
Си + Ch — CuCh;
Си + 4HNOxkohU)= 2NOz + Cu(NO3)2+ 2HzO;
3Cu + 8HNOj(pa36) = 2N0 + 3Cu(NO3)z + 4HzO;
Си + 2HzSO4(kom) = SOz + C11SO4+ 2HzO;
2Cu + 2HzSO4(pa36) + Oz - 2CuSO4 + 2НзО (кипячение порошка Си).
Оксид меди (II) CuO - твердое вещество красно-коричневого цвета,
проявляет основные свойства. Реагирует с неметаллами, металлами,
аммиаком, кислотами, щелочами;
4CuO = 2Cu?O+ Oz; (Гренки ,°C 1100)
CuO + Hz = Си + HzO; (200)
CuO + CO = Си + CO2; (300)
CuO + С - Си + CO; (1200)
3CuO + 2NH3(r)= Nz+ ЗСи + ЗН2О; (500)
ЗСиО + 2A1 = 3Cu + АЬОз; CuO + 2HC1 = CuCh + H2O. (1100)
Гидроксид меди (II) Cu(OH)z - соединение голубого цвета, не раство-
рим в воде, термически неустойчив, проявляет основные свойства,
слабый окислитель:
CuS04 + 2NaOH = Cu(OH)z + NazSCk
Cu(OH)z = CuO + 2HzO; (200)
Cu(OH)z+ 2HC1 = CuCh + 2HzO;
2Cu(OH)z+ COz = CuzCO3(OH)zi + HzO;
Cu(OH)2 + 4NH4OH = [Cu(NH3)4](OH)z + 4HzO;
2C.u(OH)z + CHjCHO = CuzO + СНзСООН + 2HzO.
Оксид меди (I) CuzO - твердое вещество темно-красного цвета, обла-
дает основными свойствами. Часть солей меди (I) растворима в воде,
39
но легко окисляется кислородом воздуха, устойчивы комплексные
соединения одновалентной меди [Cu(NIh)2]‘ :
С112О + 2НС1(|„и6) = 2СиС11 + 1ЬО;
2Cu3O + 8HCI(v«.r,) ь О2 = 4CuCh + 41ЬО;
2Сп:О + 4Н2О + О2 = 4(41(011)2; (кипячение)
С112О 4- СО = 2Си + (Юг.
Серебро. Золото
Серебро Ag - тяжелый пластичный металл с характерным блеском,
Гпл = 962°С, обладает наибольшей среди металлов электро- и тепло-
проводностью, образует сплавы со многими металлами.
Нахождение в природе.
Очень редко встречается самородное серебро. Встречается как при-
месь в виде сульфида AgzS либо тиосолей - тиоантимонита AgiSbSj,
тиоарсенита - AgsAsSs.
Химические свойства.
Является малоактивным (благородны м)м стал лом, непосредственно не
взаимодействует с О2, не реагирует с разбавленными растворами НС1,
H2SO4, ио реагирует с растворами H2S и НГ, вступает в реакции с кис-
лотами- окислителями:
2Ag + Ch = 2AgCl;
4Ag + 2SO2 + 202 = 2Ag2SO4; (>450°C)
2Ag + H2S = Ag2S + H2;
2Ag + 2HI = 2AgI + H2;
2Ag + 2H2SO4(kOhu) — Ag2SO4 + 2НгО + SO2;
Ag 4- 2HNO1(kohu) ~ AgNOs 4* H2O 4- NO2.
Серебро в пренебрежимо малых количествах растворяется в воде, но
даже в таких количествах ионы серебра “убивают” микроорганизмы.
Оксид серебра Ag2O - твердое вещество темно-коричневого цвета,
разлагается при нагревании, проявляет основные свойства, плохо
растворяется в НС1 и H2SO4 за счет образования на поверхности солей
AgCl и Ag2SO4, хорошо растворимо в HNO3 и растворе аммиака:
Способы получения.
2AgNO3 + 2КОН(ра3б) = 2KNO3 + Ag2O + Н2О.
Химические свойства.
2Ag2O = 4Ag 4- О2; (150°С)
Ag2O + 4NH4OH = 2[Ag(NH3)2]OH 4- ЗНгО;
Ag2O 4- 2НЫОз(разб) = 2AgNO3 4- Н2О;
Ag2O 4- Н2О2(конц) — 2Ag 4- O2 4* H2O.
Соли серебра не растворимы в воде, исключение составляют AgF,
AgNO3, AgC103, AgClO4.
AgCl, AgBr - растворимы в растворах аммиака или тиосульфата:
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2НгО;
AgBr + 2K2S2O3 = K3[Ag(S2O3)2] 4- KBr.
Иодид и сульфид серебра растворяются в растворах цианидов:
Ag2S + 4KCN = 2K[Ag(CN)2] + K2S.
40
Золото Au - желтый, ковкий, тяжелый металл, /ш» - 10644’, благород-
ный металл.
Нахождение в природе.
Встречается в виде самородного золота.
А и 1 шческие свойства.
Нс реагирует с водой, кислотами, щелочами, кислородом, азотом, уг-
леродом, серой. Переводится в раствор “царской водкой со ртутью
образует амальгаму, при нагревании взаимодействует с галогенами.
Au + HNO3(КОНЦ)+ 4НС1(КОНЦ) = ЩАиСЬ] + NO + 2IhO;
2Au + 3Ch = 2AuCh. (130"C)
II группа, главная подгруппа. Щелочноземельные металлы
Be, Mg, Са, Sr, Ba, Ra - обладают ярко выраженными металлически-
ми свойствами, которые усиливаются при переходе от Be к Ra. Рас-
творимость гидроксидов щелочноземельных элементов увеличивается
от Mg к Ва, растворимость многих солей, наоборот, уменьшается от
Mg к Ba. Be - отличается по своим свойствам от остальных элементов
II группы: реагирует с раствором.NaOH, образуя Н? и комплексный ион
[Ве(ОН)4]2 не реагирует с водородом: Be и его соединения повторяют
свойства А1 (правило диагонали).
Нахождение в природе.
Щелочноземельные металлы входят в состав различных минералов:
CaCChMgCOj - доломит, MgCCh - магнезит, CaSO4 2НзО - гипс,
ЗСаз(РО4)2 CaFz - апатит, BaSO4 - барит.
Способы получения.
Общий способ получения металлов главной подгруппы II группы -
электролиз расплавов солей. Обычно используют галогениды соот-
ветствующего металла. Чистые металлы могут быть получены при
восстановлении оксидов соответствующих металлов; в качестве вос-
становителей могут быть использованы водород, углерод, СО, другие
восстановители.
На примере Mg реакции выглядят так:
MgO + СаС2 = CaO + Mg + 2С; (1200°С)
2MgO + 2СаО + Si = Ca2SiO4 + 2Mg. (1300°С)
Физические свойства.
Имеют серебристо-белый цвет. Для них характерны относительно
низкие температуры плавления. Ra - радиоактивен.
Э Р,Г/СМ3 Тпл, °C Ткип,0С Э p,r/CM3 Тпл, °C Ткип, °C
Be 1,85 1278 2970 Sr 2,6 769 1384
Mg 1,74 649 1090 3,5 725 1640
Са 1,54 839 1484
Химические свойства.
Me - металл II группы. Металлы II группы реагируют:
а) с неметаллами:
6-3549
41
Me + Ch = McCh ; (Mg '/’комн , остальные при нагрспаиии)
Me + 11. = Mell2 *, (I pcnxti /’(’ 175 700)
3Mc + N2 = МслЬЪ; (300 800)
3Mc+ 2P = Mc3P2 ; (350 600)
Me + 2C = McCi; (500 600)
2Me + O2 = 2McO; (600 700)
б) с водой, кислотами, Nth, I hS, оксидами:
Me + 21 hO = Me(011)2 + НзТ (Mg - с водяным паром, Ca при
кипячении, остальные при комн, теми.);
Ме+ H2SO4(P;n6) = MeSO4 + Н2?;
Me + H2S(rn3) = Me S + H2; (500 600)
3Me + 2 NH3(r) = Me3N2 + 3H2; (500-600)
4Me +10 HNO3(pai6) = 4Me(NO3)2 + 5H2O + N2O;
Me +2 HNO3(kohu) = Me(NO3)2 + 2H2O + 2NO21;
2Mg + SiO2 = 2MgO + Si. (1000)
Магний и кальций реагируют с галогенидами менее активных метал
лов:
2Са + TiCh = 2CaCh + Ti.
(850)
Оксиды металлов - белые вещества, плавящиеся при высоких темпе-
ратурах (>2600°С), обладают основными свойствами (ВеО проявляет
амфотерные свойства): реагируют с кислотами, кислотными оксида-
ми, некоторыми металлами и неметаллами, водой (ВеО и MgO не вза-
имодействуют с водой на холоде, но реагируют с водяным паром), по-
глощают СО2:
МеО + 2НС1 = MeCh + Н2О;
МеО + SiO- = MeSiOr,
МеО + СО2 = МеСОз:
МеО + ЗС = МеС2 + СО;
МеО + С = Me + СО;
MgO + Са = Mg + СаО:
МеО + Н2О = Ме(ОН)2.
(Трсакц ,°С 1000-1300)
(ко мн.те мп.)
(1800-1900)
(>2000)
(1300)
Гидроксиды металлов - белые вещества, при нагревании разлагаются,
проявляют основные свойства, реагируя с кислотами, кислотными
оксидами (Ве(ОН)2 проявляет амфотерные свойства), плохо раство-
римы в воде (Ва(ОН)2 хорошо растворим в воде. Mg(OH)2 растворяет-
ся в водных растворах солей аммония):
Ме(ОН)2 = МеО + Н2О; (600-900)
Ме(ОН)2 + 2НС1 = МеС12 + 2Н2О;
Ме(ОН)2 + СО2 = МеСОз + Н2О;
Ме(ОН)2 + 2 СО2 = Ме(НСОз)2;
Ва(ОН)2 + Na2SO4 - BaSO4 + 2NaOH;
Mg(OH)2 + 2NH4CI = MgCh + 2NH3 + 2H2O (кипячение).
Насыщенный водный раствор Са(ОН)2 называется известковой водой.
Процесс взаимодействия оксида кальция с водой называется гашени-
ем. Гашеная известь поглощает СО2 и превращается в СаСОз.
42
II ipynha, побочная подгруппа
Цинк
Цинк Zn - металл белого цвета, на воздухе покрывайся оксидной
пленкой и поверхность его тускнеет, Тт = 420-С, на холоде довольно
хрупким металл, но при температуре 100-150'’С легко обрабагываегся,
ооразует сплавы с другими металлами.
Нахождение в природе.
ZnS - цинковая обманка, ZnCO - смитсонит, ZnO - красная цинковая
руда.
Способы получения.
динковую руду обжигают с целью получения оксида цинка с после-
дующим восстановлением углеродом-
2ZnS + 30г = 2ZnO + 2SO2;
ZnO + С = Zn + СО.
Химические свойства.
Является довольно активным металлом, легко реагирует с кислоро-
дом, галогенами, серой, фосфором-
2Zn + О2 = 2ZnO;
Zn + Ch — ZnCh;
Zn + S = ZnS;
3Zn + 2P = Zn3₽2.
При нагревании в заимодействует с аммиаком, водой; реагирует с кис-
лотами и щелочами, растворяется в водном растворе аммиака:
3Zn + 2NH3 - Zn3N2 + ЗН2;
Zn + Н2О = ZnO + H2;
Zn + 2HC1 = ZnCh + H2;
4Zn + IOHNO3 = 4Zn(NOs)2 + NH4NO3 + ЗН2О;
Zn + 2NaOH + 2НгО = Na2[Zn(OH)4] + H2T;
Zn + 4NH4OH = [Zn(NH3)4](OH)2 + H2 + 2НгО.
Цинк вытесняет из растворов солей менее активные металлы:
Zn + C11SO4 = ZnSO4 + Си.
Оксид цинка ZnO - проявляет амфотерные свойства, легко растворя-
ясь как в кислотах, так и в щелочах, образуя соли цинка и цинкаты:
ZnO + СаО = CaZnO2; (1 i00°c)
ZnO + SiO2 = ZnSiOs; (1000°С)
ZnO + H2SO4 = ZnSO4 + H2O;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4].
Гидроксид цинка Zn(OH)2 - твердое вещество белого цвета, ооладает
амфотерными свойствами:
Zn(0H)2 + 2HCI = ZnCh + 2НгО;
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4];
Zn(OH)2 + 4NH4OH = [Zn(NH3)4](OH)2 + 4H2O.
43
6*
1’туть
Ртуть Hg серебристо- белый жидкий металл, затвердевает при 38"С,
кипит при 357°С. В ртути растворяются многие металлы, образуя
амальгамы, В амальгамах металлы ведут себя, как и в свободном со-
стоянии. но являются менее активными. Пары ртути ядовиты.
Нахождение в природе.
Встречается в виде сульфида ртути IlgS (киноварь) или в виде само-
родной ртути.
Способы получения.
Ртуть получают при прокаливании киновари на воздухе либо в при-
сутствии железа или оксида кальция:
HgS + Oz = Hg + SOz;
HgS + Fe = Hg + FeS;
4HgS + 4CaO = 4Hg + 3CaS + CaSO4.
Химические свойства.
Ртуть является малоактивным металлом, не реагирует с водой, кисло-
тами-неокислителями, щелочами, гидратом аммиака. Реагирует с кон-
центрированными серной и азотной кислотами, “царской водкой”,
галогенами, кислородом, серой:
Hg + 2HzSOi(Kohu) - HgSO4 + SOz + 2HzO;
Hg + 4HNO3(kohU) = Hg(NO3)z + 2NOz + 2HzO;
2Hg + Oz = 2HgO; (100°C)
Hg + Ch = HgClz (сулема); (на холоде)
Hg + HgClz = HgzClz (каломель); (250°C)
Hg + S = HgS; (>100°C)
Hg + Hg(NO3)z = Hgz(NO3)z.
Оксид ртути HgO - вещество ярко-красного цвета, не реагирует с во-
дой. При нагревании легко разлагается на кислород и ртуть. Прояв-
ляет только основные свойства:
HgO + 2HCI = HgClz + HzO;
HgO + 2HNO3 = Hg(NO3)z + HzO;
HgClz + 2NaOH = 2NaCl + HgO + HzO.
Оксид ртути выделяется при действии щелочей на растворы солей
ртути (II) или (I):
Hg(NO3)z + 2NaOH = 2NaNO3 + HgO + HzO;
Hgz(NO3)z + 2NaOH = 2NaNO3 + HgO + Hg + HzO.
Ill группа
В, Al, Ga, In, T1 - главная подгруппа, Sc, Y, La и лантаноиды, Ac и
актиноиды составляют третью группу периодической системы эле-
ментов.
Все эти элементы, за исключением бора, - типичные металлы, бор про-
являет неметаллические свойства , повторяя свойства Si (правило диа-
гонали). При увеличении порядкового номера металлические свойства
элементов усиливаются; гидроксид алюминия обладает амфотерными
44
свойствами, амфотерность гидроксида галлия проявляется слабее;
гидроксид индия очень трудно растворяется в растворах щелочей;
гидроксид таллия вообще не обладает амфотерными свопы нами.
Элементы побочной подгруппы проявляют только основные свойства
Из элементов III группы программа начальной (шкот,ной) химии рас-
сматривает только свойства бора и алюминии.
Бор
Бор В - неметалл, существует в виде двух модификаций: аморфной
(темно-бурого цвета) и кристаллической (красно-черного цвета). Но
твердости кристаллический В близок к алмазу, полупроводник. Тип -
2075°С (аморф.), Тил = 2300иС (кристал.)
Нахождение в природе.
Находится только в химически связанном виде. NaiBK)- IOH2O - бура.
Способ получения.
Восстановление В2О3 с помощью магния или алюминия:
В2О3 + 2А1 = AI2O3 + 2В.
Химические свойства.
При обычных условиях кристаллический бор инертен; аморфный бор
на воздухе реагирует с кислородом:
4В + ЗОз = 2 В2О3.
При нагревании реагирует с неметаллами (галогенами, азотом, серой,
фосфором, углеродом), оксидами, водяным паром, металлами, кисло-
тами-окислителями, щелочами: Трсакц ,сС
2В + ЗХ: = 2В?Хз; (Хз = F2, Ch, Вг2,1з) ; (400)
2В + N2 = 2BN; (900-1000)
2B + 3S = B?S3; (>600)
В + Р = ВР; (900-1000)
4В + ЗС = ВтСз; (>2000)
4В + 3SiO3 = 2В30з + 3S i; (1400)
2В + ЗНзО = В>Оз + ЗН2; (800)
3Mg + 2В = Mg-,B3; (2100)
В + 3HNOs = НзВОз + 3NO3;
2В + 2КОН +2Н3О = 2КВОз+ ЗН2.
Галогениды бора - галогенангидриды кислот, вследствие гидролиза
дымят на воздухе, реагируют со щелочами:
ВС1з + ЗНгО = НзВОз + ЗНС1;
ВС1з + 4NaOH = Na[B(OH)4] + 3NaCI.
Борная (ортоборная) кислота НзВОз - бесцветное кристаллическое
вещество, хорошо растворимое в горячей воде, очень слабая кислота.
При нагревании теряет воду, превращаясь в метаборную НВОг, затем
в тетраборную Н2В4О7 кислоты и конечный продукт - оксид бора:
НзВОз = НВОз + Н2О;
4НВО2 = Н2В4О7 + Н2О;
НгВ4О7=2В2Оз+Н2О.
45
Тетраборат натрия (бура) NiizIhO/ 7П>() получается ори пзаимо-
дейепшн борной кислоты и гидроксида натрия:
4Л1ВО..+ 2NaOII = NajIMh 7Н?О.
Алюминий
Алюминий А1 - серебристо-белый легкий металл, пластичен, обладает
ВЫСОКОЙ ТСПЛО- И ТЛСКТрОИрОВОДНОСТЫО, 7ш1 = 660"С.
Нахождение в природе.
Является самым распространенным металлом в природе. Важнейшие
природные соединения алюминия - алюмосиликаты, которые состав-
ляют основную массу земной коры. Продукт их выветривания - гли-
на, состав которой соответствует формуле AI2O3 2SiOx 2НгО. Боксит -
АЬОз пНгО.
Способы получения.
1. Электролиз расплавов солей или оксида алюминия - глинозема;
2. Восстановлениё'А1С1з металлическим натрием:
АЮз + 3Na = Al + 3NaCI.
Химические свойства.
Очень активный металл, на воздухе устойчив из-за плотной пленки
оксида, покрывающей поверхность металла. Очищенный от оксидной
• пленки легко реагирует с водой; взаимодействует с неметаллами
(галогены, кислород, сера, азот, углерод, фосфор), оксидами, кисло-
тами, щелочами, аммиаком. Не реагирует с концентрированной азот-
ной кислотой (пассивирование поверхности):
2А1 + 6Н2О = 2А1(ОН)з + 3H2t;
2 AI + ЗХг = 2А1Хз; (Х2= F3, СБ.ВггДг) (7>акЦ ,°С 30)
4AI + ЗОг = 2 АЬОз, (150)
2AI + N2 = 2A1N ; (300)
4А1 + ЗС = АБСз; (1500)
8 Al + 3Fe36.i = 4 АЬОз + 9Ft; ,, (2000)
2A1 + 6HCI = 2AI Ch + ЗН2Т.
На холоде разбавленная HNCh пассивирует алюминий, при нагрева-
нии, в зависимости от концентрации, образует соль и ряд соединений
азота - N2O, NO, N2, NHa:
8AI + 30HNO3(paiC) = 8A1(NO3)3 + 15НгО + 3N2O.
Оксид алюминия АБОз - белое вещество, Гпл - 2050°С, обладает ам-
фотерными свойствами, не растворяется в воде, водных растворах кис
лот и щелочей. Реагирует при сплавлении со щелочами и некоторыми
солями:
AI2O3 + 2NaOH = 2NaAIO2 + Н2О; ( Гр^ц ,°С 1300)
АБОз + Na2CO3 = 2NaAIO2 + СО2; (1300)
AI2O3 + 3Na2S2O7 = А1г(ЯО4)з + 3Na2SO4. (1300)
Гидроксид алюминия А1(ОН)з - обладает амфотерными свойствами,
легко растворяется в кислотах и щелочах (но не в NH4OH):
А1(ОН)з + 3HCI = А1С1з + ЗНгО;
А1(ОН)з + NaOH = Na[ А1(ОН)4].
46
IV ।руина
C, Si. Ge, Sn, I’b - главная подгруппа, Ti, Zr, Ilf - побочная подгруппа.
Углерод, кремний С, Si - типичные неметаллы, элементы подгруппы
Ge - металлы, нарастание металлических свойств наблюдается в ряду
Ge -> Pb. У элементов главной подгруппы IV группы с увеличением
атомной массы уменьшается устойчивость соединений со степенью
окисления 4+ , увеличивается устойчивость соединений со степенью
окисления 2+. В побочной подгруппе наблюдается обратная законо-
мерность: титан образует соединения, в которых проявляет степень
ниже четырех; Zr и Hf таких соединений нс образуют. В обеих под-
группах с увеличением атомной массы усиливаются основные
свойства и ослабляются кислотные.
Углерод
Углерод - аллотропные модификации: алмаз, графит, аморфный (чер-
ный) углерод.
Алмаз - прозрачное, самое твердое природное вещество. Аномально
высокая твердость алмаза объясняется особенностью строения кри-
сталлической решетки (расстояния между атомами в элементарной
ячейке одинаковы). Не проводит тепло и электрический ток. При на-
гревании без доступа воздуха переходит в графит.
Графит - темно-серое вещество с металлическим блеском, хорошо
проводит тепло и электрический ток, мягок, р = 2,27 г/см3, тугоплавок
- Тпл - 3800°С, Кип = 4000°С, имеет слоистую структуру кристалли-
ческой решетки (расстояния между слоями внутри кристаллической
решетки больше расстояний между атомами внутри слоя).
Аморфный (черный) углерод - сажа, кокс, древесный уголь.
Нахождение в природе.
В природе находится как в свободном, так и в связанном состоянии. В
свободном состоянии встречаются две модификации - алмаз и графит.
В связанном состоянии углерод входит в состав карбонатов: СаСОз -
мрамор, известняк, мел; MgCCh - магнезит, СаСОз MgCOs - доломит.
Кроме того, углерод является основной составной частью всех живых
и растительных организмов, нефти, природных горючих газов, углей.
Способы получения
Основным источником углерода являются залежи графита. Модифи-
кация углерода - сажа - получается термическим разложением угле-
водородов:
СНл = С + 2Н2.
Химические свойства.
Наиболее рекционноспособен аморфный углерод, за ним идут графит
и алмаз. При обычной температуре углерод инертен; при нагревании
реагирует с водой, неметаллами,, металлами, оксидами, кислотами-
окислителями:
47
(С
C + 14’0 - CO + Ih; (/’prnr.1 ,'<.’800 1000)
C + 2H2 = Clh; (600. кат. Pt)
2C + lh = Czlb; (1700)
C + 2Fz = CF.,; (1000)
Ch.BnJj- нс реагирует)
2C + Oz = 2CO; (> 1000)
С + O2 = COz; (700)
C + 2S = CSz; (700)
C + Si = SiC; (1250)
2C + Ca = CaCz; (550)
3C + 4A1 = AI4C3 (600)
3C + CaO = CaCz + CO; (700)
3C + SiOz = SiC + 2CO; (1000)
(Треаки ,°С 300, кат. FezCh)
(250-300, Р, кат. Сг2Оз)
(130, кат. Pt)
(сжигание на воздухе)
(600, кат.АЬОз)
(700)
(130, Р)
С + 2H2SO4 (кони) = СО2 + 2SO2 + 2HzO;
С + 4HNO3 (кони) = СО2 + 4NO2 + 2НгО.
Оксид углерода (II) СО (угарный газ) - ядовитый газ без цвета и запа-
ха, легче воздуха, мало растворим в воде, сжижается при -192°С, за-
твердевает при -205°С.
По химическим свойствам - типичный восстановитель, реагирует с
водой, водородом, кислородом, аммиаком, щелочами, хлором:
СО + Н2О = СО2 + Hz;
СО + 2Hz = СНзОН;
СО + Ch = СОСИ (фосген);
2СО + О2 = 2СОг;
СО + NHz = HCN + Н2О;
СО + FeO = СО2 + Fe;
СО + NaOH = HCOONa.
Оксид углерода (IV) СО2 (углекислый газ) - бесцветный газ, тяжелее
воздуха, термически устойчив, сжижается при Т = 20°С и Р= 69 атм,
твердый COz , называемый “сухим льдом”, при комнатной температу-
ре возгоняется (возгонка - переход твердого вещества в газообразное
без плавления).
Химические свойства.
СОг является ангидридом угольной кислоты Н2СО3. Проявляет
свойства кислотных оксидов, реагирует со щелочами, основными
оксидами, солями, неметаллами, металлами, пероксидами, плохо рас-
творим в воде:
COz + NaOH =NaHCO3;
2СО2 + NaOH = NazCOa + НгО;
CO2+ NazO = NazCO3;
CO2 + CaOCh = СаСОз * Ch;
CO2+ 4Fb = CH< + 2НгО;
COz+C = 2CO;
CO2+2Mg = 2MgO + C;
2COz + 5Ca = CaCz + 4CaO;
2COz + 2NazO2 = 2№азСОз + Oz;
( Треаки ,°C 200, Ka r.CuzO)
(>1100)
(500)
(500)
48
CO; + КзОл = КзСОз I- 1,5Оз.
5 голыши кислота ПзСОз очень слабая кислота, в свободном виде нс
выделена, существует только в разбавленных растворах, со щелочами
дает кислые и средние соли
Кремнии
Кремний Si - существует в кристаллическом и аморфном состояниях.
Кристаллический кремний - твердое вещество серовато-стального
цвета с металлическим блеском, хрупкий, р = 2,4 г/см3, Т,т = 1420°С,
Кип = 2620°С, полупроводник. Аморфный кремний - порошок белого
(чистый) или коричневого (с примесями) цвета.
Нахождение в природе.
Кремний занимает второе место после кислорода по распространен-
ности в природе. В свободном состоянии не встречается. Основными
природными соединениями кремния являются: SiO2 - оксид кремния
(IV) и соли кремниевых кислот, входящие в состав многочисленных
пород и минералов: AhOjZSiCh2НзО - каолин, NazO AlzCheSiCh -
альбит и др.
Способы получения.
Кремний получают восстановлением оксида кремния (IV) сильными
( Трсакц ,°С 450)
(350-750)
(250)
(250-600)
(2000)
(1200)
(40-100)
восстановителями - углеродом, алюминием, магнием:
S1O2 + 2С = 2СО + Si;
3SiO2 + 4А1 = 2 AI2O3 + 3Si;
S1O2+ 2Mg = 2MgO + Si.
Побочными продуктами указанных процессов являются силицид маг-
ния - MgzSi и карбид кремния (карборунд) - SiC
Химические свойства.
Аморфный кремний более реакционноспособен, чем кристаллический.
При комнатной температуре довольно инертен, при нагревании вза-
имодействует с водой, неметаллами (галогены, кислород, сера, азот,
углерод), аммиаком, сероводородом, с кислотами не реагирует, за
исключением плавиковой кислоты, легко растворяется в щелочах:
Si + 2Н2О = S1O2 + 2Нг;
Si + 2X2 = SiX4; (X2 =F2, Ch. Br2,12)
Si + O2 = SiCh ;
Si + 2S = SiS2;
Si + C = SiC;
Si + 2H2S(r) = SiS2 + 2H2;
Si + 4HF(r> = SiF4 + 2Нг;
Si + 6HF(kohu) = HzfSiFe] + 2Нз;
Si + 2NaOH + H2O = Na2SiO3 + 2H2.
По отношению к металлам ведет себя по-разному: с расплавами ряда
металлов (Zn, Al, Sn, Pb) образует твердые растворы; с расплавами
других металлов (Mg, Си, Ре)образует химические соединения:
Si + 2Mg - Mg2Si. (700°С)
7-3549
49
Оксид кремнии (IV) SiOi - бесцветное твердое вещей ио. тугоплавок
существует в кристаллическом (кварц) и аморфном (трепел) состояни-
ях. диэлектрик.
А имические свойства.
Кислотный оксид, химически малоактивен; реагирует с плавиковой
кислотой, растворами и расплавами щелочей, солями некоторых ще-
лочных металлов (при сплавлении), металлами, фтором:
SiO’ + 6 HF(kohu) — IhfSiFc] + 2 НгО;
SiO2 + 2NaOH = NaiSiOj + H2O;
SiOa + N a2CO j = N агЗЮз + CO2; (1150'C)
S1O2 +21-2= SiF< + O2; 1 (300°C)
SiOz+2Mg= Si+2MgO. (900‘C)
Кремниевая кислота H2S1O3 - студенистое, не растворимое в воде ве-
щество, растворяется в щелочах, образуя соли, малоустойчива, при
нагревании разлагается с образованием SiOz и воды. Частично обез-
воженная H2S1O3 называется силикагелем и используется для адсорб-
ции влаги и других веществ.
V группа, главная подгруппа
N, Р, As, Sb, Bi - первые два - типичные неметаллы, мышьяк и сурьма
проявляют металлические и неметаллические свойства, висмут - ме-
талл. Строение внешних слоев элементов таково, что они могут про-
являть в соединениях степень окисления от 3- до 5+, наиболее харак-
терными являются 3- и 5+.
Азот
Азот Nz - бесцветный газ, сжижается при 195°С, затвердевает при
-210°С, плохо растворим в воде, основная составная часть воздуха .
Нахождение в природе
В связанном состоянии азот встречается в виде нитратов (селитры),
входит в состав белковых веществ и многих органических соединений
животного и растительного происхождения
Способы получения.
В больших количествах азот получают перегонкой (ректификацией)
жидкого воздуха. В лабораторных условиях азот может быть получен
с помощью следующих химических процессов:
NH4NO2 = Nz + 2НгО;
NH4CI + KNO2 = KCI + N2 + 2НгО;
2NHs + ЗСиО = Nz + ЗСи + ЗНзО.
Химические свойства.
При комнатной температуре химически пассивен, при высоких темпе-
ратурах реагирует с металлами, водородом, кислородом:
N4+6Na = 2Na3N;(100°C)
№+2Al = 2AlN; (900°С)
N2+O’=2NO; (2000°С)
(150°С)
(кипячение)
(550°С)
50
(сгорание на воздухе)
(8ОО'’С,кат.Р1)
(350°С)
(550»С)
N2 + ЗНг = 2NIh (500-С, кат. Pt)
Аммиак NIL- бесцветный газ с резким запахом, сжижается при 37-0
н повышенном давлении, затвердевает при 78"С. I) одном объеме
воды растворяется 700 объемов NIIi, раствор аммиака в воде наша-
тырный спирт.
Химические свойства
Весьма реакционноспособен. Для него характерны реакции присоеди-
нения. реагирует с кислородом, металлами, легко алкилируется:
NHj<r) + НС1(о - NlliClon);
NH3 + I I2SO4 = NH4HSO4; (или (NH4)zSO4)
4NHj + ЗО2 = 2N2 + 6Н2О;
4NHj + 5Oi = 4NO + 6H2O;
2NHj + 2Na = 2NaNHz + H2;
2NHs + 3CuO = N2 + 3Cu + ЗН2О;
NH3 + СНзВг = [CHsNHsJBr.
Гидроксид аммония NH4OH - слабое основание, реагирует с кислота-
ми, кислотными оксидами, некоторыми солями
NH4OH + H2SO4= NH4HSO4+ Н2О;
NH4OH + NH4HSO4 = (NH4)2SO4 + Н2О;
2NH4OH + СО2= (NH4)2CO3+ Н2О.
При нагревании аммонийные соли разлагаются на аммиак и кислоту,
исключение составляют NH4NO3, NH4NO2, (МШ^СпО?:
NH4C1 = NHj+HCI;
NH4NO3 = N2O + 2 Н2О;
NH4NO2=N2 + 2H2O;
(NH4)2Cr2O7 = СпОз + N2 -I 4HzO.
Оксиды азота NjO, NO, N2O3, NO2, NzOs.
Оксид азота (I) N2O - газ без цвета и запаха, сжижается при -89°С,
затвердевает при -91 °C, возбуждающе действует на нервную систему
человека, поэтому его применяют как анестезирующее средство -
“веселящий газ”.
Химические свойства.
Несолеобразующий оксид, при обычных условиях проявляет малую
реакционную способность. Неустойчив, при нагревании легко разла-
гается на азот и кислород:
2N2O = 2N2 + О2. (Треакя ,°С >500)
При разложении N2O выделяется кислород, поэтому N2O реагирует с
неметаллами, металлами:
N2O + Н2 = N2+ Н2О; (500)
2N2O + С = 2N2 + СО2; (>500)
N 2О + Mg = N2 + MgO. (500)
В зависимости от условий, проявляет слабые свойства окислителя или
восстановителя:
5N2O + 2КМпО4 + 3H2SO4 = IONO + 2MnSO4 + K2SO4 + ЗН2О;
N2O + Н2О + SO2 = N2 + H2SO4.
г
51
(Треакц "С 200)
(500)
(200)
(600)
(кипячение)
(кипячение)
(Треакц ,°С > 5)
(12)
(холодный раствор)
(горячий раствор)
(кипячение)
Оксид азота (11) NO бесцветный газ, сжижается при 152,,С, затвер-
девает при 163"С, термически устойчив, плохо растворяется в воде.
Auwiwcm* свойства.
Несолсобразующий оксид, при комнатной температуре легко pcai и
руст с кислородом и галогенами:
2NO + O2=2NO2;
2NO + Cl 2= 2NOCI - нптрозилхлорид
При нагревании реагирует с неметаллами, металлами, сильными
окислителями и восстановителями:
2NO + 2H?= Ni+2НгО;
2NO + С = N2 + СО2;
10NO + 4Р= 5N2+2P2Os;
2NO + 2Cu = N2+ 2CuO;
2NO + SO2 + Н2О = N2O + H2SO4;
2NO + 3HC1O + H2O = 2HNO3 + 3HCI.
Оксид азота (III) N2O3 - жидкость темно-синего цвета, р = 1,4 г/см3,
кипит при 3,5°С, разлагаясь на оксид азота (II) и оксид азота (IV),
затвердевает при -102°С, растворяется в воде.
Химические свойства.
Проявляет свойства кислотных оксидов, реагирует с кислородом,
металлами:
N2O3 = NO + NO2;
2N2O3+ O2=2N2O4;
№Оз + H2O = 2HNO2;
3N2O3 + Н2О = 2HNO3 + 4NO;
N2O3 + 2NaOH = 2NaNO2 + H2O.
Оксид азота (IV) NO2 - бурый газ с характерным запахом, сжижается
при 21°С. затвердевает при -11°С, с понижением температуры димери-
зуется (при -11°С существует в виде димера N2O4), хорошо растворя-
ется в воде.
Химические свойства.
Растворяясь в воде, дает две кислоты - азотистую и азотную:
2NO2 + Н2О = HNO2 + HNOa;
3NO2 + Н2О = 2 HNO3 + NO;
4NO2 + 2Н2О + О2 = 4HNO3;
2NO2 + 2NaOH = NaNO2 + NaNOs + H2O.
Окислитель - реагирует с неметаллами, металлами, сильными восста-
новителями:
2NO2 + 7Н2 = 4Н2О + 2NH3;
2NO2 + S = N2 + 2SO2;
10NO2+8Р = 5N2+4Р2О5;
2NO2 + Na = NO + NaNO3;
2NO2+4Cu = N2+4CuO;
NO2 + SO2 + H2O = H2SO4 + NO;
4NOi + 6FeSO4 + 3H2SO4 = N2 + 3Fe2(SO4)3 + 2HNO3 + 2НгО.
(Треакц ,°С 100, КИТ)
(150)
(150)
(20)
(600)
52
(7ре««.< ,"С 20-50)
(500)
(40)
(кипячение)
Оксид азота (V) N2O5 - твердое кристаллическое всщесию. которое
плавится с возгонкой при 324.’, разлагаясь при пом на оксид а юта
(IV) и кислород, хороню растворим в воде.
Химические свойства
Проявляет свойства кислотного оксида, сильный окислитель:
2N?Os= 4NO? + О2;
N2O5 + Н2О = 2IINO3;
N2O5 + 2NaOH = 2NaNO.i + Н2О;
N2O5+ 5Cu = 5CuO + N2;
3N20s + AhCh = 2AI(NOj)j.
Азотистая кислота HNCh - слабая, неустойчивая кислота, существует
при низких температурах только в разбавленных растворах, с повы-
шением температуры разлагается:
3HNO2 = HNO3 + 2 NO + Н2О;
HNO2 + NaOH = NaNO? + Н2О;
HNO2 + NH4OH = NH4NO2 + Н2О.
Проявляет окислительные и восстановительные свойства:
2HNO? + 2HI = L + 2NO + 2Н1О;
HNO2 + Н2О2 = HNO3 + НзО;
5HNO2+ 2KMnO4+ 3H2SO4 = 5HNOj+ 2MnSO4+ K2SO4 + ЗН2О;
2HNO2 + 6FeSO4 + 3H2SO4 = N2 + 3Fe2(SO4)3 + 4H2O.
Азотная кислота HNO3 - бесцветная, гигроскопичная жидкость (жел-
теет при хранении), р = 1,5 г/см3, кипит при 86°С, затвердевает при
-45°С С водой смешивается в любых соотношениях, безводная азот-
ная кислота “ дымит “ на воздухе.
Способы получения
1 Вытеснение HNO3 из ее солей серной кислотой:
NaNOs + H2SO4(M„U) = NaHSO4 + HNO3.
2. Дуговой способ - продувание воздуха через электрическую дугу с
целью получения NO и последующего превращения его в кислоту:
N2+O2=2NO;
2NO + О2= 2NO2;
4NO2 + О2 + 2Н2О = 4HNO3.
3. Аммиачный способ - каталитическое (кат. Pt) окисление аммиака
до NO с последующим превращением в HNO3.
Химические свойства.
4HNO3 = 4NO2 + 2НгО + О2. (кипячение)
Сильная кислота - реагирует с основными оксидами, гидроксидами,
солями слабых кислот:
2HNO3 (раэб) + MgO = Mg(NO3)2 + Н2О;
HNO3 (разб) + КОН = KNO3 + НгО;
HNO3 (раэб) + NH4OH = NH4NO3 + НгО;
L13N + 4HNO3 = 3LiNO3 + NH4NO3;
2HNO3 + К2СО3 = 2KNO3 + НгО + СО2.
Сильный окислитель - реагирует с неметаллами, металлами, любыми
восстановителями. Концентрированная кислота пассивирует Al, Be, Сг,
53
Fe, Ni, I’b н ряд других металлов; не реагирует с Ли, Pt и рядом других
металлон; с тяжелыми металлами реагирует с обра юпаиисм нитрата и
выделением NO2; со щелочными и щелочноземельными - N2O.
Разбавленная азотная кислота со щелочноземельными, а также с Zn и
Fe образует NHj (NH4NO3), разбавленная с тяжелыми металлами об-
разует NO:
4Zn + ю HNO3(P1116) = 4Zn(NO3)i + NIL1NO3 + ЗН2О;
8Na + 10 HNOX)1WW)= 8NaNO3+ N2O + 5H2O.
Концентрированная HNOa, реагируя с неметаллами, образует NO2 ,
разбавленная - NO:
5HNO3(Koml) + Р = Н3РО4 + 5NO2+ НгО,
5HNO3(pM6) + ЗР + 2НгО = ЗНзРОд + 5NO;
6HNO3(kohu) + S = H2SO4 + 6NO2 + 2НгО;
8HNO3(kohu) + H2S = H2SO4 + 8NO2 + 4НгО;
2HNO3(pa36) + 3H2S = 3S + 2NO + 4НгО.
Царская водка - смесь одного объема концентрированной (63%) азот-
ной кислоты и трех объемов концентрированной соляной кислоты В
ней растворяются золото и платина.
Au + HNO3 + 4НС1 = H[AuCk] + NO + 2НгО;
3Pt + 4HNO3 + 18НС1 = 3H2[PtC16] + 4NO + 8H2O.
Фосфор
Фосфор Р - существует в виде трех аллотропных модификаций.
Белый фосфор - твердое кристаллическое вещество, р -1,82 г/см3, пла-
вится при 44°С, кипит при 275°С, на воздухе самовоспламеняется, не
растворим в воде, хорошо растворим в сероуглероде (CS2), при нагре-
вании переходит в красный фосфор, ядовит, ’’светится” в темноте .
Красный фосфор - порошок темно-вишневого цвета, не светится в
темноте, воспламеняется при Т> 260°С, не растворим в воде и в серо-
углероде, не ядовит.
Черный фосфор - твердое вещество, похож на графит, проводит элек-
трический ток.
Способ получения.
Нагревание смеси фосфата кальция с песком и углеродом при темпе-
ратуре 1200°С Затем пары фосфора поступают в реактор с водяным
охлаждением. В целом реакция выглядит следующим образом:
Саз(РО4)2 + 3SiO2 + 5С = 3CaSiO3 + 2Р + 5СО.
Химические свойства.
Типичный неметалл, легко реагирует с О2, S, С1г, металлами. Образует
соединения фосфора со степенью окисления (V)h (III):
4Р+ ЗОз= 2РзОз;
4Р + 5Оз= 2РгОз;
2Р + 3S = P2S3;
2Р + 5S = P2S5;
54
2Р+ 3CI2 = 2PCh;
2Р + 5Ch = 2PCh:
2P + ЗСа = СазРг.
PCb. PCT - хлорангндрнды кислот, взаимодействуя с водой, обра-
зуют фосфористую НзРОз и фосфорную НзРОз кислоты:
РС1з + ЗНЮ = НзРОз + 3HCI;
РС1з+ 4ШО = НзРОз + 5HCI.
Оксид фосфора (III) Р2О3 - белое кристаллическое вещество, плавится
при 24°С, кипит при 174°С, обладает свойствами кислотного оксида,
при взаимодействии с водой образует НзРОз.
Фосфористая кислота НзРОз - бесцветные кристаллы, хорошо раство-
ряются в воде, плавятся при 74°С, при дальнейшем нагревании разла-
гаются:
4НзРОз = ЗНзРОд + РНз.
Кислота средней силы, двухосновная. Как РгОз.так и НзРОз являются
сильными восстановителями.
Оксид азота (V) Р2О5- белое гигроскопичное порошкообразное веще-
ство. Возгоняется при 359°С, плавится только при повышенном дав-
лении. Прекрасно растворяется в воде, образуя ряд кислот. Использу-
ется как осушитель газов и жидкостей, отнимает воду у химических
соединений. Проявляет свойства кислотных оксидов:
Р2О3 + Н2О = 2НРОз - метафосфорная кислота;
Р2О5 + 2Н2О = Н4Р2О7 - пирофосфорная кислота ;
Р2О5 + ЗН2О = 2Н3РО4 - ортофосфорная кислота;
Р2О5 + 2HNO3 = 2НРОз + N2O5;
Р2О5 + ЗСаО - Саз(РОз)2;
Р2О5 + 6NaOH = 2Na3PO4 + ЗН2О.
Метафосфорная кислота НРОз - стекловидная масса, очень ядовита,
растворяется в воде, проявляет свойства слабой кислоты.
Пирофосфорная кислота Н4Р2О7 - белая аморфная или кристалли-
ческая масса, растворима в воде, проявляет свойства сильной кислоты
по первой ступени и слабой кислоты по остальным ступеням.
Ортофосфорная кислота НзРОз (или просто фосфорная) представляет
собой прозрачные кристаллы, которые плавятся при 43°С, не ядовита,
с водой смешивается в любых соотношениях. В отличие от азотной
кислоты не проявляет сильных окислительных свойств. Реагирует с
металлами, оксидами, основаниями. Является трехосновной кислотой
и образует три ряда солей: фосфаты, гидрофосфаты, дигидрофосфаты.
НРОз+Н2О = Н3РО4; (кипячение)
Н3РО4 = НРОз + НгО; (300°С, вакуум)
2Н3РО4 = Н4Р2О7 + Н2О; (150°С)
Н4Р2О7 = 2НРОз + НгО; (300°С, вакуум)
Н3РО4+ ЗКОН = К3РО4 + ЗНгО;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4+ КОН = КН2РО4+ Н2О;
2Н3РО4 + 3Mg = Mg3(PO4)2 + ЗН2 ?;
55
2НзРО« + 3MgO = Mg,(1'04)2 + 31 I2O;
21Ijl’O4(|,„)r,)+ 3Ca(OIl)2 = Caj(P0<)2 + 6И2О.
Способы получении.
1. Депствие серной кислоты на фосфори т или апатит:
Са,(РО4)г + 3H2SO4 = 3CaSO4 + 2113РО4;
ЗСаз(РО4)2 CaF2 + IOH2SO4 = 10CaSO4 + 6Н3РО4 + 2IIF.
2. Окисление фосфора:
а) кислородом и последующим растворением Р2О5 в воде;
б) азотной кислотой
Р + 5HNO3 = Н3РО4 + 5NO2 + Н2О.
Фосфин РНз- бесцветный ядовитый газ с запахом гнилой рыбы, са-
мовоспламеняется на воздухе, донорные свойства выражены гораздо
слабее, чем у аммиака, сильный восстановитель, плохо растворим в
воде:
2РНз + 4Ог = 2Н3РО4;
РНз + 8HNO3 (кокц) = НзРОз + 8NO2 + 4Н2О.
Минеральные удобрения и их состав
Минеральные удобрения - вещества, которые улучшают питание рас-
тений и плодородие почв.
Азотные удобрения (элемент питания - азот).
Аммонийная селитра
Сульфаз аммония
Хлорид аммония
Гидрокарбонат аммония
Аммиак жидкий
Натриевая селитра
Кальциевая селитра
Мочевина (карбамид)
Цианамид кальция
Карбамидоформ
Аммиачная вода
Аммиакат
NH4NO3
(NH4)2SO4
NH4CI
NH4HCO3
NH3
NaNOs
Ca(NO3)2
CO(NH2)2
Ca(CN)2
CO(NH2)2+ CH2O
NH3 + H2O
1NH4NO3 + NH3
CO(NH2)2+NH3
Ca(NOs)2 +NH3
(NH4)2SO4 + NH4NO3
Сульфат-нитрат аммония (NH4)2SO4 + NH<
Фосфорные удобрения (элемент питания - фосфор)
Суперфосфат простой Са (НгРО4)г + Са
Суперфосфат двойной Са (НгРСЬ):
Преципитат Са НРО4 2НгО
Фосфористая мука Саз(РО4>2
Аммофос NH4H2PO4+ (NF
Нитрофоска Са (НзРСМ)? + Сг
Калийные удобрения (элемент питания - калий).
Хлорид калия КС1
Сильвинит KCINaCI
Са (Н2РО4)2 + CaSO4
Са (НгРСЬ):
Са НРО4 2НгО
Саз(РО4)г
NH4H2PO4+ (NH4)2HPO4
Са (Н2РО4)2+ Ca(NO3)2
56
Каинит КО MgSOHII.O
Сульфат калия K .,S( >.i
Поташ, карбонат калия КгСОз
Микроудобрения, кроме указанных выше веществ. содержа ! л неболь-
ших количествах другие элементы: Zn, Мо, Си, Мп и т.д.
VI группа, главная подгруппа
О, S, Se, Тс, Ро - главная подгруппа. У этих элементов ярко выраже-
ны неметаллические свойства. По активности их можно расположить
в ряд: О > S > Se > Те. Электронное строение атомов позволяет им
проявлять степени окисления 2-, 2+, 4+, 6+ (кислород проявляет сте-
пень окисления 2- и только во F?O степень окисления кислорода рав-
на 2+). Из кислородных соединений серы наиболее устойчивыми яв-
ляются соединения серы (6+), для Те - (4+), Se занимает промежуточ-
ное положение.
Кислород
Кислород Ог - газ без цвета и запаха, слабо растворим в воде, сжи-
жается при -183°С (1 атм), затвердевает при -219°С, в жидком и твер-
дом состояниях окрашен в голубой цвет. В молекулярном состоянии
существует в виде 62 и Оз - озон (аллотропия).
Объемные и массовые доли основных компонентов воздуха составля-
ют соответственно: для Ог 20,9 и 23,2%, для № 78,16 и 75,5%, для
инертных газов 0,94 и 1,3%.
Нахождение в природе. Кислород является самым распространенным
элементом на Земле. Свободный кислород находится в воздухе, в мор-
ской и речной воде. В связанном виде этот элемент входит в состав
воды, почти всех минералов, а также подавляющего числа органиче-
ских веществ животного и растительного происхождения.
Способы получения
I. Сжижение воздуха.
2. Элек тролиз водных растворов кислородсодержащих солей.
3. Термическое разложение кислородсодержащих веществ:
2КС1Оз = 2КС1 + ЗОг; (кат.МпОг)
2КМпО4 = КгМпО, + МпОг + Ог;
Нитраты металлов, стоящих в ряду напряжений до Са включительно,
при нагревании разлагаются с образованием нитрита соответствую-
щего металла и кислорода; нитраты металлов, расположенных между
Mg - Си включительно, образуют оксид металла, NO? и Ог, металлы,
расположенные правее меди, образуют свободный металл, МОги О2:
2KNO3 = 2KNO2 + Ог;
Cu(NO3)2 = CuO + 2NO2 + 1/2 О2;
Hg(NO3)2 = Hg + 2NO2 + Ог.
Химические свойства.
Активный неметалл, особенно при повышенных температурах. Вза-
имодействует со всеми металлами, за исключением Au, Pt, образуя ос-
8-3549 57
новныс или амфотерные оксиды, пероксиды, а также со нссми неме-
таллами. кроме галогенов, образуя кислотные или иесолсобратукипис
оксиды:
2Са + Ог = 2СаО ;
4А1 + ЗО2= 2А1гОз
2Na + 02 = Na2O2;
S + О2 = SO2;
2С + О2 - 2СО.
Реагирует со сложными неорганическими и органическими вещества-
ми:
2H2S + ЗОг = 2SO2 + 2НгО ;
СгНзОН + ЗО2 = 2С0г + ЗН2О .
Озон Оз - аллотропная модификация кислорода, неустойчив, очень
сильный окислитель за счет атомарного кислорода, который выде-
ляется при разложении озона:
Оз=О2 + [О];
Оз + NO = NO2 + Ог;
4Оз + 3H2S(pp) = 3H2SO4j
4Оз + 3PbS = 3PbSO<
Оз + 2KI + НгО = 1г + О2 + 2КОН.
Озон получают при пропускании кислорода через тлеющий электри-
ческий разряд.
Пероксид водорода Н2Ог— вязкая бесцветная жидкость, разлагается на
свету с образованием НгО и Ог, неограниченно растворим в воде, об-
ладает слабыми кислотными свойствами:
Ва(ОН)г + НгОг= 2НгО + ВаОг.
Проявляет окислительные и восстановительные свойства (окислитель-
ные преобладают):
2NaI + НгОг= h + 2NaOH;
С1г* НгОг = Ог + 2НС1.
НгОг + 2FeSO« ► H2SO4 = Fe2(SO4)s + 2НгО;
НгОг+ NazSO3 = Na2SO4+ НгО;
Сера
Сера S - твердое вещество желтого цвета, образует три аллотропные
модификации: ромбическую, моноклинную, пластическую. Наиболее
устойчива ромбическая сера, Тпп = 113°С. Молекула кристаллической
серы состоит из 8 атомов, замкнутых в кольцо. Сера практически не
растворима в воде, но хорошо растворяется в органических раствори-
телях (СбНе, CS2).
Нахождение в природе.
Встречается в виде самородной серы, а также в виде сульфидов и
сульфатов различных металлов. FeSz - пирит или железный колчедан,
ZnS - цинковая обманка, PbS - свинцовый блеск, Na2SC>4 ЮН2О -
глауберова соль, MgSCUJHzO - горькая соль. Сера входит в состав
белковых веществ.
58
,"С 200),
(20)
(120)
(750)
(120)
(кипячение)
(кипячение)
Химические свойства.
Активный неметалл, реагирует с неметаллами, металлами, кислотами
окислителями, щелочами.
S + H2 = H2S
S + Oj = SO2;
S +C12 = SC12;
2S + Ch - S2C12;
2S + C = CS2 ;
S + 2K = K2S;
S + 2H2SO4(wo„u>= 3SO2 + 2H2O;
S + 6HNO3(koh.,) = 6NO2 + 2H2O + H2SO4;
4S + 6NaOH(Ko.>u)= 2Na2S + 3H2O + Na2S2O3;
S + Na2SO3(KOHu) = Na2S2C>3.
Сероводород HiS - бесцветный газ с запахом тухлых яиц, ядовит,
сжижается при -60°С, затвердевает при -86°С, термически неустойчив,
плохо растворяется в воде, водный раствор называется сероводород
ной водой и является очень слабой кислотой, диссоциирует ступенча-
то. Как кислота реагирует с основаниями, оксидами, солями; сильный
восстановитель, реагирует даже со слабыми окислителями:
H2S(r) = Н2 + S (500°С) ;
2H2S(rj + ЗО2 = 2Н2О+ 2SO2; 2H2S(r) + О2 = 2Н2 О + 2S (150°С)
H2S + NaOH = NaHS + НгО; H2S + 2NaOH = Na2S + 2H2O ;
H2S + H2SO4(kohu) = S + SO2 + 2Н2О;(на холоде)
H2S + 3H2SO4(kohU)= 4 SO2 + 4H2O ; (кипячение)
H2S + 2FeCh = 2FeCl> + S + 2HC1.
Оксид серы (IV) SO2 бесцветный газ с резким удушливым запахом,
сжижается при -10°С. затвердевает при -73°С, термически устойчив,
растворяется в воде, образуя сернистую кислоту. Кислотный оксид,
H2S(r) + Na = NaHS + l/2H2(150°C)
реагирует с основными оксидами, основаниями, солями; восстанови-
тель, слабый окислитель.
SO2 + Н2О = H2SO3; SO2+СаО = CaSOs;
SO2 + Са(ОН)2 = CaSCh + Н2О, 2SO2 + Са(ОН)2 = Ca(HSO3)2;
SO2 + Na2 СОз= Na2SO3 + СО2; SO2 + С = S + СО2 (500°С)
SO2 + I2 + 2НзО = H2SO4 + 2HI; SO2 + 2H2S = 3S + H2O;
SO2 + H2O + l/2O2 = H2SO4.
Способы получения.
4FeS2 + 11O2 = 2Ре2Оз + 8SO2;
Na2SO3+ H2SO4 = Na2SO4 + SO2+ H2O;
Cu + 2H2SO4(kohu) = SO2 + 2H2O + CuSO4.
Сернистая кислота H2SO3- слабая, неустойчивая, существует только в
разбавленных растворах, обладает окислительными и восстанови-
тельными свойствами:
H2SO3 + 2H2S = 3S + ЗН2О;
H2SO3 + I2 + Н2О = H2SO4 + 2HI;
4Na2SO3 = 3Na2SO4 + Na2S. (600°C)
8"
59
Сернистая кислота является двухосновной, полому образует средние
и кислые соли К SOi, KHSOi.
Оксид серы (VI) SO3 - бесцветная жидкость, кипит при 45Г,С затвер-
девает при температуре ниже 17”С , обладает всеми свойствами кис-
лотного оксида, промежуточный продукт при получении серной кис-
лоты, прекрасно растворяется в воде и серной кислоте (раствор S0J в
H2SO4 - о.чег..и).
Серная кислота H2SO4 - тяжелая маслянистая бесцветная жидкость,
затвердевает при 10,4°С, при нагревании частично разлагается, об-
разуя БОз, прекрасно растворяется в воде выделяя много тепла.
Способы получения.
Получение H2SO4осуществляют в несколько стадий:
1.Обжиг деросодержащих веществ:
4FeS2+ 1 lO2=2Fe2O3 +8SO2.
2.Каталитическое окисление SO2b SO3.
З.Растворение БОзв концентрированной H2SO4.
Разбавленная H2SO4 проявляет все характерные свойства сильных кис-
лот: реагирует с металлами, расположенными в ряду напряжений ле-
вее водорода, основными оксидами, основаниями, солями:
H2SO4 + Fe = FeSCU + Н2Т;
H2SO4 + ZnO — ZnSO4 + Н2О;
H2SO4 + Са(ОН)2 = CaSO4 + 2Н2О;
H2SO4 + BaCh = BaSO4 + 2НС1.
Является двухосновной кислотой, поэтому образует средние и кислые
соли - K2SO4, KHSO4.
Концентрированная H2SO4 - сильный окислитель (пассивирует неко-
торые металлы - Be, Со, Fe, Mg), в реакциях с металлами степень вос-
становления H2SO4 зависит как от активности металла, так и концент-
рации кислоты:
Hg + 2H2SO4 (кони) = HgSO4 + SO2 + 2Н2О;
Zn + 2H2S04(kohu) = ZnSCh + SO2 + 2НгО;
3Zn + 4H2S04<kohu) = 3ZnSO4 + S + 4H2O;
4Zn + 5H2SO4 (КОНЦ) = 4ZnSO4 + H2S + 4H2O;
C + 2H2SO4(kohu) = CO2 + SO2 + 2H2O;
S + 2H2S04(kohu) = 3 SO2 + 2H2O;
NaCl + H2SO4 (кони) = NaHSO4+ HC1;
2KBr + 2H2SO4 (кони) = K2SO4 + SO2 + 2H2O + Br2;
8KI + 5H2SO4(kohu) = 4K2SO4 + H2S + 4H2O +4I2.
VI группа, побочная подгруппа
Хром
Хром Сг — белый блестящий металл, очень твердый, хрупкий, туго-
плавкий, Tki - 1903°С. На воздухе покрывается оксидной пленкой,
пассивируется сильными окислителями (НЬЮзконц).
60
Нахождение в природе.
В природе встречается в виде различных соединений, например.
РЬСгОч - свинцовая красная руда, 1;с() Cr2()i хромис тый железняк.
Способы по п ченин
Хром получаю!' восстановлением его оксида алюминием или углеро-
дом:
Сг2Оз + 2А1 = 2Сг + АЬОз;
СпОз + ЗС = 2Сг + ЗСО.
Химические свойства.
Хром реагирует при нагревании с неметаллами, кислотами, солями:
4Сг + ЗО2 = 2СггОз;
2Сг + ЗС12 = 2СгС1з;
2Cr + 3S = СггБз;
Сг + 2НС1 = СгС12 + Н2;
4Сг+ 12НС1 + ЗО2= 4СгС1з + 6Н2О;
2Сг + КСЮз = СггОз + КС1; (500°С)
2Cr + 3KNO3 = СггОз + 3KNO2. (500°С)
Оксид хрома (III) СггОз - порошок зеленого цвета, амфотерный ок-
сид, не растворяется в воде, плохо растворяется в кислотах и щелочах,
восстанавливается типичными металлами в жестких условиях, реаги-
рует со щелочами и солями при сплавлении:
СггОз + 2NaOH = 2NaCrO2 + Н2О; (7PeaKU ,°С 500)
СггОз+ Na2CO3 = 2NaCrO2+CO2; (500)
2СггОз + 8NaOH + ЗО2 = 4Na2CrOi + 4НгО. (500)
Способы получения.
(NH4)2Cr2O7 = СггОз + N2 + 4Н2О. (170)
2КгСгг67 + ЗС = 2СггОз + СО2 + 2КгСОз. (700)
Гидроксид хрома (III) Сг(ОН)з - при действии щелочей на соли хрома
(III) выпадает серовато-голубой осадок, легко растворимый в кисло-
тах и щелочах (амфотерный гидроксид):
Сг(ОН)з + ЗНС1 = СгС1з + ЗНгО;
Сг(ОН)з + ЗКОН = Кз[Сг(ОН)6];
2Сг(О Н)з = СггОз + ЗНгО. (500)
Оксид хрома (VI) СгОз - вещество темно-красного цвета, кислотный
оксид, взаимодействует с водой, основными оксидами, основаниями:
СгОз + НгО = НгСгО4;
2СгОз + НгО = Н2Сг2О?;
СгОз + СаО = СаСгОч;
СгОз + 2NaOH = Na2CrO4 + Н2О.
СгОз является очень сильным окислителем. Его получают взаимодей-
ствием сухих дихроматов и хроматов с концентрированной H2SO4:
K2CrO4 + H2SO4 (конц) = СгОз + НгО + K2SO4;
КгСггО? + H2SO4 (кони) = 2СгОз + НгО + K2SO4;
4СгОз + СгНзОН + 6H2SO4 (кони) = 2Сгг(8О4)з + 2СО2 + 9НгО.
КгСггО? - дихромат (бихромат) калия - сильный окислитель:
КгСггО? + ЗКгБОз + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4Н|О;
61
К2С12О7 + 6KI + 7H2SO.1 = Cn(SO4)i + 3I2» 4K2SO4+ 7IbO,
KjCi’O? + 3H>S + 4H;SO4 = Cr.(SOi)i + 3S I K2SO4 * 7fb<7;
К2Ф2O7 + 31hS + 112O = 2( 1 (01l)i ' 3S + 2KOII;
K2C12O7 + 3Ih = СггОз + K2SO4;
К2СГ2О7 + S = СггОз + K2SO4;
К2СГ2О7 + 2C = Ci 2O3 + K2CO1 + CO;
K2C12O7 + 4Л1 = 2Cr + 2КАЮ2 + AI2O3;
(5004 )
(800 10004)
(80042)
(800 90042)
VII группа, главная подгруппа
Водород
Н, F, Cl, Br, I, At - элементы главной подгруппы. Водород, имея один
электрон на внешнем уровне, должен стоять в 1 группе, но по
свойствам он более похож на галогены. Химическая активность эле-
ментов находится в зависимости от радиуса их атомов; по активности
галогены располагаются в ряд F > Cl > Br > I. Все галогены прини-
мают и отдают (кроме F) электроны, образуя соединения со степенями
окисления 1-, 1+, 3+, 5+, 7+. Легче всего отдает электроны иод, затем
бром, хлор. Более активные галогены вытесняют менее активные из
их соединений.
Водород Н2 - газ без цвета и запаха, легче воздуха, слабо растворяется
в воде, сжижается при -253°С (1атм), затвердевает при -25942; при
повышенной температуре растворим во многих металлах - Ni, Pt, Pd.
Для водорода известны три изотопа: протий с массовым числом 1,
дейтерий - 2, тритий - 3.
Нахождение в природе.
Встречается в свободном состоянии в атмосфере и некоторых горючих
газах. В связанном состоянии входит в состав воды, многих минера-
лов, а также всех органических соединений.
Способы получения.
1. Электролиз водных растворов солей (KNOi.NajSOa).
2. Zn + H2SO4 = ZnSO4 + Н2Т.
3. Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2T.
4. Конверсия углерода и водяных паров:
С + Н2О = СО + Н2; (Треакц ,42 800-1000)
СО + Н2О = СО2 + Н2 . (300, кат. Fe2Oi)
5. Конверсия метана с водяным паром, углекислым газом.
СН4 + СО2 = 2СО + 2Н2; (800)
СН4 + Н2О = СО + ЗН2; (800)
ЗСН4 + СОг + 2Н2О = 4СО + 8Н2. (800)
Химические свойства.
Активное вещество, легко реагирует со многими неметаллами (осо-
бенно при нагревании), металлами, оксидами, солями:
Н2+ Х2 = 2НХ; (X = F2-co взрывом; С12- на свету; Вг2,12- 30042
2Н2 + О2 - 2Н2О; (сгорание на воздухе)
H2+S = H2S; (200)
ЗН2+N2= 2NFh; (500, кат)
62
(/ренкн /’С 600, кат)
(300)
(КОО)
(КОО)
2H2+C=CHi;
lh+ 2I<= 2KII;
H2+CuO= Си + H2O;
H2+CuCh=Cu + 2IIC1.
Особенно высока восстановительная способность атомарного водо-
рода, образующегося в результате реакций непосредственно в реакци-
онном объеме.
Галогены
Фтор F2 - газ, обладает характерным резким запахом, при -181"С
сжижается. Сильнейший окислитель.
Хлор С12 - газ желто-зеленого цвета, тяжелее воздуха, сжижается при
-34°С, затвердевает при -101°С, растворяется в воде (хлорная вода),
хорошо растворяется в органических растворителях (CCU) .
Бром Вп - тяжелая красно-бурая жидкость, Тк«п = 59°С, затвердевает
при -7°С. В обычных условиях бром умеренно растворим в воде, хо-
рошо - в органических растворителях.
Иод 12 - твердое темно-серое кристаллическое веществе), легко возго-
няется, образуя пары фиолетового цвета. Иод плохо растворим в во-
де, хорошо - в органических растворителях.
Нахождение в природе.
В свободном состоянии галогены в природе не встречаются. Входят в
состав многочисленных соединений. NaCI - каменная (поваренная)
соль, КС1 MgCh 6Н2О - карналлит.
Способы получения.
I .Электролизом расплавов или растворов солей галогенидов метал-
лов.
2. Действием концентрированной галогеноводородной кислоты (за
исключением HF) на различные окислители:
MnO2 + 4НС1 = MnCh + CL+ 2Н2О;
2КМпО4 + 16НВг = 2МпВг2 + 5Вг2 + 8Н2О + 2КВг;
КСЮз + 6НС1 = KCI + 3Ch + ЗН2О;
2CuSO4 + 4HI = 2CuI + 2H2SO4 + I2.
Химические свойства.
Галогены непосредственно реагируют с металлами и неметаллами (не
реагируют с Oj, N2, С):
2Fe+ ЗС12= 2FeCh;
2Сг + ЗС12 = 2СгС1з;
Zn + Ch = ZnCh;
2Na + Ch = 2NaCl;
2KBr + Ch = 2KC1 + Br2;
Br2 + 2KI = 2KBr + fc;
H2+Ch=2HCl;
2S + Ch = S2CI2;
2P + 3Ch = 2PCL;
2P + 5Ch = 2РСВ.
63
Реагируя с водой и растворами щелочей, галогены образуют кисло-
родсодержащие кислоты и их соли:
CI2+H2O = НС 1 + 11CIO;
Ch + ’NaOH = NaCl + Na( IO + I bO, (на холоде)
Ch 4 6NaOH = 5NaCI + NaCIOi + 3114). (кипячение)
Проявляют свойства окислителей:
Ch + 2FcCh = 2FcCh;
Ch + H2SO3 + Н2О = II2SO4 + 2НС1.
Иод проявляет свойства слабого восстановителя:
h + 5Н2О2 = 2НЮз + 4Н2О;
I2 + 10HNO}(ko.,u)= 2НЮз + 4Н2О + IONO2.
Фтор обладает исключительно высокой реакционной способностью
взаимодействует почти со всеми химическими элементами (непосред-
ственно не реагирует с Ог и N2; с Pb, Си, Mg, Ni образует на поверх-
ности непроницаемые пленки фторидов).
Галогеноводороды HCI, HBr, HI - бесцветные газы с резким запахом,
прекрасно растворяются в воде, образуя соответствующие сильные
кислоты, которые реагируют с металлами, оксидами, основаниями,
солями:
Сг+ 2НС1 = СгСЬ + Н2;
CuO + 2НС1 = CUCI2+ 2НгО;
Са(ОН)2 + 2НС1 = CaCh + 2Н2О;
К2СО3 + 2НС1 = 2КС1 + Н2О + СО2.
Обладают свойствами восстановителей - (HI среди них - самый силь-
ный восстановитель):
2HI + H2SO4(kohu) = Ь + SO2 + 2Н2О;
8HI + НзЗОдконц) = 4h + H2S + 4Н’О;
2НВг + НЮ2 = Вгз + 2Н’О;
14НС1 + К2СГ2О7 = 2КС1 + 2СгС1з + ЗС12 + 7Н2О;
2НВг + H3S04(kohu) — Вгг + SO2 + 2НгО.
Плавиковая (фтороводородная) кислота в отличие от других галоге-
новодородных кислот - слабая кислота. Реагирует с металлами, окси-
дами, основаниями, солями, SiO3:
SiO2 + 6HF = H2[SiF6] + 2Н2О.
Способы получения.
1. Н2 + Хг = 2НХ, где X = F, Cl, Вг, I.
2. Р1з + ЗНгО = НзРОз + 3HI.
3. РВгз + ЗНгО = НзРОз + ЗНВг.
4. CaF2 + H2SO4(kohU) = CaSCh + 2HF.
5. NaCl + H2SO4(«OHU) = NaHSO4+ HCI.
Обратите внимание на то, что при взаимодействии НгБСЦконц) с NaBr
и Nal галогеноводороды не выделяются.
Кислородсодержащие кислоты. Хлор образует 4 кислоты: хлорнова-
тистую НС1О, хлористую НСЮ2, хлорноватую НСЮз, хлорную
НС1О4.
НС1О - слабая, очень неустойчивая кислота:
64
НСЮ - IICI + О; (солнечный свет)
3HCIO = 2HC.I + ИСКИ. (кипячение в темноте)
Соли этой кислоты гипохлориты очень сильные окислители:
CI2 + Ca(OII)i= С аОСЕ (хлорная известь);
СаОСЕ + СО2 = CaCOj + CI2;
2CaOCh + CO2 + II2O = СаС.Оз I CaCh +211(10.
НСЮз существует только в разбавленных растворах, сама кислота и
се соли - сильные окислители. Ее соли хлораты находят применение
для лабораторного получения кислорода и взрывчатых веществ, а
также солей хлорной кислоты - перхлоратов:
2КСЮз = 2КС1 + ЗО2; (кат. МпОг, Гря«ц ,"С 200)
4КС1Оз = 3KCIO4 + КО; (400)
5КСЮз + 6Р = ЗР2О5 + 5KCI; (400)
КСЮз + ЗМпОг + 6КОН = КО + ЗКгМпОз + ЗНгО;
4КС1Оз + 3K2S = 4КС1 + 3K2SO4.
VII группа, побочная подгруппа
Марганец
Марганец Мп - серебристо-белый металл, твердый и хрупкий, по
свойствам похож на железо, с которым образует сплавы с любым со-
отношением компонентов, 7Ш, = 1260°С, поглощает водород, не реа-
гируя с ним.
Нахождение в природе.
Марганец входит в качестве примеси в состав всех железных руд. Са-
мостоятельные минералы: МпОгиНзО - пиролюзит, МпСОз - марган-
цевый шпат, ЗМпгОз MnSiOj - браунит.
Способы получения.
Марганец получают восстановлением предварительно прокаленного
природного МпОг с помощью алюминия:
ЗМпОг = МпзС>4 + Оз:
ЗМП3О4 + 8AI — 9Мп + 4ALO-,.
Для получения ферромарганца сплавляют оксиды марганца и железа с
углеродом:
ЕегОз + МпОг + 5С = Мп + 2Fe + 5СО.
Химические свойства.
Марганец Мп - реагирует с неметаллами, кислотами, оксидами, во-
дой. Наиболее устойчивы и распространены соединения в которых
Мп имеет степень окисления 2+, 4+, 6+, 7+ :
Мп + Ch = MnClz;
ЗМп + 2Р = МпзРг;
ЗМп + N2 = Мпз№;
Мп + S = MnS;
Мп + 2НС1 = MnCh + Н2?;
Мп + Оз = МпОг;
Мп + Нг5О4(разб) = MnSO4 + Н2Т;
Мп + 2H2SO4(koi,u) = MnSO4 + SO2 + 2Н?О;
9-3549
65
Мп + 811N(.)1(|,„,r.) = 3Mn(NOi)2 + 2NO t- 41 f2Cl
Mn + 4nNOi(K.„I1,) = Mii(NOi)2 i 2NO2 + 21l2O;
3Mn + FcjOi = ЗМпО i- 2Fc;
Mn + 2NIhCI +2lh()= MnCh । 2NIhOll + Ibt
Кислородные соединения марганца.
Оксид марганца (II) МнО - вещество зеленовато-серого циста, терми-
чески устойчиво, легко окисляется кислородом до МнО2, практически
не растворимо в воде и щелочах, проявляет свойства основного окси-
да.
МпО 4- SO3 = MnSO.i;
MnO + H2SO.> = MnSO< + IhO.
Гидроксид марганца (II) Mn(OH)2- соединение белого цвета.
MnCh + 2NaOH = Mn(OH)2 + 2NaCI.
Проявляет основные свойства, реагируя с кислотами, кислотными
оксидами, не растворим в воде:
Mn(OH)i + 2НС1 = MnCh + 2Н2О.
Оксид марганца (IV) МпО2- вещество темно-серого цвета, при нагре
вании разлагается, реагирует с кислотами, щелочами. Проявляет
свойства окислителя и восстановителя:
4МпОз = 2Мп2Оз + О2; (550°С)
2МпО2 + 2Н28О4(кИш) = 2MnSO4 + 2Н2О + О2; (кипячение)
MnO2 + 2FeSO4 + 2H2SO4 = MnSO4 + 2Н2О + Fe2(SO4)3;
2МпО2 + 4КОН + О2= 2К2МпО4+ 2Н2О.
Перманганат калия КМпО4- очень сильный окислитель:
2КМпО4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + ЗН2О + 6K2SO4;
2KMnO« + K2SO3 + 2KOH = 2K2MnO4 + H2O + K2SO4;
2KMnO4 + 3K2SOs + H2O = 2MnO2 + 2KOH + 3K2SO4;
2KMnO4 = K2MnO4 + MnO2 + O2.. (250°C)
VIII группа, побочная подгруппа
Железо
Железо Fe - серебристо-белый пластичный металл, Г™ = 1540°С, об-
ладает хорошей тепло- и электропроводностью, легко намагничивает-
ся и размагничивается. Чистое железо химически устойчиво на возду-
хе и в воде, но “обычное11 железо содержит примеси и во влажной
атмосфере быстро “ржавеет":
4Fe + ЗО2 + 6Н2О = 4Fe(OH)3.
Нахождение в природе.
В свободном виде не встречается. Основные минералы, содержащие
связанное железо: РезОд - магнитный железняк , FeS2 - железный кол-
чедан (пирит).
Способы получения.
Чистое железо получают восстановлением водородом оксида железа
(III) или хлорида железа (II):
РезОз + ЗНг = 2Fe + ЗН2О; (> 1000°С)
FeCh + Нг = Fe + 2HCI. (>500°С).
66
(Треакц ,°С >500)
(>200)
(>900)
(400)
(900)
В промышленности железо используется )> лиде различных сплавом,
например, чугуна, стали. Является продуктом много)оииажиого про-
изводства. в основе которого лежит восстановление оксидов железа
углеродом (коксом).
Химические свойства.
Железо является активным металлом, реагирует с неметаллами, кис-
лотами. солями, пассивируется концентрированными HNOs и II2SO4:
2Fe + ЗСЬ = 2FeCh;
3Fe + 2Ог = РезО4(РеОРегОз);
3Fe + С = РезС;
Fe + S = FeS ;
Fe + РегОз = 3FeO;
Fe + 2HC1 = FeCh + H2T;
Fe + FbSO-npa-ie) = FeSOa + H2T;
Fe + C11SO4 = FeSC>4 + Cu;
Fe + НЬЮз(кони) -> (не реагирует при обычной температуре);
Fe + FFSCUckohu) —> ( не реагирует при обычной температуре);
2Fe + 6H2SO4(kohu) = Рег(8О4)з + 3SO2 + 6Н2О; (нагревание)
Fe + 6НМОз(кони) = Fe(NO3)3 + 3NO2 + ЗН2О; (нагревание)
Fe + 4НЬЮз(Разб) .= Ре(МОз)з + NO + 2НгО.
Оксид железа (П) FeO - кристаллы черного цвета, проявляет слабые
амфотерные свойства с преобладанием основных, не растворяется в
воде, проявляет свойства слабого восстановителя:
FeO + H2SO4(paa6) — FeSO4 + Н2О;
3FeO + 10НМЭз(разб) = ЗРе(ИОз)з + NO + 5НгО;
FeO + H2S = FeS + H2O; (Треакц ,°C 500)
FeO + H2 = Fe + H2O: (350)
FeO + C = Fe + CO, (> 1000)
6FeO + Ог-2РезОт (350)
Гидроксид железа (II) Fe(OH)i - вещество голубовато-белого цвета,
образуется при взаимодействии соли железа (II) с раствором щелочи.
На воздухе осадок быстро темнеет за счет перехода Fe2* в Fe3+:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4;
4Fe(OH)2 + Оз + 2H2O = 4Fe(OH)3.
В кислой среде железо (II) окисляется значительно медленнее.
Оксид железа (III) РегОз - твердое вещество красно-бурого цвета, не
реагирует с водой, обладает слабо выраженными амфотерными
свойствами, восстанавливается до свободного металла:
РегОз + 6HCI = 2FeCI3 + ЗНгО;
РегОз + 6HNO3 = 2Fe(NO3)3 + ЗНгО;
РегОз + ЗНг = 2Fe + ЗНгО;
РегОз + СО = 2FeO + СОг ;
РегОз + ЗСО = 2Fe + ЗСОг;
РегОз + Fe = 3FeO;
РегОз + №гСОз = 2NaFeO2 + СОг;
РегОз + 2NaOH = 2NaFeO2 + НгО.
(Треакц
С >1000)
(500-600)
(700)
(900)
(900)
(600)
9*
67
Ферриты вщлочных металлов полностью гпцрочитуются:
2NaFeCh + НО = Ье>Оз + 2Na()ll.
Соли железа (III) легко гидролизуются, их водные растворы имеют
слабокислую реакцию, являются слабыми окислителями:
FeCh + 2Н >О = Г-сС1(О1 !)г + 21 КТ, (кипячение)
2FcCb + IhS = 2FeCh + S + 2НС1;
2FeCh + 2Nal = 2FeCh + 1, + 2NaCI;
FeCh + Al = AlCh + Fe;
2FeCh + Fe = 3FeCh;
2FeCh + Cu = 2FeCh + CuCh;
41-eCh + 3O2 = 21-егОз + 6Ch.
Гидроксид железа (III) Fe(OH)j - выпадает в осадок при взаимо-
действии растворимых солей железа (III) и щелочей:
FeCh + ЗКОН = Fe(OH)3 + ЗКС1.
Комплексные соединения железа
Желтая кровяная соль (гексацианоферрат (II) калия) K<(Fe(CN)6l обра-
зуется при действии на раствор соли железа (П)избытка цианида ка-
лия:
FeCh + 6KCN = K4[Fe(CN)6] + 2КС1.
При взаимодействии с ионами Fe34 в водном растворе желтая кровя-
ная соль дает синий осадок KFe[Fe(CN)61 (берлинскую лазурь):
FeCh + K4[Fe(CN)6] = KFe[Fe(CN)6] + ЗКС1.
Эта реакция является качественной на ионы Fe34 .
Красная кровяная соль (гексацианоферрат (III) калия) Ka[Fe(CN)6] об-
разуется при действии на раствор соли железа (III) избытка цианида
калия:
FeCh + 6KCN = K3[Fe(CN)61 + ЗКС1.
При взаимодействии с ионами Fe24 в водном растворе красная кровя-
ная соль дает синий осадок KFe[Fe(CN)6] (турнбуллеву синь):
FeCh + Kj[Fe(CN)6] = KFe[Fe(CN)6] + 2КС1.
Эта реакция является качественной на ионы Fe24 .
68
ЧАС ТЬ 111. ОРГАН! I’ll.СКАЯ химия
Теоретические основы opi ипнчсской химии
Органическая химия что химия соединений углерод;!. В виде исклю-
чения угольная кислота, карбонаты, карбиды, оксиды углерода, кар-
бонилы Металлон относятся к неорганическим соединениям.
Основные положения теории строения органических соединений
А.М.Бутлсрова:
1. Атомы в органических молекулах связаны Друг с другом в опреде-
ленном порядке химическими связями.
2. Строение можно изучить экспериментально, используя химические
и физические методы.
3. Структурные формулы выражают порядок химической связи ато-
мов, символы элементов соединяются черточками, изображающими
химическую связь. При построении структурных формул необходимо
учитывать валентность элементов.
4. Каждое вещество имеет одну определенную формулу строения, от-
ражающую порядок химической связи в молекуле.
5. Связанные в молекуле атомы оказывают друг на друга взаимное
влияние, свойства каждого атома в составе молекулы зависят не толь-
ко от его собственной природы, но и от окружения, в котором этот
атом находится.
6. Физические и химические свойства органических соединений опре-
деляются составом и строением молекул.
Тип химической связи в органических соединениях, как правило, ко-
валентный. В большинстве органических соединениях ковалентные
связи являются полярными. В солях органических кислот и ряде других
соединений осуществляется ионный тип связи.
Согласно теории гибридизации атом углерода, образующий только
одинарные связи, находится в центре тетраэдра молекулы, в вершины
которого направлены четыре sp’-гибридные атомные орбитали ато-
ма углерода с величиной валентного угла равного 109°28’. Атом уг-
лерода, образующий двойные связи, гнбридизуется по хр2-типу с вели-
чиной валентного угла 120°. При наличии тройной связи - по хр-типу
с величиной валентного угла 180°.
Гибридизация sp3 характерна для алканов; sp2 - для алкенов и аре-
нов, sp — для алкинов.
Гомологические ряды - это ряды органических соединений , в кото-
рых каждый последующий член ряда отличается от предыдущего на
CHz-группу. Например, СНд, СгНб - гомологи, C„Hz„+z — формула
гомологического ряда алканов, СгШ, СзНс - гомологи, С„Нг„ - фор-
мула гомологического ряда алкенов. В пределах гомологического
ряда физические свойства гомологов закономерно изменяются при
удлинении цепи.
69
Химические органические соединения, входящие в про! рамму средней
школы, могут бы ть классифицированы:
ациклические
карбоциклические гетероциклические
Органические соединении
состоящие из
СиН
состоящие из
С, И, О
состоящие из
С, II, О, N
Первичный атом углерода соединен в молекуле с одним соседним
атомом углерода, вторичный - двумя, третичный - тремя, четвертич-
ный - четырьмя. В приведенной ниже формуле разновидности атомов
углерода обозначены римскими цифрами.
I
СН3
1 II III liv
СН3-СН0-СН— С—СН3
I I 1
СН3 СН3
I I
70
Функциональная группа атом (кроме водорода) иди группа атомов,
связанные с атомом углерода в молекуле и определяющие химические
свойства (химическую функцию) молекулы.
Функциональ- ная группа Класс сое- динений Название в пристанкс I [азвание вокончании Формула пред- став и геля
Карбоксиль- ная, соои кислогы карбокси оная кислота (((•ООН
Супьфогруп-. па, -SO,H сульфо кислоты сульфо- сульфоно- вая кислота ( ,,((. SO,И
Гидроксиль- ная, -ОН фенолы спирты гидрокси- ол сн,он
Альдегидная -СНО альдеги- ды формил- (альдо) - аль нсно
Карбонильная -СО- кетоны оксо- - он СНзСОСИз
Аминогруппа -NH2 амины амино- -амин СНзМЪ
Нитрогруппа -NO2 нитросое- динения нитро- - CH3NO2
Алкоксигруп- па -OR простые эфиры алкокси- — СНзОСНз
Ацилатная группа R-C =О \О- сложные эфиры алкилокси- карбонил- алкил... ...оат СНз-С =о ОСНз
Меркапто- группа, -SH тиолы меркапто- - тиол СНз-SH
Галогены F,Cl,Br,I галоген- галогено- производные - фторид ИТ.Д. СНз-F
Радикалы - атомные группировки, углеродный атом которых имеет
неспаренный электрон. Они образуются путем расщепления в молеку-
ле простой углерод-углеродной или углерод-водородной связи и в
большинстве случаев крайне неустойчивы. Названия радикалов с
неспаренным электроном имеют окончание -ил, общий символ -R:
СНз- метил;
С2Н5- этил;
СзНт- пропил;
СН2=СН-СН2- аллил;
СН2 =СН-
винил;
фенил; бензил.
71
।роипыс эффскгы смещение ineicipoinn.ix niioinoi irn и молоку
лс под влиянием замес) и гелей.
)лскipoorpiiHUTCJibiioeII* м1гменin эго мери пр1Г1яжспия HicKipoiion.
которую проявляет атом лапши о элсмс1па . участующий в ковалент-
ной связи.
Отрицательный индуктивный эффект. Заместители с шсктроогрица-
тслыюстыо большей, чем у углерода или водорода, проявляют по
отношению к атому С отрицательное действие , которое проявляется в
том, что на атоме С возникает заряд +6, а заместитель приобретает
заряд 5. Смещение электронной плотности быстро ослабевает по
мере удаления от заместителя
И Отрицательный ( /) индуктивный эффект
4-+8 —8 эффект проявляют: -F,-CI,-Br,-OH, NHz,
Н -> С -> F -NOz
?
Н
Н Положительный (+7) индуктивный эффект
Т -6 +6 проявляют атомы щелочных металлов,
Н <- С <- Na алифатические радикалы (-СНз, -CzHs).
J- Распределение зарядов для +/ противопо-
Н ложно -1.
Мезомерный эффект (М) - смещение электронной плотности л-связи
или в сопряженной системе л- связей.
Мезомерный эффект является положительным (+ М), если заместитель
отдает свою электронную пару для участия в общем сопряжении. За-
местители с неподеленной электронной парой: -Cl, -F ,-Вг, -I, -ОН,
NHz отдают свою электронную пару для участия в сопряжении.
Мезомерный эффект (-М) является отрицательным, если заместитель
оттягивает электронную пару из сопряженной системы. Свойство
оттягивать электронную пару проявляют СН-О, -СООН, -NOz.
Изомерия - это явление существования молекул с одинаковыми сум-
марными формулами (брутпю-формулами), но с различным строением
или различным расположением атомов в пространстве. Химические и
физические свойства изомерных соединений различаются.
Выделяют два типа изомерии: структурную изомерию и простран-
ственную изомерию.
Структурная изомерия - изомеры различаются химическим строением
молекул. Структурную изомерию подразделяют на несколько типов:
1) изомерию углеродного скелета,
2) изомерию положения кратных связей или функциональных групп;
3) межклассовую изомерию:
а) С4Н10, СНз-(СНг)2-СНз, СНз-СН-СНз;
бутан’ н-бутан
брутто-формула СНз
изобутан
72
cncah. cih i и ; ii (ib. (ib=< H < ih rib.
бутен бутен 2 6yrcil-l
CH3 -CH—СООН, CHZ - Cl k - COOI-I;
Ан Ah
а-оксипрочиоповая
кислота
С2Н5ОН,
этиловый спирт
Р-оксинропиоиовая
кислота;
СПз О СПз
диметиловый эфир
в) CiHeO,
брутто-формула
Пространственная изомерия - изомеры имеют одинаковое химическое
строение, но различаются расположением атомов в пространстве.
Пространственную изомерию подразделяют на:
геометрическую (цис-, транс-)-, оптическую.
Геометрическая изомерия характерна для алкенов; двойная связь не
допускает свободного вращения
родной связи:
группировок вокруг углерод-угле-
н
Н
\=С
Н3С
СН3
НзС Н
цис-бутен-2 транс-6утен-2
Оптическая изомерия обусловлена наличием ассиметричного атома
углерода С* (атома углерода, связанного с четырьмя различными
заместителями). Проявляется в способности таких соединений вра-
щать плоскость поляризованного света по часовой стрелке {право-
вращающие изомеры [обозначаются значком (+)]} или против часо-
вой стрелки {левовращающие изомеры [обозначаются значком (-)]}:
СНО
I
Н— С*-ОН
I
СН2ОН
СНО
I
но—с*—н
I
СН2ОН
Г>-(+)-гзицери- Г-(-)-глицериновый
новый альдегид; альдегид.
Оптически активные вещества, имеющие конфигурацию, сходную с
конфигурацией правовращающего или левовращающего глицерино-
вого альдегида, относятся к веществам D и L ряда.
D - dextrum (лат.) - правый, L - laevus (лат.) - левый.
Типы органических реакций.
реакции замещения - СзНб + Ch -> C2H5CI + НС1;
реакции присоединения-СНзСН^СНг + Вп -> СНзСНВг-СНгВг;
реакции отщепления - СНгВг-СНзВг + Zn -> С2Н4 + ZnBrj.
10-3549
73
К реакциям присоединения относя гея реакции полимери ищии, конден-
сации. по тконденсации.
В ходе органических реакций разрыв ковалентных свя!сй может быть
гомолитическим:
А:В-> А- + В-, (Л- ,В- - радикалы >лек1нро11еитрал1,пые часзипы ),
гстсролптпчсскнм:
А:В -> А‘ + :В , (А+, :В - ионы сто /пряженные частицы).
По механизмам протекания реакции подразделяются на; радикальные
R и ионные; а ионные, в свою очередь, па нуклеофильные N и >лек-
трофильные - Е.
В органической химии выделяют 9 типовых реакций, обозначаемых
символами S, А, Е и индексами R, N, Е.
Реакции Радикальные Нуклеофильные
Замещения Sr Sn
Присоединения Ar An
Отщепления Er En
Электрофильные
Se
Ае
Ее
Некоторые из этих типов могут быть разделены на подтипы: SnI, EnI,
имеющие ступенчатый механизм; Sn2, En2 - имеющие одностадийный
механизм.
Нуклеофильные частицы отрицательно заряжены - “ любящие ядро".
Электрофильные частицы положительно заряжены - “любящие элек-
трон”.
Механизм реакции - последовательность элементарных стадий, через
которые проходят реагенты, превращаясь в продукты реакции.
Механизмы радикальных реакций :
а) радикального замещения Sr C2H6 + Ch ; 1) инициирование цепи б) радикального присоединения Ar СН2=СН2 + Ch .
Ch + Av-> 2C1- 2) развитие цепи: Ch + /jv-> 2С1-.
С2Н6 + Cl-—> СгН5- +HCI, С2Н5 + Ch C2H5CI + С1, и т.д. до СгС1б: СН2=СН2 + Cl- -> HCI + + CICH2-CHT. С1СН2-СН2- + Ch CICH2-CH2CI + Cl-.
3) обрыв цепи:
Cl- + ci- -> Ch , CzHs' + C2H5- —> C4H10; Cl- + Cl- -> Ch CICHz-CHr + Cl--> CICH2-CH2CI.
в)радикального отщепления Ен - пиролиз высших алканов:
R-CH2-CH2-CH2-CH2-R - > 2R-CH2-CHr .
R-CHa-CHr -> R-CH=CH? + Н-,
R-CH2-CHT Rr + СН2=СН2.
74
Мсхани imi.i ионных реакции
Нуклеофильные реакции нгк1еоф1П1,ныи peaieiii ataxyci nrrmpo
фильный субстрат пли чеы11рофии>ный центр субстрата:
нуклеофил + электрофил > продукты
(. реаген г) (субсзpai )
Нуклеофильное замещение Sn:
-С-Х * : Y — -Чс -Vi X- •
/ /
R—Cl+ОН —R-ОНгСГ
Нуклеофильное присоединение An:
х \ /О н+ ч /ОН
С=О +Y —* с —► с
/ / \у / \ '
r~c^o+cn-- rV° ±с\_сс°н
ЧН HCN Ь " / xCN
Нуклеофильное отщепление En :
СН3-СН2С1 —• СН3-СН2 + CI-.
СН3-СН2 —- Н++ СН2=СН2.
Н+ + ОН-—- Н2О.
Электрофильные реакции - электрофильный реагент атакует нуклео-
фильный субстрат или нуклеофильный участок субстрата:
электрофил + нуклеофил -> продукты.
( реагент ) (субстрат)
Электрофильное замешение Se :
XY-> Х+ + Y-
п-комплекс
о-комплекс
Н++ Y ->HY.
HNOi + 2 H2SO4 -> NO2+ + 2 HSO4- + НзО+,
n-комплекс а-комплекс
Н+ + HSO4 H2SO4.
10'
75
Эи'ктрофшнное присоединение Ли:
СН2 - СН2 +H-CI— • СН2=СН2 +CI” ,
СН2 = СН2 + Н+
I —* СНз“СНг ,
н+
сн3-сн2+ + ст—►сн3-сн2а
Углеводороды - органические соединения, в состав молекул которых
входят только атомы С и Н.
76
Алканы
Алканы - это насыщенные ациклические углеводороды, молекулы
которых содержат только одинарные спичи С С и С II. ('nlh»>z
формула гомологического ряда.
Гибридизация атома углерода в молекуле sp\ Изомерия структур-
ная.
Название углеводорода Формула /кип, °C р, г/см’
Метан СНч -161,4 0,415*
Этан СгНс -88,3 0,546'
Пропан СзНв -44,5 0 585'
Бутан СчНы -0,5 0.601'
Пентан С5Н|2 36,3 0,630
Гексан СбН|4 69,0 0,660
Гептан СэНи, 98,4 0,684
Октан CsHis 124,6 0,706
Нонан С9Н20 150,5 0,718
Декан С10Н22 174,0 0,718
Эйкозан С20Н42 345,0 0,778
' - при температуре кипения.
Название радикала образуется из названия углеводорода заменой
суффикса -ан на - ил.
Номенклатура рациональная систематическая
СН3 СН3 1 2| 3 4
СНз-С—СН2-СНз сн3-с—сн—снэ II 4
сн3 СН3 СНз
триметилэтилметан 2.2,3-триметилбутан
Выбирается элементарное Нумеруется самая длинная
звено - называются ради- цепь - название : цифры-
калы по старшинству. алкилы - цепь-ан.
Алканы - главная составная часть природного газа и нефти. Основ-
ные фракции перегонки нефти газ (т Ci до Сч), пе троленный эфир (от
Cs до С?), Гкип 20+100 °C, бензин (от Cs до С12), 7х1|П 35+205 °C, керосин
(от Си до Cis), Тит 175+300°С, соляровое масло (от Си до Си), Тит
200+400 °C, смазочные масла (от Сго до Сзч), труднолетучие, парафины
(от C?s до Счо), твердый битум (асфальт).
Способы получения.
1 Природные газы, фракционная перегонка нефти.
2 Каталитическое - Pd, Pt - гидрирование алкенов:
СгНч + Нз -> СзНе.
77
3. Восстановление iалогелпроитпидных c иомошыо II? или III ' ис-
пользованием катализаторов I’d. I’t. Ni:
<>11,1 + 111 > C.||(, l
4. Реакция Вюрца просекает n прпсутс until металлического Na:
2С11з1 + 2Na ►Clli Clh i 2Nal.
5. Разложение cojicii органических кислот при iiai рсияиии cNaOJJ
C„lh„.iCOONa + NaOH > C.„H2>,i1+NiuCOi.
6. Гидролиз карбидов:
АЬСз + 12 H;O-» 3Clh + 4 Al(OII)i.
7. Синтез из CO и СОг - метан, моторные топлива:
CO + ЗН2 -> СНа + H2O, (300"C, Ni)
CO + mH? -> СпНгп+2 + пНгО; (I, кат)
CO2 + 4Hj -> CH< + 2Н:0. (400-C, Ni)
Химические свойства.
Характерными для алканов реакциями являются реакции радикаль-
ного замещения.
1. Галогенирование особенно легко идет на свету:
СН4 + Ch -> СНзС! -> CH2CI2 -> CHCh СС14;
а
I
СН3-СН2-СН—СН3 + С12 --► СНз-СНг-С—СН3 ---
СН3 QI ci CI СНз
-- СН3—CH —С—СН3 ---СНз-С—С—СНз
II II
CI сн3 CI сн3
Замещение идет сначала у третичного атома С, затем - у вторичного,
в последнюю очередь у первичного атома углерода.
2. Нитрование - парофазное (реакция Коновалова);
СН4 + НМОз(разб) -> CH3NO2 + ГЪО. (140°С, Р)
3. Крекинг а) высших алканов -
сажа, алкены
CeHis—гСдНв + С4Н10;
C8His-> СзНб + С5Н12 ;
4. Окисление
б) метана - низшие алканы,
алкин:
2СН.1 -> С2Н2 + ЗН2; (1500° С)
СН4->С + 2Н,. (1000°С)
кислородом: С?Н, + 7/20, -> 2СОз + ЗНзО:
концентрированной “дымящен”НЬЮз:
С15Нз2 + 92HNO.3-+ 15СОг + 92NO2 + 62Н3О.
5. Каталитическое окисление алканов, в зависимости от условий, дает
альдегиды, кислоты, спирты:
СН4 + О2 -> СНзО + НзО; (500°С,10 атм, кат)
2С4Н10 + 5О3 -> 4СНзСООН + 2НгО; СНт+ 1/202-»СНзОН. 6. Изомеризация и-алканов: (MnO, 1) (400 °C, 100 атм)
СНз-СНз СНз-СНз СНз-СН(СНз)-СНз
78
7. Конверсия метана
<Я1|+ НгО »СО + 31Ь; (ММ) Ч’,М/Л1/О.)
Clh + СО' -> 2t’O + 2lh. (КОО "C.Ni/ЛЬО»)
Цнклоалкппы одноядерные насыщенные циклические углеводоро-
ды. Они содержат цикл из 3,4, 5,6 и более атомов углерода; возможно
налично одной или нескольких боковых цепей. Циклоалканы с пяги-
и HiecTH'iJicHHi.iMii циклами содержатся в нефти, для них принято на-
звание нафтены.
Формула гомологического ряда циклоалканов - СЛЦ» (и > 3). 'Гии
гибридизации атома углерода - sp3.
Изомерия: 1) структурная, обусловлена размером цикла, строением и
положением боковой цепи;
2) пространственная (цис-,транс-), обусловлена невозможностью вра-
щения заместителей вокруг связей -С-С- цикла.
Для циклогексана цикл - неплоский, устойчивый, может существовать
в двух основных конформациях - кресла и ванны, из которых более
устойчива конформация кресла.
Все циклоалканы - бесцветные, малорастворимые в воде, горючие
вещества. При Т = 20 °C СзНб, СзНб - газы, CsHe, CeHiz- жидкости,
высшие циклоалканы - твердые вещества.
Название циклоалканов: - цифры (местоположение) - алкилы - цикло-
алкан:
Н2С-СН2
Н2С
циклопропан.
Н2С—СН,
I I
Н2С—CHj
циклобутан,
СН,
сн3
транс-1,2-
диметил-
Н3С СН3
цис-1,2-
диметил-
циклопропан, циклопропан.
Способы получения.
1. Общим способом получения циклоалканов и их производных яв-
ляется действие металлов на дигалоидпроизводные алканов:
BrCH2CH2CH2Br + Zn —- Н2С—CHj + ZnBr2
2. Циклогексан и его производные получают гидрированием бензола
и его производных:
С«Нб +ЗН2->СбН|2. ( 150-200 °C, 20 атм, Ni)
Химические свойства
Малые циклы (Сз-Сг), вследствие специфики строения, проявляют
склонность к реакциям присоединения с разрывом цикла и образо-
ванием алканов и их производных. Циклы с большим числом звеньев
более склонны к реакциям замещения, напоминая этим алканы.
79
I. Малые никлы прпсосдппяют галогены, иодород, i яло!сноводоролы
с образованием соответствующих продуктов
। Br; > BrClbCIbX IbBr;
НгС -СН2 ц2 _> cihClbCIh;
Н2С + IIBr-rClhClbCIhBr.
Реакции присоединения протекают легко с Cilk и с ('.ЛЬ (при нагре-
вании на никелевом катализаторе); С5Н10, Cdliz и высшие циклоалка-
ны с галогеноводородами не реагируют, с галогенами дают циклога-
логензамещенные продукты, а при нагревании с водородом идет не
присоединение а дегидрирование (см. далее).
2. При действии галогенов на CsHio, CcHiz и другие высшие циклоал-
каны не происходит разрыва цикла, а образуются галогензамещенные
циклоалканы:
3. Нагревание циклогексана приводит к его дегидрированию с обра-
зованием бензола:
СбНп —> СбНс +ЗНг.
4. При окислении циклоалканов происходит разрыв цикла и образу-
ются двухосновные кислоты с тем же числом атомов углерода:
цикло-Ctllt + [О] -> НООС-СН2СН2-СООН. ( КМпОд.НгБОд)
5 Нитрование циклоалканов, имеющих пяти- и шестичленные циклы,
протекает в тех же условиях, что и ни трование алканов.
Алкены
Алкены - это ненасыщенные углеводороды, молекулы которых содер-
жат одну двойную С-С связь.
СЛН2„ - формула гомологического ряда. Гибридизация атома углеро-
да в молекуле - sp2.
Изомерия - структурная и пространственная.
Название Формула Т кип,°C р, г / см3
Этилен СН2=СН2 -105 0,610*
Пропен СНз-СН=СН2 -47,8 0,610*
Бутен-1 СНз-СНг-СН^СНз -6,3 0,629*
Бутен-2 СНз СН=СН-СНз цис-изомер транс-изомер +3,5 +0,9 0,639* 0,634*
Изобутен СНз-С(СНз)=СН2 -140 0,594*
* При температуре кипения.
Первые три члена ряда Сг-Сд представляют собой газообразные ве-
щества, от Сз до Ci? - жидкости, С is и выше - твердые вещества.
80
Помснклазура
CH.-CH- CH=CH2;
I
CH.
1 -Мстил-1 -этилэтилсн;
Wi’anMi-мстнлэтил этилен.
Выбирается
старшинству
piimioiiiijti.iisin
СП. ( 1Ь СП СП СП.
( /МШ-МСТИЛТIИ ЛЭ I идеи
элементарное звено этилен - радикалы называются по
с указанием положения.
- систематическая
СНз-СН2-С=СН-СНз
I
СНз
З-метил-пентен-2
Нумеруется самая длинная цепь', название - цифры - алкилы - цепь -
ей- - цифры.
Способы получения.
1 Крекинг и пиролиз нефти.
2. Дегидратация спиртов:
СН3СН2ОН -> СН2=СН2 + НзО. (IhSO., 180°С или АИОз, 400°С)
При дегидратации вторичных спиртов атом Н отщепляется от того
атома С, который беднее водородом (правилоЗайцева).
3. Дегалогенирование производных алканов:
СНзСНВг-СНВгСНз + Zn -> СНзСН=СНСНз + ZnBr2.
4. Дегидрогалогенирование алкилгалогенидов при их нагревании со
спиртовыми растворами щелочей происходит по правилу Зайцева:
сн,-сн-сн- сн, -к—. сн,-с=сн-сн, + квг.
3 I । С2Н5ОН 3 ।
СН3 Вг сн3
Химические свойства.
Характерными для алкенов являются реакции присоединения.
1 Гидрирование алкенов'.
R-CH=CH2 + Н2 -» R-CH2-CH3 (Pd, Ni, 100°С)
2. Галогенирование алкенов:
СН2=СНад + Одо—> СНС1СН.С1; (20°С)
СН2=СН2 + Вг2 -> ВгСНз-СН2 Вг; (в растворителе CCh)
СН2=СН2 + 2Вгз + Н2О -> НОСНзСНзВг + ВгСН2СН2Вг + НВг.
3. Гидрогалогенирование алкенов
СНз-СН=СН2 + НВт -> СНз-СНВг-СНз.
Правило Марковникова: при присоединении галогеноводорода НХ к
ненасыщенному соединению, атом водорода присоединяется к тому из
атомов С, который уже соединен с большим числом атомов водорода.
Пероксидный эффект. Свободнорадикальное присоединение не под-
чиняется правилу Марковникова:
СНз-СН=СН2 + НВг -> СНз-СН2СН2Вг. (в Н2О2)
81
II 3549
1. Присоединение концс|прпроп:шиой серной khciioim по двойной
связи протекает аналогично присоединению НХ, при лом правило
Марковнпкова выполняется. Продукзы реакции кислые тфлры сер-
ной кислоты:
С1Ъ=С112+ H2SO4 >1 Нз CH; OSO2OH. (2(H)
Гидролиз зтнлгпдросульфата даст ппловый спирт:
СНз-СП- )SO?O11 + 112(.)->С11з С Ih ОН I 4/SO4. (50 70"С)
5. Гидратация алкенов:
СН2=СН2 + Н2О -> СН3-СН2-ОН. (1ГРО4, 300-С, 60 атм, кат.)
6. Алкены легко присоединяют озон, образуя циклические перекиси
озониды:
СН2=СН2 + о3
(20 °C , ссц )
Озониды гидролизуются с образованием двух карбонильных соедине-
ний:
СН2ОООСН2 + Н2О -> НСНО + НСНО + Н2О2.
Озонолиз может быть использован для определения положения
двойной связи в молекуле.
7. Реакции алкилирования - присоединение алканов по двойной связи
алкена. Наиболее легко реагируют алканы с третичным атомом угле-
рода в молекуле. Катализаторы - AlCb, HF, BF3:
CH, СН, н
I I I
CH3— C— H + СН2=С—СНз СНз-С—СНз-С-СНз
I I II
СНз СНз СНз СНз
Действие окислителей.
1. Мягкое действие щелочного раствора KMnCh на алкены приводит к
образованию двухатомных спиртов - гликолей:
СН2=СН2 + [О] + НгО -» НОСН2СН2ОН. (КМпО4, НгО)
Действие сильных окислителей - KMnO<, H2SO4, К2СГ2О7, H2SO4 -
приводит к расщеплению молекулы по месту двойной связи:
СНз-СН=СН2 + [О] -> СНз СООН + СО2;
СНз-СН=СН-СНз + [О] -> 2СНз-СООН;
СН3 — С=СН2 +[О] —► сн3-с=о + со2.
сн3 сн3
По продуктам окисления можно определить место положения двой-
ной связи в молекуле и строение углеродного скелета.
2. Каталитическое окисление кислородом приводит к образованию а-
оксидов алкенов:
СН2=СН2+1/2О2 —* Н2С^рН2 . (Ад,300°С)
О
82
Оксид >гилспа легко реагирует с подои, давая паи-1,2-диол:
Н2С.рН2 + ц7о - - НОСН2 СП2ОН .
О
3. При сжигании на воздухе алкены образуют воду и ( ()>
CHj-CH=CH2 + 9/20? > ЗСОг + 311 О.
4. Алкены могут вступать в реакции замещения.
Наиболее легко замещается водород у атома углерода в а-иоложсиии
по отношению к двойной связи (аллильное замещение):
а
Н-СНз СН=СН2 + Ch -> С1СН2-СН=СН2 + IICI; (hv)
—’ сн2-с=сн2 ; (85-90%)
СН3-С=СН2 + Cl2 CI СНз
снз ---• СНз-CCI—СН2С1 (10-15%)
СНз
5. Реакции полимеризации заключаются в присоединении друг к дру-
гу большого числа одинаковых молекул (мономеров):
«СН2=СН2 -> (-СН2-СН2-К.
Сополимеризация - совместная полимеризация смеси различных мо-
номеров.
тсн2 = сн-сн=сн2+пс6н5-сн=сн2 — -сн2-сн-сн2-сн=снь-сн2-сн-
СвН5 СвН5
Реакции полимеризации идут за счет присоединения к кратным связям
или за счет раскрытия циклов. Особое значение имеет полимеризация
алкенов, при которой получаются разнообразные практически значи-
мые материалы.
Стереоспецифическая полимеризация - это полимеризация, при кото-
рой создается строго упорядоченная пространственная структура ли-
нейной цепи полимера. При полимеризации возникают ассимметрич-
ные атомы углерода. Их конфигурации могут чередоваться неупоря-
доченно и образуется полимер, который называется атактическим
полимером. Ниже приведена формула атактического полипропилена:
При стереоспецифической полимеризации возникают пространствен-
но упорядоченные структуры: синдиотактический полимер и изотак-
тический полимер. Особенностью синдиотактического полимера яв-
ляется упорядоченное пространственное расположение заместителей
л
83
Ниже прицелена формул:! синдиотактического полипропилена
Схема использования этилена в химическом синтезе:
84
ЛлК1|Д|1<Ч1Ы
Органические соединении, содержащие в углеродной цепи дне двой-
ные связи, называются диеновыми yi леподородами.
Углеводороды с открытой цепью называются алкадиенами а цикли-
ческие - Ц11КЛ0:1ЛК11ДНСШ1М11.
Алкадиены могут быть с изолированными двойными связями:
СН’=С11-СН2 -СИ=С1Ъ 1,4-нентадиси;
с сопряженными двойными связями:
СН:=СН-СН=СН2 1,3-бутадиси;
с кумулированными двойными связями:
СН2=:С=СН2 аллен.
Алкены с изолированными двойными связями не отличаются по сво-
им свойствам от моноалкенов. Алкены с кумулированными двойными
связями имеют два атома углерода в состоянии гибридизации sp2 и
один атом углерода в состоянии гибридизации sp. Две тг-электронные
орбитали направлены перпендикулярно друг другу. Химия соедине-
ний с кумулированными связями в курсе средней школы не рассмат-
ривается.
Алкадиены с сопряженными связями.
Формула гомологического ряда - С„1Ь„2. Изомерия - структурная,
положения двойной связи.
Номенклатура - систематическая.
Нумеруется самая длинная цепы, название - ци^ры - алкилы - цепь -
диен - цифры.
СНз=СН-СН=СН-СНз СН2=С(СНз)-СН=СН2.
пентадиен-1,3. 2-метилбутадиен-1,3
Природа химической связи определяет химические свойства сопря-
женных диенов. В молекуле сопряженных диенов атомы углерода на-
ходятся в состоянии гибридизации sp2 и лежат в одной плоскости
Молекулярная орбиталь состоит из четырех параллельных друг другу
я-орбиталей, перпендикулярных плоскости, в которой лежат ядра
атомов углерода.При взаимодействии подвижных л-электронных
облаков двух сопряженных связей возникает единое для четырех ато-
мов углерода л-электронное облако.Электроны не закреплены жестко
на определенных связях, а распределены (делокализованы) по всем
находящимся в сопряжении связям - простым и кратным. Три связи,
соединяющие атома углерода, являются ни истинно простыми, ни
истинно кратными. Более правильно изображать сопряженные двой-
ные связи следующим образом:
СН2—СН^СН—СН2
Способы получения.
1. Дегидрирование бутенов:
СНз-СН=СН-СНз -> СН2=СН-СН=СН2; (600°С,СггОз/ А1гОз)
СНз-СНг-СН=СНг -> СНг=СН-СН=СН3. (600°С,СггОз/ АБОз)
85
2. Из этилового спирта ( синтез С ВЛсбсдсна )
2CjHsOH >С1Ь=СН СП СНг.
3. Дегидрирование изопентана:
сн3-сн-сн2-сн3 - - сн2—с—сн =сн2.
I I
СН3 сн3
(4(Ю"С, ZnO, AhOi)
(550 °С.Сг7О:1/А12О1)
4, Отщепление НВг от 1,2-дибромциклопснтана:
ВгНС-СНВг
2КОН
СНз СН2ОН
+ 2КВГ
Химические свойства
Алкадиены с изолированными связями обладают такими же химиче-
скими свойствами, что и алкены.
В системе сопряженных связей два ненасыщенных центра ведут себя
как единое целое. Реакции присоединения к этим соединениям могут
протекать двояко - в концевые положения сопряженной системы 1,4 и
с образованием новой двойной связи между 2 и 3 атомами углерода
,^-присоединение) или по месту одной из двойных связей - (1,2-
присоединение).
1 .Присоединение галогенов
[—> СНгС! СН=СН-СН2С1;
СН2=СН-СН=СН2 + С12
L* СН2С1-СНС1-СН=СН2.
Циклопентадиен-1,3 присоединяет бром только в положения 1,4:
нс —сн
И \\
нс сн
Ч /
СН;,
НС=СН
Rr______ / \
вг2 -* ВгНС СНВ г .
чсн2
2. Присоединение водорода в зависимости от условий, может прохо-
дить либо в положения, либо в 1,4:
, СПз СН2-СН=СН2; (Pd)
СН2=СН-СН=СН2 + Нг —► I
СНз-СН=СН-СНэ. (СгНзОННМа)
3. Диеновый синтез - 1.4-присоединение алкена к сопряженным систе-
мам (реакция Дильса-Альдера):
СН-СН . СН;
// \\ + II
Ц,С СНг СН2
Реакция протекает при повышенной температуре и давлении, но если
двойная связь имеет активирующую группу (нитрильную, альдегид-
ную), то реакция протекает в мягких условиях.
4. Полимеризация диенов различного строения с сопряженными двой-
ными связями протекает за счет 1,4-присоединения:
л(СН2=СН-СН=СНг) -> ( СНг СН=СН CH2-)„ .
86
Длинны
Алкины - ненасыщенные углеводороды, содержащие и молекуле
только одну тройную связь. Cnlljn-j - формула гомологического ря-
да. Гибридизации атома углерода при тройной связи sp.
Изомерия - структурная, положения тройной связи.
Название углеводорода Формула Гкип,пС р, г / см3
Ацетилен(этин) С2Н2 -83,6 0,613
Пропин С3Н4 -23,3 0,671
Бутин -1 С«Н6 8,6 0,668
Бутин -2 27,2 0,693
Пентин -1 CsHs 39,7 0,695
Пентин -2 55,5 0,712
Гексин -1 CsHio 72 0,719
С5-С16- жидкости, высшие алкины - твердые вещества.
Названия наиболее часто встречающихся радикалов:
СН=С этинил, СН= С- СНз ~ пропаргил .
Номенклатура: - рациональная - систематическая
СН3-СН-СЕС—СНз
I
СНз
метилизопропилацетилен
Выбирается элементарное
звено - называются ради-
калы по старшинству .
4-метилпентин-2
Нумеруется самая длинная
цепь - название: цифры -
алкилы - цепь - ин - цифры.
Способы получения.
1 .Из дигалоидпроизводных алканов отщеплением галогеноводорода:
C2HSOH
С2Н5-СНВг-СНзВг + 2КОН ---►- СгНз-СЕСН + 2КВг + 2Н2О.
2 .Из алкилгалогенидов и ацетиленидов натрия и магния:
R-C=C-Na + I-СНз -> R -С=С-СНз + Nal;
HOC-MgBr + Вг-С2Н» -» НОС-СДЬ + MgBr2.
3 . Гидролиз карбида кальция:
СаС2 + 2Н2О -> С2Н? + Са(ОН)2.
4 . Высокотемпературный пиролиз легких или средних фракций неф-
ти или природного газа.
Химические свойстве
Для ацетилена и его гомологов, как для ненасыщенных соединений,
характерны реакции присоединения. Вместе с тем, специфика трой-
ной связи приводит к тому, что моноалкильные производные ацети-
лена способны участвовать в реакциях замещения.
87
Реакции присоединения
1. галогенов:
Br2 Вг2
НС =СН —* QIUr-CHBr -----► CHBr7 -CHBr?
2. - водорода:
Н2 Н2
НС=СН ► СН2 = СИ2 —-► СНз-СНэ
3. - галогеноводородов:
HCI HCI
НСЕСН ----► СН2 = СНС1 -► СНз-СНСЬ
4. - спиртов с образованием простых виниловых эфиров:
НС=СН + ROH —> h2c=ch-o-r .
5,- карбоновых кислот с образованием сложных эфиров:
НСеСН + RCOOH —> h2c=ch-o-co-r .
6 - альдегидов с образованием ненасыщенных спиртов:
НСеСН + R-CH=O---> HC=C-CH(OH)-R
НС=СН + 2R-CH=O--> R-CH(OH)-CbC-CH(OH)-R .
7. - циановодорода:
НС=СН + HCN---» CH2=CH-CN .
8. - воды, реакция Кучерова:
НСеСН + Н2О---> СН3-СН=О . (HgSCX, Н‘)
R-CeCH + Н2О--» R-СО-СНз (HgSO4, Н+)
Реакции замещения водорода в молекуле ацетилена и моноалкиль-
ных производных идут при действии аммиачных растворов азотно-
кислого серебра или однохлористой меди с образованием ацетиле-
нидов серебра или меди:
НСеСН + 2[Ag(NH3)2]OH -» AgCsCAg l + 4NH3 + 2Н2О .
Под действием сильных оснований - амидов щелочных металлов в
жидком аммиаке - протекает реакциия замещения водорода щелоч-
ным металлом с образованием ацетиленида:
R-C=CH + NaNH2 —- R--C=CH + NH3 .
Алкины вступают в реакции полимеризации, причем, в зависимости
от условий, получаются различные продукты:
2НОСН----> СН2=СН-С=СН , (CuCI, NH4CI, Н2О)
ЗНСеСН > С6Н6 (600 °C, СМо)
Алкины легко окисляются с разрывом тройной связи. Обесцвечива-
ние раствора КМпОг - качественная реакция на тройную связь.
88
< \ема псполь юппппя at<cIiiJU'Hsi.
Ch
итрахлорлап
Cl <11 CHCI2
И2О
t plIX JlOpi Г HJICII
CCb <HCI .
HC1
CHj-CHOH CII2-CH0
H2O
Ni(C0)4
HCN
12-3549
89
Л|№111>|
Арены или ароматические соединении углеводороды, содержащие
кольцевую систему атомов углерода с делокализованными л- элек-
тронами. Выделяют мопоцпкличсскис арены:
СН,
бензол, толуол, о-ксилол, кумол;
полициклические арены с изолированными ядрами:
бифенил, дифенилметан, стильбен;
полициклические арены с конденсированными ядрами:
нафталин, антрацен.
Производные бензола, в которых атомы водорода замещены на ал-
кильный радикал, называют гомологами бензола. Общая формула
таких соединений СлНэ«.б
Углеводородными заместителями могут быть также ненасыщенные
радикалы - алкенильные, алкинильные.
Электронная природа ароматичности заключается в том,что каждый
атом С в кольце находится в состоянии гибридизации sp1. Помимо
трех о-связей (две о-связи С-С и одна о-связь С-Н), в системе имеется
шесть л-элекгронов, равномерно распределенных по всему бензоль-
ному ядру и образующих обшее электронное облако, изображаемое в
молекуле кружочком.
Согласно правилу Хюккеля. ароматической устойчивостью обладают
сопряженные циклические полиеновые системы с числом ^.-электронов
4п+2, где п= 0,1,2,3 и т.д. Следовательно, ароматичностью обладают
системы с 2, 6, 10, 14 и т.д. л- электронами (см. нафталин, антрацен).
Однозамещенные бензолы изомеров не имеют. Дизамещенные бензо-
лы существуют в виде трех изомеров, отличающихся взаимным рас-
положением заместителей, их положение указывают с помощью при-
ставок орто-, мета-, пара- или обозначают цифрами:
орто- (1,2-),
мета- (1,3-), пара- (1,4-).
90
В молекулах ''бензоидных" yi лсподородоп различаю! лае части: бен-
зольное ядро II боковую цепь
Изомерии них соединении определяется строением заместителей и их
расположением.
Название Формула / р, i/cm1
Бензол Cello 80,1 0,878
Толуол CJhClh 110,0 0,867
о-Ксилол СДЦСНф 144 0,880
Кумол СбП5СН(СПэ)2 152 0,862
/ррядс-Стпльбен СбН5СН=СПСб115 307 -
Бифенил СбН5СбН5 254 -
Дифенилметан CoHsCHCeHs 262
Нафталин CioHs 218 -
Антрацен С12Н10 340 -
Общее название ароматических радикалов - арильг. -С«Н4 фенилен
(о-, м-, п-), СНз-СбН4— толил (о-, м-, п-)_ CeHs- фенил.
Номенклатура ароматических соединений
Названия углеводородов ряда бензола составляются из названий ра-
дикалов боковых цепей с добавлением окончания бензол. Кроме ука-
занных выше соединений, перечислим другие важные соединения:
Формула тривиальное название систематическое название
СбНзЫНзС! Анилиний хлорид Фениламмоний хлорид
СеНзСОгН Бензойная кислота Бензолкарбоновая кислота
С6Н5СО2С2Н5 Этилбензоат Этиловый эфир бензол- карбоновой кислоты
CeHsCOCI . Бензоилхлорид Бензолкарбонилхлорид
CoHsCONH? Бензамид Бензолкарбоксамид
CoHsCN Бензонитрил Бензолкарбонитрил
СбН5СНО Бензальдегид Бензолкарбальдегид
СсНзСОСТЬ Ацетофенон Ацетофенон
СбНзОН Фенол Фенол
CoHsNHj Анилин Фениламин
СбНзОСНз Анизол Метоксибензол
При построении названия ароматического соединения с несколькими
заместителями в бензольном кольце, атом бензольного кольца, к ко-
торому присоединен заместитель, находящийся ближе других к началу
в приведенном выше списке, получает номер 1. Остальные атомы уг-
12- 91
лсрода n\Mepvioic>i i;ik. чгобы номер нос целующих замс< iniemit бы»
минимален.
COOH
З-гцдрокснбспзол- 2-ампнобс1Пол- 1-бром-2-иизро 3-
карбоновая кислота, карбальдегид, хлорбензол
Способы получения.
1. Фракционная перегонка каменноугольной смолы.
2. Тримеризация ацетилена.
3. Сплавление щелочных солей ароматических кислот со щелочью:
+ NaOH
Na2CO3 .
4. Каталитическое дегидрирование циклогексана и его производных
(катализатор - палладиевая чернь, 300°С ):
5. Каталитическая дегидроциклизация алканов: из гексана получается
бензол, из гептана - толуол, из октана - этилбензол и ксилолы (ката-
лизатор - платинированный уголь, 500°С, Р):
/СН2 СН2-
Иг^С^-сНз
+ 4Н2.
6. Синтез Вюрца-Фиттига, в котором смесь ароматического галоге-
нопроизводного и алкилгалогенида обрабатывают натрием:
CeHsBr + С2Н5ВГ-> GH5-C2H5 + 2NaBr.
7. Алкилирование ароматических углеводородов галогенопроизвод-
ными и олефинами (реакция Фриделя-Крафтса):
+ СН3-СН2С1 —-
СНгСНз
* на. (А1С13)
8. Восстановление ароматических кетонов:
Zn, HCI
92
У. Реакция Гриньяра Вюрца: 1ПН11МодсЙ<*1 вис м<я iiiiHopi апичсскою
соединения с алкилгало) спидом:
R-CI —
з McjCI, .
Химические свойства.
Специфика строения ароматических соединений приводи! к тому, что
при явной ненасыщенности состава (Colк) бензол проявляет свойства,
характерные для насыщенных соединений: склонность к реакциям за-
мещения, устойчивость к действию окислителей.
Наиболее характерны для ароматических соединений реакции элек-
трофильного замещения, хотя известны реакции нуклеофильного за-
мещения н радикальные реакции.
Реакции электрофильного замещения.
1. Нитрование:
Ar-H + HONO2 -» Ar-NCh + Н2О;
2. Галогенирование в ядро:
СеНб + Ch -> CeHsCI + НС1;
3. Сульфирование:
(bhSChbouii))
(AlCh, А1Вгз, FeCh)
н2о;
4. Алкилирование действием алкилгалогенидов (см. способы получе-
ния) или алкенов в присутствии катализаторов - ВРз или Н3РО4:
* сн2=сн2 —►
* сн2=сн—снэ —-
сн2-снз;
5. Ацилирование в присутствии А1С1з
+ R-С=О —-
I
а
HCI .
Реакции присоединения
1. Водорода в присутствии катализаторов - Ni (150°С), Pt (50°С):
2. Хлора на свету:
на
с
+ зс12 —> ciHc сна
С1НСХ ,СНС1
с
на
Реакции окисления. Такие окислители, как HNO3. КгСггО? + H2SO4,
93
раствор KMnlh 11>(Ъ при обычных условиях ив (гикш нс pciiciriyioi
При дснпвнп О’ на Вешня и при-
сутсгвин V’Os. получас гея
малеиновый ангидрид:
Бензол горит в кислороде коптя-
щим пламенем с образованием
При Остннтн окне lume/ieii на
’отологи Гнчпоча окт пяется бо-
ковая цепь:
углекислого газа, воды и углерода:
СбНе + 11/202 -> 4С0г + ЗНгО + 2С.
Реакции замещения в боковой цепи
При пропускании хлора в кипящий толуол-и ультрафиолетовом облу-
чении реакционной смеси замещение идет в боковую цепь:
Ориентация при электрофильном замещении в бензольном ядре.
При введении в бензольное кольцо какого-либо заместителя вместо
атома водорода реакционная способность получившегося соединения
отличается от реакционной способности бензола.При взаимодействии
с электрофильными частицами, такими, например, как ион NOz+ .за-
местители, подающие электроны в ядро, ускоряют реакцию, а замес-
тители, оттягивающие электроны, замедляют ее. Заместители, подаю-
щие электроны, называются активирующими, а заместители, оттяги-
вающие электроны, - дезактивирующими. Активирующие заместите-
ли увеличивают электронную плотность в бензольном кольце в орто-
и лара-положениях, где и идет замещение. Такие заместители назы-
ваются заместителями первого рода или орто-лара-ориентантами.
Дезактивирующие заместители оттягивают электроны из орто- и
лара-положений сильнее, чем из .шала-положения. В этом случае за-
мещение идет в пета-положение. Такие заместители называются за-
местителями второгороОа или .неша-ориентантами,
Оргло-лара-ориентанты: -R, -NHz, -ОН, -OR, -NHR, -NRz, галогены.
Мета-ориентанты: -NOz, -CN, -СНО, -СООН, -£ОзН, -C(O)R.
Исключение составляют галогены: они дезактивируют кольцо, но
являются орто-ларл-ориентантами.
Если в бензольном кольце одновременно присутствуют несколько
заместителей, то необходимо рассматривать их суммарное воздей-
ствие на реакционную способность соединения.
94
Схема испопьчопания (iciiiona и химическом сишсзс.
95
IJO-'IIIIUIK.'III'ICCKIIC lipOMll'l ll'K-CKIIC VI ЛС11ОДО|Ю/1Ы
Углеродный скелет препон с конденсированными ядрами состоит из
двух (нафталин) или более бензольных ядер. В молекуле нафталина,
как н в молекуле бензола, нет двойных связей, хотя часто используют-
ся формулы, в которых пять двойных связей чередуются с простыми.
Ароматичность обусловлена сопряжением 10 тс-тлек тронов.
В молекуле нафталина нс все атомы углерода равноценны: различают
а-атомы углерода (положения 1,4 ,5, 8) и 0-атомы (положения 2, 3, 6.
7).
У однозамещенных нафталинов известны 2 изомера: а- и 0-изомеры.
Положения двух и более заместителей обозначают цифрами. По хи-
мическим свойствам нафталин напоминает бензол, однако легче бен-
зола вступает в реакции присоединения.
Реакции замещения (преимущественно идут в а-положения).
1. Сульфирование идет с образованием а- или 0-нафталинсульфо-
кислоты:
H2so4
о*"
160 С
+ HjO;
+ НгО.
2. Нитрование с образованием
а-нитронафталина
3. Галогенирование - с образова-
нием а-бромнафталина
Реакции присоединения..
Нафталин легче, чем бензол, всту-
пает в реакцию с водородом, при-
чем сначала гидрируется одно
ядро, а затем второе:
Реакции окисления.
Нафталин окисляется легче, чем
бензол, при этом одно из ядер раз-
рушается и а- углероды превра-
щаются в карбоксильные группы:
тетралин декалин.
96
фталевая кислота.
Схема inaiiMoiipenpaiiiciiiiii v леподородоп
13-3549
97
Спирты
Спирты - органические соединения, содержащие функциональную
гидроксильную группу (гидроксогрунпу) ОН, связанную с углеводо-
родным радикалом.
Насыщенные ациклические спирты называются алканолами, ненасы-
щенные - алкенилами и алкинолами Фенолами называют соединения,
у которых группа -ОН связана с ароматическим ядром. /Ароматиче-
ские спирты - соединения, у которых гидроксильная группа находится
в боковой цепи. По числу групп -ОН, входящих в молекулу, спирты
делятся на одноатомные, двухатомные, трехатомные и т.д. Органиче-
ские соединения, содержащие у одного атома углерода несколько
групп -ОН, крайне неустойчивы, самопроизвольно разлагаются с
отщеплением воды и образованием другого класса соединений. Не
может гидроксил находиться и при кратной углерод-углеродной свя-
зи; такие соединения крайне неустойчивы и легко изомеризуются.
Одноатомные спирты.
Изомерия - структурная, положения функциональной группы.
По положению гидроксила в молекуле различают первичные
R-CH2-OH, вторичные R-CH(OH)-R’ и третичные R-(R”)C(OH)-R’
спирты.
Название спирта Формула Тки„, °C р, г/см3
Метиловый СНэОН 64,7 0,792
Этиловый С2Н5ОН 78,3 0,789
Пропиловый СзНтОН 92,7 0,804
Аллиловый СН2=СНСНгОН 96,7 0,854
Циклогексанол СбНпОН 161,5 0,962
Бензиловый СбНзСНзОН 205 1,046
Ci - Си - жидкости, от C12 и выше - твердые вещества.
У низших спиртов проявляется особый тип межмолекулярного вза-
имодействия - водородная связь, поэтому молекулы спиртов ассоции-
рованы (связаны друг с другом), при этом существенно уменьшается
летучесть спирта.
Растворимость спиртов в воде зависит от длины углеводородного
радикала: чем он длиннее, тем растворимость ниже а также от числа
групп -ОН в молекуле.
Номенклатура: - рациональная - систематическая
CfiHs - сн--сн2- сн= сн2
он
аллилфенилкарбинол
Выбирается элементарное зве-
но карбинол - называются заме-
стители по старшинству.
1 -фенилбутен-3-ол-1
Нумеруется цепь, включая С-функ-
ции, название: цифры - радикалы
- цепь - ол - цифры
98
Сщ><ооы получения
1 Гидратация алкенов в кислой среде Присоединение идет ио право
.чу Марковнпкова:
С1Ь=СП С1Ь +1ПО >С1ЬСН(ОП)( JIi. (IbSOi)
2. Гидролиз галогснпронзводных:
R X + НОН -> R ОН -I- ИХ. (в щелочной или кислой средах)
3. Восстановление карбонильных соединений.
СНзСНО + 2[Н] -> СПзСНгОН; (Нг/Ni, LiAIJh)
СНзСОСНз + 2[Н] ->СНзСН(ОН)СНз. (Hz/Ni, LiAlH*)
4. Взаимодействие альдегидов и кетонов с реактивом Гриньяра:
Н2О
Н2С=О + R—MgCI —- R—CH2-OMgCI —* RCH2-OH + MgOHCi;
сн3 сн3
I н20 1
СН,-С=О tCH3-MgO —►СНз-С—oMgO СИ—С —он + MgOHCi.
к к I*
5. Спиртовое брожение углеводов:
СеНиОб -> 2С2Н5ОН + 2COz.
Химические свойства.
Связи углерод-кислород и кислород-водород в молекуле спирта по-
ляризованы, причем отрицательным концом диполей является кисло-
род, а на атомах водорода и углерода имеются частичные положи-
тельные заряды. Поэтому спирты участвуют в реакциях, в ходе кото-
рых разрываются либо связи С-О, либо О-Н.
1. Взаимодействие со щелочными металлами с образованием алкого-
лятов:
2CzHsOH + 2Na -> 2CzHsONa + Hz.
Алкоголяты легко гидролизуются водой (как соли сильного основа-
ния и очень слабой кислоты):
CzHsONa + HzO -> С2Н5ОН + NaOH.
2. Образование простых эфиров:
2С2Н5ОН —> С2Н5ОС2Н5 + Н2О. (H2SO4 конц)
3. Образование сложных эфиров:
а) минеральных кислот:
С2Н5ОН + HOSO3H -> C2H5OSO3H + Н2О;
б) карбоновых кислот:
R-%H + R—ОН R~C^r + Н2О. ( H2so4 )
4. Замещение гидроксильной группы галогеном:
R-OH + НХ <-----> R-X + Н2О ; (X - галоген)
3R-OH + ЗРС1з---> 3R-C1 + НзРОз.
5. Дегидратация спиртов - внутримолекулярная - алкены,
-межмолекулярная- простые эфиры:
13'
99
о о
H;SO4,170C Н2БОл , 140 С
СН.. -СН; --------- CHj-CHjOH - ► CHjCH/JCH/A
А!2Оэ , 350°С Al а . 2S0 'С
6. Спирты окисляются до альдегиде», кетонов, кислот, причем пер-
вичные и вторичные спирты окисляются легче третичных:
(О) (О]
СН3СН2ОН ----- СНз-С-Н ------» СНз-С-ОН
II II
СНз-СН-СНз ---* СНз-С-СНз
А п
ОН о
циклогексанол циклогексанон
Окисление первичных и вторичных спиртов до альдегидов и кетонов
осуществляется с помощью хромовой смеси. Окисление третичных
спиртов идет в жестких условиях с разрывом связи С-С и образовани-
ем кислот и кетонов.
При сгорании спирты образуют СО? и НгО:
СН3СН2ОН + ЗОг -> 2СО2 + ЗНгО.
7. Каталитическое дегидрирование спиртов с образованием альдеги-
дов и кетонов:
СН3СН2ОН —* снз сх.н + Нг ;
(Си, 300° С)
СН3—НС—СНз
он
--► СН3- с—СНз + Н2 -
8. Атомы водорода в a-положении в молекулах спиртов, подобно
атомам водорода в углеводородах, способны замещаться галогенами
с образованием соединений со смешанными функциями - спиртовыми
и галогенидными.
Многоатомные спирты
Номенклатура.
Двухатомные спирты называют гликолями, или диолами, трехатом-
ные - глицеринами, или триолами. Положение гидроксильных групп
указывают цифрами:
СНз-СН—сн2он; НОСН2-СН2—сн2он; НОСН2----------СН—CHjOH.
ОН триметиленгиколь ОН
пропиленгликоль пропандиол-1,3 глицерин
пропандиол-1,2 пропантриол-1,2 3
100
Многотомные ышрты хороню растворимы в поде, плохо распюри-
мы к органических растворителях, имеют высокие температуры кипе-
ния (за счет молекулярной ассоциации).
Гликоли могут быть получены способами, аналогичными способам
получения одноатомных спиртов.
Этиленгликоль, HOCH2-CII2OII, бесцветная жидкость, 7'М1П = 197°С, с
водой смешивается во всех соотношениях. Получают его из этилена:
СН2-СН, + С12
СН2—СН2
2КОН
CH2CI-CH2CI HOCH2-CH2OH
СН2С1- СН2ОН
СН2=СН2 + НСЮ
НОСН2-СН2ОН.
Химические свойства гликолей и вообще многоатомных спиртов на-
поминают свойства одноатомных спиртов. Увеличение числа гидро-
ксильных групп усиливает кислотный характер, что проявляется в
способности моногоатомных спиртов образовывать алкоголяты не
только со щелочными металлами, но и с гидроксидами тяжелых ме-
таллов. Качественной реакцией на многоатомные спирты является
реакция с Си(ОН)г с образованием внутрикомплексного соединения -
алкоголята меди ( синего цвета):
сн,- он
2 I +
сн, - он
Си(ОН)2 —►
н
СН,- О_ о-сн,
I Ч.Си-' | + 2 Н2О -
сн2-о-' 4о—сн2
н
При действии на этиленгликоль НО или НВг замещается одна гид-
роксильная группа с образованием этиленгалогенгидрина, второй
гидроксил замещается под действием Pels:
HCI PCI5
HOCH2-CH,OH -----•> HOCH2-CH2CI ------ СЮН,—СН,С1
ГКО -POCJ,
Глицерин - трехатомный спирт, в обычных условиях вязкая гигро-
скопическая жидкость сладкого вкуса, 7л™ = 290°С. Смешивается с
водой во всех соотношениях. Входит в состав жиров.
Способы получения.
1. Из синтетических методов укажем схему превращения пропилена в
глицерин:
сн, сн,а СН2ОН
<5н сн сн нои
СН, 500°с сн, Hz° сн.
сн,он сн,он
СНОН NaOH снон
I ------” I
СН,С1 н2О сн,он
101
*-• I идролп! жиров ii масел (уравнение см. в разделе. Жиры.)
Но своим химическим свойстам глицерин подобен HiDieHninKonio
легко дает с гидроокисями тяжелых металлов пишераты: i идроксшп.-
ныс iруины обмениваются на галоген; образует простые и сложные
эфиры. Эфир глицерина и ачотной кислоты нитро! лиисрин, разло-
жение которого сильно экзотермическая реакция:
ch2-ono2
4 сн—0N02 —- 1ZC02 + 6N2 + 10H20 + 02.
сн2 - ono2
Глицерин применяют в медицине и пищевой промышленности.
Фенол
Фенолы - кислородсодержащие ароматические соединения, в молеку-
лах которых гидроксильная группа связана непосредственно с угле-
родным атомом бензольного ядра. По числу групп -ОН различают
одно-, двух- и многоатомные фенолы.
1,2-диокси- 1>диокси. гидрохинон
бензол , 1,4-диокси-
бензол бензол
ОН
пирогаллол.
1,2,3-триокси-
бензол
Изомерия положения группы ОН. Для двухатомных фенолов из-
вестны три изомера: орто- 2), мета- (1,3), пара- (1,4).
Фенол - белые, розовеющие на свету кристаллы с сильным запахом,
Кип - 182°С. Плохо растворим в воде.
Способы получения.
1. Сплавление бензолсульфоната натрия с NaOH с последующей об-
работкой фенолята натрия подкисленным водным раствором:
CcHiSOjNa + 2NaOH -> CeHsONa + NajSOs + НгО ,
CcHsONa + CO2 + H2O -x CtllsOH + NaHCOs.
2. Окисление кумола кислородом воздуха с последующим разложени-
ем гидроперекиси водой:
СПз СН, н о
СбН5-СН + О2 --*• СбН5-С-О-О-Н ——» СбН5-ОН + СНз-СО-СНз .
СН3 СПз
3. Гидролиз хлорбензола водой в присутствии солей меди:
102
CdhCI + IbO >Cf,lh()ll + IICI
Химические свойства фенола определяются специфичностью взаимо-
действия гидроксила и бензольного ядра,
В водном растворе фенол проявляет кислые свойства, диссоциируя по
уравнению:
CgHsOH == С^о” <• н+.
I. Взаимодействие как щелочных металлов , так и щелочей приводит к
образованию фенолятов.
2GHsOH + 2Na -> 2C6HsONa + НгТ ,
CsHsOH + NaOH -> CtHsONa + H2O .
2. Образование простых эфиров при взаимодействии фенолятов с га-
логеналкилами или галогенарилами:
C6H5ONa + CHjI —► С6Н6ОСН3 + №1.
C6HsONa + C6H5Br —• CgH^OCgHj + NaBr-
3. Образование сложных эфиров при действии на фенолы хлорангид-
ридов или ангидридов карбоновых кислот:
СбН5ОН +CI-C— СН3 —* CfeHs-O—с—СНз + HCI.
& о
4. Обмен гидроксила в молекуле фенола на хлор с образованием
хлорбензола идет только при действии PCls с небольшим выходом
5. Фенолы легче, чем арены, нитруются, сульфируются и галогениру-
ются. При этом группа -ОН направляет электрофильное замещение в
орто- и ндрд-положения. Так, при действии бромной воды выпадает
белый осадок трибромфенола (качественная реакция на фенол); при
действии хлора образуются орто- и лора-хлорфенолы:
он он он он
2,4,6 трибром- 4-хлорфенол
фенол
Концентрированная азотная кислота с фенолом образует 2,4,6-три-
нитрофенол (пикриновую кислоту); разбавленная азотная кислота при
комнатной температуре образует смесь орто- и лдро-мононитрофено-
лов.
6, Фенол легко гидрируется на Ni-катализаторе, образуя циклогекса-
нол:
СбН5ОН +ЗНз->СбНпОН.
7. Фенол с хлоридом железа (III) дает фиолетовое окрашивание, что
используется как качественная реакция на фенол.
103
Альдегиды. Кетоны
Альдегиды - класс органических соединений, содср-
жащнх функциональную карбонильную группу I R-C-H
Кетоны - класс органических соединений, содержа- . о
щнх функциональную карбонильную группу, связан- I R_^_R.
ную с двумя углеводородными радикалами. •
В зависимости от радикала, связанного с карбонильной группой, кар-
бонильные соединения могут быть насыщенными, ненасыщенными,
ароматическими и гетероциклическими.
Изомерия альдегидов обусловлена строением углеводородного
радикала;
кетонов обусловлена строением углеводородного ради-
кала и положением функциональной трупы.
Общая формула насыщенных альдегидов и кетонов - СлЬЬлО.
НоменклатураИанбопее употребительны названия альдегидов, про-
изведенные от соответствующих карбоновых кислот: уксусный альде-
гид, (ацетальдегид) , муравьиный альдегид (формальдегид).
- рациональная
триметилуксусный
альдегид
Выбирается элемен-
тарное звено - уксус-
ный альдегид -
называются радикалы
по старшинству.
СН3
сн3- с-
СН3
- систематическая
2,2-диметилпропаналь
Выбирается самая длин-
ная цепь, атом углерода
альдегидной группы оп-
ределяет начало нуме-
рации - название - цифры -
заместители - цепь - аль.
О СНз
II 1
си3—с-сн-сн,
метилизопропилкетон
Выбирается элементар-
ное звено, называются
радикалы по старшинству
и окончание - кетон.
З-метилбутанон-2
Выбирается самая длинная
цепь, нумерация начинается
от ближайшего к кетонной
группе конца- название -
цифры - заместители - цепь -
он - цифры.
Название Формула 7кип,°С р, г/см3
Формальдегид Н-СНО -21 0,815
Ацетальдегид СНз-СНО 20,8 0,781
Акролеин СН2=СН-СНО 52,5 0,841
Бензальдегид СсНз-СНО 180 1,05
Ацетон СНз СО-СНз 56,1 0,791
Метилэтилкетон СН2-СО-СН2СН3 79,6 0,805
104
Способы получения.
1. Mj спиртов: при окислении первичные спирты дани альдпилы; вто-
ричные спирты кетоны. Окисли гель КЛ;Г*О»,П‘.
2. Декарбоксилирование солей кароононых кислоi общий способ
получения кетонов. Соли одноосновных кислот дают кетоны с <пкры-
той цепью, соли двухосновных кислот циклические кетоны, соли
муравьиной кислоты - альдегиды:
t
(СНзСОО)2Са ------- СН3-С-СН3 + СаСО3 ;
и
О
t
(СНзСОО)2Са + (НСОО)2Са --► 2СН3-С-Н + 2СаСО3 ;
О О
II
СН2-СН2-С-О
I /Са
СН2-СН2-С-О/
II
О
t СН2-СН2
--► I ^С=О + СаСО3.
CH2-OV
З. Гидролиз дигалогенпроизводных, содержащих оба атома галогена
при одном атоме углерода в присутствии щелочей или кислот:
2KOH
СНз-СНС12 ------1
-2KCI
СНз-СН(ОН)2 -----► СНз-СН=О.
J -Н20
2KOH
СНз-СОг-СНз
он
I
СНз-С-СНз
I
он
СНз-С-СНз
II
о
4. Гидратацией по Кучерову ацетиленовых углеводородов (альдегид
образуется из ацетилена, ацетон - из пропина):
Hg2*. H2SO4
HCSCH + HjO --------»- СН3-СН=О,
Hg2‘.H2SO.
СНз-CECH + HjO ---------► СН3-С-СН3.
О
5. Каталитическое окисление углеводородов кислородом ( альдегид
образуется из этилена, ацетон -- из кумола:
СНз СНз
I । н2о
СеНз-СН + Ог ->- СбН5-С-О-О-Н --► СеН6-ОН + СН3-СО-СН3
СН3 СНз
6. Гидроформилирование алкенов - взаимодействие алкенов различ-
ного строения с синтез-газом (смесью СО и водорода):
14-3549
105
со*н2
СН2=СН2-------► СНЛ-СН, сн=о,
со*н,
сн3 - сн= сн2---* снл - ад, - сн2 - сн= о + сн, сн сн-о
СИ,
Химические свойства.
Кабонпльная группа - одна из наиболее реакционноспособных функ-
циональных групп. Характерными являются реакции нуклеофильного
присоединения по двойной связи карбонильной группы, замещения
карбонильного кислорода, конденсации, окисления, полимеризации.
Реакции присоединения.
I. Водорода - восстановители LiAIH<, Нг/Ni:
Ni, t
R-CH=O + H2---> R-CH2-OH.
Кетоны в аналогичной реакции дают вторичные спирты.
2. Цианистого водорода с образованием оксинитрилов:
KCN
СНз-СН=О + H-CN ---» CH3-CH(CN)-OH
3. Гидросульфита натрия к альдегидам, метилкетонам и циклокетонам
с образованием бисульфитных соединений, которые хорошо кристал-
лизуются, нерастворимы в избытке бисульфита натрия, гидролизуют-
ся как в кислой, так и щелочной средах. Эта реакция используется для
очистки альдегидов и кетонов и выделения их из смесей
?Н3 о о
R- с + S—ONa-----» R—С— S—ONa ;
О Ан Ан О
4. Воду формальдегид легко присоединяет при комнатной температу-
ре, образуя гидрат формальдегида. Гидраты альдегидов не получены
в свободном состоянии, но гидраты галогензамещенных альдегидов и
кетонов можно выделить в свободном состоянии:
Н2С=0 + Н20о Н2С(ОН)2.
5. Спирты с альдегидами легко образуют полуацетали, а из полуаце-
талей при нагревании с избытком спирта в присутствии НС1 - полные
простые эфиры гидратных форм - ацетали:
/,° Н+ /°Н R'OH, Н+
R—С + R'OH R—HC ~
\ OR'
полуацеталь
OR'
R—НС +Н2О
OR'
ацеталь
106
6. Магиийорганнчсскпс соединения присоединяются к альдегидам с
образованием вторичного спирта, к кетонам третичного спирга.
н,о
R—СН=О + R'MgBr ► R СН ОМдВг ► R СИ ОН
Mq(OII)Br |
R’ R’
Реакции смещения карбонильного кислорода хлором осуществляются
с помощью PCIs:
уэ РС15
R—сх --------- R—С—Н + Р0С13.
Н il
Реакции конденсации.
1. Альдольная конденсация происходит при действии разбавленной
щелочи на альдегиды:
Т II Т Г
СН,-С+ Н—С—С —► Н,С—С—СН,-С альдегидоалко-
ц I II । || голь-альдоль
ОНО ОН О
При нагревании альдоль теряет воду, превращаясь в кротоновый аль-
дегид (бутен-2-аль) СНз-СН=СН-СН=О;
2. Альдегидов с кетонами:
-н,о
HjCzO + HCHj-C-CHa -- НОСН2-СН2-С-СНз -----► СН2=СН-С-СНз.
и и II
О 0 0
3. Кетонов с кетонами:
СН3-С-СН3 +СН3-С-СНэ ----•" СН3-С-СН=С-СНз .
и и и I
О О О СНз
Реакции окисления.
Альдегиды легко окисляются до карбоновых кислот.
Окисление слабыми окислителями - аммиачным раствором оксида
серебра и свежеосажденным раствором гидроксида меди с образова-
нием осадков: серебра - “реакция серебряного зеркала”; CuzO - крас-
ного цвета - являются качественными реакциями на альдегиды:
R-CHO + 2[Ag(NFh)iOn] -> 2Agi + 3NH3 + R-COONHt + Н2О;
СНз-СНО + 2Cu(OH)z -> СНзСООН +Cu2Oi + 2HzO.
Кетоны, в отличие от альдегидов, окисляются только сильными окис-
лителями в жестких условиях с разрывом углерод-углеродной связи и
образованием смеси разных продуктов (кислот и кетонов) с меньшим
числом атомов углерода, чем в исходном кетоне. В качестве окислите-
лей используют хромовую смесь или КМпОд:
14
107
CH3-C— CH2CHs3!2^|CH3COOH + СН3СООН ; [Oj
о I CH3CH2COOH + HCOOH—- CO2+ H2O .
3[O)
(CH3)2CHCOCH(CH3)2 —► (CHJjCHCOOH + (CH3)2O0.
Для ароматических альдегидов, в молекуле которых ист атома водо-
рода при а-углсродном атоме, характерна реакции Канниццаро
окисление одной молекулы за счет другой под действием конце» гри-
рованных щелочей с образованием кислоты и спирта:
2СбН5-СН=О + NaOH -► СбН5-СН2ОН + CtHs- COONa.
Алифатические альдегиды, содержащие атома водорода при а-угле-
родном атоме, в присутствии этилата алюминия образуют сложные
эфиры (реакция Тищенко):
Z-° А1( оСгНзЬ z,0
СН,— с' ----------- сн,— с'
5 4 ^ocyis-
Реакции полимеризации.
При реакциях полимеризации остатки молекул в полимере связы-
ваются через атом кислорода, в отличие от реакций конденсации, в
которых молекулы образуются за счет непосредственного соединения
атомов углерода. Полимеризация альдегидов катализируется мине-
ральными кислотами (H2SO4,HC1) при этом образуются незамкнутые
цепи различной длины или молекулы циклического полимера.
Н Н Н Н Н Н
III III
с=о + с=о + с=о — --с-о-с—0-с-о—-
III III
R R R R R R
Реакция полимеризации обратима, так как при нагревании полимеры
альдегида распадаются на исходные молекулы.
Карбоновые кислоты
Карбоновые кислоты - органические соединения, содержащие в моле-
куле функциональную карбоксильную группу -СООН.
По числу карбоксильных групп различают одноосновные, двухоснов-
ные и многоосновные кислоты. По характеру радикала, связанного с
карбоксильной группой, различают предельные, непредельные и аро-
матические карбоновые кислоты.
108
Одноосновные насыщенные карбоновые кисло im
Общин формула („1Ь„.,(()()П Изомерии прук|уриая, положения
функциональной । рунпы.
Номенклатура Для пиппнх членов ряда наиболее употреби! слоны
тривиальные названия: 11(0011 муравьиная кислоia, ('Н<( ООН
уксусная кислота, С,11/('ООН масляная кислота, C-iII/'OOH вале-
риановая кислота, СзПпСООП капроновая кислота.
По рациональной номенклатуре сложная кислота производное ук-
сусной кислоты или другой менее сложной кислоты.
По систематической номенклатуре название составляется с добавле-
нием окончания -опия кислота. Углеродный атом карбоксильной
группы определяет начало нумерации и входит в состав главной yiне-
родной цепи.
- рациональная
днмстилуксусная
кислота
3 2 1
с н3 — с н —с оо н
снэ
- системат ическая
2-метилпропановая
кислота
Радикалы - ацилы. Названия основных радикалов:
0 0 0 О II
Н—L СНД CHj и— СНзСН^-С— С6Н5- С—
формил ацетил пропионил бензоил
Названия солей: название ацила с изменением окончания ил на ат -
формиат, ацетат, пропионат, бензоат.
Название кислоты Формула Ткиг^С Константа диссоциа- ции в Н2О при 25°С
Муравьиная НСООН 100,7 1,77 10"4
Уксусная СНзСООН 118,1 1,7510-5
Хлоруксусная . ОСНгСООН 189 1,4010-з
Дихлоруксусная ChCHCOOH 194 510-2
Трихлоруксусная ChCCOOH 195 110-'
Пропионовая CtHsCOOH 141 1,310-5
Масляная СзН.СООП 163 1,510-5
Валериановая СзНоСООН 187 1,4-10-5
Капроновая C5HIICOOH 205,8 1,3210-5
Стеариновая С17Н35СООН 360 (разлагается)
Способы получения
1 Реакции окисления.
Окисление первичных спиртов и альдегидов приводит к образованию
кислот с тем же числом атомов углерода; кетонов - кислот с меньшим
числом атомов углерода, чем в исходной молекуле. Окисление алке-
нов сильными окислителями приводит к разрыву двойной связи и
образованию кислот различного строения
109
2. Гидролиз нитрилов в кислой или щелочной средах
R Clb ON з 2Ib() > R (lb ( ООП • Nib.
3. Гидролиз тригалогсноп]>оизподпых yi лсподородон ( жомы r.iruur
на у одного атома углерода) в щелочной среде:
R ОСЬ+ 3NaO!I >R ('ООН I 3Na('l • IhO
4. Карбоксилирование металлоорганических соединений:
ОСЬ IbO
R-MgBr-------> R-CO-O-MgBr------ > R-COOII ь Mg(OH)Br.
5. Карбонилирование алкенов - взаимодействие алкенов с СО и водой
при нагревании, под давлением, на Ni-катализаторе:
со, н2о //°
СН7===СН2 - - - -> СНз-CHj-C .
300 С, P.Ni он
6. Гидролиз жиров.
Химические свойства.
Карбоновые кислоты в воде диссоциируют с образованием карбокси-
лат-иона и протона:
На силу кислот (легкость отщепления протона) оказывает влияние
радикал, связанный с карбоксильной группой. Введение в радикал,
особенно в a-положение, групп, оттягивающих на себя электронную
плотность, усиливает кислотные свойства. В таблице приведены зна-
чения констант диссоциации подтверждающие сказанное. Введение в
радикал двойной связи в со положения повышает силу кислот. Аро-
матические кислоты сильнее алифатических вследствие влияния бен-
зольного ядра на карбоксильную группу.
Для кислот наиболее характерны реакции, сопровождающиеся разры-
вом связи О-Н и замещением -ОН. Для другой части молекулы воз-
можны реакции, обусловленные ее структурой.
1. Карбоновые кислоты реагируют с активными металлами, основа-
ниями, основными оксидами, образуя соли:
2RCOOH + 2Na -> 2RCOONa + H2t ;
2RCOOH + Na2O -> 2RCOONa + Н2О ;
RCOOH + NaOH -> RCOONa + H2O ;
Соли карбоновых кислот, как соли сильных оснований и слабых кис-
лот, легко гидролизуются; при этом их водные растворы дают щелоч-
ную реакцию.
ПО
2. Электролиз иодных растворов солей карбоновых кислот припилит к
образованию углеводорода н выделению СО? и 1Ь:
2RCOONn + 2IUO > R R + 2C(h t lb । ZNaOll.
3. Замещением гидроксильной группы другими группами получают
функциональные производные кислот.
Хлорангндрнды действием па кислоту I’Cl.i или I’C'Is:
О Q >
R-С. т РО5-► R-cf + РОС13 ; 3R-Cf + ра3—3R-C<с * н3ро3;
UM \-zi он
Сложные эфиры - нагреванием кислот со спиртами и ирисутствии
концентрированной H2SO4:
/Р H2SO4
R-%H+ H0R r-C^OR+ H*0;
Амиды - действием аммиака на галогенангидриды кислот, сухой
перегонкой аммониевых солей:
D // /Г
Ангидриды карбоновых кислот получают взаимодействием хлоран-
гидрида кислоты и натриевой соли органической кислоты
Характерным для функциональных производных кислот является то,
что при их гидролизе образуются кислоты:
R-CO-X + Н2О -> R-CO-OH + НХ.
4. Кислоты восстанавливаются до первичных спиртов под действием
L1AIH4:
RCOOH + 4[Н] -> RCH2OH + Н2О.
Йодистый водород восстанавливает их в углеводороды:
СНз-СООН + 6HI СНз-СНз + 2Н2О + 31г.
5. Насыщенные кислоты с нормальной углеродной цепью окисляются
трудно. Кислоты устойчивы к действию концентрированных мине-
ральных кислот Исключение составляет НСООН, которая под дей-
ствием концентрированной H2SO4 первращается в оксид углерода (II):
НСООН -» СО + Н2О (H2SO4 конц).
Кислоты с третичным атомом углерода дают при окислении оксикис-
лоты:
(СНз)гСНСООН + [О] (СНз)?С(ОН)СООН
В кислороде все кислоты сгорают с образованием СО2 и Н2О:
111
CHiCOOH + 20? -> 2СОг + ZIHO.
6. Водородные атомы н «-положении к карбоксильной i руине лег ко
замещаются на атомы галок сна в присутствии красного фосфора:
1’и.
CHj-CH.’-COOII + Вг?---->CIh-CHBr гоон + НВг
7. При нагревании солей карбоновых кислот со щелочами происходит
декарбоксилирование с образованием углеводорода:
CHjCOONa + NaOH-> СИ«+ NazCCh,
+ NaOH —-
+ Na^Oj .
Непредельные одноосновные кислоты — это соединения, которые со-
держат в радикале, связанном с карбоксильной группой, одну или
несколько кратных связей.
Изомерия - структурная, положения кратной связи в углеродной цепи;
цис- транс.
Способы получения.
1. Дегидрогалогенирование галогензамещенных кислот:
КОН,С2Н5ОН
СНзСН2СНС1СООН 1------------► СНзСН=СНСООН.
— HCI кротоновая
кислота
CH3CHCICH2COOH J
2. Дегидратация оксикислот:
-Н2О
HOCHjCHjCOOH -----► СНгСНСООН.
акриловая
кислота
3. Гидролиз нитрилов, получаемых из галогеналкенов:
KCN Н* Н20 Н+
СН2-СН—СНгС! — - CI-bCH-CHsCN ' ► CH^CH-Q-feCOOH .
винилуксусная
кислота
Химические свойства.
Непредельные кислоты являются бифункциональными соединениями,
которые проявляют как свойства кислот, так и свойства ненасыщен-
ных соединений. Влияние функциональных групп друг на друга в мо-
лекуле проявляется, когда кратная связь находится в а,р-положениях
по отношению к карбоксилу. Кислотность непредельных кислот вы-
ше, чем соответствующих предельных. Присоединение галогеноводо-
родов и гидратация идут против правила Марковникова.
Р а
СН2=СН-СООН + НВг -» СН2ВГ-СН2-СООН;
1 + НгО (Н+) -> НОСН2-СН2-СООН.
112
В отлично or трудно окисляемых предельных кислоI. непредельные
кислоты, как и алкены, окпслякнся легко: при мятом окгн Ленин об
разуются дпоксикпслогы. при шсргпчном окислении смесь рашых
продуктом, по которым можно определить положение двойной свяш.
По мере удаления кратной свяли от карбоксильной i рунпы се влияние
уменьшается.
Двухосновные кислоты, пли дикарбоновыс соединения, содержат в
.ио.текг к’ <)«е карбоксильные группы. Общая формула лих кислот
НООС R СООП.
Номенккип)pa. Для многих кислот используют тривиальные названия.
По систематической номенклатуре двухосновные кислоты получают
окончание -дновая или дикарбоповая кислота; щавелевая, или тгаи-
диовая. малоновая, или пропандиовая кислота.
Двухосновные кислоты - кристаллические вещества, растворимые в
воде; в водном растворе диссоциируют ступенчато, их кислотность
выше, чем у монокарбоновых кислот.
Название кислоты Формула Тил,°C Раство- римость К, 10 5
Щавелевая НООС-СООН 189 8,6 г 5900
Малоновая НООССНгСООН 136 74 149
Янтарная НООС(СН2)2СООН 185 5,8 6,6
Глутаровая НООС(СН2)зСООН 98 64 4,7
Адипиновая НООС(СН2)4СООН 152 1,5 3,7
Пимелиновая НООСДСНгДСООН 105 5,0 3,3
Малеиновая (цис) НООС-СН=СН-СООН 130 79 1420
Фумаровая (транс) НООС-СН=СП соон 260 0,7 93
Фталевая СбН4(СООН)2 г^-СООН — соон 231 - 112
Ki - константа дисоциации кислоты по первой ступени в воде при
25°С.
Способы попучения.
1. Гидролиз в кислой среде динигрилов, получаемых при действии
KCN на дигалогенпроизводные:
KCN 4Н2О, Н'
С1-(СН2)2-С1-----> NC-(CH2)2-CN--------> НООС-(СН2)2-СООН.
2.Окисленис двухатомных спиртов - гликолей - с первичными спир-
товыми гидроксилами:
15-3549
113
сн2—он
I
CH2-OH
10]
СИ; COOII
СН; 00011
.VllMItWCKIIC ( «DUl imid.
Двухосновные кислоты вступаю! в тс же реакции, которые характер-
ны для одноосновных кислот. Они дают два ряда производных, в об-
разовании которых участвуют одна или две карбоксильные группы.
I ак. двухосновные кислоты образуют:
Р~~ОН C^ONa
1^0 |^,о
c^~ONa c~^ONa
кислые средние
с°ли _ соли,
х°
Р<К1Н2
I
С<
nh2
полные
амиды
^О
Р^ОСНз
1^0
С"0Н
кислые
эфиры ,
х-°
Р^ОН
неполные
галоген
ангидриды ,
/О
Р—ОСНз P^NH2
С"ОСНз С~"0Н
полные неполные
эфиры _ аМиды,
полные
галоген
ангидриды.
Специфическим свойством двухосновных кислот, у которых-группы
-СООН связаны непосредственно или отделены одним атомом уг-
лерода, является разложение при нагревании с выделением СО? и пре-
вращением в одноосновную кислоту:
НООС-СООН -> НСООН + СОг.
При нагревании остальных кислот в присутствии Р?Оз образуются
циклические ангидриды:
сн,-соон
| 2
СН2-СООН
t°c
СК-СО1
1.
+ Н2О
Простые и сложные эфиры
Простые эфиры - это соединения, в молекулах которых два углево-
дородных радикала связаны атомом кислорода: R-O-R.
Радикалы могут быть одинаковыми или разными; с открытой цепью и
циклические или ароматические.
Номенклатура. Название простых эфиров составляется по названиям
радикалов с добавлением слова "эфир”. СНз-О С2Н5 - метилэтило-
вый эфир, СбН5-О-СбН5 - дифениловый эфир.
Изомерия - структурная, межклассовая со спиртами.
Простые эфиры имеют более низкие температуры кипения, чем изо-
мерные им спирты или фенолы; они не образуют водородные связи.
Простые эфиры легче воды и почти не растворяются в ней. В органи-
114
четких раствориелях эфиры рас1 норию ня хорошо и сами ря< i коряки
многие opi аничсские нещеепш.
< швобы получения.
1. Дегидратация еннргон.
2. Действие алкоголигов па алкплгалогениды:
CHj ONa + СЛЫ >Clh О CjlIs-lNal
3. Присоединение спиртов к алкенам в кислой среде в присутствии
Bl-д. Выполняется правило Марковникова:
CIhdI=CH2 + НО C2lIs-> СП1 -СН(СНз)- O-Cdls.
Химические свойства.
Простые эфиры, в отличие от спиртов и сложных эфиров, являются
весьма стойкими в химическом отношении веществами. Металличе-
ский натрий не действует на них при комнатной температуре, насы-
щенные простые эфиры не гидролизуются водой, на них не действуют
едкие щелочи, большинство кислот также не действует на них. Ис-
ключение составляют концентрированные H2SO4, HI, разлагающие
простые эфиры:.
R-O-CH2-R + HI -> RI + RCH2OH.
В отличие от насыщенных простых эфиров, виниловые эфиры гидро-
лизуются в кислой среде:
+Н2О.Н+ /р
R— О—CH=CHj —--------►R—ОН+СН,-С, .
Простые виниловые эфиры проявляют склонность к полимеризации,
поэтому используются при производстве высокомолекулярных соеди-
нений различного строения.
Сложные эфиры - производные кислот, у которых атом водорода в
карбоксильной группе замещен на углеводородный радикал.
Номенклатура. Сложные эфиры называют по кислотам и спиртам,
остатки которых участвуют в их образовании.
По рациональной номенклатуре- НСООСНз - метиловый эфир мура-
вьиной КИСЛОТЫ, СН3СООС2Н5 - этиловый эфир уксусной кислоты.
По систематической номенклатуре название производят от углеводо-
родного радикала спирта и латинского названия кислоты с изменени-
ем окончания на -ат или -оат: название первого эфира - метилфор-
миат, второго - этилацетат.
Сложные эфиры низших кислот и спиртов - жидкости легче воды, с
приятным запахом. В воде растворимы только эфиры с небольшим
числом атомов углерода. В спирте и диэтиловом эфире сложные эфи-
ры растворимы хорошо. Температура кипения сложных эфиров ниже,
чем у соответсвующих кислот, т.к. им не присуща ассоциация за счет
проявления водородной связи.
Способы получения.
1 Взаимодействие спиртов и кислот - реакция этерификации:
15* 115
RCOOH । HOR - - l-COOR » H/D.
2 . Взаимодействие хлорапгндридов кислот и спирит ( или алкоголя
row щелочных металлов):
RCOCI <• NaOR —► RCOOR • NaCI.
А ылтческие свойства.
I. Гидролиз сложных эфиров - важнейшая реакция этой группы ве-
ществ. Гидролиз - обратимая реакция, для смещения равновесия впра-
во используются щелочи:
+
Н
RCOOR + Н2О == RCOOH + HOR,
RCOOR + NaOH •. RCOONa + HOR
2. Восстановление сложных эфиров приводит к образованию двух
спиртов, в качестве восстановителей используются натрий в кипящем
спирте, LiAlHc
RCOOR’ + [Н] -> RCIbOII + R’OH.
3. Под действием аммиака сложные эфиры образуют амиды карбоно-
вых кислот:
RCOOR’ + NIL -> RCONH2 + R’OH.
4. При нагревании сложных эфиров со спиртами в присутствии кисло-
ты происходит обмен алкоксигрупп (переэтерификация):
RCOOR +R”OH RCOOR” + R’OH.
Жиры и масла
Жиры и масла - это сложные эфиры высших ациклических монокар-
боновых кислот и трехатомного спирта - глицерина. Они являются
смешанными триглицеридами, как правило, трех кислот; пальмити-
новой С15Н31СООН, стеариновой С17Н35СООН и олеиновой
СрНззСООН. Жиры и масла ненасыщенных кислот - жидкие, насы-
щенных кислот - твердые. Путем присоединения водорода по двойной
связи остатка кислоты, масла превращают в твердые жиры.
Мыла - это натриевые или калиевые соли высших насыщенных моно-
карбоновых кислот, как правило, стеариновой и пальмитиновой.
Мыла получают действием щелочей на кислоты или щелочным омы-
лением жиров.
CH2-O-CO-R'
CH-O CO-R" +3NaOH -----*
I
CH2-O-CO-R’”
CH2—OH R'COONa
СН-ОН + R"COONa
I
CH2—OH R’"COONa
116
Схема niaiiMiiiax превращении кислородсодержащих
оргапичесkiix соединений
117
Углеводы
Названием углеводы объединяют довольно разнообразные по своим
свойствам вещества, имеющие общую формулу СмНгиОл.
Углеводы разделяют па две группы простые углеводы (простые саха-
ра) и сложные углеводы (сложные сахара). Простыми углеводами
(моносахаридами) называются такие соединения, которые нс могут
гидролизоваться с образованием более простых углеводов. Сложными
углеводами (полисахаридами) называют такие соединения, которые
могут гидролизоваться с образованием простых углеводов.
Моносахариды.
Важнейшими представителями моносахаридов являются глюкоза и
фруктоза.
Строение моносахаридов.
Глюкоза и фруктоза являются изомерами и имеют молекулярную фор-
мулу CtHizOe. Строение этих веществ было установлено с помощью
следующих реакций.
1. При энергичном восстановлении глюкозы иодистым водородом
был получен 2-иодгексан с неразветвленной углеродной цепью.
2. Глюкоза вступает в реакцию с аммиачным раствором оксида се-
ребра, что говорит о наличии в молекуле глюкозы альдегидной груп-
пы:
(С5НиО5)СНО + 2[Ag(NH3)2]OH -> (C5HiiO5)COONH4 + 2Ag +
+ 3NH3 + Н2О.
Глюкоза также окисляется бромной водой в глюконовую кислоту:
(С5НнО5)СНО + Вг2 + НгО -> (CsHnOsKOOH + 2НВг.
3. При взаимодействии глюкозы с гидроксидом меди происходит
окрашивание раствора в синий цвет, что является характерной реак-
цией для многоатомных спиртов. Количественные эксперименты по-
казали, что в молекуле глюкозы пять гидроксильных групп. Таким
образом, глюкоза - это пятиатомный альдсгидоспирт:
НОСНг-(СНОН)4 -СН=О.
4. В молекуле фруктозы также установлено наличие пяти спиртовых
групп, но при энергичном окислении фруктоза образует две оксикис-
лоты с двумя и четырьмя атомами углерода. Такое поведение харак-
терно для кетонов. Таким образом, фруктоза является пятиатомным
кетоноспиртом следующего строения:
НОСН2-(СНОН)з-СО-СН2ОН.
Т.е. моносахариды - это многоатомные альдегидо- или кетоноспирты.
Однако ряд экспериментальных фактов не находит объяснения в рам-
ках такого строения моносахаридов
I. Моносахариды не дают некоторые реакции, характерные для аль-
дегидов; в частности, они не образуют бисульфитных соединений при
взаимодействии с NaHSOj.
118
2. Оптическая активное гь cncwclipiti оloiuicniii.ix par r поров глюко гы с
течением времени падает (явление мгпи/ротацин)
V При нагревании моносахаридов с мег иловым спиртом п при
сутствип HCI выпадает' кристаллический осадок гликозида, который
вес ко гидролизуется с образованием одной молекулы спирта.
Нее перечисленные факты нашли объяснение, когда предположили,
что каждые) моносахарид может существовать в виде нескольких тау-
томерных форм. В растворах, кроме развернутых цепей, существуют и
циклические формы, которые образуются при внутримолекулярном
взаимодействии альдегидной группы и гидроксильной группы при 5-м
углеродном атоме.
Р-глюкоза линейная форма а-глюкоза
глюкозы
Наличие циклической формы объясняет все приведенные выше ано-
малии следующим образом:
1. В растворах преобладают циклические формы моносахаридов, от-
крытые формы находятся в небольших количествах;
2. Изменение оптической активности связано с установлением равно-
весия между открытой и циклической формами.
Образование гликозидов объясняется наличием гликозидного, или
полуацетального гидроксила, который отличается большей реакци-
онной способностью, чем остальные гидроксилы. Поэтому он легко
взаимодействует со спиртами с образованием гликозидов
Хеуорс предложил изображать циклические формы сахаров так, чтобы
отчетливо были видны и кольцо, и заместители
+ н2О
гликозид
Циклические формы моносахаридов могут содержать пять или шесть
атомов в цикле. Сахара с шестичленным циклом называются пирано-
зами; например, глюкоза - глюкопираноза. Циклические формы саха-
119
ров с пязнчлсппым циклом шпыняются фуратиснт. 1ак, 1люкоза с
пяспиленным циклом называется глюкофурапозой. а фруктоза с пя-
тпчленным циклом называется фруктофуранозой.
Номенклатура и томерин. Названия моносахаридов содержат грече-
ское название числа а сомов н окончание -оза: пентоза, гексоза. Нали-
чие альдегидной или кстонной группировки обозначается приставка-
ми альдо- или кето-: глюкоза - альдогсксоза, фруктоза кстог сксоза.
Изомерия моносахаридов обусловлена наличием:
а) альдегидной или кстонной группировки;
б) асимметричного атома углерода;
в) таутомерии, т.е. равновесия между разными формами молекулы.
Способы получения.
1. Ряд моносахаридов встречается в природе в свободном виде (фрук-
тоза и глюкоза во фруктах).
2. Гидролиз полисахаридов.
3. Неполное окисление многоатомных спиртов.
Физические свойства. Моносахариды представляют собой твердые ве-
щества. Гигроскопичны, легко растворимы в воде. Растворы имеют
нейтральную реакцию, обычно обладают сладким вкусом. В спирте
растворяются плохо, в эфире не растворяются.
Химические свойства моносахаридов обусловлены наличием в их мо-
лекулах различных функциональных групп.
1. Окисление моносахаридов рассмотрено выше.
2. Реакции спиртовых гидроксилов:
а) взаимодействие с гидроксидом меди (II);
б) образование простых эфиров;
в) образование сложных эфиров, например реакция глюкозы с уксус-
ным ангидридом или хлорангидридом:
о=с-н
I
сн—он
I
СН—он
I
СН£>Н
I
Ан—О-СО—СН3
I + 5HCI
сн—о—со—сн3
с!н—о—со—сн3
сн^—о—со—сн.,
3. Образование гликозидов (см. выше).
4. Брожение. Брожением называется сложный процесс расщепления
моносахаридов под влиянием различных микроорганизмов. Различа-
ют несколько видов брожения, например:
а) спиртовое:
СбНнОе -> 2CzHsOH + 2СОг.
глюкоза
б) молочнокислое;
СбНпОб-> 2СНз-СН(ОН)-СООН.
глюкоза молочная кислота
120
Сложные углеводы (no.|iiicii\:ipiini,i)
Сложные углеводы подразделяются па дне i руппьг
I Сахароподобные сюмные I, iciuh)i,i. пли олшосахариды. Ли ве-
щества обладают свойствами, сближающими их с простыми yiдено-
лами. Опп растворяются в воде, образуя истинные растворы, в боль-
шинстве случаев сладки на вкус, их легко можно получить в виде кри-
сталлов. Примером является сахароза Cplb?.On. При гидролизе обыч-
но дают две или несколько молекул моносахарида:
!!♦,/
С12Н22О11 + НгО-------» СеНпОб + QH12O6.
сахароза глюкоза фруктоза
2. Несахароподобные сложные углеводы, или высшие полисахариды.
Эта группа углеводов совершенно не похожа по своим свойствам на
простые сахара. Высшие полисахариды либо не растворимы в воде
(как клетчатка, образующая стенки растительных клеток), либо дают
коллоидные растворы (как крахмал). Они безвкусны, не образуют
видимых кристаллов. При гидролизе высших полисахаридов образу-
ется большое число молекул моносахарида (сотни и тысячи).
Сахароподобные полисахариды.
В зависимости от числа молекул моносахаридов, которые образуются
при гидролизе каждой молекулы олигосахарида, различают дисаха-
риды, трисахариды и т.д.
Рассмотрим строение дисахаридов. Все дисахариды построены по
типу гликозидов, все они являются производными циклической фор-
мы моносахарида, у которого атом водорода в полуацетальном гид-
роксиле замещен остатком другой молекулы моносахарида. Остатки
двух молекул могут быть одинаковыми или разными. При образова-
нии связи одна молекула участвует в реакции за счет своего гликозид-
ного гидроксила, а другая молекула может реагировать или полуаце-
тальным гидроксилом, или каким-либо из остальных, т е. спиртовых,
гидроксилов. При этом в первом случае образующийся дисахарид не
содержит полуацетального гидроксила, а во-втором случае содержит
один полуацетальный гидроксил. И, как следствие, у них будет прояв-
ляться различие в химических свойствах. Первые дисахариды не про-
являют восстановительных свойств (например, сахароза), вторые
(целлобиоза, мальтоза, лактоза) являются восстановителями, их назы-
вают восстанавливающими дисахаридами. В частности, они дают реак-
цию серебряного зеркала.
целлобиоза
16 3549
121
('ПОСООЫ получения
Практически дисахарпды получают только нт природных источников.
Химические ечойепма.
Будучи но своему строению глико лидами, дисахариды леч ко i идроли-
зуются разбавленными минеральными кислотами и сравнительно
стойки к щелочному гидролизу. Восстанавливающие дисахариды про-
являют свойства многоатомных спиртов при взаимодействии с гид-
роксидом меди (II). Дисахариды, обладающие одним свободным по-
луацетальным гидроксидом, нс только своей восстанавливающей ено
собностью, но и всеми свойствами похожи на моносахариды.
Несахаронодобныс сложные углеводы, высшие полисахариды
Высшие полисахариды являются высокомолекулярными соединениями,
содержащими сотни и тысячи остатков моносахаридов. Общим для
строения высших полисахаридов является то, что остатки моносаха-
ридов связываются за счет полуацетального гидроксила одной моле-
кулы и спиртового гидроксила другой и т.д. Каждый остаток моноса-
харида связан с соседними остатками гликозидными связями.
Полигликозиды могут содержать разветвленные и неразветвленные це-
пи. Остатки моносахаридов, входящие в состав молекулы, могут быть
одинаковыми или разными. Наибольшее значение из высших полиса-
харидов имеют крахмал, гликоген (животный крахмал), клетчатка
(целлюлоза). Все эти высшие полисахариды состоят из молекул глю-
козы, различных образом соединенных друг с другом; состав всех трех
соединений выражается формулой (СеНюОз),,.
Крахмал образуется в зеленых листьях в виде зерен. Крахмальное
зерно иодом окрашивается в синий или зеленый цвет. Крахмал пред-
ставляет собой белый аморфный порошок. Высушенный крахмал
очень гигроскопичен. При настаивании с водой крахмальные зерна
разбухают, и лишь небольшая часть переходит в раствор. Крахмал
практически не обладает восстанавливающей способностью. Обнару-
жить в крахмале свободные спиртовые группы при помощи Си(ОН)з
не удается, так как сам крахмал не растворяется в воде. Однако дру-
гими методами можно обнаружить, что в молекуле крахмала на каж-
дый остаток глюкозы приходится в среднем по 3 свободные гидро-
ксильные группы. При быстром нагревании крахмала происходит
расщепление гигантской молекулы на более мелкие.
Крахмал представляет собой смесь гигантских молекул общей форму-
лы (СбНюОз),,, содержащих сильно колеблющееся число остатков глю-
козы. Большинство связей в молекуле крахмала находится в ct-форме,
т.е. а-1,4-гликозидные связи. Это означает, что остатки глюкозы свя-
заны за счет первого и четвертого атомов углерода при помощи гли-
козидной связи. Точно такая же связь соединяет два остатка глюкозы
в молекуле мальтозы; отсюда понятно, почему при гидролизе крахма-
ла получается мальтоза. Однако в молекуле крахмала содержатся и
разветвленные цепи, а именно а-1,6-гликозидные связи, которые свя-
зывают первый атом углерода с шестым.
122
Фрагмент линейной структуры крихмпли выгляди г следующим обра
зо м:
Клетчатка, или целлюлоза (CellioOs)» - основное вещество раститель-
ных клеток. Хлопок представляет собой почти чистую клетчатку.
Наиболее чистыми образцами клетчатки, с которыми приходится
встречаться в жизни, являются вата и фильтровальная бумага.
Физические и химические свойства.
Клетчатка обладает довольно большой механической прочностью. Не
растворима в воде, растворяется в следующих веществах:
1) в реактиве Швейцера, который представляет собой раствор
Си(0Н)2 в концентрированном растворе аммиака;
2) в концентрированная серной кислоте. В этом растворителе проис-
ходит частичный гидролиз клетчатки.
Для полного гидролиза клетчатки ее растворяют в серной кислоте, а
затем разбавляют водой и кипятят длительное время:
(СбНюО5)„ + «НгО = иСбН|20б.
Молекулы клетчатки представляют собой чрезвычайно длинные цепи
остатков глюкозы. В целлюлозе имеются р-1,4-гликозидные связи.
Фрагмент молекулы целлюлозы выглядит следующим образом:
1 СН2ОН
н он ,
' ' п
В связи с почти полной нерастворимостью клетчатки, наличие в ее
молекуле гидроксильных групп нельзя доказать обычной реакцией с
гидроксидом меди, но можно доказать реакциями образования про-
стых и сложных эфиров. Например, реакция образования сложного
эфира многоатомного спирта с уксусной кислотой имеет вид:
(С6Н7О2(ОН)3)П + ЗлСН3СООН-----> (С6Н7О2(ОСОСНз)3)п + ЗлН2О,
1б‘
123
Амины
Амины органические соединения, козорыс можно рассма ipnna п,
как производные аммиака, и которых атомы водорода (один или
несколько) замещены на углеводородные радикалы.
В зависимости от природы радикала амины могут быть алифатиче-
скими (предельными и непредельными), алициклическими, аромати-
ческими. гетероциклическими. Они подразделяю гея на первичные,
вторичные, третичные в зависимости от того, сколько атомов водо-
рода замещено па радикал.
Четвертичные аммониевые соли типа [R<N]'C1 это органические
аналоги аммониевых солей.
Названия первичных аминов обычно производят от названий соответ-
ствующих углеводородов, добавляя к ним приставку амино- или окон-
чание -амин. Названия вторичных и третичных аминов чаще всего
образуют по принципам рациональной номенклатуры, перечисляя
имеющиеся в соединении радикалы.
Первичные: R NH2: CH3-NH2-метиламин; CeHs-NHz -фениламин.
Вторичные: R-NH-R': (CHz)NH - диметиламин; СеНз-МН-СНз - ме-
тилфениламин.
Третичные: R-N(R')-R": (СНз)зК - триметиламин; (СбНз)зМ трифе-
ниламин.
Способы получения.
1. Нагревание алкилгалогенидов с аммиаком под давлением приводит
к последовательному алкилированию аммиака, при этом образуется
смесь солей первичных, вторичных и третичных аминов, которые
дегидрогалоген ируются при действии оснований:
NaOH
СНзС1 + NH3 -> CH3NH2 + НС1 -> [СНзКНз]С1-------> CH3NH2;
СНзС1 + CH3NH2 -> (СНз)зНН + НС1 -> [(СНз)2КН2]С1;
СНзС1 + (СНз)гНН -> (CH3)3N + НС1 -> [(СНз)зЫН]С1;
СНзС! + (C'H3)jN -> [(СНз)?ч]С1.
2. Ароматические амины получают восстановлением нитросоедине-
ний:
C0H5NO2 + 6[Н] -> C6H5NH2 + 2НзО.
Для восстановления можно использовать цинк в кислой среде.
3. Низшие амины получают, пропуская смесь спирта и аммиака над
поверхностью катализатора:
СНз-ОН + NH3 -> CH3-NH2 + НгО; (АИОз)
СНз-ОН + CH3-NH2 -> (СНз)2МН + НгО. (400°С)
Физические свойства аминов. Простейшие алифатические амины при
нормальных условиях представляют собой газы или жидкости с низ-
кой температурой кипения, обладающие резким запахом Все амины
являются полярными соединениями, что приводит к образованию во-
124
дородных связей в жидких аминах и, слсдопа icjii.ho. icMiiepaiypi.i их
кипения превышают температуры кипения со<>твстс1вующих алканов.
Первые представители ряда аминов растворяются в воде, по мере ро-
ста углеродного скелета их раствори моей, в воде уменьшается. Ами-
ны растворимы также в органических раствори телях.
Химические свойства аминов
I.Будучи производными аммиака, все амины обладают основными
свойствами, причем алифатические амины являются более сильными
основаниями, чем аммиак, а ароматические - более слабыми. Это
объясняется тем. что радикалы СНз-, С2Н5- и др. проявляют положи-
тельный индуктивный (+/) эффект и увеличивают электронную плот-
ность на атоме азота: СНз-эЬШг, что приводит к усилению основных
свойств. Напротив, фенильный радикал СсНз- проявляет отрицатель-
ный мезомерный (Л/) эффект и уменьшает электронную плотность на
атоме азота. Щелочная реакция растворов аминов объясняется обра-
зованием гидроксильных ионов при взаимодействии аминов с водой:
R NH, + НзО о [R-NH3]+ + ОН .
Амины в чистом виде или в растворах взаимодействуют с кислотами,
образуя соли.
CH3NH2 + H2SO4 -> [CH3NH3FHSO4 ,
CbHsNHz + НС1 -> [CeHsNHsj+CI-.
Обычно соли аминов - твердые вещества без запаха, хорошо раство-
римые в воде. В то время как амины хорошо растворимы в органиче-
ских растворителях, соли аминов в них не растворяются. При
действии на соли аминов щелочей происходит их разложение с выде-
лением свободных аминов
t
[СНзМНз]С1 + NaOH CH3NH2T + NaCl + Н2О.
2. Амины сгорают в кислороде, образуя азот углекислый газ и воду:
4C2H5NH2 + 15Оз 8СО2 + 2N2 + 1431:0.
3. Первичные алифатические амины при действии азотистой кислоты
превращаются в спирты:
R-NHi + NaNO2 + HCI -> R ОН + N? + NaCl + Н2О.
Первичные ароматические амины при действии HNO2 превращаются
в соли диазония:
CeHs-NH: + NaNO, + 2HCI -> [CsHs-N^NpCI + NaCl + Н2О.
Вторичные амины (алифатические и ароматические) с азотистой кис-
лотой дают нитрозосоединения - вещества с характерным запахом:
R>NH + NaNO2 + HCI -> R2N N -O + NaCl + H2O.
125
Аминокислот 1,1
Аминокислоты - производные органических кислот, получающиеся и
результате замещения одного пли более атомов водорода в yi леводо-
родных радикалах на одну или более аминогрупп.
В простейших случаях формулы аминокислот: IhN-R-COOH
В зависимости от взаимного расположения обеих функциональных
групп различают а-, |3-, и у-амипокпелоты. Количество функциональ-
ных групп, которые могут входить в состав аминокислот, различно.
Название Формула
моноаминомонокарбоновые кислоты
Глицин, аминоуксусная кислота H2N-CH2-COOH
Аланин, а-аминопропионовая кислота СНз-СН(МНг)-СООН
Валин, а-аминоизовалериановая кислота
(CH3)2CH(NH2)-COOH
Лейцин, а-аминоизокапроновая кислота
(СНз)2СН-СН2-CH(NH2)-COOH
Фенилаланин СбН5-СНг-СН(МН2)-СООН
моноаминодикарбоновые кислоты
Аспарагиновая кислота HOOC-CH2-CH(NH2)-COOH
Глутаминовая кислота HOOC-(CH2)2-CH(NH2)-COOH
диаминомонокарбоновые кислоты
Лизин H2N-(CH2)4-CH(NH2)-COOH
оксиаминокислоты
Серин HO-CH2-CH(NH2)-COOH
меркаптоаминокиелоты
Цистеин HS-CH2-CH(NH2)-COOH
Номенклатура. Названия аминокислот образуются из названий соот-
ветствующих кислот с прибавлением слова амино- и указанием места
расположения аминогруппы (1-, 2-, 3-) по отношению к СООН-группе.
Многие аминокислоты имеют эмпирические названия, которые проч-
но вошли в практику и являются наиболее употребительными (см.
табл.).
Изомерия аминокислот определяется строением углерод-углеродной
цепи; положением функциональных групп; наличием асимметриче-
ских атомов углерода (оптическая изомерия).
Способы получения.
1. Гидролиз белковых веществ обычно дает сложные смеси аминокис-
лот. Однако разработан ряд методов, позволяющих из сложных сме-
сей получать отдельные чистые аминокислоты.
126
2. Замещение галогена на аминогруппу n cooincicTiiyioiiuix lanoieoo-
кпелотах )тот способ получения аминокислот полноепио аналое ичсн
получению аминов из галогеппроп людных алканин и аммиака:
CI-CIl(R) ('ООН I 2NIh >IbN ( M(R> (ООН • NlhCl.
3. Присоединение аммиака к « fl-iieiipc/iejii.iii.iM i<iiciioi;im, при эюм
образуются р-аминокнслоты:
Clb=CH COOH+NHj >lbN f lh Clh COOH.
Физические свойства.
Аминокислоты представляют собой твердые кристаллические вещест-
ва, хорошо растворимые в воде и мало растворимые в органических
растворителях. Многие аминокислоты имеют сладкий вкус. Они пла-
вятся при высоких температурах и обычно при этом разлагаются. В
парообразное состояние переходить пс могут.
Л омические свойства.
Аминокислоты содержат в составе молекулы две функциональные
группы противоположного характера: аминогруппу с основными
свойствами и карбоксильную группу с кислотными свойствами. По
аналогии с неорганическими веществами (гидроксиды алюминия,
цинка) аминокислоты можно назвать амфотерными соединениями.
Амфотерность аминокислот позволяет им реагировать как с кислота-
ми, так и с основаниями:
H2N-CH2-COOH + HCI -> С1[НзМ-СН2-СООН],
H2N-CH2-COOH + NaOH -> H2N-CH2-COONa + Н2О.
Химические свойства в других реакциях будут определяться действи-
ем одной или другой функциональной группы. Эти реакции подобны
реакциям аминов и кислот, поэтому мы не будем их подробно рас-
сматривать.
При растворении в воде аминокислоты будут проявлять нейтральные,
основные или кислотные свойства в зависимости от того, сколько они
содержат амино- и карбоксильных групп. Это объясняется тем, что
аминогруппа и карбоксильная группа взаимодействуют друг с другом
(реакция нейтрализации: кислота + основание) с образованием соеди-
нений, называемых внутренними солями, которые образуются за счет
переноса протона с карбоксильной на аминогруппу:
H2N-CH2-COOH <-> ‘IbN-CHaCOO
Молекулу внутренней соли аминокислоты называют биполярным ио-
ном. В данном примере рассмотрена нейтральная аминокислота. Глу-
таминовая кислота (см. таблицу) образует кислый раствор, лизин -
щелочной.
Специфика свойств аминокислот приводит к тому, что две молекулы
аминокислоты могут реагировать друг с другом с отщеплением моле-
кулы воды и образованием продукта, в котором фрагменты связаны
пептидной связью:
127
RO R’ О
। и ------, । и
H2N-CH~C-OH + H-rNH-CH-C-OH --
I II I II
-----► H2N-CH-C-NH-CH-C-OH + H2O
ДИ11СТ1ТИЛ
Соединения с пептидной связью относятся к классу амидов кислот.
Полученное соединение называют дипептидом. Если продукт реакции
содержит три остатка аминокислоты, то он будет называться трипеп-
тидом. Вещества, построенные из многих остатков аминокислот, на-
зываются полипептидами. Полипептидная цепь, которая содержит
повторяющуюся последовательность аминокислот, является полиме-
ром. Примером может служить полиамид капрон:
2/H2N-(CH2)5COOH -> (-NH-(CH2)5-CO-)„ + (л-1)Н20.
Внутримолекулярное отщепление воды приводит к образованию цик-
лических соединений, носящих название лактамов:
77°
н ^C>NH
CHj— CHf- N СН,—СН,
н
Особенно легко протекает образование пяти- и шестичленных цикли-
ческих амидов.При действии азотистой кислоты на аминокислоты из
последних получаются оксикислоты.
а -Аминокислоты играют особую роль в природе, поскольку при их
совместной поликонденсации в природных условиях образуются важ-
нейшие для жизни вещества белки. В состав белков входят лишь не-
которые из возможных а-аминокислот. В большинстве белков встре-
чаются лишь двадцать аминокислот, часть из которых приведена в
таблице. Некоторые из этих аминокислот не могут быть синтезирова-
ны живыми организмами и называются незаменимыми. Они поступа-
ют в организм с растительной пищей.
Белки
Белки - это природные полипептиды с высокими значениями относи-
тельной молекулярной массы, которые могут колебаться от 10000 до
нескольких миллионов. Белки в состав которых входят исключитель-
но а-аминокислоты, называются простыми белками. Такие белки
принято подразделять по их растворимости в воде на глобулярные и
фибриллярные.
Глобулярные белки - это простые белки, растворимые в воде либо об-
разующие в ней коллоидные растворы. Все они растворимы в разбав-
ленных водных растворах кислот, оснований и солей, но осаждаются в
128
концентрированных растворах солей it кислот, а также и органиче-
ских растворителях. Например, глобулярной белок альбумин, содер-
жащийся в яичном белке, растворим и воде.
Растворимость и биологическая активность глобулярных белков сни-
жается при повышении температуры и в средах с предельными значе-
ниями pH. Это явление называется денатурацией белков. В процессе
денатурации происходит изменение упорядоченной структуры белка на
неупорядоченную, хаотическую структуру
Фибриллярные белки -это простые белки, нерастворимые в воде. Такие
белки содержатся в коже, волосах и мускульных тканях и поэтому
иногда называются структурными белками. К числу фибриллярных
белков относятся, например, кератины - белки, содержащиеся в шер-
сти, волосах, ногтях.
Способы получения.
Основным источником белков являются природные соединения. Бел-
ки в них обычно присутствуют в виде смесей. Для их разделения наи-
более часто применяемыми методами являются фракционное осажде-
ние и хроматография.
Методика фракционного осаждения основана на различной раство-
римости белков в водных растворах солей или в органических раство-
рителях, например, в ацетоне или в этаноле. При осторожном добав-
лении одного из таких растворителей происходит осаждение опреде-
ленных белков, тогда как другие белки остаются в растворе.
Способность белков по-разному взаимодействовать с поверхностью
адсорбента используется в хроматографическом методе разделения.
Белки не характеризуются резко выраженными температурами плав-
ления, поскольку нагревание приводит к их разложению. Для опреде-
ления чистоты белка и определения его относительной молекулярной
массы применяется методика ультрацентрифугирования. Скорость
перемещения белков в пробирке и образования осадков зависит от
формы, плотности и относительной молекулярной массы белков.
Скорость осаждения чистых белков отличается от скорости осаждения
неочищенных белков.
Для аналитического обнаружения белков в растворе может быть ис-
пользована биуретовая проба. При добавлении к раствору белка рас-
твора едкого натра и нескольких капель разбавленного медного ку-
пороса появляется фиолетовое окрашивание.
Структура белков. Белки обладают очень сложной структурой. При-
нято рассматривать 4 различных элемента структуры белков: первич-
ную, вторичную, третичную и четвертичную структуры.
Первичная структура белка определяется последовательностью кова-
лентно связанных аминокислотных остатков в полипептидной цепи.
Число аминокислот , содержащихся в полипептиде или белке, а также
их природу можно определить с помощью гидролиза и последующего
анализа смеси методами хроматографии, электрофореза, спектроско-
пии. Вторичной структурой называют упорядоченное свертывание
17-3549 *29
полнпсптндной цепи в результате обрачопаиии внутримолекулярных
водородных связей между кярбоксигруппами и амиши руинами. Об-
разование внутримолекулярных водородных связей и (лобулярных
белках может приводить к возникновению спиральной структуры,
назваемоп а-спиралыо. В фибриллярных белках образование водо-
родных связен может приводить к возникновению складчатой листе
вон структуры.
Третичной структурой называют свертывание полипептидной цепи,
приводящее к наложению одних участков а-спирали и складчатого
листа на другие участки цепи,то есть образование третичной структу-
ры обусловлено сшиванием между различными участками полипеп-
тидной цепи. Это сшивание происходит в результате образования
химических связей и различных взаимодействий между боковыми
цепями аминокислотных остатков. Наиболее распространенной фор-
мой сшивания между цепями является образование дисульфидных
мостиков (связей) между атомами серы двух цистеиновых остатков.
Четвертичная структура белка образуется между несколькими субъ-
единицами белка. Каждая субъединица имеет отдельную полипеп-
тидную цепь. В некоторых белках такие субъединицы одинаковы или
имеют сходное строение, а другие белки состоят из субъединиц с це-
пями различных типов. Четвертичная структура удерживается как
единое целое благодаря взаимодействиям между боковыми цепями,
как в третичной структуре.
Важнейшая роль белков заключается в их способности катализиро-
вать отдельные биохимические реакции. Такие катализаторы получи-
ли название ферментов. Сложность строения белка обеспечивает воз-
можность "распознавания" ими молекул, необходимых для данной
химической реакции, среди огромного количества молекул, находя-
щихся в живом организме.
Гетероциклические соединения
Гетероциклические соединения - это органические соединения, содер-
жащие в своих молекулах кольца (циклы), в образовании которых
кроме атома углерода принимают участие и атомы других элементов.
Атомы других элементов, входящие в состав гетероцикла, называются
гетероатомами. Наиболее часто в составе гетероциклов встречаются
гетероатомы азота, кислорода, серы, хотя могут существовать гетеро-
циклические соединения с самыми различными элементами, имеющи-
ми валентность не менее двух.
Гетероциклические соединения могут иметь в цикле 3, 4, 5, 6 и более
атомов. Пяти и шестичленные циклы, как и в ряду карбоциклических
соединений, образуются наиболее легко и отличаются наибольшей
прочностью. Во многих гетероциклических соединениях электронное
строение связей в кольце такое же, как и в ароматических соединени-
ях, поэтому типичные гетероциклические соединения условно обозна-
130
чают нс (олько формулами, содержащими чередующиеся двойные и
одинарные связи, по и формулами, в которых сопряжение п->лскзро
нов обозначается кружком, вписанным в формулу.
He\<eiiKnim}/>a. Для гетероциклов обычно использую! эмпирические
названия:
пятичленные гетероциклы
н фуран тиофен н тиофан
пиррол имидазол
шестичленные гетероциклы
пиперидин
Большое значение имеют гетероциклы, конденсированные с бензоль-
ным кольцом или с другим гетероциклом.
хинолин
индол
пурин
Для обозначения мест заместителей в неконденсированных циклах
атомы нумеруют обычно начиная с гетероатома. Если в гетероцикле
имеются два гетероатома азота - вторичный (-NH-) и третичный
(-N=), то нумерацию начинают со вторичного атома. Названия про-
изводных гетероциклов строятся по общим названиям системати-
ческой номенклатуры органических соединений.
Кислотно-основные свойства гетероциклических соединений.
Основные свойства гетероциклических соединений обусловлены на-
личием гетероатома с неподеленной электронной парой, способной
присоединять протон. Таким свойством обладает атом азота в пири-
диновом кольце:
пиридин
+ HCI
хлорид пиридиния
Поэтому пиридин является основанием и с сильными кислотами об-
разует соли. Аналогичные основные свойства будут проявлять и все
другие гетероциклы, содержащие пиридиновый атом азота.
17'
131
Напротив, атом водорода при пиррольном атоме азота отщепляется
при действий сильных оснований, таких как амид натрия NaNHz
Щелочные металлы также могут замещать атом водорода у пирроль-
ного атома азота. Образующиеся соли легко гидролизуются:
Имидазол, содержащий атомы азота двух видов, одновременно прояв-
ляет как основные, так и кислотные свойства, т е. является амфотер-
ным соединением.
Пиридин - шестичленный гетероцикл с одним гетероатомом - можно
рассматривать как аналог бензола. Это жидкость с т. кип. 115 °C, об-
ладающая характерным неприятным запахом, смешивается с водой в
любых отношениях. Пиридин и его ближайшие гомологи содержатся
в каменноугольной смоле. Пиридин можно синтезировать из ацетиле-
на и синильной кислоты:
2НС=СН + Н— C=N —•
Гомологи пиридина можно получать конденсацией альдегидов с ам-
миаком:
ЗСН3-СН=О+ NH3 ~ЗН2°1
Нг
сн3
Химические свойства пиридина.
Из-за наличия ароматического секстета свойства пиридинового ядра
во многом сходны со свойствами бензола. Для пиридина характерны
реакции электрофильного замещения. Он подвергается галогенирова-
нию, нитрованию, сульфированию. При этом атом азота пиридиново-
го ядра играет роль заместителя II рода, направляющего группы в fl-
положение и затрудняющего (по сравнению с бензолом) реакции элек-
трофильного замещения:
, |^VNO2
[I I + HNO3 -----* Н \ +Н2О
Sr
3-нитропиридин
При взаимодействии с нуклеофильными заместителями ориентация
осуществляется в а- и у-положения (реакция Чичибабина):
132
При действии окислителей гомологи пиридина ведут себя как и про-
изводные бензола: затрагивается только боковая цепь соединения,
которая превращается в карбоксильную группу (окислитель - хромо-
вая смесь).
а-,у-Оксипиридины ведут себя как вещества таутомерные, в химиче-
ских реакциях получаются как производные оксипиридиновой так и
пиридоновой форм.
М-метилпиридон-2
4N^OH
2 оксипиридин
2-метоксипиридин
При каталитическом гидрировании H2/N1 пиридин превращается в
пиперидин, имеющий строение и свойства вторичного амина.
Пятичленные гетероциклы с одним гетероатомом. Простейшие пя-
тичленные гетероциклы: пиррол, тиофен, фуран. Все они проявляют
ароматические свойства. Электронная пара пиррольного азота не сво-
бодна, а участвует в образовании электронного секстета, поэтому
пиррольный азот почти лишен свойств оснований. При действии
сильных минеральных кислот электронная пара азота "вытягивается"
из ароматического кольца, и пиррол, утрачивая ароматичность, пре-
вращается в неустойчивое непредельное соединение, которое быстро
полимеризуется. Аналогично ведет себя и фуран.
Ароматичность свойств проявляется в реакциях электрофильного за-
мещения: галогенирования, нитрования, ацилирования, сульфирова-
ния. Проще всего эти реакции осуществить с тиофеном, поскольку он
не разрушается при действии кислот.
133
В случае фурана п пиррола реакции осложняю ия н-м, чю под дей-
ствием кислот они сами разрушаются, по ному пропсдеиис таких ре-
акции грсбует особых условии.
Родство пятичленных гетероциклов пиррола, фурана и тиофена нахо-
дит свое выражение в легкости взаимных превращений над катализа-
тором AI2O.1 при 400-450 °C соответственно и токе IhS, НЮ, NIL
(цикл Юрьева):
Пиррол получают также путем конденсации ацетилена и NIL:
с Fe2O3
2НС=СН + NH3------> C4H4NH + Н2 .
Пиррол - бесцветная жидкость с т.кип. 130 °C. На воздухе быстро
окисляется и темнеет. Для обнаружения пиррола используют его спо-
собность окрашивать сосновую палочку, смоченную в соляной кисло-
те, в красный цвет. Пиррол способен восстанавливаться в присут-
ствии катализаторов (Pd, Ni и др.) с образованием насыщенного цик-
ла пирролидина:
— Q
1 I
н н
пиррол пирролидин
Шестичленные гетероциклы с двумя гетероатомами. В этой группе
гетероциклических соединений наиболее важными являются гетеро-
циклы, содержащие два атома азота. Они имеют общее название диа-
зины и различаются взаимным расположением атомов азота.
Каждый из этих гетероциклов содержит сопряженную шестиэлектрон-
ную систему. Наличие двух атомов азота в кольце еще больше, чем в
пиридине, понижает электронную плотность на атомах углерода, что
приводит к снижению активности диазинов в реакциях электрофиль-
ного замещения и, напротив, облегчает реакции нуклеофильного за-
мещения в сравнении с пиридином. При этом уменьшается и основ-
ность диазинов; они являются очень слабыми основаниями и образу-
ют соли с одним эквивалентом сильной кислоты, несмотря на наличие
двух центров основности:
N N Y
Н
134
Средн производных диазинон, имеющих Giiojioi ичсскос значение и
применяемых в медицине, наиболее важными являкнея 1илрокси- и
амннопроизводные пиримидина и пурина.
пиримидин пурин Н
Пиримидин представляет собой кристаллическое вещество с 7*яя 2О'*С
Из его производных рассмотрим урацил, цитозин и тимин.
Урацил, или 2t4-du?udpoxamuptiMuduH, в зависимости от условий мо-
жет существовать в разных формах:
ОН О
I
Н
Наряду с урацилом, важное значение имеют близкие ему вещества -
цитозин, или 2-гидрокси-4-аминопиримидин:
а также тимин, или 2,4-дигидрокси-5-метилпиримидин:
Наиболее широко из производных пурина в природе распространены
аденин и гуанин. Аденин, или 6-аминопурин представляет собой кри-
сталлическое вещество, плавящееся с разложением при 360 °C, трудно
растворимое в воде. В свободном состоянии он содержится в расти-
тельных и животных тканях.
NH2
н
135
Гуанин, или 2-ам1111о-6-гндрокс1П1ур11Н, имеете с аденином содержится
в растительных и животных тканях.
В воде и спирте гуанин почти нс растворим, ио легко растворяется в
кислотах и щелочах с образованием солей. Производные пиримидина
- урацил, тимин, цитозин, и производные пурина - аденин и гуанин
называются пиримидиновыми и пуриновыми основаниями, соответ-
ственно.
Нуклеиновые кислоты
Нуклеиновые кислоты - это органические кислоты с очень большой
относительной молекулярной массой. Они содержатся во всех живых
организмах и играют определяющую роль в биосинтезе белков, а
также в передаче наследственных свойств.
Нуклеиновые кислоты являются материальными носителями генети-
ческого кода, который определяет последовательность аминокислот в
белках. Именно эта генетическая информация программирует струк-
туру и метаболическую активность живых организмов.
Нуклеиновые кислоты являются полимерами. Их мономерными звень-
ями служат нуклеотиды. Поэтому нуклеиновые кислоты представляют
собой полинуклеотиды.
Различают нуклеотиды и нуклеозиды. Всякий нуклеотид состоит из
трех составных частей: фосфатной группы, сахарного остатка и осно-
вания, а нуклеозид включает только две из этих трех составных частей
~ сахарный остаток и основание:
Нуклеотид
Нуклеозид
Важнейшими нуклеиновыми кислотами являются дезоксирибонуклеи-
новая кислота (ДНК) и рибонуклеиновая кислота (РНК). Сахарный
компонент ДНК представляет собой 2-дезоксирибозу, а сахарным
компонентом РНК служит рибоза:
136
он он
(3-рибоэз
(С5Н10О5)
ОН Н
р-дсзоксирибозп
(СБН10О4)
В молекулу ДНК входят четыре разных основания - два пиримидино-
вых и два пуриновых: цитозин, тимин, гуанин, аденин. В молекулу
РНК входят те же основания, что и в ДНК, за исключением тимина,
вместо которого входит урацил. Для обозначения каждого основания
используется начальная (латинская) буква его названия. Цитозин - С,
тимин - Т, гуанин - G, аденин - А, урацил - U.
Генетическая информация определяется последовательностью основа-
ний в молекуле ДНК, но сама эта молекула не принимает участия в
синтезе белков. Она передает необходимую для этого информацию
путем образования молекулы РНК. РНК непосредственно участвует в
синтезе белков всех живых организмов.
Обобщенную структуру ДНК и РНК можно представить так:
Здесь буквой X обозначены атомы водорода в ДНК и гидроксильные
группы в РНК.
18-3549
137
ПРИЛОЖЕНИЕ.
Таблица П.1
Растворимость твердых веществ в воде
( безводного соединения в г на 100 г раствора )
Вещество Твердая фаза Температура ,
0_ 20 80
| (N НОзСпОт (Nl-hhCuOi 18,3 35,6 115,0
inh4nc)3 NH4NO3 54,2 63,9 85,9
|(NH4)2SO4 (NH4)2SC)4 41,4 43,0 48,8
[NH4C1 NH4C1 23,0 27,1 39,6
[NH4HCO3 NH4HCO3 10,9 17,5
KNO2 KNCh 73,7 75,4 79,0
[KNCh KNO3 11,6 24,1 62,8
I К2СГ2О7 К2СГ2О7 4,4 11,1 41,1
KMnCh KMnCh 2,8 6,0
KHSO4 KHSO4 26,6 32,7
K2SO4 K2SO4 6,9 10,0 17,6
КС! KCl 22,2 26 33,8
КСЮз КСЮз 3,2 6,8 28,4
Са(СНзСОО)2 Са(СНзСОО)2 H2O 37,4 34,7 33,5
MgCh MgCl26H2O 34,5 35,3 39,7
ВаВгз ВаВгз 2H2O 90,5 98 121
BaS BaS 2,9 7,9 49,9
Ва(ОН)2 Ba(OH)28H2O 1,7 3,9 101,4
Са(ОН)2 Ca(OH)2 0,18 0,160 0,092
CaSO4 CaSChZHzO 0,18 0,206 0,102
ZnBn ZnBr?3H2O 389 438 644
PbSO4 PbSCh 3,310 3 4,310-3
РЬВГ2 PbBl2 0,5 1,1 3,3
Ag?SQ4 AgzSCh 0,6 0,8 1,3
CuSO4 CUSO45H2O 14,3 20,5 55,5
FeSO4 FeSO47H2O 15,8 26,3 43,7
Ah(SCh)3 Ah(SO4)316H2O 37,9 38,3 48,8
AIF3 A1F33H2O 0,13 0,5 0,9
Al(NO3)3 Al(NO3)39H2O 60,0 62,6 122,2
FeCh FeCh6H2O 74,4 91,9
138
'Таблица П.2
Kohci анты диссоциации кислот п иодном
растлорс при 25 "С
Кислота К'| Ki Къ
HI 1,6 10"
HCN 7,910-'°
НСЮ4 Ю‘°
НВг 10’
HCI 10»
H2SO4 103 1,110-2
HNO3 27
нсю3 10
СС13СООН 2,2-10-2
H2SO3 1,6-10-2 6,3-108
НС1О2 1,1 102
Гн3ро4 7,6-10-’ 5,9-10-8 3,5-10'3
HF 6,7-10-4
hno2 5,1 104
нсоон 1,8-10-4
СНзСООН 1,7-10-5
Н2со3 4,3-10-7 4,7-10"
H2S 1,1 ю-7 1,2-10-'3
нею 2,8-10-8
НВгО 2,6 10’
F3CCOOH 5,910-'
С1СН2СООН 1,3810-з
С6Н5ОН 1,0-10 10
Н2О 1,8-10-16
18*
139
Таблица 11.3
Константы диссоциации оснований в водном
рас творе при 25 "С
Основание Ki Кг Ks
КОН 2,9
NaOH 1,5
ион 0,44
Ва(ОН)2 - 0,23
Sr(OH)2 - 0,15
Са(ОН)2 - 5,9-IO-2
Мд(ОН)2 - 2,6-10’
Fe(OH)2 l,2-10-2 5,510 е
NH3 1,7 10 s
Zn(OH)2 1,310 s 4,9-10-’
AI(OH)3 8,3-10’ 2,1-10’ 1,0-10’
Fe(OH)3 4,8-10-" 1,8-10" 1,5 IO '2
Таблица П.4
Произведения растворимости малорастворимых
веществ при 25 °C
Вещество ПР Концентрация насыщенного раствора, моль/л
LiF 1,5-10’ 3,9-10 2
CaSO4 3,7-10-5 6,1 103
MgCO3 7,9-106 2,8 10 з
BaSO3 8,0-10’ 8,9-104
CaSO3 3,2-10’ 5,7-IO-4
CaHPO4 2,2-10-’ 4,7-10-4
140
11родолжспне таблицы 11.4
Вещество IIP Концентрация насыщенного раствора, моль/л
А1(ОН)3 5,7 10’2 6,8-10’
FeS 3,4-10 17 5,8-10’
PbS 8,7-102’ 9,3 1015
Cu2S 2,3-1 O’8 8,3 -10 17
A02S 7,2-1050 2,6-10'7
CuS 1,4-1036 1,2-IO'8
HgS 1,4 10« 3,7-10-2’
Mg(OH)2 6,8-10'2 1,2 10-4
BaCO3 4,9-10’ 7,0 10 5
CaCO3 4,4-10’ 6,6 105
AgCl 1,8-10-'° 1,3-10-5
BaSO4 1,8-10 10 1,3 10-5
Fe(OH)2 7,9-iO'6 5,8 106
Zn(OH)2 3,0-I0'6 4,2 10°
Ca3(PO4)2 1,0-10 25 3,9-10-°
AgBr 5.0-10 •’ 7.1 107
Cu(OH)2 5,6-10” 2,4-10-7
Agl 2,3-10-'° 1,5-10 8
Cr(OH)3 1,1-10’° 1,4-108
Ba3(PO4)2 6,0-10” 8,9-10-’
141
ОГЛЛВЛЕНИ1
ЧАСТЬ I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ.................... 3
Основные определения II 311КО11Ы химии........... 3
Классификация химических соединений.............. 7
Оксиды........................................ К
Основания..................................... 9
Теории кислот и оснований. Кислоты........... 10
Соли..........................................11
Комплексные соединения........................J4
Строение атома.................................. 15
Химическая связь............................... 16
Строение ядра атома. Радиактивность..............18
Таблица электронных конфигураций атомов элементов.19
Периодическая система элементов Д.И.Менделеева...22
Агрегатное состояние вещества....................23
Типы химических реакций..........................24
Скорость химических реакций..................... 25
Химическое равновесие. Принцип Ле-Шателье........26
Основные понятия химической термодинамики........27
Тепловые эффекты химических реакций. Закон Гесса.28
Растворы.........................................29
Способы выражения концентрации растворов......30
Электролиты. Электролитическая диссоциация.......31
Ионное произведение воды. pH раствора. Произведение
растворимости....................................32
Гидролиз солей...................................33
Окислительно-восстановительные реакции...........34
Электролиз.......................................36
ЧАСТЬ II. НЕОРГАНИЧЕСКАЯ ХИМИЯ.........................37
I группа, главная подгруппа. Щелочные металлы....37
I группа, побочная подгруппа.....................39
Медь..........................................39
Серебро. Золото...............................40
II группа, главная подгруппа. Щелочноземельные
металлы..........................................41
II группа, побочная подгруппа...................43
Цинк.................‘...................... 43
Ртуть....................................... 44
III группа.......................................45
Бор...........................................45
Алюминий......................................46
IV группа.......................................47
Углерод.......................................47
Кремний.......................................49
142
V группа, главная подгруппа....................50
Азот. 50
Фосфор.........................................54
Минеральные удобрения и их состав........... 56
VI группа, главная подгруппа..................... 57
Кислород.................................... 57
Сера........................................... 58
VI группа, побочная подгруппа................. 60
Хром........................................ 60
VII группа, главная подгруппа...................62
Водород..................................... 62
Галогены.................................... 63
VI I группа, побочная подгруппа................65
Марганец.................................... 65
VIII группа, побочная подгруппа................... 66
Железо......................................... 66
Комплексные соединения железа..................... 68
ЧАСТЬ III. ОРГАНИЧЕСКАЯ ХИМИЯ.......................... 69
Теоретические основы органической химии.........69
Алканы............................................ 77
Алкены............................................ 80
Алкадиены......................................... 85
Алкины..........................................87
Арены............................................. 90
Полициклические ароатические углеводороды.......96
Спирты..........................................98
Многоатомные спирты............................100
Фенол..........................................102
Альдегиды.Кетоны...............................104
Карбоновые кислоты............................ 108
Простые и сложные эфиры...........................114
Жиры и масла...................................... 116
Углеводы.......................................... 118
Амины......................................... 124
Аминокислоты...................................126
Белки..........................................128
Гетероциклические соединения.................. 130
Нуклеиновые кислоты............................... 1 36
Приложение.
Таблица П. 1. Расворимость твердых веществ в воде. 138
Таблица П.2. Константы диссоциации кислот в водном
растворе при 25°С............................. 139
Таблица П.З. Константы диссоциации оснований в
водном растворе при 25°С...................... 140
Таблица П.4 Произведение растворимости малораство-
римых веществ при 25°С........................ 140
143
ДОПОЛНИТЕЛЬНАЯ ЛИ Н РА ГУРА
1. Кузьменко ПЛ... Еремин В.В., Попков В.А. Химия для школьников
старших классов и поступающих в вузы М : Дрофа, 1997.
2. Кузьменко НЕ., Еремин В.В., Попков В.А. Начала химии. Совре-
менный курс для поступающих в вузы - М.: 1-я Федерат, книготорг
компания, 1997
3. Фельдман Ф.Г., Рудаитис Г.Е. Химия: Учебники для 8-11 классов
средней школы. - М.: Просвещение, 1989-1995.
4. Цветков Л.А. Органическая химия: Учебник для 10 класса средней
школы. 25-е изд. - М.: Просвещение, 1988.
5. Химия: Справочные материалы / Под ред. Ю.Д.Третьякова. 1-3-е
изд. - М.: Просвещение, 1984, 1988, 1993.
6. Еремина Е.А., Еремин В.В., Кузьменко Н Е. Справочник школьника
по химии (8-11 классы). - М.: Дрофа, 1996.
7. Фримантл М. Химия в действии. В 2-х ч. - М.: Мир, 1991.
8. Ахметов Н.С. Неорганическая химия. В 2-х ч. 3-е изд. - М.: Про-
свещение, 1992.
9 Органическая химия / Под ред. Н.А.Тюкавкиной. - М.: Медицина,
1989.
10. Потапов В.М., Татаринчик С.Н. Органическая химия. - М.: Хи-
мия. 1989.
11 Рэмсден Э.Н. Начала современной химии. - Л.: Химия, 1989.
Вас ожидает контрольная работа,
зачет по химии,
выпускной, вступительный экзамены?
Вам необходимо повторить курс
элементарной химии?
Данное пособие поможет решить эти
вопросы.