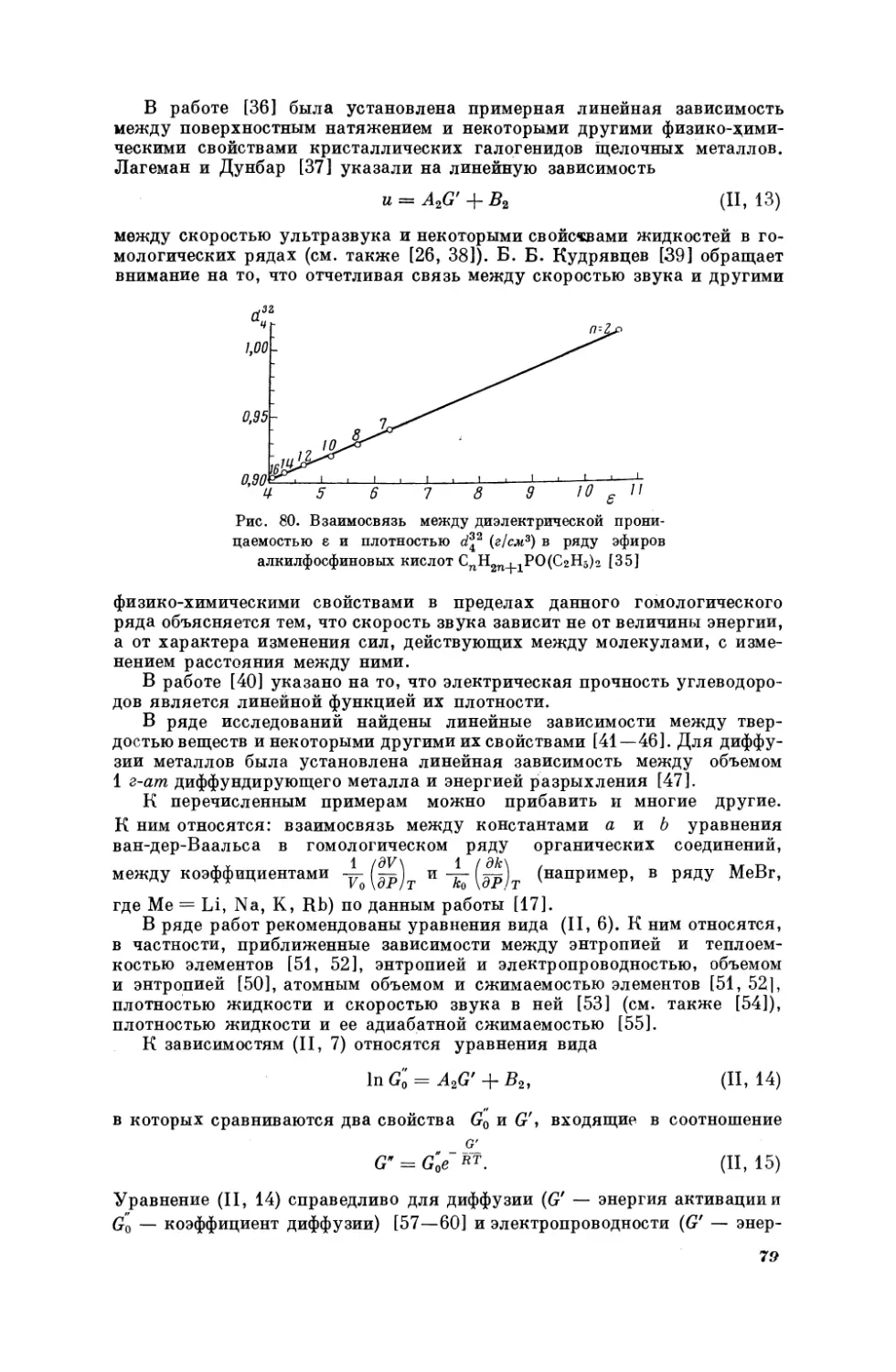
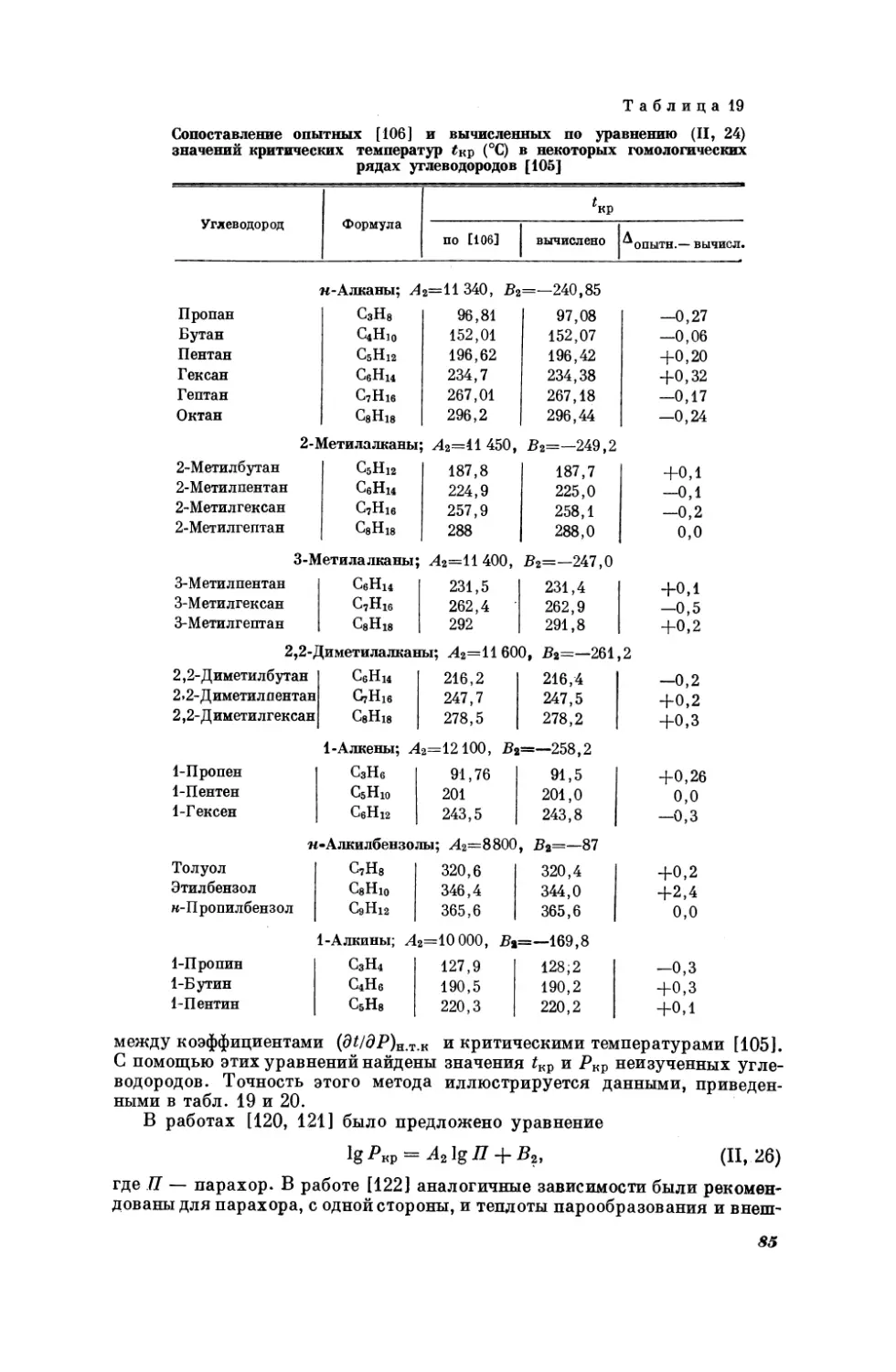
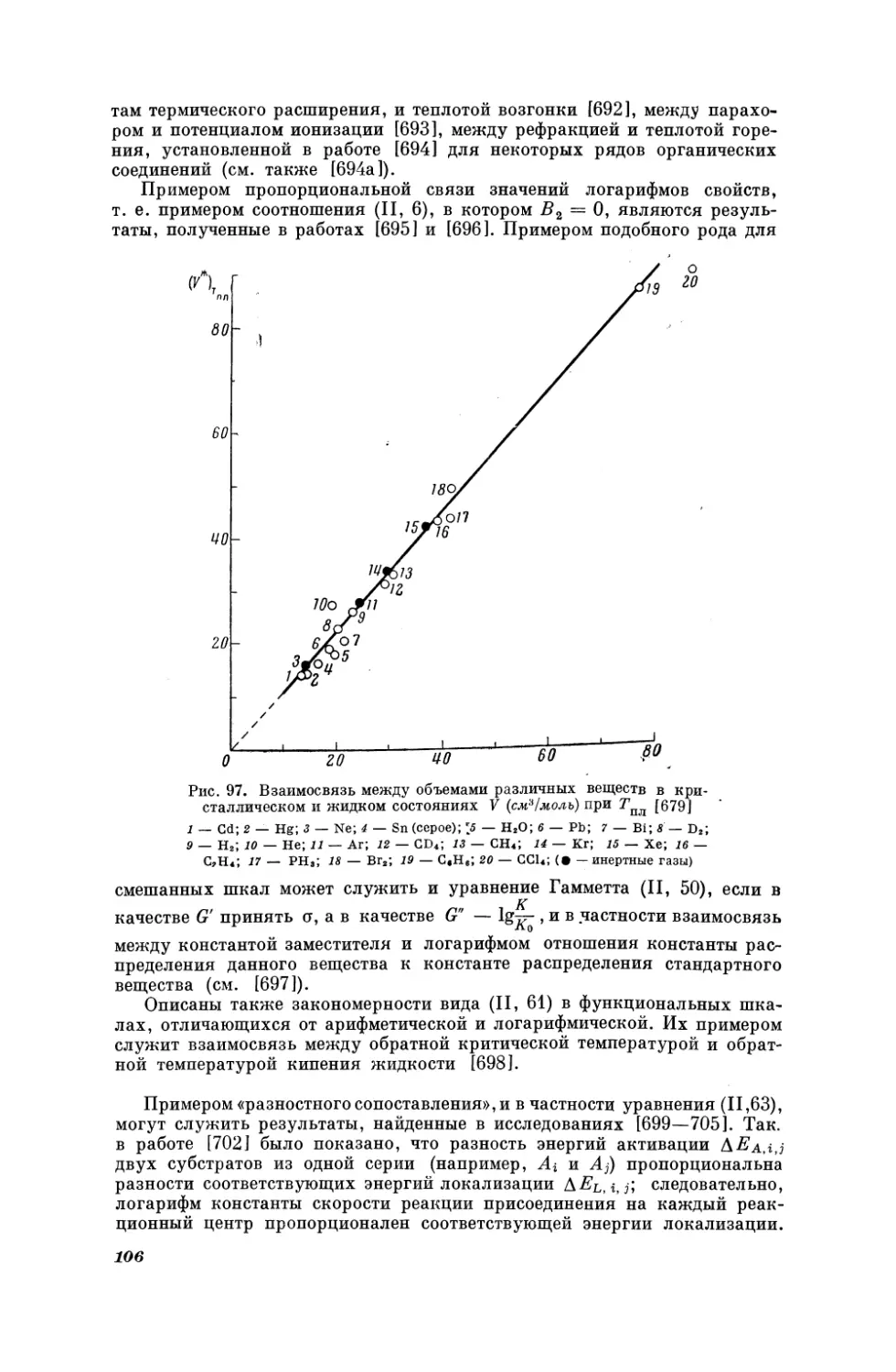
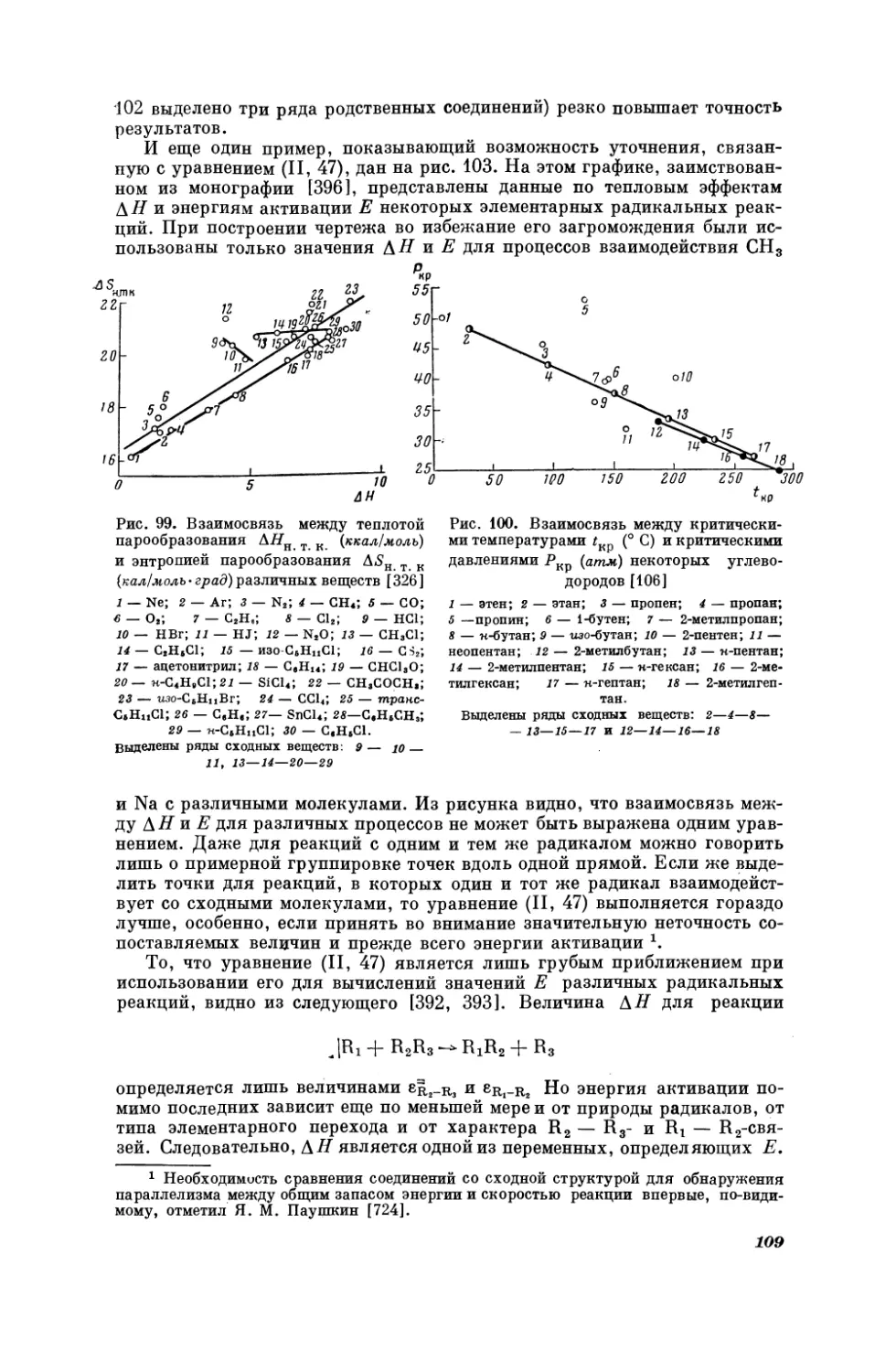
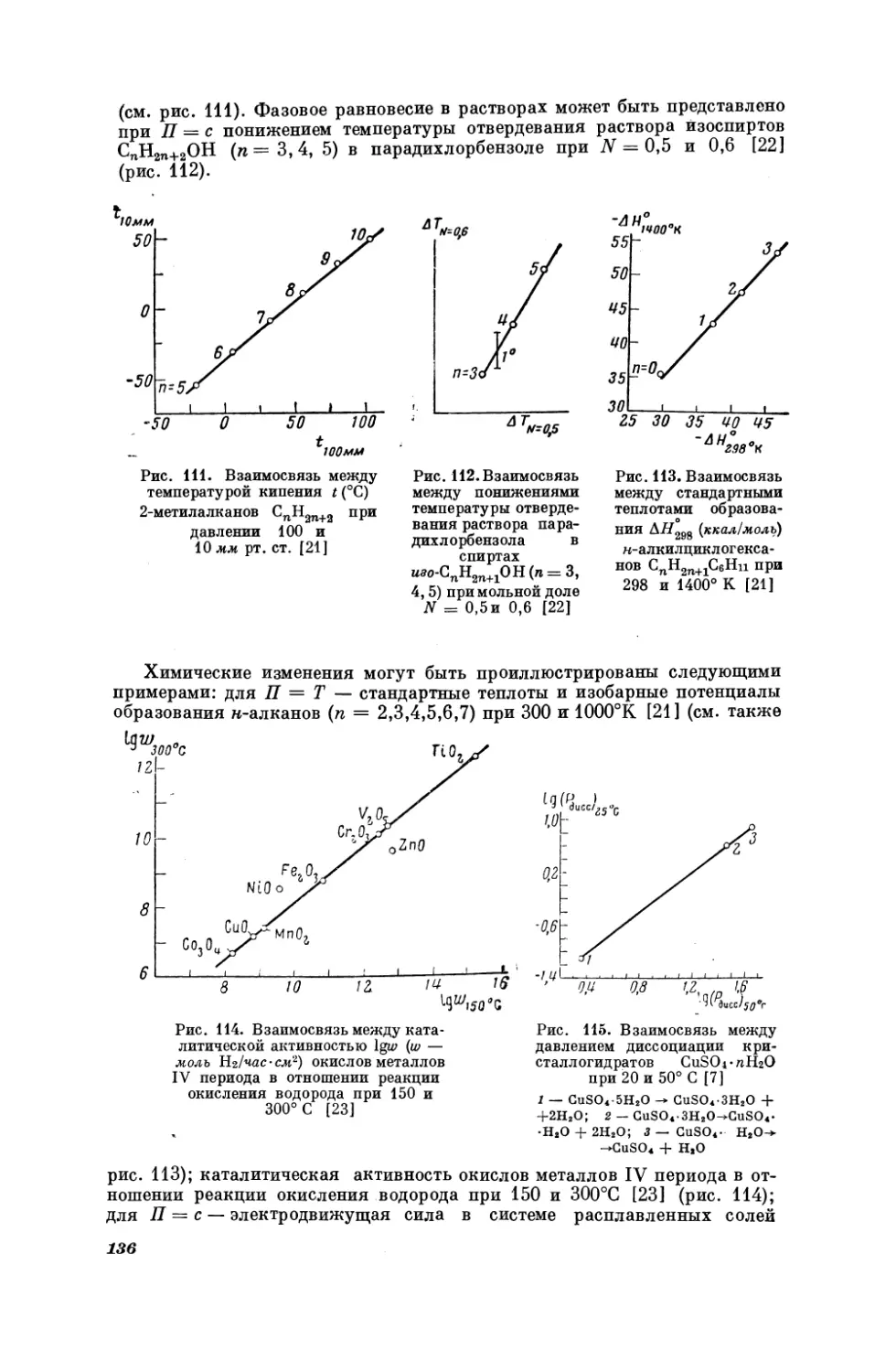
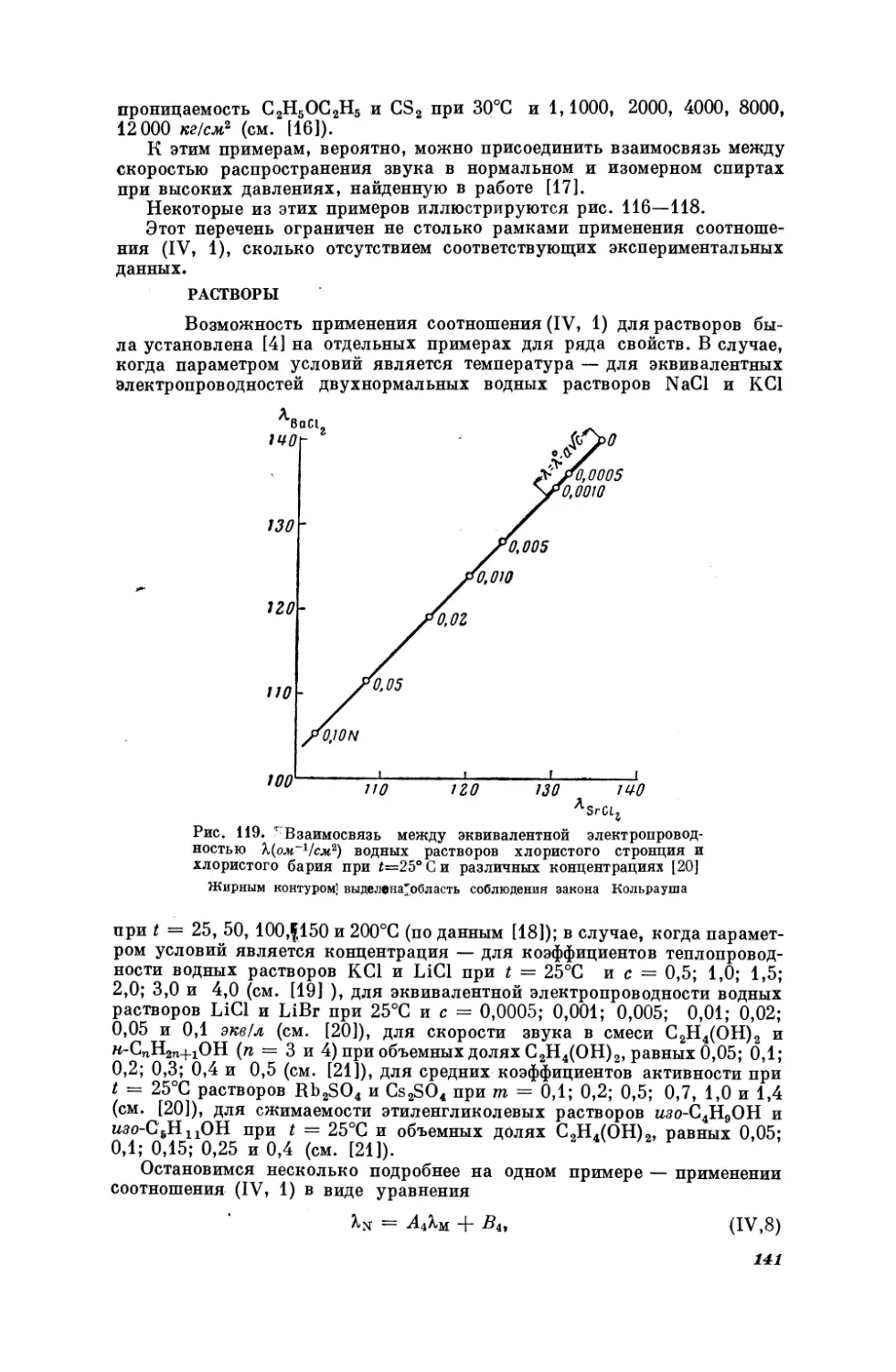
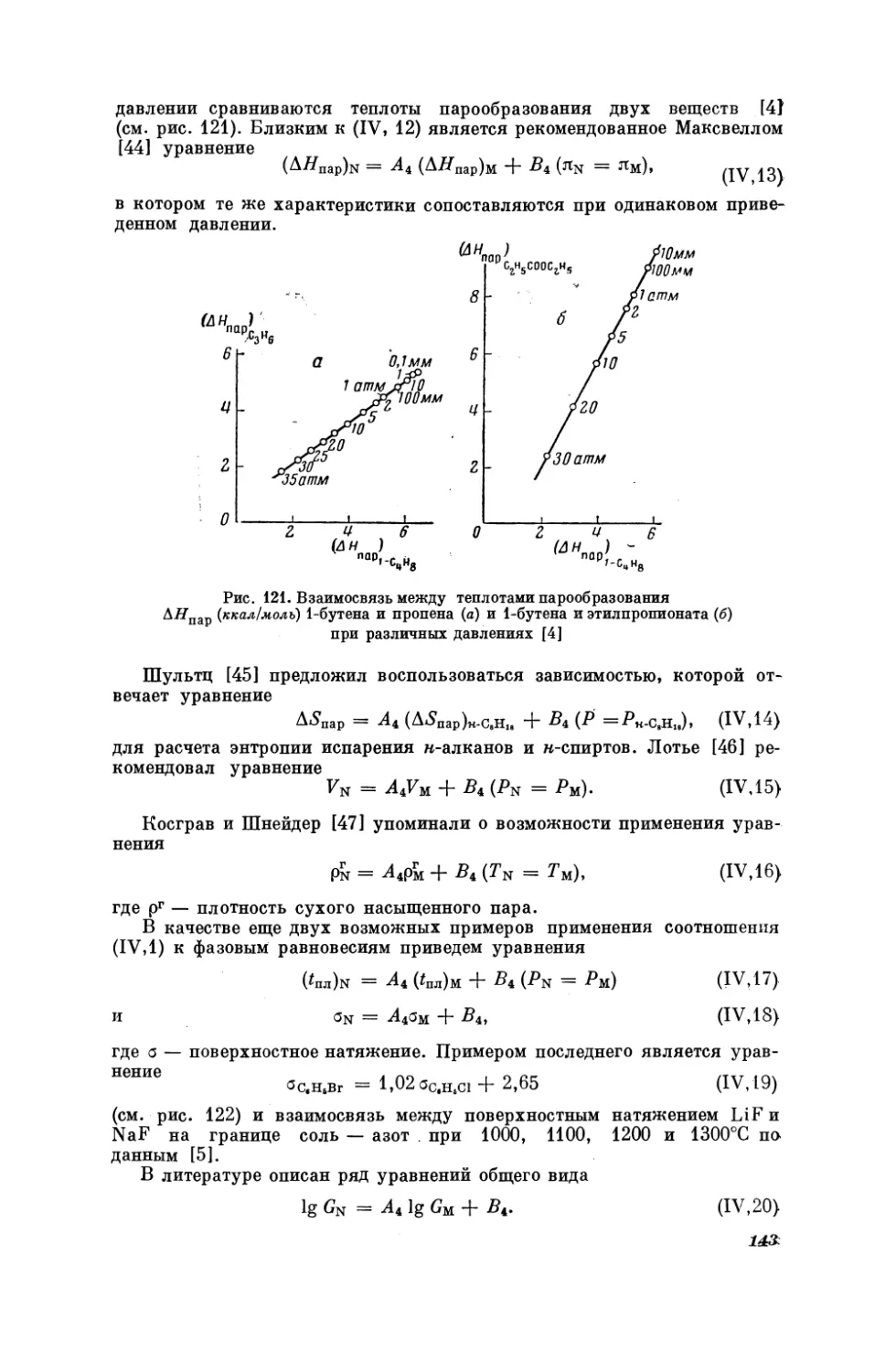
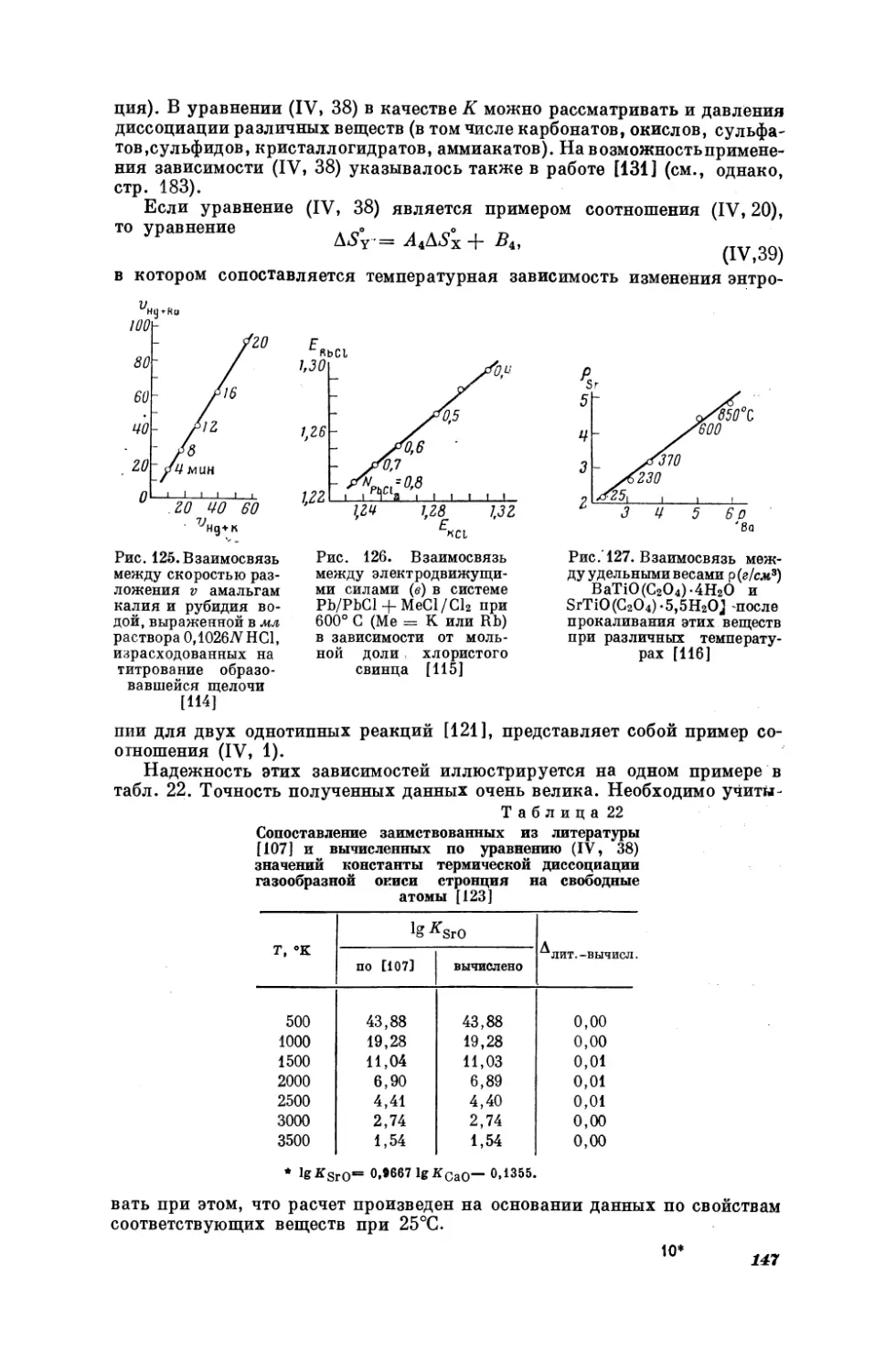
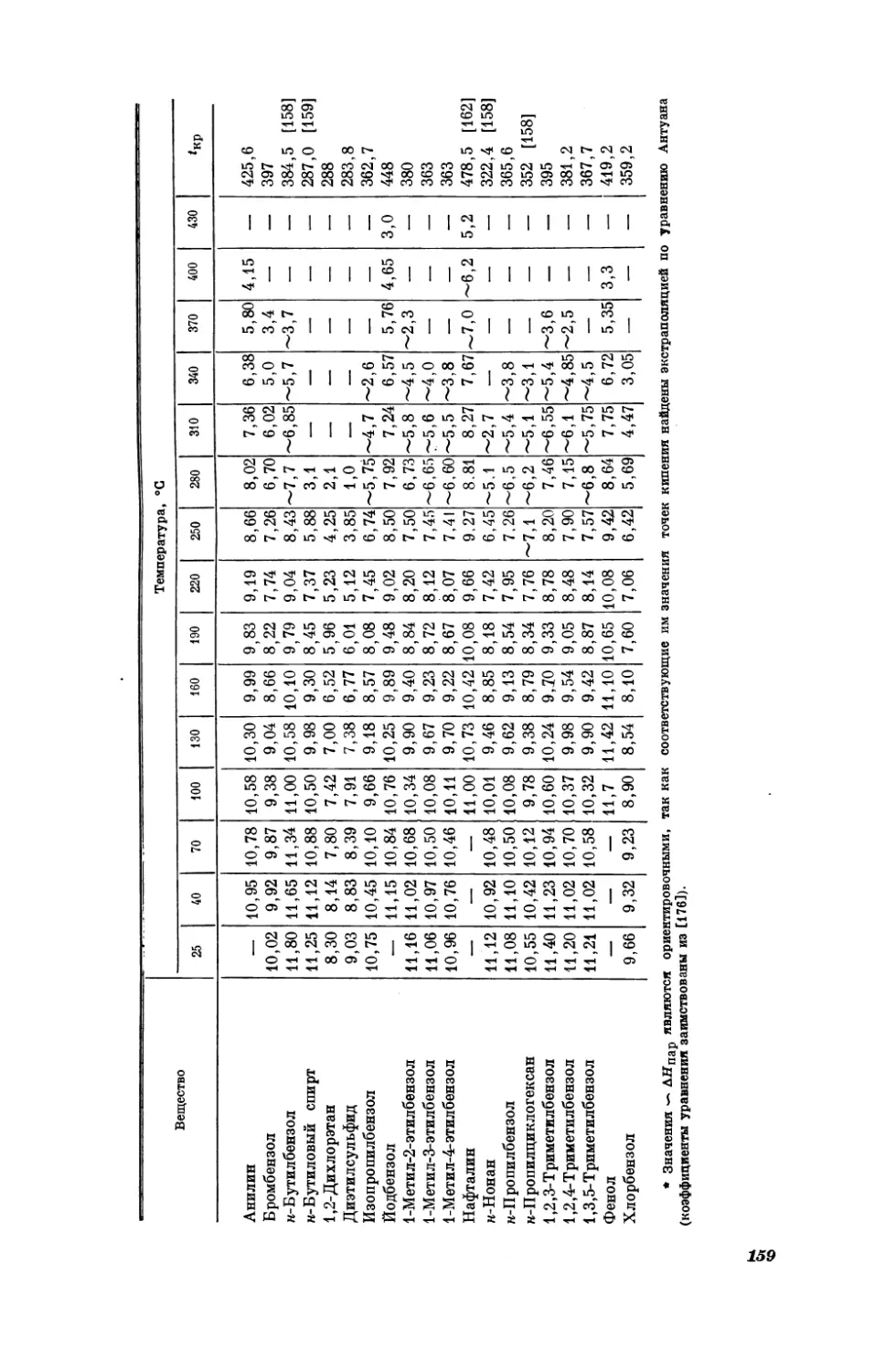
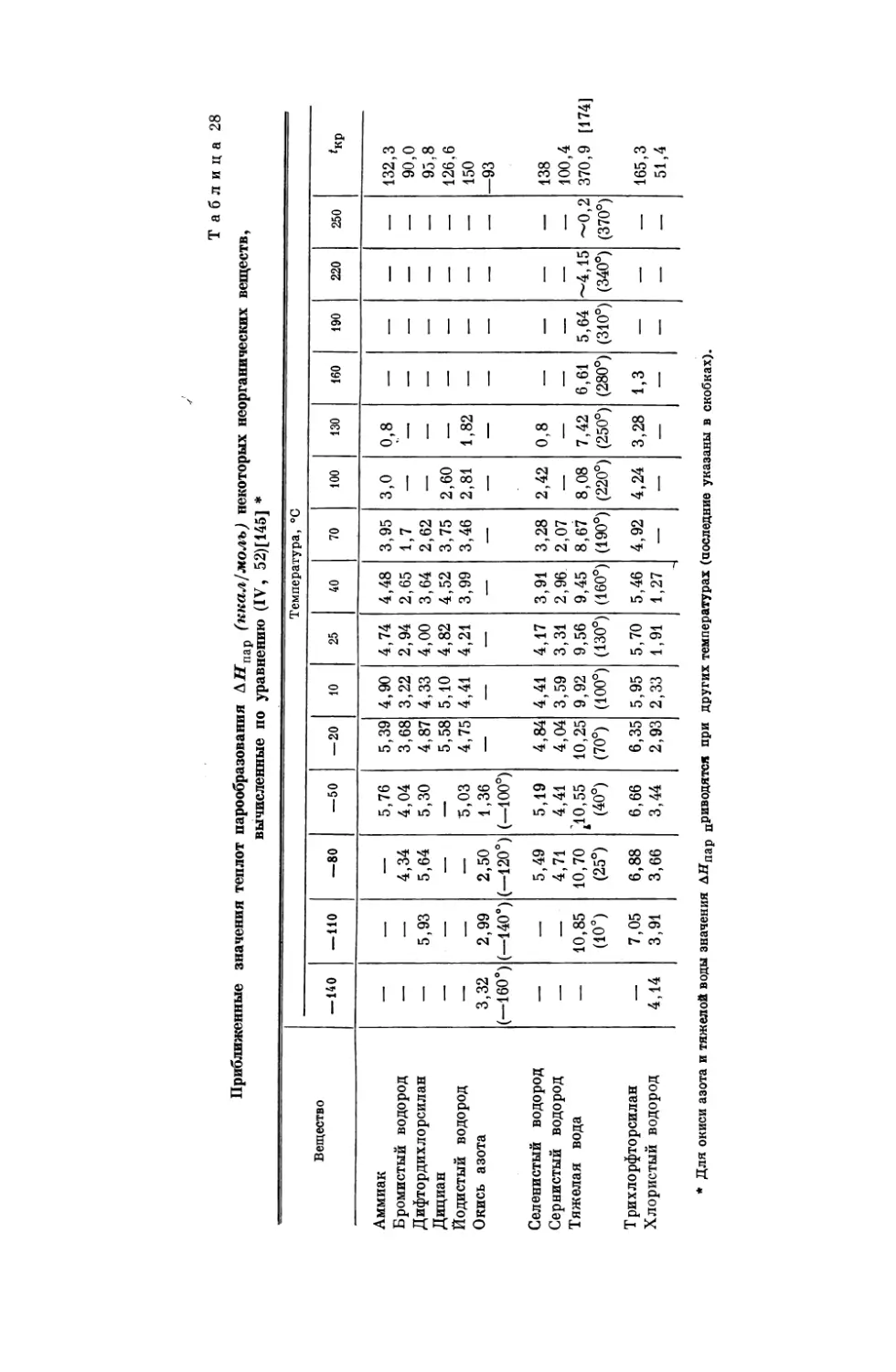
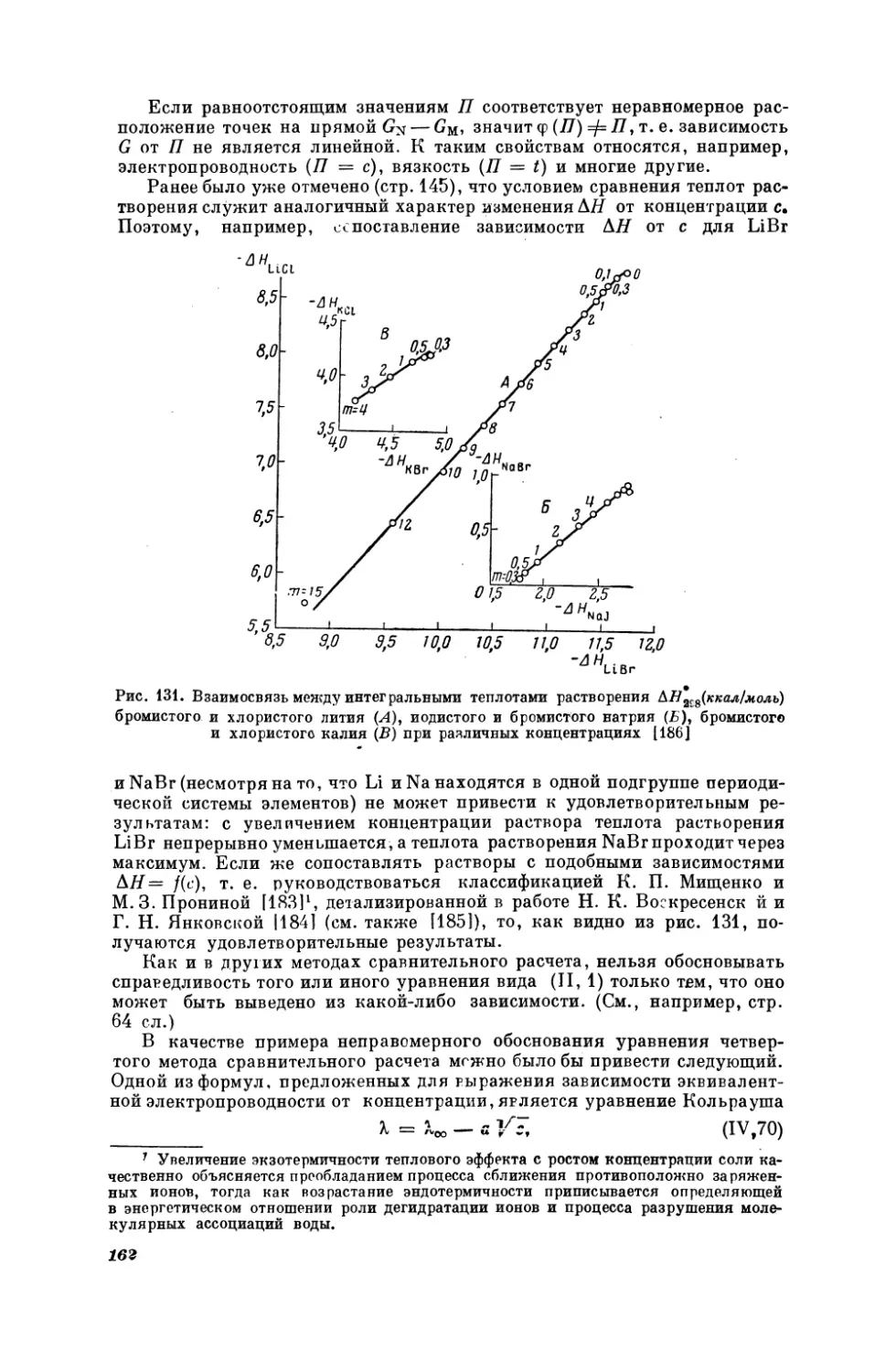
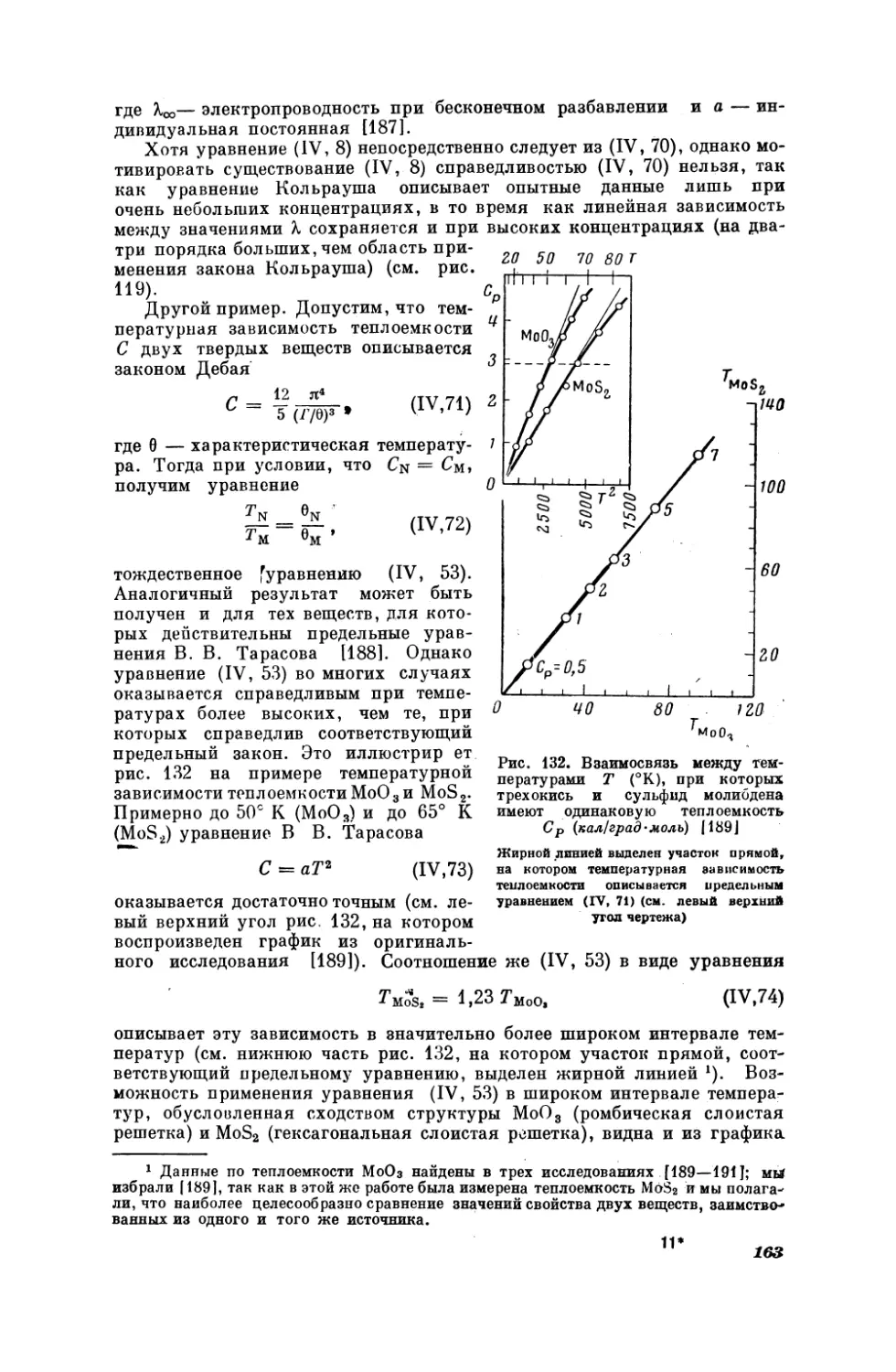
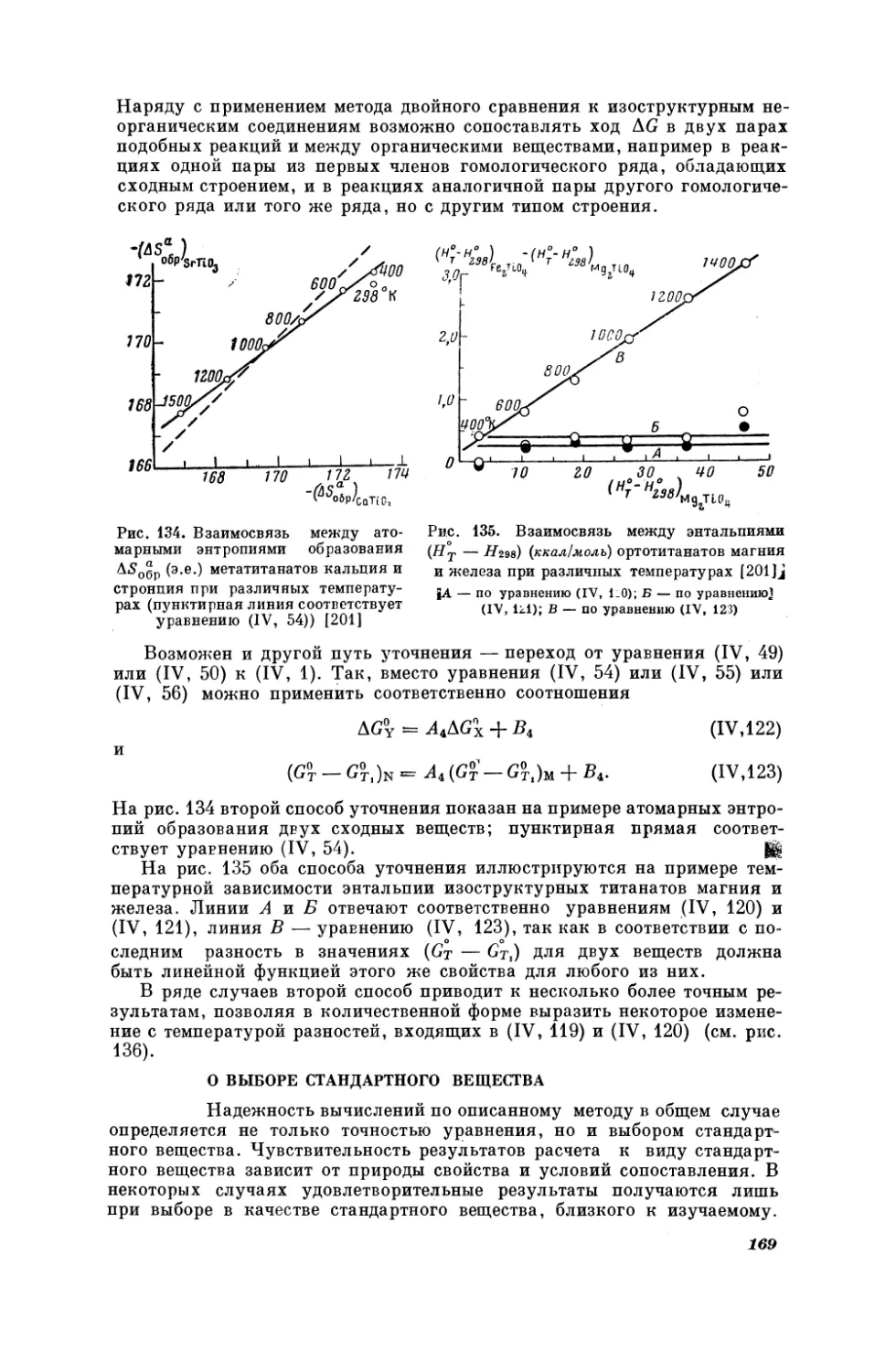
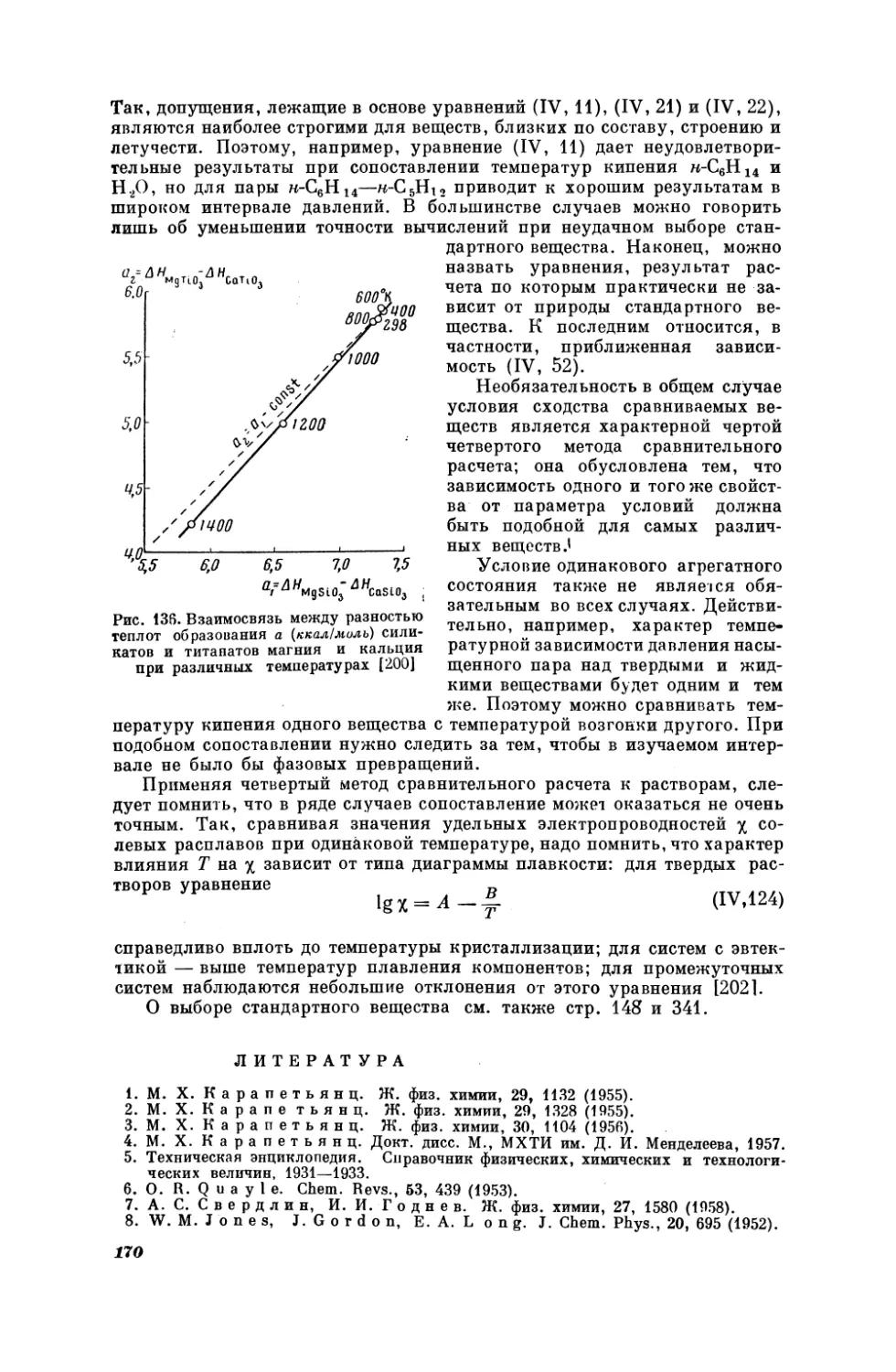
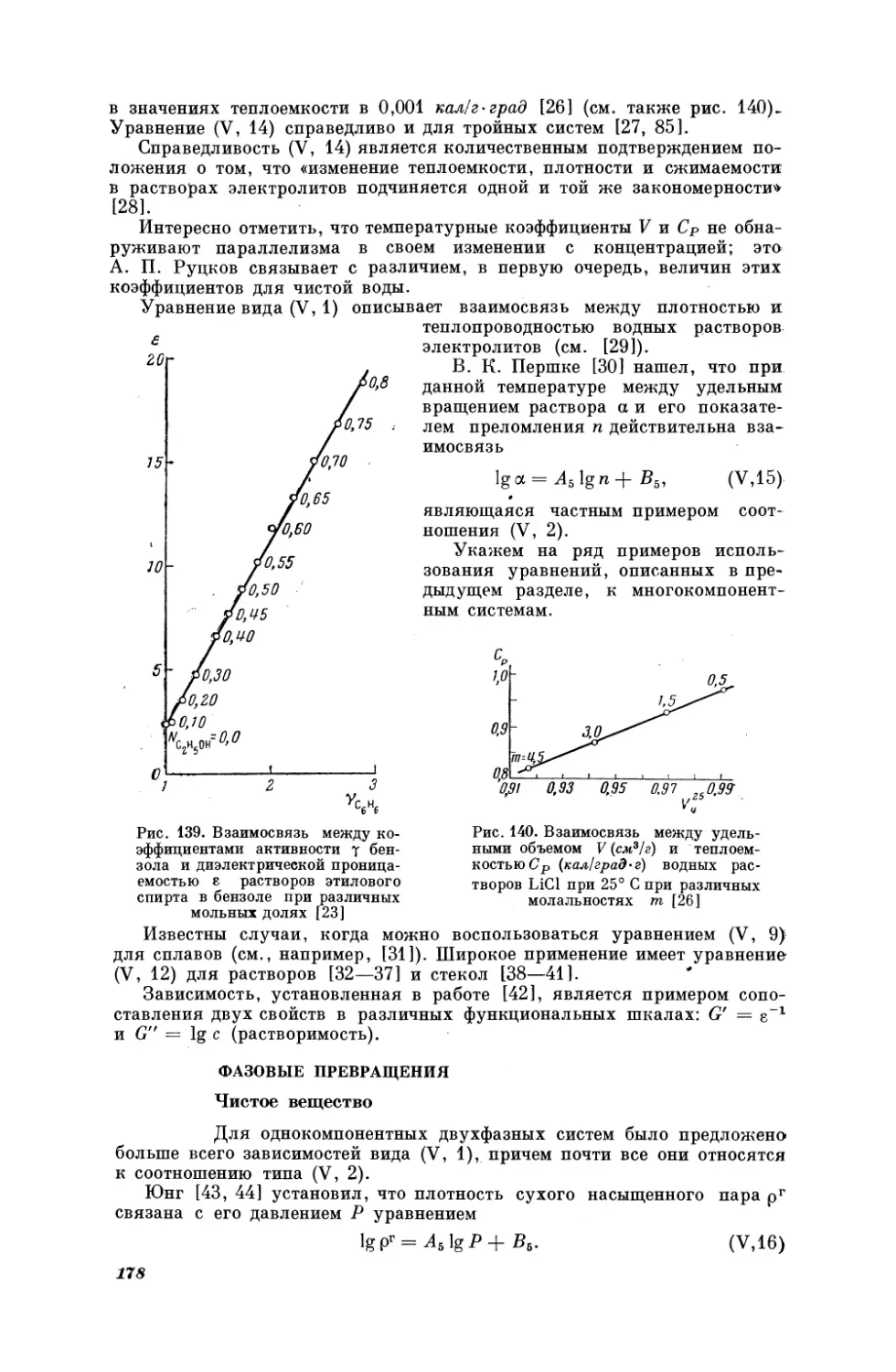
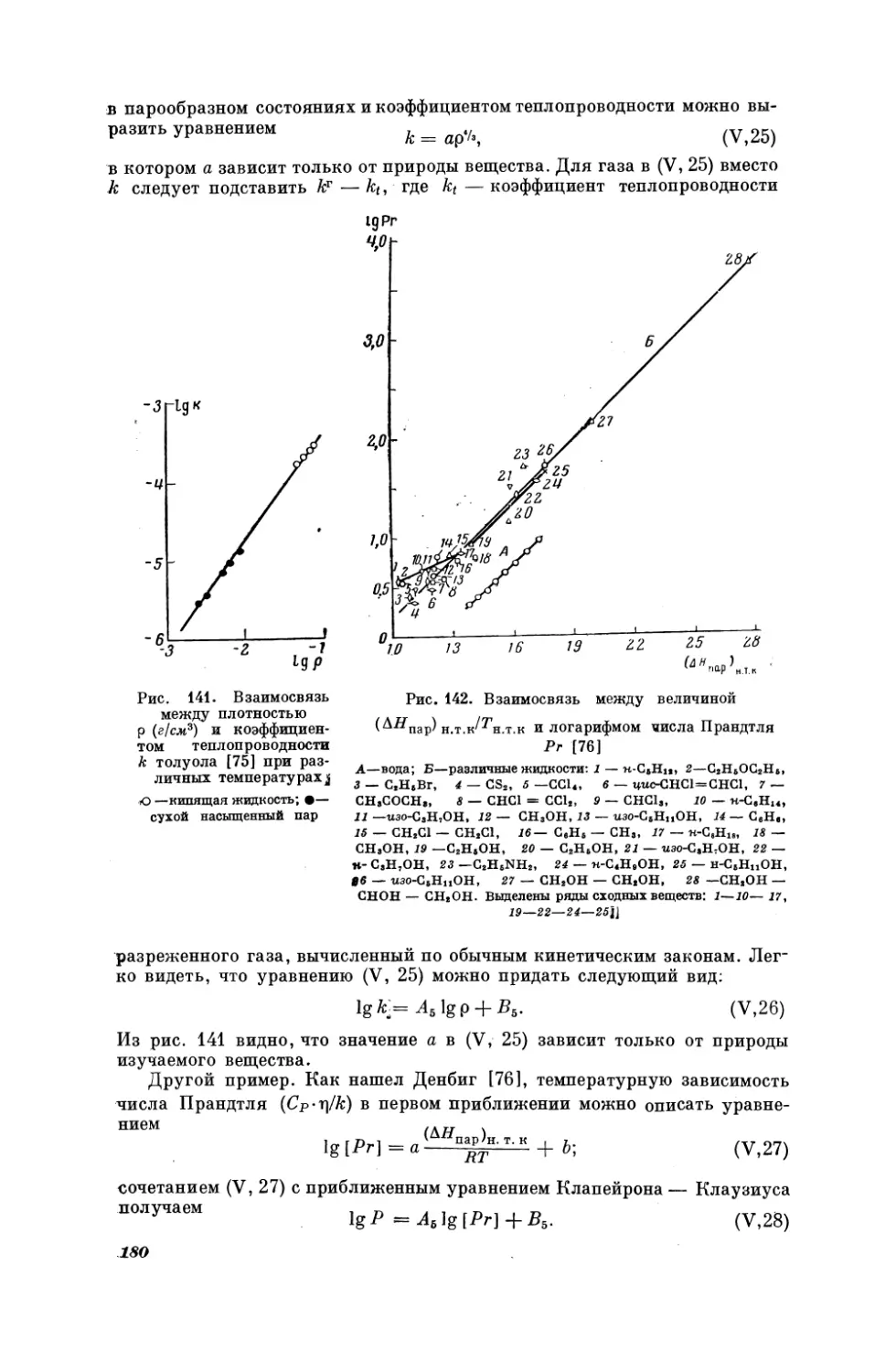
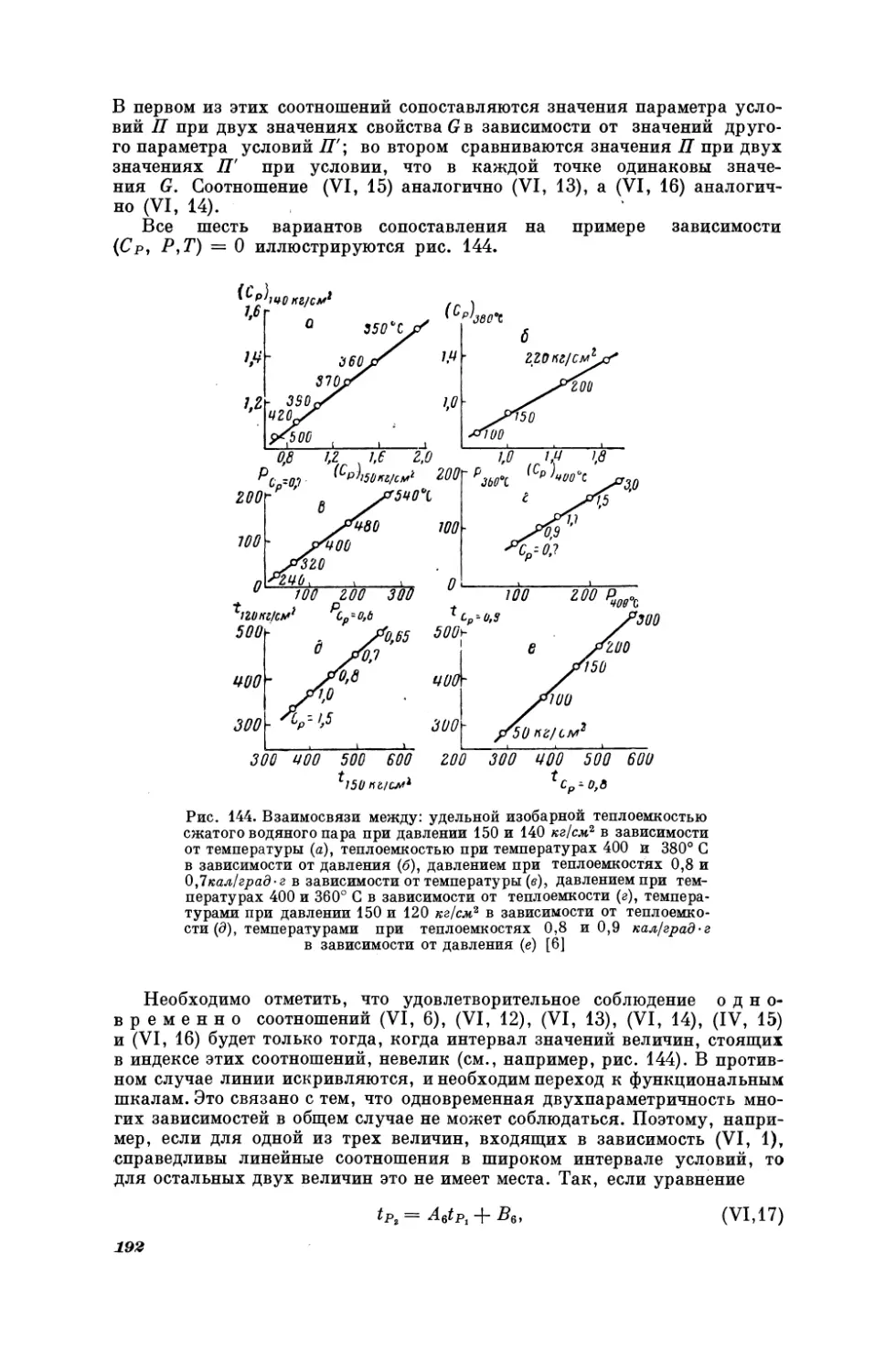
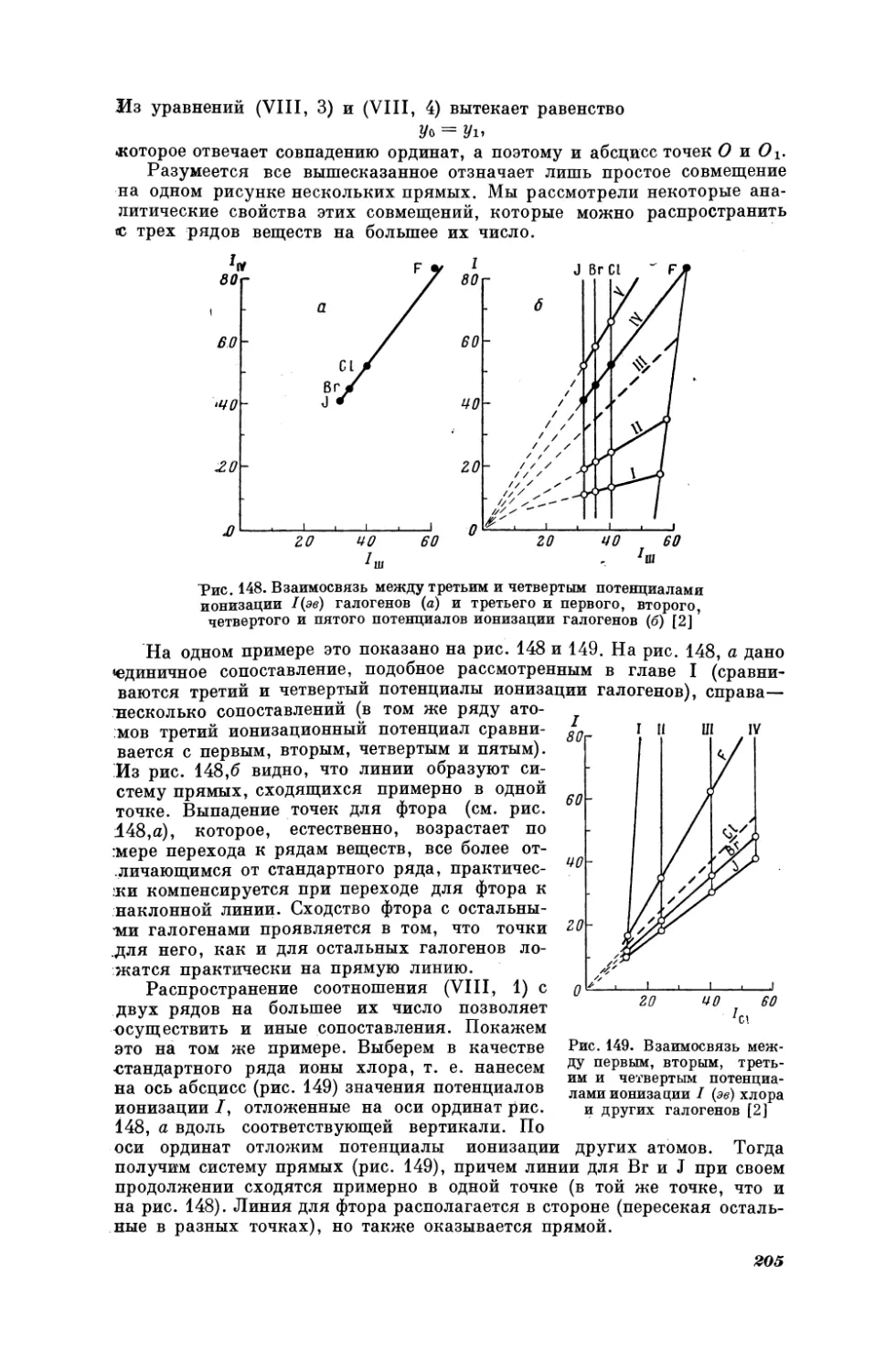
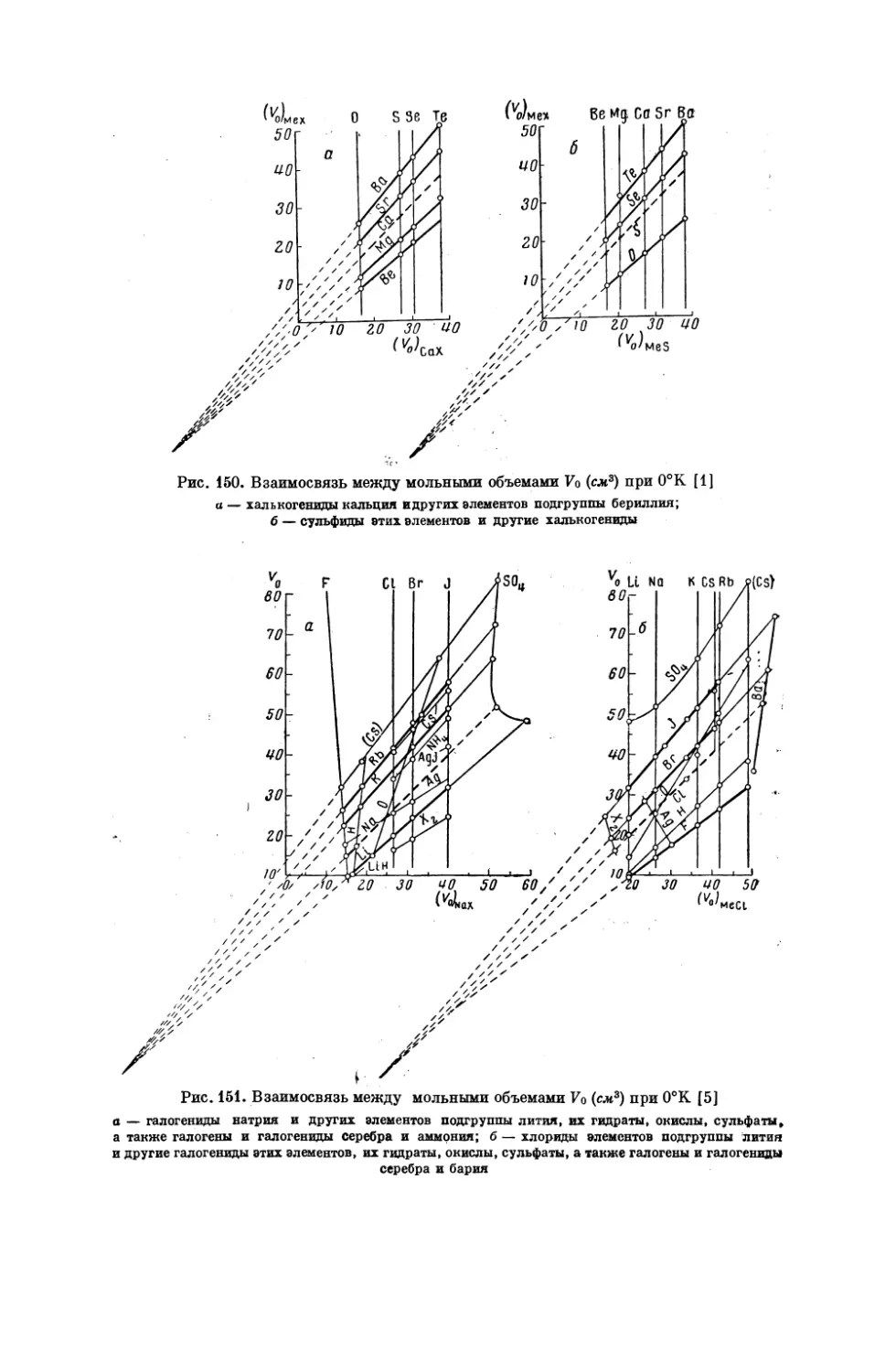
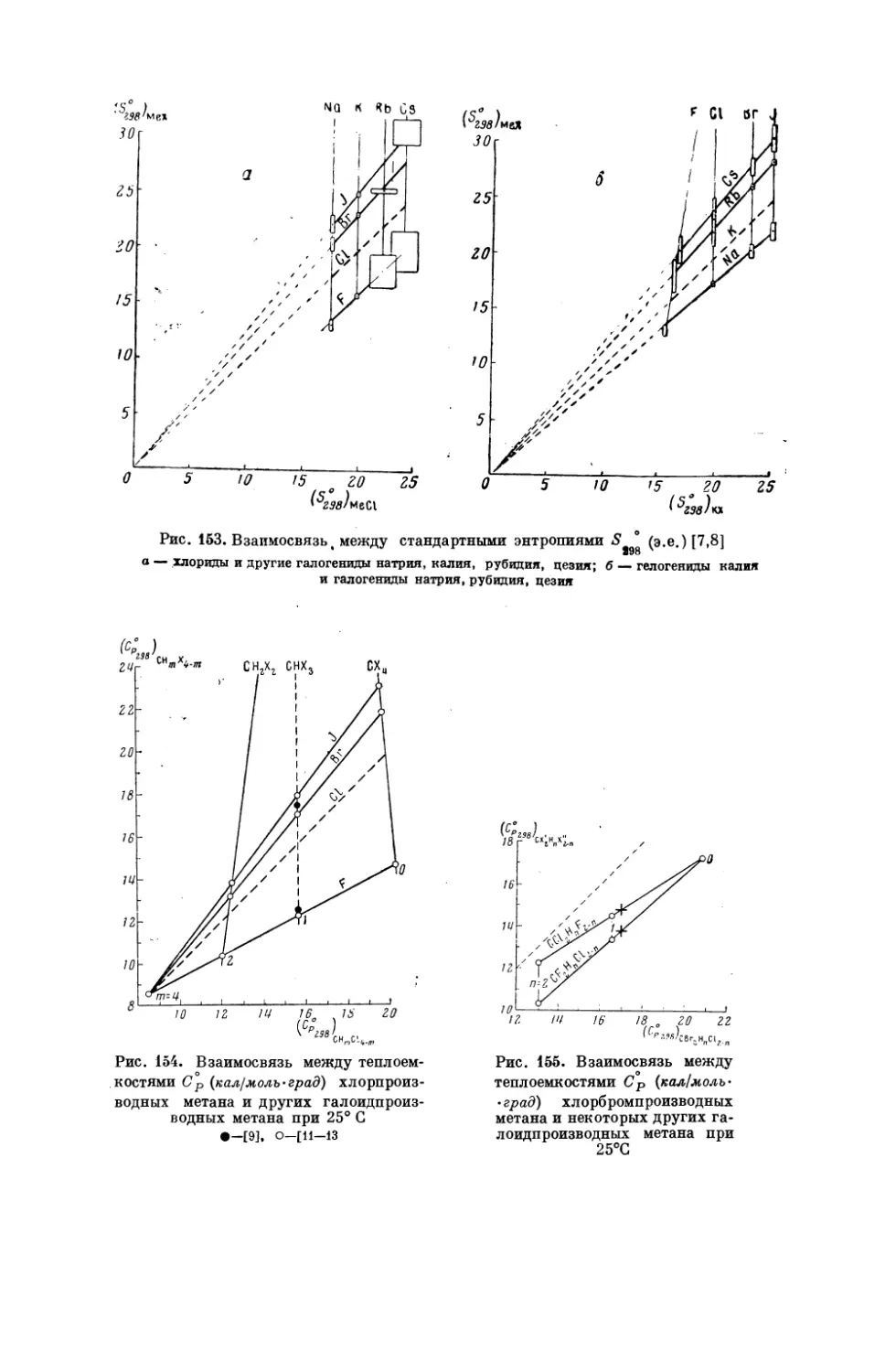
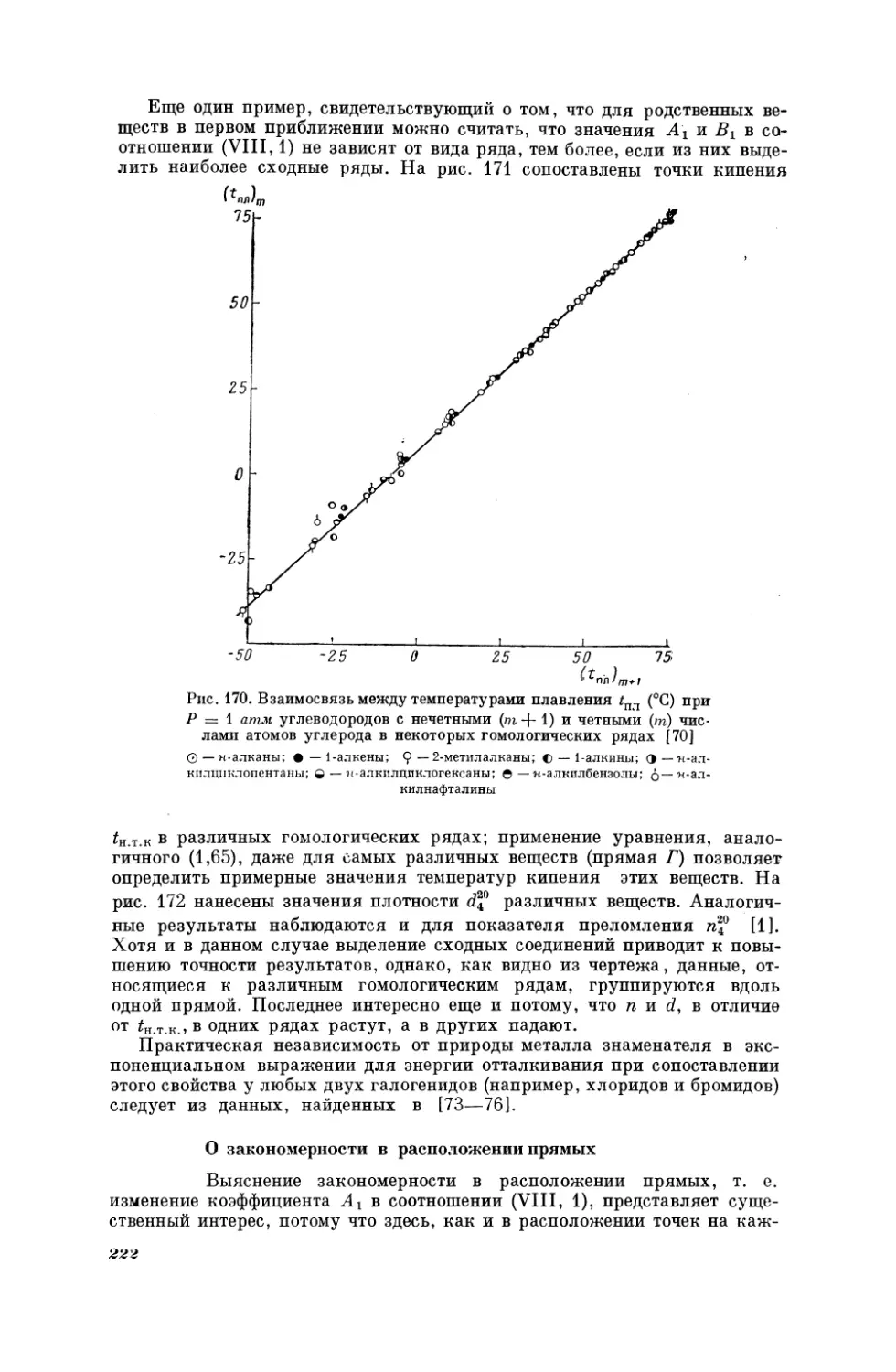
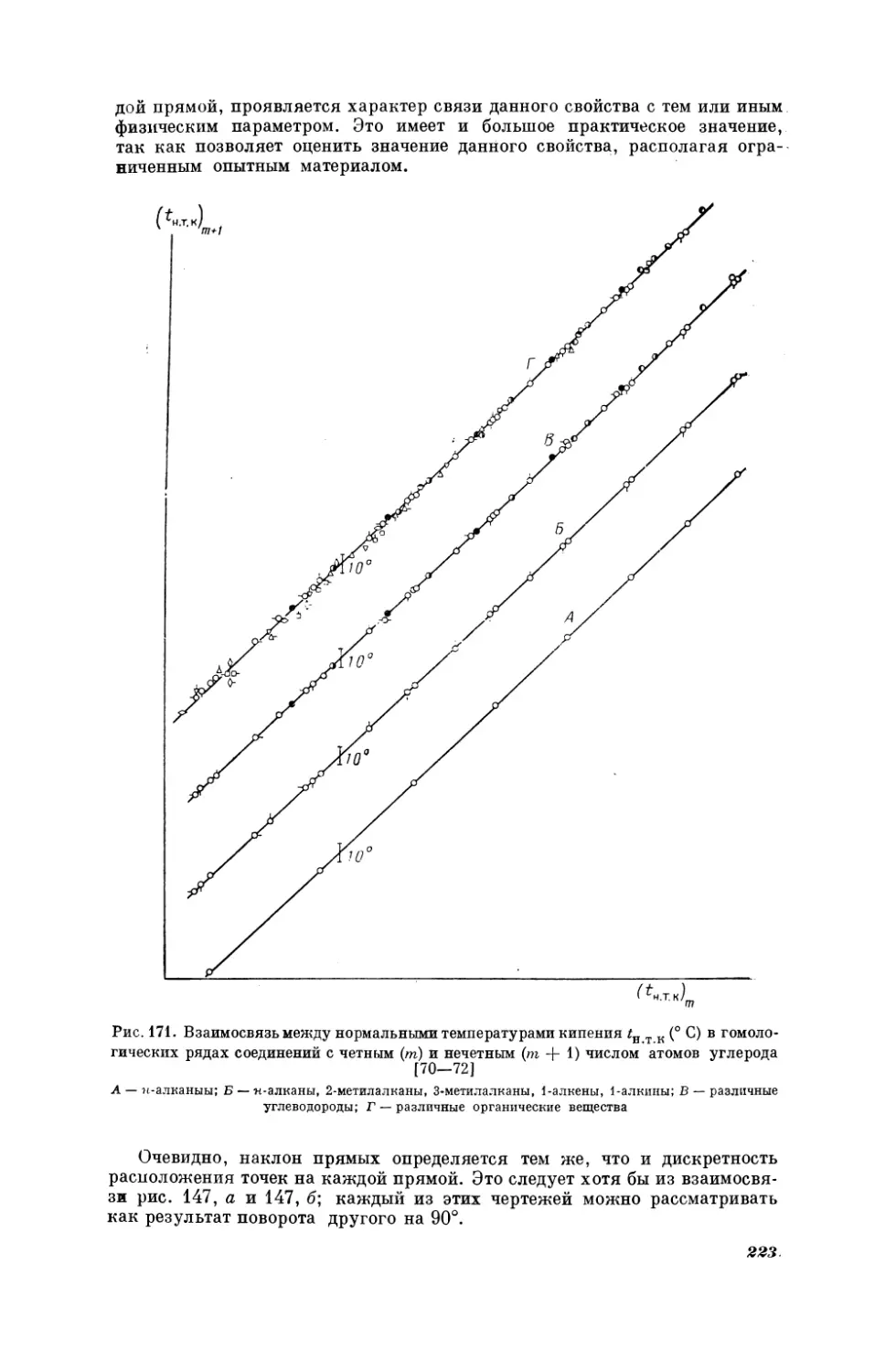
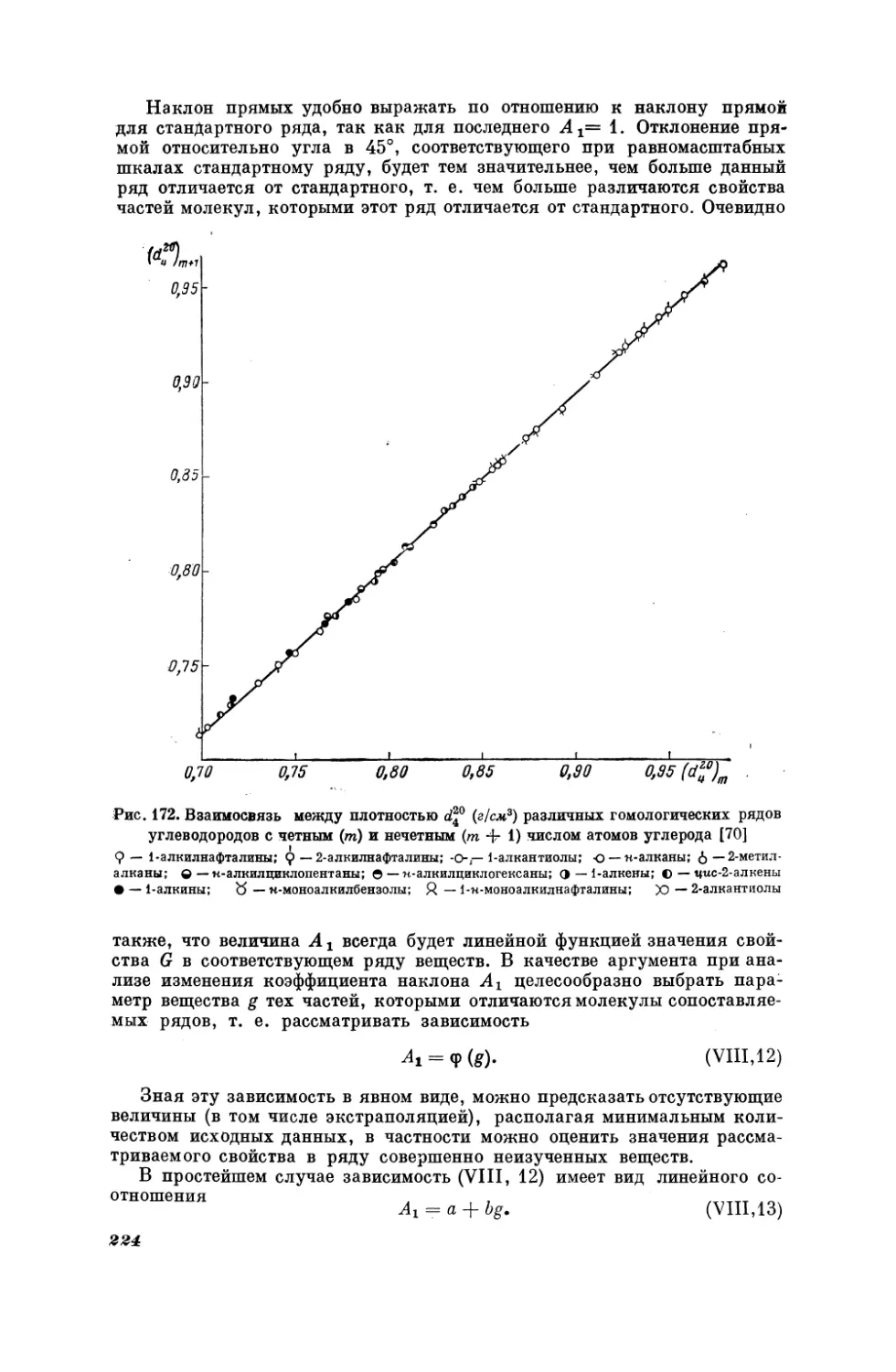
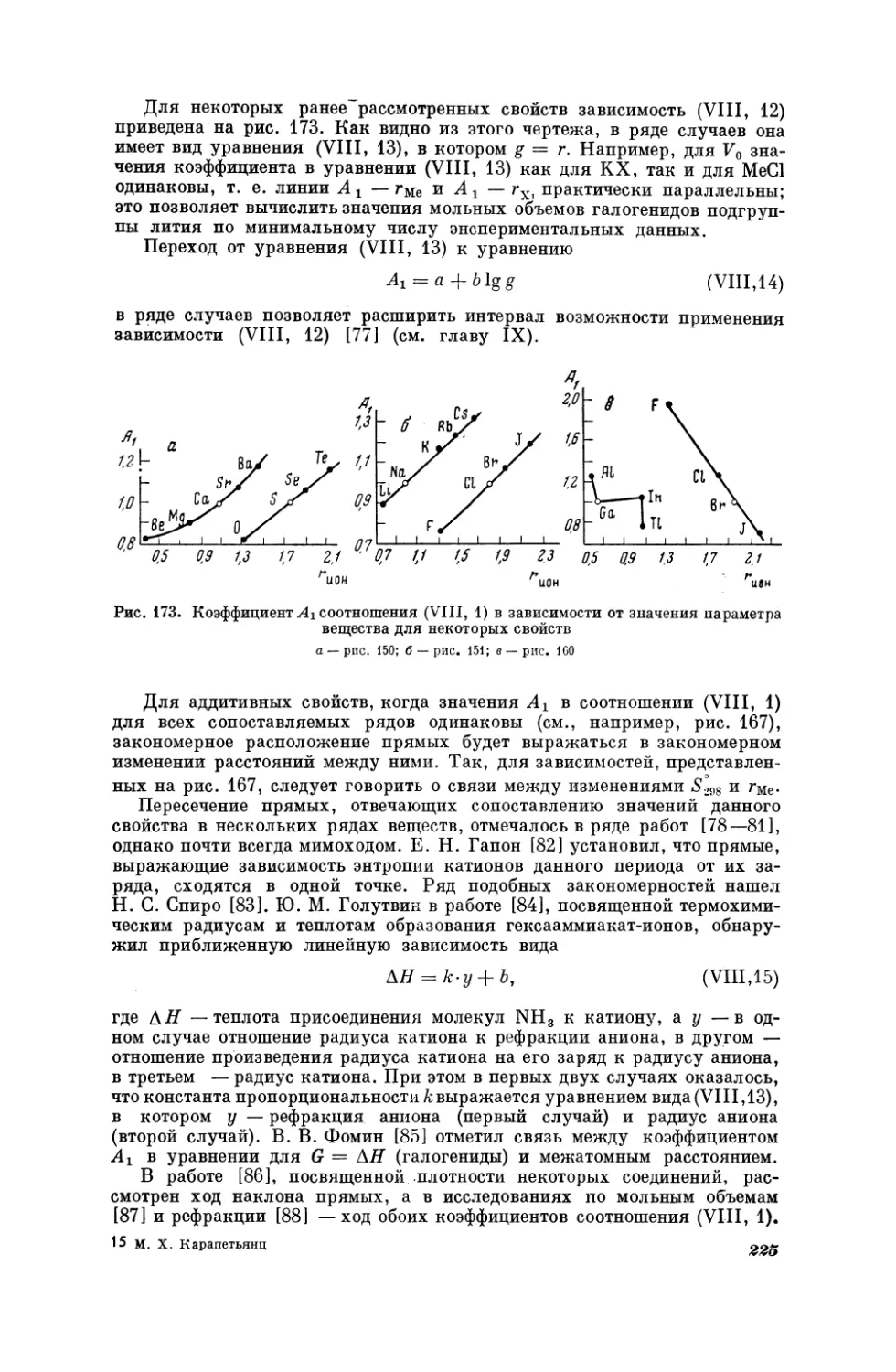
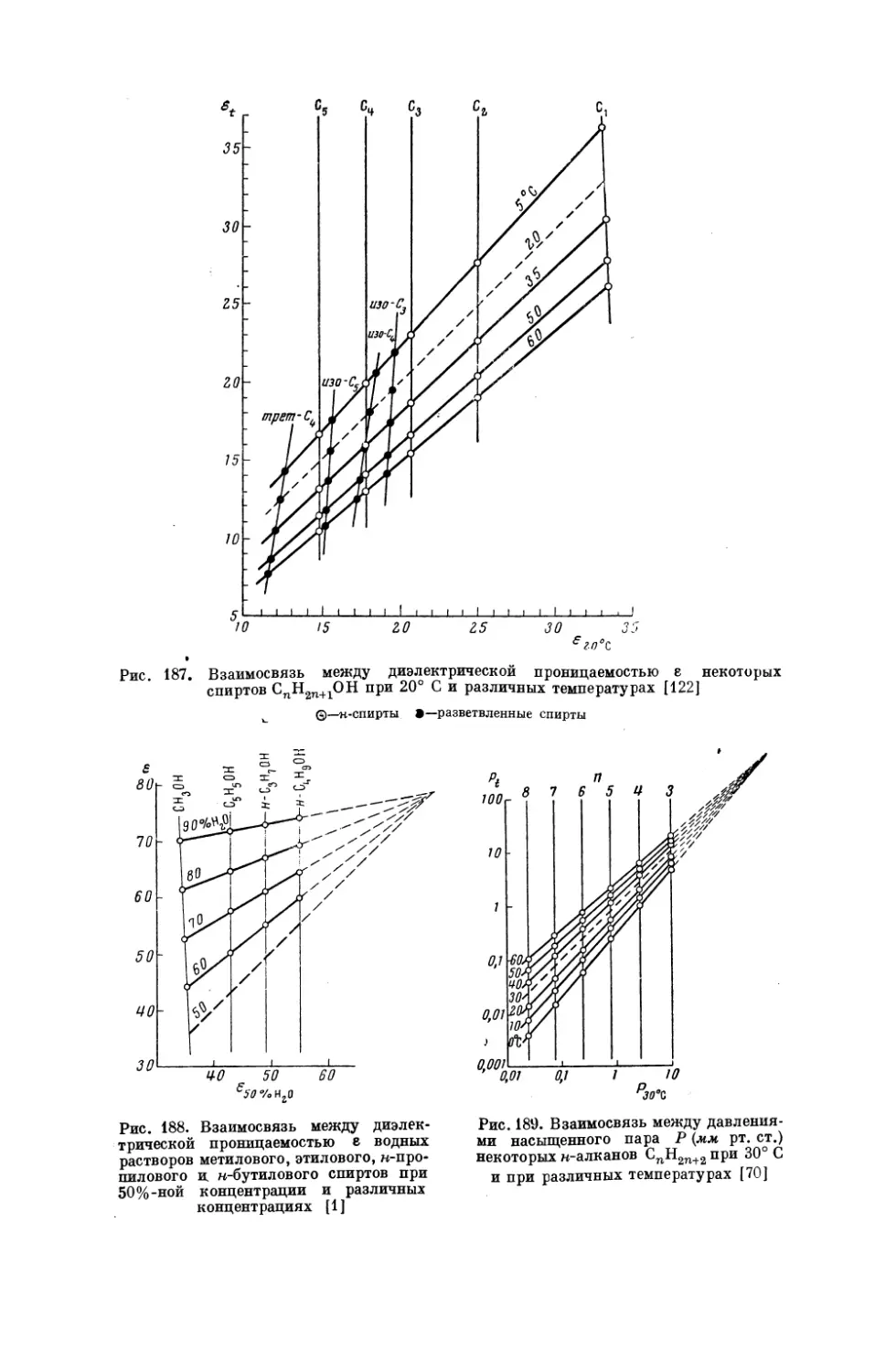
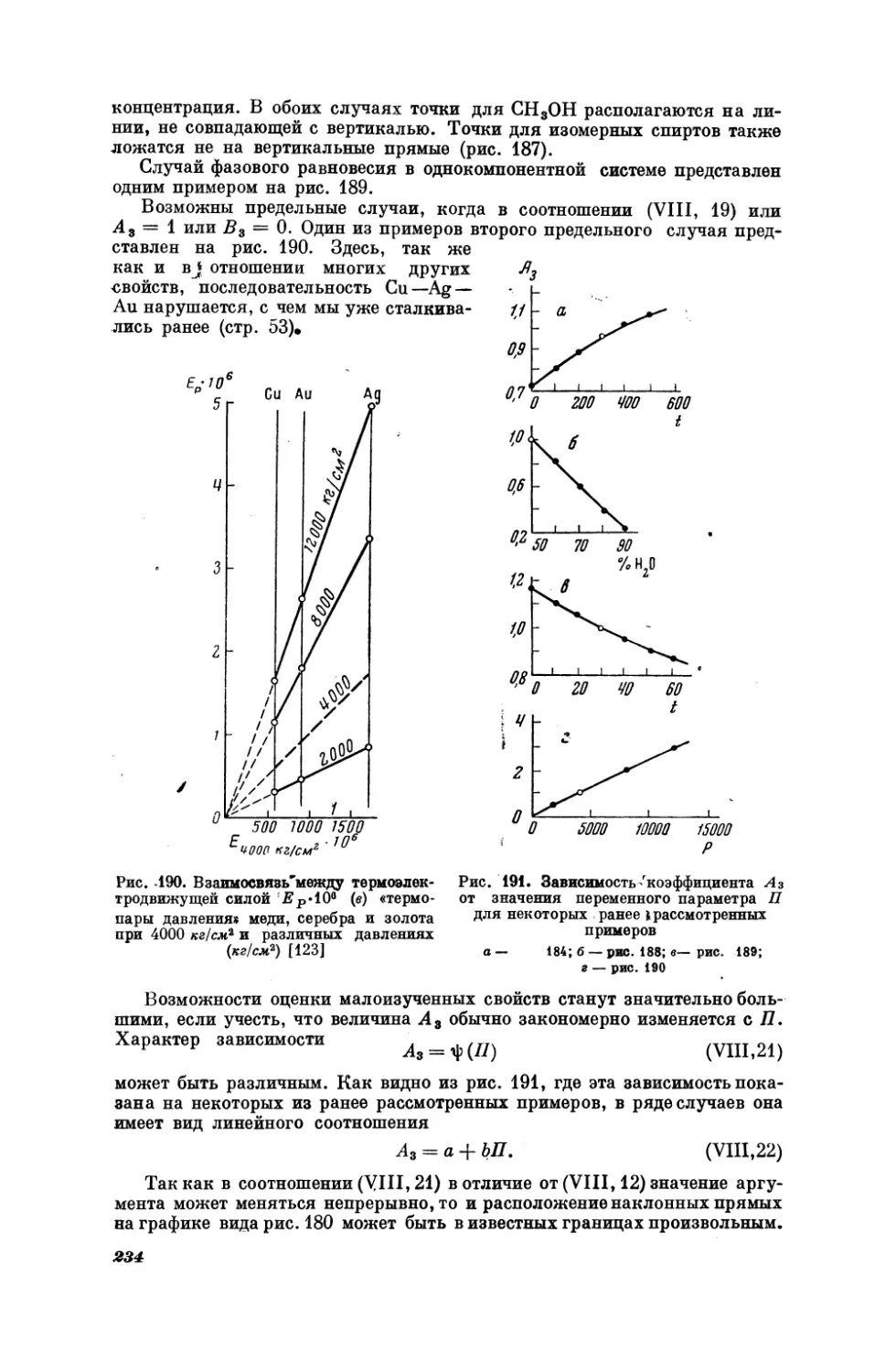
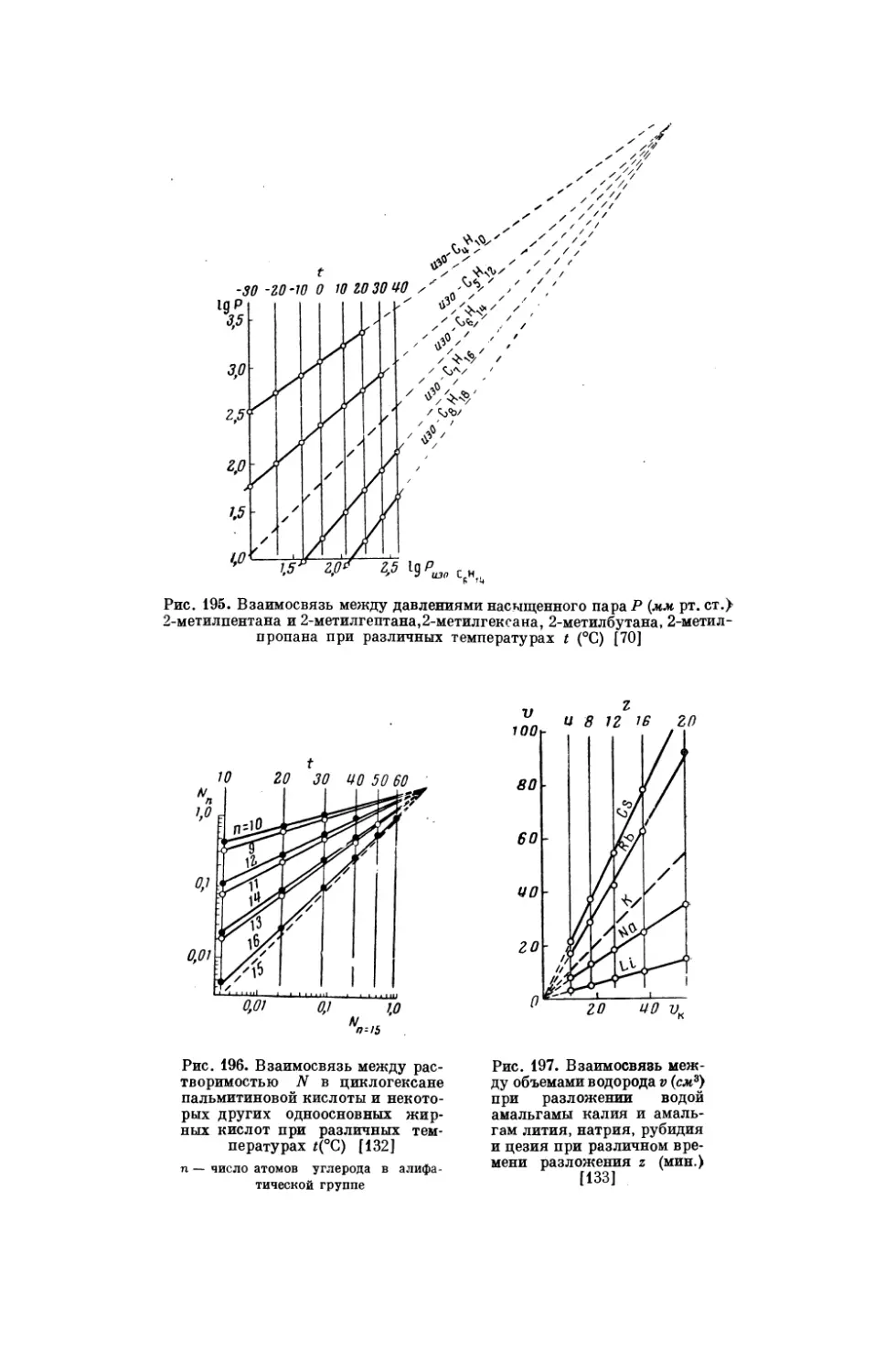
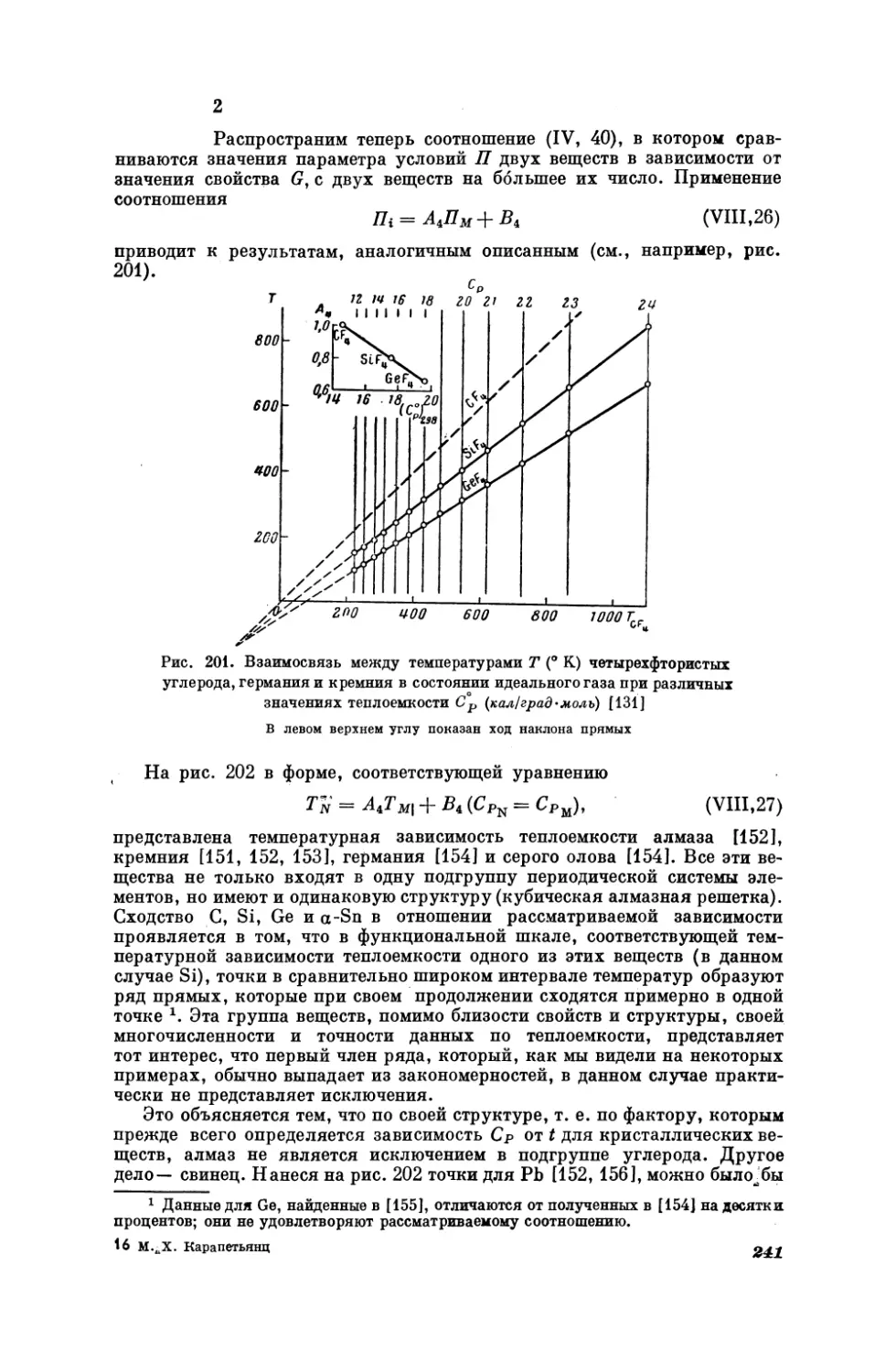
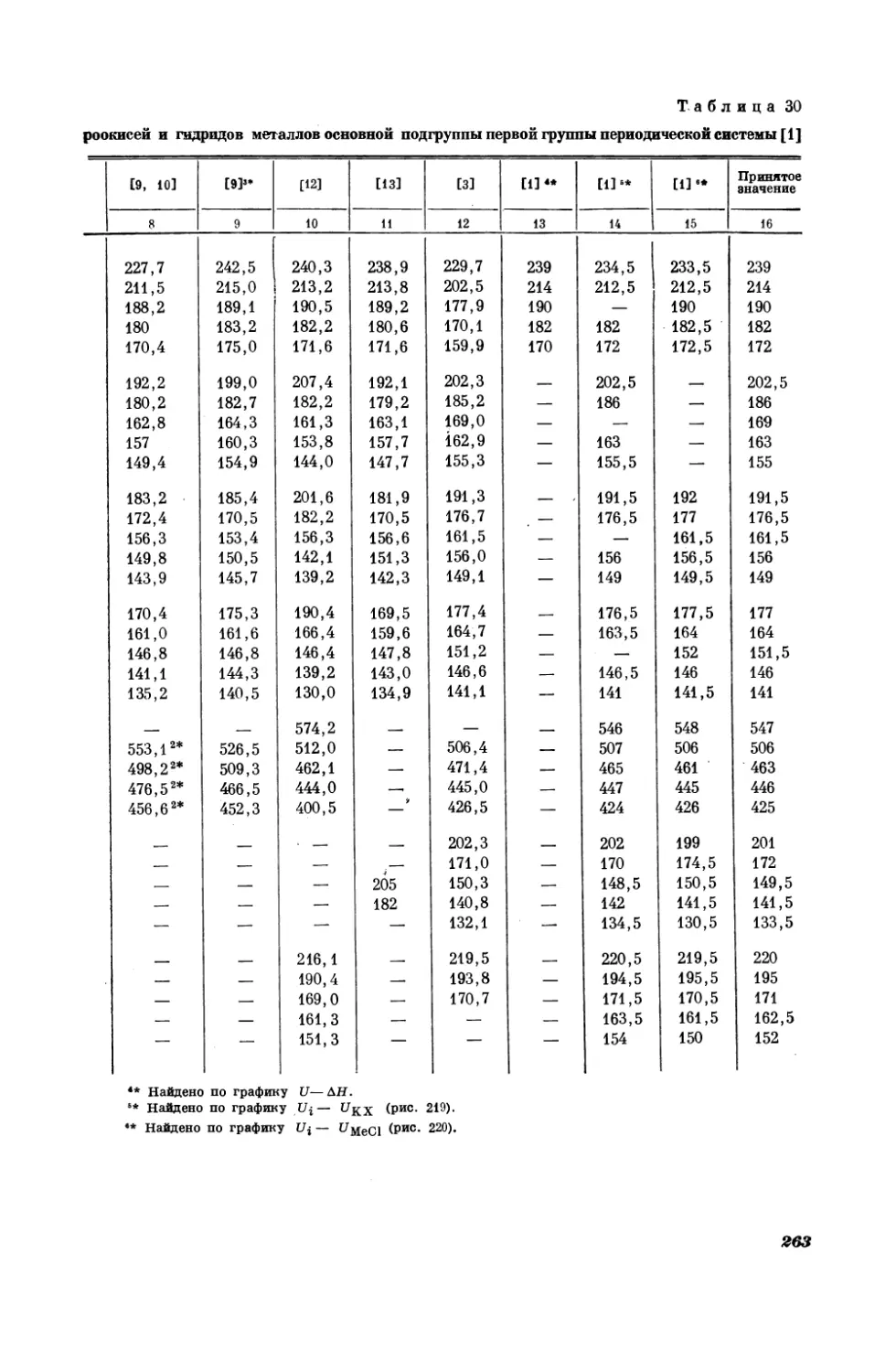
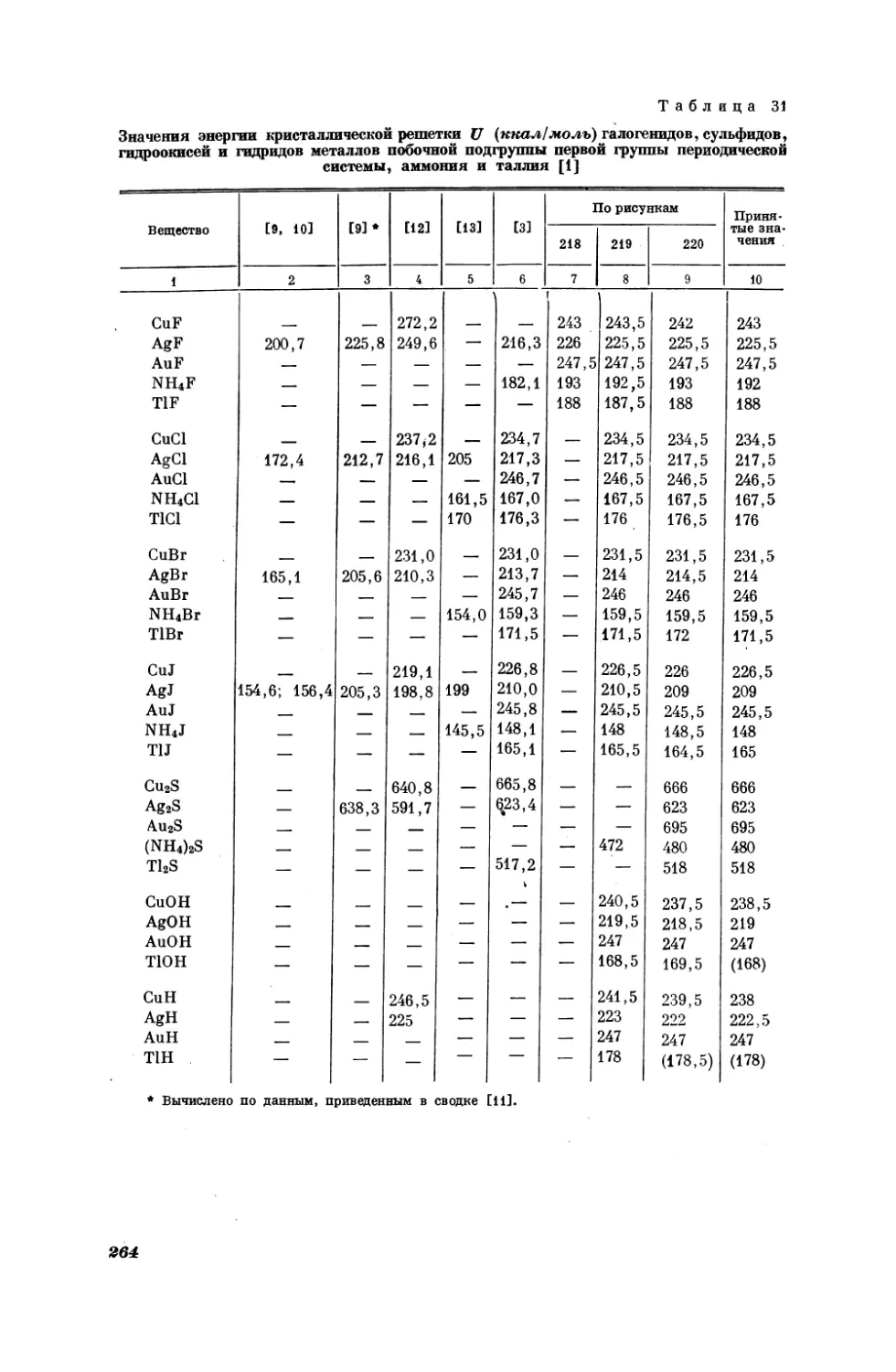
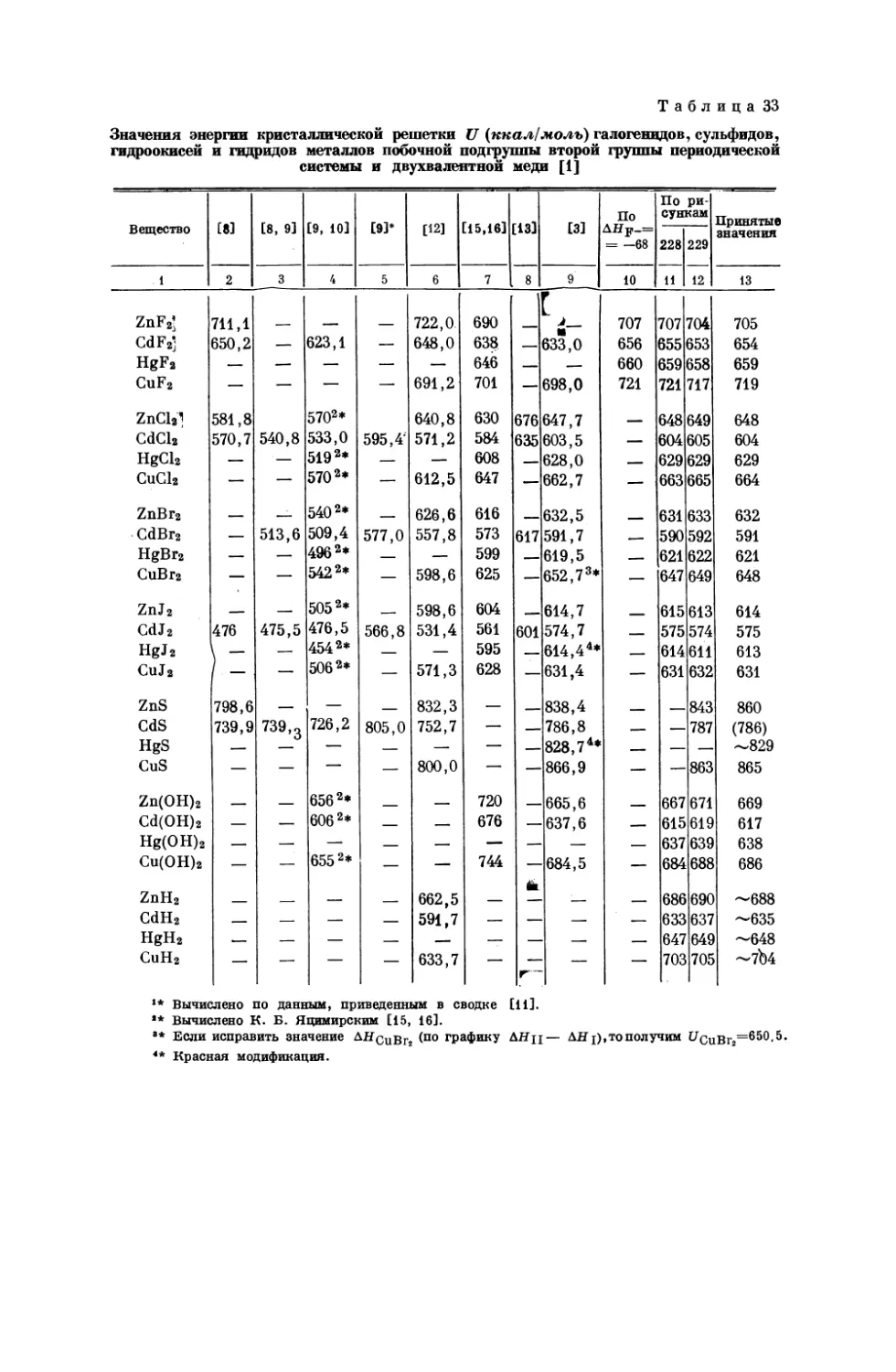
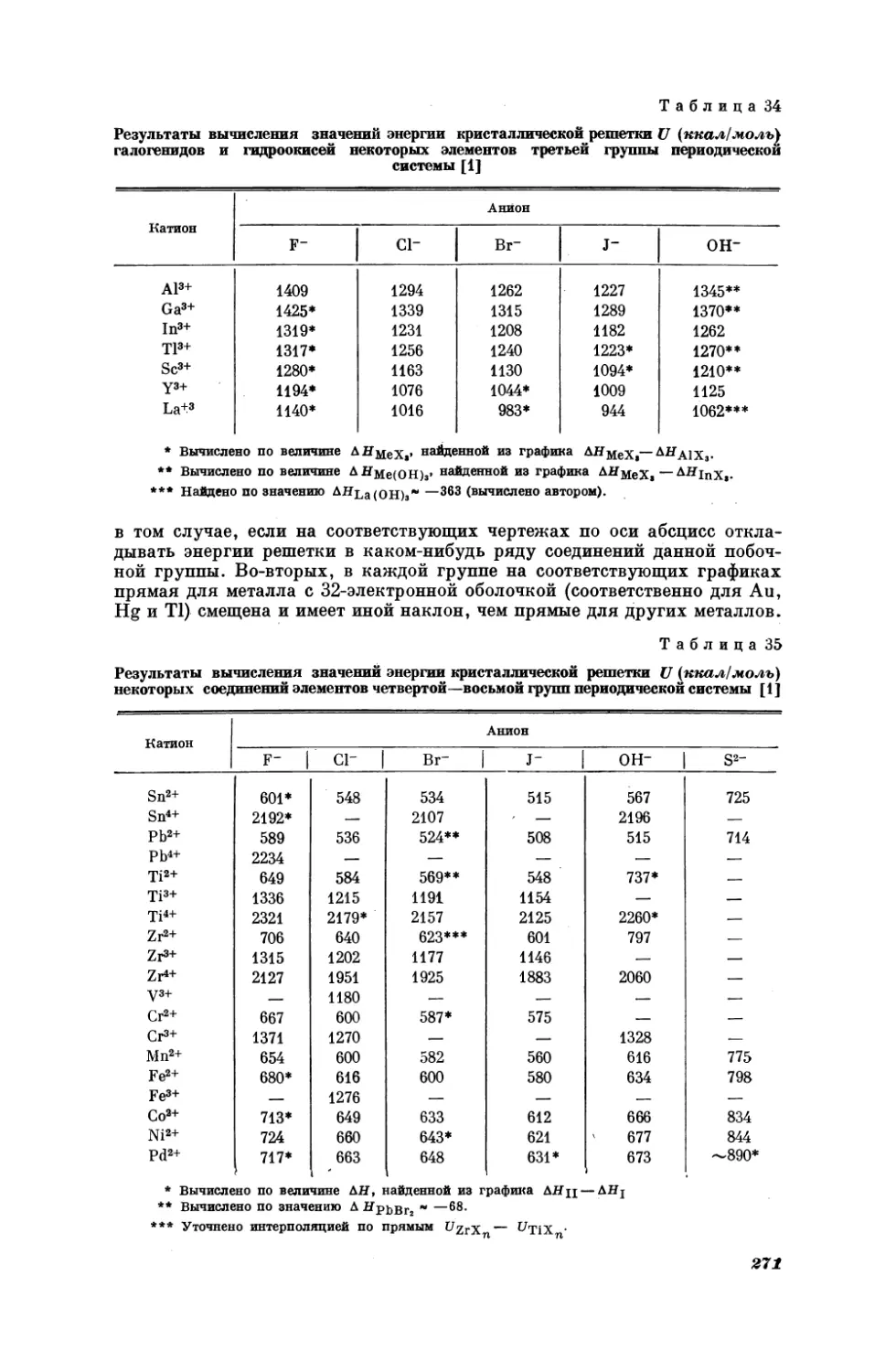
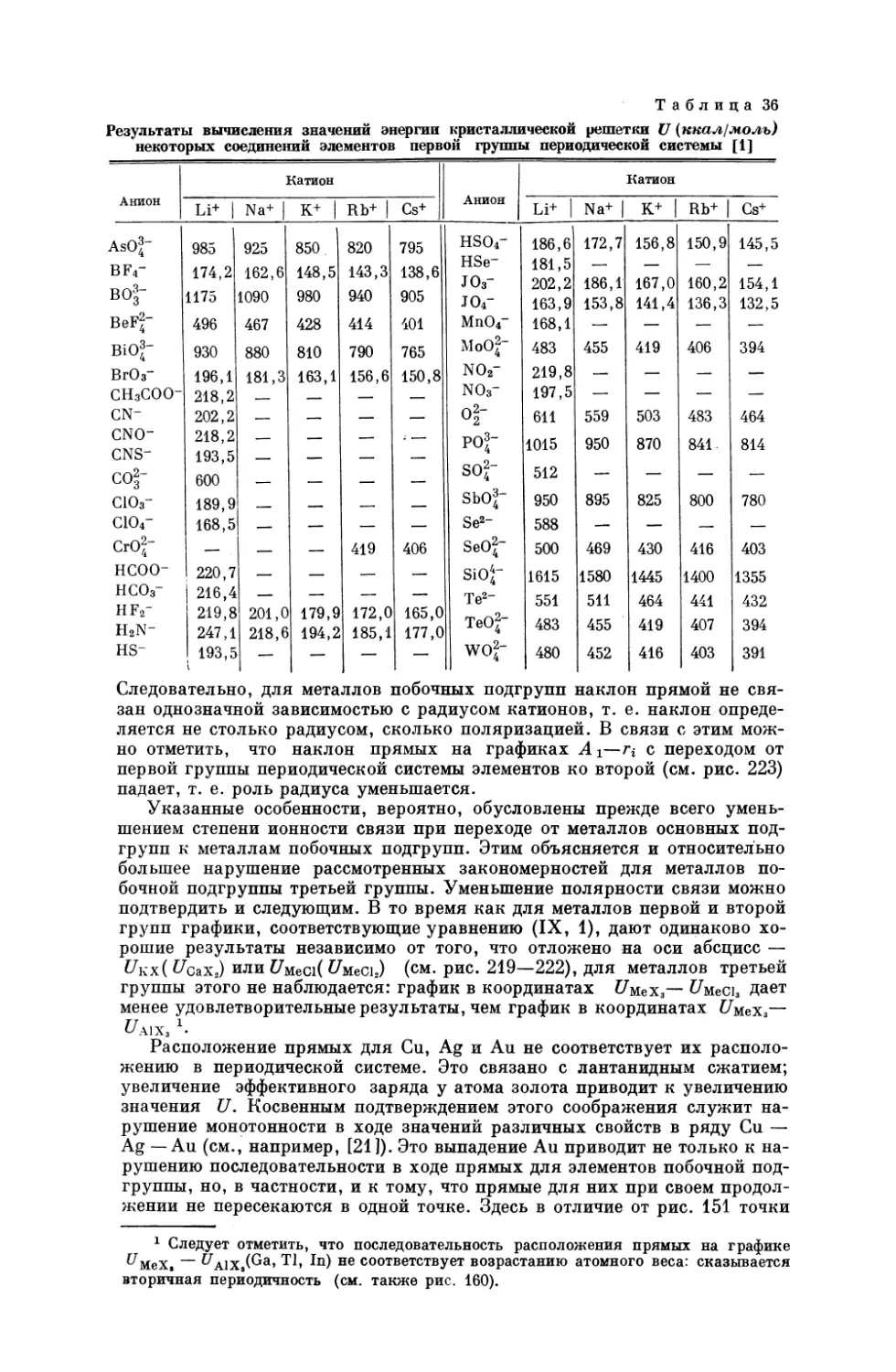
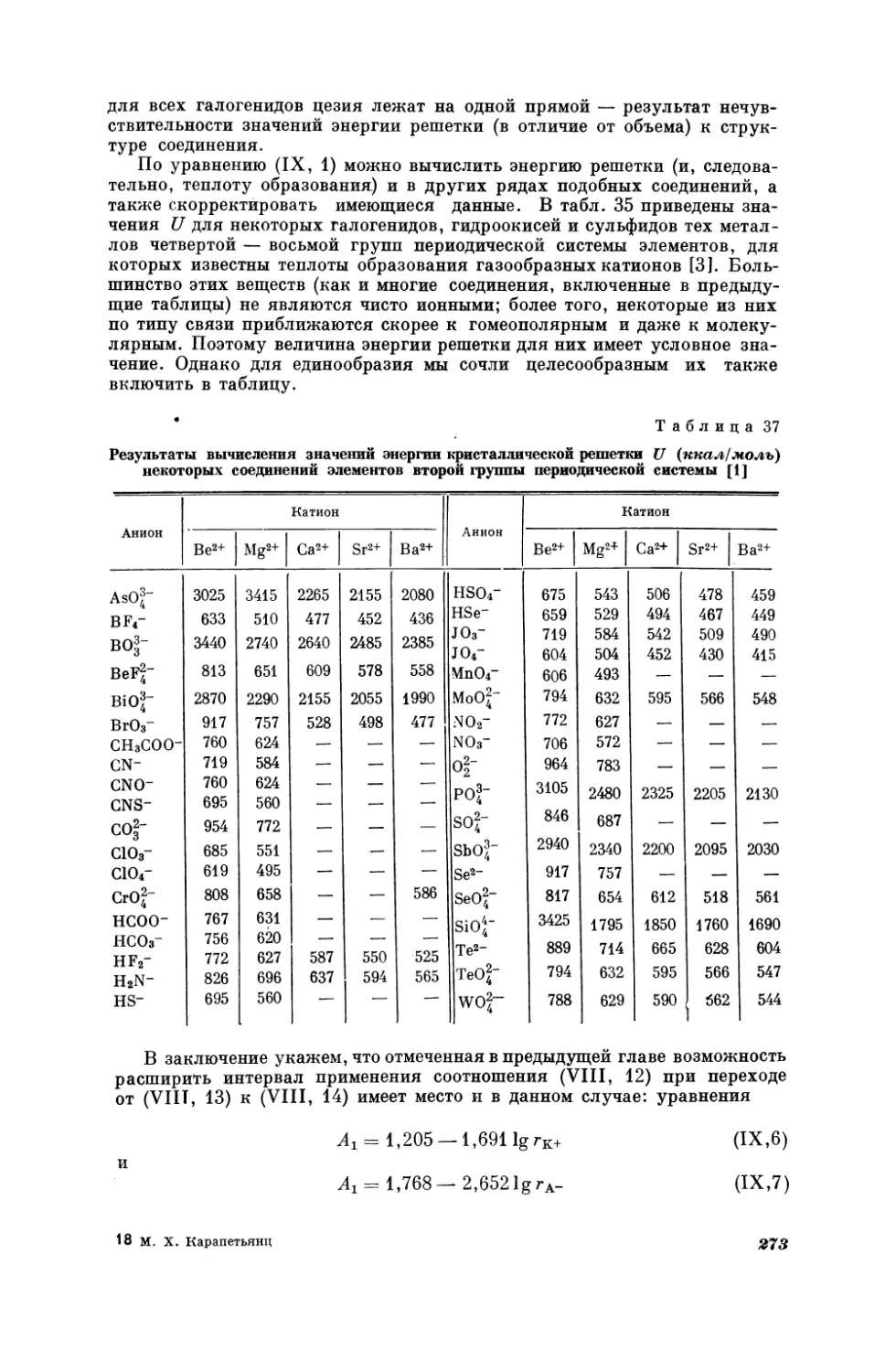
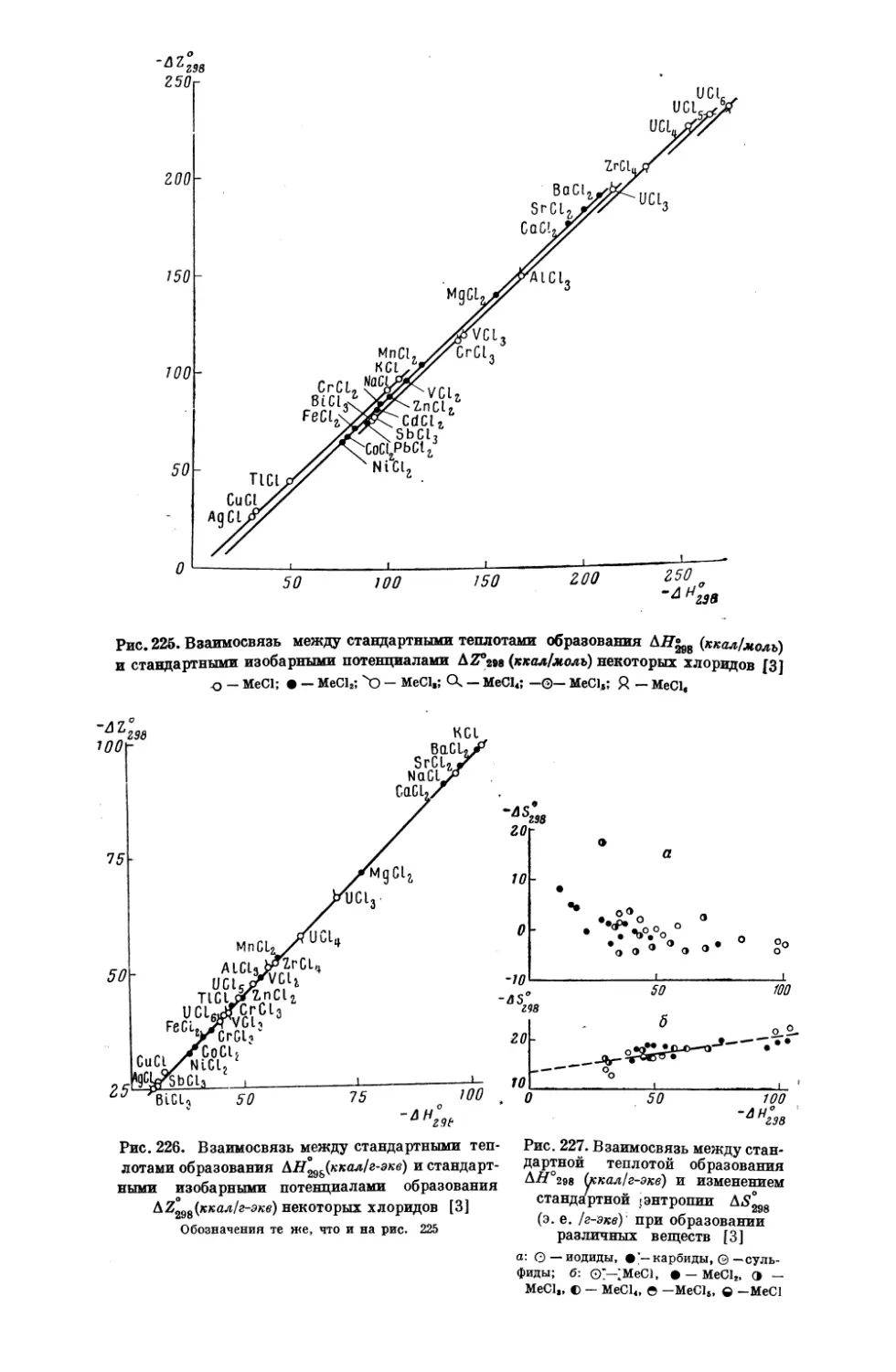
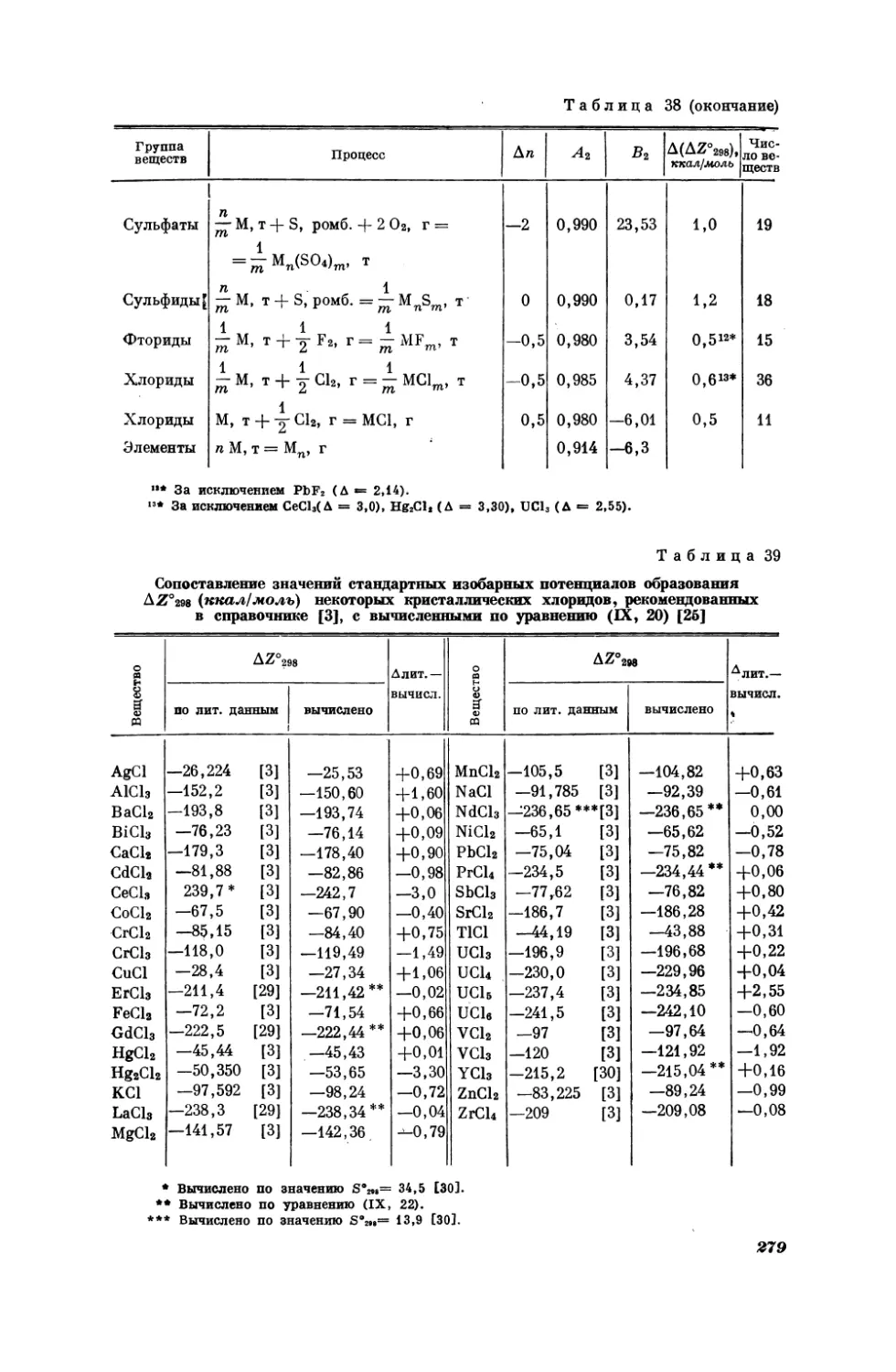
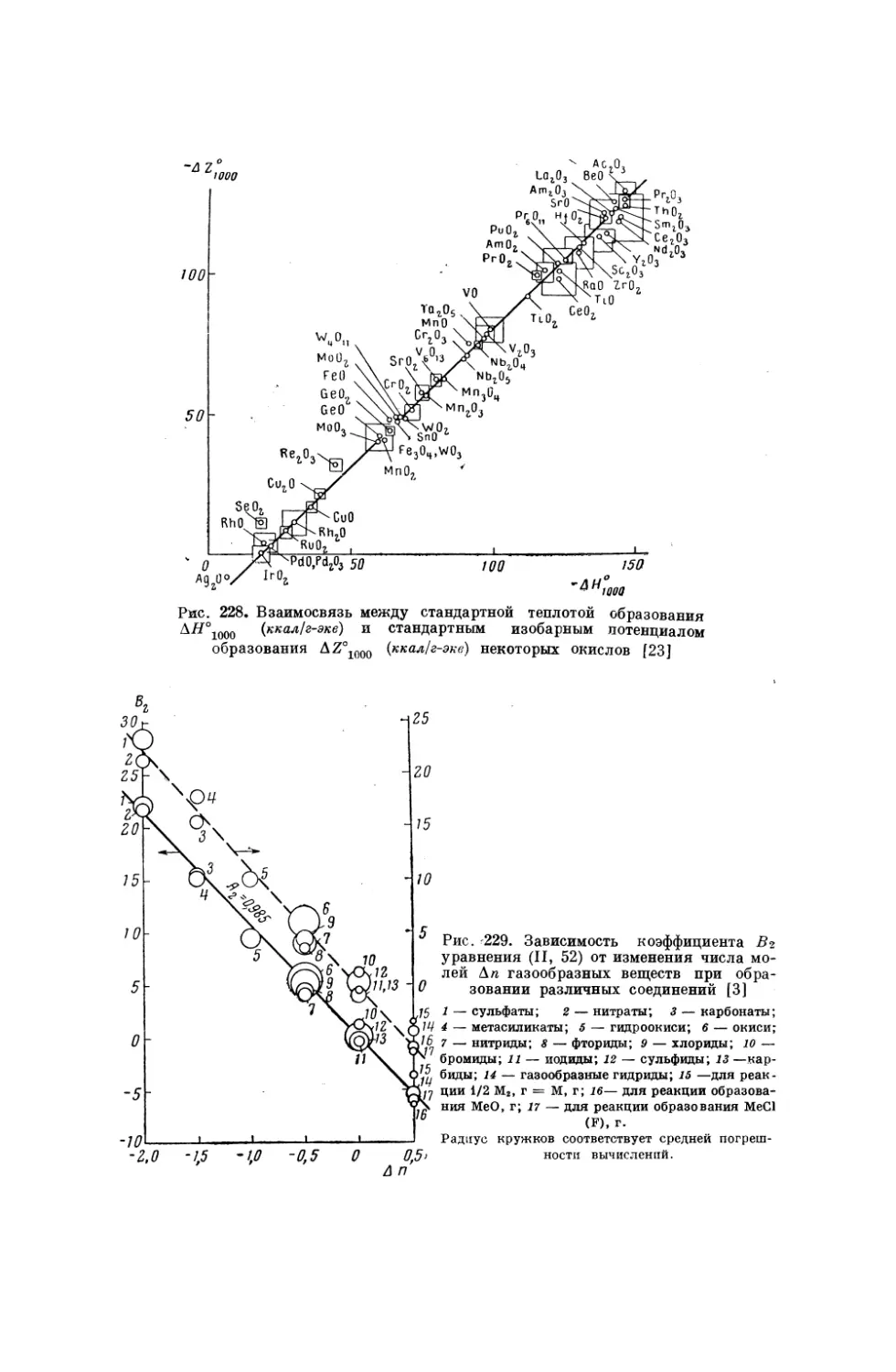
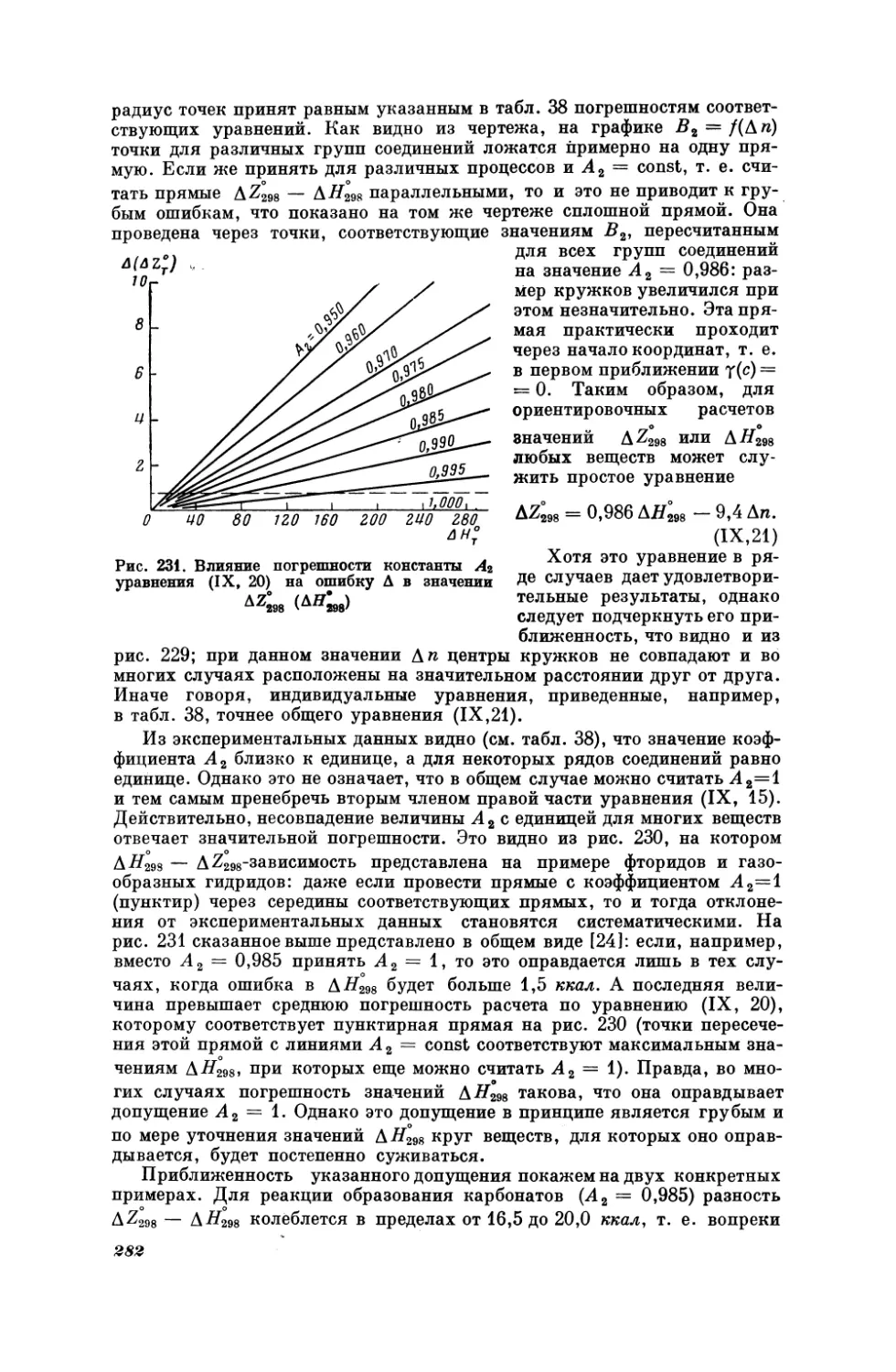
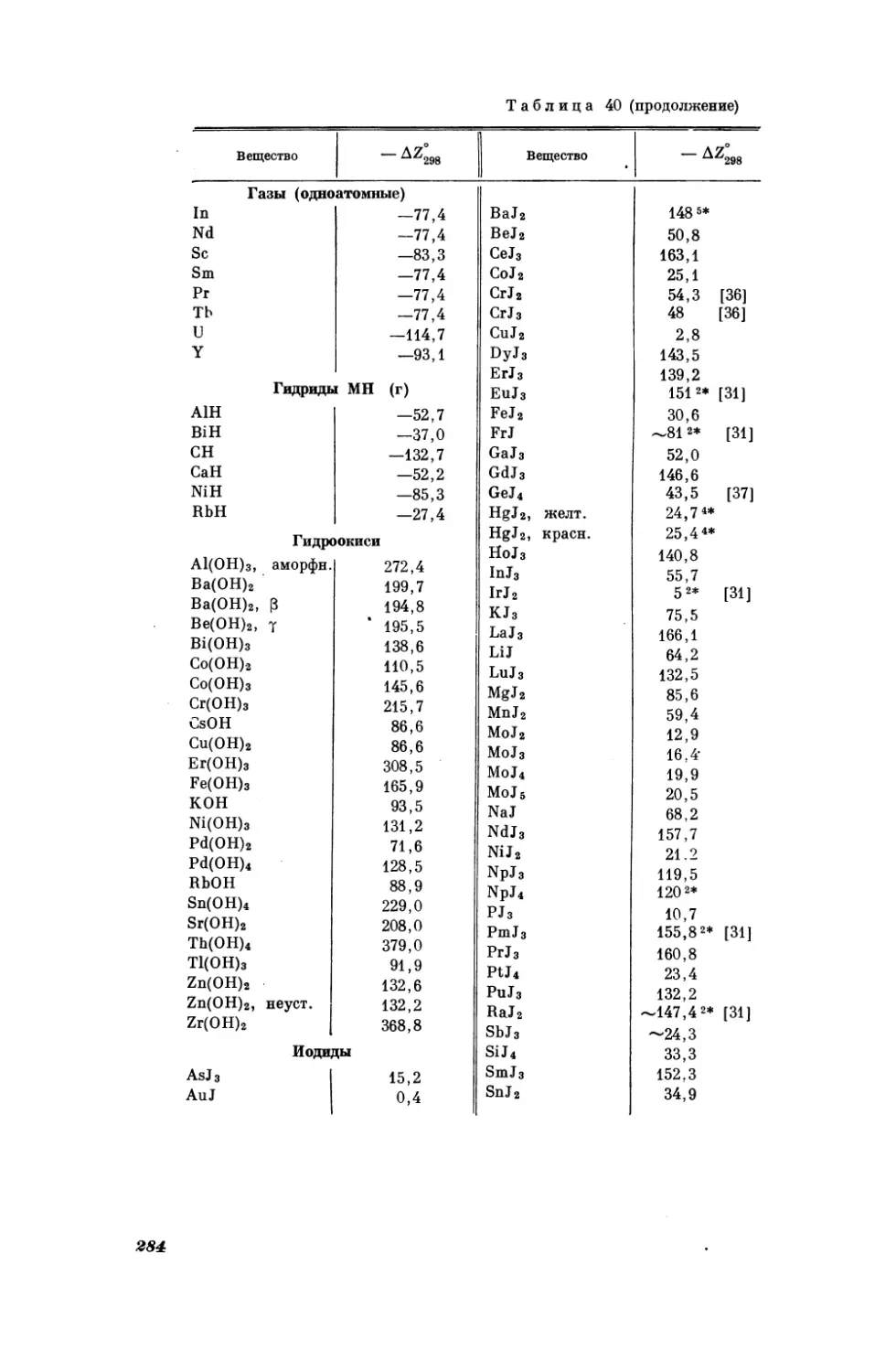
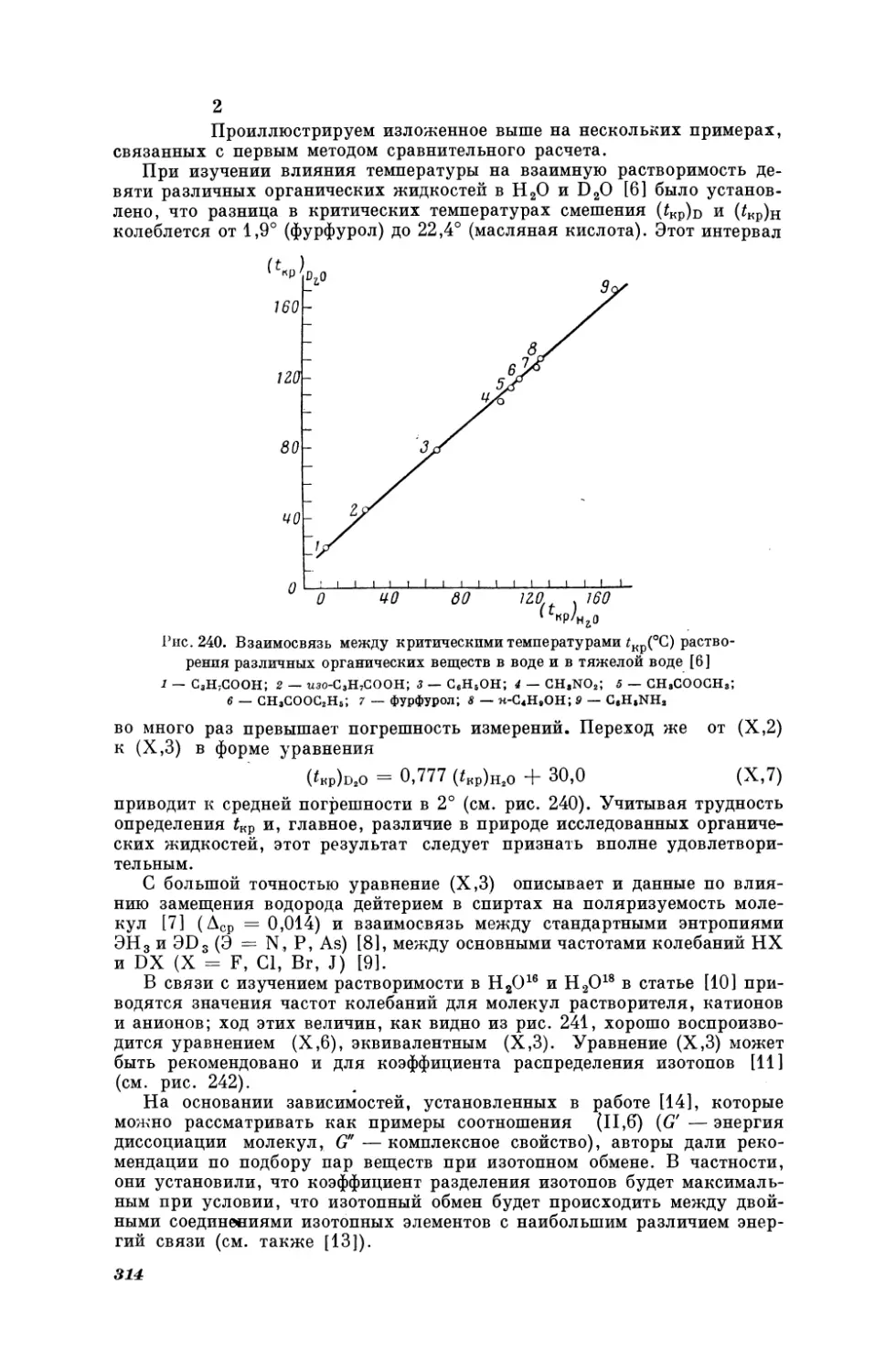
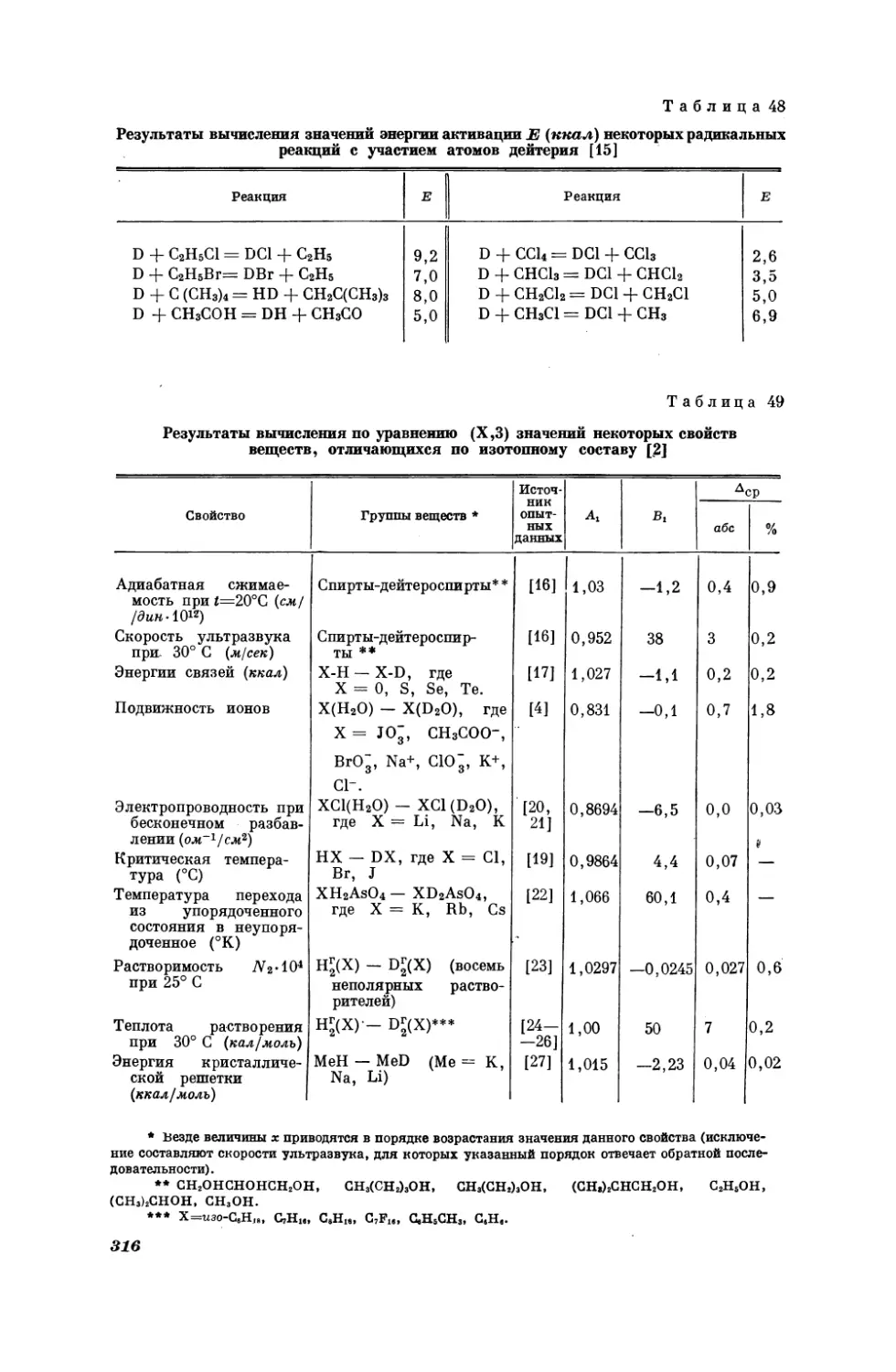
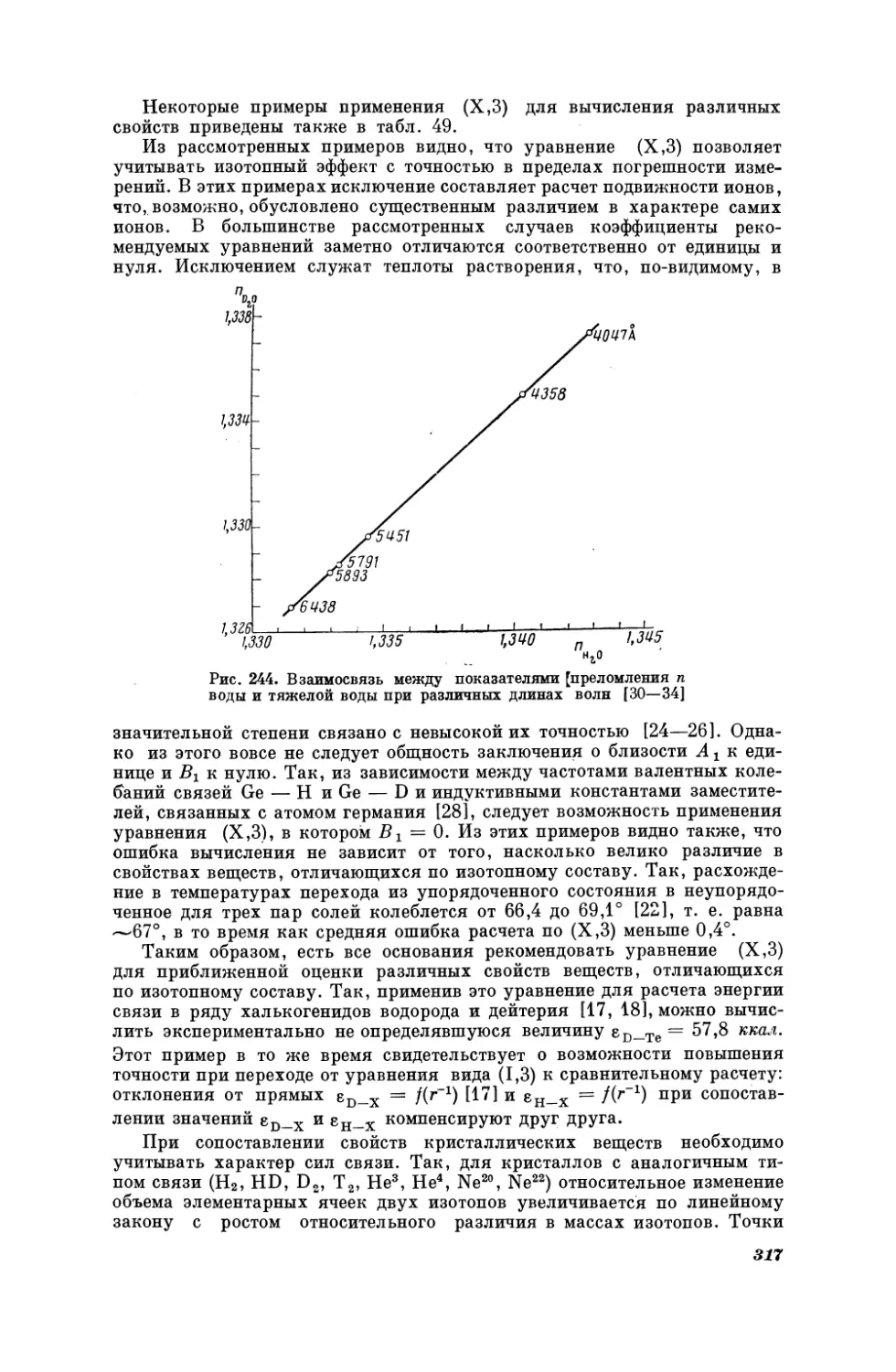
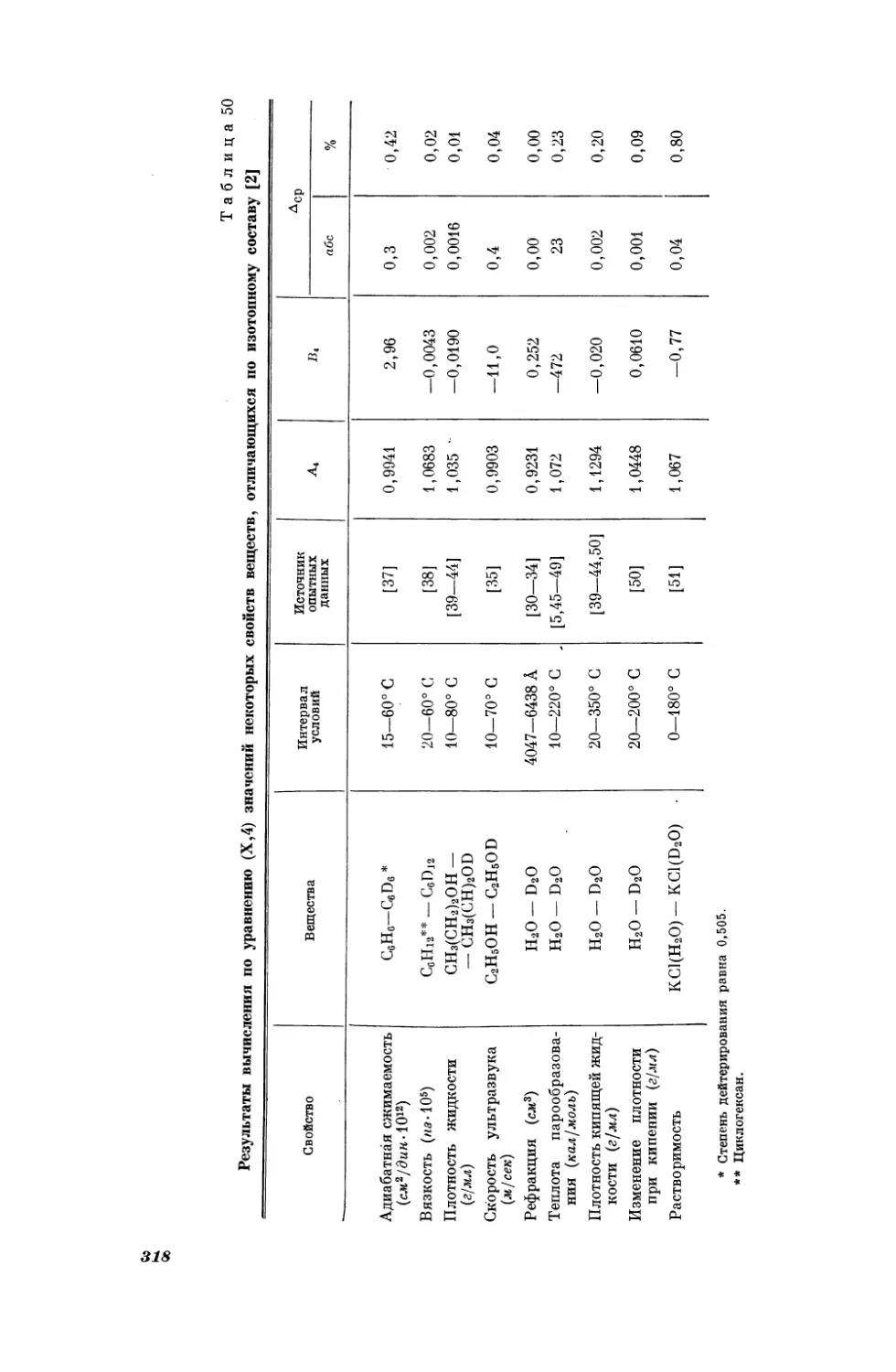
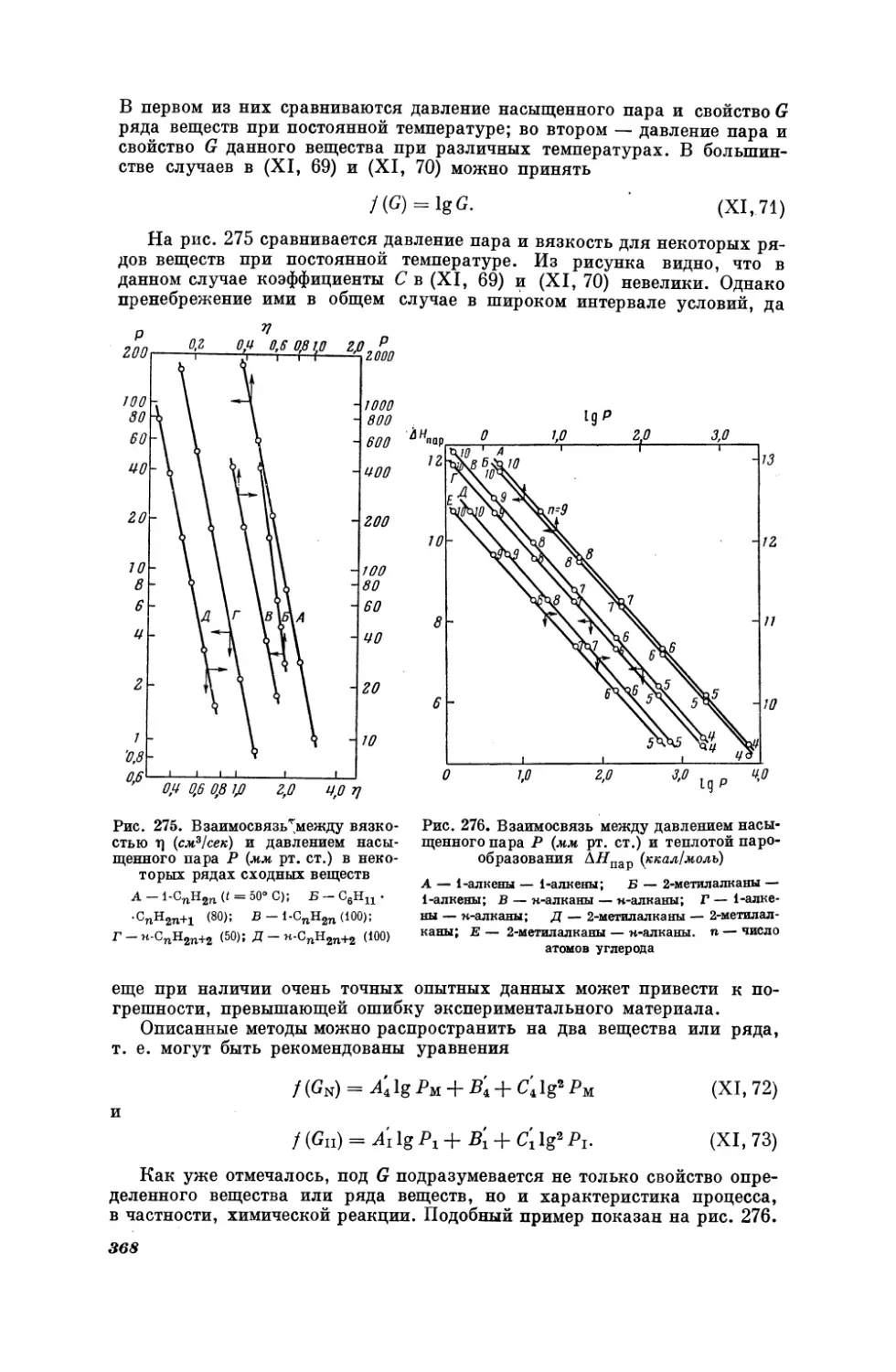
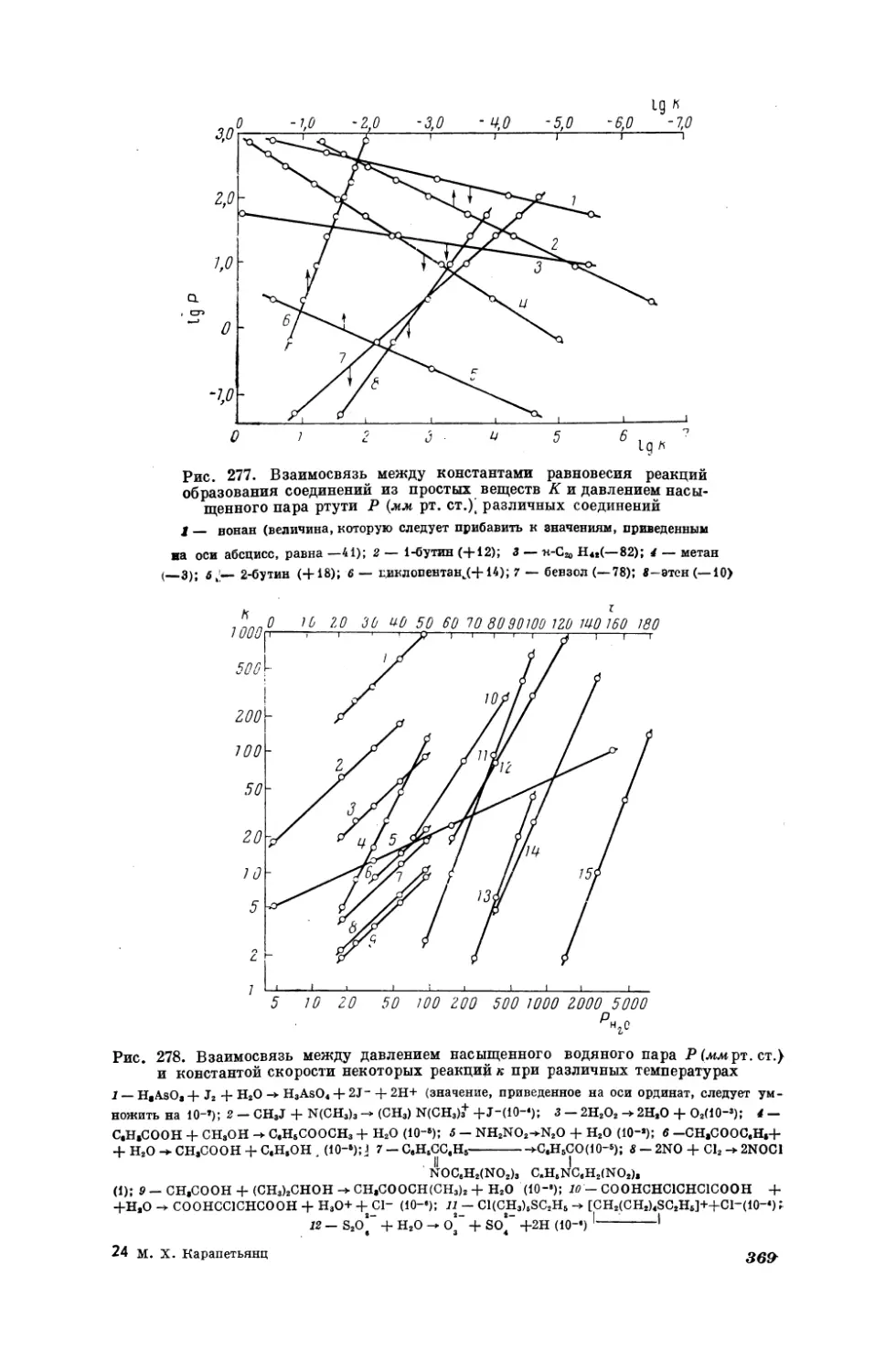
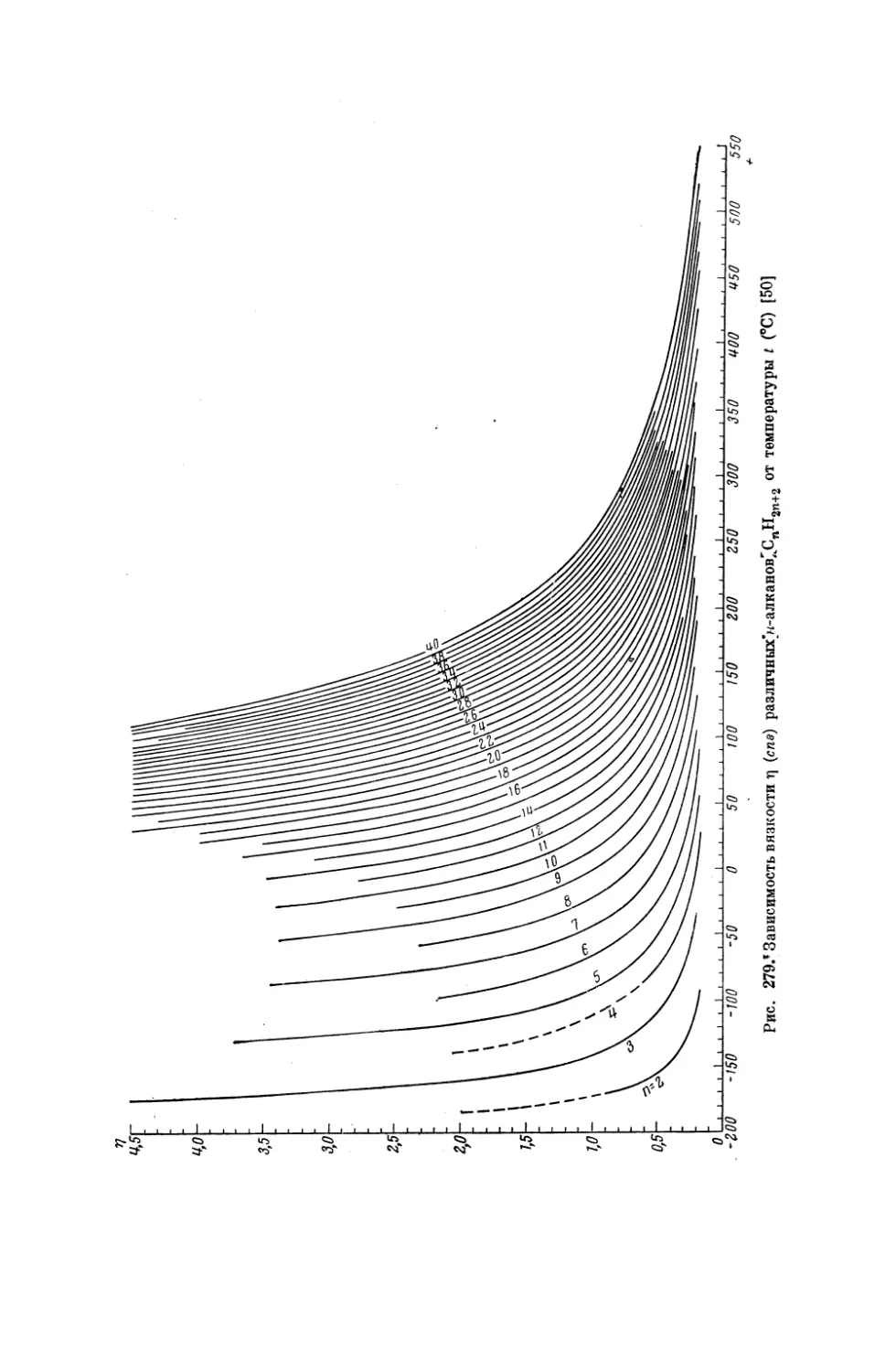
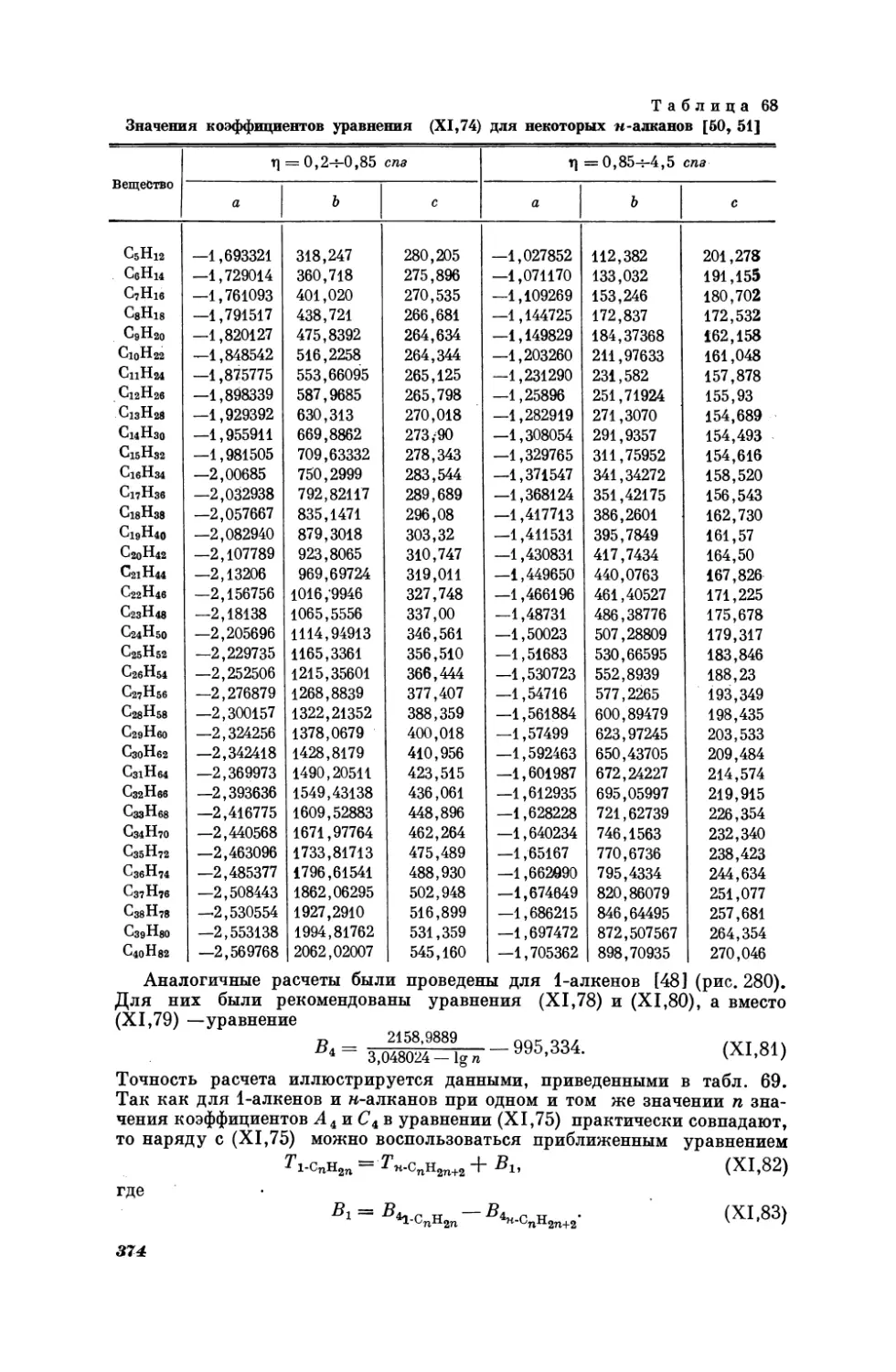
Текст
АКАДЕМИЯ
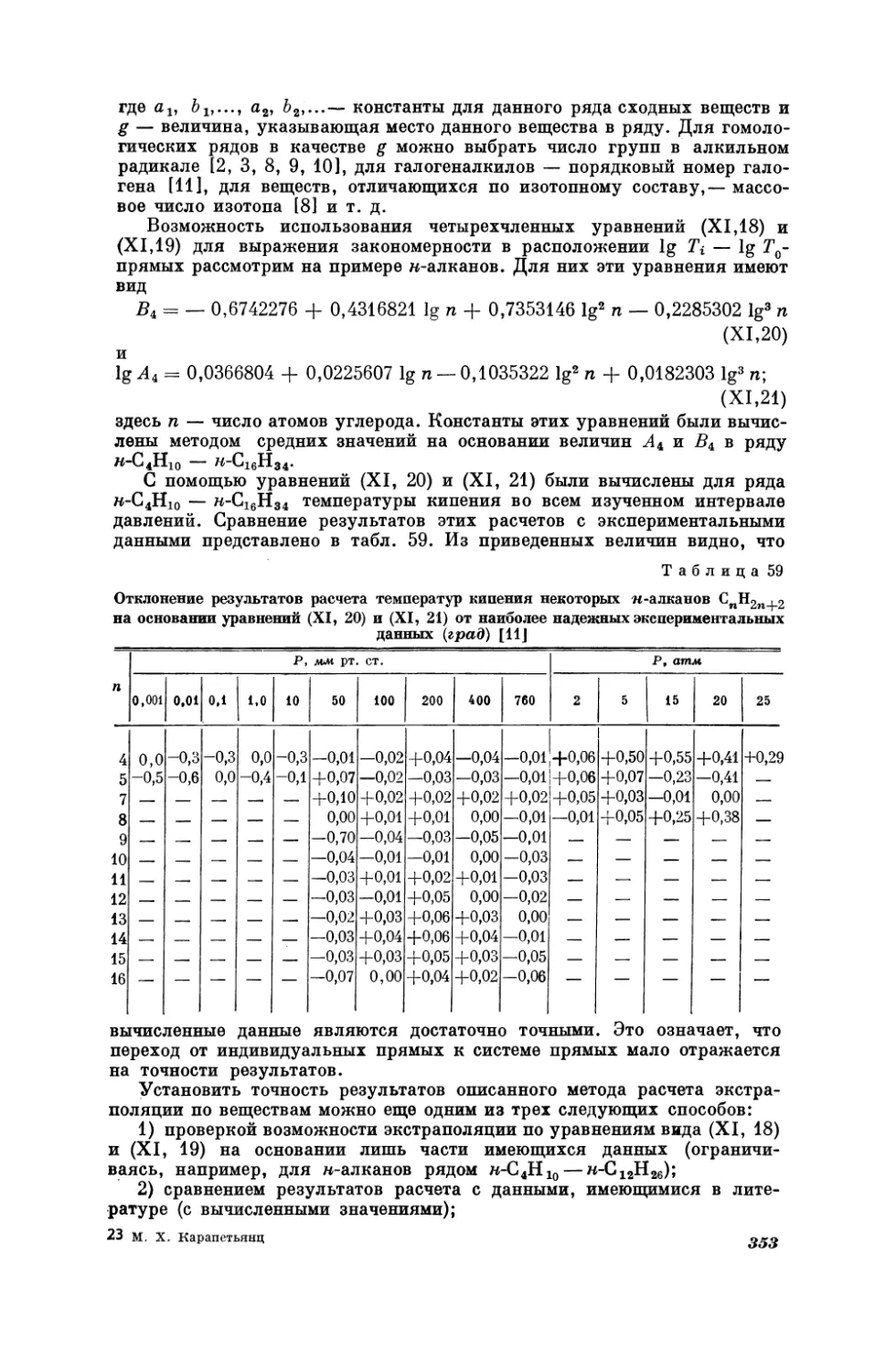
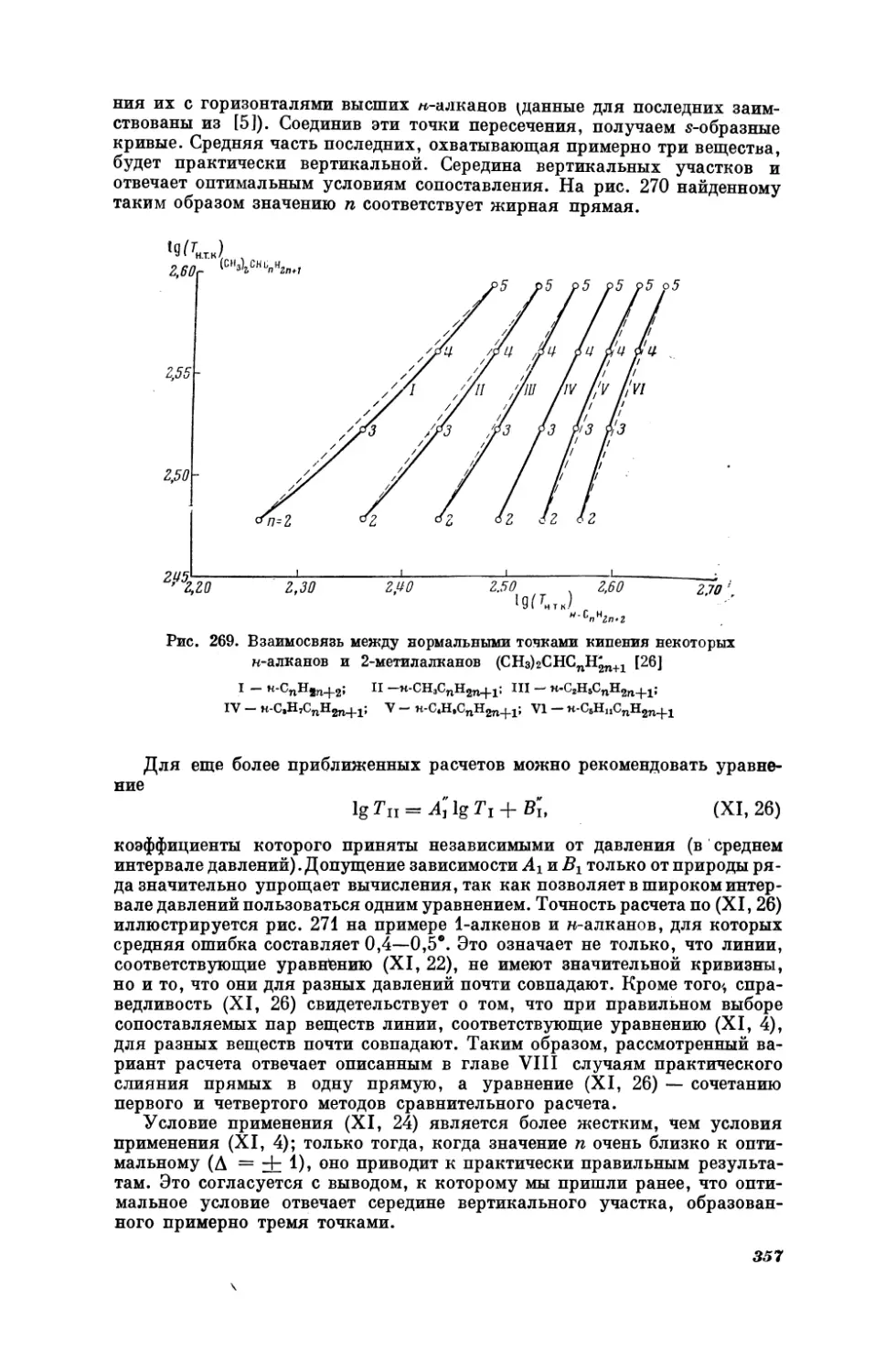
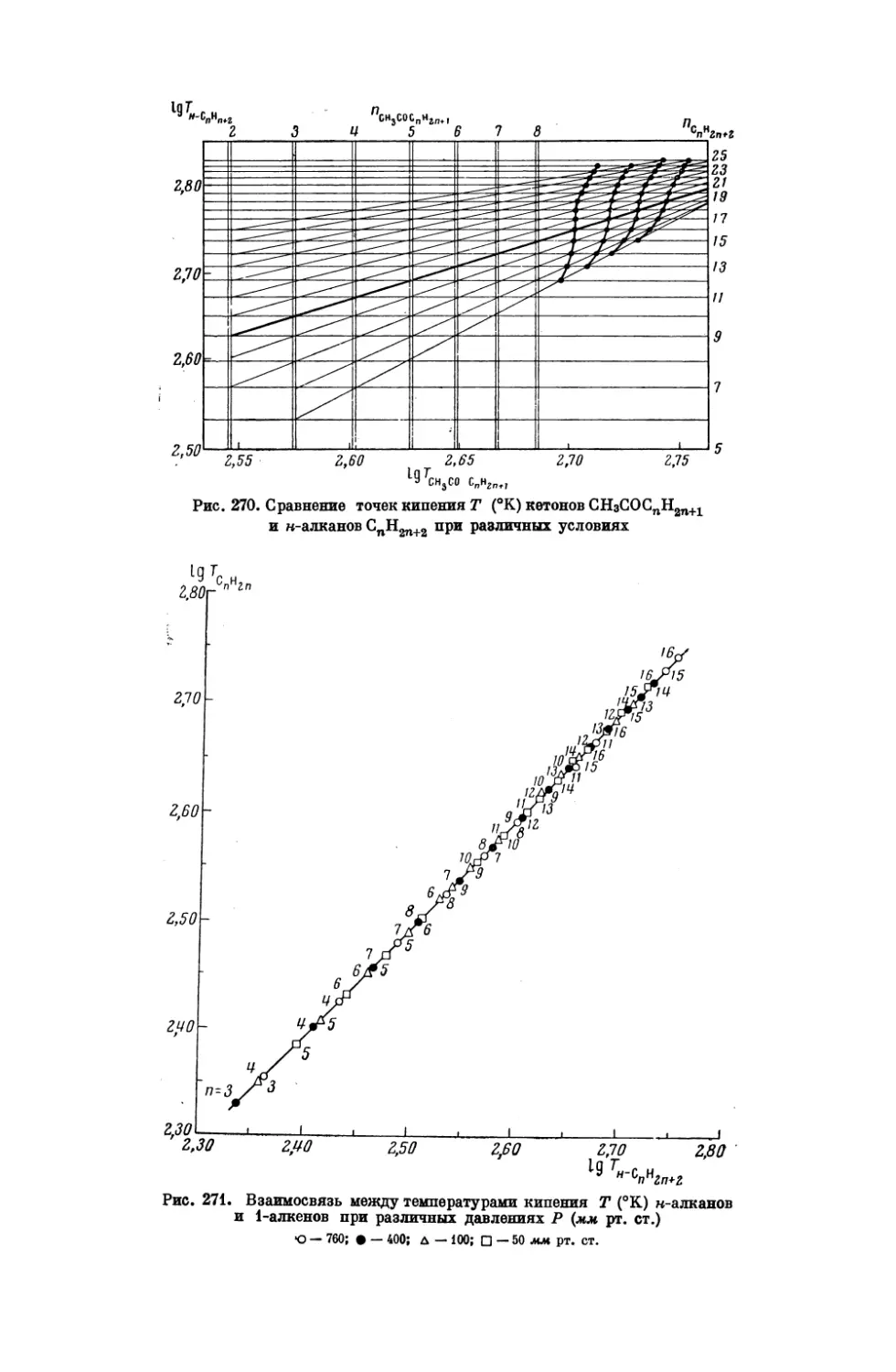
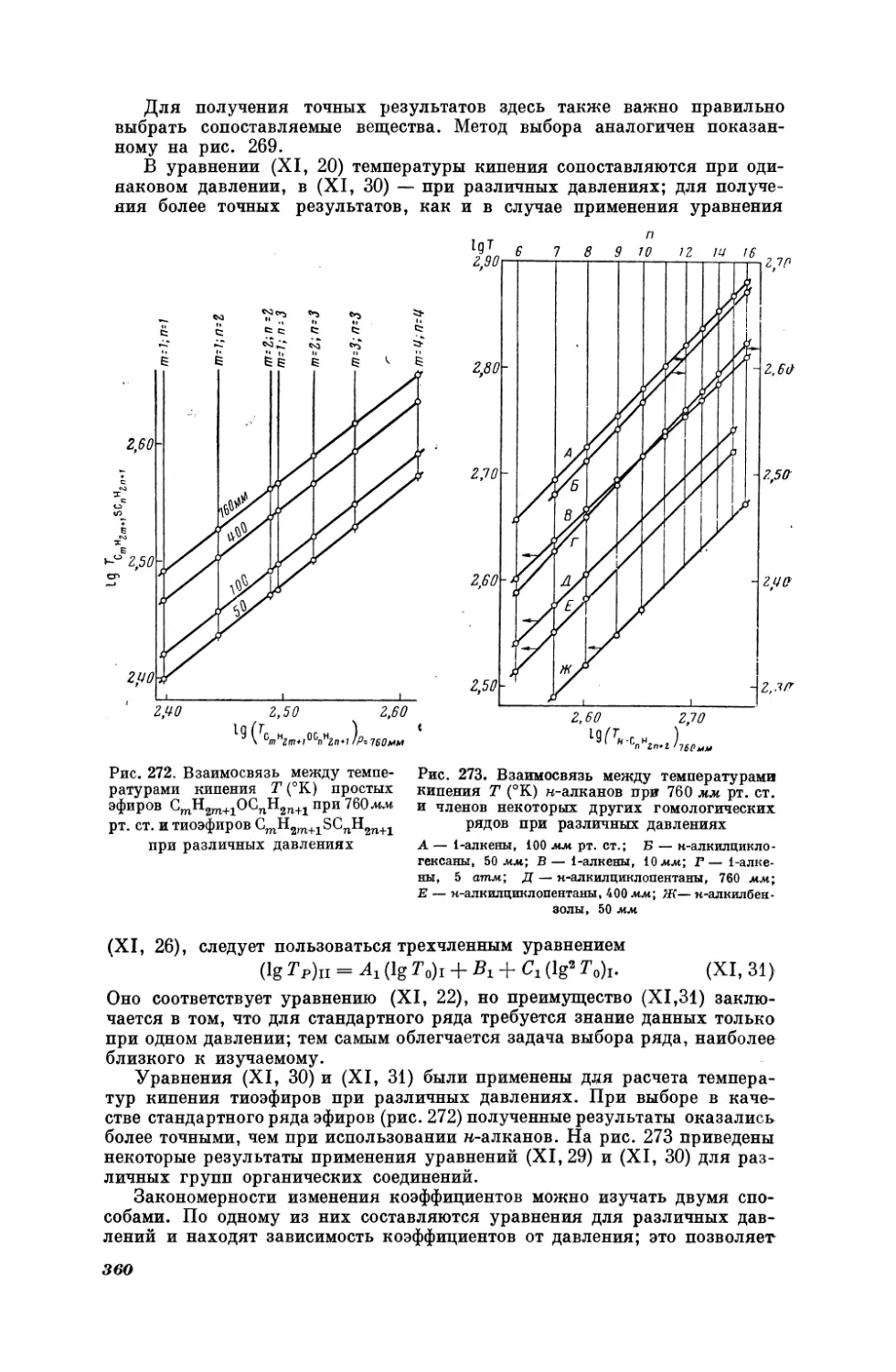
НАУК
СССР
М. Х. Карапетьянц
Meron СРАВНИТЕЛЬНОГО Расчета
_ ФИЗИКОХОМИЧЕСКИХ своиств
53--54 : 004.12--66.02 : 518
ОТВЕТСТВЕННЫЙ
член-корр. АН
СССР
РЕДАКТОР
Я. И. ГЕРАСИМОВ
ПРЕДИСЛОВИЕ
Настоящая монография. посвящена одному из способов определения свойств веществ и физико-химических характеристик
процессов.
В ней изложена система методов сравнительного расчета и показана возможность их применения для вычисления свойств чистых веществ, растворов и характеристик фазовых и химических превращений.
Монография содержит обтирный фактический материал. В многочисленных таблицах наряду с данными, иллюстрирующими точность рассматриваемых закономерностей, приведены значения различных свойств многих неизученных веществ, найденные с помощью описываемых методов.
Последнее обстоятельство, а также упоминание большого числа зависимостей, которые автор рассматривает как частные примеры методов сравнительного расчета, позволяют пользоваться настоящей монографией и как
справочником.
|
В основу предлагаемой читателю книги положены главным образом
статьи автора, а также материал его диссертации !, циклы лекций, прочитанных в Сычуаньском университете (1959 т.) *, в Рангунском университете
(1961 г.), в МХТИ им. Д. И. Менделеева (1962 г.), в Гиредмете (4963 г.), в
Софийском химико-технологическом институте (1964 г.), и различные доклады.
Монография рассчитана на научных работников, преподавателей вузов, аспирантов и студентов, производственников и проектировщиков,
деятельность которых связана с химией и химической технологией, нефтехимией, физикой и теплофизикой, энергетикой, металлургией, геохимией
‘и другими отраслями науки и техники.
При работе над книгой автору в разное время была оказана большая
помощь со стороны проф. В. Я. Аносова, проф. К. В. Астахова, чл.-корр.
АН СССР Я. И. Герасимова, проф. В. В. Кафарова, проф. К.А. Путилова,
1 М. Х. Карапетья нц. Исследованиев области методов сравнительного расчета физико-химических свойств различных веществ. МХТИ им. Д. И.. Менделеева,
957.
? М.Х. Карапетьянц.
Лекции по методам сравнительного расчета (на правах рукописи). Чэнду, Сычуаньский ун-т, 1959 (на кит. яз.).
3
проф. В. М. Татевского. Они-прочитали или всю рукопись, или отдельные ее главы и сделали ценные замечания. Во многом помог при подготовке
рукописи
к печати
доц. В. А. Медведев. Этим лицам автор
дечную благодарность.
Особую признательность
доц. М. Л. Карапетьянц
готовке данной работы.
за
|
автор
выражает
постоянную
проф.
поддержку
|
выражает
В. А.
и
сер-
Кирееву
помощь
и
при под-
Автор будет весьма признателен читателям за указание недостатков
книги и за рекомендации, направленные на ее улучшение. Он отдает себе
отчет в том, что настоящая монография, будучи первой попыткой систематического изложения методов сравнительного расчета, не может быть
свободна от самых разнообразных недостатков и упущений. Все замечания
будут приняты со вниманием и благодарностью.
«Чтобы ece обнять, надо
метод сравнительный...».
Д.И.
Менделеев
ВВЕДЕНИЕ
С каждым днем все большее число веществ входит в круг инте-
ресов исследователей, инженеров и проектировщиков. Непрерывно растет
и многообразие условий проведения различных процессов в лабораториях
и на предприятиях.
Однако число изученных веществ резко отстает от числа известных и
используемых, и это отставание непрерывно увеличивается. Количество
известных «в настоящее время химических индивидов. .. вероятно превышает
500 000,
...причем
многие
из
них
обладают
весьма
ценными в
практическом отношении свойствами» писали 17 лет назад В. Я. Аносов и С. А. Погодин [1]. В настоящее время мы знаем о существовании примерно 100 000 неорганических и 3 500 000 органических соединений. А
ведь число хорошо изученных веществ вряд ли доходит до 100. Действительно, к единственному веществу — Н.О, почти все свойства которого
известны в широком интервале температур и давлений, можно присоединить
еще
два-три
десятка
веществ
(немногие
углеводороды,
CO,,
NHs,
(температуры
кипе-
некоторые фреоны и несколько других соединений), подавляющее большинство свойств которых исследовано довольно полно.
Достаточно познакомиться с современной справочной литературой,
чтобы убедиться в том, что мы иногда не знаем даже основных свойств
веществ, принадлежащих к наиболее изученным классам соединений. Так,
например, в справочнике Р.Д. Оболенцева [2], в котором собраны фундаментальные
свойства
1323
важнейших
углеводородов
ния и плавления, показатель преломления, плотность, теплота испарения
ит. д.), читатель найдет 15 876 мест
ствующих
318
свойств.
ароматических
Однако
углеводородов
т. е. из 12-ти возможных
для
заполнения
11 525 мест пустует.
указано
всего
значениями
соответ-
При этом, например,
1350
значений
для
свойств,
(на каждое вещество) только 4. Некоторые свой-
ства практически не известны;
так, из 406 цикланов
только для 7 найдены
критические температуры и давления. Все это отражает объективное положение дел и отнюдь не является характеристикой полноты указанного
справочника; подобная картина наблюдается и в других сводках.
Еще
более скуден фонд данных
по свойствам других
классов
органиче-
ских соединений; не лучше обстоит дело и с неорганическими веществами.
Таким образом, можно со всей определенностью сказать, что данные, накопленные многими поколениями исследователей, в целом совершенно
недостаточны.
Отсутствие надежных,
а нередко
и вообще каких-либо значений свойств
веществ является серьезным тормозом в развитии науки и техники. Научно-исследовательские институты, лаборатории, проектные организации,
5
вузы
и
предприятия
химической,
нефтеперерабатывающей,
топливной,
металлургической и многих других отраслей промышленности, не располагая значениями тех или иных свойств различных веществ, подчас лишены
возможности ставить и решать многочисленные и разнообразные задачи.
Весьма ограниченаи возможность систематизации имеющегося материала,
его критического анализа и научной обработки; ограничена вследствие
этого и возможность теоретических обобщений.
Следует также иметь в виду, что многие из известных в литературе
значений свойств являются приближенными, а некоторые — даже весьма
ориентировочными. Это плохо не только само по себе, не только в связи с
тем, что непрерывно повышаются требования к точности измерений и к
чистоте материалов, но и потому, что отдельные свойства связаны между
собой, т. е. образуют систему
значений. Поэтому нередко небольшая ошибка в значениях одного из свойств служит источником большой
погрешности в значениях других. Так известно, например, что расчет
тепловых эффектов взаимодействия органических соединений по их теплотам сгорания может привести к веущественным ошибкам, так как нередко он
сводится к вычислению небольшой разности больших величин, и поэтому
незначительная неточность в какой-либо составляющей может привести
к огромной относительной погрешности в искомой величине. Вот колоритный пример, иллюстрирующий это положение: расхождение в значениях
теплоты сгорания этена на 1% при TJ = 600°К приводит к 17-кратной
ошибке в величине константы равновесия реакции
CoH,
ret
Н.О,
Г =
С.Н5ОН,
Г,
при Т = 300°К она становится 300-кратной. Поэтому мы долгое время не
располагали достаточно надежными величинами по расчету равновесия
реакции гидратации этена.
Часто весьма разноречивы данные по свойствам различных веществ, что
обусловлено многими причинами и в первую очередь недостаточной чистотой изучаемого препарата. Так, для теплоты образования ЛЯ пятиокиси
ниобия в литературе приводится 11 значений: от—442,8 до—473,2 ккал/моль;
температура кипения теллура оценивается разными исследователями в
пределах от 943 до 1087° С. И это отнюдь не самые яркие примеры. Часто
оценить действительное значение свойства невозможно из-за трудности
количественного учета влияния различных факторов. Во всяком случае
нельзя судить об истинном. значении только по величине вероятной ошибки
(так,
большинство
— 1 ккал,
авторов).
что
на
значений
порядок
АНмьо,
меньше
было
рекомендовано
расхождения
в
с точностью
данных различных
2
данных
Из всего изложенного
по свойствам
веществ
выше
(а также
очевидно,
уточнение
что накопление
существующих
новых
данных)
является весьма насущной задачей.
Это может быть осуществлено тремя способами: путем постановки
опыта, посредством расчета по теоретическим уравнениям и с помощью
различных приближенных закономерностей.
Эксперимент приводит непосредственно к искомым результатам. Вмете с тем он требует надежной методики и наличия достаточно чистых препаратов; кроме того, он сопряжен с большой затратой квалифицированного
труда, времени и материальных средств, да и не всегда осуществим.
Теоретический расчет, хотя в принципе и может дать безукоризненно
точные результаты, однако также не всегда возможен. Во-первых, не для
всех свойств и не для всех веществ взаимосвязь между различными свойствами облечена в форму теоретических уравнений. Достаточно указать,
О
|
6
1
например, что нам не известно уравнение состояния вещества. Во-вторых,
если теоретические зависимости и известны, то очень часто их применение
упирается в существенное затруднение — отсутствие
или недостоверность значений тех свойств, которые наряду с рассчитываемым свойством
входят в эти зависимости. Последнее во многих ‘случаях означает невозможность доведения анализа конкретной задачи до нахождения достаточно
надежного
(а подчас
и
вообще
какого-либо)
численного
значения
для вычисления
одной из
искомой величины. В качестве примера сошлемся на фундаментальное
термодинамическое соотношение — уравнение Клапейрона — Клаузиуса
дР/ОТ
=
АНъ. п (ТФ. п
АТ. п.
Его применение
важнейших характеристик жидкости — температурной зависимости давления ее насыщенного пара Р во всем интервале сосуществования кипящей жидкости и насыщенного пара в настоящее время ограничено единичными веществами из-за скудости и неточности данных по изменению теплоты парообразования АНпар и скачка объемов при парообразовании AVuap
с температурой Г.
Вот почему существенное значение приобретает третья возможность —
получение новых данных по свойствам веществ путем применения различных закономерностей. Не случайно, например, зависимость Р = ДТ)
для подавляющего большинства жидкостей найдена не по уравнению
Клапейрона — Клаузиуса, а с помощью многочисленных (их более 200)
приближенных закономерностей (см., например, [3]). Кроме того, наличие эмпирических и полуэмпирических зависимостей во многих случаях
позволяет решать задачи, связанные с большими экспериментальными
трудностями, обусловленными невысокой точностью измерения данного
свойства, трудностью очистки объектов исследования, их нестойкостью,
токсичностью, агрессивностью и т. д. ‘вплоть до невозможности осуществить эксперимент. Не приходится говорить о свойствах веществ при таких температурах и давлениях, когда экспериментирование особенно
затруднено или, например, о свойствах неустойчивых частиц (в частности,
радикалов).
Приближенные соотношения имеют не только практическое значение.
Их применение, приводящее к расширению фонда данных по свойствам
различных веществ, дает возможность выявить новые закономерности.
Анализ последних и их обобщение в свою очередь способствуют развитию
теории, позволяя глубже вникнуть в строение вещества, в сущность химических превращений.
Применение приближенных методов расчета особенно плодотворно в
тех случаях, когда они, во-первых, достаточно общие, т. е. применимы к
разнообразным свойствам различных веществ; во-вторых, надежные, т. е.
позволяют с удовлетворительной для практических целей точностью оценить ту или иную величину; в-третьих, достаточно простые и их применение не требует большой затраты времени.
Следует подчеркнуть, что все сказанное выше не означает, конечно,
предпочтительности применения закономерностей опыту или теоретическому расчету; все три пути «равноправны» и не заменяют друг друга.
Важно, чтобы исследователь учитывал все возможности и сознательно выбирал оптимальный
этих методов.
для данных
условий
метод или
различные
сочетания
3
Различные приближенные уравнения и методы расчета можно
объединить в несколько групп.
Часть из них представляет собой интерполяционные уравнения, константы которых определяются на основании опытных данных. В большинстве случаев в этих уравнениях рассматриваемое свойство выражено как
степенная функция переменного параметра. К числу последних, например,
7
относятся широко распространенные уравнения для расчета температурной зависимости теплоемкости, энтальпии и некоторых других свойств.
Укажем, что одними из наиболее простых и точных формул для описания
различных свойств веществ являются соотношения типа уравнения Ан-
туана
[4].
Сравнительно
нованные
частности,
на
небольшую
принципе
для
расчета
группу
образуют
аддитивности.
ряда
свойств
Эти
методы
методы
органических
вычисления,
рекомендованы,
соединений.
ос-
Наряду
в
с
уравнениями, в которых рассматриваемое свойство определяется путем
суммирования слагаемых, каждое из которых приписывается атому или
группе атомов, в последнее время рекомендованы методы, в которых численные значения этих инкрементов зависят не только от природы частей
молекулы, но и от их структуры. Это позволяет получить более точные
результаты. К числу таких методов относится метод расчета, разработанный В. М. Татевским [5]. Он основан на учете природы данного типа связи атомов в молекуле соединения и влияния на него атомов, непосредственно связанных с данными атомами (подтип связи). Каждому типу и подтипу связи приписывается определенный вклад в значение рассматриваемого свойства С (он определяется из экспериментальных данных)
и расчет величины С сводится к суммированию этих вкладов. Применение
этого метода позволило
Татевскому
и его сотрудникам
найти ‘ряд свойств
парафиновых
углеводородов
(мольный объем и плотность,
рефракцию, теплоты испарения, образования и сгорания, изобарный потенциал
образования, точки кипения, давления пара, магнитную восприимчивость).
‚Указанный метод в настоящее время распространяют и на другие классы
органических соединений, для которых удалось найти значения отдельных свойств; по мере накопления надежных опытных данных методом
Татевского удастся охватить новые классы веществ.
Третью группу составляют методы, основанные на приНципе соответственных состояний. Учение о соответственных состояниях, его развитие и
применение являются ярким примером продуктивности обращения к
приближенным закономерностям.
Сравнительная физика, возникшая на основе этого учения в 90-х годах
прошлого столетия, служила главным образом для проверки многочисленных следствий, вытекающих из этого учения, и для связи между наблюдаемыми отклонениями от этих следствий и свойствами изучаемых веществ.
Конец ХХ и первая четверть ХХ в. ознаменовались ослаблением интереса исследователей к учению о соответственных состояниях. Вновь пробудился
интерес
к нему
в последние
десятилетия.
Необходимость
распола-
гать хотя бы приближенными значениями свойств разнообразных веществ
при высоких давлениях и прежде всего сжатых газов (в особенности углеводородов) опять заставила обратиться к учению о соответственных состояниях. Был предложен целый ряд приближенных методов расчета, многие
из которых для удобства были облечены в графическую форму. Учение
о соответственных состояниях находит широкое применение для расчета
свойств
газов
под давлением
(как чистых,
так и смесей),
в частности
для
введения соответствующих поправок на неидеальность газа в связи с пересчетом к стандартному состоянию; для описания свойств жидкостей, в
особенности
для
свойств
Применению принципа
сот работ 1.
на
кривой
равновесия
соответственных
жидкость
состояний
—
посвящено
пар
и т. д.
несколько
В последние годы были предложены видоизменения учения о соответст-
венных состояниях, позволившие за счет введения дополнительного параметра повысить точность результатов вычисления примерно на один порядок.
1 Сводку
исследований
в этой
области см. в работе
[6].
4
Настоящая монография посвящена одному из расчетных путей
оценки свойств различных веществ — методам сравнительного расчета.
Каждая из первых шести глав содержит описание одного из методов
сравнительного расчета. В них дан обзор ранее описанных закономерностей, являющихся частными случаями этих методов расчета, и описывает-
ся ряд новых
соотношений.
экспериментальный материал,
При
этом широко использован большой
почерпнутый в основном из исследований
последних лет. В каждой главе данный метод сравнительного расчета рассматривается на отдельных примерах последовательно для свойств чистых веществ и растворов, для характеристик физических процессов (фазовые превращения в одно- и многокомпонентных системах) и химических
реакций. Седьмая глава посвящена обоснованию методов сравнительного
расчета. В восьмой главе рассматривается и иллюстрируется на ряде примеров переход от одного к нескольким сопоставлениям и возможность совместного использования различных методов сравнительного расчета. В девятой и десятой главах более подробно изложены отдельные примеры применения методов сравнительного расчета, в том числе в областях, в которых они вплоть до последнего времени почти не использовались. В одиннадцатой главе изложено сочетание методов сравнительного расчета с
некоторыми другими методами. Двенадцатая глава содержит описание
сравнительного расчета в полярных координатах.
ЛИТЕРАТУРА
1В.Я. Аносов,
С.А. Погодин.
Основные начала физико-химического анализа. М.—Л., Изд-во AH CCCP, 1947.
2. Р. Д. Оболенцев.
Физические константы углеводородов жидких топлив
и масел. Изд. 2. М.—Л., Гостоптехиздат, 1953.
3. М. Х.
ление
Карапетьянц,
насыщенного
‘пара
Чэн
Гуангюе.
углеводородов.
М.,
4. М. Х. Карапетьянц. Ж. физ. хим., 37,
Температура кипения и дав-
Гостоптехиздат,
1885 (1963).
1961.
5. В. М. Татевский,
В. А. Бендерский,
С. С. Я ровой.
Методы
расчета физико-химических свойств парафиновых углеводородов. М., Гостоптехиздат, 1960.
6. М. Х. Карапетья нц. Исследование в области методов сравнительного расчета физико-химических свойств различных веществ. Дисс., МХТИ им. Д. И. Мен-.
делеева, 1957.
ГЛАВА
1
СРАВНЕНИЕ ЗНАЧЕНИЙ ДАННОГО СВОЙСТВА
В ДВУХ РЯДАХ ВЕЩЕСТВ
ВВЕДЕНИЕ
1
ближенное
В
основе
первого
соотношение
метода
сравнительного
расчета
лежит
ап = A,Gr + Bu
при-
(1,1)
в котором при данных условиях сопоставляются значения С u Gir
свойст-
ва ав Ти П рядах сходных веществ [1, 2]. Сопоставление осуществляется
как в обычных, так и в функциональных шкалах (в частности, логарифмических); в качестве С может быть взято как одно свойство, так и комплекс
свойств.
Вид соотношения (1, 1) свидетельствует о том, что для расчета по нему
необходимо знать свойства С всех членов изученного ряда и двух членов
изучаемого
ряда.
В дальнейшем для удобства и единообразия во всех случаях
изученным
будем считать [Г ряд и называть его стандартным.
|
Вероятно, наиболее типичными группами родственных соединений,
охватывающих к тому же большинство возможных вариантов, следует
считать ряды веществ, в каждом из которых одна часть молекулы (например, атом, ион или радикал) будет одинаковой, а другая — переменная
часть — будет химическим аналогом. Если иметь в виду неорганические
соединения, то к таким совокупностям веществ относятся, например, ряды
соединений с данным «катионом» и меняющимся по подгруппе периодической системы элементов Д. И. Менделеева «анионом». Примером подобных рядов могут служить ЭгХ. и ВаХ., где 'X = Cl, Br, J; ZnMeO, u
СаМеО ‚, (Ме
= Сг, Мо, \). Возможны
и другие группы веществ с одним и
тем же «анионом» и переменным «катионом» (например, Ме(| и MeBr, rae
Ме=К, Rb, Cs, nam MeS au МеЗе, где Ме = Са, 5г, Ва). В качестве других
примеров Ги ПП рядов неорганических веществ укажем на соединения, переменная часть молекул которых отличается лишь массой. К объектам
‘подобного рода относятся комплексные соединения, в частности кристаллосольваты (например, СаС1..пН,О и МеС..пН.О, где п = 1, 2, 4, 6) или
аммиакаты (в частности, LiCl. nNH, u LiBr-nNHs, roe n = 1, 2, 3).
К группам сходных органических веществ относятся два гомологических ряда (например, н-алкилциклопентаны и н-алкилциклогексаны) 1. К
сходным веществам принадлежат и органические соединения, состоящие из
1 Здесь и в дальнейшем, под гомологическим рядом подразумевается изоструктурный ряд органических соединений, каждый последующий член которого может быть
получен из предыдущего усложнением его состава на группу СН. в алкильном
радикале.
10
данного радикала и атомов — электронных аналогов (например, н-СзН.Х
и H-C,H,X, rae X = Cl, Br, J).
Следует подчеркнуть, что объектами изучения могут служить не только
индивидуальные вещества, но и химические системы, т. е. в качестве С можно’рассматриватькак свойства веществ (например, их критическую температуру), так и характеристики различных процессов (например, тепловые
14
(С)
ох
|
13+
|
Вг
12
J
;
1
|
12h
FS
|
о
13
Cl
rie
]0
бр
11+
/
ь
а
13, (C3)
|
Ш
’’.
|
0
F Cl
ем
Br
J
ООО
40
80
= 120 Z,-
Рис. 1. Взаимосвязь между стандартными
изобарными теплоем-
Рис.
генидов
и натрия при 25° С [3] от порядкового
костями С р (кал/град- моль) галокалия
и
натрия
25° С [3]
2. Зависимость
стандартной
изобарной теплоемкости С р
(кал/град-моль)
при
‚
галогенидов
калия
Номера 2х- галогена
эффекты в родственных реакциях, причем под последними подразумеваются реакции взаимодействия между сходными веществами).
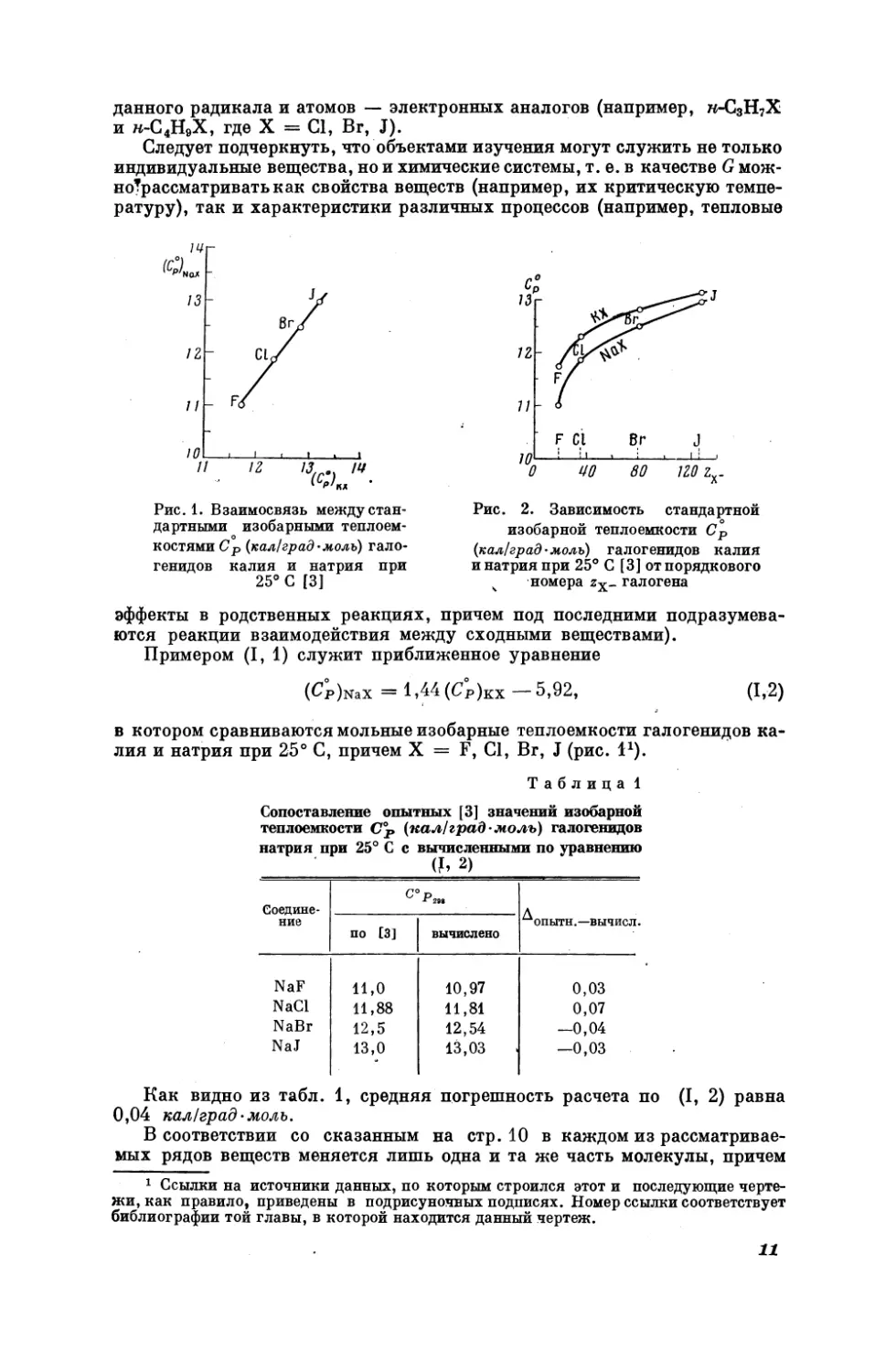
Примером (Т, 1) служит приближенное уравнение
(Cp)nax = 1,44 (Cp)xx — 5,92,
(1,2)
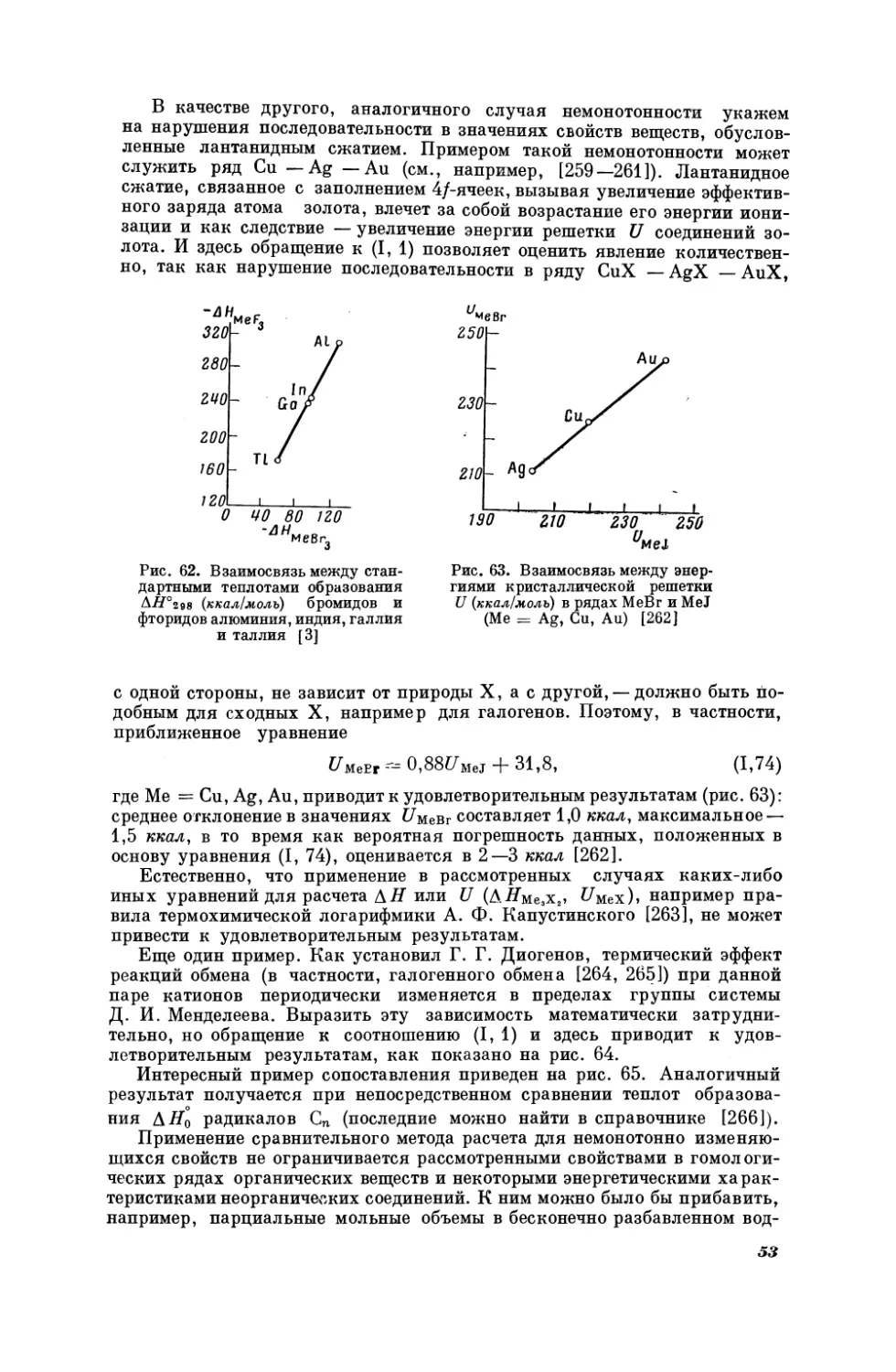
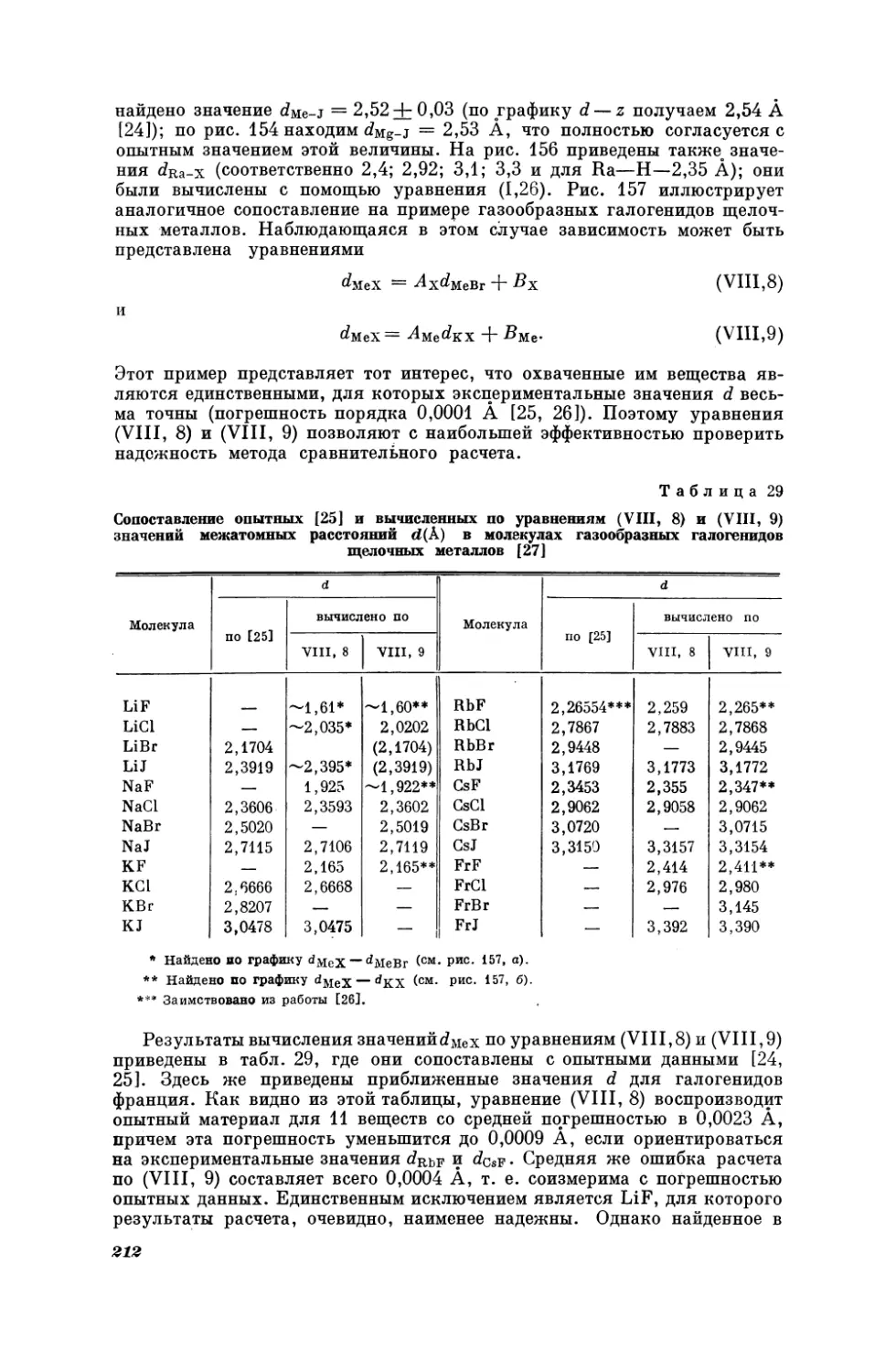
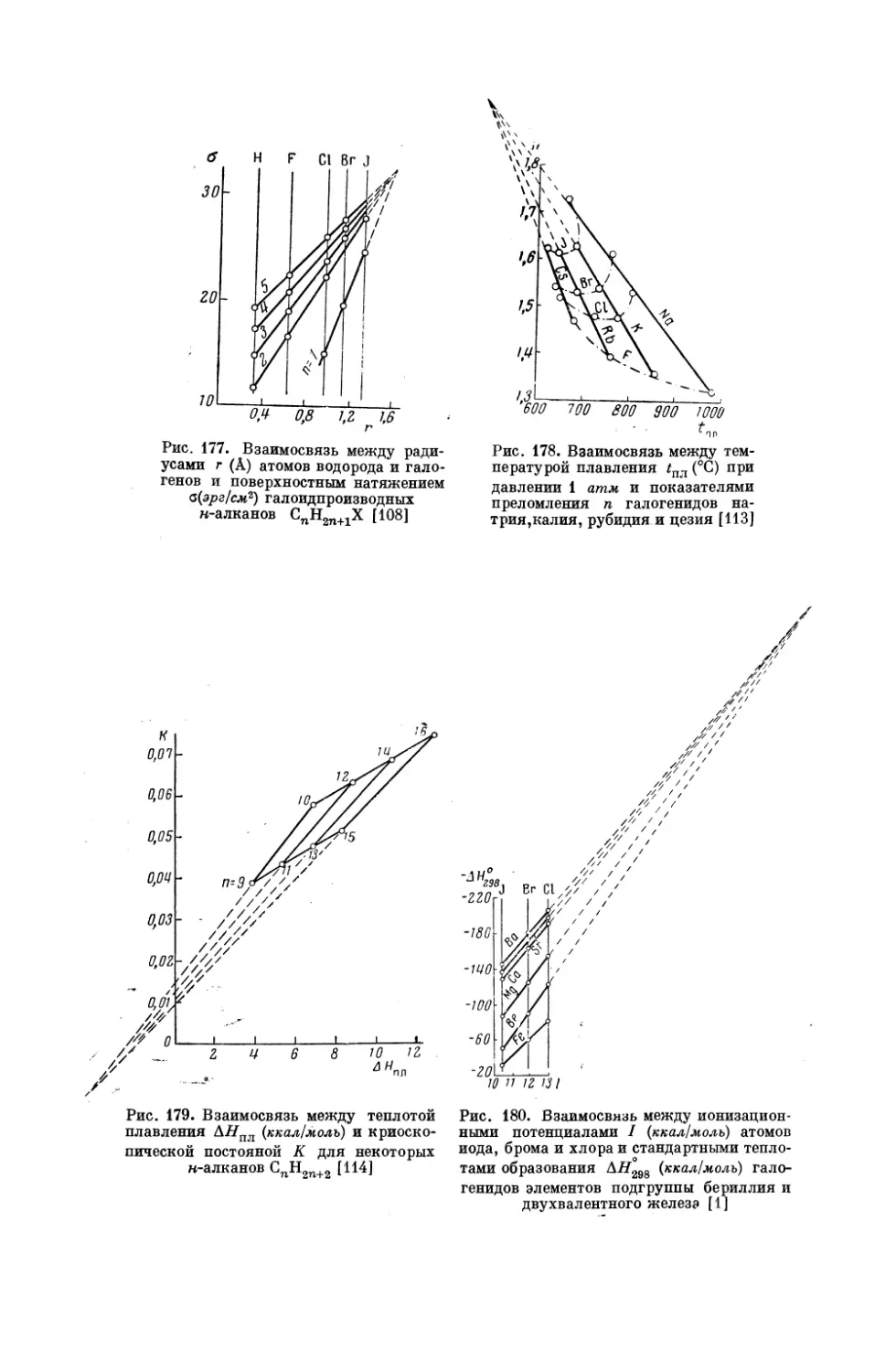
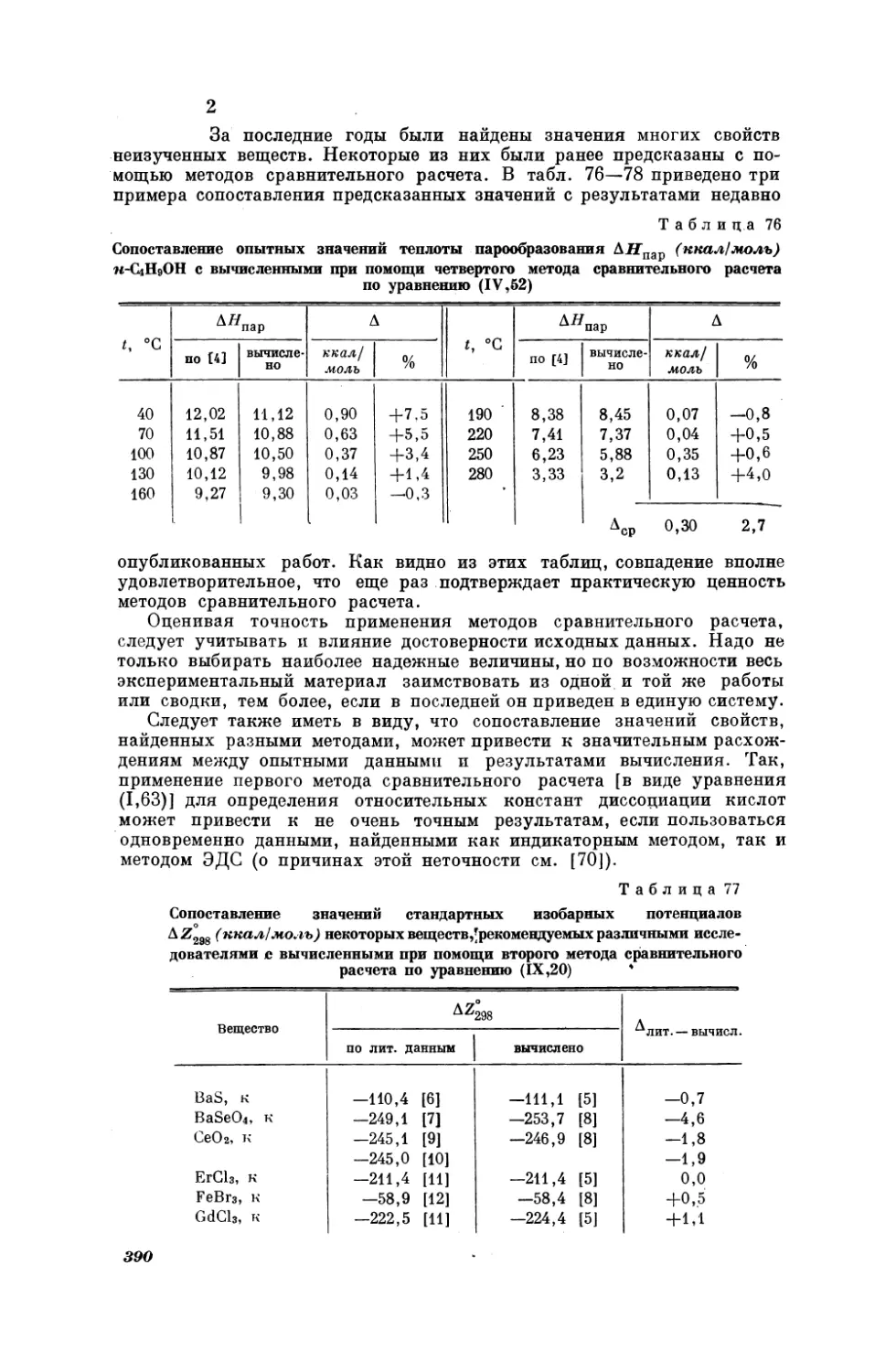
в котором сравниваются мольные изобарные теплоемкости галогенидов калия и натрия при 25° С, причем Х = К, (, Вт, У (рис. 17).
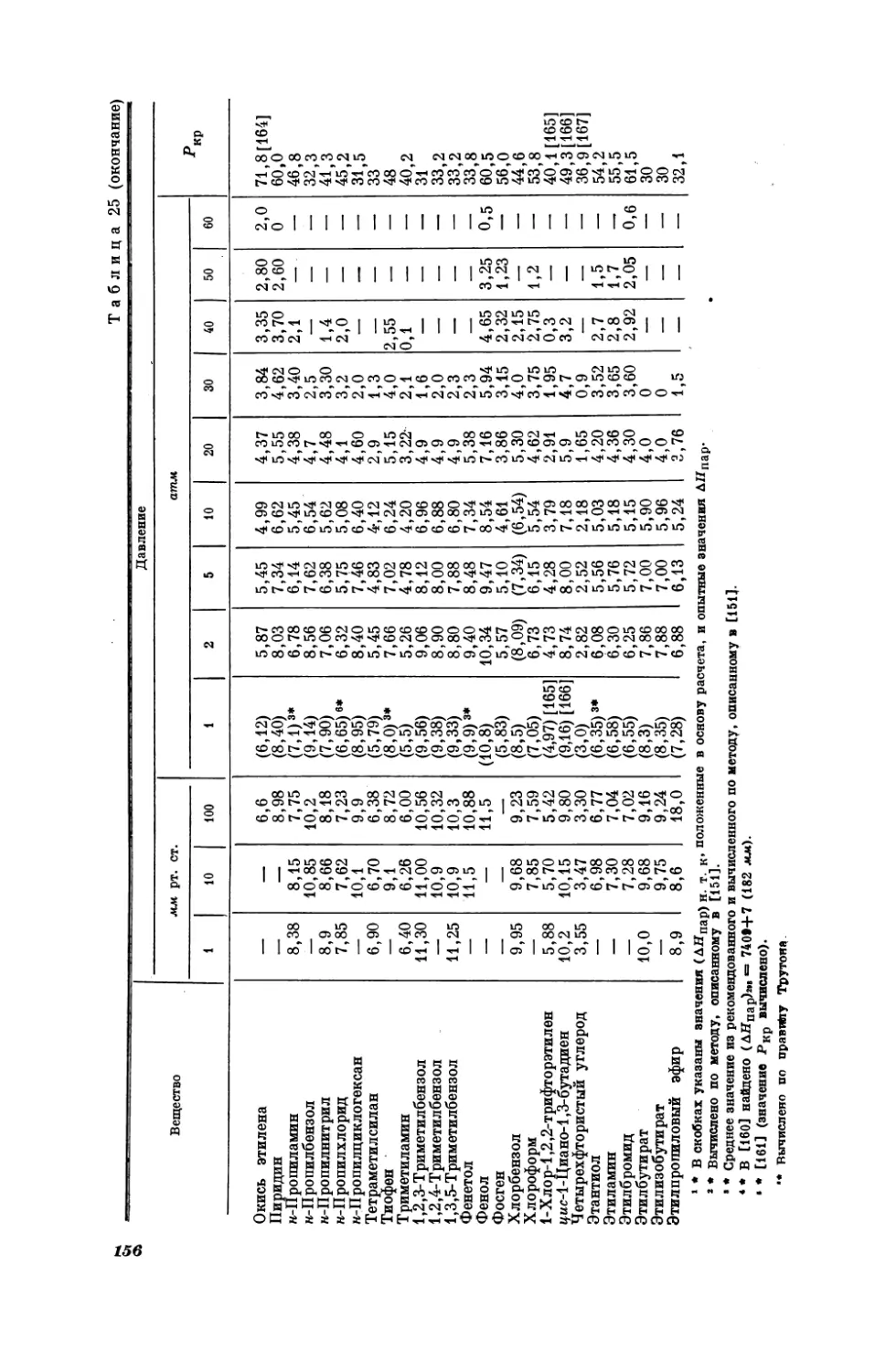
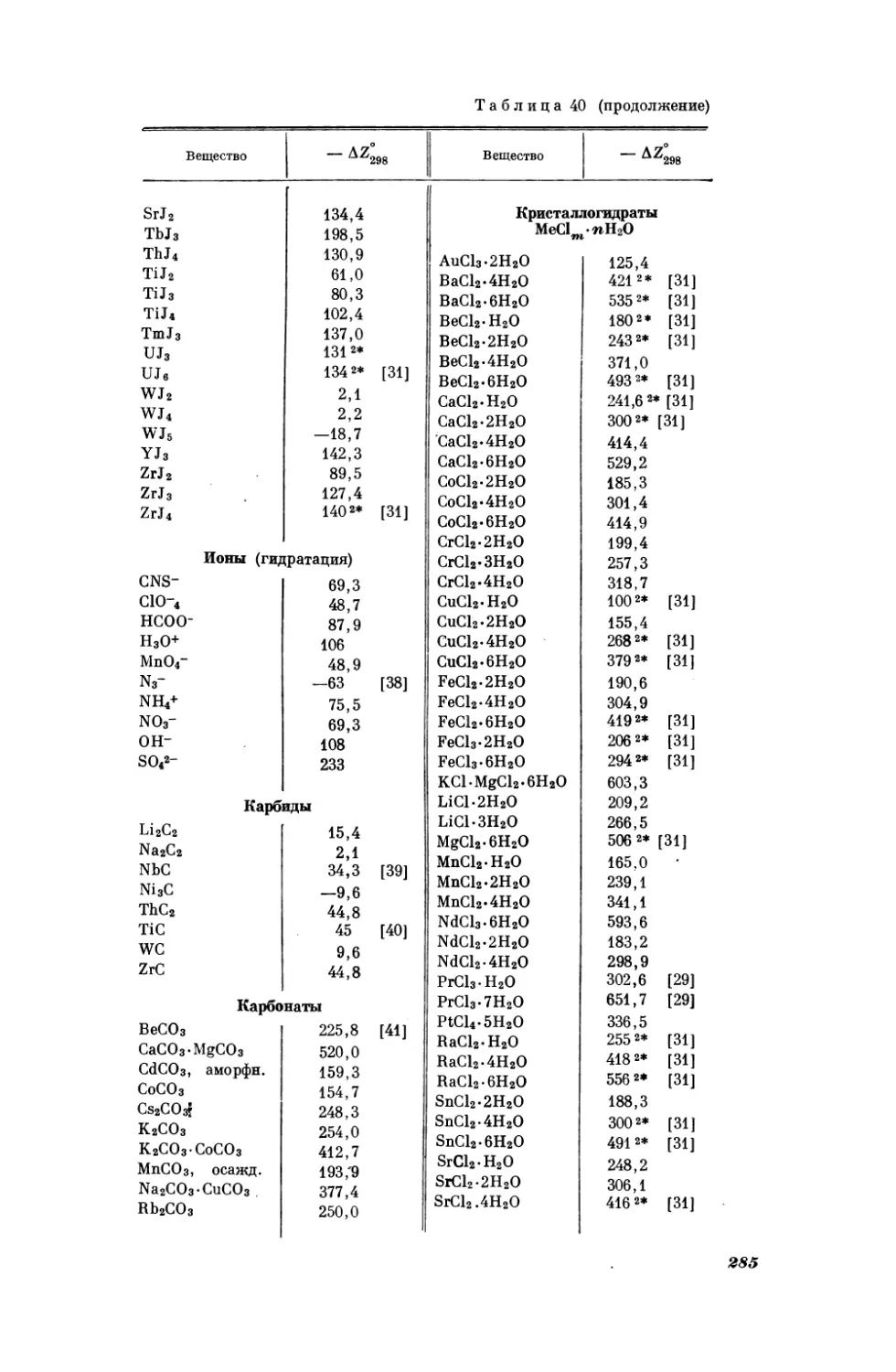
Таблица1
Сопоставление
опытных
[3] значений изобарной
теплоемкости Съ (кал/град-моль) галогенидов
натрия при 25° С се вычисленными по уравнению
(I, 2)
Соединение
С° Рив
по
NaF
41,0
NaCl
[3]
A
вычислено
опытн.—вычисл.
10,97
0,03
12,54
—0,04
NaBr
11,88
12,5
11 , 84
Ма 7
13,0
13,03
0,07
J
—0,03
Как видно из табл. 1, средняя погрешность расчета по (Г, 2) равна
кал/ерад. моль.
В соответствии со сказанным на стр.10 в каждом из рассматриваемых рядов веществ меняется лишь одна и та же часть молекулы, причем
0,04
1 Ссылки на источники данных, по которым строился этот и последующие чертежи, как правило, приведены в подрисуночных подписях. Номер ссылки соответствует
библиографии той главы, в которой находится данный чертеж.
11
таким образом, что вновь вводимый атом (или группа атомов) аналогичен
заменяемой части. Переменными частями могут быть электронные аналоги,
сходные группы атомов, родственные радикалы, различное количество
одинаковых частиц и т. д. Поэтому можно ожидать, что в таком ряду веществ данное свойство меняется закономерно, причем будет справедлива
зависимость
С
—
f(g)
(1,3)
Ve
ty
в которой & — некоторая характеристика неодинаковых (но аналогичных)
частей молекул ряда. Будем называть 2 параметром вещества. Им может
быть порядковый номер элемента, радиус соотCo
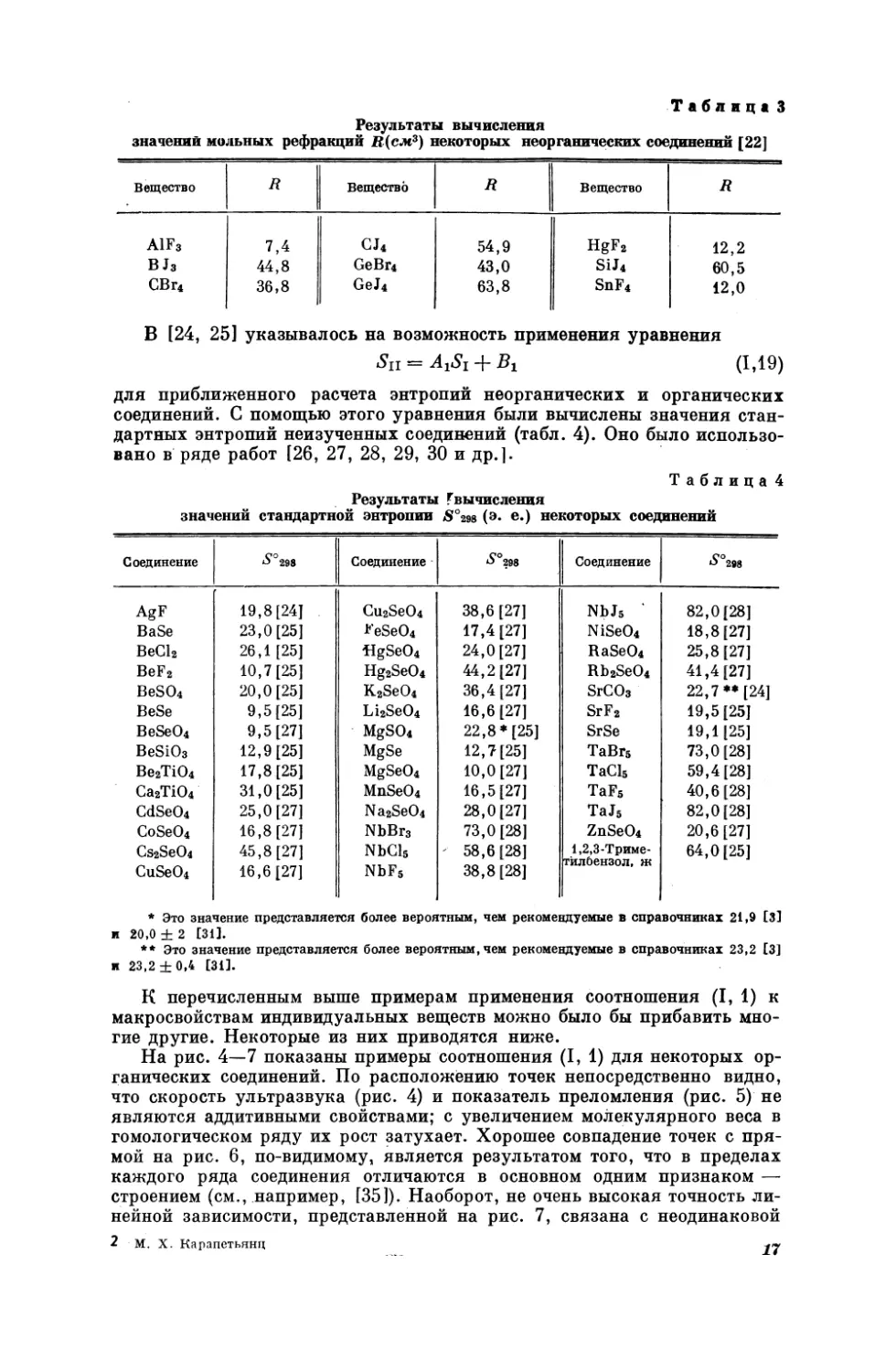
ветствующих атомов или ионов ит. д. Так теп157
лоемкость в ряду КХ или МаХ (Х = Е, @, Вт, J)
|
можно рассматривать как однозначную функцию порядкового номера галогена 2х (рис. 2).
12
.
Допустим, что с достаточной для практичесг
кой цели точностью зависимость (Т, 3) можно выTit
разить следующим двухпараметрическим урав|
нением
-
10
Рис. 3.
Дартной
F
Ct BrJ
|
_L
_t
(2, -)
а =а-
J
Зависимость станизобарной тепло-
емкости Ср
(в),
(1,4)
rye au 6 — постоянные, значения которых определяются видом той части молекулы, которая
одинакова для всех веществ ряда, а характер
функции ф зависит от природы переменной части
Молекулы, выбранного параметра вещества и от
Природы свойства (. Уравнению (Т, 4) можно
(кал/град: моль)
галогенидов калия и нат.
рия при 25°С [3] от порядкового номера 2-х галогена
придать
(в функциональной шкале)
также
следующий
ИИ
вид:
AG = bAg (g)
(1,3)
где индекс Л относится к двум (например, следующим друг за другом)
членам ряда, первый множитель правой части характеризует неизменную
часть молекулы, а второй — ее переменную часть. Так, для сходных веществ
АВ,, АВь, АВ. ит. д. уравнения
(1,4) и (1,5) имеют вид
Gan, = an + ba (въ)
ИЛИ
АС дв, = b,- Ag (в;)-
(1,6)
|
(1,7)
Представим теперь, что наряду с изменением свойства С в одном ряду
рассматривается его изменение в другом ряду сходных веществ, причем
оба ряда сформированы по одинаковому
признаку — переменные
части молекул в них одинаковы, а постоянные являются аналогами (примеры подобных рядов приводились выше). Допустим, что изменение (4
в каждой
для
обоих
паре
таких
рядов
рядов
будет
характер
описываться
функциональной
уравнением
зависимости
(1,4),
причем
одинаков,
Gy = ay + 61$ (8)
(1,8)
Gir = air + bn ($).
Другими
словами,
Ст-зависимости,
функциональная
приведет
к
шкала,
выпрямлению
т. е.
|
приводящая
и
к
(1,9)
выпрямлению
Сип-зависимости.
Так,
ф(2) на рис. 3, построенная таким образом, чтобы точки для (Ср)кх легли на
прямую,
дает прямую
и для
(Cp)Nax-
Следовательно,
подобие в ходе
кри-
вых Ср = {(2) для МаХ и КХ привело к их выпрямлению в одинаковых функциональных шкалах, что и обусловило справедливость уравнения (Г, 2). Действительно, исключив из (Т, 8) и (Т, 9) ф(5), т. е. сравнивая
12
значения С в рядах Ти [ сходных веществ при одинаковом
характеризующем меняющуюся часть молекулы 1, получим
b
a,b
Gu ==I Gi + an—
что
совпадает
значении
&,
(1,10)
I
с (1,1).
Очевидно, полученный результат — при справедливости (1,4) — не зависит от того, сравниваются ли ряды веществ А.В; и А.В; или А;В,
и
А;В
Qe
Хотя во всех уравнениях мы писали С, но нё исключено, что под С
следует иногда подразумевать некоторую функцию от С(, т. е. (1,4) окажется
справедливым при условии, что в левой части этого соотношения будет не
С, а, например,
12 < или
С"
функциональных
шкалах.
ит.
д.
Тогда
и
во
всех
последующих
уравнениях
вместо С следует ввести (С); в подобных случаях ив
соотношении (Т, 1) значения G должны сопоставляться в соответствующих
под
С подразумевается
Все это справедливо также в тех случаях, когда
характеристика
процесса
или
комплекс
свойств.
2
Преимущества
того
или
иного аргумента
в (Г, 3) (значения 5,
например, в отличие от радиуса иона гбезошибочны и не зависят от валентного состояния элемента) не имеет смысла обсуждать не потому, что неко-
торые
из
них
связаны
между
собой,
а по той
причине,
что
из
окончатель-
ного соотношения, т. е. из (1,1), аргумент 5 выпадает. А это значит, что
мотивируя справедливость соотношения (|, 1), нет необходимости обращаться к какому-либо конкретному параметру вещества (например, к 2),
а можно ограничиться лишь изложенным выше, тем более, что вид аргумента в функциональной связи (Т, 3) не зависит от того, по какому принципу
сформированы
сопоставляемые
справедливости соотношения
ряды
соединений.
Иными
словами,
факт
(Т, 1) не зависит от того, на каком расстоянии
расположены точки на первоначальном графике С = {(=). Оно может быть
каким угодно, в частности произвольным: в сопоставление вводятся величины, значения которых отложены на оси
ординат графиков,
соответствующих уравнению (1, 3).
Но если линейное расположение точек обусловлено только одним —
родственностью сопоставленных рядов, т. е. не связано с тем, является ли
а в данных
рядах той или иной функцией
того или иного параметра
g, TO
характер (дискретность) расположения точек при заданной последовательности веществ в рядах определяется именно видом зависимости (1, 3).
Поэтому
обосновать
соблюдение
соотношения
(Т, 1) для
данного
случая
можно только той конкретной зависимостью (Г, 3), которая по точности
результатов совпадает с (1, 1).
|
Хотя речь идет о том, что в характере расположения точек на ат —
Ст-прямой проявляется та G— 5-зависимость, которая справедлива для рассматриваемых рядов веществ в данных условиях сопоставления, и тем
самым подразумевается, что соотношение (Т, 1) будет столь же точным,
что и лежащие в ее основе зависимости
виду следующие два обстоятельства.
(Т, 3), однако
необходимо иметь в
1) Соотношение (Т, 1) в принципе является приближенным. Действительно, во-первых, на результаты вычисления по (1, 1) накладывается
погрешность в значениях свойств стандартного ряда (Ст); это может привести к существенным
член
быть
ошибкам,
особенно в тех случаях,
1 Разумеется, если в одном из сопоставляемых рядов
(какие-нибудь члены), то соответствующий
исключен из рассмотрения в другом ряду.
когда в пределах
пропущен
какой-нибудь
им член (члены)
должен
18
данного ряда изменение С от соединения к соединению соизмеримо с погрешностью в значениях С. Во-вторых, если С является не свойством вещества, а характеристикой процесса (например, его тепловым эффектом),
то ошибка может возрасти, так как в этих случаях на достоверность результатов будет влиять различие в свойствах как продуктов реакции, так
и исходных веществ. В-третьих, на точности результатов скажется и ряд
факторов, количественный учет совокупного влияния которых обычно
представляется
. весьма затруднительным. К ним относятся: возможное
различие в типе структуры, в модификации, в поляризуемости; в характере связи, в степени дисперсности и компактности вещества. Эти и другие факторы приводят к уменьшению подобия сопоставляемых рядов, а
поэтому к уменьшению точности расчета по (1, 1). Влияние этих и других
причин уменьшения подобия в свойствах зависит и от природы рассматриваемого
свойства,
и от вида
ряда,
и
от
условий
сопоставления.
Чем
меньшим числом признаков будут отличаться сопоставляемые ряды веществ, тем, при прочих равных условиях, более точным окажется соотношение (Т, 1).
|
Если погрешность экспериментальных данных является постоянно
действующим источником ошибок и в первом
приближении
можно
считать,
что она имеет примерно одинаковое значение для различных свойств и
различных классов соединений, то этого нельзя сказать о других источниках неточности. Действительно, вторая причина для органических соединений, особенно при группировке их в гомологические ряды, в общем случае менее ощутима, чем для неорганических соединений (сравните, например, ряды ВИ и ВВг, где В =СН., СНь, н-С.Н.,..., с рядами
MeC] u MeBr, rye Me = Li, Na, K, Rb, Gs, Fr).
Что касается третьей причины, то ее влияние во многом определяется
агрегатным состоянием веществ; в рядах жидких и, тем более, газообразных соединений влияние этого источника погрешности в общем случае
сказывается меньше, чем`для кристаллических соединений.
При
оценке точности
расчета
по
(Т, 1) следует,
наконец,
иметь
в виду
отличие первых членов ряда сходных веществ от всех последующих: первые гомологи в гомологических рядах органических соединений( например,
этен в ряду 1-алкенов), неорганические соединения, содержащие элементы
второго периода (например, МаЁ в ряду МаХ или Ве, в ряду МеС.,
ит.
д.).
2) Хотя соотношение (ТГ, 1) соблюдается лишь при условии двухпараметричности С — 2-связей, однако, если не ограничиваться требованием
высокой точности (Т, 4), можно значительно расширить рамки применения
основного соотношения. Так, если, например, (Т, 3) в явном виде выражается
уравнениями
И
И
то,
переписав
их
в виде .
x8?
ан = ay + bug + erg’,
Gr= arth (e+ see]
ст о
|
|
(1,44)
(1,12)
|
(1,13)
И
Gyr = aq + br («+
убеждаемся
в том, что условием
С
соблюдения
(Т, 1) является
“1 _ at
by
Ви.
Но даже если последнее будет не абсолютно точным
емлемый для практических целей результат.
14
(1,14)
>. с")
равенство
1,45
(1,15)
‚!(Т, 1) может дать при-
С другой стороны, в некоторых случаях для расширения возможности
сопоставления и повышения точности мыслим и некоторый отход от изложенных соображений за счет незначительного усложнения
условий.
Так, для уменьшения погрешности расчета возможен переход от урав-
нения
lg Gu = A,lgGi+ By,
являющегося одним из вариантов соотношения
lg Git
=
A,
Ig Ст
+
B,
+
Cy
(1,16)
(I, 1), K
lg? Gy,
(1,17)
в котором коэффициент (1 очень мал. Подобные усложнения нередко позволяют учесть и влияние различных факторов, о которых шла речь выше.
В соответствии с тем, что соотношение (I, 1) своим происхождением
обязано подобию двух рядов веществ, оно с той или иной точностью применимо к самым различным параметрам состояния и процессов и к самым
разнообразным классам соединений.
|
Перейдем теперь к обзору различных закономерностей вида (1, 1).
о ЧИСТЫЕ ВЕЩЕСТВА:
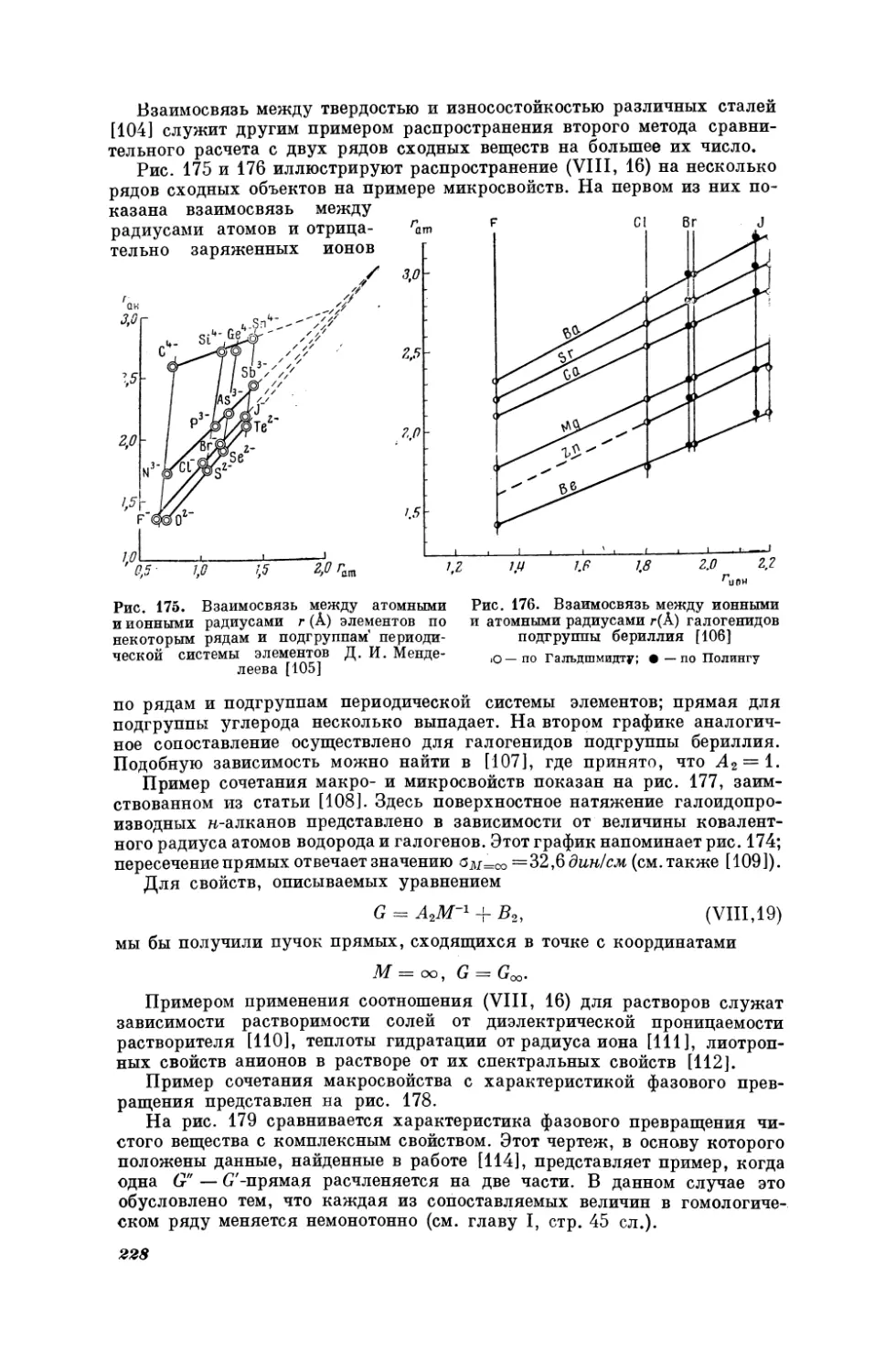
Макросвойства
Вероятно, одной из первых по времени
закономерностей,
кото-
рую можно рассматривать как пример соотношения (1, 1), является линейная связь между объемами в двух рядах родственных веществ, установлен-
ная Фаянсом, Гриммом
[4] и Бильтцем
[5, 6]. Эти исследователи нашли,
что мольные объемы галогенидов металлов Гмех и галогенидов калия Vex
связаны уравнением
Умех
=
A,Vxx
+
B,
(1,18)
(см. также [7, 8, 9]) *. Многочисленные работы Бильтца с соавторами (см.,
например, [40—12]), а также некоторых других исследователей [13, 14],
связанные с рассмотрением закономерностей в объемах неорганических
веществ, в том числе с уравнением (ТГ, 18), были обобщены в монографии [15], в которой приведен обширный экспериментальный материал (см.
также [16]). Монография Бильтца [15] — единственная в мировой литературе фундаментальная работа, в которой отведено значительное место
сравнительному расчету (объемов) при температуре абсолютного нуля. В
ней основное внимание уделено неорганическим веществам (органическим
соединениям отведено лишь 10 страниц). При этом на обширном фактическом материале рассмотрены различные случаи (прямые параллельны,
линии расположены с возрастающим наклоном, почти сливаются, линии
криволинейны). Уравнение вида (1, 3) распространено также на галогениды и органические галогенпроизводные (см., например, [17]). Уравнение
вида (Т, 8) для 4 = У
(А!
= 1,012; В:=
ливановой и автором [18] для расчета
натов; в качестве стандартного ряда
числения приведены в табл. 2.
6,40) было использовано Н. М.Се-
мольных объемов неизученных селевыбраны сульфаты; результаты вы-
1 Обозначения коэффициентов в уравнениях, являющихся частными выражениями соотношения (1, 1), здесь и далее приняты такими же, как ив (Т, 1), т.е. Ати В1. То
же относится к другим методам сравнительного расчета: везде нижние индексы будут
соответствовать номеру метода.
15
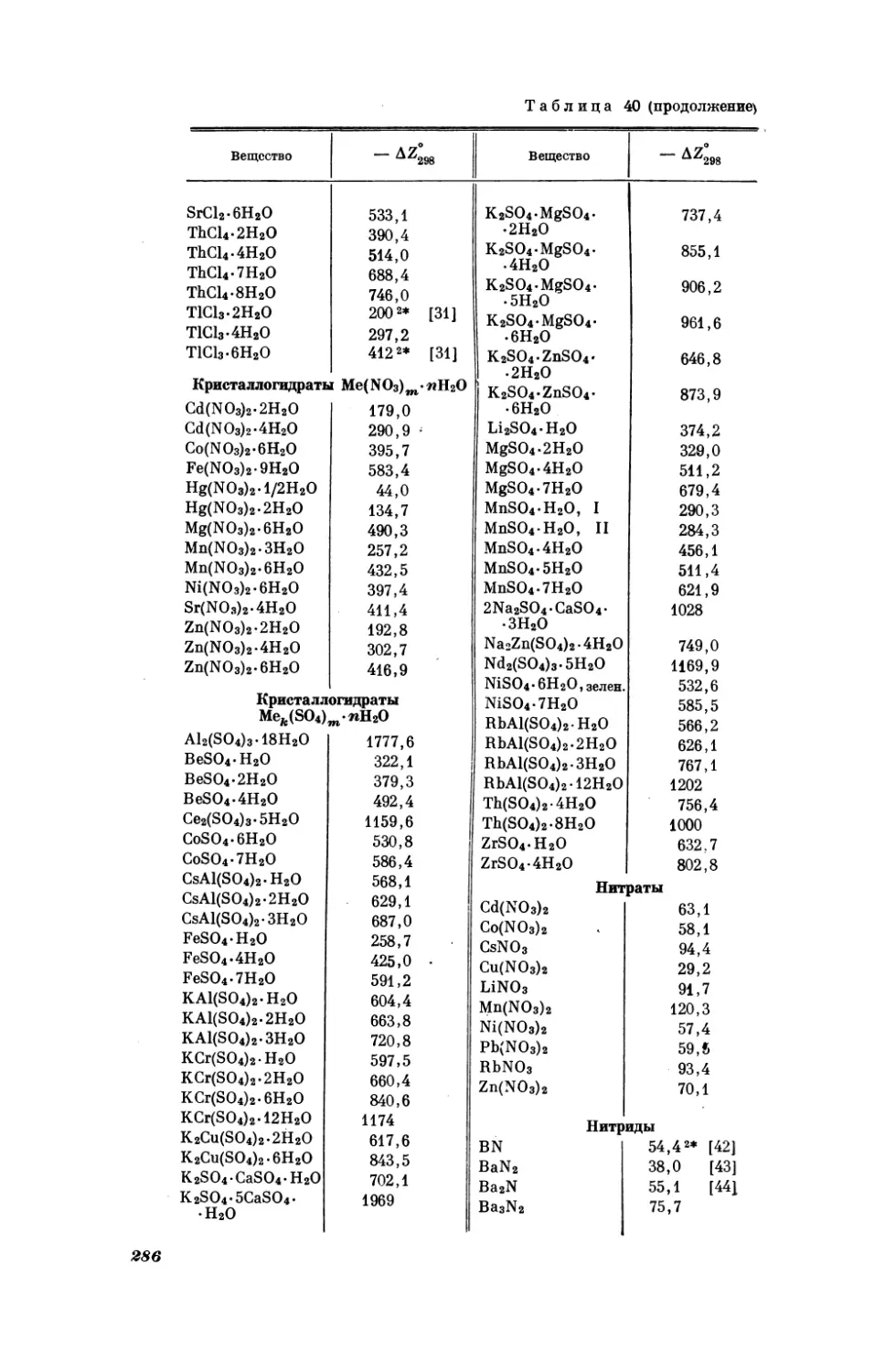
Таблица2
Результаты вычисления значений мольных объемов У (смЗ/моль) и удельных
весов 4(г/см3) некоторых селенатов, найденных в работе [18] *
Вещество
7
OV
а**
Вещество
|
Ale(SeO4)3
Al2(SeO4)3-18H20
В15(5е04)з
CdSeO,
145,7 | 3,34
431,2 | 1,87
115,0
|7,36
50,9 | 5,06
La2(SeO.)s
La2(SeO4)3- 9H20
MgSeO4-7H20
MnSeO,
Ce2(SeOz)3-8H20
CoSeO.4
266,5 | 3,20
51,2 | 4,00
MnSe04-4H20
Мпз(5е04)з
CoSeO4-4H20
Собе04-7Нз0
Сгз(Зе04)з
Cr2(SeO4)3-18H20
Ру2(ЗеО4)з
Ег2(Зе04)з
Er2(SeO4)3-8H20
98,5
149,8
149,5
444,0
187,3
189,0
257,7
CdSeO4-H20
CoSeO4- H20
ЕебеО4
FeSeO,-H20
66,3 | 4,12
MnSeO,-H20
176,5
214,8
153,2.
53,0
4,04
2,24
1,92
3,74
112,3
148,5
2,48
3,63
98,5
149,7
172 ‚5
212,5
166,7
497,5
269,7
2,18
2,19
4,12
3,40
4,03
3,07
3,24
63,1
3,24
Nd2(SeO4)3-8H20
275,8 |
51,5
У. (5е04)з.8Н2О
259,9
|
|
|
|
|
2,78
2,19
3,57
1,94
4,03
|4,04
| 3,60
|3,86
№ 2(5е04)з-4Н2О
NiSeO4-7H20
Pr2(SeOa)s
Pro(SeO4)3-8H20
Sbe(SeO.)s
Sce(SeOa)s
Sm2(SeO4)3-8H20
Ybe(SeOu)s
FeSe04-4H20
103,5 | 2,62
Y be(SeO4)3-8H20
Fe2(SeO4)3-9H20
281,1 | 2,81
ZnSeO4-H20
HgSeO.
1п2(ЗеО4)з
4**
62,7 | 3,54
62,7 | 3,46
Feo(SeOa)s
©
У
148,7 | 3,64
50,8 | 6,78
170,1 | 3,87
ZnSeO4
ZnSeO4-7H20
187 ‚0
*|
3,13
2,88
4,45.
256,5
3,54
49,5
61,5 |
453,4
4,20
3,68
2,18
* Здесь и в дальнейшем таблицы с заголовком «Результаты вычисления...» содержат только
приближенные значения соответствующих свойств, найденные с помощью методов сравнительного
расчета.
**
При
18—20°
С.
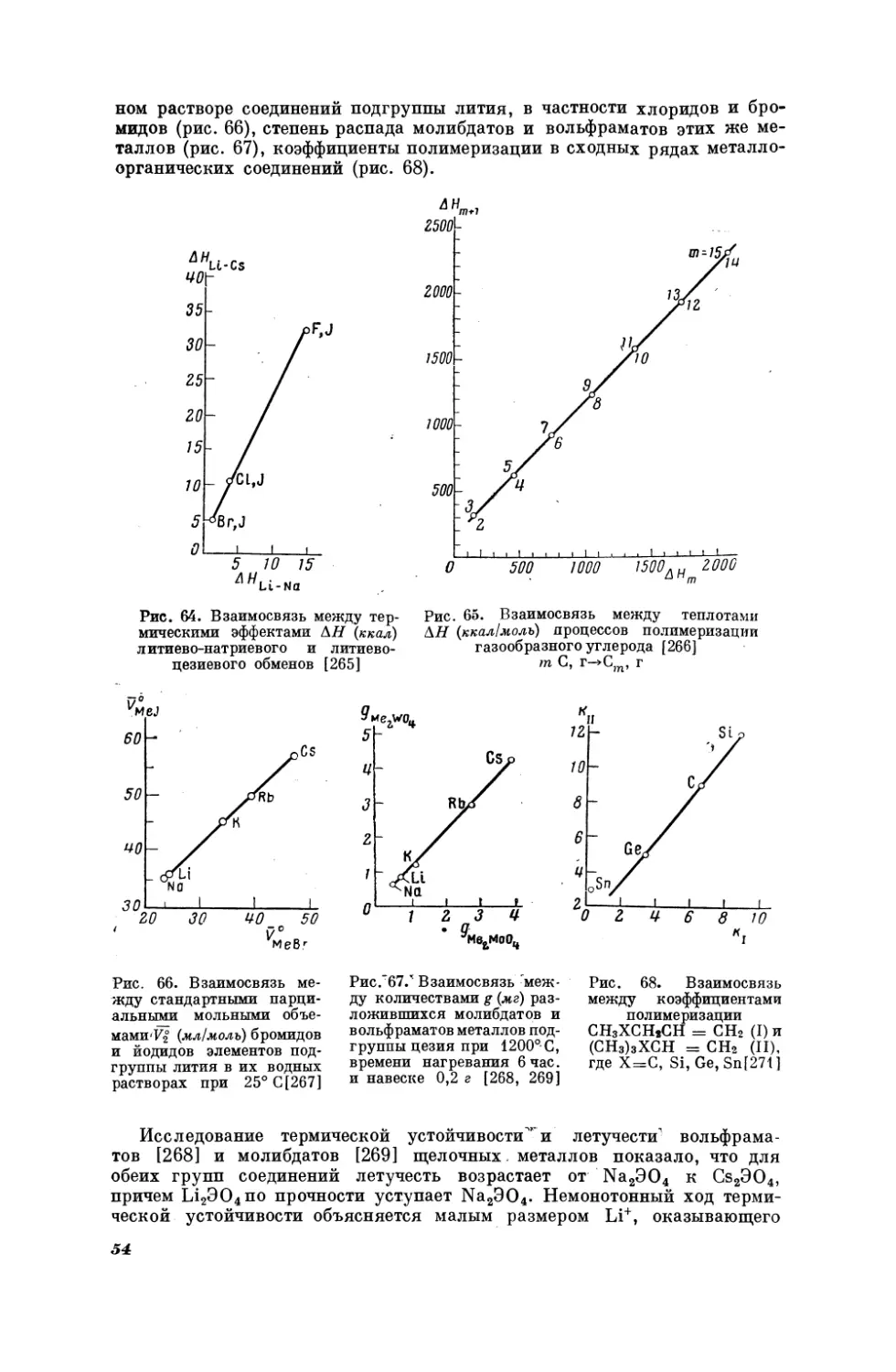
Ряд зависимостей вида (1,1) описал
объемы галогенидов щелочных металлов
Ли.
как
Он показал, что мольные
в кристаллическом, так и
в жидком состоянии являются линейной функцией
объема анионов как
вычисленных по радиусам Л. Полинга, так и найденных из объемов их
растворов
[19]. Из
этих
зависимостей был получен ряд производных
соотношений [20]. Аналогичные зависимости найдены для рефракции
в частности,
генидов
было
щелочных
показано,
металлов
что мольные
можно
рефракции
выразить
как
одного
линейную
ряда
[21];
гало-
функцию
рефракцийв другом ряду, имеющем общий катион или общий анион.
Линейные
зависимости
вида
(1,1)
для
мольных
рефракций
га-
зообразных и жидких
неорганических соединений были рассмотрены в
работе [22]. С помощью этих зависимостей были определены рефракции
ряда неизученных веществ (табл. 3).
Авторы этой работы отмечают, что линейная зависимость между рефракциями не зависит от типа связи; поэтому нет необходимости вводить
условные системы «атомных», «ионных» и тому подобных рефракций или
же инкрементов рефракций. Это достоинство сравнительного метода расчета, разумеется, распространяется не только на рефракцию.
Возможность применения (1, 1) для ряда свойств показана на графиках.
приведенных в [23].
16
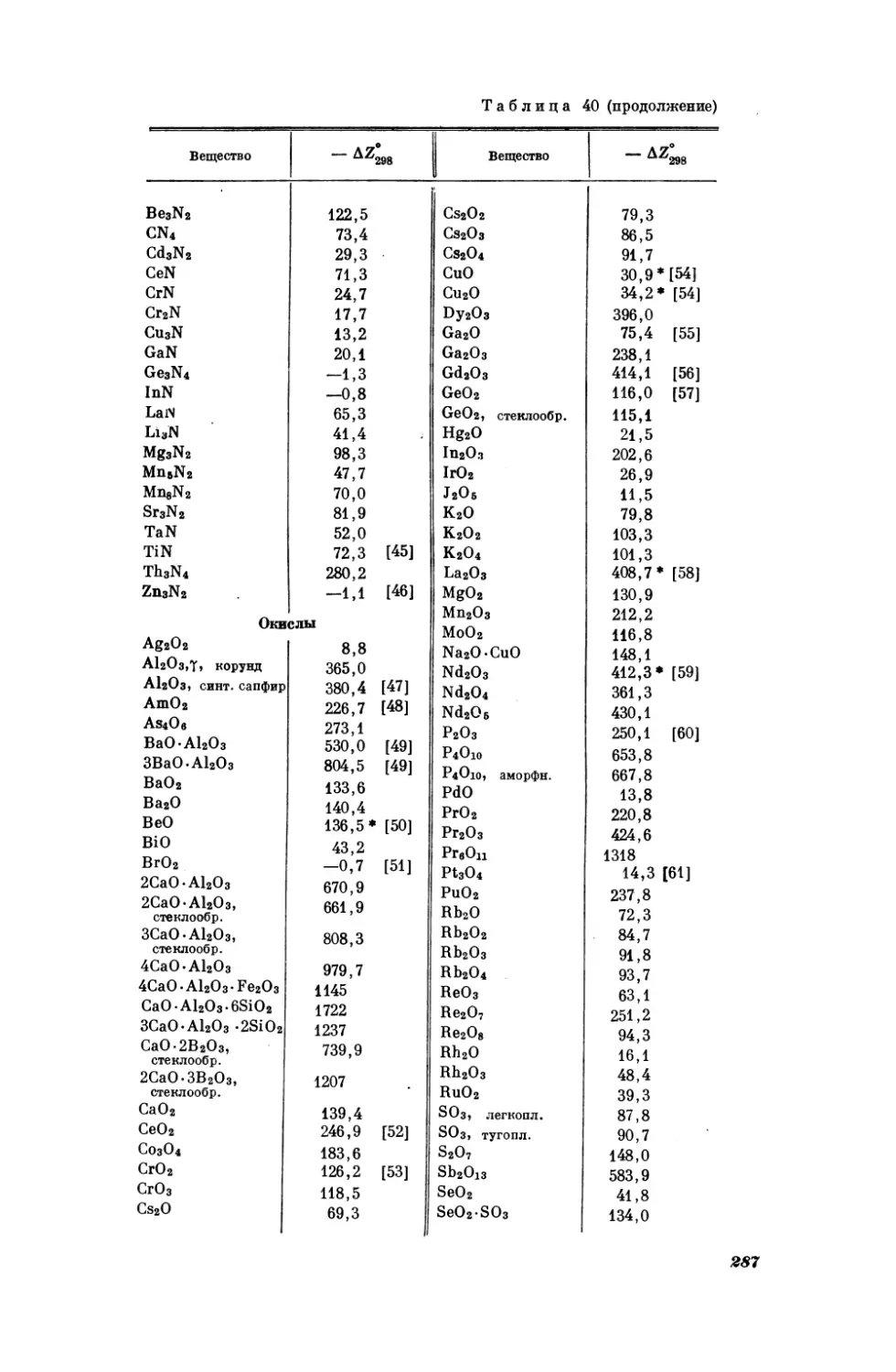
Таблица3
Результаты вычисления
рефракций В(см3) некоторых неорганических соединений [22]
значений мольных
Вещество
R
AIFs
|
Вещество
7,4
BJs
CBra
CJ,
44,8
36,8
СеВга
Gel,
R
Вещество
54,9
НЕЕ»
43,0
63,8
R
42,2
Sid,
snk,
60,5
42,0
В [24, 25] указывалось на возможность применения уравнения
9т = А15т-[ В:
(1,19)
для приближенного расчета энтропий неорганических и органических
соединений. С помощью этого уравнения были вычислены значения стандартных энтропий неизученных соединений (табл. 4). Оно было использо-
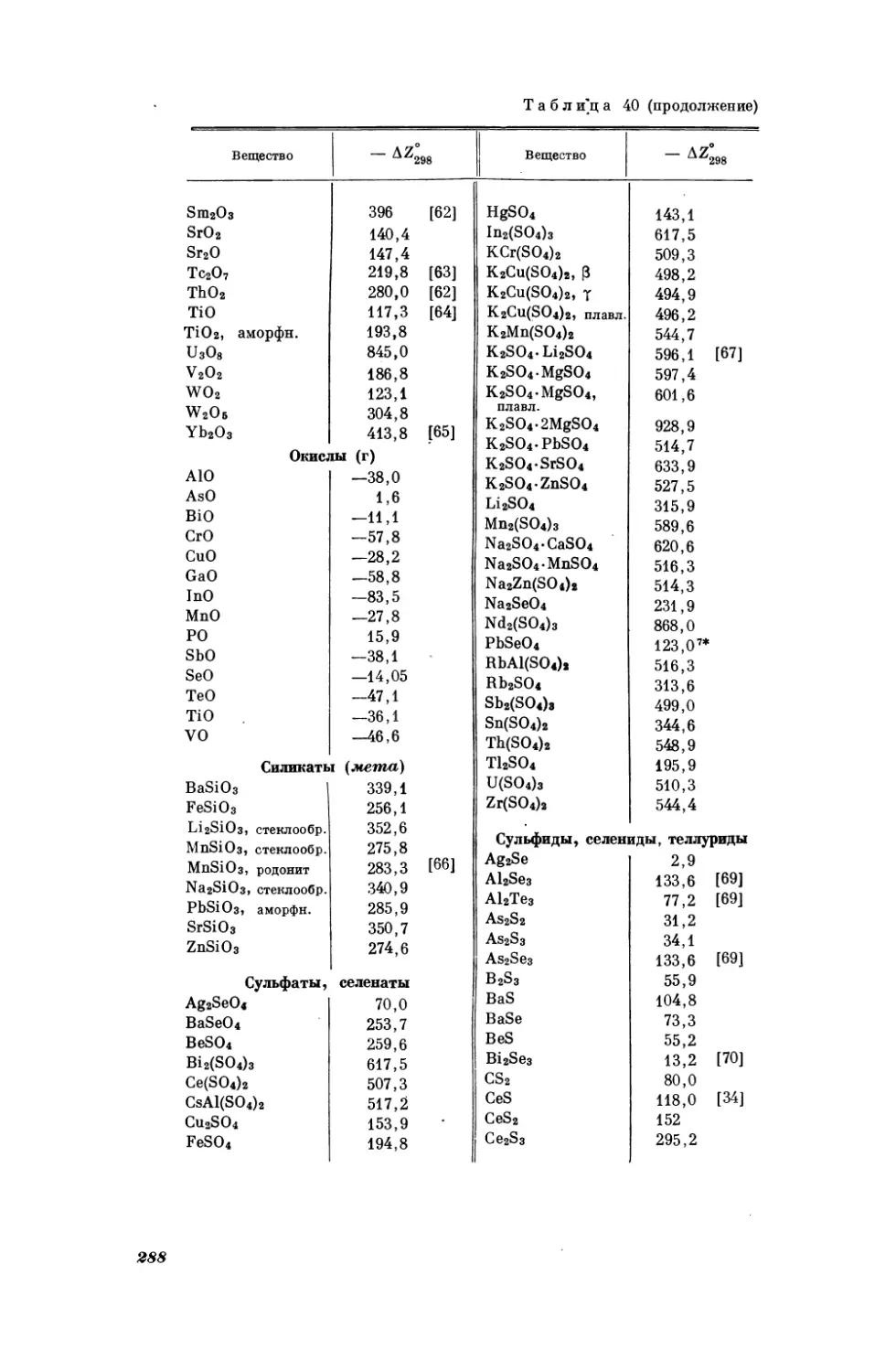
вано в ряде работ [26, 27, 28, 29, 30 и др.]|.
‚ Результаты вычисления
значений
стандартной
Соединение
598
AgF
5°2з (э. е.)
Соединение
некоторых
5 9298
соединений
Соединение
S298
19,8 [24]
Си Зе04
38,6 [27]
NbJs
82,0 [28]
BeCle
ВеЕ»
BeSOu
BeSe
26,1
10,7
20,0
9,5
HeSeO,
HgeSeO, |
К.5е04
1.125е04
24,0 [27]
44,2[27]
36,4 [27]
16,6 [27]
RaSeO.
RbeSeO, |
ЗС Оз _
SrFe
25,8
44,4
22,7
19,5
Ве! Оз
12,9 [25]
12,7 [25]
TaBrs
73,0 [28]
BaSe
23,0 [25]
BeSeO,
*
Это
17,8
31,0
25,0
16,8
45,8
16,6
значение
и 20,02
FeSeO,
[25]
[25]
[25]
[25]
9,5 [27]
BeeTiOg
CasTiOg
CdSeO4
СоЗе04
Cs2SeOq
Сибе0.
и
энтропии
Таблица4
[31].
°Мо504
[25]
[25]
[27]
[27]
[27]
[27]
Мо5е0.
MnSeO,
Ма›бе0л
NbBrs
NbCls
NDF;
** Это значение представляется
23,20,
[31].
К
перечисленным
выше
более
№15е04
22,8* [25]
MgSe
представляется
макросвойствам
17,4 [27]
10,0 [27]
16,5 [27]
28,0 [27]
73,0 [28]
58,6[28]
38,8 [28]
вероятным,
TaCl;
TaFs
TaJs
ZnSeOa
|| 1.2,3-Tpmme- |
[27]
[27]
** [24]
[25]
19,1 [25]
59,4[28]
40,6 [28]
82,0 [28]
20,6 [27]
64,0 [25]
_
рекомендуемые
в справочниках
21,9
[3]
более вероятным, чем рекомендуемые
в справочниках
23,2
[3]
примерам
индивидуальных
чем
SrSe
18,8 [27]
применения
веществ
можно
соотношения
было
(1, 1) к
бы прибавить
мно-
гие другие. Некоторые из них приводятся ниже.
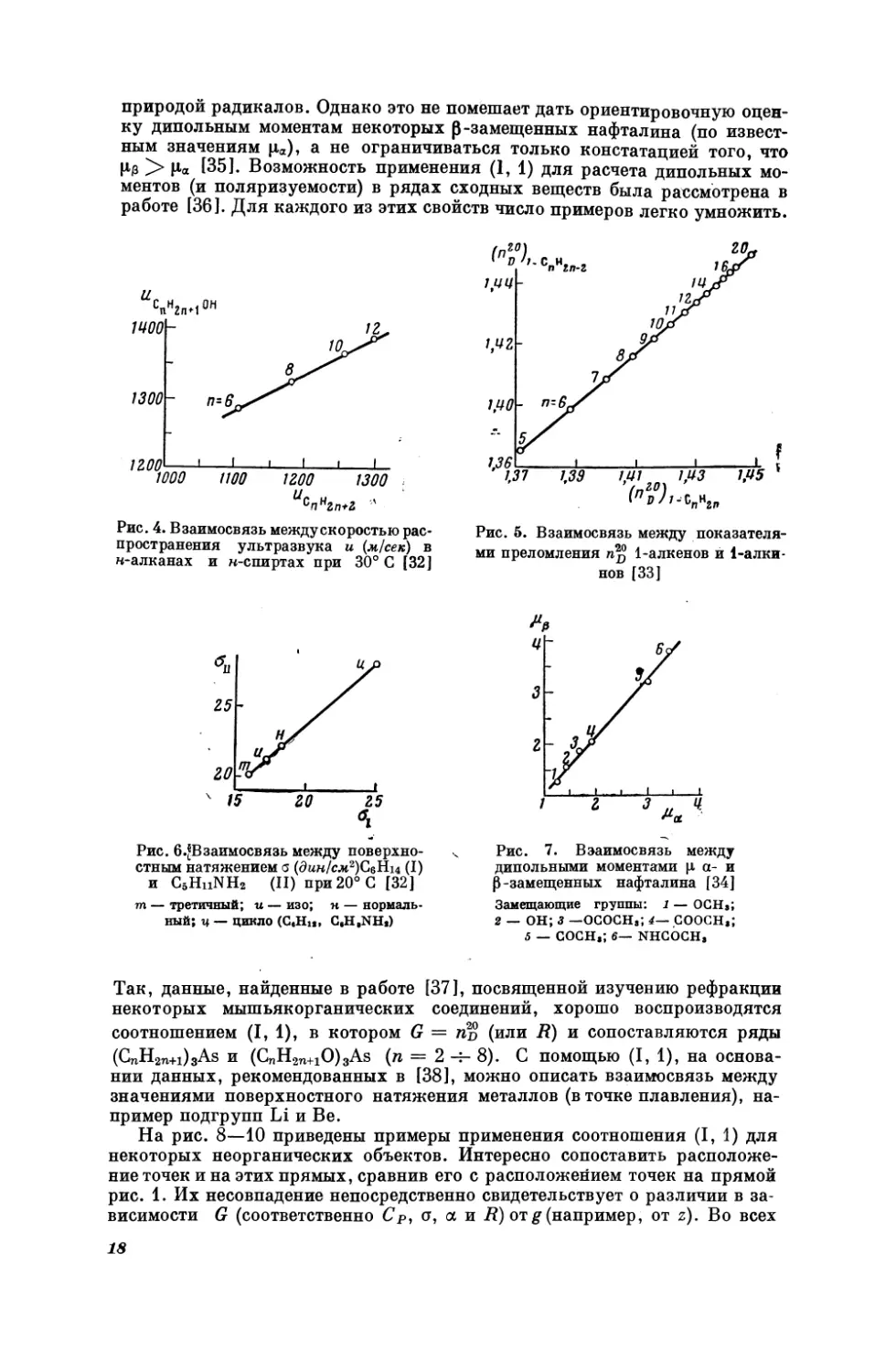
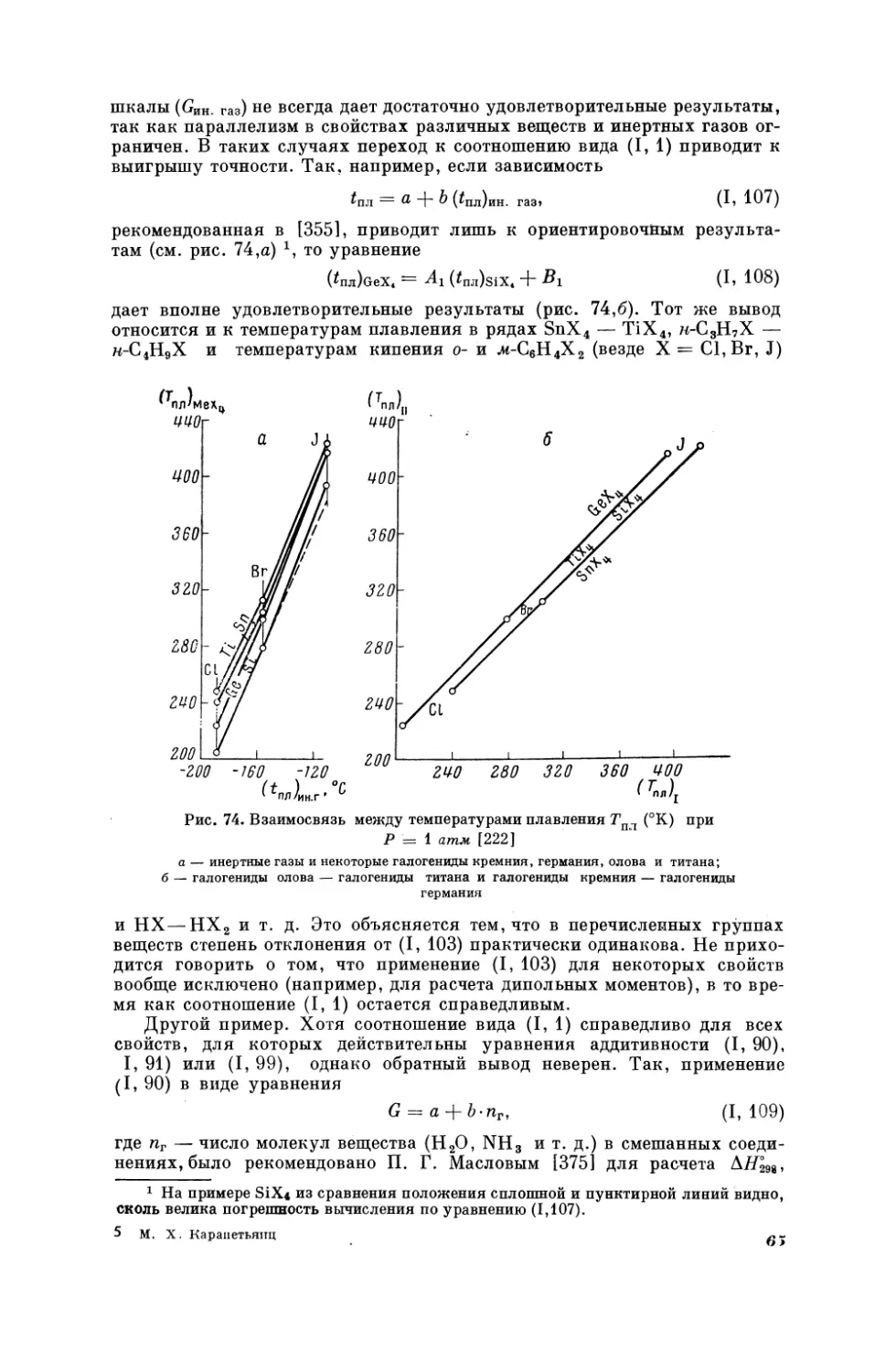
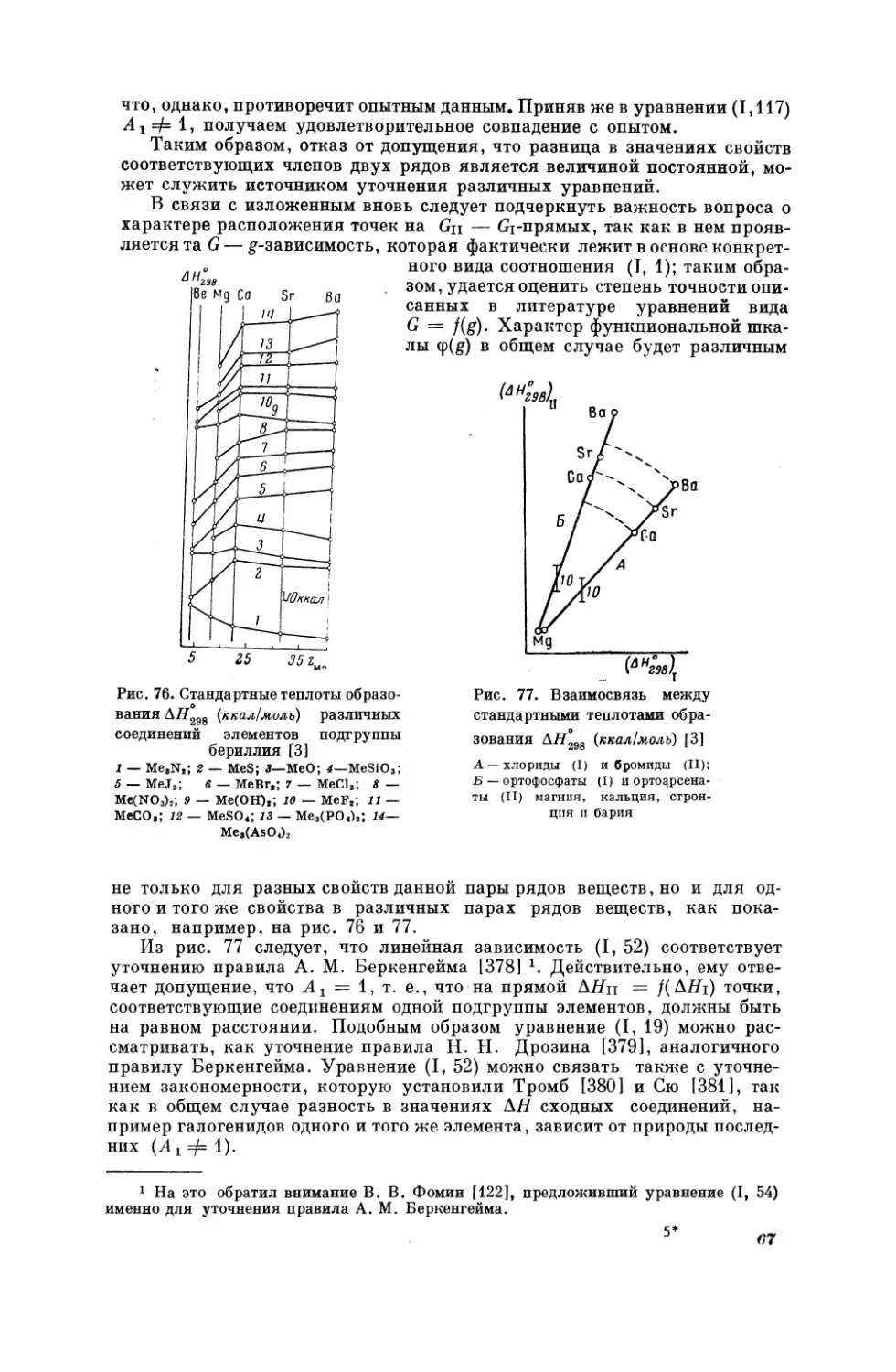
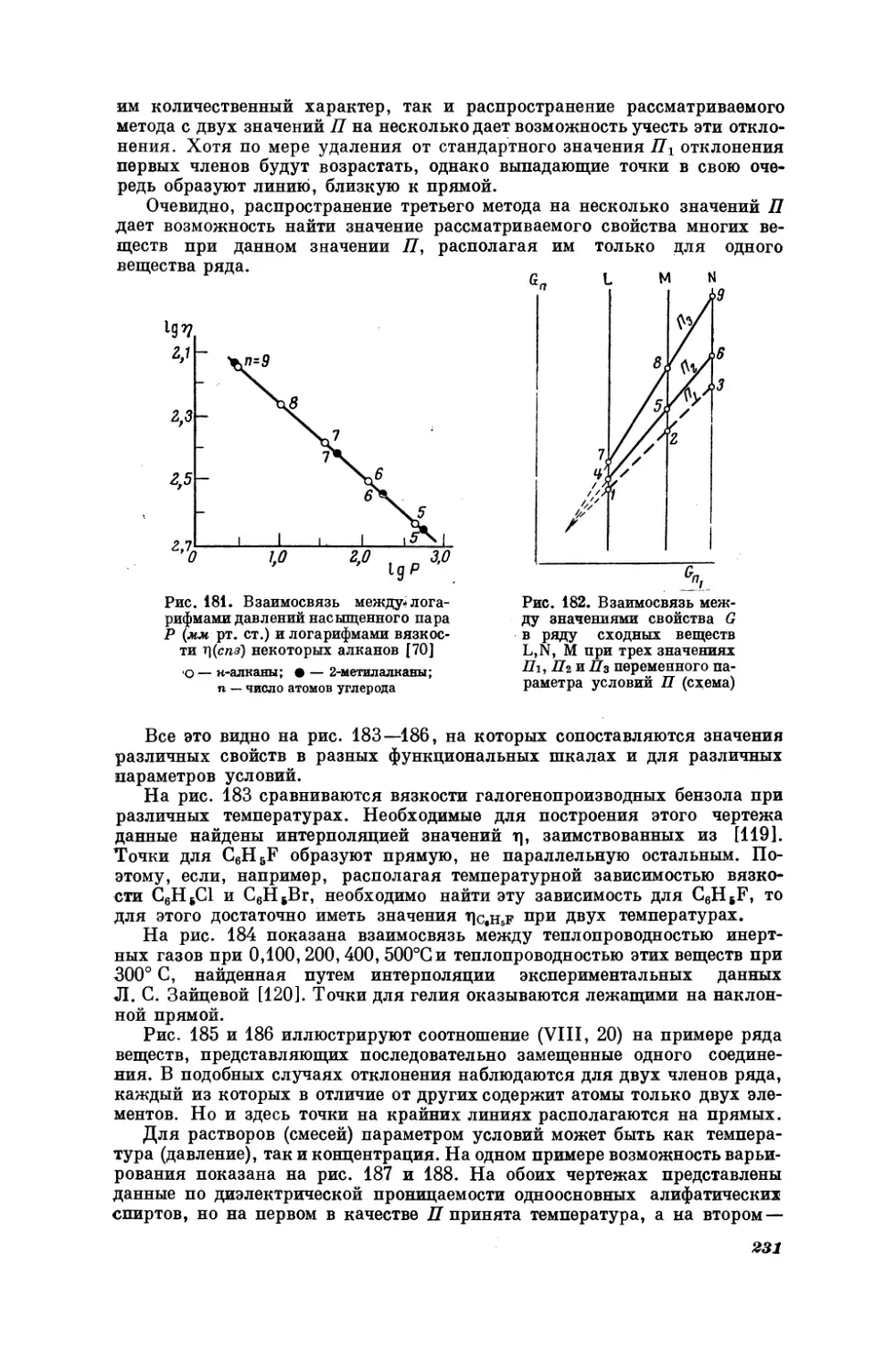
На рис. 4—7 показаны примеры соотношения (Г, 1) для некоторых органических соединений. По расположению точек непосредственно видно,
что скорость ультразвука (рис. 4) и показатель преломления (рис. 5) не
являются
аддитивными
свойствами;
с увеличением
молекулярного
веса
в
гомологическом ряду их рост затухает. Хорошее совпадение точек с прямой на рис. 6, по-видимому, является результатом того, что в пределах
каждого ряда соединения отличаются в основном одним признаком —
строением (см., например, [35]). Наоборот, не очень высокая точность линейной зависимости, представленной на рис. 7, связана с неодинаковой
2
.М.
Х.
Карапетьянц
17
природой радикалов. Однако это не помешает дать ориентировочную оценку дипольным моментам некоторых В-замещенных нафталина (по известным значениям |1.), а не ограничиваться только констатацией того, что
Ив > Ва [35]. Возможность применения (1, 1) для расчета дипольных моментов (и поляризуемости) в рядах сходных веществ была рассмотрена в
работе [36]. Для каждого из этих свойств число примеров легко умножить.
20
n
( D ).
TAU
И
20
CAH en-2
16
id
Cones OH
1400+Г
142
8
1300
1200
12
10
n=6
1009
!
140
{
|
1100
|
I
1200
|
MCnHaneg
hoe 4. Взаимосвязь
ранения
н-алканах
и
ультразвука
н-спиртах
и
рас.
я
nH
CsHuNHe
третичный;
Так,
(П) при 20°С
и —
изо;
найденные
|
н —
[32]
В-замещенных
нормаль-
в работе
|
L
МИ.
13
("5
1-O,Hen
Рис.
7.
Взаимосвязь
дипольными моментами
15
|
между
Ц а- и
нафталина
[34]
Замещающие
группы:
1— ОСН,;
2 — OH; 3 —OCOCHSs; 4+— COOCH;;
5 — СОСН,; 6— МНСОСН,
ный; у — цикло (С‹.Н::, С.Н,МН:)
данные,
i
199
[37], посвященной
изучению
рефракции
некоторых мышьякорганических
соединений, хорошо воспроизводятся
соотношением (Т, 4), в котором @ = про (или В) и сопоставляются ряды
(С„Ноп+1)з3Аз и
(С„Н„.О)зАз
(п =
2-
8).
С
помощью
(Т, 1), на основа-
нии данных, рекомендованных в [38], можно описать взаимосвязь между
значениями поверхностного натяжения металлов (в точке плавления), например подгрупп Ши Ве.
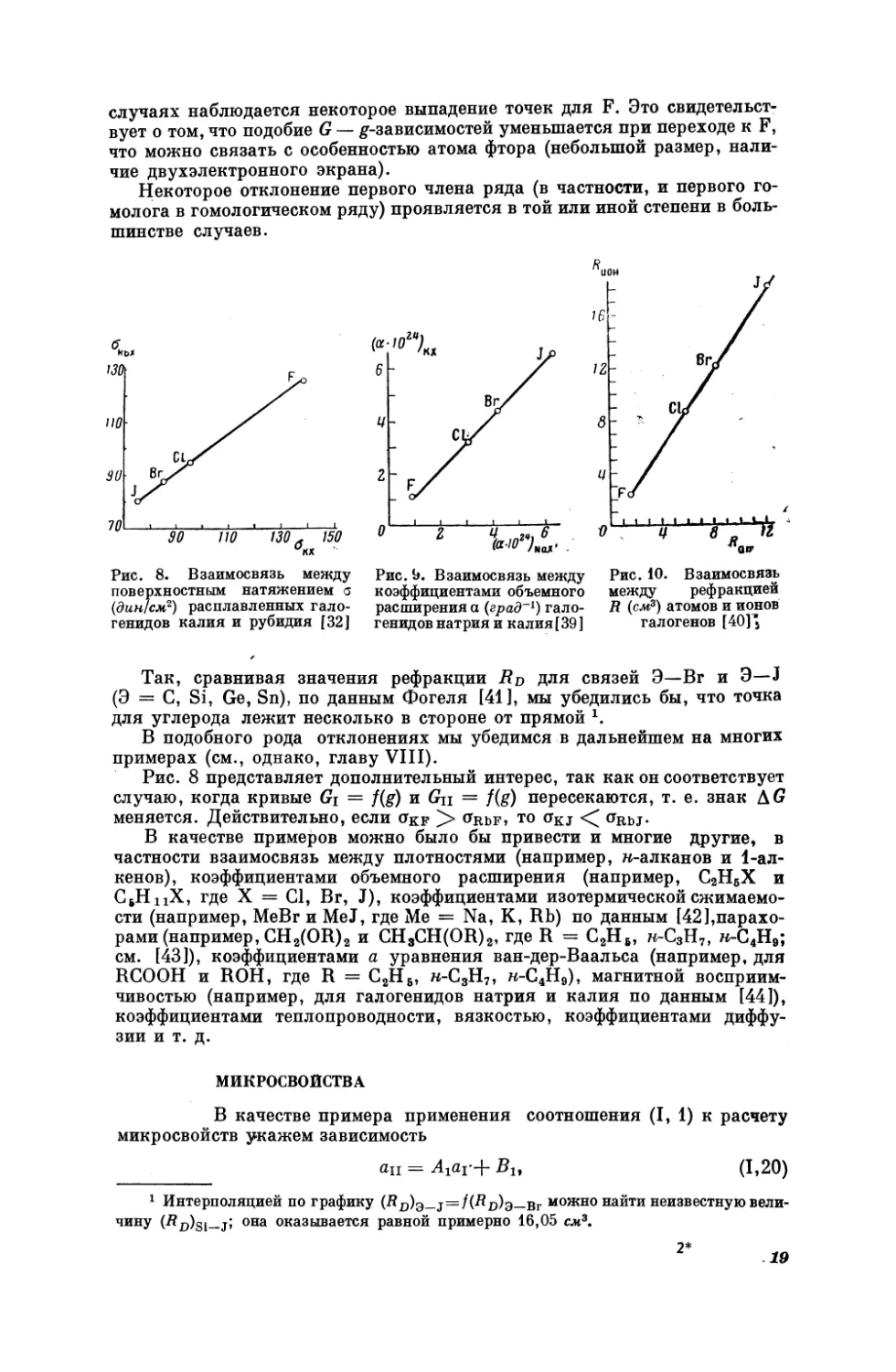
На рис. 83—10 приведены примеры применения соотношения (1, 1) для
некоторых неорганических объектов. Интересно сопоставить расположение точек и на этих прямых, сравнив его с расположением точек на прямой
рис. 1. Их несовпадение непосредственно свидетельствует о различии в зависимости С (соответственно Ср, 0, хи В) отв (например, от 2). Во всех
18
f
Рис. 5. Взаимосвязь между показателяMH преломления п 20D 3 4. ana
и14-1-алки -
30°С(м/сек) [32]в
Рис. 6Взаимосвязь между поверхностным натяжениемс (дин/см?)Сь
Нла (Г)
т —
197
a
ро
при
136
1300:
случаях наблюдается некоторое выпадение точек для Е. Это свидетельствует о том, что подобие С — 8-зависимостей уменьшается при переходе к Е,
что можно связать с особенностью атома фтора (небольшой размер, наличие двухэлектронного экрана).
Некоторое отклонение первого члена ряда (в частности, и первого гомолога в гомологическом ряду) проявляется в той или иной степени в большинстве случаев.
Kbx
130}
:
ОЕ
|
CL
go} = Br
J
.
1
70
9
1
0
8.
Рис.
i
1
|
i.
0
1 ID
Взаимосвязь
1
6
0
1
150(
Рис.9.
между
1
2
_
\
1
1
(o:10°)
Yt)
7,
Oo
.
Взаимосвязь между
коэффициентами объемного
а (град`!) галорасширения
натяжением с
поверхностным
(дин/см?) расплавленных гало-
генидов калия и рубидия
1
[32]
генидов натрия и калия[39]
Взаимосвязь
Рис.10.
рефракцией
между
В (см?) атомов и ионов
галогенов [40]
¢
Так,
сравнивая
значения
(9 = C, Si, Ge, 8п), по данным
рефракции
Фогеля
Вр
для
[41], мы
связей
убедились
Э—Вг
и Э—4
бы, что точка
для углерода лежит несколько в стороне от прямой 1.
В подобного рода отклонениях мы убедимся в дальнейшем на многих
примерах (см., однако, главу УГ).
° Рис. 8 представляет дополнительный интерес, так как он соответствует
случаю, когда кривые Ст = {(2) и Си = {К (5) пересекаются, т. е. знак Аб
меняется.
Действительно, если окр >> Овьг,
ТО Oxy < о0вь:.
В качестве примеров можно было бы привести и многие другие, в
частности взаимосвязь между плотностями (например, н-алканов и 1-алкенов), коэффициентами объемного расширения
(например,
С.НьХ и
СН \1Х,
где
ВСООН
и
Х
=
С,,
Вг,
где
В =
Т), коэффициентами
изотермической сжимаемо-
сти (например, МеВг и Меу, где Ме = Ма, К, ВЬ) по данным [42] парахорами (например, СН.(ОВ), и СН.СН(ОВ)., где В = С.Нь, н-СзНа, н-С.Ну
см. [43]), коэффициентами а уравнения ван-дер-Ваальса (например, для
ВОН,
С.Н ‚„, н-С.На,
н-С.Н.),
магнитной
восприим-
чивостью (например, для галогенидов натрия и калия по данным [44]),
коэффициентами теплопроводности, вязкостью, коэффициентами диффузии и Т. Д.
МИКРОСВОЙСТВА
В качестве примера
микросвойств
применения
укажем зависимость
соотношения
(1, 1) к расчету
ат = А1ат’- Вт,
чину
(1,20)
1 Интерполяцией по графику (А р)э_т=/(В р)э—вг МОЖНО найти неизвестную вели(К р)‹1_т; Она оказывается равной примерно 16,05 смз.
2
*
19
значения
сопоставляются
которой
в
периодов
двух рядах изоструктурных кристаллических
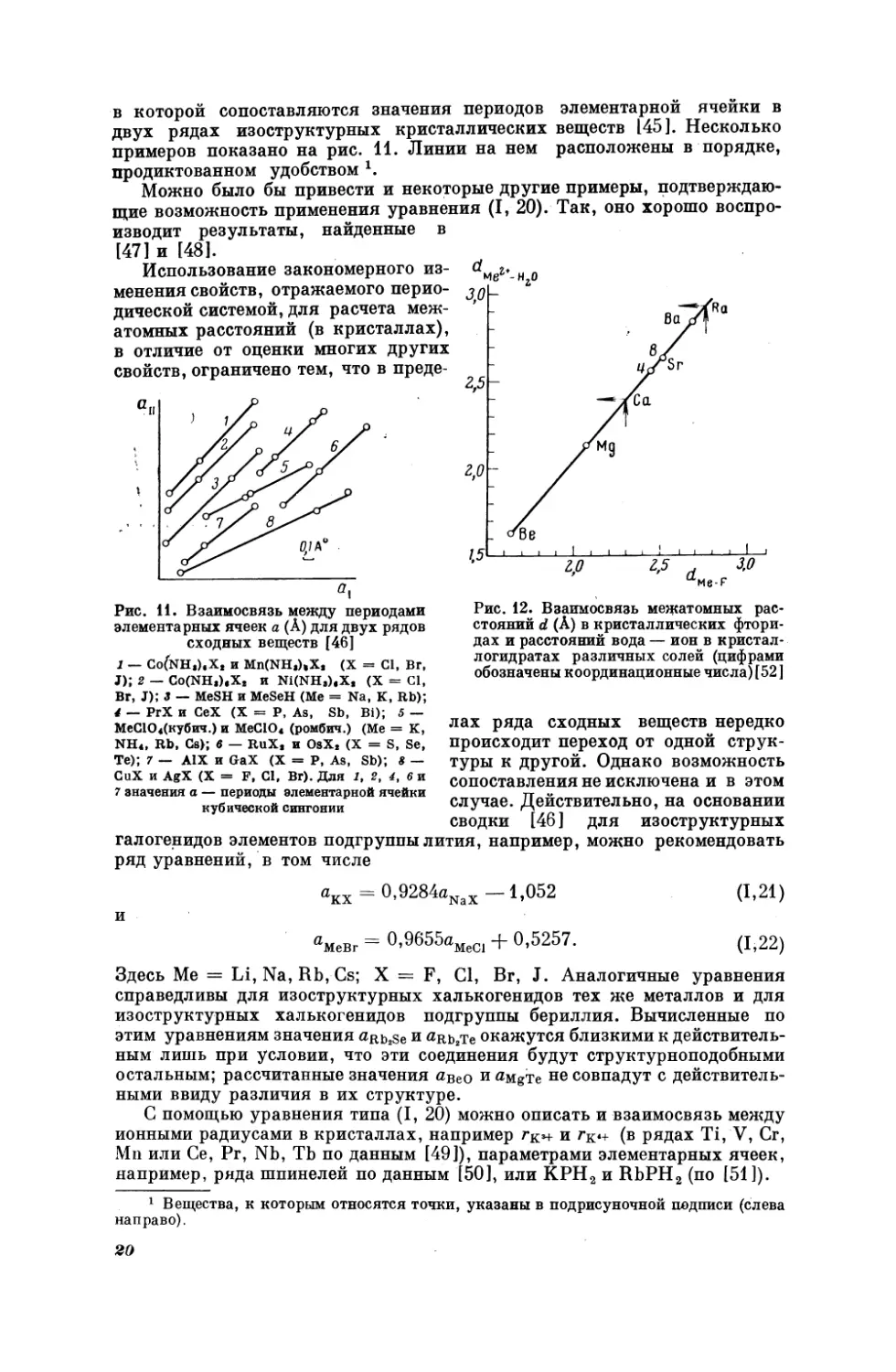
примеров показано на рис. 11. Линии на нем
продиктованном
удобством '.
ячейки
элементарной
веществ [45]. Несколько
расположены в порядке,
в
Можно было бы привести и некоторые другие примеры, подтверждающие возможность применения уравнения (Т, 20). Так, оно хорошо воспро-
[47] и [48].
|
в
найденные
результаты,
изводит
Использование закономерного из-
@„ 1
менения свойств, отражаемого перио-
Зое
(в кристаллах),
|
es
«2
атомных расстояний
меж-
расчета
дической системой, для
в отличие от оценки многих других
свойств, ограничено тем, что в преде-
?
2
но
|
|
2,5|-
2.0|-
ааа
'
11. Взаимосвязь между
Рис.
J); 3 —
MeSH
PrX uw CeX
uw MeSeH
(Me
(X = P, As,
=
Sb,
Na,
МеС10«(кубич.) и МеС!О. (ромбич.)
Fux iw AB
(Х =Р, Аз,
межатомных
рас-
логидратах различных солей (цифрами
обозначены координационные числа) [52]
K, Rb);
Bi);
5—
(Ме=к,
Лах
55);
туры
МНа, ВЬ, С8); 6 — Вах, и ОзХ, (Х = 5, $е,
Те); 7 — А1Х и бах
30
Ч ме.
стояний 4 (А) в кристаллических фторидах и расстояний вода — ион в кристал-.
1 — Co(NHs).X+ 4 Mn(NHa)Xs
(X =(Xx Cl,= Br,
J); 2 — Со(МНз)‹Х,
и Ni(NHs)¢Xs
Cl,
Br,
2,5
,
Рис. 12. Взаимосвязь
периодами
элементарных ячеек а (А) для двух рядов
сходных веществ [46]
4—
увел
20
ряда
сходных
веществ
происходит переход от одной
8—
x т
С во. я 2 ии
кубической сингонии
к другой.
Однако
нередко
струк-
возможность
сопоставления не исключена и в этом
случае. Действительно, на основании
сводки
[46]
для
изоструктурных
галогенидов элементов подгруппы лития, например, можно рекомендовать
ряд уравнений, в том числе
акх = 0,9284а„хх — 1,052
а
Здесь
Ме
=
МеВг
Гл, Ма, ВБ, Сз;
—= 0,9655а,с, Х =
Е,
С,
|
(1,24)
0,5257.
Вг,
Т.
(1,22)
Аналогичные
уравнения
справедливы для изоструктурных халькогенидов тех же металлов и для
изоструктурных халькогенидов
подгруппы бериллия. Вычисленные по
этим уравнениям значения авь,5е И авь.те окажутся близкими к действительным лишь при условии, что эти соединения будут структурноподобными
остальным; рассчитанные значения авео и амете не совпадут с действительными ввиду различия в их структуре.
С помощью уравнения типа (Т, 20) можно описать и взаимосвязь между
ионными
радиусами в кристаллах, например
гк++ и Гк.+
(в рядах Т1, V, Cr,
Мь или Се, Рг, М№Ь, ТЬ по данным [49]), параметрами элементарных ячеек,
например, ряда шпинелей по данным [50], или КРН., и ВЬРН, (по [51]).
_
Е Вещества,
направо).
20
к которым относятся точки, указаны в подрисуночной
педписи
(слева
В качестве
уравнение
примера
применения
Чиет+—н.о
—
(Т,
1) к микросвойствам
А1@ епт
+
укажем
B 1,
(1,23)
в котором сопоставлены значения расстояний Ме—Г
в кристаллических фторидах с расстоянием ион
— вода в кристаллогидратах [52].
Это уравнение должно приводить к удовлетворительным результатам,
так как ион фтора изоэлектронен молекуле воды. С помощью уравнения (Т, 23) С. И. Дракин нашел приближенные
значения
Фвь+—н,о
,
46з+—н,о,
@Са+—н.0
и Чва+—н,о [52], отсутствовавшие в литературе (рис. 12).
Более широкие возможности и ббльшую точность Должно дать применение метода сравнительного
расчета
межядерных
расстояний
в
молекулах газов, так как в этом случае влияние структурных различий невелико (см., на-
пример,
[53]. ’
Данные
:
по межатомным
[54—62]).
Кроме
того,
хотя
ность в ряде случаев
незначительна
:
порядка 0,01А
велика;
следует
и меньше), однако
иметь
в
виду
и
—
=
——
Qe
pp
|-—=
=
—
=
=
=
.®
расстояниям
образных веществ не очень обширны
пример,
` Чжи
‘3
(см.,
газо-
на-
погреш-
(зачастую
нередко
она
противоречи-
Мени
Puc. 13.
155
3
°
ос мевеГ 1
Взаимосвязь меж-
Вне
с ‚расстояний
а(А)
азообразных
бромидах
и хлоридах
элементов под-
группы бериллия
[55—59]
вость результатов различных авторов, а также
экспериментальные трудности
(в частности,
разложение веществ при нагревании). Но даже на этом сравнительно ограниченном и подчас противоречивом материале легко показать продуктивность применения сравнительного расчета, сопоставляя в сбответствии
с идеей этого метода ряды сходных веществ. Это видно на примере уравне-
_
И
dmte-pr = 1,01dye-ci + 0,13
(1,24)
dgn-x = 0,98dca_x — 0,12,
(1,25)
описывающих взаимосвязь межатомных расстояний металл — галоген в бромидах и хлоридах подгруппы бериллия (рис. 13) и в галогенидах кадмия и
цинка (последние — по данным [60—62].
Эти уравнения являются примерами приближенной зависимости
т = Азат -
B,,
(1,26)
которая, в свою очередь, представляет частный пример соотношения (1, 1).
Эта зависимость была использована для расчета межатомных расстояний
в молекулах газообразных галогенидов щелочных металлов [63]; в частности, было рекомендовано уравнение
4ме_т = 1,06044м._в, - 0,0575,
где
Ме = Ма, К, Rb, Cs, Fr.
В этой же работе для расчета
валось уравнение
Дгг_х
методом
(1,27)
экстраполяции
Аме+-х = А1Аме+-х + Bi,
использо-
°
(1,28)
в котором сравнивались межатомные расстояния галогенидов щелочных
и щелочноземельных металлов. Как видно из рис. 14, результаты расчета
по
уравнению
([, 28)
лежат
в
пределах
погрешности
значений
мез+_х.
(Последние отмечены вертикальными отрезками. Во избежание загромождения чертежа на нем нанесены прямые только для фторидов и иодидов.)
Хотя полученные таким образом величины являются приближенными,—
21
ме? *х
3,0
Z,9F
bee
35
а ме!-Х
Рис. 14. Взаимосвязь межатомных расстояний4 (А) в газообразных галогенидах
щелочных
и
щелочноземельных
металлов [55—59, 64]
1 — фториды;
2 — иодиды
Oue-s
2ub
(для тех же Ме, что и на прямой
1)
. Pb
:
n
2.20
а 3 P=$
2,207
a
Ge
Br
2,00-
2,0
CL
180+
160
160
=
| 14
‘ 10
pod
1,2
Vuи
]5
HU —
7
18OF
ме-0
Рис.
45.
Взаимосвязь
межатомных
расстояний &(А) в газообразных окислах и сульфидах элементов четвертой
группы
[54]
| oF
Рис.
780 = 200
ЗР:0
16. Взаимосвязь
ni SP —
0
a SP—S
coeqHHeHHAx
межатомных
B
расстоя-
газообразных
Tuma POX3uPSX3
[52]
сказывается и неточность значений 4 ме+_—х, и погрешность расчета по (Т, 28),
иошибка в принятых значениях 4в._х,—однако они близки к рекомендован-
ным в [65] (Ле < 0,02 А). В [66] и [67] были описаны уравнения, в которых сопоставлены длины связей между атомами в различных группах для
органических
соединений.
Можно было бы привести и другие примеры применения первого
метода сравнительного расчета для вычисления межатомных расстояний
в газообразных молекулах, например, при сопоставлении н_х и Ах-х
{(X =F, Cl, Br, J), dtp_x w dga_x (X =P, As, Sb) (cm. tarme [68]). Xopomo
укладываются на прямую и значения dng_x U dx-x (X = F, Cl, Br, J, At),
рекомендованные в [69].
Здесь уместно отметить, что в ряде случаев зависимость Гмех. от 2х ДЛЯ
Х =
(4, Вт, У линейна
[70]; но для фтора линейность нарушится
ясняется резким изменением эффективного
(что объ-
заряда галогена при переходе
от ФТ, Вг, Си Е. Обращение же к (Т, 20) дает линейное
как отклонение Е для сходных Ме будет подобным.
соотношение,
так
Рис. 15 иллюстрирует использование уравнения (I, 26) для определения отсутствующих в литературе данных путем интерполяции (из него находим
Ясе_5
—
=
2, 09
А
И
dsn—s
=
2, 30
A
На рис. 16 показано еще одно сопоставление, отвечающее соотношению
(I, 26).
Воспользовавшись уравнением (Т, 26) и недавно опубликованной сводкой [71], В. П. Спиридонов и В. М. Татевский [72] оценили значения d
для 112 межатомных
расстояний,
для которых
опытные данные отсутству-
ют (см. также [36]). В работе [72] сопоставление производилось как по
группам, так и по периодам периодической системы элементов. Из графиков, приведенных в этой работе, видно, что точки ложатся на прямые очень
хорошо; несколько в стороне оказываются точки для первых членов рядов
(например, при сравнении значений межатомных расстояний гидридов
Пи Ш рядов точка для МН — МаН). Результаты их вычислений представлены в табл. 5; в нее же внесены результаты некоторых других работ.
Эти же авторы предсказали значения 4 для 18 химических связей разных
типов в многоатомных молекулах.
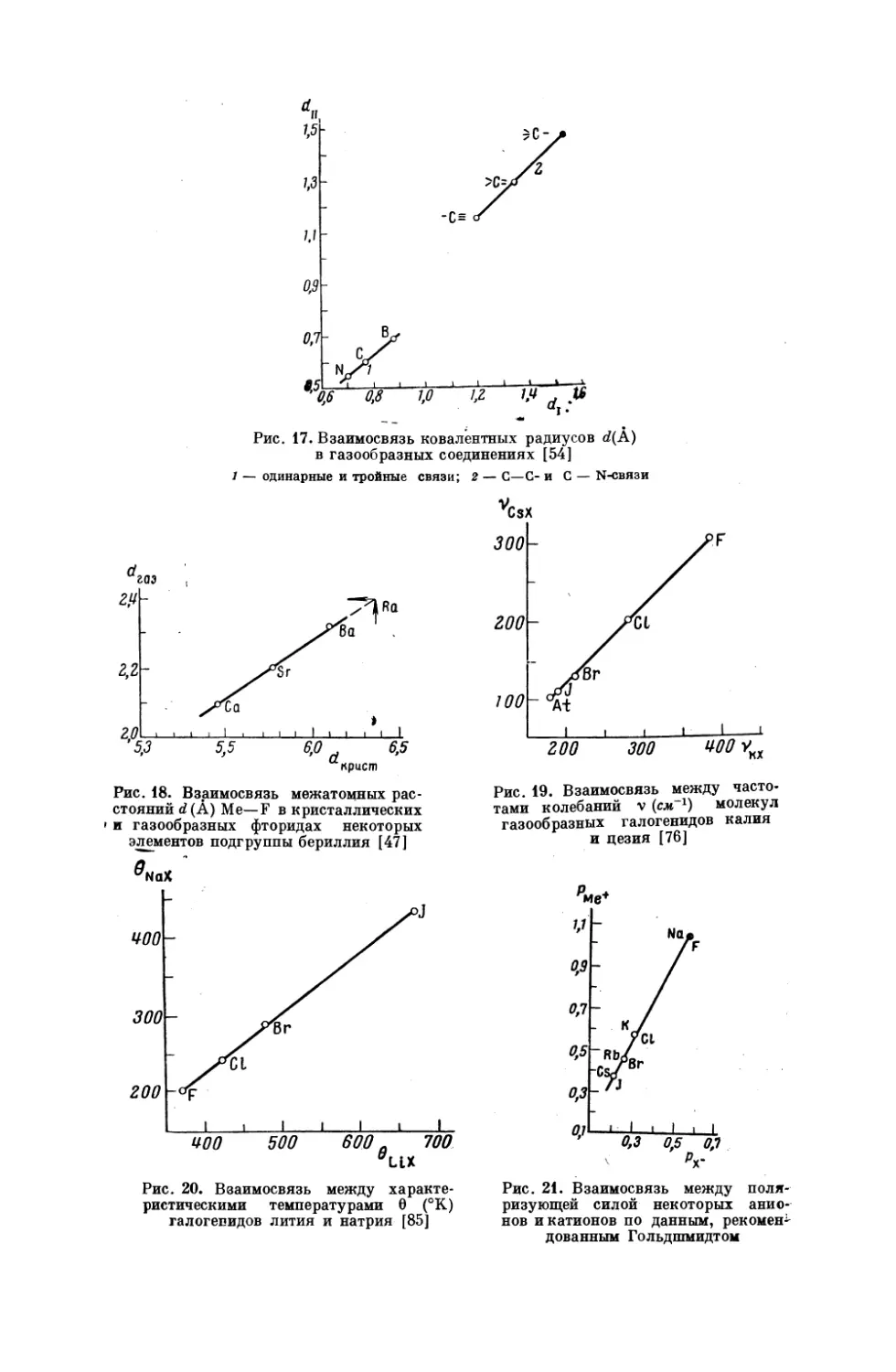
На рис. 17 приведено два примера сопоставления с учетом кратности
связи.
Пример смешанного сопоставления — межатомных расстояний кристаллических и газообразных соединений
— показан на рис. 18!. Хорошие
результаты обусловлены изоструктурностью кристаллических фторидов.
Найденная с помощью этого графика величина 4в.—х была
для оценки значений (ггг (см. рис. 44).
использована
Укажем также на ряд закономерностей, ббльшая часть которых могла
бы быть перенесена в раздел настоящей главы, посвященный химическим
изменениям.
Найденная Бернштейном [74, 75] закономерность для частот колеба-
ний,
которой
в общем
случае
можно
Уп =
придать
Ai
вид
+ Bi,
также относится к типу описываемых (в работе
CoHynBr,
и
С.Н. „Сш,
где
п = 4,
$3,
(1,29)
[751] сопоставлялись ряды
2, 1, 0). Она подтверждается
и за-
висимостью, показанной на рис. 19. Метод сравнительного расчета использован в работе [77] для вычисления частот колебаний и других молекулярных' постоянных
дДвухатомных молекул
щелочных
галогенидов
(см. также [78]).
В работах [79], [80], [81]и [82] осуществлены сопоставления, которые
тоже связаны с зависимостью (Т, 28) (см. и [83].
76
6
1 тот
и 118)
пример можно
рассматривать
также
как пример
второго метода (см. стр.
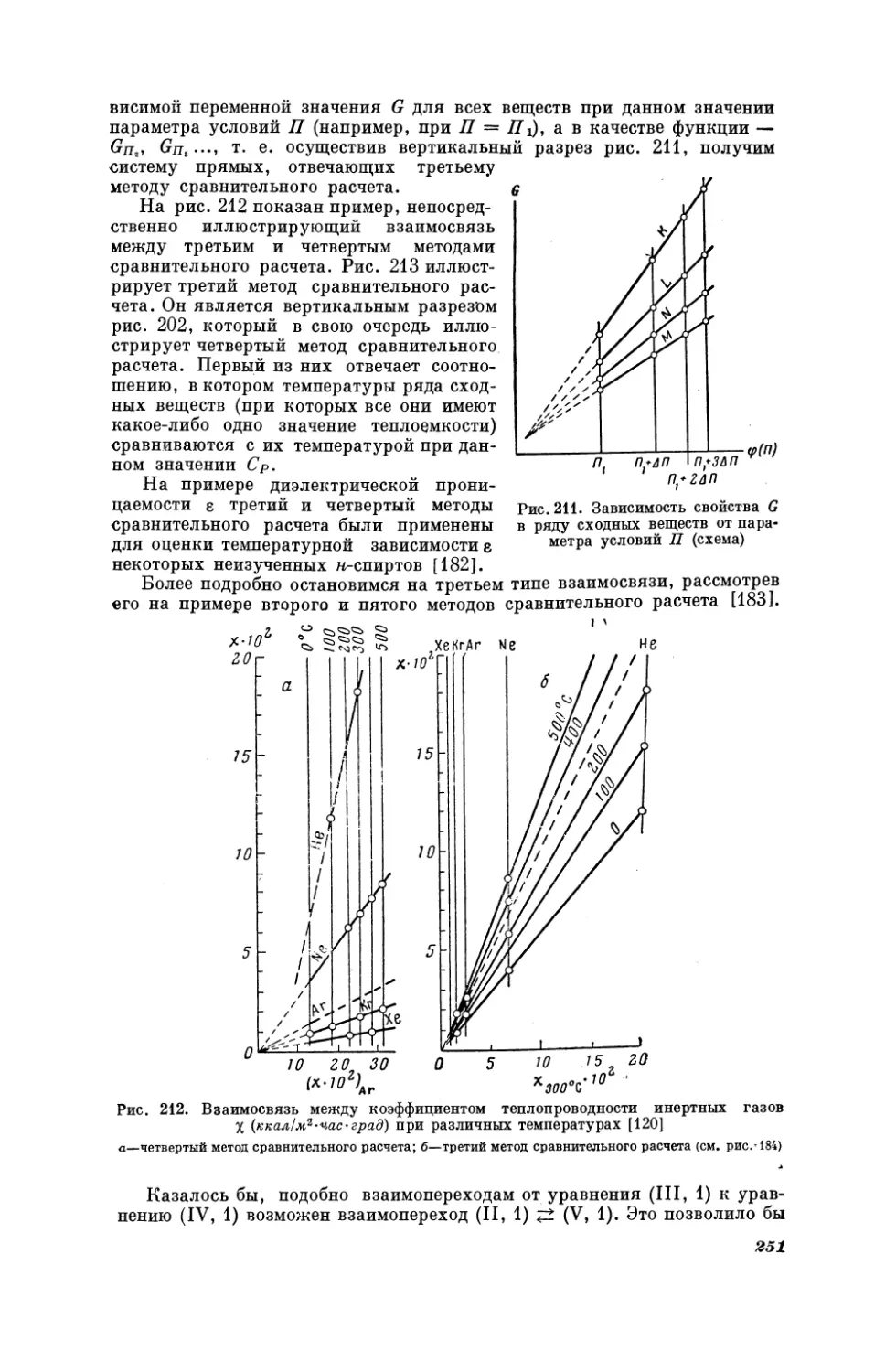
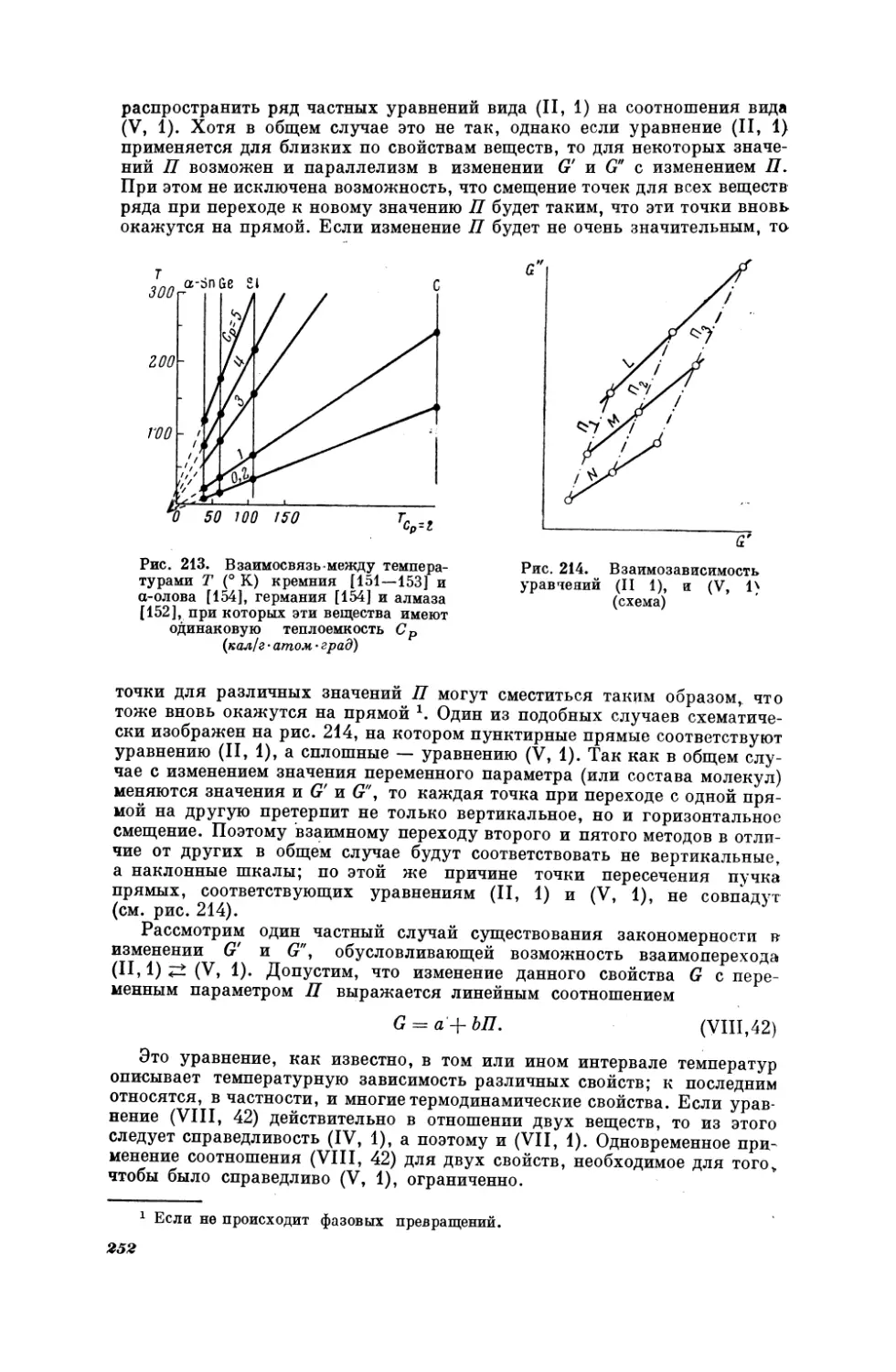
23
Таблица5
Результаты
Молекула
AlJ
AlPo
AlS
вычисления
а
значений
межядерных
Молекула
а
расстояний
d(A)
Молекула
а
2,59
2,50
2,05
GeF
GeN
GeS
1,66
2,72
2,09 *
AlTe
Аз2
AsBi
2,44
2,08
2,32
GeTe
СеРо
KAt
2,47
2,25
3,2 **
555
SbSe
SbTe
AsH
AsN
AsO
Ass
AsSb
Аз5е
AsP
AsPo
AsTe
BJ
BPo
BSe |
BTe
1,52
1,64
1,56
2,07
2,24
2,24
2,00
2,64
2,51
2,15
2,07
1,76
1,98
Гас]
Lak
LaH
LaJ
LaO
ГаРо
Таз
LaSe
LaTe
LiAt
NPo
NSe
NTe
2,80
2,17
2,17
3,15
1,81
2,77
2,28
2,44
2,68
2,6 **
1,89
1,63
1,83
BaH
Big
BiC
2,17*
2,50
1,98
PPo
PSe
PTe
2,8
2,42
2,08
2,33.
**
ScCl
ScF
ScH
ScJ
560
ScPo
ScS
ScSe
ScTe
SeO
SePo
SeTe
SiBr
SiSe
SiTe
Sng
В №.
1,94
PbBr
2,58
*
SnBr
2 50*
BiO
ВР
1,76
2,22
PbhJ
РЬМ.
2,71 *
2,01
SnN
SnPo
1,94
2,79
BiS
BiSb
BiSe
2,36
2,45
2,56
PbSe
PbTe
Pog
2,56
2,81
2,89.
SnSe
SnTe
SrF .
2 45
2,70
2,13
AlSe
AsC
BaF
BiPo
2,20
Себе
1,70
2,22
СРо
PbPo
1,96
СТе.
CsAt
1,88
3,4 **
FrAt
RaC] ***
2,90
2,28
2,47
2,98
ScBr
2,66
—
SiPo
2,90
PoO
RaBr ***
1,87
1,70
2,15
SbPo
2,96
NaAt
2,87
2,48
SDN
SbO
SbP
2,25
LaBr
2,98
В! Те
BrJ
2 37
2 08
2 29
2.75*
спб
1,80 |
3,4 *
2,30 *
TePo
Тео
2,92*
2,50
1,96
1,93
2,88
1.69
2,62,
2,13
2,29
2 53
1 60
2 50
2 42
2 22*
2,78
1,74
YBr
2,80
Ван.
RaJ ***
2,35 *
3,3 *
3,6 **
SPo
2,33
ЕгВг
3,15
**
SSe
2,04
YO
1,79
FrCl
2,98 **
STe
2,24
YPo
2,72
FrF
2,41
Sbe
2,39
YS
2,25
GeBr
2,27*
SbH
1,74
YTe
2,63
Е]
FrJ
1,88
RbAt
**
2,39 **
SbC
3,3
**
YC]
YF
(2°65
2,08
YJ
3,01
YH
4,90
2,09
YSe
2,40
ZrF
* Значения
** Значения
***
4, найденные
4, найденные
Значения: 4 для
ВасС!
в работе
в работе
(2,92),
ВаВг
шем согласии с ‚ рекомендованными в [451.
24
[72]
1,98
[45].
[63].
(3,1) и Вау
|
(3,3),
найденные
в
[73],
оказались
в ‚ хоре.
И
15|-
0,78
TN
B
С
AT
1
1
Рис. 17. Взаимосвязь ковалентных радиусов
в газообразных соединениях [54]
1 —
одинарные
и тройные
связи;
2 —
С
С-и
4(А)
С —
М№М-вязи
Vosx
300+
а;
LE
oul |
’
| |
or
5
.
3
аа
100-
|
Ca
PS
yp
i
yl
5065
крист
|
2
элементов подгруппы бериллия
Вг
Ч
“А+
200
1
|
|
10%,|
|-
1
галогенидов
газообразных
и цезия
[47]
р
-
90
I
Рис. 19. Взаимосвязь между частомолекул
(см!)
тами колебаний
Рис. 18. Взаимосвязь межатомных расстояний 4 (А) Ме Е в кристаллических
‚и газообразных
фторидах
некоторых
нах
Ct
200+
Ra
2,2
20
Е
J
| if
+00
[76]
калия
Ме*
a9
300
0,1
95,
200
0,3
|
400
|
]
500
lid
600
L
Я Ех
|
о.
700
Рис. 20. Взаимосвязь
между
характеристическими
температурами
@ (°K)
галогевидов лития и натрия. [85]
’
pie,
\
03
}
05
|
Рх-
7.
Рис. 24. Взаимосвязь
между
ризующей
силой некоторых
нов
икатионов
дованным
поляанио-
по данным, рекомен:
Гольдшмидтом
Найденные в [84] значения силовых постоянных также можно сопоставить, используя уравнение типа ([, 1).
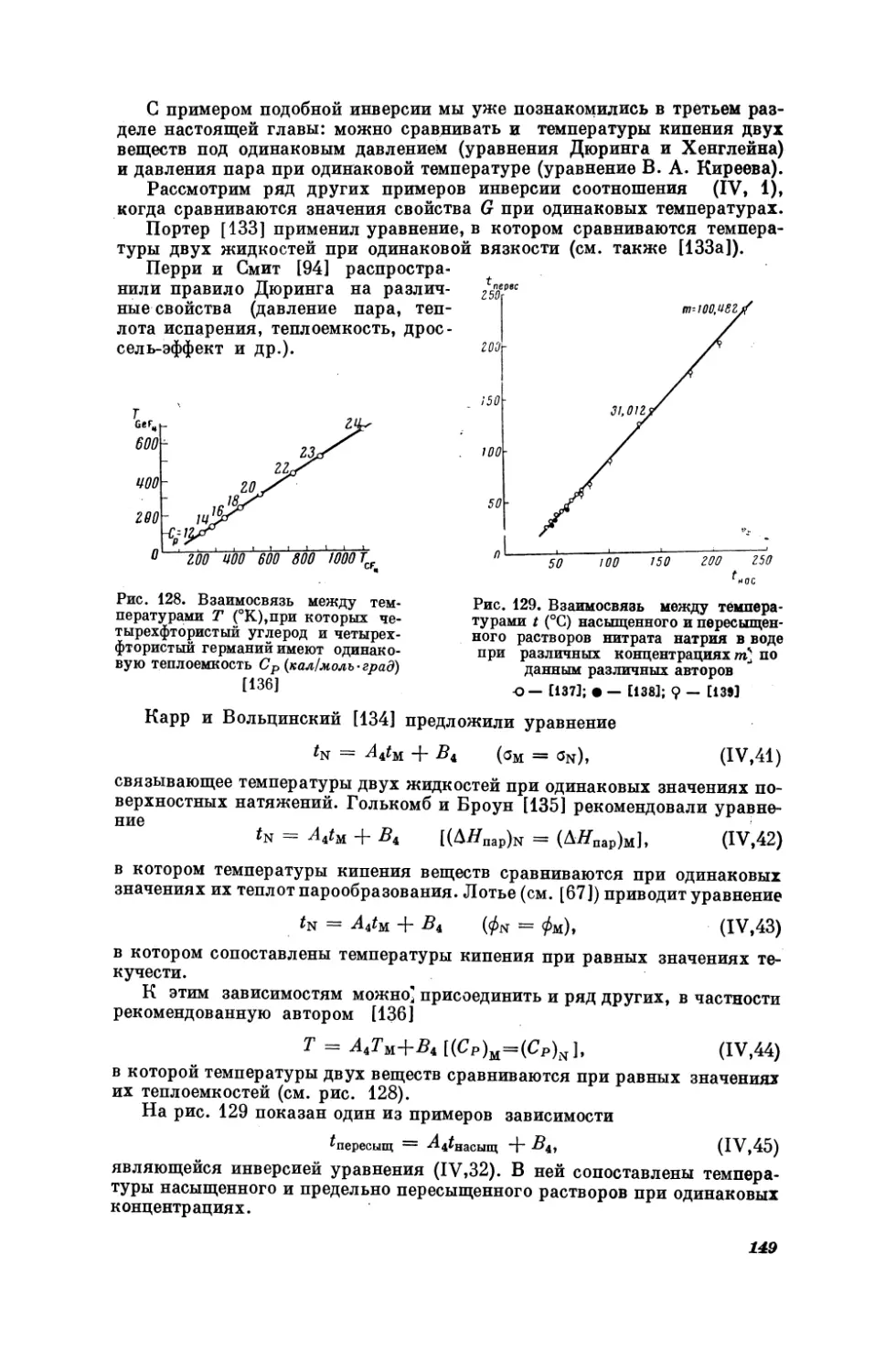
Кроме того, можно рекомендовать уравнение
9 = 4,0, + By,
в котором сравниваются характеристически6в
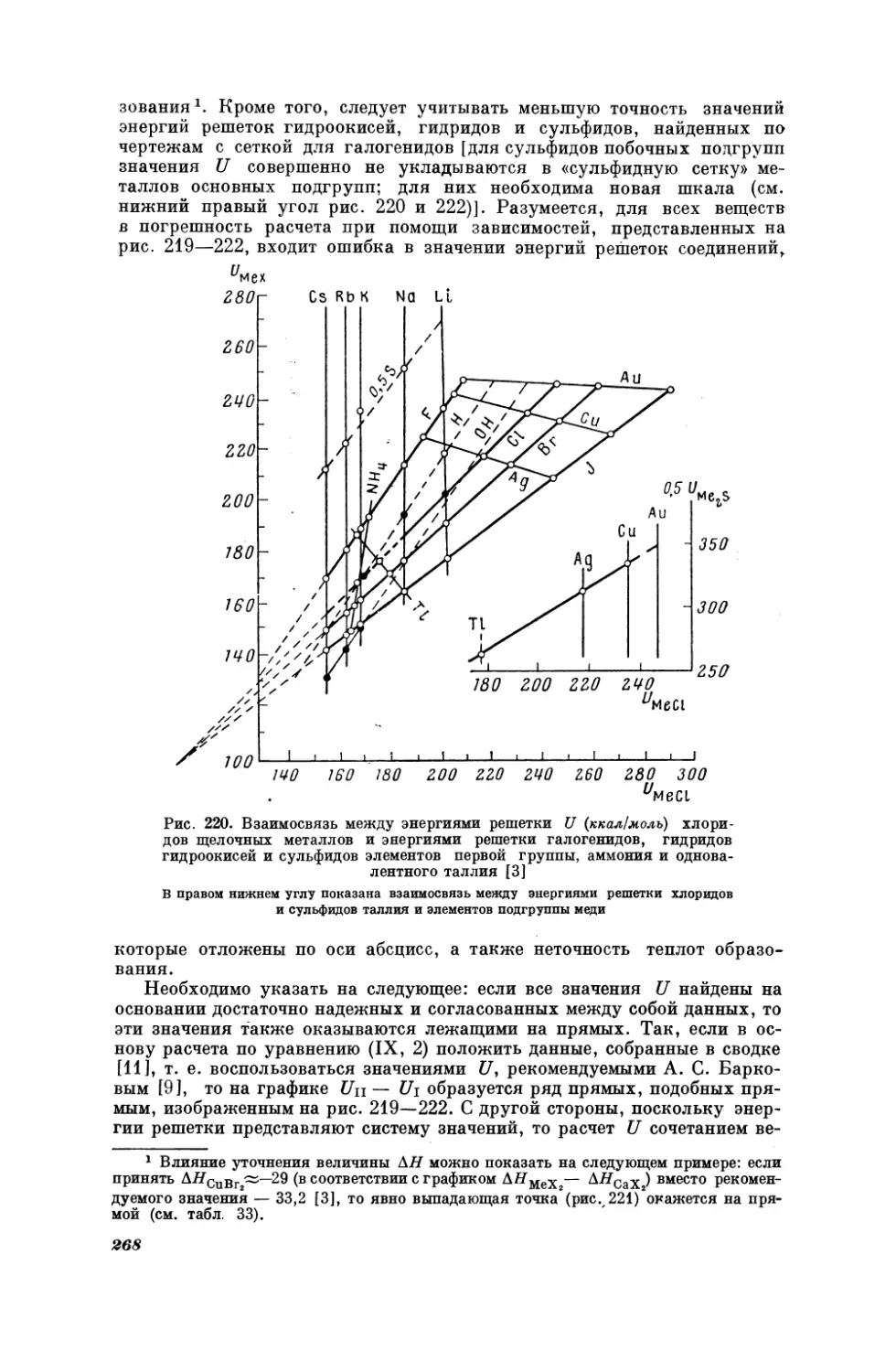
сходных веществ (см. рис. 20).
Приведем еще один пример. Для расчета
можно воспользоваться уравнением
Pay, —
в котором р — поляризующая
шмидту.
А1Рь,
(1,30)
температуры в двух
рядах
поляризующей
ионов
силы
(1,34)
+ By,
сила в газообразных
молекулах по Гольд-
Как видно из рис. 24, для получения удовлетворительных резуль-
татов сопоставляемая пара ионов должна быть изоэлектронной.
В заключение приведем еще два примера. В работе [86], посвященной
закономерностям в спектрах протонного магнитного резонанса трехзамещенных силанов, исследовано влияние природы заместителей В: и В,
на химические сдвиги т протонов метильной и этильной групп силанов
типа (СН.)В.В ЗН и (С,Н,)В:В,ЗН. В результате была установлена ли-
нейная
зависимость между
тсн, (он)
и химическим сдвигом
тн протонов,
непосредственно присоединенных к атому кремния.
Удовлетворяют соотношению (Т, 1) и данные, найденные в работе [87]
при изучении ядерного магнитного резонанса некоторых метилпроизводных
элементов [ГУ группы [например, в рядах (СН з)„51С И „ — (СНу„эвСИ_и,
где п =
4, 3,2,
1].
РАСТВОРЫ
Рассмотрим несколько примеров применения соотношения (1, 1)
к свойствам растворов 1.
Различные закономерности можно разделить на две группы. В одну из
них можно объединить уравнения, в которых сравниваются значения данного свойства нескольких сходных веществ в двух близких по свойствам
растворителях. В другую следует включить те уравнения, в которых сопоставляются значения данного свойства двух веществ в нескольких растворителях.
К первой группе относится, например, зависимость между энтропиями
различных веществ в воде и метаноле, найденная в [88].
Примером второй группы может служить взаимосвязь между значениями дн молекул СНВг. и СН. в различных растворителях [89].
—
Можно привести еще ряд примеров. Так, из данных, найденных при
изучении дипольных моментов и оловоорганических хлоридов и их способности к комплексообразованию [90], следует, что
Вт
Это уравнение,
=
Aip,
+
B,.
(1,32)
как видно из рис. 22, приводит к удовлетворительным
ре-
зультатам.
Значения рН, найденные при определении констант ионизации некоторых гидроокислов и галогенидов перфторалкилртути [91], также описы-
ваются соотношением вида (Т, 1) (рис.
23).
|
На рис. 24 сопоставлены комплексные свойства — произведение вязкости растворителя на предельную эквивалентную электропроводность
№] для двух веществ в трех сходных растворителях (см. [92].
Отмеченная на стр. 23 линейная связь между значениями %, как
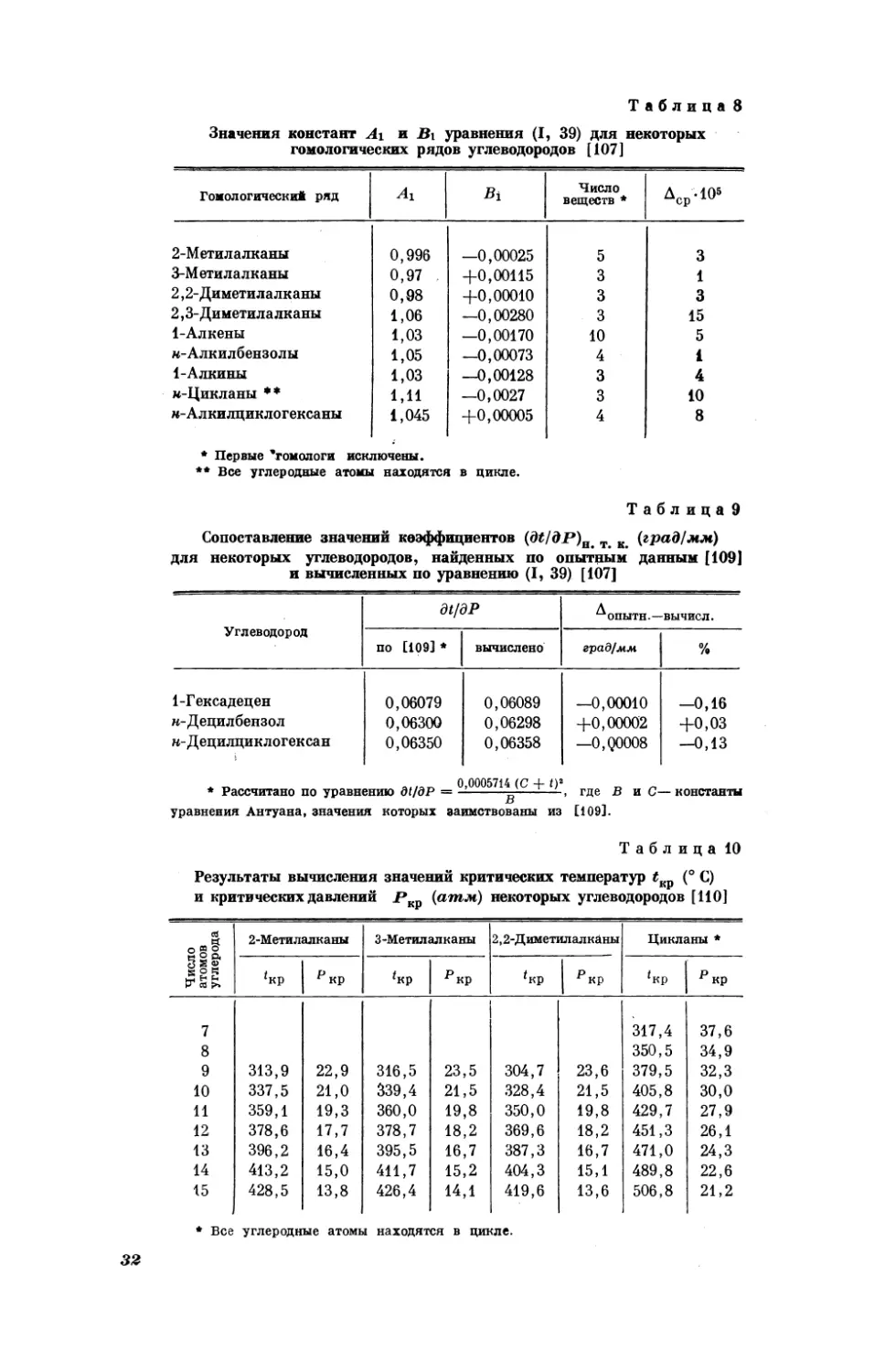
видно из данных [93], справедлива и для растворов.
это
1 Энергетические характеристики и свойства растворов, связанные с диссоциацией
растворенных веществ, описаны в следующем разделе.
26
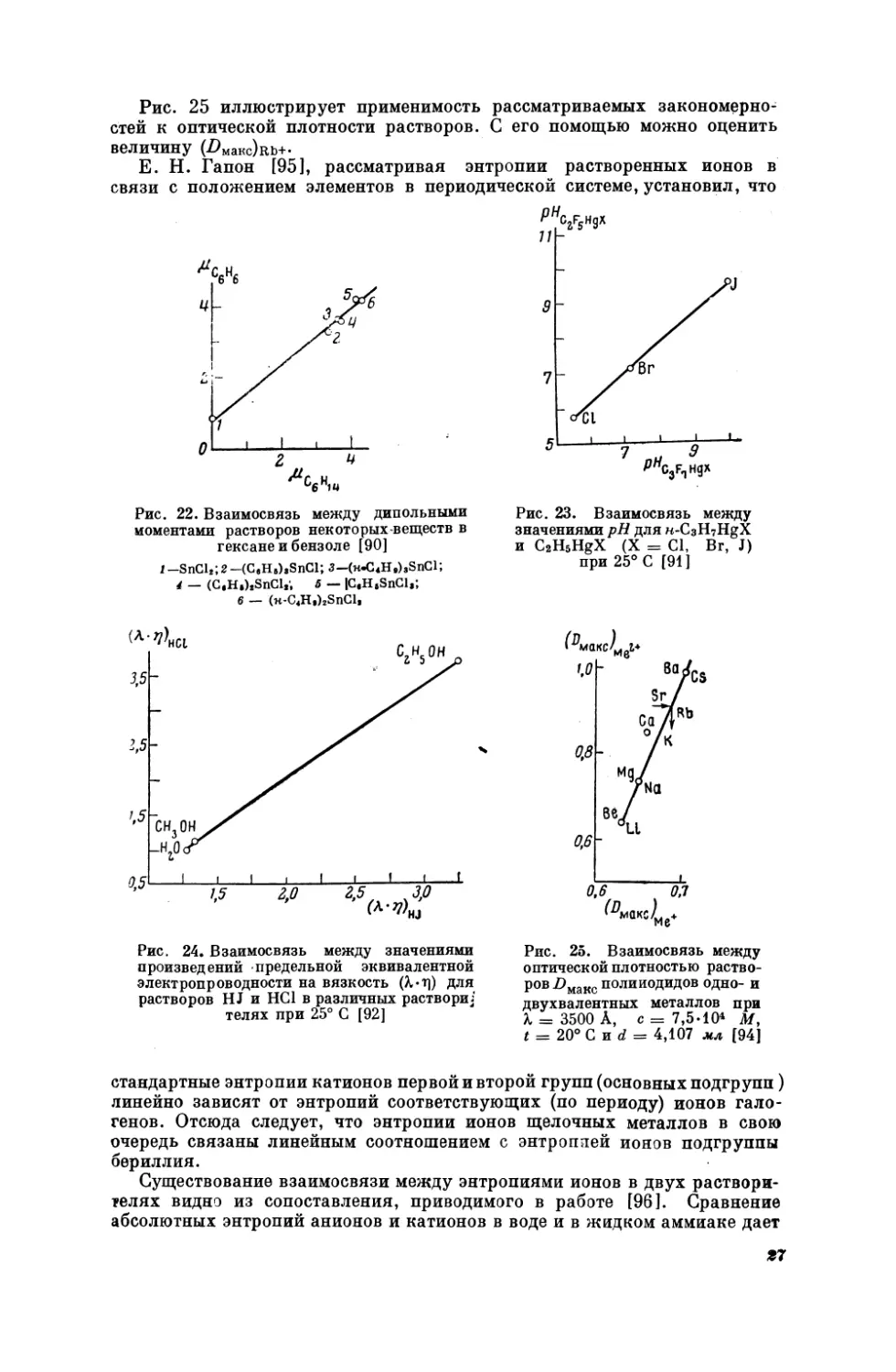
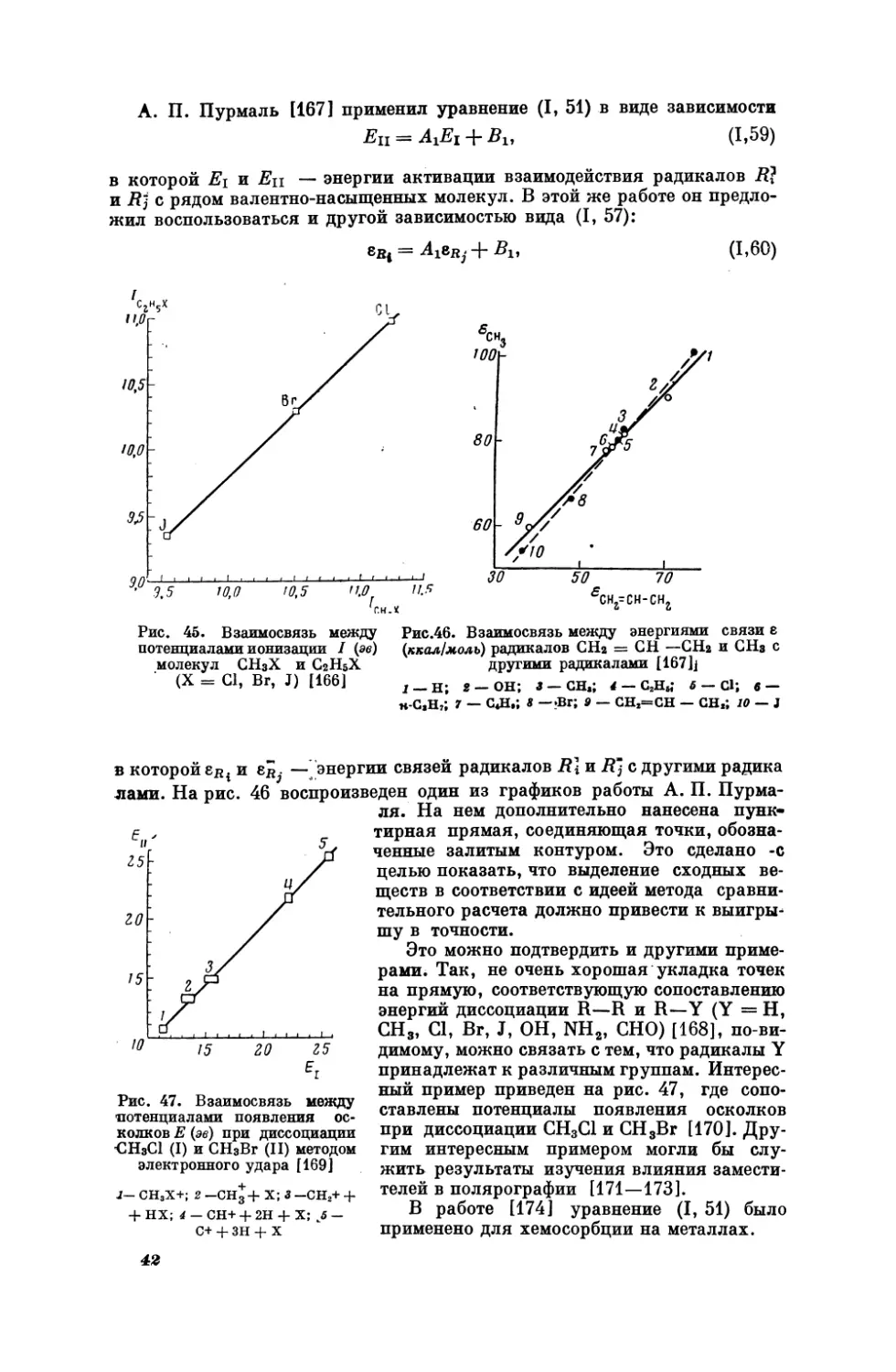
Рис. 25 иллюстрирует применимость рассматриваемых закономерностей к оптической плотности растворов. С его помощью можно оценить
величину
(Рыакс)вь+.
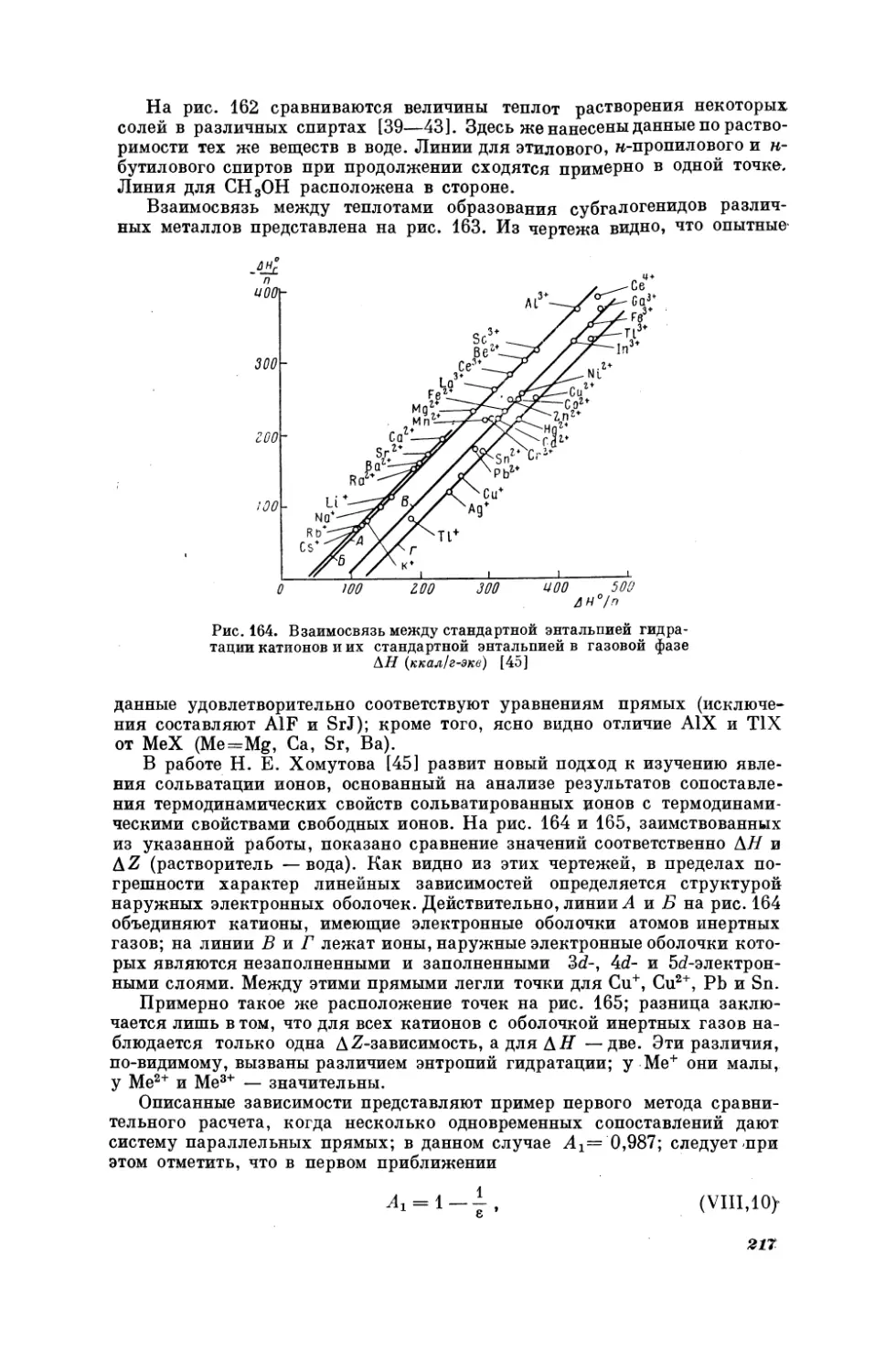
Е. Н.
связи
с
Гапон
[95],
положением
энтропии
рассматривая
элементов
в
растворенных
периодической
системе,
PH Ен
7
ионов
установил,
в
что.
gX
,
gr
7b
Br
|
SEL
5
7
-
Рис.
22. Взаимосвязь
между
дипольными
растворов некоторых -веществ
гексане
и бензоле [90]
в
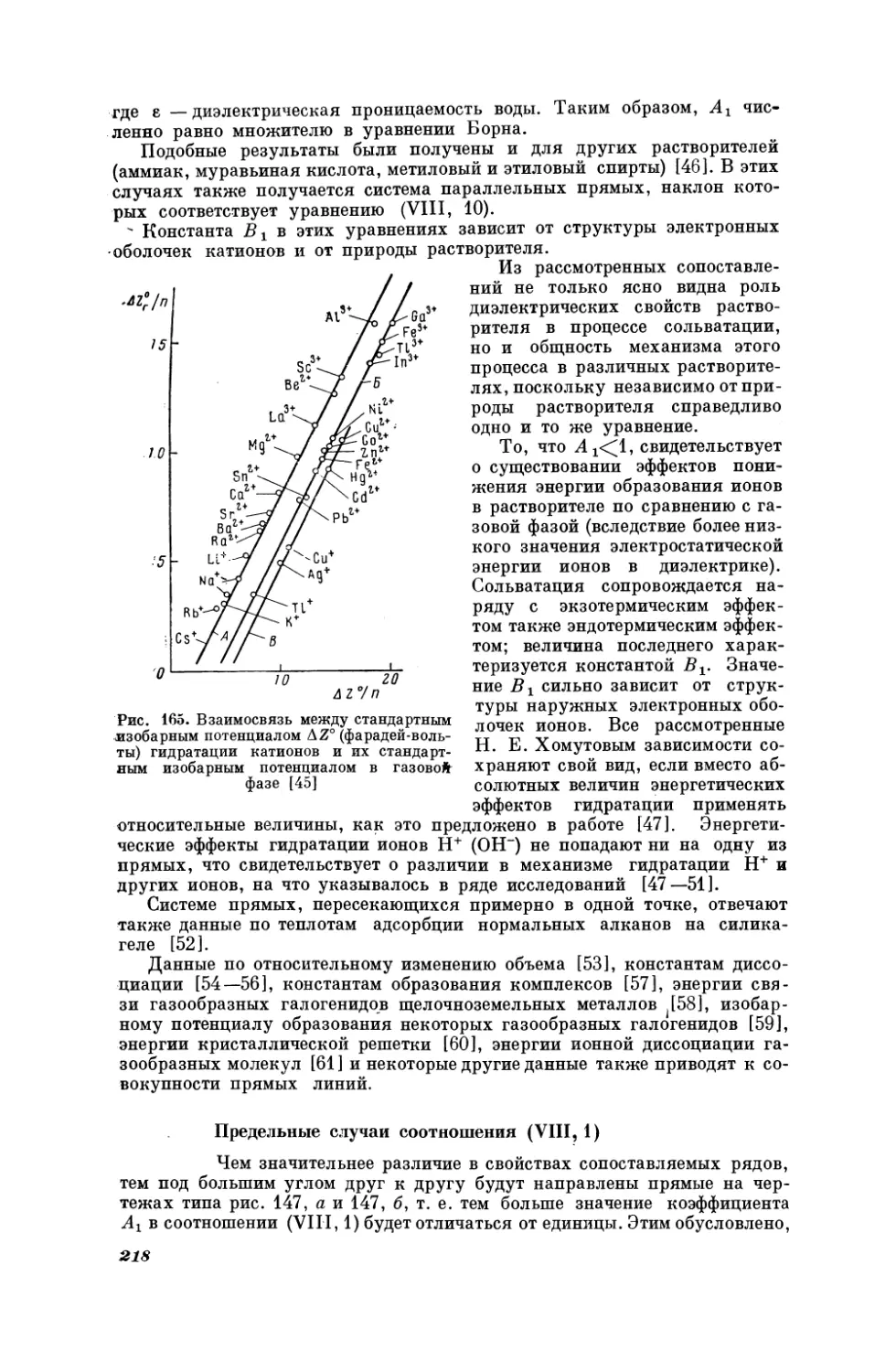
Рис. 23.
|
i
Взаимосвязь
между
значениями рН для н-СзН,НЕХ
Hw CeH;sHgX
(X = Cl,
при 25° С [91]
1—$1(С1ь;
2 —(СзНь)з$ пс; 3—(+*Са«Н.)з5пС1;
4 —
9
РИС,
Ел нах
с, Hy
моментами
}
Br,
J)
(СНь:5 0101,
5 — |CgH;SnCls;
6 — (n-C,H,)2SnCl,
ме)
25
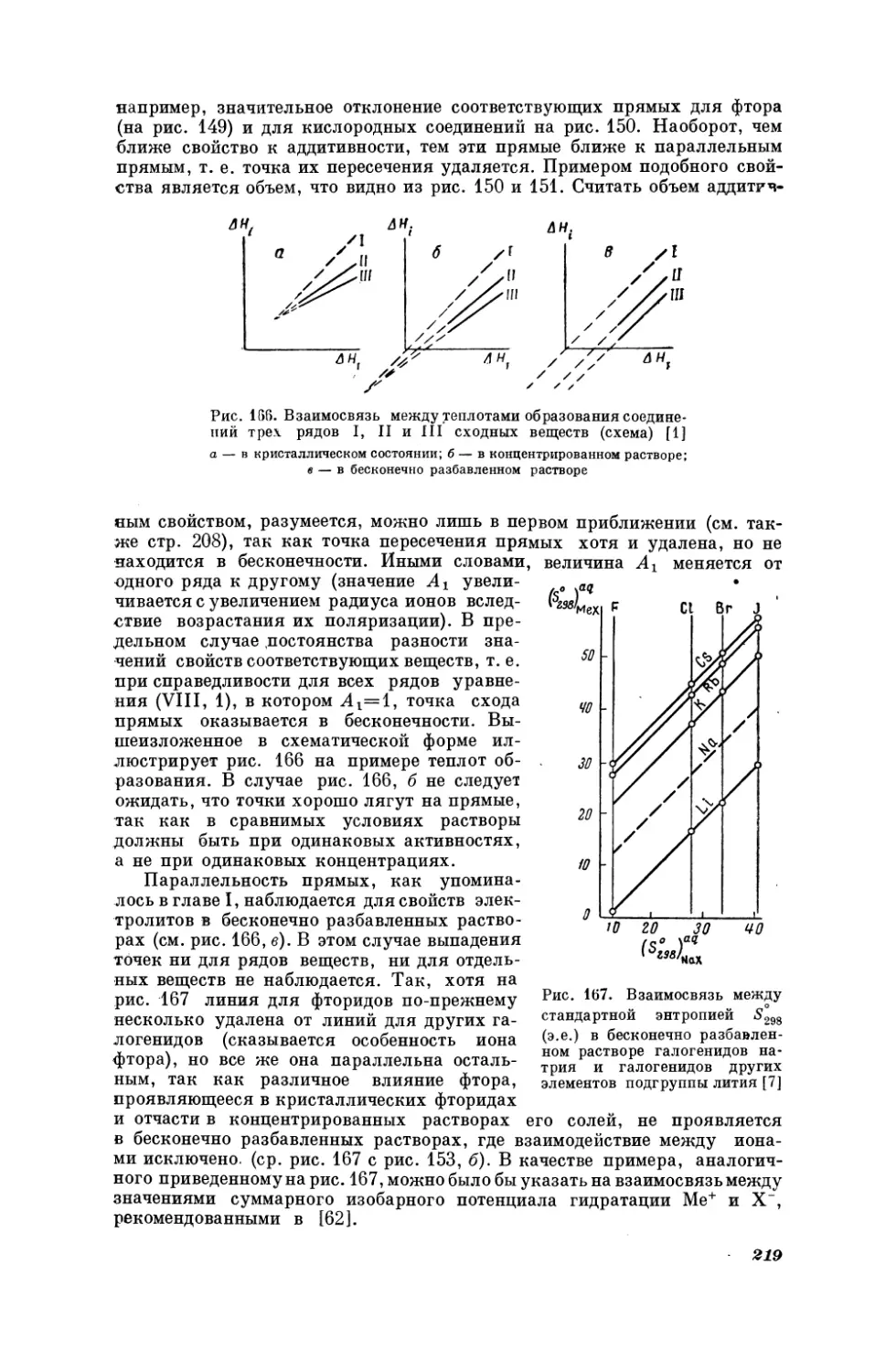
3,5
Or
g
05
__f
|
15
|
|
20
]
|
25
|
(Г
(AM)
30
Рис. 24. Взаимосвязь
между значениями
произведений ‚предельной
эквивалентной
электропроводности на вязкость (^.1) для
растворов
НУ и НС в различных раствори;
телях при 25° С
[92]
Рис. 25.
Взаимосвязь между
оптической плотностью растворов Ри.кс ПОЛИииОдИидОв ОДНО- и
двухвалентных
, = 3500 А,
t=
20°C
ud
с=
=
металлов
7Т,5-10%
4,107
ma
при
М,
[94]
стандартные энтропии катионов первой и второй групп (основных подгрупп }
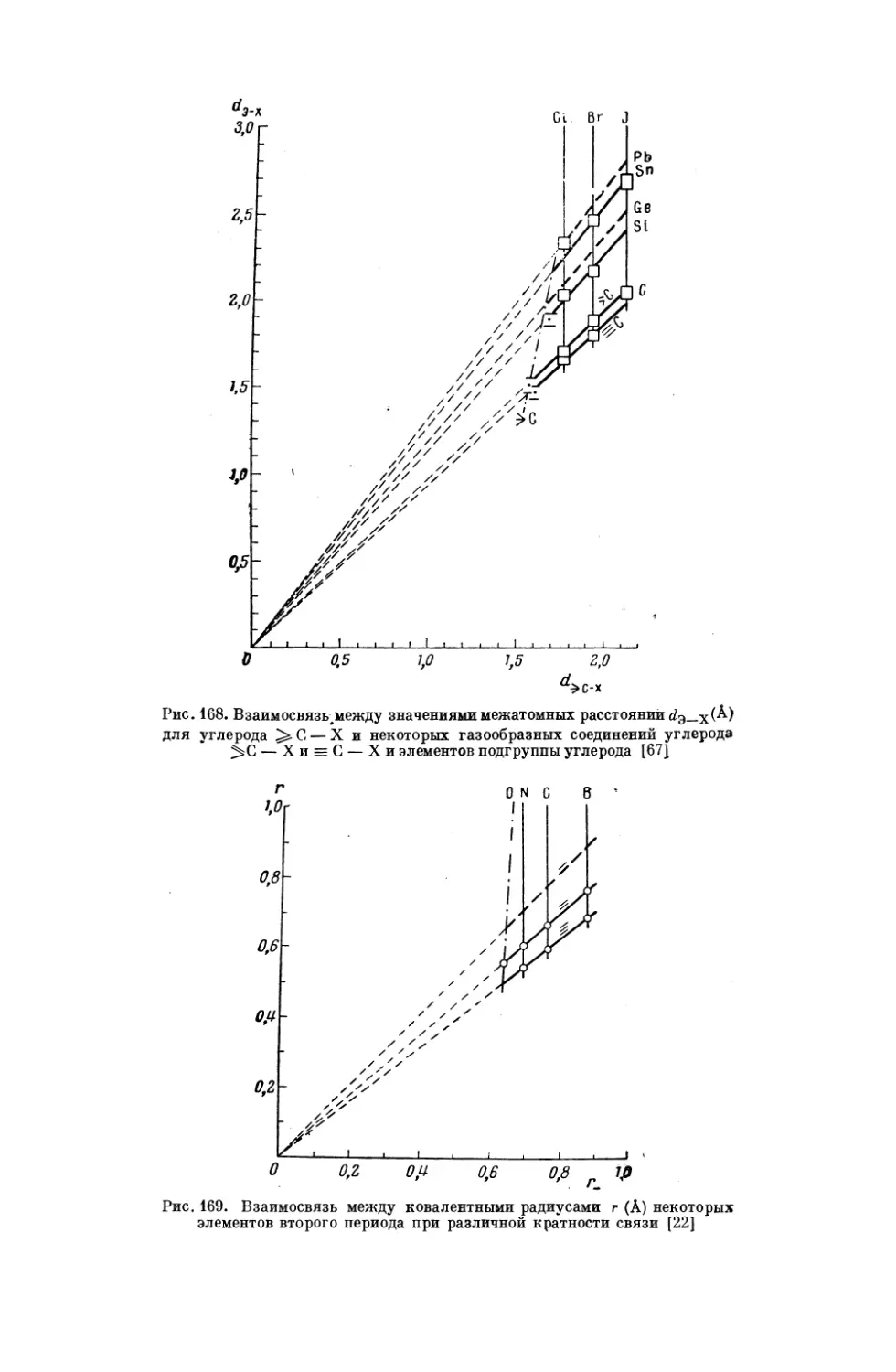
линейно зависят от энтропий соответствующих (по периоду) ионов галогенов. Отсюда следует, что энтропии ионов щелочных металлов в свою
очередь связаны линейным соотношением с энтропаей ионов подгруппы
бериллия.
Существование
взаимосвязи
между
энтропиями
ионов
в двух
раствори-
телях видно из сопоставления, приводимого в работе [96].
Сравнение
абсолютных энтропий анионов и катионов в воде и в жидком аммиаке дает
27
в первом
приближении
совершенно
отчетливой,
линейную
зависимость.
Последняя
становится.
если в соответствии с идеей метода сравнительно-
го расчета выделить ряд сходных ионов (Т.4*, Ма", К’, МН. , ВЬ!, (5).
Укажем также на линейную зависимость между сжимаемостью растворов (например, МаХ и КХ; Х = С, В!, Т, по справочным данным) парциальными мольными теплоемкостями (>, (например, Ме] и МеС; Ме = Li,
Ма, К — по данным [97].
Все рассмотренные примеры относились к случаям, когда в (1,1) и
Сти
Си
—
свойства
растворов.
В
заключение
приведем
примеры
(I, 1),
когда одна из сравниваемых величин относится к раствору, а другая к
чистому веществу.
Как показал Ли [98], диамагнитная восприимчивость ионов в растворе:
и в кристаллическом состоянии описывается линейной зависимостью вида
(1, 1). Он нашел также [19] линейную зависимость между кажущимися
объемами в бесконечно разбавленном растворе и объемами, вычисленными по системе радиусов Л. Полинга.
ФАЗОВЫЕ
Чистые
ПРЕВРАЩЕНИЯ
вещества
В этом разделе
рассматриваются
однокомпонентные
гетероген-
ные системы. Прежде всего остановимся на применении (1, 1) к различным
свойствам в системе кипящая жидкость — сухой насыщенный пар.
Взаимосвязь между температурами кипения при постоянном давлении
в рядах подобных соединений в общем случае выражается плавными кривыми. Если процесс испарения осложнен ассоциацией или диссоциацией
в жидкой или паровой фазе, то кривые могут утратить правильность; от
изобары к изобаре меняется температура кипения, а с ней и степень ассоциации (диссоциации), что может привести к искажению кривых. Ход.
температур кипения в рядах сходных по составу неорганических соединений, как правило, весьма специфичен. То же наблюдается и для органических веществ; если даже ограничиться галогенопроизводными, то трудно указать два ряда веществ, для которых закономерность в температурах
кипения была бы количественно подобной. Это обусловлено неодинаковой
для разных веществ интенсивностью влияния таких факторов, как тип
связи, поляризуемость и т. д., к которым температура кипения весьма
чувствительна. Изменение структуры также может сказаться на результатах, так как оно приведет к изменению энтропии вещества и тем самым
к изменению теплоты испарения, а поэтому и зависимости температуры
кипения от давления. Если же рассматривать два родственных гомологических ряда, то можно считать, что ход температур кипения в них от соединения к соединению количественно подобен, и будет справедливо прибли-
женное
уравнение
(кип)1т
=
A; (¢xnn)1
+
B,,
(1,33)
в котором при Р = с0п3ё сравниваются температуры кипения веществ
в [и П гомологических рядах [99].
Наиболее подходящими соединениями для оценки возможности применения уравнения (1,33) являются углеводороды, так как эти вещества
отличаются друг от друга лишь структурой, а давление их насыщенного
пара известно для большинства соединений с высокой точностью и в широком интервале температур. Все это позволяет рассмотреть возможность
расчета по (Т, 33) не только при Р =
1 атм, но. и при других давлениях
с
погрешностью, практически определяемой неточностью этого уравнения.
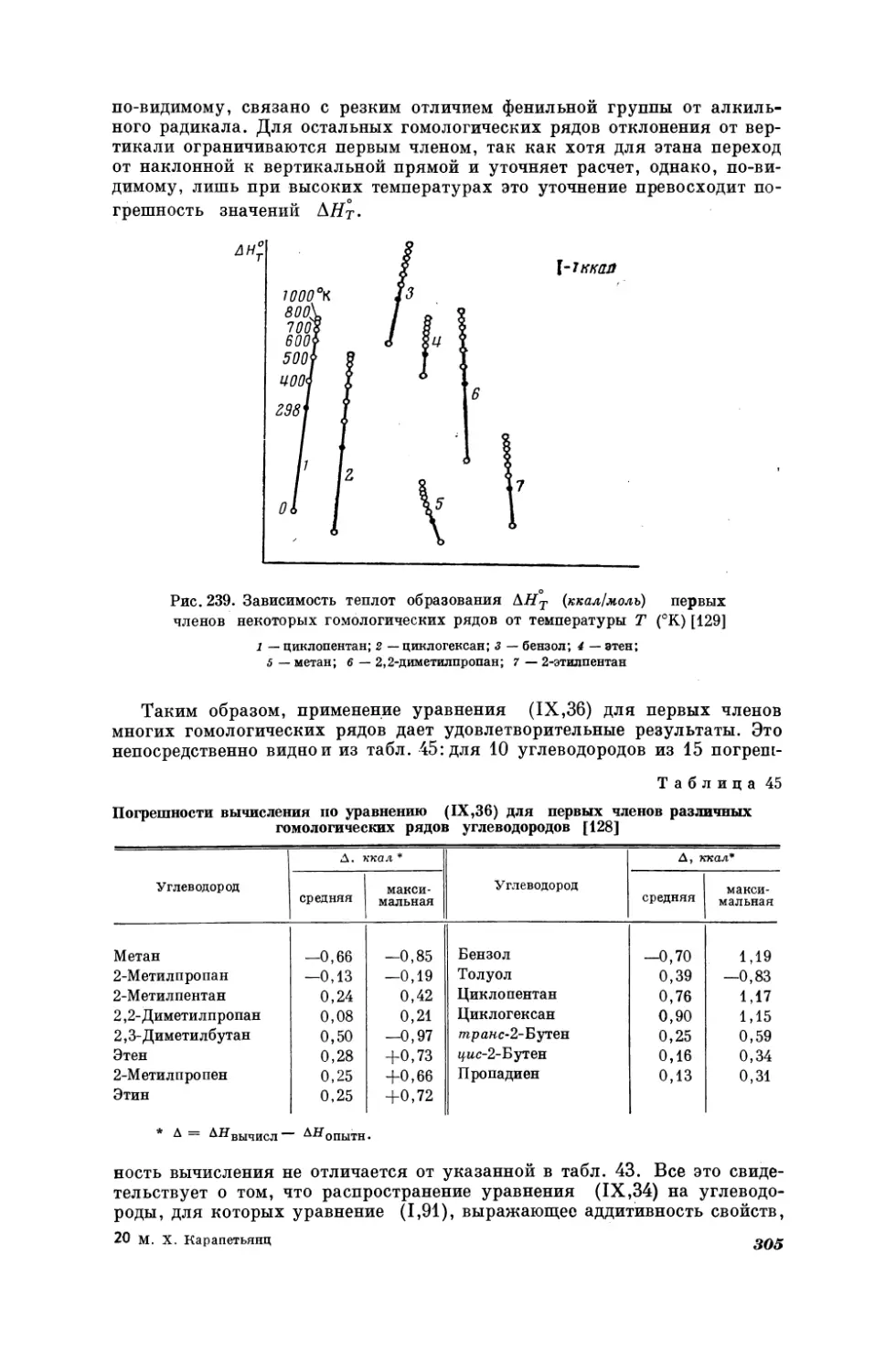
Уравнение (Т, 33) иллюстрируется рис. 26 на примере сравнения темпе28
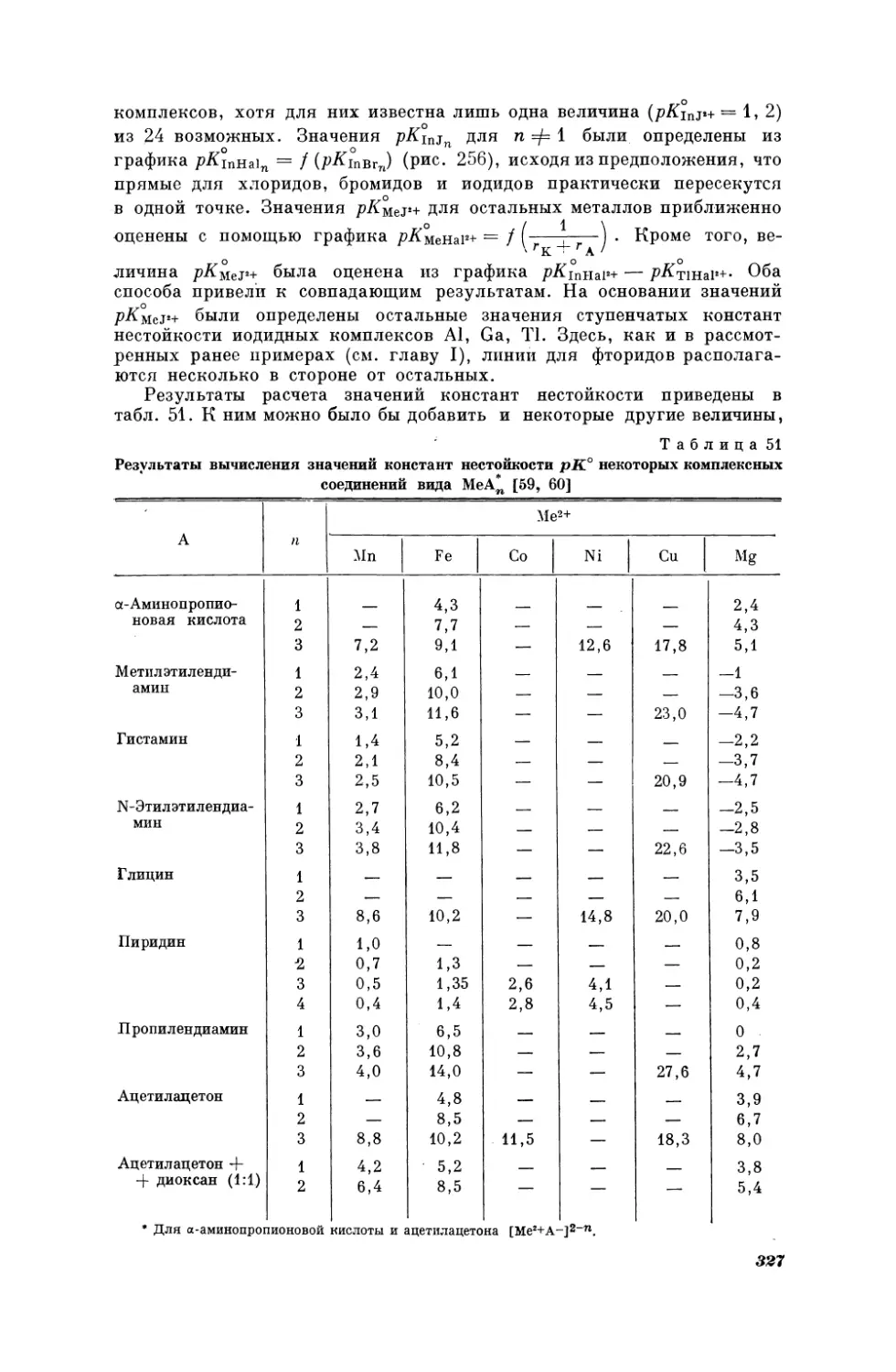
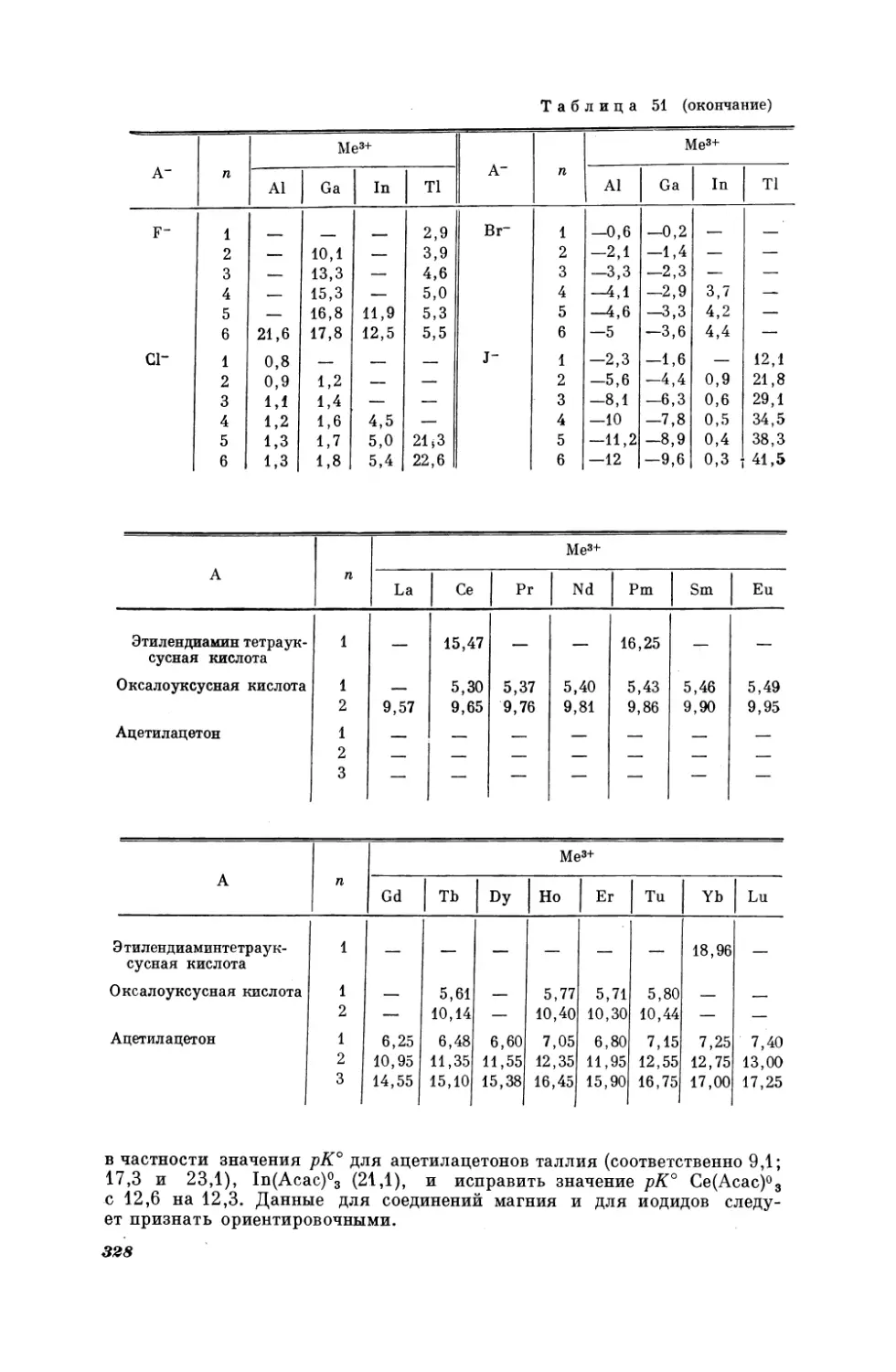
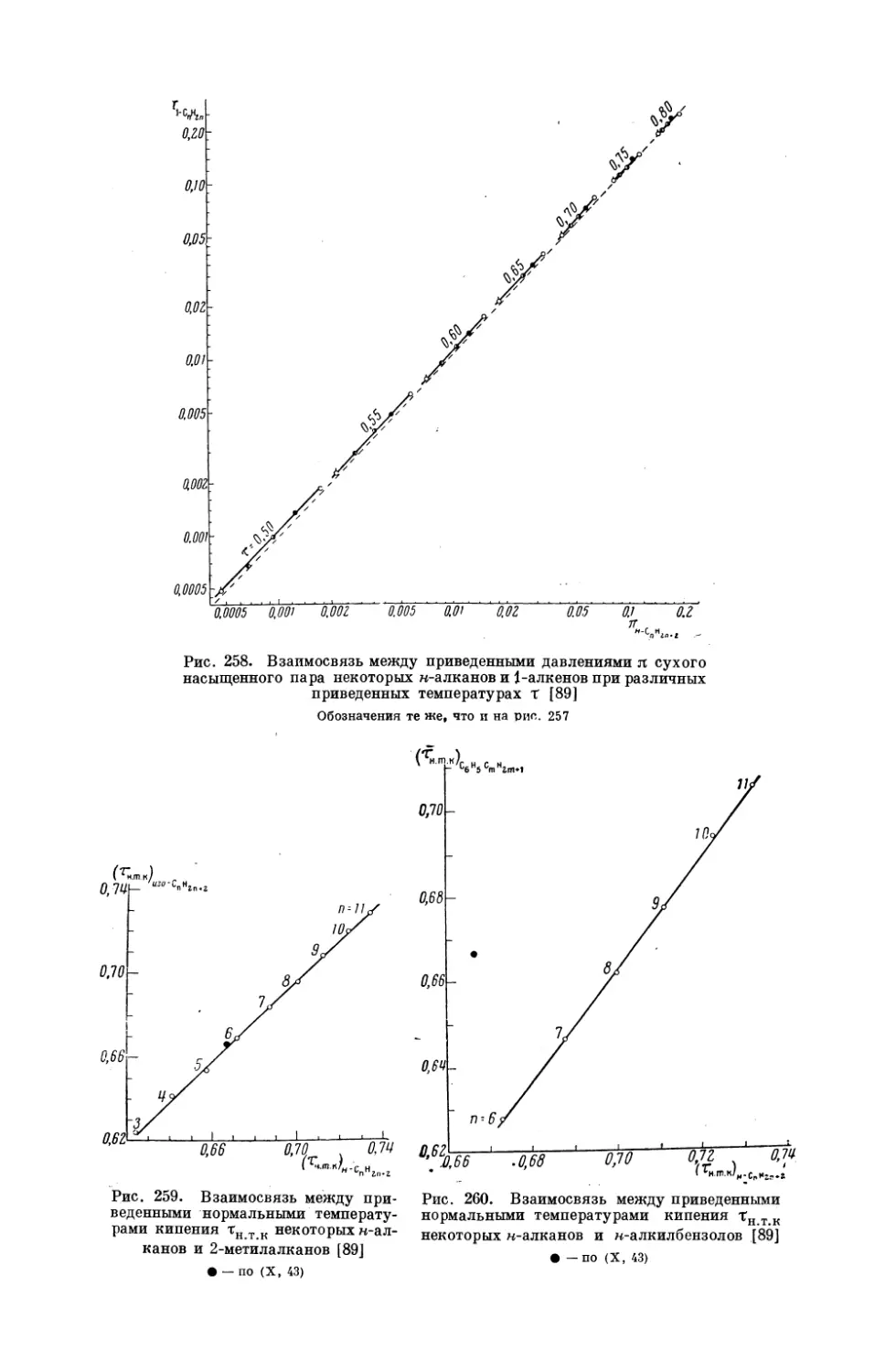
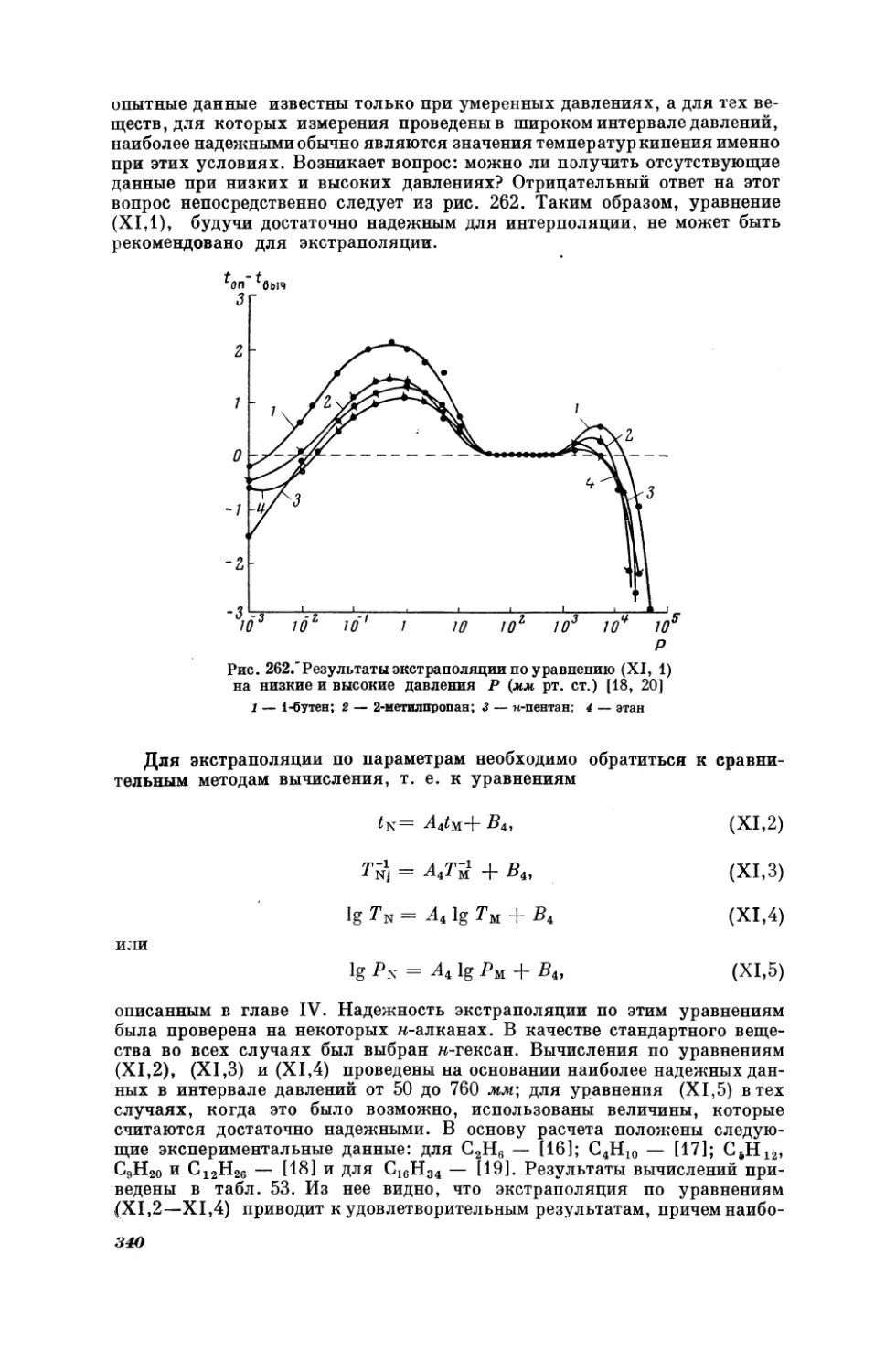
ратур кипения некоторых н-алканов и 2-метилалканов при двух давлениях; изобаре Р = 100 мм рт. ст. соответствует уравнение
130-СиНоп. 9 =
1,01 dty.cpHonte — 7,74.
(1,34)
Для частного случая Р =1 атм уравнение (Т, 33) было применено
для вычисления точек кипения эфиров по точкам кипения соответствующих
им спиртов [400] (см. также [401 ]).
190
120
90
60
2207
i
80
110
i
Г
4
140
170 t,
|
4
2,60
|
|
,
|
)
|
2,65 [т
oo
Рис. 26. Взаимосвязь
между
температурами кипения
(°С)
некоторых н-алканов
|
L
|
i
2,70
H-CatglyHones
Рис. 27. Взаимосвязь между точками
кипения
Т (°К) н-алканов С4Н.С„Н.,,
(Г) и2-
и н-галогеналкилов С„Н.„.:Х
метилалканов (1Т) при давлении 100 мм рт. ст. (А) ид атм
{Б) (п — число атомов углерода в углеводороде) [99]
[102—106]
Как видно из данных, приведенных в [100], отбор при проведении сравнения сходных веществ повышает точность сопоставления.
Вероятно, к более точным результатам приводит сравнение температур кипения в логарифмических шкалах, т. е. использование зависимости
вида
Ig (Т кип)
Примером
(Т, 35) может
Ig (Linum) -CpHonyyF
=
служить
A, Ig (Т кип)т +
Вл.
(1,35)
уравнение
= 1,2677318 (Ткип)н-с.н.синои.: — 1,59289,
(1,36)
иллюстрируемое рис. 27 [108], на котором показано также ьравнение точек кипения н-алканов с точками кипения н-бром- и н-иодгалогеналкилов.
На основании соответствующих уравнений легко найти точки кипения
некоторых неизученных веществ [4108]. В табл. 6 приведены приближенные
значения точек кипения некоторых жидкостей, найденные методом сравнительного расчета [101, 108].
Для расчета давления пара в первом приближении можно воспользоваться и уравнением
Ри = А.Р: + В,
в котором
одинаковых
Уравнение
сравнивается
Давление
температурах,
однако
пара
к
_ (1,37)
в двух
более
рядах
точным
lg Py = A, lg Py + By.
сходных
веществ
результатам
при
приводит
(1,38)
Таблица
Результаты
вычисления
Вещество
ASF3
BeF2
BiFs
СС 3з
CCleJa
CFsBr
Са
CHJs3
Было
значений
Т
Вещество
225,11 [101]
С5На:Вг
678,52 [101]
578,93 [101]
499,76 [101]
CgHisBr
CeHisJ
CgHi7F
точек кипения
Т
400,1
692,82[101] || CsHiJ
225,74 [101] |
СаЕз
[108]
[108]
[108]
PSJs
S1(CH3)3J |
Si (CH3)2J2}
385,42 [401] || Si(CHs)Js|
668 ,95 [104]
веществ
Т
616,10 [101]
POJs
469,03 [404] || Si(CeHs)sJ|
NJs
рекомендовано
||. PJs
[108]
423,4
454,3
421,1
некоторых
Вещество
[108]
429,8
658,14 [401] | МВз
568,92 [101]
Т'(°К)
Zr¥,
614,80 [104]
689,60 [101]
395,00 [101]
453,10 [101]
507,40 [101]
474,90 [104]
034,62 [101]
также ‘уравнение
(55)
(1,39)
== Ai (Spв): + В,
в котором сопоставляются значения величин, обратных температурным
коэффициентам давления насыщенного пара в точке кипения [107 ]. Это
уравнение использовалось для углеводородов. Его можно распространить
и на другие давления.
При расчете по (Т, 39) [4107] в качестве стандартного ряда были приняты н-алканы с тем же числом атомов углерода. Хотя подобный выбор аргумента не может дать наиболее точных результатов во всех случаях 1, однако, по-видимому, в рассматриваемом примере он не приводит к значительным ошибкам.
Результаты расчета по уравнению (Г, 39) приведены в табл. 7; для подавляющего большинства приведенных в ней веществ температурная зависимость давления пара не изучалась. Значения констант этого уравнения для различных гомологических рядов углеводородов указаны в табл.8.
Достаточная надежность вычисления по (1, 39) подтверждается величинами средних ошибок, приведенных в этой таблице (для 38 углеводородов она
составляет 0,00006 граб/мм). Об этом свидетельствует и сравнение результатов расчета с данными исследования [409] (табл. 9).
Можно назвать еще один пример применения соотношения (Г, 1) к
свойствам на кривой равновесия жидкость — пар, а именно: к теплоте
парообразования (в точке кипения). В общем виде эта зависимость отвечает приближенному уравнению
(АНпар)1т
—
А(АН парт
+
(1,40)
Вл,
в котором при Р = с013% сравнивается теплота парообразования в двух
рядах однотипных соединений.
Соотношение (Т, 1) было использовано также при расчете критических
параметров в гомологических рядах [107, 140].
Зависимость
была
(Cup) 11 =
рекомендована
для
Ay
вычисления
(tup)t
&5
+
(1,41)
B,
в различных
рядах
углеводоро-
дов по критическим температурам н-алканов (см. табл. 7). Примером (Т, 41)
может служить уравнение
(1кр)цикланы
—
1,1334
(кр)н-алканы
+
14,8,
(1,42)
1 Точнее было бы вводить в сравнение н-алкан с иным числом атомов углерода
(см. [108]) или‘’же
30
сопоставлять
наиболее сходные гомологические
ряды (см. главу ХТ).
6
Таблица7
Результаты
и критичееких
вычисления значений коэффициентов (05/0Р)„ т.к. (гра9/мм)
температур &„р (°С для некоторых углеводородов [107]
Углеводород
wea
н-Алканы
Нонан
С»Нэо
0t/OP
|
|
Углеводород
ор
о
Ot/OP | bey
|
322,4
2,2-Диметилгексадекан
|СлзНза
0,06142
Декан
СН | 0,05472*| 345,7
2,2-Диметилгептадекан
|СюНа|
0,06282 | 467,5
Додекан
С12Нав | 0,05528*| 386,0
~
Ундекан
0,04967 *
buen
СиНа | 0,05356*| 366,5] 2 ›2-Диметилоктадекан
Тридекан
СзНзз | 0,0568 *| 403,3] 2›3-Диметилгептан
Тетрадекан
СиНэ | 0,0582
Пентадекан
Гексадекан
Гептадекан
*| 419,1|
|С»Наз| 0,0638
2,3-Диметилоктаны
Нонадекан
CioHe2 | 0,05202 | 350,8
СизНзз | 0,0595 *| 433,9] 2,3-Диметилнонан
СьНы | 0,06077*| 448,3] 2›3-Диметилдекан
СиНа | 0,05398 | 374,2
СааНав | 0,05580 | 395,4
СзНзз | 0,0630
*| 473,6|
2›3-Диметилдодекан
СаНзо | 0,05889 | 430,5
СоНа|
+| 496,2]
2,3-Диметилтетрадекан
|СёНз|0,06462
С Нь| 0,064
Эйкозан
я Метплалканы
Merunwouan
0,065
*| 484,9]
23Диметилтридекан
|С5На | 0,06027
|414,2
|446,8
|462,7
2,3-Диметилпентадекан
2,3-Диметилгексадекан
|Си’Нз | 0,06284 | 476,7
|С1зНзз | 0,06398
|490,5
2›Диметилоктадекан
|СыНаз|
[Calla 0.05126 | ЗЗ77 ^^. Димотиатотадекаи |СьНь 0.06504 | 502,8
2-Метилдекан
2-Метилундекан
101122!
0,
,
Са На| 0,05344 | 358,9
С12Н2в 0,05481 | 378,4
2-Метилдодекан
2-Метилтридекан
1-Бутен
С:зНзз| 0,05632 | 395,7]
1{-Гоптен
|С15Нз2| 0,05904 | 426,5
1-Нонен
|Ci;H36/0,06140 | 453,8
Ae
2-Метилпентадекан
2-Метилгептадекан
|СзНзз| 0,06245 | 466,4
2-Метилоктадекан
|СэН| 0,0635 | 478
2-Метилнонадекан
|СюНа? 0,0645 | 489
3-Метилалканы
3-Метилоктан
3-Метилнонан
CeHis 0 04944 *
340.0
1-Ундецен
Cy Hos 0.05348 *
388 9
1-Тридецен
СН
0.05694
130. А
1-Тетрадецен
1-Пентадецен
СлаНзз 0 ,05825
CisH30/0,05959
446,6
|462,8
С18Нзв!0 ‚06319
СэНзз |0 ,06423
С»Н4 |0, 06525.
1506,4
1549,0
[530,9
СоН» 0 05157* |3658
1-Додецен
CioHos 0.05502 * 440.0
СэЭНао| 0,04933 | 347,0] 1-Гексадецен
СН» 0,05432 | 339,6] 1-Гептадецен
3-Метилдекан
3-Метилундекан
3-Метилдодекан
СаНаы|
С!2На|
С!зН2з|
3-Метилтридекан
0,05344 | 360,2]
0,05477 | 379,0]
0,05634 | 396,9]
СаНэо| 0,05760 | 444,2
3-Метилтетрадекан
|СьНз2|0,05887 | 425,7|
3-Метилгексадекан
Ci7H36} 0,06419 | 452,2]
3-Метилпентадекан
3-Метилгептадекан
3-Метилоктадекан
3-Метилнонадекан
СзНло10,04898*
|344
,0 **
|С1зНзз| 0,06227 | 464,5]
н-Гексилбензол
Cy2H18|0,05734
1447,3
СьНа| 0,06323 | 475,4] н-Гептилбензол
Со На | 0,0642
486 ,5| н-Октилбензол
С1зН210,05904
СаН.2 |0, 06038
[432,2
|444,3
н-Амилбензол
С12Нав | 0,05428 | 368,5|
|С.зН.з|0,05586 | 386,8]
но
СиНи 0,05260 | 349,0] 1-Гексин
CisH39
С: Н1в|0,05552
м повилоонвол
2,2-Диметилдекан
2.2-Диметилундекан
кан
2,2-Диметилпентадекан
н-Алкилбензолы
Этилбензол
CroH14 10, 05358+ |384
‚5
СэНоо| 0,04878 | 304,5
CioH22! 0,05079 | 328,0
2,2-Диметилтридекан
2,2-Диметилтетраде-
1-Октадецен
1-Нонадецен
1-Эикозен
[478,6
[492,7
н-Бутилбензол
2,2- Диметилгептан
2,2-Диметилоктан
2,2-Димет илдодекан
Св Нз2|0,06089
СиНз|0,06206
|СьНза|0,06043 | 440,1!
2 2-Диметилалканы
2,2-ПДиметилнонан
48,4
С8Нв 0 04744 * |344 8**
|СвНы 0,06028 | 441,0] {_Цецен
2-Метилгексадекан
0,06610 | 515,5
0.0336 ***|
СНи 0 04447 * 279 9
|СлаНзю| 0,05772 | 411,7] |_Октен
2-Метилтетрадекан
* Заимствовано
|479
CoH20| 0,04985 | 325,2
2›3-Диметилоктан
СН | 0,0619 *| 461,1| 2,3-Диметилундекан — |СизНзз| 0,05751
Октадекан
|453,8
0,05744
401,6
1-Гептин
1-Октин
НЫ
tA
из [243].
** Это значение {кр представляется
*** Заимствовано из [214].
более
1-Нонин
1-Тридецин
1-Тетрадецин
надежным,
С НЫ о ор
С СеНш 0,0419
|CasHss} 005841 | 416,0| 11-Додецин
Suneuma
Св Нз4| 0,05954 | 430,9
|С1”Нзз|0,06064 | 443,6]
0,06175
чем рекомендованное
CrHie2 00449
CgH 10,0475
СэНав
0,0499
СлзНа
СН
10,0573
|0,0587
сон
0'0539
СН 0,0557
в справочной
1404,6
|456,4
р
[249,1
278,8
1305,4
329,0
[869'2
[3868
1403,5
1416,8
литературе.
Таблица8
Значения
констант
4;
и В1 уравнения
гомологических
Гомологический
ряд
Ay
Bi
2-Метилалканы
3-Метилалканы
2,2-Диметилалканы
2,3-Диметилалканы
1-Алкены
0,996
0,97 .|
0,98
1,06
1,03
н-Алкилциклогексаны
1,045
* Первые
**
Все
°гомологи
углеродные
для
некоторых
[107]
nemenn
‚3
10
-+0,00005
4
-
A oy -10°
3
1
3
15
5
5
3
3
—0,00025
-+0,00145
--0,00010
—0, 00280
—0, 00170
i
4
10
4
3
3
—0, 00073
—0,00128
—0, 0027
1,05
1,03
1,41
н-Алкилбензолы
1-Алкины
‚ н-Цикланы **
(I, 39)
рядов углеводородов
8
исключены.
атомы
находятся
в
цикле.
Таблица9
Сопоставление значений коэффициентов (0/0Р) Н. т. К. (град/мм)
для некоторых
углеводородов, найденных по опытным данным [109]
и вычисленных по уравнению (Т, 39) [107]
.
0/0Р
Углеводород
по
[109] * |
А сопытн.—вычисл.
вычислено
град/мм
%
1-Гексадецен
0,06079
0,06089
н-Децилциклогексан
0,06350
0,06358 | —0,Q0008 | —0,13
н-Децилбензол
*
Рассчитано
уравнения
по
Антуана,
0,06300
ypaBHeHnw
значения
Ot/AP
заимствованы
—0,16
--0, 00002
0,0005714 (C + t)?
=
которых
—0,00010 |
0,06298
‚
из
где
В
и
--0,03
С-— константы
[109].
Таблица
Результаты
вычисления
и критических давлений
on Ee
RSS
Ee Е
7
8
9
10
11
12
13
14
15
*
32
2-Метилалканы
ep
313,9 |
337,5 |
399,1
378,6
396 , 2
413,2
428,5
Все
углеродные
Prp
(атм)
3-Метилалканы
P up
22,9
24,0
19,3
17,7
16,4
15,0
13,8
значений критических
tsp
|
|
|
|
|
атомы
316,5 |
339,4 |
360,0
378 ,7
395,5
441,7
426,4
находятся
1 кр
23,5
24,5 |
19,8
18,2
16,7
15,2 |
14,1
304,7
328,4
350,0
369,6
387,3
404,3
419,6
цикле.
р
(°С)
углеводородов
|2,2-Диметилалканы
Ркр
в
температур
некоторых
1р
23,6
21,5
19,8
18,2
16,7
15,4
13,6
317,4
350,5
379,5
405,8
429,7
451,3
1471,0
489,8
506,8
|
|
|
|
|
|
[110]
Цикланы
Ркр
10
*
Р кр
|
|
|
|
|
|
|
31,6
34,9
32,3
30,0
21,9
26,1
24,3
22,6
21,2
средняя
ошибка
расчета по которому
составляет 0,5°. Погрешность
вы-
числения по (ТГ, 41) для 15 изученных углеводородов в гомологических
рядах 2- и 3-метилалканов, 2,2-диметилалканов, 1-алкенов и цикланов так-
же равна примерно 0,5° (исключение составляют 1-бутен и 1-октен).
С
оотношение
также
дает
| (Prep) 11 —
удовлетворительные
А,
.
(Рир)1
+ B,
результаты.
(Ркр)з-метилалканы
—
0,90
(1,43)
Так,
уравнение
(Ркр)н-алканы
приводит к средней ошибке в 0,2 атм
+
2,8
(1,44)
[107].
В табл. 10 приведены значения &;р и Ркр некоторых неизученных углеводородов, в табл. 11 — те же характеристики н-перфторалканов [111]
(в качестве стандартного во всех случаях был принят ряд н-алканов).
Таблица
Результаты вычисления
и критических
n
кр”
2
о
6
8
22,68
147,50
176,45
223,17
**
—2,725;
для
трех
для
трех
м)
некоторых
уравнению
перфторалканов
это
кр”
Ркр**
9
10
44
12
242,60
260,25
216,3
290,8
42,70
11,24
10,0
8,8
0,75973 (tup)n-C,H enta—
уравнение дает
(Pip)n-CrFon 427
соединений это
(° C)
n
крн-СиЕоп 42>
соединений
по уравнению
изученных
температур bop
W-C,Fon so [111]
30,60
20,30
17,95
14,29
изученных
Вычислено
критических
Р кр(@
Ркр**
* Вычислено по
—1,86;
значений
давлений
11
Аср
0,69132
уравнение дает
=
0,31°.
(Ркр) н-СаНоиа
Асер
=
0,13
—
атм.
Наконец, для расчета третьего критического параметра можно воспользоваться
в аналогичных
случаях
(У крут
Результаты
табл. 12
[111].
Результаты
применения
—
Ay
(Укр)т
(1, 45)
для
(1,45)
+ By.
н-перфторалканов
приведены
Таблица
вычисления
и плотностей
n
2
5
. 6
8
4(г/смз)
значений
некоторых
объемов
перфторалканов
Ур
dip
209,7
415,5
568,4
7167,2
0,658
0,605
0,595
0,571
9
10
41
12
838 ,3
933 ‚3
1034
1119
0,582
0,576
0,57
0,57
оно
(Vip)u-CnFon 42 =1,6361
дает
Аср
=
4,3 (m0 Укр)
12
(смз/ моль)
н-С„Ео„ 49 [111]
n
веществ
в
У,
dup
* Вычислено по уравнению
М. Х. Карапетьянц
критических
Vip
для трех изученных
3
уравнением
(Vp)-CyrHon ча
— 31,5;
и 0,007 (по dip).
33
=
—
Возможноеть сопоставления критических констант не ограничивается
гомологическими рядами. Так, к удовлетворительным результатам приводит сравнение критических температур, давлений и плотностей галогенидов четырехвалентных циркония и гаф(Т
ес
ния, значения которых были рекомендованы
tort
3
в работе
[412].
К перечисленным
с
co
0
3
о
rrr
си = A,or + By,
J
1
аль
950 —
1000
(1,46)
в котором сопоставлены поверхностные натяжения жидкостей, находящихся в равно-
=a
=.
1050
уравнениям можно было
бы просоединить и
ry
1100
La
1050
весии со своим насыщенным паром.
nae Br,
Это уравнение, в частности, описывает
взаимосвязь между значениями © расплавРис. 28. Взаимосвязь
температурами
плавлениямежду
7,
Л@ННых галогенидов при температуре плаво(°К) бромидов и хлоридов
ления (на границе
с инертной фазой),
рекоОК С
113
некоторых лантанидов [4115]
Мендованными
О. В. Соколовым [113] (см.
также рис. 8).
Применение соотношения (Т,1) для температур плавления приводит
к уравнению
(fon) 11 =
Ay
(ton)t
+ By.
В работе Ганча и Карлсона [414] указано
которой отвечает приближенное уравнение
(ton) Mex,
=
Ay
(ton) six,
(1,47)
на
+
наличие
зависимости,
В\,
(1,48)
являющееся примером (I, 47). Здесь сравниваются точки плавления галогенидов Се, Эп и Т] и галогенидов 5(Х = С1, Вг, Т). Уравнение (Т, 47)
может быть иллюстрировано на примере точек плавления (Р = 1 атм)
МаХ и ШХ (Х = Х, Вг, Ц, В). Другим примером служит связь между
Гол
МеВг.
и МеС],
(Ме =
Ма,
РЕ, Се, Га),
найденная
по
данным
[115]
(см. рис. 28).
В работе [116] была установлена примерно линейная зависимость между точками плавления галогенидов металлов подгруппы лития.
&
\
23
с
г |
|
|
|
Т|-
ign,
35|-
Lave
2,5
19
15
|.
05
17Jy re
“G5
и
3
[1
\
1
1
1
71
|
“30-20-10
1
1,9)
|
0 40 20 40
т
UG Cig MS
Рис. 29. Взаимосвязь между растворимостями окислов некоторых
двухвалентных металлов в расплавленных [1С1 и КСГпри 800°С
[417]
"ра
-
Рис. 30. Взаимосвязь между коэффициентами расПределения протактиния и золота при р
различными растворителями из 8н
2 — диизопропиловый эфир; 3 — ди1 — хлорбензол;
бутилфталат; |4 — нитробензол; 5 — амилацетат;. в—В-8Вдихлордиэтиловый
эфир; 7 — бензальдегид;
8 — трибутилфосфат;
34
9 —
ацетофенон
Растворы
телях
Данные по растворимости различных веществ в двух растворимогут быть воспроизведены приближенным линейным уравнением
Ig
cil
=
A,
Ig
СТ —-
B,,
(1,49)
в котором сопоставляется растворимость двух рядов веществ в одном растворителе или одного ряда веществ в двух растворителях.
|
Справедливость (1, 49) на одном примере иллюстрируется рис. 29.
Другим примером (Т, 49) может служить соотношение между растворимостью СН.(СН.)„СООС,Нь и СООС.Н „СН ›)„СООС.Нь по’ данным [118]
или растворимость 7. и $53; в различных растворителях (см. [419].
Аналогом (ТГ, 49) является уравнение
15 Ки = 4, 15 Ат -
В1,
(1,50)
связывающее коэффициенты распределения. На одном примере это уравнение иллюстрируется рис. 30 (см. также [207].
Многочисленные примеры (1,1) для энергетических характеристик
процессов растворения рассмотрены в следующем разделе.
ХИМИЧЕСКИЕ
ПРОЦЕССЫ
Энергетические
Гепловые
эффекты
эффекты
реакций
В общем случае для тепловых эффектов Q данного процесса в
двух рядах сходных веществ согласно соотношению (Т, 1) будем иметь
(1,51)
|
Qtr = AiQi + Bi.
Обзор различных вариантов (Т, 51) начнем с теплоты образования ДН,
так как, во-первых, это одна из важнейших характеристик вещества, вовторых, значения ДН известны для большого числа разнообразных 00единений, что делает применение сравнительного метода особенно перспективным. Для теплот образования (I, 51) принимает вид
(1,52)
АНт = А. АНт-| Вл,
для стандартных теплот образования при 25° С
и, В частности,
(АНив)и = Аз (АНзвв)т + В+.
(1,53)
Уравнение (Т, 53) для отдельных веществ применялось в литературе и ранее. По-видимому, впервые это было сделано Лотье [124]. В. В. Фомин
[122, 123] предложил уравнение
AT
erx’
—
AM
rx”
АН
у
„х’
AH мех” = AH Мех” =
AM very”м А
Tr
м
—
АН
ух»
(1,54)
AH Мех”—
nr
при
в котором сопоставляются значения АН соединений двух металлов
Поразличных галогенах Х и которое является видоизменением (Т, 53).
.
ь.
ккал/мол
5
меньше
в
галогено
грешность расчета по (Т, 54) для 26
Hp.
A
й
значени
расчета
для
(1,53)
ие
уравнен
овал
Автор широко использ
различных веществ, в том числе кристаллогидратов, и нашел прибли-
‚кенные значения Л Н®в для 102 неизученных
приведены
в табл.
13.
соединений
[124]. Эти данные
3"
35
Таблица
13
Результаты вычисления значений стандартных теплот образования ДН °эз (квал/ моль)
некоторых галогенидов и их кристаллогидратов
[124]
Соединение
—AH 98
AuF
_ Соединение
18
BeF2
В1Вгз
СУа
CaBre
СеВгз
CrBre
СтВгз
RaJe
239
60
59
1631*
218
77
96
|
—АН 398
Соединение
148
RhBre
RhJe
эсЕз
ScJ3
SmBrg
SnFe
ТЬВгз
‚
16
—10
370
128
207
155
200
—АН 298
СаВг..АНзО
CaCle-2H20
CoBr2-2H20
CoBre-4H20
CuCle- H20
СиС]5.4Н2О
CuCl.-6H20
FeCl,-2H20
453°*
3388*
200
343
123
334
473
244
CrJ3
56
ThJ3
147
ЕеС]..4Н.О
388
CuBre
CuF
302
503*
ThJa
О
455**
195
FeCle-6H20
KF.4H20
513
206
ТаВгз
UBrs
189
205
MgBre-2H20
MgBr.2-4H20
276
425
600°*
РуВз
|
ЕгВгз
EuBrs
197
TIF
191
205
72
MgBre-H20
Eud3
152
UBrg
211
MgCle
FeF >
159
HoBrs
194
NaJ- Н.О
142
FrBr
95
InFs3
246
NaJ-3H20O
280
ГУ.
ГаВгз
—5
221
SnCle-6H20
SrJ2-4H20
905
283
ГаЕз
415
ВаС]5.НзО
280
187
ВаС]5.4Н2О
484
ЕгС]
104
FrF
FrJ
IrBre
122
82
GaF3
241
СаВгз
203
НЁВга
HfCl,
Hg Fe
NpBrs
NpJs
Рат›
219
270
100
186
130
—5
PmBr3
23
LuBrs
|
МоСз
МаВгз
AgF-2H.20
BaBre-4H20
ВаВг..6Н›О
ВаС]5.4Н.О
. 6Н.оО
202
SnCl2-4H20
366
90
212
194
467
611
487
ВаС]5.6Н2О
TICl3-2H20
TICl3-6H20
UF,
ОТ,
ОТ
625
228
506
460°*
131
133
210
~ BaCle- 6H.O
629
У Вгз
195
157
ВеС]..Н.о
203
УЕз
382
РтВгз
215
BeCl.-2H20
281
YbBr3
194
RaBrz
184
ВеС]..6Н.О
587
YAW
479
RaCle
208
CaBre-H20
2397*
ИТ] а
1418*
PmJ3
|
ВаЕ>
290
CaBre-2H20
1* Эта величина близка к 162,22 [31]
3117*
и представляется более вероятной, чем 161,3 [3].
2* Эта величина представляется более вероятной, чем 33,2 [3].
3* Эта величина представляется более вероятной, чем 60 [125], и совпадает с рекомендованной в
[31]. «* Эта величина представляется более вероятной, чем 134
5*
Эта
величина
‘+ Эта величина
* Значение
представляется
представляется
более
более
АНсавг, принято равным
вероятной,
вероятной,
3 6
чем
443
130
[3].
[3].
[3].
163 вместо 161,3 [3].
** Эта величина (вместо 335,5 [3]) дает на графике
зультаты для семи веществ из восьми.
** Эта величина представляется более
чем
вероятной,
AH vec} ‚.тН.о- АНсас1,.тн.о лучшие peчем
597,4
[3].
Таблица
Результаты вычисления значений стандартных теплот образования ДН”
некоторых
| Вещество
—АН 508
Вещество
AIF.
173* [145]
CCIF.H
BF,
453**[145] ||
CCIF2J
ВСЁ
30* [145]
BaSiOs
381,4 [138] |
Ba2Si04
BeMoO,
BeWO.z
508 , 7[138]
316 ,3[137]
342, 9[137]
BaWO,
СВта
CBrsCl
СВтзЕ
СВгзН
CBrs3J
CBr2Cle
CBr.ClF
CBr.ClH
CBr.ClJ
CBreF2
CBr.FH
СВтг2ЕТ
CBreHe
CBreHJ
веществ
403 ,0[137]
—АН 9398
121[139]
CC1HJ.
CClJ3
СС
|| CF2He
СЕН]
| CFeJe
|| CFHs
—1[139]
CJ,
|
27[139]
—22[139]
98[139]
HgSeO,
63[140] ||
KeSiOs
48[139]
25[139]
—2[139]
CFH2J
СЕН]
CFJs
CHsCOO
|
269, 6[138]
281 ,5[137]
97, 0[143]
HgeSeO,4
106, 5[138]
365, 0[138]
KeTiOs
[125103
LisTiOs
453,1[144]
336 ,5[137]
361 ,1[137]
290 ,7[137]
183 ,5[143]
269,5[143]
320,4[138]
376 ,9[138]
450 [30]
190,6[30]
370 [30]
—70[139]
NiMoOs
254 ,5[137]
МЬТь
06[142]
№5е04
—46[139] |
63[139]
13[139]
—10[139] ||
411[139]
62[139]
38[139], ||
12[139]
CeClFHe
CeCleFH
CeCl3F
CeFHs
C3H;COO
CsHsCOO
CaCreOa
СаМоО4
35[145] |
39[145]
38[145]
33[145]
62[142]
25[142]
492,4[144]
369, 9[137]
NiSeO4-6H,O}
NiTiOs3
NiWC,
PF.
PF3
PbTiOs
PbeTiO.
ВаМоО4
CBrClJ2
CBrF:H
CBrF2J
—34[139]
110[139] ||
87[139]
CaTiOs
CdMoO,
CdWO.
248, 6[138]
261,1[437] |
282,3[137]
RaWO,a
$1(С1Оа)а
SiFe
—11[139]
СВтЕН.›
CBrFHJ
CBrFJ.
CBrHaJ
CBrHJe
CBrJ3
CClsC0O
СС]з7
ССЬЕН
60[139]
37[139]
14[139]
—12[139]
—36[139]
59[139]
62[142]
0[139]
73[139]
ССЬЕ?
ССЬНУ
СС Е
_ 66,5[140]
50[139]
0[139]
—23[139]
*
АН 0:
**
Значения
Вычислено
CaSiOs
380, 5[138]
381 ,5[138]
397,0[138]
MgCr2O4
MgMoO.
|| MgWO,
| MnMoO,
| МпбеОа
|| MnSeO4-H20|
| MnTiOs
| NaeTiOs
NbBrs
NbCls
МЬЕь
СВтоТэ
CBrCleF
CBrCl.H
CBrCleJ
CBrClF,
CBrClFH
CBrClFJ
CBrClHe
CBrclHJ
—АН в
—25[139]
—49[139]
—46*[145]
118[139]
96[139]
73[139]
68[139]
58,5[140]
47[139]
24[139]
0[139]
49[142]
C2H sCOO
Вещество
Ее\О4
72[139]
CCIFHJ
СЕТ»
CClHe2J
(ккал/ моль)
FeSiOs
109—112[140]|
CCIFHs
—20[139]
—10[139]
41[139]
—10[139]
—32[139]
1[439]
52(139]
21139]
—24[139]
99[139]
50[139]
|
14
233 , 1[138]
СоМо04
246 ,6[137]
CoSiOs
CoTiOs
263,6[138] |
279 ,1[438]
RaSeOa
SiF3
102
[30]!
142,5[143]
573,1[143]
273,4[138]
274 ,5[137]
102,6**[145]
215*[145]
273, 7[138]
340, 4[138]
375 ,0[138]
281 ,0[143]
404,7[137]
123 [146]
168*[145] .
250**[145]
СоЗе04.6Н20]| 574 ,0[143]
CoSeQa-7H20} 644,0[143] |}
Si(NOs)a
Si(SO4)e
240
498
CoWO,
Cs:Si03
CseTiOs
TaBrs
TaCls
TaFs
164 [30].
205,5[30] |
380 [30].
269, 3[137]
385, 5[138]
374 ,0[138]
CuzSeO,
FeSeO4
FeSeO4-H2O |
FeSeO4-4H20|
Еебе04.7Нз0]
108 ,5[143]}
149,5[143] |
225,5[143]
437,0[143] ||
649,5[143]. |
SrSiOs
Sr2Si04
[146]
[146]
380 ,8[138]
516, 3[138]
ТаТь
117
УСЬ
УСИ
ZnMoO.
ZnTiOs
[30]
142 [136]
140 [136]
272 ,4[137]
300,7[138]
о
на
основании
значения
П,,
найденного
из
соотношения
(Т,56). _
37
Из
Несколько примеров применения (1,53) показано на рис. 31—38.
рис. 34 видно практическое
совпадение коэффициентов А; и В!
уравнения
(1,53)
— МенО„С-эт
для
рядов
(т = 0—3).
значения
АН WCl,
(—94)
титанатов
и силикатов
МеС1,
— Мен,
С помощью
и AH moc,
этого
(п = 2—6) и MeyOmCle-am
—
чертежа
(—143 вкал/моль).
можно
оценить
Из рис. 36 следует,
что в пределах вероятной погрешности опытных данных все точки,
кроме первой, укладываются на прямую. Таким образом, здесь, как
и во многих других случаях, первый член ряда выпадает.
Можно было бы привести много других примеров применения (I, 53).
Так, сопоставление АН сульфитов [134] и сульфатов [3] приводит к линейной зависимости.
Уравнение (Т, 53) в настоящее время широко используется исследователями. Укажем, в частности, на работы Л. П. Рузинова и С. Ф. Белова
[135], применивших это уравнение для сопоставления значений Л Hoo,
Мес, и МеО. (Ме = ТЕ, 2г, НЕЁ, ТЬ). С. И. Скляренко, Л. ПЦ. Рузинов и
Ю. И. Самсон [436] сравнили АН» МеО, и МеС, (Ме = Се, \У, Т! и
Me,O, uw MeCl, (Me = Ее, Мп,.Сг, У, Т!). Я. И. Герасимов и Л. А. Жаркова
воспользовались уравнением (1,53) для сравнительного расчета стандартных теплот образования некоторых вольфраматов, молибдатов
[137],
[138], Б. Ф. Юдин и
Г. А. Хачкурузов
[139] при-
менили ([, 53) для оценки теплот образования некоторых галогензамещенных метана *. Уравнение (Т, 53) было использовано для расчета АН перекисных соединений [144, 142], селенатов [4143] и некоторых других вест
[144]. Ono было широко применено при составлении справочника
145 |.
|
С помощью значений стандартных теплот образования, найденных методом сравнительного расчета, авторы справочника [145] определили значения энергии диссоциации для 38 молекул и радикалов.
В
табл.
14
даны
значения
АН,
найденные
в
перечисленных
выше
работах для тех веществ, для которых отсутствуют опытные данные.
Для оценки значений ДН Хоппе [146] рекомендовал уравнение.
в котором
и
A (AHxo,, 0) = AiA (AH, 0) + Bis
|
A (AH 1,0) = 0,0 (AHmec!, — AH eo)
(1,55)
A (AHxo,, o) = 0,0 (AHmexo, — AHmeo — AHxo,,,).
Для Х = Миу
= 3, naupumep, A, = 0,93 uo В, = 13,51. Это уравнение
можно рассматривать как усложненный вариант (1,52), в котором простое
свойство заменено на комплексное (см. также [147].
Использование уравнения (Т, 52) при температурах, отличных от стандартной, ограничено значительно меньшим количеством опытного материала. Однако оно также возможно, что видно, например, из рис. 39: К нему
можно было бы присоединить, например, результаты сопоставления значений энтальпий диссоциации ряда веществ при абсолютном нуле, рекомендованные в работе [149]; то же относится ик [150].
Сравнение ЛЯ при Р `> 1 атм исключено вследствие практически полного отсутствия опытных данных.
Рассмотрим теперь примеры применения уравнения (1, 51) к процессам, отличным от реакций образования соединения из простых веществ —
начиная с процессов, лишь приближающихся к химическим, и кончая разнообразными, чисто химическими изменениями.
1 В работе С. М. Скуратова
достатки исследования [139].
38
и В. П. Колесова[140]
было указано на некоторые не-
nes
Zn
{Qt
0
30Г
Cd
Zor
Hg C,H<X
qn
-AH
4H
fo
20Е
|
Н9
20-4067,
-А Нмед
20
8
А Нидсньх
Рис. 31. Взаимосвязь
между
стандартными теплотами обра-
зования
слов и
Рис. 32.
ду
АН
(ккал/моль) окисульфидов элементов
.
о
чодгруппы
цинка
9
ми
[3]
Взаимосвязь
стандартными
Ly
Рис.
меж-
33.
200. .
1
NbCL,,K
Взаимосвязь
между ‹. стандартными
теплотами
образования АН; (ккал/моль)
некоторых
галогенидов ниобия и тантала [3]
теплота-
образования
150,
ty
АН,
о
(ккал/моль) НёСНзХ и
НеС.НьХ [126—127]
“-AH
oy
vor
wel,
Мед;
>
Me0, CL, P
г
меось, „/
|
150\-
i
100;-
4 но
=
m=
3
“20
и [1:2
~
rs
70
a
_
| ty
100
7
y
|
y
pin
3
2
7
)
J
“30
150 ay
200
-^ мой
i
720
Рис. 34. Взаимосвязь между ‘стандартными
теплотами ‘образования АН»,
-10
|
1
0
10
HoH Blom
Рис. 35. Взаимосвязь между стан-
образоватеплотами
AB oog (ккал/моль)
бром- и
хлорпроизводных метана [3] *
дартными
HHA
некоторых — соединений
(ккал/моль)
молибдена и вольфрама [128]
AH,
$007
AH,
30
АН, ,
20+
Uh
-
LE
70-
° 900[2
г
;
1
‚
20
50
-DHesy
Рис. 36.
Взаимосвязь
J
200
30
меж-
ду стандартными теплотами
образования АН 298
(ккал/
/моль)молекул ВЗН и радикалов В
1—
н-С,Н»
50|-
СН.
2 —
[129]
С.Н;
4 —н-С.Н,;
5—
2—
н-С,Нал1
900
1
|
400
1
Е
0—1
|
A Н,
519
0
`
Рис. 37. Взаимосвязь между стандартными теплотами
образования
/моль)
Вг
АН. (ккал/
о
кристаллических
и
tana TaCl, [130—132]
nd
газообразных хлоридов тан-
о
|
80
y
4
Рис.
pt
40
ALX
38. Взаимосвязь меж-
ду теплотами образования
AH sos (ккал/моль) субгалогенидов
алюминия
таллия [133]
И
На рис. 40 и 44 сопоставлены теплоты растворения ряда солей в двух
растворителях.
Можно
было
бы привести
и ряд других
примеров.
Так,
воспользовав-
шись значениями энергий сольватации ионов в различных растворителях,
рекомендованных Н. А. Измайловым
-AH,,
[153], мы бы убедились в том, что они
70|-
Г
й
отвечают уравнению
(в частно-
гий сольватации ВЬХ и СзХ, найденных
ИЗ Э.Д.с. и по растворимости).
На рис. 42—44 показаны результаты применения (Г, 51) к различным про-
60
цессам.
|
90
(Т, 51)
сти, при сопоставлении суммарных энер-
40}
Рис. 39.
дартными
“4H,
Взаимосвязь
между
тенлотами
АН” (ккал/моль)
стан.
_
образования
при 1000°К [148]
А — н-алканов и 2-метилалканов; Б —1cance ne toMoR vrncoon
(” — чл
углерода)
Можно
уравнения
было
бы
привести
Из рис. 44 непосредственно вид-
но резкое отличие реакционной способности фтора от других галогенов.
Сравнение
теплот взаимодействия
MeCl (Me = Na, K, Rb, Cs) coorsercrвенно с МЬС, и ТаС;, как это следует
из опытных данных, приведенных
в
[157], также отвечает уравнению (Т, 54).
Для двух сходных процессов свобод-
ный член соотношения (Т, 51) может окаЗаться
одинаковым.
нальны
друг другу. Последний резуль-
А(АН)у
и
А(АН)и
Тогда
будут
величины
пропорцио-
тат был получен в работе, посвященной тепловым эффектам реакций метили этилмагнийбромидов с некоторыми
кетонами
[158].
многочисленные
примеры
применения
(AH erop)1t = Ay (AH orop)t + Ba,
(1,56)
в котором сопоставляются теплоты сгорания в двух рядах сходных веществ.
Здесь укажем лишь на один пример применения (Т, 56), позволивший оценить теплоту сгорания фенилизоцианата [159].
Другие
энергетические эффекты
Частным случаем уравнения
(1, 51) является уравнение
Oy = А, От-
В;,
(1,97)
‚в котором U — энергия кристаллической решетки; следовательно, это
уравнение относится к процессу диссоциации кристалла на газообразные
ионы. Оно было рекомендовано в [160] и дальнейшее распространение получило в [161]. Впоследствии это уравнение было использовано в ряде работ
[162—165],
в частности, для вычисления
теплот образования
чивых соединений [например, Ас(МО.).]|..
Для процесса ионизации (1,54) примет вид
Пт:=
Aly
+'By;
неустой-
(1,58)
возможность оценки / с помощью (Т, 58) упоминалась в [160]. Рас. 45, построенный по данным, найденным Ватанабе [166], подтверждает правиль-
ность уравнения
40
([, 58) на примере метил-
и этилгалогенидов.
“AH снзбн
тт
Mg
OH
эф
го
ч0-
--
.
30-
bq
Sr
rol
Г|.
20
Г
Ba
0
5
0
0
20
90
~
WO
“4H u,0
rr
некоторых
в воде [3] ив метаноле
re
^
0
Рис. 40. Взаимосвязь между стандартными
интегральными
теплотами
растворения
AB ogg (ккал/моль)
-
10
АН,
0
Рис. 44. Взаимосвязь
между
теплотами
растворения Л Hoos
перхлоратов
(ккал/моль) кристаллогидратов
[154]
00-(№0з)2-пН2О в воде и эфире
[152]
4 и меси,
Bey
706\-
600Г
500\-
400
Ba
|
900
Г
|
|
600
|
j
700
]
600
4H ver,
Puc. 42. Взаимосвязь между теплотами реакций
Ao,
(ккал/моль)
MeXe,r > Me®*,r+ 2X7,r
(X = F, Cl;{Me*—'Ba, Sr, Ca, Mg, Be) [154]
-AH
100+" :
AH
rob
Mee
9+
80
nrg
.
5
a
Mn
a
Nt
у
Fe
10
..
50
unk
Co
19
DH uye2+s29
ty
20r
20
on
éU
J
0
|
1
J
22
4
(1
10
|
8.
td
80
Рис. 43. Взаимосвязь между теплотами
взаимодействия
— AH og
Рис. 44. Взаимосвязь
химических реакций
валентных
металлов с этилендиамином (9) [155]
NC—H+Xe=SC—X+4+
/
(ккал/моль) ионов некоторых двух-
>С
=С<-+
(DD
120
между теплотами
ДАН. (ккал/моль)
Х.= > СХ — СХ
НХ
(X= J, Br, Cl, F) [456].
(Пи
(Ш)
(Т, 51) в виде зависимости
уравнение
[467] применил
A. II. Пурмаль
(1,59)
Еп = А: Ёт- В,
в которой Е и Ен — энергии активации взаимодействия радикалов В}
и В; с рядом валентно-насыщенных молекул. В этой же работе он предлоCR, =
[
CoHeX
вида
зависимостью
и другой
воспользоваться
жил
Алек,
+
(Г, 57):
(1,60)
By,
Г
110
AL
105
100
92
Г
ре
р
р
40 9.5
10,0
10,5
г
10,
ILS
сн-Х
Рис. 45.
Взаимосвязь между
потенциалами ионизации Г (26)
молекул
(Х = Cl,
СНзХ
Br,
Рис.46. Взаимосвязь между энергиями
(ккал/моль) радикалов СНз = СН —СНэ
и С>НьХ
J)
[166]
другими радикалами
1—H;
#-C3H;;
[167]}
2—OH;
3—CH,;;
+— СН;
7 — C.H.; 8 — Br, 9 — CH,=CH
связи Е
и СНз с
5—0;
6—
— CH;; 10 — J
в которой в, и &к, — энергии связей радикалов А; и А; с другими радика
лами. На рис.
46
воспроизведен
Е,
;5
TTT
20
T_T
To
9
15|
10
Ot,
15
20
82
СНзС1 (Т) и СНзВг (П) методом
электронного удара [169]
1—сн,х+;2—сн*4+х;2—сня4+ HX; 4—CH+4+2H 4X: 6—
42
из
графиков
энергий диссоциации
Е,
Рис. 47. Взаимосвязь между
потенциалами появления
ocколков Е (26) при диссоциации
Ct+3H+xX
один
работы
А. П. Пурма-
ля. На нем дополнительно нанесена пунк“
тирная прямая, соединяющая точки, обозначенные залитым контуром.
Это сделано -с
целью показать, что выделение сходных веществ в соответствии с идеей метода сравнительного расчета должно привести к выигрышу в точности.
|
Это можно подтвердить и другими примерами. Так, не очень хорошая
` укладка точек
на прямую, соответствующую сопоставлению
R—R
CH,, Cl, Br, J, OH, NH,,
димому,
можно
wa R—Y
(Y = 4H,
CHO) [168], mo-su-
связать с тем, что радикалы У
принадлежат к различным группам. Интересный пример приведен на рис. 47, где сопоСТавлены потенциалы появления
осколков
При диссоциации СНзС] и СН‹Вх [470]. Другим
интересным
примером
могли
бы
слу-
жить результаты изучения влияния заместиТ@лей в полярографии [171—173].
В работе [174] уравнение (I, 51) было
применено для хемосорбции на металлах.
Другие характеристики
Если сопоставить в двух рядах сходных веществ температуры,
при которых оба вещества обладают одинаковым значением какого-либо
свойства,
то можно
ожидать соблюдения приближенной
зависимости
(1,64)
a
><
act3
tr = Aity + By.
250
200
150
]
_ 90
100
|
150 +
200
RbXY,
Рис. 48. Взаимосвязь между температурами { (°С),
при которых давление диссоциации в реакции
МехУ. = Мех -|- Уз, г (Х, У — галоген; Ме —
ВЬ и С$) делается равным 1 атм [175]
Teun
ed
700} t,o
200!
600
B
500
100
0
.
.
40
|
100
]
200
L
300
300
1
|
"400 500°
1
1
600
1
]
100
L
1
Л
1
LL
80 „90, 1000
cenexam
Рис. 49. Взаимосвязь между температурами # (°С)
дегидратации
селенатов и сульфатов
различных
металлов [27, 176]
1— МЕХО.-6Н;0 — МёХО,-4Н,О -- 2Н.0; 2 —Сихо..5Н.0 =
Сих0.-3Н:0
+ 2H,0;
3 — BeX0,-4H,O > BeX0,2H,0 + —
+2H,0; 4 —CuX 0,-3H,0->CuX 0,-H,0+2H,0; 5—CaX 0,-2H,0
+ CaX0,+2H.0;
6—CuX0,4-H,O — CuX0,+H,0;
7 — МЕХ 04. НО -> МЕХО. + Н,О
Примеры, приведенные на рис. 48—50,
Первый пример отвечает сопоставлению
ние диссоциации в реакции
Рис. 50.
Взаимосвязь
температурами (°С), при
рых делается заметным
ЛИЗ хлоридов и бромидов
между
котогидрокаль-
ЦИЯ, стронция и бария [177]
иллюстрируют это соотношение.
температур, при которых давле-
МехУ, = Мех + У,, г
43
достигает 1 атм; второй — соответствует сравнению температур дегидратации различных изоморфных сульфатов и селенатов; третий — температуре, при которой делается заметным гидролиз различных галогенидов в
паровой фазе.
Из данных,
которыми
“lek
Wy
приведенных
сопровождается
ме(он),
—
a
90-
следует,
MeCl a MeBr,
|
Fe
rye
Me
AZy=
Гм
50
к
3
Взаимосвязь
70
H, Li,
Na,
(например,
K, Rb, Cs,
А
АЙ
B,
ему
(для
(1,62)
стандартных
Ig Kyy= A,lg Ky
+ By,
MeO
(1,63)
<
.
где АДи А — изобарный потенциал и константа
равновесия
реакции.
На рис. 51 эта зависи-
меж-
ду константами равновесия
образования из простых веществ окислов и гидроокисей никеля, железа
ганца при 95° С
соединений
=
или соответствующего
30
Рис. 51.
что сопоставление сжатий,
сходных
МН.), приводит к зависимости вида (1, 4), где
С — Тшл/ХТ-т (см. также данные, приведенные
в [179] и [180], а также [184].
Широкое применение соотношение (Т, 1) Haходит в виде уравнения
“an
|
в [178],
образование
мость иллюстрируется одним примером. Другим примером может служить связь между AZ
образования лития и натрия из ионов в газовой
и мар[3]
фазе,
отвечающая
данным,
рекомендованным
B [182].
Уравнение (Т, 63) можно рекомендовать для обработки данных, полученных в различных исследованиях, в частности в статье [183], авторы которой изучали взаимодействие ароматических соединений с НЕ. Воспользовавшись
данными,
приведенными
в статье
[184], можно
было
бы осущест-
вить сопоставление трех констант диссоциации Н.АзО, и Н.РО.. Параллелизм в изменениях значений АЙ органических и неорганических веществ
(см., например, [185]) также может быть показан сопоставлением по уравнению (Т, 62). С помощью (ТГ, 62) были определены значения стандартных
изобарных
потенциалов
образования
АЙ5.-
различных
неорганических
соединений ([137, 138, 144, 175] и др.) (см. табл. 15). Отметим, что коэффициенты уравнений (Т, 62) и (1, 52) совпадают, если их применять для одних
и тех же веществ при одинаковой температуре (см., например, [137].
Таблица
15
Результаты вычисления значений стандартных изобарных? потенциалов
7 (кнал/моль) образования некоторых веществ
Вещество
BeSeO.u
`_А
в
188 ,0[176]
|
Вещество
FeSeOu
CaCr204
424 ,8[144]
HgSeO.
CseSeO4
239, 5[176]
HgeSeO4
CdSeO.4
123 ,0[176]
K2SeO,
Собе04
Си2Зе04
СиЗе04
107,0[476]
83,0[176]
85,0[176]
|
— Роб
125 ,0[176]
68 ,0[176]
16,5[176]
241 ,5[176]
11 23е04
244 ,0[176]
MeCr204 | 492,4[144]
|
Вещество
|
—AZoog
MgSeO.
207 ,0[176]
Na2SeQ,
230 ,O[176]
MnSeO.
№5е04
RbeSeOs
ZnSeO4
155, 0[176]
112,0[176]
| 240,0[176]
135,5[176]
В исследованиях Н. А. Измайлова с сотрудниками: [187—193], в которых разработана теория влияния растворителей на силу кислот и изучены
44.
термодинамические свойства электролитов в неводных растворах, уравнение (1, 63) нашло широкое применение для констант диссоциации различных электролитов в двух растворителях (см. также [194]).
Данные по константам взаимодействия 15 К „(Г = 1, 2, 3) различных
ионов с органическими соединениями, приводимые в работах Изатта с
соавторами (см., например, [195 —197]), также удовлетворяют уравнению
(I, 63).
Уравнение,
соответствующее
|
уравнению
(I,
63),
было
получено
в
работе [198], в которой изучался пиролиз дитиокислот фосфора в среде
бензола и хлорбензола основанием гексаtan
метилкрасного.
9",
Уравнение вида (Г, 62), в котором сопоставлены изобарные потенциалы образования газообразных галогенидов водороН.
ему
Е.
(в воде
растворителях)
Хомутовым
дать
сольватации
[199],
было
приближенную
НЕ
в
Н.О
и
что
некоторых
применено
8
позволило
оценку
МН. (362 ккал/моль), СНзОН (346 ккал/моль)
различных
закономерностей
lg Gy
=
А, 12 а1-
о наличии
B,
Так,
Х.
С.
Багдасарьян
[200]
эт
Lo
(1,64)
подобных (Г, 63) и являющихся примерами соотношения (1, 1) в логарифмических
шкалах. К ним относятся зависимости,
описывающие
реакционную способность
различных веществ (см., например, [200—
211].
БЕ
вида
4
в
ба
117656
теплот
(361 ккал/моль),
и С.Н,ОН (348 ккал/моль).
Следует также упомянуть
Al
у
Nd
Е
DE
да и их сольватации
других
/2f
4
‘9 te
рис.52. Взаимосвязь между второй
и первой константами образования
ионовнекоторых элементов третьей
группы [196]
статье, посвященной относительной реакционной способности радикалов,
показал, что для рассмотренных им процессов коэффициент А, уравнения
(Г, 64) характеризует относительную восприимчивость реакций с участием
двух радикалов к влиянию структурного фактора в общем ряду однотипных молекул, с которыми эти радикалы реагируют.
° В работе Брауна и Штука [206] установлена кинетическая зависимость
вида ([, 64) между относительными константами скорости гидролиза и
меркурирования для ряда электрофильных реакций. Ряд примеров сопоставления сродства различных радикалов можно найти в обзоре [211].
На рис. 52 представлен пример использования уравнения (Т, 64); в
основу
положены
данные,
найденные
в
[196].
|
НЕМОНОТОННО ИЗМЕНЯЮЩИЕСЯ СВОЙСТВА
ношения
До
сих
пор
мы
ограничивались
примерами
(1, 1) к монотонно изменяющимся свойствам.
применения
соот-
Однако существуют
группы родственных соединений, ряд свойств которых претерпевает немонотонные
изменения;
в подобных
случаях не только количественная,
но даже полуколичественная
оценка их значений становится затруднительной.
В гомологических рядах к скачкообразно изменяющимся свойствам относятся точки плавления, точки фазовых превращений, теплоты плавления, криоскопические постоянные. Это, по-видимому, связано с различием
в плотности упаковки в кристалле молекул, с четным и нечетным числом
‚атомов
углерода.
Так
как
при
четном
числе
атомов углерода
в
45
молекуле возможна более плотная упаковка, чем при нечетном, то в первом случае энергия молекулярного воздействия будет больше, а поэтому
будет больше и температура плавления.
В подобных случаях обращение к соотношению (Т, 1) позволяет _приближенно
оценить
значение
свойства.
Температуры и теплоты фазовых
в конденсированных системах
нительного
Прежде
физической
идентификации
bon
150
всего рассмотрим возможность применения метода срав-
расчета для вычисления
важнейшей
константой,
точек плавления
которая
и определения чистоты
|
100
превращений
°’
А
|
служит
[242], являющихся
для характеристики,
органических веществ.
Для дальнейшего изложения важ-
но подчеркнуть, что для высших чле..
нов гомологических рядов значения
Нл, Как правило, неизвестны или известны с очень небольшой точностью.
(для большинства изученных веществ:
с ошибкой
порядка
41°).
Лишь
для
н-алканов они известны примерно доСо с погрешностью меньше. 1°. С та-
{
кой же погрешностью известны вх,
многих 1-алкенов и н-моноалкилциклогексанов. Только для отдельных
соединений с болыпим молекулярным весом достигнутая чистота образцов (— 99,9%) обеспечила опре-
деление
~1007
-150
5
Еис. oe.
10
пл
15
\
25
иметь темтерату ры.плав-
ла
атомов
углерода (п) в некоторых
гомологических
рядах
А —
двухосновные
одноосновные
ч-алканы;
20
Г —
карбоновые
карбоновые
кислоты;
кислоты:
Б —
В—
н-моноалкилциклогексаны
ty,
C
точностью
порядка
0,4 —0,01° [243, 214].
Впервые обнаруженная Байером
[215] периодичность изменения точек
плавления в дальнейшем послужила.
предметом ряда эксперименлальных
и теоретических исследований. Сводку этих работ можно найти в [216];
некоторые
из
них
рассмотрены
[247] (см. также [248 —220]).
Перио
риодичность точек плавления ,
характерна не только . для низкомоле-.
КУЛЯярных
лимеров.
соединении,
Так,
количеством
но
полиамиды
атомов
и
с
углерода
для
кой плавления, чем эти же соединения с нечетным
[221].
количеством
по-
четным
кисло-
ты и диамина обладают более компактной упаковкой и более высокой
лерода
в
точ-
атомов уг-
Если отбросить несколько первых гомологов, то можно говорить о четырех типах изменения точек плавления. На отдельных примерах они по-
казаны на рис. 53. К гомологическим рядам, в которых последовательность.
изменения точек плавления соответствует линии А, относятся двухосновные дикарбоновые кислоты, линии Б — одноосновные карбоновые кисло-ты, меркаптаны (1-алкилтиолы), диамины. К гомологическим рядам, в
которых Шл с увеличением молекулярного веса непрерывно возрастает по.
линии вида ВБ, можно отнести н-алканы, 2-алкантиолы, предельные одноатомные спирты, н-моноалкилнафталины, 1-алкины,
н-моноалкилциклопентаны. В пределах ошибок опыта монотонный ход точек плавления
46
(tna)
50 It
-90-
7009
-159
1
1
“100
1
-50
0
(tn)
50
(tng )
Рис. 54. Взаимосвязь
между
температурами плавления #1„ (°С) приР = 1 атм в
гомологических
А — налканы
(II);
рядах
[2144, 222, 223]
СиНои-ро(Т) и1-алкины
Б — н-алкантиолы
карбоновые
кислоты
СиНои_—о
C,Hon+4 $ (Г ин-моноC,H,1,;COOH
(II)
Рис. 55. Взаимосвязь между -температурами плавления &„ (°С) при Р = 1 атм
членов некоторых гомологических рядов, содержащих четное (т) и нечетное
(т -- 1) число атомов
углерода
[214,
222, 223]
Обозначения те же, что и на рис. 53
(п —
число
атомов
углерода)
(tra) I
(пл )
Рис. 56. Взаимосвязь! между температурами плавления #1 (°С) при Р = 1 атм членов
|
А—2-алкилбензилидазолы
`’Р—
некоторых гомологических
рядов
[227]; Б — метиламиды жирных кислот [228]; В — н-спирты [222, 229];
этиленгликолевые
эфиры
глутаровой
кислоты
[230]
(п —
число
атомов
углерода)
‘
(линия
Г) наблюдается у н-моноалкилциклогексанов,
н-моноалкилбензолов, 2-метил-1-алкенов и кетонов СН. — СО — С„НЪиа.
|
Для некоторых гомологических рядов погрешность экспериментальных данных, возможно, соизмерима с отклонением от плавной кривой, что
затрудняет отнесение этих рядов к соответствующей группе. Таким рядом
являются, например, 1-алкены. Если же считать, что осцилляция точек
плавления — общее свойство гомологических рядов, тогда следует ряды,
отнесенные к типу Г, причислить к типу ВБ.
Казалось
бы, немонотонный
ход точек плавления
не позволяет
пользо-
ваться для них соотношением (Т, 1) так же широко, как и для вычисления
других
свойств.
Действительно,
оно
может
дать
удовлетворительные
ре-
зультаты лишь при монотонном изменении &л или при одинаковом характере осцилляции их значений. Примером последнего случая могут служить ряды н-алкантиолы — монокарбоновые кислоты и н-алканы — 1-алкины. Но, например, сопоставление точек плавления 1-алкенов и 1-алкинов— рядов, сходных в отношении многих свойств, — неосуществимо *. Однако простой прием позволяет распространить уравнение (1, 1) и на подобные случаи. Все молекулы с четным числом СН,-групп в углеводородной
цепи имеют аналогичное строение; также является аналогичным и строение молекул с нечетным числом СН.ь-групи. Это проявляется, в частности,
в том, что при соединении на каждой из линий рис. 953 точек с четным и не-
четным значением п мы получили бы (во всех случаях, когда значения {1
достаточно
надежны)
две плавные
кривые.
Косвенно
это можно
подтвер-
дить, например, уравнениями, которые рекомендованы в работе [224]
(см. также [225]). Поэтому данный гомологический ряд можно рассматривать состоящим как бы из двух групп соединений. Это позволяет для вычисления точек плавления высших членов любого гомологического ряда
рекомендовать соотношение (1,4) в виде приближенного уравнения
(ton) neers
в котором
(Ёл)четн И (л)нечетн
=
Ay (ton) aern + By,
— Температуры
(1,65)
плавления
(при одинако-
вом давлении) соседних гомологов, содержащих соответственно четное и
нечетное число атомов углерода, а А. и В, — постоянные для данного гомологического ряда (рис. 954). Коэффициент А | в этом уравнении всегда
отличается от единицы, так как осцилляция точек плавления в любом гомологическом ряду с увеличением молекулярного веса затухает (см., например, рис. 953).
Уравнение (ТГ, 65) распространяется и на случай практически монотонного изменения Ц сп (рис. 53, тип Г), который можно рассматривать как
предел
в
последовательности
А -> Б >
В->
Г,
когда
линии
четных
и
нечетных и при всех значениях п сливаются в одну кривую.
На рис. 55 уравнение (1, 65) показано на примере тех четырех гомологических рядов, которые были представлены на рис. 53 [212].
На рис. 56 аналогичное сопоставление показано на примере еще четырех
гомологических
рядов
[226]. Масштаб
лен для каждой прямой вертикальным
Как
видно
из
этих
чертежей,
на обеих
осях
одинаков и представ-
отрезком ценой в 10°.
уравнение
(Г, 65) с удовлетворительной
точностью описывает опытные данные 3, причем характер чередования точек
плавления не отражается на достоверности результатов. Если ограничить1 Значения 1
ганических
заимствованы для углеводородов из [2413] или[214], для других ор-
соединений
главным
образом из
[222,
223].
2 Этот пример интересен в том отношении, что он может служить иллюстрацией следующего принципиально важного положения:
два ряда веществ,
будучи
сходными в отношении одних свойств, оказываются несходными в отношении других.
3 При оценке точности уравнения следует учитывать, что достоверность значений
л В ряду двухосновных
кислот для большинства соединений невелика (различные
рекомендации во многих случаях отличаются больше чем на 1°).
48
ся сравнительно небольшим числом высших гомологов, то можно
чить весьма точные результаты. Так, с помощью уравнения
(tnn)em+1
взаимосвязь
между
точками
—
0,945
плавления
(пл)эт
+
полу-
(1,66)
5,6
н-алканов
с
п =
19 -:_ 39 описы-
вается со средним отклонением меньше 0,1° от данных, рекомендуемых в
литературе в качестве наиболее надежных [213].
Чтобы с помощью уравнения (1, 65) получить хорошие результаты для
большого числа веществ, следует осуществить два сравнения: (&л)т-1 —
— (Е п)ти (В л)эт-1— (л)эт и после этого принять среднее значение. Это связано с тем,
что
кривизна
линий (& л)нечетн = /(л)четн,
КОТОрая становится
ощутимой при распространении (1, 65) на большое число веществ, является
противоположной по знаку для этих двух сравнений.
Вместе с тем, указанная рекомендация свидетельствует о том, что в общем случае нельзя
отдавать предпочтение какой-либо из двух возможных последовательностей при сравнении значений точек плавления.
Таблица
16
Сопоставление опытных [213] значений точек плавления &пл (°С)
некоторых высших н-моноалкилдиклогексанов с вычиесленными
по уравнениям (Т, 67) и (Т, 68) [212]
t
Число
атомов
|
углерода
=
Среднее зна-
вычислено по
чение из вы- | бпытн ^^ ср
no [213]
(1,67)
11
—57,5
—60,5
—55,1
—58,1
+0,3
13
—30,5
—31,6
—30,1
—30,9
+0,4
15
—10,2
—10,4
—10,3
—10,4
+0,2
17
5,8
5,9
5,4
5,7
+0,4
19
18,5
18,9
18,0
18,5
0,0
21
29,3
29,3
28,6
29,0
0,0
23
37,8
38,1
37,4
37,8
0,0
20
45,2
45,4
44,9
45,2
0,0
27
51,5
21,6
54,4
51,5
0,0
29
51,0
57,0
51,1
57,1
—0,1
31
61,9
61,6
61,9
61,8
+0,2
33
66,1
65,7
66,4
66,1
0,0
35
69,9
69,4
70,4
69,9
0,0
37
73,3
72,7
73,9
73,3
0,0
|
численных
4,68)
Данные, приведенные в табл. 16, иллюстрируют точность вычисления
по уравнению (Т, 65) на примере некоторых высших н-моноалкилциклогексанов. Здесь экспериментальные величины сопоставлены с вычисленными
по
уравнениям
(tan)m41
—
0,91
(tan)m
++
7,0,
(1,67)
(ust) m-1
—
1,10
(fon)m
—
8,4.
(1,68)
Как видно из таблицы, средние отклонения данных, рассчитанных по
уравнениям (Т, 67) и (Т, 68), составляют соответственно 0,5 и 0,4°.о Если
же взять средние значения 1; из вычисленных по этим уравнениям, TO
ошибка уменьшится до величины, меньшей 0,1°. Принимая во внимание,
что на результатах расчета отражается и погрешность опытных данных,
такую точность расчета следует признать вполне удовлетворительной.
4
м. Х. Карапетьянц
49
Наряду’ соТсходством четных и нечетных] членов данного
гомологического ряда! можно говорить и о сходстве четных (или соответственно
нечетных) членов различных гомологических рядов. В принципе это значительно расширяет возможности вычисления, так как наряду с уравнением (Г, 65) позволяет воспользоваться соотношением (Т, 1) в обычном ви-
де,
т.
е. в форме
уравнения
(л)т = Ал (бил) + Br,
(1,69)
в котором (&л)т и (В л)п — температуры плавления (при данном давлении)
соответствующих веществ в Ги П гомологических рядах.
Разумеется, с помощью этого
т)
90
50
-30
т
7
т
30
т>
60
уравнения возможно и
у
„
сравнение
точек плавления веществ
гомологического ряда
с.
одного
четным
числом атомов углерода с точками
плавления веществ другого гомологического ряда с нечетным Числом атомов углерода. Такое сопоставление показано на рис. 57, Из
которого
видно,
ходе йл
что при
различном
в сопоставляемых
рядах
t
( ne, $0,
1200
| _
Rb
1000
_
- 800
-730
-100
-70
-40
(tna)
-10
Ко
GS
Ма
Li
600
i
i
8
00
1
L
\
1000
t
1
1200
пл ма, 560,
Рис. 57. Взаимосвязь между температурами
плавления #, (°С) при Р=1 атм
Рис. 58. Взаимосвязь
ратурами
плавления
между темпе&„ (°С) при
A — н-алканы и н-монокарбоновые кислоты; Б—
Р=1
и
н-алканы
и 1-алкины;
В — 1-алкены и 2-метилалкены. Цифры показывают число атомов углерода
в алкильном радикале
(линия
А)
четные
и нечетные
точки
атм
элементов
располагаются
селенатов
подгруппы
на двух
сульфатов
лития
линиях,
[175]
при
аналогичном ходе &л (линия Б) эти линии сближаются, располагаясь,
однако, на расстоянии, превышающем погрешность эксперимента; наконец, в случае, когда для обоих рядов зависимость &„ = (п) является
практически одинаковой, т. е. выражается плавными кривыми, линии
Нг —
Ц практически
сливаются
в одну
(В). Таким
образом,
только
в по-
следнем случае метод сравнительного расчета различных свойств в той
форме, которой отвечает соотношение (1, 1), может быть использован
для вычисления точек плавления.
В остальных же случаях следует
пользоваться его видоизменением, описанным выше и обусловленным
особенностью хода точек плавления в гомологических рядах.
_В заключение отметим, что возможность применения метода сравнительного расчета, и в частности уравнения (Т, 65), для вычисления точек
плавления неизученных веществ и уточнения недостаточно надежных
значений этой величины в настоящее время ограничена скудностью и недостаточной точностью опытных данных. Для большинства гомологических
рядов точные значения точек плавления известны для 5—6 первых членов
50
ряда, т. е. как раз для тех веществ, для которых еще не проявляется
правильность чередования значений рассматриваемого свойства в молекулах с четным и нечетным числом СН,-групп, позволяющая воспользоваться уравнениями (Г, 65) и (Т, 69).
Температура плавления в рядах неорганических соединений меняется
монотонно. Однако и в этом случае возможно немонотонное изменение.
Один из таких примеров представлен на рис. 58. Он свидетельствует не
только о том, что селенаты более легкоплавки, чем сульфаты (вследствие
большей ковалентности первых по сравнению со вторыми), но и о возможном нарушении монотонности в значениях #и в ряду К — ВЬ — Cs.
(toon
80
(Aon)
70
26].
60
aor
50
18
га
14
40
вольт |
ты
9
10 80
t
Рис. 59. Взаимосвязь
Другим
между
точками
а- в В-модификацию
o — [214]; ®@ — [219]
примером,
ПЛ
ПР’л-1
перехода #1} (°С) н-алканов С„Н».,
из
ОР. Pit tiiiiiit Е.
4 18, 28 22
10
осциллирующего
ii-f
Рис. 60. Взаимосвязь ‚между
Tamm плавления
при
t
тепло-
ДН’ ил (®кал/моль)
Р=1 атм а- иВ-модификацией н-алканов С„Но„.. [220]
свойства
в гомологических
рядах
служит температура перехода ревращ Из одной кристаллической модификации в другую (см., например, [225]). Для этого свойства также действительна зависимость (1, 1) [226], принимающая в данном случае следующий
вид:
(tupespam)II
=
А: (tnpespam)1
Справедливость (1, 70) показана на рис. 59.
Соотношение (1, 1) можно распространить и на
Рис. 60 иллюстрирует эту возможность на примере
И
(1,70,
+ By.
другие свойства.
уравнений
(1,71)
(AA ga )it = Ai (AH pa): + By
(АНиз)и
—
Ay (АН)
+
B,,
(1,72)
в которых сравниваются изменения энтальпии при переходе соответственно o- и В-модификаций н-алканов в жидкое состояние.
;
Примером соотношения (Т, 1) может служить и уравнение
АН, = А.АН®, + В);
(Т, 73)
различие в свойствах &- и В-модификаций н-алканов проявляется B TOM,
что экспериментальные данные (найденные по кривым нагревания образ.
цов) образуют две линии, одна из которых относится к четным, а другая
к нечетным членам ряда. Принадлежность же о- и В-модификаций к одному
гомологическому ряду проявляется в том, что наклон прямых (Т, 19) одинаков.
>
4*
51
Другие
примеры
немонотонно
Теперь обратимся
в
изменяющихся
к более сложным
свойств
примерам
немонотонности
изменениях свойств [234].
Остановимся прежде всего на случае немонотонности некоторых свойств
элементов побочных подгрупп периодической системы элементов Д. И. Менделеева, вызванной так называемой вторичной периодичностью
[232].
Этой особенности посвящен ряд работ
[233—237], причем более всего
немонотонность обнаруживается
в теплотах
образования
[238—246].
На протяжении многих лет явление вторичной периодичности, несмотря
на то, что оно охватывает большую совокупность свойств и веществ,
ме
100°
к,
|
-
а
A
HOE
Во
grit
I
м
|
wet
Р
Рис. 64. Зависимость
60
‘80 100 129
АЗ
7
X
Sb
p
|
20-
Sb
.
0
;
!
20
40
стандартной теплоты образования
As, Sb) or NOpAyKOBOrO
стандартными
5
|
|
20140
Cd3X2 (X—P,
между
Cdese
рп
601
`
Н
ug
8Ur
HOMepa элемента
образования
теплотами
СазХ2 (Х =Р, Аз, 55)
A Hog
;
1
60
AH og
‘
!
80
OH
j
100
LngXo
(ккал/моль)
Zn3Xo
2х [255—258] (а) и взаимосвязь
7пзХа и
(ккал/моль) в рядах
[254—258]
(6)
почти не привлекало внимания исследователей; достаточно указать, что
об этом явлении упоминалось лишь в единственной монографии [248].
Только в последние годы к нему вновь пробудился интерес. В работах
С. А. Щукарева и его сотрудников [248—253] был дан теоретический анализ явления вторичной периодичности и накоплен обширный экспериментальный материал, подтверждающий правильность этого анализа на примере энергетических свойств различных веществ.
Однако во всех ранее проведенных исследованиях отсутствовали попытки количественной оценки рассматриваемого явления. Между тем, для
воспользоваться соотношением (1, 1). Проиллюстрируем
этого можно
такую возможность на примере стандартных теплот образования A Hoos 7п и Са обладают близкими свойствами. Поэтому зависимость A Hoos UX
соединений с элементами главной подгруппы пятой группы от порядкового
номера последних имеет аналогичный характер, как это видно из рис. 61а.
Поэтому в данном случае также невелико различие в степени проявления
вторичной периодичности, что позволяет рекомендовать приближенное
уравнение
(AH o98)ca,x, = 9,25 (AH eo8)zn,x» + 2,4,
являющееся
Средняя
частным
погрешность
примером
расчета
уравнения
(Г, 53); здесь Х =Р,
(А Ноов)са.х, равна 0,3 ккал,
Аз, 5Ъ.
в то время, как
неточность опытных данных достигает 1,8 —3,0 ккал. Достаточная надежность этого уравнения показана на рис. 61,6, на котором размер каждого
прямоугольника соответствует вероятной погрешности значений ЛАЯ°..в.
Такая же картина наблюдается и в случае галогенидов элементов
ПТ группы (рис. 62) и в рядах ХО, и ХЕ, где Х = 5, Se, Te [124].
Be
В качестве другого, аналогичного случая немонотонности
укажем
на нарушения последовательности в значениях свойств веществ, обусловленные лантанидным сжатием. Примером такой немонотонности может
служить ряд Си — Ав —Аи (см., например, [259 —261]). Лантанидное
сжатие, связанное с заполнением 4}-ячеек, вызывая увеличение эффективного заряда атома
золота, влечет за собой возрастание его энергии ионизации и как следствие — увеличение энергии решетки ( соединений зо-
лота.
И здесь
обращение
но, так как нарушение
ae мег;
320
к (1, 1) позволяет
In
Ga
62.
— Аах,
Au
230+
Cu
|
"
210- Ag
|
]
|
|
2 4080 120
Взаимосвязь между стан-
теплотами
Рис. 63.
образования
гиями
АН®2ов (ккал/моль)
бромидов
и
фторидов алюминия, индия, галлия
и таллия
—
}
1
190 ~~ 210
меВг,
Рис.
количествен-
— АРХ
29
2900г
дартными
СаХ
LE
240-
120
явление
в ряду
Ome Br
Al
280|-
во-
оценить
последовательности
t
|
-
}
230” 250
Med
Взаимосвязь между энер-
кристаллической
решетки
О (ккал/моль) в рядах МеВг и Ме]
(Ме = Арх, Си, Ап) [262]
[3]
с одной стороны, не зависит от природы Х,, а с другой, — должно быть подобным для сходных Х, например для галогенов. Поэтому, в частности,
приближенное
уравнение
U merry
=
0,88U
mez
+
31,8,
(1,74)
где Ме = Са, Ас, Аа, приводит к удовлетворительным результатам (рис. 63):
среднее отклонение в значениях Имевг составляет 1,0 ккал, максимальное —
1,5 ккал, в то время как вероятная погрешность данных, положенных в
основу уравнения (1, 74), оценивается в 2—3 ккал [262].
Естественно, что применение в рассмотренных
случаях
иных
уравнений для расчета ЛН
или
ПО (АНмех,,
ОИмех),
вила термохимической логарифмики А. Ф. Капустинского
привести к удовлетворительным результатам.
Еще
один пример.
Как
установил
Г. Г. Диогенов,
каких-либо
например
пра-
[263], не может
термический
эффект
реакций обмена (в частности, галогенного обмена [264, 2651) при данной
паре катионов периодически изменяется в пределах группы системы
Д. И. Менделеева. Выразить эту зависимость математически затруднительно, но обращение к соотношению (1,1) и здесь приводит к удовлетворительным результатам, как показано на рис. 64.
|
Интересный пример сопоставления приведен на рис. 65. Аналогичный
результат получается при непосредственном сравнении теплот образования ЛН, радикалов С» (последние можно найти в справочнике [266]).
Применение сравнительного метода расчета для немонотонно изменяющихся
свойств
не ограничивается
рассмотренными
свойствами
в гомологи-
ческих рядах органических веществ и некоторыми энергетическими характеристиками неорганических соединений. К ним можно было бы прибавить,
например, парциальные мольные объемы в бесконечно разбавленном вод53
ном растворе соединений подгруппы
лития,
в частности хлоридов
и бро-
мидов (рис. 66), степень распада молибдатов и вольфраматов этих же металлов (рис. 67), коэффициенты полимеризации в сходных рядах металло-
органических
соединений
(рис. 68).
Anne
2500
AH ics
Г
ОЕ
.
2000-
З9|30
Г
FJ
|.
15004
25
Г
20
1000-
15
Г
т-
3
500}-
Br,J
5
Г
70
Г
16
И He
0
to
300
1
1000
00,
AH,
2000
L-Na
Рис.
64.
Взаимосвязь
мическими
эффектами
литиево-натриевого
цезиевого
обменов
между
и
АН
тер-
Puc.
литиево-
[265]
Ут
‘Med
9ме мо
60
a
60.
Взаимосвязь
т
72”
sh
40
2 a
‘
0
"20
Oo
Рис. 66. Взаимосвязь между стандартными парциальными
мольными объе-
мами'У? (мл/моль) бромидов
и
иодидов
элементов
под-
группы лития в их водных
растворах при 25° C[267]
С, г>Си,
г
Cs
Rb
K
1
3
теплотами
Ч
Ur
90
между
АН (ккал/моль) процессов полимеризации
газообразного углерода [266]
(ккал)
ALi
ма
7
!
2.3
e
@
I
4
9
.
Me,Mo0,,
Рис. 67.` Взаимосвязь меж-`
ду количествами & (мг) разложившихся молибдатов и
вольфраматов металлов подгруппы цезия при 1200°С,
времени нагревания 6 час.
и навеске 0,2 2 [268, 269]
Рис.
68.
Взаимосвязь
между
коэффициентами
полимеризации
СНзХСНзСН = СН. (Ги
(CHs)sXCH = CHe (II),
rye X—=C, Si, Ge, Sn[271]
Исследование термической устойчивости”и
летучести‘’ вольфраматов [268] и молибдатов [269] щелочных. металлов показало, что для
обеих групп соединений летучесть возрастает от Ма,ЭО0О, к С3.90,,
причем 11.90, по прочности уступает Ма.ЭО.. Немонотонный ход термической устойчивости объясняется малым размером
Ш”, оказывающего
54
поляризующее действие на ион ЭО4 [268, 269]. Эта контрполяризация
приводит к уменьшению прочности (по сравнению с Ма.Э0,).
В ряду Ма,9О, — К,ЭО. — ВЬ,90, — Сз,90, термическая устойчивость растет, так как возрастает деформируемость катионов под действием
анионов; это приводит к увеличению полярности связи и как следствие —
к возрастанию летучести. Усиление связи О? с Ме* за счет поляризации
вызывает ослабление связи атома 9 с одним из окружающих его атомов О,
|
что приводит к возрастанию' стремления к диссоциации (Ме.Э О, — Ме. О-- (Те) с00), м
+ ЭО.) в каждом из этих рядов. Анаue
ye
-»
9Mn
логичные результаты
были получены
и в работе Г.Б.Сейфер [270] при изучении Ме.Ее(СМ.). Сходство обоих ря-
700
LE
ме 60
дов, обусловленное близостью свойств
анионов (Гусо»- = 3,45 А; Гу» =
600| bu
= 3,02 А) и приводящее к симбатности хода термической устойчивости,
200
°
4
4
позволяет, рассчитывать
—
на получение
—
(7
расположения точек на пря-
мых обусловлен изложенным выше,
а характер расположения прямой обусловлен
оксалатов
При
МеС.О,
изучении
(Ме = Мь,
термического
Ее, Со,
№,
разложения
Са,
|
75)
и формиатов
800
7п)
была
[272].
|
вслед-
тем, что Гу»з+ >> Гмо-+,
ствие чего ион \О? менее монолитен, чем ион МоО’.
_
an
дисс ме(с00),
:
рис 69. Взаимосвязь между температурами диссоциации Тис (°К) некоторых
надежных; значений при применении
соотношения (Т, 1). Это подтверждают данные, приведенные на рис. 67.
Характер
“
|
700
Л Fe
оксалатов
установлена
[272]
в
ряду
|
немонотонность
значений температур разложения. Параллелизм в значениях В азлож. ОКсалатов и формиатов позволяет предположить существование примерной
линейной зависимости между ними. Однако оказалось, что точки легли на
две прямые (рис. 69). Это можно объяснить тем, что механизм разложения
этих солей различен: для Си, М№ и Со — по схеме МеС.О, -> Ме + 2CO,,
для Ги, Ее и Мп — по схеме МеС.О, —> MeO + CO + CO,.
Использование графиков сравнительного расчета в случаях, подобных рассмотренным, целесообразно не только потому, что из них непосредственно видна степень точности соответствующих уравнений, но и потому, что по расположению точек на прямой можно судить о нарушении
монотонности в значениях рассматриваемого свойства и о характере этого
нарушения.
|
|
Следует подчеркнуть, что рассмотренные в этом разделе примеры не
свидетельствуют о том, что погрешность сравнительного расчета всегда
соизмерима с неточностью опыта, однако, вероятно, в большинстве случаев
можно говорить если не о строго количественных, то, по крайней мере,
ополуколичественных
оценках.
Так, сравнение значений теплот реакций ионов переходных металлов
Ме в ряду Мп?
— 712
с образованием [Ме еп,]?* u [Me trieu]?* [273]
приводит к удовлетворительному результату.
РАСПРОСТРАНЕНИЕ ОПИСАННОГО ПРИЕМА
НА МОНОТОННО: ИЗМЕНЯЮЩИЕСЯ СВОЙСТВА
Существует целый ряд свойств, которые в пределах каждого
гомологического ряда меняются монотонно. Если исключить аддитивные
свойства, то к ним следует отнести температуры кипения, показатели
преломления, плотности, критические температуры ий давления, темпера55
турные коэффициенты давления пара, поверхностное
и
испарения
другие *.
некоторые
натяжение,
теплоты
Для вычисления значений этих свойств наряду со многими другими
зависимостями можно воспользоваться соотношением (Т, 1), т. е. сравнивать их значение в двух рядах сход20
ных веществ. Но для таких свойств
жно
в пределах дани сравнение
возмо
(La dist
080-
ного ряда путем попарного сопостав-
С соседних членов
ления значения
[270 а], т.е. использования уравнения
0,76
С нечетн —
0,76
+
B,,
(I, 79)
то ждественного (Т, 66). На примере
плотности уравнение (11, 75) иллюстрируется рис. 70. | Я
(1,75)
Возможность применения
обусловлена характером изменения G
сл в гомологическом ряду и тем, чго
0.74
0,72
oo
значения п образуют арифметическую
070
Рис.
A, Guers
078
|
074
70. Взаимосвязь
a
076
прогрессию. Поэтому, в частности,
независимо от того, приняты ли за аргумент значения С для четных членов
ряда или для нечетных, точки ока-
1
„078
(ay),
зываются на одной прямой.
Разумеется, расчет по уравнению
между плотностями
(г/смЗ) в ряду н-алканов
(Т, 75) приводит к приближенным результатам
(исключение составляют
аддитивные свойства); однако он тем
точнее, чем больше молекулярный вес гомолога, с которого начинается сопоставление. Иначе говоря, всегда можно указать на тот член ряда, начиная с которого это уравнение приводит к погрешности, меньше заданной
если ограничиться определенным числом
веществ).
(п — число атомов углерода)
ПРЕДЕЛЬНЫЕ
СЛУЧАИ
СООТНОШЕНИЯ (I, 1)
1
Первый предельный случай рассматриваемого
тельного'расчета отвечает соотношению
вида’,
метода
Gyy'=Gy + B,.#
Следовательно,
он
соответствует
(1,76)
независимости
свойств веществ от природы несовпадающих
сравни-
различия
в
значениях
частей каждой из пар молекул
в двух рядах. В этом случае линии на чертеже типа рис. 2 будут эквидистантны, и поэтому на чертеже типа рис. 3 параллельны. К пределу, отве-
чающему
соотношению
(Т, 76),
приближаются
зависимости,
выражающие
взаимосвязь между свойствами веществ, в которых атомы (группы атомов),
отличающие соединения одного ряда от соединений другого ряда, очень
близки
по свойствам.
Так,
(1, 76)
описывает
(СНз).ВХ и (С.Н ,}).ВХ (Х = Е,
1 Как
недавно
показал
В.
А.
С
взаимосвязь
между
точками
Комаров
[2706],
осцилляция
величины
ских констант в зависимости от четности и нечетности числа атомов
в случаях, считавшихся классическим примером аддитивности.
56
кипения
Вт, Т). В данном случае на основании
имеет
физиче-
место
и
опытных данных (см., например, [274]), В, = 6,027. Это позволяет предсказать неизвестную точку кипения (С.Н ,).ВУ (24,96° С).
Соотношение (1,76) совершенно строго описывает свойства электролитов в разбавленных (теоретически в бесконечно разбавленных) растворах,
где исключается поляризация и другие явления, в которых проявляется
специфическая особенность ионов. Оно в косвенной форме свидетель-
ствует
о
полной
диссоциации
электролита
и
о
независимости
свойств
ионов друг от друга. К числу этих свойств относятся электропроводность,
объем, внутренняя энергия, изохорная и изобарная теплоемкости, изохорный и изобарный потенциалы, энтропия, энергия, энтальпия сольватации, теплопроводность и некоторые другие свойства (см., например, [275]).
Так, например,
[276] соответствует
закон Кольрауша
применению (1, 76)
о независимом движении ионов
к случаю, когда @ = Ло и когда
(I, 76) принимает вид уравнений
м:
(Aco)KA, = (Aco)As + Bi,
причем В, не зависит от природы А, а В, — от природы
Так
называемый
закон
постоянных
разностей
или
К.
закон
модулей,
сформулированный
в виде эмпирического правила Фавром и Зильберманом
[277] (см. также [278]), соответствует соотношению (Г, 76) для < = АН...
Аддитивность коэффициентов теплопроводности, установленную И. И. Ру-
завиным
[279], также можно свести к
Как показали
И. Н.
Годнев,
(Т, 76) }.
А. М. Александровская
и А. С. Свердлин
[281], взаимосвязь между силовыми постоянными А. и к, молекул ХУ,
и ХУ (У =С, Вт, Л) в первом приближении для элементов подгруппы
ГУБ выражается уравнением (Т, 76), в котором В, = 0,4.
В работе [68] упомянуто о применимости уравнения вида (Т, 76) для
межатомных расстояний в молекулах; в этом случае каждому атому
можно
приписать
некоторый
также
наблюдается
эффективный
постоянный
радиус.
Авторы
отмечают, что эта закономерность имеет широкое значение, если ввести
представление о рядах связей различного типа (или подгрупп), в которых
Для расчета
воспользоваться
В: = 23
[442].
линейное
изменение
межатомных
расстояний.
теплот образования гидроперекисей
было предложено
уравнением (1,76), в котором Г — КОН, П — ВООН и
Последняя
#, — энергия сопряжения
величина
радикала
равна
ХО7,
0,5
(=, + e+ Eo_o),
где
в, — энергия перехода молекулы
О., получаемая при отрыве Х от ХО; в реальном устойчивом состоянии.
В [142] отмечается, что постоянство величин (#, -- #5) для различных со-
единений
и
применимость
уравнения
Л Нвоон=
АНвон-№
23
позволяет
предсказать значения Л Н неизученных гидроперекисей.и на их основании
рассчитать энергию разрыва связей О—О. С помощью этого же уравнения можно рассчитать энергию сопряжения перекисного радикала для
случая, когда А, определимо по теплоте реакции ВК +1 О. = ВО,, а также проанализировать структуру ряда поликислородных соединений.
Примером (1, 76) в функциональных шкалах может служить зависимость
°
12 аи = 12а: -- В,
(1,77(
в том числе уравнение
12 Ки = 1 Ат+ В,,
в котором
ный
1 Здесь
сравниваются
уместно
константы
равновесия.
отметить, что иногда
отождествляют
случай — соотношение
(1,
76)
[280].
(1,78)
соотношение
(1, 1) и его част-
57
. К (1,78) относится, в частности, и уравнение Брёнстеда [282], выражающее зависимость кислотно-основного равновесия от свойств среды. Изменение силы заряженных ‘и незаряженных кислот при переходе от одного
растворителя
к другому
выражается
уравнением
[283]
(1,79)
РКп = рЁ1 + В1,
rye pK =—l1g
показал
Н.
Кцисс
А.
(см. рис.
Измайлов
[187],
71 [283]).
Постоянство
соблюдается
лишь
для
В: в (1, 79), как
кислот
одного
химического типа (например, всех карбоновых, всех фенолов и т. д.)
и для родственных растворителей.
М. И. Кабачник
[284] распространил развитую Брёнстедом [282]
и Н. А. Измайловым
[187] теорию
кислотноосновного протолического равновесия на таутомерное, показав возможРК
ность применения уравнения (1, 79) к константам таА
утомерного кетоэнольного равновесия. В дальнейшем
он подтвердил возможность применения уравнения (Т,
79) для определения влияния растворителя на полоВ
жение таутомерного равновесия в различных рядах
органических соединений [285, 286 (см. также [287]).
Можно
Ок.
было
бы
привести
целый
ряд
работ,
где
Рис. 71. Взаимосвязь между рК ка-
рассматривается это уравнение
(или его аналоги).
Так, его можно
иллюстрировать данными по изу:
чению таутомерии в апротонных средах [288].
Если применение уравнения (Т, 76) для разбавлен-
анионных (В) кис-
Пользование
а
лот в двух
раство-
ных
растворов приводитк точным результатам,
дать
лишь
рителях (схема)
[283]
ность
опытных
свойств
приближенные
твердых
веществ
результаты
то исможет
(это отмечал еще
Н. Н. Бекетов [289] для теплот образования). Однако,
если применять это уравнение для очень близких по
свойствам рядов, Учитывая при этом невысокую точ-
зультаты.
Так, в первом
образования
его для
данных,
Мех,
То
часто.
приближении.
и МеХ,
(для
получаются
можно
считать,
переходных
‘удовлетворительные;:
что разница
металлов
в ряду
ре-
в теплотах
Ми
— 7п,
т.е. для середины четвертого периода), где Хи У — галоген (исключая Е),
гидроксил или анион кислородсодержащей кислоты, не зависит от природы
Ме [290]. Это позволило К. Б. Яцимирскому [290] исправить значение
АН.»
для (п(МО3).,
а также
ния для
рекомендовав вместо
оценить значение
ряда неизученных
—115,4
ккал/моль
[3] — 123 + 2,
стандартной мольной
теплоты
образовасолей: ЕРе(НСО.), — 208+ 2; Fe(NO;), —
— 106 + 2; NiCO, —176 + 2. Можно допустить, что разность
ных теплотах
образования с селенатов и сульфатов постоянна
в стандарт-
[475].
эти и другие (см., например, [291, 292]), примеры распространения
постоянных разностей не являются очень точными. Так, если
Однакс
закона
AH 5.09-, ag’— AH g02- aq = 71,6 £0,2,
4’
TO
причем
АН ме+3еб.
только
для двух
.
=
4°
АН ме+30,
из двадцати
—
двух
70,5
+
3,0
пар солей
[175]
’
A(AH)
>
71,6 ккал.
Велик разброс и в значениях А Нкх —А Нмн,х: если для Е`А(АН) составляет
22.9, то, например, для СО; — достигает 34,2 ккал. Как видно из рис. 72,
выделение более близких веществ позволяет уточнить результаты. При
этом (Г, 76) фактически переходит в (Т, 1). Эта возможность связана с достоверностью данных для галогенидов (выпадение Е обусловлено тем, что
соли находятся не в бесконечно разбавленном растворе).
58
Высокую
расстояний для Р&Ме
ных
микросвойств
(1,76) для сопоставления
точность применения
подтверждает практическая
разности в значениях межатом-
независимость
5г, Ва)
(Ме = Са,
и РаМе
и
[293] и для Мез
MeGe [294].
Возможны случаи, когда (1, 76) будет справедливо и для немонотоннс
аддитивность
этого может служить
свойств. Примером
изменяющихся
свободных энергий активации газофазных свобод-
норадикальных
реакпий, установленных в работе
[295]. Была найдена линейная зависимость между
данного
реакции
свободной энергией активации
радикала с различными молекулами и молекулярными инкрементами свободной энергии активации.
AH
35г
30F
АН
х
Г
Г
C10;
Br
2
ЕН
Второму
соотношение
предельному
—
Gi
Примером
простейшим
этого
видом
=
случаю
25-0
Г
|
отвечает
:
Ат.
(1,80)
соотношения,
являющегося
линейной зависимости
— про-
порциональности !, может служить,
в частности,
взаимосвязь ме
плотностями
в
двух
группах
3
TRAY
ABY
PY
веществ
которая
J
оказывается
IT =
Ad
(1,81)
441%1-
справедливой
рых рядов изологов
. [296].
для
некото-
2057
Рис.
305
~ NO,
и
>
pop
72.
Cl
OND;
p
yp
ar
-
оЁ-.
100Pt
160
KX
Взаимосвязь
между разностями станДартных теплот образования АН?2ов (ккал/моль)
некоторых солей калия и
аммония и стандартными
теплотами
образования
|
солей
‘калия
[3]
А. Н. Баратов [297, 298], применив метод сравнительного расчета
для вычисления нижних концентрационных пределов воспламенения Сиред.
нашел,
что.
а
=
(Спред)
(1,82)
Ay (Спред)т;
здесь сравниваются (спред) в гомологических рядах н-алканови н-спиртов
‘(или формиатов и ацетатов).
Примером (Т, 80) в функциональных шкалах может служить зависи-
MOCTP
в
частности
le Git = A, le Gu,
(1,83)
lg Ku = Aylg Kt.
(1,84)
Можно привести примеры, когда (1, 80) непосредственно следует из
(1, 1) не потому, что в последнем В, = 0, а потому что для двух рядов веществ (процессов) свободные члены уравнений вида (1,1) одинаковы. Так,
если для реакции двух рядов веществ с радикалами В. и ВН. справедливы
уравнения вида (Т, 64), то, решив их совместно, получаем зависимость
К
В.А;
.
—
As
В.А;
Ig
,
Кр,
Ao
ABIAIOMyIOCA ypaBHeHuem I[Inapua. B strom ypasreHuu cpaBHUBaeTCA
сительная реакционная способность двух групи реакций.
OTHO-
1 Следует обратить внимание на то, что вид уравнения, отвечающего предельному
случаю соотношения (Т, 1), зависит от характера шкал. Действительно, если (1, 80)
соответствует случаю, когда в (Т, 1) В\ = 0, то (Т, 80) в логарифмических шкалах тожпественно логарифмическому варианту (Т, 1), т. е. соотношению (Т, 16), когда в нем
1=
1.
59
Возможны случаи подобных соотношений и для комплексных свойств
(см., например, [299]).
Пропорциональность *изобарных потенциалов образования окислов
празеодима и церия, отмечаемая в работе [28], отвечает уравнению (Т, 84).
3
Рассмотрим
временно применять
вращается в
в заключение
А, = 1 и
примеры,
ВБ, = 0,
когда
в (Т, 1) можно
т. е. когда это
соотношение
ат = Ст.
одно-
пре-
(1,85)
Это условие соблюдается редко, так как относится к случаям очень большого сходства веществ в обоих рядах. Ему отвечают, например, равенства
:
AHy = AHt,
AZu = AZy
(1,86)
(1,87)
Ku = Ky,
(1,88)
где К — константа равновесия. Эти уравнения можно применить, например, к процессам гидрирования [300]:
1-C,Hon + He = H-CaHonis,
H-Cn Honig +
И
если
п >
He = 2Co snHn+e
H-CrHonie = Cn-2Hen-2)
6.
-- С.На,
Другой пример. Близость энергетических свойств РтОх
ловленная тождественностью
внешних
и ТЬОх,
обус-
электронных оболочек Ртг и Тр, про-
является, в частности, в том, что различия в стандартных теплотах образования этих веществ [301, 302] практически не зависят от величины Х,
т.е.
гдех
AH
Н
—
proxy = AH pox »
(1,89)
= 1,5 -- 1,8 (изученный интервал составов). Поэтому в соответствии
со значением АНрго,, найденным в [303], можно рекомендовать величину
А Нтьо.—=232 ‚9 ккал/моль. К менее точным результатам, но для практических
целей достаточно надежным, приводит примерное равенство стандартных теплот образования окислов и первых оксихлоридов, установленное
в [304].
ОБ
ОБОСНОВАНИИ
НЕКОТОРЫХ
УРАВНЕНИЙ
1
Рассмотрим
обосновать некоторые
теперь
К групое зависимостей,
относятся уравнения вида
являющиеся
те зависимости,
соотношения
из
вида
которых
а=а-Ь.е,
с помощью
(Т, 1).
непосредственно
=
которых
можно
следует
(I, 1),
_ (1,90)
частным примером (1,4) при Ф(2)=г. Наиболее широкое приме-
нение оно находит в случае гомологических рядов, так как для них многие
свойства,— если исключить первые гомологи, могут быть описаны линейным уравнением
Ga=atoben,
(1,94)
где п — число групп СН. в алкильном радикале. К таким свойствам относятся характеристики веществ в стандартном состоянии (теплоемкость,
60
энгропия,
изобарный
по-
ция, объем,
критический
oy)
тенциал образования, теплоты образования, сгорания, парообразования),
скорость звука, парахор, рефрак-
QR
энтальпия,
объем, кон-
станты в уравнения ван-дер-Ваальса
и некоторые другие (см. рис. 73).
Для ряда свойств в (Т, 91) величинуС
следует
нальной
выражать
шкале.
Так,
насыщенного пара С =
в
функцио-
для давления
lg P (cM., Ha-
пример, [307]). Уравнение вида (1,91)
широко применяется
для
расчета
теплот
образования
([307—315]
и др.), энтропий, изобарных потенциалов образования [160, 316—318]
и других свойств высших гомологов о
различных углеводородов (см. также
М7, 319—322, 323, 324].
Одним из многих примеров (Т, 94),
где ( =У, может служить уравнение,
рекомендованное в [325]. Связи месвойствами
священа работа [326].
В работе
в от-
рядах
по-
[327], посвященной
ад-
Следует
иметь
в
виду,
что
AS)
дитивности некоторых энергетических величин в нормальных алкильных соединениях, подчеркивается,
что сведения о вкладе
отдельных
групп в теплоты парообразования,
сублимации и
растворения
могут
оказаться полезными при рассмотрении вопросов, связанных с полимерами.
|
Рис. 73. Зависимость между значениями
некоторых аддитивных свойств С и числом атомов углерода п в гомологическом
ряду н-алканов
AZooq
из
тический объем
уравнения
S =
находим,
—
(57-5
ной энтальпии
(1,92)
[152];
изобарный
[305]; в (смз/моль) — константа
ван-дер-Ваальса
[305];
Ср
при нагревании
(АН обр) 1000
[306];
20
Ер(см?)
20° С [213].
(1,93)
щий
[213]; Ssoq
(8. €.) —
при
500° K [213];
ультразвука при 20°С
— молярная
прямую,
об.
о
Вертикальный
каждую
от 238 до 1000° К
(ккал/моль) — теплота
разования
при
1000°
К
стандартная
энтропия
Ugge С (м/сек) — скорость
рефракпия
отрезок,
показывает
при
рассекаю-
масштаб
что
= — (т)
9 =а’--
6’. п.
ob
—п (г),
Из уравнений (Т, 92) и (1, 93) в сочетании
нением
получаем
стандартный
Н 1000 —H 598 (ккал/моль)— изменение стандарт-
да
или
—
(хал/моль-град) — изобарная теплоемкость при
500° К [213]; (АН сгор) а98(®хал/моль)— стандартная
теплота
сгорания
при
25°С
[213];
где п — число СН.-групп в углеводородном радикале, в соответствии
© термодинамическим уравнением
97,
(ккал/моль)
потенциал при 25° С [213]; Ук р (смз/моль)— кри-
аддитивности одних свойств непосредственно вытекает аддитивность
некоторых других. Так, при справедливости для изобарного потенциала уравнения вида (Т, 94), т.е.
Z=a+ben,
WN
гомологических
<
аддитивными
Qo
жду
дельных
с термодинамическим
H=Z4+4TS
(1,94)
урав-
(1,95)
Н =а- 5 + Та’ + Тьп = (а + Та’) - ® + ТЬ)
61
Или
Н = а" + №”.п.
|
(Т, 96)
Из последнего уравнения вытекает аддитивность теплот
теплот сгорания. Из (1, 96) и уравнения
следует,
o> = (4),
что
”
„
и
п,
|
Сь = (57°) +" (5),
ИЛИ
образования
Cp =a" +0"n.
(I, 98)
Уравнение, аналогичное (Т, 98), можно получить и для изохорной теплоемкости.
|
Применение (Т, 91) не ограничено оргьническими соединениями. Если
ему придать вид
=а-
где М — молекулярный
и к неорганическим
М,
вес, то можно
веществам.
Так,
|
указать примеры
Бильтц
[328] нашел,
(Т, 99)
его применения
что уравнение
(Т, 99) справедливо в отношении объемов некоторых твердых неорганических соединений, Робинсон и Скотт [329] показали его правильность для
поверхностного натяжения неорганических веществ.
Различные случаи применения (Г, 90) рассмотрены в монографиях
(см., например, [330]). Из исследований последних лет необходимо упо-
мянуть работы П. Г. Маслова и А. Е. Луцкого.
П. Г. Маслову принадлежат многочисленные
исследования
охвачены
н-алкилбензолов,
н-ал-
[308, 325,
330а — 341], в которых на основании спектральных данных развиты методы расчета термодинамических функций (теплоемкости, изобарных потенциалов и теплот образования) в гомологических рядах. Расчетом были
ряды
н-алканов.
1-алкенов,
1-алкинов,
кинцикланов и некоторые другие. Исходя из сформулированного им обобщенного принципа аддитивности («термодинамические и некоторые иные
свойства органических соединений в первом приближении аддитивны по
всем видам взаимодействия»), Ц. Г. Маслов вывел уравнения, выражающие
зависимость указанных свойств от температуры и числа атомов углерода;
если исключить первые члены каждого гомологического ряда, то при
Т = соп$6 эти формулы совпадают с уравнением (1, 91).
Ю. П. Маслов рекомендовал приближенные уравнения вида (1, 99}
для расчеза характеристик плавления и парообразования отдельных неорганических соединений (галогениды некоторых элементов и их кристаллогидраты) [342].
А. Е. Луцкий [296, 343—346] обратил внимание на то, что уравнение
(Т, 91)
только
в тех
случаях
приводит
к достаточно
удовлетворительным
результатам, когда оно применяется к изологам. Нод изологами подразумевается ряд веществ, в состав которых, помимо общей части, входят
элементы одной и той же подгруппы и которые по микросвойствам отличаются в основном только массой (при практически одинаковой поляри-
зуемости, дипольным
ских рядах
уравнение
моментам
и другим
микросвойствам).
В изологиче-
(1, 91) соблюдаетсяв отношении плотности,
модуля
расширения, вязкости, поверхностного натяжения, температур кипения
и плавления, внешней теплоты парообразования (во всех случаях 6 >> 0) и
удельной теплоемкости жидкостей (6 < 0).
Необходимо подчеркнуть, что проверкой надежности уравнения (Т, 91)
в каждом конкретном случае может служить характер расположения то-
чек на (1: —
62
С1!-прямой.
Если
бы это уравнение
было абсолютно
точным,
т. е. аддитивность соблюдалась бы для всех веществ каждого из сопоставленных
рядов,
то точки
на прямой,
отвечающей
соотношению
(1, 1), ле-
жали бы на одинаковом расстоянии друг от друга (конечно, при условии,
что не будет пропущена ни одна из пар веществ).
Для расчета нескольких свойств в гомологических рядах органических соединений были рекомендованы уравнения вида
Gaa+ 7,
(I, 100)
где для данного свойства а — универсальная постоянная, независящая от
природы
ряда
и
равная
предельному
значению
См».
Это
ypaB-
нение было предложено для вычисления плотности 4 (при t = 20° G;
= 1/0,857) _ 47
значений У У/ю
(а = 13,56)
[348],
внутреннего
давления Р;
А Опар /У [349], коэффициента
адиабатной сжимаемости
В (а = 44,9) 1350).
Запишем уравнение (Т, 100) для двух изомерных гомологических рядов
(например, для н-алканов и 2-метилалканов). Тогда сопоставляя их свойство С таким образом, чтобы каждый раз соблюдалось условие М: = Ми,
получим
соотношение
(Т, 1), в котором
b
A, = >. и В. =а (1-1 А,).
Можно привести и другие примеры, когда справедливость (Т, 1)"для
тех или иных свойств в тех или иных рядах веществ можно связать с раз-
личными
уравнениями
(см., например, [101 ]).
Так, в работе [354] для теплоты образования соединений двух элементов, находящихся в одноатомном газообразном состоянии, было рекомендовано уравнение
AH =a-+t b-noy,
(I, 101)
где пл — число электронов. Из уравнения
дует один из частных случаев (Т. 52).
Уравнение
G
_
A, Guy.
(Т, 101) непосредственно
газ + B,,
(I,
сле102)
соответствующее ряду соединений, переменный атом которых изоэлектронен инертному газу, можно рассматривать не только как зависимость ви-
да (1, 1), но и как источник такого рода зависимостей.
Это уравнение
было
рассмотрено в ряде работ [352—363], в частности в [352] оно было проверено для многих свойств, в том числе для объемов, точек кипения, крити-
ческих температур, рефракций и других.
Еще один пример. Из линейной зависимости между длинами С —С-и
С = С-связей с одной стороны и числом соседних
в [364], непосредственно следует уравнение вида
Рассмотрим теперь случаи, когда справедливы
Это будет тогда, когда коэффициенты наклона 4
рядов будут совпадать.
Так, приняв, что для газообразных соединений
п > 3 справедливо уравнение
AH oop = a+
где а — постоянная,
величина, одинаковая
[300]), получим
где
характеризующая
для
всех
=
ay,—
типа СН (СН .)„-— У при
bn,
(I, 103)
функциональную
гомологических
AHy = AH; +
By
атомов, установленной
(Т, 25).
НЯ
уравнения вида (Т, 76).
— #-прямых для обоих
B,,
4y,-
рядов
группу У,
(см.,
|
иб
—
например
(I, 104)
(I,
105)
63
Условию соблюдения (Т, 76) соответствует, в частности, и случай, когда
данное свойство С — Н- и С — С-связей (для алканов) зависит лишь от
того, какому влиянию подвергаются эти связи со стороны ближайших атомов. Другими словами, одним из примеров соблюдения соотношения
(Т, 76) будут те свойства гомологических групп углеводородов, для которых приводит к точным результатам метод, разработанный в исследованиях В. М. Татевского с сотрудниками [365—369] и обобщенный в монографиях [370, 371].
Для таких свойств в уравнении (I, 91) коэффициент 6 не зависит от
природы ряда (к ним относятся, в частности, стандартные теплоты сгорания; см., например, [372]). Этот вывод непосредственно следует из уравнения (Г, 10).
Справедливость уравнения (Т, 76) для бесконечно разбавленных растворов электролитов (см. стр. 957) является следствием того, что в таких
растворах, согласно теории электролитов, многие их свойства являются
аддитивными по отношению к свойствам ионов. Действительно, если 060значить через Скл,
грамм-эквивалента
Ск и Сл соответственно значения свойства
электролита
и ионов,
то
( для одного
СкА = Ск + СА.
(I, 106)
3dalvcaB 9TO paBeHCTBO AA BemectB K,A,, K,A,; K,A,, K,A,; KyAs3, KA;
ит. д. и вычитая из уравнений для К.А; соответствующие уравнения для
К.А;, получим
Gx,a, — Gx,a, = Guia, — @к,л, = @к,л, — Ск,А, =. -` = @к,— Gx,.
Проведя аналогичный расчет с К.А и К.А, и обобщив найденные результаты, приходим к выводу, что в бесконечно разбавленных растворах
разность эквивалентных значений какого-либо свойства любых пар электролитов, имеющих одинаковый анион (катион), но разные катионы (аниоы), является
(катионов).
величиной
постоянной
Таким образом, это положение
соотношения (Т, 76), являющегося,
когда в нем
А, = 1.
и не зависящей от природы
анионов
представляет собой один из примеров
в свою очередь, частным случаем (Т, 1),
Еще один пример. Из линейной зависимости теплот гидратации ионов
щелочных металлов и галогенов от их обратного радиуса [373] непосредст-
венно вытекает соотношение (1, 1) для данного свойства.
Говоря, в частности, о применении (Т, 76) для случая, когда а =У,
к кристаллическим соединениям, следует помнить не только о приближенном соблюдении аддитивности объемов (в этом случае), но и о сказанном
на стр. 14. Так, близость свойств изоструктурных (изомерных) соединений
нарушается, например,
в результате проявления
водородной связи.
Она приводит к нарушению равенства ЛУ = соп56, в частности, в гомологических рядах, так как образование водородной связи вызывает увеличение плотности (см. [374].
2
Необходимо
обратить
внимание
на следующие
два
обстоятель-
ства. Нередко переход от уравнения ( = {(5) к соотношению (1, 1) приводит
к выигрышу точности. Это означает, что неточность первого
детельствует о неприменимости второго.
Вот несколько примеров.
вовсе не сви-
Хотя из уравнения вида (Т, 102), записанно-
го для двух рядов, непосредственно следует (Т, 1), однако
только факт
вывода (1, 1) из уравнения (Т, 105) не может служить доказательством справедливости последнего. Следует иметь в виду, что применение «жесткой»
61
шкалы (Син. газ) не всегда дает достаточно удовлетворительные результаты,
так как параллелизм в свойствах различных веществ и инертных газов ог-
раничен.
выигрышу
В таких случаях переход к соотношению вида (1, 1) приводит к
точности.
Так, например,
если зависимость
ton = a+b
рекомендованная в [355], приводит
там (см. рис. 74,а) !, то уравнение
—
(tnn)Gex,
(ton) au.
газ»
лишь
(I,
к ориентировочным
Ay (ton)six,
++
107)
результа(Т,
B,
108)
дает вполне удовлетворительные результаты (рис. 74,6). Тот же вывод
относится и к температурам плавления в рядах ЭпХ, — ТИХ, н-С.,Н.Х —
н-С.Н.Х
(1
и
температурам
кипения
л)мехь
(Tn),
YUOr
ALOT
400-
4O00r
3E0r
360r
320+
J3ZLOF
286 }-
0- и м-С.Н.Х», (везде
X = Cl, Br, J)
280-
Cl
LEO
240
200 |
_
-200
|
-760
200
-720.
(tng
иН.Г '
а —
инертные
газы
|
240
В
]
280
1
320
|
860
400
C
Рис. 74. Взаимосвязь
б — галогениды
CL
nal,
между температурами плавления Г.
P = 1 amm [222]
и некоторые
галогениды
олова — галогениды
кремния,
германия,
титана и галогениды
германия
о
(°К)
олова
и
при
титана;
кремния — галогениды
и НХ—НХ., ит. д. Это объясняется тем, что в перечисленных группах
веществ степень отклонения OT (I, 103) практически одинакова. Не прихо-
дится
говорить
о том,
вообще исключено
мя как соотношение
Другой
свойств,
Г, 91)
(1, 90)
пример.
для
что
(Т, 103)
для
([, 1) остается справедливым.
Хотя
которых
соотношение
действительны
или (1,99),
однако
в виде уравнения
где п, — число молекул
нениях, было
применение
(например, для расчета дипольных
обратный
(1, 1) справедливо
уравнения
вывод
свойств
аддитивности
неверен.
Так,
в то вредля
П.
(Н.О,
МН.
Г. Масловым
всех
(Т, 90),
применение
G=atbd-n,,
вещества
рекомендовано
вида
некоторых
моментов),
(I, 109)
ит. д.) в смешанных
[375]
для
расчета
соеди-
АН»,
т На примере 51Х4 из сравнения положения сплошной и пунктирной линий видно,
сколь велика погрешность вычисления по уравнению (1,107).
5
М.
Х. Карапетьянц
6;
А72ов, 528и (СЪ) различных неорганических соединений, в частности
кристаллогидратов. При этом было установлено, что для сходных веществ
р одинаково. В частности, для аммиакатов [АХ .тМН.(Х
= Cl, Br, J) Onna
рекомендованы
[375]
—
—
уравнения
АНт:с1-тмн,
=
106,6 —-
19
т,
(Т,
110)
АНтлвг.ткн,
—
96,6 —-
19
т,
(Т,
111)
АНтау.-тмн,
=
83,9
19
т.
(Т,
112)
—
+
Уравнение (Т, 109) и, в частности, уравнения (Т, 110—112) в принципе
являются приближенными, так как в общем случае присоединение последующих молекул к сольвату сопровождается меньшим энергетическим эффектом, чем присоединение предыан). ANN
дущих молекул (в частности, при4(4Н)
|
y соединение второй молекулы воды
28
26|
oul
oer
20
18
op
Рис.
a
|
5
Г
i
75.
20k
CL
Г
6
(0
ох
и
1
1
2345
°
п
Зависимость
стандартных
1
aa
L
разностей
теплот
1
1
с
(I, 114)
А(АН)
Как это видно
имосвязь между
игрышу
Br, Л) и Х
от числа молей МНз (а) и вза-
LiX-nNHs
(X= Br, J)
(613]
/
связано
значений
(ккал/моль) аммиакатов 11Х-пМНз(Х— С1,
значениями
ГИидрату
AH yisr-nnu, = AiAHMzici.nnu, + Pi
И
(I, 113)
АНтаупмн, = А.АН мс. мн, + Вл,
J
20
LiCl NH,
образования
ОДНнОВОДНОМУу
меньшим выделением тепла, чем
присоединение первой молекулы
воды к безводному соединению) '.
Переход же к уравнениям
“if
и
J
Вг К
.
Ot
Д(ДН)
рис.
для
mw АН
икн
75,а
и
при
сопоставлении
75,6,
приводит
точности,
что
к вы-
является
езультатом примерно одинаково-
yt го
характера уменьшения А(АН)
с возрастанием п в каждой паре
рядов. Увеличение точности при переходе от (Т, 109) к (Т, 1) будет тем
большим, чем ближе друг к другу свойства сопоставляемых рядов.
Уравнение
(Т, 99) не всегда
будучи применено
для а = Ытк
дает удовлетворительный
Вг, Г) [316], оно приводит для Х
к рядам СН11Х
= С], Вг
и} к
результат.
Так,
и СН изХ (X = F, Cl,
средней ошибке в
1,2°, но
для Х = ГЕошибка превышает 30°. Переход же к (Т, 33) приводит к средней
погрешности расчета для всех соединений — 0,8°.
По-видимому, и переход от уравнения
АН (ккал/г-экв) = а- bz,
где
Z — порядковый
номер
элёмента,
аи
(I, 115)
6 — постоянные
для
однотип-
ных соединений [377], к уравнению (Т, 76) также будет связан с выигрышем точности.
И еще один пример. Если бы правило Писаржевского — Вальдена
Лоо = const
(I, 116)
относилось к числу точных,
можно было бы получить
то,
(Лот тт
записав
—
(Лот т
его для
+ B,,
двух
растворителей,
(I,
117)
1 В качестве примера‘ укажем, что процесс Me2tS(Se)O, + Н2О сопровождается
тепловым эффектом, в 1,5—2 раза большим, чем процесс Ме?+5($е)О..НзО + НО
(что 1376). связать и. с неаддитивностью объемов в подобных процессах) (см., например,
[37
66
что, однако, противоречит опытным данным. Приняв же в уравнении (1,117)
1, получаем удовлетворительное совпадение с опытом.
A,=+
Таким образом, отказ от допущения, что разница в значениях свойств
соответствующих
рядов
двух
членов
является
величиной
постоянной,
мо-
жет служить источником уточнения различных уравнений.
В связи с изложенным вновь следует подчеркнуть важность вопроса о
характере расположения точек на Ст — С1-прямых, так как в нем проявляется та С — 8-зависимость, которая фактически лежит в основе конкретного вида соотношения (Т, 1); таким обраДН,
Be Mg
|
|
с
Sp
Гры
|
|
13
|
.
|
—
7]
:
Ba
зом, удается
оценить
степень
точности опи-
санных
в литературе
уравнений
вида
а = К®. Характер функциональной шкалы @(g) B общем случае будет различным
о
10 9
(Новой,
Ва
6
7!
5
6
YQ
i
|
|
3
2
Onna
ee
5
|
dt,
2
35 2,,,
|
J
(44298)e
Рис. 76. Стандартные теплоты образования АН; (ккал/моль)
различных
Рис. 77. Взаимосвязь
между
стандартными теплотами обра-
соединений
зования
элементов
бериллия
[3]
подгруппы
1 — Ме, М,; 2 — MeS; 3—MeO; 4—MeSiO,;
5—MeJ,;
6 — Мевг,: 7 — Мес;
8 —
Me(NO,).; 9 — Me(OH),; 10 — MeF,; 11 —
MeCOs3; 12 — MeSQ,; 13 — Me,(PO,4)23 14—
Ме. (АзО.),
не
только
для
разных свойств данной
ного
и того же свойства в различных
зано, например, на рис. 76 и 77.
Из
рис.
77
следует,
что
линейная
AH vos
А — хлориды
(0)
(ккал/моль)
[3]
и бромиды
(II);
Б — ортофосфаты (Т) и ортоарсенаты (П) магния,
кальция, стронция и бария
пары рядов
парах
рядов
зависимость
веществ, но
веществ,
(Т, 52)
|
и для
как
од-
пока-
соответствует
уточнению правила А. М. Беркенгейма [378]. Действительно, ему отвечает допущение, что А, = 1, т. е., что на прямой АНи = КАН) точки,
соответствующие соединениям одной подгруппы элементов, должны быть
на равном расстоянии. Подобным образом уравнение (Т, 19) можно рассматривать, как уточнение правила Н. Н. Дрозина [379], аналогичного
правилу Беркенгейма. Уравнение (Т, 52) можно связать также с уточнением закономерности, которую установили Тромб [380] и Сю [381], так
как в общем случае разность в значениях АН сходных соединений, например галогенидов одного и того же элемента, зависит от природы последHux (A, = 1).
1 На это обратил внимание В. В. Фомин [122],
именно для уточнения правила А. М. Беркенгейма.
предложивший
уравнение
°
*
(Т, 54)
67
Из рис. 77 видно также, что, хотя ход изменения АНме(он), и АНмео подобен, но сопоставление этих величин не может привести к точным результатам вследствие того, что изменение каждой из них в границах ряда для
многих соединений лежит в пределах неточности значений ЛА.
В литературе описан ряд зависимостей, которые можно свести к уравнениям вида (Т, 1). Так, Г. А. Матвеев [382] нашел, что для изоструктурных мета- и ортосиликатов справедлива зависимость
Gme,sio, — GMe,’sio, = 2 (Gme,sio, — Gme,’sio,):
где G =
AH,
АА, Ср, 5. Переписав
(I, 118)
(Т, 113) в виде
С ме, 10, — 2@мезо, = @ме/510.—2@
ме, з10,,
получим
С ме,510.
—
24 ме, 510, -++ const,
т. е. соотношение (Т, 4), в котором А! = 2.
ЛИТЕРАТУРА
1. М. Х. Карацпетьянц.
2. М. Х. Карапетьянц.
3. Selected values of chemical
D. D. Wagman,
W. H.
Bur. Stand., 500, 1952.
4.K. Fa
ans, H.Grimm.
5. \. В Ht z. Z. anorg. allg.
6. W.
Biltz.
Z.
8.
R.
Lorentz,
12.
Le
7. F. Ephraim,
anorg.
allg.
Ж. физ. химии, 27, 934 (1953).
Ж. физ. химии, 29, 1328 (1955).
thermodynamic
properties, by F. D. Rossini,
Ewans,
S. Levine,
J. Jaffe.
Cire. Natl.
Z. Phys., 2, 299 (1930).
Chem., ИЕ. 291 (1921).
Chem.,
0. Schitz.
W.
Herz.
117,
Helv.
Z. anorg.
84 (1921).
Chim. Acta, 9, 914 (1926).
allg. Chem.,
145,
88 (1925).
9. F. A. Henglein.
Z. anorg. allg. Chem., 120, 77 (1921).
10. W. Biltz, A.Sapper. Z. anorg. allg. Chem., 203, 277 (1932).
141. W. Biltz, W. Wien. Z. anorg. allg. Chem., 121, 257 (1922). .
Boucher,
W.
(1932).
13. A. F. Hallimond.
14. A. F. Hallimond.
15.
16.
Biltz.
Z. ‘anorg.
allg.
W.
Fischer,
Fan g-h suim.
Chem.,
207,
71
т.
М.—Л.,
Mineral Mag., 21, 277 (1927).
Mineral Mag., 21, 480 (1928).
Н. М. Селиванова,
М.
мич. технол., 6, 534 (1963).
19. Lee
20.
21.
22.
W.
W. Biltz.
Raumchemie der festen Stoffe. Leipzig, 1934.
В. Бильтц.
Труды
Юбилейного
Менделеевского
съезда,
Изд-во АН СССР, 1936, стр. 213.
17. W. Biltz,
13 (1930).
18.
Fischer,
E.
Х.
Witihnenberg.
Карапетьянц.
Z.
Изв.
1.
phys.
Chem.,
A151,
вузов,
Химия
и хи-
J. Chinese Chem. Soc., 9, 46 (1942).
Lee
Fang-hsuim.
J. Chinese Chem. Soc., 11, 155 (1944).
Lee
Fanghsuim.
J. Chinese Chem. Soc., 11, 166 (1944).
В. П. Спиридонов,
В. М. Татевский.
Вестник МГУ,
30 (1944).
химия,№
1,
23. V.C.G. Trew, S. F. A. Husain.
Trans. Faraday Soc., 57, 223 (1961).
24. M. X. Каранетьянц.
Ж. физ. химии, 27, 7175 (1953).
25.
26.
М. Х. Карапетьянц.
Труды МХТИ им. Ik. И. Менделеева, 18, 27 (1954).
С. И. Скляренко,
С. Ф. Белов.
Сборник научных трудов Гиредмета
(1931—1956 гг.), т. 1. M., Металлургиздат, 1959, стр. 329.
27. Н. М. Селиванова.
Докт. дисс. М., МХТИ им. Д. И. Менделеева, 1963.
28. Е. А. Букетов,
М. 3. Угорец,
А. С. Пашинкин.
Ж. неорг. химии,
9, 526 (1964).
29. Ф. А. Кузнецов,
30.
81.
Т.Н.
Резухина.
Ж. физ. химии, 36, 1364 (1962).
В. М. Аносов.
Изв. вузов, цветн. металлургия, № 2, 103 (1963).
Термические константы неорганических веществ. Составили: Э. В. Брицке,
А. Ф. Капустинский, Б.К. Веселовский, Л.М. Ш амовский,
Л. Г. Ченцова,
Б.Н. Анваерф.
М., Изд-во АН СССР, 1949.
32. Справочник химика. M.—JI.,
Госхимиздат, 1951—1952.
33. Р. Д. Оболенцев.
Физические константы углеводородов жидких топлив
и масел. Изд. 2. М.—Л., Гостоптехиздат, 1953.
34 А.Е. Луцкий,
Л. A. Кочергина.
Ж. физ. химии, 37, 460 (1963).
68
А. Е. Луцкий.
З. физ. химии, 32, 116 (1949).
В. А. Коряжкин,
В. М. Татевский.
Вестник
МГУ,
С.
и
№1,
Г. Камай,
Б. Д. Чернокольский.
Докл. АН СССР,
В.Н. Еременко.
Укр. хим. ж., 28, 427 (1962).
Ван
Аркель.
Химическая связь. М., ОНТИ, 1934.
С. С. Бацанов.
Докл. АН СССР, 110, 390 (1956).
С.
Бацанов.
Электроотрицательность
Новосибирск. Изд-во АН СССР, 1962.
J.C. Slater.
Phys. Rev., 23, 488 (1932).
O. R. Quayle.
Chem. Rev., 53, 439 (1953).
элементов
21 (1962).
149, 850 (1963).
химическая
связь.
Ф. Зейтц. Современная теория твердого тела. М.—Л., Гостехтеоретиздат, 1949.
М. Х. Карапетьянц,
Лин
Тинчин.
Ж. структ. химии, 1, 277 (1960).
. Б. Ф. О рмонт. Структура неорганических веществ. М.—Л.., Гостехтеоретиздат,
1950.
П. И. Крипякевич,
Е. И. Гладышевский,
О.С. Заречнюк.
Докл. АН СССР, 95, 525 (1954).
. а. ЧтезесКе,
H. Pfister. Acta crystallogr., 11, 369 (1958).
С. С. Бацанов.
Ж. структ. химии, 3, 616 (1962 ).
. F. H.S. Vermaas,
E. R.Schmi dt.
Beitr. Mineral. u. Petrogr., 6, 219
(1959).
. а. Ве rgerholl,
E. Schultze, Rhonhof.
Acta crystallogr., 15, 420
(1960).
|
С. И. Дракин.
Ж. структ. химии, 4, 514 (1963).
G.R.Samayajulu.
Т.
Коттрел.
П. А. Акишин,
СССР,
.П. А.
умов.
Ж.
химии,
Акишин,
31, 648 (1957).
кишин,
= >>.
П.
физ.
Phys., 28, 822 (1958); 30, 1357 (1959).
химических
связей.
В. П. Спиридонов,
118, 1134 (1958).
Акишин,
В. П.
ыы
о
ы
Но
x
.П.
мии,
IT.
J. Chem.
Прочность
В.П.
Спиридонов,
31, 461
М.,
Г.
(1957).
Спиридонов,
А.
В. ЦП. Спиридонов, Г. А.
химии,
Акишин,
32,
58
(1958).
В. П. Спиридонов,
биди.
Ж. физ. химии, 30, 155 (1956).
. П.А. Акишин,
Л. В. Волков,
В.
СССР, 101, 77 (1955).
П. А. Акишин,
В. П. Спиридонов,
`мии, 30, 954 (1956).
1956.
Соболев,
Г. А. Соболев.
. физ. химии, 31, 1871 (1957).
кишин,
В. П. Спиридонов, Г. А.
физ.
ИЛ,
Г. А. Соболев.
В. А.
П.
J. Phys. Chem.,
J. Phys. Chem..,
Ж.
А.
АН
На-
физ.
хи-
Нау-
Соболев,
В. А. НауНаумов,
Н. Г.
Наумов.
М. Х. Карацетьянц.
Ж. структ. химии, a 399 (1960).
П. А. Акишин,
В.П. Спиридонов. Ж.
физ. химии,
К. С. Краснов.
Ж. неорг. химии, 3, 1993 (1958).
.G.Glockler.
G.Glockler.
В.
Соболев, В.А.
Спиридонов.
В. А.
Докл.
Рам-
Докл.
АН
Ж. физ. хи32,
1682
(1958).
61, 31 (1957).
62, 1049 (1958).
|
В. М. Татевский,
B. II. Спиридонов,
П. А. Акишин.
Докл.
АН СССР, 138, 624 (1961).
. М. Е. С. Ladd,
W.H. Lee.
J. Inorg. Nucl. Chem., 20, 163 (1961).
. П.А. Акишин,
В. А. Наумов,
В. М. Татевский.
Научн. докл.
Высшей школы, химия, № 2, 229 (1959).
71. Tables of Interatomic Distances and Configuration in Molecul and Ions. London,
1958.
В. М. Татевский. Ж. физ. химии, 36, 2024 (1962).
72. В. П. Спиридонов,
72а. В. П. Спиридонов, В. М. Татевский.
Ж. физ. химии,
38, 405 (1964).
ЖЖ. структ. химии, 4, 884 (1963).
73. К. С. Краснов.
ТА. J.C. Evans,
H.J. Bernstein.
Canad. J. Chem., 33, 1171 (1955).
То. H. J. Bernstein.
Canad. J. Chem., 34, 617 (1956).
А. И. Максимо в.
Оптика и спектроскопия, 8, 403
76. К. С. Краснов,
(1960).
ТТ. В. А. Коряжкин,
В. М. Татевский.
Вестник МГУ, № 2, 15 (1962).
78. В. А. Коряжкин,
В. М. Татевский. В с6б.: Физичесние проблемы
79.
80.
81.
82.
83.
84.
85.
спектроскопии, т. 1. М., Изд-во АН СССР, 1962, стр. 190.
В.Р. Бат |еу, J. М. Shoolery.
J. Am. ‘Chem. Soc., 77, 3977 (1955).
W.Gordy,
8.C.Stanford.
J. Chem. Phys., 9, 204 (1944).
L.J. Bellamy.
J. Chem. Soc., 1955, 4221.
J. Krueger,
Doob,
J.M.
Overend,
.N. Karo.
H. W. Thompson.
Proc. Roy. Soc., A250, 22:(1959).
Vandenbelt.
J. Am. Chem. Soc., 77, 4335 (1955).
J.C. Evans.
J. Chem. Phys.,
Trans. Faraday Soc., 55, 1817 (1959).
31, 1489 (1959).
69
Егорочкин,
И.
88
89
90.
91
M.
АВЕ
87.
М.
А. Задорожный.
а
P.
Brown,
D.
E.
.G.
Paterson,
Хидекель,
Webster.
Ja kuszewski,
m., 7, 31 (1961).
Л.
Изв. АН СССР, ОХН,
S.
J. Phys.
В.
1963,
А.
Chem.,
Tanienska-Osinska.
D.M.
Cameron.
Canad.
Пономаренко,
1868.
64, 698
(1960).
Soc.
sci.
Lodz.
acta
J. Chem., 41, 198 (1963).
П. Гольдштейн,
Е. Н. Гурьянова,
Е. Il. Делинская,
. А. Кочешков.
Докл. АН СССР, 136, 1079 (1961).
-B. Powell,
J.J. Lagowski.
J. Chem. Soc., 1962, 2047.
92. Я. Ф. Меженный.
93
. А.
В. А. Измаильски
й, М.
М.
Шайкина.
—
В
Ея
~~
химии, 32, 1746 (1962).
орелов, В. В. Серебренников. Ж. физ. химии,
36, 2075 (1962).
95.
HL Гапон.
Докл. АН СССР, 58, 823 (1947).
96. W. M. Latimer,
W. L. Jolly. J. Am. Chem. Soc., 75, 4147 (1953).
co
‚общ
Ж. физ. химии, 35, 2649 (1961).
Мостославский,
97.
iT. Мищенко.
Докт. дисс. Л., ЛТИ им. Ленсовета, 1953.
98.
Lee Fan g-hsuim.
J. Chinese Chem. Soc., 12, 80 (1945).
99. М. Х. Карапетьянц. Труды МХТИ им. Д. И. Менделеева, 23, 3 (1956).
100
L. Fein,
C.H. Fischer.
J. Org. Chem., 13, 749 (1948).
104
102.
R.Samayajulu,
5. В. Ра11
J. Chem. бос., 1957, 4837.
B.Cupp,
H. E. Rogers.
J. Am. Chem. Soc., 61, 3353 (1939).
105.
106.
Milazo.
Swarts.
103.
104.
Deffet.
Bull. Soc. chim. Belg., 40, 385 (1931).
Desreux.
Bull. Soc. chim. Belg., hh, 249 (1935).
.
Gazz. Chim. Ital., 74, 49 (1944).
J. chim. phys., 17, 3 (1945).
107. М. Х. Карапетьянц.
Ж. физ. химии, 30, 2218 (1956).
108. М. Х. Карапетьянц,
Чэн
Гуангюе.
Температура кипения
ление насыщенного пара углеводородов. М., Гостоптехиздат, 1961.
109. D. L.Camin,
(1954).
A. F. Forziati,
F.D. ‘Rossini.
J. Phys.
и дав-
Chem., 58, 440
110. М. Х. Карапетьянц.
Нефтяное хозяйство, № 4, 66 (1955).
111. М.Х. нарапетьянц, Л. В. Чуричева. Хим. промышл.,
№ 2, 50 (1964).
112. Л.А. Нисельсон, Т. Д. Соколова.
Ж. неорг. химии, 7, 2653 (1962).
113. О. В. Соколов.
Изв. вузов, цветн. металлург.,
№4, 52 (1963).
114. A. Hantzsch,
H. Carlson. Ber., 58, 1741 (1925).
115. Е. $ Вт шаха k i, K. Niwa. Z. anorg. allg. Chem., 314, 21 (1962).
116. A. Kutzelnigg.
Monatsh., 89, 459 (1958).
147.
R.
Littlewood.
120.
A.G.
122.
B. B. ‘O омин.
118. H.Sobotka,
119. E.B.Smith,
121.
Goble,
R. Lautié.
J. Electrochem.
Soc.,
109,
525
(1962).
J. Kahn.
J. Am. Chem. Soc., 53, 2935 (1931).
J. Walkley.
Trans. Faraday Soc., 56, 220 (1960).
A.G.
Maddock.
Bull. Soc. chim.
Ж. физ.
J.
Inorg.
Nucl.
France, 5, 1306 (1938).
химии,
Chem.,
27, 1689 (1953).
123. В. В. Фомин.
Ж. физ. химии, 28, 1896 (1954).
124. М. Х. Карапетьянц. Ж. физ. химии, 30, 593 (1956).
125. The chemistry and metallurgy of miscellaneous materials. Ed.
1950.
126. K. Hartley,
H.O. Pritchard, H. A. Skinner.
Soc., 46, 1019 (1950).
127.
128.
K.
Hartley,
47, 254 (1951).
H.
O. Pritchard,
H.A.
Skinner.
by L. L. Quile.
Trans.
R.T.McClean.
131. С. А. Щу
TypxmCCP, 5,
ев, Е. К. Смирнова,
о 4, 14 (1962).
A. P. Курбанов.
132.
Автореф.
Faraday
Faraday
Soc.,
Trans. Faraday Soc., 58, 895 (1962).
канд.
дисс.
Л., ЛГУ
им. А. А. Жданова,
А’. Р. Курбанов.
С. А. Цукаревьв, А.Р. Курбанов.
Изв. АН ТуркмССР,
и технич., № 1, 56 (1962).
133. Е. А. Укше,
Н. Г. Букин.
Усп. химии, 30, 243 (1961).
134. E. Erdés.
135. (1960).
136.
Trans.
С. А. Щукарев,
Г. И. Новиков,
И. В. Василькова,
А. В. Суворов,
Н.В. Андреева,
Б.Н. Шарупин,
А. К. Баев. Ж. неорг.
химии, 5, 1650 (1960).
129. H.Mackle,
130.
7, 94 (1958).
Coll. Czechosl. Chem.
Рузинов,
С. Ф.
Белов.
Communic., 27,
1428 (1962).
Изв. вузов, цветн.
отд.
металлургия,
Докл.
1962.
АН
геохимич.
№
6, 104
С. И. Скляренко,
Л. П. Рузинов,
Ю. У. Самсон.
Ж. неорг. химии, 7, 2645 (1962).
137. Л. А. 'Каркова,
Я. И. Герасимов.
Ж. физ. химии, 35, 2291 (1961).
138. Л.А. Жаркова.
Ж. физ. химии, 36, 1819 (1962).
139. (£959), Юдин,
Г. А. Хачкурузов.
Труды Ин-та прикл. химии, 42, 132
70
С. М. Скуратов, В. П. Колесов.
Ж. физ. химии,
35, 1156 (1961).
Г. И. Лихтенштейн, А. Л. Бучаченко, В.И. Веденеев.
Докл.
АН СССР, 133, 1102 (1960).
Ж. физ. химии, 36, 1503 (1962).
142. Г. И. Лихтенштейн.
Ж. неорг. химии, 8, 2024 (1963).
143. Н. М. Селиванова.
Изв. АН СССР, металлургия и горное дело, № 2,
144. И. А. Новохатский.
1963).
145. Термодинамические свойства индивидуальных веществ. Справочник. Под ред.
В. И. Глушко, Л. В. Гурвича, Г. А. Хачкурузова, И. В. Вейщ, В. А. Медведева.
Т. 1—2. М., Изд-во АН СССР, 1962.
296, 104 (1958).
146. В. Н opp 'е. Z. anorg. allg. ‘Chem.
Canad. J. Chem., 37, 1451 (1959).
147. А. О. Westland.
Термодинамические расчеты нефтехимических процес148. А. А. Введенский.
cos. M., Гостоптехиздат, 1960.
L. F. Phillips,
T. M.Sugden.
Trans. Faraday
149. E. M. Bulewicz,
Soc., 57, 924 (1961).
R. P. Burns,
J. Drowart,
M. G. Ingkram.
J. Chem.
150. De Maria,
Phys., 32, 1373 (1960).
151. Чжан Ю-мин.
Автореф. канд. дисс. М., МХТИ им. Д. И. Менделеева, 1962.
Л.
А.
Мальцева.
Труды
Радиевого
ин-та им.
152. В. М. Вдовенко,
В. Г. Хлопина,
8, 25 (1938).
|
Докл. АН СССР, 149, 1403 (1963).
153. Н. А. Измайлов.
E.B. Brackett.
J. Phys. Chem., 66, 1542 (1962).
154. T.E. Brackett,
P. Paoletti,
L. Sacconi. ‘J. Chem. Soc., 1960,
155. M. Ciampolini,
553.
|
Химия органических соединений фтора. М., Госхимиздат,
156. М. Гудлицкий.
1964.
И. В. Василькова,
Н. Ф. Кудряшова.
Ж.
157. Е. К. Смирнова,
неорг. химии, 9, 489 (1964).
3.0. Парть,
А. Р. Плоом. `Ж. общ. химии, 33, 3124.
158. А. В. Туулметс,
(1963).
Ю. И. Баранов,
О.А. Бурмистрова. Изв.
159. Ю. А. Стрепихеев,
—^
со.
140.
141.
вузов, химия и химич. технол., 5, 387 (1962).
160. М.
161. М.
162.
163.
164.
165.
Х.
x
Карапетьянц.
Карапетьянц,
N 2, 105 (1958).
о. Е. C. Morris.
D. F.C. Morris.
S.C.
Bevan,
WK. ‘физ. химии, 28, 1136 (1954).
Лин Тин-чин. Айа 361. Natur. Univ. Szechuan,
Phys. Chem. Solids, 7, 214 (1958).
Rec. trav. chim., 78, 150 (1959).
D.
F.C.Morris.
J. Chem.
Soc., 1960, 516.
R. Perret. B6.: Thermodynamics, Intern. Union of Pure and Applied Chemistry. Sect. of Phys.— Chem. Commission on Chem. Thermod., 1961, p. 104.
J. Chem. Phys., 26, 542 (1957).
166. K. Watanabe.
167.
168.
169.
170.
171.
172.
173.
174.
175.
‚ 176.
177.
А. П. Пурмаль.
M. A. Fiheman.
H. Branson,
М.
Х.
Ж. физ. химии, 30, 172 (1956).
J. Phys. Chem., 62, 947 (1958).
C.Smith.
Карапетьянц.
P. Zuman.
P.Zuman.
P.Zuman.
Kan-ichi
Coll. Czechosl.
Ж.
J. Am.
физ.
Chem.
Chem.
химии,
Communic.,
F. Ephraim.
(1955).
25, 3225 (1960).
Н. М. Селиванова.
ЖЖ. неорг. химии, 8, 1826 (1963).
P. L. Robinson,
H.C.Smith,
H. V. A. Briscol.
H. H.
F.E
Stephenson.
Chem. News,
phraim.
Helv. Chim. Acta., 7,
182.
В. П. *" Васильев,
F. Epphraim,
E. Michel.
J.C.
McGowan.
Helv. Chim.
Chem.
Ind.,
J.H.
N 40,
3. К. Одинец.
Univ.
Acta, 2, 266
(1919).
Изв. вузов, химия
и химич.
van
632
Proc.
(1963).
146, 315, 1925.
102, "178 (1911).
298 (1924). —
В. Н. Васильева.
6, 693, 1963.
А. Hofstra,
183. Е. Г.. МасКог,
Soc., 54, 186 (1958).
А. М. Егоров,
366
Ber., 50A, 1069 (1917).
179.
180.
184.
185.
186.
187.
188.
938
Coll. Czechosl. Chem. Communic., 27, 630 (1962).
Coll. Czechosl. Chem. Communic., 27, 648 (1962).
Tanaka,
Kenzi Tanuru.
J. Catalysis, 2,
ham., 7, 164, 1926; CZ, 1, 1781, 1927.
178 Т.Г. ЗазТа wsky. Z. anor. allg. Chem.,
181:
Soc., 753, 4133 (1953).
29,
der
Waals.
|
Dar
технол. ,
Trans. Faraday
(1948).
ЖЖ. неорг. химии, 7, 707 (1962).
В. А. Киреев.
Ж. физ. химии, 36, 2547, 1962.
Н.А. Измайлов.
Ж. физ. химии, 24, 321, 1950.
Н.А. Измайлов.
Труды Научно-исслед. ин-та химии
кого, 20. 5 (1953).
змайлов.
Труды Научно-исслед. ин-та химии
189. Н. А
кого, 10, 49 (1953).
ХГУ
им. А. М. Горь-
ХГУ
им. А. М. Горь71
Н. А. Измайлов,
Т. В. Можарова.
Ж. физ. химии, 34, 1543 (1960).
Н.А. Измайлов,
Т. В. Можарова.
Ж. физ. химии, 34, 1709 (1960)..
Н.А. Измайлов, Л.Л. Спивак.
Ж. физ. химии, 36, 757 (1962).
Н.А. Измайлов,
Л. Л. Спивак.
Ж. физ. химии, 36, 1158 (1962).
L.A. Wooten,
L. P. Hammett.
J. Am. Chem. Soc., 57, 2289 (1935).
R.M.Izatt,
C.G.Haas,
B.P. Block,
W. C. Fernelius.
J. Phys.
Ch em., 58, 1138 (1954).
196. R.M.Izatt,
W.C. Fernelius,
C.G.Haas,
B.P.Block.
J. Phys.
Chem., 59, 170 (1955).
197. R. M.Izatt, W. C. Fernelius, B. P. Block. J. Phys. Chem., 59, 180
1955).
В
190.
191.
192.
193.
194.
195.
198. М.
мии,
И. Кабачник,
199. Н.Е.
200.
201.
202.
30,
2763,
1960.
Хомутов.
С. Т. Иоффье,
Т. А. Мастрюкова.
Ж. общ.
хи-
Ж. физ. химии (в печати).
Х. С. Багдасарьян.
Ж. физ. химии, 34, 1517 (1960).
Я. М. Варшавский.
Труды НИФХИ им. Л. Я. Карпова, 2, 61 (1959).
H. G. Kuivile,
A. K. Hendrickson.
J. Am. Chem. Soc., 74, 5068
1952).
203. HE. C. Brown,
K. L. Nelson.
J. Am. Chem. Soc., 75, 6292 (1952).
204. J. K. Kochi,
G.S. Hammond.
J. Am. Chem. Soc., 75, 3445 (1953).
205. Y. Okamoto,
T.Inukai,
H.C. Brown.
J. Am. Chem. Soc., 80, 4973
206. Н. С. Вго wn, L.M.Stook.
J. Am. Chem. Soc., 84, 3298 (1962).
207. F. H. Carpenter,
W. H. McGregor,
J. A. Close.
J. Am.
Soc., 82, 849 (1959).
208.
J.S mid,
M.Szwarc.
J. Am.
209. A. F. Trotman-Dickenson.
210.
211.
А.
М.
стр.
212. М.
213 . Е.
214.
Chem.
Chem.
Soc., 79, 1534 (1959).
Chem.
Ind., N 37, 1243 (1957).
И. Коновалов.
Докл. АН СССР, 149, 1334 (1963).
|
Шварц, Д. Бинкс. В
с6б.: Теория органической химии. М., ИЛ, 1963,
327.
Х. Карапетьянц.
Ж. общ. химии, 27, 3379 (1957).
D. Rossini,
K.S. Pitzer,
R. L. Arnett,
R.M. Brawn,
G. C.
Pimentel.
Selected values of physical and thermodynamical properties of
drocarbons and related compounds. Garnegie Press, Pittsborhg, 1953.
hy-
М. Д. Тиличеев.
Основные физические константы углеводородов.— В кн.:
Физико-химические свойства индивидуальных углеводородов., вып. 5. Под ред.
М. Д. Тиличеева. М., Гостоптехиздат, 1954, гл. ХУ.
215. A. Bayer.
Ber. d. chem. Gesellsch., 10, 1286 (1887).
216. J. R. Partington. An advanced treatise on physical chemistry, vol. III. The
properties of solids, 1952.
217.
218.
219.
Physical chemistry of hydrocarbons. Ed. by A. Farkas, vol. I, New York, 1950.
R. Foster,
D. L.Hammick.
Nature, 175, 255 (1955).
A.A.Schaerer,
G.G.Baylé,
W.M.Mazee.
Rec. trav. chim., 75, 513
(1956).
220. A.A.Schaerer,
G.G.Baylé,
W.M.Mazee.
Ree. trav. chim., 75, 529
221. R. Hull, E. E. Walker.
J. Polym. Sci., 3, 609 (1948).
222. Handbook of chemistry and Physics. Ed. C. D. Hodgman, 33 ed., 1951.
223. F. D. Rossini,
K.S. Pitzer,
W.J.Taylor,
J. P. Ebert,J. E.
Kilpatric,
C. R. Backett,
M.G. Williams,
H.C. Werner.
Selected values of properties of hydrocarbons. Circ. Natl. Bur. Stand., N 461, Wash.,
224.
F. W.
Seyer,
R.
F.
Patterson,JjJ.
L. Keyes.
J. Am.
Chem.
Soc.,
66,
225.
226.
227.
228.
229.
И. А. Нечитайло,
Г. Б. Равич.
Усп. химии, 26, 640 (1957).
М. Х. Карацетьянц.
Труды МХТИ им. Д. И. Менделеева, 24, 3 (1957).
A. W. Ralston.
Fatty and their derivatives. New York, London, 1948.
Ц. Е. Э’А | е]10,
Е.Е. Ве! 4. J. Am. Chem. Soc., 59, 109 (1937).
а. 5. РагКз,
\\. О. Кеппеду,
КВ. В. Сафез,
.. В. Моз1еу,
С.Е.
Moore,
M. L. Renquist. J. Am. Chem. Soc., 78, 56 (1956).
|
230. В. В. Коршак,
С. В. Виноградова,
Е. С. Власова.
Докл. АН
СССР, 94, 61 (1954).
231. М. Х. Карапетьянц.
Ж. физ. химии, 35, 1727 (1961).
232. Е. В. Бирон.
233.
234.
235.
Ж. русск. физ-хим. об-ва, ч. химич., 47, 964 (1915).
А. Базаров.
Ж. русск. хим. об-ва, 19, ч. физич., вып. 2, отд. Г, 61 (1887).
W. Klemm,
Westling.
Z. anorg. allg. Chem., 242, 291 (1940).
Д. Баларев, Ст. Андреев. Годишник на Софийск. ун-т, природно-матем.
фак., 46, кн. 2 (химия), 159 (1949—1950).
236. В. П. Шишокин.
Ж. общ. химии, 23, 889 (1953).
237. Z.Z.Hugus. J. Am. Chem. Soc., 74, 1076 (1955).
238. Lory. Phil. Mag., 154, 15 (1882).
|
72
Д. И. Менделеев.
239.
240.
Lory.
241.
242.
Philos.
Основы химии.
Mag.,
151, 42
(1882).
Изд. 5, 1889, примеч.
19 к гл. ХУ.
J. W. Richards.
J. Franklin Inst., 131, 477 (1891).
J. Thomsen.
Systematische Durchfiihung thermochemischer Untersuchungen.
Stuttgart, 1906, S. 152, 160, 171.
_ A. Roth, O.Schwartz.
Z. phys. Chem., B134, 456 (1928).
.А. Roth,
G. Becker.
Z. phys. Chem., A159, 1 (1932).
.H. Hildebrandt.
J. Chem. Educ., 18, 294 (1940).
Lacotos. Acta chim. Hungaricae, 8, "207 (1955).
243.
244.
245.
246.
247.
Курбатов.
248.
249.
200.
201.
202.
Д. И. Менделеева.
Научн.
химико-технич.
изд-во.
Л.,
. В асилькова. Канд. дисс. Л., ЛГУ им. А. А. Жданова, 1949.
. i укарев, И. В. Василькова. Вестник ЛГУ, № 2, 115 (1958).
. il укарев. Вестник ЛГУ, № 11, 127 (1954).
. il укарев. ЖЖ. общ. химии, 24, 581 (1954).
.А рия, М. П. Морозова, С. А. Щукарев. Ж. общ. химии, 27,
1131
Ли
253.
254.
Закон
(1957).
Мяо-сю.
Канд.
дисс. Л., ЛГУ
им. А. А.
Жданова,
1958.
С. А. Щукарев, Г. Гроссман,
М. П. М орозова. Ж. общ. химии,
25, 633 (1955).
255. С. А. Щукаревьв,
М. П. Морозова,
Ю.П. Сапожников.
Ж. общ.
химии, 26,
304 (1956).
химии, 27,
293 (1957).
С.М. Ария,
256.
М. ЦП. Морозова,
С. А 'Щукарев,
251.
259.
260.
261.
А. Щукарев,
Б. В.
М.
Некрасов.
Ш. Я. Коровский.
Ан.
А.
Цзи-тао, 9. Вольф. Ж. общ.
М. П. Морозова,
химии, 28, 3289 (1958).
258. С.
Хуан
П. Морозова,
Курс
Несмеянов,
М. М.
общей
химии.
Ли
Изд.
Бортникова. Ж. общ.
Мяо-сю.
А.
Смахтин,
общ.
9. М., Госхимиздат,
Ж. общ. химии, 21, 439 (1954).
Л.
Ж.
В.
И.
Лебедев.
химии,
1952.
Докл.
АН
262. A. P. Altschuller.
J. Chem. Phys., 22, 1136 (1954).
263. А. Ф. Капустинский.
Изв. АН СССР, ‘OXH, 1948, 568.
264. T.T. Диогенов.
Ж. общ. химии, 23, 20 (1953).
Ж. общ. химии, 23, 24 (1953).
265. Г. Г. Диогенов.
266. В. И. Веденеев,
Л. В. Гурвич, В. Н. Кондратьев,
В. А. Медведев,
Е. Л. Франкевич.
Энергия разрыва химических связей. Потенциалы ионизации и сродство к электрону. М., Изд-во AH CCCP, 1952.
Б. Оу эн.
Физическая химия растворов электролитов. М.,
267. Г. Харнед,
ИЛ, 1952, стр. 242.
Ж. общ. химии, 20, 550 (1950).
268. Викт. И. Спи цын.
269. Викт. И. Спицын,
И. М. Ку лешов.
Ж. общ. химии, 21, 401 (1950).
270. Г. Б. Сейфер.
Ж. неорг. химии, 7, 4242 (1962).
210а. М. Х. Карапетьянц.
Ж. физ. химии, 35, 949 (1961).
2706.
271.
В. А. Комаров.
В.В.
Коршак,
Ж. общ. химии, 33, 3683 (1963).
А. М. Полякова,
В. Ф. Миронов, А. Д.
Петров.
215.
276.
277.
278.
279.
280.
xf oeaereer ey
Изв. АН СССР, ОХН, 1959, 178.
272.
If. Корниенко.
Укр. хим.
23, 159 (1957).
273.
Sacconi,P.Paoletti, M. Chiamp o lini. J. Chem. Soc., 1961,5115.
274.
. H. Anderson. J. Chem. Eng. Data, 8. 576 (1963).
. Е.
Хомутов.
Труды
МХТИ
им.
Д.
И.
Менделеева,
38, 68 (1962).
ohlrausch.
Ann. Phys. Chem., 6, 1 (1879); 26, 161 (1885).
‚ Рауге,
J.-T. Silbermann.
Ann. chim. phys., 37, 406 (1953).
. Хомутов.
.Рузавин.
Труды МХТИ им. Д. И. Менделеева, 6, 1134 (1940).
Канд. дисс.
М., МХТИ им. Д. И. Менделеева, 1954.
me рмонт. Труды конф. по химии бора и его соединений. М., Госхимиз9 58.
Г однев,
А. М.
Александровская,
А. С. Свердлин.
из. химии, 36, 2609 (1962).
J. M. Bronsted.
7. phys. Chem., A169, 52 (1934).
ЕК
)
со
—=
T,
282.
283. Н. А. Измайлов.
Электрохимия. растворов. Харьков, Изд.
ун-та им. А. М. Горького, 1959.
284. М. И. Кабачник.
Докл. АН CCCP, 83, 407 (1952).
285. М. И. Кабачник. В с6.: Проблемы механизма органических
ев, 1954, стр. 126.
286. М. И. Кабачник,
С. Т. Иоффе,
Т.А. Мастрюкова.
287.
мии, 25, 684 (1955).
П. С. Пелькис,
Р. Г. Дубенко.
Докл.
АН
СССР,
Харьковского
реакций.
Ки-
Ж. общ. хи-
120, 320 (1958).
соединений.
288. С. Т. Иоффе. В
с6.: Химия и применение фосфорорганических
Труды П Конф. в Казани. М., Изд-во АН СССР, 1962, стр. 65.
#3
289.
290.
291.
N.
Beketoff.
К.Б.
Chem.
Яцимирский.
Central.
Blatt,
1,
14
(1892).
Ж. неорг. химии, 3, 2244 (1958).:
А. Ф. Капустинский,
кая.
Изв. АН СССР, ОХН,
А. А. Шидловский,
№ 4, 385 (1958).
Ю.
С.
Шидловс-
292. А. А. Шидловский.
ЖЖ. физ. химии, 36, 1773 (1962).
293. E. A. Wood, V.B.Compton.
Acta crystallogr., 11, 429 (1958).
994.
295.
E. Busmann.
Z. anorg. allg. Chem., 313, 90 (1961).
И. В. Березин.
Докл. АН СССР, 148, 609 (1963).
296. ih
297.
E. i у a x ий.
2 3,
(
Сообщ. о научн. работах членов ВХО
им. Д. И. Менделеева,
).
А. Н. Баратов.
В с6.: Вопросы горения и пожарной профилактики. M.,
изд. Мин-ва комм. хоз-ва РСФСР, 1957, стр. 41.
298. A. ‘A. Баратов,
Н. В. Соловьев. Ж. физ. химии, 34, 1661 (1960).
299. М. Г. Гоникберг.
Ж. физ. химии, 37, 477 (1963).
300.
301.
В. А. Киреев.
Ж. физ. химии, 28, ‘372, (1954).
C. T. Stubblefield,
H. Eick,
L. Eyring.
3018 (1956).
302. C. T. Stubblefield,
H. Eick,
L. Eyring.
3877 (1956).
303. L. Eyring,
H.R. Lohr,
B.B.Cunningham.
1186 (1952).
/
304.
305.
306.
Б.Н.
Шарупин,
И. В. Василькова.
J. Am.
J. Am.
J. Am.
Chem.
Chem.
Chem.
Soc.,
|
78,
Soc., 78,
Soc., 74,
Ж. общ. химии, 31, 2077 (1961).
Б. Ф. Додж.
Химическая термодинамика. М., ИЛ, 1950.
Б. Б. Кудрявцев.
Применение ультраакустических методов в практике физико-химических исследований. М.—Л., Гостехтеоретиздат, 1962.
307. C. D. F. Eerbeck. Ree. trav. chim., 72, 5 (1953).
308. П. Г. Маслов.
Ж. физ. химии, 33, 1461 (1959).
309.
310.
311.
312.
313.
314.
315.
316.
317.
318.
319.
320.
П. Г. Маслов.
Ж. неорг. химии, 5, 1669 (1960).
П. Г. Маслов.
Хим. промышл., № 8, 539 (1961).
Е. Г. Ргозеш,
У. Н. Johnson,
F. D. Rossini.
J. Res. Natl. Bur.
Stand., 39, 173 (1947).
|
Е. J. Prosen,
W.H. Johnson.
F. D. Rossini.
J. Res. Natl. Bur.
Stand., 37, 541 (1946).
E.J. Prosen,
F.D. Rossini.
J. Res. Natl. Bur. Stand., 34, 263 (1945).
E. J. Prosen,
F. D. Rossini.
J. Res. Natl. Bur. Stand., 36, 269 (1946).
F. D. Rossini.
Ind. Eng. Chem., Ind. Ed., 29, 1424 (1937).
G.S. Parks,
K.K.Kelley,
H.M.
Huffman.
J. Am. Chem. Soc., 51,
1969 (1929).
|
а. 5. РагК$,
@. Е. Моотге,
М. Г. Вепадуи1$%
В. Е. Мау 1ох, Г.А.
Maclaine,
P.S. Fujii,
J. A. Hatton.
J. Am. Chem. Soc., 71, 3386
(1949).
|
G.S. Parks.
Chem. Rev., 27, 75 (41940).
|
Н.Н. Авгуль,
Г. И. Березин,
А. В. Киселев,
И.А.
Лыгина.
Ж. физ. химии, 30, 2106
(1956).
А. А. Исирикян,
А. В. Киселев,
Б. А. Ф ролов.
Ж. физ. химии,
33, 389 (1959).
321. Э.А. Мелвин-Хьюз.
Физическая химия,
кн. ЦП., ИЛ, 1962, стр. 626—
629.
322. M. Davies,
V. E.Malpass.
J. Chem. Soc., 1961, 1048.
323. В. М. Татевский.
Ж. общ. химии, 28, 2935 (1958).
324. В. М. Татевский.
Вестник МГУ, серия матем., мех., астроном., физ.,
хим., № 4, 205 (1958).
325. П. Г. Маслов.
Докл. АН СССР, 84, 993 (1952).
326. H.J. Bernstein.
J. Chem. Phys., 20, 263, 1328 (errata) (1952).
327. M. Davies.
J. Polymer. Sci., 40, 427 (1959).
328. W. Biltz.
Z. Elektrochem., 36, 815 (1930).
|
329. R. Robinson,
W.Scott.
J. Chem. Soc., 1932, 972.
330. Р. Креман,
М. Пестемер.
Зависимость между физическими свойствами
и химическим строением. Л.—М., ГОНТИ, 1939.
330а. П. Г. Маслов.
Докл. АН СССР, 86, №4, № 5 (1952).
3306. П. Г. Маслов.
ЖЖ. эксп. техн. физ., 22, 164, 276, 340 (1952).
ЗЗ0в. П. Г. Маслов.
Ж. физ. химии, 26, 1310 (1952).
330г. П. Г. Маслов. Ж. прикл. химии, 26, 388 (1953).
330д. П. Г. Маслов.
Ж. прикл. химии, 26, 388, 543 (1953).
331. П. Г. Маслов.
Ж. физ. химии, 27, 243 (1953).
332. П. Г. Маслов.
Ж. физ. химии, 27, 505 (1953).
333. П. Г. Маслов.
Ж. физ. химии, 27, 509 (1953).
334. П. Г. Маслов.
Ж. физ. химии, 27, 69, 237, 243, 505, 509 (1953).
335. П. Г. Маслов.
Докт. дисс. М. ‚МГПИ им. В. И. Ленина (1953).
aay IT. г. Маслов.
Я. прикл. химии, 27, 749, 868 (1954).
7. П.
Г. Маслов.
Ж. прикл. химии, 27, 868 (1954).
74
|
Ж.
—
.Маслов.
Ж.
Я
цкий.
da.
прикл.
прикл.
химии,
28, 328, 330 (1955).
химии,
29,
330
(1955).
Ж. физ. химии, 29, 718 (1955).
Усп. химии, 25, 1069 (1956).
Ж. физ. химии, 35, 974 (1962).
Ж. физ. химии, 24, 786 (1950).
Труды ХТИ им. В. И. Ленина,
Ss
A
я
Маслов.
Маслов.
Маслов.
уцкий.
цкий.
ваа‘ч
>
ыы
345.
346.
347.
348.
349.
350.
351.
352.
303.
304.
355.
396.
357.
358.
359.
360. 361.
362.
363.
364.
365.
Маслов.
co Ss
SS RNNAS SOS > BEES
388.
339.
340.
341.
342.
343.
344.
An.
4, серия
хим.-технол,
№
2,
Ж. физ. химии, 25, 1086 (1951).
Ж. физ. химии, 25, 1397 (1951).
Fis. Quim.,
thasarathy,
35, 45 (1939).
N.N.Bakhshi.
J. Phys. Chem., 57, 453 (1953).
DOA PR
OTS
thasarathy, N. N. Bakhshi. J. Sci. Ind. Res., 12, 455 (1953).
thasarathy,
N.N. Bakhshi. Nuovo cimento, 11, 310 (1954).
. М. Голутвин. Ж. физ. химии, 30, 2607 (1956).
. Biltz.
Z. Elektrochem., 28, 65 (1922).
- Kossel.
Z. Phys., 1, 395 (1920).
Paneth,
E. Rabinowitsch.
Ber., 58, 1138 (1925).
- Carlson.
Ber., 58, 1747 (1925).
F. Durand.
Bull. Soc. chim. France, 3, 1382 (1936).
Lautié.
Bull. Soc. chim. France, 3, 2339 (1936).
Lautié.
Bull. Soc. chim. France, 4, 860 (1937).
I autié.
Bull. Soc. chim. France, 4, 863 (1937).
Lautié,
M. Oswald. Bull. Soc. chim. France, 5, 277 (1938).
L
utié. Bull. Soc. chim. France, 5, 695 (1938).
Г <utié,
S. Artiéres.
Bull. Soc. chim. France, 4, 664 (1937).
P. Taegan,
A.D. Walsh.
J. Chem. Phys., 19, 1070 (1951).
P. Stoicheff.
М.
Татевский.
Уч.
17, 135 (1962).
зап. МГУ
им.
М.
В. Ломоносова,
неорг.
и физ.
хи-
в
. Татевский.
.Татевский.
.Татевский.
.Татевский.
= =
= =
366.
367.
368.
369.
370
os td tte
Ss
Ss
я, 174, 235 (1955).
Tetrahedron,
. М. Татевский.
их физико-химических
Докл. АН СССР, 109, 131 (1956).
Докл. АН СССР, 119, 836 (1957).
Вестн. МГУ им. М. В. Ломоносова,
Ж. физ. химии, 32, 1168 (1958).
Химическое строение углеводородов
свойствах. М., Изд. МГУ,
1958.
№
4, 205
и
(1958).
закономерности
,
>!
371 . В. М. Татевский,
В. А. Бендерский,
С. С. Я ровой.
Физикохимические свойства парафиновых углеводородов. М., Гостоптехиздат, 1960.
372. Kharasch.
J. Research Natl. Bur. Stand., 2, 359 (1929).
373. Е Н. Гапон.
Ж. физ. химии, 22, 233 (1948).
374. С . С. Бацанов,
В. И. Пахомов. Ж. физ. химии, 30, 142 (1956).
375. П Г. Маслов,
Ю. П. Маслов. Ж. физ. химии, 33, 1687 (1959).
376. Е Moles, M. Crespi. Z. phys. Chem.,. 130, 337 (1902).
Г. Ключников.
УЧч. зап. МГПИ им. В. И. Ленина, 146, 228 (1960).
377.
И. Беркенгейм.
Основы теоретической химии, изд. 3. М., ГИЗ, 1922;
378.
А. Berkenheim. Z. phys. Chem., 136, 231 (1928).
379. Н. Н. Дрозин.
380.
381.
Ж.
физ. химии,
29, 288 (1955).
Е. Тгош Бе.
Compt. rend., 248, 457
P. Sue.
J. chim. Phys., 42, 45 (1944).
(1944).
‘
ГЛАВА
П
СРАВНЕНИЕ ЗНАЧЕНИЙ ДВУХ СВОЙСТВ
В ОДНОМ РЯДУ ВЕЩЕСТВ
ВВЕДЕНИЕ
Второму методу сравнительного
линейное соотношение
ное
в
С" = А, С’ -
котором
при
одинаковых
расчета
а’и
С”
при
условиях
одинаковых
уравнении
С’
(П, 1}
сравниваются
И
значениях
—а’
4
ИЖ
ф(5).
(zg)
значения
двух
Это соотношение будет
(1,4) справедлива для
Действительно,
|
(II, 3)
т. е. соотношение
И
Как и в первом методе
случаи, когда (’иС” должны
например,
Если
бы
о
вполне
lg
в
первом
шкалах
методе
B,
—
As
а”
lg
С’ ии
сравнительного
исключено,
сопоставляемых
Многие
=
(II, 5)
a’b”
—
b’
сравнительного
расчета, здесь возможны
сопоставляться в функциональных шкалах,
С”
Практически
несходстве
возможно.
(II,4)
+a"——,
(П, 1), в котором
As =
личных
ye
,
by
,
G'=—G
В».
расчета
так
рядов,
зависимости
(П,
как
то
сопоставление
оно
во
ВИА
часто
значения
С’и
в
6)
раз-
свидетельствовало
втором
методе
оно
типа
p (G") = Aof (G’) + Ba,
в которых
из
(П, 2)
G" =a" + b’p(g)
следует
76
приближен-
В»,
свойств С’и С” в ряду сходных веществ [1—3].
соблюдаться в тех случаях, когда зависимость
свойств
отвечает
С” сравниваются
ф (С") = 4,6’ - В»;
In G” = 4.4’ -+ В..
в различных
(II, 7)
шкалах, имеют
(II, 7а)
(П, 8)
Иногда различия шкал являются чисто формальными. Так, если существует свойство
С””,
которое
связано
с
другим
свойством
С”
зависимостью
G” = соп$. ш А”,
(П, 9)
то вместо (ПП, 8) можно пользоваться соотношением (II, I), сопоставляя
значения С’и С”.
Во всех описанных соотношениях в качестве С может служить характеристика процесса. Следует также иметь в виду значительное расширение возможностей использования второго метода сравнительного расчета
при переходе от индивидуальных свойств к их комплексам.
Ниже рассматриваются примерно в той же последовательности, что
и в первой главе, различные примеры второго метода сравнительного расчета. В тех случаях, когда С(’и С” относятся к разным группам свойств
или характеристик процессов (например, одно из них является макросвойством, а другое — характеристикой химического изменения), соответствующее
вом разделе
уравнение помещенов более дальний раздел. Поэтому в перрассмотрены примеры применения (П, Г) только к макро-
свойствам; во втором — и к сопоставлению двух микросвойств, и к сопо<тавлению микро- и макросвойств и т. д. В четвертом разделе характеристика фазового равновесия для чистого вещества сначала сопоставляется с
другой характеристикой фазового равновесия чистого вещества, затем с
макросвойствами чистого вещества, с микросвойствами чистого вещества
и со свойствами растворов ит. д.
ЧИСТЫЕ
ВЕЩЕСТВА
Макросвойства
В качестве примера соотношения (1, 1) укажем на приближенную ли-
нейную
зависимость
5 = AsCp + By,
(II, 10)
в которой при одинаковой температуре сравниваются теплоемкость Ср
и энтропия 5 в ряду сходных веществ. Эта зависимость [4, 5] иллюстрируется рис. 78. Аналогичные результаты получаются, например, в рядах
Li,X,(X = Cl, Br, J), XH,D (X =N,P, As),
nCaO-B,O, (n = 1, 2,3)
и др. Уравнение (11, 10) было использовано в ряде работ [9—16]. С его
помощью можно было бы обработать и данные, полученные в [17] по
МеЕ, (Ме = Мо, \, Ш, Ве). Результаты расчета по уравнению (П, 10)
помещены
Другим
в табл.
17.
примером
соотношения
(ЦП, 1) является уравнение
4— Ат - Вь,
*
(И, 44)
где сопоставляются показатель преломления п и плотность 4 веществ
данного гомологического ряда углеводородов [18—26]. Уравнение (11,11)
было
использовано
для
определения
свойств
некоторых
масел
[26].
Применение уравнения (1, 11) для различных изомеров данного углеводорода приводит к менее точным результатам [27].
В работах [28—31] показана справедливость линейного уравнения, в
котором показатель преломления сравнивается с температурным коэффициентом плотности. Это уравнение было применено для анализа различных углеводородных смесей.
Как видно из рис. 79, уравнение (11, 11) может быть использовано и для
неорганических соединений. Другим примером применения (1, 11) к
последним
может
Экспериментальные
служить
данные,
ряд
(СЕ,=<СЕ).Ме,
найденные
в
работе
где
Ме
[33].
= Се,
РЬ,
Sn.
иллюстрируют
C7
возможность
применения
динениям.
Взаимосвязь
4 также
между
может
32h
(1, 11) к фосфорорганическим
диэлектрической
быть
5
уравнения
выражена
проницаемостью
приближенным
e = And+ By.
линейным
сое-
|
и плотностью
уравнением
(II, 12)
(5°
|
к
‚ 24-е
-
№
2016
Li
|
8
Рис. 78. Взаимосвязь
20 C,
между
стандартными
Рис. 79. Взаимосвязь между показателем
о
TeMNOeMKOCTRIO Cp,
(xou/epad--moas) HW SHTропией S°s9s (9. €.) в ряду гидрофторидов
МеНГ. элементов
подгруппы лития
*
<
преломления пр20 и плотностью dP (elen,
в ряду сульфанов Н2бт [32]
[6, 7, 8]
Таблица
Результаты вычисления
(кал/град. моль)
стандартных
«
о
и энтропии 5.45
(э.
е.)
некоторых
о
(С p)208
веществ
AgF
11,4[5]
CoHs5J,
21
ВеЕ.
10,8[15]
СаО . А] Оз
24,4[9]
[4]
BeCle
15 ,0[15]
CaO -2A1203
(CH3)2N H,x
28 ,5[5]
CaO-Al2O3
104 ,5[10]
ЗСа0
103, 3[10]
С.Н ,COOH ж
н-СзН.С8Ньж
н-СзН;ОН
PbFe
TiCle
TiCls
49 [5]
51,0[5]
2Са0О. А! Оз
3СаО . А] Оз
17, 4[5]
17,4[12]
22,6112]
4СаО . Аз Оз
0CaO-Al203
MgCl-6H20
35
[4]
|
|
. 5А15Оз
PreOs
PreOu
TiCl,
ТВ
.*
IIo
этой
величине
(AZogg) Pr,O, = —412,6
a*
По
этой
найдено
36 ,1[9]
ЗА, 0[9]
43,2[9]
46,5[10]
87,7[10]
86 [5]
31 ,0*[14]
116, 7**[14]
23, 8[12]
30,6[12]
29,8[12]
приближенное
значение
ккал/моль.
величине
(42098) Pr.O,, = — 1282
было
17
$ 908
Вещество
(С p)298
‚: Вещество
теплоемкостейи
ea
было
найдено
приближенное
значение
xxan/moro.
Его справедливость можно подтвердить на примере н-алканов и 1-алке-
нов (по данным, рекомендованным в [34] ) и некоторых других соединений
(см. рис. 80).
#8
В работе [36] была установлена примерная линейная зависимость
между поверхностным натяжением и некоторыми другими физико-химическими свойствами кристаллических галогенидов щелочных металлов.
Лагеман и Дунбар [37] указали на линейную зависимость
= A,G’ + В,
(II, 13)
между скоростью ультразвука и некоторыми свойсчвами жидкостей в гомологических рядах (см. также [26, 38]). Б. Б. Кудрявцев [39] обращает
внимание на то, что отчетливая связь между скоростью звука и другими
а,
32
П=2
1.00.
035090
8
7
6
9
4
1
}
9
|
|
L
10
Рис. 80. Взаимосвязь
между диэлектрической
цаемостью = и плотностью 437 (г/смз) в ряду
pd
Г]
Е
прониэфиров
алкилфосфиновых кислот CH ent1PO(C2Hs)2 [35]
физико-химическими свойствами в пределах данного гомологического
ряда объясняется тем, что скорость звука зависит не от величины энергии,
а от характера изменения сил, действующих между молекулами, с изменением расстояния между ними.
В работе [40] указано на то, что электрическая прочность углеводоро-
дов является линейной функцией их плотности.
В ряде исследований найдены линейные
зависимости
между
твер-
достью веществ и некоторыми другими их свойствами [41 —46]. Для диффузии металлов была установлена линейная зависимость между объемом
1 г-ат диффундирующего металла и энергией разрыхления [47].
К перечисленным примерам
можно
прибавить и многие
другие.
К ним относятся:
ван-дер-Ваальса
между
в
взаимосвязь между константами
а и 6 уравнения
гомологическом
ряду
органических
соединений,
коэффициентами
1
/дУ
1 / 0k
=, (55)
rye Me = Li, Na, K, Rb) no данным
<= (35),
работы
(например,
B
pany
MeBr,
[47].
В ряде работ рекомендованы уравнения вида (Ш, 6). К ним относятся,
в частности, приближенные зависимости между энтропией и теплоемкостью элементов [51, 52], энтропией и электропроводностью, объемом
и энтропией [50], атомным объемом и сжимаемостью элементов [51, 52],
плотностью жидкости и скоростью звука в ней [53] (см. также [54],
плотностью
жидкости
К зависимостям
и ее адиабатной
(П, 7) относятся
сжимаемостью
уравнения
вида
[55].
In G, = AsG’ + Bo,
в которых сравниваются два свойства
Фи
с
С" = (ее ЕТ.
С’,
(II, 14)
входящие
в соотношение
|
(П, 15)
Уравнение (11, 14) справедливо для диффузии ((’— энергия активациии
С, — коэффициент диффузии) [57—60] и электропроводности (С’ — энер73
rua активации,
С”, — коэффициент
электропроводности)
[61—66].
Во многих случаях уравнение (11, 14) оказывается справедливым в широком интервале значений С’и Су; так, в работе [65] было показано, что
для электропроводности х полимеров с сопряженнымисвязями оно справедливо в диапазоне 60 порядков изменения у и 20-кратного изменения энерГИИ..
Примером соотношения (П, 1), в котором одно из свойств является
комплексным, могут служить уравнения, найденные в работах [67],
[68], [69] и [70]. Примером линейной зависимости между двумя сложными функциями является уравнение, связывающее рефракцию с константой Саудерса
[71].
|
Микросвойства
Вначале рассмотрим
возможность применения
соотношения
(1,1) к двум микросвойствам и прежде всего к расстоянию между различными частицами. Подобного :рода случаи представлены на рис. 81 и 82.
a
SL
Е
am
20h
Ba
=
Sr
Ca
р
Ч |-
Mg
0
Ur
0
"0
Г
Ir
|_
Be
|
05
1
10
2
15
1
1
1
yf
6
Lf
I
6C
Рис. 81. Взаимосвязь между
Рис. 82. Взаимосвязь между периодами элеменионными Гони атомными г, — тарных ячеек а и с некоторых веществ
с гекса-
радиусами
элементов
подгруппы бериллия (А) [75]
г а.со;
InN;
гональной решеткой (А) [75|
2— ве0;
3—CuH; 4—a-Ta,C: 5—GaN:
7— He;
12 — CdSe;
8—H,;
13 — B-H,0;
Первый из них является одним из примеров
Гат =
(см.
[73, 74]), второй
9—ZnS;
10 —y-MnS;
14—8-AgJ;
15—
8B-SiO,
зависимости
АэГион - Во
— примером
6—
11 — CdS;
(II,
16)
зависимости
a = A,c + B,;
(11,47)
в последней сравниваются значения параметров решетки в ряду изоструктурных веществ. Другие примеры (11, 17) приведеныв [75]. Экспери-
ментальные
данные,
найденные
для
боридов
Се,
ТВ и
U, Ho, Gd [77], MeCl, (Me = Al, In, Tl, Lu, Yb, Tu, Er,
для
монотиоокислов
[79]
и гидридов
[80]
редких
земель,
U
[76],
боридов
Ho, Y, Dy)
[78],
халькогенидов
платины [81], вольфраматов некоторых элементов 182] и для многих дру.
гих изоструктурных соединений, также описываются этим уравнением.
К (П, 16) и (П, 17) можно присоединить [83] и взаимосвязь между
ионными и ковалентными расстояниями в кристаллах, например для сое
динений цинка с элементами подгруппы кислорода (эти величины можно
найти в работе [84]), между радиусами ионов с различными зарядами,
например между гх- и
80
гх»-, где Х
=
0,5,
5е (по данным,
приведенным
в
[85]), и между радиусами ионов и их деформируемостью,
ряду СГ, Вг` и Л
по данным работы [86].
в частности в
|
Линейная зависимость между радиусами «недеформированных» газовых ионов и кристаллохимическими радиусами ионов была установлена
К. С. Красновым [87].
На
основании
данных,
приведенных
в обзоре
Г.
В.
Самсонова
[88],
|
можно говорить о практически линейной зависимости между параметраатомов для боридов
ми решетки и радиусами
С
редкоземельных элементов (немонотонность хода
8Л
обеих величин не может сильно отразиться на
результатах, так как максимумы на зависимостях о
а —
гиг
—
2 совпадают).
= gst
применения
Рассмотрим некоторые примеры
второго метода сравнительного расчета, когда
С’— микросвойство, а С”—макросвойство. |
К ним относится уравнение
a= A,d + Bo,
gab
г
(II, 18)
6
7
et
в котором сравниваются параметры решетки кристалла с плотностью (см., например, рис. 83). Аналогичная связь была установлена между атомны-
рис. 83.
Взаимосвязь
между
плотностью
4
(2/cm?) и
параметром
92] найдена линейная зависимость между радиусами
частиц и их рефракциями.
9. П. Саль-
ряда
ми радиусами и плотностями
дау
жду
[90]. В работах [914,
era (A) cyanbuno „решет-
[931рекомендовал зависимость вида (1,4) мепоказателем преломления и размером элемен-
редкоземельных
элементов [89].
гта;
+— №а;
2— бе;
5—5щ;
3— рк
6 — Gd;
тарной ячейки для Изоморфного ряда форсте7— Dy
рит — фаялит.
Возможность применения соотношения (1, 6) для связи между твердостью и межатомным расстоянием в молекулах была установлена в работе [94] (см. также [95]).
РАСТВОРЫ
ся
Начнем
к раствору.
с рассмотрения примеров, когда оба свойства относят-
Найденная в [96] связь между величиной 0;, характеризующей
изме-
нение содержания свободного растворителя в растворе с изменением температуры, и диэлектрической проницаемостью = может быть выражена
уравнением вида (П, 1). В ряду Г[,1—(С$ из линейной зависимости выпадает
только Li.
Для обработки данных по свойствам стекол Л. И. Демкина [97] предложила воспользоваться уравнением (ТП, 44). Эта рекомендация мотивируется тем, что, во-первых, в этом случае на разбросе экспериментальных точек не сказывается погрешность определения состава стекол; это
весьма существенно, так как точность измерения оптических постоянных
и плотности стекол значительно выше по сравнению с точностью опреде-
ления
их состава.
Во-вторых,
гиперболические
кривые диаграммы
свой-
ство — состав большей частью превращаются в прямые в координатах
свойство — свойство и в них гораздо’ отчетливее проявляется дискрет-
ность изменения
свойств стекол.
Для более надежного
обнаружения
по-
следних Демкина использует метод линейного преобразования координат,
позволяющий резко увеличить разность коэффициентов наклона соответствующих прямых: по одной из осей откладывается не величина,
а разность между измеренными и рассчитанными значениями. На рис. 84 эти
данные иллюстрируются
6
М. Х. Карапетьянц
на примере стекол системы
|
РЪО — Р.О,.
81
К этим соотношениям можно прибавить и некоторые другие, в частности, зависимость между кажущимися молярными рефракциями ряда солей в растворах и текучестью растворов. Линейная зависимость между
ними следует из опытных данных, найденных при изучении водных растворов нитратов некоторых редкоземельных элементов [99].
_
В ряде работ А. Ф. Капустинского и соавторов
новлены
зависимости
вида
(1,
7),
связывающие
[1400—4103] были уста-
парциальные
теплоемкости и энтропии ионов в растворах [4 ((”) = Сь, 5]
сталлохимическими радиусами [f(G’) = г1].
ФАЗОВЫЕ
Чистые
мольные
с их
кри-
ПРЕВРАЩЕНИЯ
вещества
Рассмотрим зависимости вида (ШП, 1), в которых оба свойства
являются характеристиками фазового превращения в однокомпонентной
системе.
Начнем со случаев, когда С’ и
(” относятся к одному и тому же
превращению. Примером подобного рода зависимостей является уравнение
Pup
=
Ар
+
В,
(II,
19)
в котором сопоставлены критические температуры и давления в ряду
гомологов [104, 105] (см. рис. 85). Для н-алканов в работе [107] были
|.
а.
5,0
1/90
40
1750
30
414,70
2,0
160
д
0
L
4
20
|
40
i
БИ
1
60
60
PbO, Mod. Lo
Рис. 84. Диаграмма состав — плотность (а) и показатель преломления — плотность (6) для стекол системы РЬО — Р2О. [98]
Цифры
обозначают стекла различного состава
кр
ч0-
4S,
-
Os
5
30L
Ub
|
3+
_
Re
Ir
Mo
РА
20
i
50
г
150
250
4
1
7 590
Hw
400
800
1200 р 1600
пл
Рис.
85.
тической
Взаимосвязь между кри-
температурой
+; (“С)
и критическим
давлением
Pup
(атм) в ряду н-алканов CAH eno
[106]
82
Рис. 86. Взаимосвязь
между
теп-
лотой плавления АН „(ккал/моль)
и энтропией
плавления
ASin
(э. е.) гексафторидов
некоторых
металлов [109]
Результаты
вычиеления
Углеводород
значений
критических
углеводородов
Формула
Pup
Углеводород
Co Heo
22,2
3-Метилоктан
3-Метилнонан
СиНы
СН
18,3
16,6
3-Метилундекан
3-Метилдодекан
н-Алканы
Нонан
Декан
Со На
Ундекан
Додекан
Тридекан
CisHog
Пентадекан
CisHae
Тетрадекан
[105]
20,1
15,1
Таблица 18
давлений
3-Метилдекан
Ркр(атм)
|
Формула
3-Метилтридекан
СаНаа
СавНза
Сл? Нзв.
11,2
10,0
Нонадекан
Эйкозан
Сэ Нло
СаоНаз
7,9
6,9
2-Метилдекан
2-Метилундекан
8,9 |
СлэНао
3-Метилнонадекан
Со Н42
2,2-Диметилалканы
16,1
2,2-Диметилдоде-
CuHs0
12,4
|
декан
2,2-Диметилтетрадекан
2,2-Диметилпен-
14,8
13,6
19,1
С12Нзв
11,4
2-Метилгептадекан
2-Метилоктадекан
С18Нзв
Сэ Нло
10,4
9,5
2-Метилнонадекан
CaoHez
8,6
2,2-Диметилгептан
2,2-Диметилоктан
9,9
8,9
16,7
С14Нзо
Cis H32
Сл Нз4
11,8
10,8
CysHos
17,5
2-Метилпентадекан
2-Метилгексадекан
3`Метилоктадекан
Ci7H3e
CigHsgg
2,2-Диметилунде-
Ci2Hee
С1з3Нав
2-Метилтридекан
2-Метилтетрадекан
3-Метилгексадекан|
3-Метилгептадекан|
23,5
21,5
22,7
20,8
2-Метилдодекан
14,1
12,9
С»Ноо
Со Н2>
СН
СлоНаа
С На
15,4
12,4 || 3-Метилпентадекан| — СивНа
2-Метилалканы
2-Метилоктан
2-Метилнонан
19,9
18,1
16,6
Си Но
Гексадекан
Гептадекан
Pup
23,5
21,5
С Нав
Ci3Heg
13,7 || 3-Метилтетрадекан| — СльНзе
CigHsg
|
3-Метилалканы
СэНоо
_ СюН22
CiaH30
Октадекан
некоторых
2,2-Диметилнонан
2,2-Диметилдекан
кан
кан
2,2-Диметилтри-
СиНа
С12Н2в
CisH3e2
19,8
18,6
15,4
.
14,2
CisH34
13,4
Ci7H36
12,4
Са8Нзв
11,3
2,2-Диметилгепта-
CipH 40
10,0
2,2-Диметилокта-
Со На2
9,0
тадекан
oe oe
декан
декан
ек-
рекомендованы значения А.= —0,082268 и В.=71, 80. В табл.18 приведены результаты вычисления по уравнению (Ш, 19) критических давлений
некоторых углеводородов, для которых экспериментальные данные отсутствуют.
Приближенное линейное уравнение, связывающее критическую температуру с нормальной точкой кипения, было найдено в работе [108].
Еще одним примером может служить зависимость
ASy. 1 = AsAHg. 1 + Bo,
(II, 20)
в которой сопоставлены изменения энтальпии и энтропии при данном фа‚зовом превращении. Она подтверждается для плавления результатами,
приведенными на рис. 86. На основании опытных данных, найденных в
[4140], можно
воспользоваться
уравнением
(П, 20) для сравнения
6*
83
характеристик парообразования фторидов и оксифторидов различных металлов. То же уравнение можно применять и для сублимации [444, 142].
гомологических ря-
Параллелизм в изменении А Илл и А 5пл [413] в случае
дов может быть описан соотношением
Как
[115] на примере
в работе
показано
(II, 4)
[114].
10 жидкостей,
ния справедливо приближенное уравнение, связывающее
лоемкости жидкости и пара (А, = 0,983; В, = — 10,87).
зовой
[4116], посвященной
работы
результатов
Анализ
щелочных
испарения
среды на скорость
в точке кипе-
изобарные
влиянию
хлоридов,
природы
приводит
теп-
га-
к
t mp,ti
oor
Ir
40r
АН бл
857
05
JOP
20 |.
Re
—
.
мо
70|.
9
10h
—
J
10
и
1
|
4
4
|
20 30 40 50
65
60
н.т.к
Рис. 87. Взаимосвязь
между
нормальной
температурой кипения
Ён тк (°С) И температурой в трой-
ной точке #,, (°С)
ридов
некоторых
в
ряду
|
]
ли
]
Г
"9.
пар
Рис. 88. Взаимосвязь между
теплотой
парообразования»,
AF nap (ккал/моль) и теплотой
гексафто-
металлов
55
сублимации
[109]
АН усл [119]
1 — ГаС]з; 8 — CeCls; 3 —PrCls;
4 — МС
параллелизму между их летучестью [мес! и температурой кипения тк.
В ряде случаев эта зависимость может быть выражена приближенным
линейным
соотношением
Справедливость
разования,
а
[мест = Аэвы.т.к + Bo.
уравнения
С” — давление
(1,
14), в котором
насыщенного
ре), была показана на примере некоторых
родов
[448].
пара
эфиров
(П, 24)
С’ — теплота парооб-
(при данной
температу-
[147, 118] и углеводо-
Теперь обратимся к тем зависимостям, в которых С(’и С” являются
характеристиками различных фазовых превращений. Примером таких
зависимостей
И
являются
ton = Aston + By
AHon = AgAHg.n + Bo.
(I, 22)
(II, 23)
В первом уравнении сравниваются температуры различных фазовых пре‘вращений (например, нормальные точки кипения и температуры тройной точки или температуры превращения и плавления), во втором — теплоты различных фазовых превращений. Эти зависимости иллюстрируются соответственно рис. 87 и 88 (см. также [3] и [83].
На примере инертных газов и некоторых гомологических рядов углеводородов были Установлены линейные зависимости
и
84
д
tep = As (Blew
th Bs
Ро = 45 (ов)тк В
д
(II, 24)
о
(IL, 25)
|
Таблица
19
Сопоставление опытных
[106] и вычиеленных по уравнению
(П, 24)
значений критических температур &кр (°С) в некоторых гомологических
рядах углеводородов [105]
t
Углеводород
Формула
по
н-Алканы;
Пропан
Бутан
В›—=--240,85
96 , 81
152,04
97,08
152,07
CsHie
CeHia
C7 Hie
СзН18
2-Метилалканы;
2-Метилбутан
2-Метилпентан
2-Метилгексан
2-Метилгептан
С5Н12
CeHis
СНлв
Cg Hig
42—11 600,
Вз—=—261,2
216,2
216,4
C,Hie
CgHig
247,7
278,5
42—12 100,
С5Нло
СеНл›
н-Алкилбензолы;
Толуол
Этилбензол
н-Пропилбензол
1-Пропин
1-Бутин
1-Пентин
|
C,Hg
СзНуо
Co Hie
187,7
225,0
258,1
288 , 0
231,4
262,9
291,8
СзНв
1-Пентен
1-Гексен
В.—=— 249,2
231,5
262,4
292
CeHi4
1-Алкены;
1-Пропен
4›=44 450,
В.—=р—247,0
2,2-Диметилалканы;
2,2-Диметилпентан
2,2-Диметилгексан
196 , 42
234,38
267,18
296 , 44
42—41 400,
СеН1а
С.Нле
CsgH18
2,2-Диметилбутан
196,62
234,7
267,01
296,2
187,8
224,9
257,9
288
3-Метилалканы;
3-Метилпентан
3-Метилгексан
3-Метилгептан
вычислено
4›2=11 340,
СзНа
СаНь
Пентан
Гексан
Гептан
Октан
[106]
Kp
247,5
218,2
А опытн.— вычисл.
—0,27
—0,06
+0, 20
+0, 32
—0,17
—0, 24
+0,14
—0,4
—0,2
0,0
+0,4
—0,5
+0,2
—0,2
+0,2
+0,3
Вз=—258,2
91,76
91,5
201
243,5
42=8800,
204,0
243,8
+0,26
0,0
—0,3
Ва=— 87
320,6
346,4
365,6
320,4
344,0
365,6
+0,2
+2,4
0,0
1-Алкины; 4.—=10000, Вз—=—169,8
СзНа
СаНв
С5Нз
127,9
128,2
—0,3
220,3
220,2
--0,1
190,5
190,2
+0,3
между коэффициентами (01/0Р)тк и критическими температурами [105].
С помощью этих уравнений найдены значения #:р и Рьр неизученных углеводородов. Точность этого метода иллюстрируется данными, приведен|
ными в табл. 19 и 20.
В работах [420, 124] было предложено уравнение
lg Pup = А, 8 HT + Bo,
(II, 26)
где П — парахор. В работе [122] аналогичные зависимости были рекомендованы для парахора, с одной стороны, и теплоты парообразования и внеш85
Таблица
20
Сопоставление опытных
[106] и вычиеленных по уравнению (П, 25)
значений критических давлений Ркр(атм) в некоторых гомологических
рядах углеводородов [105]
Pup
Углеводород
Формула
no
н-Алканы;
СзНв
‚
СмНо
С5Наз
CoH
Пропан
Бутан
Пентан
Гексан
Гептан
СНав
Октан
CgHis
[106]
42—=—1000,
42,01
37,47
33,34
29,92
27,04
|
В.=71 ‚85
42,15
37 , 20
33,29
29,94
—0, 44
+0,27
--0,02
—0,02
24,47
+0,17
27,06
24,64
2-Метилалканы;
.42—=р—925,
С5Н12
СвН14
32,9
29,95
32,9
29,9
2-Метилгептан
CgHig
24,8
24,8
С7Н1в
27,2
2-MeTuuamkaHbl;
3-Метилпентан
3-Метилгексан
3-Метилгептан
CeHis
(Нав
CgHig
CeHus
2,2-Диметилпентан
2,2-Диметилгексан
С.Н1в
CgHig
|
0,0
0,0
27,2
Az——980,
0,0
0,0
Be=71,8
30,83
28,4
25,6
2,2-Диметилалканы;
2,2-Диметилбутан
—0,05
В.=68,2
2-Метилбутан
2-Метилпентан
2-Метилгексан
A опытн.—вычисл.
вычислено
30,82
28,4
25,6
As=—960,
--0,04
0,0
0,0
Be=70,3 |
30,67
30 ‚ 8
—0,
28,4
25,6
28,1
25,7
--0,3
—0,1
11.
ней работы парообразования — с другой. Описаны также уравнения вида
(II, 7), B koropmx f (G’) = IgG’(G’ — mapaxop), a p(G’) = G”’, roe G"” =
— Укр» Гкр и Рьр [124], Тнт.ки
Тьр [123]. В первом приближении
для
различ-
ных металлов соблюдается линейная зависимость между температурным
интервалом существования жидкой фазы и отношением средней энергии
дыркообразования к энергии испарения [124].
Перейдем к зависимостям, в которых С’ — характеристика фазового
превращения, а С” — свойство вещества. Рассмотрим вначале уравнения, в которых С’’— макросвойство.
В
ряде
работ
С’ — температура
рой
плавления
были
и показателем
и нефтяных фракций
Ю.
В. Мнюх
установлены
плавления.
зависимости
Линейная
вида
взаимосвязь
преломления
найдена
[125] и для ионных кристаллов
[127] установил
линейную
(ЦП,
1), в которых
между
для
температу-
углеводородов
[126].
зависимость между
температу-
рой плавления и энтальпией н-алканов при данной температуре 7 (Т< Грл).
Этот
пример
соотношения
Нт являются свойствами,
ряду.
(ТП,
4) представляет
тот интерес,
что
и
Гли
немонотонно изменяющимися в гомологическом
А. Виноградов [128] нашел, что для металлов между &л и средней атомной теплоемкостью в интервале от 0°К до Гиз существует линейная зависимость, в которой А, = 0,00104 и В. = 5,45.
86
Между температурой плавления и усадкой металлов
ет приближенная линейная зависимость [128a].
Если исключить
МеКи
[1Х (Ме =
также существу-
14, Ма, К, ВЬ, Сз; Х
=
Е, С1, Вг, J),
то между изменением объема при плавлении солей и некоторыми их
свойствами также существует линейная зависимость [306].
Линейная зависимость между изменением энтропии при испарении и
мольными объемами в ряду сходных веществ была показана на примере
ряда С«Н,В (В =Н,
СН.,
С.Н», н-С.Н., ЕСН.1) в работе [83]. Там же
указывалось на справедливость (1, 1) для С(’= Ытки С" = М (молекулярный вес) в ряду СЕиСЬшт (т = 0, 1,2, 3, 4).
Зависимости вида (П, 6) для гомологических рядов справедливы для
давления насыщенного пара и вязкости жидкости [83] (см. также [129]),
для теплоемкостии точки кипения [130], для
.
теплоты парообразования и скорости ультразву(97
ка, экстраполированной
которой Г"
зависимость
Данные,
тельствуют
на
температуру,
при
= 22,4 л [131]. На одном примере
типа (П,6) иллюстрируется рис. 89.
приведенные в работе [50], свидео существовании приближенной ли-
нейной зависимости вида (11,7) между температурой плавления и энтропией в ряду элементов
подгруппы лития. Соотношение вида (11,7) было установлено в работах В. Гупта между показателем преломления [7((’) = поз] и нормальной точкой кипения (критической темпе-
ратурой) [4$(С”) = Тиль, Тьр] [433] и Мокрушина между мольным объемом в нормальной
точке кипения [1 ((’) = У, к]
и поверхност-
ным натяжением [ф((”) = с] [134, 135].
Зависимости вида (11, 1), в которых
“oer
`
-07
0
г
0
10
20
[9Р
Рис. 89. Взаимосвязь между давлением васыщенного
"Pa р (ии рт. ст.) и вяз.
enon СИН при I ee [132]
|
одна Из сравниваемых
величин
является комплексом свойств, были найдены в ряде работ: рефракция —
нормальная точка кипения [436, 137]', рефракция — критическая температура
[138,
[140]*. Примером
139],
коэффициент -
(5%
—
критическая
температура
п
(П, 8), в котором С’ — комплексное свойство, является
уравнение, рекомендованное С. А. Войткевичем (бС’=7**-0; (” = Р) [141].
Примером
сравнения
двух
комплексных
свойств
служит
взаимосвязь
между парахором и рефракцией. Она может быть подтверждена многими
другими результатами, например данными, найденными для н-С„НиаЕ
[142].
|
Приведем
теперь
несколько
примеров
линейных
соотношений,
в кото-
С” — микросвойство.
Связь между температурами кипения и атомными радиусами была установлена в работах [143] и [144]. Аналогичная зависимость была найдена
рых
между
критической
температурой
и атомными
радиусами
[145]
и темпе-
ратурой плавления и атомными радиусами анионов галогенидов щелочных металлов [83, 146]. Автор последней работы оценил точки плавления
солей астатина и франция (табл. 21).
Сравнивая различные свойства элементов, Хенглейн [147] установил,
что некоторые физические свойства галогенов являются линейной функцией их атомных объемов в точке кипения.
1 В первой из этих работ указывалось и на линейную зависимость между показате‚ лем преломления и температурой кипения.
2 у, т, л — приведенные объем, температура и давление.
87
Таблица
21
Результаты
вычисления
значений
температур
плавления &1, (°С) некоторых
солей астатина
и франция
Соединение
lon
LiAt
440
NaAt
KAt
RbAt
[146]
Соединение
FrF
622
670
632
CsAt
645
FrCl
FrBr
FrJ
613
ton
620
605
585
FrAt
580
Жолье [148] нашел зависимость поверхностного натяжения озохс от
числа атомов углерода в различных
галогензамещенных
н-алканов;
она отвечает соотношению (ШП, 1), в котором г — ковалентный радиус
галогена. В работе О. А. Осипова [4149] подобная зависимость была установлена для различных солей (т — ионный радиус).
Растворы
Вначале опишем уравнения, в которых
характеристиками фазовых превращений.
В работе
углеводородов
[150] на основании
данных
обе величины являются
|
по изучению
растворимости
24
в жидком метане от их {л до (р )сн, была найдена линейная
зависимость между нижней критической температурой растворения и
параметром растворимости Гильдебрандта.
В упомянутой выше работе [448] было показано, что уравнение вида
(Г, 14) справедливо для растворимости родственных веществ в данном
растворителе
((’— теплота
растворения,
С” — растворимость);
см.
также
[151].
В
работе
[152],
являющейся
продолжением
работы
[418],
Берроуз,
уподобив
испарение
чистых
жидкостей
выделению
из
них газов, пришел к выводу, что для каждого из этих процессов справедлива зависимость
TAS = A,AH + Ba,
(II, 27)
где А5 относится к стандартному состоянию Р = 1 мм рт. ст., причем для
обоих процессов действительно общее уравнение, в котором А, = 0,45
и В. =Т.
Другие примеры
дующий
раздел.
зависимостей вида (11,20) и (11,27) перенесены в сле-
Зависимость вида (1, 8), в которой Са’ — изменение объема при образовании осадков солей бария и сульфидов различных металлов, а G”’ их растворимость в воде, была установлена в [453].
Теперь обратимся к примерам, в которых характеристики фазового
равновесия в растворе сопоставляются со свойствами чистого вещества.
В
работе
[154]
сравнивались
силовые
постоянные
газов
Леннард-
Джонса с логарифмами их растворимости в данном растворителе.
В ряде исследований было использовано соотношение вида (1,
lo G” = Ase + By,
|
7)
(II, 28)
в котором диэлектрическая проницаемость растворителя = сравнивается
с растворимостью [155—157] или с объемом удерживания в газожидкостной хроматографии [158]. В последнем случае можно воспользоваться
уравнением (Ш, 28) для выбора неподвижной фазы при хроматографиче-
ском разделении
88
газовых
смесей.
В заключение рассмотрим зависимости, в которых сравниваются характеристики фазового равновесия в растворах с характеристиками фазового
равновесия чистого вещества.
При
изучении
ния {р различных
взаимосвязи
между
критической
температурой
смеше-
веществ с н-алканами и {:т.к последних было обнару-
жено [159], что для СН.ОН, $0,, СН.СОМО, СН,СООН, СН.СОСН, и
бис-В-хлорэтилового
нение
кр =
эфира
справедливо
Ан.т.к + Bo.
урав-
(1,29)
;
nn
. 800-
Зависимость вида (ТТ, 2) в логарифмических
шкалах
tom [160]
была
‚установлена
Ig AT
=
Ag
Ig
Колларом
Tap
+
и
Bg.
“›
работы
[162],
они отвечают
700+
30)
Здесь при данном давлении сопоставлены температура кипения растворителя с повышением
температуры кипения раствора.
Уравнение вида (1, 8), в котором @’ —
критическая температура газов, С no их PaC- _
творимость в данном растворителе, было найдено в работе [164 ]. Как видно изрис. 90, накотором в графической форме представлены результаты
-
Проз-
(II,
второму
К
Rp
os
60
м
:
ЧИ
\
.
L
50
4
200,
L
700
Рис. 90. Взаимосвязь между
температурами
&ь
(С)
ommun Wak
EHO
муотвечающи
давлению при равнове- сии водяного пара с МеС1,
итемпературами плавления
солей #11 (°С) [162]
,
“>
о
методу сравнительного расчета. Установленную в [163] зависимость
между коэффициентом эвтектического взаимодействия и разностью в температурах плавления компонентов также можно отнести к этому методу. <
ХИМИЧЕСКИЕ
ПРОЦЕССЫ
1
Соотношения
(11,
1), (П,
6)
и другие
могут
быть
широко
использованы для химических реакций и различных процессов, которые
являются промежуточными
между
фазовыми превращениями и химическим взаимодействием.
Рассмотрим сначала зависимость вида
AH = A,G' + Bs,
(II, 31)
в которой теплота (энергия) процесса сравнивается с другой его характеристикой.
Одним из первых на линейную взаимосвязь между значениями двух
свойств ряда веществ указал Н. Н. Бекетов в 1865 г. Начав с рассмотре-
ния отдельных веществ
[464], он в дальнейшем пришел к обобщению
[465],
отметив,
что параллелизм, существующий между сжатием и теплотой
образования, в ряде случаев отвечает линейной зависимости между этими характеристиками процесса. Это означает, что
AH = A,AV + Bo.
(II, 32)?
Предметом обсуждения в ряде работ [166—172] было соответствие степени сжатия при образовании соединения его устойчивости. Соотношение между сжатием химического соединения и другими его свойствами
рассмотрено в работах [4173—1476].
Для некоторых веществ закономерность (11, 32) можно связать с тем,
что сжатие при образовании соединения будет тем меньше, а теплота
1 Здесь ЛУ — условная величина, так как одни авторы сопоставляют АН с абсолютным сжатием, другие — с коэффициентом сжатия (см. ниже), третьи выражают величину сжатия в процентах ит. д.
89
образования тем больше, чем ярче выражен ионный характер связи [476].
Уравнение, аналогичное (Ш, 32), было рассмотрено Боусфильдом [477].
А. А. Баландин [4178] предложил формулу, которую можно привести к
виду,
аналогичному
(П, 32); в ней вместо ЛУ константа сжатия
с (равная
мольному объему соединения, отнесенному к сумме атомных объемов
элементов). Несколько ранее он же нашел линейную зависимость между
теплотами образования солей и их спектральными характеристиками [179].
Бильтц
[180]
установил
зависимость
между
разностью
стандартных
потенциалов компонентов и теплотами образования двойных интерметаллических соединений с общим элементом, имеющих одинаковый стехиометрический состав. Кубашевский и Эванс [181] отметили неточность соотношения Бильтца, указав на решающее влияние различия в природе
связи, и предложили пользоваться им для соединений, образованных за
счет главных валентностей. Они приводят [181] уравнение вида
АН
=
А5=% -|-
Во,
(П,: 33)
в котором теплоты образования МеС1,, МеС1, МеВг, МеЗО., Ме0 сопоставлены со стандартными потенциалами катионов (потенциалы анионов Кубашевский и Эванс из расчета исключают, так как в каждой группе веществ анионы являются общими). Уравнение (11, 33) весьма приближенно: ему отвечает погрешность порядка --10 ккал/моль. Это уравнение можно уточнить, если отнести к образованию соединений, растворенных в воде. Справедливость этого была показана в работе [182] для многих солей
34 различных кислот. При этом оказалось, что наклон АЯ — &-прямой
для разных групп соединений колеблется в сравнительно небольшом интервале значений и в среднем равен 24,2 (см. также [183]).
Лотье [484] обратил внимание на существование зависимости (для некоторых групи неорганических соединений) вида
AH" = A,AH’ + Bs,
связывающей
теплоты
В. П. Шишокин
нических
нию
соединений
[185,
образования,
186] показал,
растворения
экспериментальные
AH
= AJ2
(II, 34)
(и
гидратации).
что для некоторых
+
данные
+B 2,
рядов
удовлетворяют
неорга-
уравне
(П,
35)
roe AH — стандартная теплота образования, отнесенная к 1 г-экв, а Г —
ионизационный потенциал соответствующего элемента (см. также [187]).
В работе [188] упоминалось о приближенной зависимости
АНлдисс
—
Agl
дисс
(II,
+ Ba,
связывающей температуры и теплоты диссоциации карбонатов
[189] и рис. 94).
В. А. Комаров
нашел
[190], что для однотипных
A Hoos
—
Aol yp
++ Bp,
36)
(см. также
реакций 1
(II,
37)
rye 7p) — температура начала реакции. Эта зависимость была найдена
на основании изучения процессов восстановления окислов металлов водородом и спиртом и диссоциации карбонатов.
В работе [192] применено приближенное уравнение
AH = AgU + Bo,
(II, 38)
1 Под однотипными реакциями
В. А. Комаров, согласно определению, данному
В. А. Киреевым [191], имеет в виду такие реакции, в которых каждому компоненту
‚ одной реакции соответствует однотипный с ним по структуре молекул компонент другой
реакции, находящийся в одинаковом с ним агрегатном состоянии.
90
в котором сопоставлены теплоты образования и энергии кристаллической
решетки галогенидов металлов (см. также [193]).
В работах
[194—196]
была
установлена
линейная
зависимость
между
энергией кристаллической решетки и некоторыми другими величинами.
Данные,
рекомендованные
в. [197] для Uyeo, (Me = Ag, Pd, Au, Pt)
и энергии связи Ме — О, также удовлетворяют линейному соотношеНИЮ.
В исследованиях, посвященных связи термодинамических свойств
сольватации ионов с их термодинамическими свойствами в газовой фазе,
Н. Е. Хомутов описал ряд уравнений вида (1, 1) [198—201], в частности
(4 НН
60°
сс )
Bao
YOL
20|
0
!
J00
Рис.
ij
|
509
94. Взаимосвязь
(ккал/моль)
|
между
он показал,
!
карбонатов
что теплоты
линейной
1
900
температурами
диссоциации
приближенной
\
700
ТГ дисс
некоторых
сольватации
функцией
I
1
1100
и
|
1
1300
теплотами
двухвалентных
в данном
|
1500
работе
[203]
линейная
1
T дисс.
растворителе
являются
от их энтальпии в газовой фазе
зависимость
была
найдена
J
1700
(АН дисс ) "Тдисс
металлов [189]
Моррис [202] установил линейную зависимость между
ратации анионов и их лиотропным числом (А,<0).
В
|
теплотой
между
[200].
гид-
теплотой
образования ЛН и протонным магнитным резонансом в комплексных соединениях, в [204] и [205] — между АН и сдвигом частот колебаний
Ауо-н
(см. также
[206]).
|
А. В. Киселев с соавторами [207] установили линейную зависимость
между разностью теплот адсорбции на гидратированной и негидратированной поверхности кремнезема и смещением полосы поглощения свободной поверхности гидратированных групп кремнезема.
Уравнение
(II, 31),
rae
с’ —
энергия
С —
Н-связи,
справедливо
для
элементарных реакций образования свободных радикалов при жидкофазном окислении [208].
Линейное изменение энергии диссоциации аминов с их потенциалами
ионизации установлено в работе [209]. Была найдена аналогичная зависимость между энергией возбуждения и потенциалом ионизации углеводородов
[210].
Описана
линейная
зависимость между
силовыми
постоянны-
ми некоторых молекул и их энергией диссоциации [210]. Параллелизм в
значениях энергии диссоциации Ме—0 и энергии связи кислорода реагирующей молекулы с поверхностью катализатора окисления установлен
‘в работе [242].
Найдены линейные зависимости между энергией диссоциации связей
и некоторыми другими величинами [243—215].
На основании данных, определенных в работе [216], можно показать,
что существует приближенная зависимость вида (11,1), в которой сравнивается энергия о-связей с энергией л-связей в молекулах ЭХ. (9 = В,
А1;
Х=Е,
С,
Вт,
Л.
В
работе [247] приводится линейная зависимость
между электронным сродством некоторых ароматических молекул и коэффициентом, характеризующим молекулярный орбитальный резонансный
интеграл.
91
Согласно [218], энергия диссоциации двухатомных молекул связана
с их потенциалом ионизации зависимостью вида (ПТ, 6) (см. также
[249].
Интересно отметить, что на графике |2 Е = } (1с Г) выпадают точки для
1. (в ряду Ме.) и\Е. (в ряду Х,), но точка для Н» оказывается на одной
прямой с Ма., K,, Rb, и С3..
Е. К. Золотарев [220] установил линейную зависимость между энергией гидратации ДН, изозарядных катионов и эквивалентным потенциалом ионаф, равным корню квадратному из отношения суммарного потенциала катионов К радиусу катиона. Таким образом, эту зависимость можно считать примером сопоставления простого свойства с комплексным
(для трехвалентных катионов А, = — 79,8; В, = 321). В другой работе
[224], также посвященной гидратации ионов, найдено, что линейная за-
висимость существует между энергией гидратации и суммарным ионизационным потенциалом, отнесенным к радиусу. Автор этого исследования
считает, что на основании установленного им соотношения можчо объяснить изменение электродных потенциалов металлов в зависимости от их
положения
в периодической
системе
элементов.
Судя по значениям энергии связи кислорода с поверхностью окисного
катализатора и энергии связи металла с кислородом в твердом окисле
(см. [222]), между ними в первом приближении должна соблюдаться за-
висимость вида (|, 1). Хотя значения теплот диссоциации МеС1., (Ме = 5с,
Та, \, Сг, М, Ее, Со, М№ь Си, 7п) меняются немонотонно, но примерно
также немонотонно меняются (хотя антибатно) и значения сумм теплот
диссоциации Ме с их первыми ионизационными потенциалами [223].
Поэтому сопоставление этих величин приводит к результатам, удовлетворяющим в первом приближении уравнению (Ш, 34) (выпадают точки
только для ии №.
В ряде работ было показано существование линейной зависимости вида
АЕ = А.С’ -- Бь
‘между
шириной
запрещенной
зоны
АЁ
(II, 39)
и некоторыми
другими
свойства-
ми полупроводников, в том числе подвижностью носителей тока [224] (см.
также [225]) 1, относительным
значением
силового
коэффициента
[227],
энергией связи [228], поляризацией [229], теплотой образования [230],
энергией кристаллической решетки [234], теплотой атомизации и некоторыми другими свойствами [232—236].
2
Обратимся
теперь
к соотношению вида
AZ = A2G' + Ba,
(II, 40
где изобарный потенциал сравнивается с другой характеристикой хими
ческого процесса. Прежде всего укажем на уравнение
AZ ='A,AH + Bo,
связывающее
основные
его тепловой эффект
АН
термодинамические
(II, 41)
характеристики
процесса —
и изобарный потенциал ЛЯ [237]. Это уравнение
позволяет найти одну из входящих в него величин, не располагая значением энтропии. Последнее весьма существенно, так как наиболее распространенный метод определения энтропии, предусматривающий в общем случае измерение теплоемкости вещества при различных температурах, а также теплот и температур его фазовых превращений, является
сложным и трудоемким, а применение статистического метода ограничено
сравнительно простыми газообразными и немногими твердыми соединеНИЯМИ.
1 В работе
92
[226] дана критика взглядов,
изложенных
в [225].
)
8
Уравнение (11, 44) было широко использовано автором [238—241]
и применено в ряде других работ [242—245]. Оно справедливо и для процессов комплексообразования [246—249] (см. также [250—-252]). Линейное
соотношение
между
тепловым
эффектом
и
изобарным
потенциалом
было установлено и для процесса сольватации ионов [253—255]. В работе
[256] показано применение уравнения ([, 44) для хемосорбции газов на
металлах. К этим примерам можно было бы прибавить много других, в
частности, на основании результатов обработки данных, найденных в
исследованиях
Другим
[257—259]. [См. также уравнение (П, 33)].
примером
зависимости
вида
(П,
40)
служит
уравнение
AZ =$A,AS + Ba,
(II, 42)
справедливость которого для процессов гидратации ионов показана в
работе С. И. Дракина [260] (см. также [261]). Для адсорбции оно было
рассмотрено в [261а].
Зависимость вида (Ш, 40), где 4’— потенциал ионизации, установлена в работах [262—265]; аналогичное уравнение найдено для кинетики
процессов
присоединения
радикала
СГ.
к
олефинам,
их
производным
[266] и к замещенным бензола [267]. Для разности электроотрицательностей она была установлена в работе [268] *. Сравнение суммарного изобарного потенциала возгонки металлов и последующей их ионизации с
работой выхода электронов из металла [269] и в первом приближениис
перенапряжением водорода и катодного восстановления кислорода на
разных
нения
металлах
(ТТ, 40).
Связь
вида
[270] также может
(ПШ, 40)
между
(11,
следует
быть осуществлено с помощью
стандартными
электродными
урав-
потенциалами
и изобарным потенциалом восстановления атомарным водородом окислов
(или гидратов окислов) металлов установил Н. Д. Бирюков [271].—
Можно считать, что изобарный потенциал металлической решетки является примерно линейной
функцией
работы выхода электронов [272]
и перенапряжения [270]Учитывая, что АЙ пропорционален электродному потенциалу, к уравнениям
вида
Н.Е.
Хомутовым
между
работой
40)
[273, 274] для
отнести
и
зависимости,
атомов — электронных
установленные
аналогов. Эти
зависимости справедливы как для водных, так и для неводных растворов.
По аналогичным причинам соотношения, найденные в работах [275—
282], также можно отнести к (II, 40).
Приближенные уравнения вида (П, 40), выражающие взаимосвязь
выхода
электрона
и потенциалом
нулевого
заряда,
были
установлены в исследованиях [283] и [284].
Помимо нескольких упомянутых выше работ можно назвать и ряд
других, авторы которых нашли связь между термодинамической характеристикой процесса (2) и кинетическими ее характеристиками. Так, в
исследованиях В. А. Комарова [190, 285—287] была установлена зависимость (11, 40), в которой АЙ» сопоставлялся с температурой начала
реакции
Гн.р;
Это уравнение
металлов
ния
им
же
было
водородом
окислов
найдено,
что
Таро = АзГнр-
подтверждено
[190],
металлов
для
диссоциации
спиртами
[287].
В».
реакций
(II, 43)
восстановления окислов
карбонатов
В.
[286]
П. Корниенко
и восстановле-
[288—294]
на
1B работе [268] при помощи найденных соотношений были вычислены значения
показателей произведения растворимости рК для 18 неизвестных или неисследованных веществ: Аиз (78), А25(62), Т15(38), (3 (14), VS (—2), TiS (—10), AueSs3 (113),
MneS3 (47), CreS3 (55), VeSs (39), Т155з (39) SceS3 (30), Ag(OH)s3 (50), Cu(OH)s (48),
Au(OH)2(39),Ag(OH)2
(36), InJ (8), InCl 1).
93
примере формиатов и оксалатов Мп, Ее, Со, №1, Са и 7п нашел приближенную линейную зависимость между температурой равного времени
разложения в каждом из этих рядов солей и потенциалами ионизации
Г1.з соответствующих металлов; он показал также, что изобарный потенциал реакций термического разложения этих солей связан с температурами равных скоростей реакции уравнением вида (11, 40). Однотипность реакций, изучавшихся Комаровым и Корниенко, делает понятным
удовлетворительность полученных ими результатов, а влияние степени
компактности и дисперсности объясняет довольно значительный ‘разброс
точек на соответствующих прямых.
~В ряде работ найдены зависимости, которым можно придать вид
А7= Aw+-Bo
здесь изобарный
потенциал
процесса
(или
=
2 А,
(II, 44)
или рК,
или
потенциал;
в частности окислительно-восстановительный потенциал) сравнивается в
ряду сходных процессов с частотами колебаний (или с их изменением)
[204, 292—301]. Так, в работе [299] была установлена линейная зависимость между погарифмом константы устойчивости А комплексов, образованных
Двухвалентными
металлами
(Са,
№1,
Со
и Мп)
с этилендиами-
ном и этилендиамином тетрауксусной кислоты и разностью волновых
чисел максимумов в спектрах поглощения иона металла и внутрикомплексного соединения. Подобные соотношения можно распространить на другие комплексы с целью оценки значений А, трудно определяемых обычными методами.
Упомянем также исследования, где установлены зависимости, которые
можно отнести к соотношениям вида (11,8) и (1,6). В них значения А7(] К)
данного
процесса
сравниваются
с
логарифмом
другого
свойства
(характеристики процесса). К таким работам относится работа [302],
посвященная
роли
химических
реакций
в термоионной
эмиссии,
и работа
[303], в которой была установлена линейная зависимость между величиной константы диссоциации в ряду сложных эфиров алкилбензойных кислот и логарифмом коэффициента экстракции.
3
<
Многие
исследования
связаны
с
уравнением
А5 = АзАН ++ В..Так, в работах [246, 247, 304—306]
|
показана применимость
(II, 45).
(11,45) к про-
цессу комплексообразования (см. также [307]), в [308—340] — к солевым
эффектам, в [341, 312] —
мерах
стирола
к ионному
и бензола);
в работе
обмену (на
сульфированных
[313] это уравнение
сополи-
применено
для
окклюзии (иода на пористых красителях), в [314] — для адсорбции, в
[315] — для гидролиза, в [346—324] — для гидратации (растворение со-
лей), в [322—331] — для растворения
соединений
‘.
газов и разложения
органических
При применении уравнения (Ш, 45), как, впрочем, и других рассматриваемых уравнений, возможно разного рода варьирование: например,
можно сопоставлять характеристики растворения данного газа в различных, но сходных по природе, растворителях и характеристики растворения близких по свойствам газов в одном растворителе.
В работах [246, 247, 304—334] был получен ряд интересных результатов. Так оказалось, что в ряду ионов с одинаковым типом гидратации
величина интегрального изменения связанной энергии Т`А5 однозначно
определяет изменение энтальпии; следовательно, независимо от того, при
1В
94
некоторых
из упомянутых
исследований
применено
уравнение
вида
(11! 27).
помощи каких факторов получена величина АН (путем варьирования температуры или сетчатости ионитов, или размера иона), ей всегда сопутствует одинаковая
новленной
ции Ку
в работе
величина
ТАУ
[320], удалось
некоторых солей 1. В
[3141]. На
основании
оценить
работе
зависимости,
значения стандартной
уста-
энтро-
[331], посвященной процессам кра-
шения, было изучено взаимодействие между некоторыми дисперсеными
красителями антрахинонового типа и органическими растворителями;
автор установил, что величина А, зависит от полярности растворителя;
таким образом, угловой коэффициент может быть использован для определения характера взаимодействия при растворении красящих веществ.
4s”
10r
|
Ba
+
он
гм
q
-
Рис.
лотой
92. Взаимосвязь
АН
между
(ккал/моль.град)
теп-
2
Рис.
и
|
я
93. Взаимосвязь
ниями АН*
энтропией
Ах
(кал/моль-град)
процессов экстракции [332]
Sr
Co
j
|
Ш,
дн*
между
значе-
(ккал/моль) и изменением
энтропии
А5* (кал/моль-град) при
самодиффузии ионов в силикатных
расплавах [К›О-МеО-4510.] [333]
К рассмотренным примерам можно было бы прибавить ряд других.
Так, уравнению (1, 45) соответствуют данные работы [332] (см. рис. 92}
и результаты обработки данных, найденных в исследовании, посвященном самодиффузии щелочных ионов в силикатных расплавах
[333]
результаты
определения относительной силы алкилгалидов
(рис. 93),
как акцепторов протонов [334], результаты
исследования влияния катионов Ме’(Ма’, К’, ВЫ, С3з*) на образование хлоридных комплексов
кадмия
[335]
и т. д.
Обзорные работы, посвященные уравнению (Ш, 45}, написаны TK. Лефлером [336] и О. Экснером [337].
Следует
подчеркнуть
два
обстоятельства.
Во-первых,
уравнение
(П, 45) непосредственно связано с уравнениями (ТТ, 41) и (Ш, 42): любое
из них вытекает из остальных двух. Во-вторых, из уравнения (Ш, 45)
непосредственно вытекает (см., например, [338]) зависимость вида (11,44),
известная под названием компенсационного эффекта. Помимо упоминавшихся ранее работ [57—66, 417, 118], в которых этот эффект связывался
главным образом с нехимическими процессами, существует много исследований, где его наличие установлено для химических процессов или
процессов, приближающихся к химическим. В виде уравнения
In ko
=
ДЕ
--
Ba,
(II,
46)
где А, — предэкспоненциальный множитель в уравнении Аррениуса и
Ё — энергия активации, компенсационный эффект впервые был обнаружен в работе Констэбла [339] и в дальнейшем служил предметом изучения и обсуждения в других публикациях [340—383]: Так, в работе [355]
были изучены отравление и модифицирование катализаторов; оказалось,
что графики А, —Ё для Са—Сг- и Ме Сг-катализаторов с различными
1 [1С1Оа (29,3 э.е.), ВЪМОз (32,0 э.е.),
Ca(C1O4)2 (54,0 9.e.), Sr(ClO4)e (55,6 9.€.).
СзМОз
(31,7
9.e.),
Mg(NOs)e
(36,0
9.e.),
95
добавками отвечают общей прямой. В работе [384] была установлена связь компенсационного эффекта с эффектом трансвлияния И. И. Черняева.
Необходимо
иметь
в виду, что компенсационный
эффект
может
прояв-
ляться не только вследствие влияния разных образцов катализаторов оди-
наковой
химической
природы,
но
и в результате
влияния
способов
при-
готовления одного и того же катализатора, а также в результате влияния
изменения катализатора в процессе его работы.
Совпадение уравнений (1, 46) и (Ш, 45) иллюстрируется
(рис.
94), построенным
“4H
на основании
|
-
закономерностей
катали-
тической дегидроген изации алкилароматических
углеводородов, в
результате чего был установлен
параллелизм между АН и А5 при
адсорбционном
вытеснении продуктов
дегидрогенизации с активных центров катализатора.
70-
60|-
Объяснению компенсационного
эффекта уделено внимание в ряде
исследований [342, 370, 371, 376,
oO
y
ит
10
50
0
Рис. 94. Взаимосвязь между
AS
изучения
|
графиком
(кал/град. моль)
и
7
-45
энтропиями
энтальпиями
АН
378]. Попытка его теоретического
обоснования сделана и в работе
[384], где отмечена также возможность применения уравнения вида
(П, 46) к различным
процессам.
Действительно, например, при расТВОрении
Данном
ряда
сходных
растворителе
солей
получается
в
Srna, neeapen Aauaporemsoene © тарифмом растворимости и энер
о)
процессов
1—crmpon:
2 —mponen
луол;
4 —
абсорбционного
вы-
ропенилбензол;
$ — винилтовинилксилол;
5 — метилстирол: 16 —
изопропенилтолуол;
7 — изопропенилксилол
линейная
гией
зависимость
растворения
(см.
между
[385]).
Применимость уравнения
(II, 46),
по-видимому,
не
ло-
вида
ограни-
чивается рассмотренными случаяМИ. Можно было бы присоединить к ним результаты кинетических исследований (например, на электрохимическом материале) и некоторых других (см. также стр. 79—80 и 85).
Таким
образом, хотя автор работы
[337] не без основания
считает, что
рода
и охват
линейные соотношения между энтальпией и энтропией в ряду родственных реакций, строго говоря, часто и не соблюдаются, однако если иметь в
виду
приближенный
характер
такого
закономерностей
большого и разнородного фактического материала,
выводу о продуктивности их применения.
ими
то следует прийти
к
4
величины
сится
К соотношениям supa (II, 31), 8 koTropHx o6e сопоставляемые
являются
характеристиками
химических
процессов, отно-
и зависимость
E = A,A
+H
Bo,
(II, 47)
где сравнивается ‚тепловой эффект с энергией активации [386—389]. Эта
зависимость, которая известна как уравнение Поляни, послужила темой
исследования и обсуждения в нескольких работах [390—399]. Так, в
статье
[390],
посвященной связи между строением
виниловых
соединений
и их способностью к полимеризации, было установлено, что в ряду бутадиен — стирол — метилакрилат — винилацетат по отношению к радика96
лам любого типа падает реакционная способность и убывает экзотермичность соответствующих реакций. В исследованиях посвященных реакционной способности свободных углеводородных
радикалов
|394, 392],
было высказано предположение, что А, является характеристикой типа
электронного перехода, а В, — характеристикой данного ряда.
Эванс и Поляни произвели детальный теоретический анализ (11, 47),
причем они исходили из предположения, что это соотношение своим
происхождением обязано линейной зависимости Ё и АН от некоторого
параметра
A. H. Ji. Соколов
[395] указывает
на сомнительность
того, что-
бы в общем случае мог существовать параметр, который, отражая особенности молекулярного взаимодействия в некотором ряду реакций в зависимости от структурных характеристик реагентов, в то же время отвечал условию, постулированному Эвансом и Поляни. Соколов делает
попытку
обоснования
(11,
47),
свободного
от
указанного
недостатка.
В
работе Ю. Л. Спирина [399], посвященной энергии активации радикальных реакций, дан вывод уравнения ([, 47) из уравнения Лондона.
Зависимость между теплотой образования (разложения) промежуточных мультиплетных
комплексов
и‘ энергией активации
также выражается уравнением
(П, 47) (см., например, [400]). С этим уравнением
связаны и так называемые
«вулканообразные
кривые» [401—
410], связывающие
высоту
энергетического
барьера
с адсорбционным
по-
тенциалом в гетерогенных каталитических реакциях и позволяющие подойти к решению вопроса о подборе оптимального катализатора. «Вулканообразные кривые» получены и в других кинетических исследованиях,
в частности при изучении зависимости температуры достижения определенной степени превращения в зависимости от теплоты образования соединений
[4141].
В заключение
женным
зультатам,
[396],
отметим, что хотя уравнение
однако
оно
приводит
если изучаемые процессы
[412] и [413].
к
вполне
|
(ПП, 47) является прибли-
аналогичны
удовлетворительным
(см., например,
ре-
рабаты
5
С уравнением
(ПШ, 47)
связано
соотношение
Igk = A,lgK + Bo,
(II, 48)
в котором сравниваются константа равновесия К и константа скорости
реакции А. Действительно, если принять, что коэффициенты уравнения
(1, 48) не зависят от температуры, то из (Ш, 48) непосредственно следует
|
(ПТ, 47).
Кинетические и термодинамические характеристики относятся к различным свойствам системы. Поэтому при их сопоставлении по уравнениям
типа
(ПП, 47) и (1, 48)
хорошего
соответствия в общем
случае не наблю-
дается. Ведь ряды сродства не тождественны рядам реакционной способности. Однако в группе родственных веществ можно ожидать появления
такого параллелизма. На это было обращено внимание более 50 лет тому
назад в работе [414], где отмечался параллелизм между силои кислоты и
ее каталитическим действием (см. также [415] и [415]). Количественная
связь между ними впервые
была
дана Тэйлором
[447].
Уравнение (11, 48) обычно называют уравнением
Брёнстеда, так как в
работах Брёнстеда и соавторов [418—421] оно было подвергнуто тщательно-
му анализу. Если в соответствии с работой Брёнстеда считать, что к — каталитическая константа (константа скорости реакции, катализируемой кисили
лотой
нования),
7
М.
Х.
основанием),
то
в
Карапетьянц
(ШП,
а К — константа
47)
Е — энергия
диссоциации
активации
кислоты
(или
ос-
каталитического
97
процесса, а АН — теплота диссоциации кислоты
(основания).
Уравнение, аналогичное (11, 48), было выведено А. Н. Фрумкиным [422].
В ряде статей приводится вывод уравнения Брёнстеда, его анализ для
различных процессов, обобщение и обоснование [423—425].
Это уравнение широко используется химиками; для примера сошлемся как на несколько старых работ [426, 427], так и'на ряд новых [428—
432]. С помощью уравнения (1, 48) можно решить многие задачи; в частности, зная константы уравнения Брёнстеда, можно предсказать результаты каталитического действия неизученных кислот.
6
получим
Если отнести
уравнение
уравнение
k
lg
([, 48)
K
к
стандартным условиям,
= Arle =.
то
(II, 49)
Пусть оно связывает константу скорости взаимодействия У с каким-либо
реагентом и силу соответствующего замещенного бензойной
кислоты
ХС.Н.СООН.
Тогда К
и,
— константы
скорости
реакции
соответствен-
но при наличии и отсутствии заместителей Х, КиК, — константы ионизации замещенной и незамещенной бензойной кислоты (в воде при 25°С).
ля
каждого
заместителя
рактеризовать его влияние.
Тогда (ЦП, 49) примет вид
величина
К
]о
— будет
Ко
различной
Введем обозначения
у
1
— 05.
А, =р
м
и будет
и
ха-
К
Igy о. =о.
(П, 50)
Эта зависимость известна в литературе под названием уравнения Гамметта.[433—435]. В нем р — величина, характеризующая процесс и завися-
щая
только
от типа,
условий
реакции
и участвующих
в ней производных
бензола (она является мерой восприимчивости реакционного центра к
влиянию заместителя), ас — величина, характеризующая заместитель и
зависящая только от его вида и положения в бензольном кольце (она является мерой влияния заместителя на реакционную способность).
Таким образом, уравнение Брёнстеда относится к типу уравнения
Гамметта. Последнее применимо и к константам равновесия:
ШК. = 03.
Обычно
значение
А,
при
=
расчете выбирают
1. За
стандартную
стандартную
принимают
|
реакцию,
ионизацию
(II, 51)
приписывая
бензойной
ей
кис-
лоты в растворе при 25°С; для нее сн+= 0. Для любого заместителя б выражается логарифмом отношения к ней константы ионизации замещенной
бензойной кислоты.
Придав уравнению (ЦП, 50) вид
Igk = ps — Ig ko
(II, 52)
и проделав аналогичное преобразование для уравнения (ШП, 51), мы получим зависимость, отвечающую второму методу сравнительного расчета в
виде соотношения (Ш, 6), в котором С(’=оа и С" = А.
Уравнение Гамметта применимо к конотонтем скорости или равновесия для производных бензола в мета- или пара-положениях. Оно не применимо
для
орто-замещенных
(вследствие стерического эффекта). Ряд
клонений от (П, 52) обусловлен кроме
сопряжения и другими причинами.
98
стерических
факторов
от-
явлением
Не имея возможности даже перечислить хотя бы часть многочисленных исследований (их сотни), которые связаны с уравнением (11, 52), его
видоизменением и развитием, отметим лишь некоторые работы. Тафт
(см.
[436]) осуществил количественное разделение влияния заместителей на составляющие, соответствующие эффектам сопряжения,:- индуктивному и стерическому. Браун и Окамото [437—439] модифицировали
уравнение Гамметта и показали, что при изменении значения константы с,
уравнение (|, 52) может быть использовано для описания реакций электрофильного замещения водорода в бензольном кольце ароматических соединений. В работе [440] осуществлена проверка уравнения Гамметта, а
в [441—445] показано, что это уравнение находится в соответствии с выводами квантово-механического подхода к оценке реакционной способности.
М.
М.
Хидекель
выявления
Л.
М.
Кабачник
таутомерии
[450]
с соавторами
[446—448]
описали
применил
и протолиза
уравнение,
уравнение
Гамметта
для
[449]. А. А. Баландин
являющееся
аналогом
(Ш,
и
52).
Примеров применения уравнения (ШП, 52) для обработки опытных данных можно привести очень много. Важно отметить, что оно позволяет получить ряд выводов. Так, авторы работы [451 ], сравнивая наклонр прямых
Igk = Ко) для реакций водородного обмена двух кетонов, смогли количественно оценить эффекгивность передачи влияния
‘' заместителей через
бензольное кольцо, двойную связь, сопряжение с бензольвым кольцом и
систему дифенена. В другой работе [452] небольшое значение р привело
ее авторов к выводу о том, что изучаемая ими реакция гидролиза сложных
виниловых эфиров при катализе ионами ртути мало чувствительна к изменениям в строении алкильных остатков виниловых эфиров.
|
Уравнение Гамметта, играющее существенную роль в количественной
оценке реакционной способности органических соединений в связи с их
строением, с каждым годом находит все большее применение; оно распространено на алифатические кислоты, амины и многие другие классы органических соединений. Оно используется и для фосфорорганических соединений
(см.,
например,
[453]),
и
для
фторорганических
солей
[454].
Широкое применение уравнение Гамметта нашло в полярографических исследованиях, где оно используется в слидующем видоизменении:
Ex.’ = EX + pysx;
(II, 53)
здесь £1, — потенциал полуволны, т. е. потенциал в точке, где ток достигает половины предельного значения. Это уравнение использовано в
работах Зумана и других исследователей (обзор см. в работе [455]). Ука-
жем
также
на
последние
работы
в этой
области
[456,
457].
С
помощью
уравнения (Ш, 53) можно решить ряд задач: выяснить механизм электродных процессов, предсказать возможности разделения аналогичных соединений
ит.
Уравнение
стям
Д.
(11, 53), так же как и (Ш, 52), можно
вида
Другим
G’
примером
=
зависимости
Ao
(П,
4
отнести к зависимо-
Bo.
(II,
54) служит
у = А.с - В.,
54)
уравнение
|
(П, 55)
связывающее эффект заместителей с частотой колебаний (полосой поглощения) [458—478]. Из только что опубликованных работ отметим два исследования [479, 480], в которых была найдена линейная зависимость
между константамио и смещением электронных спектров поглощения, являющимся следствием замены растворителя («сольватохромный эффект»).
Зависимости вида (П, 54) были установлены также в работе [481] для
С” — потенциала ионизации, в работе [482] — для электроотрицатель-
ности,
в
[483] — для
коэффициента
влияния,
в
[484]
— для
7*
силовых
99
постоянных, в [485—487] — для магнитного резонанса, в [488] — для дипольного момента.
В работах [488] и [489] отмечается, что с константами заместителя коррелируются многие физические свойства молекул.
Большой
материал
по связи строения
с реакционной
способностью
ор-
ганических соединений, и в частности относящийся к уравнению Гамметта, можно найти в обзорах [490] и [491] и в трудах конференции по
проблемам
химии
[492].
применения
корреляционных
уравнений
в
органической
7
Ряд уравнений вида (1, Г) можно сгруппировать по следующе.
му признаку: в них сопоставляются спектральные характеристики родственных молекул с другими характеристиками (например, энергетическими):
v= A,G’ + Bo,
_ (1,56)
где у — частота колебания (или ее смещение). Таким образом, уравнение
(ТТ, 55) можно рассматривать как частный случай (11,56). К числу уравнений вида ([], 56) относятся и уравнения, упоминавшиеся в первом раз-
деле
этой части,
в которых
С’ — тепловой эффект
процесса.
К ним можно
присоединить
результаты
других
работ,
в частности
работ [493],
[494] и [495]. В [496] частотный сдвиг сопоставлен с константой основности различных соединений, в [497—500]
— с энтропией растворения
(гидратации), в [5041] и [502] —с ядерным магнитным
[503—508] — с потенциалом ионизации. В работе [506]
ние линейной взаимосвязи между потенциалом
молекулы и ее спектральной характеристикой.
резонансом, в
дано обоснова-
ионизации органической
В исследованиях [509—
512] частота колебания
сопоставлена с рядом других свойств. Так, в
работе [509] найдена линейная зависимость между инфракрасными часто-
тами связей С — Н в монопроизводных бензола (при условии, что заместитель соединен с кольцом через насыщенный атом углерода) и процентом
ориентации в мета-положение первой группы при нитровании. В работах
[514—527] была показана справедливость приближенного уравнения
—AX+B,
=
(II, 57)
где Х — электроотрицательность. Так, Кагарайс [517] показал, что частоты колебаний связейС = О в соединениях у >С = О линейно зависят
от суммы электроотрицательностей атомов Х и У, ав ХСООВ — от электроотрицательности атома Х, тогда как строение алкильного радикала
практически не оказывает влияния на них. Уилмшерст [520] нашел линейную зависимость между частотой колебаний группы СН. и электроотрицательностями атомов Х и У в молекулах СН.ХУ. Борелл [524] пока<
зал,
что
смещение
ew
xX
абсорбционного
максимума
ow
в ультрафиолетовой
обла-
сти у алифатических карбонильных соединений является линейной функцией электроотрицательностей элементов, соединенных с С = О. Было
найдено также [525], что в спиртах типа Phy-n 9 (ОН)„,где Э — один из элементов четвертой группы периодической системы, частоты валентных колебаний ОН-групп линейно зависят от ХЪ.
Помимо сопоставлений электроотрицательности со спектральными характеристиками известны сопоставления этой величины с другими параметрами. В уравнении
Х = A,G’ + B,
(II, 58)
Х (или разность электроотрицательностей) сравнивается с ядерным магнитным резонансом
[528—537], со стерическими постоянными
[538],
100
со степенью ионности связи [539], с энергией сопряжения [540], с термоионной функцией работы [544], с константой сжатия [542]. Введенная
A. Ф. Капустинским кристаллохимическая электроотрицательность также
является
линейной
[543].
функцией
различных
физико-химических
свойств
8
Приведенными выше примерами не исчерпываются возможности
применения второго метода сравнительного расчета к системам и свойствам, связанным с химическими изменениями. К этим примерам можно было
бы прибавить, — имея в виду соотношение (11,1), — и взаимосвязи между
энтропией гидратации и энтропией ассоциации в водном растворе [544],
энтропией и изменением объема при активации [545], силовой постоянной
и потенциалом ионизации [546], силовой постоянной и порядком связи
[547], числом гидратации и степенью обмена [548], величиной химического сдвига и константой спин-спинового взаимодействия [549, 550], хими-
ческим
сдвигом
протонов
и ряд других примеров.
Параллелизм в скачках
типа
радикала
объема
и выходом
ДУ
продуктов
и теплоемкости
Me, + Me.SO,4 = Me, + Me,SO,,
синтеза
АСр
[551]
в реакциях
установленный в работе [552], также приводит к удовлетворительному согласию с уравнением вида (Ш, 1).
Примером (1, 6) может служить найденная в работе [553] зависимость
между относительной когезией и константой скорости реакции, примером
(11,8)
— результаты изучения обменной экстракции [554].
9
Теперь
обратимся
к обзору зависимостей, в которых
для
ряда
сходных
веществ величина, в той или иной степени характеризующая
химические свойства, сопоставляется с макросвойством вещества.
К уравнениям вида (ПП, 1) можно отнести зависимости между теплотами образования Мех», (Х = С1, Вг, 7) иатомным объемом (Ут-о)х,
[555],
теплотами
соединений
образования
Га.Оз, Се.Оз,
ческих
и молекулярной
[70], теплотами
Рг.Оз
рядах
образования
концентрацией
и энтропиями
[44], теплотами сгорания
органических
соединений
в рядах
соединений
и рефракцией
[556],
теплотами
ионных
в ряду
в гомологисмачивания
кремнезема одноосновными спиртами и объемом сорбционных пор силикагелей, получаемых из этих спиртов
реакций и полярностью заместителей
[557], между энергией активации
[558, 559], сродством к метильному
радикалу и молекулярной рефракцией [560], изобарным потенциалом образования некоторых полийодидов и оптической плотностью [564], парциальными молярными теплотами растворения некоторых газов в воде и
их поляризацией [562], «эффектом растворимости» и показателем преломления [563], электрической прочностью и другими свойствами кидких
диэлектриков
[564,
565].
К уравнениям вида (II, 6) относятся взаимосвязи в рядах сходных веществ мольных объемов и энергии кристаллической решетки [566], каталитической активности ионных катализаторов и электропроводностью
[567], константой равновесия и диэлектрической проницаемостью растворителя [568], шириной запрещенной зоны и показателем преломления по-
лупроводников
Зависимости
и константой
и шириной
[569—571]. —
между
скорости
запрещенной
диэлектрической
реакции
[572,
573],
проницаемостью
магнитной
зоны изоэлектронных
растворителя
восприимчивостью
соединений
[574], показа“es
101
телем преломления и энергией кристаллической решетки [575] принадлежат к уравнениям вида (ПЦ, 7).
К уравнению вида (Ц, 8), являющемуся частным примером (11,7),
относятся зависимости между дипольным моментом и константой диссоциации [576], атомным объемом металлов и их энергией решетки [577],
удельным сопротивлением полупроводников и температурным коэффици-
ентом ширины запрещенной зоны [578].
Взаимосвязь между диэлектрической
проницаемостью
диэлектриков
и энергией запрещенной зоны, отнесенной к первому ионизационному потенциалу [579], можно рассматривать как пример второго метода сравни-
тельного
свойством
расчета,
в
в котором
комплекс
функциональной
свойств
шкале.
сравнивается
с простым
10
Ряд закономерностей можно считать примером сопоставления
физико-химических величин, связанных с химическими свойствами, и
микросвойств веществ. К уравнениям вида (П, 1) относятся взаимосвязи
между радиусами ионов и различными величинами: теплотой гидратации [ 580]) и некоторымитермодинамическими характеристиками солей, связанными с их растворимостью
Е
в воде [581]; между перенапряжением водорода (и кислорода)
на различных металлах и межатомным расстоянием [582]; положением длинноволнового мак‚симума поглощения различных
комплексных анионов и ионным радиусом комплексообразователя
лентных
[583]; частотами ваколебаний и длиной
связей [584]; минимумом погло-
|
щения в инфракрасном спектреи
сс
расстоянием металл — кислород
Рис. 95. Взаимосвязь между энергиями активации Ё (ккал/моль) реакций ВС1-|Ма МаС!--- В и электронным зарядом связей © —С1
<
сн
м сон
ес: «сна
5 — CH. GH,CH.Cl;
6—
CH,
=
CH,CH,C;
CHCH.Cl
}
CHCl: 3 |
В некоторых
минералах [585];
энергией и длиной связей СХ
[586—587]; энергией активации
и
межатомным
расстоянием
|
[588—590];
и
энергией
электронным
[590а];
активации
зарядом
коэффициентами
связи
влия-
ния для колебаний многоатомных молекул и длиной связей
[594—593];
электрическим зарядом и длиной связи [594] ит. д. Судя по данным, приведенным в работе [595], характер немонотонности хода значений теплот
образования алюминидов в ряду переходных металлов Т! — Си совпадает
с характером немонотонности
хода значений Айм._л1; вероятно поэтому в
первом приближении взаимосвязь между АН и Ла будет описываться
уравнением вида
Выпадение
(Ш,
точек
1).
для
OsO,,
ReO;
u WO?
авторы
исследования
[583] связывают с участием ]-электронов в комплексообразовании тяжелых металлов. В работе [587] приведены предсказанные (по линейному
графику) значения энергий связей для ряда веществ.
Все
точки
на
прямой,
выражающей
энергии активации и о-электронным
нии атома хлора в реакциях
зависимость
зарядом
RCI + Ма-—> МаС1 + В
102
между
связи. СС
изменением
при
отщепле-
(рис. 95), отстоят от прямой по вертикали менее чем на 0,5 ккал, тогда как
точность значений ЕЁ, положенных в основу построения рис. 13 в [590а],
составляет в лучшем случае - 0,5-1,0 кал/моль [396]. Единственным исключением
является
точка
для
хлористого
аллила;
по
Г.
В.
Быкову
в
[598] —
[590а], это объясняется тем, что при образовании активированного состояния уже частично совершается переход к аллильному радикалу, сопровождающийся выделением части энергии реорганизации.
Во многих работах установлена зависимость вида (11,6): так, в [596] и
[597] — между
между
радиусами
радиусами
атомов
атомов
и потенциалами
и силовой
постоянной,
в
ионизации;
[599] — между
сило-
вой постоянной и длиной связи; в [600] — между интенсивностями колебаний; в [601] — между силовой постоянной и энергией диссоциации.
Закономерность, установленная в [600], позволяет отличать сопряжен-
ные
МО.-группы
лать по частотам
К
в
молекулах
неизвестного
колебаний).
соотношениям
вида
(П,
7)
относятся
строения
нельзя
закономерности,
ные в работах [602]и [603] для полупроводников.
когда 1(С”) = (”, можно
(чего
сде-
установлен-
К ним же для случаев,
присоединить и взаимосвязи между энтропия-
ми гидратации ионов и их радиусом [604, 605], потенциалом ионизации и
радиусом недеформированного газообразного иона [606], электропровод-
ностью и „постоянной
решетки
[607],
микротвердостью
и радиусом атомов
[608], силовой постоянной и межъядерным расстоянием [609]-шириной запрещенной зоны и радиусом атомов
YF
3
[610],
ALP
i
энергией и длиной связей [611].
Примером второго метода сравнительного расчета, в котором
энергетическая характеристика сопоставляется
с
комплексом
результаты,
для
ширины
ношения
диусу
свойств,
найденные
в работе
запрещенной
зоны
а в работе
и
[612]
OT-
[613]
для
предельной теплоты растворения жидкого нитрата Са (5ги Ва) в нитратах
щелочных металлов в зависимости от
функции
радиуса
уравнений,
В литературе
которые
сопоставлению
описан
можно
характеристик
ряд
отнести
химичес-
к
кого процесса со свойствами раствора.
Так, к уравнениям вида (П, 8) относятся
ТЕ
НЧ
ионов.
11
зависимости,
найденные
ALAS
служат
межатомного расстояния к ра-
катиона,
GaP
в
рабо-
400
InAs
|
800
1200 ‚ 1600
Рис.96. Взаимосвязь
турами плавления
nn
между
темпера-
1,5 (°С) и шириной
запрещенной зоны АЕ (ккал/моль)
некоторых соединений [633]
тах [614] и [615] для коэффициента активности электролита и энергии
и других свойств, в работе [616] — для конценткристаллической решетки
рации, отвечающей минимальной электропроводности раствора электролита,
и силы
нениями,
кислот
которые
(см.
также
[647]).
Есть
работы,
можно объединить соотношением
AZ = А.-=1- Б.;
связанные
с урав-
(П, 59)
здесь г — диэлектрическая проницаемость растворителя, А2 — изобарный
потенциал различных процессов [616, 618—620]. Это соотношение было
применено в ряде полярографических исследований, посвященных влиянию
103
растворителя
на
состав
и устойчивость
комплексных
соединений
[621—629].
Некоторые работы можно объединить по следующему признаку: в них
найдены соотношения, в которых сравниваются характеристики химического процесса с характеристиками фазового превращения в однокомпонентных или в многокомпонентных системах. К первым относятся взаимосвязи между температурой плавления окислов карбидообразующих
металлов и температурой начала их восстановления углеродом [631], температурой
плавления
полупроводников
и
шириной
запрещенной
зоны
[632, 633] (см. рис. 96), теплотой сублимации металлов и температурой
заданной степени превращения [634] (см. также [400]), поверхностным
натяжением
и
энергией
решетки
и
энергией
связи
[149],
температурой
плавления и энергией решетки [635], электрической прочностью и теплотами сублимации [636], поверхностным натяжением и перенапряжением
водорода [637] и ряд других (см., например, [36]). Ко вторым можно отнести взаимосвязи между растворимостью в рядах сходных солей и энергией
частот
кристаллической
в спектрах
решетки
[639].
ПРЕДЕЛЬНЫЕ
СЛУЧАИ
[638]
и между растворимостью
и сдвигом
|
СООТНОШЕНИЯ
(п, 1)
`е
В литературе описан ряд приближенных закономерностей, которые можно рассматривать как примеры предельных случаев соотношений (11,1), (II, 6), (II, 7), UI, 7a) a (П, 8). Так, предельными соотношениями вида
(Ш, 1) будут
G’ =G’+
и
B,
(II, 60)
G" = A,G’.
(II, 64)
Если иметь в виду возможность сопоставления в различных шкалах,
то следует учитывать, что данное уравнение может одновременно относиться к соотношениям, в которых 4. = 1, и к соотношениям, в которых
Б. = 0. Так, прологарифмировав (11, 64), получаем уравнение
IgG” = IgG’ + B,; ему отвечает прямая
на
Ao
=
1.
Возможны
в логарифмической
случаи,
когда
соотношение
(ТТ, 61), хотя в (11,1) А.==1иВ.-Н0.
г
шкале
(II, 62)
с коэффициентом
(11,4) приводит
накло-
x (II, 60) uum
Так, если в рядах Ги П (В.)1 = (Вь)п,
АС" = ААС’;
(II, 63)
если в (П, 1) для обоих свойств будут одинаковы коэффициенты наклона,
т
АС” = Аб’ + В».
К
уравнениям
вида
(ПП,
60)
относятся
(II, 64)
взаимосвязи
между
атомными
и ионными радиусами [640], теплоемкостями пара и жидкости [641],
нормальной точкой кипения и критической температурой членов гомологического ряда [642], энтропией гидратации катионов и энтропией комплексообразования [643], коэффициентом, характеризующим энергию наинизшей незанятой орбиты, и потенциалом полуволны [644]. Частный слу-
чай связи
энергии
активации
с теплотой
реакции,
рассмотренный
в рабо-
те [645], также отвечает условию (Ш, 60).
Взаимосвязь между мольным объемом жидкости и разностью энергий
вещества в состоянии идеального газа и жидкости, согласно работе
[646], в первом приближении можно выразить уравнением вида (II, 62).
Эта же зависимость справедлива и для связи между теплопроводностью и
104
атомным
объемом
металлов
[647].
Согласно
[648],
для
металлов
взаимо-
связь между коэффициентами линейного расширения и их температурой
плавления также представляет собой зависимость вида (ЦП, 62). В работе
[649] была предложена формула, связывающая температуру плавления
с межатомным расстоянием кристаллов; ей можно придать вид (Ш, 62),
причем для кристаллов Мех типа МаС ВБ. = 2,303 1 3050. Связь между
электропроводностью и внутренним трением найдена в [650]. При рассмотрении механизма окисления органических соединений на твердых неметаллических катализаторах [651] было предположено существование зависимости вида (1, 62) между константой скорости перехода электрона от органической молекулы к катализатору и редоксипотенциалом катионов.
В исследовании [652] установлена зависимость между работой кислотной диссоциации К и электронным
можно придать вид (Ш, 62), где 4’=
Значительно
больше
Пропорциональная
известно
сродством заместителя
Еи а” = К.
закономерностей
зависимость
альных веществ установлена в работах
между
вида
Ё,
(11,
которой
61).
макросвойствами
индивиду-
[652] (коэффициент расширения ме-
таллов и их теплоемкость), [653—656] (энтропия и теплоемкость), [657]
(изобарная и изохорная теплоемкости жидкостей).
Примером (IT, 61) для микросвойства может служить зависимость
между частотой колебаний для связи 51—Н иэлектроотрицательностью
углерода
[658].
Во многих исследованиях найдены уравнения вида (11, 61), в которых
одно из свойств (или оба свойства) является характеристикой фазового
превращения. ВК ним относятся работы [659] (теплота парообразования и
температура кипения), [660] (объем в точке плавления или в точке кипения и при абсолютном нуле), [664, 662. 663] (критическая температура и
температура кипения или плавления), [664] (плотности жидкости в тройной и критической точках), [664—668] (различные физико-химические
константы электролитов), [669, 670, 6711 (поверхностное натяжение и
теплоты
фазовых
превращений
металлов),
[672]
(поверхностное
натяже-
ние и теплота парообразования расплавленных солей; см. также [673]),
[674, 675] (характеристики плавления и энергия активации самодиффузии металлов;
см. также
[665]),
[676] (фактор ассоциации и силы ассоциа-
ции жидкости в нормальной точке кипения), [677] и [678] (различные
свойства).
К этим примерам можно было бы прибавить и другие. Так, обработка
данных [679] по мольным объемам различных веществ в кристаллическом
и жидком состоянии в точке плавления позволяет рекомендовать приближенное уравнение вида (ТТ, 61) (рис. 97).
|
К зависимостям
связаны
энергией
(1, 61), в которых
кристаллической
турой кипения)
дов
вида
с химическими свойствами,
[684],
[680—683],
адсорбционным
решетки
одна
можно
из величин
отнести
и температурой
или обе они
взаимосвязи между
плавления
(темпера-
энергией связи и частотой колебаний
перенапряжением
и
каталитическим
гидри-
перена-
пряжением [685], константой, характеризующей энолизирующую способность электролита, и константой таутомерного равновесия [686, 687],
энергией
структур
восстановления катиона и энергией возбуждения электронных
СО-групп [688], работой выхода электрона из металлов и изо-
барным потенциалом возгонки металлов и последующей их ионизации
[689], потенциалом полуволны и константой заместителей [690].
К уравнениям вида (11, 60), в которых одно из свойств является комплексом, можно отнести взаимосвязь между величиной, содержащей порядковые номера и валентности ионов, и межионным расстоянием; это
уравнение
было выведено К. А. Путиловым
между изохорной теплоемкостью
металлов,
[691]. Укажем
также на связи
отнесенной к их коэффициен-
105
там термического расширения, и теплотой возгонки
ром и потенциалом
ния,
ионизации
установленной
соединений
[693], между
в работе
(см. также
[694]
[694а]).
для
[692], между
рефракцией
некоторых
парахо-
и теплотой
рядов
горе-
органических
Примером пропорциональной связи значений логарифмов свойств,
т. е. примером соотношения (Ш, 6), в котором ВБ. = 0, являются результаты, полученные в работах [695] и [696]. Примером подобного рода для
о
и“, [
20
AN
80+
60+
UO
201
0.
Рис.
| /
97.
|
|
i
20
Взаимосвязь
]
между
сталлическом и жидком
J
40
объемами
состояниях
]
различных
смешанных
17 —
шкал
РНз;
18 —
может
качестве С’ принять
Вгз;
служить
с, ав
в
веществ
Pb;
Кг;
кри-
[679]
Pun
`
7 — Bi; 8 — D,;
15 — Хе; 16 —
20 — СС14; (® — инертные газы)
и уравнение
качестве
между константой заместителя
пределения данного вещества
вещества (см. [697].
лах,
19 — СН;
80
У (смЗ/моль) при
1 — Са; 2 — Hg; 38 — №; 4 — 8п (серое); *5 — НО; 6 —
9—Н,; 10 — Не; 11 — Ar; 12 —CDa;
13 — CHa;
14—
СНа;
—
60
С” —
Гамметта
(Ш,
50),
если
в
а ‚и в частности взаимосвязь
и логарифмом отношения константы раск константе распределения стандартного
Описаны также закономерности вида (1, 61) в функциональных шкаотличающихся от арифметической и логарифмической. Их примером
служит взаимосвязь между обратной критической температурой и обратной температурой кипения эжкидкости [698].
Примером «разностного сопоставления», и в частности уравнения (11,63),
могут
служить
результаты,
найденные
в исследованиях
[699—705].
Так.
в работе [702] было показано, что разность энергий активации ЛЁд;;
двух субстратов из одной серии (например, А; и А;) пропорциональна
разности соответствующих энергий локализации ЛЁЕт,;;; следовательно,
логарифм константы скорости реакции присоединения на каждый реакционный
106
центр
пропорционален
соответствующей
энергии
локализации.
В работе [705] было установлено, что необходимыми достаточным условием соблюдения уравнения Гамметта для всех заместителей Х. водорода в
молекуле
*
=
»
*
В —Н служит равенство изменения энтропий активации: Лот, х==
.
Аэтн.
Следует подчеркнуть, что подавляющее большинство известных в литературе зависимостей вида (ПП, 61) являются приближенными. Так, в ряде работ [706—709] отмечается неточность упомянутых выше соотношений
между критической температурой и температурой кипения [661].
ВОЗМОЖНОСТИ
УТОЧНЕНИЯ
НЕКОТОРЫХ
СООТНОШЕНИЙ
Если исключить влияние погрешности опытных данных и не
рассматривать некоторые грубо приближенные закономерности, то следует иметь в виду два возможных способа уточнения результатов вычисления.
1
Многие уравнения были предложены для описания свойств
самых разнообразных веществ. Это удобно, так как позволяет охватить
большой фактический материал одним уравнением. В ряде случаев погрешность результатов вычисления оказалась незначительной (см., например, [102], [185]). Однако
ных уравнений для описания
в большинстве случаев применение подобсвойств группы сходных веществ ,в COOT-
ветствии с идеей методов сравнительного расчета приводит к существенному выигрышу в точности. Это позволяет также дать оценку точности
значений
С’и
С”,
рекомендуемых
в различных
исследованиях.
Для иллюстрации повышения точности за счет выделения родственных веществ ! можно сослаться на многие из упомянутых выше исследований,
в том числе
на
[141, 224, 228, 265, 302, 326, 395, 549, 671, 703]. Так,
выделив точки для н-алкилацетатов (или 2-метилалканов), мы обнаружили
бы очень хорошее следование уравнению, рекомендованному в [141]. Исключение тех веществ, для которых можно ожидать парамагнитные вклады,
приводит к повышению точности расчета по соотношению, найденному в
[549 ].
|
К этим примерам можно прибавить много других. Так, выделение
сходных веществ приводит к значительному уменьшению разброса точек
при расчете по уравнению, рекомендованному в [710], и на графиках,
приведенных в [711—715]. Если, например, исключить точку для СН. =
—= СНСН.&, то остальные ложатся на две прямые: СС, — (СН.)3 С(@— (СН). CHCl — CH,CH,Cl u CCl, — CHCl, — CH,Cl, —CH,Cl [714].
Ряд криволинейных зависимостей за счет уменьшения интервала значений С’ и С” (связанного с выделением сходных объектов) дает линей-
ные соотношения. Укажем, например, на графики, приведенные в работах [716—719]. Так, исключение точек для нитрогруппы в [747] и [718]
приводит
ных
к линейной
молекул
линейным
зависимости;
и паразамещенных
зависимостям.
объединение
молекул
(см.
точек
[719])
для
также
метазамещен-
приводит
к
Проиллюстрируем сказанное на нескольких графиках.
В работе Е. Ф. Пичугина [720], в которой было установлено, что поверхностное натяжение о и теоретическая прочность металлов омакс ПОдобно различным физическим свойствам подчиняются принципу периодичности, было найдено также, что в первом приближении связь между этими свойствами линейна. Действительно, как видно из рис. 98, амакс пример-
но
пропорциональна
о.
Однако
выделение
сходных
веществ
приводитк
+ Разумеется, это выделение имеет смысл только в том случае, когда фактический
материал достаточно надежен.
107
существенному выигрышу в точности. Так, элементы, имеющие незаполненную 4-оболочку (Та, Мо, \), лежат на одной прямой. Значительно
отклоняющиеся от общей зависимости щелочные металлы также лежат на
одной прямой, что показано в левом верхнем углу рисунка. Эта прямая
резко отличается от первой. Элементы подгруппы меди также образуют
отдельную прямую, причем и здесь, так же как и в других случаях
(см., например, стр. 53), последовательность Си— Ас — Аи нарушается.
Можно добиться значительного повышения точности, если на графике
АФнлт.к —
АН
ниям (рис. 99).
выделить
точки,
соответствующие
сходным
соедине-
12
nao?
7,
[326]
Г
0,06
Г
004
0,8
0,02,
г
0
060,4
Г
|
02
Mg
Al
an I
r Cd
0
Рис.
Oo
on
Na
500
|
Cs
K
1000
98.
Взаимосвязь между
1500
|
поверхностным
|
2000
натяжением
прочностью металлов акс
[7
у
2900
3000
9900
с (эрг/см?)
и теоретической:
б
Если описание с помощью уравнения (11, 19) критических параметров
различных (низкокипящих) углеводородов (A, = — 0,095); B, = 51,75.
[721, 722]) приводит к мало удовлетворительным результатам (рис. 100),
то применение этого уравнения к одному гомологическому ряду дает су-.
щественное уточнение.
Вместо того, чтобы применить уравнение:
Ot
tw = Aa (SP)aan TB
к ряду
те [723]
родственных
веществ, как это было
было предложено
воспользоваться
ниях
составит
:
сделано
им для
(IT, 69)
в [105],
большой
в рабогруппы
различных изомеров; естественно, такое использование уравнения (11,65).
резко уменьшает точность результатов. Так, если для всех алканов использовать одно и то же уравнение (1, 65), то среднее отклонение в значе{р
2,5” (что
примерно на порядок превышает погрешность
экспериментальных
данных),
причем для
н-алканов
(С.Н, — СН:
вычисленные величины оказываются преуменьшенными на 5,3° (см. также рис. 101).
Как видно из рис. 102, пропорциональность энтропии и теплоемкости
[653—655] дает очень большой разброс точек (так как ею охватываются
самые разнообразные вещества). Но выделение сходных веществ (на рис.
108
102 выделено
три ряда родственных
соединений)
резко повышает
точность
результатов.
И еще один пример, показывающий возможность уточнения, связанную с уравнением (11, 47), дан на рис. 103. На этом графике, заимствованном из монографии [396], представлены данные по тепловым эффектам
АН и энергиям активации Ё некоторых элементарных радикальных реакций. При построении чертежа во избежание его загромождения были использованы только значения ЛН и Е для процессов взаимодействия СН.
р
Kp
JOT
50
45
40
35
30t
и
5
в
Рис.
99.
Взаимосвязь
парообразования
между
АН, .
„
29
теплотой
(ккал/моль)
|
50
]
100
|
190
!
200
18 _}
300
250.
Рис. 100. Взаимосвязь между критическими температурами [у (°С) икритическими
и энтропией парообразования Аб т 4
(кал/моль- град) различных веществ [326]
давлениями Р„, (атм) некоторых
1— №;
2 — Ar; 3— N23; 4— СН; 5 — CO;
6 — 033
7 — С.Н.
8 — (41,
9 — HCl;
10 — HBr; 11 — HJ; 12 — N.O; 13 — CH;Cl;
1 — этен; 2 — этан;
3 — пропен;
4 — пропан,
5 —пропин;
6 — 1-бутен;
7 — 2-метилпропан;
8 — н-бутан; 9 — изо-бутан; 10 — 2-пентен; 11 —
неопентан;
.12 — 2-метилбутан;
13 — н-пентан;
14 — 2-метилпентан;
15 — н-гексан;
16 — 2-метилгексан;
17 — н-гептан;
18 — 2-метилгептан.
Выделены ряды сходных
веществ:
2—4—8—
— 18—15—17 и 12—14— 16—18
14
—
С,Н
СТ;
15
—
17 —
ацетонитрил;
23 —
u30o-C;Hi,;Br;
C35 H::Cl;
26
29
Выделены
—
—
СН;
изо-С,Н!:1С1;
18 —
24 —
27—
н-СьН11СГ;
ряды
11,
CgHi4;
сходных
16
19 —
СС;
25 —
SncCl,;
30
—
—
C323
CHCI,0;
транс-
28—C,H;CH;;
C.H,Cl.
веществ:
9 —
10 —
дородов [106]
углево-
13—14—20—29
и Ма с различными молекулами. Из рисунка видно, что взаимосвязь между АН и Е для различных процессов не может быть выражена одним уравнением. Даже для реакций с одним и тем же радикалом можно говорить
лишь о примерной группировке точек вдоль одной прямой. Если же выделить точки для реакций, в которых один и тот же радикал взаимодейст-
вует со сходными молекулами, то уравнение (1, 47) выполняется гораздо
лучше, особенно, если принять во внимание значительную неточность
поставляемых величин и прежде всего энергии активации '.
То, что уравнение
(1, 47) является лишь
грубым приближением
со-
при
использовании его для вычислений значений Ё различных радикальных
реакций, видно из следующего [392, 393]. Величина
АН для
реакции
В,
-
В.В
— В.В, -
В;
определяется лишь величинами ER,-R, H ER,R, Ho sneprua активации помимо последних зависит еще по меньшей мереи от природы радикалов, от
типа элементарного перехода и от характера В, — В.- и В, — В.-связей. Следовательно, ДА Н является одной из переменных, определяющих Е.
1 Необходимость сравнения соединений со сходной структурой для обнаружения
параллелизма между общим запасом энергии и скоростью реакции впервые, по-видимому, отметил Я. М. Паушкин [724].
109
28
29
Cap
9300г
29,627
-
426
292119
80
154
479817
250+
7113
9
°"8-
10
8
а
7
2007
5,
750
6
|
J
a
0030
0,050
0,045
C040
0,035
_—
}
|
|
1004
(at /
Рис.101. Взаимосвязь между величиной
OP)
mx
(Ot/OP)., on 4. и критической температурой р
для различных
углеводородов
[83]
С)
1 — пропан;
2 — изо-бутан;
3 — н-бутан;
4 — неопентан;
5 — 2-метилбутан;
6 — н-пентан;
7—2,2-диметилбутан;
8 — метилпентан;
8а— 2,3-диметилбутан;
9 — н-гексан;
10 — 2.4-диметилпентан; 11 — 2,2-диметилпентан; 12 — 2-метилгексан; 13 — 2,2-триметилбутан;
14 — 3-метилгексан; 15 — 2,3-диметилпентан; 16 — н-гептан; 17 — 3,3-диметилпентан;
18 — 2,2,4-триметилпентан;
19 — 2,5-диметилгексан;
20 — 2,2-диметилгексан;
21— 2,4-диметилгексан;
22 — 2-метилгептан;
23 —
4-метилгептан;
Выделены
ряды
24 — 3-метилгептан; 25 — 3-этилгексан;
26 — 3,3-диметилгексан;
27 — 2,3,4триметилпентан; 28 — ч-октан; 29 — 3,4-диметилгексан.
сходных веществ: 1—3—6—9— 16—28 (н-алканы), 4—7— 11—20 (2,2-диметилалканы), 2--5—12—22 (2-метилалканы)
о
5298
б0Г
ТГ
#0|-
df |
40 |90
5
20
25
30
85
YO
|
]
45
SO
]
|
55
60
Р 298
Рис.
102. Взаимосвязь
между
теплоемкостью
S 308 (9. €.) жидких
Выделены
5(н-СН::ОН);
110
ряды
сходных
веществ:
(С р)ээв
(кал/моль-град)
органических веществ
1(СНзОН)
—
2(С,НзОН)
6(HCOOH)—7(CHsCOOH) —8
(n-C,H,COOH);
11 (C,H;H — C,H,)
—
и
энтропией
[83]
3 (н-С.Н,ОН)
9(C,H,CHs) —
—
10
4(н-СН:ОН)
—
(C.H,;C.H;) —
Если
же
ного
рассматривать
гомологического
производить
С’ и
С”
реакции
ряда,
экспериментальные
происходит
аналогичным
‘мостей этих свойств
данного
радикала
то уравнение
данные,
от некоторой
так
образом
с молекулами
(II, 47) должно
как
в этом
хорошо
случае
вследствие
изменение
подобия
третьей переменной.
од-
вос-
зависи-
В данном
случае
BH
20
1
р
Рис.
103.
|
5
Взаимосвязь
|
|
10
15
между
энергией
|
20
e2s
|
25
|
30
активации
___L
5
Е
a
Ё (ккал/моль) и тепло-
вым эффектом АН(ккал/моль) в реакциях СН; -- ВН — СНа--В(О)и Ма --
+ ВХ -, Мах +В
1
—
СН.;
2
—
C.Hs;
— СН(СН.) —СН;
15 —
22 —
3
—
u30-C4H,;
4
7 — (СНз):зС; 8 —
—
(®) [396], где В:
и30-СьНат;
CH.Br; 146—CHBr,.; 17 — CH3;
18 — CH.C;
C3H,; 23— (CH3)3C; 24 — CH. = CH; 25 —
C.H;;
Выделены
ряды
28
сходных
—
5
—
1430-СзНаз,
(СН.).СС(СНз).СНз;
C,H:;;
веществ:
29
—
6
9 — (СНз).@
—
СН.С(СН.)—
— СН(СН.) —
19 — CCl H; 20 — CCl3; 21 — C.H;;
CH, = CH — CH; 26 — СН.; 27 —
СН,
=
СН.
1—2—8—4—5,
12—138—14,
18—
19—20,
17—21—22
речь
идет
энергия
об аналогичном
разрыва
характере
связи
зависимости
ЕЁ и АН
отв,
где ё —
В, — В. (так как остальные переменные,
деляющие величину Ё, фиксированы). С теоретической точки зрения
дует ожидать, как отмечает Н. Д. Соколов [395], что при уточнении
периментальных данных для Ё и АН окажется, что для реакций
ВВ +В,
>В -
опре-
слеэкс-
ВВ,,
различающихся, например, природой двух радикалов, значения А. и ВБ.
в (1, 47) будут несколько различными. Это означает, что опытные данные
можно описать системой прямых.
|
2
Вторая возможность уточнения описываемых в литературе
уравнений обусловлена переходом от уравнения, в котором А. (или В.)
имеет определенное значение (в частности, предельное), к уравнению вида
(II, 1).
Подобным
образом
описанных в работе
[726],
а также
можно
уточнить
ряд
уравнений
вида
соотношения
вида
G’ (G’)" = const,
рекомендованные
(II,
61),
[725] (см. [37]), или зависимость, рекомендованную
в ряде
работ
(см.,
например,
в
(II, 66)
[49,
53,
727]).
К возрастанию точности приводит переход от пропорциональной зависимости между теплотами образования соединений и сжатием при их
образовании
[165] к линейной
Если вместо уравнения
зависимости.
U = Aslan,
(II, 67)
111
рекомендованного
в
[680—683],
воспользоваться
уравнением
UO = Aslan + Be,
(II, 68)
то получим более точные результаты. Действительно, построив по значениям энергии кристаллической решетки и температурам плавления галогенидов МеХ
(Ме = Ма, К, ВЬ, Сз) графики
0 /Гьл =
(Гия), убеждаемся
в том, что точки, вопреки уравнению (1, 67), ложатся на кривые; в коx
|
ординатах же О/Гнл = ] (Тил) они, в соответствии с уравнением (1, 68),
в первом приближении оказываются на прямых (рис. 104).
ИТ
Во многих случаях оба пути уточне018 =
ta
ния связаны друг с другом: выделение
_
5
aime
cr
0,16 }0,15
Рис.
CL
90
чиной,
ления
ити
(Br
95
между
вели-
решетки
приводит
к
необходи-
ной работе уравнения вида (11, 61) к зависимости вида (П, 1). Это можно проиллюстрировать и ранее приведенным
— примером (см. рис. 102), и уравнениями,
связанными с работами [684] и [693].
Можно указать и на рис. 97: точки для
инертных
обратной температуре плавJT) (°K-1), w
отношением
кристаллической
веществ
мости перейти от рекомендуемого в дан-
Rh PX
ip
|
Br
>
©
‚[—
100
в
nn
104. Взаимосвязь
энергии
сходных
Q
газов
(они изображены
тым контуром), Ни
прямую, которая при
(7
попадет
(ккал/моль) к температуре плавления
в начало
Наконец,
натрия калия, рубидия и цезия [83]
зали-
ШО. ложатся
продолжении
координат.
необходимо
иметь
ва
не
в виду,
что если для одного ряда веществ второй метод сравнительного расчета при-
меним в виде соотношения (11,1), то для
другого ряда та же связь (’ = КО’) описывается
циональных шкалах. Примером подобного рода
имосвязь
между
теплотами
образования
АН
и
уравнением в функможет
служить вза-
потенциалом
иониза-
ции / [185, 186]; для различных групп веществ требуется переход от / к
ф(Г), причем характер ф (Г) зависит от вида ряда, что является результатом сложного влияния различных факторов на сопоставляемые величины.
ОБ
ОБОСНОВАНИИ
НЕКОТОРЫХ
УРАВНЕНИЙ
Помимо мотивов, связанных только с конкретными видами соотношений (Ц, 1), (11, 6), (11, 7) или (1, 8) 1, в ряде случаев можно привести общие соображения, являющиеся основой нескольких аналогичных уравнений.
Так, если для двух свойств или характеристик процессов С’ и С”
справедлива зависимость вида (1,4) и, в частности, (Т, 90)
G=a- bg,
rye
(11,1).
—
В
параметр
частности,
вещества,
это
то тогда
относится
(II, 69)
будет
действительно
к результатам,
соотношение
найденным
в работах
[728] и [729]. В первой из них установлена линейная зависимость между
различными свойствами (сродство к электрону, теплота образования,
энергия гидратации анионов, энергия ионизации) и логарифмом радиуса
анионов;
во второй найдена линейная зависимость
свойств соединений типа ВХ», где Х — элемент данной
ряда физических
подгруппы перио-
дической системы элементов и В — атом или группа атомов (температура
кипения,
' поляризуемость, показатель преломления и т. д.), от суммы
эффективных
галогенов).
номеров
атомов
элементов
данной
подгруппы
(например,
1 См., например, обоснование уравнения (11, 41) в главе [Х или уравнения
в [625], уравнения (ПП, 48) в [394] и др.
(11, 59)
Подобным
образом
попарным
сочетанием
линейных
зависимостей
раз-
личных свойств полупроводников от суммарного атомного номера [633]
можно получить некоторые уравнения вида (ШП, 1), в частности взаимо-
‘связь
между
шириной
запрещенной
зоны
и
температурой
Ряд примеров второго метода сравнительного
вать, исходя из уравнения (Т, 91)
расчета
плавления.
можно
а =а- т,
являющегося частным примером
обосно-
(I, 70)
(11, 69). В уравнении
(ТТ, 70) п — число
групп СН. в алкильном радикале соединений, образующих гомологические ряды. Как известно, это уравнение справедливо для теплот образования, теплот сгорания и многих других свойств (см. главу Г), а в варианте
62а =а-
бп
(П, 71)
оно справедливо для давления пара, произведения растворимости, константы равновесия и т. д. (см. главу Г). Это было установлено в ряде ра-
бот (см., например,
[730].
Если уравнение (|, 70) справедливо для двух свойств, то из него непосредственно следует уравнение вида (ШП, Г), а в случае справедливости
уравнения
(11, 71) — уравнение
с числом атомов углерода
метиламидов алифатических
Подобным
образом
можно
вида (1, 6). Так, из линейного изменения
теплоты и
энтропии возгонки
некоторых
кислот [731] следует уравнение вида (Ш, 45).
вывести
линейную
зависимость
между
раз-
личными физико-химическими свойствами углеводородов
[732]. В ряде
случаев мотивировать применимость (11,48) можно с помощью уравнения
(II, 71).
Необходимо при этом иметь в виду, что для многих свойств и параметров процессов справедливо условие
b’ = b";
в подобных случаях будет соблюдаться
стве примеров приведем уравнения
(II, 72)
соотношение
(П, 60).
В
каче-
Vip = bp + Be
(II, 73)
AH crop = (Hr — Ho) + В».
(II, 74)
В первом
из
этих уравнений
сравнивается
константа уравнения
‘ван-дер-Ваальса с критическим объемом, во втором
— энтальпия вещества
с его
для
ний
(это
на
теплотой
сгорания.
Справедливость
уравнений
(П, 73)
и (П, 74)
гомологических рядов обусловлена постоянством разности значе‘указанных свойств для всех членов данного гомологического ряда
непосредственно видно из параллельности соответствующих прямых
рис. 73).
|
Соотношение (П, 1) будет справедливо и в тех случаях, когда для
каждого
вида
из
если с’= с”
сопоставляемых
о
[19]
(см.
также
свойств
ба
[21]
а’и
Ес’
С” действительна зависимость
(II, 75)
и [25]).
Ряд уравнений
может
быть найден
сочетанием
других. Так, если
для свойств С’, Ца” и С” справедлива зависимость вида (Ц, 1), т. е.
С" = A,G' + B,,
G" = A,G’ + Ba,
8
м.
Хх. Карапетьянц
(II, 76)
(II, 77)
113
то
будет
справедлива
и
зависимость
С" = А, ("+ В».
(П, 78)
В качестве примера укажем на результаты работы [37]. В ней было
установлено, что в гомологических рядах скорость звука связана линейной
зависимостью
с пятью
другими
физическими
свойствами
жидкостей.
Из этих пяти уравнений вида (П, 1) можно
получить
много новых, часть которых в литературе не описана.
К этому примеру можно присоединить и ряд других. Так, сочетание
уравнений,
описанных
в
работе
[108]
(и
[123]),
приводит
для
гомологических рядов к линейной зависимости
между
нормальной
точкой кипения
и критической температурой.
Примеры
подобного
рода следуют и из результатов работ [303] и [555].
В ряде случаев связь одних уравнений с другими требует дополнительных условий. Так, связь уравнений (П, 47) и (П, 48) очевидна,
но из последнего вытекает предыдущее лишь при условии, что коэффициенты уравнения (1, 48) не зависят от температуры.
Если каждое из сопоставляемых свойств связано с другим соотношением
вида
с’
G=a-e RT,
(II, 79)
причем для С’и С” справедливо (П, 1), то будет справедливо и уравнение (ПШ, 6). Последнее может оказаться действительным и при менее
жестких условиях. Так, объяснить хорошую воспроизводимость опытных данных по вязкости и давлению насыщенного пара с помощью
УР
Ign = 4.
авнения
(см. рис. 89) можно следующим
зависимость этих свойств для
уравнениями
р;
=
Р- В»
(II, 80)
образом. Как
1-того члена
,
известно, температурную
ряда можно
выразить
_ (АНпар i
Aye
|
RT
|
(II,
81)
И
N=
a-e
о
(Ел
=
ВТ,
|
(II, 82)
где АНпар
— теплота парообразования
и Е, — энергия
течения. Переписав (П, 81) и (П, 82) в виде
ПР
И
находим
Сравнение
АН
рее
18 а,
(II, 83)
(Е.
lon, 81; ==
—
(П, 84)
+ в,
lgn;, = БТ
ay le© Pit
(gqh
i
(АН.
(Ana
(П, 85) с (ЦП, 80) показывает,
(Ei
ях
>i
са;
+
ра:
.
что в данном
(II, ’ 85
)
случае
= А.
И
(II, 86)
-
Fahy a;-+lga;—B
(Hn
oo) BE Oe
114
активации вязкого
.
(II, 87}
|
Соблюдение этих условий связано с тем, что хотя (Е,); и (АНнар); от
вещества к веществу меняются, но их изменение в пределах небольшого
числа соединений данного гомологического ряда можно считать примерно
одинаковым, как одинаковы и относительные изменения отрезков, отсекаемых экстраполированными прямыми Ig P;— 7! uw 1№1;.—Т"
на осях
ординат.
В ряде случаев применение полулогарифмических шкал, т. е. уравнений вида (П, 8), обусловлено тем, что для свойств G’’’ ua С’ справедливо
соотношение
результаты
(11,1),
а для
использования
а’ и
С” — (Ш, 79). Так, например,
уравнения
lg K = A,AH + Bp,
хорошие
(II, 88)
где А и ЛН — соответственно константы равновесия и тепловые
ты реакций, связаны со справедливостью уравнений (Ш, 41) и
AZ? = — RT ink.
эффек-
(II, 89)
Однако не во всех случаях можно обосновать уравнения, аналогичные (, 80), подобным образом. Иногда применение логарифмических
шкал продиктовано соображениями удобства, так как эти шкалы уменьшают кривизну линий. То же относится к полулогарифмическим и другим функциональным шкалам.
Иногда можно заранее судить о характере рассматриваемой зависимости. Так, параллелизм в значениях показателя преломления пи и точек
плавления &л в рядах галогенидов щелочных металлов объясняется тем,
что эти свойства зависят от общей причины [126]. Этот параллелизм находит свое выражение в уравнении вида (1, 1). Не обращаясь к экспериментальному материалу, можно утверждать, что постоянная А. в этом уравнении будет величиной
отрицательной,
так как с ростом межатомного
рас-
стояния в рядах МеЕ — Ме] уменьшается энергия решетки, а поэтому
уменьшается и температура плавления и увеличивается,
— вследствие
роста поляризуемости аниона, — показатель преломления.
Было бы ошибочным полагать, что все уравнения, принадлежащие : К
одному и тому же типу зависимостей, имеют одинаковую точность или что
доказательство достаточной точности одного из уравнений доказывает
одновременно точность всех уравнений данного типа. Действительно, анализ надежности каждого из уравнений должен проводиться с учетом характера входящих в него величин. Так, хотя справедливые для гомологических рядов уравнения
AHnap =alnP +b
и (П, 38), являющиеся видоизменением
MOCTBIO
(II, 90)
(Ц, 44), аналогичны, однако зависи-
(AH nap)u.t.n = а-- ВМ
(II, 94)
(М —молекулярный вес) в отличие от АН = а | 0M не описывается ход
теплот парообразования в гомологическом ряду. Действительно, считая
возможным для каждого вещества ряда воспользоваться в первом приближении правилом Трутона, получим
|
(АН
(AH
пар
пар \n
+1
—
(
(AH
— (AH
пар
\n __
пар \n-1
(
[с
T
H.T.HK
H.T.K \n
+1
—(T(
— (т
Н.Т.К
\n
(II,
92)
H.T.K \n-1
где ип — число атомов углерода. Но левая часть этого уравнения в соответствии с (П, 91) должна была бы равняться единице; в то же время
правая часть не равна единице, так как точка кипения не относится к
аддитивным
свойствам.
Если
даже
учитывать
изменение
значения
8
+
115
(Азпар)н.т.к В ГОМОЛОГИЧеСкОм ряду,
то и в этом
случае
останется
несоот-
ветствие между правой и левой частями уравнения (ТТ, 92). Следовательно,
и АНпар не является аддитивной величиной, так как на прямой, отвечающей соотношению (II, 1), точки расположены не на одинаковом расстоянии. Неточность
уравнения
(П, 91) станет
значительной
в
0бласти высоких давлений; наоборот, в стандартных условиях (Ш, 91) бу-
дет
практически соблюдаться.
Точность рассмотренных
в
настоящей
главе
уравнений
различна.
К уравнениям высокого класса точности относится, например,
взаимосвязь между рефракцией и теплотой сгорания в гомологических рядах,
так как эта зависимость вытекает из уравнения (11, 70), справедливого в отношении обеих величин для высших гомологов лишь с небольшой ошибкой.
В связи с этим примером отметим следующее. Хотя из двух уравнений, содержащих общее свойство, легко получить третье уравнение, подоб-
ное первым двум, однако надежность последнего может быть самой различной.
Действительно,
если
уравнения
(ПШ, 76) и (ПШ, 77) являются точными, то будет точным и (ПЦ, 78)*. Если же эти уравнения не
точны, то будут возможны рёзличные варианты. Так, может оказаться,
что уравнение (11, 78) плохо воспроизводит опытный материал. Это будет
свидетельствовать о неточности (11, 76) и (1, 77) и тем самым о принципиальной невозможности описания взаимосвязи между соответствующими
свойствами с помощью соотношения вида (1, 1). Может
ратное: переход .от (ЦП, 76) и (1, 77) к (П, 78) позволит
случиться и 0обповысить надеж-
ность результатов вычисления С(’”’. Это произойдет в тех случаях, когда
отклонение от уравнений (11, 76)и (1, 77) будет одинаковым, что в свою
очередь будет свидетельствовать о сходстве свойств Са” и С(’”. Последнее
существенно и потому, что обращение к (1, 78) позволит отказаться от
необходимости уточнять (Ш, 76) и (П, 77). Следовательно, судить о надеж-
ности уравнений (ПТ, 76), (1, 77) и (ТТ, 78) по точности одного из них в
общем случае не представляется возможным.
Неодинаковая точность отдельных уравнений следует также из того,
что
для
некоторых
свойств
были
рекомендованы
зависимости
различной
формы.
К не очень точным уравнениям можно отнести взаимосвязь между
теплотами плавления и парообразования, так как между «бесструктурной»
величиной
АНпар
и величиной
А Нил,
зависящей
от структуры
кри-
сталлов, в общем случае параллелизма не будет.
Можно указать и на другие примеры априорного установления надежности того или иного метода расчета. Так, номограмма для расчета свойств
органических соединений
[139], основанная на
между рефракцией и критической температурой,
линейной
не может
зависимости
дать точных
результатов, так как аддитивное (рефракция) и неаддитивное (критическая температура) хвойства не могут быть описаны уравнением вида (1, 1).
К. приближенным зависимостям относятся и некоторые из эмпирических уравнений, которые были предложены в то время, когда достаточно
надежных значений соответствующих свойств было еще очень мало. В качестве примера укажем на ранее упомянутое правило Павлевского [642].
В заключение отметим, что нередко уравнения вида (1,4) и, в частно-
сти, вида (1, 69) приводят к весьма ориентировочным результатам, а
сравнительный расчет позволяет их уточнить. Так, если расчет по уравнению вида (1, 70) энтальпий и энтропий сублимации высших дикарбоксильных кислот приводит к преувеличенным результатам (авторы работы
объясняют это влиянием циклизации), то сравнение значений ЛНосубли
А бсубл Позволяет и для них получить удовлетворительные результаты.
1 Это следует из того, что ‚коэффициенты A, “a By связаны определенным образом с коэффициентами А, ‚ В. ‚ А. и By:
116
О СОЧЕТАНИИ ПЕРВОГО И ВТОРОГО
СРАВНИТЕЛЬНОГО РАСЧЕТА
МЕТОДОВ
1
Остановимся на некоторых вопросах, связанных с первым и
вторым методами сравнительного расчета [83, 192].
Хотя, вообще говоря, эти методы не сводятся один к другому, так как
первый
относится к одному
свойству
в
двух
рядах
веществ,
а второй —
к двум свойствам одного ряда веществ, все же при некоторых условиях
можно говорить о существовании связи между ними. Найдем эти условия.
Напишем уравнение (Т, 1) для двух свойств С’ и С":
Допустим,
что
для
этих
Си = А! Ст + В
(П, 93)
Ст = А. ат- Ву.
(II, 94)
же
свойств
справедливо
(П, 1), т.
е.
Gi = A.G; + Bi
Gy = Аз би Записав (П, 93—II,
ветственно
96)
для
двух
И
Разделив
(П, 97)
на
(II, 95)
By.
соседних
|
членов
:
ряда,
получим
(II, 97)
AGi/AG; = Aj,
_ (II, 98)
AG,/AG; = A}
(II, 99)
AGu/AGy = Ag.
(II, 100)
(П, 99),
получим
AG.,
(ШП, 98)
на
(П, 100),
|
Так как левые
части, т. е.
A,
AG,
(П, 101)
и
А”
(П, 102)
I
(II, 102)
|
равны,
то
Ay _ Aa
4,
Соотношение
(II, 101)
находим
=.
AG,
A,
части
соот-
AGy/AG, = Aj,
ит.
AG,
Al
Разделив
(II, 96)
(П, 103)
является
(1, 1), и
(П,1).
и правые
(II, 103)
Ay
необходимым
равны
и
достаточным
усло-
вием совместимости системы уравнений (II, 93—П, 96) и тем самым
условием
возможности
применения к расчету свойств С’и С” обоих
соотношений
— и
117
Чем
ближе
свойства
Ги
друг к другу значения Ai
единений можно считать
П групп
И
АН.
— Ст
и
Си-
(ТТ, 103) следует, что
|
веществ,
тем ближе
достаточно
сходных
групп
I
U
A,=A,,.
что соответствует параллельности
Си
родственных
Для
С@г-прямые
(II, 104)
Ст — С1будут
,
”
A, = Aj.
со-
и (1 — Си-прямых.
параллельны,
Тогда и
так
как
из
(1,105)
Угловые коэффициенты для прямых (ШП, 93—П, 96) могут принимать
различные значения; в предельном случае, когда рассматриваемые свой-
ства
будут
аддитивны,
Связь между
одном частном
главу У[Ш.
Если
к уравнениям
номер
первому.
(1,106)
первым и вторым методами сравнительного расчета на
примере
рассмотрена также в [733] (подробнее см.
G’— микросвойство,
порядковый
A, = A, = Al =A; = 1.
вида
причем
(11,1) отнести
элемента),
оно
то
неизменно
и такие
уравнения,
(например,
можно
перейти
от
радиус
второго
в которых
иона
или
метода
к
2
При применении тех или иных уравнений вида (11,41) всегда
следует иметь в виду возможность их сочетания с теми или иными уравнениями вида (I, 1). B pane случаев это позволит значительно расширить
возможности предвычисления неизвестных величин (см. главу УПО.
В качестве примера совместного использования первого и второго методов укажем на уравнения
|
4
=
A.a
—
В.
(11,107)
drt = Aydt + By,
И
при помощи
которых
в работе
[75] были
(11,108)
оценены
значения
{ для
галоге-
нидов радия. В (1, 107) сравниваются межатомные расстояния для сходных веществ в газообразном состоянии с константами решетки этих ве-
ществ
в кристаллическом
состоянии,
а в
(Ш;
108)
сопоставляются
меж-
атомные расстояния в двух рядах сходных веществ. Таким образом, уравнение (11, 107) является частным примером второго, а (ТТ, 108) — первого
методов сравнительного расчета. Так как уравнение (11, 107) будет применимо при условии тождественности структуры твердых веществ, то
из элементов основной подгруппы второй группы периодической системы
необходимо выбрать изоструктурные соединения. Таковыми являются
фториды в ряду Са — Ва; все они обладают решеткой одинакового типа
(вплоть до совпадения координации, типа и пространственной группы)
и для всех них есть необходимые для расчета данные [72]. Поэтому воспользуемся уравнением (ПП, 107) в форме
мег
= Аоамек, -- В»;
экстраполяцией (см. рис. 18) находим 4в-_к = 2,40 А. По
с помощью графика, соответствующего уравнению
ме+-х = А5мен-са + Be,
определяем
118
значения
4в.—х
(см.
табл.
5).
(1,109)
этой величине
(1,110)
В
заключение
отметим,
что еще
одним
преимуществом
рассматри-
ваемого
метода
сравнительного
расчета по сравнению с предыдущим
является возможность широкого его применения к элементам, ионам и свободным радикалам.
ОРЕБЕЕЕЕ
CO COMI
OTS
Co DO >
ЛИТЕРАТУРА
Х. Карапетьянц.
Ж. физ. химии, 29, 938 (1955).
Х. Карапетьянц.
Ж. физ. химии, 29, 1328 (1955).
Х. Карапетьянц.
Ж. физ. химии, 30, 1164 (1956).
Х. Карапетьянц.
Ж. физ. химии, 27, 775 (1953).
Х. Карапетьянц.
Труды МХТИ им. Д. И. Менделеева, 18, 27 (1954).
L. Davis,
E. F.Westrum.
J. Phys. Chem., 65, 338 (1961).
F.Westrum,
G.A. Burney.
J. Phys. Chem., 65, 344 (1961).
A.Burney,
E. F.Westrum.
J. Phys. Chem., 65, 349 (1961).
. С. Новаковский,
Д. М. Гинзбург,
Л. И. Понировская.
Труды химич.
фак-та
и Ин-та химии ХГУ им. А. М. Горького, 14, 103 (1956);
цит. по [10].
М. С. Новаковский, Л. И. Понировская.
Труды химич. фак-та и
Ин-та химии ХГУ им. А. М. Горькогс, 14, 263 (1956).
Е. С. Ицкевич,
П. Г. Стрелков.
С. И. Скляренко,
С. Ф. Белов. В
11.
12.
Ж. физ. химии, 34, 1312 (1960).
сб.: Научные труды Гиредмета (1931—
1959), т. Г. Технология. М., Металлургиздат, 1959, стр. 329.
С. Ф. Белов.
Автореф. канд. дисс. М., Гиредмет, 1961.
. Ф.А. Кузнецов,
Т.Н. Резухина.
Ж. физ. химии, 36, 1364 (1962).
15. Термодинамические свойства индивидуальных
веществ,
справочник.
Под ред.
В. П. Глушко, Л. В. Гурвича, Г. А. Хачкурузова, И. В. Вейц, В. А. Медведева.
13.
Т. 1и2.
М., Изд-во АН СССР, 1962.
о eedings Sec. VI,
ан-Нес,
не
Г
24.
20.
.В.
Агтаж.
естен.
АНШЧдаа,
. У. Сошес. В
М.,
p. 312.
Х. Ван-В
из. М., ИЛ, 1954.
>
23.
rg
Smt Cy Ot PD
ЖЖ. физ. химии, 37, 850 (1963).
16. Н. М. Селиванова.
. Sundaram.
Z. phys. Chem., 34, 225 (1962).
17.
.M.Deanesly,
L.T.Carleton.
J. Phys. Chem., 45, 1104 (1941).
18.
Smittenberg,
D.Mulder.
Ree. trav. chim., 67, 813 (1948).
19.
Smittenberg,
D. Mulder.
Rec. trav. chim., 67, 826 (1948).
20.
T. H. Fortain.
Вес. trav. chim., 77, 5 (1958).
21.
.Smittenber
S
g. B c6.: Third world petroleum:Congress. The Hague, 1951.
22.
Гостоптехиздат,
Состав
17, М 206,68
масляных
(1960); цит.
с6б.: Пятый международный
1961,
стр.
107.
фракций
нефти и их ана-
по РЖХим,
нефтяной конгресс.
35397
(1961).
1959. Т. ПУ..
(in collaboration with C. Boelhower, J. Cornelissen). Corre26. H. 1. Waterman
lation between physical constants and chemical structure. Graphical statistical
methods of identification of mineral and fatty oils, glass, silicous and catalysts.
SS ну о
=
ки ны
= = one
со 9 59
Els. Publ. Co, Amsterdam, London, New York, Princeton, 1958.
. A. L. Ward,
S.S. Kurtz. Ind. Eng. Chem., Anal. Ed., 10, 559 (1938).
L 1 pkin, S.S. Kurtz. Ind. Eng. Chem., Anal. Ed., 13, 91 (1941).
= 1 р kin, C.C.Martin, S.S. Kurtz. Ind. Eng. Chem., Anal. Ed.,
6 ( 1 94 6).
L 1 р kin, C.C. Martin. Ind. Eng. Chem., Anal. Ed., 18, 380 (1946).
L 1 р kin, C.C. Martin. Anal. Chem., 19, 183 (1947).
W.Laue,
G.Winkhaus. Z. anorg. allg. Chem., 290, 52 (1957).
е В е Г,
Г у С сейнов, Б.В. Лопатин, Г. С. Васильев, Л. В. Орлова, М. Ф. Шостаковский.
Изв. АН СССР. ОХН, 1962, 1550.
. Физико-химические
свойства
индивидуальных
углеводородов
(рекомендуемые
точь,
J.K. Bragg,
A.H.Sharbaugh.
J. Appl. Phys., 25, 392
<
Я =>
= р
—
значения), справочник. Под ред. В. М. Татевского. М., Гостоптехиздат, 1960.
.M. Kosolapoff.
J. Am. Chem. Soc., 76, 615 (1954).
.А. Долов.
Уч. зап. Кабард.-Балк. госпединститута, 13, 335 (1957).
Lageman,
W.S.Dunbar.
J. Phys. Chem., 49, 428 (1945).
Луцкий,
В.Н. Солонько.
Ж. физ. химии, 88, 1091 (1964).
Кудрявцев.
Ж. физ. химии, 29, 671 (1955).
Я sn
.Хрущов,
М. А. Бабичев. В с6б.: Трение и износ в машинах. СборИзд-во АН СССР, 1941, стр. 69.
|
K 1. М.—Л.,
. М. Хрущов,
М. А. Бабичев. В
с6б.: Трение и износ в машинах. Сбор-
ик 1. М.—Л., Изд-во АН СССР, 1941, стр. 89.
. М.М. Хрущов,
М. А. Бабичев. В
с6б.: Исследования в области машиностроения. М.— Л., Изд-во АН СССР, 1944, стр. 147.
М. М. Хрущов,
М. А. Бабичев.
Докл. АН СССР, 88, 445 (1953).
119
45. В. П. Жузе, Т.А. Конторова.
ЖЖ. техн. физики, 28, 727 (1958).
46. Л. Н. Гусева, А. А. Бабарэко.
Ж. неорг. химии, 7, 2200 (1962).
47. В. 3. Булгаков. Диффузия в металлах и сплавах. М. —Л. ‚ Гостехтеоретиздат,
1949.
48. J.C. Slater. Phys. Rev., 23, 488 (1924).
49.
W.
Herz.
Z. anorg.
52.
53.
L. Edjed.
W. He er z.
55.
Б. Б. Кудрявцев.
Применение ультраакустических методов в
физико-химических исследований. М.—Л., Гостехтеоретиздат, 1952.
50. E. T. Pur kdo gan,
51. 0.K. Rice. J. Chem.
allg. Chem.,
180, 284 (1929).
J.Pearson.
J. Appl. Chem., 3, 495 (1953).
Phys., 1, 649 (1933).
Acta Geol. Acad. Sci. Hungr., 2, 205 (1954).
Z. anorg. allg. Chem., 179, 277 (1929).
54. M. Rama-Rao.
Cur. Sci., 8, 510 (1939); Indian J. Phys., 14, 109 (1940).
практике
56. М. Ваша Вао.
J. Chem. Phys., 14, 699 (1946).
57. П. П. Кобеко. Аморфные вещества. М., Изд-во АН СССР, 1952.
58. И. Е. Ампилогов.
Ж. физ. химии, 38, 1350 (1964).
59.
60.
61.
62.
63.
64.
Л.П.
Л. П.
Рузинов,
Рузинов.
(в печати).
W.Meyer, H.Neldel. Z. techn. Phys., 18, 588 (1937).
W.Meyer,
H.Neldel.
Phys. Z., 38, 1014 (1937).
G. Busch.
Helv. phys. Acta, 19, 189 (1946).
J. H.Gisolf.
Ann. Phys., 1:, 3 (1947).
65.
Е. И. Балабанов,
А.А. Берлин,
В.П. Парини, В. Л. Тальрозе,
Е. Л. Франкевич.
М. И. Черкашин.
Докл. АН СССР, 134, 1123
66.
Б. И.
Сажин,
69.
П.
Савинцев.
70.
Il. А. Савинцев,
М. С. Иванкина.
Изв. Томск.
политехн. ин-та
мм. С. М. Кирова, 95, 176 (1958).
Т. Lagemann.
J. Am. Chem. Soc., 67, 498 (1945).
Ф. осо
монт.
Структура неорганических веществ. М.—Л., Гостехтеоретизт
5
(1960).
Н.
67. М. М. Самыгин.
68. П.А. Савинцев.
|
Г.Н. Дубинин.
WK. физ. химии
Ж. физ. химии (в печати).
73.
SAP UPD
etl <y bi
ОСЕР
71.
72.
А.
(1958).
82.
83.
84.
АН
СССР,
Изв.
Томск.
политехн.
ин-та
им.
148,
С. М.
627 (1963).
Кирова,
alkin,
D. H. Templeton.
Степанова,
95,
152
Trans. Faraday Soc., 25, 253 (1929).
Treiber.
Wien Ber., 157, 11B, 4 (1948).
Карапетьянц,
Лин
Ти aa ин. Ж. структ. химии,
~]
<
78.
79.
80.
81
D>,
Докл.
Ж. физ. химии, 11, 228 (1938).
Докл. АН СССР, 110, 769 (1956).
-Goldschmidt.
ТА.
79.
77.
Г. Подосенова.
H.
H.
Chem.
Hypapaee
1, 277 (1960).
Phys., 18, 391 (1950).
wH. CTpyKT.
xumun,
1, 618 (1960).
Templeton,
G. F. Carter.
J. Phys. Chem., 58, 940 (1954).
Eick. J. Am. Chem. Soc. , 80, 43 (1958).
ebler, W.E.Wallace.
J. Phys. Chem., 66, 148 (1962).
rénvold, Н. Haraldsen, A. Kjekshus.
Acta chem.
, 1879 (1960).
Scand.,
В. А. Наумов.
Ж. структ. химии, 3, 59 (1962).
М. Х. Карапетьянц.
Докт. дисс. М. ‚ МХТИ им. Д. И. Менделеева, “4957.
О. К. Райс.
Электронное строение и химическая связь в неорганической хи-
мии. М., ИЛ, 1949.
85. W. D. Treadwel
1,
W. Werner.
Helv. chim. Acta, 36, 1435 (1953).
86. Б. В. Некрасов.
'Курс общей химии. Изд. 9, М., Госхимиздат, 1952.
87. К. С. Краснов.
ОЖ. неорг. химии, 3, 1993 (1958).
88. Г. В. Самсонов.
Усп. химии, 28, 189 (1959).
89. M.Picon,
L.Domange,
J.Flahaut,
M.Guittard,
M.Patrie.
Bull. Soc. chim. France, N 2, 221 (1960).
90.Sun Cheng-e,
T. С. Cheng. Acta Chim. Sinica, 10, 19 (1943).
91.Sun Cheng-e,
T.C. Cheng. Acta Chim. Sinica, 11, 121 (1944).
92. Li Shinttsin. Acta Chim. Sinica, 8, 143 (1941).
93. Э.П. Сальдау.
Зан. Всесоюзн. минерал. об-ва, 88, 234 (1959).
94.
у
36). Goldschmidt.
(1926
‘95. А.С.
Борщевский,
Norske
Н.А.
Vid.
Akad.
i OsloI.
Горюнова,
Н.К.
физики, 27, 1408 (1957).
96. В. И. Кузьмич,
В. К. Прохоренко, О. Я.
шер. Докл. АН СССР, 141, 400 (1961).
97.
Л.
И.
Демкина.
М., Оборониздат,
1958.
Исследование
зависимости
Mat.-Nat.
Kl.,
Тахтарева.
120
Ж.
общ.
химии,
7. техн.
Самойлов, И. 3.
свойств
стекол
от
98. Е. Ког4ез.
7. anorg. allg. Chem., 241, 1 (1939).
99. F. D. Leipziger,
J. E. Roberts.
J. Phys. Chem., 62, 10!4
100. А. Ф. Капустинский.
Докл. АН СССР, 730, 792 (1941).
101. А. Ф. Капустинский.
N 8, 102
12, 186 (1942).
их
Фи-
состава.
(1958).
|
102.
А. Ф. Капустинский,
С.И.
Дракин,
Б.
Ж. физ. химии, 27, 433 (1953).
103. А. Ф. Капустинский,
Б.М. Яцимирский,
104.
105.
106.
Якушевский
С.И.
физ. химии, 27, 793 (1953).
Дракин.
М. Х. Карапетьянц.
Нефтяное хозяйство, № 4, 66 (1955).
М. Х. Карапетьянц.
Ж. физ. химии, 30, 2218 (1956).
K. A. Kobe.
R. E. Lynn.
Chem. Revs., 52, 117 (1953).
107. М.
108.
М.
Д. Тиличеев,
1948).
Ch en
В. М.
Mei-chio,
Hu
Татевский.
Dji-bin.
Нефтяное
J. Chinese Chem.
хозяйство,
№
Ж.
12, 33
Soc., 12, 29 (1945).
109. G. H.Gady,
G. B. Hargreaves.
J. Chem. Soc., 1961, 1563.
110.G. H.Gady,
G. B. Hargreaves..J. Chem. Soc., 1961, 1568.
110a. H.S. Frank.
J. Chem. Phys., 13, 493 (1945).
141. мо
у1е$, А.Н. Лопез,
С.Н. ТБошаз.
Тгапз. ЕагаДау Soc., 55, 1100
(1959).
112. М. Рау!ез,
Ц. Н. ТБошаз.
113.
114.
115.
116.
117.
Тгапз. ЕагаДау 5ос., 56, 185 (1960).
A. Eucken.
Die Chemie, 55, 163 (1942).
H.Schinke,
F.Sauerwald.
Z. phys. Chem.
(DDR), 216, 26 (1961).
D. K. H. Briggs.
Chem. Ind., 1954, 1328.
В. И. Спицы,
В. И. Шостак.
Ж. общ. химии, 22, 1063 (1952).
Р. as)” mall,
K.W.Small,
P.. Cowley.
Trans. Faraday Soc., 44, 810
(1948).
118. G. Burrows,
F. H. Preece.
J. Appl. Chem., 3, 451 (1953).
119. А.К. Баев.
Автореф. канд. дисс. Л., ЛГУ им. А. А. Жданова, 1962.
120. R. Herzog.
Ind. Eng. Chem., Ind. Ed., 36, 997 (1944).
121.3. L.T. Waugh,
P.M.Christopher.
Ree. trav. chim., 81, 661 (1962).
122. M. M. Ventura.
Escola agren. Ceara, Fostaleza, Ceara, Brasil, Pub. téc., 2A,
6 pp. (1949).
;
123. T. D. Lewis.
J. Chem. Soc., 1938, 1056.
124, 15 3) Пронин,
С. И. Филатов.
Изв. вузов, черн. металлург., № 11, 11
(1963).
125. 1946). Mills,
A. E. Hirschler,S.S. Kurtz. Ind. Eng. Chem., 38, 442
(1946).
|
126. С. С. Бацанов.
Кристаллография, 1, 140 (1956).
127. Ю. В. Мнюх.
Ж. физ. химии, 37, 2371 (1963).
128. А. Виноградов.
Изв. Екатериносл. горн. ин-та, 11, № 1 (1915).
128а. А. М. Корольков.
Заводская лаборатория, № 1, 69 (1947).
129.G. W. Nededbragt,
J. M. Boelhower.
Physica, 13, 305 (1947).
130.
131.
132.
Н.А.
B. R.
F. D.
Колосовский.
Ж. общ. химии, 4, 269 (1934).
Rao,
P. R. K. L. Padmini.
Nature, 187, 311 (1960).
Rossini,
K.S. Pitzer,
R. L. Arnett, R. M. Braun,
Pimentel.
Selected
values
of
physical
and
thermodynamical
G.
133.
134.
135.
136.
137.
138.
139.
hydrocarbons and related compounds, Pittsbourgh, Carnegie Press, 1953.
V.S.Gupta.
J. Chem. Phys., 24, 164 (1956).
С. Г. Мокрушин.
Ж. общ. химии, 1, 856 (1931).
С. Г. Мокрушин.
Ж. общ. химии, 2, 911 (1932).
М. М. Самыгин.
Ж. физ. химии, 11, 325 (1938).
Н.Н. Яровенко.
Ж. общ. химии, 28, 2506 (1958).
S. W. Van.
J. Phys. Chem., 45, 903 (1941).
A. F. Orlick.
Mitt. chem. Forsch. Inst. Wirtsch. Osterr., 7, N 2, 46 (1953).
141.
142.
С. А. Войткевич.
а. Н. аеЕЁегу,
J.
140.
J. Nyvlt,
E.
Erdos.
N 34, 1045 (1954):
143. Chen
Chem.
144.Sun
Chu-yao,
Soc., 5, 193
Chenge,
nica, 7, 65 (1940).
Collect. Czechosl.
Chem.
Communic.,
Ж. физ. химии, 37, 1029 (1963).
Leicester,
W. Macey, A.I.
Tseng
(1937).
Tseng
Chaolun,
Chao-lun,
Cheng
Li
of
26, 500 (1961).
Vogel.
Chem.
E-sun.
J.
Shih-tsin.
S.
properties
Acta
Ind.,
Chinese
chim.
Si-
145.Sun
Cheng-e,
T.C. Chen.
Acta chim. Sinica, 14, 118 (1944).
146. A. Kutzelnigg.
Monats. Chem., 89, 459 (1958).
147. F. A. Henglein.
Z. anorg. allg. Chem., 118, 165 (1921).
148. J. F. Joliet. Compt. rend., 234, 428 (1952).
149. О.А. Осипов.
Докл. АН СССР, 102, 1171 (1955).
150. A.J. Davenport,
J.S. Rowlinson. Trans. Faraday Soc., 59, 78 (1963).
151. A. Lannung.
J. Am. Chem. Soc., 52, 68 (1930).
152. G. Burrows.
J. Appl. Chem., 4, 394 (1954).
153. K. Krishnamurti,
P. Venkataratnam.
Research, 7, 515 (1954).
154. J. E, Jolley,
155.
Н.
А.
J. H. Hildebrand.
Измайлов,
Е. И. Вайль.
Докл.
И.
АН
В.
J. Am.
Красовский,
СССР,
74, 94 (1950).
Chem.
В.
В.
Soc., 80, 1050 (1958).
Александров,
121
156.
157.
158.
(1957
Ч Вознесенский,
С. А. Вознесенский,
Б. И. Анваер,
Сахаров, Н. М.
159. K. Zieborak,
geol.
et
geogr., 6,
160. G. Kollar,
161. Е. Когозу.
162.
W.
164.
165.
166.
167.
168.
169.
170.
171.
Н.Н.
Н.
J.
T.
T.
T.
F.
W.
Р.С. Биктимиров.
ЖЖ уховицкий,
Туркельтауб.
Ж.
K. Olszewski.
127
2,
93
Ж. неорг. химии, 4, 028 (6955).
И.
И. Литовцева,
анал. химии,
Bull. Acad.
(1958).
Ж. неорг. химии
19, 178
polon.
В. М
(1964).
sci. Ser. Sci. chim.,
J. Proszt. Z. phys. Chem., 215, 215 (1961).
Trans. Faraday Soc., 33, 416 (1937).
Morey,
163. В. М.
А. А.
Р.С. Биктимиров.
W.T.
Chen.
Воздвиженский.
Бекетов.
Ж.
Русск.
J. Am.
Ж.
Chem.
физ.
Soc., 78, 4249
химии,
физ.-хим.
об-ва,
Н. Бекетов.
Речи химика. СПб., 1908,
Thomsen. Pogg. Ann., 138, 65 (1869).
W. Richards.
Z. phys. Chem., 40, 169
W. Richards.
Z. phys. Chem., 40, 597
W. Richards.
J. Franklin Inst., 198, 1
Ephraim,
P. Wagner. Berichte, 50,
MillerErz
bach.
172. W.MillerErzbach.
Berichte,
14,
217
19,
(1956).
37, 2455 (1963).
№
стр. 80.
1, 57 (1887).
(1902).
(1902).
(1924).
1088 (1917).
(1881).
Berichte, 14, 2043 (1881).
173.
174.
175.
176.
И.
И.
И.
И.
И. Заславский.
И. Заславский.
И. Заславский.
И. Заславский,
177.
\.
В. Воиз
179.
180.
A. Balandin.
Z. Phys., 26, 145 (1924).
W. Biltz.
Z. anorg. Chem., 134, 37 (1934);
183.
184.
185.
186.
JI. A. Pes ницкий.
Ж. физ. химии, 35, 1853 (1961).
R. Lautié.
Bull. Soc. chim. France, 5, 1306 (1938).
В. П. Шишокин.
Ж. общ. химии, 23, 1689 (1953).
В. П. Шишокин.
Труды ЛПИ им. М. И. Калинина, №
(1952).
1е14.
178. A. Balandin.
Изв. Иван. -Вознес. политехн. ин-та, 81, 61 (1919).
Труды Российск. научно-хим. ин-та, 2, 53 (1920).
Изв.
Иван.-Вознес. политехн. ин-та, 6, 407 (1922).
К. Б. Яцимирский.
Ж. общ. химии, 22, 1711
Ргос. Воу. 50с., А88,
Z. phys. Chem.,
116,
147 (1913).
123 (1925).
Z. Metallkunde,
29, 73 (1937).
181. О. Кубашевскияй, 9. Эванс. Термохимия
в металлургии. М., ИЛ, 1954.
182. а. Тамшаю,
Н. О. Samson-Himmelstjerna.
Z.
anorg.
allg.
Chem., 216, 288 (1934).
180,
177
(1955).
187. С. И. Скляренко,
Л. П. Рузинов,
Ю. У. Самсон.
Ж. неорг. химии, 7, 2645 (1962).
188. М. Х. Ка рапетьянц. Химическая термодинамика. Изд. 2. М., Госхим189.
190.
издат, 1953.
М. Х. Карапетьянц, В.Н. Финякина.
Изв. вузов, химия и химич.
технол. (в печати).
В. А. Комаров.
УЧ. зап. ЛГУ им. А. А. Жданова, № 169, серия химич..,
13, 29 (1953); Ж. физ. химии, 27, 1749 (1953).
194. В.А. Ки реев. Ж. физ. химии, 28, 372 (1954).
192. М. Х. Карапетьянц.
Ж. физ. химии, 28, 1136
193. Б. Ф. Ормонт.
Ж. физ. химии, 3, 300 (1932).
194.
195.
196.
197.
198.
199.
200.
К.Б.
Г.А.
А. А.
Ю. Ц.
Н.Е.
Н.Е.
Н.Е.
Яцимирский,
Г.А. К рестов.
Ж. физ. химии, 34, 2263 (1960).
К рестов.
Изв. вузов, химия и химич. технол., 6, 578 (1963).
Воробьев, Е.К. Завадовская. Докл. АН CCCP, 81, 375 (1951).
Вол,
Н.А. Шишаков.
Изв. АН СССР, ОХН, 1963, 1920.
Хомутов.
Труды МХТИ им. Д. И. Менделеева, 38, 87 (1962).
Хомутов.
Труды МХТИ им. Д. И. Менделеева, 38, 93 (1962).
Хомутов.
Ж. физ. химии, 36, 2477 (1962).
201. Н. Е. Хомутов.
202.
203.
D. F.C. Morris.
S.M. Brandon,
1960).
204. OL D.Joesten,
205. T. Kubota.
206.
207.
208.
R. West,
Schleyer.
B. HA.
134
(1954).
(1962
Ж. физ. химии, 36,
R.S.
J. Chem.
Drago.
Soc.
D. L. Powell,
J. Am.
дов,
Е. Т. Денисов.
2043 (1962).
Ree. trav. chim., 78, 150 (1959).
M.Tamres,
S.Searles.
J. Am.
Chem.
Japan,
J. Am.
L.S. Whatley y,
Soc., 84, 3221
физ. химии,
Soc., 84, 3817
78, 196 (1957).
А. В. Киселев,
Ж.
Chem.
(1962).
В.И.
Chem.
K.T.M.
Лыгин.
Lee,
Soc., 82, 2129
(1962).
R.
P.
Докл.
АН СССР,
von
147,
38, 3 (1964).
209. H.A.S kinner. Modern Aspects of Thermochemistry. The Royal Inst. of Chem.
Lectures, monographs and reports. N 3, L., 1958.
210. R. Bhattacharya.
J. Chem. Phys., 30, 1367 (1959).
211.
212.
122
M.G.
А. А.
Brown.
Trans. Faraday Soc., 55, 9 (1959).
Баландин,
А. А. Толстонпятова,
АН СССР, 148, 825 (1963).
В.
А.
Наумов.
Докл.
213. Г. В. Быков.
Докл. АН СССР, 153, 855 (1963).
214. L. A. Errede.
J. Phys. Chem., 64, 1034 (1960).
215. R.S. Neale. J. Phys. Chem., 68, 143 (1964).
216. F.A.Cotton,
J. R. Leto. J. Chem. Phys., 31, 993 (1959).
217.
L. E.
Lyone.
Nature,
166,
193 (1950).
218. 5.5. Мтёга.
0. Phys., 137, 520 (1954).
219. Y. P. Varshni.
Z. Phys., 135, 512 (1953).
220. Е. К. Золотарев. ТУ Укр. республ. конференция по физ. химии. Рефераты
докладов, Харьков, 1960, стр. 93.
221. H. В. Ко ровин. Изв. вузов, химия и химич. технол., 3, 844 (1960).
222.
223.
А.
AH
А.
Толстопятова,
CCCP,
OXH,
А.
1963, 423.
А.
Баландин,
C. A. Il yka pes, М. А. Оранская,
инский.
3. неорг. химии, 5, 8 (1960).
Т.А.
В. "A. Наумов.
Толмачева, Ю.С.
224. В. П. Ж узе. ЭЖ. техн. физики, 25, 2079 (1955).
225. А. П. Блум, А.Р. Регель. Ж. техн. физики, 21, 317 (1951).
226. Б. Ф. О рмонт.
Докл. АН СССР, 124, 129 (1959).
221.
В.А.
Романовский,
В.В.
Тарасов.
Физ. тверд. тела, 2,
228. P. Manca. Phys. Chem. Solids, 20, 268 (1961).
229.0.G. Folberth.
Z. Naturforsch., 13а, 856 (1958).
230.
K.
Pigon.
Bull.
Acad.
polon.
с6.:
Труды
sci. Sér.
sci. chim.,
9, 761
232.
В.А.
Шарифов.
235.
К. А. Шарифов.
238.
М.
240.
241.
242.
М. Х. Карапетьянц. Труды МХТИ им. Д. И. Менделеева, 20, 39 (1955).
М. Х. Карапетьянц.
Труды МХТИ им. Д. И. Менделеева, 38, 52 (1962).
Л.А. Жаркова,
Я. И. Герасимов.
HK. физ. химии, 35, 2294 (1961).
244.
Л.
АН
АзССР,
Докл. АН АзССР,
Докл. АН АзССР,
Изв. АН
АзССР,
19, №
металлов
и
(1961).
Сирота.
Докл.
цветных
золота,
1286 (1960).
Н.Н.
233. В.А. Шарифов.
234. К.А. Шарифов.
Ин-та
Иль
231.
(1957).
В
Изв.
№
Х.
Карапетьянц.
серия. физ. -техн. и матем. наук,
Ж.
243. Л.А.
А.
Жаркова.
Н.
(1964).
245. Т. Н. Резухина,
В. А.
физ. химии, 35, 2639 (1961).
В. М.
К eefer,
248.
P. A.D.
250.
A.
I. Briggs.
252.
L.
Sacconi,
L.
Naina.
249. Ф. Я. Кульба,
251.
253.
L.Sacconi,
3828 (1960).
82,
3831
Г.
J. Am.
J. Chem.
R.M.
Phys.,
Ю. А. Макашев.
J. Chem.
Soc.,
P. Paoletti,
(1960)
P.
1961,
Paoletti,
1, 71
28, 353 (1954).
Левицкий,
J. Andrews,
№
им. Д. И. Менделеева, 20, 10 (1955).
Баранчеева.
L. J. Andrews.
247. N. Ogi machi,
77, 4202 (1955).
de
химии,
Ж. физ. химии, 36, 1819 (1962).
Жаркова,
246.
физ.
Труды МХТИ
117,
3, 23 (1963).
19, № 5, 11 (1963).
19, № 9, 15 (1963).
|
(1964).
236. К. А. Шарифов.
Докл. АН АзССР, 20, № 3, 31 (1964).
231. М. Х. Карапетьянц.
Ж. физ. химии, 28, 186 (1954).
239. М. Х. Карапетьянц.
30,
26,
Н.
М.
Chem.
|
Ж.
химии,
38,
Soc.,
77, 2164
J. Am.
260. С. И. Дракин.
261. С. И. Дракин,
261a. R. M. Barrer,
Ж.
(1955).
Chem.
Soc.,
(1957).
Ж. общ. химии, 32, 1724 (1962).
2572.
M. Ciampolini.
J. Am.
M.Ciampolini.
J.
Chem.
Am.
Soc., 82,
Chem.
Е. К. Золотарев,
В. Е. Калинина. В
с6.: Труды по химиии
технол., 2 (8), 207 (1963). Горький.
254. Н. Е. Хомутов.
Ж. физ. химии (в печати).
255. Н. Е. с омутов.
Ж. физ. химии, 38, 1254 (1964).
256. Kanichi
Tanaka,
K. Tamury.
J. Catalists, 2, 366 (1963).
257. И. Е. п а уков.
Автореф. канд. дисс. М., МГУ, 1959.
258. Я. Я. Сычев,
259. L. Petrakis.
752
Казимирова.
Keefer.
1192
физ.
А. П. Гэрбэлэу.
Ж. "Heo pr. химии,
J. Phys. Chem., 66, 433 (1962).
Soc.,
химич.
7, 269 (1962).
Канд. дисс. M., МХТИ им. Д. И. Менделеева, 1952.
Б. М. Якушевский.
Ж. физ. химии, 27, 1636 (1953).
L. V.C. Rees.
Trans. Faraday Soc., 57, 999 (1961).
262.C. L. van Panthaleon
van Eck. Rec. trav.
263. W. S. Fyfe.
J. Chem. Soc., 1952, 2018.
264. R. M.
ава,
\. С. Fernelius,
B. P. Block.
(1955).
chim., 72, 50 (1953).
J. Phys. Chem.,
59, 80
265.
R.M.Izatt,
W.C.Fernelius,
C.G.Haas,
B.P. Block.
J. Phys.
Chem., 59, 170 (1959).
266. A.P.Stefani,
L.Herk,
M.Szwarz.
J. Am. Chem. Soc., 83, 4732 (1961).
267. 1.M. Whittemore,
A. P.Stefani,
M.Szwarz.
J. Am. Chem. Soc.,
84, 3799 (1962).
268. A. F. Clifford.
J. Am. Chem. Soc., 79, 5404 (1957).
123
Н. Е. Хомутов.
Н.Е. Хомутов.
Н. Д. Бирюков.
Н.Е. Хомутов.
Ж. физ. химии, 36, 2721 (1962).
Ж. физ. химии, 37, 526 (1963).
Ж. неорг. химии, 2, 2240 (1954).
Труды МХТИ им. д. Th. Менделеева,
Н.
Е.
Ж.
С.
Г. Майрановский,
279.
С.
Г.
281.
282.
283.
284.
E.S.G.
286.
287.
288.
289.
В.А.
В.А.
В. П.
В.П.
кого,
В. П.
269.
270.
271.
272.
273.
274.
215.
276.
277.
278.
Н. Е. Хомутов.
Ж. физ. химии, 38, 1256 (1964).
Хомутов.
физ.
химии
G.H.Hoitink,
J. van
G. J. Hoijtink,
J.van
G.J. Hoijtink, J. van
мии, 36, 2621
Май
141 (1962).
(в печати).
Schooten.
Ree. trav. chim., 71, 1089 (1952).
Schooten.
Rec. trav. chim., 72, 694 (1953).
Schoot en. Ree. trav. chim., 72, 903 (1953).
Я.
(1962).
ановский,
Коутецкий,
Н.
Я.
J. Biol. Chem.,
В.
Гануш.
Григорьева,
ва. Изв. АН СССР, ОХН, 1963, 240.
280. S. Koide,
I. Tachi.
J. Electrochem.
Barron.
38,
Н.
В.
Ж.
физ.
хи-
Барашко-
Soc. Japan, 23, 522 (1955).
97, 287 (1932).
Найки. Сэнъи гаккайси, J. Soc. Text. a. Cellulose Inds. Japan, 16, 251 (1960).
Р. М. Васенин.
Ж. физ. химии, 27, 878 (1953).
В. М. Новаковский, Е. А. Укше, А. И. Левин. Ж. физ. химии, 29,
1847 (1955).
285. В.А. Комаров.
Докл. АН СССР, 87, 624 (1952).
290.
291.
Комаров.
УЧ.
Комаров.
УЧ.
Корниенко.
Корниенко.
10, 123 (1953).
Корниенко.
зап. ДГУ, серия хим. наук, 13, 36 (1953).
зап. ЛГУ, серия хим. наук, 13, 41 (1953).
Укр. хим. ж., 18, 579 (1952).
Труды Научно-исслед. ин-та химии ХГУ им. А. М. ГорьУкр.
хим.
ж.,
23,
159
(1957).
В. ЦП. Корниенко. Труды Научно-исслед. ин-та химии ХГУ им. А. М. Горького, 18, 63 (1957).
292. Т. О. $. бои 14ев.
Spectrosc. Acta, 6, 129 (1954).
N. Fuson, J.-M. Lebas,
T.M.Gregory.
J. Chem.
293. M.—L. Josien,
Phys., 21, 334 (1953).
294. С. В. Го ‘'рбачев,
С. Ф. Белевский.
Труды МХТИ им. Д. И. Менделеева, 26, 180 (1957).
|
3. Р. Грабовски.
Ж. физ. химии, 33, 728 (1959).
A. A. Vicek.
Disc. Faraday. Soc., N 26, 164 (1958, 1959).
“I
Kho
co
295.
296.
298.
299.
300.
301.
302.
303.
W.Gordy,
H.
S.C.Stanford.
J. Соколов,
Докл. AH
J. Chem.
CCCP,
60, 825
Disc.,
p. 172.
Phys., 9, 204 (1941).
1948).
K. Krishnamurti.
Naturwiss., 48, 157 (1961).
E.Augdahl,
P.Klaboe.
Acta chim. Scand., 16, 1655 (1962).
Т. Е. Cordon.
J. Organ. Chem., 26, 738 (1961).
Г. М. ‘Панченков,
А. М. Колчин. Докл. АН
СССР, 131, 357
(1960).
321.
322.
323.
324.
325.
326.
321.
328.
329.
124
С. Солдатов,
Г. Л. Старобинец.
ЖЖ. физ. химии, 38, 681 (1964).
Л. Старобинек,
В. С. Солдатов.
Ж. физ. химии, 38, 992 (1964).
M. Barrer,
S. Wasilewski.
Trans. Faraday Soc., 57, 1153 (1961).
H. Everett.
Trans. Faraday Soc., 46, 957 (1950).
C.J. Oliver.
Rec. trav. chim., 42, 775 (1923).
Н. Гапон.
Ж. физ. химии, 22, 233 (1948).
Б. Яцимирский.
Доклад на VI Совещ. по химии компл. соед., М., 1953.
Б. Яцимирский.
Ж. физ. химии, 30, 1689 (1956).
Б. Яцимирский,
Л.В. Гуськова.
Ж. неорг. химии, 3, 2039 (1957).
a
Васильев,
В.Н. Васильева.
Изв. вузов, химия и химич.
нол., 2, 522 (1959).
К. Золотарев,
А. Е. Калинина.
Ж. неорг. химии, 7, 1225 (1962).
G. Evans.
Trans. Faraday Soc., 33, 166 (1937).
eee ob ban
311.
312.
313.
314.
315.
316.
317.
318.
319.
320.
coepeoueun fue
eee
O.R. Pérez. Rev. Real. acad. cienc. exact.,
fis. y natur. Madrid, 56, 183 (1962);
РЖХим, “18634 (1963).
304.
.M. Keefer,
L. J. Andrews.
J. Am. Chem. Soc., 77, 2164 (1955).
Tamres,
S.M. Brandon.
J. Am. Chem. Soc., 82, 2134 (1960).
305.
306.
Schinke, F. Sauerwald. Z. anorg. allg. Chem., 287, 313 (1956).
J. Malawski.
Roczn. Chem., 38, 7137 (1964).
307.
308.
.Н. Сгаваш,
Т.Е. Leffler.
J. Phys. Chem., 63, 1274 (1959).
D. Cook, B. E. Noreross. J. Am. Chem. Soc., 81, 1176 (1959).
309.
И. Шатенштейн,
Ю.П. Вырский,
Е.А. Рабинович.
Докл.
310.
Н СССР, 124, 146 (1959).
A. V.
Butler.
Trans.
Faraday
Soc. ., 33,
168
(1937).
A. V. Butler. Trans. Faraday Soc., 33, "229 (1937).
P. Bell. Trans. Faraday Soc., 33, 496 (1937).
M.
Barclay,
J. A. V.
Butler.
Trans.
Faraday
Soc.,
34,
1445 (1938).
P. Bell. Trans. Faraday Soc., 35, 324 (1939).
F. Frank, M. W. Evans. J. Chem. Phys., 13, 507 (1945).
L. Clever, J.H.Saylor, P.M.Gross. J. Phys. Chem.,
62, 89 (1958).
330. Р. М. Флид,
Ю.Ф.
Голынец.
Изв. вузов, химия и химич.
технол., 2, 173
331. uM. Cyga. Bull. Text. Res. Inst., N 59, 39 (1962).
К. Б. Яцимирский,
Ф. Д. Каширина.
332. К. С. Краснов,
335.
336.
337.
338.
339.
340.
chleyer.
OPP HEP OOP POSS OV oun OmROM mmm
333.
334.
341.
342.
343.
344.
340.
346.
347.
348.
349.
350.
351.
302.
353.
354.
355.
356.
357.
358.
Радио-
химия, 4, 148 (19602).
В. И. Мал кин,
Б. М. Могутнов.
Докл. АН СССР, 161, 1127 (1961).
. Уезьф
О.
Г. Роме11,
Г. 5. У\УБа1еу,
М.
К. Т. Гее,
Р. у. В.
‚В.
J.
Миронов
Am.
Chem.
В. А.
Soc. ., 84,
3221
Назаров.
(1962).
ЖК. неорг.
химии,
8, 1857 (1963).
.E. Leffler.
J. Organ. Chem., 20, 1202 (1955).
Exner.
Collect. Czechosl. Chem. Communic., 29, 1094 (1964).
. К. Сыркин,
М. А. Губарева.
Докл. АН СССР, 23, 1685 (1939).
.H. Constable.
Proc. Roy.
‘rim m,
Schwamberger.
Soc., A108, 355 (1926).
Reuwion Intern. Chim.
Phys.
Paris.
1928,
214.
Cremer.
Z. phys. Chem., A144, 231 (1929).
Cremer,
G.-N. Schwab.
Z. phys. Chem., A144, 243 (1929).
-M. Schwab.
Z. phys. Chem., BS, 406 (1929).
|
.-Roginsky,
Г. Rosenkewitsch.
Z. pays: Chem., B10, 47 (1930);
. 3. Рогинский,
Л. В. Розенкевич. Ж.
. И. Гапон.
Ж. физ. химии, 2, 253 (1931).
‚ К. бугКупю.
.A.
АД. anorg. allg. Chein.
Holzschmidt.
Z.
физ.
199, 28 (1931).
anorg.
allg.
Chem.,
200,
`3. Рогинский.
Уси. физ. наук, 2, 805 (1931).
A. Balandin.
Z. phys. Chem., Bi9, 451 (1932).
А.
K.
Баландин.
Ingold,
W.S.
Ж.
физ.
химии,
Nathan.
4, 257
J. Chem.
(1933).
Soc.,
химии,
82
1,
293
(1931).
(1931).
1936, 222.
Hinshelwood.
J. Chem. Soc., 1937, 538, 858, 1573.
А. Баландин.
Усп. химии, 13, 365 (1944).
Я. Марголис,
О.М. Тодес.
Изв. АН СССР, ОХН, 1947, 443.
. Я. Марголис,
О. М. Тодес.
Докл. АН СССР, 58, 421 (1947).
Б. Шехтер,
Ю. Ш. Мошковский.
Докл. АН СССР, 72, 339 (1950).
А. Баландин.
Докл. АН СССР, 97, 667 (1954).
Ф. Волькенштейн.
Полупроводники как катализаторы химических
реакций. (Полупроводники и их техническое применение, вып. 18.) Л., 1956.
359. Е. Крамер. В с6б.: Катализ. Электронные явления. М., ИЛ, 1958, стр. 86.
360. С. 3. Рогин г кий.
Адсорбция и катализ на неоднородных поверхностях.
361.
362.
363.
364.
365.
.366.
367.
368.
369.
370.
371.
372.
М.—Л., Изд-во АН СССР, 1948.
Ф. Ф. Волькенштейн.
Ж.
E.
Cremer.
E.Malinari,
A. A.
Z.
Elektrochem.,
физ.
56, 439
G. Parravano.
Баландин.
Ж.
физ.
химии,
химии,
(1952).
J. Am.
25,
Chem.
1214
(1951).
Soc.,
31, 745 (1957).
75, 5233 (1953).
Н.Н. Лебедев.
Ж. общ. химии, 27, 2460 (1957).
Е. Т. Денисов.
Изв. АН СССР, OXH, 1960, 1298.
С. 3. Рогинский.
Докл. АН СССР, 130, 366 (1960).
Я. С. Лебедев,
Ю. Д. Цветков,
В. В. Воеводский.
Кинетика
и
катализ, 1, 497 (1960).
Ф. Ф. Волькенштейн.
Электронная теория катализа на полупроводниках. М., Физматгиз, 1960.
Г. М. Tr анченков,
В. П. Лебедев... Химическая кинетика и катализ.
М., Изд. МГУ, 1961.
A. A. Ba ландин.
В с6б.: Катализ в высшей школе, вып. 1, ч. 1. М., Изд.
МГУ, 1962, стр. 5.
Ю. М. Жоров,
Г. М. Панченков.
Труды Москв. ин-та нефтехим. и газ.
промышл. им. И. М.
Губкина, 37, 19 (1962).
а. С. Воп4.
Catalysis by Metals. London, New York, 1962.
Т.А. Славохотова,
А. А. Баландин,
Г.И. Усова.
Вестник МГУ,
№ 5, 22 (1962).
375. ож
Богданова,
А. А. Баландин, И. П. Беломестных.
Изв.
AH CCCP, OXH, 1963, 611.
Кинетика и катализ, 4, 35 (1963).
376. Г. И. Лихтенштейн.
Б. И. Сухоруков.
Ж. физ. химии, 38, 747
377. Г. 4 Лихтенштейн,
(1964
378. В. Н. Никулин.
Ж. физ. химии, 38, 1103 (1964).
379. О. В. Крылов,
Е. А. Фокина.
Кинетика и катализ, 5, 284 (1964).
380. W.B. Person.
J. Am. Chem. Soc., 84, 536 (1962).
381. Б. И. Пещевицкий,
В. WT. Казаков.
Ж. неорг. химии, 8, 250 (1963).
382. R. P. Bell.
Proc. Roy. Soc., A154, 494 (1936).
383. В. С. К узнецов.
Кинетика и катализ, 0, 277 (1964).
384. P.Raetschi.
Z. phys. Chem., Neue Folge, 14, 277 (1958).
385. T. G. Ow e Berg. Acta chim. Scand., 7, 1313 (1953).
373.
374.
125
393.
394.
395.
396.
397.
398.
399.
400.
401.
402.
403.
404.
405.
406.
<<9
стоны”
.Ogg, M.Polanyi. Proc. Manchester Lit., Phil. Soc., 78, 42, 1933—1934.
riuti, M. Polanyi.
Acta phys- -chim. URSS, 2, 505 (1935).
ans, M. Polan yi. Trans. Faraday Soc., 31, 875 (1935).
ans, M. Polanyi.
Trans. Faraday Soc., "34, 44 (1938).
. Ба r д асарьян.
. Ти хомирова,
Ж. физ. химии, 23, 1375 (1949).
В. В. Воеводский.
Докл.
АН
СССР,
79,
993
ел
392.
EE
oe esShs:
Ht bd eS
386.
287.
388.
389.
390.
391.
BL Воеводский.
nes, Изд-во АН УССР,
.П.
Пурмаль.
В с6б.: Проблемы
1953, стр. 58.
Ж.
физ. химии,
механизма
органических
реакций.
30, 172 (1956).
.Д. Соколов.
Усп. физ. наук, 57, 205 (1955).
.Д. Соколов.
Докл. АН СССР, 112, 710 (1957).
Н. Семенов.
О некоторых проблемах химической кинетики и реакционой способности. Изд. 2. М., Изд-во АН СССР, 1958.
А. Е. Шилов.
В кн.: Совещание по механизму гетеролитических реакций,
тезисы докладов, Киев, 1960, стр. 24.
Х. С. Багдасарьян.
Кинетика и катализ, 1, 503 (1960).
Ю. Л. Спирин.
А.
А.
А.
А.
Ж. физ. химии, 36, 1202 (1962).
А. Баландин.
Усп. химии, 33, 549 (1964).
А. Баландин.
Ж. общ. химии, 16, 793 (1946).
А. Баландин.
УЧ. зап. МГУ, орган. химия, 175, 97 (1956).
А. Баландин, А. А. Пономарев.
ЖК. общ. химии, 26, 1146
Р. Магз. В c6.: The Mechanism of Heterogeneous Catalysis.
Amsterdam, Elsevier, 1960, p. 49.
Си
Сяу-
фан,
Ву
W. M.-H. Sachtler,
Paris, 1961, p. 831.
Юе.
J.
Проблемы
кинетики
Fahrenfort.
и катализа,
Actes
(1956).
Ed. J. H. de Boer.
II Congr.
10,
329
Catal.
(1960).
Techn.
Г. И. Голодец,
В.А. Ройтер. Укр. хим. ж., 29, 667 (1963).
А. А. Толстопятова,
3. Дудзик,
А. А. Баландин.
Изв. АН
СССР, ОХН, 1963, 616.
409. А.А. Баландин,
А. А. Пономарев.
Докл. АН СССР, 100, 917 (1955).
А. А. Баландин. Ж. физ. хи410. А.А. Толстопятова, В.А. Наумов,
мии, 38, 1622 (1964).
411. J. Fahrenfort,
L. L. van
Reyen,
W.M.H.Sachtler.
B c6::
The Mechanism of Heterogeneous Catalysis, Ed. J. H. de Boer. Amsterdam, Elsevier,
407.
408.
1960, p. 232.
|
412. А. А. Филиппов,
В.И. Смирнов.
Изв. вузов, цветн. металлург., № 6,
55 (1960).
Lister, P. Rosenblum.
Canad. J. Chem., 41, 3013 (1963).
413. МУ
Z. Elektrochem., 18, 539 (1912).
414. H.cC.S.Snethlage.
F.M. Rixon.
J. Chem. Soc., 107, 728 (1915).
415. O.C.M. Davis,
‘Angew. Chem., 46, 571 (1933).
416. O. Dinroth.
Z. Elektrochem., 20, 201 (1914).
417. H. S. Taylor.
K. Pedersen.
Z. phys. Chem., 108, 185 (1924y.
418. J. Bronsted,
H. Duns.
Z. phys. Chem.., A117, 299 (1925).
419. J. Bronsted,
Chem. Rev., 5, 231 (1928).
420. J. Bronsted.
edersen.
Kgl. ‘danske videnskabernes
selskab.
Mat.-fis.
421. K. J
12, М1, 3 (1932).
Z. phys. Chem., A160, 116 (1932).
422. A. Frumkin.
423.
424.
425.
426.
427.
G. N. Burkhardt.
Nature, 136, 684 (1935).
L. P. Hammett.
Chem. Rev., 17, 125 (1935).
M.G. Evans,
M. Polanyi.
‘Nature, 137, 530 (1936).
а.
М.
Burkhardt,
431.
М.
М.
(1963).
Г. Р. Hammett,
H. L. Pfluger.
W.G.
K.
J. Am.
Ford,
E.
Chem.
medd.,
Soc., 55, 4079 (1933).
Singleton.
J. Chem.
Soc.,
1936, 17.
428. A.V. Celiano,M. Cefola,P.S.Gentile. J. Phys. Chem., 66, 1132 (1962).
JK. crpykt. xumuu, 4, 342 (1963).
429. В. А. Щербаков.
430. К. А. Гуськов,
Н. Н. Лебедев.
Труды МХТИ им. Д. И. Менделеева,
42, 57
(1963).
|
ona
Н.
Н.
Лебедев.
Труды
МХТИ
ева, 42, 89 (1963).
432. М. М. Смирнова,
Н.Н. Лебедев. Труды МХТИ им.
42, 84 (1963).
J. Am. Chem. Soc., 59, 96 (1937).
433. L.P. Hammett.
им.
Д.
И.
Менделе-
Д.И. Менделеева,
434.
435.
436.
L.P. Hammett.
Trans. Faraday Soc., 34, 156 (1938).
L. Hammett.
Physical Organic Chemistry. McGraw-Hill. N. Y., 1940.
Р. У. Тафт
(мл.). Пространственные эффекты в органической химии. М., ИЛ,
437.
438.
439.
Y.Okamoto,
126
1960,
гл.
ХПЕ.
H.C. Brown,
H.C.
Brown,
H.C.
Brown.
Y.Okamoto.
Y.
Okamoto.
J. Organ.
Chem.,
22, 485
J. Am. Chem. Soc., 79,
J. Am.
Chem.
Soc., 80,
(1957).
1913 (1957).
4979
(1958).
440.
4414.
442.
443.
444,
445.
446.
447.
R.A. Robinson.
B cé.: Electrolytes, ed. B. Pesce. Symposium Publication Division. Pergamon Press. Oxford. London, New York, Paris. 1962, p. 165.
H. H. Jaffé. J. Chem. Phys., 20, 279 (1952).
H. H. Jaffé. J. Chem. Phys., 20, 778 (1952).
H. H. Jaffé. J. Chem. Phys., 20, 1554 (1952).
H. H. Jaff£é.
J. Chem. Phys., 21, 415 (1953).
F. L.Sixma.
Ree.
М. И. Кабачник.
М. И. Кабачник,
лентьева.
trav. Chim., 72, 673 (1953).
Усп. химии, 25, 137 (1956).
Т. А. Мастрюкова,
А.
Докл. АН.СССР,
Мастрюкова.
В сб.:
448.
Т.
А.
450.
451.
А.
3.
А.
452.
Л.А.
454.
455.
И. Л. Кнунянщц,
Б.Л. Дяткин.
П. Зуман.
Труды конференции по
456.
Ю.
457.
В.
458.
L. L. Ingraham,
1322
(1960).
Кипранова,
П.
Китаев,
Ж.
L. Holleck,
461. С. М. В. Вао.
СССР,
Докл. АН
В.
В.Н.
Дмитриева,
|
С. Е. Bailey,
E.M.Sheton.
R.Schindler.
Chem.
Изв.
Z.
АН
И.А.
34, 376 (1964).
J. Corse,
154, 423 (1964).
Изв. АН СССР, ОХН, 1964, 923.
проблемам корреляционных уравнений
Троенольская.
общ. химии,
СССР,
110, 393 (1958).
Т. П. Тарту, 1963, стр. 3.
Т.
Безуглый,
Мельник.
АН
Soc., 74, 2297 (1952).
459. N. Fuson, M.-L. Josien,
(1954).
460.
М., 1962, стр. 57.
Изв. АН СССР, ОХН, 1958, 628.
А. Ф. Кекашева.
Докл.
в органической химии.
Д.
Ме-
Баландин,
М. Л. Хидекель. Докл. АН СССР, 123, 83 (1958).
HL a PH Cs В.И. Зданович,
Д.Н. Курсанов.
Докл. АН СССР,
453. М. И. Кабачник.
454.
Т.А.
Химия и применение фосфорорганических соедине-
ний. Труды П Казанской конференции.
449. М. И. Кабачник,
С.Т. Иоффе.
132,
9. Шипов,
124, 1061 (1959).
Elektrochem.,
ОХН,
Шкодина,
F.Stitt.
J. Am.
a. Ind., 1956, 666.
СССР,
60,
J. Am.
Chem.
1142
1963,
Л.
А.
Chem.
Soc., 76, 2526.
(1956).
462. C. N. R. Rao.
Chem. a. Ind., 1957, 1239.
463. C. N. R. Rao.
J. Sci. a. industr. Res. (India), 17B, 56 (1957).
464. C.N. R. Rao,
G. B. Silverman.
Current Sci. (India), 26, 375 (1957).
465. C. N. R. Rao.
Chem. a. Ind., 1958, 894.
466. A. Balansubramanian,
Cc. N. R. Rao.
Chem. a. Ind., 1960, 1025.
467. D. G.O’ Sullivan,
R.W.Sadler.
J. Chem. Soc., 1957, 4144.
468. T. L. Brown.
469.
T.
L.
471.
P.J.
Brown.
470. M. F. A. El
472. H.
W.
J. Am.
Chem.
Sayed.
Krueger,
J.
H.W.
Thompson.
Chem.
Soc., 80, 6490 (1958).
Rev.,
58,
581
(1938).
Inorg. Nucl. Chem., 10, 168 (1959).
Thompson.
Spectrochim.
Acta,
Proc.
473. L. C.‘Thomas.
Chem. a. Ind.,
1961, 1913.
478.
Л. Б. Володарский,
Roy.
Soc. (L.), A250, 22 (1959).
16, 238° (1960).
474. С. М. В. Вао, В. Уеп Каф агау Вата п. Canad. J. Chem., 39, 1757 (1961).
475. В. И. Словацкий,
А. А. Файнзильбер,
С. С. Новиков.
Изв.
АН СССР, ОХН, 1962, 989.
476. Л.М. Литвиненко.
Изв. АН СССР, ОХН, 1962, 1737.
477. М.Р. Ягудаев,
Ю.Н. Шейнкер. "Изв. АН СССР, OXH, 1963, 2230.
479.
480.
481.
482.
483.
484.
485.
486.
В.А.
отт юг,
А.
Финкельштейн,
34, 151 (1964).
В.
С.
В.
И. К. Баева.
Лукьянчук,
М.
А.
УЖ. общ.
химии,
Наукина,
3. М. Кузьмина.
Ж. физ. химии, 38, 2954 (1964).
А. В. Финкельштейн,
В.Л. Погребная,
С. В. Лукьянчук.
Ж. физ. химии, 38, 2092 (1964).
Ц. Е. Crable, G.L. Kearns.
J. Phys. Chem., 66, 436 (1962).
W. Zeil, H. Buchert.
Z. phys. Chem., Neue Folge, 38, 47 (1963).
В. И. Бе р езин.
Докл. АН СССР, 155, 629 (1964).
M.St.C. Flatt. Trans. Faraday Soc., 44, "767 (1948).
R. W. Taft,
S. Ehrensen.
J. Am. Chem. Soc., 81, 5352 (1959).
Г. А.
Разуваев,
А. Н. Егорочкин,
М. Л. Хидекель,
В.
Миронов.
Изв. АН СССР, ОХН, 1964, 928.
487. А. Н. Егорочкин,
М. Л. Хидекель,
В. А. Пономаренко,
Г. Я. Зубова, Г.А. Разуваев. Изв. АН СССР, ОХН, 1964, 373.
488. С. М. В. Вао. % Sci. Ind. Res. (India), 20A, 24 (1961).
489. R.W. Taft,t
P.S.Skell, N.C. Deno. Ann. Rev. Phys. Chem., 9, 1958.
490. H. H. Jaffé.
Chem. Revs., 53, 194 (1953).
491.
В.
А.
Пальм.
Yeu.
химии,
30,
1069
(1964).
492. Труды конференции по проблемам корреляционных уравнений в органической:
химии. Тарту, т. Г, 1962; т. II, 1963.
493. J. Koutecky,
R. Zahradnik,
I. Arient.
Collect. Czechsl. Chem.
Communic.,
27, 3490
(1962).
127
J. Koutecky,
R. Zahradnik.
Collect. Czechosl Chem. Communic.,
28, 2089 (1963).
)
495. Д. Н. Шигорин,
А. П. Сколдинов,
Т. С. Рябчикова.
Докл.
AH CCCP, 149, 341 (1963).
ау, 5. C.Standford. J. Chem. Phys., 8, 170 (1940).
496. W.Gor
. O’Brien. J. Am. Chem. Soc.. 63, 2709 (1941).
497.
. O’Brien.
O’Brien,
llman,
See
чроноои ЗИноотии:
498.
499.
500.
501.
502.
AP=
494.
Горбачев,
ELV Nebster.
yw se IU
Хидекель,
А. Н. Егорочкин,
аддорожный,
Г. А. Разуваев,
ОХН, 1963, 1130.
_T.
В. А. Пономаренко,
Д.
Петров.
Изв. АН
Josien.
B.
Pullman,
J. Chem.
Bull.
Soc.
Soc., 76, 5185 (1954).
. Ве
Га
ш у.
J. Chem.
chim.
France,
Soc., 1951, 2456.
С.
Berthier.
Bull.
Soc.
62 (1956).
chim.
France,
Докл. АН СССР, 134, 1128 (1960).
J. Phys. Chem., 60, 1615 (1956).
Bull. Soc. chim. France,
H. Tannenbaum,
Soc.,
N 4,
19,
J.
389 (1952).
Goldenson.
1955, 4221.
BP
—
Ss
тя
сл
°
М
908(02), 1957;
ilmshurst.
цит. по
Canad.
[522].
Chem.,
335,
937
(1957).
ИН
ilmshurst.
J. Chem, Phys., 26, 426 (1957).
aasch. Spectrochim. Acta, 13, 257 (1958).
mshurst.
J. Chem.
Phys.,
28,
733
(1958).
©
ll. Nature, 184, 1932 (1959).
‚ В.Н. Baney.
J. Phys. Chem., 64, 822 (1960).
pse. Rev. chim. (RPR), 19, 419 (1961).
zold, K. Aurich.
Z. anorg. allg. Chem., 317, 156 (1962).
iley, J.N.Shoolery.
J. Am. Chem. бос., 77, 3977 (1955).
ick, A.A. BothnerBy.
J. Phys. Chem., 2%, 362 (1956).
CO
ел
со
—
ker. J. Chem. Phys., 26, 960 (1957).
rasimhan,
N. Laine, M.T. Rogers.
rownstein,B. C.Smith,G.
. Chem. Soc., 81, 3826 (1959).
НЕРВ
Oo
PO
panwell,
N.Sheppard,
J.them.
Ehrlich,A.W.
J.J. Turner.
Phys., 28, 1257
Laubengayer.
Spectrochim.
Acta,
549.
128
Ес
ея
541.
542.
543.
544.
545.
546.
547.
548.
16,
ef er
J. Chem., 40, 1 (1962).
Ca nad.
.А
ed, E G. Rochow.
J. Am. Chem. Soc., 79, 5361 (1957).
.А
ed, Е. G. Rochow.
J. Inorg. Nucl. Chem., 5, 269 (1958).
. А
ед,
А. L. H ensley.
J. Inorg. Nucl. Chem., 17, 43 (1961).
el isinset h. A cta chim. Scand., 16, 1601 (1962).
. Г ольданский,
Г. М. Городинский,
С. В. Корячин,
К орытко,
Л. М. Крижинский,
Е. Ф. Макаров, И.
П
д а лев,
В.В. Х рапов.
Докл. АН СССР, 147, 127 (1962).
. Лихтенштейн, А. Л. Б учаченко,
В. И. Веденеев.
Докл.
СССР,
133, 1102 (1963).
. а ordy,
J.O.Thomas.
J. Chem. Phys., 24, 439 (1958).
‚ С. Бацанов,
Л. И. Горогоцкая.
Ж. неорг. химии, 4, 62 (1959).
. Ф. Капустинский.
Докл. АН СССР, 63, 663 (1949).
iH. B.George.
J. Am. Chem. Soc., 81, 5530 (1959).
. Т. Y.Chen,
K.J. Laidler.
Canad. J. Chem., 37, 599 (1959).
. \ entink.
J. Chem. Phys., 30, 105 (1959).
. Г. Gillespie,
E. A. Robinson. Canad. J. Chem., 41, 2074 (1963).
. К. Cka a P Pe
М. О. Терешкевизч,
Т. С. К уратова,
Л. Н. Лар-
<j
ZФ
я
540.
J.
»Kagaris.
J. Am. Chem. Soc., 77, 1377 (1955).
pern,
J. Goldenson. Report CRL642, Army Chemical Center,
т.
ebergall, J.C. Prake. Final Report on Reaction of Silcnes ONB
>
534.
535.
536.
531.
538.
539.
M.-L.
Davison.
(1950).
о родько,
Я. К. Сыркин.
aggins,
G.C. Pimentel.
520.
521.
522.
523.
524.
525.
526.
521.
528.
529.
530.
531.
533.
А.
(1949).
СССР, 81, 625 (1951).
nee
. Lebas,
Chem
519.
П.А. Загорец.
Докл. АН
J. Chem. Soc., 1960, 5132.
sien,
N. Fuson.
Be LL.
J. Heisler,
516.
517.
518.
Soc., 64, 951 (1942).
J. Am. Chem. Soc., 71, 3632
Connell, J.S. Hann, J. R. Platt. J. Chem. Phys., 21, 66 (1953).
iegleb,
J. Czecalla.
Z. Elektrochem., 63, 6 (1959).
i egleb,
J. Czekalla.
Angew. Chem., 72, 404 (1960).
u о mUr a, R.S. Milliken.
J. Am. Chem. Soc., 82, 5966 (1960).
Spectrochim. Acta, 17, 503 (1961).
raajower,
J. Jortner.
J. Am. Chem. Soc., 85, 542 (1963).
ны
512.
513.
514.
515.
. 3
я.
uGG
503.
504.
505.
506.
507.
508.
509.
510.
511.
532.
J. Am. Chem.
C. V. King.
.А.
ко.
Ж. физ. химии,
Matwiyoff,
37, 839 (1963).
В. 5. Drago.
J. Chem.
Phys.,
38, 2583 (1963).
550.
551.
502.
553.
554.
В. Ф. Быстров,
Кнунянц.
Докл.
А. А. Неймышева,
А. У.
АН СССР, 156, 637 (1964).
Степанянц,
И.
Б.А. А рбузов. Ж. ВХО им. Д. И. Менделеева, 7, 447 (1962).
T. W. Richards.
Z. phys. Chem., 42, 129 (1903).
М. Richardson,
F.G. Soper. J. Chem. Soc., 1929, 1837.
Л. М. Гиндин, П. И. Бобиков, А. М. Розен. Докл. АН СССР,
295 (1959).
550. O.Schitz,
F. Ephraim.
Helv. Chim. Acta, 9, 920 (1921).
556.
557.
М. М. Самыгин.
Ж. физ. химии, 9, 929, 938 (1937).
Б. м. Ию
К,
3. 3. Высоцкий,
М. В. Поляков.
155, 1464 (1964).
558. Е. с. Williams,
C.N.
559. 9. А. Мельвин-Хьюз.
560.
Такэмото.
Кагаку,
Докл.
Л.
128,
АН
СССР,
Hinshelwood.
J. Chem. Soc., 1934, 1079.
Физическая химия, кн. П, М., ИЛ, 1962, стр. 1108.
25,
585
(1954);
РЖХим,
№ 10,
33624
(1957).
с
ТЕ
561. И. П. Горелов,
В. В. Серебренников. Ж. неорг. химии, 4, 1428
(1959); 5, 2824 (1961); Ж. физ. химии, 35, 2075 (1962).
562. О. М. Н immelblau.
J. Phys. Chem., 63, 1803 (1959).
963. K. Hirayama. J. Inst. polytechn. Osaka city Univ., 4, sec. C, Chem., 70, 1953.
564. А. А. Воробьев,
Е. К. Завадовская,
А. М. 'Трубицын. Докл.
CCCP, 100, 1065 (1955).
565.
‚ Воробьев,
А. Ф. Калганов.
Ж. физ. химии, 29, 1942 (1955).
566. |
. Б ацанов, Л. И. Горогацжая.
Изв. вузов, химия
и химич. тех2,
858 (1959).
Ж. физ. химии, 24, 1068 (1950).
.Вол ькенштейн.
.-Gobble, A.G.Maddock.
J. Inorg. ‘Nucl. Chem. , 7, 94 (1958).
. Moss.
Photoconductivity in the Elements. London, 1952.
я 2778,
567. ¢
568.
-969.
—570.
. Вт! орз,
В. Е.
Саш
ш!05$,
Н.Т.
Hrostowsky,
M. Tannen-
т. nye, Rev., 93, 912 (1954).
571. S.I1buki,
S. Yoshimatsu.
J. Phys. Soc. Japan, 10, 549 (1955).
572. W. F. W y nneJones.
Proc. Roy. Soc., A140, 440 (1933).
Н.
о
576.
577.
Лебедев. В кн.:
. Waters.
©
O by
581.
582.
583.
Phil.
. Хомутов.
uza,
579.
580.
Катализ
в высшей
школе,
1962, стр. 429.
|
а ф уаз. Czechosl. J. Phys., 12, 838 (1962).
Воробьев.
Докл. АН СССР, 112, 53 (1957).
Beы
578.
Н.
39а SE p> > =
|
МГУ,
574.
-575.
a
noe
573.
K.
Bar.
(C. F. Cole).
obertson.
ssner.
Z.
Mag.,
Труды
Z.
8, 436 (1929).
МХТИ
anorg.
им. Д. И. Менделеева,
allg.
Chem.,
283,
230
1, ч. 1. М.,
1201 (1950).
M.C. R.S ymons.
J. Chem. Soc.,
1957, 659.
584. Ю.И. Харитонов.
Изв. АН СССР, ОХН, 1962, 1953.
585. И.Н.
Плаксин,
В.И. Солнышкин.
Докл. АН СССР,
586. G. Glockler.
J. Phys. Chem., 61, 31 (1957).
587.
G.
Glockler.
590.
А. А.
J.
Phys.
(1961).
590а. Г. В.
П.
Chem..
Быков.
63,
Тетени. В
П. Тетени.
Толстопятова,
А. А.
Электронные
Ж.
(1959).
с6б.: Проблемы
Докл. АН
заряды
эксперимент.
828
Баландин.
М., Изд-во АН СССР, 1960.
591. П. Г. Маслов.
Докл. AH CCCP,
592. П. Г. Маслов.
Ж. физ. химии, 25,
593. П. Г. Маслов.
(1962).
62, ‘445. (1958).
Ж. физ. химии, 24,
D. Schonland,
588. А. А. Баландин,
10, 339 (1960).
589. А. А. Баландин,
Изд-во
38, 108 (1962).
(1956).
Труды Ин-та радиоинженеров, N 8, 1902
J. Chem. Phys., 18, 1365 (1950).
Elektrochem.,
OMY TOR.
rington,
вып.
связей
CCCP,
кинетики
АН
СССР,
в органических
физики,
и катализа,
132, 577 (1960).
`Докл.
71, 867 (1950).
814 (1951).
теорет.
144, 186 (1962).
138,
1365
соединениях.
22, 729 (1952).
594.
995.
096.
597.
Г. В. Быков.
Изв. АН СССР, ОХН, 1958, 827.
O. Kubaschewski,
G. Heym er. Trans. Faraday Soc., 56, 473 (1960).
W. W. Hunt,
R. F. Huffman.
J. Chem. Soc., 31, 266 (1959).
Ф. М. Шемякин.
Труды
Г Моск. мед. ин-та им. И.М. Сеченова, 17, 84 (1962).
999.
600.
601.
602.
R. P.S mith.
J. Phys. Soc., 60, 1318 (1956).
А. В. Иогансен,
Г. Д.Л итовченко. Докл. АН
J. J. Fox,
A. E. Martin.
J. Chem. Soc., 1939, 884.
C. H. L. Goodman.
J. Electronics, 1, 415 (1955).
604.
W.M.
606.
607.
К. С. Краснов.
J.T. Kendalt.
598.
Е. А.
Roninson.
603. T. S. Moss.
Canad.
М.
Х
Карапетьянц
41, 3021
Photoconductivity of the Elemens.
Latimer,
R.M.
605. А. Ф. Капустинский.
9
J. Chem.,
Buffington.
ЭЖ. физ. химии,
(1963).
London,
J. Am.
СССР,
Chem.
153, 1367 (1963).
Butterworth,
1952.
Soc., 48, 2297 (1926).
15, 1055 (1941).
ЗК. пеорг. химии, 3, 1993, (1958).
Phil. Mag., 45, 361 (1954).
129
A.Schuit,
a Q
СГС.
|
L. L. van
Reyen,
Actes II
W.M.H.Sachtler.
Intern. Catalysis Technol., Раг1з. 1961, р. 893; цит. по [400].
т
gress
Изв. Томск. политехн. ин-та им. С. М. Кирова, 95, 92 (1958).
А. Воробьев.
Е. К. Завадовская. ЖЖ. физ. химии, 28, 1210 (1954).
Воробьев,
Ж. физ. химии, 36, 1037 (1962).
В. Демченко.
.
В кн.: Современные проблемы физической химии и
; К. Семенченко.
имической, технологии.
Сборник
Т. М.,
Изд-во
3.
938, стр.
W. F. Mizza.
Krishnamurti,
Z. Kristallogr., 80, 465
.-Herlinger.
Macleod.
Naturwiss.,
(1931).
47,
Менделеева,
И.
ВХО им. Д.
493
(1960).
Faraday Soc., 31, 746 (1935).
Trans.
Kosmos (Lwow), 6, 498 (1881).
. Pawlewski.
Изв. вузов, химия и химич.
Г. А. Карачева.
Яцимирский,
ол., №5, 13 (1958).
Nature, 163, 178 (1949).
ссо |е.
Ж. физ. химии, 31, 925 (1957).
лупов.
Nature, 178, 276 (1956).
R. F.StricklandConstable.
ing,
RH
@
я
4
bi
_B.
Азерб. индустр. ин-та им.
М. Азизбекова,
OO
Иоффе,
903
(1964).
3. И. Ежкова, А. Г. Любарский.
|
Докл.
АН
элек-
СССР,
rineisen. Ann. Phys., 26, 393 (1908).
Труды Харьковск. химико-технол. ин-та им. С. М. Киро. Стрелков.
92
a Fe
5
Труды
амазанзаде.
954).
Compt. rend., 1341, 1291 (1900).
meray.
А. Путилов, В. В. Тарасов. В сб.: Молекулярные силы и их
ская природа. Под ред. Б. В. Ильина. М., ГИЗ, 1929, стр. 254.
Ж. Русск. физ.-хим. об-ва, 37, 1134 (1905).
емке.
.
654.
656.
им.
Я. И. Турьян.
Ж. неорг. химии, 4, 813 (1959).
Ж. неорг. химии, 4, 1070 (1959).
Н. И. Бондаренко.
Я. И. Турьян,
ЖЖ. неорг. химии, 5, 1749 (1960).
Б. П. Жантелай.
Я. И. Турьян,
ЖЖ. неорг. химии, 5, 2243 (1960).
Ю. С. Милявский.
Я. И. Турьян,
Изв. вузов, химия и химич. технол.,
О.К. Кудра.
О.И. Хацяновский,
№ 1, 43 (1958).
Изв. вузов, химия и химич. технол.,
О.К. Кудра.
О.И. Хацяновскияй,
|
№2, 36 (1958).
Труды Моск. ин-та стали, 39, 16 (1960).
Ю. А. Павлов.
Ргос. Воу. Soc., 67, 258 (1954).
оод4щап.
С. Н. Г.
Д. П. Белоцкий. В с6б.: Вопросы металлургии и физики полупроводников.—
Полупроводниковые соединения и твердые сплавы. М., Изд-во АН СССР, 1961,
стр.
18.
652.
653.
655.
МХТИ
конференция
und
Ж. неорг. химии, 1, 599 (1959).
Я. И. Турьян, Н. Г. Чеботарь.
4, 808 (1959).
Ж. неорг. химии,
Я. И. Турьян, Р.Я. Штинельштейн.
>> aS м ыы
650.
651.
MHeibleiter
Изв. вузов, химия и химич. технол., 3, 36 (1960).
Шкодин.
Шкодин.
Ж. физ. химии, 34, 1625 (1960).
Brodsky.
Z. phys. Chem., 121, 96 (1926).
Ж. Русск. физ.-хим. об-ва, ч. физ., 61, 535 (1929).
Бродский.
физ. химии, 23, 647 (1949).
Ж.
Измайлов.
Турьян.
Докл. АН
СССР, 102, 295 (1955).
Турьян.
Ж. неорг. химии, 1, 2337 (1956).
Psd boone P
648.
649.
S. 463.
а, 3, 187 (1941).
Труды Харьковск. политехн. ин-та им. В. И. Ленина, сер.
. Стрелков.
им.-технол., 1, 37 (1952).
Труды Харьковск. политехн. ин-та им. В. И. Ленина,
И. Стрелков.
.
‚ 31 (1954).
К ео
644.
645.
646.
647.
Clark.
=
639.
640.
641.
642.
643.
J.C.
J. Field,
Ж. физ. химии (в печати).
Н. Е. Хомутов.
А. М.
А. М.
A.I.
А. И.
Н. А.
Я. И.
Я. И.
OER mm pd WO > >S
635.
636.
637.
638.
N.
Научно-техническая
сб.
В
Е. Хомутов.
И. Менделеева. Тезисы докладов, 1964, стр. 16.
Н.
Д.
Dram
о:
634.
L. Toman,
N.Sclar.
J. Appl. Phys., 33, 2999 (1962).
L. Pauling.
J. Phys. Chem., 58, 662 (1954).
J. Phys. Soc. Japan, 12, 308 (1957).
T.Miyanchi.
J. Phys. Soc., 66, 1668 (1962).
O.J.Kleppa.
is Fass
615.
616.
617.
618.
619.
620.
621.
622.
623.
624.
625.
626.
627.
628.
629.
630.
631.
632.
633.
A. Wolff,
osphore, Ed. M. Schon, H. Walker. Braunschweig, 1958,
Y. P. Varshni.
J. Phys. Chem., 28, 1081 (1958).
SS
609.
610.
611.
612.
613.
614.
Р
nS
608.
.Е. Луцкий,
Г.Л. Юхновский,
В.А.
Ганенко.
Ж. физ. химии,
205 (1955).
с6б.: Применение ультразвука к исследованию
ителев. В
С. Предвод
657.
ещества. Вып. 7, М. 1958, стр. 27.
В. А. Пономаренко, А. Д. МатвееА. Д. Петров,
658. М. И. Батуев,
ва. Изв. АН СССР, ОХН, 1956, 1243.
659. F. Trouton. Phil. Mag., 18, 54 (1884).
660. В. Lorentz. Ramerfaillung und Ionenbeweglichkeit. Leipzig, 1922, S. 28.
5
>Г
9,
130
661.
C.M.
Guldberg.
Z. phys. Chem., 5, 374 (1890).
662.
663.
Д.А.
Поспехов.
Труды Одесск. с.-х. ин-та, 16, 177
R. Lorentz.
Z. anorg. allg. Chem., 94, 246 (1916).
666.
С.
674.
М. Н. Nachtrieb, J.-A.
Chem.‘Soc., 20, 1189 (1952).
(1959).
‚664. А. В. Воронель.
Ж. физ. химии, 29, 392 (1955).
665. С. Д. Герцр!кен. Доповд: АН УРСР, № 1, 54 (1954).
Д.
667. С. Д.
668. С. Д.
ской
669. R. A.
670. N. R.
671. В. Н.
672. В. И.
673. В. И.
Герц
р1кен.
Доповё
АН
YPCP,
Ne 4,
72
(1956).
Герцр!кен.
Наук. зап. Ки!вск. ун-та, 15, Ne 5, 107 (1956).
Герцрикен. В
с6б.: Первое Республиканское совещание по физичехимии. Тезисы докладов. Киев. Изд-во АН УССР, 1954, стр. 25.
Oriani.
J. Chem. Phys., 18, 575 (1950).
Mukherjee.
J. Appl. Phys., 22, 1215 (1956).
Еременко.
Укр. хим. ж., 28, 427 (1962).
Рыков, Г. С. Яковлева.
УЧ. зап. Кишиневск. yee 63, 41 (1963).
Рыков.
Труды по физике полупроводников, 1, 142 (1962).
Weil,
E.
Catalano,
A.
W.
Lawson.
J.
675.
676.
677.
678.
679.
J.
K.
W.
S.
Э.
A.M. van Liempt.
Z. Phys., 96, 534 (1935).
Billig.
Ber., 76, 300 (1943).
Herz. Z. anorg. allg. Chem., 159, 316 (1927).
Sugden.
The Parachor and Valency. London, 1930, p. 31.
А. Мельвин-Хьюз. Физическая, химия., KH. II. М. ‚ ИЛ, 1962, стр. 666.
681.
682.
683.
684.
685.
R.
R.
R.
Л.
А.
Gopal. Z. anorg. allg.
Gopal.
Z. anorg. allg.
Gopal.
Z. anorg. allg.
И. Кришталик.
Ж.
А. Баландин. Докл.
680.
686.
687.
688.
689.
690.
В.
Gopal.
K. H.
K. H.
Н. А.
Н.Е.
Л. Г.
J.
Indian
Chem.
Soc., 30,
55
(1953).
|
Chem., 278, 42 (1955).
Chem., 279, 229 (1955).
Chem.. 281, 217 (1955).
физ. химии, 31, 2403 (1957).
АН СССР, 43, 273 (1953).
Meyer.
Ber., 45, 2843 (1912).
Meyer.
Ber., 47, 826 (1944).
Валяшко,
Ю. С. Розум.
Ж. общ. химии, 18, 710 (1948).
Хомутов.
ЖЖ. физ. химии, 36, 2721 (1962).
Феоктистов,
С. И. Жданов.
Изв. -АН СССР, ОХН, 1963, 45.
691. C. Putilov.
Z. Physik, 76, 814 (1932).
692. M. W.Zemansky.
Heat and Thermodynamics. New York, Toronto, London,
NcGraw-Hill Book Co., 4 ed., 1957, p. 327.
693. C. A. Buchler.
J. Phys. "Chem., 42, 1207 (1938).
694.
В. В. Щекин.
Труды
Ин-та нефти АН
СССР,
1, 295 (1950).
694a. W. Herz. Z. Elektrochem., 36, 99 (1930).
695. C. C. Price. Chem. Rev., 29, 37 (1941.
696.
V. Gold,
D. P. Satschall. J. Chem. Soc., 1956, 2743.
697.
698.
699.
700.
701.
L. K ué a.
Collect. Czechosl.
Chem.
бое,
R.F.Marschner,
J.B.Beverly.
A. L. Ward, S.S. Kurtz.
Ind. Eng.
3. В. Звонкова.
Труды НИФХИ им.
H. Steiner,
H.R. Watson.
Disc.
27,
2490 (1962).
J. Chem. Educ., 33, 604 (1956).
Chem., Anal. Ed., 10, 559 (1938).
Л. я, Карпова, 2, 97 (1959).
Faraday Soc., 2, 88 (1947).
702. C. A. Coulson.
J. Chem. Soc., 1955, 1935.
103..В. П. Васильев,
Е. ЦК. Золотарев,
А. Ф. Капустинский,
К.П. Мищенко,
Е. А. Подгорный,
К.Б. Яцимирский. Ж. физ.
704.
химии, 34,
М.М. Ра
1763
у is,
(1960).
H.B.Hetzer.
705. C.-R. Guérillot.
706. В. Я. К ‘ рбатов,
J. Res. Natl.
Bur. Standards, A65, 209 (1961).
Compt. rend., 242, 2565 (1956).
Ж. Русск. физ-хим. об-ва, ч. хим., 40, 813 (1908).
707.
708.
Г.Н. Tho mas.
Y. P. Varshni.
J. Chem.
J. Chem.
Soc.,
Soc.,
1949, 3411.
21, 2235 (1953).
7414.
L. William~s,
Р. Мигге
y.
7114.
715.
716.
Г. В. Быков.
Ж. общ. химии, 28, 584 (1958).
J. Jortner,
U.Sokolov.
J. Phys. Chem., 65, 1633 (1961).
S. B Hastings,
J. L. Franklin,
J.C. Schiller,
F.A.Matson.
709. S.T. Bowden.
Nature, 174, 613 (1954).
710. H. P. Meissner, E. М. Redding. Ind. Eng. Chem., 34, 521 (1942).
Metallurgia,
49, 210
(1954).
712. W. Ruppel,
A. Rose,
H. J. Gerritsen.
Helv. Phys. Acta,
(1957).
713. В.М. Ва dger, S.H. Bauer. J. Chem. Phys., 5, 839 (1937).
J.
30, 238
. Chem. Soc., 75, 2900 (1953).
717. We 5. Nathan,
H. B. Watson.
J. Chem. Soc., 1933, 890.
718. W.S. Nathan,
H. B. Watson. J. Chem. Soc., 1933, 1248.
719. DUP. Evans,
V.G.Morgan,
H.B.Watson.
J.Chem.
7
Soc.,
1935,
720. Е. Ф. Пичугин.
Изв. вузов, физика, № 6, 77 (1962).
721. A. B. т рост.
В кн.: Физико-химические свойства индивидуальных углеводородов.
од ред. М. Д. Тиличеева, вып. 2, гл. УПТ. М.,Гостоптехиздат, 1947.
7"
131
.B.Kistiakowsky,
W. W. Rice. J. Chem. Phys., 8, 610 (1940).
van Hecke. Ann. Soc. Sci. Bruxelles, Sér. 1, 69, N 4, 11 (1955).
. М. Паушкин.
Ж. общ. химии, 6, 1433 (1936).
Desreaux.
Bull. Soc. chim. Belg. 44, 249 (1935).
alden. Z. phys. Chem., 66, 385 (1909).
PeySrmoOs
maa
OWZOHwOM
122.
723.
724,
725.
726.
721.
728.
729.
730.
731.
732.
133.
-McGowan.
Rec.
trav. ’ chim.,
76, 155 (1957).
. Спиро. Труды Всес. научно-исслед. ин-та галургии, 21, 262 (1949).
-Somayajulu.
Ind. J. Phys., 30, 258 (1956).
.F. Eerbeek.
Rec. trav. chim., 72, 5 (1953).
avies,
A. H. Jones.
Trans. Faraday Soc., 55,
.Татевский.
Ж. физ. химии, 32, 1168 (1958).
. Кутолин.
Ж. физ. химии, 38, 1269 (1964).
1329
(1959).
ГЛАВА
Ш
СРАВНЕНИЕ ЗНАЧЕНИЙ ОДНОГО СВОЙСТВА
В РЯДУ ВЕЩЕСТВ
ПРИ ДВУХ ЗНАЧЕНИЯХ ПАРАМЕТРА УСЛОВИЙ
Третьему
соотношение
в котором
методу
Gn,
в обычных
или
сравнительного
—
Аз Сп,
+
расчета
отвечает
следующее
Bs,
(I
функциональных
шкалах
сопоставляются
1)
зна-
чения данного свойства С в ряду сходных веществ при двух значениях
ПШ и П. переменного параметра П (температуры, давления, концентрации ит. д.) [1—3]. В дальнейшем ЛП будем называть параметром условий.
Если допустить, что двухпараметрическое уравнение (1,4) справедливо
как при Пу, так и при По, то из уравнений
и
следует,
Сп, = ап, + вп, Ф (5)
(III,2)
Спл= ап, - Ви, (8)
(1,3)
что
— bn,
Сп,
— Бы.
апп,
ОП.
+
ап,
—
bn
’
(III, 4)
1
или
(III, 1).
Соотношение (Ш, 1) при прочих равных условиях тем точнее воспроизводит опытные данные, чем ближе друг к другу значения параметра
Условий Пи П., причем если между Пи По. происходит фазовое превращение, то это может вызвать искажение хода С в ряду рассматриваемых
веществ, что приведет к утрате точности (ПТ, 1). Очевидно, в общем случае
А. будет
тем
значительнее
будет отличаться от П1.
Ниже приводятся некоторые
личных
веществ
и
систем 1.
отличаться
примеры
от
единицы,
соотношения
чем
(ПТ,
больше
IT,
1) для раз-
Примерами (ПТ, 1) для макросвойств для случаев, когда параметром
Условий является температура, служат следующие.
Диэлектрическая
проницаемость п-, М- и о-ксилолов при 20 и 30°С (по данным [5]);
изобарная теплоемкость СН. „Е
(т = 0,1,2,3,4) при 600 и 800° К
[6];
вязкость С,Н.Х (Х = Е, С, Вт, Л) при 20 и 40°С [7]; показатель преломления н-алканов С„Нои+ (п = 6,7,8) при 40 и 80°С [8]; стандартная энтро-
пия С, пЕм (т = 0,1,2,3,4) при 400 и 700°К
[5],
для Не, №, Аг, Кг при 298 и 500°К [9]; скорость
звука
функция
— or — т
н-алкилацетиленов
1 Большинство этих примеров описано в [4].
133
(п = 6,7,8,10,12)
при 500 и 1000°К
при 20 и 30°С
10]; энтальпия Т1С] (т = 2,3,4)
[11]. На рис. 105—107 применение соотношения (П1,1)
к макросвойствам
Относительное
показано на трех. примерах.
уменьшение объема при сжатии
|
Na,
Li,
K,
Rb
uw Cs
при Р = 4000 и 8000 атм [12] может служить примером применения (111,1)
(7:
Lol
,
10°
60°C
|
J
a
06
ос
er
F
|
Ga
|
06
ГО
0,
ООО]
(7-10 Л с
хе Кг
14
к
к микросвойствам
В применении
goto
:
Chay
CHF,
Н.Е
OH,
70-
—
Я
|
90
1
|
60
1
. 10
5 600°к
в
Рис. 107. Взаимосвязь между стандартными
энтропиями
бов
CH, mh m(m=0, 1, 2,3,
600 a 700° K [8]
(э. е.)
4)
при
._
065,
020
300°с
параметром
условий
иллюстрацией
при 20 и —
и 0°С [19]
является
(ПТ, 1) служит
195°С
[3]
(см.
давлз-
связь
рис.
Для растворов применение третьего
метода сравнительного расчета возможно
при переменных температуре и концентрации
(примеры, когда П = Р, трудно
привести из-за отсутствия соответствующих
CHF
,
00
тазов при 300
для нафталина
расстояний
межатомных
Когда
,
005
Рис. 106. Взаимосвязь
между коэффициентом теплопроводности ху инертных
[7]
веществ,
макросвойствам
ние.
Ar
“0
Рис. 105. Взаимосвязь между вязкостью
галогенпроизводных бензола -СёН5Х при
30 и 60° С
|
He,
ых
015+
опытных данных).
Иллюстрацией для
случая растворов, когда П = & могут
служит кажущийся объем ионов Х`(Х` =
—=СГ, Вг`, Г) в водном растворе при 40
и 50°С [44] и эквивалентная электропроводность водных двухнормальных растворов Ме (Ме = Тл, Ма, К) при 100 и 150°С
[15]. Примером (ПТ, 1) для случая, когда
П=с (концентрация), являются: коэффициенты теплопроводности водных растворов Ме( (Ме=Тл, Ма, К, ВЬ,Сз) при т =
—= 1,5и 2,0 [46], коэффициенты активности при 25°С Ме(СО),). (Ме = Са, Sr,
Ва) при т = 1,0 и 1,4 [17] и электропро-
водность при 25°С водных растворов MeCl, (Me = Mg, Ca, Ва) при концентрациях 0,02 и 0,05 экв/л [18]. Пример применения третьего метода
сравнительного расчета для растворов приведен на рис. 109.
Примером применения (ПТ, 1) для фазовых равновесий в однокомпонентных системах служат при П = Е поверхностное натяжение С,Н;Х
(Х = С, Вт, Г) при 20 и 100°С [6] и теплота парообразования Ме] (Ме =
—Ма, К, (5) при 0 и 800°К;
при П=Р — температуры плавления
CH,, Кги
Хе при 970 и 2692 атм [20] (см. рис. 140) и температуры кипения н-алканов СН» (п = 3,4,5,6,7,8) при 10 и 100 мм рт. ст. [24]
134
|
}
108.
Взаимосвязь межатомных
расстояний 4 в молекуле
при гемпературе 20 и —195° С [13]
О — в слое; ш — между слоями
25
Рис.
a
!
i
{
30
1
—
4
L
1
220
[10%
70.
н,0
[
1
3,5
anes
|
1
д
i
20°C
_)
“0
нафталина
атм
Г
|
2007
в0Е
и
|
uO
50
:
57
“50% H,,0
100
И
190
|
ааа
Ona),
~
Рис. 109. Взаимосвязь между диэлектрической проницаемостью
50%-ного
и
70%-ного
водных
растворов x-coupros C,,H,,,, OH
датм
200
Рис. 110. Взаимосвязь между температурой плавления 7 (°К.) мета-
на, криптона и ксенона при давлении 970 и 2692 атм
[20]
135
(см. рис. 144). Фазовое равновесие в растворах может быть представлено
при П = с понижением температуры отвердевания раствора ийзоспиртов
С,Ни.2ОН (п = 3,4, 5) в парадихлорбензоле при М = 0,5 и 0,6 [22]
(puc. 112).
t 10мм
_
Л, дв
50
|
9
Yo
1?
|
1
1_
100
2
5
7
YOR
50
n=3
!
9
Эд
Ц
Г
о
с”
30
41-05
1
25
|
90
2-метилалканов
С„Н.„..
давлении
100 и
10 мм рт. ст. [21]
между
Ё (°С)
при
|
40
“4
© coma
Рис. 111. Взаимосвязь
температурой кипения
L
35
45
298 °K
Рис. 113. Взаимосвязь
между стандартными
Рис. 112.Взаимосвязь
между понижениями
температуры отвердевания раствора парадихлорбензола
В
спиртах
uao-C,,H,,,,,0H (n = 3,
4, 5) при мольной доле
№ = 0,5и 0,6 [22]
теплотами
образова-
о
ния АН.оз (ккал/моль)
н-алкилциклогексаHos C,H,,,,,CeHu upa
298 и 1400° К [21]
Химические изменения могут быть проиллюстрированы следующими
примерами: для П = Т — стандартные теплоты и изобарные потенциалы
образования н-алканов (п = 2,3,4,5,6,7) при 300 и 1000°К.
[21] (см. также
Lg
РРР Г
1D;
08
4
Рис.
114. Взаимосвязь между ката-
литической активностью 15
(w —
моль Н2/час-см^) окислов металлов
IV периода в отношении реакции
окисления водорода при 150 и
300° C [23]
115.
Puc.
jt
i
4
Jt
1
{id
1
16
1
5 (Bucel s9°%
Взаимосвязь
между
давлением
диссоциации
кристаллогидратов
CuSO1-nHe2O0
при 20 и
1 —
+2He О;
-Н.0
50° С [7]
CuS0O,:5H.O
+
2 —
2Н.О;
—
CuS0O,:3H.O
+
Си5О04.3Н,О->(СибО4.
3 —
—CuSO,
+
CuSOQ,-:
H,O>
H,0
рис. 113); каталитическая активность окислов металлов ТУ периода в отношении реакции окисления водорода при 150 и 300°С [23] (рис. 1144);
для П =с— электродвижущая сила в системе расплавленных солей
136
Pb/Pb Cl, + MeCl/Cl, (Me = Li, Na, K, Rb) upu 550°K a Nppc,
= 0,6 u 0,7
[24].
К этим примерам можно было бы присоединить и другие, в частности,
объем выделившегося водорода при разложении водой амальгам щелочных металлов за время 14 и 18 мин. [25]; теплоту адсорбции активирован-
ным углем СНХ., (Х = Я, Вт, 7) при 0°С и общем количестве адсорбента,
приведенном
к нормальным температуре и давлению, равным 90 и
120 см3/г адсорбата [7].
Одному
из
указанных
примеров
соответствует
уравнение
Noe = 0,72 29° + 0,000453,
(III,
9)
KoTopoe gua paga C,H,F — C,H,Cl — C,H,Br — C,H;J воспроизводит
опытные данные [7] с погрешностью в пределах неточности эксперимента
(на рис. 105 в том же ряду веществ
при 30 и 60°С).
Как
видно
из приведенных
значения вязкости были сопоставлены
примеров
соотношения
же как и в первом и втором методах сравнительного
ны
ряда
несколько
выпадают
из
общей
зависимости
(ПТ,
1),
здесь,
так
расчета, первые чле(Не —
на рис.
106,
СН. и СЕ, — на рис. 107, циклогексан — на рис. 143). То, что метан оказывается на одной прямой с инертными газами (рис. 110), объясняется
тем, что он подобен им по межмолекулярным связям, которые и определяют температуру плавления.
Если зависимость свойства вещества или характеристики процесса
имеет
вид
lg
G=a
+
bg,
(IIT,6)
соотношение (111,1) будет справедливо в логарифмических шкалах. Это
относится, в частности, к давлению насыщенного пара, растворимости и к
константе химического равновесия. Действительно, для этих величин можно воспользоваться уравнением
IgG =
в котором
рения
или
__Q
4,515Т
--++ const,
(III,7)
О — соответственно теплота парообразования,
теплота
реакции.
Рис.
145 иллюстрирует
теплота раство-
это на примере
дис-
социации кристаллогидратов. Другим примером могут служить данные по
растворимости
инертных
газов при разных температурах, найденные
в [26].
|
В тех случаях, когда в (Т, 4) Ф(2) = с, т. е. свойство С или характери-
стика процесса
аддитивны,
на прямой,
отвечающей
соотношению
(ПТ,
1),
точки будут располагаться на одинаковом расстоянии (при условии, что
молекулярный вес каждого последующего члена ряда больше, чем пре-
дыдущего на одну и ту же величину). Эту особенность мы, несомненно, обнаружили бы, если бы, например, смогли проследить прямую рис. 113
для
высших членов ряда н-алкилциклогексанов.
Если немонотонность эначения данного свойства сохраняется при
двух достаточно близких значениях параметра условий (см., например,
данные по плотности изомеров #-додеканола [27], то можно предположить,
что будет справедливо соотношение (1, 1).
Говоря о рамках применения третьего метода сравнительного расчета,
не следует забывать, что он не распространяется на ряд свойств, значения которых можно сопоставить с помощью первого и второго метода
сравнительного расчета. К ним относятся свойства, которые не могут иметь
больше одного значения (например, критические параметры, ионизационные потенциалы, химические постоянные и т. д.). Следует также иметь
в виду,
что
ограниченность
многие свойства известны
то при Р = 1 атм).
применения
при
(ПТ,
1) обусловлена
и тем,
что
одном значении П (например, если ПД =Р,
137
Общим для первого, второго и третьего методов сравнительного расчета является то, что в основу каждого из них взят ряд различных веществ;
поэтому
каждому
из
этих
методов
соответствует прямая, характер
расположения точек на которой определяется природой веществ ряда.
ЛИТЕРАТУРА
Ж.
Ж.
физ.
физ.
химии,
29,
химии,
938
29, 1328
(1955).
(1955).
Ж. физ. химии, 30, 1104 (1956).
Докт. дисс. М., МХТИ им. Д. И. Менделеева,
3 >> >
Phys. Chem., 58, 392 (1954).
Годнев. 'Ж. физ. химии,
Справочник
физических,
1957.
27, 1580 (1953).
химических
и технологи-
‚3
NOOR
S225
Whe
. xX .Карапетьянц.
Хх .Карапетьянц.
. Х. Карапетьянц.
. Х. Карапетьянц.
.Р. Altschuller.
J.
. С. Свер-длин,
И. Н.
ехническая энциклопедия.
еских величин.
РРР
=
=
COCO
.Н. Никитина,
В.М. Сафонова.
Ж. физ. химии, 29, 356 (1955).
.J. Katz,
J.L.Margrave.
J. Chem. Phys., 23, 983 (1955).
Б. Кудрявцев.
Применение ультраакустических методов в
зико-химических исследований. М.—Л.,
Гостехтеоретиздат, 1952.
K. Kelley,
HS= OC om
> jm
Cw bk
Mines
Rept.
A. D. Mah. Metallurgical
of
Investigation.
.A.Swenson.
Thermochemistry
Washington,
Phys. Rev., 99, 423 (1955).
Кожин,
А.
И.
1959,
Китайгородский.
48 pp.
Ж.
физ.
of Titanium, Bur.
химии,
29,
1897
105,
1145
—
|B. OM.
5490,
практике
5).
АН
СССР,
©
SEs
OES
. Г. Ма аслов.
Ж. физ. химии, 25, 814 (1951).
15. И. М. Рооднянский,
И. С. Галинкер.
Докл.
.И.
Рузавин.
Канд.
р нед,
уэн.
.-A. Robinson,
C.K.
Б.О
дисс.
М.,
МХТИ
Linn,
K.P.
Физическая
им.
Д. И.
Ang.
химия
Менделеева,
1954.
J. Am. Chem. Soc., 75, 5130
растворов электролитов." М., ИЛ
19. Л. С. Зайцева. Автореф. канд. диссерт., М., 1956.
20. Г. С. Б4гу|ап@,
Г. Е. Сгам
ЕЁ ога, М. А. Mastoor.
Canad. J. Phys.
38, 1546 (1960).
241. Selected values of physical and thermodynamical properties of hydrocarbons and
related compounds,
G. C. Pimentel.
22. и.
И.
Бу
Е. О.
Стрелков.
7 (1952).
23. Г. К. Боресков. В
Труды
25.
phys.
Chem.,
220,
ХТИ
им.
R. L.
В. И. Ленина,
физической
M., Госхимиздат,
Ю. К. Делимарский,
химии, 28, 1987 (1954).
С. И. Скляренко,
26. Н. Г. С | еуег,
27. Ц. Geiseler,
K. S. Pitzer,
с6б.: Проблемы
хим. ин-та им. Л. Я. Карпова,
24. Б. Ф. Марков,
Rossini,
Pittsboergh, Carnegie Press, 1953.
Б. А. Сахаров.
Ж.
Arnett,
M.
Braun,
серия хим.-технол.,
химии,
вып. 1. Труды
1958, стр. 101.
И.
R.
Д. Панченко.
физ. химии,
№
1,
Физ-
Ж. физ.
24, 97 (1947).
Т.Н. Зау1от, Р. М. Сгоззв. J. Phys. Chem.., 62, 89, 1958.
К. Quitzsch,
J. Hesselbach,
R. Hittig.
Z.
79,
1962.
ГЛАВА
IV
СРАВНЕНИЕ ЗНАЧЕНИЙ ОДНОГО СВОЙСТВА
ДВУХ ВЕЩЕСТВ ПРИ РАЗЛИЧНЫХ ЗНАЧЕНИЯХ
ПАРАМЕТРА УСЛОВИЙ
|
ВВЕДЕНИЕ
ое
Четвертому
линейное
в котором
методу сравнительного расчета отвечает приближен-
соотношение
в простой
или
Gy
=
AyGu
+
Ba,
(IV,1)
в функциональной
шкале
сопоставляются
зна-
чения свойства @ веществ М и М при одинаковом, но различном от точки
к точке значении параметра условий П [1—3]. Вещество М, свойства
которого должны быть известны, будем называть стандартным веществом.
Соотношение (ТУ, 1) справедливо в тех случаях, когда зависимость
может
нием.
быть выражена
для
|
И
G = 7 (I)
обоих
веществ
(IV,2)
двухпараметрическим
уравне-
Gy = ay + by @ (I)
(IV,3)
Gy = ак + 659 (П).
Действительно,
лучим
решив уравнения
ск N=; Gu
@
M
т. е. уравнение
(ТУ,1),
(ТУ,4)
([У,3) и (ГУ,4) относительно
ф(П), по-
oN
1 On — Om 5,
|
(IV,5)5
м
в котором
5
|
A, = ы,
(ГУ,6)
b
.
By = ay — ay 5 .
(IV,7)
M
Из сказанного следует, что четвертый метод сравнительного расчета
отличается от первого, второго и третьего тем, что дискретность расположения точек на прямых, отвечающих соотношению (ТУ, 1), может быть
любой,
так
как
она
определяется
набором
значений
П,
который
вслед-
ствие непрерывности изменения этого параметра произволен. В трех предыдущих методах дискретность расположения точек на соответствующих
прямых определялась значениями параметра вещества 2; они вполне определены, так как в отличие от ЛП параметр 2 в любом ряду веществ имеет
ряд дискретных значений.
139
При оценке возможности применения четвертого метода следует учесть,
что в ряде случаев интервал значений ПЦ, в котором получаются удовлетворительные результаты, может оказаться ограниченным (например, фазовым превращением, вызывающим нарушение монотонности изменения 14).
ЧИСТЫЕ ВЕЩЕСТВА
Можно указать на многие свойства веществ, для которых справедливость соотношения (ТУ,1) подкрепляется рядом примеров. К ним
относятся теплоемкость, вязкость, энтропия, показатель преломления,
дроссель-эффект,
плотность,
коэффициент
звука,
скорость
сжимаемости,
E, 10°
4OP
|
40
|
I
60
L
1
80,
KesBp ‚ 10
1
.
Рис. 116. Взаимосвязь между
коэффициентами
линейного
расширения бромистого цезия
и иодистого цезия при различных температурах [8]
0
:
10
1
i
:
20 iy A
T
1
I
40
'298/Li ALO,
Рис.
117. Взаимосвязь
между энтальпией (Нт —
Рис. 118.
Взаимосвязь между элек-
— Hage) (xxaa/moav) алюмината и феррита лития
при различных температурах [13]
тродвижущей
силой «термопары давления» (в) золота и
серебра при различных давлениях
[15]
диэлектрическая проницаемость, коэффициент линейного расширения и
некоторые другие [4].
Вот несколько примеров соотношения (ТУ, 1) для случаев, когда параметром условий является температура: коэффициенты сжимаемости жидких СН,Ми
СН 5) при Р = 5000 атм и 20, 40, 60 и 80°С (по данным [5];
вязкости
тех же жидкостей;
теплоемкости К(
и КВг при 100,
150, 200 в
298°К (см. [5]) и функции (7т — Н°..з)/Т для этих же веществ при 298,
500 и 1000° К. (см. [6]); стандартные энтропии СНЕ, и СН.Е при 298, 400,
500, 600, 700, 800, 900, 1000° К. (см. [71); коэффициенты линейного расширения
СзВг и СзЁ при 25, 100, 200, 300, 400, 500 и 600°_ С
(cm. [8] )};
дифференциальный дроссель-эффект для н-С.Ни и изо-С.Н
11,1; 87,8; 104,4°С (см. [4]); показатели преломления н-С.На4
при 20, 40, 60, 80 и 100°С (см. [9] и [10]); энтальпии
при 54,4
и н-СНиз
(Нт — Но.)
А.
и [1ЕеО. в интервале от 400 до 1800°К (см. [13]).
В работе Н. Н. Дрозина [11] четвертый метод сравнительного расчета
применен для приближенного вычисления температурных изменений энтропии твердых неорганических соединений. Результаты измерения показателя преломления органических жидкостей в широком интервале температур [12] также описываются соотношением (ТУ,4) при П = Т.
Приведем ряд примеров (ТУ,1) для случаев, когда параметром Условий
является давление: атомные объемы Ас и Аи при 2000, 4000, 8000, 12.000 атм
(по данным
([14]);
относительное
уменьшение
объема К и ВЬ при
10, 20, 50, 70, 100 тыс. кг/см? [44]; электродвижущая сила «термопары дав-
ления»
Ап и Ас при Р = 800,
1000 и 2000 кг/см?
[15];
т Интересно отметить, что в последнем примере линейность
точек плавления обеих солей (см. рис. 116).
140
диэлектрическая
сохраняется
вплоть до
проницаемость
С,Н5ОС.Н;
и СЗ.
при
30°С
и 1,1000,
2000,
4000,
8000,
12000 кг/см? (см. [46]).
К этим примерам, вероятно, можно присоединить взаимосвязь между
скоростью распространения звука в нормальном и изомерном спиртах
при высоких давлениях, найденную в работе [17].
Некоторые из этих примеров иллюстрируются рис. 116—118.
Этот перечень ограничен не столько рамками применения соотношения (ТУ, 1), сколько отсутствием соответствующих экспериментальных
данных.
РАСТВОРЫ
Возможность применения соотношения (ТУ, 1) для растворов была установлена [4] на отдельных примерах для ряда свойств. В случае,
когда параметром условий является температура — для эквивалентных
электропроводностей двухнормальных водных растворов МаС] ua KCl
А
Вас,
POF
130
120
110
100
n
1
710
1
120
|
130
[
Asrol,
740
Рис. 119. "Взаимосвязь
между эквивалентной
электропроводHOCThIO
A(om!/em?) водных
растворов
хлористого
стронция и
хлористого бария при {=25°Си различных концентрациях [20]
Жирным
контуром!
выделена”область
соблюдения
закона
Кольрауша
при # = 25, 50, 100,150 и 200°С (по данным [18]); в случае, когда параметром условий является концентрация — для коэффициентов теплопровод-
ности водных растворов КС] и [/1( при # = 25°С
ис = 0,5; 1,0; 1,5;
2,0; 3,0 и 4,0 (см. [49] ), для эквивалентной электропроводности водных
растворов 41
и ТАВг при 25°С ис = 0,0005; 0,004; 0,005;
0,04; 0,02;
0,05 и 0,1 экв/л (см. [20]), для скорости звука в смеси С.,Н.(ОН), и
н-С„Ни--ОН (п = Зи 4) при объемных долях С.Н.(ОН),, равных 0,05; 0,4;
0,2; 0,3; 0,4 и 0,5 (см. [21]), для средних. коэффициентов активности при
t = 20°C растворов ВЪ,ЗО; и С3.50. при т = 0,1; 0,2; 0,5; 0,7, 4,0 и 1,4
(см. [20]), для сжимаемости этиленгликолевых растворов изо-С.Н.ОН и
изо-С(,Н.1ОН при # = 25°С и объемных долях С.Н,(ОН),, равных 0,05;
0,1; 0,15; 0,25 и 0,4 (см. [21]).
Остановимся несколько подробнее на
соотношения (ТУ, 1) в виде уравнения
Ах = Aghy + Ba,
одном
примере — применении
(IV,8)
141
в котором сравниваются эквивалентные электропроводности растворов
двух электролитов при одинаковой концентрации [22]. В частности, для
водных растворов 5гС]. и ВаС1, при 25° С справедливо уравнение
Авась, = 1,033Agrci, — 0,32
(IV,9)
(см. рис. 119). Сходство этих электролитов, высокая точность опытных
данных и то, что последние заимствованы из одного источника [20], позволяют проверить надежность уравнения (ТУ,9). Результаты проверки
показывают [22], что простое уравнение (1У,9) не уступает по достоверности наиболее точным из имеющихся в литературе уравнениям [23],
рекомендованным
для
описания
зависимости
точность
Асгс!,. Заслуживает
Авась
=
}
(с).
Необходимо
при этом учитывать, что на точность расчета по (ТУ,9) накладывается незначений
внимания
и то, что сравнительный
расчет приводит к хорошему совпадению в значениях
Лю бесконечно разбавленного раствора.
ФАЗОВЫЕ
_Чиетые
электропроводности
ПРЕВРАЩЕНИЯ
вещества
Обратимся теперь к уравнениям, которые являются примерами
соотношений вида (ТУ, 1) в применениик однокомпонентным гетерогенным системам (фазовые превращения чистых веществ).
В литературе описан ряд таких
зависимостей. По-видимому, по времени первой из них
=
©
es
т
ГРЕЕТ
{
100
50
-90
и, вероятно,
ду четвертый
одной
метод
из первых,
если
сравнительного
иметь
в ви-.
‘расчета,
является уравнение (правило) Дюринга [24,25] 1
ty — ty
> = const.
tu— ty
Tamm.
|
_
ааа
“50
0,
30
НВг
Рис.
120.
Взаимосвязь
(°С)
бромистого
В нем сравниваются температуры кипения жидкостей М и М при одинаковом давлении насы-
щенного пара.
нению обычно
ме-
ty
жду температурой кипения
и иодистого
водорода
водорода
при
различных давлениях [5]
(IV,10)
Таким
N
=
В настоящее время
придают вид
At
образом,
=
alu
TF By (Py =
правило
этому
урав‚у
Ры).
(IV, 11}
Дюринга
является
частным видом соотношения (ТУ, 1) при < =1
и П =Р (см. рис. 120).
\ Если исключить многочисленные работы, в которых это правило использовалось для обработки опытных данных, то все исследования, св занные с правилом Дюринга, можно разбить на три группы. Одни из них посвящены в основном анализу и применению этого правила [27—43], в
других работах правило Дюринга распространено на многокомпонентные
системы (см. стр. 145), в третьих излагалось применение правила Дюринга для расчета различных свойств (см. стр. 149).
Автор настоящей работы предложил приближенное уравнение
(АНпар)м
являющееся
1 Клаузиус
ложенного
142
частным
случаем
=
Ag (AA nap)m
соотношения
[26] показал, что (IV,
Гросхансом.
+
Bs (Px
([У,1);
=
в нем
Pm),
(1У,12)
при
одинаковом
10) почти не отличается сот соотношения, пред--
давлении сравниваются
теплоты парообразования двух веществ [4]
(см. рис. 121). Близким к (ТУ, 12) является рекомендованное Максвеллом
[44] уравнение
(АНпар)м
=
A, (АН пар)м
в котором те же характеристики
денном давлении.
+
By (tx
сопоставляются
AH,,,)
<=.
=
при
лм),
(IV ,13)
одинаковом
приве-
10MM
00мм
сн СОН
8
>
°
Татм
дн)”
OPEHs
le
lt
6
ДН
ЦЕ
at
aL
0
!
1
1
(ан
"вр
1
) С.Н,°
.
7
I
9 (2
1
H "ар,")
~
на
°
Рис. 121. Взаимосвязь между теплотами парообразования
(ккал/моль) 1-бутена и пропена (а) и 1-бутена и этилпропионата (6)
АНпар
при различных давлениях
Шультц [45] предложил
вечает уравнение
А пар
для
=
расчета
энтропии
комендовал
уравнение
Косграв
нения
и Шнейдер
—
воспользоваться
Аа
(АФпар)н-с.на
испарения
н-алканов
[4]
зависимостью,
+
Ба
(Р
которой
= Р!н-с,нь),
и н-спиртов.
(IV ,14)
Лотье
[46] pe-
Vy = Au + Ba (Pn = Py).
(IV, 15)
[47] упоминали о возможности применения урав-
oh = Ah + By (Tx = Tm),
(IV,16)
где рог — плотность сухого насыщенного пара.
В качестве еще двух возможных примеров применения
(ТУ,1) к фазовым равновесиям приведем уравнения
соотношения
(ton)n = Ag (toa)m + Ba (Px = Pm)
и
|
от-
On =
Agom
(IV,17)
+ Ba,
(IV,18)
где с — поверхностное натяжение. Примером последнего является урав-
seus
Sour = 1,02 coH,c1 + 2,65
(см. рис.
NaF
на
122)
и взаимосвязь
границе
между
соль
— азот. при
(IV, 19)
поверхностным
1000,
1400,
данным [5].
|
В литературе описан ряд уравнений общего вида
le Gy = Aglg Gu + By.
|
натяжением
1200
и
11ЕРи
1300°C
no
(IV,20)
145
К
ним
относится
уравнение
Ig Tw
=
|
A,
Ig
Гм
+
Ва,
(IV,21)
предложенное Хенглейном [48—50], а впоследствии Ли Юнь-хуа
[51],
и связывающее температуры кипения двух веществ при одинаковых давлениях. Этому уравнению посвящен ряд работ
[52—57].
В. А. Киреев [52] вывел уравнение
Ig
также
также
Py
=
A,
Ig
(
25409
25
26
rene
поверх-
Являющееся
натяжением
с (эрг/см?) хлорбензола и бромбензола при
yy pax
)
Уравнение
Взаимо-
между
ностным
(для @=Р
и
П=Т) (вм.
и
«Химические процессы»).
давления
насыщенного
пара
Ig Лм
=
A,
Ig Лм
|
Ва,
(IV ,23)
в котором сравниваются приведенные
давления наодинаковых
при
жидкостей
двух
пара
сыщенного
приведенных температурах кипения.
ааа
3134
122.
(ТУ,22)
двух веществ при одинаковых температурах. Гордон
[60] и Отмер [61] предложили видоизмененное уравнение (ТУ, 22
32k
т
Ва,
В нем сопоставляются
10°C
35|
связь
-|-
являющееся
примером
(ТУ, 20)
[58, 59]) (см. разделы «Растворы»
pate
Рис.
Py
Ig fy =
аналогом уравнения
комендовано А. М. Мамедовым
тучести кипящих жидкостей.
By}
В литературе
(1V,24)
Aglg fu + Ba,
также
(ТУ, 22), было
[62] для
описаны
расчета
ре-
ле-
уравнения
Ig pw = Aa lg pm + Bu,
(1,25)
lg on =
Ag lg oy + Bu,
(IV ,26)
Ig Sn = Agle Sy + By,
(IV,27)
в которых сравниваются соответственно плотности жидкости [63], ее поверхностное натяжение [64] и энтропия вещества [65, 66].
В заключение приведем несколько примеров уравнений, в которых
значения свойств веществ сравниваются в шкалах, отличных от обычной
шкалы или логарифмической.
Для расчета температур кипения Хенглейн [49,50] предложил урав-
нение
TN = АаТы - Вь,
(IV,28)
в котором значения этих свойств двух веществ сопоставляются при
наковых давлениях (см. также [68—72]). Опубликован ряд работ,
занных
с этим уравнением
Зеглин
[84] рекомендовал
[31, 73—79, 81—83].
уравнение'
tr = Ayty + Bu,
которое можно
одисвя-
считать обобщением, уравнения
(IV,29)
(ГУ, 28).
Растворы
Автор
настоящей
работы
предложил
уравнение
[3]
AHy = A,AHy + Ba,
(ТУ,30)
связывающее тепловые эффекты некоторых процессов. Возможность его использования была показана на нескольких примерах, в частности на при144.
мере интегральных теплот растворения. Если условием применения урав‚нения (ТУ, 24) для кристаллических веществ (П = Т или П=Р) является
их подобие, то в случае, когда ДН — интегральная теплота растворения,
а П — концентрация с, условием сопоставления служит аналогичный
характер изменения АН с с.
Уравнение (ТУ, 30) можно использоватьи для расчета теплот адсорбции. Так, это уравнение описывает опытные данные по адсорбции СНВг.
и СНУ, активированным углем
[5].
Ряд работ посвящен распространению правила Дюринга на многокомпонентные системы [85—92] (каждая прямая отвечает постоянному составу).
Гаррис [93] использовал уравнение вида (ГУ, 11) для сравнения рас-
творимости неорганических веществ в воде. Перри и Смит [94] распространили правило Дюринга на ряд свойств и, в частности, на растворимость.
Для расчета влияния давления на температуру азеотропной смеси Кайзер [95] рекомендовал уравнение, аналогичное уравнению (ТУ, 11).
Описанными соотношениями можно воспользоваться не только для
обработки соответствующего экспериментального материала, но и для решения
некоторых
других
задач.
Так,
И.
Н.
Кузьминых
и М.
Д.
Бабуш-
кина [96], применив правило Дюринга для обработки опытных данных
по давлению сернистого газа над растворами бисульфита кальция, обнаружили на прямых «температура раствора бисульфита — температура
стандартного раствора» излом, который, по их мнению, обусловлен тем,
что при 37°С происходит превращение СаЗО..2Н.О в Са5Оз.5Н.О (см.
рис. 123). Этот пример свидетельствует также о том, что не всегда графическая экстраполяция является правомерной.
В. А. Киреев [52, 97] указал на возможность применения уравнения
(ТУ, 22) к растворам и предложил номограмму для расчета давления пара
водных растворов аммиака
[53] (см. также [98—101]). Он же распростра-
нил уравнение (ТУ, 21) на смеси [52, 97, 102, 103]. В
было распространено уравнение (ТУ, 23).
Джонсон и соавторы
[105] применили
[104] на растворы
уравнение
для сравнения растворимости М веществ при одинаковых температурах.
Интересным примером использования соотношения (ТУ, 20) служит
уравнение
в котором
творов
13 Тпересыщ = 44 18 Muacum + Ba,
сопоставлены
данного
вещества
концентрации
в данном
насыщенных
растворителе
в
и
(IV,32)
пересыщенных
зависимости
от
рас-
темпера-
туры [106—109] (см., например, рис. 124).
В работах [110] и [111] уравнение (ТУ, 28) было применено для сплаBOB.
К рассмотренным здесь зависимостям можно было бы прибавить ряд
других, в частности эмпирически установленную в [112] линейную зависимость между относительной адсорбцией брома (и иода) в присутствии
двух
солей.
|
ХИМИЧЕСКИЕ ПРОЦЕССЫ
Применение соотношения (ТУ, 1) к химическим
иллюстрируется приведенными ниже уравнениями:
А7м = A,AZu + By.
vy = Agvoy + Ba,
10
м.
x.
Карапетьянц
превращениям
(IV,33)
(IV,34)
145
='"A,ky
kn
+
(ТУ,35)
Ва,
(IV 36)
Ey= AsEu + Ba,
В
из
первом
разования
600 и 700°К
них
стандартные
сравниваются
н-пентана
(например,
двух веществ
[113]), во втором
(по данным
(IV ,37)
Аарм -- Ва.
Pn=
изобарные
и пропана)
при 400, 500,
амаль-
скорость разложения
—
об-
потенциалы
гам К и ВЬ водой (выраженная количеством п мл раствора НС!
М№ = 0,1026), израсходованного на титрование образовавшейся щелочи) при
4, 8,12,
—
16 и 20 мин.; в третьем
скорости
константа
ния щелочью) СН.СООСН.СН(СН.). и СН.СООСН.СН.
и[
1234
|
20
167
Ш
|
0
а
50
L
|
80
110
i
12b5 67
Loy
1,0
140
м
|
Рис. 123. Взаимосвязь между температурами кипения # (°С)
рас-
творов
бисульфита
М — стандартный
кальция
Рис. 124. Взаимосвязь
между концентрациями насыщенных и пересы-
[80]
щенных
1 — Pgo,=
рт. ст.; 2 —150 мм; 3 —
4— 50 mm
водных
при
натрия
раствор; № — рас-
твор бисульфита кальция.
—=200 мм
20 и
2 9 rene
в
1
“ol
(омыле-
при 0,2; 10;
<
60
гидролиза
растворов
различных
рах [109]
нитрата
температу-
100мм;
30°C (cm.
[5]); B weTBepromM — электродвижущая сила (в) в системе
Pb/PbCl, + Me Cl/Cl, npa600°K ana Me = Ku Rb up мольной доле Мрьси, =
= 0,8; 0,7; 0,6; 0,5; 0,45; 0,4 [445]; в пятом — изменение удельного веса
при прокаливании ВаТ10(С.О.).-4АН,О и 5гТ10(С.0.).:5,5 Н.О при 45,
230, 370, 600 и 650°С [416]. Некоторые из этих примеров воспроизводятся
на рис. 125—127.
|
Уравнение вида (ТУ, 11) было применено в работе [147] для давления
диссоциации некоторых окислов металлов и карбонатов.
Ряд уравнений, которые можно рассматривать как частные примеры
соотношения
(ТУ,1) для химических
реакций,
были
описаны
В.
А.
Кире-
евым в серии исследований, посвященных однотипным соединениям и реак-
циям
[118—129]
(см.
также
[430]).
Под
однотипными
соединениями
подразумеваются такие соединения,
которые
имеют
подобные
формулы и различаются лишь
элементами-аналогами, находящимися в
одинаковых валентных состояниях. Однотипными реакциями считаются
такие, в которых каждому компоненту одной реакции соответствует однотипный с ним компонент другой реакции, находящийся к тому же в одинаковом с ним агрегатном
лива зависимость
[123]
Ig Ky
состоянии.
=
A,
Ig
Для
Kx
=
однотипных
Ва.
реакций
справед-
(ТУ, 38)
Здесь сравниваются при одинаковой температуре константы равновесия
двух реакций Х и У (например, диссоциации карбонатов кальция и строн146
ция). В уравнении (ТУ, 38) в качестве К можно рассматривать и давления
диссоциации различных веществ (в том числе карбонатов, окислов, сульфатов‚сульфидов, кристаллогидратов, аммиакатов). На возможность применения зависимости (ТУ, 38) указывалось также в работе [4134] (см., однако,
стр. 183).
Если уравнение (ГУ, 38) является примером соотношения (ТУ, 20),
то уравнение
ASy-=
в
котором
Уно
0
сопоставляется
20
м
B ,
температурная
24
(IV,39)
зависимость
изменения
JHTPO-
8
Е ост
|
"5
40}
‚ РОГ
ох т
о
80г
7
A,ASx +
1,30
|
72
1,26
У4 мин
деть
.20
122
40 60
Унд+к
Ne
Puc.
126.
Взаимосвязь
между электродвижущими силами (в) в системе
Рис. 125. Взаимосвязь
между скоростью разложения + амальгам
калия и рубидия во-
дой, выраженной
Рис. 127. Взаимосвязь
BaTiO(C2Q,)-
РЬ/РЬС] -- МеСс1/С]5 при
пии для двух однотипных
отношения (IV, 1).
реакций
[121],
4H.O
И
ЭТТ1Ю (С>04).5,5Н20] -после
прокаливания этих веществ
при различных емперату-
600° С (Ме = К или ВЬ)
в зависимости от MOJIbной
доли.
хлористого
свинца
[115]
в мл
раствора 0,1026№ НС],
израсходованных на
титрование
образовавшейся щелочи
[114]
меж-
ду удельными весами р(г/см3)
рах
представляет
[116
собой пример
со-
Надежность этих зависимостей иллюстрируется на одном примере
в
табл. 22. Точность полученных данных очень велика. Необходимо учитыТаблица
22
Сопоставление заиметвованных из литературы
[107] и вычисленных по уравнению (ТУ, 38)
значений
константы термической диссоциации
стронция
окиси
атомы [123]
газообразной
на
свободные
1 Кзго
T, °K
500
1000
1500
2000
2000
3000
3500
по
[107]
43,88
19,28
11,04
6,90
4,41
2,74
1,54
вычислено
43 , 88
19,28
11,03
6,89
4,40
2,74
1,54
А лит. вычисл.
0,00
0,00
0,01
0,01
0,04
0,00
0,00
* Е Ксго== 0,9667 1 Ксао— 0,1355.
вать при этом, что расчет произведен на основании данных по свойствам
соответствующих
веществ
при
25°С.
10*
147
При оценке точности результатов расчета следует различать степень
однотипности веществ и реакций. Наиболее однотипными неорганическими соединениями являются вещества, различающиеся элементами,
принадлежащими к одной подгруппе периодической системы. Менее однотипными являются аналогичные соединения элементов различных пПодгрупп (например, СабО, и 2150.). Еще менее однотипными. будут соединения, относящиеся к различным группам (например, РЬЗО, и ЕеЗО)).
Однако, например, окислы типа Ме.О; элементов от 5© до Fe, принадлежащих к одному ряду периодической системы, обладают еще отчетливой
однотипностью [4123]. Для органических соединений наиболее однотипными следует считать аналогичные производные данного углеводорода
(например, С+Н ‚„Вг и С, НьТ) и различные члены данного гомологического
ряда (если исключить первые члены).
В качестве примера наиболее однотипных химических реакций укажем
на процессы диссоциации карбонатов щелочноземельных металлов. Менее
однотипными будут, например, аналогичные реакции этилгалогенидов
или взаимодействие этена с Н.Ои Н.5, а также аналогичные реакции различных членов одного гомологического ряда [120] (лучше — для гомологов, обладающих сходным строением, например нормальных 1-алкенов)'.
Необходимо
также иметь в виду,
что различие
в валентном
состоянии
уменьшает степень однотипности реакций. Поэтому для реакции образования соединения из простых веществ степень однотипности обычно меньше,
чем
для образования
из соответствующих
соединений
(сравните,
на-
пример, образование карбонатов из простых веществ и из окислов). Приходится также учитывать степень однотипности элементов. Так, реакции
образования сульфатов и хроматов из соответствующих окислов более однотипны, чем реакции образования этих соединений из простых веществ
(элементарные сера и хром не являются аналогами).
|
Наконец, следует учитывать [129], что элементы второго ряда периодической системы (в меньшей степени — третьего ряда) в состоянии положительной валентности иногда обнаруживают меньшую аналогию в
свойствах
однотипных
соединений,
чем
элементы
из той же
подгруппы
с
оболочек
и
большими атомными весами. Это связано с тем, что катионы этих элементов
обладают
более
существенными
отличиями
электронных
соответственно размеров и потенциалов ионизации. В области высоких
температур (выше 2000—3000°К.) систематические отклонения наблюдаются иногда для соединений более тяжелых элементов, что свидетельствует, по-видимому, о влиянии возбуждения новых энергетических уровней и
усилении ангармоничности колебаний атомов в молекулах.
СОПОСТАВЛЕНИЕ
ЗНАЧЕНИЙ ПАРАМЕТРА УСЛОВИЙ
ПРИ ОДИНАКОВЫХ ЗНАЧЕНИЯХ
СВОЙСТВ
Остановимся на одной особенности четвертого метода сравнительного расчета, отличающей его от первых трех методов: этот метод позволяет сопоставлять не только значения ( при одинаковых ЦП, но и значения П при одинаковых (С, т. е. наряду с соотношением (ТУ,1) можно
пользоваться соотношением
Пк = А.Пы -- Ва
при Условии, что Ск = См. Такая инверсия
изменением (в зависимости от П (в пределах
но расширяет возможности
вычислений.
(ГУ, 40)
обусловлена непрерывным
данной фазы) и значитель-
* При этом необходимо соблюдать следующее условие: в уравнения реакции однотипные соединения должны входить с одинаковым стехиометрическим коэффициентом.
Поэтому реакции образования гомологов из простых веществ или реакции их сгорания
не являются однотипными (в них Апга = 0084).
148
С примером подобной инверсии мы уже познакомились в третьем разделе настоящей главы: можно сравнивать и температуры кипения двух
веществ под одинаковым давлением (уравнения Дюринга и Хенглейна)
и давления пара при одинаковой температуре (уравнение В. А. Киреева).
Рассмотрим ряд других примеров инверсии соотношения
(IV, 1),
когда сравниваются значения свойства @ при одинаковых температурах.
Портер [133] применил уравнение, в котором сравниваются температуры двух жидкостей при одинаковой вязкости (см. также [4133а]).
Перри и Смит [94] распростра,
нили правило Дюринга на различ—›.лее
ные свойства
(давление
пара, теплота испарения, теплоемкость, дрос-
сель-эффект
и др.).
т: 100,462
20
_ 150
у
бег,|--
600-
100+
ибо
Е
Z260r
50
р;
0— 700100 600 800 1000Т..
n
|
Рис. 128. Взаимосвязь
пературами Т (°К),при
между темкоторых че-
и Вольцинский
sy
ad
15D
—
200 — 2
нас
Рис. 129. Взаимосвязь
между тёмпературами & (°С) насыщенного и пересыщен-
тырехфтористый углерод и четырехфтористый германий имеют одинаковую теплоемкость Ср (кал/моль-град)
[136]
Карр
|
‚ ного
при
растворов нитрата натрия в воде
различных концентрациях т` по
данным различных авторов
© — [137]; ® — [138]; © — [439]
[134] предложили уравнение
tn = Agly + By
(бм = см),
(1У,41)
связывающее температуры двух жидкостей при одинаковых значениях поверхностных натяжений. Голькомб и Броун [135] рекомендовали уравне-
ame
te = Asta + By
[(AHnap)w = (AH nap atl
(IV,42)
в котором температуры кипения веществ сравниваются при одинаковых
значениях их теплот парообразования. Лотье (см. [67]) приводит уравнение
| in
в
котором
=
сопоставлены
A,ty
+
Ва
температуры
кучести.
(dn
—
фм),
кипения
при
(IV,43)
равных
значениях
те-
К этим зависимостям можно; присоединить и ряд других, в частности
рекомендованную автором [436]
Г
=
А.Тм-- Ва
[(СР)м=(Ср)ц ],
в которой температуры двух веществ сравниваются при равных
их теплоемкостей (см. рис. 128).
На рис. 129 показан один из примеров зависимости
пересыщ
являющейся
—
инверсией уравнения
туры насыщенного
концентрациях.
А
насыщ
([\,32).
+
Ва,
В ней сопоставлены
и предельно пересыщенного
(ТУ,44)
значениях
(IV,45)
темпера-
растворов при одинаковых
149
Уравнения, соответствующие инверсии (ТУ, 38), были рекомендованы
В.А. Киреевым [423, 128]. Сопоставление двух реакций при одинаковых
значениях констант равновесия имеет и практическое значение. Так,
представляет интерес определение температур, при которых давление дис-
социации
сходных
металлов) равно
уравнения;
веществ
14 атм.
(например,
В работе
ТУ
;
карбонатов
щелочноземельных
[123] были рекомендованы
=
A,Ty?
+
следующие
Ва,
(IV,46)
In Ty = AginTx + By
(LV,47)
Py = Aglx + By.
В них
сравниваются
блюдается
условие
Кх
температуры,
=
(IV ,48)
при которых для
Ку.
ПРЕДЕЛЬНЫЕ СЛУЧАЙ СООТНОШЕНИЙ
Рассмотрим
отношения вида
предельные
реакций
Х и У со-
(ТУ, 1) и (ТУ, 40)
случаи соотношения
(ТУ, 1), т. е. со-
Gy = Gy + Ba
и
Gy = A,Gy.
Первое из них означает независимость
ства двух веществ от параметра условий
4nagheucer
6
é
|
=
_—
=
для
теплотами
па-
рообразования АНизр (ккал/моль) бензола и
хлордифторметана при различных давлениях
[145]
предложенные
|
и [145]
автором
сильно
гид-
сходных
солей,
содержа-
щих
слабо
гидратированные
ионы
И обладающих сложной
структурой,
уравнение
вида
(ГУ,
50)
(см. также
[142].
—м,
bn , anor,
между
содержащих
ратированные ионы, применимо уравнение вида (ТУ, 49), а
|
Рис. 130. Взаимосвязь
(\,50)
разности значений данного свойП, второе — постоянство отношения значений данного свойства для двух веществ в некотором интервале значений IT.
Рассмотрим несколько примеров соотношений (ТУ, 49) и
(ТУ, 50).
Как показал Чин [140, 141],
для водных растворов сходных
солей,
Zr
р ye
0
——
(1V,49)
приближенные
В
обоих
случаях
@ =с
(кон-
Центрация).
К уравнениям типа (ТУ, 50)
применительно
к однокомпонентным системам относятся и
зависимости [4143, 144]
(АНпар)м
=
Аа (АНпар)м
(IV,51)
(АНпар)м
=
A, (AH nap )M-
(IV,52)
В первом уравнении теплоты парообразования сравниваются при температурах, равно удаленных от их критических температур, т. е. при условии,
что: (Lip — к = (р — м. Оно было широко использовано для вычислений [146—149] (см. также [150]). Второе уравнение является уравнением
(ГУ, 12), в котором В. = 0; на одном примере оно иллюстрируется
рис. 130. При сравнении его с рис. 121 видно влияние соотношения между
150
‘критическими
давлениями
циента B,.
_ Уравнение
(ТУ,
сопоставляемых
жидкостей
52) удобнее и точнее уравнения
на
знак
коэффи-
(ТУ, 12). Во-первых,
для рассматриваемого вещества достаточно знать всего лишь одно значение АНпар,
а так как для многих веществ известны только значения
(А Нпар) нтк И при этом с высокой степенью точности, то отсюда вытекает
возможность
широкого
применения
даже величина [(АН ар)нлк|м
скажется
давления
существенным
при
именно
определена
уравнения
образом на результатах,
постоянной
относительной
значений
(Рьр)м
и
(Рьр)ук
оказывается
52).
Если
так как с повышением
погрешности
абсолютная
ка будет уменьшаться. Во-вторых, уравнение (ТУ, 52)
сти
(ТУ,
недостаточно точно, то это не
ошиб-
при условии близо-
справедливым
независимо
от
природы сопоставляемых веществ. Это значит, что различие в характере
связи, в полярности и других свойствах веществ не отражается на точности
результатов 1. В-третьих, возможности применения этого уравнения велики еще и потому, что наличие веществ, для которых значения
А Нпар известны до Рьр, во многих случаях позволяет подобрать стандартное вещество
с необходимой
величиной
критического
давления
(наиболее
надежных результатов следует ожидать в интервале критических давлений от 25 до 50 атм). В-четвертых, уравнение (ТУ, 52) приводит к удовле-
‘творительным
по точности результатам.
Это видно
из табл.
23, в которой
Таблица
Сопоставление опытных и вычисленных значений теплот парообразования
(ккал/моль)2,2-диметилгексана (Pup = 25,6amm; р = 279° C) [145]
23
АНп.
AH yap
р
вычислено
опыт
мм
рт. ст.
10
400
.
2
8, 96
8,47
7, 30
5
10
20
8,90
8,42
7,19
6,42
5,28
3,06
6,30
5,24
3,16
.
среднее
Ree
9,02
8,46
7,17
6,28
5,25
3,25
(АН
Л Ay ap
По, | Зоя
9,18
8,60
атм,
по
7,17
*
Ркр
=
25,4
атм
***
Среднее
значение
(кр
=
ккармыь |
%
0,16
0,14
1,7
1,6
0,13
6,29
5,20
3,10
ep
** Pup = 25,4 ame
пар)опытн— (А Нпар)ер
1,8
0,13
0,08
—0,04
2,0
1,5
1,3
0,14
1,7
270,9).
(typ = 290).
из двух
предыдущих
(после сглаживания
но давлению
и температуре).
результаты вычисления АН,.ар = } (Р) по уравнению (ТУ, 52) сравниваются с наиболее надежными значениями этих величин, заимствованными
из литературы (см. [145]).
1 Если
соблюдается
точное
равенство
критических
давлений сопоставляемых веществ [что не является необходимым условием применения уравнения (ТУ, 52}],
то будет соблюдаться равенство приведенных давлений насыщенного пара tn = Ny
В этом случае описанный метод совпадает со способом расчета, предложенным для
вычисления теплот испарения углеводородов (и спиртов) по теплотам испарения гексана (лм =Лн-с.н,) [44]. Ясно, что в общем случае эти методы не тождественны, так
как в равенстве лк = лм не содержится условия Ру = Ру.
151
_ Аналогичная проверка дала Ась (в ккал/моль): для С.Н, (по СН.СООН
a CHC1,F) — 0,09; CH,COOC,H,
[m0 CH,C(CH,),CH,; a CC1,F — ‘CCIF;)
—0,17; SnCl, [110 0- CyH,(CHs)s nu C,H,,CH;] — 0,04; C,H;OH (по HCOOCH,
И CH,Cl) — 0, 23; SO, (no С и СНзОН)
— 0, 09. Среднее отклонение для
всех шести
веществ
составляет
немногим
больше
0,1
ккал.
По уравнению (ТУ, 52) были вычислены приведенные в табл. 24—28
значения АНпар для тех веществ, для которых имеющиеся в литературе
значения (АНпар)н.т.к И Рьр достаточно надежны. Первые были заимствованы из различных источников (см. [145]), а для некоторых веществ вычи-
слены по приближенному уравнению Клапейрона —Клаузиуса с внесением
поправки по методу, описанному в [151]. Вторые значения были заимство-
ваны из сводки [152], а для отдельных
ничных случаях значения
(АНнар)нтк
веществ — из [153] и [154]. В гедии Рькр почерпнуты
из дополни-
тельных источников, ссылки на которые приводятся ниже. Расчет был произведен также для нескольких высших углеводородов, так как хотя для
большинства из них значения Рьр (и &р) являются приближенными, од-
нако,
помимо
(АНнар)н.т.к ‚ Для них
известны
значения
(AH nap) o98 [155].
Таблица
24
Сопоставление опытных значений (АН п. p)298 (ккал / моль) некоторых
углеводородов с вычисленным по уравнению (ТУ, 52) [145]
.
(АН пар)598,16
Вещество
по
Изопропилбензол
1-Метил-2-этилбензол
1-Метил-3-этилбензол
1-Метил-4-этилбензол
н-Нонан
н-Пропилбензол
1,2,3-Триметилбензол
1,2,4-Триметилбензол
1,3,5-Триметилбензол
лит.
данным | вычислено
10,78 [156]
10,75
11,40 [413]
41,24 [113]
11,14 [113]
‘11,0099 [156]. |
11,049 [156]
—0,03
11,16
11,06
10,96
41,12
—0,24
—0,15
—0,18
0,02
41,40
11,20
11,24
—0,32
—0,26
—0,14
11,08
14,725 [156]
14,457 [156]
14,346 [156]
А опытн.- вычисл.
0,03
Надежность описанного метода расчета при низких давлениях (порядка
1 им) подтверждается данными, приведенными в табл. 24 (Ар = 0,45 ккал),
из которой видно также, что в качестве опорной точки можно пользоваться и значением (АНнпар)зов (если известно значение Роз).
Следует отметить, что результаты расчета более чувствительны к
погрешности
значений
АНнар
[в частности,
(АНпар)н.т.к],
торому несовпадению в величинах
(Рьр)м и (Рьрм.
Результаты
вычисления по уравнению
(1У,52)
табл. 25—28.
К предельным случаям соотношения (ТУ, 40) относится
уравнение
Ty =
Aly,
Чем
к
неко-
приведены
в
приближенное
(IV, 53)
выражающее
пропорциональность
температур
двух изоструктурных
веществ при одинаковом значении их теплоемкости (см. также [477].
Ряд уравнений, которые можно рассматривать как примеры предельных соотношений (У, 49) и (ТУ, 50) в применении к химическим процессам, предложил
реакций
сти
152
вида
В. А.
[124, 123,
Киреев
для однотипных
АСу —
АСХ
124, 130]. К уравнениям
= const
соединений
и однотипных
(ТУ, 49) относятся зависимо-
=
Ва,
(IV,54)
уравнениям
(ТУ,
50) — зависимости
AG.
Y=
AGy
здесь
а = ь, Ср,
Н,
вида
const =
7. Эти уравнения
Аз;
(IV,95)
означают,
что изменение
разности
соответствующих термодинамических характеристик процессов в зависимости от температуры в однотипных реакциях остаются практически одинаковыми. При
оценке точности расчетов по этим уравнениям следует
иметь в виду изложенное выше, на стр. 148. Кроме того, необходимо учи-
тывать, что уравнение (ТУ, 55) для АС
будет соблюдаться хуже, чем для
АН”, так как первая величина является производной от второй.
К однотипным соединениям эти соотношения применимы в более узких пределах, так как сказываются индивидуальные отклонения в низкотемпературной теплоемкости простых веществ (элементов). Для повышения точности уравнение (ТУ, 55) целесообразно применять в виде зависи-
‘мости
о
о
о
°
(Gr — Gr,) n = A, (Gr — Gr,)
(ТУ,56)
т. е. в качестве начала отсчета свойства (например, Н или 5) вводить не
величину
С., а значение
свойства при сравнительно
высокой
температуре
ТГ: (например, 273 или 298°), выше которой указанные отклонения не проявляются.
Было показано также [126], что уравнение (ТУ, 54) применимо к атомарной энтропии А5об› образования веществ (изменение энтропии при
образовании 1 моля вещества из свободных атомов элементов в их стандарт-
ном состоянии при той же температуре) и обсуждена [129] возможность
применения этого уравнения для определения влияния температуры на
Аб обр, при использовании аналогичных
данных для другой реакции,
типной с первой.
Предельным случаем уравнений (ТУ, 46— У,
сии уравнения (ТУ, 38), будет зависимость
48), отвечающим
ш Гу = Ш Хх + В,
о
В
уравнении
Ту
Ty
Tx
Ty
Ty
Te
Туи
инвер-
(IV.,57)
77’
(1У,58) каждая пара температур
одно-
(IV,58)
Тх, Туи
Тх
ит.
д.
соответствует различным значениям константы равновесия.
В работах Б. С. Эльянова и М. Г. Гоникберга 178, 179] была показана
возможность применения уравнения
|
.
K
lg — = Ay
Ky
M
(IV, 59)
для расчета или констант скорости или констант равновесия реакций в
растворах под давлением. В уравнении (ТУ, 59) индексы М и М относятся
к двум сравниваемым реакциям, а
AVyn
A, = AV?
M
(IV ,60)
re AVy au. AVy — u3aMenenua объема при образовании продуктов (в частности активированного комплекса) из исходных веществ в реакциях M uN.
Известны случаи, когда соотношение (ТУ, 1) может быть рекомендовано в виде приближенной зависимости.
би = Ск,
(IV,61)
153
|
|
|
|
|
—
—
—
—
—
|
|
|
|
|
0 |
95|
4/5 | 797
|898 | 19
08°8
[|
829
89‘6
|
|
|
|
|
|
|
|
|
|
«в (071) |
оп
вине
|
89°, | 90'8
88'9
$8'2
97'6 |
96'8
—
686
49|
|504 |
|876
OF TE. |
—
eh |
LSD
95'9 |
(671) |
05'6 |
878 |
98'9 |
ce'6 |
10|
7/'9
19'8
ZS‘Ob |
OL'OV |
SOV]
LESTE |
—
—
8'9
G‘L
99'$
26
—
—
И
LV‘L
|576
OS‘TT
—
—
|
| 947
7G
| 9F‘OF
| 1'07
7‘8
—
—
О
|
|
OFT
958
56'6
8e‘Or
818
82'8
807
94'07
“1d ww
07
SL‘OD |
867 |
876 |
88‘6 |
SL‘L |
T6'L |
07'07|
G‘Or |
007
"19
неледо:ф
„т нетедогхи-р“у
ичяогитАч-4ошь
2“
-еЧ 191-72‘ 0‘ Т-Чокхи
нетоидогхи
Ч огхи\
негэидолфи
нииегипо@пи\Г
пифчиКогитежи!
нешолшгитеми!-2‘2
ии
нигинегите
HUWeLHLONY/
Ач
гиЧтиноЧих
BUY HLA -x
HeOMOIOLN
1Чипо иччоги:АЧ-шг4ш
14ипо имчзогизАч-н
1Чипо
поенеогихАч-н
neLondoipudiwodgq
IroeHagnodg
ind LHHIOEHEg
rnd wHOLeny
нолепу
нигин\,
повину
oaLooltiog
е4000йет тогпэг кинэБене эчнножигоиац
отчннэгоиычя
|
|
|
|
|
|
|
as (ZOU) |
«в (1‘6)
(19‘9)
(8/'7)
(99‘L)
в (7'9)
758
(86)
(ze‘9)
(c6‘L)
(ec‘6)
#2(6'6)
(0
|
139 | 665
(58*8) | (96*9)
|(<7'9) | (689)
979 | 751
60'S | 99'8
09'9 | 892
05'8 | 85:6
595 | 80'9
8/'9 | 99'4
00°8 | 00‘6
OL'S | 876
868 | 1416
7‘9 | FL
477 |
|(95'6) |
(09*$)
598 |
907 |
966 |
872 |
OFS |
06'8 |
9°9 |
ZBL |
$08 |
ee | 967
ст | 965 |
—
04$ | $79
08|
15|
— | (СР | (09‘5) |
|-—
9°Т | 266 |
—
>
85 | 886 |
17|
—
0'5 |
—
—
-—
08 | 086 |
—
|СТ | 895 | 886 | 087 |
85 | 577 |
—
oY
—
—
—
9‘¢ | oS | OF'9 |
7
15$ | 09'9 |
|996]
—
den ry
оиноняедА
6
(2°6)
113И (69)
(<1'‘8)
(co‘6)
(<)
(GZ‘L)
(01'6)
az (S76)
3
98 | 116
646 | с
|(98*4) | (658)
082 | 598
719 | 8L'9
|(9z‘9) | (06‘9)
958 | 656
70 ‘6
058
07
ss‘9 |
066 |
(089)
06°9 |
OS'S |
eS‘S
6/2 |
ЗА |
<‘
с‘ |
ТЯ |
16
sc‘e |
se‘e.|
078 |
09 |
05
05
6‘y |
565 |
09°8 |
|. 56 |
es‘y |
ery |
$99 |
0/58 |
07
WULD
(<е ‘АГ)
эинэгае
„т [47И
‘яхоошоя хичээвине14о хгч4дололэн (чи“0ож//ряя)
03
—
— | —
—
— | —
05|
||
-— |
yc |
— |
— | — | G0'%]
|055 | 977 |
—
|
--
О
—
—
—
——
08 | —
87
ewe |
09—|
98'68 |
в |
978 |
[867] $‘ |
8 |
<< |
vue |
[887165 |
6y |
[657] 987 |
|
|
|
|
|
|
|
09
вигов J,
а
[898%
[ust] ‘se
9%
oy
Lily
9‘o9y
e‘cs
ew
сс
154
||
089 |
6'< | 20‘9 | 064 |
998 | F9'9 | 752 |
9/6 |
GL‘y |
GL‘Y |
987 |
079 |
oy |
67 |
L‘'y |
595 |
069 |
0889 |
8$ |
579 |
Oz‘y |
$59 |
68'9 |
097 |
00$ |
L‘G
BE°9 |
99
|
|
|
|
|
|
|
564
779
879
$09
$87
666
'<
80°9
|
|
|
|
|
|
|
|
|
|
|
|
|
6
QB‘L
8/6
708
80'8
L‘L
659
8/'9
09‘9
ZE'L
89‘z
85:6 | 9/6
O8‘L | GL‘8
O8'L | 8/8
664 | 968
079 | 60'4
OL‘L
79'8
8/14 | 0/'8
98‘L | 92‘8
966 | 98'8
8'6 | 859
311 | $94
806 | 066
098 | 886
ZH‘S | CB‘S
958 | 996
056
70° 07
552 | 908
$6'6 | 087
(578) | (50°6)
8F‘8
oo 6
092 | 178
888
054
052
569
19'S
879
80'9
519
00°9 | 88'9 |
897 |
L9°9 |
79°9 |
58'9 |
598 |
95°9 |
899 |
s9‘9 |
47$ |
876
89 |
099 |
0/1 |
HEF |
787 |
958 |
059 |
18$ |
|(ob‘z) |
ZO'L |
|199 |
0$ | 9/8 | 574 | 078 | 65.6
96 | 59% | 845 | 989 | LIL
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO
069
067
97
846
897
0'7
906
85 | 867 |
165
ея
Ус
9°%
ere
OF
0'8
0'%
875
486
УТЯ
ре
855
GL‘e
04'$
19'S
81
875
УЯ
eS
(0
--
$59 | СТ | 465 | 476 |
[8671850 | —
[971 6'68 | — | — | — |
6 |
| - | 81|
|
— | ДТ|
— | -— | —
||
—
|
— | — | — |
—
—
—
|
—
—-]
-]
50| 70'7| 99° |
—
СТ | 64'5 |
— |
|
Тр
— | ОР
ес
—
106.
17|
05| S9°C | HZ'E |
96'7т| 995 | РР |
—
ОТ | ОТЯ |
|
[50|
$Т| 961 |
— | — | Sel
—
7G]
bY]
|-|-
— | 9811
—
87|
— | От
— | — | se}
TS
cit
-|-|-— | -— |
ye?
—
—
— | 606
сс
065 | 88'$
65|
86
06|
909
ese | — | -— | -
7‘ 87
*29°CE |
a9 SCE
#9 7 CE
‘65
Ee
78
we}
9—|
9'7¢ |
ce |
9 |
cus |
9'52 |
УИ |
8‘ 04
7 58
9
997 |
$5
6
8, |
Е
wre |
7. 66
eS a
6'13 |
$'76
eg |
60‘6 |
(658)
(/°6)
#0 (S*L)
|
|
|
|
|
|
(07'8) |
xe (0‘9) |
xs (0g‘6) |
вкз (15'6) |
ag (97'6) |
(G‘z)
(816)
(756)
(62 ‘6)
ив (0'7) |
«с (669) |
(18)
(ZL‘S)
(g‘6) |
(11'9)
(18‘S)
(6‘07 |
(96'8) |
(06'7) |
(3'6) |
(09 ‘6)
(16'8) |
(90'07)
(c‘g)
(cc‘g)
«ib 8)
(69‘9)
в (7'/)
xe (G8'9)
(co‘z)
8'8
76
—
6707 | 26‘OT | OF‘TT
96'9
OF TE
40°
SE‘TE
9L‘8
1'0Т
SLZ‘OF
56'0Т
|887
95'4
|596
|869
86°OR
069
OS‘9
И
|166
86'7
607
CL OF
99'0Т
ненон-н
нетэиодтиН
ниие1фен
пифчидопиченило
Чифе имчаогилегите|
LroeHeQrunnLe-7Ale W-}
поенеогините-е-гилеу|-1
поенеогиниле-с-ги1э-т
нохенгитегите|
поеноогите-т-гите(-р
IroeHoguule-¢-IHLo
J -]
поенеогиле-2-иитэ-р
пидотфиитеу
пи гоигите|
тедэгеагито|
|
ии огите
ANIMALSW
нииеги1о|
гоитнете
1roeed
yy -n
ги тинод
ие
иифчидогиноодез
поенэогоИ
инчяогиподноеИ
поенеогиподпоеИ
1Чипо
твиидофгитА00еИ
Ci
| S¥‘TT
| 46
| OS‘TT
0‘6
| 96 ‘07
OF
| 08 ‘TF
|977
—
86
‘9
| ЗИ
—
—
—
|707
|80‘6
| —
07
6'07
|
1Чипо иччогит^Ао0еИ
гетопегих^908И
твиидофиииеоИ
иифчиАокилеи
нииегитеи]
негитедогхи[-с‘у-опй
негиледогхи\-с‘т-2нош
wetedorxuy/-2'}
90|
С | 9И
c‘8 | OL'8 | S0'6
15'9 |
se‘Or |
0707 |
OS‘OT |
97‘8 |
<7'07 |
ОТ‘ОТ |
‘ОТ |
459
GO‘L |
0'6
с<'9
9S‘OF |
08'9 |
LZ‘9 |
98°TT |
876
08'7 |
98'07|
82'OT |
96'6 |
| 871 | 3%4'И
‘Ot
|986
0‘ | $07
| &7'6
—
|892
108
| 98°
—
| GGL
—
| 79'S
—
96'8 | 26'6 | S8‘6
40°
456
<7'6
768
062
8S°L
$81
¥2°8
155
Wee}
— | — | — |
15|
08
|
|
|
|
|
|
966 |
05
‘eHOLAGY,
Ациавап
оп
онэкомьян
..
“(онэкоиыча ЧУ‹т оиновене) [191] +,
‘(ww 28h) 5-09, = (Ч Пту) оношщен [097] A wy
"[7$Н]
я Амониеоипо
88'9
88‘L
98‘L
659
059
80°9
088
| 99°4
| ча
078
56'9 |
904
98:8
|
|
|
188
$08
©
оп
онэкоиычя
y ;
9'8 | 68
dupe имчаогиподпиите
(85°) | 0'87
HornledolpudL-¢'¢' }-dor
yx -}
6‘OT
—
(Go‘L) | 6S‘L | 984
—
(G*g) | e276 | 89°6 | 6°
(68' | —
—
—
(80|
ФИ | —
—
—
«с (6'6) | 8807 | “И |
$07 |
(ge‘6) | ce‘Or |
(ce*6) |
J
‘6
—
OL°9 | 06‘9
у. 07
—
59° | 98*/
99°8
6'8
S8‘OF
—
(96'6) | 9°'07 | 00°1Р | 08
(G*c) | 00'9 | 95'9 | 07'9
|
|
|
|
ZL‘8
ge‘9 |
6‘6
ес'р |
878 |
Z‘OF |
|888
«в (0°8)
(6z‘S)
(G6 ‘8)
жэ(69'9)
(06‘L)
(416)
«s(T‘L) | GL‘L | 978
—
—
OF
—
|
-Ld ww
|
—
00}
9'9
(07'8) | 86'8
(<7°9)
J
“LO
Of. LOaMleg
еногиле
чоимО
Hud ay]
нииегипо4 [[-н
нофоиТ,
негиогит
ива то,
неомелокчишгипо4
| [-н
иидогхиипо4
| [-н
иидтиниипо4 |-н
гоЕнеогипо4
| [-н
ковноогитеии@
J -¢'Z' |
нииегитииЧ |,
поенеогитениа
1,7‘ ср
ndododorx
roeHagdorx
Had00¢p
гонэф
иолэнэф
гедигдоозигиге
тедизАогите
imnod orate
нииегите
гоитнеге
Yoderid wMLondoipxedmiep,
ноигетА9-6‘т-онеи-р-2иЯ
[sor] (Ze) | crs | OLS | 88*6
повноопизюмий 1-56“
(ce‘s) | 72‘6 | SL‘6
—
(6'8) | 976 | 89°6
0‘07
(Go‘9) | co‘L | 8z‘L
—
(gg‘9) | 70° | 08*/
—
—
«с (66'9) | //'9 | 86'9
(o‘e) | og‘e | 176 | 96°
11997] (976) | 08'6 | St‘or | 5.0
607 | 4%"
мневенд XBNQONO | 4;
‘Ацозэм
[ТИ] я Аионнеоипо ‘АЦолеи оп отоннокоиымча и олоннечоннойоной ви эиновене ээнцэ@о в;
|
|
|
|
998 |
585
$48
88:1 |
50°Ё
$87
94|
9/'6
869
59°
88°9 | 00‘8 | 06‘8
90'6
958
089 |
969 | 78 |
059 | 849 |
95'9 |
ся |
079 |
806 |
596 |
79'9 |
$
66° | 376 |
599 | 764 |
OF
|
"ЧеИуту ниновене омначно и ‘влоьов@ Ааоноо а эчнножогоп ‘Я ‘1 'Н (ЧП ту) виновене
$808 |
OOcL
OO‘L
5/6
96
Sb | 9288 | 75 | 879 |
566 | 057 |
0
o'y | 96°S |
—
0
o'7 | 06'S |
c6‘z | 09° | OFF | 418 |
85| 996 | 96% | 876 |
— |
Gtr]
78|
oe;
— | -— |
og}
— | — |
G19 | 9'0 | Go‘? |
$96 | — | 2 Т|
875 | 565 |
ЗА | 008 |
648 | вс | в/’у
|
|
|
T9'y | OFS | 196
|
|
|
|
419
65
097
ТУ
877
L‘y
507
06
| 958 | $679 | 6/'9
| (7S‘9) | Gen | (60‘8)
476 | 986 |
[19716.96 | — | — | —
6'0 | 491
[99718.67 | — | —
[58|
1
6'с
[497,07 | — | — | 80| 967 | 65
8.56 | — | СТ] 6/5 | 4/6 | 599
9% | — | — | ar'c}]
oF | 08'S
09S | — | &e‘b | ceo]
6‘7 |
67 |
2.09 | S‘o | S2‘e | Go‘v | 76'S | 974 | 158 | 176 |
ge‘ | sec | E‘L | 878 |
— | -— |
gee}
65 |
0°?
-|- |
— | -— | —
|
eee}
$81
0%
ww
эинэгае
|
Ove | sec” | 676 | $79 | 819
|095 | 048 | 597 |
FS]
9°
6'7 |
Тс | 5566 |
09
су
0‘<
се
066
‘5
0
— || — |
|-|—
70
— | — | 9599
—- | -— |
-|-|— | — | 05|
— | — | 77|
— | — | =
в
207)
— |
87;
ee}
|
|
и|
cece]
89|
0°09 |
06
сх епикое
09
[yor]e‘tz | oc | 08'% | Se‘e | 78's | Ley
au
(эинеьноно)
156
|
|
|
|
09
|586
|587
—
—
(015)
985
1РЕ
055
95
457
|990
98'0
|965
ви
‘илоеиоо
я АионнееемА
a ЧЕПНу
01|
се‘е
506
575'0
(059
156
<5'6
809
1/97
06°5
195
795
| 96'8
| 647
|6/5‘0
| 79‘9
| с0*я
| ¥Q‘9
|
|
|
|
|
|
|
|
ниноьене
и
[137]
799 |
оте |
86% |
ТО |
(077 |
09°9 |
08'8 |
9/°е |
059 |
0/5 |
475 |
075 |
069
087
$550
70'9
08'6
cH‘9
05
09'6 | ТУ | УМУ | 7/9
896
85
—
569
оре
02'S
05
07
3
с
—
[137
я
Алоннеоипо
‘Аполэй
оп
кинэьене чнеееяА
онэгоиьчЯ
ип
ше
вогнповиап
eLoee чоимохобмчтер
Yodoroa umiondory
Hermodoipdorxud1,
иитий т
OgLoo mag
эчннежигоиа |
чеииугу
wmioutoy
—
—
G6‘9
{sor‘o
—
киноБене
odoroa
егоя негожнт
подопоя имчлоинае)
подопоч ичлоиноиео
е1088 чоичо
HOEO
HOHO9\J
—
J
—
—
—
—
—
—
—
—
—
неипи!
негиэдозфииЧогхи |
иидэгио
ене@А УиЧо1феомо1
vodorog wmaLounodg
nodg
07
—
—
—
—
18'8 | 10'9
see‘o | ве‘0
0'8 | 958
—
—
тогпох
“19 Ld ww
—
59'6
0580 |
59°
—
911
(76‘S)
00}
хизАай
xz
„в (06'7)
(zG‘¢)}
(9'6)
*с (606)
[tz] (e6z‘o)}
[[69Т ‘8970‘/|
вв (05'7)
(o'n)}
J
хнинэгяеп
‘Апохэм оп озоннэкоиьчя и олоннечо!немомэ4 ви эинзэьене ээнпэ@)
“1 `н(Чеп НУ)
эинЦэгооп)
шт
‘Я
а 1чнееенА
хезоомо Я
*(хечооно
‘елэьоеа Авоноо
а эчнножокоп
|086 |
|645 |
|756 |
—
(097) |
609 |
858 |
65 |
046 |
075 |
105 |
to's |
У |
7/е |
70 |
866 |
186 |
SB6‘S |
ИА
зв (0'8)|
87'8
L‘8
| gece
ac (L‘€)|
6'E
—
| gc‘
«zc (6°S)|
06‘9
8'9 |
|075'0 [ИЯ ($8‘0)! s9e‘o | sse‘o
(oot)
(06) |(ишт 08)|(ишт 01)
в/с
€0‘9
oe ‘9
9¢‘9
99'6 | [И (06'6)
сот]
080% |
967 | [9 (26%)
—
—
16
же (7'6)]
—
—
80'е
(<'8)|]
76
‘в |
885
(00$)
—
_—
18%
(o‘e)|
058
—
|
|
|
|
|
|
ионноьАви
|7т@
$75
87
—
(087) |
|086 |
98°, |
|765 |
|066 |
|905 |
|897 |
Go‘d |
|085 | 6ТЕ |
|097
|975 |
—
—
| (005) |
| 65
| 672 |
|865
| 65
|897
| 4СТ
| oe'F |
07
WuULD
onHolaeyy
жт (Сс ‘ЛУ оинэняеА оп эчннэгоиьчя
‘атоэшоя химозьинелдоэн хлчдотомен (9/^0о%ж/июнн) 91 НУ квинеяоев4ооофен
OS
o'€ | see | G9°e | ce‘e | (oe‘'y) | (ez‘¥) | (90S) | (ge‘s)
—
ЕТ | 75:5
|865 |
—
—
—
97
—
—
—
—
—
—
O'S | 92° |
L't | 80°5 | 475 | 9/5 |
6% | GE | G0°¥ | O9'F |
|967
се
497Т
—
—
(055) |
341'Т |
98'9 |
81 |
тс |
|660 |
—
— |
Чейну винэвене чпон иогожни
66
678
e‘ge
[zt] ‘St
—
[7ЕИ $99
—
[217]
78
6 88 |
06—|
79
9'78° |
oss |
эзпипов {|
ая,
cbr}
$89 |
Gye |
7‘ 97
[01/7187 |
0'78
coh}
97
157
1085 |
$81 |
‘655 |
СТ | ve'e | 6ТЯ | 987 | 6 | 686
— | GO? | 766 | сиу | 80°6 | 988 | 5759
— | — | —
|165 | 819 | 00-6 | 88.6
—
|85‘9
|56*9
|55‘9
|19‘9
66% lez‘e
|96‘9 | zE'L
|68‘7 [88‘6
|60‘$ |896
|84'9 |254
—
9‘0
J|oT‘s
|68“®
|676
9z‘OT
|00‘6
< 17
|5'9
2d |
|67‘9
|06‘7
67‘У
05'9
—
|96‘9 |5
180‘6
|89‘е
|9e‘9
1686
OL‘OT
Le‘ TF
| 07
‘edAredenno,
OL
|0°/ | 08°/
|7
|78*<
|96‘9
|786
сут
|86‘6
16$
9T‘OT}
e8‘OT |
Do.
| 00
|
56$
99 |
|56'6 |
8T‘OT |
86*6 |5‘
|978‘
985 | 96*6 |0/°Я
96*е |98“9. |976
BFS |Sz‘6 | 78'6 |
06*4 |80'8 |88‘8
04*6 |57'0Т|96‘ОТ |
90$ | 86°6 | 0/*Я | 78*$ | 68*8
— | — | —
— | — |
Gc‘T | 09°€ | 89°F | 07*6 | 16*6
|
— | —
с‘< | 766
—
—
—
|565 | 196 |
— |
17| 19 | 0/*9 | 66*6 |
— |
—
— |
|
<7|
6/5 |
— |
516 |
OS‘L |
58°9 |
9/‘8 |
|88‘9
106‘4
|е6‘9
60|
— |
97|
97°9 |
10‘9 |
88° |
|57'9
|$6‘9
|66‘9
— | — |
||
— | — |
—
ТЯ |
1'$ | 97$ |
1'$ | 96$ |
|06'6
|06'9
|<т'9
ТУ | 95$ | 77 | 756
| 6° | LL‘Y | OFS | 26‘°S
|846 | ЕТУ | 967 | 59°6
7/6 | 0/°Я | 88*© | 663
—
G9'e
—
67|
— | "ес
—
—
6‘ 195
—
—
| ор
807 | 76 | 06°6 | 56'9
676 | 98‘9 | 86°Я |
— |
| 196 |
579 | 18*4 | 04'8
70'L | Ze‘s | 986 |
—
—
|345
—
—
1‘
СТИ
—
| o9F
|
<
|
01
Пилодогиге
нииегиге
1074 | —
пигоии
ит |
пииоботите|
нииеги19|
IOHLHELOW
14ипо ичяогиподноеИ
теиидофиитА
908 И
1Чипо иччогитА00И
HeLedorxuy/-}‘}
нимегитеи]]
негиледонхи|-с‘у-2пй
негитедоихи|[-с‘у-оно4ш
—
-ЧотфеЧ 11-2‘ ‘р т-Чоихи|-с‘у
HeLondoirpuitdorxuy/
очнножигои
O@LOO MIO g
ноу
пифчиАэгизаии
нииегите
ии
1Чипо инчаогитА-ш.аш
1Чипо имчаонитАч-40шь
H®LE
|L9‘9
ее
—
—
—
СР
|57‘9
|0/‘9 |00‘1
|с7'9 159‘
|651 | —
|70‘0т|
—
— | —
—
|S8‘L
—
поитнеге
iL
—
ОД | GL |
86'9 |754 |
негитедо1фи@1-с‘с‘у-Чоих-у
ndopodory
нелооф
негиэгитие
4.19 |,
нииегипо4
| |-н
пиЧофгие
ср
<8°9 | 00°2 | РА
98°F | 72'S | Gg‘
O8'L
[864 5у8
‘9
— | —
Le‘9 je9‘9 |с8‘9
86‘L
195'8
|8
9b‘
|29'¢ zo‘
c6‘G
ce‘9
97'9
G6‘OF
cL‘6
81|
19° 1
SL°L
09° 1
|z¢e°9
loo‘s
goin | — |
$0'9
19‘®
|811
—
106'9 | Р/
—
—
—
—
jos‘s | —
с6‘9
79‘9
—
—
05'8
| os— | os—
LOLUGL BHHOhEHE
| &—
«(377 (с ° ЛГ) оинэоняеА оп эчннэгоиычя
хияээьинел4о хлчфотонон (чиож/уюнн) ЧП НУ винезозедооо4деп
| oct
‘ятоошоя
| oz
— | 415 |
— | — |
—
|009 |
98
|966 |
$95. |
Ч;
впишов|,
os
6622
c'79t
685
695
EGG
0° 745
8675
76)
6957
8°96)
9 ‘Se?
<‘ 8/5
695
966
[sot] 8‘scon}
6‘79Z
87
687
8‘ 655
9‘77
15
158
енеАану
057
оп иэипькопейлоне
007
OLE
чнэпцен
098
078
нинэпия
086
WOhOL
WH
067
OMMOIAGLOLOALOOD
097
057
нем чех
00}
07
GG
овлоэшэЯ
гоенеодогх
IroHa@
IroeHegiuLowHd J-c'¢' |
Z' J
1-4‘ d
roeHogIMLeNu
roeHeglruLaNud J-¢'Z' |
|-н
нвомэлогнипгипо@
|-н
коенодкипой
неноН-н
ниге:фен
LoeHoguule-7-LHLeJ\-}
поенодгите-е-иитэу|-1
поенеогиле-с-иитэ1
иоенеооИ
иоенеогиподноеИ
пифчиАокитеи
HeLEdOIrXH}/-7'J
14ипо имчаокигАч-н
поенеогилАч-н
IroeHagwodgq
нигин\
"([921] еи зневоахомиее ыинонаеаА чхнэипиффеон)
‘илчньонойбитноийо возовивы Ч9ПНу -— ниноьене з
OL
|90'2 | 09'/ |078 |76'8 |06'8 |55'6 |586 |996
80‘OH) SO‘OT/OFTEI 27 IT] Lith) — | — |
¥b‘8 | L8‘8 | 27'6 | 06‘6 |5$‘07|88'0Т | 50° 77 | ve Ud
8¥°8 | S0‘6 | ¥S‘6 | 86‘6 | LE‘OT} OL‘OT| 20°F] 07 by
8z‘8 | ee°6 | OL‘6 | ¥2‘OT | 09‘OF | 76°0F | £2 TT | OF TT
94'4 | 988 |64'8 |886 |84'6 |<7'07|57'0Т| 98 °0Т
86°1 | 78'8 |716 |59°6 |80‘0%]08“0Т | 077 | 80°
572 | 878 |68'8 |976 | Т0‘0Т| 87‘07| 56° 0Т | $7
|- | =
—
99°6 | 8007 <7'0Т| $4 ‘071 00°]
|7'0Т| 97‘ОТ| 92° ОТ | 96'07
{OL‘6
20°8 | 29°8 | 226
578 | 248 |856 |19'6 | 8001} OS‘OT | 26°01 | 90° FF
05°8 | 98'8 |07°6 |06'6 |75‘0Т| 8907 | 50° ТР | OF TF
—
50°6 | 876 |68'°6 |<5‘01|94‘0Т| 7807 | “17|
99° | 808 |18'8 |876 |99“6 | 07'0Т| 9#‘0Т | SZ‘0F
| 8e'L | T6‘L | 6E'8 |€8'8 | £06
2's | 10'9 |2z‘9
6531968 |58'9 |002 |572 1082 |778 1088
ze‘z | sys |oe'6 |96‘6 | 0S‘Or] 88‘OT | Zt TF] Se TF
90'6 | 646 |07'0Т| 86'0Т | 00° ТУ | 98° ТУ | S9' TT | 08 TT
vL‘L | 2 8 |99'8 |¥0‘6 |8E'6 |28°6 | 266 | 20 OF
676 | €86 | 666 | 0S‘0T| 8S‘0F | 8L°0F| S601 | —
BMHIhVHE
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
055
‘edALedouwnoy,
095
160$ [Ley 169'$ [079
| — | — | —
— [ ее 1656 15/‘9 16/'р 179'8 [276
| — | — | — | G'yrlgu‘'s~| B‘9~|zc‘L
|06‘L
— | — | Sit~les‘y~| bo~lch‘e
fjoz‘s
| — | — | 9'e~] 7'G~lac‘g~loy‘z
— | ре ре 5'9—| 7'4-|
—
—
|8'6—/ 9—1 9'9—195`4
| — | — | —
|115! 79-—167'9
—
-—-|-|158 |78`8 |15`6
| 56| 5'9—| 0‘4^19°А
— | — | g‘e~| o‘g~log'9~}i7'L
| —
1097- 9'62169'9— 9
— | — | —
8‘8-—181'9 los'z
— | еб <
| —
|z6‘L [06'8
| o‘e | <9°я 191‘ |/9'9 95°
1|9'5—| 179-99
| — | — | —
{o'r |ss‘e
—
— | —
—
| —
|1с 1459
| — | — | — | — | —
[e8‘¢
— | — | — | — | — | ve
|146 19-1989 ‘15878
| — | —
| — | — | ¥#e | o's |zo‘9 |0/‘9 j9z‘L
| — | ст 108°е 188'9 198‘. |z0‘8 199'8
ошнэнчеаА
zese
свт!
Litgg
Ze}
сбе
[gct] 54|
9'69
[8997 9581
[zor] ‘8/7
$98
ee}
08$
sry
15%
8585
gaz
fect] o‘zezg}
[867] ©‘588
we
g‘czy
du,
Hn.
159
[yLb]
Sc
7 13
6097 |
6'OLE
seh}
y00r |
e6—|
—
—
(OLE)
—
—
|(078)
—
—
*(хенооно
я 1чнеевяА
еинЦеиоов)
|(,0S2) |(,02z)
—
—
||
—
—
р
—
80|
—
—
|(oer)
—
хизАЯг
—
ийп
ыогнповиап
|265 | яе |
|66‘9 | 99'9 |
09
Гиз |
Чеп ту
—
—
—
FF
—
чПоа понт
76'$ |
co‘z
винэьене
996
88‘9 |
(oF)
—
—
oz‘or | ss‘or |
из
67
и етоее изино
ни
»
игиоинего’)
итчлоин9э)
BROW],
vodorod umioudory
Hermodoxpdorxud J,
eOd
подопоя
Yodoiog
OsLOOMeg
чвиииу
vodoroa yrionifoy
эчнножигои@г
OFF
—
—
втоЕв чинно
От— |
—
—
ве
—
665 |
961 |
(,001—) |(,0%1—)|(,077—) |(,09T—)
$08 |
065 |
— |
|
—
неипи\ |
негиодогхи Ч олфи\ |
rodotoa wmionwodg
9/6
—
—
—
97| ИЕ
ру | Vey 9 | 616 |
— | L0°% | 96'2 | te‘ | бе
—
GZ
— |
56'6
—
|66'6 |
976 | 668 |
07
IEG‘
—
—
|187 | 066 | 79'°6 |
89° | 709 | те
08—
85|
OL
Loriiol BuHOheHe
09—
96'6 | 87$ | 71'9 | 069
007
sunesocedgooden
оп эчнногоиьчя
0 | 05— |
0$ |
|
801975 [ 856 | 66|
—
871
—
08
‘edAredouwnay,
cc‘orl
|(,008) | (oz) | (ow) | (Sz) |
тт | 565
04'$ | 96°6
хеаАледэпиох
|(,064) |(,094)
—
—
—
—
у
ЕТ | 85$ | 959 | 567 | %'$%|
|(,018) |(,08%)
—
—
|
|St‘¥~| 79'S | F9‘9 | zy‘z | 80‘8 | 19'8 | 76 | 98°6 | 26*6 165 ‘от
—
—
|Z'O~
—
Os} | — | — | — |
—
097
— | 09°¢ | 6/6 | 569 | 78°F | OTS
—
— | 29°c | 79'S | 00'F | $6‘
ДТ] 995 | 962 | 50$
—
061
Do
den НУ
‘АП оинзняедА
(ч/“0ж/июнх)
« [97 (6
хлчдотомэн
055
химоэьинезоон
065
9‘97T | —
—
—
—
8' 66
—
—
—
—
006 |} — | — | — | — |
6587 |
Ч;
‘чтоэшоя
BUULOR TF
В качестве
примера
укажем
на
уравнение
AGx
B koTopoM
G = 8S, Cp,
H,Z
=
AGy,
UT...
(IV ,62)
koTOpoe
AevcTBUTeIbHO
TNA
OTHOTUI-
ных реакций Х и У в сравнительно широком интервале температур. Уравнения (ТУ, 62) можно рассматривать как предельные случаи (У, 55) и
(ТУ, 54), справедливые при высокой степени однотипности реакций.
В частности,
справедливость
(ТУ,
62)
для
соответствующих
высших
чле-
нов гомологических рядов в органических реакциях [120] связана с тем,
что для них энтропия возрастает пропорционально числу вводимых групп
СН, [180—182]. В таких случаях будет соблюдаться равенство констант
равновесия:
—
|
Kx = Ау.
(IV ,63)
Предельные случаи представляют интерес и в том отношении, что для
них связь между значением Hi приобретает наиболее простой вид. Действительно, для уравнения
(ТУ, 49) и (ТУ, 50) получаем соответственно
эп — эп
и
0G
(IV, 64)
0G
Гомо
Первое
взятые
что эти
Эти
(ГУ,65)
уравнение означает, что производные от свойства по параметру,
при одинаковых значениях /[, не зависят от значения С, второе,
производные обратно пропорциональны С.
О
случаи представляют ин тот интерес, что поскольку величины зу
г
берутся при одинаковых значениях Ш, то тем самым создается связь четвертого метода с первым и вторым методами сравнительного расчета, где
IT = const (cm. стр. 250 сл.).
6
ОБ
дом Ф(П)
ОБОСНОВАНИИ
НЕКОТОРЫХ
УРАВНЕНИЙ
Характер расположения точек на (1.—С:-прямых определяетсявив уравнении (ТУ, 2). Если можно считать, что ф (И) = Пл. е.
если уравнение
(ТУ, 2) имеет вид
с =ач+ ви,
то для значений ИП, образующих арифметическую
ние между точками будет одинаковым \.
Примером (ТУ, 66) могут служить зависимости
(Г\,66)
прогрессию,
различных
расстоясвойств
от
температуры, которые справедливы в том или ином (в общем случае сравнительно небольшом) интервале температур.
К ним относятся, в частности, уравнения
и некоторые
другие.
АН =а- ФТ,
AZ =a +0T,
Cp=a+0bT
:
(ГУ, 67)
(IV,68)
(IV,69)
1 Разумеется, по дискретности расположения точек на прямой Су — Сы можно
судить о характере зависимости С от ДП только в тех случаях, когда величины И образуют закономерный
ряд
значений
(удобнее и нагляднее всего — арифметическую
прогрессию).
11
м. Х. Карапетьянц
161
Если равноотстоящим значениям // соответствует неравномерное расположение точек на прямой ах
— См, значитф (П) Е П,т.е. зависимость
С от П
не является
линейной.
К
таким
свойствам
относятся,
например,
электропроводность (П = с), вязкость (П = #) и многие другие.
Ранее было уже отмечено (стр. 145), что условием сравнения теплот растворения служит аналогичный характер изменения АН от концентрации с.
Поэтому,
например,
сспоставление зависимости АН от с для ГВт
OH с
85]
т
MD
S
Т
~“
<
T
—
<л
6,0
9,9.
85
|
90
I
95
у
1
100
105
10
15
120
e
Рис. 131. Взаимосвязь между интегральными теплотами растворения АН. (ккал/моль)
бромистого. и хлористого лития (4), иодистого и бромистого натрия (6), 6pomuctore
и хлористого калия (В) при различных концентрациях [186]
и МаВг (несмотря на то, что Тл и Ма находятся в одной подгруппе периодической системы элементов) не может привести к удовлетворительным результатам: с увеличением концентрации раствора теплота растворения
ТлВг непрерывно уменьшается, а теплота растворения МаВг проходит через
максимум. Если же сопоставлять растворы с подобными зависимостями
АН=
Кс), т.е. руководствоваться
классификацией К. П. Мищенко и
М. 3. Прониной [183]', детализированной в работе Н. В. Вогкресенск йи
Г. Н. Янковской [|184] (см. также 1[485]), то, как видно из рис. 131, по-
лучаются удовлетворительные результаты.
Как и в других методах сравнительного расчета, нельзя обосновывать
спратедливость того или иного уравнения вида (11, 1) только тем, что оно
может быть выведено из какой-либо зависимости. (См., например, стр.
64
сл.)
В качестве примера неправомерного обоснования уравнения четвертого метода сравнительного расчета мсжно было бы привести следующий.
Одной из формул. предложенных для выражения зависимости эквивалентной электропроводности от концентрации, ятляется уравнение Кольрауша
= м — а Vs,
(IV,70)
7 Увеличение экзотермичности теплового эффекта с ростом концентрации соли качественно объясняется преобладанием процесса сближения противоположно заряженных Ионов, тогда как возрастание эндотермичности приписывается определяющей
в энергетическом отношении роли дегидратации ионов и процесса разрушения молекулярных ассоциаций воды.
162
а — ин-
и
разбавлении
|
где Л»— электропроводность при бесконечном
дивидуальная постоянная [187].
Хотя уравнение (1У, 8) непосредственно следует из (ТУ, 70), однако мотивировать существование (ТУ, 8) справедливостью (ТУ, 70) нельзя, так
при
лишь
данные
описывает опытные
уравнение Кольрауша
как
очень небольших концентрациях, в то время как линейная зависимость
между значениями /, сохраняется и при высоких концентрациях (на два20 50 7
три порядка больших, чем область при0 8OT
|
И
менения закона Кольрауша) (см. рис.
бр
,
119).
Другой пример. Допустим, что температурная зависимость теплоемкости
С двух твердых веществ описывается
законом Дебая
12
C=
д
(1У,71)
5 (Г/0)з
где 9 — характеристическая
ра.
что
Тогда при условии,
получим
уравнение
Тк
On
температу-
Ск = См,
4100
x
тождественное
’уравнению
(IV, 53).
Аналогичный
результат
может быть
получен и для тех веществ, для которых действительны предельные уравнения В. В. Тарасова
[188].
уравнение (ТУ, 53) во многих
60
Однако
случаях
420
оказывается справедливым при температурах более высоких, чем те, при
которых
справедлив соответствующий
предельный
закон. Это иллюстрир ет.
рис.
132
на
зависимости
примере
теплоемкости
MoO,4u
С = аТ?
достаточно
Рис.
температурной
трехокись
К
имеют
(см.
Ср
Жирной
(1V,73)
точным
132.
пературами
MoS,.
Примерно до 50° К (МоО.) и до 65°
(Моз,) уравнение В В. Тарасова
оказывается
M00,
на
вый верхний угол рис. 132, на котором
воспроизведен график из оригинального исследования
[189]). Соотношение
и
между
(°К), при
сульфид
(кал/град-моль)
линией
котором
уравнением
же
Т
одинаковую
теилоемкости
ле-
Взаимосвязь
выделен
описывается
(ТУ,
молибдена
теплоемкость
[189]
участок
температурная
71) (см.
иредельным
угол чертежа)
описывает эту зависимость в значительно
верхний
уравнения
Tuts, = 1,23 Taco,
ператур (см.
ветствующий
прямой,
зависимость
левый
(ТУ, 53) в виде
тем-
которых
(IV,74)
более широком
интервале
нижнюю часть рис. 132, на котором участок прямой,
предельному уравнению, выделен жирной линией !).
тем-
соотВоз-
можность применения уравнения (ТУ, 53) в широком интервале температур, обусловленная сходством структуры MoO, (ромбическая слоистая
решетка) и МоЭ. (гексагональная слоистая решетка), видна и из графика.
1 Данные
по теплоемкости
МоОз
найдены
в трех
исследованиях [189—191]:
мы
избрали [189], так как в этой же работе была измерена теплоемкость МоЗ2 ‘и мы полагали, что
наиболее
целесообразно сравнение
ванных из одного и того же источника.
значений свойства двух веществ, заимство-
11
+
163
С = !(Т*), приведенного на рис. 132; значения С, начиная с которых
опытные точки не попадают на прямую С — Т?, для МоЗ, и Мо0; примерно одинаковы (они располозкены выше пунктира), как одинаков и характер отклонений экспериментальных
данных от этих прямых при более
высоких температурах.
В некоторых случаях для обоснования различных закономерностей
можно обратиться к уравнениям (У, 49) и (У, 50).
Так, если в случае сопоставления температур кипения (при одинако-
вом
—
давлении)
будет
соблюдаться
зависимость
(ТУ,
(ru = (Gee
49),
то
она
примет
v.75)
Если ограничиться областью температур, далеких от критической, т. е.
считать, что справедливо приближенное уравнение Клапейрона-Клаузиуса
АН
In P = =" + const,
(IV, 76)
то уравнению
(ТУ, 75) можно придать вид
А5 пар
Г
Если
же
соблюдается
зависимость
ap
(; In тм
то на основании
AS
be —
(IV,
Г
пар
|.
50),
т. е.
ЭР
—
(5 In т)
—
(А
(LV, 77)
,
.
|
(1У,78)
(ТУ, 76) получаем
(Абпар)м
пар)м.
(IV,79)
Уравнение (ТУ, 79), в соответствии с которым энтропия испарения не зависит от природы вещества, как известно, удовлетворительно соблюдается
для
высококипящих
(строение, полярность и
- Рк
=
Татм
жидкостей,
обладающих
близкими
свойствами
т. д.). В применении к 1 молю вещества при Ри =
это уравнение тождественно правилу Трутона
[192].
Как
известно, это правило является приближенным, но для сходных веществ
(с достаточно большим молекулярным весом) приводит к удовлетворительным результатам. В качестве примера укажем на следующее: для
35 высококипящих алканов (АЗ пар)н.т.к. = 20,6 5. е. со средним отклонением Аср = 0,3 э.е.; если же взять только диметилгептаны, то для них
(Абпар)н.т.к. = 20, 74, причем Дер = 0,12 э. е. (см. также стр.335).
|
‚ Приведем
модействиям.
еще несколько
примеров,
относящихся
Примем а = АНи =f.
Тогда при условии
шений (ТУ, 49) и (ТУ, 50) получим соответственно
И
(АСр
)n
AC p
( AH }
=
—
(AC p
)м
ACp
АН Me
к химическим
соблюдения
взаи-
соотно(ТУ,80)
(У,
Первое равенство означает, например, одинаковое (при равных значениях
температур) изменение теплоемкости в реакциях образования различных
веществ, второе — неизменность отношения упомянутой характеристики
процесса к его тепловому эффекту.
Примем С = AZ u ИП = Т. Тогда получим соответственно
ASx = ASy
164
(IV,82)
и
ASy
7.
Из (ТУ,
следует,
= AS
= АИ,
(1У,833)
69) в связи с термодинамическим
уравнением
|
AZ = AH —TAS
что
AZy — AHy
или
(LV ,84)
= AZy — AHy
(IV ,85)
|
|
(IV,86)
AZy — AZy = AHy — AHy.
Это
означает, что величины Б.в
уравнении
(ТУ, 49) для
АН и
AZ norman
совпадать. Применение для частного случая С = АН” и А17° уравнения
(ТУ, 49) и вытекающих из него зависимостей (ТУ, 80), (ТУ, 82) и ПУ, 85)
для случая
однотипных
Уравнение
(ТУ,
реакций было описано
86) является
предельным
AZ = A.AH + Bo,
В. А. Киреевым
случаем
[118, 119].
уравнения
|
(IV,87)
тождественного (II, 41). Takum образом, может быть установлена связь
между вторым и четвертым методами сравнительного расчета.
Сущестзование ряда приближенных зависимостей вида (ТУ, 20) можно
связать с тем, что для многих характеристик физических и химических
превращений
справедлива
экспоненциальная
зависимосте
С от Ц,
когда
изменению /] в арифметической прогрессии соответствует изменение ( в
геометрической прогрессии. В частности, речь может идти о соотношении
(ТУ, 2)
вида
Q
Qu
G=a-eRT,
(IV,88)
в котором (0 — энергетическая характеристика процесса, а Г — температура.
Действительно, записав (ТУ,88) для двух веществ
и
Gy
Qu
= ay-eRT
(ТУ, 89)
Gy
Qn
= ay-eRT
(IV ,90)
и решив эти уравнения относительно П (имея в
Ям и См осуществляется при условии, что Им
lg Gy = М1 би
т. е.
(1У,20),
в
котором
Qu
ван —
|
0
<N
A, —.
= бу
‚|
Чм
ем.
|
(IV ,91)
(IV ,92)
и
nl
|
Ясно,
не
С
виду,
что сравнение
= Им), получаем
что если
в виде
для
данного
соотношения
свойства
(ТУ,66),
а в
“Om
зависимость
виде
С от И
соотношения
16а =а-6П,
(ТУ, 94)
то замена (1У,20) на (1У,1) в общем случае не может дать
результатов. Действительно, заменив в точном уравнении
Iny,=
Alny,+
справедлива
B
надежных
(IV,95)
165
величину
у на (4 -- 2),
получим
лишь
‘приближенное
равенство
= A’r, + В’,
так
как,
в соответствии
(IV ,96)
с зависимостью
|
Iny=In(it+a2)=2—[_—2_...,
(IV,97)
замена шу через + является лишь первым приближением, оправданным при соблюдении условия 5 << 1.
Рассмотрим несколько примеров. Температурная зависимость давления насыщенного пара может быть описана приближенным соотношением вида (1У,88):
т.
(LV,98
|
Р =а-е
RT,
из которого вытекает уравнение Киреева (1У,22);
ствии с ([У,92
me)
|
Ay
|
= ар)м
(AA nap)
M
в последнем в соответ-
(IV,99)
"
Очевидно также, что в уравнении (1У,31) коэффициент наклона прямой может быть принят равным отнотениго теплот растворения веществ Ми
М, аналогично в уравнении (1У,38) — отношению тепловых эффектов
соответствующих химических реакций (например, теплот. образования
двух родствепных веществ). В уравнении (ТУ,23) этот коэффициент
равен
величине
(AH
gap)
(АН пар)
w/(T
ep)
N
м/(Гко)
М
”
В заключение укажем, что соотношение (У,20) можно
вать, как математическое следствие уравнений типа
С =а(1 — т),
G =a(G’ —G’),
G = a(G’)?
G=a+ bn (ty, —2)
и
при
условии,
что
для
веществ
венно т, ((”— С’) a G’.
Действительно, записав,
М
рассматри-
и
И
N,
получим
у
М
и М
одинаковы
например,
(ГУ,100)
In Gu = In ay + dy In (1 — ty)
значения
для
двух
(IV,100)
(IV,104)
(IV,102)
(IV,103)
соответст-
жидкостей
(IV,104)
ш Сы = шан- В № (4 — м.
Решив уравнения (ТУ,102) и (1У,103) относительно
tN = Tm,
получаем (1У,20), в котором
|
b
A, =,
bx,
(IV ,105)
(1 —т)
и
приняв
У
]
M
Краткий обзор уравнений вида (1У,100—102) будет дан в следующей главе, так как их можно положить в основу некоторых частных
зависимостей пятого метода сравнительного расчета (что, кстати сказать, является иллюстрацией взаимосвязи этих методов).
166
78)
Отметим
вывод
лишь,
что
уравнения
и
в
вида
этих
(1У,1)
случаях
[в
нельзя
частности,
считать,
(ГУ,20)]
что
из
только
какого-либо
уравнения (Т\У,100—ТУ,102) является обоснованием первого. Действительно, известно, например, что для расчета внутренней теплоты парообразования / было предложено несколько уравнений вида
[= а(Г— т),
(IV ,108)
являющихся
частным
примером
(1У,100).
Однако, в одной работе
рекомендовано
5 [195].
Но
lМ
лежат
(ГУ,108)
значение
все
B
+
4
(
не
IV ’ ,109
три уравнения
котором,
= ae
это, конечно,
A,lАим
=
6
)
именно то, в
скажем,
6 =
Еще
Уравнения
одно
7
lg Tacoocgtt,
2,1
.
и
iI
что
(IV,22)
»
в
2
—- [194],
основе
в третьей
e
уравнения
AS [05,
т
05 0
cooOpamenne.
(1\,21)
в другой
означает,
вида
или же
[193],
10
20
30
2.6|-
можно вывести из приближенного уравнения Клапейрона
—
Клаузиуса
d\inP
or
в
RI
сочетании
уравнениями
(АНпар)м
И
Zor
AA nap
соответственно
=
7
(IV, 110)
с
;
27
lg Tyco0c,Me
Рис. 133. Взаимосвязь
(IV,111)
между . температурами
и пропилфоркипения Т (°К) этилформиата
миата при различных давлениях [4]
—= А. (А Snap)M
(Py = Pm),
__t
}
2,6
25
44 (АНпар)м
(Тк = Тм)
(A Snap )N
24|
24
(IV,112)
являющимися, в свою очередь, частными примерами предельного сгучая
соотношения (ТУ, 1). Казалось бы, уравнения (У, 24) и (1У,22) должны
давать большую погрешность, чем уравнения (ТУ, 114) и (ТУ, 112). В действительности же наблюдается обратное, т. е. заведомо приближенное
допущение мало отражается на результатах расчета. На. одном примере
это показано
на
рис.
133;
в то время,
как
(ТУ,
21) приводит
к хорошим
результатам до 5 атм и к удовлетворительным — до 30 атм, уравнение
(ТУ. 111) дает мало удовлетворительные результаты.
В качестве другого примера укажем на уравнение вида (ГУ, 101)
АЙ пар = а (0% — рг)’,
(ГУ, 113)
рассмотренное Бенсоном [496, 197]. Приняв на всем протяжении равновесной кривой 6 == 3 ‚ по мере приближения к критической точке мы обнаружили
бы,
что
расхождение
возрастает !. Если
же
между
обратиться
левой
и правой
к зависимости
частями
т (АО пар)х = Аа ш (АОпар)м -- Ва,
то окажется, что она обладает
критической точки. Указанные
стояния
между
точками
на
уточнения
Бенсон
113)
(IV ,414)
удовлетворительной точностью вилоть до
же отклонения выразятся в том, что рас-
прямой
In (AU
1 Для
(ТУ,
nap)N
предложил
=
fin
(AU
перейти
nap) M
в этой
области
к значению
6 = 2.
167
вблизи критической точки станут иными (разумеется, при условии постоянства значения р* — 07).
Следует обратить внимание на то, что известны случаи, когда для одной
и той же зависимости предлагается несколько уравнений. Примером могут служить уравнения (ТУ, 11), (ТУ, 21), (ТУ, 22) и (У, 28); к ним можно
присоединить уравнения (ТУ, 23) и (ТУ, 29). Все эти уравнения выражают
взаимосвязь между температурой кипения и давлением (сухого насыщенного пара). В подобных случаях относительная точность уравнений различна и она легко определяется на основании анализа надежности тех
допущений, которые лежат в их основе.
Обоснованию (ТУ, 1) для ряда случаев
посвящено
исследование
К.
Ф.
Павлова
Дюринга
[198,
рассмотрены
ОБ
199].
Условия
Г. И.
УТОЧНЕНИИ
применения
Микулиным
НЕКОТОРЫХ
обобщенного
[200].
|
правила
ЗАВИСИМОСТЕЙ
Ряд рассмотренных в предпоследнем разделе уравнений, являю-
щихся частными
(ТУ, 50), можно
примерами предельных соотношений вида (ТУ, 49) или
уточнить. Рассмотрим эту возможность на некоторых
приметах, относящихся к химическим реакциям.
Так, для учета небольших изменений разности соответствующих характеристик химических процессов или их отношения, т. е. значений Ва в
(ТУ, 54) и А. в ПУ, 55), В. А. Киреев рекомендовал метод двойного сравнения [127]. Этот метод основан на сравнении данной пары реакций (или
соединений) с аналогичной ей другой парой реакций (или соединений).
Введем обозначения
AGax
и будем
считать,
—AGpx
что
(ay)
=
ay,
= (ах т,
(ay)r =
Для однотипных
AGay
(ay),
АС ву
=
ay
(ГУ,115})
+ Px (T),
+
(IV,116)
Gy (Г).
реакций можно принять, что
Фх (Т) =
Тогда
—
Фу (T).
(ТУ, 117)
получим
[((AGax)r — (AGgx)r] — (Аблу)т — (АСву)т] = (ах)т, — (ау)т,
(ТУ,118)
или
(AGr
Для
—
АСт,) Ах
—
(АСт
—
АСт,)вх
=
(AGr
—
AGr,)ay
—
(AGr
—
АСт,)ву.
(ГУ,119)
расчета по (ТУ, 118) или (ТУ, 119) необходимо располагать соответст-
вующими данными не для одной, а для трех реакций, однако эти уравнения обладают значительно большей точностью и применимы в более ши-
роком интервале температур, при этом не только к однотипным реакциям,
но и к однотипным веществам. Для последних уравнение (ТУ, 119) принимает вид
(Gr —Gr,)ax — (Gr — Gr,) Bx = (Gr — Gr, ay — (Gr —Gr,)By. (IV,120)
Аналогичные
пример,
соотношения
|
(Ст — Ст,)дх
(Ст—
168
получаются
Ст)вх
при
_ (Ст- Ст) ау
(Gp — Gp)py
уточнении
|
(ТУ,
56),
на-
(IV, 121)
Наряду с применением метода двойного сравнения к изоструктурным неорганическим соединениям возможно сопоставлять ход АС в двух парах
подобных реакций и между органическими веществами, например в реакциях одной пары из первых членов гомологического ряда, обладающих
сходным строением, и в реакциях аналогичной пары другого гомологического ряда или того же ряда, но с другим типом строения.
>
{
A
то,
а
|
.
972
и
‘nn
(H?-H°
oO.
о
|)
.
(н°-
о_
и?)
о
;
170
168
О
®
а
|
}
|
Lt
]
1
2
Пт.
L
i
4
|
0.0.)
~ 8505p caTit,
Рис. 134. Взаимосвязь
между
атомарными
энтропиями
образования
а
А5 обр (э.е.) метатитанатов кальция и
pax (YH! при различных температурах
или
(пунктирная
линия
уравнению
Возможен
(ТУ,
(ТУ,
56)
(1У,
соответствует
54))
|
т
А
1
0
Рис. 135. Взаимосвязь
между энтальпиями
(Нт — Нээв) (ккал/моль) ортотитанатов магния
я
и железа при различных температурах [201] 1
7A — по уравнению (ТУ, 1-0); Б — по уравнению!
о
(ТУ,
[201]
можно
1). Так,
применить
‚__)
298 Mg Tid,
121);
В
—
по
уравнению
(ТУ,
и другой путь уточнения — переход от уравнения
50) к (ТУ,
80
|
вместо
уравнения
соответственно
(ГУ,
54) nau
соотношения
(IV,
123)
(IV, 49)
55) или
AGS = A,AG% + By
(IV ,122)
(Gr — Gh,)w = Ag (GP —Gt,)m + Bg.
(IV,123)
На рис. 134 второй способ уточнения показан на примере атомарных энтропий образования двух сходных веществ; пунктирная прямая соответствует уратнению (IV, 54).
в
На
рис.
135
оба
способа
уточнения
иллюстрируются
на примере
тем-
пературной зависимости энтальпии изоструктурных титанатов магния и
железа. Линии А и Б отвечают соответственно уравнениям (ТУ, 120) и
(ТУ, 121), линия В — уравнению (ТУ, 123), так как в соответствии с последним
разность в значениях (Ст — Gr,) для двух веществ должна
быть линейной функцией этого же свойства для любого из них.
В ряде случаев второй способ приводит к несколько более точным результатам, позволяя в количественной форме выразить некоторое изменение с температурой разностей, входящих в (ТУ, 119) и (ТУ, 120) (см. рис.
136).
О ВЫБОРЕ
СТАНДАРТНОГО
ВЕЩЕСТВА
Надежность вычислений по описанному
методу в общем
случае
определяется не только точностью уравнения, но и выбором стандартного вещества. Чувствительность результатов расчета к виду стандартного вещества зависит от природы свойства и условий сопоставления. В
некоторых случаях удовлетворительные результаты получаются лишь
при выборе в качестве стандартного вещества, близкого к изучаемому.
169
Так, допущения, лежащие в основе уравнений
(ТУ, 11), (ТУ, 24) и (ТУ, 22),
являются наиболее строгими для веществ, близких по составу, строению и
летучести. Поэтому, например, уравнение (ТУ, 11) дает неудовлетворительные результаты при сопоставлении температур кипения н-СН 1. и
Н.О, но для пары н-С,Н ,.—н-С НЯ! приводит к хорошим результатам в
широком интервале давлений. В большинстве случаев можно говорить
лишь 0б уменьшении точности вычислений при неудачном выборе станантон
60
3
дартного вещества.
3
Наконец,
можно
назвать уравнения, результат расчета по которым практически не ‘зависит от природы стандартного ве-
100
986
щества.
К
частности,
последним
относится, в
приближенная
зависи-
мость (ТУ, 52).
Необязательность в общем случае
условия сходства сравниваемых ве-
ществ
является
четвертого
расчета;
она
характерной
метода
чертой
сравнительного
обусловлена
тем,
что
зависимость одного и того же свойст-
WO
"25
;
60
ва от параметра
условий
быть подобной для самых
ных веществ.\
4
6,5
7,0
49
07 DHyasio, 4 4asio,
‚
Рис. 136.образования
Взаимосвязь а ме
т
(ккал/моль) сили
теплот
катов и титаватов магния
при различных
и
кальция
температурах
[200]
должна
различ-
Условие одинакового агрегатного
состояния также не являелся обязательным
во всех случаях.
тельно, :например,
характер
Действи-
темпе-
ратурной зависимости давления насыщенного
пара
над
твердыми
и
жид-
кими веществами будет одним и тем
же. Поэтому можно сравнивать температуру кипения одного вещества с температурой возговки другого. При
подобном сопоставлении нужно следить за тем, чтобы в изучаемом интервале не было бы фазовых превращений.
Применяя четвертый метод сравнительного расчета к растворам, следует помнить, что в ряде случаев сопоставление может оказаться не очень
точным. Так, сравнивая значения удельных электропроводностей ух солевых расплавов при одинаковой температуре, надо помнить, что характер
влияния Т на ) зависит от типа диаграммы плавкости: для твердых растворов
уравнение
(ГУ, 424)
ех=А —=
справедливо вплоть до температуры кристаллизации; для систем с эвтектикой — выше температур плавления компонентов; для промежуточных
систем наблюдаются небольшие отклонения от этого уравнения [202].
О выборе стандартного вещества см. также стр. 148 и 341.
8 = =
. Х. Карапетьянц.
x.
.Х.
CONIS>
‚9
ао нЕ
блю к
ЛИТЕРАТУРА
170
na
рапе
тьянц.
арапнетьянц.
Карапетьянц.
хническая энциклопедия.
еских величин, 1931—1933.
Ж. физ. химии,
Ж.
физ.
химии,
29, 1132 (1955).
29,
1328
(1955).
З. физ. химии, 30, 1104 (1956).
Докт. дисс. М., МХТИ им. Д. И. Менделеева,
Справочник
физических,
химических
R. Quayle.
Chem. Revs., 53, 439 (1953).
. С. Свердлийы,
И. И. Tonnes.
Ж. физ. химии,
-M.Jones,
J.Gordon,
E.A.L ong.
J. Chem.
и
1957.
технологи-
27, 1580 (1958).
Phys., 20, 695 (1952).
9. E.R.
28,
718
Kennedy,
(1936).
10. B. H.Sage,
B.H.Sage,
W.N.
Lacey.
W.N.
Lacey.
Ind. Eng. Chem.,
Ind. Eng. Chem., Ind. Ed.,
Ind. Ed., 30, 673 (1938).
11. Н.Н. Дрозин.
Ж. физ. химии, 37, 1292 (1963).
12. А.Н. Никитина,
В. М. Сафонов.
MM. физ. химии, 29, 356 (1955).
13. A. U. Christiansen,
K.C. Conway,
K. K. K elley.
US Dept.
Interior
Bur.
Mines,
Rept.
of Investigation,
5665,
Wash.,
1960.
14. P. W. Bridgman.
Phys. Rev., 60, 351 (1941).
15. П. Бриджмен.
Физика высоких давлений. М.—Л., ОНТИ, 1935.
16. М. Г. Гоникберг.
Химическое равновесиеи скорость реакций при
17.
18.
19.
20.
21.
22.
23.
давлениях.
М.,
Изд-во
АН
СССР,
1953.
of
высоких
Л. В. Верещагин,
Н. А. Юзефович.
Ж. физ. химии, 36, 969 (1962).
И. М. Роднянский,
И. С. Галинкер.
Докл. АН СССР,
105,
1145
(1955).
И. И. Рузавин.
Канд. дисс. М., МХТИ им. Д. И. Менделеева, 1954.
i Xapueg,
Bb. Oyou.
Физическая химия растворов электролитов. М.,
Л, 1952.
И. В. Персиянова.
Канд. дисс. М., МХТИ им. Д. И. Менделеева, 1955.
М. Х. Карапетьянц.
Ж. физ. химии, 32, 1675 (1958).
С. Jones,
M.Dole.
J. Am. Chem. Soc., 52, 2245 (1930).
24. E. Dihring.
Neue Grundgesetze zur rationelle
25. U.Dihrin
Ann.
1878,
5. 70;
цит.
по
и.
Physik und
[67].
D.W.Murphy.
W. Herz.
Z. Elektrochem., 24, 48 (1918).
C. von
Rechenberg.
Einfache und fraktionierte
34.
35.
36.
37.
38.
39.
40.
41.
W.
R.
R.
J.
В.
E.
R.
C.
Praxis. 2 Aufl.,
по
[31].
J. Am. Chem. Soc., 51, 116 (1929).
32.
33.
und
Leipzig,
Phys., 11, 163 (1881).
26. R. Klausius.
Die mechanische Wirmetheorie. S. 387.
27. E. Colot.
Compt. rend., 114, 653 (1892).
28. W. Herz.
Z. Elektrochem., 25, 45 (1919).
29. Lewis,
Weber.
Ind. Eng. Chem., 14, 486 (1922); mur.
30. Adamson.
Manch. Mem., 76, 1 (1932).
31. A. R. Carr,
Chemie.
Leipzig, 1923.
Destillation
in
Theorie
Herz.
Z. Elektrochem.., 24, 333 (1918).
Lorenz.
Z. anorg. allg. Chem., 138, 104 (1930).
Lorenz.
Z. anorg. allg. Chem., 138.
A.M. van
Limpt.
Z. anorg. allg. Chem., 189, 287 (1930).
Lorenz.
Z. anorg. allg. Chem., 179, 293 (1929).
A. Ravenscroft,
Ind. Eng. Chem., 21, 1203 (1929).
Lorenz,
W.Iierz.
Z. anorg. allg. Chem., 143, 336 (1925).
C. Monrad.
Ind. Eng. Chem., 21, 139 (1929).
42. F.T.
Biley,
K.C.
43. A.M.McLaren
44. Т. В. Maxwell.
45. J. M. Schultz.
46. R. Lautié.
Bull.
47, L. A.Cosgrove,
48. F. A. Henglein.
49. F. A. Henglein.
Baily.
Proc.
Roy. Soc. Irish Acad., B38, 450 (1929).
White.
Ind. Eng. Chem., 22, 230 (1930).
Ind. Eng. Chem., 24, 502 (1932).
Ind.
Eng. Chem., 21, 557 (1929).
Soc. chim. France, N 1—2, 86 (1947).
P.E.Snyden.
J. Am. Chem. Soc., 75, 3102 (1953).
Z. Elektrochem., 26, 431 (1920).
Z. anorg. allg. Chem., 114, 234 (1920).
90. F. A. Henglein.
Z. phys. Chem., 98, 1 (1921).
51. Li Yun-hua.
J. Chinese Chem. Soc. .. 2, 108 (1934).
52.
В.
А.
04.
V.
Kirejew.
56.
57.
58.
59.
R. Lautié.
Bull. Soc. Chim. France, N 5—6,
503 (1947).
М. А. Гедис.
Compt. rend., 156, 65 (1913).
В. А. Киреев.
Кокс и химия, 3, № 8, 56 (1933).
В. А. Киреев.
Нефтяное хозяйство, № 2, 67 (1934).
62.
А. М. Мамедов.
53.
В.А.
Киреев.
Ки
реев.
oo. V. Kirejew.
F.
физ.
прикл.
Z. anorg.
Othmer,
химии,
allg.
Z. anorg.
60. D. H.Gordon.
64. D. F.Othmer.
63. D.
Ж.
Ж.
a
химии, Г,
66.
67.
68.
69.
r,
(1931).
1 (1934).
Chen. 201,
allg. Chem..,
197,
221
(1931).
350 (1931).
Ind. Eng. Chem., Ind. Ed., 35, 851 (1943).
Ind. Eng. Chem., Ind. Ed., 34, 1072 (1942).
Азерб.
S.
нефтяное
хозяйство,
Josefowitz,
Chem., 40, 883 (1948).
64.D. F. Othm er,
S. Josefowitz,
Chem., 40, 886 (1948).
65. D. F. Othme
233
R.D.
Beattie.
A.
E.
A.
E.
№
2, 20 (1953).
Schmutzler.
Ind.
Eng.
Schmutzler.
Ind.
Eng.
Petrol. Refiner, 31, 129 (1952).
J. M. Smit м "Ind. Eng. Chem., 46, 947 (1954).
J. P. Partington.
An advanced treatise on Physical Chemistry.
London. 1949, 1951.
W. Ramsay,
S. Young.
Phil. Mag., 20, 515 (4885).
W. Ramsay,
S. Young.
Phil.Mag., 21, 33 (1886).
Vol.
I, II.
171
\.
Вашзау,
W.
S. Young.
Ramsay,
Phil. Mag.,
S. Young.
22, 32 (1886).
Z. phys. Chem..,
1, 237 (1887).
W.E. Ayrton,
J. Perry.
Phil. Mag., 21, 259
A.W]. BepkmMan.
Yxp. xum. m., 1, 553 (1925).
E.R. Cox.
Ind. Eng. Chem., 15, 592 (1923).
J. D. Everett.
Phil. Mag. , 4, 335 (1902).
A. Findlay.
В.
Lautié.
Magnus.
Proc.
Bull.
Roy. Soc., 69,
Soc.
chim.
France,
(1886).
471 (1902).
9, 787
(1942).
Ann. Phys., 61, 223 (1844); mur. 10 [89].
Magnus.
Ann.
chim.
phys., (3), 12, 69
A. Winkelmann. Handbuch der
Physik,
S. A. Moss.
S. A. Moss.
Ss. А. Мо SS.
L.Segli
Phys.
Rev.,
16, 356 (1903).
(1844).
И, 2, 733, 1896.
Phys. Rev.., 25, 453 (1907).
Phys. Rev., 26, 439 (1908).
Ind. Eng. Chem., 38, 402 (1946).
. М.
Х. Kapanerbann,
643
(1925
Я. физ.
химии,
32, 306 (1958).
.E.M.Baker,
E.E. Pettibone.
Ind. Eng. Chem., 21, 562 (1929).
.E,M. Baker,
W. H. Waite.
Chem. Met. Eng., 25, 1437 (1921).
. E.M. Baker,
W. H. Waite.
Chem. Met. Eng., 25, 1174 (1921).
E.M. Baker, W.H. Waite.
Trans. Am. Inst. Chem. Eng., 13, (2), 223 (1920).
A, R. gen
В. Е. Townsend,
W. L. Badger. Ind. Eng. Chem., 17,
E.H. Leslie,
A. R. Carr.
Ind. Eng. Chem., 17, 840 (1925).
C.C.Monrad,
W.L. Badger.
Ind. Eng. Chem., 21, 40 (1929).
E. J. Roehl.
Ind. Eng. Chem., 30, 1320 (1938).
R. L. Harris.
Ind. Eng. Chem.
24, 455 (1932).
J.H. Perry,
E.R.Smith.
Ind. Eng. Chem., 29, 195 (1933).
L. Kaiser.
(1988)
(1956).
Compt.
К узьминых,
V. Kireeff.
rend., 242,
М.
Д.
1314 (1956).
Бабушкина.
Ж.
прикл.
24,
1488
Z. anorg. allg. Chem., 207, 350 (1931).
D. F. Othmer.
Chem. Metall. Eng.,
D. F. Othmer.
Chem. Metall. Eng.,
D. F.Othmer.
Ind. Eng. Chem., Ind.
S.Josefowitz,
D. F.Othmer.
47, 554 (1940).
47, 631 (1940).
Ed., 32, 841 (1940).
Ind. Eng. Chem., 40, 739 (1948).
V. Kirejew.
Z. Elektrochem., 39, 268 (1933).
В. А. Киреев.
ЭЖ. общ. химии, 3, 622 (1933).
R
химии,
Gijimont,
167 (1953).
A.I.Johnson,
Th.
Roszkowski,
Huang
Technol., 32, 127 (1954).
D. F.
Chen-jung,
Oth mer.
Kwei
Petrol.
Refiner,
Ti-kang.
32,
Canad.
J.
Е. И. Ахумов,
Б.Я. Розен.
Докл. АН СССР, 85, 363 (1952).
Е. И. Ахумов.
Ж. физ. химии, 27, 1760 (1953).
Е. И. Ахумов.
Ж. неорг. химии, 3, 456 (1958).
Исследование пересыщенных водных растворов солей. Труды
109. Е. И. Ахумов.
Всес. научно-исслед. ин-та галургии, вып. ХТ. Л., Госхимиздат, 1960.
C. H. Cheng.
J. Metall, 4, 428 (1949).
110. C. E. Birchenall,
У. А. А | ехап (ег.
Аба metallurg., 8, 833 (1960).
111. Н. \. Каузоп,
Б. Я. Розен.
Ж. физ. химии, 32, 2094 (1958).
112. Е. И. Ахумов,
113. Selected values of physical and thermodynamical properties of hydrocarbons and
114.
115.
related compounds,
by F. D. Rossini, K. S. Pitzer, R. L. Arnett, R. M. Braun,
Б. Ф. Марков,
Ю. К. Делимарский,
ков.
Докл. АН
J. Johnston.
СССР, 133, 1347 (1960).
Z. phys., 62, 330 (1908).
G. C. Pimentel. Pittsbourgh, Carnegie Press,
С. И. Скляренко,
Б. А. Сахаров.
1953.
#H. dus.
химии, 28, 1987 (1954).
Б. В. Стрижков,
А.
В. Лапицкий,
$18.
В. А.
Киреев.
Вкн.:
Сборник
работ
419.
В. А.
Киреев.
В кн.:
Сборник
работ
420. B.A.
12 .В.А.
122. В. А.
123. В. А.
124. В. А.
125. В. А.
126. В. А.
127. В. А.
128. В.А.
Kupees.
IK. oud. xumun, 28, 372 (1954).
Киреев.
Киреев,
ЖЖ. физ. химии, 35, "4393 (1961).
Ж. физ. химии, 36, 2547 (1962).
Киреев.
Киреев.
Ж. физ. химии, 37, 452 (1963).
Ж. физ. химии, 37, 1381 (1963).
116.
117.
1972
CCCP,
CCCP.
xumun,
21, 97 (1947).
Н. Д. Панченко.
Л.
Г. Власов,
|
М., Изд-во
АН
по физической
химии.
М.,
АН
URSS,
20, 905 (1945).
1947, crp. 197; Acta
phys. -chim.
URSS,
21, 159 (1946).
Киреев.
Ж.
физ.
28,
921
34,
химии, 37,
Цвет-
химии.
phys -chim.
Ж. физ. химии,
Усп. химии, 23,
Ж. физ. химии,
И.
по физической
1947, crp. 181; Acta
Киреев.
Киреев.
Киреев.
А.
Ж. физ.
568 (1954).
(1954).
945 (1960).
211
(1963).
Изд-во
129. В. А. Киреев.
Ж. общ. химии, 33, 724 (1963).
130. В. А. Киреев.
Курс физической химии. М., Госхимиздат, 1955.
131. D. F. Othmer,
A. H. Luley.
Ind. Eng. Chem., 3 408 (1946).
132. И. В. Вейц, Л. В. Гурвич,
Н.П. Ртищева.
К. физ. химии, 32, 2535
(1958).
133. A. W. Porter.
Phil. Mag., 23, 458 (1912).
133a. A.M. Rente,
F.E.Seuffert.
Ind. Eng. Chem., Ind. Ed., 26, 550 (1934).
134. A. R. Carr,
Т. Wolcz ynski.
J. Am. Chem. Soc., 56, 2541 (1936).
135. D. E. Holcomb,
G.G. Brown.
Ind. Eng. Chem., 34, 590 (1942).
136. М. Х. Карацпетьянц.
Ж. физ. химаи, 32, 1763 (1958).
137. В. Сора1.
J. Indian Chem. Soc., 20, 183 (1943).
138. R. Gopal.
J. Indian Chem. Soc., 24, 279 (1947).
139. EF. 1. Achumow,
1958).
140. С С.
141. С. С.
142. М.Д.
143. М. Х.
144. М. Х.
145. М. Х.
146. М. Х.
147. М. Х.
В
кн.:
E. W. P-ylkowa.
Freiburger Forschungshefte, A123, 251
Чин.
Ж. физ. химии, 26, 960 (1952).
Чин.
Ж. физ. химии, 26, 1225 (1952).
Гавриш,
И. С. Галинкер.
Докл. АН СССР, 102, 89 (1955).
Карапетьянц.
Хим. промышл., № 6, 21 (1945).
Карапетьянц.
Нефтяное хозяйство, № 10, 50 (1947).
Карапетьянц.
ОЭ. физ. химии, 32, 554 (1958).
Карапетьянц.
Труды МХТИ
им. Д. И. Менделеева, 14, 3 (1951).
Карапетьянц. Теплоты испарения низших углеводородов С! —Са.—
Физико-химические
свойства индивидуальных
углеводородов,
вып.
4.
Под
ред. М. Д. Тиличеева. М., Гостоптехиздат, 1952, гл. ХИ.
М.
Х. Карапетьянц,
М. Л. Карапетьянц.
'Теплоты испарения
углеводородов С5—Св.— В кн.: Физико-химические свойства индивидуальных
углеводородов, вып. 5. Под ред. М. Д. Тиличеева. М., Гостоптехиздат, 1954, гл.
ХУГ.
148.
149.
М.
Х.
Карапетьянц,
М.
Л.
Карапетьянц.
Теплоты
испарения
углеводородов С»›—Сю — В кн.: Физико-химические свойства индивидуальных
углеводородов, вып. 6. Под ред. М. Д. Тиличеева. М., Гостонтехиздат, 1957, гл.
|
XIX.
А. А. Петрушенко,
Ю. А. Васнецов,
Г. И.
150. А. П. Клименко,
Высоцкий.
Термодинамические свойства легких соединений парафинового
ряда.
Кигв,
Изд-во
AH
CCCP,
1960.
М. Х. Карапетьянц.
Ж. прикл. химии, 26, 432 (1953).
kK. A. Kobe,
R. E. Lynn.
Chem. Revs., 52, 117 (1953).
Д.Р. Стэлл.
Таблицы давления паров индивидуальных веществ.
1949.
151.
152.
158.
154.
155.
Справочник
F.
D.
J. Jaffe.
Stand.,
химика,
Rossini,
Circ.
1.
D.
М.,
Госхимиздат,
Wagman,
W.
1951.
H.
Ewans,
5.
Levine,
Sclected values of chemical and thermodynamical properties, Natl. Bur.
500,
М. $. ОзБогп
156.
157.
158.
159.
160.
161.
т.
D.
М., ИЛ.
e,
Washington,
1952.
D.C.Ginnings,
J. Res. Natl. Bur. Stand., 39, 453 (1947)
P EPP EyO nD
oer eee
С. A., 45, 1705 (1951).
М. Х. Карапетьянц.
Ж. физ. химии, 30, 2218 (1956).
R.Singh,
L.W.Shemilt.
J. Chem. Phys., 23, 1370 (1955).
Т. С. М. Li,
K.S. Pitzer.
J. Am. Chem. Soc., 78, 1077 (1956).
. Е. Clements,
K.V. Wise,
S.E.J. Johnsen.
J. Am. Chem. Soc.,
‚ 1593 (1953).
162.
chroéer.
Z. phys. Chem., B49, 271 (1941).
. Pitzer,
W. D. Gwinn.
J. Am. Chem. Soc., 63, 3313 (1941).
163.
164.
.-Walters,
J. M.S mith.
Chem. Eng. Progr., 48, 337 (1952).
165.
Oliver,
J. W.Grisard,
C.W.Cunningham.
J. Am. Chem.
‚ 73, 5719 (1951).
Wise.
J. Am. Chem. Soc., 76, 3094 (1954).
166.
. Fiske.
Refrig. Eng., 57, 336 (1949).
167.
168.
Llewellyn.
J. Chem. Soc., 1953, 28.
vliéek.
Z. Naturforsch., 11a, 99 (1956).
169.
170.
Aver
H. T. Milton,
J. W.Grisard.
J. Am. Chem. Soc., 75,
174.
175.
==>
171.
172.
173.
lly.
J. Am. Chem. Soc., 73, 843 (1951).
ins,
C. M. Birdsa 11. J. Chem. Phys., 20, 1158 (1952).
k, A.H.Cockett,
H.S.Eisner.
Proc. Roy. Soc., (L.), A209,
iver,
J. W.Grisard.
Friedman,
26 6 (1951).
D. White,
J. Am.
H.
Chem.
Soc., 78, 561
L. Johnston.
(1956).
J. Chem.
Phys.,
19,
176.№ . Д. Тиличеев.
Давление насыщенных паров углеводородов С›—С.— В
Е
Физико-химические свойства индивидуальных углеводородов, вып. 4. Под
ред. М. Д. Тиличеева. М., Гостоптехиздат, 1952, rn. XIII.
ОО в:
Collect. Czechosl. Chem.
Communic.,
19, 189 (1954).
вы
о
oe
. П. Мищенко,
К.
М.
36, 559 (1946).
3. Пронина.
Воскресенская,
Г. Н.
Ж.
общ.
химии, 6, 85
Янковская.
В кн.:
(1936).
Сборник
работ
Das Leitvermogen der Elektrolyte.
Leip-
о физической химии, М., Изд-во АН СССР, 1947, стр. 263.
. № 1. Пономарева.
Автореф. канд. дисс. Л., ЛХТИ им. Ленсовета, 1954.
а ткий справочник физико-химических величин. Под ред. К. П. Мищенко и
.А. Равделя. Л., Госхимиздат, 1955.
190.
191.
.
188.
189.
ee
ie
оная Bee
187.
. Res. Natl. Bur. Stand.,
о °
185.
186.
= няня
183.
184.
C. Cerny.
ee
182.
09
181.
rdés,
. Эльянов,
М. Г. Гоникберг.
Изв. АН СССР, ОХН, 1961, 934.
.Э льянов,
М. Г. Гоникберг. Ж. физ. химии, 36, 604 (1962).
Prosen,
W. H. Johnson,
F. D. Rossini.
J. Res. Natl. Bur.
tand. ‚ 37, 51 (1946).
. Та ву ог,
D.D.Wagman,
M.G. Williams,
K.S. Pitzer, F. D.
si
J. Res. Natl. Bur. Stand., 37, 95 (1946).
. Е. К! ilpatrick,
E. J. Prosen, K.S. Pitzer,
F.D. Rossini.
hlrausch,
L. Holborn.
eubner, 1916.
а расов.
Докл. АН СССР, 46, 1417 (1945).
mith,
D. Brown,
A.S. Dworkin,
D.JjJ.Sasmor,
E. R.
rtsdalen.
J. Am. Chem. Soc., 78, 1533 (1956).
osgrove,
P. E.Snyder.
J. Am. Chem. Soc., 75, 1227 (1953).
tz, F. J. Dunkerley,
B.J.DeWi
tt. J. Am. Chem Soc., 65, 600
^^
ees
177.
178.
179.
180.
192.
193.
194.
195.
196.
197.
198.
.Trouton.
.J.Jones,
Phil. Mag., 18, 54 (1884).
S.T. Bowden.
Phil. Mag.,
37, 480 (1946).
nter.
J. Phys. Chem., 32, 576 (1928); цит. по [67].
Thiesen.
Verhandl. d. D. phys. Gesellschaft, 16, 80 (1897).
_W. Benson.
W. Benson.
К. Ф. Павлов.
ния в области
J. Chem. Phys., 15, 367 (1947).
J. Chem. Phys., 15, 866 (1947).
Ж. хим. пром. 13, 327 (1936); К. Ф.
процессов
и аппаратов
химической
Павлов.
технологии,
Исследова-
сборник
статей.
Труды ЛХТИ им. Ленсовета, вып. ХУГ. Л.—М., Госхимиздат, 1947, стр. 19.
199. К. Ф. Павлов.
Исследования в области процессов и аппаратов химической
технологии, сборник статей.— Труды ЛХТИ им. Ленсовета, выи. 16. М.—Л.,
Госхимиздат , 1947, стр. 53.
200.
201.
202.
Г. И. Микулин.
В с6б.: Работы по технологии
химии, т. 13. Л., Госхимиздат, 1961, стр. 53.
F.D. Rossi
ni,
P.
A.
Cowie,
Е.
О.
соды.
Ellison,
Труды
НИИ
основной
C. C. Brown.
Properti-
es of Titanium. Compounds and Related Substances (with Appendix by M.
sem). ONR. Report AC R-17. Washington, Oct., 1956.
Б. Ф. Марков,
А. М.
Тарасенко.
Ж.
физ.
химии,
32,
C. Ar-
1333 (1958).
ГЛАВА
У
СРАВНЕНИЕ ЗНАЧЕНИЙ ДВУХ СВОЙСТВ
ОДНОГО ВЕЩЕСТВА ПРИ РАЗЛИЧНЫХ ЗНАЧЕНИЯХ
ПАРАМЕТРА УСЛОВИЙ
ВВЕДЕНИЕ
В предыдущих главах были описаны методы сравнительного расчега, основанные на сопоставлении значений свойств нескольких веществ:
одного свойства в первом, третьем и четвертом мегодах и дьух свойств во
втором методе.
|
Теперь рассмотрим способ вычисления. основанный на сравнении двух
свойств одного вещества; ему соответствует соотношение
G’ = A,G’ + B,,
|
(V,1)
в котором два свойства С’ и С” одного вещества сравниваются в обычных
или функциональных шкалах [1—3]. Как и в случае четвертого метода
сравнительного расчета, (У, 1) часто справедливо в виде соотношения
1“ С" = Аз ю С’
в котором значения
Справедливость
дения
уравнений
С’ и
С" сопоставляются
соотношения
(У,
а’ =а--
И
6’ =а+
а соотношение
В,,
в логарифмических шкалах.
1) можно
5
(V,2)
связать
соблю-
(П)
(У,3)
(1),
(У,4)
(У, 2) — с условием соблюдения
уравнений
IgG’ =a'+ b'g (1)
IgG” =a" +b’ (I).
ЧИСТЫЕ
с условием
(V,9)
(V,6)
ВЕЩЕСТВА
К свойствам индивидуальных веществ, описываемым соотношением (У, 1), относятся удельный объем У жидкости и ее текучесть $.
Полагая, что зависимость этих свойств от температуры можно выразить
уравнениями (У, 3) и (\, 4), получаем
=, Ф-+ В,
|
(V,7)
175
Здесь ф и ТУ сравниваются при одинаковых температурах. Легко видеть,
что уравнение (У, 7) является
видоизмененной
записью
уравнения
А. И. Бачинского [4, 5, 6, 7]
|
где п — вязкость.
Уравнение, подобное
=
V—bd?
|
7), в котором
(У,
(V,8)
У — удельный
объем
жидко-
сти и В, = 0, было рассмотренов [8]. Однако пропорциональность между
У и ф, мотивированная
допущением,
что при И=
к удовлетворительному совпадению с опытом. В работе [9] уравнение (У, 7) при-
менено для расплавленных
Aa
97 117, 0°С
хлоридов
ме.
0 и ф = 0,
не приводит
%
КУ
6,4
79g
7,1
29
33
387
47
45p-10° 49g
9
Рис. 137. Взаимосвязь между удельным
сопротивлением
(om -cm™ })
и теплопроводностью
свинца при
различных температурах [11]
19Е
10
iy! 20
Рис. 138. Взаимосвязь между козэффициентами расширения 3(град-!)
и теплоемкостью С р› (кал/град- моль)
хлористого аммония при различных температурах [13]
таллов. В этой же работе уравнение вида (У, 1) было рекомендовано
maa G =Vu
G" = A, rae V — свободный
объем и А— коэффициент
диффузии
ионов
указанных
веществ.
Линейная зависимость между
нием наблюдается. при ‚Условии,
-1
Зори
=o @ 110}.
текучестью и поверхностным натяжеесли в (У, 1) принять, (= фи (' =
we
‚ Другим
‘уравнение
примером _ соотношения
A =
(У,
AsOen
1) может
служить
приближенное
+ Bs,
(V,9)
в котором при одинаковой температуре сопоставляются электрическое сопротивление и теплопроводность металла [10а] и которое можно рассматривать как результат примерно антибатного хода этих свойств с температурой
(поэтому
сятся
к
в нем А,< 0). На
одном примере
уравнение
(У, 9) иллюст-
рируется рис. 137. Очевидно, оно не может охватить широкий интервал
температур; не приходится говорить о высоких и низких температурах,
так как первые ограничены плавлением, а при очень низких температурах электрическое сопротивление металлов начинает падать гораздо быстрее, чем растет их теплопроводность. Наконец, следует иметь в виду,
что сопоставляемые в (\, 9) величины и особенно теплопроводность относвойствам,
того, их значения
размеров
весьма
чувствительным
зависят от характера
кристаллов
и т. д. Поэтому
к наличию
термической
проверку
(У,
примесей;
обработки
9) следует
кроме
металла,
осуществ-
лять лишь тогда, когда измерения обоих свойств производились с одним
и тем же образцом, обладающим высокой чистотой.
В работе [12] была установлена линейная зависимость между энергией активации
ции процесса
17
квазивязкого
разрушения)
течения
металла
и его прочностью.
(а также
энергией
актива-
В работе [13], посвященной изучению термических свойств вблизи Аточки, была найдена линейная зависимость, которую можно рассматривать
как частный пример соотношения (У,1) при условии, что С’ = В (коэффи-
циент расширения) и (” =
МН.С1 (см. рис. 138).
Примером
найденную
в
Ср. Эта зависимость подтверждена данными для
соотношения
[14]
при
вида
(У,
изучении
1)
можно
закономерностей
считать
и
зависимость,
деформации
каучуков
и сырых резиновых смесей при их одноосном сжатии.
Примером применения соотношения (У, 2) к однокомпонентным
фазным системам может служить и уравнение
одно-
Ig P = A,lgV
+ Bs,
в котором
ливо для
Мариотта)
реженных
В ряде
(V,10)
сопоставлены объем и давление газа. Это уравнение справедидеального газа (так как соответствует уравнению Бойля —
и удовлетворительно воспроизводит опытные данные для разгазов.
исследований было рекомендовано уравнение вида
. lgn =f{Aslg of-HB;,
(У,11)
в котором при одинаковой температуре (П = Т) сравниваются
поверхностное натяжение
си
вязкость жидкости 1 [45—17]. В работе [16]
отмечается, что вопреки предложенному ранее [18] уравнению [которое
сводится к (У, 11)
с А;
веществу (см. также
ное
уравнение
Возможность
в котором
(У,
= 0,5]
11).
применения
ух — удельная
исследований
наклон
[17]). В работе
[20,
прямых
[49]
от
на
вещества
приближен-
к
уравнения
электропроводность,
21].
меняется
указывается
была установлена
в
ряде
Взаимосвязь между изотермической сжимаемостью жидкости и поверхностным натяжением также выражается соотношением вида (\У, 2) (см.
[22].
РАСТВОРЫ
уравнение
Примером
в котором при
проницаемость
соотношения
одинаковой
раствора
(У,
1) для
растворов
8 = АБТ! | В»,
концентрации
с коэффициентом
сравнивается
активности
может
служить
(V,13)
диэлектрическая
растворителя.
Это
уравнение соответствует найденной Г. Л. Старобинцом [23] пропорциональности в значениях отклонений Дё и АТ, растворов по сравнению с
чистым растворителем. Уравнение (У, 13) иллюстрируется рис. 139. &
‚ Другим примером (\, 1) является уравнение
Cp = AV + Bs,
(V,14)
в котором при одинаковой концентрации сопоставлены удельные объемы
и теплоемкости растворов. Эта зависимость, справедливость которой
можно объяснить аналогией изотерм зависимости У и Ср некоторых солей
от их концентрации, была установлена давно [24]. А. П. Руцков [25]
указал, что уравнение (У, 14) применимо для растворов негидрофильных
и слабогидрофильных солей.
В. А. Василев [26,26а], оно
материал
и для гидрофильных
(Cp)oo8
дает в интервале концентраций
12 м. Х. Карапетьянц
Однако, как показали М. С. Стаханова и
удовлетворительно воспроизводит опытный
солей.
—
2,068
Так,
° Voog
уравнение
—
1 ‚078
т = 0,2—5,0 максимальную погрешность
|
177
в значениях
теплоемкости
в 0,004
кал/г-град
[26]
(см.
также
рис.
Уравнение (У, 14) справедливо и для тройных систем [27, 85].
Справедливость (У, 14) является количественным подтверждением
140)по-
ложения о том, что «изменение теплоемкости, плотности и сжимаемости
в растворах электролитов подчиняется одной И ТОЙ же закономерности»
[28].
Интересно
руживают
отметить, что температурные
параллелизма
в
своем
А. П. Руцков связывает с различием,
коэффициентов для чистой воды.
Уравнение вида (У, 1)
Е
Zor
коэффициенты
изменении
в первую
У и Ср не обна-
концентрацией;
очередь,
это
величин
этих
описывает взаимосвязь между плотностью и
теплопроводностью
водных растворов.
электролитов (см. [29]).
В. К. Першке
[30] нашел,
что при
46 — данной температуре между удельным
вращением раствора чи его показателем преломления п действительна взаимосвязь
72
2
= А; еп -
являющаяся
ношения
(У,
частным
2).
В,
(У,15)
примером
соот-
Укажем на ряд примеров использования уравнений, описанных в предыдущем разделе, к многокомпонентным системам.
10
0
с
}
4
2
You6
08
9
09'
случаи,
когда
ООН
095
6
Рис. 139. Взаимосвязь между коэффициентами активности 7 бензола и диэлектрической проницаемостью &
растворов этилового
спирта в бензоле при различных
мольных долях [23]
Известны
0393
можно
097
у
„099.
ц
Рис. 140. Взаимосвязь
между удельными объемом У (см3/г) и `теплоемкостью Ср (кал/град-г)
водных
растворов Ё1С] при 25° С при различных
_ молальностях
т [26]
воспользоваться
уравнением
(У,
9}
для сплавов (см., например, [31]). Широкое применение имеет ‚уравнение
(У, 12) для растворов [32—37] и стекол [38—41].
Зависимость, установленная в работе [42], является примером сопоставления двух свойств в различных функциональных шкалах: С’=
1
и С’=
с
(растворимость).
ФАЗОВЫЕ
Чистое
больше
ПРЕВРАЩЕНИЯ
вещество
Для однокомпонентных двухфазных систем было предложено
всего зависимостей вида (У, 1), причем почти все они относятся
к соотношению типа (\, 2).
Юнг [43, 44] установил, что плотность
связана с его давлением Р уравнением
сухого
leo" = A; lg P + Bs.
178
насыщенного
пара ог
(V,16)
Связь между теплотой парообразования АНпар и скоростью звука и
Богдан [45] выразил в виде уравнения
и =ЕУ АНчаь,
(V,17)
которое легко преобразовывается в соотношение типа (У, 2).
Мак Леод [46] нашел, что при данной температуре
1-7.“ = с01$%,
|
(V,18)
где п — вязкость и ух — объем свободного прозтранства, связанный с определенным объемом молекул, причем для нормальных жидкостей а—1,
а для ассоциированных
а>>1. Этому уравнению, которое было проверено [46] на шести веществах, причем расхождение оказалось меньше 1%,
также легко придать вид. (У, 2).
Герц
[47] установил, что
ig AHnap = 45 85+ Вь,
(V,19)
гдео — поверхностное натяжение. К подобному уравнению пришли также Винтер [48] и Магарил [49]. Аналогичная связь была установлена
между поверхностным натяжением и теплотой парообразования
[50].
Несколько публикаций
[51—61] посвящено уравнению
lon = Asle P+ B,,
(V,20)
связывающему
давление пара жидкости
с ее вязкостью.
Следует отметить, что допущение о независимости А; от природы
вещества (А; = \1/. [52]) приводит к значительным ошибкам, и уравнеHue (V, 20) в широком интервале температур дает не очень точные результаты вследствие
некоторого искривления зависимости 1 = } (Р)
[57—59].
Это побудило ввести
вида C (lg п)?
Отмер
[59].
и Такар
в уравнение
(У, 20) дополнительный
[62] описали уравнения
где D — коэффициент диффузии
Ряд описанных в литературе
в жидкости.
зависимостей
можно
рассматривать
частные случаи (У, 2) при условии, что С’ равно скачку плотности
—=©*
— 0` при
кипении:
lg G” = Aslg Ap + Bs.
К
ним
относятся
найденные
в
[63—68]
свойств,
может
служить
уравнения
для
С”
величин
=
[74].
Приведем
еще
А. К. Абас-заде
вил,
что
два
примера
AMnap,
является
уравнение
lg a — A,leT + Ba,
которое было предложено для воды
как
Ао =
(V,23)
в [66, 69—71] (см. также [72])
— для с.
Примером (У, 2), когда одна из сопоставляемых
комплексом
член
(V,24)
[73], метилового
соотношения
(У,
и
этилового
спиртов
2).
[75] на примере С,Нь, С,Н,СН. и СН (СН) › устано-
взаимосвязь
между
плотностью
вещества
как
в жидком,
12*
так
и
179
в парообразном состояниях и коэффициентом теплопроводности
азить
уравнением
k= aos,
можно
ee
вы-
(V,25)
в котором а зависит только от природы вещества. Для газа в (У, 25) вместо
Е
следует
подставить
АГ — К,
где
Ё: — коэффициент
теплопроводности
ig Pr
28
40
5,07
-3plgk
|
20r
-Ц
=
_
10
_
05]
g
Pony
‚|918
-
-2
6;
i
|
441.
между
Рис. 142.
Взаимосвязь
плотностью
р (г/см3) а коэффициентом _ теплопроводности
к толуола
[75] при
раз-
личных температурах ;
о
—кипящая
сухой
жидкость;
насыщенный
@—
пар
26
|
(4 * nop ) te
tg р
Рис.
—L
25
22
19
16
1
!
+
t
4
13
oD
-1
Взаимосвязь
(АН пар) ute! Тнт.ки
А— вода; Б—различные
3 — С.,Н,Вг,
4—CS.,
CH;COCHs,
8
11
—из0-СзН.ОН,
15
—
CH.Cl
CH;0H,
ч-
19
C;H,OH,
—
—
CH.Cl,
—C.H,;0OH,
23
—
СН,ОН.
[76]
=
CCl.,
CH;08H,
16 —
20
—
—
27 — CH,OH
Выделены
—
—
числа
Прандтля
—
СНО\.,
10
и30-СьНа1ОН,
CHs,
C.H,;OH,
24
величиной
1 — н-С5Н!:, 2—C2H,OCG.H.,
6 — yucCHCIl=CHCl,
7 —
9
13
C.H;
—C.:H;NHse,
#6 — u30-C;H:,0H,
СНОН
—
логарифмом
Рг
жидкости:
5—CCl,4,
CHC!
12
между
17
21—
n-C,4H,OH,
— CH,0OH,
—
—
н-СН: а,
14 —
н-С,Наь,
u30-C3H;:OH,
25
—
18
—
22
—
H-C;H1,0H,
28 —CH,OH
ряды сходных веществ:
19—22—24—25]}
CeHe,
1—10—
—
17,
|
разреженного газа, вычисленный по обычным кинетическим законам. Легко видеть, что уравнению (У, 25) можно придать следующий вид:
Из рис. 144 видно, что значение ав (У, 25) зависит только от природы
изучаемого вещества.
Другой пример. Как нашел Денбиг [76], температурную зависимость
числа Прандтля (Ср.\/К) в первом приближении можно описать уравнением
(АН пари. т.к
lg [Pr] __=
(V,27)
- 5;
сочетанием (У, 27) с приближенным уравнением Клапейрона —
ees
а
180
lg P = Aglg [Pr] + Bs.
Клаузиуса
(V,28)
Надежность уравнения (\, 27), а поэтому и уравнения (У, 28) подтверж-
дается данными, приведенными
оценки значений Рг по Р.
на рис. 142. Уравнение (У, 28) удобно
для
Растворы
Здесь так же, как и в случае однокомпонентных систем,
симости С” = } ((’) обычно имеют вид (У, 2).
Отмер [771 приводит график, соответствующий уравнению
зави-
< Мн,о = 4, е
(У,29)
Р- ВЬ,
в котором мольная доля воды в аммиачном растворе сравнивается с давлением ее насыщенного пара при данной концентрации и различных температурах.
Отмер
и Уайт
[78] предложили
уравнения
lg Py = Aslg P +{B;
(V,30)
Ig
K = Aslg P+ Bs,
(V,31)
где Ри — парциальное давление, А — константа
водяного пара.
Отмер [79] описал уравнение
Генри
и Р — давление
lg Kg = Asle P+ Bs,
(№32)
tye Ky — константа фазового равновесия.
Аналогичные
уравнения
были рассмотрены
в работах
[80—82].
К подобного рода зависимостям можно присоединить и некоторые дъугие, в частности уравнения
lgP = A,loc-+ В,
И
(V,33)
lgp = Aslgc + Bs.
(V ,34)
Первое уравнение было предложено А. В. Сперанским [83] и подтверждено на примере водных растворов сернокислого бериллия в работе
[84]; в нем сравниваются растворимость и давление пара над насыщенным
раствором. Второе уравнение было использовано для описания взаимосвязи Между концентрацией соли, растворенной в сжатом водяном паре,
и плотностью пара. Аналогичная зависимость была установлена в [143].
ХИМИЧЕСКИЕ
ПРОЦЕССЫ
Ряд уравнений вида
(У, 2) был рекомендован в работе
[81]:
lgk= Aslg P+ B;
и
1 К; = А; [с Р
(У,36)
---Бь;
(V,37)
здесь А, Ки! — соответственно константа химического равновесия,
станта скорости реакции и константа ионизации.
Правило Гейгера — Неттола [87]
12Г = А, 18 1-- ВЬь,
связывающее
можно
пробег
рассматривать
а-частиц
как
в веществе
частный
пример
кон-
(V,38)
(Г) с
(У,
постоянной
2).
распада
Г,
182
В работе [88] установлена линейная. зависимость вида (У, 2) между
коэффициентом экстракции и коэффициентом активности; в ряде исследований [89—91] приведена взаимосвязь вида (У, 1) между изменением
энтропии и некоторыми другими характеристиками физико-химических
процессов.
ПРЕДЕЛЬНЫЕ СЛУЧАИ СООТНОШЕНИЙ (У, 1) и (У, 2)
Примером (У, 1), в котором В, = 1, может служить зависимость
(АНпар)внутр = Аз (АН пар)
|
(У,39)
между полной и внутренней (АН. — РАГрнар) теплотами парообразования [92]. Другим примером (\, 1), в котором можно считать В,=0, является приближенная зависимость
АН = А, Аб,
(У,40)
где теплота образования жидких смесей из чистых компонентов сравнивается с избыточным — по сравнению с идеальным раствором — изменением энтропии при этом процессе. Справедливость (У, 40) показал В. А. Ки-
реев [93]. Из этого уравнения, в соответствии с тем, что
AZ = AH —TAS,
следует
где
| AH = A,AZ,
AZ — избыточное
изменение
(V,41)
изобарного
потенциала
}.
Отклонение от уравнений (У, 40) и (У, 41) В.А. Киреев связывает с образованием неусхойчивых соединений. В другой работе [94] В. А. Киреев,
пользуясь этими соотношениями, вывел новые уравнения, связывающие
теплоты смешения с парциальными давлениями и составом пара над растворами.
|
|
Примером
может
предельного
служить
отвечающее
однотипных
случая,
уравнение
изобарных
ОБОСНОВАНИИ
К уравнению
в соотношении
(У)
AZ = AH + By,
сопоставлению
реакций [95].
ОБ
когда
|
(У,
=1,
(V,42)
потенциалов
НЕКОТОРЫХ
А;
и тепловых
эффектов
УРАВНЕНИЙ
8) можно прийти
и другим путем; обозначим
через Ё силу взаимодействия между частицами вещества, а через b —
величину, близкую к постоянной уравнения
Ван-дер-Ваальса. Тогда
F = const-p =
и
(У,43)
и
F = const’-y = м
(У,44)
Сочетание (У, 43) с (\, 44) приводит к (У, 8).
Уравнению (У, 13) соответствует пропорциональность между разностью значений $ и7 для раствора и чистого растворителя — вывод, к которому пришел Г. Л. Старобинец [23] на основании параллелизма изме1 Oxesugno, (As)v,41)
182
9
(45)
V,40
и —1
нения $ и 1 в зависимости от состава раствора полярного вещества в неполярном растворителе. Этот параллелизм обусловлен примерно одинаковой зависимостью з и 7 от величины дипольного момента и от изменения
структуры раствора с его составом.
Большое число уравнений вида (У, 2) обусловлено тем, что для многих свойств справедлива зависимость
{см.,
например,
Подобие
G=a-eRT
[97]).
температурной
Q
|
зависимости
(У,45)
различных
свойств
(вязкости,
удельного электросопротивления, времени релаксации и др.), отмеченное
в ряде работ (см., например, [98—100]), связано со строением жидкостей.
Так, в работе [100] это объясняется следующим: увеличение электропроводности при нагревании связано с ростом подвижности, число же ионов
остается постоянным. Подтверждением этому служит то, что прибавление
НЕ к изоамиловому спирту только увеличивает общую проводимость,
но не меняет температурного коэффициента электросопротивления. Это
наблюдается у простых жидкостей;у полимеров картина сложнее. Таким образом, уравнение (У, 2) может служить своеобразным индикатором
полимеризации.
Различными сочетаниями (У,
уравнения вида (У, 2), в которых
45)
для
двух
свойств
легко
получить
As = о
где
О’и
0” энергетическая
Эту зависимость,
шение
вида
(У, 1)
в свою
для
(V,46)
характеристика соответствующих
очередь,
предельного
можно
случая,
рассматривать
когда
В,
изменений.
как
= 0, так
соотно-
как
в 0б-
щем случае и О’, и О” меняются с изменением параметра условий П.
В связи со сказанным выше необходимо остановиться на двух обстоятельствах. Так как в соотношении (У, 46) вотличие от соотношения (ТУ, 92)
сопоставляются
энергетические
эффекты
различных
процессов, то в общем
случае
рожности, чем применение
применение
первого требует
большей
остовторого. Действительно, если Ох и Ом в урав-
нении (ТУ, 92) изменяются с Т односторонне, что и приводит к практичеCKOMY постоянству их отношения в сравнительно широком интервале
Т, то О” и О’ в уравнении (У, 46) могут меняться с Т по-разному, и тогда
их отношение не будет постоянным даже в узком интервале значений Т.
Примером подобного рода может служить сопоставление константы равновесия с давлением пара: теплота парообразования уменьшается с повышением температуры, а тепловой эффект реакции с повышением температуры может как уменьшаться, так и возрастать. По-видимому, это
не было учтено Отмером [81] (см. [96].
|
Второе обстоятельство рассмотрим на конкретном примере. Одним из
частных примеров (У, 2) является уравнение
Ign= Aslex+ Bs,
=
(У,47)
в котором при одинаковой температуре сопоставляются вязкость и электропроводность вещества. Это выражение можно рассматривать как иную
форму записи уравнения
x7n = const,
(V ,48)
описанного и использованного в ряде исследований [24, 34, 38, 40, 104,
102] и являющегося, в свою очередь, видоизменением правила Писаржев-
ского
[103] — Вальдена
[104],
которое
№.
= const
выражается
уравнением
(V,49)
183
й применяется для водных и неводных растворов и для расплавленных
органических солей электролитов. Однако. мотивировка справедливости
соотношения (У, 47) на основании зависимостей вида (У, 45), т. е. с по-
мощью
уравнений
Ел
| = а'.еЁТ
И
x
—
(У,50)
Ех
а”.-е_ ЕТ,
(У, 51)
в которых Е. иЁх— энергии активации вязкого теченияи электропроводнос-
ти,
не может
быть
признана общей, а поэтому
и правильной.
В частности,
последние плохо описывают температурную зависимость вязкости и электропроводности стекол. В то же время уравнение (У, 47) хорошо согласуется
с этими данными. Это противоречие является кажущимся, так как, согласно
К. С. Евстропьеву
летворительные
результаты
[24, 34, 105, 106], для силикатных
дают уравнения
систем удов-
b
Ig f= a+ ae
(V,52)
In X = a2 ++ 7 ,
(У,53)
И
основанные на допущении, что величины Ё, и Е, обратно пропорциональны температуре. Сочетание уравнений (У, 52) и (У, 53) приводит к уравнению (У, 47).
В этом случае несовместимость (У, 50) и (У, 51) с (У, 47) [и совместимость последнего с (У, 52) и (У, 53)] можно было бы легко обнаружить и
по характеру расположения точек на шт — шу-прямых при заданных
значениях 7 (например, при значениях Т, образующих арифметическую
прогрессию). Можно полагать, что и при температурах ниже линии ликвидуса, когда (У, 52) и (У, 53) становятся неточными, уравнение (У, 47)
будет давать,
может
быть,
и не столь
точные,
как
при
высоких
темпера-
турах, но достаточно надежные для практических целей результаты.
Применимость многих уравнений, являющихся частными примерами
соотношения (У, 1) в логарифмических шкалах, можно связать с тем, что
для некоторых свойств справедливы уравнения вида
@=а (1—т)',
G =a(G"—G’)”,
(V,54)
(V,55)
G =a.(G’')*,
(У,56)
а —=а--Ь Ш (typ — 2)
(V,07)
и другие (здесь т — приведенная температура).
Так, уравнение (У, 54) было рекомендовано для теплоты парообразования АНпар [63, 107—112] (см. также [47, 49, 143, 114]), поверхност-
ного натяженияс
[114,
115,
118]
(см. также [72, 146, 117, 119—124]), вяз-
кости [122], скачков плотности [63, 72, 122, 123, 125] и объема [114]
при парообразовании.
Сочетание (У, 54) для двух свойств приводит к зависимости вида (У, 52). Примером последнего является уравнение
Ig
Зависимости
вида
(\У,25)
АНпар
=
(были
A;
Ig
6
+
B;.
предложены
(У,58)
для
а = АНнпар,
@’=
0т
и а”
= ож [49, 63—65, 67, 68, 126]
и =, Ц’ = рж, 4" = р" [46, 66, 69, 70,
126, 129]. Записав уравнение (У,55) для АНпар и 6, мы также получим
184
уравнение
(\У,58),
однако
в этом
случае
сопоставление
АНнар
и с будет
отвечать
ложены
АНпар
[130]
также
в
отличие
условию
от
предыдущего
одинаковых
значений
(ож
— рг), что, вообще говоря, не соответствует условию одинаковых
значений т.
Зависимости вида (\У,55), в которых а’ =Т и ("= ТГьр, были преддля
(см.
[63,
67,
129а,
131—136,
(127, 138, 144],
(126, 128], текучести Ф [139]. Подобные
сводятся к (V,04)*. Поэтому, например, из уравнений
AH pap =20 (TR — TY”
6 = dy (Tee —T)”
140]),
в
зависимости
(V,59)
-(V,60)
|
также вытекает уравнение (У, 58), однако при условии одинаковых значений (Т,р
— Г). Следовательно, в этом случае коэффициент В, в уравнении (У, 58) будет. ИНЫМ.
Ряд уравнений вида (У, 2) был предложен В. К. Першке
[126],
полагавшим, что в основе зависимостей логарифмического вида ле-
жит
одинаковый
закон
изменения
любого
физического
свойства
жидкости
с температурой,
выражаемый
уравнением (У,55). Послед-
нее было проверено им для < =р* —рг,с, т, АНпар и
для
ких жидкостей на теплоемкости, показателе преломления и
нескольскорости
звука. Першке указывал, что в отдельных случаях в уравнении (У, 55)
значения 6 для данного свойства, нодля различных жидкостей равны или
близки между собой (гомологические ряды, бензол и его галогенпроизвод-
ные, сжиженные газы). Записав уравнение (У, 55) для двух жидкостей и
исключив величины (р —#), Першке получил десять уравнений, шесть из
которых относятся к уравнениям вида (У, 55), а четыре — к уравнениям
вида
(У, 56).
К этим
десяти
уравнениям
можно
присоединить
еще десять
попарным сочетанием соответствующих свойств. В тех случаях, когда в
уравнении (У, 55) значения коэффициента 6 совпадают для обоих свойств,
в уравнении
(У, 2) коэффициент
чает, что разница в значениях
раметра
условий.
наклона
совпадает
с единицей.
Это озна-
свойств не будет зависеть от значения па-
Для растворов в основу рассматриваемых соотношений, согласно
шке, положена одинаковая зависимость вида
lgx "As lge-+ Bs,
Пер-
(м, 64)
где х — удельное вращение « или показатель преломления п, а с — концентрация раствора [30]. В частности, из (У, 61) следует (У, 15).
'’
В связи с изложенным выше подчеркнем следующие обстоятельства,
связанные с обоснованием справедливости того или иного уравнения
вида (\, 2).
Во-первых, основывая зависимость вида (У, 2) на конкретных уравнениях ( = } (ЦП), например вида (У, 54), следует учитывать, что в разных
работах они нередко рекомендуются с отличающимися значениями коэф-
фициентов (это имеет место, например, для АНнар и 6).
Во-вторых, обосновать справедливость той или иной
зависимости в
ряде случаев можно, исходя из нескольких уравнений. При этом необхо-
димо иметь в виду точность последних (которая при заданных значениях
параметра ПП может быть проконтролирована по характеру расположения
точек на прямой,
отвечающей
выведенной
зависимости).
Так, хотя к урав-
нению (У, 2) можно прийти как из (У, 46), так и из (У; 55), однако справедливость (У, 46) в соответствии с физическим смыслом входящих в него
величин в общем случае, как это уже отмечалось выше, не является стро1 Переписав
(У,
54) в виде
С = a
кр
(Тк —
T)?,
получаем
(У,55).
185
той. Неприменимость же уравнения (У, 55) в очень широком
значений С(’—=1{не следует из характера этой зависимости.
В. К. Першке отмечал, что величина
турный
а в этом уравнении
ход.
имеет
интервале
Впрочем,
темпера-
В-третьих, неточность исходных уравнений часто компенсируется
при обращении к сравнительному расчету. Так, неточности, обусловленные изменением числа, размеров (и возможно, строением) сольватов с концентрацией, приводят к некоторому несовпадению результатов вычисления
по уравнению (У, 61) сопытом, но практически не отражаются на уравнении (\У,15), так как эти изменения в растворе влияют примерно одинаково
на а и п.
В-четвертых, многие из рассмотренных уравнений могут быть положены
в основу зависимостей,
отечающих
не только пятому,
но и
четвертому методам сравнительного
расчета
(об этом упоминалось в
главе
ТУ).
Однако
в общем
случае,
обосновывая
уравнения
вида
(У,
1)
и (ТУ, 1) (в частности, в логарифмических шкалах), необходимо иметь в
виду несколько различную погрешность результатов. Это обусловлено
различием в точности применения зависимостей вида G = f (JJ) к одному
<войству двух веществ (систем) и двум свойствам одного вещества (системы).
ЛИТЕРАТУРА
1. М.
Х.
Карапетьянц.
Ж.
2. М. Х. Карапетьянц.
физ.
химии,
29,
1132
(1955).
Ж. физ. химии, 29, 1328 (1955).
3. М. Х. Карапетьянц.
Ж. физ. химии, 30, 1104 (1956).
4. А. И. Бачинский.
Временник об-ва содействия успехам
их
практических
применений
им.
Х.
С.
Леденцова,
№
3, 23—92
опытных
наук
(1913).
и
5. A. Batschinsky. Phys. Z., 13, 1157 (1912).
6. A. J. Batschinsky.
Z. phys. Chem., 84, 643 (1913).
7. А. И. Бачинский.
В сб.: Современные проблемы физико-химии и химической технологии.
стр. 113.
Сборник
1.
М.,
ВХО
им.
Д.
И. Менделеева,
моск.
отд.,
1938,
8. A.K.Mukherjee.
J. Indian Chem. Soc., 28, 363 (1951).
9. Е.А. Укше, Ю.М. Рябухин. Изв. АН СССР, металлургия и горное дело,
№ 5, 84 (1963).
10.D.Silverman,
W.E. Roseveare.
J. Am. Chem. Soc., 54, 4460 (1932),
10а.
11.
12.
13.
14.
М.
В.Е.
С.
A.
Б.
Х.
Карапетьянц..
Научн.
докл.
высш.
школы,
№
1, 12
(1958).
Микрюков,
С. М. Работнов.
УЧ. зап. МГУ, вып. 74, 167 (1944).
Н. Журков,
Т. П. Санфирова.
Ж. техн. физики, 28, 1719 (1958).
B. Pippard.
Phil. Mag., 1, 473 (1956).
И. Генгринович.
Докл. AH CCCP, 134, 400 (1960).
15.
Sharma.
J.
Indian
Chem.
Soc.,
2, 310
(1925).
18.
J.
N.
20.
А.
П. Але
24.
J. Thomsen.
Systematische Durchfiirung thermochemischer Untersuchungen.
Stuttgart, 1906.
А. П. Руцков.
Изв. сектора физ.-хим. анализа АН CCCP, 17. 286 (1949).
В.А. Василев. Автореф. канд. дисс. М., МХТИ им. Д.И. "Менделеева, 1963.
16. A. K.Mukherjee.
J. Indian Chem. Soc., 30, 670 (1953).
17.S.S.Mitra,
D.N.Chakravarty. Z. phys. Chem., 205, 1 (1955).
19.S.S.
Fri
Mitr
eng.
Nature,
150,
432
(1942).
Indian J. Phys., 30, 423 (1956).
к сандров.
Ж.
техн.
физики,
3, 823 (1933).
21. А. М. Лазарев.
ЖЖ. техн. физики, 2, 329 (1932).
22.J.C. McGowan.
Вес. trav. chim., 76, 155 (1957).
23. Г. Л. Старобинец.
Уч. зап. Белорусск. гос. ун-та, №
25.
26.
2ба. М. С. Стаханова,
27. М.
28.
29.
С. Стаханова,
32.
33.
М.
Х.
Ж. физ. химии,
Карапетьянц,
Ю. А. Епихин. Ж. физ. химии, 38, 2420 (1964).
В. ВЕ. Семенченко. „Усп. химии, 5, 641 (1936).
Н.
К.
Прудников.
73 (1962).
30. В. К. Першке.
.31.
В. А. Василев.
Труды
Ивановского
37, 1568 (1963).
В. А.
энергетического
Василев,
ин-та,
10,
Ж. русск. физ.-хим. об-ва, ч. химич., 64, 119 (1929).
В. Е. Мокрюков,
Н.А. Тяпунина,
МГУ, серия мат., мех., астрон., физ., хим., №
Johnston.
14, 82 (1953).
J. Am.
В. С. Е встропьев.
Chem. Soc., 31,
Ж.
физ.
химии,
В. П. Черпаков.
1, 127 (1956).
1010 (1909).
2, 331
(1932).
№
Вестник
2,
К. С. Евстропьев.
Ж. физ. химии, 6, 454 (1935).
П. П. Кобеко, Е. В. Кувшинский,
И. П. Вачеев.
Ф.А.
Гор
децкая,
С. С. Житников.
Ж. физ. химии, 9, 376 (1937).
П. П. Кобеко,
Е. В. Кувшинский,
Н. И. Шишокин.
химии, 9, 387 (1937).
И. Н. Максимов. Ж. физ. химии, 38, 277 (1964).
Babcock.
J. Am. Ceram. Soc., 17, 239 (1934).
N.M.
Taylor,
E.
P. McNomara,
J.Sherman.
nol., 21, 61 (1937).
N.M. Taylor,
J. Am. Ceram. Soc., 22, 1 (1939).
E. Preston,
E.Seddon.
J. Soc. Glass Technol.,
С. А. Вознесенский,
Р. С. Биктимиров.
Ж.
oфиз.
J. Soc. Glass Tech-
|
21, 123 (1954).
Ж. неорг. химии,
4,
623 (1959).
S. Young. 7. de Phys., 8, 5 (1909).
5. Young
Вуз. ‚СВеш., 70, 620 (1910).
Bogdan. Beat Acad. Romania, 2, 30 (1923).
D.B.Macleod.
Trans. Faraday Soc., 19, 6 (1923—1924).
W. Herz. Z. anorg. allg. Chem., 155, 348 (1926).
Winter.
J.
Phys.
Р. 3. Магарил.
А.А.5 сВаегег,
L. M. J. Sto ет
L. M. J. Stoel
L.M.J.Stoel.
Chem.,
32,
576
(1928); uur.
Ж. физ. химии,
С.(.Вау
16, М. М. Матее.
E. Lucatu.
Compt.
S.S.
D. N. Chakravarty.
G. W. Nederbragt,
5.5. М1 tra. J. Chem.
Mitr
F. Othmer,
Вес. trav. chim., 75, 529 (1956).
J. W.M. Boelhouwer.
Phys., 13, 305
Phys., 22, 250 (1954); erratum., 22, 1471 (1954).
M.S.
Laar.
26, 550 (1934).
rend., 207, 1403 (1938).
S.Josefowitz.
р. Е. О thmer,
J.J.van
[142].
Pays: Rev., 1, 513 (1892).
hys. Chem.., 11, 126 (1893).
г P ys. Chem., Ч, 700 (1897).
Porter.
Phil. Mag., 23, 458 (1912).
Prasad. Current Sci., 1, 237 (1933).
Rente,
Senggert.
Ind. Eng. Chem.,
D.
mo
29, 1301 (1955).
Thaker.
J. Chem.
Ind.
Eng.
Phys., 22, 1775 (1954).
Chem.,
Ind. Eng. Chem., 45,
Die Zustandsgleichung
von Gasen und
1924.
W. Herz. Z. anorg. allg. Chem., 159, 304 (1927).
S.W. Benson.
J. Chem. Phys., 15, 367 (1947).
R.D. Kleeman.
Phil. Mag., 21, 83 (1944).
W.M.
Jones,
S. W.
Benson.
S. T. Bowden.
J. Chem.
Phys.,
Phil.
Mag.,
(1942).
38,
114
(1946).
589 (1953).
Fliissigkeiten.
Leipzig,
|
37, 480 (1946).
15, 866 (1947).
W. Herz.
Z. anorg. allg. Chem., 175, 277 (1928).
W. Herz.
Z. anorg. allg. Chem., 203, 271 (1932).
D.B. Macleod.
Trans. Faraday Soc., 19, 38 (1923).
F. J. Wright.
J. Appl. Chem., 11, 193 (1961).
Hsu Shaoling.
J. Chinese Chem. Soc., 16, 75 (1949).
Liu Jo-chuang.
J. Chinese Chem. Soc., 16, 78 (1949).
А. К. Абасзаде.
К. Ц. Реп
D.
D.
D.
1 сб.
F. Othmer.
F.Othmer,
F.Othmer.
D. F.Othmer,
.D. F.Othmer,
.D.F.Othmer,
.A.Speranski.
А.В.
Ж.
эксперимент.
J. Soc. Chem.
J.W. Conwell.
Ind. Eng. Chem., 37, 1112 (1945).
A. H. Luley.
Ind. Eng. Chem., 38, 408 (1946).
E.H. Ten Eyck.
Ind. Eng. Chem., 41, 2897 (1949).
Z. phys. Chem., "70, 519 (1910).
Новоселова,
Е
нко.
Л.
ЦП. Решетникова.
М.
С.
физ. химии
171 (1956).
Стаханова,,
(в печати).
М.Х.
Вестник МГУ,
серия
Карапетьянц,
К.
К.
мат.,
Вла-
т
H6 mig. Mitt. Verein. Grosskessekbezitzer, N 52, 9 (1958).
r,Nettol.
Phil. Mag., 22, N 80 (1911); 23, N 85 (1912.
С. боЪ|е, А. А. Маадоск.
J. Inorg. Nucl. Chem.., 7, 94 (1958).
93
E.
Ж.
23, 60 (1952).
Chem. Metal. Eng., 47, 554
1940).
R. E. White.
Ind. Eng. Chem., 34, 952 (1942).
Ind. Eng. Chem., Ind. Ed., 36, 669 (1944).
мех., астроном., физ., хим., №2,
В. Базлова,
теор. ‘физики,
Ind., 65, 61 (1946).
M. Barrer,
L. V.C.
Rees.
Trans.
Faraday Soc., 55,
992
(1959).
.А. Трегер, Р.М. Флид., С. С. Спектор. Ж. физ. химии, 38, 478(1962).
Г. Л. Старобинец,
В. С. Солдатов.
Ж. физ. химии, 37, 294 (1963).
о. М. ог уазфата,
В. А. Киреев.
Ж.
В. А.
В. А.
1947,
.В.А.
Киреев.
Киреев.
стр. 197.
Киреев.
У. Е. Уагз
В п1. J. Indian Chem. Soc., 32, 479 (1955).
физ.химии, 14, 1456 (1940).
Ж. физ. химии, 14, 1469 (1940).
Сборник работ по физической химии.
Ж.
физ. химии,
М., Изд-во
АН
СССР,
28, 568 (1954).
18%
97.
98.
99.
100.
101.
В. А. Маринин.
Ж. физ. химии, 30, 129 (1956).
Е. В. Кувшинский,
П.П. Кобеко.
`Ж. техн. физики, 8, 608 (1938).
П. П. Кобеко,
Н.И. Шишокин.
Ж. техн. физики, 14, 10 (1944).
П. П. Кобеко.
Аморфные вещества. М.—Л., Изд-во АН СССР,
1952, гл.
XIII.
ВК. С. Евстропьев.
Труды
ЛТИ
им.
Ленсовета,
45,
54 (1958).
102. С. Карпачев,
А. Стромберг.
Ж. физ. химии,
103. Л. В. Писаржевский,
Н. Лемке.
Ж. русск.
химич.,
37,
492
11, 852 (1938).
физ.-хим. об-ва, ч.
(1905).
104. P. Walden.
Z. phys. Chem., 55, 207, 249 (1906).
105. А. С. Коновалов,
К. С. Е встропьев.
Ж. физ. химии, 15, 109 (1941).
106.
107.
М. М. Скорняков.
окись’ натрия — окись
щикова. М.—Л., Изд-во
M. Avenarius.
Bull.
109.
L.
108. H. A. Fales,
В с6б.: Физико-химические свойства тройной системы:
свинца — кремнезем. Под ред. акад.
И. В. ГребенАН СССР, 1949, стр. 39.
Acad. St. Petersb.., 22, 378 (1876).
C.S.Shapiro.
Riedel.
Chem.
Ing.
Techn.,
J. Am. Chem.
26,
83
Soc., 60, 794 (1938).
(1954).
110. M. Tiesen. Verhand. d. D. phys. Gesellschaft,
111. Tyrer.
J. Phys. Chem., 27, 734 (1913).
16, 80 (1897).
112.J.D. Van
der Waa Is. Continuitit. 2 ed., 1, 158, 1899.
113. W. Meissner.
Ind. Eng. Chem., Ind. Ed., 33, 1440 (1941).
114. Г. ОР. Уап
der
Waals. Z. hy s. Chem., "43, 657 (1894).
1145.
L6vgren.
Svensk.
116. F.de
Block.
117. F.de
Block.
118. A. Ferguson.
119. A. Ferguson.
120. A. Ferguson,
121. 5.5. Муфга,
122.
W.
124.
J.
M.
Kem.
129.
129a.
E.
Jones, "5.
(1925).
(1925).
T.
Bowden.
Comm.
Verschaffelt.
Archiv.
Phil.
Mag.,
of Leiden,
36,
705
(1945).
N 28 (1896).
Neérlandaises
(2),
9,
125
(1904).
Sugden.
J. Chem. Soc., 1927, 1780.
К. Першке.
Ж. русск. физ.-хим. об-ва, 60, 1019, . 1928.
E. Verschaffelt, F.de Block.
Z. anorg. allg. Chem.,
Titani.
Bull. Chem. Soc. Japan, 2, 196 (1927).
А. И.
Бачинский.
J. Kendall.
цит.
354 (1944).
S. J. Kennedy.
J. Faraday Soc., 32, 1474 (1936).
N.Chakravarty.
Naturwiss., ‘43, 273 (1956).
123. J. E. Verschaffelt.
125.8.
126. В.
127. J.
128. T.
Tid... 53,
Bull. Acad. Roy. Belg., 11, 292
Bull. Acad. Roy. Belg., 11, 353
Sci. Progr., 1915, 445.
Phil. Mag., 31, 37 (1916).
по
[130].
Meddel
Изв.
Физ.
fran.
ин-та и Ин-та
K. Vet.
Akads.
биол.
физики,
159, 265.
2, 60 (1922).
Nobelinstitut, 2, N 29 (1912);
130. J. Kendall.
J. Am. Chem. Soc., 36, 1620 (1914).
131.M.de Hemptinne.
Bull. Acad. Roy. Belg., 12, 296 (1926).
132. M. Prud’homme.
J. chim. phys., 24, 461 (1924).
133. K. my” sselmann,
F. Dardin. Wiss. Veroff. Siemens— Konzern, 10, 129
(1921).
134. I.C.de Wijs. Rec. trav. chim., 62, 449 (1943).
135. J. €.de Wijs. J. Phys. a. coll. chem.,
54, 599 (1950).
136. Z. Seha.
Chem. listy, 55,
1431 (1958).
137. W. Perschke.
7. Elektrochem., 35, 13 (1929).
138. D. A.Goldhammer.
Z. phys. ’СВеш., 71, 577 (1946).
139.
Telang.
J. Phys.
Chem.,
50, 373 (1946).
140. M. Thiesen. Phys. Z., 12, 321 (1911).
141.3. D. Vander Waals. Z. phys. Chem., 13, 716 (1894).
142. J. Pp. Partington.
An advanced treatise on Physical Chemistry. Vol. I, II.
London, 1949, 1951.
143. A. W. "Plummer. Chem. Eng. Progr., 48. Symposium, N 3, 124 (1952).
ГЛАВА
У!
СРАВНЕНИЕ
ЗНАЧЕНИЙ ОДНОГО СВОЙСТВА ВЕЩЕСТВА
ПРИ ДВУХ ЗНАЧЕНИЯХ ПАРАМЕТРА
В ЗАВИСИМОСТИ ОТ ЗНАЧЕНИЙ
ДРУГОГО ПАРАМЕТРА УСЛОВИЙ
вещества
В тех случаях, когда значение данного свойства изучаемого
зависит от двух параметров условий ЛП и И’, т. е. существует
функциональная
возможно
УСЛОВИЙ
зависимость
применение
еще
(VI)
/(G, П, Il’) =0,.
одного
метода
сравнительного
тельно, из (УГ, 1) следует, что при двух значениях
Пи
ПП.)
Л
расчета.
Действи-
(соответственно при
Guo, = f (Ll)
И
(V1.2)
ап, = (ГГ).
Если допустить, что уравнения
рическими и имеют вид
7
то, исключив
|
(УТ, 2) и (УГ, 3) являются
Сп,
=
a,
+
Же
(П’)
Сп,
=
Ao aL
рф
(Г,
из уравнений
(УТ,3)
двухпарамет(УТ, 4)
|
(УТ, 5}
(УТ, 4) и (УГ, 5) ф (П’), получим
соотношение
Gro,= AgGu,+ Be.
(VI, 6)
В нем при одинаковых (но переменных от точки к точке) значениях параметра условий П”’ сопоставляются значения С при двух значениях другого
параметра условий ПИ.
Это соотношение является аналитическим выражением шестого метода
сравнительного расчета [4—3].
В качестве примера приведем приближенное уравнение
У! —150 —
1,06 У,
10
—
0,97,
(V1,7)
в котором сравниваются значения мольных объемов азота (С = У) при
двух значениях температур (П = #) в зависимости от давления (П = Р).
Среднее отклонение от опытных данных составляет 0,03 с.м3, что свидетель-
ствует о достаточной надежности уравнения (УГ, 7). Для сравнения укажем, что применение уравнения Тэта приводит к величине средней по-
грешности 0,04 см? (см. [4].
Ниже перечислен еще ряд примеров существования
ражаемых
соотношением
(УТ,
1)
последовательно
зависимостей, вы-
для
свойств
чистых
189
веществ, растворов, характеристик фазовых превращений и химических
процессов [5].
‘Чистые
вещества.
'Теплоемкость сжатого водяного пара
при давлении 80 и 90 кг/см? в зависимости от температуры в интервале от.
360 до 600° С (по данным [6]); показатель преломления н-бутилбензола
при О и —20° С в зависимости от длины волны в интервале /^, = 450—
650 ти [7]; коэффициент теплопроводности водяного пара при давлении
60 и 100 кг/см? в зависимости
n
60°C
0,340-
от
температуры
—
[6]; летучесть.
600 атм
[8];
oTHocuTenbHaA
BAB-
кость воды при 0 и 10,3° С
в зависимости от давления [9].
Растворы.
_ Удельная.
электропроводность
расплавов
0335+
B330-
(400—600° С)
воды при 25 и 50° С в зависимости
от Давления при 1, 200, 400 и
КМО,
— ВЬМО.,
бр мик
|
0930
0,335
_|
0.340
n
0°
0,345
”
Рис. 143. Взаимосвязь между показателями преломления п н-бутилбензола
при 0
и —60°С
в зависимости от длины волны
(ммк) [7]
содержащих
40
и 60% КМО., в зависимости от
температуры
(по данным
[10]);
коэффициент
активности
Н( в
водном растворе (25° С) при давЛении 1 и 1000 атм в зависимоСТИ от концентрации [11]; объем
смеси
СО-2Н, + СН.ОН
пря
давлении 150 и 170
атм
в зависимости
от содержания
CH,OH
[12]; относительная
парциальная
молярная энтальпия водного рас-
твора
НС]
при
т = 0,05 и
0, 1 в
зависимости от температуры [11|; оптическая плотность сернокислых
растворов аминобензола
при длинах волн 318 и 497 ммк в зависимости
от концентрации раствора [13].
Фазовые
равновесия.
Давление насыщенного пара над
10 и 85%-ными водными растворами КОН в зависимости от температуры
(по данным [14]); растворимость СО, в Н.О при 10 и 30° С в зависимости
от давления [15]; растворимость КС в водяном паре при 400 и 500° С
в зависимости от давления [16].
Химические
превращения.
Константа
скорости
инвер-
сии тростникового сахара в растворе Н,50. (№ = 0,4) при 30 и 40° С
[8]; тепловой эффект синтеза аммиака при 300 и 400° С в зависимости от
давления [17]; относительная константа ионного равновесия {1 воды при
200 и 400 бар в зависимости от температуры [18].
На одном из примеров шестой метод сравнительного расчета иллюст-.
рируется рис. 143.
Так как соотношение (УТ, 1) относится только к тем свойствам, значения которых зависят от двух параметров, то для большинства свойств
жидких и твердых веществ его применение нецелесообразно; исключение
составляет область очень высоких давлений, при которых свойства конденсированной фазы зависят и от температуры, и от давления. То же относится и к однокомпонентным двухфазным системам, так как в них число.
степеней свободы в обычных условиях равно единице. Лишь в тех редких
случаях, когда система находится под действием внешнего поля, можно
говорить о применении шестого метода сравнительного расчета. Наоборот,
1 Относительная
константа ионного
равновесия4 определяется соотношением
(Км ) p/(K м }р—1» Числитель которого равен этой величине при высоком давлении, а зна-
менатель— при
190
атмосферном
давлении.
для газов, для которых многие свойства весьма чувствительны к давлению,
возможно широкое применение метода, в частности для оценки значений
сжимаемости, теплоемкости, энтальпии, дроссель-эффекта, вязкости, теплопроводности и некоторых других свойств. Исключениями являются все
свойства газов в стандартном состоянии; которые, по определению, зависят
только от температуры.
Шестой метод сравнительного расчета в соответствии с характером соотношения (УТ, 1) отличается от всех ранее описанных большим числом вариантов.
Если
первый,
второй,
третий
и пятый
методы
не имеют вариан-
тов применения, а четвертый применим только в двух вариантах, то применение шестого метода возможно в шести вариантах. Действительно, из
соотношения
TT, a II,)
(УТ, 1) следует, что при данном
Gy=f (I)
значении Л” (соответственно
:
(VI,8)
И
(VI,9)
= /(П).
Если допустить, что
рическими, т. е.
уравнения
И
(УТ, 8) и (УГ, 9) являются двухпарамет-
Gy
(VI, 10)
Сп, = a2 + beg (ID),
(VI,411)
то, исключив из уравнений (УТ, 10) и (УГ, 11) ф (П), т. е. произведя
ставления при одинаковых значениях //, получим соотношение
сопо-
являющееся вторым вариантом шестого метода сравнительного расчета.
В нем при одинаковых, но переменных от точки к точке значениях параметра условий П сопоставляются значения С при двух значениях другого параметра условий Л.
Соотношение (УТ, 12) на том же примере, что и (УТ, 6) [см. уравнение
(УТ,7)], иллюстрируется уравнением
УР—вооо
—
1,007
р—лооо
—
1,0,
в котором сравниваются значения мольных объемов сжатого азота (@=7Т)
при двух давлениях (П = Р) в зависимости от температуры (П’ =}.
Это уравнение воспроизводит
опытные данные в интервале от 50 до 150° С
со средней погрешностью 0,02 смз.
Другому примеру применения соотношений (УТ, 6) и (УТ, 12) соответствует зависимость
(т,
р,
с) =
=0
для водных растворов уксусной кислоты: значения вязкости
можно
сравнивать при 25 и 35° в зависимости от концентрации кислоты (с =
— 10 —- 70%) и при с = 20 и 40% в зависимости от температуры (Ё =
— 20
При
70° С) (по данным
условии
справедливы
[8].
двухпараметричности
еще четыре
соотношения:
уравнений
будут
Пс, = Аз‹Пв, + Be,
IL = Acll7 + Be,
(VI,13)
(VI,14)
Пс, = Аз Ив, + Вь
(VI,15)
Пп, = АвПп, + Ве.
(УГ,16)
2
И
соответствующих
1
191
В первом из этих соотношений сопоставляются значения параметра условий /[[ при двух
значениях
значениях
при
го параметра
условий /Т’;
Ш’
свойства С в зависимости
во втором
условии,
что
в
от
значений
друго-
одинаковы
значе-
сравниваются значения [ при двух
каждой
точке
ния (С. Соотношение (УТ, 15) аналогично (УТ, 13), а (УГ, 16) аналогично (УТ, 14). |
Все
шесть
вариантов сопоставления на
примере
зависимости
(Cp, P,T) = 0 иллюстрируются рис. 144.
(С P)iyp nesow?
gs
14;
9
1,2
р.
0
CG
200.’
07.
0
EO
|
(Ср)
унес:
200
100
100
и,
ПОВ
Пи
Creu nerem?
500
К, = 0,6
п
t;
900+
00
«я
300
300
300400
500
80
200
30
254 wesc
Рис.
144. Взаимосвязи
400
to
между:
удельной
изобарной
500
600
=0,8
теплоемкостью
сжатого водяного пара при давлении 150 и 140 кг/см? в зависимости
от температуры (а), теплоемкостью при температурах 400 и 380° С
в зависимости от давления (6), давлением при теплоемкостях 0,8 и
0,7кал/град-г в зависимости от температуры (5), давлением при температурах 400 и 360° С в зависимости от теплоемкости (г), температурами при давлении 150 и 120 кг/см? в зависимости от теплоемкости (д), температурами
при
теплоемкостях 0,8 и 0,9 кал/град-е
в зависимости от давления (г) [6]
Необходимо
временно
отметить,
соотношений
и (УТ, 16) будет только
что
удовлетворительное
соблюдение
одно-
(УТ, 6), (УТ, 12), (УТ, 13), (УТ, 14), (ТУ, 15)
тогда, когда интервал
значений
величин,
стоящих
в индексе этих соотношений, невелик (см., например, рис. 144). В против-
ном случае линии искривляются, и необходим переход к функциональным
шкалам. Это связано с тем, что одновременная двухпараметричность многих зависимостей в общем случае не может соблюдаться. Поэтому, например, если для одной из трех величин, входящих в зависимость (УТ, 1),
справедливы линейные соотношения в широком интервале условий, то
для остальных двух величин это не имеет места. Так, если уравнение
tp, = Agtp, + Be,
192
(VI,17)
в котором сравнивается температура газа при двух давлениях в зависимости от его теплоемкости, и уравнение
Cp, = АвСь, + Вь
в
котором
мости
от
сравнивается
его
теплоемкость
темаературы,
приводят
газа
к
(91,18)
при
двух
давлениях
удовлетворительным
в
зависи-
результатам
"00 мг /см?
tn.
500+
506
“UN0+
400
a
900
t
900-—
400
при давлении
б — при Ср
GOO
;
500
150ка/смё
Co.
Рис. 145. Взаимосвязь между
а —
he
температурами
600
08
‘водяного
150
и 300 атм
и различных
теплоемкостях
= 0,8 и 1,5 хал/град.г и различных давлениях
t
пара
Ср (кал/ерад.г);
Р (атм) [6]
Na,0-3Si0,.
1400
Inq ,9-3510,
100000 r
a
1300
10000
1200
1100
1000r
1000
1 00Tu00
10
900
1
100
4
1000
1 800
19000
po
900
на,6-2540,
7000
1100
1200
Ь
1300
Cya,0-25t0,
рис. 146. Взаимосвязи между вязкостью 1 (пз) стекол состава М№а›О .2510
и Ма›О-3$10з при различных температурах (а) и между температурами
+ °С стекол МазО
.2$10» и Ма20 .35102
при различных вязкостях
[20].
даже при значительной разнице соответственно в Р или Ср (см. рис. 145),
то этого нельзя сказать об остальных четырех уравнениях.
Остановимся еще на одном примере применения шестого метода сравнительного расчета к многокомпонентным системам — на вязкости расплавленных силикатных стекол [20]. В данном случае можно воспользоваться
зависимостью
тс, — Ата, + Вв;
| (УГ, 19)
здесь в функциональных шкалах сопоставлена вязкость стекла при двух
значениях концентрации в зависимости от температуры. Это уравнение
13
м.
Хх. Карапетьянц
1938
должно привести к удовлетворительным результатам для стекол, близких
по составу и структуре. Так как (УТ, 19). в неявной форме выражает температурную зависимость вязкости, то характер функциональной шкалы
обусловлен характером зависимости
— #. Если, например, считать, что
(УТ, 119) имеет вид приближенного линейного уравнения
(VI,20)
e
lg mc, = Ав 18 Те, + Be,
то получим неравномерную шкалу температур. На одном примере
казано
на рис.
146,
а. Если
же положить
в основу
равномерную
это пошкалу
температур, то соотношение (УТ, 19) будет удовлетворяться при неравномерной шкале вязкости (см. рис. 146, 6). В рассматриваемом случае удобно
пользоваться
уравнениём
te, = Aste, + Bes
(VI,21)
являющимся инверсией уравнения (УТ, 20). В уравнении (УТ, 214) сравни-
ваются значения температур двух жидкостей при равных значениях их
вязкости. Наблюдающееся в области больших значений 1 сгущение шкалы
вязкости на рис. 146, а и соответствующее ему разрежение шкалы темпе-
ратур на рис. 146, б отвечают резкому повышению
температурах.
вязкости при низких
о oN oN
DERE SS
ЛИТЕРАТУРА
Х.
Х.
Х.
Карацетьянц.
Карапетьянц.
Ж.
Ж.
Карапетьянц.
Ж.
физ.
физ.
химии,
химии,
физ. химии,
29, 1132 (1955).
29, 1328 (1955).
30, 1104 (1956).
С. Циклис.
Докл. АН СССР, 79, 289 (1954).
Х. Каранпетья нц. Докт. дисс. М., МХТИ им. Д. И. Менделеева, 1957.
Вукалович.
Термодинамические свойства воды и водяного пара. `М.,
Машгиз, 1950.
Г. Д. Гальперн,
Л. А. Коновалова, М. М. К усаков. Труды Ин-та
нефти
АН
. Техническая
СССР,
Т, 223
энциклопедия.
ских величин.
9. П. Бриджмен.
10.
П.. И.
12.
Д.
11.
Проценко,
49 Харнед,
52.
(1955).
Справочник
Физика
Н.
Б. О уэн.
П.
Б. Казарновская.
физических,
высоких давлений.
Поповская.
химических
М.—Л.,
Ж.
общ.
ОНТИ,
химии,
и технологиче-
1935.
24, 2119
Физическая химия растворов электролитов.
Канд.
дисс.
М., МГУ,
(1954).
М., ИЛ,
1956.
13. Ю. Л. Каминский,
И. Я. Бернштейн,
о. Ф. Гинзбург.
Докл.
AH CCCP, 145, 330 (1964).
14. В. И. Коробков,
И. С. Галинкер.
Ж. прикл. химии, 29, 1479 (1956).
15.
Справочник
17.
Я.
химика.
16. а. С. Кеппеаду.
С.
М.—Л.,
Казарновский,
1092 (1941).
18. D. M. Newitt,
Госхимиздат,
1951—1952.
Есоп. Geol., 39, 25 (1944); 45, 629 (1950).
M.
X.
R. P. Linstead,
Карапетьянц.
R. H. Sapiro,
Ж.
физ. химии,
25,
E. J. Boorman.J,
Chem. Soc., 1937, 876.
19. Таблицы термодинамических свойств воды и водяного пара. М.—Л., ‚Госэнергоиздат, 1952.
20. М. Х. Карапетьянц.
Стекло и керамика, № 1, 22 (1958).
ГЛАВА
УП
ОБ ОБОСНОВАНИИ МЕТОДОВ СРАВНИТЕЛЬНОГО РАСЧЕТА
В предыдущих главах были изложены шесть методов сравнитель-
ного расчета.
Этим методам
соответствуют
соотношения
Си = А, Ст + В,,
G" = A,G' + By,
Сп, = Азби,+ В»,
Gy = AgGu + Bi,
G" = A;G’ + Bs,
бп,= Авбп, + Ве.
В соотношениях (УП,
1) u (VII,
—
(УПИ)
_ (УП,2)
.(УП,3)
(УН,4)
(УП,5)
(VII,6)
условиях
сравни-
|
2) при одинаковых
ваются соответственно значения одного свойства С в двух рядах Ги П
сходных веществ и двух свойств С’ и С” в одном ряду сходных веществ.
В соотношении (УП, 3) сопоставляются значения одного свойства‘ ряда
сходных веществ при двух значениях ЛП, и П› переменного параметра П.
В соотношениях (УП, 4) и (УП, 5) сравниваются соответственно значения
одного
свойства
двух
веществ
М и М и два свойства
одного вещества при
одинаковых (но меняющихся от точки к точке) значениях переменного параметра 1. В соотношении (УП, 6) сопоставляется значение данного свойства одного вещества при двух значениях переменного параметра /Л в зависимости
от значения
другого
параметра
И’.
При
этом предполагается,
что в общем случае сопоставление значений С должно
функциональных шкалах, в частности } (()
= С.
Было
показано
также,
что
соотношения
(УП,
1 —
осуществляться
УП,
6)
в
позволяют
с той или иной степенью точности обобщить большой материал по многим
свойствам разнообразных веществ и характеристикам различных процессов. Они отличаются простотой и удобством применения, требуют сравни-'
тельно немногих исходных данных и позволяют осуществить как интерполяцию, так и экстраполяцию.
Настоящая глава посвящена вопросу обоснования методов
сравни-.
тельного расчета, т. е. выявлению необходимых и достаточных условий
их применения (отдельные примеры см. также стр. 164 сл.).
Пусть для рассматриваемой системы
а =\ (5,
21, 5%,...П,
П’,П",...),
(УП, 7)
13°
195
|
где р, #1, 2.... — параметры вещества и ЛП, П’, П”,...— параметры услоВИЙ.
При фиксированных условиях (постоянные температура, давление,
и т. д.) эта зависимость примет вид
а
= ‘р
(2,
51,
52...
.).
(VII,8)
Если совокупность рассматриваемых объектов является рядом сходных
веществ или таких, в структуре которых наблюдается определенная закономерность, то зависимость (УП, 8) превращается в
G = p, (g).
(Ц,
К таким рядам относятся, в частности, гомологи одинакового строения, на-
пример
H-C,H,,,
н-СНв,
н-С,Наь;
соединения,
отличающиеся
только
атомами — электронными аналогами, в частности КС], КВт, КУ; кристаллогидраты, отличающиеся лишь по числу молекул воды, например
CaCl,-2H,O, CaCl,-4H,O, Са. -6Н.О и т. д. В подобных случаях рассматриваемое свойство С будет однозначной функцией только одного параметра
вещества. В качестве последнего в приведенных примерах можно было бы
принять, в частности, число СН.»-групп в молекуле н-алкана, порядковый
номер галогена, количество молей кристаллизационной воды и т. д.
Допустим, что наряду с данной группой родственных веществ рассмат-
ривается другая, подобная ей. Например, не только н-алканы, но и 2метилалканы; не только галогениды калия, но и галогениды рубидия; не
только гидраты СаС]., но и гидраты Эг(. и т. д. или в общем случае не
только [ ряд, но и ПЦ. Тогда, построив графики @1=](:) и би=} (2), мы убе-
дились бы в том, что они выражаются сходными кривыми. Пусть это сходство
проявляется в том, что при одинаковых значениях = соблюдается
Fe = Aan
Тогда
после
интегрирования
получим
Ст
являющееся
аналитическим
сравнительного
нем
расчета,
—
(VII,10)
уравнение
A,G,
+
выражением
B,,
(УП,11)
частного
т. е. соотношения
(УП,
случая
14) при
f (G) = G.
Рассмотрим теперь случаи, когда условие (УП, 10)
т. е. производные не пропорциональны друг другу:
96
условие
961
ag FAL
первого
условии,
не
метода
что в
соблюдается,
(VII,12)
Допустим, однако, что существует интегрирующий множитель, при умножении на который неравенство (УП, 12) обращается в равенство, т. е
at ф (Си) = А, =
Тогда,
после
введя
обозначение
интегрирования
ф (Ст.
\®(@) 46 = 7 (6) + С,
(VII,13)
(VII,14)
получим
/ (Сп) = А
(Gi) + By.
(VII, 15)
Это равенство тождественно (УП, 1), когда сопоставление значений свойств
следует осуществлять в функциональных шкалах. Таким образом, усло196
вием применения первого метода сравнительного расчета в общем случае
будет равенство (УП, 13) и, в частности, (УП, 10).
Наконец, обратимся к еще более сложному случаю, когда совокупность
рассматриваемых веществ каждой группы такова, что приходится учитывать несколько (минимум два) параметров вещества, т. е. обращаться к
Уравнению (УП, 8). Тогда условием соблюдения соотношения (УП, 1)
будет справедливость системы уравнений
(ou)
„„..Ф(@и) = 41 (or)
an. PD)
of
(on) 9 (Gu)= A, (2!
их
число
равно
числу
переменных
параметров
|
(VII,16)
вещества
5.
Действи-
тельно, если, исходя из (УП, 15), найти частные производные от G
по &, 21, &., ..., то непосредственно получим (УП, 16). Если же каждый
член (УП, 16) умножить на соответствующие 42, а затем произвести сумми-
рование по вертикали,
то это приведет
о.
к уравнению
0G
"AG
g (Gi) dy (sy) 48; = Arp (G1)>) ([5=—) 48+.
Но
из зависимости
(УП,
8) следует,
(УП,17)
что
n
dG => (=. dg,
i=0
поэтому
Интегрируя
(VII,18)
йе
|
ф (С) аби = А.Ф (61) аб.
уравнение
(УП,
19), получаем
соотношение
(VII,19)
(УП,
1).
Все эти рассуждения можно распространить с двух на большее
рядов.
Таким
образом,
в
самом
общем
случае
необходимым
число
и достаточным
условием применения первого метода сравнительного расчета является существование такого интегрирующего множителя ф, который удовлетвоpan On следующему требованию: первые частные производные от С@ по
различным параметрам вещества 2; (взятые при одинаковых значениях д),
умноженные на ф, должны быть для сопоставляемых веществ пропорциональными друг другу. Это условие можно считать критерием подобия этих
рядов. Если равенства (УП, 16), и в частности (УП, 13) и (УП, 10), являются приближенными, то приближенным окажется и соотношение
(УП, 1).
Аналогичные рассуждения можно привести и по отношению к остальным пяти методам сравнительного расчета. Так, в частности, для четвертого метода вместо уравнений (УП, 8), (УП, 9), (УП, 10), (УП, 11), (УТ, 13)
и (УП, 16) получим соответственно
с =Ф(П, П’, И',...),
(УП,20)
G= ~ vs (11),
(VII,21)
м
(Пк
эп АМ
= Aa oi
dGx
(Им =
= Им),
Gy = A,Gu + Ba,
0Gy
VI
(УН,22)
(VII,23)
197
(ле...
(26x
sn
= А),
ие. 9 @ы), |
Gx
a,...° (Gu) = Ag (4),
m,...? (Gm),
)
причем во всех этих уравнениях значения соответствующих
берутся при одинаковых значениях Л..
Следовательно,
условием
соблюдения
соотношений
(VIL, 25)
производных
(УП,1
—
УП,6)
является наличие [при данных условиях для различных веществ (систем)
или при различных условиях для данного вещества (системы)] интегри-
рующей
функции,
д
0G
яв,
умножение
которой
.
на
соответствующие
|
производные
(или эй.) приводит к пропорциональной зависимосги между ними.
Зависимости, рассмотренные в настоящей главе, могут оказаться полезными как для обоснования различных частных уравнений методов срав‘нительного расчета ‚так и для вывода новых соотношений, причем возможны
случаи, когда из одного линейного соотношения непосредственно сле.
дует ряд других.
2
Проиллюстрируем изложенное выше, ограничившись некоторыми примерами четвертого метода сравнительного расчета, которым соответствуют описанные в литературе уравнения.
Начнем
с однокомпонентной двухфазной
системы;
для нее будет
спра-
ведливо уравнение (УП, 24). Выберем
в качестве свойства температуру кипения Т, а в качестве параметра условий — давление сухого насыщенного пара Р. Тогда в соответствии с зависимостью (УП, 24) будем иметь
aT y
Введем
в.соответствии
aT y
|
с уравнением,
аналогичным
(УПЦ, 14), обозначение
\ч (T)dT =f(T) +c.
(VII,27)
‚Если теперь принять последовательно
|
|
то найдем
соответственно
}(T)=T
(VIT,29)
(ТГ) = ШТ,
(УП,30)
ф(Т) = соп$%,
|
(УП,31)
—
p(T) =T?
И
|
(VII,28)
А(Т) =Т,
(VII,33)
Ф(Т) =Г".
Подставив
найденные
дифференциальные
значения
уравнения
ф(Т) в (УП,26), получим
ЭТ
aTy
ap = Аа р,
oT
м1T?.
==
ОР
198
=
oT
А ——
40P
(VII,32)
|
соответственно
(VII,34)
1
иTy.
о
^
(VII,35)
OP To Asap
(УП,36)
коэффициенты которых легко могут быть найдены из уравнения
пейрона — Клаузиуса.
Интегрируя уравнения (УП,34), (УП, 35) и (УП,36), получаем
ветственно уравнения Дюринга [1].
|
и Хенглейна
Тк = А.Тм - Ва (Рух = Py)
|
[2]
Если
принять
G=
ЭР
т
и
и принять,
Ри
ф (Py)
П =Т,
—
о
В. (Рх= Py).
т.
е.
исходить
Ay OT и © (Py)
(VII,38)
—.
из
(УП, 39)
соотношений
(Гы = Ты).
(VII,40)
|
| p(P) dP = f(P) +c,
что
/(P)=
то это дает дифференциальное
(VII,44)
PI,
|
(УП,42)
уравнение
OPy 4
OPy 4
Pap
|
Aspoape
коэффициент которого также может
Клапейрона—Клаузиса.
Интегрируя
Киреева [3]
соот-
(УП,37)
|
Ту = АаТы -+ Ва (Рк = Рм),
ш Гк = А. ш Тм -
Кла-
(УП,43)
быть определен из
(УП,43),
получаем
|
уравнения
уравнение
In Py = AglnPy+ Ba (Tn = Tw).
(УП,44)
Уравнения (УП,37), (УП,38), (УП,39) и (УП,44) являются примерами соотношения (УП,4).
Некоторые другие примеры соотношений, являющихся предельны-
ми случаями (УП,4),
На
были описаны в
примере однокомпонентных
чаи, когда из одного уравнения
венно следуют другие. Ко многим
соотношение (УП,23), относится и
Сочетая
|
условие
применимости
Sy = Аабм + Ва.
OS x
уравнения
|
в соответствии
о
_
(УП, 49)
95
с
тормодинамическим
Ср
|
что
уравнением
_
Cp
Cp
= 44 (9)
(=F)
с тем,
win’)
95
at)p=
получим
или
[4].
однофазных систем рассмотрим слусравнительного расчета непосредстсвойствам, для которых справедливо
энтропия ©. Это означает, что
Ty = Fy,
(Сь)к = Аа(Сь)м.
|
Си
|
(УП,48)
—-
(VH,49)
199
Из уравнения
(УП,49)
в связи
с тем,
что
0H
Сь = (5)
>
непосредственно
следует
(VII,50)
уравнение
Нк = А.Нм -+ Ва.
Если
справедливо
уравнением
о.
уравнение
(УП,50),
о
о
(УП,51)
°
то
можно
пользоваться
(H° — Нок = А. (Н°— Ном - Ва.
и
(УП,52)
Очевидно, наклоны прямых 9м—05м, (Ср)м —(Ср)м,
Нк —Нм
и
(H — H.)n —(H — Ном будут совпадать; очевидно также, что степень
точности уравнения (УП,49) не зависит от значения В. в уравнениях
(УП,45), (УП,51) и (УП,52) (этот коэффициент, в частности, может оказаться равным нулю). В случае же приближенности условия Ал = с0п3%
ход
величины
А.
будет
для
9, Ср
и Н
практически
одинаковым.
Обратимся теперь к двухкомпонентной однофазной системе. Примем
а =с (концентрация растворенного вещества) и П =Т; тогда в соответствии с (УП,24)
де
т
введя
дем
Ф (ск) = Аа т Ф (см);
(УН,53)
\ gp (c) dc = f(c) + const.
(УП,54)
обозначение
|
и приняв
последовательно
и
получим
i(c) =e,
(VII,55)
f(c)=c?
(УП,56)
7 (с) = шс,
соответственно
см = А.см + Ва
(Тк = Тм),
сх = Aru +B,
И
Incn = А. Шсм-
В.
(VII,57)
(УП,58)
(Тк = Тм)
(VII,59)
(Тк = Тм).
(УП, 60)
Зависимость (УП,58) установил Чин [5] для водных растворов,
причем для сходных солей, содержащих слабогидратированные ионы
и обладающих сложной структурой Ва = 0, т. е.
CN
а
для
16.
солей,
содержащих
=
сильно
Аасм,
(УП,61)
гидратированные
ex = em + By.
ионы,
А. = 1,
(VII,62)
Уравнение (УП,59) предложил Скотт
[6], ypasnenue
(VII,60)—
Джонсон и соавторы [7].
Примем а =Т и П = с, т. е. будем исходить из уравнения
oT
Fling
тогда,
чим
допустив,
авнение
уравнени
предложенное
200
—
что
Перри
aT
(cn) = Ag (=)
в уравнении,
подобном
Ty = Aq’ + Ba,
и Смитом
[8].
ф (см);
(УП,27),
(VIT,63)
}(Т)=Т,
полу-
(VII,64)
Примером применения четвертого метода сравнительного расчета к
величинам, характеризующим химическое взаимодействие, может служить зависимость, в которой G = K (константа химического равновесия) и ПЛ =Т. В этом случае условие линейности
OK
т Ф(Км) = Aso p (Ku) (Tx = Tm)
(VII,65)
аналогично уравнению (\УП,40)
и (УП,53). Здесь индексы
относятся к двум сходным реакциям. Тогда из уравнения
\ p(K) dK
= f(K) +e,
подобного
получим
уравнению
(УП,41),
уравнение
In Ky
=
М
|
|
(К) = К-
+ B,
(Тк
М
(VII,66)
и из допущения
A, In Км
и
(VII,67)
—
=
Тм),
(УП,68)
подобное уравнениям (УП,44) и (VII,60)
и тождественное предложенному В. А. Киреевым для однотипных реакций [9] и распространенному им на аналогичные реакции различных членов одного гомологического ряда [10]. Частным примером (УП,68) является уравнение
In
Км
=
ш
Ku -|-
Ва
(Тх
=
Гм),
(УП, 69}
которое, как показал Киреев, справедливо для реакций с высокой
степенью однотипности, причем для однотипных реакций высших членов одного гомологического ряда, обладающих аналогичным строением.
можно считать, что в (УП,69) В. =0 (см. [44]), т. е., что справедливо
Если
нить
же
(УП,24)
исходить
в виде
[к
из условия, что
условия
а =Т
и
ИП =К,
т.
е.
приме-
(VII,71)
(Ky = Ku),
Ф(Ты) = Ав (к) и $ (Ты)
то, введя обозначение, аналогичное (У1,27), а вслед за этим и допущения, подобные соответственно (УП,28), (УП,29) и (УП,30), получим
соотношения, аналогичные (УП,37), (УП,38) и (УП,39), которые также
были описаны Киреевым [12]. Значения коэффициентов в последних
можно определить на основании уравнения Вант-Гоффа (см. [12]).
Если можно
циях примерно
считать, что изменение энтропии
в
одинаково [12], то можно получить
шп Гх = ш Тм Ty = А.Гм
Ва
однотипных
уравнение
реак-
(Kn = Km),
(VII, 72)
(Ky = Km)
(VII,73)
3
Изложенное в первом
сравнительного расчета [13—15]
множителя.
Возможно
и другое
разделе главы обоснование методов
связано с введением интегрирующего
обоснование
[16];
оно излагается ниже.
Рассмотрим
два ряда
родственных
соединений.
Пусть
свойства
первого ряда описываются функцией С(,(2), а второго
— Сл: (=), причем в интервале значений р =8: и в = в. эти функции непрерывны,
имеют конечные производные и Си (2) ==0. Тогда
в этом
интервале
значений параметра вещества &, согласно теореме Коши (см., напри201
мер, [17]), при 8 = 8, (81< 8;< 8) справедливо равенство
Оно является обоснованием
так как соотношение (УП,1)
(УП, 74)
|
и (&) °
аби)
— Ст(Е)
СЕ)
|
о
— Ст (81) _ а@` (5)
Ст (81)
первого метода сравнительного
можно представить в виде
4СТ (8)
ава
= Ат
расчета,
|
(УП, 75)
Очевидно,
|
__
Ст (52) — Ст (21)
A, =
откуда
Gs (@)—G, a)?
(VII,76)
Gy (82) Gry (81)
— Gy (81) Gyy (2)
—
a
Gry (82)
— Gyr (81)
случаям (УП,1) отвечают соотношения
By =
Предельным
: (VIL,77)
ап (8) = А!Ст (2), —
Си (8) = @т(8) + В,
или
(УП, 78)
(УП,79)
Grr (g) = Gr(g)
соответственно
Стт (81)
(VII,80)
Gy (ga)
би) = б:@)’
(УП,81)
Ст (82) — Git (81) = Gr (82) — G1 (g1)
a
Gyy (2)
— Gy, (81)
__
Gry
(g2)
—_
(УП,82)
|
Gy (82)
1
Ст (Ез)
— Gy (81) —°’ би()
Gy (Bs)
Аналогичные результаты могут быть получены и
пяти методов сравнительного расчета.
для
(УП,85)
остальных
` ЛИТЕРАТУРА
1. E.
Dihring.
Folge.
Leipzig,
Neue
1878.
2. F.A.Henglein.
431 (1920).
Grundgesetze
zur rationellen
cTBo, Ne 2, 67 (1934); D. F. Othmer.
Х.
Ка
7. A.
I.
Johnson,
рапетьянц.
Perry,
Erste
Ind. Eng. Chem., Ind. Ed., 32, 841 (1940).
Труды МХТИ
ChenJung
J. Technol., 32, 123 (1954).
8. Г.Н.
Chemie.
2. anorg. allg. Chem., 197, 350
№8, 56 (1933); Нефтяное хозяй-
им. Д.И.
5. С. С. Чин. Ж. физ. химии, 26, 960, 1225 (1952).
6. Scott.
J. Phys. Chem., 33, 1009 (1929).
‹
und
Z. anorg. allg. Chem., 114, 234 (1920); Z. Elektrochem., 26,
3. В. А. Киреев.
ЖЖ. физ. химии, 2, 233, 1931;
(1931); Ж. прикл. химии, 1, 1 (1931); Кокс и химия,
4. М.
Physik
E.R.
Smith.
Huang,
Ind.
Eng.
Менделеева, "22, 100
Kwei
Chem.,
Ti-kang.
(1956).
Canad.
25, 195 (1933).
9. В. А. Кирееюв. В
кн.: Сборник работ по физической химии. М., Изд-во АН
CCCP, 1947, crp. 181, 197; Acta Phys.-chim. URSS, 20, 905 (1945); 21, 159 (1946).
10. В.А. Ки р еев. Ж. физ. химии, 28, 372 (1954).
11.
12.
13.
14.
15.
_
В. А.
Киреев.
Усп.
В. А. Киреев.
М.
Д.
Х.
И.
химии, 23,
Ж. физ. химии,
Карапетьянц.
Менделеева.
Тезисы
Чэн
Гуангюе.
Труды
М. Х. Карапетьянц,
ние
насыщенного
пара
В
921
(1954).
34, 945 (1960).
с6б.: Научно- технич.
докладов,
1960,
стр.
7;
М.
конференция
Х.
МХТИ
им.
Карапетьянц,
МХТИ им. Il. И. Менделеева, 38, 59 (1962).
Чэн Гуанг-юе. Температура кинения
и давле-
углеводородов.
Гостоптехиздат,
1961.
М. Х. Карапетьянц, Чэн Гуанг-юе. Температура кипения и давление насыщенного пара углеводородов. Пекин. Китайское научное издательство,
4963 (на кит. яз.).
16. Л.П. Холпанов, М. Х. Каранпетьянц.
nh. физ. химии, 38, 2093 (1964).
47. Г. М. Фихтенгольц.
Курс дифференциального и интегрального исчисления.
Том
Г[. М.,
Физматгиз,
1962.
1 B простейшем частном случае, когда (УП,9) имеет вид @ = а -- $ (например,
для свойств высших гомологов в стандартном состоянии), с помощью теоремы Лагранжа [417] получаем уравнения, подобные (УП,74—УП,83).
|
ТЛАВА
VIII
ПЕРЕХОД ОТ ЕДИНИЧНОГО
К НЕСКОЛЬКИМ СОПОСТАВЛЕНИЯМ
При описании методов сравнительного расчета были рассмотрены различные уравнения и графики, каждый из которых отвечал одному сопоставлению. Теперь рассмотрим для каждого из шести методов
возможность одновременного осуществления нескольких соцоставлений [1 ].
Такие сопоставления, к сожалению, используются сравнительно редко.
В то же время они значительно расширяют рамки применения методов
сравнительного расчета, позволяют во многих случаях устранить выпадение первых ‘членов ряда, а также позволяют установить связь между отдельными методами. Кроме того, возрастает возможность проверки значений данного
свойства, рекомендованных
различными
авторами. Переход
к нескольким прямым свидетельствует о том, что значения данного свойства
образуют
совокупность
величин,
т. е. являются
системой значений.
Соз-
дается возможность решить и другие задачи, в частности придать количественный характер ряду закономерностей (например,
отклонению
от
аддитивности в значениях свойств).
ПЕРВЫЙ
МЕТОД
СРАВНИТЕЛЬНОГО
РАСЧЕТА
При использовании первого метода сравнительного расчета
соотношение (Т, 1) распространяется с Ги П рядов сходных веществ на
большее их число, т. е. применяется соотношение
Gi = A,G,+ By,
|
(Ши)
в котором i = II, III...
Нанесем на ось ординат чертежа, подобного рис. 1, 4 и др. , свойство стандартного ряда веществ А;В!:, применив, как и раньше, ‘равномасштабные
оси координат (рис. 147,а). Тогда
получим
прямую,
которая
будет
биссек-
трисой координатного угла (пунктирная прямая 1—3); на ней нанесены
значения свойства веществ АВ, (точка 7), А.В! (точка 2) и АзВ 1 (точкад).
Прямая 4—6, характеризующая изменение того же свойства в сопоставляемом ряду веществ А.В. (А!В., А.В, и А. В.), не будет параллельна
ранее нанесенной прямой, так как в общем случае коэффициент А 1 в уравнении (УПТ, 1) будет меняться от одного ряда веществ к другому. Это
обусловлено тем, что различие в значениях свойств двух веществ, молекулы
которых обладают общей соетавной частью (А 1, Ag, Аз), будет в той или
иной мере зависеть от ° другой неодинаковой составляющей этих молекул (В.).
Введем
чодобных
в
сопоставление
веществам
Г
и’ П
ПТ
ряд
рядов.
веществ
А;В. (А\Вз, А>Вз, AsBs),
Построенная
для
этого
ряда
203
веществ прямая (7 - 9), очевидно, также будет
пересекаться
с пунктирной.
Примем, что эта точка пересечения (0) совпадает с ранее полученной.
Это допущение, которое означает, что линии Сл; в,— &4,, Сл, в,- ВА;
и Сл, в,—2А; образуют для родственных веществ семейство кривых,
является правдоподобным. Действительно, рассмотрение взаимосвязи.
G
ae
А
G
Ay |
A,
G
Рис. 147. Взаимосвязь между
значениями свойства (
в нескольких рядах сходных веществ А,В; (схема)
а — сопоставление
значений свойства
С в ряду А.В}
А;Вз
часть
B;);
(переменная
молекулы
а в ряду А.В, и в рядах
А.В.,
—
и
в
рядах
б — сопоставление
А, Во,
свойства
АзВ, (переменная часть молекулы — А;)
значений свойства веществ, которым отвечают точки, расположенные
на двух вертикалях рис. 147, а (например, на вертикалях 1—4—7 и
2—5—8), также приводит к прямой (рис. 147,6; 8—65—9). Последнее
же очевидно и априорно, так как является следствием того, что применение соотношения (1,1) в общем случае не зависит от того, какими
атомами будут отличаться друг от друга вещества в сопоставляемых
рядах. Так, сравнивая межатомные расстояния в рядах Х/—
Х: можно
сопоставлять
частицы
с
переменными
Хх:
(например,
х. —= С] и
Х, = Вг) или с переменными xy (например, Х, = Аз’
и Х, = Sb’).
Комбинируя различные вертикальные разрезы на рис. 147, а, легко.
получить ряд прямых, причем, если в каждом случае в качестве аргумента
принять значения С, отвечающие одному и тому же ряду веществ (стандартный ряд), т. е. одной и той же вертикали на рис. 147, а, то образуется совокупность прямых, подобная изображенной на схематическом
рис. 147, 6.
|
Координаты точек О (рис. 147; а) и О, (рис. 147, 6) совпадают. Действительно,
из рис.
147,
а следует,
САБ,
Сл,
где уо = хо —
декс номером
в.—
что
|
Yo —_ А.В,
№
—
G 4B,
№
?
(VIII, 2)
координаты точки О. Заменив для простоты буквенный инсоответствующих точек на рис. 147, а и обозначив значения
свойства через у, можно переписать уравнение (УТ,
2) в виде
ии.
Y9 — Yo
(VIII,3)
Ут — Yo
Из подобия треугольников
на рис. 147, б следует,
a
У? — Yo
204
BO
Yo —
Yo
что
(VIII,4)
Из
уравнений
(УПТ,
3) и (УПТ,
4) вытекает равенство
Yo =
91,
которое отвечает совпадению ординат, а поэтому и абсцисс точек О и О.
Разумеется все вышесказанное отзначает лишь простое совмещение
на одном рисунке нескольких прямых. Мы рассмотрели некоторые аналитические свойства этих совмещений, которые можно распространить
«< трех рядов веществ на большее их число.
|
Ту
Е
1
"т
80:
|
a
60r
60
|
|
WH Oe
Вг
Cl
J
40
Г
вое
20
it
2
20
40
;
j
60
РЯ
2
ly
Puc. 148. Взаимосвязь между третьим и четвертым потенциалами
ионизации [(э6) галогенов (а) и третьего и первого, второго,
четвертого и пятого потенциалов ионизации галогенов (6) [2]
На одном примере это показано на рис. 148 и 149. На рис. 148, а дано
единичное сопоставление, подобное рассмотренным в главе [ (сравниваются третий и четвертый потенциалы ионизации галогенов), справа—
‘несколько
сопоставлений
(в
том
же
ряду
ато-
‘MOB третий ионизационный потенциал сравнивается с первым, вторым, четвертым и пятым).
Из рис. 148,6 видно, что линии образуют систему прямых, сходящихся примерно в одной
точке. Выпадение точек для фтора (см. рис.
148,4),
которое,
естественно, возрастает по
‘мере перехода к рядам веществ, все более отличающимся от стандартного ряда, практичесжи компенсируется при переходе для фтора к
‘наклонной линии. Сходство фтора с остальны‘ми галогенами проявляется в том, что точки
для него, как и для остальных галогенов лоэжатся практически на прямую линию.
Распространение соотношения (УШ,
1) ©
двух рядов на большее их число позволяет
осуществить и иные сопоставления. Покажем
это на том же примере. Выберем в качестве
стандартного
ряда
ионы
хлора,
т.
е. нанесем
на ось абсцисс (рис. 149) значения потенциалов
dn
I
ul
i
OW
60
40
20
07“
Рис. 149. Взаимосвязь меж-
ЛУ первым,
им
вторым,
треть-
четвертым
—ламии ионизации
Г потенциа(96) хлора
ионизации /, отложенные на оси ординат рис.
и других галогенов [2]
148, а вдоль соответствующей вертикали. По
‘оси ординат отложим потенциалы
ионизации других атомов.
Тогда
получим систему прямых (рис. 149), причем линии для Вт и 7 при своем
продолжении сходятся примерно в одной точке (в той же точке, что и
на рис. 148). Линия для фтора располагается в стороне (пересекая осталь‚ные в разных точках), но также оказывается прямой.
205
Ранее уже отмечалось (см., например, стр. 14) отклонение первых членов:
ряда; оно обусловлено тем, что соединения элементов второго периода для:
неорганических веществ, первые члены гомологических рядов (например,
изобутан) для органических соединений и т. д. несколько выпадают из
общих
закономерностей
в свойствах
соединений, соответствующих
им
по.
группе периодической системы и по гомологическим рядам.
Эти отклонения могут стать значительными, когда части молекулы, которыми рассматриваемый ряд отличается от стандартного,
относительно сильно.
различаются. Это подтверждается не только рис. 148 и 149, но и рядом приводимых ниже примеров. Из этих примеров видно также, что из выпадающих в каждом ряду веществ в свою очередь образуется линия, причем, ввиду того, что отклонение выпадающих точек от каждой прямой
будет закономерным (прямые описывают свойства родственных веществ),
то линия,
образованная
этими
точками, также
будет практически
прямой. При продолжении она в общем случае не попадает в точку
пересечения остальных прямых, а при расположении последних в вертикальном направлении будет наклонной. Таких выпадающих линий может
быть несколько,
однако
в этом
случае
ряд
точек
пересечения
будет
располагаться с известной закономерностью 1. Степень отклонения прямых от вертикали (или от общей точки пересечения) определяется степенью отклонения свойств первых членов от остальных членов ряда.
К рассмотренным примерам можно было бы прибавить и ряд других.
в частности‘ взаимосвязь между поляризуемостью в различных рядах не-
которых галогенидов элементов подгруппы ПЛ (по данным
связь между поверхностным натяжением в различных
ных солей (по данным [2].
Чистые
[3]) и взаимо-
рядах расплавлен-
вещества
Макросвойства
На рис. 150 сопоставлены значения мольных объемов (при абсолютном нуле) окислов, сульфидов, селенидов и теллуридов элементов подгруппы бериллия. Прямые для Мф, Са, 5г и Ва на рис. 150,а практически
сходятся в одной точке, как
и
прочих
а также
дение точки для MgTe
соединений
прямые для 5, 5е, Те на рис. 150,6.
обусловлено
магния,
прежде
всех
Выпа-
всего тем, что в отличие
соединений
Са,
5г и Ва,
от
обра-
зующих решетку типа NaCl, МеТе принадлежит к кристаллам типа цинковой обманки. Линии для Вех и Ме0 лежат несколько в стороне от остальных.
Следует
иметь в виду,
во-первых,
что значение (И
)вете
не
известно
и, во-вторых, что три соединения, для которых значения У известны, образуют кристаллы двух типов (BeO — тип вюрцита, Веб и BeSe — тип цинковой обманки), отличающихся от структуры остальных веществ. Однако
в первом приближении можно считать, что (Т’)вете
= 26 смЗ/моль.
На рис. 154 взаимосвязь мольных объемов (при абсолютном нуле)
представлена на примере соединений элементов первой группы. Ли-
нии для Г1Х и МеЕЁ выпадают, но также являются прямыми. Прямая для
CsX (X = &@
Вт, Т) оказалась между прямыми для КХ и ВБХ, нарушая
тем самым последовательность, отвечающую периодической системе элементов; кроме того, она не попадает в общую точку пересечения прямых
для
галогенидов
СзВг и С$Т
решетку
типа
Ма,
К
и ВЬ
(рис.
151,а).
в отличие от других галогенидов
СзС],
поэтому
прямая,
Это
вызвано
тем,
что
С$СТ,
образуют кристаллическую:
проведенная
через
общую
точку
пе-
ресечения и точку для СзКЁ, позволяет определить значение Г’, для кристаллов СзХ (Х = С, Вг, Т), если бы они образовывали решетку типа NaCl.
1 Из выпадения линии для некоторых
честве стандартных рядов.
206
рядов следует неудобство их выбора
в ка-
(И нех
Be Mg Ca Sr Ba
Jor
7070
ии
Рис. 150. Взаимосвязь между мольными
1
20
30 1
(YO) mes
объемами У (см3) при 0°К
[14]
а — халькогениды кальция идругих элементов подгруппы бериллия;
б — сульфиды этих элементов и другие халькогениды
Vy Li Na
80-
Рис. 151. Взаимосвязь между
а —
галогениды
натрия
и
других
KCSRb
мольными объемами У (см3) при 0°К [5]
элементов
подгруппы
лития,
их
гидраты,
окислы,
сульфаты,
а также галогены и галогениды серебра и аммония; б — хлориды элементов подгруппы лития
и другие галогениды этих элементов, их гидраты, окислы, сульфаты, а также галогены и галогениды
серебра
и бария
Правильность
ложатся
Сходство
ственно
и
положения
точки
для
этой
в расположении
свидетельствует
прямой
других
линий
подтверждается
соединений
для
о близости
цезия
галогенидов
свойств
этих
тем,
что
(СзН, Сз.О,
и гидридов
соединений,
на
нее
С$.50.).
непоеред-
что отмеча-
лось в ряде исследований. Здесь, так же как и на рис. 150, видна чувствительность объемов к структуре (см. расположение прямой для АсХ). А
так как неорганические вещества отличаются разнообразием кристаллических структур, то несмотря на наличие большого экспериментального
материала построить ряд прямых для других групп веществ, аналогичный
представленному
с
на рис.
150 и 151, в настоящее
Е
Cl
Br
время
- J
затруднительно.
09
GgRbK NaLi
у
Рис.
(отношение
152. Взаимосвязь
объема
между
сжимаемостью
соединения к сумме
с
объемов атомов)
а — галогениды натрия и других элементов подгруппы
этих элементов и другие их галогениды
‚лития;
[6]
б — хлориды
Из рис. 150 и 151 непосредственно следует, что привлечение уравнении
вида
(Т, 76)
для
С =У в
ряде
случаев
не является
достаточно
обосно-
ванным и может быть оправдано лишь не очень высокой точностью экспериментальных данных. Действительно, уравнение аддитивности объемов
Vir —V1 + Br,
как видно
стью 1.
На
рис.
из указанных
чертежей,
152 сопоставлены
не выполняется
константы
V
“=
(VIII,5)
с достаточной
абсолютного
сжатия
точно-
[6]
соед
ХТ ат
галогенидов подгруппы лития. Учитывая невысокую точность значений
этих величин, результаты следует признать
удовлетворительными.
1 Согласно Шредеру, если аналогичные бинарные соединения расположить в таблицы так, чтобы соединения одного и того же элемента находились на одной горизонтальной или вертикальной линии, то разность межцу мольными объемами на пересекающихся линиях будет одинаковой. Хотя эта правильность была ограничена ее автором изоморфными группами, однако даже в пределах таких групп отклонение от аддитивности может быть значительным (см., например, [5])
208
о
5.98 /мех
Na
|
mr
Rb us
(Sag ) мех
г
З0г
|
[|
a
|
oor
251
Гу
20]
4
154
№
20.
15
ee
ии
10h
‚”
yor
‚и
и
7
ии
52
/
,
0
и
47
_
'
a
10
,
,
'
15
20
25
9
(5,58) MeCl
Рис. 153. Взаимосвязь, между
стандартными
и галогениды
(Cp 298
CH in Х,-т
CH,X, CHK,
@
15
—
20
4
4
25.
(5255) xx
а — хлориды и другие галогениды натрия, калия,
2ur
5
энтропиями
рубидия,
натрия, рубидия,
цезия;
5S sos (э.е.) [7,8]
б — гелогениды
цезия
калия
сх,
}
|
|
|
|
1
1
|
(Co295)
18
10
Рис. 15%. Взаимосвязь между теплоем‚костями Ср (кал/моль-град) хлорпроизводных
метана и других галоидпроизводных метана при 25° С
о
@—[9],
O—[11—13
72
Рис.
'
ft
CX HX on
и
155.
/
16
re
14-0
Взаимосвязь
о
e
20
22
2988г. НОС, п
между
теплоемкостями Ср (кал/моль.
.град)
хлорбромпроизводных
метана и некоторых других галоидпроизводных метана при
25°С
На рис. 153 сравниваются стандартные энтропии галогенидов подгруппы лития (размеры прямоугольника отвечают вероятной погрешности значений 55%).
На
рис.
154 и 155 представлены
еще
два
сопоставления
значения
од-
ного свойства в нескольких рядах веществ. Они отвечают случаям, когда
все прямые совершенно точно сходятся в одной точке, причем последняя
имеет вполне определенный физический смысл. На рис. 154 эта точка отвечает стандартной изобарной теплоемкости при 25° С общего члена сопоставляемых рядов (метана), на рис. 155—той же характеристике дихлорметана,
Как видно из рис. 154, некоторая кряволинейность зависимости
(Сь) CH Xp
(CP) CH Xeon? возрастающая по мере увеличения различия в
свойствах Х’и Х”, практически устраняется путем применения для
СН.Х., и СХ, наклонных шкал. Линия для СНХ.; на рис. 154 должна
быть близкой к вертикали, так как прямые для СН.Х., и СХ, имеют противоположный наклон. Из этого, в частности, следует, что значение теплоемкости СНЕ., равное 12,49 кал/моль-град [9], несколько уступает по
точности значениям 12,20 [41], 12,21 [42] и 12,198 [13], a для СНВг,
величина СЪ... ближе к 16,99 [411] и 17,08 [1431], чем к 17,44 [9] 1.
Рис. 155 отличается от рис. 154 тем, что линия, отвечающая величинам, отложенным на оси абсцисс (она, как всегда, изображена пунктиром),
не попадает в точку пересечения остальных прямых. Это очевидно и из
сопоставления характера сравниваемых рядов веществ.
Из расположения
нение
и
уравнений
точек на прямых
рис.
154 и 150 видно, что приме-
(Св)охих, = Ч [(Ср)ох. + (Сь)сх.|
(Cp)ox,vz = "fo [(Сь)схих, | (Сьусхи,
для расчета значений Ср неизученных
приближенным результатам *.
веществ
может
_
привести
(УТТ,6)
(УШ.Т)
лишь
к
Mux poceoticmea
Обратимся к примерам нескольких сопоставлений для микросвойств. Начнем с межатомных расстояний 4 в молекулах газообразных
соединений в нескольких рядах сходных веществ [22, 27].
На рис. 156 приведены значения 4 для галогенидов элементов подгруппы
бериллия, заимствованные из [10,14—17] (см. также
[18]. Все эти экспериментальные данные весьма надежны и получены в одной лаборатории. На рис. 156 нанесены данные и для гидридов, свидетельствующие об
их сходстве с фторидами, а также для галогенидов кадмия [19] и цинка
[20], указывающие на отличие последних от галогенидов подгруппы бе-
риллия
(иной наклон прямых,
выпадение точек для фторидов). Это сопо-
ставление позволяет сделать ряд выводов. Для всех молекул (вероятно,
за исключением ВеЁ.) погрешность результатов расчета лежит в пределах
ошибки опыта, которая показана высотой и шириной прямоугольника
(для тех веществ, для которых она известна). Если значения Две_в = 1,36 и
вес! = 1,7 А, рекомендованные в [21], правдоподобны, то этого нельзя
сказать о значении 4с._к = 2,02
и особенно о значении с._с! = 1,86 А из
той же сводки. По окончании работы над статьей [22] ее авторы познакомились с исследованием [23], в котором экспериментальным путем было
1 Менее точные значения отмечены на рис. 154 залитым контуром.
* Степень точности этих уравнений различна. Действительно, если на рис. 155 точка для п = 1 в первом приближении лежит в центре каждой прямой (она отмечена
крестиком), то на рис. 154 линия для СН›Х. делит все прямые на неравные части. Из
рис 154 видна также приближенность допущения, что (Croux, равна
полусумме
(Ср) сньх, И (Ср)сх,:
210
Са
12
"
23
20
р
26,
р
Ca-X
Ba Ва
2,7
ot
1
18
29
Sr
te
30
Me-Cl
Рис. 156. Взаимосвязь межатомных расстояний 4 (А) в газообразных галогенидах и
гидридах элементов подгруппы бериллия [11—15, 16], а также цинка [20] и кадмия [19]
Ч ме-х
350
и
кальция
-> галогениды
Li
г
|
других
галогениды
Na
K
RbCSFr
ЕТИМ
и |
a
vy
” 200
Рис.
157.
|
о 900 |
Г
Hae
2,50
Взаимосвязь
а — бромиды
tl
|
|
Г
о
2,00
15 Q
|
„8
2,90
галогениды
30
70
|
aan
v4
и другие
мех Е
|
ao
400
хлориды
б —
элементов;
;
|
2,90
Г
2,90,
f5OL41
3,00
2,00
Me-B8r
межатомных
расстоянии
подгруппы
лития
[23,
14
d(A)
1
24]
и другие галогениды;б — галогениды
i
2,50
в
калия
га
3,00
aK-x
газообразных
и других
галогенидах
элементов
найдено значение 4ме-; = 2,52 -- 0,03 (по графику 4— 2 получаем
[24]);
по рис.
154 находим 4ме-;
= 2,53
А,
что
полностью
2,54 А
согласуется с
опытным значением этой величины. На рис. 156 приведены также значения
Дьа_х
(соответственно
ных
металлов.
2,4; 2,92;
3,1;
3,3 и для
Ва _НЫ—2,35 А);
они
были вычислены с помощью уравнения (1,26). Рис. 157 иллюстрирует
аналогичное сопоставление на примере газообразных галогенидов щелочпредставлена
Наблюдающаяся
в этом
уравнениями
случае
зависимость
может
быть
Чмех = Ах4мевг -- Бх
(УПТ,8)
мех
(VIII,9)
=
Аме@кх
+
Bue.
Этот пример представляет тот интерес, что охваченные им вещества являются единственными, для которых экспериментальные значения ( весьма точны (погрешность порядка 0,0001 А [25, 26]). Поэтому уравнения
(УПТ, 8) и (УШ,
надежность
метода
9) позволяют
с наибольшей
сравнительного
расчета.
эффективностью
проверить
Таблица
Сопоставление опытных
значений
межатомных
[25] и вычиеленных по уравнениям (УШ, 8) и (УШ, 9)
расстояний
d(A)
в молекулах газообразных галогенидов
щелочных металлов [27]
а
Молекула
а
вычислено
по [25]
LiF
LiCl
—
—
LiBr
2,1704
LiJ
МаЕ
NaCl
МаВг
NaJ
КЕ
KCl
КВг
KJ
по
Молекула
—1,61*
|—1,60** | ВЪЕ
~2,035* | 2,0202 || RbCl
(2,1704) |
ВЪВг
2,3949
|—2,395* | (2,3919)|
—
1,925
|~1,922**|
2,3606. | 2,3593 | 2,3602 ||
2,5020
—
2,5019 |
2,7115
2,7106 | 2,7119 ||
—
2,165
2,165**|
2.5666
2,6668
—
2,8207
—
—
3,0478
3,0475
—
Найдено
вычислено
по [25]
VIII, 8 | VIII, 9
* Найдено но графику аАмех — @мевг
**
по графику
29
мех —@Чкх
*** Заимствовано из работы
(см. рис.
1571, а).
(см.
157,
рис.
VIII, 8 | VIII, 9
2,26554***|
2, 1867
2,259
2,265**
2,7883 | 2,7868
3,4769
2,3453
2,9062
3,0720
3,3159
—
—
—
—
3,1773 | 3,1712
2,355
2,347**
2,9058 | 2,9062
—
3,0715
3,3157 | 3,3154
2,414
2,411**
2,976
2,980
—
3,145
3,392
3,390
2,9448
ВБ
CsF
CsCl
СзВг
CsJ
FrF
Frcl
FrBr
Ег]
по
—
2,9445
6).
[26].
Результаты вычисления значений мех по уравнениям (УПТ, 8) и (УПТ, 9)
приведены в табл. 29, где они сопоставлены с опытными данными [24,
25].
Здесь
франция.
же
Как
приведены
видно
приближенные
d для
галогенидов
со средней погрешностью
в 0,0023 А,
из этой таблицы,
значения
уравнение
(У1Ш, 8) воспроизводит
опытный
материал для 11 веществ
по (УПТ,
9) составляет всего 0,0004 А, т. е. соизмерима
причем эта погрешность уменьшится до 0,0009 А, если ориентироваться
на экспериментальные значения Двьг И св. Средняя же ошибка расчета
с погрешностью
опытных данных. Единственным исключением является [1Е, для которого
результаты расчета, очевидно, наименее надежны.
Однако найденное в
212
[24] значение дав = 1,60 А удовлетворительно
денной
величиной
1,545 -- 0,006
[23].
согласуется с недавно
най-
Из рис. 156 и 157 видна не только неаддитивность межатомных расстояний, вызванная влиянием поляризации ионов, ван-дер-ваальсовским
взаимодействием между ними и другими факторами и проявляющаяся
даже в простейших соединениях, где связи близки к ионным, но и закономерный ход в отклонениях от аддитивности, связанный с положением
металлов и галогенов в периодической системе элементов. Здесь, так же
‘как и в других случаях, наблюдается выпадение прямых для первых членов ряда (MeF,
SL
MeF,, LiX um BeX,); upmaem, ecuu pana MeF u
MeF, это выпадение примерно одинаково,
то для
Вех..
|
[ЛХ
оно
гораздо
больше,
чем
для
На рис. 158 показана связь между значениями 4 галогенидов подгруппы углерода. Наряду со значениями 4,-х (Х = Е, С], Вг, Т) нане-
|
=
A774
ye
“We
oo"
ии
, Yo и
хи
Zor
9
2.0[-
Loe
1—4
10
i
tj:
1,9
фе
2,0
2,0
23.
Cl
Рис. 158. Взаимосввязь межатомных расстояпий 4 (А) в связях Э—С1 (9=5ЩСе,
и Э — ХЭ = В, №, СН}, Вт, Ф) [29]
сены также значения 4 и для связей 9—9,
СН.—Х,
а также для РЬ?* и
$п, РЬ)
5п?“.
Из рис. 158 видно, что отклонение от аддитивности в межатомных расстояниях для элементов ПУ группы значительно больше, чем для элементов |
и П групи, и оно тем больше (в сторону уменьшения), чем сильнее проявляется ионный характер связи. Выпадение прямых С-—Х и Ме— Е вызвано
тем, что соединения углерода и фтора являются первыми в рядах соответствующих сходных веществ. Некоторое отклонение прямых для РЬ?“
и. 51?’ от вертикали свидетельствует об отклонении их свойств от
вевойств 9“*"; характер же этого отклонения говорит о сходстве Рь?*
и 5п?*. Рис. 156 позволяет оценить значения 4 для некоторых связей:
dpp-py
= 2,98;
dpp-y =~ 2,77; 45-2 2,15 А; наиболее надежное значение dsi-pr, по-видимому, ближе к 2,20, 4сес — к 1,95, 4ве-вг— к 2.27 и
Я сп
В:
— К
2,50 А.
213
К перечисленным сопоставлениям можно прибавить некоторые другалогенидов
гие, в частности взаимосвязи между частотами колебаний
щелочных металлов (по данным [30]), межионными расстояниями для
(по
них
данным
[31]),
Характеристики
рефракциями
молекулярными
между
неорганических соединений
[32] и т. д.
некоторых
|
различных
процессов
Рассмотрим несколько примеров применения первого
метода
сравнительного расчета для сопоставления характеристик фазовых превращений и химических процессов.
7
13
n=
3
2
/
=
‘
Zr
1
VIP
10
:
|
i]
12
“- С,
Рис.
159.
Взаимосвязь
н-алканов
С„Нои.2 и
между
13
Нлп+2
потенциалами
углеводородов других
ионизации
Г
гомологических
(э6в)
некоторых
рядов
[34]
Материал, позволяющий распространить первый метод сравнительного расчета с двух рядов на большее число рядов сходных веществ для
фазовых равновесий, содержится в работах [34| и [35].
Более обширными данными мы располагаем для такого распространения в случае химических процессов (особенно для их энергетических
эффектов). Поэтому рассмотрим несколько подробнее эти примеры.
На рис. 159 показано сравнение потенциалов ионизации молекул в
различных гомологических рядах органических соединений. В этом случае отклонение первых членов ряда гораздо более значительное, чем на
рис. 149
На рис. 160 сопоставлены стандартные теплоты образования кристаллических галогенидов алюминия и элементов подгруппы галлия. Этот
пример интересен потому, что вторичная периодичность, проявляющаяся
в немонотонном ходе теплот образования галогенидов главной подгруппы
третьей группы при движении в направлении возрастания порядкового
номера (1Х. и СаХ., поменялись местами), практически не сказывается
на точности расчета.
|
Та же характеристика процесса, но уже для органических веществ
приведена на рис. 161. Здесь сравниваются значения ЛН-з в рядах веществ, образованных последовательным замещением
одного элемента
другим. Все прямые пересекаются в одной точке, соответствующей значению (Л Нэз)сн,; экстраполяция дает (Л Н›оз)ст,
= 59 ккал/моль. К графикам, подобным рассмотренным, приводит и сопоставление значения
энергии
групп
214
кристаллической
[37] (см. главу [Х).
решетки
соединений
элементов
первой
и второй
~AH
мех,
3207
TL
бат
А
"AH
м
3000
Br
Га
C40r
-
ВЫ
&
160
160
80+,
/
80
}
т
/
/
It
oe
2
Рис. 160. Взаимосвязь
ij
между стандартными теплотами образования
АНьз(вкал/моль) [7, 8]
а — бромиды и другие галогениды таллия, галлия,- индия, алюминия;
б— галогениды галлия и галогениды таллия, индия, алюминия
(OH
uo}
CH, CH, CH CCL
40
Br
J
90
20
10
С
. `20
|
0
aH
10
СНВ тт
Рис.
161. Взаимосвязь
образования
OAH
между
20
Xk,
стандартными теплотами
A Hog (ккал/моль)
[7, 8]
а — бромзамещенные
метана
и хлор- и]! иодзамещенные
Opom-, иод-)замещенные и тетра-, три- и моно-(хлор-, бром-,
метана;
б — ди-(хлор-,
иод-)замещенные метана
“4H
50
Ba
Sr
fo
Рис.
162.
растворения
спирте
Ca
10
Взаимосвязь
'
.
1
20
между
Mg
1
i
30
40
OH, C,H_0H
предельными
|
интегральными
теплотами
АН”?з (ккал/моль) некоторых перхлоратов в н-пропиловом
и в других
спиртах
н-С„Но, 4,0H и в воде [39—43]
4H
Sr Ba
Ca
Mg
F
Cl
Br
70-9
|
|
Tl
©
BOF
90
40
90
20
10
0
|
i
!
20
1)
30
40
|
20
]
|
|
|
30
AH. oy
Рис. 163.
а —
Взаимосвязь
АНооз
субгалогениды
кальция
|
js
Ut 0)
AH
между
теплотами
(ккал/моль) [44]
и некоторых
других
50
ect
образования
элементов;
и другие субгалогениды этих же элементов
б —
субхлоридыь
На рис. 162 сравниваются величины теплот растворения некоторых
солей в различных спиртах [39—43]. Здесь же нанесены данные по растворимости тех же веществ в воде. Линии для этилового, н-пропилового и нбутилового спиртов при продолжении сходятся примерно в одной точке.
Линия для СН.ОН расположена в стороне.
Взаимосвязь между теплотами образования субгалогенидов различных металлов представлена на рис. 163. Из чертежа видно, что опытные
L4H,n
ч00-
300F
COOr
100+
0
+
200
100
!
900
.
1
400
AH
Ш
о 208
/n
Рис. 164. Взаимосвязь между стандартной энтальпией гидратации катионов иих стандартной энтальпией в газовой фазе
АН (ккал/г-экв) [45]
данные
ния
удовлетворительно
составляют
А1Ё
и 917);
соответствуют
кроме
того,
уравнениям
прямых
отличие
(исключе-
ясно
видно
МХ
и TIX
рис.
164 и 165, заимствованных
ot MeX (Me=Mg, Ca, Sr, Ba).
В работе Н. Е. Хомутова [45] развит новый подход к изучению явления сольватации ионов, основанный на анализе результатов сопоставления термодинамических свойств сольватированных ионов с термодинами-
ческими
свойствами
из указанной
свободных
ионов.
На
работы, показано сравнение значений соответственно АН и
АС (растворитель — вода). Как
грешности характер линейных
видно из этих
зависимостей
чертежей, в пределах поопределяется структурой
наружных электронных оболочек. Действительно, линии/А и Б на рис. 164
объединяют катионы, имеющие электронные оболочки атомов инертных
газов; на линии
В и Г лежат ионы, наружные электронные оболочки кото-
рых являются незаполненными
ными
слоями.
Между
и заполненными
этими прямыми
легли
34-, 44- и 54-электрон-
точки для Си*, Си?", Pb a Sn.
Примерно такое же расположение точек на рис. 165; разница заключается лишь в том, что для всех катионов с оболочкой инертных газов наблюдается только одна Л 7-зависимость, а для АН — две. Эти различия,
по-видимому, вызваны различием энтропий гидратации; у. Ме’ они малы,
у Ме*+ и Ме3* — значительны.
Описанные зависимости представляют пример первого метода сравнительного расчета, когда несколько одновременных сопоставлений дают
систему параллельных прямых; в данном случае А, =0,987; следует при
этом отметить, что в первом приближении
A,=1—-,
&
|
— (VIIT,10y
217
где = — диэлектрическая проницаемость воды. Таким образом, А: чис‘ленно равно множителю в уравнении Борна.
Подобные результаты были получены и для других растворителей
(аммиак, муравьиная кислота, метиловый и этиловый спирты) [46]. В этих
‘случаях также получается система параллельных прямых, наклон которых соответствует уравнению (УПТ, 10).
- Константа В, в этих уравнениях зависит от структуры электронных
‚оболочек катионов и от природы растворителя.
Из рассмотренных сопоставлений не только ясно видна роль
диэлектрических
свойств раство-
82?/n
рителя
15
но
и
в
процессе
общность
сольватации,
механизма
этого
процесса в различных растворителях, поскольку независимо от природы
растворителя справедливо
одно и то же уравнение.
|
То,
LO
свидетельствует
что А <],
о существовании эффектов понижения энергии образования ионов
в растворителе по сравнению с газовой фазой (вследствие более низ-
кого значения электростатической
энергии
ионов
в
диэлектрике).
Сольватация
сопровождается на-
дут
.
Рис.
165.
изобарным
Взаимосвязь
потенциалом
ты) гидратации
ным
ряду с экзотермическим эффектом также эндотермическим эффектом; величина последнего характеризуется константой В,. Значе-
изобарным
между
А 7°
катионов
ние В, сильно
зависит
почек
Все
туры наружных
стандартным
(фарадей-воль-
и их стандарт.
потенциалом
фазе [45]
в
газовой
H.
ионов.
от
струк-
электронных оборассмотренные
В. Хомутовым
зависимости со-
солютных величин
энергетических
храняют
свой
эффектов
вид,
если вместо
гидратации
аб-
применять
относительные величины, как это предложено в работе [47].
Энергетические эффекты гидратации ионов Н* (ОН`) не попадают ни на одну из
прямых, что свидетельствует о различии в механизме гидратации Н* и
других
ионов,
на что указывалось
в ряде
исследований
[47—51|.
Системе прямых, пересекающихся примерно в одной точке, отвечают
также данные по теплотам адсорбции нормальных алканов на силика-
геле
[52].
Данные
по относительному изменению
циации
[54—56],
константам
энергии
кристаллической
образования
объема
[53], константам диссо-
комплексов
[57],
энергии
свя-
зи газообразных галогенидов щелочноземельных металлов [58], изобарному потенциалу образования некоторых газообразных галогенидов [59],
зообразных молекул
вокупности прямых
Предельные
решетки
[60],
энергии
ионной
диссоциации
га-
[61] и некоторые другие данные также приводят к солиний.
случаи
соотношения
(УШ,
1)
Чем значительнее различие в свойствах сопоставляемых рядов,
тем под большим углом друг к другу будут направлены прямые на чертежах типа рис. 147, аи 147, 6, т. е. тем больше значение коэффициента
А! в соотношении (УП, 1) будет отличаться от единицы. Этим обусловлено,
218
например,
(на рис.
значительное
149)
и для
отклонение
кислородных
соответствующих
соединений
прямых
на рис. 150.
для фтора
Наоборот,
чем
ближе свойство к аддитивности, тем эти прямые ближе к параллельным
прямым, т. е. точка их пересечения удаляется. Примером подобного свойства является объем, что видно из рис. 150 и 151. Считать объем аддитгз-
AH
[
ДН. t
J)
a
JL!
JZ"
a
и
OH
и
=”
4g”
Рис. 166. Взаимосвязь между теплотами образования соединений трех
рядов [, Ши [Ш сходных веществ (схема) [1]
а —
в кристаллическом состоянии; 6 — в концентрированном растворе;
в — в бесконечно разбавленном растворе
чым свойством, разумеется, можно лишь в первом приближении (см. также стр. 208), так как точка пересечения прямых хотя и удалена, но не
чаходится в бесконечности. Иными словами, величина А, меняется от
одного ряда к другому (значение А, увелио ав
.
чивается
с увеличением радиуса ионов вслед(5558) 10x Е
ив)’
ствие возрастания их поляризации). В предельном случае постоянства разности значений
Е
свойств соответствующих веществ, т.е.
при справедливости для всех рядов уравнения (УПТ, 1), в котором А,=1, точка схода
прямых
оказывается в бесконечности. Вышеизложенное в схематической форме иллюстрирует рис. 166 на примере теплот образования. В случае рис. 166, б не следует
ожидать, что точки хорошо лягут на прямые,
так как в сравнимых условиях растворы
должны быть при одинаковых активностях,
а не при одинаковых концентрациях.
Параллельность прямых, как упоминалось в главе 1, наблюдается для свойств электролитов в бесконечно разбавленных
yp |
„|
on |
раство-
логенидов
(сказывается особенность
иона
фтора), но все же она параллельна остальным,
так
как
различное
влияние
фтора,
7
io +
7
pax (cm. рис. 166, в). В этом случае выпадения
точек ни для рядов веществ, ни для отдельных веществ не наблюдается. Так, хотя на
рис. 167 линия для фторидов по-прежнему
несколько удалена от линий для других га-
и
Рис.
11
167.
и
У
oY
YW
я
20
90
(5° 4
298 ах
Взаимосвязь
СТандартной
)
энтропией
rT;
между
о
65593
(9.е.) в бесконечно разбавленя прия Ш галогенидов других
элементов
подгруппы лития [7]
проявляющееся в кристаллических фторидах
и отчастив концентрированных растворах его солей, не проявляется
в бесконечно разбавленных растворах, где взаимодействие между ионами исключено. (ср. рис. 167 с рис. 153, 6). В качестве примера, аналогичного приведенному на рис. 167, можно было бы указать на взаимосвязь между
значениями суммарного изобарного потенциала гидратации Met u X,
рекомендованными в [62].
219
43-х
Г
6,9|-
2,0-
J
|.
/7
/
m
a
10
yl
i,
и’
//
yl
—
/
W и
yl 47
Г
Г
7,
=
ии
\
40
Yl
AO
7a
Ke.
'
a
ии“
YUL
7 47
|.
ИИ
г
-
fly! GC
fly! fC
Mtl
‘GY 7
a
05
//
=
Я
17
Uy’ 7
yy?7
ih
a
VialoO
-
J.
[-
pop
0
Y 4
4
"О
О
ОО ОО ОО О
05
АО
ООО ООО ООО
ООО ООО ООО ООО ОО ООО
1,0
1,9
2,0
aso.
Puc. 168. Bsaumocaa3p. MexTy 3HATeCHHAMM Me?/KATOMHEIX paccTOAHHH d5__x (A)
для
углерода >
С — Х и некоторых газообразных соединений углерода
SC — X uw = С-—_Х иэлементов подгруппы углерода [67]
Г
В
10
08
0,6
од
0,2
[_
l
i
4
|
0,8
ГОН
Г
|
10
\
Рис. 169. Взаимосвязь между ковалентными радиусами г (А) некоторых
элементов второго периода при различной кратности связи [22]
Здесь уместно отметить, что применение аддитивных схем для расчета
свойств кристаллических веществ в общем случае не дает точных результатов. Это относится не только к объему, но, например, и к энтропии.
О не-
возможности применения аддитивного метода расчета для энтропии (см.
[63]) свидетельствует некоторое несовпадение значений энтропий кристаллических ионов, рекомендованных в различных работах, посвященных
аддитивному расчету этой функции [64 —6ба]. Неприменимость уравнения (Г, 76) для 5 видна и из рис. 158, показывающего, что энтропия относится к свойствам, для которых скорее справедливо уравнение
(УП,
1),
чем (Г, 76). К сожалению,
ограниченность и недостаточная точность
экспериментальных данных не делает это суждение бесспорным. Однако
из рис. 153 все же можно заключить, что приписывание — в отличие от
состояния в бесконечно разбавленном растворе (см., например, рис. 167)—
каждому иону в кристаллическом состоянии постоянного значения энтропии является не очень точным. Даже для чисто ионных соединений энтропия данного иона зависит от состояния его электронной оболочки, которое может быть различным в зависимости от поляризующего действия соседних ионов. Однако это не исключает параллелизма в изменении состояния электронной оболочки для сходных атомов, о чем свидетельствует
как прямизна соответствующих линий на рис. 153, так и их пересечение
практически в одной точке.
Приведем еще два примера предельного случая соотношения (У, 1),
когда
ВБ, =
0.
Рис. 168 построен по данным,
зв работе,
посвященной
типам
рекомендованным
химической
связи
В. М. Татевским
атомов
и
[67]
межатомным
расстояниям в молекулах галоидопроизводных. Как видно из чертежа,
три типа связи углерод — галоген образуют взаимосвязанную систему
значений. Высота и ширина прямоугольника отвечают колебаниям межатомных расстояний, обусловленных влиянием атомов, непосредственно не
участвующих в образовании данной связи.
О существовании аналогичных закономерностей в ковалентных радиусах в зависимости от кратности связи свидетельствует рис. 169 (см. также [68].
Примером подобного рода зависимостей для комплекса. свойств могут
служить взаимосвязи, найденные в работе [69], посвященной энергии
диссоциации органических молекул.
В другом предельном случае, когда величины 4, и В! в соотношении
(УПТ, 1) можно считать не зависящими от природы ряда, линии для нескольких рядов веществ практически сливаются в одну.
Примером подобного случая является температура плавления высших
членов гомологических рядов родственных соединений. Так как особенность каждого гомологического ряда в группе нескольких подобных рядов
с увеличением числа атомов углерода п будет стираться,
значений
п можно
tun, рассмотренного
предположить
примерное
совпадение
в форме, соответствующей уравнению
то для больших
хода
в величинах
(1,65). Это под-
тверждает рис. 170, из которого видно, что точки плавления высших членов восьми различных гомологических рядов в первом приближении ло-
жатся
на
общую
прямую.
Последней
отвечает
(ton)m+1 = 0,935 (пл )т +
приближенное
0,6,
уравнение
(VIII, 11)
в котором индекс т относится к четным членам данного гомологического
ряда, а индекс т -- 1 —к нечетным членам ряда. Уравнение (УПТ, 11),
давая для легкоплавких веществ лишь ориентировочные результаты (см.
левый нижний
угол на рис.
170), вполне
удовлетворительно
согласуется
с опытом для высших углеводородов. Следует заметить, что наибольшие
отклонения показывают углеводороды тех гомологических рядов, для
которых значения Ё&л рекомендованы с небольшой точностью (—1°) [1].
221
Еще один пример, свидетельствующий о том, что для родственных веществ в первом приближении можно считать, что значения Ати В, в соотношении
лить
(УТ, 1) не зависят
наиболее
(я)
сходные
ряды.
от вида ряда, тем более, если из них
На
рис.
174
сопоставлены
25
50
точки
выде-
кипения
Tob
50
-50
-25
д
1
|
1
]
75
1
(Loi 7 п
Рис. 170. Взаимосвязь между температурами плавления #1; (°С) при
Р = 1 атм углеводородов с нечетными (т -|- 1) и четными (т) числами атомов углерода в некоторых гомологических рядах [70]
О — н-алканы;
®
килциклопентаны;
—
1-алкены;
Ф —
2-метилалканы;
@ — и-алкилциклогексаны;
килнафталины
© —
1-алкины;
@ — н-алкилбензолы;
Ф — н-ал-
©— н-ал-
т.к В различных гомологических рядах; применение уравнения, аналогичного (1,65), даже для самых различных веществ (прямая Г) позволяет
определить примерные значения температур кипения
этих веществ. На
рис. 172 нанесены значения плотности 4+’
различных веществ. Аналогич-
ные результаты наблюдаются и для показателя преломления п?
[1].
Хотя и в данном случае выделение сходных соединений приводит к повышению точности результатов, однако, как видно из чертежа, данные, относящиеся
к различным
гомологическим
рядам,
группируются
вдоль
одной прямой. Последнее интересно еще и потому, что п и 4, в отличие
ОТ тк. В ОДНИХ рядах растут, а в других падают.
Практическая независимость от природы металла знаменателя в экспоненциальном выражении для энергии отталкивания при сопоставлении
этого свойства у любых двух галогенидов (например, хлоридов и бромидов)
следует из данных, найденных
в [73—76].
О закономерности
изменение
Выяснение
в расположении прямых
закономерности
коэффициента
А,
в
в соотношении
расположении
(УПТ,
прямых,
14), представляет
т.
е.
суще-
ственный интерес, потому что здесь, как и в расположении точек на каж223
дой прямой, проявляется характер связи данного свойства с тем или иным.
физическим параметром. Это имеет и большое практическое значение,
так как позволяет оценить значение данного свойства, располагая огра-ниченным опытным материалом.
|
|
(нтк)
т
Рис. 171. Взаимосвязь между нормальными температурами кипения #,
(°С) в гомологических рядах соединений с четным (т) и нечетным (т -- 1) числом атомов углерода
[70—72]
А — н-алканыы;
Б — н-алканы, 2-метилалканы, 3-метилалканы, 1-алкены, 1-алкины;
углеводороды; Г — различные органические вещества
В — различные
Очевидно, наклон прямых определяется тем же, что и дискретность
расиоложения точек на каждой прямой. Это следует хотя бы из взаимосвязи рис. 147, а и 147, 6; каждый из этих чертежей можно рассматривать
как результат поворота
другого на 90°.
223.
Наклон прямых удобно выражать по отношению к наклону прямой
для стандартного ряда, так как для последнего А ‚= 1. Отклонение прямой относительно угла в 45°, соответствующего при равномасштабных
шкалах стандартному ряду, будет тем значительнее, чем больше данный
ряд отличается от стандартного, т. е. чем больше различаются свойства
частей молекул, которыми этот ряд отличается от стандартного. Очевидно
4”),
095|-
090-
0,80у
0,755
,
i
0,70
t
0,75
|
0,80
{
0,85
|
9,90
0,95 (dy),
Рис. 172. Взаимосвязь между плотностью ae (г/см3) различных гомологических рядов
углеводородов с четным (т) и нечетным (т -- 1) числом атомов углерода [70]
Ф —
1-алкилнафталины;
алканы;
Ф — 2-алкилнафталины;
© —н-алкилциклопентаны;
® — 1-алкины;
©
-О-;— 1-алкантиолы;
@ — н-алкилциклогексаны;
— н-моноалкилбензолы;
®
—
© — н-алканы;
@Ф — {-алкены;
1-н-моноалкилнафталины;
6 — 2-метил-
© — цис-2-алкены
XO — 2-алкантиолы
также, что величина А, всегда будет линейной функцией значения свойства С в соответствующем ряду веществ. В качестве аргумента при ана-
лизе
метр
мых
изменения
коэффициента
наклона
А,
целесообразно
выбрать
пара-
вещества 2 тех частей, которыми отличаются молекулы сопоставляерядов, т. е. рассматривать зависимость
А: =Ф (2).
(УП. 12)
Зная эту зависимость в явном виде, можно предсказать отсутствующие
величины (в том числе экстраполяцией), располагая минимальным количеством исходных данных, в частности можно оценить значения рассматриваемого свойства в ряду совершенно неизученных веществ.
В
простейшем
отношения
224
случае
зависимость
A, =a-+
(УПТ,
bg.
12)
имеет
вид
линейного
со-
(VITI,13)
Для некоторых ранее рассмотренных свойств зависимость (УПТ, 12)
приведена
на рис. 173. Как видно из этого чертежа, в ряде случаев она
имеет вид уравнения (УТ, 13), в котором # = г. Например, для У, зна-
чения
коэффициента
одинаковы, т.
это позволяет
пы лития по
Переход от
в уравнении
(УПТ,
13) как для
А
так и для МеС]
=а-+- 68
(УП1,14)
в ряде случаев позволяет расширить интервал
зависимости (УПТ, 12) [77] (см. главу IX).
возможности
А,
A,
47-6
13
Te,
{
21
Пион
07
12
|.
—
—
7 07
[1
F
ff
ГО
)
15
Коэффициент 41 соотношения (УП,
4
{i
19
G8
|
23
95
Пон
применения
Е
—
16}-
J
7/7
09
'
Рис. 173.
КХ,
е. линии А, — гм. и А! — гу, практически параллельны;
вычислить значения мольных объемов галогенидов подгрупминимальному числу энспериментальных данных.
уравнения (УПТ, 13) к уравнению
Al
In
Ga
{|
09
|
Tl
13
|
17
21
NY
Puen
1) в зависимости от значения параметра
вещества для некоторых свойств
а — рис.
150;
6 — рис.
151;
в — рис.
160
Для аддитивных свойств, когда значения А, в соотношении (УП, 1)
для всех сопоставляемых рядов одинаковы (см., например, рис. 167),
закономерное расположение прямых будет выражаться в закономерном
изменении расстояний между ними. Так, для зависимостей, представленных на рис. 167, следует говорить о связи между изменениями ба И Гме.
Пересечение прямых, отвечающих сопоставлению значений данного
свойства в нескольких рядах веществ, отмечалось в ряде работ [78—81],
однако почти всегда мимоходом.
выражающие
ряда,
Е. Н.
зависимость энтропии
сходятся
в
одной
точке.
Гапон
катионов
Ряд
[82] установил, что прямые,
данного
подобных
периода
от их за-
закономерностей
нашел
Н. С. Спиро [83]. Ю. М. Голутвин в работе [84], посвященной термохимическим радиусам и теплотам образования гексааммиакат-ионов, обнаружил приближенную линейную зависимость вида
AH =k-y +,
(VIII, 15)
где AH — теплота присоединения молекул МН. к катиону, ау — в одном случае отношение радиуса катиона к рефракции аниона, в другом —
отношение произведения радиуса катиона на его заряд к радиусу аниона,
в третьем — радиус катиона. При этом в первых двух случаях оказалось,
что константа пропорциональности Ё выражается уравнением вида (УПТ,13),
в котором у — рефракция аниона (первый случай) и радиус аниона
(второй случай). В. В. Фомин [85] отметил связь между коэффициентом
А, в уравнении для С = АН (галогениды) и межатомным расстоянием.
В работе [86], посвященной плотности некоторых соединений, рассмотрен ход наклона прямых, а в исследованиях по мольным объемам
[87] и рефракции [88] — ход обоих коэффициентов соотношения (УПТ, 1).
15 м. Х. Карапетьянц
225
В заключение следует подчеркнуть, что критерием закономерного изменения наклона @; — Ст-прямых не является обязательность их пересече-
ния в одной точке.
жении
или
уменьшаются
же
1.
Поэтому,
совсем
если это имеет место лишь
не наблюдается,
возможности
в первом прибли-
расчета
все же
не
Если сопоставление свойств двух рядов веществ можно осуществить
для нескольких десятков свойств (см. главу Г), то распространение первого метода сравнительного расчета с двух на несколько рядов в настоящее время можно показать лишь на немногих примерах.
Так, к рассмотренным или упомянутым выше примерам можно было бы прибавить еще лишь несколько: энергия образования`из газообразных ионов при 0°К для галогенидов щелочных металлов (по данным
[89]), стандартная суммарная энергия гидратации ионов этих соединений
(по данным [62]), термические эффекты солевого обмена (по данным [90].
Параллелизм в свойствах летучих гидридов некоторых элементов подгруппы углерода непосредственно следует из данных, приведенных в [91].
В работах В.М. Татевского с соавторами [92, 93] соотношение (УПТ, 1)
применено к расчету межатомных расстояний, поляризуемости ионов и
дипольным моментам молекул галогенидов различных элементов.
Если учесть некоторую неаддитивность межатомных расстояний в газообразных молекулах (см., например, рис. 156 и 157), то вероятно можно
несколько
уточнить
значения
[94]. Учет отклонения прямых
о
энергии
решеток
и для
мег,
рекомендованные
для А.Х
соединений
лития
позволил
[95].
в работах
бы уточнить
[92]
и
значения
Сравнительно небольшое число рассмотренных примеров распространения первого метода сравнительного расчета на несколько рядов обусловлено как отсутствием в настоящее время соответствующих опытных данных, так и возрастанием влияния различных факторов (см. стр. 14) при
переходе с двух на большее число рядов.
ВТОРОЙ
МЕТОД
Рассмотрим
шения (11,1)
СРАВНИТЕЛЬНОГО
прежде
всего
РАСЧЕТА
примеры
распространения
G’ = A,G’ + Ba,
соотно(VIII, 16)
в котором сравниваются значения свойств С’ и С”’, с двух свойств на больmee их число. Однако такое распространение весьма ограничено (за единичными исключениями аддитивных свойств). Поэтому мы рассмотрим
распространение соотношения (УПТ, 16) с одного ряда сходных веществ
на несколько рядов. Степень соблюдения соотношения (УПТ, 16) будет
зависеть от сходства рядов веществ, а расположение точек на прямых —
от природы
веществ
Различные
и сравниваемых
примеры
сопоставления
свойств.
значений
двух
свойств
в несколь-
ких рядах веществ приведены на рис. 174—181 в последовательности, соответствующей принятой при изложении материала предшествующих глав.
Рис. 174, на котором сравниваются показатели преломления и плотности (см. стр. 77 и рис. 79) в нескольких гомологических рядах углеводородов [96], иллюстрирует соотношение (УПТ, 16) на примере макросвойств чистого вещества. Графики, подобные изображенным на рис. 174,
позволяют судить о принадлежности вещества к тому или иному гомологическому ряду. Координаты точки пересечения прямых соответствуют
предельным значениям сравниваемых свойств
do. = 1,4152). Практическое совпадение этой
1 См. главу ХГ (стр. 351 сл.).
226
при М = со (пь = 0,8513;
точки для разнообразных
20
148r,
TAT
у
1“6Г1
THO
7
ay
143
142
Lut
7
Г
1,39
1,38
0.67
0,70
0,73
0,76
0,82
0,79
‚8
20
0,
Doa
Рис. 174. Взаимосвязь между показателем преломления „=; и плотностью d,’ (2/cm3)
в некоторых
А —
2-метилалканы;
Е —
гомологических
рядах углеводородов
Б — 14-алкены;
В — н-алканы;
Р — 1-алкины;
1-алкантиолы. Цифры на прямых — число атомов
[71]
Д — н-алкилциклонентаны
углерода
гомологических рядов свидетельствует о независимости предельных значений п и Д от вида рассматриваемого ряда. В соответствии с уравнением
Смиттенберга и Мулдера [97, 98]
G =a—
они равны
значениям
константы
(VIII,17)
о
c+n
а для этих свойств
(см. также
[99, 400].
Так как линии, изображенные на рис. 174, имеют различный наклон,
так называемый интерцепт рефракции (104, 102]
R=n—0,5d
хотя и полезен
на неточном
для характеристики
предположении
[96].
углеводородов
то
(VIII,18)
[403],
однако
15
*
основан
227
сталей
различных
и износостойкостью
твердостью
между
Взаимосвязь
[104] служит другим примером распространения второго метода сравнительного расчета с двух рядов сходных веществ на большее их число.
Рис. 115 и 176 иллюстрируют распространение (УТ, 16) на несколько
рядов сходных объектов на примере микросвойств. На первом из них показана взаимосвязь
между
“4
L-t
S
4-
п --
7
„И
ЗЕ
9
J
Br
Cl
F
Tam
радиусами атомов и отрицаионов
заряженных
тельно
|-
|.
д
740
|
U0
20
и
2,0
15
О —
[105]
и подгруппам
по рядам
14
1.6
18
=)
}
l
{
ба
2.0
22
Гуен
Рис. 176. Взаимосвязь между ионными
и атомными радиусами г(А) галогенидов
подгрунпы бериллия [106]
Рис. 175. Взаимосвязь между атомными
иионными радиусами г(А) элементов по
некоторым рядам и подгруппам’ периодической системы элементов Д. И. Менделеева
1
J
i
\
1,2
20 Г
15
10
705
—!
1
1
10
|
по
Гальдшмидту;
системы
периодической
® — по
Полингу
прямая
элементов;
для
подгруппы углерода несколько выпадает. На втором графике аналогичное сопоставление осуществлено для галогенидов подгруппы бериллия.
Подобную
Пример
зависимость можно
сочетания
макро-
найти
в [107], где принято,
и микросвойств
ствованном из статьи [108]. Здесь
изводных н-алканов представлено
показан
на
рис.
что А, =1.
177,
заим-
поверхностное натяжение галоидопров зависимости от величины ковалент-
ного радиуса атомов водорода и галогенов. Этот график напоминает рис. 174;
пересечение прямых отвечает значению см
Для
свойств,
описываемых
уравнением
а = А.М" -
=32,6 дин/см (см.также [109]).
Bao,
(УПТ,19)
мы бы получили пучок прямых, сходящихся в точке с координатами
М = со, С = С...
Примером применения соотношения (УПТ, 16) для растворов служат
зависимости растворимости солей от диэлектрической проницаемости
растворителя [440], теплоты гидратации от радиуса иона [441], лиотроп-
ных
свойств анионов в растворе от их спектральных свойств [412].
Пример сочетания макросвойства с характеристикой фазового прев-
ращения представлен на рис. 1768.
На рис. 179 сравнивается характеристика фазового превращения чистого вещества с комплексным свойством. Этот чертеж, в основу которого
положены
данные,
найденные
в работе
[114], представляет
пример,
когда
одна С” — (’-прямая расчленяется на две части. В данном случае это
обусловлено тем, что каждая из сопоставляемых величин в гомологическом ряду меняется немонотонно (см. главу Г, стр. 45 сл.).
228
0
20
13
10
L
600
~-2nt+1
900
1
17008
Пл
Рис. 178. Взаимосвязь между температурой плавления #1. (°С) при
давлении {
6(зрг/см?) галоидпроизводных
С.Н.
n°
800
о
Рис. 177. Взаимосвязь между радиусами г (А) атомов водорода и галогенов и поверхностным натяжением
н-алканов
1
700
атм
и
показателями
преломления
п галогенидов
натрия, калия, рубидияи цезия [113]
..Х [108]
0,07
0.06
005
004
“220,
“186
-140
“100*
__
Z
Рис.
Ч
179. Взаимосвязь
плавления
пической
6
8
между
-bGt
12
10
4H,
теплотой
АНгх (ккал/моль) и криоско-
постояной К для некоторых
н-алканов С„Н„.. [114]
ys
10 11 12 1391
Рис.
180.
Взаимосвязь
между
ионизацион-
ными потенциалами / (ккал/моль) атомов
иода, брома и хлора и стандартными теплотами образования АН».з (ккал/моль) галогенидов элементов подгруппы бериллия и
двухвалентного железа [1]
о
Теперь приведем примеры для случаев химического взаимодействия.
На рис. 180 стандартные теплоты образования галогенидов подгруппы
бериллия сопоставляются с потенциалами ионизации галогенов. Здесь же
для сравнения приведены данные для ЕРеХ.,; точки для последних также
оказываются на прямой, но она не проходит через общую для других галогенидов точку пересечения — сказываются отличия в природе Ме”*.
О системе прямых можно говорить и на основании данных, полученных в
[41151. Наряду с этим можно было бы привести и другие примеры, в частности связь, установленную в [114]. Найденная в работе [146] зависимость между потенциалами ионизации и силовыми постоянными в рядах
ЭХ
(9 = С, 51, Це;
Х =
0, 5, 5е, Те)
также
соответствует
совокупности
линий, которые при своем продолжении сходятся примерно в одну точку.
Из рассмотренных примеров видно, что расположение точек может
быть различным: сочетание сходящихся прямых с параллельными (например, рис. 177 и 180), сочетание сходящихся прямых с кривыми (рис. 178).
Возможны случаи, когда линии для различных групп веществ будут параллельны. Это будет, в частности, в тех случаях, когда в гомологических
рядах свойства С(’и С” с молекулярным весом меняются линейно, при-
чем
обе прямые имеют одинаковый наклон.
‚Наконец на рис. 181 представлен пример, соответствующий уравнению (Ш, 6), когда несколько линий практически сливаются в одну. В данном случае это обусловлено сходством н-алканов и 2-метилалканов, приводящим к близким значениям коэффициентов Аз и В. в уравнении (П, 6).
Другим примером слияния нескольких прямых в одну могут служить
данные по кинетике процесса переноса протона (см., например, [117,
118]). Здесь все точки, независимо от природы основания, оказываются
примерно на одной прямой. Это говорит о том, что во всех случаях наи-
более медленной ступенью процесса является переход протона от кислоты
к основанию.
|
Как видно
из рассмотренных примеров, а также из рис. 1 B [37] и
рис. 178, распространение второго метода сравнительного расчета с одного сходного ряда на несколько рядов в общем случае не приводит к
столь простым и однотипным зависимостям, как это наблюдалось при аналогичном расширении первого метода расчета (см. главу Г). По-видимому,
это обусловлено тем, что во втором методе изменяются два разных свойства, а в первом —лишь одно.
ТРЕТИЙ
МЕТОД
СРАВНИТЕЛЬНОГО
РАСЧЕТА
Рассмотрим на нескольких примерах распространение соотношения (ПТ, 1) с двух на большее число значений параметра условий П,
т. е. применение соотношения
|
Сп, = Азби, - В»,
в
котором
Е=
(VIII,20)
2,3....
Произведя построение, аналогичное осуществленному при распространении уравнения (Т, 1) с двух рядов на несколько, получим зависимость,
представленную
чает значению
в схематическом
Сп,,
отложенному
виде на рис. 182.
на абсциссе,
Линия
1—92—3
т. е. аргументу
отве-
уравне-
ния (УП,20) (в дальнейшем значение Ш, будем называть стандартным).
Линия 4—65——6 соответствует значению того же свойства при Л = П..
Эти прямые при своем продолжении пересекутся, так как различие в
свойстве данного вещества при П\ и П. в общем случае зависит от природы вещества. Линия 7—8—9 отвечает значению С при Пз. Эта ли-
ния,
что
очевидно,
также
пересечется
с прямой
1—2— 3.
Будем
считать,
в первом приближении все три прямых сойдутся в одной точке (0).
Подобно тому, как отклонения в значениях С для первых членов ряда
при переходе к нескольким рядам сходных веществ позволяют придать
230
им количественный характер, так и распространение рассматриваемого
метода с двух значений Л на несколько дает возможность учесть эти отклонения. Хотя по мере удаления от стандартного значения ИП! отклонения
первых членов будут возрастать, однако выпадающие точки в свою очередь образуют линию, близкую к прямой.
Очевидно, распространение третьего метода на несколько значений П
дает возможность найти значение рассматриваемого свойства многих веществ при данном значении ГП, располагая им
только
пля
одного
вещества ряда.
G,
1977
2,1 |-
2,3|-
2,5 |[-
2,7
|
0
[
|
10
|
2,0
| 5
gr
р
Рис. 181. Взаимосвязь
между: логарифмами давлений насыщенного пара
Р (мм рт. ст.) и логарифмами вязкости 1(слз) некоторых алканов [70]
‘O —
н-алканы;
п —
число
® —
2-метилалканы;
атомов
углерода
|
3,0
on,
Рис. 182. Взаимосвязь между значениями свойства С
‚в ряду
сходных
веществ
Г, №, М при трех значениях
Ш, П2 и Пз переменного
па.,
раметра условий П (схема)
Все это видно на рис. 183—186, на которых сопоставляются значения
различных свойств в разных функциональных шкалах и для различных
параметров
условий.
На рис. 183 сравниваются вязкости галогенопроизводных бензола при
различных температурах. Необходимые для построения этого чертежа
данные найдены интерполяцией значений п, заимствованных из [1419].
Точки для С,НьК образуют прямую, не параллельную остальным. Поэтому, если, например, располагая температурной зависимостью вязкости С.Н,
и С,Н,Вг, необходимо найти эту зависимость для С.Н,Е, то
для этого достаточно иметь значения Пснк при двух температурах.
На рис. 184 показана взаимосвязь между теплопроводностью инертных газов при 0,100, 200, 400, 500°Си теплопроводностью этих веществ при
300° С,
найденная
путем интерполяции
экспериментальных
данных
Л. С. Зайцевой
ной прямой.
[120]. Точки для гелия оказываются лежащими
на наклон-
Рис. 185 и 186 иллюстрируют соотношение (У, 20) на примере ряда
веществ, представляющих последовательно замещенные одного соедине-
ния.
В подобных
случаях
отклонения наблюдаются для двух членов ряда,
каждый из которых в отличие от других содержит атомы только двух элементов. Но и здесь точки на крайних линиях располагаются на прямых.
Для растворов (смесей) параметром условий может быть как температура (давление), так и концентрация. На одном примере возможность варьирования показана на рис. 187 и 188. На обоих чертежах представлены
данные по диэлектрической проницаемости одноосновных алифатических
спиртов, но на первом в качестве П принята температура, а на втором—
231
(77-100),
24
22+
Сон.
Сон. Вг
СН.
2, Xe Kr Ar
10 }
25Е
}
2.0}
rat
16
.
[|
20+
|
|
rab
15,
| |
i |
| !
|
12
104
10b 1
||
|
08
? |
oT
04|
|i
|
YG
02
0
Рис.
| |
|
O6r
183.
Взаимосвязь
между
вяз-
костью {-10? (пз) фтор-, хлор-, броми иодбензола при 30° С и различных
температурах [119]
CH,F
о) СН
(бр)
+
og
Я
10
у
15
у
20
2
Рис. 184. Взаимосвязь между коэффициентами
теплопроводности
А-10? ксенона, криптона,
аргона,
неона и гелия при 300°С и при
различных температурах [120]
CH.F,
se
24
90
22
60
60
70
60
1
I
1
|
1
1
18
1
{
bone
20
(C3) 600°к
Рис. 185. Взаимосвязь между стандартными теплоемкостями С р,(кал/град. моль)
метана, фторметана, дифторметана, трифторметана и тетрафторметана при 600°К
и различных температурах
[121]
Рис. 186. Взаимосвязь между стандартными
энтропиями 5” (э. е.) метана, фтор-, ди-
фтор-,
трифтор-
и
тетрафторметана
600°К. и различных температурах
при
[121]
8, _
5
by
C5
Cy
C,
35
|-
oS
30. L
;
Г
.
130-С,
Г
-
u30-C,
и
г
L
20h
7
u30-C, |
Г прет-с,
15|
-
‚ИИ
с ^
a
10
187.
Рис.
,
&
=
,
by
A
Ay
;
т
й
OZ
@
1
pop
7,
pt
tp
15
tt
ft
20
25
30
Go
2 20°с
проницаемостью & некоторых
диэлектрической
между
Взаимосвязь
спиртов С„Н.„.ОН при 20° С и различных температурах [122]
©—н-спирты
=
5
=.
=”
os
<
5 657
=
=
=.
=
5
<=
ao
3
@—разветвленные
спирты
=r
=
70r
a
——
_
i
60
/
т
ко
7
.
80
oy
oY
иК
7
7"
f
7
|.
ОЕ
7
vo
t
|.
29
/
a TE
a
и
aT
Pass
agen
ии
coe
Г
7
/
oor
40+
50
I
40
4
20
O50 YoH 20
[
000
60
” 001
между диэлекРис. 188. Взаимосвязь
& водных
проницаемостью
‘трической
растворов метилового, этилового, н-про-
пилового
50%-ной
и н-бутилового
концентрации
концентрациях
спиртов
при
и различных
[1]
0
1
P90
10
Рис. 189. Взаимосвязь между давлениями насыщенного
пара
Р (мм рт. ст.)
о
некоторых н-алканов С„Нои„.о при 30° С
и при различных температурах
[70]
концентрация.
В обоих
случаях
точки
для СН.ОН
располагаются
на ли-
нии, не совпадающей с вертикалью. Точки для изомерных спиртов также
ложатся не на вертикальные прямые (рис. 187).
Случай
фазового
равновесия
одним примером на рис. 189.
Возможны
предельные
в однокомпонентной
случаи,
когда
в
системе
соотношении
А; = 1 или В. = 0. Один из примеров второго предельного
ставлен на рис. 190. Здесь, так же
как
и
в;
многих
отношении
представлен
(УПТ,
19)
или
случая пред-
других
свойств, последовательность Си —Аз—
Ал нарушается, с чем мы уже сталкивались ранее (стр. 53).
р и
Си
Au
Ag
2
4
д
i
L
р
500 1000 1500
Eu ooa wojeme
бд
19
Рис. .190. Взаимосвязь”"между термоэлек-
тродвижущей силой 'Е р*108 (в) «термопары давления» меди, серебра и золота
при 4000 хг/см? и различных давлениях
(кг/см?) [123]
Рис. 191.
от
L
1
50
10000
_t
‘15000
р
Зависимость“ коэффициента
Аз
значения
переменного параметра И
для некоторых . ранее } рассмотренных
примеров
‚а —
184; 6 — рис. 188; в— рис. 189;
г —
рис.
190
Возможности оценки малоизученных свойств станут значительно большими, если учесть, что величина А. обычно закономерно изменяется Cc I.
Характер зависимости
As= (II)
(VIII, 21)
может быть различным. Как видно из рис. 191, где эта зависимость показана на некоторых из ранее рассмотренных примеров, в ряде случаев она
имеет
вид
линейного
соотношения
Аз=а
ВП.
(VIII,22)
Так как в соотношении (У Ш, 24) в отличие от (У, 12) значение аргумента может меняться непрерывно, то и расположение наклонных прямых
на графике вида рис. 180 может быть в известных границах произвольным.
234
в которых
работы,
Известны
зависимость
(ТУ, 2) для гомологиче-
вида
ских рядов отвечает совокупности прямых, сходящихся при своем продолжении примерно в одну точку. Из последнего непосредственно следует
линейное соотношение, отвечающее третьему методу сравнительного расчета. Так, в [124] было показано, что для описания температурной зависимости теплоемкости газов можно рекомендовать в широком интервале
о
1
температур уравнение типа уравнения Антуана, т. е. Ср= (=) ‚ причем константа с для данного гомологического ряда постоянна. Сечение
прямых,
стему
из
каждая
одну
в
‚ сходящихся
Сь = (=)
прямых
точку, изотермами,
дает
си
соотношению
Ш,
1).
соответствует
которых
Другим примером могут служить данные, найденные в работе [125]. Если
[126, 127] для температурной
ф-шкалу
построить
вязкости
зависимости
в
ряду изоструктурных веществ, то изотермические разрезы этого графика
дадут прямые, каждая из которых будет соответствовать сопоставлению
значений вязкости ряда веществ при двух температурах (см. также раздел, посвященный шестому методу сравнительного расчета). Аналогичный
пример можно привести на основании данных, полученных в работе [128].
Располагая связью (УТ, 24), можно решить задачу расчета значений
Сп, независимо от того, пересекаются прямые или нет.
На одном примере распространение третьего метода сравнительного
расчета с двух значений параметра условий на большее их число рассмот-
рено в [129] (см. главу [Х).
ЧЕТВЕРТЫЙ
МЕТОД: СРАВНИТЕЛЬНОГО
РАСЧЕТА
1
Распространим соотношение (ТУ, 1), в котором сравниваются
значения свойства С двух веществ в зависимости от значения параметра
условий П, с двух веществ на большее их число, т.е. воспользуемся соотношением
Gi = AyGy+ Bi,
(УПТ,23)
в
котором
# =
М,
L,...
|
Это означает, что на ось ординат (см. рис: 192) наряду с зависимостью
Got I для исследуемого (прямая М) и стандартного (пунктирная прямая М)
веществ должна быть нанесена аналогичная зависимость и для третьего
вещества [.. В общем случае первые две прямые не будут параллельны,
так как различие в значениях свойств двух веществ зависит от значения
параметра условий Л *. По этой причине прямая для вещества Г, пересечет
прямую для вещества М. Предположим, что обе точки пересечения практически совпадут. Распространим эти рассуждения на большее число
веществ. Таким образом, если сопоставление свойств двух веществ не
обязательно
связано
с их сходством,
то необходимым
(но не достаточным)
условием пересечения прямых при распространении четвертого метода
на несколько веществ является образование этими веществами ряда сходных соединений (см. ниже). По мотивам, аналогичным изложенным на
стр.
206,
можно
предположить,
что
вещество,
несколько
отличающееся
от остальных членов ряда, на графике вида рис. 192 будет представлено
прямой,
жении
расположенной
в стороне
от других
эта линия не попадает в общую
прямых.
При
точку пересечения.
своем продол-
1 Так, например, из уравнения (ТУ, 22), записанного для веществ М и М, следует,
что только при условии, когда (АНпар)м = (АН пар)» величина 12Р— IgPy практически не зависит от температуры (см. стр. 166).
235
Сопоставление
значений
свойств
нескольких
веществ,
схематически
представленное на рис. 192, показано на нескольких примерах на рис.
193—197.
На
рис. 193 представлены данные по температурной зависимости
вязкости моногалогензамещенных бензола (ЛП = 1. Точка пересечения
прямых для СёеН;5У, С6Н Вт и СН,
;
общая; прямая для СьН ‚Е расположе0 he, .
на
мер,
несколько
в стороне.
также
случая,
;
На рис. 194 приведен другой придля
когда
И =
22
&.
”
Здесь сравнивается энтальпия газооб-
20.
несколько
отклоняется
ных, Сходство веществ
от остальпроявляется
ВЕ
в том, что значения ЛЁ, для них
также оказываются на одной прямой.
Lr
разных спиртов. Прямая
для СН.ОН
G
,
тм
1,2 |
1,0b
об
Gor
РИ
7
"yee
ip
0,2
свойствами С вещества М и веществ Ми Г при значениях Пу, 112
Рис.
192.
вязкостью 1-10? (пз) хлорбензола и фтор-, бром- и иодбен-
Рис. 193.
Взаимосвязь
И
переменного
золов
различных
ITs
Взаимосвязь
(схема)
между
параметра
П
при
турах
между
темпера-
¢ (°C) [119]
Рис. 195 и 196 иллюстрируют распространение четвертого метода с
двух веществ на большее их число на примере характеристик фазового
превращения соответственно в одно- и двухкомпонентной системах. Последний чертеж воспроизведен из оригинального исследования [132] с
той лишь разницей, что линии продолжены вправо вверх, где они сходятся
примерно в одной точке. Рис. 195 отвечает распространению уравнения
В.А. Киреева (ТУ, 22) с двух жидкостей на пять (линия для первого члена
ряда расположена несколько в стороне), рис. 196 соответствует аналогичному распространению уравнения (ТУ, 314). Возможно, точнее было бы
считать, что существуют две точки пересечения: одна для четных, а другая — для нечетных членов ряда. На рис. 197 приведен пример характеристики химического процесса — кинетики разложения амальгам щелочных металлов.
Возможны случаи, когда прямые, отвечающие различным значениям
П, сливаются в одну прямую. Это показано на одном примере на рис. 198.
К этому примеру можно было бы прибавить и другие, в частности сравнительные данные по вязкости расплавленных солей: [1.50.-|-КЦи [1.50 .--- ВЪ
по данным
[136]. В подобных
случаях
системы
прямых,
ствующие третьему и четвертому методам сравнительного
тически превращаются в одну прямую.
236
соответ-
расчета, прак-
Для данного ряда веществ и для данного свойства наклон прямых от
вещества к веществу претерпевает определенное изменение. Зависимость
(УПТ,24)
а =\(5)
характер. В ряде случаев
различный
может иметь
рис. 199, д) уравнение (УПТ, 24) принимает вид
А, = а
(см.,
например,
Ь.в.
(VIII,25)
Может наблюдаться и немонотонный ход А.. Так, своеобразное изменение А., представленное на рис. 199, г, связано с немонотонным изменением
некоторых свойств твердых веществ в гомологических рядах (см. главу Г,
0-02 98 200 700 900 T
Но
14001600 |800 | 1000
60-
~
50
40)
90
20
10
1
0
20
J
о
о
90 (НЕ) бон
Рис. 194. Взаимосвязь между
энтальпиями Н° — Е‹
(ккал/моль)
н-пропилового спирта и метилового,
этилового и н-бутилового
спиртов при
различных
температурах
Т (°К) [130, 131]
стр. 46), так как наклон этих прямых в соответствии с уравнением ([У, 92)
определяется отношением теплот плавления соответствующих соединений.
Установление вида зависимости (УПТ, 24) позволяет определить значение
данного
свойства
в некотором
интервале
значений
//,
причем
отпа-
дает необходимость знать хотя бы одно значение этого свойства. Так,
например, можно приближенно оценить температурную зависимость давления насыщенного пара 2-метилоктана, приняв для него (см. рис. 199, д)
А.—1,46.
Следует
подчеркнуть, что справедливость зависимости (У ПТ, 24)
и, тем самым, положительное решение задачи, подобной только что
рассмотренной, совершенно не связаны с тем, пересекаются прямые в одной точке или нет (см. также стр. 352 ел.).
В качестве другого примера укажем на возможность применения уравнения (ТУ, 51) к гомологическим рядам. Были предложены [140] уравнения и графики для расчета теплот парообразования н-алканов, 2-метилалканов, 1-алканов и цикланов, основанные на закономерном изменении
постоянной А. этого уравнения в данном ряду. При этом оказалось, что
в первом приближении (если исключить первые гомологи) можно воспользоваться уравнением (УП, 25), приняв в нем в качестве параметра вещества число атомов углерода в алкильном радикале.
Если, как было видно из ранее изложенного, сопоставлению различных
свойств
ние
двух
подобного
веществ
посвящено
сопоставления
много исследований,
на несколько
веществ
то распростране-
встречается
редко,
237
7
vo
oo
и“
yee
l
г
-90 -20-10 0 102039040 -%
У»
7
й
301
И
2,9
и
2,0
7
/
y
/
7
4, 9
и
y
|.
и
4
ГИ’
у
,
и
/
or,
/¢
sy
у
,
„’
./
Sy
7
и
7 ey’
pL ad
¥/ ee
7
и
yo
ye’
‚”
7
WW
„У“
yo
,
‚”
.
9
3
a”
р
5
?
и
”
“7/1
SY
ии
ИИ
„7
и“
и
и,
7
хо
7
7
7
Lh
MY
/
/
:
/
У,
,
^
„
19
о
15°
20
25 ЧР
Я
CoH,
Рис. 195. Взаимосвязь между давлениями насыщенного пара Р (мм рт. ст.}
2-метилпентана и 2-метилгептана, 2-метилгексана, 2-метилбутана, 2-метилпропана при различных температурах ¢ (°C) [70]
100+
U8
12
16
20
t
80
60
40
20
А
ААА
Ш
лай)
10
0
Рис. 196. Взаимосвязь между рас-
творимостью
ЛМ в циклогексане
пальмитиновой кислоты и некоторых других
одноосновных
жирных кислот при различных температурах #°С) [132]
п —
число
атомов
углерода
тической группе
в
алифаяа-
Рис. 197. Взаимосвязь меж-
ду объемами водорода » (см3)
при
разложении
BOOK
амальгамы калия и амальгам лития, натрия, рубидия
и цезия при различном времени равления 2 (мин.)
1
(4 Haap) uso -C_H
n
Znez
ake
aL
9-Е
7
8
(4 Hnap) GH
9
10
1+2
Рис. 198.1 Взаимосвязь между теплотами парообразования АНп.р
(ккал/моль) некоторых н-алканов С„Н„.. и 2-метилалканов (использованы
данные
O—n=4;
от 1 мм
рт. ст. до
надежными)
@—n=55
26
5 атм, являющиеся
[134, 135]
O~—n=6;
O—n=7;
наиболее
O@O-—-n=8
10
>
7 fm
Puc.
199. Коэффициен.
Ag ypapHenua
(VIII, 24)
B 3aBucumoctTu
oT
параметра вещества в некоторых из ранее рассмотренных примеров
а —
рис.
193; 6 —
рис.
194; в-рис.
197;2 —
рис.
196;
д —
рис.
195
а использование пересечения прямых и закономерного хода их наклона
(в ряду сходных веществ) почти не применяется. Можно назвать лишь единичные исследования по температурной зависимости давления насыщенного
пара, авторы которых в той или иной степени рассматривают несколько
прямых.
К
ним
относятся,
в
частности,
работы
Кокса
[138].
Как
известно,
построение графика Кокса основано на принципе создания такой функциональной шкалы ф (7), в которой выпрямление кривых шРы для стандарт-
50000,
30000 |20000 |7000
---
"т
—
тт"
10000
М
3000+
2000
“110
ae
-100
Рис. 200.
i
-90
i
!
1
80
-70
1
-60-50
"ОИ
-30
‚м.
0
50
би
100
200
1
'
300
“90
Зависимость давления насыщенного пара Р (мм рт. ст.) некоторых
н-алканов от температуры (°С) (график Кокса)
`Двойными кружками отмечены критические
точки.
В левом верхнем
коэффициента наклона прямых А. от числа атомов
углу приведена
углерода п
зависимость
ного вещества приводит к превращению кривых шР в прямые для других веществ. На рис. 200 воспроизведен график Кокса для н-алканов
[139] (см. также [140]). Из него непосредственно следует, что замена на
оси абсцисс температурной шкалы функциональной шкалой давления
насыщенного пара приводит к зависимости вида (ТУ, 22) *. Разрез рис. 200
по вертикалям (изотермам) непосредственно приводит к системе прямых;
каждая из них описывается уравнением, являющимся частным примером
третьего метода сравнительного расчета.
В ряде работ [142—145] рассмотрены вопросы, связанные с точкой
для
в методе Кокса. Ашворт [4146] предложил
пересечения прямых
н-алканов диаграмму, аналогичную графику Кокса, и указал координаты
точки пересечения прямых: 12Р (атм) = 2,68; Т = 1522,5° К.
В некоторых работах отмечалось, что применение правила Дюринга к
гомологическим рядам приводит к системе прямых, пересекающихся в одной точке (см., например, [147, 148]).
Однако ни в одном из этих исследований не рассматривалась закономерность в изменении наклона прямых. Исключение составляет работа
В. А. Киреева [149], в которой указано, что наличие общей точки пересечения прямых для веществ одного класса связано с правилом Трутона (см.
также [150].
1 Следует
отметить,
что мы
не получим результатов, тожкдественных
уравнению
(ТУ, 22), так как, хотя, как показали Калингерт и Дэвис [141], прямым на графике Кок-
са соответствует уравнение
с
ПР =@—т5,
однако,
740
в отличие
от
уравнения
Киреева,
метод
Кокса
является
эмпирическим.
2
Распространим теперь соотношение (ТУ, 40), в котором сравниваются значения параметра условий П двух веществ в зависимости от
значения свойства С, с двух веществ на ббльшее их число. Применение
соотношения
приводит
204).
к
результатам,
аналогичным
T
72 4 16
18
КРИ
И
описанным
Ср
20 21
22
(см.,
23
например,
рис.
eu
800}
600;
400
260
и
_
ffL202
fee"
|
1
2100
1
400
1
600
i
800
1000 I, -
Рис. 201. Взаимосвязь между температурами Т’'(° К) четырехфтористых
углерода, германия и кремния в состоянии идеального газа при различных
значениях теплоемкости Cp (xan/epad+moar)
В
левом
верхнем углу
На рис. 202 в форме,
TN
показан
ход
соответствующей
=
АТ
м! -- B,
(СРх
наклона
[131]
прямых
уравнению
—
СРу),
|
(VIII,27)
представлена температурная зависимость теплоемкости алмаза
[152],
кремния [151, 152, 153], германия [154] и серого олова [154]. Все эти вещества не только входят в одну подгруппу периодической системы элементов, но имеют и одинаковую структуру (кубическая алмазная решетка).
Сходство С, 51, Се иа-5п в отношении рассматриваемой зависимости
проявляется
в том,
что
в функциональной
шкале,
соответствующей
тем-
пературной зависимости теплоемкости одного из этих веществ (в данном
случае 51), точки в сравнительно широком интервале температур образуют
ряд прямых, которые при своем продолжении сходятся примерно в одной
точке '. Эта группа веществ, помимо близости свойств и структуры, своей
многочисленности и точности данных по теплоемкости, представляет
тот интерес, что первый член ряда, который, как мы видели на некоторых
примерах, обычно выпадает из закономерностей, в данном случае практически не представляет исключения.
Это объясняется тем, что по своей структуре, т. е. по фактору, которым
прежде всего определяется зависимость Ср от & для кристаллических веществ, алмаз не является исключением в подгруппе углерода. Другое
дело—
свинец. Нанеся на рис. 202 точки для РЬ
[152, 156], можно было ‘бы
1 Данные для Се, найденные в [155], отличаются от полученных в [154] на десятки
процентов; они не удовлетворяют рассматриваемому соотношению.
16 М..Х. Карапетьянц
241
убедиться, что эта прямая не попадает в точку пересечения остальных
прямых, да и опытные данные (особенно в области высоких температур)
несколько отклоняются от прямой. Это обусловлено в первую очередь тем,
в отличие “от ‘осталь-
что свинец
9
подгруппы углеро-
элементов
ных
да имеет кубическую гранецентрированную решетку. То же дейст-
600|
вительно и для В-5п [152, 157],
имеющего тетрагональную решетку, являющуюся деформированной
.
|
алмазной.
I00F
применения
Продуктивность
(УТТ, 27) подтверждается законо0 —Т-кривых
в ходе
мерностью
(9 — характеристическая темпераИз
веществ.
тура) для сходных
Г
рис. 203 видно, что для сходных
линии С’, = const обравеществ
2
300
9
ц
Чи
45
400
9300
C00,
200
100
A [ss a
ar
WOOF
ra
а
i
.
темРис. 202. Взаимосвязь между
пературами Т (°K) кремния [451—
153] и а-олова [154], германия [154] и
алмаза [152 ]при различных значениях
теплоемкости
зуют
Ср
систему
(кал/моль-град)
прямых.
Wy!
у
0
#00
200
100
0
1
i
д
/
|
Hy ty 4,
а
bk
tlt,
if
ty ’,
Изотермы
р
1
1
i
L
1
i.
|
1d
1
1
4
Ц
характеристической
Зависимость
Рис. 203.
температуры Дебая 09 для а-олова, германия
и кремния от температуры Т (°К) [158]
Залитым контуром ‘отмечены точки, соответствующие
указанным
на
чертеже
значениям
теплоемкости
Ср (кал/моль-град)
в отличие
от
этих
линий
проходят
через точки, лежащие на различных участках кривых 0 = } (7); так, вертикаль Г = 20°К
пересекает кривую для Эп в восходящей ее части,
кривую для
Се — в точке
минимума,
кривую
для
части. Другие примеры были рассмотрены в [158].
51 — в нисходящей
Не останавливаясь из-за ограниченности материала на пятом методе
сравнительного расчета (один из немногих примеров — сопоставление
вязкости и давления насыщенного пара сходных веществ при разных температурах [159]), обратимся к шестому.
ШЕСТОЙ
МЕТОД
СРАВНИТЕЛЬНОГО
РАСЧЕТА
Рассмотрим переход от двух сопоставлений к большему
лу для случая шестого
Соотношения
метода сравнительного
[160].
их чис-
(УТ, 6) и (УТ, 12)—(УТ, 16) связаны между собой, что выдно
из их распространения с двух значений Л, П’ и
242
расчета
С на несколько. Действи-
тельно, поступим аналогично тому, как делали в ранее рассмотренных методах сопоставления, для чего вернемся к уже изложенному в главе УГ.
Представим себе, что на ось ординат чертежа, подобного рис. 143, нанесены
не только значения @п,, но и значения Сп, (см. рис. 204, а). Обе прямые
не будут параллельны друг другу, так как различие в значениях данного
свойства при двух значениях одного переменного параметра в общем случае зависит от величины другого пеnf, п,
ременного параметра. Введем в сопоставление еще одну прямую, отвечающую зависимости а от И при
значении // = П.. Если Из мало отличается
от И
приводит
к
иП.,
то можно
при-
нять, что вновь проведенная прямая
пересечется с ранее
проведенными
примерно в той же точке 1.
Сечение этого пучка прямых по
вертикалям //'; и //”. непосредственно
соотношению
(VI,
12);
аналогичному соотношению (УТ, 6).
А сечение по большему числу вертикалей дает пучок прямых, схематически представленных
на
204,
рис.
6,
где точка О пересечения прямых совпадает с точкой О’ пересечения на
рис. 202, а.
ния
там
Аналогичные
рассужде-
и к другим
применимы
шестого
метода расчета,
мер,
к
(УГ,
14).
соотношениям
варианнапри-
(УГ,
13)
и
Рис. 204.Взаимосвязь между значениями
свойства С одного вещества
АИ
а— при значениях Пуи По, П.
Пти
По, Пу переменного параметра П в зави-
спмости
Таким образом, устанавливается
взаимосвязь между вариантами рас-
сматриваемого
метода
расчета.
При
переменного
параметра П’ в зависимости от значения переменного параметра IT; 6— при значениях
этом
параметра
от значения переменного
П’(схема)
|
очевидно,
что точное следова-
ние (УТ, 6) означает столь же точное соблюдение (УТ, 12) в том интервале
значений ДП,
в котором действительно (УТ, 6), и наоборот, в том промежутке
значений ИП, в котором точно (УТ, 12), будет точным и (УТ, 6).
На
рис.
205—207
показаны
все
шесть
вариантов
метода
расчета
на
примере теплоемкости водяного пара.
Из этих чертежей ясно видна невозможность в общем случае применения
различных
вариантов
сопоставления
в виде
однотипнои
зависимости
(в данном случае — сравнение в обычных шкалах). Действительно,
(VIII, 28)
Сы = АвСр-яо -Ё В
нение
урав-
(рис. 205, а), являющееся частным примером (УТ, 6), приводит к удовлетворительным результатам лишь для давлений, отличающихся от стандартного не более чем на 10 кг/см?. Уравнение
|
(Cr): = Ag (Cp)1=400 + Be
(УПТ,29)
(рис. 205, 6), которое служит примером (УТ, 12), надежно лишь при температуре, отличающейся от стандартной на несколько градусов. Урав-
нения
же
(Pcp, = As (P) cpio
+ B,
(VITI,30)
(puc. 206, a) u
Ра,
1
=
A¢P
:=a00 +
Bg
(VIII, 31)
1 Полагаем, как и ранее, что фазовые превращения исключаются.
16*
243
460420390 870 1
380] 360
Рис. 205.
а —
р
бр
9700г
при
Взаимосвязь
50100 150
35,
между значениями удельной
изобарной теплоемкости водяного
пара Ср (кал/г-град) [161]
150 кг/смз и различных давлениях в зависимости от температуры {(°С); б —
и различных температурах в зависимости от давления Р (кг/см:).
240280320 360 400
440
480
Cp= 06
9300г
250
250
200
200
150
150}-
100
100
90
30
при 400° С
р
%
065 07 08 0910 м 13 15
0
Рис. 206. Взаимосвязь между давлениями водяного. пара
2
34
250
460 °С
Р
(кг/см?)
[161]
от температув зависимости
0,8 и различных теплоемкостях Ср (кал(г.град)
‚ а— при Ср =
ры Ё (°С); 6 — при 400° С и различных температурах в ‘зависимости от значения теплоемкости
Ср (кал/г-град)
As
492153 И 1,0 09
f th, 15
550'-
Cp
08075
070
0665
Lot
500+
05
ч500
707
20
д
00
4O0t
300
Р
(00,
/
/
a,
4,
/
350r
/
и
7
ии,“
‘и
Sly
Lr
300r
ou
7 yo
fe
-
250
{/
Sy
ии
ии
и
00
fe
WF
poe
й
Uo
Vy
ry
ТИ 72007250
200
4
Me
и
Wren
oa
„”
—
oo
ro
7
„7“
|
__-300
72--=7
=
yo
os
и
/
277
ee
=“
„”
и
г’
&
0S
/
)
71
aoa
Рис. 207.
Взаимосвязь
от
давления
Ср
(хг/с.м?)
=
|
40
100
200
120
150
400
G50
500
|
'
500
о Траяд
250
550
300
550
C2 0,8
между температурами { (°С) водяного пара [164]
150 кг/см”и различных давлениях
(в левом верхнем
углу, показана
А. от давления); 6—при
симости
j-
_450-- 400
350
а — при Р =
Ср (кал/г-град)
—
0,8
и
(в левом
прямых
различных
верхнем
в зависимос
ги от значения
зависимость
коэффициента
значениях
углу
теплоемкости
показана
зависимость
C p = const от значений Ср)
теплоемкости
наклона изобар
(хал/г.град)
в
кооффициента
завинаклона
(рис. 206, 6), являющиеся частными выражениями соотношений (УТ, 13)
и (УТ, 14), достаточно точны в более широком интервале условий. УравнеНИЯ
И
(рис. 207, аи 207, 6), —
(Кр = Ag (t) Poise + Be
(VIH,32)
(Иср = Ав (Юср=о,в + В
(VIII,33)
первое из которых служит примером соотношения
(УТ, 16), а второе — примером соотношения (УТ, 15),— приводят к весьма
удовлетворительным результатам. Как видно из чертежей, они описывают
теплоемкость сжатого водяного пара, начиная от кривой насыщения
вплоть до самых высоких температур и давлений, достигаемых при измерении теплоемкости пара. Кроме того, все прямые в первом приближении
пересекаются в одной точке — дополнительное свидетельство того, что
уравнения (УП, 32) и (УПТ, 33) в наиболее простой и точной форме описывают рассматриваемую зависимость. Из характера изменения теплоемкости
с давлением
и температурой
следует,
что если уравнения
(УПТ,
32)
и (УТ, 33) удовлетворительно воспроизводят опытные данные в широком
интервале Р и Т, то уравнения (У, 28—31) будут заведомо приближенными, т. е. вместо последних следует пользоваться соотношениями с различными функциональными шкалами. Это видно и непосредственно из
рис. 207, а; так, из характера расположения точек следует, что каждую
изобару наряду с уравнением (УПТ, 32) можно представить зависимостью
Qi (Cr) = Азф (Ср=1ь) -Е Вь,
(УТ, 34)
а не (VIII, 28).
Кстати говоря, пример, которому соответствуют:рис.\205—207, вызывает интерес не только потому, что внедрение пара высоких параметров требует знания его характеристик, но и потому, что расчет теплоемкости сжатых газов вызывает существенные затруднения (см., например,
[162]),
судить
а ее измерение является очень сложной задачей; об этом можно
хотя бы по тому, что известно всего несколько работ, посвящен-
ных измерению Ср при высоких давлениях. Поэтому рассмотренному примеру была посвящена специальная работа, в которой более детально разбиралась возможность применения описываемого метода как для приближенного расчета теплоемкости водяного
кости других сжатых газов [164].
пара
где Г = ИП, П’или С. В
нейная зависимость вида
ряда
[163|, так и для теплоем-
Закономерное расположение прямых на графиках Gay— Gr, 4G, — Gr
и других можно проследить по изменению значений коэффициента AgB
соответствующих соотношениях, так как очевидно, что
частности,
для
случаев
—a+blil.
справедлива
ли-
(VIII,36)
Это показано на примере зависимостей, соответствующих соотношению
(УТТ, 33), на рис. 207. Располагая зависимостью вида (УП, 35), можно
существенно упростить вычисления и найти приближенные значения
данного свойства в случаях, когда другие методы не могут дать надежных
результатов. Так, с помощью
уравнения,
соответствующего графику, изоб-
раженному в левом верхнем углу рис. 207, а, можно найти значения теплоемкости водяного пара при Р = 350 кг/см?, не располагая ни одной
опытной точкой на этой изобаре.
Другим
примером
нескольких
сопоставлений
в
однокомпонентной
системе может служить взаимосвязь между показателями преломления
н-бутилбензола при разных температурах в зависимости от длины волны,
найденная в работе [1] по данным [165].
246
^ си 25° 50
500
450
400
920
IDO
L290
200
150
о
190
Рис. 208.
а —
при
туры
200
250
A
300
G50
KCl c= 3
Взаимосвязь ‘между эквивалентной электропроводностью
А (0м *-см?) водных растворов КС] [166]
с =.3М№
и
tf (°C); 6 — при
различных
100° С
концентрациях
и различных
от концевтрации
C
с
0851 20 40 60 80 100985300
x +
Хх.
’
р
080.
0,75
yw’
зависимости
от темпера-
(°С) в зависимости
с {№}
320 340
t
360 380
|
400
a8)
or
J
7
й
SSN RS,
070]
в
температурах
)
045+
040
RDNO,
2
1
om
050 055 060
xX
065
t= 360°
—
(0
0,70' 940
KNO.
a
O45
L
050
1
1
055
860
—^
465
eee
6/0
чо %o KNO4
Рис. 209. Взаимосвязь между yHeIbHOM dIeKTPOMPOBORHOCTHIO YX (ом 1+см-1)
расплавов азотнокислого калия и азотнокислого рубидия [167]
а — при 360° С и различных температурах {К° С) в зависимости от состава; б — при
40 %-ной ‘концентрации
КМО; им различных концентрациях с (% КМО:) в зависие
мости от температуры Ё (°С)
Переход от двух к нескольким сопоставлениям для двухкомпонентных
систем показан на рис. 208 и 209. Из рис. 209 видно, что кривые зависимости электропроводности от температуры проходят через максимум,
причем расположение максимумов вообще достаточно закономерно, так
как, хотя изотермы #= 300 и 340° С не являются вертикальными линиями
{на рис. 208, а) или сходящимися в общую точку пересечения (на рис. 208,
6) 1, однако они являются прямыми линиями. В данных случаях также
имеет место закономерное расположение прямых. Так, ход прямых на
рис. 209, аи 209, 6 описывается соответственно уравнениями
A, = — 0,480 + 0,00412 t
и
(с — мольный
Аз = 0,895 -- 0,0024 с
% КМО}), являющимися
примером (УП,
(VIII,37)
36).
(УПТ,38}
Еще одним примером применения рассматриваемого метода к двухкомпонентным системам может служить график для расчета энтальпии водных растворов серной кислоты в зависимости от концентрации и темпера-,
туры [168].
Несколько подробнее остановимся на одном примере многокомпонентных систем — на вязкости расплавленных силикатных стекол [169].
В данном случае можно воспользоваться зависимостью]
(ne, = Ad(ne +.Be,
(VIII,39)
являющейся частным примером соотношения (УТ, 6). Здесь в функциональных шкалах сопоставляется вязкость
стекла с концентрацией с+
с вязкостью стекла, имеющего концентрацию с. Если сравнивать стекла,
близкие по составу и структуре, то можно предположить, что это уравнение будет приводить к результатам, удовлетворительно совпадающим
с опытом. Так как (УП, 39) в неявной форме выражает зависимость вязкости от температуры, то характер функциональной шкалы обусловлен
характером п — {-связи. Если, например, исходить из приближенного
линейного
уравнения
|
Ig Пе; = Ale no, + (Вь,
(VIII, 40)
то получим неравномерную температурную шкалу. Уравнение (УПТ, 40)
соответствует зависимости Фф (1) от температуры в функциональной шкале,
тождественной предложенной в работах Айрани ф-шкале
[126, 127]
(см. также [170—175]).
Сравнительные методы расчета позволяют воспользоваться ф-шкалой не
только для выявления веществ, изоструктурных стандартному веществу,
но и в качестве своеобразного индикатора взаимодействия. Взяв в качестве стандартного вещества данную жидкость, построив по температурной зависимости ее вязкости ф-шкалу и нанеся на полученный таким путем график температурную зависимость вязкости смеси стандартной жидкости с рядом других, можно прийти к следующему выводу: при отсутствии
химизма линии для растворов будут прямыми (см., например, [173, 176]),
при наличии химизма они будут искривлены (см., например, [173]).
Переход к расчету вязкости нескольких сходных соединений показан
на рис. 240 на примере системы РЬО — 510..
Как видно из этого и других примеров [169], большинство точек в
пределах погрешности измерения, т. е. с ошибкой приблизительно в 10%
по вязкости или —--10° по температуре, лежит на прямых ?. Родствен1 Это свидетельствует о некотором изменении характера зависимости электропроводности.
* Точность | — #{-данных в общем еще недостаточно велика, чтобы на основании
опытного материала по вязкости расплава стекол судить об их строении, в частноств
о возможности фазовых превращений.
248
ность веществ сказывается в том, что прямые сходятся примерно в одной
точке. Это. означает, что если известна точка пересечения прямых, то
можно найти температурную зависимость вязкости стекла данного состава
по значению
1, измеренному
Рассмотренные
более
сложные
методы
объекты.
лишь
при
расчета
Если,
одной
вязкости
в частности,
температуре.
можно
распространить
изучать
тройные
и на
системы,
то
следует рассматривать разрезы, соответствующие постоянной концентрации одного из компонентов (см., например, рис. 152 в [1], построенный
по данным [178]).
A
3
,
0
6
7
9.
„би
}
05
|
1
j
бе
2.00
7 1300 1200 100 1000 # 900
700° 600°
190009
LE
“7
tt
ИИ
5007,
и
1000
A
900
700
90
20
70
7
2
3
2
710
277
52-7
100010000
7
Рис. 240. Взаимосвязь между вязкостью 1 (па) стекла М
стекол различного состава в зависимости от температуры
шкала температур) [177]
(Ма>О-РЪО)и
(равномерная
Цифры
левом
ряду
на
прямых
приведена
соответствуют
различным
составам
стекол.
В
зависимость
коэффициента Аз наклона прямых от состава
(% Ма,О/% РЬО):
ю — по анализу;
® — по синтезу
верхнем
стекол
с
Разумеется, пример с вязкостью силикатных стекол можно было бы
считать иллюстрацией четвертого метода сравнительного расчета и рассмотреть его в соответствующем разделе; это следует из общности всех
методов сравнительного расчета, и в частности четвертого и шестого.
Аналогия в свойствах сравниваемых стекол проявляется и в том, что
наклон прямых на рис. 210 с составом системы изменяется закономерно
(см. верхний левый угол рисунка). Отклонения не имеют систематического характера (они невелики и находятся в области переохлаждения)
и вероятно обусловлены не столько неточностью метода расчета, сколько
ошибками опыта, а также погрешностью определения химического состава
стекол.
Пересечение прямых в одной точке вместе с закономерным изменением
их наклона позволяет во многих случаях оценить температурную зависимость вязкости совершенно неизученных стекол. Эти расчеты можно провести и с помощью уравнения, объединяющего зависимости А’ = {(с)
и Пс;= (Пси), причем, как видно из рис. 210, в широком интервале концент249
раций в первом приближении
(УПЦ, 36) в виде уравнения
можно
воспользоваться
соотношением
Ав = а-6.с.
(11,44)
Кроме того, становится возможным отбор наиболее достоверных данных по температурной зависимости вязкости стекол; так, можно заключить, что значения вязкости Ма.О.251О0., рекомендованные в статье [4179]
и особенно
в статье
[180],
не являются
достаточно
надежными.
Можно
установить и наличие химизма (см., например, [174])..
Если в ранее рассмотренных методах сравнительного расчета встречаются случаи, когда пучок прямых на соответствующих графиках практически сливается в одну прямую, то в описываемом случае это исключено
(если не рассматривать примеров практической независимости С от П).
Можно лишь указать на то, что переход от зависимости } (а, Р, ТГ) =0
к /((, Р/Рьь, Г/Тьь) =0 приводитк такой возможности. Действительно,
для многих свойств зависимость С от приведенного давления при данном
значении приведенной температуры, как известно, в первом приближении
выражается одной кривой, а поэтому в функциональной шкале может
быть представлена одной прямой.
О ПЕРЕСЕЧЕНИИ
НРЯМЫХ
В тех случаях, когда прямые, отвечающие тому или иному методу сравнительного расчета, при своем продолжении пересекаются в одной точке, последняя, как правило, лишена физического смысла. Так,
точки
схода
имеет
определенный физический
слимого
прямых
изменения
С другой
одной,
стороны,
а в разных
является
к другому,
на
рис.
свойств.
известны
точках.
кажущимся;
148—153
Однако,
смысл
случаи,
Бывает
достаточно
и др.
возможны
(см.,
и так,
что
за
пределами
случаи, когда
например,
когда
перейти
лежат
линии
рис.
от одного
154
и
пересекаются
пересечение
мы-
эта точка
в одной
масштаба
155).
не в
точке
чертежа
чтобы убедиться в отсутствии одной точки схода. Иллюзия
мо-
жет быть устранена и аналитическим путем (см. стр. 351 сл.). Следует, однако, иметь в виду, что в тех случаях, когда прямые не сходятся в одной
точке, целесообразно обратиться не к отысканию закономерности в смещении точки пересечения,— например вдоль диагонали (т. е. линии стандартного ряда или стандартного вещества),— а к анализу изменения наклона
прямых,
так
как
в
большинстве случаев будет
(см. также стр. 352 сл.).
значениях
коэффициента
соблюдаться
О СВЯЗИ МЕЖДУ РАЗЛИЧНЫМИ
СРАВНИТЕЛЬНОГО РАСЧЕТА
A;
определенная
B
подавляющем
закономерность
МЕТОДАМИ
Можно говорить о нескольких типах взаимосвязи — в пределах одного и того же метода, между «смежными» методами и между методами, отличающимися по номеру больше чем на единицу.
Первый тип взаимосвязи был рассмотрен в настоящей главе на ряде
примеров для первого, четвертого и шестого методов сравнительного расчета.
Второй тип взаимосвязи покажем на примере третьего и четвертого
методов сравнительного расчета. Представим себе, что в некоторой совокупности сходных веществ справедлива зависимость, схематически изображенная
на рис. 211
(в качестве примера
можно
указать на
температур-
ную зависимость некоторых свойств в гомологических рядах, установленную в [181 ]). Тогда, приняв в качестве аргумента значения Си, а в качестве функции — Ск, Сг...., получим систему прямых, соответствующих
четвертому методу сравнительного расчета. Приняв же в качестве неза250
висимой переменной значения С для всех веществ при данном значении
параметра условий [ (например, при П = П,), а в качестве функции —
п, @п,.... т. е. осуществив вертикальный разрез рис. 211, получим
систему прямых,
отвечающих
третьему
методу сравнительного расчета.
На рис. 212 показан пример, непосредственно
иллюстрирующий
взаимосвязь
между третьим и четвертым
методами
сравнительного расчета. Рис. 213 иллюстрирует третий метод сравнительного расчета. Он является вертикальным разрезом
рис. 202, который в свою очередь иллюстрирует четвертый метод сравнительного.
расчета. Первый из них отвечает соотношению, в котором температуры ряда сходных веществ (при которых все они имеют
какое-либо одно значение теплоемкости)
сравниваются
ном
с их температурой при дан-
значении
На
Ср.
примере
цаемости
=
диэлектрической
третий
сравнительного
и
для оценки температурной
некоторых
прони-
четвертый
расчета были
неизученных
п
методы
рис.2114.
применены
'П*98П
y(n)
+241
Зависимость
свойства
С
в ряду сходных веществ от пара-
зависимости g
н-спиртов
П»рдП
метра условий П (схема)
[182].
Более подробно остановимся на третьем типе взаимосвязи, рассмотрев
его на примере второго и пятого методов сравнительного расчета [183].
2
х-10
сое
SSSR
ОГ
=
15
-
|
j
Ne
|
ТЕ
“|
.
!
|.
и
и
YE
10F
/
Взаимосвязь
г
if
5х1
М
pe
|
10
а— четвертый
XekrAr
;
|
212.
х.10
—
Or
Рис.
8
а
..
0
1.
20,
(x-10°),
между
L
©
|
30
0
коэффициентом
1
|
10
Q
1
15,
—-
20
Х 300°с'10
теплопроводности
инертных
Х (ккал/м?-час-град) при различных температурах [120]
метод
сравнительного
расчета;
б—третий
метод
сравнительного
расчета
(см.
газов
рис.` 184)
2
Казалось бы, подобно взаимопереходам от уравнения (1, 1) к уравнению (ТУ, 1) возможен взаимопереход (11, 1) => (У, 1). Это позволило бы
251
распространить ряд частных уравнений вида (II, 1) Ha соотношения вида
(У, 1). Хотя в общем случае это не так, однако если уравнение (Ш, 1)
применяется для близких по свойствам веществ, то для некоторых значений [П возможен и параллелизм в изменении С’и С” с изменением II.
При этом не исключена возможность, что смещение точек для всех веществ
ряда при переходе к новому значению /1 будет таким, что эти точки вновь
окажутся
на прямой.
т
300-8188
Если изменение
// будет не очень
TO
G
С
cb
значительным,
Г
)
Г
>
Z00F
оо!
[и
А
0
и
:
/
1
1
<
i.
т.
50 100 15
Ср=ё
«
Рис. 213. Взаимосвязь-между температурами Т (°К) кремния [151—153] и
а-олова [154], германия [154] и алмаза
Рис. 214.
уравчений
[152], при которых эти вещества имеют
одинаковую
теплоемкость Ср
$
Взаимозависимость
(Ш 1), и (У, 1\
(схема)
(кал/г-атом -град)
точки для различных значений /[ могут сместиться таким образом, что
тоже вновь окажутся на прямой '. Один из подобных случаев схематически изображен на рис. 214, на котором пунктирные прямые соответствуют
уравнению (П, 1), а сплошные — уравнению (У, 1). Так как в общем случае с изменением значения переменного параметра (или состава молекул)
меняются
значения и С(’и С”,
то
каждая
точка при переходе с одной пря-
мой на другую претерпит не только вертикальное, но и горизонтальное
смещение. Поэтому взаимному переходу второго и пятого методов в отличие от других в общем случае будут соответствовать не вертикальные,
а наклонные шкалы; по этой же причине точки пересечения
пучка
прямых, соответствующих уравнениям (П, 1) и (У, 1), не совпадут
(см. рис. 214).
Рассмотрим
изменении
С’
один частный случай существования закономерности в
и С”,
обусловливающей
возможность
взаимоперехода
(И, 1) => (У, 1). Допустим, что изменение данного свойства
менным параметром ЛП выражается линейным соотношением
G=a-+ oll.
|
@
с пере-
(VIII, 42)
Это уравнение, как известно, в том или ином интервале температур
описывает температурную зависимость различных свойств; к последним
относятся, в частности, и многие термодинамические свойства. Если уравнение (УП, 42) действительно в отношении двух веществ, то из этого
следует справедливость (ТУ, 1), а поэтому и (УП, 1). Одновременное применение
соотношения
чтобы было
1 Если
252
(УПЦ,
справедливо
не происходит
42) для двух
свойств,
(У, 1), ограниченно.
фазовых
превращений.
необходимое
для
Toro,
Но если, например, в (У, 1) под С” иметь в виду величину ТА” (где
А5° — разность в значениях стандартной энтропии соединения и суммы
стандартных энтропий простых веществ), то можно говорить о справедливости (У, 1) и, тем самым, о взаимосвязи (II, 1) a (V, 1). Действительно,
для многих веществ практическая независимость теплоты их образования
от температуры наблюдается в сравнительно широком интервале температур. В этом случае будут справедливы
«298, 16°К
(|
уравнения
AH®° = const
А2° =а-
(VIII, 43)
6Т,
(УПТ, 44)
где Л 7/°— стандартный изобарный потенциал образования. Но из (УПТ, 44),
в соответствии с термодинамическим
уравнением
92° = AS,10
co
(VITI,45)
следует,
что
откуда
45° = — 6,
(УПТ,46)
TAS° = const’-7.
(УП, 47)
Coyetan (VIII, 44) с (УШ, 47) и
попутно обозначая ГА5” через 0°,
получаем уравнение
(00° =
являющееся
ния
A,AZ°
частным
(У, 1) *. Это
рис.
рируется
215
+ В»,
(VIII,48)
видом
соотноше-
уравнение
на
иллюст-
примере
нес-
кольких окислов, для которых
в очень
большом интервалетемпературне про-
Az
Рис. 215. Взаимосвязь между А2°и
(0° = ТА5° (ккал/моль) для реакции
образования
некоторых
простых
окислов из
веществ [184]
на каждой прямой точки] отвечают пяти тем-
пературам
для
нанесены
значения
(их
$0,). Оси
масштаб отмечен
координат
м
на
рис.
высокотемпературных
245;
во-вторых,
значений
для большинства
А”
ккал
превосходит
известных
на
прямую
равномасштабны,
исходит фазовых превращений. При
оценке точности уравнения (УПТ, 48) следует учесть, во-первых,
грешность
5
окислов
от
что по-
указанные
изменение
АН” с Т в изученном интервале температур меньше погрешности значений
АН»з, в то время как неточность значений
АЙ
существенно меньше
изменения Л7° с Г.
Уравнение (УПТ, 48) справедливо не только для образования вещества,
но и для более сложных
процессов
(если оно справедливо для каждого реа-
гента). Примеры подобных процессов приведены на рис. 2146 (реакции
дегидрирования этана и изомеризации бутана).
Хотя, как видно из рассмотренных примеров, уравнение (УПТ, 48)
может привести к достаточно надежным результатам, однако оно все же
относится к приближенным зависимостям, так как величина АН всегда
несколько меняется с изменением Г. Это уравнение становится неточным,
если в (У1Щ,
44) значение 6 невелико;
ебли же 6—0,
то это приводит к не-
удовлетворительным результатам, так как изменение АН® становится
соизмеримым с изменением ДА2^” (примером подобного процесса является
реакция 2 С.Н: = н-С.Н ,-+ Н.). Наоборот, если имеет место аддитивность теплоемкости, что приближенно соблюдается для конденсирован-
1 Величину (° в первом приближении можно считать тепловым эффектом при обрязовании вещества в результате обратимого изотермического процесса; однако это не
строго, так как величина ()° относится к стандартным условиям.
253
ных систем, то уравнение (УП, 48) должно удовлетворяться с большей
точностью '. Последнее можно проиллюстрировать на примере синтеза
карбида кремния, для которого величина Д5° практически не зависит от
температуры
[183].
о
90
40
90
20
10-19
}
i
-0
-9
Puc. 216.
i.
{
0
о
1
j
005
20, 525
Взаимосвязь между значениями
и О° (ккал/моль) для реакций
A '— н-С.Нь
=
чзо-С.Ни;
Б —
С.Н
=
С.Н-
AZ°
На" [10]
Если бы уравнение (УПТ, 48) было абсолютно точным, то это означало
бы не только безукоризненную (с учетом погрешности значений AS*° u AZ°)
укладку точек HaQ° — AZ°-npa0°
А,
мой,
но
и
TO,
что
точки,
соответствующие значениям 7’,
отстоящим
друг от друга на
равное число градусов, располагались бы на равных расстояниях.
В этом случае, применив
уравнение (УТ, 48) для нескольких сходных веществ, мы
получили бы уравнение, совпа-
дающее с (УТ, 48), но coorветствующее
соотношению
(Ц,
т.т
1) (при соблюдении указанного условия — с равномерным
расположением точек на пря-
'
мой).
ности
1
-80
Е
9
и
39
0 yz°
Рис. 247. Взаимосвязь между значениями д72°
и (0° (ккал/моль) при
некоторых
н-алканов
веществ.
Зависимости
реакции
образования
С„Но„ Чо "Из ‚простых
коэффициента
/4› от
T (°K) (а) и коэффициента „4; от п(б). [70]
ствующие
линии
— пересекающимися
Вследствие
приближенуравнения (УПТ, 48) эта
правильность несколько наруШается; поэтому, в частности,
вместо одной точки получается
СКоЛЬзЯЩая
точка
пересечения
Соответствующих
прямых.
Однако не в очень широком интер-
вале
температур
рассматривае-
мые уравнения можно считать
достаточно точными, а соответпрактически в одной точке *
1 Правда, необходимо учитывать, что в этом случае величина (° будет сравнительно небольшой, поэтому сильнее скажется погрешность в значениях свойств реагентов.
* При строгом соблюдении условия (УПТ, 43) переход от (УП, 48) к уравнению
А 2^= 4. АН°-- В» ([У, 41) дал бы расположение точек, соответствующее параллельным
(наклонным) прямым для (11, 1) и вертикальным прямым для (У, 1). При приближенном
соблюдении условия (УП, 43) первые утрачивают параллельность, а вторые несколько отклоняются от вертикалей.
254
Рис. 217 иллюстрирует все сказанное выше на примере реакции образования н-алканов при различных температурах. Каждая крутая прямая соответствует одному веществу, т. е. иллюстрирует уравнение вид:.
(У, 1). Каждая (проведенная через те же точки) пологая прямая соответствует одному значению температуры, т. е. иллюстрирует уравнение
вида (Ш, 1). Первые (если исключить прямую для этана) при своем
продолжении (влево вверх) пересекаются в одной точке; так как они
почти параллельны
(0 чем косвенно можно судить по зависимости наклона изображенных прямых от числа атомов углерода, представленной в левом нижнем углу рис. 247), то точка пересечения будет расположена далеко за пределами рисунка. Вторые при
своем продолжении также пересекаются в одной точке; здесь уже их наклон значи-
тельно
больше
ности,
аналогии
меняется
от
одной
прямой
к
другой
(зависимость
их
на-
клона от температуры показана в правом верхнем углу рис. 217). Закономерное изменение наклона прямых на рис. 217 позволяет описать одним
уравнением зависимость значений Д° и Г от числа атомов углерода и от
температуры в данном гомологическом ряду.
На рассмотренном примере взаимоперехода (Ш, 1) => (У, 1) ясно видно,
что в уравнениях и графиках, соответствующих различным методам сравнительного расчета, содержится не только требование аналогии (в частделенного
изменения
расположения
данному
характеру
вающий
крайние
ставных
частей,
С’ и
С”
с изменением
точек на прямой
изменения
значений
Т), но и условие
(в частности,
//). Только
при
опре-
отвечающего
соблюдении
за-
по-
следнего условия возможен переход от одного метода сравнительного
расчета к другому,
в том числе и рассмотренный переход, связырых изменение
виды
методов
свойств вещества
а в другом
—
сравнительного
расчета,
в одном из кото-
обусловлено только изменением
только
изменением
внешних
его со-
условий.
Мы уже отмечали случаи, когда несколько прямых, характеризующих
данный метод сравнительного расчета, сливаются в одну прямую
(см.
стр. 221, 222, 229). Известны случаи, когда прямые для различных ве-
ществ совпадают с прямыми для различных значений параметра условий.
Так, уравнение
5,75
(УПТ, 49)
[3-метилалканы
= 0,998 Н-СпНоп-о
дает удовлетворительные результаты для п =7,
изобар в широком интервале давлений [185].
8 и 9 вдоль различных
О связи между
различными
методами
сравнительного
также стр. 164, 164, 165, 235, 330 сл., 357.
расчета
см.
ЛИТЕРАТУРА
1. М. Х. Карапетьянц.
Докт. дисс. М., МХТИ им. Д. И. Менделеева, 1957.
2. Справочник химика. М.—Л., Госхимиздат, 1951—1952.
3. Ван
Аркель.
Химическая связь, ОНТИ, Госхимиздат, 1934, стр. 70..
4,.J.N. Bronsted,
K. Pedersen.
Z. phys. Chem., 108, 185 (1924).
5. J. K. Partington.
Advanced treatise on physical chemistry, vol. III, The
properties of solids, 1952.
6. И. И. Заславский.
Ж. общ. химии, 10, 369 (1940).
6a. D. E. Holcomb,
G.G. Brown.
Ind. Eng. Chem., 34, 590 (1942).
‘7. Selected
values of chemical
and
thermodynamical
properties,
by
Е.
О.
Rossini,
D.D.Wagman, W.H. Ewans, S. Levine, J. Jaffe. Circ. Natl. Bur. Stand., 500, 1952.
8. Термические константы неорганических веществ. Составили:
9. В. Брицке,
А. Ф. Капустинский, Б. К. Веселовский,
Л. М. Шамовский,
Л. Г. Ченцова,
Б. Н. Анваер. М., Изд-во АН СССР, 1949.
9. Ю. П. Маслов, П. Г. Маслов. ЖЖ. физ. химии, 32, 1715 (1958).
Г. А. Соболев.
Докл.
АН СССР,
10. П.А. Акишин, В.П. Спиридонов,
118, 1134 (1958).:
E.Gelles,
K.S. Pitzer.
J. Am. Chem. Soc., 75, 5250 (1953).
С. Е. Decker,
A. G. Meister,
F. F. Cleveland.
J. Chem. Phys.,
19, 784 (1951).
255
. R.H. Valentine,
66, 392 (1962).
П.А.
Акишин.
. П.А.
Акишин,
мов.
Ж.
физ.
G.
E.
Brodale,
W.
В. ЦП. Спиридонов,
химии,
31,
461
F.Gitauque.
Г. А. Соболев,
(1957).
В.П. Спиридонов,
мии., 31, 648 (1957).
J. Phys.
П.А.
Акишин,
П.
Акишин,
В.
П.
Спиридонов,
мов.
Ж. физ. химии, 32, 58 (1958).
П. А. Акишин,
В. IL. Спиридонов.
А.
биди.
П.А.
Ж.
физ.
Акишин,
101, 77 (1955).
В.
П.
химии,
Л.В.
Г. А.
Спиридонов,
30, 155 (1956).
Волков,
В.П.
В. А. Нау-
Г. А. Соболев.
‚ П.А, Акишин, В.П. Спиридонов,
Г. А. Соболев,
Ж. физ. химии, 31, 1871 (1957).
Chem.,
Ж. физ. хи-
В.А. Наумов.
Соболев,
В. А.
Нау-
Кристахллография, 2, 475
(1957).
В. А.
Наумов,
Спиридонов.
Н. Г.
Рам-
Докл. АН
СССР,
. Т. 'Коттрелл.
Прочность химических связей. М., ИЛ, 1956.
. М.Х. Карапетьянц,
Лин
Тинчин.
Ж. структ. ‘химии, 1, 277 (1960).
П. А. Акишин,
В. П. Спиридонов.
Ж. физ. химии, 32, 1682 (1958).
R.G. Luce, J. W. Triskchka.
J. Chem. Phys., 21, 105 (1953).
A. Honig,
M.Mandel,
M. L. Stitch, C. H. Townes.
Phys.
96, 629 61954).
H. Lew,
Phys., 36,
D.
Morris,
171 (1958).
M.
X.
Карапетья
М.
Дяткина.
В.
П.
G. L. Vidole.
F.
E-Geiger,
нц.
К.
структ.
физ.
химии,
20,
J. T.
химии,
J. Phys. Chem., 64, 314 (1960).
Ж.
Eisinger.
1, 399
Rev.,
Canad.
J.
(1960).
4 (1946).
К. С. г раснов, А.И. Максимов. Оптика
и спектроскопия, 8, 403 (1960).
M. F.C.
Ladd, W.H. Lee. J. Inorg. Nucl. Chem., 20, 163 (1961).
СпLn pu
ROHOD,
В. М.
Татевский.
Вестник
.30 (1964).
В. М. Татевский.
Ж. физ. химии, 36, 1275 (1962).
G.C. Benson.
J. Chem. Phys., 35, 2113 (1964).
A. Kutzelnigg.
Monatsh.
f. Chem..,
МГУ,
химия,
№ 1,
89, 459 (1958).
K. Watanabe.
J. Chem. Phys., 26, 542 (1957).
М. Х. Карапетьянц.
Ж. физ. химии, 28, 1136 (1954).
Yamashita.
Rept. Inst. Sci. Technol. Univ. Tokyo, 4, 269 (1950).
Чжан
Ю- мин. Автореф. канд. дисс., М., МХТИ им. Д. И. Менделеева,
С. И. Дракин, Чжан Ю-мин.
Ж. "физ. химии, 38, 2800 (1964).
JI. H. Е рбанова, С. И. Дракин,
химии, 38, 2670 (1964).
. Л.Н. 'Ербанова.
Канд. диссерт.,
. Л. Н. Ербанова, С. И. Дракин,
мии (в печати).
Е. А. Укше,
Н. Г. Букун.
Усп.
Н.Е. Хомутов.
Труды МХТИ им.
Н.Е. Хомутов.
Труды МХТИ им.
В. Н.
Кондратьев,
Н.Е. Хомутов.
Н.Е. Хомутов.
Н. Е. Хомутов.
М. Х. Карапетьянц.
химии, 30, 243 (1961).
Д.И. Менделеева, 38, 87 (1962).
Д. И. Менделеева, 38, 93 (1962).
Н. Д. Соколов.
Ж. физ. химии, 29, 1265 (1955).
Ж. физ. химии, 34, 380 (1960).
Труды МХТИ им. Д.И. Менделеева, 26, 206 (1959).
У Ш
Менделеевский съезд по общей и прикладной
электрохимии, М.,
.Н.Е. Хомутов,
. А.А.
Изд-во АН СССР, 1959, стр. 8.
В. В. Цодиков.
Труды МХТИ им.
Исирикян,
33, 389 (1959).
. Е. "Ephraim,
Ж. физ.
М., МХТИ им. Д. И. Менделеева, 1964.
М. Х. Карапетьянц. Ж. физ. хи-
мии. Рефераты докладов и сообщений № 13, секция теоретической
32, 109 (1964).
1962.
А. В.
Киселев,
E. Michel.
Helv.
chim.
Б. А.
Acta,
Д. И. Менделеева,
Фролов.
2, 266
хи-
и прикладной
Ж.
физ.
химии,
(1919).
.Н.А. Измайлов,
Т. В. Можарова.
Ж. физ. химии, 34, 1543 (1960).
.Н.А. Измайлов,
Т. В. Можарова.
Ж. физ. химии, 34, 1709 (1960).
.Н.А. Измайлов,
Л. Л. Спивак.
Ж. физ. химии, 36, 757 (1962).
R. M.Izat,
W.C. Fernelius,
C.G. Haas, B. P. Block.
J. phys.
Chem., 59, 170 (1955).
T. E. Brackett,
.В. п. Васильев,
E.B. Brackett.
J. Phys. Chem., 66, 1542 (1962).
В. Н. Васильева.
Изв. вузов, химия
и химич. тех-
нол., 6, 693 (1963).
В. в’ erret. Bc6.: Thermodynamics. Intern. Union of Pure and Applied Chemistry. Sect. of Phys. Chem. Commission on Thermod. London, 1961, p. 101.
L. Brever,
G.R.Somayajulu,
E. Brackett.
Chem. Rev. (в пе-
чати);
Е "`. А.
В. А.
.Н. Н.
A ot
#56
цит. по J. Phys. Chem., 66, 1542 (1962).
Каневский.
Ж. физ. химии, 25, 1092
Киреев.
Дрозин.
iggy
(1956
OT
Ж. физ. химии, 22, 847 (1948).
Ж. физ. химии, 29, 288 (1955).
OR
К.
Б.
(1951).
Яцимирский.
Ж.
физ.
|
химии,
22,
Г.
Улих.
Химическая термодинамика. М., Госхимтехиздат,
R. Lautié.
Bull. Soc. chim. France, 3, 2337 (1936).
В. М. Татевский.
Докл. АН СССР, 101, 901 (1955).
66.
66a.
67.
68.
69.
70.
G.R.Somayajulu.
А.
В.
Савицкий.
J. Chem.
Докл.
АН
1933.
Phys., 28, 822 (1958).
СССР, '87,
634
(1952).
Selected values of physical and thermodynamical properties of hydrocarbons and
related compounds, by F. D. Rossini, K. S. Pitzer, R. L. Arnett, R.M. Braun,
C. C.
Pimentel.
Pittsbourg,
Carnegie Press,
1953.
71. Selected values of properties of hydrocarbons, by F. D. Rossini, K. S. Pitzer, W. J.
Taylor, J. P. Ebert, J. E. Kilpatric, C. R. Beckett, M. C. Williams, H. C. Werner.
72.
Cire. of the Natl. Bur. Stand., Circ. 461, Washington,
1947.
Handbook
of Chemistry and Physics, ed. C. D. Hodgman, 33 ed.,
73. KH. С. К раснов.
Ж.
общ.
химии,
30, 3844
(1960).
1951.
74. В. С. Краснов.
Я. неорг. химии, 5, 1658 (1960).
75. В. С. Краснов.
Изв. вузов, химия и химич. технол., 4, 38 (1961).
76. В. С. Краснов.
Радиохимия, 2, 668 (1960).
77. М. Х. Карапетьянц,
Лин
Тин-чин.
Аба 5. Маг. Univ.
78.
79.
chun., N
2, 105 (1958).
П. Г. Маслов. Докт. дисс., М., МГПИ им. В. И. Ленина,
А. Па сын ский.
Ж. физ. химии, 11, 606 (1938).
Sze-
1953.
80. W. Bilt
Raumchemie der festen Stoffe. Leipzig, 1934.
81. J. P. Taegan, A.D. Walsh. J. Chem. Phys., 19, 1070 (1951).
82.
83.
84.
Е.Н. Гапон.
Докл. АН СССР, 58, 823 (1947).
Н. С. Спиро.
Труды Всес. научно-исслед. ин-та галургии, 24, 262 (1949).
Ю. М. Голутвин.
Труды МХТИ им. Д. И. Менделеева, 11, 32 (1947).
86.
W.
88.
89.
Lee
Fanghsuin.
В. С. Краснов.
Ж.
85. В. В. Фо ми
87.
Lee
Bilt
Fan р
н.
Ж.
физ. химии,
A.Sapper.
suin.
28, 1896 (1954).
Z. anorg. ‘allg.
Chem.,
J. Chinese Chem. Soc., 11,
203, 277 (1932).
155 (1944).
J. Chinese Chem. Soc., 14, 166
структ. химии, 2, 200 (1961).
(1944).
90. А. Г. Бергман.
Изв. сектора физ. -хим. анализа, 19, 113 (1949).
91. F. Paneth,
E. Rabinowitsch.
Ber., 58, 1138 (1925).
92.
93.
B.
M.
АН
В. А.
(1962).
94.
95.
96.
Татевский,
СССР,
138, 621 (1961).
Коряжкин,
В.
П.
В. М.
Спиридонов,
Татевский.
П.
А.
Вестник
Акишин.
МГУ,
химия,
Докл.
№
1, 21
П.А. Акишин,
В.А. Наумов.
ЖЖ. структ. химии, 2, 3 (1961).
S.C. Bevan,
D. F.C. Morris.
J. Chem. Soc., 1960, 516.
К. Ван-Нес,
Х. Ван-Вестен.
Состав масляных фракций нефти и их анализ. М., ИЛ, 1954, стр. 186—187.
97. J.S mi ‘ttenberg,
98.
J.Smittenberg,
99. H.J.
100.
101.
102.
Hubert,
G
D.Mulder.
D.Mulder.
R.Schultzer.
Rec. trav. chim.,
Rec.
trav. chim.,
67, 813 (1948).
67, 826 (1948).
Z. Elektrochem., 61, 1261 (1957).
J. M. H. Fortuin.
Rec. trav. chim., 77, 5 (1958).
S.S. Kurtz,
A. L. Ward.
J. Franklin Inst., 222, 563 (1936).
S.S. Kurtz,
A. L. Ward.
J. Franklin Inst., 254, 697 (1937).
103. W.
Gordy.
J. Chem.
Phys., 9, 204 (1941).
103a. W. Gordy,
S. T. Stanford.
J. Chem. Phys., 8, 170 (1940).
104. М. М. Хрущов,
М. А. Бабичев.
Докл. АН CCCP, 88, 445 (1953).
105. Б. В. Некрасов.
Курс общей химии. Изд. 9. М., Госхимиздат, 1952.
106. Краткий справочник физико-химических величин. Под ред. К. П. Мищенко,
А. А. Равделя. Л., Госхимиздат, 1955.
107. Ю. В. Ходаков.
Элементы электростатической химии. М., Госхимтехиздат,
1934.
108. J.
109. О.
110. Н.
Е.
141. A.
ГВ. Е. J oliet.
Compt. rend., 234, 428 (1952).
А. Осипов.
Докл. АН СССР, 102, 1171 (1955).
А.
Измайлов,
И. В.
Красовский,
В.
И. Вайль.
Докл. АН СССР, 74, 91 (1950).
Voet.
Trans. Faraday Soc., 32, 1304 (1936).
112. D. Meyerstein,
113.
С. С.
Баданов.
115.
E.Shimazaki,
117.
118.
Н. Д. Соколов.
Н. Д. Соколов.
1950, стр. 62.
114. А. А. осваегег,
543 (1956).
116. T. Wentink.
119.
17
A. Treinin.
J. Phys. Chem.,
С. СЦ. Вау16,
W.M.Mazee.
Кристаллография,
K. Niwa.
J. Chem.
Z. anorg.
Phys., 30, 105
х.
Карациетьянц
(1956).
allg. Chem.,
(1959).
Докл. АН СССР, 60, 825 (1948).
Труды Всес. совещ. по катализу.
Техническая
энциклопедия.
Справочник
гических величин,
1931—1933.
м.
1, 140
физических,
В.
Александров,
66, 446 (1962).
Rec.
trav. chim., 75,
314, 21 (1962).
Киев,
Изд-во
химических
АН
и
УССР,
техноло-
257
120. Л.
С.
Зайцева.
Автореф.
канд. дисс., М., МАИ
им. С. Орджоникидзе, 1956.
121. А. С. Свердлин,
И. Н. Годнев.
Ж. физ. химии, 27, 1580 (1953).
122. N. Koizumi,
T. Hanai. Bull. Inst. Chem. Res., Kyoto Univ., 33, 14 (1955).
123. П. Бриджмен.
Физика высоких давлений. М.—Л., ОНТИ, 1935.
124.Z.Seha,
125.
126.
127.
R. Holub.
Collect. Czechosl. Chem. Communic., 24, 1741 (1959).
C. E. Rehberg,
M. B. Dixon,
C. H. Fischer. J. Am.
69, 2966 (1947).
e
E. P. Irany.
J. Am. Chem. Soc., 60, 2106 (1938).
E. P. Irany.
J. Am. Chem. Soc., 61, 1734 (1939).
128. A. K. Mukherjee.
J. Indian Chem.
Soc., 26, 493
Chem.
Soc.,
(1949).
129. М. Х. Карапетьянц.
Химия и технол. топлива, № 9, 21 (1956).
130. М. Е. Дяткина.
Ж. физ. химии, 28, 377 (1954).
131. H. Zeise.
Thermodynamic, B. III, 1 H.
Leipzig, 1954.
|
132. A. I. Johnson,
Huang
Chen-jung,
Kwei Ti-kang.
Canad. J.
Technol., 32, 127 (1954).
133. С. И. Скляренко,
Б. А. Сахаров.
Ж. физ. химии, 241, 97 (1947).
134. М. Х. Карацетьянц.
Теплоты испарения низших углеводородов С! —С.—
В кн.:
Физико-химические
свойства индивидуальных углеводородов, вып. 4.
Под ред. М. Д. Тиличеева. М., Гостоптехиздат, 1952, гл. ХИ.
135. М. Х. Карапетьянц,
М. Л. Карапетьянц.
Теплоты испарения
углеводородов С5—С.— В кн.: Физико-химические свойства индивидуальных
углеводородов, вып. 5. Под ред: М. Д. Тиличеева. М., Гостоптехиздат, 1954, гл.
XVI.
136. В. К. Семенченко,
Л. П. Шихобалова.
Ж. физ. химии, 21,
707
(1947).
137. Ю. М. Голутвин.
Ж. физ. химии, 30, 2607 (1956).
138. С. С. Monrad.
Ind. Eng. Chem., 24, 139 (1929).
139. Справочник по разделению газовых смесей. М., Госхимиздат, 1958.
140. М. Х. Карапетьянц.
Хим. промышл., № 10, 306 (1952).
1414.G.Calingaert,
142.
143.
D.S.
Davis.
Ind. Eng. Chem.,
17, 1287 (1925).
Физические методы органической химии, т. П. Под ред. А. Вайсбергера, М.,
ИЛ, 1952, гл. ХХ.
G.Calingaert,
H.A.Beattie,
H.R.Neal. J. Am. Chem. Soc., 61,
2755 (1939).
144. R.V.Culver,
C.J. Hamdorf.
J. Appl. Phys., 5, 383 (1955).
145. R. R. Dreisbach. Tables of vapor Pressure-Temperature Data for Organic Com146.
147.
148.
149,
pounds, 2 ed., The Dow Chemical Co., Midland, Mich., 1946.
A.A. Ashwort.
J. Inst. Petrol. Techn., 10, 787 (1924).
A.R.Carr,
W.D.Murphy.
J. Am. Chem. Soc., 51, 116 (1929).
F. T. Riley,
K.C. Bailey.
Proc. Roy. Soc. Irish Acad., B38, 450
В.А. Киреев.
Ж. прикл. химии, 7, 1 (1934).
1514.
растворителей, гл. П.— В кн.: Л. Пиатти. Рекуперация
телей. М., Госхимиздат, 1934.
W. De
Sorbo.
J. Chem. Phys., 21, 876 (1953).
150. В.
А.
Киреев.
Физико-химические
основы
процесса
рекуперации
летучих
(1929).
летучих
раствори-
152. K. K. Kelley. Contribution to the data on theoretical metallurgy. XI. Entropies of inorganic substances. Revision (1948) of data and methods of calculation,
U.S. Bur. Mines Bull., 477. Washington, 1950.
153. N. Pearlman,
P. H. Keesom.
Phys. Revs., 88, 398 (1952).
154. R. W. Hill,
D. H. Parkinson.
Phil. Mag., 43, 309 (1952).
155.5. Cristescu,
F.Simon.
Z. phys. Chem., 25B, 273 (1954).
156. M. Horowitz,
157.
158.
159.
160.
161.
162.
163.
164. Тянь
|
165.
166.
167.
258
A.A.Silvidi,
S.F.Malaker,
J.C. Daunt.
Phys.
Rev., 88, 1182 (1952).
Е. В. Lippincott,
M.C. Tobin.
J. Am. Chem. Soc., 75, 4141 (1953).
М. Х. Караплетьянц.
Ж. физ. химии, 32, 1763 (1958).
5.5. Мтфга,
О. М. СВаКгауагфу.
УТ. Свет. Phys., 22, 1775 (1954).
М. Х. Карапетьянц.
Научн. докл. Высш. школы, № 1, 12 (1958).
Таблицы термодинамических свойств воды и водяного пара. М.—Л., Госэнергоиздат, 1952.
М.
та рапетьянц.
Химическая термодинамика. Изд. 2. М., Госхимиздат,
М. Х. Карапетьянц,
Тянь
Ан-минь.
Аба
Sci. Natur. Univ. Szechuan., N 2, 47 (1959).
Ан-минь,
М.
Х. Карапетьянц.
Аба
$.
Маг.
Ошу.
57е-
chuan., N 2, 59 (1959).
Г. Д. Гальперин,
Л.А. Коновалов,
М. М. Кусаков.
Труды Инта нефти АН СССР, 1, вып. 2, 223 (1955).
|
П. И. Проценко,
Н. П. Поповская.
Ж. общ. химии, 24, 2419 (1954).
И. М. Роднянский,
И.
С. Галинкер.
Докл. АН СССР, 105, 115
(1955).
168.
169.
170.
171.
М.
М.
Х. Карапетьянц.
Х. Карапетьянц.
В. Т. Славянский.
Ж. физ. химии, 30, 1104 (1956).
Стекло и керамика, № 1, 22 (1958).
Ж. физ. химии, 27, 1776 (1953).
В. Т. Славянский.
Труды Совещ. по строению стекла. М.—Л., Изд-вс
АН СССР, 1955, стр. 251.
Ю.И. Шиманский,
С. Д. Равикович.
Ж. физ. химии, 29, 48 (1955).
Ф. П. Довженко. Канд. дисс., Одесса, 1955; Ж. физ. химии, 30, 2596 (1956).
172.
173.
174. М. М. Скорняков,
А. Я. Кузнецов,
К. С. Евстропьев.
Ж.
физ. химии, 15, 116 (1941).
Ж. физ. химии, 26, 1721 (1952).
175. В. Т. Славянский.
А. Б. Вязовская.
Ж. физ. химии, 38, 980 (1961).
176. А. Я. Дейч,
К. С. Евстропьев.
Ж. физ. химии, 15, 109 (1941).
177. А. С. Коновалов,
с6.: Физико-химические свойства тройной системы
178. М. М. Скорняков. В
окись натрия — окись свинца— кремнезем. Под ред. акад. Н. В. Гребенщикова. М.—Л., Изд-во АН СССР, 1949, стр. 36.
(79. Preston.
J. Soc. Glass Technol., 32, 45 (1934).
J. Am. Ceramic Soc., 17, 239 (1934).
180. Babcock.
Collect. Czechosl. Chem. Communic., 25, 1688 (1960).
181. Z.Seha.
182. М. Х. Карапетьянц,
А. И. Воробьева.
Труды МХТИ им. Д. И.
Менделеева, 48, 5 (1965).
183. М. Х. Карапетьянц. Ж. физ. химии, 30, 1420 (1956).
Contribution to the data on theoretical metallurgy. XII.
184. G. P. Coughlin.
Heat and Free energies of formation of inorganic oxides. Bur. of Mines Bull. 542.
Washington, 1954.
185. М. Х. Карапетьянц.
Труды МХТИ им. Д. И. Менделеева, 23, 3 (1956).
ГЛАВА
НЕКОТОРЫЕ ПРИМЕРЫ ПРИМЕНЕНИЯ МЕТОДОВ
СРАВНИТЕЛЬНОГО РАСЧЕТА. 1
В этой главе остановимся подробнее не нескольких примерах
применения методов сравнительного расчета, ограничиваясь лишь тремя
из них. Первый метод рассмотрим на примере энергии кристаллической
решетки, второй — на примере изобарных потенциалов и тепловых эф-
фектов
симости
химических
теплот
реакций,
третий —
образования.
ЭНЕРГИЯ
КРИСТАЛЛИЧЕСКОЙ
на примере
температурной
|
зави-
РЕШЕТКИ`
Энергия решетки 0 является одной из фундаментальных характеристик кристаллического вещества. Она связана с рядом других важнейших свойств и имеет большое значение при изучении геохимических
процессов. Для ее вычисления был предложен ряд методов (их обзор
можно найти в статьях [1] и [2]) и в том числе метод сравнительного
расчета,
которому
соответствует
приближенное
Oy = AO,
Значения
(, входящие
в (Х,
уравнение (1,57)
+ By.
1), вычислялись
(IX,1)
по уравнению
U = 3 (AH o0)4 — AH x8,
(IX,2)
где (A Haos)i 1 A Hogg — стандартные теплоты образования соответствующих газообразных ионов и химического соединения '. Для единообразия
все тепловые
[3].
ний
Расчет
эффекты
по этому
элементов
были
заимствованы
уравнению
первой
—
был
восьмой
из одного
произведен
групп
источника
—
для различных
периодической
системы
В табл. 30 результаты вычисления энергии решетки по уравнению
сводки
соедине[4,
2].
([Х, 1)
1 Так как правая часть уравнения (Х, 2) включает в себя работу против внешнего
давления, то она равна изменению энтальпии, а не внутренней энергии (в процессе распада кристаллов на газообразные ионы). Внутренняя энергия отличается от.энтальпии на величину пАТ (или при 25° С приблизительно на 0,6 ккал), где п — число ионов
в соединении. Здесь мы придерживались общепринятого в настоящее время приема
расчета, т. е. пользовались уравнением (1Х, 2). Следует, впрочем, отметить, что расхождения в значениях АГи АН почти для всех соединений находятся в пределах погрешности
применяемых
методов
расчета и
возможных
источников
ошибок.
To же, по-видимому, можно сказать и о различии в значениях величины Со и вычисляемой по (1Х, 2) величины И»›о8; так, например, для М№аС1 (о = 185, в то время как
(298—186.
В связи с этим отметим, что общепринятая рекомендация значений 0 с по-
грешностью 0,1 ккал является малообоснованной.
260
`
(см. последний
столбец)
для
галогенидов,
сульфидов,
гидроокисей
и гид-
— Майера
с более
ридов щелочных металлов сопоставлены с результатами расчета по различным методам. Во втором и третьем столбцах приведены величины,
найденные [4] по уравнению Борна, в четвертом [5] — величины, найденные по уравнению Борна — Майера. Пятый и шестой столбцы содержат
значения
(7, вычисленные
[6, 7] по уравнению
Борна
точной оценкой ван-дер-ваальсовских сил. В седьмом столбце помещены
средние значения из вычисленных А. Ф. Капустинским [8] по его первому
уравнению и С. А. Барковым [9] по этому же уравнению на основании
данных сводки [411] (оба ряда величин, за исключением [1Ё и ТТ, практически
совпадают).
В
восьмом
столбце
указаны
средние
из результатов
расчета по уточненному уравнению Капустинского, осуществленного им
[4101 и Барковым (оба ряда величин,
за исключением ВЪЕ и ВЪС/|, практически совпадают). В девятом столбце приведены величины, найденные
Барковым [9] по данным, приведенным в сводке [411], в десятом — результаты расчета по уравнению Капустинского с «кристаллохимическими
электроотрицательвостями» [12], в одиннадцатом
рекомендованные К. П. Мищенко [13].
—
приведены
величины,
_В двенадцатом столбце собраны результаты вычислений по уравнению (]Х, 2). Для всех фторидов эти величины не соответствуют результатам расчета по другим данным. Это, по-видимому, объясняется тем, что
теплота образования газообразного иона фтора (—79,5 ккал), включенная в сводку [3], несколько преуменьшена *. Поэтому для определения U
фторидов мы воспользовались приближенным уравнением (1, 38)
U = A,AH + Bo,
являющимся частным примером
чета.
Возможность применения этого
мере рассматриваемых соединений
туре значения АН gana AuF, CuF
второго
—
метода
(IX,3)
сравнительного
pac-
уравнения подтверждается на пририс. 218. Отсутствующие в литераu TIF были определены по графику
АНмех -—— АНкх.
Для проверки достоверности
найденных таким образом значений Uyex
по уравнению
(Х,2)
была
вычислена
величина
AHy-; она оказалась равною примерно — 68 ккал/г-ион.
Это значение
несколько
отличается
от принятого в обзоре [14], но лежит в пределах ошибок суммарного значения половины энергии диссоциации и электронного сродства, рекомендуемых в различных работах,
в том числе и в исследованиях последних лет [17]. Для’ 10 фторидов
среднее отклонение от принятой величины АНьк- равно 0,8 ккал. Даже
если учесть приближенность экстраполяции, обусловленную возможным выпадением фторидов, дальностью расположения точек для МеЕ
(рис. 218) и некоторую неточность значений теплот образования фторидов [3], все же значение АЯ — —68 ккал, по-видимому, не содержит
ошибки, превышающей 1—2 ккал (см. также ниже). Поэтому для всех
фторидов расчет 0 произведен по найденному значению AHy-. Отсутствующие
в литературе
величины АН для ВеЁ,, ZnF,, HgF, u CuF,
были определены по графику
АНмех,— АНсах,.
Найденные по
этим
данным
приближенные
значения
столбцы
13, 7, 8 и 10).
Вместе
Имек,
в пределах
1%
совпали
со зна-
чениями (мег, Которые были определены по графику U mex,
— AH mex,Значения Имег и (мег,
помещены
в табл. 30—33
(соответственно
1 Обращают
сульфидов;
на себя внимание
с энергиями
и значительные
решетки,
расхождения
вычисленными по
в величинах
0 для
это обусловлено прежде всего тем, что по. работе [3] AHg, =125,2, в то
время как найденное по [11] АН‹,_ = 146. В связи с этим подчеркнем, что значения 0
для сульфидов, гидроокисей и гидридов, найденные по уравнению (1Х,, 2) на основании
значений АНэ.в для 5?-, г; ОН, гиН`, г, вероятно, являются недостаточно точными.
261
Значения
энергии
кристаллической
Вещество
4
LiF
галогенидов, сульфидов, гид
[5]
[6]
[7]
2
3
4
5
6
—
—
240,1
243,0
195
189,7
193,5
226
RbF
163
477
494
170
175
213,4
181,6
173,7
243,6
[8, 9]
7
242
2416,4
215,4
186 ‚0
183 ‚0
181 ‚5
197 ‚5
183,5
162,5
155,1
—
192,5
175,7
224,6
192,4
171 ‚8
Lic]
NaCl
KCl
RbCl
—
189
164
156
—
179
161
156
199,2
183,1
‚ 165,4
160,7
201,9
186,5
168,9
164,7
200,2
183 ‚5
167,9
162,0
153,4
148,0
LiBr
МаВг
КВг
RbBr
CsBr
—
172
156
149
139
—
172
156
150
138
188 3
174,6
159,3
153,5
146,3
192,0
178,3
163,4
158,6
—
189,5
175,5
161,3
156,4
149,6
186,8
1741
155,6
148,4
141,8
LiJ
Ма]
KJ
RbJ
—
158
445
140
—
163
148
143
174 ‚1
163,9
150,8
145,3
178,7
168,9
154,6
150,3
176,1
164,3
152,4
148,0
173
164,0
145,0
138,7
CsC]
CsJ
146
131
142
132
152,2
139,4
—
—
142,5
133,0
112$
_
_
_
_
_
609,51*
Ма25
—
—
—
—
—
564,71*
K2S
Rb2S
_
_
ОН
205
Cs2S
NaOH
KOH
RbOH
CsOH
_
_
_
_
—
476
153
447
436
LiH
_
NaH
_
_
KH
RbH
_
_
CsH
—
работы
[8].
—
—
—
_
_
__
из
—
—
—
—
—
—
1* Заимствовано
_
—
_
_
—
—
_
_
—
—
_
_
—
_
_
_
_
_
_
_
_
_
—
_
_
__
_
__
:* Заимствовано из работы [9].
з* Вычислено по данным, приведенным в сводке [11].
262
(ккал/моль)
[4а]
222
CsF
0
[4]
МаЕ
КЕ
решетки
500,31
475 ,51*
453,11”
_
—
_
—
_
_
_
_
_
_
—
_
_
—_
_
_
_
Таблица
роокисей
и гидридов
[9, 10]
8
227,1
241,5
188,2
180
170,4
металлов основной
[9]
[12]
9
10
242,5 | 240,3 |
2145,0 {| 243,2 |
189,1
190,5 |
183,2 | 182,2 |
175,0 | 174,6 |
30
подгруппы первой группы периодической системы [1]
[13]
[3]
114 |
11
12
13
111 |
(41 | Принятое
14
238,9
243,8
189,2
180,6
174,6
|
|
|
|
|
229/71
202,5
477,9
170,1
159,9
239
214
190
182
170
15
16
234,5 | 233,5 |
212,5 |! 242,5 |
—
190
182
182,5 |
172
172,5 |
239
244
190
182
112
202,5
186
169
163
155
192,2
180,2
162,8
157
149,4
199,0
182,1
_ 164,3
160,3
154,9
|
|
|
|
|
207,4
182,2
164,3
153,8
144,0
|
|
|
|
|
192,1
179,2
163,1
157,7
1447,7
|
|
|
|
|
202,3
185,2
169,0
162,9
155,3
—
—
—
—
—
202,5
186
—
163
155,5
183,2
172,4
156,3
149,8
143,9
185,4
170,5
153,4
150,5
145,7
|
|
|
|
|
201,6
182,2
156,3
142,4
139,2
|
|
|
|
|
181,9
4170,5
156,6
154,3
442,3
|
|
|
|
|
191,3
1716,71
161,5
156,0
149,1
—
—
—
—
—
191,5 |
176,5 |
—
156
149
192
177
161,5 |
156,5 |
149,5 |
191 ‚5
176,5
161,5
156
149
170,4
161,0
146,8
141,1
135,2
175,3
161,6
146,8
144,3
140,5
|
|
|
|
|
190,4
166,4
146,4
139,2
130,0
|
|
|
|
|
169,5
159,6
147,8
4143,0
134,9
|
|
|
|
|
177,4
164,7
151,2
146,6
144,1
—
—
—
—
—
176,5 |
163,5 |
—
146,5 |
141
177,5 |
164
152
146
144,5 |
4177
164
151,5
146
144
—
526,5
509,3
466,5
452,3
|
|
|
|
574,2
512,0
462,1
444,0
400,5
—
—
—
—
—
—
506 , 4
471 ,4
445 ,0
426,5
—
—
—
—
—
546
507
465
447
424
548
506
464 °
445
426
—
—
205
182
—
202,3
174 ,0
150,3
140,8
132,1
—
—
—
—
—
202
170
148,5 |
142
134,5 |
199
174,5
150,5
141,5
130,5
—
—
—
—
—
219,5
193,8
170,7
—
—
—
—
—
—
—
220,5
194,5
171,5
163,5
154
249,5
195,5
170,5
164,5
150
—
553,12*
498,22*
476,52*
456,62*
|
|
|
|
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
246, 1
190, 4
169, 0
161,3
151,3
*х Найдено
по графику
(— АН.
'*
Найдено
по
графику
U;—
Окх
(рис.
219).
‘*
Найдено
по
графику
0; —
Имеси
(рис.
220).
—
—
—
—
—
|
|
|
|
547
506
|463
446
425
|
|
|
|
|
|
|
|
204
112
4149,5
144,5
133,5
220
195
171
162,5
152
263
Таблица
31
Значения энергии кристаллической решетки 0 (ккал/моль) галогенидов, сульфидов 9
гидроокисей и гидридов металлов побочной подгруппы первой группы периодической
системы, аммония и таллия [1]
По рисункам
10]
[9,
Вещество
4
[121 |
[9]* |
2
3
[3]
[43]
4
5
218
6
7
\
CuF
AgF
AuF
NH4F
TIF
—
200,7
—
—
—
CuCl
AgCl
AuCcl
NH,Cl
тс
_
472,4
_
—
—
|
CuBr
|
AgBr
AuBr
МНаВг
TIBr
Си]
154,6;
Аи]
NH4J
—
Ag2S
CuOH
AgOH
AuOH
тон
CuH
AgH
AuH
тн.
* Вычислено
264
—
—
_
—
—_
—
_
|640,8|
638,3
|594,7|
—
—
_
_
—
_
—
_
—/
_
_
_
—
|2494|
—
_
_
—
—
_
156,4|205,3 | 198,8
—_
Cues
T1.S
_
|234,0|
|240,3|
—
—
_
_
Ту
(NH4)2S
_
—
|237;,2|
—
|234,7]
212,7 | 246,4 |205
|247,3|
—
—_
—
|246,7|
—
—
1164,5 | 467,0|
—
—
|170
1476,3]
205,6
—
—
—
_
—
по данным,
—
—
_
—
—
__
приведенным
—
|499
—
—
—
—
—
—
|145,5|148,1|
—
—
|245,8|
—
|165,1|
—
—
—
—
— |
—]|]
_
—
—
—
—
—
—
_
—{
—_f
_
_
1226,8|
243
226
247,5]
193
|188
|210,0/
—
|246,5}
1234,0]
|243,7|
|24571|
|154,0|159,3|
—
|171,5|
_
|225
—
—
—
—
—
— |
|9017,2;
—
— |
— |
—
—
в сводке
220 |
|
9
8
чения.
10
— |
—
— |
[11].
1243,5|
|225,5|
247,5|
|192,5]
|187,5|
242
243
2925,5 | 225.5
241,5 | 241,5
193
192
188
188
1|234,5|
1247,5!
|246,5|
1467,5|
[1476 |
234,5
247,5
246,5
167,5
176,5
1234,5
234.5 | 2341,5
|244
1246
1|459,5|
|471,5]
|226,5|
1240,5|
|
|
|
|
|
234,5
247,5
246,5
167,5
476
214,5 | 244
246
246
459,5 | 159,5
4172
171 ‚5
226
209
226,5
209
—
|245,5|
245,5 | 245,5
—
|165,5|
464,5 | 165
1665,8 | —
1623,4]
.— |
—]
— |
— |
—
| 219 ©
риня-
\
—
|272,2|
—
— |
225,8 | 249,6| —
1246,3 |
—
—
—
— |
—
— | — 1 182,4|
—
—
—
—
—
_
_
Ас]
AussS
—
165,1
_
п.
тые зна-
—
—
—
—
|148
— |
— |
—
1472
— |
148,5 | 148
666
666
695
695
623
480
548
623
480
518
—
|240,5}
— | 249,5|
— | 247
—
1168,5
237.5 | 238,5
248,5
|219
247
247
169,5 | (468)
—
1241,5]
239,5
—
|247
247
—
—
1223
1178
202
|238
222 5
247
(178,5) | (478)
Таблица
Значения
энергии
гидроокисей
кристаллической
и гидридов
Вещество
4
ВеЕ›
MgF2
СаЕз |
ЗЕ
BaF
BeCle
МЕС
металлов
решетки
ОС
основной
системы
[8, 91 | [9, 10]| [9]* | [42] | [1311
— |
| 727,9 |
642,7 |
590,8 |
556,5 |
6
5
3
2
—
6834
616,9
574,8
546,3
714,2 | 672.8
593,0 | 576,7
816,11
699,4|
619,5|
584,8|
551,1|
729,6:
621,4
(ккал/моль)
подгруппы, второй
[1]
—|
—|
—|
—|
—|
[3]
7
—
666,3
594,7
559,0
523,6
— | 720,1
|597 | 598,6
По
32
галогенидов, сульфидов,
группы
о
Но
периодической
рисункам
[р
10
9
828 | 823
690 | 684
614
582 | 581
553 | 552
719 |
599
—
—
Принятые
значения
11
820
685
616
582
552
720
599
CaCle
SrCle
BaCle
535,2 | 528,2
498,7 | 496,8
474,0 | 475 ,2
544,5 | 513 | 536,8
542,0| —| 509,1
480,5 | 452 | 484,6
—|
507 |
482 |
—
—
—
537
508
483
BeBre
MgBre
CaBre
667,8 | 636,8
560,6 | 549,7
508,6 | 505,4
714,4| — | 692,2
605,5 | 567 | 574,9
531,4 | 484 | 514,4
687 | 692
575 | 576
— | 545
690
575
514
SrBre
BaBre
Ве]
МЕТ»
475,5 | 476,5
453,1|
456,6
604,7 | 586,3
515,4 | 544,3
489,3|
— | 487,2
468,2|
— | 465,6
664,5|
— | 664,6
578,0 | 540 | 547,4
485 |
489
487
462 | 465
464
658 | 657
658
548 | 546
547
CaJe
Зт7о
BaJe
471,2 | 412,6
442,6 | 447,2
423,1 | 429,6
505,6 | 459 | 490,8
414,3| — | 462,8
444,0] — | 439,3
— | 491
463 | 461
441 | 443
491
462
442
Веб
Mgs
CaS
SrS
BaS
—
812,7 |
731,4 |
680,4 |
646,1 |
—
786,9
719,4
675,8
645.9
933,1|
808,0|
122,0|
662,5|
648,0|
895,2
770,0
703,3
660,4
626,9
895
768
696
659
628
|
|
|
|
|
903
764
694
661
632
900
766
695
660
630
_
— | 780,4
—/630,4
—| 546,4
—|504,2
— | 470,9
784
618
539
503
473
|
|
|
|
|
781
624
540
504
472
781
620
540
504
472
—|
—.
—
—|
— | 5716,6
810 | 814
654 | 655
576 | 515 |
Be(OH)2
Mg(OH)s
Ca(OH)e
Sr(OH)2
Ва(ОН)>
— |
—f
—
— {|
—
_
_
_
—
—
—
—
—
Вен»
МН»
СаН2
— |
—|
— |
_
—
_
752,7,|
640,8
564,5|
Sri2
ВаН»
* Вычислено
—|
— |
—
—
по данным,
|
|
|
|
|
531,4|
499,3|
приведенным
—|
—|
—|
—|
—|
— | 537,8
— | 504,7
в сводке
538 | 538
507 | 506
812
654
576
538
506
[11].
265
Таблица
33
Значения энергии кристаллической решетки О (ккал/моль) галогенидов, сульфидов .
гидроокисей и гидридов металлов побочной подгруппы второй группы периодической
системы и двухвалентной меди [1]
По
вещество | [81 | [8, 91 |9, 101|
4
2
3
Рок
CdF2}
HeFs
СиЕ2
174411
[650,2]
—}
—{;
4
5
— | —
— |623,1 |
—|]
—
—j-—
ZnCle! = (581,8
Сас
(91* | (121 |{15,16]|[43)}
—
—
—|
—
5702*
6
7
CuCle
ZuBrz
7012
640,8}
630
— |
—
|642,5)
—|
—
|5407*|
_.
|626,6]
646 | —l632,5
—
|5057*|
_
|598,6]
604 | —l614,7
HgJe
Си
—
—
1454*|
15062%*|
_ | — | 595 | —]614,44*)
_ |574,3| 628 | — 634.4
15102*|
—|
476
647 | —I662,7
|415,5 1476,5 | 566,8 | 531,4|
—|
—|
ZnS
798,6
CdS
Hgs
Cus
— ! — |
Zn(OH), |
—|
Cd(OH)2 | — |
НЕ(ОН)|
—|
Са(ОН): | —|
ZnH,
сан.
HgHe
СиН2
—
16562* |
—
16062*|
— 18323]
— | —
— 16552**,
—{
—|
|
—
—
|
— |
—
|
_
16041574,7
— | — 838,4
— | — 786,8
— | —/928,74*|
— | —Il866,9
— |
_ |
573 |647/591,7
599 | — 619,5
625 | —l652,73*]
561
139,9] 739,3 |726,2 | 805,0 | 752,7|
—|/
—|—
—
—|
—|{
—
— |800,0|
—|
720 | —665,6
676 | — 637,6
И
=
_ | — | 744 | —leg4,5
die
—
|662,5,
—
}|—|
—
—
15%,7/
—
|—|
— |
о
—
1633,71
—
|-|
г
1*
Вычислено
**
Красная
по
данным,
приведенным
:* Вычислено К. Б. Яцимирским [15,
з* Если исправить значение АНсивг,
модификация.
в
10
alae
13
707
656
660
724
|707|704|
(655/653)
16591658]
|724/717)
705
654
659
749
16481649]
648
[629629]
629
—
|631/633}
632
—
1615/6413}
614
—
—
1644644]
16341632]
643
634
—
1519%*|
—
—|
= —68 | 228/229
608 | — 628,0
—
сводке
16].
(по графику
—
:
|^Нт-= зы
—
1635603 ,5
ри-
сункам
|676/647,7
584
— | 5143,6 509,4 | 577,0 | 557,8|
—|
— 1496%*|
_ | —|
—|
— |5427*|}
_ |598,.6|
|
Сато
9
—|
—|
-CdBre
НеВго
CuBre
i
|722,0| 690 | —| 2— |
|648,0| 638 | 633,0 |
— | 646
||
—|
|691,2; 704 | —l698,0 |
570,71 540,8 |533,0 | 595,4'| 574,2]
НС]
8
3]
По
—
16041605]
—
1663665]
—
—
_
—
1590592]
|621/622|
1647649]
|575|574|
— | —I843|
— | —|787|
— | —| —|
— | —863|
604
664
594
6214
648
575
860
(786)
~829
865
—
1667674!
669
—
—
1637639|
16841688!
638
686
—
—
—
—
—
[645619
16861690]
{633/637}
1647649]
17031705]
617
—688
~635
—648
—704
.
[11].
АН1т—
АН т), то получим
Осив:,=650.5.
уравнению
ны
на
(1Х,2)
на
графики
U mex—Uxx
основании
данных
Uy, =f (U1).
(puc.
219),
сводки
[3],
Ha рисунках
UO Mex—U
mec
они
показана
(puc.220),U
были
нанесе-
взаимосвязь
mex,—U cax,
(рис.
221)
и (мех,О мес, (рис. 222); здесь же приведены значения энергии решетки
гидроокисей, гидридов и сульфидов (пунктирные прямые). На рис. 2149 и
220 радиус точек принят равным 1 ккал, а на рис. 221 и 222—2 ккал.
мех
280
0
ty
ne
24
ie
\ <.
Ve<
220 -
м
вс
Е
05$
260+
|
“Mo
240 |. ah
9
Or
220-|
<
Z200r-
.
200
180Е.
Е
Г
180 +
/
160Е
/
(607
140
ии
1
И
ий
чо
!
-140
t
-100—
1
!
-60
)
|
-20
AH?
и
“4
И
(fo
298
Рис. 218.
дартными
Рис. 249.
стан-
Взаимосвязь "между
решетки
теплотамиз образования
°
аммония и одновалентного таллия
ИП
ЧФИДОВ
[3]
240
220
200
180
160
Ux
Взаимосвязь
(ккал/жоль)
энергиями
между
галогенидов калия
и
гидридов,\ гидроокисей и сульаммония
ы,
г руппы,
пер
элементов первой
Галогенидов,
АНооз (ккал/моль) и энергиями кристаллическойss решетки И (ккал/моль)
в рядах галогенидов первой- группы,
ee
1/40
100
овалентного
и однова
ew
таллия
[3
[3]
Как видно из этих чертежей и из табл. 30—33 (соответственно столбцы 14 и 15,8 и 9, 9 и
10, 11 и 12), для большинства веществ погрешность вычисления по уравнению (Х,1) не превышает указанных значений, причем точность вычисления не зависит ни от типа решетки,
ни от степени полярности связи. Среднее расхождение в значениях,
заимствованных
на основании
из
рис.
данных,
219—222
и вычисленных
по
из 90 не превышает
1 ккал; для остальных веществ
некоторых соединений элементов побочных подгрупп)
дение
несколько
больше,
но
ляют ШЕ, К,5, СзОН,
ние оказалось равным
ВеЕ.,
—2%,
(по
К.5
несколько
ным
крайней
больше
мере,
источником
3%.
для
ошибок
уравнению
(1X,2)
приведенных
в справочнике [3], для 65 соединений
не
превышает
Саб и Мо (ОН).,
и Са (ОН)., для
Вероятно,
и Саб,
служит
для
1%.
неточность
Исключение
состав-
для
которых расхождекоторого оно составляет
некоторых
возможно,
(в том числе для
среднее расхож-
для
из
этих
соединений
гидроокисей)
значений
теплот
основ-
их обра267
зования!. Кроме того, следует учитывать меньшую точность значений
энергий решеток гидроокисей, гидридов и сульфидов, найденных по
чертежам с сеткой для галогенидов [для сульфидов побочных полгрупп
значения ( совершенно не укладываются в «сульфидную сетку» металлов основных подгрупп; для них необходима новая шкала (см.
нижний правый угол рис. 220 и 222)]. Разумеется, для всех веществ
в погрешность расчета при помощи зависимостей, представленных на
рис.
219—222,
входит
О мех
280
ошибка
Cs RbDK
в значении
Na
энергий
решеток
соединений,
Lt
260
2и0220200Е-
780300
i
DOF
f
100
|
1,
140
|
Ш
160
200
180
|
220
[
l
1
240
{
240
220
200
180
„1,“
|
|
260
250
Mec
|
J
1
300
280
Мес
Рис. 220. Взаимосвязь между энергиями решетки 0 (ккал/моль) хлоридов щелочных металлов и энергиями решетки галогенидов,
гидридов
гидроокисей и сульфидов элементов первой группы, аммония и одновалентного таллия [3]
В правом нижнем углу показана взаимосвязь между энергиями решетки
и сульфидов таллия и элементов подгруппы меди
хлоридов
которые отложены по оси абсцисс, а также неточность теплот образования.
Необходимо указать на следующее: если все значения ( найдены на
основании достаточно надежных и согласованных между собой данных, то
эти значения Также оказываются лежащими на прямых. Так, если в 0снову расчета по уравнению (ТХ, 2) положить данные, собранные в сводке
[41], т. е. воспользоваться значениями (, рекомендуемыми А. С. Барко-
вым
[9],
то на графике
1: —
О
образуется ряд прямых,
подобных пря-
мым, изображенным на рис. 249—222. С другой стороны, поскольку энергии решетки представляют систему значений, то расчет И сочетанием ве* Влияние уточнения величины АН можно показать на следующем примере: если
принять АНсив,,=—29 (в соответствии с графиком АНу.х,— АНсах,) вместо рекомендуемого значения — 33,2 [3], то явно выпадающая точка (рис. 221) окажется на прямой (см. табл. 33).
268
Uvex
3900г
мех,
g00-- Ba
с
800-
800-
700
700+
600-
G00r
500-
A
Be
Sr
Ca
(
100
|
—
L
__3
|
Рис. 221. Взаимосвязь между
энергиями
решетки (И (ккал/моль)
галогенидов
кальция и энергиями решетки галогенидов, тидридов, гидроокисей и сульфидов
элементов второй группы и двухвалентной
меди
[3]
A,
Г
13}
1,1+
09
7
|
689
660
Mecl,
J]
tL
700
МЕСИ,
600
900
сах,
|
640
|
1
|
100
700
1
620
600
Г
Взаимосвязь между энергиями
Рис. 222.
решетки И (ккал/моль) хлоридов элементов
подгруппы бериллия и энергиями решетки
галогенидов, гидридов, гидроокисей и сульфидов элементов второй группы и двухвалентной меди [3]
В правом нижнем углу показана взаимосвязь между энергиями решетки хлоридов и сульфидов
кадмия, цинка и меди
Li*
Na’
-Г
а
|
05
1}
07
L
l
|
|
)
09
l
If
L
2,3
A;
1,4
1,2
7
1,0
0,8
03
l
Рис. 223.
|
05
И
0,7
|
089
1
11
Lee
15
Зависимость коэффициента
|
1,7
1
|
19
|
у
27
4: уравнения
1
}
г
23
(1Х, 1)
а — в рядах 11Х—С5Х
(рис. 219) от радиуса г (А) катиона и в рядах Мер — MeJ (puc.
радиуса г аниона; 6 — в рядах
ВеХх, — Вах, (рис. 221) от радиуса
гкатиона
и в рядах
Мет.
(рис. 222) от радиуса г аниона. о — по Гольдшмидту;
® — по
Полингу
220) or
МеЕ,—
личин, заимствованных из различных источников, может привести к значительным ошибкам и исказить соответствующие закономерности даже
в тех случаях, когда отдельные слагаемые будут отличаться высокой точностью. По этой причине мы не включили расчет энергии решетки окислов, селенидов и некоторых других соединений (стандартные теплоты
образования газообразных ионов ОН”, 5е и других ионов в работе [3}
не приводятся).
Как и следовало ожидать, точки для галогенидов металлов основной
подгруппы в каждой из групп образуют пучок прямых, в который не
укладываются прямые для побочной подгруппы. Это показано на рис. 219—
222 (см. также рис. 248), на которых точки для металлов основных подгрупп расположены по вертикалям (исключение составляют [* и Ве**),
в то время
как
для
Си",
Ар’,
Аи’
(ТГ)
они
образуют
пучок
наклонных
прямых. Аналогичная закономерность наблюдается и для анионов: ионы
СГ, Вг и ТГ
соответствуют вертикальным прямым, а Е` — наклонной
прямой; ионы Н`, ОНТ ($?) образуют сетку с ббльшим наклоном (см.
рис. 219—222). На рис. 223 тангенс угла наклона прямых соответственно
naa KX, MeCl, CaX,, МеС|. представлен как функция Гме+, Гх-, Гме+ И
гх-. Закономерное расположение точек является косвенным подтверждением принятого значения АНк-. Из этого чертежа следует также, что
системы радиусов Гольдшмидта и Полинга являются одинаково
ными, на что указывал К. П. Мищенко, отмечая, что нет никаких
вероятоснова-
ний отдавать предпочтение тем или другим из них [13]. Для галогенидов
обе системы приводят к практически совпадающим результатам; для металлов они несколько отличаются. Отметим, что радиус иона лития, найденный по прямой А 1—тме+, меньше радиуса, рекомендованного Гольдшмидтом (0,78 А), и равен —0,6 А, т. е. совпадает е 7г1+ по Полингу.
Выражая в аналитической форме зависимость, представленную на
рис. 223, можно вычислить энергию решеток галогенидов металлов основных
подгрупп первой и второй групп по
для основной подгруппы первой группы
O vex
—
(1 ‚834—0,615
ГМе+)
. (Икх
приближенным
—
100)
+
~ (2,270—0,703 rx-)(U mec: — 100) + 100,
для основной
подгруппы
второй
100
уравнениям:
=
(IX,4)
группы
Омех, = (1,332—0,33 гме:+) Осах, = (1,51 —0,28 rx-) Uveci,
(1X,9)
(здесь г — радиусы ионов по Полингу).
Средняя погрешность вычисления по уравнению (1Х,4) (если исключить [1Е) равна 0,8 ккал, по уравнению (1Х,5) (если исключить расчет
ОУвех, по
Исах ‚)— менее
5 ккал.
В табл. 34 приведены значения энергии решетки галогенидов
гидроокисей некоторых элементов третьей группы.
Расхождения
значениях
Смех,
найденных
по
графику
(мех, —Илмх,
и
и
в
вычислен-
ных по данным работы [3], не превышают 2 ккал. Значения U yeon),
менее точны; отметим, что для большинства гидроокисей они были
найдены косвенным путем, так как теплоты образования известны
только для четырех веществ [3], причем для АКОН)з и ТКОН); они
представляются сомнительными.
Если
прямые
на графиках
U;; —
U;
и
0 —
АН
для
соединений
ме-
таллов основных подгрупп располагаются в последовательности, отвечающей возрастающим зарядам ядер, причем при продолжении прямых они
сходятся примерно в одной точке, то для соединений элементов побочных
подгрупп этих закономерностей не наблюдается. Во-первых, здесь нет
веерообразного расположения прямых От: = 71 (0). Оно не создается даже
270
Таблица
34
Результаты вычисления значений энергии кристалличеекой решетки U (кнал/ моль}
галогенидов и гидроокисей некоторых элементов
третьей
группы периодической
системы [1]
AHHOH
Катион
Al3+
Саз+
In3+
T13+
Sc3+
Y3+
Lat3
* Вычислено
**
***
Вычислено
Е-
Cl-
Br-
J-
OH-
1409
1425*
1319*
4317*
1280*
1194*
4140*
1294
1339
1234
1256
1163
1076
1016
1262
1315
_ 1208
1240
1130
1044*
983*
1227
1289
4182
1223+
1094+
4009
944
1345**
1370**
1262
4270**
4210**
1125
1062***
по величине
АНмех,,
по величине
АНме(онН).›
Найдено по значению
в том случае,
АНта(он).”
энергии
решетки
прямая
для металла
—363
в каждой
АН Mex,— 4H alx,.
из графика
АНмех,
— АНтах,.
(вычислено автором).
чертежах
в каком-нибудь
Во-вторых,
из графика
Найденной
если на соответствующих
дывать
ной группы.
найденной
ряду
по оси абсцисс
соединений
данной
группе на соответствующих
с 32-электронной
оболочкой
(соответственно
откла-
побоч-
графиках
для Ап,
Но и Т!)} смещена и имеет иной наклон, чем прямые для других металлов.
Таблица
35
Результаты вычиеления значений энергии кристаллической решетки ( (кнал/ моль)
некоторых соединений элементов четвертой —восьмой групп периодической системы [1]
Катион
Sn?2+
50+
РЬ?+
Pbt+
Ti2+
Ti3+
Tit+
72+
73+
Zrt+
V3+
Cr?+
Сг3+
Mn?+
Ее?+
Fe3+
Co?+
Ni2+
Pd?+
* Вычислено
F601*
2192*
589
2234
649
1336
2324
706
4345
2127
—
667
1374
654
680*
—
713*
724
717*
|
|
Ch
Br-
548
—
536
—
584
4215
2179*
640
4202
1954
1180
600
4270
600
616
1276
649
660
534
2107
524**
—
569**
1194
2457
623***
1177
1925
—
587*
—
582
600
—
633
643*
по величине
** Вычислено по значению
663
АН,
|
|
АНИОН
648
найденной
OH-
S2-
515
—
508
—
548
4454
2125
604
1146
1883
—
575
—
560
580
—
612
621
567
2196
545
—
737*
—
2260*
797
—
2060
—
—
1328
616
634
—
666
677
725
—
714
—
—
—
—
—
—
—
—
—
—
715
798
—
834
844
631 *
из графика
А Нрьвг, ® — 68.
*** Уточнено интерполяцией по прямым
J-
Uzrx,—
|
`
673
~890*
АН11— АНТ
UTiX,:
271
Таблица
Результаты вычиеления значений энергии кристаллической решетки
некоторых соединений элементов
первой
группы периодической
Катион
Анион
Lit
|
Nat
|
ВЕ _
Boe
14, QI 162,6]
3
1175 1090 |
BeF; | 496 | 467 |
Bio
|930 |380
ВгОз- | 196,1 484,3|
Kt
8,5| .
148,5
980 |
428 |
|810
463,1|
|
143,3|
940 |
444 |
|790
456,6!
—
CNO-
218,2|
—
189.9
—_ | — | — |
168,5]
—
CNS-
coe
<10;-
|6
C1047
СО:
On
8
НЕ;
HeNН5
193.5)
— |
| 220,77
| 246,46
_
R bt
218,2)
202,2
0 (ккал/моль)
системы [1]
Катион
|
CH3;COO-}
CN-
36
_
Cst
Анион
189 138,6
905 ||
404 ||
|765 |
150,8
_
Н$е-
10; |
yo. |
MnOs |
М 0%
NOz |
—
—
—
—
—
644
1045
PO?-
|
90
й
|| 850:
—
181,5]
Se2-
|
Nat
|
Kt
—
—
—
—
|
Rbt
—
|
202.2] 486,4 467,0] 460,2]
463,9| 153,8] 141,41 136,3)
468,14, — | — | — |
|483 |455 |419 |406 |
219,8) — | — | — |
NOs~ | 197,5)
— | — | — | — |] 0F
— | — | — | —
Lit
|559 |503
|950 | 870
—
Cst
—
154,4
132,5
—
394
—
—
|483 | 464
|844. | 814
15|
|950 | 895 | 825 | 800 | 780
588
—
—
—
133 | 455 ‘| 49
407
—
— | —
[449 |406 || 9е0% | 500 | 469 | 430 | 416 | 403
— | — | — | — || 810
11645 [4580 11445 [41400 4355
— | — | — | — |] Te | 554 | 544 | 464 | 444 | 432
| 249,8, 201,0] 179,9] 172,0] 165,01 1. (2
| 247,4] 218,6| 194,2] 185,14] 177,0
| 193,5 |||
|
М0
4
|480
5 | 4
|452 |446
,
39
|403 | 391
Следовательно, для металлов побочных подгрупп наклон прямой не связан однозначной зависимостью с радиусом катионов, т. е. наклон определяется не столько радиусом, сколько поляризацией. В связи с этим можно отметить,
что наклон
прямых на графиках А 1—7; с переходом от
первой группы периодической системы элементов ко второй (см. рис. 223)
падает, т. е. роль радиуса уменьшается.
Указанные особенности, вероятно, обусловлены прежде всего уменьшением степени ионности связи при переходе от металлов основных под-
групи к металлам побочных
подгрупп.
Этим объясняется и относительно
большее нарушение рассмотренных закономерностей для металлов побочной подгруппы третьей группы. Уменьшение полярности связи можно
подтвердить и следующим. В то время как для металлов первой и второй
групп
графики,
соответствующие уравнению
(Х,
1), дают одинаково хо-
рошие результаты независимо от того, что отложено на оси абсцисс —
кх(Осах,) или Имес( Омеси,)
(см. рис. 219—222), для металлов третьей
группы этого не наблюдается: график в координатах
Имех.— Имес, дает
менее удовлетворительные результаты, чем график в координатах Uyex,—
UO six, 1.
Расположение прямых
жению в периодической
увеличение
эффективного
значения
0. Косвенным
рушение монотонности в
для Си, Ас и Аи не соответствует их располосистеме. Это связано с лантанидным сжатием;
заряда у атома золота приводит к увеличению
подтверждением этого соображения служит находе значений различных свойств в ряду Си —
Ас — Аа (см., например, [21]). Это выпадение Ап приводит не только к нарушению последовательности в ходе прямых для элементов побочной подгруппы, но, в частности, и к тому, что прямые для них при своем продолжении не пересекаются в одной точке. Здесь в отличие от рис. 151 точки
1 Следует отметить, что последовательность расположения прямых
О мех, — И ах‚(Са, Т1, Г) не соответствует возрастанию атомного веса:
вторичная периодичность (см. также рис. 160).
на графике
сказывается
для
всех
галогенидов
ствительности
туре
цезия
значений
лежат
на
одной
энергии решетки
соединения.
прямой
(в отличие
—
результат
от объема)
нечув-
к струк-
По уравнению (Х, 1) можно вычислить энергию решетки (и, следовательно, теплоту образования) и в других рядах подобных соединений, а
также скорректировать
имеющиеся данные. В табл. 35 приведены значения О для некоторых галогенидов, гидроокисей и сульфидов тех металлов четвертой — восьмой групп периодической системы элементов, для
которых известны теплоты образования газообразных катионов [3]. Большинство этих веществ (как и многие соединения, включенные в предыдущие таблицы) не являются чисто ионными; более того, некоторые из них
по типу связи приближаются скорее к гомеополярным и даже к молекулярным. Поэтому величина энергии решетки для них имеет условное значение. Однако для единообразия мы сочли целесообразным их также
включить в таблицу.
Таблица
Результаты вычиеления значений энергии кристаллической решетки
некоторых соединений элементов второй группы периодической
Катион
АНИОН
AHHOH
Mg?t
Са?+
Sr2t+
Аз0— | 3025 | 3415 | 2265 |
633 | 540 | 477 |
ВЕ:BO? 33440 | 2740 | 2640 |
BeF?813}
651 | 609]
в103- | 2870 | 2290 | 2455 |
ВгО:947 | 757 | 528 |
—|
624;
CH;COO-| 760}
719 |
584
CNOCNS"
760 || 6244;
695
sco}
cos”
954 |
с10з-
772
685 | 55|
С10-
619 | 495 |
5000
НСО;
||
cro?
H2N-
HS-
О (ккал/моль)
системы [1]
Катион
`
Be@t
CN-
37
808 | 658 |
695 | 560 |
|
Be2t
2155 | 2080 |] HSOs- |
452 | 436 |Н$е7
2485 | 2385
2385 7037
|0
578]
558 |IMno,2055 | 1990 ||Mo07498 | 477 NOs"
— |INOs—|
—
—
—}—|
—|—|
_
_
—|
—|
— |
—|
—|
—
826 | 696 | 637!
Ba2t
— |
—|
| |
—
—
—
586
—
594|
565
—
|
|
||
543
529
584
soz
Ca2t
964 |
3105
i
783
liseg?-
Ba2t
—|
595 |
—|
—|
_
—|
566 |
—|
—|
—
548
—
—
_
_
2480 | 2325 | 2205 | 2130
687
[|562
Sr2t
| 506 | 478 | 459
| 494 | 467 | 449
|| 452
542 || 480
509 || 490
dds
606 | 493;
794 | 632 |
772)
627,
706 | 5721
50
- 15503
—
—|
oF
—— POs 3
675
659
719
soz
Mg?t
—
—
—
|290 | 2340 | 2200 | 2095 | 2030
947 | 7571
—|
—|
—
817 | 654 | 612 | 548 | 561
[905 | 3425 | 1195 | 1850 | 4760 | 4690
_
||TeOZ”
|iwo?-
794 | 632 |
788 | 629
595 |
566 |
547
590 | 562 | 544
В заключение укажем, что отмеченная в предыдущей главе возможность
расширить интервал применения соотношения (VIII, 12) при переходе
от (УШ, 13) к (УШ, 14) имеет место и в данном случае: уравнения
18 м. х. Карапетьянц
Ay = 1,205
— 1,694 lg rx:
(IX,6)
A, = 1,768 — 2,602 1¢ ra-
(IX,7)
273
позволяют вычислить приближенные значения энергии решетки большого
числа соединений (см. рис. 224) [2]. В соответствии c уравнениями
(1Х, 6) и ([Х, 7) получено уравнение
Ume,x,, = (1,205 — 1,694 Ig rx+) (130,2 — 188,2 Igra-) + 86,0.
(1Х,8)
Проверка этого уравнения на 162 соединениях привела к среднему отклонению от расчета по уравнению А. Ф. Капустинского и К. Б. Яцимирского
А
0,0
|
Na
05
10
15
20 '9%K* 25
|
+
1,1
0,9
0,7
|
1,1
|
16
Рис. 224.
Зависимость
[22,
26],
ствовали.
равному
0,5%.
—
катионы;
Были
|
9,1
Б
4:
[2]
—
95
уравнения
([Х,
|
|
441
ign -
|
1) от ради-
анионы
вычислены
[2] приближенные
значения
решетки 256 соединений, для которых данные в литературе отсут-
Они представлены
в табл. 36 и 37.
ИЗОБАРНЫЕ ПОТЕНЦИАЛЫ
ХИМИЧЕСКИХ РЕАКЦИЙ
ного
|
2,6
коэффициента
уса г (А)
А
энергии
|
2,1
И ТЕПЛОВЫЕ
ЭФФЕКТЫ
В качестве другого примера рассмотрим
уравнения (11, 41)
AZ = A,AH + Ba.
вариант
приближен(IX,9)
Ранее уже отмечалась (см. стр. 93) целесообразность широкого использования этого уравнения. Поэтому на уравнении (]Х, 9) и возможности
его применения остановимся подробнее.
Чем можно объяснить параллелизм между теплотой и изобарным потенциалом образования? Почему он находит свое конкретное выражение
именно в соотношении вида (ЦП, 1)?
|
Обосновать рассматриваемое соотношение можно следующим образом.
Изменение энтропии Л5 при процессе, в частности при образовании
данного соединения, определяется прежде всего изменением числа молей
Ап газообразных реагентов. Имеет значение и специфика данного прев274
ращения. В качестве величины, характеризующей особенность процесса,
выберем наиболее доступный его параметр — тепловой эффект АН. Таким
образом,
будем
считать, что
AS =f (An, AH).
(IX 40)
В первом приближении примем, что эта зависимость может быть выражена
уравнением
А5 — аАп + БАН - с,
((Х,44)
в котором а, Би с — постоянные для данной группы веществ '.
Подставляя значение Дб из (1Х, 11) в уравнение
AZ= АН
— ТА»,
получим
(IX ,12)
А2 =АН—Т-45
— Т.Б.АН — Т.с =
= (1 — 7.5) АН —Т-а-Ап —Т.с
(1Х,13)
или в соответствии с тем, что Г = соп$ё и для данной
значения а, 6 и с приняты постоянными,
AZ = А». АН + ВАп
где
Будем
относить
14) следует
величины
= КАН)
АЙ и
АНк 1
уравнение, тождественное
B, = BAn-+y¥.
Таким образом, если
та А, не должно зависеть
динению) элемента, то
циональны валентности
А2
1,
точки
веществ
(IX,14)
As = 1—DOT,
B= —al
т= — СГ.
И
(Х,
группы
(IX ,15)
(IX, 16)
(IX,17)
2-aKe;
Torga
An
=
const u w3
([Х, 9), в котором
(IX 18)
для данной группы веществ значение коэффициенот валентности переменного (от соединения к соезначения коэффициента В, должны быть пропорэтих элементов. Это означает, что на графике
для данной
группы
веществ
должны
лечь
на ряд
па-
раллельных прямых, расположенных в порядке, отвечающем увеличению
(или уменьшению) валентности соответствующего элемента. Если переход
от одной
прямой
к другой
будет
соответствовать
изменению
валентности
на одинаковую величину (например на единицу), то в соответствии с уравнением (]Х, 14) линии будут располагаться на равном расстоянии друг
от друга.
|
Все сказанное выше иллюстрируется рис. 225 и 226.
жены мольные изобарные потенциалы и мольные теплоты
ридов элементов разной валентности; в соответствии с
чающие им точки располагаются на ряде параллельных
226 нанесены грамм-эквивалентные
оказываются практически на одной
величины;
прямой.
в
Здесь необходимо отметить, что хотя уравнения
ответствуют друг другу,
или Ат — Ат в отличие
значительный
этом
На рис. 225 отлообразования хлоизложенным отвепрямых. На рис.
случае
все
точки
(IX, 9) w (IX, 11) co-
однако графики в координатах
от графиков АЙт — АНт в общем
разброс точек (сравните рис. 226 с рис. 227) ®.
AS; —
случае
AAr
дают
1 Необходимость введения последнего слагаемого обусловлена тем, что не исключены процессы, для которых Ал = On AH = 0, Ho AS=K0. Это непосредственно следует и из уравнения (IX, 9).
|
2? На рис. 227 (аи 6) нанесены грамм-эквивалентные величины; это удобнее, так
как уравнение (1Х, 11) превращается в ДА = А-- ФАН.
|
|
\
18
*
275
о
“OZ 29g
250
UC,
UCL,
200
oy
yp
UCI
— Ball,
Srl,
Cac!
150+
UCL.
4
3
4
100-
50}
0
|
|
50
100
150
20
—
70
550
OH >
_
298
Рис. 225. Взаимосвязь между стандартными теплотами образования ДН?,; (ккал/мо ль)
и стандартными изобарными потенциалами Л 2°ээз (ккал/моль) некоторых хлоридов [3]
о — МеС1;
@ — MeCl.; О
— МеС\; Ц; — Меб1;
“42 29g
—©—
Мес;
Q — MeCl,
KGL
700r
75|
50
29
АН,
о
Рис. 226. Взаимосвязь между стандартными теплотами образования АН, (ккал/г-экв) и стандарт-
ными
изобарными потенциалами образования
А7.в(ккал/г-экв) некоторых хлоридов [3]
Обозначения
те же,
что и на
рис. рис.
225
|
.
-
АН в
о
Рис. 221. Взаимосвязь между станной
теплотой
образования
298
кам 2—2кв) и изменением
с
‚энтропии
Дб.,,
ст андартной
(э.е. /2-экв)
различных
при
образовании
веществ
[3]
а: © — иодиды, ®`— карбиды, © — сульФиды; 6: © Мес], @ — Мес, © —
MeCl;, © — MeCl,, @ —MeCl;, © —MeC!
|
Этот на первый взгляд парадоксальный результат обусловливается
прежде всего очень большой разницей в абсолютных значениях величин
Аз и АА.
К уравнению (1Х, 9) можно было бы прийти и несколько иным путем,
рассматривая Лэ как функцию ДН и АС. Сочетая уравнения (IX, 11) u
AS = a,AZ + 6,AH + с!
(IX ,19)
и исключая из ([Х, 11) и (Х, 19) величину Лэ, мы получили бы
мии)
b
C1
т. е. уравнение (1Х,, 14), а из него и ([Х, 9).
Так как для большинства веществ известны термодинамические свойства лишь при стандартных условиях и 25° С, то в дальнейшем целесообразно рассматривать уравнение (1Х,, 9) лишьв виде частной зависимости
Абв = АзАНв | В,
—
(IX,20)
хотя, разумеется, все выше- и нижеизложенное справедливо при любой
(постоянной) температуре. Это иллюстрируется рис. 228 на примере окислов при 1000° К. Для этих соединений значения ЛЯ! и Л 7лоо заимствованы
из одного
источника
— сводки
грешность расчета по уравнению
96
выходит
за
пределы
[23].
Как
видно
из
рис.
228,
по-
(1Х, 20) лишь для шести соединений из
неточности
значений
сравниваемых
величин.
При оценке достоверности результатов вычисления следует учитывать, что
размеры каждого прямоугольника отвечают погрешности значений АН”
и Л7° не при 1000°, а при 298°К, т. е. значениям несколько преуменьшенным (так как на сопоставляемые величины накладываются неточности
температурной зависимости теплоемкостей соответствующих веществ).
Для родственных веществ значения А’ в ([Х, 9) и, в частности, в (1Х, 20)
практически одинаковы. Так, в ([Х, 20) для реакций образования бромидов и иодидов (из простых веществ) имеем (А›)мевг, = 0,983 и (А,)мез „=
= 0,982.
Значения постоянных уравнения (Х, 20) были найдены автором для
28 групп различных веществ, причем эти уравнения были проверены на
обширном экспериментальном материале, охватывающем 600 веществ
[24,
25].
В табл. 38 приведены значения коэффициентов уравнения (1Х, 20),
а также средняя арифметическая погрешность вычисления и число веществ,
можно
для которых значения АН
и АС. известны,
проверить точность предлагаемых уравнений.
т. е. для
которых
Вычисления показали, что средняя погрешность расчета АЙ»
по
уравнению (СХ, 20) меньше 1 ккал/моль. Однако для ряда веществ (см.
[25]) она значительно превышает эту величину, достигая 3 ккал/моль и
более.
В табл. 39 приведены результаты проверки уравнения (1Х,, 9) на примере кристаллических хлоридов [25].
Ошибки расчета по (Х, 20) обусловлены как приближенностью метода
вычисления, так и погрешностью литературных данных". Решающее влия-
ние
на
неточность значений
A Zoos оказывает погрешность величин А Ноев -
Действительно, допустим, что табличные значения Д7оз соответствуют уравнению ([Х, 12). Тогда можно говорить о двух источниках ошибки в ЛА...
Но погрешность слагаемого 298,2-Аб.: будет невелика,
1
Большие
чениями
расхождения
между
AZ°o9g nue Sr(r), Sr2+,
MgSiOs
MW
некоторых
де всего неточностью
.
других
приводимыми B справочниках
RaCle-2HeO,
веществ
A Zoos.
и рассчитанными
NaeSO4-10H20,
(см. [25]) обусловлены,
литературных значений
.
CuSO4-3H20,
зна-
3CaO-SiO2,
по-видимому, преж-
277
Значения констант 4. и В. уравнения (ТХ, 20) для реакций
неорганических
ест
веществ
[24,
Процесс
Ап
г
As
о
Bs
Чис-
8), позе.
Атомы
1/2 М2,
Им, т > Bre, ж = — МВт, , | 0
10,983 | 1,10]
0,53" | 14
0,2
6
Tash
М, т=М,
Гидриды
M,
Гидроокиси
п
— М,
Бромиды
г =М,
25]
Таблица
38
образования некоторых
0,50,995
|—3,61
1
10,980
|—7,84
0,7
54
0,510,965
|—4,45
0,5
16
10,994
|-—9,98
0,9
15
О
10,982
j—0,56
0,4
14
аа
|0
10,956
|0
т
О
10,995
|—0,93
г
1
T+ 5 Но,
г = МН,
г
4
1
т- 5 Os, r+ 5 На,
1
= =; М, (ОН),
г =
т
Иодиды
1
= M,
1
1
5 Jo T= = Мл,
Ионы
— МС
++ аа =
Карбиды
=. М, т-+ С, графит
= =. М С,
r+
—1
1
T
м" +9,
п
1
3
Kap6onars|— M, r4C, графит + 5-Оьг=
—т
Кристалло- | М,
гидраты
нитратов
1
M,, (COs),
t + > №,
+
n
_|nM,
Ha,
|--4,50,985 | 15,54]
r+ mtn
(МО
Os, r+
)т-п H.0,
1,00
Нитраты
-п НО,
=>
1
— M, t+ 5 №
Окислы
— M,
р O. r=
о
t+
if
r=>
0, г=;
1
“
А =
*
"*
278
m
М
(5103) т,
значения
исключением
{0,981 | 21,42}
0,78]
8
1
3,88
1,1
11
М.О,
т
—0,51,00
6,62
1,49* |
76
—0,5/0,988
|—6,37
—1,5/0,99310* | 17,9219*\
0,3
6
0,61*|
6
T
В, относятся
С9$0.-8/3Н.О
значение
к
(А
образованию
=
— 54,0),
В. относится к образованию
исключением Кас. 2Н.О (А = 5,4).
исключением МФ (МО,).
(А = 1,87).
иск лючением
ЗСаО.2В,О, (А = — 12,98).
В работе
За
1,367 12
исключением He-Br. (A = 3,69).
исключением Sr?*(A = —8,1).
исключением А1.С. (А == 3,31).
‘* Указанное
* За
:# За
** За
[1,00 | 940°*|
—0,50,96
|М, т-- 5 О», г = МО, г
Указанные
s* За
10,5).
5
T
Силикаты | — M, T+ Si, T+ > Oz, r=
(мета)
|”
|
1* За
3* За
3* За
1,4
M,N,
1
=
10,31 4*
М(МОз)п, т
Нитриды
Окислы
т
* M, 7-4 > Nor
1
1,0 | 14
0,980 | 9,05 | 3,35" | 19
Кристалло-| М, т-- 5 Ch, r+5O,r+nHsr=|
= МС!
13
T
pomé. +
Arann | -L (2m Е 0,5)Оь, гп Ньг=
сульфатов
= М„(504)и-пНзО, т
хлоридов
0,63* |
T
r=M
t+ mS,
0,92* | 18
[27] это уравнение
исключением
М#$1О..
(А
=
применено для
10,27).
тн
Na.SO,-40H.O
молей
(A =
кристаллогидрата.
11,73)
mw
0,5 mi 1,5n молей кристаллогидрата.
метатитанатов.
|
ZnSO,-6H.O
Таблица
Группа
веществ
Процесс
An
n
Сульфаты
= М, т-- 5, ромб. +202,
=.
1
г=
1,0
19
М„(ЗО4)т» т
Фториды
1
1
1
|= М, тэ Е», г= „МЕ,
Хлориды
= М,
Хлориды
|М, т
Элементы
|п М, т=М,,
1
T+
о | 0,990 | 0,47|
т
1
5 Ch,
r= = МС,
т
0,980 |
3,54
0,512*|
15
—0,5|
0,985 |
4,37
0,613*|
36
0,5
14
1
0,5|
г
РЬЕ, (А == 2,14).
За исключением
СеС1.(А
=
3,0), Н#.С1, (А
=
1,2 | 418
—0,5!
5 СЁ», г = МС], г
з* За исключением
':#
А(А7°эвв),| ЧисAAs yas’) ло ве.
Be
—2 | 0,990 | 23,53
1
Сульфиды = M, 1 + S, pom. =—M,S,,,
7
1
Ag
38 (окончание)
3,30),
ОС,
0,980
|-—6,04
0,914
|—6,3
(А
= 2,55).
Таблица
Сопоставление
значений
AZ°o0g (ккал/моль)
в
справочнике
а
$
во
AgC]
лит.
|—152,2
|—193,8
BiCl; | —76,23
ErCls
|—211,4
FeClg | —72,2
GdCls |—222,5
HgCl, | —45,44
HgeCle| —50,350
KCl | —97,592
LaCls
|—238,3
|—141,57
* Вычислено
**
***
[3] |
—25,53
Вычислено
Вычислено
[3] | —76,14
[3]
[3]
[3]
[3]
[3]
[3]
[3]
|
|
|
|
|
|
|
по уравнению
g
0,69!
Мо
АР ви
по
лит.
|+0,09|/ NiCle | —65,4
[3] | —65,62
|+0,90||
|—0,98||
—3,0 ||
|—O,40|}
|-+0,75||
|—1,49]]
|+4,06||
[3] | —53,65
[3] | —98,24
PbCle
PrCl,
SbCls
SrCle
TIC]
UCls
UCl,
| —75,04
|—234,5
| —77,62
|—186,7
| —44,19
|—196,9
|—230,0
|—237,4
|—3,30|} YCls |—215,2
|—0,72|| ZnCle | —83,225
[29] | —238,34** | —0,04||
[3] | —142,36 | +-0,79
уравнению
по значению
вычислено
[3] | —104,82
[3] | —74,54
|+0,66]] UCle |—241,5
[29] | —222 ‚44 ** | 0,061 УС | —97
[3] | —45,43
|-0,01| УС
|420
значению
данным
Алит.—
вычисл.
|—105,5
[29] | —241,42** | —0,02|| UCls
по
(1Х, 20) [25]
|-+4,60|| NaCl | —91,785
[3] | —92,39
| +0,06|| NdCls |—236
,65 ***[3] | —236,65**|
—178,40
—82,86
—242,7
—67,90
—84,40
—119,49
—27,34
по
образования
хлоридов, рекомендованных
а
9
вычислено
[3] | —150,60
= [3] | —193,74
|—179,3
| —81,88
| 239,7*
| —67,5
| —85,15
|—118,0
| —28,4
МЕС
Алит. —
вычисл.
данным
|—26,224
AICl3
BaCl,
кристаллических
[3], с вычиесленными
Аи
Е
CaCle
CdCla
CeCly
CoCle
CrCle
CrCl3
CuCl
стандартных изобарных потенциалов
некоторых
5°».=
34,5
(Х,
22).
5°.„==
13,9
ZrCl,
39
|—209
[3]
[3]
[3]
[3]
[3]
[3]
[3]
|
|
|
|
|
|
|
‘
+0,63
|—0,64
0,00
|—0,52
-—75,82
|—0,78
—234,44**|+0,06
—76,82
|-+0,80
—186,28
|+0,42
—43,88
|-+0,31
—196,68
|-+0,22
—229,96
|-+0,04
[3] | —234,85
[3] | —242,10
[3] | —97,64
[3] | —124,92
| 42,55
|—0,60
|—0,64
|—1,92
[30] | —245,04
** | 0,46
[3] } —89,24
|—0,99
[3] | —209,08
|—0,08
[30].
[30].
279
“AZ 1000
100F
50
a
2
1
\
|
|
420
OX
415
Yo
|
15|-
J
|
6
10
7
;
\
6
Е
-70
10
1;
Рис. :229.
12
11,13 10
зовании
1 —
различных
сульфаты;
14 4 — метасиликаты;
OF
16 7 — нитриды;
ij
бромиды; 11
И) биды; 14 —
17 ции 1/2 М»,
ния Мео, г;
-5|
-2,0
Зависимость
}
- 15
|
-10
1
“OS
0
i
05;
An
коэффициента
В>
уравнения (1, 52) от изменения числа молей Ди газообразных веществ при обра-
15
-10
о
AHдд
|
‘Ou
aN
-
Г.
150
между стандартной
теплотой
образования
и
стандартным — изобарным
потенциалом
(ккал/г-экв) некоторых окислов [23]
о
|
_
100
2
Рис. 228. Взаимосвязь
АН“ 000
(ккал/2-экев)
образования А2°
30
L
9 Pd0,Pd.0; 59
0
Ag 0°
Радиус
2 —
соединений
нитраты;
3 —
5 — гидроокиси;
8 — фториды;
[3]
карбонаты;
6 — окиси;
9 — хлориды;
10 —
— иодиды; 12 — сульфиды; 13 —каргазообразные гидриды; 15 —для реакг = М, г; 16— для реакции образова17 — для реакции образования Мес]
кружков
(Е), г.
соответствует
ности
средней
вычислений.
погреш-
|
так как возможная неточность значений ©›3 простых веществ за единичными исключениями составляет величину порядка 0,1э.е., а неточность
значений 5»: для соединений в большинстве случаев не превышает
1 э. е., что дает
«
погрешность
член правой части
уравнения
А
(А2.з)
= 0,3 вкал.
(1Х, 12): ошибка
Иное
дело —
©
в значении АН»
первый
может
о
4 2 98
о
Рис.
и
230. Взаимосвязь между стандартными теплотами образования
стандартным
оказаться
изобарным потенциалом образования
фторидов (4) и гидридов (Б)
очень
большой.
Это обусловлено
A Zoo
[3]
многими
, 4 Hog, |
ЛН..з(ккал/г-экв)
(ккал/г-экв)
причинами
некоторых
и, в ча-
стности, неточностями, связанными с методикой термохимических измерений, недостаточной чистотой исследуемых препаратов, влиянием степени дисперсности и компактности образцов, возможным накоплением
ошибок при использовании закона Гесса и т. д.
При этом анализ цифрового материала (см. [25]) показывает, что точ-
ность вычисления Л
в большинстве случаев определяется не погрешностью уравнения (Х, 20), а недостоверностью значений АНов. Поэтому
по мере уточнения данных по тепловым эффектам могут быть уточнены и
значения А. и Б., что приведет к увеличению достоверности предсказанных
значений
Лоо.
Уточнить величины АНэз
иногда можно и без постановки соответствующих опытов, в частности, воспользовавшись уравнением (1,53). В
ряде случаев это было осуществлено в работах автора (см., например, [25].
Из приведенных в табл. 38 данных следует, что в первом приближении
для различных процессов можно считать в уравнении (IX,14)B = const
и 7 =
с013%, т. е. принять величины а и с в уравнении
(]Х,13) не завися-
щими от природы вещества. Это иллюстрируется рис. 229 [24], на котором
281
радиус точек принят равным указанным в табл. 38 погрешностям соответствующих уравнений. Как видно из чертежа, на графике В, = (Ап)
точки для различных групп соединений ложатся примерно на одну прямую. Если же принять для различных процессов и А, = с018%, т. е. считать прямые A Zoo, — АНооз параллельными, то и это не приводит к грубым ошибкам, что показано на том же чертеже сплошной прямой. Она
проведена через точки, соответствующие значениям В,, пересчитанным
для всех групп соединений
на значение A, = 0,986: pasais Ze)
мер кружков увеличился при
д
у
BF
\
БЕ
„У
oo
этом незначительно. Эта пря-
8
Рис. 231. Влияние
уравнения
жить простое уравнение
0,93
120 160
|
Zoos = 0,986 AH, — 9,4 An.
tg
200 210 280
погрешности
(1Х, 20) на ошибку
A Zoog (AH gag)
AH;
константы
А в
для
— расчетов
значений = AZoog WIM А Нов
любых веществ может слу-
0,990
5
,
80
образом,
ориентировочных
7,982
ЕЕ40
Таким
—=0.
038
2b
7
в первом приближении 7(с) =
и 9,912
yb
проходит
через начало координат, т. е.
в
Я
практически
мая
.42
значении
(IX, 21)
Хотя это уравнение в ря-
Д@ случаев дает удовлетворительные результаты, однако
следует подчеркнуть его приближенность, что видно
и из
рис. 229; при данном значении Ап центры кружков не совпадают и во
многих случаях расположены на значительном расстоянии друг от друга.
Иначе говоря, индивидуальные
уравнения, приведенные,
например,
в табл. 38, точнее общего уравнения (1Х,24).
Из экспериментальных данных видно (см. табл. 38), что значение коэф-
фициента А. близко к единице, а для некоторых рядов соединений равно
единице. Однако это не означает, что в общем случае можно считать 4 .=1
и тем самым пренебречь вторым членом правой части уравнения (1Х, 15).
Действительно, несовпадение величины А. с единицей для многих веществ
отвечает значительной погрешности. Это видно из рис. 230, на котором
A Hoos — A Zoog-38BUCHMOCTh представлена на примере фторидов и газо-
образных гидридов: даже
(пунктир) через середины
если провести прямые с коэффициентом А.=1
соответствующих прямых, то и тогда отклоне-
ния от экспериментальных данных
становятся
систематическими. На
рис. 231 сказанное выше представлено в общем виде [24]: если, например,
вместо А, = 0,985 принять А, = 1, то это оправдается лишь в тех случаях,
чина
когда
ошибка
превышает
в
A Hoos
среднюю
будет
больше
погрешность
1,5 ккал.
расчета
по
А последняя
уравнению
(IX,
вели-
20),
которому соответствует пунктирная прямая на рис. 230 (точки пересечения этой прямой с линиями А. = соп5% соответствуют максимальным значениям Л Но, при которых еще можно считать А, = 1). Правда, во мно-
гих случаях погрешность значений ДН такова, что она оправдывает
допущение А, = 1. Однако это допущение в принципе является грубым и
по мере уточнения значений ДНо»з круг веществ, для которых оно оправдывается, будет постепенно суживаться.
Приближенность
указанного допущения
примерах.
А78
282
—
Для
АНоэв
реакции
колеблется
образования
покажем на двух
карбонатов
конкретных
(А. = 0,985) разность
в пределах от 16,5 до 20,0
ккал,
т. е.
вопреки
допущению, что А, = 1, Д7ж — АНов =
—= 18,25 -- 1,75, между тем как средняя
составляет 1,0 ккал/моль (см. табл. 38).
Если бы для процесса Н.(г) - 1/2 Х,
Те, вместо А, = 0,983 принять А. =1, то
мерно
в
в 10 раз.
0,017
АН..,
|
что
соответствует
сопзв. Действительно, (В.)ср =
погрешность вычисления Аср
= Н.Х(г), где Х = 0, 5, $е,
это привело бы к ошибке приуменьшению
точности
расчета
Таблица
Результаты
вычисления
образования Д72298
значений
стандартного
(ккал/моль)
некоторых
Бромиды
42.5
РВгз,
PdBra
3,2
AuBr
AuBr3
95
PmBrs
ВаВге
175
BiBrs
582* [31]
ВеВгь
84,7
о
СаВг2
157
[34]
CeBrs
2112*
[34]
CrBra
СгВгз
СиВго
РуВгз
ЕгВгз
EuBrs
FeBre
FeBrs
74 2* [34]
~912* [34]
~272*
[31]
~1902* [34]
~1822* [34]
~146 2* [34]
56,8 3*
59,5
[32]
СаВг
FrBr
СаВгз
GdBr3
~932*
87,5
~1962*
НЁВиа
~2112*
НоВгз
—187 ** [31]
GeBra, ж
80
HgBre
37,1
InBrs
IrBre
LaBrs
LiBr
LuBrs
[34]
PtBr
|
MoBra
42
МоВгз
MoBrs
Мавгз
—205 2*
NpBrs
NpBre
167,7
175,9
NiBra
48 5*
см.
на
стр.
293
~9,5
PtBre
~20
PtBra
~36 , 2 6*
PtBrs
РаВгз
~30
181,3
RaBre
—180 2*
SbBrs
ScBrs
SiBra
SmBrs3
SnBre
ЭпВга
SrBre
TbBrs
57,7
173,0
96,8
~2002*
60,3
76,9
_ 166,0
~1932*
~1822*
TiBrs
TIBrs
UBr,
UBreg
WBrz
WBrs
WBra
WBrs
WBre
54,7
~195 2*
~201 2*
г у
ve
[35]
[31]
[37]
[34]
[34]
[34]
30,0 2*
35,8
36,5
167,7
Газы
[35]
[35]
16,5
27,22
ZrBrg3
D
[34]
126,5
187,5 2*
ZrBra
[34]
30,3
218,9
88 5*
УВгз
ZrBre
a4 :
’
184,3 2*
TuBrs
38
МаВг
~208 2*
448
86,8
26,3
[33]
22,3
TiBrg
[31]
MnBre
[31]
43,8
[34]
—1822*
MoBre
~178,32*
[34]
[37]
[31]
119,4
г
TeBra
ТВВга
TiBre
91,6
—202*
215°"
81,2
MgBre
Примечания
PrBrs
69,5 2*
52,4
[28]1*
— AZoog
NpBrs
AsBr3
СоВгз
веществ
40
потенциала
Вещество
— AZoog
Вещество
изобарного
115,8
184,3
(одноатомные)
—71,4
— 75, 5
283
Таблица
о
Вещество
In
Газы
— AZ rag
(одноатомные)
Nd
—77,4
—77,4
Se
|
Вещество
| Bade
7
50,8
—83,3
CeJs
—77,4
163,1
Со]
25,1
Th
11,4
CrJ3
48
DyJs
143,5
FeJe
30,6
—77,4
U
—114,7
у
—93,1
Гидриды
AlH
BiH
МН
(г)
—52,7
37.0
CH
Сан
С?
|] Cude
АКОН)з, аморфн.
Ba(OH)e
FrJ
Ве(ОН)з,
т
Bi(OH)s3
Gel,
HgJ2,
желт.
ae
красн.
Со(ОН)з
75,5
138,6
LiJ
145,6
166,1
LuJ3
132,5
59,4
12,9
Мет»
Мо
MoJe
Ег(ОН)з
308,5
MoJa
86,6
КОН
Pd(OH)e
Pd(OH)a
RbOH
Зп(ОН)а
Sr(OH)e
-
HeycrT.
19,9
131,2
Мат:
157,7
68,2
71,6
128,5
88,9
229,0
мо
NpJ3
NpJ
PJ;
21.2
119,5
120 2*
10,7
379,0
PrJ3
160,8
91,9
132,6
132,2
368, 8
Иодиды
AuJ
16,4
20,5
208,0
Th(OH)4
85,6
MoJs
Ма]
15,2
0,4
PJ;
Ptl,4
Puls
RaJ>
SbJ3
SiJ4
Эш
Sn.
[34]
64,2
165,9
93,5
Ni(OH)s
MoJs
4x
52*
Газ
215,7
86,6
Fe(OH)s3
а
KJs
Cr(OH)3
CsOH
Cu(OH)2
48,5
[31]
24,74*
194,8
110,5
[34]
146,6
55,7
[172
[34]
52,0
InJ3
` 195,5
Co(OH)2
AsJ5
~812*
—85,3
97,4
199,7
Ba(OH)2, B
Zn(OH)e,
Zr(OH)e
139,2
151°*
ErJs
EuJ3
GaJ3
212,4
[36]
[36]
2,8
—432,7
Гидроокиси
Tl(OH)s
Zn(OH)e
54,3
—52,2 | @41з
NiH
RbH
АР
148 **
BeJs
Sm
Pr
284
40 (продолжение)
155,82* [34]
23,4
132,2
~147,42*
~24,3
33,3
152,3
34,9
[31]
Таблица
Вещество
—
ord
|
42.53
Вещество
134,4
TbJ3
198,5
Tha
130,9
Tide
Tids
Та
61,0
80,3
102,4
Тиз
Un, в
40
2,1
2,2
W4s
YJs
—18,7
142,3
те
89,5
2
т
ZrJ4
1
Ионы
CNS-
69,3
с10HCOOH30+
MnO,№-
48.7
87.9
106
48.9
—63
NH,t
75,5
NO 37
69,3
OH-
408
$0:2-
233
Карбиды
Г.С,
МазС
2Ue
д
о.
AuCls-2H20
BaCle-4H20
BaCle-6H20
BeCle-H20
CaCle-H20
CaCle-2H0
‘CaCl-4H20
CaCle-6H20
СоС]2.2Н2О
мл | CoCla-4H20
125,4
424 2*
5352*
1802*
243%
ре
493°*
185,3
30 ‚4
414.9
CrCle-3H20
257 ,3
CuCle- H20
CuCl,-2H20
CuCle:4H20
CuCle-6H20
[38] || FeCle-2H20
1002*
155,4
2682+
3792*
190,6
FeClz-6H20
4192*
FeCl3-6H20
KCl-MgCle-6H20 |
2942*
603,3
FeCle-4H20
FeCl3-2H20
LiC]-2H20
LiCl-3H20
MgCle-6H20
199,4
318,7
206 2*
2
6
re
40) | NdCls-6H20
NdCly-2H20
NdClz-4H20
593,6
183,2
298,9
BeCOs
СаСОз.МЕСОз
СаСОз,
СО 3
Сосо
аморфн.
302,6
[29]
[29]
[52]
225,8
[44] | ptClsoH20
159.3
RaClz-4H20
4182*on
188,3
3002*и
4912*
[34]
[34]
306,1
4162*
[34]
520,0
154,74
348
,
Васа. НзО
RaClz-6H20
NaeCO3-CuCOsz |
377,4
5ЕСЬ-2Нз0
Rb»CO,
344,1
651,7
442.7
осажд.
°
PrCl3-7H20
K2CO3-CoCOs
МпСОз,
[34]
PrCl3-H20
SnCle-2H20
$0»
.4НО
SnCl
nCl:-6H20
К2СОз
[31]
[34]
206 2* [31]
Tic
WC
С
’
254,0
193 -9
350.0
SrCl2-H20
SrCle .4H20
|
209, 2
165,0
239,1
Карбонаты
[34]
[31]
266,5
[39] | MaCl-H20
МпС1..2Н20
MnCle-4H20
[34]
304,9
34°3‚1
96
Lh 8
[34]
414,4
529,2
[51] | сось-6 НО
CrCl,-4H20
[34]
[34]
[34]
[34]
241,62 [34]
3002* [34]
NbC
NieC
ThCe
AZ oog
MeCI,,,: nH,0
CrCl,-2H20
(гидратация)
—
Кристаллогидраты
tie
BeCle-2H20
13428 34) ] || BeCle-6H20
BOCa4B20
We
Wia
(продолжение)
556
248 , 2
а
[34]
[341]
285
Таблица
Вещество
—
SrC]2-6H20
ThCl4-2H20
Ав
Вещество
533,1
Kae Mes 0«-
514,0
RE
390,4
ThCl4-4H20
ThCl4-7H20
on
688, 4
ThCl4-8H20
746 ,0
TICl3-2H20
200°
TICl3-4H20
TICl3-6H20
297, 2
4122*
Кристаллогидраты
Fe(NO3)2-9H2O
Ni(NO3)2-6H20
ымозаню |
К. 50.. 70504:
873,9
MgS0,4-2H20
329,0
Мп50О4.Н2О,
CsAl(SOa)e-
258 , 7
FeSO,4-7H20
KAI(SO4)2- H20
KAI(SO4)2-2H20
KAI](SO4)2-3H20
KCr(SO4)2-H2O
KCr(SO4)2-2H20
660,4
K Cr(SO4)2-6H20
840,6
КСг($О4)2.
1174
12H20
Ke2Cu(SO4)2-2H20
KeCu(SO4)2-6H20
KeS04-CaSO4- H20
*
286
591 ‚2
604,4
663,8
720,8
597,5
oCaSOu112
617,6
843,5
102,1
1969
767,1
1202
ТЬ($04)2.4Н2О
Th(SO4)2-8H20
156,4
4000
ZrSO4- H20
Z1SO4-4H20
268,1
425,0
626,1
RbAI(SO4)2-12H20
632.7
802 ,8
Нитраты
629,1
687,0
FeSO,-4H20
Rasa
RbAI(SO4)2-2H20
530,8
586,4
FeSO4:-H20
566,2
RbAI(SO4)2-3H20
492,4
1159,6
‚
585, 5
ВЬА1(504)2.Н2О
379,3
H20
мы
1469,
532 6
№1$04.7Н2О
322,1
CsAl(SO4)2-2H20
CsAl(SO4)e-3H20
1028
sexen,
1777,6
CoSO4-6H20
CoSO4-7H20
621,9
| Медщводья
ню|
2(504)з-5Н2
NiSOq-6H20,
|
„-аНзО
BeSO.4-4H20
Ce2(SO4)3-5H20
456,1
541,4
-dHe
Кристаллогидраты
BeSQ,-2H20
284,3
MnSO4-7H20
aay
BeSO«4- H20
290,3
П
ааа ЗО" СабО«-
416,9
А15(504)з.18Н2О
679,4
I
MnSO,-4H20
Мп50О4:5Н20
397,4
Ме; (504)
541,2
Мп50О4.Н20,
444,4
.
Zn(NO3)2-6H2
0
374,2
М2504.4Н2О
257,2
432, 5
_
6Н20.
Г2504.НзО
MgSO4-7H20
134,7
Mn(NO3)2-6H20
Sr(NOs)2-4H20
646,8
490,3
Mn(NOs3)2-3H20
906,2
-6H20
K2804-ZnS04-
44,0
Hg(NO3)2-2H20
855,1
;
[34]
583,4
Mg(NOs)2-6H20
Oe
964 ‚6
395,7
Hg(NOs)2-1/2H20
AZoog
737,4
Kase 590
_ 479,0
290,9:
Co(NOs)2-6H20
—
[31] || K.S04-MgSOu-
Me(NOs),,-72H20
Cd(NOs)2-2H2O
Cd(NOs)2-4H20
40 (продолжение)
Cd(NO3z)2
Co(NOs)e
'
.
CsNO3
94,4
Cu(NOs3)e
29,2
LiNO3
Mn(NOs)2
Ni(NOs)e
Pb{NOs)2
RbNO;
.
63,1
58,1
.
94,7
120,3
57,4
59,5
93,4
Zn(NOs)2
BN
ВаМ№
Ваз №
BasNe
70,4
Нитриды
54,42*
38,0
55,1
75,7
[42]
[43]
[44]
Таблица
Вещество
—
AZ og
BesNe
122,5
Cd3Ne
29,3
CN,
Вещество
Cs202
73,4
Сем
CrN
24,7
GaN
20,4
Ста М
CusN
СезМа
LigN
MgsNe
Mn,No
TiN
BaO-Al203
IrOz
8,8
365,0
380,4
226,7
273,1
№4203
[47] | ма20.
[48] | ма.о,
P203
[49]
Bio
Boo.
138139'5° 50)
Pr2O3
BrOz
0.7
(st) | ee
Pt304
661,9
mie
ВЬ.О
133,6
’
2Ca0-Al203
стеклообр.
3Ca0-Al2Os,
670,9
'
стеклообр.
4Ca0-Al203
808,3
4CaO-Al203- Fe203
Са0О .-А]2Оз.65102
ЗСаО
. А]2Оз .25102
4145
1722
1237
2CaO-3B20s,
1207
елси
стеклообр.
139,4
246,9
Co304
183 ,6
СгО>
СгОз
Cs20
126,2
118, 5
69,3
Ione
667,8
13,8
ite
14,3
|
84,7
91,8
93,7
63,1
254,2
94,3
ВИО:
48,4
Rh20
16,1
RuQ2
легкопл.
ryronn.
5207
[53] | $Ъ201з
SeOe
[61]
2378
72,3
ReO3
|
Ве>0Ов
SO3,
SOs,
[60]
oe
Rb204
[52]
412,3® [59]
361,3
430,1
424 ,6
Rb202
733,9
СаО2
Се02
аморфн.
ВЬ. Оз
979,7
116,8
148,1
653,8
РаО1о,
[58]
212,2
250,1
P4010
PdO
*
130,9
Мо0»
NazO-CuO
804,5
2СаО. Аз Оз
408,7
Mg0O2
3Ba0-Al203
24,5
101,3
La2O3
[49]
[57]
103,3
[45] || KO,
[46]
[56]
116,0
115,4
79,8
K202
, 2
[55]
26,9
K20
530, 0
BaOz
стеклообр.
Mn203
Окислы
Аз4Ов
414 ,1
11,5
—1,1
АЪОз,1, корунд
А12Оз, синт. сапфир
АтОэ
Gd203
J205
72,3
Ag202
238, 4
202 ,6
280
Zn3Ne
Ga203
In2Os
52,0
ThsN4
34,2* [54]
396,0
15,4
98,3
81,9
TaN
94,7
НО
70,0
Згз №
30,9 * [54]
GeOz
Се0О>,
41,1
Mn,N2
98
CuO
—0,8
65,3
41,4
©
79,3
Dy203
Са20
—1,3
InN
LaN
AZ
86,5
Cuz0
17,7
13,2
—
Сз2Оз
Cs2O4
71,3
40 (продолжение)
5е02-503
39,3
87,8
90,7
148,0
583 ‚9
41,8
134,0
287
Таблица
Вещество
— AZ oon
Sm203
396
5тО2
140,4
Sr2O
147,4
Вещество
КСг(5О4)2
[63]
|| KeCu(SOa)e,
TiO
117,3
[64]
KeCu(SO4)e,
1102,
0308
аморфн.
V202
УГО»
Ww
193,8
O
Окислы
Alo
633,9
—141
578
— 08 5
598
935
vee
п2(5О4)з
NaeSO4-CaSO4
Na2SOz.-MnSOa
NaeZn(SO4)e2
315,9
589,6
620,6
516,3
514,3
—2715 89
азов
Nd2(SOa)s
2319
868,0
RbAI(SO4)2
Rb2SO4
516,3
313,6
Sn(SO4)e
344 6
be
36
— 46
LieSiOs, crexmoo6p.
MnSiOs, отеклообр.
MnSi03,
pogonut
Ма251Оз, стеклообр.
PbSiOs, аморфн.
35103
708103
AgeSeOg
Вабе04
BeSOu
плавл.
РЬЗе04
14.05
47 , |
Ва510з
FeSiO3
Сульфаты,
В15($04)з
4
,
(мета)
339,4
256, 1
340,9
Сульфиды,
[66]
Аве
AlsSes
285,9
350,7
АБТез
Asa5a
селенаты
As2Se3
Вз5з
617,5
BizSe3
274.6,
70,0
253,7
259,6
AsiSs
селениды,
теллуриды
2,9
133,6
77,2
31,2
34,4
CeSe2
CeS
Се25з
[69]
[69]
13,2
[70]
118,0
[34]
80,0
153,9
[63]
133,6
55,9
104,8
73,3
55,2
CueSO4
194,8
510,3
544,4
Bas
Base
Bes
CSe
517,9
548 ,9
195,9
9(504)з
Z1(SO4)a
352 ‚6
5158
283,3
499,0
Th(SOa)e
115504
507,3
FeSO.
[67]
123,07
5Ъ2(504)з
6
Се(304)2
СзА1($04)2
597,4
601 ,6
521,5
MnO
PO
Силикаты
544,7
KeSO4-SrSO4
О
Gad
10
Tio
496,2
K2504- 20504
BiO
то
vO
494.9
596,4
К2504-М5504
К35 04. МЕЗОл,
— 38 0
| ?6
S00
TeO
KeMn(SOa)e
плавл.
509,3
498,2
изв °(05) | KeS04KeS0u-2MgS0
, | 514,7
928,9
(г)
PbSO,
AsO
an
8
К›5О4. 42504
186,8
123,1
¥b.0:
617,5
[62] || KeCu(SO,)e, 7
845,0
AZoog
143,1
Ine(SO4)s3
219,8
280,0
—
[62] | Н#504
Tc.07
ТЬО:
288
—
40 (продолжение)
152
295,2
Таблица
Вещество
Ce3S4
CoS, ocaxy.
Co2Ss
CoSe
CoTe
CuSe
Си25е
FeS, 8
Ее5>, марказит
FeSe
FeTe
Аа
446,6
19,8
50,0
‚9.7
8,7
14,9
5,3
344
28,1
135,0
Ga2Se3
103,4
СазТез
HgSe
[123ез
InTe
IneTes
[384] | Pts
PtSe
RbeS
ReSe
RuSa
SbeS3,
SbeS3,
5152
ЭГ
Srse
Th2S3
[74]
9
20,4
17,6
6,8
44,7
33,5
[71] || AuF
29,4
CeF4
419
CoFe
148,7
[74] || AuFs
[74] || BeFe
[71] | BiFs
98,8
СоЕз
CrF.
Га25з
303,2
CuF
79,4
154,8
xpacu.
зелен.
208,
27,8
111,2
MnS,
Мп,
34,0
106,8
77,7
ZnSe
К254
Mgs
MgTe
42,7
[71] | TleSe
[71] | ТЬТе
[74] | 705
50,0
K2Se
LaSe
черн.
AZooe
20,4
27,3
82,2
43,5
47,3
35,4
ocak.
[71] | TLS
IreS3
KeS
—
[71]
80,9
226
467
IrSe
Вещество
63,9
5,0
InSe
|
24,0
36,2
17,7
45,8
GaSe
GaTe
Ga2Ss
81,0
49,3
Фториды
14*
71,0
2252*
2002*
170,3
CuF2
FeF,
114,3 5*
1502*
[34]
45,5°*
60,4
HgFe
Ма2оз
28,0
МазА] Ес
83,0
NpFs3
340,9
100,4
NpF,
493,2
№5, осажд.
Ni2Se
NiSe
47,2
42,6
9,7
PrFy
РиЕз
ВаЕ>
383
357
2712*
№253
278,5
SbF;
82,0
Ма. Те
Ма› Тез
NiS,
a
М Те
OsSe
PbSe
РЬТе
Х.
Карапетьянц
18,2
8,7
34,3
17,6
17,1
[76]
249,3
120,8
MoSs3
Naese
[75]
[24]
[31]
СгЕз
CsF
FrF
[72] || GaFs
88,1 8*
[31]
170,3
46,9
48,8
№25
м.
—
18 , 2
Gas
19
Л
40 (продолжение)
1162*
225 6*
94 2*
InFs3
2302*
МЕ.
149,2
PbF4
ВЬЕ
SCF3
SnF.
120,8
203, 7
125,1
[31]
[31]
[31]
[31]
|
[76]
[73]
[31]
186 °*
392 2+
145 2*
[31]
[31]
289
Таблица
Вещество
— Абв
Вещество
217,4
453,3
NpCls
ПЕ
187,0
PdCle
36,0
TiFs3
298,1
PmCls3
235,0
TiFs
TIF
TIF;
UF,
YF;
ZnF;
ZrFe
лс.
AuCl
AuCls
ВСВ
BeCle
CrCl;
CsCl
CuCl.
DyCls
EuCl;
FeCl;
ЕгС]
GaCls
Хлориды
РгС1з
Ptcl
PtCle
PtCls
РАСЫ
PuCls
240,7
13,4
26,2
36,0
444
213,4
332,5
3682*
|
RbCl
[34] | ВВС!
97,0
11,4
a
ВВС
26,7
204,
0
55 6
99,2
111,7
35,0
(79) Tt SmCl,
sacl
[92] | sac,
183,99
939°
TbCls
TeCl,
224,
8
57,4
217,2
ThCle
263.2
97,6
39,7
230,3
TICls
81,3 10*
тис,
8**
[311 | wer,
410,4
InCls
113,4
(Ц
197 в*
ScCls
SeCl,
216,2
IrCls
RaCle
3,9
14,8
Нос
ис]
||
||
||
|
||
1m |
103
Incl
InClz
249,1
[34]
[75]
[34]
[77]
[73]
сес
Нес
214,9
348,4
662*
123,5
4372*
364,4°*
165°*
218,3
ZrF;
ZrF,
NpCla
— AZ,,,
ТЕ
ThF,
45,04*
[37]
[82]
69,5
129
387
a
Wel,
110
УЬСЬь
YbCl;
ZrCle
ZrCls
17,6
33,4
73,6
,
weL
39,5
76,8
[84]
173,0
212,2
134.4
181]
191,7
ZrCly
241 ‚0
47,5
KCl-MgCle
243 ,0
ВС, 8
LuCls
211,4
РС
69,7
MnCls
103 5*
PLC
*0
[84]
34,6
SC]
19
[82]
LiCl
MoCle
91,9
MoCls
46,02*
wows
67,5
МоС]ь
MoCle
NpCls
290
|
40 (продолжение)
[31]
с Cl,
08
62,4
199,6
S.C]
С,
|
2 р
| SbCis
4
о г
10
9,4
94
_.°
86,1
3]
Таблица
Вещество
— 42
SeCle
VCh
12,6
122,7
Хаорилы
aoe
°
AlCl
AIF
т
52
—18,5
23,1
—17,5
14,8
CaCl
CaF
CuF
—0,6
15,1
—37,1
ВЕ
GaCl
NaCl
SrCl
CH.CFz
38,4
CrCla
Хлориды (г)
103.4
SeCle
a1 5
SbCl;
73.8
TiC]
113.6
Элементы
са
р?
“10 4
2
“ros
с 2
910
с,
5
Sh
*
А2С103
6
16.8
33.3
Прочие соединения
AgClO«
AgF-2H20
Ар2МоО4
Al.Se, r
АзНз, г
В.Нуо, т
BaBi
BaBr2-4H20
С2Еа,
8s
13,5
—15,9
1602*
178,8
—175,1
— 32,8
73,7
39,6
4042*
—126,2
.
r
г
[91]
[91]
67
[92]
159
[94]
140
[92]
CaBr2-2H20
277%*
Са(СО0)з
299,6
СаВг». НО
CaBr2-4H20
Са№
Ca(NOz)s
CaOCle
Са\О4
Саз(АзО4)2
Cd(CNS)2
СезНа, т
г
Cl20,, r
CoBr2-2H20
CoBre-4H20
224 2*
380 2*
697,2
—39
147,6
[91]
[941
[31]
[31]
[31]
[90]
[99]
[38]
162,0
368,2
741,3
6
130,0
[94]
we
—45,9
—95,4
1692*
1822*
Сон, т
—0,7
Cr(CO)e
Cr7He, 7
254,7
—5,8
[34] || CoHe, т
[89] || Co(HCOO)e
[70] || Co(JOs)e
т
[89]
60
101
191
250
[89] || CsH,
[31] || CsNs
[49]
[49]
[49]
[49]
208,7 [15, 16]
306 ,6
1,2-CoF4Cle
CoFe, ©
[87] | С1Оз,
co?
[49]
946, 5
Са(НРО4)2
(®М, т)
= Ми, г
ors
в,
264,5
471 ,0
768,4
CF3Cl,
10,9
TIF
BaSO3
BaSiOa
Bas(AsOa)2
CFCls, r
CF.Cle, r
—2,8
SrF
587,3
620,4
929,6
977,4
534,3
BeMoO,
—8,7
6,0
30,9
BaO- Al2O3-2H20
Ва0. А15Оз-7Н2О
2BaO-AleO3.5H20|
ТВаО.бАНОз-
Ве2$104
76,6
NiCl
SbF
435,8
Ваз(РО4)2
78,0
NaF
BaHPO,
Ba3Bize
4,41
—AZ a,
5182* [34]
307 — [90]
135,4
491,6
[67]
-3He
—2,8
(продолжение)
BaBrz-6H20
Ва(СОО)2
Ва(С103)2
BaF>- BaCle
[86] | BaO-Al,03-H20
—0,9
MgCl
Вещество
ВаН»
10,8
ВС
BF
BaCl
BaF
|
40
[31]
[34]
0,7.
175,4 [15, 16]
85,0
|
[94]
8,6
—11,8
[95]
[96]
19*
291
Таблица
Вещество
—
CuCl,-CuO
204,6
CuWO,
227,7
FeBrCl.
FeMoO,
FePO,
FeWO.
GeBre, T
НВе0. .
Н.Ва0'
.
|
г
Н25О4,
H2SiO3
ж
НзРОз,
НзРОз
НзРО4
H4P20,
H4Si0,4
InSb
т
H3AsO4
НзВОз
624,7
144,2
243,4
179,3
228,7
|
К2СгО4
Тя МО
Li3As
MgBre-H20
Mgs(POua)e
292
225,1
NFs, P
8,0
NH.F
81,8
[97] | МНаН$Оз
|
138 ,9
МНаН$О4
|
194,4
МНа№
МНаМОз
(NH4)2CrO4
|
—63
43,7
214
[37] || (NH4)2eCre0-,
[38]
339,6
[63] | (МНа)2НРО4
300,3
(МНа)250:з
: | (NH4)2SO4-SrSOa |
(NH4)3AsO4
(NH4)3PO4
МОз, г
147 ,9
628,8
215,5
306,9
—31,6
[95] | Ман, т
NaHS
NaHSO,
NaJ-H20
NaJ-3H20
[63] | NaNOs
МаРОз
90
[95]
51,0
241,9
127°* = [31]
2342*
[34]
70,6
270,5
446,2
384,5
249,1
339 11*
54,5
`МазСгОа
NasHPO3
МазНРО4
МазРЬОз
[99] || NaeS20s.
294,4
344,5
338 ‚1
188,0
249,2
30,1
[89] || NasSnOs
307,1
81,2
2442*
3632*
277,2
|
МоОз. Н2О
Ав
9,2
207,3
249,4
257,3
63,2
197,4
245,1
1852*
MgBr2-2H20
MgBr2-4H20
Mg(COO)e
—
№03, г
№04, г
№05, т
№, г
МаС102
[98] || NaClO3
|
38,9
76,7
=
Mgsa(AsOa)e
|
_|
Вещество
120,0
200,7
269,0
478,8
298,6
8,5
1422*
КэСгз О?
К2Си(СОз)э_
K2SO3
|
ГазНа
LiHS
MgO-MgCle
MgSO;
MgsAse
276,6
951,5
—34,3
90
КН, т
KHCO3
KHSO,
KNHaCrO,
KNO,;
KTcOa
KVO,
MgCrO,.
73,8
235,4
156,1
KF.4H20
LisBi
LisSbh
|
70,0
CuMoO,
СеВга,
А
40 (продолжение)
295,1
—43,2
` | — 314,8
—23,1
—1419
. 571,5
65,7
[31] || NaClOg
67,4
NaeBaO,
733,9
.
№2520
966, 1
258,0
[89] |} NasAsO4
МазРО4
341,1
434 ‚8
[34] || NasP20;
[34] | МН, т
[31] || NiHe, rT
[90] || Ni(HCOO),
РНаВг
717,3
—2,0
—3,3
174,3 [15, 16]
5,6
294,1
223,5
—80,1
PH,Cl
РНа]
[100] || POBrs,
1
16,9
—7,9
102,9
683,5
POC]s,
T
123,0
910,5
[96]
PbClg- PbO
128,4
.
.
[33]
[70]
Таблица
Вещество
| —AZ og
|
40 (окончание)
Вещество
—А 2 og
|
PbClz .2PbO
177,6
PbCly .3PbO
225,8
Эгз(РО4)2
РЬМо04
239,6
TiSi
PbCrOa
195,9
РЬОНМОз
|
ThHa,
76,5
1
411,7
11351 5
РЬЗ!0О4, аморфн.
PdeH, -t
285,9
4,1
Т15СгО4
ОБз, т.
141,7
PuDe, Tt
PuHe,
ВЬН,
т
[104] || UHs,
27,5
[101] || UTs,
8,1
ВЪНСОз
RbHSO,
RbN3
SbOCI
Sr(COO)e
307,0
[90]
SrF.-SrCle
481 ‚4
[67]
SrHPO,
401,8
2232*
|
ЗгН2
+ «~[102]
145
[102]
197,5
16,5
[103]
[104]
46,7
[104]
[102]
247,8
7
15,8.
т
197,4
247,5.
:
28,6.
ZrOCle-2H20
375,5
ZrOC]l,-31/2H2O0
452,3
ZrOCle-8H20
713,9
|| Zn3P2
388 ,8
Sr(NOs3)2
186,0
ZrO(NO3)2-3H20
444,7
SrSie
147,9
ЗО.
ZrO(NOs)2-31/2-
477 ,4
-H20
373,9
ZrO(NO3)2-6H20
494,4 -
[46]
604,6
ZrO(NOs3)2-2H2O
Sr2SiOa
[100]
97
[34] || ZrOCle-6H20
111,4
[94]
337,0:
:
32,3
SrSi
[104}
150,8.
Zn3ASe
80,4
39
42
71025104
12,9
SrJ_-4H20
23,6
УТ (СО)в, г
У\Оз.Н.0
—14.*
т
[95] | УОС,
206,5
246,2
SO2Cle,
935,9
TIBrOs
25,6
T _
751,9
:
TiSie
PbSOq-(NHa4)2S04
PbS203
`’
Згз(АзО4)2
614,5
ZrO(OH)2
309,8
1* Для тех веществ, для которых в справочнике [3] значения
АН 298 OTCYTCTBYют, даны ссылки на работы, из которых взяты эти величины. В единичных случаях
(они отмечены звездочкой) расчет произведен по значениям АНооз,
ставляются более точными, чем рекомендованные в работе [3].
** Рассчитано по величине
табл. 13).
з* Если
=]
4%
(AH ‘пл)298
для
5*
Рассчитано
по
НЕ
= —58,7
принята
величине
[32], то получим
равной
АН 298)
0,5
АНи=
425%
f (AHI)
(cm.
|
= — 55,5.
кхал/г-атом..
CKOppeKTHpOBaHHOM
No
rpaduky
принять
АНооз = —44,0
[35], то
получим
AHI]
=
42593 = — 38,8.
"* В работе
[68]
была найдена
величина
425%; = — 119,0.
з* В работе
[74] рекомендуется
значение
AZo59g =
'* Если
принять
0* Если
принять
=—117.
11*
Для
AHoog
‚, найденной по графику
пред-
(АН).
‘* Если
является
принять
АНооз
которые
АНо5з = —160
.
Приближенный
некоторых
следствием
АНооз
вместо —382
[32],
то
Ав
[3], то получим
=
AZoog
=
— 78,9.
расчет.
групп
не
= —93,&
[73]
— 86,52.
веществ
только
рекомендация
недостаточной
А, = 1
точности
(см.
табл.
значений
38)
A Mags
293
Таблица
41
Результаты вычисления значений стандартного изобарного потенциала образования
А2.в(ккал/моль) некоторых вольфраматов, молибдатов, силикатов и титанатов *
Вещество
ВаМо04
Ваб!Оз.
Ва\О4
Ba2SiO.
ВеМо0О4
Ве\о.4
CaMoO,
СаМо04
CdWO,
СоМо04
CoSiO3
СоТ!Оз
Со\О4
-Co28i0s
Cs2TiO3
СиМо04
* При
**
том
— А 2508
|
|
Си510з
CuTiOs
214,7
230,2
482‚0
293 ,6
318,9
345 ,8
238,3
258 ,5
224,0
243,6
259,0
239
336, 0
353,1
202,7
ЕеМмМо04
FeSiO3.
FeWO,
FeeTiO4
К251 Оз
KeTiOs
1129103
LieTiO3
МЕМо04
М5\УО4
MnMo0O,
MnTiO3
235,3
[418]
252,4
[27]
252
[148]|
347,1
[27]
342,5
[27]
359,6
[27]
360,8
[27]
377, 2, [27]
314,3 ^" [418] |
337,7
[1418]|
267,5
[118]|}
301,8
[27]
377,9[118]
В работе
CuWO,
[27]
[118]
[118]
[118]
[118]
[118]
[118]
[27]
[27]
[118]
[27]
[27]
[118]
42503
использовано
[119] найдено
по
— 42508
350
[118]
363,3 [37]
вычислении
вычисления
Вещество
уравнению
значение
223,1
|
|
|
|
значение
25;
[27]
[27]
[418]!
АН 298
из
Вещество
— А 2098
NagTiO3
NiMoO,
356, 9 [27]
226,5 [118]
МТ! Оз
МУ О4
PbMoO,
РЬТ!Оз
РЬТ!О4
ВаМоО4
RaWO,4
SrSiO3
SrW0O.
SreSiOg
20Мо04
ZnTiO3
253,2
248
236,4
256,1
312,7
351 ,9
380, 4
362,3
372,8
488, 8
249,4
281 , 2
NiSiOs
указанных
= — 315,1, что хорошо
257, 3 [27]
[27]
[118]
[118]
[27]
[27]
[118]
[118]
[27]
[27]
[27]
[118]
[27]
работ.
согласуется
с
результа-
(ТХ,20).
(а поэтому и неточности значений А 7), но и результатом объединения
в одну группу разнородных веществ. С другой стороны, если
в одну группу
объединены близкие по свойствам вещества, то в этом случае
А.—1.
Примером таких веществ являются хлориды лантанидов. Для
них переход от общего уравнения для
-- 4,37 (см. табл. 38) к уравнению
АЙ
приводит
Хотя
к уменьшению
уравнение
Дер
(1Х,9)
= 1,00. АН
хлоридов
= 0,985.
А Hoos +
(IX 22)
— 17,65
от 0,25 до 0,07 ккал.
позволяет
А 7:8
рассчитать
любую
из входящих
в
него величин (если известна другая), однако наибольшее практическое
значение оно имеет для расчета ЛД, так как эту величину найти гораздо
труднее, чем ДН. Об этом можно судить хотя бы по следующим данным:
если величина АН.» известна примерно для 2,5 тысяч неорганических
соединений, то лишь меньше чем для одной трети из них известны одновременно и изобарные потенциалы образования.
По уравнению (1Х,20) были вычислены значения Дов образования
тех веществ, для которых известны теплоты образования, но отсутствуют
значения
стандартной
энтропии,
найденные
по
опытным
данным.
Вычисленные величины приведены в работах [25] и [28]. Эти данные
помещены в табл. 40 (см. также табл. 41). Погрешность расчета для хлоридов, бромидов и иодидов меньше 1 ккал, для фторидов, вероятно, несколько больше. Для многих из этих веществ расчет осуществлен по уравнению (1Х,21). Для остальных веществ к более точным результатам привело использование уравнения, выражающего взаимосвязь между A Zoos
и АН для соединений, близких по свойствам к рассматриваемым. В тех
случаях, когда для реакции образования соединения величина Ли отли294
чалась от значения, соответствующего данному ряду веществ, в постоянную В. уравнения (1Х,20) вносилось соответствующее изменение (это
относится, например, к таким веществам, Kak NH,F, KHCO; и т. д.).
В работе [25] вычисленные ранее значения А7в сравнивались с данными, заимствованными из литературы последних лет или же с рассчитанными по недавно опубликованным данным. Среднее расхождение
между
предсказанными и «из5
меренными»
значениями
ДЛЯ
вновь изученных веществ мень-
ше 1,2 ккал.
15т-9
-10
-в
-7
т
20
05,
-6
“6
as
Я
4120
“SOP
тЫ
6
130
4130
4740
120
4150
110
4760
Sf YG
4770
100
47180
70
4790
80
4200
+210
70
co
8!
130
АЯ 29в
-б
-7
-5
-4
|
-3eg -2
an
-1 220
Рис. 232. Взаимосвязь
между
стандартной
теплотой
AH cog
(ккал/моль) и изменением стан-
Рис. 233. Зависимость изменения энтроНИИ А5т (э. е.) при образовании различных углеводородов из простых ве-
дартной
ществ
при
энтропии
ASoop
(2.
e.)
образовании
некоторых
н-алканов СН.» [129]
от
изменения
числа
молей
Ап
газо-
образных веществ в этих процессах [129]
1 — н-алканы, Т = 298° К; 2 —н-моноалкил-
циклогексаны,
Т = 298° К; 3 —арены,
Т =
—298° К; 4 — 1-алкены, Т = 900°К; 5 — н-алканы, Т = 1200° К; 6— 1-алкины, Т = 298°К
Выше возможность применения уравнения (1Х,20) была показана на
примерах неорганических веществ. Для органических соединений, если
их рассматривать по гомологическим рядам, описываемые соотношения
упрощаются
[26]. Это обусловлено
тем, что
в отличие
от неорганических
веществ в пределах данного гомологического ряда (если исключить первые его члены) можно пренебречь особенностями каждого соединения,
поскольку оно отличается от другого на одну и ту же группу. Это проявляется в аддитивности стандартных теплот образования. Поэтому уравнение (1Х,411) превращается в зависимость
AS = аАп - с,
(IX ,23)
295
а уравнение
(1Х,14) принимает вид‘
AZ = AH + BAn-+
¥.
(IX, 24)
Ilostomy 2H romonormyeckux paAgoB 3aBucumoctu AS — AH u (AS— AZ)
не дают большого разброса точек (ср. рис. 232 с рис. 227), что подтверждается также данными, приведенными на рис. 233.
Объединение второго и третьего членов первой части уравнения (IX, 24)
в отличие от неорганических соединений здесь в общем случае исключено, если отвлечься от того, какова доля этих слагаемых в общей сумме,
так как не представляется возможным записать реакцию образования гомологов
данного
ряда
таким
образом,
чтобы
значения
Ап
гомологических
рядов
углеводородов
были
одинаковы
для всех членов ряда.
Так как в каждом гомологическом ряду последующее соединение отличается от предыдущего на одну и ту же группу атомов, то в первом приближении можно принять, что при данной температуре и данном агрегатном состоянии численное значение коэффициентов а (В) не зависит от
вида ряда. Действительно, например, согласно литературным данным,
при
25° С
Таким
для
всех
образом,
а = 23,4.
независимость значения коэффициента
а в уравнении
(Х,11) от вида ряда является следствием того, что Д2, АНи
ся к величинам, которые описываются уравнением (1,91).
А$ относят-
Постоянные с в уравнениях (1Х,11) для разных гомологических рядов
имеют различные значения, так как именно они отражают особенности
строения данного гомологического ряда. В этом проявляется отличие гомологических рядов от ранее рассмотренных, где фактор структуры не
имел первостепенного значения и можно было считать с = 0 (см. рис. 229).
В
то же
время
данные,
АН
реакций,
приведенные
в работе
[26],
наглядно
иллюстри-
руют чувствительность энтропии к особенностям внутренней структуры
веществ.
Хотя на практике область применения уравнения (Х,9) ограничена,
как правило, вычислением ЛД
по АА, однако возможны случаи расчета
величин теплот образования различных веществ по их изобарным потенциалам. Так, уравнение (]Х,9) можно использовать для вычисления
значений
измеряя температурных
прибегая к уравнению
осуществляемых
в гальванических элементах,
коэффициентов
AH = 23064 m (T
электродвижущих
OF
oT
сил,
—E),
не
т. е. не
(1X25)
где т — число грамм-эквивалентов, соответствующее протеканию процесса.
В табл. 42 приведены значения АН», вычисленные по соответствующим
уравнениям
вида
(]Х,20)
на
227).
Однако
основании
этот путь
оценки
значений
значений
A Zoos-
Уравнение (1Х,20) было широко использовано при составлении справочника [4116] (см. также [117]) и применено в ряде работ [27, 80, 118,
149, 1321.
Что касается возможности использовать найденные (по ЛА) значения
А для расчета энтропий неизученных веществ, то в общем случае она
ограничена невысокой точностью результатов (см. также стр. 277 и рис.
5 не исключен.
опубликованной работе [120] с помощью предложенного
ния ЛЁь= 0,990 АН» - 0,47 [24] было вычислено
для
реакции
образования
А1.5.,
а
по
ней —
Так,
в недавно
автором уравнезначение
Дб.
величина
(боев) Аз. ====
— 30,61 э. е. Для сравнения укажем, что по Истману та же величина рав-
на
30, 65
9.
e.
[20].
1B oTOM случае из уравнения
(1Х,23) следует
постоянство значений (при
T —const) А5 для реакций типа изомеризации или [гидрирования (см. [104а]).
296
Результаты
вычисления
Вещество
Гидроокиси
— AH
440,0 [405]
Dy(OH)s
337,8
Ga(OH)s3
Gd(OH)s
Hg(OH)e
Hg2(OH)e
162,4 [105]
230,3
Ba(JOs3)e
Са(ТОз)2
соединения
168,6 [106]
316,4 [106]
335,2 [405]
341,6
АрзРО4
Al3+
236,1 [106]
1102*
326,5 [105]
340,8
39,8 [106]
242,5
[406]
236,3 [106]
Cu(J Оз)2
88,1
Hge(JOs)e
83,9 [106]
[106]
AgsAsO,4
ВазеО4.
CBrN,r
С9$0..2Са(ОН)>
2CdSO4-2Cd(OH)sz
491 ,0 [108]
576,5 [108]
45,5
401,1 [108]
FeSOq4-2Fe(OH)e
497,9
Fe2(SO4)3- Fe(OH)s
605 , 1 [108]
5Fee(SO4)3-2Fe(OH)s
Hg2(CN)e
1076
—
HgNs3
HgeS
НТ
715,3
4541
In3S4
Cee(SO.4)3-9H20
4605
[1556
4515
[108]
[108]
53,8 [106]
HgeCrO,
Cee(SO4)3-8H20
Ere(SO4)3-8H2O
271 ‚2 [107]
— 43,6 [109]
CuSO,4-2Cu(OH)2
118,0 [106]
Dy2(SO4)3-8H20
148,6 [106]
258,6 [106]
CoF,.-4H20
282,4 [106]
62,4
143 ,3 [106]
Ва(ВгОз)2
BaMnO,
Га(ТОз)2
T1JO3
8,5 [106]
AgNOz
Pb(JO3)e2
Кристаллогидраты
Ме, (504) „-яН>О
CaSO4.6H20
38,2 [406]
AgeCrO4
AgeCr207
342,7
190,5 [105]
Иодаты
AgJQO3
AgBrOs3
91,7 [105]
90,3 [105]
340,1
Pr(OH)3 |
Sb(OH)s
Sc(OH)s
Различные
352 ‚3 [106]
235,8 [106]
118,0 [106]
344,8
Sm(OH)s
УБ(СОО)2
Zn(COO).
164,9 [106]
—
141,14 [71]
21,8 [71]
~ 24 = [105]
1504 _
К.СгО4
Еч2(504)з.8Н2О
1524
K 2eCr2O,
485,3
Но2(504)з.8Н2О
1514
K4Fe(CN)¢-3H20
337,5 [114]
Lu2(SO4)3-8H20
4498
NaS
4530
NiCO3
Sme(SO.4)3-8H20
4526
Tbe(SOa)3-8H20
Y be(SO4)3-8H20
1524
‚ 1502
Оксалаты
247,5
948,9
Fe(COO)e
217,6 [106]
Cu(COO)e
Hg2(COO).
Газ [(СОО)»1з
№4 [(СОО)2]з
Pb(COO)2
эт(СОО)›
*
182,7
168,0
952,4
_ 942,4
208,3
332,9
331,1 [443]
~
87,6
[106]
[106]
[406]
[106]
[106]
[406]
[106]
[106]
[113]
[74]
164,7
РЬ(ВгОз)>
С4(СОО0)2
Се [(СОО)2]з
31 ‚9
[106]
PbCIF
РЬСгО4
126,4 [106]
215,2 [106]
РоО.
92-
58,7
1242*
РЬНРО4
ЗаНа,
SrCrO4
|
64,1 [110]
7,5 [105]
64,1 [111]
—
IreO3
Pre(SO4)3-8H20
42
— АН5о8
AgMnO,
La(OH)s3
Lu(OH)s
Nd(OH)s
Таблица
некоторых
Вещество
АОН
Cr(OH)e
когда
значений стандартных теплот
образования
веществ (ккал/моль)
[25] *
310,7 [406]
г
—80,4 [145]
331,5 [106]
Sr(HCOs3)2
466,8 [106]
71С5.270(ОН)2
Zn(NOs3)2-4Zn(OH)s
420,7 [108]
737,5 [108]
ZnSO,-Zn(OH)s
В скобках указаны источники,
из которых заимствованы значения
AZ508сноски нет, необходимые данные взяты из сводки [3].
2* Для процесса гидратации иона в бесконечно разбавленном растворе.
392,7 [106]
В
тех случаях,
297
Можно
было
бы
привести
еще
много
других
примеров
применения
(ТХ, 9). Так, данные, найденные в работе [121] для моногалогенидов хрома ив [112] для комплексов никеля с моноэтиламином, хорошо описываются этим уравнением.
Остановимся на возможности некоторого уточнения результатов рас-
чета по уравнению ([Х,20).
Переход от уравнения (Х,, 20), объединяющего
различные вещества (например
все двухвалентные хлориды), к уравнениям, объединяющим более сходные вещества (например только хлориды
подгруппы бериллия), в принципе должен привести к повышению точности
результатов вычисления.
То же относится и к уравнению, объединяющему все соединения данного вида. Так, средняя ошибка вычисления по уравнению
АЙ.оз = 1,00 АН
велика
— 13,24
|
(ТХ,26)
(Аз» р = 1,4), вероятно, потому, что оно было использовано
для р рас-
АЙ = 0,953 АН»з — 6,00,
(1Х,27)
чета ЛП.з самых разнообразных
кислородных соединений, различающихся по структуре, характеру связи, валентному состоянию и т. д.
Использование этого пути уточнения, к сожалению, во многих случаях
ограничено недостаточной надежностью значений ЛН.з. Однако там,
где возможно, этот путь дает существенный выигрыш точности. Приведем
несколько примеров.
Если вместо уравнения (1Х,20), коэффициенты которого приведены
в Табл. 38, для возгонки элементов подгруппы лития воспользоваться
уравнением
то для этих элементов ошибка вычисления Л ср уменьшится с 1,2 до0,2 ккал.
Более чем в два раза увеличит точность расчета ЛА 0..3 для процесса
гидратации
одновалентных
ионов
переход
к уравнению
AZoo3 = 0,887 AHoo, + 5,4.
Применение
соотношения
позволяет
для
уменьшить
(1X, 28)
Na,CO;-nH,O
вместо общего
^7° — 0.974 AH’
+78
уравнения
(ТХ, 21)
(IX,29)
Аср с 7 до 1 ккал.
Ошибку расчета можно несколько уменьшить, если вместо общего уравнения для окислов применить для высших окислов уравнение
AZso¢ = 0,98 AHoo, — 15,0.
Еще
один
пример.
При
сопоставлении
(IX,30)
значений
Л2»з
и AHoog
Для
соединений, образованных водородом и элементами одной и той же подгруппы элементов (подгруппы кислорода), находящихся в одинаковом
агрегатном состоянии, получим уравнение
AZoo3 = 0,983 AH oo, — 3,16,
(IX,31)
приводящее к погрешности всего в 0,01 ккал.
Следует, однако, подчеркнуть, что в большинстве случаев точность
данных все еще недостаточно велика для того, чтобы переход к индивидуальным уравнениям давал бы существенный выигрыш в точности.
Рис. 234 иллюстрирует на рассмотренном примере переход от одного
к нескольким
сопоставлениям в рядах сходных веществ.
Приближенные
уравнения
(Х,9) и
(1Х,20)
справедливы
не только
для реакций образования различных веществ, а поэтому и для химических
реакций вообще, но и для других процессов. Так, возможно их примене298
ние к процессам гидратации, в частности
к
гидратации
ионов
(в
последнем
случае
-/ Zo ag
|
„Ио“:
6565г
для того, чтобы одно
уравнение применить
к ионам различного
заряда, величины ЛД
и АН должны
быть
отнесены
к1
г-иону.)
Уравнение,
предло-
женное С. И. Дракиным [124, 125], можно
рассматривать каквидоизмененное уравне-
ние
вида
(Х,
9)
применении к процессам гидратации ионов
в бесконечно
ленном
Уравнение
в
разбав-
~
растворе.
(1Х,
9)
действительно
pt
78
и
82
~ 64
80
-Д Но дв
Рис. 234. Взаимосвязь“между стандартными
цессов, например для
и
|
76
и для
чисто физических происпарения
РГ).
57
теплота-
ми образования AH sop (ккал/г-экв) и изобарными по-
возгон-
тенциалами образования
нидов некоторых
ки. Так, для возгонки
элементов можно воспользоваться зависимостью
о
Д2.., (ккал/г-экв)
лантанидов [123]
галоге-
AZoon = 0,980 AHoo, — 7,84.
Средняя
погрешность
вычисления
составляет 0,7 ккал.
В заключение отметим,
(IX ,32)
по этому уравнению’ для
что частному
случаю уравнения
954 элементов
([Х, 9), когда
в нем коэффициент А, = 1 (коэффициент В, пропорционален изменению
числа молей газообразных реагентов), отвечает правило Н. И. Кобозева
[126]. Из изложенного видно, что это правило в первом приближении
соблюдается
для
гомологических рядов".
Если
значения
А,
и В.
близки
соответственнок единице и к нулю, то можно говорить о возможности
применения принципа Бертло, что будет справедливо для всех веществ
при 0°К [см. уравнение (IX, 13)].
ТЕМПЕРАТУРНАЯ
|
В
(ГП,
1) для
этом
разделе
приближенного
ЗАВИСИМОСТЬ
будет
ТЕПЛОТ
рассмотрено
расчета
ОБРАЗОВАНИЯ
применение
температурной
соотношения
зависимости
теплот
образования на примере гомологических рядов углеводородов [128].
Для рассматриваемого свойства это соотношение имеет вид
АНт, = АзАНт, - Bs,
где ЛНти
гического
1 К
АНт, — теплоты
ряда
при двух
несколько
более точным
3An
+
[Ап| ’ предложенное для
щими в газовой
фазе
(при
(1Х,33)
образования углеводородов данного гомолозначениях
температуры.
Так как наиболее
результатам
.
приводит
соотношение AS Sog 26 An +
реакций между органическими соединениями, протекаю-
Ал=Е0)
[127].
299
надежными
являются значения Л Но»,
шем целесообразно
использовать
Рис. 235 иллюстрирует
килциклогексанов.
то
в виде
уравнение
(1Х,
33)
в дальней-
|
АНт = АзАН»в + Bo.
(IX ,34)
это уравнение на примере некоторых
моноал-
Как и следовало ожидать, на каждой прямой, соответствующей уравнению (]Х, 34), точка для первого члена ряда выпадает, причем отклонение оказывается тем значительнее, чем больше температура 7 отличается
о
-ДН r
6 т
‚ВН,
:
и
о
0 |.
50
3
Ч
чо
40
JSF
SOF
|
зо
вон
25
„И
20r
y
101
о
1
15
1
25
90
|
$35
!
in
40
-
и
Н
x
› 90
298
Рис.
235. Взаимосвязь
между
стандартными теплотами образования АН” (ккал/моль) некоторых
н-моноалкилциклогексанов
298,16°
1 —
о
К и при Т (°К)
циклогексан,
2 —
сан; 3 — этилциклогексан;
при
4 —
н-про-
10
L
20
90
!
_
40
о
ДН, ов
у
50
Рис. 236. Взаимосвязь между стандартными
тенплотами образования
ЛИ”
(ккал/моль)
некоторых н-моноалкилциклогексанов при
298,16° К. и при Т
[1293]
метилциклогек
1
0
1 — циклогексан;
-
этилциклогексан;
(°К) [129]
2 — метилциклогексан;
4
—
н =
3 —
пропилциклогексан
пилциклогексан
от 298° К. Однако эти отклонения устраняются
при рассмотрении нескольких изотерм; в этом сказывается родственность соединений данного гомологического ряда. Последнее приводит к тому, что изотермы,
—
если ограничиться не очень широким интервалом температур,— пересекаются примерно в одной точке (см. рис. 236). Как видно из чертежа, точки, выпадающие на рис. 235, хорошо ложатся на прямую, если для циклогексана принять наклонную линию. В то же время то, что эта линия,
подобно остальным, является именно прямой, свидетельствует о сходстве
циклогексана с другими углеводородами этого ряда. Из рис. 236 видно
также, что в первом приближении все изотермы (за исключением 0° К)
пересекаются в одной точке. Это свидетельствует о примерном подобии
изменения ЛЯ” от 7 для различных членов ряда, которое несколько нарушается лишь при очень низких температурах. Как и следовало ожидать,
наклон прямых в пределах каждого ряда закономерно изменяется с температурой. Что касается характера расположения точек на прямых, то он
определяется характером изменения ЛЯ с п. В простейшем случае, т. е.
когда
действительно
уравнение
(Т, 91),
нии; это и наблюдается для высших
300
точки
гомологов.
лежат
на равном
расстоя-
Таблица
значений
Погрешноети
(первая строчка)
400—1000° К,
и
углеводородов
газообразных
некоторых
ДНз.; образования
средняя погрешность значений
вычисленных по уравнению (1Х,
43
(ккал/моль) в интервале
ДН».
[128]
34) (вторая строчка)
n
Гомологический
ряд
н-Алканы
о
|
3
|
0,1210,44|
'
2-Метилалканы
3-Метилалканы
2,2-Диметилалканы
h
|
5
0,46]
0,46]
0,19}
0,13)
0,13
—
—
—|—|
—{|—|
—
—
—
0,49]
0,23]
0,261
0,25
0,24;
0,24)
—|—|
— [0,121
0,280,27|
—
— |
—|
0,1910,24]
0,25|0,20)
1-Алкены
2-Метил-1-алкены
1-Алкины
н-Моноалкилбензолы
|
—|—|
н-Моноалкилциклопен- | — | — |
таны
—|—|
н-Моноалкилциклогек- | — | —|
саны
транс-2-Алкены
|
цис-2-Алкены
1,2-Диены
|
—
|
8
|
0,19) (0,19) | (0,20)
—
0,381
0,07
0,27
0,08
9
|
022)
—
—
—
—
—
10.
41
— |
—
—
—
—
—
|—
—
—
—
—
—
0,43]
0,22
—
0,20
0,50)
0,231
0,08] 9,07 | —
0,30! 0,36 | —
0,48} 0,49 | —
0,44 (0,45) | (0,46)
0,22
—
—
—
—
—
—
—
—
—
—
—
—
—
—
0,15}
0,20 | 0,20 | 0,31 | 0,37
—
0,18)
|+4+0,76
0,70]
0,20)
0,10;
0,39|
0,25]
0,08;
0,22 | 0,147
0,30 | 0,36
0,08 | 0,08 |
0,90]
0,53)
0,211
0,53!
0,16]
0,22|
—
—
—
—
0,26 | 0,30 | 0,28 | —
—
—
— | —
—
—
— | —
—
—
— | —
—
—
— | —
—
0,08}
—
—
— | —|
— | —|
—
|—|
—|
—|
0,24
0,25
0,30
0,146
—
0,146]
0,1401
|0,13|
7
0,07)
0,24|
0,50;
0,44]
0,22|
—
0,20]
—
—
0,25)
—
0,26)
0,26]
0,26]
0,40
—|— |
|
—
0,30)
0,40
0,30]
0,06)
—
—
—
—
6
0,19)
0,25}
0,101
0,231
0,24)
0,21;
0,20)
0,06]
—
—
0,20/0,20}
—|
— |
—|
— |
—{—]
—|—|
—|— | —
|
2,3-Диметилалканы
|
0,14]
— „|
0,23)
0,42!
0,19]
—
0,32) 0,24}
0,25
—
—
Вычисление по уравнению (1Х, 34) для четырех
санов привело к среднему отклонению от значений
|
|
|
|
—
—
|
|
|
|
|—
— |—
—
|
—
—
(0,48) | 0,5
—
|—
— | —
je
—
— | —
_
‚18 | 0,18
—
— | —
0,37 | 0,30 | 0,33 | —
—
—
—
—
— | —
— | —
н-моноалкилциклогекДЛ, рекомендованных
в [129], равному 0,26 ккал/моль.
Чтобы оценить точность результатов вычисления, на которую влияют
как погрешность метода расчета, так и ошибочность величин АН и
АНт
[129], в табл. 43 приведены
дованных
величин
ДН»
значения вероятной неточности
(первые
строчки).
В скобки
рекомен-
заключены
значе-
ния, вычисленные по уравнению (Г, 91). Как видно из этой таблицы, для
четырех н-моноалкилциклогексанов Аср в интервале 400—1000° К даже
несколько меньше погрешности величин АН». А ведь последние величины являются наиболее достоверными, так как на рекомендованные в
литературе значения
ЛАт при высоких температурах накладываются
погрешности в температурной зависимости теплоемкости соответствующих
углеводородов.
Существующий в настоящее время фонд данных по зависимости A H®
от 7 позволил
дов.
Расчет
был
применить
произведен
уравнение
(1Х., 34) для 14 гомологических
в интервале
400—1000°
К, так как,
ря-
хотя при
301
более высоких температурах точки удовлетворяют уравнению (ХХ, 34}
(см., например, рис. 235) !, однако при 7 `> 1000° К отклонение изотерм
от общей точки пересечения становится значительным. Это обстоятельство,
обусловленное как возможным уменьшением подобия в ходе кривых (Л Н°,
Г), так и меньшей точностью высокотемпературных значений ЛИ°, не
позволяет распространить на Г>>1000°К расчет значений ДНт, основанный на использовании схода изотерм в одну точку ?.
Координаты точки пересечения изотерм данного
гомологического
ряда определялись по уравнению
AH 7, — As-AH,,,
ga
(IX, 35)
вытекающему из ([Х, 34) при исключении В..
Чтобы установить, к какой погрешности приводит допущение о пересечении изотерм в одной точке, после нахождения среднего из всех значений 5х вычислялись величины Л НТ,
лялся по тому же уравнению .
а затем и Аср. Расчет АНт
осуществ-
АНт = (Аз)т- АНэвв + 2 [(Аз)т —1].
(1Х,36)
Для вычисления хи АНт необходимо располагать также значениями
А, выражающими наклон соответствующей изотермы. Для н-алканов,
1-алкенов, 1-алкинов, н-моноалкилбензолов, н-моноалкилциклопентанов,
н-моноалкилциклогексанов зависимость А .= ф(Г) была найдена по значениям инкрементов в величинах
АЯт, рекомендованных в сводке [129].
Та же зависимость использована и для 2,2-диметилалканов и транс-2алкенов. Для 2-метилалканов, 3-метилалканов и цис-2-алкенов приняты
несколько иные значения Аз, так как они, по-видимому, приводят к более
точным результатам; по крайней мере, они лучше согласуются © данными,
рекомендованными
в сводке [129]. Так, если, например, для четырех
2-метилалканов Аср в интервале 400—1000°К. при принятой зависимости
А.—Т
составляет
0,11 ккал (х = 4,2), то использование зависимости
A;—TY по данным, рекомендованным в сводке [129] для перечисленных
выше рядов, приводит к Асер = 1,27 ккал (х = 3,9), т. е. увеличивает
погрешность вычисления на целый порядок.
Для 2,3-диметилалканов
достижение максимальной точности потребовало принятия индивидуального хода зависимости Аз от Г.
Зависимость А; от Г изображена на рис. 237. При вычислениях принимались во внимание значения Л Нт только тех углеводородов, у которых
число атомов углерода не превышает величины, начиная с которой рекомендуемые в литературе значения ЛНт вычислялись по уравнению (ТГ, 91).
Для удобства определения значений А. зависимость А; от 7 целесообразно выразить в аналитической форме. Характер этой зависимости позволяет представить ее в виде приближенного уравнения
A3— 1
3
oy
T — 298
у
— ya —
В
BT
’
(
=
IX,37
’
значения констант которого для н-алканов, 2,2 -диметилалканов,
1-алкенов, 2-метил-1-алкенов, 1-алкинов, н-моноалкилбензолов, н-моноалкил-
циклопентанов,
1 Из
вплоть
рис.
н-моноалкилциклогексанов, транс-2-алкенов а = 88.10°
235 следует,
до температуры
1500°
что уравнением
К, которой
(1Х,
34) можно
было
ограничиваются известные
бы воспользоваться
значения
АН°®
для
большинства изученных углеводородов.
* Однако
сохраняется возможность воспользоваться закономерным изменением
коэффициента .4з с Т (см. главу ХТ), что позволило бы уточнить результаты излагаемого расчета.
302
)
Таблица
Погрешноети
значений АН т
Гомологический
ряд
вычиеленных
по
Число
веществ 1*
уравнению
средняя
5
4
2
0
4,2
—5,1
2,3-Диметилалканы
1-Алкены
2-Метил-1-алкены
1-Алкины
н-Моноалкилбензолы
н-Моноалкилциклопентаны
2
4
о
3
44*
4
40
24
19
55
37
14,3
транс-2-Алкены
цис-2-Алкены
1,2-Диены
2
2
2
22
31
58
3
н-Моноалкилциклогексаны
1*
Первые
гомологи
з*
Для
2,2-диметилбутана
“*
Ряд
начат
[428]
максимальная
©
—0,57
—0,29
—0,34
0,073*
2,5
--0,173*
0,48
0,22
0,20
0,22
0,20
0,09
—0,87
+0,60
+0,53
+0,65
—0,55
0,27
0,26
0,13
0,13
+0,71
+0,33
—-0,36
0,26
—0,81
исключены.
** А = АНвычисл —"АН [129].
к уменьшению
|
0,20
0,14
0,07
8,3
4
34)
А, ккал
х
н-Алканы
2-Метилалканы
3-Метилалканы
2,2-Диметилалканы
(1Х,
44
погрешности
приняты
значения
АН,
Дер от 0,49 до 0,07 ккал.
приведенные
в работе
[130],
что
приводит
с. этилбензола.
и В = 0,058-10-°; для 2-метилалканов,
3-метилалканов,
цис-2-алкенов,
1,2-диенов а = 74.10? и
В = 0,050-10-°; для 2,3-диметилалканов а =
= 46-10°° и В = 0,033. 10°°.
Как
видно
из рис.
238,
уравнение
вида
([Х,
37) удовлетворительно
воспроизводит экспериментальные данные; даже в худшем случае, т. е.
для 2,3-диметилалканов при 400° К, применение этого уравнения для
трех изученных углеводородов приводит к значениям Аср = -{ 0,21 и
А макс = -Ё 0,26 ккал.
Результаты вычислений приведены в табл. 44, в которой
ваются с рекомендованными значениями АЯт [1429, 130].
Из
табл.
43 и 44 видно,
ность результатов
чений
AHoo, *.
что
для
всех
гомологических
они сравни-
рядов
погреш-
расчета не превышает предполагаемой неточности зна-
Средняя
ошибка
для
43
углеводородов
составляет
0,20 ккал/моль. Если же ограничиться интервалом 400—800° К, то ошибка
вычисления уменьшится примерно вдвое, так как для всех углеводородов
максимальное расхождение приходится на Т = 900 и 10007 К.
Таким образом, хотя применение уравнения ([Х, 36) связано с дополнительной по сравнению с уравнением (1Х, 34) погрешностью, о чем свидетельствует непостоянство значений А для каждого углеводорода и прохождение величины ДЛ (с температурой) через нуль, однако результаты вычисления
по
уравнению
(ТХ,
36)
являются
все
же
вполне
удовлетвори-
тельными. Вероятно, в дальнейшем удастся: несколько повысить точность
расчета: для этого необходимо увеличить число изученных углеводородов
1 Хотя в работе [131] для н-алканов хо\: .1з3 = ф (Т) несколько
браженного
на рис. 237, однако
результаты
было принято и несколько иное значение х
практически
(х-= 2,8;
отличается
не изменились,
Аср =
0,19;
от изо-
так как в [131]
Аманс =
0,54).
303
3-метилалканы, 2,3- диметилалканы), а также увеизвестных значений АНт, и в частности АНовв.
(в частности, в рядах
личить Достоверность
Возможно, что для тех или иных гомологических рядов все это отразится
на зависимости Аз = 9(Т).
Степень сходства углеводородов гомологических рядов проявляется
в значениях 2 (см. третью графу табл. 44). Так, они близки для н-алканов
2-метилалканов,
и
заключить,
1-алкинов
для
чем 1-алкены несколько
и
1 ‚2-диенов.
х можно
значению
По
ближе по свойствам к транс-2-алке-
Аз
| вон
ИБ
Ио
7
105
1,00
095
0 90
‘
1
200
400
|
600
i
|
800
1000
Г
Ag
коэффициента
Рис. 237. Зависимость
уравнения (Х, 34) от температуры Т (°К)
для различных гомологических рядов
углеводородов [129]
1 — н-алканы,
2,2-диметилалканы,
1-алкены,
зн-моноалкилбен1-алкины,
2-метил-1-алкены,
н-моноалч-моноалкилциклопентаны,
золы,
килциклогексаны, транс-2-алкены; 2 — 2-метилал1,2-диены;
цис-2-алкены,
3-метилалканы,
каны,
3 — 2,3-диметилалканы
10
400
L
600
800
1000
T
величины
238. — Зависимость
Рис.
уравнении
в
— 298)
у= (43 — 1)/(Т
для
(Х, 37) от температуры Т (°К)
рядов
гомологических
различных
углеводородов
[128]
1-ал2,2-диметилалканы,
1 — н-алканы,
н-моно1-алкины,
2-метил-1-алкены,
кены,
н-моноалкилциклопентаны,
алкилбензолы,
транс-2-алкены;
н-моноалкилциклогексаны,
Yyuc-23-метилалканы,
2 — 2-метилалканы,
алкены,
1,2-диены;
3 —
2-3-диметилалканы
нам, чем к цис-2-алкенам. Значения х для алканов, алкенов и алкинов
соответствуют последовательности изменения свойств при переходе от
одного гомологического ряда к другому. Отличие значений х для 2,3диметилалканов от других алканов, по-видимому, в значительной степени обусловлено недостаточной точностью АНт для них; об этом свидетельствует и повышенная Аср для веществ этого гомологического ряда.
Наряду с вычислениями для всех рассмотренных гомологических рядов были построены графики (в масштабе1 ккал=5 мм), аналогичные приведенным на рис. 236. Рассмотрение этих графиков позволяет высказать
некоторые дополнительные соображения.
Для первых членов каждого ряда при всех температурах точки хорошо ложатся на прямые линии. Это непосредственно видно из рис. 239,
на котором изображены линии, подобные прямой 1 на рис. 236.
Отклонение линий первых гомологов от вертикали для ряда веществ
не очень велико. Так, оно незначительно для 2-метилпропана, 3-метилпропана,
2,2-диметилпропана
и
2,3-диметилпропана,
т.
е.
для
веществ,
которые сравнительно мало отличаются от последующих членов
ряда;
для ацетилена незначительность отклонения связана с небольшим изменением ЛАЯ” с изменением температуры. Отклонения велики для циклопентана и циклогексана. Для н-моноалкилбензолов отклонение, уменьшающееся с ростом п, распространяется на три первых члена ряда, что,
30+
по-видимому, связано с резким отличием фенильной группы от алкильного радикала. Для остальных гомологических рядов отклонения от вертикали ограничиваются первым членом, так как хотя для этана переход
от
наклонной
димому,
к
лишь
грешность
вертикальной
при высоких
значений
Axe
Рис. 239.
членов
прямой
и
температурах
АНТ.
уточняет
расчет,
это уточнение
однако,
по-ви-
превосходит
по-
о
[-75кап
Зависимость
теплот
о
образования
АНт
(ккал/моль)
некоторых гомологических рядов от температуры
первых
7 (°К) [129]
1 — циклопентан; 2 — циклогексан; 3 — бензол; 4 — этен;
5 — метан;
6 — 2,2-диметилпропан;
7 — 2-этилпентан
Таким образом, применение уравнения
(1Х,36) для первых членов
многих гомологических рядов дает удовлетворительные результаты. Это
непосредственно
виднои
из табл. 45: для
10 углеводородов
из 15 погрешТаблица
Погрешности
вычисления по уравнению
(1Х,36) для первых членов различных
гомологических рядов углеводородов [128]
А.
Углеводород
Метан
2-Метилпропан
2-Метилпентан
2,2-Диметилпропан
2,3-Диметилбутан
Этен
2-Метилпропен
Этин
* А =
45
АНвычисл—
ккал *
средняя
—0, 66
—0, 13
0,24
0,08
|
максимальная
А,
Углеводород
—0,85 | Бензол
—0,19 |
Толуол
0,42 | Циклопентан
0,24 | Циклогексан
0,50 |
—0,97 | транс-2-Бутен
0,25
+0,66 | Пропадиен
0,28
0,25
--0,73 |
цис-2-Бутен
+0,72
ккал*
максимальная
средняя |
—0,70
0,39
0,76
0,90
|
119
—0,83
1,47
1,15
0,25
0,59
0,13
0,34
0,16
0,34
АНопытн.
ность вычисления не отличается от указанной в табл. 43. Все это свидетельствует о том, что распространение уравнения
(1Х,34) на углеводороды,
для
которых
20 м. Х. Карапетьянц
уравнение
(1,91), выражающее
аддитивность
свойств,
305
совершенно неприменимо, в ряде случаев может привести к удовлетворительным результатам.
Прямые для 3-метилпентана, этена, этина, бензола (толуола и этилбензола), циклопентана, цис-2-бутена, транс-2-бутена и 1,2-пропадиена
наклонены к оси абсцисс, подобно прямой для циклогексана (см. рис.
236). Прямые для метана (этана), 2-метилпропана, 2,2-диметилпропана
и 2,3-диметилбутана имеют противоположный наклон. И в том, и в другом
случае степень отклонения прямых от вертикали неодинакова, поскольку
свойства первых гомологов в различной степени отличаются от свойств
остальных членов ряда. Первый случай связан с ускоренным (по сравнению
с
остальными
гомологами)
изменением
АНт
в
зависимости
от
изме-
нения температуры, второй — с замедленным изменением АНт с Т; эта
разница
обусловлена
различным
ходом
температурной
зависимости
энтальпии у первых членов гомологических рядов.
Для всех гомологических рядов точки при 0° К ложатся на прямую
линию.
Хотя, вероятно, ход кривой А. =ф (Т)
при Т <
298° К не будет
одинаковым для всех гомологических рядов, однако отсутствие экспериментальных данных не позволяет с достаточно высокой точностью установить эту зависимость для различных рядов. Тем не менее для приближенных вычислений можно воспользоваться зависимостью, представлен-
ной на рис. 237 (на основании
данных
для
н-алканов).
Для
гомологиче-
ских рядов, у которых ход изменения А.с Т одинаков с этим ходом, при
высоких температурах результаты будут вполне удовлетворительными.
Об этом можно судить по следующим данным: среднее отклонение от значений, рекомендованных в [129] для низших н-алканов (п = 2-5; 12 точек), составляет всего 0,12 ккал/моль, для 2,2-диметилпропана (2 точки) —
0,07 ккал. Для 2-метилалканов (п = 4 и5; 4 точки) Аср = 0,07. Таким образом, для всех семи углеводородов, для которых известны значения
АНТ при T < 298° К
1129],
Ах = 0/40 ккал/моль. Эту величину следует признать незначительной, тем более, что два из перечисленных углеводородов являются первыми членами соответствующих гомологических
рядов.
Следовательно,
для вычисления
значений
ЛНт
при низких
темпера-
турах не только для н-алканов, но и для других гомологических
можно воспользоваться приближенным уравнением
Аз = 0,82 + 0,0006 Т,
(ГХ,38)
соответствующим пунктирной прямой на рис. 237.
Для упрощения вычислений описанный метод можно
вым методом сравнительного расчета.
первому методу отвечает уравнение
Для
АН = А.АНТ-
рядов
сочетать
рассматриваемого
By,
с пер-
свойства
(IX ,39)
где АН: и АНи — теплоты образования углеводородов в двух гомологических рядах при данной температуре. Записав
(1X,39) для Т =
— 298,16°К
и приняв
в качестве стандартного ряда
A Fogg
Если
со
сравнивать
второго
члена
—
A, (A F598)
углеводороды
ряда
(например,
н-Си Нопзо
данного
пропен
+ By.
ряда
с
н-алканы,
с
этаном,
получим
(IX ,40)
налканами,
бутен
с
начиная
пропаном
и
т. д.), то, учитывая близость свойств большинства гомологических рялов,
можно принять А. = 1, т. е. использовать уравнение (1Х,40) в виде
AH o9g == (A Hogs )x-Cn Wonsg + Br
306
/ (IX,41)
Погрешности
вычисления
по
уравнению
(ТХ,41)
'Габлица
[128]
46
А, ккал?*
Гомологический
ряд
ея
2-Метилалканы
3-Метилалканы
2,2-Диметилалканы
2,3-Диметилалканы
1-Алкены
2-Метил-1-алкены
н-Моноалкилбензолы
1* Первый
**
3*
4*
A=
Для
Для
максимальная
0,14
0,15
0,32
0,5
0,10
0,29
0,18
0,49
0,5
0,20
0,30
—16,55
—25,85
—24,05
—26,85
25,05
3
11,44
0,25
64,60
0,13
3
н-Алкилциклопентаны
н-Алкилциклогептаны
транс-2-Алкены
цис-2-Алкены
1,2-Диены
Ay
средняя
4
2
3
2
4
2
1-Алкины
лога.
Ва
26,75
4
4
2
2
2
0,25
0,06
—5,25
—16,10
"42,45
13,40
59,30
АН вычисл.—
—1,48,
0,09
0,33
0,20
0,16
0,30
—3,094*
0,30
0,65
0,20
0,17
0,30
—4,68
—4,56
—1 ,82
—2 ‚82
—4,51
первые два гомо-
АН [129].
гомолога.
толуола.
Результаты,
—2,44
0,10
гомолог не учитывался; для н-моноалкилбензолов не учитывались
первого
—2,29
—2,72
—2,27
—2,25
—5,34
приведенные
в табл.
46, свидетельствуют
о достаточной
точ-
ности расчета по уравнению (ТХ,41) 1.
В последней графе табл. 46 приведены величины погрешности вычисления для первых членов ряда. Они, естественно, значительно больше
величин,
(например
приведенных
сдвиг
в
табл.
стандартного
от допущения
А. =
1) в данном
с близким
можно
44.
ряда
Изменение
на один
случае
условий
углеводород
существенно
не
сопоставления
пли
же
отказ
сказывается
на
повышении надежности расчета. Лишь путем сопоставления данного ряда
Так,
ему
применение
получить
уравнения
более
точные
результаты
(см.
AA reve = AA gens — 10,84,
табл.
46).
(IX ,42)
в котором сравниваются теплоты образования н-моноалкилциклопентанов с теплотами образования н-моноалкилциклогексанов, Дает для пяти
изученных
углеводородов (включая и первые гомологи)
Acp = 0,24.
При этом для каждого из десяти веществ погрешность вычисления по уравнению (ТХ,42) лежит в пределах неточности экспериментальных данных.
Для сравнения укажем, что отклонение от уравнения аддитивности теплот образования для циклогексана составляет более 1,2 ккал/моль и для
метилциклогексана
— более
Комбинируя уравнения
ближенное уравнение
АНт =1-+
0,8
ккал/моль.
(1Х,36),
(ГХ,37)
и
(1Х,41), получим
|
(a —BT) (Т — 300) (АН) синь. Е В +2] —х,
позволяющее найти
ных гомологических
1 Возможность
при-
(1Х,43)
значения АНт углеводорода любого из рассмотренрядов в интервале температур 298—1000° К. по теп-
принять
в (1Х,39)
41 =
1,
разумеется,
не
распространяется
о
ка
другие
гомологические
ряды;
Tak,
для
газообразных
н-спиртов
AH...—
—1,115 (АНоз)н-СиНоиьо1 — 34,5; здесь значительное отклонение „41 от единицы обусловлено сопоставлением полярных соединений с неполярными.
о
20"
307
Результаты
вычиеления
Углеводорол
Таблица 47
значений стандартных теплот образования ДН (ккал /моль)
некоторых углеводородов [128]
400
2-Метилоктан
2-Метилнонан
2-Метилдекан
—
2-Метилундекан
2-Метилдодекан
2-Метилтридекан
56,54
61,44
66,37
71,29
76,22
81,15
|
|
|
|
|
|
57,8
65,0
70,2
75,4 |
80,6
85,8
2-Метилпентадекан
3-Метилоктан
3-Метилнонан
3-Метилдекан
3-Метилундекан
2,2-Диметилгептан
94,00
56,00
60,85
65,81
70,74
59,05
|
|
|
|
|
|
96,4 | 100,2 | 103,3 |
59,3
61,9}
63,9]
64,4
67,2 | 69,4|
69,6: | 72,6|
75,0|
74,8
78,0 | 80,5|
62,4
65,0 | 671|
16,76
21,60
26,56
31,49
|
|
|
|
2-Метилтетрадекан
2,2-Диметилоктан
2,2-Диметилнонан
2,3-Диметилгептан
цис-2-Гептен
цис-2-Октен
цис-2-Нонен
цис-2-Децен
лоте образования
86,07 |
|
50
94,0
64,04 | 67,7
68,94 | 72,9
55,98 | 59,8
19,3
24,4
29,7
34,9
|
|
|
|
|
T, °K
298,16 |
62,3|
67,7
73,1
78,5|
83,9
89,3
94,7
|
|
|
|
70,6 |
76,1 |
61,8 |
24,3|
26,6 |
32,0|
374|
соответствующего
600
|
643|
69,91
75,5|
81,0|
87,2|
92,2|
97,7
72,9!
78,6}
63,7|
22,9|
28,4|
340|
39,6|
700
|
65,8 |
74,5|
77,2|
82,8|
88,5 |
94,2|
99,9 |
800
|
67,0|
72,7]
78,5|
84,3|
90,4 |
98,8 |
104,6 |
105,6 |
65,4]
70,9|
76,7]
82,3]
68,6]
107,4 |
66,5|
72,2|
78,0]
83,8]
69,6]
244]
29,6|
35,4]
444|
25,0]
30,7|
36,5|
42,2|
74,5}
80,3}
64,6|
75,5 |
81,5]
6541|
н-алкана при 25° С
стоянных х, а, Ви В., приведенным в табл. 45 и 46.
Так как, согласно сводке [129], начиная с н-гексана
ваться уравнением
высших
углеводородов
уравнение
(1Х,44)
примет
| 1000
67,8
68,5
73,7
74,7
79,5
80,3
85,3 |. 86,2
94,2
92,1
97,0
98,0
102,8 |
108,7 |
67,4
73,1
79,0
84,9
70,1
76,2
82,2
65,6
25,6
31,4
37,3
43,41
|
|
|
|
и значениям
можно
— AH*, 9, = 39,96 + 4,926 (n — 6),
TO для
900
103,9
109,8
68,1
73,9
79,8
85,7
70,3
76,4
82,4
65,8
26,2
32,0
37,9
43,8
по-
пользо-
(IX ,44)
вид
АНт= 1 -|- («— ВТ) (Т — 300) [39,96 - 4,926 (п — 6) + B, +2] —z, (XI,45)
где п — число атомов углерода в н-алкане, соответствующем рассматриваемому углеводороду данного гомологического ряда.
При помощи описываемого метода были вычислены приближенные
значения
AH?
гомологических
в литературе
B интервале 298—1000° К для 20 углеводородов шести
рядов (табл. 47), для которых экспериментальные данные
отсутствуют.
Хотя
в уравнении
(ТХ,44)
аккумулированы
неточности уравнений
([ГХ,36),
(1Х,37) и (ГХ,41), однако
можно полагать, что Аср для этих веществ не будет превышать 0,3 ккал/моль. Если
не ‘ставить перед собой задачу получения очень точных результатов, то
указанное число веществ можно было бы значительно увеличить, а также
определить для многих углеводородов зависимость АНТ от Т при низких
температурах, при которых данные особенно скудны.
В заключение отметим, что‘к закономерностям в температурной зависимости теплот образования углеводородов, рассмотренным в настоящей
главе, можно. было бы прийти на основании анализа особенности их теп-
лоемкости Ср и зависимости Ср от Г. Однако одним из достоинств метода сравнительного расчета как раз и является то, что его применение
не связано с необходимостью располагать дополнительными сведениями.
В данном случае это означает возможность вычислить АНт, не зная величины Ср.
308
. Х. Карапетьянц.
. Х. Карапетьянц,
an., М2, 105 (1958).
lected values of chemical
oo
Е
№
ФЕ вк
—
ЛИТЕРАТУРА
oD
=
r. Stand., 500, by F. D.
J. Jaffe. Washington, 1952.
Ж. физ. химии, 28, 1136 (1954).
Лин
Тин-Чин.
Acta sci. Natur.
and
thermodynamical
Rossini,
D.
properties,
D. Wagman,
W.
Univ.
Szec-
Circ. of the Natl.
H.
Ewans,
S.
Levine,
4.M. Born,
УМ. Heisenberg.
Z. Phys., 23, 388 (1924).
4a. J. E. Lennard- Jones, B. M. Dent. Proc. Roy. soc., A113, 673, 690 (1927).
5. J. E.Mayer,
L.Helmholz. Z. Phys., 75, 19 (1932).
6. E.J.W.Verwey,
J. H.de Boer. Rec. trav. chim., 55, 431 (1936).
7. M. L. Huggins.
J. Chem. Soc., 5, 143 (1937).
8. A. i Kapustinski.
Z. Kristall., 86, 350, 1933; Z. phys. Chem. 22, 257
(1933
9. С. А. Барков.
Ж. общ. химии, 19, 991 (1949).
10.
А.
Ф.
Капустинский.
Ж.
общ.
химии,
13,
497
(1943).
12.
13.
А.
К.
Ф.
П.
Капустинский.
Докл. АН СССР, 67, "467,
Мищенко.
Я. физ. химии, 26, 1736 (1952).
16.
К.
Б.
Яцимирский.
114. F. R. Bichowsky,
F. D. Rossini.
The Thermochemistry of the Chemical Substances, Reinhold Publishing Corp. New York, 1936.
14. И. Г. Рысс. Усп. химии, 21, 851 (1952).
15. К.Б. Яцимирский. Изв. АН СССР,
AH
47.
CCCP,
L. G.
1952).
18. В. №.
1951.
Cole,
M.
Farber,
Doescher.
19.
H.
Wise.
22.
А.
Ф.
J.
Термохимия
Chem.
G.
J. Chem.
Phys.,
20,
W.
ОХН,
663
(1949).
1948, 590.
комплексных
Elverum.
соединений.
J. Am.
Chem.
М.,
Изд-во
Soc.,
20, 586
Phys., 20, 330 (1952).
927
(1952).
20. W.Gilles, J. L. Margrave. J. Chem. Phys., 21, 384 (1953).
21. Yamashita.
Rept. Inst. Sci. Technol. Univ., Tokyo, 4, 269 (1950).
Капустинский,
944 (1956).
23. J. P. Coughlin.
Heat
and
Contribution
free energies
of formation
Washington., 1954.
.Х. Каранпетьянц.
O28 RUDE RSEREEES
К.
Б.
Яцимирский.
to
HE.
общ.
the data on theoretical
of inorganic
oxides.
Bur.
химии,
metallurgy.
of Mines
Bull.
26,
XII.
542,
Ж. физ. химии, 28, 353 (1954).
.Х. Карапетьянц.
Труды МХТИ им. Д. И. Менделеева, 20, 10 (1955).
.Х. Карапетьянц.
Труды МХТИ им. Д. И. Менделеева, 20, 39 (1955).
27. Л. А. Жаркова.
Ж. физ. химии, 36, 1819 (1962).
28.
Х. Карапетья нц. Докт. дисс., M., МХТИ им. Д. И. Менделеева, 1957.
Н. Spedding,
J.P. Flynn. J. Am. Chem. Soc., 76, 1474 (1954).
H.Spedding,
C. F.Miller. J. Am. Chem. Soc., 74, 4495 (1952).
Х. Карапетьянц.
Ж. физ. химии, 30, 593 (1956).
.
Oo
Oo
29.
31.
32.
33.
34.
35.
C.M.
Li,
N. W.Gregory.
Charnley,
J. Am.
H. A.Skinner.
Chem.
J. Chem.
Soc.,
74, 4670
Soc., "1952, 450.
(1952).
|
W.Ewans.
Natl. Nucl. Energy Soc., Div. IV, 19B.— B xu: «The Chemistand Metallurgy of Miscelaneous Materials. Thermodynamics», ed. L. L. Quill,
312, 1950.
А. Щукарев,
мандровская.
36. N. W. Gregory,
37. D. F. Evans,
R.
Т. А. Толмачева,
М. А. Оранская,
Л. В. КоЖ. неорг. химии, 1, 8 (1956).
T. R. Burton.
J. Am. Chem. Soc., 75, 6054 (1953).
E. Richards.
J. Chem. Soc., 1952, 1292.
38. F. Gray, T.C. Waddington.
Proc. Roy. Soc., A235, 106 (1956).
39. A.D. Mah, B.J. Boyle. J. Am. Chem. Soc., 77, 6512 (1955).
40. G. L. Humphrey.
J. Am. Chem. Soc., 73, 2261 (1951).
41.
2.
А.
Ф.
1947).
Капустинский,
S. Dworkin,
Phys., 22, 837
43. С.М. Ария,
44. С. М. Ария,
25, 534 (1955).
45. M. Hoch, D.
304 (1955)
46.
С. А.
D.
М.
С. Стаханова.
J.Sasmor,
(1954).
Е.А. Прокофьева.
Е.А. Прокофьева,
P. Dingledy,
Щукарев, Г.
E.
АН
СССР,
R.VanArtsdal
en.
57,
575
J. Chem.
Ж. общ. химии, 25, 849 (1955).
И. И. Матвеева.
Ж. общ. химии,
H. L. Johnston.
Гроссман,
Докл.
М.
J. Am.
П. Морозова.
Chem. Soc., 77
Ж.
общ.
химии.
_ 25, 633 (1955).
47. C. E. Holley, E.J. Huber. J. Am. Chem. Soc., 73, 5577 (1951).
48. L. Eyring, H. R. Lohr, B. B. Cunningham.
J. Am. Chem. Soc.,
1186 (1952
|
74,
309
.R.B.
Peppler,
E.S.
Newnan.
J. Research Natl.
(1952).
.L. A. Cosgrove,
P. E. Sn yder
.A. Pflugmacher,. R.
chwa
Chem., 264, 204 (1951).
.E.J.
Huber,
C. E. Holley.
ae
J. Am.
Am.
H.
Bur. Stand., 47,
Chem. Soc., 75,
J. Rabben.
Chem.
439
3102 (1953).
Z. anorg. allg.
Soc., 75, 5645 (1953).
г. ©.
Boek,возня
re
(
. С.М. Ария, С.А.
Щ укарев,
В.Б. Глушкова.
Ж. общ. химии, 23,
241 (1953).
.-Balesdent.
Compt. rend.. 240, 1884 (1955).
J. Huber,
E. L. Head, C. E. Holley.
J. phys. Chem., 60, 1457
95
. ХТ.
lley. J. Am. Chem. Soc., 77, 1444 (1955).
J.
. J.
.Е.
Koerner,
timer.
J. Am.
Chem. Soc., 74, 5757 (1952).
lley.
J. Am. Chem. Soc., 75, "3594 (1953).
,
qn
Qo
—
_ Huber,
Морозова,
А. А. Рейха рдт.
C. E. Holley, Е.
obb le,
greene
aoe
i°
55
—.
—
co
. М. Ария, М. П.
lley. J. Am. Chem. Soc., 74, 5930 (1952).
F. Daniels.
J. Chem. Phys., 20, 113 (1952).
W.
T. Smith,
Ж. общ.
H. Meierkord.
G. E.
Boyd.
J. Am.
J. Am.
Chem.
химии,
Chem.
23,
Soc.,
Soc., 75, 5777
Капустинский,
Н. М. Селиванова. Ж. физ. химии, 23, 1508
Капустинский,
Ю.
М.
Голутвин.
Изв.
АН
СССР,
ОХН,
—=
92.
attow,
=
Or
=
НОЕ?
Humphrey.
J. Am. Chem. Soc., 73, 1587 (1951).
.Huber, E.L. Head,
C.E. Holley.
J. Phys. Chem., 60, 1457 (1956).
Термохимия силикатов. М., Промстройиздат, 1957.
T ель.
B оскресенская,
Г. А. Бухалова.
Ж. общ. химии, 24, 1957
ah ‚п,
A.Schneider.
F. Burow.
Angew.
Angew.
Chem.,
Chem., 67, 306 (1955).
68, 382. (1956).
Je ffes, F. Ш. Richardson,
J. Pearson.
А (1 954).
‘on oe.
Quart. Rev., 7, 134 (1953).
андия.
Ж. физ. химии, 24, 257 (1950).
oolf. J. Chem. Soc., 1954, 4694.
гоз, Т. В. Мипзоп,
С. В.
Маезег.
J. Chem.
Faraday
Educ.,
30, 402
—
~~
co
Рег
|
Trans.
G.G.Baylé,
W.M.Mazee.
Rec.
trav. chim., 75, 529
>
—
—.
>
S chaerer,
БР
ТВ. ‘Lohr,
B. B. Cunningham.
J. Am. Chem. Soc., 73, 2025 (1951).
Ф. Капустинский,
О. Я. Самойлов.
Изв. АН СССР, ОХН,
or
0, 218.
С.
М.
Петров,
ия», 1964.
константы
В.Р.
Хайруллина,
серусодержащих
В.
Г. Япринце-
соединений.
М. Изд-во
mpm? weSs
°
И
Айвазов,
Физико-химические
‚ МасЬ 1ав,
C. T. Stubblefield,
L. Eyring.
J. Am. Chem.
77, 2975 (1955).
уг! по,
E. W. Westrum.
J. Am. Chem. Soc., 71, 5555 (1950).
. 5 kinner,
N. B. Smith.
Trans. Faraday Soc., 49, 601 (1953).
.Ё ульба.
3K. o6m. xumun, 24, 1700 (1954).
Т urkdogan,
J. Pearson.
J. Appl. Chem., 3, 495 (1953).
ros s, C. Hayman,
D. L. Levi. Trans. Faraday Soc., 50, 477 (1954).
.Gu thrie,
D. W. Scott,
G. Waddington.
J. Am. Chem. Soc.,
488 (1 954).
.Ми Idrow,
L.G. Hepler.
J. Am. Chem. Soc., 78, 5989 (1956).
Щ укарев,
М. П. Морозова,
Кан
Хо
Bla, B.T. Wapos.
I. химии,
27, 290 (1957).
*
OQ: Aro
РВ
. В.
?
eo
310
wy:
О.
Я.
Самойлов.
Изв.
АН
СССР,
ОХН,
0
>
7.
.Kirkbride,
F.G. Davidson.
Nature, 174, 79 (1954).
. Neugebauer,
J.L. Margrave.
J. Phys. Chem.. 60, 1318 (1956).
Ee
Z.T. Wakefield,
K. L. Elmore.
J. Am. Chem. Soc., 78,
РЕ UP =
°
—
95.
96.
97.
Капустинский,
956
. Шарифов.
—
>
<>
ел
94.
=
23 09= Е © ==
>
o>
о
e
A. Herold.
Р. Сгау,
Труды
Ин-та
физ.
и матем.
Compt. rend., 228, 686 (1949).
Т. С. Waddington.
A. S. Friedman,
126 (1951).
D. White,
Proc.
H.
Roy.
Азерб. ССР,
Soc., A235,
L. Johnston.
серия
461
физ., 9, 377
(1956).
J. Chem.
Phys.,
19,
98.
99.
100.
O.J.
Kleppa.
J. Am.
Chem.
Soc., 77, 897
(1955).
R.Juza, P. Laurer. Z. anorg. allg. Chem., 275, 79 (1954).
С. М. Ария, М. ПЦ. Морозова,
Хуан
Цзи-тао,
9. Вольф.
общ. химии, 27, 293 (1957).
R.N.R.Mulford,
G.E.Sturdy.
101.
102.
103.
104.
Ю. М. Голутвин.
Ж. физ. химии, 30, 2248 (1956).
S.Suzuki. J. Chem. Soc. Japan, Pure Chem. Sect., 74, 219 (1953).
105.
106.
107.
Н.
104a.
108.
109.
110.
111.
112.
113.
114.
115.
116.
Chem.
B.M. Abraham,
H. E. Flotow.
J. Am. Chem.
В. А. Киреев. ЖЖ. физ. химии, 28, 372 (1954).
Н. П. Жук.
Ж. физ. химии, 28, 1523 (1954).
П.
Н.
М.
Жук.
Ж.
физ.
химии,
Селиванова,
А.
28,
1690
Soc., 77, 3449
Soc.,
(1954).
Ф. Капустинский.
77,
Ж.
1446
(1955).
(1955).
физ. химии,
27, 565 (1953).
В. Л. Хейфец,
А. Л. Ротинян. Ж. общ. химии, 24, 930 (1954).
G. Lord,
A. A. Woolf. J. Chem. Soc., 1954, 2546.
S.Suzuki. J. Chem. Soc. Japan, 73, 278 (1952).
W.M. Jones. J. Chem. Phys., 16, 1077 (1948).
H. Mauras.
Bull. Soc. chim. France, N 5, 613 (1955).
М. М. Попов,
В. П. Колесов.
Ж. общ. химии, 26, 2385 (1956).
C.C.Stephenson,
У}. С. Моггом.
Л. Ам. Chem. Soc., 78, 275 (1956).
N.deZoubov,
E.Deltombe.
Refr. tech., N 26 (1955): C. A., 50, 12608b.
М. Х. Карапетьянц, М. Л. Карапетьянц. Таблицы некоторых Tepмодинамических свойств различных веществ. Труды МХТИ
им. Д. И. Менделеева, вып. 34. М., 1961.
М. Х. Карапетьянц. Труды МХТИ им. Д. И. Менделеева, 38, 52 (1962).
Л. А. Жаркова,
Я. И. Герасимов.
ЖЖ. физ. химии, 35, 229 (1961).
Т. Н. Резухина,
В.А. Левицкий,
Н. М. Казимирова.
Ж. физ.
ии, 35, 2639 (1961).
. Л. Верт,
М. В. Каменцев. Ж. общ. химии, 26, 30 (1956).
.Petrakis.
J. Phys. Chem., 66, 433 (1962). _
. Я. Сычев,
П.А. Гэрбэлэу.
Ж. неорг. химии, 7, 269 (1962).
-Shimazaki,
K. Niwa.
Z. anorg. allg. Chem., 314, 24 (1962).
И. Дракин.
Канд. дисс. М., МХТИ им. Д. И. Менделеева, 1952.
И. Дракин,
Б. М. Якушевский.
Ж. физ. химии, 27, 1636 (1953).
. И. Кобозев.
Ж. физ. химии, 22, 1002 (1948).
.Bakos.
Magyar Kem. Kusok Lapia, 8, 291 (1953).
. Х. Карапетьянц.
Хим. и технол. топлива, Ne 9, 22 (1956).
D. Rossini,
K.S. Pitzer,
R. L. Arnett,
R.M. Braun, G.G.
+
ASS DOOM
120.
121.
122.
123.
124.
125.
126.
127.
128.
129.
Fe
=
117.
118.
119.
J. Am.
Ж.
Pimentel.
Selected values of physical and thermodynamic
properties of hyd-
rocarbons and related compounds. Pittsbourgh, Carnegie Press, 1953.
130. А. А. Введенский.
Термодинамические расчеты процессов топливной
промышленности. М.—Л., Гостоптехиздат, 1949.
|
131. М. Х. Карапетьянц. Ж. физ. химии, 30, 1104 (1956).
132. Н. П. Жук. Коррозия и защита металлов. Расчеты. М., Машгиз. 1957.
ГЛАВА
Х
НЕКОТОРЫЕ ПРИМЕРЫ ПРИМЕНЕНИЯ МЕТОДОВ
СРАВНИТЕЛЬНОГО РАСЧЕТА. П
Несмотря
на
большое
распространение
методов
сравнитель-
ного расчета, существуют области, в которых они до сих пор почти не используются. Так, лишь совсем недавно было обращено внимание на возможность их широкого применения для расчета свойств веществ, отличаю-
щихся
по изотопному
составу
[1—3].
|
В связи с этим остановимся на применении описываемых методов для
тех объектов и свойств, для которых эти методы или совершенно не применялись или же применялись ограниченно.
В качестве таких примеров мы избрали следующие: свойства веществ,
отличающихся по изотопному составу; свойства комплексных соединений; уточнение принципа соответственных состояний (вернее, следствий,
вытекающих из этого принципа); уточнение различных приближенных
закономерностей,
в которых за постоянную величину принимается тот
или иной комплекс свойств.
Каждому из этих четырех примеров будет посвящен раздел настоящей
главы.
-
СВОЙСТВА ВЕЩЕСТВ,ОТЛИЧАЮЩИХСЯ ПО ИЗОТОПНОМУ СОСТАВУ
1
сообразно
Это направление применения рассматриваемых методов целепо двум причинам. Во-первых, вследствие трудности точного
определения
менении
свойств
изотопного
и затруднений,
указанных
состава
связанных
веществ
происходит
с их
очисткой.
(обусловленной
небольшое
Не
тем, что при
изменение
случайно,
что
из-
свойств)
в настоящее
время точные значения многих свойств в широком интервале условий
известны только для тяжелой воды; для нескольких десятков веществ
имеются лишь разрозненные и зачастую противоречивые сведения. Этим
фактически исчерпывается опытный материал. Поэтому даже приближенная оценка свойств веществ, отличающихся по изотопному составу, имеет
весьма существенное значение. Во-вторых, сходство свойств веществ, отличающихся по изотопному составу, позволяет надеяться на то, что применение к ним методов сравнительного расчета приведет к особенно надежным результатам (в частности, выпадение первых членов рядов при
использовании первого метода сравнительного расчета будет незначительным).
312
Ограничимся рассмотрением в основном первого и четвертого методов (главным образом из-за недостатка опытного материала).
В работах, посвященных изучению влияния изотопного эффекта на
свойства веществ, экспериментальный материал принято характеризовать
величинами
Gy
И
Gp —Gy
здесь
r
= B;
(X,2)
Gy — свойство вещества, содержащего
один изотоп
(например
во-
дород), a Gp — это же свойство вещества, содержащего другой изотоп
(например дейтерий), причем отношение или разность значений С берет-
ся или при одинаковых условиях, но для разных веществ, или же при
разных условиях (например при разных температурах), но для данной
пары веществ (см., например, [4] и [5]). Однако в исследованиях, в которых изотопный эффект изучался для большого числа веществ или в широком интервале условий, было установлено, что величины А и ВБ не яв-
ляются
постоянными.
В
последних
случаях
констатацией
этого
С
факта
р
обычно принято ограничиваться, хотя изменение с_ Или Gp — Gy HeH
редко лежит за пределами ошибок измерений; лишь в единичных работах
анализируется характер изменения этих величин
(указывается, напри-
мер, на то, что разность
ав —
Сн
увеличивается
с ростом
Сн).
Между тем, в большинстве случаев можно достичь удовлетворительных результатов, если перейти от (Х,1) и(Х,2) кприближенным линейным
уравнениям
Gp = A,Gy + B,
(Х,3)
и
Gp = A,Gy + By.
(Х,4)
В первом из них при данных условиях сопоставляются значения данного
свойства в двух рядах веществ, отличающихся по изотопному составу, во
втором сравниваются значения данного свойства двух веществ, отличающихся по изотопному составу, при разных значениях параметра условий.
Таким образом, уравнения (Х,3) и (Х,4) являются частными примерами
соотношений (1,41) и (ТУ,1), т. е. соответственно первого и четвертого методов сравнительного расчета.
Каждое из уравнений (Х,3) и (Х,4) можно рассматривать, как уточ-
нение
(Х,1)
и (Х,2);
действительно,
Gyn
они
отвечают
зависимостям
B
И
т. е. учитывают изменение величин А
состава
Лишь
и
интервалу
условий.
и В
соответственно с изменением
в тех случаях, когда набор веществ в первом из рядов мал (по
составов)
или
невелик
перепад
условий,
нением, можно принять в (Х,3) А, =1
или
ay A,=i1u B,=0], т. е. пользоваться
Хр).
охватываемый
урав-
В, = 0 [в (Х,4) соответстзависимостями (Х,2) или
У
313
2
Проиллюстрируем изложенное выше на нескольких примерах,
связанных с первым методом сравнительного расчета.
При изучении влияния температуры на взаимную растворимость деBATH различных органических жидкостей в Н.О и О.О [6] было установлено, что разница в критических температурах смешения (р) и (txp)x
колеблется
от 4 ,9° (фурфурол)
(Е)
до 22,4° (масляная
кислота).
Этот интервал
0,0
160
40)
Q
ett
tip
tt
)
KP/H
Puc. 240. BaauMocaa3b MeK/y KPATHYeCKHMH TemiepaTy
рения различных органических веществ в воде и в
1—
C3;H;COOH;
6 —
2—
0
40
60
u30-C,;H,COOH;
СН.СООС,Н,;
7 —
3
—
2
C,H;OH;
фурфурол;
во много раз превышает погрешность
к (Х,3) в форме уравнения
8 —
4
—
A
160
0
pau ¢,.,(°C) pacTBoтяжелой воде [6]
CH,;NO,;
н-С4.Н,ОН;
9 —
измерений.
5
—
СН,СООСН.;
С@«НьМН,
Переход
же
от
(txp)p,0 = 0,777 (tep)u,0 + 30,0
(Х,2)
(X,7)
приводит к средней погрешности в 2 (см. рис. 240). Учитывая трудность
определения {р и, главное, различие в природе исследованных органических жидкостей, этот результат следует признать вполне удовлетворительным.
С большой точностью уравнение (Х,3) описывает и данные по влиянию замещения водорода дейтерием в спиртах на поляризуемость молекул [7] (Аз = 0,014) и взаимосвязь между стандартными энтропиями
ЭН.и
ЭО; (9 =
М, Р, Аз)
[8], между
основными частотами колебаний НХ
u DX (X = F, Cl, Br, J) [9].
B cpa3u ¢ u3syaeHuem pactsopumoctu B H,O' mw Н.ОР в статье [10] приводятся значения частот колебаний для молекул растворителя, катионов
и анионов; ход этих величин, как видно из рис. 241, хорошо воспроизводится уравнением (X,6), эквивалентным (Х,3). Уравнение (Х,3) может
быть
(см.
рекомендовано
и
для
коэффициента
распределения
рис. 242).
;
На основании зависимостей, установленных в
можно рассматривать как примеры соотношения
диссоциации
мендации по
при
что коэффициент
условии,
что
изотопный
ными соединениями изотопных
гий связи (см. также [13]).
314
[41]
|
работе [414], которые
(11,6) (С’— энергия
молекул, С” — комплексное свойство), авторы дали рекоподбору пар веществ при изотопном обмене. В частности,
они установили,
ным
изотопов
разделения изотопов
обмен
элементов
будет
будет максималь-
происходить
с наибольшим
между
двой-
различием энер-
Примером применения (Х,3) для случая фазовых превращений в однокомпонентных системах может служить взаимосвязь между температурами плавления
н-силанов и н-пердейтеросиланов, представленных на
рис. 243. Этот пример представляет и тот интерес, что величина В в (Х,2)
оказывается в данном случае не только непостоянной, но и меняющей
знак: если Взин, = 1,73°, то Взин, = — 2.0° (см. рис. 243).
№076 - 4, 0'8
2,0}-18
1 6b
ak
260
|
]
280
|
J
600
L
1
E20
]
]
E40
|
|
660
|
|
680
-
{_
700
“uo
2
Рис. 241. Взаимосвязь между частотами колебаний % (см') ионов галогенов,
щелочных металлов и молекул воды и разностью частот колебаний молекул
воды и тяжелокислородной воды [10]
t
(Toy.
бана
|
nf
“10;
Но +ТХ
|
71
6
,
5b
DT,
3
—_
-150-
CL
Г
-170--
2 |
tL
0
30
г
Вг
ЦН
Q
-]
г
a
Г
2.
en 9 ИВ
H,O+DX
oy
.
Рис. 242. Взаимосвязь меж-
Наконец,
1
|
-170
1
-1
|
_t
-]
90
LL
4
и
НИ
Рис.
243. Взаимосвязь
ления 11 1(°С)
[11]
укажем
]
_
ду коэффициентами распределения изотопов а для DX
u TX
“199
на линейные
между
-71
|
1
0
Ни п, 2
температурами
н-силанов 51Н.и 49 H
силанов $: ПО
J
- 90
плав-
н-пердейтеро-
пота
зависимости
при
обработке
данных
по
характеристикам химических процессов — скорости реакций [12] и по
термодинамике изотопного обмена [13, 14]. А. П. Пурмаль применил первый метод сравнительного расчета для сопоставления значений энергии
активации Н-и ПО-атомов в реакциях с различными молекулами
[15].
В этой же работе были вычислены с помощью уравнения (Х,3) приближенные значения Ё некоторых реакций с участием дейтерия (табл. 48).
315
Таблица
48
Результаты вычисления значений энергии активации Е (ккал) некоторых радикальных
реакций с участием атомов дейтерия [15]
Реакция
Е
Реакция
Е
О + СН = DCl + CeHs
D + C;HsBr= DBr + CeHs
9,2
7,0
D + СС = РЕ -- ССВ
D + CHCls = DCI -+ CHCl.
2,6
3,5
D + CH;COH = DH + CH3CO
5,0
D + CHsCl = DCl + CHs
6,9
D + C(CHs)4 = HD + CH2C(CHs)3 | 8,0
р + СН.СЬ = РЕ + CHCl
5,0
Таблица
49
Результаты вычисления по уравнению (Х,3) значений некоторых свойств
веществ, отличающихся по изотопному составу [2]
ИсточСвойство
Группы
веществ
ник
*
оПЫТ-
ных
Аср
А,
B,
абс
%
|0,4
[0,9
данных
Адиабатная
сжимае- | Спирты-дейтероспирты** |
мость при t=20°C (cu/
/Oux
- 1012)
[16]
11,03
—1,2
[16]
10,952
38
3
0,2
[17]
}1,027 |
-—4,4
| 0,2
[0,2
[4]
|0,834 |
—0,14 | 0,7
1,8
Электропроводность при | ХСКНз0) — ХС1 (00), | [20,
бесконечном
разбав-|
где Х= Ш, Ма, К!
21]
|0,8694
—6,5
00,03
Критическая
|0,9864
Скорость
ультразвука
при. 30°С (м/сек)
Энергии связей (ккал)
Подвижность
ионов
Спирты-дейтероспирты *
X-H — X-D,
Х = 0, 5,
Х(Н20) — Х(О:0),
где|
Х = JO,,
CHsCOO-, |
BrO,,
СГ.
лении (ом- 1/см?)
тура
темпера-
(°С)
Температура
из
mepexoga|
упорядоченного |
состояния
в неупоря-
доченное
при
Энергия
ской
Nat, ClO,,
Kt,
|НХ — ОХ, где Х = С1,|
[19]
XHeAsOs — XDe2AsOaz,
[22] | 1,066
Br,
J
Tae
X=
K,
Rb,
Cs
|0,0
i
4,4 | 0,07 | —
60,1
10,4 | —
—0,0245|
0,027| 0,6
(°К)
Растворимость
при 25° С
Теплота
где
Se, Te.
№.10*|
Н(Х) — 0.5(Х) (восемь |
неполярных — раство-
|4,0297|
рителей)
растворения | Нь(Х)`— О.(Х)***
30°С
[23]
(кал/моль)
— кристалличе- | Мен — Мер
решетки
Na,
(ккал /моль)
[24—| 4,00
(Ме =
Li)
К,|
—26]
[27]
50
7
0,2
|1,045 | —2,23 | 0,04
10,02
|
* Везде величины х приводятся в порядке возрастания значения данного свойства (исключение составляют скорости ультразвука, для которых указанный порядок отвечает обратной последовательности).
** CH,OHCHOHCH,OH,
(CH;),CHOH,
eee
316
CH;0H.
Х=из0-СьНаа,
СНв,
CH,(CH,),0H,
С,Нв,
(Ев,
CH,(CH.),0H,
C,H;CHs,
C.He.
(CH;),CHCH.OH,
C.H;OH
3
Некоторые примеры применения
(X,3) для вычисления различных
свойств приведены также в табл. 49.
|
Из рассмотренных примеров видно, что уравнение
(Х,3) позволяет
учитывать изотопный эффект с точностью в пределах погрешности измерений. В этих примерах исключение составляет расчет подвижности ионов,
что, возможно, обусловлено существенным различием в характере самих
ионов.
В
большинстве
рассмотренных
случаев
коэффициенты
реко-
мендуемых уравнений заметно отличаются соответственно от единицы
нуля. Исключением служат теплоты растворения, что, по-видимому,
"ро
и
в
,
1,938
YUOYUTA
|
-
4358
1934
1330--
1326
1330
1
|
i
|
1,335
|
1
[
1
|
1340
1
{
n
{et
н.о
|
1,345
Рис. 244. Взаимосвязь между показателями [преломления п
воды и тяжелой воды при различных длинах волн [30—34]
значительной
степени
связано с невысокой их
точностью
[24—26].
Одна-
ко из этого вовсе не следует общность заключения о близости А/ к единице и В, к нулю. Так, из зависимости между частотами валентных колебаний связей Се — Н и Че — О и индуктивными константами заместителей, связанных с атомом германия [28], следует возможность применения
уравнения (Х,3), в котором В, = 0. Из этих примеров видно также, что
ошибка вычисления не зависит от того, насколько велико различие в
свойствах веществ, отличающихся по изотопному составу. Так, расхождение в температурах перехода из упорядоченного состояния в неупорядоченное для трех пар солей колеблется от 66,4 до 69,1° [25], т. е. равна
—67°,
в то время
как средняя
ошибка
расчета по (Х,3) меньше
0,4°.
Таким образом, есть все основания рекомендовать уравнение
(Х,3)
для приближенной оценки различных свойств веществ, отличающихся
по изотопному составу. Так, применив это уравнение для расчета энергии
связи в ряду халькогенидов водорода и дейтерия [47, 18], можно вычислить экспериментально не определявшуюся величину
р _т. = 57,8 ккал.
Этот пример в то же время свидетельствует о возможности повышения
точности при переходе от уравнения вида (1,3) к сравнительному расчету:
отклонения от прямых ¢,x = Кг") М7] игн_х = Г") при сопоставлении значений #._х Изц_х компенсируют друг друга.
При сопоставлении свойств кристаллических веществ
необходимо
учитывать характер сил связи. Так, для кристаллов с аналогичным типом связи (Н», НО, О., Т,, Нез, Не“, №, Ме?) относительное изменение
объема элементарных ячеек двух изотопов увеличивается по линейному
закону
с ростом
относительного
различия в массах изотопов. Точки
317
LL‘O—
8770 'T
L90‘T
[os]
[7$]
Э 08—05
9 .00Z—0Z
О ‹087—0
ОЕ — 7H
o?d — 07H
‘с0$‘0
70‘0
0190'0
[06'77—6$]
еняе@
ОА — ОН
чнапэто
иинэпия
+
хх
ин
qLo0owudoaLoe
-неочэлокчи|
винезобиЧэтиэи
(уж/г)
“100%
оиненоиеИ
(yw/2)
WLOOHLOIM
вин
eLoruey,
(499 /w)
випязафэа
azoodoxy
(v/2)
члоочевЯ
чтоонтоги
(g10} 220/22)
(«0Т-2и)
илоочпиж
eudgevdiarAé
(сиэ)
(ачутож/тья)
—пиж иэшвпим чтоонтои]
— (ОНО
08‘0
100°0
т6СТ ‘т
(ОО
60°0
050‘0—
У 8579—1707
-eaoeedgooden
[78—08]
Э ‹04— 07
ОА — ОЗН
1E26 ‘0
[68]
d0°H*D — HO*H*D
do(H))*HD —
Э 05—07
2S ‘0
$066 `0
[77—65]
[67—67‘6]
00‘0
0‘ 7—
GEO‘ T
Э 08—07
81195) — „= НЗ)
ZLO‘T
00°0
7‘0
0610‘0—
5) «09—05
CL¥—
70°0
9700‘0
[8$]
65
10‘0
Z00‘O
€890‘T
оп виногоиьчя
1челчиАео
чтооиэвиижо кентедвипу
минэнае4А
оялонояо
хч4олонон
ечтоэшэя
ялоиозо
yuaottos
readaLHy
‘ялоошюя
хчнней
SHHROLOTT
(У°Х)
— НО“ НОНО
<0‘0
€700‘0—
‘
« 9990
—° HD
У
О ‹09—67
,
[18]
Я
кохишогевикхо
ииновене
1766 ‘0
29ъ
оп
96 ‘ ‘Z
‘
cy'0.
%
Аионнотови
e‘0
67'0
<00‘0
У
05‘0
5
[<] Ачехоо»
09 впиковт,
318
для № и №: лежат вне этой прямой [28а]. Однако атомные кристаллы
(Не, №) несколько отклоняются от прямой, что можно отнести к мень-
шим
силам
связи по сравнению
с молекулярными
кристаллами [29].
Теперь обратимся к примерам сопоставления свойств двух веществ,
т. е. к уравнению
(Х,4). Разница в показателях преломления п для
Н.О
лется
и О.О
0,00090;
при
в интервале
20°С
в
вероятная
длин
волн
пределах
от 4047
от 0,00543
погрешность
до
6438
А
до 0,00453,
измерений
[30—34]
т. е.
оценивается
колеб-
меняется
в 0,0001,
на
т.
е.
примерно на порядок меньше,
Средняя ошибка расчета по уравнению вида (Х,4)
пр,о = 0,919075пн,о - 0,10319
(X,8)
составляет всего 0,00003, т. е. 0,002% (рис. 244).
Разница в скоростях ультразвука и для СН ОН и СН.ОР [35] уменьшается от 30 (10°) до 24 м/сек (60°), а их отношение возрастает с 0,9740 до
0,9788. Таким образом, при измерении и даже в сравнительно узком интервале температур ход этой величины превы|
шает точность измерения (1 м/сек). ПримеCH4 |OD
нение же уравнения (Х ,4) позволяет умень-
1190
19°C
шить
погрешность
сопоставления
до
1 м/сек (см. рис. 245).
1100При исследовании влияния замещения
на вязкость глицерина было найдено, что
при
20° вязкость
СН.ОН — СНОБ — 1050
СН.ОО больше вязкости СН.ОН—СНОН—
СН.ОН на 16,5%, а при 90°
— на 9%.
+000
20
т
30
Таким образом, величина А —~P(x ‚1) имеет
значительный
можно
температурный
сказать ио величине
Ян
B=
ход. То же
yn, — Ny
(Х,2),
которая
уменьшается
от
(20°) до 2,2 спз (90°). Переход жеот
и (Х,2)
к уравнению
ь
(Х,4)
1,167: —
=
233,0
(Х,1)
(Х,9)
2,6
40
50
50
950
|
1050
1000
1100
|
1150
СНЗОНи
5
Рис. 245. Взаимосвязь между ско-
ростью ультразвука и (м/сек) в
метаноле и дейтерометаноле при
различных температурах
[35]
позволяет описать взаимосвязь между р ин со средней погрешностью
в 14,6 сиз (1,38%).
Обработка данных, полученных при изучении диффузии молекул
воды в присутствии гидратированных ионов [36] с помощью уравнения
(Х,4), также приводит к удовлетворительным результатам.
Если разность в значениях рАн,о и рА ,о для растворения Са(ТО .),. Н.О
и соответственно
Сл(10.),-2.,О
не
зависит от температуры
[36а],
то для растворимости АсВтгО+, [366] в тех же растворителях и в том же ин-
тервале температур эта разность имеет температурный ход; однако он хорошо описывается уравнением (Х,4).
Некоторые примеры применения
(Х,4) для вычисления различных
свойств приведены также в табл. 50.
Здесь, так же как и в случае предыдущего соотношения, возможны
случаи, когда А. 1 и Б.-0. Так, зависимость температуры плавле-
ния водорода
и
дейтерия
от
давления
такова
[52],
что
для
нее
мож-
но воспользоваться уравнением
(Х,4), приняв в нем А. < 1. Действительно, в интервале температур 25,05
— 56,98° К разность Рн, — Pp, =
== 170-26 кг/см?, в то время как предельная неточность эксперимента составляет -- 7 кг/см?.
Если температурный
интервал,
в котором изучались
свойства веществ,
отличающихся по изотопному составу, велик, то соотношение
(Х,4) приводит к не очень точным результатам. В таких случаях для повышения
319
точности
применить
расчета
следует воспользоваться
логарифмической
(Х,4) в виде соотношения
Ig
Покажем
Gp
=
это на примере.
A,
Ig
Gy
шкалой,
+ By.
т. е.
(Х,10)
Как видно из рис. 246, уравнение
1р,о
=
АаИн,о
+
|
Ва
(Х,11)
позволяет удовлетворительно описать температурную зависимость вязкости тяжелой воды (в пределах от 5° до 250° С средняя погрешность вычисления составляет 2,5%, что примерно на порядок меньше разности значений пр,о И \н,о). Если бы к точкам, нанесенным на рис. 246, добавить
результаты исследований, полученные другими авторами, то оказалось
бы, что в первом приближении такие отклонения от линейной зависимости находятся в пределах ошибок опыта и расхождений результатов,
полученных
кую
в различных
точность
тить
некоторую
позволяет
кривизну
Вместе
т вблизи
© этим, даже
критической
линии тр
=
учитывая
точки,
} (Ян). Применение
Ig np,o
= 1,0617 Ig уно + 0,09624
уменьшить
Высокую
работах.
измерений
точность
проиллюстрировать
и
погрешность
вычисления
логарифмического
и на примере
до 0,76%
варианта
уравнений
следует
же
=
невысо-
отме-
уравнения
(Х,42)
[53].
сопоставления
можно
lg To, = 0,9929882 lg T'p-17, + 0,0127267
(X,13)
10 Тр»о = 0,9858796 1е Тньо - 0,0381572,
(X,14)
в которых при одинаковом давлении пара сопоставляются температуры
кипения соответствующих веществ [54]. Первое уравнение в интервале
давлений
от 92 до 1312 мм
дает среднее
отклонение
в То.н, меньше
и поэтому может быть рекомендовано для расчета
давлениях, значительно превышающих изученные.
интервале
нию
давлений
вычисленных
от 0,015 до 222
значений
В соответствии с данными,
Ть,о
кг/см? приводит
от опытных
найденными
к среднему
отклоне-
в 0,24°.
в статье
0,04°
То-н, (по Тр-н,) при
Второе уравнение в
[55], с помощью
соот-
ношения (Х, 10) можно описать взаимосвязь между диэлектрической проницаемостью Н.О и О.О. Этим же соотношением можно воспользоваться
для расчета констант кислотной диссоциации различных веществ в Н.О
и О.О [56]. Хотя в последнем случае точки ложатся несколько разбросанно, однако следует учитывать различие в природе растворенных веществ. В то же время возможность рекомендовать расчетное уравнение
означает шаг вперед, так как в работе [56] лишь констатируется факт
подтверждения правила: разность рАь — рн растет с рн.
3
Сравнительный
метод расчета можно
использовать и для
приближенного вычисления значений свойств веществ с различным содержанием
изотопа, например
с различной
степенью дейтерирования. Для
этого (см. главу ГУ) следует установить закономерность изменения коэффициентов А. и В.в уравнении (Х,4) в зависимости от степени дейтерирования 5. Так, для вязкости дейтеробензолов [53] в первом приближении
можно принять,
что
А. = 14 0,0735
т. е. считать,
.
—_
что
c,D,.(x)
=
(1 +
0,073
x)Nc,H, —
Средняя ошибка вычисления по уравнению
рис. 247). Расчет же по уравнению
(Х,16)
(X,47)
0,0060 z.
(Х,47)
меньше
le Nopexy) = [1 + 0,01204 x + 0,0110 2? (14 —2)] lg no, + 0,029522
320
(Х,45)
Ва = — 0,060 х,
И
0,5%
(см.
(X,18)
120
|
#00
1
80
60
40
20
1
0
[
J
20
i
j
40
60
|
[
80
1
_]
100
__ ft
120
7450
76
Рис. 246. Взаимосвязь между вязкостью 1" (ке-сек/м) воды и тяжелой
воды при различных температурах # (°С) [5]
710° 1060
г
t
50
10
30
20 |
«
4
HX
4000+
HY
9
TOF
3500
3000
во
2500
50
40
2000
1500
)
1000
30
i
__t
40
|
|
50
!
]
60
7
i
«10° 79
CgHe
Рис. 247.
Взаимосвязь
между
вязкостью
1(кг- сек/м?) бензола и дейтеробензолов с различной степенью дейтерирования х при различных
температурах
# (°С)
900
_t
1000
4
7500
}
2000
|
2500
Рис. 248. Взаимосвязь между частотами колебаний *\ (см!) дейтеридов
и гидридов
|
3000
Урх
некоторых элементов
точприводит к ошибке всего в 0,06%. Дополнительным подтверждением
полна
оляции
экстрап
его
аты
результ
я
ности уравнения (Х,18) являютс
HOCTHIO дейтерированный бензол: для х=1 получаем уравнение
(X,19)
lg nop, = 1,04204 1g no, + 0,02952,
которое дает значения 1, совпадающие с опытными [38]. По уравнениям
вычислить температурную зависимость вязкости
можно
(Х 17) и (Х,18)
бензола с заданной степенью дейтерирования, не располагая какими-либо опытными данными. Кстати говоря, надежность результатов, получен(Х,17) и
ных по уравнениям
4
ует
о том,что
(Х 18), свидетельств
(K-10 д 0
о пропорциопредположение
нальности изотопного эффекта
Г“
содержанию
вязкости
дейте-
рия — лишь первое приближение.
Примером
практического
слияния
линий
для
несколь-
ких рядов в одну прямую, когда
величины
А,
и
ВБ,
можно
считать независящими от природы ряда, может служить взаимосвязь
между
значениями
|
0
2
|
‚ |
|
|
6
(к- 10°)
4
*°
0
основных частот % для дейтеридов и гидридов. Она предетав-
8
Рис. 249. Взаимосвязь между константами
скорости сольволиза К различных соединений
в воде и тяжелой
воде
`
[58]
лена на рис. 248. Учитывая невысокую
точность некоторых
Из значений
VHx
Если
бы
значения
у были
достоверны
(например
у
для
бора), в первом приближении
можно считать, что
для
всех
=
1,34
Vox
веществ,
+
59.
(Х,20)
представленных
на рис. 248, то имело бы смысл одну прямую заменить несколькими, приписав каждой группе родственных соединений свое уравнение. Однако
это
целесообразно
Х =Е,
сделать,
вероятно,
С, Вт, Т (см. пунктирную
Другой пример
совпадения
пока
лишь
для
прямую на рис. 248).
линий
для
различных
групп
ОХ
и
веществ
НХ
с
пред-
ставлен на рис. 249, где сравниваются константы скорости сольволиза различных соединений. Некоторый разброс точек, вероятно, обусловлен
неодинаковым значением температур.
КОМПЛЕКСНЫЕ
СОЕДИНЕНИЯ
В настоящем разделе продуктивность применения методов
сравнительного расчета для вычисления физико-химических констант
комплексных соединений будет показана на примере первого метода сравнительного расчета. При этом ограничимся лишь одним свойством —
константой нестойкости рК 159, 60]. Для этого свойства соотношение
(Х,3) принимает вид
Ап
—
A, pky --
B,.
Это уравнение можно рассматривать также, как
реакциям комплексообразования ранее описанной
322
(X,21)
пример применения
зависимости
к
в которой сопоставляются изобарные потенциалы в однотипных реакциях
[64].
Выберем
M;A.,
М;А.,
в качестве
объектов
..., т. е. будем
ряды
рассматривать
комплексных
соединений
М;Ау,
ступенчатые константы нестой-
кости, не ограничиваясь при этом только двумя рядами [62], а распространяя (Х,21) на большее число рядов. Для достижения наиболее точных результатов в соответствии с идеей первого метода сравнительного
расчега все
сопоставления будем осуществлять в одинаковых условиях, тем более, что, согласно опытным данным, изменение концентрации электролита
может
вызвать
изменение константы
равновесия
(в растворе электролитов) даже на несколько порядков. Поэтому литературные
значения
pK, найденные при различных значениях ионной
силы раствора п, следует пересчитать на одинаковое значение ц. Оптимальной будет экстраполяция рк на нулевую ионную силу. Для этого воспользуемся уравнением Дэвиса
[63]. Хотя
оно было рекомендовано
автором для
p< 0,1,
однако К. Б. Яцимирский
показал,
применимо до и = 0,7—0,8 [64], а
в ряде последующих
что оно
работ им
пользовались для пересчета значений рК на нулевую ионную силу даже
си =3 [65, 66]. Так как в рассматриваемых случаях в большинстве
своем и < 1, то экстраполяция по уравнению Дэвиса ки = 0, вероятно,
не приведет к большой погрешности.
Таким образом, в дальнейшем будем иметь в виду уравнение (Х,24)
в виде соотношения
(Х,23)
pKi = AypKi+ By
в котором & =
П,
ТЩ,
... и в котором
в отличие
от (Х,24)
константы
не-
стойкости сравниваются при значении и = 0. Для единообразия экспериментальный материал заимствован из сводок [67] и [68].
Продуктивность
перехода
от
(Х,24) к (Х,23)
иллюстрируется
рис. 250 на примере комплексов
с органическими аддендами и на
рис. 251 — на примере комплексов с неорганическими аддендами.
Практическое пересечение рК1з — рК1-прямых в одной точке наблюдалось во всех случаях, независимо от природы аддендов и комплексообразователя, причем точка пересечения прямых не совпадает с началом
координат. В связи с этим отметим следующее. Если принять, что энергия
связи в комплексе описывается уравнением Матнуса [69], и рассматривать соединения вида МА», то можно вывести уравнение для оценки изменения констант равновесия в ряду MA,, МА....., [70, 74]. После его
преобразования легко получить уравнение, тождественное
(X,23), B
котором В, = 0. Так как в основе этого вывода лежит уравнение Магнуса, то полученный результат означает следующее: если бы энергетика
комплексных соединений определялась только электростатикой, то прямые пересекались бы в начале координат. Но накладывается поляризационный
эффект.
Можно
предположить,
что он вызывает
смещение
точки
пересечения, при этом тем больше, чем значительнее поляризация. Справедливость данного предположения подтверждается следующими результатами: точка пересечения прямых на графике, аналогичном рис. 251,
имеет
координаты:
Установление
лексов
ного
с данным
метода
для
хода
хлоридов
0,5, бромидов
коэффициентов
аддендом
(см., например,
с приближенными
являющимися
чета
частными
примерами
(а — электроотрицательность,
воляют оценить
значения
рис.
зависимостями
рК? = А.С рК° многих
1,3,
уравнения
252)
иодидов
(Х,23)
вида
2.0
в ряду
и сочетание
описан-
В.,
второго
[60].
комп-
(X,24)
метода
потенциал
сравнительного
ионизации
неизученных
и
т.
соединений.
21*
д.),
pac-
поз-
323
Na
Cu
SS
ND
TTS
Co
=}
Yt
19|
uv
16—
far
fZr
/
/
i)
`и
af
17
1!
4
ji
/!
ple
/
)
$
Y
и’
4
Un
7
/
/
f
я
4
.
7
3
.
|
|
e
1,’
j
|
44
у
,
Y
7
re
7
Vv
\7
7
/
и
/
и
.
4
7
у
a
/ /,/
вп
0
о
6
pK,
1
>
8.
pK
10
Рис. 250. Взаимосвязь между константами нестойкости рК (а)
и рК° (6) М-этилендиаминов кобальта, никеля и меди [67]
20
ни
pk,
18
Ga
Al
=2--я-------
In
т
207
ри’
In
i
Ga
|
Al
|
f
|
1
18
}
a
6
16
=
|
{
Е
|
|
1
Г
2k
0-е
f
-
{
10+
;
|.
/
о
1
i
8
Г
{
|.
6
Zn
/
р,
17
и
}
|
/ ,
и
f
4г
й iy , ¢
|.
ab
Wee
i
у”
|.
и
Е
0
2.
\
Ww
1
4
6
l
.8
a
j
Рис. 251. Взаимосвязь между константами нестойкости рК(а)и
‚РК° (6) фторидных
комплексов
таллия
алюминия,
[67, 68]
галлия,
индия
и
1
Рис. 252. Зависимость коэффициента накях рА РК мена! — 7
°
лона А: прямых
MeHal,
Рис. 253. Зависимость между константами
нестойкости рК, комплексных соединений
и электроотрицательностью Х в ряду метилэтилендиаминов меди,
никеля, кобальта,
железа и марганца
wv
ОТ Координационного числа п для фторидных, хлоридных и бромидных комплексов
[60
о
wv
pr
Yur
Cu
3}
Co
or
mnt
м
„>
o——
TF
J}
i
500
4
p)
1
|
550
yyy
ри!
600
Г
650
we
о
Рис. 254. Зависимость между константами нестойкости рК, и потенциалом ионизации Г (ккал/моль) в ряду пиридинов меди, никеля,
кобальта, железа и марганца
р"
181
6
0
08
У
Lu у
Er Dy
ть
om Nd
Gd EusPmPr
Cece
Г NO
L
09
1
1
‚ Рис. 255. Зависимость
ионов
10
l
1
между
г (А) в ряду
iS
константами нестойкости рК° и
ацетатов
A—i=1;
ifr
I
редкоземельных
B—i=2;
B—i= 3
радиусами
элементов
(X,24) показано на рис.
На нескольких примерах уравнение вида
253—255.
Опытный материал по константам нестойкости галогенидных комплек(11 фторидов, 8 хлоридов,
сов А1, Са, № и Т! ограничен 29 соединениями
<
о
pr,
654
п
3
2
которых
(для
рКт1е
оценки
приближенной
Для
и 1 иодид).
9 бромидов
3
[
Zor
|
о
г
в
\
РИ
2
ох,
"rh 6543
|
Jar
Mar
2
|
|
6b
|
Г
ко
;
a
|
~8F
|
“6h
|
|
к
-}2
“6
-4
|
;
1
L
J
2.
0
PM ner,
„и“
> 4
-10
\
Br
\
^
\
АТ
в
\
„7
У
|
-е
1
<
[п
1
0
"авг,
n
|.
q
|
б
!/
п
к
Г
у<
4
Tl
2
PR паг,
Key
4
/
20r
+
5
/|
Wg
i
0
7
„Г
|
on
l
1
10
|
y
лы
“к
и,’
7
+
1
A
A
>
WW
FEF
|
1
a
К.
]
I“
|
ОЕ
‹
2
т
|=
Lr
1
/
4b
1
2-6
|
TUX,
59
ЧЕ
й
i
и
10k
{Ga
к
-
-2P
/
p
|
“Hr
e
1 2 3456
\
ми
|.
n
lak
1
lob
4|
or
РК,
\
|
-
|
Bk
Я
3
YY
Е
ee
L
1
20.
30
ту ве,
Рис. 256. Взаимосвязь между константами нестойкости рК° бромидных и других
галогенидных комплексов алюминия, галлия, индия и таллия [67, 68]
экспериментальные
Данные
отсутствуют)
путем
экстраполяции
по
пря-
мой зависимости 1 рК” от Te TTA
Oba Halifena BenuaquHa pK,.,.,. Ho
ней (она оказалась равной— 2,9) были определены графическим путем
остальные ступенчатые константы фторидных комплексов Т]1 (см. рис.
251,6).
|
»
о
Можно
o
предположить,
что
рк,
о
и рК;
о
о
существуют
не
только для
А, но и для элементов подгруппы галлия. Это предположение можно
подтвердить из пространственного анализа — по соотношению объемов
центральных атомов и аддендов (см. [72]. В связи с этим была произве>
о
о
дена оценка значений рА, и рК. и для Са3*, [03' и TI.
Значение рАтис, определено экстраполяцией опытных
о
ординатах
о
PAinsr, —
O°
рАшс:, —
v
РК ше, (П =
о
PKinci, (п =
18 рКмесь+=
о
(—)
1,2, 3, 4),
1, 2, 3, 4);
(Me = Al,
значение
Ga,
In,
о
a
pKinpr,—B
о
рКдисг+
Tl).
Bce
эти
в ко-
координатах
ей
найдено
практически были прямолинейными.
Методы сравнительного расчета позволили произвести
ную оценку значений ступенчатых констант нестойкости
326
данных
из графика
зависимости
и
приближениодидных
a
комплексов, хотя для них известна лишь одна величина (рЁАтол-+ = 1, 2)
из 24 возможных. Значения pK ins, yma n= 1 были определены из
графика pK tata, = t (pKinsr,) (рис. 256), исходя из предположения, что
прямые для хлоридов, бромидов и иодидов практически пересекутся
в одной
точке.
оценены
с
личина
ПОМ
b
ОМОЩЬЮ
pK wey
способа
Значения
привели
pK Mes*+ для
Г рафика
была
остальных
К°
P4S
MeHal?+
оценена
из
к совпадающим
=
7
РК
графика
результатам.
РКмез-+
были
определены
остальные
нестойкости иодидных комплексов А|,
металлов
4
+
).
ГА
Кроме
рКтинав+ —
На
приближенно
того,
РКтлнав+.
основании
веОба
значений
значения ступенчатых констант
Са, Т1. Здесь, как и в расемот-
ренных ранее примерах (см. главу Г), линии для фторидов располагаются несколько в стороне от остальных.
Результаты расчета значений констант нестойкости приведены
в
табл.
51. К ним можно
Результаты
вычисления
было
бы добавить
значений констант
соединений вида
и
некоторые
другие
величины,
Таблица 51
нестойкости рК° некоторых комплекеных
МеА,„ [59, 60]
*
Ме?+
А
n
o- AMHHOU ponHoновая кислота
1
5
|
a
Mn
Fe
Co
Ni
—
__
4,3
7,7
—
__
—
__
|
.
Cu
|
Mg
—
—_
2,4
4,3
3
7,2
9,1
—
12,6
17,8
Метилэтилендиамин
1
2
3
2,4
2,9
3,1
6,1
—
—
_
10,0
11,6
—
—
—
—
—
23,0
—3,6
—4,7
Гистамин
1
2
3
1,4
2,1
2,5
5,2
8,4
10,9
—
—
—
—
—
—
—
—
20,9
—2,2
—3,7
—4,7
4
2,7
6,2
—
—
М№-Этилэтилендиа-
мин
2
—
—2,5
—
—
—
—
22,6
—2,8
—3,5
—
—
—
—
—
14,8
—
—
20,0
3,5
6,1
7,9
—
1,3
1,35
1,4
—
—
2,6
2,8
—
—
4,1
4,5
—
—
—
—
0,8
0,2
0,2
0,4
3,4
10,4
3
3,8
11,8
Глицин
1
2
3
—
—
8,6
—
—
10,2
Пиридин
1
2
3
4
1,0
0,7
0,5
0,4
Пропилендиамин
Ацетилацетон
Ацетилацетон -{
—
диоксан
* Для
(1:1)
—
4
3,0
6,5
—
—
—
О .
2
3
3,6
4,0
10,8
14,0
—
—
—
—
—
27,6
2,7
4,7
4
—
4,8
—
—
—
3,9
2
3
—
8,5
10,2
—
‚ 41,5
—
—
—
18,3
6,7
8,0
1
4,2
° 5,2
—
3,8
2
а-аминопропионовой
6,4
кислоты
_
5,1
—4
8,5
и ацетилацетона
—
__
—
__
__
5,4
[Me?+A—]2-”,
327
Таблица
Мез+
А-
n
F-
1
—
2
—
—
3
4
—
5
— |
6 | 24,6 |
СГ
— |
0,91
1,11
1,2 |
1,3 |
1,3;
1,2;
14|
1,6 |
1,71
1,8]
— |
Мез+
AW
n
2,9
3,9
4,6
5,0
5,3
5,5
Вг-
1
2
3
4
5
6
|—0,6 |—0,2|
|—2,1 |—1,4]
1-—3,31—2,3|
|—4,1 | —2,9|
|—4,6 | —3,3]
|—5
|-—3,6|
Ш
J-
4
|—2,3/—1,6|
|
Tl
In
—
—
|10,4/
—
|133 1 —
114531
—
16,8 | 14,9 |
17,8 | 12,5 |]
11081
2
3
4
5
6
(окончание)
|
Ga
Al
51
—
—
—
—
4,5
5,0 | 24;3
5,4] 22,6
2
3
4
5
6
In
Tl
—
—
—
3,1
4,2
4,4
—
—
—
—
—
—
Ga
Al
— | 12,1
|—5,6 |—4,4}
|—8,1 |—6,3/
|-—10
|-7,81
|—11,2})—8,9]
|—12
|—9,6]
0,9
0,6
0,5
0,4
0,3
|
|
|
|
24,
29,1
34,5
38,3
; 41,9
|
Eu
Мез+
А
п
Га
Этилендиамин тетраук-
1
—
Оксалоуксусная кислота
|
1
2
—
9,57
1
—
сусная
кислота
Ацетилацетон
2
3
Се
15,47|
5,30 |
9,65 |
Nd
Pm
—
—
16,25
5,37 |
`9,76 |
—
—
—
Рг
5,40
9,81
—
—
—
Sm
—
—
5,43 | 5,46
9,86 | 9,90
—
—
—
|
—
—
—
5,49
9,95
—
—
—
—
—
—
—
—
Met
A
n
Этилендиаминтетраук-
1
сусная кислота
Оксалоуксусная кислота
1
17,3
a
Er
—
—
—
1 | 6,25]
2 |} 10,95}
|
в частности
Tb | Dy | Ho
—
2
Ацетилацетон
Gd
значения
23,4),
3
| 14,55
рК° для
In(Acac)°;
5,611
| 10,144
—
—
—
5,77
5,74
— | 10,40} 10,30)
6,48) 6,60/
19,10
15,38
ацетилацетонов
(21,1),
7,05] 6,80]
— |
Yb | Lu
18,96]
5,80]
—
10,444
—
7,45]
—
_
—
7,25]
7,40
17,00}
17,25
141,35) 14,55} 12,35) 11,95) 12,55} 12,75} 13,00
и
18,45)
исправить
с 12,6 на 12,3. Данные
для соединений
ет признать ориентировочными.
328
—
|} Tu
15,90)
16,75}
таллия (соответственно 91;
магния
значение
и
для
рК°
Се(Асас)°,
иодидов
следу-
СВОЙСТВА ВЕЩЕСТВ,
СОСТОЯНИЯХ
НАХОДЯЩИХСЯ
В СООТВЕТСТВЕННЫХ
Как известно, принцип соответственных состояний и вытекающие.
из него многочисленные следствия (см., например, [73]) приводят лишьк
весьма приближенным результатам. Известно также, что в литературе:
описан
ряд
методов
расчета,
которые
являются
его
уточнением
[74,
75,,.
171—831. Для его уточнения можно воспользоваться и методами сравнительного расчета. Рассмотрим эту возможность на примере температурной.
зависимости давления насыщенного пара.
1
Из принципа соответственных состояний следует, что температурная зависимость давления
насыщенного пара для всех веществ.
должна выражаться общим уравнением
(м, т) = 0,
(Х,25),
т.
е.
данному
должно
значению
приведенной
соответствовать
приведенного
одинаковое
давления
.
температуры
кипения
различных
веществ
для
насыщенного
пара
Р
л = р
(см.,
Рк
т =
Т
F_
кр.
значение
например.
[84]). Однако совпадение зависимостей л = } (т) имеет место лить для
нескольких веществ (к числу немногих примеров относялся СО и М, [85]).
Поэтому
одной
ориентировочных
Тм
(общей)
л — т-кривой
расчетов
=
тм
можно
воспользоваться
[86] 1. Следовательно,
=Шш
=...
(Лим
=
лк
=
и уравнение
л=...),
в котором индексы отвечают различным веществам,
бым приближением. Поэтому и равенство
т
=
ти
«(Ny =
лишь
для
(Х,26)
является
лишь
ли,
гру-
(X,27)
являющееся распространением
(Х,26) с отдельных веществ на два ряда
сходных соединений, приводит лишь к ориентировочным результатам. Но
можно воспользоваться приближенным линейным соотношением
=
тт =
В
нем
сходных
сопоставлены
веществ
нение — пример
сматривать и как
(Х,26) является
Наконец (Х,28)
4:91 + В:
приведенные
при одинаковых
(п1= ли).
температуры
приведенных
|
кипения
давлениях
(X,28)
в двух
[87]. Это
рядах
урав-
первого метода сравнительного расчета. Его можно расуточнение принципа соответственных состояний, так как
предельным выражением (Х,, 28) при А, = 1 и
В, = 0.
можно толковать как распросгранение ранее описанного.
[88] приближенного
уравнения
Ги
=
А.Г, - В,
с абсолютных температур. кипения на приведенные.
Проверка (Х,28) была проведена на примере н-алканов
ряд) и 2-метилалканов. Наиболее надежные результаты
(Х,29)
(стандартный
получаются,
1 В литературе описан ряд уравнений, содержащих одну или несколько индивидуальных постоянных (или свойств жидкости), которые можно рассматривать, как.
уточнение уравнения (Х, 26) (см., например, [54]).
329:
если применять
(Х,28) в виде уравнения
V(CHs),CCHp_gHo(n—2)42
AjTH-C,Hengg
B,,
(Х,30)
т. е. при сопоставлении рядов со сдвигом на одно соединение (сплошные
прямые на рис. 257). Средняя ошибка расчета в интервале л = 0,05—
0,20 равна
пунктир,
приводит
уравнение
0,20°.
Это
означает,
проходящий
что
на рис. 257
к выигрышу
переход`от
через
git
угол,—к
отвечает
(Х,30)
в точности примернов 50 раз (как видно из рисунка,
(Х,30) дает удовлетворительные
Яссы
ae
(Х,27) — ему
координатный
результаты
и при п = 0,01).
бы Нл.
7
yw
)
MA ”
1
2
G60
1
.
1
O63
i
1
1
06
1
1
1
O69
L
‚
1
Die
1
А
1
-
075
1
д.
a
0718
O81
~
084
H-CyHenes
Рис. 257. Взаимосвязь между приведенными температурами кипения Т некоторых н-алканов и 2-метилалканов при различных
приведенных давлениях л [89]
O—n=3:;@—n=450—n=5,0—n=6,90-—n=
В первом приближении
(Х,30)
вид:
меняются
7
можно принять, что коэффициенты
с л линейно.
Это позволяет
придать
(Х,30)
уравнения
следующий
T(CH,),CHCygHoqn_ayag = (01872 — 0,28632) Ty.cyHaneg — 0,20606л — 0,1005.
(X ,34)
С помощью (Х,31) можно найти температуру кипения 2-метилалканов
по температуре кипения н-алканов при любом давлении в указанном
выше интервале значений л. Естественно, что переход от индивидуальных приведенных изобар (Х,30) к их системе (Х,31) приводит к снижению
точности:
средняя погрешность вычислений оказывается равной
пар
0,73°.
Если на
330
веществ
приведенных
изобарах
соединить
(на рис. 257 во избежание
точки
для
загромождения
одних
чертежа
и тех
же
это сде-
лано только для п = Зип = Т; штриховой пунктир), то также получится
система прямых. Следовательно, наряду с (Х,28)
можно рекомендовать
приближенное линейное уравнение
tN
=
Атм
+
Ба,
(Х,32)
в котором при одинаковых (но меняющихся от точки к точке) приведенных давлениях сравниваются приведенные температуры кипения двух
сходных веществ М и №. Это уравнение является примером четвертого
метода сравнительного расчета для частного случая фазового равновесия
в однокомпонентной двухфазной системе и в то же время распространением правила Дюринга (см. стр. 142) с Т на т. Средняя погрешность вычисления
по
(Х,32)
при
л = 0,01-: 0,20
равна
0,14°.
Таким
образом,
в
данном случае уравнение (Х,32) оказывается точнее (Х,28). Кроме того,
оно позволяет охватить более широкий интервал условий; это означает,
что штрих-пунктирные линии на рис. 257 являются прямыми до больптих значений л (практически вплоть до критической точки).
Закономерное изменение А, и В. в (Х,32)
позволяет рекомендовать
приближенное уравнение
Tus0-CyHonsg = (—0,005825 n + 1,0498) т, синь.» - 3,475 п — 33,4, (Х,33)
где п — число атомов углерода в молекуле соединения. Если при сопоставлении осуществить тот же сдвиг, что и при применении уравнения
(X,30),
т. е. сравнивать приведенные температуры кипения пропана
и изобутана, бутана и изопентана и т. д., то средняя погрешность вычисления окажется равной 0,08°. Тогда, с учетом изменения A, u В. сп получим
T(CH,)2CHCyn_ Hong) +9
{здесь
п — число
для п =
3—1
=
(0,00650
n—+t
0,972)
THt-CyHonse
|
атомов
углерода в молекуле
—
0,0024
н--алкана).
п -|-
0,0169
(Х,34)
Это уравнение
в интервале значений л = 0,01—0,9 приводит к Ар
= 0,2°
Найденными
результатами можно воспользоваться для вычисления
температур
кипения
высших
изо-алканов.
Результаты
расчета по
уравнению (Х,34) для 2-метилоктана и 2-метилнонана, для которых температуры
в табл. 52.
кипения
при
высоких
давлениях
неизвестны,
приведены
2
ственных
Аналогично
состояний
лм
или
его
=
изложенному
лх
=
распространение
Лль=...
с
Л
можно
уточнить
вытекающее
следствие
в виде
(тм
отдельных
=
Ли
=
тм
веществ
(тт
=
из
принципа
==...)
на
их
(Х,35)
ряды
т)
(X ,36)
соотношения
Myr = Ayn, + By
(ty = Tyr).
В нем сравниваются приведенные давления насыщенного
рядах сходных веществ в зависимости от их приведенной
кипения
соответ-
[90]. Это соотношение,
как
(X,37)
пара в двух
температуры
и (Х,28), представляет собой пример
первого метода сравнительного расчета в применении к одной из характеристик фазового превращения в однокомпонентных системах.
331
Таблица
Результаты
вычисления значений температур кипения
2-метилоктана и 2-метилнонана [87]*
2-метилоктан
Р, атм
|
0,228
1,14
2,28
3,42
11,40
264,4
9,12
В скобках
указаны
ниях, рекомендованные
чай
303,7
10,45
18,82
308
,4
как
118,99
170,60
199,92
233,77
12,54
300,0
20,52
кипения
наиболее
надежные
(199,04)
(170,23)
(200,23)
(233,40)
287,33
312,8
16,72
температуры
t
255,82
276,22
14,63
288,0
|
6,27
8,36
279,0
15,96
18,24
атм
0,209
1,045
2,09
4,18
251,45
13,68
*
Р,
100,06 (99,96)
150,83 (151 ,12)
179,37
197,17
212,86
242,65
& (°С}
2-метилнонан
:
4,56
6,84
52
325,5
332.7
при соответствующих
[89].
давле-
Уравнения (Х,35) и (Х,36) можно рассматривать как предельный
(Х,37) при А, =Т1и В. =0
Проверка (X,37) Ha примере уравнения
T-CrHon = AiMn-CyHonig + Br (T1-6,Hgn = Tr-CpHonsg)
для
п = 3—7
в интервале
т = 0,5—0,8 дала удовлетворительные
таты (см. рис. 258; пунктирная прямая
отвечает уравнению
Учет изменения А, и В, в (Х,38) ст привел к уравнению
Th CgHyn = (4,04 + 0,1881) песни — ^^ + 3,188.
Наряду
с (Х,37)
можно
рекомендовать
являющееся
Это уравнение
одним
можно
из
возможных
рассматривать
Ig Pyy
=
Ay
(X,38)
резуль-
(Х,36)).
(X,39)
и уравнение
12 ли = 4, lg my + By,
также
слу-
вариантов
и как обобщение
Ig Py --
_ (Х,40}
уточнения
уравнения
B,
(Х,36).
(X ,41)
с абсолютных давлений и температур на приведенные. Коэффициент Б,
в уравнении
(Х,37) отличается от нуля, и поэтому коэффициент А! в
уравнении (Х,40)— от единицы. Константы уравнения (Х, 41) также закономерно
изменяются
с т.
|
Нанеся на рис. 258 несколько приведенных изотерм и мысленно соединив точки для одних и тех же пар веществ, получим ряд линий, каждая
из которых будет отвечать приближенному уравнению
Ig
tn
=
A,
Ig
ty
-|--
Ва.
(Х,42)
Это уравнение совпадает с рекомендованным Гордоном и Отмером [57].
Оно является примером четвертого метода сравнительного расчета (см.
главу [У, стр. 144), а также уточнением (Х,35).
Можно было бы привести и другие примеры уточнения различных
следствий, вытекающих из принципа соответственных состояний. Необходимо подчеркнуть, что даже те из них, которые приводят лишь к самым
332
тн,
г
020.
Г
0.05
002.
001
80035;
0002-
0000
Т
0.001-
00005 000i 0002
109 2
002
1
_
ay
Wz
На
=
Рис. 258. Взаимосвязь между приведенными давлениями л сухого
насыщенного пара некоторых н-алканов и 1-алкенов при различных
приведенных температурах т [89]
Обозначения
те же,
что
т.
и на
рис.
257
Hs OmN2mes
0,70\-
0,68\-
0,66|-
064
052
У.
Рис.
А
259.
веденными
рами
1
166
]
}
i
}
0.70
]
1
po
(т.н)
Взаимосвязь
сн
п
между
O74
21-2
при-
‘нормальными температукипения Тн.т.к некоторых н-ал-
канов
и 2-метилалканов
® — по
(Х,
43)
[89]
бб
.- 066
Рис.
0668
260.
0,
Взаимосвязь
нормальными
|
nn
0
между
температурами
некоторых н-алканов
®
— по
и
(Тк)
приведенными
кипения
н-алкилбензолов
(Х,
43)
м-СьМзсь&
т H.T.K
[89]
4
ориентировочным
становятся более
га
91)
[97]
—T
fou
92
результатам, будучи уточнены
подобным
удовлетворительными. Так, если правило
[92]
Тн.т.к =
образомГульбер,
23
(Х,43)
приводит к грубо приближенным результатам (для примера укажем, что.
для Н-алканов отклонение от опытных данных,— кроме пентана и гексана,— превышает 10°), то приближенное линейное уравнение
(Тн.т.к) и
—
Ат(Тн.т.к)т
+
B,,
(Х,44)
рекомендованное в статье [93], приводит к выигрышу точности примерно
на один порядок. Это означает, что вместо одной точки, соответствующей
И
нтк.)
0,75
7
Io
8
0, 60
bop
a
Lt
р
0,65
070 (г)
H.M.K/ mp
875
Рис. 261. Взаимосвязь между приведенными нормальными температурами
кипения т.к углеводородов различных гомологических рядов с четным
т и
о — н-алканы;
(X,43),
нечетным
(т -|- 1) числом
атомов
углерода
@— 2-метилалканы; Ф — 2,2-диметилалканы;
-O — 1-алкены
получается
линия,
близкая
к прямой,
[89]
6— 2,3-диметилалканы;
т. е. отвечающая
(Х,44),
причем эта точка часто расположена далеко от линии. Так, если для некоторых гомологических рядов (например для 2-метилалканов, рис. 259)
точка и линия почти совпадают, то для н-алкилбензолов (рис. 260) и мно-
гих других рядов (их большинство)
и, как правило, над ней.
точка
расположена
далеко
от линии
В данном случае можно рекомендовать воспользоваться и попарным
сопоставлением значений свойств соседних членов ряда (см. главу Г,
стр. 56), т. е. приближенным уравнением
(Тн.т.к)ич
=
A,
(Тн.т.к)т
- By.
(Х,45)
Справедливость (Х,45) иллюстрируется рис. 261 (во избежание загромождения чертежа часть данных опущена). Из чертежа виден сходный характер изменения тнтк В гомологических рядах углеводородов, наиболь334
шая надежность данных для н-алканов, неточность значений Гкр
Для
других рядов (особенно для 1-алкенов). И в данном случае (см. также
стр. 221 сл.) коэффициенты А: и В, в первом приближении можно считать.
не зависящими от природы гомологических рядов углеводородов.
НЕКОТОРЫЕ
В
ные
ПРИБЛИЖЕННЫЕ
литературе
закономерности
описаны
и
ЗАКОНОМЕРНОСТИ
широко
используются
многочислен--
вида
/(G’,G’,...) = const = K,
(X ,46).
где К — Kommsekc cBoiicTs (cm., Hanpumep, [94]). B 6onbmmuctTBe cBoem 9TH
уравнения являются весьма приближенными.
Одной из возможностей
их уточнения является использование метода сравнительного расчета,
в частности, приближенного линейного соотношения вида
Ky = A,Ky + By.
(X,47)
В нем значения свойства К сравниваются в двух рядах сходных веществ.
Целесообразность перехода
от (Х,46) к (Х,47Т) покажем на примере
правила Трутона [95]
АНт
—
24,
(X, 48).
H.T.K
часто применяющегося для оценки теплоты парообразования в нормальной точке кипения
АНнтк по его нормальной точке кипения Гн.тк.
Известно, что это правило является весьма приближенным. Даже
если
отбросить ассоциированные вещества, отклонение от
(Х,48) достигает
очень больших величин. Известно также, что многочисленные уравнения,
являющиеся по своему существу уточнением правила Трутона и, в частности,
те
из
них,
в
которых
Н.Т.К
величина
выражена
T
как
функция
H.T.K
Тнтк, не приводят к достаточно точным результатам (см., например,
[96]). Аналогичные соображения в большинстве случаев справедливы и
в отношении других зависимостей типа (Х,46б).
Посмотрим, что дает замена (Х,48) на уравнение
AA,
T
ox
т
Н.Т.К
—
АН
Ay
T
нтк
H.T.K
I
+
В
1-
|
(Х,
т
4
9)
В качестве рядов однотипных соединений выберем углеводороды, для которых данные по теплотам парообразования наиболее полны и достоверны, в качестве стандартного ряда выберем самый изученный (по числу
соединений) ряд н-алканов. Для единообразия все величины заимство-
ваны
из
одного
источника
В качестве примера
АНнл.к
Т н.л.к
—
сводки
(Х,49) укажем
Jose.
= 1,294
[97].
на уравнение
АН
=
Тн.т.к
— 6,235.
н-С
|
(Х,50)
иНоидо
Оно приводит
для четырех 2-метилалканов
к средней погрешности’
0,01 ккал/моль.град, в то время как уравнение (Х,48) дает погрешность.
в 0,92 ккал/моль. град.
Проверка на некоторых других рядах (3-метилалканы, н-алкилциклопентаны, н-алкилциклогексаны, 1-алкены) показала, что переход от:
336:
(X,43)
к
(Х,49)
приводит
к уменьшению
погрешности
вычислений
на
один-два порядка (средняя ошибка расчета для 19 соединений уменьшилась с 0,66 до 0,01 ккал/моль:град) [98]. Таким образом, отказ от допуще-
ния, что в (Х, 49) А, = 1и В, =
в
0, приводит к значительному выигрышу
точности.
Pp)
o>
За»
R. E.
Robertson.
SEE
—.
ЕР
Heppolette,
NF OO
W~eco@eur
=>.
.Розен,
А. И. Михайличенко.
. Розен,
А.И. Михайличенко.
. Пурмаль.
Ж. физ. химии, 30, 176
5
—
—
М>
СЫ
Р.
59).
о
SNS
Докл. АН
Докл. АН
(1956).
Chem.
СССР,
СССР,
Ж. физ. химии, 34, 423 (1960).
. Капустинский,
Рабинович,
Т.
Soc., 88, 1834
148, 1133 (1963).
148, 1354 (1963).
Каньковский.
Ж.
физ.
химии,
32,
Р. Т. Каньковский.
Ж.
физ.
химии,
33,
В. А. Горбушенков.
Докл.
АН
СССР,
OUMREMS
°
ae ROMO <
TAS=
=
WOR
#9778
S
.Chittum,
V.K.La
Mer.
J. Am. Chem. Soc., 59, 2425 (1937).
арнед,
Б. О уэн.
Физическая химия растворов ‘электролитов. М., 1952.
Stephenson,
J.M.Corbella, L.A. Russell. J. Chem. 'Phys.,
(1953).
ook, S.N. Hanson,
B.J. Alder.
J. Chem. Phys., 26, 748 (1957).
>
ан,
А. С. Булатов.
Т.
. Washburn,
о
~=
—
Kor
Г.
Омаров.
E.R.
(1958).
Изв.
АН СССР,
ЖЖ. эксперимент. теорет. физики, 42, 1499
Ж.
Smith,
эксперимент.
M.
теорет.
Frandsen.
физики,
J. Chem.
336
44,
1878
Phys.,
1,
>
=
MORPS
e
о
J. Am. Chem. Soc., "59, 1666 (1937).
33).
. 5 elwood, A. A. Frost. J. Am. Chem. Soc., 55, 4335 (1933).
_L uten. Phys. Rev., 45, 164 (1934).
.Т ilton, Т.К. Tay lor. J. Res. Natl. Bur. Stand., 13, 207 (1934).
Kgl. Norske Videnskab. selskabs Forh., 10, "М 39, 145 (1937).
to kland.
.Р абинович,
В. Г. Голов,
Н.А. Ефимова,
С. М. РустаДокл. АН СССР, 114, 590 (1957).
Андреев.
Докл. АН СССР, 145, 358 (1962).
gio
SACO
Нк
D.A.MacInnes.
HOZA
We
.К оган,
Go. DOS
BOR
52
bo
ongsworth,
tland.
J. Am. Chem. Soc., 68, 2532 (1946).
oan.
J. Am. Chem. Soc., 71, 102 (1949).
unn, Le Roy G.Green.
J. Am. Chem. Soc., 80, 4782
ономаренко,
Г. Я. Зуева,
Н. С. Андреев.
‚ 1964, 1758.
R. W.
Ramette,
R.
F.Broman.
J. Phys.
Chem.,
67,
942
(1963).
366. R.W. Ramette,
E. A. Dratz. J. Phys. Chem., 67, 940 (1963).
.37. И.Б. Рабинович,
В. П. Кучерявый, П. Н. Николаев.
химии, 32, 1499 (1959).
38. J. A. Dixon, R. W.Schiessler. J. Phys. Chem., 58, 430 (1954).
39. K. Stokland, E. Ronaess, L. Transtad.
Trans.
Faraday
312 (1939).
40.
44.
42.
120, 566
CO
).
J. Am.
—
>
pach
SOON
—
№
ee
ол
a
ho
Oo
Rho
8
Co
Ro
co
>
eo
).
.Рабинович.
eo
5%
абинович,
3. В. Волохова.
Докл. АН СССР, 122, 844 (1958).
лебникова,
В. П. М о.розов. Укр. хим. ж.., Qh, 3 (1958).
. Варшавский,
С. 9. Вайсберг.
Ж. физ. химии, 29, 523 (1955).
. Thornton.
J. Am. Chem. 50с., 84, 2474 (1962).
изический энциклопедический словарь, т. 2. М., Изд-во «Сов. энциклопедия»,
2, стр. 147.
. 36.
36a.
Янь Го-сень. Ж. физ. химии, 34, 1647 (1960).
Вестник технич. и экономич. информации, № 3, 16
апетьянц. В кн.: Научно-техническая конференция МХТИ им.
елеева. Тезисы докладов. М., 1960, стр. 9.
одский.
Химия изотопов. Изд. 2. М., Изд-во АН СССР, 1957.
иршенбаум.
Тяжелая вода. М., ИЛ, 1953.
бинович,
В. Д. Федоров,
Н. П. Пасхин, М. А. АвдесН. Я. Пименов.
Докл. АН СССР, 105, 108 (1955).
_L.
18.
Ка арапетьянц,
Ка арапетьянц.
.К
Ме
Б
erm sn §
Pos
AO FSD Oy DIS SS pd aK
loi ===
=“
ow вы
ЛИТЕРАТУРА
Ж. физ.
Soc., 35,
R.C.Hardy,
R.L.Cottington.
J. Res. Natl. Bur. Stand., 42. 573 (1949).
R. Schrader,
K. Wirtz.
Z. Naturforsch., 6a, 220 (1951).
P. Isberg,
L. Lundberg.
Z. Naturforsch., 9a, 472 (1954).
.J.R.
Heiks,
M.
K.
Barnett,
Chem., 58, 488 (1954).
.
ты
ebert,
K.
V.
H.F.McDuffie,
Jones,
E. Orban.
C.H.Secey.
J.
Phys.
J. Phys. Chem., 62, 431
.E.Bartholomé,
K.Clusius.
Z. phys. Chem., B28, 175 (1935).
.E.H. Riesenfeld,
T. L.Chang.
Z. phys. Chem., B33, 120 (1936).
. F.T.Miles,
A. W.C.Menzies.
J. Am. Chem. Soc., 58, 1067 (1936).
K. Niwa,
E.Shimazaki.
J. Fac. Sci. Hokkaido Imp. Univ., ser. III, 3,
35 (1940).
F.D. Rossini,
J. W. Knowlton,
H. L. Johnston.
J. Res. Natl.
Bur. Stand., 24, 369 (1940).
S.T. Bowden,
J.M.Costello.
Rec. trav. chim., 77, 32 (1955).
R.W.Shearman,
A.W.C.Menzies.
P. F. Chester,
J.S. Dugdale.
Phys.
J. Am. Chem. Soc., 59, 185 (1937).
Rev., 95, 278 (1954).
Янь
Го- сень,
М. Х. Карапетьянц. Acta sci. natur. Univ. Szechuan.,
N 6, 71 (1959).
М. Х. Карапетьянц.
Чэн
Гуангюе.
Температура кипенияи давление насыщенного пара углеводородов. М., Гостоптехиздат, 1961.
Т.
Мущаю,
Е. М. Гоба11$.
А. О. Мс
Dougall,
Ind.
Chem.,
D.H.
Gordon.
Eng.
1505
Long.
Ed., 34,
1072
J. Phys.
Ind. Eng. Chem.,
Ind.
К. Т. Lefflek,
38,
J. Am. Chem.
F. A.
М. Х. Карапетьянц,
Э. В. Скленская,
Chem., "66,
Ind. Ed., "35, 851 (1943);
(1942).
J. A. Llewellyn,
(1960).
Soc., 60, 1182 (1938).
9. В. Скленская.
Ж.
р. Н. Об
.E. Robertson.
физ. химии,
шег.
Canad. J. Chem.,
Ж. физ. химии, 38, 1312 (1964).
М. Х. Карапетьянц.
М. Х. Карапетьянц.
429 (1962).
Ж. неорг. химии, 9, 2564
29, 938 (1955).
(1964).
К. Б. Яцимирски й. Ж. общ. химии, 24, 1498 (1954).
W.C. A. Wise,
C. V. Davies.
J. Chem. Soc., 1938, 273.
H.B.HowamMupcKrun,
B.A.Tetomkauana.
MM. Heopr. xumun, 2, 320 (1957).
Я. И. Турьян,
Б.П. Жанталай.
Ж. неорг. химии, 5, 1749 (1960).
Я. И. Турьян,
Ю. С. Милявский.
Ж. неорг. химии, 5, 2243 (1960).
К.Б. Яцимирский,
В. П. Васильев.
Константы
нестойкости
комплексных соединений. М., Изд-во АН СССР, 1959.
J. Bjerrum.
Stability. constants, vol. 1. ‘London,
1957.
H. Magnus.
Z. anorg. allg. Chem.., 124, 289 (1922).
Ю. В. р одаков.
Элементы электростатической химии.
А. К. Бабко.
Физико-химический анализ комплексных
рах. Киев, Изд-во АН УССР, 1955.
М.,
ОНТИ,
соединений
1934.
в раство-
А. А. Гринберг.
Химия. координационных соединений. М., Госхимиздат,
1955.
Е. В. Бирон.
Учение
о соответственных
состояниях
(дополнит. глава).—
В
кн.:
О.
Д.
Хвольсон.
Учение
о газах
K.S. Pitzer,
D. Z. Lippman,
D. E. Petersen.
J. Am. Chem. Soc.,
L. Riedel.
L. Riedel.
Л.
№
Л.
95,
Л.
№
и жидкостях.
R. F. Curl,
77, 3433 (1955).
Chem.—Eng.—Tech., 24, 353 (1952).
Chem.—Eng.—Tech., 26, 83 (1954).
П. Филиппов.
1, 111 (1956).
П. Филиппов.
1956.
П. Филиппов.
1. 85 (1957).
Вестник
МГУ,
Вестник МГУ,
Вестник
|
Л. П. Филиппов.
|
серия
мат.,
мех.,
1962.
О. Д. Хвольсон.
. Е.А. Сисвеп ре!
physist. Amsterdam,
. М.
Х.
C.M.
астроном.,
ГИЗ,
1923.
физ.,
XHM.,
Huggins,
сер. мат., мех., астроном., физ., хим., №
МГУ,
сер.
Ж. физ. химии,
мат.,
мех.,
астроном.,
физ.,
1,
хим..,
31, 1136 (1957).
Л. П. Филиппов.
Ж. физ. химии, 31, 1999 (1957).
Л. П. Филиппов.
Ж. физ. химии, 32, 986 (1958).
И. С. Бадылькес.
Рабочие вещества и процессы
Госторгиздат,
М.—Л.,
холодильных
машин.
М.,
Курс физики, т. ПГ. Теплота. М., ГИЗ, 1923.
м. Thermodynamics. An advanced treatment for chemists and
1957, p. 53.
Карапетьянц.
Примеры
и
задачи
по
химической
термодинамике.
Изд. 3. М., Росвузиздат, 1963.
М.Х. Кара петьянц,
Г. В. Жуков.
Ж. физ. химии, 38, 1015 (1964).
М. Х. Карапетьянц.
Труды МХТИ им. Д. И. Менделеева, 23, 3 (1956).
. Физико-химические
свойства индивидуальных углеводородов, справочник. Под
ред. В. М. Татевского. М., Гостоптехиздат, 1960.
. М.Х. Карапетьянц, 'Ю. М. Хожаинов.
Труды МХТИ им. Д. И. Менделеева, 44, 10 (1964).
.C.M.Guldbe
>
+
. P.
A.
Guye.
22 М. Х. Карапетьянц
rg.
Bull.
Z.
Soc.
phys. Chem., 5, 374 (1890).
chim.,
4, 262
(1890).
337
93. М. Х. Карапетьянц,
С. В. Варнаков.
Ж.
физ. химии,
94.J. H. Partington.
An advanced
treatise on physical
London. 1951.
95. F. Trouton.
Phil. Mag., 18, 54 (1884).
38, 1679 (1964).
chemistry.
Vol. IT.
96. М. Х. Карапетьянц.
Химическая
термодинамика.
Изд. 2. M., Госхимиздат, 1953.
97. М. Х. Карапетьянц,
М. Л. Карапетьянц.
Теплоты испарения углеводородов.— В кн.: Физико-химические свойства индивидуальных углеводородов. Под ред. В. М. Татевского. М., Гостоптехиздат, 1960, гл. УП.
98. М. Х. Карапетьянц,
Э.
И.
Боев.
Ж.
физ. химии, 38, 1019 (1964).
ГЛАВА
XI
„ МЕТОД КОМБИНИРОВАННОГО РАСЧЕТА
В настоящей главе описано сочетание методов сравнительного
расчета с некоторыми другими методами. Это сочетание под названием
метода комбинированного расчета физико-химических свойств было разработано автором совместно с Чэн Гуанг-юе [1—10, 33]и изложенов монографии [11,11а] (см. также [12]). Метод состоит из сочетания интерполяции
по параметрам,
экстраполяции
по параметрам,
экстраполяции
по
веществам и экстраполяции по свойствам. Описание этого метода дадим
на примере температурной зависимости давления насыщенного пара и ча-
стично на примере вязкости.
ИНТЕРПОЛЯЦИЯ
[11] для
|
ПО ПАРАМЕТРАМ
На основании анализа описанных в литературе уравненийР = }(Т)
интерполяции по параметрам рекомендовано уравнение Антуа-
igP=a——h,
д
содержащее три индивидуальные постоянные. В настоящее время это
Уравнение широко используется для обобщения опытных данных. Оно
удобно не только потому, что достаточно надежно, но и потому, что легко
позволяет найти { =ф (Р), 0Р/0Ё и ОШОР. Для получения точных результатов следует разделить интервал сосуществования жидкости и пара на
три части (низкие, средние и высокие давления) { и применить это уравнение для каждой части отдельно. При этом условии погрешность вычисления лежит в пределах ошибок опыта [41]. Достоинством уравнения
(Х,1) является также легкость определения его коэффициентов. Для этого
можно воспользоваться одним из трех методов: графическим, алгебраическим усреднением и методом наименьших квадратов [12].
ЭКСТРАПОЛЯЦИЯ
ПО
ПАРАМЕТРАМ
1
Допустим,
интервале давлений, в
жим, что это интервал
весьма существенным,
1 Примерно
0,001
что мы знаем константы Уравнения
(ХГ,1) в том
котором оно дает хорошие результаты. Предполосредних давлений. Последнее допущение является
так как для большинства изученных
веществ.
— 30 мм; 30 мм
—- 2 атм
и 2 amu
Pup:
22
*
339
опытные данные известны только при умеренных давлениях, а для тех веществ, для которых измерения проведеныв широком интервале давлений,
наиболее надежными обычно являются значения температур кипения именно
при этих условиях. Возникает вопрос: можно ли получить отсутствующие
данные при низких и высоких давлениях? Отрицательный ответ на этот
вопрос непосредственно следует из рис. 262. Таким образом, уравнение
(XI,1),
будучи
достаточно
рекомендовано
для
ton
~
надежным
для
экстраполяции.
интерполяции,
не может
быть
Copy
1
3—3
10°
16°
-2
1
0’
=|
1
‘
1
10
10—
|
L
3
4
10°
p
Рис. 262. Результаты экстраполяции по уравнению (ХТ, 1)
на низкие и высокие давления Р (мм рт. ст.) [18, 20]
1 —
1-бутен;
2 —
2-метилпропан;
3 — н-пентан;
Для экстраполяции по параметрам необходимо
тельным методам вычисления, т. е. к уравнениям
t= Agtu-+ Ba,
или
4 — этан
обратиться
|
к сравни-
(XI,2)
lg Ty = Aglg Ty + By
(ХТ,4)
lg Px = Aglg Py + Ba,
(XI,5)
описанным в главе ТУ. Надежность экстраполяции по этим уравнениям
была проверена на некоторых я-алканах. В качестве стандартного вещества во всех случаях был выбран н-гексан. Вычисления по уравнениям
(XI,2), (XI,3) a (XI,4) проведены на основании наиболее надежных данных в интервале давлений от 50 до 760 мм; для уравнения (ХГ,5) втех
случаях, когда это было возможно, использованы величины, которые
считаются достаточно надежными. В основу расчета положены следующие экспериментальные данные: для С.Н, — [46]; С.Нь — [17]; C,H,,,
С.Н и С.Н. — [18] и для СьН.. — [19]. Результаты вычислений приведены
в
табл.
(ХТ,2—Х1Т,4)
340
53.
Из
нее
видно,
что
экстраполяция
по
уравнениям
приводит к удовлетворительным результатам, причем наибо-
Таблица
Среднее
отклонение
результатов вычисления по уравнениям (ХТ, 2—Х1, 5)
от экспериментальных данных [11]
t,
АР
°C
“Dp”?
Уравнения
%
Р
низкие
давления
(ХТ,2)
(X1,3)
(X1,4)
(ХТ,5)
*
0,7
0,5
0,3
—
*
**
**®
53
средние
высокие
давления ** | давления ** |
0,04
0,07
0,02
0,01
средние
высокие
давления ** | давления ***
0,73
1,26
0,17
0,96
0,10
0,30
0,08
3,95
1,67
3,04
_ 0,44
2,04
Экстраполяция.
Интерполяция.
См. стр. 346—341.
лее точные данные получаются по уравнению
денная на опытном материале для различных
в общем подтвердила эти выводы.
(ХТ,4). Проверка, провеорганических соединений,
2
При использовании методов сравнительного расчета, в частности уравнения (ХТ,4), важным
является вопрос о стандартном веществе, так как от выбора этого вещества во многом зависит надежность
результатов вычислений. Стандартное вещество в рассматриваемом случае должно отвечать следующим требованиям:
1) экспериментальные (или вычисленные) данные по температурной
зависимости давления пара стандартного вещества должны быть по возможности точными во всем интервале сосуществования фаз;
2) желательно,
чтобы
стандартное
вещество
принадлежало
к тому
же
задача
ре-
гомологическому ряду, что и изучаемое вещество, т. е. для каждого ряда
сходных веществ следует иметь свое стандартное вещество. Это особенно
важно для экстраполяции по веществам (подробнее см. стр. 351 сл.);
3) желательно, чтобы стандартное вещество находилось ближе к середине рассматриваемого ряда веществ.
Следует отметить, что не всегда удовлетворяются все перечисленные
требования
одновременно.
В
тех
случаях,
когда
поставлена
шить лишь один конкретный вопрос, некоторые из них отпадают. Так,
если необходимо осуществить только экстраполяцию по параметрам, то
вторым требованием можно пренебречь. С другой стороны, например, при
экстраполяции по веществам важно выбрать в качестве стандартного вещества гомолог, расположенный в середине ряда. Если для него полных
и точных данных нет, можно воспользоваться методом, изложенным в
следующем разделе (см. стр. 342).
Выбор стандартного вещества покажем на примере н-алканов. Если
для них в качестве стандартного вещества выбрать н-пентан или н-бутан,
то это будет не очень удачно, так как тогда стандартное вещество окажется вблизи начала ряда. н-Гептан или н-октан, хотя и расположены блия:е
к центру ряда, но отпадают вследствие неточности для этих веществ данных по температурам кипения при высоких давлениях. Для веществ выше
н-октана вообще нет экспериментальных данных при высоких давлениях,
и, следовательно, использование их как стандартного вещества исключается.
3-1
Поэтому в качестве стандартного
него при низких давлениях точные
сутствуют; однако их можно найти
ложенному ниже методу, который
числения.
вещества выбираем н-гексан; но и
экспериментальные данные также
расчетным путем, обратившись к
можно назвать методом обратного
для
отизвы-
3
для
Метод
решений
обратного
задачи
проверки
вычисления,
который
и расширения
можно
интервала
рекомендовать
значения
свойств
стандартного вещества (если интервал изменения температуры для рассматриваемого вещества больше, чем для стандартного), состоит в расчете
зависимости } (Р, Г) = 0 для стандартного вещества по завиеймости
f (P, T) = 0 aaa ero гомологов. В случае применения уравнения ` (ХТ,4)
ему отвечает соотношение
12 То = Ay
i=1
Здесь
Го — температуры кипения
a, (le T;— B,,).
стандартного
о
|
вещества,
(ХГ,6)
Г; — темпера-
туры кипения его гомологов и т — число изученных гомологов..
Рассмотрим этот метод на примере н-алканов, приняв, как: и.. ранее,
в качестве стандартного вещества н-гексан.
В работе [20] были изучены 19 веществ, в том числе ряд метан—н-пентан.
Температуры кипения измерялись в интервале от 0,001 до 10: мм рт. ст.
с погрешностью порядка
0,5°. Воспользовавшись
результатами этой
работы, можно следующим путем получить достаточно надежные данные
для гексана при низких давлениях.
Если выбранное нами уравнение (ХГ,4), коэффициенты которого найдены На основании данных для различных н-алканов при средних давлениях, справедливо и при низких давлениях, то при любом (постоянном)
значении Р в этой ‚области в соответствии с (ХТ,6).
=о, (lg т: — - Вы) = const = Тыс.
©
KL
Здесь' индекс i соответствует числу атомов углерода в ‘молекуле, а т —
числу углеводородов, по которым производится расчет; в данном случае
= 4ui = 2, 3, 4, 51. Результаты расчета по этому уравнению приведены в табл. 54. Из таблицы
чения —— (lg 7; — B,)
4
видно, что для этана, н-бутана и н--пентана зна-
действительно
при
каждом
давлении практически
одинаковы, погрешность сравнительно велика только при температуре
ниже точки‘ кристаллизации соответствующих углеводородов. Лишь для
пропана наблюдаются систематические отклонения (в сторону уменьшения). При этом разница между этими величинами для пропана и трех других углеводородов с уменьшением давления возрастает. На рис. 263
эти данные представлены для всех перечисленных веществ при различных давлениях вплоть до критической точки.
Как видно из чертежа, линия для пропана, в отличие от линий для дру-
гих
гомологов
в области
давлений,
измеренных
в
[20], искривляется.
Трудно представить себе, что линейные соотношения, справедливые для
веществ, расположенных перед данным веществом (С.Н.) и после него,
нарушаются для самого вещества. Вероятнее всего предположить, что указанное выпадение пропана вызвано недостаточной точностью эксперимен\ При
3 12
низких
давлениях
метан
находится
в твердом
состоянии.
Таблица
Расчет температур
Р
;
кипения
Ty, °K
‘
мм рт. ст.
|
13
2
3
.|
0,05
|
O41
0,5
2
_3
9, 25529
180,0
2.28404
192,3
192,14 | _o9
198,2
2
110,6
139,2
2.32833
2.32524
191 ,5
2,32959.
|
2.32888
..2,35805
3
4
5
150,0
| 479,38
205,0
2.35597.
9, 35859
2,35862
_ 227,0
228,4
228,4
2.37937
239,5
125,6 —
2
3
4
|
5
58,2
188,5
245,1
2
3
4
5
130,7
164,8
195,9
223,4
*
Ниже
точки
кристаллизации
**
Ниже
точки
кристаллизации
*#*
Для
пропана
(см. рис, 263).
исходные
228 ‚1
238,7
_ 239,6
239,4
9, 39534
2, 39468
2,39566
2,39526
248,5
248, 1
248,7
248,5
13,
\
Г -0,3
05 | № 6 ***
220,5 | 0,0
—0,3 .
0,4
|
|
0,0
|
|)
220,9
2.37787
2, 379541
2,3792
0,2
| 40,3
| | ong | +H, 8 ***
(220,2 |
2489
220,5
119,1
40,5
+2,1 ***
198,0 | 02
)
243,3.
9
|
49
|
‚243,6
2.34269
234034
2.34340
5,0
—0,4
213,0
211,5
114,7
144,4
472,9
20
42,4 ***
198,2
2.29718
2.34425
—0,4
192,5
2,28434
2.29704
5 | 198,2.
10,0 .
+0,6
2
3
4
1,0 >
40,6
42,0 *#*
190,4
177 ‚4
167,0
0,0
—0,6
191,5
5
4
42.2 **
2, 28224
197 ,5
195,9
154,8
+0,6
179,6 | oo»
2.27896
|
)
164,7
‚|
179,8
2,25480
2,29545
2,29198
5.
|
161,2
101,9
128,4
4
_3
179,0
177,6
Top — Torn
средняя
165,3
2,25209
9, 24948
172,2
°K
162,5
91,4** |
115,8
150,0
5
164,7
221834
124,4
4
2,24676
147,5
98,6 **
2
3
464,1
2, 24076
140,0
4
|5
отдельная
2,24504
105,4
127,7 **
4
5
001
“A, (8 Ti — Bu)
83,4 **
:2
по методу обратного
TH-CoHiw?
4
.
7
* |
0,004
н-гексана при низких давлениях
вычисления (см. стр. 342) [11]
54
)
998.3
5
939 5
| J
р 248,6
2
)
+0,2
44,3 ***
|041
—0,1
0,0.
10,8 ***
0,0
40,4
40,1
40,5 ***
—0,1
40,1
н-гексана.
данного
углеводорода
экспериментальные
данные
[0],
пс-видимому,
неточны
343
Таблица
55
Экстраполяция методом обратного вычисления значений температур кипения
некоторых
н-алканов
Р, атм
T;,
1
25 **
30
30
40
45
5
$
С„Но„, овыше
°K
критической
точки [11] *
1
12 Г; — Ва
A,, 1s Ti — Bai)
172,34
177,63
182,33
186,58
190,47
3,151090
3, 164639
3, 175984
3,185988
3,194950
2,695025
2, 706613
2, 716313
2, 724872
2,132531
495 ,48
508,88
520,57
530, 33
540,18
05 **
275, 64
2,917431
2 , 694827
495
, 26
30)
30
40 `
45
283,43
290,33
296,55
302,24
2,929335
2,939781
2,948987
2,957244
2, 106008
2,115658
2, 124162
2,131187
508,17
519,59
229,86
539,25
3
25 **
30
30
40
341 , 94
301 , 37
359,69
367,16
2, 845258
2,857114
2, 867214
2,816201
2,694991
2, 706218
2,115844
2,124301
495
, 44
208,41
519,81
530,03
4
25 **
30
35
400,57
411,37
420,91
2,800245.
2,811800
2,821756
2,694609
2,105731
2,115308
495,00
507,84
519,17
о
25 **
30
451 , 86
463,95
2, 747142
2, 198609
2, 695499
2, 706738
496 ,02
509,02
* Экспериментальные данные:
**
Включено
для
оценки
Т,-С,Ны,
0
K
СН, [21], С„Н‹ [22], С.Н [23, 24], н-С.Н.о [10], н-С5Н‚» [25].
точности
метода
расчета.
тальных данных. Добавим к этому, что (как это видно из того же чертежа) даже вещества другого гомологического ряда углеводородов дают (при
сравнении с н-гексаном) прямую, хотя и с несколько меньшей точностью.
Поэтому значения температур кипения н-гексана при низких давлениях были вычислены только по температуре кипения этана, бутана и
пентана;
они
приведены
в шестой
графе
табл.
54.
Из
данных
последнего
столбца этой таблицы можно заключить, что полученные результаты достаточно удовлетворительны: все они лежат в интервале ошибок опыта.
Даже
при
давлении
0,001
мм рт. ст.,
т. е. ниже
точки
кристаллизации,
максимальные отклонения не превышают -{ 0,6°.
С помощью данных по н-гексану можно найти Р — Т-зависимость для
веществ, для которых кривая равновесия продолжается до давлений, превышающих критическое давление н-гексана. Для этого следует экстраполировать кривую для н-гексана, что также можно осуществить методом
обратного вычисления по Р — Т-зависимости низших н-алканов.
Результаты расчета этих величин по температурам кипения СН,,
C,H,, Сз,Нь, н-С.Нь и н-СН 1. приведены в табл. 55. В табл. 56 дана
сводка средних значений &,с.н, Для каждого давления. Эти данные могут быть положены в основу установления температурной зависимости
давления пара низших членов некоторых других гомологических рядов
углеводородов при высоких давлениях (см. ниже).
Для оценки точности применения этого метода экстраполяции в табл.
25 и 56 включены значения температур кипения н-гексана, вычисленные
при давлении Р=25
атм,
т.
е.
ниже
его
критического
давления
(Py,
=
= 29,9 атм [25]) *. Полученное при этом среднее значение равно 495,40°К;
odd
Таблица
Результаты
экстраполяции
температур
выше
кипения
критического
[5]
Температура
Вещества,
при
по которым
произведен
расчет
25 *
кипения,
Р,
30
н-гексана
при
56
давлении
°С
атм
35
40.
45
CH,
222,32
239,72
247 ,21
251,54
267 , 02
СН
C3H,
н-СаНл1о
H-CsHie
222,10
222,28
224 ‚84
222,86
235 , 01
235,25
234,68
235,86
246,43
246 , 65
246 ,04
—
256,70
257 ,05
—
—
266,09
—
—
—
222,24
235,30
246.58
257 ‚11
266.56
Среднее
значение
#
* Включено
для
оценки
точности метода
оно отличается от наиболее
с помощью уравнения
Ig
P
точного
(атм)
—
2,70
значения
4,99788
—
Г
70
20°
(495,35° К), вычисленного
1981 ,398
“334,401
p
[gq T h+--———ww
00
расчета.
—760
5
— t
5
iX1,8)
атм
15 25
2,60
21014
РИ
BSG
:
|
20
2
lg
Рис.
263.
Взаимосвязь
других
между температурами кипения
углеводородов при различных
®
—
критические
т.
н
‚|
280
ОБН
Т (°К) н-гексана
давлениях [20]
п неногорых
точки
рекомендованного М. Д. Тиличеевым [26], всего на 0,05°. Это свилетельствует о надежности примененного метода экстраполяции.
1 Разумеется,
за исключением этой величины все остальные имеют
пературы кипения, а лишь чисто расчетных вспомогательных величин.
смысл
зе
тем-
4
Вычисление температуры кипения и давления пара при помощи
методов сравнительного расчета должно дать наиболее удовлетворительные результаты для сходных веществ, в первую очередь для веществ одного и того же гомологического ряда. В последнем случае можно говорить
не только о достижении высокой точности, но и о наличии закономерного
изменения коэффициентов уравнения. Это означает, что создается возможность экстраполяции не только по параметрам, но и по веществам
(подробнее ‘см. стр. 354 сл.):
|
Но в гомологических рядах, в частности в рядах углеводородов, значения давлений пара различных членов ряда вблизи тройной и: критической точек отличаются не очень сильно. Наоборот, разница в температурах кипения в этих областях велика. Поэтому в гомологических рядах
сравнивать температуру кипения при одном и том же давлении удобнее,
чем сопоставлять давление пара при одинаковой температуре.
Важно учитывать и следующее: в настоящее время самые точные данные по давлению пара различных ‘веществ, и в частности углеводородов,
измерены примерно в одном и том же интервале давлений (Р = 50—
180 мм. рт. ст.). Естественно, что одному и тому же интервалу давлений
соответствуют совершенно различные интервалы температур.
==
Вышеизложенному
можно
придать
количественный
характер.
Для
этого введем следующие величины: коэффициенты a (a’) применимости
уравнения и коэффициентыВ (В’) точного применения уравнения '.
Под первым коэффициентом будем подразумевать отношение интервала значений соответствующего параметра (давления или температуры),
в котором в принципе возможен расчет с помощью данного уравнения,
ко всему интервалу сосуществования жидкости и пара для данного вещества.
Для веществ молекулярного веса, большего, чем у стандартного вещества,
применяя
получаем 2
уравнения
вида
т.)
ав =
(Х[,5)
в соответствии
— Ть.
ne
a
KD
тр.-т
(XI,9)
где Т.р. — температура в тройной точке.
При использовании уравнений вида (Х1,2),
o's
=.
с определением
—Р5
( Р po
Kp
тр.т
,
(Х1Т,3)
или
(ХТ,4) имеем
(XI,
10)
тр.т \**_
где Р‚„., — критическое давлениеи Р.р.‚' — давление в тройной точке (его
для всех веществ можно принять равным нулю).
Под коэффициентом точного применения уравнения подразумевается
отношение интервала значений соответствующего параметра (давления
или температуры), в котором можно производить вычисления по уравнению на основании наиболее надежных экспериментальных данных, ко
всему интервалу существования точных данных. Считая, что последний
интервал простирается от 50 до 760 мм рт. ст., получим для уравнения типа
(ХТ,5)
для вещества с большим молекулярным весом, чем стандартное
вещество:
И
д — Три
я
Г
н.Тт.к
~
Г
P=50
’
' Коэффициенты a u В относятся к уравнениям, в которых сравниваются давления
пара, коэффициенты а’ и
В’р— к уравнениям, в которых сравниваются температуры
кипения.
обозначают соответственно вещества
* Здесь и в дальнейшем нижние индексы
с ббльшим (В) и меньшим (Н) молекулярным весом, чем молекулярный вес стандартного вещества.
346
случае
к
равенству
в этом
(ХТ,2), (ХТ,3) и (ХГ,4) приводит
вида
уравнений
же
Применение
в
—1.
(ХТ, 12)
Для веществ меньшего молекулярного веса, чем стандартное вещество,
будем
иметь
соответственно
on
sg
Spe
a=
.
Понятно,
что
чем
уравнений, ‘тем более
Мм
ost
мя
B= ft.
больше
широкий
зн&чения
интервал
- (XI,16)
коэффициентов
условий
можно
применимости
охватить
расче-
том. Когда этот коэффициент больше единицы, то возможность применения уравнения для данного вещества уже не ограничена самим уравнением. Наоборот, если коэффициент применимости
уравнения меньше
единицы, то с помощью данного уравнения часть величин определить невозможно.
В
предельном
случае,
когда
этот
коэффициент
превращается
в нуль или становится меньше нуля, метод для данных веществ совершенно неприменим.
р
аЕ---------=
Е
--------
он --------ее
еее
а’
ен-----тт7“
TT
frm
TT
.
TTT Tp
@)
OP
Ty
НЕЕ
|
|
|
|
76дмм--- ------%
fl
| |
Г
|
|(г.|
50мм
Te
0
Qy
|
5,6, ВВ
d,
Рис.
264. Зависимость
Lit
©
|
а,
9,6263
,
J,
|
©, Ч 4,6;
|
|
f,
в, 1,9, №
:
9, 9,
9
давления насыщенного пара от температуры в ряду
сходных веществ (схема)
Из определения ясно также, что если коэффициент точного применения равен единице, то расчет осуществим полностью на основании наиболее точных экспериментальных данных, а если этот коэффициент меньше единицы, то приходится пользоваться некоторыми неточными данны-
ми. Если же этот коэффициент равен нулю или меньше нуля, то примене-
ние точных
веществ,
данных
исключается
и для стандартного,
и для
сравниваемых
347
Смысл рассматриваемых коэффициентов
пояснить с помощью рис. 264, на котором
для
нескольких
членов
(А,
В, <,
О,
Е,
Е,
в наглядной форме можно
изображены Р — Т-кривые
С)
гомологического
ряда
(Р — стандартное вещество). Строчными буквами обозначены характерные точки для данного вещества (они вынесены на ось абсцисс), причем
индексы 1, 2, Зи 4 соответствуют значениям Ттр.т, Г, Гьо, Глво и Гьр. Вещества А, С, ВиЕ
выбраны по следующему признаку: для первых двух
а = 0, для вторых двухВ = 0 (разумеется, в действительности подобных
веществ может и не оказаться
в рассматриваемом
гомологическом ряду).
Таблица
Значения
коэффициентов
Вещество
|
a, a’, В и В’ для веществ,
на рие. 264 [9]
a
Сад
A
ааа
ab,
B
1>
С
dic4
1 > с
Е
1>
bibs
> 0
1>
od’
>
od’
Oe
i>
>
fida
Tifa
184
>0
ods
debs
9
bobs
> 0
2!
od’
of
= 0
1>
dec3
Cats
1>
€2€3
feds
21
od’
=
1
4
> 0
1
>
1
= 0
4
e2d3
ое’
> 0
В’
dsa3
0>
od’
е1е4
gid4
С
oa’
1>
>20
B
od’
1>
е1 44
F
предетавленных
a”
= 0
57
og’
fof
>!
°>
gods
8283
I
Таблица
Значения
n
1
2
3
4
5
6
7
8
9
10
a
0,13
0,59
0,68
0,85
0,89
—
0,94
0,82
0,76
0,70
коэффициентов
a’
0,65
0, 62
0, 71
0,80
0, 94
-1
1
1
1
В табл. 57 приведены
ных на этом чертеже.
чая
_В
0
0
0
0
0,55
—
0,59
0,29
0
0
а, а’, В и В’ для
В’
—
1
1
1
1
1
1
1
1
1
|
н-алканов
n
a
a’
B
В’
14
12
13
14
15
16
17
18
30
0,66
0,64
0,59
0,56
0,53
0,51
0,43
0,36
0,32
1
1
1
1
1
1
1
1
1
0
О
0
0
0
О
0
0)
0
1
1
1
|
1
|
1
|
|
значения а, а’,В иВ’ для всех веществ, представлен-
Для конкретности в табл. 58 они указаны для слу-
н-алканов (стандартное вещество — гексан).
Выводы,
вытекающие из вышесказанного,
поясняются
266. На рис. 265 нанесены прямые, отвечающие уравнению
соотношению первого типа. На рис. 266 дано графическое
уравнения (ХТ,5), т. е. соотношения второго типа.
348
58
С„Н.,, 42
рис.
265
и
(ХГ,2), т.е.
выражение
р
~<——MM —
t
рр
|
600+
|
500 \-
“oor|
|
10 50
И
|
—-—<
5
7602
'
/
:
|
Ги
/
ol
|
if
”
р
||
||| |
ОА
\/
ОД
1:
2.
—
45 Fry
1020
eT TART
1
|
атм
fe
|
|| |
Е
||
ff
|'
/ foi
1
||
|
||
.
Meo | |
и
|
|
|
|
|
|
|
900
200
100
-100
-200
Гр
cial mp.m,
100
3.1.
J)|
0
|
100
|
‚
ИШЕ 5
200
300
ф, _
H Ce Hay
Рис. 265. Взаимосвязь между температурами кипения { (°С) н-гексана и
некоторых других н-алканов С„Н.„„. при различных давлениях [26, 31, 37]
В обоих случаях взят один и тот же ряд веществ (н-алканы). На этих
чертежах линия АД’ соответствует значению критического давления (кри-
тической температуры) н-гексана; следовательно, она отвечает верхнему
пределу применения данного метода. Линия ББ’, соответствующая температуре кристаллизации н-гексана, отвечает нижнему пределу метода.
Очевидно, только те величины, которые попадают в поле, ограниченное
вертикалями АА’и ВВ’, можно найти с помощью данного уравнения °.
1 Pp — [-значения, соответствующие.точкам, лежащим вне поля .4.4’В’В, можно вычислить при помощи метода обратного вычисления (см. стр. 342—343).
349
Линии СС’, ОШ’, сс’и 44’ соответствуют значениям Р=50 и 760 мм.
Наиболее точные данные для всех веществ, изображенных на рис. 265,
находятся в поле, ограниченном прямыми СС’и ОР’. На рис. 266 наиболее точные данные ограничены для стандартного вещества вертикалями СС’ и ОО’, а для других веществ — горизонталями сс’и dd’.
|
-100 1795
100000
>——F
|
Е
|8
Г
10000 '
-60
-60
-40
т
-20
+
№
|
1000
—_—
eo
eee
0
20
60 100 140 180220 t, =234,7
toro
МР
PIG
pp
AL TE
К
D:
ee
oP
=<.
100+!
10
:
=.
,
Q*
7
01
|
‚|
BOT
|
Е
|
0007
Рис.
.
pu
0007
266.
В
|
1
a)
у
7
и
0,07
Г
и
и
Lot
(01
4
Z
и
]
i
/
‘4
и
10
|
D
‚.
4
| _4
100
Взаимосвязь между давлениями! насыщенного
Г
|
IG
/
wl
1000
пара
]
/
it
|
|
oad,
ИЕ
1
10000 + 100000
р
Р (мм рт.
j
1000000
HOCH
ст.) н-гексана
и некоторых других н-алканов С„Н.„.. при различных температурах # (°С) [26. 31, 37]
Из всего изложенного можно сделать следующие выводы:
1) для гомологических рядов использование уравнения, в котором
давление пара сравнивается при равных значениях температур, весьма
ограничено. Это непосредственно следует из табл. 58 и рис. 266. Из рисунка видно, что большая часть Р — {-кривых не только для высших, но
и для низших гомологов выходит за пределы прямоугольника
А’АР’Б.
Наоборот, применение уравнения, в котором производится сравнение
температур кипения при разных давлениях, почти не ограничено;
2) линии на рис. 266 значительно сильнее отклоняются от параллельных, чем на риз. 265. Для высших гомологов (п`> 6) они сосредоточены
в правом верхнем углу рис. 266, т. е. в области наиболее неточных
Р—{-значений для стандартного вещества. Данные для низших гомологов
целесообразно сопоставлять с данными для стандартного вещества в ‚средней или левой части чертежа. Но, как видно из графика, в этих областях
давление пара стандартного вещества слишком мало. Иное положение на
рис. 265, где линии близки к параллельным;
3) область, соответствующая на рис. 266 наиболее точным данным как
для стандартного, так и для сравниваемого вещества, является весьма
узкой (прямоугольник $1525354, образованный пересечением прямых СС’
и РО’ с прямыми сс’ и 44’). В эту область попадает лишь часть линий и
350
при этом для немногих веществ (в данном случае для н-С „Нл, н-С.Нуь,
н-С,Н.з). Поэтому для всех других веществ приходится пользоваться неточными данными. Иное дело — сравнение температур кипения. На puc.
265 точки, соответствующие наиболее надежным данным для всех веществ,
в том числе и для стандартного вещества, расположены между прямыми
СС’ и ПОП’; иначе говоря, в этом случае сравнение всегда осуществимо в
оптимальных условиях;
|
4) при экстраполяции по веществам с помощью уравнений
(ХТ,2),
(ХТ,3) и (ХГ,4) ' не возникает принципиальных затруднений, чего нельзя
сказать об уравнении (ХТ,5). Так, если температурную зависимость дав-
ления насыщенного пара для н- Cy5Hye 1 H-C4o Hg легко выразить с помощью
рис. 265, то с помощью рис. 266 это сделать очень трудно. Это объясняет-
ся не столько тем,
на краю чертежа,
правее
линии
АЛ’.
что Р —Г-линии для указанных веществ расположены
сколько тем, что большая часть данных оказывается
‚ Вопрос о тех точках, которые находятся вне области АА’ВББ’, при применении
уравнений (XI, 2), (X1,3) a (XI,4)— B orawae or (XI, 5) —
легко разрешить с помощью рассмотренного в предыдущем разделе метода
обратного вычисления.
После расширения интервала параметра для стандартного вещества
можно получить область, ограниченную прямыми ЕЁ’ и РЁ”. При этом
на рис. 265 линии для всех веществ оказываются в области, в которой можно осуществить расчет 3. На рис. 266 этого расширения явно недостаточно. Таким образом, для того, чтобы линии, соответствующие различным
веществам, оказались в области применения уравнения вида. (Х[,5),
необходимо очень сильно расширить интервал изменения параметра стандартного вещества, что не всегда осуществимо, а если это возможно, то
связано со значительным уменьшением точности.
|
Разумеется, соображения о преимуществе уравнения (ХТ, 4) по сравнению
с (ХТ,5), изложенные в этом разделе, нельзя ‘распространить с
рассматриваемых нами веществ, обладающих аналогичным строением
и поэтому значительно отличающихся по летучести, на любые другие.
Так, если сопоставлять вещества, мало отличающиеся по точкам кипения, То отпадает вывод об ограниченности применения уравнения (Х1,5)
(см. пункт 1). Это относится, например, к сравнению изомеров, а также
веществ,
близких по летучести,
в последнем случае следует
зультатов вычислений).
но сильно отличающихся
ожидать
некоторого
по составу
снижения
(хотя
точности
ре-
ЭКСТРАПОЛЯЦИЯЗПО "ВЕЩЕСТВАМ
В расположении прямых, выражающих температурную зависимость давления насыщенного пара, существует определенная закономерность (см., например, рис. 265 и 266). В частности, можно предположить, что прямые будут пересекаться практически в одней точке. При
этом условии по одному экспериментальному значению для данного вещества можно было бы оценить Р — Езависимость для него на протяжении всего интервала сосуществования жидкости и пара. Это важно, так
как позволяет не только обобщить имеющиеся данные, но и вычислить
новые (для неизученных веществ). Если график строить в небольшом
масштабе и пользоваться неточными экспериментальными данными, то
надежность такого расчета оценить трудно. Но если воспользоваться
результатами точного измерения температурной зависимости давления
1 См. следующий раздел.
? Это наибольший интервал, который можно охватить упомянутым
обратного вычисления.
3 Кроме очень
небольших участков для очень немногих веществ.
выше методом
нара, в частности для н-алканов воспользоваться результатами, найденными в (18, 19, 28—30], то можно прийти к определенным выводам.
Пересечение указанных прямых в одной точке означало бы справедливость уравнения
|
By = К (1 — А. ),
(X1,17)
где А—
Ач
—
величина,
постоянная для данного ряда,
коэффициент наклона прямых.
Как
В. —свободный
член и
видно из рис. 267, допущение
пересечения прямых
в одной
к
Bar
точке является приближенным.
Оно может быть использовано
р
’
соседних
гомологов,
причем
ошибки будут
невелики
при
условии, что их молекулярный
вес достаточно велик.
Можно
предположить, что
это
заключение
справедливо
для подавляющего числа рядов,
причем полученный
результат
не зависит от выбора стандартного вещества. Это подтверждается произведенными расчетами, в частности и для рядов,
отличающихся от гомологиче-
только
< 5,5
Рис. 267. Зависимость коэффициента
К урав-
7
для
небольшого
числа
ских.
нения”(ХТ, 17) от числа
атомов
углерода п
в некоторых гомологических рядах углеводо-
Lo,
1 — 4-алкены (стандартное вещество 1-гептен); 2 —
1-алкены (н-гексан); 3 — 2-метилалканы (2-метилгек-
либо
для
родов [26, 31, 37]
сан); 4 — н-алкилциклогексаны (метилциклогексан);
5 — н-алкилциклогексаны (н-пропилциклогексан)
Однако хотя’`в общем
слуточки
пересечения
какойпрямой (например прямой
стандартного
вещества)
с
ПРрямыми,
другим
соответствующими
членам
данного
ряда,
не
совпадают, однако они изменяются закономерно; при этом чем ближе члены данного ряда (по свойствам и
структуре),
тем
закономернее
меняются
значения
4 .
I—B,, . Например, для
н-алканов изменение наиболее закономерно, а для цикланов и цикленов
(все атомы углерода в цикле) эта закономерность уже почти совсем не соблюдается. Можно заметить также, что изменение координат точки пересечения с числом атомов углерода трудно выразить простым уравнением.
Таким образом, допущение о пересечении различных Р — {-прямых в
одной точке в общем случае может привести только к приближенным результатам (см. также [11]).
Поэтому для надежной оценки Р — 1-зависимости неизученных веществ по аналогичной зависимости для других (изученных) членов того
же ряда следует рекомендовать другие методы экстраполяции, которые
излагаются ниже.
1
Первый метод экстраполяции основан на определении закономерностей изменения в ряду сходных веществ величины коэффициентов
А.
и
щества
Б.
уравнения
(ХТ,4),
12 Аа =а
Ва =
332
выраженных
как
функция
2. В частности, для этого можно рекомендовать
+ 9 ее -
a. + 65 ее -
с! 12? & - 4, 1538
со 12? в -
4$ |3 в,
параметра
[5] уравнения
ве-
(XI,18)
(ХТ,19)
где а:,
6,,..., ао, 6.,...— константы
для данного
ряда сходных
веществ
и
& — величина, указывающая место данного вещества в ряду. Для гомолотических рядов в качестве г можно выбрать число групп в алкильном
радикале
[2, 3, 8, 9, 10], для
галогеналкилов
—
порядковый
номер
гало-
гена [11], для веществ, отличающихся по изотопному составу,— массовое число изотопа [8] ит. д.
Возможность использования четырехчленных уравнений (Х1,18) и
(ХГ,19) для выражения закономерности в расположении 15 Т; — #Т.прямых рассмотрим на примере н-алканов. Для них эти уравнения имеют
ВИД
В. = — 0,6742276 -- 0,4316821 ]с п -- 0,7353146 15? п — 0,2285302 153 п
(X1,20)
Ig Aq = 0,0366804 + 0,0225607 lg n — 0,1035322 lg? n + 0,0182303
lg п;
(ХГ,21)
И
здесь п — число атомов углерода. Константы этих уравнений были вычислены методом средних значений на основании величин Аз и В. в ряду
н-С.Ну
—
#-C,.H 34.
С помощью уравнений (ХТ, 20) и (ХГ, 21) были вычислены для ряда
н-С.Нь — н-СН.. температуры кипения во всем изученном интервале
давлений. Сравнение результатов этих расчетов с экспериментальными
данными
представлено
в табл.
59.
Из
приведенных
величин
видно,
что
Таблица
Отклонение результатов расчета температур кипения некоторых
на основании уравнений
0,0011
0,041
0,4 | 1,01
С„Но„ |
(ХТ, 20) и (ХТ, 21) от наиболее надежных экспериментальных
данных (град) [11]
Р,
”
н-алканов
59
10
мм
рт.
50
ст.
100
Р,
200
400
760
2
5
атм
15
20
25
4| 0,0}—0,3}—9,3}
0,0|/—0,3|—0,01;—0,02/+-0,04/—0,04 oot
0,06 ++0,50)-++-0,55}-+-0,44 |+0,29
5|—0,5|—0,6}
0,0/—0,4|—0,1|+-0,07;—0,02| 0,03] —0,03/—0,01 !+-0,06|-+-0,07;—0,23;—0,41]
—
77 —}| — | — | — |] — |+0,10]+-0,02]-+-0,02!-+-0,02]-++-0,02!-+-0,05/-+-0,03/—0,04]
0,00}
gi — | —|— | — | — | 0,00/+0,04/-+0,01!
0,00/—0,014|—0,01!-+-0,05]-++-0,25/+-0,38}
9
40;
44]
42}
43}
АА
45}
46
— |} — | — | — | —
— | — | — | — | —
—
—
—
—
—
—
|
|
|
|
|
|
—
—
—
—
—
—
|
|
|
|
|
|
—]|
— |
— |
— |
— |
— |
—
—
—
—
—
—
|
|
|
|
|
|
—
—
—
—
—
—
|—0,70)—0,04)—0,03/—0,05/—0,01;
|-—0,04;—0,01/—0,01}
0,00)—0,03;
|—0,03/+-0,01/+-0,02!-+0,01/—0,03)
|—0,03/—0,01/-++0,05] 0,00]-—0,027
|—0,02]-+40,03/-+0,06/-++0,03) 0,00,
|-0,03]-+0,04/+0,06]+-0,04/—0,01)
[—0,03]-+0,03]-+0,05]-+0,03/—0,05)
|—0,07] 0,00/+0,04/+-0,02/0,06)
—
—
—
—
—
—
—
—
|
|
|
|
|
|
—
—
—
—
—}/
—
—
—
—
—
|] — |
| — |]
—}]
} — |
| — |
|} — |
—
—
— | —
— | —
~—
—
~]
—
~—
~]
] —
|] —
—
J] ~
|] —
~—
Это означает, что
данные
являются
достаточно
точными.
переход от индивидуальных прямых к системе прямых мало отражается
на точности результатов.
Установить точность результатов описанного метода расчета экстраполяции по веществам можно еще одним из трех следующих способов:
1) проверкой возможности экстраполяции по уравнениям вида (ХТ, 18)
и (ХГ, 19) на основании лишь части имеющихся данных (ограничиваясь, например, для н-алканов рядом H-C,H,,
— н-С:.Н.);
2) сравнением результатов расчета с данными, имеющимися в литературе (с вычисленными значениями);
вычисленные
23 М. Х. Карапетьянц
353
3) проверкой результатов расчета с помощью экспериментальных значений для высших гомологов, для которых есть единичные надежные
значения (для н-алканов — выше н-СвНза) [5].
Все три варианта проверки привели к вполне удовлетворительным
результатам. В табл. 60—62 приведены полученные таким образом значения коэффициентов уравнения (ХТ, 4), позволяющие рассчитывать температурную
зависимость давления пара неизученных соединений различных гомологических рядов.
2
Хотя из вышеизложенного следует, что описанный метод является довольно точным, но он имеет тот недостаток, что требует сравнительно большого количества исходных данных; вычисления показывают,
что если число веществ, на основании которых определены значения коэф-
фициентов
(ХТ, 18) и (ХТ, 19), слишком мало, то получаются уравнения,
недостаточно точные для широкой экстраполяции. Вместе с тем, трудно
назвать
какие-либо
другие
гомологические
ряды, кроме н-алканов и
1-алкенов, для которых в настоящее время имеется значительное число тщательно изученных веществ. Поэтому представляет существенный интерес
нахождение метода расчета, с помощью которого можно было бы осуществить достаточно надежную экстраполяцию по веществам в тех случаях,
когда мы располагаем небольшим количеством исходных данных. Было
установлено [5а], что для этого можно рекомендовать приближенное уравнение
12
Ти
=
4,
12
ТГ:
В, -
С,
12?
Ту,
(XI,
22)
в котором при данном давлении сопоставляются температуры кипения
веществ изученного’ряда с температурами кипения соответствующих членов сходного по структуре и свойствам стандартного ряда. Таким образом, уравнение (ХТ, 22) можно отнести к первому методу сравнительного
расчета,
т. е.
считать
его
частным
примером
соотношения
(1,
1),
когда
свойства веществ в нем сопоставляются в различных функциональных
шкалах.
|
Уравнение (ХТ, 22) целесообразно применять в среднем интервале давлений не только потому, что имеющиеся экспериментальные данные при
низких и высоких давлениях, как правило, недостаточно надежны, и на
погрешность результатов вычисления по уравнению (ХГ, 22) будет накладываться их ошибочность. Даже при высокой точности опытных данных
во всем интервале сосуществования жидкости и пара экстраполяцию на
низкие и высокие давления предпочтительнее осуществлять с помощью
Уравнения (ХТ, 4), так как это значительно упрощает вычисления без
ущерба для точности.
В качестве примера (ХТ, 22) укажем на уравнение
То,н„=—0,354165--1,2386191= Тонн» ,:—0,040557 192 Тони, (ХТ,23)
в котором при Р={ атм сопоставлены температуры кипения 1-алкенов
(изучаемый ряд) и н-алканов (стандартный ряд). Среднее отклонение от
экспериментальных данных составляет 0,03°.
Укажем также, что если коэффициенты Уравнения (XI, 22) onpeneлить, например, на основании данных для п = 6-10 и п = 6-:16, то.
различия в результатах окажутся весьма незначительными.
Среднее расхождение между расчетом по (ХТ, 22) и по уравнениям
вида (ХТ, 18) и (ХТ, 19) составляет для 1-алкенов при средних давлениях
0,05°. Таким образом, можно считать, что этот метод экстраполяции по
веществам не уступает по точности изложенному
354
в предыдущем
разделе.
Таблица
Значения
коэффициентов
n
уравнения
Ва
п
17 | 0,874286|
18
|0,866806 |
0,5444748
0,5742731
19
0,6023180
0,859712 |
(ХТ, 4) для выеших
20
0, 852968 | 0,6287803
21
0,846545 | 0,6538074
22 | 0,840444|
0,6775265
23
0,834555 |! 0,7000503
2А | 0,828942|
0,7214789
Ва
|
н-алканов
n
Ag
|
Ba
25 | 0,823562 | 0, 7418938]
26 | 0,818394 | 0, 7613773]
33 | 0,787117|
34 | 0,783226 |
0,8766357
0,8906373
27
35
0,779454 |
0,9047318
36
37
38 |
39 |
40 |
0,775795 | 0,9171481
0,772245 | 0,9297423
0,768796|
0,9448492
0,765443|
0,9535844
0,762482 | 0,9649288
0, 813426 | 0, 7799973)
28 | 0,808642 | 0,7978150]
29 | 0,804033 | 0,8148857]
30
|0, 799584 | 0, 8312600]
31
0, 795288 | 0,8469829|
32 | 0,791136 | 0,8620960}
Таблица
Значения коэффициентов
60
С„Н.„ +e [5]
уравнений (ХТ, 1) и (ХТ, 4) для 1-алкенов
(ХЕ)
С„Н.,
61
[33]*
(XI,4)
п
а
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
*
b
6, 76503
6 85658
6,92540
6, 78568
6 86573
6,90069
6, 93262
6, 95389
6,96036
6, 96662
6, 97522
6, 98563
7, 02005
7, 01555
7, 04437
Область
средних
с
590,388
798,456
961,437
1014,294
41152, 974
1257 ‚505
1353 ,486
1435, 359
1504 ‚872
1562 ,469
1619 , 862
1674, 744
1745 004
1781 ‚974
1843, 5841
255,684
248,584
243,977
229,783
225,849
219,179
212,764
205,535
197,578
189,743
482,274
475,214
170,475
162,585
157,947
|
Ag
Ва
40899124
1, 0604874
1, 0442856
1, 03079014
1,0163430
(1,0000000)
0,9854857
0,9708884
0,9575832
0, 9451604
0, 9335989
0, 9229666
0,9435108
0,9039478
0,8956492
—0, 5659243
—0, 3657649
—0, 2545688
—0, 1618066
—0,0790967
(0,0000000)
-+-0 ,0687730
0,4334978
0, 1914460
0, 2444045
0, 2929142
0,3374846
0,3768880
0,4455737
0,4498045
давлений.
Таблица
62
Значения коэффициентов уравнения (ХТ, 4) для выеших аминов н-С„Н»„ ; „МН: [3]
п
18
19
20
21
22
23
24
25
Ag
0, 94289
0, 94334
0, 93274
0, 93569
0, 92363
0, 92933
0, 94534
0, 92408
Ва
0,
0,
0,
0,
0,
0,
0,
0,
22571
23170
27233
26888
34447
30064
35292
32803
|
п
26
27
28
29
30
31
32
33
А
0,90778
0,91962
0,90080
0, 94588
0,89435
0,91270
0,88834
0,91000
Ва
|
|
|
|
|
|
|
|
0,38829
0,35187
0,42102
0,37275
0,45448
0,39445
0,47996
0,40746
п
|
|}
|
|
|
|
|
34
35
36
37
38
39
40
А
Ва
0,88269
0, 90772
0,87743
0,90575
0,87245
0,90409
0,86772
23*
0, 50670
0,42497
0,53191
0, 43493
0,55575
0,44643
0, 57835
355
(XI,
Так как последний член (ХТ, 22) относительно невелик
23) ), To для приближенного
расчета
нением
можно
‚
Ig Tu
=
A,
lg
T,
+
(см., например,
воспользоваться
,
ВБ.
урав-
(XI,
24)
Это не означает, конечно, что (ХТ, 24) получается из (ХГ, 22) путем отбрасывания
его
последнего
члена;
коэффициенты
(Х[,
24)
должны
опреде-
ляться непосредственно на основании опытных данных (например, с помощью метода наименьших квадратов), т. е. независимо от коэффициентов (ХТ, 22). В качестве примера укажем, что для Р=1 атм в рассмотрен-
ном случае
(ХТ,
24) примет
вид
lg Tc, Han = 1,023489 lg Tc,
Hon+2
— 0,06589.
(XI,
Погрешность расчета по этому уравнению для и == 4--16 невелика;
няя
ошибка
2.60
равна
0,13°.
Если
лк)
тервале давлений,
во всем
то эта
(среднем)
величина
сред-
ин-
ока-
Хотя в данном случае получились хорошие результаты, однако это не значит,
что при сопоставлении температур кипения в любых двух гомологических рядах
следует обязательно сравнивать вещества
с одинаковым числом атомов углерода
или числом СН.ь-групп. Так, сравнивая
температуры кипения 2-метилалканов и
2,90
2
|
осуществить
жется равной примерно 0,2°.
95
245-—
расчет
25)
н-алканов,
2 и
;
и с
от
9
2 3
(нтк н.
’?
имеющих
то
же
число
СН.-
22),
будет
групп, получим результаты, изображенные на рис. 268. Из этого чертежа видно,
что
C,
B (XI,
а уравнение
(ХТ, 24) не бу-
Рис. 268. Взаимосвязь между нор-
Дет справедливым.
Для выбора сопоставления, приводящего
к наиболее точным
результатам,
(`К) некоторых(сравнение
н-алканов и.2-метилалканов
членов
обоих рядов с одинаковым числом
цом ряду до тех пор, пока не получится
Прямая линия. Этот прием показан на рис.
мальными точками кипения Т.к
атомов углерода п) [26]
для 2-метилалканов
.
коэффициент
очень велик,
можно постепенно изменять п в стандарт-
269. Здесь линия / воспроизводит рис. 268,
т. е. отвечает сравнению значений | Г
со значениями [с Г; для н-алканов при Р=1 атм и при
одном и том же числе СН,-групп. Линии 1/—7/ соответствуют другим
вариантам сопоставления, которые поясняются в подписи к рисунку.
Изображенные на рис. 269 линии последовательно переходят от вогнутой
к выпуклой, давая лишь при одном сопоставлении прямую (линия IV).
Последней отвечают оптимальные условия применения уравнений (ХТ,22)
и (ХТ, 24).
|
Для отыскания оптимального значения п в стандартном ряду можно
поступить и иначе. Это видно на примере рис. 270, на котором сравниваются температуры кипения н-алкилкетонов СН.СОС,Нэ.+, и н-алка-
нов. Двойные вертикали соответствуют погрешности опытных значений
TcH,COC,Hon 443 B OTAWGMe OT вертикалей горизонтали — одинарные, так
как точность значений Гс.н., 42, относительно велика. В подобных слу-
чаях ввиду неопределенности значений абсцисс соответствующих точек
целесообразно пользоваться не ранее описанным методом определения п,
а нижеизлагаемым.
Соединяем точки пересечения вертикальных и горизонтальных прямых ' и продолжаем наклонные прямые до пересеч е1 Соединение производится таким образом, чтобы сумма квадратов отклонений от
середины интервала ошибок была бы минимальной.
356
ния их с горизонталями высших н-алканов (данные для последних заимствованы из [5]). Соединив эти точки пересечения, получаем 5-образные
кривые. Средняя часть последних, охватывающая примерно три вещества,
будет практически вертикальной. Середина вертикальных участков и
отвечает
оптимальным
условиям
сопоставления.
На
таким образом значению и соответствует жирная
рис.
прямая.
270 найденному
к) (CHls), CHLо Hones
260
РТ
2,00
215
7 6,20
Рис.
—
2,30
269.
ТУ
ние
Для
Взаимосвязь
н-алканов
—
н-С»Н.СиНоп
—_
240
между
|
2.20
У
Mon
нормальными точками
и 2-метилалканов
1;
LG Tar)
—
еще более приближенных
СН
СиНои
2ne2
кипения некоторых
(СНз)»СНС„Нои..
т;
У1
—
—_,
2,70 *
a
,
2,60
[26]
n-CsHi1CnHonty
расчетов можно рекомендовать уравне-
12 Ти = Ay lg Ty + Bi,
(XI, 26)
коэффициенты которого приняты независимыми от давления (в ‘среднем
интервале давлений). Допущение зависимости А! и В, только от природы ряда значительно упрощает вычисления, так как позволяетв широком интервале давлений пользоваться одним уравнением. Точность расчета по (ХТ, 26)
иллюстрируется рис. 271 на примере 1-алкенов и н-алканов, для которых
средняя ошибка составляет 0,4—0,5°. Это означает не только, что линии,
соответствующие уравнению (ХТ, 22), не имеют значительной кривизны,
но и то, что они для разных давлений почти совпадают. Кроме того, справедливость (ХТ, 26) свидетельствует о том, что при правильном выборе
сопоставляемых пар веществ линии, соответствующие уравнению (ХТ, 4),
для разных веществ почти совпадают. Таким образом, рассмотренный вариант расчета отвечает описанным в главе УПП случаям практического
слияния прямых в одну прямую, а уравнение (ХТ, 26) — сочетанию
первого и четвертого методов сравнительного расчета.
Условие применения (ХТ, 24) является более жестким, чем условия
применения (ХТ, 4); только тогда, когда значение п очень близко к оптимальному (А = -|- 1), оно приводит к практически правильным результатам. Это согласуется с выводом, к которому мы пришли ранее, что оптимальное условие отвечает середине вертикального участка, образованного примерно тремя точками.
357
Ta
п
n+2
9
Ц
5
6
7
8
2,8
27
2,
2,99.
2,60
ЦТ
2,65
2,70
2,75
CHyCO ChHons)
Puc. 270. Cpasnenue Touek KuuenuA 7 (°K) ketonos CH3COC,H,,,,,
и н-алканов С„Н.„.. при различных условиях
lg 7 С
2807
non
270
260
у
2,90
240
,
2,30
[
2,30
240
J
|
|
250
250
aa
2,70
250
Ja CH Hanez
Рис. 271.
и
Взаимосвязь между температурами кипения
1-алкенов
при различных
‘O — 760; @
— 400;
Т’ (°К) н-алканов
давлениях Р (мм рт. ст.)
a — 100; В — 50 мм рт. ст.
|
Применение описанного метода для других разветвленных алканов
подтвердило большие его преимущества: даже в тех случаях, когда в стандартном ряду число изученных веществ ограничено, а в рассматриваемом
ряду равно только двум, т. е. применение (ХТ, 24) исключено 1, уравнение (ХГ, 26) позволяет этот вопрос разрешить успешно.
Уравнения (ХТ, 22), (ХТ, 24), (ХТ, 26) и (ХТ, 4) позволяют вычислить
температуры кипения в гомологическом ряду на основании небольшого
количества исходных данных. Так, пользуясь (ХГ, 26) и (ХТ, 4), можно
рассчитать температурную зависимость давления пара всех членов данного гомологического ряда при всех давлениях, если известно по одной
точке для каких-либо двух членов ряда (при одинаковых или разных давлениях) или две точки одного члена ряда.
Приведем пример. Для 1-октена при давлении, равном 50 мм рт. ст.,
{ = 45,86° С [29] и для 1-тетрадецена при Р = 760 мм рт. ст., Е = 254,40°
[27]. На основании этих данных получаем
Ig Tc
nHen
—
—
0,04571 -|- 1,01606
Ig DC Hone"
(XI,
21)
Пользуясь этим уравнением, можно: вычислить температуру кипения в
среднем интервале давлений для всех 1-алкенов (п = 6-16) со средним
отклонением, равным 0,5° [5а].
На основании полученных таким образом результатов можно с помощью уравнения (ХТ, 4) произвести экстраполяцию по параметрам и
получить данные по давлению пара для всех веществ во всем интервале
сосуществования жидкости и пара.
3
Третий, метод экстраполяции основан на сопоставлении при
двух давлениях температуры кипения различных веществ, находящихся
в одном ряду сходных соединений:
Ig
он
отвечает
обычно
третьему
данные
уравнением
(ХТ,
по
Гр,
методу
=
T p, + Bs;
сравнительного
нормальным
28) удобнее
Аз 1
точкам
пользоваться
расчета.
кипения
в виде
lg Tp = Aglg T py + Bs.
Ввиду
наиболее
(XI,
28)
того,
что
достоверны,
зависимости
(XI, 29)
Применяя этот способ, можно одновременно экстраполировать и по
параметрам. Он отличается от первого тем, что в него не входит экстраполяция коэффициентов уравнения для экстраполяции по параметрам, а
тем самым предварительное определение температур кипения различных
веществ
при
различных
давлениях.
Рассмотренный
способ
применим
даже в тех случаях, когда температура кипения низших гомологов известна лишь при одном давлении (кроме нормальной точки кипения).
Очевидно, располагая столь незначительным количеством исходных данных, нельзя получить точных результатов с помощью первого способа.
Поэтому рассматриваемый способ особенно полезен при изучении малоисследованных рядов веществ. Для расширения возможностей применения уравнения
(ХТ, 28) или, в частности, (ХГ, 29)
обе его стороны должны
быть представлены веществами, принадлежащими к двум сходным рядам;
в этом случае уравнение (ХТ, 28) примет вид
(Тр,)т = А (Тру -
В.
(ХТ, 30)
1 Так как, с одной стороны, через две точки всегда можно провести прямую, а
< другой, отсутствие надежных данных для высших членов стандартного ряда не позволит получить нужного пересечения.
359
Для
выбрать
получения
точных результатов здесь также важно правильно
сопоставляемые вещества. Метод выбора аналогичен показан-
ному на рис. 269.
В уравнении (ХТ, 20) температуры
наковом давлении,
ния более точных
кипения
сопоставляются
290?
8
19т
;
—
Е
©
Е
Е
ge
при оди-
в (ХГ, 30) — при различных давлениях; для получерезультатов, как и в случае применения уравнения
ess
" “>
“>
в
“>
БЕ
Е
Е
п
9
7
10
12
14 16
+
&
с
©
Е
|
280+
ip 2,60
2,60
A
2,70
т
a
г
8
°
|
||
2,50
ии 7 я
и
ии
Г
ИИ
их
A
Z260r
=
Yi
и
р
=” 2,50
4,
/
/
и
и
- 246
Е
$40
|
240
|
2,50
Ig
рт. ст. и THOapupos C,, Hy, ,SC, Hon.
давлениях
2,37
260
Jo. 760MM
эфиров C,,H,,,,0C,H,,,, upu 760.1%
различных
|
2,60
(Fo, Homes Satan
Рис. 272. Взаимосвязь между температурами
кипения
Т(°К)
простых
при
Ж
250+
2 7
tg (7, CMe nee
) sous
Рис. 273. Взаимосвязь между температурами
кипения Т (°К) н-алканов при 760 мм рт. ст.
и членов некоторых
рядов
при
других
различных
А —
1-алкены,
ны,
Е —
5 атм;
Д — н-алкилциклопентаны,
760 мм;
н-алкилциклопентаны, 400 мм; Ж— н-алкилбен-
гексаны,
50 мм;
100 мм
В —
рт.
ст.;
гомологических
давлениях
1-алкены,
золы,
Б —
н-алкилцикло-
10 мм;
Г —
1-алке-
50 мм
(ХТ, 26),
следует пользоваться трехчленным уравнением
(12 Тр) = А! (1 Тодт
В: -{ С, (15? Тот.
(XI, 31)
Оно соответствует уравнению (ХТ, 22), но преимущество (ХГ,31) заключается в том, что для стандартного ряда требуется знание данных только
при одном давлении;
тем самым облегчается задача выбора ряда, наиболее
близкого к изучаемому.
|
Уравнения (ХТ, 30) и (XI, 31) были применены дяя расчета темпера
тур кипения тиоэфиров при различных давлениях. При выборе в качестве стандартного ряда эфиров (рис. 272) полученные результаты оказались
более точными,
чем при использовании
н-алканов.
На рис. 273 приведены
некоторые результаты применения уравнений (ХТ, 29) и (ХТ, 30) для различных групп органических соединений.
Закономерности изменения коэффициентов можно изучать двумя способами. По одному из них составляются уравнения для различных давлений и находят зависимость коэффициентов от давления; это позволяет
360
рассчитать температуру кипения не только при изученных, но и при других давлениях. По другому способу составляют уравнения для различных
сходных рядов и определяют зависимость значения их коэффициентов от
параметра вещества 2, характеризующего особенность каждого ряда; выразив эту зависимость в явном виде, рассчитывают температуры кипения
в различных, в том числе неизученных, сходных рядах.
Применение второго способа наиболее целесообразно, по-видимому, для
двухкомпонентных систем. При расчетах можно поступить следующим обра-
зом. Изучив системы, состоящие из компонента А и других сходных между
собой соединений
(В1,
Во,
В.з....),
т. е. системы А —В!:, А—В.,
А-В....,
находят зависимость коэффициентов уравнения для этих систем от параметра, характеризующего вещества В,,В., Вз...; после этого нужно заменить
первый компонент в ряду сходных веществ (т.е. изучить системы А! — В;,
А. —В;,
А,— В,
изменения
...,
где
#=
этих коэффициентов
1,
2,
3,...)
в этом
и исследовать
закономерности
ряду.
4
В тех случаях, когда неизученные вещества чередуются с изученными, рекомендуется сравнивать температуры кипения четных и нечетных членов гомологических рядов (CM. стр. до сл.), т. е. пользоваться уравнением
lg Tomit= Arlg Tom
+ Br + Cy lg? Tom.
(XI, 32)
Этот метод, который можно считать и методом. интерполяции
по веще-
ствам, весьма удобен. Для приближенного расчета или в случае отсутствия очень точных исходных данных уравнение (ХТ, 32)
целесообразно
применять
в
виде
Ig
Toms1
=
A,
Ig
lomit
=
A,
tom
Tom
+
B,
(XI,
33)
(XI,
34)
ИЛИ
+ B,.
Расчеты показывают, что для различных рядов соединений экспериментальные точки отклоняются от прямой примерно на одну и ту же величину, причем отклонения тем меньше, чем ближе свойства различных
рядов.
5
Для многокомпонентных систем можно рекомендовать уравнение
12 Ух, = А’
Ух + В’
С' 19° Ух (2 = 25),
(XI, 35)
где Х, У и
— давление пара Р, температура кипения Г или концентрация с. Уравнение (ХТ, 35) может быть использовано в одном из шести вариантов, приведенных в табл. 63.
Выбор того или иного уравнения при решении конкретной задачи
определяется следующим: исходные данные должны быть удобными для
применения
[например, если они изотермические,
можно
применять
уравнения (ХТ, 39) или (ХТ, 40)], а коэффициент С’ должен иметь наимень-
шее
значение.
При
соблюдении
этих
условий
результаты
расчета
будут
наиболее точными. При небольшом значении С в ряде случаев можно воспользоваться уравнением
12 Ух, = Ав Ух -- Вь (2, =),
являющимся
примером
шестого
метода
сравнительного
(ХТ, 42)
расчета.
Области применения уравнений (ХТ, 35) и (ХТ, 42) могут быть расши-
рены
как
путем
изучения
зависимости
их
коэффициентов
от Х,
так
и
361
Различные
варианты
уравнения
(ХТ,
Таблица
63
|
(XI,
36)
(XI,
37)
35)
Переменные
x
Y
Z
Уравнение
с
.Т
Р
gt
P
T
С
12Тр
T
с
Р
19 ст, = А’
P
ec .|
= A’ |g Те, + B’ + C’ Ig? То,
=
Ig Тр,
+ В'- С’ lg? Тр,
|
ст, + В’ С' 19° ст,
(XI, 38)
T
Igcp =A’ lg Cp, + B+
C' lg? Cp,
(XI,
39)
с
Р
Т
Ig Р., = 4’ 18 Ре, + B’+C’ lg? Pa.
(XI,
40)
T
P
с
Ig Pp, = A’ lg Pp, + B+ Clg? Pr,
(XI, 41)
путем сравнения значений | У не для
т. е. при использовании
уравнения
одной, а для двух сходных систем,
(lg Yx,)1r = A" (Ig ¥x,)1 + BY + C" (Ig? Yx,)1
ИЛИ
(2
Ух,) т
—
A”
(lg
Y x,)1
+
(ХТ, 43)
В".
(XI,
44)
В обоих случаях коэффициенты при квадратичном члене очень малы. На
рис. 274 приведены результаты расчета по уравнению (ХТ, 40) для смесей
CH,COCH, + H,O (два летучих компонента) и‘по уравнению (ХГ,36)
для смесей Ма] — Н.О (один летучий компонент). В обоих случаях С” — 0.
р
#0
И
10005
800
7
H0
2
00 100
200
42,59
600
#00
- 2,98
=" 200
42,57
7100
39
12°
ad
60
и
3
$
=
42 199 а=
20
294
4253
42,52
|
2,520
Рис. 274. Взаимосвязь
‚ 362
{
}
2,54
255
lg Te,
i
256
]
257
251
между давлением Р (мм рт. ст.) воды и водных растворов ацето-
на при различной концентрации
раствора
{
253
иодистого
(а) и между температурами кипения Т (°К)
натрия
при
различной
концентрации
(6)
водного
Следовательно,
можно
воспользоваться
уравнениями
вида
(ХТ,
36)
и (ХГ, 40), пренебрегая третьим членом правой части. Эти примеры уравнения (ХТ, 42) при У = Те, Х = с (0 =Р)иТ = [Р,Х = с(2 = Т) были
описаны В. А. Киреевым (см. стр. 144, 145).
6
Описанные методы экстраполяции по веществам можно использовать только для весьма близких по свойствам соединений (например, для членов изоструктурного ряда). Но существует много изученных
веществ, объединить которыев группы сходных веществ не представляется
возможным. Для них применение комбинированного метода ограничено
лишь
интерполяцией
и экстраполяцией
по
параметрам.
Так, изучено немало разветвленных алканов, но лишь немногие из
них
можно
сгруппировать в изоструктурные ряды. Поэтому возникает задача
отыскания
способа
расчета
температурной зависимости
давления пара для веществ, не образующих такие ряды, но имеющих известное структурное сходство.
Для этого можно изучить связь между температурой кипения и строением вещества. Одним из возможных вариантов является исследование
влияния инкрементов структурных групп (атомы, ионы, радикалы, связи) на температуру кипения. В числе других методов можно рекомендовать следующий [6].
Сгруппируем разветвленные алканы таким образом, чтобы в одну группу входили все вещества, являющиеся производными данного н-алкана.
Для того, чтобы на основании температурной зависимости давления
пара некоторых из них рассчитать эту зависимость для всех других членов группы, можно применить уравнение
AlgT = DS} AlgT; + 3} 4;.
i
i
|
(XI, 45)
Левая часть уравнения представляет собой разность логарифмов температур кипения данного изоалкана и отвечающего ему н-алкана (стандартного вещества),
гарифмов
н-алкана,
ние
на
первый
член правой части является
суммой разностей ло-
температур кипения соответствующего моноалкилалкана и
а второй член — суммой инкрементов, характеризующих влия-
температуру
кипения
замещений
в нормальной
цепи
(при
этом
подразумевается постоянство давления).
Значения ДТ; и 0; вычисляются по имеющимся экспериментальным
данным. В качестве примера в табл. 64 приведены значения коэффициентов уравнения
(ХТ, 45) для алкилпентанов
будет ясен из дальнейшего).
Поясним уравнение (ХТ, 45)
этого вещества оно примет вид
Ig Г 2,2-диметилпентан ~~ Ig Г н-пентан
где
AlgTomernn
=
lg
на
2A
—
To-merannenran
—
(смысл входящих в нее величин
примере
2,2-диметилпентана;
Ig Г 2-метил +
Ометил-метил
12 Тн-пентан
И
(а),
Ометил-метил (а)
для
(XI,
46)
—
по-
правка на влияние СН.-групп, расположенных по обе стороны главной
цепи друг против друга *.
Если в данной молекуле количество и характер расположения боковых
групп
таковы,
что имеет
место два или
большее
число
влияний
одного
и того же типа, то эти группы будут ослаблять взаимодействие. Предположим, что каждое новое влияние вносит поправку вдвое меньше предыдущего.
цепь
ТТ. е. группы, находящиеся при
не учитывается).
одном
и том же
атоме
углерода
(сама главная
363
Таблица
Коэффициенты
уравнения
(ХТ,
45)
для
_
изопентанов
Р, мм
Вещества
[6]
рт. ст.
50
100
400
760
н-С5Н12
2,39393
2,41587
2,46486
2,49030
AlgT | 2-Merum
3-Метил
3-Этил
0 ,03336
0,03744
0,07603
0,03318
0,03697
0,07562
0,03284
0,03672
0,07447
0, 03274
0,03664
0, 07393
leT
6
Метил-метил
(5) *
0,00024
Метил-метил (В) **
***
расположены
расположены
Группы
расположены
0,00028
0,00027
0,00022
—0,00977 | —0,00934 | —0,00874 | —0,00845
Метил-метил (7) ***
Метил-этил (В) **
Этил-этил (1) **
* Tpynuh
** Группы
64
—0,00624 | —0,00625 | —0,00610 | —0,00606
—0,00995 | —0,00950 | —0,00863 | —0,00820
—0,01833 | —0,01765 | —0,01629
—0,01560
у одного атома углерода главной цепи.
у соседних атомов углерода главной цепи.
у атомов
углерода,
расположенных
через
один в главной
цепи.
Если боковые группы расположены не у соседних атомов углерода
главной цепи, а через один, а при этом между ними также находятся какие-либо заместители, то будет наблюдаться эффект экранирования. В таких случаях значения 0 следует уменьшить на некоторую величину а.
Значения & в среднем интервале давлений можно вычислить по уравнениям
a = 0,902 + 0,00316 lg P
(одна промежуточная
метильная
(XI, 47)
группа) и
х = 0,416 -- 0,040 = Р
(две
(ХТ,
промежуточные метильные группы).
Поясним это на примере. Для 2,2,3,4-тетраметилпентана
45) примет
вид
Ig T’s,9,3,4-rerpamerunueHtan
+
+
На
(XI, 48)
(1 +
1
2
(3
Ig Г э-метил
1
J) Smerua-nern
+
оснований
данных
+
Ig
(Y) +(4
табл.
Ig T’s,,3,4-verpamMeruanenTan
=
Тз-метил)
+
Ig
+
1
5 (0,902
Т „-пентан
0,00316
64 находим,
что при
=
(3.0,03271
2,49030
+
+
Ометил-метил
+
уравнение
(а)
+
Ig Р)быетил-метил (В).
Р == 760 мм
+
0,03661)
+
+ (—0,00845) + +.0,00022 + 5.0,914 (—0,00608) = 2,60869,
откуда
12 2.3,4-тетраметилпентан
—
406,15—273,16
что практически совпадает с опытной величиной
=
132,99° C,
133,016° С
[30].
Аналогичный расчет для 16 других алкилпентанов, для которых
есть надежные экспериментальные данные, привел к среднему расхож-.
364
дению в0,3°; для
птанов —0,5°.
алкилгексанов
эта
величина
равна
0,6°, для
алкилге-
Возможности расчета по уравнению (ХГ, 45) можно существенно расширить, если установить зависимость ДТ; и 0; от структуры соединения. Покажем это на примере н-алкилалкенов-1, взяв за основу опытные
данные по Гнлт.к. для С.Н. —— СоНзз, найденные в [31—40].
Обозначим через и, А и т число атомов углерода соответственно в глав-
ной цепи,
в боковой цепи и в главной цепи до начала
к которому присоединена
ответвления
(вклю-
боковая н-алкильная груп-
‚=
чая атом углерода,
па):
C—C——¢_...
|
C=C—C—C—C—C—C~—.-.
ener
ee
ee sn
a
eee”
т
—
aS
—
—
n
Эчевидно, наиболее простым будет влияние на Л 18 Т; ид, величин пи_;
поэтому ограничимся лишь их рассмотрением. По мере удлинения главной
цепи относительное влияние заместителей уменьшается; поэтому с возрастанием п величины А1Т;
должны падать; это хорошо согласуется
< опытными данными. Характер этой зависимости позволяет рекомендовать для ее описания уравнение типа уравнения Антуана, т. е. считать,
что для данного (постоянного) значения т = т
и К = К, справедливо
соотношение
В
(А
Так,
например,
для
Ig
Тм,
ко —=
71 =2 и
1
—
№ =1,
и
т.
.
(XI,
49)
(XI,
50)
е. для
С
|
C=C—
можно
рекомендовать
Cre
He (п-2)+1
уравнение.
(А lg Tie
=—
0,005956
0,239914
+ п— 0195043
,
расчет по которому дает результаты, совпадающие с экспериментальными
данными в пределах погрешности последних.
Для вычисления А [с Г; при разных значениях т и п можно воспользоваться и сравнительным методом расчета, т. е. уравнением
Так,
рассчитав
различных
по
значениях
для
т=з3
и
+
(ХТ, 51) значения
п,
можно
C=C
т. е.
O
k,n =
(А Ig Гут,
k=1
С
|
—C—
при
(XI,
Be (A lg Di) mg,’ tos n>
А] Т; для
вычислить
т=а
А] Г; для
и
№ =1
при
Cn-sHe(n-s) 41»
различных
значениях
п
по уравнению
(A lg ТГ, в = 0,7200 (А 18 Гол, п.
Было установлено также, что коэффициенты уравнения
ются линейными функциями вида
И
91)
(ХТ, 52)
(ХТ, 52)
явля-
9х = аз - Вз-А
(ХТ, 53)
Bo —
(ХТ,
04 +
Ba lg К.
54)
365
Так,
для
Cy Hers
G=C
т.
е. для
m=
|
—Си-2Н2
(n-2)+19
2,
а» —= —0,0125 -+ 0,0125 2,
|
(ХТ,55)
Bp = 1,000 ++ 1,95015 А.
(XI, 56)
Для расчета значений 6', = ] (п) также можно воспользоваться уравнением типа уравнения Антуана, т. е. считать, что
8; =
—
№8
(XI, 57)
n—%s5°
Вследствие недостатка опытных данных это уравнение удалось проверить.
лишь для двух случаев:
0,00934
бъетил-метилео) =| 0,0055 — ору
|
и
0,009646
7—
Ометил-метил(а) = 0,00215 — 3,0
(XI, 58)
(ХТ, 59)
°
Рассмотрим этот метод ‘расчета значений ДТ; и 0; на двух примерах.
Вычислим нормальную точку кипения 2-этилдецена-1. Для него т = 2,
Е =2
и п=10.
С помощью
уравнения (ХТ, 50) находим
сначала
АТ,
для 2-метилдецена-1: (15 Т+)2 1,10 =0,018513. Затем по уравнениям (ХТ, 53}
и (ХТ, 54) определяем значения о›= 0,0125 и В. = 1,5870. Подставляя последнее в (ХТ, 51), находим (А 15 Г)2,2,1о = 0,04188. Так как (1. т. к)1-децен =
= 170,570 [29], то 15 Т>,›1о = 2,64712 -- 0,04188 = 2,68900
децена-1
чиной
{.т.к = 488 ,7—373,2 —= 215,5°С,
216°С,
рекомендованной
что хорошо
в литературе
[34].
и для 2-этил-
согласуется с вели-
Теперь определим #.. т. к для 2, 3, 3-триметилбутена-1; здесь т = 2, А =1
ип = 4. Из уравнения (Л 15 Г:)21 = / (п) получаем (А 15 Т;) = 0,05710, а из
(ХТ, 51) (А1
Т}:з,1,1 = 0,04111. По (ХТ, 58) дыетил-метил(у) = —0,00721, по
(ХТ, 58) дметил-метил(а) = —0,1056. Заимствуя для 1-бутена из [37] значение
{1 тк=-6,25°, получаем для 2, 3, 3-триметилбутена! 12 Гн.т.к =2,42635-+ 0,05710-+ 0,04412.2—3/,.0,007214—0,01056 = 2,54430 и щ.т. к = 77,0? С;
по опытным данным имеем 77,9 [35].
Увеличение А (при данном значении т и п) естественно приводит
к возрастанию величин А]2 Г;.
можно
воспользоваться
Для
—
(A lg Ti)miny =
(Alg
и
расчета
уравнениями
Li), п"
=
OL,
PLvy ;
k—
+ В.
a, = a+ Bin
Ва
зависимости
(A Ig T's) mg,ngsFke9
гв
04 — ор.
АТ;
от К
(XI, 60)
(XI, 61)
(XT, 62)
(XI, 63)
Эта совокупность уравнений подобна совокупности уравнений, примененных для расчета зависимости Д12Т; от п, с той только разницей, что
уравнение зависимости В’, от п сложнее зависимости В.» от К.
Результаты расчета по обеим группам уравнений хорошо согласуются
друг с другом при сравнительно небольших значениях тип.
Если же по366
следние очень велики, то расхождение становится существенным. В таких
случаях
предпочтительнее
пользоваться
He
уравнениями
(XI, 49),
(ХГ,
51), (ХЬ
53) и (ХТ, 54), так как опытные данные,
лежащие
в основе
уравнений (ХТ, 60— ХТ, 63), менее точны.
Описанный метод может быть применен двояко. Если известно строение данного вещества, то можно найти для него Р — {-зависимость. Так,
имея данные по температурной зависимости давления насыщенного пара
нескольких сходных веществ, можно на основании этих данных определить значения соответствующих коэффициентов уравнения (ХТ, 45), а
с их помощью найти Р — {-данные для неизученных сходных веществ.
С другой стороны, так как этот метод связывает температуру кипения
со структурой веществ, то можно решить и обратную задачу — на основании
Р — {-данных
проверить или предсказать структуру данного
соединения.
|
ЭКСТРАПОЛЯЦИЯ
ПО
СВОЙСТВАМ
Для экстраполяции по свойствам
тым методом сравнительного расчета [12].
В
главе
свойства,
ГУ
отмечалось,
зависимость
соотношением
что
которых
^
можно
существуют
от параметров
а=Ее
воспользоваться
многие
и
пя-
физико-химические
И
можно
выразить
keg
п.
(XI, 64)
Если (ХТ, 64) справедливо для двух свойств G’ u G’’, то сравнение значений этих свойств при данном значении Д приводит к уравнению
lg G" = Aslg G’ + Bs.
(XI, 65)
Так как температурная зависимость давления насыщенного пара приближенно также выражается соотношением (ХТ, 64), то можно говорить о
существовании зависимостей вида
|
с их
IgG = Ajlg P+ B;;
помощью
можно
осуществить
(XI, 66)
экстраполяцию
по
свойствам.
Дейст-
вительно, такие зависимости описаны в литературе (см. главу У). Они рекомендованы
для
нескольких
частных
случаев:
@ —
растворимость
[41],
константа фазового равновесия [42], константа Генри [43], константа скорости реакции [44], константа ионизации [44], вязкость [45], коэффициент
диффузии [46] 1.
Для повышения точности экстраполяции по свойствам можно рекомендовать два соотношения, отвечающие второму и пятому методам сравнительного расчета в различных функциональных шкалах:
И
f(G") = Aof(G’) + Be + Cof? (G’)
1 (") = Аз) (6) + Вь- СР (6).
`В частности, при экстраполяции по свойствам
ных можно воспользоваться уравнениями
на
(XI, 67)
(ХТ, 68)
основании
Р — {-дан-
(а)= 4.1 РВ.
- С.15?Р
и
/(G)=AslgP+B,+C;lg?P.
(ХТ, 69)
~
(XI, 70)
+ Напомним два обстоятельства: уравнения (ХТ, 65) и, в частности, (ХТ, 66) могут
оказаться точнее, чем экспоненциальные зависимости (ХТ, 64), вследствие некоторой
взаимной компенсации неточности последних, и уравнения (ХТ, 65) и, в частности,
(ХТ, 66); могут привести к значительным ошибкам, если С’и С” будут по-разному меняться с изменением Ц (стр. 183).
367
В первом из них сравниваются давление насыщенного пара и свойство @
ряда веществ при постоянной температуре; во втором — давление пара и
свойство @ данного вещества при различных температурах. В большинстве случаев в (ХГ, 69) и (ХТ, 70) можно принять
1(@) = 150.
|
(ХТ, 71)
На рис. 275 сравнивается давление пара и вязкость для некоторых рядов веществ при постоянной температуре. Из рисунка видно, что в
данном случае коэффициенты С в (ХТ, 69) и (ХТ, 70) невелики. Однако
пренебрежение ими в общем случае в широком интервале условий, да
|
р
02
200
Ц
OOF
Я
20,р
И
100
47000
80
4800
60
| 609
LO
A
|
АН
0
10
19Р
20
_
930
4400
20
+200
10
8
6
4700
480
460
г
Ал
440
ВЕ
- 20
7h
0,8
470
0
"
bo)
ТОВ
04 G6 0B
!
20
|
0
401
Рис. 275. Взаимосвязь“между вязкостью 1 (см3/сек) и давлением насыщенного пара Р (мм рт. ст.) в некоест
торых рядах сходных веществ
А — 1-СиНои, @ = 50° С);
‘CnHont,
Г-—ч-С.Н
niente
(80);
Б— СН.
В — 1-СиНои (100);
(50); Д
— n-C,Hon+o
nevenre
(100)
10
2,0
3,0
40
Рис. 276. Взаимосвязь между давлением насыщенного пара Р (мм рт. ст.) и теплотой парообразования АНц.р (ккал/моль)
А — 1-алкены — 1-алкены;
1-алкены;
ны — н-алканы;
каны;
Е —
Б — 2-метилалканы —
В — н-алканы — н-алканы;
—Д —
2-метилалканы —
2-метилалканы
атомов
—
н-алканы.
Г — 1-алке-
2-метилалп —
Число
углерода
еще при наличии очень точных опытных данных может привести
грешности, превышающей ошибку экспериментального материала.
Описанные методы можно распространить на два вещества или
т. е. могут быть рекомендованы уравнения
к поряда,
1 (Ск) = 4418 Ри - В + С.19? Ры
(ХТ, 72)
f (Gu) = Arlg Py + By + Cylg? Pr.
(XI, 73)
Как уже отмечалось, под С подразумевается не только свойство определенного вещества или ряда веществ, но и характеристика процесса,
в частности, химической реакции. Подобный пример показан на рис. 276.
368
0
30
-10
о
-20
та
-30
2
-40
Т
-50
7
-60
Т
2,0-
-720
|
1
]
2
‚ОЕ
CKO
с.
ow)
о
0
о
a
.
“L0F
a
0
>
}
i
9
é
|
y
1
С
5
|
|
—__—|
7
6
Рис. 277. Взаимосвязь между константами равновесия реакций
образования соединений из простых веществ К и давлением насыщенного пара ртути Р (мм рт. ст.), различных соединений
1 —
(величина,
нонан
на оси абсцисс, равна —41); 2 — 1-бутин (--12);
(—3);
5 /— 2-бутин
(+18); 6 —
приведенным
к значениям,
прибавить
следует
которую
8 — ч-С» На.(—82); 4 — метан
гиклопентан,
(-- 14); 7 — бензол (—78);
8—этен (—10)
4
mae
36т
20T
10}
Т
180
1204 140т 160
4O7 50 60} 70T 8090109
T
т
T
|
тт
505
als
,
7
200
о
(19 ri
100
:
y,
50
20
с
d
74
15
710
i3d
®
9
0
2
]
5
L
|
И
|
16
20
50
i
100
200
Lo
t
i
\
|
500 1000 2000
5000
HAC
Рис.
1—
278. Взаимосвязь между давлением насыщенного водяного пара Р (мм
рт. ст.)
и константой скорости некоторых реакций к при различных температурах
H,As0,+
J, + H.0 > H;AsO,-+
ножить на 10-1); 2 — СН.
СН»)
2J- | 2Н+
(значение,
приведенное
— (СН) М(СН,)3 -7-(40-‘);
на
оси
ординат,
следует
3 —2H,0, > 2H,0 + 0,(10-%);
ум-
4—
C.H,COOH + CH,OH > C,H,COOCH, + H,0 (10-5); 5 — NH:NO,+N,0 + H20 (10-%); 6 —-CHsCOOC,Hs+
+ H,0 + CH;COOH + C,H,0H , (10-5);} 7 — C.H,CC,H; > C,H;C0(10-5); 8 — 2NO + Cl, + 2NOCI
-NOC,H,(NO,)3
CaHsNC.H2(NOz)s
(1); 9 — CH,COOH + (CH;),CHOH — CH,COOCH(CH;)2-+ H20 (10-"); 12— COOHCHCICHCICOOH
+
+H,0 — COOHCCICHCOOH -+ H;0+ + Cl" (10-*); iW — Cl(CHs),SC.Hs > ПОНИ ВОНЫН-НОТ 4079 ;
12— 5:0,
24
М. Х. Карапетьянц
+Н:0 +0,
+50,
РН (10-*)
369
Учитывая вероятную неточность определения теплот парообразования
можно считать, что коэффициент Ст в р(ХГ,3) равен нулю.
Применение этого метода для расчета константы равновесия реакции
образования некоторых углеводородов по давлению пара иллюстрируется рис. 277, а для сравнения давления пара и констант скорости химической реакции — рис. 278. Последние два примера уравнения
(XI,66),
как уже упоминалось, были рекомендованы ранее [44].
РАСЧЕТ
ТЕМПЕРАТУРНОЙ
ЗАВИСИМОСТИ
ВЯЗКОСТИ
Частично комбинированный метод расчета
вычисления зависимости вязкости от температуры
для
рядах
На
[47—51].
Ниже
изложены
основные
результаты
ЖИДКОСТЕЙ
был использован
в гомологических
этого
расчета.
основании анализа различных уравнений для приближенного расчета температурной зависимости вязкости жидкости было рекомендовано
сочетание интерполяционного
Ign=a+
И
экстраполяционного
b
ay
(ХТ,74)
Tx = Au + By t re
(XI,75)
уравнений. Первое из них является одним из видов соотношений типа уравнения
Антуана
[52]. Уравнение
(Х1,75),
рекомендуемое
для экстраполя-
ции как по параметрам, так и по веществам, в котором при одинаковых
значениях вязкости сопоставлены температуры данного (№) и стандартного (М) веществ, можно рассматривать как частный пример уравнения
типа уравнения Дюринга [53], усложненного поправочным членом.
Высокая точность интерполяции по параметрам с помощью уравнения
(Х1Г,74) может быть подтверждена, например, результатами, полученными
для гомологического ряда спиртов н-С„Но„.. ОН [49]. Для этого ряда
можно принять, что в уравнении (Х1[,75) А, =ТиС, = 0; это означает,
что разница в температурах данного и стандартного вещества (например,
н-гексанола), при условии что 1х = Цм, практически не зависит от величины вязкости. Следовательно, здесь справедлив один из предельных случаев четвертого метода сравнительного расчета. Для спиртов было рекомендовано уравнение
870,5935
где
3375,957
Таблица
Результаты
вычисления значений вязкости 1] (с7%з) некоторых спиртов
65
[49]
12С
Вещество
15
н-СзНиОН
н-С,НзОН
H-Ci2H250 H
* 10,64
** 6,125
370
20
25
30
40
50
60
70
80
90
10,63*| 8,84 | 7,93 |6,26**| 4,55 | 3,39 | 2,58 | 2,00 | 1,58 | 1,27
|14,19| 8,98| 7,77 | 5,56 | 4,08 | 3,06 | 2,35 | 1,83 | 1,46
—
— [17,41 14,18 | 9,66 | 6,79 | 4,94 | 3,64 | 2,75 | 2,43
—
no данным
по данным
[54].
[54].
Средняя
погрешность
расчета
для шести
спиртов
(п = 4,
5, 6, 7, 10,
11)
уравнения,
вы-
оказалась равной 1,0%. С помощью уравнений
(Х1,76) и (Х1,77) в интервале 20—90° С была вычислена вязкость н-октилового, н-нонилового
и н-додецилового спиртов, для которых экспериментальные данные отсутствуют. Результаты расчета приведены в табл. 65.
Для достижения лучшего соответствия с опытом данные по вязкости
были расчленены на два интервала (примерно от 0,1 до 1 иот 1 до 5 спз)
и для каждого из них найдены значения индивидуальных постоянных а,
р и с уравнения (ХТ,74) [47].
Для
н-алканов
ражающие
значения
были
рекомендованы
[50]
следующие
коэффициентов А., Ва и С. в
15 (1,4— 44) = —0,5101455 + VASO
(XI,75):
8,437614.103.п,
(Х1,18)
1289,956
Bs = був
ея — 719,186
И
|(ХТ,
С. = — 2000 (п — 7).
ным
Для
высших
результатам
гомологов
(табл.
66,
(п>
67).
6)
они
79)
(XI,80)
приводят
к весьма
надеж-
Таблица
Результаты
вычисления
температурной
С„Но„-.› по уравнениям
зависимости
(ХТ,
Интервал
=
температур,
п
до
a
| 5
:
a
опытных
данных,
%
80)
[50,
некоторых
51]
температур,
5
Погрешность
вязкости
н-алканов
Интервал
я
С
от
78—ХТ,
°C
7
5
Bis
|5
=
:
до
a
©
<
0,5
а
Погрешопытных
данных, %|
OT
Е
=
HOCTb
п
66
<
6
—90,3
40,0
2,4
20
37,8
[232,2
8
—10
99,5
0,2—0,5
1,5
24
70,0
1306,01:
0,3
9
—10,1
150,0
0,1—0,9
4,2
28
99,4
|300,711,2—4,5
0,6
11
—10,1
201 , 2
0,1—0,6
0,3
35|
1411,0
1306,0
—
2,0
13
—9,9
201,3
0,1—0,6
0,6
36;
150,0
|300,4
1,9
1,0
47
22,0
300,6
0,2—0,8
0,9
43|
132,0
|306,0
—
43
—
0,5
1,0
Ilo ypapHenuio (XI1,75) uy — t-3aBMCMMOCTH AIA H-TreuTaHa (B MHTepBase
0,2—0,85 и 0,85—4,5 спз) была рассчитана вязкость н-алканов, начиная с
н-СьН 14 до н-СьНз. По полученным данным вычислены значения коэффициентов уравнения (Х1,74) для всех перечисленных углеводородов. Они
приведены в табл. 68. Для ориентировочных расчетов можно рекомендовать рис. 279, на котором приведены также данные для n = 1, 2, 3, 4.
Кривые и = (И проведены влево вверх до точек плавления; своеобразный
вид графика в этой области обусловлен особенностью изменения точек
плавления в гомологических рядах (см. главу Г, стр. 46).
Следует заметить, что из указанных в табл. 68 тридцати шести углево-
дородов вязкость 12 (п= 19, 22, 25, 27, 29, 32, 33, 36—40) совершенно не изу-
чена, а вязкость 19 (п = 8, 10, 12—46, 18, 20, 21, 25, 24, 26, 28, 30,
31, 34, 35) исследована в сравнительно узком интервале температур.
25 М. Х. Карапетьянц
371
ai
+
1
\
1—1
>
S
]
А
Lt
l
er
|
ir
фо
<
XQ
x
.
PL
<
&*
yg
-150
ре
аа
-90
4
[
ot
1
1
|
90
tu
at
py
1
100
Рис. 279.* Зависимость вязкости 1] (спз)
1:_]
-100
у
|]
200
А
|
890
i
Leh
ee
]
900
1
4
|
350
1
1—4
400
450
различных н-алканов,С„Ни +2 ОТ температуры [Е (°C) [50]
150
ГОО ОВ
4
1
]
900
l
1
[
i
J
950
Таблица
Вязкость
1 (ema)
н-гексадекана
СивНы
(вхриет.
Nn
t, °C
n
[50, 51]
[55]
|[56, 57]|
[58].
(6,05)
|6,194)
—
—
(0) |
(10) |
20
25
30
37,8 |
40
50
60
70
80
90
98,9 |
100
410
120
130
132
67
= 18,2°C) [50, 54]
[59]
|
— |
(4,51)
— | —
—
— |
3,472
|3,516 13,452*
—
1|3,451|
3,079
— | —
3,08
|3,076|
2,749
— | —
—
1|2,754|
2,329
— [2,338
—
— |
2,228
— | —
—
|2,232|
1,843
{1,859}
—
—
11,852|
4,554
— |1,559*
—
|14,560|
1,325
— | —
—
[4/338]
1,147
14,172]
—
1,164
|1,164|
1,005
— | —
—
1|1.044|
0,9005 | — | 0,9081*| 0,9052**|
— |
0,8888 |0,927|
—
—
10,892|
0,794
— | —
—
{0,799}
0,712
— | —
—
10,746|
0,642
— | —
—
|0,645!
0,629
— | — | 0,635**|
— |
‚о
[50, 511
140 |
450
4160
470
180
184
190
200
240
220
230
240
245
250
260
270
280
290
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,582
0,529
0,484
0,444
0,409
0,396
0,378
0,354
0,326
0,304
0,285
0,267
0,259
0,254
0,236
0,223
0,244
0,200
|5
5
<
[58]
[59]
|—|—
—
0,584
|—|—
|—|—
|—|—
|—|—
|—|—|
[—|—
|-—|—
|—|—
|—|—
|—|—
| |—
|—|—|
|—|—
;—|]—
|—|—
|—|—
|—|—
—
0,532
—
0,486
—
0,446
—
0,409
0,399 **| —
—
0,377
—
0,349
—
0,323
—
0,299
—
0,278
—
0,259
0,252 **|]
—
—
0,242
—
—
—
—
—
—
_
_
* Пересчитано из значений л в сантипуазах
и алотности, приведенных в [57].
**
4]
Среднее
из
данных
для
двух
образцов.
Pm
TTT)
45
10
ae
3
ee
39
rere
Т
05
ТЕТ
"РТТ
15
7
2,0
tt
a
25
ae as ee
ee a
3.0
*
=
OQ
-200
Рис.
1
1
280.
1
al
1
Зависимость
вязкости 1] (спа) различных 1-алкенов
t (°C) [48]
С„Н»и„
от темп ературы
25*
373
Значения
коэффициентов
уравнения
n = 0,2+0,85
(XI,74) для некоторых
cna
Таблица
68
н-алканов [50, 51]
=0,85-—4,5
спа.
Вещество
а
CsHie |
‚ (Нм |
С.Н |
СзНв |
СН» |
СН» |
CuHos |
СН» |
CisHes |
СаНзо |
С5Нз2 |
CisHse |
СНзв |
CisHsg |
С9Наве |
CopHae |
CoiHas |
С>2Нав |
CosHag |
CosaHso |
CosHs2 |
CosHsa |
СН |
CogHsg |
CepHeo |
СзоНв2 |
CsiHes |
CseHes |
CsgHes |
СиНю |
Сз5На2 |
СзНа« |
СН |
CssH7g |
CspHgo |
CaoHse |
Для
b
—1,693321 | 318,247
—4,729044 | 360,718
—1,764093 | 404,020
—4,794547 | 438,724
—4,820427 | 475,8392
—1,848542 | 516,2258
—1,875775 | 553,66095
—4,898339 | 587 ,9685
—4,929392 | 630,313
—1,955911 | 669,8862
—1,981505 | 709,63332
—2,00685 | 750,2999
—2,032938 | 792,82447
—2,057667 | 835,1474
—2,082940 | 879,3048
—2,107789 | 923,8065
—2,13206 | 969,69724
—2 156756 | 1016 9946
—2,18138 | 1065,5556
—2,205696 | 1114,94913
—2,229735 | 1165,3364
—2,252506 | 1215,35601
—2,276879 | 1268 ,8839
—2,300457 | 1322,21352
—2,324256 | 1378,0679
—2,342448 | 1428 ,8179
—2,369973 | 1490, 20541
—2,393636 | 1549,43138
—2,416775 | 1609,52883
—2,440568 | 1674 ‚97764
—2,463096 | 4733,841743
—2,485377 | 4796 ‚61544
—2,508443 | 186206295
—2,530554 | 1927,2910
—2,553138 | 1994,81762
—2,569768 | 2062 ,02007
Аналогичные
них были
280,205
275,896
270,535
266,681
264,634
264,344
| 265,125
265,798
270,048
273 ;90
| 278,343
283,544
| 289,689
296 ,08
303,32
310,747
| 319,011
327,748
337 ,00
| 346,564
356,540
366,444
377,407
| 388,359
| 400,048
440,956
423,515
| 436,064
| 448,896
| 462,264
| 475,489
488,930
| 502,948
516,899
| 531,359
545,160
а
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b
—4,027852 | 112,382
—4,074470 | 133,032
—4,409269 | 153,246
—4,144725 | 172,837
—1,149829 | 184,37368
—4,203260 | 244 ‚97633
—41,231290 | 234,582
—1,25896 | 251,71924
—4,282949 | 271 ‚3070
—1 ‚308054 | 294 ‚9357
—1,329765 | 341,75952
—1,374547 | 341,34272
—1,368124 | 351,42175
—1 ‚447743 | 386,2604
—1,411531 | 395,7849
—1,430834 | 447,7434
—4,449650 | 440,0763
—1,466196 | 464,40527
—41,48731 | 486,38776
—41,50023 | 507,28809
—1,54683 | 530,66595
—41,530723 | 552,8939
—1,54716 | 577,2265
—1,561884 | 600,89479
—1,57499 | 623,97245
—1,592463 | 650,43705
—4,601987 | 672,24227
—1,612935 | 695,05997
—4,628228 | 721,62739
-—1,640234 | 746,1563
—1,65167 | 770,6736
—1,662990 | 795,4334
—1,674649 | 820,86079
—1,686215 | 846,64495
—1,697472 | 872,507567 |
—4,705362 | 898,70935
с
204 ,278
194 ‚155
180,702
472,532
162,158
164 ‚048
157,878
155,93
154,689
154,493.
154,616
158,520
156,543
162,730
464,57
164,50
167 ‚826.
474 ,225
175,678
179,347
183,846
188,23
_ 193,349
198,435
203,533
209 ,484
214,574
219,915
2.26
, 354
232,340
238,423
244,634
254,077
257 ,681
264,354
270 ,046
расчеты были проведены для 1-алкенов [48] (рис. 280).
рекомендованы уравнения (ХГ,78) и (ХТ,80), а вместо
(ХТ,79) —уравнение
|
С
9158. 9889
Ва =
3.048024 —len
995,334.
(ХТ, 81)
Точность расчета иллюстрируется данными, приведенными в табл. 69.
Так как для 1-алкенов и н-алканов при одном и том же значении п значения коэффициентов А. иС.в уравнении (ХТ,75) практически совпадают,
то наряду с (Х1Т,75) можно воспользоваться приближенным уравнением
DP y.CpHoy = L'n-CyHensg + Pr,
(XI,82)
где
|
374
44-CpHonte’
(XI,83)
Таблица
Вязкость
п (с7пз)
1-пентадецена
7
t, °C
[48]
0
10 |
20
25
30
37,8 |
40
50
60
70
80
90
98,9 |
100
110
4,157
3,193
2,525
2,267
2,047
1,764
1,695
1,428
1,223
4,064
0,932
0,827
0,747
0,738
0,662
[60]
‚ —
—
| 2,493 |
—
| 2,049
—
1,666
| 1,418
| 1,243 |
1,056
; 0,925
—
—
—
—
[56, 57]
Су;Ну
[48]
7
t, °C
[59]
69
4,160 |
4,164
120 |
—
3,240 | 130 |
2,549 | 2,520 | 140 |
—
2,271
150 |
—
2,052 | 460 |
1,764
—
170 |
—
1,694 | 180 |
—
1,432 | 190 |
1,246: | 1,224 | 200 |
—
1,064 || 210 |
—
0,937 | 220 |
—
0,826 || 230 |
0,7452
—
240 |
—
0,735 || 250 |
—
—
260 |
[48]
|1[60] ру [59]
0,597
0,542
0,493
0,454
0,415
0,382
0,354
0,328
0,306
0,286
0,2607
0,254
0,236
0,223
0,244
}—|—| —
|—|—|]—
|—|—| —
|| —| —
|—|—| —
|—|—| —
|—|—| —
;—|—|—
|—!—| —
|—|—|—
|—|—| —
|—|—| —
}—|—| —
|—|—| —
|—|—| —
|
Таблица
Коэффициенты
уравнения
=0,2--0,85
Вещество
CoH, *
СзНз **
1-CeHie
1-СНаа
1-CgHis
1-СоНзв
1-CipHeo
1-Cy;H22
1-С12Ноа
1-С1зН2в
1-CyaHog
1-Cy5H39
1-СлвНз2
1-Ci,H34
1-CigH3e
1-СлэНзв
1-Сэо Нло
1-Ce; Hay
1-Сэ2Наа
1-CesHa46
1-Co4Hag
1-CosHs0.
а
(Х1,74)
с
110,223
200 , 564
360,718
401 ,020
438,727
415,839
516,2258
553 , 661
587, 9685
630,3430
669, 886
709,6333
150,300
792,8212
835 , 1471
879 ,3018
923,8065
969,6972
| 1016,9946
| 1065,5556
| 1114,9491
| 1165, 3361
|
|
|
|
|
|
|
|
|
|
|
Расчет
произведен
по уравнению
1C,H,
1-алкенов
а
251,16
268,86
294,59
275,82
279,94
275,90
274,70
273,45
273,06
276,46
279,72
283,72
288,64
294,53
301,07
308,45
316,13
324,77
333,98
343,81
354,04
364,75
спа
b
с
61,9276
133,032
153,246
172,837
184,3737
211 , 9764
231 , 582
251 , 719
271,307
291 ,9357
3141,7595
341,3427
351,4218
386,2601
395,7849
417,7434
440 ,0763
461,4053
486,3878
507 , 2884
230,666
211,52
209,85
185,98
185,79
173,54
171,41
166 , 20
163,20
161,43
160,34
160,00
163,61
161,39
167,72
166,70
169,88
173,58
177,46
182,49
186 ,80
192,09
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
—0,918797
—1,071170
—1,109269
—1,144725
—1,149829
—1,20326
—1,23129
—1,25896
—1,282919
—1,308054
—1,329765
—4,371547
—1,368124
—1,447743
—1,411531
—1,430831
—1,44965
—1,466196
—1,487130
—1,50023
—1,51683
0,83845 NCH, —
=
70
[48]
=0,85-—4,5
b
—1 ,508321
—1 ,612090
—1, 729014
—1, 761093
—1,791517
—4 ‚820127
—'{ , 848542
—1 ,875775
—1 , 898339
—1 ‚929392
— 4, 95591
—1 ‚981505
—2,00685
—2 ,032939
—2 ,057667
—2,082940
—2,107789
—2,132060
—2,156756
—2,181380
—2,205696
—2,229735
некоторых
спа
* Расчет произведен по уравнению яс,н, =
**
для
|
|
|
|
|
|
|
|
|
|
|
|
|
|
30,135.
0,854795 тон, —
22,84.
375
Уравнение (Х1Т,82) можно
рассматривать как один из предельных случаев первого метода сравнительного расчета.
Результаты расчета температурной зависимости вязкости различных
1-алкенов в виде значений коэффициентов уравнения (ХТ,74) приведены
в табл. 70. Для подавляющего большинства из 22 алкенов температурная
зависимость вязкости была или совершенно не известна или изучена в
сравнительно узком интервале температур. Для ориентировочного расчета можно воспользоваться также данными, приведенными на рис. 280.
ЛИТЕРАТУРА
ком
1. М. Х. Карапетьянц,
Чэн
Гуангюе.
О температурной зависимости
давления пара (на правах рукописи). Чэнду, Сычуаньский ун-т, 1959
М. Х. Карапетьянц,
Чэн
Гуанг-юе.
Химия и технол. топл. и масел,
Ne 10, 28 (1959).
М. Х. Карапетьянц,
Чэн
Гуанг-юе.
Ж. физ. химии, 35, 781 (1961).
.Чэн
Гуанг-юе.
Комбинированный метод расчета температурной зависимости давления насыщенного пара (на кит. яз.). Научный руководитель М. Х. Карапетьянц. Чэнду, Сычуаньский ун-т, 1959.
Гуанг-юе,
. Чэн
Гуанг-юе,
CO
ыч>on
Чэн
N 1, 97 (1959).
- Won Tyaur-we,
М. Х. Карапетьянц.
Аса 51.
Маг.
Univer. Szechuan.,
M.X.Kapanetbann.
Chem. Ind. Eng. (xut.),
N 1, 69 (1959).
М.Х. Карапетьянц.
Афа’ 5.
Майг.
М 5 (1959).
Ч эн Гуанг-юе,
Кан Бао-цзюн.
Acta Sci.
Natur.
М 4, 97 (1959).
. М
.Карапетьянц,
Чэн Гуанг-юе. А&а 501. Natur.
М 2, 91 (1958).
Univ. Szechuan.,
Univ.
Szechuan.,
Univ.
Szechuan.,
WwW B. Kay.
Ind. Eng. Chem., 32, 358 (1940).
M . Х. Карапетьянц,
Чэн
Гуанг-юе.
ние насыщенного
пара
углеводородов.
М.,
Температура кипения
Гостоптехиздат, 1961.
и давле-
Pondres
. М. Х. Карапетьянц,
Чэн Гуанг-юе. Температура кипения и давление насыщенного пара углеводородов. Пекин. Китайское научное издательство.
1963 (на кит. яз.).
. Х. Карапетьянц,
Чэн Гуанг-юе. Хим. промышл., № 3, 32 (1963).
Antoine.
Compt. rend., 107, 684 (1888).
. Antoine.
. Antoine.
BuO
.G.
Loomis,
Compt.
rend.,
107,
836
(1888).
Compt. rend., 107, 1143 (1888).
J. E. Walters.
J. Am.
Chem.
Soc., 48, 2054 (1926).
C. Aston, G.H.Messerly.
J. Am. Chem. Soc., 60, 1917 (1940).
B. Willingham,W.J.Taylor,J.M. Pignocco,F. D. Rossini,
. Res. Natl. Bur. Stand., 35, 219 (1945).
.L.Camin,
A. F. Forziati,
F.D.
(1926).
73°
Pass
D
‚ 387
Ae
4
Ws
PooOswWs завгеняр
м
J. Phys. Chem.,
58, 440
ickner,
F. P. Lossing.
J. Phys. Chem., 55, 733 (1951).
eyes, R.S. Taylor,
L.B.Smith.
J. Math. Phys., 1, 244 (1922).
Beattie,
.
Rossini.
Su
eschner,
Kay. J. Am.
Gougq-jen,
G.L.Simard.
J.
Am.
Chem.
G.G. Brown.
Ind. Eng. Chem., 32, 836 (1940).
Chem. Soc., 68, 1336 (1946).
Soc.,
.
DPip
Д. Тиличеев.
Давление насыщенных паров углеводородов
С5—С.—
кн.: Физико-химические
свойства индивидуальных углеводородов, вып. 3. М..
остоптехиздат, 1951, гл. IX.
.-L.Camin,
F.D. Rossini.
J. Phys. Chem., 59, 1173 (1955).
.L.Camin,
F. D. Rossini.
J. Phys. Chem., 60, 1446 (1956).
.F.Forziazi,D.L.Camin,
F.D.Rossini.
J. Res. Natl. Bur. Stand.,
5, 406 (1950).
. F. Forziati,
W. R. Norris,
F. D. Rossini.
J. Res. Natl.
Bur.
tand., 43, 555 (1949).
. М. Д. Тиличеев.
Давление
насыщенных
паров углеводородов Сэ— Сао. —
В кн.: Физико-химические
свойства индивидуальных углеводородов, вып. 4. М.,
Гостоптехиздат, 1953, гл. ХШ.
32. R. R. Dreisbach,
R. Robert.
Pressure-volume-temperature relationships
of organic compounds. 3 ed., Sandusky, Ohio
33. М. Х. Карапетьянц,
Чэн Гуанг-юе.
62 (1959).
37 6
Handbook Pub., 1952.
Chem.
Ind. Eng. (kut.),
N
1,
ЕЁ. Physical constants of hydrocarbons, vol. I—IV. 1939—1947.
34. С. Ес 1о
Handbook of hydrocarbons, 1955.
35. S. W. Ferris.
36. Selected values of chemical thermodynamic properties by F. D. Rossini, D. D. Wag37.
38.
man, W. H. Evans, S. Levine, J. Jaffe. Natl. Bur. Stand., Circ. 500, 1952.
M. Д. Тиличеев.
Давление
насыщенных
паров ‘низших
углеводородов
(от С: до Са).— В кн.: Физико-химические свойства индивидуальных углеводородов,
вып. 2. М., Гостоптехиздат, 1947, гл. IV.
П. Д. Об о ленцев. Физические константы углеводородов жидких топлив и
масел. М., Гостоптехиздат, 1953.
39. International
logy,
40. R.
М.
44. D.
42. D.
43. D.
44, D.
45.D.
46. D.
47.
М.
Natl.
Critical Tables of Numerical
Res.
Con.,
1926—1933.
Data,
Physics,
Chemistry
and Techno-
E. Jo г d ane Vapor Pressure of organic compounds, Interscience, Publishers.
У. —
5
F. Oth mer.. Chem. Met. Eng., 47, 554 (1940).
F. Othmer.
Ind. Eng. Chem., 36, 669 (1944).
F.Othmer,
R.E. White. Ind. Eng. Chem., 34, 952 (1942).
F.Othmer,
A. H. Luley.
Ind. Eng. Chem.., 38, 408 (1946).
F. Othmer,
S. Josefowith.
Ind. Eng. Chem., 38, 114 (1946).
F.Othmer, M.S.Thaker.
Ind. Eng. Chem., 45, "589 (1953).
Х.
Карапетьянц,
N 6, 65 (1959).
48. (1960).
Го-сень.
Аба
Sci.
Natur.
Univ.
Szechuan.,
T ERED
Янь
Госень.
Изв. вузов,
Нефть
и газ,
Янь
Го-сень.
Изв.
Химия
50.
М. Х. Карапетьянц,
нол., № 4, 580 (1961).
М. Х. Карапетьянц,
Янь
Го-сень.
51.
Янь, To-ceub,
52.
R.W.Schiessler,
58.
59.
um Inst., 26, 254 (1946).
а. \. Nederbragt,
J. W.M. Boelhouwer.
Physica, 13, 305, 1947.
М. Д. Тиличеев.
Вязкость углеводородов в жидком состоянии в зависимо-
60.
углеводородов, вып. 6. М., Гостоптехиздат, 1957, гл. XVIII.
А.
Schmidt, У. Schoeller,
K. Eberlein.
Ber., B74, 1313
49.
(1960).
PaO
Ян
50а. Янь Го-сень,
М 1, 103 (1962).
1, 93 (1962).
М. Х. Карапетьянц.
M.X.KHapanetbauHny.
F.C.
Whitmor.
Ж.
вузов,
физ. химии,
и химич.
37, 2044
Аса 5с1. Майх. Univ.
Acta Sci. Natur.
Ind.
Eng.
№ 4,
Univ.
99
тех-
(1963).
Szechuan.,
Szechuan.,
Chem., 47, 1660 (1955).
o3. A. V. Porter. Phil. Mag., 23, 458 (1912).
|
54.1. Simon.
Bull. Soc. chim. Belg. ., 38, 47 (1929).
55. E. B. Evans,
J. Inst. Petroleum Technol., 24, 38 (1938).
06. R. W.Schiessler,
C. H. Herr,
A. Ww. Rytina,
C. A. Weisel,
F.Fischl, R.L. MacLaughlin, H. H. Kuehner. Proc. Am. Petroleum
Inst., 26, 114 (1946).
57. R. W. Schiessler,
C.H. Herr,
A.W. Rytina,
C. A. Weisel,
F.Fischl,
R. L. Mac Laughlin, H.H. K uehner. Proc. Am. Petroleсти
от
температуры.— В
кн.:
Физико-химические
свойства
индивидуальных
(1941).
ГЛАВА
ХП
МЕТОДЫ СРАВНИТЕЛЬНОГО
КООРДИНАТАХ
РАСЧЕТА
В ПОЛЯРНЫХ
1
Линейность
отвечающих
и (УГ,
1),
одним
членом
соотношений
шести методам
(1,1), (П,1), (111,1), (1У,1), (У,4)
сравнительного расчета, является
их существенным достоинством. Но в некоторых случаях прямизна линий
лишь кажущаяся (из-за необходимого размера чертежа). Переход же к
функциональным шкалам не всегда прост. В подобных случаях в правую
часть уравнения можно ввести дополнительные члены. Хотя нередко для
получения удовлетворительного согласия с опытом можно ограничиться
(см.
главу
ХГ),
однако
необходимость
определения
допол-
нительных постоянных величин приводит к возрастанию трудностей при
выводе и применении уравнений. Кроме того, утрачивается важное преимущество
—
возможность
Поэтому целесообразно
одной
стороны,
осуществления
применить
сохранились
бы
линейной
экстраполяции.
такой метод расчета,
преимущества
линейных
в котором,
соотношений,
а с другой,— была бы возможность определить свойства веществ (систем)
и параметры процессов в тех случаях, когда функциональные зависимости
заведомо
Для
криволинейны.
этого можно
рекомендовать
[4] соотношения
вида
А = 6.50 (В — 6%),
(XII,1)
где А и В — постоянные,
а С и С° — либо различные свойства одного
и того же вещества (или ряда веществ), либо одно и то же свойство различных веществ (или рядов веществ), либо одно и то же свойство одного
вещества (или ряда веществ) при различных условиях. Таким образом,
это соотношение можно рассматривать как вариант метода сравнительного расчета и принять его за основу системы этих методов в полярных
координатах.
Как
углу
легко
показать,
прямой,
причем
если
величину
принять
равной
расстоянию
(50)
полярному
(Х,1) выра-
прямой и исходной точкой (0), а В — соответствующему
Действительно, введем обозначения
углу (< ао$).
И
и запишем
378
(ХП,1)
< — радиусу-вектору
С°
(06), то соотношение
3HTCH
(< а06), а
А
будет
отвечать
между
этой
G cosG° = x
(ХП,2)
Сзш 69 = у,
(XII,3)
в виде
A =G-cos B-cos G° + Gesin B-sin G?,
с
откуда
Gsingo =
или
в соответствии
—4
с (ХП,2)
где
608 BG cos G°
sin B
(XII,4):
sin B
и (ХП,3)
(XII,6).
|
"РВ,
4 = А.зт
B= —ctg B.
Так
как
а при
А=С со В=оа’соз В,
С° = л/2 = 90°
|
A = G-cos(B —n/2) = Gsin B.
также
(ХП,5)
(XII,7)
является
Сочетая
является уравнением прямой, то уравнение
линейным.
(ХП,1)
находим,
что при
(° =0
(ХП,1).
|
(ХИП, 8}.
(XII, 9).
(ХП, 8) с (ХП, 9), получаем
tg b=
т. е.
При
Из
зш В
oa’
oR
В =<ос’а’= < аоз.
(° = В из (ХИ)
находим
A =G-cos(B—
B) = os.
Для определения коэффициентов уравнения (ХП,1) можно воспользоваться одним из трех способов.
Исходные данные наносятся на график в полярных координатах;
по положению полученной линии определяются величина отрезка 05
и угол а0$ и тем самым значения коэффициентов Ви А.
Преобразованием соотношения
(ХП,1)
в уравнения, отвечающие:
линии в Декартовых координатах, получим в соответствии c (XII, 2).
и (ХП,3) уравнение (ХИ, 5), после чего находим
В = — агсофо В,
|
- (XIT,10)
A=asin B.
(XIT,11);
Определив по опытным данным значения © и В, по уравнениям (ХП,10).
и (ХП,11) вычисляем величины Аи В.
Можно воспользоваться и методом наименьших квадратов. Прида-
дим
(ХИ,1)
вид
соотношения
где
y= acosz-+ bsing,
у = | (-1,
.
(ХИ,12)
|
д = (0,
a = A“cos B,
(XII,13).
|
-
(XIT,14)
|
(XIT,15)
р = Asin B.
Если
теперь
1. и у, (их
подставить
легко найти
в
(ХП,12)
исходные
(XIT,16)
данные,
т.
е.
значения
по величинам С: и С;) и ввести обозначение
А; = cos 2%; + bsin x;
— y,,
(ХП,47}
373
то,
согласно
величины
ХД®.
теории
ошибок, должно
Следовательно,
2
м
соблюдаться
условие
3A} = 2XA;=—
г = 22XA;-cos 7; = 0
|
ZA}= OSA; =
oot = 22A;: sin 2; = 0,
минимума
(XIT,18)
(XII,19)
откуда
a> cos x; -- 61
11-608 2: — Ly,-cos 1 = 0
(ХП,20)
и
а>, эп 2; с0$ 2 -- 61 1? д; — Ly, sin x; = 0.
(XIT,21)
Совместным решением (Х11,20) и (ХП,21) находим значения а и 6, а по
ним в соответствии с уравнениями (ХП,15) и (ХП,16) определяем коэф‘Фициенты A u ВБ.
2
нения]
Рассмотрим применение соотношения
(Х1,1)
на примере урав-
1
КА = (saz
— 1) cos (B—lgT),
г (ХТ,22)
в котором сравниваются температуры кипения жидкости Гс ее теплотой
парообразования Л Япар. Так, для 1-гексена, например, уравнение (Х,22)
имеет вид
|
1
0,09036 = ( Mina
— 1) cos (65°59’— lg T);
(ХП,23>
Таблица
71
Результаты вычисления температурной зависимости теплоты парообразования ДН пар
(ккал/моль) {-rexcena по уравнению
(ХП,23) [1]
lg T
4, °С
—120
—100
—80
—60
—40
—20
0
20
40
60
80
100
420
140
460
180
200
2410
220 |
$380
АНпар
радианы
градусы
2,185
2,239
2,286
2,329
2,368
2,403
2,436
2,467
2,496
2,523
2,548
2,972
2,596
2,616
2,637
2,656
2,675
2,684
. 2,693
125°53’
128 15
130 58
133 26
135 39
137 42
139 36
144 20
143 59
144 32
145 59
147 22
148 39
149 53
154 4
152 42
153 16
153 47
154 18
©
(65°59'——lg T)
0,5015
0,4652
0,4227
0,3835
0,3473
0,3135
0,2820
0,2527
0,2079
0,1983
0,1936
0,1498
0,1276
0,1060
0,0857
0,0660
0,0480
0,0382
0,0294
по [2]
|вычислено
8,72
8,55
8,38
8,20
8, 01
1,81
7,59
7,36
1,40
6,83
6,53
6,19
5,84
5,38
4,86
4,23.
3,42
2,99
2,13
8,45
8,37
8,24
8,09
7,94
7,76
7,57
7,37
6,97
6,87
6,58
6,24.
5,85
5,40
4,87
4,22
3,47
2,97
2,16
Аопытн.—вычисл.’ %
3,0
2,1
1,7
1,3
.0,9
0,6
0,3
0,0
0,9
0,6
0,7
0,8
0,7
0,4
0,2
0,2
1,4
0,6
1,4
здесь единицей |2 Г является
ты
радиан,
а АНпар —
10* ккал/моль.
Результа-
вычисления по уравнению (ХП,23) приведены в табл. 71.
Результаты расчета температурной зависимости теплот парообразования других углеводородов по уравнению
(ХП,23) также удовлетвори-
тельно
совпадают
с опытом.
Это непосредственно
видно
из табл.
72, в ко-
торой приведены результаты вычисления АНпар для 94 углеводородов,
принадлежащих к 12 различным гомологическим рядам.
Таблица
72
Результаты вычисления температурной зависимости теплот
парообразования некоторых углеводородов по уравнению
(XII,23)
Ряд
Число
н-Алканы
2-Метилалканы
3-Метилалканы
7; n=4—10
5; п=5-—9
4; n=6—9
2,4-Диметилалканы
Циклоалканы
3;
4;
n=7—9
n=3—6
4;
п=5—8
2,2-Диметилалканы
2,3-Диметилалканы
4; п=6—9
4; п=6—9
н-Алкилциклогексаны
1-Алкены
Циклоалкены
1-Алкины
н-Алкилбензолы
Интервал средних
веществ
|4; п=7—10
5; п=6—10
5; n=2—6
5; п=6—10
Аст,
приведенных
температур
|
0,67—0, 97
0,56—0,96
0,64—0, 98
9%
0
1,2
0,7
1,4
0,59-—0,97
0,62—0,97
| 14,1
0,8
0,77—0,97
0,67—0,98
0,9
1,0
0 ,68—0,97
0,72—0,94
1,3
1,0
0,58—0,96
0,5
0,62—0, 94
0,77—0,97
Кроме того, коэффициенты уравнения
(ХП,22)
рядах изменяются закономерно; их изменение можно
ми соотношениями.
1,3
0,9
в гомологических
выразить просты-
3
В некоторых случаях выбор функций для С и С° (он носит
эмпирический характер) затруднен;
приходится
подбирать
сложную
функцию, что создает неудобства как при нахождении функции, так и при
применении
уравнения.
|
В качестве примера укажем, что уравнение
(ХП,22), будучи точным
для углеводородов, для других соединений (в том числе неорганических)
дает не очень удовлетворительные результаты. Иными словами, для этих
веществ соответствующие линии несколько искривлены.
В таких случаях можно рекомендовать [3] соотношение
A.=-(G— C) cos (B — G),
отличающееся
от (ХП,1)
наличием
( XIT,-24)
третьего коэффициента
—
С, который
представляет собой значение С в исходной точке. Таким образом,
ход от (ХП,1) к (ХП,24) отвечает перенесению начала координат.
пере-
Для определения значения С можно рекомендовать два способа.
Меняя последовательно значения С и построив графики, отвечающие
уравнению
(ХП,24),
получаем ряд линий,
которые последовательно
пе-
реходят от выпуклых к вогнутым (или от вогнутых к выпуклым). Интерполя цией находим значение С, отвечающее прямой линии.
Второй метод заключается в следующем. Допустим, что имеются зна-
чения
исходных опытных
данных:
(Gi, G;), (G,, G2)
uw (G3, G3). Torga B
381
соответствии с уравнением
(ХП,24)
с.—С
откуда
me
|
Аналогично
Из
(
cos (B — G})
G2—C
после преобразования получаем
B=G,-+
rue
соз (В — (8)
=
(ХП,26)
arctg =
С sin! K,—ctg К!
,
(XIT,26)
К, = @— 6%.
определяем
XII, 25 )
_ (ХП,27)
В = (1-1 агфе (A==e = sin™ K,— ctg K.),
(ХП,28)
K,=@—@.
(ХП,29)
и (ХП,28)
находим
Gi—C
Gs
G,—C
—a’ =Ва.—а
где
06
—
sin
— В’,,
(ХП,30)
K,,
a’ = ctg Ky,
| В —
sin?
Ko,
В’ = ctg Ke.
Умножим обе части уравнения (ХИ, 30) на
Тогда после преобразования получим
величину
a (G;G3— CG, — CG3 + C?)--++ (B’ — a’) (@>б:3 — Са. —
—
откуда
В
(412
C=
—
CG,
—
CG,
—qtV@—4PR
ap
+.
С?)
(С
— С) (43— С).
CG3 — C*) —
— 0,
,
(ХП,31}
где
д = —a(G, + Gs)-+ B (Gi + Ge) — 7 (Ge + Gs),
Р=а— В+ Т,
(XII,32)
R = aG,G3 — BG,G, + 7G2G;3,
причем
|
а — $171 (@2 — (1),
B = sin (G2— G8)
И
1 = ctg (G3 — Gi) — ctg (G, — G}).
4
Применение соотношения (ХП,24) сграфическим определением
величины С рассмотрим для случая теплоемкости. Для Ср это соотношение
примет вид
А = (Ср
— С) соз (В —11Т)1.
(ХП,33}
Целесообразность
перехода от (ХПИ,1) к (ХП,24) и определение С
покажем на примере водяного пара при Р=1 кг/см?. Как видно из
рис. 281, А, уравнение
А = Срсоз (В
— 11 Т)
‘(ХП,34)
1 Выбор
линию
382
в качестве
в одном
(0 (величин
квадранте.
10]%Т
обусловлен
стремлением
получить
вск
температурной
не выражает
от
перейти
Если
допущения
С = 0,30,
С = 0 к допущению
пара.
водяного
теплоемкости
зависимости
то кривиз-
на значительно уменьшится, но все же сохранится (рис. 281, Б). Увеличив С’ до 0,450 (рис. 281, В), убеждаемся в том, что кривая из выпуклой превратилась в вогнутую. Следовательно, искомое значение С должно
5
23”
A
а, °
——
050
040
0384
a—
B —
Cp= =0,30;
B—
=
Cp=
С,
100°
beeen)
055
для водяного
0,45; T—Cp=
0;
=
0,544 ккал/кг-град; А —Cp
Ср=
0,384
последовательно
Принимая
и 0,450.
0,300
между
находиться
6—
4
(Х11,24)
пара при Р = 1 кг/см? [4]
0,472 ккал/кг-град;
С; Ср =
200°
t=
i
уравнения
коэффициентов
значений
Определение
281.
Рис.
>
0,50
0,45
050
С = 0,400
(вогнутая кривая), 0,350 (выпуклая), 0,390 (вогнутая), 0,380 (выпуклая), путем интерполяции находим значение С = 0,384, которое отвечает
<
‘
у
at
/
08
30-04
20
ии
АО
О
ПО
90
,
ООО ООО О О
"О
"О С
15
ОО О О
ООО
|
10.0
t
|
g
\
\
dd
173
4
\
\
\
a
130
td
173
О
20.0
ОР
|
220
0 .0
Рис. 282.
1 —
С =
Определение
значений
12,8 ккал/г-град;
2 —
при
13,86;
коэффициентов уравнения
Р = 140 кг/см? [5]
3 —
8 — 19,86;
14,86; 4 —
15,86;
5 —
9— 20,86; 10 — 21,86
(Х11,24)
16,86; 6 —
для
|
воздуха
17,86; 7 —
18,86;
прямой
линии (рис. 281, Г). Следовательно, если принять в качестве полярного угла величину |: 1©Т, а радиусом-вектором считать величину (Ср — 0,384), то на графике в полярных координатах получим
прямую. Другими словами, экспериментальные данные по удельной
изобарной теплоемкости водяного пара на изобаре Р = 1 кг/см? удовлетворительно описываются уравнением
|
A = (Cp
— 0,384) cos (B—
Ig Ig T).
(XII, 35)
383
Таблица
Результаты
вычисления
(кнал/кг-град)
]о
_
200
300
400
500
600
700
740
gig2
Т
температурной
зависимости
водяного пара при Р =1
(°К
TUS)
|
—cos (59°26'30" —
радианы
градусы
|0,427326|
10,440638|
|0,451500|
|0,460678}
10,468509|
|0,475407|
|0,472943|
24°29’08"
25 1449
25 5209
26 2334
26 5037
27 1420
27 2328
|
— Ig lg 7)
С
no
0,4058
0,0926
0,0845
0 ,07264
0,06479
0,05790
0,05537
удельной
теплоемкости
кг/ем? по уравнению
[4]
P
(ХП,36) [3]
73.
С р
A
|вычислено
0,472
0,484
0,495
0,510
0,527
0,544
0,551
ЛИТ. — вычисл.
0,472
0, 484
0, 496
0,542
0,527
0, 544
0,554
0,000
—0,003
—0,004
—0,002
0,000
0,000
0,000
Таблица
Результаты
вычисления температурной зависимости удельной
различных газов по уравнению (ХП,33) [3]
Н2О
5
—.
ss
At,
x
№
°C | A*¥/
4 | 200—740 |
30 | 500—740 |
150 | 460—740 |
200 | 480—740 |
250 | 500—740 |
300 | 440—740 |
400 | 560—740
0,28}
0,20]
0,32}
0,25!
0,30]
0,47}
10,24|
3
—.
3
50]
100 |
200 |
400 |
500 |
600}
700 |
a
°C |
30—150 |
3090—4150 |
30—150 |
30—150 |
30—450 |
30—150 |
30—150 |
CO
3
—.
A*
S
0,09
0,05
0,14
0,03
0,26
0,13
0,30
25
80
| 160
| 240
| 350
| 500
АВС | А* |
50]
200]
1000}
30001
ника
384
090—450
0—450
0—150
0—450
*
Средняя
[4],
для
&|
А
|0,26|]
50|]
10,37| 400]
|0,15|4000]
|0,592000]
погрешность,
остальных
°С!
3
—.
A*
|125—700|
75—250|
50—350|
|125—300|
| 125—500 |
| 200—500]
|
|
0,29
0,52
0,75
0,27
1,02
0,56
С
ЛЬ
°С |
0—150
0—450
0—450
0—150
%
газов —
|
|
|
|
(для
из
>
А*
З
А
0,11
0,35 |
0,30 |
0,36
Н.О
[5]).
At,
ay
20
60
| 100
| 140
| 180
| 220
|
|
|
|
|
|
°C |
0—280
0—280
0—280
0—280
0—280
O0—280
А*
|
;
|
|
0,05
0,413.
0,48
0,17
10,16
| 0,39
МН:
*
>
Ср
Воздух
95% CeH;0H+5% H20
>
|
АЕ
aX
Ar
Е
>
CO
At,
ay
теплоемкости
74
3
АЕ, °С |
80 | 300—360]
140 | 310—360]
200 | 260—360]
экспериментальные
>
A*
8
А
0,24
0,49 |
0,49
данные
At, °C |
60 | 150—300]
200 | 175—300]
заимствованы
из
A*®
0,4
2,6
справоч-
Определив ранее изложенными методами (см. раздел 1) коэффициенты А
и В, окончательно получаем
Q,009256 = (Cp — 0,384) cos (— 59°26’30" — Ig Ig T).
(ХП,36).
Результаты расчета по этому уравнению приведены в табл. 73.
Подобным образом можно убедиться, что для СО. при Р = 25 кг/см?*
температурная зависимость удельной теплоемкости описывается уравнением (Х11,33), в котором С = 0,086.
С помощью уравнения (ХПИ, 33)
были найдены значения Ср многих
газов при разных температурах и давлениях. Результаты расчета приведены в табл. 74.
5
При вычислениях с помощью методов сравнительного
в полярных координатах можно воспользоваться закономерным
нием
коэффициентов
расчета
измене-
уравнений.
А
С,
. 1
sinB
>
408998
—W\sin8
-
0,9996
‚ 0060046
)
0,6994
0,8992
005
18990
029988
2
поз 300
Рис. 283.
70,8986
320
340
360
380
p
YOO
Зависимость значений коэффициентов уравнения
от давления Р (кг/см?) для водяного пара
Так, в случае гомологических рядов углеводородов
нения (ХИ, 22) можно выразить соотношениями
12 А=а. 48,12 п
И
sin? B = o,-+
где
Belg n,
(Х11,33)
константы
урав-
(XII,37)
|
_
(XTT,38)
п — число атомов углерода.
|
|
В случае (ХП,33) можно воспользоваться зависимостью изменений
коэффициентов А, В и С с давлением. Так, для водяного пара в интервале
давлений от 300 до 370 кг/см? можно воспользоваться уравнениями
А = 3,623.10-3 - 7,467.10: Р,
(XIT,39)
sin B =—0,90383 + 1,355-107°P
(XIT,40)
И
С = 0,4859 —М ‚067.10 P.
(ХП,41)
Их
точность
иллюстрируется
рис.
283.
Экстраполяция
по этим
ниям до Р = 400 кг/см? приводит к вполне удовлетворительным
там (см. табл. 75).
уравне-
результа385.
Таблица
75
Сопоставление опытных и вычиеленных значений удельной теплоемкости С’
(ккал/кг.град)
водяного пара при различных температурах [3]
Р=390
по
520
580
640
700
740
[4]
1,174
0,908
0,790
0,725
0,697
кг /см?
вычислено *
1,194
0,913
0,793
0,726
0,696
Р=400
А,
%
—1,7
—0,6
—0,4
—0,2
+0,4
по
[4]
кг/см?
вычислено *
1,204
0,924
0,799
0,731
0,702
1,230
А,
%
—2,4
0,930
0,803
0,733
0,704
—0,4
—0,5
—0,3
+0,1
* Экстраполяция на основании уравнений (Х11,39), (Ж11,40) и (Х11,41).
УИ
Аналогичные расчеты были проведены для воздуха
также дали удовлетворительные результаты.
и
других
газов
ЛИТЕРАТУРА
mo
. М.Х. Карапетьянц,
Чэн
Гуангюе. Ж. физ. химии, 37, 2351 (1963).
. М.Х. Карапетьянц,
М. Л. Карапетьянц.
Теплоты испарения индивидуальных углеводородов.— В кн.: Физико-химические свойства индивидуальных углеводородов. М., Гостоптехиздат, 1960, гл. УГ.
М. Х. Карапетьянц,
Чэн
Гуангюе. Ж. физ. химии, 37, 2577 (1963).
ВТИ. Таблицы термодинамических свойств воды и водного пара. М., Госэнергоиздат, 1958.
. Теплофизические свойства веществ. Под ред. Н. Б. Варгафтика. М.—Л., Госэнергоиздат, 1956.
|
ЗАКЛЮЧЕНИЕ
1
Описывая методы сравнительного расчета и иллюстрируя их
различными примерами, мы ставили перед собой задачу показать продуктивность их применения и не преследовали цель дать исчерпывающий
обзор тех многочисленных формул, которые были описаны или могут быть
рекомендованы в качестве примеров того или иного метода сравнительного
расчета.
Каждый читатель при желании легко может увеличить числс примеров, тем более, что он будет располагать новыми данными, опубликованными после выхода настоящей монографии. А ведь почти в каждом номере
основных химических журналов можно найти материал, или отвечающий
частному примеру одного из методов сравнительного расчета, или дающий возможность подтвердить новыми данными ту или иную линейную
закономерность, или же позволяющий предсказать с помощью сравнительного вычисления свойства неизученных веществ.
Конечно, рассмотренные закономерности не равноценны. Одни из них
очень точны, другие дают лишь первое приближение. Одни имеют весьма
общий характер, охватывая обширный экспериментальный материал,
применение других весьма ограничено.
Одни
легко
обосновываются
(и в процессе обоснования вырисовывается степень их надежности. и
общности), другие являются чисто эмпирическими.
Конечно, любое из многочисленных уравнений, которые можно рассматривать как пример одного из шести методов сравнительного расчета,
должно
быть
предметом
специального
изучения.
Ведь
в общем слу-
чае трудно заранее судить о результатах его применения: они зависят
и от объектов, и от свойств, и от условий сопоставления. Это изучение даст возможность установить точность данного соотношения и границы его применения, что, в свою очередь, позволит ставить и решать
другие задачи. Возможно, данная зависимость окажется столь само-
очевидной
или
столь
неточной,
что
возвращаться
к ней
будет
нецеле-
сообразным; возможно, она окажется столь надежной, что ее следует
рекомендовать и в других случаях; возможно, что обнаружится связь
установленной
закономерности с другими; может быть, она послужит
источником
новых
зависимостей
и теоретических
обобщений.
Обнаружив линейную зависимость, исследователь задумается над тем,
почему она существует, взглянет иными глазами как на полученные
им результаты, так и на методы сравнительного расчета. Может быть,
он увидит в обнаруженной им закономерности лишь проявление универсальности разложения в ряд Тейлора (см., например, [65a] a [71]),
возможно, проявление аддитивности свойств или закономерного откло38$
нения
от нее,
может
быть,
он вскроет
физические
основы
линейности.
Может
быть,
обращение
к методам
сравнительного расчета даст ему
возможность
выявить
структуру
изучаемых
объектов,
обнаружить
ускользнувшее
ранее
от его внимания
химическое
взаимодействие.
Пусть это будет даже
только
приемом,
позволившим
исследователю
рассчитать неизвестную
или труднодоступную
величину,
согласовать
различные величины и оценить их погрешность, или же получить для
различных свойств и явлений
результаты в тех случаях, когда теоретические зависимости неизвестны, или же когда математический анализ
сложен
или мало
разработан.
Кроме того, использование
методов сравнительного
расчета позволяет во многих случаях так организовать
эксперимент, чтобы, определив по возможности с высокой точностью лишь опорные величины, можно было бы
найти остальные расчетным путем.
Хотя в последние годы методы сравнительного расчета довольно; широко используются, все же до сих пор их применяют немногие исследователи и то для единичных свойств. Здесь стоит отметить, что
большинство статей, особенно по органической химии, содержит лишь опытный
материал; во многих работах авторы ограничиваются качественной констатацией
(больше — меньше) полученных результатов; в сравнительно
небольшом числе публикаций даны физические мотивировки результатов
исследования. Так, например, можно встретить указания на то, что температура дегидратации данного вещества меньше, чем другого, подобного
ему, так как первое содержит ион большего размера, или, например, утверждение, что теплота гидратации меньше, так как меньше энергия водородной связи, или констатируется уменьшение температуры плавления
как результат увеличения степени ковалентности связи, или обсуждается
влияние поляризуемости и т. д. и т. п. Методы сравнительного расчета
во многих этих и подобных им случаях позволили бы придать установленным закономерностям полуколичественный,
а зачастую и количественный характер.
Для иллюстрации продуктивности применения методов сравнительного
расчета приведем следующее высказывание: «За последнее время в области
зависимости реакционной способности органических соединений от их
строения и от свойств растворителя открыт ряд количественных закономерностей. Аналогичные количественные соотношения существуют также
и между некоторыми физическими параметрами, с одной стороны, и строением или свойствами растворителя,— с другой. Эти закономерности не
являются только разрозненными чисто эмпирическими зависимостями.
Они образуют некий комплекс, настолько единый, что не лишено
смысла
дискутировать вопрос: не имеем ли мы здесь дело с фундаментом весьма
общей количественной теории в данной области» [1].
В связи с этим
В. А. Пальм напоминает об идее, высказанной в Докладе Комиссии ОХН
АН
СССР
[2]: «Проблема
реакционной
способности должна
быть постав-
лена как проблема количественного изучения химических превращений
в различных системах... Под этим углом зрения весь огромный экспериментальный
материал
органической
химии,
относящийся
к проблеме.
реакционной
способности,
должен
быть
смотрению и тщательному анализу».
Заканчивает свой обзор Пальм словами:
но
общими,
роды,
весьма
хотя,
которые
возможно,
могут
универсальной
органических
количественной
При
этом
критическому
рас-
«‹... мы имеем дело с достаточ-
и приближенными
рассматриваться
соединений.
подвергнут
в качестве
теории
существенно
закономерностями
основы
для
реакционной
отметить,
что
при-
построения
способности
в этой
тео-
рии использован ряд известных качественных представлений о строении
и реакционной способности последних. Благодаря этому в большинстве
случаев различным постоянным в корреляционных уравнениях может
388
быть присвоен конкретный физический смысл. Поэтому правило л. с. э.!
и принцип аддитивности являются не только средством для практических расчетов, но также и весьма полезным орудием при исследовании
проблем детального строения органических соединений и механизмов
реакций».
По этому же поводу М. И. Кабачник пишет: «Вопрос о зависимости
реакционной способности соединений от их строения является центральным теоретическим вопросом химии. Современный этап исследования
этого вопроса характеризуется тенденцией к установлению количественной связи между строением реагирующих молекул и константами скорости их реакций или константами химических равновесий, в которых
они участвуют. В общем виде эта задача является столь сложной, что
мало
оснований
ожидать
ее
решения
в обозримом
будущем.
Вместе
С
тем частные закономерности оказываются вполне доступными.
Возможности применения уравнения Гамметта далеко не исчерпаны.
Особенно велико его принципиальное значение: химик-органик получил возможность выражать числом, влияние структуры фрагментов молекулы на ее реакционную способность..., вычислить скорость реакции, исходя из строения.
Доложенный ряд явлений — начало большого пути, по которому,
как нам кажется, пойдет развитие вопроса о реакционной способности
органических соединений. Это — путь количественных сопоставлений и
расчетов. На этом пути, несомненно, удастся поднять теоретическую
вооруженность химика-синтетика, усилить его предвидение и облегчить решение многочисленных задач, вызванных перед нами жизнью...
Это
путь
увлечения
и надежд»
[56].
А ведь здесь речь идет в сущности о немногих линейных закономерностях, представляющих частные примеры только первого и второго методов сравнительного расчета и только в применениик взаимодействию органических веществ. Какие же возможности открывает вся система методов
сравнительного расчета в применении ко всему многообразию веществ И
процессов органической и неорганической химии!
В сказанному можно было бы добавить многое, но ограничимся еще
одним высказыванием, относящимся к одному варианту полуэмпирического метода расчета межатомных расстояний в многоядерных ароматических соединениях: этот метод «... позволит получить очень просто и с
относительно хорошей точностью данные об очень сложных молекулах,
изучение которых было бы невозможно ни одним другим методом, а будучи
применен для изучения молекул средней сложности, дает через пять минут информацию более надежную, чем та, которую дал бы метод мезомерии после трехмесячных вычислений» [3].
Методы сравнительного расчета целесообразно ввести и в курс обучения химиков. Первые птаги в этом направлении уже сделаны, что
видно по появлению несколько лет назад учебного пособия, в котором
описаны различные зависимости, являющиеся частными, но практически весьма важными случаями четвертого и пятого методов сравнительного расчета [57]. В этой книге содержится и много полезных
примеров
вычислений.
Методы сравнительного расчета могут найти применение и в других областях науки, например в геохимии. Так, закономерности в распределении редкоземельных элементов в различных минералах [58—69]
можно рассматривать как пример одного из этих методов. Подобные закономерности позволяют решить различные задачи, возникающие, например,
при изучении редкометальной минерализации щелочных пород [66].
1 Правило линейной зависимости
ного потенциала) (М. К.).
26
м.
X.
Карапетьянц
между
изменениями
свободной энергии (изобаг.
359
2
За
последние
годы
были
найдены
значения
многих
свойств
неизученных веществ. Некоторые из них были ранее предсказаны с помощью методов сравнительного расчета. В табл. 76—78 приведено три
примера сопоставления предсказанных значений с результатами недавно
|
Таблица
76
Сопоставление опытных значений теплоты парообразования АНц.` ( ккал/ моль)
н-С.НьОН е вычиесленными при помощи четвертого метода сравнительного расчета
по уравнению (ТУ,52)
АН пар
t,
°C
А
[4] | ВЫЧИСсле-|
HO
го
АН пар
ккал/
моль
7%
fT
40 | 12,02 | 14,42 | 0,90 | +7.5
70
100
130
160
14,51
10,88
10,87 | 10,50
10,12
9,98
9,27 | 9,30
0,63
0,37
0,14
0,03
|
°C
mo [4]
190 |
+5,5
+3,4
+1,4
—0,3
220
200
280
вычисле-|
HO
8,38 |
"
А
8,45 |
7,44
6,23
3,33
7,37
5,88
3,2
Ар
ккал/
моль.
7%
0,07 | —0,8
0,04
0,35
0,13
+-0,5
+0,6
+4,0
0,30
2,7
ees
опубликованных
работ. Как видно из этих таблиц, совпадение вполне
удовлетворительное, что еще раз подтверждает практическую ценность
методов сравнительного расчета.
Оценивая
точность
применения
методов
сравнительного
расчета,
следует учитывать и влияние достоверности исходных данных. Надо не
только выбирать наиболее надежные величины, но по возможности весь
экспериментальный материал
заимствовать из одной и той же работы
или сводки, тем более, если в последней он приведен в единую систему.
Следует также иметь в виду, что сопоставление значений свойств,
найденных разными методами, может привести к значительным расхождениям между опытными
данными
и результатами вычисления.
Так,
применение первого метода сравнительного
расчета [в виде уравнения
(1,63)] для определения
относительных
констант
диссоциации кислот
может
привести
к не очень точным
результатам, если пользоваться
‘одновременно данными, найденными как индикаторным методом, так и
методом ЭДС (о причинах этой неточности см. ["70]).
Таблица
77
Сопоставление
значений
стандартных — изобарных
потенциалов
А. (ккал/моль) некоторых веществ'рекомендуемых различными иселедователями © вычисленными при помощи второго метода сравнительного
расчета по уравнению (1Х,20)
`
о
AZ ong
Вещество
по
Ваз, к
ВазеО4,
CeQg, K
ErCls, K
FeBrs, K
САС, к
390
к
лит.
—110,4
—249,1
—245,1
—245,0
—211,4
—58,9
—222,5
данным
[6]
[7]
[9]
[10]
[411]
[12]
[411]
А лит. — вычисл.
вычислено
—111,1
—253,7
—246,9
[5]
[8]
[8]
—211,4
—58,4
[5]
[8]
—224,4
[5]
—0,7
—4,6
—1,8
—1,9
0,0
+0,5
+1,1
‘Таблица
AZoog
Вещество
Алит.—
по
—413,4
—419,7
—157,0
[1253,
—104
к
IrSe, K
Ir2S3, к
КВе0., к
KeCrOu, к
KeCreO7, K
КзЕе (С№)в, к
LaCl3-7H20, к
Г азОз, к
№, к
МН.М0Оз, к
—31,5
—52,7
—238,5
— 307,35
—445,6
‘42,4
—645,0
—407,6
18,5
—43,86
Ма2Ва0О:,
NaAlOs, k
К
NaS, K
NbN, к
Nbe2Os, K
№19, а, к
PrCls,
&
k
К
Tc207, к
Ti (SOa)o,
TiCle, r
[8]
—1,1
[7]
—123,8
[8]
3,3
[11]
[414]
—589,4
—646,0
[5]
[5]
[34]
—1318 [8]
—13014*
—27,3 [8]
—415,6
—412,6
[10]
[31]
—416,4 3*
[16]
[33]
[14]
—43,5
—251,2
[26]
Вычислено
по
Вычислено по
и —436,8 [30].
значению
*» Вычислено
по значению
:*
по
РВычислено
[40].
значению
[40]
—219,8
[8]
+4,3
= —786,4
AH...
+1,4
[8]
—2,3
—4,0
+7,0
+3,4
+0,1
—0,3
[23].
— 252,4 [41].
—436,3,
АН и, —
AH
+0,7
—112,5 5*
[40]
AH, =
1,9
+3,8
0,0
—68,4 [5]
|
[39]
АН
—2,0 .
+3,8
—0,5
—548,9
[36]
—36
_49
—3,3
[5]
[37]
значению
‘|
—53,7
—551,2
2* Вычислено по значению
—0,8
—3,8
[8]
[8]
[5]
—109,4 [5]
—412,2
—0,9
—0,6
21,0
33,3
—244,7
[36]
—71,8
—0,7
[8]
[8]
—110,2
—112,6
+0,9
—37,4 [5]
[25]
—3,3
—0,6
+0,8
+2,8
[8]
—235,2 2*
—64,4 [38]
—75,4 [39]
TiCle, K
[39] и —1{23,0
—412,3
[14]
—224,1
—2,8
[10]
—18,2
9
—2,2
,
[8]
[5]
[5]
—234,5
—588,2
—645,4
+2,1
2,7
—2,0
+-0,3
—0,6
.—0,2
—1,7
—2,1
—1,9
0,2
—88,1
—50,6
—422,1
[28]
—38,1
Там, к
[5]
7
7
9
[24]
[25]
[26]
[27]
—53,2
TcOs, K
—257,8
—742,51*
19,43 [34]
37,08 [34]
—244 ‚74 [35]
SrSeOu, K
[5]
[22]
—41,5
—255,0
TaC, k
—100,1
[23]
—24,0
Ве›О., к
ба, г
Зы, г
[8]
[8]
[8]
—739,7
—1282
ReSs, к
—444,1
—116,0
—156,1
—255,6
—120,5
вычисл.
вычислено
. —29,4 [8]
—50,0 [8]
240,5 [5]
—307,1 [8]
—446,2 [8]
—12,6 [5]
—646,7 [5]
—408,7 [8]
16,6 -[5]
—43,7 [8]
—19,08
к
PtSe, K
з*
[15]
‚
[16]
[16]
[17]
[18]
[18]
[149]
[14]
[40]
[20]
[21]
—424,9
ProOs, K
[29]
[10]
[43]
[14]
—411,2
PrCl3-6H20,
- PrCls-7H20,
РгвО11,
данным
—84,8
—50,0
—422,9
к
PbSeQs,
1»
лит.
С 42О0з, к
СеО2, к
HReO,
№4203,
77 (продолжение)
= —1374
=
—123,3,
являющемуся
— 435,8
средним
из
средним
из—123,5
[32].:
являющемуся.
_..
Таблица
AZ og
Вещество
TiCls,
по лит. данным
r
—125,1
—126,2
—127,3
TiCls, K
[38]
[39]
[40]
kK
ZrCly, к
ZrF4, K
[39]
—155,0
[5]
—171,5
[38]
--170,4
[5]
+1,5
70,97
[20]
69,0
[5]
—2,0
[39]
[40]
—236,4 [41]
—244,8 : [44]
92,497 [34]
—215,2 [11]
—981,1
[42]
—413,2 [44]
—172,5 [47]
—38,9 [00]
—238,3 [5]
—243,7 [5]
93,1 [8]
—215,0 [5]
—571,7 [5]
—411,1 [43]
—184,3 [45]
—43,9 [45]
—116,0
—116,07*
—213,4
—432,6
K
лит. — вычисл.
[5]
—174,2
—173 ,35
TINs, K
ZrJa,
вычислено
—155,95 [40]
TiCly, r
A
(окончание)
—125,0
—156,3
ЧОВго, к
UOCle, kK
У, г
УС, к
YCl3-6H20,
Yb203, K
ZrBra, K
ZrC, K
77
[47]
[47]
+1,3
+1,0
+3,8
+3,0
—1,9
+1,1
—0,6
+0,2
19,4
+2,1
—11,8
—5,0
—211,1 [8]
—433,46*
[47]
‘*
Вычислено
по значению
АН,
= — 456,8
[47].
7*
Вычислено
по
АН,
—= — 145,9
[47].
значению
+0,1
+1,2
+2,3
©
+2,3
—0,8
+0,6
Таблица
es
78
о
Сопоставление
значений стандартных
теплот
образования АН...
(ккал/моль)
некоторых веществ, рекомендуемых различными иееледователями, се вычисленными
при помощи второго метода сравнительного расчета по уравнению (1Х,20)
_— АН
Вещество
о
лит.
ВычИС-
данным |
АрзСгОа | 172,37
Аст Оз
41,6
Ba(JOs)2|
249,5
BaSeOs | 279,2
Cd(COO)2| 217,4
Лено
[47] | 168,6
[48] |
[48] |
[7]
[49] |
Алит.— выч. | Вещество
39,8
242,5
|27,2
217,5
3,8
+41,8
+7,0
48,0
—0,4
|К2СгО« |
— АН
110
BEIWHC-
лит. данным
лено
332,8
[49] | 3,4
|KeCr207 | 488,3 [49] | 485,3|
|Pb(COO)s| 206,2 [51] | 208,3)
|/TIJOs
65,7 [48] | 65
А лит.— выч.
+1,7
+3,0
—2,4
+-0,7
3
Только что опубликованы работы ["71, 72], посвященные общему
подходу к нахождению закономерностей в свойствах химических соединений. В одной из них [71] установлено соотношение, связанное
с первым
и вторым
методами
сравнительного
расчета;
в другой
формального анализа авторы приходят к выводу,
случаев исчерпывается
шестью
сопоставлениями,
392
[72] на
основании
что полный набор
соответствующими
шести методам сравнительного расчета. Они отмечают, что одновременное использование поисковых алгоритмов и конкретных программ
на их основе совместно с алгоритмами, реализующими сравнительнорасчетные методы, позволит значительно расширить возможности электронных вычислительных и информационных машин для накопления и
обработки литературных данных по химии.
В заключение напомним, что при работе над созданием и развитием
периодической системы элементов Д. И. Менделеев широко пользовался
сравнительным методом изучения. Он писал: «Надежный путь сравнительного изучения, которого я старался держаться, скорее приведет к той
цели,
которую
стремятся
достичь
химики»
[52]. «... Многие
химические
выводы приобретают новый смысл и значение, замечается правильность
там, где без того они ускользнули бы от внимания» [53] (см. также
[54, 55].
ЛИТЕРАТУРА
ON
Hs OO
.В.А. Пальм.
. Состояние теории
Убсп. химии, 30, 1069 (1961)химического строения в органической
химии.
Докл.
Комиссии
ОХН АН СССР. М., Изд-во АН СССР, 1954.
C. Vroelant,
R. Dandel.
Bul. Soc. chim. France, 16, 217 (1949).
L. W. Shemi lt,
R. W. Esplen, E. Singh
Mann.
Canad. J. Chem.
Eng., 37, 192 (1959).
M.
X. Карапетьянц.
Докт.
дисс. М., МХТИ
им. Д. И. Менделеева,
1957.
CO 00
Mo:
.-R.V. Culver,
C.J. Hamdorf.
J. Appl.
Chem., 5, 383 (1955).
Н. М. Селиванова,
А. Ф. Капустинский,
Г. А. Зубова.
АН СССР, ОХН, 1959, 187.
|
10.
М. Х. Карапетья нц.
Ф. А. Кузнецов, В.И.
Труды МХТИ им. Д. И. Менделеева, 20, 10 (1955).
Белый,
Т.Н. Резухина,
Я. И. Гераси-
мов.
Докл. АН СССР, 139, 1405 (1961).
E. F. Westrum,
F. Grénvold.
B xu::
rials.
International Atomic
Изв.
Energy
Agency,
Thermodynamics of nuclear mate-
Vienna,
1962,
p. 3.
F.H.Spedding,
J.P. Flynn. J. Am. Chem. Soc., 76, 1474 (1954).
В. О. МасГагеп,
М. У. Сгероту.
J. Phys. Chem., 59, 77, 184 (1955).
M.Shimoji, K. Niwa. J. Am. Chem.
13. T. Yokokawa, М. Koizumi,
Soc., 79, 3365 (1957).
11.
14.
15.
16.
R. H. Busey.
J. Am. Chem. Soc., 78, 3263 (1956).
H. Hahn,
F. Burow.
Angew. Chem.., 68, 382 (1956).
E. F. Westrunm,
H. G. Carlson,
Е. Сгбомот а,
18.
19.
20.
М.
J. Phys. Chem., 35, 1670 (1961).
17. J.W. Cobble, G. D. Oliver, W.T.S
“)
<.
1.
М.
Попов,
В.
П. Колесов.
mith.
Ж.
общ.
A.
Kjekshus.
|
J.Am.Chem.Soc.,
75, 5786 (1953).
химии,
26, 2385
(1956).
С. С. Stephenson,
J.C. Morrow.
J. Am. Chem. Soc., 78, 275 (1956).
P. Gray
T.C. Waddington.
Proc. Roy. Soc., A235, 106 (1956).
c.c.Stephenson,
D. R. Bentz,
D.A.Stevenson.
J. Am. Chem
Soc., 77, “464 (1955).
J. Am. Chem. Soc., 79, 2397 (1957).
22. Г. Р. Со ughlin.
G.Grenier.
J. Am. Chem. Soc., 79, 1799 (1957).
23. E. F.Westrum,
Suomen Kem., 31, B228 (1958).
|
24. E. Uusitalo.
N. L. Gellert.
J. ‘Am. Chem. Soc., 78, 3261 (1956).
25. A.D.Mah,
J. Am. Chem. Soc., 76, 978 (1954).
26. G. L. Humphrey.
27. В. И. Лаврентьев,
Я. И. Герасимов,
Т. Н. Резухина.
АН
СССР,
136, 1372 (1961).
29.
Н. П. Жук.
mK. физ. химии,
C.T. Stubblefield,
H.
30.
L.
3018
(1956
Eyrin
H.R.
Lohr,
|
Докл.
a
28, 1523 (1954).
Eick,
L. Eyring.
J. Am.
Chem.
Soc.,
78,
B.B. Cunningham.
J. Am.
Chem.
Soc.,
74,
1186 (1952).
31. D. White,
P.N. Walsh, H.W.Goldstein,
D. F. Dever. J. Phys.
Chem., 65, 1404 (1964).
32. Г. Р. Соц ghlin. Heat and free energies of formation of inorganic oxides. Contui bution to the data on theoretical metallurgy. XII. Washington, 1952, Bur. Mines,
33.
34.
Bull.
542.
J. E.McDonald,
J. W.
Cobble.
J. Phys.
Chem.,
66, 791
р. В. 5%и11, С. С. Sinke.
Thermodynamic
properties
Advances in Chemistry. Ser. N 18. Washington, 1956..
of
(1962).
the
elements.
393
Н. М. Селив
37.
S. W.
а H ова, J. \. C
388. O.
В.В.В
Mayer,
J. Phys.
Chem.,
64,
911
. А. Зубова.
бов
Ж. физ. химии, 33, 141 (1959).
b le, G. E. Boyd.
J. Am. Chem. Soc., 75, 5777
Ом
(196
Kubaschewski,
H.
>в
35.
36. W..T. Smith,
(1953).
s,
T. H.
Villa,
Rutherford,
W.
A.
|
Dench.
R.B.
Serrins.
Trans. Faraday Soc., 52,
' 244 (1956).
|
39. F. D. Rossini,
P. A.Cowie,
F.O. Ellison,
C.C. Brown.
Properties of titanium compounds and related substances (with Appendix by W. C. Arsem).
ONR
Report ACR-17.
40. K. K: Kelley,
44.
42.
Washington,
A. D. Mah.
Oct.,
1956.
Metallurgical thermochemistry of titanium. Bur.
Mines Report of Investigation 5490. U. S. Dep. of Interior. Washington, 1959.
E.Greenberg,
E. F.Westrum.
J. Am. Chem. Soc., 78, 5144 (1950).
W.D.
Good,
D.W.Scott,
J. L.
Lacina,
J. P. McCullough.
J.
Phys.
Chem.,
63,
1139
(1959).
43: М. Х. Карапетьянц,
термодинамических свойств
делеева, вып. 34, 1961.
44. A.G.
Х.
Turnbull.
45.
М.
47.
48.
Kuan
Pan.
J.H.Stern,
М. Л. Карапетьянц.
Таблицы некоторых
различных веществ. Труды МХТИ им. Д. И. Мен-
J. Phys. Chem., 65, 1652 (1961).
Карапетьянц.
46. B. D. Pollock.
Ж.
J. Phys.
физ.
химии,
28,
353
(1954). .
Chem., 65, 731 (1961).
J. Chinese Soc. (Taiwan), Ser. II, 1, 16, 26 (1954);C. A., 49, 7419g.
R. Parker,
L.S. Peak,
W.V.Volland. J. Chem. Eng.
Data, 8, 40 (1963).
|
А. Ф. Капустинский,
К. К. Самплавская.
2241 (1961).
50. L. G. Hepler.
J. Am. Chem. Soc., 80, 6181 (1958).
49.
51.
А.
Ф.
52.
Д. И. Менделеев.
ческого закона. М.—Л.,
И.
И.
А. В. Алапина, М. С. Стаханова,
химии, 34, 1088 (1960).
53. Д. И.
54.
Капустинский,
Новые
Изд-во
Менделеев.
И. Кабачник.
ний. Труды
В с6б.:
Е.
|
Ганенко.
периоди-
сочинения.
архив,
Химия
т.
Л., ОНТИ — Химтеорет,
Г. Периодический
закон.
т. IV,
М.,
2, 112 (1952).
и применение
И Казанской конференции.
фосфорорганических
Изд-во
|
соедине-
М., 1962, стр. 24.
57. A. Pilat. Linearni zavislosti v chemicko-inzenyrskych vypo¢tech. Praha,
58. K. J. Murata, H. J. Rose, M. K. Garron.
Geoch.
Cosmoch. Acta,
(1953).
59.
9. Е,
60.
Э. Е.
64.
K.
62.
63.
Н. В. Туранская.
Е. И. Семенов,
Р.
65.
K. J. Murata,
Geoch. Cosmoch.
AH
№
66.
Вайнштейн,
2, 36 (1956).
J. Murata,
Л.
А.
И.
104, 268 (1955).
H.
А. И.
Баринский.
К. Ф. Павлов.
Тугаринов,
Тугаринов,
J. Rose,
Acta, 41, 141 (1957).
64. Р.
65а.
Вайнштейн,
CCCP,
M.
Н.
Н.
K. Carron,
В.
В.
Glass.
Геохимия,
Geoch.
Cosmoch.
Канд. диссерт. М., ГЕОХИ АН СССР, 1958.
Л. Баринский.
Геохимия, №4 (1953).
Докл. АН
СССР,
CG. V. Dutra,
M.
Acta, 16, 1 (1958).
Ж. хим. пром.,
120, 573 (1958).
Teixeirada
‚
13, 327 (1936).
Costa,
J. J.
R.
Branco.
и
67.
69.
Л.
и кристаллохимии
С.
Бородин.
элементов,
Докл.
|
Туранская.
J. J.
1957.
4, 292
Туранская.
Л. С. Бородин. Труды Ин-та минерал., геохимии
элементов, 9, 94 (1962).
Л. С. Бородин,
Р. Л. Баринский.
Геохимия,
68. Л. С. Бородин.
Геохимия,
Труды
7, 3 (1961).
Ин-та
№
6, 506 (1960).
минерал.,
геохимии
№4
кристаллохимии
редких
(1960).
редких
70. Н. А. Измайлов, Л. Л. Спивак. Ж. физ. химии, 36, 757 (1962).
1. А. Л. Сейфер, Е. А. Смоленский.
В с6б.: Информационные системы.
Ин-т
научной
информации
АН
6,
материалы
по’ истории
открытия
АН СССР, 1950, стр. 51, 58, 67, 81..
АН СССР, 1953, стр. 609, 614.
55. Б. М. Кедров.
Вопросы философии,
56. М.
В.
химии,
ЖЖ. физ.
Научный
Н.М.
неорг.
Селиванова.
Избранные
стр. 269.
Д. И. Менделеев.
Стрелков,
Ж.
СССР,
1964,
стр.
107.
712. А. Л. Сейфер,
А. А. Зенкин. В сб.: Информационные
научной информации АН СССР, 1964, стр. 65.
системы.
М.,
М..,
Ин-т
ПРЕДМЕТНЫЙ
УКАЗАТЕЛЬ*
Аддитивность свойств 17, 955, 56, 57, 959,
61, 62, 63, 137, 219, 225, 226, 295, 305,
307, 387
Активность
219
Время
разложения 238
релаксации 183
Вторичная
Вязкость 19, 105, 140, 339, 367
веществ, отличающихся по изотопному
составу 318, 319, 320—322
газов 191
жидкостей 26, 27, 62, 87, 114, 133, 134,
137, 149, 176, 177, 179, 183, 184, 185,
190, 230, 231, 232. 235,
236.
368,
369—376
расплавленных солей 178.
спиртов 370: 370
стекол 184, 193, 194, 248, 249, 250
углеводородов 371—374, 373, 375, 316
внутреннее
газа 177.
63
насыщенного
пара]
жидкости
7, 8, 28,
29, 61, 84, 87,
113, 114, 115, 137, 142, 144, 149, 166,
170, 178, 179, 180, 183 198—199, 231,
233—240, 242, 320, 329—335, 339—363,
367, 369, 370
раствора 145, 181, 182, 190, 361—363,
’ 367
в тройной точке 346, 347
Деформация
(каучука)
Деформируемость
‚Диамагнитная
19,
26,
27,
65,
Диэлектрическая
проницаемость
78, 79,
81, 88, 101, 102, 103, 133, 135, 140, 141,
177, 178, 182, 183, 218, 228, 231, 233,
201, 320
волны 190, 246
связи 63, 102, 103
Дроссель-эффект
177
ионов
55,
81
восприимчивость
* Курсивом выделены
ветствующих величин.
28 .-
страницы, на
140,
149,
191
Закон
(см. также
Правило,
Уравнения)
Гесса 281
Гейгера-Неттола 181
Дебая 163
Кольрауша 57
постоянных разностей 57
Уравнение,
Изобарный потенциал
возгонки металлов 105
восстановления 93
гидратации 93, 218, 219
, ионизации
диссоциации 43, 44, 136, 146, 147, 150
критическое (см. Критическое давление)
приведенное
250, 329—334
при равных значениях теплоемкости 192,
244
сухого
18,
Длина
периодичность 52
Давление
Дипольный момент 17,
100, 102, 183, 226
93,
105
комплексообразования 93,
образования стандартный
60, 61,62, 65, 92, 93, 94,
153, 161, 164, 165, 182,
254, 255, 274, 276—282,
293—296, 294, 298, 299,
растворения 182 ^^
реакции 44, 60, 61, 68, 93,
165, 274, 388
сольватации 93
сублимации 277,
хемосорбции 93
Износостойкость
сила
219
уравнения
7—8
323
Каталитическая
активность
Каталитическое
действые
которых
101, 445, 161,
228
Интерполяционные
Ионная
322, 323
44, 44, 45, 57,
103, 136, 152,
217, 218, 253,
279, 888—793,
390—392
приведены
таблицы
101,
136
кислоты
значений
97
соот-
395
Киреева метод двойного сравнения 168--169
Когезия
101
Кокса график 240
Компенсационный
Комплекс
свойств
эффект
26, 27,
эвтектического
95—96
179,
224,
335
Константа
(см. также Коэффициент, Постоянная, Число)
Генри 181, 367
диссоциации 45, 94, 97, 102, 218, 320, 390
термической 147
ионизации 181, 367
нестойкости 3419, 322—327, 327—328
равновесия 6, 26, 44, 45, 57—58, 59, 60,
98, 94,
97,
100, 104, 105, 1143, 115,
137, 146, 147, 150, 153, 161, 181, 183,
190, 201, 218, 323, 369, 370
распределения 106
Саудерса 80
сжатия 90, 101, 208
скорости реакции 45, 97, 98, 101, 105,
106, 146, 153, 181, 190, 322, 367, 369,
370, 389
,
уравнения
ван-дер-Ваальса:
а 19, 61, 79, 113,
182, b 61, 79, 113
Гамметта 98, 99, 100, 105, 106, 347
устойчивости 93, 94
фазового равновесия 181, 367
химическая 137
Концентрация 81, 182, 183, 185, 234, 2471,
248, 361, 362
молекулярная 101
при минимальной электропроводности 103
Коши
теорема
Коэффициент
201
(см.
стоянная, Число)
также
Константа,
По-
активности 103, 134. 141, 177, 178, 182,
183, 190
влияния 93, 102
диффузии 19, 79, 176, 179, 319, 367
полимеризации 54
применимости уравнения 346—348
разделения изотопов 314
распределения 34, 35, 314, 315
расширения 18, 19, 105, 136, 140, 176,
177
|
сжимаемости 19, 63, 79, 140
силовой 92
|
температурный
давления пара 30, 31, 32, 56
поверхностного натяжения 56
теплоты парообразования (см. Теплота
парообразования)
ширины запрещенной зоны 102
эдс 296
396
теплопроводности (см. также Теплопроводность) 19, 57, 134, 141, 179, 180,
190, 231, 232, 251
взаимодействия
экстракции 94, 182
электропроводности
1 / Ok
Е (Sr),
= (>>)
Vv \ Ot
(5)
oP
H.
/k
89
80
87
Т.К.
30, 31, 32, 86, 108, 110
Критические
давление 5, 30, 32, 33, 34, 55, 82, 83, 84,
85, 86, 109, 154, 152, 345, 346, 349
объем 38, 33, 61, 86, 113
параметры 108, 137
плотность 38, 34, 105
температура 5, 11, 30, 31, 32, 33, 34, 55, 63,
82, 83, 84, 85, 86, 87, 89, 104, 105,
106, 107,
108, 109,
110, 114, 116,
150, 164, 166, 184, 185, 316, 349
растворения 88, 89, 314
точка 167, 168, 320, 344
Летучесть
144,
190
Лиотропные свойства 91,
Магнитные
восприимчивость 8, 19,
резонанс 26, 91, 100
Межядерные расстояния
межатомные)
Метод
двойного
сравнения
комбинированного
228
101
(см.
Расстояния
168—169
расчета
339—376
интерполяция по параметрам 339
экстраполяция
по
параметрам 339—351
веществам 351—367
свойствам 367—369
мезомерии 389
обратного вычисления 342, 349, 351
Татевского
8, 64
Методы сравнительного расчета 3, 9, 387—
393
первый 10—68, 117—118, 195, 196—197,
_ 203—226, 260—274, 306—307,'313— 347,
322—328, 329—336, 357, 374, 376 ,389,392
второй 76—119, 195, 226—230, 261, 274—
299, 367, 389, 394, 392
третий 133—138, 195, 230—235, 251, 299—
308, 359
четвертый 139—170, 195, 197—201, 235—
‚ 242, 250, 313, 318—322, 330—331, 332,
357, 389, 390
пятый 175—186, 195, 367, 389
шестой 189—194, 195, 242—250
вещества, находящиеся в соответственных состояниях 329—335
вещества,
отличающиеся
по изотопному составу 312—322
взаимосвязь между ними 161, 164, 165,
235, 236, 250—255, 330—334, 357
в
полярных
координатах
378—386
комплексные соединения
298, 322—328
немонотонно
изменяющиеся
свойства
45—55, 237, 238
несколько сопоставлений 203—255, 299,
321, 324, 325, 326, 330; 331, 332, 333,
345, 349, 350
об обосновании 60—68, 112—116, 161—
168, 182—186, 195—202
отклонение первых членов ряда 14, 19, 23,
205, 206, 207, 208, 209, 241, 243, 215,
216, 219, 220, 228, 231, 232, 233, 234,
236, 238, 251, 261, 267, 268, 269, 300,
305, 312, 326, 337
предельные случаи (4 = 1 или В =0)
56—60,
104—107, 150—161, 182, 3143,
317, 319, 323
растворы 26—28, 81—82, 134—135, 141—
142, 177—178,
190, 193—194
сочетание 117—119, 261, 306—308, 357
фазовые превращения
чистые вещества 28—34, 82—88, 134,
142—144, 178—181, 198—199, 315
растворы 35, 88—89,
136, 144—145,
181—190, 200
химические
процессы
35—45,
89—104,
136—137, 145—148, 181—182, 190, 201
чистые вещества
15—26, 77—81, 133—
135, 140—144, 175—177, 190, 194—193
макросвойства
15—19, 77—80, 133—
134, 199—200
микросвойства 19—26, 80—81, 134—135
Микротвердость
Модуль
103
расширения
Молекулярный
347, 352
62
вес 62,
115,
плавлении 84, 87
реакции 66, 101, 137, 153, 248, 238
сжатии 134, 130
ионов 957
кажущийся 28, 134
мольный 8, 15, 16, 51, 61, 62, 63, 189,
191
|
жидкости в точке плавления 105, 106
кристаллов
в точке плавления
105,
106
при абсолютном нуле 206—208, 225
парциальный 53, 54
при абсолютном нуле 105
свободного пространства 179
137,
Объем 317, 326
аддитивность 57, 208
отклонение 249, 221
атомный 63, 79, 87, 101, 102,
в точке
кипения 87
плавления 106, 112
газа 177
|
смеси ‘190
изменение при
активации 101
. кипении 7, 84
образовании осадков 88
230,
105,
346,
140
сорбционных
пор
101
удельный `
жидкости 175, 176
растворов
177, 178
удерживания (в хроматографии)
Однотипные
вещества 148, 152, 168
реакции 94, 146, 148, 152,
182, 201
Оптическая
плотность
27,
153,
101,
88
161,
189,
168,
190
Параметры
вещества 12, 13, 196, 197, 201, 225, 231,
239, 352, 353, 361
растворимости Гильдебрандта 88
решетки 80, 81
условий 133, 134, 137, 140, 141, 148,
150, 161, 170, 175, 183, 185, 189, 191,
192, 195, 196, 198, 230, 231, 234, 235,
236, 237, 241, 243, 251, 252
Парахор
19,
Парциальные
pH
26,
61,
86,
87
величины
53,
54,
101
27
Перенапряжение
адсорбционное 105
водорода 93, 102, 104
кислорода 93, 102
Период
элементарной
ячейки
19, 80
Плотность 5, 8, 59, 62, 64, 137, 140, 225.
в тройной точке 105
таза 19, 55, 56, 63, 77, 18, 222, 224, 226.
227
жидкости 79, 144
изменение
при
парообразовании
168,
184, 185
кипящей жидкости 179, 180, 184, 318.
критическая 38, 34, 105
раствора 178
стекла 81, 82, 83
сухого насыщенного пара 143, 178, 179,
180, 184, 185
твердого вещества 81
39:
Поверхностное натяжение
жидкостей 17, 18, 34, 56, 62, 87, 104,
105, 134, 143, 144, 149, 176, 177, 179,
228, 229
134, 144,
зависимость от температуры
149, 177, 184, 185
кристаллических веществ 105, 108
расплавленных солей 19, 206
Подвижность
ионов
3416,
носителей
317
тока
92
Показатель преломления 5, 17, 18, 55, 171,
78, 81, 82, 86, 87, 1041, 102, 112, 115,
— 185, 222, 226, 227, 228, 229, 319
зависимость от
длины
волны
температуры
раствора 178
Поляризация
323
190,
246,
133, 140,
347,
246
319.
55, 57, 92, 101, 213, 219, 211,
Поляризуемость
226, 314, 388
14,
Поляризующая
сила
19,
28,
25,
112,
115, 206,
26
номер
Постоянная
(см.
элемента
также
11,
13,
Константа,
105,
Коэд-
|
Принцип
аддитивности 8,
Бертло 299
соответственных
99, 104,
осколков
105
42
Работа
выхода
56,
61,
62,
состояний
108, 176
79, 101,
электрона
кислотной
7
87,.
143
|
растворимости
93,
диссоциации
Равновесие
104, 103,
адсорбционный 93, 97
изобарный (см. Изобарный потенциал)
изохорный 57
иона, эквивалентный 92
понизации 40, 42, 53, 90, 91, 92, 93, 94,
99, 100, 101, 102, 103, 106, 112, 137,
148, 205, 214, 229, 323, 325
нулевого заряда 93
окислительно-восстановительный
183
Капустин-
329—333
389
8,
329,
93,
332
143
104
105
105
парообразования, внешняя 86
против внешнего давления 260
Потенциал
94, 105
Правило
(см. также
Закон,
Уравнение,
Уравнения)
Беркенгейма 67
Гульберга-Гюи
334
Дрозина 67
Дюринга 142, 145, 146, 149, 168, 170,
199, 240, 334, 340, 341, 349. 350—351,
370
398
87
Прочность 107,
электрическая
фициент, Число)
криоскопическая 45, 229, 230
распада 181
решетки 103, 118
силовая 24, 57, 88, 91, 99—100,
229
*
полуволны
появления
объем
измененис. э.) 388
температура 184, 185, 250
кипения 87, 144, 184, 185,
нормальная’ 333—335
Произведение
Полярность 151, 164
‚ заместителей
101
связи 267, 271
Порядковый
118
Кобозева 299
линейной зависимости между
ями свободной энергии (л.
Павлевского 116.
Писаржевского-Вальдена
66,
термохимической логарифмики
ского 53
Тромба и Сю 67
Трутона 115, 164, 240, 335
Предел воспламенения 59
Приближенные
закономерности
Приведенные
давление 250
сухого
насыщенного
пара’
144,
329—333.
кислотноосновное
таутомерное
Радиус
атомов
80,
58,
81, 87,
эффективный
57
протолитическое
99
103,
104,
228,
58
229
ионов 20, 55, 60, 81, 88, 102, 103, 104,
112, 118, 219, 225, 228, 269, 270, 271,
272, 273, 325, 326, 327
ковалентный 25, 80, 88, 220, 221, 228,
229
Расстояния
межатомные 20, 21, 22, 23, 24, 25, 5717,
81, 102, 103, 105, 115, 148, 134, 135,
204, 210—213, 212, 220, 221, 225, 226,
319
межионные 105, 214
Растворимость 34, 35, 88, 89, 96, 102, 104,
137, 145, 146, 149, 150, 178, 181, 190,
200, 228, 236, 238, 314, 316, 318, 319,
367, 368
Реакционная способность
99, 100, 388, 389
40,
45,
59,
97,
Рефракция 8, 16, 17, 18, 19,19, 61, .63, 80,
81, 82, 87, 101, 106, 116, 214, 225, 34
интерцепт 227
Ряды
изологов 62
сродства 97
сходных веществ
|
10,
11,
oO
14, 15
Свойства электролитов в бесконечно
бавленных растворах 57, 64, 219
раз-
заряд 102
Энергия связи)
Сжатие
абсолютное 89
лантанидное 53,
при образовании
272
соединений
44,
89,
111
Сжимаемость . 208
адиабатная 79, 316, 318.
газов 191
изотермическая 177
растворов 28, 141, 178
элементов 79`
Сила кислоты 45, 97, 98, 103
реакции 109, 146, 147, 236, 238, 345
17, 18, 61, 87, 316, 3148, 319
Стандартные
вещество 148, 169—170, 235, 240,
340, 341—342, 346, 347, 348, 350,
302, 360, 363
ряд (веществ) 10, 13, 30, 206, 224,
329, 354
состояние 191
электродные
энтропия
потенциалы
(см.
Энтропия
Степень
дейтерирования 320—322
дисперсности 14, 94, 281
ионности
связи 104, 272
ковалентности связи 388
компактности
обмена 101
однотипности
Структура
жидкостей
14,
94,
148,
164,
161
183
281
79,
90,
92,
250,
351,
250,
93
стандартная)
81,
365
218
8, 64
228
"Гейлора ряд 387
82, 149,
(см.
175,
176,
также
185
Точка)`
азеотропной смеси 145
дегидратации 43, 44, 388 `
диссоциации 55, 90, 91
кипения 28, 29, 55, 56, 134, 136,
145, 149, 164, 166, 167, 168,
185, 198, 199, 255, 320, 329,
332, 340, 341, 342, 348—344.
380—381
|
раствора 89
растворителя 89
кристаллизации 170, 349
раствора
136
критическая
(см. Критическая:
тура)
Скорость
звука 61, 79, 1414, 133, 140, 144, 179, 185
испарения 84
процесса переноса протона 230
ультразвука
метод
Твердость
Температура
14, 24, 28, 90, 151, 224, 272,
317
электронный
энергия (см.
Татевского
Текучесть
Связь
,
длина (см. Расстояния межатомные)
Кратность 220, 221
межмолекулярная 137
степень ионности 101, 272
степень ковалентности 388
характер
кристаллов 116, 208, 241
молекул 96, 296, 352, 363,
раствора 183
электронных оболочек 217,
|
142, 144,
170, 179,
330, 331,
344—367,
гемпера-
насыщенного раствора 149
начала
гидролиза 43, 44
‚реакции 90, 93, 104
пересыщенного
раствора
149
плавления 134, 135, 137, 319
полиморфного превращения '51, 84, 316,
317
сублимации 176
фазовых превращений 46, 84, 92
характеристическая 25, 26, 163, 242
Температуры при равных значениях
времени разложения 94
вязкости 193
давления диссоциации 43
насыщенного пара 142, 144, 145
константы равновесия 150
поверхностного натяжения
149
скорости реакции 43, 44, 94
степени превращения 97, 104
текучести 149
теплоемкости 149, 152, 163, 193,
242, 245, 262
теплоты парообразования 149
241,
Тепловой
эффект
(см.
также
Теплота,
Энергия, Энтальпия) 6, 11, 14, 35, 40—
41, 66, 90, 93, 95, 96, 100, 105, 109, 114,
115, 144, 152, 153, 161, 165, 166, 182,
281, 282,
183, 200, 226, 253, 260, 274—277,
293,- 294—296
зависимость от температуры 299—308
399
Теплоемкость 11, 68, 77, 79, 92, 149, 199—
200
атомная 86
газов 61, 133, 149, 194, 209, 210, 235,
241
жидкостеи 62, 84, 87, 104, 105, 108, 110,
185
зависимость от
192—193, 243—246,'
давления
190,
384—386
концентрации
177—178
температуры 133, 140, 149, 161, 163—
164, 176, 190, 192—193, 232, 235,
241—242, 243—246, 308, 384—386
изменение при реакции 101, 152, 153,
161, 164
кристаллических веществ 11, 140, 149,
163—164, 176
парциальная мольная 28, 82
растворов 57, 177—178
сжатых газов 190, 192—193, 243—246,
383—386, 386
стандартная 60, 61, 78, 153, 209, 210,
231, 232, 235, 241, 308, 383
сухого насыщенного пара 84, 104
удельная 62, 178, 192, 244, 245, 383,
384
Теплопроводность
(см. также
Коэффициент
теплопроводности) 57, 104, 176,. 178, 194
Теплота
(см.
также
Тепловой
эффект,
Энергия,
Энтальпия)
абсорбционного
вытеснения
96
адсорбции 91, 94, 137, 145, 218
атомизации 92
выделения газа из жидкости 88
гидратации 64, 90, 91, 94, 102, 228, 388
гидролиза 94
диссоциации 90, 91, 92, 98
ионного обмена 94
комплексообразования 94, 95
образования 6, 35, 38, 54, 57, 62, 63,
68, 89—91, 92, 97, 101, 102, 111, 112,
113,
166,
170,
217,
219, 225, 260,
268, 270, 273
стандартная 35, 36, 37, 38, 39, 52—53,
58, 08, 61, 65—66, 67, 90, 136, 214—
216, 229, 230, 253—255, 260—261,
267, 270, 276, 2717, 280—283, 293—
296, 297, 298—308, 301, 303, 305,
307, 392
окклюзии
94
парообразования 5, 7, 8, 28, 30, 56, 61,
84, 85, 87, 88, 105,114, 115,116, 134,
137, 149, 152, 166, 167, 183, 235, 370
внешняя 62
в нормальной точке кипения 84, 108,
109,
368
115,
116,
154—160,
внутренняя
167,
182
335—336.
зависимость
от
температуры
158—160,
170,
184,
185, 318; 380, 381, 390
давления 142, 143, 150, 154, 151,
152, 154—157, 239
плавления
45,
51, 82,
83, 116, 228,
229, 2371, 239.
полимеризации 53, 54
разложения 94, 97
растворения 40, 41, 61, 88, 90, 94, 101,
103, 137, 145, 162, 166, 216, 247,
316, 317
реакции 38, 40, 41, 53, 54, 60, 89, 90,91,
93, 137, 166, 182, 225, 226, 274—275
самодиффузии
ионов
95
сгорания 6, 8, 40,
113,
116
смачивания 101
смешения 182
солевого
эффекта
61,
62,
101,
106,
94
сольватации
45, 91,
93
сублимации
61, 84, 104,
фазовых превращений 83,
хемосорбции 42, 93
экстракции
95
-
105, 113, 299
84, 92. 105
ские
Термодинамиче
свойства
91
ионов
электролитов в неводных
характеристики процессов
Термоэлектродвижущая
Точка
(см.
также
растворах 45
93, 97, 315
сила
234
Температура)
азеотропная
145
критическая
167, 168, 320, 344
кипения 5, 30, 56, 57,
84, 86, 87, 104, 105,
115, 146, 222, 223,
308, 399, 365, 366
кристаллизации 344,
_ плавления
|
62, 63, 65, 66, 83,
106, 107, 112, 114,
335, 351, 356, 357,
345
5, 34, 45—51,
49, 62,
84,
87, 88, 89, 103, 104, 105, 1441,
113, 115, 221, 222, 229, 315, 388
тройная
фазовых
84,
85,
86,
346,
превращений
45
86,
112,
347
Удельные
вес 15, 16, 146, 147
вращение 178, 185
объем 175, 176, 177, 178
сопротивление 102, 176
теплоемкость
62, 178,
192, 244,
383, 384
электропроводность 170, 177, 178,
247, 248
245,
190,
Уравнение (см. также Уравнения, Закон,
Правило)
Абас-заде 180
Антуана 8, 32, 235, 339, 365, 366, 369
Аррениуса 95
Бачинского 176, 182
Бекетова 89
Бернштейна
23
Берроуза 88
Бильтца 15
Богдана 179
Бойля—Мариотта 177
Борна 218, 261, 262, 263
Борна
— Майера 261, 262, 263
Брауна
99
Брёнстеда
Ван
58, 97, 98
Лаара
|
179
Вант-Гоффа
201
Гамметта 98, 99, 100, 106, 107, 389
Ганча и Карлсона 34
Герца
179
Герцога 85
Голькомба и Брауна 149
Гопала 113
Гордона и Отмера 144, 332
Денбига 180
Денсли и Карлтона 77
Джонсона,
Чен-юнга
и Ти-канга 145,
202, 236, 238 .
Дракина
299
Дэвиса
324
Зеглина 144
Зиборака и Ольшевского 89
Капустинского 261
КБапустинского и Яцимирского 274
Карапетьянца
Карапетьянца
Карлсона 65
Карра
и
и Жукова
и
Вольцинского
Климана
179
Коллара и Прозта 89
Кольрауша
162, 163
Констэбла 95
Косграва и Шнейдера
Косселя
63
329
Хожаинова
331
149
143
Кубашевского и Эванса 90
Лазарева и Александрова 177
Магнуса 323
Мак Леода 179
Мамедова 144
Отмера и Такара 179.
Поляни 96
Пурмаля 52
Скотта 200
Смиттенберга и Мулдера 227
Сперанского 181
Сривастава и Варшни 182
Стела 179
Тарасова 163
Томсена 177
Тэта
189
Фрумкина 98
Хоппа 38
Чина 150, 200
Шао-линга
179
Шарма 177
Шварца 59
Шишокина
90
Шульца 143
Эльянова и Гоникберга 153
Юнга 178
Уравнения (см. также Уравнение,
Правило)
Ахумова 145, 149
Баландина
Закон,
90
Карапетьянца 417, 18, 19, 24, 26, 28, 30,
33, 34, 40, 43, 48, 541, 56, 77, 78, 80,
83, 84, 90, 92, 108, 112, 141, 144, 145,
146, 149, 150, 170, 176, 237, 241, 260,
261, 274
Карапетьянца и Чэн-Гуанг-юе 352, 354,
356, 357, 359, 360, 361, 363, 367
Киреева 144, 145, 146, 147, 149, 150,
153, 154, 155, 166, 168, 171, 182, 199,
201, 236, 238, 240, 340, 341, 350—351,
362, 363, 364
|
Клапейрона — Клаузиуса 7,
152, 164,
167, 180, 199
Комарова
90, 93
Лагемана и Дунбара 79
Ли 15—16
Лотье 35, 90, 143, 149
Отмера 144, 181, 367
Отмера и Люли 184, 183, 367
Отмера и Уайта 184, 367
Перри и Смита 145, 149, 200
Першке 178, 185, 186
Путилова
105
Хенглейна 87, 144, 145, 149, 171, 199,
320, 340, 341, 345, 351
Хомутова 217—218
Усадка металлов 87
Устойчивость
соединений
Функция aoe
ф-шкала
235,
54,
55,
89,
104
133, 140
248
Частота колебаний 23, 24, 25, 26, 99, 100,
102, 105, 244, 344, 345, ЗАТ, 321, 322
сдвиг
94, 99, 100, 104
Число
(см.
также
Константа,
Коэффициент, Постоянная)
волновое 94
401
гидратации 101
координационное 325
Прандтля
180, 181
Ширина запрещенной зоны
103, 104, 113
Электрическое
92,
104,
сопротивление 176, 178,
Электродвижущая сила 136,
140,
Электронное
105,
сродство
Э1,
Электроотрицательность
105, 323, 325
кристаллохимическая
. 93,
Электропроводность
80,
101,
79,
183—184
146,
102,
183
147
112, 261
99,
100,
261
101,
103,
|
105,
предельная 26, 27, 57, 66, 142, 162,163,316
удельная 170, 177, 178, 190, 247, 248
эквивалентная 134, 141, 142, 162, 247,:248
Энергия (см. также Тепловой эффект, Теплота, Энтальпия)
активации
|
вязкого течения
114, 115, 176,
184
диффузии
разрушения
79
самодиффузии
металла
176
металлов
105
химического процесса 42, 59, 80, 95,
96, 97, 101, 102, 104, 106, 109, 111,
315, 316
электропроводности 80, 184
внутренняя 57, 260
водородной связи 388
возбуждения 91, 105
гидратации 92, 112, 226
диссоциации 38, 42, 91, 92, 103, 221, 261
дыркообразования
86
ионизация
(см. Потенциал ионизации)
ионной диссоциации 218
кристаллической решетки 40, 53, 91, 92,
101, 102, 103, 104, 105, 141, 112, 115,
214, 218, 226, 260, 261, 262--266, 267,
268, 270—274, 271, 272, 2738, 316
локализации 106
образования ионов 218
отталкивания 222
процесса 89
разрыхления 79
растворения 96
связанная 94
связи 42, 91, 92, 102, 103, 104, 105, 141,218, 314, 316, 317, 317, 319, 324, 387
сольватации 40, 57, 218
сопряжения 57, 101
электростатическая
218
Энтальпия (см. также Тепловой эффект,
Теплота, Энергия) 86, 94, 113, 134, 194,
200, 260
`
абсорбционного вытеснения 9
гидратации 94, 217
eee 77
диссоциации
‘38.
^^
.
и
зависимость от
концентрации 248
температуры 61, 134, 140,
237, 248, 306 |
парциальная мольная 190
сольватации 57
стандартная 61
сублимации
116
фазового
превращения
54,
169,
236,
83
Энтропия 17, 68, 77, 79, 144, 199, 200, 221
газов 134, 140, 232
жидкостей 105, 108, 110
зависимость
от температуры
92, 133,
134, 140, 199, 232
ионов 26, 217, 82, 221, 222, 225
растворов 219
стандартная 17, 61, 78, 95, 133, 134, 140,
©
209, 231, 232, 281, 294, 296, 314
Энтропия
процесса
абсорбции 96.
адсорбции 93, 94
активации 101, 107
ассоциации
101
выделения газа из жидкости
гидратации 93, 94, 100, 104,
217, 298
гидрирования 295
гидролиза 94
изомеризации 295
ионного обмена 94
комплексообразования 94, 95,
образовация, атомарная 153,
окклюзии 94
парообразования 83, 87, 88,
116, 143, 164, 167, 180
плавления
82,
|
88
103,
104,
104
169
108,
109,
83, 84
разложения соединений 94
растворения 27, 94, 100, 182
самодиффузии
ионов 95
солевого
эффекта
94
сольватации 957
сублимации 113, 116, 117
фазового превращения 83
химической реакции 95, 147, 152, 153,
161, 164, 201, 253, 254, 274, 275—277,
295
|
экстракции 95
Эффект
зтелей 99
изотопный 317, 322
комгенсационный 95—96
поляризационный 55, 57, 92,
219, 271, 323
растворимости 101
сопряжения
99
стерический 98, 99, 100
трансвлияния Черняева 96
экранирования
364
101,
213,
ОГЛАВЛЕНВЕ
Предисловие.
Введение.
Глава Г.
..
еее
Сравнение
значений
данного
двух свойств
в двух
в одном
рядах
веществ
П.
Глава
ПП.
Глава
ТУ. Сравнение значений одного свойства двух веществ при различных
Глава
значений
свойства
Глава
Глава
Сравнение
ии
ряду веществ
Сравнение
значений
одного
свойетва в ряду
двух значениях
параметра уеловий
. . . . значениях параметра
условий.
.
6
веществ
ee
ew
(еее
при
139
еее
У. Сравнение значений двух свойств одного вещества при различных
значениях параметра условий
..
„еее
еее
УТ. Сравнение значений одного свойства вещества при двух
параметра условий в зависимости от значений
другого
условий
. .
еее
еее
еее
глава. УП.
06
Глава
УПГ.
Переход
Глава
[Х. Некоторые примеры применения методов сравнительного
Глава
Х. Некоторые
Глава
ХГ. Метод
Глава
ew
обосновании
Предметный
от единичного
сравнительного
к нескольким
сравнительного
..
указатель
расчета
еее
...
195
203
сопоставлениям
расчета.
1
расчета. П
уе
260
312
339
. .
расчета
189
расчета,
примеры применения методов сравнительного
комбинированного
ХПИ. Методы
Заключение
методов
значениях
параметра
нее
175
в полярных
координатах
.
еее
еее
еее нина
.
378
387
395
Михаил
Христофорович
Методы
сравнительного
Карапетьянц
расчета
физико-химических свойств
2
Утверждено к печати
Институтом общей и неорганической
им. Н. С. Курнакова
Академии наук СССР
химии
*
Редактор В. А. Медведев
Художник Н. П. Фролов
Технические редакторы:
И. В. Дорохимна, Е. В. Макуни
*
Темплан 1964 года № 562. Сдано в набор 13/У1ПТ 1964 г.
Подписано к печати 9/Т 1965 г. Формат 70х 1081...
Печ. л. 25,25=34,45 усл. nm. Уч.-изд. л. 31,8. Тираж 4500 экз.
Т-00312.
Изд. № 2510. Тип. зак. № 1104
Цена
Издательство
Москва,
2 т. 48 к.
«Наука»,
К-62, Подсосенский
пер., 21
2-я типография издательства «Наука»,
Москва, Г-99, Шубинский пер., 10