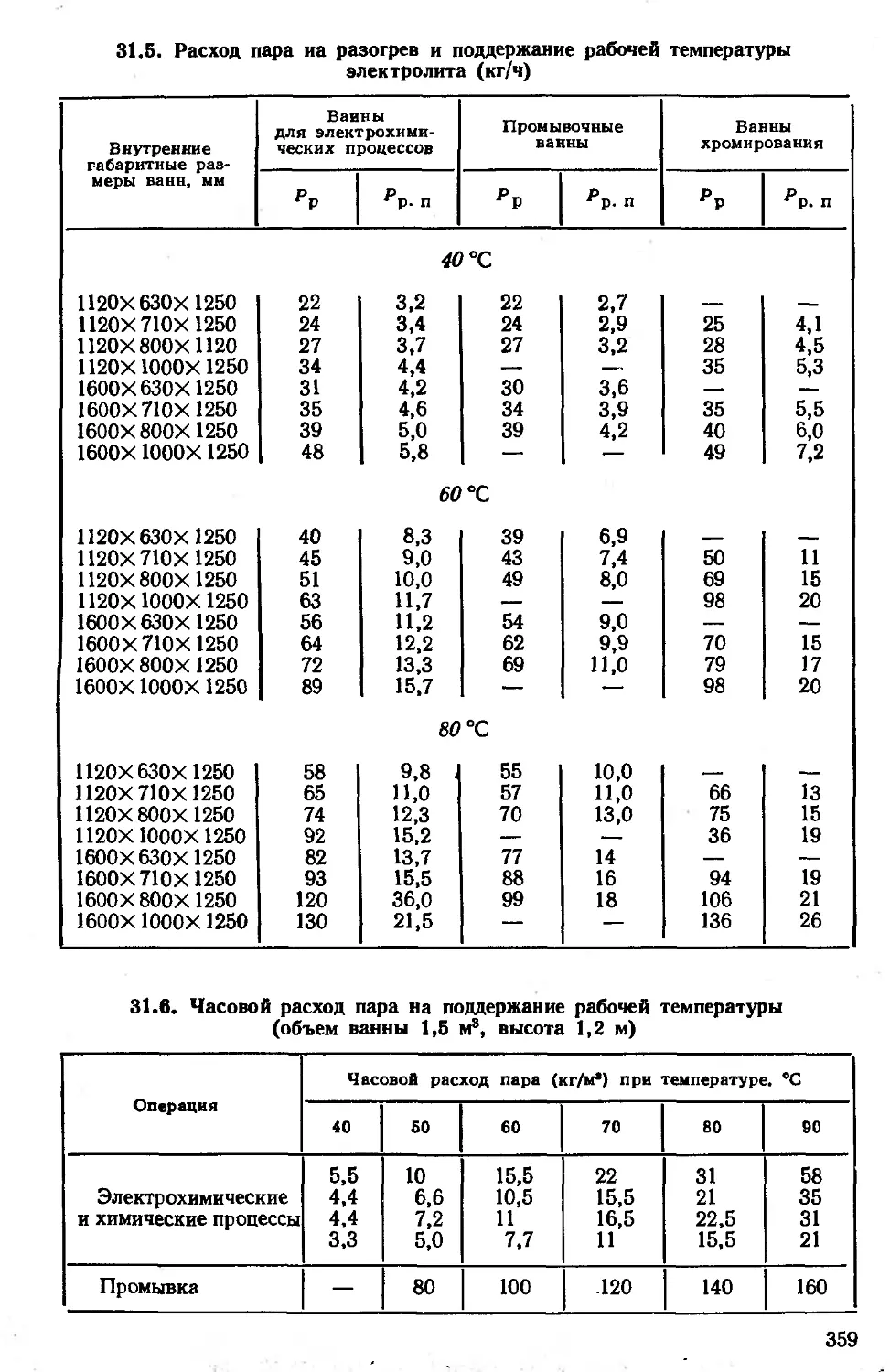
Автор: Дасоян М.А.
Теги: отдельные машиностроительные и металлообрабатывающие процессы и производства гальванотехника электрохимия электролиз
ISBN: 5-217-00381-2
Год: 1989
Текст
ДЛЯТЕХ^ИО'МОв
М.А.Дасоян
И.Я.Палъмская
Е.В. Сахарова
ТЕХНОЛОГИЯ
ЭЛЕКТРО-
ХИМИЧЕСКИХ
ПОКРЫТИЙ
L/«1^14301 РО-1ИЫ
ДЛЯ ТЕХНИКУМОВ
М.А.Дасоян
И. Я. Пальмская
Е.В. Сахарова
ТЕХНОЛОГИЯ
ЭЛЕКТРО-
ХИМИЧЕСКИХ
ПОКРЫТИЙ
Попущено Управлением кадров и социального развития
Министерства автомобильной промышленности в каче-
стве учебника для средних специальных учебных заведений
Ленинград
„Машиностроение"
Ленинградское отделение
1989
ББК 34.663я723
Д20
УДК [621.357.6/.7 + 331.45 + 504.3.06] (075.32)
Рецензенты: Н. Ф. Николаева, Г. В. Овчарова
Дасоян М. А. и др.
Д20 Технология электрохимических покрытий: Учеб, для
средних специальных учебных заведений/М. А. Дасоян,
И. Я. Пальмская, Е. В. Сахарова. —Л.: Машиностроение.
Ленингр. отд-ние, 1989. —391 с.: ил.
ISBN 5-217-00381-2
В учебнике изложены основные закономерности электролиза и меха-
низм образоваиня катодных осадков. Приведены современная рецептура
ванн н режимы работы. Описаны технологические процессы нанесения
металлических и оксидных покрытий. Рассмотрены вопросы техники
безопасности, промышленной санитарии и охраны окружающей среды.
2704070000—178 .
Д —лчв /лit—яо~ — Св. план для сред. спец. учеб. ББК 34.663я723
odB(oi)—ва заведений 1989
ISBN 5-217-00381-2 © Издательство «Машиностроение», 1989
ПРЕДИСЛОВИЕ
Гальванические покрытия применяются практически
во всех отраслях промышленности для защиты деталей от кор-
розии и получения новых функциональных свойств: повышен-
ных поверхностной твердости, износостойкости, антифрикцион-
ной способности, высокой отрицательной способности и т. п.
Гальванические покрытия используют для восстановления
изношенных деталей, облегчения пайки. Они во многих случаях
позволяют заменить цветные металлы черными, благородные —
неблагородными, дефицитные — распространенными. По меха-
ническим свойствам, чистоте, коррозионной стойкости и экономич-
ности гальванические покрытия превосходят все остальные. Воз-
можность регулировать толщину слоя изменением продолжи-
тельности процесса и плотности тока, а также уменьшать рас-
ход цветных металлов, на покрытие поверхности, выгодно отли-
чает гальванический метод покрытия от других.
Советские ученые являются основоположниками многих важ-
нейших методов нанесения покрытий. Создание гальванотех-
ники — заслуга русского ученого, академика Б. С. Якоби. Работы
В. В. Петрова, Э. X. Ленца и других крупных русских ученых
послужили основой развития химических и электрохимических
методов защиты металлов. Большой вклад в развитие гальвано-
стегии внесли своими теоретическими и практическими работами
советские ученые В. А. Кистяковский, Н. А. Изгарышев, Г. В. Аки-
мов, Ю. В. Баймаков, Н. П. Федотьев, В. И. Лайнер, Н. Т. Куд-
рявцев, К. М. Горбунова, А. Т. Баграмян, А. П. Машовец,
В. П. Машовец и многие другие.
Дальнейшее развитие гальванотехники предполагает автома-
тизацию и механизацию процессов нанесения покрытий, снижение
вредного влияния гальванического производства на окружающую
1* 3
среду путем создания малоотходных, экологически чистых тех-
нологий.
В учебнике приведены основные наиболее распространенные
способы подготовки металлических поверхностей к нанесению
различного вида покрытий: механические, химические и электро-
химические. Рассмотрены вопросы полирования поверхностей,
механизм образования и структура осадков, рассеивающая и
кроющая способности электролитов. Приведены составы электро-
литов и режимы нанесения многослойных комбинированных по-
крытий типа би- и три-никель, сил-никель и т. д.
а
РАЗДЕЛ I
ОБЩИЕ СВЕДЕНИЯ О ПОКРЫТИЯХ
ГЛАВА 1. СПОСОБЫ НАНЕСЕНИЯ ПОКРЫТИЙ
§ 1.1. ФИЗИЧЕСКИЕ СПОСОБЫ
Все существующие способы нанесения покрытий можно
разделить на физические, химические и электрохимические. Физи-
ческие способы нанесения покрытий осуществляются погружением
в расплав, диффузией, металлизацией, напылением и конденса-
цией в вакууме. Химические и электрохимические способы осно-
ваны на окислительно-восстановительных реакциях, которые про-
текают на поверхности изделий, помещенных в соответствующие
среды. Химическим способом можно наносить покрытия в жидкой,
пастообразной или газообразной среде при различных темпера-
турах. Электрохимический способ производится только в электро-
проводных средах с применением внешнего источника тока.
Металлические покрытия можно наносить всеми перечислен-
ными способами. В табл. 1.1 приведены способы нанесения наи-
более распространенных покрытий.
Неметаллические покрытия (лаки, краски, пластмассы) нано-
сят в основном физическими способами. Исключение составляют
оксидные и фосфатные покрытия, которые получаются путем
химической или электрохимической обработки деталей.
Природа сцепления покрытия с основой обусловлена способом
его получения. Электрохимические покрытия, а также покрытия,
полученные металлизацией или напылением в вакууме, связаны
с поверхностью основного металла чисто механически, т. е. сла-
бее, чем покрытия, нанесенные путем диффузии или окунания
в расплав, когда под влиянием высокой температуры на поверх-
ности деталей образуются сплавы, состоящие из металла покрытия
и металла основы.
На протяжении нескольких веков на железные изделия нано-
сили металлические покрытия горячим способом. Благодаря своей
простоте и высокой производительности этот способ широко при-
меняется и в настоящее время. Изделия после соответствующей
подготовки погружают на непродолжительное время в расплав
металла покрытия. После извлечения из расплава на них остается
прочно сцепленная с основой пленка, образующая после за-
твердевания покрытие, толщина которого колеблется от 20
до 200 мкм.
6
1.1. Способы нанесения металлических покрытий
Способ нанесения Алюми- ний Кадмий Олово Циик Хром
Погружение в расплав + -— + + —.
Диффузия + ——• ’—. + +
Металлизация + — —• + —
Напыление в вакууме + •— — + +
Электрохимический -—, + + + +
Химический — .— + — +
Основными условиями, определяющими возможность нанесе-
ния покрытий этим способом, являются следующие: 1) расплавлен-
ный металл должен хорошо смачивать поверхность металла изде-
лия; 2) металл покрытия должен растворяться в основном ме-
талле; 3) температура плавления основного металла должна быть
намного выше температуры плавления металла покрытия. Этим
требованиям удовлетворяют такие металлы, как цинк, олово,
алюминий. Кадмий вследствие высокой токсичности своих паров
этим способом не получают. Свинец плохо смачивает сталь, по-
этому его можно наносить на тонкий подслой олова, который
хорошо сплавляется как с основным металлом, так и со свинцом;
можно вносить олово и непосредственно в ванну со свинцом. Таким
образом на изделиях образуется сплав олово—свинец.
Горячий способ получения покрытий с промежуточным под-
слоем называется гомогенным. Этим способом можно наносить
свинец значительной толщины на стальные конструкции больших
размеров, при этом расплавленный свинец хорошо заполняет
отверстия и каналы швов.
Отличительной особенностью покрытий, полученных горя-
чим способом, является отсутствие четкой границы между метал-
лом основы и покрытием вследствие образования диффузионного
слоя. Особенно это характерно для горячего цинкования — при
взаимодействии железа с расплавленным цинком образуется по-
крытие, состоящее из ряда слоев железоцинковых фаз, последо-
вательность расположения которых точно соответствует диаграмме
состояния железо—цинк. При температуре 450 °C, начиная с же-
леза, образуются следующие фазы: альфа (а) — твердый раствор
цинка и железа с содержанием цинка около 6 %; гамма (Г)-фаза,
представляющая собой интерметаллическое соединение Fe5Zn21,
она содержит от 20 до 28 % железа; дельта (б^-фаза — интерме-
таллическое соединение типа FeZn7 с содержанием от 7,0 до 11,5 %
железа; дзета (£)-фаза с наибольшим содержанием цинка и 6,0—
6,2 % железа; следующий слой представляет собой эвтектическую
смесь С + Tl-фаз; последний слой эта (т])-фаза представляет собой
почти чистый цинк. Таким образом, оцинкованный слой состоит
из шести фаз, на долю верхнего слоя цинка падает 50—65 %
общей толщины покрытия. Фазы Г и £ — промежуточные слои,
6
4 2
J
4
.5 6
Рис. 1.1. Схема ванны горячего цинкования проволоки
они являются наиболее хрупкими, и с точки зрения общей пла-
стичности цинкового покрытия следует стремиться к подавлению
их роста.
Цинкование погружением в расплав применяется в промышлен-
ности более 100 лет. Из известных способов цинкования этот
способ занимает первое место. Около 45 % добываемого цинка рас-
ходуется на горячее цинкование кровельного железа, труб,
листов и проволоки. Технологическая схема цинкования включает
в себя обезжиривание, травление, флюсование, погружение в рас-
плав и охлаждение готовой продукции.
Флюсование производят для окончательной очистки основ-
ного металла от продуктов реакции железа с травильными раство-
рами, а также от оксидов, которые образовались на поверхности
протравленного металла при контакте с воздухом. Кроме того,
флюс должен способствовать смачиванию поверхности железа
расплавленным цинком. Флюс обычно состоит из хлоридов аммония
и цинка. При «мокром» способе расплавленный флюс находится
в непосредственном соприкосновении с расплавом. Флюс состоит
из смеси NH4CI и ZnCl2 (по 42—43 %), остальное — ZnO. Тем-
пература смеси должна поддерживаться равной 300—350 °C.
На рис. 1.1 приведена схема ванны для горячего цинкования про-
волоки. Проволока 2 проходит через флюс 4, освобождается от
образовавшейся при травлении корки солей 5 и попадает в расплав
цинка 3, где покрывается железоцинковым сплавом; часть сплава
при движении проволоки при этом падает на дно ванны, образуя
там гартцинк 6. При выходе из ванны на поверхности железоцин-
кового сплава откладывается слой 1 чистого цинка.
При «сухом» флюсовании изделия сначала помещают в раствор,
содержащий 100—150 г/л ZnCl2 и 400—600 г/л NH4C1, а затем
подсушивают при температуре 150—200 °C до полного испарения
воды. Сухой способ позволяет добавлять 0,2 % А1 в расплав
цинка, что улучшает пластичность покрытий.
Температура при горячем цинковании поддерживается в пре-
делах 440—470 °C. Время выдержки зависит прежде всего от
массы изделия, его формы и от массы флюса на поверхности.
Толщина и равномерность во многом определяются условиями
7
Рнс, 1.2. Схема установки горячего оловя-
нирования листов
выгрузки. Например,
слишком быстрая выгруз-
ка приводит к образова-
нию толстых и неравно-
мерных покрытий. Послед-
ней операцией является
охлаждение изделий в воде
при температуре 80—90°C.
Если детали должны со-
хранять блеск, в воду до-
бавляют масло или жидкое
мыло.
На втором месте по масштабам промышленного применения
находится горячее оловянирование. В связи с тем что температура
плавления олова почти на 200 °C ниже температуры плавления
цинка, оловом можно покрывать не только черные металлы,
но и медь, алюминий и их сплавы. Горячее оловянирование широко
применяется для получения белой жести, а также для покрытия
стальной проволоки. Подготовительный процесс при этом подобен
подготовительному процессу при цинковании. Оловянирование
производят при температуре 200—300 °C в течение нескольких
секунд. Зеркало расплава покрывают флюсом из хлорида цинка,
который приготавливают путем растворения металлического цинка
в соляной кислоте. Для усиления действия флюса к хлориду
цинка добавляют 3—5 % хлорида аммония. Окончательный слой
олова формируется при прохождении полуфабрикатов через
валки жировой ванны.
На рис. 1.2 представлена схема установки для оловянирования
листов. Увлажненные листы 1 с помощью специальных валков
автоматически подаются во флюс 2, а затем в ванны с расплавом
олова. После выхода из ванны с маслом листы охлаждаются возду-
хом. Применение двух ванн оловянирования оправдано тем, что в
первой ваннеЗ олово со временем становится загрязненным различ-
ными примесями, тогда как вторая ванна 4 содержит иистое олово.
При диффузионной обработке происходит насыщение поверх-
ностного сло!я активным компонентом внешней среды. Это может
быть металл, неметалл, соль или газ. В качестве металлов чаще
всего используют цинк, хром, алюминий.
Диффузионные покрытия отличаются большой равномерностью
и высокой коррозионной стойкостью при эксплуатации в атмо-
сферных условиях. Слой практически состоит из сплава металл
основы — металл покрытия. Следовательно, так же, как при
цинковании, имеются диффузионные зоны, которые обеспечивают
прочное сцепление покрытия с поверхностью изделия. Темпера-
тура обработки должна быть ниже температуры плавления ме-
талла покрытия.
При диффузионном цинковании изделия помещают в специаль-
ные ящики и заполняют порошком, который состоит из мельчай-
8
Рис. 1.3. Структура покрытия,
полученного путем металлиза-
ции:
7 — основной металл; 2 — частицы
металла покрытия; 3 — поры
трубы, сложнопрофилиро-
ших пылинок цинка, покрытых тон-
кой пленкой оксида (пусьеры). Для
ускорения процесса насыщения в пу-
сьеру добавляют 1 %-ный раствор
НС1 или NH4C1. Пусьера не должна
содержать примесей меди, свинца и
сурьмы. Содержание оксида цинка
в пусьере составляет примерно 10 %,
его добавляют для предотвращения
спекания цинкового порошка. Гер-
метически закрытые ящики или, как
их называют, контейнеры, загружают
в печь при температуре 200—300 °C
и нагревают до 380—400 °C, выдер-
живая при этой температуре несколь-
ко часов. Толщина покрытия зависит
от времени обработки и от тем-
пературы. Таким образом можно
покрывать крепеж, детали арматуры,
ванные детали. Размеры деталей ограничены размерами печей.
Для получения жаростойких покрытий на углеродистых ста-
лях применяются диффузионное хромирование и алюминирование
(алитирование). Диффузионной средой для хромирования яв-
ляется порошкообразный хром или феррохром. Для ускорения
процесса добавляют растворы NH4C1 или НО. Образующийся
при этом атомарный хром выделяется на поверхности изделия
и диффундирует в глубь металла. В ящики засыпают смесь,
которая состоит из 65 % хрома или феррохрома, 30 % шамота и
5,0 % флюса. Температура обработки 1000 °C, выдержка не менее
9 ч. Толщина слоя достигает 0,02—0,05 мм. Детали, предназна-
ченные для алитирования, укладывают в ящики и засыпают
смесью, которая состоит из алюминиевой пудры и оксида алю-
миния. Температура обработки 800—1000 °C. Время в зависимости
от необходимой толщины колеблется в пределах от 4 до 25 ч.
Жаростойкость стали после алитирования увеличивается в 6—
10 раз.
Металлизация — наиболее универсальный способ, так как
позволяет наносить покрытия на крупногабаритные конструкции,
восстанавливать размеры изношенных деталей и, что особенно
важно, наносить локальные слои. Диффузионных зон при этом
способе не образуется, так как изделия не успевают прогреваться,
поэтому покрытие получается пористым и имеет слабое сцепление
с основой. Схема такого покрытия представлена на рис. 1.3.
Осуществляется металлизация путем распыления расплавлен-
ного металла на различные поверхности под действием сжатого
воздуха. Для нанесения таких покрытий используют специальные
пистолеты-распылители — металлизаторы. Наибольшее распро-
странение получили электрометаллизаторы проволочного типа.
9
Этим способом можно наносить такие металлы, как алюминий,
цинк, олово, медь, молибден независимо от их температуры плавле-
ния. Лучше всего наносить покрытия после пескоструйной обра-
ботки. На нарезные и резьбовые соединения этим способом на-
носить покрытия нельзя.
Весьма перспективным и универсальным является способ
конденсации покрытий в вакууме. Этот способ так же, как метал-
лизация, позволяет получать металлические покрытия на различ-
ных материалах. Наиболее часто применяют для этих целей
алюминий, хром, титан, цинк, серебро и золото. Толщина покры-
тий не превышает нескольких микрометров. Механизм процесса
состоит в том, что металл при нагревании в вакууме переходит
в парообразное состояние, а затем конденсируется на твердых
поверхностях. Расположение деталей в вакуумной камере должно
быть таким, чтобы они не экранировали друг друга. Не допускается
наличие влаги и других летучих компонентов. Промышленные
установки для вакуумной металлизации состоят из вакуумной
камеры, системы для откачки воздуха и испарителей. Испарители
изготавливают из тугоплавких металлов, например вольфрама
или тантала. Испаряемый металл помещают на испаритель в виде
проволочки, лент или кусочков. Оптимальное расстояние деталей
от испарителя 200—400 мм при вакууме 1,33 Па. Весь цикл обра-
ботки, включая загрузку, откачку воздуха, напыление и выгрузку,
занимает 15—20 мин.
§ 1.2. ХИМИЧЕСКИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ
СПОСОБЫ
Химические способы нанесения покрытий широко при-
меняются в промышленности. Одной из основных особенностей
этого способа является ведение процесса без наложения электри-
ческого тока. Химический способ позволяет получать равномерные
покрытия на деталях сложной конфигурации, причем не только
на внешней поверхности, но и на внутренней. Химическая метал-
лизация в основном применяется для получения никелевых и
медных покрытий. Покрытие осуществляется в слабокислых или
слабощелочных растворах. Основными компонентами являются
соль металла покрытия и восстановитель. Температура растворов
90—100 °C.
После нанесения химического никеля производят термиче-
скую обработку, которая обеспечивает прочность сцепления по-
крытия с основным металлом благодаря образованию диффузион-
ных слоев. Более подробно способ химического никелирования
описан в § 15.8.
Химическое меднение широко применяется для металлизации
пластмасс и других непроводниковых материалов. Благодаря
сравнительно простому оборудованию и достоинствам этого спо-
10
соба в настоящее время имеются рекомендации по химическому
нанесению кобальта, платины, палладия и других металлов.
Химическим способом можно наносить также оксидные и фос-
фатные покрытия. Вследствие небольшой толщины и сравнительно
низких механической прочности и антикоррозионной стойкости
этих покрытий их часто комбинируют с другими видами покрытий.
Химические оксидные пленки образуются при обработке металлов
в растворах, содержащих окислители, которые способны генери-
ровать на поверхности кислород, вступающий во взаимодействие
с металлом.
С давних пор применяется в промышленности оксидирование
(воронение) стали. Прочные пленки получаются на меди и ее
сплавах. Подвергаются химическому оксидированию и магниевые
сплавы. Толщина оксидных пленок составляет от 2 до 5 мкм,
предельная эксплуатационная температура 250—300 °C. Повысить
защитные свойства таких покрытий можно путем последующей
обработки минеральными маслами или нанесением лакокрасочных
покрытий.
Фосфатные пленки образуются в результате взаимодействия
черных или цветных металлов с растворами фосфорной кислоты и
ее солей. Получение фосфатных пленок несложно и легко осуще-
ствимо, при этом не требуется сложного и дорогостоящего обо-
рудования. Стоимость фосфатных покрытий по сравнению с дру-
гими видами покрытий самая низкая.
Фосфатировать можно не только черные металлы, но и алюми-
ний, магний, цинк, титан и их сплавы, при этом размеры и кон-
фигурация деталей не имеют значения. Толщина пленок от 3 до
25 мкм. Предельно допустимая эксплуатационная температура
200—250 °C.
К химическим способам нанесения покрытий следует отнести
такую обработку, как хроматирование. При химическом хромати-
ровании на поверхности цинка, кадмия, магния, алюминия и их
сплавов образуются тонкие пассивные пленки, которые состоят
йз солей труднорастворимых хроматов.
Все большее внимание в настоящее время находят новые син-
тетические вещества под общим названием кремнийорганические
соединения. При нанесении подобных веществ, растворенных
в углеводородах, на оксидные или фосфатные покрытия обра-
зуются гидрофобные пленки, которые улучшают антикоррозион-
ные свойства покрытий.
Электрохимический способ нанесения покрытий является наи-
более распространенным и применяется для нанесения метал-
лических покрытий, сплавов, а также для получения оксидных
пленок при анодной обработке изделий. По сравнению с другими
способами этот способ является наиболее совершенным. Основ-
ным его преимуществом является возможность получать покры-
тия заданной толщины — от нескольких микрометров до десятков
и даже сотен микрометров. Покрытия имеют высокие эксплуата-
11
ционные свойства, на них намного меньше расходуется металла
по сравнению с другими способами нанесения покрытий. Процесс
нанесения покрытий можно механизировать и автоматизировать.
Непосредственно из ванн осаждения можно получать не
только матовые, но и блестящие покрытия. Одной из важнейших
проблем современной гальванотехники является получение бле-
стящих покрытий с выравненной поверхностью. Механизм про-
цесса основан на известных законах электролиза, описание кото-
рых дается в главах 8 и 15.
К основным недостаткам этого способа следует отнести необ-
ходимость применения внешнего источника постоянного тока;
значительный разброс толщины покрытия на сложнопрофилиро-
ванных деталях; необходимость обезвреживания сточных вод;
плохие санитарно-гигиенические условия труда.
ГЛАВА 2. КЛАССИФИКАЦИЯ ПОКРЫТИЙ
В зависимости от функциональных свойств покрытия
подразделяются на декоративные, защитные и специальные.
Однако такая характеристика достаточно условна, так как прак-
тически чаще всего декоративные покрытия выполняют защитные
функции, а специальные — всегда обладают защитными или де-
коративными свойствами. Таким образом, при классификации
покрытий речь идет о преобладании той или иной функции.
Основными декоративными параметрами покрытий являются
цвет и фактура.
Окраска пленок зависит от природы материала покрытий и
от их способности окрашиваться красящими веществами. Металли-
ческие и оксидные покрытия, получаемые электрохимическими и
химическими способами, обладают в основном серым цветом.
Нейтральные белесые и светло-серые тона имеют покрытия из
олова, кадмия, серебра и платины. Теплые сероватые цвета с жел-
товатым и розовым оттенком характерны для никеля и его сплавов
с оловом. Покрытия цинком и хромом имеют холодные с голу-
боватым оттенком цвета. Исключение составляют покрытия на
основе меди, золота и их сплавов, которые имеют золотисто-
розовые тона.
Покрытия, которые способны окрашиваться, располагают
практически неограниченными возможностями. Например, оксид-
ные пленки на алюминии окрашиваются органическими и неорга-
ническими красителями в различные цвета.
Наряду с цветом важной характеристикой декоративных
свойств является фактура (характер слоя). Фактура может быть
матовой, блестящей, гладкой и шероховатой. Варьируя режим
работы, можно при хромировании на одинаково обработанной по-
верхности получать «молочный», блестящий или матово-серый
12
Рис. 2.1. Металлические
коррозией: а — анодное;'
покрытия, поврежденные
б — катодное
хром. В этом случае рельеф основы не имеет значения. Противо-
положным примером является получение блестящих зеркальных
и матовых покрытий хрома. В данном случае фактура зависит от
макрорельефа основного металла.
За последние годы созданы декоративные, так называемые
текстурированные, покрытия, напоминающие изморозь, агат,
нефрит и др.
По способу защитного действия металлические покрытия можно
разделить на катодные и анодные в зависимости от того, какую
функцию выполняет покрытие в той или иной эксплуатационной
среде. Если слой покрытия является беспористым и сплошным,
то любое покрытие защищает изделие от коррозии. Однако по-
крытие практически всегда повреждается при эксплуатации и его
защитные свойства определяются процессами, которые происхо-
дят на поврежденных местах. При наличии влаги на оголенных
местах начинает работать локальный микрогальванический эле-
мент «металл основы — металл покрытия». Если электродный
равновесный потенциал металла покрытия по отношению к металлу
основы является более положительным, покрытия являются ка-
тодными, в противоположном случае — анодными.
Применение катодных покрытий обеспечивает лишь механи-
ческую защиту основного металла. При наличии в покрытии пор,
трещин и других дефектов эти участки в образовавшейся гальва-
нической паре будут выполнять роль катода. Основной металл,
являясь анодом, начнет растворяться, причем тем интенсивнее,
чем больше будет разность равновесных электродных потенциалов.
В отличие от катодных анодные покрытия обеспечивают не
только механическую, но и электрохимическую защиту. При этом
покрытие, являющееся анодом, растворяется. Например, при
нанесении цинка на сталь работа локального элемента вызывает
коррозию цинка, а железо в большей или меньшей степени ока-
зывается защищенным от разрушения. Степень защищенности
зависит от активности,металла покрытия: чем меньше он подвер-
гается коррозии, тем лучше защищает основной металл даже там,
где уже не покрывает его поверхность.
На рис. 2.1 приведена схема коррозионных анодного и катод-
ного покрытий. К катодным покрытиям следует отнести медные
и никелевые — по стали, золотые и серебряные — по меди и ее
13
Рис. 2.2. Зависимость защитных свойств покрытия от сте-
пени сцепления с основой
сплавам; к анодным — цинковые покрытия на стали, нике-
левые — на меди и т. д. Оксидные и фосфатные покрытия
являются нейтральными, так как относятся к диэлектрикам.
Защитное действие покрытий зависит не только от природы
металла покрытия, но и от состава коррозионной среды. Например,
олово является катодным покрытием по отношению к железу,
но в среде органических кислот изменяет свой потенциал и ста-
новится анодным покрытием, что широко используется в пищевой
промышленности для защиты консервной тары. Кадмиевые по-
крытия в морской воде и атмосфере, насыщенной морскими испа-
рениями, также меняют свой потенциал, который становится более
отрицательным по отношению к железу, и в этих условиях яв-
ляются анодными покрытиями.
Непременным условием обеспечения защиты покрытия неза-
висимо от его типа является надежное сцепление покрытия
с основой («адгезия»). На рис. 2.2 приведена схема защитных
свойств покрытия в зависимости от степени его сцепления с осно-
вой. Коррозионный процесс, который начался на участке сквозной
поры или царапины, при прочном сцеплении имеет локальный
характер (рис. 2.2, а), при ослаблении адгезии продукты коррозии
способствуют отрыву покрытия от основного металла (рис. 2.2, б
и в).
Требования, предъявляемые современной техникой к свой-
ствам конструкционных материалов, непрерывно возрастают.
Во многих случаях эта задача может быть решена с помощью
нанесения покрытий, обладающих необходимыми специальными
свойствами. Применение специальных покрытий экономически
выгодно, так как снижает металлоемкость изделий из специальных
сортов конструкционных сталей. Например, нанесение металличе-
ских покрытий на пластмассы дешевле и конструктивнее, чем
изготовление механических деталей.
Специальные свойства покрытий условно можно разделить на
несколько групп: физико-механические, физические, физико-
химические и др.
К физико-механическим свойствам относят прочностные и анти-
фрикционные характеристики покрытий. Детали, испытывающие
при эксплуатации большее давление или локальные ударные на-
грузки, а также детали, работающие на трение, должны иметь
высокую твердость, износостойкость, хорошую притираемость,
низкий коэффициент трения и равномерно смазываться.
14
Микротвердость гальванических покрытий определяется на
приборе ПМТ-3 в соответствии с ГОСТ 9450—76. Измерение микро-
твердости производится путем вдавливания при незначительных
нагрузках алмазных наконечников различной формы. Глубина
вдавливания составляет обычно не более 5 мкм, что исключает
влияние основного металла на микротвердость покрытий, имею-
щих небольшую толщину.
Наиболее распространенным покрытием, имеющим высокую
твердость и износостойкость, является хромовое. В автомобиле-
строении значительный объем занимает пористое хромирование
поршневых колец, изготовленных из чугуна, стали или керамики.
В зависимости от условий эксплуатации толщина пористого хрома
составляет не менее 70—100 мкм.
Высокую поверхностную твердость и износостойкость имеют
твердый хром, никель, сил-никель, никель-фосфорные покрытия,
полученные химическим путем, а также толстые слои оксидных
пленок на алюминии. Разработана технология твердого серебрения
и золочения с добавками сурьмы, никеля и других металлов.
Весьма перспективным является способ получения железных по-
крытий, которые имеют вследствие высокой пористости хорошую
смачиваемость (в пять раз большую, чем смачиваемость пористого
хрома).
Применение антифрикционных покрытий позволяет экономить
дорогие и дефицитные цветные металлы и сплавы типа баббитов
и бронз. Покрытия, обладающие высокими антифрикционными
свойствами, должны иметь хорошую прирабатываемость и удер-
живать смазку. Для этих целей можно рекомендовать покрытия из
олова, свинца и их сплавов, а также фосфатные, пропитанные
эмульсиями или маслами.
К физическим свойствам относятся тепло-, электро- и свето-
технические свойства.
В тех случаях, когда металлические детали подвергаются
воздействию высоких температур, условием их долговечности
является жароустойчивость. С целью экономии дорогих и дефи-
цитных жаростойких сплавов в ряде случаев используют обычные
конструкционные стали с последующим нанесением жаростойких
покрытий. При воздействии высоких температур, вплоть до 1000 °C,
наносят хром, для защиты от газовой коррозии при температуре
600—700 °C — хром или никель. Перспективными становятся
комбинированные покрытия типа сил-никель и др.
В связи с развитием электротехники, автоматики и радио-
электроники широкое применение находят электротехнические
свойства покрытия. С их помощью различные материалы приоб-
ретают повышенную электрическую проводимость или, напротив,
электроизоляционные свойства, а также магнитные и другие
характеристики.
Для увеличения электрической проводимости наносят медные
и серебряные покрытия, а в некоторых случаях —золотые, палла-
15
диевые и родиевые. Роль нагревательных элементов могут выпол-
нять покрытия из сплавов хром—железо, хром—никель.
Важную роль в технике играют покрытия, обладающие ферро-
магнитными свойствами. Магнитомягкими являются сплавы же-
лезо—никель, магнитожесткими — кобальт—никель, кобальт—
фосфор и др.
Способность отражать или поглощать свет является основной
характеристикой нагревательных приборов. Высокую отражатель-
ную способность должны иметь рефлекторы и зеркала. В этих
случаях наносят серебро или хром. Некоторые оптические при-
боры должны полностью поглощать свет, для этих целей нано-
сят черный хром или черный никель.
К специальным свойствам, имеющим физико-химическую при-
роду, относится сорбционность — способность поглощать и удер-
живать различные масла, красители и другие наполнители.
Такими свойствами обладают оксидные и фосфатные пленки,
а также пористые покрытия хрома и железа.
Р А 3 Д Е Л П
ПОДГОТОВКА ПОВЕРХНОСТИ
МЕТАЛЛИЧЕСКИХ ДЕТАЛЕЙ К ПОКРЫТИЮ
ГЛАВА 3. МЕХАНИЧЕСКАЯ ПОДГОТОВКА
§ 3.1. ШЛИФОВАНИЕ И ПОЛИРОВАНИЕ
Механическая подготовка поверхности состоит в уда-
лении с поверхности детали окалины, заусенцев, раковин и при-
дании поверхности требуемой шероховатости. Качество поверх-
ности и ее шероховатость после механической обработки регла-
ментируются ГОСТ 9.301—86.
Шероховатостью называется разность высот между микро-
выступами и микровпадинами на поверхности изделия. Шерохо-
ватость поверхности определяется следующими параметрами:
Ra — средним арифметическим отклонением профиля от средней
линии и Rz — высотой неровностей, т. е. высотой выступов и впа-
дин реальной поверхности. Шероховатость поверхности не должна
превышать 1/3 общей толщины антикоррозионного покрытия.
Шероховатость основного металла зависит от назначения
покрытия. При нанесении защитных и специальных покрытий Rz
не должна превышать 40 мкм, при нанесении защитно-декоратив-
ных покрытий Ra должно быть не более 2,5, а при нанесении
оксидных пленок Ra < 1,25.
На поверхности деталей после механической обработки не
должно быть дефектов, способствующих получению некачествен-
ных покрытий, содержащих неоднородности, окалину, раковины,
поры, расслоения и трещины. Острые углы и кромки должны быть
закруглены, чтобы во время осаждения на них не образовывались
наросты.
На поверхности деталей после механической обработки не
должно быть видимого смазочного слоя или эмульсии, металли-
ческой стружки, заусенцев, пыли и продуктов коррозии.
Шероховатость поверхности определяют по эталонам или
с помощью специальных приборов. По принципу измерения эти
приборы делятся на контактные (щуповые) и бесконтактные (оп-
тические). Контактный метод основан на движении по поверхности
металла иглы, вертикальные перемещения которой регистри-
руются, увеличиваются и записываются отсчетными устройствами.
Этим способом можно получить шероховатость без предваритель-
17
ной записи рельефа. Для определения шероховатости выпускаются
профилометры П-7, П-10, П-16, профилографы ПГ-5, ПГ-10,
профилографы-профилометры 201 и 202, портативный профило-
метр 253 и другие приборы.
Бесконтактные (оптические) приборы основаны на принципе
светового сечения (ПСС), теневой проекции (ПТС) и интерферен-
ции света (МИИ). Оптические приборы показывают форму, глу-
бину и частоту поверхностных дефектов.
Механическая обработка, применяемая в цехах электрохими-
ческих покрытий, бывает следующих видов: шлифование, полиро-
вание, крацевание, дробеструйная и гидроабразивная обработка,
галтовка.
Шлифованием называется процесс механической обработки
для получения ровной и гладкой поверхности, когда при помощи
мелких зерен абразивных материалов с поверхности снимают
тонкую стружку.
Шлифование бывает грубым (обдирка), оно производится при
помощи шлифовальных кругов, и тонким, или декоративным,
осуществляемым эластичными кругами или непрерывной лентой,
на которые наносят слой абразивной пасты.
Полированием называют процесс получения блестящей зер-
кальной поверхности путем сглаживания мельчайших неровно-
стей.
При шлифовании достигается шероховатость, соответствующая
Rz = 254-0,160 мкм по ГОСТ 2789—73 (СТ СЭВ 638—77), а при
полировании Rz = 0,1 мкм.
При шлифовании и полировании применяют абразивные ма-
териалы, состоящие из зерен, обладающих высокой твердостью
и режущей способностью.
Абразивные материалы бывают природные (горные породы и
минералы) и искусственные. Природных абразивов мало, они
недостаточно однородны и тверды. Из природных материалов для
шлифования применяют корунд (А12О3), наждак (смесь корунда
с оксидами железа, кремния, титана и т. п.), кремень, кварцевый
песок, Пензу; для полирования — крокус [75 % оксида железа (III)
Fe2O3l, трепел, доломит, технический мел, венскую известь
(до 95 % оксида кальция), каолин, тальк. К искусственным
абразивным материалам относятся карбид кремния — карборунд
S1C, карбид бора, электрокорунд, применяемые для шлифования,
и крокус, оксид хрома (III) Сг2О3, оксид алюминия, — для поли-
рования.
Зерна шлифующих материалов имеют острые грани и при
шлифовании, разрушаясь, образуют осколки с острыми гранями,
как бы самозатачиваются. Зерна полирующих материалов имеют
округлую форму, что способствует выравниванию поверхности
металла.
В соответствии с ГОСТ 3647—80 (СТ СЭВ 5386—85) абразивные
материалы подразделяются по крупности зерен на группы, номера
18
3.1. Группы абразивных материалов в зависимости от зернистости
Группа Зерни- стость Размерная характе- ристика зерна, мкм Группа Зерни- стость Размерная характе- ристика зерна, мкм
12 160—125
10 125—100
200 2500—2000 8 100—80
160 125 2000—1600 1600—1250 Шлифпорошок 6 5 80—63 63—50
100 1250—1000 4 63—50
80 1000—800 3 40
Шлифзерно 63 800—630
50 630—500
40 500—400 М40 40—28
32 400—315 М28 28—20
25 315—250 Микро- М20 20—14
20 250—200 порошок М14 14—10
16 200—160 М10 10—7
М7 7—5
М5 5—3
которых обозначают размеры зерен в метрической системе
(табл. 3.1). Для отделочного шлифования и полирования приме-
няют в основном шлифовальные порошки и микропорошки.
К связующим веществам относятся цементирующие связки и
связующие. Их назначение — удерживать абразивный материал.
Цементирующие связки применяют для удержания шлифовальных
зерен на поверхности твердых кругов. Для мягких кругов и в по-
лировальных пастах используют связующие. Связующие должны
быть достаточно твердыми при комнатной температуре, а при об-
работке — плавиться от нагрева детали.
Цементирующими связками могут служить огнеупорная глина,
жидкое стекло, бакелит, каучук. В качестве связующих материа-
лов для наклеивания абразивного материала можно использовать
жидкое стекло, столярный клей, искусственные клеи. Связующими
веществами для полировальных паст являются олеиновая кислота,
парафин, стеарин, воск и т. п.
Шлифование и полирование осуществляют при помощи кругов
либо непрерывной гибкой абразивной ленты, укрепленных на
механических станках или полуавтоматах и автоматах. Шли-
фовальный круг для получения грубой поверхности состоит из
шлифовальных зерен, связанных каким-либо веществом. Эти круги
изготовляют прессованием или литьем абразивного материала.
В качестве абразивного материала используют карборунд, ко-
рунд, наждак с размером зерен 250—1200 мкм, в качестве связки —
различные глины, полевой шпат, жидкое стекло, смолы, резины.
Для отделочного шлифования применяют круги из эластичных
материалов: войлочные, фетровые, хлопчатобумажные, кожаные.
Они изготавливаются прессованием, склеиванием или сшиванием
19
отдельных листов-дисков. Абразивным материалом служат мелкие
зерна (75—120 мкм) корунда, наждака, кварца, которые наклеи-
вают по периферии круга при помощи связок (клея, жидкого
стекла).
Шлифовальные круги различаются по твердости. Твердостью
шлифовального круга, состоящего из шлифовальных зерен, при-
нято считать сопротивление связки круга выкрашиванию зерен
при работе. Чем прочнее держатся зерна, тем выше твердость
круга. При шлифовании твердых материалов следует применять
менее твердые круги, в которых выпадение затупившихся зерен
и оголение новых происходят быстрее. При шлифовании мяг-
ких металлов зерна тупятся медленнее, и круг может быть
твердым.
Твердостью эластичных накатных кругов считается сопротив-
ление материала круга деформациям, возникающим под воздей-
ствием внешних усилий. Чем мягче металл, тем эластичнее должен
быть круг. Изделия сложной формы шлифуют мягкими кругами
независимо от твердости металла изделия. Эластичные круги мо-
гут быть разных размеров, профилей, упругости и эластичности.
В качестве основы для приготовления кругов применяют дерево
или сталь. Круги обтачивают, балансируют и обтягивают кожей,
на которую наносят шлифовальные зерна.
Для изготовления матерчатых кругов сшивают круглые диски,
вырезанные из парусины, брезента, бязи, байки, фланели и дру-
гих подобных материалов. Круги состоят из 12—15 секций тол-
щиной по 8—10 мм. В каждой секции 16—20 сшитых или склеен-
ных дисков. Диски вырезают вручную или на прессах. Прошивают
круги различными способами. Наибольшее распространение по-
лучили концентрические и спиральные способы прошивки. Чем
чаще расположены швы, тем тверже круг. У твердых кругов рас-
стояние между швами составляет 5—10 мм, у мягких доходит до
15—20 мм.
Лепестковые эластичные шлифовальные круги состоят из
полосок шлифовальной шкурки требуемой зернистости, закреплен-
ных в металлическом патроне; они принимают профиль обраба-
тываемой поверхности. Эти круги отличают высокая производи-
тельность, повышенная износостойкость и хорошее качество
обработки.
Цветные металлы шлифуют кругами из мягкого войлока,
стальные детали — кругами из жесткого войлока, алюминиевые —
кругами из мягкого войлока, накатанными электрокорундом.
Перед полированием рекомендуется проводить матирование,
т. е. шлифование выполнять при помощи засаленного круга,
смазанного специальными шлифующими пастами (табл. 3.2).
При этом сглаживаются мельчайшие неровности поверхности.
Полировальные круги изготовляют из фетра, войлока, бязи,
миткаля, байки, сукна, киперной ткани и т. п., на которые в про-
цессе работы наносится полирующая паста. Полировальные круги
20
3.2. Рецептура паст для матирования
Обрабатываемый металл Компоненты пасты Состав, масс, доли
Черные металлы Абразивный микропорошок Парафин Говяжье сало Смазочное масло 0,60 0,20 0,10 0,10
Маршаллит Парафин Солидол 1 или сало говяжье Церезин 0,80 0,10 •0,08 0,02
Медь, а люми н и й, цинк и их сплавы Абразивный микропорошок Стеарин 0,40 0,60
могут быть прошитыми или сшиваться из секций. Наибольшее
распространение получила спиральная прошивка.
Полировочные пасты содержат тонкие шлифовальные порошки,
связующие вещества и добавки. Паста должна быть вязкой, эла-
стичной, легко смазывать поверхность круга и удерживаться на
ней, не засаливать поверхности металла, давать хорошее качество
отделки и легко смываться с поверхности при обезжиривании.
В качестве абразивного материала применяются оксиды хрома,
железа, алюминия, кремния, венская известь; в качестве связую-
щих веществ — стеарин, парафин, церезин, техническое сало,
олеиновая кислота, жирные синтетические кислоты. В качестве
специальных добавок в пасты вводятся скипидар, керосин — для
уменьшения вязкости пасты, сера — для улучшения ее полирую-
щих свойств, поверхностно-активные вещества — для облегчения
последующего удаления пасты.
Пасты готовят следующим образом: на закрытом огне умерен-
ной температуры расплавляют связующие вещества, вводят спе-
циальные добавки, а затем абразивный материал. Керосин, ски-
пидар вводят в пасту, сняв последнюю с огня. Массу хорошо пере-
мешивают, разливают в формы и охлаждают. Пасты, содержащие
венскую известь, необходимо хранить в герметичной упаковке.
Для предварительного полирования применяют крупнозер-
нистые фракции абразивного материала (М63—М40), для последую-
щей обработки — материал зернистостью от М28 до М3. Состав
паст для полирования металлов и сплавов приведен в табл. 3.3.
На заводе ВЭФ разработаны водорастворимая шлифовально-
полировальная и полировальная пасты для деталей из черных
и цветных металлов и сплавов (табл. 3.4), которые могут быть
удалены с поверхности промывкой в горячем 50 %-ном растворе
кальцинированной соды.
21
3.3. Состав паст для полирования металлов и сплавов
Полируемый металл Компоненты пасты Состав, масс, доли
Сталь, никель, хром Сг2О3 Стеарин Каолин Олеиновая кислота Жир технический Петролатум окисленный 0,73 0,17 0,10 0,37 0,37 0,13 0,13 0,40 0,40 0,10 0,10 —
Сталь, никель, медь и ее сплавы Cr2Os FesOs Каолии Стеарин Парафин Церезин Олеиновая кислота Петролатум окисленный 0,73 0,19 0,05 0,02 0,01 0,68 0,17 0,15 0,72 0,14 0,14 0,36 0,37 0,27
Алюминий, ни- кель, медь и ее сплавы Cr2Os F егОз Венская известь Стеарин Парафин Олеиновая кислота Жир технический Скипидар 0,49 0,18 0,33 0,70 0,18 0,08 0,04 0,72 0,23 0,02 0,02 0,01 ——
Алюминий, медь, цинк и их сплавы FeaOs SiO2 А12О3 Стеарин Парафин Церезин Олеиновая кислота Жир технический Минеральное масло 0,02 0,45 0,37 0,06 0,10 0,36 0,36 0,08 0,13 0,03 0,04 — —
Широкое распространение получили пасты ГОИ на основе
оксида хрома (III) (табл. 3.5).
Режим шлифования определяется материалом обрабатываемых
деталей, скоростью вращения круга и его давлением на поверх-
ность металла (табл. 3.6).
Качество шлифования и полирования кругами в значительной
степени зависит от окружной скорости круга. Как правило, чем
мягче шлифовальное зерно, тем больше должна быть окружная
скорость круга. При отделке твердого металла необходима более
высокая окружная скорость, чем при отделке мягкого.
При шлифовании следует поддерживать определенную частоту
вращения круга; увеличение ее равносильно применению более
твердого круга. Частота вращения шлифовальных кругов, при-
22
3.5. Состав паст ГОИ (масс, доли)
3.4. Состав водорастворимых паст
(масс, доли)
Компоненты пасты Паста
шлифоваль- но-полиро- вальная полироваль- ная 1
Сг2О3 марки 0X4-2 Микропорошок М10 Хозяйственное мы- ло (60 % -ное) Глицерин дистил- лированный Смазка УН Карбамид марки А Вода 0,34 0,34 0,16 0,05 0,04 0,02 0,05 0,69 0,16 0,05 0,04 0,01 0,05
Шлифование
Компоненты пасты грубое среднее тонкое
Сг2О3 0,81 0,75 0,740
Силикагель 0,02 0,02 0,018
Стеарин 0,10 0,10 0,100
Расщепленный 0,05 0,10 0,100
жир
Олеиновая — — 0,020
кислота
Кальциниро- — — 0,002
ванная сода
Керосин 0,02 0,02 0,020
3.6. Режимы механической обработки эластичным кругом
Обрабатываемый материал Окружная скорость, м/с
Шлифование Полирование
Сталь, никель, хром Медь и ее сплавы Алюминий, цинк, олово 20—35 16—25 12—20 30—35 25—30 20—30
3.7. Частота вращения шлифовальных кругов (об/мин)
Обрабатываемый материал Частота вращения круга при диаметре, мм
200 250 300 350 400
Чугун, сталь, никель, хром 2850 2300 1880 1620 1440
Медь, латунь, томпак, бронза, серебро 2400 1900 1500 1350 1190
Цинк, олово, свинец, алюминий и их сплавы 1900 1530 1260 1090 960
меняемых при обработке различных металлов, зависит от диаметра
круга (табл. 3.7).
Для окончательной отделки деталей сложного профиля при-
меняют круги-щетки, изготовляемые из травы, волоса или синте-
тических материалов (капрона) обычно на деревянной основе.
Кроме обработки кругами шлифование и полирование можно
производить непрерывной абразивной лентой. С помощью абра-
зивных лент можно обрабатывать сложные криволинейные по-
23
3. 8. Режимы шлифования и полирования абразивными лентами
Материал Обрабатываемая деталь Основа ленты Абразив- ный ма- териал Скорость ленты, м/с
Низкоуглеро- дистая сталь Среднеуглеро- дистая сталь Коррозионно- стойкая сталь Медь Латунь ' Плоская Цилиндрическая или фа- сонная Плоская или слабопро- филированная Цилиндрическая или фа- сонная Плоская Плоская или слабопро- филированная Цилиндрическая или фа- сонная Плоская или слабопро- филированная Цилиндрическая или фа- сонная Бумага Ткань » Бумага Ткань » » » » » Карбид кремния Электрокорунд 15—20 30—35 10—20 15—20 25—40 25—30 10—15 35—40 20—25 35—40
верхи ости. При обработке абразивными лентами повышается
производительность труда. Шлифовально-полировальные ленты
можно разделить на три группы: ленты, покрытые пастами; ленты
с тонким слоем шлифовального зерна, укрепленного клеем (шли-
фовальная шкурка); ленты с толстым абразивным слоем, в котором
связкой служит резина или искусственные смолы (гибкая абразив-
ная лента).
Ленты первой группы применяют при полировании. Наиболь-
шее распространение получили ленты второй группы. Эти ленты
изготавливают нанесением шлифовального зерна на бесконечные
ремни или склеиванием полос шлифовальной шкурки. По стой-
кости ленты второй группы уступают лентам третьей группы
с толстым абразивным слоем, но они значительно дешевле и про-
изводительнее. В зависимости от размеров обрабатываемых де-
талей применяются ленты шириной 10—775 мм. Технологические
параметры шлифования и полирования абразивными лентами
приведены в "табл. 3.8. Шлифование поверхности деталей произ-
водят либо при свободном натяжении ленты, либо поджимая ее
к месту обработки неподвижной или роликовой опорой. Наиболее
распространено шлифование с опорными (контактными) роликами.
При шлифовании абразивными лентами применяют специаль-
ные эмульсии или машинное масло для смазывания ленты, зача-
стую для этих целей используется и животный жир, который
особенно эффективен при шлифовании деталей из углеродистых
сталей.
Сухое ленточное шлифование служит для обработки неметал-
лических материалов, за исключением стекла и термореактивных
24
3.9. Последовательность переходов при шлифовании и полировании
деталей из различных материалов
Обрабатываемый материал Абразивный материал зернистостью Полировальная паста
50—40 25—16 10—8 6—5 кро- кус- ная извест- ковая хро- мовая
Чугунные отливки и стальные детали ± + + + + + ±
Стальные кованые детали — + + + + + ±
Стальные нештам- пованные детали боль- ших и средних разме- ров ± + + + + ±
Детали из корро- зионно-стойкой стали '—• — + + ± ± ±
Детали из латуни и цинкового сплава простой формы — — — ± + + +
Детали из латуни и цинкового сплава сложной формы — — —. ± + + ±
Детали из алюми- ниевых сплавов — ± ± + ± ± +
Условные обозначения: Ч---------применяется; >-не приме-
няется: ± — применяется в отдельных случаях.
пластмасс. Для ленточного полирования пригодны различные
пасты, в частности, может быть использована паста следующего
состава, масс, доли: 0,108 стеарина, 0,115 парафина, 0,057 тех-
нического вазелина и 0,720 абразивного материала.
При обработке плоских поверхностей деталей из чугуна,
бронзы, стали рекомендуется работать со скоростью ленты 15—
20 м/с. При чистом шлифовании цилиндрических стальных деталей
скорость ленты может достигать 35—40 м/с. При шлифовании и
полировании легких металлов скорость достигает 45—50 м/с,
а при шлифовании титана не должна превышать 10—15 м/с. В про-
цессе шлифования рекомендуется изменять параметры обработки
и очищать ленту. В табл. 3.9 указана примерная последователь-
ность операций при шлифовании и полировании различных
деталей.
§ 3.2. обработка металлическими щетками
(КРАЦЕВАНИЕ)
Крацевание применяют для очистки поверхности де-
талей от шлама, заусенцев, разрыхленной окалины. Крацевание
производится стальными, латунными, медными щетками, насажен-
ными на вал электродвигателя или станка. Иногда крацевание
25
3.10. Характеристика металлических щеток для крацевания
Обрабатываемый материал Материал проволоки щеток Диаметр проволоки» мм
Чугун, сталь, бронза Никель, никелевые покры- тия Цинковые, оловянные, мед- ные и латунные покрытия Сталь Сталь, нейзильбер Латунь, медь 0,05—0,30 0,15—0,25 0,15—0,20
производят ручными щетками. При обработке мягких гальваниче-
ских покрытий используют волосяные, капроновые или травяные
щетки. При подборе щеток можно воспользоваться данными
табл. 3.10. Для чистовой обработки рекомендуются щетки из
проволоки диаметром 0,05—0,10 мм; для грубой обработки —
щетки с диаметром проволоки 0,30—0,60 мм.
Крацевание можно производить сухими щетками — для очи-
стки деталей от шлама, заусенцев и разрыхленной окалины.
При декоративной обработке щетки обычно смачивают в содовом
или мыльном растворе. Скорость вращения щеточных кругов
может изменяться от 450 до 1800 об/мин. В процессе крацевания
вращающиеся щетки должны касаться деталей только кончиками
проволоки, так как сильный прижим деталей к щеткам увеличи-
вает съем металла и изгибает проволоку.
§ 3.3. ГАЛТОВКА
Галтовка предназначена для очистки поверхности мел-
ких деталей от различных загрязнений, травильного шлама,
заусенцев и неровностей, а также для шлифования и полирования.
Галтовка заключается в обкатке деталей совместно с абра-
зивными или полирующими материалами в колоколах или бара-
банах. При вращении с выступающих частей поверхности деталей
в результате трения их между собой, а также с абразивными ма-
териалами снимается тонкий слой металла. Для плоских деталей
предпочтительны барабаны. Детали с наружной резьбой, которые
могут быть подняты при интенсивном перемешивании, обычно
обрабатывают в колоколах.
Галтовка бывает сухая (абразивная) и мокрая (жидкостно-
абразивная). Сухая галтовка может быть безабразивной и абра-
зивной. Сухую галтовку обычно применяют для окончательной
отделки винтов и болтов небольшого размера, поверхность кото-
рых должна быть блестящей, без заусенцев. Мокрая галтовка
обычно используется перед нанесением покрытий для очистки
деталей от травильного шлама, а также для сглаживания поверх-
ности.
26
В качестве галтовочных материалов при мокрой галтовке
для шлифования используют речной песок, мелкую гальку, фар-
форовый бой, стальную сечку, стальные шарики, а для полирова-
ния — стальные шарики, древесные опилки, обрезки кожи,
фетра и другие мягкие материалы. При мокрой галтовке в качестве
жидкой среды применяют 2—3 %-ный раствор кальцинированной
соды, слабые растворы серной или соляной кислоты, растворы
щелочей и солей аммония.
Продолжительность галтовки (ч) в зависимости от ее назначе-
ния следующая:
Удаление заусенцев ................0,25—2,00
» окалины...................... 1—4
Шлифование...................... . 4—40
Полирование небольших деталей:
стальных штампованных.............. 3—4
» поковок .................. 4—6
латунных и бронзовых........... 2—4
Детали с окалиной или грубым слоем оксидов предварительно
подвергают травлению, а затем — галтовке. В таких случаях
3.11. Режимы обработки деталей при галтовке
Обраба- тывае- мый ма- териал Вид галтовки Абразивный материал Компо- нент раствора Режим обработки Шерохова- тость по- верхности R , мкм
। J/н- ция, г/л частота вра- щения, об/мии продолжи- тельность, ч до обработ- ки после обра- ботки
Сталь Сухан Шлифпоро- шок зерни- стостью 3 или 4 — — 20—60 10—24 40—20 8—5
я Мокрая (шлифо- вание) Бой электро- корундовых кругов Т, ВТК размером 5—30 мм Мыло хозяй- ственное 72 %-ное 2 —5 30 2 — 12 40—5 5—2,5
я Мокрая (полиро- вание) Бой фарфора размером 5—20 мм Стальные шарики диаметром 4 — 10 мм То же ж 2 2 —5 —5 30 30 2 — 12 2 — 12 5—2,5 1,25— 0,63
Алюми- ний и его сплавы, цинковый сплав Мокрая (полиро- вание) То же ж 20 —30 30 2 — 12 5 1,25
Алюми- ний и его сплавы Мокрая (шлифо- вание) Электро- корундовый шлнфпоро- шок Известь гашеная 500 — 600 30 2 — 12 40—5 5—2,5
27
в качестве абразивного материала применяется кварцевый песок
с добавкой 2—3 %-ного раствора кальцинированной соды. Объем
песка должен превышать объем деталей. Режимы обработки де-
талей при галтовке приведены в табл. 3.11.
Разновидностями галтовки являются подводное шлифование и
полирование, при котором обработку деталей производят в перфо-
рированных барабанах, помещаемых в ванны с растворами,
чаще всего с растворами мыла.
Абразивным материалом при подводном шлифовании служит
бой шлифовальных электрокорундовых кругов зернистостью 8—6.
При обработке боем кругов на органической основе качество
обрабатываемой поверхности выше, чем при обработке боем кругов
на керамической основе. Бой рекомендуется составлять из трех
равных по массе частей: одна часть с размерами кусков 5—10 мм;
вторая — с размерами кусков 10—20 мм и третья — с размерами
кусков 20—30 мм. В качестве полирующего материала применяют
бой фарфора вместе со стальными закаленными шариками.
Параметры шероховатости поверхности при шлифовании из-
меняются с Rz = 40 мкм до Rz — 1,25 мкм и с Ra = 2,5 мкм до
Ra = 0,63 мкм; при подводном полировании —.с Ra — 2,5-=-
-=-0,63 мкм до Ra = 0,324-0,80 мкм.
§ 3.4. ВИБРОАБРАЗИВНЫЕ СПОСОБЫ ОБРАБОТКИ
Сущность виброабразивной обработки заключается
в следующем. Детали и обрабатывающая среда (абразивные ма-
териалы, наполнители, поверхностно-активные вещества) поме-
щаются в контейнер, которому сообщается колебательное движе-
ние различной частоты и амплитуды.
При вибрационной обработке можно производить следующие
операции: шлифование и полирование; снятие заусенцев и при-
тупление острых кромок; зачистку деталей после литья; очистку
поверхности деталей от окалины, следов коррозии; глянцевание.
Виброобработку можно сравнить с обработкой в барабанах,
но в отличие от нее она имеет следующие преимущества: высокую
производительность; равномерную обработку наружных и вну-
тренних поверхностей; возможность обрабатывать тонкостенные
и хрупкие детали, детали разных размеров; механизацию и авто-
матизацию загрузки и выгрузки деталей; использование виброуста-
новок в автоматизированных линиях.
В основном процесс виброобработки поверхности сводится
к уменьшению параметра Rz от 40 до 0,63 мкм за 3—5 переходов
в течение 10 ч.
Для проведения грубой очистки рекомендуется использовать
абразивные частицы с большой массой. Оптимальное соотношение
рабочей среды и деталей по насыпной массе в зависимости от
назначения обработки 1 : 1—5 : 1. В этом случае происходит
максимальный съем металла.
28
3.12. Режимы струйно-абразивиой обработки
Толщина стенок де- талей, мм Внд обработки Размер зерен, мм Давление воздуха, МПа
До 1 3 Св. 3 Обработка шлифовальным порошком 0,20—0,16 0,05—0,15 0,15—0,25 0,3—0,4
До 1 2,5 5 Св. 5 Обработка металлическим песком или дробью 0,15—0,30 0,3—0,5 0,8—1,0 0,8—1,5 До 0,5 0,5 0,6 0,6
Вибрационная обработка деталей может осуществляться влаж-
ным и мокрым способами. При влажном способе количество
рабочей жидкости составляет до 20 % объема контейнера. При
мокром способе отходы удаляются промывкой контейнера во
время работы. Промывка может быть периодической — раство-
рами высокой концентрации и непрерывной — растворами низ-
кой концентрации. В зависимости от назначения обработки и ма-
териала обрабатываемой детали применяют кислые^ нейтральные
и щелочные среды.
Режимы обработки (амплитуда и частота вибрации) выбираются
в зависимости от назначения обработки; при более грубых ра-
ботах амплитуда берется большей и частота вибрации—меньшей,
для отделочных работ — наоборот. Оптимальные значения ча-
стоты вибрации для шлифования 1000—1500 и для полирования —
2200—3000 колебаний в минуту, амплитуды вибрации до 5 мм
при шлифовании и 1—3 мм при полировании. Необходимо иметь
в виду, что при виброабразивной обработке происходит съем
части металла по контуру и в отверстиях, поэтому необходим
припуск на обработку 0,002—0,005 мм.
В качестве рабочей среды применяют бой шлифовальных кру-
гов, абразивные гранулы различных формы и размеров, шлиф-
порошок. Для очистки поверхности деталей и снятия заусенцев
используют бой шлифовальных кругов твердостью СТ2—Т2, для
отделки деталей — ВТ1—ВТ2. Наиболее распространенным ма-
териалом является электрокорунд. При виброполировании при-
меняют мягкие искусственные материалы — оксиды железа, хрома,
алюминия и т. п. и природные — мрамор, мел, гранит и др.
Наиболее употребительные размеры гранул 8—40 мм. В качестве
вспомогательного к основному абразивному материалу часто
добавляются кусочки резины, деревянные, войлочные или фетро-
вые кубики и др.
Струйно-абразивная обработка заключается в очистке поверх-
ности струей абразивного материала, подаваемого с большой
29
скоростью на обрабатываемую поверхность при помощи сжатого
воздуха, жидкости или пескометного аппарата.
Этот метод очистки имеет следующие разновидности: песко-
струйный, дробеструйный, жидкостно-абразивный. Этот метод
применяется для удаления оксидов, старых покрытий и в случаях,
когда другие способы очистки поверхности (подготовка к покрытию
больших поверхностей, листового материала и т. п.) не могут
быть использованы.
С помощью струйной обработки создается поверхностный
упрочняющий наклеп, который положительно сказывается на меха-
нических свойствах детали. При таком методе обработки поверх-
ность становится равномерно матовой, что используется для
повышения светопоглощающих характеристик оптической аппа-
ратуры.
Абразивный материал (металлический песок, чугунные опилки
и др.), ударяясь с большой силой о поверхность деталей, очи-
щает ее от всех загрязнений и придает ей равномерную шерохо-
ватость. После очистки поверхность деталей становится матовой,
покрывается большим количеством кратеров, способствующих
прочному сцеплению покрытия с основным металлом.
В качестве абразивного материала применяют металлические
дробь и песок. Детали из чугуна, низкоуглеродистой стали обра-
батывают чугунным или стальным песком. Для очистки черных
металлов применяются рубленая стальная проволока, чугунные
опилки (металлический песок), получаемые при размоле чугун-
ной дроби.
Металлический песок может быть получен при дроблении
закаленной стружки. Металлический песок и чугунные опилки
непригодны для очистки деталей из коррозионно-стойкой стали
и цветных металлов, так как остающиеся на поверхности частицы
металла подвергаются коррозии. В таких случаях рекомендуются
дробленые фруктовые косточки (абрикосовые, вишневые и др.),
дробленые пластмассы и т. п., пригодные для очистки деталей,
изготовленных из меди, цинка, алюминия и их сплавов. Для
очистки деталей из алюминиевых и магниевых сплавов применяют
песок из сплава АЛЮ, который можно изготовить из стружки,
полученной при механической обработке, либо из расплава.
Материалы для очистки должны храниться в сухом помещении
и в закрытой таре. Перед очисткой детали требуется тщательно
обезжирить и высушить. При наличии грубой окалины рекомен-
дуется предварительное травление.
Режимы обработки шлифовальными порошками, металличе-
ским песком и дробью приведены в табл. 3.12. Тонкостенные де-
тали и детали из хрупких и мягких материалов обрабатывают при
малых давлениях мелкозернистыми шлифпорошками. На произ-
водительность очистки оказывают влияние многие факторы: при-
меняемый материал, давление воздуха, диаметр сопла и его рас-
стояние от обрабатываемой поверхности, а также угол направле-
30
ния струи. Рекомендуемые углы атаки струи при обработке
плоских поверхностей 45—60°.
Детали очищают в камерах и аппаратах различной конструк-
ции. Мелкие детали могут быть очищены в барабанах, в которые
под давлением подается абразивный материал.
Гидроабразивной обработкой называется операция очистки
поверхности деталей струей суспензии, состоящей из воды и
абразивных материалов.
При обработке стальных деталей применяется пульпа, со-
стоящая из 30 % песка и 70 % воды; для цветных металлов —
пульпа из 20 % песка и 80 % воды. Чтобы предохранить детали
после гидропескоструйной очистки от коррозии, в пульпу добав-
ляют кальцинированную соду, нитрит натрия, мыло и т. п.
Производительность гидропескоструйной очистки зависит от
давления воздуха, скорости и угла падения струи, а также от
зернистости и концентрации абразивного материала в жидкости.
Чем больше давление воздуха и чем крупнее зерно, тем выше
производительность. Для каждой зернистости существует опти-
мальное давление воздуха. При размере зерна 40—28 мкм при-
меняют давление 0,5 МПа, а при 125—100 мкм — давление 6—
9 МПа. Давление жидкости не оказывает влияния на чистоту по-
верхности. Расстояние сопла от обрабатываемой поверхности
должно быть в пределах 50—100 мм, а угол направления струи —
в пределах 35—45°. При угле 30—3510 происходит полирование
поверхности.
Микрорельеф поверхности при гидропескоструйной обработке
получается мельче и более равномерным по сравнению с обдувкой
сухим песком. Имеются данные, что износостойкость гидрополи-
рованных деталей на 25—30 % выше, чем механически полиро-
ванных. Усталостная прочность стали, обработанной гидропо-
лированием, повышается на 15 %.
ГЛАВА 4. ХИМИЧЕСКОЕ И ЭЛЕКТРОХИМИЧЕСКОЕ
ОБЕЗЖИРИВАНИЕ ПОВЕРХНОСТИ
§ 4.1. ОБЕЗЖИРИВАНИЕ ОРГАНИЧЕСКИМИ
РАСТВОРИТЕЛЯМИ
Обезжиривание в органических растворителях при-
меняется для очистки от минеральных масел, неомыляемых жи-
ров, полировальных паст, остатков консервационной смазки.
После обезжиривания в органических растворителях на поверх-
ности деталей остается очень тонкая пленка жиров, которая пре-
пятствует прочному сцеплению покрытия с основным металлом.
Для удаления этой пленки проводят химическое или электрохими-
ческое обезжиривание.
31
Органические обезжириватели токсичны, использовать их
можно только при наличии специального оборудования и соблю-
дении правил техники безопасности. Пожароопасные растворители
(бензин, керосин, бензол, толуол, ксилол, уайт-спирит и др.)
применять не следует. Их заменяют негорючими хлорированными
углеводородами: трихлорэтиленом, тетрахлорэтиленом, перхлор-
этиленом, четыреххлористым водородом, фреоном.
Растворяющая способность (кг/м2-с) различных растворителей
следующая:
Фреон Ф-113.................4,45
Трихлорэтилен ..............3,10
Ксилол......................2,20
Тетрахлорэтилен ...........1,70
Бензин......................1,30
Уайт-спирит ................0,90
Керосин ....................0,65
В трихлорэтилене можно обезжиривать большинство металлов:
сталь, медь, никель и их сплавы. Из-за большой реакционной
способности в трихлорэтилене не допускается обрабатывать из-
делия, смоченные водой или водными растворами, так как в при-
сутствии водяных паров трихлорэтилен разлагается с образова-
нием соляной кислоты, что может вызвать коррозию аппаратуры и
обезжириваемых деталей. Не разрешается обезжиривать трихлор-
этиленом детали из алюминия и его сплавов и из титана и его
сплавов, используемых в авиастроении, из-за большого выделе-
ния тепла, в результате чего может происходить разложение
реактива с выделением ядовитых соединений.
Водородный показатель (pH) водной вытяжки трихлорэтилена
должен быть не менее 6. Для стабилизации трихлорэтилена в него
добавляют стабилизаторы в количестве 0,01 кг/м3. В качестве
стабилизаторов применяют триэтиламин, монобутиламин, уро-
тропин. Можно применять СТАТ-1 в количестве 5—10 кг/м3.
Для удаления влаги перегонку трихлорэтилена производят в при-
сутствии соды.
Тетрахлорэтилен можно использовать для обезжиривания
всех металлов, в том числе магния и алюминия.
Наиболее универсальными являются фторсодержащие угле-
водороды, например фреон Ф-113. Обезжиривание этими раствори-
телями проводят на оборудовании, исключающем попадание па-
ров в атмосферу.
Недостатки хлорированных углеводородов — их сравнительно
высокая стоимость и высокая токсичность. Однако применение
механизированных и закрытых моечных установок, снабженных
вытяжкой вентиляцией и устройством для регенерации загряз-
ненного растворителя, обеспечивает быстроту, высокое качество
и безопасность мойки. Фторированные углеводороды нетоксичны,
но дефицитны. Режим обработки деталей органическими раствори-
телями в зависимости от характера загрязнений приведен
в табл. 4.1.
Схемы обезжиривания органическими растворителями раз-
личны. Обезжиривание холодными растворителями осуществляется
32
2 Дасоян М.
4.1. Режим обработки деталей органическими растворителями
Тип вагряаненнв Материал детали Растворитель Режим обработки
Темпе- ратура, °C Продолжительность, мин
обработки погружением обработки выдержкой в парах
Все металлы, кроме титана Тетрахлорэтилен 121
Рабочие и консер- вационные масла и смазки То же, кроме серебра, ти- тана Детали из меди, алюминия и их сплавов, медных покры- тий Трихлорэтилен технический со стабилизатором pH водной вытяжки должна быть ие ниже 6,8 87 70 0,5 0,5—5,0
Все металлы, кроме титана, все шлифованные и полиро- ванные покрытия Тетрахлорэтилен, нат-10 в количестве 1- катио- -3 г/дм3 121
Шлифовальные и полировальные па- сты То же, кроме титана, се- ребра, все шлифованные н по- лированные поверхности, кро- ме серебряных, медных и мед- ных сплавов Трихлорэтилен стабилизиро- ванный, катионат-10 в количе- стве 1—3 г/дм3 87 Не менее 0,5 0,5—5,0
Алюминий, медь и их спла- вы и медные покрытия Трихлорэтилен стабилизиро- ванный, катионат-10 в количе- стве 1—3 г/дм3 70
погружением, протиркой, обрызгиванием металлических деталей.
При обработке погружением детали обрабатывают последова-
тельно в двух-трех ваннах.
Горячее обезжиривание (в парах) производят при темпера-
туре, близкой к точке кипения растворителя. Горячее обезжири-
вание производят в специальной аппаратуре, не допускающей
утечки растворителя.
Применяют двухфазные системы, состоящие из слоя воды и
слоя растворителя, не смешивающегося с водой. Такие системы
успешно применяют в случаях, когда используются водораство-
римые смазки и нельзя для обезжиривания нагревать изделие,
а также в небольших цехах, где экономически нецелесообразны
установки для обезжиривания в парах.
Применяют также струйное обезжиривание, продолжитель-
ность обработки при этом составляет 3—15 мин.
§ 4.2. ХИМИЧЕСКОЕ ОБЕЗЖИРИВАНИЕ
По происхождению жировые загрязнения бывают двух
видов: жиры животного и растительного происхождения, пред-
ставляющие собой сложные эфиры глицерина и высших жирных
кислот (стеариновой, пальмитиновой) и минеральные (нефтяные)
масла, состоящие из смеси углеводородов (парафин, вазелин).
Обезжиривание применяют для снятия с поверхности деталей
жировых загрязнений. Жиры животного и растительного про-
исхождения являются омыляемыми, так как, вступая во взаимо-
действие со щелочными растворами, образуют растворимые в воде
мыла. Например, реакция взаимодействия стеарина (одна из
составляющих частей сала) с гидроксидом натрия (едким натром):
(С^НзвСОО^СзНб + 3NaOH = 3C17HSBCOONa + СзНв(ОН)3
приводит к образованию растворимой натриевой соли стеарино-
вой кислоты — стеарата натрия (мыла), которая образует с водой
коллоидный раствор. Минеральные масла являются неомыляе-
мыми, и их можно удалить только специальными органическими
растворителями или моющими средствами.
Химическое обезжиривание заключается в том, что под воз-
действием щелочи жиры омыляются и переходят в раствор, а ми-
неральные масла в присутствии специальных поверхностно-ак-
тивных веществ — эмульгаторов — образуют эмульсию.
К веществам, входящим в состав обезжиривающих растворов,
предъявляются особые требования. Они должны хорошо удалять
жировые пленки, не должны вызывать коррозии обрабатываемых
деталей и должны хорошо смываться при промывке водой.
Растворы для химического обезжиривания обычно содержат
щелочи, фосфаты, силикаты, мыла, различные синтетические
моющие вещества — поверхностно-активные вещества (синтанол
ДС-10, синтамид-5 и др.), эмульгаторы — органические соедине-
34
ния с большой молекулярной массой (желатин, декстрин), каль-
цинированную соду.
По степени щелочности обезжиривающие растворы можно
разделить на три группы: сильнощелочные для грубой очистки
стальных деталей (pH 12—14); среднещелочные для очистки
деталей перед нанесением покрытий (pH И—12); слабощелочные
для обезжиривания цветных и легких металлов (pH 10—11).
Для обезжиривания металлов, растворяющихся в щелочах
алюминия, цинка, олова, применяют растворы на Основе слабо-
гидролизующихся щелочных солей — кальцинированной соды,
карбоната калия (поташа), тринатрийфосфата.
При химическом обезжиривании следует применять разбав-
ленные растворы щелочей\так как концентрированные щелочные
растворы обладают способностью образовывать оксидные пленки
на поверхности деталей, изготовленных из стали, меди и медных
сплавов. Повышенное содержание щелочи может вызвать пассива-
цию и коррозию изделий. Коррозия легких металлов происходит
при pH 10, коррозия цветных металлов — при pH > 12,5. Фос-
фаты натрия Na2PO4 и Ма4Р2О7 образуют щелочную среду в ре-
зультате гидролиза; обладают буферными свойствами, поддержи-
вая концентрацию водородных ионов при изменении состава
раствора. Они также обладают поверхностно-активными свой-
ствами: пептизируют загрязнения. Фосфаты уменьшают жест-
кость воды, образуя комплексные соединения с солями каль-
ция и магния.
Из фосфатов наилучшими обезжиривающими свойствами обла-
дают ортофосфаты и полифосфаты; концентрацию последних
берут в 2—3 раза меньше.
Силикат натрия (жидкое стекло) znNa2O.nSiO2 кроме мягкого
щелочного действия оказывает ингибирующее и эмульгирующее
действие. Силикаты при гидролизе образуют нерастворимую
кремниевую кислоту, находящуюся в коллоидном состоянии,
способность которой диспергировать твердое вещество улучшает
качество очистки поверхностей и предотвращает повторное осажде-
ние загрязнений на поверхность деталей. После обработки в рас-
творах, содержащих силикат натрия, на поверхности металлов
остается тонкая пленка. Фосфаты и силикаты хорошо смываются
водой. Кроме того, в присутствии фосфатов лучше смываются
едкий натр и карбонат натрия. После обезжиривания в растворах
силикатов необходима тщательная промывка деталей в нейтраль-
ной или слегка щелочной воде.
Оптимальная концентрация щелочи зависит не только от
материала детали, но и от наличия в растворе того или иного
поверхностно-активного вещества. Для стальных деталей макси-
мальная концентрация щелочи 100 г/л, для медных — 50 г/л,
а для амфотерных металлов, способных растворяться в щелочных
растворах, обезжиривание проводят в растворах, которые со-
держат соли щелочных металлов, — Na2CO8, Na2SiO8, Na8PO4 и т. д.
2*
35
4.2. Состав (г/л) растворов для химического обезжиривания
и режим работы
Компоненты раствора и режим работы Номер раствора
1 2 3 4 5 6
Моющее средство «Лабо- мид» или «Деталин» или «Им- 20—30 — — — — —
NaOH —1 5—15 20—40 8—12 — —
Na3PO4- 12Н2О * ч 15—35 5—15 20—50 —. 15—35
Na2CO3 15—35 — — —, 15—35
Ситанол ДС-10 — 3—5 —. —— —. 3—5
Обезжириватель ДС-10 — — 3—5 —. —, —.
Na2SiO3 — -—' 10—30 — — —.
Стекло натриевое жидкое — — — 25—30 — —
Средство моющее ОСА-1 •—• — •—- — 10—50 —
t, °C 60—80 60—80 50—70 40—70 70—80 60—80
т, мин 3—10 3—20 2—5 3—10 7—10 5—20
При выборе поверхностно-активных веществ необходимо учиты-
вать возможность обезвреживания сточных вод после обезжири-
вания. Например, такие препараты, как контакт Петрова, суль-
фанолы НП-1, НП-3, применять нежелательно, так как они яв-
ляются биологически жесткими веществами. Их можно заменять
биологически мягкими веществами, такими как синтанол ДС-10
или синтамид-5.
Моющая способность поверхностно-активных веществ при кон-
центрации около 1 г/л и температуре 60 °C достигает наибольшего
эффекта у синтанола ДТ-1, синтамида-5, синтанола ДС-10 и т. д.
Оптимальная концентрация поверхностно-активных веществ со-
ставляет 2—8 г/л.
Химическое обезжиривание производят при температуре 70—
90 °C, при которой омыление и процесс эмульгирования протекают
более интенсивно. Продолжительность обезжиривания зависит
от степени загрязнения деталей и составляет примерно 3—20 мин.
Увеличение температуры и перемешивание раствора ускоряют
удаление масла с поверхности.
Составы для химического обезжиривания приведены в табл. 4.2.
В растворе 1 можно обезжиривать детали из любых металлов
и сплавов. Растворы 2 и 3 применяются для обезжиривания
деталей из сталей, растворы 4 и 5 — для алюминия и его сплавов,
раствор 6 — для всех деталей и сплавов, кроме полированного
алюминия и его сплавов.
Шлифовальные и полировальные пасты с поверхности любых
металлов удаляют моющими средствами (концентрация 60—
80 г/л) Полинка (ТУ 38-10951—79), Верталин-74 (ТУ 38-10960—81)
или ТМС-31 (ТУ 38-107113—78). Детали выдерживают в указан-
ных растворах в течение 5—10 мин при температуре 70—80 °C.
36
4.3. Состав растворов для удаления СОЖ
Обрабатываемый материал Состав раствора Концентрация , %
Все металлы и их сплавы Na2CO3 технический Сиитанол ДС-10 Моющие синтетические препара- ты МЛ-51 или МЛ-52 10—15 1—3 15—35
Цинковые сплавы: ЦАМ 4-1; ЦАМ 9-1,5; ЦА4 Тринатрийфосфат (можно заме- нить пирофосфатом) 25—50
Смазочно-охлаждающие жидкости (СОЖ) удаляют в растворах,
приведенных в табл. 4.3.
Эмульсионное обезжиривание применяют для удаления с по-
верхности деталей веществ, не растворимых в органических
растворителях, например водомасляных эмульсий, часто приме-
няемых при обработке деталей в машиностроении.
Растворы для эмульсионного обезжиривания состоят из двух
фаз: органического растворителя и водного моющего раствора.
Эмульсионное обезжиривание обеспечивает одновременное обез-
жиривание деталей и эмульгирование загрязнений.
Составы растворов для эмульсионного обезжиривания при-
ведены в табл. 4.4.
Для эмульсионного обезжиривания применяют также составы
ТМС-31-1А и Аполир—К для всех металлов и ЭО-1 для черных
металлов.
Ускорения процесса и улучшения качества очистки можно
достигнуть, применяя струйное обезжиривание, которое произ-
водят в специальных моечных машинах. Этот метод можно исполь-
зовать в автоматических линиях после операции химического обез-
жиривания.
4.4. Состав (г/л) растворов для эмульсионного обезжиривания
Компоненты раствора Номер раствора
1 2 3 4
ДС—РАС натриевый 1,5—2,0 — .
Препарат ОП-Ю 0,75—1,0 — 17 30
Трихлорэтилен 2—3 .—- 46 —>
Na4P2O7 0,5 —. —
Т риэтаноламин 0,2—0,3 4 — —
Карболовое масло •— .—. 19 54
Керосин — 88 — 0,6
Олеиновая кислота .—. 7 — 0,6
Сульфонат — —. 5 6
NaBP3O10-10H2O — —. — 0,5
37
g 4.5. Состав (г/л) моющих растворов и режим обезжиривания
Обрабатнваемнй иатернал Метод обработки Моющее средство (марка) Концен- трация, г/л Режим обработки
Темпе- ратура, °C Давление жидко- сти, МПа Продол- житель- ность, мин
Сталь Погружение КМ-1; КМ-2; КМ-3; КМ-5; КМ-51; МЛ-52; МС-6; МС-8; ОС-1; лабо- мид-203; аэрол; вимол 15—30 50—70 — 5—20
Распыление КМ-1; КМ-5; КМ-2; МЛ-51; МС-6; лабомид-101; триас-А 5—15 50—70 0,1—0,2 1—5
Медь и ее сплавы; се- ребро; никель; ковар; ин- вар; супериивар; титан и его сплавы; цинковые сплавы Погружение МЛ-51; КМЭ-1; ОС-1; МЛ-52; КМ-2; КМ-1; КМ-5; лабомид-203; аэрол; ви- мол 20—40 60—80 — 3—15
Распыление КМ-2; КМ-5; МС-5; МЛ-51; лабо- мид-101 5—15 40—60 0,1—0,2 —
Алюминий и его сплавы Погружение КМЭ-1; КМ-2; КМ-5; МЛ-52; МС-8 Лабомид-203; Омега-1; Импульс 10—20 30—40 50—60 — 5—10 5—15
Распыление КМ-2; МЛ-51; лабомид-101; МС-6; КМ-5 5—15 40-60 0,1—0,2 1—5
Магниевые сплавы Погружение КМ-2; КМ-3; КМ-5; МЛ-52; ОС-1; лабомид-203 30—50 70—80 •— 3—15
Для струйного обезжиривания стальных деталей применяют
растворы, г/л, и режим работы:
Раствор 1 Раствор 2
NaOH.................................. 40—30 5—7
Na2CO3 ............................... 40—30 —
NaBP3O10-ЮН2О .......................... — 3—5
Трилон Б................................ — 1—3
Добавка ТАЗЗ или авироль ОГ .... — 0,1—0,2
Л °C.................................. 60—70 60—65
т, мин............................ ....... 6
Для струйного обезжиривания полированных деталей после
меднения используют раствор, г/л, и режим работы:
Na2CO3...................3—5 t, °C...................50—60
Na3PO4-12H2O ..........3—5 т, мии.................. 4
Для уменьшения количества пены рекомендуется добавлять
к обезжиривающему раствору пеногаситель КЭ-10-12 (0,1—0,2 г/л);
уайт-спирит (10—20 мл/л); силоксановую жидкость А-154 (0,05—
0,5 г/л); ЭАП-40; ПМС-1000А; ПМС-200А; КАВ-1.
Химическое обезжиривание в моющих средствах применяется
главным образом для замены органических растворителей. Мою-
щая способность растворов синтетических моющих средств зна-
чительно выше, чем растворов едкого натра и щелочных растворов.
Состав моющих растворов на основе этих средств и режим обез-
жиривания приведены в табл. 4.5.
§ 4.3. ЭЛЕКТРОХИМИЧЕСКОЕ ОБЕЗЖИРИВАНИЕ
Электрохимическое обезжиривание является эффектив-
ным способом очистки поверхности и применяется главным обра-
зом для удаления тонких жировых пленок, которые остаются
после других видов обезжиривания и которые трудно удалить
другим способом.
При электрохимическом обезжиривании используются те же
растворы, что и при химическом обезжиривании, но концентрации
веществ берутся меньшими.
Электрохимическое обезжиривание в щелочных растворах
производится при помощи постоянного, а иногда и переменного
тока. При постоянном токе обезжиривание осуществляется и на
катоде, и на аноде. В процессе электролиза на поверхности де-
талей наблюдается интенсивное выделение пузырьков газа, об-
легчающих отрыв капелек масла от поверхности деталей, чем
значительно ускоряется обезжиривание.
Мелкие пузырьки газа под воздействием силы поверхностного
натяжения, отделяясь от электрода около капли масла, задержи-
ваются ею. По мере увеличения размеров пузырька за счет при-
соединения соседних мелких пузырьков капля масла будет вы-
тягиваться и в какой-то момент оторвется от поверхности металла.
39
Скорость обезжиривания деталей на аноде меньше, чем на
катоде. Это объясняется тем, что в прианодном пространстве не
происходит защелачивания электролита, вследствие чего процесс
омыления растительных и животных жиров у анода происходит
медленнее. Кроме того, объем выделяющегося при электролизе
кислорода меньше объема водорода, а пузырьки кислорода больше
пузырьков водорода и меньше задерживают на поверхности ка-
пелек масла, а поэтому и удаление масла с поверхности проис-
ходит менее интенсивно. Однако процесс катодного обезжиривания
сопровождается наводороживанием стальных деталей, вследствие
чего при продолжительном обезжиривании на катоде зака-
ленные или тонкостенные стальные детали, пружины и т. п. могут
становиться хрупкими, поэтому катодное обезжиривание подобных
деталей не допускается.
В последнее время в Казанском сельскохозяйственном инсти-
туте синтезированы вещества, введение которых устраняет водо-
родное охрупчивание. Наилучшим ингибитором оказался азот-
содержащий полимер КСХИ-40 с низкой молекулярной массой.
При концентрации КСХИ-40 1 г/л полностью исключается водо-
родное охрупчивание стали. Добавка нелетуча, нетоксична и не
образует пены, что упрощает обслуживание ванн и исключает
возможность возникновения гремучей смеси.
На практике чаще всего применяется комбинированное обез-
жиривание: сначала — на катоде (5—8 мин), затем — на аноде
(1—2 мин). В качестве второго электрода применяют при анодном
обезжиривании сталь (катод), при катодном — никель, никели-
рованную и коррозионно-стойкую стали (анод). Углеродистая
сталь на аноде при катодном обезжиривании немного разрушается,
загрязняя раствор железом, которое частично осаждается на
поверхности обезжириваемых деталей. Это особенно нежелательно
при катодном обезжиривании меди, ее сплавов и полированных
деталей непосредственно перед покрытием.
Электрохимическое обезжиривание деталей из меди, цинка,
алюминия и их сплавов осуществляется только на катоде. Скорость
электрохимического обезжиривания значительно выше, чем хими-
ческого. Качество обезжиривания лучше. При электрохимическом
обезжиривании пользуются в основном теми же химикатами,
что и при химическом, только в меньшей концентрации.
Недостаток электрохимического обезжиривания — низкая рас-
сеивающая способность применяемых электролитов, вследствие
чего очистка сложнопрофилированных деталей затруднительна.
Состав электролитов и режим работы при электрохимическом
обезжиривании некоторых металлов приведены в табл. 4.6. Элек-
тролиты 1, 2, 3 рекомендуются для обезжиривания на подвесках,
электролит 5 — в барабанах. Обезжиривание на переменном токе
производится в электролите 4. Электролит 6 для обезжиривания
меди содержит цианид натрия, который не только улучшает обез-
жиривающие свойства, но и активирует поверхность меди. Сталь-
40
4.6. Состав (г/л) растворов и режим электрохимического обезжиривания
Компоненты электролита и режим работы Сталь | Медь
Номер раствора
1 2 3 4 6 6 7
NaOH 20—40 5—10 — 45—55 60—70 10—15 10—15
Na2CO3 20—40 20—40 25—30 — 10—20 25—30 25—30
Na8PO4 20—40 20—40 25—30 10—20 5—10 25—30 25—30
Na2SiOs —, 3—5 —. 15—25 — — —
NaCN —. 5—15 — —. 10—15 —
Na6P8O10-10H2O — —. 10—20 —. — —
Синтанол ДС-Ю —. — 1—2 — —. — —
Авироль —. — — 0,1—0,2 —. — —
Элва — — — • — 0,1—1 мл/л — —.
Трилон Б — — —, — 4—6 — —
t, °C 60—80 60—80 60—70 75—85 35—40 65—70 40—50
iK, А/дм? 2—10 2—10 10 4—8 1—1,5 2—5 —
ia> А/дм? — — — 3—5 —. — 2—3
тк, мин 3—10 3—10 10 4 3,5 4 —
та, мин 1—3 1—3 —• 1—2 — — 1—2
ные омедненные детали обезжиривают сначала на катоде в элек-
тролите 6, затем на аноде в электродите 7.
При выборе состава электролита следует учитывать его элек-
тропроводность, эмульгирующую и смачивающую способность,
а также воздействие на материал катода. Электропроводность рас-
творов солей уменьшается в ряду NaOH -> Na2SiO3 -> Na2CO3 ->
-> фосфаты. Эмульгирующая способность возрастает в ряду
NaOH -> Na2CO3 -> фосфаты -> силикаты.
В процессе электрохимического обезжиривания необходимо
удалять накапливающуюся на поверхности электролита пену, так
как в ней могут задерживаться выделяющиеся пузырьки водорода
и кислорода, образующие гремучий газ. Из этих соображений не
следует добавлять в ванну электрохимического обезжиривания
большое количество эмульгаторов и ПАВ. Во избежание накопле-
ния пены применяют пеногасители А-154, ПМС-200А и др.
Увеличение температуры ускоряет процесс очистки и, кроме
того, повышает электропроводность раствора, способствуя сни-
жению напряжения на ванне и уменьшению расхода электроэнер-
гии. Можно повышать плотность тока, ускоряя процесс. При по-
вышении температуры раствора на каждые 14 °C свыше 60 °C
время обезжиривания уменьшается в 2 раза. Напряжение на за-
жимах электродов меняется в зависимости от состава, температуры
раствора и плотности тока в пределах 3—10 В.
41
§ 4.4. ОБЕЗЖИРИВАНИЕ
С ПРИМЕНЕНИЕМ УЛЬТРАЗВУКА
Качество обезжиривания деталей и скорость очистки
можно значительно повысить ультразвуковой обработкой. Обез-
жиривание деталей с помощью ультразвука осуществляется в ванне
с органическими растворителями или со слабощелочными раство-
рами моющих средств.
Сущность метода ультразвуковой очистки заключается в сле-
дующем. При распространении ультразвуковой волны в жидкости
возникают области резко повышенного давления, чередующиеся
с областями пониженного давления. При достаточной интенсив-
ности колебаний в местах пониженного давления (узлах волны)
происходят разрывы жидкости, которые с силой захлопываются
при прохождении через пучность. При этом развиваются огромные
силы, достигающие нескольких тысяч атмосфер. Это явление на-
зывается кавитацией. Кавитация обычно начинается вблизи гра-
ницы раздела жидкости и твердых тел. Огромные механические
усилия, развивающиеся при возникновении кавитации, не только
удаляют с поверхности жировые загрязнения, но могут разрушать
также пленки оксидов, например, удалять окалину со стальных
деталей. Таким образом, при ультразвуковой обработке поверх-
ность деталей не только обезжиривается, но и протравливается.
Интенсивность влияния ультразвука повышается с темпера-
турой. Состав жидкости для ультразвуковой очистки также влияет
на скорость и качество обезжиривания. Если жидкость не ока-
зывает химического воздействия на загрязнения, то обезжири-
вание происходит в основном за счет механического воздействия
кавитационных пузырьков. Если же жидкость растворяет или
омыляет загрязнения, то очистка осуществляется как за счет
физико-химического воздействия жидкости, так и за счет механи-
ческого разрушения пленки жиров.
В табл. 4.7 приводятся некоторые составы моющих растворов,
применяющиеся при ультразвуковом обезжиривании. В рас-
творе 1 обрабатывают детали из черных и цветных металлов;
4.7. Состав (г/л) моющих растворов для ультразвукового обезжиривания
Компоненты раствора Номер раствора
1 2 3 4 6
NaOH 5—10 — 25—30 - . .
Na2CO8 15—25 4—6 —. 3—5
Na2PO4-12H2O 40—60 6—8 — 30—40 3—5
Na2O-SiO2 — 10—12 20—25 — —.
Синтанол ДС-10 — —. — 1—3 1—3
NaNO2 —. .—- 10—12 .—. —.
KaCr2O7 — —. — — 0,5—0,8
42
в растворе 2 — медь, цинк, алюминий; в растворе 3 — стальные
детали; растворы 4 и 5 предназначены для обработки деталей из
меди и ее сплавов.
Частота ультразвуковых колебаний, при которых достигается
наибольший эффект кавитации, составляет примерно 20 кГц.
Для обработки сложных мелких деталей, имеющих узкие зазоры,
щели, частоту повышают до 200—500 кГц.
ГЛАВА 5. ХИМИЧЕСКОЕ И ЭЛЕКТРОХИМИЧЕСКОЕ
ТРАВЛЕНИЕ ПОВЕРХНОСТИ
§ 5.1. ТРАВЛЕНИЕ ЧЕРНЫХ МЕТАЛЛОВ
Химическое травление. Травлением называется процесс
удаления оксидов с поверхности металлических деталей при по-
мощи кислых или щелочных растворов. При травлении также
происходит выявление структуры металла. Травление можно
осуществлять химическим или электрохимическим способом. Вы-
бор способа травления зависит от природы металла, состояния
его поверхности и от последующей технологической операции.
Поверхность черных металлов обычно покрыта слоем оксидов
железа, куда входят вюстит FeO, гематит Fe2O3, магнетит Fe3O4,
а также гидроксиды железа (II) и (III).
Для химического травления черных металлов обычно приме-
няют разбавленные растворы серной или соляной кислоты или их
смеси.
При травлении наблюдаются два процесса: растворение окси-
дов и растворение железа, находящегося под слоем оксидов. Эти
два процесса могут протекать одновременно. В зависимости от
природы кислоты, ее концентрации и температуры меняется ско-
рость протекания процесса.
В первый период раствор кислоты через поры и трещины в на-
ружном слое окалины, который состоит из Fe2O3, проникает
к слоям Fe3O4 и FeO, а затем — к поверхности металла. Поскольку
оксид FeO растворяется с наибольшей скоростью, происходит
преимущественное его растворение, а трещины и поры в слое
Fe2O3 и Fe3O4 увеличиваются. С момента проникновения кислоты
к поверхности металла начинается его растворение с выделением
водорода.
Механизм удаления окалины в серной и соляной кислоте не-
одинаков. В соляной кислоте растворяются преимущественно
оксиды; в серной — главным образом металлическое железо
с выделением водорода, который механически разрыхляет и уда-
ляет окалину.
При взаимодействии окисленного железа с разбавленными
кислотами могут протекать следующие реакции:
43
при взаимодействии с соляной кислотой
FeO + 2НС1 = FeCl2 + Н2О; ,
Fe2O3 + 6НС1 = 2FeCl3 + ЗН2О; /
Fe3O4 + 8НС1 = 2FeCl3 + FeCl2 + 4H2O;
2FeCl3 + H2 = 2FeCl2 + 2HC1;
2FeCl3 + Fe = 3FeCl2;
Fe + 2HC1 = FeCl2 + H2f;
при взаимодействии с серной кислотой
FeO + H2SO4 = FeSO4 + H2O;
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;
Fe3O4 + 4H2SO4 = FeSO4 + Fe2(SO4)3 + 4H2O;
Fe2(SO4)3 + H2 = 2FeSO4 + H2SO4;
2Fe2(SO4)3 + 2Fe = 6FeSO4;
Fe + H2SO4 = FeSO4 + H2O.
Наибольшая скорость травления достигается в растворах,
содержащих 0,20—0,25 масс, долей кислоты (табл. 5.1). Однако
во избежание сильного разъедания металла рекомендуются рас-
творы, содержащие не более 0,20 масс, долей кислоты.
Продолжительность травления значительно сокращается при
повышении температуры растворов (табл. 5.2).
Данные табл. 5.2 и рис. 5.1 показывают, что скорость травле-
ния в растворе соляной кислоты в большей степени зависит от
концентрации кислоты, а в растворах серной кислоты — от тем-
пературы.
Так как при повышении температуры от 15 до 60 °C скорость
травления в растворах серной кислоты возрастает в 10—15 раз
независимо от состава раствора, целесообразно вести процесс при
температуре 50—60 °C. Повышение температуры растворов соля-
ной кислоты не оказывает сильного влияния на интенсивность
5.1. Продолжительность травления в зависимости от массового
содержания кислоты (масс, доли) при комнатной температуре
Массовое содержание Продолжительность травления, мин Массовое содержание Продолжительность травления, мин
в соляной кислоте в серной кислоте в соляной кислоте в серной кислоте
0,02 90 135 0,20 10 85
0,05 55 135 0,25 9 65
0,10 18 120 0,30 — 75
0,15 15 90 0,40 — 95
44
5.2. Продолжительность травления в зависимости от температуры
Массовое содержание, масс, доли Продолжительность травления, мии, при температуре
18 °C 40 СС 60 сс 18 °C 40 °C 60 сс
Соляная кислота Серная кислота
0,05 55 15 .—. 135 45 13
0,10 18 6 — 120 32 8
процесса. Поэтому травление в соляной кислоте при повышенных
температурах нецелесообразно, тем более, что при этом вы-
деляется большое количество вредных паров хлороводорода и
происходит интенсивное растворение основного металла, приво-
дящее к излишнему расходу кислоты, потере металла, выделению
вредных испарений; при этом возможно наводороживание ме-
талла. Кроме того, поверхность металла может оказаться разъ-
еденной и шероховатой.
Травление в растворе соляной кислоты проводят при комнат-
ной температуре или при температурах не более 40 °C, что свя-
зано с летучестью хлороводорода. Продолжительность травления
в соляной кислоте значительно меньше, чем в серной, вследствие
значительно большей скорости растворения оксидов. Применяемые
концентрации соляной кислоты 150—200 г/л.
На продолжительность травления большое влияние оказывает
содержание солей железа в травильном растворе (рис. 5.2). При
накоплении солей железа в растворе активность серной кислоты
падает, а активность соляной кислоты растет примерно до накопле-
ния 0,16 масс, долей железа в растворе, а затем начинает падать.
Предельно допустимая концентрация солей железа приведена
в табл. 5.3.
Рис. 5.1. Зависимость скорости травления низколегированной стали от кон-
центрации серной кислоты и температуры:
1 — t = 25 °C; 2 — t = 35 °C; 3 — t = 50 °C; 4 — t = 60 °C; 5 — t ~ 80 °C
Рис. 5.2. Влияние содержания железа на скорость травления в серной (/) и
соляной (2) кислотах
45
5.3. Максимальная концентрация
солей железа (г/л)
в травильных растворах
Соль железа Способ травления
погружение распыление
FeSOj 150—180 250—300
FeCl2 200—220 300—380
Fe3(PO4)2 20—25 15—18
Преимущества сернокислых
травильных растворов — невы-
сокая стоимость, нелетучесть
серной кислоты даже при тем-
пературе до 100 °C, возможность
извлечения сульфатов железа,
растворимость которых резко
падает с уменьшением темпера-
туры раствора.
К преимуществам солянокис-
лых растворов относятся низкая
температура обработки и воз-
можность получать более чистую и менее шероховатую поверх-
ность деталей.
При травлении железа, покрытого сравнительно толстым слоем
окалины, целесообразно применять смесь серной и соляной
кислот с добавкой хлорида натрия. Добавка хлорида натрия
увеличивает скорость растворения окалины и замедляет процесс
растворения металла. Благодаря этому в несколько раз возрастает
скорость травления и тормозится процесс наводороживания.
Для подготовки деталей к нанесению лакокрасочных покрытий
применяют фосфорную кислоту. Последнюю используют также
в тех случаях, когда детали покрыты толстым слоем оксидов
и абсолютно недопустимо травление основной поверхности. В слу-
чае применения растворов, содержащих 0,10—0,20 масс, долей
фосфорной кислоты, детали после тщательной промывки необ-
ходимо дополнительно подвергнуть травлению в горячем 1—
2 %-ном растворе фосфорной кислоты в течение 0,3—0,5 мин.
Для травления коррозионно-стойких сталей применяют смесь
азотной и соляной кислот. Обильно выделяющийся при травлении
водород частично диффундирует в железо. При повышенной тем-
пературе повышается степень поглощения металлом водорода,
в связи с чем появляется так называемая водородная хрупкость.
Изменения, вызываемые поглощением водорода, особенно опасны
для деталей, изготовленных из высокозакаленных сталей, для
тонкостенных деталей, а также для пружин и крепежных деталей.
В некоторых случаях водород, накапливаясь под поверхностными
слоями металла, образует так называемые травильные пузыри,
часто обнаруживаемые только при последующем нанесении галь-
ванических покрытий или при хранении.
Для того чтобы уменьшить объем выделяющегося водорода,
предохранить поверхность деталей от перетравливания, а также
для экономии кислоты применяют ингибиторы травления.
К ингибиторам предъявляется ряд требований. При травлении
в ингибированных растворах не должны ухудшаться физико-ме-
ханические свойства металлов, т. е. ингибитор должен защищать
металл не только от коррозии, но и от наводороживания. Ингиби-
тор не должен снижать скорость растворения оксидов. Оптималь-
46
5.4. Состав (г/л) растворов и режим работы при химическом травлении
углеродистых, низко- и среднелегированиых сталей и чугунов
Компоненты раствора н режим работы Сталь, чугун Сталь, ковар Чугун- ное литье Стальные детали высокой точности
Номер раствора
1 2 3 4 6 6
H2SO4 НС1 Н8РО4 КУ Ингибитор КИ-1 Сульфонол НП-3 Ингибитор БА-6 Уротропин 1, °C 150—200 3—5 3—5 40—80 120—200 40—50 18—25 150—350 40—50 15—45 200—220 5—7 15—30 120—160 60—70 100—200 0,8—1,0 8—10 60—80
Примечание. Обработка производится до полного удаления оксидов.
ный ингибитор должен сохранять свои свойства и при уменьшении
концентрации кислоты и при накоплении в ней солей железа.
При непрерывном травлении металл проходит через травильные
растворы с большой скоростью. В этих случаях необходима бы-
страя адсорбция ингибитора.
Ингибиторами служат главным образом органические ве-
щества или их смеси: смолы, алифатические амины, производные
ароматических и гетероциклических соединений, белковые ве-
щества, уротропин и т. д. Механизм действия ингибиторов при
травлении в кислотах объясняется адсорбцией их частиц (молекул)
на анодных или катодных микроучастках поверхности металла,
вследствие чего растворение замедляется. Влияние ингибиторов
при травлении стали в серной кислоте сводится к увеличению
перенапряжения водорода, вследствие чего растворение железа
уменьшается.
В настоящее время для травления черных металлов рекомен-
дуются следующие ингибиторы кислотной коррозии, выпускае-
мые отечественной промышленностью: для растворов серной
и соляной кислот — И-1-А, И-1-Б, И-1-В, И-2-В, И-З-В;
серной, соляной, плавиковой и фосфорной — КПИ-1; серной и
азотной — С-5; серной, соляной, фосфорной и их смесей —
ХОСП-Ю; серной, соляной, фосфорной — ОР-2; соляной — БА-6,
БА-12; серной и соляной—катапин, ингибиторы серии ПКУ и др.
Как правило, ингибиторы вводят в кислотные растворы
в количестве 1—5 г/л, наиболее эффективный (ХОСП-Ю) — в ко-
личестве 0,25—0,50 г/л. Перспективными ингибиторами являются
также пеназолин, ингибиторы серии КПП, ОР-2К, ХОД-4, ХОД-7
и др.
47
б. б. Состав (г/л) растворов и режим работы при химическом травлении
коррозионно-стойких сталей
Компоненты раствора и режим работы Сталь марок 12X18H9T, 12X21H5T, 08X17H5M3 и др. Сталь марок 20X13, 40X13
Номер раствора
1 2 3 4 6 6
H2SO4 80—110 350—450
НС1 .— •—. — —. 90—100 70—90
HNOS 50—150 350—400 220—240 70—200 — 70—90
HF 15—50 15—25 — 15—50 — .—
NaF —. —- 20—25 —> .—. —
NaNO3 —1 —. — — —
NaCl — 20-25 —. — —
Сульфоуголь — •— — 1,0—1,6 — —
t, °C 15—30 15—30 15—30 15—30 40—45 40—45
X, Мии До 60 15—20 До 60 До 60 10—15 1—2
Рекомендуемые состав растворов и режим обработки для трав-
ления углеродистых, низко- и среднелегированных сталей и чу-
гунов приведены в табл. 5.4. После травления в растворах, со-
держащих фосфорную кислоту, перед нанесением покрытий сле-
дует проводить активирование поверхности с целью удаления
фосфатного слоя. Для удаления остатков песка и шлаков с чугун-
ных и стальных отливок применяют 3—4 %-ные растворы фтори-
стоводородной кислоты. При наличии большого количества ока-
лины целесообразно к указанному раствору добавить 10—15 %
H2SO4.
Травильный шлам, образующийся в некоторых случаях на
поверхности, может быть удален одним из следующих способов:
погружением деталей в концентрированный раствор азотной
кислоты; погружением деталей в раствор, содержащий 200—
250 г/л хромового ангидрида и 3—5 г/л серной кислоты; анодной
обработкой в растворе едкого натра (60—100 г/л) при плотности
тока 5—10 А/дм2; погружением деталей в раствор нитрита натрия
(200 г/л) на 1—2 мин, затем — в раствор соляной кислоты (1 : 1)
на 20—30 с.
Химическое травление коррозионно-стойких сталей из-за на-
личия на них очень сильной пассивной пленки требует применения
более активных растворов повышенных концентраций кислот и
введения активаторов: Cl~, HF~. В табл. 5.5 приведены наиболее
часто применяемые растворы для травления коррозионно-стой-
ких сплавов.
Растворы 1 и 3 применяют для разрыхления окалины после
термообработки и сварки для сталей всех марок. Хромоникелевые
и хромоникелево-молибденовые стали обрабатывают в растворах
1—4, хромистые стали — в растворах 5, 6.
48
\Для травления отдельных участков или деталей крупных
размеров, которые не могут быть помещены в ванны, применяют
специальные травильные пасты, состоящие из травильных раство-
ров, ингибитора и наполнителя (инфузорная земля, легкие су-
глинки, асбест). Ниже приведен состав травильной пасты:
H2SO4 (плотность 1,84 г/см8), см8 .........................29
Н8РО4 ( » 1,70 г/см3), см8 .........................46
НС1 ( » 1,19 г/см8), см8 ........................356
Уротропин, г.................................................6
Сульфитцеллюлозный щелок (плотность 1,22 г/см8), см8. . . 50
Асбест измельченный, г..........................'...........400
Вода, см8................................................. 590
Травильную пасту наносят шпателем, штукатурной лопаткой
или пастопультом и выдерживают в течение 1—6 ч, после чего
смывают. Толстые слои окалины и ржавчины с поверхности изде-
лий сложной формы удаляют погружением в расплав гидрооксида
натрия при 420—480 °C или в расплав смеси гидрооксида натрия
и нитрата натрия в соотношении 3 : 1 при 450—500 °C на 10—
45 мин.
Скорость травления во всех случаях можно повысить встряхи-
ванием или качанием деталей, и особенно применением струйного
травления или ультразвука.
Струйное травление или травление распылением повышает
производительность процесса в 5—7 раз. Струйная обработка
интенсифицирует все процессы, поскольку к обрабатываемым дета-
лям все время подводятся свежие порции раствора. Кроме того,
струя оказывает и механическое воздействие, так как способ-
ствует быстрому удалению с очищаемой поверхности продуктов
растворения окалины и ржавчины. Установлено, что при струй-
ном травлении происходит меньшее наводороживание, чем при
травлении в стационарных ваннах. Угол атаки струи относительно
поверхности составляет обычно 45—90°. Скорость подачи раствора
составляет 15—30 м/с для серной кислоты и 20—26 м/с для соля-
ной кислоты. Травление ускоряется при возрастании скорости
подачи раствора, повышении температуры' и увеличении угла
подачи струи.
Струйное травление превосходит по скорости травление в ста-
ционарных ваннах в 2,5—5 раз в серной кислоте и в 5—10 раз
в соляной кислоте.
Травление в ультразвуковом поле позволяет ускорить процесс,
улучшить качество поверхности, снизить расход химикатов,
а в некоторых случаях уменьшить водородную хрупкость деталей.
Оптимальный состав раствора для травления, хг/л, и темпе-
ратура:
H2SO4 (плотность 1,84 г/см8)................ 100
NaCl ....................................... 50
t, °C......................................50—60
4»
5.6. Состав (г/л) растворов и режим работы
для одновременного обезжиривания и травления
—---------------------------L-,
Компоненты раствора н режим работы Номер раствора
1 2 3 4
Н3РО4 200—220 200—220 150—200
H2SO4 100—120 .—- —
НС1 ,—, — 150—180
NaOH — .—- —- 10—30
NaF — — —. 40—60
Na8PO4 —, .—. 40—50
Na2SiO8 — — — 4—6
Синтанол ДС-10 10—12 10—12 —. —-
Уротропин — — 30—40 —
t, °C До 60 До 60 20—30 50—70
Введение хлорида натрия ускоряет процесс в 2—2,5 раза.
Одновременное обезжиривание и травление целесообразно
применять при обработке деталей, поверхность которых незна-
чительно загрязнена. Такая обработка позволяет сократить число
технологических операций. Основными компонентами растворов
для одновременного обезжиривания и травления служат кислоты
и эмульгаторы. Состав и режим работы растворов приведены
в табл. 5.6
Обработку рекомендуется вести при повышенных температурах.
Растворы 1—3 применяются для обработки черных металлов,
продолжительность обработки 3—10 мин. В растворах 1 и 2 хо-
рошо удаляются штамповочные и консервационные смазки; рас-
твор 4 предназначен для обработки алюминиевых деталей перед
анодированием.
Электрохимическое травление. Электрохимическое травление —
это травление деталей при помощи электрического тока; его можно
проводить как на аноде, так и на катоде.
При анодном травлении удаление оксидов происходит вслед-
ствие электрохимического растворения и механического отрыва
оксидов пузырьками выделяющегося водорода. В качестве элек-
тролита применяют растворы серной и соляной кислот, а также
растворы сульфидов и хлоридов железа. В качестве анода исполь-
зуют обрабатываемое изделие, в качестве катода — свинец. В ре-
зультате анодного травления детали получают совершенно чистую,
слегка шероховатую поверхность, что способствует сцеплению
покрытий с основным металлом.
При анодном травлении сначала происходит удаление оксид-
ной пленки, а затем образование на деталях пассивной пленки.
При этом преобладает электрохимический процесс разряда ионов
ОН" и выделения газообразного кислорода:
4ОН- = 2Н2О + Оя + 4ё.
50
Процесс анодного травления протекает очень интенсивно,
поэтому важно, чтобы поверхность деталей не оказалась пере-
травленной.
Анодное травление применяется для углеродистой и легирован-
ной стали и рекомендуется для деталей простой формы. При
катодном травлении на деталях происходит разряд ионов во-
дорода:
Н++ е = Н; H + H^H2f.
Атомы водорода, реагируя с оксидами металла, частично их
восста навливают.
Выделяющиеся пузырьки водорода разрыхляют пленку окси-
дов, удаляя ее. Электролитом может служить раствор кислоты
или соли, обладающий хорошей электропроводностью. Наилуч-
шие результаты получают в смеси растворов соляной и серной
кислот. Анодами при катодном травлении служат свинец, сплав
свинца с сурьмой (6—10 % сурьмы) или кремнистый чугун
(20—24 % кремния).
Катодное травление применяется главным образом для дета-
лей из углеродистой стали. Никелевые и хромовые детали плохо
поддаются катодному травлению. При катодном травлении не
происходит перетравливания поверхности.
Для устранения неравномерности травления оксидов и умень-
шения наводороживания в травильный раствор вводят небольшое
количество солей олова или свинца. Олово или свинец осаждается
на участках, очищенных от окалины, и вследствие высокого пере-
напряжения на них выделяется значительно меньшее количество
водорода. Эту пленку в случае необходимости легко удалить
в щелочном электролите на аноде.
Плотность тока при анодном и катодном травлении превышает
5 А/дм2. Скорость травления в обоих случаях с повышением плот-
ности тока возрастает. Однако эта зависимость не строго пропор-
5.7. Состав (г/л) электролитов и режим работы
при электрохимическом травлении углеродистых сталей
Компоненты электро- лита н режим работы Номер электролита
1 2 3 4 5
H2SO4 200—250 _ 640 100—150 50—60
НС1 — 8—10 .—. —— 25—30
Н8РО4 — — 970 — —
FeSO4-7H2O 2—1 —. — —. -
NaCl 25—20 40—50 -—. .—. 15—20
FeCl2-6H2O — 140—150 — —. —
Триэтаноламин — — 5—10 — —
i, А/дм2 5—10 5—10 10—60 3—10 8—10
t, °C 40—50 18—35 70—80 40—50 60—70
т, мин 10—20 5—10 3—10 10—15 10—15
51
циональна, и скорость трав-
ления сильно зависит от ро-
да и состояния оксидов на
5.8. Состав (г/л) электролитов и режим
работы при электрохимическом травлении
коррозионно-стойких сталей
Компоненты электролита и режим работы Номер электролита
1 2 3
H2SO4 35—40 80—100 35—40
hno8 25—30 — —
Н8РО4 — —. 45—55
i, А/дм2 5—10 * 20—30 5—6
t, °C 15—20 40—50 30—40
т, мин 5—10 5—10 5—10
• Ток 10—20 В. переменный, напряжение
поверхности металла.
Составы электролитов и
режимы работы для электро-
химического травления ста-
лей приведены в табл. 5.7 —
для углеродистых и в табл.
5.8 — для коррозионно-стой-
ких сталей.
Электролиты 1—3 исполь-
зуются для анодного, а 4—
5 — для катодного травления.
Электролит 1 применяется
для травления деталей с гру-
бой окалиной,электролит 3—
для очистки деталей слож-
ной конфигурации и после травления в соляной кислоте.
В качестве катодов применяют стальные или свинцовые пластины.
При травлении в электролитах 3, 4 и 5 в качестве анодов при-
меняется кремнистый чугун, содержащий 20—24 % кремния,
или сплав свинца с сурьмой.
Выбор условий для анодного травления определяется природой
металла и его оксидов, состоянием поверхности и характером
последующей обработки. Для травления стали обычно применяют
серную кислоту и подкисленные растворы сульфата или хлорида
железа. При травлении сильно окисленной поверхности приме-
няют подкисленные растворы солей железа, так как скорость
электрохимического травления в них больше, чем в серной кис-
лоте.
Когда травлению подвергается относительно чистая, свободная
от оксидов поверхность, можно применять бесшламное травление
в растворе серной кислоты, содержащем 800—1100 г/л H2SO4
при 20—30 °C и анодной плотности тока 2—5 А/дм2 в течение
10—20 мин.
Катодное травление применяется главным образом для удале-
ния оксидов с поверхности деталей, подвергнутых термической
обработке и закалке в масле.
§ 5.2. ТРАВЛЕНИЕ ЦВЕТНЫХ МЕТАЛЛОВ
Травление цветных металлов может производиться как
для окончательной отделки поверхности деталей с последующим
пассивированием или лакированием, так и для подготовки по-
верхности к нанесению гальванических покрытий.
Травление меди и ее сплавов осуществляется в серной кислоте
или в смеси азотной кислоты с серной или соляной. Обработку де-
52 ' <
талей обычно проводят двумя способами в зависимости от назна-
чения процесса и вида оксидов на металле. Для удаления окалины,
образующейся на меди в процессе прокатки, прессования, отжига
применяют серную кислоту. Серная кислота практически не
действует на основной металл, при этом растворяются только
оксиды меди.
При обработке готовых изделий из меди и медных сплавов
обычно проводят глянцевое травление в смеси серной и азотной
кислот с добавлением соляной кислоты. Травление меди в азот-
ной кислоте протекает по следующим реакциям:
в разбавленной кислоте
3Cu + 8HNO3 = 3Cu(NO3)2 + 4Н2О + 2NO;
в концентрированной кислоте
Си + 4HNO3 = Cu(NO3)2 + 2Н2О + 2NO2.
В этом случае обработку деталей из медных сплавов ведут
в две стадии. Предварительное травление проводят в концентри-
рованной азотной кислоте или смеси азотной и серной кислот;
при этом удаляется основной слой оксидов. Затем проводят
кратковременную обработку в смеси тех же кислот с добавкой
небольшого количества хлоридов, получая при этом светлую,
слегка блестящую поверхность. В табл. 5.9 приведен состав рас-
творов для химического травления деталей из меди и ее сплавов.
При добавке в травильный раствор сажи улучшается качество
травления и повышается блеск поверхности металла.
При травлении латуни с повышенным содержанием азотной
кислоты растворимость меди увеличивается, растворимость цинка
остается без изменений (рис. 5.3).
Составы 1 и 2 применяются для предварительного травления
растворов, прошедших термообработку, или после длительного
их хранения. Для матового травления деталей проводят обра-
ботку в растворах 3 и 4 последовательно без промежуточной про-
мывки. Для деталей с паяными швами применяют раствор 7.
Пружины, тонкостенные и резьбовые детали обрабатывают в рас-
творе 6. Для блестящего травления применяются растворы 8—
12, в том числе для термообработанных и бериллиевых бронз —
раствор 8. Кроме того, растворы 3, 4 и 12 рекомендуется исполь-
зовать на автоматических линиях.
Повышение концентрации соляной кислоты (рис. 5.4) приводит
к повышению скорости растворения цинка, но не сказывается на
скорости растворения меди; повышение концентрации серной
кислоты до 500 г/л (рис. 5.5) способствует повышению скорости
растворения как меди, так и цинка. Повышение температуры
больше сказывается на скорости растворения меди (рис. 5.6).
Таким образом, чрезмерно высокая концентрация азотной
кислоты при травлении латуни ведет к вытравливанию меди, и
сплав приобретает бледно-желтый цвет. При повышении кон-
53
5.9. Состав (г/л) растворов и режим работы при химическом травлении
меди и ее сплавов
Компоненты раствора и режим работы Номер раствора
1 2 3 4 5 6
H2SO4 НС1 NH4NO3 или NaNO3 Н3РО4 HNO3 t, °C т, с 140—250 50—60 До удале- ния оксидов 300—450 15—30 10—30 600—800 13—30 10—30 500—900 15—30 10—30 1300— 1400 15—30 10—30 750—850 1—5 50—70 15—30 5—10
Компоненты раствора и режим работы Номер раствора
7 8 9 10 11 12
H2SO4 НС1 NH4NO3 или NaNO3 Н3РО4 HNO3 СН3СООН Н2О2 NaOH NaCl Тиомочевина t, °C Т, С 830—850 260—265 90—110 15—25 0,5—1,5 100—200 400— 650 135—145 20—40 мин 450—500 15—30 30—60 900—920 440—450 5—10 15—30 До Ю 1050— 1100 260—290 15—30 До Ю 935—950 280—290 250—260 0,2—0,3 15—30 0,5—1,5
Рис. 5.3. Зависимость скорости рас-
творения меди (/) и цинка (2) от кон-
центрации азотной кислоты. Выдерж-
ка 15 мин
Лтп,г
Рис. 5.4. Зависимость скорости рас-
творения меди (/) и цинка (2) от кон-
центрации соляной кислоты. Выдерж-
ка 15 мин
54
tons
Рис. 5.5. Зависимость скорости рас-
творения меди (Т) и цинка (2) от кон-
центрации серной кислоты. Выдержка
15 мин
Лп,г
Рис. 5.6; Зависимость скорости рас-
творения меди (/) и цинка (2) от тем-
пературы травильного раствора
центрации соляной кислоты преимущественно вытравливается
цинк и детали приобретают красноватый оттенок. В связи с тем
что повышение температуры также приводит к преимуществен-
ному растворению меди, травление латуни, как и других медных
сплавов в смеси кислот, производится при комнатной темпера-
туре.
Травление медных сплавов должно производиться в вытяжных
шкафах или специальных агрегатах, так как при этой операции
выделяется большое количество вредных паров оксидов азота
и аэрозолей кислот.
Детали перед травлением должны быть обезжирены и высу-
шены во избежание разбавления травильных растворов. После
предварительного травления детали рекомендуется погрузить
в горячую воду, тщательно промыть, высушить на воздухе и
погрузить в раствор для глянцевого травления, а затем тщательно
промыть в проточной воде.
Растворы для глянцевого травления используются до накоп-
ления в них 200—250 г/л солей. Для матового травления меди
и ее сплавов применяют раствор, содержащий 300 г/л HNO8,
200 г/л H2SO4, 2 г/л NaCl, 2 г/л ZnSO4.
6.10. Состав (г/л) растворов для химического травления
алюминия и его сплавов и режим работы
Компоненты раствора и режим работы Номер раствора
1 2 3 4 5
NaOH 50—150 _ — 125—150
HF — 80—140 -—. .—. —
HNO3 — 450—680 —. — —
Н3РО4 — — 80—100 — —
K2SiF4 — 4—6 — —
NaCl — —_ г-~—35 .—.
HC1 — .—, — 10—20
t, °C 45—80 15—30 15—30 50—60 13—18
T, мин До 1,5 До 3,0 До 10 0,5—1,0 6—60
55
Травление алюминия и его сплавов производят в растворе едкого
натра. При этом растворяется пленка А1(ОН)3, которой всегда
покрыты алюминий и его сплавы. После травления и промывки
детали подвергают нейтрализации и осветлению в 15—20 %-ном
растворе при температуре 15—25 °C. Состав растворов и режим
работы приведены в табл. 5.10.
Состав 1 применяется для алюминия, деформируемых и ли-
тейных сплавов, состав 3 — для сварных деталей с негерметизи-
рованным швом. Для матирования алюминия марок АД1, АМц,
АМг2 применяется раствор 4, а для декоративного матирования
алюминия марок АД1, АД, АДО, АД00 — состав 5. Для осветле-
ния деталей из кремнийсодержащих алюминиевых сплавов (силу-
мина) применяется смесь азотной и плавиковой кислот (раствор 2).
Для травления магниевых сплавов используется раствор сле-
дующих состава (г/л) и режима работы:
HNO8 ..................... 90—100 t, °C......................18—25
КаСгоОу..................4—6 т, мии.....................10—20
НС1........................3—5
Травление цинка и кадмия осуществляется в растворах серной
и соляной кислот (50—200 г/л) при комнатной температуре.
Свинец травят в растворе азотной кислоты (50—100 г/л), олово —
в растворе соляной кислоты (50—100 г/л).
Травление титана проводят в растворах, содержащих фто-
риды, оказывающих агрессивное воздействие на титан. Состав
раствора (г/л) следующий:
НС1 ................................60
NaF.................................27
NaCl................................21
Если травление проводится перед нанесением гальванических
покрытий, способы удаления оксидных пленок различны и за-
висят от того, из каких электролитов будут в дальнейшем осаж-
дать покрытия (табл. 5.11).
5.11. Состав растворов для удаления оксидных пленок с титана
Способ нанесения электрохи мического покрытия Компоненты раствора Концентрация компонентов
Пирофосфатное меднение Химическое никелирова- ние Анодное оксидирование С HF (40 %-ная) ( H2SO4 (Н2О ( НС1 (1,19); NiCl2 < nh4f ( НС1 (1,19) ( HNO8 (1,4) ( HF (40%-иая) 10 мл 15 мл 90 мл 220 г/л 20—40 г/л 120 мл/л 160—180 г/л 40—50 г/л
56
§ б.З. АКТИВИРОВАНИЕ И ПРОМЫВКА
Активирование. Активированием называется процесс
удаления с поверхности металлических деталей тончайшего, за-
частую незаметного глазу слоя оксидов, которые могли образо-
ваться в промежутках между операциями. При активировании
одновременно происходит легкое протравливание верхнего слоя
металла и выявление кристаллической структуры металла, что
благоприятствует прочному сцеплению покрытия с основой.
Активирование осуществляется непосредственно перед за-
грузкой деталей в ванны для нанесения покрытий. Если детали
поступают в гальванический цех непосредственно после механиче-
ской обработки и на их поверхности имеется только тонкая оксид-
ная пленка, то активирование может производиться без предва-
рительного травления деталей.
Процесс активирования с применением постоянного тока назы-
вается электрохимическим активированием. Электрохимическое
активирование осуществляется исключительно на аноде. Состав
растворов для химического и электрохимического активирования
различных металлов и режим работы ванн приведены в табл. 5.12.
Катодами при электрохимическом активировании в кислых рас-
творах служат свинцовые пластины, в щелочных — железные.
Электрохимическое активирование особенно рекомендуется при
подготовке стальных деталей перед никелированием.
Промывка. В технологическом процессе подготовки и нанесе-
ния электрохимических и химических покрытий недостаточная
промывка деталей может быть причиной плохого сцепления по-
крытия с основным металлом, появления пятен и других видов
брака.
При дефиците воды применяют диффузионный способ про-
мывки, который заключается в том, что детали вносят в камеру,
заполненную водяным паром, который, конденсируясь на их
поверхности, смывает пленку раствора, перенесенную из преды-
дущей ванны. Такой способ является экономически выгодным
и часто применяется за рубежом.
Большинство отечественных предприятий используют промыв-
ные воды, которые полностью смешиваются с пленкой растворов,
переносимых с деталями при их загрузке. При этом способе
промывка осуществляется или путем погружения деталей в про-
мывочные ванны, или при помощи струи, или и тем и другим путем.
Во всех случаях в промывной воде происходит изменение концен-
трации переносимых компонентов за счет разбавления. При этом
концентрация отдельных компонентов не должна быть выше
предельно допустимой. Например, при содержании в воде более
3 г/л SOl” степень обезжиривания снижается с 93 до 75 %. Резко
ухудшает качество обезжиривания совместное присутствие Fe2+
и SOf-. Предельно допустимая концентрация компонентов в про-
мывных водах приведена в табл. 31.8.
57
5.12. Состав (г/л) растворов и режим работы
при химическом и электрохимическом активировании
Компоненты раствора и режим работы Сталь, никель Сталь Медь и ее сплавы
Активирование
химическое электро- химическое хими- ческое электро- химиче- ское
Номер раствора
1 2 3 4 5
H2SO4 НС1 KCN К2СО8 К2СГ2О7 / °C Г, А/дм? т, с 50—100 15—25 30—60 50—100 15—25 30—60 700—800 20—30 15—25 5—10 3—5 30—40 15—25 5—10 30—40 20—30 15—25 3—5 20—30
Компоненты раствора и режим работы Цинк и его сплавы Алюминий и его сплавы Никель
Химическое активирование
Номер раствора
6 7 8 9 10 11
H2SO4 НС1 KCN HNO3 СН3СООН t, °C т, с 30—50 15—25 3—10 30—50 15—25 3—10 50—100 40—60 3—10 30—50 15—25 3—5 0,2 28—38 50—58 15—30 15—30 300—350 15—30 30—60
Источником водоснабжения является городской или промыш-
ленный водопровод, а также внутрицеховая сеть деминерализо-
ванной воды, которая применяется для приготовления электроли-
тов при нанесении покрытий из благородных металлов, никеля,
а также для окончательной промывки перед сушкой. Для эконо-
мии воды широко применяют системы непрерывной циркуляции
промывной воды; обезжиривающие и фильтрующие установки
позволяют повторно использовать 50—80 % отработанных про-
мывных вод.
Эффективность промывки зависит также от качества воды.
При наличии в ней значительного количества солей на поверх-
ности деталей образуется пленка труднорастворимых солей.
При взаимодействии ионов кальция и магния с мылами также
Б8
образуются трудносмываемые пленки. В связи с этим необходимо
очищать и смягчать воду. Предельная жесткость воды для ряда
ответственных деталей составляет 1,8 мг-экв./л, в остальных
случаях — 6 мг-экв./л. Обессоливают воду дистилляцией или
ионным обменом.
Промывная вода может быть холодной (температура не нор-
мируется), теплой (49—59 °C) и горячей (60—90 °C). Теплая вода
применяется после операций обезжиривания, травления легких
металлов и сплавов, снятия шлама, после химического оксидиро-
вания черных металлов. Горячая вода используется перед сушкой
деталей. Исключение составляют цинковые и кадмиевые покрытия
после хроматирования.
РАЗДЕЛ Ш
ЭЛЕКТРОХИМИЧЕСКОЕ И ХИМИЧЕСКОЕ
ПОЛИРОВАНИЕ МЕТАЛЛОВ И СПЛАВОВ
ГЛАВА 6. ОСНОВЫ ТЕОРИИ ПРОЦЕССОВ
ЭЛЕКТРОХИМИЧЕСКОГО И ХИМИЧЕСКОГО
ПОЛИРОВАНИЯ
Электрохимическое полирование. Электрохимическое и
химическое полирование применяется как для декоративной
обработки деталей после нанесения покрытий, так и в процессе
обработки деталей. Электрохимическое полирование дает возмож-
ность получать поверхность, микрорельеф которой значительно
больше сглажен, чем при механическом шлифовании и полиро-
вании (рис. 6.1).
Покрытия, получаемые на полированных электрохимическим
способом образцах, более мелкокристаллические и малопористые.
Электрохимическое полирование деталей после нанесения покры-
тий повышает их коррозионную стойкость. Во многих случаях
электрохимическое полирование применяют с целью снижения
коэффициента трения, а также облегчения скольжения материа-
лов, соприкасающихся с полированной поверхностью. Электро-
химическое полирование применяют для придания деталям спе-
циальных оптических свойств, а также для подготовки образцов
к исследованию.
Процесс электрохимического полирования, изобретенный
в 1910 г. Е. И. Шпитальским и усовершенствованный француз-
ским ученым П. Жаке, заключается в том, что обрабатываемые де-
тали завешивают в качестве анодов в ванну со специальным элек-
тролитом. В качестве катодов используются какие-либо пластины,
устойчивые в данном растворе.
В процессе электролиза поверхность деталей в результате
различной скорости растворения микровыступов и углублений
сглаживается и становится блестящей.
Существует несколько объяснений механизма электрохимиче-
ского полирования. В конечном счете все они сводятся к неодина-
ковому энергетическому состоянию поверхности выступов и углуб-
60
лений в процессе элекролиза, что
обусловливает различие в скоро-
сти их растворения.
По теории П. Жаке, при раство-
рении металла в определенных
электролитах на поверхности об-
разуется вязкая нерастворимая
пленка. Толщина этой пленки не-
равномерна (рис. 6.2). Во впади-
нах пленка толще, на вершинах
выступов она тоньше вследствие
более интенсивной диффузии со-
ставляющих ее частиц в электро-
лите. Из-за высокого электриче-
Рис. 6.1. Профилограммы поверх-
ности стальных образцов, обрабо-
танных шлифованием (а); механи-
ческим полированием (б); электро-
химическим полированием (в)
ского сопротивления пленки плотность тока на выступах обраба-
тываемой поверхности значительно выше, чем в углублениях.
Неравномерность скорости растворения металла обусловливает
сглаживание поверхности и появление блеска.
Н. П. Федотьев и С. Я- Грилихес объясняют эффект полирова-
ния образованием на металле поверхностной тонкой оксидной
пленки, предотвращающей или тормозящей травящее воздействие
на металл. Толщина пленки неодинакова на микровыступах и
микровпадинах, вследствие чего раствор сильнее действует на
те участки, где толщина пленки меньше, т. е. на микровыступы.
В результате этого процесса сглаживаются мельчайшие неров-
ности на поверхности металла.
Наибольший эффект полирования поверхности достигается
при минимальной толщине оксидной пленки, которая должна быть
достаточной для предотвращения травящего действия электролита
на металл. Образование на аноде пассивирующей пленки приводит
Рис. 6.2. Схема располо-
жения пленки на поверх-
ности анода:
1 — анод; 2 — анодная
пленка; 3 — катод
к повышению электрохимической однород-
ности поверхности металла, так как пре-
имущественное растворение происходит на
участках химических, структурных и мик-
рогеометрических неоднородностей, где
пассивирующий слой менее совершенен.
Благодаря этому блеск увеличивается.
Течение процесса электрополирования
и съем металла в основном зависят от
плотности тока, температуры электролита
и продолжительности электролиза. С по-
вышением температуры увеличивается ско-
рость растворения металла, усиливается
блеск деталей и становится возможным
снизить плотность тока. Повышение плот-
ности тока увеличивает скорость сглажи-
вания и позволяет сократить продолжи-
тельность полирования.
61
ционная кривая при электро-
химическом полировании
При электрохимическом полиро-
вании большое значение имеет вели-
чина анодной поляризации. Руковод-
ствуясь ходом кривых потенциала —
плотности тока, можно управлять
процессом.
На рис. 6.3 приведена потенцио-
динамическая поляризационная кри-
вая зависимости анодной плотности
тока от потенциала анода. Первый
подъем поляризационной кривой АВС
соответствует процессу анодного рас-
творения металла. Концентрация
ионов металла в прианодном слое электролита увеличивается.
На участке ВС скорость диффузии продуктов анодного растворе-
ния больше, чем скорость анодного растворения металла. По мере
приближения к точке С эта разница уменьшается.
На участке CD скорость растворения превышает скорость
диффузии. Продукты анодного растворения накапливаются на
поверхности анода, в результате чего увеличивается сопротивле-
ние слоя у анода и падает сила тока. На участке DE напряжение
возрастает при постоянной силе тока, т. е. масса растворяющегося
при этом металла не меняется. Повышенная гладкость анодной
поверхности способствует повышению плотности тока. Далее
с ростом напряжения пленка продуктов растворения становится
прочнее и повышается сопротивление.
В точке Е кривая круто поднимается вверх, начинается разряд
ионов гидроксида и выделение газа. Полированная поверхность
чаще всего получается после перегиба кривой в точке Е, хотя в от-
дельных случаях полирование меди и ее сплавов в ортофосфорной
кислоте происходит и на горизонтальном участке. Если после
точки Е образуется сплошная беспористая пленка, то прохождение
тока прекращается из-за ее высо-
кого сопротивления. Если пленка
пористая, то сила тока опреде-
ляется электропроводностью слоя
на участке пор.
На рис. 6.4 приведены кривые
зависимости анодного потенциала
от плотности тока для меди в рас-
творах фосфорной кислоты раз-
Рис. 6.4. Зависимость потенциала анода
от плотности тока при электрополиро-
ваиии меди в фосфорной кислоте при
температуре электролита 30 °C и плотно-
сти растворов (г/см8):
t — 1.ББ; 1 — 1,52; 3 — 1.40; 4 — I.3D: В —
1,20; 6 — 1,10
62
личной концентрации. Горизонтальный участок наиболее резко
выражен в концентрированных растворах. При разбавлении
кислоты горизонтальные участки сужаются. С повышением тем-
пературы возрастают значения плотности тока, которым соответ-
ствуют горизонтальные участки кривых анодной поляризации.
Перемешивание электролита оказывает такое же влияние на плот-
ность тока, как и повышение температуры.
Электролиты, пригодные для электрополирования, должны
удовлетворять следующим требованиям: обеспечивать образова-
ние вязкой пленки на поверхности деталей; иметь длительный
срок службы; не оказывать разрушающего действия на полируе-
мый металл при отсутствии тока; обладать широким рабочим
интервалом, причем применяемая плотность тока, напряжение
и температура не должны быть чрезмерно высокими.
Наибольшее распространение в качестве электролита для
электрополирования получили фосфорная, серная и хромовая
кислоты с добавками и без них.
В электролит часто вводят глицерин, метилцеллюлозу для
повышения вязкости растворов и ингибиторы травления для пре-
дотвращения разъедающего действия электролита на поверхность
полируемых деталей. В большинстве случаев применяют концен-
трированные растворы, вода обычно вводится для некоторого по-
вышения электропроводности и снижения напряжения.
Влияние введения ионов шестивалентного хрома при электро-
полировании меди на ход поляризационной кривой показано
на рис. 6.5. Введение этих ионов приводит к повышению предель-
ного тока и смещению потенциала меди в сторону положительных
значений. Предполагают, что в растворах, содержащих окисли-
тель, например хроматы, он принимает участие в формировании
оксидной пассивирующей пленви, тормозящей процесс травления,
и облегчает ее образование.
Добавление в электролит органических ПАВ оказывает также
положительное влияние на процесс электрополирования: введение
ПАВ (1—1,5 г/л) позволяет снизить плотность тока, расход элек-
троэнергии и температуру электролита. Кроме того, появляется
возможность полировать труднополируемые (полуферритные)
марки стали.
Предполагается, что ПАВ оказывают влияние на формирова-
ние адсорбционных пленок на поверхности стали. Возможно, что
63
ПАВ образует на поверхности коррозионно-стойкой стали фазо-
вые пленки комплексов ионов металлов с ионами ПАВ.
Для электрохимического полирования хрома, хромистых и
хромоникелевых сталей в растворы фосфорной и серной кислот
вводят ингибиторы травления: сульфоуреид, триэтаноламин и др.
Применение ингибиторов коррозии способствует улучшению ан-
тикоррозионных свойств металла и позволяет вести электролиз
при более низких плотностях тока. Таким образом, введение
в растворы кислот окислителей и органических соединений благо-
приятно сказывается на качестве поверхности металла.
Химическое полирование. Наряду с электрохимическим спо-
собом полирования металлов и сплавов находит применение и хи-
мический способ. Механизмы электрохимического и химического
способов полирования имеют много общего. По-видимому, и здесь
возникновение блеска связано с наличием на поверхности тонкой
пленки, предотвращающей или тормозящей травящее действие
раствора на металл в углублениях.
Преимущественное растворение выступов достигается как за
счет их повышенной химической активности, так и вследствие
большей скорости диффузии ионов металла от выступов в элек-
тролит и свежего электролита к выступам.
Сравнительная характеристика процессов электрохимического
и химического полирования. Наибольшее распространение полу-
чил процесс электрохимического полирования таких материалов,
как коррозионно-стойкая сталь, медные и алюминиевые сплавы,
механическое полирование которых затруднительно. Целесооб-
разно электрохимическое полирование деталей сложной конфи-
гурации, а также деталей до и после нанесения покрытий. Широко
применяется электрополирование никелированных и серебряных
деталей.
Основными преимуществами процесса электрохимического по-
лирования являются высокая производительность, поскольку
процесс не зависит от площади деталей; хорошее сцепление галь-
ванических покрытий с электрополированной поверхностью; вы-
сокая коррозионная стойкость электрополированных деталей;
возможность включить процесс в поточную линию и автоматизи-
ровать операции электрополировки; возможность исключить опе-
рации последующего обезжиривания; возможность улучшить
условия труда,, так как отпадает необходимость механического
полирования.
К недостаткам процесса электрохимического полирования
относятся необходимость в частой смене электролитов; отсутствие
универсального электролита для различных металлов; необхо-
димость предварительной механической подготовки поверхности
деталей; повышенный расход электроэнергии.
Преимущество химического полирования перед электрохими-
ческим полированием заключается в том, что оно не требует при-
менения источников постоянного тока и контактирующих при-
64
способлений. При химическом способе можно полировать детали
сложной конфигурации и больших размеров.
К недостаткам данного способа относятся меньший блеск по
сравнению с блеском, получаемым при электрохимическом поли-
ровании, а также то, что применяемые растворы сравнительно
недолговечны и во время работы выделяется значительное коли-
чество агрессивных газов.
ГЛАВА 7. ЭЛЕКТРОХИМИЧЕСКОЕ И ХИМИЧЕСКОЕ
ПОЛИРОВАНИЕ СТАЛИ, МЕДИ, НИКЕЛЯ
И АЛЮМИНИЯ
Большинство электролитов для электрохимического по-
лирования стали основаны на смесях растворов ортофосфорной
и серной кислот с добавкой хромового ангидрида (табл. 7.1).
При полировании коррозионно-стойкой аустенитной стали марки
12Х18Н9Т присутствие ионов шестивалентного хрома не является
обязательным.
Электролит 1 является универсальным, электролиты 2 и 3
предназначены для полирования коррозионно-стойкой стали
12Х18Н9Т. Электролиты, содержащие ПАВ, имеют большую
работоспособность, съем металла в них происходит интенсивнее,
электролиты не требуют проработки, корректировка их проста.
Химическое полирование стали не находит такого широкого
применения, как электрохимическое, хотя отличается большой
простотой, и поэтому в некоторых случаях имеет неоспоримые
преимущества.
Состав растворов для химического полирования и режим ра-
боты указаны в табл. 7.2.
Для электрохимического полирования меди и ее сплавов при-
меняют концентрированные растворы ортофосфоной кислоты и
7.1. Состав (г/л) электролитов и режим работы
при электрохимическом полировании стали
Компоненты электролита н режим работы Номер электролита
1 2 3
Н2РО< 500—1100 950—1050 730—900
h2so4 250—550 150—300 580—725
CrOs 30—80 — —
Триэтаноламин — — 4—6
Катапии БПВ — — 0,5—1,0
t, °C 60—80 60—80 60—80
i, А/дм1 15—80 10—100 20—50
т, мин 1—10 1—5 3—5
3 Дасоян М. А. и др.
65
7.2. Состав (г/л) растворов и режим работы
при химическом полировании стали
Сталь Компонента раствора Концентра- дня, г/л Режим полирования
t, °C Т, мнн
Углеродистая н8ро4 Н3РОЭ СгО3 Na2O-SiOa КМпО4 NaCl 1 0,2 10 2 2 4 100—105 2—5
Коррозионно-стойкая марок 12Х18М9Т, 12X17 и др. H2SO4 HNO3 НС1 Краситель 2JK 350—430 35—40 20—40 20—25 65—75 2—10
смесь ее с хромовым ангидридом. Для повышения блеска поверх-
ности меди в электролиты добавляют ПАВ (маннит, этиленгли-
коль, сульфопонат и др.) и ингибиторы травления (полиэтилен-
полиамин, триэтаноламин, моноэтаноламин и др.).
Рекомендуемый состав электролита: Н8РО4 (850—900 г/л) и
СгО8 (100—150 г/л). Режим работы: t = 304-40 °C; i = 204-
4-50 А/дма; <t = 0,54-5 мин.
Фосфатный электролит без добавок практически не исполь-
зуется из-за трудностей регулирования процесса, так как полиро-
вание происходит в режиме предельного тока. Добавка ионов
шестивалентного хрома способствует получению более блестящих
покрытий и улучшению качества полирования. Недостатками
этого электролита являются повышенный съем металла и умень-
шение сглаживания микрошероховатостей, необходимость окис-
лять накапливающиеся ионы трехвалентного хрома. Катодами
при этом служат медь, свинец.
Этих недостатков лишены электролиты с добавками органиче-
ских соединений: ингибиторов и ПАВ. Применение этих веществ
способствует уменьшению съема металла, предотвращению трав-
ления, повышению блеска и сглаживанию микрошероховатостей.
Для химического полирования применяют растворы, содержа-
щие фосфорную, азотную и уксусную кислоты (г/л):
HSPO4 ................................ 935—950
HNOS.................................. 280—290
СН4СООН (ледяная)..................... 280—200
Температура — 15—30 ‘’С, продолжительность полирования
4—6 мин.
Ванны для электрохимического полирования меди и медных
сплавов нужно время от времени очищать от губчатой меди, па-
дающей с катодов. *
66
Электрохимическое полирование никеля ведут в простом по
составу сульфатном электролите, содержащем 1000—1100 г/л
H2SO4. Режим работы: ia = 204-40 А/дм2, t = 204-30 °C, напря-
жение U = 104-15 В. Продолжительность полирования 0,5—
2 мин. При накоплении в растворе 80—90 г/л сульфата никеля
производят смену электролита.
Электрохимическое полирование можно проводить также в рас-
творах серной кислоты (1750 г/л), содержащих хромовый анги-
дрид (30 г/л) и глицерин (15 г/л), которые оказывают положитель-
ное действие на качество полирования. Плотность электролита
при этом составляет 1,6—1,62 г/см8, анодная плотность тока —
25—30 А/дм2, температура — 20—35 °C, напряжение—12—15 В,
продолжительность полирования — 30—45 с.
Электрополированные никелированные детали перед хромиро-
ванием должны быть проактивированы в 5 %-ной соляной кислоте.
Для химического полирования никеля рекомендуются рас-
творы следующих составов и режима работы:
Раствор 1 Раствор 2
HNOS (1,4 г/см8), г/л................ 420 300 см®
H2SO4 (1,84 г/см8), г/л.............. 180 —
НС1 (1,19 г/см8), г/л.................. — 5 см®
Н8РО4 (1,7 г/см8), г/л .............. 170 —
5 СНзСООН (ледяная), г/л................. 500 700 см®
t, °C................................ 80—90 75—80
т, мин............................ До 2,0 0,5—1
Электрохимическое полирование алюминия и его сплавов про-
исходит в том случае, если скорость растворения оксидной пленки
на их поверхности превышает скорость ее образования.
Электрохимическое полирование алюминия и его сплавов
можно вести как в кислых, так и в щелочных электролитах. Наи-
большее распространение среди кислых электролитов получили
трехкомпонентные фосфатносульфохроматные электролиты, при-
годные для полирования не только алюминия, но и большинства
его деформируемых сплавов.
При обработке в смеси фосфатной и серной кислот поверхность
анода частично покрывается пленкой фосфатов и частично растрав-
ливается. Введение в электролит СгО8 приводит к прекращению
травления и повышению блеска поверхности металла.
Введение серной кислоты способствует увеличению электро-
проводности электролита, поддержанию плотности тока на не-
обходимом уровне и предотвращению коррозии поверхности.
Состав электролита (г/л) и режим работы следующие:
Н8РО4 ................ 730—900 t, °C....................60—80
H2SO4 ................ 580—725 i, А/дм?................10—50
Триэтаноламин......... 4—6 Т, мин..................3—5
Каталин БПВ...........0,5—1,0
Для приготовления электролита необходимое количество хро-
мового ангидрида растворяют в минимальном количестве воды и
3* • 67
7.3. Состав (г/л) растворов и режимы работы
химического полирования алюминия и его сплавов
Компоненты раствора и режим работы Номер раствора
1 2 3 4
Н3РО4 1300—1400 1500—1600 1500—1600 840—860
H2SO4 200—250 — —- —~
HNOg 110—150 60—80 — ’ —
Na-карбоксиметил- 0,8 — — —
целлюлоза
NH4NOs —- — 85—100 .—
(СООН)а-2НаО —II— — — 45—55
t, °C 100—110 65—75 95—100 60—80
т, мин 2,5-4,0 До 5 До 5 До 1
декантируют в рабочую ванну. Затем туда же вливают ортофос-
форную кислоту. В охлажденный раствор осторожно, непрерывно
помешивая, добавляют серную кислоту. Электролит нагревают
при температуре 100—ПО °C и выдерживают при этой температуре
до тех пор, пока плотность его не достигнет требуемой величины.
Охлажденный свежеприготовленный электролит прорабатывают
в течение 1—2 ч с алюминиевыми электродами.
В процессе работы электролита происходят восстановление
шестивалентного хрома и накопление алюминия в ванне. Пре-
дельно допустимое содержание алюминия в растворе составляет
примерно 40 г/л; при большем содержании электролит частично
или полностью заменяется новым. Трехвалентный хром, накопив-
шийся в электролите, окисляют в шестивалентный.
Корректирование электролита осуществляют добавлением воды
до требуемой плотности, прибавлением необходимых кислот, а
также окислением трехвалентного хрома.
Для полирования сплавов алюминия с высоким содержанием
кремния применяют электролит на основе фтористоводородной
кислоты и глицерина, масс, доли!
HF ...................................0,13
Глицерин .............................0,54
Вода .................................0,33
Режим работы электролита следующий: температура 20—25 °C,
плотность тока 20 А/дм2, продолжительность работы 10—15 мин.
Щелочные электролиты содержат в качестве компонентов
тринатрийфосфат NasPO4, кальцинированную соду Na2COs, едкий
натр NaOH и алюмокалиевые квасцы KAl(SO4)a.
Щелочные электролиты дешевле, но в этих электролитах
нельзя полировать сплавы алюминия с большим количеством
легирующих добавок. Кроме того, коэффициент зеркального
отражения получающейся поверхности несколько ниже.
Состав (г/л) применяемых электролитов и режим работы сле-
дующие:
68
NasPO4-12H2O.......................
Na2COs-10H2O.......................
NaOH...............................
KA1(SO4)2-12H2O....................
t, °C..............................
i, А/дм2...........................
T, мин.............................
Раствор 1 Раствор 2
150—200 320—350 230—250
10—20 .—
40—60 2
65—90 80—85
2—4 26
5-13 10—20
л, Катоды изготовляются из коррозионно-стойкой стали.
Для химического полирования алюминия применяют растворы
на основе фосфорной кислоты с добавками (табл. 7.3).
Электролит 1 применяется для полирования алюминия высо-
кой чистоты и сплавов марок АМг5, электролиты 2 и 3 — для
полирования алюминия марок АМг, электролит 4 — для полиро-
вания алюминия и деформируемых сплавов марок АД1, АМг, АМц.
РАЗДЕЛ IV
МЕХАНИЗМ ОБРАЗОВАНИЯ
ЭЛЕКТРОЛИТИЧЕСКИХ ПОКРЫТИЙ
ГЛАВА 8. СТРУКТУРА ЭЛЕКТРОЛИТИЧЕСКИХ
ПОКРЫТИЙ
§ 8.1. ОБЩИЕ СВЕДЕНИЯ
Химические реакции, протекающие за счет электриче-
ской энергии, называются электрохимическими. Взаимное пре-
вращение химической и электрической форм энергии совершается
только в электрохимических системах. Электрохимическая си-
стема, в которой протекает электрохимический процесс, состоит
из электролита, который представляет собой водный токопрово-
дящий раствор одного или нескольких веществ; из металличе-
ских электродов, находящихся в электролите и обеспечивающих
обмен электронами с участниками реакции; из проводников
I рода, которые соединяют электроды с источником постоянного
тока.
Электрохимическая система может находиться в равновесном
и неравновесном состоянии. В равновесном состоянии между
электродом и электролитом образуется двойной электрический
слой, в котором электродная реакция
Мп+ + пё=₽*:М (8.1)
протекает с одинаковой скоростью в обоих направлениях. Так как
во всех электрохимических реакциях принимают участие заря-
женные частицы, то частота их перехода через границу электрод—
электролит эквивалентна некоторому току. При этом значения
-> -4-
силы тока в прямом и обратном направлениях i = i — i0, где
-* ч-
i и i — токи, отвечающие анодному и катодному процессам,
а 10 — ток обмена, который равен по абсолютной величине и ха-
рактеризует собой скорость обмена ионами на границе электрод—
электролит в условиях равновесия.
Равенство скоростей электродной реакции в прямом и обратном
направлениях приводит к тому, что никаких изменений на элек-
тродах и в электролите не происходит. Потенциал электрода по
70
отношению к раствору в этих условиях называется равновесным
и может быть определен по формуле Нернста
Ер = £° + -^- In a, (8.2J
где Е° — нормальный электродный потенциал, В; R — газовая
постоянная; Т — абсолютная температура; а — активность ка-
тионов в растворе электролита; F — число Фарадея; п — валент-
ность катиона.
Как видно из уравнения (8.2), электродный потенциал зависит
от активности (концентрации) ионов в растворе, их валентности
и температуры. Если в уравнение подставить соответствующие
величины и перейти от натурального логарифма к десятичному,
то при 25 °C получим следующее выражение для определения
электродного потенциала:
с со । о оло 8,314-298 с । 0,059 -/о
£Р = Е + 2>303 п 96 500 й = Е + -ГТ" С’ М
где R = 8,314 Дж/(кмоль-К); Т = 273 + 25 = 298 К; F =
= 96 500 Кл.
В неравновесной системе электрохимические процессы про-
текают в заданном направлении за счет внешней электрической
энергии. На поверхности положительного электрода протекает
реакция электрохимического окисления. На электроде, подклю-
ченном к отрицательному источнику постоянного тока, происхо-
дит присоединение электронов, т. е. реакция электрохимического
восстановления. В результате преимущественного протекания
электродной реакции в одном направлении токи прямой и обрат-
ной реакции не равны между собой. На катоде i £> i, а на аноде
-4- , ->
i < i.
Потенциал электрода под током отличается от равновесного
электродного потенциала, потому что зависит не только от при-
роды системы, ее температуры и давления, но и от силы тока,
проходящего через электролит.
Количественная связь между прошедшим через границу элек-
трод—электролит электричеством и количеством образующегося
или расходуемого вещества определяется законами Фарадея.
Первый закон Фарадея гласит, что масса прореагировавшего
при электролизе вещества пропорциональна количеству про-
шедшего через раствор электричества»
m = cQ — clt, (8.4)
где Q —• количество электричества; о — электрохимический экви-
валент; I — сила тока; t — время.
Коэффициент пропорциональности называется электрохими-
ческим эквивалентом и представляет собой массу вещества, реа-
гирующего при пропускании единицы количества электричества.
Игё
8.1. Химические и электрохимические эквиваленты металлов
Элемент Хими- ческое обозна- чение Атомная масса Валент- ность Хими- ческий экви- валент Электро- химический эквивалент Плот- ность. г/см8
м/Кл г/(А-ч)
Железо Fe 55,85 3 18,61 0,193 0,694 7,80
/ 3 65,73 0,681 2,452 1
Золото Au 197,20 1 1 197,20 2,043 7,357 } 19,50
Индий In 114,76 3 38,25 0,399 1,429
Кобальт Со 58,94 2 29,47 0,204 0,733 7,31
/ 63,57 2 31,78 0,329 1,186 8,50
t 63,57 1 63,57 0,658 2,372 8,90
Никель Ni 58,69 2 29,34 0,304 1,095 8,90
/ 4 29,67 0,307 1,107) 8,80
Олово Sn 118,70 I 2 59,35 0,615 2,214/ 7,30
Палладий Pd 106,7 2 53,35 0,551 1,99 11,90
/ 4 48,83 0,506 1,821 1
Платина Pt 195,23 I 2 97,65 1,012 3,642 / 21,45
Родий Rd 102,91 2 51,45 0,533 1,920 12,44
Свинец Pb 207,21 2 103,60 1,074 3,86 11,40
Серебро Ag 107,88 1 107,88 1,118 4,025 10,50
Хром Cr 52,01 6 8,66 0,090 0,323 6,50
Цинк Zn 65,38 2 32,69 0,339 1,22 7,00
За единицу количества электричества может быть принят
1 Кл = 1 А-с или IF = 26,8 А-ч = 96 500 Кл. Электрохимиче-
ские эквиваленты металлов и некоторые другие данные представ-
лены в табл. 8.1.
Согласно второму закону Фарадея, при прохождении постоян-
ного количества электричества массы прореагировавших веществ
относятся между собой как их химические эквиваленты:
ffii/Ai = ma/Aa = ms/As = const. (8.5)
Если Q — IF, то ffii = clt tn^ = ca и m8 — св. Тогда уравнение
примет вид
q/At = Са/Аа = c8/A8 = IF. (8.6)
Следовательно, для превращения 1 г-экв. любого вещества
необходимо пропустить через электролит количество электриче-
ства, равное 96 500 Кл.
На электродах при электролизе часто протекает несколько
процессов, один из которых является основным, а остальные —
побочными. Для определения количества электричества, израсхо-
дованного на основной процесс, введено понятие выхода по току
ВТ = тп/тт, (8.7)
где тп — практически прореагировавшая масса вещества; тт —
теоретическая масса вещества, которая должна была прореаги-
ровать в соответствии с законом Фарадея.
72
Выход по току показывает, насколько правильно и целесооб-
разно проводится основной электрохимический процесс. Выход
по току может быть представлен в виде отношения
ВТ = QJQa, (8.8)
где QT — количество электричества, расходуемое на основной
процесс, вычисленное по закону Фарадея; Qn—практически из-
расходованное количество электричества.
Катодный выход по току (%) для наиболее распространенных
гальванических процессов:
Золочение.................. 90
Кадмирование..............85—95
Меднение:
цианидный электролит. . . 40—75
кислый » ... 95—100
Никелирование..............90—100
Свинцевание................90—-100
Серебрение ................ 95—100
Хромирование:
блестящее................8—12
твердое .................12—28
Цинкование:
цианидный электролит. . . 75—95
кислый » ... 95—100
цинкатный » ... 85—100
Скорость электрохимической реакции определяется массой
прореагировавшего вещества в единицу времени. Так как между
массой прореагировавшего вещества и количеством прошедшего
электричества существует прямопропорциональная зависимость,
то можно считать, что скорость электрохимической реакции про-
порциональна силе тока. В гальванотехнике принято относить
скорость электрохимической реакции к единице поверхности и
называть ее плотностью тока [А/см2 (дм2, м2) ]. Различают катодную
и анодную плотность тока:
iK — I/SK;
= I/S&,
(8-9)
(8.10)
где S„ и Sa — площадь катода или анода, дм2; I — сила тока,
проходящего через электролит, А.
В ряде случаев важно знать объемную плотность тока, которая
определяется из выражения
/об = HV, (8.11)
где I — сила тока, А; V — объем электролита, л.
Если анод отделен от катода пористой перегородкой, то раз-
личают плотность тока в катодном пространстве (католите) и
анодном пространстве (анолите) и тогда
= Z/V«; (8.12)
4 = Ж, (8.13)
где VK и Va — объем католита и анолита соответственно.
73
§ 8.2. УСЛОВИЯ ОБРАЗОВАНИЯ
ЭЛЕКТРОХИМИЧЕСКИХ ПОКРЫТИЙ
Электродные процессы при электрохимическом осажде-
нии металлов на первый взгляд кажутся простыми. На аноде
протекает растворение металла
Мп+—• пё -* М, (8.14)
а на катоде в результате разряда катионов образуются атомы
металлов покрытия:
Мп+ 4- пё -> М. (8.15)
На самом деле механизм электродных процессов весьма сложен
и его исследование является сложной проблемой. Катодные и
анодные процессы протекают ступенчато и состоят из нескольких
стадий. Кроме того, следует учитывать, что в водных растворах
находятся дипольные молекулы воды, в которых центры положи-
тельного и отрицательного зарядов не совпадают. Катионы ме-
таллов, которые находятся в растворе, притягивают к себе про-
тивоположно заряженный полюс и отталкивают одноименный.
Поэтому каждый катион металла окружен оболочкой молекул
воды.
На первой стадии катионы мигрируют к катоду и вместе с ги-
дратной оболочкой достигают ее поверхности. Здесь они частично
теряют часть гидратной оболочки и вступают в контакт с поверх-
ностью катода, адсорбируясь на ней. На следующей стадии элек-
троны покидают катод и присоединяются к электронной оболочке
катиона, превращая его в нейтральный атом металла, который
в момент своего возникновения адсорбируется на катоде.
На этом катодный процесс не заканчивается, так как его
конечным продуктом является не атом, а кристалл металла и об-
разовавшиеся атомы либо образуют новый кристалл, либо спо-
собствуют росту уже образовавшихся на поверхности кристаллов.
Скорость электродной реакции в целом определяется стадией,
которая протекает с наименьшей скоростью. Любое торможение
одной или нескольких стадий вызывает поляризацию (перенапря-
жение) катода, и его потенциал сдвигается в отрицательную
• сторону:
т] = Ер - Et, (8.16)
где Et — потенциал поляризации, В; Ер — равновесный потен-
циал, В.
Между катодной поляризацией (перенапряжением) и структу-
рой осадков существует определенная связь. Многочисленными
исследованиями подтверждено, что чем выше электродная поля-
ризация, тем меньше величина зерна. Поэтому все факторы, уве-
личивающие поляризацию, благоприятно сказываются на струк-
туре покрытий.
%
В зависимости от природы электродных процессов различают
следующие виды перенапряжений: диффузионное, переходное,
реакционное, кристаллизационное и др.
Диффузионное перенапряжение (поляризация) т)д возникает
из-за снижения концентрации потенциалоопределяющих компо-
нентов в двойном электрическом слое вследствие замедленной
диффузии. Диффузионная поляризация может быть вычислена
по уравнению Нернста для концентрационных цепей
<817>
где сх — концентрация потенциалоопределяющих ионов в прика-
тодном слое; с0 — концентрация тех же ионов вдали от электрода;
п — их валентность; R — газовая постоянная; Т — абсолютная
температура; F — число Фарадея. Так как
Ci = со (1 — i7Zd), (8.18)
где i — плотность тока, поляризующего электрод; id = Кс0 —
плотность предельного тока диффузии исходных веществ к элек-
троду; /С — константа, подставляя значение (4.17) в (4.18),
получим
гг)' <8|9>
Из уравнения (8.19) следует, что перемешивание электролита,
повышение температуры и прочие факторы, облегчающие подачу
веществ к катоду, повышают поляризацию.
Химическое (реакционное) перенапряжение (поляризация) т]г
возникает за счет замедления отдельных этапов катодной реакции.
Химическое перенапряжение тесно связано с диффузионной по-
ляризацией, поэтому их часто объединяют и называют концен-
трационным перенапряжением!
Т)с = Уд + Dr- (8-20)
Переход ионов через двойной слой также может вызвать тормо-
жение электродной реакции. Освобождение ионов от гидратной
оболочки или от комплексообразующих лигандов вызывает так
называемое переходное перенапряжение т]п, которое определяется
по формуле Тафеля
Tin = а + blog 1, (8.21)
где i — плотность тока, А/дма; а и Ь — константы, определяемые
опытным путем.
И, наконец, адсорбция ионов на катоде с последующим вступ-
лением в кристаллическую решетку может быть причиной кри-
сталлизационного перенапряжения т]к, которое зависит прежде
всего от тока обмена.
75
Взаимосвязь между кристаллизационным перенапряжением,
током обмена и величиной зерна хорошо видна при осаждении
металлов из растворов простых солей, так как в этом случае дру-
гие виды поляризации незначительны.
Все металлы в зависимости от величины кристаллизационного
перенапряжения могут быть разбиты на три группы: 1) серебро,
кадмий, олово и др.; 2) висмут, медь, цинк; 3) кобальт, железо,
никель.
Серебро, кадмий, олово и другие металлы, имеющие большие
токи обмена (t = 10-1-=-10-2 А/см2), осаждаются с очень малым
перенапряжением, порядка несколько милливольт. При плотно-
стях тока, применяемых в гальванотехнике, образуются грубо-
кристаллические покрытия с зернами, линейные размеры которых
достигают десятков микрометров.
Висмут, медь, цинк имеют более удовлетворительные осадки.
Величина зерна у них 10-3—10-4 см. Токи обмена намного меньше
(i = 10~44-10~б А/см2), а перенапряжение равно 10-2 В.
Кобальт, железо, никаль осаждаются в виде мелких кристал-
лов величиной 10“Б—10-в см. Токи обмена у них очень малы
(i = 10-8 4- 10“® А/см2). Перенапряжение достигает 1СГ1 В.
Кристаллизационное перенапряжение зависит от природы
металла и обратно пропорционально току обмена.
Общее перенапряжение электродного процесса выражается
следующим образом:
П = По + Пп + Пк- (8.22)
Следовательно, электролитическое осаждение металла на ка-
тоде протекает при сдвиге потенциала катода относительно рав-
новесного потенциала в сторону отрицательных значений.
§ 8.3. МЕХАНИЗМ ОБРАЗОВАНИЯ
ЭЛЕКТРОХИМИЧЕСКИХ ПОКРЫТИЙ
Гальванические покрытия имеют четко выраженную
кристаллическую структуру, поэтому процесс катодного восста-
новления металлов называют электрокристаллизацией. Много-
численными исследованиями установлено, что чем плотнее и
мельче структура покрытия, тем выше их свойства.
Несмотря на специфичность условий, связанных с переходом
иона из раствора в кристаллическую решетку, образование и рост
кристаллов подчиняются общим законам, по которым происходит
образование твердой фазы из расплава или раствора.
Кинетика процесса электрокристаллизации характеризуется
двумя основными параметрами: скоростью образования центров
кристаллизации или кристаллических зародышей, возникающих
на единице поверхности в единице времени, и линейной ско-
ростью их роста.
76
Величина кристаллов зависит от соотношения этих скоростей.
В тех случаях, когда скорость образования новых центров кри-
сталлизации превышает скорость роста, образуется мелкокри-
сталлическая структура. При обратном соотношении скоростей
кристаллы вырастают до крупных размеров.
Фактором, определяющим скорость возникновения кристалли-
ческих зародышей при кристаллизации твердой фазы из раствора,
является степень пересыщения последнего, характеризуемая отно-
шением
Р = с/ся, (8.23)
где с — концентрация раствора, из которого идет кристаллизация;
сн — равновесная концентрация насыщенного раствора.
Чем больше р отличается от единицы, тем выше скорость об-
разования зародышей и тем мельче кристаллы. Для расплавов
роль пересыщения играет степень переохлаждения жидкой фазы.
Для случая катодного выделения металла за степень пересыщения
может быть принята величина, пропорциональная плотности
токаз
Р = Шо, (8.24)
где i — плотность тока, при которой ведется осаждение; i0 —
ток обмена.
Так как ток обмена зависит от природы металла, то при одной
и той же плотности тока металлы с малым током обмена образуют
мелкокристаллические покрытия, а металлы с большим током
обмена в тех же условиях осаждаются в виде отдельных крупных
кристаллов. Для одного и того же металла увеличение плотности
тока приводит к уменьшению размеров кристаллов.
Ток обмена в неявном виде входит в уравнение Тафеля, опре-
деляя значения коэффициента а, поэтому между коэффициентом
и поляризацией катода имеется определенная связь. Многочис-
ленные исследования подтверяодают, что мелкокристаллические
покрытия образуются в условиях значительной катодной поля-
ризации, т. е. при увеличении коэффициента р. В тех случаях,
когда поляризация мала, осадки, как правило, имеют крупно-
кристаллическую структуру.
Процесс возникновения кристалла начинается с создания за-
родыша критической величины. В связи с тем что поверхность
катода, соприкасающаяся с раствором, находится в пассивном
состоянии, создание первых критических зародышей происходит
при некотором начальном перенапряжении. Дальнейший рост не
требует дополнительной поляризации, и перенапряжение сни-
жается до устойчивой величины.
Всякое кристаллическое тело состоит из многих кристалликов,
которые называются кристаллитами, или зернами с линейными
размерами 10-5—10~® см. Каждое зерно — кристаллит — это кри-
Рис. 8.1. Схема роста двумерного зародыша
сталл, имеющий неправильную форму, так как его росту пре-
пятствуют соседние кристаллы.
Различают одномерный зародыш, который представляет собой
цепочку атомов, двумерный зародыш — островок атомов и, на-
конец, трехмерный зародыш — кристаллик. Атомы, попадающие
на поверхность катода, могут быть встроены в кристаллическую
решетку только в местах роста. На атомарно гладкой поверхности
катода таких мест нет. Однако если в результате флуктуации
возникает двумерный зародыш, то около его краев возникнут
места роста и атомы, которые адсорбируются около него и будут
встроены в кристаллическую решетку.
На рис. 8.1 схематически показана поверхность кристалла
с простой кубической решеткой. На плоскости решетки образу-
ются и растут новые плоскости. Цифрами обозначены участки,
где рост кристалла наиболее вероятен.
Наибольший выигрыш энергии получается, если пристройка
произойдет на участке 1, так как атом будет иметь наибольшее
количество «соседей» по сравнению с другими возможными ва-
риантами. Место, которое занимает этот атом, получило название
«повторимого шага», так как таких мест большинство.
Каждая ступенька атомов будет перемещаться ряд за рядом
до тех пор, пока атомный ряд не достигнет границы растущей
плоскости решетки. Поэтому элементарный процесс кристаллиза-
ции называют ступенчатым ростом.
Несколько меньшая энергия освобождается тогда, когда атом
находится в положении 2 около плоскости кристалла, давая тем
самым начало новому ряду атомов, который затем будет ступен-
чато расти. Еще меньше энергетическая выгода от продолжения
роста одиночного ряда атомов на границе кристаллической пло-
скости (положение 3). Когда рост плоскости решетки закончен,
новые атомы будут осаждаться только на ней, т. е. начнется по-
строение новой плоскости. Наиболее благоприятное положение
для развития зародыша новой плоскости будет на середине пло-
скости, например на месте 4, наименее благоприятны места 5 и 6.
Как только на новой плоскости появится зародыш, начнется по-
строение новой плоскости путем присоединения атомов в местах 1,
78
Рис. 8.2. Последовательные стадии образования винтовой дислокации
2 и 3. Построение новой плоскости решетки может начаться и до
окончания постройки нижележащей плоскости, в таком случае
рост кристалла становится нерегулярным.
Изображенная здесь картина роста кристалла чрезвычайно
упрощена. При микроскопическом наблюдении за ростом кри-
сталла на катоде обнаруживается, что в первый момент форма
кристалла оказывается предельно простой и правильной, т. е.
развитие граней происходит путем периодического распростране-
ния слоев, возникающих чаще всего у ребра. Толщина и скорость
распространения слоя зависят от концентрации ионов, подверга-
ющихся разряду, наличия поверхностно-активных веществ, ре-
жима работы и других условий электролиза.
Однако по мере увеличения размеров кристаллов происходит
искажение их формы, так как даже при соблюдении самых тща-
тельных предосторожностей кристалл всегда содержит значитель-
ное число дислокаций—дефектов структуры, образующихся за счет
сдвига одной группы атомов по отношению к другой. Плотность
дислокаций достигает 1011—1012 см-2.
Взаимодействуя друг с другом, дислокации могут быть при-
чиной возникновения уступов, петель, краевых и винтовых ди-
слокаций. На рис. 8.2 показаны последовательные стадии обра-
зования ступени вокруг точки выхода на поверхность кристалла
винтовой дислокации. В начальный момент времени ступень О А
прямолинейна. В процессе роста ступень начинает двигаться
вправо. Форма ступени будет меняться до тех пор, пока она не
превратится в спираль.
На рис. 8.3 приведена микрофотография спирального роста
осадка серебра. Наличие винтовой дислокации резко снижает
уровень образования двумерного зародыша, и, если край винтовой
дислокации превышает высоту края двумерного зародыша, рост
кристалла будет происходить путем прямого присоединения атомов
к дислокационному выступу.
Дислокации способны адсорбировать инородные атомы, моле-
кулы, ионы, поверхностно-активные вещества, что заметно ска-
зывается на оптических, полупроводниковых и электропроводных
свойствах покрытий.
Физико-механические свойства покрытий зависят также от
текстуры металлического покрытия. Под текстурой понимают
преимущественную ориентацию кристаллов в одном или несколь-
ких направлениях. До возникновения текстуры металл состоит из
79
Рис. 8.3. Микрофотография спирального роста осадка серебра
Рис. 8.4. Текстура: а — ориентированная; б — неориентированная
кристаллитов (кристалликов), однотипно построенных, но по-
разному ориентированных в пространстве. При появлении тек-
стуры направление многих кристаллитов становится параллель-
ным некоторому направлению, которое называется осью тек-
стуры. Разница между текстурированным и нетекстурированным
металлами схематично представлена на рис. 8.4.
Особенно сильное влияние на характер текстуры оказывает
структура основы, на которую наносится покрытие. При осажде-
нии никеля на ряд металлов структура осадков как бы продол-
жает структуру основного металла. Это явление называется эпи-
таксией. При увеличении толщины покрытия одновременно с пер-
воначальной образуется дополнительная текстура, совершенство
которой возрастает с увеличением покрытия.
Перерывы при нанесении покрытий, наложение переменного
тока, промывка устраняют влияние подкладки. Ориентирующее
влияние структуры основного металла исчезает также при при-
менении высоких плотностей тока, когда в большом количестве
возникают беспорядочно ориентированные кристаллики или соз-
дается собственная ориентация осаждающего металла. Напри-
мер, при осаждении цинка на полированную латунную пластинку
сначала получается мелкокристаллический осадок с беспоря-
дочно расположенными кристалликами, а затем часть кристаллов
цинка, имеющих общую ось ориен-
тации, вырастает до значительной
величины (рис. 8.5).
Зависимость текстуры от усло-
вий электролиза весьма сложна.
Однако в определенных границах
каждый параметр электролиза
может оказывать сильное влия-
ние на текстуру. Физико-механи-
Рис. 8.5. Схема возникновения текстуры
при росте кристалла цинка: а — началь-
ная стадия — беспорядочная ориентация;
б — конечная стадия — упорядоченная
ориентация
80
ческие, электрохимические и другие свойства текстурированных
покрытий в значительной мере отличаются от свойств нетексту-
рированных покрытий. Более того, одни и те же покрытия могут
иметь различные свойства в зависимости от того, какие грани
кристаллов находятся на его поверхности, т. е. наличие текстуры
осадка придает анизотропию его свойствам.
Например, текстура ферромагнитных материалов способствует
резкому увеличению их коэрцитивной силы и электрической про-
водимости и повышает блеск покрытий. При анодном окислении
алюминия, меди, железа оксидные пленки, имеющие текстуру,
становятся более компактными и плотными.
В то же время нередки случаи, когда текстуру приходится
устранять специальной обработкой для получения изотропных
свойств поликристаллических покрытий. В связи с разнообраз-
ными требованиями, предъявляемыми в настоящее время к свой-
ствам покрытий, полученных электрохимическим путем, значение
текстуры становится очевидным.
§ 8.4. ВЛИЯНИЕ СОСТАВА ЭЛЕКТРОЛИТА
НА ЕГО СТРУКТУРУ
Основной компонент. Применяемые в гальванотехнике
электролиты условно подразделяются на простые и сложные.
В простом электролите основным компонентом является соль
неорганической кислоты, которая в водных растворах полностью
диссоциирует на ионы. В связи с этим процесс катодного восста-
новления ионов протекает при низкой катодной поляризации и
осадки имеют крупнокристаллическую структуру и низкую рас-
сеивающую способность. Уменьшение концентрации основного
компонента за счет разбавления раствора нецелесообразно, так
как предельный ток уменьшается и осадки становятся рыхлыми
(медь) или игольчатыми (свинец).
Повышение концентрации основного компонента позволяет
применять более высокие плотности тока, при этом укрупнение
структуры, связанное с увеличением концентрации простых ионов
металла, компенсируется противоположным действием плотности
тока.
Простые электролиты имеют высокий выход по току, который
тем больше, чем выше плотность тока. В основном они приме-
няются для нанесения покрытий на детали простой конфигурации
и на полуфабрикаты (ленты, листы, проволоку).
Основным компонентом сложных электролитов является ком-
плексная соль, которая получается в результате взаимодействия
исходных компонентов. Механизм восстановления металлов из
растворов комплексных солей был предметом многочисленных
исследований. В настоящее время имеются две принципиально
разные точки зрения.
Первая заключается в том, что катодное восстановление
металлов происходит за счет разряда простых ионов металла;
КМ (CN)2 К+ + М (CN)2i
М (CN)a Г + 2CN-J
М+ + ё -> М.
Согласно другой точке зрения, катодное восстановление сво-
дится к непосредственному разряду комплексных ионов:
КМ (CN)2 К+ + М (CN)2;
s М (CN)i + ё -> М + 2CN-.
Независимо от точки зрения разряд ионов металла протекает
при значительной поляризации, которая тем больше, чем меньше
константа нестойкости, являющаяся мерой устойчивости комплекс-
ных соединений:
Кн — CAf+C^N-/C[M (CN),]-, (8.25)
где См+, С&ы- и С'[Л1(СЬ1) j-— концентрации центрального
иона, адденда или лиганда (координационная группа, связанная
с центральным ионом) и недиссоциированного комплекса.
Появление комплексов сказывается не только на величине по-
ляризации, но и на характере катодных осадков, которые оса-
ждаются гладкими, мелкозернистыми и равномерными. Поэтому
комплексные электролиты широко применяются в промышлен-
ности для получения покрытий на деталях сложного профиля.
Особо следует выделить осаждение металлов железной группы
(Fe, Со, Ni), восстановление которых протекает при высокой
катодной поляризации из растворов простых солей за счет ги-
дратации их ионов.
Для увеличения электропроводности в электролиты вводят
электропроводные добавки, которые не участвуют в катодном
процессе, но являются переносчиками электричества. В кислые
электролиты можно добавлять кислоты с одноименным анионом
основной соли, в щелочные электролиты — гидроксиды натрия
или калия, так как ионы натрия и калия не могут разряжаться
в водных растворах. В слабокислые, нейтральные и слабощелочные
электролиты вводят соли щелочных или щелочноземельных ме-
таллов, при этом электропроводные добавки не должны изме-
нять кислотность электролитов.
Буферные добавки. Так как многие электролиты работают
в определенном интервале pH раствора, то для его регулирования
вводят буферные добавки. Чаще всего применяют борную кис-
лоту, ацетат натрия, уксусную кислоту и т. п. Каждая буфер-
ная добавка применяется в определенном интервале pH.
Поверхностно-активные добавки. Большое влияние на струк-
туру осадка оказывают поверхностно-активные вещества (ПАВ)
82
и коллоиды. Накапливаясь на поверхности катода, они образуют
адсорбционный слой. Адсорбция зависит от многих факторов, и
в первую очередь от концентрации адсорбирующихся веществ,
заряда поверхности катода, температуры электролита и присут-
ствия на поверхности катода других веществ, помогающих или,
наоборот, мешающих адсорбции данного ПАВ.
Действие каждого ПАВ весьма специфично. При осаждении
они могут претерпевать ряд изменений, в результате которых
активное воздействие на процесс оказывают уже другие вещества.
В настоящее время нет единой теории, объясняющей механизм
действия ПАВ. Согласно теории комплексообразования, ПАВ
образуют с ионами металлов адсорбционные комплексы коллоид—
ион металла, при этом замедляется процесс осаждения и повыша-
ется катодная поляризация. Такая теория, вероятно, справед-
лива при большом количестве ПАВ. Однако в электролиты вводят
ПАВ в небольших количествах. И в этом случае предпочтение
следует отдать адсорбционной теории, согласно которой ПАВ
адсорбируются на отдельных участках катодов и тормозят их
рост. Так как при этом уменьшается поверхность катода, то про-
исходит возрастание плотности тока и, как следствие, повышение
поляризации. При этом активные участки катода периодически
перераспределяются. Склонность к адсорбции возрастает с увели-
чением молекулярного веса ПАВ, поэтому такие добавки отно-
сятся к классу высокомолекулярных соединений, многие из кото-
рых способны образовывать коллоидные и полуколлоидные рас-
творы, например столярный клей, желатин и др.
По строению молекулы ПАВ делятся на симметричные, пове-
дение которых не зависит от ориентации, и несимметричные.
Последние состоят из полярной гидрофильной части и неполяр-
ного гидрофобного радикала. По типу гидрофильных групп их
подразделяют на ионогенные и неионогенные. Ионогенные диссо-
циируют в воде на ионы, один из которых обладает адсорбционной
активностью, а другой — адсорбционно не активен. Если адсорб-
ционно активен анион, ПАВ называются анионными, если ка-
тион — катионными. К анионным относят мыла карбоновых
кислот, алкилсульфокислоты, алкиларсульфонаты и др. Катион-
ные ПАВ — амины, аммониевые основания и др. Неионогенные
ПАВ в отличие от ионогенных устойчивы в любой среде. Они
являются производными алифатических и ароматических аминов,
а также гетероциклических соединений.
При выборе ПАВ необходимо обратить особое внимание на
их биохимические свойства. Некоторые ПАВ способны, попадая
со сточными водами в водоемы, распадаться и обезвреживаться
естественным путем вследствие их окисления бактериями и дру-
гими микроорганизмами, такие ПАВ являются биологически мяг-
кими. Поверхностно-активные вещества, приводящие к загряз-
нению естественных водоемов, называются жесткими; к ним
относятся ОЦ-7, ОП-Ю, контакт Петрова и др. Биологически
83
мягкими ПАВ являются «Прогресс», сульфанол, ОС-20, синтанол,
синтамид и др.
Поверхность металла, погруженного в электролит, несет на
себе электрический заряд, отрицательный или положительный,
несмотря на то, что металл подвергается катодной поляризации.
Естественно, что частицы, имеющие заряд, противоположный по
знаку заряду металла, обладают повышенной адсорбцией. По-
этому катионные ПАВ адсорбируются легче на отрицательно
заряженной поверхности, а анионные — на положительной. Так,
например, для серебра, меди, кадмия, свинца и олова, у которых
в кислых электролитах поверхность заряжена положительно,
полезны анионные ПАВ, например сульфокислоты. Для цинка,
поверхность которого в кислом электролите заряжена отрица-
тельно, применяют катионные ПАВ — пиридин, амины и т. п.
Поверхностно-активные вещества не должны оказывать вред-
ного влияния на процесс осаждения, ухудшать механические
свойства покрытий, вызывать хрупкость; действие их должно быть
стабильным; они должны поддаваться контролю и легко корректи-
роваться.
Блескообразующие добавки. Среди поверхностно-активных до-
бавок большой интерес представляет группа веществ, в присут-
ствии которых удается получить блестящие осадки непосред-
ственно из гальванических ванн. Такие добавки, известные
также под названием блескообразователей, получили довольно
широкое распространение в гальванотехнике и особенно успешно
применяются в электролитах для никелирования, меднения и цин-
кования. К числу таких добавок относятся сульфированный наф-
талин, мочевина, желатина, тиокарбамид, декстрин, фенол, кре-
зол, нафтол, сульфид натрия, тиосульфат и др.
Благодаря применению электролитов, дающих блестящие по-
крытия, становятся ненужными вредные, дорогостоящие и трудно
механизируемые операции полирования и глянцевания обычных
покрытий, на проведение которых затрачивается много материала,
электроэнергии и рабочей силы.
Преимущества электролитов для нанесения блестящих покры-
тий особенно ощутимы при нанесении многослойных покрытий
медь—никель—хром, когда детали дважды демонтируются с под-
весок, отправляются на полирование, каждый раз снова проходят
операции обезжиривания и повторно монтируются на подвески.
При нанесении блестящих медного и никелевого покрытий не
только сокращается число технологических операций, но и от-
крываются перспективы для полной механизации и автоматиза-
ции всего процесса нанесения покрытия.
Благодаря внедрению электролитов для нанесения блестящих
покрытий достигается экономия цветных металлов, так как при
определении толщины обычных покрытий заранее исходят из
повышенной против требуемой толщины с учетом предполагаемых
потерь металла при полировании и глянцевании осадков. Вели-
84
чина таких потерь составляет до 20 % от общей массы осадков.
Кроме того, у блестящих осадков всегда повышенная твер-
дость и, следовательно, большая износоустойчивость. Это дает
возможность дополнительно уменьшить их толщину по сравнению
с осадками из обычных ванн, что имеет немаловажное значение
при нанесении покрытий из благородных металлов — серебра,
золота и др.
Для объяснения действия блескообразователей были пред-
ложены две гипотезы. Одна из них исходит из того, что блеско-
образователи настолько измельчают структуру осадка, что раз-
меры выступающих на поверхности покрытия граней и вершин
кристаллов не превышают длины полуволны падающего света.
Такая поверхность не рассеивает света — падающий луч испыты-
вает только зеркальное отражение. Вторая гипотеза сводится
к тому, что под действием добавок кристаллы растут строго упо-
рядоченно, в результате чего все они оказываются ориентированы
одной и той же кристаллографической гранью параллельно по-
верхности катода. Однако ни та, ни другая гипотезы эксперимен-
тально не подтвердились, и вопрос пока остается открытым.
Кроме блескообразователей в настоящее время вводят наряду
с ними выравнивающие и смачивающие добавки.
Депассиваторы. В большой части электролитов концентрация
ионов металла в известной степени поддерживается постоянной
за счет применения растворимых анодов. Их основным недостат-
ком является пассивация. При этом аноды покрываются пленкой
труднорастворимых солей и оксидов. Частичная или полная пас-
сивация уменьшает площадь анодов, вследствие чего анодная по-
ляризация увеличивается и на аноде начинает выделяться кис-
лород.
Для устранения пассивации в электролиты добавляют депас-
сиваторы — вещества, препятствующие образованию труднорас-
творимых соединений на поверхности анода. Например, при ни-
келировании вводят ионы С1~, при цианидном меднении — сегне-
тову соль или роданиды.
Современные электролиты очень чувствительны к примесям,
в частности к примесям солей посторонних металлов, поэтому
аноды должны быть изготовлены из металла высокой чистоты.
Ионы посторонних металлов ухудшают качество покрытий. Они
могут вызывать ухудшение механической прочности и, в частно-
сти, быть причиной хрупкости покрытий из-за выделения водо-
рода в присутствии посторонних катионов.
§ 8.5. ВЛИЯНИЕ РЕЖИМА ЭЛЕКТРОЛИЗА .
НА СТРУКТУРУ ЭЛЕКТРОЛИТА Л
Плотность тока. В современной гальванотехнике для
интенсификации процессов осаждения применяют концентриро-
ванные электролиты с различными добавками и ведут процесс
85
Рис. 8.6. Дендриты меди
при высоких плотностях тока, повышенной температуре и интен-
сивном перемешивании. Для каждого электролита необходимо под-
бирать оптимальный режим осаждения, при котором образуется
мелкокристаллическое покрытие.
Высокие плотности тока способствуют получению мелко-
кристаллических, компактных и равномерных покрытий, так как
образование кристаллических зародышей протекает более интен-
сивно не только на выступах, но и на гранях кристаллов. Напри-
мер, при плотности тока 0,75 А/дм2 олово из сульфатного элек-
тролита осаждается в виде отдельных кристаллов, а при увеличе-
нии плотности тока до 3 А/дм2 осадки олова получаются сплош-
ными и мелкозернистыми.
Кроме того, при повышении плотности тока происходит обед-
нение прикатодного пространства разряжающимися ионами, что,
в свою очередь, приводит к увеличению поляризации, способствуя
формированию мелкокристаллической структуры.
Чрезмерное повышение плотности тока недопустимо, так как
образуются осадки с шероховатой поверхностью, на которых
появляются дендриты (рис. 8.6), различные наросты и «пригары».
При достижении предельного тока, как правило, образуются
порошкообразные осадки.
Кроме того, при повышении плотности тока растворимые аноды
могут перейти в пассивное состояние и резко обеднить электролит
ионами осаждающихся металлов. Следует учитывать, что выход
по току нередко падает с повышением плотности тока.
Повысить предельную плотность тока, обеспечивающую полу-
чение гладких осадков при более высоких плотностях тока, можно
путем увеличения температуры и концентрации основного ком-
понента и создания принудительной циркуляции. При низких
плотностях тока получают неравномерные крупнокристаллические
осадки, при этом часто осаждение сопровождается выделением во-
дорода.
Таким образом, удовлетворительные осадки получаются в опре-
деленном, характерном для каждого электролита, интервале
86
плотностей тока. Чем шире ра-
бочий интервал плотностей тока,
тем равномернее осаждается по-
крытие. Особенно это важно при
нанесении покрытий на сложно-
профилированные поверхности.
Например, при золочении рабо-
чий интервал плотностей тока
0,1—0,3 А/дм2, а при хромирова-
нии — от 15 до 100 А/дм2.
Рис. 8.7. Кривая реверсирования
тока
Обычно электролиз начинают с так называемого «толчка»
тока. При этом рабочую плотность тока в течение первых 10—•
30 с повышают в 2—3 раза. Этот прием способствует образованию
большого числа равномерно распределенных по поверхности кри-
сталлов. С «толчка» тока начинают процесс хромирования. Про-
цессы цинкования, оловянирования, железнения в некоторых
электролитах также начинают при повышенных плотностях тока.
Эффективным способом интенсификации гальванического про-
цесса с одновременным улучшением качества покрытий является
применение источников тока, которые позволяют получать ток
различной формы: реверсированный, асимметричный, прерыви-
стый, импульсный и т. п.
Начиная со второй половины XX в., в гальванотехнике стали
применять реверсированный ток. Принцип реверсирования со-
стоит в том, что в процессе осаждения покрытий через короткие
промежутки времени на ванне автоматически изменяют поляр-
ность. На рис. 8.7 приведена кривая изменения полярности при
реверсировании тока. Отрезок ОВ соответствует продолжитель-
ности тока в прямом направлении, отрезок CD — продолжитель-
ности тока в обратном направлении. В это время изделия поляри-
зуются анодно, а аноды включены в качестве катодов. После пере-
мены полярности электродов цикл повторяется вновь.
Таким образом, реверсирование характеризуется следующими
параметрами: /к — сила тока прямого направления (катодная
поляризация); /а — сила тока обратного направления (анодная
поляризация); тк — время осаждения металла; та — время анод-
ной поляризации; Т — полный период реверсирования,
Т = + та. (8.26)
Количество электричества, протекающее через электролит во
время катодной поляризации, должно быть больше количества
электричества, протекающего во время анодной поляризации:
/л > I&t&. (8.27)
Следовательно, при этом способе только часть электричества
расходуется на процесс осаждения покрытий. За каждый полный
период реверсирования тока на поверхности наращивается слой
металла, который затем частично растворяется. При этом проис-
87
Рис. 8.8. Схема питания гальванической ванны асимметричным переменным
током:
2 — трансформатор; 2 — диоды; 3 — реостат; 4 — ваина
Рис. 8.9. Влияние температуры иа катодную поляризацию в медноцианидном
электролите:
] _ t с= 75 °C; 2 — / - 35 °C; 3 — t = 18 °C
ходит сглаживание рельефа за счет растворения острых высту-
пающих граней. Оптимальным соотношением tK : tB является
для различных видов покрытий 5 : 1 или 10 : 1. Периодичность
перемены поляризации составляет 5—-10 раз в минуту.
Электрополирующий эффект во время анодной обработки
позволяет повысить катодную плотность тока, так как во время
катодной поляризации выделяющийся водород разрушает пас-
сивную пленку на аноде.
Таким образом, реверсирование тока позволяет ускорить про-
цесс осаждения за счет возрастания предельного тока и тока пас-
сивирования при сохранении высокого выхода по току и обеспе-
чивает получение покрытий с более высокими защитными свой-
ствами.
Для получения ровных беспористых осадков можно наряду
с реверсированием рекомендовать применение асимметричного
переменного тока, характеризуемого различными амплитудами
прямого и обратного токов. Схема питания ванны асимметричным
переменным током приведена на рис. 8.8. Проходя через транс-
форматор, напряжение понижается до 12 В и при помощи диодов
делится на две ветви. При равенстве сопротивлений обеих ветвей
в гальваническую цепь поступает переменный ток частотой 50 Гц
и процессов осаждения и растворения не происходит. Регулируя
при помощи реостатов силу тока в обеих ветвях, можно подавать
на катод 80—90 % тока, остальной ток будет тратиться на анодное
растворение покрьГтия, т. е. на его сглаживание. Анодный про-
цесс будет происходить 50 раз в секунду, т. е. намного чаще, чем
при реверсировании, и покрытия будут получаться равномерными,
гладкими, без внутренних напряжений и питтинга.
Температура электролита. Повышение температуры позволяет
применять более концентрированные электролиты, так как воз-
88
растает растворимость исходных компонентов. Кроме того, уве-
личивается электропроводность электролита и уменьшается пас-
сивация анодов. Все эти факторы позволяют использовать более
высокие плотности тока. Однако повышение температуры влечет
за собой снижение катодного потенциала осаждения за счет уско-
рения процессов диссоциации и диффузии.
На рис. 8.9 показано влияние температуры на поляризацию
в медноцианидном электролите. При температуре 75 °C (кривая 1)
поляризация для всех плотностей тока резко уменьшается. Такое
же явление можно наблюдать и при осаждении никеля и железа.
При этом осадки при прочих неизменных условиях имеют крупно-
кристаллическую структуру.
Одновременное повышение плотности тока может сбаланси-
ровать негативное влияние температуры и привести к осаждению
мелкокристаллических покрытий. Поэтому многие электролиты
эксплуатируются при повышенных температурах, так как это
позволяет интенсифицировать процесс осаждения.
Перемешивание электролита. В процессе электроосаждения
прикатодный слой, обедненный ионами осаждаемого металла,
поднимается вверх, а прианодный слой, обогащенный этими
ионами, стекает вниз. В результате происходит расслоение элек-
тролита и условия осаждения по высоте ванны становятся неоди-
наковыми. Этот недостаток устраняют перемешиванием электро-
лита, при этом происходит выравнивание концентрации электро-
лита по всему объему ванны, уменьшение поляризации и, как
следствие, ухудшение структуры покрытий.
Плотные мелкокристаллические осадки можно получать при
одновременном повышении температуры и плотности тока, кото-
рая тем выше, чем интенсивнее перемешивание. Его осуществ-
ляют продуванием сжатого воздуха через электролит, периоди-
ческим качанием катодных штанг с подвесками при помощи
механических мешалок. Перемешивание необходимо сочетать
с непрерывной или периодической фильтрацией, чтобы нерас-
творимые частицы, увлеченные конвекционными потоками, не
осаждались на катоде, в противном случае образуются недоб-
рокачественные покрытия.
Цианидные и щелочные электролиты сжатым воздухом пере-
мешивать нельзя из-за образования карбонатов при взаимодей-
ствии углекислоты воздуха с компонентами раствора. Наиболее
эффективно перемешивание при применении проточных электро-
литов.
§ 8.6. ВЛИЯНИЕ ВОДОРОДА
НА СТРУКТУРУ ЭЛЕКТРОЛИТА
Процесс электрохимического восстановления металлов
чаще всего осложняется одновременным выделением водорода,
при этом снижается выход металла по току и ухудшаются механи-
Рис. 8.10. Поляризационные кривые с преимущественным
разрядом металла М и водорода Ня
ческие свойства покрытий. Суммарную электродную реакцию
выделения водорода в кислой и щелочной средах можно предста-
вить в следующем виде:
HSO + ё -* 0,5На + НаО; (8.28)
*г; НаО + ё -* 0,5На + ОН-. (8.29)
Разряд ионов водорода зависит от многих факторов: металла
катода, состава электролита, условий электролиза и т. п.
При осаждении покрытий в зависимости от перенапряжения
водорода могут иметь место следующие случаи:
1) на катоде выделяется металл со 100 %-ным выходом по
току, так как его потенциал выделения имеет более положитель-
ное значение;
2) на катоде выделяется лишь водород, так как его потенциал
выделения по сравнению с потенциалом выделения металла имеет
более положительное значение; по этой причине удается осаждать
из водных растворов такие металлы, как А1, Та, W и др.;
3) на катоде происходит совместное выделение металла и
водорода.
На рис. 8.10 представлены поляризационные кривые с преиму-
щественным разрядом металла (рис. 8.10, а) и водорода
(рис. 8.10, б). В первом случае при меньших плотностях тока
происходит выделение металла, при больших — водорода, во
втором случае — наоборот.
Как видно из приведенных примеров, осаждение покрытий
становится возможным тогда, когда возможно самостоятельное
или совместно с водородом вы-
деление металла. Выделяющийся
газообразный водород задержи-
вается на поверхности катода и
Рис. 8.11. Виды питтинга:
1 непрерывное скольжение пузырька во-
дорода; 2 — грушевидный пнттинг; .3 — сфе-
рический питтинг ..
препятствует осаждению в этих местах металла. Величина пу-
зырька водорода и время его нахождения на поверхности катода
определяют глубину и размеры пор. Точечные кратеры на поверх-
ности катода называют питтингом (рис. 8.11). Кроме того, атомар-
ный водород проникает в покрытие и даже при незначительном
содержании отрицательно сказывается на структуре и механиче-
ских свойствах покрытий.
Механизм включения водорода в осадок может быть различ-
ным. Диффузия водорода происходит вдоль границ зерен, в пло-
скости сращивания кристаллов и сквозь кристаллическую решетку.
Проникая в кристаллическую решетку, водород занимает узлы
или располагается между ними, что приводит к нарушению роста
кристаллов и ослабляет их связь между собой. Атомарный во-
дород может также растворяться в металлах, образуя с ними
химические соединения (гидриды) или твердые растворы, вызывая
деформацию и отслаивание покрытий.
Степень наводороживания покрытий зависит от металла по-
крытия, его структуры и условий электролиза. Например, мас-
совая доля водорода в хромовых покрытиях составляет 0,045,
в железных и никелевых — 0,1, в цинковых — от 0,01 до 0,001.
Такие металлы, как свинец, медь, вообще не поглощают водород.
Частично водород проникает и в основной металл. Например,
при хромировании стали ее пластичность резко уменьшается,
особенно в первые минуты электролиза, так как потенциал выде-
ления водорода на железе имеет более положительное значение.
Поэтому при хромировании стальных пружин перед нанесением
хрома наносят подслой металла, который не растворяет водород.
При цинковании и кадмировании в цианидных электролитах по
той же причине наблюдается снижение пластичности и водородное
растрескивание сталей. Накапливаясь в микротрещинках и по-
рах основного металла, водород может вызвать при последующей
температурной обработке или хранении вздутие и отслоение по-
крытий.
§ 8.7. МНОГОСЛОЙНЫЕ КОМБИНИРОВАННЫЕ
ПОКРЫТИЯ
Требования, предъявляемые к покрытиям, во многих
случаях не могут быть обеспечены нанесением однослойных по-
крытий, поэтому в гальванотехнике применяются комбинирован-
ные многослойные покрытия, состоящие из двух и более слоев.
Условно их можно разделить на две группы: многослойные по-
крытия, состоящие из различных металлов, и многослойные по-
крытия из слоев одного и того же металла, обладающих различ-
ными свойствами. Классическим примером первого варианта
являются многослойные покрытия типа медь—никель, никель—
хром, медь—никель—хром. Такая комбинация широко приме-
91
няется в качестве защитно-декоративных покрытий. По сравне-
нию с однослойными покрытиями они имеют ряд преимуществ.
Одним из главных условий, определяющих защитные свой-
ства любого покрытия, является его беспористость. При нанесении
двухслойных покрытий это условие легче выполнить, так как
менее вероятно совпадение каналов пор у покрытий, которые
имеют разные структуру и свойства. Декоративные свойства
у двухслойных покрытий также могут быть выше. Например,
подслой меди хорошо «затягивает» всевозможные поры и поли-
руется до блеска, обеспечивая блеск и у никелевого покрытия.
Нельзя забывать и об экономических преимуществах много-
слойных покрытий, так как медь намного дешевле никеля.
Трехслойное покрытие, в котором толщина слоя хрома не
превышает нескольких микрометров, позволяет сохранить блеск
даже во влажной атмосфере. Благодаря этому данное покры-
тие нашло широкое применение в автомобильной промыш-
ленности.
Кроме указанных многослойных покрытий в промышленности
применяют системы медь—серебро, медь—золото и т. п. В этом
случае медь наносят для обеспечения адгезии драгоценных метал-
лов со стальными и латунными деталями.
Вторым вариантом многослойных покрытий являются медные
покрытия из цианидного, а затем из кислого электролита. Медные
покрытия, полученные из цианидных электролитов, имеют мелко-
кристаллическую структуру, а покрытия из кислого электролита—
крупнокристаллическую структуру. Зато в нем можно наращи-
вать толстые слои меди при высоких плотностях тока.
. В настоящее время получают многослойные хромовые покры-
тия, которые резко отличаются друг от друга по своим свойствам.
Изменяя плотность тока и температуру, получают сначала мяг-
кий, «молочный», а затем твердый и блестящий слой хрома.
В оптическом приборостроении применяют двухслойные по-
крытия типа никель—черный никель. Для увеличения коррозион-
ной стойкости блестящих никелевых покрытий применяют покры-
тия типа би-никель, три-никель и сил-никель. Преимущество
таких покрытий очевидно, так как при той же толщине слоя кор-
розионная стойкость у них почти в 2—5 раз выше. Внедрение
таких процессов позволяет экономить дорогостоящий и дефицит-
ный никель.
Следует отметить увеличение удельного веса так называемых
композиционных электрохимических покрытий КЭП. Они от-
личаются от гомогенных покрытий наличием второй фазы, кото-
рая представляет собой мелкодисперсные неэлектропроводные
частицы. Соосаждение происходит вследствие «захвата» частиц
по мере роста покрытия. В первую очередь к ним следует отнести
сил-никель и др. Все КЭП обладают высокими твердостью, изно-
состойкостью и химической стойкостью. Внедрение таких покры-
тий приведет к значительной экономии цветных металлов.
92
ГЛАВА 9. РАССЕИВАЮЩАЯ СПОСОБНОСТЬ
ЭЛЕКТРОЛИТОВ
§ 9.1, РАСПРЕДЕЛЕНИЕ ТОКА В ЭЛЕКТРОЛИТЕ
Одним из основных требований, предъявляемых к по-
крытиям, является их равномерность. При нанесении покрытий
погружением в расплав, напылением или химическим способом это
требование обеспечить гораздо легче, чем при электроосаждении.
Условия получения электрохимических покрытий гораздо слож-
нее и зависят прежде всего от распределения тока по поверхности
изделия. Считают, что если катод и анод имеют одинаковую по-
верхность и расположены строго параллельно, то толщина осаж-
даемого покрытия должна быть одинаковой по всей поверхности
катода. Однако эта точка зрения ошибочна, так как с краев и по
углам осаждение протекает более интенсивно. Примером может
служить осаждение хрома из универсального электролита при
плотности тока 22 А/дма. Плотность тока, вычисленная затем
исходя из толщины слоя на краях и углах, почти в 5 раз превы-
шала плотность тока на середине образца. Таким образом, если
рабочая плотность тока 22 А/дм2, то на углах и краях она доходит
до 50 А/дм2, в то время как на середине катода составляет всего
лишь 11 А/дма. При переходе к сложнопрофилированным деталям
неравномерность токораспределения, а следовательно, и тол-
щины покрытия выражена еще резче (рис. 9.1).
На токораспределение влияет ряд факторов. Условно их
можно разделить на следующие группы;
1) электрохимические параметры электролита—поляризация,
электропроводность, выход по току и т. д.;
2) геометрические размеры и форма ванн и электродов, а также
их взаимное расположение;
3) природа покрываемого металла, его структура и состояние
поверхности основного металла.
Распределение тока, которое зависит только от геометрических
факторов и подчиняется законам Кирхгофа, называется первич-
ным распределением, оно является наименее равномерным и имеет
место при отсутствии катодной поляризации. Однако при элек-
троосаждении электрохимические факторы вызывают перераспре-
деление основных линий, в этом случае речь идет о вторичном рас-
пределении тока. Чем выше поля-
ризация, тем равномернее распре-
деление силовых линий, и на-
оборот. Например, металличе-
ский шарик диаметром 4—5 см,
Рис. 9.1. Схема распределения тока на
сложнопрофилнрованных деталях
93
Рис. 9.2. График изменения потенциала катода
при повышении плотности тока
помещенный в цианидный электролит
золочения на расстоянии 10—55 см от
анода имел равномерную толщину слоя
во всех точках. Плотно свитый кабель
из 84 медных проволок диаметром
0,7 мм каждая равномерно покрывался
оловом и в станнатном электролите
лужения. В приведенных случаях про-
цесс осаждения протекал при повы-
шенной поляризации.
На рис. 9.2 приведены две поляризационные кривые. Кри-
вая 1 относится к случаю, когда с повышением плотности тока
потенциал катода изменяется незначительно, кривая 2 — к слу-
чаю, когда потенциал катода резко увеличивается с повышением
плотности тока. При изменении потенциала на одну и ту же ве-
личину разница в плотностях тока, а следовательно, скорость
осаждения между ближним и дальним участками катода в первом
случае гораздо больше. Следовательно, чем резче повышается
потенциал катода при увеличении плотности тока, тем равномер-
нее распределение тока.
С повышением электропроводности равномерность осаждения,
как правило, увеличивается. Однако при повышении темпера-
туры или перемешивании одновременно с увеличением электро-
проводности катодная поляризация может уменьшаться и распре-
деление тока в таком случае будет ухудшаться.
Следует упомянуть и о влиянии выхода по току на равномер-
ность распределения силовых линий. Равномерность увеличивается
для тех электролитов, в которых с увеличением плотности тока
выход по току падает. К ним относятся все комплексные электро-
литы и некоторые другие. В тех электролитах, в которых выход
по току с увеличением плотности тока увеличивается, распределе-
ние тока и металла ухудшается. Степень перераспределения тока
и металла на поверхности катода в сторону большей равномер-
ности называется рассеивающей способностью электролита.
При электроосаждении металла из-за различия скоростей ток
на микронеровностях поверхности распределяется неравномерно.
Способность электролита выравнивать микрорельеф поверхности
определяется выравнивающей или микрорассеивающей способ-
ностью. Способность электролита покрывать углубленные участ-
ки поверхности характеризует его «кроющую» способность.
§ 9.2. КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА
РАССЕИВАЮЩЕЙ СПОСОБНОСТИ ЭЛЕКТРОЛИТОВ
Первичное распределение тока подчиняется за-
кону Ома, поэтому сила тока /, проходящего через галь-
ваническую ванну, равна напряжению на штангах ванны Е,
94
Рис. 9.3. Схема прибора для измерения рассеивающей
способности:
А •— анода К катод
деленному на
та R:
сопротивление электроли-
I = EIR. (9.1)
Если считать электролит равномерным U |_
по составу, то сопротивление R зависит
только от межэлектродных расстояний. На
рис. 9.3 представлена схема прибора для измерения рассеивающей
способности электролита. Электролиз ведется в ванне с двумя
катодами одинакового размера, расположенными на разных рас-
стояниях от него (/б и /д). Катоды отделены друг от друга стек-
лянной перегородкой. Обозначим сопротивление электролита до
ближнего катода /?б, а сопротивление электролита до дальнего
катода /?д. Допустим, что их отношение равно величине К, тогда
/?д = и Для ближнего участка катода будем иметь следующее
падение напряжения в электролите:
Яб — /б^б»
(9.2)
а для дальнего участка —
Яд = /дЯд = K^Rs- (9.3)
Так как рабочее напряжение на всех участках катода одина-
ково, то можно приравнять правые части уравнений (9.2) и (9.3).
Решая полученное равенство относительно /б, получим
1б = К/дЯб/Яб = К1Д, или К = 1бПд, (9.4)
где К — коэффициент первичного распределения тока.
Следовательно, при первичном распределении тока ток об-
ратно пропорционален сопротивлению. При равном удельном со-
противлении и одинаковых площадях ближнего и дальнего участ-
ков катода коэффициент К обратно пропорционален межэлектрод-
ным расстояниям:
К = 1бПд = /?д//?б = /д//б. (9.5)
При вторичном распределении тока напряжение на клеммах
ванны Еобщ будет зависеть от электродных потенциалов и от па-
дения напряжения в самом электролите:
ЯОбщ = Яа + Е9 + Ек, (9.6)
где Е& и Ек — потенциалы катода и анода; Ев — падение на-
пряжения в электролите.
Падением напряжения в металлах электродов можно прене-,
бречь. Так как между любыми точками анода и катода падение
напряжения одинаково, имеем ( '
Яа + Ед + Ек. б = Еа + Ед + Ек, п, (9.7)
где Ек, б и £к. д — потенциалы ближнего и дальнего участков
катода соответственно; Еб и £д — падение напряжения в ближ-
нем и дальнем объеме электролита соответственно.
Подставляя вместо £б и £д их значения из уравнений (9.2)
и (9.3), имеем
Еа + /б£б + £к. б = Еа + KJrRr + £в. д. (9.8)
Поделив обе части на 7д/?б и сократив £а, получим
7б/7д = К + (£к. д - £к. б)/(7д7?е). (9.9)
Подставляя значение £д из уравнения (9.3) в (9.10), полу-
чаем
7б/7д = К + К (Ек. д - £к. б)/£д. (9.10)
§ 9.3. МЕТОДЫ ИЗМЕРЕНИЯ РАССЕИВАЮЩЕЙ
СПОСОБНОСТИ ЭЛЕКТРОЛИТОВ
Определение рассеивающей способности производится
следующими методами: измерением распределения тока и металла
на катоде; исследованием поляризационных кривых; построением
электрического поля и т. п.
Измерение распределения тока и металла на катоде является
самым распространенным способом. На рис. 9.4 приведена ячейка
Херинга и Блюма. Анод расположен параллельно двум разно-
удаленным катодам. Для выравнивания концентрации в электро-
лите применяют сетчатый перфорированный анод. Для устране-
ния краевого эффекта электроды должны быть несколько выше
уровня электролита. Межэлектродные расстояния относятся друг
к другу как 5:1.
Рис. 9.4. Ячейки Херинга и Блюма для
определения рассеивающей способности:
А •— анод: К, и К» — катоды
Рис. 9.5. Диаграмма рассеивающей спо-
собности кислых и щелочных электро-
литов (по Г. Херингу и В. Блюму)
96
Рис. 9.6. Ячейка Фильда для определения рассеивающей способности:
А — анод: К — катоды; Д — диэлектрик
Рис. 9.7. Ячейка Кудрявцева и Никифоровой
При таком расположении электродов в случае первичного
распределения тока на ближнем катоде осаждается в 5 раз больше
металла, чем на дальнем. Фактическая масса металла может быть
меньше или больше в зависимости от рассеивающей способности
электролита. На рис. 9.5 приведена диаграмма рассеивающей
способности кислых и щелочных электролитов, вычисленная этим
методом. Г. Херинг и В. Блюм предложили определять рассеива-
ющую способность как отклонение от первичного распределения
тока (%)
РС = (к — 100/К. (9.11)
Так как между привесами и фактическим распределением тока
существует прямая зависимость, то выражение (9.11) можно пред-
ставить в виде
РС = (к — 100/К, (9.12)
где Мб и 7ИД — привесы металла на ближнем и дальнем участках
катода.
Подставляя значение из уравнения (9.10) в уравнение
(9.11), получаем
РС = ^-^ + ^№к-д-£к.б)/£д = (£к + Ек б)/Е (9,13)
д
Таким образом, рассеивающая способность увеличивается
с ростом поляризации и электропроводности электролита. Так
как, по методу Херинга и Блюма, даже в случае идеального рас-
пределения тока РС + 100 %, Фильд предложил формулу:
РС — ~ мб/мд юо (9 14)
Ячейка Фильда для определения рассеивающей способности
приведена на рис. 9.6. Катоды расположены по одну сторону от
анода и отделяются диэлектриком. По этой формуле РС может быть
равна 100 %, если металл распределяется равномерно, и может
быть равна нулю при первичном распределении тока.
4 Дасоян М. А. н др.
97
Для определения рассеивающей способности Н. Т. Кудрявцев
и А. А. Никифорова предложили катод, изогнутый в двух местах
под углом 60° (рис. 9.7). Катод помещается между двумя анодами
на одинаковом расстоянии. После нанесения покрытия катод
разрезают по вершинам углов на три части и определяют методом
струи толщину покрытия по средней линии каждой грани.
Более точные данные о массе металла, осажденного на раз-
личных участках катода, дает применение разборных электро-
дов, предложенных различными авторами. Каждую составную
часть такого электрода взвешивают до и после электролиза и по
величине привеса судят о распределении металла на катоде.
Очень удобные конструкции углового и цилиндрического раз-
борных катодов были предложены А. Т. Баграмяном и Т. Б. Ильи-
ной-Кукуевой. Угловой катод собирается из нескольких метал-
лических пластинок, устанавливаемых вдоль двух сторон треу-
гольных плит из непроводящего материала таким образом, что
они образуют острый угол, обращенный к аноду.
Цилиндрический разборный катод состоит из набора металли-
ческих шайб, плотно пригнанных друг к другу и надетых на об-
щий стержень; торцовая часть катода снизу и сверху закрывается
шайбами, изготовленными из оргстекла или винипласта. Осажде-
ние металла происходит на боковой поверхности цилиндра.
Анод представляет собой пластинку, согнутую в виду трубки,
в центре которой устанавливается катод. Распределение металла
в обоих случаях оценивается по привесу отдельных участков ка-
тода. Преимущество указанных катодов состоит в том, что они
просты в изготовлении, их сборка и разборка производятся легко.
§ 9.4. МИКРОРАССЕИВАЮЩАЯ СПОСОБНОСТЬ
ЭЛЕКТРОЛИТОВ
Способность электролитов образовывать равномерные
осадки на микровпадинах называется микрорассеивающей спо-
собностью. Иногда применяются термины «выравнивающая» или
«сглаживающая» способность. Понятие МРС применимо лишь
в тех случаях, когда линейные размеры микропрофиля меньше
десятых долей миллиметра.
О степени выравнивания судят по изменению глубины впадины
до и после покрытия, а также путем измерения углов, образо-
ванных сторонами V-образного микропрофиля. На рис. 9.8
представлены схемы двух микровпадин V-образного профиля.
На рис. 9.8, а углы ух и уа, измеренные до и после покрытия,
равны между собой, а микропрофили до и после покрытия
геометрически подобны.
Такой вид выравнивания называют геометрическим в отличие
от положительного или истинного выравнивания (см. рис. 9.8, б),
когда ft > yg, а < 7?а.
98 ' ' ;
t Ч -ум
Рис. 9.8. Схемы микровпадин: а — геометри- Рис. 9.9. Схема осадка на
ческое выравнивание; б — истинное выравни- микровпадине
вание
Микрорассеивающая способность ничего общего с рассеиваю-
щей способностью не имеет. Очень часто электролиты, которые
имеют хорошую рассеивающую способность, имеют плохую мик-
рорассеивающую способность, и наоборот. Только электролиты
с высокой концентрацией разряжающихся на катоде ионов, раз-
ряд которых происходит при незначительной катодной поляри-
зации, могут иметь высокую микрорассеивающую способность
и выравнивать микрорельеф. В таких электролитах убыль ионов
в прикатодном пространстве быстро восполняется за счет их диф-
фузии и конвекции из глубины электролита. Различная скорость
осаждения на микронеровностях поверхности катода приводит
к различному микрораспределению металла: замедляется разряд
ионов на выступах, в то время как на впадинах разряд ионов за-
метно увеличивается.
К таким электролитам следует отнести сульфатный электро-
лит меднения, микрорассеивающая способность которого выше мик-
рорассеивающей способности цианидного электролита. В последнем
из-за низкой концентрации простых ионов меди затруднен про-
цесс их доставки в прикатодный слой.
Увеличить микрорассеивающую способность удается при по-
мощи введения в электролиты некоторых органических соедине-
ний, так называемых выравнивающих добавок. Адсорбируясь на
микровыступах, выравнивающие добавки блокируют выступы,
замедляя процесс осаждения на них металла. При этом скорость
осаждения металла во впадинах начинает возрастать. Для истин-
ного выравнивания необходимо, чтобы концентрация ионов раз-
ряжающегося металла была достаточно высокой, а концентрация
выравнивающих добавок — достаточно низкой.
Микрорассеивающую способность выражают отношением тол-
щины покрытий на различных участках микровпадины. На
рис. 9.9 представлена схема микровпадины, 6ц и 68 обозна-
чают толщины покрытия соответственно вне выемки, на середине
одной из сторон и в углублении. По мере увеличения отношений
68/б2, и 62/6i микрорассеивающая способность возрастает.
Для количественной характеристики микрорассеивающей спо-
собности Е. Рауб и К- Мюллер предложили оценивать ее по ана-
4* 99
Рис. 9.10. Примеры выравнивания микровпадин
логии с рассеивающей способностью как степень перераспределе-
ния толщины или глубины впадины до и после покрытия (%)
МРС = (d2 — dj 100/Я2 = (Я2 — .KJ 100//?2, (9.15)
где dlt d2 — толщины покрытия вне выемки и в углублении соот-
ветственно; R± — глубина профиля после покрытия; R2 — глу-
бина профиля до покрытия.
На рис. 9.10 приведены примеры выравнивания V-образного
профиля после нанесения электролитического покрытия. При
идеальном выравнивании (рис. 9.10, а) МРС=100 %, = 0.
Если R± = R2/2, МРС = 50 %. В тех случаях, когда профили до
и после покрытия геометрически подобны, т. е. R± = R2, МРС = 0
(рис. 9.10, в). Отрицательная МРС возникает, когда во впадине
толщина покрытия меньше, чем на краях, т. е. Rx > R2
(рис. 9.10, г).
§ 9.5. КРОЮЩАЯ СПОСОБНОСТЬ ЭЛЕКТРОЛИТОВ
Под кроющей способностью подразумевается способ-
ность электролита покрывать углубленные участки поверхности.
Кроющая способность электролита имеет в гальванотехнике мень-
шее значение, чем рассеивающая способность, так как представ-
ляет интерес лишь в тех случаях, когда требуется нанести слош-
ное покрытие, хотя бы и неоднородной толщины. Разряд ионов
металла на катоде начинается при определенной плотности тока,
которая зависит от природы металла покрытия, основы, состава
электролита и температуры. Так, например, меднение в сульфат-
ном электролите начинается при плотности тока 0,001 А/дм2,
в то время как для осаждения хрома необходима плотность тока
10—25 А/дм2. Если из-за неравномерного токораспределения
в глубине детали плотность тока окажется меньше минимальной,
часть детали останется непокрытой. Повышать плотность тока
можно лишь до определенного предела, после которого образу-
ются некачественные покрытия. Таким образом, кроющую спо-
собность можно выразить как отношение предельной к минималь-
ной критической плотности тока. Кроющая способность тем выше,
чем выше рассеивающая способность.
Для измерения кроющей способности применяют ванну с пло-
ским катодом, согнутым под углом (рис. 9.11). После осаждения
100
Рис. 9.11. Угловой катод для измерения кро-
ющей способности
катод распрямляют и графически
фиксируют относительное распределе-
ние на нем покрытых и непокрытых
поверхностей. Та часть поверхности
катода (выраженная в процентах), ко-
торая занята покрытием, характери-
зует кроющую способность исследуе-
мого электролита.
§ 9.6. СПОСОБЫ ПОЛУЧЕНИЯ РАВНОМЕРНЫХ
ПОКРЫТИЙ
Для равномерного распределения тока и металла на
поверхности деталей в гальванотехнике применяют дополнитель-
ные катоды; профилированные и дополнительные аноды; непро-
водящие экраны; подвески, обеспечивающие рациональное раз-
мещение деталей, и т. п.
Этой же цели служат гидродинамические факторы: перемеши-
вание электролитов и растворов; качание, вращение и вибрация
деталей; применение струйных и проточных электролитов, а
также равномерное осаждение покрытий.
Сочетание перечисленных способов позволяет повысить ка-
чество покрытий и интенсифицировать процесс осаждения даже
в тех случаях, когда электролит имеет низкую рассеивающую
способность.
Приведем несколько примеров, иллюстрирующих улучшение
токораспределения при помощи различных приспособлений. В ос-
нове многих приспособлений лежит принцип ограничения покры-
ваемой поверхности непроводящими экранами и продления ее при
помощи дополнительных катодов.
На рис. 9.12 приведены ячейки, которые могут быть исполь-
зованы для получения равномерных покрытий на плоских като-
дах. Двухэлектродная ячейка (рис. 9.12, а) обеспечивает рав-
номерное распределение тока на катоде и аноде за счет ограниче-
ния поверхности покрытия. Одноэлектродная ячейка (рис. 9.12, б)
дает возможность получать равномерные покрытия при условии,
если высота экрана будет не менее высоты покрываемой детали.
Уменьшить высоту экрана в 3—5 раз можно за счет выравниваю-
щих козырьков. При наличии углублений, пазов и сквозных от-
верстий на деталях их следует изолировать непроводящими встав-
ками, иначе вблизи отверстия будет наблюдаться уменьшение
толщины покрытия (рис. 9.12, г).
На рис. 9.13 приведена схема более сложного приспособления
для хромирования внутренней поверхности пресс-формы при
101
Рис. 9.12. Ячейки для получения равномерных покры-
тий: а — двухэлектродная; б — одноэлектродная; в —
выравнивающие козырьки; г — непроводящие вставки;
1 — анод; 2 — непроводящий экран; 3 — катод; 4 — козырек;
5 — непроводящая вставка; 6 — трубчатая непроводящая
вставка
помощи непроводящих экранов, которые имеют скозные отверс-
тия. К пресс-форме прикладываются пластины из оргстекла или
целлулоида толщиной 1—3 мм, в которых сделаны соосные от-
верстия с отверстиями в детали. Диаметр отверстий в непроводя-
щем экране составляет 0,2—0,4 диаметра отверстия детали.
На рис. 9.14 представлена схема приспособления для повыше-
ния равномерности покрытия при помощи дополнительных като-
дов и непроводящих экранов. Отделенные от пресс-форм допол-
нительные катоды устанавливаются на расстоянии не менее 2 мм
от покрываемой поверхности против выступающих частей детали.
При нанесении покрытий на крупные детали отделенные допол-
нительные катоды представляют собой контурные рамки 1.
Можно пользоваться в таких случаях и непроводящими экрана-
ми 2 и 3.
Для уменьшения неравномерности покрытия применяют до-
полнительные и фигурные аноды. Во многих случаях используют
перфорированные аноды, воспроизводящие очертания поверх-
ности детали. Однако такой прием не всегда позволяет получать
Рис. 9.13. Схема приспособления для хромирования пресс-
форм при помощи непроводящих экранов: '
1 — деталь; 2 — изоляция; 3 — непроводящий экран
102
Рис. 9.14. Схема приспособления для повы-
шения равномерности покрытия при помощи
дополнительных катодов и непроводящих
экранов:
1 — деталь; 2 — дополнительный катод; 3 —
непроводящие экраны
равномерные покрытия, так как ток
концентрируется на выступающих
частях, в то время как углублен-
ные места находятся в худшем по-
ложении. Более благоприятным яв-
ляется другой вариант, когда анод
представляет собой сочетание цен-
трального анода с контурными (рис. 9.15). Повышение равномер-
ности осаждения покрытий за счет непрерывного удаления газов
из прикатодного пространства и поступления новых порций эле-
ктролита широко применяется в гальванотехнике.
Кроме обычных гидродинамических способов существуют и
более сложные способы: нанесение покрытий в проточном электро-
лите, струйный и размерный способы нанесения покрытия.
Для нанесения покрытий в управляемом проточном электро-
лите применяют обычно двухэлектродные ячейки. Ток подводится
через отверстия или щели, имеющиеся в аноде, или через специаль-
ные перфорированные трубки. При струйном способе подвод
тока осуществляется струями электролита, выходящими из пер-
форированного анода и отделенными друг от друга воздушными
промежутками, что позволяет в отличие от предыдущего способа
дозировать распределение тока.
При размерном покрытии размеры детали должны строго соот-
ветствовать требуемым по чертежу. Для нанесения таких покры-
тий используют метод дозирования тока. Детали помещают в не-
проводящий разборный экран (рис. 9.16), который имеет ряд
отверстий для подвода электролита к наружным отверстиям
деталей.
Рис. 9.15. Схема приспособления для хромирования
’ сложной пресс-формы со сплошными (с) и контурными (б) I
анодами: • ГТСЛ
> t —пресс-форма; 2 — фигурный анод; 3 — центральный анод
103
Рис. 9.16. Схема приспособления
для размерного никелирования:
1 — деталь; 2 — верхняя часть экрана;
5 — центрирующая часть экрана; 4 —
нижняя часть экрана; 5 — токопровод;
6 — центрирующие отверстия
К внутренним поверхно-
стям деталей электролит по-
дается через трубки, вмонти-
рованные в отверстия. Таким
образом, электрический ток
дозируется при помощи отвер-
стий в экране и трубок, за-
полненных электролитом.
Размеры, число трубок и от-
верстий рассчитываются'исходя из их сопротивления, которое опре-
деляется из принципа дозировки тока. Перечисленные способы поз-
воляют ускорить процесс осаждения, получить равномерные по-
крытия и снизить расход цветных металлов.
мМаодоют МА мпоядпоооэААЛ ймтхЭ ЛГ If .а>Л
ItaMKfephMMi — ь fe&a •Винка*"-' »1
РАЗДЕЛ V
ЭЛЕКТРОХИМИЧЕСКИЙ МЕТОД НАНЕСЕНИЯ
МЕТАЛЛИЧЕСКИХ ПОКРЫТИЙ
ГЛАВА ю. ЦИНКОВАНИЕ
§ 10.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЦИНКА
И ОБЛАСТЬ ПРИМЕНЕНИЯ ЦИНКОВЫХ ПОКРЫТИЙ
Цинк представляет собой металл светло-серого цвета
с голубоватым оттенком. В холодном состоянии хрупок, а при
температуре 100—150 °C весьма пластичен, хорошо гнется и легко
прокатывается в листы и фольгу толщиной до сотых долей мил-л
лиметра. При температуре свыше 250 °C вновь становится хруп-
ким и легко превращается в порошок. Цинк можно паять исполь-
зуя активные флюсы, например ZnCl2. Температура плавления
419,5 °C. Плотность 7,133 г/см3. Цинк обладает средней твердо-
стью, которая в значительной мере зависит от способа его по-
лучения и чистоты. Твердость цинковых покрытий колеблется от
0,4 до 2,0 ГПа. Удельное электрическое сопротивление составляет
0,06 X 10е Ом-м. Цинк — химический элемент II группы пери-
одической системы Менделеева, его атомный номер 30, атомная
масса 65,38, валентность 2, электрохимический эквивалент
1,22 г/А-ч. Его нормальный потенциал цинка — 0,763 В, что
характеризует его как активный металл и сильный восстанови-
тель; он способен замещать многие металлы, например железо,
медь, никель, в растворах их солей.
В сухом воздухе при комнатной температуре цинк почти не
изменяется, однако, начиная с температуры 225 °C, скорость его
окисления быстро возрастает. Во влажном воздухе и в пресной
воде, особенно в присутствии СО2 и SO2, цинк быстро разрушается
даже при комнатной температуре, покрываясь поверхностной
пленкой основных гидрокарбонатов. По мере накопления на
поверхности продуктов коррозии и частичного заполнения ими
пор скорость коррозии цинка уменьшается и пленка служит
дополнительной защитой. В горячей воде может начаться язвен- л
ная коррозия цинка с образованием белых чашеобразных отложе-»
ний вокруг газовых пузырей. 1
При сильном нагревании на воздухе, особенно при наличии
СО2, цинк сгорает, образуя оксид цинка. Цинк легко растворяется
в растворах сильных кислот с образованием соответствующих со-
105
10.1. Скорость коррозии цинка и кадмия
Микроклиматический район Скорость коррозии, г/м* Концентрация, мг/м*
Zn Cd so, ci-
Москва (промышленный район) 17 49 0,190 0,10
Звенигород (сельскохозяйствен- ный район) 7 10 0,010 0,02
Батуми (влажный тропический район) 11 14 0,020 0,06
Северный приморский район 19 12 0,012 0,80
лей и водорода. При взаимодействии с разбавленными кислотами
НС1 и H2SO4 также выделяется водород:
Zn + 2Н+ Zn2+ + На,
а с HNO3 — оксиды азота. При этом большое влияние оказывают
примеси посторонних металлов. Например, медь, олово и другие
металлы с низким перенапряжением водорода увеличивают ско-
рость растворения цинка в кислых средах, а примеси ртути,свинца с
высоким перенапряжением водорода на цинке не влияют на процесс
растворения. Растворы сильных щелочей окисляют цинк с образо-
ванием растворимых в воде цинкатов. В интервале pH 7—12,5
цинк практически не растворяется. Цинк легко реагирует с
H2S и SO2, которые находятся в атмосфере воздуха. В при-
сутствии иона С1 цинк легко растворяется. Органические кисло-
ты — уксусная, муравьиная и др. — вызывают значительную кор-
розию цинка.
В настоящее время цинкование является наиболее распростра-
ненным способом металлизации железа для защиты его от атмос-
ферной коррозии. На эти цели расходуется приблизительно 40 %
мировой добычи цинка. Широкое распространение цинкования
объясняется анодным характером защиты. Потенциал цинка отри-
цательнее потенциала черных металлов: стали, железа, чугуна,
поэтому цинк защищает их от коррозии электрохимическим путем.
Защитные свойства покрытий сохраняются даже при малой
толщине слоя, а также при наличии пор и обнаженных участков,
отстаящих на несколько миллиметров от кромки покрытия.
Забоины и царапины не влияют существенно на коррозию изде-
лий. Протекторное действие цинка обусловливает также защиту
от коррозии непокрытой части резьбы, если гайки навинчены на
оцинкованные болты; срезов оцинкованных листов, проволоки
и т. п. При температуре свыше 70 °C анодный характер защиты
нарушается и цинк защищает основу лишь механически.
Цинковое покрытие обладает низкой химической стойкостью
при воздействии летучих продуктов, выделяющихся при старении
таких органических материалов, какими являются синтетические
106
10.2. Толщина цинковых покрытий
Обозначение покрытия Назначение покрытия Толщина, мкм, для условий эксплуатации
1 2 з 4 5 6 7 8
Ц.хр бесцветное Защитно-деко- ративное, защит- ное 6 12 15 — — — — —
Ц.хр То же 6 15 15 15 — — 30 —
Ц.хр.хаки » 6 9 9 9 15 — 18 —
Ц.хр./лкп Защитное — 6 6 9 9 9 12 12
Ц.фос/лкп » — 6 6 9 9 9 12 12
смолы, олифы, хлорированные углеводороды. Покрытия легко
разрушаются, если они находятся в контакте или в закрытом объ-
еме со свежеокрашенными или промасленными деталями.
В табл. 10.1 приведена скорость коррозии цинка и кадмия
в различных атмосферных условиях.
Из табл. 10.1 видно, что скорость коррозии цинка в присут-
ствии SO2 намного меньше, чем кадмия, а в присутствии ионов
СГ— в 1,5 раза выше. Для повышения коррозионной стойкости
цинковые покрытия можно подвергать специальной химической
обработке в растворах, содержащих хромовую кислоту или ее
соли, а также в растворах фосфорной кислоты. Толщина цинко-
вых покрытий устанавливается в зависимости от условий и срока
их эксплуатации. В табл. 10.2 приведена толщина цинка согласно
ГОСТ 9.303—84*.
§ 10.2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
ЭЛЕКТРОЛИТОВ
Цинкование производят в простых и сложных электро-
литах. К первым относят сульфатные, хлоридные, борфторидные
и др.; ко вторым — цианидные, цинкатные, аммонийные, амино-
комплексные с различными добавками. Группа аминокомплексных
электролитов представляет собой этилендианиновые, полиэтилен-
диаминовые, содержащие комплекс трилона Б и др.
Характер разряда ионов цинка на
катоде и катодная поляризация зависят
от типа электролита и от условий элек-
тролиза. На рис. 10.1 приведены кри-
вые катодной поляризации различных
электролитов цинкования. В простых
электролитах разряд ионов цинка про-
Рис. 10.1. График катодной поляризации цин-
ковых электролитов: сульфатного (/); аммо-
нийного (2); цианидного (3) и цинкатного (4)
107
Рис. 10.2. Зависимость выхода по току
от состава цинковых электролитов:
1 — борфторидный; 2 — аммонийный; 3 —
цианидный; 4 — пирофосфатный
!•
текает при низкой катодной поля-
ризации, в сложных — поляриза-
ция достигает значительной вели-
чины, например, в цианидных —
доходит до 1 В. Поэтому осадки,
полученные из кислых электролитов, имеют крупнокристалли-
ческую структуру. Введение различных добавок позволяет улуч-
шить структуру и получать осадки, сопоставимые по своим свой-
ствам с осадками, полученными из сложных электролитов. В слож-
ных электролитах осадки цинка имеют плотное, мелкозерни-
стое строение.
Низкая рассеивающая способность простых электролитов не
позволяет получать равномерные покрытия на деталях сложной
конфигурации, поэтому их используют для изделий простой кон-
фигурации: листов, проволоки, ленты и т. п. Осаждение цинка
из сложных электролитов протекает при высокой рассеивающей
способности, поэтому эти электролиты, особенно цианидные с вы-
соким содержанием свободного цианида, дают не только мелко-
зернистые, но и равномерные покрытия на деталях как простой,
так и сложной формы.
Для сравнительной оценки рассеивающей способности цин-
ковых электролитов их можно расположить в следующий ряд
по мере убывания рассеивающей способности: цианидный (I =
= 25 °C), полиэтиленполиаминовый, пирофосфатный (pH 3,3;
t = 50 °C), аммонийный (pH 6,8; t = 20 °C), фторидный (t =
= 20 °C), сульфатный (t = 25 °C).
Перенапряжение водорода на цинке достигает значительной
величины: при катодной плотности тока 1 А/дм2 оно равно 0,75 В,
а при 3 А/дм2 — приближается к 1 В. В связи с этим катодный
выход по току цинка в простых электролитах достигает 96—98 %;
следовательно, на катоде происходит преимущественный разряд
ионов цинка.
При нанесении покрытий в сложных электролитах происходит
совместное выделение цинка и водорода. Скорость выделения во-
дорода увеличивается по мере возрастания плотности тока, так
как при этом возрастает потенциал выделения цинка. Например,
при цианидном цинковании потенциал выделения цинка равен
—1,74-1,9 В, что намного превышает перенапряжение водорода на
нем. Выход по току при увеличении плотности тока может быть
равным 10 % (рис. 10.2). Потенциал осаждения цинка может быть
снижен за счет введения в электролит свободной щелочи. В этом
случае условия осаждения изменяются в пользу выделения ме-
талла и выход по току возрастает. « -м®
108
Выделение водорода приводит к значительному наводорожи-
ванию изделий, что ухудшает их механические свойства — умень-
шается пластичность и увеличивается склонность стали к хруп-
кому разрушению. Поэтому в электролитах с низким выходом
пр току не допускается нанесение цинка на детали, изготовленные
с пределом прочности 1400 МПа и более.
Следует учитывать, что цианидные электролиты токсичны и
при определенных условиях возможно выделение сильнейшего
яда, каким является цианистый водород. Поэтому взамен этих
электролитов разработаны многочисленные сложные электролиты.
§ 10.3. ПРОСТЫЕ КИСЛЫЕ ЭЛЕКТРОЛИТЫ
Сульфатные электролиты. Основным компонентом яв-
ляется ZnSO4-7H2O, его растворимость при температуре 25 °C
составляет 579 г/л. При выборе концентрации сульфата цинка
руководствуются следующими соображениями. Осадки цинка
из очень концентрированных электролитов имеют большую по-
ристость и склонны к образованию дендритов. Использование сла-
боконцентрированных электролитов неэкономично, так как
уменьшается их электропроводность и, как следствие, ухудшается
качество покрытий. Поэтому оптимальной концентрацией ZnSO4
в электролитах, работающих при комнатной температуре, явля-
ется 200—300 г/л.
Для цинкования листов, проволоки и ленты, движущихся не-
прерывно и при температуре электролита 40—50 °C, концентра-
цию основного компонента можно увеличить до 400—700 г/л.
Скорость осаждения цинка в таких электролитах значительно
выше.
Сульфатные электролиты просты в работе, не токсичны, имеют
высокий выход по току, однако из-за низкой рассеивающей спо-
собности применяются главным образом для деталей простой кон-
фигурации.
На катоде происходит разряд гидратированных ионов цинка:
( Zn2+-mH2O + 2е = Zn + mH20.
Осаждение идет при низкой катодной поляризации, что при-
водит к образованию грубокристаллических осадков. Для улуч-
шения структуры в электролит вводят различные добавки. По-
вышение электропроводности электролита достигается за счет
введения солей с одноименным анионом: сульфата натрия, суль-
фата аммония, сульфата алюминия.
Для стабилизации pH в состав электролита необходимо вво-
дить буферные добавки. Обычно электролиты работают при
pH 4—5. При увеличении кислотности резко снижается выход
по току цинка, так как на катоде начинает выделяться водород,
при уменьшении рн осадки становятся хрупкими и губчатыми
вследствие образования оксидов и гидроксидов цинка, которые,
109
Рис. 10.3. Влияние сульфата
алюминия на катодную по-
ляризацию в сульфатном
электролите цинкования:
1 — отсутствие Als(SO4)a; 2 —
наличие Ala(SO4)a
Рис. 10.4. Влияние ПАВ
на катодную поляризацию
в сульфатном электролите
цинкования:
1 — без ПАВ; 2 — 10 г/л дек-
стрина
внедряясь в покрытие, ухудшают его качество. Лучшей буферной
добавкой является сульфат алюминия (если pH электролита не
превышает 4,5). При pH 4,0 сульфат алюминия подвергается гид-
ролизу, образуя студнеобразный гидроксид алюминия, наличие
которого является своеобразным индикатором правильного ве-
дения процесса.
Введение сульфата алюминия, являющегося коллоидом, по-
вышает катодную поляризацию, вследствие чего осадки улучшают
структуру и приобретают красивый внешний вид. На рис. 10.3
показан ход поляризационных кривых в отсутствии и при нали-
чии сульфата алюминия. Вместо сульфата алюминия можно вво-
дить эквивалентное количество алюмокалиевых квасцов.
Введение ПАВ позволяет улучшить структуру покрытий.
Так как поверхность цинка в кислых электролитах заряжена от-
рицательно, необходимо вводить ПАВ катионного типа, а также
коллоиды: столярный клей, декстрин и т. п. Эффективное действие
ПАВ проявляется лишь при комнатных температурах. На рис. 10.4
показано влияние ПАВ на катодную поляризацию.
В качестве блескообразователей применяют добавки ДЦУ
и У-2, применяемые в текстильной промышленности в качестве
закрепителей при окраске. Добавка ДЦУ представляет собой аце-
тат продукта конденсации дициандиамида с формальдегидом.
Технический продукт хорошо растворяется в воде и представляет
собой сиропообразную жидкость желтого или коричневого
цвета. Продукт У-2 получается путем конденсации дициандиамида
и уротропина в уксусной кислоте. Технический продукт представ-
ляет собой мутную сиропообразную жидкость. При совместном
введении в электролит ДЦУ и У-2 осадки становятся блестящими
и имеют хорошую адгезию.
Плотность тока в сульфатных электролитах без перемешивания
поддерживается 2—3 А/дм2. При перемешивании ее можно увели-
чить до 6 А/дм2. При нанесении цинка на полуфабрикаты в про-
точных электролитах плотность тока повышают до значительных
значений при одновременном повышении температуры.
Состав сульфатных электролитов приведен в табл. 10.3.
110
КПЗ. Состав (г/л) сульфатных электролитов цинкования н режим работы
Компоненты электролита и 1 режим осаждения Номер электролита
1 2 3
1 ZnSO4-7H2O 200—250 250—300 575—700
Al2(SO4)s-18H2O 20—30 30—40 25—30
Na2S04-10H20 50—100 80—100 —
Декстрин 8—10 1—2 •—
ДЦУ 0,5—1 0,5—1 2
У-2 —. 1,5—2 —
iK, А/Дм2 1—4 2—4,5 50—400 *
/, °C 15—30 15—30 40—50
рн 3,6—4,4 3,0—4,0 3,8—4,4
• При перемешивании.
%
I
Электролит 1 рекомендуется для покрытия деталей на под-
весках и во вращательных установках, электролит 2 — для по-
лучения блестящих покрытий, электролит 3 — для цинкования
проволоки и листов.
Цинкование можно вести и на токе переменной полярности.
В этом случае плотность тока может быть увеличена в 2—3 раза
по сравнению с обычными электролитами. Выход по току 96—
98 %, рассеивающая способность не уступает электролитам, ра-
ботающим на постоянном токе. Полный период обработки около
6 с, отношение катодной обработки к анодной составляет 6:1.
Анодный процесс протекает без осложнений, и аноды растворя-
ются с выходом по току, не превышающим 100 %. Цинкование
проводят не только на подвесках, но и в барабанах и колоколах.
За счет истирания слоя цинка и частичного экранирования дета-
лей условия осаждения во вращательных установках существенно
отличаются от обычных, поэтому расчетное время осаждения
увеличивают в 1,5—2 раза. При толщине слоя 9—12 мкм скорость
осаждения настолько уменьшается, что практически осаждение
цинка прекращается. Выход по току во вращательных установках
не превышает 50 % за счет экранирования, истирания и других
факторов, влияющих на процесс осаждения.
Для приготовления сульфатных электролитов все компоненты
растворяют в отдельных емкостях в воде, нагретой до 50—60 °C.
Борную кислоту растворяют в горячей воде. После отстаивания
и фильтрации растворы сливают в рабочую ванну и доливают
ее водой до заданного объема. После проверки pH электролит
корректируют 2—3 %-ным раствором серной кислоты или гидро-
ксида натрия и прорабатывают током со случайными катодами при
напряжении 1—1,5 В и плотности тока 0,5—0,8 А/дм2 до полу-
чения светлых и гладких покрытий, после чего приступают к
Э КС ПЛ у аТ а ЦИ И. ’ ; ~ tдр i ак л ч < л *.* ‘ ’1 •«*. ? ? ч* « ч * ч »v
Hl
Блескообразователи вводят после проработки электролита.
Добавку ДЦУ разбавляют водой в соотношении 1 : 10 и добавляют
небольшими порциями в ванну при периодическом помешивании,
У-2 вводят непосредственно в ванну. При наличии дисульфонаф-
талиновой кислоты ее растворяют в небольшом количестве/воды,
нейтрализуют слабым раствором гидроксида натрия и добавляют
через фильтр в ванну. Декстрин растворяют в холодной воде и
добавляют в электролит, нагретый до 70 °C. Корректируют элек-
тролит по данным химического анализа, добавляя отдельные
компоненты до заданного состава. Вредными примесями в (кислых
электролитах являются соли более положительных, чей цинк,
металлов. Выделяясь на предельном токе, они делают покрытие
губчатым, темно-серым, а иногда и черным. Предельно допус-
тимая концентрация As > 0,005 г/л, Sb >0,05 г/л, Си > 0,8 г/л,
Fe > 0,6 г/л. Не допускается присутствие соединений Мп, Сг и ни-
тратных солей. Очищают электролит от вредных примесей прора-
боткой током при напряжении 2 В и низкой плотности тока —
порядка 0,2—0,3 А/дм2. Кроме того, их можно удалять, остав-
ляя цинковые аноды без тока. При этом происходит контактное
выделение более положительных металлов. Затем аноды из-
влекают из ванны и очищают металлическими щетками.
Железо удаляют, добавляя в электролит пероксид водорода
Н2О2 (0,5 мл на 1 л раствора) для перевода Fe2+ в Fe3+, а затем
осаждают его в виде Fe(OH)3 при помощи NaOH или Na2CO3.
Темные пятна на покрытиях могут появиться вследствие недобро-
качественного декстрина. Для устранения этого дефекта электро-
лит прорабатывают током при pH 2—3, перемешивая его сжатым
воздухом и добавляя 0,5—1,0 мл/л пероксида водорода. Большое
содержание органических добавок вызывает хрупкость покрытий,
их удаляют фильтрованием электролита через активированный
уголь.
Хлоридные электролиты. Хлоридные электролиты применяются
значительно реже, несмотря на то, что их электропроводность
в 2 раза выше сульфатных. Объясняется это тем обстоятельством,
что получение химически чистого хлорида цинка крайне трудно,
а остальные марки этой соли имеют большое количество вредных
примесей.
Для получения блестящих цинковых покрытий на деталях
сложного профиля могут быть рекомендованы электролиты сле-
дующего состава, г/л:
Электролит 1 Электролит 2
ZnCl2 60—120 20—70
КС1 180—230 200—250
Н3ВО„ 15—30 15—30
Лимеда НЦ-10 30—70 20—70
Лимеда НЦ-20 2,5—5,0 2,5—10
tK, А/дм2 0,5—5,0 0,5—1,5
7, °C 15—30 15—30
рн 4,5—6 4,5—5,8
112
Рис. lb.5. Влияние плотности тока и тем-
пературы на выход по току в борфторидиом
\ электролите цинкования:
1 — /f= 5 °C; 2 — t = 40 °C; 3 — t = 20 °C
Электролит 2 предназначен для нанесения цинка во вращатель-
ных установках. Необходима фильтрация электролитов, а электро-
лит 1 должен перемешиваться. Толщина цинка 18 мкм. Ион хлора
очень активен, поэтому аноды быстро разрушаются, а при пло-
хой промывке ионы хлора вызывают коррозию цинковых покрытий.
Борфторидные электролиты. Основным компонентом является
борфторвд свинца, который получается при взаимодействии оксида
цинка и (борфтористоводородной кислоты:
ZnO + 2HBF4 = Zn(BF4)2 + Н2О.
Для повышения электропроводности вводят NH4CL Обра-
зующаяся при этом соль NH4BF4 способствует увеличению катод-
ной поляризации, так как имеет одноименный с основной солью
анион. Кислотность электролита поддерживают при помощи
Н3ВО3. Введением ПАВ улучшают структуру покрытий.
Масса поглощенного водорода в 6—8 раз меньше по сравнению
с покрытиями, полученными из цианидных электролитов. Как
видно из рис. 10.5, на выход по току оказывает большое влияние
режим работы. С ростом плотности тока выход по току уменьша-
ется и, наоборот, с повышением температуры — увеличивается.
При температуре 20 °C катодная плотность тока может быть
4—5 А/дм2, при повышении температуры до 40 °C плотность тока
составит более 10 А/дм2. Высокие плотности тока выгодно отли-
чают борфторидный электролит от сульфатного (который, в свою
очередь, намного дешевле) и позволяют применять его для непре-
рывного цинкования проволоки. Ниже приведены один из составов
(г/л) борфторидного электролита и режим его работы:
Zn(BF4)2 ................
NH4BF4...................
HSBO8....................
Тиомочевина .............
250—300 ОС-20..................1,5—2,0
25—30 iK, А/дм2.................До 4—5
15—30 t, °C..................15—25
4—5 pH......................3,0—4,5
При наличии борфтористоводородной кислоты составление элек-
тролита не вызывает затруднений. При ее отсутствии в рабочую
ванну заливают плавиковую кислоту и вводят борную кислоту:
Н3ВО3 + 4HF = HBF4 + ЗН2О.
В соответствии с уравнением реакции для получения 180 г
HBF4 необходимо 300 г технической 40 %-ной плавиковой кислоты
113
и 106 г борной кислоты, которая берется с небольшим избытком.
Так как плавиковая кислота вызывает сильные ожоги, а реакция
взаимодействия ее с борной кислотой является экзотермической,
необходимо соблюдать большую осторожность. /
В полученный раствор борфтористоводородной кислоты для
получения соответствующих солей вводят оксид цинка и 25 %-ный
раствор аммиака: /
ZnO + 2HBF4 = Zn(BF4)a + НаО; /
NH4OH + HBF4 = NH4BF4 + H2O. /
Быстрое растворение оксида цинка происходит лишь в том
случае, если он находится в виде порошка, еще быстрее происходит
образование Zn (BF4)2 при растворении свежеосажденного гидрок-
сида цинка. Все растворы готовят в ванне, выложенной свинцом
или винипластом. Готовый электролит прорабатывают^ током.
§ 10.4. ЦИАНИДНЫЕ ЭЛЕКТРОЛИТЫ I
Основным компонентом цианидных электролитов яв-
ляется комплексная соль Naa [Zn (CN)41, которая образуется при
взаимодействии оксида цинка или гидроксида цинка с цианидом
натрия:
Zn(OH)2 + 4NaCN Na2[Zn(CN)4] + 2NaOH;
Zn(OH)2 + 2NaOH -» Na2ZnO2 + 2HaO
или в целом
2Zn(OH)a + 4NaCN—> Naa[Zn(CN)J + Na2ZnO2 + 2HaO.
Таким образом, в результате растворения гидрооксида цинка в
растворе цианида натрия обязательно образуется гидроксид натрия,
часть которого идет на образование цинката натрия.
Диссоциация комплексной соли цинка протекает в несколько
стадий, и на катоде восстанавливаются ионы цинка:
Na2[Zn(CN)4l — 2Na+ + Zn(CN)|~;
Zn(CN)2’ Zn2+ + 4CN~; Zn2+ + 2e Zn.
Константа нестойкости комплексного аниона
= [Zn2+]-[CN’]4/[Zn(CN)t] = 4,2- IO-24.
Комплексные анионы Zn (CN)2- диссоциированы в электролите
в очень малой степени, поэтому их концентрацию практически
можно считать постоянной величиной. Концентрацию ионов
CN- заменяем их исходной концентрацией, так как NaCN нацело
114
Рис. 10.6. Зависимость катодной по-
ляризаций в цианидных электролитах
цинкования от концентрации цианида
I натрия, г-экв/л:
1 — 2,18; 12 — 2,58; 3 — 3.225; 4 — 4,3
Рис. 10.7. Влияние плотности тока на
выход по току в цианидном электро-
лите цинкования при температуре
30 °C NaCN: Zn:
1 — 2,0; 2 — 2,25; 3 — 2,5; 4 — NaCN :
: Zn — 2,75
диссоциируют на ионы, тогда уравнение принимает следующий
вид:
[Zn2+] [NaCN] = [Zn(CN)M Ки = Kt.
Следовательно, концентрация ионов цинка в цианидном элек-
тролите обратно пропорциональна четвертой степени концентрации
NaCN и первой степени концентрации комплексного аниона.
Процесс осаждения цинка из-за малой концентрации ионов
протекает при значительной поляризации, что способствует
осаждению мелкозернистых покрытий. Поляризация тем выше,
чем больше концентрация NaCN. На рис. 10.6 представлена за-
висимость поляризации от концентрации NaCN, общее количество
свободных NaCN и NaOH составлят 4,3 г-экв/л. Однако при вы-
соких значениях NaCN из-за выделения водорода выход по току
падает, приближаясь с повышением плотности тока к нулю
(рис. 10.7), состав электролита, г/л: Zn — 35; NaCN общ — 75;
NaOH общ — 75.
Заметно выше выход по току у электролитов, содержащих
в своем составе цинкаты натрия, которые образуются в щелочной
среде, поэтому введение в электролит NaOH или КОН позволяет
увеличить выход по току. Цинкаты натрия диссоциируют в рас-
творе, образуя ионы Zn2+:
Na2ZnO2 —► 2Na+ 4~ ZnOl ;
ZnO2~ + 2H2O Zn2+ + 4OH~.
В связи с этим на катоде происходит дополнительный разряд
ионов цинка, что создает условия для увеличения выхода по току.
Для правильного ведения процесса необходимо, чтобы цианида
натрия и гидроксида натрия содержалось в электролите в избытке.
Качество осадка во многом зависит от суммарного соотношения
избытка цианида натрия и щелочи. При завышенном соотношении
в электролите образуется большое количество карбонатов за счет
115
Рис. 10.8. Влияние температуры на катодный
выход по току в цианидном электролите/1 цин-
кования: /
; _ t = 85 °C; 2 — t «= 56 °C; 3 — t — ЗО°С
взаимодействия NaOH с оксидом угле-
рода (IV), который находится в вфдухе,
а
и
также благодаря окислению / NaCN
NaOH: J
NaCN 4- NaOH + H2O + l/20a =
= Na2CO3 4- NH3; /
2NaOH 4- CO2 = Na2CO3 4- ’H2O.
При недостатке щелочи может произойти крайне нежелатель-
ное явление — образование циановодородной (синильной) кис-
лоты:
2NaCN 4- СО2 4- Н2О = Na2CO3 4- 2HCN.
Процесс карбонизации приводит к уменьшению концентрации
цинка и цианида натрия в электролите, что снижает не только ка-
тодный, но и анодный выход по току. Ухудшается адгезия покры-
тия, и происходит пассивация цинковых анодов. Предельно допу-
стимая концентрация карбонатов 30—40 г/л.
Большое влияние на качество покрытий оказывает режим
электролиза. Температуру в цианидных электролитах поддержи-
вают в пределах 20—40 °C. Как было указано выше, с повышением
температуры выход по току увеличивается (рис. 10.8), однако сле-
дует учитывать, что увеличение температуры свыше 35 °C крайне
опасно в связи с образованием сильнейшего яда, каким является
циановодород. Существует прямая зависимость между плотностью
тока, температурой и концентрацией цинка в электролите. Обы-
чно плотность тока составляет 0,5—5,0 А/дм2. Дальнейшее увели-
чение плотности тока \приводит к снижению выхода по току до
50 % и ниже; pH электролита поддерживается в пределах 10—13,
при этом образуются в основном цианидные комплексы и электро-
лит обогащается ионами CN-. При pH > 13 образуются преиму-
щественно цинкаты натрия. В применяемых в промышленности
электролитах (табл. 10.4) выход по току составляет 80—90 %.
Для получения блестящих покрытий в электролит добавляют
органические вещества. Блескообразующее действие этих добавок
зависит от температуры и может исчезнуть при температуре свыше
30 °C.
Электролиты 1—2 предназначены для цинкования на под-
весках. Электролиты 3—5 рекомендуются для получения блес-
тящих покрытий. Электролит 5 используется для цинкования
деталей во вращательных установках.
При цинковании в цианистых электролитах применяют цинко-
116
10.4. Состав (г/л) цианидных электролитов цинкования и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3 4 5
ZnO 10—18 40—45 40 10—45 40—45
NaCN общий 20—30 80—85 75—85 20—90 80—90
NaOH 50—70 40—60 75—85 60—85 70—90
Na2S Глицерин 0,5—1,0 — — — —
Блескообразователь БЦУ — — 1 мл/л 4 мл/л —
Циклогексанон — — 0,5—10 — —
Блескообразователь БЦ-2 — — — — 8 мл/л
iK, 0,5—2,0 0,5—2,0 2—20 1—6 0,5—2,0
t, °C 15—40 15—20 18—25 18—35 18—35
вые аноды марок ЦО, Ц1 и Ц2. Для увеличения выхода по току
к ним добавляют 0,3 % ртути и 0,5 % алюминия, так как величина
перенапряжения водорода на них выше, чем на цинке. В некоторых
случаях, например при избытке Zn2+, в электролит добавляют не-
растворимые стальные аноды. Соотношение площадей растворимых
и нерастворимых анодов устанавливается опытным путем.
Исходными компонентами для приготовления цианидных элек-
тролитов являются Zn (ОН)2, ZnO, NaCN и NaOH. Гидроксид
цинка получают из сульфата цинка
ZnSO4 + 2NaOH = Zn(OH)2 + Na2SO4.
Осадок гидроксида цинка отделяют от раствора путем деканта-
ции и тщательно отмывают от сульфата натрия. При наличии ок-
сида цинка его разводят в небольшом количестве воды до пасто-
образного состояния и тщательно перемешивают.
Отдельно, соблюдая правила безопасности при работе с сильно-
действующими ядовитыми веществами, приготавливают раствор
цианида натрия и постепенно при тщательном перемешивании до-
бавляют в приготовленные ранее растворы. После растворения
основной массы оксида цинка вливают раствор гидроксида натрия
и все тщательно перемешивают. Затем раствор переливают в ра-
бочую ванну и добавляют необходимое количество воды. В течение
нескольких часов прорабатывают электролит током до получения
светлых осадков цинка, после этого добавляют блескообразова-
тели.
В цианидных электролитах, как и в кислых, вредными приме-
сями являются соли более электроположительных, чем цинк,
металлов: меди, серебра, мышьяка, висмута, сурьмы, олова и др.
Однако примеси в цианидных электролитах оказывают гораздо
меньшее влияние на качество осадков, чем в кислых. Различие
обусловлено тем, что в данном случае часть примесей, образуя
комплексные соединения, находится в электролите в небольших
117
количествах. Удалить их можно химическим путем, осаждая в
виде сульфидов серосодержащими соединениями, чаще всего при
помощи Na2S. Для компенсации убытка через каждые 2—3 дня
вводят Na2S в количестве 0,1—0,3 г/л.
Можно производить удаление вредных примесей, осаждая их
цинковой пылью. Особенно это касается меди, сульфиды которой
хорошо растворимы в цианидных растворах. Цинковую пыль
добавляют из расчета 5—10 г/л, выдерживают раствор в течение
24 ч при температуре 45 °C, прорабатывают затем током при ком-
натной температуре в течение 0,5—2 ч со свинцовыми катодами при
плотности тока 5—9 А/дм2.
Удаление органических примесей производят введением 1—
, 2 г/л активированного угля, через 2—3 ч электролит перемешивают
и фильтруют. Пассивную пленку с анодов удаляют стальной щет-
кой. Карбонаты удаляют при помощи гидроксидов бария или
кальция из расчета 1,5 на 1 г карбонатов. В случае чрезмерного
накопления их можно удалить вымораживанием, охлаждая элект-
ролит до —5 °C.
§ 10.5. цинкатные электролиты
Основным компонентом цинкатных электролитов яв-
ляется комплексная соль цинка Na2ZnO2 или K2ZnO2, которая
образуется в результате взаимодействия оксида или гидроксида
цинка с гидроксидом натрия. Диссоциация комплексов протекает
ступенчато, и процесс осаждения происходит при достаточно вы-
сокой катодной поляризации:
ZnO + 2NaOH = Na2ZnO2 + Н2О;
Na2ZnO2 2Na+ + ZnO2';
ZnO2" + 2H2O Zn2+ + 4OH“.
Без специальных добавок осадки цинка даже при малых плот-
ностях тока имеют темный цвет и губчатую структуру за счет
внедрения в них мельчайших частиц, образовавшихся за счет хи-
мического растворения цинковых анодов в щелочной среде. До-
бавки небольших количеств олова в виде соединений, содержащих
его в четырехвалентной форме, позволяют полностью перевести
металлический цинк в раствор:
2Zn + Sn*+ — 2Zna+ + Sn.
Вместо олова можно добавлять соли ртути или свинца. Такие
электролиты с успехом применялись длительное время в про-
мышленности и в ряде случаев заменяли ядовитые цианидые
электролиты при осаждении малонапряженного цинка на детали
сложного профиля.
В настоящее время в цинкатные электролиты добавляют орга-
нические добавки: полиэтиленполиамин, трилон Б, полиэтилен-
118
Рис. 10.9. Влияние концентрации цинка в цинкатном
электролите на допустимый верхний предел плот-
ности тока:
1 — 0,45 н.; 2 — 0,26 и.; 3 — 0,124 и.; 4 — 0,05 н.
имин и др. Это позволяет получать плотные
осадки цинка при более высоких плотностях
тока.
Концентрация цинка в применяемых элек-
тролитах составляет 10—35 г/л, что опреде-
ляется растворимостью исходных компонен-
тов. Отношение общей концентрации NaOH к концентрации Zn
равно 9—10 г-экв/л. Гидроксид натрия находится в электро-
лите не только в связанном, но и в свободном виде. Избыток
необходим для устойчивости комплексного соединения. При его
недостатке снижается электропроводимость раствора и становится
возможным выпадение в осадок гидроксида цинка. Чрезмерная
масса свободного гидроксида натрия снижает выход по току,
покрытия становятся грубыми, а аноды начинают химически
растворяться.
Катодная плотность тока находится в прямой зависимости от
концентрации цинка и температуры электролита (рис. 10.9). Пере-
мешивание электролита сжатым воздухом позволяет увеличивать
верхний предел плотности тока в 1,5—2 раза. Температура элек-
тролита должна быть 50—70 °C. В качестве блескообразующих
добавок в цинкатные электролиты добавляют НБЦ—О, НБЦ—К.
При повышении плотности тока свыше 4—-5 А/дм2 аноды легко
пассивируются, покрываясь черной пленкой оксидов. При более
низких плотностях тока катодный выход по току по сравнению
с анодным понижается и для стабилизации раствора необходимо
вести осаждение при iK: ia = 1,5 4-2,0.
Аноды можно изготавливать из технического цинка с содержа-
нием Sn до 1 %, а РЬ —-от 0,5 до 1 %. В табл. 10.5 приведены
составы и режим работы цинкатных электролитов В электро-
лите 4 получаются блестящие покрытия. Блескообразователь
НБЦ—О вводится только при приготовлении электролита.
Блескообразователем НБЦ—К производится корректирование
электролита по мере ослабления блеска. При нанесении покрытий
во вращательных установках плотность тока iK = 0,54-1,5 А/дм2.
Для приготовления цинкатных электролитов необходимый
объем гидроксида натрия (1/10 рабочего объема) растворяют в воде
и нагревают до 90—100 °C. После этого добавляют оксид цинка
или свежеосажденный гидроксид цинка. Раствор фильтруют через
щелочестойкий фильтр в рабочую ванну и вводят остальные ком-
поненты. Олово вводят в виде Na2SnO3, который приготавливают
из SnCl2. Для окисления Sn2+ в Sn4+ добавляют Н2О2 из расчета
2 мл Н2О2 на 1 г Na2SnO3. Проработку электролита током ведут
до получения на катоде светлых осадков. Покрытие получается
119
10.5. Состав (г/л) и режим работы цинкатных электролитов
Компоненты электролита и режим работы Номер электролита
I 2 3 4
ZnO 10 15 10 10—17
NaOH общий 80 150 100 90—120
SnCl4 1 — — —
Полиэтиленполиамин _—, 3 -—. —
(ПЭПА)
Трилон Б — 10 _—, —
Фурфурол 1 мл/л -— —
Блескообразователь НБЦ-О -— — 4—6 мл/л
Блескообразователь НБЦ-К -— — — 4—6 мл/л
Полиэтиленимин (ПЭИ) — -—. 1 —
»к, А/дм2 До 1,2 0,5—3 1—5 1—4
«а, А/дм2 До 1,5 1—3 6—7 1—2
t, °C 50 18—25 50 20—30
темным, губчатым при наличии в электролите Sn2+. В этом слу-
чае необходимо добавить Н2О2. Отсутствие покрытия по всей по-
верхности наблюдается при наличии окислителей в электролите,
например Н2О2, и т. п. Необходимо проработать электролит со
случайными катодами постоянным током, а при загрязнении
солями HNO3 его следует заменить новым. При загрязнении шла-
мом или механическими примесями электролит отфильтровывают
и на аноды надевают чехлы.
§ 10.6. ХЛОРАММОНИЙНЫЕ И АМИНОКОМПЛЕКСНЫЕ
ЭЛЕКТРОЛИТЫ
Хлораммонийные электролиты. Основным компонен-
том электролита является комплексная соль Zn (NH3)nCl2, которая
образуется при растворении цинка в избытке NH4C1 (п = 2 в
кислой среде, п = 4 в щелочной среде):
ZnO + nNH4Cl — Zn(NH3)nCl2 + Н2О.
В результате диссоциации образуется катион Zn (NH3)2+
устойчивый во всех средах: •
Zn(NH3)nCl2^ [Zn(NHs)n]«* + 2С1-;
[Zn(NH3)„]2+ + nH2O^Zn2+ + nNHJ + nOH".
Высокая катодная поляризация и хорошая электропроводность
электролита оказывают благоприятное влияние на рассеивающую
способность, которая выше рассеивающей способности всех не-
цианидных электролитов. Покрытия получаются светлыми, рав-
номерными даже на деталях сложного профиля с мелкокристалли-
ческой структурой. Аммонийные электролиты с успехом приме-
120
няются для нанесения цинка на мелкие детали во вращательных
установках.
Растворимость ZnO в растворе NH4C1 зависит от кислотности,
при pH 6,3—7,0 растворяется 14—15 г/л ZnO. В более кислой и
щелочной средах растворимость резко увеличивается. В применяе-
мых электролитах концентрация ZnO составляет 15—100 г/л
в зависимости от pH и концентрации NH4C1.
Ранее в промышленности применялись аммонийные электро-
литы на основе ZnSO4. При взаимодействии с раствором NH4C1
они также образуют комплексные соединения типа Zn (NH3)2SO4.
Сернистый цинк хорошо растворяется в NH4C1 при pH >7. В кис-
лой среде его растворимость уменьшается и доходит до нуля,
при этом в осадок выпадает труднорастворимая соль цинка.
Для стабилизации pH в электролиты добавляют буферные до-
бавки, чаще всего Н3ВО8. С целью улучшения структуры в хлор-
аммонийные электролиты вводят в качестве ПАВ столярный клей,
желатину и т. п. Для получения блеска используют блескообразо-
ватели.
В промышленности хорошо зарекомендовали себя хлораммо-
нийно-уротропиновые электролиты. В их состав входит дополни-
тельно уротропин, который с цинковыми солями образует комп-
лексные соединения. Такие электролиты имеют рассеивающую
способность, приближающуюся по своим значениям к рассеиваю-
щей способности цианидных электролитов. Цинковые аноды при
низких плотностях тока легко пассивируются, поэтому в качестве
депассиваторов вводят ацетат аммония.
После цинкования во всех хлораммонийных электролитах не-
обходима тщательная промывка деталей от иона С1_, иначе нач-
нется ускоренная коррозия цинковых покрытий. Составы и ре-
жим работы хлораммонийных электролитов приведены в табл. 10.6.
Электролиты 1—3 применяют для осаждения матовых покры-
тий, электролиты 4—5 — для осаждения блестящих. Перемеши-
вать электролиты сжатым воздухом нельзя. Корректирование
электролитов при уменьшении блеска производят при помощи
Ликонда ZnSZ?—S. Электролит 4 можно применять во вращатель-
ных установках. Предельная толщина слоя цинка 18 мкм.
Хлораммонийный электролит готовят следующим образом.
Растворяют оксид цинка в небольшом количестве воды до сметано-
образного состояния и тщательно перемешивают. В половине ра-
бочего объема воды, нагретой до 70—80 °C, растворяют NH4C1
и вводят раствор ZnO. Отдельно в горячей воде растворяют бор-
ную кислоту. После растворения всех компонентов раствор
декантируют в рабочую ванну, столярный клей или декстрин за-
ливают холодной водой на сутки, нагревают до 60—80 °C и вводят
в электролит. Полученный раствор доводят до рабочего объема и
проверяют pH. Если pH меньше заданного значения, вводят вод-
ный раствор аммиака, если выше, — раствор ацетата натрия.
121
10.6. Состав (г/л) хлораммонийных электролитов цинкования
и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3 4 6
ZnO 25—40 .
ZnSO4-7HaO — 80—100 120—140 — —
ZnCl — — — 20—80 40—120
NH4C1 200—220 160—200 240—280 180—240 180—220
Ацетат натрия 80—100 —. ,— —. —
Н3ВО3 — .— 20—30 ,— —
Клей столярный — 1—2 — — —
Уротропин 20—25 — — — —
Диспергатор НФ 6—8 — 70—80 — —.
ОС-20 4—5 — — —. .—.
Тиомочевина — — 10—15 .— —
Ликонда ZnS/?—А, мл/л — — — 30—70 30—70
Ликонда ZnS/?—В, мл/л — — — 5—15 3—5
iK, А/дма 1—3 0,8—1,5 До 11 0,5—1,5 0,5—5,0
/, °C 20—35 15—30 15—30 15—30 15—30
рн 7,5—8,2 5,8—6,5 4,5—6,0 4,5-6,0 4,5—6,0
Затем добавляют блескообразователи. Проработку ведут до вве-
дения блескообразующих добавок при tK= 0,25-4-0,50 А/дм2.
Сульфатаммонийный электролит готовят аналогичным путем.
Только в раствор NH4C1 вводят растворенный в минимальном
количестве воды ZnSO4 и отдельно приготовленный раствор
CH3COONa. После растворения всех компонентов раствор фильт-
руют и вводят диспергаторы, доливают водой до рабочего объема
и прорабатывают электролит током, как указано выше, до полу-
чения светлых и гладких осадков цинка.
Аминокомплексные электролиты. Добавление к хлораммоний-
ным электролитам органических соединений типа триэтаноламин,
моноэтаноламин, полиэтиленполиамин позволяет в значительной
степени увеличить катодную поляризацию цинка за счет образо-
вания дополнительных аминокомплексных соединений. Рассеиваю-
щая способность таких электролитов достаточно высока, осадки
получаются мелкокристаллическими, а из полиэтилендиамино-
вого электролита — блестящими. Полиэтилендиамин представляет
собой смесь, 90 % которой составляет триэтилентетрамин, осталь-
ное — этилендиамин, диэтилендиамин и т. п. Все электролиты на
основе аминокомплексных соединений работают при комнатной
температуре. Так как электропроводность растворов невелика
вследствие больших размеров молекул аминов и их малой подвиж-
ности, в электролиты добавляют соли аммония. В таких растворах
можно покрывать цинком сложнопрофилированные детали, при
этом осадки получаются светлыми и блестящими, однако выход
по току при введении солей аммония несколько снижается.
122
10.7. Составы (г/л) электролитов цинкования на основе
аминокомплексных соединений и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3
ZnO 30
ZnSO4-7HaO 120
NH4C1 180 200
Желатин или столярный клей 1,0—1,5 .—
МЭА (40 % -ный раствор) 160 мл/л —- —
ТЭА (75 % -ный раствор) — 250 мл/л —
ПЭПА — — —
«к, А/дма 1,5—2,0 1—10
ia, А/дм? 1,0 —
t, °C 15—25 20
pH 8—9 7,95
В моноэтаноламиновый электролит добавляют соли кадмия,
что улучшает растворимость цинковых анодов за счет образования
микрогальванического элемента Zn—Cd. В остальных электро-
литах цинк растворяется хорошо.
Так как амины токсичны, необходимо приготавливать все
растворы в специальных помещениях, снабженных вентиляцией.
Этилендиаминовый и моноэтаноламиновый растворы готовят сле-
дующим образом. В теплой воде растворяют NH4C1 и в него вводят
при помешивании ZnO, смоченный водой, после охлаждения раст-
вора до 35—40 °C к нему добавляют триэтаноламин или моноэта-
ноламин и заранее приготовленный раствор желатина или клея.
Порабатывают электролит из расчета 1—5 А-ч/л. Для приготов-
ления полиэтиленполиаминового электролита растворяют ZnSO4,
а затем добавляют полиэтиленполиамин и концентрированный
раствор NH4C1. В табл. 10.7 приведены составы электролитов на
основе аминокомплексных соединений.
§ 10.7. ПИРОФОСФАТНЫЕ ЭЛЕКТРОЛИТЫ
Основным компонентом электролита является комп-
лексное соединение, образующееся при взаимодействии сульфата
цинка с пирофосфатом натрия или калия, которые, особенно пи-
рофосфат калия, достаточно дефицитны и дороги. Осаждение цинка
протекает при высокой катодной поляризации, что наряду с вы-
сокой электропроводностью электролита обусловливает его хоро-
шую рассеивающую способность.
При взаимодействии исходных компонентов сначала выпадает
творожистый осадок пирофосфата цинка, который затем в из-
бытке пиросфосфата натрия растворяется с образованием комплекс-
ного соединения цинка:
2ZnSO4 + Na4P2O7 = Zn2P2O7 + 2Na2SO4;
Zn2P2O7 + 3Na4P2O7 = 2Nae[Zn(P2O7)2l.
123
10.8. Состав (г/л) пирофосфатных электролитов цинкования и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3
ZnSO4-7HaO 50—60 60—70 35—40
К4РаО7-ЗНаО — 300-330 140—150
Na4PaO7 • ЮНаО 180—200 .— —
(NH4)aHPO4 16—20 45—55 —
NaaHPO4 — -— 50
NH4C1 3—5 — —
Декстрин 3—5 — 10
Сульфаниловая кислота — 0,1—0,5 —
1к, А/дма 1—2 2—5 0,3—1,0
га, А/дма — 0,5—1,0 —
/, °C 50—55 20—30 15—30
pH 8,0—8,3 8,5—9,0 11,2—11,6
ВТ, % 95—75 92—83 95
Плотность тока прямо пропорциональна концентрации цинка
и температуре электролита. Обычно температуру электролита под-
держивают около 50 °C; при введении ПАВ и блескообразователей
температуру следует снижать до 30—35 °C.
Цинковые аноды склонны к пассивации, особенно если электро-
лит работает при пониженных температурах. В качестве депас-
сиваторов применяют сегнетову соль, хлорид аммония, цитрат
аммония. Площадь анодов при добавлении депассиваторов долж-
на быть в 2—3 раза больше катодной.
Составы пирофосфатных электролитов и режим их работы при-
ведены в табл. 10.8.
В электролит 1 в качестве блескообразователя можно добав-
лять фурфурол (1—3 мл/л), в этом случае температуру электро-
лита надо поддерживать в пределах 30—35 °C. В электролите 2
осаждаются блестящие покрытия. Электролит 3 может быть ре-
комендован для нанесения цинка во вращательных установках.
Для приготовления пирофосфатного электролита сначала раст-
воряют соли пирофосфата натрия или калия в подогретой до
80 °C воде. Отдельно растворяют при той же температуре сульфат
цинка. Растворы сливают и образовавшийся творожистый осадок
пирофосфата цинка при интенсивном перемешивании растворяют
в избытке пирофосфата натрия или калия. После этого раствор
охлаждают до комнатной температуры и сливают, удаляя оса-
док. Отдельно растворяют остальные компоненты и вливают их
в рабочую ванну. Доводят раствор водой до заданного уровня и
корректируют pH. Приготовленный электролит не требует про-
работки током.
124
§ 10.8. ОБРАБОТКА ЦИНКОВЫХ ПОКРЫТИЙ
Хроматирование. Цинковые покрытия под влиянием
активных агентов, которые находятся в атмосфере промышленных
городов, подвергаются интенсивной коррозии, и на их поверх-
ности появляются белые налеты солей.
Для повышения защитных свойств и улучшения товарного вида
цинковые покрытия подвергают хроматированию. Обработку ведут
в подкисленных растворах, содержащих хроматы и бихроматы
натрия. В результате такой обработки на поверхности цинка об-
разуется пассивная пленка, в состав которой входят наряду с ок-
сидами цинка и хрома гидратированные оксиды цинка и хрома.
Цвет пленки зависит от состава и режима раствора, она может
быть светло-зеленой, радужной с красноватым оттенком и бес-
цветной. Пленка имеет прочное сцепление с основным металлом,
но низкую механическую прочность. При периодическом сопри-
косновении с ней инструмента или рук она теряет декоративный
вид. Благодаря высокой пористости пленки улучшаются адгези-
онные свойства цинка и облегчается нанесение на него лакокра-
сочных покрытий.
Толщина пленки 0,25—0,50 мкм. При наличии в растворе суль-
фат-анионов, которые активизируют процесс хроматирования,
толщина пленки заметно увеличивается, особенно до температуры
20 °C, затем рост ее прекращается. Такие пленки имеют более
высокую коррозийную стойкость, так как в их состав входят
труднорастворимые хроматы цинка.
При нагреве свыше 60 °C начинается дегидратация и коррозий-
ная стойкость хроматной пленки уменьшается. Поэтому сушку
пленок следует производить теплым воздухом, нагретым до 50 °C.
Пленку следует оберегать от повреждений, так как ее окончатель-
ное отвердение наступает только через 24 ч. Категорически за-
прещается промывка деталей в горячей воде после хроматирова-
ния. При наличии небольших повреждений пленка способна ко
вторичному пассивированию, так как имеющаяся на поверхности
влага выщелачивает ионы хромовой кислоты, которые, попадая
на оголенные места, вновь пассивируют цинк.
Перед хроматированием производят химическое активирова-
ние цинковых покрытий в растворе H2SO4 (5—15 г/л) при тем-
пературе 15—30 °C в течение 3—5 с. Затем детали тщательно про-
мывают и подвергают • хроматированию. Осветление производят
в растворе HNOS (2—30 г/л) при температуре 15—30 °C в течение
0,1—0,3 мин.
В настоящее время выпускают концентраты под названием
Ликонда, которые позволяют получать хроматные пленки разных
цветов. Состав растворов хроматирования цинка приведен в
табл. 10.9.
Раствор 1 применяют после нанесения цинка в цианидных
электролитах, растворы 2, 3, 5 — для одновременного осветления
125
10.9. Состав (г/л) растворов хроматирования цинка и режим работы
Компоненты раствора и режим работы Номер раствора
1 2 3 4 6
h2so4 8—12 3—5 1,5—1,8 8—12
HNOS — 3—7 — 2 25-35
Na1CraO, или КзСгяО9 150—200 25—35 — — —
СгО8 — — 80—100 .—. 100—150
Na2SO4 — 10—15 -—. .— —
Ликонда 21 — .—. 40—50 —
t, °C 15—30 15—30 15—30 15—30 1&-30
%, мин 0,1—0,3 0,5—1,0 0,05—0,1 0,25—2,00 0,2
и хроматирования; пленки получаются радужными. Раствор 2 ис-
пользуют на автоматических линиях и во вращательных установ-
ках. Растворы для хроматирования необходимо корректировать,
так как постепенно концентрация исходных компонентов умень-
шается за счет внесения воды после промывки и уноса с деталями
части раствора. Разбавление раствора приводит к появлению пя-
тен, особенно внутри полостей и отверстий, т. е. там, где задержи-
вается вода.
Качество всех хроматных пленок проверяют при помощи
раствора (СН8СОО)2РЬ концентрацией 50 г/л. Если хроматной
пленки нет, остается черное пятно контактного цинка через 5 с
у бесцветных пленок. У цветных пленок черное пятно должно
появиться лишь через 60 с.
Фосфатирование. Цинковые покрытия можно подвергать фос-
фатированию обычно перед нанесением лакокрасочных покрытий.
Для этой цели используют готовый препарат Ликонда Ф1А (120—
140 г/л). Фосфатирование производят при температуре 18—40 °C
в течение 5—10 мин. Общая кислотность 25—30 точек. Можно
производить фосфатирование в растворе препарата Мажеф (30—•
40 г/л) с добавлением 30—60 г/л Zn (NO8)2 при температуре 20—
35 °C, время выдержки 20—40 °C.
Обезводороживание. Наводороживание стали при нанесении
цинковых покрытий отрицательно сказывается на ее механических
свойствах. Особенно это касается электролитов с низким выходом
цинка по току. Сильное наводороживание по этой причине проис-
ходит в цианидных электролитах, меньшее — в кислых электро-
литах, однако оно достаточно для ухудшения механических свойств
стальных деталей.
Для удаления водорода после нанесения цинковых покрытий
производят термическую обработку. Стальные детали с пределом
прочности 900—1400 МПа, а также детали, подвергающиеся де-
формации после нанесения покрытия, нагревают при темпера-
туре 180—200 °C в течение 2—3 ч. Детали с цементированными по-
верхностями обезводороживают при температуре 140—160 °C
126
в течение 3—4 ч. Детали, имеющие швы и пайку припоями с тем-
пературой плавления выше температуры обезводороживания,
нагревают в течение 3 ч при той же температуре. Нагрев деталей
производят постепенно.
ГЛАВА п. КАДМИРОВАНИЕ
§ 11.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА КАДМИЯ
И ОБЛАСТЬ ПРИМЕНЕНИЯ КАДМИЕВЫХ ПОКРЫТИЙ
Кадмий — серебристо-белый металл с синеватым от-
тенком, пластичнее цинка, хорошо выдерживает запрессовку,
вытяжку, развальцовку, завинчивание. Кадмиевые покрытия
имеют прочное сцепление с основным металлом, они обладают
хорошими антифрикционными свойствами, но низкой износостой-
костью. Температура плавления 321 °C, плотность 8,6 г/см3.
Твердость кадмиевых покрытий от 0,6 до 1,5 ГПа. Удельное
электрическое сопротивление кадмия 0,076-10_* Ом-м.
Кадмий — химический элемент II группы периодической си-
стемы Менделеева, атомный номер 48, атомная масса 112,41.
Во всех соединениях двухвалентен. Нормальный потенциал —
0,403 В. Близость стандартных потенциалов кадмия и железа
приводит к тому, что характер защиты кадмия меняется в зави-
симости от условий эксплуатации. Так, в обычных условиях кад-
мий по отношению к стали является катодным покрытием, т. е.
защищает его лишь механически, в то время как в морской
воде, содержащей такие ионы, как СГ и SO4-, потенциал кадмия
становится более отрицательным и характер защиты меняется,
кадмий в таких условиях является анодным покрытием. Следует
учитывать, что при непосредственном соприкосновении с морской
водой, солевыми брызгами и туманом кадмий по сравнению с цин-
ком обладает большей химической стойкостью (см. табл. 10.2).
В сухой атмосфере кадмий длительное время сохраняет свой
внешний вид. При наличии в атмосфере влаги он быстро тускнеет,
покрываясь тонкой оксидной пленкой, которая защищает его от
дальнейшего разрушения. Декоративный вид кадмия в этих усло-
виях лучше, чем у цинка, продукты коррозии которого очень
объемны.
В атмосфере промышленных городов, содержащей сульфиды,
кадмий покрывается пленками сульфида кадмия, которые хорошо
растворяются в воде и легко смываются дождями, усиливая даль-
нейшее разрушение металла. Скорость коррозии кадмия в этих
условиях в 1,5—2 раза выше, чем у цинка. Поэтому не рекоменду-
ется применять кадмиевые покрытия для деталей, работающих
в атмосфере промышленных городов, а также в контакте с топли-
вом и синтетическими маслами. Не применяют кадмиевые покры-
127
11.1. Толщина кадмиевых покрытий
Обозна- чение по- крытия Назначение покрытия Толщина кадмия, мкм, для условий эксплуатации
1 2 3 4 6 6 7 8
Кд Кд.хр Защитное Защитное; защитно- декоративное — — 12 — 30 18 30 18 40 18
тия в атмосфере, содержащей летучие агрессивные соединения,
выделяющиеся при старении из органических веществ: олифы,
масляных лаков и др.
В минеральных кислотах кадмий растворяется медленнее, чем
цинк. Наиболее энергично кадмий растворяется в HNO3. В отли-
чие от цинка кадмий не растворим в щелочах.
Продукты коррозии кадмия и его пары ядовиты, поэтому запре-
щается применять кадмий для защиты от коррозии деталей,
соприкасающихся с пищевыми продуктами. Отливку анодов из
кадмия необходимо производить под тягой, не допуская перегрева
металла свыше 400 °C. При приготовлении электролитов кадми-
рования следует соблюдать правила техники безопасности, пре-
дусмотренные для подобных веществ.
Высокая стоимость кадмия (в 50 раз дороже цинка) ограничи-
вает область применения. Кадмирование применяют для защиты
от коррозии наиболее ответственных деталей машин и приборов,
которые работают в условиях морского или влажного тропического
климата, например для защиты корабельной аппаратуры, различ-
ных судовых и портовых сооружений, находящихся в среде мор-
ских испарений, туманов или в морской воде, для защиты деталей
из высокопрочных пружинных сталей, работающих при темпера-
туре до 250 °C и эксплуатируемых в условиях морского климата,
для покрытия электрических контактов, так как кадмий поддается
пайке и имеет низкое переходное контактное сопротивление.
Высокая пластичность кадмия создает условия для легкой и плав-
ной затяжки всех резьбовых соединений, эксплуатируемых до
250 °C. Наносят кадмий для снижения электродных потенциалов
медных деталей, сопрягаемых с алюминием и коррозионно-стой-
кой сталью. Наносить кадмий можно на сталь, медь, алюминий и
их сплавы.
Для повышения защитных свойств кадмиевые покрытия, как
правило, подвергают хроматированию, что улучшает их товарный
вид. Исключение составляют покрытия на электроконтактных
деталях. Однако следует учитывать низкую механическую проч-
ность хроматных пленок. Кадмиевые покрытия можно также
фосфатировать, покрывать эмалями, лаками и т. п. Так как при
кадмировании снижается механическая прочность из-за наводоро-
живания, производят дополнительно термическую обработку по-
128
покрытий при температуре 180—200 °C, а для деталей с цементиро-
ванными поверхностями ее снижают до 140—160 °C.
Толщина кадмиевых покрытий устанавливается в зависимости
от условий эксплуатации. В табл. 11.1 приведена толщина кадмия
на стальных деталях согласно ГОСТ 9.303—84*.
§ 11.2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
ЭЛЕКТРОЛИТОВ
Существует большое количество электролитов кадми-
рования. Как и электролиты цинкования, они делятся на две груп-
пы: простые кислые и сложные комплексные. К простым кислым
электролитам, широко применяемым в промышленности, отно-
сятся сульфатные, борфторидные и др.; к сложным — цианидные,
аммонийные, пирофосфатные и некоторые другие на основе слож-
ных органических комплексов.
Из кислых электролитов удовлетворительные осадки можно
получать только в присутствии ПАВ, при этом структура покрытий
приближается к структуре покрытий, полученных в цианидных
электролитах, вследствие повышения катодной поляризации
(рис. 11.1). Выход по току из-за высокого перенапряжения водо-
рода на кадмии так же, как и при цинковании, около 100 %, т. е.
на катоде происходит преимущественный разряд ионов кадмия.
Кислые электролиты как с добавками, так и без них, имеют не-
большую рассеивающую способность, и поэтому их применение
ограничивается деталями простой конфигурации.
Цианидные электролиты позволяют получать плотные, мелко-
зернистые покрытия. Они обладают высокой рассеивающей спо-
собностью, поэтому до сих пор широко применяются в промышлен-
ности для нанесения кадмия на сложнопрофилированные детали,
зато выход по току у них несколько ниже, чем у кислых, так как
осаждение кадмия идет при высокой катодной поляризации и соз-
даются условия для выделения водорода на катоде (рис. 11.2).
Рис. 11.1. Кривые катодной поляризации электролитов цинкования:
1 — сульфатный; 2 — сульфатный с добавками ПАВ; 3 — цианидный; 4 — пирофос-
фатный
Рис. 11.2. Зависимость выхода по току от плотности тока и состава электролита
кадмирования:
1 — сульфатный; 2 — цианидный
5 Дасоян М. А. и др. Ий
Для замены вредных цианидных электролитов разработаны
сложные электролиты на основе аминопроизводных. Эти электро-
литы имеют высокую рассеивающую способность и обеспечивают
получение мелкозернистых покрытий. Однако большие трудности,
связанные с обезвреживанием сточных вод, препятствуют широ-
кому применению этих электролитов в промышленности.
§ 11.3. ПРОСТЫЕ КИСЛЫЕ ЭЛЕКТРОЛИТЫ
Сульфатные электролиты. Основным компонентом элек-
тролита является сульфат кадмия. Растворимость этой соли около
430 г/л при комнатной температуре. Концентрация кадмия в элект-
ролитах колеблется от 40 до 400 г/л. При более высоких концентра-
циях соли, чтобы избежать выпадения кристаллов на дно ванны,
необходимо одновременно повышать температуру электролита.
Такие высококонцентрированные электролиты позволяют рабо-
тать при повышенных плотностях тока и применяются главным
образом для нанесения кадмия на проволоку. В обычных же элект-
ролитах из-за высокой стоимости кадмия концентрация сульфата
кадмия составляет 40—60 г/л.
Так как рязряд ионов кадмия протекает при низкой катодной
поляризации, в электролиты для улучшения структуры вводят
ПАВ. Одновременное присутствие нескольких ПАВ оказывает
сильное влияние на катодную поляризацию и структуру покрытий,
так как при этом в прикатодной зоне образуются плотные адсорб-
ционные слои. В качестве ПАВ добавляют мездровый или столяр-
ный клей, желатин, закрепитель ДЦУ, ОС-20.
Для повышения электропроводности в электролит вводят
сульфат алюминия или сульфат аммония. Последние две соли,
а также борная кислота являются и буферными добавками, так
как удовлетворительные осадки получаются лишь в определенном
интервале pH. В зависимости от состава электролита и режима ра-
боты pH может колебаться в пределах 2—5,5. При повышении pH
происходят защелачивание электролита в прикатодной зоне и
образование гидроксида кадмия. Включаясь в осадок, гидроксид
кадмия способствует образованию рыхлых, губчатых и шерохова-
тых покрытий. При повышении кислотности на катоде начинает
выделяться водород и выход по току падает. Для интенсификации
процесса осаждения температуру и плотность тока повышают
одновременно с перемешиванием электролита. Однако увеличи-
вать температуру свыше 40 °C не рекомендуется, так как снижается
эффективное действие ПАВ.
Борфторидные электролиты. В состав борфторидного электро-
лита входят борфторид кадмия, борфтористоводородная кислота
и ПАВ. По сравнению с сульфатным электролитом он имеет бо-
лее высокую рассеивающую способность и позволяет вести про-
цесс осаждения при более высоких плотностях тока.
130
11.2. Состав (г/л) кислых электролитов кадмирования и режим работы
Компоненты электролита н режим работы Номер электролита
1 2 3 4 Б
CdSO4-8/3H2O 40—60 32—64
CdO — 15—30 10—12 — — —
Cd(BF4)2 — — — 140—145 140—145
H2SO4 40—60 38—75 25—30 — — —
H2SO4 40—60 ,— — —. —
A12(SO4)2 — — 50—100 — —,
nh4bf4 — -— —. 100—110
hbf4 — -— .— 33—35 40—45
Синтанол ДС-10 — — 10 — —
ДЦУ — — 10 — 2—3
Клей столярный — — 1 —
Лимеда Б К-10, мл/л — 1D—dU 10—12 — — —
iK, А/дма А °C 1—3 15—30 1—4 0,5—1,5 15—25 4—5 18—25 1—3 15—30 20—30
Примечание. В числителе указаны концентрация и плотность тока
при осаждении кадмия на подвесках, в знаменателе ~ во вращательных уста-
новках.
Добавление ПАВ вызывает значительное торможение катод-
ного процесса и образование светлых мелкокристаллических по-
крытий. В качестве ПАВ используют ДЦУ и ОС-20. Добавление
в состав нескольких ПАВ оказывает более сильное влияние на
катодную поляризацию и структуру покрытий, чем отдельно
введенные ПАВ, что можно объяснить образованием плотных ад-
сорбционных пленок в прикатодном слое.
Аноды для кадмирования в кислых электролитах изготавли-
вают из чистого электролического кадмия. Во всех электролитах
аноды растворяются с высоким выходом по току. В табл. 11.2
приведены составы кислых электролитов кадмирования.
Электролит 1 широко применяется в промышленности для на-
несения кадмия. Электролит 2 используется для нанесения кад-
мия на подвесках и на мелкие детали во вращательных уста-
новках. Электролиты 2 и 3 применяются для блестящего кадми-
рования. В электролите 4 наносится кадмий на крепеж во
вращательных установках. При повышении температуры до 50 °C
и перемешивании плотность тока можно увеличить до 10 А/дм2.
Приготовление простых кислых электролитов сводится к сле-
дующему. Компоненты, входящие в состав сульфатных электро-
литов, растворяют отдельно в теплой воде. В рабочую ванну,
заполненную до половины водой, осторожно добавляют серную
кислоту, а затем — растворы солей. Клей сначала выдерживают
5*
131
в холодной воде в течение 1—2 сут, после чего сливают воду и
растворяют в горячей воде. Поверхностно-активные вещества
тщательно растворяют в теплой воде и вводят при перемешивании
в рабочую ванну. Затем электролит доливают до требуемого объема
и прорабатывают током в течение 2—3 ч со случайными катодами,
перемешивая его сжатым воздухом. Кислотность электролита
поддерживают на уровне pH 3—5. Эксплуатировать электролит
можно без предварительной проработки током.
Основным недостатком кислых электролитов является появ-
ление в них губчатых темных пятен, связанных с недостатком
ПАВ или с повышенной плотностью тока.
§ 11.4. ЦИАНИДНЫЕ ЭЛЕКТРОЛИТЫ
Основным компонентом электролита является комплекс-
ная цианидная соль кадмия Na2 [Cd(CN)2], которая образуется
в результате взаимодействия гидроксида кадмия с цианидом
натрия:
CdO + 4NaCN + Н2О = Na2[Cd(CN)4] + 2NaOH;
Cd(OH)2 + 4NaCN = Na2[Cd(CN)4] + 2NaOH.
Наряду с цианидным комплексом в растворе образуется экви-
валентное количество щелочи, так как кадмий в отличие от цинка
не является амфотерным металлом и не растворяется в щелочных
растворах.
Диссоциация комплексной соли кадмия протекает по схеме:
Na2[Cd(CN)4l 2Na+ + Cd(CN)h
Cd(CN)4~ Cd2+ + 4CN~.
На катоде восстанавливаются ионы кадмия и выделяется во-
дород:
Cd2+ + 2ё — Cd;
2Н+ + 2ё Н2.
Из-за выделения водорода выход по току в цианидных электро-
литах составляет 90—95 %. При использовании цианида калия
выделение водорода значительно ниже.
Осаждение кадмия вследствие устойчивости комплексного
аниона протекает при значительной катодной поляризации, поэ-
тому покрытия имеют мелкокристаллическую структуру и проч-
ное сцепление с основой. Электролит обладает высокой рассеиваю-
щей способностью, поэтому осадки кадмия получаются равномер-
ными даже на глубокопрофилированных деталях.
Большое влияние на плотность тока и выход по току оказы-
вает концентрация кадмия в электролите. Повышение концентра-
ции кадмия от 15 до 30 г/л при постоянной концентрации свобод-
132
Рис. 11.3. Кривые катодной поляризации в электролитах с различным содер-
жанием NaCN (CdO 35 г/л):
1 — 150 г/л; 2 — 125 г/л; 3—22 г/л
Рис. 11.4. Кривые катодной поляризации кадмия в цианидном электролите
(35 г/л CdO и 90 г/л NaCN) при различном содержании NaOH, г/л:
1 — 20; 2—40; 3 — 60
ного цианида способствует повышению допустимой плотности
тока и выхода металла по току. Так, например, при плотности
тока 2 А/дм2 и концентрации кадмия 15 г/л выход по току равен
75 %, а при концентрации 30 г/л он повышается до 93 %. В элект-
ролитах с концентрацией 30—50 г/л кадмия плотность тока
может быть повышена до 2 А/дм2. При более высоких плотностях
тока (около 4 А/дм2) кадмий начинает осаждаться на катоде при
предельном токе и качество осадков ухудшается. При этом про-
исходит увеличение потенциала разряда и на катоде начинает
интенсивно выделяться водород. Таким образом, в цианидных
электролитах кадмирования концентрация кадмия оказывает
решающее влияние на выход по току.
Цианид натрия находится в электролите как в связанном,
так и в свободном виде. Для устойчивой работы ванны от-
ношение концентрации цианида натрия к концентрации кад-
мия должно поддерживаться около 3,75. Наличие свободного
цианида повышает рассеивающую способность, улучшает струк-
туру покрытий и позволяет работать при более высоких плотно-
стях тока.
На рис. 11.3 показан ход поляризационных кривых в электро-
литах с различным содержанием цианида натрия при концентрации
CdO, равной 35 г/л. При плотности тока около 4 А/дм2 и концентра-
ции NaCN 150 г/л достигается предельный ток, при более низких
концентрациях inp еще меньше.
При недостатке цианида натрия происходит пассивация кадмие-
вых анодов, они покрываются труднорастворимой пассивной
пленкой. Аноды становятся темно-серыми и даже черными, по-
тенциал анода заметно возрастает, и в осадок выпадает гидроксид
кадмия, который ухудшает качество покрытий.
Для увеличения электропроводности в электролиты вводят
гидроксид натрия. Следует отметить, что по сравнению с цинко-
133
Рис. 11.5. Зависимость выхода по току в цианид-
ном электролите кадмирования от плотности тока
и температуры:
1 — t ~ 60 °C; 2 — < = 35 °C; 3 — /= 18 °C
выми цианидными электролитами гидро-
ксид натрия не образует с кадмием хими-
ческих соединений и поэтому его роль в
данном случае несколько иная.
На рис. 11.4 показан ход поляриза-
ционных кривых в электролите при раз-
личном содержании NaOH. Его влияние
на допустимую плотность тока противо-
положно влиянию NaCN. Оптимальной концентрацией NaOH яв-
ляется 15—30 г/л, при более высоких значениях выход по току
падает и качество покрытий ухудшается.
В цианидных электролитах кадмирования обязательно обра-
зуются карбонаты, наличие которых в присутствии NaOH спо-
собствует получению блестящих и более светлых покрытий. Од-
нако при концентрации карбонатов более 100 г/л, a NaOH более
40 г/л блеск теряется и покрытия становятся матовыми.
Наличие сульфата натрия делает электролит более устойчи-
вым. В качестве блескообразователей вводят соли никеля и ко-
бальта, эффективность которых возрастает при одновременном
введении сульфированного касторового масла. В настоящее время
широко применяются блескообразующие добавки, например Ли-
меда БК—2С, разработанные в АН Литовской ССР ИХХТ. Эти
добавки используются в автомобильной промышленности. При
нанесении кадмия на высокопрочные стали блескообразователи
применять не следует, так как это приводит к водородной хруп-
кости вследствие дополнительного проникновения водорода в ос-
нову при обезводороживании за счет низкой водопроницаемости
покрытия. Избежать наводороживания можно за счет применения
калиевых соединений KCN, КОН и добавления 0,3—0,8 г/л ти-
тана в виде метатитана калия.
Влияние температуры на выход по току показано на рис. 11.5.
С увеличением температуры выход по току возрастает, а с увели-
чением плотности тока — падает. Обычно процесс нанесения кад-
мия проводят при температуре 15—30 °C. Применение реверси-
рованного тока расширяет рабочий диапазон до 3—6 А/дм2.
Соотношение катодного и анодного периодов должно составлять
6—10.
В промышленности широко применяют электролит следующего
состава, г/л:
CdO....................25—40
NaCN общий............80—130
NaOH..................20—30
NiSO4-7H2O..............1,0—1,5
Na2SO4-10H2O..............40—60
Декстрин ............... 2—5 ч
134
Режим электролиза: iK = 0,54-1,0 А/дм2 для вращательных
установок, iK = 1,04-2,0 А/дм2 для стационарных ванн; t =
= 204-30 °C. Применение реверсированного тока позволяет уве-
личить плотность тока до 3,5 А/дм2 при соотношении катодного
и анодного периодов тока 5:1.
Блестящие кадмиевые осадки получают в электролите следую-
щего состава, г/л:
CdO ............................. 18—26
NaCN............................80—130
Лимеда БК—2С, мл/л.............18—20
Режим электролиза: iK = 0,84-1,2 А/дм2 во вращательных
установках, в стационарных ваннах iK = 14-2 А/дм; t = 154-
4-25 °C. Электролит применяется для деталей сложной конфигу-
рации.
В минимальном количестве воды приготавливают растворы циа-
нида натрия, гидроксида натрия, сульфата натрия и сульфата
никеля. При работе с цианидом натрия необходимо соблюдать
правила техники безопасности, предусмотренные для сильнодейст-
вующих ядовитых веществ.
Оксид кадмия разводят в небольшом количестве воды до пасто-
образного состояния и постепенно добавляют при тщательном пе-
ремешивании в растворы цианида натрия. После полного его раст-
ворения добавляют растворы гидроксида натрия, сульфата натрия
и сульфата никеля. Раствору дают отстояться и декантируют его
в рабочую ванну, доводя водой до заданного объема.
Оксид кадмия можно заменить свежеосажденным гидроксидом
кадмия, полученным из сульфата кадмия или хлорида кадмия при
его взаимодействии с гидроксидом натрия. При добавлении гидро-
ксида натрия необходимо учитывать то количество, которое обра-
зовалось в результате взаимодействия оксида или гидроксида
кадмия с цианидом натрия. Последним вводят сульфид натрия
из расчета 0,5 г/л. Готовый электролит прорабатывают током со
случайными катодами и вводят в него блескообразователи.
В процессе эксплуатации электролита необходимо поддержи-
вать на заданном уровне концентрацию кадмия, свободного циани-
да и гидроксида кадмия. При накоплении в растворе Cd2+ выше
нормы наряду с кадмиевыми анодами завешивают стальные.
К вредным примесям относят Pb, Sn, Sb, Ag, которые попадают
в электролит из-за растворения в нем припоев с деталей, упав-
ших на дно ванны. Предельно допустимая концентрация As не
более 0,005, остальных металлов — 0,05, карбонатов — менее
100 г/л. Примеси Ag и Sn удаляются обработкой электролита цин-
ковой пылью с последующей проработкой при iK = 0,34-0,5 А/дм2.
Свинец удаляется сульфидной обработкой, органические при-
меси — путем фильтрования электролита через активирован-
ный уголь.
135
§ 11.5. НЕЦИАНИДНЫЕ СЛОЖНЫЕ ЭЛЕКТРОЛИТЫ
Аммонийные электролиты. Аммонийные электролиты
по значению рассеивающей способности занимают промежуточное
место между сульфатными и цианидными электролитами. Все
аммонийные электролиты обладают высокой электропроводностью
и могут с успехом применяться во вращательных установках.
В отличие от цианидных электролитов они не токсичны.
При взаимодействии оксида или гидроксида кадмия с концент-
рированными растворами сульфата или хлорида аммония обра-
зуются комплексы. Растворимость комплекса на основе сульфата
аммония значительно выше, что позволяет вести процесс осажде-
ния при более высоких плотностях тока. Состав (г/л) и режим
работы электролита следующие:
CdO.....................
(NH4)2SO4...............
HaBOs...................
Клей столярный.........
30—40 iK, А/дм2.............
250—300 /, °C.................
20—30 pH ......................
2
0,7—1
18—25
5—6,8
При pH 6 катодная поляризация уменьшается и осадки имеют
крупнокристаллическую структуру. При этом рассеивающая спо-
собность электролита уменьшается и приближается к рассеиваю-
щей способности сульфатных электролитов, работающих без
добавления ПАВ.
В последнее время получили распространение аммонийно-
уротропиновые электролиты, имеющие высокую рассеивающую
способность. Осадки получаются мелкокристаллическими и свет-
лыми. Электролиты безвредны, устойчивы в работе и могут при-
меняться во вращательных установках.
Осаждение кадмия происходит при высокой катодной поляри-
зации за счет образования комплексных соединений кадмия не
только с сульфатом аммония, но и с уротропином. Состав (г/л)
аммонийно-уротропинового электролита, а также режим его ра-
боты приведены ниже:
CdO-8/3HaO..............
(NH4)2SO4...............
Уротропин...............
ОС-20...................
40—60 Диспергатор НФ, мл/л . . 50—100
240—260 iK, А/дм2.................0,8—1,2
15—20 Л °C.....................25—30
0,7—1,2 pH ...................... 4—6
В некоторых случаях применяют аммонийные электролиты на
основе хлорида аммония. Как было указано выше, растворимость
оксида кадмия в растворе хлорида аммония очень мала и поэтому
вместо него используют хлорид кадмия. Ниже приведен состав
такого электролита, г/л, и режим его работы:
CdCl2-2H2O ...............40—50
NH4C1.....................30—40
Тиомочевина............. 7—10
Клей мездровый.......... 1—2
»к, А/дм2..................
/, °C......................
pH ........................
0,8—1,2^
20—40 '
4,0—4,5
136
Аммонийно-уротропиновый электролит готовят следующим
образом. Растворяют CdSO4-8/3H2O и (NH4)2SO4 в теплой воде
в отдельных емкостях. Растворы сливают и декантируют в рабо-
чую ванну. Диспергатор НФ—А, уротропин и препарат ОС-20
тщательно растворяют в теплой воде и добавляют в них электро-
лит до полного удаления маслянистых комочков. Полученный рас-
твор вводят в рабочую ванну и доливают водой до заданного объема.
Затем его подкисляют H2SO4 до pH 4,0—5,5 и прорабатывают то- ,
ком при iK = 0,254-0,50 А/дм1 2 из расчета 0,5—1,0 А-ч на 1 л.
Остальные аммонийные электролиты на основе (NH4)2SO4
готовят таким же образом. Электролит, который содержит в ка-
честве комплексообразователя NH4C1, лучше приготавливать на
конденсате. Электролит CdCl2 готовят в винипластовой ванне.
На 100 л электролита необходимо залить 5 л НС1 плотностью
1,19 и 35 л воды, в раствор добавить 2,8 кг CdO, все перемешать
и нейтрализовать избыток НС1 25-%-ным раствором NH4OH до
pH 4—4,5. Полученный раствор следует перелить в рабочую ванну
и добавить NH4C1, NaCl, тиомочевину и мездровый клей. Прора-
батывать электролит током необходимо при той же плотности тока.
Электролиты на основе аминопроизводных. В таких электро-
литах кадмий образует сложные комплексные катионы. Комплек-
сообразователями могут быть полиэтиленполиамин, трилон Б
(натриевая соль этилендиаминтетрауксусной кислоты) и др.
Электролиты имеют хорошую рассеивающую способность, мелко-
кристаллическую структуру. Однако следует учитывать токсич-
ность аминопроизводных соединений и необходимость обезврежи-
вания сточных вод. Наименее вредным стоит считать трилонатные
электролиты. В этих электролитах большое значение имеет pH
электролита. При pH 3 выделяется водород, а при pH 3—4 про-
цесс протекает при низкой катодной поляризации. Поэтому в за-
висимости от состава электролита поддерживают нейтральную или
щелочную среду. Состав, г/л, электролита и режим его работы
следующие:
CdSO4-8/3H2O................40
Трилон Б....................75
Na2SO4-10H2O................45
NiSO4-7H2O................ 1,0
iK, А/дм2.................До 3
Л °C.......................15—25
pH.........................12—13
1 Анодный выход по току несколько выше катодного, и с тече-
нием времени в электролите накапливаются ионы Cd2+, в связи
с этим часть кадмиевых анодов следует заменить графитовыми.
Свежеприготовленный гидроксид кадмия получают при до-
бавлении концентрированного раствора гидроксида натрия в раст-
вор сульфата кадмия. Полученный осадок растворяют в 20 %-ном
растворе трилона Б. Величина pH 12—13 получается за счет
образования гидроксида натрия при растворении гидроксида кад-
мия в трилоне Б. iV, „
137
Пирофосфатные электролиты. Исходными компонентами яв-
ляются соли кадмия и пирофосфата калия. Растворимость пиро-
фосфата кадмия, образующегося при взаимодействии исходных
компонентов, незначительна, особенно при использовании пиро-
фосфата натрия, поэтому необходим 15—20-кратный избыток
комплексообразователя. Состав электролита (г/л) и режим его
работы приведены ниже:
CdSO4-8/3HaO.............. 9,2 «а, А/дм’..............0,2—0,4
К4РаО,-ЗНаО............. 192 t, °C.................. 50
iK, А/дм2..............0,2—0,4
При добавлении к этому электролиту трилона Б катодная по-
ляризация увеличивается и качество покрытий улучшается.
При этом получают электролит следующих состава (г/л) и режима
работы:
CdSO4-8/3HaO..........
KiPA-SHjO.............
Трилон Б .............
18—20 iK, А/дм2.............
120—200 ia, А/дм2..............
35—38 /, °C.................
До 2
До 0,4
50
В пирофосфатных электролитах выход по току с ростом по-
ляризации уменьшается, при добавлении трилона Б снижение
выхода по току не так явно выражено.
Для приготовления электролита трилон Б растворяют в теп-
лой воде. Отдельно растворяют оксид кадмия до пастообразного
состояния и смешивают их вместе. Остальные компоненты раст-
воряют в теплой воде и вводят в ванну, выпавший осадок
CdaP2O7 при интенсивном перемешивании растворяют в избытке
пирофосфата калия. В ванну доливают воду до заданного объема,
корректируют pH и электролит прорабатывают током.
§ 11.6. ОБРАБОТКА КАДМИЕВЫХ ПОКРЫТИЙ
Для повышения коррозионной стойкости и улучшения
декоративного вида кадмиевые покрытия подвергают хроматирова-
нию. Перед пассивацией производят осветление в 1—3 %-ном
растворе или в растворе, который содержит 150—160 г/л СгО3,
8—10 г/л H2SO4. Осветление производят при комнатной темпера-
туре в течение 2—3 с.
Пассивирование можно производить в составах, применяемых
для обработки цинковых покрытий (см. табл. 12.9). Бесцветные
пленки образуются в растворе, который содержит Ликонду 25
в количестве 70—78 г/л, время обработки 0,10—0,75 мин. Такая
обработка производится для блестящих покрытий при темпера-
туре 18—30 °C. Пленка цвета хаки образуется в растворе, который
содержит 28—34 г/л СгО3, 21—26 г/л уксусной кислоты, 56—
65 г/л муравьинокислого натрия (безводного), 48—72 г/л Ликонды.
Обработку ведут при pH 2,9—3,6, температуре 21—32 °C в тече-
ние 0,5—1,0 мин. Пассивирование следует проводить при переме-
шивании сжатым воздухом. . ,
138
При кадмировании, так же как при цинковании, в цианидных
электролитах происходит сильное наводороживание деталей, из-
готовленных из стали. Пластичность сталей при этом значительно
уменьшается в зависимости от марки стали. Наиболее сильное
наводороживание происходит в начальный момент осаждения.
Термическую обработку для удаления водорода из основного ме-
талла проводят при температуре 180—200 °C в течение 2—3 ч
для деталей с пределом прочности 900—1400 МПа, с цементиро-
ванными поверхностями обработки производится при 140—160 °C
в течение 3—4 ч. Детали с пределом прочности до 900 МПа не
обезводороживаются. Детали после хроматирования подверга-
ются обработке при температуре 200—300 °C в течение 3 ч. За
это время удаляется около 2/3 объема водорода, особенно интен-
сивно водород удаляется в течение первых двух часов.
Для деталей типа пружин и других лучше наносить покрытия
в хлоридаммонийном электролите с предварительной обработкой
в 10 %-ном растворе соляной кислоты с добавлением 40—50 г/л
уротропина. При этом не происходит изменения механических
свойств высокопробных сталей.
ГЛАВА 12. ОЛОВЯНИРОВАНИЕ
, § 12.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ОЛОВА
И ОБЛАСТЬ ПРИМЕНЕНИЯ ОЛОВЯННЫХ ПОКРЫТИЙ
Олово — мягкий металл серебристо-белого цвета с мяг-
ким голубым оттенком. Плотность 7,28 г/см3, температура плав-
ления 232 °C, атомная масса 118,7, удельное электросопротивле-
ние 11,5-10-8 Ом-м. Электрохимический эквивалент Sn2+ равен
2,214 г/(А-ч.). Стандартный потенциал Sn/Sn2+ = —0,14 В,
Sn2+/Sn4+ = +0,20 В, Sn/Sn4+ = +0,05 В. В 3 %-ном растворе
NaCl электродный потенциал Sn2+ = —0,25 В.
В атмосферных условиях даже в присутствии влаги олово
окисляется медленно. Разбавленные растворы минеральных кис-
лот при комнатной температуре практически не растворяют олова.
В концентрированных соляной и серной кислотах олово при на-
гревании легко растворяется. В растворах едкой щелочи олово
неустойчиво и при кипячении растворяется с образованием стан-
нитов. Сернистые соединения на олово почти не влияют. С орга-
ническими кислотами олово образует комплексные соединения,
при этом потенциал олова становится отрицательнее потенциала
железа, т. е. олово становится анодным покрытием. Это обстоя-
тельство, а также безвредность олова позволяют широко исполь-
зовать оловянные покрытия в пищевой промышленности для
защиты внутренней стороны консервной тары от коррозии. На
1ча
12.1. Толщина оловянных покрытий
Назначение покрытия Условное обозначение Толщина, мкм, оловянных покрытий для условий эксплуатации
I 2—4 Б—6 7—8
Детали из углеродистой, низко- и среднелегированной стали
Под пайку, защитное с подслоем никеля Под пайку, защитное, для устранения иглооб- разования с подслоем: н.о 9; 6 18; 9 — —
никеля Н.О.опл 9;3 18; 3 •— —
меди, никеля М.Н.О.опл. 6; 3; 3 24; 3; 9 30; 3; 9 3 0;3;9
Детали из меди и ее сплавов
Под пайку, защитное, Н.О 3; 6 3; 9 3; 9 3; 12
для устранения иглооб- разован и я с подслоем Н.О.опл. 3; 3 3; 3 3; 3 3; 3
никеля
Детали из алюминия и его сплавов
Под пайку, для сни- жения переходного со- противления с подслоем меди, никеля М.Н.О 6; 9; 9 •— — —
изготовление белой жести расходуется около 50 % добываемого
олова.
Оловянирование применяется для защиты медного кабеля от
воздействия серы, содержащейся в резиновой изоляции; для пайки
электрических контактов; для создания на трущихся поверхно-
стях легко прирабатывающегося слоя и т. д. Оловянированию
подвергаются детали из стали, меди, алюминия и его сплавов,
цинковых сплавов. Защитные свойства оловянных покрытий на
железных деталях в атмосферных условиях надежны только при
отсутствии пор.
Оловянные покрытия пластичны и хорошо выдерживают ме-
ханические деформации (вальцовку, штамповку, вытяжку). Для
оловянных покрытий, полученных электрохимическим методом,
при хранении луженых изделий характерен самопроизвольный
рост нитевидных кристаллов олова, длина которых достигает
5 мм. Нитевидные кристаллы могут привести к коротким замыка-
ниям при эксплуатации электрорадиотехнической аппаратуры.
Скорость роста нитевидных кристаллов связана с природой ме-
талла и сплава, на которые наносятся покрытия. Так, наиболь-
шая скорость роста кристаллов наблюдается в случае осаждения
олова на цинк, латунь или медь. Оплавление оловянных покры-
140
тий и нанесение перед оловянированием тонкого слоя никеля за-
тормаживают рост нитевидных кристаллов олова.
Толщина оловянных покрытий в зависимости от их назначе-
ния и условий эксплуатации изделий приведена в табл. 12.1.
Оловянные покрытия могут наноситься горячим путем, мето-
дом гальванического или контактного осаждения или электроли-
тически из солевых расплавов.
§ 12.2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
ЭЛЕКТРОЛИТОВ
Электрохимические покрытия оловом производятся пу-
тем выделения олова как из кислых, так и из щелочных электро-
литов. К кислым электролитам относятся сульфатные, галоге-
нидные, фторборатные и фенолсульфоновые электролиты; к ще-
лочным — станнатные и пирофосфатные.
В кислых электролитах олово находится в виде двухвалентных
ионов Sn2+. Из кислых электролитов без добавок олово выделяется
без заметной поляризации (рис.'12.1, кривая /); осадки полу-
чаются крупнозернистыми и рыхлыми. Даже при самых низких
плотностях тока происходит преимущественно рост отдельных
кристаллов, которые достигают анодной поверхности и вызы-
вают короткие замыкания. Для получения гладких покрытий
в электролиты вводят поверхностно-активные вещества, увеличи-
вающие катодную поляризацию и обеспечивающие получение
гладких покрытий (рис. 12.1, кривая 2).
В щелочных электролитах олово присутствует в виде комплекс-
ных ионов двух- и четырехвалентного олова: станниты SnOi"
или Sn (ОН)1“ и станнаты SnOl~ или Sn (ОН)|-. Катодная поля-
ризация в станнатных электролитах более сильно выражена, чем
в сульфатных (рис. 12.1, кривая 3). Рассеивающая способность
станнатных электролитов больше, чем кислых, выход по току до-
стигает 60—70 % при температуре 65—70 °C. Покрытия полу-
чаются плотные, мелкокристаллические.
Практическое применение нашли только станнатные электро-
литы, так как из станнитных электролитов олово выделяется
ся в виде крупных кристаллов из-за не-
значительной поляризации восстановле-
ния ионов.
Рис. 12.1. Поляризационные кривые при Элек-
тр оосажденни олова нз кислых и щелочных элек-
тролитов различного состава прн температуре
25 °C:
1 — 0,5 г-экв/л SnS04; 1,8 г-экв/л HfSO4; 2 — то же,
что / 1 г/л столярного клея: 10 г/л о-креозола; 3 —
1,5 г-экв/л NaeSOa; 0,25 г-экв/л NaOH
§ 12.3. КИСЛЫЕ ЭЛЕКТРОЛИТЫ
К кислым электролитам оловянирования относятся
сульфатные,. фенолсульфоновые, борфторидные, галогенидные
и др. В состав сульфатных электролитов оловянирования входят
сульфат олова, серная кислота, а также коллоиды и поверхностно-
активные вещества. В некоторых случаях в электролит прибав-
ляют сульфат натрия, повышающий электропроводность раствора.
Серную кислоту вводят в электролит для снижения гидролиза
оловянных солей, а также для предотвращения окисления двух-
валентного олова в четырехвалентное и образования шероховатых
осадков. При отсутствии органических веществ в кислых электро-
литах невозможно получить приемлемые осадки олова из-за об-
разования крупных кристаллов и усиленного роста дендритов
на краях деталей.
При отсутствии добавок в сульфатном электролите катодная
поляризация весьма незначительна. При добавлении крезолсуль-
фоновой кислоты или смеси со столярным клеем катодная поляри-
зация достигает 500—600 мВ.
Сульфатные электролиты оловянирования с добавкой ПАВ
отличаются сравнительно высокой рассеивающей способностью,
приближающейся к рассеивающей способности медных циани-
стых электролитов. Выход по току сульфатных оловянных элек-
тролитов равен примерно 90—98 %.
Анодный процесс при лужении протекает без заметной поля-
ризации, олово переходит в раствор в основном в виде двухвалент-
ных ионов. Поверхность анодов покрыта легко удаляемым тон-
ким слоем черного шлама. При повышенных плотностях тока по-
верхность анодов имеет резко выраженную кристаллическую
структуру; пленок на поверхности не наблюдается. Анодный
выход по току, как правило, превышает катодный.
Изменение концентрации сульфата олова в пределах 30—
60 г/л не сказывается заметно на характере катодного процесса.
Пониженная концентрация сульфата олова снижает максималь-
ный предел рабочей плотности тока, но положительно влияет
на рассеивающую способность электролита. При повышен-
ном содержании сульфата олова аноды склонны к пассиви-
рованию.
Серная кислота повышает электропроводность электролита,
предохраняет электролит от гидролиза и появления шерохова-
тости на осадках. Концентрация серной кислоты может коле-
баться в пределах от 20 до 100 г/л. При малых концентрациях кис-
лоты увеличивается опасность гидролиза и окисления сульфата
олова; слишком большая ее концентрация приводит к снижению
выхода по току, быстрому разрушению коллоидных добавок
и пассивированию анодов.
Сульфат натрия иногда добавляют в электролиты для повы-
шения электропроводности и снижения степени диссоциации
142
% 12.2. Состав (г/л) сульфатных
:,/ электролитов оловянирования
и режим работы
Компоненты электролита и режим работы Номер электролита
1 2
SnSO4 HaSO4 Na2SO4 Препарат ОС-20 О-крезол тех- нический Клей столяр- ный 1,4-бутнндиол (35 % -ный рас- твор) t, °C i, А/дм2 40—50 50—80 30—50 2—5 15—20 1—2 25—50 80—100 8—10 1—2 25— 50 мл/л 18—25 2—7
12.3. Состав (г/л) сульфатных
электролитов блестящего
оловянирования н режим работы
Компоненты электролита и режим работы Номер электролита
1 2
SnSO4 25-60 35-45
HaSO4 50—160 120—180
Синтанол ДС-10 3—5 5—15
Формалин S-6 3—5
Ацетилацетон 3—4 —
Лимеда Sn-2 5—10 5—10
t, °C 15-30 15—25
iK, А/дм2 2—4 2—4
ia, А/дм2 1—2 1—2
сульфата олова. Впрочем, указанные функции с большим успехом
выполняются серной кислотой.
Матовые гладкие покрытия можно получить в электролитах,
состав которых приведен в табл. 12.2.
Сульфатные электролиты оловянирования имеют склонность
к расслаиванию. Концентрация олова в нижних слоях может
в 3—4 раза превышать концентрацию в верхних слоях. Для устра-
нения этого явления рекомендуется перемешивать электролит.
Присутствие хлоридов и нитратов вредно сказывается на нор-
мальной работе сульфатного электролита оловянирования. Ионы
меди также оказывают отрицательное влияние на качество оло-
вянных осадков. Присутствие в сульфатном электролите оловяни-
рования ионов свинца, железа, цинка и никеля до известных пре-
делов не оказывает влияния на ход катодного процесса.
Разработаны электролиты для получения блестящих оловян-
ных покрытий (табл. 12.3.). Для этого в растворы вводят добавки
нескольких блескообразователей. Хорошее качество осадков по-
лучается при введении одновременно двух или трех поверхно-
стно-активных веществ.
Хорошими блескообразующими свойствами обладают электро-
литы, содержащие синтанол ДС-10 и ДИ-7, формалин, ацетил-
ацетон, р-нафтол, желатин и р-толуидин, блескообразователь
Лимеда Sn-2. Осадки блестящего олова очень чувствительны
к механическим загрязнениям, которые могут попадать в электро-
лит из шлама, образующегося в результате окисления Sn2+.
Нерастворимый осадок, содержащий ионы четырехвалентного
олова, является коллоидным, и для полной очистки электролита
следует пользоваться коагулянтами.
143
Блестящие оловянные покрытия после длительного хранения
сохраняют хорошую способность к пайке, красивый декоратив-
ный вид и высокие защитные свойства.
Режим электролиза — плотность тока и температура — в зна-
чительной степени влияет на качество осадков. При малых плот-
ностях получаются осадки с крупнокристаллической структу-
рой, отличающиеся повышенной пористостью. Чрезмерно высо-
кая плотность тока приводит к тому, что осадки становятся шеро-
ховатыми, на краях растут дендриты. Перемешивание электро-
лита может осуществляться при повышенных плотностях тока.
При электрохимическом оловянировании жести в конвейерных
автоматах допустима сравнительно высокая плотность тока, на-
много превышающая (в 10—15 раз) плотность тока при оловяни-
ровании в механизированных ваннах.
Для тонких покрытий (около 1—2 мкм) допустимы большие
плотности, чем для толстых покрытий. Повышение температуры
в период работы с сульфатными электролитами приводит к сни-
жению катодной поляризации, уменьшению рассеивающей спо-
собности и ухудшению качества осадков. Так, при нагреве суль-
фатного электролита до температуры, превышающей 40 °C, об-
разуются грубокристаллические шероховатые осадки. При повы-
шенной температуре уменьшается стабильность ванны.
Сульфатный электролит приготавливают следующим образом.
Сульфат олова растворяют в теплой воде при непрерывном поме-
шивании. Воду подкисляют серной кислотой (20—25 г/л). После
фильтрации раствора в рабочую ванну добавляют оставшуюся
серную кислоту и растворенный в воде сульфат натрия. Столяр-
ный клей предварительно заливают холодной водой, выдержи-
вают в течение 1—2 сут. для набухания и растворяют в горячей
воде при 60—70 °C на водяной бане.
Крезол или карболовую кислоту, чтобы предупредить всплы-
вание, добавляют в ванну вместе с раствором клея. Тщательно
перемешанную смесь, помешивая, вливают в ванну. Раствор
в ванне вначале мутнеет, но вскоре светлеет и приобретает нормаль-
ный желтовато-зеленый цвет. Препарат ОС-20 растворяют в не-
большом количестве теплой воды и вводят в электролит. Приго-
товленный электролит прорабатывают при плотности тока 1—
1,5 А/дм2 в течение 3—5 ч со случайными катодами.
Основными компонентами фенолсульфоновых электролитов
являются сульфат олова и фенолсульфоновая кислота
CeH4OHSOsH. При смешивании этих компонентов в воде обра-
зуется фенолсульфонат олова:
SnSO4 + 2CeH4OHSOsH = Sn(CeH4OHSO3)2 + H2SO4.
£ Эти электролиты менее склонны к окислению, чем сульфатные.
Органические добавки — диоксидифенилсульфон, монобутил-
фенилфенолмоносульфат и нафтоксол 7 с вводят для получения
144
12.4. Состав (г/л) фторборатных электролитов оловянирования
и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3 4
Sn(BFi)2 98—196 180—200 180—200 200
HBF4, свободный 40—200 45—60 45—60 50
HSBDS, свободный 10—30 25—30 25—30 25
[J-нафтол 0,5—1,0 — — 1
Желатин 1—3 —. -— -
Ингибитор И-1-А — — 2—3 —
Клей столярный — 3—5 — 6
t, °C 40—20 25 20—40 20—40
iK, А/дм2 До 13 До 10 3—10 2,5—12,5
мелкокристаллических гладких покрытий и зеркально-блестя-
щего покрытия или оплавлении.
1 При использовании фенолсульфоновых электролитов допус-
кается высокая плотность тока, что необходимо для получения
белой жести при непрерывном движении стальной полосы со ско-
ростью до 160 м/мин.
Применяют фенолсульфоновые электролиты следующего со-
става, г/л:
Раствор 1 Раствор 2
SnSO4 ................................. 50—70 50—70
Пара-фенолсульфокислота............ 80—90 80—90
Дигидрооксиднфенилсульфон ......... 6,5—11,5 —
Натрнй-монобутилфеннлфенолсульфон 0,4—1,0 —
Нафгоксол 7с............................. — 2—4
Режим работы: температура 40—50 °C, iK = 204-30 А/дм®.
Поскольку анодный выход по току больше катодного, то для
предотвращения накопления олова в электролите часть анодов
выполняется из высококремнистой стали.
Основными компонентами фторборатных электролитов яв-
ляются основная соль борфтористоводородной кислоты, свобод-
ная борфтористоводородная кислота, борная кислота и добавка
нескольких ПАВ, без которых нельзя получить осадки олова
хорошего качества. В качестве добавок применяют 0-нафтол,
крезолсульфоновую кислоту, пирокатехин, желатин, ингиби-
тор И-1-А. Состав некоторых фторборатных электролитов приве-
ден в табл. 12.4.
При использовании фторборатных электролитов допускается
повышенная плотность тока, поэтому их применяют для нанесе-
ния олова на стальную ленту или проволоку. Анодный и катод-
ный выход по току составляет 95—96 %. Аноды изготавливают
из чистого олова.
S i i*’ - *•< 4»'» =»
145 ‘
Рис. 12.2. Влияние концентрации
NaF и NH4F на катодную поля-
ризацию при электроосаждении
олова из раствора, содержащего
0,25 г/экв/л SnCl, 3—4 г/л НС1
и 1 г/л желатины:
/, 3 —добавка 0,4 и 0,9 моль/л NH4C1
соответственно; 2, 4 — добавка 0,4
и 0,9 моль/л NaF соответственно
Приготовление электроли-
та состоит в получении бор-
фтористоводородной кислоты
4HF + HSBOS = HBF4+ ЗНаО
12.5. Состав (r/л) галогенидных
электролитов оловянирования
и режим работы
Компоненты электролитов и режим работы Номер электролита
1 2 3
SnCla-2HaO 30—50 40—60 75
NaF 30—70 40—60 35-40
NH4F — -—. 35
НС1 0,5— 0—30 12—15
4,0
NaCl — 20—40 20—22
Препарат ОС-20 1—2 0,5- —
5,0 ч
Желатин 1—2 — —V
Днсульфонаф- —— —. Ц
талиновая кис-
лота
Роданид аммо- -— — 0,25
НИЯ
/, °C 13—40 20—35 30—45
iK, А/дм2 0,5— 0,5— До 50
1,0 3
и последующем растворении в ней гидроксида олова:
Sn(OH)2 + 2HBF4 = Sn(BF4)2 + 2Н2О.
Остальные компоненты вводят согласно описанной выше мето-
дике.
Высокая стоимость кислоты несколько препятствует широ-
кому распространению фторборатных электролитов. Однако воз-
можность достижения высоких скоростей осаждения олова де-
лает их применение перспективным, особенно для получения
жести.
Высококачественные осадки получают из галогенидных элек-
тролитов, содержащих одновременно ионы С1_ и F~. В таком
растворе олово образует комплексы SnF?” и SnFzCll-. Было уста-
новлено, что катодная поляризация в системе Sn/Sn2+ резко воз-
растает при увеличении концентрации фтора и практически не
зависит от концентрации хлора (рис. 12.2). Высокая катодная
поляризация способствует получению мелкозернистых осадков.
В электролит также вводят ПАВ, способствующие увеличению
катодной поляризации: желатин, столярный клей, препарат
ОС-20, дисульфонафталин, роданид аммония. Благодаря высокой
катодной поляризации и высокой электропроводности рассеиваю-
щая способность этих электролитов выше, чем сульфатных и
фторборатных, поэтому ими можно покрывать сложнопрофили-
рованные детали.
Рекомендуемые составы электролитов приведены в табл. 12.5.
Электролит / используется для деталей простой конфигурации.
146
Электролит 2 при pH 6 рекомендуется применять для нанесения
покрытий толщиной до 30 мкм, при pH 2,5 — покрытий средней
толщины (5—10 мм). Электролит 3 высокопроизводителен, его
рекомендуют для покрытия непрерывно движущейся полосы или
ленты толщиной 0,5—1,5 мкм.
Электролит приготавливают, растворяя в воде, подогретой
до температуры 50 °C, фторидную соль, затем добавляют соляную
кислоту для предотвращения гиролиза солей олова. Затем при
непрерывном перемешивании вводят хлорид олова и ПАВ. Вред-
ными примесями являются медь и другие электроположительные
металлы, соли азотной кислоты и механические примеси.
I § 12.4. ПИРОФОСФАТНЫЕ ЭЛЕКТРОЛИТЫ
* В растворах пирофосфатных солей олово образует не-
растворимый пирофосфат олова:
2SnCla + Na4P2O7 = Sn2P2O7 + 4NaCl,
который в избытке пирофосфата растворяется, образуя комплекс-
ные соединения олова:
f Sn2P2O7 + Na4P2O7 = 2Na2Sn(P2O7) при pH < 4;
Sn2P2O7 + 3Na4P2O7 = 2NaeSn(P2O7)2 при pH 8—9.
В пирофосфатных растворах, не содержащих органических
добавок и ионов хлора, выделение плотных осадков до опреде-
ленной небольшой плотности тока происходит без заметной по-
ляризации. При повышении плотности тока до 1,0 А/дм2 катодная
поляризация скачкообразно увеличивается, а далее ухудшается
качество осадков. Для улучшения качества осадков в электро-
литы вводят декстрин, желатин, 0-нафтол, клей.
Хорошие покрытия получаются из растворов, содержащих
пирофосфат олова только в виде двухвалентных комплексных ио-
нов. Для предотвращения окисления Sn2+ в Sn4+ вводят стабилиза-
торы: гидрохинон, гидразин солянокислый, пирокатехин, резор-
цин.
Для получения блестящих осадков Институтом неорганиче-
ской химии АН ЛитССР разработан электролит, стабильный
в эксплуатации, следующего состава, г/л:
SnCl2-2H2O .......... 130—160 Смачиватель 133 или СВ-104 0,9—1,1
КгРгОу . . ............. 500—570 Клей мездровый........... 1—2
Солянокислой гидразин. . 15—40 Жидкое моющее вещество
«Прогресс»...............3—6 мл/л
Режим работы: плотность тока 1—3,5 А/дм2, при температуре
16—25 °C; до 4 А/дм2 — при 40—50 °C; до 6 А/дм2 — при 60—
70 °C.
Вместо дорогих пирофосфатов можно применять более доступ-
ные и дешевые продукты — триполифосфаты.
147
7
Приготовление пирофосфатных электролитов производится сле-
дующим образом. В подкисленной НС1 воде растворяют хлорид
олова, затем вводят пирофосфат, растворенный отдельно. Полу-
ченный осадок отстаивают, промывают и растворяют в остав-
шемся пирофосфате.
§ 12.5. СТАННАТНЫЕ ЭЛЕКТРОЛИТЫ
Основными компонентами щелочных электролитов, при-
меняемых для оловянирования, являются станнат натрия и ед-
кий натр. В щелочных электролитах олово находится в виде стан-
ната натрия или калия (Na2SnOs или K2SnOs). Присутствие двух-
валентного олова способствует образованию губчатых крупно-
кристаллических осадков.
К преимуществам щелочных электролитов оловянирования и
получаемых из них осадков относятся высокая рассеивающая
способность, превосходящая рассеивающую способность всех
известных в настоящее время электролитов; весьма мелкокристал-
лическая структура осадков; меньшая пористость по сравнению
с осадками из кислых электролитов; простота состава применяе-
мых электролитов; хорошая способность к оплавлению и паяе-
мость с канифольными флюсами.
Недостатки щелочных электролитов следующие: меньшая ско-
рость осаждения, чем из кислых электролитов, что объясняется
применением солей четырехвалентного олова и более низким вы-
ходом по току; необходимость работы при повышенной темпера-
туре; склонность анодов к пассивированию.
Щелочные оловянные электролиты имеют безусловное преиму-
щество перед кислыми во всех случаях, когда речь идет о по-
крытии готовых изделий или деталей сложной конфигурации.
При оловянировании листов, ленты и т. п., т. е. в тех случаях,
когда решающую роль играет форсирование процесса, предпочте-
ние следует отдать кислым электролитам.
Как уже указывалось, щелочные электролиты для оловяни-
рования не должны содержать двухвалентных ионов олова. В слу-
чае, если в электролите одновременно содержатся двух- и четырех-
валентные ионы олова, на катоде в первую очередь будет проис-
ходить разряд ионов, в состав которых входит двухвалентное
олово, так как разложение станната начинается при значительно
более отрицательном потенциале. В результате из таких электро-
литов олово выделяется в виде губчатых и рыхлых осадков.
Если же раствор содержит олово только в четырехвалентной форме,
то осаждение металла происходит при высокой катодной поляри-
зации, равной примерно 500—600 мВ, что, как известно, способ-
ствует получению мелкокристаллической структуры.
Ионы двухвалентного олова образуются в растворе при рас-
творении анодов. Кривая анодной поляризации приведена на
рис. 12.3. Растворение оловянных анодов при малых плотностях
148
Рис. 12.3. Анодная поляризация олова в стан-
натном электролите
тока и, следовательно, при малой поля-
ризации происходит преимущественно
с образованием ионов двухвалентного
олова Sn2+, которое окисляется до
аниона Sndl-:
Sn + 4ОН" — 2ё — SnO2~ + 2Н2О.
Этот процесс протекает при менее положительном потенциале,
чем процесс образования соединений четырехвалентного олова.
С увеличением плотности тока на аноде образуется пленка желто-
вато-зеленого цвета, которая приводит к увеличению катодной
поляризации и свидетельствует о частичной пассивации анода.
При растворении олова образуются станнатные ионы:
Sn 4- 6ОН“ — 4е SnOl- + ЗН2О.
При дальнейшем повышении плотности тока на анодах обра-
зуется черная пленка и происходит полная их пассивация, т. е.
растворение их прекращается полностью и выделяется газообраз-
ный кислород при разряде гидроксид-ионов:
4ОН- — 4е -► 2Н2О + О2|.
В связи с этим при оловянировании в щелочных электроли-
тах очень важно поддерживать аноды в таком состоянии, чтобы
они были частично пассивированы (внешним признаком этого
является наличие на анодах желтовато-зеленой пленки) и чтобы
при растворении они образовывали исключительно четырехвалент-
ные ионы олова. Для достижения данной цели можно вести
оловянирование с нерастворимыми анодами. Однако такое реше-
ние вопроса нецелесоборазно, так как при этом прекращается
пополнение электролита ионами олова и затрудняется его кор-
ректирование
Обычно оловянирование ведут с предварительным пассивиро-
ванием или, как иногда называют этот процесс, «формированием»
анодов. Формирование анодов осуществляют в щелочном электро-
лите при повышенной плотности тока постепенным включением
их по одному, обработкой в отдельной ванне или постепенным
погружением в электролит. При этом активная поверхность ано-
дов все время остается небольшой, следовательно, на ней будет
повышенная плотность тока.
Во время перерывов в работе пассивная пленка на аноде
растворяется, поэтому перед окончанием работы до выключения
тока аноды выгружают из ванны оловянировании и помещают
в ванну с водой. Загружают аноды в ванну под током. Концен-
трация станната натрия практически не влияет на внешний вид
149
Рис. 12.4. Влияние концентрации свободной щелочи на анодную поляризацию
олова:
1 — 1,375 г-экв/л NaOH; 2 — 0,66 г-экв/л NaOH; 3 — 0,31 г-экв/л NaOH
Рис. 12.5. Влияние плотности тока на анодный (2, 5) и катодный (4, 1) выход
по току. Температура электролита:
1, 2 — 70 °C; 3, 4 — 65 °C
осадков. При повышении содержания станната натрия в электро-
лите применяют более интенсивные режимы осаждения; при этом
повышается катодный выход по току и несколько уменьшается
анодный.
Концентрация едкого натра играет очень важную роль в ра-
боте станнатных электролитов. При увеличении концентрации
едкого натра катодная поляризация возрастает, а анодная —
снижается. С повышением содержания свободной щелочи увеличи-
вается плотность тока, при которой происходит пассивирование
анодов (рис. 12.4).
С увеличением содержания щелочи катодная плотность должна
быть снижена, а анодная — повышена. Выход по току при повы-
шении содержания щелочи снижается, а рассеивающая способ-
ность увеличивается. Большой избыток щелочи в электролите
приводит к образованию темных губчатых осадков.
В станнатных электролитах может накапливаться карбонат
натрия вследствие поглощения едким натром углекислоты из
воздуха. Наличие в электролите до 60—70 г/л карбоната натрия
не сказывается заметно на процессе оловянирования. Ацетат
натрия, добавляемый в некоторые станнатные электролиты, при-
дает раствору буферные свойства.
Повышение плотности тока в щелочных электролитах, приго-
товленных на основе станната натрия, приводит к снижению вы-
хода по току (рис. 12.5). Снижение катодного выхода по току
сообенно заметно в случае работы при пониженной температуре
и малых концентрациях олова. Из-за резкого падения выхода по
току работа при плотности тока выше 4 А/дм2 нецелесообразна.
Температура оказывает значительное влияние на процесс лу-
жения в станнатных электролитах. Как видно из рис. 12.6, повы-
150
Рис. 12.6. Зависимость выхода по току (/) и напряжения на ванне (2) от тем-
пературы; 45,8 г/л Sn2+, iK = 1 А/дм2
Рис. 12.7. Изменение выхода по току в растворах станната калия (/, 2, 3)
и станната натрия (4, 5) при температурах 90 °C (/), 75 °C (2, 4), 65 °C (3, 5)
шение температуры приводит к увеличению выхода по току и сни-
жению напряжения на ванне.
Аноды для оловянирования из щелочного электролита должны
быть изготовлены из чистого олова марок 01 и 02; примеси мышь-
яка, меди и свинца недопустимы. Аноды следует периодически
очищать от шлама.
Электролиты на основе станната калия при оловянировании
обладают следующими преимуществами перед электролитами на
основе станната натрия: более высокой растворимостью (в 1,5—
2 раза), лучшей электропроводностью (примерно на 25 %), более
широким пределом рабочей плотности тока и несколько более
высоким выходом по току (рис. 12.7).
По имеющимся данным, электролиты на основе станната ка-
лия более стабильны, чем электролиты на основе станната натрия,
так как менее подвержены гидролизу. Следует отметить, что с по-
вышением анодной плотности тока растворимость оловянных
анодов в калиевых электролитах заметно снижается. В связи
с этим было предложено использовать оловянные аноды, содержа-
щие около 1 % алюминия. Аноды из сплава олова с алюминием,
так же, как и оловянные аноды, в процессе работы должны быть
покрыты пассивной пленкой.
Считают, что аноды, изготовленные из указанного сплава,
пассивируют при рабочей плотности тока. Анодная поляризация
несколько меньше, а анодный выход по току выше, чем в случае
применения оловянных анодов. Повышение содержания олова
в электролите приводит к лучшему использованию тока. Повы-
шение содержания едкого кали снижает катодный выход по току,
повышает выход по току и одновременно критическую плотность
тока, при которой наступает пассивирование анодов; при этом
повышается проводимость электролита. Повышение температуры
способствует увеличению проводимости, а также анодного и ка-
тодного выходов по току.
151
12.6. Состав (г/л) станнатных
электролитов и режим работы
Компоненты электролита и режим работы Номер электролита
1 2
Na2Sn(OH)e-3H2O 28—90
K2Sn(OH)e —. 150—165
NaOH 7—15 -—.
кон — 20—25
NaCHsCOO 10—20 —.
t, °C 60—80 80—90
«к, А/дм2 ВТ, % 0,5—1,5 6—10
70—50 90—80
Приготовление из тетрахлорида
реакции получения станната олот
Рекомендуемые составы
и режим работы станнатных
электролитов приведены в
табл. 12.6.
При использовании гото-
вых солей электролит гото-
вится последовательным вве-
дением в рабочую ванну
концентрированных раство-
ров станната натрия, щелочи
и ацетата натрия.
При отсутствии готовых
растворов станната натрия
электролит готовят из хло-
рида или тетрахлорида оло-
ва.
олова основано на следующей
SnCl4 + 6NaOH = Na2SnO3 + 4NaCl + 3H2O.
Требуемые количества тетрахлорида олова и едкого натра
растворяют в возможно малом количестве нагретой воды. Затем,
энергично перемешивая, вливают раствор тетрахлорида олова в рас-
твор едкого натра. Небольшой осадок метаоловянной кислоты уда-
ляется декантацией или фильтрованием. После анализа, корректи-
рования и введения остальных добавок электролит готов к работе.
При использовании хлорида олова в отдельных сосудах рас-
творяют едкий натр и хлорид олова. Затем, осторожно помешивая,
добавляют раствор щелочи к теплому раствору хлорида олова.
При этом вначале получается осадок Sn (ОН)2, который затем рас-
творяется в избытке едкого натра, образуя раствор станната
олова Na2Sn О2, в котором олово находится в двухвалентном со-
стоянии. Перевод двухвалентного олова в четырехвалентное осу-
ществляется добавлением пероксида водорода, а также путем
проработки электролита с частично запассивированными анодами.
Корректирование электролита проводят по данным анализа
оловом в виде станната и щелочью. Вредными примесями в стан-
натных электролитах, как уже указывалось, являются ионы
двухвалентного олова, ионы меди, свинца и железа. В присут-
ствии меди получаются темно-серые осадки, плохо паяющиеся
непосредственно после покрытия. Свинец и железо препятствуют
образованию на анодах пассивной пленки.
§ 12.6. ДОПОЛНИТЕЛЬНАЯ ОБРАБОТКА
ОЛОВЯННЫХ ПОКРЫТИЙ
Для повышения стойкости оловянных покрытий при
контакте их с пищевыми продуктами разработаны химические и
электрохимические методы пассивирования.
‘«ЙЙ1
152
Химическое пассивирование проводят в хроматных растворах.
Для защиты от коррозии применяют раствор, состоящий из
10 г/л СгО3 и 50 г/л Н3РО4 при температуре 85 °C. Продолжитель-
ность обработки 10—20 мин. Раствор, содержащий 80—100 г/л
Na2Cr2O7, обрабатывают при температуре 80—100 °C в течение
10—20 мин.
Консервную жесть обрабатывают в растворе, содержащем
3 г/л Na2Cr2O7, 10 г/л NaOH и 3,5 г/л эмульгатора ОП-Ю при тем-
пературе 85—95 °C в течение 3—5 с.
Электрохимическое пассивирование с целью защиты от кор-
розии проводят в растворе, содержащем 30 г/л СгО3 и 30 г/л
Na2Cr2O7 при t = 5ч-80 °C, pH 4,0—6,5 i = Зч-5 А/дм2.
Консервную жесть для получения пленок толщиной до 0,3 мкм
пассивируют электрохимически на аноде в растворе, содержащем
5 г/л NaOH при температуре 20 °C и анодной плотности тока
2—5 А/дм2.
Оплавление применяют для покрытий толщиной около 1 мкм,
полученных из щелочных электролитов, для уменьшения пори-
стости, придания поверхности декоративного вида и облегчения
пайки после длительного хранения.
Для оплавления мелких деталей используют муфельные или
шахтные печи, в которых обработку производят при 550—600 °C
в течение 10—15 с. Детали после оловянировании смачивают
5—6 %-ным раствором флюса (ZnCl2 : NH4C1 = 3:1), сушат и по-
мещают в печь или нагретый жидкий теплоноситель (касторовое
масло или смесь глицерина и соляно-кислого диэтиламина) на
1—2 с. После оплавления детали промывают горячей водой и
сушат.
Декоративное покрытие «кристаллит», разработанное А. П. Эй-
чисом, широко применяется для придания поверхности краси-
вого внешнего вида. Сущность метода заключается в нанесении
слоя олова небольшой толщины (3—4 мкм), оплавлении его,
проявлении кристаллической структуры застывшего слоя олова
и закреплении его лаком. В результате такой обработки поверх-
ность деталей приобретает красивую ярко выраженную узорча-
тость, напоминающую изморозь на окнах. Оловянированию по
способу «кристаллит» могут подвергаться детали, изготовленные
из железа, меди, алюминия, их сплавов и др.
Детали, покрытые оловом, подвергаются термической обра-
ботке; простейшей является прогрев деталей в воздушной среде
при температуре 250—300 °C до начала оплавления олова. Про-
грев заканчивается при появлении на деталях соломенно-желтых
цветов побежалости.
Структура покрытия зависит от температуры оплавления,
скорости охлаждения и вида основного металла или подслоя, на
которые наносится слой олова. При нагреве до температуры,
равной примерно температуре плавления олова (235 °C), на по-
верхности образуется мелкокристаллическая структура. При
153
повышении температуры нагрева до 250 °C получаемая микрострук-
тура укрупняется.
Скорость охлаждения оказывает большое влияние на внешний
вид покрытия, размеры и форму кристаллитов; особенно сильно
сказывается резкое местное охлаждение. В случае нанесения
олова на стальную и алюминиевую поверхности кристаллический
узор получается крупным; при нанесении же олова на подслой
цинка, кадмия, латуни, меди образуется мелкий узор.
Проявление кристаллического узора производится следующим
образом. Сначала поверхность активируется в 5 %-ном растворе
серной кислоты в течение 2—3 с, а затем подвергается оловяниро-
ванию в сульфатном электролите, содержащем 45—50 г/л сульфата
олова, 1,0—1,5 г/л клея и 3—4 г/л фенола. Плотность тока при
оловянировании 0,2—0,4 А/дм2, продолжительность проявления
узоров 10—20 мин. После оловянирования и сушки изделия по-
крывают бесцветными лаками.
§ 12.7. ОЛОВЯНИРОВАНИЕ БЕЗ ВНЕШНЕГО ТОКА
(ХИМИЧЕСКОЕ ОЛОВЯНИРОВАНИЕ)
Этот метод применяется для деталей, изготовленных
из металлов или сплавов менее электроотрицательных, чем олово,
т. е. из меди, латуни, бронзы. Для химического оловянирования
деталей из меди и ее сплавов применяют растворы следующего
состава, г/л:
SnCl2..................10—20 NaCl.....................75—90
Тиомочевина ........... 80—90 НС1 (1,19), см3/л ......15—17
Режим работы: температура 55—65 °C, продолжительность
осаждения 25—30 мин, толщина получаемого покрытия около
1 мкм.
Покрытие деталей из стали и других металлов производится
с применением контакта из цинка в растворе, содержащем хлорид
олова (2—5 г/л) и насыщенном виннокислым натрием или калием
при температуре 85—100 °C. Детали загружаются в оцинкован-
ные корзины, периодически встряхиваются. Продолжительность
обработки от 10 мин до 2 ч.
ГЛАВА 13. СВИНЦЕВАНИЕ
§ 13.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА СВИНЦА
И ОБЛАСТЬ ПРИМЕНЕНИЯ СВИНЦОВЫХ ПОКРЫТИЙ
Свинец — голубовато-серый металл, очень пластичный,
Мягкий, режется даже ножом. Температура плавления свинца
327 °C, твердость свинцовых покрытий 60—90 МПа, плотность
11,34 г/см3. Удельное электросопротивление 0,21 10-в Ом м.
Металлический блеск свежего разреза быстро тускнеет на воздухе
154
вследствие образования тончайшей пленки оксида свинца, пре-
дохраняющей его от дальнейшего окисления. В жесткой воде на
свинце создается такая же пленка, которая предохраняет воду от
загрязнения растворимыми и токсичными соединениями свинца.
Мягкая вода растворяет свинец, что может привести к отравле-
ниям. По этим соображениям не следует использовать свинец для
покрытия труб и резервуаров с питьевой водой.
Свинец не растворяется в разбавленных растворах НС1 и
H2SO4 из-за образования на поверхности защитных пленок трудно-
растворимых солей РЬС12 и PbSO4. Устойчив при наличии в атмо-
сфере H2S, SO2 и паров H2SO4. В концентрированных растворах
НС1 и H2SO4 заметное растворение свинца начинается лишь при
температурах свыше 180—200 °C. Легко реагирует свинец с HNO3;
органические кислоты, особенно уксусная, растворяют свинец.
В присутствии щелочей свинец разрушается.
Стандартный потенциал свинца 0,126 В, поэтому, являясь
катодным покрытием по отношению к железу, он может обеспечи-
вать лишь механическую защиту при достаточной толщине осад-
ков. Низкая температура плавления, небольшая электропровод-
ность, слабая механическая прочность, растворимость в маслах
ограничивают применение свинцовых покрытий в приборострое-
нии и машиностроении. Однако высокие антифрикционные свой-
ства свинцовых покрытий (при сухом трении свинца в паре со
сталью коэффициент трения равен всего лишь 0,05—0,06) и стой-
кость в серосодержащих средах позволяют применять эти покры-
тия для защиты изделий от коррозии в H2SO4 и серосодержащих
средах; для защиты от газовой коррозии в атмосфере, содержа-
щей H2S и SO2; для защиты от рентгеновских лучей; для защиты
подвесных приспособлений от растворения при электрополиро-
вании в растворах серной, хромовой и фосфорной кислот, а также
для изготовления дополнительных анодов при хромировании; в ка-
честве твердой смазки в узлах трения.
Толщина свинцовых покрытий колеблется в широком диапа-
зоне — от 3 до 2000 мкм. При выборе толщины следует учиты-
вать, что свинец — очень мягкий металл, который легко исти-
рается.
§ 13.2. ЭЛЕКТРОЛИТЫ СВИНЦЕВАНИЯ
Свинцевание производят в основном в кислых электро-
литах: фторборатных, кремнефторидных, фенолсульфоновых; при-
меняются и щелочные электролиты. В кислых электролитах сви-
нец находится в виде катиона РЬа+. Известны и щелочные электро-
литы, в которых свинец образует анионы РЬОг”. Во всех электро-
литах свинец осаждается при незначительной катодной поляриза-
ции, поэтому осадки имеют крупнокристаллическую структуру
и склонны к дендритообразованию. Введение ПАВ меняет характер
осаждения и позволяет получать плотные и компактные покрытия.
155
В качестве ПАВ применяют столярный клей, глицерин, канифоль
и другие органические соединения.
Для свинцевания применяют борфторидные, кремнефторидные,
фенолсульфоновые, плюмбитии и некоторые другие электролиты.
Исходными компонентами борфторидных электролитов яв-
ляются основной карбонат свинца и борфтористоводородная кис-
лота:
2РЬСО3 • Pb(OH)2 + 6HBF4 = 3Pb(BF4)2 + 2СО2 + 4Н2О.
Борфтористоводородную кислоту получают растворением бор-
ной кислоты в плавиковой кислоте (см. с. 113).
Электролит должен содержать избыток HBF4 и Н3ВО3. Избы-
ток HBF4 подавляет концентрацию ионов РЬ2+, в связи с чем уве-
личивается катодная поляризация и улучшается структура осадка.
При этом создаются условия для осаждения свинца при более
высоких плотностях тока. Кроме того, наличие кислоты в сво-
бодном виде увеличивает электропроводность электролита и
предотвращает гидролиз свинцовых солей. Избыток Н3ВО3 преду-
преждает шламообразование фторида свинца и делает электролит
более устойчивым в работе. В качестве ПАВ применяют столяр-
ный клей. Осадки свинца получаются светлыми, плотными.
Так как электролит имеет склонность к дендритообразованию,
детали, имеющие острые кромки, углы и другие выступающие
части, рекомендуется покрывать свинцом при пониженных плот-
ностях тока. При нанесении толстых слоев необходима предвари-
тельная пескоструйная обработка.
Вследствие высокого перенапряжения водорода на свинце
катодный выход по току в рабочем интервале плотностей тока
близок к 100 %. Анодный выход по току приблизительно равен
катодному, поэтому соотношение анодной и катодной поверхностей
одинаково. Аноды изготавливают из чистого свинца марок С-0
и С-1. К недостаткам электролита следует отнести его пониженную
рассеивающую способность.
Основным компонентом кремнефторидных электролитов яв-
ляется кремнефторид свинца, который образуется при взаимодей-
ствии основного карбоната свинца с кремнефтористоводородной
кислотой:
2РЬСО3 • Pb(OH)2 + 3HaSiFe = 3PbSiFe + 2СО2 + 4Н2О.
По сравнению с борфторидным электролитом кремнефторидные
электролиты намного дешевле; в остальном они особых преиму-
ществ не имеют. Для обеспечения сцепления свинца со сталью
необходимо предварительное меднение.
Концентрация свободной H2SiFe должна поддерживаться на
заданном уровне. При избытке свободной H2SiFe на катоде на-
чинается выделение водорода и выход по току падает; при не-
достатке — возможен гидролиз с образованием фтористого водо-
рода, который, являясь ядовитым газом, отравляет атмосферу
156
13.1. Состав (г/л) борфторидиых и кремнефторидных электролитов
и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3
Pb(BF4)a HBF4 свободная Н3ВО3 PbSiFe HaSiFe свободная Клей столярный «к. А/дм2 t, °C 125—200 40—60 10—30 0,5—1,0 0,5—2,0 15—30 180—200 40—45 До 30 0,5—1,0 2 15—25 5—6 80—150 20—35 0,5—1,0 1,0—1,2 15—25
цеха. В качестве ПАВ в электролит добавляют желатину или
столярный клей. Состав электролитов и режим работы приведен
в табл. 13.1.
Фенолсульфоновые электролиты получают следующим образом.
Фенолсульфоновый свинец приготавливают путем взаимодействия
фенолсульфоновой кислоты с карбонатом свинца:
2CeH4OHSO3H + РЬСО3 = Pb(CeH4OHSO3)2 + Н2О + СОа.
Осадки получаются светлыми и имеют прочное сцепление
с основой. Выход по току 90—95 %. Состав электролита, г/л,
и режим его работы следующие:
Фенолсульфоновая кислота 20—25 Столярный клей........0,4—0,5
Фенолсульфоновокислый iK, А/дм2.............0,5—1,0
свинец................ 170—180 t, °C.................. 18—60
В плюмбитных электролитах свинец находится в виде плюмбита
натрия или калия. Диссоциация протекает так же, как и в цин-
катных электролитах. Осаждение происходит за счет диссоциации
РЬ(ОН)4 . Растворимость плюмбита незначительна, поэтому про-
цесс свинцевания ведут при повышенной температуре.
Без специальных добавок осаждение свинца сопровождается
образованием дендритов. Введение в электролит олова в виде
станната задерживает рост кристаллов. Особенно благоприятное
действие оказывают добавки глицерина, увеличивающего раство-
римость свинца за счет образования глицератов. В таком электро-
лите можно наносить покрытия толщиной до 1200 мкм, поддержи-
вая плотность тока 0,5 А/дм2. При перемешивании ее можно уве-
личить до 2—3 А/дм2. Добавка глицерина способствует увеличению
растворимости анодов. Состав (г/л) плюмбитного электролита и
режим его работы представлены ниже:
РЬ в пересчете на металл 80—100
NaOH......................140—180
Sn в виде станната .... 0,3—1,0
Глицерин
t, °C . . .
iK, А/дм2 .
...........50—60
...........20—60
...........0,5—2,0
157
Анодный и катодный выходы по току равны 100 %. Для обес-
печения прочного сцепления наносят подслой меди или никеля
толщиной 0,2—0,5 мкм.
В промышленности применяют электролиты с добавками сегне-
товой соли, которая в щелочном растворе образует комплексы:
Pb(CH3COO)2 + KNaC4H4Oe + 2NaOH =
= KNa[Pb(C4H4Oe) 1 + 2NaCH3COO + 2H2O.
Вследствие диссоциации аниона РЬ (С4Н4Ов)2- в растворе про-
исходит замедленный разряд ионов свинца и катодная поляриза-
ция увеличивается. Ацетат натрия, являясь буферной добавкой,
стабилизирует работу электролита. Состав (г/л) раствора и режим
его работы приведены ниже:
РЬ(СН3СОО)2................ 75
NaOH ......................200
Сегнетова соль.............. 50
Канифоль ..................... 6
iK, А/дм2.................... 1,5
Л °C....................... 60—70.
В плюмбитных электролитах обязательно образуются карбо-
наты за счет взаимодействия оксида углерода (IV) с гидрооксидом
натрия. Удаление карбонатов производится обычным путем (см.
П. 10.4). Аноды изготавливают из свинца марок С-0 или С-1.
Все электролиты свинцевания необходимо приготовлять под
тягой, соблюдая правила техники безопасности, так как все рас-
творимые соединения свинца, а также плавиковая, борфтористо-
водородная, кремнефтористоводородная и другие кислоты, не-
обходимые для составления растворов, ядовиты.
Борфторидные электролиты приготавливают следующим об-
разом. Дигидроксокарбонат свинца (свинцовые белила) или оксид
свинца (свинцовый глет) мелко растирают и вводят в раствор
борфтористоводородной кислоты. Так как эти соединения легко
растворяются лишь в свежеосажденном виде, выгоднее их пере-
вести сначала в нитраты с последующим осаждением при помощи
карбоната натрия. После их растворения раствор декантируют
в рабочую ванну, добавляют необходимое количество свободной
борфтористоводородной кислоты и доливают водой до заданного
объема. Столярный клей предварительно замачивают в холодной
воде, а затем растворяют в горячей. Электролит необходимо про-
работать током в течение нескольких часов.
Приготовление кремнефторидного электролита сводится к сле-
дующему. Кремнефтористоводородная кислота является побочным
продуктом при производстве суперфосфата. Готовая кислота имеет
низкую концентрацию (до 37 %), поэтому приготавливать из нее
растворы с высоким содержанием свинца трудно, в связи с этим
лучше ее делать на месте. Для этой цели берут плавиковую кислоту
и фильтруют ее через два слоя кварца: первый слой состоит из
кусков величиной до 0,5 см, второй — с более мелкими частицами.
Так как при этом выделяется большое количество теплоты, его
охлаждают, добавляя лед, иначе образуется газообразный фторид
158
водорода. После отстаивания раствор сливают в ванну, добавляют
остальные компоненты и прорабатывают током.
Для приготовления фенолсульфонового электролита приго-
тавливают фенолсульфоновую кислоту путем сульфирования фе-
нола в концентрированной серной кислоте:
СвН6ОН + HaSO4 — C4H4OHSOsH + На.
В химически чистую емкость загружают фенол и нагревают
до плавления (45 °C), затем небольшими порциями добавляют кон-
центрированную серную кислоту, которую берут в избытке.
При непрерывном помешивании доводят температуру до 100—
ПО °C и выдерживают полученную смесь в течение 24 ч. Готовый
раствор фенолсульфоновой кислоты должен быть прозрачным и
иметь цвет слабого чая, на его поверхности не должно быть масля-
нистых пятен. Избыток серной кислоты нейтрализуют мелом.
Полученный раствор декантируют, вводят избыток фенолсульфо-
новой кислоты и доводят водой до заданного объема. В последнюю
очередь прибавляют столярный клей.
Щелочные электролиты готовят химическим или электрохими-
ческим путем. В первом случае растворяют свежеосажденный
гидрооксид свинца в растворе гидрооксида калия или натрия,
нагретом до 80 °C. Вторым способом является анодное растворение
металлического свинца в щелочном растворе при температуре
60 °C. Стальные катоды помещают в диафрагму, чтобы ионы свинца
накапливались в электролите, а не осаждались на катоде.
Приготовление щелочных электролитов, содержащих сегне-
тову соль, сводится к следующему. Сначала приготавливают рас-
твор оксида натрия и сегнетовой соли, затем вводят хлорид или
ацетат свинца. После полного растворения солей вводят заранее
приготовленный раствор канифоли. Ее предварительно раство-
ряют в небольшом объеме электролита, а затем кипятят в течение
10—20 мин, охлаждают и фильтруют через стеклоткань.
ГЛАВА 14. МЕДНЕНИЕ
§ 14.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА МЕДИ
И ОБЛАСТЬ ПРИМЕНЕНИЯ МЕДНЫХ ПОКРЫТИЙ
Медь — пластичный, легко полируемый металл. Плот-
ность меди при 20 °C составляет 8,96 г/см3, атомная масса 63,54,
температура плавления 1083 °C, удельное электрическое сопро-
тивление при 20 °C 1,68 X 10-8 Ом-м.
В химических соединениях медь одно- и двухвалентна. Элек-
трохимический эквивалент одновалентной меди 2,372 г/А-ч, двух-
валентной — 1,186 г/А-ч, стандартный потенциал Cu/Cu2+ ра-
вен +0,34 В, Cu/Cu+ равен +0,52 В.
159
На воздухе во влажной атмосфере в присутствии агрессивных
соединений медь легко окисляется. При наличии в воздухе серни-
стых соединений медь быстро покрывается серым или темно-
коричневым налетом сульфида меди CuS. Под воздействием влаги
и углекислоты медь постепенно покрывается зеленым налетом
гидр окар бонатов.
Медь интенсивно растворяется в азотной кислоте, медленнее —
в хромовой. Концентрированная серная кислота хорошо реаги-
рует с медью, особенно при нагревании. Разбавленные серная и
соляная кислоты на медь практически не действуют. Однако в при-
сутствии кислорода или окислителей скорость коррозии становится
заметной. Медь неустойчива в аммиаке; в других щелочах она
быстро темнеет, но растворяется весьма медленно.
Медь имеет более положительный потенциал, чем железо,
т. е. является катодным покрытием по отношению к железу,
поэтому медные покрытия не могут защищать поверхность желез-
ных деталей от коррозии электрохимически, а только механически
и при отсутствии пористости. При наличии пор в медном покрытии
во влажной атмосфере образуется гальванопара с железом. В этой
паре железо является анодом и коррозия его протекает весьма
интенсивно.
Как правило, медные покрытия без дополнительной обработки
самостоятельного защитно-декоративного значения не имеют.
Медные покрытия легко полируются до высокой степени блеска
и создают прочное сцепление со многими металлами: никелем,
хромом, серебром и др. Поэтому медные покрытия широко приме-
няются в качестве подслоя при никелировании, серебрении и т. п.
Медные покрытия получили довольно широкое распростране-
ние для защиты отдельных участков деталей от науглероживания
при цементации. Меднение применяется также во многих специаль-
ных случаях. Слой медных покрытий в зависимости от их назначе-
_ ния имеет следующую толщину, мкм:
Подслой под никелирование, хромирование................... 6—30
Защита от науглероживания при цементации.................. 48—50
Получение медной электролитической фольги................. 10—70
Улучшение пайки черных металлов........................... 6—30
Восстановление изношенных деталей............................ До 3000
Покрытие валов для глубокой печати........................... До 3000
Получение медных деталей сложного профиля :................ 1000 и более
» металлических копий с художественных изделий. . . 1000 и более
» копий при производстве грампластинок и клише. . . 1000 и более
§ 14.2. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
ЭЛЕКТРОЛИТОВ
Для электрохимического осаждения меди разработано
большое количество электролитов, которые можно разделить на
две основные группы: простые кислые и комплексные, преиму-
щественно щелочные, в которых медь присутствует в виде отри-
цательно или положительно заряженных комплексных ионов.
160
Рис. 14.1. Поляризационные кривые
электроосаждения меди из различных
электролитов:
/ — сульфатный (1,6 г-экв/л CuSO4 и
1,6 г-экв/л H,SO4); 2 — пирофосфатный
(0,72 г-экв/л CuSO4 и 3,85 г-экв/л К4РЯО,);
3 — цианидный (0,94 г-экв/л CuCN и
0,20 г-экв/л NaCNcB); 4 — цианидный
(0,94 г-экв/л CuCN и 0,4Б г-экв/л NaCNcB)
Из простых кислых электролитов используются сульфатные
фторборатные, нитратные, кремнефторидные, сульфамидные и
хлоридные. Кислые электролиты просты по составу, устойчивы
в работе, процесс их осаждения ведется при достаточно высоких
плотностях тока, особенно при повышении температуры и переме-
шивании. Они имеют высокий выход по току, приближающийся
к 100 %.
Основными компонентами кислых электролитов являются соль
меди и соответствующая кислота. В кислых электролитах осажде-
ние меди происходит в результате разряда двухвалентных ионов
при положительных значениях потенциалов, мало изменяющихся
с повышением плотности тока (рис. 14.1, кривая 1). Катодная по-
ляризация не превышает 50—60 мВ. Поэтому осадки меди из
кислых электролитов имеют крупнокристаллическую структуру,
но вместе с тем они достаточно плотны.
Недостатками кислых электролитов является низкая рассеи-
вающая способность и невозможность непосредственного меднения
стали, цинковых сплавов и других металлов, имеющих более отри-
цательный потенциал, чем медь. Это объясняется тем, что при по-
гружении этих металлов в кислый электролит происходит контакт-
ное выделение меди в виде пористого рыхлого, плохо сцепленного
с основой осадка. Поэтому перед меднением в кислых электроли-
тах детали из стали или цинка и цинкового сплава покрывают
тонким слоем меди (около 3 мкм) из комплексного цианидного
электролита, в котором вследствие высокого электроотрицатель-
ного значения потенциала контактного вытеснения меди железом
не происходит. Применяют также осаждение никеля от 1 до 5 мкм
из обычного кислого электролита. Никелевое покрытие в резуль-
тате способности легко пассивироваться приобретает менее элек-
троотрицательный потенциал и поэтому не так быстро, как цинк
и железо, вытесняет медь из кислых электролитов.
В комплексных щелочных электролитах медь находится в со-
ставе комплексных ионов, степень диссоциации которых мала.
Для восстановления этих комплексных анионов требуется повы-
шенная катодная поляризация (рис. 14.1, кривые 2—4).
Константы нестойкости Кн комплексных ионов, характеризую-
щих степень их активности, очень малы:
[Cu(CN)s]s-............. 2,6-10~28
[Cu(P2O7)s]«-........... 3,0-1(Г13
[CuNH4CH2CH2NH2]2+. . . 2,14-Ю-28
[Cu(NHs)4]2+............2,14- 1O"1S
6 Дасояи М. А. и др;
161
В связи с этим равновесный потенциал меди в комплексных
электролитах сдвинут в сторону электроотрицательных значений.
Выход металла по току в этих электролитах меньше, чем в кис-
лых, и резко снижается с повышением плотности тока. Эти фак-
торы способствуют получению равномерного распределения ме-
талла по поверхности при осаждении. Вследствие высокой катод-
ной поляризации осадки меди из комплексных электролитов имеют
мелкозернистую структуру. Разработано большое количество
комплексных щелочных электролитов: цианидные, пирофосфат-
ные, триполифосфатные, аммонийные, этилендиаминовые, окса-
латные, цитратные и др.
Цианидные медные электролиты обладают весьма высокой рас-
сеивающей способностью. При их применении медь осаждается
непосредственно на железных и стальных деталях и создается
хорошее сцепление с основным металлом. Осаждение меди из
цианидных электролитов происходит при высокой катодной поля-
ризации (рис. 14.1, кривые 3, 4). Осадки из цианидных электроли-
14.1. Рассеивающая способность электролитов меднения (%)
Компоненты электролитов Концентрация, г/л Катодная плотность тока, А/дм1
0,5 1.0 1.5 5,0
CuSO4-5H2O Na4P2O, CuSO4-5H2O K4PsO7 CuSO4-5H2O K4PsO7 CuSO4-5H2O Этиленди амии Na2SO4 (NH4)2SO4 CuSO4-5H2O (NH4)sSO4 Полиэтилен поли амин 1,0—2,5 1 80—100 / 70—90 1 330—370 / 90 1 370 f 90—125 45—60 1 45—60 ( 45—60 J 50—150 •) 100—200 i 60—180 J 81 77 70 40 50 59 58 15—18 40 38 57 15—18 —
CuSO*-5H2O (NH4)2SO4 NH4NOs nh4oh 90 i 80 40 [ 180 J — — — 30
CuCN NaCN св или KCN св NaOH KNaC4H4O,-4H2O CuCN NaCN св или KCN св NaOH 50—70 5—10 10—15 30—60 20—30 1 5—10 i 5—10 J 80 50 — ~60 —
162
тов отличаются мелкокристаллической структурой и незначитель-
ной пористостью. Однако цианидные электролиты приготовляются
из ядовитых, дефицитных и дорогих солей и требуют частой кор-
ректировки. Кроме того, цианидные электролиты характеризуются
пониженным выходом по току.
Цианидные электролиты могут работать при комнатных тем-
пературах и невысоких концентрациях только при довольно низ-
ких плотностях тока. Выход по току при меднении в цианидных
электролитах обычно не превышает 60—70 %.
Пирофосфатные электролиты просты по составу, устойчивы,
безвредны. Медь выделяется из пирофосфатных электролитов
при повышенной катодной поляризации (рис. 14.1, кривая 2)
в виде плотных мелкозернистых и относительно равномерных по
толщине осадков. Рассеивающая способность этих электролитов
близка к цианидным. Триполифосфатные, гексаметафосфатные
электролиты недороги, устойчивы в работе, осадки имеют мелко-
зернистую структуру.
В аммонийных и этилендиаминовых электролитах осадки полу-
чаются плотными и мелкозернистыми. Аммонийные электролиты
недостаточно устойчивы из-за летучести аммиака, этилендиамино-
вые и полиэтиленполиаминовые — относительно дороги и эколо-
гически опасны.
Основной недостаток указанных электролитов кроме поли-
этиленполиаминового — трудность получения прочного сцепле-
ния со стальной основой.
Рассеивающая способность некоторых комплексных электро-
литов приведена в табл. 14.1.
§ 14.3. ПРОСТЫЕ КИСЛЫЕ ЭЛЕКТРОЛИТЫ
Сульфатные электролиты. Основными компонентами
сульфатных электролитов являются сульфат меди и серная кис-
лота.
Предполагается, что на катоде разряд двухвалентных ионов
меди протекает в две стадии: Cu2+-> Си+ -> Си0, причем замедлен-
ной стадией является Си2+ + ё -> Си+. Доля каждой стадии за-
висит от состава электролита и режима электролиза: плотности
тока, температуры перемешивания.
Электропроводность нейтральных растворов сульфата меди не-
велика, поэтому в них добавляют серную кислоту, которая зна-
чительно повышает электропроводность растворов (табл. 14.2).
Выход меди по току около 100 %, так как выделения водорода
на катоде не происходит, поскольку потенциалы выделения меди
имеют более положительные значения, чем потенциалы выделения
водорода.
Повышение кислотности электролита способствует уменьшению
растворимости сульфата меди, что приводит к снижению верх-
него предела допустимой плотности тока. Для увеличения кон-
б* 163
14.2. Влияние концентрации серной кислоты
на удельную электропроводность электролита при температуре 25 °C
Содержание CuSO4-5H*O, г/л Удельная электропроводность, Ом^-см"1 при концентрации свободной H8SO4, г/100 см3
0 Б 10 15 20
0 0,2165 0,4069 0,5559 0,6684
50 0,0148 0,1977 0,3714 0,5123 0,6195
100 0,0252 0,1868 0,3480 0,4819 0,5729
150 0,0333 0,1772 0,3214 0,4392 0,5256
200 0,0402 0,1750 0,3017 0,4087 0,4852
центрации ионов меди в катодном слое применяют перемешивание.
В этом случае кислотность электролитов можно увеличивать.
Чем интенсивнее перемешивание, тем выше может быть содержание
серной кислоты. Повышение температуры способствует увеличению
растворимости сульфата меди: при 25 °C — 23,05 г CuSO4 на 100 г
воды; при 100 °C — 73,6 г. Повышенная кислотность способствует
получению более мелкокристаллических осадков.
Вблизи анодов наряду с ионами Си2+ в растворе могут нахо-
диться в незначительном количестве ионы одновалентной меди,
образующиеся в результате протекания реакции диспропорцио-
нирования:
Си + Си2+ -> 2Си+.
При накоплении в растворе ионов Си+ равновесие будет сдви-
гаться влево, и металлическая медь будет выпадать в виде осадка.
При недостаточной кислотности раствора сульфат одновалент-
ной меди будет гидролизоваться с образованием Си(ОН)2 или
СиО2
Cu2SO4 + Н2О Cu2O + H2SO4.
В результате в электролите будут взвешенные частицы метал-
лической меди и оксида меди, которые, включаясь в катодный оса-
док, делают его темным, шероховатым, а иногда — рыхлым.
Присутствие серной кислоты способствует протеканию реак-
ций окисления одновалентной меди:
Cu2SO4 + H2SO4 + l/2O3 -> 2CuSO4 + Н2О;
Cu2O + 2H2SO4 + 1/202->2CuS04 + 2H2O.
Таким образом, серная кислота прежде всего нужна для преду-
преждения накопления ионов Си+ и гидролиза ее солей.
В сульфатные электролиты иногда вводят поверхностно-ак-
тивные вещества. Эти вещества вводят для повышения катодной
поляризации, что способствует получению более мелкозернистых
плотных, иногда блестящих, осадков. Благоприятное действие
164
14.3. Состав (г/л) сульфатных электролитов меднения и режимы работы
Компоненты электролитов и режим работы Номер электролита
1 2 3 4
CuSO4-5H2O 200—250 180—240 240—250 150—250
H2SO4 35—70 50—65 40—60 50—70
Декстрин сульфирован- ный — — — 0,8—1,0
Сульфирол-8 — — — 0,1—0,2
Блескообразователь Б-7211 3—5 мл/л — — —
Блескообразователь БС-1 или БС-2 — 4—6 мл/л — —
Блескообразующая до- бавка ЛТИ — — 1—10 —
Ион Cl” 30—75 мг/л 40—60 мг/л 30—60 мг/л .—_
/, °C 13-30 18—25 15—25 25—48
iK, А/дм8 2—7 0,5—11 2—6 До 8
/а. А/дм8 До 2,5 До 5 —
этих добавок сказывается в том, что они предупреждают образова-
ние наростов на краях и выступающих частях деталей. Наилуч-
шими добавками являются декстрин (не более 1 г/л) и фенол или
его сульфосоединения (1—10 г/л).
Для получения блестящих медных покрытий предложено боль-
шое количество блескообразующих добавок, обеспечивающих
зеркальный блеск покрытий, придающих им пластичность и сни-
жающих внутренние напряжения. Это блескообразующая добавка
ЛТИ, блескообразователи Б-7211 и БС-1, разработанные Единым
центром по химии Болгарской академии наук и Институтом
химии и химической технологии АН ЛитССР.
Наиболее распространенные составы электролитов меднения
и режимы осаждения приведены в табл. 14.3.
Электролиты 1 и 2 предназначены для получения медных бле-
стящих покрытий, обладают относительно хорошей рассеивающей
и хорошей выравнивающей способностью Покрытия, полученные
в электролите 2, имеют пониженные внутренние напряжения.
В электролите 3 получаются блестящие осадки. Электролит 4
предназначен для получения матового покрытия. При работе
с повышенными плотностями тока обязательно применять пере-
мешивание электролита сжатым воздухом, очищенным от пыли
и масла.
При работе с электролитами для получения блестящих покры-
тий особое внимание следует уделять анодам. Используют аноды
марки АМФ, не дающие шлама и содержащие 0,03—0,06 % фос-
фора. В остальных случаях применяют аноды из чистой рафини-
рованной меди (99,9 %), содержащей не более 0,1 % примесей.
Взвешенные частицы шлама обычно являются причиной гру-
бого шероховатого осадка.
165
Рис. 14.2. Влияние концентрации меди во фтор-
боратном электролите на допустимую плот-
ность тока с перемешиванием (/) и без перемеши-
вания (2)
Для предотвращения попадания
шлама в электролит рекомендуется ано-
ды помещать в чехлы из кислотостой-
кого материала и вести непрерывную
фильтрацию электролита.
На качество получаемых блестящих
покрытий большое влияние оказывает
концентрация ионов С1~. При пониженной концентрации сни-
жается блеск покрытий и образуются прижоги на острых
кромках деталей, при повышенном содержании образуются
полосы на покрытиях.
Вредными примесями в медных сульфатных электролитах яв-
ляются мышьяк, сурьма, некоторые органические вещества,
образующие коллоидные растворы, анодный шлам.
Фторборатные электролиты. Эти электролиты обладают высо-
кой устойчивостью; получающиеся покрытия плотные и мелкокри-
сталлические, рассеивающая способность электролитов примерно
такая же, как у сульфатных. Большая растворимость фторбората
меди позволяет применять повышенные плотности тока. Из этих
электролитов осаждать медь непосредственно на стальные детали
нельзя; необходим подслой никеля или меди из цианидных элек-
тролитов.
Концентрационная поляризация и склонность к шламообразо-
ванию во фторборатных электролитах меньше, чем в сульфатных.
Рекомендуемый состав (г/л) фторборатных электролитов и
режим работы приведены ниже:
Cu(BF4)2 .... 450 220—230
HBF............... 30 2—3
HsBOs.......... 30 15—16
t, °C .......... 20—40 60—70
/к, А/дм* .... До 40 25—50
pH.............0,2—0,6 1,2—1,7
При повышении концентрации меди в растворе и перемешива-
нии допустимая плотность тока может быть повышена (рис. 14.2).
Для приготовления электролита борную кислоту растворяют
в 25 %-ной плавиковой кислоте. К полученному раствору после
охлаждения добавляют свежеосажденный карбонат меди, получен-
ный смешиванием растворов сульфата меди и карбоната натрия.
Контроль электролита осуществляют измерением его плотности
и pH раствора. Корректировку производят добавлением карбо-
ната меди или карбоната натрия для повышения pH или борфто-
ристоводородной кислоты для понижения pH.
Нитратные электролиты Лимеда ГНМ. Эти электролиты при-
меняются в гальванопластике. Их состав (г/л) и режим работы
приведены ниже:
166
Cu(NOs)2-3H2O......... 500—600 Г, °C .................. 18—25
CuC12-2H2O ............. 0,4 tK, А/дм?.............. 5—20
pH ..................... 1—2
§ 14.4. КОМПЛЕКСНЫЕ ЭЛЕКТРОЛИТЫ
Цианидные электролиты. Условия осаждения меди из
цианидных электролитов существенно отличаются от условий
осаждения в кислых электролитах.
В цианидных электролитах медь находится в составе комплекс-
ных ионов, степень диссоциации, а следовательно, и активность
ионов меди очень мала. Поэтому потенциал выделения меди в них
примерно на 0,9—1,2 В отрицательнее, чем в сульфатных рас-
творах.
Поляризационные кривые цианидных медных электролитов
(рис. 14.1, кривые 3, 4) показывают, что с увеличением плотности
тока катодный потенциал меди резко смещается в сторону отрица-
тельных значений. Значительная катодная поляризация обуслов-
ливает получение мелкокристаллических осадков и высокую
рассеивающую способность. Однако следует иметь в виду, что
плотность тока нельзя сильно увеличивать, так как выход ме-
талла по току может упасть до нуля.
Потенциал меди в цианидных электролитах сильно зависит и
от содержания свободного цианида в растворе. Увеличение со-
держания свободного цианида способствует повышению катодной
поляризации (см. рис. 14.1, кривые 3, 4). Влияние содержания
свободного цианида на катодный потенциал меди при концентра-
ции CuCN 9 г/л следующее:
CKCn. г/л............... 13 26 65
Ек, В .................. —0,60 —0,964 —1,169
Анодный процесс в цианидных электролитах также сопрово-
ждается значительной поляризацией, которая в основном опреде-
ляется содержанием свободного цианида.
Влияние содержания свободного цианида и плотности тока на
катодный выход по току приведено на рис. 14.3 и 14.4. При малом
количестве цианида аноды пассивируются.
Содержание свободного цианида оказывает на катодный и
анодный процессы противоположное влияние: для катодного
процесса требуется минимальное содержание цианидов, для анод-
ного — максимальное. При недостатке свободного KCN на анодах
образуется зеленоватая пленка CuCN из-за того, что ионы меди не
в состоянии перейти в комплексное соединение. Свободная по-
верхность анода уменьшается, плотность тока растет, и анодное
растворение происходит с образованием ионов двухвалентной
меди, которые в виде нерастворимого гидрата осаждаются на
аноде. При этом аноды пассивируются и наблюдается интенсивное
выделение кислорода.
167
Рис. 14.3. Влияние концентрации свободного цианида на анодный (/) и катод-
ный (2) выход меди по току при Ccu = 65 г/л, С Na,СО, = 44 г/л; tH = ia =
= 2 А/дм8; t = 23 °C
Рис. 14.4. Влияние концентрации свободного цианида на выход меди по току
в зависимости от плотности тока в электролитах с концентрацией CN~ 15 г/л
(/); 20 г/л (2); 30 г/л (3)
Основными компонентами медных цианидных электролитов
являются комплексный цианид меди и свободный цианид натрия.
Из приведенных данных видно, что степень диссоциации комплекс-
ных ионов очень мала и уменьшается с увеличением содержания
CN" в комплексе. Этим, по-видимому, объясняется повышение ка-
тодной поляризации при увеличении содержания свободного циа-
нида в электролите.
Содержание меди в электролите во время работы обычно умень-
шается вследствие недостаточной растворимости анодов. Снижение
концентрации ионов меди в электролитах приводит к образованию
пористых осадков. Кроме того, работая с малоконцентрирован-
ными медными электролитами, можно применять только понижен-
ные плотности тока.
О влиянии содержания свободного цианида говорилось выше.
Здесь следует добавить, что при недостаточном количестве сво-
бодного цианида, когда происходит пассивация анодов и на них
разряжаются ионы ОН- с выделением кислорода, то не весь об-
разующийся кислород выделяется в виде газа, а часть его рас-
ходуется на окисление цианида в цианит. Уменьшение содержания
цианидов происходит также из-за взаимодействия их с углекисло-
той воздуха и образования карбонатов.
Постоянным компонентом цианидных электролитов является
карбонат. Он накапливается в результате окисления цианида
кислородом воздуха, особенно при нагревании:
2NaCN + 2Н2О + 2NaOH + О2 = 2Na2CO3 + 2NH3f.
Присутствие карбонатов в небольших количествах полезно,
поскольку при этом повышается электропроводность электроли-
тов. Однако при их накоплении свыше 70 г/л, а в концентрирован-
ных — до 140 г/л аноды проявляют склонность к пассивированию,
а покрытия получаются пористыми. Карбонаты можно удалять
при помощи хлорида бария и вымораживанием, охлаждая элек-
168
14.4. Состав (г/л) цианидных электролитов
меднения и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3
CuCN 50—70 20—30 40—45
NaCN 10—25 5—10 12—15
NaOH — 5—10 10—15
NH4CNS — — 10—15
KNaC4H4Oe-4HsO — — 5—10
MnSO4-5H2O — — 0,Ol- О.05
Циклогексановый спирт — — 0,03— 0,05
pH 10—11 — —
/, °C 40—50 15—55 50—60
tK, А/дм8 1—5 0,3—2,0 1,0—3,0
тк : xa, c — — 25 : 3
тролит до —5 °C. Сле-
дует отметить, что
карбонаты натрия
легче выпадают в оса-
док, чем калиевые. Сульфаты существенного влияния на процесс
ВТ,%
Рис. 14.5. Зависимость
выхода меди по току от
температуры электроли-
та при плотности тока
10 А/дм8
электролиза не оказывают.
Введение в электролит депассиваторов, в качестве которых
применяют сегнетову соль KNaC4H4Oe-4H2O и роданид калия
KCNS, позволяет повысить рабочую плотность тока и устра-
нить пассивацию анодов, но при этом следует одновременно
повышать температуру электролита.
Высококонцентрированные по меди электролиты, содержащие
депассиваторы, позволяют применять высокие плотности тока
(до 10 А/дм2) при повышенной температуре и перемешивании.
При этом возможно получить выход по току, близкий к 100 %.
На рис. 14.5 проводится установленная Н. Д. Лиознер зави-
симость выхода меди по току от температуры в медном цианидном
электролите с добавкой роданида калия и едкого натра. Выход
по току увеличивается с повышением температуры, но при этом
ускоряется разложение цианидов и накопление карбонатов.
Сульфиды, вводимые в электролит, играют роль восстанови-
теля, предупреждая накопление в ванне ионов меди Си2+. Реко-
мендуемые составы электролитов и режим работы приведены
в табл. 14.4.
По мере роста толщины осадков увеличивается их шерохова-
тость. Получать толстые покрытия хорошего качества с малой
пористостью Н. Н. Бибиков рекомендует, применяя реверсиро-
ванный ток.
Рекомендуемый состав электролита (г/л) и режим работы:
CuCN.......................70—90
NaCN свободный ...........6—10
NaaCOs.....................15—30
NaOH ......................15—30
t, °C.......................50—60
iH, А/дм8..................4—6
тк : та, с.................15 : 3
169
Блестящее меднение деталей, изготовленных из стали, чугуна,
цинковых сплавов, титана и его сплавов, можно осуществлять
в электролите следующих состава, г/л, и режима работы:
CuCN................... 40—60
NaCN свободный. . . . 10—15
NaOH .................. 10—15
NH«C1 ................. 10—15
NaaC4H4Oe .............. 3—10
MnSO<-5HaO...........
pH...................
t, °C................
iK, А/дм1............
0,03—0,05
10,7—12,8
50—60
1,0—3,5
Медные цианидные электролиты могут быть приготовлены
растворением цианида меди в растворе цианида натрия. Для этой
цели в горячей воде (60—70 °C), взятой в количестве 1/2 объема
ванны, растворяют все расчетное количество цианида натрия.
Туда же, помешивая постепенно, вводят цианид меди. Раствору
дают отстояться и осторожно сливают в рабочую ванну. Остальные
составные части растворяют в небольшом объеме воды и после
отстаивания вливают в ванну, затем ванну доливают холодной
водой до требуемого объема, тщательно перемешивают, произво-
дят анализ на содержание меди и свободного цианида, в случае
необходимости корректируют.
Пирофосфатные электролиты. Из пирофосфатных электроли-
тов получают медные осадки с мелкозернистой структурой. При
нанесении тонких слоев осадки получаются гладкими, блестящими
или полублестящими. Преимущества пирофосфатных электроли-
тов перед кислыми заключаются в высокой рассеивающей способ-
ности и возможности непосредственно проводить меднение сталь-
ных деталей в малоконцентрированном пирофосфатном элек-
тролите.
Основные компоненты пирофосфатных электролитов: CuSO4
или Си2Р2О7 и К4Р2О7 или Na4P2O7. В растворах в присут-
ствии Na4P2O7 образуется комплексная соль Nae[Cu(P2O7)2];
при избытке свободного пирофосфата может образовываться
Na2[Cu(P2O7)2]. Константы нестойкости комплексов [Си(Р2О7)2 Iе-
и [Си(Р2О7)2Р~ соответственно равны 3-10-8 и 2-10-®.
В щелочных растворах при pH 8 и достаточном избытке сво-
бодных ионов P2OI" медь находится преимущественно в виде
шестизарядных комплексных ионов [Cu(P2O7)2]e_.
В пирофосфатные электролиты вводят NH4NO3, который спо-
собствует повышению допустимой катодной и анодной плотностей
тока и улучшает качество осадков. Из пирофосфатных электроли-
тов можно получать блестящие осадки. В качестве блескообразую-
щих добавок вводят Na2SeO3 совместно с лимонной или триокси-
глутаровой кислотой, 2-меркаптотиазол и другие вещества.
При повышенных плотностях тока может происходить пассива-
ция анодов за счет образования на их поверхности труднораствори-
мой оксидной или солевой пленки. Введение в электролит NH4OH,
Na2HPO4-12Н2О, NH4NO3, сегнетовой соли, лимонной кислоты
и других добавок улучшает работу анодов и повышает допустимую
анодную плотность тока.
170
Рис. 14.6. Влияние плотности тока
на анодный (/) и катодный (2) выход
меди по току в пирофосфатных элек-
тролитах
! Катодный потенциал меди в
пирофосфатных электролитах
имеет более отрицательное зна-
чение, чем в кислых (см. рис.
14.1, кривую 2). Большая катодная поляризация объясняется пас-
сивированием поверхности катода вследствие адсорбции ионов Р2О7-
или образования оксидных (Си2О8) и труднорастворимых соедине-
ний (Си2Р2О7) в виде фазовой пленки.
Предполагают, что выделение меди на катоде из пирофосфат-
ных растворов происходит в результате восстановления двух-
зарядных комплексов:
СЦР2О?' + 2ё Си + Р2О7”,
образующихся при диссоциации шестизарядных комплексов:
Си(РЮ7)!' СиРЮ?" + Р2О7'.
С повышением температуры ускоряется выделение меди, что
связано как с ускорением диффузии комплексных анионов к ка-
тоду, так и с облегчением их разряда.
Анодный выход по току в этих электролитах несколько выше
катодного (рис. 14.6), поэтому при корректировке нет необхо-
димости добавлять медные соли. Анодную плотность тока реко-
мендуется поддерживать в пределах 2—4 А/дм2. При более низ-
кой плотности тока растворение идет недостаточно быстро, при
более высокой — на поверхности анодов образуется трудно-
растворимая оксидная пленка.
> Для предотвращения пассивации анодов должно быть достаточ-
ное количество свободных анионов Р2О7” и достаточно высокое
pH раствора. Повышение температуры способствует отводу про-
дуктов реакции и, следовательно, уменьшению пассивации анодов.
Для этой же цели в электролиты вводят депассиваторы, которые
способствуют снижению активности ионов Сиа+ в прианодном слое.
Для меднения предложено большое количество электролитов,
составы некоторых из них приведены в табл. 14.5.
Электролит 1 предназначен для получения полублестящих
осадков на стали, цинковых и алюминиевых сплавах. В электро-
лите 2 получают блестящие медные покрытия. Электролиты 3 и 4,
разработанные Институтом неорганической химии АН СССР,
рекомендуются для получения блестящего слоя меди непосред-
ственно на стали перед никелированием. В указанных электроли-
тах подавление контактного выделения меди происходит вслед-
ствие введения в электролит лимонной и триоксиглутаровой
кислот.
i
171
14.6. Состав (г/л) пирофосфатных электролитов меднения
и режим работы
Компоненты электролита н режим работы Номер электролита
1 2 3 4
CuSO«-5H2O 60—90 70—90 70—90 90
к4р2о7 300—330 330—380 330—370 350
Сульфосалицилат натрия 25—30 •—- — —
Лимонная кислота — 15—25 — 20
Na2SeOs — 0,01—0,03 0,002 0,002
Триоксиглутаровая кислота — — 7 —
NH4OH -—. .— —— 1—2
рн 8,2—8,9 8,3—8,7 8,3—8,5 7,8—8,5
t, °C 18—50 30—40 35—40 50—60
i„, А/дм2 0,5—2,0 0,8—3,0 0,8—3,5 0,8—1,7
Для приготовления пирофосфатного электролита растворяют
все составные части в воде, подогретой до 60—70 °C, в отдельных
сосудах. Затем к раствору сульфата меди постепенно добавляют
теплый раствор пирофосфата калия (натрия) при непрерывном
перемешивании. При этом выпадает осадок пирофосфата меди го-
лубого цвета:
2CuSO4 + К4Р2О7 = Cu2P2O7 + 2K2SO4.
Осадок отфильтровывают. После отмывки от ионов SO|“
к осадку добавляют раствор пирофосфата калия (натрия) в таком
количестве, чтобы образовалась растворимая комплексная соль
и остался необходимый избыток свободного пирофосфата калия
(натрия). Электролит имеет темно-синий цвет.
Корректируют pH электролита, добавляя ортофосфорную кис-
лоту или раствор едкого натра. При pH >• 9 аноды начинают
пассивироваться, а внешний вид осадков меди ухудшается. При
pH < 7 медь контактно выделяется на поверхности деталей.
Наиболее вредными примесями в пирофосфатных электролитах
считаются свинец, цианиды и жиры.
При работе пирофосфатных ванн рекомендуется фильтрация
электролита: для полублестящих осадков — периодическая или
непрерывная, для блестящих — непрерывная.
В последнее время предлагается много составов на основе
триполифосфата натрия Na6P3Oi0 или калия К5Р3О10 и гекса-
метафосфатов. Достоинства этих электролитов в хорошем качестве
покрытий, устойчивости по составу и невысокой стоимости.
Основные закономерности катодного процесса в этих электролитах
аналогичны пирофосфатным. В электролиты вводят соли аммония,
которые способствуют уменьшению скорости контактного вы-
теснения меди железом, что улучшает сцепление медного покрытия
со сталью. Однако широкого распространения эти электролиты
не получили.
172
Этилендиаминовые электролиты. Из этилендиаминовых элек-
тролитов медь можно непосредственно осаждать на сталь. Струк-
турная формула этилендиамина NH2—СН2—СН2—NH2, условное
обозначение — Еп. В растворах с pH ~ 10 медь образует с эти-
лендиамином прочный комплексный ион Си (£п)2+, константа
нестойкости которого составляет 2,1-10-20. Вследствие этого
электродный потенциал меди в этом электролите сдвинут в сторону
электроотрицательных значений.
Катодная поляризация достигает значительной величины, осо-
бенно при низких плотностях тока. Предполагается, что это обус-
ловлено адсорбцией этилендиамина на катоде. Высокая катодная
поляризация способствует получению мелкокристаллических осад-
ков. Рассеивающая способность этих электролитов выше, чем
сульфатных, но ниже, чем цианидных.
Для меднения предложен следующий состав (г/л) и режим ра-
боты электролита:
CuSO4-5H2o...............110—125
Этиленднамин (70 % -ный) 60—70
Na2SO4-10H2O..............50—60
(NH4)2SO4.................50—60
pH .....................6,8—8,4
/, °C.....................22—40
iK, А/дм2...............0,7—2,0
/а, А/дм2...............0,3—1,0
Загрузку и выгрузку деталей ведут при минимальном токе.
В первые 40—60 с дается толчок тока, в три раза превышающий
рабочий ток.
Электролит приготавливают следующим образом. К раствору
сульфата меди, охлажденному до 30—35 °C, добавляют осторожно,
небольшими порциями, при постоянном перемешивании 70 %-ный
раствор этилендиамина, разбавленный водой в соотношении 1:1.
Раствор приобретает фиолетовую окраску и разогревается до
температуры 55—60 °C. Через 30 мин добавляют раствор сульфата
натрия и сульфата аммония, доливают до рабочего уровня водой
и прорабатывают при катодной плотности тока 0,5—0,7 А/дм2
в течение 8—10 ч.
Полиэтиленполиаминовые электролиты. Получили некоторое
применение электролиты на ос-
нове полиэтиленполиаминов. Медь
образует прочные комплексы с
ними, поэтому потенциалы меди
в этих электролитах значительно
смещены в сторону электроотри-
цательных значений. Электроли-
Рис. 14.7. Зависимость выхода меди по
току от плотности тока. Состав электро-
лита: CuSO4-5H2O 90 г/л, (NH4)2SO4
80 г/л, NH4OH (25%) 180 мл/л;
pH 9,3—9,6:
1 — электролит без добавок; 2, 3, 4 — с до-
бавками 20; 40 и 80 г/л NH<NO, соответ-
ственно
173
ты на основе полиэтиленполиаминов используют взамен цианид-
ных. Для получения хорошего качества осадков в электролит
вводят сульфат аммония, pH раствора должно быть в преде-
лах 8,2—9,0.
Рекомендуются следующие составы (г/л) и режим работы
электролитов:
Детали
сложной формы
Детали
простой формы
CuSO4-5H2O.................... 100
(NH4)2SO4..................... 200
Полнэтиленполиамнны . . 100
pH ..................... 8,2—9,0
t, °C........................ 18—25
iK, А/дм2............... 0,5—1,2
100
200
20
8.2—9,0
18—25
2,5—3,2
Аммонийные электролиты. Они приготовляются на основе
сульфата меди, аммиака и сульфата (хлорида) аммония. При вза-
имодействии солей меди с аммиаком образуются хорошо раствори-
мые комплексные соединения меди типа Cu(NH3)n(OH)3C. В раство-
рах с pH 8,5 медь находится в основном в виде комплекса
Cu(NH3)l+.
Зависимость выхода металла по току от катодной плотности
тока показана на рис. 14.7, из которого видно, что при низких
плотностях тока выход по току очень мал. С увеличением плот-
ности тока в электролитах без добавок выход по току резко воз-
растает, а затем резко падает. Введение в электролит нитрата ам-
мония меняет картину осаждения. Осадки меди получаются плот-
ными полублестящими и более равномерными по толщине. Это
объясняется тем, что нитрат-ионы при потенциалах, соответствую-
щих повышенным плотностям тока, на выступающих частях де-
талей восстанавливаются до гидроксиламина и аммиака. Это при-
водит к снижению доли тока, приходящейся на выделение меди,
и соответственно к возрастанию допустимого верхнего предела
средней плотности тока. Добавка нитрата аммония снижает анод-
ную поляризацию и позволяет применять повышенные плотности
тока.
Для меднения рекомендуется электролит состава, г/л, и сле-
дующего режима работы:
CuSO4-5H2O................. 90
NH4NOs..................40—60
(NH4)2SO4.................. 80
NH4OH (25 %-ный), мл/л 180
PH .......................
t, °C.....................
iK, А/дм2.................
«а. А/дм2.................
8,5—9,0
18—25
1,5-10
5
Электролит готовят добавлением к раствору сульфата меди
раствора гидроксида аммония до pH 8,5—9,0. Затем вводят
остальные соли.
Следует отметить, что без специальной подготовки поверхности
стали медные осадки плохо сцепляются с основой, по-видимому,
174
вследствие пассивирования стали в растворе аммиака. Для улуч-
шения сцепления проводят предварительное осаждение меди
в растворе нитрата меди или катодное активирование стали в под-
кисленных растворах сульфата или хлорида никеля.
ГЛАВА 15. НИКЕЛИРОВАНИЕ
f
, § 16.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА НИКЕЛЯ I
И ОБЛАСТЬ ПРИМЕНЕНИЯ НИКЕЛЕВЫХ ПОКРЫТИЙ
Никель — серебристо-белый металл, ковкий и пластич-
ный, хорошо полируется до зеркального блеска. Твердость нике-
левых покрытий зависит от состава электролита и условий оса-
ждения. Твердость матовых осадков никеля колеблется от 2,5
до 4,0 ГПа, твердость блестящих осадков — от 4,5 до 5,0 ГПа.
Предел прочности 400—500 МПа, относительное удлинение 40 %.
Никель является одним из важнейших магнитных материалов
с минимальным коэффициентом теплового расширения. Ферро-
магнитные свойства проявляются до температуры 358 °C. Удель-
ное электросопротивление 0,07-10~® Ом-м. Отражательная спо-
собность 58—62 %. Плотность никеля 8,9 г/см8. Температура плав-
ления 1452 °C. Допустимая рабочая температура 650 °C.
Никель — химический элемент первой триады VIII группы
периодической системы Менделеева, его атомный номер 28, атом-
ная масса 58, 70. В химическом отношении он сходен с железом
и кобальтом, а также с медью и благородными металлами. В соеди-
нениях проявляет переменную валентность 2 и 3.
В атмосферных условиях никель покрывается прозрачной ок-
сидной пленкой, которая пассивирует его поверхность. При на-
личии сернистых соединений поверхность никеля быстро тускнеет.
Никель устойчив в естественной, дистиллированной и движущейся
воде. В морской стоячей воде никель быстро корродирует. В раз-
бавленных кислотах H2SO4 и НС1 он растворяется медленнее
железа. Легко растворяется в разбавленной азотной кислоте,
концентрированная HNO3 пассивирует никель. С азотом никель
не реагирует даже при высоких температурах (до 1400 °C). В ще-
лочных растворах и расплавах' никель устойчив, органические
кислоты действуют на него лишь при длительном соприкоснове-
нии. Никель не разрушает витамины, не ядовит.
Недостатком никеля является способность поглощать большое
количество газов, что ухудшает его механические свойства. Вза-
имодействие с кислородом начинается лишь при температуре
500 °C.
Никель можно наносить на Fe, Си, Ti, Al и их сплавы, а также
на неметаллические материалы — керамику, пластмассу, стекло
и т. п.
ITO1MW ХЧЛ:
175
Рис. 15.1. Модель пористости однослойного (а), двухслойного (б) и трехслой-
ного покрытия (в)
Стандартный потенциал никеля 0,25 В. Во всех средах никель
является по отношению к железу катодным покрытием, поэтому
основное условие для обеспечения защиты железа от воздействия
внешней среды — беспористость никелевых покрытий. Чем меньше
слой никеля, тем больше пористость. Не видимые глазом поры ста-
новятся очагами коррозии, как только в них попадает влага.
Образующийся микроэлемент, в котором железо является раство-
римым электродом, вызывает коррозию на поверхности никеле-
вого покрытия. Толщина слоя никеля, при которой покрытие
становится практически беспористым, 25—30 мкм.
Для уменьшения толщины слоя никеля, так как он относится
к дорогостоящим и дефицитным металлам, его наносят на медный
подслой. При отсутствии цианидных электролитов иногда нано-
сят тонкий слой никеля, а затем — слой меди. Такая комбинация
обеспечивает более надежную защиту стали от коррозии, чем
покрытия из чистого никеля такой же толщины. Объясняется
это также тем, что образование сквозных пор, доходящих до
основного металла, в случае двухслойного покрытия менее ве-
роятно (рис. 15.1).
Электрохимическое поведение никеля при наличии подслоя
меди коренным образом меняется: в паре Си—Ni он становится
растворимым электродом, а следовательно, начинает быстро тус-
кнеть и разрушаться во влажной атмосфере. Этот недостаток
двухслойных покрытий устраняется путем нанесения на никель
тонкого слоя хрома (0,5—1 мкм). Такие трехслойные покрытия,
как Си—Ni—Сг, являются защитно-декоративными и широко
применяются в приборо- и машиностроении, в автомобильной,
тракторной промышленности и т. п. Большое распространение
получил способ получения блестящих покрытий непосредственно
в электролитах никелирования, что позволило наносить трех-
слойное покрытие типа Си—Ni6—Сгб.
Матовый однослойный никель наносят для защиты химического
оборудования от воздействия агрессивных сред, особенно щело-
чей; для защиты медицинского инструмента; для повышения из-
носостойкости и электропроводности деталей.
В последнее время разработаны способы получения комбини-
рованных слоев никеля с различными физико-химическими свой-
ствами: би-никель, три-никель, сил-никель. Такие покрытия
обладают более высокими защитными свойствами. В промышлен-
176 ,
16.1. Толщина никелевых покрытий
। Номер ПО- ' крытия Обозначение покрытия Назначение покрытия Толщина покрытия, мкм, для условий эксплуатации
1 2 3 4 5 6 7 8
1 н Защитное под пайку н сварку для повышения электропроводно- сти 9 — 18 — — — —- —
2 Н.Х.б Защитно-декора- тивное 9 24 24 — — — — —
3 Н.сил.Х.б То же — 21 21 21 30 30 40 40
4 м.н Защитное 6; 3 18; 9 18; 9 18; 9 18; 9 18; 9 — —
5 М.Нб Защитно-декора- тивное 6; 6 18; 12 18; 12 18; 12 18; 18 18; 18 — —
6 М.Нб.Х.б То же 9; 6 24; 12 24; 12 24; 12 24; 15 24; 15 35; 15 —
7 М.Ндз.Х.б » — — — — 24; 15 24; 15 24; 21 24; 15
8 МН.Х.ч Защитно-декора- тивное светопо- глощающее — 6; 15
9 Хим.Н Повышение из- носостойкости 9 9 9 9 9 9 9 9
Примечание. Для покрытий 2 и 6 толщина слоя хрома 0,5—1,0 мкм;
для покрытий 3 и 7 толщина слоя хрома 0,25—0,5 мкм.
ности нашел применение черный никель, который применяется
для придания деталям специальных оптических и декоративных
свойств.
Никелевые покрытия можно получать химическим путем.
Химическое никелирование несколько дороже электролитиче-
ского, но позволяет получать более твердые и равномерные по-
крытия даже на деталях сложного профиля, имеющих узкие и
глубокие отверстия, полости. Толщина никелевых покрытий
в зависимости от условий и срока эксплуатации приведена
в табл. 15.1 по ГОСТ 9.303—84*.
§ 15.2. КАТОДНЫЙ И АНОДНЫЙ ПРОЦЕССЫ
НИКЕЛИРОВАНИЯ
Электроосаждение металлов железной группы (Ni, Fe,
Сг) из растворов простых солей имеет ряд особенностей по сравне-
нию с другими металлами. Разряд ионов металла протекает при
высокой катодной поляризации и низком перенапряжении водо-
177
рода, что создает определенные трудности, так как на катоде
одновременно с металлом выделяется водород:
Ni2+-/nH2O + 2ё -> Ni + /пН2О;
2Н+ + 2ё Н2|.
Ионы никеля в электролите окружены оболочкой из диполь-
ных молекул воды. В двойном электрическом слое часть молекул
воды отрывается. Дегидратация последних молекул воды требует
затрат энергии, что проявляется ростом перенапряжения, называ-
емого химической поляризацией. При этом равновесный потен-
циал никеля даже при малых плотностях тока становится от-
рицательным. На рис. 15.2 представлена зависимость выхода
по току от плотности тока при различных значениях pH. При
низких значениях pH (ниже 1—2) никель почти не осаждается
и на катоде выделяется водород. По мере увеличения pH по-
тенциал выделения водорода становится более отрицательным
и на катоде создаются условия для совместного выделения водо-
рода и никеля. При этом доля выделения водорода тем меньше,
чем выше pH. При высоких значениях pH вести осаждение
никеля нельзя, так как начинается гидролиз. Продукты ги-
дролиза (оксид и гидроксид никеля), внедряясь в покрытие,
способствуют удержанию пузырьков водорода на поверхности
катода, поэтому осажденный никель становится пористым, ше-
роховатым и темным. При очень высоких значениях pH невоору-
женным глазом можно заметить на деталях зеленый осадок не-
растворимых солей никеля.
Для никелирования характерно явление, называемое питтин-
гом. Пузырьки газообразного водорода задерживаются на катод-
ной поверхности, и в этих местах становится невозможным даль-
нейший разряд никеля. Никель начинает разряжаться около
пузырьков (рис. 15.3). На покрытии возникают поры, и оно теряет
защитные и декоративные свойства.
Прилипанию пузырьков к катоду
способствуют все вещества, которые
увеличивают поверхностное натяже-
ние. Сильное влияние могут оказать
Рис. 15.2. Влияние плотности тока на выход по току в никелевом электролите:
7 — pH 5,3, t = 25 °C: 2 — pH 1.9. t = 52 °C; 3 — pH 1,9, t = 25 °C
Рис. 15.3. Схема образования питтинга:
Л — анод: М — основной металл; В — пузырек водорода
1,78
Рис. 15.4. Влияние темпера-
туры на выход по току при
никелировании
Рис. 15.5. Влияние pH н темпера-
туры на рабочий интервал плот-
ностей тока
гидроксиды и органические соединения, а также продукты их раз-
ложения и даже пыль.
Большое влияние на выход по току оказывает режим работы.
При увеличении температуры выход по току никеля возрастает,
так как вследствие ускорения процесса диффузии снижается хи-
мическая поляризация — потенциал осаждения никеля становится
более положительным (рис. 15.4). Перенапряжение водорода
при этом изменяется незначительно. Выход по току увеличивается
при повышении концентрации ионов никеля в электролите. Такое
же влияние оказывает и перемешивание раствора.
На рис. 15.5 показано влияние температуры на рабочий интер-
вал плотностей тока при разных значениях pH. Рабочий интервал
плотностей тока тем шире, чем выше температура и ниже pH.
Таким образом, верхний предел плотности тока в более кислых
электролитах значительно выше.
Режим работа оказывает большое влияние на физико-механи-
ческие свойства никелевых покрытий. Твердые, напряженные
осадки получаются при pH 5,5, особенно при температуре ниже
20 °C. Повышение температуры приводит к некоторому снижению
внутренних напряжений. Осадки, полученные при низких значе-
ниях pH, более мягки и эластичны (рис. 15.6 и 15.7).
При никелировании чаще всего применяют электролиты с pH
4,5—5,5. Такие электролиты имеют высокую рассеивающую
способность, а осадки получаются мелкозернистыми.
В промышленности нашли применение и электролиты с pH <
< 4. По сравнению с обычными электролитами они применяются
при более высоких плотностях тока, с более широким рабочим
интервалом, что позволяет получать равномерные осадки на де-
талях сложного профиля. Осадки получаются более мягкими и
эластичными, что особенно важно при нанесении никеля под хром.
Аноды лучше растворяются, коллоидные частицы отсутствуют.
К недостаткам, таких электролитов следует отнести более низ-
кий выход по току и невозможность нанесения никеля на такие
металлы, как цинк и алюминий.
179
Рис. 15.6. Влияние плотности тока на твердость (/) и удлинение (2) никеле-
вых покрытий (t = 55 °C, pH 5)
Рис. 15.7. Влияние pH и температуры на твердость никелевых покрытий
(pH 5,6—5,9):
/ — / = 43 °C; 2 — t = 49 °C: 3 — t = 54 °C; 4 — t = 60 °C
Осаждение никеля из растворов его солей сопровождается
пассивацией анодов. Механизм пассивации можно представить
следующим образом. При низких плотностях тока никелевый анод
растворяется с образованием ионов никеля:
Ni -> Ni2+ + 2ё.
Ионы никеля накапливаются в прианодном слое и при неко-
тором значении плотности тока выпадают на поверхность анода
в виде пористой пленки, которая состоит из кристаллов никеля.
Уменьшение рабочей поверхности анода приводит к резкому по-
вышению анодной плотности тока, и потенциал анода достигает
значения, при котором происходит разряд ионов ОН-. На аноде
начинает выделяться кислород, который окисляет никель, обра-
зуя на его поверхности плотную оксидную пленку. Растворение
анода резко замедляется или совсем прекращается (рис. 15.8).
Пассивация анодов приводит к нежелательным явлениям,
так как за счет обеднения электролита ионами никеля на катоде
начинает выделяться водород и выход по току резко уменьшается.
Для депассивации анодов вводят соли, которые содержат
ион Cl" (NaCl, NiCl2). Разряжаясь на аноде, ион С1- образует
хлор, который растворяет пассив-
ную пленку. Концентрацию ионов
С1- необходимо поддерживать на
заданном уровне, так как их избы-
ток увеличивает растворимость ано-
дов. Таким образом, избыток иона
С1- так же, как и его недостаток,
нарушает стабильную работу элек-
Рис. 15.8. Кривая анодной поляризации
в никелевом электролите: с добавкой иона С1“
(1) и без нее (2)
180
тролита. Нормально работающий анод имеет серый цвет и
шероховатую поверхность. При полной пассивации он становится
гладким и приобретает желто-коричневый цвет, на кромках и
углах интенсивно выделяется О2.
§ 15.3. ЭЛЕКТРОЛИТЫ НИКЕЛИРОВАНИЯ
Сульфатные электролиты. Для никелирования приме-
няют сульфатные, хлоридные, сульфаматные, борфторидные, крем-
нефторидные и другие электролиты. Наибольшее распространение
в промышленности получили сульфатные электролиты. Разрабо-
тано большое количество составов и режимов осаждения, позво-
ляющих получать осадки никеля с различными физико-химиче-
скими свойствами.
Основным компонентом сульфатного электролита является
NiSO4.7H2O. Его растворимость в воде около 300 г/л. Если кон-
центрация NiSO4-7H2O не превышает 200 г/л, в электролит для
увеличения электропроводности вводят Na2SO4. ЮН2О и MgSO4 X
х 7Н2О. Сульфат натрия обладает значительно большей электро-
проводностью, однако магний включается в никелевые покрытия,
при этом они становятся более мягкими и светлыми.
В качестве буферного соединения наиболее широко приме-
няется борная кислота. Оптимальная концентрация ее в электро-
лите 20—30 г/л. Борная кислота регулирует pH не только в об-
щем объеме электролита, но и в прикатодном слое, который
вследствие разряда и выделения водорода непрерывно защелачи-
вается. Для электролитов с низким значением pH более эффек-
тивными являются добавки фторидных соединений NaF и т. п.
В некоторые электролиты вводят ион NHJ, так как в его
присутствии гидролиз никелевых солей начинается не при pH
6,6—7,0, как обычно, а при pH 7,6. В таких электролитах можно
получать твердое никелевое покрытие.
Так как никелевые аноды склонны к пассивации, в электро-
литах обязательно должны находиться ионы С1_. Для этой цели
вводят хлориды NaCl или NiCl2. Для устранения питтинга в элек-
тролит вводят смачивающие добавки; жидкость «Прогресс», ла-
урилсульфат, алкилсульфат натрия и др., концентрация их
в электролите 0,005—0,1 г/л. Уменьшает питтинг барботаж сжатым
воздухом и качание катодных штанг со встряхиванием 30—60 раз
в минуту.
Для нормальной работы электролита и получения осадков
с заданными физико-механическими свойствами необходимо строго
поддерживать режим работы. Снижение температуры до 50 °C
приводит к охрупчиванию покрытий, а при снижении темпера-
туры до 10 °C электролит становится непригодным. Чрезмерное
увеличение плотности тока может привести к резкому падению
выхода по току. Для каждого электролита устанавливается опти-
181
15.2. Состав (г/л) сульфатных электролитов
обычного (матового) никелирования и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3 4 6 6
NiSO4-7H2O NiCl2-6H2O NaCl Н8ВО8 Na2SO4- ЮН2О MgSO4-7H2O NH4C1 NaF Na2S2O8 pH iK, А/дм2 t, °C 140—200 30—40 10 25—30 60—80 5,2—5,8 0,5—0,8 20—55 150—200 140—150 10—15 5—10 25—30 40—50 50—60 25—30 5,0—5,5 0,5—2,0 0,5—1,5 20—30 70—75 5—10 25—30 40—50 5,6—5,8 0,5—1.0 17—27 300—350 45—60 30—40 1,4—4,5 2,5—10 45—65 180 30 25 25 4,0—5,5 2—10 45—60 180—200 1,5—2,5 25—40 40—60 1,5—2,5 1—3 4,0—5,5 1—2 20—45
20—35
Примечание. В числителе указаны значения прн нанесении никеля на подвесках, в знаменателе — во вращающихся установках.
мальное значение pH в соответствии с концентрацией солей ни-
келя, плотностью тока и температурой электролита.
Никелевые электролиты устойчивы в работе и при соблюдении
режима работы и систематической очистке от вредных примесей
могут использоваться в течение нескольких лет. Состав сульфат-
ных электролитов никелирования приведен в табл. 15.2.
Электролит 1 предусмотрен ГОСТ 9.305—-84*. Электролит 6
рекомендуется для нанесения никеля на алюминий и его сплавы,
электролит 5 — для получения твердых покрытий, остальные —
, для нанесения никеля на подвесках.
Для никелирования применяют горячекатаные аноды марок
НПА1 и НПА2. Кроме того, используют непассивирующиеся
аноды марок НПАН, легированные серой в пределах 0,0002—
0;01 %. При наличии в них кислорода и углерода в пределах,
необходимых для получения плотного слитка, депассивирующее
свойство серы сохраняется. Недостатком таких анодов является
образование большого количества шлама. Осадки получаются
более равномерными при использовании эллиптических или ромбо-
видных анодов, кроме того, по сравнению с прямоугольными
анодами они более экономичны. Скорость растворения никеля
зависит от отношения анодной поверхности к площади покрывае-
мых деталей, обычно его поддерживают 2:1.
Наиболее эффективно использование в качестве анодов плоских
рам из полосового титана со стенками из перфорированной пласт-
182
массы. В такие рамы помещают кусочки никеля, что позволяет
увеличить активную поверхность анодов и способствует их более
полному использованию. Все аноды, в том числе и рамы, следует
помещать в чехлы из ткани «хлорин» или «бельтинг», предвари-
тельно обработанные в 2—10 %-ном растворе НС1; аноды пред-
варительно следует зачистить стальными щетками от шлама.
Сульфаматные электролиты. Основным компонентом является
сульфамат никеля Ni(H2NSO3)2, растворимость которого при тем-
пературе 70 °C доходит до 600 г/л. Для депассивации анодов и
поддержания pH на заданном уровне в электролит добавляют
хлорид никеля и борную кислоту. Высокая концентрация основ-
ного компонента позволяет применять высокие плотности тока.
Покрытия получаются малонапряженными, в связи с чем этот
электролит целесообразно применять для получения толстых
слоев никеля, например в гальванопластике и в специальных
случаях. Недостатками электролита являются его высокая стои-
мость, необходимость перемешивания и подогрева, а также не-
прерывная очистка от вредных примесей. Ниже приведены
составы (г/л) сульфаматного электролита и режим его работы:
Ni(H2NSO3)2 ......... 300—400 pH ..................3,0—4,2
NiCl2-6H2O ........... 12—15 iK °C.................20—60
Н8ВО8................. 25—40 t, А/дм2............... 5—12
Сахарин..............0,5—1,5
В качестве антипиттинговой добавки вводят 0,1—1,0 г/дм3
лаурилсульфата натрия.
Сульфамат никеля растворяют в половинном объеме воды,
нагретой до 60 °C, и добавляют остальные компоненты, затем
доводят раствор до заданного объема. Для удаления примесей
тяжелых металлов при непрерывном помешивании вводят взму-
ченный карбонат никеля, пока pH не поднимется до 5,5. После
этого из расчета 1,2 мл/л добавляют пероксид водорода и выдер-
живают раствор при непрерывном перемешивании в течение 4 ч
и более. Температура раствора поддерживается около 60 °C.
Органические примеси удаляют добавляя 2—5 г/л активирован-
ного угля. Через 8 ч раствор следует профильтровать и довести
при помощи 10 %-ного раствора сульфаминовой кислоты до
заданной величины pH. Затем прорабатывают электролит при
iK = 0,5 А/дм2 током, завешивая стальные гофрированные ка-
тоды.
§ 15.4. БЛЕСТЯЩЕЕ НИКЕЛИРОВАНИЕ
В настоящее время около 80 % всех никелевых по-
крытий получают блестящими непосредственно из гальваниче-
ских ванн. Такие покрытия применяют на деталях, не требующих
высокой коррозионной стойкости в качестве защитно-декоратив-
ных. Блестящее никелирование по сравнению с матовым имеет
ряд преимуществ: , ... .
183
1) отпадает трудоемкая операция механического полирования
и устраняется опасность прополирования покрытий;
2) сокращается расход никеля, так как при механическом
глянцевании на углах, кромках и ребрах деталей снимается
верхний слой покрытия толщиной 2—3 мкм;
3) сокращается число технологических операций и создаются
условия для автоматизации всего технологического цикла;
4) интенсифицируется процесс осаждения за счет применения
более высоких плотностей тока.
Основными недостатками блестящих покрытий по сравнению
с матовыми являются сильное наводороживание, наличие вну-
тренних напряжений и большое количество примесей, ухудша-
ющих механические свойства. Блеск покрытий возникает за счет
добавления в электролит блескообразователей. Они могут быть
как органического, так и неорганического происхождения.
Неорганические блескообразователи применяются значительно
реже, в основном это соли кобальта или кадмия. Добавки солей
кобальта вследствие высокой стоимости практического применения
не нашли. Кадмий в качестве блескообразователя иногда приме-
няют, например, при нанесении никеля на мелкий крепеж во
вращательных установках. Концентрация солей кадмия состав-
ляет примерно 0,03—0,10 г/л.
Одним из первых блескообразователей органического проис-
хождения была натриевая соль сульфированного нафталина.
Длительное время применялся электролит, разработанный еще
в 1940-х годах Н. Т. Кудрявцевым, следующего состава, г/л,
и режима работы:
NiSO4-7H2O..............
Н8ВО8...................
NaCl ...................
NaF.....................
1,5 нафталиндисульфокис-
лота ...................
200—300 Формалин
25—30 pH . . ,
3-15 t, °C . . ,
4—6 iK, AJдм2
ВТ, %
2—4
1—1,5
5,8—6,3
20—30
1—2
95—98
При перемешивании электролита плотность тока может быть
повышена до 4—5 А/дм2. Электролит длительное время сохраняет
способность осаждать блестящие покрытия без дополнительных
добавлений блескообразователя, однако неравномерный блеск
и хрупкость покрытий являются недостатками этого электролита.
Мощным стимулом для внедрения блестящего никелирования
явилось развитие автомобильной промышленности, и в частности
производство легковых машин. В настоящее время разработано
большое количество электролитов, в состав которых входят
различные органические водорастворимые добавки, позволяющие
получать блестящие, малонапряженные и гладкие осадки.
Современные электролиты блестящего никелирования имеют
выравнивающие и смачивающие добавки. Являясь ПАВ, вырав-
нивающие добавки блокируют выступающие части поверхности,
в связи с чем осаждение происходит в микроуглублениях. Смачива-
184
ющие добавки способствуют снижению поверхностного напряже-
ния электролита, удалению грязи и пузырьков водорода с по-
верхности катода.
По одной из принятых классификаций блескообразующие
добавки делятся на два класса: первый — слабые блескообразо-
ватели, второй — сильные блескообразователи.
Слабые блескообразователи позволяют получать блестящие
покрытия только на полированной поверхности, их блеск обратно
пропорционален толщине. Они не влияют на катодную поляри-
зацию. К ним относятся уротропин, паратолуолсульфамид, саха-
рин, хлорамин Б и др.
Сильные блескообразователи способствуют получению блеска
не только на полированной, но и на матовой поверхности, причем
блеск не зависит от толщины покрытий. Они повышают катодную
поляризацию и выравнивают микрорельеф, но ухудшают механи-
ческие свойства осадков. К ним относятся кумарин, тиомочевина,
1,4-бутиндиол и др.
При совместном действии добавок 1-го и 2-го классов осадки
получаются пластичными с равномерным блеском. Блескообра-
зователи 1-го класса являются в таких случаях пластичными
добавками. Для реализации их положительных свойств важна
такая комбинация блескообразователей, при которой добавки
2-го класса не подавляют адсорбции на катоде добавок 1-го класса.
Классическим примером является электролит, разработанный
в Институте химии и химической технологии АН ЛитССР, следу-
ющего состава (г/л) и режима работы:
NiSO4-7H2O.............. 260—300
NiCl-6H2O................ 40—60
Н8ВОа.................... 30—40
Сахарин ...............0,7—1,2
Бутиндиол, мл/л (35 % -ный
раствор) ..............0,7—1,75
Фталимид.................
pH ......................
«к, А/дм2..............
«а, А/дм2................
t, °C....................
0,08—0,1
4,3—5,1
2—8
1—2,5
55—65
Добавка сахарина резко снижает степень наводороживания
никеля, добавка бутиндиола в сочетании со фталимидом увеличи-
вает выравнивающую способность электролита и расширяет ра-
бочий диапазон плотностей тока. В результате совместного дей-
ствия этих блескообразователей осадки получают интенсивный
блеск, высокую твердость и пластичность.
В автомобильной промышленности для блестящего никелиро-
вания применяются электролиты, приведенные в табл. 15.3. Со-
ставы 1—2 дают блестящие осадки; состав 2 может быть рекомен-
дован для деталей, изготовленных из цинкового сплава. Для на-
несения полублестящего никеля применяют составы 3—4. Мини-
мальная концентрация блескообразователей исключает попада-
ние серы в осадки. Такие покрытия обладают более высокой кор-
розионной стойкостью.
Следует отметить, что большинство блескообразующих и сма-
чивающих добавок являются сульфосоединениями. Во время
185
15.3. Состав (г/л) электролитов блестящего никелирования и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3 4 б 6
NiSO4-7H2O 260—300 90 250— 300 280—300 250—300 280—300
NiCl2-6H2O 40—60 200 40—60 40—60 10—15 10—15
HSBO3 35—40 40 30—40 35—45 30—40 25—40
1,4 бутиндиол 35 %-ный, мл/л 0,2 0,2 0,1 —. 1,0—1,5 0,5
Сахарин 0,7—1,5 0,7—1,5 — — — —
Фталимид 0,08—0,1 0,08— —0,1 — —- •— —
Формалин 40 %-ный, мл/л — — -— 0,3—0,5 0,01—0,03 0,5—1,0
Хлорамин Б — — —- 1 — 2—2,5 2—2,5
ОС-20 — — .— — 0,003—0,005 —-
iK, А/дм® t, °C 4—6 4—6 2—6 2—6 3—5 2,5—3,5
55—60 50—60 50—60 45—60 45—60 50—60
pH 4—4,8 4—4,8 4,5 4,3—4,8 4,5—5,5 4,5—5,5
электроосаждения в результате ряда превращений образуется
сульфамид никеля. Содержание серы в осадках неблагоприятно
сказывается на механических и коррозионных свойствах осадков.
Электролит 5 применяется на ряде заводов. Для осаждения бле-
стящего никеля во вращательных установках применяют элек-
тролит 6.
На свойства никелевых покрытий влияет также режим работы.
Увеличение температуры и плотности тока в заданных пределах
способствует уменьшению внутреннего напряжения и увеличению
блеска покрытий. Оптимальной считается температура 50—60 °C.
Все электролиты требуют перемешивания, непрерывного фильтро-
вания и селективной очистки.
§ 15.5. ПРИГОТОВЛЕНИЕ СУЛЬФАТНЫХ
НИКЕЛЕВЫХ ЭЛЕКТРОЛИТОВ
Все никелевые сульфатные электролиты готовят сле-
дующим образом. Соли, входящие в состав электролитов, раство-
ряют отдельно в теплой деминерализованной воде; борную кисло-
ту и фториды — в кипящей. Фториды рекомендуется растворять
в посуде из винипласта. Перед приготовлением ванну промывают
3—5 %-ным раствором H2SO4 или НС1 в течение 2—4 ч при тем-
пературе 50—60 °C. Затем ее промывают и сливают в нее все
растворы, перемешивают и определяют pH. Для повышения pH
добавляют 0,3 %-ный раствор NaOH, а для понижения pH —
1 н, раствор H2SO4 (1 мл/л) и через 5—10 мин определяют pH.
Откорректированный по pH раствор можно использовать для
матового никелирования. Электролит для блестящего никелиро-
186
вания необходимо подвергнуть химической и селективной очистке.
Раствор перекачивают в запасную емкость, доводят pH до 5—5,5
и добавляют 1—2 r/л активированного угля и 2 r/л перманганата
калия или 2 мл/л пероксида водорода. Раствор перемешивают
сжатым воздухом в течение 3 ч. После отстаивания раствор через
сутки фильтруют и перекачивают в рабочую ванну. Этим способом
удаляют органические примеси, железо и частично цинк.
Для очистки от меди и следов цинка электролит подкисляют
до pH 2,5—3, завешивают катоды из листовой рифленой стали
и прорабатывают током при температуре 45 °C, перемешивая их
сжатым воздухом. Проработку ведут при напряжении 0,8—1,0 В
и плотности тока 0,1—0,2 А/дм2 до получения светлых покрытий.
После приготовления и очистки в электролит вводят добавки
в соответствии с указанной рецептурой, растворив их предвари-
тельно в теплой воде. При приготовлении матовых электролитов
никелирования из технических солей рекомендуется их также под-
вергать химической и селективной очистке.
Электролиты никелирования корректируются ежедневно при
трехсменной работе по данным химического анализа. Расход
добавок определяется по количеству электричества, прошедшего
через электролит. По данным автомобильных заводов, на каждые
1000 А.ч количества электричества требуется 25—30 г 1,4-бутин-
диола; 10—12 г сахарина; 10—15 г формалина. По данным дру-
гих заводов рекомендуется вводить 0,13 мл/л 1,4-бутиндиола
и 0,02 мл/л формальдегида один раз в смену; хлорамина Б —
один раз в неделю. Сахарин и фталимид добавляют 2 раза в не-
делю.
Кислотность электролита поддерживают на заданном уровне
при помощи 3 %-ных растворов химически чистой H2SO4 или
NaOH. В электролиты матового никелирования можно добавлять
для понижения pH NiCO8. Добавление всех растворов в электро-
литы производят при интенсивном перемешивании электролита
в течение 30—40 мин. Контролируют pH ежедневно.
Никелевые осадки очень чувствительны к примесям, попада-
ющим в электролит с солями при его приготовлении, при раство-
рении никелевых анодов, а также с деталями, упавшими на дно
ванны.
Органические примеси образуются за счет попадания жировых
загрязнений с деталями, разложения блескообразователей и т. п
Наиболее вредными примесями являются Fe, Zn, Pb, Си, Сг
и органические соединения. Примеси Cd, Sn, S недопустимы.
Примеси вызывают образование хрупких растрескивающихся
осадков. В присутствии меди осадки получаются шероховатыми;
примеси цинка вызывают появление темных и даже черных полос.
При наличии даже небольших примесей свинца образуется темное,
чешуйчатое покрытие, которое легко осыпается. Из анионов наи-
более вредными является N Оз, способствующий отслаиванию
покрытий. Такие электролиты непригодны к эсплуатации. Азот-
187
ная кислота попадает в электролит при недостаточной промывке
деталей после травления. Органические соединения вызывают
образование питтинга, хрупкость и шероховатость покрытий.
Предельно допустимым является следующее содержание вредных
примесей, г/л: Fe <0,1; Zn <0,01; Си <0,02; Pb <0,001;
Сг < 0,04; К < 0,4; Sn < 0,02; S < 0,005.
Для удаления и устранения питтинга в электролит при тем-
пературе 50—60 °C вводят Н2О.2 и интенсивно перемешивают ее
сжатым воздухом для окисления Fe2+ до Fes+, который при pH 6,0
выпадает в результате гидролиза в виде Fe(OH)3 в осадок. С осад-
ком удаляются адсорбированные на нем органические соединения.
Удаление меди производят при pH 2,5—3, прорабатывая электро-
лит током при напряжении 0,8—1,0 В и плотности тока 0,1—
0,2 А/дм2 со «случайными» катодами. Быстрое и полное удаление
происходит при фильтровании электролита через слой порошко-
образного металлического никеля за счет контактного выделения
меди. Цинк осаждают добавлением 0,01 г/л взмученного мела или
гашеной извести до pH 6,1—6,3, интенсивно перемешивая элек-
тролит. Примеси хрома удаляют вводя в электролит 1,2 г/л
перманганата калия или 2,4 г/л карбоната свинца.
Удаление органических примесей и устранение питтинга можно
производить при помощи активированного угля из расчета 2 г/л,
выдерживая его в ванне при перемешивании в течение одной
смены.
Для поддержания высокой химической и физической чистоты
электролита, особенно при блестящем никелировании, необхо-
димо производить химическую очистку один раз в месяц при
трехсменной работе; очистку внутренней поверхности ванны 1—
2 раза в месяц; периодическую или непрерывную фильтрацию через
фильтровальную ткань со слоем активированного угля со ско-
ростью 1—2 объема/ч. Уголь можно помещать в мешочки между
рамами фильтр-пресса и менять их не реже одного раза в месяц.
Селективную очистку производят в специальной ванне со скоростью
протекания электролита 1/3 объема/ч при температуре 50—60 °C,
катодной плотности тока 0,2—0,3 А/дм2, напряжении 0,8 В.
Катоды из гофрированных листов железа предварительно под-
вергают никелированию, аноды должны быть без чехлов. Пере-
мешивание производят сжатым воздухом.
При работе с никелевыми электролитами необходимо соблю-
дать следующие правила: ванны подготавливают заранее; катодные
и анодные штанги тщательно чистят; системы перемешивания и
фильтрации включают предварительно; детали загружают бы-
стро, под током. Запрещаются выключение тока, изъятие подве-
сок для осмотра, а также корректирование pH во время элек-
тролиза. Касаться деталей можно только в резиновых перчатках,
иначе образуются непокрытые места. Подвесные крюки к анодам
должны быть изготовлены из меди или железа, изолированного
пластмассой.
188
§ 15.6. МНОГОСЛОЙНОЕ НИКЕЛИРОВАНИЕ
Большое распространение получило в настоящее время
двух- и трехслойное никелирование. Защитные свойства би-никеля
в два раза, а три-никеля в три раза превосходят защитные свой-
ства блестящих никелевых покрытий. Интерес представляют и
композиционные покрытия, например, сил-никель, который по
своим защитным свойствам не уступает три-никелю.
В основе многослойного никелирования заложен принцип
электрохимической защиты нижележащих слоев никеля. При
двухслойном никелировании нижний полублестящий слой имеет
более положительный потенциал, чем верхний блестящий слой.
Такое сочетание двух слоев никеля с неодинаковой электрохими-
ческой активностью приводит к распространению коррозии в про-
дольном направлении по поверхности раздела слоев никеля,
и только после полного растворения верхнего слоя, который
в данном случае является анодом, начинает корродировать ниж-
ний слой никеля. Обычно толщина нижнего слоя составляет
50—70 % от общей толщины покрытия.
Нижний полублестящий слой должен быть малонапряженным,
иметь минимальное количество пор и не содержать серы. Поэтому
электролиты должны иметь блескообразующие добавки, в состав
которых не входят сера или сульфогруппы (см. табл. 15.3).
Верхний блестящий слой наносится из обычного электролита
блестящего никелирования и содержит 0,08—0,1 % S. Сера,
включаясь в никелевые осадки, сдвигает потенциал никеля в более
отрицательную сторону, и между нижним и верхним слоями
создается разность потенциалов, достигающая 0,12—0,20 В.
При нанесении три-никеля между нижним полублестящим и
верхним зеркально-блестящим слоями включается тонкий про-
межуточный слой никеля, содержащий повышенное количество
серы. Толщина слоя никеля 1,5—2 мкм. Слой приобретает еще
более отрицательный потенциал по сравнению с верхним слоем
никеля и поэтому является анодом как по отношению к нижнему
полублестящему, так и по отношению к верхнему блестящему
слою. Вследствие этого при наличии пор в верхнем слое коррозия
резко замедляется и идет горизонтально по промежуточному слою.
Все слои можно наносить без промежуточных промывок водой.
Ниже приведены состав (г/л) электролита для нанесения
высокосернистого промежуточного слоя и режим работы:
NiSO4-7H2O............... 280—300
NiCl2-6H2O ...............40—80
H3BOs.....................35—45
Параамннбензолсульфамид 0,1—0,15
Сахарин.................0,5—0,6
pH .....................4,2—4,7
Л °C....................50—60
iK, А/дм2...............2,5—3,3
Скорость осаждения,
мкм/мин................. 2—1,5
Обязательно перемешивание и непрерывная фильтрация.
В последнее время наблюдается повышенный интерес к ком-
позиционным электрохимическим покрытиям. Они обладают осо-
189
Инетные частицы
Рис. 15.9. Схема покрытия иикель-сил —
микропористый хром
быми физико-механическими и хи-
мическими свойствами. По сравнению
с деталями, изготовленными из ком-
бинированных материалов, например
металлокерамики, такие покрытия
имеют определенные преимущества. Композиционные электрохими-
ческие покрытия можно получать непосредственно на поверхности
изделий, при этом отсутствует последующая термо- и механиче-
ская обработка. Можно осаждать сплавы, которые не осаждаются
обычным путем. Чаще всего композиционные электрохимические
покрытия получают на основе никелевых покрытий.
Покрытие типа сил-никель наносят на слой блестящего ни-
келя. Сил-никель образуется из суспензий, представляющих
собой обычные электролиты с добавками высокодисперсного
порошка. При прохождении электрического тока происходит
соосаждение никеля и частиц инертного вещества, которые гер-
метизируют дефекты нижнего слоя.
Механизм осаждения композиционных электрохимических по-
крытий состоит из нескольких стадий: 1) встреча инертных
частиц с катодной поверхностью; 2) задержка частиц на этой
поверхности; 3) зарастание частиц, оказавшихся на поверхности
катода.
Первая стадия осуществляется благодаря интенсивному пере-
мешиванию электролита сжатым воздухом. Такое же действие
оказывает и нагрев электролита. Покрытие как бы «вбирает»
в себя частицы.
Вторая стадия-протекает за счет адсорбционных сил, действу-
ющих на частицы. Силы адгезии зависят от поверхностного натя-
жения, состава электролита и от ряда других факторов.
Третья стадия — зарастание частиц покрытием; она зависит
от поведения металлопокрытия по отношению к частицам. Так
как никель обладает сродством к большинству применяемых ча-
стиц, он легко образует с ними покрытия и не оттесняет их.
В качестве неэлектропроводных добавок применяют тугоплав-
кие бориды, карбиды, шлифовальные порошки, оксиды алюми-
ния и т. п. Добавки не должны растворяться в воде, электролите
и должны быть бесцветными. Количество частиц зависит от плот-
ности тока и от продолжительности процесса осаждения. Размеры
частиц около 0,01—0,02 мкм, оптимальная концентрация — 0,5—
1,0 г/л. Используя различные добавки или их смесь, можно по-
лучать покрытия с высокими защитными свойствами и повышен-
ной износо- и термостойкостью.
На рис. 15.9 представлена схема образования микропористого
хрома на сил-никеле. Видно, что осаждение хрома происходит
лишь на тех участках никелевых покрытий, где нет инертных
190
Рис. 15.10. Схемы коррозионного разрушения многослойных никеле-
вых покрытий: а — однослойный никель; б — бн-никель; в — три-
ннкель; г — сил-никель;
1 — хром; 2 — сил-никель; 3 — блестящий никель; 4 — высокосериистый
никель; S — полублестящий никель; 6 — медь; 7 — сталь
частиц. В этих местах образуются мельчайшие поры, их число
достигает 20 000—100 000 пор на 1 см2 поверхности. Такие покры-
тия имеют более высокие защитные свойства, чем покрытия типа
медь—никель—хром и не нуждаются в медном подслое.
Ниже приведен состав (г/л) электролитов, которые рекомен-
дуются для нанесения сил-никеля, и режим работы:
NiSO4-7H2O.....................
NiCl2-6H2O ...................
HsBOs..........................
Сахарин .......................
1,4-бутиндиол ................
Каолин (высокодисперсный) . . .
Аэросил А-380 .................
«к, А/дм®.......................
«а, А/дм?.......................
Лимеда НС-1
260—280
40—60
30—35
0,7—1,2
0,2—0,3
0,3—2,0
3—4,8
50—60
2—3
2,5—2
Лимеда НС-2
280—320
40—60
30—35
1,5—2,5
0,13—0,3
1—20
0,1—2
3—4
50—60
2—7
2
На рис. 15.10 приведены схемы коррозионного разрушения
различных видов никелевых покрытий. В случае многослойного
покрытия медь—никель—хром при попадании влаги коррозия
начинается в порах хромового покрытия и распространяется
вертикально, вплоть до основного металла.
При нанесении би-никеля коррозия начинается в верхнем
блестящем слое и распространяется горизонтально. Коррозия
три-никеля распространяется сначала вертикально, а затем —
горизонтально вдоль высокосернистого промежуточного слоя ни-
келя.
Коррозия в сил-никеле протекает наиболее удачно: она идет
по узкому кольцу вокруг непроводящей частицы. При этом обра-
зовавшиеся продукты коррозии герметизируют микропоры хрома,
приостанавливая дальнейшее разрушение.
д
§ 15.7. ЧЕРНОЕ НИКЕЛИРОВАНИЕ
Поверхность многих деталей, например оптических
приборов, должна обладать способностью максимального свето-
поглощения. Такие покрытия используют не только в оптической
191
промышленности, но и в машиностроении; применяют их и для
декоративной отделки.
Черное никелирование имеет ряд недостатков: низкую корро-
зионную стойкость и слабое сцепление с основным металлом,
поэтому на детали наносят подслой меди или матового никеля.
Толщина слоя черного никеля не превышает 0,5—1 мкм. Осадок
представляет собой мельчайшие частицы никеля, включенные
в массу гидроксида и сульфида цинка. Черный цвет аналогичен
черному фотографическому изображению, образованному части-
цами серебра, равномерно распределенными в массе желатина.
Состав (г/л) электролитов черного никелирования и режим
работы приведены ниже:
NiS04-7H2O.............
(NH4)jSO4...............
ZnSO4-7H2O.............
NiSO4-(NH)2SO4.........
nh4cns.................
NaCNS .................
HSBOS..................
Лимонная кислота ....
pH ....................
iK, А/дм®...............
t, °C..................
Электролит l Электролит 2
50—60 65—75
15—20 -—,
20—25 30—40
—. 45—50
15—20 —
.—1 15
— 20
2—3 —
5—5,5 5,2—5,5
0,1—0,15 1,0—1,5
18—25 45—55
Электролит 2 применяют в оптической промышленности. Аноды
изготовлены из никеля и цинка.
§ 15.8. ХИМИЧЕСКОЕ НИКЕЛИРОВАНИЕ
Процесс химического никелирования позволяет полу-
чать равномерные осадки на деталях сложной конфигурации.
По сравнению с электрохимическими никелевыми покрытиями
они обладают повышенной твердостью и износостойкостью, по-
этому могут быть рекомендованы для деталей, работающих в усло-
виях трения, особенно при отсутствии смазки.
Покрытия имеют небольшую пористость и достаточно высокие
декоративные свойства, поэтому применяются в качестве защитно-
декоративных.
В основе процесса лежит реакция взаимодействия гипофосфита
натрия с ионами никеля. В водном растворе гипофосфит натрия
подвергается гидролизу с образованием фосфита натрия и атомар-
ного водорода
NaH2PO2 + Н2О = NaH2PO3 + 2Нат.
Атомарный водород, адсорбированный на поверхности покры-
ваемого металла, восстанавливает ионы никеля:
Ni2+ + 2Нат -> Ni + 2Н+.
Одновременно атомарный водород взаимодействует с анио-
нами Н2РО21 и Н2РО31, восстанавливая фосфор до элементарного
192
состояния, поэтому образуется никелевое покрытие, содержащее
фосфор.
При химическом никелировании всегда выделяется водород:
2Нат - H2f.
На эту реакцию расходуется более 60 % выделяющегося по
реакции водорода.
При обычных условиях восстановления никеля не происходит.
Для того чтобы происходило восстановление ионов никеля,
необходимо наличие катализатора. Каталитическими свойствами
обычно обладает металл детали, например железо, титан, алю-
миний, а в дальнейшем — никель.
Наносить химический никель можно и на металлы, которые
не являются катализаторами данной реакции: медь, серебро и др.
В этом случае необходимы предварительный контакт детали с более
отрицательным металлом, например с алюминием, или подача
короткого импульса тока. На таких металлах, как свинец, кад-
мий, олово и др., покрытие получить не удается. Химический
никель наносят и на неметаллические материалы: стекло, керамику
и пластмассу. Перед нанесением покрытия поверхность подвер-
гают активированию обычным способом.
Содержание фосфора в покрытии колеблется в пределах от 3
до 12 % и зависит от величины pH, снижаясь с понижением кис-
лотности. Вероятно, это связано с тем, что скорость восстановле-
ния ионов никеля с возрастанием pH увеличивается быстрее,
чем скорость восстановления фосфора.
На скорость химического никелирования оказывают влияние
и такие факторы, как температура, концентрация и соотношение
гипофосфита натрия и соли никеля, природа и количество орга-
нических добавок.
Температуру никелирования поддерживают равной 80—90 °C.
При повышении температуры с 80 до 90 °C скорость осаждения
увеличивается в 1,5 раза, а при снижении ее до 70 °C процесс
осаждения прекращается.
Химическое никелирование протекает при pH 4—4,5 и при
pH 8—10, поэтому растворы, в которых происходит осаждение
покрытия, подразделяются на кислые и щелочные. При pH < 4
процесс осаждения прекращается. При pH > 5,5 начинается
гидролиз солей никеля, при этом частицы гидроксида никеля
становятся центрами разложения рабочего раствора и может
произойти «саморазряд» ванны — выделение металлического ни-
келя во всем объеме раствора.
Так как во время химического никелирования все время выде-
ляется кислота, необходимо вводить буферные добавки: уксусную
кислоту, янтарную кислоту и т. п. Введение в раствор комплексо-
образователей препятствует образованию фосфита никеля, кото-
рый, выпадая в осадок, делает его непригодным для дальнейшего
использования.
7 Дасоян М. А. и др.
193
Обычно раствор используют один раз, при этом 10—15 %
исходных компонентов пропадает, а буферные добавки пропадают
полностью. Однако из-за своей простоты этот способ широко при-
меняется в промышленности.
Кроме буферных добавок и комплексообразователей в рас-
творы вводят в очень малых количествах специальные добавки-
стабилизаторы, например катионы сурьмы, висмута и мышьяка.
В кислых растворах оптимальным отношением соли никеля к
гипофосфиту натрия, выраженным в молях, является 0,4. Для
поддержания кислотности вводят буферные добавки. Накопление
фосфитов никеля оказывает вредное влияние на процесс осажде-
ния: взвешенные частицы труднорастворимых фосфитов оседают
на деталях, делая поверхность шероховатой. Введение комплексо-
образователей типа глицерин, гликолевокислый и янтарнокислый
натрий связывает никель в слабодиссоциированный комплекс-
ный ион, препятствуя до некоторой степени образованию фос-
фитов.
Процесс протекает при температуре 80—100 °C. Так как
кислотность раствора все время увеличивается из-за образования
фосфористой кислоты, добавляют 1—2 %-ный раствор NaOH или
25 %-ный раствор NH4OH (1 : 10).
Кислые растворы по сравнению со щелочными имеют ряд
преимуществ: они более стабильны, имеют более высокую ско-
рость осаждения и обладают более высокими защитными свой-
ствами.
Щелочные растворы кроме солей никеля и гипофосфита натрия
содержат комплексообразователи — аммиак и лимонную кислоту,
что позволяет вести процесс осаждения длительное время. Раство-
римость фосфитов в щелочных растворах значительно выше, чем
в кислых. Накапливающийся фосфит не оказывает вредного влия-
ния при концентрации менее 340 г/л. В щелочных растворах можно
наносить покрытие на коррозионно-стойкую сталь, алюминий,
титан и т. п.
На скорость процесса большое влияние оказывает темпера-
тура. Повышение температуры от 80 до 90° С увеличивает скорость
осаждения в 1,5 раза. Кислотность в щелочных, растворах под-
держивается путем добавления 25 %-ного водного раствора ам-
миака до перехода зеленой окраски в устойчивую синюю. Приго-
тавливают раствор обычным путем. Все компоненты растворяют
отдельно в небольшом количестве горячей воды и вводят в рабо-
чую ванну, затем добавляют аммиак, а при температуре 60—
65 °C — концентрированный раствор гипофосфита. Состав раство-
ров и режим работы приведены в табл. 15.4.
Покрытия, полученные при химическом никелировании, имеют
слоистую аморфную структуру. Недостатком покрытия является
его хрупкость, которая начинает проявляться при толщине
слоя около 10 мкм и выше. После термической обработки покры-
тие становится кристаллическим и представляет собой твердый
194
15.4. Состав (г/л) растворов для химического никелирования
и режим работы (ГОСТ 9.305—84*)
Компоненты раствора и режим работы Номер раствора
1 2 3 4 5
NiSO4-7H2O или 20—25 20—25 20—25 20—50 20—30
NiCl2-6H2O ! NaH2PO2 (технич.) 25—30 20—25 15—20 10—25 10—25
Малеиновый а нгидрид 1,5—2,0 — —. — —
(NH4)SO4 40—50 — — — —
nh4ci — .— —— 35—55 —
CHSCOOH, ледяная 20—25 — — — 6—10
CHsCOONa — 10—15 —- — 8—15
Аминоуксусная кислота — 7—20 — — ,—
(гликол) PbS (II) _ 0,001— -—. -—.
Тиомочевииа _ . 0,050 0,001 0,001—
Н3ВО3 5—15 0,002
Молочная 'кислота — 35—45 .— —
(40 %-ная), мл/л Цитрат натрия . _ 35—55
рн 5,0—5,5 5,0—6,0 4,6—5,0 7,5—9,0 4,1—5,0
t, °C 90—95 90—95 88—92 78—88 85—95
Плотность загрузки, 1—2 1—2 1—2 1—2 1—2
дм2/л Скорость осаждения, 18—25 15—25 15—18 8—12 10—15
мкм/ч Массовое содержание Р,% 7—10 4—8 8—12 3—7 3—7
раствор никеля с небольшим содержанием фосфора и интерметал-
лическое1 соединение Ni3P. Содержание фосфора 4—8 % для
щелочных и 8—10 % для кислых растворов.
Зависимость микротвердости никель-фосфорных покрытий от
температуры обработки приведена на рис. 15.11. Из графика
видно, что после термической обработки твердость покрытия
увеличивается до известного предела, а затем падает до первона-
чального значения, причем чем выше содержание фосфора в осадке,
тем выше максимум твердости.
Термическая обработка позво-
ляет повысить микротвердость
покрытий до 8400—11 800 МПа.
Термическая обработка стальных
деталей производится при тем-
пературе 300—400 °C, алюминие-
Рис 15.11. Влияние температуры тер-
мической обработки на твердость никель-
фосфорных покрытий. Содержание фос-
фора в покрытии:
( / — 9 %; 2 — Б %
вых — при 275—280 °C, а деталей из дюраля — при 375—385 °C.
Время выдержки 1 ч. Структурные превращения в покрытиях
сопровождаются выделением тепла и изменением: объема, поэтому
при очень быстром нагреве возможно разрушение покрытий.
Сцепление никель-фосфорных покрытий сильнее сцепления
электролитического никеля, так как осаждение происходит рав-
номерно как внутри, так и снаружи детали, заполняя все микро-
углубления и неровности. Отклонения толщин не превышают
10 %, поэтому химический никель наносят на прецизионные
детали, например на плунжерные пары топливных насосов дви-
гателей, мелкие детали в часовой и оптической промышленности
и т. п.
Высокие защитные свойства наряду с небольшой пористостью
позволяют применять никель-фосфорные покрытия в качестве
защитных, в том числе в условиях перегретого пара и воздуха,
вплоть до 700 °C. Для увеличения износоустойчивости и снижения
коэффициента трения никель-фосфорное покрытие наносят на
трущиеся поверхности. Незаменимо покрытие в полевых усло-
виях и в небольших мастерских для восстановления размеров
изношенных деталей. Целесообразно нанесение покрытия на
крупногабаритные детали.
Скорость осаждения при химическом никелировании колеб-
лется в зависимости от состава электролита от 10 до 25 мкм/ч.
Химическое никелирование проводят в проточных и непроточных
растворах. В проточных растворах постоянство состава поддер-
живается при помощи циркуляции раствора по замкнутому циклу:
из реактора, в котором происходит осаждение, в теплообменник,
где раствор охлаждается до 55 °C, затем насосом перекачивается
через фильтр, оттуда самотеком стекает в корректировочный бак
и поступает в реактор. Установка снабжена приборами Автомати-
ческого регулирования pH и температуры.
При работе с непроточными электролитами использую*! ванны
со съемными пластикатовыми чехлами. При очистке ванн чехлы
извлекают и обрабатывают в азотной кислоте.
ГЛАВА 16. ЖЕЛЕЗНЕНИЕ !
§ 16.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА \
И ОБЛАСТЬ ПРИМЕНЕНИЯ ЖЕЛЕЗНЫХ ПОКРЫТИЙ
Атомный вес железа 55,85; плотность электролитиче-
ского железа 7,71; температура плавления 1650 °C; электрохими-
ческий эквивалент Fe2+ 1,042 г-А-ч; стандартный потенциал
Fe/Fe2+ — 0,44 В, Fe2+/Fe3+ + 0,75 В, a Fe/Fe3+ —0,44 В.
В сухой атмосфере на поверхности железа образуется пассив-
ная пленка оксидов, предохраняющая его от дальнейшего окисле-
196
ния. Во влажной атмосфере железо подвергается коррозии. В раз-
бавленных кислотах железо растворяется с образованием солей
двухвалентного железа. Концентрированные азотная и серная кис-
лоты пассивируют его поверхность. В щелочах, за исключением
концентрированных горячих растворов, железо не растворяется.
Осадки железа, полученные электрохимическим путем, по
своему строению и свойствам отличаются от железа, полученного
металлургическим путем. Благодаря своей чистоте и однородно-
сти оно менее подвержено коррозии, чем обычные сорта железа.
Цвет железных покрытий в зависимости от условий электро-
лиза колеблется от серебристо-белого до темно-серого. Покрытия
могут быть бархатистыми, со слабым блеском или блестящими.
Микротвердость покрытий колеблется в широких пределах
от 1,2—1,3 до 6,5—7,5 ГПа. Основным недостатком покрытий
является их повышенная хрупкость, которая объясняется выде-
лением на катоде водорода. Проникая внутрь покрытия, он адсор-
бируется на дефектах структуры и вызывает снижение прочности
и пластичности. Масса поглощенного водорода зависит от режима
работы и колеблется в широких пределах (0,003—0,1 масс. доли).
Полностью удалить водород можно путем нагрева деталей до
температуры 800—900 °C, однако при этом происходят укрупне-
ние структуры железа и снижение его твердости. Следует иметь
в виду, что при температуре 200—400 °C наблюдается резкое по-
вышение твердости вследствие образования гидридов железа,
которая затем снижается, так как гидриды являются непрочными
соединениями и легко распадаются.
Детали, работающие в жестких условиях, после железнения
подвергают цементации. При этом удаляется водород, а поверх-
ностный слой насыщается углеродом. Такая обработка позволяет
увеличить твердость покрытий и улучшить их сцепление с осно-
вой. Цементацию проводят при температуре 830—850 °C с после-
дующим охлаждением в соленой воде. После цементации произ-
водят закалку и отпуск или хромирование.
Электролитически осажденное железо применяется в основном
для восстановления изношенных деталей или доведения занижен-
ных размеров деталей до заданных при их изготовлении. По
сравнению с хромированием железнение имеет ряд преимуществ:
повышенную скорость осаждения; прочное сцепление с основой;
более низкий расход электроэнергии. Железные покрытия можно
шлифовать, цементировать, наносить на них хром. Добавляя
в электролиты специальные добавки, можно получать покрытия
с высокой твердостью и износостойкостью.
Разработан технологический процесс получения пористого
железа, покрытия из него обладают значительной маслоемкостью,
хорошо прирабатываются и имеют высокие антифрикционные
свойства.
В полиграфической промышленности производят осталивание
печатных форм для увеличения их тиражеспособности, а также
197
для зашиты основного металла от вредного действия типограф-
ских красок. Иногда железо наносят в качестве промежуточного
подслоя на чугунные детали при нанесении цинка или олова.
В последнее время путем железнения осуществляют пайку пла-
стин твердого сплава с телом инструмента. Железный слой пре-
дохраняет пластину от окисления во время пайки, обеспечивает
прочное сцепление пластин и гасит внутренние напряжения,
возникающие в инструменте после напайки во время охлаждения.
Толщина слоя достигает 3—5 мм, скорость осаждения — 0,20—
0,25 мм/ч.
§ 16.2. ЭЛЕКТРОЛИТЫ ЖЕЛЕЗНЕНИЯ
При электроосаждении железа так же, как при нике-
лировании, на катоде выделяется водород, а осаждение железа
протекает при значительной катодной поляризации. В этом слу-
чае необходимо создать такие условия осаждения, при которых
выделение водорода сводится к минимуму.
При увеличении температуры электролита выход по току же-
леза возрастает за счет одновременного уменьшения наводора-
живания и поляризации железа. При комнатных температурах
скорость разряда ионов водорода превышает скорость разряда
ионов железа и выход металла по току падает.
Резкое понижение выхода по току с увеличением кислотности
заставляет поддерживать pH на возможно более высоком уровне.
Однако чрезмерное увеличение pH недопустимо, так как в ней-
тральных или близких к нейтральным растворах происходит
гидролиз солей железа.
На катодный выход по току оказывает большое влияние на-
личие в электролите ионов Fe3+. Их появление ухудшает качество
покрытий и уменьшает выход по току. Поэтому свежеприготовлен-
ные электролиты необходимо прорабатывать током до полного
восстановления ионов Fe3+ в ионы Fe2+. Для предотвращения
анодного окисления Fe2+ в Fe3+ аноды помещают в чехлы; по этой
же причине нельзя перемешивать электролиты железнения сжа-
тым воздухом.
Для железнения применяют хлоридные, сульфатные и смешан-
ные электролиты. Так как существенным фактором, влияющим на
свойства покрытий, является температура, их подразделяют также
на горячие и холодные.
В горячих электролитах содержание водорода составляет всего
лишь 0,002 %, осадки получаются мягкими и пластичными. Эти
электролиты нашли применение для восстановительного ремонта.
В холодных электролитах содержание водорода достигает 0,1 %,
осадки получаются хрупкими и твердыми. Зато холодные элек-
тролиты менее агрессивны, проще в эксплуатации и более ста-
бильны в работе. Йх применяют главным образом в полиграфиче-
ской промышленности.
198
Рис. 16.1. Зависимость выхода
по току и твердости железных
покрытий от скорости проте-
кания электролита (плотность
тока 20 А/дм2, температура
80 °C, концентрация НО 2,0 г/л):
1 — выход по току; 2 — твердость;
3 — скорость осаждения, мкм/ч
16.1. Состав (г/л) хлоридных электролитов
железиения и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3
FeCl2-4H2O 200—220 400—450 600—650
НО 0,5—1,0 1,5—2,0 2,0—2,0
iK, А/дм2 t, °C 30—50 До 50 20—30
60—80 60—70 80—100
Н, ГПа 4,5—6,5 2,5—4,5 1,8—2,0
Толщина, мм 0,8—1,5 До 2,0 2,0—3,0
Для получения покрытий, прочно
сцепленных с основой, перед железне-
нием производят анодную активацию.
При нанесении покрытий в хлорид-
ных электролитах применяют следующий состав, г/л, и режим
работы: __
— ------—- • —
/H2SO4 ....... . . . . 350—370'' «а, А/дм2...........60—70
! FeSO4-7H2O......... 10—25 Время, мин .......... 2—3
7, °C................ 15—25
___-— ................ _ ———~~
Катодами служат свинец или сталь марки 08Х18Н10Т.
'> Перед железнением в сульфатных электролитах активацию
проводят в растворе, содержащем 350—365 г/л H2SO4 при ia =
= 40^-60 А/дм2 для углеродистой стали и ia = 154-20 А/дм2
для чугуна.
После активации детали необходимо промыть в холодной про-
точной воде до полного удаления остатков серной кислоты и
мокрыми загрузить в ванну для железнения. Для удаления пас-
сивной пленки, которая образовалась во время активации, де-
тали сначала выдерживают в течение 10—180 с в электролите
без тока, а затем начинают осаждение при плотности тока 1—
5 А/дм2, доводя ее в течение 5—10 мин до заданного значения.
Основным компонентом хлоридных электролитов является
хлорид железа (II) FeCl2-4H2O. Кристаллы этой соли имеют светло-
зеленый цвет. Растворимость соли при комнатной температуре
составляет 626 г/л, а при температуре 100 °C доходит до 950 г/л.
Концентрация соли легко определяется по плотности раствора.
В настоящее время применяют электролиты, которые отли-
чаются друг от друга концентрацией хлорида железа (II).
В табл. 16.1 приведены состав хлоридных электролитов и режим
работы.
Малоконцентрированный электролит 1 получил широкое при-
менение для восстановления деталей на авторемонтных заводах.
Осадки получаются плотными и гладкими с высокой твердостью.
Толщина покрытия регламентируется появлением дендритов. Уве-
личить ее можно повторным нанесением железа после механиче-
199
ской обработки покрытий. Чрезмерное понижение температуры
может привести к растрескиванию покрытий. Среднеконцентри-
рованный электролит 2 применяется при большом износе, он
обеспечивает получение гладких, плотных и более мягких покры-
тий. Высококонцентрированный электролит 3 позволяет полу-
чать мягкие и вязкие покрытия.
Перспективным является проточное железнение деталей в элек-
тролите, содержащем 650 г/л FeCl2 при 80 °C. Концентрация со-
ляной кислоты 2—2,5 г/л, плотность тока iK = 404-60 А/дм2.
Расстояние между катодом и анодом 2,5 мм. Скорость протекания
должна быть менее 15 см/с. Влияние скорости протекания ипр
электролита на выход по току, твердость и скорость осаждения иос
представлено на рис. 16.1. С увеличением скорости протекания
электролита выход по току возрастает до 97,6 % против 87,9 %
в непроточном электролите. Если при стационарном режиме
твердость равна 3,0—4,0 ГПа, то в проточном электролите она
возрастает до 4,0—5,0 ГПа. Скорость осаждения увеличивается
также и доходит до 270 мкм/ч.
Из хлоридного электролита можно получать пористые осадки
железа.
Состав электролита (г/л) и режим работы приведены ниже:
FeCl2-4H2O............. 600
КС1 ................... 100—120
МпС12-4Н2О............- 15—20
Аскорбиновая кислота . . 0,25—0,5
pH ....................... 2—3
Л °C.................... 18—25
iK1 А/дм2................ 20—30
Перед железнением необходима анодная активация в концен-
трированной серной кислоте с добавлением 20 г/л К2Сг2О7 при
температуре 18—25 °C, плотности тока 10 А/дм2 в течение 2 мин.
При эксплуатации хлоридных электролитов следует следить
за их кислотностью. При недостатке кислотности за счет защела-
чивания прикатодного пространства раствор мутнеет из-за обра-
зования Fe (ОН)2 и Fe(OH)3, которые в виде белых хлопьев вы-
падают в раствор. При увеличении кислотности резко падает
выход по току. Верхний допустимый предел НС1 3 г/л. Кислот-
ность электролита можно корректировать из расчета, что за
) 1 А-ч расходуется 0,8 г кислоты.
При введении в электролит органических добавок можно полу-
чать покрытия с повышенным содержанием углерода. Добавляя,
например, 60—70 г/л глицерина и 30—40 г/л сахара, можно по-
лучить железные покрытия, содержащие 0,5—0,6 % С.
Введение в хлоридные электролиты 0,5 г/л аскорбиновой кис-
лоты и 30 г/л аморфного бора позволяет получать покрытия,
содержащие от 2 до 5 % бора. Осаждение ведут при комнатной
температуре, плотность тока 20 А/дм2. Последующая обработка
в вакууме при 1100—1150 °C в течение 1 ч повышает износостой-
кость в 10—12 раз по сравнению с чистыми железными покры-
тиями. Микротвердость таких покрытий достигает 12 000—
16 000 МПа.
200
Для приготовления хлоридного электролита растворяют в НС1
(2 : 1) стружку низкоуглеродистой стали (Ст10, Ст20). Нельзя
применять стружку легированной стали, содержащую хром.
Предварительно стружку обезжиривают в 10 %-ном растворе
NaOH при температуре 60—70 °C. Затем ее тщательно промывают
и активируют для удаления ржавчины. Растворение стружки
следует проводить в кислотостойкой емкости, включив венти-
ляцию. Температура раствора 30—40 °C. Количество кислоты
берется с избытком.
i Загружают стружку в несколько приемов и травят до прекра-
щения выделения пузырьков водорода. Обычно процесс раство-
рения продолжается несколько дней. После отстаивания раствор
пропускают через фильтр в ванну железнения и прорабатывают
током в течение 5 ч из расчета 2 А/л при концентрации НС1 2—
3 г/л. Приготовленный электролит должен иметь светло-желтый
цвет; на воздухе с течением времени он приобретает из-за окисле-
ния Fe2+ в Fe3+ желтый цвет. В таком электролите осадки полу-
чаются шероховатыми и неровными.
Основным компонентом сульфатных электролитов является
сульфат железа (II) FeSO4 -7H2O, его растворимость при 20 °C
485 г/л. Для получения твердых железных покрытий применяют
электролит, состав (г/л) и режим работы которого приведены ниже:
FeSO4-7H2O............... 200-250
Щавелевая кислота .... 1—4
K2SO4....................100--150
iK, А/дм2................... 3—10
Л °C................... 20—60
pH ................... 2,5—3
ВТ, % .............. 70—80
Зеркально-блестящими и твердыми получаются покрытия из
электролита с добавками гликоля состава (г/л), работающего при
следующем режиме:
FeSO4-7H2O.............. 180—200
Гликоль................... 10
Щавелевая кислота .... 0,5
pH ....................2,0—2,2
t, °C...................20—25
«к, А/дм2.............. До 9
ВТ, % ............... 82—87
Существуют также электролиты, которые позволяют полу-
чать мягкие, блестящие железные покрытия, применяемые в ка-
честве подслоя под кобальт, никель или хром.
ГЛАВА 17. ХРОМИРОВАНИЕ
§ 17.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ХРОМА
И ОБЛАСТЬ ПРИМЕНЕНИЯ ХРОМОВЫХ ПОКРЫТИЙ
Электролитический хром — серебристо-белый металл
с синеватым оттенком, обладающий высокой твердостью и хо-
рошо сопротивляющийся механическому износу. По значению
стандартного потенциала (£'сг/Сг’+ = —0,7 В) он должен отно-
ситься к активным металлам. Однако в атмосферных условиях
201
17.1. Минимальная толщина, мкм, подслоя и основного покрытия
в зависимости от условий эксплуатации деталей
Назначение покрытия Условное Условия эксплуатации
обозначение 1 2—4 6—6 7 — 8
Детали из углеродистой, низко- и среднелегированной стали
Защитное, защитно-де- коративное с подслоем ни- келя Защитно-декоративное То же с подслоем медь— никель Работа на трение > > > за- щитное н.х Хмол.Х М.Н.Х * Хтв Хмол.Хтв 15; 1 12 9; 6 18 12; 6 24; 1 35 24; 9 35 24; 12 45 30; 12 45 24; 12 60 35; 15 60 30; 30
Детали из коррозионно-стойкой стали
Работа на трение Защитное Хтв Хмол 9 18 24 18 35 24
Детали из меди и ее сплавов •
Работа на трение » » » при ма- лых нагрузках, защитное Защитно-декоративное Хтв Хмол Н.Х; Н.Хч 9 9 6; 1 18 18 9; 1 24 18 12; 1 35 24 15; 1
Детали из алюминия и его сплавов
Работа на трение при ма- лых нагрузках Защитно-декоративное с подслоями: медь—никель никель—медь—никель Хтв М.Н.Х Н.М.Н.Х 18 6; 18; 1 9; 1 35 -
Детали из цинковых сплавов
Защитно-декоративное с подслоем медь—никель М.Н.Х 9; 6; 1 24; 9; 1 30; 12 35; 15
Детали из титана и его сплавов
Для работы на трение Хтв 9 9 9 9
Примечание. Толщина черного хрома Хч не нормируется.
* Суммарная толщина подслоя.
202
хром сохраняет цвет и блеск длительное время, что объясняется
образованием на его поверхности тонкой, но очень прочной оксид-
ной пленки. Наличием этой пленки объясняется высокая антикор-
розионная стойкость хромовых покрытий. На воздухе (в при-
сутствии влаги) и в окислительных средах хром принимает по-
тенциал +0,2 В, т. е. хромовые покрытия являются катодными
по отношению к стали, поэтому защитные хромовые покрытия
должны быть беспористыми.
Хром устойчив во влажной атмосфере; в атмосфере сероводо-
рода и сернистого газа; в растворах серной, азотной, фосфорной
и органических кислот, щелочей. В растворах соляной кислоты
и горячей концентрированной серной хром растворяется из-за
разрушения оксидной пленки.
В соединениях хром трех- и шестивалентен. Соединения ше-
стивалентного хрома являются сильными окислителями. Хромо-
вый ангидрид при растворении в воде образует смесь полихромо-
вых кислот. В разбавленном растворе образуется Н2[СгО4], при
средней концентрации — Н2 [CrOs(CrO4) 1. При дальнейшем уве-
личении концентрации образуются Н2 [CrO3(CrO4)21 и
Н2 [СгО3(СгО4)3 ]. Все хромовые кислоты относятся к сильным.
Электрохимический эквивалент хрома при расчете на трехва-
лентный 0,648 г/А-ч.
Важнейшими областями применения электролитического хро-
мирования являются отделка деталей (защитно-декоративное хро-
мирование); защита от коррозии (защитное хромирование); повы-
шение износостойкости трущихся деталей и восстановление изно-
шенных деталей машин (твердое хромирование).
При нанесении многослойных покрытий при защитно-декора-
тивном хромировании толщина слоя хрома составляет 1—60 мкм
(табл. 17.1). Электролитические слои хрома хорошо сцепляются
со сталью, никелем, медью и ее сплавами при тщательном прове-
дении подготовительных операций и соблюдении режима хроми-
рования. Наносить поверх хромовых покрытий другие металлы
трудно, так как в этом случае сцепление отсутствует (из-за оксид-
ной пленки на хроме).
§ 17.2. ТИПЫ ХРОМОВЫХ ПОКРЫТИЙ
f И ИХ НАЗНАЧЕНИЕ • ?
В зависимости от режима электролиза могут быть
получены осадки хрома с различными свойствами. В зависимости
от условий электролиза образуются три типа хромовых покрытий
(рис. 17.1): серые, обладающие низкими физико-химическими
свойствами и не находящие практического применения; блестя-
щие, отличающиеся высокими значениями твердости и износо-
стойкости; молочные, наименее пористые и наиболее пластичные.
Электрохимически осажденный хром по своим физико-механи-
ческим свойствам отличается от металлургического хрома. Плот-
203
Рис. 17.1. Области получения различных хромо-
вых покрытий прн содержании СгО3 250 г/л:
/ — серые; II — блестящие; III — молочные
ность хрома зависит от режима осаждения
(табл. 17.2) и различна для разных типов
хромовых покрытий.
По функциональному назначению хро-
мовые покрытия делятся на защитно-деко-
ративные, защитные коррозионно-стойкие,
износостойкие и антифрикционные. Защит-
но-декоративные покрытия применяются
для отделки деталей, эксплуатирующихся
в атмосферных условиях. Эти покрытия могут быть блестящими, ма-
товоблестящими, черными и цветными. Для увеличения защитных
свойств их обычно наносят по подслою меди и никеля. Черное
хромирование производят из электролитов специального состава.
Защитные покрытия могут быть одно- и двухслойными. Одно-
слойные покрытия — это малопористые покрытия молочного
хрома с толщиной не менее 20 мкм. Двухслойное покрытие при-
меняется тогда, когда нужно получить высокие защитные свойства
в сочетании с повышенной износостойкостью. С этой целью первый
слой покрытия представляет собой молочный хром толщиной
20 мкм, а второй слой — блестящий хром толщиной 30—50 %
общей толщины покрытия.
Износостойкие и антифрикционные покрытия могут быть
плотными и пористыми. Плотные покрытия используются для
повышения износостойкости вновь изготовленных деталей и для
восстановления деталей, бывших в эксплуатации. Пористые по-
крытия, обладающие высокими антифрикционными свойствами,
получают после специальной обработки, в процессе которой на
поверхности хрома образуются углубления, способные удержи-
вать на своей поверхности смазочные материалы при высоких
температурах.
17.2. Плотность электролитического хрома в зависимости
от режима осаждения
Вид хрома Режим осаждения Плотность хрома, г/см8 Удельное электриче- ское сопро- тивление, мкОм - см
(к, А/дм* t. °C
Матовый 40 45 6,9 60
Блестящий 35 55 7,0 60
Молочный 20 65 7,1 30
Отожженный при 1200 °C — — 7,2 10
204
§ 17.3. ОСОБЕННОСТИ ПРОЦЕССА ХРОМИРОВАНИЯ
Электрохимическое осаждение хрома существенно отли-
чается от других гальванических процессов. Хромирование про-
изводится из электролитов, содержащих не соли осаждаемых
металлов, а смеси хромовых кислот (Н2СгО7 и Н2Сг2О4). При этом
установлено, что электролит должен содержать определенное
количество активных анионов, чаще всего SOl”, F", SiF|“, без
которых хром не выделяется из растворов хромовой кислоты
(рис. 17.2). Особенностями процесса хромирования являются
высокий отрицательный '-потенциал восстановления хромат-ионов,
низкий выход металла по току, высокие плотности тока, необхо-
димость применения нерастворимых анодов, очень низкая рас-
сеивающая способность Электролита.
Механизм осаждения-хрома очень сложен. Во время хромиро-
вания на катоде одновременно протекают процессы осаждения
хрома; выделения водорода; восстановления шестивалентного
хрома до трехвалентного; образования на поверхности катода
тонкой пленки, состоящей из продуктов восстановления хромовой
кислоты и активного аниона.
Не только вид, но и концентрация активного аниона оказы-
вают влияние на процессы, протекающие на катоде. На рис. 17.3
приведена зависимость выхода по току от концентрации ионов SOl”
для выделения хрома и водорода и образования трехвалентного
хрома. Из рис. 17.2 видно, что максимальное значение выхода
хрома по току достигается при определенном соотношении между
концентрацией Н2СгО4 и постороннего аниона, близком к 100 : 1.
Как видно из рис. 17.4, форма поляризационной кривой су-
щественно изменяется, когда в хромовую кислоту вводят сульфат-
Рис. 17.2. Влияние концентрации активного аниона Са на выход по току SiF2-
(/); F- (2); SO2- (5)
Рис. 17.3. Выход по току для частных катодных процессов в зависимости от
концентрации иона SO2- (содержание СгО3 — 350 г/л, tK = 15 А/дм2, t = 20 °C):
1 — образование трехвалентного хрома; 2 — выделение водорода; 3 — выделение хрома
\ ‘ 205
Рис. 17,4. Поляризационные кривые при электро-
лизе хромовой кислоты без добавок (/) и с добавкой
серной к'аслоты (2)
ионы. Без добавки посторонних анионов
характер кривой плавный, так как на
электроде во всем интервале плотностей
тока выделяется водород. В присутствии
сульфат-ионов кривая состоит из двух вет-
вей ab и cd, отличающихся характером
электродных реакций.
На участке at? происходит восстановле-
ние шестивалентного хрома до трехва-
лентного; на участке cd протекают одновременно три процесса:
восстановление шестивалентного хром(а до металла, восстановле-
ние шестивалентного хрома до трехвалентного и восстановление
ионов водорода. /
Сила тока увеличивается с увеличением потенциала электрода,
что свидетельствует об изменении / состояния поверхности (см.
рис. 17.4, кривую 2). Это влияние/оказывают небольшие количе-
ства посторонних анионов, которые изменяют поверхностное
состояние катода и таким образом влияют на электродные про-
цессы. В области кривой ab поверхность становится более актив-
ной, а в области cd наблюдается торможение реакции восстановле-
ния. Пассивность катода связайа с появлением на поверхности
электрода пленки из продуктов электролиза, которая служит
тормозом для одних реакций ц способствует протеканию других.
В зависимости от состава и структуры тормозящее воздей-
ствие образующейся пассивной пленки на восстановление хромо-
вой кислоты проявляется по-разному. На серебре и меди в разбав-
ленной хромовой кислоте стабильная пленка не образуется, так
как эти металлы хорошо растворяются в хромовой кислоте.
В этом случае оксидные пленки не оказывают тормозящего воз-
действия на реакцию восстановления Сгв+ -> Сг3+, поэтому на
серебре и меди катодное восстановление ионов хрома может про-
текать без добавки посторонних анионов.
По-иному ведут себя в хромовой кислоте никель, кобальт,
железо, хром. Эти металлы покрыты прочной оксидной пленкой,
а в растворе хромовой кислоты они дополнительно пассивируются.
На таких электродах в хромовой кислоте без добавок не про-
исходит реакция Сгв+ -» Сг3+ несмотря не высокую поляризацию
электрода.
Исследования катодной пленки, выполненные А. М. Шлуге-
ром с сотрудниками, показали следующее. Катодная пленка
состоит из двух слоев; особо тонкого, прилегающего к металлу,
близкого по своей природе к пассивирующему слою, и внешнего
сравнительно толстого слоя, состоящего из продуктов восстанов-
ления хроматов и активного аниона. - i
/г
206
Катодная пленка имеет коллоидную природу и состоит из
65—67 % Сг6+, 22—23 % Сг3+, 10—12 % SO1’, причем состав
пленки не зависит от состава электролита и содержания ионов
SO4". Толщина прилегающего слоя около 0,1 мкм, а толщина
всей пленки 20—25 мкм. Состав пленки и ее свойства зависят от
режима хромирования, а от свойств пленки зависят структура и
свойства покрытия. Толщина пленки увеличивается с увеличе-
нием концентрации постороннего аниона.
Детально механизм воздействия посторонних анионов не
выяснен. Существуют две гипотезы, объясняющие их влияние. По
первой из них анионы являются активаторами, вызывающими
активацию катодной поверхности. В отсутствие этих ионов по-
верхность покрывается гидрооксидом Сг3+, препятствующим пол-
ному восстановлению Н2СгО4. По второй гипотезе посторонние
анионы образуют с Н2СгО4 реакционные комплексы, обладающие
большей способностью к восстановлению, чем чистая поверх-
ность.
При хромировании применяют нерастворимые аноды. Это
объясняется тем что хром растворяется на аноде с большим вы-
ходом по току, чем осаждается на катоде, и переходит в раствор
в виде ионов разной валентности.
Применяются аноды из свинца или его сплавов. Анодный про-
цесс состоит в выделении кислорода и окислении трехвалентного
хрома до шестивалентного. В процессе электролиза аноды по-
крываются слоем оксида свинца (IV) РЬО2, который является
катализатором процесса Сг3+ -* Сг®* и защищает аноды от разру-
шения. При определенном соотношении анодной и катодной плот-
ностей тока можно установить равновесие, при котором на аноде
будет окисляться такое же количество трехвалентного хрома,
какое попадает в электролит из катодной зоны. Рекомендуется
поддерживать соотношение катодной и анодной поверхности
в пределах 1 : 2—2 : 3.
§ 17.4. СТРУКТУРА И СВОЙСТВА
ХРОМОВЫХ ПОКРЫТИЙ
Осадки электролитического хрома обладают чрез-
вычайно мелкой кристаллической структурой. Наименьшие раз-
меры (0,001—0,01 мкм) имеют кристаллы блестящего хрома,
размеры кристаллов матового и молочного хрома 0,1—10 мкм.
Электролитически осажденный хром содержит кислород, во-
дород и незначительное количество азота. Массовая доля кисло-
рода 0,2—0,5, водорода 0,03—0,07. Объем газов, включенных
в осадок, зависит от температуры и плотности тока: при увеличе-
нии температуры и уменьшении плотности тока объем газов
в осадке несколько уменьшается. Термическая обработка после
хромирования приводит к частичному удалению водорода из
покрытия («2/3).
207
Рис. 17.5. Зависимость твердости осадков хрома от температуры и плотности
тока при содержании CrOs 250 г/л, H2SO4 2,5 г/л:
2—10 А/дм*; 2 — 20 А/дм*; 2—50 А/дм*; 4 — 100 А/дм*; 5 — 500 А/дм»
Рис. 17.6. Изменение твердости хромового покрытия при термообработке в те-
чение 1 ч
Известны две основные структурные модификации электро-
осажденного хрома: а-Сг с кубической объемно-центрированной
плотностью 7,1 г/см3 и р-Сг с плотноупакованной гексагональной
плотностью 6,08 г/см3.
При высоких плотностях тока и повышенной температуре
электролита образуется преимущественно кубическая структура
а-Сг, при низких плотностях тока и комнатной температуре —
в основном гексагональная структура £-Сг. Эта структура устой-
чива при температуре ниже 25 °C. При более выских она переходит
в стабильную a-форму, давая усадку и образуя сеть трещин.
Особенностями строения осадков хрома обусловлены их спе-
цифические свойства.
Хромовые покрытия отличаются очень высокой твердостью.
Твердость кубического хрома значительно выше твердости гекса-
гонального. Твердость определяется режимом электролиза: плот-
ностью тока и температурой (рис. 17.5). Нагрев хромового покры-
тия уменьшает его твердость (рис. 17.6).
Осадкам хрома свойственны высокие внутренние напряжения.
Причина возникновения этих напряжений — самопроизвольный
переход нестабильного Р-Сг в стабильный а-Сг, имеющий более
высокую плотность. В. результате в осадках образуется сетка
трещин. При повышении температуры электролита внутренние
напряжения уменьшаются и число трещин сокращается.
В результате растрескивания под влиянием внутренних на-
пряжений в хромовых покрытиях возникает пористость в виде
сетки трещин. Появление пористости начинается по достижении
определенной толщины покрытий (табл. 17.3). На пористость
хрома основное влияние оказывают температуры электролита
и соотношение между СгО3 и H2SO4.
Наиболее износостойкие покрытия получают при режимах
электролиза, обеспечивающих получение покрытий на границе
областей осаждения блестящих и молочных покрытий. Йзносо-
208
17.3. Максимальная толщина беспористого хромового покрытия
в зависимости от режима электролиза
t, °C iK, А/дм* Максимальная толщина беспо- рнстого покры- тия. мм t, °C /к, А/дм* Максимальная толщина беспо- ристого покры- тия, мм
1 16 2,5 ( 30 30
1 30 1,5 55 { 40 10
f 10 1,2 ( 64 14
50 { 30 3 65 80 1,5
(. 64 4
стойкость покрытий, полученных из универсального электролита,
возрастает при повышении температуры и, пройдя через макси-
мум при 55—65 °C, снижается до минимума при 75 °C. Для осад-
ков, получаемых из разбавленного электролита, максимум изно-
состойкости смещается в область более высоких температур. На
рис. 17.7 приведены области режимов осаждения хрома высокой
твердости и повышенной износостойкости.
Пластичность электролитического хрома существенно зависит
от режима хромирования. Хрупкие осадки хрома (блестящие и
матовые) получаются при низких температурах электролита и вы-
соких плотностях тока, более пластичные покрытия — при высо-
ких температурах и низких плотностях тока (молочные осадки).
Наводороживание стали при хромировании происходит из-за
того, что одновременно с выделением хрома на покрываемой де-
тали происходит выделение водорода, причем на этот процесс
тратится большая часть тока.
Наводороживание стальной основы отрицательно влияет на
ее физико-механические свойства. Наиболее активно водород
внедряется в металл в начальный период, когда еще не образо-
вался сплошной слой хрома.
25 35 45 55 65 t;C
Рис. 17.7. Области получения твердых (Т) и износостойких (И)
хромовых покрытий прн концентрации CrOs 150 г/л (я) и
________________________ 250 г/л (б)
Наибольшее влияние на наводороживание оказывает темпе-
ратура. При повышении температуры от 55 до 75 °C масса погло-
щенного водорода увеличивается в 6—10 раз.
§ 17.5. ЭЛЕКТРОЛИТЫ ХРОМИРОВАНИЯ
Сульфатные электролиты. Все электролиты хромирова-
ния содержат хромовые кислоты Н2СгО4 и Н2Сг2О7 и активные
добавки SO4“, Fe-, SiFf” и соединения трехвалентного хрома.
Сульфатные электролиты содержат два основных компонента:
хромовый ангидрид СгО3 (150—350 г/л) и серную кислоту H2SO4
(1,5—3,5 г/л). Для получения покрытий хорошего качества отно-
шение СгО3 : H2SO4 должно поддерживаться постоянным на уровне
около 100. Характеристика сульфатных электролитов приведена
в табл. 17.4.
Увеличение концентрации серной кислоты приводит к отло-
жению мелкозернистых блестящих осадков, уменьшение — к полу-
чению серых недоброкачественных. В обоих случаях выход хрома
по току снижается. Выход хрома по току при увеличении содержа-
ния хромового ангидрида снижается (рис. 17.8).
Особенно велико влияние на нормальную работу хромовых
электролитов двух факторов: плотности тока и температуры. Оба
фактора находятся в тесной взаимозависимости и с изменением
одного требуется изменять другой. При увеличении температуры
электролита снижается выход хрома по току (рис. 17.9), умень-
шается рабочий интервал, повышается испарение электролита и,
следовательно, надо повысить плотность тока. Наряду с этим при
17.4. Характеристика сульфатных электролитов хромирования
Тип электро- лита Концентрация компонентов, г/л Режим работы Техническая характеристика
СгО, H,S04 1К’ А/дм* t, °C
Разбав- ленный 150—175 1,5—1,75 45—100 55—65 Выход по току 13—15 %. Рассеивающая способность наиболее высока. Твердость осадков высокая. Состав элек- тролита в процессе работы ме- няется быстро
Стан- дартный 220—250 2,2—2,5 15—60 45—55 Выход по току 12—14%. Рассеивающая способность средняя. Рабочий интервал широкий. Состав электролита меняется медленно
Концен- триро- ванный 275—300 2,75—3,0 10—30 35—45 Выход по току 8—10%. Рассеивающая способность низкая. Электролит стабилен. Рабочий интервал широкий
210
Рис. 17.8. Влияние содержания хромового ангидрида на выход хрома по току
при плотностях тока 120 А/дм2 (/); 45 А/дм2 (2) и 15 А/дм2 (3)
Рис. 17.9. Влияние температуры на выход хрома по току при плотностях тока
85 А/дм2 (/); 45 А/дм2 (2); 22 А/дм2 (3); 10 А/дм2 (4); 5 А/дм2 (5)
повышении температуры понижается и твердость хромовых осад-
ков.
Влияние плотности тока на выход хрома по току при отноше-
нии СгО3 : H2SO4 = 100 : 1 представлено на рис. 17.10. Для
каждой температуры хромирования существует определенный
минимум плотности тока, ниже которого прекращается выделение
металлического хрома. Чем выше температура хромирования,
тем выше нижний предел плотности тока. Рассеивающая способ-
ность электролитов несколько улучшается с увеличением плот-
ности тока.
Увеличение содержания трехвалентного хрома повышает вяз-
кость растворов и снижает электропроводность. Сужается интер-
вал плотностей тока, при которых получаются блестящие осадки.
С увеличением концентрации трехвалентного хрома (15—20 г/л)
осадки становятся хрупкими, а при значительной концентрации
трехвалентного хрома получаются темные осадки, как и при не-
достаточном содержании сульфатов или при низких температурах.
Примеси железа в хромовых электролитах действуют примерно
так же, как и примеси трехвалентного хрома. Присутствие азот-
ной кислоты вредно влияет на работу хромовых ванн.
Изменяя режим электролиза, можно получить разные типы
осадков хрома (см. рис. 17.1), различающиеся по своим свойствам,
а следовательно, областью применения (табл. 17.5).
Осаждение серых матовых осадков (см. рис. 17.1, область 7)
происходит при низких температурах электролиза (35 °C) и любой
плотности тока. Осадки хрупкие и имеют плохое сцепление с основ-
ной. Блестящие осадки (см. рис. 17.1, область 77) получаются
при средних температурах электролита в широком диапазоне
плотностей тока. Осадки молочного хрома (см. рис. 17.1, об-
ласть 777) получают при высоких температурах и плотностях
тока 25—30 А/дм2.
211
Рис. 17.10. Влияние плотности
тока иа выход хрома по току при
температуре 55 °C и концентрации
СгО3, равной 150 г/л (/); 250 г/л
(2); 350 г/л (3)
растворимых солей стронция.
17.5. Режимы осаждения хромовых
покрытий различного назначения
Тип хромового покрытия Режим работы
t, °C i„. А/дм*
Износостойкое 55—58 80—100
Твердое 45—50 100—120
Противокорро- зионное 60—65 20—40
Защитное 58—60 60—70
Для стабилизации электролита
по содержанию аниона SO4- пред-
ложено вводить его в виде трудно-
Избыток сульфата стронция, на-
ходящийся в осадке, длительное время поддерживает требуемую
концентрацию сульфат-аниона в растворе, поэтому такие электро-
литы называются саморегулирующимися.
В табл. 17.6 приведен режим работы саморегулирующегося
электролита в зависимости от вида хромового покрытия и способа
хромирования. Электролит содержит 140—170 г/л СгО3 и 6—
8 г/л SrSO4.
Для преотвращения уноса электролита с пузырьками выде-
ляющихся газов используют преператы хромин (2—3 г/л) и хро-
моксан (0,15 г/л), понижающие поверхностное натяжение элек-
тролита. Для этой же цели рекомендуется применять специальные
поплавки в виде шариков из полиэтилена, полистирола и других
полиимидных материалов.
Фторидные электролиты. Эти электролиты содержат анионы F-,
SiFg- и имеют следующие преимущества перед сульфатными элек-
тролитами: возможность работы при комнатной температуре;
лучшую рассеивающую и кроющую способность; меньшую крити-
ческую плотность тока, т. е. возможность вести осаждение хрома
при очень низкой (0,5—2 А/дм2) плотности тока; более высокий
выход по току.
Низкая температура электролита позволяет вести осаждение
хрома в колоколах и барабанах. Рекомендуемый состав электро-
17.6. Режим работы саморегулирующегося электролита хромирования
Вид хромового покрытия Температура, °C Плотность тока, А/дм*
Деталь
на подвесках насыпью
Матовое 35—45 50—80 15—25
Молочное 65—75 20—40 40—60
Блестящее 55—65 60—80 До 20
212
Рис. 17.11. Влияние температуры сульфатнокрем-
иефторидного электролита на выход хрома по току
при плотностях тока 100 А/дм2 (/); 60 А/дм2 (2);
50 А/дм2 (3); 30 А/дм2 (4); 20 А/дм2 (5)
лита: 300—400 г/л СгО3 и 8—12 г/л
KF -2Н2О. Температура 20—30 °C, iK =
= 10 А/дм2.
Недостатками электролитов, содержа-
щих фтор-ионы, являются их высокая
агрессивность и образование на анодах
пленки фторида свинца, обладающей высо-
ким электрическим сопротивлением. В свя-
зи с этим применяются свинцовые аноды,
содержащие сурьму или олово.
Осадки хрома, полученные из фторидных электролитов, имеют
более низкую твердость и более высокую пластичность, чем полу-
ченные из сульфатного электролита. Осадки блестящие.
Сульфатно-кремнефторидные электролиты. В электролитах,
содержащих одновременно ионы SO1* и SiF^, увеличивается
интервал рабочих температур и плотностей тока, при которых
образуются блестящие осадки. Рассеивающая способность этих
электролитов увеличивается, а при некоторых режимах электро-
лиза возрастает также производительность хромовой ванны.
Важной особенностью этих электролитов является стабиль-
ность состава, которую обеспечивает введение этих анионов в виде
труднорастворимых солей.
Оптимальные состав, г/л, и режим работы электролита:
CrOs...................... 250—300
SrSO4....................5,5—6,5
K2SiFe..................... 18—20
t, °C................. 55-65
«к, А/дм2...............40—100
ВТ, % 17—18
Принципы действия этих электролитов — автоматическое под-
держание постоянного соотношения между концентрациями СгОз
и постороннего аниона, которое обеспечивается, если трудно-
растворимые соли вводят в избытке.
Выход хрома по току увеличивается при повышении концен-
трации компонентов. Изменение температуры при рабочих плот-
ностях тока (50—100 А/дм2) и рабочих температурах мало влияет
на выход по току, но при малых плотностях тока увеличение
температуры способствует его резкому снижению (рис. 17.11).
Недостатком этих электролитов является их высокая агрессив-
ность в отношении свинца. Аноды для этих ванн делают из сплава
свинца с 5—10 % олова.
Для уменьшения агрессивности электролитов уменьшают
в электролите концентрацию кремнефторида. Для этой цели ре-
комендуются специальные добавки, разработанные Днепропетров-
ским химико-технологическим институтом: ДХТИ-10, ДХТИ-11,
.ДХТИ-хром-11 и ДХТИ-50. Эти добавки делают электролит
213
17.7. Состав (г/л) электролитов хромирования с добавками ДХТИ
и режим работы
Компоненты электролита Концентрация, г/л Режим осаждения Тип покрытия
iK. А/дм1 t, °C
СгО3 320—350 10—50 45—55 Блестящее твердое
ДХТИ-10 6—8 10—50 45—55 » »
СгО3 250—200 6—60 42—55 » »
ДХТИ-11 5—6 6—60 42—55
СгО3 280—350 5—80 40—55 » >
ДХТИ-хром-11 5—7 5—80 40—55 » »
СгОз 400—500 3—60 20—38 Черное
ДХТИ-50 3—60 20—38 »
саморегулирующимся, расширяют рабочий интервал плотности
тока и снижают агрессивность электролита. Характеристики этих
электролитов приведены в табл. 17.7. Рассеивающая и кроющая
способность этих электролитов выше, чем сульфатных.
Проведенные Л. Я. Богорадом с сотрудниками исследования
показали возможность снижения концентрации кремнефторида
при введении в электролит металлического кадмия. При этом
получают хромовые покрытия из электролита состава, г/л:
СгО3 .
HaSO4
NaaSiFe
180—200
0,8—1,1
4,5—5,5
Na2CraO2 .........
Сфиет............
25—35
13—17
Они имеют низкие внутренние напряжения и применяются для
покрытия деталей, работающих в условиях повышенной агрес-
сивности. В зависимости от режима электролиза получают разные
типы хромовых покрытий (табл. 17.8).
Тетрахроматный электролит отличается от обычных тем, что
хромовая кислота нейтрализуется щелочью и хром находится
в растворе в виде тетрахромата натрия Na2Cr4O13. Этот электро-
лит предназначен исключительно для получения защитно-деко-
ративных покрытий.
Тетрахроматный электролит применяют при комнатной тем-
пературе. Осадки получаются серыми, но весьма пластичными.
17.8. Режимы работы
хромфторкадмиевого электролита
Тип покрытия Режим работы Катод- ный вы- ход по току, %
*’к- А/дм1 it °C
Блестящее Молочное 45—60 20—25 58—62 68—72 20—24 10—12
Они легко полируются до зер-
кального блеска. Электролиты
неагрессивны и позволяют на-
носить хром непосредственно
на латунь и цинковые сплавы.
Покрытия, полученные из
тетрахроматного электролита,
практически беспористы. Они
рекомендуются взамен трех-
слойных Си—Ni—Сг защитно-
214
Рис. 17.12. Влияние концентрации серной кислоты на выход хрома по току
в тетрахроматном электролите, содержащем 400 г/л СгО3> 60 г/л NaOH, 0,8 г/л
сахара (iK = 50 А/дм2; t = 20 °C)
Рис. 17.13. Влияние концентрации едкого натра на выход хрома по току в те-
трахроматном электролите
декоративных покрытий. Толщина такого однослойного покры-
тия должна быть не менее 20 мкм.
Рекомендуемые состав электролита (г/л) и режим работы сле-
дующие:
СгО3 ................... 350—400 I, °C...................
HaSO4..................2,5—3,0 iK, А/дм2...............
NaOH.....................40—60
15—24
10—60
Концентрация Сг®+ в электролите должна составлять 10—
15 г/л. Для образования Сг3+ в электролит добавляют 0,8—1 г/л
сахара или глюкозы или 1—6 г/л перекиси водорода. Вследствие
высокой плотности тока электролит сильно разогревается. Чтобы
избежать разложения тетрахромата, который при температуре,
превышающей 24 °C, неустойчив, электролит следует охлаждать.
При указанной объемной плотности тока электролит нагревается
в незначительной степени. В качестве анодов служат свинцовые
пластины или сплав свинца с сурьмой.
Преимущества тетрахроматного электролита следующие: воз-
можность повторного осаждения хрома без снятия старого хрома;
возможность ступенчатого хромирования больших деталей, кото-
рые не помещаются в ванне; безопасность перерывов в подаче
электрического тока в тетрахроматную ванну. К недостаткам
тетрахроматных электролитов следует отнести серо-матовый цвет
покрытий и невысокую твердость.
Выход по току составляет примерно 30 %, поэтому скорость
осаждения хрома составляет около 1 мкм/мин. При низких плот-
ностях тока (10—25 А/дм2) осадки мягкие, легко полирующиеся;
при высоких (40—80 А/дм2) — более твердые, с небольшими
внутренними напряжениями. Осадки из тетрахроматных электро-
литов обладают практически такой же пористостью, как и «мо-
лочный» хром из обычных ванн. Внутренние напряжения, возника-
ющие в покрытии, намного ниже, чем при хромировании из обыч-
ных электролитов. Рассеивающая способность этого электролита
215
Рис. 17.14. Влияние температуры на выход хрома по току в тетрахроматном
электролите, содержащем 380 г/л СгО3, 56 г/л NaOH, 2 г/л HaSO4, 1 г/л сахара
при iK= 50 А/дм2
Рис. 17.15. Влияние плотности тока на выход по току в тетрахроматном элек-
тролите, содержащем 400 г/л СгО3, 60 г/л NaOH, 2 г/л HaSO4, 1 г/л сахара при
t = 20 °C
выше. В. И. Лайнер, учитывая физико-химические свойства
тетрахроматных электролитов, считает, что следует говорить
об их хорошей кроющей способности, однако он отмечает, что
рассеивающая способность этих электролитов низкая.
Зависимость выхода по току от концентрации серной кислоты
приведена на рис. 17.12, а от концентрации едкого натра — на
рис. 17.13. При концентрации серной кислоты 2—2,5 r/л полу-
чаются легко полирующиеся осадки хрома, при увеличении кон-
центрации кислоты на кромках деталей появляются блестящие
полосы и покрытие становится хрупким, при снижении концентра-
ции — выход по току резко падает. При отсутствии серной кис-
лоты на катоде осаждается черный налет. Оптимальное содержа-
ние едкого натра составляет 40—60 r/л, при концентрации ниже
40 г/л снижается выход по току, при концентрации выше 60 г/л
увеличивается хрупкость'и появляются блестящие полосы.
С повышением температуры резко снижается выход по току,
пониженная температура вызывает осаждение покрытия серого
17. 9. Органические добавки, используемые при хромировании
Электролит Компоненты электролита Концентрация, г/л
Стандартный Метиленовый голубой Галловая кислота Сульфаниламид, сульфатиазол 1—5 0,5—3 7—10
Саморегулирующийся Смесь сульфатов, спиртов и оксикислот Натриевая соль пиридинсульфо- новой кислоты 5 50
216
цвета, с трудом поддающегося полировке (рис. 17.14). С увеличе-
нием плотности тока выход по току возрастает (рис. 17.15).
Электролиты хромирования с добавками органических соеди-
нений позволяют увеличить выход хрома по току и повысить
блеск покрытий. Рассеивающая способность таких электролитов
намного выше. Предполагается, что введение этих добавок стаби-
лизирует работу электролита. В качестве добавок применяют ве-
щества, приведенные в табл. 17.9. Главная трудность использова-
ния этих добавок — полное отсутствие методов аналитического
контроля.
§ 17.6. ЧЕРНОЕ ХРОМИРОВАНИЕ
Черное хромирование применяется для деталей, по-
верхность которых должна обладать низким коэффициентом
отражения света. В связи с низкой коррозионной стойкостью
черного хрома на детали предварительно наносят слой никеля
или хрома требуемой толщины, после чего помещают их в элек-
тролит для черного хромирования. Используемые для этой цели
электролиты не должны содержать серной кислоты. Рекомендуе-
мый состав электролитов приведен в табл. 17.10.
Черные покрытия практически не содержат металлического
хрома. Они представляют собой композицию, в которую входят
оксиды и гидрооксиды Сг8+ и Сг®+, а также гидрид хрома.
Одним из наиболее эффективных электролитов для черного
хромирования является разработанный в СССР электролит мета-
хром, содержащий 450 г/л СгО3 и две специальные добавки:
А (3 г/л) и Б (30 г/л), оптимальная температура электролиза
20—30 °C, плотность тока 15 А/дм8. Метахром обладает высокой
стабильностью.
17.10. Состав (г/л) электролитов черного хромирования
и режим работы
Компоненты электролита и режим работы Номер электролита Компоненты электролита и режим работы Номер электролита
1 2 1
СгОз 50—400 300—350 Ва(СН3СОО)а g у
Cr(NO3)3-9H3O 3—7 — Н3ВО3 8—20 12—15
NaNOs — 7—10 Л °C 10—30 15—25
A1F3 2—5 — iK, А/дм2 15—30 20—75
217
§ 17.7. ИНТЕНСИФИКАЦИЯ ПРОЦЕССА
ХРОМИРОВАНИЯ
Для повышения скорости процесса можно не только
менять состав электролита и режим электролиза, но и применять
интенсивное перемешивание прикатодного слоя электролита для
снятия диффузионных ограничений. Перемешивание осуществ-
ляется движением электролита вдоль хромируемой поверхности
(в проточном электролите), наложением ультразвукового поля.
Ускорения процесса можно достигнуть реверсированием постоян-
ного тока, применением импульсного тока. Перемешивание элек-
тролита в прикатодном слое ускоряет диффузию ионов хрома, что
позволяет получить некоторое увеличение выхода хрома по току.
Однако это влияние проявляется только при турбулентном дви-
жении электролита, а турбулентность тем легче возникает, чем
больше расстояние между анодом и катодом и чем больше скорость
протекания электролита.
Хромирование в проточном электролите производят при по-
мощи специальных установок, обеспечивающих принудительную
подачу электролита в пространство между анодом и катодом.
При проточном хромировании рекомендуется применять элек-
тролит с повышенной концентрацией серной кислоты (3,5—7 г/л)
и 200—300 г/л СгО3.
Расстояние между покрываемой поверхностью и анодом может
быть от 3—5 до 10—15 мм. В табл. 17.11 приведена скорость
осаждения хрома в проточном электролите в зависимости от
условий электролиза.
При высокой концентрации СгО3 (280—300 г/л) плотность
тока можно увеличить до 300—400 А/дм2 и соответственно уве-
личится скорость осаждения хрома до 250—300 мкм/ч. Хромиро-
вание с протоком электролита хорошо зарекомендовало себя при
нанесении покрытий на внутренние поверхности цилиндрических
деталей.
При анодно-струйном хромировании струя электролита на-
правлена перпендикулярно к хромируемой поверхности, при этом
достигается более интенсивное перемешивание. Практически это
осуществляется использованием анодов в виде сопл, направля-
ющих струи электролита на покрываемую поверхность. Аноды
17.11. Скорость осаждения хрома в проточном электролите
Скорость протока электроли- та, см/с Режим электролиза Скорость осаждения, мкм/ч Скорость протока электроли- та, см/с Режим электролиза Скорость осаждения, мкм/ч
А/дм1 t, °C А/дм1 /, °C
8—15 55 75 50 60 48—52 68—74 100—120 85 НО 60 65 78—86 97—107
100 65 87—93 150 65 120—140
218
изготовляют с круглыми или щелевидными отверстиями, распре-
деленными по всей поверхности. Электролит, подаваемый в по-
лость анода насосом, направляется на поверхность детали через
указанные отверстия в аноде.
Хромирование в ультразвуковом поле способствует интен-
сивному перемешиванию электролита в прикатодном слое и поз-
воляет повысить применяемые плотности тока до 200 А/дм2. Важ-
ный эффект хромирования в ультразвуковом поле заключается
в возможности непосредственного хромирования алюминиевых
и титановых сплавов.
Нестационарные режимы электролиза (реверсивный и импульс-
ный ток, программное изменение режима электролиза) рекомен-
дуются для интенсификации процесса и улучшения физико-меха-
нических свойств осадков.
Хромирование реверсивным током позволяет увеличивать ка-
тодную плотность тока до 120 А/дм2 и получать малопористые
осадки хрома повышенной износостойкости с низкими внутрен-
ними напряжениями, без опасности получения покрытий с ден-
дритами.
В электролите обычного состава при температуре 50—60 °C
рекомендуют применять следующие длительности анодного и ка-
тодного периодов: тк = 14-5 мин, та = 14-5 с. Полученные при
этом осадки обладают высокой износостойкостью и коррозионной
стойкостью. Они имеют блестящий или матово-молочный вид.
Механизм действия реверсирования тока можно представить
следующим образом. Во время анодного периода происходит анод-
ное растворение активных центров кристаллизации и выступаю-
щих над поверхностью шишкообразований и происходит сглажи-
вание поверхности. Гладкие покрытия могут быть получены тол-
17.12. Условия получения многослойных хромовых покрытий
Назначение покрытия Т ип хромового покрытия Электролит Режим работы
t, °C 'к. А/дм1
Износостойкое и коррозионно-стойкое Молочный беспори- стый толщиной 20— 30 мкм Блестящий износо- стойкий толщиной 20— 50 мкм Сульфат- ный То же 70 50—55 25—30 45—55
Защитно-декора- тивное мерительно- го инструмента Матово-шероховатый беспористый Молочно-блестящий толщиной 5—10 мкм Тетра- хроматный Сульфат- ный 15—25 48—52 25—30 15—20
219
щиной до 0,3 мм. Для получения беспористого покрытия процесс
ведут при ти = 1 мин и та = 1 с.
Хромирование импульсным током производят при плотности
тока до 200—250 А/дм2 и температуре 60—70 °C в стандартном
электролите. Продолжительность импульса 1—2 с, паузы 0,2—
0,5 с. Применение этого режима позволяет уменьшить наводоро-
живание сталей и повысить производительность хромирования
в 2 раза.
Для получения осадков хрома, сочетающих в себе положитель-
ные свойства различных его видов, применяют многослойное хро-
мирование (табл. 17.12), производимое из разных электролитов
или при разных условиях осаждения.
§ 17.8. ПОРИСТОЕ ХРОМИРОВАНИЕ
Хромированная поверхность плохо смачивается жидко-
стями. Для улучшения смачивания хромированных поверхностей
и создания условий, способствующих хорошему удержанию сма-
зочных материалов, рекомендуется применять пористое хромиро-
вание. При пористом хромировании получаются износостойкие
покрытия, поверхность которых испещрена каналами и порами,
достаточно широкими для проникновения в них масла.
Сущность получения пористого хрома заключается в анодном
травлении слоя блестящего хрома, имеющего сетку тончайших
трещин. Растворение хрома протекает в основном по граням тре-
щин, вследствие чего они расширяются и образуется пористость
канальчатого типа. Каналы пористого хрома обладают капилляр-
ными свойствами, что обеспечивает смачивание поверхности хрома
маслом.
Разновидностью пористого хрома является точечный хром, ко-
торый представляет собой осадок с множеством углублений в виде
мельчайших пор или раковин, в которых хорошо удерживаются
смазочные материалы.
Покрытия из пористого хрома состоят из двух слоев: нижнего
плотного и верхнего пористого. Пористый слой составляет при-
мерно 1/3 от общей толщины хрома. Рекомендуется наносить плот-
ный слой хрома при высокой плотности тока: iK = 804-200 А/дм2
и температуре 65—75 °C. Для получения пористости канальчатого
типа хромирование ведут при плотности тока 60 А/дм2 и темпе-
ратуре 60—65 °C. Пористость точечного типа образуется при плот-
ности тока 50 А/дм2 и температуре 50—52 °C. Повышение темпе-
ратуры или плотности тока приводит к образованию резкой сетки
каналов и увеличению ширины и глубины самих каналов. Одно-
временное увеличение катодной плотности тока и температуры
электролита создает условия для образования широких каналов.
Для выявления сетки трещин проводят анодное травление (де-
хромирование) . Анодное травление для получения пористой струк-
туры производится в электролите такого же состава, который
220
применяется для хромирования. Травление осуществляют при
плотности тока 50—55 А/дм2 в течение нескольких минут. При
увеличении времени травления канальчатая пористость перехо-
дит в точечную и до известных пределов увеличивается глубина
пор.
Режим анодного травления также играет важную роль в созда-
нии пористости. Так, повышение анодной плотности тока приводит
к увеличению ширины и глубины каналов. Повышение темпера-
туры способствует уменьшению ширины каналов и увеличению их
густоты.
При увеличении продолжительности травления от 2,5 до 10 мин
сетка и ширина трещин достигают такой степени, что процент
пористости увеличивается примерно в 2 раза. При дальнейшем
травлении площадки хрома, окруженные со всех сторон каналами,
постепенно уменьшаются, и в конечном итоге на поверхности могут
остаться почти одни трещины.
Точных установившихся предпосылок для выбора типа пори-
стости в настоящее время не существует. Обычно для поршневых
колец рекомендуют выбирать точечную пористость, а для поверх-
ности цилиндров — пористость канальчатого типа с редкой сеткой
глубоких каналов.
Существует несколько вариантов схем технологического про-
цесса пористого хромирования. При первом варианте травление
выполняют сразу после хромирования, т. е. до механической об-
работки. Указанный вариант удобен тем, что не требуется точно
выдерживать размеры деталей при хромировании. К тому же об-
разующиеся при хромировании дендриты, неровности, наплывы
и т. д. сошлифовываются при механической обработке.
По второму варианту механическая обработка предшествует
анодному травлению. В этом случае нет необходимости наращи-
вать толщину хромовых покрытий, поверхность их получается
более гладкой и быстрее прирабатывается.
После анодного травления детали промывают, сушат и прогре-
вают в течение 1,5—2 ч при температуре 150—180 °C для устра-
нения хрупкости и деформации.
§ 17.9. ПРИГОТОВЛЕНИЕ И ЭКСПЛУАТАЦИЯ
ЭЛЕКТРОЛИТОВ ХРОМИРОВАНИЯ
Сульфатные электролиты приготовляют растворением
хромового ангидрида в конденсате или дистиллированной воде.
Растворимость хромового ангидрида в воде следующая:
; /, °C................... 0 20 40 60 80 100
PCrOj, г/л............ 617 625 634 645 658 677
Раствор хромовой кислоты тщательно перемешивают и дают
отстояться в течение суток.
221
Обычно технический хромовый ангидрид содержит достаточную
примесь сульфатов, поэтому серную кислоту вносят после ана-
лиза раствора хромовой кислоты.
Медные или латунные детали при хромировании во избежание
растравливания следует опускать в электролит под током. Перед
погружением в электролит детали необходимо прогреть в горячей
воде.
Стальные и железные детали прогревают непосредственно в хро-
мовой ванне или ванне для анодной активации. Перед началом
хромирования анодную активацию рекомендуется выполнить в
хромовом электролите в течение 0,5—3 мин. В начале хромирова-
ния нужен «толчок» тока, т. е. процесс необходимо вести в течение
0,5—1,0 мин при плотности тока, превышающей нормальную
в 2—3 раза. При осаждении хрома на хромовый слой необходимо
после «обратного» тока продолжительностью до 0,5 мин начать
хромирование при пониженной плотности тока, которую в тече-
ние 3—5 мин требуется довести до нормы.
Чугунные детали перед хромированием обезжиривают только
химически и тщательно протирают опилками или венской известью.
При хромировании деталей из коррозионно-стойкой стали анод-
ное активирование либо не применяют, либо применяют в течение
очень непродолжительного времени. В начале хромирования ре-
комендуется на 1—-2 мин дать «толчок» током, сила которого в 2—3
раза превышает нормальный. После этого детали хромируют по
обычной схеме.
Никелированные детали следует хромировать непосредственно
после извлечения из никелевой ванны, подвергнув их лишь ак-
тивации и промывке. Даже после недлительного хранения детали
хромируются с трудом.
Электрополированные детали рекомендуется погрузить на ко-
роткое время в 3—5 %-ный раствор соляной кислоты.
Хромировать детали, изготовленные из деформируемых алю-
миниевых сплавов, рекомендуется после двойной цинкатной об-
работки. Иногда рекомендуют перед хромированием выполнить
цинкатную обработку, нанести слой никеля толщиной 15—20 мкм
и провести термообработку при 220—250 °C в течение 30 мин.
Детали из литейных алюминиевых сплавов после обезжирива-
ния и травления можно без дополнительной обработки подвергать
хромированию.
Детали из магниевых сплавов рекомендуется хромировать после
контактного осаждения цинка из пирофосфатного раствора и мед-
нения в цианидном растворе до получения слоя толщиной в 3—
5 мкм.
Детали из титановых сплавов перед хромированием обезжи-
ривают органическими растворителями, подвергают травлению
в смеси азотной и плавиковой кислот, а затем — анодному трав-
лению в растворе, содержащем 0,06 масс, доли плавиковой кис-
лоты, 0,06 масс, доли фторида цинка, 0,88 масс, доли этиленгли-
222
коля. Сцепление хрома с титаном улучшается в результате термо-
обработки в течение 2 мин при 800 °C.
Азотированные стальные детали могут подвергаться хромиро-
ванию после удаления поверхностного, наиболее богатого нитри-
дами слоя.
Саморегулирующиеся электролиты приготовляют растворе-
нием необходимого количества хромового ангидрида и определе-
нием содержания СгОз и SO4". Избыток сульфатов нейтрализуют
карбонатом стронция. После введения всех солей по рецептуре
электролит нагревают до 60—70 °C и тщательно перемешивают.
Нагревание продолжается 16—18 ч. Перед пуском в эксплуатацию
электролит прорабатывают постоянным током при рабочей темпе-
ратуре в течение 2—3 ч.
Для приготовления тетрахроматного электролита вначале рас-
творяют хромовый ангидрид и определяют в растворе содержание
сульфатов. Раствор едкого натра осторожно приливают к раствору
хромового ангидрида. В охлажденный раствор вводят недостающее
количество серной кислоты.
Для корректирования хромовых электролитов приготавливают
концентрированный раствор хромового ангидрида. При корректи-
ровании саморегулирующегося электролита по хромовому ан-
гидриду нужно одновременно вводить карбонат стронция для пе-
ревода сульфатов в осадок. Корректирование электролита по
SrSO4 и K2SiFe производят, когда площадь поверхности отхроми-
рованных деталей составит примерно 1 м2 на 1 л электролита.
При этом в ванну вводят 1 г SrSO4 и 6 г K2SiF6.
При накоплении в электролите больших количеств трехвалент-
ного хрома раствор прорабатывают постоянным током. Аноды из-
готовляют из свинца, в качестве катодов применяют железные
стержни. Анодная плотность тока 1—1,5 А/дм2, катодная должна
быть больше.
ГЛАВА 18. ПОКРЫТИЕ БЛАГОРОДНЫМИ
И РЕДКИМИ МЕТАЛЛАМИ
§ 18.1. СЕРЕБРЕНИЕ
Физико-химические свойства серебра и область приме-
нения серебряных покрытий. Серебро — мягкий, пластичный
металл. Электрохимический эквивалент 4,025 г/(А-ч). Микротвер-
дость покрытий 883—1370 МПа. Удельное электрическое сопро-
тивление при 18 °C составляет 1,6-10~8 Ом-м. Серебряные покры-
тия имеют высокую электро- и теплопроводность, а также отра-
жательную способность. Выдерживает гибку, развальцовку, но
плохо переносит запрессовку.
223
18.1. Толщина серебряных покрытий в зависимости
от назначения и условий эксплуатации деталей
Назначение покрытия Условное обозначение Толщина покрытия (мкм) для группы условий эксплуатации
1 2-4 5, 6 7, 8
Углеродистая, низко- и среднелегированная сталь
Снижение переходно- го сопротивления М.Ср 9; 3 24; 9 30 ; 9 —
Повышение электри- ческой проводимости, снижение переходного сопротивления; защит- ное Ср 3 6 9 12
То же; защитное (до температуры менее 400 °C) Н.Ср 9; 3 9; 6 9; 9 9; 12
То же; защитное Ср.Пд 3; 2 6; 2 6; 2 12; 3
Повышение износо- стойкости, сохранение постоянства электриче- ских параметров Ср; Ср.Пд 3; 2 6; 2 6; 3 12; 3
Снижение переходно- го сопротивления, со- хранение постоянства электрических параме- тров, повышение корро- зионной стойкости н от- ражательной способно- сти Ср.Зл 6; 3 9; 3 12; 3 15; 3
Алюминий и его сплавы
Повышение электри- ческой проводимости, под пайку с подслоем: меди, никеля химического нике- ля, меди М.Н.Ср Хим.Н.М.Ср 6; 9; 6 9; 6; 6 — — —
Титан и его сплавы
Повышение электри- ческой проводимости, под пайку: без подслоя с подслоем химиче- ского никеля, меди с подслоем меди Ср Хнм.Н.М.Ср М.Ср 3 3; 3; 6 3; 6 3 3; 3; 6 3; 6 3 3; 3; 6 3; 6 3 3; .3; 6 3; 6
224
Серебро устойчиво в растворах щелочей и во многих органиче-
ских кислотах. Концентрированная H2SO4 растворяет его лишь
при кипячении, a HNO3 — при нагревании. При действии хлора,
аммиака и серосодержащих соединений на поверхности серебра
появляется пленка, повышающая переходное сопротивление и
затрудняющая пайку.
Физико-химические свойства серебра определяют область при-
менения покрытий, несмотря на его дефицитность и высокую стои-
мость. Покрытия применяют для повышения отражательной спо-
собности светотехнических и оптических изделий (фар, зеркал,
рефлекторов и т. п.), для снижения переходного сопротивления
у контактных деталей, для повышения коррозионной стойкости
изделий, работающих в агрессивных средах, например в щелоч-
ных растворах. Серебряные покрытия широко применяются в ка-
честве декоративных в ювелирном деле, а также при изготовлении
значков, медалей и т. п.
Толщина серебряных покрытий в зависимости от назначения
и условий эксплуатации приведена в табл. 18.1.
Для электрохимического серебрения применяются исключи-
тельно растворы комплексных солей, так как в растворах простых
солей серебро вытесняется химически менее благородными метал-
лами, в результате чего образуются рыхлые и неплотные осадки.
Наибольшее распространение получили цианидные электро-
литы, осаждение из которых сопровождается значительной катод-
ной поляризацией. Как заменители токсичных цианидных элек-
тролитов разработаны гексацианоферратные (II), йодидные, ро-
данидные, пирофосфатные и другие электролиты.
Цианидные электролиты серебрения. Основными компонентами
цианидных электролитов являются комплексная серебряная соль
серебра AgCN-nKCN (п = 2 4-4 в зависимости от концентрации
свободного цианида) и свободный цианид (KCN или NaCN).
Образование цианидных солей серебра происходит в резуль-
тате взаимодействия простой соли серебра и цианида калия. При
их смешивании образуется белый творожистый осадок цианида
серебра
AgNOs + KCN = AgCN + KNOS,
который легко растворяется в избытке цианида с образованием
комплексной соли,
AgCN + KCN = KAg(CN)2.
Образовавшиеся комплексы серебра диссоциируют по уравнению
Ag(CN)j Ag+ + 2CN-.
Константа нестойкости этого комплекса
К ___ [Ag+1 [CN~]a _ о i q_22
Лн [Ag(CN).J- н;за к
8 Дасояи М. А. в др.
225
18.2. Зависимость потенциала серебра от концентрации
свободного цианида (В. И. Лайнер)
Концентрация серебра в виде цианидного комплекса, г/л Концентрация свободного цианида, г/л BAg. в
27 +0,150
27 1,6 —0,217
27 16,0 —0,369
очень мала, концентрация простых катионов серебра Ag+ также
мала. Выделение серебра на катоде происходит непосредственно
из комплексных анионов в результате разряда ионов серебра
Ag(CN)2 Ч~ ё — Ag + 2С№.
Чем больше концентрация свободного KCN, тем больше ка-
тодная поляризация, мельче кристаллы, равномернее распределе-
ние тока на катоде, но тем ниже предельная плотность тока, при
которой получаются хорошие покрытия. С увеличением концен-
трации свободного цианида область потенциалов, в которой полу-
чаются гладкие осадки серебра, расширяется. Зависимость по-
тенциала серебра от концентрации свободного цианида приведена
в табл. 18.2.
Из таблицы видно, что при отсутствии или малом содержании
свободного цианида большинство металлов (медь и ее сплавы)
вытесняют серебро из раствора, в результате чего сцепление покры-
тия с основой будет непрочным. Лишь в электролитах с большим
содержанием цианида можно получать прочное сцепление серебра
с основой. Для такого предварительного серебрения применяют
электролиты, имеющие очень малое содержание серебра (0,9—
2,7 г/л) и большой избыток (70—100 г/л) свободного цианида ка-
лия. Серебрение в таком растворе ведут при повышенной плотности
тока (8—12 А/дм2) при температуре 18—30 °C в течение 20—40 с.
Аноды — нерастворимые.
Качество осадков улучшается после тщательной очистки рас-
творов от примесей. Качество осадков зависит также от природы
катиона щелочного металла. В электролитах, приготовленных на
основе солей калия, хорошие осадки получают в присутствии ио-
нов NO3, без специальной очистки электролита. Калиевые соли
предпочтительнее, так как по сравнению с натриевыми они лучше
растворяются и поэтому их растворы имеют большую электриче-
скую проводимость, что позволяет применять более высокие плот-
ности тока. Осадки, полученные из электролитов на основе ка-
лиевых солей, обладают лучшими физическими свойствами.
Цианидный электролит для серебрения содержит также неко-
торое количество карбонатов, вводимых искусственно или обра-
зующихся вследствие поглощения углекислоты воздуха и гидро-
226
18.3. Составы (г/л) цшанидных электролитов серебрения
и режимы работы
Компоненты электролита и режим работы Номер электролита
1 2
KAg(CN)2 (в пересчете на серебро) KCN . К2СОа Селен металлургический Этамон ДС Диспергатор НФ марки Б (в пересчете на сухое вещество) Плотность тока /к, А/дм2 Температура t, °C 20—30 20—40 20—30 0,3—1,5 18—30 35—40 140—160 0,03—0,05 0,4 0,08—0,125 1,0—1,5 18—30
лиза цианида калия. Для образования блестящих серебряных осад-
ков наибольшее применение получили органические вещества, со-
держащие серу: 1,5—2 мл/л сероуглерода, 0,5 г/л гипосульфита,
0,2 г/л тиомочевины. Вводят также селен и другие добавки. Полу-
чению блестящих электролитических осадков серебра способствует
также электролиз с реверсированием тока. Образующиеся при
этом осадки имеют более мелкокристаллическую структуру по
сравнению с осадками, полученными из обычных ванн.
Повышение температуры и перемешивание ведут к снижению
катодной поляризации. Следовательно, при наличии этих факто-
ров допустимая плотность тока может быть повышена.
В табл. 18.3 приведены составы цианидных электролитов се-
ребрения.
Электролит 1 предназначен для наращивания слоя серебра
до заданной толщины после предварительного серебрения. В элек-
тролите 2 получают блестящие серебряные покрытия.
Серебряные покрытия, полученные из обычных электролитов,
не отличаются достаточной твердостью. Н. П. Федотьев и его со-
трудники разработали электролит, позволяющий повысить твер-
дость покрытия в полтора раза, а износоустойчивость — почти
в три раза. Состав (г/л) и режим работы этого электролита следую-
щие:
KAg(CN)2 (в пересчете на ме-
талл) ......................... 30
KsCofCNJe (в пересчете на ме-
талл) .......................... 1
KCN....................... 20
К2СО9..................... 30
iK, А/дм2..............0,8—1,0
t, °C.................... 18—30
Ускорить процесс серебрения, а также уменьшить вредность
электролита можно заменой свободного цианида калия роданидом
калия при следующем режиме работы:
KAg(CN)2 (в пересчете на pH................... 9—10
серебро)................ 40—50 Аноды из серебра, % . . 99,95—99,98
KCNS.................... 200—250
8*
227
К2СОя.................... 20-40
iK, А/дм2.................. 1—2
t, °C..................... 18—30
Аноды для предваритель-
ного серебрения .... Никель
или графит
! Исходными компонентами для приготовления цианидных элек-
тролитов серебрения являются нитрат серебра и цианид калия.
Расчетное количество этих компонентов растворяют в обессолен-
ной воде. Затем в раствор цианида калия вводят при перемешива-
нии раствор нитрата серебра. Все операции с солями серебра сле-
дует производить в затемненном помещении. Корректирование
электролита заключается в поддержании определенной концен-
трации цианида калия. Для приготовления электролита 2 произ-
водят химическую очистку раствора цианида калия раствором
пероксида водорода и активированным углем. Селен растворяют
отдельно в растворе цианида калия.
Нецианидные электролиты серебрения,. Эта группа электроли-
тов применяется для замены вредных цианидных электролитов.
В настоящее время разработаны и получили распространение:
гексацианоферратный (II), сульфитный, йодидный, роданидный
и пирофосфатный электролиты.
Гексацианоферратный (II) электролит, обеспечивает получе-
ние мелкокристаллических матовых покрытий, стабилен в работе
и обладает высокой рассеивающей способностью. Катодный про-
цесс протекает при значительной поляризации, поэтому осадки
получаются мелкозернистые. Роданид калия, который входит в со-
став электролита, предотвращает пассивацию анодов и позволяет
вести процесс с высоким анодным выходом по току.
Рекомендуются следующие состав электролита (г/л)
работы:
AgNO3 (в пересчете на се-
ребро) ...................25—30
KCNS ......................120—150
К2СО3 ......................25—30
и режим
50—80
0,3—0,5
18—30
1 : 1—2 : 1
K4Fe(CN)e-3H2O (свобод-
ный) . . . ।.............
/и, А/дм2 . ।............
t, °C . . . <............
Sa : ...........
Для приготовления электролита к раствору нитрата серебра
приливают раствор K<Fe(CN)6. После образования белого осадка
гексацианоферрата (II) серебра добавляют раствор К2СО3 и на-
гревают до кипения. При появлении коричневой окраски в рас-
твор медленно при перемешивании добавляют 30 %-ный пероксид
водорода из расчета 50—60 см3/л и кипятят в течение 1,0—1,5 ч.
В процессе кипячения образуется комплекс серебра. Выпавший
при этом осадок Fe(OH)s отфильтровывают, промывают горячей
водой и проверяют на отсутствие серебра. В фильтрат добавляют
раствор роданида калия и доводят объем до требуемого.
В состав сульфитного электролита входит комплексная соль
серебра NaAgSOs в количестве от 25 до 100 г/л. Осаждение се-
ребра ведется при температуре 15—25 °C и плотности тока 0,2—
0,3 А/дм2 без перемешивания либо с механическим перемешиванием
электролита или покачиванием деталей при плотности тока до
228
1,5 А/дм2. Аноды — из серебра. Выход металла по току составляет
100 %. Электролит обладает ^высокой рассеивающей способностью
и позволяет получать легко полируемые мелкокристаллические
осадки.
Для приготовления сульфитного электролита к насыщенному
раствору сульфита натрия добавляют расчетное количество ни-
трата серебра. При этом образуется сульфит серебра
Na2SO8 + 2AgNOs = Ag2SO8 + 2NaNOs,
который затем растворяется в избытке сульфита с образованием
комплексной соли серебра, т. е. готового для эксплуатации суль-
фитного электролита:
Ag2SO8 + NaaSOs = 2NaAgSOs.
Значительно реже применяются йодидные электролиты. При
растворении AgCl или Ag2SO4 в концентрированном растворе KJ
образуется комплексная соль K2AgJ8. Йодид калия для правиль-
ной работы ванны приливают в избытке. К- П. Баташов с сотруд-
никами предлагают йодидные электролиты 1 и 2 следующего со-
става (г/л) при режиме работы:
№ 1 № 2 № 1 № 2
AgCl............... 27 60 iK, А/дм2 .... 0,1—0,2 2,5—3,0
KJ................ 400 450 t, °C............... 25 60
Желатин .... 1—2 1—2
Вместр желатина можно вводить 40—50 г/л полиэтиленполи-
амина.
' Рассеивающая способность этих электролитов ниже, чем гекса-
цианоферратных (II) электролитов. Йодидные электролиты устой-
чивы в работе, неагрессивны по отношению к неметаллическим
основам и позволяют получать плотные и мелкокристаллические
осадки. Серебряные осадки имеют слегка желтоватый оттенок,
для устранения которого их рекомендуется промывать после се-
ребрения сначала в 20 % -ном растворе йодида калия, а затем в воде.
Серебро образует также растворимые комплексы с роданидами
щелочных металлов. Для серебрения предложен роданидный элек-
тролит следующего состава (г/л) при режиме работы:
AgNO3 (в пересчете на се-
ребро) ....................25—30
KCNS ......................300
Препарат ОС-20.......... 5—10
iK, А/дм2...............0,5—1,0
t, °C..................... 18—30
Электролиз производится с серебряными анодами и требует
предварительного серебрения изделий. Электролит находит при-
менение при покрытии медных проводников радиоаппаратуры, а
также для металлизации картона, текстолита, керамики и прочих
материалов, неустойчивых в щелочных средах.
Пирофосфатный электролит, разработанный для серебрения
деталей сложной конфигурации, имеет следующие состав (г/л)
и режим работы:
229
AgNOs (в пересчете на се-
ребро) ................. 36—38
К4Р2О,.................. 200—250
KCNS.................... 300—350
Na2SOs .................... 1—5
Смачиватель СВ-104п . , . 0,6—0,8
tK, А/дм8...............0,5—2,0
Л °C...................... 18—50
pH .....................8,0—8,7
Покрытия — блестящие.
Серебрение без внешнего источника тока. Химический способ
серебрения основан на восстановлении ионов серебра из цианид-
ного раствора каким-либо восстановителем. Для серебрения кон-
тактным способом необходим контакт поверхности покрываемой
детали с более отрицательным металлом, например с алюминием
или магнием. Приведем составы растворов серебрения без внеш-
него источника тока (г/л) при режиме работы:
Химический способ
Контактный способ
KAg(CN)2 (в пересчете
на серебро).......... 1,2—2,4
KCN....................... 6—12
Гидразинборан .... 1—2
Л °C..................... 40—50
pH..................... 10,2—10,5
AgNOs (в пересчете на се-
ребро) .................. 10—15
K4Fe(CN)e-3H2O (свобод-
ный) ....................25—30
KjjCOs...................... 10—20
t, °C......................50-60
pH ......................6,5—7,5
Дополнительная обработка серебряных покрытий. Посеребрен-
ные изделия так же, как и металлическое серебро, под действием
сернистых соединений покрываются тонкой пленкой сульфида
серебра и тускнеют. Толщина этой пленки ничтожно мала и не
превышает 0,07 мкм, однако появление ее нежелательно, так как
покрытие теряет декоративный вид. Для защиты посеребренных
изделий от потускнения поверхность их в зависимости от условий
эксплуатации может быть покрыта либо тонкой пленкой бесцвет-
ного лака, либо тонкой металлической пленкой из цинка, кадмия,
хрома или родия. Хорошие результаты дает химическое пассиви-
рование серебра в растворе ингибитора И-1-Е с концентрацией
50—60 г/л при температуре 50—60 °C в течение 5—10 мин. Сере-
бряное покрытие, обработанное таким образом, сохраняет паяе-
мость и хороший внешний вид после длительного хранения. При-
меняют также хроматирование серебряных покрытий в растворе
би хромата калия 30—50 г/л и гидроксида калия 30—50 г/л при
температуре 15—30 °C в течение 5—10 мин. Обработку можно про-
водить током плотностью 1—3 А/дм2 со свинцовыми анодами. До-
пускается обрабатывать детали без внешнего источника с алюми-
ниевой гальванопарой.
Извлечение серебра из отработанных электролитов. Извлече-
ние серебра из цианидных и гесацианоферратных (II) электроли-
тов производят электролизом с нерастворимыми анодами до кон-
центрации 1,5—2,0 г/л серебра в растворе. Оставшееся серебро
извлекают методом внутреннего электролиза с электродами из
алюминия марки А-7 и коррозионно-стойкой стали, замкнутых
230
накоротко. Серебро осаждается на стальных пластинах и контактно
выделяется на алюминии.
Другим способом является осаждение серебра в виде AgCl
при помощи НС1 и последующим растворением осадка HNO3.
Можно извлекать серебро при помощи цинковой (алюминие-
вой) пыли, так как цинк вытесняет серебро из растворов. Полу-
ченный при этом осадок обрабатывают нагретой соляной кислотой
для перевода непрореагировавшего цинка в растворимую соль.
В случае использования алюминиевого порошка обработку произ-
водят едким натром.
Наиболее целесообразен метод, основанный на экстрагирова-
нии серебра 0,5 М раствором четвертичных аммониевых оснований
в тетрахлорэтилене с небольшими добавками децилового спирта.
Реэкстракцию серебра проводят раствором KCN и КОН, в резуль-
тате чего образуется насыщенный раствор KAg(CN)B.
i § 18.2. ЗОЛОЧЕНИЕ
Физико-химические свойства золота и область приме-
нения золотных покрытий. Золото — мягкий, тягучий и ковкий
металл, отличается очень высокой химической стойкостью. Кис-
лоты, щелочи, сероводород и другие сернистые соединения не ока-
зывают на него заметного действия. На воздухе золото не окис-
ляется и не тускнеет. Оно растворяется в царской водке и в смеси
соляной и хромовой кислот, а также в водных растворах цианид-
ных соединений.
Физико-химические свойства золота: плотность 19,3 г/см3; атом-
ная масса 197,20; стандартный потенциал трехвалентного золота
£au/aip+ = + 1,50 В, одновалентного Eau/au+ = + 1,691 В; элек-
трохимические эквиваленты 2,45 и 7,357 г/(А-ч) соответственно;
удельное электрическое сопротивление 2,25-10-8 Ом-м.
Золотые покрытия применяют для защиты от коррозии изде-
лий, лабораторного оборудования, медицинского оборудования,
для обеспечения постоянного низкого переходного сопротивления
контактов в электронной технике, для других специальных целей
и в ювелирной промышленности. Толщина золотых покрытий,
например ювелирных изделий, колеблется от 0,25 до 3 мкм, для
других целей — от 3 до 6 мкм (табл. 18.4). Золочению подверга-
ются детали из меди и ее сплавов.
Золотые покрытия являются катодными, т. е. для защиты основ-
ного металла от коррозии они должны быть практически беспори-
стыми. Пористость покрытий зависит от толщины слоя и от харак-
тера основы или подслоя. Золото легко уплотняется, приобретая
при этом блестящий вид. Для этого золотые покрытия галтуют или
уплотняют при помощи полировальников из кровавика. Недо-
статками этих покрытий являются их низкая твердость и изно-
соустойчивость. Для улучшения этих свойств, а также внешнего
вида в электролиты золочения добавляют различные металлы,
в частности кобальт и никель.
231
A. '
-&> 18.4. Толщина золотых покрытий (мкм) в зависимости
, от назначения и условий эксплуатации изделий
Назначение покрытия Условное обозначение Толщина покрытия (мкм) для группы условий эксплуатации
I 2—4 5, 6 7, 8
Снижение переходного Зл 3 3 6 6
сопротивления, повыше- ние износостойкости, отра- жательной способности, со- хранение постоянства элек- трических параметров Снижение переходного сопротивления, сохранение электрических параме- тров, повышение коррози- онной стойкости и отража- тельной способности с под- слоем: из серебра Ср.Зл 6; 3 9; 3 12; 3 15; 3
» никеля Н.Зл 9; 3 — — —
Цианидные электролиты золочения. Электрохимическое оса-
ждение золота ведут из комплексных цианидных электролитов.
Цианидные электролиты бывают щелочные, нейтральные, кислые.
Щелочные цианидные электролиты содержат золото в виде
комплексного одновалентного цианида KAu(CN)2 и свободный
цианид калия, который предотвращает выпадение цианида золота,
увеличивает электрическую проводимость электролита и способ-
ствует активации анодов; pH электролитов 11—12. Так как кон-
станта нестойкости комплекса KAu(CN)2 очень мала (Ан « 5 X
X 10-39), то равновесный потенциал золота в цианидном электро-
лите значительно смещен в сторону отрицательных значений
(рис. 18.1) и это исключает опасность осаждения контактного слоя
при золочении. Высокая катодная поляризация обусловливает
мелкозернистую структуру осадков.
Рекомендуемый цианидный щелочной электролит золочения
(г/л) и режим работы следующие:
те KAu(CN)2 (в пересчете на золото). . 4—10
s KCN (свободный)................... 10—20
»к, А/дм2 (при /= 184-30 °C) . . . 0,1—0,3
iK, А/дм2 (при t— 454-55 °C) . . . 0,2—0,5
в t, °C...................................... 18—30
pH......................................... 11—12
v Аноды...................................... Сталь 12Х18Н9Т
/ илн золото марки Зл 999,9
•г
Чем больше концентрация и температура электролита, тем
выше допустимая плотность тока и выход металла по току. Цианид
должен быть в виде калиевой соли, так как цианиднонатриевая
232
осадков большой чистоты, так как при большой концентрации KCN
примеси неблагородных металлов совместно с золотом не осажда-
ются.
Нейтральные цианидные электролиты содержат золото в виде
одновалентного комплекса KAu(CN)2 и свободный цианид в очень
небольшом количестве (1—2 г/л). pH электролитов 6,5—7,5.
Кислотность электролита поддерживается фосфорной кислотой.
Эти электролиты используются в основном для получения покры-
тий большой толщины, но малой чистоты, так как при низком со-
держании свободного цианида одновременно с осаждением золота
происходит осаждение неблагородных металлов. Работа произво-
дится с нерастворимыми анодами. Выход по току в этих электро-
литах близок к 100 %; осадки золота из этих электролитов по-
лучаются более гладкими, чем из щелочных. Выделение золота
происходит в результате непосредственного восстановления ци-
аноауратного комплекса
Au(CN)i + ё — Au + 2CN".
Выход по току всегда меньше 100 %, так как из-за отрицатель-
ного потенциала одновременно с выделением золота происходит
выделение водорода. С увеличением плотности тока выход по току
резко падает (рис. 18.2). Повышение температуры и перемеши-
вание способствуют увеличению выхода по току. Накопление кар-
бонатов не оказывает существенного влияния на процесс золо-
чения. Применяется электролит следующего состава при режиме
работы:
KAu(CN)a (в пересчете на
золото) ................ 8—12
Кислота лимонная .... 18—-20
Калия цитрат............. 40—50
КН2РО4-ЗН2О................ 35
T12SO4.............
«к, А/дм2...........
Г, °C..............
pH ................
Аноды..............
0,0007—0,0008
0,5—1,0
60—80
6,5—7,5 й
Платинирован-
ный титан
Рекомендуются перемешивание и непрерывная фильтрация
электролита. Недостатком нейтральных электролитов является
их нестабильность.
233
Рис. 18.2. Зависимость выхода по току от плот-
ности тока в электролите, состоящем из
2,05 г/л Au, 15 г/л KCN (своб.), 15 г/л
Na2HPO4-12 Н2О прн температуре 70°C:
1 — с перемешиванием; 2 — без перемешивания
Кислые цианидные электролиты со-
держат цианидный комплекс золота
KAu(CN)2 и добавку органических кис-
лот (лимонной, винной), которая под-
держивает pH электролита от 4 до 6.
электролитах отсутствует. Выделение зо-
Свободный цианид в этих
лота на катоде происходит так же, как и из щелочных электролитов,
в результате непосредственного восстановления цианоауратного
комплекса. Катодная поляризация в кислых электролитах меньше,
чем в щелочных (см. рис. 18.1), поэтому рассеивающая способность
также меньше. Выход металла по току уменьшается с увеличением
плотности тока, уменьшением температуры (рис. 18.3) и уменьше-
нием pH электролита (рис. 18.4).
Рекомендуются следующие составы цианидных электролитов
(г/л) и режим работы:
KAu(CN)2 (в пересчете на золото) . . ,
Кислота лимонная....................
Калия цитрат........................
CoS04-7H2O........................
Л °C................................
рн .................................
X, МИН..............................
Аноды ... .... ...
Ns 1 Ns 2
8—12 1,5—2,0
50—140 —
- 45—50
— 0,3—0,4
20—60 20—30
4,5—6,0 4,0—4,5
0,3—0,5 1—2
Платинированный титан
Рис. 18.3. Влияние температуры на выход золота по току в цианидном электро-
лите при концентрации 10—12 г/л Au и плотности тока (А/дм2):
1 — 0,15; 2 — 0,3; 3 — 0,5; 4 — 1,0
Л
Рис. 18.4. Влияние pH на выход золота по току в электролите при плотности
тока (А/дм2):
/ — 0,15; 2 — 0,7 - <-'>
234
В электролите 1 необходимо перемешивание качанием катод-
ных штанг. Электролит 2 применяют для предварительного золо-
чения перед нанесением сплавов золота на медь и ее сплавы, мед-
ные и никелевые покрытия. В электролите 1 можно также золо-
тить проволоку при протягивании ее через ванну при плотности
тока 5—6 А/дм2 и температуре 60—80 °C.
Нецианидные электролиты. Из нецианидных электролитов
золочения был исследован гексацианоферратный (II). Гексациано-
ферратный (II) электролит в некоторых случаях применяется
вместо ядовитых цианидных электролитов, хотя по качеству по-
лучаемых осадков, по рассеивающей способности, выходу по току
он уступает цианидным.
Аноды в указанных электролитах больше подвержены пасси-
вации, и для нормального режима электролиза поверхность ано-
дов должна быть в несколько раз больше поверхности покрывае-
мых изделий. Электролит из-за малой скорости растворения ано-
дов отличается нестабильностью и нуждается в частом корректи-
ровании солями золота. Скорость осаждения золота из гексациано-
ферратного (II) электролита почти в три раза меньше, так как
золото в нем находится в виде ионов Аи3+, а не в виде Аи+, как
в цианидном электролите. Несмотря на эти технологические не-
достатки, гексацианоферратные (II) электролиты для золочения
находят некоторое практическое применение благодаря тому, что
они не ядовиты; покрытия из них удовлетворительны по качеству.
Состав применяемого гексацианоферратного (II) электролита,
(г/л) и режим работы следующие:
АиС13-НС1-4Н2О (в пересчете
на металл).................
K4Fe(CN)e-3H2O.............
КаСОз .....................
KCNS....................
4 iK, А/дм2..................
200 t, °C......................
65 pH ........................
100
0,2—0,3
32—62
11—12
Цианидные щелочные электролиты приготавливают растворе-
нием KCN и дицианоаурата калия в обессоленной воде. Раствор
выливают в рабочую ванну, доливают водой до нужного уровня и
перемешивают.
Кислый цианидный электролит готовят следующим образом.
Лимонную кислоту и цитрат калия растворяют в воде и доводят pH
раствора до 3,4—4,2 20 %-ным раствором гидроксида калия. За-
тем вводят раствор дицианоаурата калия, доливают раствор до
рабочего уровня, замеряют pH и корректируют его лимонной кис-
лотой или 15 %-ным раствором ортофосфорной кислоты.
Для приготовления гексацианоферратного (II) электролита
нагревают растворы гексацианоферрата (И) калия, карбоната ка-
лия, сливают их вместе и продолжают нагревать до кипения, затем
прибавляют необходимое количество хлорида или гремучего зо-
лота и кипятят в течение 10—15 мин (в случае прибавления гре-
мучего золота раствор кипятят до исчезновения запаха аммиака).
После охлаждения раствор разбавляют дистиллированной водой
235
18.5. Составы растворов (г/л) и режимы работы
при золочении методом погружения
Компоненты раствора и режим работы Номер раствора
1 2 3
AllClg 0,4 3,5 1,5
КНСОз 150 —, 100
NaCl — 2 —
Na2SOs - 30 —
K4Fe(CN)e-3H2O — 3 —
t, °C 70—80 70—80 70—80
т, мин 3—5 5—10 5—10
и фильтруют. Электролит корректируют добавками K$Fe(CN)e
и АиС13 по данным анализа.
Золочение без внешнего источника тока. Золочение методом
погружения основано на создании разности потенциалов на гра-
нице поверхность покрываемого изделия — раствор. Качествен-
ные осадки золота удается получить на латунных деталях. По-
этому при золочении деталей из других металлов их рекомендуется
предварительно латунировать. Толщина слоя золота, полученного
этим методом, обычно не превышает 0,1 мкм, однако осадки отли-
чаются. высокой плотностью. Растворы, рекомендуемые для золо-
чения методом погружения, приведены в табл. 18.5.
Для химического золочения можно рекомендовать следующие
состав электролита (г/л) и режим работы:
KAu(CN)2 (в пересчете на Боргидрид натрия .... 3,5—17,0
золото) ..............1,4—5,5 t, С...................55—90
KCN....................6,5—13,0 pH .................... 12—13
КОН .................... 6—16
Извлечение золота из отработанных электролитов. Существует
несколько способов извлечения золота из отработанных растворов.
Из цианидных электролитов золото может быть осаждено цинко-
вой пылью или алюминиевым порошком. Выпавший осадок обра-
батывают соляной кислотой для перевода в раствор избытка цинка,
а затем азотной кислотой для удаления примесей серебра и меди.
Промытый золотой порошок растворяют в царской водке для при-
готовления хлорида золота.
По другому способу цианидный электролит сначала разрушают
избытком серной кислоты, а затем золото извлекают из электро-
лита цинковым порошком или стружкой, как указано выше.
Извлечение золота считается полным, если цинковый стержень,
погруженный в раствор, не покроется темным налетом.
Извлечение золота из отработанных электролитов может про-
изводиться путем предварительной обработки этих электролитов
10 %-ным раствором каустической соды. Раствор после добавления
236
щелочи подогревают до 60°, после чего производится осаждение
золота с помощью алюминия. Полноту осаждения проверяют по
сохранению блеска контрольной алюминиевой полоски. Безвоз-
вратные потери золота при применении указанного метода не пре-
вышают 0,012—0,022 % от об(цего количества золота, содержа-
щегося в отработанных электроплитах.
Наконец, извлечение золоту из отработанных электролитов,
и особенно из промывных вод, \может быть осуществлено посред-
ством ионообменных смол (нагаример, анионитных смол марок
Н-0, МН, ЭД-10П, АМ-1). Используются высокие адсорбционные
способности этих смол по отношению к катионам и коллоидным
частицам благородных металлов!
Золото можно извлекать методом экстракции органическими
растворами, в частности раствором следующего состава:
Тиалкиламин, мл/л ....-.!.............. 9
•s' Дециловый спирт, мл/л ... 1............... 20
Лерхлорэтилен, мл.......1..............До 1000
Реэкстракция производится раствором КОН (3 %-ным).
§ 18,3. ИОДИРОВАНИЕ I
Физико-химические свойства родия и область приме-
нения родиевых покрытий. Родий —1металл белого цвета с розо-
ватым оттенком. Родий обладает следующими физико-химическими
свойствами: плотность 12,4 г/см3; атомная масса 102,91; валент-
ность 1 и 3; стандартный потенциал -к-0,68 В; электрохимический
эквивалент 1,28 г/(А-ч); удельное электрическое сопротивление
4,3-10~8 Ом-м; температура плавления 1966 °C.
Родий отличается высокой химической устойчивостью в раство-
рах кислот (азотной, соляной), щелочей и сернистых соединений.
В отличие от платины родий не поддается действию царской водки.
Родий растворяется в концентрированной серной кислоте, в рас-
плавленном бисульфате калия и в расплавленной поваренной соли
в присутствии хлора.
Несмотря на высокую стоимость, родий находит некоторое при-
менение в гальваностегии. Главными особенностями родиевых
покрытий, обусловивших их распространение, являются высокая
отражательная способность и большая твердость, а также хоро-
шее сопротивление механическому изнашиванию.
Коэффициент отражения родиевых покрытий достигает 75 %
и уступает лишь коэффициенту отражения серебряных покрытий.
Отражательная способность родия в отличие от отражательной
способности серебра не изменяется от воздействия сульфидов.
Твердость родиевых покрытий уступает лишй твердости электро-
литического хрома. Родиевые покрытия стабильно сохраняют
электрические параметры.
Родиевые покрытия применяются для получения отражающих
поверхностей в оптических приборах, а также'для защиты сереб-
\ 237
Рис. 18.5. Катодные поляризационные кривые осаждения родия. Концентра-
ция серной кислоты 32,3 г/л, температура 20 °C. Концентрация родия (г/л):
1 — 9,10; 2 4,59; 3 — 2,35
Рис. 18.6. Влияние плотности тока на выход родия по току. Концентрация
серной кислоты 26,4 мл/л, температура 50 °C. Концентрация родия (г/л):
1 — 7.9; 2 — 5,7; 3 — 3.7; 4 — 2,1
I
I
ряных покрытий от потускнения и для повышения их износоустой-
чивости.
Электролиты для родирования. Для электролитического роди-
рования применяются сульфатные или фосфатные электролиты.
Сульфатные электролиты стабильны в работе, легко регенери-
руются и обеспечивают получение покрытий большой толщины.
Сульфатные электролиты дают возможность получать покрытия
с высокой отражательной способностью, но толщина покрытий не
превышает 1 мкм. В покрытиях большей толщины сначала обра-
зуются трещины, а затем происходит отслаивание покрытия от
основы. /
Сульфатные электролиты приготавливают из соли родия и
серной кислоты. Осаждение родия сопровождается значительной
катодной поляризацией (рис. 18.5). Применяются следующие со-
ставы электролитов (г/л) при режиме работы:
№ 1 №2
[Rh(H2O)x]2(SO4)s (в пересчете на родий). . . 3—8 3—10
H2SO4 ...................................... 30—80 30—100
Кислота сульфаминовая ........................ — 10—30
«к, А/дм2.................................0,4—1,2 1—6
t, °C....................................... 15—30 15—30
Электролит 1 применяют для получения покрытий толщиной
до 3 мкм. В электролит 2 добавлена сульфаминовая кислота для
снижения внутренних напряжений и предотвращения образова-
ния трещин. Этот электролит применяют для получения беспо-
ристых малонапряженных покрытий толщиной до 6 мкм. В каче-
стве анодов используют металлический родий или платинирован-
ный титан. Повышение плотности тока приводит к уменьшению
238 Д.
Рис. 18.'7. Влияние плотности тока на отражательную способность осадков ро-
дия при различной концентрации родия, г/л (концентрация H2SO4 50 г/л):
1 — 7, 9; 2 — 5. 7; 3 — 3, 7
Рис. 18.8. Влияние плотности тока на отражательную способность осадков ро-
дия (концентрация Rh 2 г/л) при различной концентрации H2SO4 (г/л):
1 — 7S; 2 — 25; 3 — 15; 4 — 1
выхода родия по току, а увеличение концентрации родия в элек-
тролите — к его повышению (рис. 18.6).
Для родиевых покрытий очень важна подготовка поверхности
под покрытие. Блестящие покрытия могут быть получены только
на блестящей основе. С повышением плотности тока и температуры
матовость покрытий увеличивается. На отражательную способ-
ность влияет концентрация родия и серной кислоты в электролите.
Повышение концентрации родия снижает коэффициент отражения
осадков (рис. 18.7). С повышением концентрации серной кислоты
в электролите область получения блестящих осадков расширяется
(рис. 18.8).
Электролиты родирования очень чувствительны к примесям,
особенно неблагоприятны для них ионы хлора, примеси циани-
дов, щелочных соединений, органические вещества. Ионы хлора
приводят к получению темных хрупких крупнокристаллических
осадков; примеси цианидов и щелочных соединений приводят
к пассивации отдельных участков металла; органические вещества
увеличивают внутренние напряжения и приводят к растрескива-
нию осадков.
Фосфатные электролиты какгс возможность получать осадки
родия с высокой отражательной способностью. Фосфатный элек-
тролит для родирования имеет следующие состав (г/л) и режим
работы:
KsRhClj (в пересчете на ме-
талл) .......................
Н„РО4 .......................
I, °C........................
и, в ...................
2 iK, А/дм2....................
50 pH .........................
18—25
2,5—6,0
0,15
1,1—1,3
Выход по току родия для фосфатных электролитов весьма
низок. Ванна применяется главным образом для получения бле-
стящих осадков родия. Электролит требует периодического кор-
ректирования хлорродиатом калия или гидроксидом родия.
239
Фосфатный электролит весьма чувствителен к примесям, рри
накоплении их в растворе производят регенерацию электролита
добавлением муравьинокислого натрия при нагревании. Выпав-
ший осадок отфильтровывают, промывают азотной кислотой й вос-
станавливают в токе водорода в трубчатой печи при 700—8(00 °C.
Полученный таким образом металлический родий используется
для приготовления нового электролита.
§ 18.4. ПЛАТИНИРОВАНИЕ I
Физико-химические свойства платины и область приме-
нения платиновых покрытий. Платина — металл серебристо-
белого цвета со следующими физико-химическими свойствами:
плотность 21,5 г/см3; атомная масса 195,23; влажность 2 и 4;
стандартный потенциал перехода платины в четырехвалентное
состояние +0,86 В; электрохимический эквивалент 1,82 г/(А-ч);
температура плавления 1777 °C; удельное электрическое сопро-
тивление 10,6-10~8 Ом-м.
Платина исключительно устойчива против большинства агрес-
сивных сред; при нагревании до высоких температур не окис-
ляется. На платину не действуют расплавленные щелочи, фосфор,
цианидные соединения, сульфиды и галлоиды. В царской водке
платина растворяется гораздо медленнее золота. Сплавы платины
с серебром, свинцом, золотом растворяются в азотной кислоте.
Благодаря высокой химической стойкости платиновых покрытий
они в ряде случаев успешно заменяют платиновые изделия. Пла-
тинирование применяется в ювелирном деле, в приборостроении,
в медицинской технике (для изготовления хирургических инстру-
ментов) и т. п. Во всех этих случаях толщина слоя платины колеб-
лется от 1 до 10 мкм.
Платинирование может быть осуществлено электрохимическим
и контактным способами.
Электролиты платинирования. Одним из наиболее часто при-
меняемых является фосфатный электролит (г/л) при следующем
режиме работы:
H2PtCle...................... 8
(NH4)2HPO4.................. 26
Na2HPO4- 12Н2О............. 120
iK, А/дм2................0,1—0,5
t, °C....................65—70
Выход металла по току, % 15—25
Исследования А. Г. Самарцева и его сотрудников показали, что
выход платины по току несколько возрастает при увеличении кон-
центрации платины и ортофосфорной
кислоты (рис. 18.9) в электролите.
Нитритные электролиты для
платинирования по сравнению с фос-
фатными более устойчивы в работе,
Рис. 18.9. Влияние коицеитрации Н3РО4
в электролите на выход металла по току,
j/ Концентрация Pt 8 г/л, iK = 5 мА/см2,
t = 20 °C
240
имеют лучшую рассеивающую способность, позволяют применять
высокие плотности тока. Осадки даже при незначительной тол-
щине! покрытия стойки против коррозии. Наилучшим является
электролит следующего состава (г/л) при режиме работы:
Pt(NH3L(NO2)2 (в пересчете NH4OH.................50—60
на металл)............... 10 iK, А/дм2............. 8—9
NH4NO3 ............... 100—120 t, °C..................90—100
NaNOa..................10—12
Диаминоплатинонитрит содержит примерно 60 % платины;
растворимость его в воде мала (0,08 г/л при 25 °C и 2,32 г/л при
75 °C), в водном растворе аммиака она сильно возрастает, при
этом содержание металла можно довести до 10 г/л.
Необходимый для составления электролита диаминоплатино-
нитрит получают следующим образом. Водный раствор хлорида
платины (IV) смешивают с 10-кратным объемом нитрита калия при
слабом нагревании. Четырехвалентная платина восстанавливается
в двухвалентную с образованием платинонитрита калия K2lPt X
X (NO3)4). Эта соль при прибавлении 25 %-ного водного раствора
аммиака переходит в Pt(NH3)2(NO2)2 и выпадает в виде объеми-
стой кристаллической массы, которая после очистки употребляется
для составления ванны. Для этого диаминоплатинонитрит раст-
воряют в 5 %-ном водном растворе аммиака и прибавляют к нему
водные растворы остальных компонентов электролита. Получен-
ную смесь перед платинированием кипятят в течение 1—2 ч.
Анодами в ваннах платинирования служит платиновая фольга
или лента.
Контактное платинирование производится в следующем рас-
творе (г/л) при режиме работы:
(NH4)2PtCle............. 40 t, °C.....................70—100
NH4CI .................. 320 т, мин................ . 60
Изделия после покрытия полируют мылом.
Платина из отработанных электролитов и промывных вод улав-
ливается в виде сульфида платины. Для этой цели через отрабо-
танные растворы после подкисления соляной кислотой пропускает-
ся струя сероводорода. Выпавший в осадок сульфид платины от-
фильтровывают, высушивают и прокаливают на воздухе для вос-
становления до металла.
§ 18.5. ПАЛЛАДИРОВАНИЕ
Физико-химические свойства палладия и область при-
менения палладиевых покрытий. Палладий — мягкий и ковкий
металл серебристо-белого цвета; он наиболее дешевый из метал-
лов платиновой группы. Физико-химические свойства палладия:
плотность 12,0 г/см3; атомная масса 106,7; валентность 2 и 4;
стандартный потенциал -|-0,99 В; электрохимический эквива-
лент двухвалентного палладия 1,99 г/(А-ч), четырехвалентного —
241
Рис. 18.10. Зависимость выхода по току Pd в акино-
хлоридных электролитах. Концентрация Р8/(г/л):
1 — 10; 2 — 1 I
1,0г/(А-ч); удельное электрическое со-
противление 10,9• 10~8 Ом-м; температура
плавления 1555 °C.
Палладий растворяется в царской вод-
ке, азотной кислоте и медленно в соляной
кислоте. Палладирование примет ется в
электротехнической промышленности при
изготовлении электротехнических контак-
тов с неизменной электрической проводимостью. В приборо-
строении способом палладирования изготовляются зеркала с вы-
сокой отражательной способностью. Кроме того, палладиро-
вание применяется для защитных и декоративных целей. Толщина
покрытия обычно составляет 0,5—5 мкм.
Палладиевые покрытия наносят непосредственно на медь или
серебро. При покрытии других металлов палладием необходим
подслой меди или серебра. Палладирование производится из
фосфатных, аминохлоридных и сульфаминовых электролитов.
Электролиты палладирования. Для осаждения палладия при-
меняют аминохлоридные, фосфатные и сульфаматные электро-
литы.
Из аминохлоридных электролитов получают матовые (толщи-
ной более 5 мкм) и блестящие (толщиной до 5 мкм) эластичные по-
крытия. Выход по току в этих электролитах уменьшается с увели-
чением плотности тока и уменьшается с уменьшением концентра-
ции палладия в электролите (рис. 18.. 10). Рассеивающая способ-
ность аминохлоридного электролита значительно ниже, чем фос-
фатного.
Фосфатные электролиты обладают большей стабильностью и
меньшей чувствительностью, чем аминохлоридные. Однако эти
электролиты малопроизводительны, из них можно осаждать по-
крытия толщиной не более 2 мкм. Выход по току в фосфатных
электролитах с малой концентрацией палладия резко умень-
шается при увеличении плотности тока, а в электролитах с кон-
центрацией 5—10 г/л Pd изменяется незначительно.
Сульфаматные электролиты позволяют получать плотные полу-
блестящие осадки толщиной до 100 мкм, не содержащие трещин
и прочно сцепленные с основой. Катодный выход по току около
50 % и незначительно возрастает с повышением концентрации
палладия в электролите.
Составы применяемых электролитов палладирования и режимы
работы приведены в табл. 18.6.
Электролит 1 применяют для нанесения покрытий на детали
простой формы, электролиты 2—4 — для деталей сложной формы.
Аноды во всех случаях — нерастворимые, из платинированного
242
118.6. Составы (г/л) электролитов палладирования и режимы работы
Компоненты электролита 1 и режим работы Номер электролита
1 2 3 4
РдС}12 (в пересчете на пал- 20—30 3—20 10—14 15—25
ладнй)
NH4C1 15—20 — 50—80 —.
Na2HPO4-12H2O — 100—130 — —
(NH4)2HPO4 — 15—60 — —
Кислота бензойная -—. 1,5—3,0 -— .—.
NaNO2 — —. 40—80 —
Аммония сульфамат — —. 80—100 —
NH4OH, 25 %-ный водный — — 100—150 150—250
раствор
НС1, плотность 1,19 —- —. —. 10—25
(NH4)2SO4 —. — —, 20—40
Сахарин — — 0,8—1,2
i , А/дм2 0,5—1,5 0,1—0,5 0,5—1,0 1—2
t«, °C 15—30 50—75 60—80 20—30
рн 8,5—9,5 6.5-7,0 6,5—7,5 4,0—4,5
титана, графита или палладия. Соотношение площади анода и ка-
тода 2 : 1 — 3 : 1.
Электролит готовится растворением хлорида (II) палладия
в соляной кислоте. В нагретый до 70—90 °C раствор, постепенно
перемешивая, приливают 25 %-ный раствор аммиака до растворе-
ния кирпично-красного кристаллического осадка. В полученный
желто-зеленый раствор тетрааминохлорида палладия добавляют
хлорид аммония, затем разбавляют водой до требуемого объема.
Приготовленный таким образом электролит после проработки под
током готов к эксплуатации.
Регенерацию электролита производят соляной кислотой. При
этом выпадает желто-оранжевый осадок диаминохлорида палла-
дия. Осадок отфильтровывают, промывают малым количеством
очень холодной воды и снова переводят в тетрааминохлорид пал-
ладия растворением в аммиаке.
§ 18.6. ИНДИРОВАНИЕ
Физико-химические свойства индия и область приме-
нения индиевых покрытий. Индий — металл серебристо-белого
цвета. Плотность индия 7,31 г/см3; атомная масса 114,76; валент-
ность 3; стандартный потенциал — 0,35 В; электрохимический
эквивалент 1,4 г/(А-ч). Он очень пластичен и имеет высокие анти-
фрикционные свойства; твердость его около 40—80 МПа. Недо-
статком индия является его низкая температура плавления —
около 150 °C.
Индий устойчив в атмосферных условиях, в щелочах, мине-
ральных кислотах на холоду (кроме азотной кислоты). Обладает
243
высокой стойкостью в смазочных маслах и продуктах их окисле-
ния, поэтому индиевые покрытия применяют в подшипниках,
работающих на трение в среде смазочных масел. Индирование ис-
пользуется при изготовлении зеркал и рефлекторов, так как (индий
способен равномерно отражать световые волны всех цветов спёктра.
Толщина индиевых покрытий обычно составляет 0,3—3 мим.
Электролиты индирования. Хлоридный электролит, разрабо-
танный А. А. Казаровым и М. А. Лошкаревым, имеет следующие
состав (г/л) и режим работы: 1
InCl3 . . .
NaCl . . .
Желатин .
Тиомочевина
. До 1,5
. 15—25
. 1,5—2,2
iK, А/дм2
t, °C . .
pH . . .
20—40
30—60
2
0,5
Получающиеся осадки плотные, мелкозернистые и равномерные.
Состав (г/л) и режим работы сульфатного электролита следу-
ющие:
In2(SO4)s-9H2O..............50—70
Na2SO4-10H2O............... 10—15
iK, А/дм2................... 1^-2
t,°C................. 15—25
pH................... 2,0—2,7
Аноды..................Индий или
графит
ГЛАВА 19. ХИМИЧЕСКАЯ И ЭЛЕКТРОХИМИЧЕСКАЯ
МЕТАЛЛИЗАЦИЯ ПЛАСТМАСС
§ 19.1. НАЗНАЧЕНИЕ И СПОСОБЫ
В настоящее время детали из пластических масс широко
используются в технике и для изготовления товаров народного
потребления. Металлизация поверхности позволяет расширить
сферу применения пластмассовых деталей, поскольку в этом слу-
чае происходит сочетание полезных свойств металлов и пластмасс.
Пластмассовые детали металлизируют для придания им новых
свойств, таких, как электро- и теплопроводность, способность к
пайке, а также для улучшения внешнего вида. Детали из металли-
зированных пластмасс обычно заменяют детали из цветных и лег-
ких металлов и сплавов. Наиболее широко металлизированные
пластмассы применяют в автомобильной и приборостроительной
промышленности.
Существуют механические, физические и химические способы
металлизации. К механическим способам относятся те, при которых
металлическое покрытие формируется заранее и в готовом виде
наносится на поверхность пластмассы, например обволакивание,
плакирование, горячее тиснение. К физическим способам относят
такие, при которых металл превращается в жидкость или пар и
которые в контакте с поверхностью пластмассы образуют на ней
244
металлическое покрытие: это металлизация в вакууме, напыление
расплавленного металла сжатым воздухом. Вакуумное напыление
применяется для нанесения тонких пленок, толщина которых ко-
леблется от 0,01 до 75 мкм. Процесс проводится в вакуумных ка-
мерах. Для этого покрываемый предмет подвешивается в камере
над тиглем, который разогревается до температуры кипения на-
пыляемого металла. В камере создается вакуум, и пары металла
„оседают на холодных поверхностях предметов, образуя тонкий,
гладкий и плотный слой. Металлизация распылением состоит
в нанесении расплавленного металла на подготовленную поверх-
ность при помощи сжатого газа. Распыленные частицы металла
с большой силой ударяют о поверхность детали и внедряются
в ее неровности. Большим достоинством метода является простота
его осуществления.
К химическим способам относятся способы, при которых метал-
лическое покрытие образуется в результате химической реакции,
происходящей на поверхности пластмассы. Из химических спо-
собов наиболее удобной и доступной является металлизация в рас-
творах. Ионы металла, присутствующие в растворе, осаждаются
на поверхности пластмассы в результате действия восстановителя.
Этот способ позволяет получать равномерные покрытия необхо-
димой толщины. К химическим способам относят и электрохими-
ческую металлизацию.
Электрохимическая металлизация пластмассовых деталей со-
стоит из следующих операций:
1) подготовки поверхности, которая включает механическую
обработку, обезжиривание и травление;
2) получения электропроводящего слоя, которое обеспечивает-
ся сенсибилизированием, активированием и химической металли-
зацией (химическим меднением или никелированием);
3) нанесения собственно электрохимического покрытия — мед-
нения, никелирования, хромирования.
Пластмасса, подвергаемая химической и электрохимической
металлизации, должна обладать определенным сочетанием хими-
ческих свойств: она должна легко травиться и в то же время быть
достаточно химически стойкой во всех растворах, применяемых при
химической металлизации; она не должна разрушаться в них и
в то же время не должна загрязнять эти растворы.
В настоящее время из всех металлизируемых пластмасс более
90 % составляют АБС-пластики (сополимеры акрилонитрила, бу-
тадиена и стирола). Эти пластики удобны для переработки, детали
из них прочны, а поверхность легко подвергается травлению. По-
следнее объясняется тем, что бутадиен в пластмассе присутствует
в виде отдельных равномерно распределенных глобул в жесткой
матрице, созданной акрилонитрилом и стиролом. Бутадиен легче
растворяется в минеральных кислотах, чем остальные компоненты
пластика. Поверхность после травления становится пористой и
обеспечивает хорошую механическую прочность сцепления ме-
245
талла покрытия с основой. Для металлизации применяют также
полипропилен, поликарбонат, полисульфон, фенолформальдегид-
ные и эпоксидные стеклопластики и т. п. ।
§ 19.2. ПОДГОТОВКА ПОВЕРХНОСТИ ПЛАСТМАССЫ
От качества подготовки поверхности зависит качество
металлизированного изделия, которое определяется, в основном,
прочностью сцепления металлического покрытия с пластмассовой
основой. К операциям подготовки поверхности относятся: меха-
ническая подготовка, обезжиривание, травление.
Механическая подготовка проводится с целью получения шеро-
ховатости поверхности. Такую подготовку проводят механическим
шлифованием, крацеванием, сухой или мокрой галтовкой, абра-
зивной или гидроабразивной обработкой. Мелкие детали обраба-
тывают во вращающихся колоколах или барабанах. В качестве
абразива применяют кварцевый песок, наждачный порошок, элек-
трокорунд и т. д. Для удаления остатков абразива детали обдувают
сухим сжатым воздухом.
Обезжиривание проводят для удаления с поверхности деталей
жировых пленок. Обезжиривание проводят органическими раство-
рителями, такими, как фреон-113, трихлорэтилен, ацетон, ксилол,
этиловый спирт, или слабощелочными растворами с добавкой по-
верхностно-активных веществ. При обезжиривании щелочными
растворами можно применять те же средства, которые рекомен-
дуются для обработки металлов. Наиболее часто применяют рас-
творы гидроксидов (100—200 г/л), фосфатов (10—30 г/л) или кар-
бонатов (2—20 г/л), содержащие поверхностно-активные вещества
(синтанол ДТ-7, ДТ-10, смачиватель ДБ и т. д.), а также моющие
средства «Лабомид-101», МС-6, МЛ-51, МЛ-52, «Прогресс» и т. п.
Для оценки чистоты поверхности применяют тест на равномер-
ность смачивания распыляемой водой или на разрыв смачивающей
поверхность водной пленки, остающейся после медленного извле-
чения из дистиллированной воды. Можно использовать тест вос-
становления перманганата калия в кислой среде до оксида мар-
ганца (IV), при этом поверхность окрашивается в бурый цвет; по
равномерности окраски судят о чистоте поверхности.
Травление — это химический процесс, протекающий на поверх-
ности пластмассы, изменяющий ее структурные и физико-химиче-
ские свойства. В результате травления на поверхности образуются
микропоры и микроуглубления, имеющие сложное строение и опре-
деляющие в дальнейшем прочность сцепления металла с пластмас-
сой. По отношению к травлению пластмассы можно делить на лег-
котравимые (обычно это не очень химически стойкие материалы,
так же как АБС-пластики), труднотравимые (химически инертные
материалы, например, фторопласты) и химически малостойкие
(метилметакрилаты, полиамины). Для улучшения травимости и
получения равномерно травленой поверхности пластмассы под-
246
вергают различным операциям предтравления: обработке раство-
рителями, кислотами, щелочами или специальными травителями.
В результате этой обработки поверхностный слой разрыхляется
или снимается. Состав растворов и режим обработки подбираются
экспериментально, в зависимости от природы полимера.
Травление поверхности производят с целью создания шерохо-
ватой поверхности и повышения ее гидрофильности. В качестве
травителей применяют различные кислоты и окислители, в резуль-
тате действия которых происходит изменение структуры и хими-
ческих свойств поверхности. Разные реактивы по-разному воз-
действуют на отдельные компоненты пластмассы. Из окислителей
наиболее широкое применение получили растворы хромовой кис-
лоты, азотная кислота и кислые или щелочные растворы перман-
ганата калия. Из восстановителей применяется раствор металли-
ческого натрия в гидрофуране, нафталине, жидком аммиаке,
дифенилсульфоксиде. Для более мягкого травления в хроматные
растворы вводят фосфорную кислоту, фосфаты, соли металлов,
поверхностно-активные вещества. Процесс травления обычно ха-
рактеризуется скоростью и селективностью — способностью тра-
вить разные компоненты одной и той же пластмассы с разной ско-
ростью.
Контроль качества поверхности пластмасс после травления
производится осмотром. Поверхность должна быть гладкой на
ощупь, слегка матовой и хорошо смачиваться водой. Под микро-
скопом поверхность имеет вид губки. Для металлизации наиболее
подходящей является поверхность со значением шероховатости
Rz да 1 мкм. После травления в хроматных растворах на поверх-
ности остаются ионы Сгв+, которые при активации могут блокиро-
вать катализаторы, наносимые на поверхность. Для удаления
этих ионов проводят нейтрализацию в растворах из NaHSO8 или
Na2S2O5 или соляной кислотой в течение 0,1—1,5 мин при комнат-
ной температуре.
§ 19.3. химическая и электрохимическая
МЕТАЛЛИЗАЦИЯ
Для осаждения металла на поверхность пластмассы ей
нужно придать особые свойства, способствующие этому. Для этого
на поверхности с помощью специального процесса, называемого
активацией, создают каталитические центры, на которых
в дальнейшем начинается осаждение металла. Наиболее простыми
являются химические методы активации. Классический способ
химической активации состоит из двух этапов: 1-й этап — сенси-
билизация (повышение чувствительности); 2-й этап — собственно
активация.
При сенсибилизации поверхность обрабатывают растворами,
повышающими активность поверхности к металлизации, чаще
всего кислыми или щелочными растворами солей двухвалентного
247
олова. При обработке в таких растворах на поверхности пласт-
массы остается хлорид олова, который при последующей промывке
водой в результате гидролиза
SfiCli' 4- Н2О -> Sn(OH)Cl + н+ + зсг
образует малорастворимые соединения олова. Они оседают на
поверхности, образуя слой до нескольких сот нанометров, со-
стоящий из агрегатов соединений олова.
Сенсибилизацию проводят в растворе, содержащем 10—100 г/л
хлорида олова и 80 см3/л соляной кислоты (плотностью 1,19 г/см3).
Обработку проводят при температуре 18—25 °C в течение 0,5—
15 мин. Раствор готовят растворением хлорида олова в концентри-
рованной соляной кислоте с добавлением дистиллированной воды
до нужного объема. Соляная кислота предотвращает гидролиз
хлорида олова и сообщает стабильность раствору. Для предотвра-
щения окисления Sn2+ до Sn4+ в раствор добавляют до 2 г/л ме-
таллического олова. Оно взаимодействует с ионами Sn4+ по реакции:
Sn4+ + Sn -► 2Sn2+
и поддерживает постоянной концентрацию ионов Sn2+.
Детали обрабатываются в указанных растворах, затем их про-
мывают в холодной воде. При этом хлорид олова, оставшийся на
поверхности, подвергается гидролизу с образованием малораство-
римых основных солей олова типа Sn(OH)li5Cl0i5, которые прочно
адсорбируются на поверхности. Если поверхность смачивается
водой полностью, значит, поверхность сенсибилизирована; если
смачивается не полностью, процесс повторяют.
Процесс активации состоит в обработке сенсибилизированной
поверхности растворами соединений каталитически активных ме-
таллов: Pd, Pt, Ag, Au и др. Растворы могут быть кислыми или
щелочными; металл-катализатор может находиться в виде про-
стого или комплексного соединения. На поверхности этот металл
может осаждаться в виде частиц металла или нерастворимого сое-
динения.
Наибольшее распространение получила активация растворами
солей палладия. Активацию проводят путем погружения деталей
в раствор хлорида палладия. При этом на поверхности происхо-
дит реакция восстановления палладия
Pd2+ + Sn2+ -+ Pd + Sn4+.
Образующийся мелкодисперсный палладий является катали-
затором химического восстановления меди или никеля. Для акти-
вирования применяется раствор состава: 0,2—0,5 г/л хлорида
палладия, 1—3 мл/л соляной кислоты (плотность 1,19 г/см3).
Процесс идет при температуре 18—25 °C, время выдержки 2—5 мин.
Раствор готовят растворением необходимого количества хлорида
палладия в дистиллированной воде, подкисленной соляной кисло-
той по рецептуре, и нагревают до 50—80 °C до полного растворе-
248
ния соли палладия. Корректирование раствора на содержание
хлорида палладия производят не реже одного раза в неделю.
Если деталь затем будет подвергаться меднению, то ее можно ак-
тивировать в растворе из 2—5 г/л нитрата серебра, 10—15 мл/л
гидроксида аммония (26 %-ный водный раствор).
Можно применять прямую активацию поверхности в растворах,
содержащих одновременно соли двухвалентного олова и палладия.
При такой активации поверхность пластмассы действует как ионо-
обменник и связывает некоторое количество ионов металла-актива-
тора, которые восстанавливаются до металла в растворе акселе-
рации или химической металлизации. Прямую активацию при-
меняют для пластмасс, легко поддающихся травлению. Для пря-
мой активации ионными растворами чаще всего используют смесь
раствора из 0,5—2 г/л хлорида палладия и 3—10 мл/л соляной
кислоты при температуре 0—6О'°С в течение 3—10 мин; pH рас-
твора 1,8—2,0.
Применяют также коллоидные или совмещенные растворы, по-
лучаемые обычно смешиванием солянокислых растворов PdCl2
и SnCl2. При этом образуются интенсивно окрашенные растворы
координационных соединений PdSnmCl”“. При обработке травле-
ной поверхности пластмасс на ней сорбируются комплексные сое-
динения, оседают коллоидные частицы и продукты гидролиза со-
лей олова. По сравнению с ионными коллоидные растворы обла-
дают большей стабильностью, более сильной активностью, боль-
шей адгезией. Для практического использования рекомендуется
раствор, содержащий (г/л): 0,1—10 PdCl2; 10—100 SnCl2-2H2O;
25—120 НС1КОВД; 100—28 КС1. Время выдержки 3—10 мин при
комнатной температуре.
Для усиления эффективности активации после ионного прямого
активирования или травления — активирования промытые водой
поверхности подвергают акселерации в растворе вос-
становителя (5—15 %-ном растворе гипофосфата натрия) в тече-
ние 2—5 мин. Используют также щелочные растворы борогид-
рида натрия, гидразина, диэтиламиноборана. Акселерация увели-
чивает скорость осаждения металлического покрытия и предохра-
няет растворы химической металлизации от загрязнения актива-
тором и разложения.
Химическая металлизация. Она проводится для получения
первичного слоя металла. Эта операция является определяющей
для всего дальнейшего процесса покрытия. Наиболее часто при-
меняются химическое омеднение и никелирование, хотя в настоящее
время разработаны методы осаждения в виде покрытий и других
металлов, в том числе кобальта, железа, серебра, золота и др.
С помощью этого процесса поверхности пластмассы придают элек-
тропроводящие свойства, что позволяет наносить затем электро-
химические покрытия. Распространение этого метода объясняется
следующими его преимуществами: простотой оборудования;
249
возможностью получения покрытия любой толщины; равномер-
ностью толщины покрытия по всей поверхности. Этим способом
наносят тонкий слой толщиной 0,1—0,3 мкм, обеспечивающий
электропроводность поверхности. Основной слой наносят элек-
трохимическим способом, поскольку скорость электрохимического
процесса больше скорости химического.
Для протекания процесса химического восстановления необ-
ходимо, чтобы в растворе присутствовал активный восстановитель,
а образующийся металл был способен катализировать процесс
восстановления, т. е. реакция восстановления должна носить ав-
токаталически й хар актер.
Растворы химической металлизации должны содержать следую-
щие компоненты: соль металла; восстановитель; лиганды, с кото-
рыми ионы металла образуют растворимые комплексы; буфер-
ные добавки и стабилизаторы. Кроме того, растворы могут со-
держать добавки, изменяющие свойства покрытий, ускоряющие
процесс металлизации и т. п.
Основными технологическими показателями процесса металли-
зации являются следующие.
1. Скорость осаждения покрытия или скорость металлизации.
Скорость эта обычно невелика, составляет 2—5 мкм/ч, со временем
обычно уменьшается. Для растворов никелирования она значи-
тельно выше и может достигать 20—25 мкм/ч.
2. Срок жизни раствора — максимальная продолжительность
его использования. Он определяется либо началом восстановления
металла в объеме раствора, либо накоплением в растворе продук-
тов реакций или загрязнений.
3. Эффективность использования восстановителя или коэффи-
циент использования — отношение теоретического количества вос-
становителя, необходимого для восстановления 1 моля металла,
к общему количеству прореагировавшего восстановителя.
4. Чувствительность раствора к активации, выражаемая ми-
нимальным количеством активатора на поверхности диэлектрика,
обеспечивающим надежное начало осаждения покрытия. Этот па-
раметр связан со стабильностью раствора: чем меньше стабилен
раствор, тем легче начинается реакция и на малоактивированной
поверхности. Растворы металлизации желательно использовать
как можно дольше, корректируя их состав, поэтому они должны
обладать высокой стабильностью и малой чувствительностью к за-
грязнениям. Растворы многоразового использования фильтруют
и производят корректирование их состава. При одноразовом ис-
пользовании применяют большую плотность загрузки.
Растворы для химического меднения содержат соли двухвалент-
ной меди, комплексообразователи для связывания двухвалентной
меди в комплексные соединения, вещества-восстановители, бу-
ферные добавки для поддержания pH раствора, стабилизаторы,
другие добавки. Наиболее часто применяемые составы растворов
приведены в табл. 19.1. Из солей меди наиболее часто используют
250
19.1. Состав (г/л) растворов химического меднения
и режим работы (при t = 184-25 °C)
Компоненты раствора н режим работы Номер раствора
1 2 3 4
CuSO4-5H2O 7 10—15 10 10—15
Тартрат К—Na .— 50—60 40 —
Na2 ЭДТА « < —. — .—„ 60—70
NaOH 4,5 10—15 7—8 10—15
Формалин 37%-ный, мл/л 26 10—15 13—14 15—20
NiCl2-6H2O 2 2—3 — 2—3
NaaSaOe или CS(NH2)2 — 0,0005— 0,0010 0,0005— 0,0010 0,0005— 0,00075
— — 0,0005— 0,0010 —
N а-диэтилдитиокарбамат — — — 0,01—0,015
Скорость покрытия, мкм/ч 0,4 0,8—1,0 1,0 1.0—1,2
т, мин 20—40 10—20 10—20 10-15
рн 12,1—12,2 12,2—12,8 12,4—12,6 12,2—12,3
сульфат меди, можно применять нитрат, хлорид, карбонат, тар-
трат, глюконат.
Практически в качестве восстановителя, используемого в рас-
творах химического меднения, применяется формальдегид, вод-
ный раствор которого называется формалином. Процесс восстано-
вления меди формалином носит электрохимический характер. На
металлической меди происходят катодное восстановление ионов
меди до металла
Си2+ + 2е -> Си
и анодное окисление формалина до муравьиной кислоты
2СН2О + Cu2+ + 4ОН- -> Си + Н2 + 2НСОО" + 2Н2О.
В водных растворах формальдегид существует в основном в виде
гидрата метиленгликоля СН2(ОН)2. В щелочной среде метилен-
уОН
гликоль диссоциирует с образованием аниона Н2С\
\0-
Н2С(ОН)2 + ОН- -> Н2С(ОН)О" + Н2О,
который считают более реакционноспособным; реакцию восста-
новления меди можно выразить уравнением
2Н2С(ОН)О- + Cu2+ + 2ОН- Си + Н2 + 2НСОО" + 2НгО.
Процесс имеет каталитический характер: начинается только на
активной поверхности и затем продолжается автокаталитически.
251
Восстановление меди формалином возможно лишь в растворах,
у которых pH не ниже 11. С увеличением pH скорость меднения
возрастает.
Для создания щелочной среды в растворы вводят едкий натр
или соду.
Добавление в эти растворы солей никеля улучшает протекание
реакций и качество покрытий.
В качестве комплексообразователей применяют тартраты, гли-
церин, соли лимонной, этилендиаминоуксусной кислот и другие
вещества, которые увеличивают растворимость солей меди в ще-
лочной среде, способствуют ее восстановлению и препятствуют
самопроизвольному восстановлению в объеме раствора. Стабили-
заторы (гипосульсит Na2S2O3, тиомочевина CS(NH2)2, диэтилди-
тиокарбонат, высшие спирты, некоторые ПАВ) предотвращают
восстановление меди в объеме раствора. Они адсорбируются на
выпадающих в растворе твердых частицах и препятствуют их
превращению в центры кристаллизации. Разбавленные растворы
более стабильны, чем концентрированные, но имеют малую ско-
рость осаждения меди.
Следует учитывать, что в процессе химического меднения про-
исходят побочные реакции:
1) реакция окисления формалина едким натром — реакция
Каницарро:
2НСОН + NaOH CHSOH + HCOONa;
2) частичное восстановление ионов меди Си2+ до одновалентного
состояния с образованием осадка оксида меди (I) Си2О
2Си2+ + НСОН + 5ОН- — Си2О + НСООН" + ЗН2О,
молекулы которого могут стать центрами кристаллизации, вос-
станавливающими медь. В этом случае происходит выпадение ме-
таллической меди в объеме раствора. Меры, принимаемые для
стабилизации растворов, направлены, главным образом, на подав-
ление образования Си2О: это введение в раствор комплексообразо-
вателей, стабилизаторов, перемешивание раствора сжатым воз-
духом для окисления Си2О, непрерывное фильтрование раствора.
Химическое никелирование позволяет получать равномерные
покрытия на деталях сложной формы. По сравнению с химическим
меднением этот процесс более производителен, растворы его более
стабильны, покрытие лучше сцепляется с некоторыми пластмас-
сами. Его возможно автоматизировать (см. § 15.8).
Для металлизации пластмасс более эффективны щелочные рас-
творы, состоящие из солей никеля, лимоннокислых солей, кото-
рые при избытке аммонийных солей образуют с никелем комплекс-
ные соединения. В качестве комплексообразователей применяют
соли аминокислот, которые позволяют проводить никелирование
в нейтральной или слабощелочной среде и при высоких темпера-
турах (98—99 °C).
252
Электрохимическая металлизация. На слой химически осажден-
ных меди или никеля наносят гальваническим способом слой меди
либо никеля, причем нанесение первого слоя является очень от-
ветственным моментом. Первый слой должен быть тонким и мак-
симально эластичным. Обычно это слой матовой меди или матового
никеля. Этот слой позволяет повысить прочность сцепления между
электропроводным подслоем и последующими слоями покрытия.
Для осаждения рекомендуют такие электролиты (г/л) и следующий
режим работы:
Для осаждения меди
Для осаждения никеля
CuSO4-5H2O.............. 190—250
H2SO4....................50—65
I, А/дма...............1,5—2,0
f, °C....................25—35
т, мин.................20—15
NiSO4-7H2O.................. 150
NiCl2-6H2O ................. 150
HSBOS....................... 30
i, А/дма................1,5—2,0
t, °C......................25—35
pH .....................1,2-^2,0
т, мин................... 8—5
Последующее наращивание металла или осаждение производят
при режимах, применяемых для покрытия металлических деталей.
РАЗДЕЛУ!
ЭЛЕКТРОХИМИЧЕСКОЕ ПОКРЫТИЕ
СПЛАВАМИ
ГЛАВА 20. ОСНОВЫ ТЕОРИИ ПРОЦЕССА ОСАЖДЕНИЯ
СПЛАВОВ
$ 20.1. ОБЛАСТЬ ПРИМЕНЕНИЯ СПЛАВОВ
Для развития всех отраслей промышленности, и осо-
бенно машиностроения, требуются новые конструкционные ма-
териалы с улучшенными характеристиками. В тех случаях, когда
требуемое качество материала должно проявляться в поверхност-
ном слое изделий, задача может быть решена с помощью нанесения
покрытий, обладающих необходимыми функциональными свой-
ствами. Так как перечень электрохимических покрытий из чистых
металлов сравнительно невелик, особый интерес проиобретают
сплавы, полученные при помощи электрохимического восстанов-
ления.
В настоящее время используется более 50 сплавов, обладаю-
щих самыми разнообразными физико-химическими и механиче-
скими свойствами. Сплав Си—Zn широко применяется для улуч-
шения сцепления стали с резиной. Сплав Си—Sn обладает высокой
отражательной способностью. Весьма перспективными и износо-
стойкими покрытиями являются сплавы Ст—Mo, Fe—Мп, Сг—W,
Fe—Ni, Ni—Со и др.
Для повышения коррозионной стойкости и снижения пере-
ходного сопротивления в радиотехнике на детали наносят сплавы
Au—Sb, Ag—Cd, Ag—Sb, Pt—Co, Pt—Си. Эти сплавы по сравне-
нию с золотыми и серебряными покрытиями имеют высокую изно-
состойкость. Покрытия, обладающие магнитными свойствами, на-
пример Ni^-Co, Со—W, Со—Fe, применяют в радиотехнике, в
счетно-вычислительных и записывающих устройствах. Находят
применение сплавы на основе никеля и кобальта с молибденом
и вольфрамом. Для защиты от химической коррозии в агрессивных
средах применяют сплавы на основе хрома: Сг—W, Сг—Мо, Сг—
Ni—Mo, V—Ni—Сг. Большой интерес представляют сплавы метал-
лов, которые не удается получить электрохимическим путем из
водных растворов: W, Mo, V и др., но найдены условия для их
совместного осаждения в виде сплавов с оловом, никелем, кобаль-
том и железом.
254
§ 20.2. УСЛОВИЯ СОВМЕСТНОГО ОСАЖДЕНИЯ
МЕТАЛЛОВ
Необходимым условием совместного осаждения двух
и более металлов является равенство их потенциалов осаждения
Е\ + ~^F~ln ai + "Hi = £2 + In а2 + т]2,
где £] и Е2 — стандартные потенциалы разряжающихся катио-
нов, В; R — универсальная газовая постоянная, Дж/моль; Т —
температура, К; и и2 — число электронов, участвующих в реак-
ции; F — число Фарадея, Кл/(г-экв); ах и а2 — активности ионов,
г-ион/л; “1)1 и т]2 — перенапряжение при разряде ионов, В.
Из этого уравнения следует, что сближение потенциалов оса-
ждения можно осуществлять путем изменения или концентрации,
или поляризации.
Сплавы металлов, стандартные потенциалы которых близки по
своим значениям, можно получать путем изменения соотношений
концентраций осаждаемых металлов в растворах простых солей.
Таким образом получают сплавы Sn—Pb, Ni—Со, Sn—Bi.
Сблизить потенциалы разряда металлов, значительно разли-
чающихся по своим стандартным потенциалам, в растворах про-
стых солей не удается. В качестве примера рассмотрим осаждение
сплава Ag—Pb. Нормальный потенциал серебра 4-0,798 В, свинца
—0,13 В. Решая уравнение относительно концентрации Ag+,
для нормальных условий получим —0,13 = 0,798 In OAg+, тогда
In «Ag+ = —16, t?Ag+ — 10-1® г-ион/л. При такой ничтожной кон-
центрации ионов Ag+ на катоде будет выделяться только свинец.
Поэтому в таких случаях более эффективными способами сближе-
ния потенциалов разряда являются комплексообразование, вве-
дение ПАВ, осаждение более положительного металла на предель-
ном токе.
Осаждение сплавов путем комплексообразования. Этот способ
является наиболее распространенным способом. 100 лет назад
петербургский ученый Б. С. Якоби впервые показал, что при
помощи комплексообразования можно получить сплав меди с цин-
ком, потенциалы которых различаются более чем на 1 В.
Успешное применение комплексных электролитов для сооса-
ждения металлов объясняется тем, что равновесные потенциалы
могут быть значительно сдвинуты в отрицательную сторону, кроме
того, в сложных электролитах потенциал выделения металла воз-
растает с увеличением плотности тока.
Сдвиг потенциала зависит от природы металла и от лиганда.
Величина сдвига потенциала определяется степенью диссоциации
комплексного иона: чем выше константа нестойкости комплекс-
ного иона, тем больше концентрация свободных ионов в электро-
лите и меньше наблюдаемый сдвиг потенциала металла. Поэтому
для осаждения сплава необходимо, чтобы более благородный ме-
255
талл образовывал более устойчивые комплексы. Например, при
осаждении сплава Си—Zn необходимо, чтобы комплексные ионы
меди были более стойкими, тогда медь будет поляризована в боль-
шей степени, чем цинк, и создадутся условия для их совместного
осаждения. Другим примером является осаждение сплава Ag—Zn.
В цианидном электролите можно создать условия, при которых
потенциал более благородного металла, каким является серебро,
будет выделяться при более отрицательном потенциале, чем цинк.
В качестве комплексообразователей могут быть использованы
не только цианидные соединения, но аммонийные, пирофосфатные
и многие другие. Потенциал палладия в аминохлоридном электро-
лите смещается в отрицательную сторону на 1,15 В, что позволяет
осаждать покрытия Ni—Pd, Со—Pd.
Сплавы, полученные из комплексных электролитов, имеют более
мелкую структуру. Высокая адсорбционная способность комплекс-
ных ионов препятствует осаждению посторонних ионов, наличие
которых ухудшает структуру покрытий. Концентрация комплек-
сообразователя, плотность тока, температура и перемешивание
оказывают существенное влияние и на химический состав сплава.
Осаждение сплавов при ПАВ. Сближение потенциалов оса-
ждения возможно при добавлении в электролиты некоторых ПАВ.
Введение их в растворы вызывает разкое торможение катодного
процесса у более положительного металла, что создает условия
для сближения потенциалов осаждения.
ПАВ путем физической адсорбции блокируют отдельные уча-
стки или всю поверхность катода. В первом случае разряд кати-
онов происходит на свободных участках катода, во втором —
разряд осуществляется через сплошную пленку ПАВ. Резкое со-
кращение поверхности катода вызывает увеличение плотности
тока и повышение поляризации.
Кроме адсорбционной теории, объясняющей действия ПАВ при
осаждении сплавов, существует теория комплексообразования. По
этой теории ПАВ коллоидного типа образуют с катионами метал-
лов комплексы — металлоколлоиды. Благодаря прочной связи
между металлами и ПАВ образовавшиеся комплексы замедляют
процесс осаждения.
Действие ПАВ зависит от природы и концентрации органиче-
ских добавок, а также от природы металлов, образующих сплав.
Для некоторых металлов трудно подобрать ПАВ, так как на катоде
образуются рыхлые адсорбционные пленки, которые не оказывают
влияния на процесс осаждения. К таким металлам можно отнести
Си, РЬ и т. д. В этих случаях вводят несколько ПАВ коллоидного
типа, которые уплотняют адсорбционную пленку. Например, вве-
дение желатины наряду с другими ПАВ при осаждении сплавов
Си—Sn и РЬ—Sn приводит к резкому увеличению поляризации.
Осаждение сплавов на предельном токе. Совместное осаждение
сплавов может быть достигнуто при возникновении предельного
тока у более положительного металла даже в растворах простых
256
Рнс. 20.1. Осаждение более электроположительного металла на предельном
токе
Рис. 20.2. Парциальные кривые разряда катионов металлов (3) и М2 (2)
и суммарная поляризационная кривая осаждения сплава Mi—М2 (/)
солей. На рис. 20.1 приведены поляризационные кривые при оса-
ждении сплава на предельном токе. Осаждение более положи-
тельного металла Mi начинается при потенциале £р1. При увели-
чении потенциала от £р1 до £пр скорость осаждения металла Мх
возрастает до тех пор, пока не достигнет определенного предела,
при котором в прикатодном слое установится равновесие между
числом поступающих за счет диффузии ионов и числом разряжа-
ющихся ионов. Потенциал катода при этом возрастает до значе-
ний, при которых становится возможным разряд ионов менее по-
ложительного металла М2 (точка а). Таким образом, на катоде
будут одновременно разряжаться ионы металлов Мх и М2. При-
мером осаждения сплава, когда более положительный металл оса-
ждается на предельном токе, является осаждение сплава Zn—Cd
из сульфатного электролита.
На практике при осаждении сплавов часто приходится сталки-
ваться с одновременным действием рассмотренных выше факторов.
Например, при осаждении сплава Zn—Cd в цианидном электролите
сближение потенциалов происходит за счет комплексообразования
и за счет выделения на предельном токе. Осаждение сплава
Au—Ag происходит, кроме того, в результате образования твердых
растворов между компонентами сплава.
На процесс осаждения сплавов, как было указано выше, влияет
фазовая структура сплава. При образовании твердых растворов
или химических соединений возможно осаждение сплава за счет
увеличения потенциала разряда у более положительного металла.
Для изучения процессов осаждения сплавов пользуются по-
ляризационными кривыми. На рис. 20.2 приведены суммарная
(общая) и паоциальные поляризационные кривые совместного раз-
ряда катионо.з металлов Mi и М2. В идеальном случае осаждение
сплава происходит так же, как осаждение отдельных металлов.
Общая поляризационная кривая строится по точкам, полученным
суммированием парциальных токов при одном и том же потенциале
разряда. Соотношение атомных долей металла в сплаве зависит
9 Дасоян М. А. и др.
257
Рис. 20.3. Осаждение сплава
Sn—Ni с деполяризацией:
1 — суммарная поляризационная
кривая осаждения сплава Sn —Ni;
2 и 3 — парциальные кривые раз-
рядов Sn и Ni; 4 — кривая осажде-
ния Sn; 5 — кривая осаждения Ni
от соотношения концен-
траций ионов металла в
растворе при прочих рав-
ных условиях.
На скорость осаждения
сплавов в реальных систе-
мах оказывают влияние
процессы, происходящие
в двойном электрическом
слое, в результате которых
меняется концентрация
ионов в при катодном слое.
Поэтому парциальные поляризационные кривые в сопряженных
системах отличаются от идеальных в несопряженных системах.
Смещение потенциала разряда одного из металлов при осажде-
нии сплава в положительную сторону по отношению к чистому
металлу при одной и той же плотности тока называется деполяри-
зацией, а смещение в отрицательную сторону — сверхдеполяри-
зацией.
Рассмотрим влияние деполяризации на примере осаждения
сплава Ni—-Sn. На рис. 20.3 представлены кривые раздельного
и совместного осаждения Ni и Sn. При совместном осаждении
потенциалы Ni и Sn становятся более положительными по сравне-
нию с раздельным осаждением этих металлов. Следовательно,
процесс осаждения сплава протекает при деполяризации. Депо-
ляризация у более отрицательного металла позволяет осаждать
сплавы, которые в чистом виде из водных растворов получить не
удается. К таким сплавам относятся W—Ni, W—Со, Мо—Ni,
Мо—Со.
§ 20.3. СТРУКТУРА И СВОЙСТВА СПЛАВОВ
Современные методы исследований позволяют всесто-
ронне изучать строение и состав электролитических сплавов.
Микроструктурный анализ с использованием оптических и
электронных микроскопов определяет взаимное расположение
зерен и их размеры. Обычно сплавы, полученные при электро-
осаждении, имеют мелкокристаллическую структуру, размеры
зерен колеблются в пределех 10~8—10~6 мкм, что на несколько
порядков ниже, чем у металлургических сплавов.
Часто сплавы имеют слоистое строение. Толщина слоев ко-
леблется от нескольких микрометров до десятков и даже сотен
258
микрометров. После термической обработки слоистость пропадает
и образуется структура, характерная для литых и отожженных
сплавов. Например, структура сплава Си—РЬ до отжига имеет
явно выраженную слоистость, которая после отжига при темпе-
ратуре 600 °C исчезает, образуя структуру обычной свинцовой
бронзы. Предполагают, что слоистость объясняется периодиче-
ским обеднением прикатодного слоя ионами более благородного
металла.
Рентгенограммы дают представление о типе связи между ато-
мами в узлах кристаллической решетки и о ее геометрии. Рентге-
ноструктурный и термографический анализы позволяют изучить
характер распределения металлов по различным фазам и струк-
турным составляющим и на основании полученных данных по-
строить диаграммы состояний. Диаграммы состояний таких спла-
вов, как Sn—Zn, Си—Zn, Ni—Со, аналогичны диаграммам со-
стояний металлургических сплавов. Однако у некоторых сплавов
фазовый состав отличается от соответствующих металлургических
сплавов. Сплавы эвтектического типа могут образовывать пере-
сыщенные твердые растворы; сплавы, которые должны давать
непрерывный ряд твердых растворов, представляют механическую
смесь твердого раствора и одного из компонентов.
В сплавах с промежуточными фазами границы отдельных зерен
отличаются от их границ на диаграммах состояний, а в некоторых
случаях наблюдается образование новых фаз, придающих сплавам
свойства, которыми не обладают сплавы, полученные другими
способами.
Несоответствие диаграмм состояний объясняется особенно-
стями электрокристаллизации, и в первую очередь влиянием ка-
тодной поляризации и скорости осаждения ионов. Различие струк-
туры у электроосажденных сплавов отражается и на их свойствах.
Твердость и удельное электрическое сопротивление у них всегда
выше, это определяется не только различными диаграммами со-
стояний, но и меньшими размерами зерен. Необходимо также
учитывать более совершенную текстуру. Антикоррозионная стой-
кость у электроосажденных сплавов также выше, так как они не
имеют примесей других металлов.
Во многих случаях сплавы, полученные путем электролиза,
обладают свойствами, которых нет у металлургических сплавов,
имеющих тот же химический состав,. Например, можно получать
сплавы с особыми магнитными свойствами, с высокими твердостью,
сверхпроводимостью, полупроводниковыми свойствами.
Разнообразные требования, предъявляемые в настоящее время
к поверхностным свойствам конструкционных материалов, вы-
зывают повышенный интерес к проблеме электрохимического
получения сплавов. Этот способ позволяет не только получать
новые комбинации сплавов, но, изменяя условия осаждения,
влиять на состав сплава, его структуру и свойства.
\
9*
259
§ 20.4. 'АНОДНЫЙ ПРОЦЕСС ПРИ ОСАЖДЕНИИ
СПЛАВОВ
Анодныр процесс при осаждении сплавов отличается
от анодных процессов, которые возникают при осаждении метал-
лов, так как элейтролит должен пополняться катионами двух
и более металлов. При электроосаждении сплавов применяют
следующие аноды. ,
1. Аноды, которое изготовлены из сплава, состав которого не
отличается от состава получаемого сплава.
2. Аноды раздельные, изготовленные из отдельных металлов,
входящих в состав с'рлава. Этот способ позволяет поддерживать
концентрацию катионов металла на заданном уровне, подавая
на каждый анод ток определенной силы и напряжения. Анодное
растворение сплавов протекает с более интенсивным растворением
электроотрицательного металла, что может привести к разрушению
анода и потерям более благородного металла.’ При использовании
раздельных анодов онйг растворяются равномерно и шламообра-
зование исключено. \
3. Аноды нерастворимые. Убыль катионов в этом случае вос-
полняется за счет введения в электролит соответствующих хими-
ческих соединений. \
4. Аноды комбинированные. В некоторых случаях используют
комбинацию растворимый и нерастворимых анодов.
Выбор ведения аноднйго процесса должен происходить с уче-
том целесообразности изготовления анодов из необходимого
сплава, с одной стороны, 'и трудоемкости корректирования элек
тролита — с другой. \
ГЛАВА 21. ЛАТУНИРОВАНИЕ И БРОНЗИРОВАНИЕ
§ 21.1. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
И ОБЛАСТЬ ПРИМЕНЕНИЯ ЛАТУНИРОВАНИЯ
Латунирование —4 старейший процесс, разработанный
Б. С. Якоби еще в 1841 г. При латунировании образуется сплав
Си—Zn. В зависимости от содержания меди различают томпак
(95—97 % меди), полутомпак (79—81 % меди), белую латунь
(5—20 % меди). Наиболее пластичны латуни, содержащие около
30—32 % меди.
Латунные покрытия, полученные электролитическим путем,
обычно содержат 60—70 % меди. Они хорошо полируются. Цвет
зависит от состава и меняется от золотисто-желтого до серо-зеле-
ного. Покрытия устойчивы во многих средах. Имеют прочное сцеп-
ление с основным металлом. На воздухе быстро тускнеют. В азот-
ной кислоте легко растворяются, несколько труднее — в серной
и плохо — в соляной кислоте. В щелочных растворах довольно
устойчивы.
260
Плотность латуни 8,5 г/см3. Электрохимический эквивалент
подсчитывается суммированием электрохимических эквивалентов
меди и цинка, взятых в соответствующих процентных соотноше-
ниях. Например, латунные покрытия, содержащие 30 % цинка,
имеют такой электрохимический эквивалент:
ccu-zn = 0,7ccu + 0,3cZn = 0,7-2,37 + 0,3-1,22 =
= 2,02 г/(А-ч). т
{ Латунные покрытия до недавних пор наносились в качестве
промежуточного слоя под никель, олово, серебро и золото. Тол-
щина подслоя в случае многослойного покрытия составляла 12—
15 мкм. Вследствие диффузии меди в вышележащие слои промежу-
точный слой обогащался цинком, что увеличивало коррозионную
стойкость покрытий.
В настоящее время латунирование широко применяется для
обеспечения сцепления поверхности стальных и алюминиевых
изделий с резиной при горячем прессовании, толщина покрытий
не превышает 3—5 мкм. Латунирование используется и для
нанесения защитно-декоративных покрытий. Например, при от-
делке малоответственных деталей латунные покрытия могут за-
менять никель.
Латунные покрытия легко окрашиваются в различные тона
растворами аммиака, сульфида натрия, а также при помощи
химического оксидирования.
§ 21.2. ЭЛЕКТРОЛИТЫ ЛАТУНИРОВАНИЯ
Стандартные потенциалы меди и цинка различаются
более чем на 1 В, поэтому осаждать сплав в простом электролите
нельзя. Сближение равновесных потенциалов возможно лишь
в присутствии таких комплексообразователей, которые умень-
шают активность ионов меди в большей степени, чем активность
ионов цинка.
» На практике чаще всего при-
меняют цианидные электролиты.
Исходными компонентами для них
являются цианиды меди, цинка и
натрия. При их взаимодействии
образуются комплексные соедине-
ния Na2[Cu(CN)3] и Na2[Zn(CN)4],
Сближение потенциалов осажде-
ния меди и цинка происходит за
счет того, что более благородный
Рис. 21.1. Суммарная поляризационная
кривая осаждения латуни (/) и парци-
альные кривые осаждения цинка (2)
и меди (3)
261
металл, в данном случае медь, образует более стойкий комплекс
и, следовательно, поляризуется в большей степени, чем цинк.
Кроме того, медь оказывает еще и деполяризующее воздействие
на цинк.
В результате действия этих двух факторов на катоде возможно
осаждение сплава Си—Zn. На рис. 21.1 приведены парциальные
кривые осаждения меди и цинка и кривая осаждения латуни.
Кривые осаждения показывают, что минимальная разность по-
тенциалов соответствует плотности тока 0,3—0,5 А/дм2, при более
низких плотностях тока совместное выделение металлов затруд-
нено.
Основное влияние на качество покрытий и их химический со-
став оказывает не соотношение солей осаждаемых металлов,
а концентрация свободного цианида. При ее повышении осадок
обогащается цинком, так как катодная поляризация меди в этом
случае возрастает в большей степени. Потенциал меди становится
более отрицательным, чем потенциал выделения цинка, и на катоде
происходит преимущественный разряд ионов цинка. При повыше-
нии pH раствор начинает обогащаться цинком за счет образования
цинкатов, константа нестойкости которых намного меньше кон-
станты нестойкости цианидного комплекса цинка, поэтому в элек-
тролитах латунирования pH поддерживают от 10 до 11.
Противоположное влияние на химический состав оказывает
температура. При повышении температуры увеличивается содер-
жание меди и повышается выход по току. Считают, что при повы-
шении температуры на 1 °C содержание меди в осадке увеличи-
вается на 1 %, поэтому для получения стабильных по составу
покрытий необходимо поддерживать температуру на заданном
уровне. При понижении температуры качество покрытий значи-
тельно ухудшается, они становятся хрупкими и шероховатыми.
Введение в электролит небольших количеств 25 %'-ного водного
раствора аммиака позволяет улучшить внешний вид осадков,
стабилизировать их химический состав в широком интервале плот-
ностей тока и повысить выход по току.
Осаждение латуни М-Ц (70) производят в электролите следую-
щего состава (г/л) при режиме работы:
CuCN..................... 35—55
Zn(CN)2................... 9—12
NaCN (свободный) . . . 8—12
Na2CO3.................. 10—30
Na2SO4................... 5-10
NH4OH (25 % -ный вод-
ный раствор).......... 0,3—1,0
iK, А/дм2............. 0,3—1,0
f, °C...................... 15—30
Аноды.................Латунь Л70
Осаждение латуни, содержащей 5—20 % меди, производят
в электролите следующего состава (г/л) при режиме работы:
CuCN.....................50—65
Zn(CN)a.................. 5-7
NaCN (свободный) .... 8—12
NaOH.....................25—35
NH4OH (25 %-ный водный
раствор).................0,3—1,0
Сегнетова соль..........40—45
iK, А/дм2................... 2—3
t, °C......................50—55
Аноды......................Томпак
262
Материалом анодов являются листы или полосы катаной
латуни. Во время работы аноды покрываются белыми и зелеными
налетами, они представляют собой нерастворимые соли меди и
цинка. Их можно удалить добавлением цианида натрия. Если
поверхность анодов блестящая, то в электролите находится избы-
ток NaCN. Если налет становится плотным и покрывает всю по-
верхность, его следует механически удалить. Темно-коричневая
пленка, не исчезающая при включении тока, свидетельствует
о загрязнении анодов свинцом. Присутствие олова вызывает
белый налет. Предельно-допустимая концентрация Ni, As, Sn,
Sb, Pb не должна быть более 0,005 %, a Fe не более 0,01 %.
Раздельные аноды применять не рекомендуется, так как при этом
сложно регулировать состав сплава. Если осаждение латуни
ведется при плотности тока ниже 0,5 А/дм2, можно применять
литые аноды. Катаные аноды сначала отжигают, травят в 5 %-ном
растворе HNOS, а затем промывают и крацуют стальными щетками.
Сегнетова соль, являясь депассиватором, стабилизирует рас-
твор и позволяет работать при более высоких плотностях тока.
При этом улучшается качество покрытий и они становятся глад-
кими и равномерными.
Для приготовления электролита в ванну сливают растворы
цианидных комплексов цинка и меди. Рекомендуется добавлять
10—15 % отработанного электролита. Цианид натрия должен
быть в избытке. Затем завешивают аноды и электролит длительное
время прорабатывают током до получения покрытий требуемого
состава и оттенка.
Корректирование электролита сводится к добавлению цианида
натрия, реже цианидов меди и цинка. Повышение pH достигается
добавлением в ванну разбавленного раствора карбоната натрия.
В ванну регулярно вводят водный раствор аммиака.
Для замены вредных цианидных электролитов разработан
пирофосфатный электролит следующего состава (г/л) при режиме
работы:
CuSO4-5H2O .
ZnSO4-7H2O .
Na4P2O7 • ЮН2О
Н2С2О4-2НаО .
4,8—6,2 Н3ВО» .
4,4—6,0 iK, Ырм*
50—60 t, °C . .
10—15 Аноды .
4—5
0,8—1,2
15—30
Л70
Для блестящего латунирования можно использовать этилен-
диаминовый электролит следующего состава (г/л) при режиме
работы:
CuSO4-5H2O.............
ZnSO4-7H2O.............
Na2SO4-10H2O...........
(NH4)2SO4..............
CdSO4-8/3H2O...........
Этилендиамин 20 % -ный
раствор, мл/л ....
20—25
40—45
10—15
40—45
2
150
Желатина...............
Дисульфонафталиновая
кислота................
pH.....................
tK, А/дм2..............
/, °C..................
0,5
1,0
8,0—8,3
0,75—1,25
20—25
263
§ 21.3. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
И ОБЛАСТЬ ПРИМЕНЕНИЯ БРОНЗИРОВАНИЯ
Химический состав и внешний вид бронзовых покрытий
могут меняться в широких пределах. При содержании 2—3 %
олова осадки по цвету напоминают медь, при 15—20 % олова
осадки становятся золотисто-желтыми, а при 35 % олова имеют
серебристо-белый цвет. Практическое применение нашли бронзо-
вые покрытия, содержащие 20 и 40 % олова. Плотность покрытия
колеблется от 8,2 до 8,6 г/см3 в зависимости от состава сплава.
Электрохимический эквивалент подсчитывается так же, как для
латунных покрытий; для белой бронзы он составляет 1,85 г/(А-ч).
Бронзовые покрытия полируются до зеркального блеска,
имеют прочное сцепление с основным металлом и сохраняют пла-
стичность при любой толщине. Их можно паять низкотемператур-
ными припоями с применением канифольных флюсов. Они на-
носятся на стали, чугун, медь и цинковые сплавы.
Покрытия, содержащие 20 % олова, применяются в качестве
самостоятельных покрытий; для местной защиты от цементации;
в качестве защитных для стальных деталей, работающих в пресной
воде при 90—100 °C; для повышения антифрикционных свойств
при производстве подшипников. Применяют эти покрытия и для
нанесения подслоя вместо меди и особенно никеля, в защитно-
декоративных многослойных покрытиях. Несмотря на катодный
характер защиты, бронзовые покрытия лучше защищают от кор-
розии, чем медь или никель той же толщины, так как имеют мень-
шее число пор, а при толщине 35—40 мкм они практически бес-
пористы.
Белая бронза имеет красивый декоративный вид. Ее можно
окрашивать в черный цвет путем анодного окисления в 20 %-ном
растворе гидроксида натрия. Она в 5—6 раз тверже меди и прибли-
жается к твердости хрома; микротвердость покрытий 5,5—
6,0 ГПа; износостойкость в 4 раза выше, чем серебра. В отличие от
него бронза длительное время не тускнеет, так как не реагирует
с сероводородом. Термостойкость покрытий проявляется до
200 °C. Коэффициент отражения 65—66 %.
По электрическим свойствам белая бронза уступает серебря-
ным и медным покрытиям, но зато переходное электрическое со-
противление у нее более стабильно. Покрытие не подвержено росту
нитевидных кристаллов и не переходит в порошковую модифи-
кацию, как олово. Сплавы, содержащие более 40 % олова, нано-
сят на столовые приборы, музыкальные духовые инструменты,
для повышения износостойкости электроконтактных деталей, для
обеспечения пайки и во многих других случаях. Из-за наличия
большего числа пор и трещин белую бронзу нельзя применять для
защиты изделий, работающих в жестких условиях. Толщина
покрытий для стали 25—30 мкм, для меди и ее сплавов 12—14 мкм.
264
§ 21.4. ЭЛЕКТРОЛИТЫ БРОНЗИРОВАНИЯ
Разность потенциалов меди и олова приблизительно
равна 0,5 В, поэтому сближение их потенциалов разряда возможно
лишь при помощи комплексообразования.
На практике применяют станнатноцианидные электролиты,
в которых медь находится в виде цианидного комплекса, а олово —
в виде станнатного комплекса, так как не образует цианидов.
Исходными компонентами являются соль меди, цианид и станнат
натрия. Электролиты имеют высокую РС. В табл. 21.1 приведены
составы таких электролитов.
На химический состав сплава влияют относительное содержа-
ние олова и меди, а также концентрация свободного гидроксида
натрия. Например, при соотношении Си : Sn = 8 : 1 сплав со-
держит всего 4 % олова, а при соотношении 1 : 1 количество олова
увеличивается до 20 %. Увеличение абсолютных концентраций
металлов почти не сказывается на химическом составе сплава
Гораздо большее влияние оказывает концентрация свободного
гидроксида натрия (рис. 21.2): при ее увеличении содержание
олова в сплаве уменьшается.
Качественные покрытия получаются так же, как при оловя-
нировании, только при повышенных температурах — около 60—
65 °C. С ростом температуры содержание олова в сплаве увеличи-
вается. Повышение плотности тока приводит к уменьшению со-
держания олова в сплаве и к снижению выхода по току.
Аноды изготавливают из бронзы. При работе с медными и
оловянными анодами должно быть раздельное регулирование
силы тока (рис. 21.3). Чтобы избежать пассивации, плотность
тока на медных анодах должна быть выше 1 А/дм2, а на оловян-
ных — 2—2,5 А/дм2. Так же, как при станнатном оловянирова-
21.1. Составы (г/л) станнатноцианидных электролитов
для нанесения сплава медь—олово (г/л) и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3
CuCN 35 40 11
Na2SnO3 38 20 40
NaCN (общий) 54 65 27
NaCN (свободный) 15 20 16
NaOH (свободный) 7,5 7,5 16
iK, А/дм2 3 0,1—0,8 3
t, °C 65 60 65
рн 12,6 13 —•
Sn, % 10 15 40
265
Рис. 21.3. Раздельное регулирование силы тока при использовании медных
и оловянных анодов:
/ — штанги медных анодов; 2 — штанги оловянных анодов; 3 — катодные штанги;
Л/, А2, АЗ — амперметры; R2 — регулировочные сопротивления
Рис. 21.2. Влияние концентрации NaOH на состав сплава олово—медь
нии, аноды следует «формировать», как при оловянировании
в щелочных электролитах, с тем чтобы в электролите отсутство-
вали ионы Sn2+. При получении белой бронзы рекомендуется за-
вешивать медные и стальные или никелевые аноды, а убыль олова
восполнять периодическим добавлением станната натрия.
Для приготовления станнатноцианидного электролита от-
дельно приготавливают растворы цианида меди и станната на-
трия, а затем смешивают их в определенном соотношении в зави-
симости от заданного сплава. Кроме станнатноцианидных элек-
тролитов применяют гексацианоферратный электролит, в котором
потенциалы меди и олова приблизительно равны. В нем наносят
покрытия для защиты стали от азотирования или от воздействия
горячей воды. Ниже приведен следующий состав такого электро-
лита (г/л) при режиме работы:
SnCl4-5H2O................
CuCl......................
K4Fe(CN)e................
K2COS ....................
100—120 NaOH ...................
30—40 iK, А/дм2...............
180—200 t, °C...................
20—25
15—20
0,5—1,0
50—60
Аноды — бронза с содержанием 10—15 % олова или раз-
дельные с соотношением 1:1. Покрытия содержат 12—20 % Sn.
Белую бронзу можно осаждать и из пирофосфатного электро-
лита, в котором Cu2+ : Sn2+ = 100 : 120, а содержание К4Р2О7- ЮН2О
составляет 300—350 г/л, / = 204-30 °C, /к = 0,54-1,0 А/дм2,
pH 7—8, аноды — из бронзы.
Содержание меди возрастает при увеличении концентрации
меди и при повышении температуры. Падение pH до 6,6 и ниже
также вызывает обогащение сплава медью. Электролит рекомен-
дуется перемешивать.
266
ГЛАВА 22. ПОКРЫТИЕ СПЛАВАМИ НА ОСНОВЕ ОЛОВА,
ЦИНКА И ЖЕЛЕЗА
§22.1. ПОКРЫТИЕ СПЛАВОМ ОЛОВО — СВИНЕЦ
л Способ электроосаждения сплава Sn—Pb с давних пор
применяется в промышленности. Такие покрытия имеют ряд пре-
имуществ по сравнению с оловянными: меньшую пористость и
высокую химическую стойкость; при низких температурах не
переходят в порошковую модификацию. Сплавы, содержащие
5 % олова, надежно защищают стальные изделия, работающие
в морской воде и в других агрессивных средах, несмотря на катод-
ный характер защиты. В условиях повышенной влажности и тем-
пературы коррозионная стойкость у сплавов Sn—Pb ниже, чем
у оловянных покрытий.
Сплавы, содержащие 5—11 % олова, используются как анти-
фрикционное покрытие; они очень пластичны и могут предотвра-
щать заклинивание винтовых соединений, а также выполнять
роль смазки при штамповке.
Сплавы, содержащие от 40 до 60 % олова, хорошо паяются
и в отличие от олова сохраняют эту способность в течение длитель-
ного времени. Поэтому это покрытие получило распространение
для пайки стальных деталей и деталей из медных сплавов в радио-
технической и электротехнической промышленности. Кроме того,
пайка облегчается из-за более низкой температуры плавления
сплава. Особенно широко сплавы используются для пайки мелких
деталей, так как по сравнению с горячим оловянированием резко
снижаются непроизводительные расходы олова. На стальные
изделия целесообразно наносить подслой меди толщиной 1—3 мкм.
Пайка при этом получается особенно чистой. На латунные де-
тали, содержащие цинк, следует осаждать подслой никеля, чтобы
предотвратить диффузию цинка в сплав. Пайка осуществляется
низкотемпературными припоями с применением неактивированных
флюсов. После оплавления покрытие не подвержено иглообразо-
ванию и имеет более высокие эксплуатационные характеристики.
Оплавление производят при температуре 240—280 °C в течение
0,25—0,35 мин в касторовом или в любом другом масле с темпера-
турой воспламенения более 260 °C.
Электролиты для нанесения сплава олово—свинец. Потенциалы
свинца и олова различаются между собой лишь на 14 мВ, поэтому
разряд их ионов протекает при незначительной поляризации,
что создает условия для их совместного осаждения из растворов
простых солей. На практике используют в основном фторбо-
ратный электролит. Состав катодного осадка определяется соот-
ношением в электролите олова и свинца. Меняя концентрацию
солей этих металлов, можно практически получать сплавы любого
состава. Выход по току во всех электролитах приближается
к 100 %. Рассеивающая способность электролитов невелика, так
267
22.1. Составы (г/л) фторборатных электролитов
для нанесения сплава олово—свинец и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3 4 5
Составы сплавов
о-с (12) о-с (25) о-с (60) о-с (30) б О-С (60) б
Pb(BF4)2 (в пересчете на РЬ) Sn(BF4)2 (в пересчете на Sn) HBF4 (свободная) Н3ВО3 (свободная) Клей мездровый Гидрохинон Синтанол ДС-10 Лимеда ПОС-1 (к, А/дм2 t, °C Скорость осаждения, мкм/ч 60—88 6—10 50—100 25—40 0,5—1,0 0,8-1,0 1—2 18—30 0,5—1,0 65—74 18—25 50—100 25-40 1—2 0,8—1,0 1—2 18—30 0,5—1,0 23—42 35—60 40—100 25—40 3—5 0,8—1,0 1—2 18—30 0,5—1,0 7—10 7—10 50—300 15—35 5—15 0,3—0,8 2—4 15—25 1—2 11—15 5,5—8,5 100—350 15—35 5—15 0,3—0,8 3—4 15—25 1,5—2,0
как осаждение происходит при низкой поляризации. Для увели-
чения рассеивающей способности уменьшают концентрацию со-
лей Sn и РЬ и увеличивают концентрацию свободной борфтористо-
водородной кислоты, а также вводят ПАВ. Наличие в электролите
избытка борфтористоводородной кислоты необходимо также для
увеличения электропроводности и нормального растворения ано-
дов. Избыток Н3ВО3 препятствует гидролизу солей, поддерживая
pH на заданном уровне. Добавки гидрохинона предохраняют
от окисления Snz+ в Sn4+. В табл. 22.1 приведены составы фтор-
боратных электролитов.
В электролиты 1—3 вместо клея можно вводить 1—2 г/л пеп-
тона. На стальные детали сплавы наносят по подслою меди или
никеля. Электролиты 1 и 4 применяют для деталей сложной кон-
фигурации и во вращательных установках при плотности тока
1—3 А/дм2, pH 1. Анодная плотность тока 1—2 А/дм2.
Все электролиты надо перемешивать при помощи качающихся
катодных штанг. Аноды применяют бессурьмянистые, марок С-1,
С-2 и 0-1, 0-2. Завешивают их раздельно, распределяя силу тока
пропорционально составу сплава. Например, при осаждении
сплава О—С (60) 60 % тока поступает на свинцовые аноды и
40 % — на оловянные. Сплав можно наносить на сталь, медь и
другие металлы.
Приготавливают электролит следующим образом. Часть борфто-
ристоводородной кислоты вводят в предварительно смоченный
268
водой карбонат свинца или оксид свинца. Остальную часть кислоты
небольшими порциями вливают в смоченный водой карбонат меди.
В полученный раствор фторбората меди, нагретый до 55'°С, вводят
олово в виде гранул или стружки. В момент окончания реакции
раствор становится прозрачным. Оба раствора сливают в рабочую
ванну и добавляют клей, растворенный в горячей воде, и гидро-
хинон. Если количество свинца в сплаве больше нормы, его оса-
ждают серной кислотой из расчета 0,25 мл на 1 г свинца.
Наряду с фторборатными применяют кремнефторидные элек-
тролиты. Для осаждения сплава О—С (50) применяют
фторидный электролит
работы:
PbSiF,................
SnSiFe................
H2SiFe (свободная) ....
следующего состава (г/л) при
н;ремне-
р\ежиме
70—100
70—100
60—100
Клей столярный
iK, А/дм2 . . . .
t, °C.........
i—2
а-з
20-430
состав (г/л) при режиме
ia, А/дм2..................
t, °C..................
pH ....................
Выход по току, % .
работы
0,1—1\
60 \
9
95—100
20
15—20
120
0,5—4
Весьма перспективным является пирофосфатный электролит.
Из него получаются покрытия, которые имеют мелкокристалличе-
скую структуру. Электролиты имеют более высокую рассеиваю-
щую способность. Они не агрессивны и просты в приготовлении.
Электролит имеет следующий
Sn2P2O7.
Pb(NO3)2
Na4P2O7
iK, А/дм2
Осаждение ведут при сильном перемешивании. При повыше-
нии плотности тока и температуры содержание олова в электролите
повышается.
§ 22.2. ПОКРЫТИЕ СПЛАВОМ ОЛОВО — НИКЕЛЬ
Сплав Sn—Ni с содержанием 35—40 % никеля яв-
ляется катодным покрытием по отношению к стали, но, несмотря
на это, может применяться в качестве защитного покрытия, так
как имеет высокую химическую стойкость в условиях повышенной
влажности и в среде, содержащей сернистые соединения. Микро-
твердость покрытий 5—7 ГПа; износостойкость их в несколько раз
выше, чем никеля; могут эксплуатироваться в сухом воздухе при
температуре до 300—350 °C; устойчивы в слабых растворах соля-
ной, серной и азотной кислот, в концентрированных соляной и
серной кислотах разрушаются довольно быстро; не взаимодей-
ствуют с маслами.
Сплав Sn—Ni хорошо полируется, выдерживает запрессовку,
но не рекомендуется для деталей, подвергаемых развальцовке и
ударным нагрузкам, из-за высокой хрупкости. Имеет высокое
переходное сопротивление, которое не меняется при эксплуатации.
Покрытия, содержащие 65 % олова, могут применяться для
замены трехслойного покрытия медь—никель—хром с медным
269
подслоем, к/оторый необходим потому, что так же, как и никель,
имеет многб пор. Толщина медного подслоя 30 мкм, толщина по-
крытия олдво—никель 15 мкм. На медные и латунные детали можно
непосредственно наносить сплав толщиной 5—15 мкм; цвет
сплава — бледно-желтоватый.
Сплав олово—никель можно наносить вместо олова на детали,
подлежащие пайке, в тех случаях, когда требуются высокие ме-
ханические свойства. Применяют сплав и в ювелирном деле в ка-
честве подслоя под драгоценные металлы, так как золото не диф-
фундирует в сплав. Весьма эффективным оказалось применение
сплава/ для покрытия арматуры различных неразъемных контак-
тов, запрессованных в пластмассу, а также колпачков гальваниче-
ских /элементов.
Нормальные потенциалы олова и никеля различаются между
собой приблизительно на 0,1 В, поэтому сближение потенциалов
разряда возможно в растворах хлоридов олова и никеля при
добавлении фторидов натрия и аммония. На качество осадка эти
солд оказывают различное влияние. В присутствии фторида на-
трия осадки получаются матовыми и эластичными, а в присут-
ствии фторида аммония—блестящими и хрупкими.. Однако
одновременное введение этих солей вызывает осаждение блестя-
щих и эластичных покрытий. Большое значение имеет кислот-
ность электролита. При pH 2—2,5 и температуре 50—70 °C полу-
чаются блестящие покрытия, а при pH 4,5 осадки имеют блеск
/только при более низких температурах — 45—50 °C.
I Для осаждения сплава никель—олово применяют фторхло-
ридный электролит следующего состава (г/л) при режиме работы:
NiCl2-6H2O .............
SnCl2 ..................
NH4C1...................
NH4F....................
iK, А/дм2...............
250—300
40—50
100
60
1
А/дм2...............0,5—1
t, °C..................50—60
pH ....................3,5—4,5
Выход по току, % ... . 96—98
Аноды — раздельные, причем площадь оловянных анодов
должна быть в пять раз меньше никелевых. Можно применять и
аноды из сплава, содержащего 30 % никеля и 70 % олова. Такой
сплав получают термическим путем. Для приготовления элек-
тролита фторид аммония растворяют в горячей воде, а затем до-
бавляют остальные компоненты и подкисляют раствор до указан-
ного значения pH.
§ 22.3. ПОКРЫТИЕ СПЛАВОМ ОЛОВО — ВИСМУТ
Добавки висмута позволяют предотвратить переход
белой модификации олова в серую и снижают вероятность игло-
образования. Покрытия сплавом О—Ви (99,8) рекомендуются
в качестве защитных для деталей, подлежащих пайке. Толщина
покрытия устанавливается равной толщине олова, эксплуатируе-
мого в таких же условиях.
270
Сблизить потенциалы осаждения можно лишь при небольшой
концентрации висмута. Так как висмут в щелочных растворах
легко разлагается, применяют сульфатные электролиты с орга-
ническими добавками. Плотные <
трации висмута 0,8 г/л.
Для осаждения сплава с 1—2
тролит следующего состава (г/л)
SnSO4 .....................45—50
Bi2(SO4)8................1,5—2
H2SO4 .................... 100
NaCl.....................0,1—1
>садки получаются при концен-
% висмута рекомендуется элек-
при режиме работы:
Формалин, мл/л..........5—10
Блескообразующая добавка,
мл/л...................... 5
«к, А/дм2............... 1—3
t, °C..................... 25
Блескообразующая добавка представляет собой продукт кон-
денсации уксусного альдегида и ацетона в щелочной среде.
Аноды — из олова. Сульфат висмута можно заменить на ни-
трат висмута. Анодная плотность тока в два раза меньше катод-
ной. Аноды помещают в чехлы из ткани «хлорин». На анодах
в отсутствие тока происходит контактное выделение висмута,
поэтому в перерывах их следует вынимать.
Выход по току приблизительно равен 100 %. Покрытие имеет
прочное сцепление с медью и ее сплавами. В начале электролиза
необходим толчок силы тока до 2—4 А/дм2 для улучшения сцеп-
ления с основным металлом. При увеличении концентрации солей
висмута увеличивается скорость контактного выделения висмута,
поэтому Bi(NO3)3 или Bi2(SO4)3 должно быть не более 1—2 г/л.
Для получения блестящих покрытий вводят смесь различных
блескообразователей: 0,6 г/л фурфурола в сочетании с 20 г/л
формалина и 0,7 г/л камфары. Такой электролит имеет высокую
рассеивающую способность и обладает выравнивающим эффектом.
Приготовляют электролит так же, как сульфатный электролит
оловянирования, затем в небольшом количестве готового электро-
лита растворяют соль висмута и вливают ее в раствор. Так же
поступают с добавкой ОС-20. После проработки электролита током
при плотности 0,5—1,0 А/дм2 вводят блескообразователи.
Продукт конденсации ацетона приготовляют следующим об-
разом: 730 мл ацетона смешивают с 33 мл 25 %-ного водного рас-
твора аммиака и 400 мл 50 %-ного раствора гидроксида натрия.
Непрерывно охлаждая смесь, к ней по каплям добавляют 400 мл
уксусного альдегида. В результате конденсации образуется верх-
ний слой коричневого цвета, который и добавляют в электролит.
§ 22.4. ПОКРЫТИЕ СПЛАВОМ ЦИНК — КАДМИЙ
Сплав Zn—Cd обладает защитными свойствами, не
уступающими кадмиевым покрытиям, но стоит намного дешевле.
Наиболее высокой коррозионной стойкостью обладают покрытия,
содержащие 83 % кадмия и 17 % цинка. Их можно эксплуатиро-
вать в условиях морской атмосферы.
271
Близость стандартных потенциалов цинка и кадмия позво-
ляет осаждать сплав из растворов простых солей после достиже-
ния предельного тока по кадмию, потенциал разряда которого
имеет более положительное значение. Сплав, содержащий 5—10 %
кадмия, можно получать во фторборатном электролите следую-
щего состава (г/л) при режиме работы:
Zn(BF4)2 .................. 180—200
Cd(BF4)2 ....................60—70
NH4BF4.......................50—60
HBF4 (свободная)...........30—50
Клей столярный.............. 1
iK, А/дм2................1,5—2,0
Л °C......................18—45
pH.......................... 1
Аноды — пластины из сплава, содержащего 90 % Zn и 10 % Cd.
Для осаждения сплава, содержащего 18—23 % Zn и 77—82 %
Cd, Г. К. Буркат и М. К. Косырева рекомендуют следующий
состав цианидного электролита (г/л) при режиме работы:
Cd (в пересчете на металл). . 4—6
Zn (в пересчете на металл). . 26—24
KCN (свободный).................18—20
КОН.......................60—70
|к, А/дм2................... 2
Л °C......................18—20
Аноды — из сплава, содержащего 80 % Cd и 20 % Zn.
§ 22.5. ПОКРЫТИЕ СПЛАВАМИ НА ОСНОВЕ ЖЕЛЕЗА
Сплав Ni —Fe используется как подслой при нанесении
никелевых покрытий, в качестве защитно-декоративных покры-
тий, а также для получения магнитомягких осадков.
Осаждение сплава можно производить в сульфатных, хлорид-
ных, сульфаматных и других электролитах. Для получения спла-
вов со специальными свойствами в электролиты вводят органиче-
ские добавки, которые содержат сульфогруппу, что способствует
снижению внутренних напряжений. Осаждение рекомендуется
вести при температуре 50—60 °C. Чтобы состав сплава был равно-
мерным по толщине, процесс осаждения производят при непрерыв-
ном перемешивании электролита. Для получения сплава, со-
держащего 20 % железа, используют электролит следующего
состава (г/л) при режиме работы:
FeSO4-7H2O................. 2
NiSO4-7H2O................ 60
HSBOS...................... 25
Сахарин ................... 0,8
Лаурилсульфат натрия . . . 0,4
«к. А/дм2.................... 4
Сплавы хрома с железом, никелем и кобальтом обладают вы
сокой стойкостью к окислению и жаростойкостью.
Сплав железо—хром можно получать в электролите следую
щего состава (г/л) при режиме работы:
Cr2(SO4)8-5H2O............. 160
Гликоль (аминоуксусная
кислота).................... 150
FeSO4-7H2O.................30—50
iK, А/дм2................. 7—12
i, °C..................... 20
Выход по току, % . . . 20—26
Аноды...............Сталь 12X17
272
Для приготовления электролита соль хрома растворяют в ди-
стиллированной воде, добавляют гликоль и кипятят 30 мин, после
охлаждения добавляют сульфат железа (II). Для предупреждения
гидролиза в электролит добавляют щавелевую кислоту.
Сплав железо—хром—никель осаждают в электролите сле-
дующего состава (г/л) при режиме работы:
FeSO4-7H2O................. 50—60
Cr2(SO4)s-15H2O ......... 250—280
NiSO4-7H2O................100—110
Мочевина ...............150—180
Н,ВО8...................... 25
iK, А/дм8....................... 6—16
i, °C........................ 50
pH ...................... 2,1
Аноды....................Платин a
Сплав содержит 8—17 % хрома и 13—20 % никеля.
РАЗДЕЛ VII
ЭЛЕКТРОЛИТИЧЕСКИЕ ПОКРЫТИЯ
АЛЮМИНИЯ, МАГНИЯ, ЦИНКА, ТИТАНА
И ИХ СПЛАВОВ
ГЛАВА 23. ПОКРЫТИЯ АЛЮМИНИЯ и ЕГО СПЛАВОВ
Алюминий и его сплавы находят большое применение
в народном хозяйстве благодаря своим ценным свойствам (малой
плотности, хорошей теплопроводности, высокой электрической
проводимости, достаточно высоким механическим характери-
стикам).
На детали из алюминия и его сплавов покрытия наносят
с целью повышения коррозионной стойкости или придания поверх-
ности новых свойств. Это позволяет сочетать ценные свойства
алюминия со свойствами применяемых покрытий. Виды покрытий
и их назначение приведены в табл. 23.1.
Алюминий обладает рядом свойств, затрудняющих получение
качественных гальванических покрытий. Сложность нанесения
покрытий обусловлена наличием на поверхности алюминия и его
23.1. Виды и назначение гальванических покрытий
на алюминии и его сплавах
Назначение Вид гальванического покрытия
Защитно-декоративное Создание поверхностной проводи- мости Покрытие под пайку Повышение твердости, износо- стойкости Улучшение скольжения Предотвращение контактной кор- розии Предотвращение заедания резьбо- вых изделий Для сцепления с резиной Подслой для нанесения других видов покрытий Хромовое, серебряное, золотое, ро- диевое Серебряное, родиевое Оловянное, оловянно-свинцовое, олово-висмутовое, кадмиевое, серебря- ное, никелевое, медное Хромовое, никелевое » , оловянное Кадмиевое Цинковое Латунное Медное, никелевое
274
сплавов прочной и легко восстанавливающейся оксидной пленки,
препятствующей удовлетворительному сцеплению осаждаемого
металла с основанием. Образование на поверхности алюминиевых
сплавов оксидных пленок связано, в свою очередь, с высоким срод-
ством этого металла к кислороду. Другой важной причиной,
осложняющей технологию нанесения электрохимических покры-
тий на алюминий и его сплавы, является высокое отрицательное
значение потенциала алюминия и его стремление к переходу в ион-
ное состояние. Этот процесс вызывает контактное вытеснение из
растворов электролитов более электроположительных металлов:
цинка, меди, серебра, никеля, олова, хрома и т. д. Контактные
осадки не отличаются, как правило необходимым сцеплением.
Существенные затруднения в технологический процесс вносит
также взаимодействие алюминия с кислыми и щелочными элек-
тролитами, применяемыми для получения обычных гальваниче-
ских покрытий, а также наличие на поверхности литых алюминие-
вых изделий трещин и пор, в которых задерживаются эти элек-
тролиты.
Возможность наносить металлические покрытия на алюминий и
его сплавы появилась только после того, как удалось разработать
способы подготовки поверхности для удаления оксидных пленок
с поверхности покрываемых изделий и уменьшить активность
ионов осаждаемых металлов. Кроме того, удалось выбрать режимы
электролиза, сводящие к минимуму контактное вытеснение ме-
таллов. Особый способ подготовки поверхности и условия элек-
троосаждения, уменьшающие возможность контактного вытесне-
ния, очень важны для покрытия алюминия и его сплавов.
Различают следующие методы подготовки поверхности алю-
миния и его сплавов.
1. Увеличение шероховатости поверхности механическими ме-
тодами (пескоструйным, гидроабразивным) или химическими с при-
менением растворов фтористоводородной, соляной и трихлор-
уксусной кислот. Благодаря такой обработке удается получать
покрытия, хорошо сцепленные с основой, но с низкими декоратив-
ными и коррозионными свойствами. Широкого практического
применения этот метод на нашел.
2. Контактный метод — получение промежуточных пленок
контактного металла.
3. Электрохимическое осаждение.
4. Нанесение оксидной пленки.
Контактное осаждение цинка перед нанесением гальванических
покрытий. Сущность метода состоит в том, что для получения
промежуточной пленки контактного металла алюминий перед
нанесением покрытия погружают в агрессивные растворы, содер-
жащие ионы более положительного металла. В результате взаимо-
действия с раствором естественная оксидная пленка снимается
и выделяется слой контактного металла, на который затем нано-
сится покрытие. Травление поверхности в процессе контактного
275
обмена происходит неравномерно, и она становится шероховатой,
что улучшает условия осаждения и сцепления покрытий.
Для формирования контактной пленки используются щелочные
и кислые растворы. При погружении в щелочной раствор оксиды
алюминия растворяются с образованием алюминатов
А12О3 + 2ОН- 2АЮ2 + Н2О.
На практике используют цинкатный и станнатный растворы.
При активировании алюминия в растворе цинката натрия на его
поверхности образуется пленка контактного цинка
3ZnOl“ + 2Al + 2Н2О -> 2А1О2 + 3Zn + 4ОН’.
Раствор для цинкатной обработки в простейшем случае состоит
из 5—100 г/л оксида цинка и 50—500 г/л едкого натра. Обработку
ведут при температуре 15—30 °C в течение 0,5—1 мин. Качество
покрытий высокое. Это объясняется рядом факторов. Цинк в ще-
лочном растворе находится в виде комплексных ионов, потенциал
его выделения достаточно отрицателен и приближается к потен-
циалу алюминия. Вследствие высокого перенапряжения выделе-
ния водорода на циИке его осаждение не сопровождается заметным
выделением водорода. Пленки получаются плотными, тонкими.
Толщина и компактность цинковой пленки зависят от кон-
центрации раствора, соотношения компонентов, температуры и
времени выдержки в нем изделий. Из разбавленных растворов
получают крупнокристаллические пленки, в то время как осадки
на более концентрированных по цинку растворах имеют мелко-
кристаллическую структуру и обеспечивают хорошее сцепление
с гальваническим покрытием. С увеличением температуры и вре-
мени выдержки толщина пленок увеличивается. При недостаточ-
ной выдержке контактное покрытие не успевает затянуть основной
металл, при передержке образуется толстая рыхлая пленка.
Часто практикуется двукратная обработка в цинкатном рас-
творе. Для этого полученную при первой обработке пленку уда-
ляют травлением изделий в разбавленной азотной кислоте (1 : 1)
и после тщательной промывки вновь обрабатывают в растворе
цинката. Хотя механизм улучшения сцепления пленки при дву-
кратной обработке не вполне ясен, результаты такой обработки
для ряда сплавов весьма заметны, поэтому на практике она приме-
няется довольно часто.
Более равномерные по толщине покрытия цинка получаются
при добавлении к приведенному выше составу раствора хлорида
железа (2—3 г/л) и сегнетовой соли (8—10 г/л). Эти добавки осо-
бенно эффективны при обработке алюминиевых сплавов, содержа-
щих магний. При обработке дюралюминия (сплав алюминия
с медью) рекомендуется заменить оксид цинка в цинкатном рас-
творе эквивалентным количеством сульфата цинка. Рост пленок
в таких растворах быстро прекращается, поэтому в отличие от
276
простейшего раствора не требуется строгого соблюдения вре-
мени выдержки изделий. После нанесения контактного цинка на
нем можно осадить покрытия из других металлов. Непосредственно
на цинк можно наносить медь, никель и другие покрытия.
Цинкатный раствор легче всего готовить из сульфата цинка.
К 40—50 %-ному раствору едкого натра добавляют 30 %-ный
раствор сульфата цинка. При этом выпадает осадок гидроксида
цинка, который тут же растворяется в избытке щелочи.
Хлоридные растворы применяются для осаждения пленок кон-
тактного железа и никеля. Наибольший интерес представляет
осаждение никеля, поскольку его коррозионная стойкость выше.
Для выделения контактного никеля рекомендуется раствор, со-
держащий 1420—1450 г/л фосфорной кислоты и 20—45 г/л хло-
рида никеля (II) NiCl2-6H2O. Обработку рекомендуется проводить
при температуре 50—60 °C, время выдержки от 0,2 до 0,5 мин.
Для обработки в растворах, содержащих в качестве актива-
торов ионы BFJ, рекомендуют процесс Лимеда А1, при котором
в виде контактной пленки осаждается сплав цинк—никель,
состоящий из 60—70 % Zn и 30—40 % Ni, он менее активен, чем
чистый цинк. Для получения контактной пленки для всех сплавов
алюминия применяется раствор следующего состава (г/л):
Zn(BF4)2 20—40; Ni(BF4)2 200; NH4BF4 40. Режим работы: pH 4,2
(для сплава АЛ-9 pH 2,5), температура 18—20 °C. Время осажде-
ния (с) пленки зависит от типа сплава и составляет: 30—60 — для
алюминия и сплава Д-16; 45 — для сплавов АМг, АМц; 210—
360 — для сплава АЛ-2; 40—60 — для сплава АЛ-9. После вы-
держки деталей в растворе дается импульс тока ia =0,15 А/дм2
продолжительностью 20—30 с.
Для алюминия и его сплавов разработаны различные схемы
предварительной подготовки (табл. 23.2).
23.2. Схемы предварительной подготовки алюминия и его сплавов
Технологические операции подготовки алюминия и его сплавов
Чистый алюминий и его сплавы с марганцем Все сплавы алюминия, за исключением высококремнистых Высоко- кремнистые сплавы
Осветление в растворе 50 % -ной HNOs Промывка, контактное цинкование Двукратная промывка Обработка в 15 %-ном раство- ре H2SO4 Промывка, освет- ление в 50 % -ном растворе HNOS Промывка, кон- тактное цинкование, двукратная промыв- ка Контактное цин- кование, промывка Обработка в 50 % -ной азотной кислоте Промывка, кон- тактное цинкование, двукратная промыв- ка Обработка в смеси HNOS и HF (3 : 1) Промывка, контактное цинкование Двукратная промывка
277
На контактную пленку наносят медь из пирофосфатного или
цианидного (pH меньше или равно 10) электролита и матовый или
блестящий никель.
Электрохимическое осаждение цинка. Слой цинка можно
наносить электрохимическим способом. Этот способ пригоден
для алюминия и всех его сплавов, кроме сплавов, содержащих
более 30 % магния. По этому способу на детали осаждают очень
тонкий слой цинка из цианидного электролита следующего со-
става (г/л) при режиме работы:
ZnCl2...................
NaCN....................
NaOH ...................
0,5 iK, А/дм2...................... 0,6
0,5 t , °C........................18—20
10,5 т, с .......................... 20
Затем детали покрывают слоем латуни, никелируют в обычном
сульфатном электролите, подвергают термической обработке при
температуре 220—230 °C. Термообработка обеспечивает высокую
степень сцепления никеля с покрываемой поверхностью и может
быть использована для осаждения покрытий на детали для жест-
ких условий эксплуатации, а также на детали для последующей
пайки.
Оксидирование алюминия перед нанесением гальванических
покрытий. Для оксидирования алюминия и его сплавов перед
нанесением покрытий применяют растворы на основе щавелевой,
фосфорной, хромовой и других кислот. Наибольшее распростране-
ние для анодирования алюминия и его сплавов получили фосфат-
ные электролиты. Лучшие результаты дает анодирование в рас-
творе, содержащем от 250 до 500 г/л фосфорной кислоты при плот-
ности тока 1,3—2 А/дм2; напряжение на ванне 10—40 В. Продол-
жительность обработки при t = 184-35 °C составляет 10—15 мин.
Толщина и качество пленки зависят от напряжения, темпера-
туры и продолжительности обработки, а также от концентрации
кислоты. Необходимая степень пористости обеспечивается кон-
центрированными растворами кислоты и повышением температуры.
Для улучшения качества оксидных покрытий из фосфатных рас-
творов раствор рекомендуется перемешивать.
Диаметр пор оксидной пленки, полученной анодированием
в фосфорной кислоте, несколько больше диаметра пор пленок,
полученных другими методами, поэтому создаются благоприят-
ные условия для хорошей адгезии металлических покрытий.
Так как в сильнощелочных электролитах существует опасность,
что анодная пленка растворится до того как начнет осаждаться
металл, рекомендуется сначала нанести промежуточное покрытие
меди из пирофосфатного раствора.
Для анодирования алюминиевых сплавов перед нанесением
гальванических покрытий применяется также 20 %-ный раствор
серной кислоты. Анодная обработка ведется при 18—25 °C и плот-
ности тока 1 А/дм2, продолжительность обработки 10 мин. После-
дующая обработка анодированных деталей ведется в растворе
278
соды при температуре 50—55 °C в течение 2—3 мин. Этой методи-
кой пользуются при изготовлении биметаллических (алюминий—
медь) форм для офсетной печати. Осаждение меди на изделиях,
анодированных в серной кислоте, осуществляется из обычных
кислых электролитов.
Для анодирования может быть использован 3—5 %-ный рас-
твор щавелевой кислоты. Обработка ведется при плотности тока
0,5 А/дм2 в течение 10 мин. Напряжение в начале процесса 5 В.
Оно быстро повышается до 50 В. Полученная таким образом оксид-
ная пленка обрабатывается в цианидном растворе или в 1 %-ном
растворе плавиковой кислоты. Продолжительность обработки
составляет несколько секунд. Чтобы получить равномерную
оксидную пленку, детали после обезжиривания перед оксидиро-
ванием рекомендуется обработать сначала в растворе едкого натра
(50 г/л) при температуре 65—70 °C в течение 3—10 с, а затем в рас-
творе карбоната натрия (30 г/л) или тринатрийфосфата (30 г/л)
в течение 10 с. После этого детали промывают в холодной воде,
опускают на 10 с в концентрированную азотную кислоту, снова
промывают и переносят в щавелевую ванну для анодирования.
Непосредственное нанесение гальванических покрытий на алю-
миний и его сплавы. Разработаны способы непосредственного
покрытия алюминия и его сплавов в гальванической ванне. При
этих способах условия для хорошего сцепления покрытий с алю-
миниевой поверхностью создаются в самой ванне электрооса-
ждения.
Ю. Я. Лукомский с сотрудниками разработали технологические
процессы и электролиты меднения, никелирования, цинкования
алюминия и его сплавов.
Для непосредственного осаждения меди и никеля на алюминий
и его сплавы рекомендуют электролит (г/л) следующего состава
при режиме работы:
Для осаждения меди
CuSO4-5H2O................... 50
Na4P2O; • ЮН2О..............220
NaH2PO4-2H2O................. 15
NaNO2........................ 15
iK, А/дм2....................0,06
t, °C........................ 60
pH........................... 7,5
Для осаждения никеля
NiSO4-7H2O.................. 200
HSBOS........................ 25
NaF........................... 2
NaCl.......................... 2
KaS2O8........................ 2
«к, А/дм2................... 0,1
t, °C........................ 55
pH.......................... 4,5
Для непосредственного цинкования алюминия и его сплавов
можно применять электролиты следующего состава (г/л) при ре-
жиме работы:
№ 1
ZnSO4 ..............200
(NHJgSC^.............. —
Н8ВОз................ 30
NH4F................. 40
№ 2
75 ПАВ..................
25 iK, А/дм2..............
20 t, °C...............
30 pH ....................
№ 1
6
0,2
25
5,0
№ 2
6
0,1
25
5,0
279
Качество покрытий не зависит от состава и свойств покры-
ваемых сплавов. На качество покрытия и его сцепление с алю-
миниевой поверхностью влияют кислотность электролитов, до-
бавки активаторов, окислителей и температура электролиза.
ГЛАВА 24. ПОКРЫТИЯ МАГНИЯ, ЦИНКА, ТИТАНА
И ИХ СПЛАВОВ
Магниевые сплавы благодаря своим ценным свойствам
находят широкое применение в технике. Однако их использованию
препятствует недостаточная коррозионная стойкость в атмосфер-
ных условиях и в растворах электролитов. Для повышения кор-
розионной стойкости, износостойкости, электро- и теплопровод-
ности, а также способности к пайке на поверхность магниевых
сплавов наносят гальванические покрытия.
Трудности нанесения гальванического покрытия на магниевые
сплавы связаны с наличием на их поверхности оксидной пленки
и сильно электроотрицательным потенциалом магния, из-за чего
магний контактно вытесняет из растворов все применяемые в галь-
ваностегии металлы. В связи с этим основное внимание при нане-
сении гальванических покрытий уделяется процессу подготовки
изделий перед погружением в ванны. Для обеспечения прочного
сцепления гальванического покрытия с поверхностью магния
применяют следующее:
1) создание тонкого однородного неметаллического неоргани-
ческого покрытия, защищающего поверхность металла от не-
посредственного воздействия электролита; покрытие должно об-
ладать электрохимической активностью и способностью восста-
навливаться при катодной поляризации;
2) предварительное контактное осаждение цинка на поверх-
ность металла.
Практическое применение нашел второй способ. Для контакт-
ного цинкования применяют раствор следующего состава (г/л)
при режиме работы:
ZnSO4-7H2O..............
Na4P2O7 • 10Н2О........
Na2COs .............
40—50 KF......................
200—220 t, °C.................
4—6 т, мин...............
6—8
85—90
После осаждения слоя цинка на изделия и тщательной про-
мывки производят меднение в цианидном электролите следующего
состава (г/л) при режиме работы:
CuCN....................40—44
NaCN....................50—52
Na2COs .................29—31
KNaC4H4O«-4H2O........44—46
NaOH..................... 7—8
pH ...................9,6—10,4
t, °C...................65—70
280
Первые 0,5—1 мин электролиз ведут постоянным током, а за-
тем реверсивным током при тк = 15 с и та = 3 с. При этом оса-
ждаются блестящие покрытия.
Перед осаждением контактного цинка производят активирова-
ние поверхности магния в растворе следующего состава (г/л)
при режиме работы:
Н3РО4 ................ 190—195 t, °C . . .............18—25
KHF2 ................. 95—105 т, мин...................0,5—2,0
После меднения можно производить осаждение других метал-
лов (никелирование, серебрение, золочение, хромирование и т. п.)
из обычных электролитов.
Детали из цинковых сплавов подвергают гальванической обра-
ботке, обычно декоративному хромированию с подслоем меди и
никеля с целью защиты их от коррозии и придания им красивого
внешнего вида.
Трудности, возникающие при нанесении гальванических по-
крытий на цинк и цинковые сплавы, обусловлены электроотри-
цательным потенциалом и большой химической активностью их
как в кислых, так и в щелочных электролитах. Большие затрудне-
ния вызывает также пористость литых изделий из цинковых
сплавов, так как в поры во время электролиза могут попадать
различные растворы, которые в дальнейшем, реагируя с цинком,
могут вызывать отслаивание и разрушение покрытий.
Схема технологического процесса подготовки поверхности
покрытий деталей из цинковых сплавов выглядит следующим об-
разом:
1) шлифование;
2) полирование;
3) обезжиривание в органическом растворителе;
4) химическое обезжиривание при температуре 60—80 °C в рас-
творе следующего состава (г/л): Na3PO4-12Н2О 15—35; Na2CO3X
X ЮН2О 15—35; Синтанол ДС-10 3—5;
5) промывка в горячей воде;
6) электрохимическое обезжиривание в одном из следующих
растворов (г/л) при режиме работы:
Состав № 1
Na3PO4-12H2O.............20—40
Na2CO3-10H2O.............20—40
t, °C....................60—80
ia, А/дм2.............. 5—6
т, с...................20—30
Состав № 2
NaOH...................... 8—12
Na3PO4.12H2O.............. 4—6
Na2CO3-10H2O.............. 8-12
Стекло жидкое...........25—30
Сульфанол...............0,1—0,3
pH .....................9,3—10,5
t, °C.....................60—70
iK, А/дм2............... 1—2
т, с.................... 30
7) промывка;
8) активация в растворе 30—80 г/л H2SO4 при температуре
15—30 °C до начала выделения пузырьков газа;
281
9) гальваническое нанесение покрытий и далее по обычной
технологической схеме.
Применяются следующие гальванические покрытия: много-
слойные, медные и хромовые.
Многослойные покрытия (медь—никель—хром). Сначала про-
изводят нанесение тонкого слоя меди (предварительное меднение)
из цианидного медного электролита низкой концентрации
(pH 11—12), затем наносят медь из кислых электролитов, никель
и хром по обычной схеме.
Медные покрытия. Для меднения цинковых сплавов разра-
ботаны процессы нецианидного меднения Лимеда МЦАМ-1 и
Лимеда МЦАМ-2. Состав электролита (г/л) следующий для про-
цесса Лимеда МЦАМ-1 при режиме работы:
CuSO4-5H2O............................
Na4P2O7 • 10Н2О........................
Кислота салициловая....................
t, °C..................................
iK, А/дм2..............................
80—100
380—400
30—40
50—55
0,2—2,0 (до 5,0 А/дм2
при перемешивании
сжатым воздухом)
Цинковые покрытия. Цинкование проводят в специальном
выравнивающем растворе, содержащем (г/л) при режиме работы:
ZnSO4-7H2O.............. 450
NH4C1.................... 15
Н3ВО3.................... 15
Натрия цитрат............ 25
Кислота лимонная .... 25
Na2SO4-10H2O............. 15
Глицерин ................. 7
Сахарин ............... 18
Паратолуолсульфамид . . 2,7
Смачивающее вещество тер-
гитол, мл................. 5
t, °C.................... 46—48
pH.....................2,35—2,45
tK, А/дм2.............. 16—32
Никелирование цинковых сплавов проводят в специальных
электролитах. Приведем состав одного из электролитов для ни-
келирования (г/л) при режиме работы:
NiSO4-7H2O.............. 280—320
NiCl2-6H2O............. 40—60
Н3ВО3.................. 30—40
1,4-бутиндиол..........0,02—0,03
Сахарин ................ До 0,6
Бензолсульфамид .... 1—2
Каолин сухого обогащения 1—20
Аэросил А-380 ......... 0,1—2,0
Блескообразователь НИБ-3 6—10
Блескообразующая добав-
ка для никелирования . . 0,04—0,06
pH..................... 2,8—3,4
t, °C..................... 55—65
tK, А/дм2................... 2—7
Хромирование цинковых сплавов после полирования, обезжи-
ривания и активации в 0,1—0,5 %-ном растворе FeCl3 проводят
в тетрахроматном электролите при iK = 30-4-60 А/дм2.
Трудности при нанесении электрохимических покрытий на
титан и его сплавы обусловлены наличием на их поверхности
оксидной пленки, которая трудно удаляется и чрезвычайно легко
восстанавливается на воздухе, в воде и в различных растворах.
Подготовка титана к осаждению покрытий проводится двумя
способами. Первый способ состоит в обработке поверхности ти-
тана гидропескоструйным методом или корундовым порошком
282
зернистостью не более 0,3 мкм. Второй способ состоит в активации
поверхности в специальных растворах и нанесении пленки или
подслоя металла на поверхность перед нанесением гальванического
покрытия. Активация титана состоит в обработке поверхности
в смеси растворов кислот (масс, доли):
1) сплаву ВТ22, ВТ6, ОТ4— в растворе, содержащем 40 %-ную
фтористоводородную кислоту — 0,15; азотную кислоту (плот-
ность 1,35 г/см3) — 0,60, воду — 0,25;
2) сплав ВТЗ-1 — в растворе, содержащем 40 %-ную фтори-
стоводородную кислоту — 0,25, азотную кислоту (плотность
1,35 г/см3) — 0,40, воду —0,35.
Режим активации: t = 18-т-25 °C, т = 14-2 мин.
После активации проводят нанесение на титан гидридной,
хроматной пленки или подслоя цинка (или никеля). Гидридную
пленку получают обработкой в смеси концентрированных раство-
ров серной и соляной кислот, хроматную — обработкой в растворе
из 250 г/л Na2Cr2O7, 50 см®/л HF (40 %-ной), 5 г/л жидкого на-
триевого стекла.
Обработку проводят при температуре 18—90 °C в зависимости
от марки сплава.
Осаждение цинка и никеля осуществляют из растворов хлори-
дов с добавкой ионов F-. Составы растворов (г/л) приведены ниже:
Для осаждения цинка
ZnCl2.....................44—47
НР(40%-ная) ..............32—35
Этиленгликоль .......... 295—305
Для осаждения никеля
NiCla.......................20—30
KF.........................2,5—10
Гликокол.................25—35
pH.......................2,8—3,2
Гальваническое осаждение меди на детали из титановых спла-
вов проводится в цианидном, пирофосфатном или кислом элек-
тролите после нанесения гидридной пленки. Химическое никели-
рование и серебрение деталей проводят после нанесения гидрид-
ной пленки или подслоя никеля. Для улучшения сцепления по-
крытия с основой после нанесения покрытий проводят термооб-
работку при 350—400 °C в течение 1—3 ч. Хромирование проводят
по гидридной, хроматной пленке или подслою металла.
РАЗДЕЛ VIII
ОКСИДИРОВАНИЕ И ФОСФАТИРОВАНИЕ
МЕТАЛЛОВ И СПЛАВОВ
ГЛАВА 25. ОКСИДИРОВАНИЕ ЛЕГКИХ МЕТАЛЛОВ
§ 25.1. ОКСИДИРОВАНИЕ АЛЮМИНИЯ
И АЛЮМИНИЕВЫХ СПЛАВОВ
Стандартный электродный потенциал алюминия
—1,66 В, т. е. алюминий является электроотрицательным метал-
лом и поэтому термодинамически неустойчив. На воздухе алюми-
ний покрывается оксидной пленкой А12О3 толщиной 5—20 мкм,
наличие которой повышает электродный потенциал алюминия.
Эта пленка сообщает металлу некоторую пассивность, однако
вследствие малой толщины, высокой пористости и низкой меха-
нической прочности она не может надежно защитить сам металл
от коррозии.
Одним из лучших способов защиты алюминия от коррозии
является создание на его поверхности искусственных оксидных
пленок значительной толщины — оксидирование алюминия, кото-
рое может быть осуществлено электрохимической или химической
обработкой.
Анодное оксидирование (анодирование) алюминия. Оксидная
пленка, образующаяся в результате анодного окисления, хорошо
защищает основной металл от атмосферной коррозии, служит
хорошим грунтом под лакокрасочные покрытия, хорошо окраши-
вается. Пленка устойчива к воде и некоторым минеральным кисло-
там, однако легко растворяется в щелочах. Она состоит из кри-
сталлической у-модификации А12О3 и аморфного оксида алюминия.
Пленка имеет достаточную твердость: 5000—6000 МПа на техни-
ческом алюминии и 2000—5000 МПа на алюминиевых сплавах,
хорошо сопротивляется механическому изнашиванию. Пленка
обладает высокими электроизоляционными свойствами. Ее удель-
ное электрическое сопротивление 1014—1015 Ом-м.
При анодном окислении можно получать покрытия с задан-
ными свойствами. Покрытия могут быть твердыми и мягкими,
хрупкими и эластичными, пористыми и беспористыми и т. д.
В зависимости от назначения они делятся на защитно-декоратив-
ные, защитные, твердые, электроизоляционные, подслойные перед
нанесением металлического покрытия. Свойства покрытий обус-
ловливаются составом электролита и режимом электролиза. Изме-
284
25.1. Влияние режима анодирования на свойства оксидных покрытий
Изменение рабочих условий Свойства покрытий
предель- ная тол- щина твердость сцепление и адсорб- ционная способ- ность корро- зионная стойкость пористость
Повышение темпе- ратуры Повышение плот- ности тока Сокращение вре- мени анодного окис- ления Снижение концен- трации кислоты Применение пере- менного тока Умень- шается Увеличи- вается Проходит через максимум Увеличи- вается Умень- шается Умень- шается Увеличи- вается То же » Умень- шается Увеличи- вается Умень- шается То же » Увеличи- вается Проходит через максимум То же Умень- шается Проходит через максимум Умень- шается Увеличи- вается Умень- шается Увеличи- вается Умень- шается Увеличи- вается
няя эти параметры, можно получать покрытия с разными свой-
ствами. Влияние режима анодирования на свойства оксидных
покрытий из сернокислого электролита приведено в табл. 25.1.
В большинстве кислых и нейтральных электролитов поверх-
ность сразу покрывается тонким плотным слоем оксидов. В резуль-
тате электрохимического окисления алюминия в начальный пе-
риод электролиза на поверхности образуется тонкий слой оксидов
2А1 + ЗН2О -> А1203 + 6Н+ + бе.
Кислород в виде ионов проникает через пленку и вызывает
дальнейшее окисление металла (рис. 25.1).
С ростом толщины пленки проникновение через нее кислорода
все более затрудняется, поэтому ионам О2- приходится сообщать
все большую энергию путем повышения напряжения на ванне.
Образующийся плотный слой оксидов имеет толщину 0,01—
0,1 мкм и называется барьерным. Если не увеличивать напряже-
ние, рост его прекратится.
Дальнейший ход процесса зависит от способности электролита
растворять оксид алюминия. Если пленка нерастворима в элек-
тролите, то электролиз прекращается,
как только толщина пленки достигнет
предела, отвечающего приложенному
напряжению. Толщина таких пленок
не превышает 1—2 мкм. Эти пленки
практически беспористы, обладают
высоким электрическим сопротивле-
Рис. 25.1. Схема образования барьерного
слоя при оксидировании алюминия
285
Рис. 25.2. Схема образования и строения оксидных пленок
нием и используются в производстве электрических конденса-
торов.
Если оксидирование проводится в электролитах, способных
растворять оксид алюминия, то рост оксидной пленки зависит от
двух параллельных процессов, протекающих на аноде:
1) электрохимического окисления алюминия у основания пор
проникающими к поверхности ионами кислорода;
2) химического растворения пленки в электролите.
Рост пленки зависит от соотношения скорости этих процессов,
и этот рост возможен только тогда, когда скорость растворения
оксида ниже скорости его образования. Схема образования и
строения оксидных пленок показана на рис. 25.2. В начале окси-
дирования скорость первого процесса больше, чем скорость вто-
рого (иначе оксидный слой вовсе не может образоваться, напри-
мер, в соляной кислоте). Но с течением времени пленка со стороны,
обращенной к электролиту, становится все более пористой и рых-
лой. Площадь контакта ее с электролитом увеличивается, а это
приводит к дальнейшему увеличению скорости растворения.
В некоторый момент скорости образования пленки и ее растворе-
ния становятся одинаковыми и рост пленки прекращается, хотя
окисление металла, естественно, продолжается с прежней ско-
ростью.
Чем выше растворяющая способность электролита по отноше-
нию к оксиду алюминия, тем тоньше получаемая пленка. Раство-
ряющее действие электролита зависит от концентрации кислоты
в ванне, температуры и других факторов, подбирая которые,
можно регулировать ход процесса. Например, при оксидировании
в охлажденных до 0° и ниже растворах серной кислоты могут быть
получены пленки толщиной 100—300 мкм. При комнатной тем-
пературе в том же электролите образуются пленки толщиной до
20 мкм.
Кинетика роста пленок при анодном оксидировании в 15 %-ном
растворе серной кислоты показана на рис. 25.3 и 25.4. Толщина
286
Рнс. 25.3. Зависимость толщины оксидной пленки и выхода по току от коли-
чества электричества, пропущенного через электролит:
1 — выход по току; 2 — эквивалентная толщина; 3 — наблюдаемая толщина
Рис. 25.4. Зависимость толщины оксидной пленки и потенциала анода от вре-
мени оксидирования:
1 — толщина пленки; 2 — потенциал анода
барьерного слоя практически не меняется: увеличение толщины
оксида происходит благодаря росту пористой части пленки, об-
ращенной в сторону электролита.
Толщина оксидных покрытий зависит также от химического
состава и структуры оксидируемых сплавов (рис. 25.5). Чистый
алюминий легче подвергается анодному оксидированию, чем его
сплавы. Чем больше легирующих добавок в сплаве, тем труднее
получить достаточно толстые пленки на поверхности. Сплавы,
содержащие большое количество кремния, не поддаются декора-
тивному анодному оксидированию, поскольку кремний не окис-
ляется, не растворяется, а остается в пленке в виде серо-черного
порошка. Магний, железо, марганец, медь находятся в алюминие-
вых сплавах в виде интерметаллических соединений, которые
растворяются быстрее, чем алюминий, поэтому покрытие полу-
чается шероховатым. Для получения декоративных и эматаль-
пленок можно использовать сплавы, в которых содержание ле-
гирующих компонентов не должно быть более указанных
в табл. 25.2 значений.
Во всех случаях пленки состоят из двух слоев: беспористого
барьерного толщиной 0,01—0,1 мкм и пористого толщиной от
нескольких микрометров до нескольких сотен микрометров. Рост
пленки происходит на внешней, по-
ристой ее части, при этом барьерный
слой постепенно обновляется и как
бы перемещается в глубь металла.
Барьерный слой представляет
собой у-модификацию оксида алю-
Рис. 25.5. Зависимость толщины оксидной
пленки от количества пропущенного элек-
тричества при оксидировании алюминия и
его сплавов в серной кислоте:
/ — алюмниий; 2 — сплав типа АЛ; 3 — сплав
АМг; 4 — сплав Д1
26.2. Состав алюминиевых сплавов, применяемых при оксидировании
Назначение оксидных покрытий Содержание в сплавах, %
Fe Si Си Мп Mg Zn Сг Т1 Ni
Для получения де- коративных про- зрачных и бесцвет- ных покрытий 0,5 2—3 1—2 0,5-0,8 7 6—8 0,3 0,3 —
Для получения эматаль-пленок 1 2 1 8 8 1
миния А12О8. Внешний пористый слой состоит из более или
менее гидратированного оксида алюминия. Степень гидратации
оксида зависит от электролита, в котором производили оксиди-
рование. Для пленок, полученных в серной и щавелевой кисло-
тах, он соответствует формуле А12О3-Н2О. Пленки, полученные
в хромовой кислоте, практически безводны. Анодные пленки из
хромовокислых электролитов содержат помимо А12Оа до 0,5 % Сг.
В покрытиях из сернокислых и щавелевокислых электролитов
помимо оксида алюминия содержится вода.
Анодно-оксидное покрытие состоит из двух слоев: пористого
толстого внешнего и тонкого внутреннего, который является
плотным и электроизоляционным. Скорость формирования пленки
определяется плотностью тока; скорость ее растворения зависит
от природы и концентрации электролита и температуры на по-
верхности металла: чем выше плотность тока, тем скорее идет
образование пленки, чем выше температура и концентрация
электролита, тем больше скорость растворения.
Для получения защитно-декоративных оксидных пленок под-
бирают такие условия электролиза, при которых скорость обра-
зования превышает скорость растворения. Для получения твер-
дых, износостойких и электроизоляционных толстых пленок при-
меняют охлаждение (рис. 25.6); электролиз проводят при низкой
температуре (около 0 °C) и в электролите с менее выраженным
травящим действием.
Свойства оксидных пленок определяются толщиной, пористо-
стью и наличием примесей. Твердость и износоустойчивость по-
крытия тем выше, чем меньше пористость. Наличие примесей
значительно снижает твердость оксидных слоев. Адсорбционная
способность у пористых пленок выше; они хорошо окрашиваются
органическими красителями и неорганическими пигментами. Ше-
роховатость пленки различна в зависимости от типа электролита,
продолжительности оксидирования и продолжительности про-
цесса (рис. 25.7).
Диэлектрические свойства оксидной пленки зависят как от ее
толщины, так и от способа получения. Это видно из рис. 25.8,
288
Рис. 25.6. Влияние температуры и
продолжительности оксидирования
дюралюминия на толщину оксидных
пленок:
1 — 36 °C; 2 — 30 °C; 3 — 25 °C; 4 —
20 °C; 5 — 15 °C; 6 — 7 °C
Рис. 25.7. Изменение шероховатости
поверхности сплава АК4-1 в зави-
симости от типа электролита и ре-
жима анодирования
показывающего зависимость пробивного напряжения от времени
оксидирования постоянным и переменным током в различных
электролитах. Кривые 1 относятся к пленкам, полученным
в 2 % -ном растворе щавелевой кислоты; кривые 2 — в 2 % -ном
растворе серной кислоты; кривые 3 — в 2 %-ном растворе хро-
мовой кислоты. Пробивное напряжение пленок, полученных при
оксидировании постоянным током, выше, чем при оксидировании
переменным током.
Пористость и толщина оксидных пленок зависят от способ-
ности электролита растворять А12О8, поэтому от выбора ванны и
Рис. 25,8. Зависимость пробивного напряжения
оксидных пленок от продолжительности оксидиро-
вания постоянным (а) и переменным (б) током
(/ = 13-7-25*0
х/а Ю’Дасоян М. А. и др.
289
условий оксидирования в значительной степени зависят эксплуа-
тационные свойства покрытий.
Твердость оксидных пленок на алюминии зависит от вида об-
рабатываемого сплава и технологии их нанесения. Наибольшую
твердость имеют пленки, полученные на чистом алюминии в сер-
ной кислоте.
Анодное оксидирование проводят в сернокислом, хро-
мовокислом, щавелевокислом и сульфосалициловом электро-
литах.
Оксидные пленки, полученные из сернокислого электролита,
обладают высокой адсорбционной способностью и стойкостью
против коррозии. Важным достоинством данного электролита
является то, что в нем можно анодировать почти все алюминиевые
сплавы, в то время как в других электролитах, например в хромо-
вокислом, анодирование сплавов с высоким содержанием меди и
кремния затруднено. Анодное оксидирование в серной кислоте
требует примерно на 30—50 % меньшей затраты электроэнергии
по сравнению с анодным оксидированием в хромовокислом и
щавелевокислом электролитах и меньшей длительности обработки.
Наконец, разбавленная серная кислота, применяемая для состав-
ления сернокислого электролита, наиболее дешевая и доступная
из трех указанных электролитов.
К недостаткам сернокислого электролита относятся:
1) необходимость охлаждения электролита при работе и неко-
торая сложность технологического процесса анодного оксидиро-
вания, вызванная необходимостью последующей обработки окси-
дированных деталей горячим раствором хромата (наполнение
пленки) для повышения ее коррозионной стойкости;
2) невозможность длительного пребывания деталей в электро-
лите при случайном перерыве тока ввиду значительного раство-
ряющего воздействия серной кислоты на оксидную пленку и
металл;
3) необходимость применения специальной кислотоупорной
футеровки ванн.
В серной кислоте не рекомендуется обрабатывать детали, имею-
щие узкие щели, зазоры, клепаные соединения, от которых трудно
отмыть кислоту.
Хромовокислые электролиты анодного оксидирования реко-
мендуются для получения антикоррозионных пленок на деталях
сложной формы. К достоинствам данного электролита относятся:
сохранение шероховатости поверхности и размеров обрабаты-
ваемых деталей;
повышенная коррозионная стойкость пленок, полученных из
хромовокислых электролитов, благодаря чему они применяются
без дополнительной обработки;
высокие эластичность и пластичность пленок;
отсутствие отрицательного влияния на усталостные характе-
ристики деталей;
290
•в несколько раз большее электрическое сопротивление этих
пленок по сравнению с пленками такой же толщины, полученными
в сернокислом электролите.
Недостатки хромовокислых электролитов аналогичны указан-
ным для сернокислых. Дополнительно необходимо отметить вы-
сокую стоимость электролита и сложность контроля. Хромово-
кислый электролит в 5—8 раз дороже сернокислого, а контроль
обычно осуществляется потенциометрическим или кондуктометри-
ческим методом. Кроме того, к его недостаткам относятся необ-
ходимость подогревать электролит, длительность выдержки дета-
лей в ванне и использование постоянного тока довольно высокого
напряжения.
Анодное оксидирование в щавелевой кислоте служит для
получения электроизоляционных и износоустойчивых пленок.
Щавелевая кислота в качестве электролита оказывает относительно
слабое растворяющее действие на пленку. В связи с этим толщина
оксидного слоя растет почти пропорционально продолжительности
процесса.
Щавелевокислые электролиты просты по составу, не требуют
охлаждения, однако процесс анодного оксидирования в них про-
текает при высоком напряжении; продолжительность процесса
обычно больше, чем при других методах анодного оксидирования.
В табл. 25.3 приведена зависимость пористости оксидных по-
крытий от типа электролита и режима работы.
Пленки, полученные в щавелевокислом электролите, толстые,
эластичные, малопористые, обладают более высокими защитными
свойствами и пластичностью, чем полученные в серной кислоте.
Покрытия имеют цвет от светлого до темно-бронзового в за-
висимости от состава сплава.
В электролитах на основе борной и сульфосалициловой кислот
получают плотные тонкие пленки с высокими диэлектрическими
свойствами. Это обусловливается малой растворимостью оксида
алюминия в этих кислотах. Анодное оксидирование в фосфорной
25.3. Число пор в оксидных покрытиях в зависимости
от типа электролита
Электролит Темпера- тура, °C Напряже- ние, В Число пор п-10~18 на 1 м*
( 16 79,1
Серная (15 %-ная) 10 J 20 53,1
( 30 28,4
( 20 36,5
Щавелевая (2 %-ная) 24 4 40 11,9
(, 60 5,9
( 20 22,2
Хромовая (3 % -ная) 29 4 40 8,3
(, 60 4,3
V, 10*
291
кислоте применяют для получения подслоя под нанесение галь-
ванических покрытий.
В сернокислых электролитах оксидируют детали из алюминия
и его сплавов с целью повышения коррозионной стойкости и улуч-
шения товарного вида. Полученные пленки плотные и твердые.
Они обладают высокими защитно-декоративными качествами.
Серная кислота обладает сильным травящим действием, ко-
торое значительно увеличивается с повышением температуры.
Анодное оксидирование можно вести как постоянным, так и
переменным током.
Для анодного оксидирования алюминия и его деформируемых
сплавов с целью, получения покрытия Ан. Оке применяют элек-
тролит, содержащий 170—200 г/л серной кислоты. Температура
электролита 15—23 °C. Режим электролиза выбирают в соответ-
ствии с составом обрабатываемого сплава.
Аиодиая плот- Напряжение
ность тока, А/дм1 иа ваине, В
Алюминий и плакированный дюралюминий . . . 1—2 10—15
Дюралюминий и силумин................. 0,5—1 12—20
Продолжительность анодного оксидирования зависит от даль-
нейшей обработки покрытия и составляет: при оксидировании
с последующим уплотнением хроматами — 30—50 мин; при окси-
дировании с последующим адсорбционным окрашиванием пленки
органическими красителями — 60—80 мин.
Катоды — сталь марки 12Х18Н9Т, свинец, алюминий марки
А00. Для получения покрытия Ан. Оке. тв анодирование прово-
дят при пониженной температуре в растворах серной кислоты.
Рекомендуются следующие составы (г/л) сернокислых элек-
тролитов твердого анодирования при режиме работы:
№ 1 № 2
H2SO<................. 180—200 300—380
ia, А/дм8............ 2,5—5,0 0,5—2,5
t, °C................ О—(—7) (-5)-(-8)
т, мин............... 20—90 35—90
Катоды—сталь марки 12Х18Н9Т, свинец.
С увеличением концентрации серной кислоты пленка растет
медленнее, так как более концентрированная кислота быстрее
растворяет растущую пленку и она получается более пористой.
По-разному оксидируются различные сплавы. Чистый алюми-
ний и дюралюминий анодируются легче, чем кремнистые сплавы.
На силумине образуется более тонкая и менее пористая пленка,
чем на чистом алюминии.
Вредными примесями являются ионы хлора, в присутствии
которых происходит местное растравливание анодируемых дета-
лей. Вредное влияние на пленку оказывают ионы азотной кислоты.
В электролите накапливаются ионы алюминия, меди, кремния.
292
Максимально допустимое содержание примесей (г/л) в элек-
тролите: алюминия 25, азотной кислоты 0,2, соляной 0,1.
Приготовляют электролит разведением серной кислоты до не-
обходимой концентрации. При содержании в электролите более
25 г/л алюминия электролит заменяют.
Оксидирование в хромовокислом электролите более трудоемко
и менее экономично, чем в сернокислом. Поэтому этот электролит
используют только в специальных случаях, главным образом для
обработки клепаных и сварных конструкций, поскольку покры-
тия, получаемые из этого электролита, малопористы, обладают
более высокими защитными свойствами и эластичностью. В этих
электролитах обрабатывают также литейные кремнистые сплавы
типа АЛ2 и АЛ9. Сплавы, содержащие более 50 % меди или тяже-
лых металлов, не следует обрабатывать в хромовокислом элек-
тролите.
Для анодного оксидирования применяют растворы оксида
хрома (VI) с концентрацией 30—35, 50—55 и 100—150 г/л. Содер-
жание примесей в растворе не должно превышать 0,5 г/л SOI”
и 0,03 г/л С1_. В присутствии сульфат-ионов изменяется внешний
вид покрытия, а при большом их содержании процесс оксидиро-
вания замедляется.
В разбавленных электролитах (30—55 г/л СгО3) анодное
оксидирование проводят при температуре (40 + 2)°C и анодной
плотности тока 0,2—0,3 А/дм2. Напряжение на ванне поднимают
ступенчато: в первые 25 мин работы электролита напряжение под-
нимают до 40 В, выдерживают 35 мин, затем повышают в течение
5 мин до 50 В и выдерживают при этом напряжении 5 мин. В элек-
тролитах с содержанием 100—150 г/л СгО3 процесс ведут при тем-
пературе 34—38 °C, при анодной плотности тока 0,3—0,5 А/дм2
для алюминия и гомогенных сплавов и 0,4—2,5 А/дм2 для гете-
рогенных сплавов. В течение первых 5—10 мин напряжение на
ванне постепенно повышают до 40 В и выдерживают 60 мин. В ка-
честве катодов применяют алюминий АО, сталь 12Х18Н9Т или
графит. Во время электролиза на катоде может происходить окис-
ление Сг6+ до Сг3+, для уменьшения этого процесса отношение SK :
: Sa не должно превышать 5:1. Толщина пленок в хромовокислых
электролитах составляет в среднем 2—5 мкм.
Анодное оксидирование в щавелевокислом электролите менее
экономично по затратам электроэнергии и дороже по стоимости
материалов, чем сернокислый электролит. Однако в названном
электролите можно получать толстые эластичные пленки на боль-
шем числе сплавов, в том числе содержащих до 5 % меди или 4 %
кремния; его применяют главным образом для получения электро-
изоляционных покрытий. Оксидирование ведут в растворе щаве-
левой кислоты Н2С2О4, содержащем 40—60 г/л, постоянным током
при температуре 15—25 °C при 2,5—3,5 А/дм2 в течение 90—
120 мин. По мере увеличения толщины пленки увеличивается
электрическое сопротивление, и для поддержания постоянного
10 Дасояи М. А. и др.
293
25.4. Цвет оксидных пленок в зависимости от режима электролиза
Цвет пленки Толщина пленки, мкм Температура электролита, °C Плотность тока, А/дм1 Напря- жение, В
Серебристый 5 25 1,5—2,0 35—40
Желтый (под латунь) 15 40 3 50
Коричневый (под бронзу) 100 50 4—5 50
Примечания: 1. Электролит — 10 %-иый раствор щавелевой кислоты. 2. Продолжительность оксидирования 35—40 мин.
значения плотности тока к концу электролиза напряжение при-
ходится увеличивать до 120 В.
Более мягкое и эластичное покрытие, применяемое для прово-
локи и ленты, получают при анодном оксидировании переменным
током в растворах, содержащих 40—50 г/л щавелевой кислоты
и 5—10 г/л оксида хрома (VI). Температура электролита 25—
30 °C, плотность тока 1,5—4,5 А/дм2. При этом напряжение на
ванне повышается от 20 до 60 В. Продолжительность процесса
30—40 мин. Катоды — из свинца или коррозионно-стойкой стали.
В щавелевокислом электролите можно получать покрытия,
окрашенные в разные цвета. Цвет зависит от режима электролиза
(табл. 25.4).
Вредными примесями являются хлор (до 0,04 г/л) и алюминий
(до 30 г/л).
Оксид алюминия плохо растворим в сульфосалициловой кис-
лоте, поэтому в этих сульфосалициловых электролитах форми-
руются плотные тонкие пленки. Эти пленки эластичны и обладают
хорошими электроизоляционными свойствами.
При анодировании в сульфосалициловом электролите, со-
держащем до 100 г кислоты, напряжение на ванне поднимается
до 70—90 В. Температура анода в первые минуты быстро повы-
шается, при дальнейшем протекании процесса повышается незна-
чительно. Предполагают, что это объясняется волокнистым строе-
нием оксидных пленок, образующихся в сульфосалициловых
электролитах и имеющих поперечные поры, что способствует
лучшему теплообмену.
Для получения более толстого слоя оксида к электролиту до-
бавляют небольшое количество серной или щавелевой кислоты,
в которой растворимость оксида алюминия увеличивается.
На рис. 25.9 показано влияние концентрации серной кислоты
в сульфосалициловом электролите на толщину растворенного
оксида алюминия 6. Максимальная концентрация серной кислоты
определяется ее способностью растворять оксид алюминия. При
содержании более 30 г/л H2SO4 наблюдается растравливание
пленки и ее неравномерное образование.
294
u 2 4 6 8 10 11 Сц1№ч,г/л
Рис. 25.9. Влияние концентрации серной кислоты
на растворимость оксида алюминия в сульфосали-
циловом электролите. Время выдержки (мин):
240 — кривая 1\ 120 — кривая 2; 60 — кривая 3;
30 — кривая 4\ t= 32-5-37 °C
Практическое применение нашел трехкомпонентный электролит
(г/л), в котором получают покрытия типа Ан. Оке. тв, Ан. Оке. из,
Ан. цвет, при следующем режиме работы:
Сульфосалициловая кислота 90—100
Щавелевая кислота .... 27—33
H2SO4................... 2—4
ia, А/дм8..............1,5—3,0
/, °C................. 10—28
т, мин.............. 20—120
Катоды..............Сталь марки
12X18Н9Т
Оксидные пленки в зависимости от марки обрабатываемого ме-
талла или сплава и состава электролита имеют различную ок-
раску. Например, для приведенного трехкомпонентного электро-
лита чистый алюминий приобретает почти бесцветную окраску;
технический алюминий — светло-золотистую; сплав АМг-2 — зо-
лотистую с зеленоватым оттенком; сплав АМг-6 — черную; сплав
Д1Т и Д16Т — голубоватую; сплав В-95 незакаленный — от
серо-голубой до сине-черной.
Глубокое, или твердое, анодное оксидирование производится
для получения оксидных пленок толщиной 40—50 мкм, имеющих
высокую твердость, износостойкость и хорошие электроизоля-
ционные свойства. Этот процесс применяют для повышения из-
носостойкости трущихся поверхностей деталей, например зубча-
тых передач, для увеличения их сопротивления эрозионному
износу. Лучшее качество пленок получают на чистом алюминии и
его сплавах с магнием и марганцем (АМг, АВ, АД31), худшее —
на сплавах с содержанием меди выше 4,5 % (Д16, Д1, Д20).
Для получения пленок большой толщины необходимы такие
условия электролиза, при которых уменьшается растворимость
образующегося оксида. Одним из эффективных путей является
уменьшение температуры электролита и, желательно, обрабаты-
ваемого металла, т. е. анода. При повышении температуры на
каждые 22—23 °C скорость растворения оксидной пленки возра-
стает почти в 10 раз.
10* 295
25.5. Режимы электроизоляционного анодирования
Алюминий и его сплавы Напряжение начальное на ванне, В конечное Продолжи- тельность, мин Пробивное напряжение, В
Алюминий А7 Сплавы Д16 » AM 20—25 20—25 20—25 60—65 60—70 60—70 75—90 25—30 60—90 600—800 380—450 600—800
Для получения электроизоляционных покрытий высокого ка-
чества поверхность деталей должна иметь параметр шерохова-
тости поверхности Rz не более 1,6—0,8. Электроизоляционные
пленки получают в 15—20 %-ном растворе серной кислоты при
температуре от —5 до -|-2 °C и анодной плотности тока 2—5 А/дм2.
Напряжение на ванне зависит от материала детали, которая под-
вергается оксидированию (табл. 25.5).
Для глубокого анодирования деталей из сплавов алюминия
с медью и кремнием, например Д1 и Д6, предлагается проводить
электролиз с наложением переменного тока на постоянный при
суммарной плотности тока 5—10 А/дм2 и соотношении плотности
постоянного и переменного тока 3:1. Продолжительность элек-
тролиза для дюралюминия 20—40 мин, для силумина — 30—
90 мин, толщина пленки до 60 и 100 мкм соответственно. Увели-
чение продолжительности электролиза приводит к разрыхлению
пленки. Микротвердость покрытий на чистом алюминии состав-
ляет 4,9—5,1 ГПа, на сплаве Д16 3,24—3,53 ГПа.
Получение оксидных пленок большой толщины сопровождается
возрастанием электрического сопротивления оксидного слоя, уве-
личением напряжения на ванне, а следовательно, выделением
большого количества теплоты. В то же время процесс глубокого
оксидирования требует низких температур. Для поддержания
низкотемпературного теплового режима применяют особый элек-
трический режим процесса: постоянной или падающей мощности.
Мощность контролируют ваттметром. В первом случае процесс
начинают при высокой плотности тока, а затем поддерживают мощ-
ность постоянной. При этом напряжение возрастает, плотность
тока снижается, а количество выделяющейся (Дж) теплоты
остается постоянным
Q = IUi.
Во втором случае процесс также начинают вести при высокой плот-
ности тока, а затем происходит самопроизвольное падение всех
электрических параметров процесса: плотности тока, напряжения
и мощности. По сравнению с анодным оксидированием при по-
стоянной плотности тока режимы постоянной или падающей
мощности позволяют уменьшить продолжительность процесса
за счет применения высокой начальной плотности тока.
296
25.6. Составы (г/л) электролитов
эматалирования и режим работы
Компоненты электролита и режим работы Номер электролита
1 2 3
Щавелевая кис- 1—2
лота
HSBOS 8,0—10,0 1—2 3
Лимонная кис- 1,0—2,0 — •—
лота
Калий—титан 40—45 .—. —
оксалат
Железо (Ш)— — — —
алюминий оксалат
СгО3 .— 30—35 100
рн », А/дм2 2,9—3,1 — —
— 0,3—1,0 —
/, °C 55—60 40—45 45—45
и, в — 40—80 —
т, мин — 60 —
Рис. 25.10. Структура эма-
таль-пленок, полученных
при разных режимах работы:
1 — при постоянном токе; 2 —
при двухступенчатом увеличе-
нии напряжения; 3 — при трех-
ступеичатом увеличении напря-
жения
Твердые электроизоляционные покрытия получают в сульфо-
салицилатных и щавелевокислых электролитах. Напряжение
пробоя пленок, полученных из этих электролитов, достигает
400—750 В.
Эматалирование — процесс получения непрозрачных пленок,
напоминающих по внешнему виду эмаль. Пленки имеют высокую
твердость, большое удельное электрическое сопротивление, от-
личаются стойкостью к органическим растворителям, маслам,
органическим кислотам, к пищевым продуктам и напиткам.
Пористость эматаль-пленок ниже, чем других оксидных по-
крытий; она зависит от условий их получения и составляет 1,3—
5 %. Цвет пленок изменяется от светло- до темно-серого и зависит
от состава сплава. На практике для эматалирования применяют
электролиты двух типов:
1) на основе щавелевой кислоты с добавками других органи-
ческих кислот и их солей;
2) на основе хромовой кислоты с добавкой борной кислоты.
М. П. Грачева, А. И. Голубев и А. М. Гинберг с помощью
электронно-микроскопических исследований показали, что основ-
ной причиной возникновения эматаль-эффекта является изменение
структуры пленки при увеличении напряжения в процессе эмата-
лирования. Каждое изменение напряжения вызывает перестрое-
ние ячеистой структуры эматаль-пленки. При ступенчатом измене-
нии напряжения находящиеся рядом поры сливаются, оксидные
ячейки укрупняются. Каждому напряжению соответствует своя
система поры-ячейки (рис. 25.10). Разветвленная система пор
297
вызывает, по-видимому, рассеяние света, определяющее непрозрач-
ность пленки, — эматаль-эффект.
Для эматалирования применяют различные электролиты
(табл. 25.6). Электролит 1, содержащий калий—титан оксалат,
позволяет получать эматаль-пленки на многих сплавах алюминия
(АД1, АМг, АМц, Д16, АК4, АК6).
Пленки, полученные в электролитах эматалирования на основе
титановых солей, имеют низкую пористость, большую толщину
барьерного слоя и твердость, хорошую химическую стойкость
и высокие диэлектрические свойства. Недостатками электро-
литов являются нестабильность состава, высокое напряжение и
дороговизна титановых солей. Особенностью процесса является
регулирование не по плотности тока, а по напряжению. Детали
завешивают в ванну без тока. За 3 мин доводят напряжение до
60 В, затем в течение 10 мин — до НО—120 В и ведут процесс
при этом напряжении. Катодами служат коррозионно-стойкая
сталь, алюминий или свинец. Соотношение <Sa : SK = 3 : 1.
Электролит чувствителен к примесям. Содержание С1_ не
должно превышать 0,03 г/л. При заниженном pH пленка желтеет
и становится прозрачной, при увеличении pH — матовой, серой.
Электролиты 2 и 3 на основе хромовой кислоты имеют более
простой состав, более стабильны в работе и более дешевы. При
использовании их применяются более низкие напряжения. Эма-
таль-пленки, полученные из этих электролитов, имеют хорошие
диэлектрические и защитно-декоративные свойства. Катодами
служит коррозионно-стойкая сталь. Детали завешивают в ванну
без тока. Потом включают ток и в течение 5 мин плавно повышают
напряжение от 0 до 40 В. Затем в течение 30 мин напряжение
остается постоянным. Плотность тока при этом должна быть 0,4—
0,5 А/дм2. Затем напряжение повышают до 80 В, плотность тока
поднимается до 1 А/дм2. Обработку ведут еще 30 мин. Соотношение
плотностей тока анодной и катодной 2—3 : 1.
В присутствии сульфат-ионов образуются полупрозрачные
пленки; ионы NOg разрушают пленку; в присутствии ионов Сг3+
более 6—7 г/л образуются полупрозрачные пленки.
Химическое оксидирование. Оно не требует применения элек-
трического тока — самый простой и дешевый способ обработки
алюминия и его сплавов. Химическое оксидирование проводят
в растворах, содержащих хроматы (табл. 25.7). При химическом
оксидировании можно обрабатывать одновременно большое число
деталей. Пленки, полученные при химическом оксидировании,
имеют небольшую толщину (2—3 мкм) и значительно уступают
по защитным свойствам оксидным пленкам, получаемым электро-
химическим методом. По этой причине химическое оксидирование
алюминия и его сплавов имеет ограниченное применение.
При химическом оксидировании необходимо соблюдать режим
обработки и концентрацию компонентов в растворе. При увели-
чении концентрации щелочи и высокой температуре образуются
298
25.7. Растворы для химического оксидирования алюминия
и его сплавов (г/л) и режим работы
Компоненты раствора и режим работы Номер раствора
1 2 3 4
СгО3 3—4 5—8 4,4—5,2 5—10
Na2SiFe 3—4 —-- — .—
khf2 — 1,5—2,0 — —
K2Fe(CN)e — 0,5—1,0 — —
Ацетонитрил — -— 0,8—7,8 —
Композиция Ликоида 71 — — 2—4 •—
Н3РО4 — — — 40—60
NaF — — — 3—5
t, °C 15—30 15—30 18—30 15—30
Т, МИИ Цвет покрытия 8—20 1—5 0,5—5 5—20
Бесцвет- Желтый, Светло- Зеленый,
ный коричневый желтый, коричневый серо- голубой
рыхлые пленки; при низкой концентрации щелочи — тонкие
пленки.
Обработка анодно-оксидных пленок. Анодно-оксидные пленки
обычно подвергают дополнительной обработке: для повышения
коррозионной стойкости и электроизоляционных свойств пленки
уплотняют; для улучшения декоративного вида — окрашивают.
Для повышения коррозионной стойкости, светостойкости окра-
шенных пленок, повышения диэлектрических свойств применяют
особый способ обработки анодно-оксидных пленок, носящий
название уплотнения, основанный на способности анодных оксид-
ных покрытий поглощать воду. Оксид алюминия при этом гидро-
лизуется, превращаясь в гидроксид алюминия, который имеет
больший объем, чем оксид, и поры пленки заполняются. Наиболь-
шее распространение получили способы уплотнения в горячей
воде. Процесс гидролиза происходит при температурах, близких
к 100 °C. Процесс уплотнения можно ускорить, добавляя в раствор
соли и ПАВ. Качество уплотнения зависит от толщины пленки,
ее пористости, продолжительности обработки, температуры и
состава раствора.
Применяют способ уплотнения в растворе бихромата калия
(40—45 г/л) при температуре 90—95 °C, pH 4,5—5,0; продолжи-
тельность уплотнения 20—25 мин. Ускоренный способ уплотнения
состоит в обработке пленки в растворе следующего состава (г/л)
при режиме работы:
KjCrjOy............... 15 t, °C.................... . 90—95
NaOH ................. 3 т, мин................ 5—6
pH....................6,5—7,5
Цвет пленки, уплотненной в горячей воде, от светло-серого
до темно-серого. Пленка, уплотненная в растворах бихромата,
299
имеет цвет от светло-зеленого до желто-зеленого. Защитные
свойства пленок одинаковы.
Декоративные детали из алюминия и его сплавов после аноди-
рования окрашивают неорганическими красителями или подвер-
гают адсорбционному окрашиванию в водных растворах органиче-
ских красителей. В сочетании со специальной механической под-
готовкой поверхности такое окрашивание придает изделиям кра-
сивый вид. Наиболее пригодны для окрашивания пленки, получен-
ные из сульфатных электролитов при электролизе постоянным то-
ком, так как они бесцветны и прозрачны.
Благодаря высокой адсорбционной способности оксидные
пленки хорошо впитывают и удерживают неорганические и орга-
нические красители. Изделия окрашивают сразу после анодирова-
ния и тщательной промывки для удаления следов электролита.
Окрашивание производят путем погружения деталей в растворы
соответствующих красителей. Интенсивность окраски опреде-
ляется, главным образом, толщиной и пористостью пленки.
Окрашиванием органическими красителями можно получить
большую гамму цветов, однако светостойкость их невысока. Для
повышения светостойкости окрашенные детали обрабатывают
в растворе уксуснокислых кобальта и никеля и борной кислоты.
Окрашивание неорганическими красителями производится оса-
ждением в порах пленки цветного химического соединения. Для
этого анодированные изделия обрабатывают сначала в растворе
одной соли, затем промывают в воде и погружают в раствор другой
соли. Продолжительность обработки в каждом растворе составляет
приблизительно 5—10 мин; температура раствора — комнатная.
Для изделий, эксплуатируемых в жестких коррозионных усло-
виях, рекомендуется после сушки дополнительно пропитывать
пленку бесцветным лаком или парафином.
При окрашивании не происходит уплотнения пор оксидной
пленки. Для повышения коррозионной стойкости производят
уплотнение пор в горячей дистиллированной воде при pH 5,6—
6,5.
§ 25.2. ОКСИДИРОВАНИЕ МАГНИЯ И ЕГО СПЛАВОВ
Магний и его сплавы легко подвергаются коррозии.
Пленка, образующаяся на нем, практически не увеличивает его
стойкости, по-видимому, из-за недостаточной плотности. Защита
от коррозии необходима и при межоперационном хранении де-
талей. Оксидирование повышает стойкость магниевых сплавов
против коррозии, но все же недостаточно для сохранности изделий
в жестких условиях эксплуатации. Оксидные покрытия на магние-
вых сплавах можно получать химическим или электрохимическим
способом.
При химическом оксидировании происходит сильное раство-
рение магния, что приводите изменению размеров деталей. При
300
25.8. Составы (г/л) растворов для химического оксидирования
магниевых сплавов и режим работы
Компоненты раствора и режим работы Номер раствора
1 2 3 4
К2СГ2О7 40—50 20—25 150—160 30—50
HNOg 75—90 30—35 — —
NH4C1 0,8—1,2 1—1,5 —. —
СгО3 •— — 1—3 —
(NH4)2SO4 .— —. 2—4 —
CHgCOOH (60 %-ная) — —, 10—20 м/л 5—8 мл/л
Алюмокалиевые квасцы .—_ — *—— 8—12
/, °C 70—80 70—80 60—80 —
Т, МИН 1—2 2—5 1—2 —
анодном оксидировании получают твердые и износостойкие пленки.
В зависимости от способа получения детали для химического
оксидирования применяют растворы различного состава
(табл. 25.8).
Раствор 1 применяют для оксидирования литейных сплавов,
раствор 2 — для деформируемых магниевых сплавов. Для обра-
ботки деталей с точными размерами используют раствор 3, в кото-
ром магний практически не растворяется. Раствор 4 предназначен
для обработки точных деталей.
В зависимости от состава сплава цвет оксидной пленки раз-
личен: от золотистого до черного.
Электрохимическое оксидирование проводят в щелочных рас-
творах. При этом образуется гидрооксид магния. Оксидирование
проводят в кислых или щелочных растворах (табл. 25.9).
25.9. Составы растворов (г/л) для электрохимического оксидирования
магниевых сплавов
Компоненты электролита н режим работы Номер электролита
1 2 3 4
NaOH 140—160 50 — .—.
Na3PO4 — 3 —. —
Фенол 3—5 — — —
Na2O-SiO2 21—25 — — —
HBF — .— 60—80 —
Н3РО4 — — 300—400 300—400
KF — — 100—120 —
i, А/дм2 0,5—10 1,5 5 5
/, °C 60—70 70 70—80 15—30
и, В — — 70—90 120—150
т, мин 30 40 30—40 20—40
301
В электролите 1 образуются пленки толщиной 7—15 мкм от
серого до зеленого цвета, в электролите 2 — пленки серого цвета.
При оксидировании в кислых электролитах (растворы 3—5)
пленка содержит труднорастворимые соединения магния. В этих
электролитах обработку можно вести как переменным, так и по-
стоянным током. В электролите 3 получают твердые пленки
толщиной 30—50 мкм, в электролите 4 — толщиной до 5 мкм.
После промывки в воде и сушки на детали наносят слой лака.
ГЛАВА 26. ОКСИДИРОВАНИЕ ЧЕРНЫХ
И ЦВЕТНЫХ МЕТАЛЛОВ
§ 26.1. ОКСИДИРОВАНИЕ ЧЕРНЫХ МЕТАЛЛОВ
Оксидирование черных металлов применяется для за-
щиты их от коррозии, для придания поверхности красивой ок-
раски. Изменяя состав электролита и режим обработки, можно
получать покрытия с заданными свойствами: высокой твердостью,
износостойкостью и хорошими диэлектрическими свойствами. Ок-
сидная пленка на поверхности стали может быть получена по
одному из следующих способов: химической обработкой изделий
в щелочных или кислых растворах; электрохимической обработкой
изделий на аноде, проводимой в щелочи или хромовой кислоте;
наконец, термической их обработкой при относительно высокой
температуре (400—800 °C).
Наиболее распространено химическое оксидирование. Образую-
щиеся при этом черные пленки толщиной до 1,5 мкм могут слу-
жить защитно-декоративным покрытием для изделий, эксплуати-
руемых в легких коррозионных условиях. Защитная способ-
ность пленок может быть повышена пропитыванием маслом
или лаками. Химическое оксидирование может производиться
в кипящем концентрированном растворе щелочи, содержащем
окислители, или в растворе фосфорной кислоты. Оксидные пленки,
полученные химической обработкой в кислых растворах, помимо
оксидов железа содержат фосфаты. По этой причине они могут
быть названы оксиднофосфатными. Механические и защитные
свойства их несколько выше, чем у пленок после обработки в
щелочи. Оксиднофосфатные пленки служат хорошим грунтом для
лакокрасочных покрытий.
Электрохимическое оксидирование производится обработкой
изделий на аноде в щелочном растворе. Покрытия имеют лучшие
защитные свойства, чем полученные химическим путем. Однако
этот способ требует сложного оборудования, высокой трудоем-
кости и поэтому не находит практического применения.
Химическое оксидирование стали и чугуна. Такое оксидирова-
ние производят в растворах едкого натра с добавкой окислителей.
302
В достаточно концентрированном растворе едкого натра при вы-
сокой температуре в присутствии окислителей сталь растворяется
с образованием соли Na2FeO2
Fe + О + 2NaOH = Na2FeO2 + Н2О.
При большом содержании окислителя Fe2+ окисляется до Fe8+
и Na2FeO2 переходит в Na2Fe2O4. Эти две соли взаимодействуют
между собой с образовнием оксида железа Fe^j
Na2FeO2 + Na2Fe2O4 + 2Н2О = Fe3O4 + 4NaOH.
Образующийся оксид покрывает поверхность металла, кристалли-
зуясь из раствора. Сначала на поверхности появляются кристал-
лические зародыши, которые, разрастаясь, образуют сплошную
пленку. Структура пленки и ее толщина зависят от соотношения
скоростей образования центров кристаллизации и роста отдель-
ных кристаллов. При повышенной концентрации окислителей
в растворе скорость образования центров кристаллизации значи-
тельно превышает скорость их роста, и на поверхности быстро
образуется тонкий плотный слой оксида, в результате чего взаимо-
действие металла со щелочью прекращается. При повышенной
концентрации щелочи в растворе образуются более толстые, но
рыхлые пленки.
1 Перемешивание раствора приводит к уменьшению числа кри-
сталлических зародышей, и пленки получаются толстые, но рых-
лые. Понижение температуры влияет так же, как перемешивание.
Иногда на поверхности образуется красно-бурый налет гидрата
оксида железа (III). Оксидная пленка на среднелегированной стали
состоит не только из Fe3O4, но и из оксидов легирующих компо-
нентов. Толстые оксидные покрытия (толщиной 2—3 мкм), свобод-
ные от указанного налета, могут быть получены оксидированием
деталей в двух растворах, в первом из них концентрация щелочи
ниже обычной. В этом растворе поверхность изделия покрывается
тонкой пассивирующей пленкой, замедляющей растворение ме-
талла, а во втором, концентрированном, растворе продолжается
рост оксидной пленки без образования гидрооксидов железа.
Нитраты и нитриты, используемые в качестве окислителей,
по-разному окрашивают оксидную пленку: в присутствии нитра-
тов щелочных металлов образуются матовые пленки черного
цвета, а в присутствии нитритов — блестящие пленки с синеватым
оттенком. Первые из этих пленок обладают большей стойкостью
против коррозии, чем вторые.
Детали из цветных металлов, а также стальные, с частями из
цветных металлов (запайка оловом или свинцом, вкладыши и т. д.)
оксидированию в концентрированных щелочно-окислительных
растворах не подвергаются из-за возможности растравливания.
Универсальным щелочным раствором для оксидирования стали
и чугуна является раствор, содержащий (г/л):
303
NaOH .......................... 500—550
NaNO3......................... 50—100
NaNOa.......................... 200—250
Режим оксидирования зависит от марок металла:
t, °C т, мни
Среднеуглеродистая сталь............. 135—145 30—50
Низкоуглеродистая * ............ 145—155 40—60
Низко- и среднелегированная сталь . . 145—155 60—90
Оксидирование производится при температуре кипения раст-
вора, поэтому по мере испарения воды температура ванны по-
вышается. Для высокоуглеродистых сталей начальная температура
оксидирования составляет примерно 135—137 °C, а для легиро-
ванных сталей 140—145 °C.
Оксидные покрытия глубокого черного цвета образуются
только после накопления в растворе небольшого количества со-
лей железа, поэтому после приготовления раствора в ванну
завешивают стальные полосы и прорабатывают их в течение не-
скольких часов.
Оксидирующий раствор контролируют, наблюдая за темпера-
турой его кипения. Температуру кипения при повышении необ-
ходимо снизить до оптимальной и долить в раствор воду; при по-
нижении температуры кипения состав раствора корректируют до-
бавлением исходных компонентов до первоначальной концентра-
ции.
При погружении деталей в оксидирующий раствор необходимо
следить за тем, чтобы в углубленных частях деталей не оставался
воздух. Вся поверхность деталей должна свободно омываться
оксидирующим раствором. В процессе оксидирования при стацио-
нарных ваннах детали через каждые полчаса подвергаются про-
межуточным ополаскиваниям холодной водой. Постепенно в ваннах
накапливается осадок гидроксида железа, который периодически
удаляют при помощи специальных скребков.
После оксидирования и тщательной промывки от щелочи
детали рекомендуется промыть в нагретом до 90 °C растворе жид-
кого или ядрового хозяйственного мыла в течение 2 мин. Для
повышения защитных свойств изделия после сушки промасливают
путем погружения их в минеральное масло (машинное, веретенное,
авиационное и т. п.), нагретое до 100—110°С, или протирают про-
масленными салфетками.
Раствор для оксидирования готовят следующим образом. Ед-
кий натр загружают в емкость с отверстиями диаметром около
3 мм, завешивают в рабочую ванну с водой, выдерживают до
полного растворения. Затем вводят NaNO3 и NaNO2, раствор пере-
мешивают до полного растворения компонентов. Состав оксиди-
рующего раствора контролируют с помощью химического анализа,
определяющего содержание щелочи.
304
Об изменении состава раствора во время работы можно судить
по величине температуры кипения раствора. Повышение ее сви-
детельствует о необходимости добавления воды, понижение —
о добавлении щелочи. Зеленоватый оттенок пленки говорит
о необходимости добавления в ванну окислителей.
Электрохимическое оксидирование стали. Покрытия, получен-
ные при электрохимическом оксидировании стали, более корро-
зионно-стойкие, чем полученные при химическом оксидировании.
Эти пленки более толстые и менее пористые.
Электрохимическое оксидирование проводят после обезжири-
вания и активирования и анодной обработки в 5-%-ном растворе
К2Сг2О7 при температуре 45—55 °C, плотности тока 3—5 А/дм2
в течение 10—15 мин.
j Оксидирование можно проводить в щелочном и кислом раство-
рах (г/л) при следующем режиме работы:
7 Щелочной раствор
Кислый раствор
NaOH ................. 350—600
ta, А/дм2.............. 3—5
Л °C.....................65—80
т, мин.................10—30
I
Оксид но- фосфатн ые
покрытия
СгО3 ................ 150—250
HBF4..................... 1—2
ia, А/дм2............. 5—10
t, °C...................40—50
т, мин................10—15
стали. Оксидно-фосфатные
пленки имеют антикоррозионные, адгезионные и механические
свойства, значительно превосходящие свойства обычных оксидных
пленок.
В состав растворов входят ортофосфорная кислота и окисли-
тели: оксид марганца (IV), нитрат кальция или бария. Фосфаты,
входящие в состав пленок, образуются в результате взаимодейст-
вия металла и фосфорной кислоты. Образованию фосфатов спо-
собствует также препарат Мажеф. Иногда в раствор вводится до-
бавка ингибитора, предотвращающая образование белого налета
нерастворимых солей на обрабатываемых изделиях.
Составы наиболее часто употребляемых растворов для получе-
ния оксидно-фосфатных покрытий приведены в табл. 26.1.
Углеродистые и легированные стали можно обрабатывать во
всех растворах, чугун — в растворе 2, закаленные стали — в рас-
творе 4. Продолжительность обработки составляет 40—60 мин.
Уменьшение концентрации фосфорной кислоты и снижение тем-
пературы приводят к получению крупнокристаллических покры-
тий с пониженными защитными свойствами.
Процесс образования оксидно-фосфатных покрытий сопрово-
ждается выделением водорода. Признаком завершения процесса
оксидирования служит прекращение обильного газовыделения.
Детали, подлежащие оксидированию в кислых растворах после
операции подготовки поверхности (т. е. после обезжиривания,
промывки, травления или пескоструйной обработки), непосред-
ственно перед оксидированием промывают в разбавленном рас-
305
26.1. Состав (г/л) растворов для получения оксидно-фосфатных покрытий
и режимы обработки
Компоненты раствора и режим работы Номер раствора
1 2 3 4
Ca(NO3)2 Ba(NO3)2 MnO2 Н3РО4 t, °C 10—20 1—3 94—98 80—100 11,8—12,2 0,5—2,5 94—98 15—30 0,5—1,0 0,5—1,0 98—100 80—100 10—15 4—5 98—100
творе фосфорной кислоты (8—10 г/л) при комнатной температуре.
После оксидирования детали промывают холодной, затем горя-
чей водой, помещают на 2—3 мин в кипящий мыльный раствор,
высушивают и промасливают. По охлаждении детали протирают
от избытка масла и оставшегося налета.
Составление ванны оксидирования начинают с растворения
окислителя. Нитрат кальция растворяют в холодной воде, а нит-
рат бария —- в горячей воде при интенсивном перемешивании.
Оксид марганца (IV) для предотвращения взмучивания насыпают
в мешочки из хлопчатобумажной ткани, которые укладывают на
дно ванны. Контроль раствора осуществляется главным обра-
зом определением содержания в нем свободной кислоты и нит-
рата (кальция или бария).
Для определения содержания свободной кислоты 10 мл окси-
дирующего раствора титруют деци нормальным раствором едкого
натра в присутствии метилоранжа до изменения окраски раствора
(пожелтения). Израсходованный при этом определении объем
(в мл) титрованного раствора щелочи указывает на кислотность
раствора в «точках», как это принято при контроле растворов для
фосфатирования. Кислотность оксидирующего раствора может
колебаться в пределах 2—10 точек.
Низший предел свободной фосфорной кислоты, допустимый при
загрузке деталями, соответствует 3,5—4 «точкам». Контроль
раствора и корректировку его по нитрату производят периодиче-
ски, в зависимости от загрузки ванны, по результатам анализа
на нитрогруппу, с последующим пересчетом на соль кальция или
бария.
§ 26.2. ОКСИДИРОВАНИЕ ЦВЕТНЫХ МЕТАЛЛОВ
Одним из распространенных способов отделки поверх-
ности изделий из цветных металлов и сплавов является оксиди-
рование. В зависимости от условий оксидирования на различных
сплавах можно получить покрытия черного, синего или корич-
невого цвета.
306
Оксидирование меди и ее сплавов. Оксидные покрытия на меди
и ее сплавах можно получать химическим и электрохимическими
способами. Химическое оксидирование проводят в персульфатном
и медноаммиакатном растворах, электрохимическое — в щелочном.
Оксидная пленка на меди состоит из оксида меди (II) СиО
черного цвета с небольшим содержанием Си2О и имеет толщину
около 1 мкм при химическом способе оксидирования и 2—5 мкм —
при электрохимическом.
Оксидные покрытия на меди и ее сплавах могут иметь цвет
от светло-коричневого до черного. Цвет зависит от состава сплава,
на котором образуется покрытие, от состава раствора и режима
обработки.
Химическое оксидирование меди производят в медноаммиач-
ном растворе (г/л) при следующем режиме работы:
CuCOs-Cu(OH)2 ........ 150—200 t, °C..................30—40
NH4OH................. 860 т, мин.................10—15
Химическое оксидирование меди и ее сплавов, содержащих не
менее 90 % меди, наилучшие результаты дает при обработке в го-
рячем растворе персульфата калия, содержащего следующие ком-
поненты (г/л), при режиме работы:
K2S2O8..................13—17 t, °C..................60—65
NaOH .................. 40—60 т, мин..................5—10
NaNOs....................5—10
В персульфатном растворе покрытия получаются от светло-
коричневого до черного цвета.
Механизм оксидирования в персульфатном растворе можно
представить следующим образом. В щелочном растворе медь
окисляется с образованием Na2CuO2
Си 4~ 4NaOH K2S2Og —> Na2CuO2 Na2SO4 4~
+ K2SO4 4- 2H2O,
где Na2CuO2 — неустойчивое соединение, которое распадается
с образованием оксида меди (II) черного цвета, осаждаемого на
поверхности металла:
Na2CuO2 4- Н2О -* СиО 4* 2NaOH.
Толщина оксидной пленки зависит от условий кристаллизации:
если скорость образования центров кристаллизации больше ско-
рости роста кристаллов, получают тонкие плотные пленки, и
наоборот. ^Увеличение концентрации СиО у поверхности способ-
ствует образованию тонких пленок, к этому приводят снижение
концентрации щелочи и повышение содержания персульфата
калия.
Изменение температуры раствора от 60 до 100 °C мало влияет
на толщину и свойства оксидных пленок. Однако при температурах
выше 60 °C усиливается разложейие окислителя, а при более
307
26.2. Составы композиций Ликонда для оксидирования меди и ее сплавов
Номер состава Композиция Ликонда Концентра- ция, г/л Режим обработки Цвет покрытия
t, °C Т, мин
1 61А 61Б 165—500 16,5—50,0 15—30 2—3 Темно-коричневый, чер- ный
2 61А 61В 60—80 6—8 15—30 1—3 Светло-коричневый
3 61А 61В 90—145 9,0—14,5 15—30 1—3 Коричневый
низких температурах уменьшается механическая прочность и ухуд-
шается внешний вид пленки.
Для получения на меди и ее сплавах покрытий от светло-ко-
ричневого до черного цвета разработаны специальные составы —
композиции Ликонда 61А, 61Б, 61В (табл. 26.2).
Для оксидирования латуни и томпака применяют медноам-
миачные растворы, для бронзы — персульфатные (табл. 26.3).
Недостаток персульфатного раствора: ограниченная область
применения — только для меди и для сплавов с большим содержа-
нием меди. Другой недостаток: необходимость строгого соблюдения
температурного режима. При снижении температуры ухудшается
26.3. Составы (г/л) растворов и режимы оксидирования сплавов меди
Компоненты раствора и режим работы Сплав меди
латунь томпак бронза
Номер раствора
1 2 3 4
СиСО3 -Си(ОН)2 NH4OH Na2CO3- ЮН2О Na2S2O8 или K3S2O8 NaOH NaNO3 t, °C т, мин 15—20 65—80 15—30 3—10 35—40 147—152 15—30 3—20 4—6 108—135 2—4 85—90 5—10 13—17 40—60 5—10 95—97 2—3
Примечание. Обработку латуни проводят последовательно в раство-
рах 1 и 2 без промежуточной промывки.
308
качество пленки, при повышении — ускоряется разложение пер-
сульфата калия.
Недостатками медноаммиачного способа являются следующие.
1. Медноаммиачный способ оксидирования обеспечивает полу-
чение черных пленок только на латуни, содержащей 65 % меди.
Латунь с другим содержанием меди после оксидирования приобре-
тает темно-синюю окраску.
2. Состав ванны (концентрация аммиака в растворе) в про-
цессе работы быстро меняется.
3. Оксидные пленки, полученные данным способом, обладают
низкой механической прочностью и для защиты от повреждений
их требуется покрывать бесцветным лаком.
Для повышения защитных свойств пленок, полученных на
латуни, их рекомендуется перед оксидированием обрабатывать
в растворе бихромата калия в серной кислоте, а затем в 5 %-ном
растворе серной кислоты.
Электрохимическое оксидирование меди и ее сплавов по
сравнению с химическими методами обладает рядом преимуществ,
главными из которых являются: возможность получения оксид-
ных пленок смолисто-черного цвета как на меди, так и на ее спла-
вах; высокая механическая прочность пленок, исключающая не-
обходимость покрывать их лаком; доступность и дешевизна при-
меняемого электролита (раствор щелочи); малая зависимость
процесса оксидирования от концентрации раствора и простота
контроля ванны; высокая рассеивающая способность ванны элект-
ролитического оксидирования и т. д.
При электрохимическом оксидировании на меди сначала об-
разуется тонкая пленка Сн2О, а затем формируется более толстая
пленка СиО черного цвета.
Для электрохимического оксидирования меди и ее сплавов приме-
няют раствор, содержащий 150—200 г/л едкого натра. Режим
работы: ia = 0,8ч-2 А/дм2; t = 80ч-100 °C; т = Юч-ЗО мин. На
окончание процесса оксидирования указывает появление пузырь-
ков газа на детали или резкое повышение напряжения на ванне.
С повышением плотности тока число кристаллических зародышей
на поверхности увеличивается и образуется тонкая плотная плен-
ка. Для получения толстой плотной пленки рекомендуется начинать
обработку при небольшой плотности тока (0,1—0,5 А/дм2), а после
небольшой выдержки повысить плотность тока до 0,8—1,5 А/дм2.
Повышение температуры приводит к увеличению скорости раст-
ворения металла; получаемые при этом пленки имеют черный цвет.
При понижении температуры образуются рыхлые пленки зелено-
ватого цвета.
С понижением концентрации щелочи уменьшается толщина
пленки и сужается рабочий диапазон плотностей тока, при кото-
рых получаются доброкачественные покрытия, ухудшается рассеи-
вающая способность. Повышение концентрации щелочи приводит
к образованию рыхлых пленок.
309
Раствор перед пуском в эксплуатацию прорабатывают с мед-
ными анодами до появления светло-голубой окраски. Катодами при
оксидировании служат листы стали или никеля. Детали загру-
жают в ванну на медных подвесках с хорошими электрическими
контактами. При этом детали рекомендуется выдерживать в элект-
ролите без тока в течение 1—-2 мин, затем включать ток и вести
электролиз, постепенно повышая плотность тока. Продолжитель-
ность оксидирования может быть сокращена за счет соответствую-
щего увеличения плотности тока. Оксидированные изделия про-
мывают в проточной воде, сушат при 90—100 °C и протирают ми-
неральным маслом.
Оксидирование цинка. Для химического оксидирования цинка
или цинковых покрытий применяется следующий раствор (г/л)
при режиме работы:
Бертолетова соль КС1О3 ... 20 А °C........................15—25
CuSO4-5H2O............... 200 т, мин......................2—5
Пленка имеет черный цвет и служит главным образом для за-
щитно-декоративной отделки изделий.
Электрохимическое оксидирование цинка может быть произ-
ведено в ваннах следующего состава (г/л) при режиме работы:
NaOH...........................
KgCrgO?........................
ia, А/дм2......................
t, °C..........................
т, мин.........................
№ 1 № 2 № 3
20 — 100—110
.—- 60 10—15
6—12 0,5 3—10
40—45 15—30 15—30
8—10 10 0,1—0,25
Пленка, полученная из ванны 1, имеет черный цвет, а из ван-
ны 2 — черный цвет с зеленоватым оттенком. Продолжительность
обработки цинковых сплавов, содержащих алюминий и медь,
в ванне 1 должна быть увеличена до 40—60 мин. Катодами служат
свинец или сталь.
Оксидирование кадмия. Оксидирование кадмия и кадмиевых
покрытий также применяется для защитно-декоративной отделки
изделий. При этом часто предпочитают электролитический метод
обработки, который может быть произведен в ванне следующего
состава (г/л) при режиме работы:
NaOH ....................
Na2CO8...................
ia. А/дм2................
25 t, °C.....................15—25
50 т, мин....................1—2
5
Полученная оксидная пленка имеет белый цвет. Для повыше-
ния механической стойкости пленки последнюю покрывают бес-
цветным лаком.
Оксидирование титана. Оно применяется для улучшения
фрикционных свойств и повышения химической стойкости дета-
лей. Электрохимическое оксидирование деталей из титана и его
310
26.4. Составы (г/л) электролитов оксидирования деталей из титана
и режим обработки
Назначение покрытия Состав электролита, г/л Режим обработки
t, °C ia, А/дм* Т, МИИ
Увеличение хими- ческой стойкости Улучшение фрик- ционных свойств H2SO4 180—200 Н2С2О4 50—55 15—30 15—30 10—12 1—1,5 10—15 50—60
Получение пленок толщиной 20— 40 мкм H2SO4 350—400 НС1 60—65 40—50 2—4 —
Получение покры- тий с мнкротвер- достью 3,2—3,5 ГПа СгОз 140 НаРО4 4 95—100 U = 504-60 В 120
сплавов проводят в растворах серной, щавелевой, фосфорной,
хромовой кислот или их смесей в зависимости от назначения покры-
тия (табл. 26.4).
Оксидирование серебра и серебряных покрытий. Его проводят
для защиты от потемнения в ванне следующего состава (г/л) при
режиме работы:
Na2S....................
Na2SO3..................
H2SO4...................
Ацетон, мл/л.............
25—30 ia, А/дм4..............0,05—0,5
15—20 t,°C...................... 18—25
3—5 т, мин....................3—5
3—5
У оксидной пленки темно-серый или темно-синий цвет.
Для химического оксидирования можно применить смесь
композиции (г/л) при следующем режиме работы:
Ликонда 61А........... 350—500 t, °C..................15—30
Ликонда 61В ....... 35—50 т, мин................ 1—3
Цвет покрытия темно-серый или черный.
ГЛАВА 27. ФОСФАТИРОВАНИЕ
§ 27.1. ОБЩИЕ СВЕДЕНИЯ
Фосфатирование — один из распространенных мето-
дов защиты металлов от коррозии. Фосфатные покрытия образу-
ются на поверхности металла в результате взаимодействия его
с растворами ортофосфорной кислоты.
311
Фосфатные покрытия представляют собой мелкокристалличе-
скую пленку, состоящую из нерастворимых фосфатов марганца
и железа или цинка и железа. Фосфатные пленки после допол-
нительной обработки маслами, лаками или красками надежно
защищают металл от коррозии.
Фосфатные покрытия обладают высоким электрическим со-
противлением и выдерживают напряжение в пределах 300—
500 В. Пропитывание фосфатных покрытий масляными и бакели-
товыми лаками значительно повышает пробивное напряжение.
По твердости фосфатная пленка превосходит медь и латунь,
но она мягче стали. Растворимость фосфатной пленки в воде при
комнатной температуре составляет около 1,5 мг/л, при 90 °C —
10,6 мг/л. В кислотах и щелочах фосфатные покрытия неустой-
чивы. Фосфатные покрытия выдерживают кратковременный на-
грев до 400—500 °C, при более высокой температуре защитная
способность покрытия снижается. Защитная способность обычных
фосфатных покрытий выше, чем оксидных пленок, получаемых
при щелочном оксидировании стали. Фосфатные покрытия при-
меняют для защиты от коррозии, для уменьшения трения и для
электроизоляции. Кроме того, фосфатные покрытия служат
очень хорошим грунтом для нанесения лакокрасочных покрытий.
Фосфатные пленки не смачиваются расплавленными металлами.
Фосфатированию можно подвергать углеродистые и низколегиро-
ванные стали, чугун, цинк, кадмий, медь и ее сплавы, алюминий.
Высоколегированные стали плохо поддаются фосфатированию.
Сущность процесса фосфатирования заключается в обработке по-
верхности металла подкисленными растворами однозамещенных
фосфатов, в результате которой на поверхности образуется пленка
нерастворимых фосфатов.
В основе процесса фосфатирования лежит реакция взаимодейст-
вия металла с ортофосфорной кислотой
Me + 2Н3РО4 = Ме(Н2РО4)2 + Н2|,
в результате которой образуются однозамещенные фосфаты ме-
талла. Концентрация ортофосфорной кислоты, а следовательно,
кислотность раствора уменьшаются. При этом происходит гидро-
лиз однозамещенных фосфатов с образованием двух- и трехзаме-
щенных солей:
5Ме(Н2РО4)2 2МеНРО4 + Ме3(РО4)2| + 6Н3РО4;
ЗМе(Н2РО4)2 =₽*= Ме3(РО4)2| + 4Н3РО4.
Образующаяся свободная ортофосфорная кислота взаимодейст-
вует с основным металлом, образуя труднорастворимые фосфаты
железа, которые являются основной составляющей частью фос-
фатных покрытий,
Fe + 2Н2РО4 = Fe(H2l/O4)2 + H2f.
812
27.1. Влияние катионов металлов на фазовый состав фосфатных пленок
Катион металла Фазовый состав пленок
Сталь Цинк
Мп2+ (Мп, Fe)BH2(PO4)4-4H2O Zns(PO4)2-4H2O; МпвН2(РО4)4-4Н2О
Zn2+ Zn3(PO4)2-4H2O; Zn2Fe(PO4)2-4H2O Zn3(PO4)2-4H2O
Са2+ СаНРО4-2Н2О; СаНРО4 Zn2Ca(PO4)2 -2Н2О; СаНРО4-2Н2О; СаНРО4
Fe2+ FeBH2(PO4)4-4H2O Zna(PO4)2-4H2O; Zn2Fe(PO4)2-4H2O; FeBH2(PO4)4-4H2O
Na+ Fe3(PO4)2 • 8Н2О Zn3(PO4)2-4H2O
Качество фосфатного покрытия зависит от общей и свободной
кислотности раствора, концентрации монофосфатов и природы ка-
тионов. Для ускорения процесса фосфатирования в растворы вво-
дят окислители — анионы NO2, NO3, СЮз и др.
Одновременно с процессом образования фосфатной пленки про-
исходит растворение основного металла. Это приводит к образо-
ванию большого количества пор. По своему составу фосфатная
пленка состоит из двух видов слоев: слоя, непосредственно при-
легающего к металлу с максимальным содержанием монофосфа-
тов железа, и наружных слоев, состоящих преимущественно из
монофосфатов марганца с незначительной примесью вторичных
фосфатов железа. Слой, прилегающий к металлу, плотно связан
с ним; он гладкий, эластичный, весьма пористый, имеет незначи-
тельную толщину. Наружный слой кристаллический, хрупкий,
состоит из вторичных и третичных фосфатов. Этот слой и обуслов-
ливает ценные свойства фосфатированных поверхностей.
Толщина, структура, пористость, цвет фосфатной пленки за-
висят от состава обрабатываемого металла, метода и режима фос-
фатирования, а также от условий подготовки поверхности.
Цвет пленки может меняться от светло- до темно-серого. Пленки
светло-серого цвета образуются на малоуглеродистых сталях
и цветных металлах. На поверхностях, обработанных пескоструй-
ным способом, в растворах повышенной кислотности также об-
разуются светло-серые покрытия. На поверхности, предварительно
протравленной, в растворах с повышенным содержанием орто-
фосфорной кислоты, на высоколегированных сталях и чугунах
получается пленка более темного цвета. Стали, содержащие хром
и никель, покрываются пленкой зеленоватого цвета.
На состав пленок большое влияние оказывает состав фосфати-
рующего раствора (табл. 27.1).
Кристаллическая структура и толщина фосфатной пленки
тесно связаны между собой. При образовании крупнокристалли-
313
ческих пленок толщина фосфатных пленок значительно больше,
чем при образовании мелкокристаллических пленок:
Толщина, мкм Т, мии
Мелкокристаллические пленки . . . 1—4 До 30
Крупнокристаллические пленки. . . 10—12 60—90
Мелкокристаллические пленки по сравнению с крупнокристал-
лическими пленками обладают лучшей защитной способностью,
поэтому их чаще используют в промышленности.
Мелкокристаллические покрытия получают из цинкофосфат-
ных растворов, содержащих ускорители (окислители). Эти покры-
тия используют в качестве подслоя под лакокрасочные покрытия.
Из марганцевофосфатных растворов получают крупнокристал-
лические покрытия, которые после промасливания служат в ка-
честве самостоятельных защитных покрытий.
От способа предварительной обработки зависят структура,
толщина, адгезионная способность и цвет фосфатных покрытий.
После пескоструйной обработки с последующим химическим обез-
жириванием или обезжириванием в органических растворителях
образуются тонкие мелкокристаллические пленки толщиной 5—
10 мкм с высокими защитными свойствами. Если же детали перед
фосфатированием подвергались травлению в H2SO4, HCI или
Н3РО4, образуются рыхлые пленки с крупнокристаллической
структурой толщиной 40—50 мкм, которые имеют низкие защитные
свойства. Для улучшения качества таких пленок после травления
рекомендуется промывка деталей в 5—8 %-ном растворе кальци-
нированной соды и 1—2 %-ном растворе хозяйственного мыла при
температуре 50—60 °C.
§ 27.2. ФОСФАТИРОВАНИЕ ЧЕРНЫХ МЕТАЛЛОВ
Фосфатирование может вестись химическим или электро-
литическим путем. Существует несколько способов химического
фосфатирования черных металлов: нормальное, ускоренное и так
называемое холодное фосфатирование.
Нормальное фосфатирование. Для получения фосфатных по-
крытий применяют однозамещенные фосфаты двухвалентных ме-
таллов: марганца, железа, цинка, кадмия. Для этой цели успешно
применяют препарат Мажеф, который представляет собой смесь
однозамещенных солей ортофосфорной кислоты, железа и марган-
ца: Fe (Н2РО4)2, Мп (Н2РО4)2-Н2О, МпНРО4 и имеет химический
состав: 2,4—2,5 % Fe, 14 % Мп, 46—52 % фосфатов (в пересчете
на Р2О5), 1,0 % SO4‘, следы СаО, СГ и 1—2 % воды.
Наиболее эффективно процесс фосфатирования протекает в
растворе, содержащем 30—33 г/л препарата Мажеф при темпера-
туре 96—98 °C. При более низких температурах образуется кри-
сталлическая структура, более высокие температуры приводят
к образованию в растворе большего количества шлама. Продол-
314
жительность фосфатирования ограничивается временем, в тече-
ние которого выделяется водород, и дополнительной выдержкой
в течение 5—10 мин. Общую Ко и свободную Ксв кислотности
фосфатных растворов принято выражать в точках. Каждая точка
соответствует количеству миллиметров 0,1 н раствора щелочи,
затраченному на титрование 10 мл фосфатного раствора. Общая
кислотность раствора должна составлять 28—30 точек, а свобод-
ная — 3—4 точки. Оптимальное соотношение Ко : Ксв = 7:14-
4-8 : 1. Повышение свободной кислотности удлиняет процесс
фосфатирования и ухудшает защитные свойства пленки. Пониже-
ние свободной кислотности приводит к образованию тонких пле-
нок с низкими защитными свойствами.
Пленки, образующиеся в растворах соли Мажеф, имеют проч-
ное сцепление с основой, достигают толщины 7—50 мкм и имеют
пористую структуру. Покрытия обладают высокими электроизо-
ляционными свойствами и жаростойкостью.
Для получения мелкокристаллических пленок с высокими
защитными свойствами рекомендуются более концентрированные
растворы препарата Мажеф (100—200 г/л), при этом процесс ведут
при пониженной температуре (80—85 °C).
Для высоколегированных сталей в фосфатный раствор, содер-
жащий 30—32 г/л соли Мажеф, вводят 10—12 г/л ВаС12. Темпе-
ратура раствора 98—100 °C, продолжительность процесса 40—
60 мин. Фосфатирование в растворе препарата Мажеф имеет
существенные недостатки: длительность процесса, высокая тем-
пература и узкий рабочий интервал температур. Кроме того,
в процессе фосфатирования происходит обильное выделение во-
дорода, что приводит к наводораживанию стали и ухудшению
ее механических свойств. Снижения эффекта наводороживания
можно достичь уменьшением времени обработки.
Ускоренное фосфатирование. Разработан и получил широкое
промышленное применение процесс ускоренного фосфатирования,
не имеющий указанных недостатков. Составы (г/л) и режим ра-
боты ванны ускоренного фосфатирования приведены ниже:
Препарат Мажеф.................
Zn(NO8)2-6H2O..................
NaF....................
NaNOa..........................
НаРО4..........................
t, °C..........................
г, мин.........................
В растворы ускоренного фосфатирова!
цесса уменьшения выделения водорода и окисления Fe2+ до Fe3+
вводят окислители Zn (NOS)2, NaF и др.
Для покрытий из ванн ускоренного фосфатирования характер-'
ны относительно малая толщина слоя и пониженная коррозион-
ная стойкость. Детали после ускоренного фосфатирования обра-
315
№ 1 № 2
30—40 30—40
50—65 50—70
2—5 —
— 0,1—1,0
45—65 92—96
8—15 8—10
я для ускорения про-
27.2. Составы(г/л)цинкофосфатных растворов
для фосфатирования и режим работы
Компоненты раствора и режим работы Номер раствора
1 2
Zn(H2PO4)2 8—12 28—36
Zn(NOa)2-6H2O 10—20 42—58
Ba(NO3)2 30—40 —
НаРО4 •—- 9,5—15,0
t, °C 75—85 85—95
т, мин 3—10 10—25
батывают в растворе би-
хромата калия и сушат.
Полученные таким обра-
зом пленки служат хоро-
шим грунтом для после-
дующего нанесения лако-
красочных покрытий. Для
ускоренного фосфатирова-
ния разработаны цинко-
фосфатные растворы, ос-
нову которых составляет
первичный фосфат цинка;
кроме того, вводят нитра-
ты, которые окисляют Fe2+
до Fe3+.
Покрытия состоят, в основном, из трехзамещенного фосфата
цинка, поскольку он растворяется значительно труднее, чем
трехзамещенный фосфат железа (II). Химический состав пленки
таков:
Zn3(PO4)2-4H2O и Zn2Fe(PO4)2-4H2O.
Основная масса пленки образуется в первые минуты процесса.
Одновременно с образованием пленки происходит ее частичное
растворение. Рост пленки прекращается, когда скорость ее обра-
зования становится равной скорости ее растворения. С повыше-
нием свободной кислотности скорость растворения фосфатной
пленки увеличивается и пленка становится более рыхлой. С по-
вышением температуры от 70 до 98 СС толщина пленки увеличи-
вается примерно в 1,4 раза. Составы цинкофосфатных растворов
и режим работы приведены в табл. 27.2.
Фосфатные покрытия, полученные из этих растворов, характе-
ризуются меньшей защитной способностью, их применя/от, глав-
ным образом, как грунт под окрашивание лаками и красками.
Растворы для ускоренного фосфатирования можно распылять
по предварительно подготовленной поверхности металлических
деталей. Рекомендуется следующий оптимальный состав раствора
для струйного фосфатирования на основе препарата Мажеф (г/л)
при режиме работы:
Препарат Мажеф........ 30—60 pH...................2,6—3,2
Zn(NOa)2-6H2O.......... 50—70 t, °C...................15—25
NaNO2................... 2—4
Разработаны и нашли широкое применение фосфатирующие
концентраты КФ-1, КФ-3, КФЭ-1. КФЭ-2 на основе монофосфата
цинка. Растворы этих концентратов применяют для получения
подслоя под лакокрасочные покрытия, перед обработкой стали
штамповкой и вытяжкой. Назначение обработки, режимы обра-
ботки и составы растворов на основе концентратов приведены
в табл. 27.3.
316
27.3. Концентраты для фосфатирования стали (г/л)
и режимы обработки
Назначение фосфатирования Марка концен- трата Концентра- ция, г/л NaNO8, г/л °C т, МИН
Получение под- слоя перед нанесе- нием Л кп КФ-1 КФ-3 25—30 / 35—40 1 70—75 0,1—0,15 0,15—0,2 50—55 70—75 50—55 1,5—2 5 3—5
Фосфатирование перед холодной де- формацией КФЭ-1 КФЭ-3 35—40 35-40 0,2 90—95 55—65 8—10 12—15
Для улучшения структуры покрытия в растворы вводят труд-
норастворимые оксалаты цинка в количестве до 0,1 г/л. Растворы
оксалатного фосфатирования имеют следующий состав (г/л) при
режиме работы:
Zn(H2PO4)2.........................
NaNO2 .............................
Zn(NOa)2-6H2O......................
НаРО4..............................
ZnC2O4.............................
t, °C..............................
т, мин.............................
№ 1
30—35
50—55
14—15
До
92—98
15—30
№ 2
45—55
45—55
11—17
55—65
3—10
насыщения
В этом растворе удаляется ржавчина и поверхность покры-
вается мелкокристаллической фосфатной пленкой.
Холодное фосфатирование. Для пленок, полученных в раство-
рах, не требующих подогрева, характерна относительно малая
толщина. Они используются, как правило, в качестве грунта под
окраску. Холодное фосфатирование производится в растворах на
27.4. Составы (г/л) растворов для холодного фосфатирования
и режим обработки
Компоненты раствора и режим обработки Номер раствора
1 2 3 4
Препарат Мажеф 25—30 — —
Zn(H2PO4)2 — 60—70 100 —
ZnO — —. 18—21
Zn(NOa)2-6H2O 35—40 80—100 — —
NaF 5—10 .—. 6 —
HaPO4 .— — .—- 80—85
NaNOa — 0,3—1,0 2 1—2
т, мин 40 15—25 30—40 15—20
317
основе преперата Мажеф и однозамещенного фосфата цинка
(табл. 27.4). Активаторами процесса являются NaF и NaNOa.
Холодное фосфатирование не получило широкого применения,
так как растворы легко гидролизуются, свободная кислотность
растет, что приводит к образованию пористых покрытий с по-
ниженной защитной способностью. Увеличение температуры раст-
вора способствует получению мелкокристаллических покрытий.
Для получения мелкокристаллических покрытий на шлифован-
ных, полированных, подвергнутых пескоструйной обработке де-
талях из углеродистых, низко- и среднелегированных сталей,
а также на деталях с покрытием цинком или кадмием рекоменду-
ется универсальный электролит следующего состава (г/л) при
режиме работы:
Zn(H2PO4)2................. 10—15
NH4H2PO4 .................. 10—15
Mg(NOa)2....................50—100
Fe(NOs)2-9H2O ...........1,7—2,0
HgQA......................1,7—2,0
Моющее вещество «Прогресс» 3—5
°C........................75—80
г, мин.................... 3—10
Покрытия, полученные в этом растворе, обладают высокими за-
щитными свойствами.
Черное фосфатирование. Оно представляет интерес для опти-
ческого приборостроения. По этому способу обработка ведется
последовательно в двух растворах: в первом — на поверхности
образуется покрытие черного цвета, во втором — происходит за-
полнение пор и отложение второго слоя фосфатной пленки. Об-
разующиеся пленки черного цвета имеют лучший внешний вид
и повышенную коррозионную стойкость по сравнению с пленками,
полученными обычным способом.
Предварительное фосфатирование проводится в одном из сле-
дующих растворов (г/л) при режиме работы:
№ 1 № 2
Fe2(PO4)8......................... 23 —
Стальная стружка................... — 5
ZnO................................ 8 8
Н3РО4......................... 32 50
Na,CO3 ........................ 1 1
t,sC............................ 90—95
г, мин..................... 5—10
Фосфатное пассивирование проводят в растворе следующего
состава (г/л) при режиме работы:
Zn(NOs)2.................. 150 Л °C.....................50—60
Препарат Мажеф............. 30 г, мин....................10—15
Na2CO3..................... 3
Электрохимическое фосфатирование. Позволяет повысить про-
изводительность процесса. Пленки, полученные этим способом,
используются как грунт под окраску. Недостатками являются
малая рассеивающая способность электролитов и вследствие этого
318
неравномерность слоя на
деталях сложной формы.
Электрохимическое фосфа-
тирование возможно с при-
менением постоянного или
переменного тока. Приме-
няемые в производстве рас-
творы приведены в табл.
27.5.
В растворах 1 и 2 про-
цесс ведут постоянным то-
ком. Детали завешивают
на катодных штангах. В ка-
честве анодов в растворе 1
применяют цинковые пла-
стины, в растворе 2 —
пластины из углеродистой
стали. Раствор 2 предна-
27.5. Составы растворов
для электрохимического фосфатирования
(г/л) и режимы обработки
Компоненты раствора и режим обработки Номер раствора
1 2 3
Препарат Ма- жеф Zn(NOs)2 ZnO - NaF HSPO4 NasPO4 HNO« iK, А/дм2 t, °C т, мин 60—80 50—100 3—10 2—10 0,3—0,5 15—30 10—15 25—28 48—50 26—28 2—3 65—75 5—8 9 22 25 2—3 65—75 15—20
значен для обработки коррозионно-стойких сталей. Через рас-
твор 3 пропускают трехфазный ток напряжением 15—20 В.
Детали завешивают на трех шинах так, чтобы они не соприкаса-
лись между собой и между стенками ванны.
§ 27.3. ФОСФАТИРОВАНИЕ ЦВЕТНЫХ
И ЛЕГКИХ МЕТАЛЛОВ
Фосфатированию часто подвергаются цинк, кадмий,
алюминий, магний и другие металлы. Для цинка, кадмия и алю-
миния фосфатные пленки служат грунтом под окраску, для маг-
ния — средством защиты от коррозии, для титана — средством
для повышения антифрикционных и износостойких свойств.
Для фосфатирования цинка и кадмия можно применять уни-
версальный раствор, состав которого приведен в § 27.2. Фосфа-
тирование цинка можно проводить в растворе, содержащем 120—
140 г/л композиции Ликонда Ф1А при температуре 18—40 °C
в течение 5—10 мин. Фосфатное покрытие на цинке получается
серо-дымчатым с мелкокристаллической структурой. По защит-
ной способности оно превосходит пленки, полученные при хро-
матировании.
Для фосфатирования алюминия применяют растворы ортофос-
фор ной кислоты, содержащие СгО3 и HF или NaF (табл. 27.6),
так называемое голубое фосфатирование. Получающиеся пленки
имеют голубовато-зеленый цвет и содержат 50—55 % СгРО4,
17—23 % А1РО4, 22—23 % Н2О. Пленки аморфные, гладкие,
имеют толщину около 3 мкм, но непрочные. Фосфатированные
детали нужно промыть в холодной воде и высушить при темпера-
туре не выше 60 °C, после чего пленка приобретает прочность и
319
27.6. Составы растворов
для фосфатирования алюминия
и его сплавов (г/л)
и режим обработки
Компоненты раствора и ре- жим обработки Номер раствора
1 2 3
Н3РО4 50—60 40—50 40—60
СгО3 7—8 4—7 5—10
НР(40%-ная) 5 мл — —
NaF — 5—7 3—5
/, °C 15—30 5—30 15—30
Т, мин 5—20 5—20 5—20
27.7. Составы (г/л) растворов
для фосфатирования магния
и его сплавов и режим обработки
Компоненты раствора и ре- жим обработки Номер раствора
1 2 3
Ва(Н2РО4)2 40—70
Препарат 27—32 .—, —
Мажеф NaF 0,2— 1—2
Zn(NO3)2 0,3 22 —
Zn(BF4)2 —. 15 —
Н3РО4 ,—. 15 5—10
t, °C 96—98 75—85 95—98
Т, мин 30—40 5 20—30
не разрушится при трении или воздействии горячей воды. Покры-
тие устойчиво при нагревании до 300 °C. Обработка в 10 %-ном
растворе К2Сг2О7 при температуре 75—80 °C в течение 10 мин
повышает коррозионную стойкость покрытия.
Фосфатирование магния и его сплавов производят в растворах
однозамещенных фосфатов (табл. 27.7).
В растворе 1 на магниевых сплавах образуется пленка, состоя-
щая преимущественно из фосфата марганца, в растворе 2 — из
фосфата магния, в растворе № 3 — из труднорастворимых фос-
фатов и фторидов бария и магния.
Никель и его сплавы рекомендуется фосфатировать в растворе
следующего состава (г/л) при режиме работы:
Н3РО4...................
NaF ......................
Zn(NO3)2..................
15 pH............-............. 2,0
13 t, °C....................25—35
200 т, мин....................35—45
Фосфатированию поддаются только матовые никелевые покры-
тия, блестящие — практически не фосфатируются.
Титан и его сплавы обычно фосфатируют в растворе, содержа-
щем 10—100 г/л Н3РО4 и 10—100 г/л фторидов KF, NaF или
NH4F при температуре 98—99 °C в течение 10—30 мин.
§ 27.4. ПОВЫШЕНИЕ ЗАЩИТНЫХ СВОЙСТВ
ФОСФАТНЫХ ПЛЕНОК
Фосфатные покрытия пористы и защитная способность
их недостаточна. Для улучшения защитных свойств применяют до-
полнительную обработку — пассивирование покрытий в растворах
Na2Cr2O7 или К2Сг2О7:
320
1) 80—100 г/л при температуре 70—80 °C в течение 10—20 мин
с последующей промывкой до сушки;
2) 3—5 г/л при температуре 70—80 °C в течение 1—3 мин
с последующей сушкой без промежуточной промывки.
После пассивирования детали пропитывают горячим мине-
ральным маслом или гидрофобизируют в 10 %-ном растворе
кремнийорганической жидкости ГФЖ-94 в бензине в течение
3—5 мин. *
Детали, предназначенные для холодной деформации, после
тщательной промывки обрабатывают' мыльным раствором 70—
100 г/л хозяйственного мыла при температуре 60—70 °C в течение
3—5 мин.
P A 3 Д Е Л IX
ТЕХНИКА БЕЗОПАСНОСТИ
И ПРОИЗВОДСТВЕННАЯ САНИТАРИЯ
В ЦЕХАХ ЭЛЕКТРОХИМИЧЕСКИХ ПОКРЫТИЙ
ГЛАВА 28. ОБЩАЯ ХАРАКТЕРИСТИКА
ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ
С ТОЧКИ ЗРЕНИЯ БЕЗОПАСНОСТИ ТРУДА
Цеха электрохимических покрытий являются неблаго-
приятными с точки зрения безопасности труда. Технология нане-
сения покрытий связана с применением и выделением веществ,
вредных для здоровья человека.
Производственные факторы цехов электрохимических покры-
тий по природе воздействия на человека можно свести в следую-
щие группы:
физические (ультразвук, шум, вибрация);
химические (вредные токсические вещества в различном агре-
гатном состоянии);
психофизиологические (физическая нагрузка и рабочая поза,
темп и ритм труда);
параметры микроклимата (повышенная влажность, температура
воздуха, движение воздуха);
другие факторы (электрический ток; пожаро- и взрывоопас-
ность; отлетание частиц при работе шлифовально-полировального
оборудования).
Технология нанесения электрохимических покрытий включает
следующие основные операции: подготовки поверхности деталей
перед нанесением покрытий; нанесения покрытий; отделки де-
талей после покрытия; вспомогательные и подготовительные
операции.
Подготовка поверхности может производиться механическими
(шлифование и полирование, дробеструйная, гидроабразивная,
виброабразивная и др.); химическими и электрохимическими
(обезжиривание, травление) способами. Механическая обработка
производится на специальном оборудовании: шлифовально-поли-
ровальных станках, в дробеструйных аппаратах, колоколах и
барабанах для галтовки и т. д.
Химическая и электрохимическая обработка поверхности, а
также процессы нанесения покрытий предусматривают исполь-
зование органических растворителей и электролитов: кислых,
322
28.1. Потенциально опасные и вредные факторы
в процессах получения электрохимических покрытий
Операция технологического процесса Потенциально опасные н вредные факторы
Механическая подго- товка и окончательная отделка поверхности Систематические физические нагрузки с повы- шенными затратами энергии и утомляемостью; повышенная запыленность воздуха; повышенный
Химическая и элек- трохимическая подго- товка и отделка по- верхности, процессы на- несения покрытий Вспомогательные и подготовительные опе- рации уровень шума и вибрации Повышенные выделения вредных веществ в воз- дух; повышенные влажность, уровень шума, уро- вень ультразвука и взрывоопасность Повышенное выделение вредных веществ в воз- дух; движущиеся машины и механизмы; система- тические физические нагрузки с повышенными за- тратами энергии н утомляемостью; электроопас- ность
щелочных, цианистых, хромовых. В электролиты вводятся специ-
альные, как правило органические, добавки: поверхностно-ак-
тивные вещества, ингибиторы коррозии и т. п.
Оборудованием для нанесения покрытий служат автомати-
ческие и полуавтоматические линии со стационарными ваннами
различного типа. Детали в ваннах располагаются на подвесках
или в барабанах.
К подготовительным и вспомогательным операциям относятся
приготовление и корректирование электролитов, их транспорти-
ровка, погрузочно-разгрузочные и транспортные работы и обслу-
живание электрического оборудования. Все перечисленные про-
цессы характеризуются наличием опасных и вредных производ-
ственных факторов (табл. 28.1).
Отличительной особенностью технологии нанесения электро-
химических покрытий является применение большого количества
разнообразных химических веществ. Многие химические вещества
являются опасными для здоровья, а в некоторых случаях и для
жизни. К таким веществам следует отнести кислоты, щелочи, ор-
ганические растворители, соли тяжелых металлов и сами металлы,
цианиды и т. д. Наиболее вредно действуют на организм человека
ртуть, свинец, хром, мышьяк и их соединения. Очень ядовитыми
веществами являются цианидные и фосфорные соединения, ор-
ганические растворители. Предельно допустимые концентрации
(ПДК) вредных веществ, которые не вызывают патологических
изменений у работающих в течение всей жизни, применяемых
в гальванических производствах, приведены в ГОСТ 12.1.005—76.
Ниже приведены краткие сведения о физиологическом воздейст-
вии некоторых вредных выделений, образующихся при эксплуа-
тации гальванических ванн.
323
Хром и его соединения наиболее опасны из всех соединений,
применяемых в электрохимическом производстве. Соединения
хрома СгО3, Сг2О3, К2Сг2О7 оказывают вредное влияние на печень,
почки, пищеварительную,. сердечно-сосудистую систему, кожу и
слизистые оболочки.
Цианидные соединения — соли синильной кислоты KCN и
NaCN — легко разлагаются на воздухе в условиях повышенной
влажности и присутствия углекислоты с образованием цианистого
водорода. Выделение паров синильной кислоты возможно также
при попадании в цианидные электролиты любой кислоты. При
отравлении появляются затрудненное дыхание, паралич, бессозна-
тельное состояние, судороги, остановка дыхания, а в тяжелых
случаях — смерть.
Оксиды азота образуются при травлении металлов. При остром
отравлении они вызывают отек легких, при хроническом — забо-
левание верхних дыхательных путей, поражение зубов.
Серная кислота и сернистые газы вызывают сильное раздраже-
ние слизистых оболочек и дыхательных путей. Серная кислота при
попадании на кожу вызывает сильные ожоги.
Щелочи обладают очень сильными едкими свойствами: они
разъедают кожу, роговицу, вызывают сильные ожоги на теле.
Хлорированные углеводороды обладают наркотическим дей-
ствием, вызывают поражения внутренних органов, особенно
печени, раздражение слизистых оболочек дыхательных путей и
кожи.
Фосфорная кислота особенно вредна в нагретом виде. При вды-
хании аэрозолей могут происходить атрофия слизистых оболочек
носа, носовые кровотечения, крошение зубов.
Растворители — бензол, толуол, уайт-спирит — при длитель-
ных воздействиях в концентрациях, превышающих ПДК, вы-
зывают хронические отравления с изменениями в кроветворной
и нервной системе, поражения печени и других внутренних ор-
ганов.
Соли никеля вызывают воспаление слизистой оболочки носа,
экзему кожи, а при длительном воздействии могут появиться приз-
наки бронхиальной астмы. Медь и ее соли могут поражать зубы,
слизистую оболочку рта, приводить к раздражению кожи, язве
желудка, а соединения цинка — к поражению слизистой оболочки
носа, языка, десен.
Металлическая пыль вызывает дерматиты, экземы, воспаление
слизистой оболочки горла и носа.
Особенности микроклимата электрохимических производств
следует учитывать при проектировании гальванических цехов и
размещении в них технологического оборудования. Наиболее ра-
циональным считается размещение гальванических цехов в двух-
этажных зданиях. На верхнем этаже производятся все основные
работы по нанесению покрытий, в нижнем — устанавливают сбор-
ные вытяжные воздуховоды, фильтры, другое вентиляционное обо-
324
рудование, а также источники тока, сборники сточных вод, кла-
довые химикатов, холодильные установки. Минимальная высота
помещений верхних этажей должна быть 6 м, а нижних — 5 м;
площадь производственного помещения на одного работающего —
не менее 4,5 м2.
Необходимо выделять в отдельные помещения следующие про-
изводственные и вспомогательные участки: отделения кислотного
и щелочного травления; отделения оксидирования; шлифовально-
полировальные участки; участки обезжиривания в органических
растворителях; участки ультразвуковой очистки; все дробеструй-
ное оборудование и галтовочные барабаны; отделение приготов-
ления электролитов; неавтоматизированные участки покрытий
с цианидными электролитами.
Стены следует облицовывать материалами, не сорбирующими
вредные вещества: керамической или стеклянной плиткой на вы-
соту 2,8—3,2 м от уровня пола. Материалы для изготовления
полов должны обеспечивать влагонепроницаемость, стойкость
к кислотам и щелочам, растворителям и другим Химическим соеди-
нениям, отсутствие скольжения. Полы в гальванических цехах
рекомендуется делать с наклоном к стоку, выкладывать метлах-
скими плитками и регулярно промывать водой. Ваннц с травиль-
ными кислотами необходимо устанавливать с таким расчетом,
чтобы их верхние края находились на высоте 0,75—1,0 м
от уровня пола и рабочим не приходилось бы нагибаться
над ваннами в момент загрузки и выгрузки изделий. На
проходы у рабочих ванн должнц быть уложены деревянные
решетки или настилы для предохранения ног от промокания
или охлаждения.
Отделочные цеха должны размещаться в просторных светлых
помещениях и обеспечиваться светом (0,25—0,50 м2 оконной
поверхности на работника) и приточно-вытяжной вентиляцией.
Выделяющиеся из ванн газы и пары, а также пыль при шлифова-
нии и полировании подлежат искусственному отсасыванию, что
может быть достигнуто только устройством местной вентиляции.
Гальванические ванны для обезжиривания, травления и горя-
чей промывки должны быть снабжены бортовыми вентиляцион-
ными устройствами.
При решении вопроса последовательности включения гальва-
нических и травильных ванн в вентиляционную систему необхо-
димо учесть следующие положения.
Ванны с легколетучими и чрезвычайно вредными растворите-
лями и растворами (трихлорэтан, дихлорэтан, цианистые препа-
раты и т. д.) включаются в вентиляционную сеть раньше других
ванн, т. е. ближе к вентилятору. За указанными ваннами следуют
ванны щелочного обезжиривания. Травильные ванны и ванны,
содержащие кислые электролиты, соединяются в одну вентиля-
ционную систему, а ванны, содержащие щелочные и цианидные
электролиты, — в другую.
325
Шлифовальные и полирование станки должны быть снабжены
кожухами из листового железа, соединенными с отсасывающей
вентиляционной магистралью. Вентиляционные трубы требуется
периодически очищать. Над пастоварками и клееварками устраи-
вают вытяжные зонты. Крацевальные станки должны быть снаб-
жены специальными устройствами для подачи жидкости, устраняю-
щей образование пыли. Для очистки мелких деталей гидроструй-
ным способом рекомендуется применять специальные установки
по централизованному приготовлению и раздаче электролитов.
Во избежание взрыва или пожара необходимо тщательно сле-
дить за тем, чтобы в пене растворов электролитического обезжири-
вания не накапливалось значительных количеств гремучего газа,
а также за тем, чтобы искры, образующиеся при шлифовании, не
попадали на полотняные полировальные круги.
Вентиляция от хромовых ванн ни в коем случае не может быть
объединена с системами, удаляющими ароматические углеводороды
и другие воспламеняющиеся растворители. Вытяжные установки
от ванн обезжиривания органическими растворителями и от по-
лировальных и шлифовальных станков с целью предотвращения
пожаров устраивают раздельно для каждого вида оборудования.
ГЛАВА 29. ТЕХНИКА БЕЗОПАСНОСТИ
ПРИ ПРОИЗВОДСТВЕ ЭЛЕКТРОХИМИЧЕСКИХ
ПОКРЫТИЙ
§ 29.1. ПРЕДВАРИТЕЛЬНАЯ ПОДГОТОВКА
При механической обработке деталей образуется вой-
лочная, металлическая и матерчатая пыль. Запыленность воздуха
в рабочей зоне не должна превышать 5 мг/м3.
Шлифовальные, полировальные станки, гидро- и дробеструй-
ные установки, галтовочное и виброабразивное оборудование дол-
жны быть снабжены местными вентиляционными отсосами. Шли-
фовальные станки должны быть оборудованы местными вытяж-
ными устройствами, объединенными с укрытиями. Количество
удаляемого воздуха зависит от скорости вращения круга. Мест-
ные вентиляционные отсосы от полировальных станков, устраивае-
мые в виде кожухов над войлочными полировальными кругами,
должны обеспечивать удаление воздуха 4 м3/ч на 1 мм диаметра
круга со скоростью 3 м/с в сечении отсасывающего устройства.
Для матерчатых кругов эти величины равны соответственно 6 м8/ч
и 4 м3/с. Удаляемый от станков запыленный воздух проходит затем
соответствующую очистку, например, в циклонах. Работа без
вентиляции в шлифовально-полировальных отделениях не до-
пускается.
326
Отделение очистки деталей металлическим песком должно
быть изолировано от смежных помещений цеха. При очистке де-
талей металлическим песком необходимо применять камеры за-
крытого типа или полуавтоматические установки, в которых про-
цесс обдувки происходит без участия рабочего. Перед началом ра-
боты в полузакрытой камере должна быть включена вентиляция,
и рабочий, надев комбинезон и шлем-скафандр, может приступать
к работе. Очистные камеры внутри должны быть облицованы ли-
стовой резиной; детали в камере следует укладывать на покрытый
резиной стол.
Установки для гидро- и гидропескоструйной очистки должны
быть оборудованы местными вытяжными устройствами и приспо-
соблениями для механического поворота деталей во время очистки.
Загрузка и возврат дроби и песка, включение и выключение подачи
сжатого воздуха, песка и пульпы должны быть механизированы.
Установки для обезжиривания и травления должны иметь
местную вентиляцию. Обезжиривание трихлорэтиленом следует
проводить только в специальных аппаратах. Рабочие, занятые
в травильном отделении, должны быть снабжены предохранитель-
ными очками, резиновыми перчатками, прорезиненными нарукав-
никами и фартуками, халатами из непромокаемого материала,
резиновыми сапогами. Не рекомендуется подогревать раствор
серной кислоты выше 60 °C, а соляной кислоты выше 40 °C. Ра-
ботающие у ванн перед работой должны ежедневно смазывать
слизистую оболочку носа, руки и лицо вазелином. Для ванн трав-
ления меди и ее сплавов в азотной и смеси азотной и серной кислот
применяют вытяжные шкафы.
Не допускается соприкосновение трихлорэтилена с крепкими
щелочами. Нельзя допускать попадания азотной кислоты на
стружки, опилки и т. д.
§ 29.2. НАНЕСЕНИЕ МЕТАЛЛИЧЕСКИХ ПОКРЫТИЙ
Нанесение металлических покрытий связано с приме-
нением вредных и опасных для организма человека цианидно-
щелочных, щелочных, хромовых и кислых электролитов, а также
солей различных металлов.
При работе с ядовитыми и опасными электролитами следует
соблюдать следующие правила. Все технологические операции
необходимо вести в строгой последовательности по установленному
режиму. За 15 мин до загрузки деталей в ванны необходимо вклю-
чить бортовую вентиляцию, а на участке с цианидными раство-
рами — за 30 мин.
Работать нужно в спецодежде, резиновых сапогах, прорезинен-
ном фартуке и нарукавниках и резиновых перчатках. Каждый ра-
бочий должен иметь предохранительные очки и респиратор.
Для предохранения дыхательных путей слизистую оболочку
носа перед работой следует смазывать вазелином.
327
При работе с цианидными электролитами нужно соблюдать
особые меры осторожности. Следует избегать любого контакта
водных растворов цианидов с кислотами, особенно минеральными.
Корректировку цианидных электролитов разрешается проводить
только ответственным лицам. В нерабочее время все ванны с циа-
нидными растворами должны быть плотно закрыты крышками.
Загрязнение воздуха синильной кислотой обнаруживается по
запаху горького миндаля, о чем нужно немедленно сообщить
администрации. Загружать детали в ванну нужно осторожно,
чтобы исключить разбрызгивание раствора. После покрытия де-
талей в цианидных растворах их следует тщательно промывать
до полного удаления остатков раствора. После окончания элект-
ролиза аноды из ванн следует извлечь и погрузить в ванну с водой.
Чистку штанг разрешается проводить только после того как
они сняты с ванны и промыты. Чистку анодов можно производить
только после промывки и во влажном состоянии. Все упавшие
в ванну детали следует извлекать магнитом, а медные, латунные—
перфорированным совком. Бортовые отсосы следует чистить не
реже одного раза в месяц. К работе на ваннах с ядовитыми элект-
ролитами не допускаются лица с повреждениями кожи и предрас-
положенные к кожным заболеваниям.
§ 29.3. РАБОТА С УЛЬТРАЗВУКОМ
Лица, обслуживающие ультразвуковые установки, мо-
гут подвергаться вредному воздействию ультразвуковых колеба-
ний. При длительном воздействии ультразвука у человека при-
тупляется слух. Ультразвук вредно действует на центральную
нервную систему, вызывая утомляемость, раздражительность,
головную боль.
Ультразвуковые установки нужно помещать в изолированном
помещении. В настоящее время ультразвуковые ванны выпускают
со звукоизоляцией. При загрузке и выгрузке деталей из ванн
источник ультразвуковых колебаний следует выключать. Для
ослабления шума рекомендуется работать на частотах ниже 22 кГц.
Обслуживающий персонал необходимо обеспечить средствами
индивидуальной защиты — заглушками или наружными противо-
шумами.
Ультразвуковые генераторы должны иметь электрическую
блокировку, у них должна быть световая сигнализация включения
накала и высокого напряжения.
При работе на электрозвуковых установках в помещении
должно находиться не менее двух человек.
§ 29.4. ЭЛЕКТРО- И ПОЖАРОБЕЗОПАСНОСТЬ
Повышенная влажность в помещениях гальванических
цехов, наличие агрессивных сред, возможность прикосновения
человека к токоведущим частям оборудования позволяют класси-
328
фицировать гальванические цеха по степени опасности поражения
электрическим током как особо опасные помещения.
Электротехническое оборудование, а также предметы, на
которых при авариях или при движении и трении могут появляться
статические электрические заряды, должны быть надежно зазем-
лены. У указанного оборудования должны быть ограждены движу-
щиеся и вращающиеся детали (шкивы, валы, муфты, штоки).
При эксплуатации ультразвуковых установок категорически за-
прещается работать при снятых облицовках генераторов; закора-
чивать или снимать блокировку; работать на незаземленной ус-
тановке.
Для защиты человека от поражения электрическим током в галь-
ванических цехах. необходимо следующее:
электропроводящие шины располагать в местах, недоступных
для случайного прикносновения, и покрывать устойчивыми ла-
ками или красками:
участки шинопроводов, расположенные вблизи сильно нагре-
тых устройств (паропроводов и т. п.), теплоизолировать;
электропроводящие шины, прокладываемые под ваннами, за-
щищать специальными укрытиями;
применять электродвигатели и электроаппаратуру во влаго-
непроницаемом исполнении;
электролизные ванны изолировать от земли;
сборные баки отработанного электролита обязательно зазем-
лять.
Пожаробезопасность обеспечивается главным образом предот-
вращением образования горючей среды и изоляцией источника за-
жигания в гальванических цехах. Предотвращение образования
горючей среды обеспечивается регламентацией допустимых кон-
центраций горючих газов, паров и аэрозолей; отдельным хранением
химических веществ, воспламеняющихся при совместном хранении;
местной вентиляцией для шлифовальных и полировальных станков
и для обезжиривания органическими растворителями.
Помещения для промывки и обезжиривания деталей запреща-
ется отапливать газовыми или электрическими приборами, а так-
же применять открытый огонь. С целью предотвращения искро-
образования и взрыва двигатели, пусковые устройства, вентиля-
торы должны быть взрывобезопасного исполнения или устанавли-
ваться в помещениях, хорошо изолированных от помещений про-
мывки.
В рабочих помещениях допускается хранить не более одной
суточной нормы растворителей и обязательно в герметичной
таре.
§ 29.5. ИНДИВИДУАЛЬНЫЕ СРЕДСТВА ЗАЩИТЫ
Обеспечение работающих средствами индивидуальной
защиты (СИЗ) производится в соответствии с действующими нор-
мами, утвержденными в установленном порядке, и в соответствии
11 Дасоян М. А. и др.
329
с выполняемыми операциями. К числу СИЗ, наиболее часто при-
меняемых при нанесении гальванических покрытий, относятся
средства защиты органов дыхания, глаз и кожных покровов.
Для защиты органов дыхания от вредных газов или паров (кроме
особо токсичных), присутствующих в воздухе производственных
помещений в концентрациях, не превышающих ПДК более чем в 15
раз, рекомендуется противогазовый респиратор РПГ-67 со смен-
ными патронами:
патрон А — поглотитель органических веществ;
патрон В — поглотитель кислых газов, паров хлор- и фосфор-
органических соединений;
патрон КД — поглотитель аммиака и сероводорода.
Для защиты органов дыхания от паров, газов, аэрозолей реко-
мендуется универсальный респиратор РУ-60М. Для кратковре-
менной работы (один-два дня) можно применять противопылевые
респираторы ШБ-1 «Лепесток» и «Снежок КУ-М». Респиратор
«Снежок КУ-М» защищает от пыли, аэрозолей кислот, токсичных
соединений кислого (HF, SiF4, НС1, SO2) и основного (NHS) ха-
рактера.
На участках приготовления электролитов, при переливании
дымящихся кислот, при дроблении хромового ангидрида или
щелочи следует использовать противогазы.
При работе с концентрированными химическими веществами,
при работе на шлифовально-полировальном оборудовании необ-
ходимо защищать глаза. Для этого выпускаются очки типов:
02-76, 06-76 — открытые защитные очки;
ЗН4-72, ЗМ8-72 — закрытые защитные очки с непрямой вен-
тиляцией;
ЗП1-80, ЗП2-8О.ЗПЗ-8О—закрытые очки с прямой вентиляцией.
Удобным и надежным средством защиты лица и глаз от брызг
и капель электролита являются различные наголовные защитные
щитки, например типа НБХ, с бесцветным химически стойким
корпусом конструкции ВЦНИИОТ. Для защиты кожи применя-
ются спецодежда, защитные фартуки, перчатки или рукавицы,
сапоги из кислощелочестойких материалов, а также нанесение на
кожу специальных защитных мазей, кремов и паст. Наибольшее
распространение получили пасты ИЭР-2, ФС 42-95-72, крем
«Силиконовый», паста Чумакова, кремы ПМС-200, ПМС-400 на
основе полиметилсилоксанов и др.
РАЗДЕЛ X
ОСНОВЫ КУРСОВОГО и дипломного
ПРОЕКТИРОВАНИЯ ЦЕХОВ
ЭЛЕКТРОХИМИЧЕСКИХ покрытий
Изучение курса «Технология электрохимических покрытий»
завершается выполнением курсовых и дипломных проектов. Во
время производственной и преддипломной практики учащиеся
должны выбрать темы и собрать необходимые сведения для проек-
тирования.
Курсовой проект. Курсовой проект состоит из пояснительной
записки и графической части. Объем пояснительной записки—
20—25 страниц; в нее входят общая и расчетная части.
I. Общая часть должна отражать следующее:
1) назначение, программу и режим работы цеха; 2) характе-
ристику детали, выбор вида и толщины покрытия; 3) выбор тех-
нологического режима и его описание; 4) выбор и описание
оборудования.
II. Расчетная часть включает следующее? 1) расчет времени
для нанесения покрытия; 2) определение единовременной за-
грузки; 3) форму и размеры подвесочного приспособления; 4) рас-
чет размеров ванны основного покрытия; 5) расчет расхода пара,
сжатого воздуха, электроэнергии; 6) расчет расхода материала
для основного вида покрытия; 7) технико-экономические пока-
затели.
Графическая часть выполняется на двух листах 24-го фор-
мата: первый лист — это чертеж нормализованной, колокольной
или барабанной ванны для нанесения основного покрытия; вто-
рой — чертеж подвесочного устройства или чертеж оборудования
для подготовительных или заключительных операций.
Дипломный проект. Дипломный проект состоит из пояснитель-
ной записки и графической части. Объем пояснительной записки —
50—70 страниц; она содержит следующие части.
I. Общая часть отражает: 1) назначение, программу и режим
работы цеха; 2) характеристику детали, выбор вида и толщины
покрытия.
II. Специальная часть должна иметь: 1) выбор и обоснование
технологического процесса; 2) анализ и приготовление электро-
лита; 3) контроль качества покрытий; 4) выбор оборудования,
j, III. Расчетная часть должна включать: 1) определение вре-
мени обработки детали при осаждении покрытия; 2) расчет ос-
11* 331
новных параметров оборудования; 3) компоновку автоматических
линий; 4) выбор источников постоянного тока; 5) расход пара и
сжатого воздуха; 6) расход воды; 7) вентиляцию; 8) расход
электроэнергии; 9) расход материалов.
IV. Организация производства и экономическая часть состоит
из: 1) расчета эффективного фонда времени работы оборудования;
2) расчета рабочего времени и численности рабочих; 3) расчета
стоимости оборудования, электроэнергии, пара, сжатого воздуха,
воды, материалов; 4) расчета цеховой себестоимости и т. п.
V. В дипломном проекте должны быть отражены прогрессивно-
технические решения.
VI. Охрана труда, техника безопасности и обезвреживание
сточных вод освещаются в пределах заданной темы.
Графическая часть проекта выполняется на пяти-шести листах
24-го формата: первый лист — чертеж общего вида линии; вто-
рой — чертеж ванны для нанесения покрытия; третий — чертеж
компоновки линии; четвертый — планировка участка; пятый —
чертеж прибора для автоматического контроля и регулирования
параметров технологического процесса; шестой — чертеж вспо-
могательного оборудования и т. п. Чертежи выполняются каран-
дашом с учетом требований ЕСКД-
ГЛАВА 30. ОБЩАЯ И СПЕЦИАЛЬНАЯ ЧАСТИ ПРОЕКТА
§ 30.1. ИСХОДНЫЕ ДАННЫЕ ДЛЯ ПРОЕКТИРОВАНИЯ
Основными исходными данными для проектирования
являются: годовая производственная программа; действительный
фонд времени работы оборудования; материал детали, ее масса
и габаритные размеры; вид и толщина покрытия и т. п.
Годовую производственную программу в гальванических цехах
выражают в единицах площади. При нанесении покрытий в на-
сыпном виде ее целесообразно указывать и в единицах массы.
30.1. Действительный годовой фонд времени работы оборудования
Режим работы цеха Оборудование
автом атизи рован иое неа втом атизи р ов а н иое
Номи- нальный фонд Фи, ч Потери времени от номи- нального фонда, % Действи- тельный годовой фонд Фв, ч Номи- нальный фонд Фи, ч Потери времени от номи- нального фонда, % Действи- тельный годовой фонд Фв, ч
Одна смена 2070 2 2030 —
Две смены 4140 3 4015 4140 8 3180
Три смены 6210 4 5960 6210 10 5590
332
Необходимые сведения о детали, а также ее эскиз приводятся на
основании данных, собранных во время преддипломной практики.
Площадь детали может быть принята по материалам завода или
определена расчетным путем. Если часть детали изолируется, то
указываются площадь всей детали и площадь покрытия.
Действительный годовой фонд времени работы оборудования
для гальванических цехов, работающих в одну, две и три сме-
ны, приведен в табл. 30.1.
В зависимости от режима работы цеха и вида оборудования
определяется из табл. 30.1 действительный годовой фонд вре-
мени работы оборудования Фв.
§ 30.2. ОБЩИЕ ТРЕБОВАНИЯ К ВЫБОРУ ВИДА
И ТОЛЩИНЫ ПОКРЫТИЯ
При выборе покрытия следует исходить из функцио-
нального назначения детали и условий ее эксплуатации. Условия
эксплуатации определяются согласно ГОСТ 15150—69 в зависи-
мости от климатического исполнения и категории размещения
детали с учетом типа атмосферы (см. приложение 1).
Установив группу условий эксплуатации, определяем в соот-
ветствии с ГОСТ 9.303—84 толщину покрытия. Его условное обоз-
начение регламентирует ГОСТ 9.306—85 (см. приложение II).
Выбирая вид покрытия, необходимо проверить допустимость
контакта металлов детали и покрытия (см. приложение Ш).
При выборе толщины покрытия, не указанного в ГОСТе, необхо-
димо руководствоваться отраслевыми нормативами. Требования
к поверхности детали перед нанесением покрытия определены
ГОСТ 9.301—86.
§ 30.3. ВЫБОР ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
Технологический процесс нанесения покрытий состоит
из операций, которые можно разделить на подготовительные, на-
несение покрытий и заключительные.
При выборе подготовительных операций необходимо учитывать
материал детали, степень ее загрязненности и шероховатость
поверхности. Шероховатость поверхности для защитных покры-
тий должна быть не ниже Rz = 40 мкм, для защитно-декоратив-
ных — Ra = 2,5 мкм; при нанесении твердого и электроизоля-
ционного покрытия — Ra = 1,25 мкм. Шероховатость поверх-
ности определяют по ГОСТ 2789—73 (СТ СЭВ 638—77).
Выбор электролита для нанесения основного покрытия произ-
водят на основании сравнительной характеристики применяемых
для данного вида покрытия электролитов с учетом электрохимиче-
ских параметров. При нанесении подслоя необходимо обосновать
его применение и выбрать состав электролита. К заключительным
операциям относятся нейтрализация, осветление и пассивация,
333
Форма 30.1. Схема технологического процесса (вид покрытия)
Процесс Состав электролита Режим работы
компонент концентрация, г/л плотность, А/дм3 температура, °C
наполнение и пропитка, сушка и т. п. Правильный выбор этих
операций во многом определяет качество покрытий. Основные схемы
технологических процессов приведены в приложениях IV и V.
После выбора всех операций составляют схему технологического
процесса согласно форме 30.1. В специальной части приводится
анализ и приготовление основного электролита. Контроль ка-
чества покрытия осуществляется по ГОСТ 9.302—79.
§ 30.4. ВЫБОР ОБОРУДОВАНИЯ
Тип оборудования определяется размерами и массой
деталей, производственной программой и схемой технологического
процесса. По степени автоматизации оборудование делят на ав-
томатические и механизированные линии и оборудование малой
механизации.
Автоматические линии бывают с нежестким и жестким единич-
ным циклом. К первому типу относят автооператорные линии,
ко второму — линии с подъемным мостом, чаще всего это кареточ-
ные овальные линии.
В табл. 30.1 приведена характеристика автооператорных ав-
томатических линий, в табл. 30.2 — кареточных автоматических
линий. Все линии имеют свой шифр. Например, лйнии, разрабо-
танные Научно-исследовательским институтом технологии трак-
торного сельскохозяйственного машиностроения, в шифре имеют
букву Л; разработанные Экспериментальным конструкторским и
технологическим институтом автомобильной промышленности, —
КГ и К. Разработчиком остальных линий является Центральное
конструкторское бюро оборудования гальванопокрытий — ЦКБ
ОГ, г. Тамбов.
Автооператорные автоматические линии. Автооператорные ли-
нии с программным управлением получили наибольшее распро-
странение во всех отраслях промышленности. В линиях такого
типа можно осуществлять: различные технологические процессы
с производительностью от 1 до 60 м2/ч; обработку деталей на
подвесках и в барабанах; обработку мелких и крупногабаритных
деталей.
Перенос деталей осуществляется при помощи автооператоров
как в прямом, так и в обратном направлениях. Ванны могут рас-
полагаться в любой последовательности. Длительность пребыва-
334
ния на каждой позиции определяется технологическим процес-
сом, при этом автооператор может переносить детали на другие
позиции и снова возвращаться на исходную. В зависимости от
производительности и числа позиций линию могут обслуживать
один или несколько автооператоров.
По способу перемещения различают линии с подвесными, пор-
тальными и консольными автооператорами. Свободное перемеще-
ние автооператоров создает условия для создания разнообразных
компоновок: однорядных прямолинейных, однорядных криволи-
нейных, двухрядных прямолинейных, двухрядных овальных и
т. п. Согласно ГОСТ 23739—79, автооператоры в зависимости от
расположения путей для их перемещения делятся на подвесные,
портальные и консольные. Подвесные автооператоры при длине
ванн до 1600 мм —монорельсовые, при длине ванн более 1600 мм—
двухрельсовые. Скорость горизонтального перемещения 1,5 м/с,
скорость подъема-опускания 0,15 м/с. Характеристика автоопера-
торов подвесного типа приведена в табл. 30.3.
Мелкие детали обрабатывают в насыпном виде в барабанах.
Для нанесения химических покрытий и для травления их изго-
товляют из стали марки 12Х18Н10Т или 10Х17Н13М2Т. Бара-
баны для нанесения покрытий изготовляют из пластических масс,
например из пропилена, с разборными обечайками. В табл. 30.4
приведена характеристика барабанов, применяемых в автоопера-
торных линиях.
Барабаны 1, 2 и 4, 5 разработаны ЦКБ ОГ, барабан 3 —
ТЭ6/2250 «Гальванотехника». Эта модель имеет два барабана, раз-
деленных на две секции. Габаритные размеры подвесок для автома-
тических линий зависят от размеров ванн, особенно от их глубины
и межэлектродных расстояний (табл. 30.5). В зависимости от кон-
струкции основания подвески бывают выполнены в неподвижном
виде, с механизмом качания, с поворотом деталей и т. п.
Кареточные овальные автоматические линии. Такие линии
применяются в крупносерийном производстве в различных от-
раслях промышленности. Производительность линий при нане-
сении электрохимических покрытий — до 80 м2/ч, при нанесении
анодно-оксидных и химических покрытий — до 100 м2/ч. Техно-
логический процесс осуществляется по жесткой программе, воз-
можно лишь незначительное изменение технологического про-
цесса, например можно наносить цинк или кадмий с пассивацией
и без нее.
Кареточная овальная линия состоит из двух рядов ванн, рас-
положенных в порядке выполнения технологических операций.
Механизм переноса кареток с барабанами или подвесками рас-
положен посередине. Вертикальное перемещение осуществляется
при помощи механизма подъема моста. Подвески перемещаются
вдоль линии толкающими штангами, передвигающими тележку
с кареткой на одну позицию. Ванны, применяемые в автоматах
подобного типа, могут быть одно- и многопозиционными. Одно-
335
30.1. Основные параметры автоопера
Шифр Назначение Производитель- ность, мх/ч Габаритные размеры ванны, мм
АЛГ-365 Цинкование стальных из- делий в барабанах 6; 23; 28 1120Х800Х1000
АЛГ-81 Цинкование стальных из- делий в барабанах и на под- весках Б26; П7,2 1120X800X1250
АЛГ-35М То же Б20; П4,35 1120X800X1250
АЛГ-389 » Б22; 18,3; 13,7; П5,2; 4,3; 3,2 1120X800X11250
АЛГ-383 » БЗО; 22; 18; П7,2; 5,4; 4,3 1600Х800Х 1250
АЛГ-379 Цинкование и кадмирова- ние стальных изделий в ба- рабанах и на подвесках Б25; 18,6; 15; П6.25; 4,7; 3,75 1600X800X1250
КГ. 1206 Кадмирование в бараба- нах и на подвесках Б5; П15 1120Х710Х 1250
АЛГ-403 Никелирование стальных изделий иа подвесках 16 2250Х710Х 160
АЛГ-241 То же 16 2240Х 710Х1600
АЛГ-217 Никелирование стальных изделий в барабанах 35; 23,6; 17,9 1600Х800Х 1250
АЛГ-76М Никелирование и хроми- рование стальных и латун- ных изделий на подвесках 3,8; 6,7; 8 1600Х800Х 1250
КГ. 1120 Твердое хромирование на подвесках 1,5 1600Х 710Х 1250
АЛГ-216 То же 4,5 1600X1120X1520
АЛГ-402 Хромирование стальных изделий на подвесках 12 1600X1120X1250
ГН66.М Меднение на подвесках 4,6 1500Х 700Х 1200
АЛГ-314 Серебрение медных изде- лий в барабанах и на под- весках Б17; 11,5 1120Х710Х 1250
АЛГ-82М Анодирование алюминия 22 1600Х800Х 1250
АЛХ-143 Оксидирование в корзин- ках 40 1600X800X1250
АЛХ-78 Фосфатирование на под- весках 42; 51,5 2240X 630X1600
АЛХ-153 Фосфатирование в корзи- нах 64 1600X800X1250
Примечание. Б — обработка в барабанах, П — обработка на подвесках.
336
торных автоматических линий
Толщина, мкм Загрузка, м® Мощ- ность, кВт Число автоопе- раторов Габаритные размеры, м
6; 9; 12; 15 4 20,1 2 18,2X3,7X3,9
9 к*.»’ Б3,5; ПО,94 20,6 3 18,1X4,4X4,6
9—12; 15—18 Б4; ПО,87 11,8 2 18.7Х2.4Х 4,6
9—24 Б4; ПО,94 18,6 2 20,8Х 2,7X4,5
9-12; 15—24; 27—30 Б6; П1.45 14,2 2 19,9X4,3X4,7
9—12; 15—24; 27—30 Б5; П1625 12,1 2 19,5X3,4X4,7
6 Б2; ПО,67 — 2 22,7X4,9X5,4
5-6 2,15 26,3 2 17,9X3,7X5,3
6—9; 12—15 2,15 23,9 2 17,9X3,7X5,3
6; 9; 12 7 29 2 24Х 2,9X4,2
Никель 9—15, хром до 1 1,32 23,7 2 18,1X2,9X4,6
30 — — 1 17.7Х6.5Х 5,4
50 0,6 8,4 1 29,6X3,9X4,6
Медь 9, никель 18, хром до 1 2 27,8 3 20,1X6,9X5,5
6 0,2 — 1 21,4X4X5,4
3; 9; 15 2 13,8 2 20,8X2,6X4,6
—- 4,15 23,2 2 18,9X2,8X4,6
0;* 6,6 9,3 2 25.2Х2.9Х 4,6
X- 12 7,8 1 20X3,5X5,2
— 10 10,5 2 21.1Х2.9Х 4,6
ЖЛИ 1 - <• 1 i
337
30.2. Основные параметры
Шифр Назначение Производитель- ность, м’/ч
АЛГ-380 Защитно-декоративное хромирование сталь- ных изделий на подвесках 140
АЛГ-139 Никелирование стальных деталей на под- весках 45
АЦП-5М Цинкование (кадмирование) стальных дета- лей на подвесках 30
АЛГ-57 То же 75
АЛГ-405 » 90
КГ.7302 Кадмирование стальных деталей 10—40
КГ.7366 Меднение на подвесках 40
АЛ Г-167 Защитно-декоративное анодирование алюми- ниевых сплавов на подвесках 67,5
АЛА-6 То же 43
КГ.7374 Фосфатирование иа подвесках 100
позиционные ванны используют для тех операций, время обра-
ботки которых меньше темпа работы линии. Многопозиционные
ванны предназначены для нанесения покрытий, сушки и других
операций, время которых больше темпа работы линии.
Типоразмер ванны выбирается в зависимости от ее назначения,
габаритных размеров подвески, числа катодных штанг и т. п.
Размеры многопозиционных ванн определяются временем нане-
сения покрытия и темпом работы линии.
Специальные автоматические линии, например Д-230, предна-
значены для фосфатирования мелких деталей, АЛА-5 применяется
для анодирования крупногабаритных деталей, АГ-12—для золоче-
ния мелких деталей, АГ-15 — для меднения печатных плат и т. п.
Оборудование малой механизации. К этому виду оборудования
относят нормализованные, колокольные и барабанные ванны, уста-
30.3. Основные параметры
автооператоров подвесного типа
Грузо- подъем- ность, т Высота подъема груза, мм Длина обслу- жива- ния, мм Масса, кг
0,05 2000 800 200
0,1 1600 250
0,2 3150 450
0,4 3000 6300 1000
1 6300 2000
2 8000 4500
новки для нанесения покры-
тий в насыпном виде, ста-
ционарные колокола, пере-
носные барабаны и т. п.
Внутренние габаритные
размеры нормализованных
ванн, разработанные ЦКБОГ,
приведены в табл. 30.6. В за-
висимости от назначения
ванны снабжены вентиля-
цией, змеевиками для нагрева
или охлаждения, электрона-
гревателями, механизмом ка-
чания штанг, барботерами
и т. д.
338
кареточных автоматических линий
Габаритные раз- меры подвески, мм Толщина, мкм Загрузка, м1 Мощность, кВт Габаритные размеры, м
400X150X 900 Медь — 12; никель — 12; хром — 0,5 0,8 48,7 20,5Х 6,5X3,9
600Х 150X1100 18 1,2 48,2 18,5Х 6,4X4,6
400Х 100X900 15-18 1,0 21,2 14,6Х 6,4Х 4,6
600X150X 900 9 1,3 30,2 24,6X6,5X4,3
600X150X1100 18 1,54 27,7 24,6Х 6,5Х 4,6
600Х200Х 800 9-15 — 24,6Х 6,2X4,4
600X200X900 12 — .— 18,2Х 4,2X6,8
600X200X800 — 1,78 — 26,ЗХ 5,9Х 4,7
600X200X1100 —. 1,8 .— 20,6Х 6,4X4,8
600X 200X 500 10 — 11,5 15,8X5,9X3,5
30.4. Характеристика барабанов для автооператорных линий
№ п/п 1 Длина ван- 1 иы, мм Загрузка, кг Частота вращения, об/мин Габаритные размеры (длина X высота X ширина) ваниы, мм Масса, кг Габаритные размеры (диаметр X XДлина) барабана, мм
Для электрохимических покрытий
1 1120 40 7,8 1127X 424X1104 370 340X 640
2 1500 60 8,3 1640X 520X1220 85 620X 800
3 2240 120 8,3 2380X520X1220 52 520X 800
Для химической обработки
4 1120 75 1,9 1287X 430X1120 190 400Х 688
5 1600 100 1,9 1758X 430X1120 210 400X1168
30.5. Размеры подвесок
Глубина ваниы, мм Межзлек- тродиое рас- стояние, мм Габаритные размеры, мм
высота ширина длина
( 450 800 150 400, 600, 900, 1300
1200 600 800 250 400, 600, 900, 1300
( 450 1100 150 400, 600
1500 600 1100 250 600, 900
339
30.6 Внутренние габаритные размеры нормализованных ванн
Тип ванны Внутренние габа- ритные размеры, мм Рабочий объем, л Тип ванны Внутренние габа- ритные размеры, мм Рабочий объем, л
01 600X500X800 250 08 1500Х 1000Х 1000 1300
02 800X 700X 800 400 09 2200Х 700Х 1000 1400
03 1200X 700X 800 600 10 2200Х 1000Х 1000 2000
04 1500X 700X 800 750 11 3000Х 700Х 1000 2000
05 800Х 700Х 1000 550 12 3000Х 1000Х 1000 2700
06 1200Х 700Х 1000 800 13 800Х450Х 1000 2700
07 1500Х 700Х 1000 1000 14 800Х 450х Ю00 3500
Мелкие детали (винты, болты, шайбы и др.) диаметром до 80 мм
и длиной до 60 мм покрывают в колокольных ваннах. Тамбовский
завод гальванического оборудования выпускает серийную мо-
дель В К-40 для нанесения покрытий (кроме хрома и драгоцен-
ных металлов). Техническая характеристика В К-40 приведена
ниже:
Производительность, кг/ч...................... 33
Объем колокола, л............................. 40
Загрузка:
л........................................ 12
кг........................................ 25
Рабочий объем ванны, л........................ 370
Габаритные размеры ванны, мм............. 1865X912X1200
Температура, °C........................... Не выше 50
Небольшие партии очень мелких деталей (иглы, молнии и
т. п.) можно покрывать в колокольных установках, которые выпу-
скает фирма «Ковофиниш» (ЧССР). Установка SPZ-5 со стационар-
ным колоколом имеет следующую характеристику:
Вместимость колокола, м*........................ 5-Ю-2
Загрузка колокола по массе, кг..................... 0,5
Габаритные размеры установки, мм ............. 376X 450X1535
Сила тока, А....................................... 40
Напряжение, В...................................... 15
Это же предприятие выпускает переносные барабаны для не-
больших партий мелких деталей. Барабан PIONIR размером
170 х250 мм обрабатывает детали диаметром не менее 3 мм, его
загрузка 3 кг; габаритные размеры ванны 340x210x485 мм,
масса 5,9 кг. В табл. 30.7 приведена характеристика ванн с по-'
гружными перфорированными барабанами.
При мелкосерийном производстве широко используются. пере-
носные барабаны типа БП со следующими характеристиками:.
340 г • :
30.7. Характеристика ванн с погружными барабанами
Тип барабана Габаритные размеры ванны, мм Размеры барабана (диаметр, длина), мм Загруз- ка, кг Объем электро- лита, л
Погружаемые на 1/2 диаметра:
шестигранные 550Х600Х 700 230X 450 12 150
круглые Шестигранные пол- ного погружения: 550X600X700 300X 450 20 150
двухкамерные 970X 550X 800 370X 750 30 250
трех камерные 1300X 620X 800 360Х1000 60 550
С подъемным меха- низмом 900X800X800 500X600 40 400
Объем барабана, л ............. 2,8
Загрузка:
по объему, л.............. 1,0
» массе, кг .............. 2,8
Частота вращения, об/мин. . 9,5
Внутренние размеры, мм:
длина.......................250
диаметр................. 125
В таких барйбанах можно совмещать операции промывки
сушки и нанесения покрытий.
ГЛАВА 31. РАСЧЕТНАЯ ЧАСТЬ ПРОЕКТА
§ 31.1. ОПРЕДЕЛЕНИЕ ВРЕМЕНИ ОБРАБОТКИ
ДЕТАЛИ В ВАННЕ ОСНОВНОГО ПОКРЫТИЯ
Общее время обработки детали в ванне основного покры-
тия определяется по формуле
= Ti + та,
где Ti — продолжительность процесса, мин; та — вспомогатель-
ное время, мин.
При электрохимическом осаждении металлов (мин) опреде-
ляется по формуле
Ti = 6у60 000/(ciKT]), (31.1)
где 6 — толщина покрытия, мм; у — плотность металла, г/см3;
с — электрохимический эквивалент, г/(А-ч); iK — плотность тока,
А/дм2; т] — выход по току.
При нанесении покрытий в насыпном виде (барабаны, коло-
кола, корзины) расчетное время необходимо увеличить не менее
чем на 25—30 %. Продолжительность процессов анодирования,
фосфатирования и оксидирования принимают по техническим
условиям. При нанесении химического никеля продолжительность
341
• -
процесса зависит от скорости осаждения покрытия. Вспомогатель-
ное врмя т2 зависит от типа оборудования. При непрерывной ра-
боте оборудования оно составляет 1—2 мин, а для оборудования,
работающего с перерывами, т. е. при малой механизации, —5—
10 мин.
д'
§ 31.2. РАСЧЕТ ОБОРУДОВАНИЯ f
Исходными данными для расчета являются: Ргод —
годовая программа, м2 (т); Фв — действительный фонд работы обо-
рудования, ч; т — время обработки, мин; у — единовременная
загрузка, м2 (т); тип оборудования.
Расчет числа ванн для оборудования малой механизации. Число
загрузок в год рассчитывается по формуле
М = РГГ)Д1у. (31.2)
Время, необходимое для обработки всех деталей,
= (31.3)
Число ванн основного покрытия
п = (31.4)
Коэффициент загрузки оборудования
К = п/пар, (31.5)
где ппр — принятое число ванн. Коэффициент загрузки должен
быть не ниже 0,85—0,95.
Расчет габаритных размеров ванны основного покрытия.
Длина ванны определяется по формуле
Ьвн = n1L1 + (п^ — 1) L2 2L3, (31.6)
1 — подвеска; 2 — анод
342
где Lx — размер подвески по длине ванны, мм; La — расстояние
между подвесками, мм; La — расстояние между торцевой стенкой
и краем подвески, мм; пх — число загружаемых на одну штангу
подвесок (рис. 31.1).
Расстояние между подвесками в зависимости от конфигурации
и размеров деталей принимается в пределах 30—100 мм. Расстояние
между торцевой стенкой ванны и краем подвески 50—100 мм.
Внутренняя ширина ванны для нанесения электрохимических
покрытий определяется по формуле
Ввн = паВ1 + 2паВа + 2В3 -}- nad, (31.7)
где — максимальный размер детали по ширине ванны, мм;
Ва — расстояние между анодом и ближайшим краем детали, мм;
Ва — расстояние между внутренней стенкой продольного борта
ванны и анодом, мм; п2 — число катодных штанг; па — число
анодных штанг; d — толщина анода, мм.
Расстояние между анодом и деталями принимается равным
100—150 мм для плоских деталей и 150—200 мм для деталей слож-
ной конфигурации. Расстояние между внутренней стенкой ванны
и анодом при наличии на стенке змеевика берется равным 80—
100 мм, в остальных случаях — 50 мм. При толщине анодов 10—
15 мм они в расчет не принимаются.
Внутренняя ширина ванн для проведения химических про-
цессов, которые не имеют электродов, определяется по формуле
Ввн = n4Bj + В4 (л4 — 1) + 2Вб,
где п4 — число штанг; Bt — размер подвески с деталями по ши-
рине ванны, мм; В4 — расстояние между двумя подвесками по
ширине ванны, мм; В5 — расстояние от края подвески до продоль-
ного борта ванны, мм.
Внутренняя высота ванны
Нт{ = Ht + На + На + Hit (31.8)
где Нг — высота подвески (без подвесного крюка), мм; На — рас-
стояние от дна ванны до нижнего края детали, мм; На — высота
электролита над верхним краем подвески, обычно 50 мм; Я4 —
расстояние от поверхности зеркала электролита до верхнего края
бортов ванны, мм.
Расстояние от дна ванны до нижнего края детали 150—200 мм,
при этом следует учитывать наличие на дне ванны змеевика и
барботера. Расстояние от поверхности зеркала электролита до
верхнего края бортов ванны принимают 100—150 мм.
Объем электролита определяют по формуле
V = LbhBbh (Нвн - нд,
где все размеры берутся в дм, а объем — вл.
Определив внутренние размеры ванны, следует откорректи-
ровать их в соответствии с размерами нормализованных ванн.
.343
Расчет колоколов и барабанов. При расчете ванн колокольного
или барабанного типа задаются размерами колоколов или бара-
банов и определяют единовременную загрузку. Иногда расчет
ведут по заданной единовременной загрузке, на основании кото-
рой определяют размеры колоколов и барабанов.
Расчет колоколов производится следующим образом. Вели
колокол имеет форму усеченного конуса, его объем (л) <
Кол = (R2 + А2 + Rr) (лЛ/3), '
где R — радиус нижнего основания колокола, дм; г — радиус
верхнего отверстия колокола, дм; h — высота колокола, дм.
При расчетах принимают г = (0,74-0,8) R, h = 2R, тогда
объем колокола
Кол = 4,67?3.
Объем колокола принимают равным 1,5—2,0 объема электро-
лита вместе с деталями, т. е. Укол = (1,54-2,0) Уэл.
Объем электролита вместе с объемом, занимаемым деталями,
принимают равным 3—6 объемам, занимаемым деталями в насып-
ном виде: Уэл = (34-6) Унас. Насыпной объем деталей составляет
3—10 объемов загружаемых деталей: Унас = (34-10) Удет. На-
сыпной объем деталей должен составлять 10—20 % всего объема
колокола.
Внутренние размеры колокола по единовременной загрузке
рассчитываются исходя из тех же данных, но в обратном порядке.
Наружные размеры колокола определяются внутренними раз-
мерами и толщиной стенок, равных 10—30 мм.
Расчет барабана шестигранной формы приведен ниже. Объем
барабана (л)
V - 2УИ = 2,6R2l,
где R — радиус описанной окружности, дм; I — длина бара-
бана, дм. Длина барабана I — (1,54-3) dBH.
Единовременная загрузка составляет 25—35 % объема ба-
рабана при электрохимическом осаждении покрытий и 50—70 %
при химических процессах: Унас = (0,254-0,35) V и Унас =
= (0,54-0,7) V. Масса деталей, соответствующая объему 1 дм®,
равна т = (0,84-2,6) кг. Площадь загрузки при заданной массе
будет равна S3 = 10/пУнас, считая, что 1 кг деталей соответствует
10 дм2.
При расчете внутренних размеров барабана по единовременной
загрузке расчет производится таким же образом, но в обратном
порядке. Внешние размеры барабана по длине отличаются от
внутренних на 100—200 мм, внешний размер диаметра барабана—
примерно на 100—150 мм. Внутренние габаритные размеры ванны,
в которой обрабатываются детали в барабане, определяются сле-
дующим образом:
i LBH = I -|- 2/lt .a ..u-'
где 1г — расстояние между торцевыми стенками ванны и барабана,
обычно принимают 100—200 мм; I — длина барабана, мм.
'Внутренняя ширина ванны при загрузке одного барабана
определяется по формуле
\ ^вн — 7>нар + 2Bi + 2Ва + 2d,
где ©нар — диаметр описанной окружности барабана, мм; —
расстояние между анодом и барабаном, принимается 100—200 мм;
В2 — расстояние между анодом и ближайшей стенкой ванны,
обычно берется 50—100 мм; d — толщина анода, обычно равная
5—20 мм.
Внутренняя высота ванны рассчитывается следующим образом:
Явн = + Н2 + Нб + Рнар,
где Нг — расстояние от дна ванны до нижнего края барабана,
обычно принимается равным 150—300 мм; Н2 — расстояние от
зеркала электролита до верхней части барабана, обычно равное
100—150 мм; Яб — расстояние от зеркала электролита до верх-
него края бортов ванны, равное 150—300 мм; £>нар — диаметр
барабана, мм.
Расчет основных параметров автооператорных линий. Расчет-
ный темп выхода 7р, мин (подвесок, барабанов и т. п.), опреде-
ляется по формуле
Т’р = Фв60у/Ргод, (31.9)
где Фв — действительный фонд времени работы оборудования, ч;
у — единовременная загрузка деталей в ванну, м2 или кг; Ргод —
годовая программа, м2 или т.
Расчет числа ванн покрытия определяется следующим образом:
п = т/Тр, (31.10)
где т — время обработки в ванне основного покрытия, мин,
т = Ti 4- т2. При расчетном п < 1 число ванн принимается
равным 1, если п > 1, число ванн округляется до большего целого
числа.
Расчет числа ванн для нанесения подслоя производится ана-
логичным путем. Потребное число ванн для подготовительных и
заключительных операций может быть также определено путем
расчета, однако из-за непродолжительности этих операций их
число принимают равным единице. Исключение должны состав-
лять случаи, когда время обработки какой-либо операции, напри-
мер сушки, превышает темп выхода подвески.
Темп выхода при 100 %-ной загрузке ванн покрытия равен
отношению продолжительности процесса обработки т к приня-
тому числу ванн:
7 = ^. (31.11)
345
Рис. 31.2. Универсальное подвесочное приспособле-
ние:
1 — рамка; 2 — подвесной крюк; 3 — барашек; 4 — цепль-,
5 — перемычка
Потребное число автоматов т определяют отношением приня-
того темпа Т к расчетному Тр
т = Т/Тр. (31.12)
Часовую производительность автомата (м2/ч или кг/ч) рассчи-
тывают по формуле
Q = 60у/Т. (31.13)
Коэффициент загрузки автомата
К = mlm^ (31.14)
где тг — принятое число автоматов.
Расчет основных параметров автоматов кареточного типа.
Темп выхода подвески определяют по формуле
Тр = (Фв60г/)/Ргод. (31.15)
Кареточные автоматы работают с темпом 0,7—1 мин или
3—3,5 мин. Если расчетный темп превышает допустимые пределы,
необходимо пересчитать его, изменив размеры подвесок и едино-
временную загрузку.
Часовая производительность автомата (м2/ч) определяется по
формуле
. Q = 60p/7p. у (31.16)
346
\ Потребное число автоматов т определяется отношением при-
нятого темпа Т к расчетному темпу Тр
m Т/Тр. (31.17)
‘ Коэффициент загрузки автомата рассчитывается как отноше-
ние расчетного числа автоматов к принятому
К = (m/mj) 100 %. (31.18)
Число позиций в каждой ванне определяется по формуле
| п = т/Т. (31.19)
Время перекидки рычагов из ванны в ванну в автоматах ка-
реточного типа составляет 25—35 с, поэтому при расчетах его
можно не учитывать.
Пример расчета основных параметров нормализованной ванны.
Определить число и размеры ванны хромирования при нанесении
защитно-декоративных покрытий Мб.НЗ.Х.б.
Исходные данные. Толщина хрома при нанесении
защитно-декоративных покрытий медь—никель—хром равна 1 мкм.
Хром наносится в универсальном электролите при плотности
тока 15 А/дм2. Ванна имеет две катодные штанги. На подвеску
размером 500 X 600 мм завешиваются 48 плоских деталей раз-
мером 50x100x2 мм (или 0,5x1x0,02 дм). Универсальное под-
весочное приспособление с размещенными деталями представлено
на рис. 31.2. Подвеска рамочного типа имеет четыре ряда, в каж-
дом ряду по шесть деталей. Годовая программа 11 500 м2. Фв =
= 3180 ч.
Расчет ведут в следующей последовательности.
1. Определяют площадь детали:
= 2 (0,5-1,0 + 1,0-0,02 + 0,5-0,02) = 1,06 дм2.
2. Определяют единовременную загрузку деталей в ванну.
Так как на одной подвеске размещается 6-4 = 24 детали, то на
двух подвесках находится 48 деталей, площадь которых равна
у = 48-SH = 48-1,06 = 50,88 дм2,
принимают у = 51 дм2.
3. Рассчитывают время нанесения хрома по формуле 31.1:
7,0-0,001-60000 с ~о
= —5-0,323.15- = 5’78 МИИ;
<г2 = 4,2 мин; т — 10 мин.
4. Число загрузок в год по (31.2)
М = 11 500/0,51 = 22 549. ‘ v'~ ' ‘ ”
5. Время для обработки всех деталей по (31.3)
2т = 22 549-10/60 = 3758 ч.
347
6. Число ванн хромирования по (31.4) /
п = 3758/4015 - 0,93, /
принимаем п = 1. I
7. Коэффициент загрузки ванны хромирования по (31.5) /
К = 0,93/1 = 0,93. /
8. Длина ванны хромирования по (31.6) /
LBH = 500 + 2-150 = 800 мм,
где = 500 мм (размер подвески по длине ванны), L3 = 150 мм,
12 = 0, так как на катодную штангу завешивают одну подвеску.
9. Ширина ванны при наличии двух катодных и трех анодных
штанг по (31.7)
Ввн = 100-4 + 100-2 + 25-2 + 5-3 = 675 мм,
где = 100 мм, В2 = 100 мм, В3 = 25 мм, d = 5 мм.
10. Высота ванны по (31.8)
Нт = 600 + 150 + 50 + 150 = 950 мм,
где Н2 = 150 мм, Н3 — 50 мм, //4 = 150 мм.
Определив размеры ванны хромирования, подбирают соответ-
ствующую ванну по табл. 30.6.
Внутренние габаритные размеры ванны 05 составляют 800 X
X 700 х 1000 мм. Объем электролита 550 л. Ванна имеет дву-
сторонние бортовые отсосы и комбинированный теплообмен:
коллектор нагрева на дне ванны и змеевик охлаждения вдоль
ванн. Корпус имеет футеровку.
Таким же образом можно рассчитать необходимое число ванн
никелирования и меднения и коэффициент их загрузки, так как
годовая программа и единовременная загрузка у них одинаковы.
Пример расчета автоматизированной автооператорной ли-
нии. Рассчитать основные параметры автооператорной линии для
нанесения покрытия Ц. хр.18.
Исходные данные. Тип автомата АЛГ-35, предназна-
чен для цинкования стальных деталей на подвесках, однорядный.
Размер подвесочного приспособления 900 X 200 X 800 мм. Еди-
новременная загрузка при коэффициенте заполнения 0,8 равна
1,15 м2. Годовая программа 21 000 м2. Фв = 3810 ч.
Расчет ведут в следующей последовательности.
1. Определяют темп выхода подвески по формуле (31.10)
„ 3810-60-1,15
ТР = —2Г000~ = 12’6 МИН’
2. Цинк наносят в хлораммонийном электролите при iK =
= 1,5 А/дм2, т] = 95 %. Продолжительность цинкования по
(31.1)
7,13-0,018-60 000 .. оп
Ч = -------175-1,22-95- ~= 44’29 МИН’
. йЛ
Рис. 31.3. Компоновка автооператорной линии
т = 46 мин с учетом времени на подготовительные работы.
3. Число ванн цинкования определяют исходя из темпа вы-
хода подвески по (31.10)
п = 46/12,5 = 3,68,
принимают пх = 4.
4. Темп выхода подвески при 100 %-ной загрузке автомата
по (31.11)
Т = 46/4 = 11,5 мин.
5. Потребное число автоматов по (31.12)
m = 11,25/12,5 = 0,9,
принимают m = 1.
6. Часовая производительность автомата по (31.13)
Q = 60-1,15/11,25 = 5,52 м2/ч.
7. Коэффициент использования автомата по (31.14)
К = 0,90/1 = 0,9.
Так как продолжительность остальных технологических опе-
раций меньше темпа выхода подвески, принимают для каждого
процесса по одной ванне. Сушку деталей производят в сушильной
349
камере. Технологическая схема автооператорной линии цинкова-
ния показана на рис. 31.3.
Пример расчета кареточной автоматической линии. Рассчи-
тать основные параметры кареточной автоматической линии для
нанесения покрытия Ц. хр. 6.
Исходные данные. Тип автомата АЛГ-405, предна-
значен для цинкования стальных деталей на подвесках. Габарит-
ные размеры подвески 600Х 150Х х 1100 мм, единовременная
загрузка 1,54 м2. Фв = 3810 ч.
Годовая программа Ргод = 450 000 м2.
Расчет ведут в следующей последовательности.
. 1. Темп выхода подвески по формуле (31.15)
Т
1 р
_ 3810-60-1,54
450000
= 0,78 мин.
Темп выхода подвески у кареточных автоматов должен быть
более 1 мин, поэтому принимаем Т = 1,3 мин, учитывая, что
коэффициент использования автомата колеблется в пределах
0,8—0,9.
2. Часовая производительность автомата при темпе 1,3 мин
будет составлять по (31.16)
<2 = 60-1,54/1,3 = 71 м2/ч.
3. Число автоматов определяют исходя из годовой программы
автомата и часовой производительности по (31.17)
m = 450 000/3810-71 = 1,66,
принимаем m = 2.
4. Коэффициент загрузки автомата по (31.18)
К = 1,66/2 = 0,83.
5. Время нанесения цинка в хлораммонийном электролите
при iK — 1,5 А/дм2 и т] — 95 % по выражению (31.1)
Ч =
7,13-0,006-60 000
1,22.1,5-95
= 11,76 мин,
принимают т = 11,76 мин.
6. Определяют число позиций в ванне цинкования
п = 11,76/1,3 = 0,95,
принимают п = 10.
Число позиций для остальных технологических операций
рассчитывается таким же образом. В тех случаях, когда время
обработки меньше темпа выхода подвески, принимается одна по-
зиция. Технологическая схема цинкования представлена
в табл. 31.1.
350
§ 31.3. КОМПОНОВКА АВТОМАТИЧЕСКИХ ЛИНИЙ
Автооператорные линии. После определения числа
ванн необходимо определить последовательность распо-
ложения технологических операций. В однорядных автоопера-
торных линиях могут быть использованы следующие варианты
компоновок:
1) загрузка-выгрузка, сушка, заключительные операции, ос-
новные операции, подготовительные операции;
2) загрузка-выгрузка, сушка, заключительные операции, под-
готовительные операции, основные операции;
3) загрузка, подготовительные операции, основные операции,
заключительные операции, сушка, выгрузка и т. п.
Число автооператоров определяется как отношение времени,
необходимого на все перемещения, паузы, подъемы и опускания
автооператора, к темпу выхода подвески или барабана. Ориенти-
ровочно один автооператор с двумя движениями (подъем-опуска-
ние и передвижение) обслуживает 6—8 позиций, автооператор
с тремя движениями (подъем-опускание, горизонтальное переме-
щение и поворот) — 11—13 рабочих позиций. Автооператоры
с тремя движениями предназначены для двурядных компоновок
О-, Г- и П-образного расположения ванн. При выборе компо-
новки ванны следует располагать таким образом, чтобы авто-
оператор имел наименьшее число холостых ходов и после выпол-
нения очередной операции кратчайшим путем возвращался в ис-
ходную позицию.
Однорядная компоновка имеет ряд преимуществ по сравнению
с другими компоновками; она позволяет экономить производ-
ственную площадь; удобна при монтаже, обслуживании и ре-
монте; загрузку и выгрузку можно производить как с одного конца
линии, так и с противоположных. Такие линии обслуживаются
автооператорами любого типа. При недостаточной длине произ-
водственного помещения применяют двухрядные линии. В этом
случае выбор компоновки следует производить с учетом конкрет-
ных условий, определяющими из которых являются площадь
участка и направление потока обрабатываемых изделий.
При выборе компоновки необходимо учитывать особенности
технологического процесса. Например, можно совмещать такие
технологические процессы, которые имеют одинаковые подготови-
тельные и заключительные операции. По этой причине часто сов-
мещают процессы цинкования и кадмирования. Нельзя совмещать
в одном автомате цинкование и никелирование, анодирование
и никелирование и т. п. При нанесении покрытий на стальные
и медные детали активирование следует проводить отдельно.
В двухрядных автооператорных линиях ряд должен кончаться
ванной промывки, чтобы при переносе деталей из ряда
в ряд стекающий раствор не разрушал металлоконструкцию
автомата.
351
Нанесение покрытий в цианидных и кислых электролитах
лучше производить в отдельных автоматах, это упрощает схему
вентиляции и канализации.
Определив компоновку автомата для ванн, требующих вен-
тиляции, необходимо установить бортовые отсосы. После этого
определяют размеры автомата. В качестве примера на рис. 31.3
приведена компоновка автомата АЛГ-35, предназначенного для
цинкования стальных деталей на подвесках. Как видно из рисунка,
выбраны вариант компоновки загрузка-выгрузка, сушка, подго-
товительные операции, заключительные операции, основные опе-
рации. Расстояние между ваннами зависит от типа сопряжения:
/ бе i вентиляционного отсоса; II — с односторонним венти-
ляционным отсосом; III — с двусторонним вентиляционным от-
сосом; IV — вентиляционный отсос у последней ванны. Рас-
стояния А10, А/ъ А/2, А/б зависят от длины ванны. Для ванн
длиной 1120, 1600 мм они равны 160, 290, 390 и 212 мм
соответственно. Ширина загрузочно-разгрузочной стойки /3 равна
2415 мм (четырехпозиционной) и 600 мм (однопозиционной);
/с — внутренняя ширина сушильной камеры, равная 800 мм;
А/3. с — зазор между стенками сушильной камеры и загрузочно-
разгрузочной стойкой.
Длина линии определяется по формуле
1~<л == nl-fBH “Ь Lc ^з. с с “I- Hq 4*
4~ Пх А1г + п2 А12 + А/б,
где п — число ванн одного типоразмера; Ввн — внутренняя ши-
рина ванны, мм; Lc — внутренняя ширина сушильной камеры, мм;
А/3. с — зазор между сушильной камерой и загрузочно-разгру-
зочной стойкой, мм; «о — число сопряжений ванн без бортовых
отсосов; А/о — зазор между стенками ванн без бортовых отсосов,
мм; — число односторонних бортовых отсосов; — зазор
между стенками ванн с односторонними бортовыми отсосами, мм;
п2 — число двусторонних бортовых отсосов; А/2 — зазор между
стенками ванн с двусторонними бортовыми отсосами, мм; А/б —
расстояние от наружной поверхности бортового отсоса до стенки
ванны, мм.
Ширина линии равна
Вл ~ Ввв + Bi + В2,
где LBH — внутренняя длина ванны; Вг — расстояние от внутрен-
ней стенки ванны до наружной плоскости опорной стойки для
подвесных автооператоров, равное 655 мм, для портальных авто-
операторов Bj = 250 мм; В2 — расстояние от внутренней стенки
ванны до наружной плоскости площадки обслуживания, равное
1165 мм.
Высота линии Нл зависит от внутренней высоты ванны, спо-
соба обработки деталей (подвеска или барабан) и типа автоопера-
тора. Если внутренняя высота ванны 1250 мм и линию обслужи-
31.1. Схема технологического процесса и распределение позиций
(темп равен 1,3 мин)
№ п/п Операция (см. рис. 31.4) Время выдержки, МИИ Число позиций
1 Обезжиривание химическое 4 4
2 Теплая промывка 0,15—1 1
3 Холодная промывка 0,15—1 1
4 Травление 4 4
5 Холодная промывка 0,15—1 1
6 » » 0,15—1 1
7 Снятие шлама 0,15-1 1
8 Теплая промывка 0,15—1 1
9 Холодная » 0,15—1 1
10 Цинкование 11,76 10
И Улавливание 0,15—1 1
12 Холодная промывка 0,15—1 1
13 » » 0,15—1 1
14 Осветление — пассивирование 1 1
15 Холодная промывка 0,15—1 1
16 Теплая » 0,15—1 1
17 Сушка 4 4
Всего: 35
вает подвесной автооператор, высота равна 4700 мм при обработке
деталей на подвесках и 4250 мм — в барабанах. При портальных
автооператорах высота линии равна 4280 и 3780 мм соответственно.
Кареточные линии. Рассчитав число позиций для всех опера-
ций технологического процесса, составляем табл. 31.1, в которой
указываем последовательно все операции технологического про-
цесса, время обработки, темп выхода подвески и число позиций.
По приведенной схеме технологического процесса стальных
деталей на подвесках в кареточном овальном автомате с жестким
циклом при заданной программе необходимо иметь 35 позиций.
На рис. 31.4 представлена компоновка такого автомата. Все
Рис. 31.4. Компоновка кареточной линии
353
ванны расположены строго по технологическому процессу и имеют
размеры в соответствии с числом позиций, определенных расчет-
ным путем. Для операций, продолжительность которых меньше
темпа выхода подвески, принята одна позиция. Цифры, указанные
на компоновке, соответствуют номеру технологической операции.
Зная габаритные размеры подвески, число рядов (катодных и
анодных), число однопозиционных ванн и их размеры, а также
размеры многопозиционных ванн и расстояния между ваннами,
определяют габаритные размеры линии.
Длина линии определяется по формуле
j _ । 2/^ = ^1П1 + (яа ~h пз)1 । 2/^
где Lr — расстояние между осями звездочек механизма горизон-
тального перемещения; — расстояние между подвесками у смеж-
ных ванн (нормальный шаг); — общее число ванн в линии;
/2 — расстояние между подвесками в многопозиционных ваннах
(укороченный шаг); т — число многопозиционных ванн; —
число позиций в многопозиционных ваннах; п3 — число позиций
на радиусном участке линии, обычно равное 2—3; R — внешний
радиус линии.
Нормальный и укороченные шаги определяют исходя из длины
подвески и расстояний между ними. Расстояние между внутрен-
ними стенками рядом стоящих ванн составляет 140 мм, расстоя-
ние от поперечного борта ванны до края подвески равно 80 мм.
Следовательно, нормальный шаг при длине подвески 40Q мм будет
равен (400/2) + 80 + 140 + 80 + (400/2) = 700 мм, а при длине
подвески 600 мм — 900 мм. Укороченный шаг равен 500 мм при
длине подвески 400 мм и при длине подвески 600 мм он составляет
700 мм, так как расстояние между подвесками в многопозиционных
ваннах принято равным 100 мм.
Ширина всех ванн в кареточных автоматах одинакова и рас-
считывается по ширине ванн для нанесения покрытий. Ширина
между центрами анодных штанг для ванн с двумя катодными
рядами составляет 450 мм, а для ванн с одним катодным рядом —
600 и 900 мм. Ширина ванны
В№ = пВ1 + 2Ва,
где п — число катодных рядов; ВА — расстояние между центрами
анодных штанг; В2 — расстояние от центра крайней анодной
штанги до продольной стенки ванны с внутренней стороны.
Глубина ванн зависит от высоты подвесок. Для подвесок 600,
900 и 1100 мм глубина ванн составляет 1000, 1300 и 1500 мм соот-
ветственно.
Ширина линии
В = 2Ввв 4-В8, ‘!,'Т
364
где Ва — расстояние между двумя рядами ванн, примерно рав-
ное 1200 мм.
Высота линии равна 4—5 м в зависимости от высоты подвески.
§ 31.4. ВЫБОР источников постоянного тока
Для питания гальванических ванн постоянным током
используют полупроводниковые выпрямители, а в отдельных
случаях — электромашинные генераторы. Выбор источников по-
стоянного тока производится на основании потребляемой силы
тока и напряжения на ванне. На каждую ванну устанавливают
отдельный выпрямитель; если потребная сила тока превышает
мощность выпрямителя, устанавливают два и более выпрями-
телей.
Сила тока рассчитывается исходя из плотности тока и едино-
временной загрузки деталей в ванну, выраженной в дм2,
I = 1«Уз-
Расчетная сила тока /р должна быть увеличена на 15—20 %.
Для правильного выбора источников постоянного тока необ-
ходимо знать напряжение на ванне, которое зависит от состава
электролита, режима работы и межэлектродных расстояний.
Для большинства электрохимических процессов рекомендуемое
номинальное напряжение выпрямителя составляет 6 В; для
анодирования в серной кислоте — 12, 18, 24 В; для хромирования,
для меднения и никелирования с перемешиванием и нагревом
в кислых электролитах, для электрохимического обезжиривания
и при снятии покрытий — 9,12 В; для электрополирования алю-
миния — 18, 24 В. При нанесении покрытий во вращательных
установках для всех видов покрытий требуется напряжение 12,
18, 24 В.
Напряжение на ванне можно вычислить по формуле
U = (1 + ₽) [£а - Ев + (1 + a) IR],
где Р — коэффициент, учитывающий потери напряжения в кон-
тактах и проводниках первого рода; £а и Ек — анодный и катод-
ный потенциалы, В; а — коэффициент, учитывающий потери
напряжения в электролите за счет газонаполнения; I — сила
тока, A; R — электрическое сопротивление электролита (Ом),
рассчитываемое по формуле R — //(ЮОх), где I — межэлектрод-
ное расстояние, см; х — удельная электрическая проводи-
мость, Ом-1, см-1.
При расчете напряжения на ванне вместо силы тока следует
подставлять значение плотности тока, а в случае несовпадения
анодной и катодной плотностей тока — среднеквадратичную плот-
ность тока icp = YМа- В табл. 31.2 приведены основные пара-
метры гальванических процессов для расчета напряжения на
ваннах.
355
31.2. Основные параметры гальванических процессов
1к X ОС ₽
Электролит А/дм’ В Ом-*Х Хсм-‘
Хромирование 27,0 10,0 —0,80 +0,80 0,60 0,20 0,10
Никелирование Цинкование: 1.0 0,5 —0,68 +0,30 0,40 0,01 0,05
кислый 1,0 1,0 —0,78 —0,60 0,10 0,10 0,04
аммонийный 1.0 1,0 —1,40 —0,90 0,11 0,02 0,04
цинкатный 2,0 1,0 —1,45 —1,30 0,30 0,02 0,04
цианидный Кадмирование: 1,0 1,0 —1,70 —1,20 0,20 0,10 0,04
КИСЛЫЙ 1,0 1,0 —0,48 —0,30 0,08 0,02 0,04
цианидный Меднение: 1,0 1,0 —1,6 —1,20 0,15 0,10 0,04
кислый 1,0 1,0 +0,25 +0,35 0,50 0,00 0,02
цианидный Оловянирование: 1,0 0,5 —1,50 —0,30 0,15 0,10 0,04
кислый 1,0 1,0 —0,50 +0,15 0,20 0,01 0,03
щелочной Серебрение: 1,0 2,0 — 1,50 —0,80 0,18 0,15 0,08
цианидный Золочение: 0,5 0,5 —0,70 +0,10 0,05 0,01 0,02
цианидный 0,3 0,3 —1,40 +0,08 0,06 0,10 0,05
31.3. Техническая характеристика выпрямительных агрегатов серии ВАК
Тип агрегата Номиналь- ное напря- жение, В Номи- нальная сила тока А Габаритные размеры, мм Мощность, кВт КПД, %
ВАК-Ю0-12У4 12/6 100 600Х360Х 1000 1,2/0,60 78/72
ВАКР-320-18У4 18/9 320 744X 496X1550 5,76/2,88 79/72
ВАК-630-24У4 24/12 630 900X400X1710 15,12/7,56 88/85
ВАКР-630-24У4 24/12 630 900Х400Х 1710 15,12/7,56 88/85
ВАКР-630-12У4 12/6 630 744X 496X1550 7,56/3,78 82/73
ВАК-1600-12У4 12/6 1 600 1000X600X1600 19,2/9,60 82/70
ВАКР-1600-24У4 24/12 1 600 1000Х600Х 1600 38,4/19,2 87/82
ВАК-3200-12У 4 12/6 3 200 1000Х600Х 1600 38,4/19,2 83/81
ВАКР-3200-24У4 24/12 3 200 1400X800X1600 76,8/38,4 89/84
ВАК-6300-12У4 12/6 6 300 1555Х 2038Х 2090 75,6/37,8 82/70
ВАК-12500-24У4 24/12 12 500 2800x 2575X 2610 151,2/75,6 88/76
ВАК-25000-48У4 48/24 25 000 4625X 5100X 4735 1200/600 90/86
Примечание. Через косую черту указаны два режима работы агрегата.
356
31.4. Техническая характеристика тиристорных преобразователей
серий ТЕ, ТВ, ТЕР, ТВР, ТВИ
Тип агрегата Номинальный ток, А Номинальное напряжение, В КПД, % Тип тиристора
ТЕ1-100/12Т-0 100 12 78 Т171-320
ТЕ1-100/24Т-0 100 24 84 Т123-320
ТЕ1-400/24Т-0 400 24 88 Т123-320
ТЕ1-400/48Т-0 400 48 89 Т123-320
ТЕ1-315/115Т-0 315 115 92 Т123-320
ТЕ1-800/12Т-0 800 12 83 Т123-320
ТЕ1-800/24Т-0 800 24 88 Т123-320
ТВ1-1600/12Т-0 1600 12 83 Т143-500
ТВ1-1600/24Т-0 1600 24 87 Т143-500
ТЕР1-400/12Т-0 400 12 82 Т123-320
ТЕР1-800/12Т-0 800 12 83 Т123-320
ТЕР1-800/24Т-0 800 24 88 Т123-320
ТВР1-1600/12Т-0 1600 12 83 Т123-320
ТВР1-1600/24Т-0 1600 24 87 Т143-500
ТВИ1-1600/24Т-0 1600 24 87 Т143-500
В гальванических цехах в настоящее время для питания ванн,
в которых идут электрохимические процессы, применяют крем-
ниевые выпрямители серий ВАК и ВАКР на тиристорах. Агрегаты
серии ВАК изготовляются 24 типов на напряжение, 6, 12, 18, 24 В
и номинальный ток 100, 320, 630, 1600, 3200, 6300, 12 500,25 000 А.
Они обеспечивают ручное регулирование напряжения и стабили-
зацию силы тока, плотности тока и напряжения. Характеристика
выпрямителей типа ВАК представлена в табл. 31.3.
Типовое обозначение агрегатов расшифровывается следующим
образом: ВАКР-320-18У4 — выпрямительный агрегат на кремние-
вых вентилях, реверсивный, номинальный выпрямленный ток
320 А, номинальное выпрямленное напряжение 18 или 9 В (два
режима), климатическое исполнение и категория размещения У4
(умеренный климат, отапливаемое помещение).
Для питания гальванических ванн разработана новая серия
преобразователей типа Т (ТЕ, ТВ, ТЕР, ТВР, ТВИ) с улучшен-
ными характеристиками. Техническая характеристика тиристор-
ных преобразователей серии Т приведена в табл. 31.4.
Условное обозначение расшифровывается так: Т — вид вы-
прямителя; Е — естественное охлаждение или В — водяное; Р —
реверс или И — импульсный ток. Первая цифра указывает класс
Форма 31.1. Выбор источников постоянного тока
Наимено- вание процесса *к» А/дм* I, А Уз- /р. А V, л iy, А/л и, в Тнп ИПТ
357
перегрузочной характеристики, вторая — номинальную силу тока,
третья — номинальное постоянное напряжение; Т-О — тропиче-
ское исполнение.
Так как при прохождении электрического тока через электро-
лит выделяется теплота, необходимо проверять объемную плот-
ность тока, особенно это касается таких процессов, как хромиро-
вание и анодирование, по формуле: iv = IIV, где iy — объемная
плотность тока, А/л; V — объем электролита, л.
Все данные для выбора источников постоянного тока сводятся
в форму 31.1.
$ 31.6. РАСХОД ПАРА И СЖАТОГО ВОЗДУХА
Расход пара. В гальванических цехах обычно нагре-
вают электролиты и воду для промывки деталей паром. При рас-
чете расхода пара необходимо учитывать расход пара на разогрев
электролитов и воды и расход пара на поддержание рабочей
температуры. Время разогрева зависит от объема ванн и давления
пара.
Расход пара на разогрев определяется по формуле
Л = /Мр.
где Рр — норма расхода пара на разогрев раствора в ванне за-
данного размера до рабочей температуры, кг/ч; tv — время разо-
грева, ч.
Расход пара на поддержание рабочей температуры
1*2 ~ Рр. П^р.П»
где Рр. п — норма расхода пара на поддержание рабочей темпе-
ратуры, кг/ч; /р. п — время работы ванны (за исключением
времени разогрева). Нормы расхода пара Рр и Рр. п берут из
табл. 31.5.
Определив расход пара, исходя из вышеприведенных норм
рассчитывают годовой расход пара
Ргод = (^1 + Р2) Т,
где Т — число рабочих дней в году.
Расчет расхода пара можно вести по укрупненным данным.
В этом случае расчет ведется исходя из объема электролита.
Примерное количество пара, необходимое для разогрева 1 м8
воды или электролита при давлении 0,3 МПа, равно:
Температура, °C............................ 40 50 60 70 80 90 100
Расход пара, кг............................ 50 70 95 120 140 170 190
Расход пара дан исходя из начальной температуры 20 °C и разо-
грева в течение 1 ч. Для ванн с пароводяной рубашкой необхо-
димо ввести коэффициент 1,5, при нагреве теплообменниками —
1,1.
Примерный часовой расход пара на поддержание рабочей
температуры приведен в табл. 31.6.
358
31.5. Расход пара иа разогрев и поддержание рабочей температуры
электролита (кг/ч)
Внутренние габаритные раз- меры ванн, мм Вайны для электрохими- ческих процессов Промывочные ванны Ванны хромирования
рр ^р. п рр Рр. п ₽р рр. п
40 °C
1120Х 630Х 1250 22 3,2 22 2,7 — —
1120Х710Х 1250 24 3,4 24 2,9 25 4,1
1120X800X1120 27 3,7 27 3,2 28 4,5
1120Х1000Х 1250 34 4,4 —- — 35 5,3
1600X 630X1250 31 4,2 30 3,6 —— —
1600X 710X1250 35 4,6 34 3,9 35 5,5
1600X 800X1250 39 5,0 39 4,2 40 6,0
1600Х1000Х1250 48 5,8 — — 49 7,2
60 °C
1120X 630X1250 40 8,3 39 6,9 _— —
1120Х710Х 1250 45 9,0 43 7,4 50 11
1120X 800X1250 51 10,0 49 8,0 69 15
1120Х 1000X1250 63 11,7 — — 98 20
1600Х 630Х 1250 56 11,2 54 9,0 — —
1600X710X1250 64 12,2 62 9,9 70 15
1600X800X1250 72 13,3 69 11,0 79 17
1600Х 1000Х 1250 89 15,7 — — 98 20
80 °C
1120X 630X1250 58 9,8 55 10,0 — —
1120Х 710X1250 65 11,0 57 11,0 66 13
1120Х800Х 1250 74 12,3 70 13,0 75 15
1120Х 1000X1250 92 15,2 — — 36 19
1600X 630X1250 82 13,7 77 14 — —
1600X710X1250 93 15,5 88 16 94 19
1600Х800Х 1250 120 36,0 99 18 106 21
1600Х 1000Х 1250 130 21,5 — — 136 26
31.6. Часовой расход пара на поддержание рабочей температуры
(объем ванны 1,5 м3, высота 1,2 м)
Операция Часовой расход пара (кг/м1) при температуре. °C
40 60 60 70 80 90
5,5 10 15,5 22 31 58
Электрохимические 4,4 6,6 10,5 15,5 21 35
и химические процессы 4,4 7,2 11 16,5 22,5 31
3,3 5,0 7,7 11 15,5 21
Промывка — 80 100 .120 140 160
359
Форма 31.2. Данные по расчету расхода пара
Опера- ция Объем V, м« Число ваин п, шт. Норма расхода, кг/м Эквивалент джоулевой теплоты ^Дж» кг Г одовой расход ргод- т Разность т
Др ^р. п
Годовой расход пара на каждую операцию подсчитывается
отдельно, а затем суммируется по всем статьям расхода
р _ nV (1,14-1,5) КРГ + (1,04-1,1) Кр.пФвт
1000 ’
где п — число ванн; V — объем электролита или воды, м3; /<р —
часовая норма расхода пара на разогрев, кг/ч; Кр. п — часовая
норма расхода пара на поддержание рабочей температуры, ч;
Фв — действительный годовой фонд времени работы оборудо-
вания, ч.
Годовой расход пара, рассчитанный по укрупненным нормам,
на нагрев ванн, в которых протекают электрохимические про-
цессы, необходимо откорректировать с учетом выделения джоуле-
вой теплоты
Одж == /[//,
которая эквивалентна теплоте, выделяющейся при расходе следу-
ющей массы пара (кг):
Рдж =
где I — сила тока, A; U — напряжение на ванне, В; t — время,
мин; г — теплота парообразования при давлении пара 0,3 МПа,
равная 2171.103 Дж/кГ; х— принятая степень сухости пара,
равная 0,95;
РДж = /[/3600/(2177-10s-0,95) = /[//573 кг.
Если количество теплоты и эквивалентное ему количество пара
при пропускании электрического тока превышают необходимое
количество теплоты на разогрев и поддержание температуры
в ванне, электролит необходимо охлаждать. Данные по расчету
расхода пара по второму варианту сведены в форму 31.2.
Расход сжатого воздуха. В гальванических цехах сжатый
воздух расходуется, в основном, .на перемешивание растворов и
электролитов, а также воды. Кроме того, сжатым воздухом про-
изводят обдувку деталей и гидропескоструйную обработку.
Расход сжатого воздуха на перемешивание 1 л раствора или
электролита составляет (л/мин): 0,5 при слабом перемешивании,
1,0 — при среднем, 1,5 — при сильном. Расчет можно произво-
360
дить исходя из следующей нормы: 0,01—0,02 м3/мин на 1 дм
длины катодной штанги. Воздух должен быть очищенным. На
обдувку расход сжатого воздуха при давлении 0,2—0,3 МПа со-
ставляет 15—20 м8/ч. Годовой расход сжатого воздуха опреде-
ляют по приведенным нормам с учетом объема ванны или длины
катодной штанги и действительного фонда времени работы обо-
рудования. Так же рассчитывают расход сжатого воздуха на у
обдувку. Расход сжатого воздуха на гидропескоструйную обра- i
ботку производят по паспортным данным. i
§ 31.6. РАСХОД ВОДЫ
Вода расходуется в основном на промывку деталей.
Расход воды на составление растворов является периодическим
и составляет небольшую часть общего расхода. Вода после про-
мывки попадает в канализацию, поэтому целью промывки яв-
ляется не только удаление растворов с поверхности деталей,но
и их минимальное попадание в сточные воды. Существуют две
схемы промывки: одноступенчатая и многоступенчатая. Односту-
пенчатая промывка применяется в тех случаях, когда растворы
имеют низкую концентрацию или после какой-то операции не
требуется тщательной промывки, например между химическим и
электрохимическим обезжириванием, осветлением и пассивиро-
ванием, между дополнительной активацией в цианидном растворе
и нанесением покрытий в цианидном электролите и т. д. Много-
ступенчатую промывку применяют после химического или элек-
трохимического обезжиривания, перед нанесением покрытий
в кислых электролитах, после анодного окисления, химического
оксидирования стали, электрохимического полирования, в других
случаях.
Многоступенчатая промывка делится на прямоточную и проти-
воточную (рис. 31.5). Методы промывки могут быть различными:
погружной, струйный и комбинированный. При обработке дета-
лей на подвесках, имеющих пазы, углубления и т. п., а также
при обработке деталей насыпью применяется погружной способ;
при обработке деталей простой конфигурации — струйный; при
обработке деталей сложной конфигурации без пазов и углублений
и после обработки в трудносмываемых растворах — комбини-
рованный.
Рис. 31.5. Способы промывки: а — одноступенчатая прямоточная; б — много-
ступенчатая прямоточная; в — многоступенчатая противоточная (каскадная);
1 — технологическая важна; 2, 3 — ваины промывки
12 Дасоян М. А. и др. ЖИ
31.7. Удельный вынос электролита
(раствора)
Вид обработки Удельный вынос, л/м’ Время сте- кания, с
Подвеска 0,2 0,6
Колокола и барабаны 0,4 15
Корзины и сетки 0,5 15
Каждая из схем промывки
может иметь ванну улавлива-
ния. Минимальная продолжи-
тельность промывки 20 с. После
обезжиривания, снятия шлама,
до и после химического оксиди-
рования, анодного окисления
температура воды 40—59°C (теп-
лая вода); перед сушкой, кроме
цинковых и кадмиевых покры-
тий, после хроматирования при-
меняется горячая вода (60—
используют холодную воду.
90 °C). В остальных случаях
Расход воды (л/м2) для любой схемы промывки в соответ-
ствии с ГОСТ 9.305—84 определяется по формуле
п.____
Qpn = qNVlCF,
где q — удельный вынос электролита (раствора) из ванны по-
верхностью деталей; N — число ступеней (ванн) промывки; К° —
критерий окончательной промывки деталей; F — промываемая
31.8. Предельно допустимые концентрации химических компонентов в воде
Компонент или ион электролита (раствора) Операция или характеристика электролита (раствора) перед промывкой Сп, г/л
Общая щелочность (в пере- счете на NaOH) Щелочной Кислый или цианидный Анодирование А1 и его спла- вов 0,8 0,1 0,05
Красители при окрашива- нии после Ан.Окс Промывка или сушка 0,005
Кислота (в пересчете на H2SO4) Кислый Щелочной Цианидный Наполнение и пропитывание Сушка 0,1 0,05 0,01 0,01 0,01
CN^ , Sn2+, Sn4+, Zn2+, Cr«+, Pb2+ CN; S-, Cd2+ Межоперационная промывка нли сушка 0,01 0,015
Cu2+, Cu+ Никелирование, сушка 0,02
Ni2+ Ni2+ Меднение Сушка или хромирование 0,02 0,01
Fe2+ Сушка 0,3
362
Форма 31.4. Данные по расчету расхода воды
Схема и спо- соб промыв- ки Формула для расчета Операция перед и ри- ! ыывкой S d я а С О после про- мывки <7, л/м1 Со сп Ко Kt к, F, м*/ч 0Р л/м* 1.6QP. л/мя
г/л
поверхность загрузки ванн, м2/ч (соответствует производитель-
ности линии). Ориентировочный удельный вынос электролита
(раствора) q приведен в табл. 31.7.
Критерий окончательной промывки К0, показывающий, во
сколько раз следует снизить концентрацию основного компонента
электролита (раствора), выносимого поверхностью деталей до
предельно допустимых значений в последней ванне промывки,
определяют по формуле
= С0/Сп,
где Со — концентрация основного компонента в электролите,
применяемом для операции, после которой производится про-
мывка, г/л; Сп — предельно допустимая концентрация в воде
после операции промывки, г/л.
Основным компонентом является ион данного раствора или
электролита, который имеет наибольший критерий промывки.
Значения предельно допустимых концентраций основных компо-
нентов приведены в табл. 31.8.
Если перед промывкой имеется одна ванна улавливания, удель-
ный расход воды уменьшают, вводя коэффициент = 0,4; при
двух ваннах Ki = 0,15, при трех = 0,06. Ванны улавливания
обязательны после кадмирования, хромирования и после нанесе-
ния драгоценных металлов (три ванны улавливания). При струй-
ной промывке коэффициент Х2 = 0,7, при комбинированном
методе К2 = 0,5. Расчетный расход воды увеличивают в 1,5 раза
на случай падения напора в водопроводной сети. Все данные по
расчету расхода воды сводятся в форму 31.4. .у
§ 31.7. ВЕНТИЛЯЦИЯ
Гальванические цеха относятся к категории вредных
производств вследствие большого количества вредных веществ,
которые выделяются во время химической и электрохимической
обработки. Для создания нормальных условий труда цеха должны
иметь приточно-вытяжную вентиляцию. Кроме того, многие ванны
должны быть оборудованы местными бортовыми отсосами, обеспе-
чивающими отвод вредных примесей с зеркала электролита или
раствора. Бортовые отсосы устанавливаются по длине ванны.
363
31.9. Коэффициент Хд4, учитывающий разность температур
раствора и воздуха в помещении
Разность температур раствора и воздуха, °C Кд/ для отсосов Разность температур раствора и воздуха, °C Кд/ для отсосов
без поддува с поддувом без поддува с поддувом
0 1,0 1,0 40 1,63 1,12
10 1,16 1,03 50 1,79 1,15
20 1,31 1,06 60 1,94 1,18
30 1,47 1,09 70 2,10 1,21
Бортовые отсосы могут быть одно- и двусторонними. По конструк-
ции их делят на простые (щелевое окно расположено перпенди-
кулярно к зеркалу электролита) и опрокинутые (щель распо-
ложена параллельно зеркалу).
Расчет объема воздуха, отсасываемого от зеркала ванн, про-
изводят по формуле
l =
где Lo — удельный объем воздуха, отсасываемого от ванн, м®/ч;
— коэффициент, учитывающий разность температур раствора
и помещения (табл. 31.9); Кт — коэффициент, учитывающий
токсичность и интенсивность выделения вредных веществ; Ki —
коэффициент, учитывающий тип отсоса; К2 — коэффициент, учи-
тывающий воздушное перемешивание раствора, барботаж; К3 —
коэффициент, учитывающий укрытие зеркала электролита пла-
вающими телами; /<4 — коэффициент, учитывающий укрытие
зеркала электролита путем введения ПАВ.
Кт = 1,0 для двухбортового отсоса без поддува и одноборто-
вого с поддувом; — 1,8 для однобортовых отсосов без поддува;
= 0,5 для двухбортового с поддувом. При воздушном пере-
мешивании /<2 = 1,2; при укрытии зеркала ванны плавающими
телами = 0,75; при укрытии зеркала ванны пеной К4 = 0,5.
Коэффициент токсичности Кт для бортового опрокинутого отсоса
приведен ниже:
г . Анодирование в H2SO4.................................. 0,8
» в Н2СгО4.................................... 0,8
Электрохимическое и химическое обезжиривание........ 0,8
Оксидирование стали..................................0,8
Кадмирование, цинкование, меднение в цианидном элек-
тролите ............................................ 0,8
Никелирование с воздушным охлаждением............... 0,8
Пассивирование ..................................... 0,9
•i Промывка в мыльном растворе........................ 0,8
Травление медных и латунных деталей................. 1,0
• > Травление стали.................................... 0,8
Хромирование........................................ 1,3
Фосфатирование...................................... 0,8
Электрополирование.................................. 1,0
364
31.10. Расход воздуха на один отсос
Длина отсоса, мм Высота щели, мм Расход воздуха, м’/ч
минимальный максимальный
790 1120 40 80 570/1250 800/1740 1140/2500 1590/3490
Примечание. В числителе даиы значения расхода воздуха на один
отсос при скорости в щели 5 м/с, в знаменателе — при скорости 11 м/с.
Удельный объем отсасываемого воздуха Lo определяется по
следующим формулам:
для отсосов простых и опрокинутых без поддува
Lo = 1400 (0,53 -+ 0,66Ввн,
где Ввв, LBB — внутренние ширина и длина ванны, м; — рас-
стояние от зеркала электролита до борта ванны, обычно рав-
ное 0,2 м;
для отсосов, опрокинутых с поддувом,
Lo = 12005вй6£внад.
В табл. 31.10 приведен расход воздуха на один отсос.
При расчете общего объема воздуха, отсасываемого из цеха,
необходимо учитывать, что по правилам техники безопасности
вентиляция от цианидных ванн не может быть совмещена с вен-
тиляцией от кислых растворов, ее лучше выполнять в виде от-
дельной системы. Для улавливания вредных выделений реко-
мендуется установка специальных фильтров. В самостоятельные
системы можно выделять также вентиляцию от хромовых ванн.
Вентиляция шлифовально-полировального отделения осуществ-
ляется местными отсосами. Компенсацию оттока воздуха, уходя-
щего в вытяжную вентиляцию, обеспечивает приточная вентиля-
ция. Объем приточного воздуха должен быть на 5 % меньше
объема вытяжного воздуха.
Определив тип бортовых отсосов и системы воздуховодов,
подсчитывают суммарный объем воздуха, отсасываемый от си-
стемы, и подбирают соответствующий вентилятор. Для выбора
вентилятора приточной вентиляции суммируют расход воздуха
всех систем вытяжной вентиляции и умножают его на коэффи-
циент 0,95, после чего подбирают соответствующий вентилятор.
Отечественная промышленность выпускает различные типы
центробежных вентиляторов низкого давления типа ВРМ (до
1 кПа), среднего давления типа Ц4-70, Ц9-76, Ц6-40 (от 1 до
3 кПа) и высокого давления типа ВВД (свыше 3 кПа). Конструк-
365
31.11. Техническая характеристика вентиляторов Ц4-70
Марка венти- лятора Производи- тельность, тыс. м’/ч Полное давление, Па КПД Мощность, кВт Г абаритиые размеры, мм
2,5 0,68 1,35 17,6 65,4 0,73 0,755 0,12 0,6 476X 515X 490
3,15 1,4 2,8 27,4 116 0,755 0,27 1.5 605X 637X 605
4 1,7 2,8 5,8 19,1 44,2 186 0,776 0,4 0,6 4 750X 780X 785
5 3,7 5,8 30,4 70,5 0,805 0,6 1,5 924X 930X 775
6,3 7,5 11,5 49 117,5 0,805 1,5 4 1620X1185X 995
10 18 20 22 24 28 33 42,2 55,8 66,6 78,3 108,0 137,0 0,80 4,5 5,5 5,5 10,0 17,0 22,0 1620Х 1830Х 1810
тивно все вентиляторы делятся на три группы: радиальные (цен-
тробежные), осевые и диаметральные. Наибольшее распростра-
нение получили первые два типа.
Вентиляторы среднего давления Ц4-70 (табл. 31.11), Ц9-76
могут исполняться в противопылевом исполнении. Для переме-
щения воздушных масс повышенной влажности или содержащих
химические соединения, агрессивные к углеродистым или алю-
миниевым сплавам, применяют вентиляторы из коррозионно-
стойкой стали или из титановых сплавов, например радиальные
вентиляторы Ц4-70—16К и Ц4-70—6,ЗК производительностью
от 3,8 до 11,5 тыс. м3/ч.
Осевые вентиляторы применяют в тех случаях, когда необ-
ходимо переместить большие объемы воздуха на небольшие рас-
стояния. Промышленность выпускает осевые вентиляторы
В-06-300 марок 8А, 10А и 12,5А производительностью от
14 до 52 тыс. м3/ч, а для перемещения воздуха с повышенной
влажностью — вентиляторы В-06-290-11 производительностью
42 тыс. м8/ч.
Все данные, необходимые для выбора вентиляторов для вы-
тяжной вентиляции, приведены в форме 31.5.
Определив суммарный объем удаляемого воздуха от самостоя-
тельных систем (цианидные ванны, а также ванны хромирования
366
Форма 31.5. Данные для выбора вентиляторов
для вытяжной вентиляции
Операция Тип бортового отсоса Размеры ваин, мм Lo, м’/ч L, ма/ч
^вн Вви Hi
имеют отдельные системы), подбирают тип вентилятора с большей
производительностью и приводят его характеристику. Воздух,
удаляемый от ванн хромирования, подвергается очистке фильт-
рами, орошаемыми 2 %-ным раствором кальцинированной соды.
В связи с токсичностью применяемых в гальванических цехах
веществ суммарные объемы воздуха, удаляемого местными вытяж-
ными устройствами, достаточно велики, поэтому главное назна-
чение приточной вентиляции — компенсировать объем удаляе-
мого из помещения воздуха. Для подачи приточного воздуха
применяют двух-, трех- и четырехлопастные вентиляторы.
Нагрев воздуха в приточных вентиляционных установках осу-
ществляется калориферами; в зависимости от теплоносителя они
бывают водяные — ВНВ и паровые — ВНП. Общую поверхность
нагрева калорифера определяют по формуле
F = Q/3600/г (tc. т — tc. в),
где Q — количество теплоты, необходимое для нагрева воз-
духа, Дж/ч; k — коэффициент теплопередачи, Вт (м2-К); tc. т —
средняя температура теплоносителя (пара или воды), К; tc. в —
средняя температура воздуха, проходящего через нагреватель, К.
Количество теплоты Q рассчитывают по формуле
Q = <71,01 (tK - tB),
где q — количество нагреваемого воздуха, кг/ч; 1,01—теплоем-
кость воздуха, кДж/кг-К; tK и tB— начальная и конечная тем-
пературы воздуха, К.
Определив общую площадь нагрева, подбирают калорифер,
поверхность нагрева которого не меньше полученной по расчету,
например пластинчатые калориферы КВС-П и КВБ-П № 1—12,
имеющие поверхность нагрева от 11,4 до 143,5 м2, или калори-
феры КСкЗ и КСк4 с площадью нагрева 10,85—102,9 и 14,26—
136,02 соответственно. В случае отсутствия пара или воды ис-
пользуют электрокалориферы серии СФО.
§ 31.8. РАСХОД ЭЛЕКТРОЭНЕРГИИ
Потребителями электроэнергии являются: 1) источ-
ники постоянного тока; 2) электродвигатели; 3) сушильные агре-
гаты; 4) вентиляторы; 5) электронагреватели для нагрева ванн;
6) лампы для освещения и т. п.
367
1. Расход электроэнергии на работу источников постоянного
тока
IFi = РвХобпФв/г],
где Рв — мощность выпрямителя, кВт; Коб — коэффициент ис-
пользования оборудования; Фв — действительный фонд работы
оборудования, ч; г] — КПД источника постоянного тока; п —
число источников постоянного тока.
2. Расход электроэнергии на работу электродвигателей
= пРвКоб^в,
где Рв — мощность электродвигателя, кВт; п — число электро-
двигателей.
При малой механизации электродвигатели необходимы для
вращения колоколов и барабанов, а также для качания штанг,
в автооператорных линиях — для вращения барабанов, качания
штанг, для перемещения автооператоров и т. п., в кареточных
автоматах — для работы маслонасосной станции, для перемеще-
ния тележек, а также для вращения барабанов и колоколов,
передвижения штанг и т. п. Обычно в технических характеристи-
ках указывают установленную мощность всех электродвигателей.
В этом случае расход электроэнергии
^2 = S ЛЛобФв,
где 2 Рв — мощность электродвигателей, кВт.
3. Расход электроэнергии на сушильные агрегаты
W3 = РспКсКобФв,
где Рс — мощность сушильного агрегата, кВт; п — число су-
шильных агрегатов; Кс — коэффициент использования сушиль-
ного агрегата; в автоматических линиях Кс = Коб.
4. Расход электроэнергии на работу вентиляторов
1Г4 = РвпФв/т],
где Рв — мощность электродвигателя вентилятора, кВт; и —
число электродвигателей; Фв — действительный фонд времени
работы оборудования, ч; т] — КПД выпрямителя.
Необходимо также учесть расход электроэнергии на работу
вентиляторов приточной вентиляции.
5. Электрический нагрев применяют в тех случаях, когда
цех не располагает достаточным количеством пара или темпера-
тура раствора выше 100 °C. Количество теплоты, необходимое на
нагрев раствора,
Q = 1,1 V Д£сэ + q,
где 1,1 — плотность раствора; V — объем раствора, л; Л/—Г:
разность начальной и заданной температур раствора; сд — удель-
ная теплоемкость раствора, Дж/(кг-К), которая колеблется от
368
4150 (почти для всех ванн) до 4483 (для ванн кислого меднения);
q — потери теплоты стенками ванн, зеркалом электролита и
потери на нагрев деталей. Потери теплоты q составляют около
30 % от величины Q в отсутствии теплоизоляции и 20 % при ее
наличии. На поддержание температуры расходуется примерно
5 % от количества теплоты, необходимого на нагрев раствора.
Приближенный расход электроэнергии на нагрев и поддержа-
ние температуры раствора
IPs = 1,05 [1,1V Мсэ + (0,204-0,30) Q1/3600.
Нагрев ванн обычно производится при помощи трубчатых нагре-
вателей типа ТЭН мощностью 4—5 кВт. Число нагревателей
п = Р/Рн,
где Р — необходимая мощность, кВт; Рн — мощность электро-
нагревателя, кВт.
Общий расход электроэнергии на нагрев ванны
W5 = Wb.
6. Расход электроэнергии на освещение
IVj = 0,0155учФв/<осв.
где 0,015 — удельная норма мощности освещения, кВт/м2; Sy4 —
площадь участка, м2; Хосв — коэффициент, учитывающий время,
необходимое на освещение.
§ 31.9. РАСХОД ХИМИКАТОВ
Гальванический цех является потребителем большого
количества химикатов, металлов для анодов и вспомогательных
материалов. Исходными данными для расчета расхода материалов
являются нормы расхода, которые определяются на основании
опытных и расчетных данных. Норма расхода растворимых ано-
дов устанавливается исходя из толщины покрытия, а нераствори-
мых анодов — независимо от толщины покрытия; исключение
составляет твердое хромирование. Норму расхода химикатов при
нанесении покрытий устанавливают расчетным путем независимо
от толщины покрытия, кроме цианида натрия (калия) и хромо-
вого ангидрида, но с учетом сложности деталей.
Нормы расхода должны быть технически и экономически
обоснованными, соответствовать снижению удельных затрат ма-
териалов за счет внедрения более совершенной технологии и
новых материалов.
Расчет норм расхода химикатов. Нормы расхода химикатов
учитывают расход исходных компонентов, необходимых для
образования покрытий, с учетом технологически неизбежных
потерь на вынос электролита с деталями, вынос в атмосферу с вен-
тиляцией, фильтрацию, корректирование и смену электролита
369
31.12. Нормы потерь электролита
(раствора)
Электролит Группа сложно- сти Норма потерь, мл/м*
А В с
Цианидный и щелочной I II III 60 80 ПО 15 15 15 50 50 50
I 60 65
Кислый II 80 — 65
III ПО — 65
(раствора). При расчете норм
расхода цианида натрия учи-
тывают потери, связанные с
разложением этого соедине-
ния.
Норму расхода химикатов
на электрохимические и хи-
мические покрытия рассчи-
тывают на 1 ма поверхности
без учета толщины покрытий,
но в зависимости от сложно-
сти конфигурации деталей.
Норма расхода химикатов
определяется по формуле
= К (Д + В + С) с,
где К — коэффициент, учитывающий тип оборудования; А —
норма потерь электролита на вынос с деталями при выгрузке, г/ма;
В — норма потерь при уносе электролита в вентиляционные
каналы, г/ма; С — норма потерь электролита при фильтрации,
корректировании и смене электролитов или растворов, г/м2; с —
концентрация компонента, г/л.
Коэффициент Д’ при нанесении покрытий в автоматических
линиях равен 0,8; в погружных колокольных и барабанных уста-
новках — 1,5; при одноразовой заливке после каждой партии
деталей — 1,8 и т. п.
По степени сложности детали делятся на три группы: I —
плоские детали и цилиндрические детали без резьбы; II — кре-
пежные, рельефные и штампованные детали без полостей, в ко-
торых задерживается электролит; III — детали с глухими от-
верстиями, в которых задерживается электролит, а также детали,
имеющие труднопромываемые участки.
Нормы потерь электролита при нанесении электрохимических
и химических покрытий приведены в табл. 31.12.
Норма расхода хромового ангидрида рассчитывается с учетом
низкого выхода по току вследствие выделения водорода, который
уносит с собой значительное количество электролита в атмосферу
при вентиляции, при этом норма потерь В зависит от толщины
покрытия. Кроме того, необходимо учесть количество хромового
ангидрида, пошедшего на осаждение хрома. Расчет нормы рас-
хода хромового ангидрида с учетом особенностей процесса хро-
мирования для каждой толщины хромового покрытия производят
по формуле
’ Нх = (А + С) с + (Р + Вс) 6,
где А — потери на унос составляют 0,125; 0,145 и 0,175 л/ма
для I, II и III групп сложности соответственно; В — потери при
твердом и декоративном хромировании равны 0,05, а при молоч-
370
31.13. Нормы расхода
хромового ангидрида
Группа сложности Норма расхода (г/м1) в зависимости от типа покрытия
декора- тивное твердое молочное
I II III 296+ 53 296 + 59 296 + 68 246 + 35 246 + 39 246 + 45 396 + 44 396 + 49 396 + 54
Примечание; б — толщина Хрома, мкм. Прн применении поплав- ков, хромнна и т. д. применяют коэф- фициент 0,6. *
31.14. Норма потерь
при разложении цианида натрия i
Процесс Норма (г/м4) Ш потерь 1 мкм
без подо- грева с подо- гревом
Цинкование 2,92 3,65
Меднение 2,16 2,7
Кадмирование 2,00 2,5
Латунирование 2,44 3,05
ном—0,1 л/м2 на 1 мкм; С = 0,05 л/м2; с — концентрация СгО3,
равная 300, 250 и 200 г/л соответственно для декоративного,
молочного и твердого хромирования; 6 — толщина хромового по-
крытия, мкм; Р — количество хромового ангидрида (г) для покры-
тия 1 м2 при толщине 1 мкм. Величину Р определяют следующим
путем: масса хрома при толщине 1 мкм и площади покрытия
в 1 м2 равна плотности хрома, т. е. 7 г. Содержание хрома в хро-
мовом ангидриде равно 50 %, следовательно, Р равно 14 г.
Подставляя в вышеприведенную формулу указанные значения,
получим упрощенные формулы для расчета норм расхода СгО3
(табл. 31.13).
При нанесении покрытий в цианидных электролитах происхо-
дит разложение цианида натрия (калия) электрическим током
и углекислотой воздуха, что необходимо учитывать при расчете
норм
Нх = (Л + С) с + (D + Вс) 6,
где А — потери на унос, равные 0,08 л/м2; В = 0,015 л/м2; С =
= 0,05 л/м2; D — норма потерь на разложение цианида натрия,
г/м2 (табл. 31.14); с — концентрация NaCN, г/л; 6 — толщина
покрытия, мкм.
Подставляя численные значения в вышеприведенную формулу,
получаем
Нх = 0,13с + (D + 0,015с) е.
Норму расхода химикатов следует рассчитывать на исходные
химикаты, которые используются для приготовления электроли-
тов или растворов. Часто в составах указывают не соль, а коли-
чество металла (в пересчете на металл). В табл. 31.15 приводится
пересчет металла покрытия на исходную соль такого же металла.
Расчет норм расхода химикатов на пуск нового оборудования
производится по формуле ч ,
= CW1000, , ....... . ... ... ’
371
31.15. Пересчет металла покрытия на соль того же металла
Металл Химическая формула Количество (r)
соли, содержащей 1 г металла металла В 1 Г СОЛИ
Медь CuSO4-5H2O 3,93 0,25
» CuCN 1.41 0,71
Никель NiSO4-7H2O 4,78 0,21
Цинк ZnSO4-7H2O 4,4 0,23
» ZnO 1,24 0,81
» Zn(CN)2 1,79 0,56
Хром CrOs 1,92 0,52
Кадмий 3CdSO4-8H2O 2,28 0,43
» CdO 1,14 0,88
Олово SnSO4-7H2O 1,80 0,55
SnCl2-2H2O 1,80 0,53
Свинец 2PbCOs-Pb(OH)2 1,24 0,81
» PbO 1,08 0,93
где с — концентрация химиката в электролите (растворе), г/л;
V — объем ванны, л; К. — коэффициент заполнения ванн, рав-
ный 0,7—0,9.
Расход химикатов на выполнение программы рассчитывается
следующим образом:
Qx = Ях65год/Ю00 кг.
Расчет норм расхода растворимых анодов. Норма расхода
растворимых анодов устанавливается на 1 м2 поверхности покры-
тия при толщине слоя 1 мкм с учетом неизбежных потерь и от-
ходов по формуле
Яа = 1,06т,
где 1,06 — коэффициент, который учитывает технологические по-
тери на шламообразование, неиспользованные остатки и т. п.
Масса покрытия площадью 1 м2 и толщиной 1 мкм численно
равна плотности металла покрытия, поэтому вместо массы по-
крытия в формуле стоит величина у.
Годовой расход растворимых анодов
\ Qa = Яа65год/1000 кг,
где 6 — толщина покрытия, мкм; 5ГОД — поверхность покры-
тия, м2.
При нанесении сплавов плотность сплава ‘*•1 ’ ’у/
5 7. .. . Тепл = + у2пх),
где Vi и Та — плотность металлов, входящих в сплав; и п2 —
процентное содержание соответствующих металлов в сплаве.
372
Форма 31.6. Расчет годового расхода химикатов
Опера- ция Компонент Концентра- ция, г/л Толщина покрытия, мкм "х’ г/м1 5год. м« О? *
Расчет расхода нерастворимых анодов (катодов). Норма рас-
хода устанавливается с учетом технологических потерь на шламо-
образование и отходы, а также сменяемости электродов в год.
Норму расхода подсчитывают по формуле
яа = /СсКв dYTo6p//Co60B6O.lO-8,
где К.с — коэффициент сменяемости анодов (катодов) в год;
К.й — коэффициент, учитывающий отношение анодной (катодной)
поверхности ко второму электроду; d — толщина анода (ка-
тода), мм; у — плотность материала анода (катода), г/см3; —
время обработки, мин; К.Об — коэффициент использования обо-
рудования. Для твердого и молочного хромирования норму
расхода надо дополнительно умножить на толщину покрытия.
При декоративном и твердом хромировании Кс — 1, a Ks = 2.
При анодировании Кс — 2, a Ks = 0.5. При электрохимическом
обезжиривании Кс = 1; Ks = 2 для стали, Ks = 0,1 для корро-
зионно-стойкой стали.
у Расчет норм расхода анодов на запуск оборудования. Расход
растворимых и нерастворимых анодов (катодов) определяют по
формуле
Д Н'а = nK1/C2LB„WBHyd/1000, ,
где К.! — коэффициент, учитывающий суммарную ширину анодов
по отношению к длине ванны, Ki = 0,6; — коэффициент,
учитывающий отношение длины анодов к высоте ванны, = 0,8;
п — число анодных (катодных) штанг; Лвн, Явн — длина и глу-
бина ванны, см; d — толщина анода (катода), см; у — плотность
металла анода (катода), г/см3.
Все данные по расчету расхода годовых количеств химикатов
и анодов (катодов) сводятся в формы 31.6 и 31.7.
Форма 31.7. Расчет годового расхода анодов
Опера- ция Материал Тип анода Толщина покрытия, мкм «а «а 5ГОД’ м1 X О *1 в>
г/м1
\
373
ГЛАВА 32. ОРГАНИЗАЦИЯ ПРОИЗВОДСТВА
\ И ЭКОНОМИЧЕСКАЯ ЧАСТЬ
i
В состав гальванических цехов входят основные про-
изводственные отделения и вспомогательные участки и службы.
Вспомогательную площадь принимают в процентах от производ-
ственной площади: для неавтоматизированных цехов она состав-
ляет 60—80 %, для автоматизированных — около 100—120 %.
В зависимости от годовой поверхности гальванические цеха
классифицируются следующим образом:
1) мелкосерийное производство — поверхность покрытия до
50 000 м2/год; в этом случае рекомендуется применять ванны
с ручным обслуживанием и механизированные линии;
2) серийное и крупносерийное производство — поверхность
покрытия более 50 000 м2/год; в цехах устанавливают автоматы
различных типов, механизированные линии, частично — обору-
дование малой механизации;
3) массовое производство — поверхность покрытия
300 000 м2/год; в цехах для нанесения покрытий рекомендуется
применять автоматы жесткого цикла, автооператорные автоматы
и незначительное число нормализованных ванн.
Потребная производственная площадь может быть определена
по нормам на единицу оборудования (табл. 32.1).
Основные условия при планировке цеха — поточность про-
изводства и обеспечение рабочих мест и проходов между обору-
дованием для обслуживания и ремонта. В цехе необходимо пре-
дусмотреть основной проход не менее 3—4 м и проходы между/
оборудованием 2—2,5 м. Оборудование лучше располагать па-/
раллельными рядами перпендикулярно к основному проезду;
при необходимости загрузки с торца автомата ее осуществляют со
стороны основного проезда. Если имеется несколько автоматов,
их лучше располагать в одну линию.
На рис. 32.1 показано расположение ванны с ручным обору-
дованием. Нормы расстояний составляют: от колонны до боковой
стенки ванны (а) 1500—1600 мм; между ваннами и выпрямите-
лем (б) 150—300 мм; между выпрямителями (в) 200—300 мм;
от колонны до боковой рабочей стороны ванны (е) 1000—1200 мм;
. ,я «
32.1. Норма площади на единицу оборудования
Оборудование Норма площади на единицу оборудования, м1 Коэффи- циент
Автоматы Вайны до 3 м » свыше 3 м Площадь, занимаемая оборудова- нием 8—10 15—18 3,2—3,5 3,5—4 / 3,5—4
374
L
Рис. 32.1. Расположение оборудо-
вания при ручном обслуживании
—О ВОАН
- ° вппвпп
Рис. 32.2. Расположение оборудова-
ния при механизированной загрузке
между ваннами, расположенными в ряд (д), 250—300 мм; от ко-
лонны до тыльной стороны ванны (е) 600—800 мм.
На рис. 32.2 приведен эскиз ванн с механизированной загруз-
кой электротельфером или автооператором со следующими нор-
мами расстояний: между тыльными сторонами ванн (а) 800—
1000 мм; от рабочей стороны ванны до колонны (б) 1200—1500 мм;
между ваннами (в) 100—200 мм; от боковой стороны ванны до
колонны (а) 800—1000 мм.
На рис. 32.3 показано расположение автооператорных авто-
матов со следующими расстояниями: между колонной и боковой
стороной автомата (а) 1500—2500 мм; между автоматами (б)
1500—2000 мм; от колонны до автомата (в) 1500—2000 мм; от
проезда до рабочего места автомата (а) 2000—2500 мм; между
выпрямителем и автоматом (д) 800—1000 мм; между выпрями-
телями (а) 250—300 мм; от колонны до выпрямителя (ж) 800—
1000 мм; между колонной и тыльной стороной выпрямителей (з)
600—800 мм.
Автоматы с жестким циклом представлены на рис. 32.4; рас-
стояние между колонной и боковой стороной автомата (о) 1200—
1300 мм; между автоматами (б) 1500—2000 мм; между колонной
и тыльной стороной автомата (в) 1500—2000 мм; от проезда до
рабочего места (а) 2000—2500 мм; от настила до выпрямителя (б)
1200—2500 мм; между выпрямителями (а) 250—300 мм.
Гальванические цеха относятся к категории вредных произ-
водств, поэтому их располагают у наружных стен зданий. Ши-
рина пролета обычно составляет 18 и 24 м, сетка колонн 6,12 м.
Высота цеха при двухэтажном расположении 6,0; 7,2 и 8,4 м.
Первый этаж или подвал (при расположении цеха в первом этаже)
служит для размещения всех коммуникаций.
В отдельных помещениях следует располагать участки дробе-
струйной обработки, шлифования и полирования, приготовления
цианидных электролитов, кислых электролитов и растворения
гидроксида натрия, а также кладовую для хранения химикатов,
375
Рис. 32.3. Расположение оборудова-
ния при установке автооператорных
линий
экспресс-лабораторию, кладовую готовой продукции, насосную
и т. п.
Выпрямители размещают около автоматов или на техническом
этаже, по возможности ближе к ваннам, сдвинув их несколько
в сторону; выпрямители силой тока свыше 3200 А не устанавли-
вают на уровне подмостков.
Ванны селективной очистки ставят около соответствующих
ванн. Фильтры для непрерывной фильтрации размещают около
автоматов или на техническом этаже. Пульты управления распо-
лагают в торце автоматов. Монтаж деталей на подвески может про-
изводиться около рабочих мест, при больших программах под-
вески монтируют централизованно и подают при помощи подвес-
ного контейнера, на который подвешивают подвески с готовыми
деталями.
В дипломном проекте должны быть отражены способы, кото-
рые позволяют улучшить технологию нанесения покрытий для
снижающих расход металлов, солей, электроэнергии, воды и т. п.
Необходимо создание малоотходной, экологически безопасной
технологии. Первоочередными задачами являются резкое сокра-
щение объема потребляемой воды, прекращение сброса сточных
вод, содержащих токсичные соединения, в канализацию и регене-
рация цветных металлов.
Самыми простыми способами уменьшения выноса солей ме-
таллов из ванн покрытий и попадания их в промывные воды
являются:
1) выдерживание подвесок или корзин с деталями при вы-
грузке над ванной в течение 10—15 с для стекания с них большей
части электролита, захваченного деталями при извлечении из
ванн;
2) введение в состав электролитов поверхностно-активных
веществ, снижающих поверхностное натяжение растворов, что
снижает количество уносимого с деталями электролита;
376
3) промывку деталей после покрытия следует производить
сначала в ваннах с непроточной водой — ваннах-улавливателях,
а затем в ваннах с проточной водой каскадного типа.
Из ванн-улавливателей извлечение металлов можно произво-
дить различными способами: способом внутреннего электролиза,
электролизом от внешнего источника и дистилляцией.
Способ внутреннего электролиза заключается в следующем.
В ванну с электролитом помещают электроды из электроотрица-
тельного металла (магния или алюминия), накоротко замкнутые
с пластинами из коррозионно-стойкой стали. Между этими пла-
стинами возникает разность потенциалов. Магний или алюминий
становится анодом, и происходит их растворение, а на стали,
являющейся катодом, выделяется металл в виде рыхлых пленок
или порошка. Этот метод позволяет почти полностью удалять
такие металлы, как медь, олово, свинец и их сплавы, кадмий и
драгоценные металлы.
При электролизе от внешнего источника тока у одной из сте-
нок ванны устанавливается кассета из двух электродов (катод-
сталь Х18Н9Т, анод — сталь Х18Н9Т, Х18Н10Т, графит, сви-
нец) с расстоянием между ними 50—100 мм. Раствор необходимо
интенсивно прокачивать через кассету.
Концентрирование электролита из промывных вод можно
производить дистилляцией. При этом способе промывания вода
проходит через систему, в которой нагревается, затем вода испа-
ряется и образуется концентрат электролита, который исполь-
зуют для корректирования электролита.
Особенно перспективными методами снижения потерь металла
со сточными водами являются методы локального обезвреживания
вредных веществ непосредственно в технологической линии.
Эти методы обеспечивают очистку сточных вод и извлечение цен-
ных компонентов для каждого технологического процесса отдельно.
Преимуществом этого метода является извлечение отдельных
компонентов, а не их смесей.
Использование физико-химических методов очистки (ионный
обмен, электрохимический, гиперфильтрация) позволяет разра-
ботать замкнутые системы водоиспользования. Применение этих
методов позволяет свести до минимума ущерб, наносимый окру-
жающей среде.
Замкнутые системы водоиспользования можно осуществить
несколькими путями:
1) возвратом очищенных сточных вод на промывку изделий;
2) возвратом воды и регенерированных ценных продуктов,
содержащихся в промывных водах;
3) специальным концентрированием промывных вод с последу-
ющим использованием их для восполнения потерь раствора в про-
мывных ваннах.
Первый вариант можно осуществлять ионным обменом, ре-
агентными и электрокоагуляционными методами. Второй — очист-
377
кой отдельных видов сточных вод путем электродиализа, гипер-
фильтрации, ионообмена или выпаривания. Третий вариант пре-
дусматривает внедрение отдельной обработки при каждой техно-
логической операции.
Экономическую эффективность дипломного проекта опреде-
ляют путем сравнения расчетных показателей с показателями,
действующими на предприятии. Основными показателями при
этом являются себестоимость продукции, сроки окупаемости и
производительность труда на одного рабочего. Кроме того, до-
полнительными показателями экономической эффективности яв-
ляются снижение трудоемкости процесса нанесения покрытия,
экономия материалов и количество продукции с 1 м2 производ-
ственной площади.
Годовую экономию определяют путем сравнения себестои-
мости, полученной в дипломном проекте, с себестоимостью, полу-
чаемой на предприятии. В годовую себестоимость входят: заработ-
ная плата с начислениями, стоимость химикатов, стоимость
тепло- и электроэнергии, амортизация, затраты на текущий ре-
монт. Критерием роста производительности труда является эко-
номия рабочей силы и снижение трудоемкости в сравниваемых
вариантах при нанесении 1 м2 покрытия.
В экономической части приводятся данные по расчету трудо-
емкости; стоимости оборудования, основных материалов, пара,
сжатого воздуха, воды, электроэнергии; фонда заработной платы
основных производственных рабочих и т. п.
Здесь же приводятся расчет технико-экономической эффек-
тивности дипломного проекта, технико-экономические показа-
тели, срок окупаемости. В конце дипломного проекта необходимо
указать прогрессивные технические решения, принятые в проекте.
К ним следует отнести применение современной технологии; полу-
чение блестящих и комбинированных покрытий; получение спла-
вов с заданными свойствами; автоматизацию производства; авто-
матический контроль режима работы; создание безотходной тех-
нологии; применение гибких производственных систем и т. п.
ПРИЛОЖЕНИЯ
Условия эксплуатации покрытий
Приложение I
Группа ус- ловий экс- плуатации Климатическое исполнение деталей Катего- рия раз- мещения деталей Группа ус- ловий экс- f Климатическое исполнение деталей Катего- рия раз- мещения деталей
1 2 3 4 Все исполнения У, УХЛ, ТС ТВ, ТМ, М, ОМ, В Т, ТВ ТС Т, ТВ, О У, УХЛ тс Т, ТВ, М, ТМ, ом, о, в 4.1 2.1; 3.1; 4 4 3.1 1.1; 2; 3 2.1 2.3 1 1.1 5 6 7 8 ГТ, ТВ, О {ТВ, т (у, УХЛ М, ТМ, ом, в / Все исполнения t О, Т, ТВ / Все исполнения t М, ТМ, ОМ, В 2 3 1 2.1; 3 5 1 5.1 1.2
Примечания: 1. Климатическое исполнение деталей обозначается:
У — умеренный климат; УХЛ — умеренный и холодный климат; ТВ — влаж-
ный тропический климат; ТС — сухой тропический климат; Т — сухой и влаж-
ный тропический климат; О — все климатические районы на суше, кроме очень
холодного; М — умеренно холодный морской климат; ТМ — тропический мор-
ской климат; ОМ — умеренно холодный и тропический климат; В — все климати-
ческие исполнения, кроме очень холодного. 2. Категория размещения условно
обозначена: 1 — открытый воздух; 2 — под навесом или в помещениях; 3 — в за-
крытых помещениях; 4 — в помещениях, где имеется естественная регуляция;
4.1 — в закрытых помещениях с искусственно регулируемыми условиями; 5 —
в помещениях с повышенной влажностью; 1.1 — в закрытых помещениях (катего-
рия 4) и на открытом воздухе; 2.1 — категория 1, 1.1 и 2, если исключена воз-
можность попадания влаги; 3.1 — в нерегулярно отапливаемых помещениях;
4.1 — в помещениях с кондиционированным воздухом; 5.1 — категория 5, если
исключена возможность попадания влаги.
Приложение 11
Условные обозначения наиболее распространенных покрытий
Покрытие Условное обозначение
Цинковое с радужным хроматированием » фосфатированное Кадмиевое с радужным хроматированием Никелевое двухслойное (дуплекс) » трехслойиое (триплекс) Никель-снл Химическое инкелевое Мед но-никелевое с подслоем меди толщиной 9 мкм и с под- слоем никеля толщиной 12 мкм Хромовое твердое » «молочное» » двухслойное «молочное» толшиной 24 мкм Медио-никелево-хромовое блестящее Оловянное с подслоем никеля Покрытие сплавом олово—свинец с оплавлением Серебряное с подслоем никеля Анодно-оксидиое хроматированное » твердое, наполненное водой » , наполненное красным красителем Ц.хр Ц.фос Кд.хр Нд или Нпб. Нб Нт или Нпб. Нс. Нб Нсил (Нб.Нз) Хим.Н М9.Н12 Хтв Хмол Хмол24.Хтв24 М.Н.Хб Н.О О—С.опл Н.Ср Ан.Окс.хр Ан.Оке.тв.ив Ан.Окс.красиый
379
Приложение III
Допустимость контакта материала детали с электрохимическими и химическими покрытиями
Материал детали, электрохимическое или химическое покрытие Медь—ни- кель—хром по стали Хром по сталн, меди и ее спла- вам Никель по сталн, медн и ее спла- вам Серебро по стали, меди и ее спла- вам Золото по меди и ее сплавам Медь и ее сплавы Олово по меди или по сталн с под- слоем меди Кадмий, хроматиро- ванный по стали Цинк, хро- матирован- ный по ста- ли Сталь, фос- фатирован- ная после пропитыва- ния Алюминий и его сплавы после ано- дирования
Медь—никель—хром по стали Хром по стали, меди и ее сплавам Никель по стали, меди и ее сплавам Серебро по стали, ме- ди и ее сплавам Золото по меди и ее сплавам Медь и ее сплавы Олово по меди или по стали с подслоем меди Кадмий, хроматиро- ванный по стали Цинк, хроматирован- ный по стали Сталь, фосфатирован- ная после пропитывания Алюминий и его спла- вы после анодирования + + + О + + + + п + + + О + + + + п + + + О + + + + п + + + + + + О О О + + + + О + + + + + + + + п + + + + + + + + + + + + + + + + + + + О + + + + + + + + + и 1 I | S3 S3 S3
Примечания: 1. Принятые обозначения: «+> — допустимый контакт; «—> — недопустимый контакт; о — контакт, допусти- мый при наличии смазки; п — контакт, допустимый при наличии изоляционных прокладок. 2. Сведения даны для 1—4-й групп ус- ловий эксплуатации.
Приложение IV
Основные схемы технологических процессов подготовки поверхности перед нанесением покрытий
(цифры указывают последовательность технологических операций)
Основной металл Характеристика детали Промывка Обезжиривание Электрохи- мическое обезжирива- ние Разрыхле- ние окалины Травление Одновремен- ное травле- ние и обез- жиривание Удаление травильного шлама Активация
органи- ческое химиче- ское
Стали углероди- стые, низколегиро- ванные Сталь пружинная Сталь коррозион- но-стойкая Медь и ее сплавы Медь и ее сплавы, цинковые сплавы, металлические по- крытия после поли- рования Алюминий и его сплавы Титановые сплавы Имеется окалина и ржавчина Имеется ржавчина Механически об- работана Окалииа Г Окалина < Окалина отсут- (, ствует Г Окалина < Незначительная (, пленка оксидов Незначительная пленка оксидов Механически не полирована Поверхность поли- рованная 2; 4; 6; 8; 10 2; 4; 6 2; 4; 6 2; 4; 6 2; 4; 6; 8; 10 2; 4; 6; 8 2; 4; 6; 8 2; 4; 6 2; 4; 6 2; 4; 6; 8 2; 4; 6 2 1 или 1 — ' г- 1 или 1 1 или 1 1 или 1 1 или 1 1 или 1 1 или 1 1 или 1 - 1 - 3 3 3 3 III — 1 III III 5 3 3 3,5 3 3 3 III III 1 1 1 I- 1 7 3 5 5 5 9 5 5 5 7 5 7 5 5
Примечания: 1. При наличия большого количества масел и смазок перед химическим обезжириванием иля перед одно-
временным обезжириванием и травлением производят промывку в горячей воде. 2. После обезжиривания в органических раствори-
телях промывку в воде ие производят.
Приложение V
Основные схемы технологических процессов заключительной обработки покрытий
(цифры указывают последовательность технологических операций)
Условное обозначение покрытия BJ м а 3 3 О о. К Активация Улявливя- 1 S а | Осветление Одновремен- ное осветле- ние и хрома- тирование Хроматиро- вание Фосфатиро- вание Пассивиро- вание Пропитка Наполнение Сушка Термообра- ботка
( 1; 3 2 — — — — 4 5
ц., Кд. { 1; 3 — — — — 2 4 — — 4 5 0
1 1 —— —. । । — - ' — □
( 1; 3; 5 — 2 — 4 — — — — 6 —
ц. б., Кд. б , : 4 1; 3 — — 2 — — — — — 4 5
1 1; 5; 7 4 — — 6 — —. — —— 2,8 3
Хтв i | 1; з — — 2 — 6 —• 4 5
(оксидное) ГФЖ-94
О., С., Н., Ж., о—н, (1 — — — .— — — —- — 2 —-
О—Ви, О—С, М—О, м—ц { 2 — 1 — .— — — — — — 3 ——
X., Ср., Зл., Пд., Рд., 12 — 1 3 — — — — — 3 —
Ср—Су, Зл—М, Зл—Су,
Ср—Зл, Зл—Ко, Зл—Н
ОСН Хтв О—С. 1 __ — 2 3
Хим.Н
1 —— —- .. . —1 2 3
i водой
Ан.Окс, Ан.Окс.эмт - 1;3 — — — — —— 2 3 —
красителями
Хим.Оке, Ah.Okc.tb, 1 — — — — — — 3 2 —
Ан.Оке.из, Хч, Пч - маслами,
лаками
Хим.Фос i 1 — — — — — — 2 4 3 —
маслами
Хим.Пас . - ,, , 1 — — — — — — 3 2 —
Smjf Л®" маслами,
лаками
Приложение VI
Удаление недоброкачественных покрытий
Покры- тие Металл Компоненты Концентра- ция, г/л Плотность тока, А/дм1 Темпе- ратура, °C
Цинк Сталь НС1 или H2SO4 NaOH 5—10 % 100—150 — 18—25 18—25
NaCN NaOH 90 100—120 2,0; катод— сталь 18—25
Кадмий Алюминий H2SO4 (1,33) 10% — 20—40
Сталь HC1 (1 : 1) Sb2Og 100 мл 15 г — 18—35
NaCN 70—90 1,0; катод— сталь 20—25
Сталь, латунь, медь NH4NO3 120 — 20—25
Олово Сталь NaOH Нитробензой- ная кислота 100—120 30—35 — 75—85
Сталь, медь, латунь NaOH Na2CO3 100—120 20—25 5—10 20—25
FeCl3-6H2O CuSO4-5H2O 75—100 135—160 — 20—25
HC1 Sb2O3 940 мл/л 5 — 20—25
Свинец Сталь, медь, латунь NaOH CH3COOH ле- дяная 100 24 об. доли 1—3 70 18—25
Медь • , , * Сталь, медь NaCN NaOH 90—120 15—20 1,0; катод— свинец 20—25
CrO3 (NH4)2SO4 250—300 100—120 7—9; катод— свинец 18—25
1. NaOH S 100 150 — 85—95
2. NaCN 120 18—25
Сталь, цинк, никель CrO3 H2SO4 450 35—40 мл/л — 20—25
Цинковое литье CrO3 CrO3 : H2SO4 150—200 100 : 1 7—14; катод— свинец 20—25
383
Продолжение прил. VI
Покры- тие Металл Компоненты Концентра- ция, г/л Плотность тока, А/дм* Темпе- ратура, °C
Медь Алюминий H2SO4 (1,84) 5 %-ный (масс, доли) 5—7; катод— свинец 20—40
Никель Сталь NaNO3 300—400 10 65
Сталь, магний Нитробензой- ная кислота NaCN NaOH 20—30 120—180 5—25 — 65—70
Медь и ее сплавы Нитробензой- ная кислота H2SO4 40—75 100 — 80—90
Сталь, медь и ее сплавы H2SO4 (1,84) Глицерин H2SO4 (1,6) 500 7,5 50% 3—8; катод— свинец 7—10 (катод— свинец) 18—25 18—25 60
Сталь, железо NaNO3 NaNO2 Na2CO3 NaCl 250—280 10—15 3—4 2—3 12—15 (10—12 В); катод— свинец 20—25
Цинковые сплавы H2SO4 (1,84) H3PO4 CrOs H2O 40 (масс, доли) 20 (масс, доли) 5 35 Катод— свинец 20—80
Алюминий H2SO4 5% 5—7 30 240
Хром Сталь, медь и ее сплавы, никель HC1 (для стали — hi 20 % {гибиторы) — 20—70
Сталь, никель NaOH 150—200 10—20; катод— сталь 20—25
Сталь вместе с никелем H2SO4 80% 3—5 20—25
Цинковое литье Na2S NaOH : 20—30 20—30 1—2 20—25
384
СПИСОК ЛИТЕРАТУРЫ
1. Антропов Л. И. Теоретическая электрохимия. М.: Высш, шк., 1975.
568 с.
2. Богорад Л. Я. Хромирование. Л.: Машиностроение, 1984. 94 с.
3. Буркат Г. К. Серебрение, золочение, палладирование и родирование.
Л.: Машиностроение, 1984. 94 с.
4. Бучило Э. Очистка сточных вод травильных и гальванических отделе-
ний/Пер. с польск. М.: Металлургия, 1974. 199 с.
5. Вячеславов П. М. Электролитическое осаждение сплавов. М., Л.: Ма-
шиностроение, 1977. 92 с.
6. Гальванические покрытия в машиностроении: Справочник. В 2-х томах/
Под ред. М. А. III л у г е р а, Л. Д. Т о к а. М.: Машиностроение, 1985 . 488 с.
7. Гальванотехника благородных и редких металлов/В ячеславовП. М.,
Буркат Г. К., ГрилихесС. Я-, Круглова Е. Г. Л.: Машино-
строение, 1970. 248 с.
8. Грилихес С. Я. Обезжиривание, травление и полирование металлов.
Л: Машиностроение, 1976. 208 с.
9. Грилихес С. Я- Оксидирование и фосфатирование металлов. Л.: Ма-
шиностроение, 1971. 120 с.
10. Грилихес С. Я- Электрохимическое полирование. Л.: Машиностроение,
1976. 208 с.
11. Дасоян М. Я-, Пальмская И. Я- Оборудование цехов гальванических
покрытий. М.: Машиностроение, 1979. 315 с.
12. Инженерная гальванотехника в приборостроеиии/Под ред. А. М. Г и н-
б е р г а. М.: Машиностроение, 1977. 315 с.
13. Каданер Л. И. Справочник по гальваностегии. Киев: Техн1ка, 1976.
253 с.
14. Ключков Б. Я., Луценко С. В., Мирен В. И. Нейтрализация сточных
вод в гальваническом производстве. М.: НИИТавтопром, 1979. 72 с.
15. Кубасов В. Л., Зарецкий С. А. Основы электрохимии. М.: Химия, 1976.
184 с.
16. Кудрявцев Н. Т. Электролитические покрытия металлами. М.: Химия,
1979. 352 с.
17. Лайнер В. И. Защитные покрытия металлов. М.: Металлургия, 1974.
560 с.
18. Лукомский Ю. Я.. Горшков В. К. Гальванические и лакокрасочные
покрытия на алюминии и его сплавах. Л.: Химия, 1985. 184 с.
19. Макарова Н. А., Лебедева М. А., Набокова В. Н. Металлопокрытия
в автомобилестроении. М.: Машиностроение, 1977. 244 с.
20. Мельников П. С. Справочник по гальванопокрытиям в машинострое-
нии. М.: Машиностроение, 1979. 296 с.
21. Типаж оборудования для нанесения гальванических, химических и
анодизационных покрытий на 1976—1988 гг. Утв. 17 дек. 1975 г. М., 1976.
22. Оборудование для нанесения гальванических, химических и анодно-
оксидных покрытий: Каталог. М.: НИИмаш, 1982. 55 с.
23. Оборудование цехов электрохимических покрытий: Справочник/A л е к-
сандров В. М., Антонов Б. В., Гендлер Б. И. и др.; Под ред.
П. М. Вячеславова. Л.: Машиностроение, 1987. 309 с.
385
24. Прикладная электрохимия/ Под ред. А. Л. Р о т и н я н а. Л.: Химия,
1974. 536 с.
25. Сайфулнн Р. С. Неорганические композиционные материалы. М.: Хи-
мия, 1983. 300 с.
26. Серебряный Л. А. Безопасность труда при нанесении гальванических
покрытий. М.: Машиностроение, 1980. 70 с.
27. Сивков В. П. Безопасность труда гальваника. М.: Машиностроение,
1986. 80 с.
28. Смирнов Д. Н., Бенкин В. Е. Очистка сточных вод в процессах обработки
металлов. М.: Металлургия, 1980. 195 с.
29. Тимонова М. А. Защита от коррозии магниевых сплавов. М.: Металлур-
гия, 1978. 160 с.
30. Типаж оборудования для нанесения гальванических, химических,
анодио-оксидных покрытий на 1981—1985 гг. М.: НИИмаш, 1980. 26 с.
31. Хайн И. И. Теория и практика фосфатирования металлов. Л.: Химия,
1973. 310 с.
32. Шалкаускас М. И., Вишкялнс А. И. Химическая металлизация пласт-
масс. М.: Химия, 1977. 169 с.
33. Ямпольский А. М. Гальванические покрытия. Л.: Машиностроение,
1978. 168 с.
34. Ямпольский А. М., Ильин В. А. Краткий справочник гальванотехника.
Л.: Машиностроение. 1981. 270 с.
ОГЛАВЛЕНИЕ
я’,,
Предисловие......................................................... 3
Раздел I. Общие сведения о покрытиях................................ 5
Глава 1. Способы нанесения покрытий ......................... —
§ 1.1. Физические способы............................ —
§ 1.2. Химические и электрохимические способы ... 10
Глава 2. Классификация покрытий............................. 12
Раздел II. Подготовка поверхности металлических дета-
лей к покрытию................................................ и
Глава 3. Механическая подготовка ............................ —
§ 3.1. Шлифование и полирование...................... —
§ 3.2. Обработка металлическими щетками (крацевание) 25
§ 3.3. Галтовка..................................... 26
§ 3.4. Виброабразивные способы обработки............ 28
Глава 4. Химическое и электрохимическое обезжиривание поверх-
ности ............................................................. 31
§ 4.1. Обезжиривание органическими растворителями —
' § 4.2. Химическое обезжиривание ................... 34
§ 4.3. Электрохимическое обезжиривание............ 39
jtTrw. § 4.4. Обезжиривание с применением ультразвука ... 42
Глава 5. Химическое и электрохимическое травление поверхности 43
, § 5.1. Травление черных металлов.................... —
W ? § 5.2. Травление цветных металлов................... 52
§ 5.3. Активирование и промывка .................... 57
Раздел III. Электрохимическое и химическое полирование
металлов и сплавов........................................... 60
Глава 6. Основы теории процессов электрохимического и хими-
ческого полирования ................................................ —
Глава 7. Электрохимическое н химическое полирование стали,
v,;, . меди, никеля и алюминия.............................. 65
Раздел IV. Механизм образования электрохимических
покрытий .................................................... 70
Глава 8. Структура электрохимических покрытий....................... —
387
§ 8.1. Общие сведения....................... . . ’70
§ 8.2. Условия образования электрохимических покры-
тий .................................................. 74
§ 8.3. Механизм образования электрохимических покры-
тий .................................................. 76
§ 8.4. Влияние состава электролита на его структуру. . 81
§ 8.5. Влияние режима электролиза иа структуру элек-
тролита .............................................. 85
§ 8.6. Влияние водорода иа структуру электролита... 89
§ 8.7. Многослойные комбинированные покрытия ... 91
Глава 9. Рассеивающая способность электролитов................. 93
§ 9.1. Распределение тока в электролите.................. —
§ 9.2. Количественная характеристика рассеивающей спо-
собности электролитов ............................... 94
§ 9.3. Методы измерения рассеивающей способности элек-
тролитов ............................................ 96
§ 9.4. Микрорассеивающая способность электролитов . . 98
§ 9.5. Кроющая способность электролитов ............... 100
§ 9.6. Способы получения равномерных покрытий . . . 101
Раздел V. Электрохимический метод нанесения металли-
ческих покрытий............................................. 105
Глава 10. Цинкование.................................................. —
§ 10.1. Физико-химические свойства цинка и область
применения цинковых покрытий......................... —
§ 10.2. Сравнительная характеристика электролитов . . 107
§ 10.3. Простые кислые электролиты................... 109
§ 10.4. Цианидные электролиты ....................... 114
§ 10.5. Цинкатные электролиты ....................... 118
§ 10.6. Хлораммоиийные и аминокомплексные электро-
' ’> i литы......................................... 120
'5§ 10.7. Пирофосфатные электролиты ................................ 123
§ 10.8. Обработка цинковых покрытий . . . •.......... 125
Глава 11. Кадмирование.......................................... 127
§ 11.1. Физико-химические свойства кадмия и область
применения кадмиевых покрытий...................... 127
§ 11.2. Сравнительная характеристика электролитов. . 129
§ 11.3. Простые кислые электролиты................... 130
§ 11.4. Цианидные электролиты ....................... 132
’Л' § 11.5. Нецианидные сложные электролиты............... 136
§ 11.6. Обработка кадмиевых покрытий................. 138
Глава 12. Оловянированне........................................139
§ 12.1. физико-химические свойства олова и область
применения оловянных покрытий ....................... —
, § 12.2. Сравнительная характеристика электролитов . . 141
§ 12.3. Кислые электролиты........................... 142
•' § 12.4. Пирофосфатные электролиты .................. 147
§ 12.5. Станнатные электролиты....................... 148
§ 12.6. Дополнительная обработка оловянных покрытий 152
. I . § 12.7. Оловянированне без внешнего тока (химическое
оловянированне)................................ 154
Глава 13. Свинцевание ............................................ —
388
§ 13.1. Физико-химические свойства свинца и область
применения свинцовых покрытий............... 154
§ 13.2 . Электролиты свинцевания . ............... 155
Глава 14. Меднение............................................ 159
§ 14.1. Физико-химические свойства меди и область
применения медных покрытий..................... —
§ 14.2 . Сравнительная характеристика электролитов . . 160
§ 14.3 . Простые кислые электролиты................. 163
§ 14.4 . Комплексные электролиты ................... 167
Глава
15. Никелирование ..................................... 175
§ 15.1. Физико-химические свойства никеля и область
применения никелевых покрытий ............. —
§ 15.2. Катодный и анодный процессы никелирования 177
§ 15.3. Электролиты никелирования ................... 181
§ 15.4. Блестящее никелирование.............. 183
§ 15.5. Приготовление сульфатных никелевых электро-
литов 186
§ 15.6. Многослойное никелирование........... 189
§ 15.7. Черное никелирование ........................ 191
§ 15.8. Химическое никелирование............. 192
16. Железнение......................................... 196
§ 16.1. Физико-химические свойства железа и область
применения железных покрытий.......................... —
§ 16.2. Электролиты железнения...................... 198
Глава 17. Хромирование............................................. 201
1 § 17.1. Физико-химические свойства хрома и область
; применения хромовых покрытий..................... —
§ 17.2. Типы хромовых покрытий и их назначение. . . 203
I § 17.3. Особенности процесса хромирования...... 205
\ § 17.4. Структура и свойства хромовых покрытий . . . 207
I, § 17.5. Электролиты хромирования.............. 210
j § 17.6. Черное хромирование................... 217
| § 17.7. Интенсификация процесса хромирования .... 218
1§ 17.8. Пористое хромирование.............................. 220
§ 17.9. Приготовление и эксплуатация электролитов хро-
мирования ........................................... 221
Глава 18. Покрытие благородными и редкими металлами.... 223
. , § 18.1. Серебрение.................................... —
1 § 18.2. Золочение................................. 231
ч’’ . § 18.3. Родирование.................................. 237
§ 18.4. Платинирование.............................. 240
• ' § 18.5. Палладирование ............................. 241
•г .И , § 18.6. Индирование.................................. 243
•> ;V
Глава 19. Химическая и электрохимическая металлизация пласт-
масс .................................................................. 244
§ 19.1. Назначение и способы металлизации пластмасс . . —
§ 19.2. Подготовка поверхности пластмассы............... 246
§ 19.3. Химическая и электрохимическая металлизация 247
389
Раздел VI. Электрохимическое покрытие сплавами ... 254
Глава 20. Основы теории процесса осаждения сплавов................ — I
§ 20.1. Область применения сплавов................. —
§ 20.2. Условия совместного осаждения металлов . . . 255
§ 20.3. Структура и свойства сплавов ............ 258
§ 20.4. Анодный процесс при осаждении сплавов . . . 260'
Г лав в 21. Латунирование н бронзирование..................... —j-
§ 21.1. Физико-химические свойства н область примеие- ।
ния латунирования.................................. —-
§ 21.2. Электролиты латунирования ............... 261
§ 21.3. Физико-химические свойства и область приме-
A t , неиия броизнроввния....................... 264
§ 21.4. Электролиты бронзирования................ 265
Глава 22. Покрытие сплавами на основе олова, цинка и железа. . 267
§ 22.1. Покрытие сплавом олово—свинец.............. —
§ 22.2. Покрытие сплавом олово—никель.......... .'269
§ 22.3. Покрытие сплавом олово—висмут............ 270
§ 22.4. Покрытие сплавом цинк—кадмий............. 271
§ 22.5. Покрытие сплавами на основе железа...... 272
Раздел VII. Электрохимические покрытия алюминия, маг-
ния, цинка, титана и их сплавов................................ 274
Глава 23. Покрытия алюминия и его сплавов.................... —
Глава 24. Покрытия магния, цника, титана н нх сплавов.... 280
Раздел VIII. Оксидирование и фосфатирование металлов
и сплавов........................................................ 284
Глава 25. Оксидирование легких металлов ...................... —
§ 25.1. Оксидирование алюминия и алюминиевых спла-
вов ................................................ —
’ § 25.2. Оксидирование магния и его сплавов........ 300
Глава 26. Оксидирование черных н цветных металлов........... 302
л § 26.1. Оксидирование черных металлов ................ —
' ’ § 26.2. Оксидирование цветных металлов.............. 306
Глава 27. Фосфатирование.................................... 311
ед-ij § 27.1. Общие сведения................................ —
§ 27.2. Фосфатирование черных металлов........... 314
§27.3. Фосфатирование цветных и легких металлов. . 319
§ 27.4. Повышение защитных свойств фосфатных пленок 320
Раздел IX. Техника безопасности и производственная са-
нитария в цехах электрохимических покрытий 322
Глава 28. Общая характеристика электрохимических процессов
с точки зрения безопасности труда ................................ —
Глава 29. Техника безопасности при производстве электрохими-
ческих покрытий ................................................ 326
' ,Л . ' § 29.1. Предварительная подготовка ................... —
§ 29.2. Нанесение металлических покрытий............ 327
§ 29.3. Работа с ультразвуком....................... 328
§ 29.4. Электро- и пожаробезопасность................. —
§ 29.5. Индивидуальные средства защиты.............. 329
Раздел X- Основы курсового и дипломного проектирова-
ния цехов электрохимических покрытий ... 331
Глава 30. Общая и специальная части проекта........................ 332
§ 30.1. Исходные данные для проектирования............ —
§ 30.2. Общие требования к выбору вида и толщины
. покрытия ................................... 333
§ 30.3. Выбор технологического процесса............... —
§ 30.4. Выбор оборудования.......................... 334
Глава 31. Расчетная часть проекта.................................. 341
§ 31.1. Определение времени обработки детали в ванне
основного покрытия ......................... —
§ 31.2. Расчет оборудования......................... 342
§ 31.3. Компоновка автоматических линий ............ 351
§ 31.4. Выбор источников постоянного тока........... 355
§ 31.5. Расход пара и сжатого воздуха............... 358
§ 31.6. Расход воды................................. 361
§ 31.7. Вентиляция.................................. 363
§ 31.8. Расход электроэнергии....................... 367
§ 31.9. Расход химикатов ........................... 369
Глава 32. Организация производства н экономическая часть. . . 374
Приложения......................................................... 379
Список литературы.................................................. 385
УЧЕБНОЕ ИЗДАНИЕ
Дасоян Мартин Аветисович,
Пальмская Ирина Яковлевна,
Сахарова Елена Владимировна
ТЕХНОЛОГИЯ
ЭЛЕКТРОХИМИЧЕСКИХ
ПОКРЫТИЙ
Редакторы И. С. Аникиева, Р. Н. Михеева
Обложка художника Г. Л. Попова
Художественный редактор С. С. Венедиктов
Технический редактор А. И. Казаков
Корректоры Ю. М. Махмутова, 3. С. Романова, Н. Б. Старостина
ИБ Ns 5683
Сдано в набор 10.01.89. Подписано в печать 11.07.89. М-29111. Формат 60 X ЭО1/*#- Бумага
офсетная № 1. Гарнитура литературная. Печать офсетная. Усл. печ. л. 24,5. Усл.
кр.-отт. 24,5. Уч.-нзд. л. 26,40. Тираж 11260 экз. Заказ 672. Цена 1 р. 10 к.
Ленинградское отделение ордена Трудового Красного Знамени издательства «Машино-
строение». 191065, Ленинград, ул. Дзержинского, 10.
Ленинградская типография № 6 ордена Трудового Красного Знамени Ленинградского
объединения «Техническая книга» нм. Евгении Соколовой Союзполиграфпрома при
Государственном комитете СССР по делам издательств, полиграфии и книжной торговли.
193144, г. Ленинград, ул. Моисеенко, 10.