Текст
I Г' и
АЛ. Чиркин/ Е.О. Данченко f
БИОХИМИЯ
Содержание
Глава 1
Введение в биохимию.............................................................— 1
Определение.................................................................1
Основные разделы и направления в биохимии...................................1
Биохимия и медицина.........................................................2
Признаки живой материи и происхождение жизни................................2
Слабые взаимодействия....................................................4
Роль воды................................................................5
Законы термодинамики.....................................................6
Возникновение жизни на Земле.............................................6
Узловые моменты развития жизни...........................................8
История биохимии............................................................9
Общие представления о химическом составе живых организмов..................11
Единицы энергии и работы и значения некоторых физических постоянных........15
Биохимия в Интернете.......................................................15
"лава 2
□елки и аминокислоты........................................................ 16
Определение................................................................16
Функции белков.............................................................16
Элементарный состав белков................................................ 17
Молекулярная масса белков..................................................17
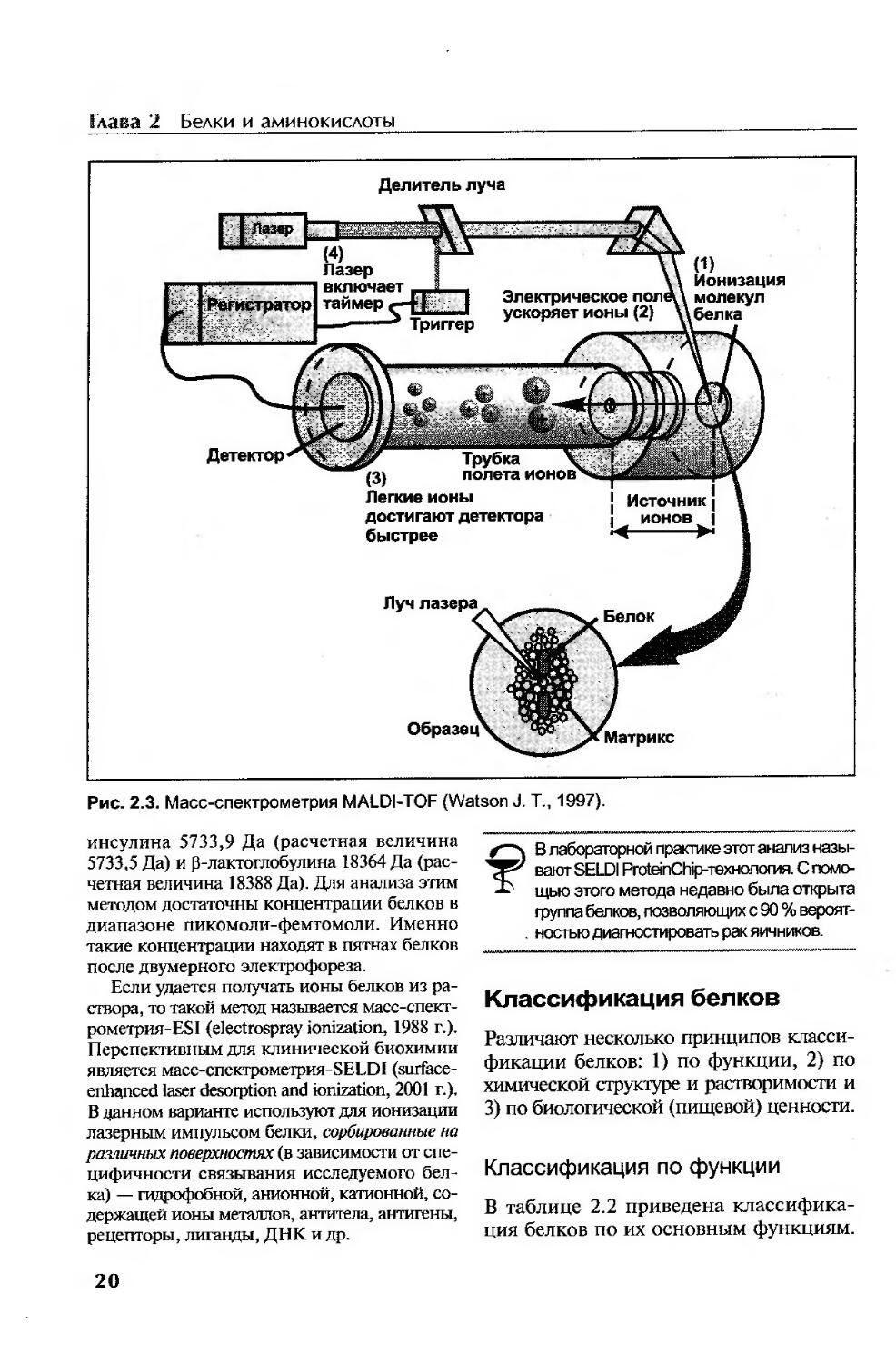
Масс-спектрометрия белков...............................................18
Классификация белков.......................................................20
Классификация по функции................................................20
Классификация по химической природе и растворимости.....................22
Классификация на основе биологической (пищевой) ценности белков.........25
Характеристика аминокислот.................................................25
Классификация аминокислот..................................................25
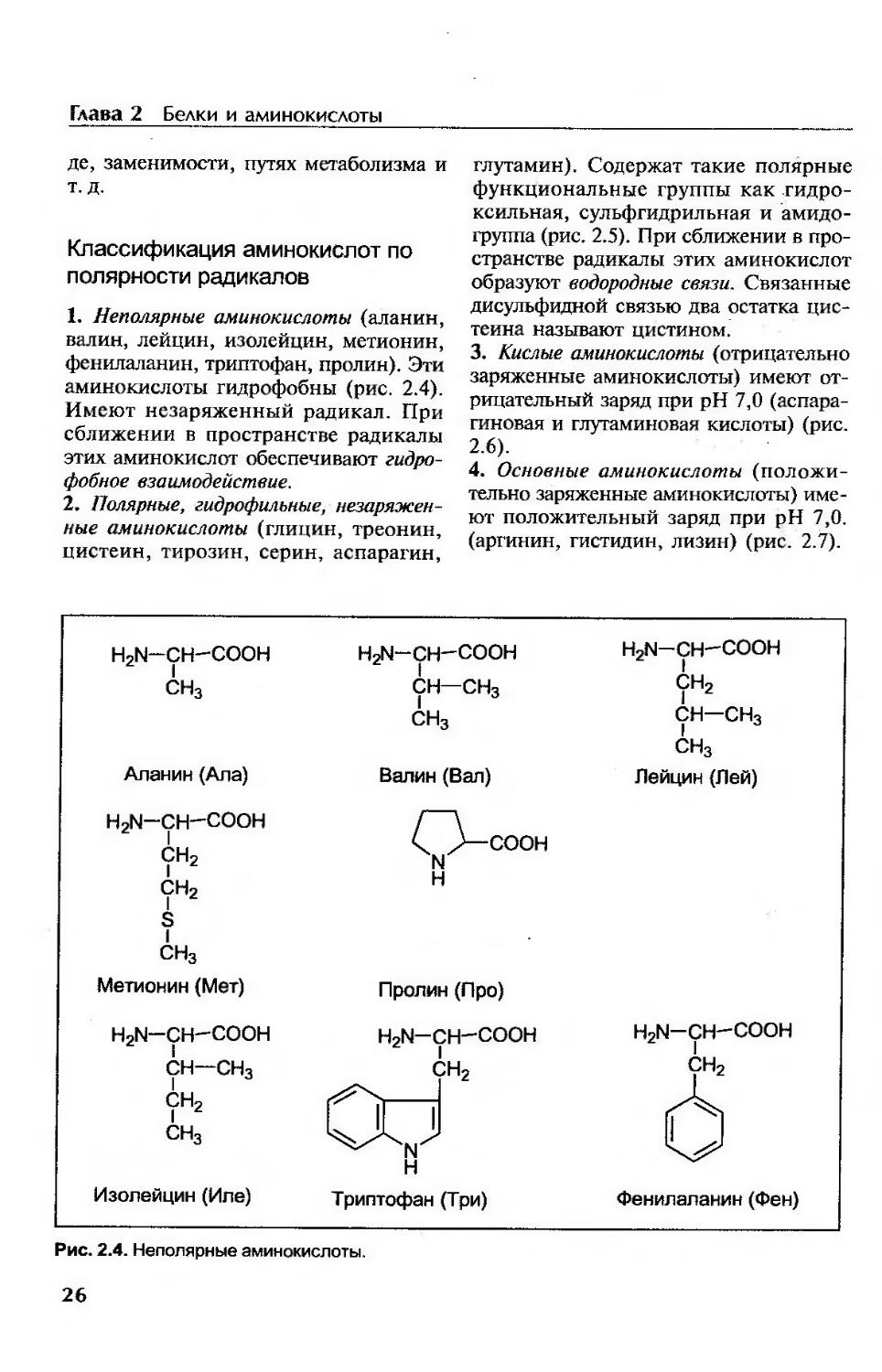
Классификация аминокислот по полярности радикалов.......................26
Классификация по биологической (пищевой) ценности.......................28
Классификация на основе метаболических превращений......................28
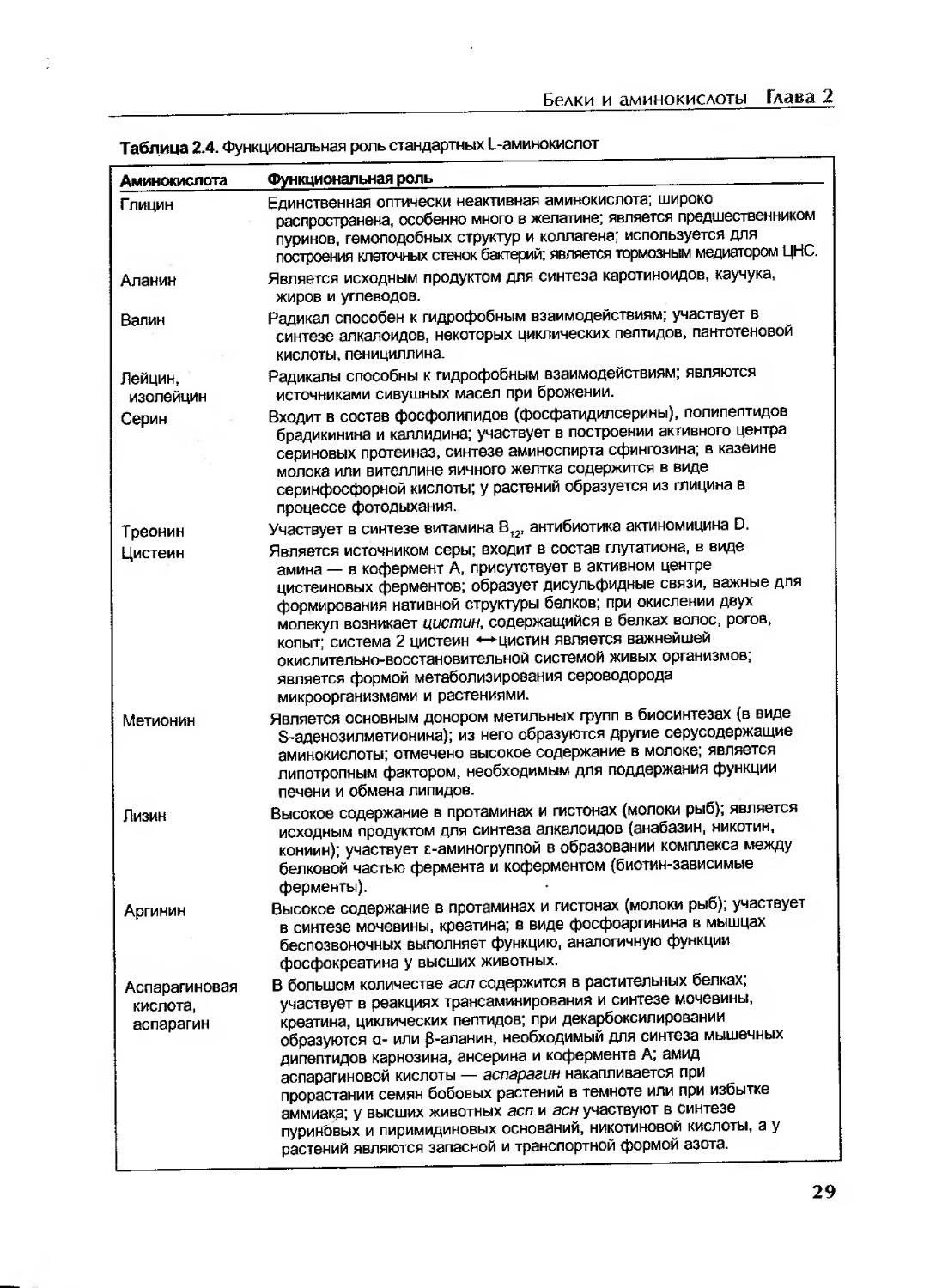
Характеристика отдельных аминокислот....................................28
Аминокислоты — структурные единицы полипептидов.........................30
iii
Содержание
Физико-химические свойства белков...........................................31
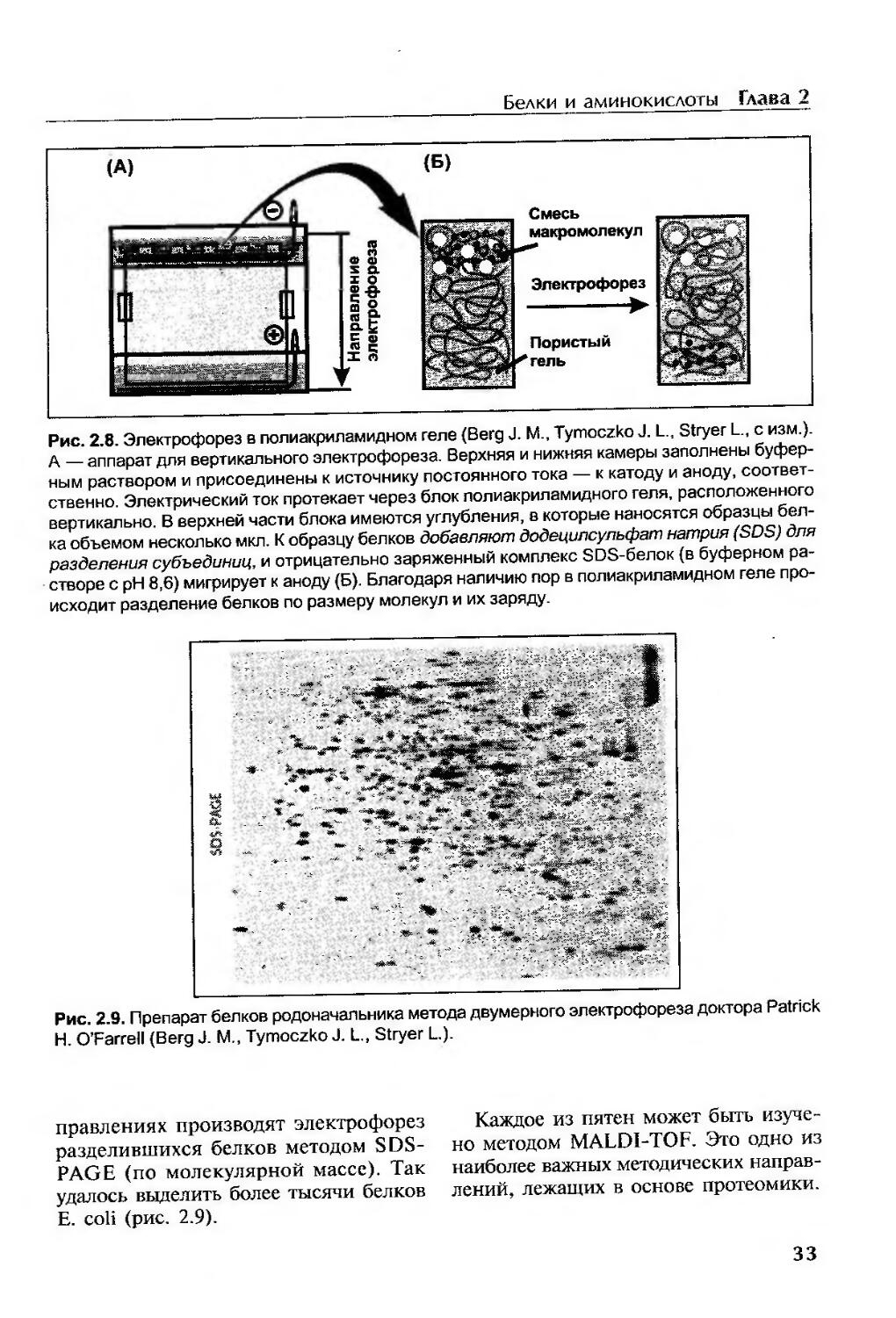
Электрофорез в полиакриламидном геле.....................................32
Глава 3
Структура белковой молекулы.................... .............................34
Первичная структура...................................................... 34
Характеристика пептидной связи..........................................34
Роль первичной структуры................................................34
Биологически важные пептиды.............................................35
Аминокислотный состав белков............................................36
Полиморфизм белков......................................................36
Вторичная структура белка..................................................38
а-Спираль...............................................................38
₽-Структура (|3-складчатый слой)........................................39
Неупорядоченная конформация.............................................42
Над вторичная структура.................................................42
Третичная структура........................................................42
Формирование третичной структуры........................................42
Нативная структура белка................................................43
Денатурация.............................................................44
Факторы, вызывающие денатурацию.........................................44
Четвертичная структура.....................................................44
Взаимосвязь структуры и функции............................................45
Миоглобин...............................................................45
Гемоглобин.................................................................47
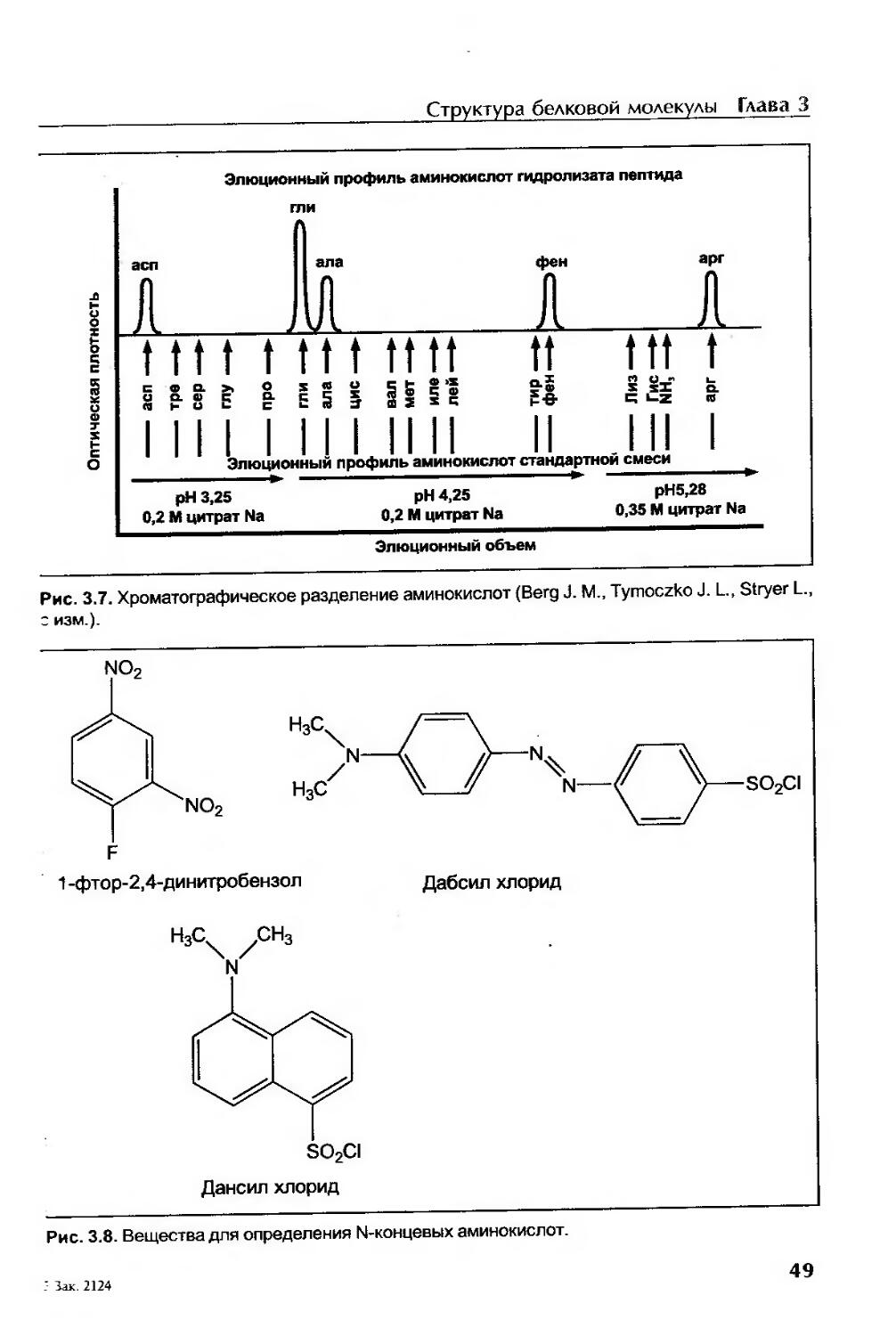
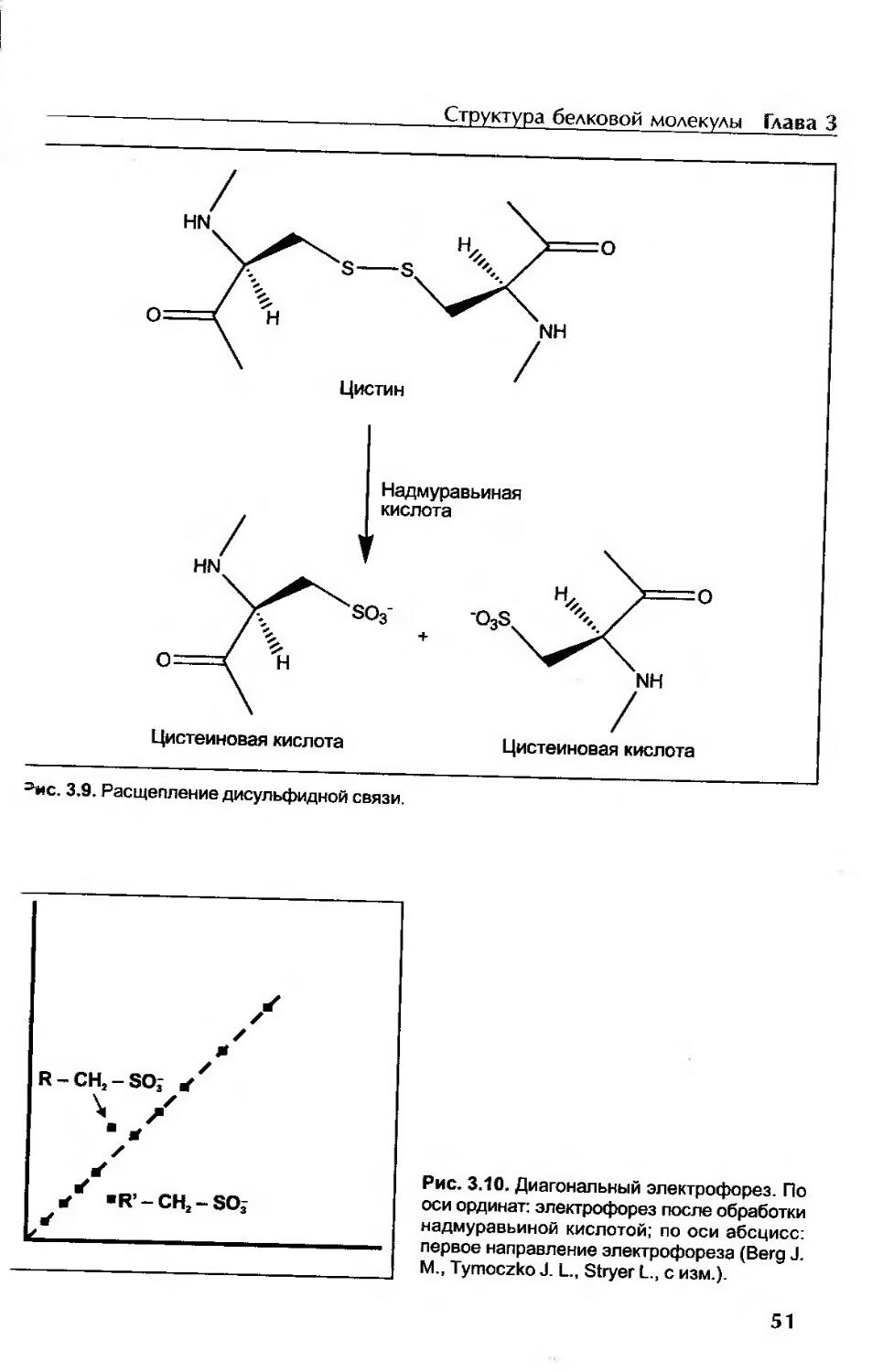
Методы исследования первичной структуры белка............................. 48
Глава 4
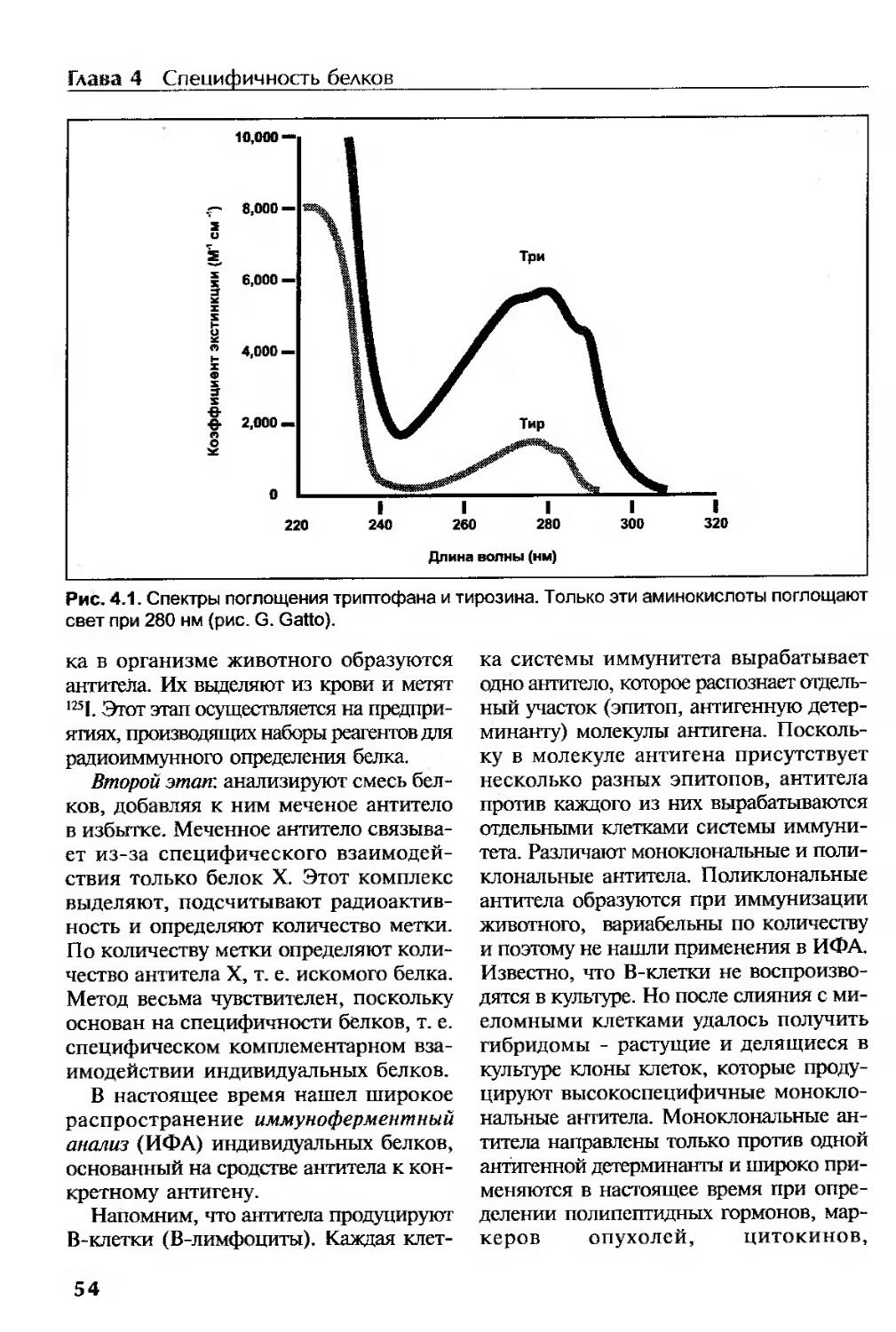
Специфичность белков..........................................................52
Самосборка белков..........................................................53
Количественное определение белков..........................................53
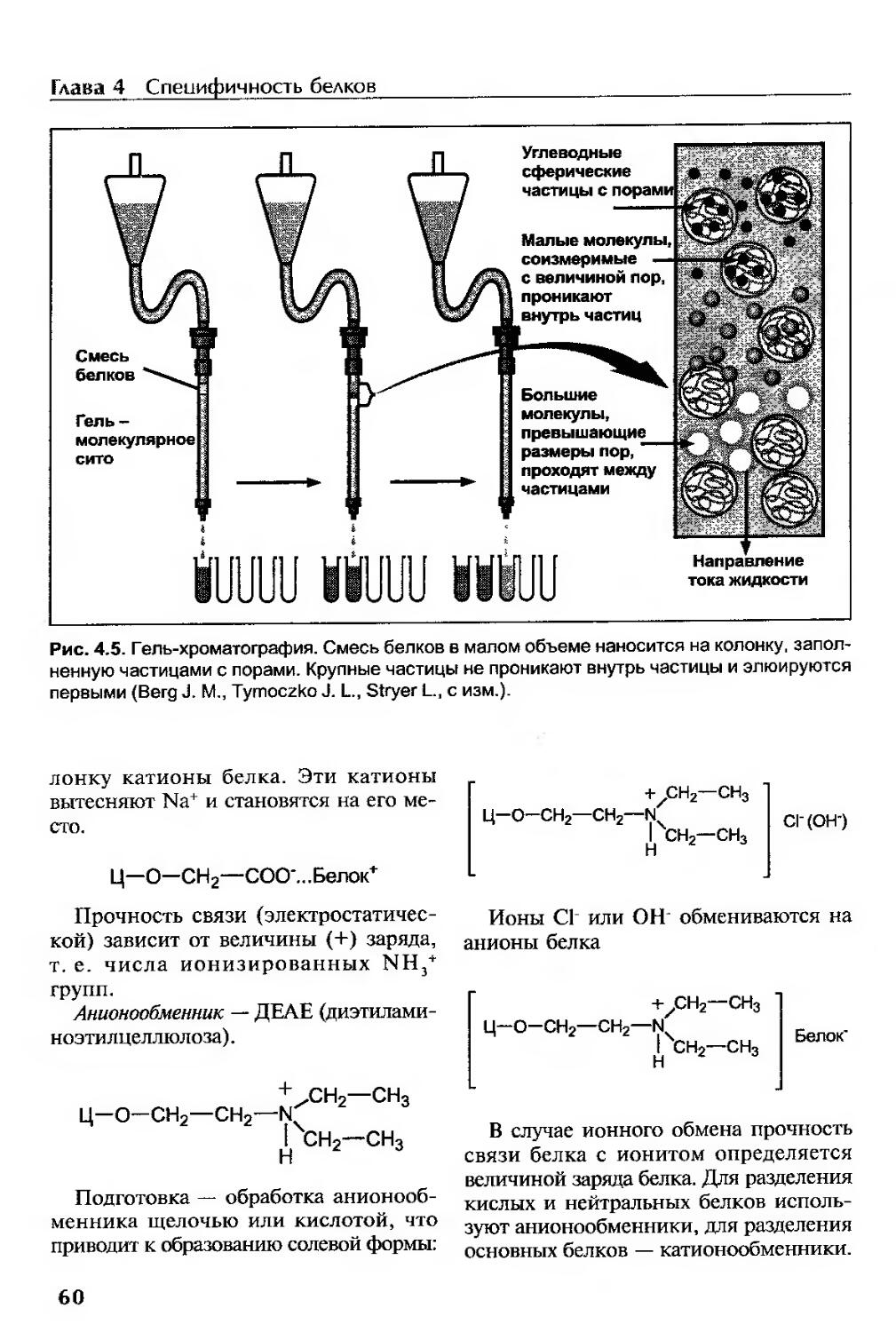
Методы выделения индивидуальных белков.....................................57
Этапы выделения.........................................................57
Протеомика.................................................................62
Глава 5
Ферменты. Кинетика ферментативного катализа................................. 64
Определение и историческая справка.........................................64
Характеристика ферментов...................................................65
Классификация и номенклатура ферментов.....................................66
Структурная организация ферментов..........................................69
Функциональная организация ферментов.......................................70
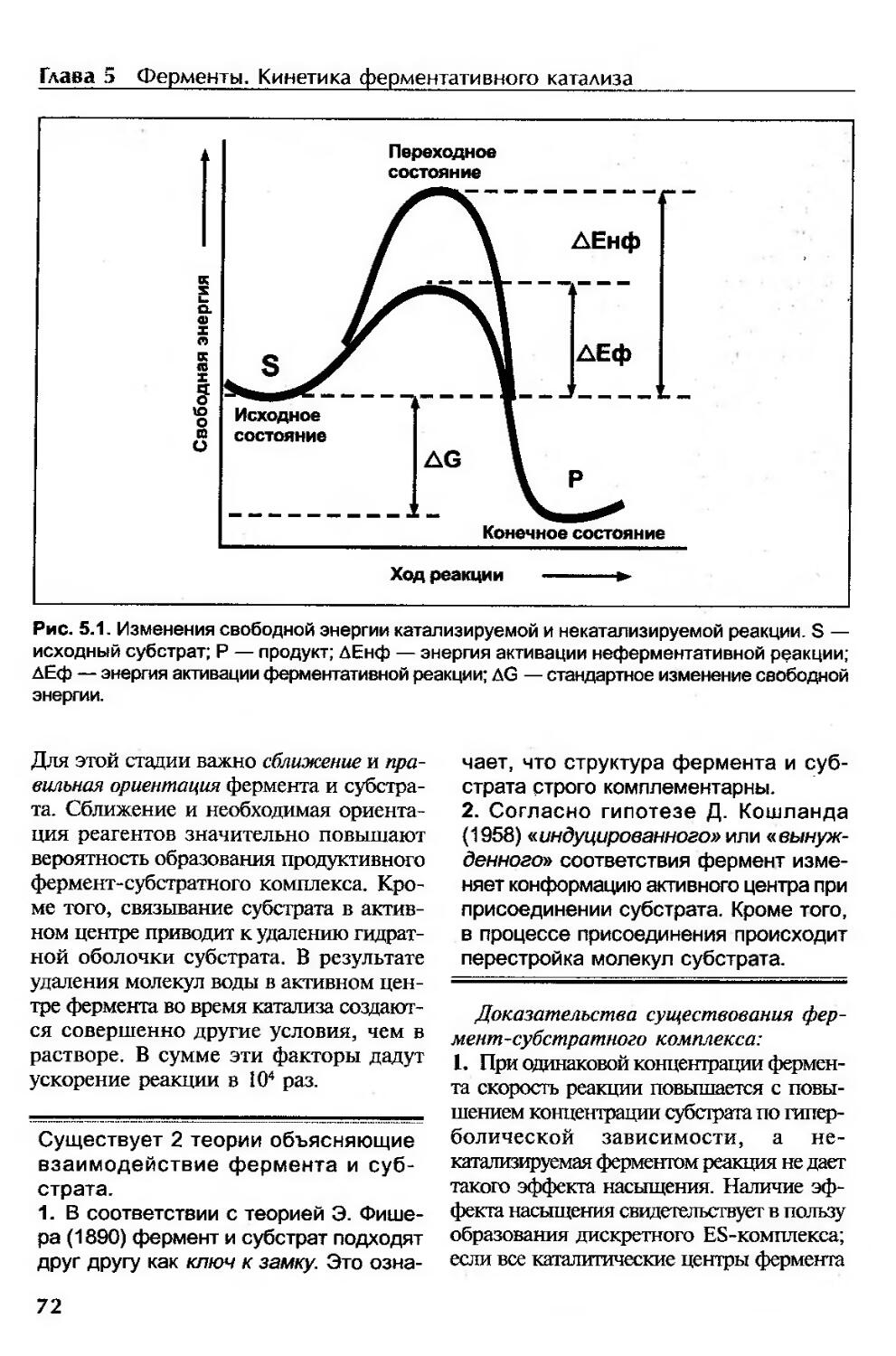
Механизм действия ферментов................................................71
Стадии ферментативного катализа.........................................71
Кинетика ферментативных реакций............................................75
Зависимость скорости реакции от концентрации фермента...................76
Зависимость скорости реакции от концентрации субстрата..................76
Зависимость скорости реакции от pH среды................................78
Зависимость скорости реакции от температуры.............................78
Управляемое изменение свойств ферментов....................................79
IV
Содержание
Глава 6
Регуляция и оценка активности ферментов.................................... .81
Активаторы.................................................................81
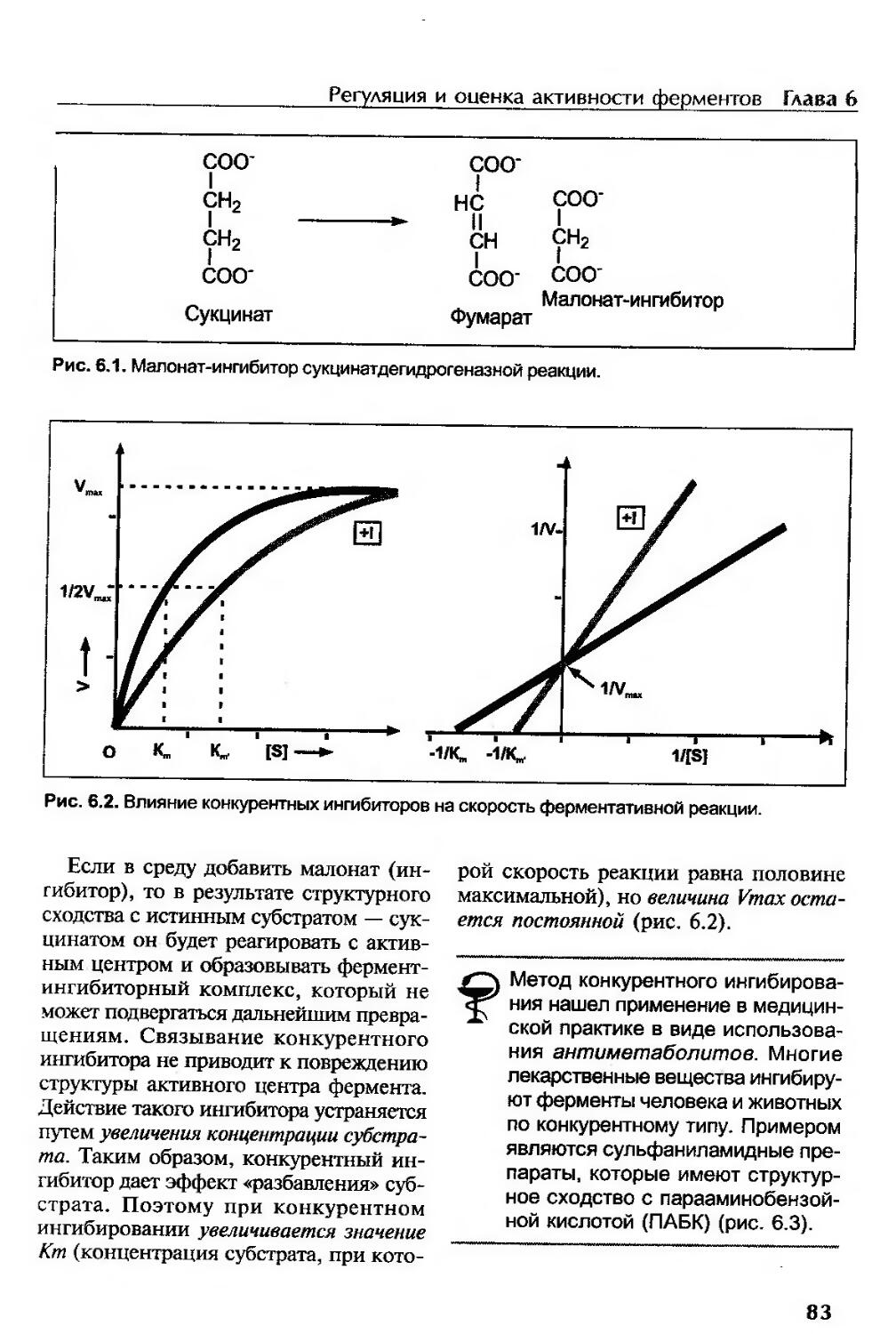
Ингибиторы.................................................................82
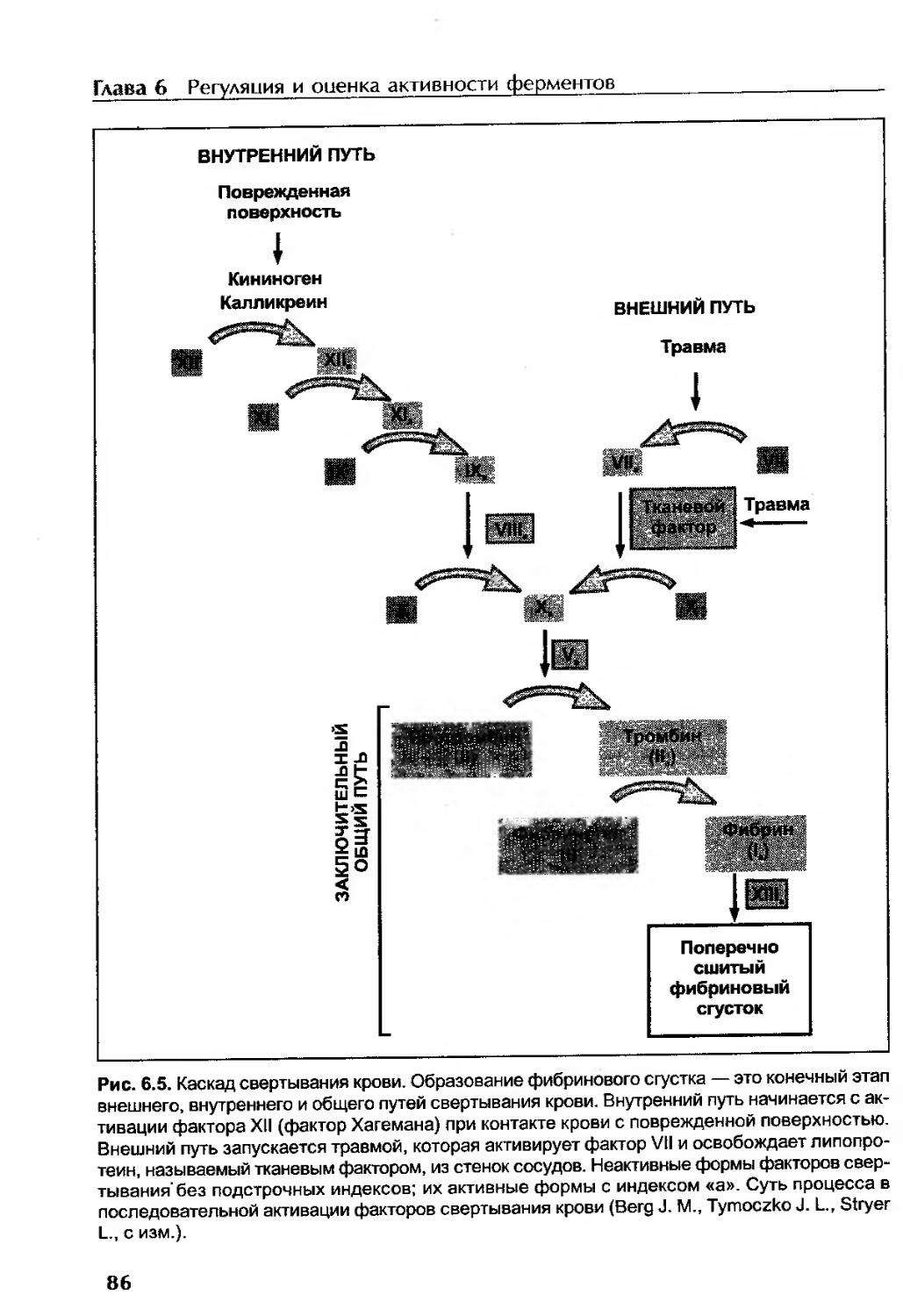
Активация проферментов.....................................................85
Свертывание крови.......................................................85
Химическая (ковалентная) модификация.......................................88
Аллостерическая регуляция..................................................90
Регуляция активности по принципу обратной связи (ретроингибирование).......91
Единицы измерения активности ферментов.....................................91
Применение ферментов.......................................................92
Энзимодиагностика.......................................................92
Наследственные энзимопатии..............................................93
Энзимотерапия...........................................................94
Ферменты как аналитические реагенты.....................................94
Глава 7
Мембраны.................................................................. 95
Функции мембран............................................................95
Структура мембран..........................................................95
Характеристика мембран..................................................95
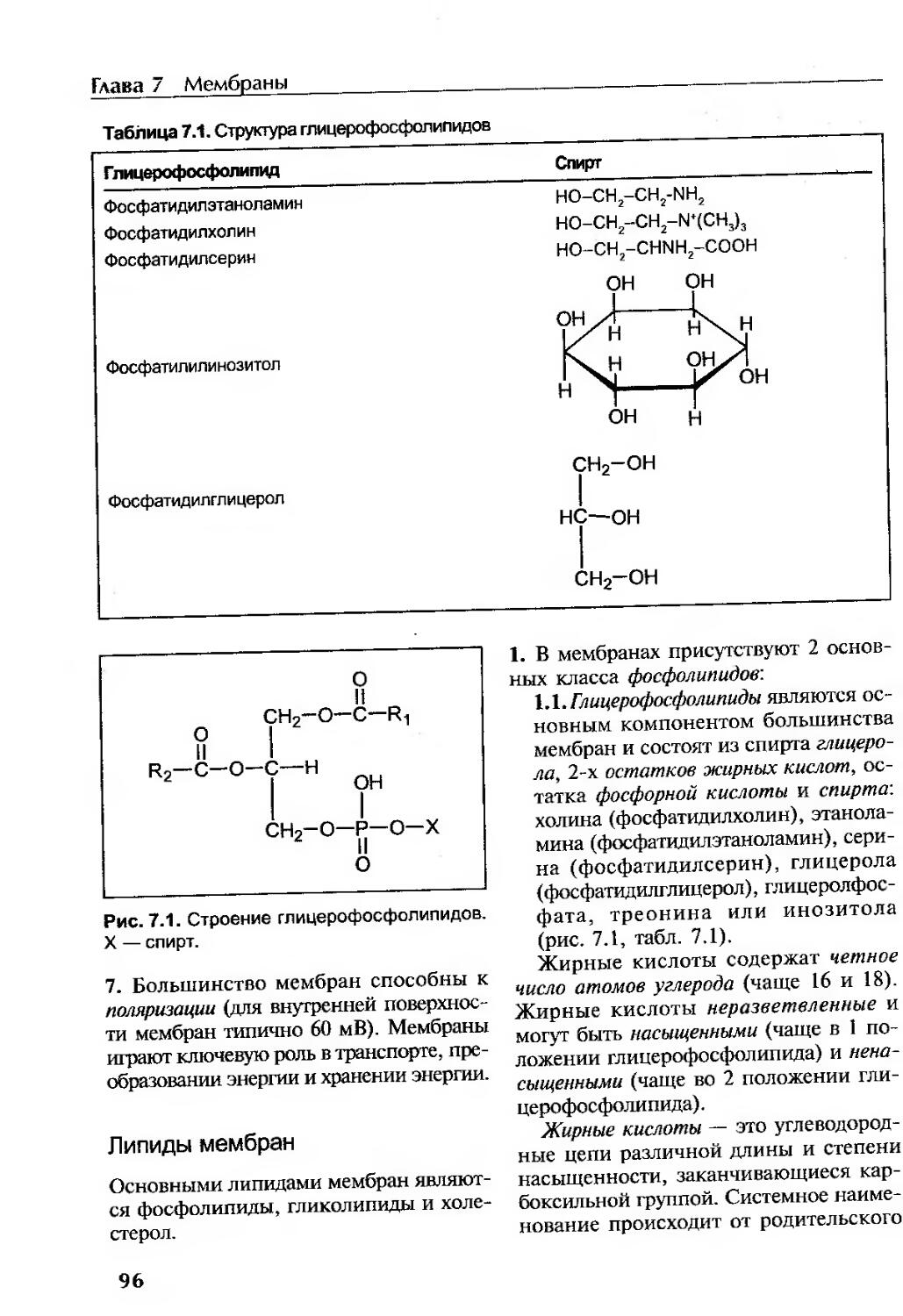
Липиды мембран..........................................................96
Мембрана является амфипатической структурой........................... 98
Липосомы................................................................99
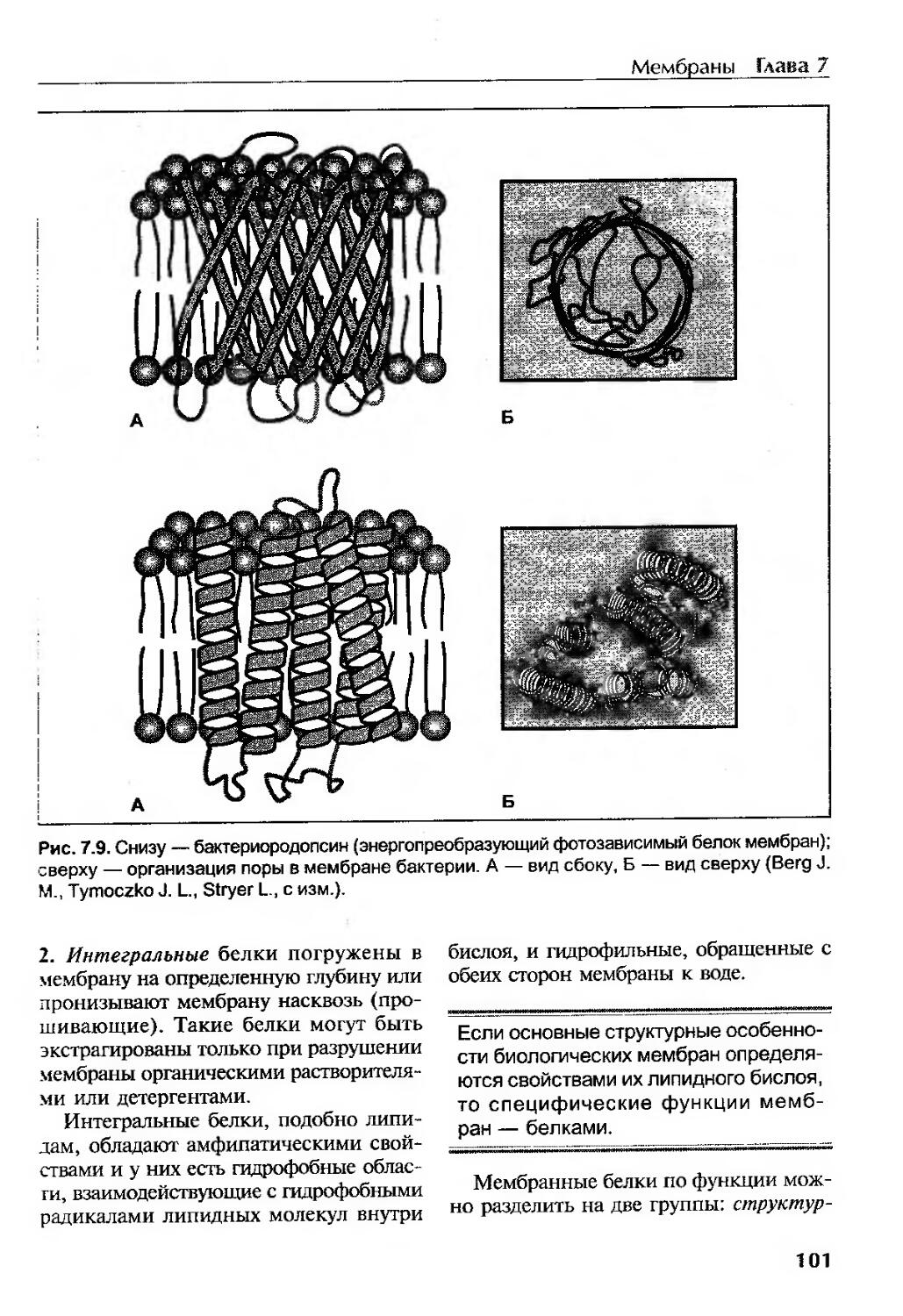
Белки мембран..........................................................100
Углеводы мембран.......................................................103
Свойства мембран.......................................................103
Модели строения мембран...................................................105
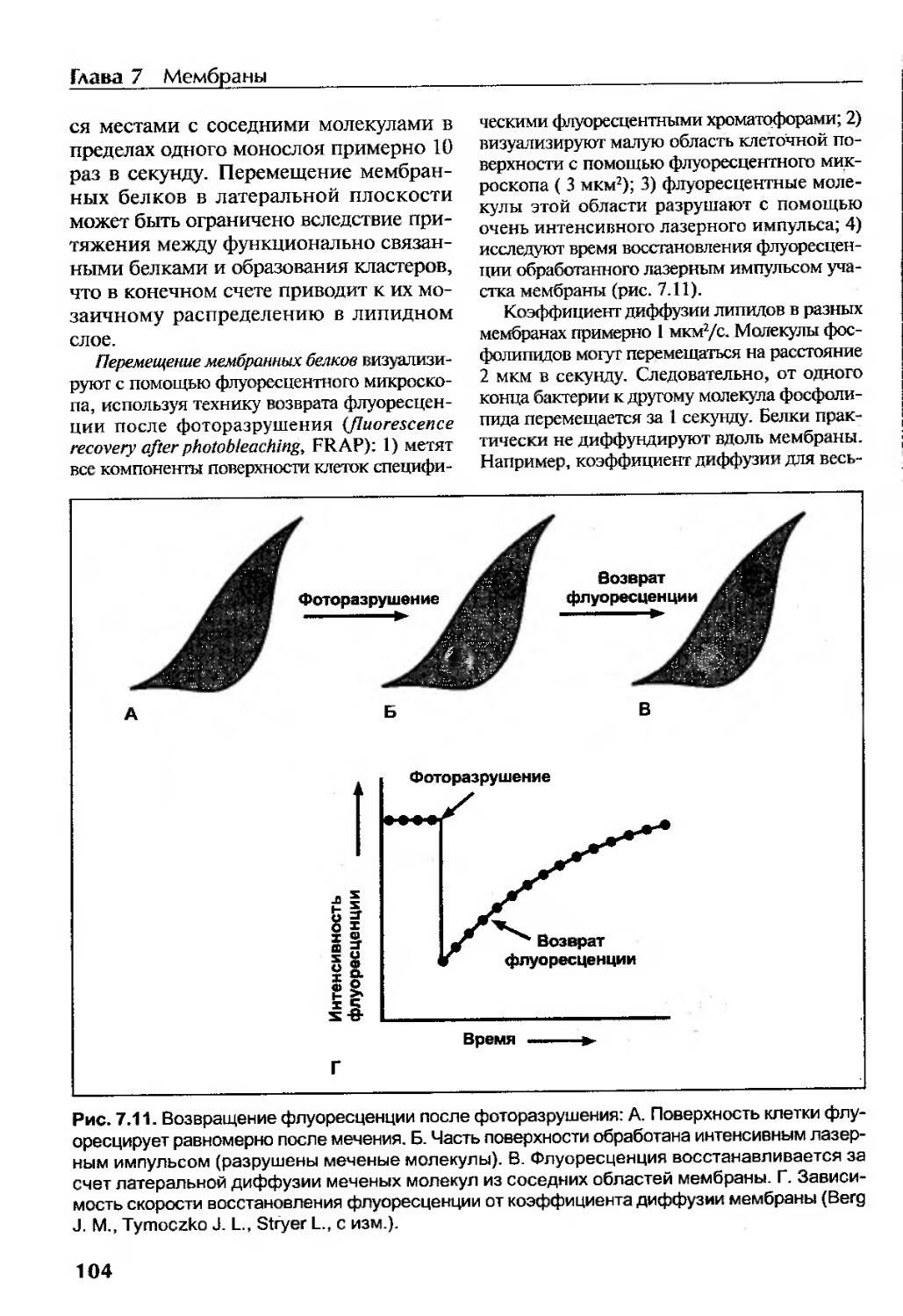
Механизмы мембранного транспорта..........................................106
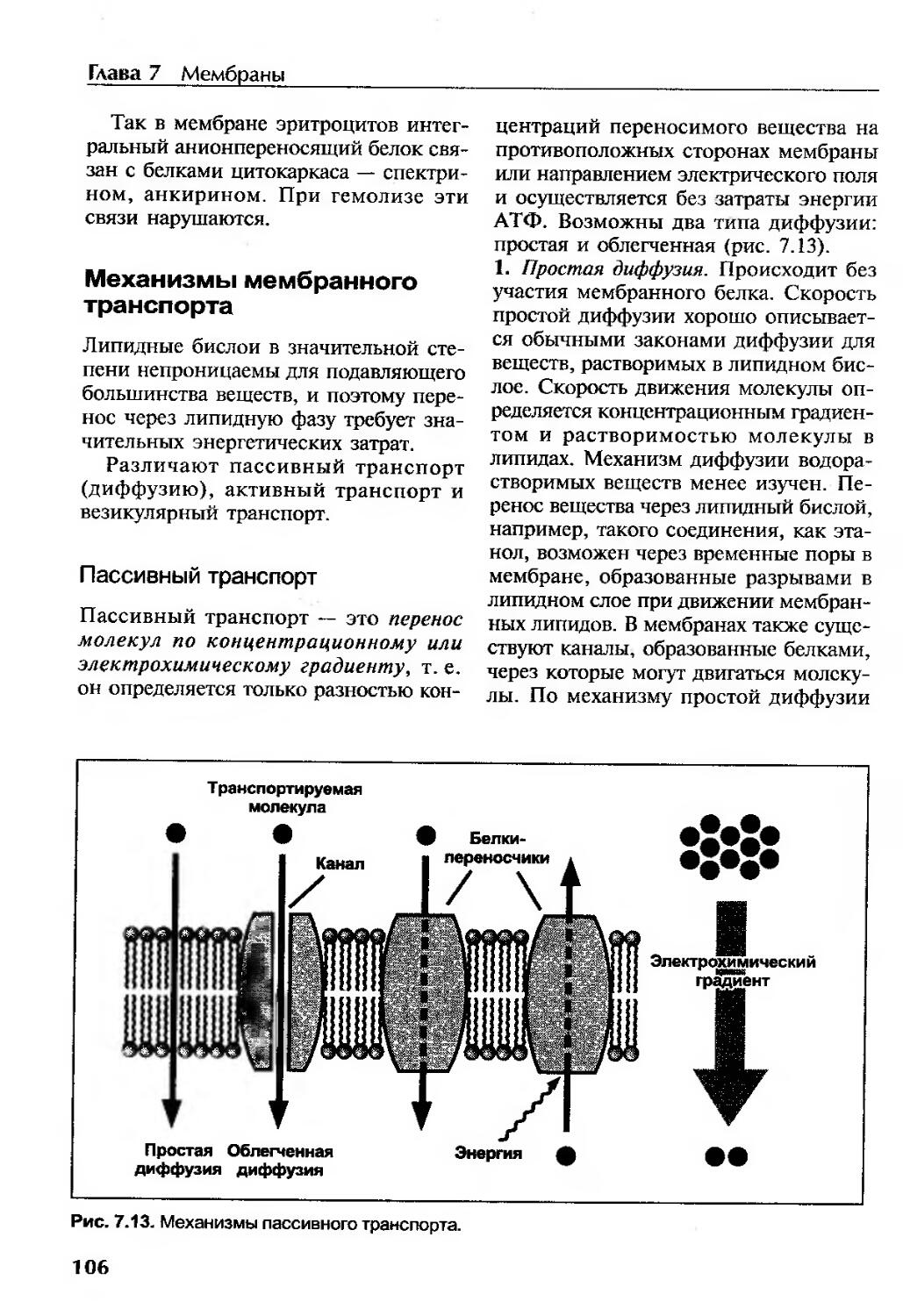
Пассивный транспорт....................................................106
Активный транспорт.....................................................108
Виды переноса веществ через мембраны...................................110
Транспорт макромолекул (везикулярный транспорт)........................111
Состояние мембран и здоровье..............................................111
Мембраны или гели?........................................................112
Глава 8
Введение в обмен веществ и энергии........................................-..114
Функции метаболизма.......................................................114
Регуляция метаболизма................................................... 116
Основные механизмы регуляции метаболизма...............................116
Фазы метаболизма.......................................................117
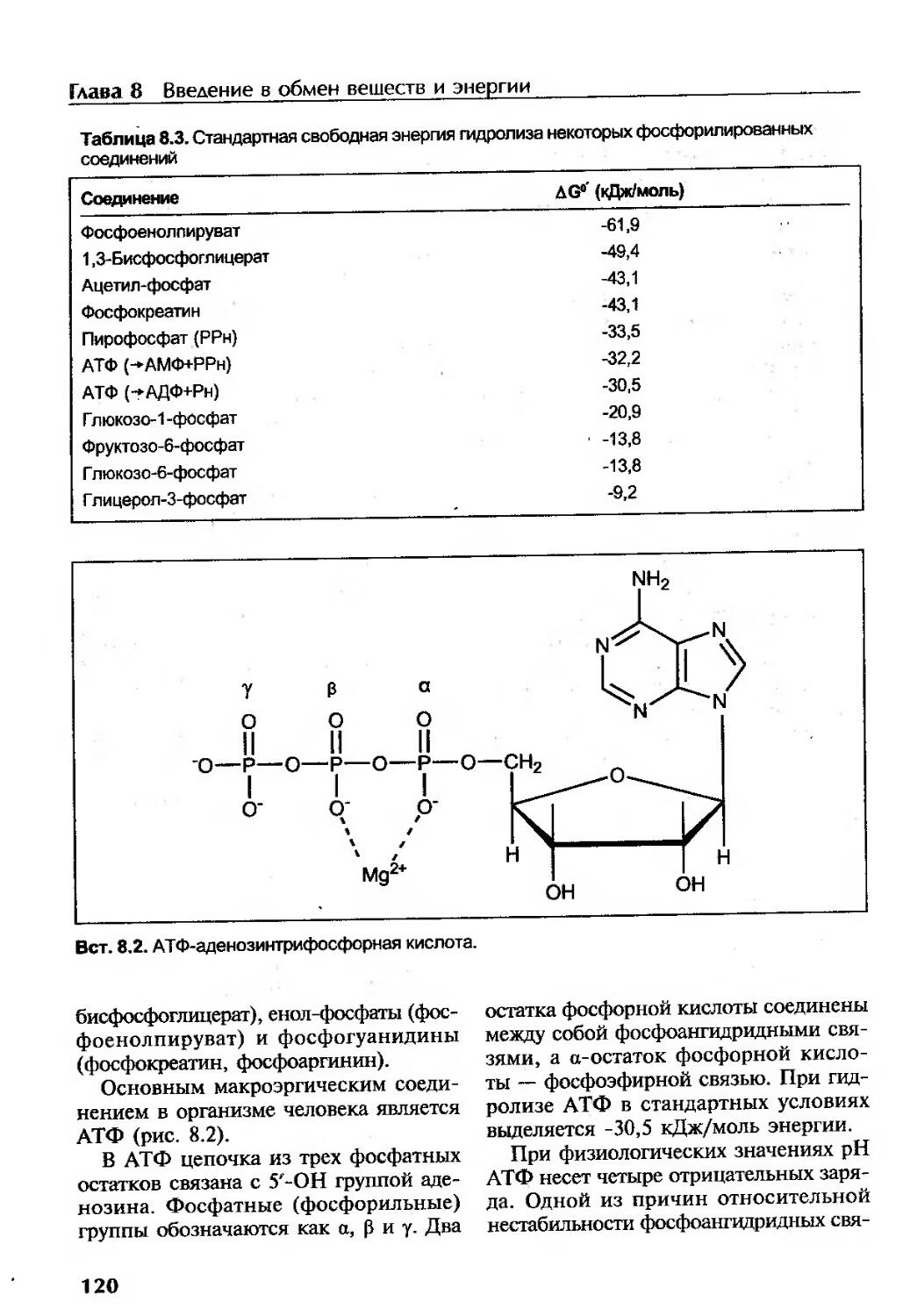
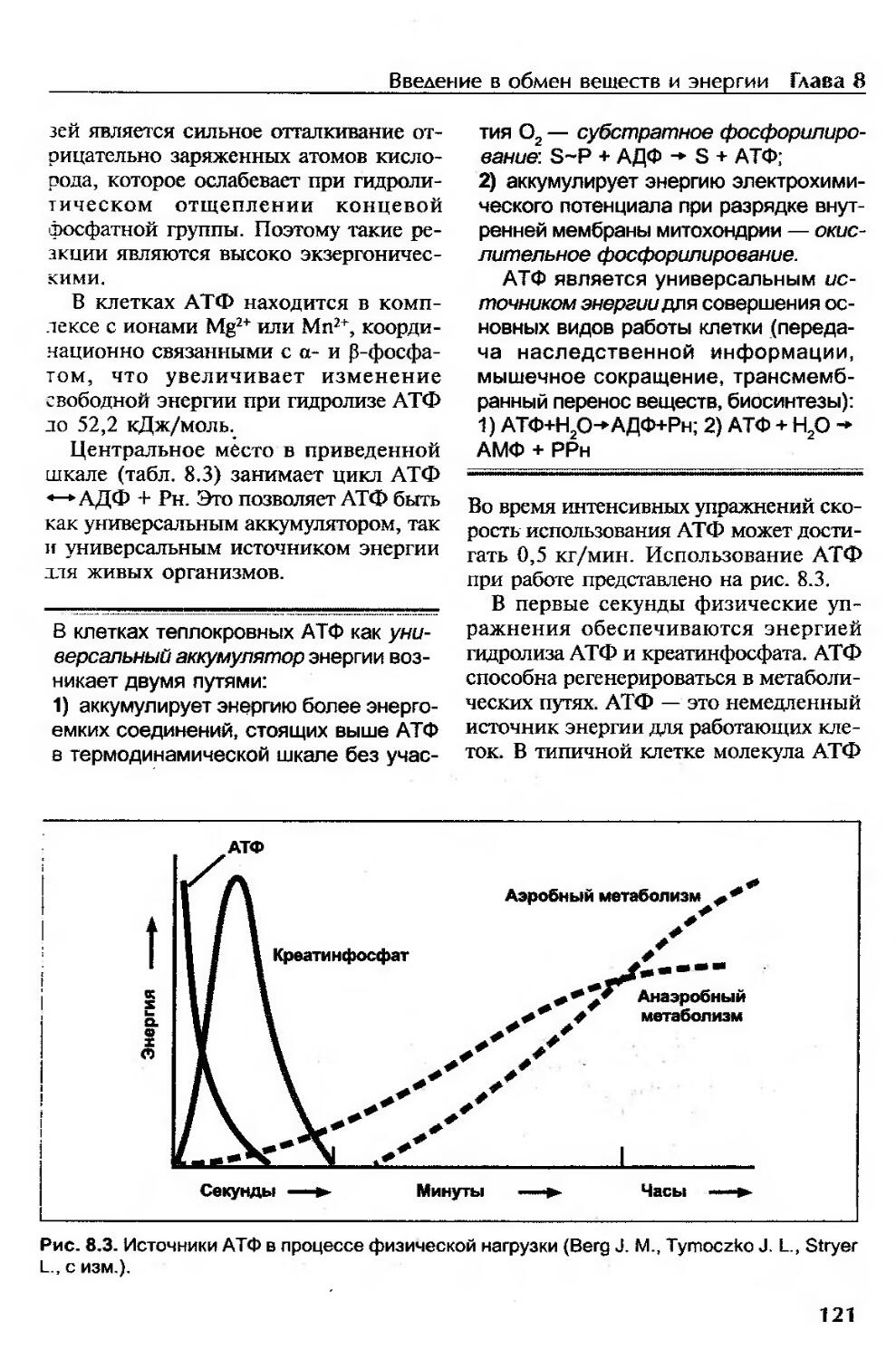
Введение в биоэнергетику..................................................118
Аккумуляторы энергии в организме.......................................119
Фазы извлечения энергии из питательных веществ.........................123
Введение в биохимию питания и пищеварения.................................123
Компоненты пищи........................................................123
Переваривание пищи.....................................................124
Регуляция пищеварения..................................................124
Всасывание продуктов пищеварения.......................................125
Запасание и распределение пищевых молекул.................................125
v
Содержание
Глава 9 Биологическое окисление. Цепь переноса электронов................................127
Пути потребления кислорода (биологическое окисление)..........................127
Строение митохондрий..........................................................129
Компоненты дыхательной цепи...................................................131
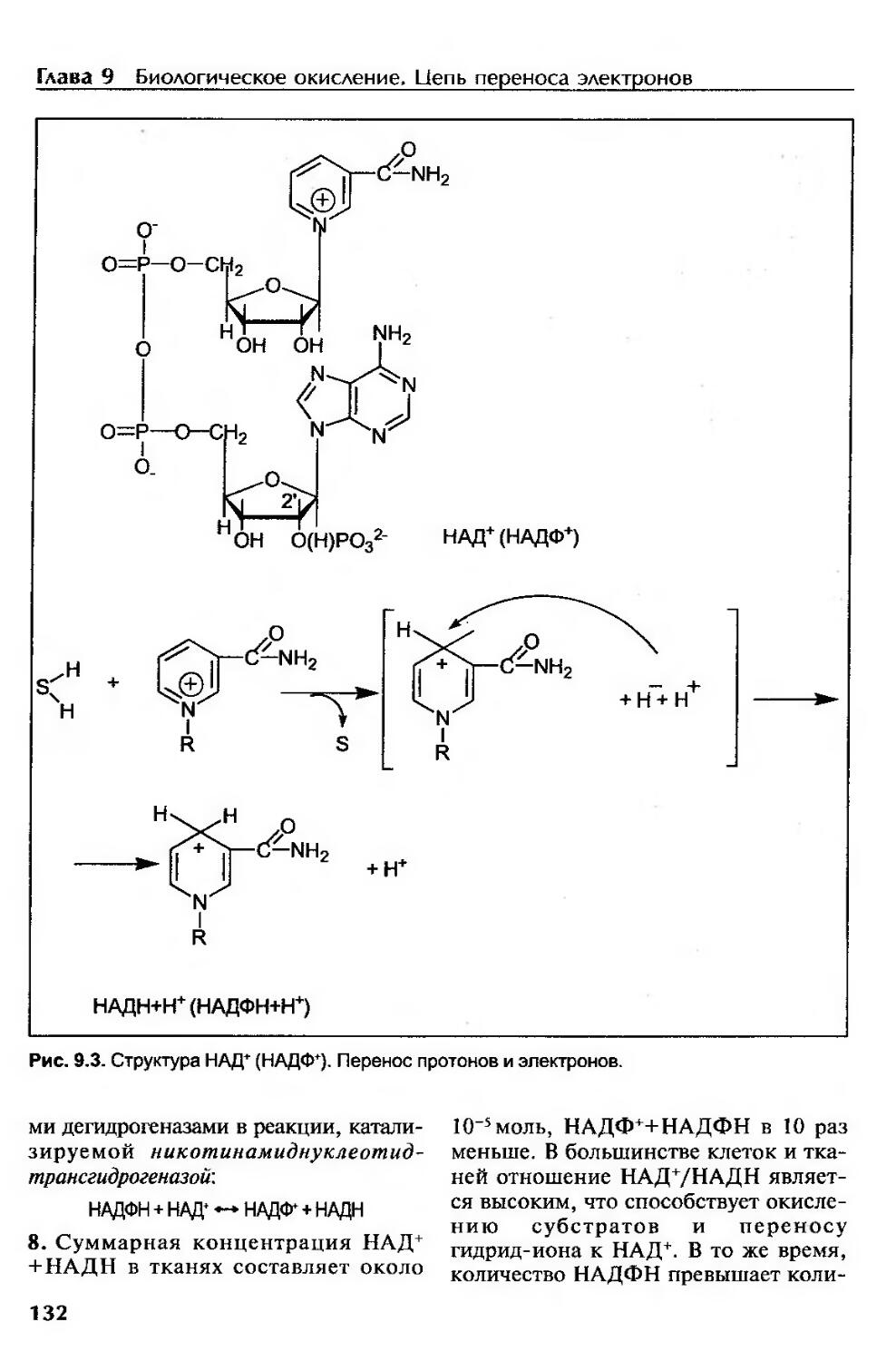
Пиридинзависимые дегидрогеназы.............................................131
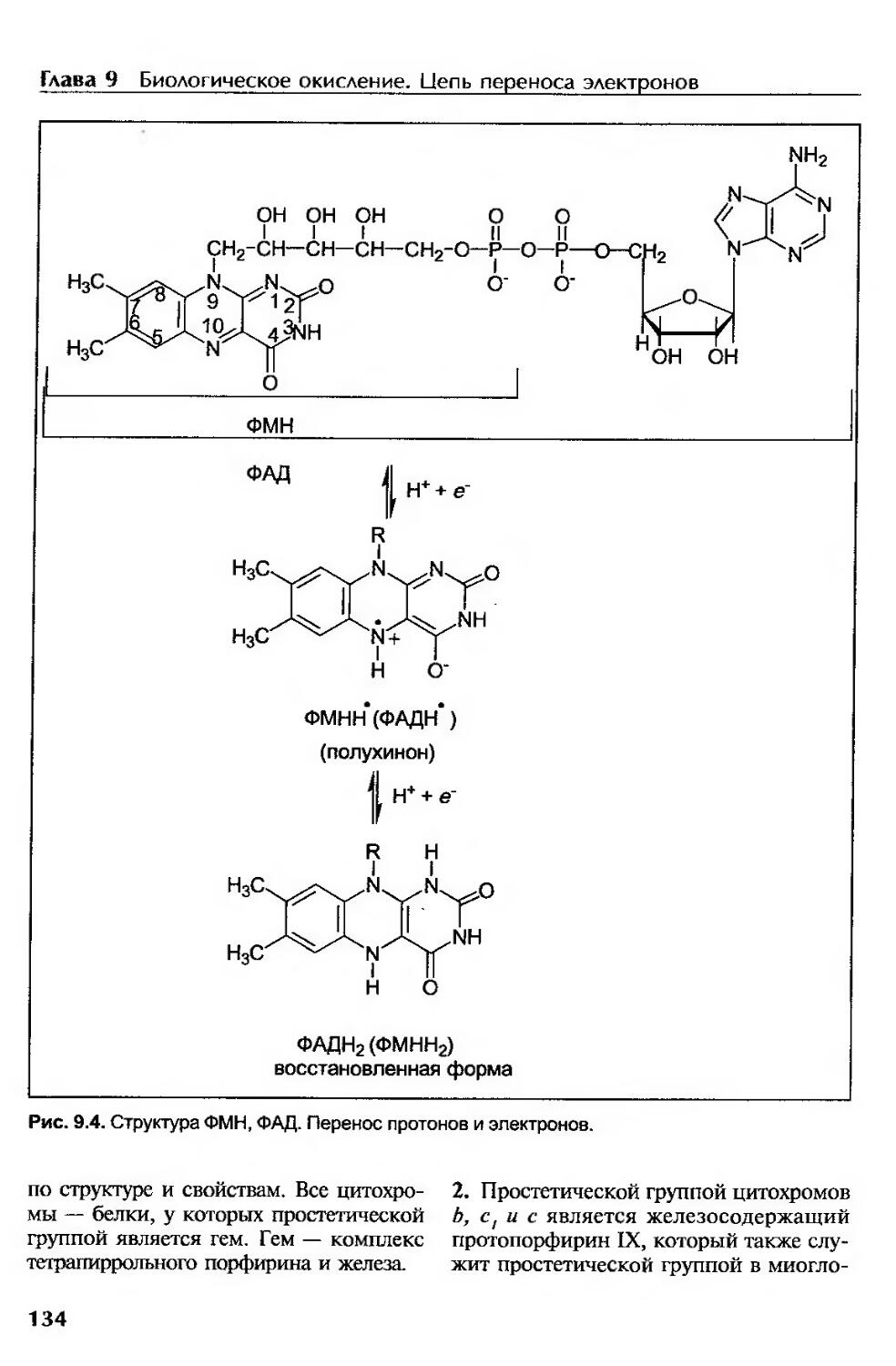
Флавиновые ферменты (флавопротеины)........................................133
Убихинон (кофермент Q).....................................................133
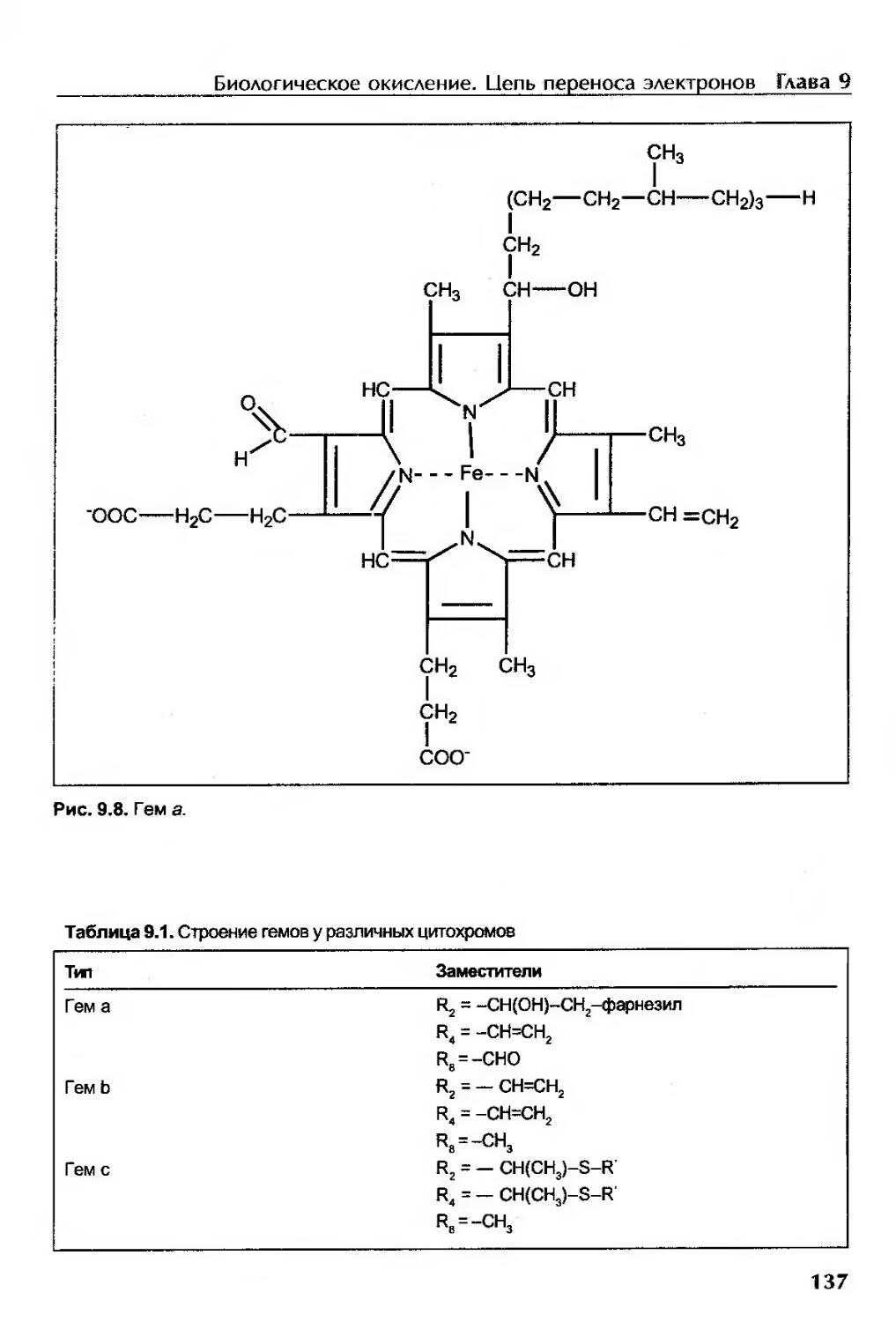
Цитохромы..................................................................133
Железо-серные (FeS) белки..................................................138
Организация цепи переноса электронов..........................................138
Комплекс I (НАДН-дегидрогеназа)............................................139
Комплекс II (сукцинатдегидрогеназа)........................................140
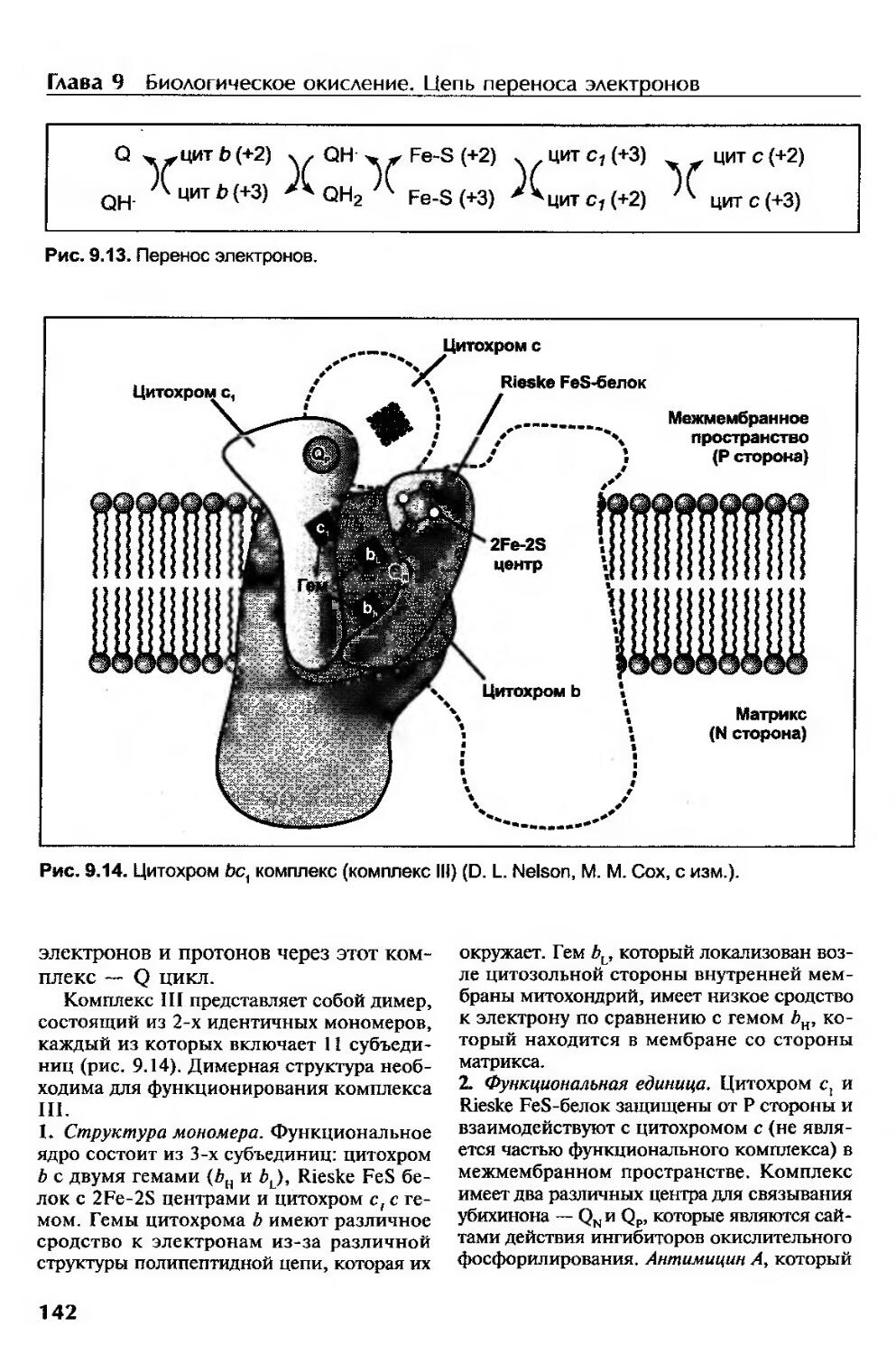
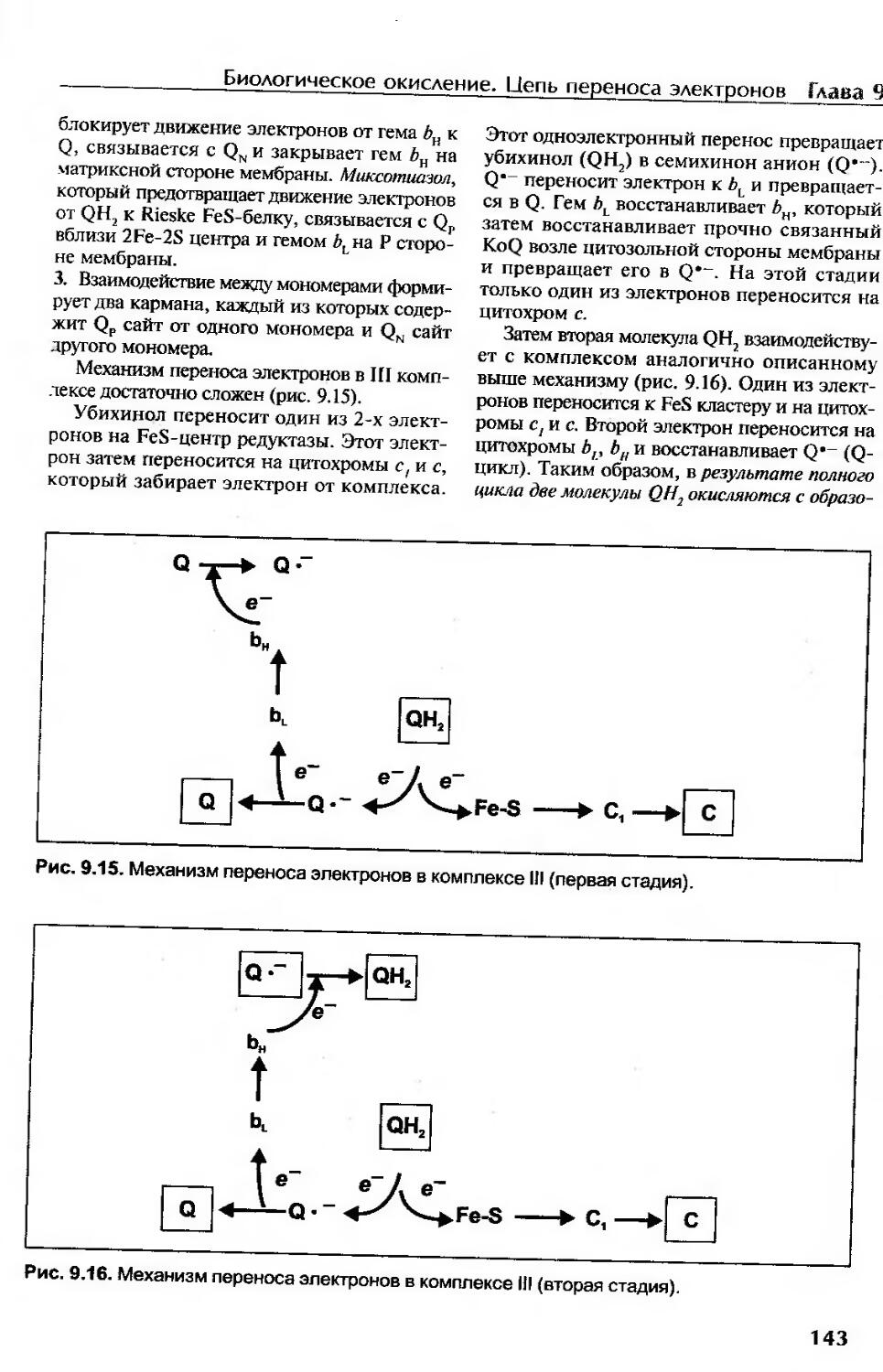
Комплекс III (цитохром Ьс1 комплекс, убихинон: цитохром с-оксидоредуктаза).141
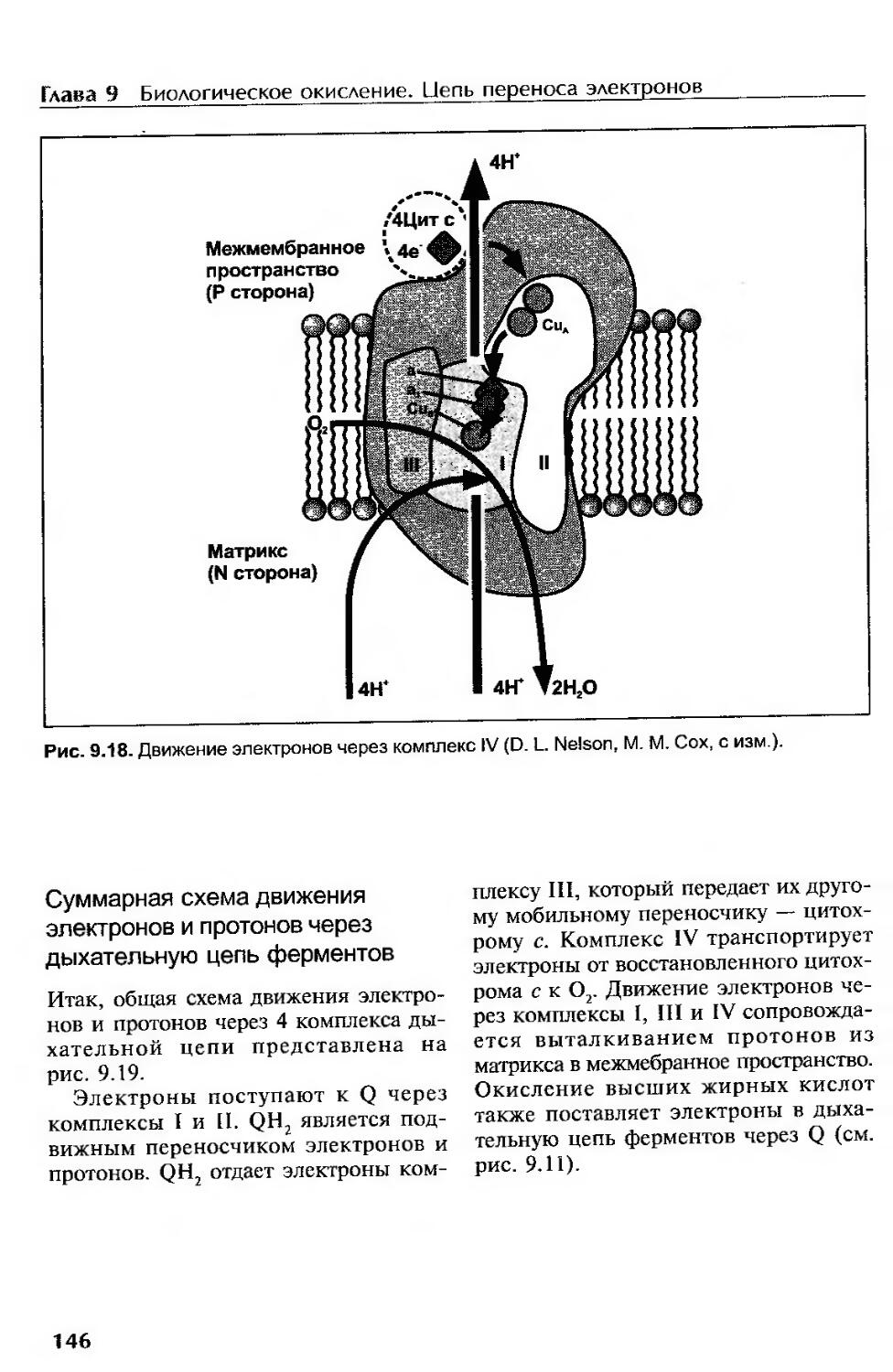
Комплекс IV (цитохром с-оксидаза, цитохромоксидаза)........................144
Суммарная схема движения электронов и протонов через дыхательную цепь ферментов.............................146
Глава 10
Окислительное фосфорилирование...................................................148
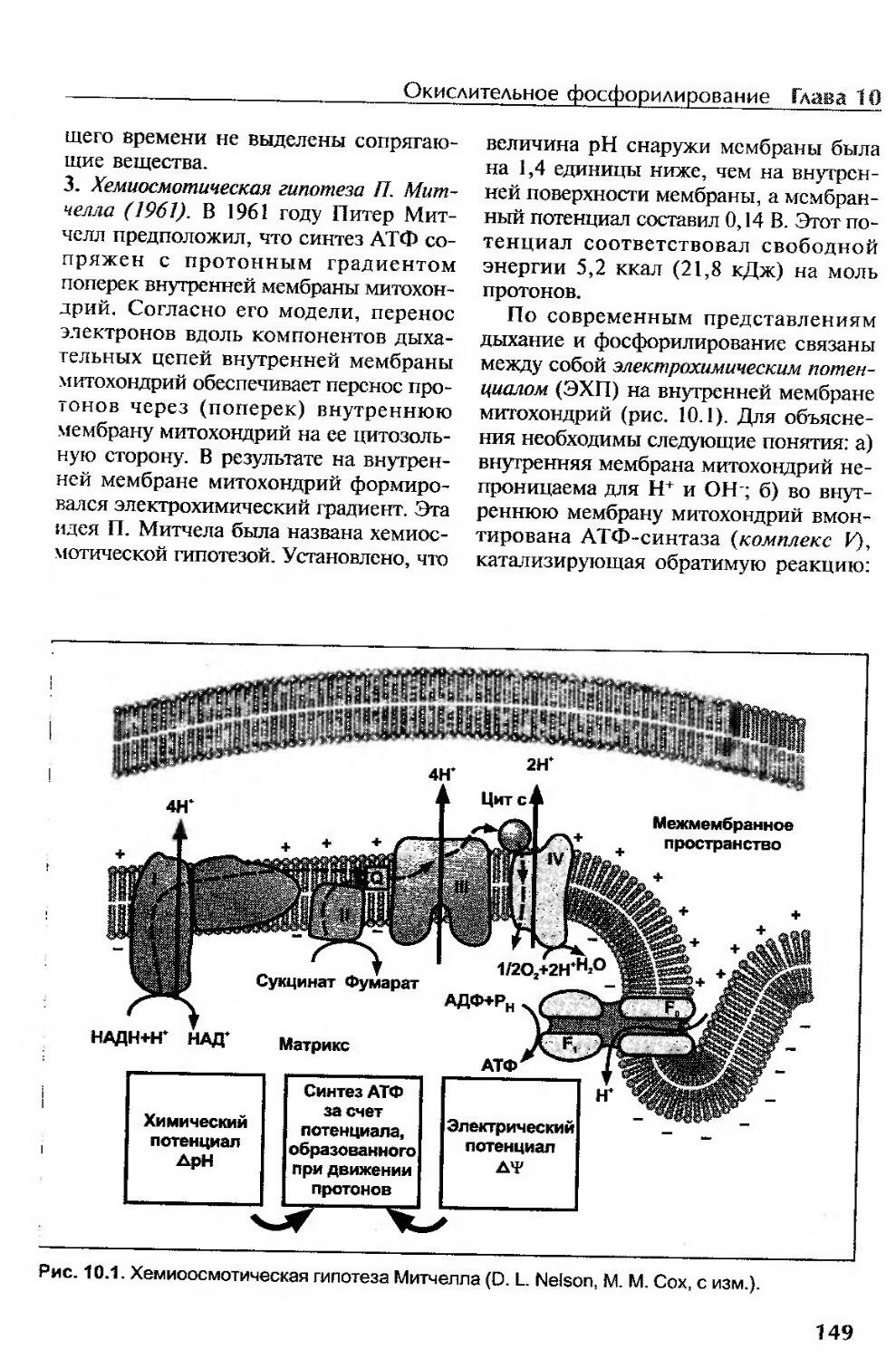
Определение окислительного фосфорилирования...................................148
Механизм окислительного фосфорилирования......................................148
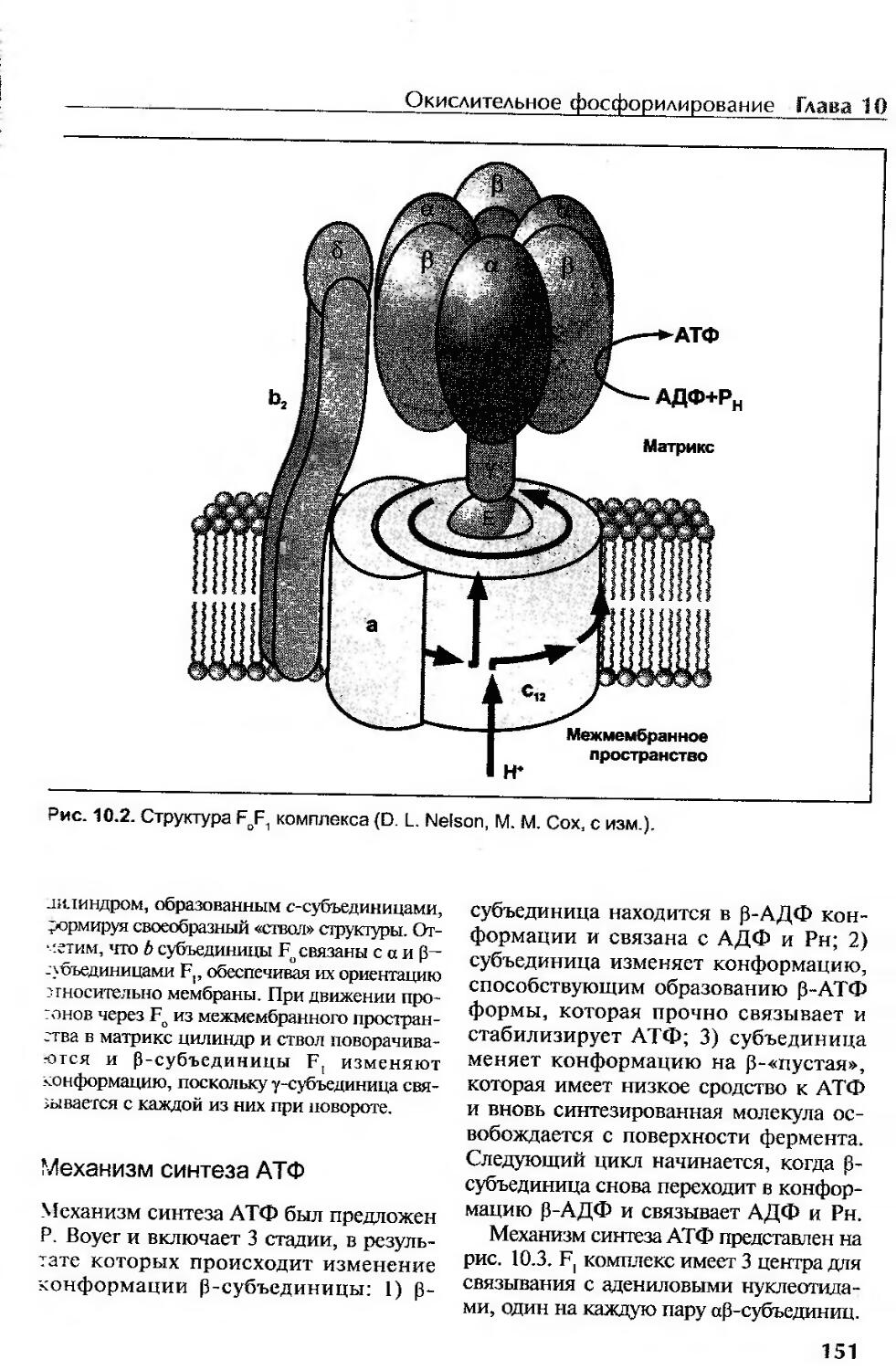
Структура АТФ-синтазы......................................................150
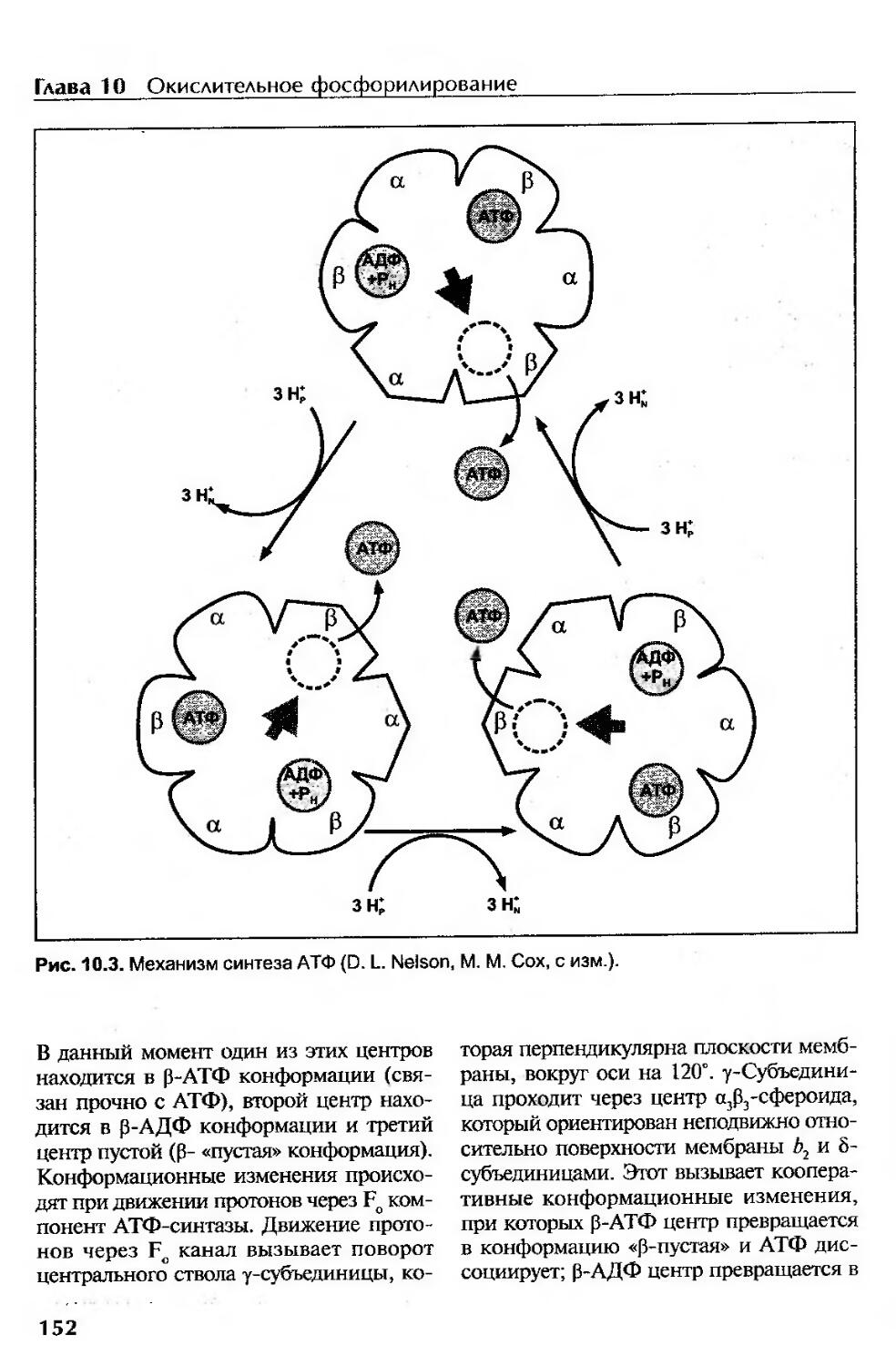
Механизм синтеза АТФ.......................................................151
Роль протонного градиента в активном транспорте............................153
Количественная оценка окислительного фосфорилирования......................153
Дыхательный контроль и нарушения клеточного дыхания...........................154
Ингибиторы дыхания.........................................................154
Разобщение дыхания и окислительного фосфорирования.........................155
Гипоэнергетические состояния...............................................155
Окислительные системы, не связанные с запасанием энергии......................156
Пероксидазный путь.........................................................156
Оксигеназный путь..........................................................157
Диоксигеназный путь........................................................158
Свободно-радикальное окисление.............................................158
Антиоксидантная защита.....................................................160
Редокс-потенциал............................................................ 160
Активные формы кислорода......................................................162
Антиокислительная система клеток..............................................164
Окислительный и восстановительный стресс......................................164
Глава 11
Общий путь катаболизма...........................................................166
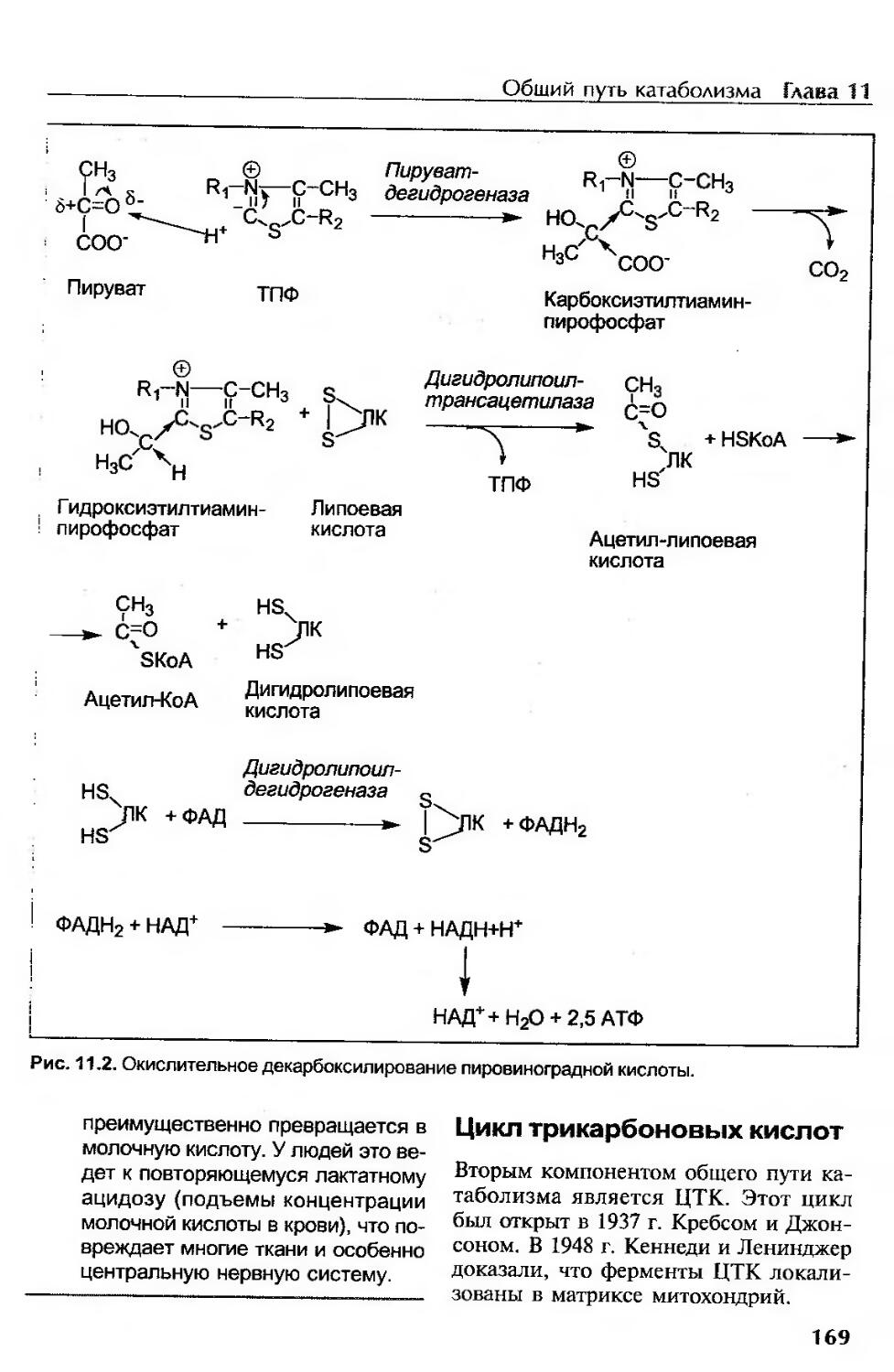
Окислительное декарбоксилирование пировиноградной кислоты.....................166
Механизм окислительного декарбоксилирования пирувата.......................167
Регуляция пируватдегидрогеназного комплекса................................167
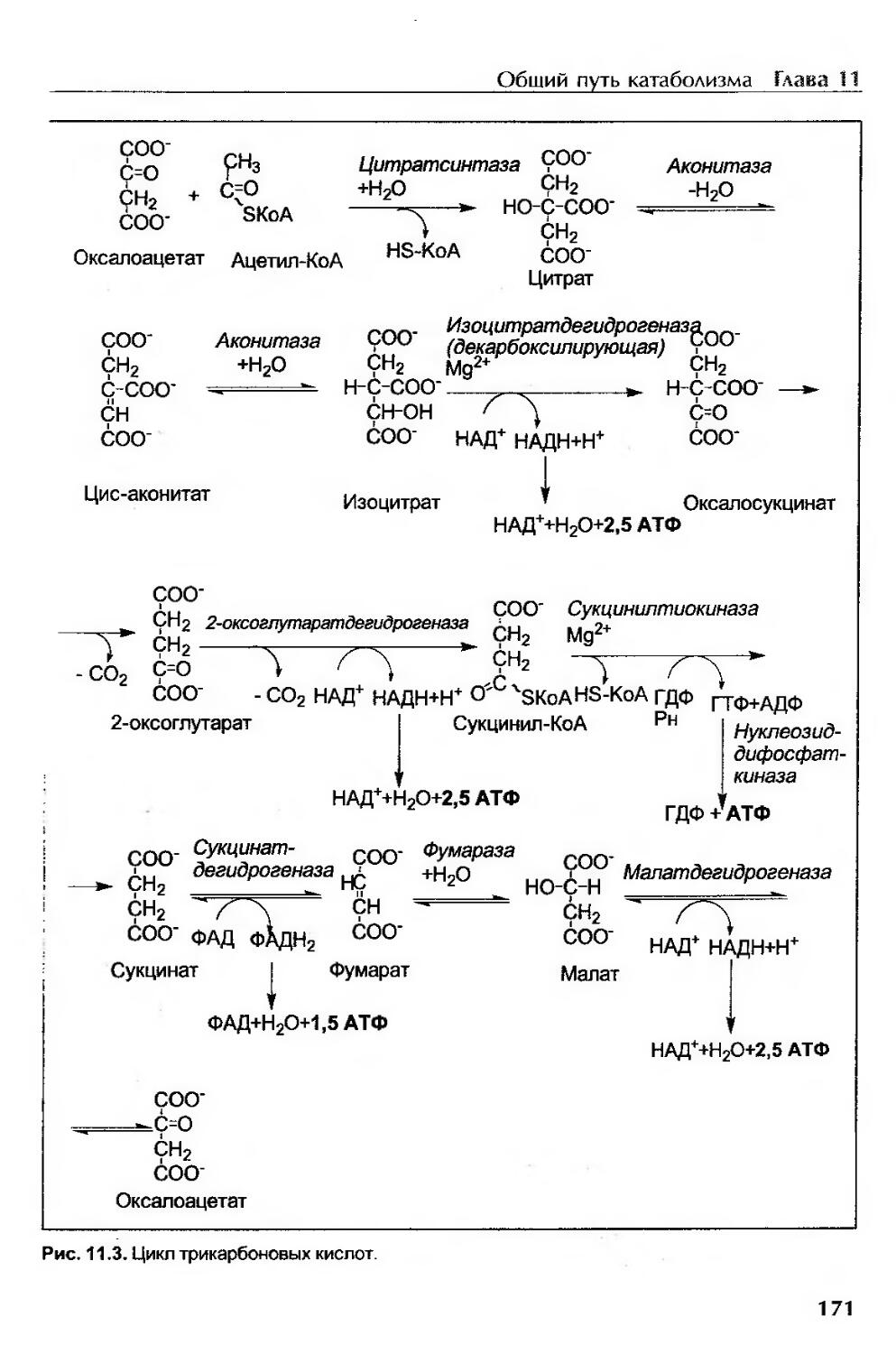
Цикл трикарбоновых кислот.....................................................169
Химизм цикла трикарбоновых кислот..........................................170
Биологическое значение и регуляция цикла трикарбоновых кислот..............170
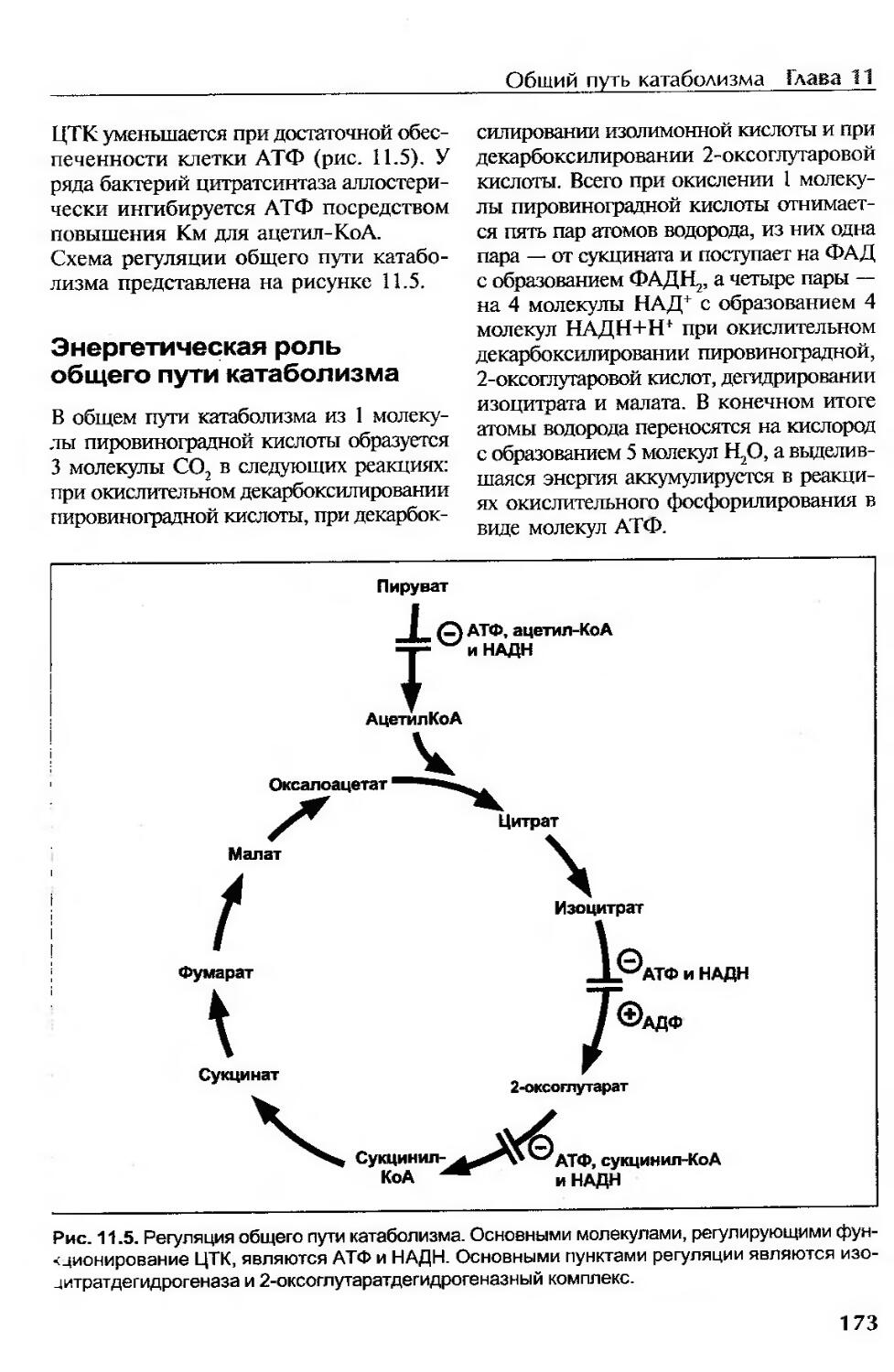
Энергетическая роль общего пути катаболизма...................................173
Амфиболическая функция........................................................174
Роль витаминов в регуляции общего пути катаболизма............................176
VI
Содержание
Глиоксилатный цикл........................................................ 176
"лава 12
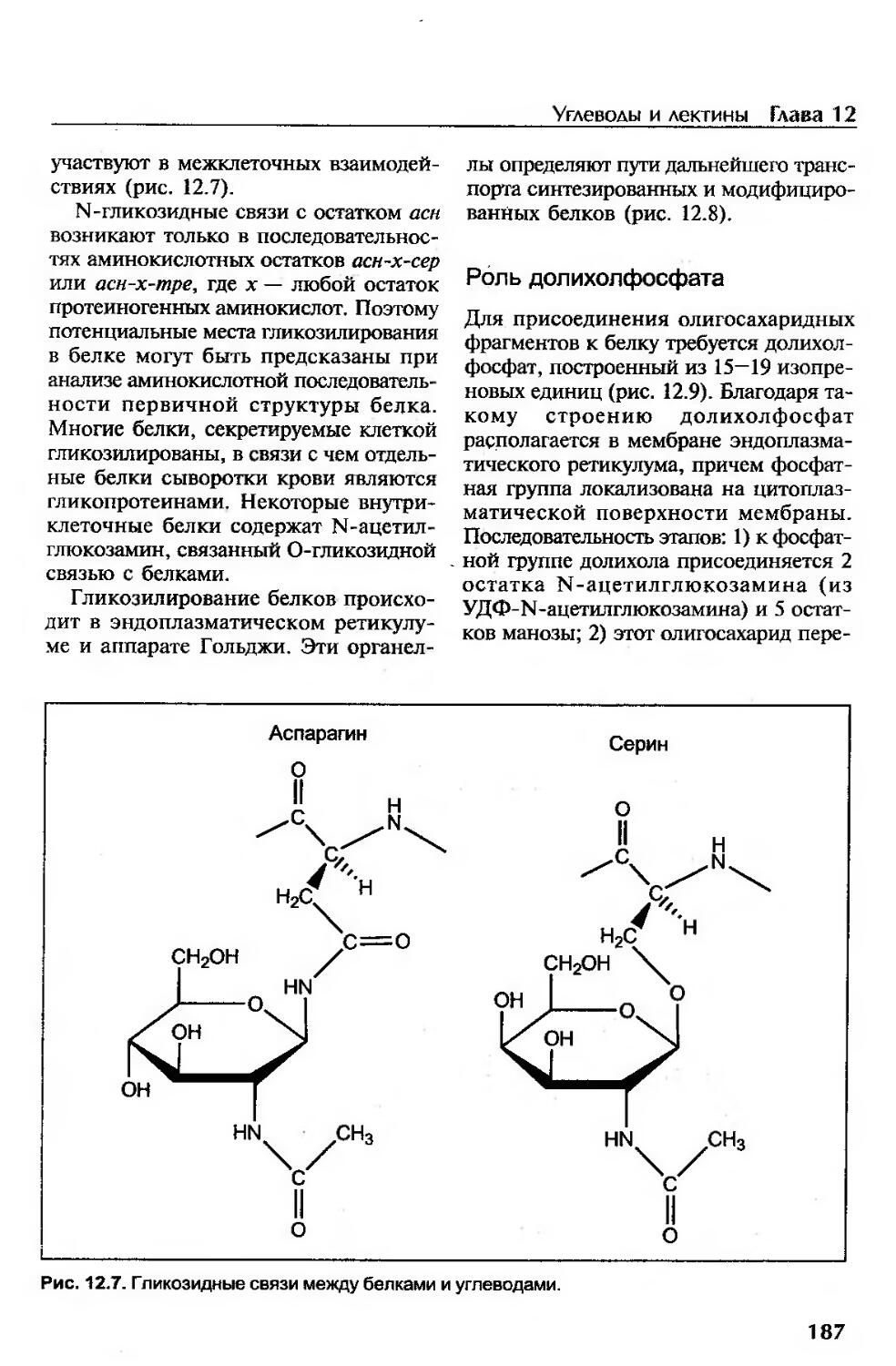
Углеводы и лектины......................................................... 178
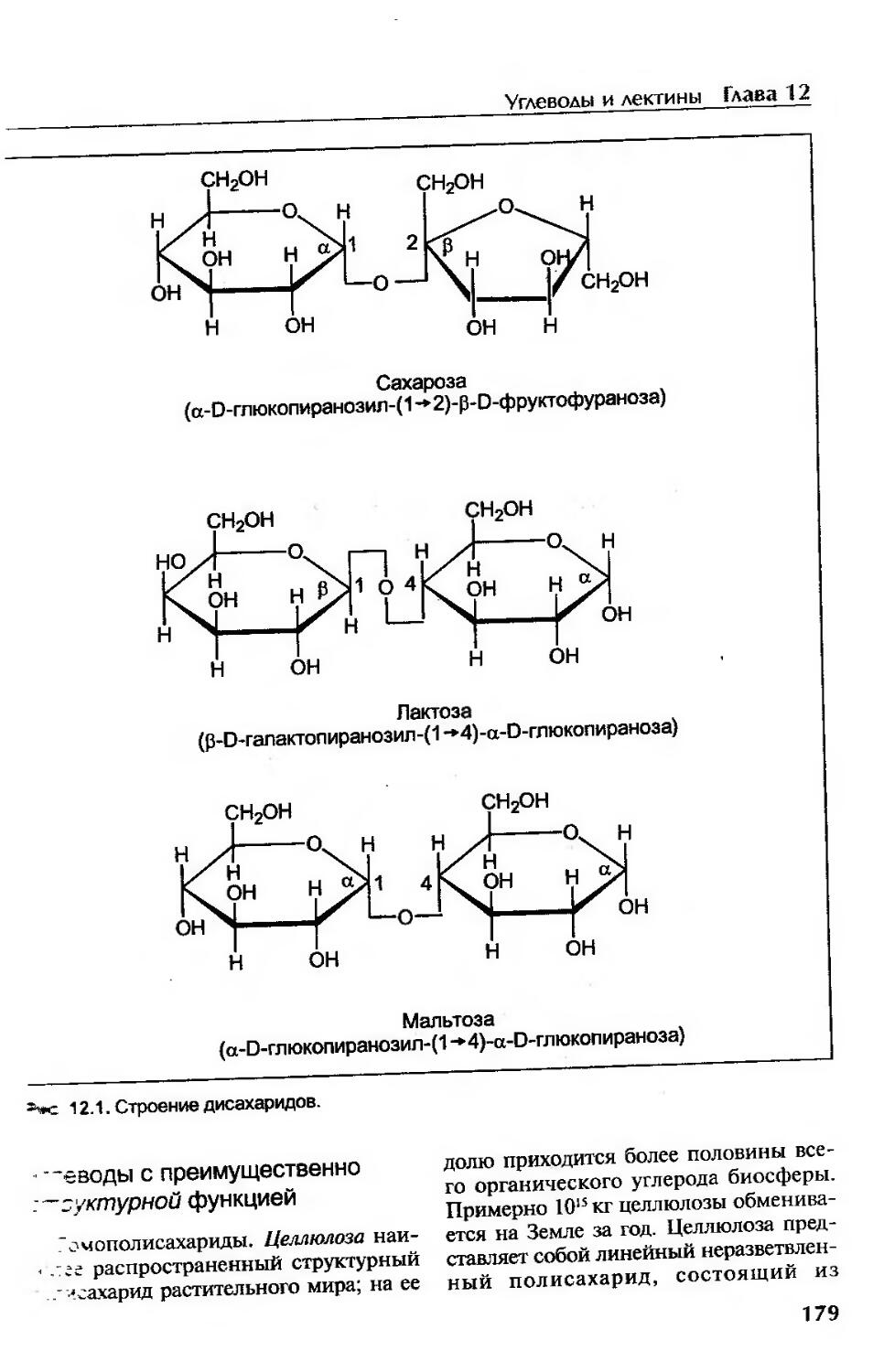
Функции и строение углеводов................................................178
Углеводы с преимущественно энергетической функцией.......................178
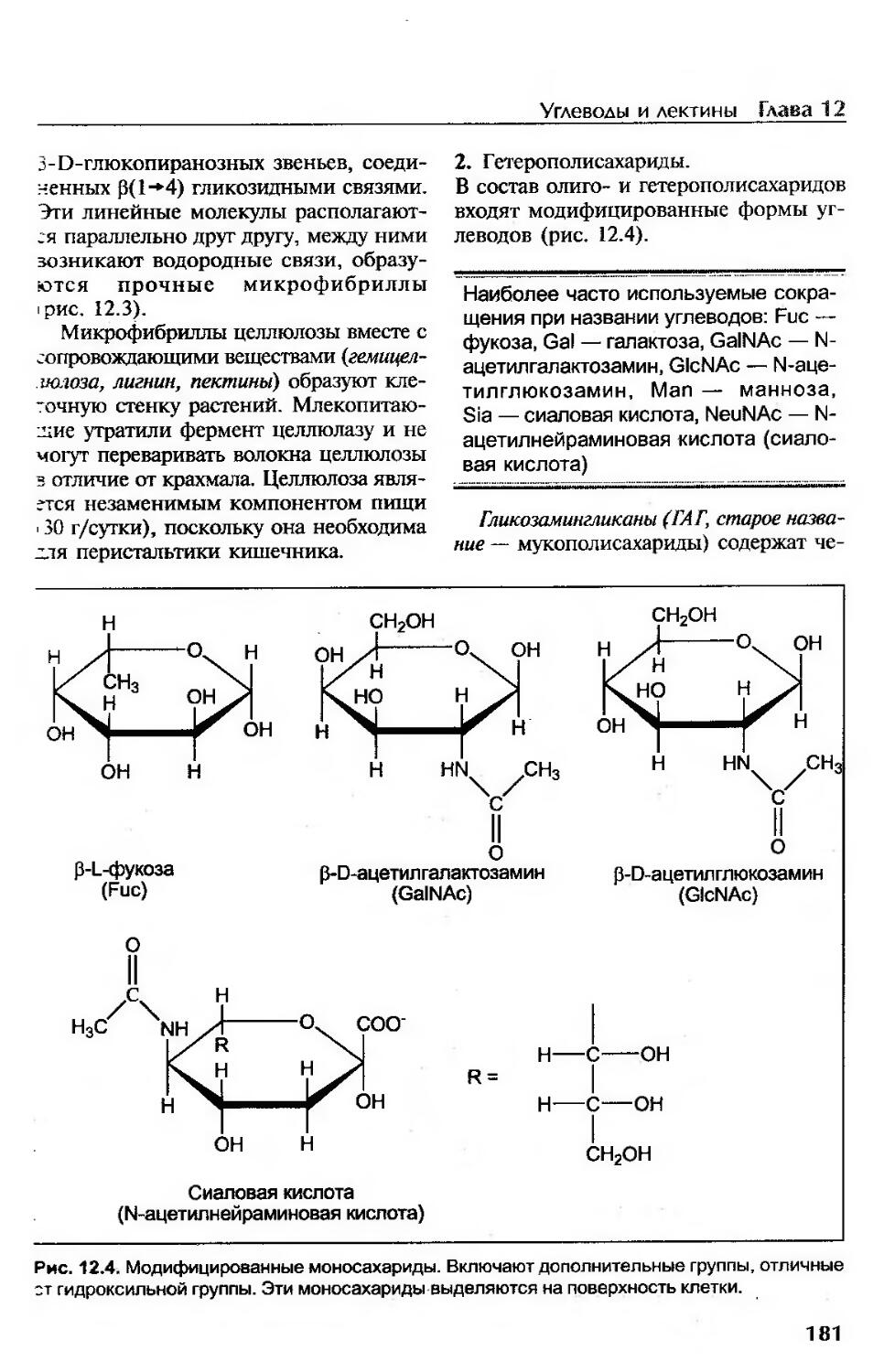
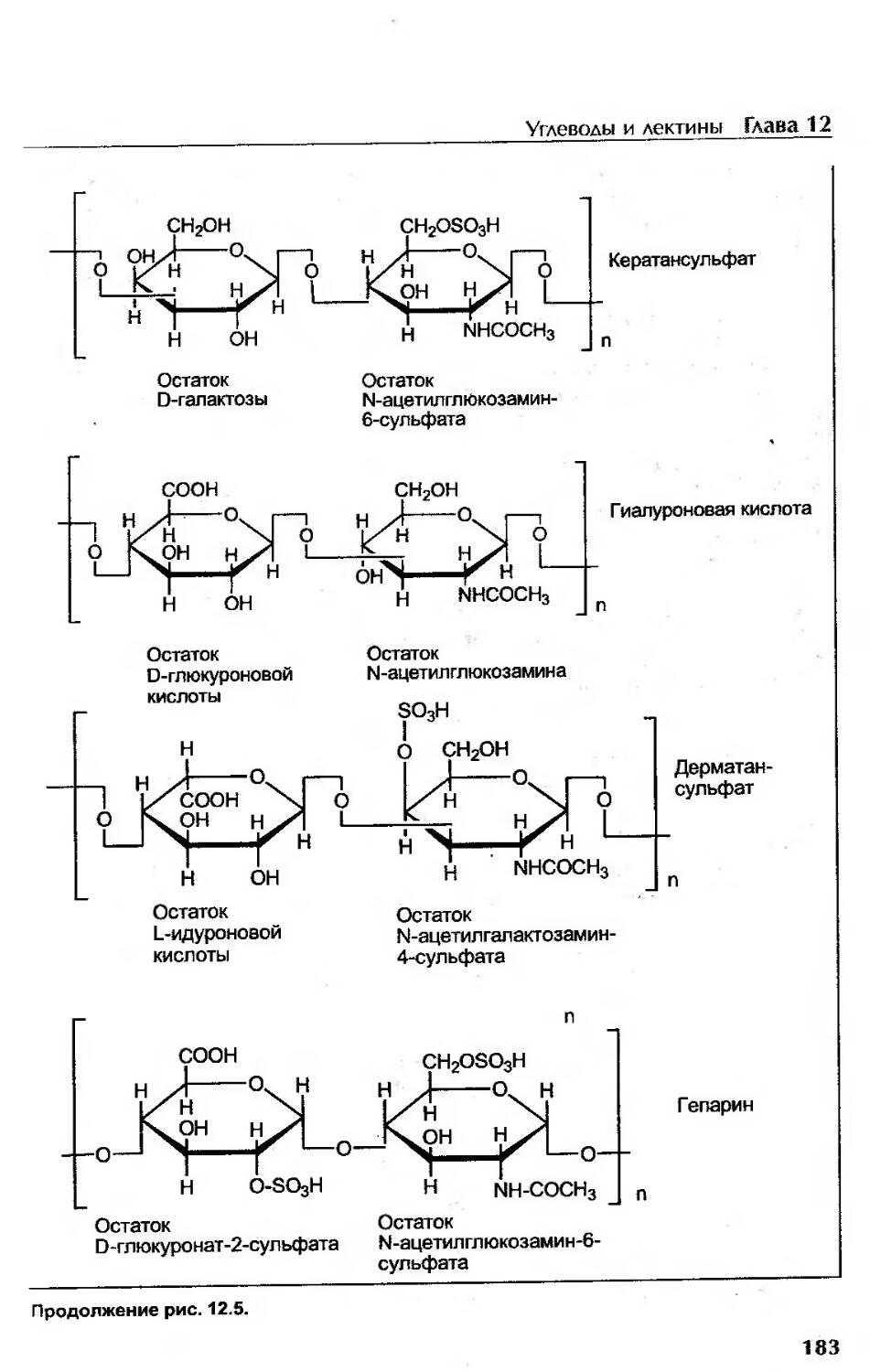
Углеводы с преимущественно структурной функцией..........................179
Лектины.....................................................................184
Синтез олигосахаридов.......................................................185
Синтез гликопротеинов (гликозилирование белков)..........................186
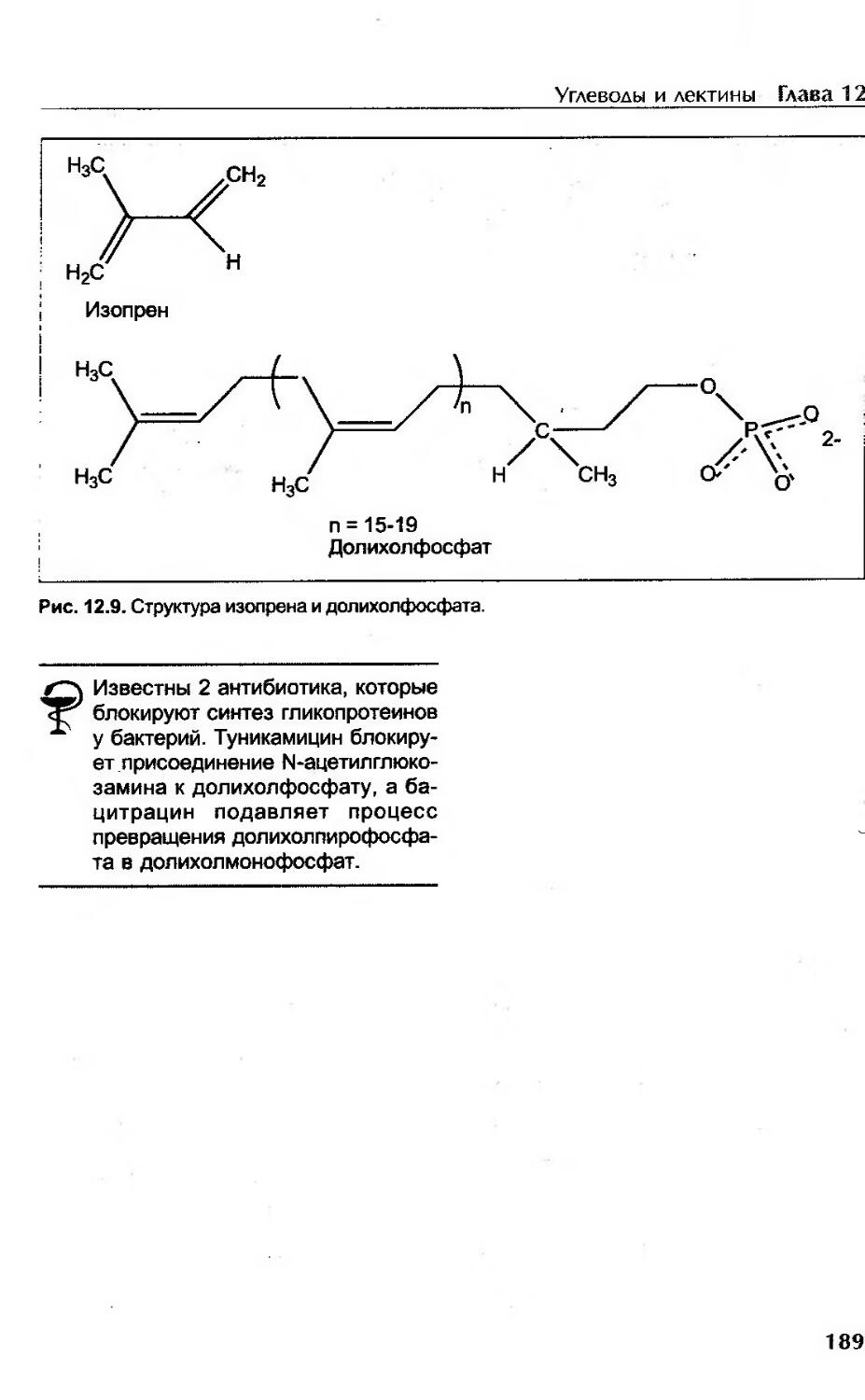
Роль долихол фосфата..................................................... 187
"лава 13
"ликолиз................................................................... 190
Переваривание углеводов.....................................................190
Всасывание моносахаридов....................................................192
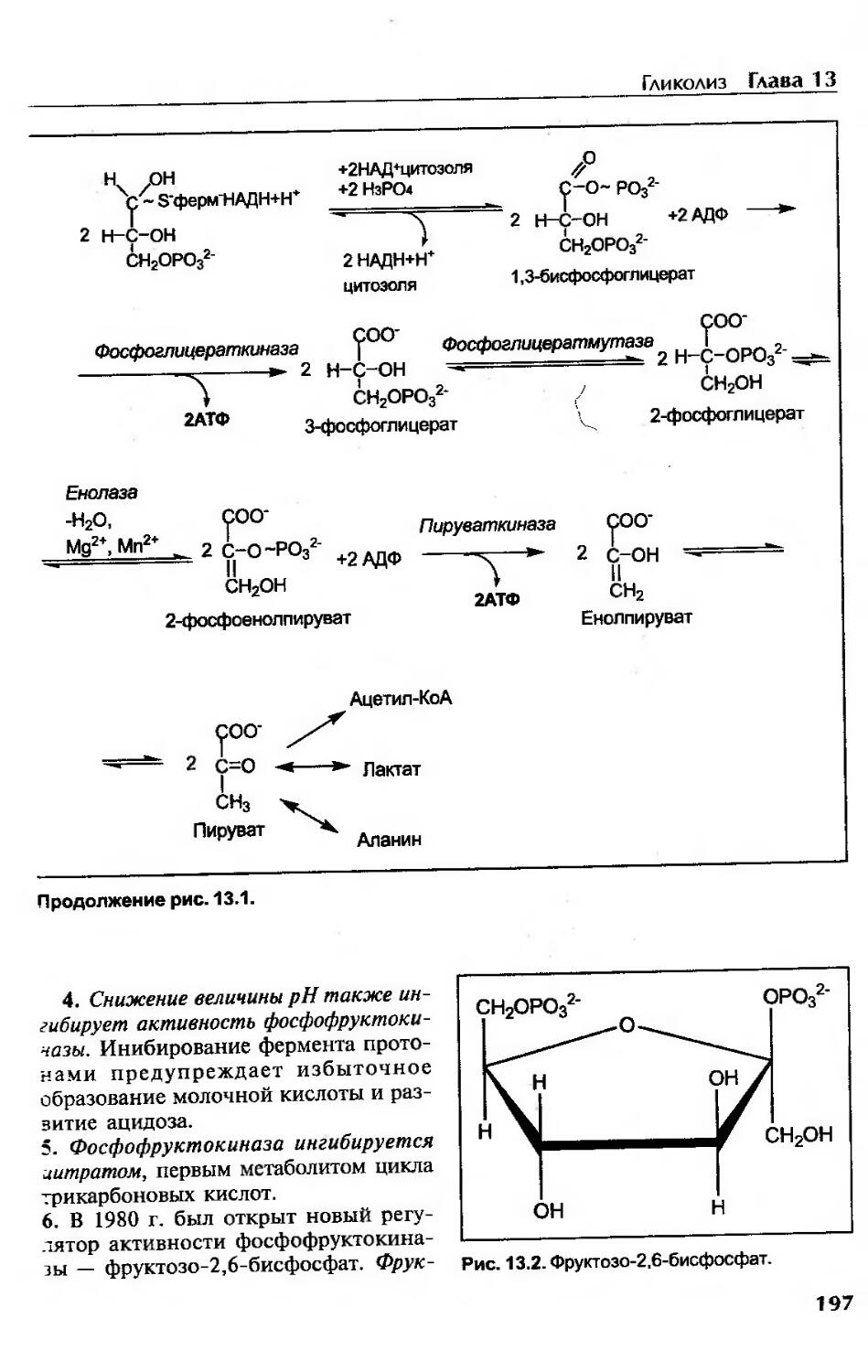
Гликолиз....................................................................193
Гликолиз как специфический путь катаболизма глюкозы......................193
Необратимые реакции гликолиза............................................195
Регуляция гликолиза.........................................................195
Метаболизм глюкозы в аэробных условиях......................................199
Энергетический баланс аэробного распада глюкозы.............................200
Метаболизм глюкозы в анаэробных условиях....................................201
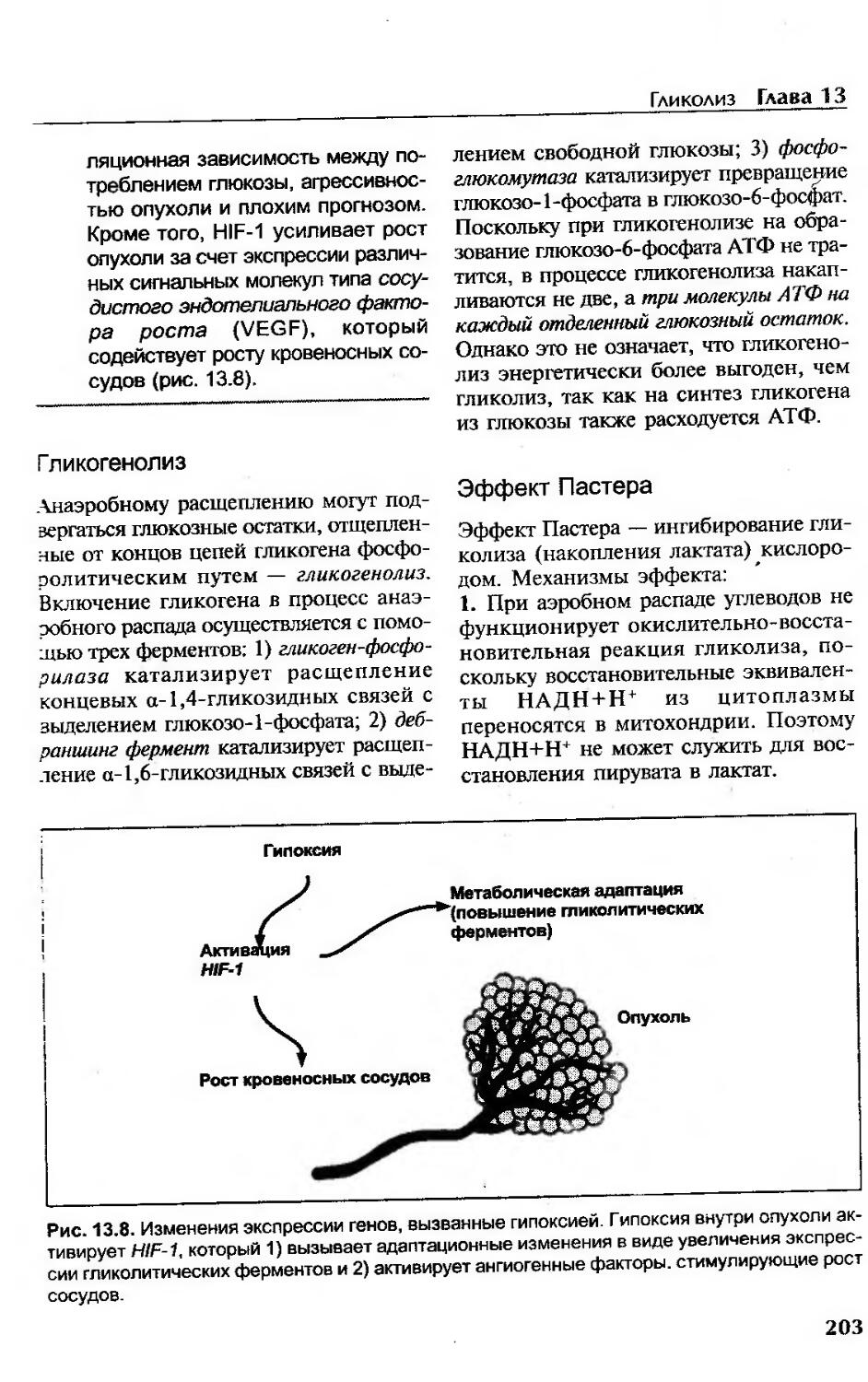
Катаболизм глюкозы в опухолевых тканях...................................202
Гликогенолиз.............................................................203
Эффект Пастера...........................................................203
Брожение............................................................... 204
Спиртовое брожение.......................................................204
Метаболизм экзогенного этанола...........................................205
лава 14
Пентозофосфатный путь обмена углеводов. Глюконеогенез..........................207
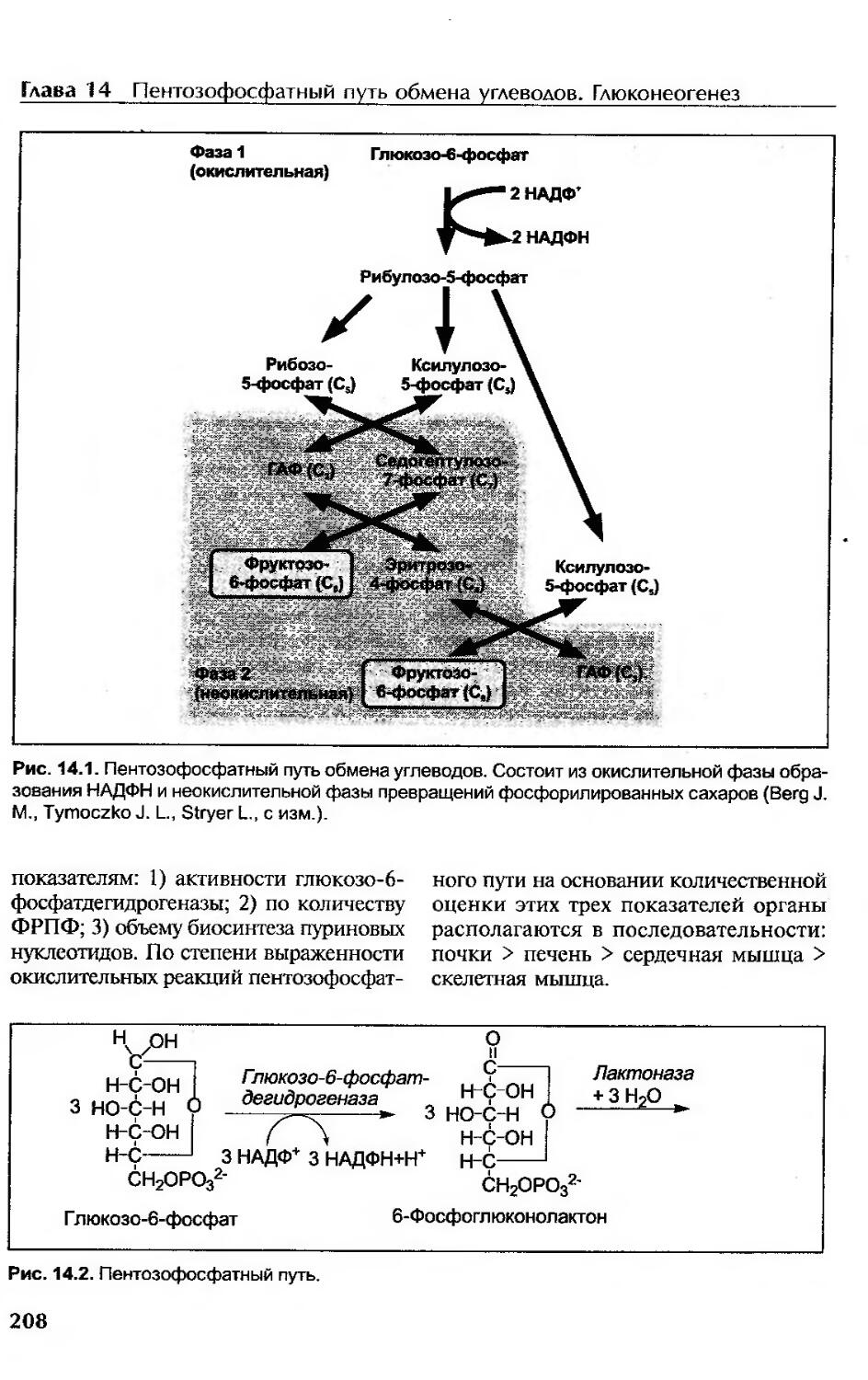
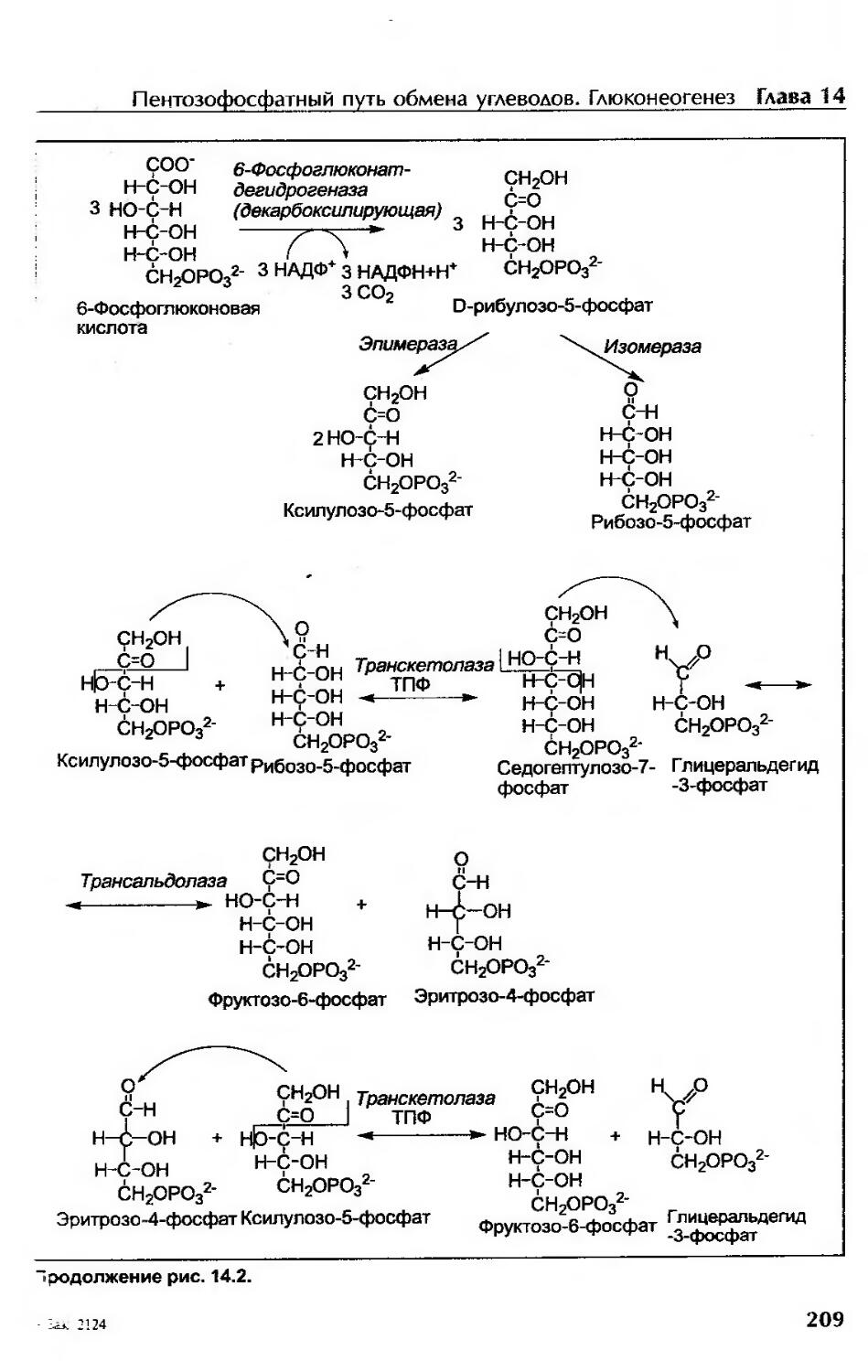
Окислительная фаза ПФП......................................................207
Неокислительная фаза ПФП....................................................210
Регуляция ПФП............................................................210
Связи пентозофосфатного пути и гликолиза.................................210
Функции пентозофосфатного пути..............................................212
Медицинское значение пентозофосфатного пути обмена углеводов................212
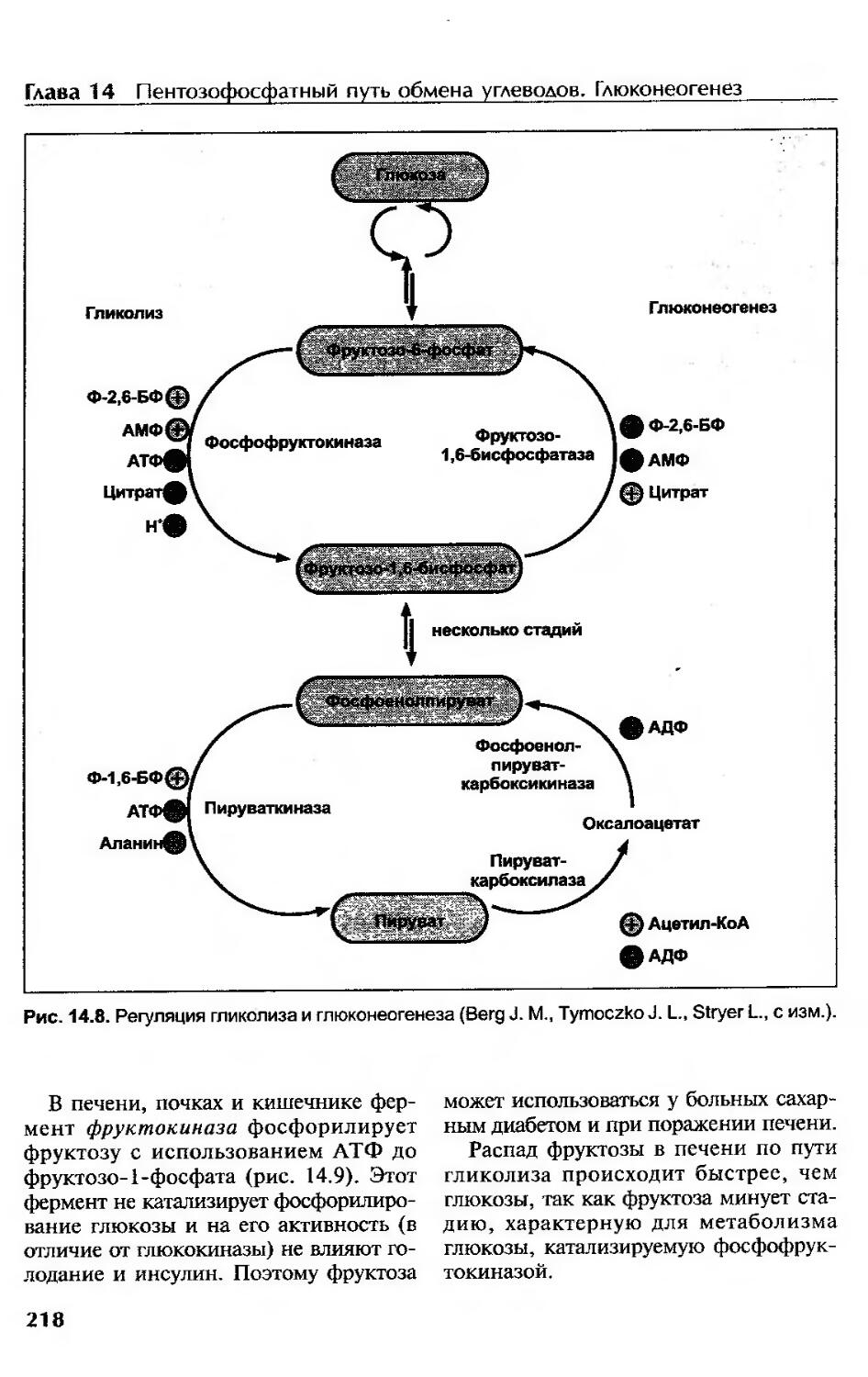
Глюконеогенез.............................................................. 213
Регуляция глюконеогенеза....................................................216
Метаболизм гексоз...........................................................217
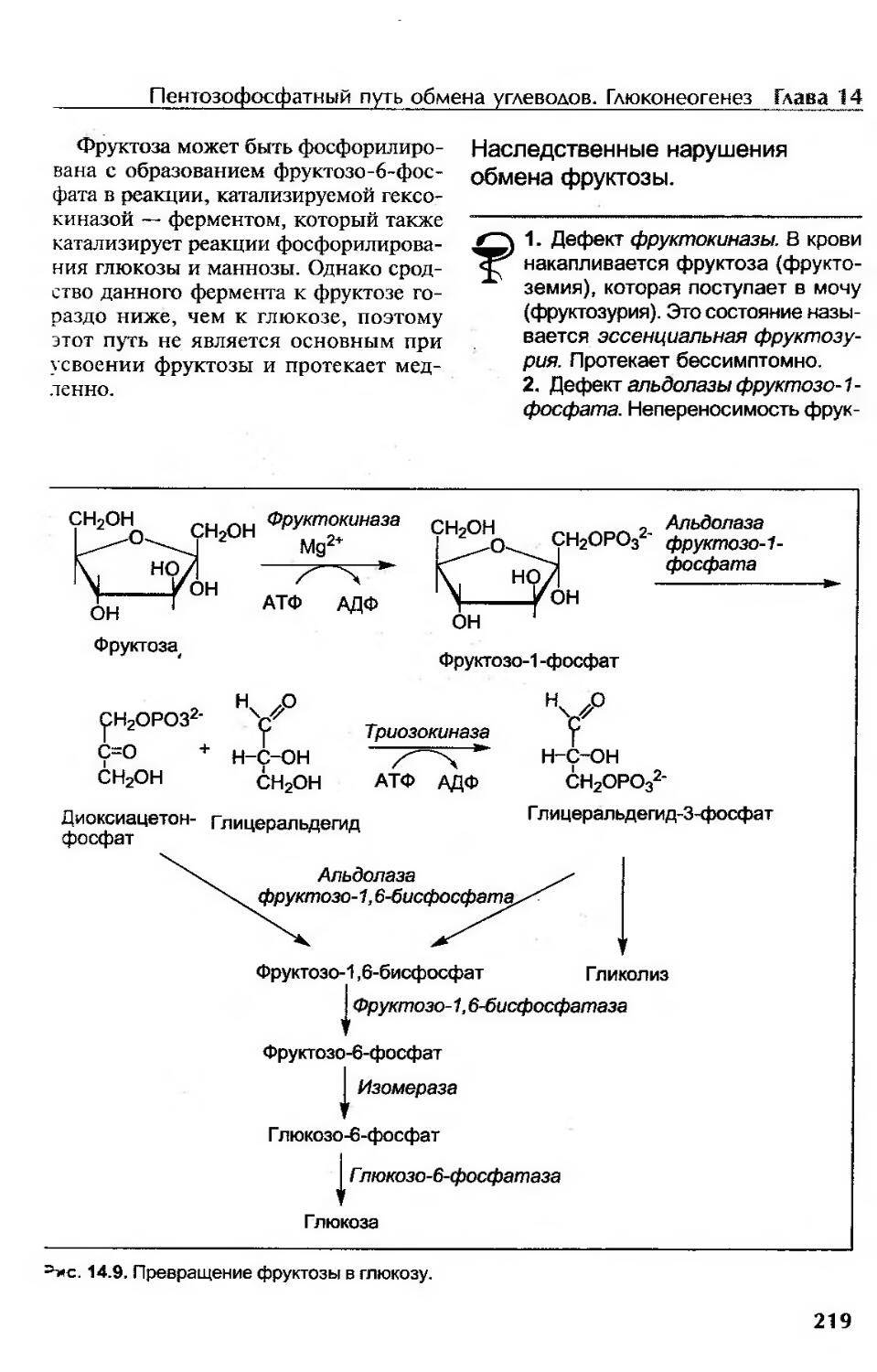
Метаболизм фруктозы......................................................217
Наследственные нарушения обмена фруктозы.................................219
Метаболизм галактозы................................................... 220
Глюкуроновый путь обмена глюкозы............................,...............220
“лава 15
Синтез и распад гликогена.................................................... 223
Синтез гликогена (гликогенез)...............................................223
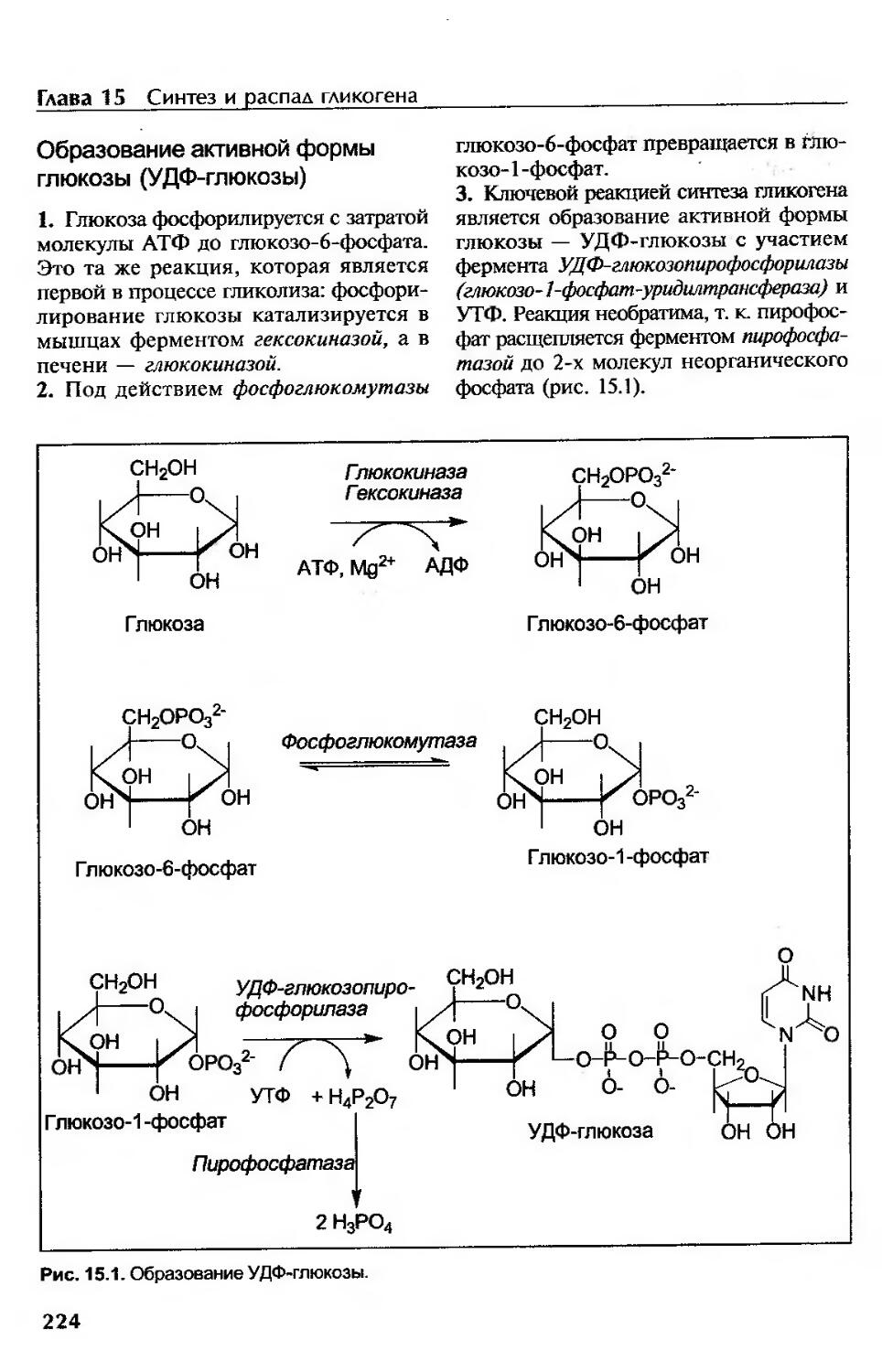
Образование активной формы глюкозы (УДФ-глюкозы).........................224
Образование о-1,4-тликозидной связи......................................225
Образование а-1,6-гликозидной связи......................................225
Синтез новых молекул гликогена...........................................225
vi i
Содержание
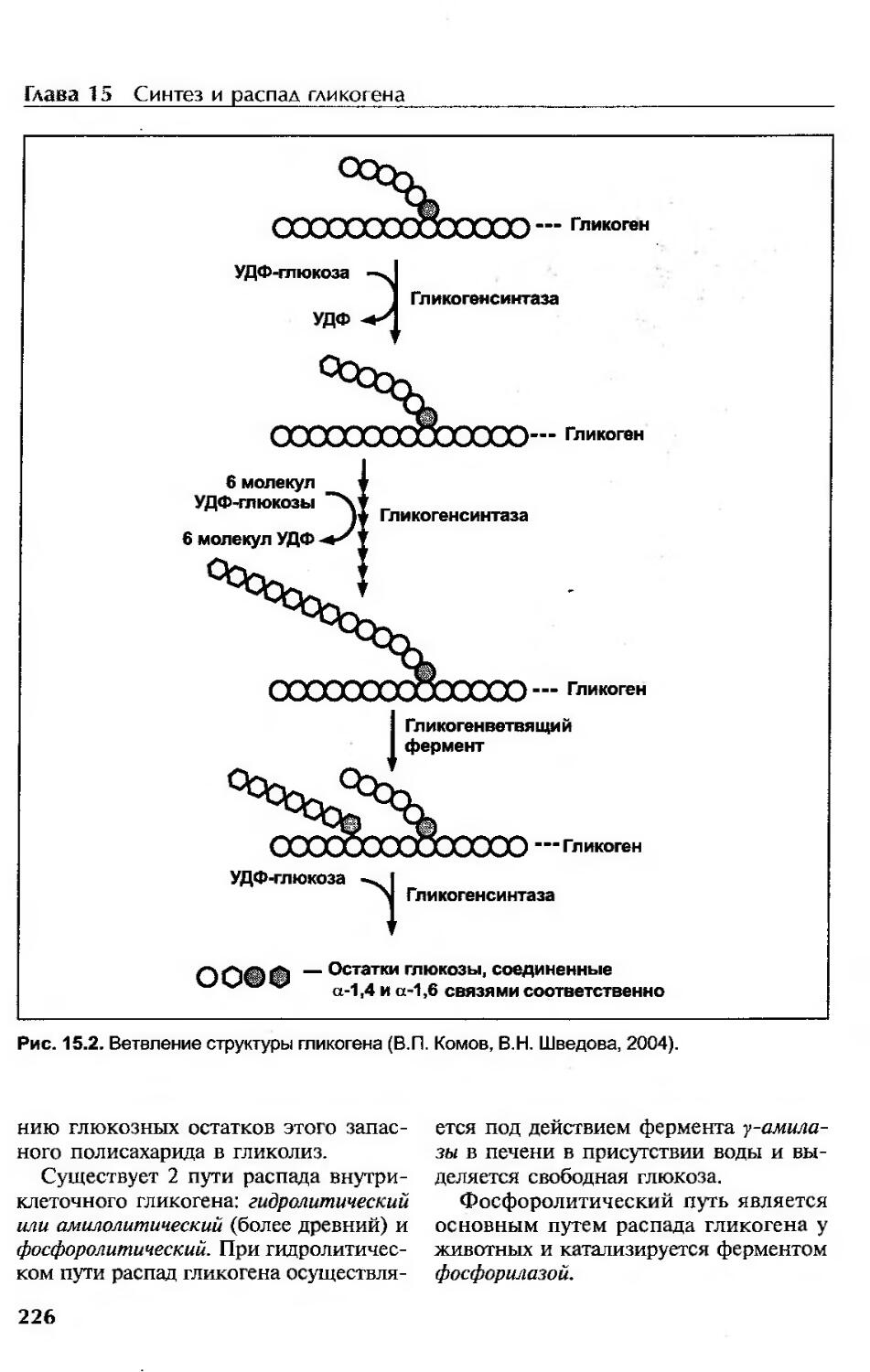
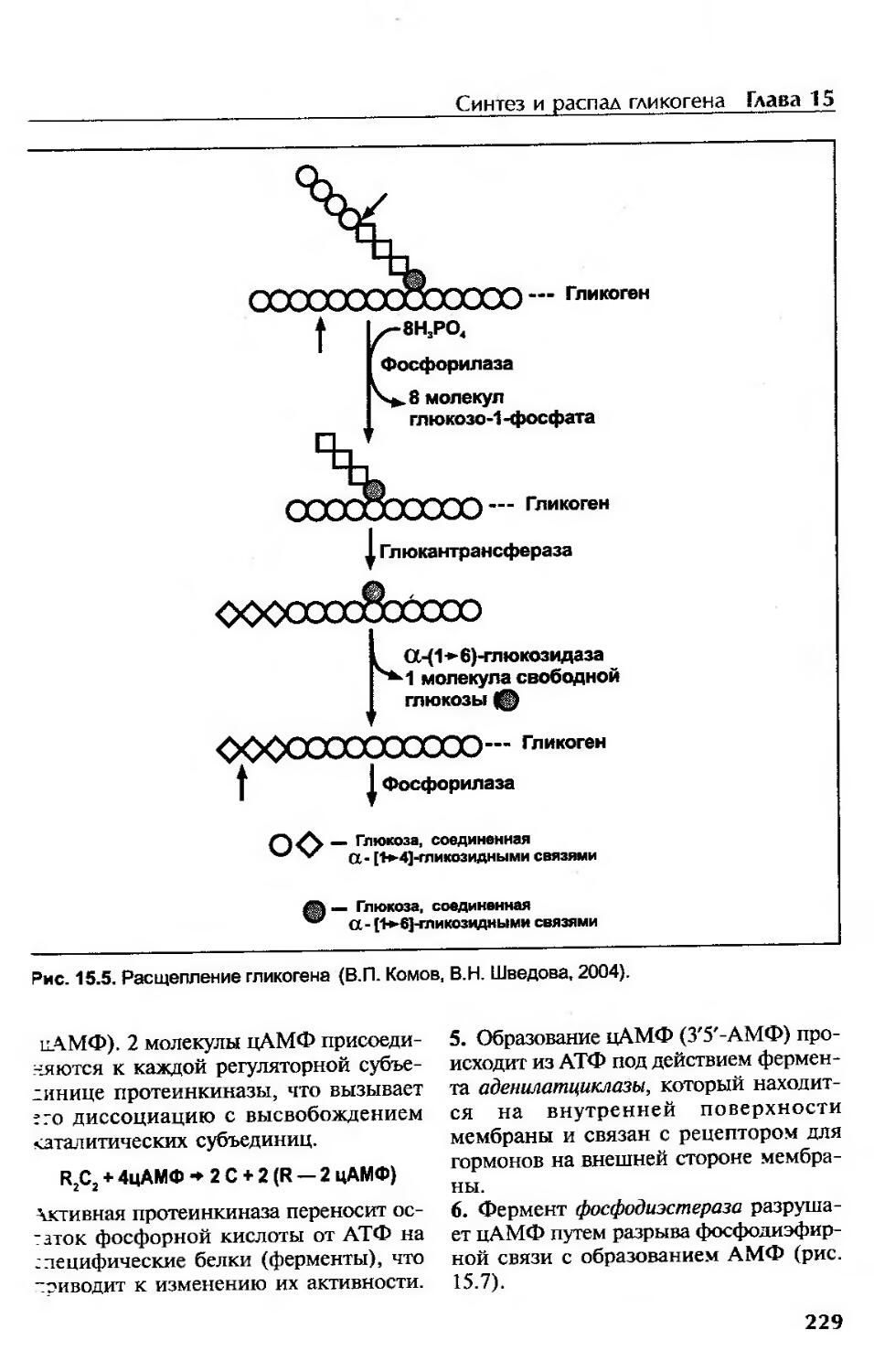
Распад гликогена (гликогенолиз)............................................225
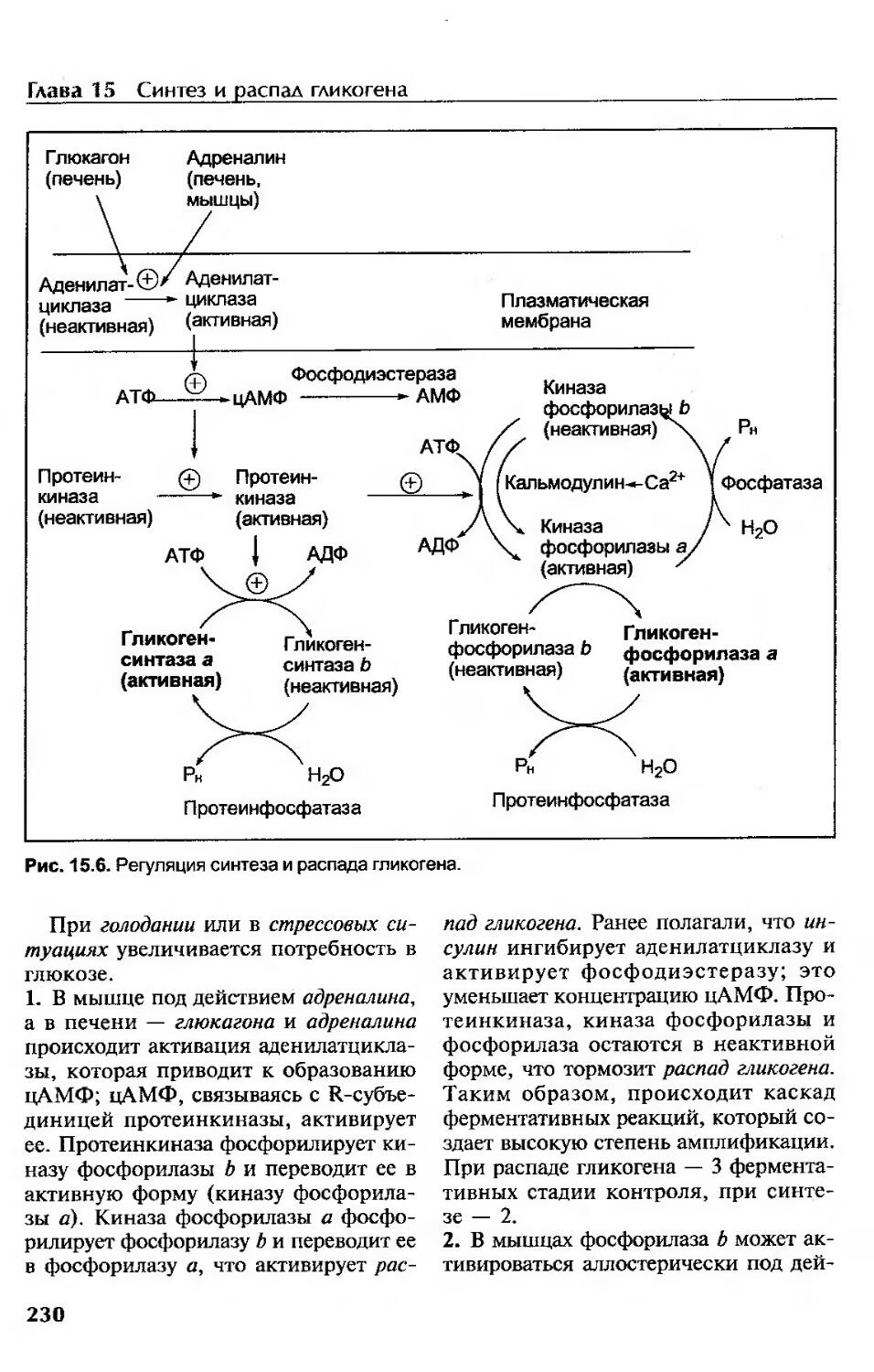
Регуляция гликогенеза и гликогенолиза......................................228
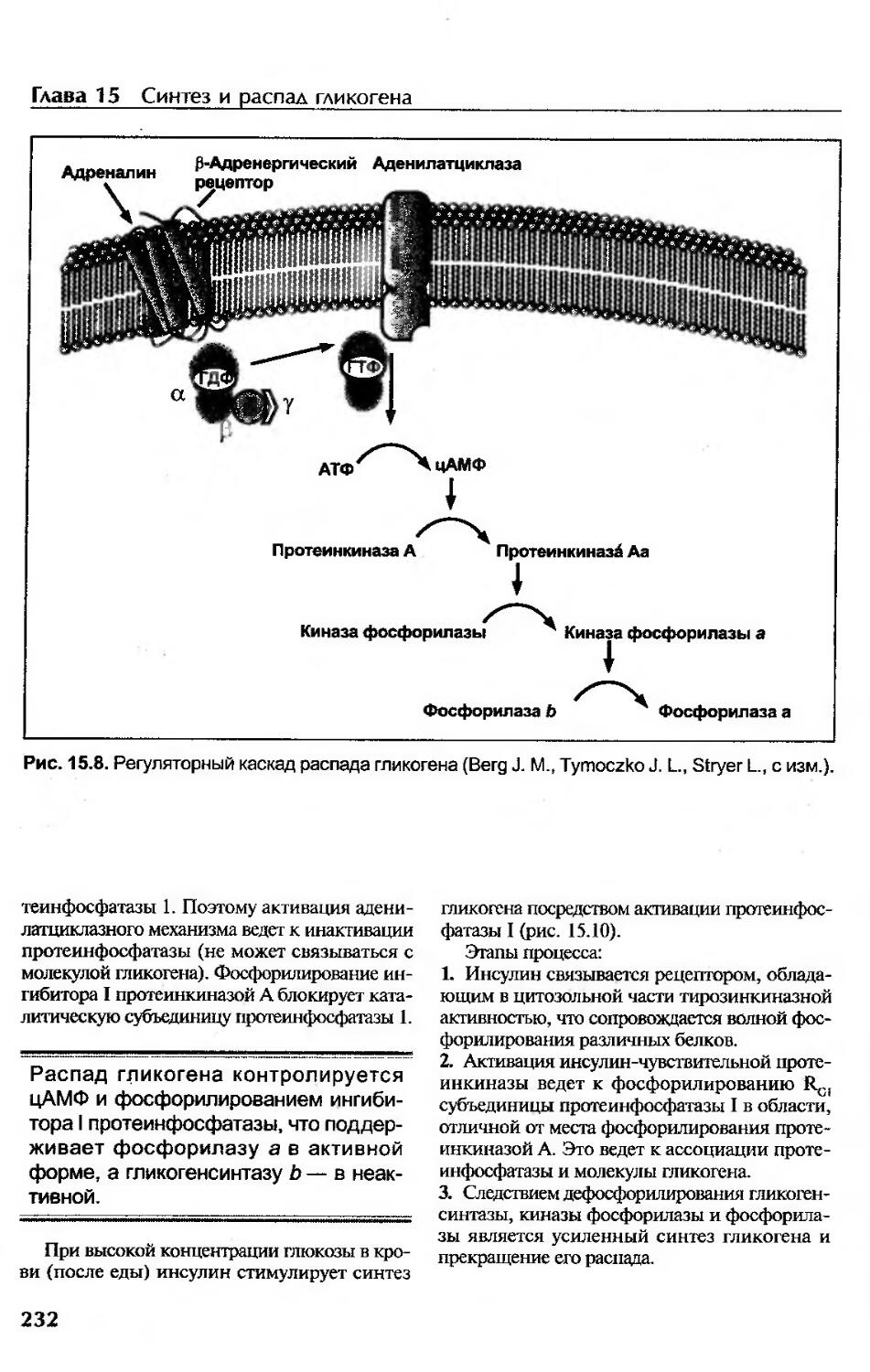
Роль протеинфосфатаз.......................................................231
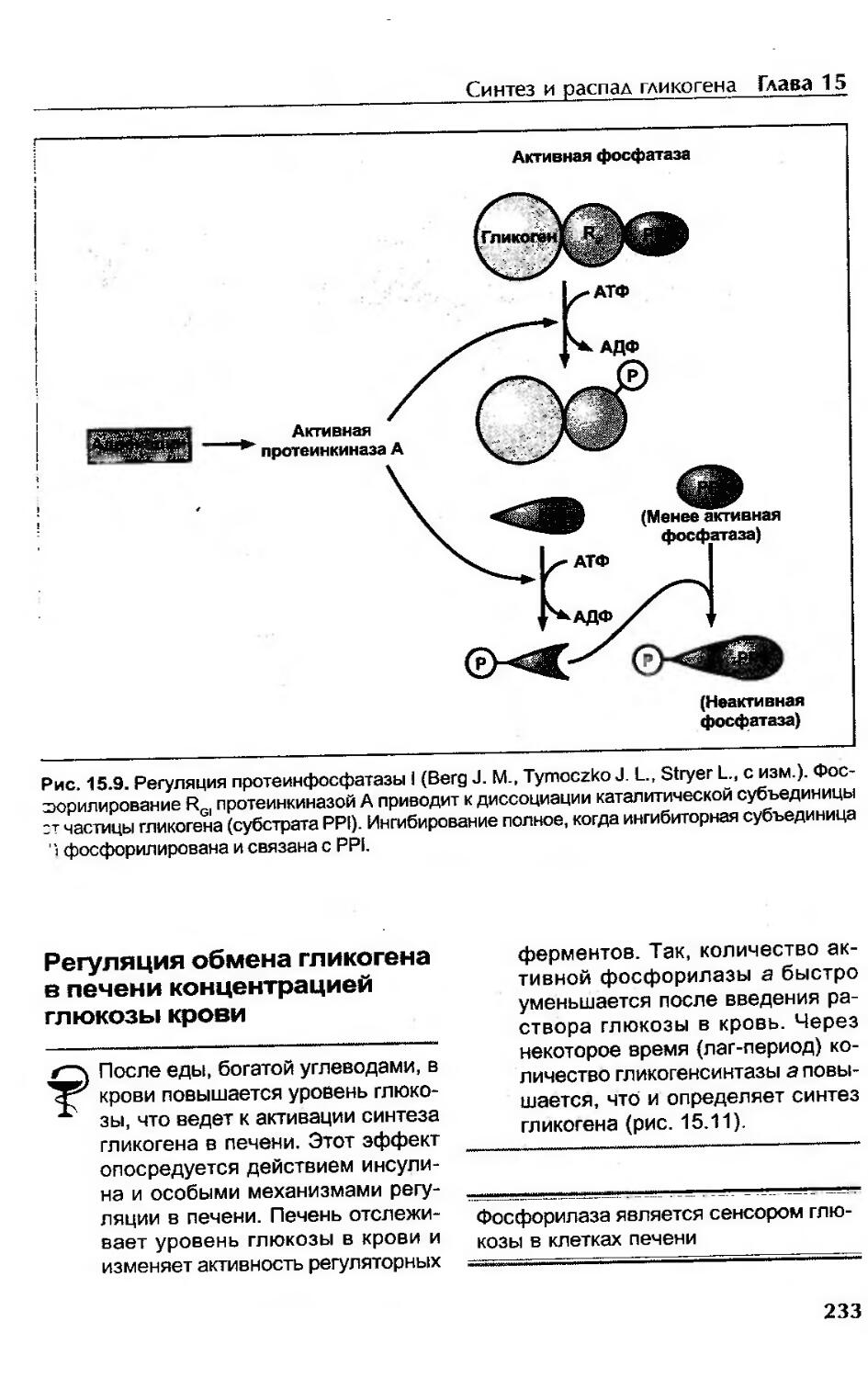
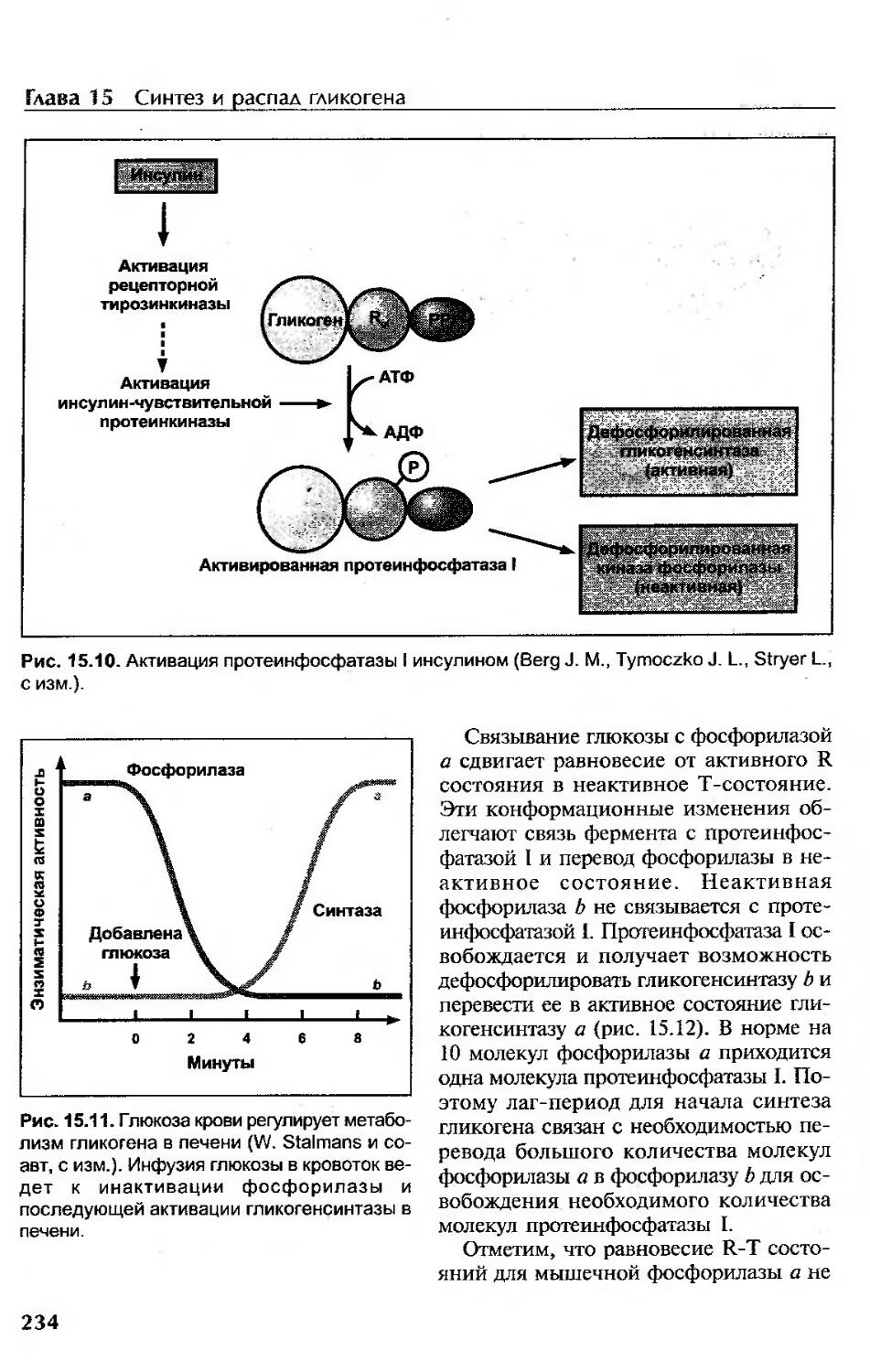
Регуляция обмена гликогена в печени концентрацией глюкозы крови............233
Гликогенозы................................................................235
Глава 16 Фотосинтез.................................................................. 236
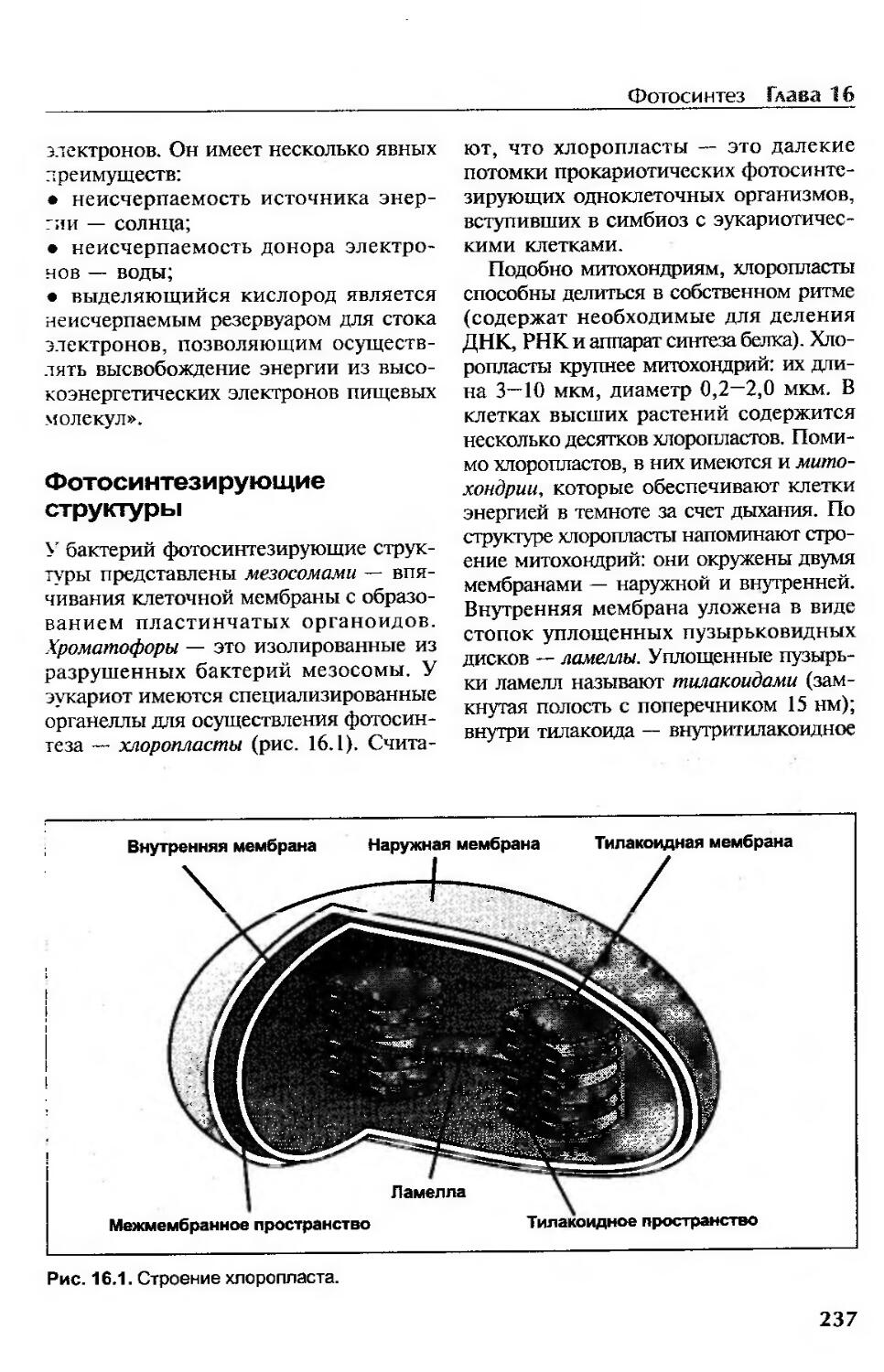
Фотосинтезирующие структуры.............................................. 237
Характеристика фотосистем..................................................239
Механизм световой стадии фотосинтеза..................................... 240
Механизм фотосинтетического фосфорилирования............................241
Темновая фаза фотосинтеза .................................................242
Регуляция темновой фазы фотосинтеза.....................................246
Эволюция рибулозо-1,5-бисфосфаткарбоксилазы.............................246
Резервные формы сахаров....................................................248
Глава 17
Обмен липидов............................................................... 249
Общая характеристика липидов...............................................249
Классификация липидов...................................................249
Функции липидов.........................................................251
Характеристика жирных кислот............................................251
Эйкозаноиды................................................................252
Синтез эйкозаноидов.....................................................252
Простагландины......................................................... 253
Простациклины...........................................................255
Тромбоксаны.............................................................255
Лейкотриены.............................................................255
Переваривание липидов...................................................... 255
Переваривание триацил глицеролов........................................256
Эмульгирование..........................................................256
Переваривание глицерофосфолипидов.......................................258
Эфиры холестерола.......................................................259
Всасывание продуктов переваривания.........................................259
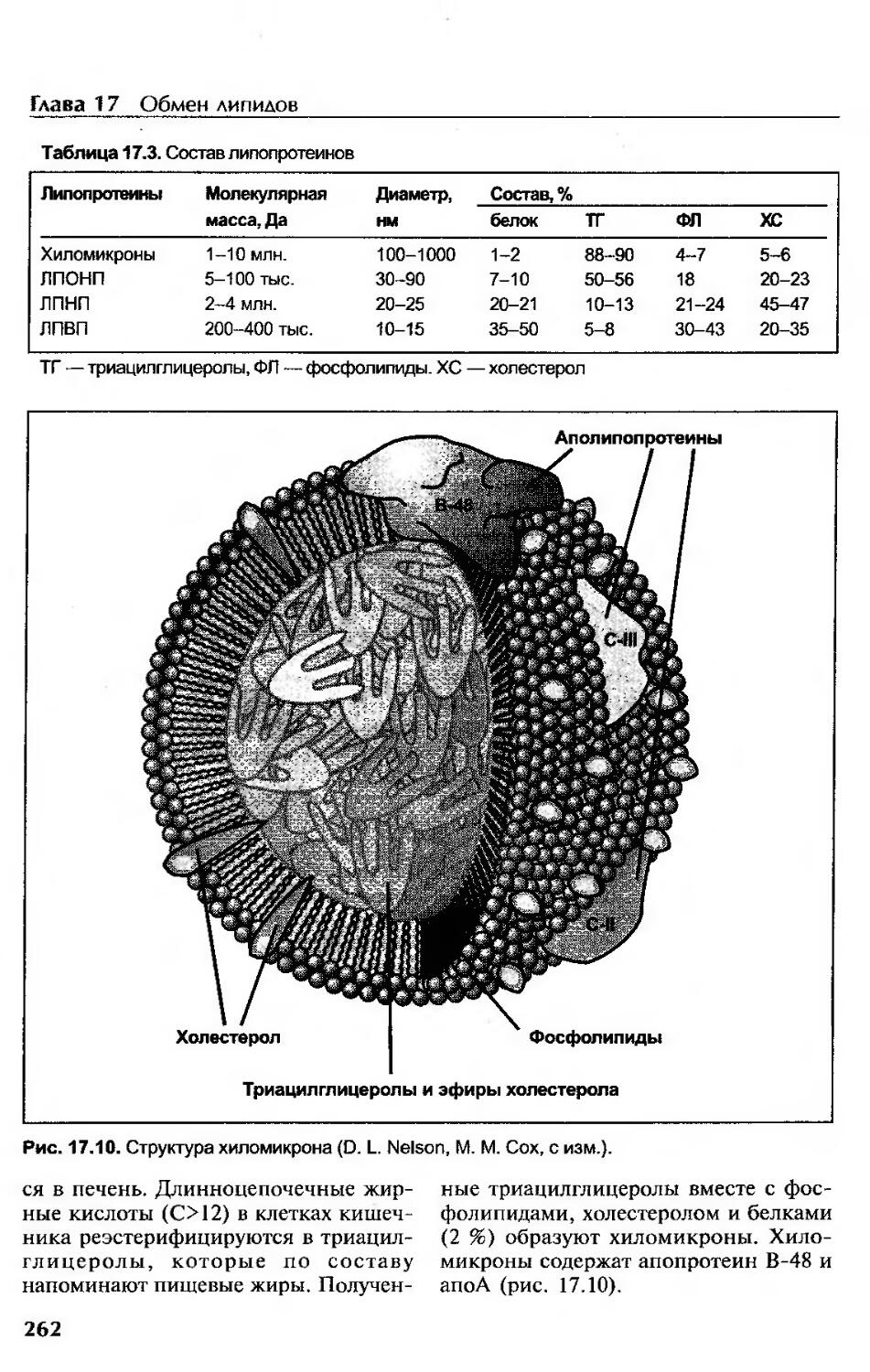
Транспорт липидов..........................................................259
Липопротеины........................................................... 259
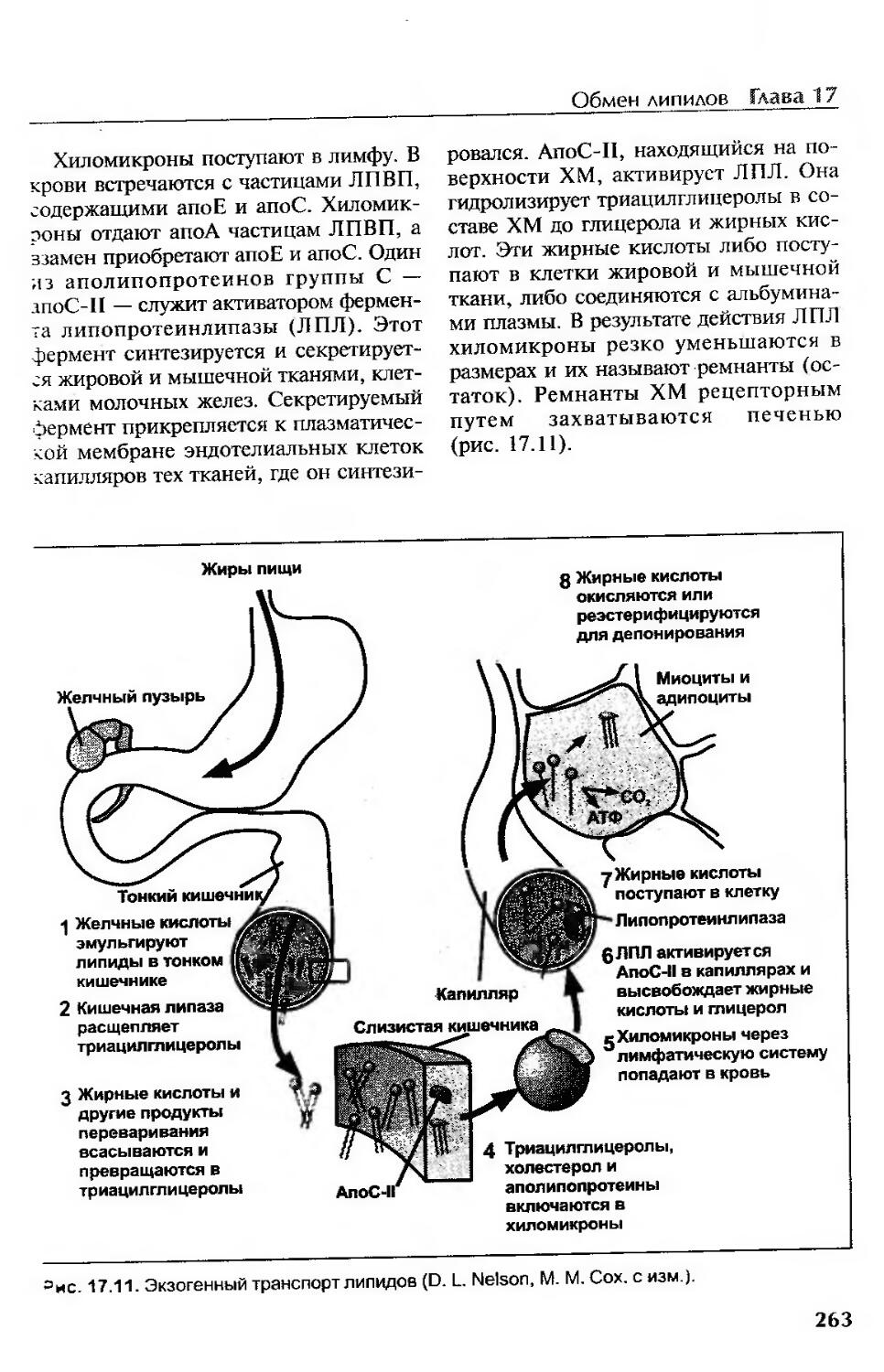
Экзогенный транспорт....................................................261
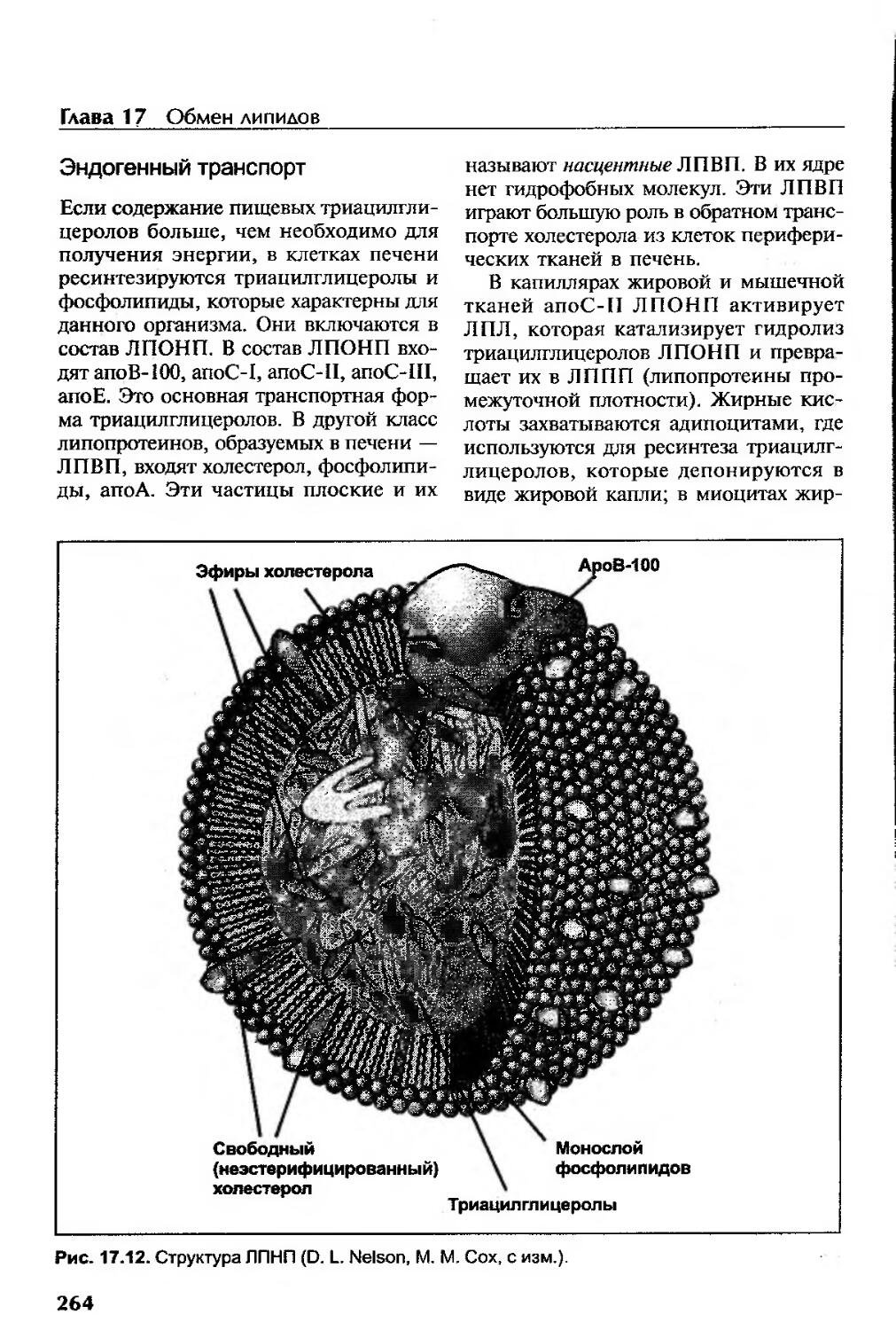
Эндогенный транспорт....................................................264
Глава 18
Обмен жирных кислот......................................................... 266
Окисление жирных кислот....................................................266
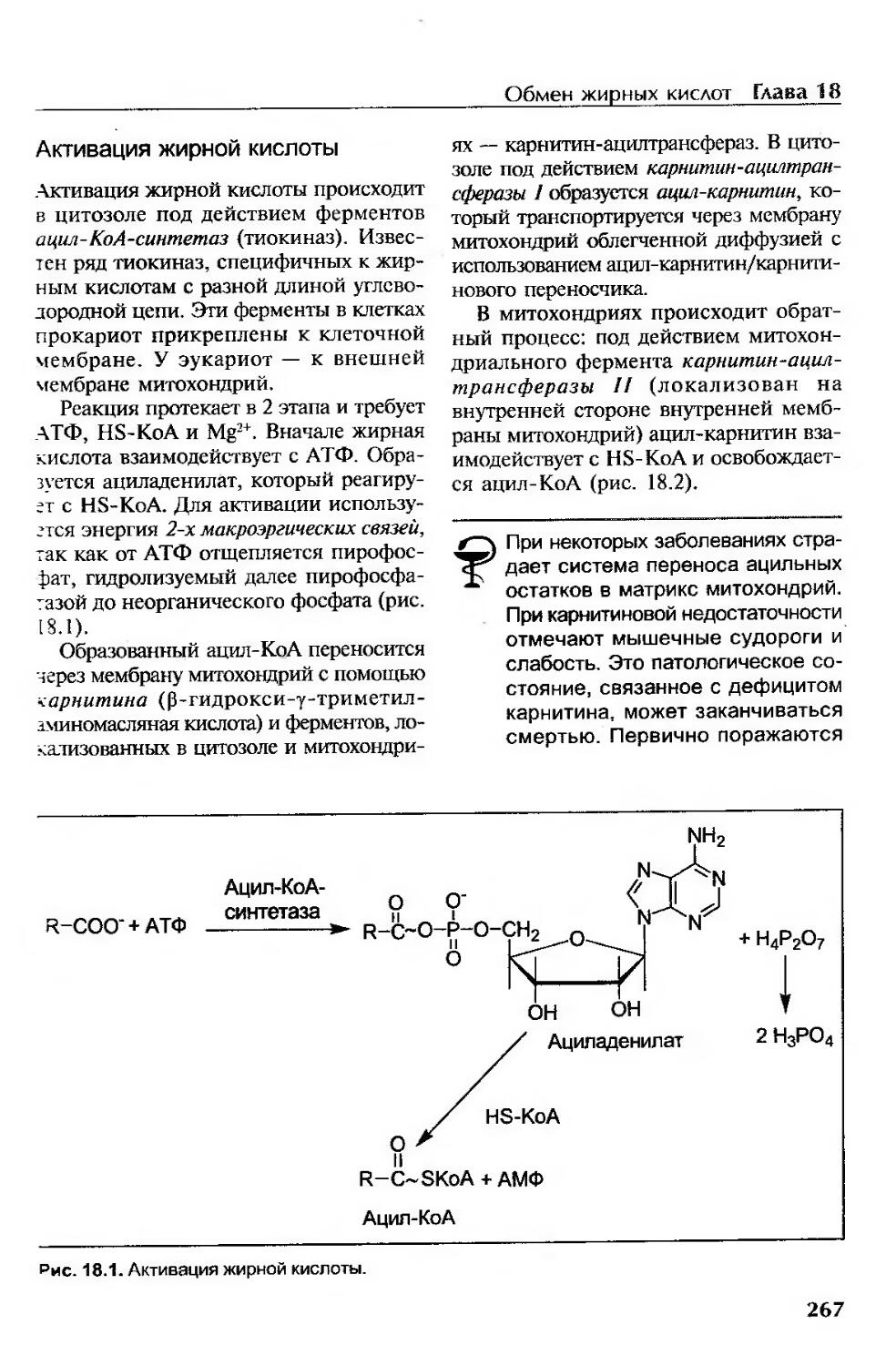
Активация жирной кислоты................................................267
р-Окисление жирной кислоты..............................................268
Окисление ацетил-КоА в ЦТК..............................................268
Энергетический баланс окисления жирных кислот...........................269
Окисление жирных кислот в пероксисомах..................................270
Окисление ненасыщенных жирных кислот.......................................271
Окисление жирных кислот с нечетным числом атомов углерода..................271
Регуляция окисления жирных кислот..........................................271
Окисление глицерола........................................................272
viii
Содержание
Синтез жирных кислот......................................................272
Общая характеристика биосинтеза жирных кислот..........................274
Реакции синтеза........................................................276
Удлинение жирной кислоты...............................................276
Синтез ненасыщенных жирных кислот......................................277
Регуляция синтеза жирных кислот........................................278
Глава 19
Синтез липидов, ожирение, атеросклероз..................................... 279
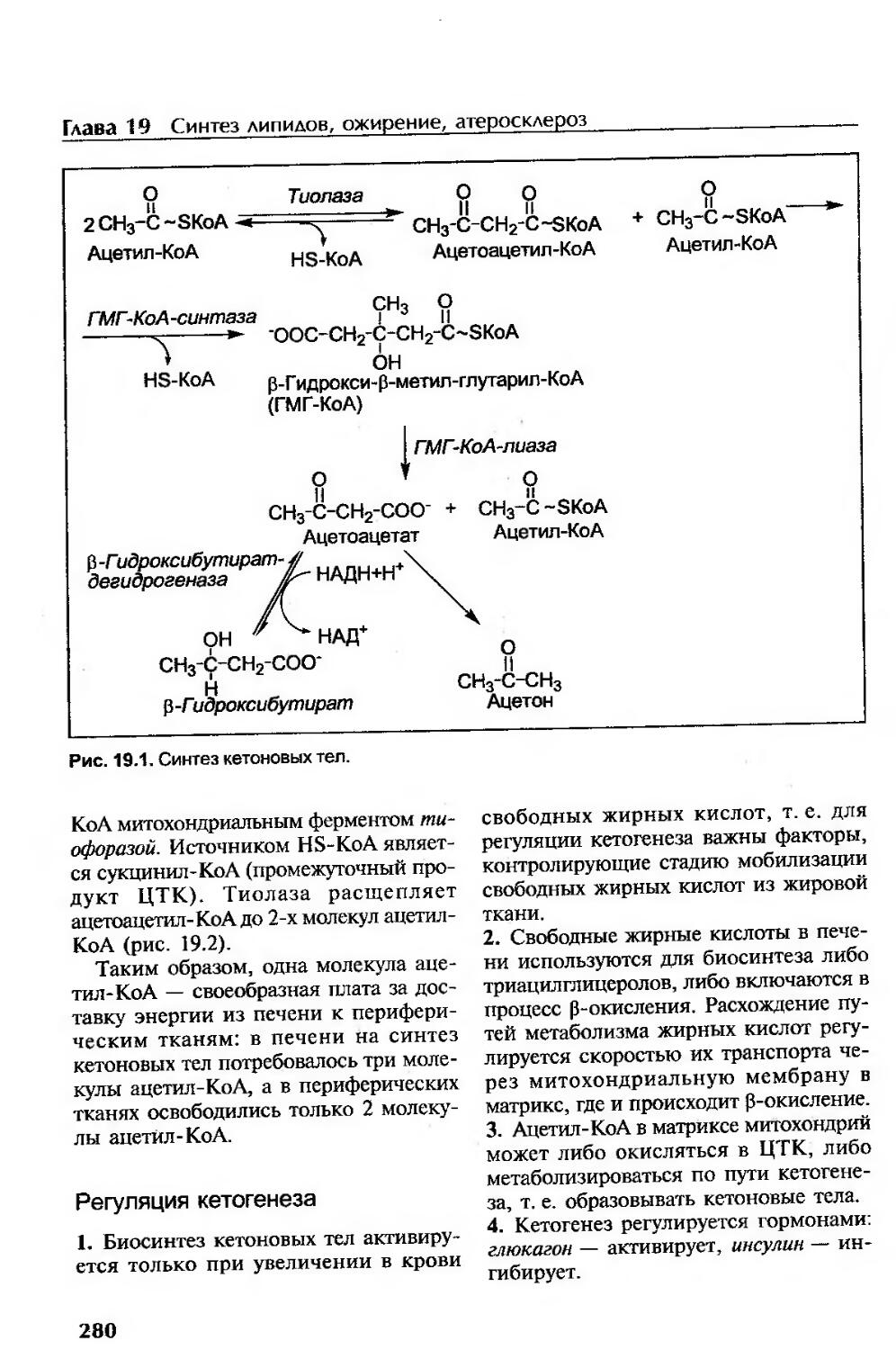
Синтез кетоновых тел......................................................279
Использование кетоновых тел............................................279
Регуляция кетогенеза...................................................280
Синтез холестерола........................................................282
Регуляция синтеза холестерола........................................ 283
Судьба синтезированного холестерола....................................284
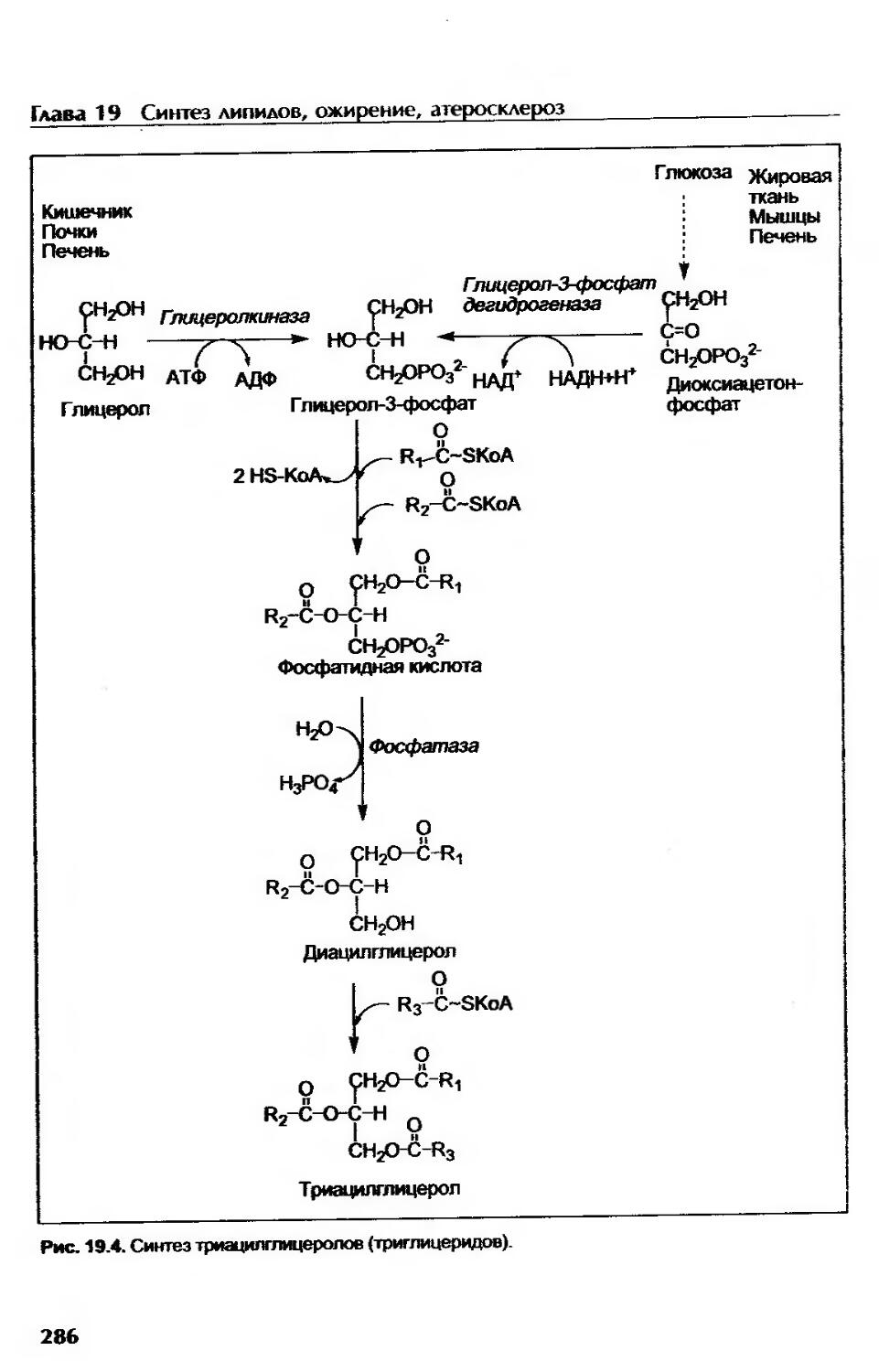
Метаболизм триацилглицеролов и фосфолипидов...............................284
Биосинтез триацилглицеролов............................................284
Биосинтез глицерофосфолипидов..........................................287
Сфинголипиды..........................................................-290
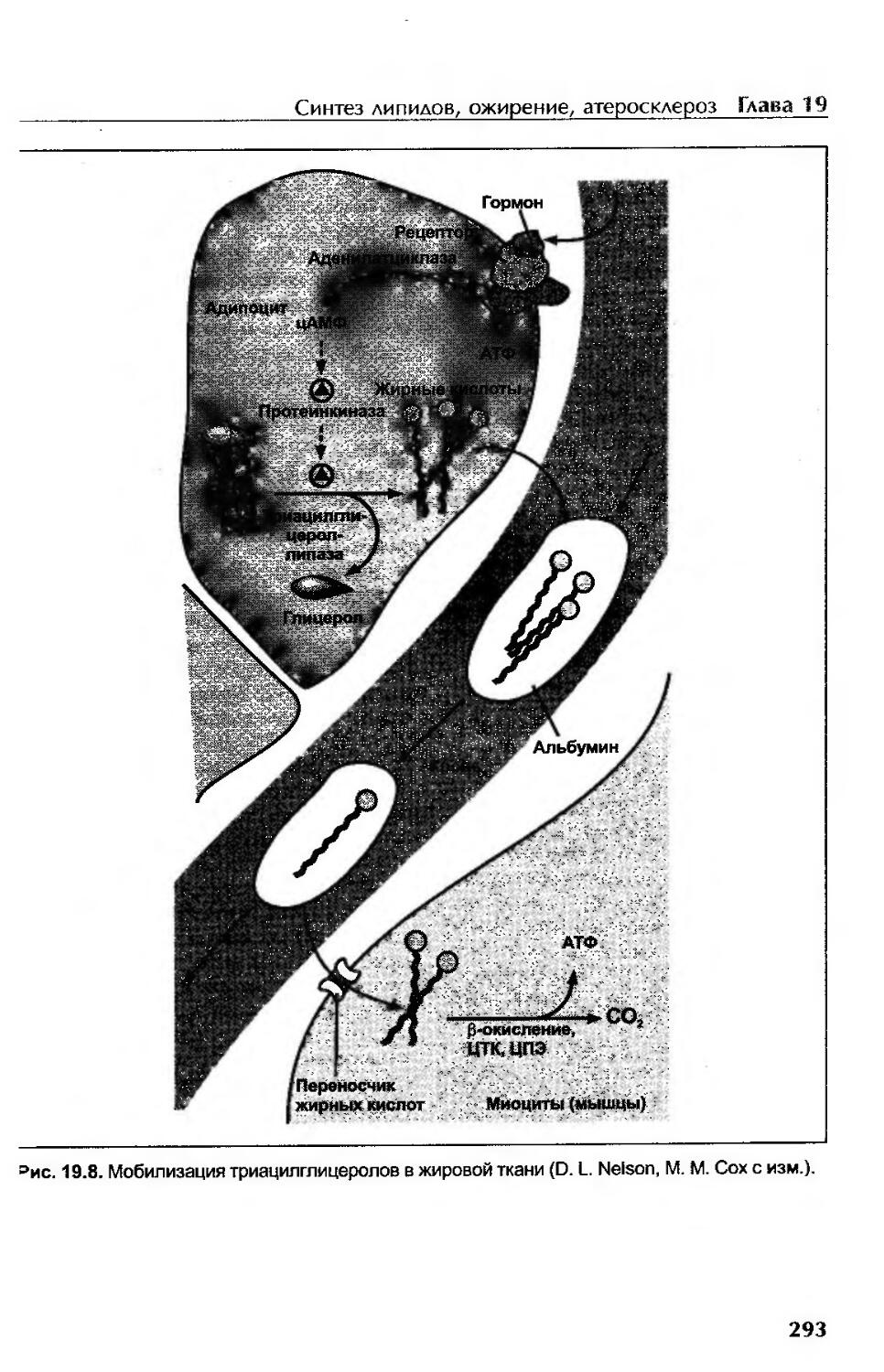
Метаболизм жировой ткани..................................................292
Метаболизм холестерола....................................................294
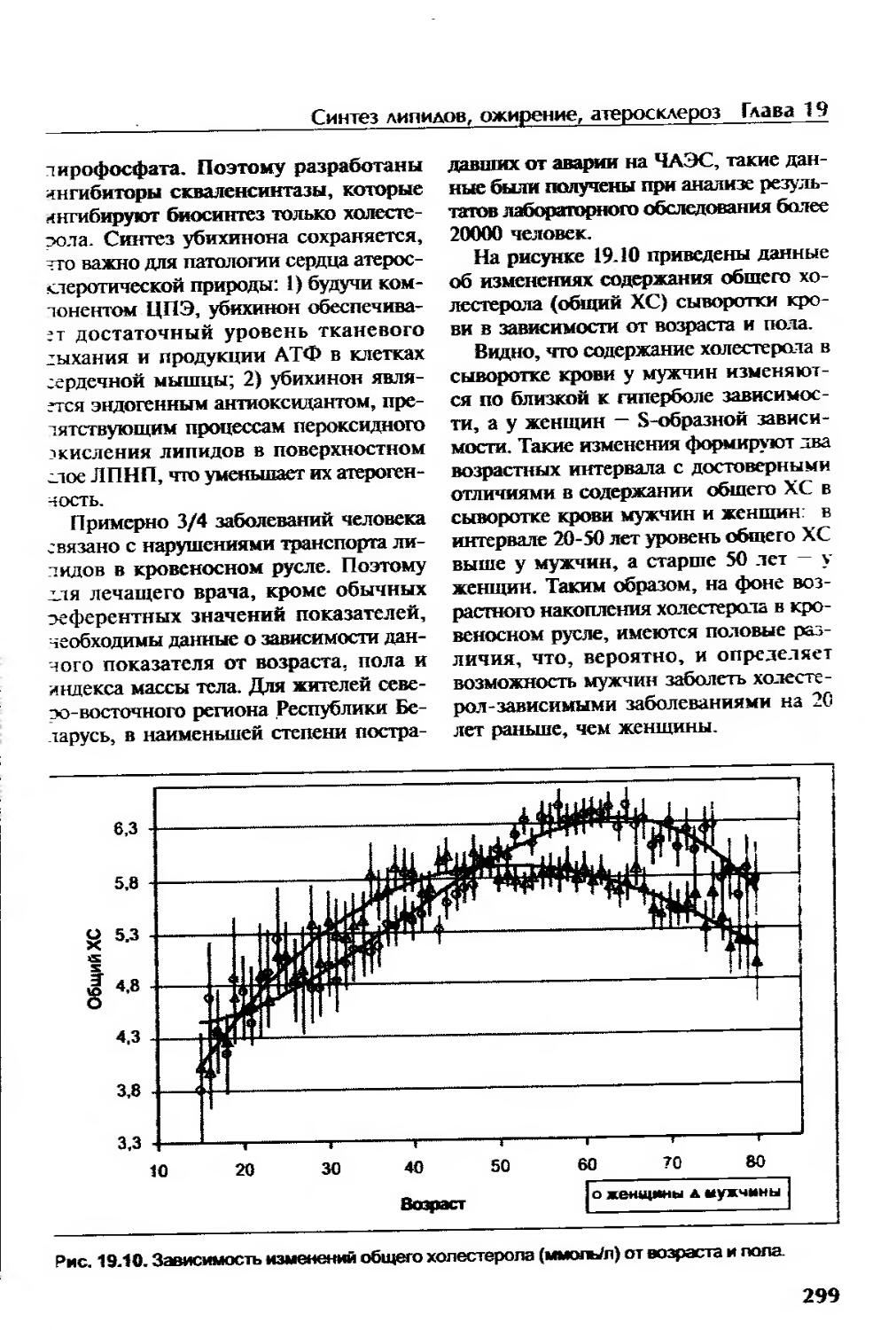
Атеросклероз..............................................................296
Глава 20
Обмен белков.......................................................... .....300
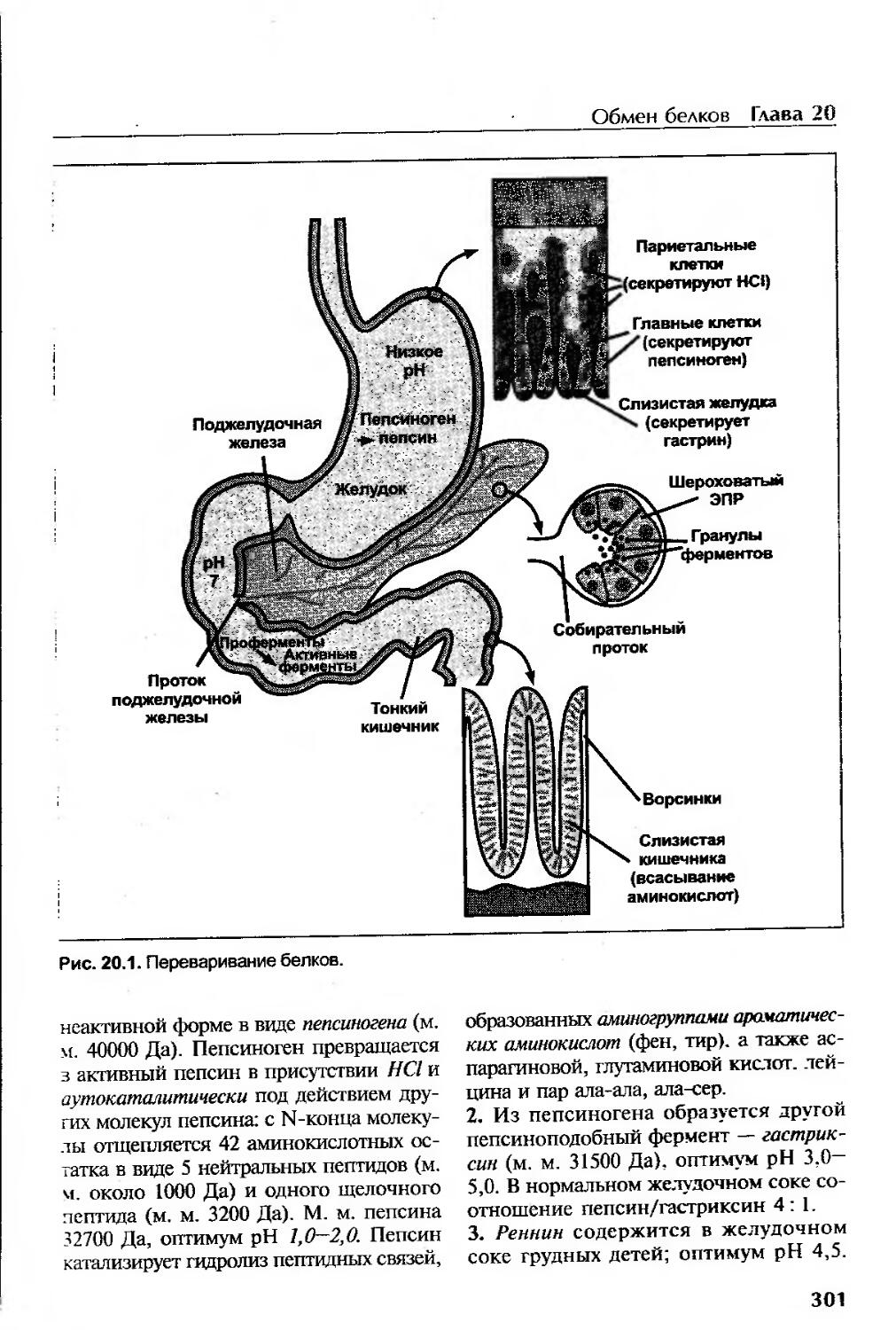
Переваривание белков......................................................300
Гниение белков в кишечнике................................................303
Всасывание аминокислот....................................................303
Всасывание интактных белков и пептидов.................................. 304
Аминокислотный фонд организма.............................................304
Источники аминокислот..................................................304
Протеолиз тканевых белков животных.....................................305
Пути расходования аминокислот..........................................308
Типичные реакции обмена аминокислот.......................................309
Трансаминирование.........................................................309
Дезаминирование аминокислот...............................................310
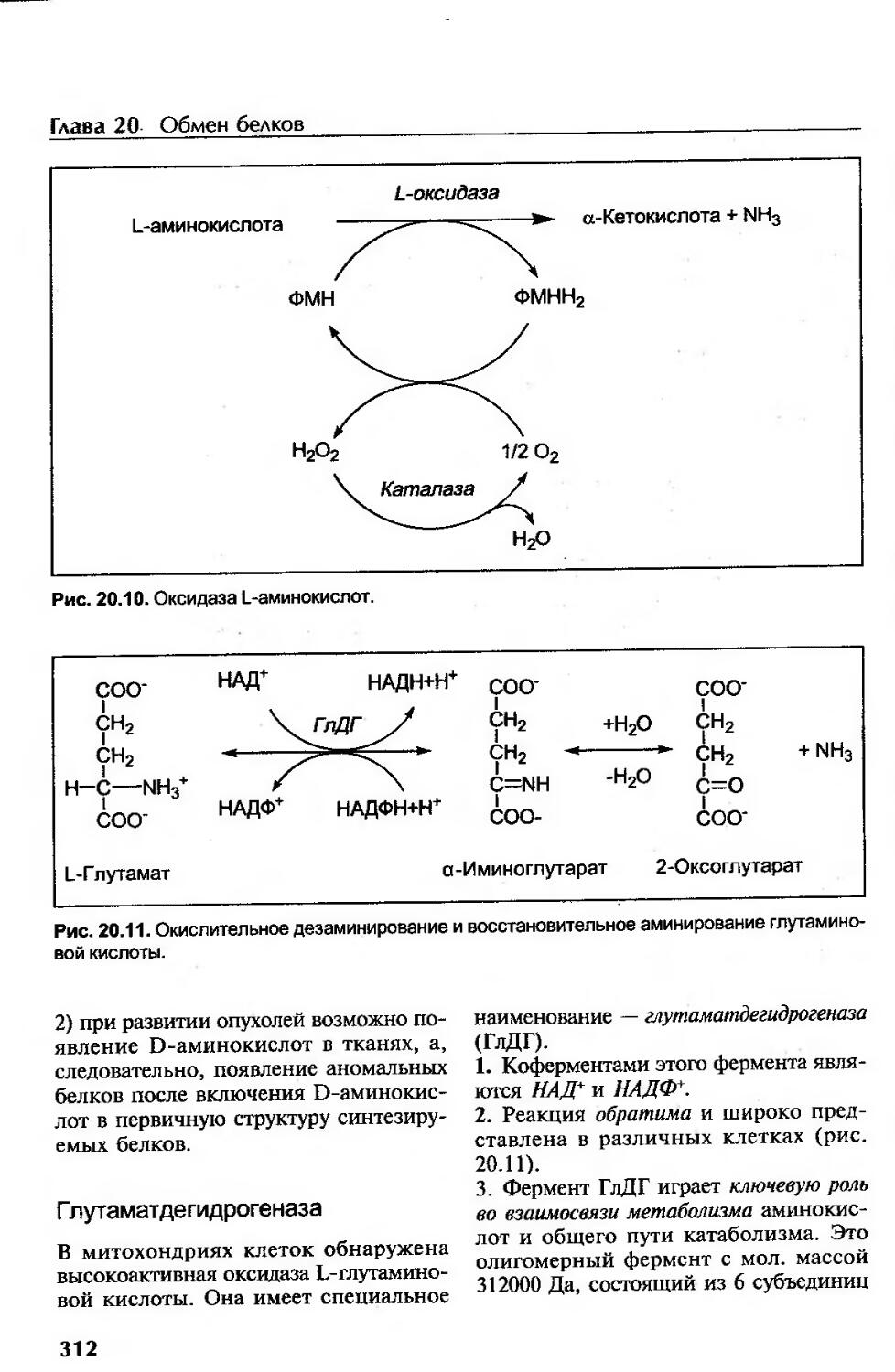
Окислительное дезаминирование аминокислот..............................311
Г лутаматдегидрогеназа..................................................312
Непрямое дезаминирование аминокислот...................................313
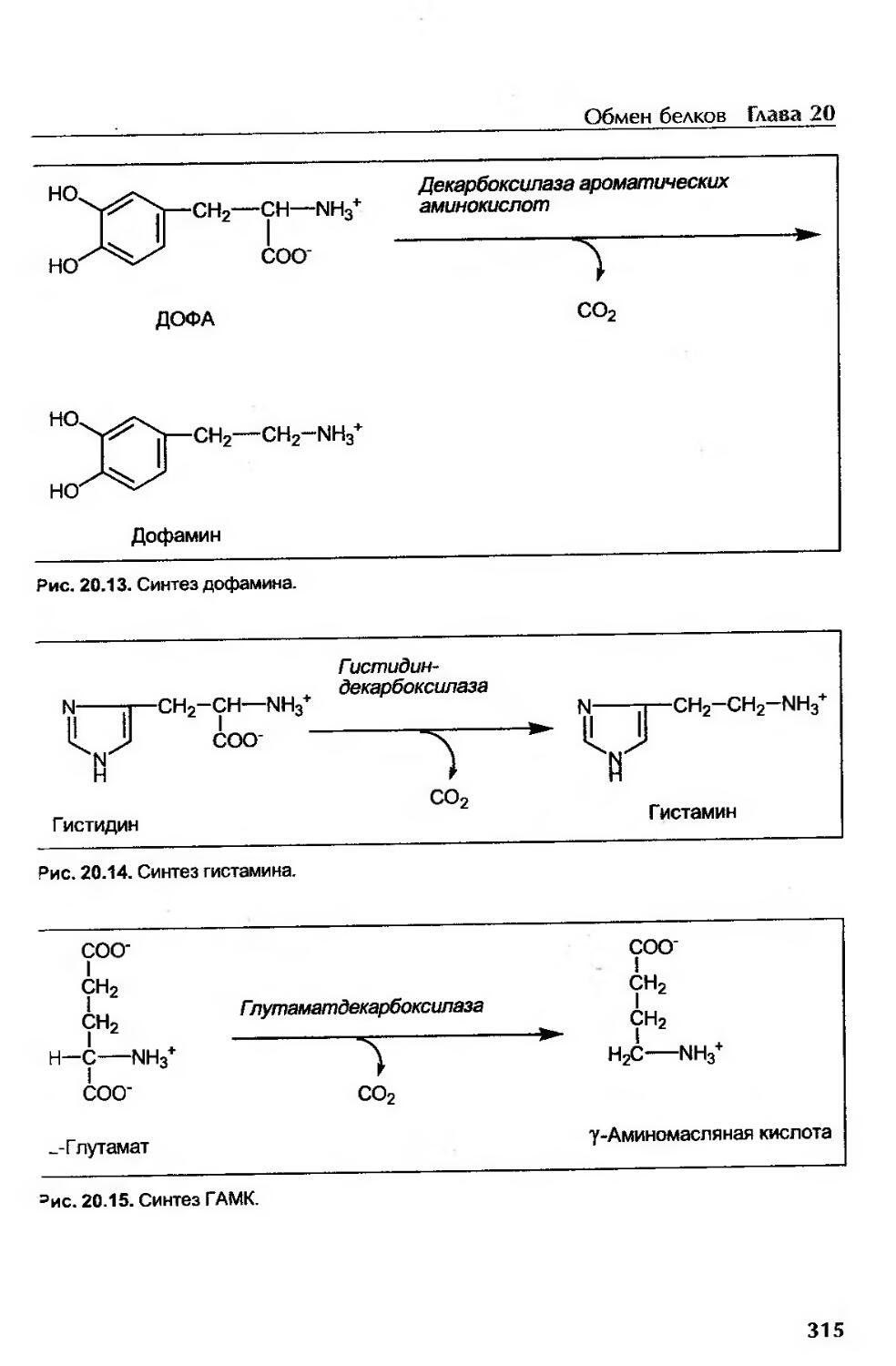
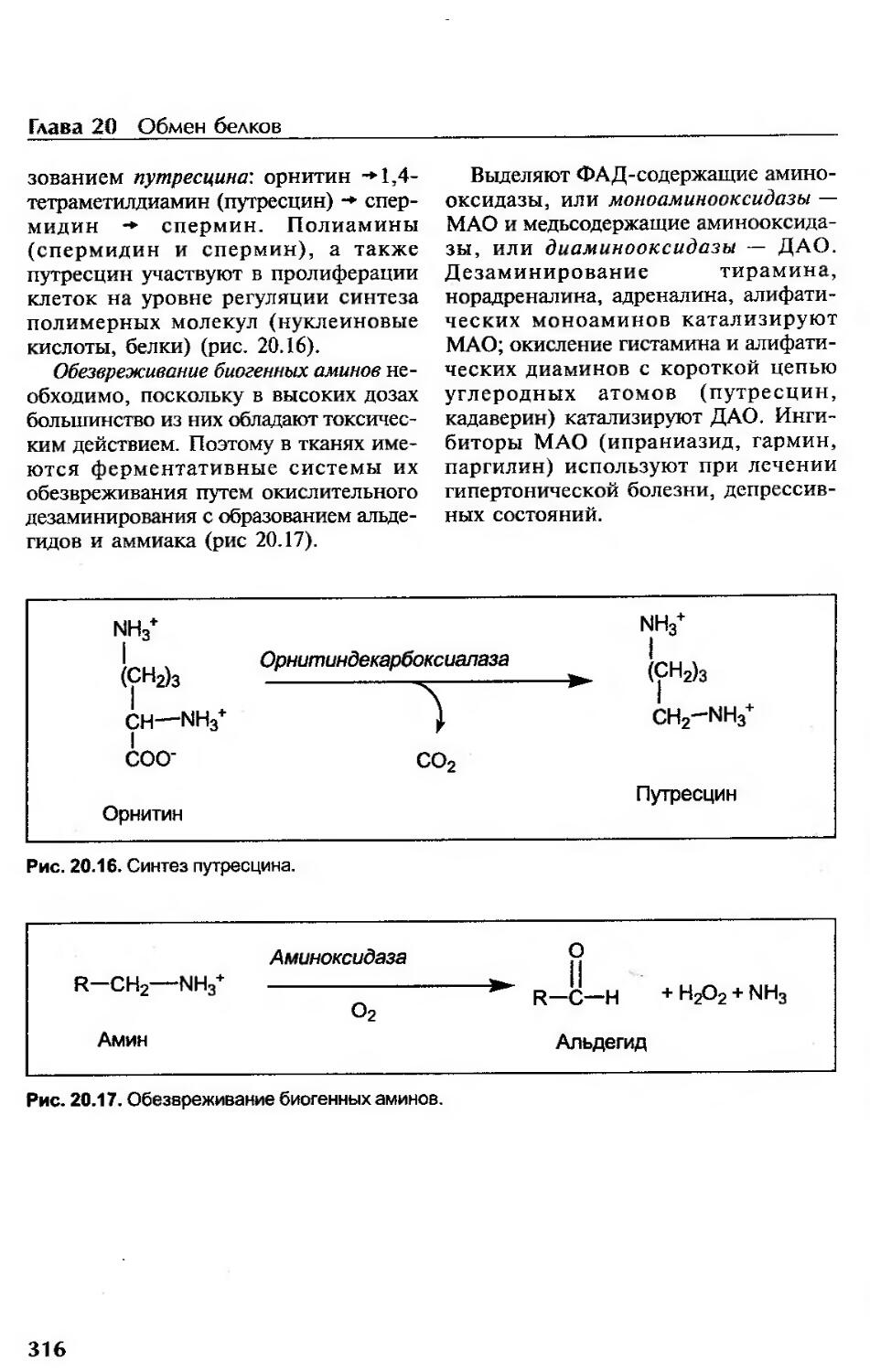
Декарбоксилирование аминокислот...........................................313
Глава 21
Источники и пути обезвреживания аммиака в организме....................*......317
Местное обезвреживание аммиака............................................318
Общее обезвреживание аммиака..............................................320
Образование и выведение аммонийных солей...............................320
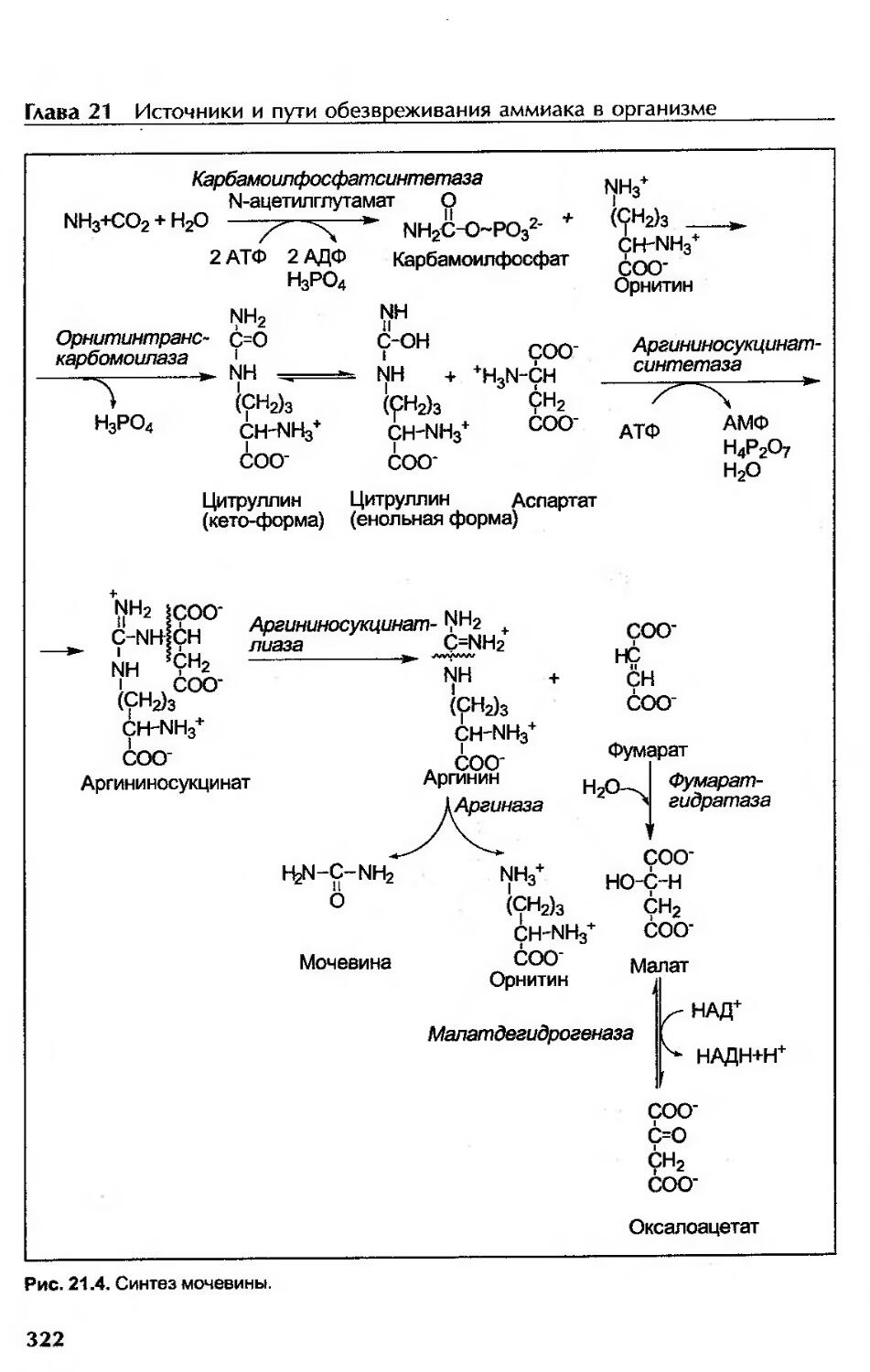
Биосинтез мочевины.....................................................320
Гипераммониемии...................................................324
"лава 22
Обмен отдельных аминокислот..................................................327
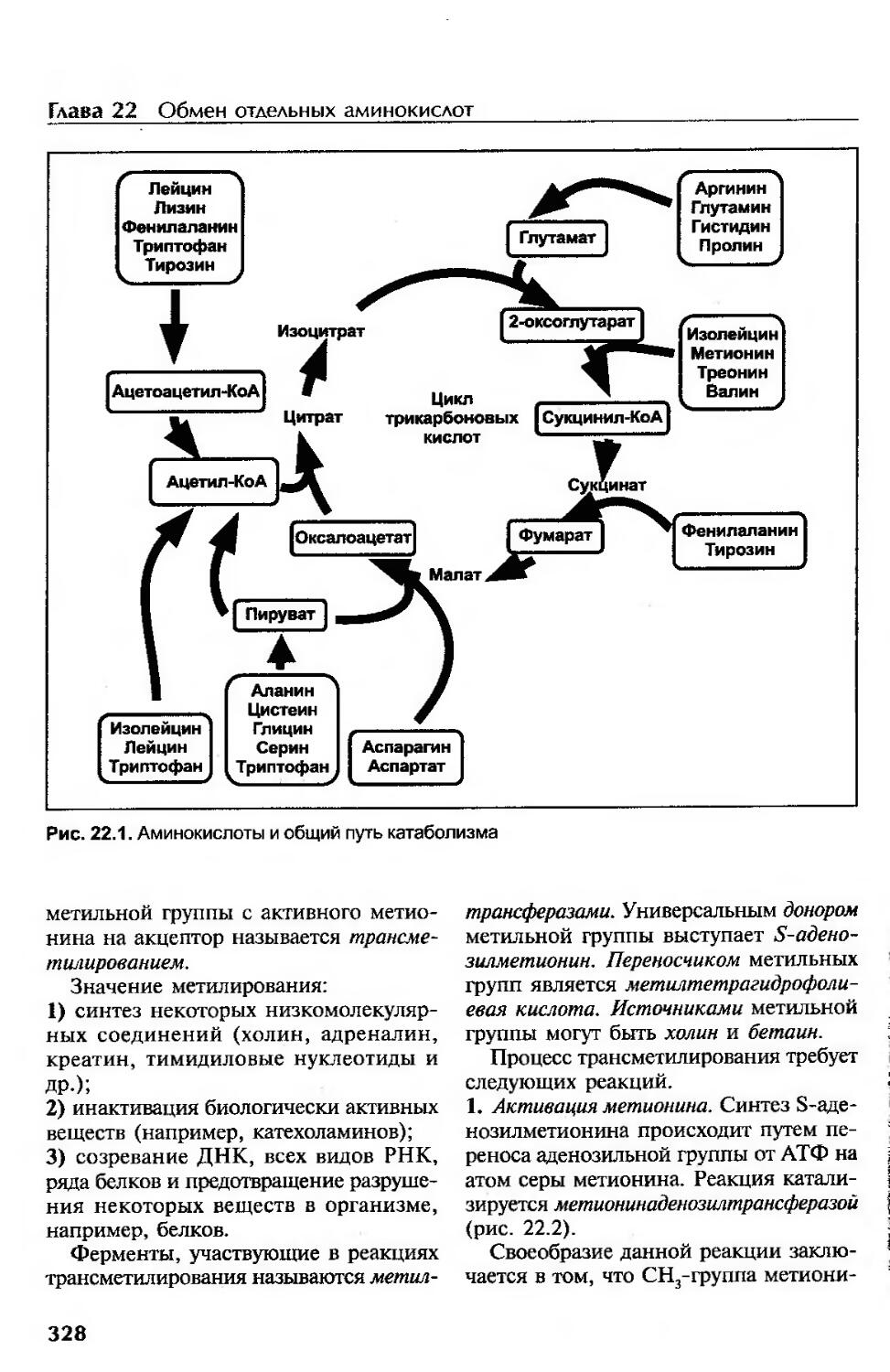
Превращение углеродного скелета аминокислот...............................327
Метилирование и трансметилирование........................................327
ix
Содержание
Наиболее важные реакции метилирования..................................329
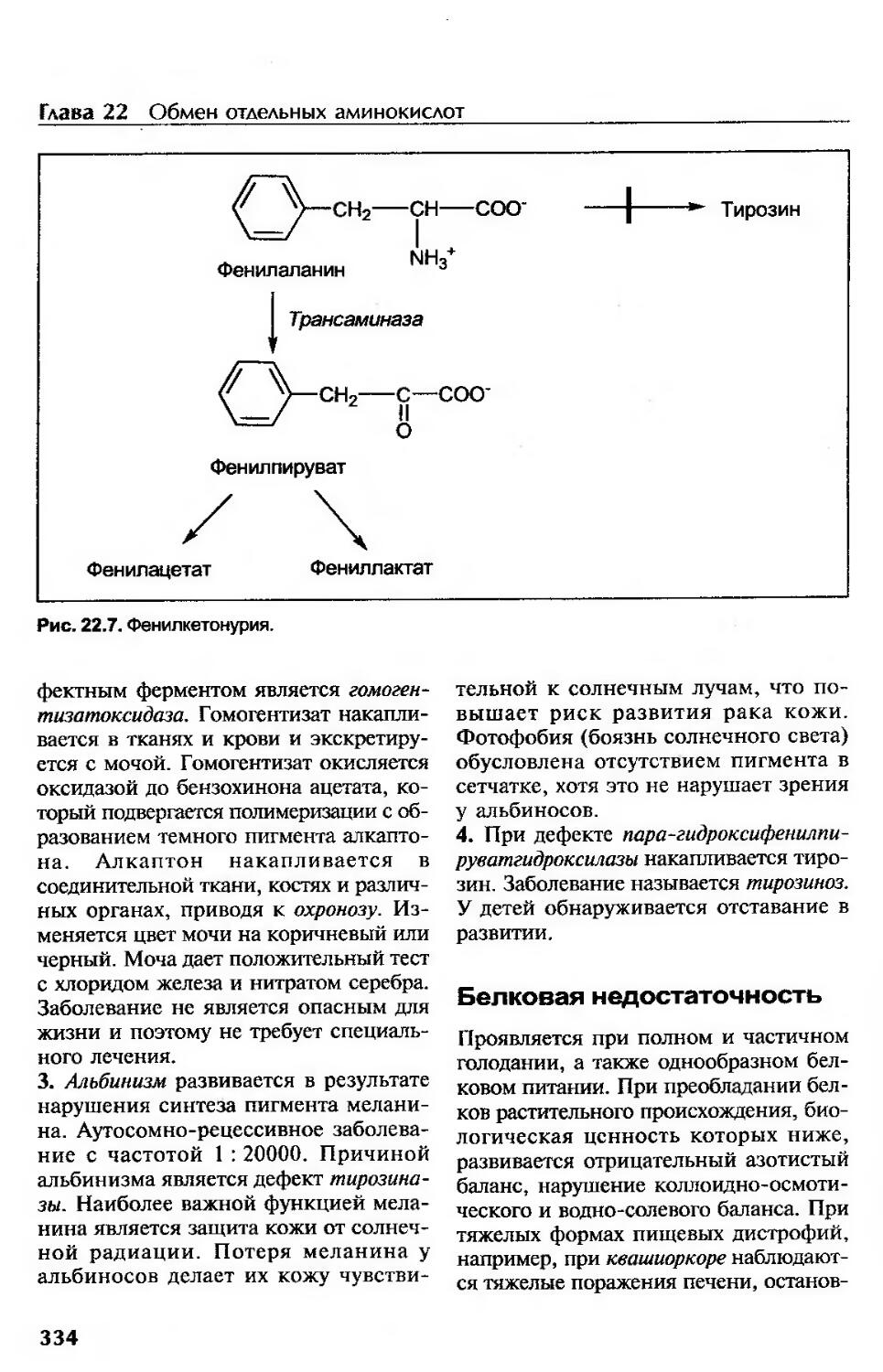
Метаболизм фенилаланина и тирозина........................................331
Нарушение обмена фенилаланина (тирозина)..................................332
Белковая недостаточность..................................................334
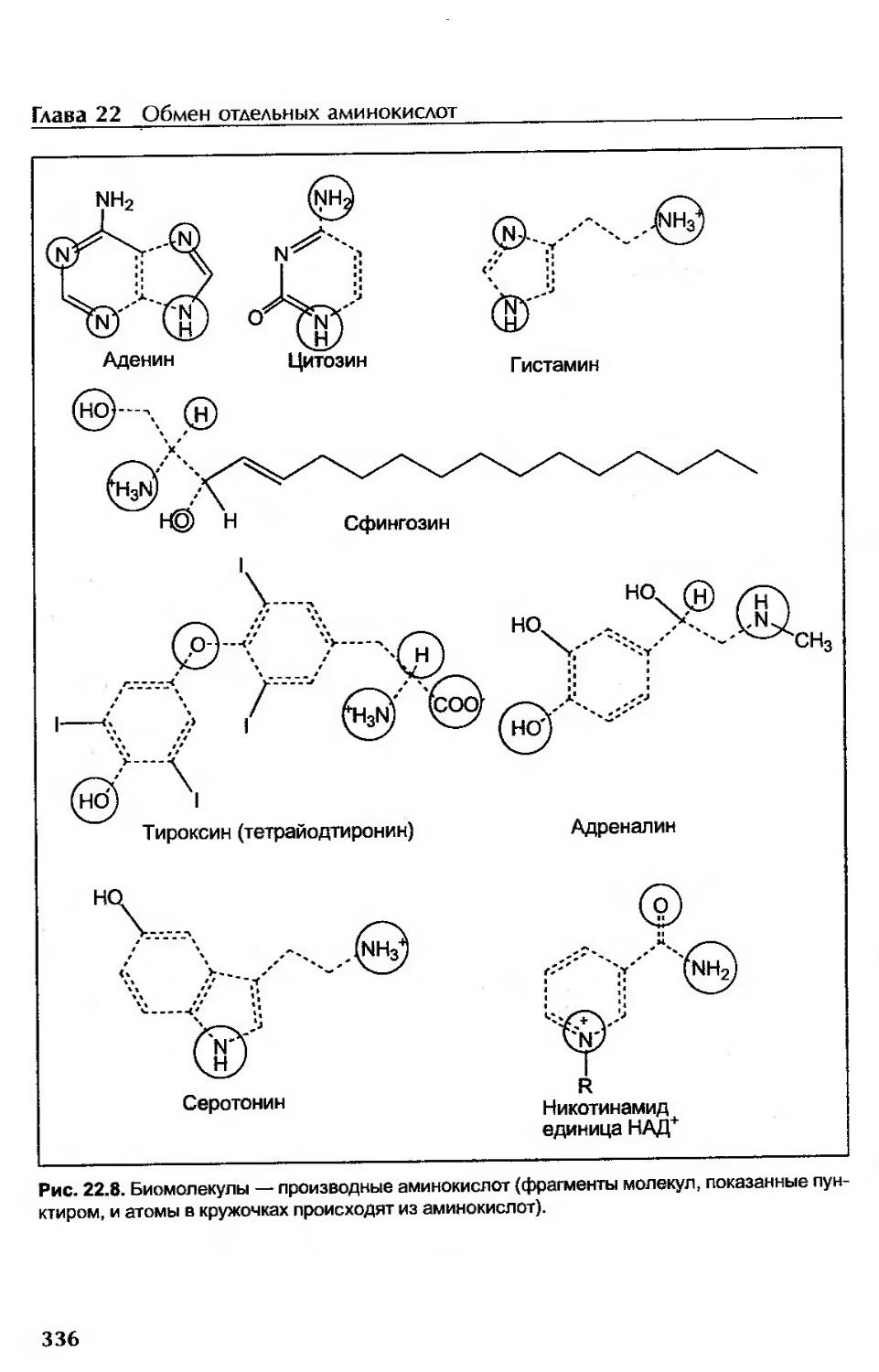
Аминокислоты — предшественники биологически активных веществ..............335
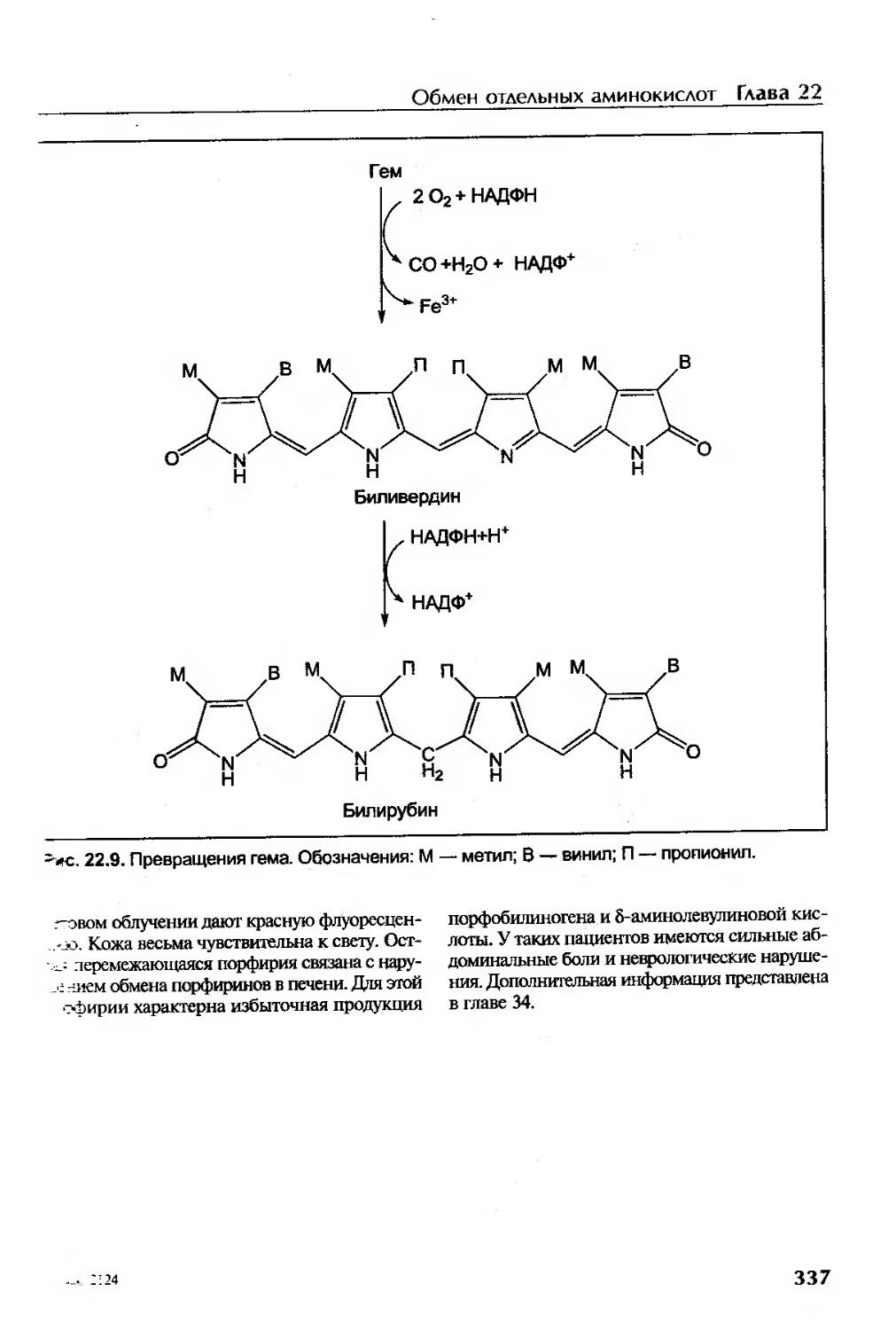
Синтез порфиринов. Порфирии...............................................335
Глава 23
Обмен нуклеотидов............................................................338
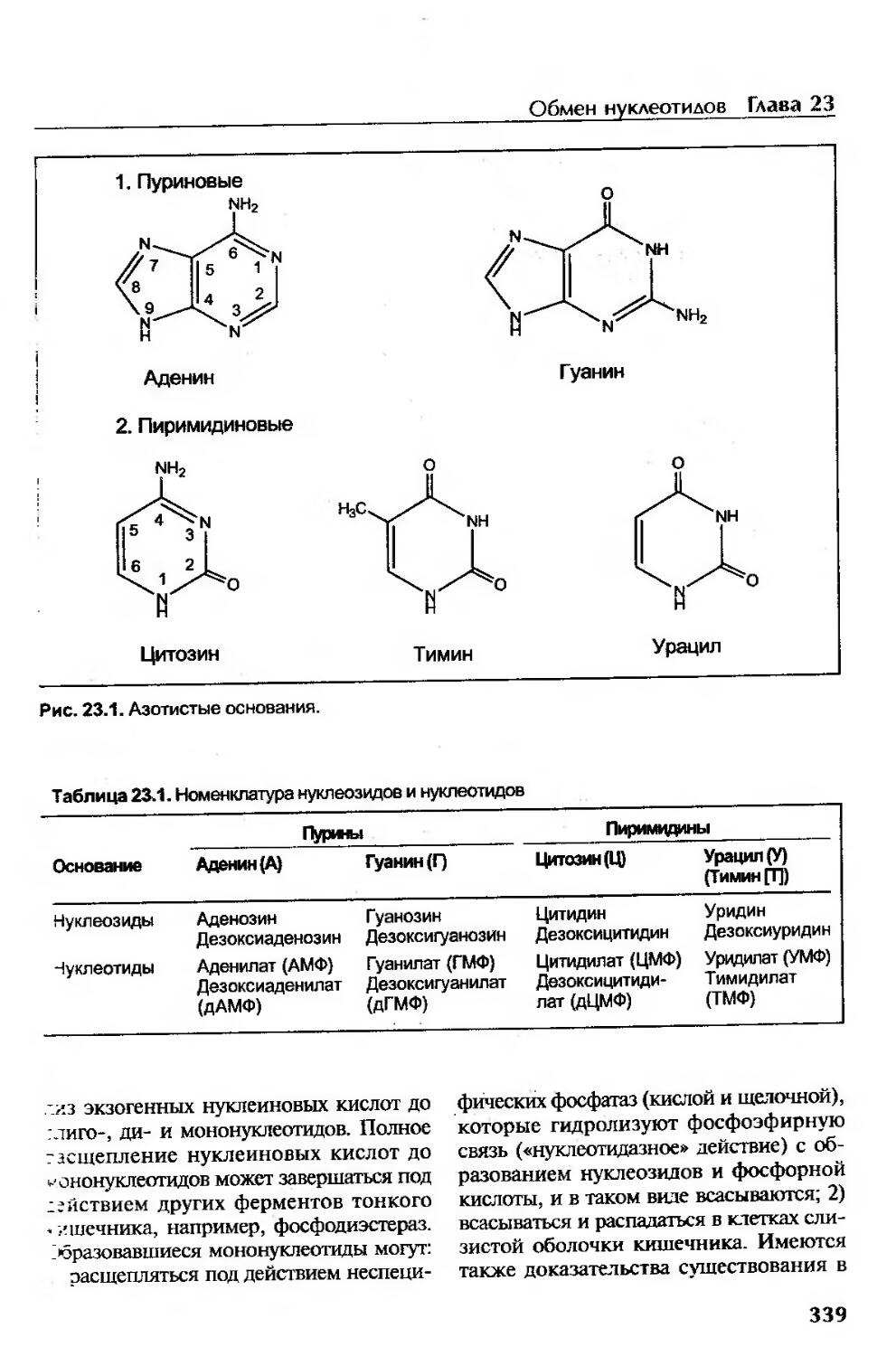
Азотистые основания, нуклеозиды и нуклеотиды..............................338
Нуклеазы..................................................................338
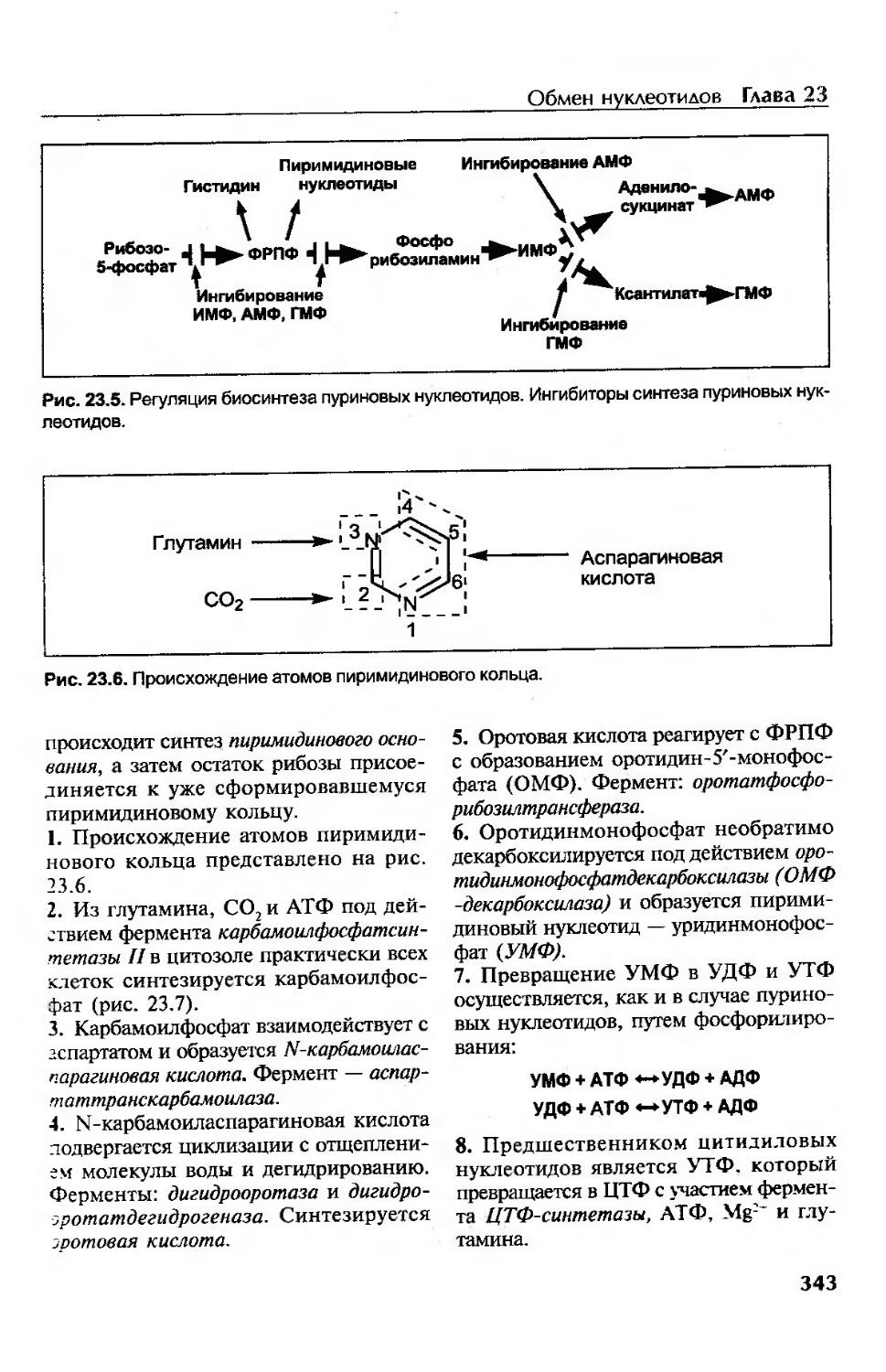
Синтез пуриновых нуклеотидов..............................................340
Альтернативный путь синтеза пуриновых нуклеотидов......................341
Регуляция синтеза пуриновых нуклеотидов................................341
Синтез пиримидиновых нуклеотидов..........................................341
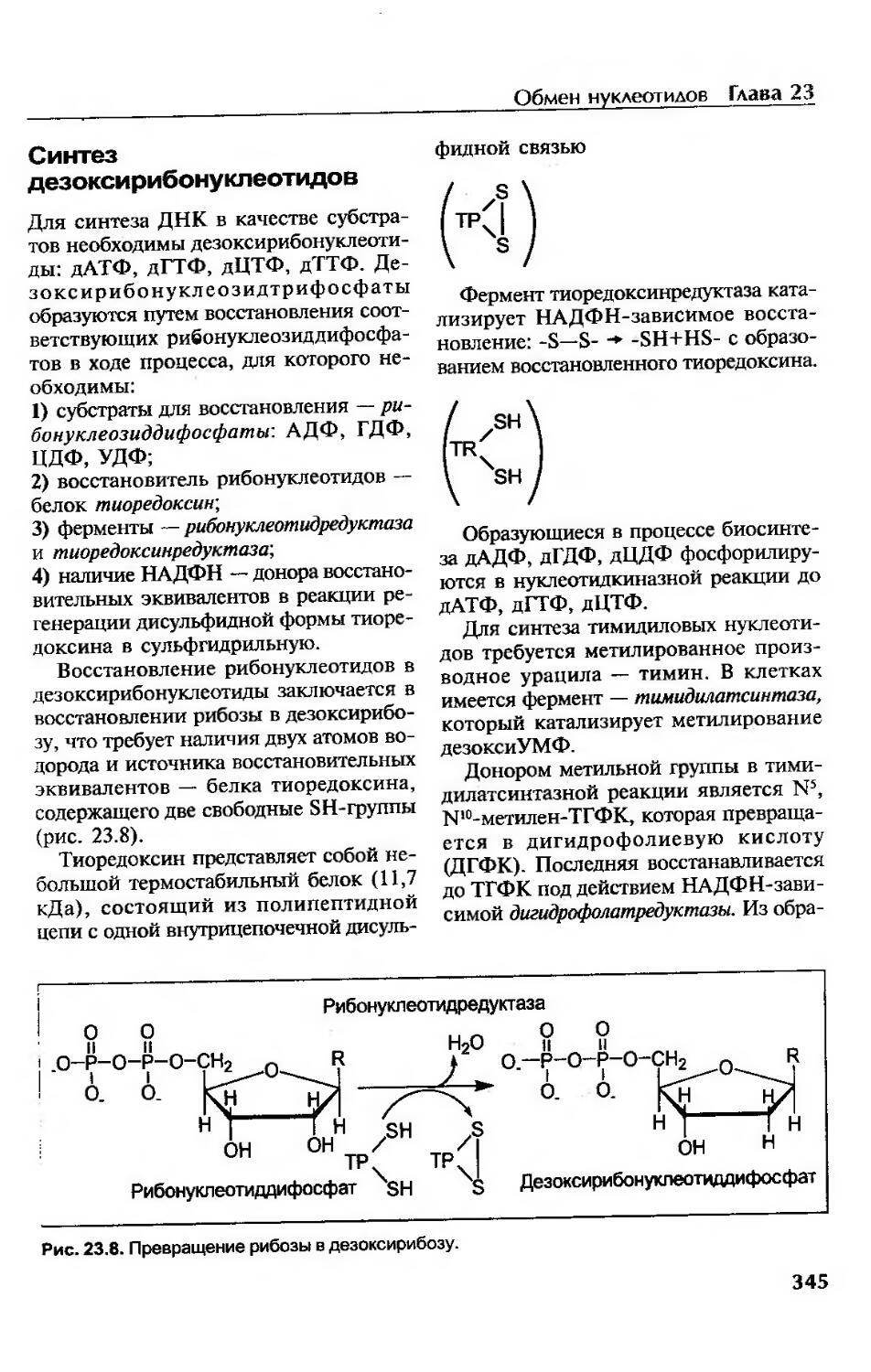
Синтез дезоксирибонуклеотидов.............................................345
Регуляция синтеза пиримидиновых нуклеотидов...............................346
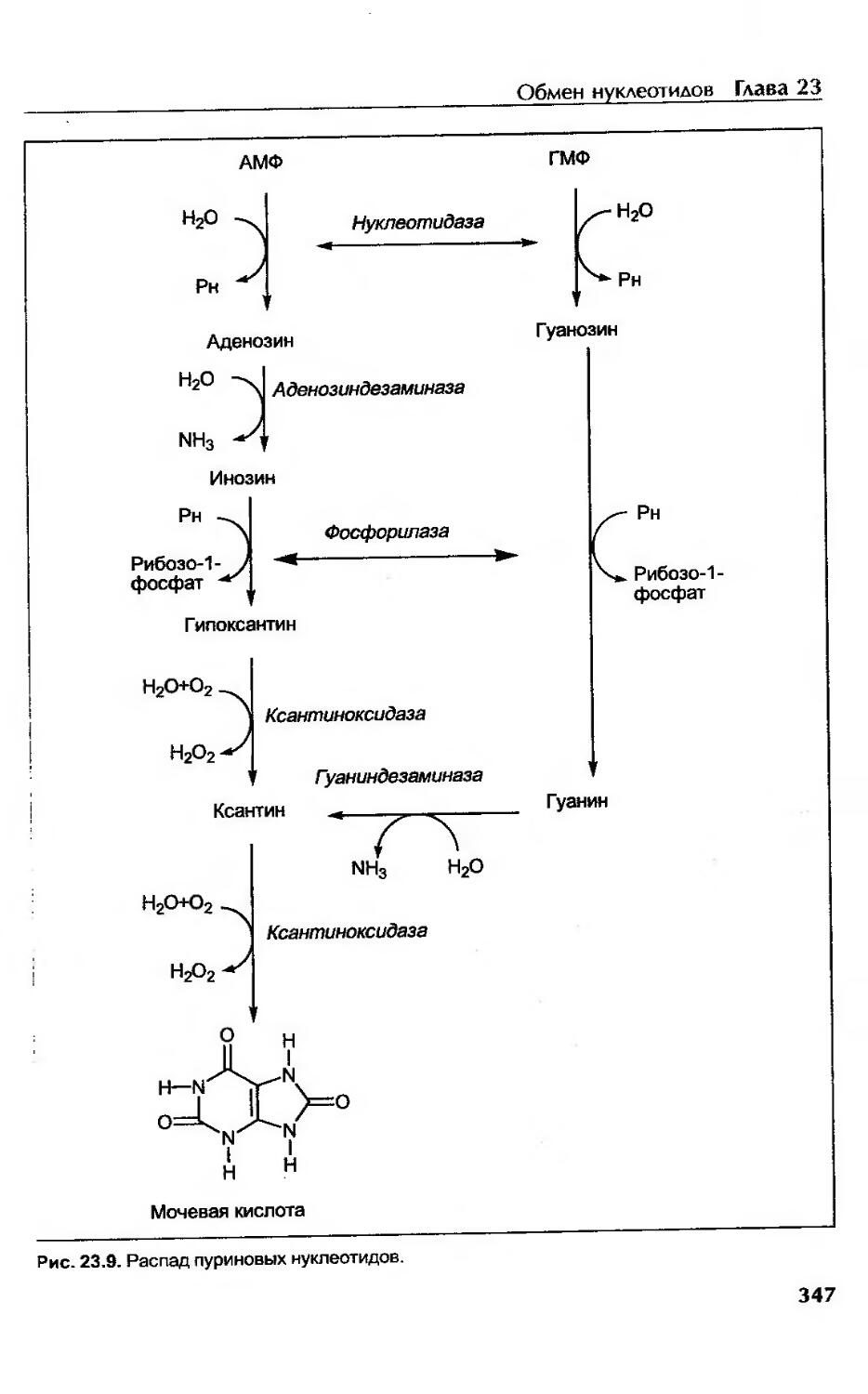
Распад пуриновых нуклеотидов..............................................346
Нарушения обмена пуриновых нуклеотидов....................................346
Распад пиримидиновых нуклеотидов.......................................... 349
Использование ингибиторов синтеза нуклеотидов.............................350
Глава 24
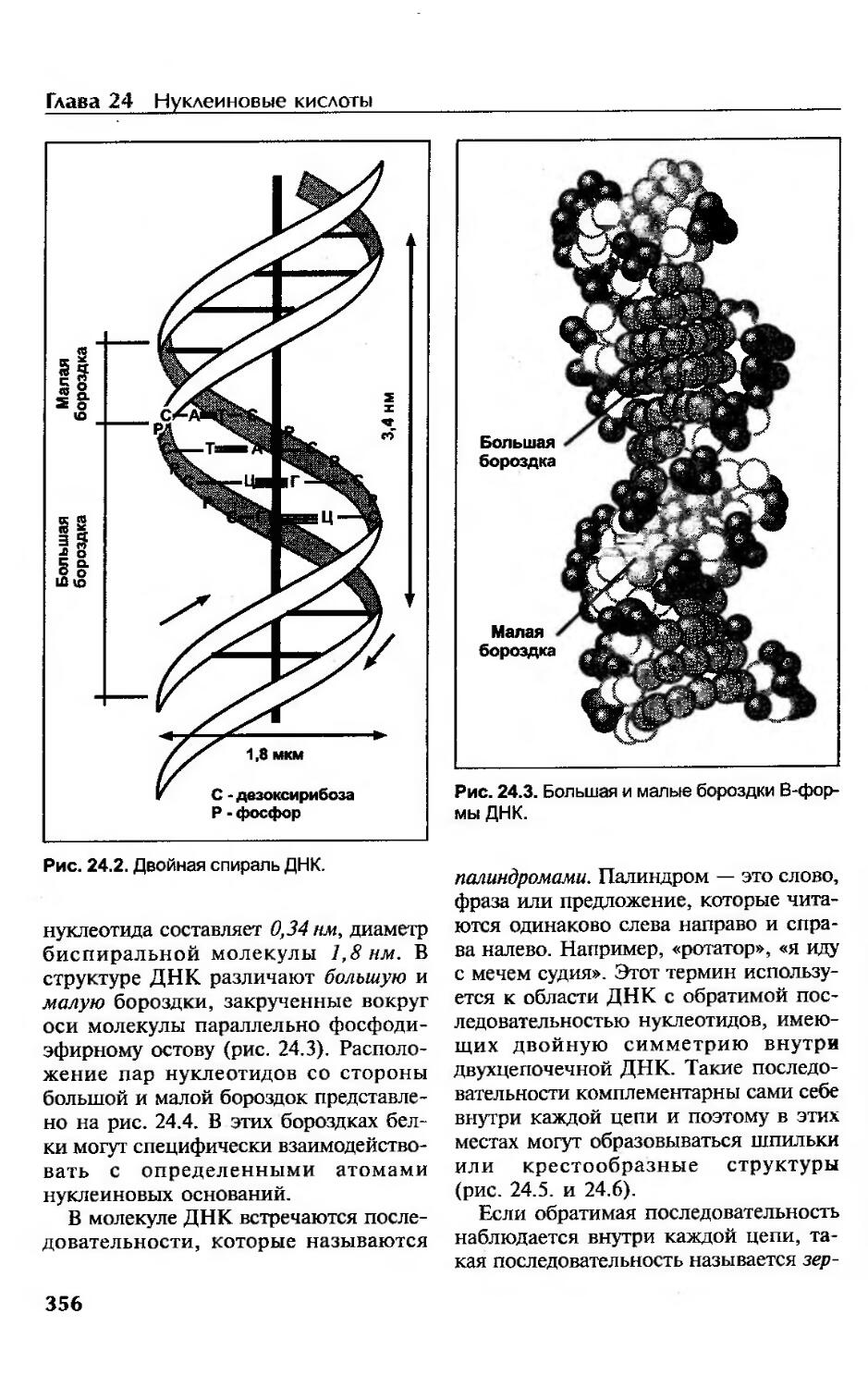
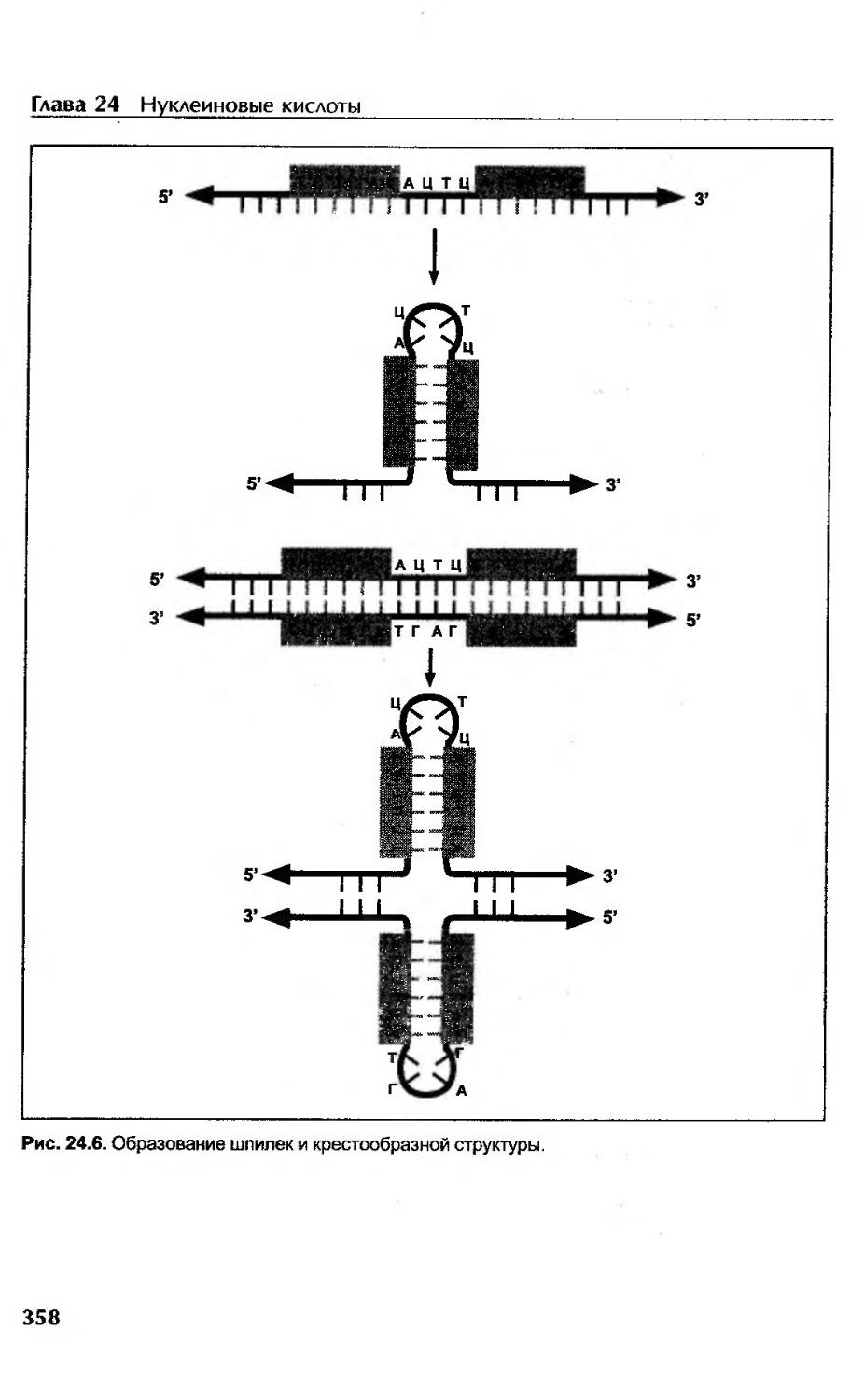
Нуклеиновые кислоты........................................-.................352
Нуклеопротеины............................................................352
ДНК и геном...............................................................352
Виды и функции ДНК........................................................353
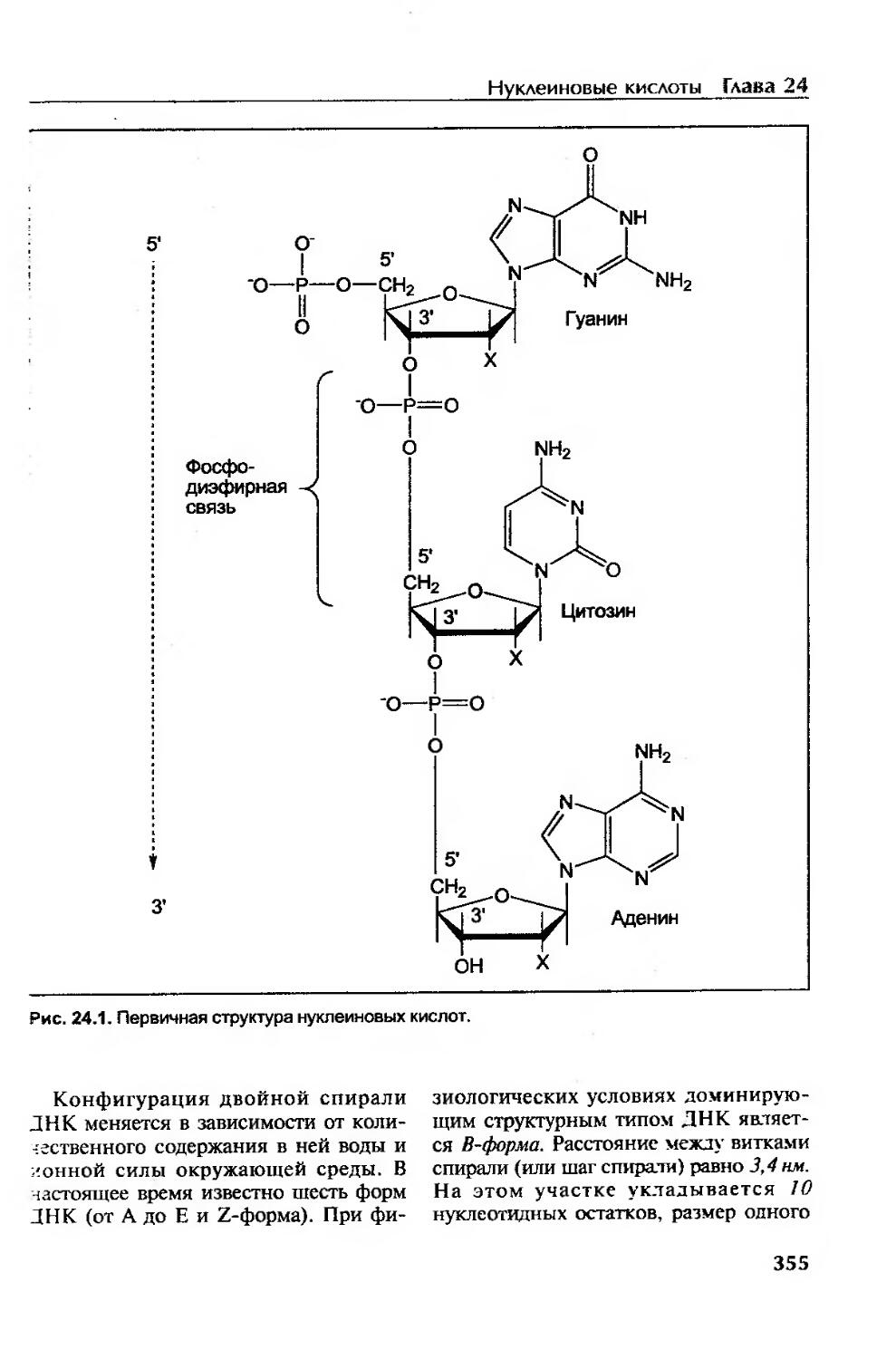
Первичная структура нуклеиновых кислот....................................354
Вторичная структура ДНК...................................................354
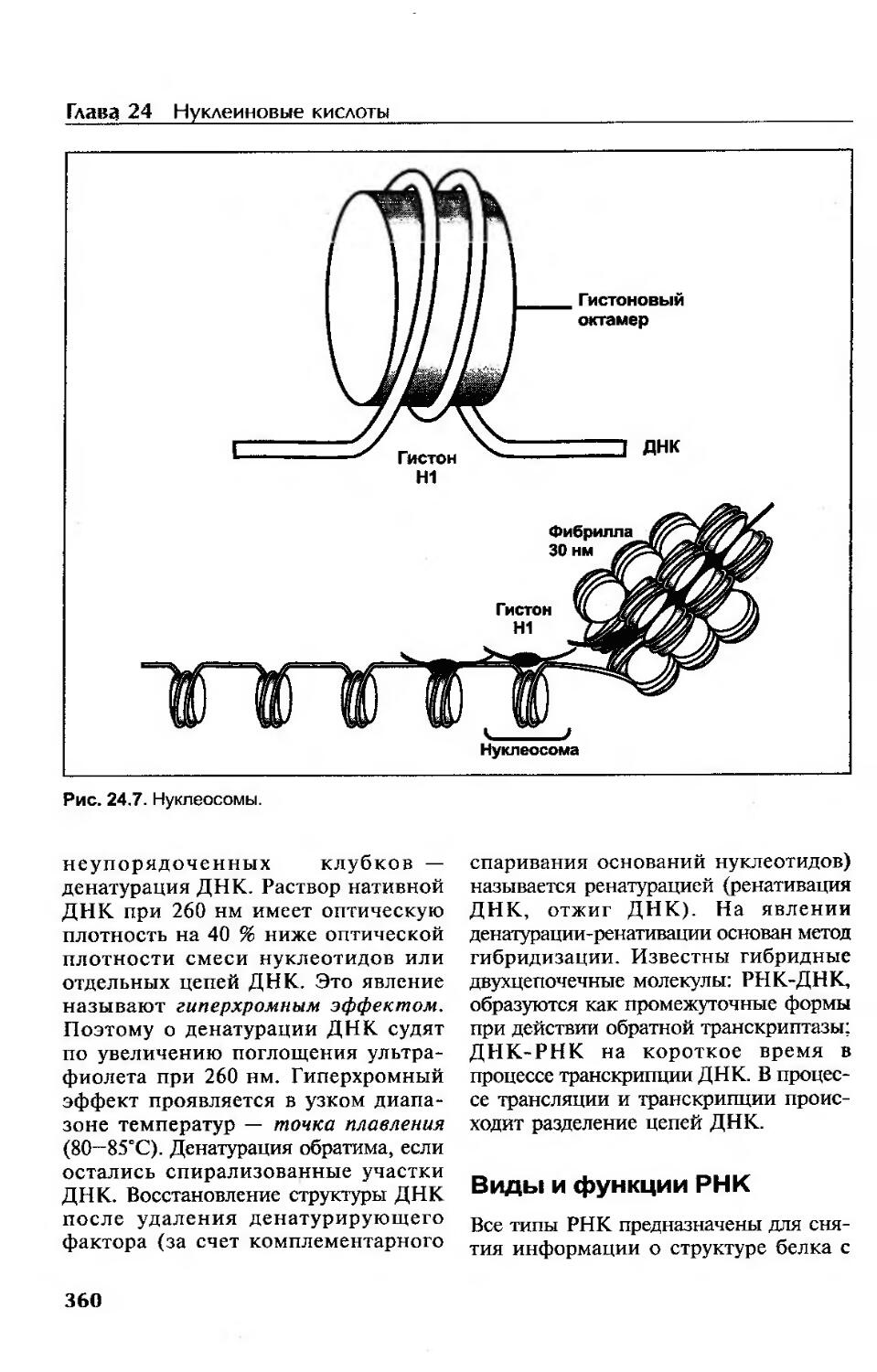
Третичная структура ДНК...................................................359
Денатурация и ренатурация ДНК.............................................359
Виды и функции РНК........................................................360
Методы исследования нуклеиновых кислот....................................363
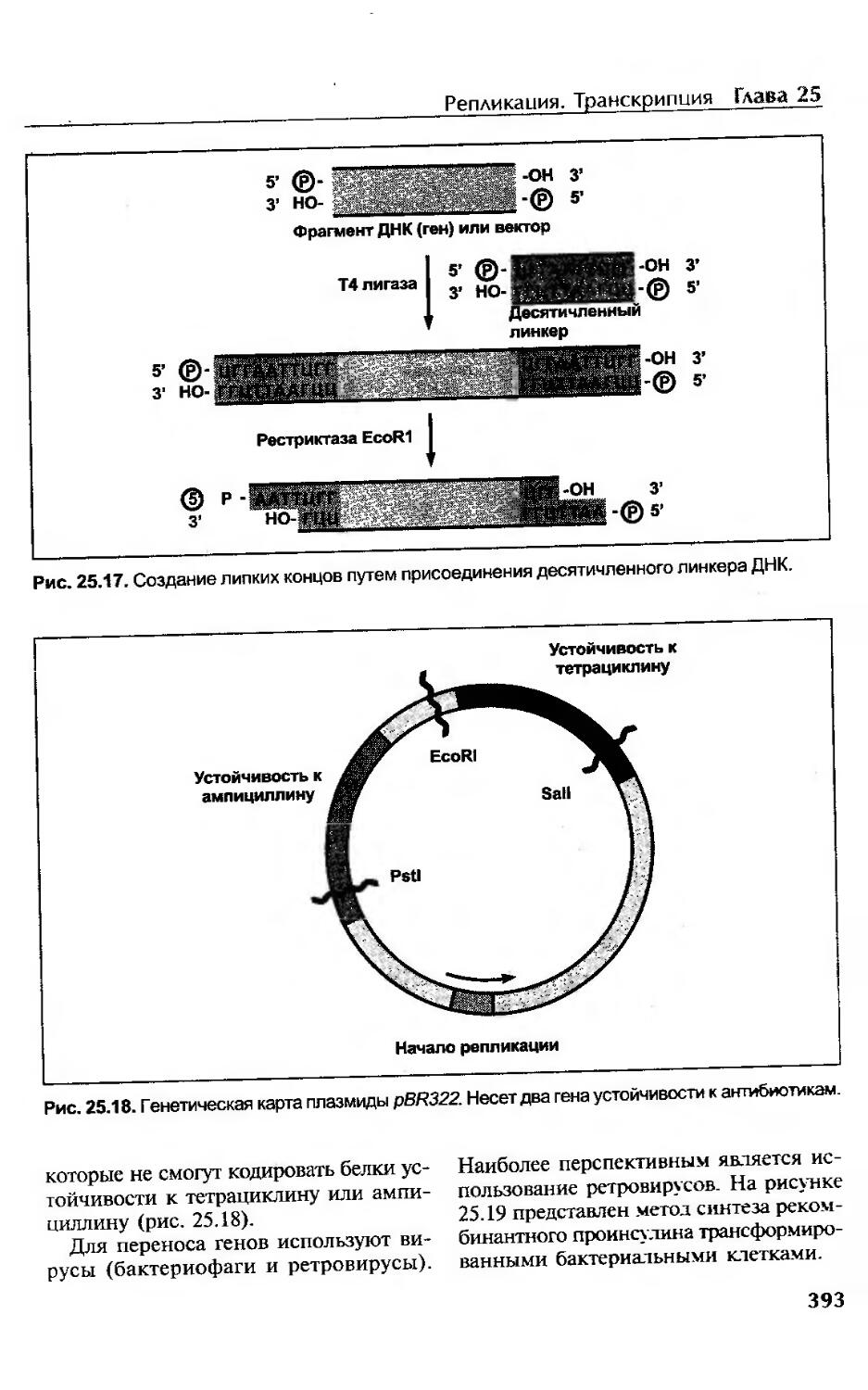
Рестриктазы............................................................364
Методы исследования продуктов расщепления рестриктазами................364
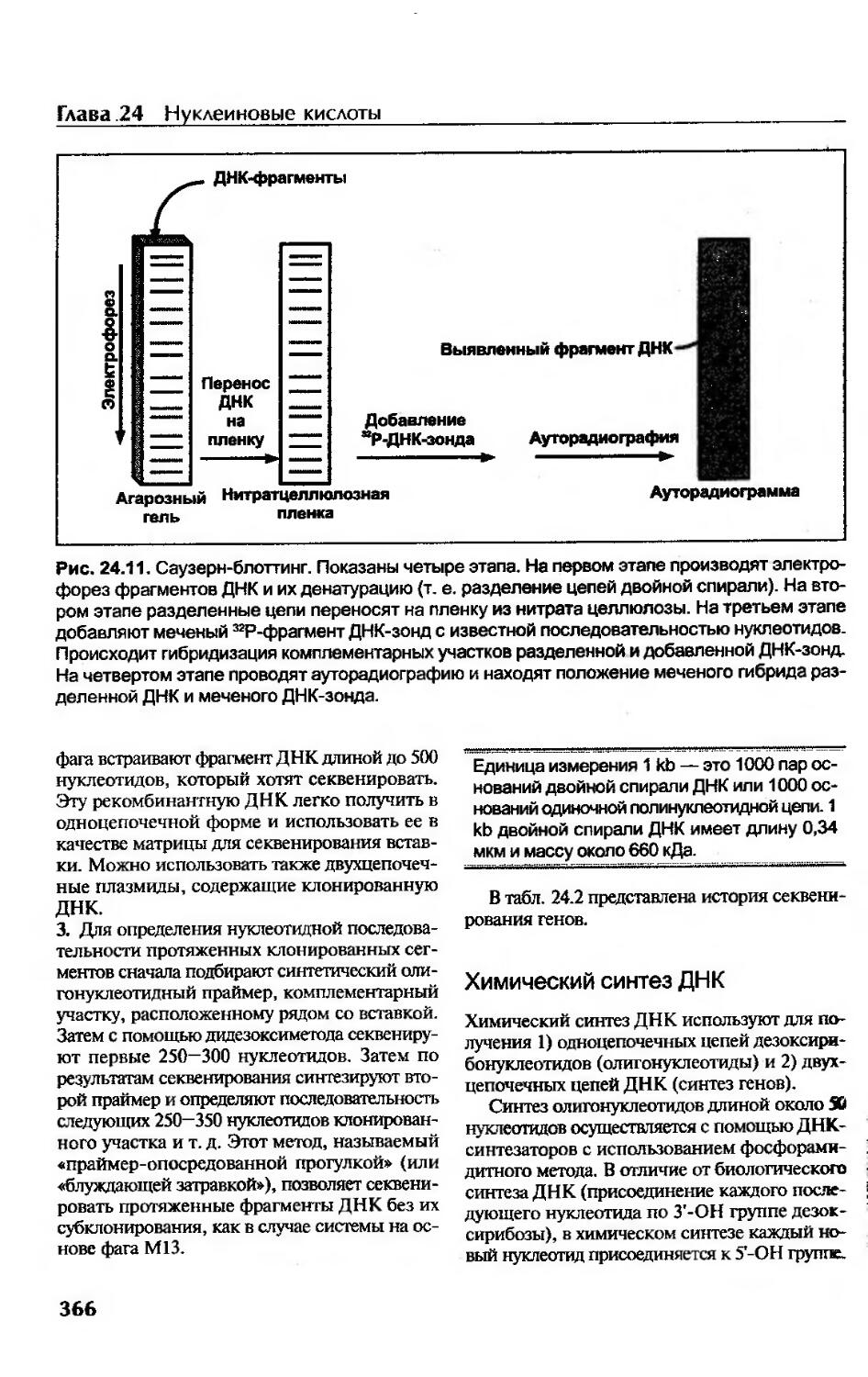
Саузерн-блоттинг.......................................................365
Секвенирование ДНК.....................................................365
Химический синтез ДНК..................................................366
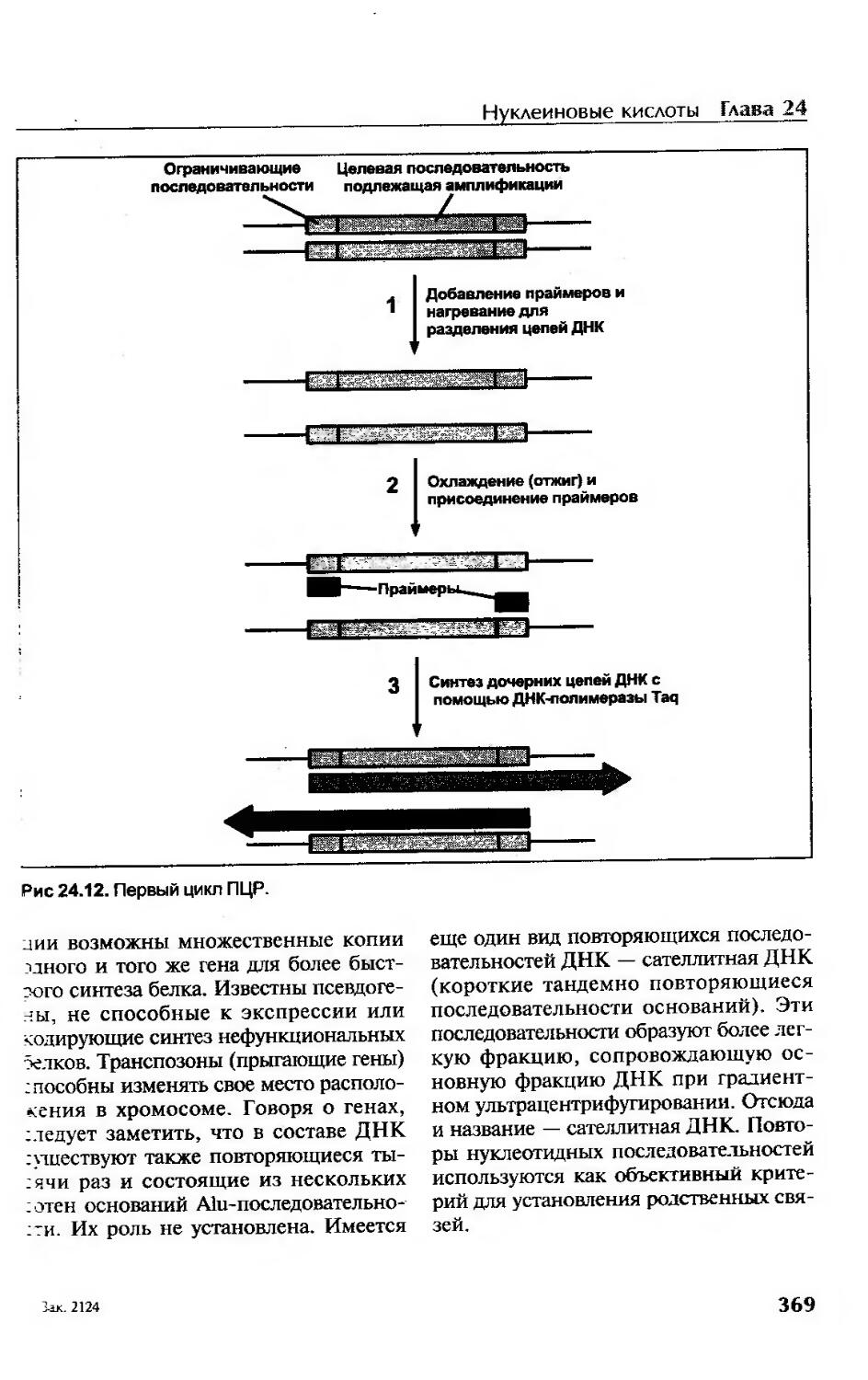
Полимеразная цепная реакция............................................367
ДНК как носитель генов....................................................368
Глава 25
Репликация. Транскрипция................................................... 370
Репликация................................................................370
Условия, необходимые для репликации....................................371
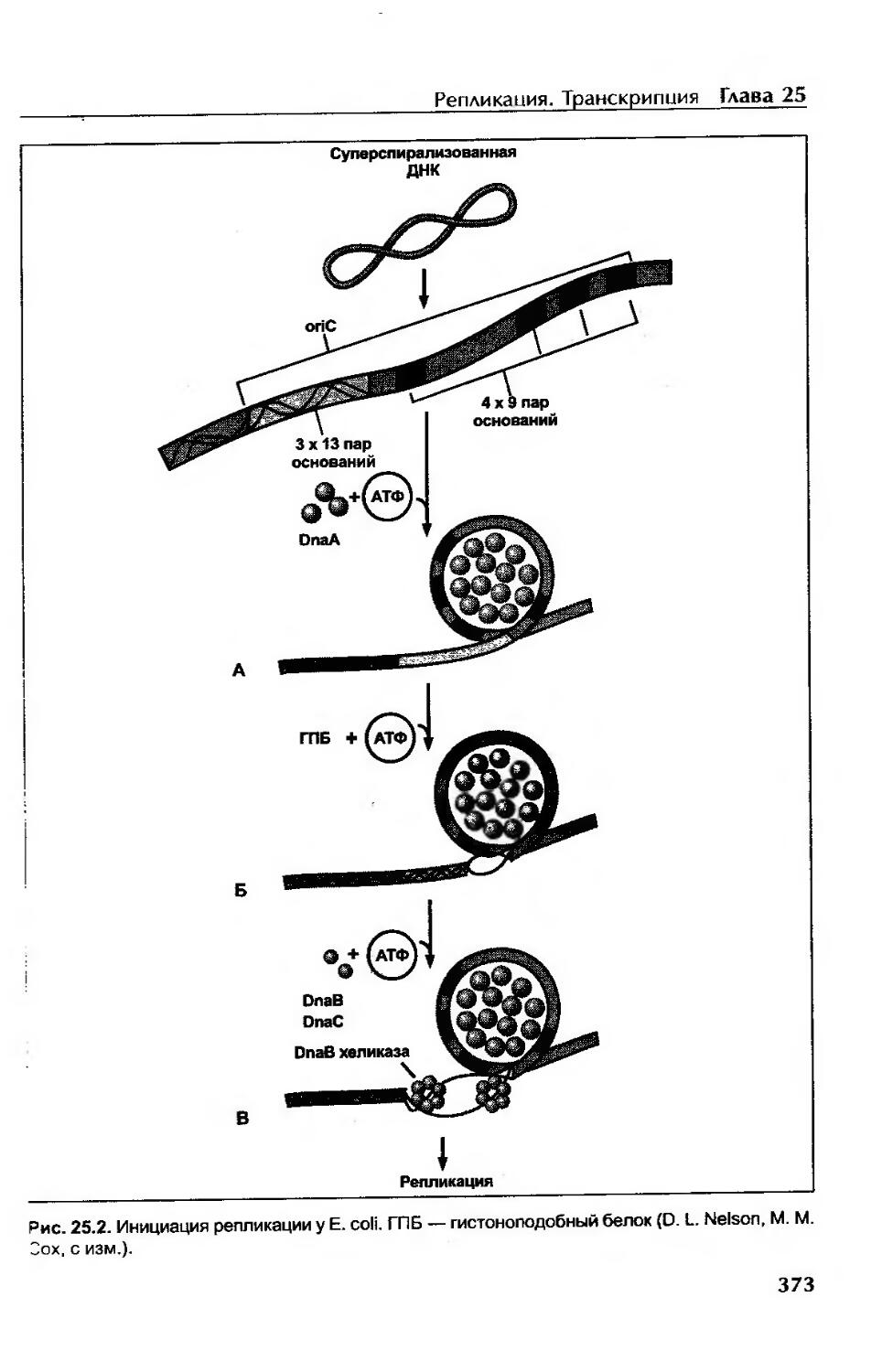
Стадия инициации.......................................................372
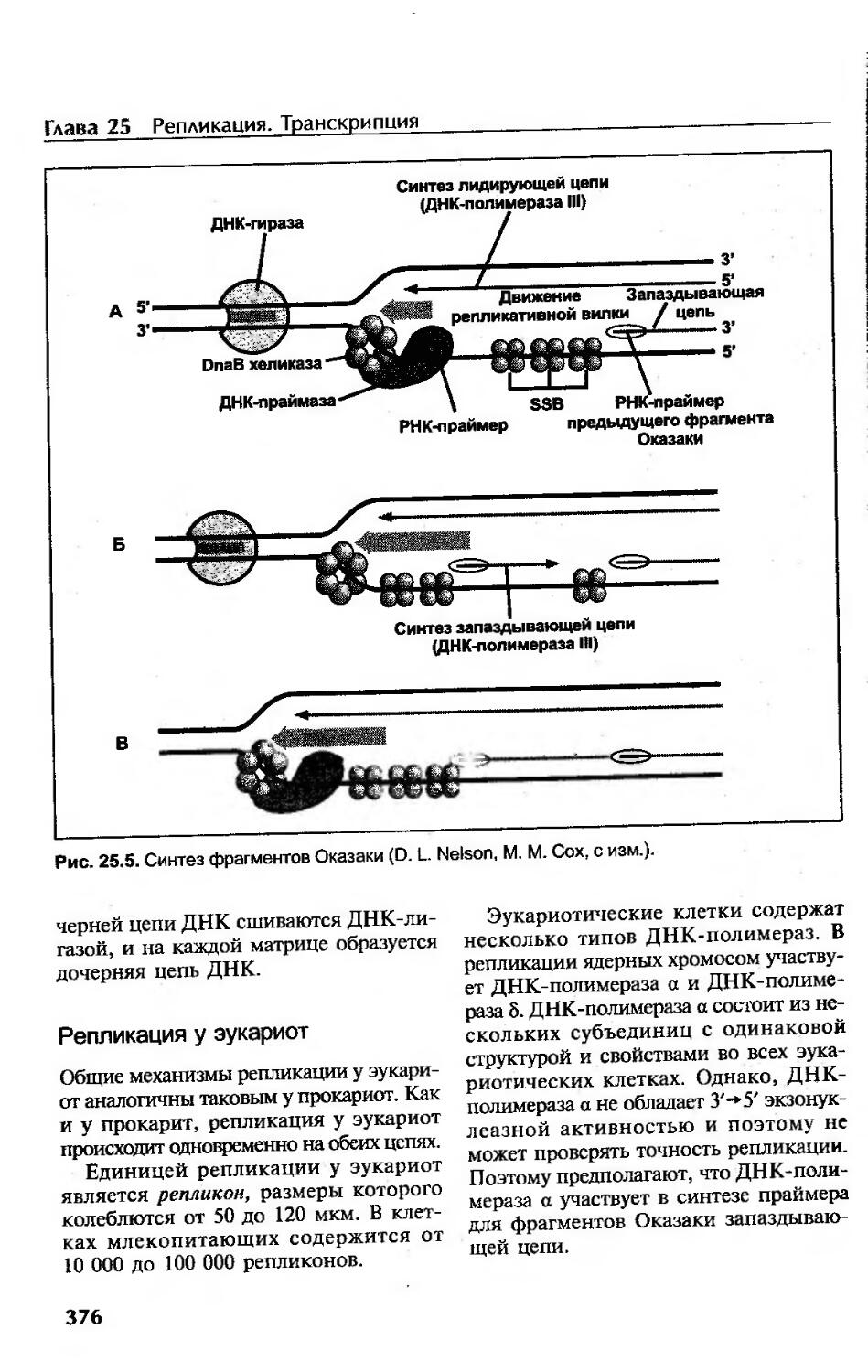
Стадия элонгации................................................... 374
Стадия терминации......................................................375
Репликация у эукариот..................................................376
Теломеры...............................................................377
Повреждения ДНК...........................................................378
Репаративный синтез ДНК................................................379
х
Содержание
Транскрипция...........................................................................................382
Факторы, необходимые для транскрипции .............................................................................383
Механизм транскрипции..............................................................................384
Посттранскрипционная модификация РНК...............................................................386
Обратная транскрипция..............................................................................388
Современная трактовка основного постулата молекулярной биологии........................................391
Конструирование молекулы ДНК в лабораторных условиях...................................................391
Глава 26
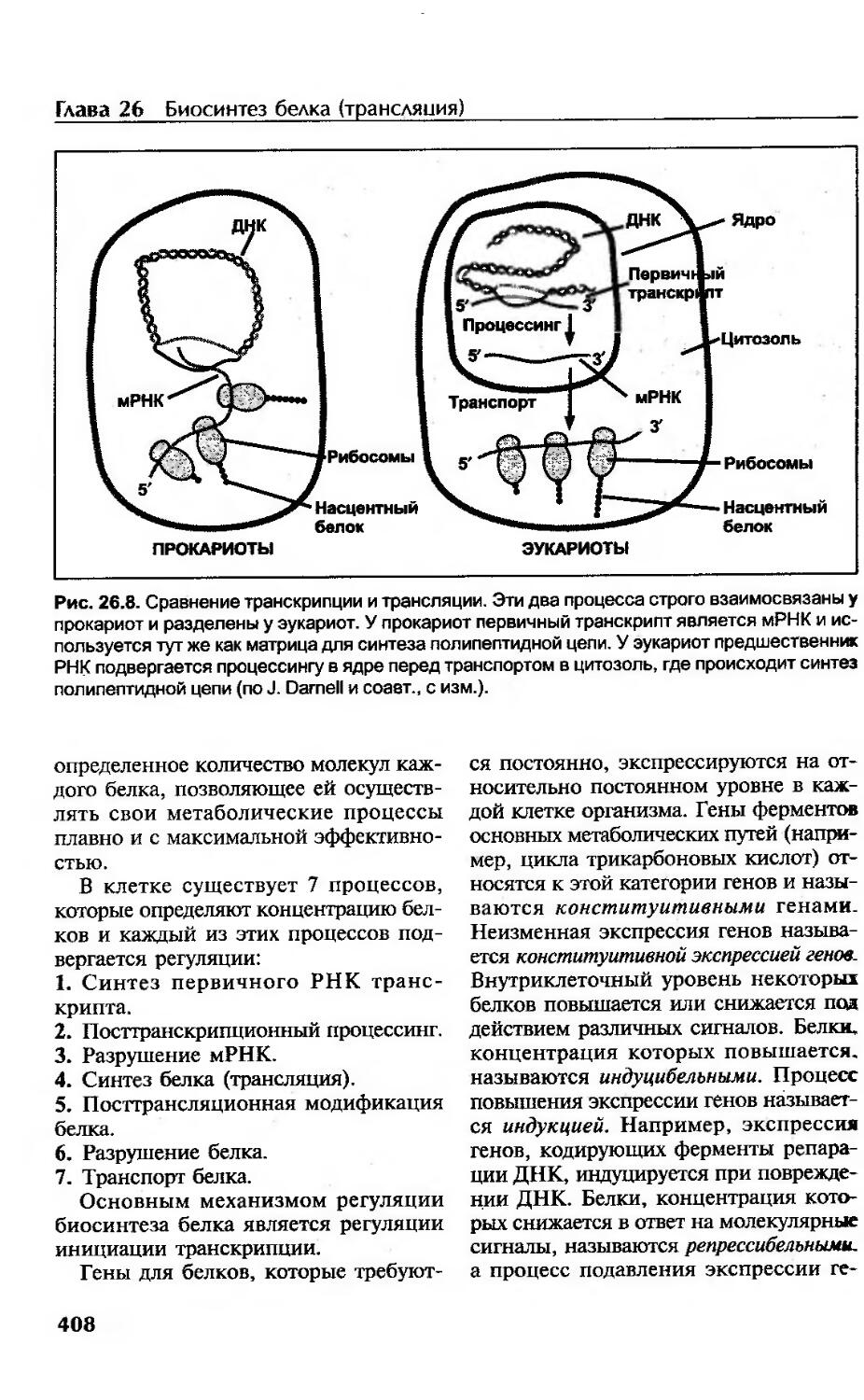
Биосинтез белка (трансляция)................................................. 395
Строение рибосом............................................................395
Генетический код............................................................396
Биосинтез белка.............................................................397
Стадия 1 — активация аминокислот.........................................397
Стадия II — инициация полипептидной цепи.................................398
Стадия III — элонгация полипептидной цепи................................399
Стадия IV — терминация...................................................404
Энергетические затраты белкового синтеза.................................405
Стадия V — посттрансляционная модификация полипептидной цепи.............405
Сравнительная характеристика синтеза белков у прокариот и эукариот.......407
Регуляция биосинтеза белка..................................................407
Фолдинг и разрушение полипептидной цепи..................................410
Препараты, влиящие на синтез белка.......................................411
Подавление синтеза белков дифтерийным токсином...........................412
Глава 27
Регуляция обмена веществ. Витамины......................................... 413
Определение и классификации...............................................413
Количественное определение витаминов......................................416
Физиологическая потребность в витаминах и рекомендуемые нормы их потребления 417
Антивитамины...........................................................418
Жирорастворимые витамины..................................................418
Витамин А (ретинол, антиксерофтальмический)............................418
Витамин D (кальциферол, анти рахитический).............................421
Витамин Е (токоферол, антистерильный)..................................422
Витамин К (филлохинон, антигеморрагический)............................424
Глава 28
Водорастворимые витамины................................................... 426
Витамин С (аскорбиновая кислота, антискорбутный витамин)..................426
Витамин В1 (тиамин, антиневритный витамин)................................428
Жирорастворимые формы тиамина..........................................430
Витамин В2 (рибофлавин)...................................................430
Витамин РР (никотиновая кислота, никотинамид, ниацин; антипеллагрический витамин) . 431
Пантотеновая кислота......................................................433
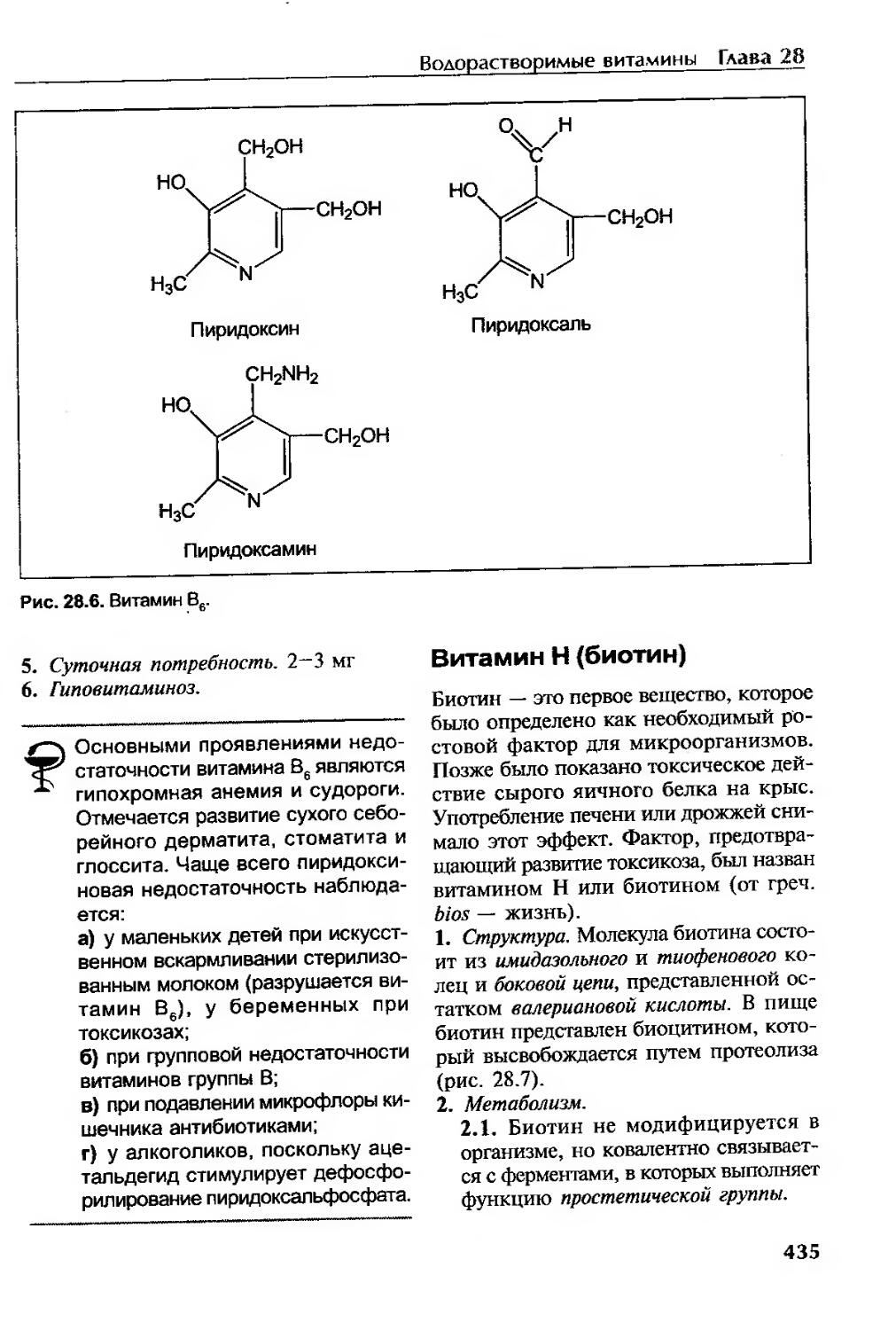
Витамин В6 (пиридоксин, пиридоксол, антидерматитный витамин)..............434
Витамин Н (биотин)........................................................435
Фолиевая кислота (фолацин, витамин В9. витамин Вс)........................436
Витамин В12 (кобаламин, антианемический витамин)..........................438
Витаминоподобные вещества.................................................441
Холин..................................................................441
Инозит.................................................................441
XI
Содержание
Липоевая кислота (витамин N)...........................................442
Парааминобензойная кислота (ПАБК)......................................442
Витамин Р (рутин, биофлавоноиды).......................................443
Витамин U..............................................................443
Витамин F..............................................................444
Кофермент Q............................................................444
Глава 29
Регуляция обмена веществ. Гормоны................................ -.......445
Основные механизмы регуляции метаболизма..................................445
Общая характеристика гормонов........................................... 445
Динамика выработки гормонов............................................446
Нейро-эндокринная регуляция синтеза гормонов...........................446
Классификация гормонов....................................................448
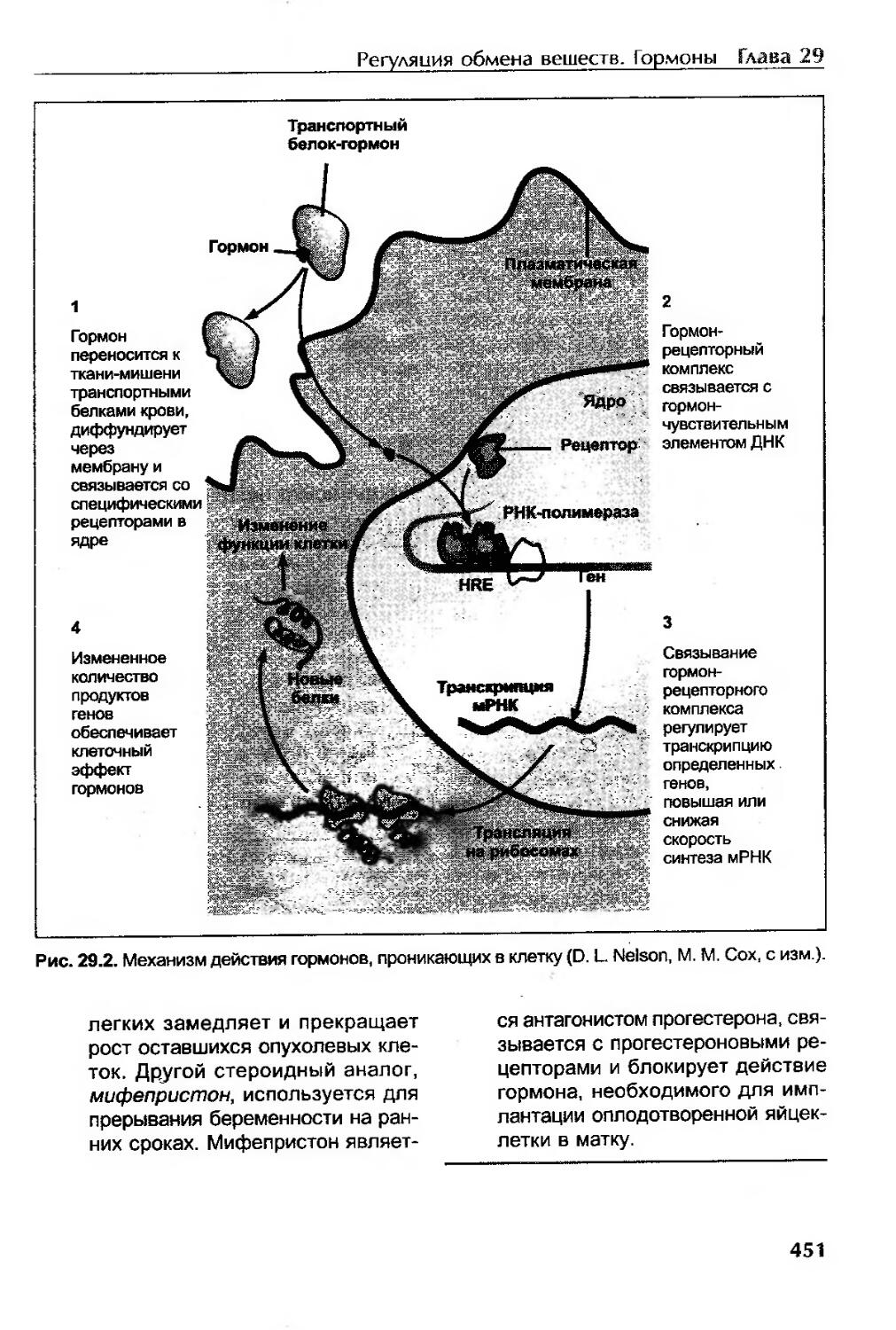
Характеристика рецепторов и механизмы действия гормонов...................450
Механизм действия гормонов, проникающих в клетку..........................450
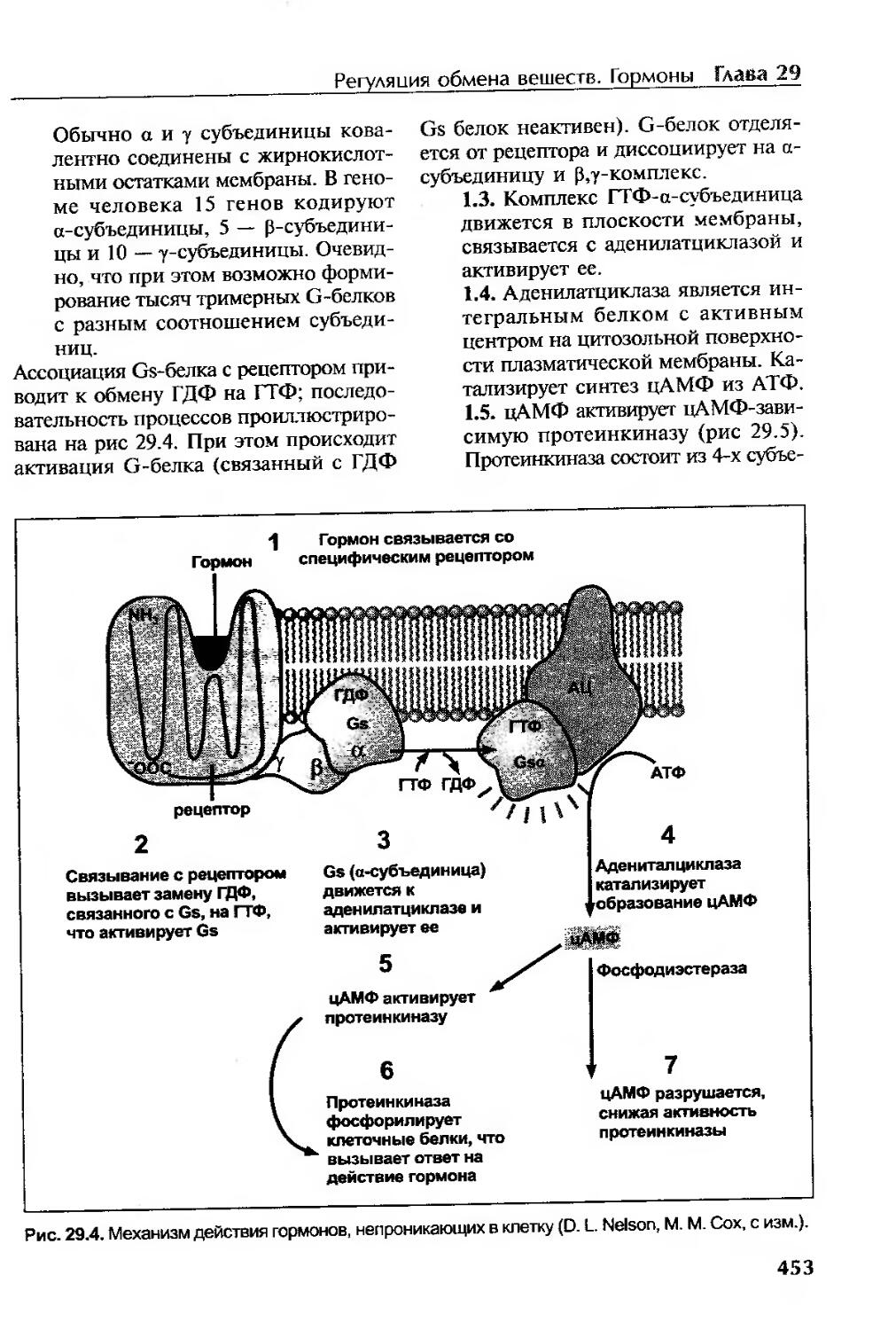
Механизм действия гормонов, не проникающих в клетку.......................452
Типы рецепторов........................................................452
Вторичные посредники.................................................. 452
Циклические нуклеотиды.................................................452
цАМФ................................................................452
Нарушения функции G-белков.............................................455
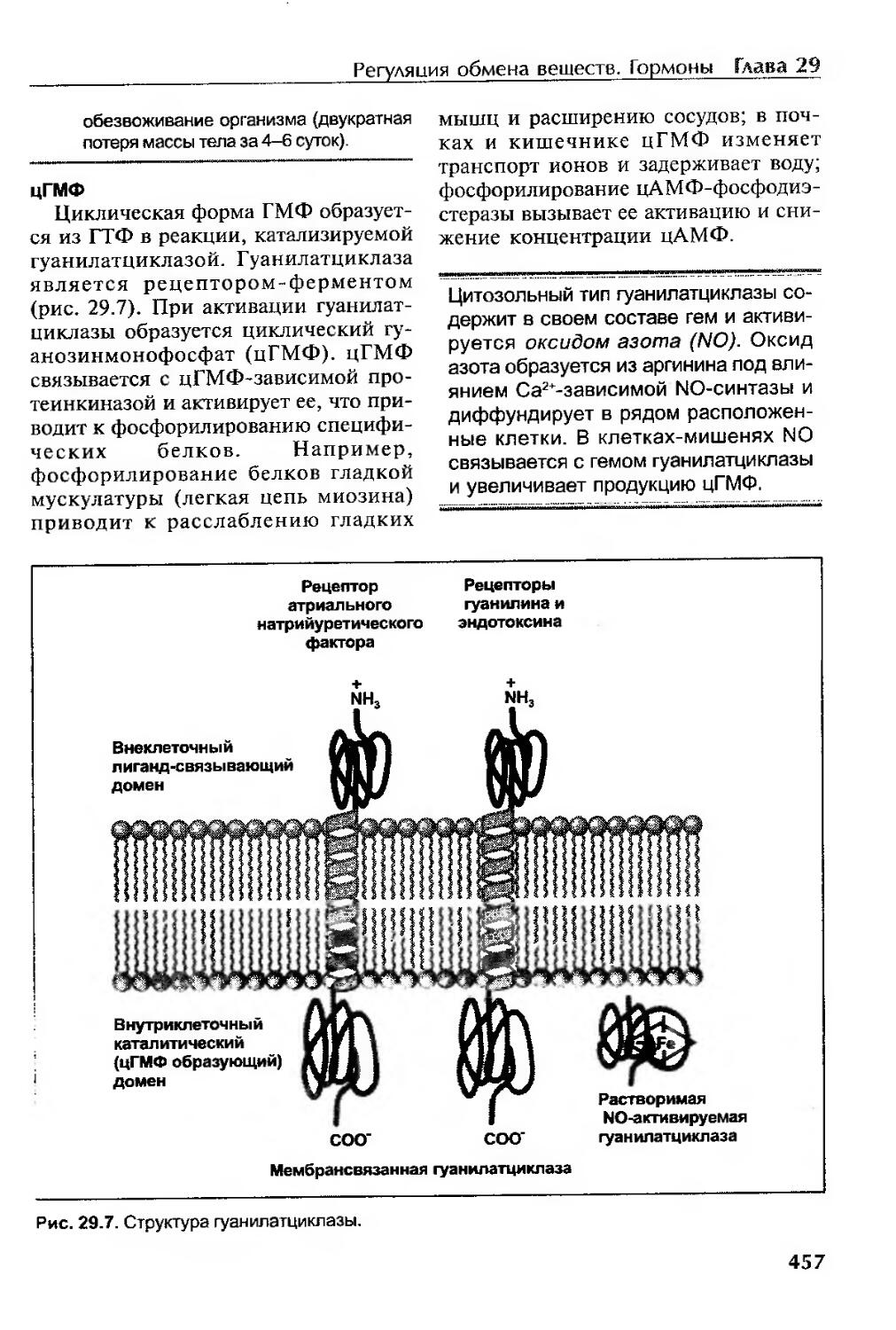
цГМФ................................................................457
Метаболиты фосфатидилинозитолов........................................458
Ионы Са2+..............................................................458
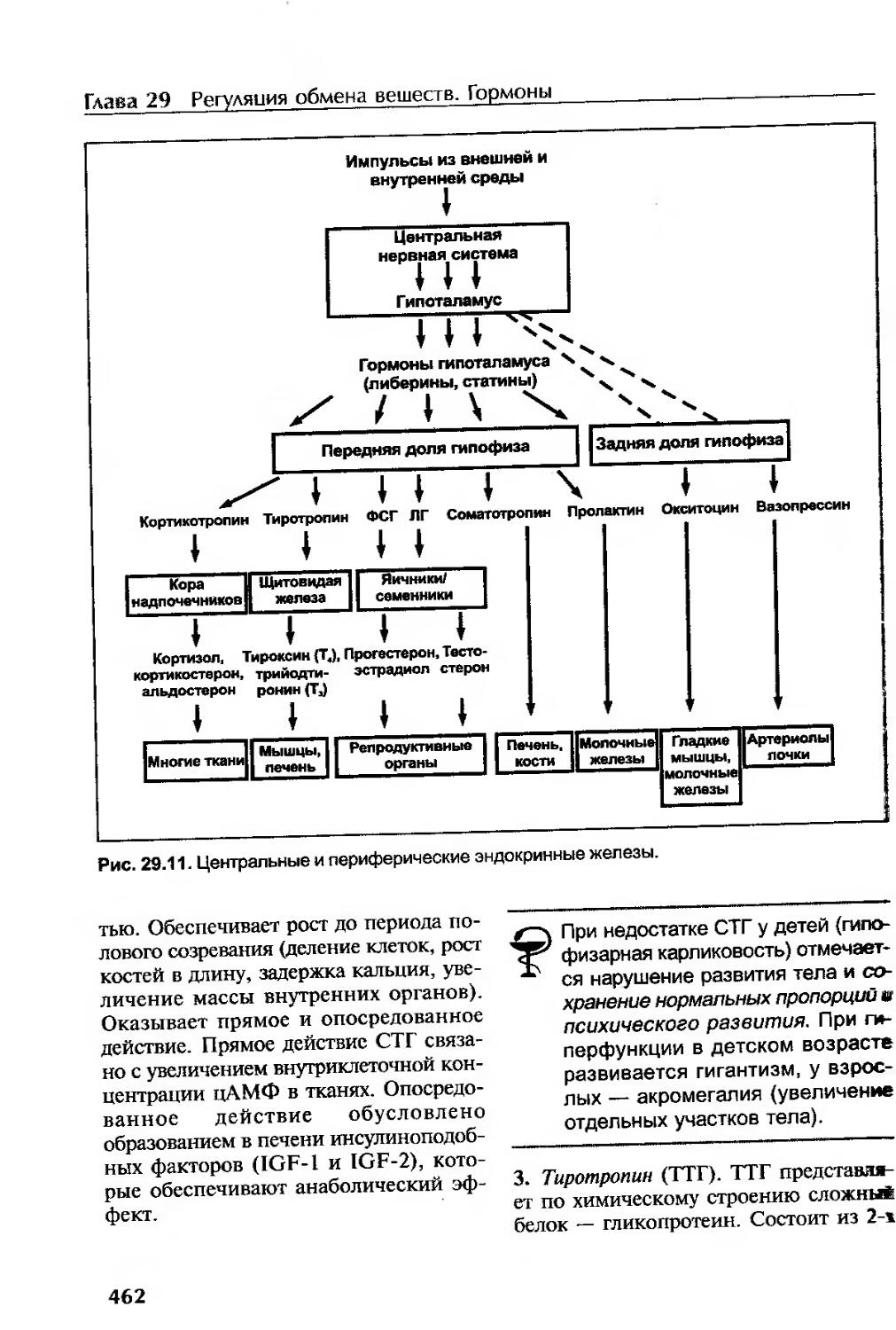
Гормоны гипоталамуса и гипофиза...........................................461
Гормоны гипофиза..........................................................461
Гормоны передней доли гипофиза.........................................461
Гормоны задней доли гипофиза (окситоцин и вазопрессин).................463
Глава 30
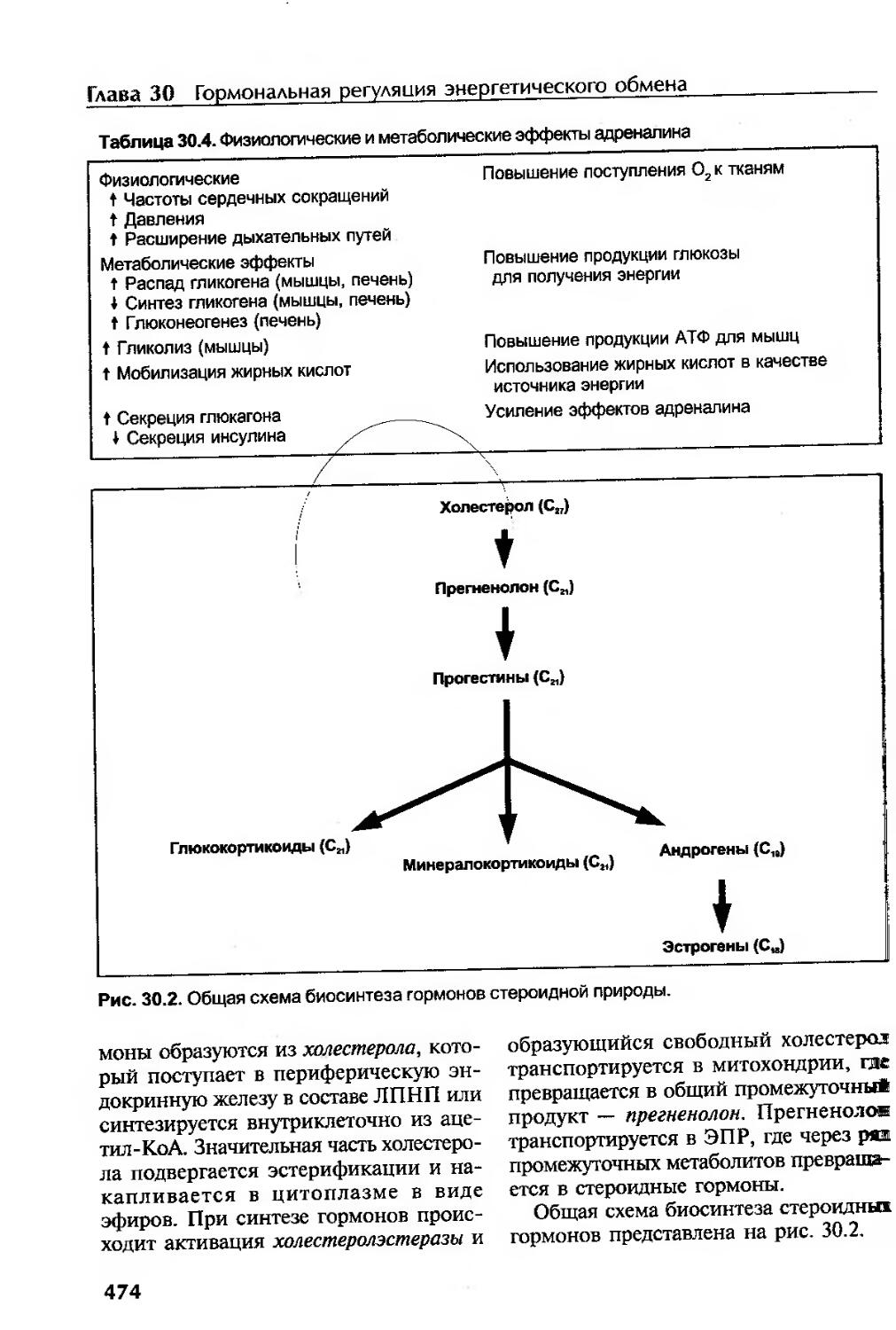
Гормональная регуляция энергетического обмена........................... ...465
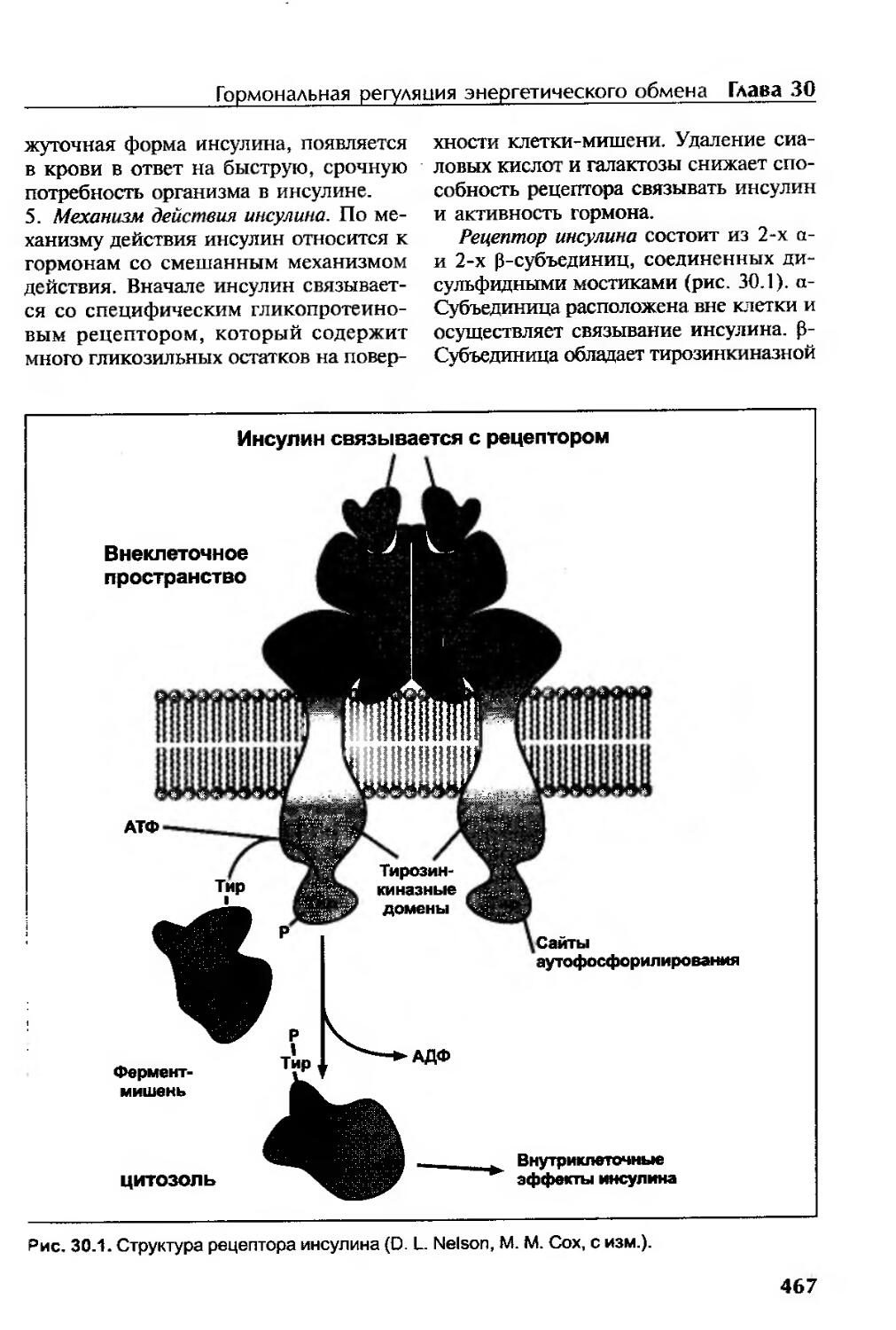
Инсулин...................................................................465
Глюкагон..................................................................470
Гормоны мозгового вещества надпочечников (катехоламины)...................471
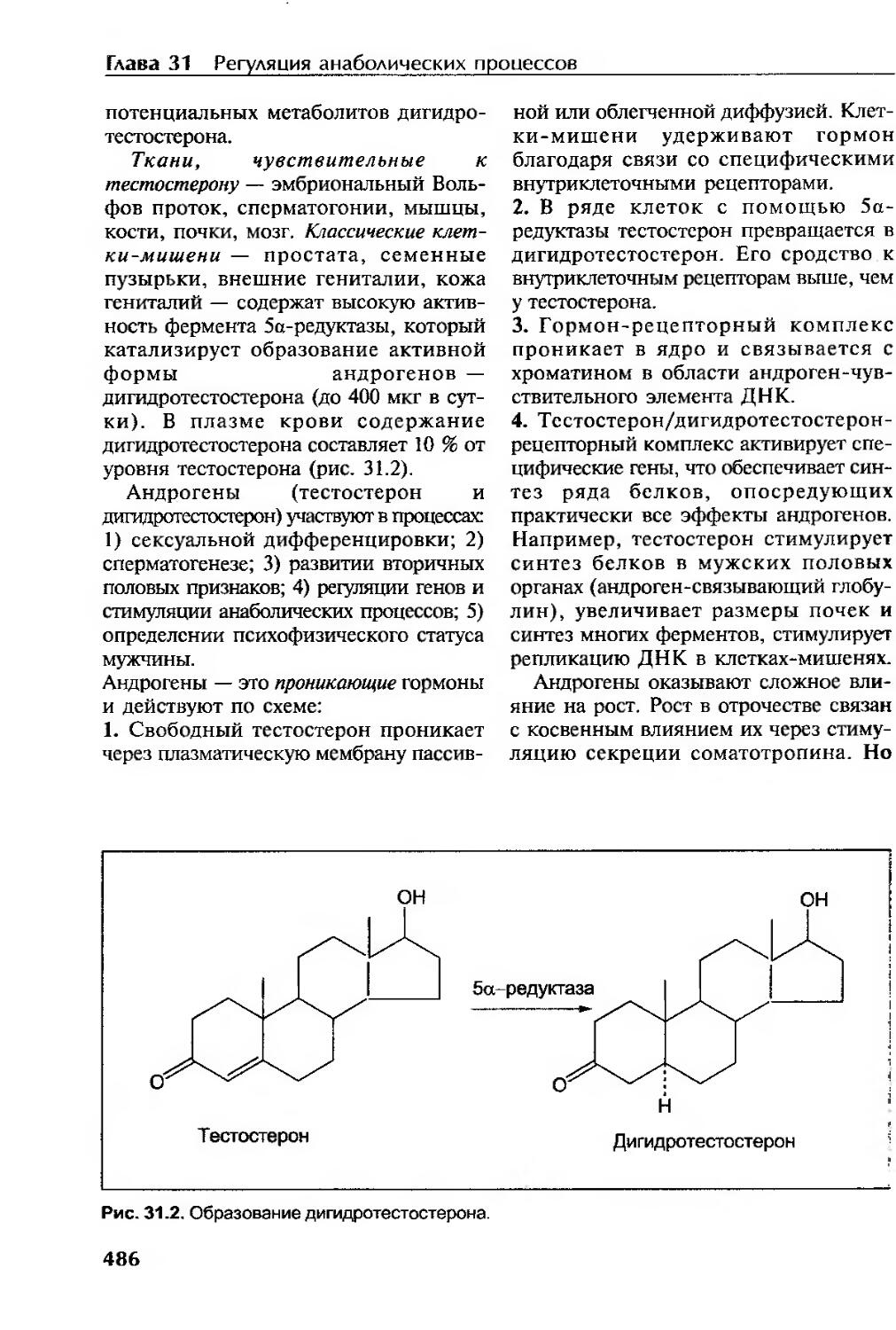
Глюкокортикоиды...........................................................473
Глава 31
Регуляция анаболических процессов, связанных с ростом и морфогенезом 479
Соматотропин..............................................................479
Физиологические эффекты.............................................479
Метаболические эффекты..............................................480
Тироидные гормоны.........................................................481
Биосинтез тироидных гормонов........................................482
Метаболизм тироидных гормонов.......................................483
Транспорт тироидных гормонов........................................483
Механизм действия...................................................483
Влияние на метаболизм...............................................483
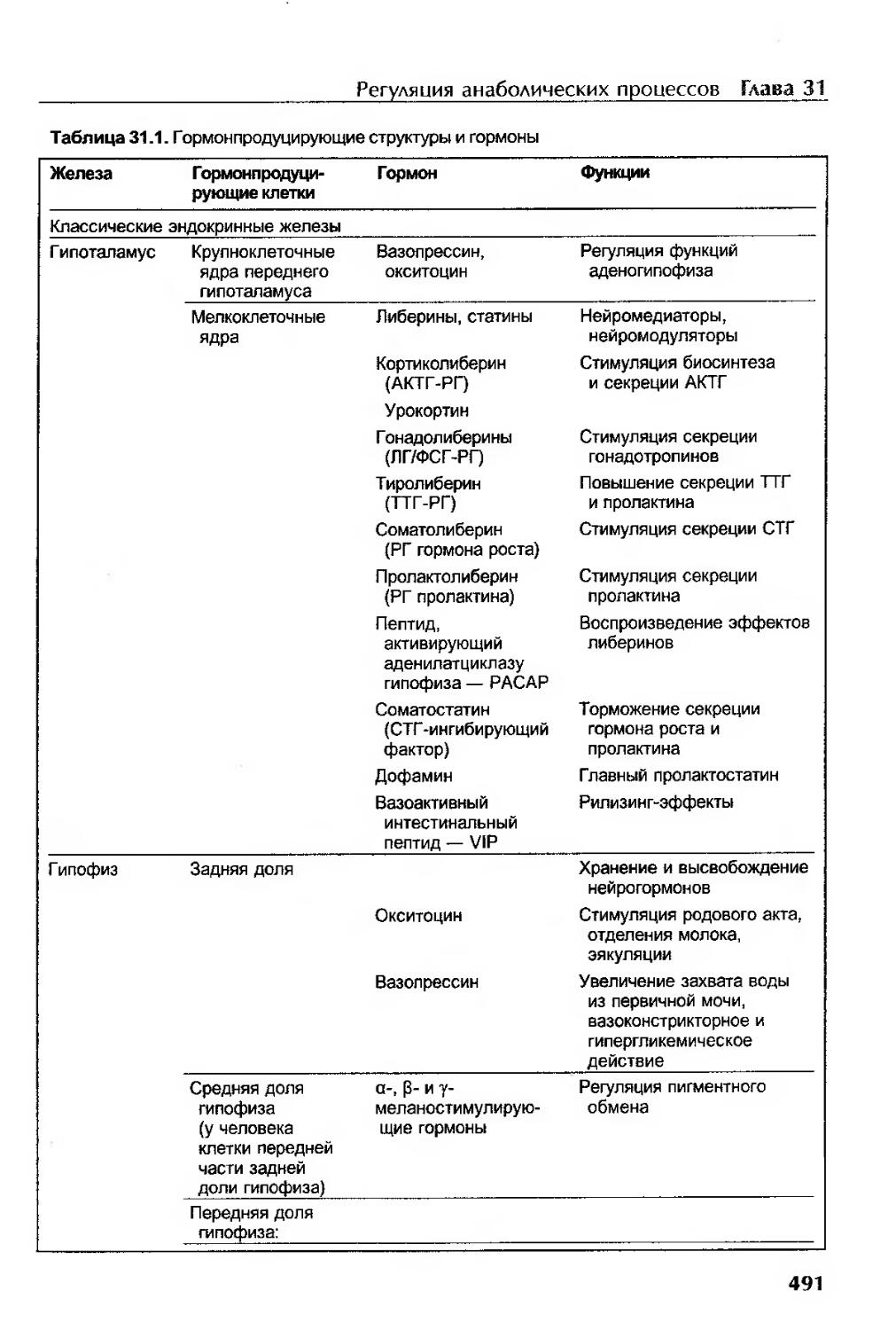
Мужские половые гормоны...................................................484
Женские половые гормоны................................................. 487
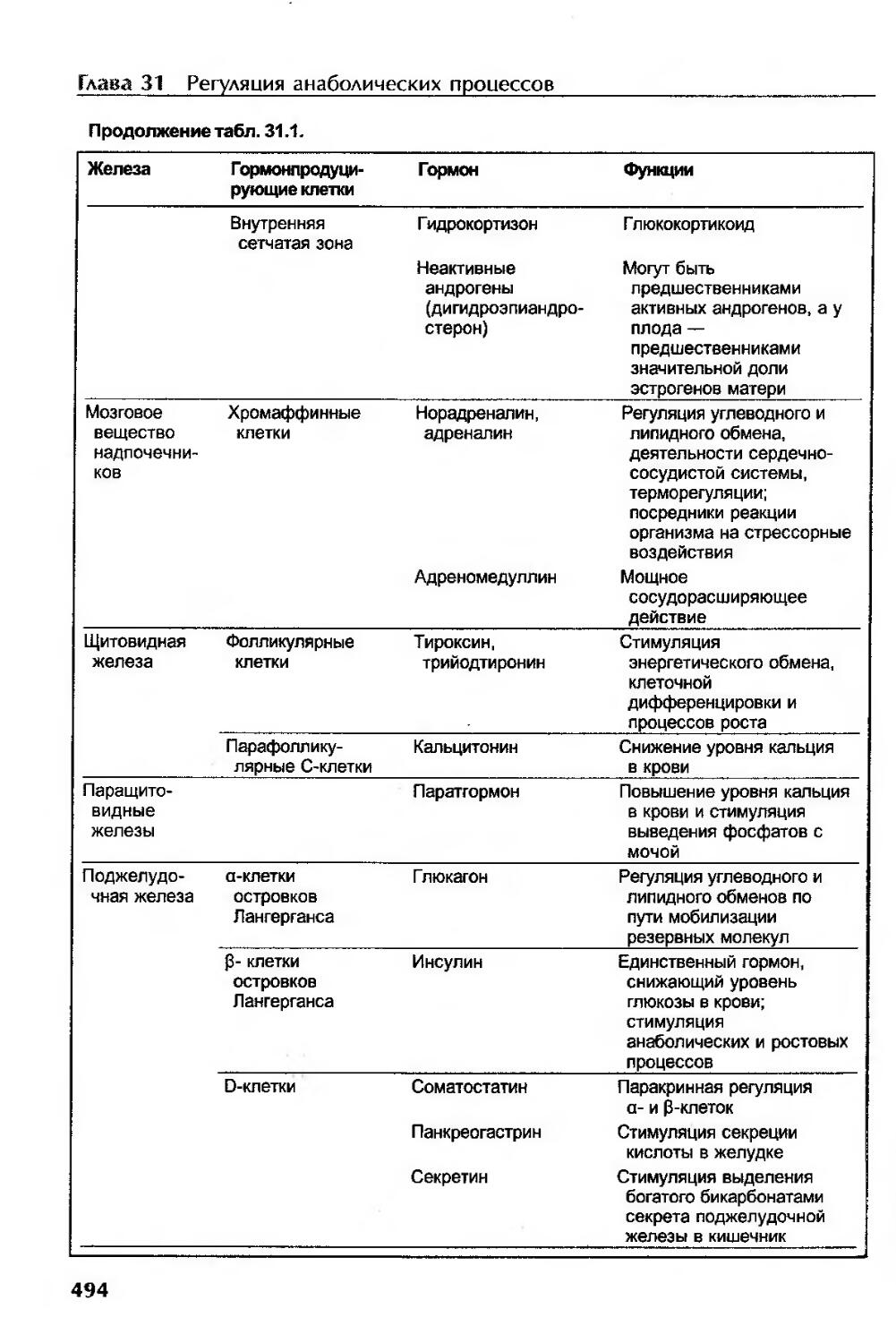
Сводные данные о гормонах.................................................490
xii
Содержание
Глава 32
Регуляция обмена воды и минеральных веществ...................................497
Функции минеральных веществ................................................497
Кальций....................................................................497
Фосфор.....................................................................498
Регуляция обмена кальция и фосфора.........................................499
Натрий, калий, йод, селен..................................................500
Распределение воды в организме.............................................504
Регуляция водно-минерального обмена........................................505
Ренин-ангиотензин-альдостероновая система...............................505
Вазопрессин (антидиуретический гормон, АДГ).............................506
Предсердный (атриальный) натрийуретический фактор.......................506
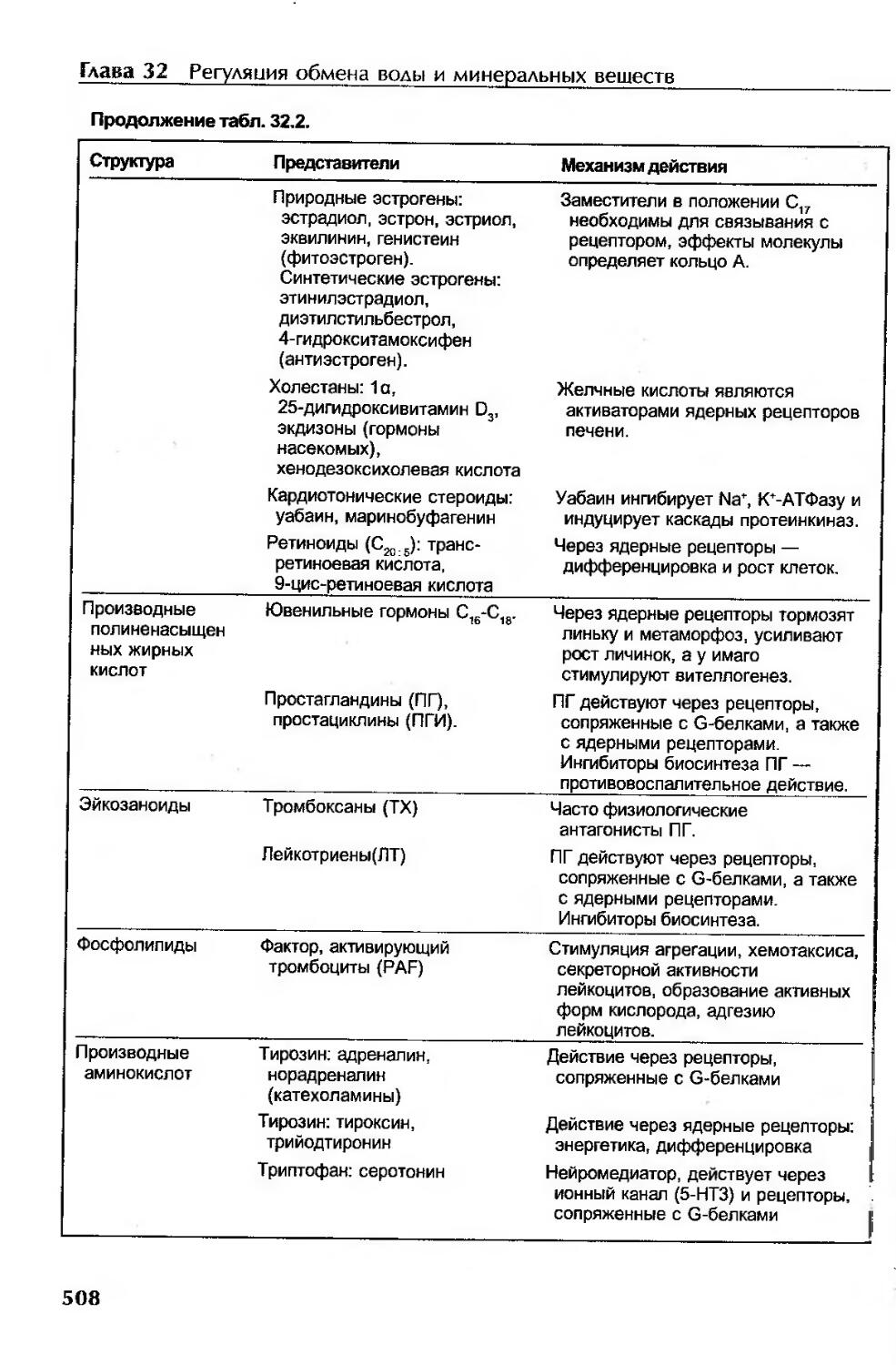
Сигнальные молекулы........................................................506
Белки, транспортирующие сигнальные молекулы.............................511
Белки — участвующие в контактах............................................512
Концентрация некоторых гормонов в крови здорового человека.................512
Глава 33
Взаимосвязи в обмене веществ................................................ 516
Интегрирующие системы......................................................516
Взаимосвязи обмена белков, жиров и углеводов...............................517
На уровне превращений метаболитов.......................................517
На уровне энергетического обмена........................................519
Количественная характеристика...........................................519
Взаимосвязи тканей и органов...............................................520
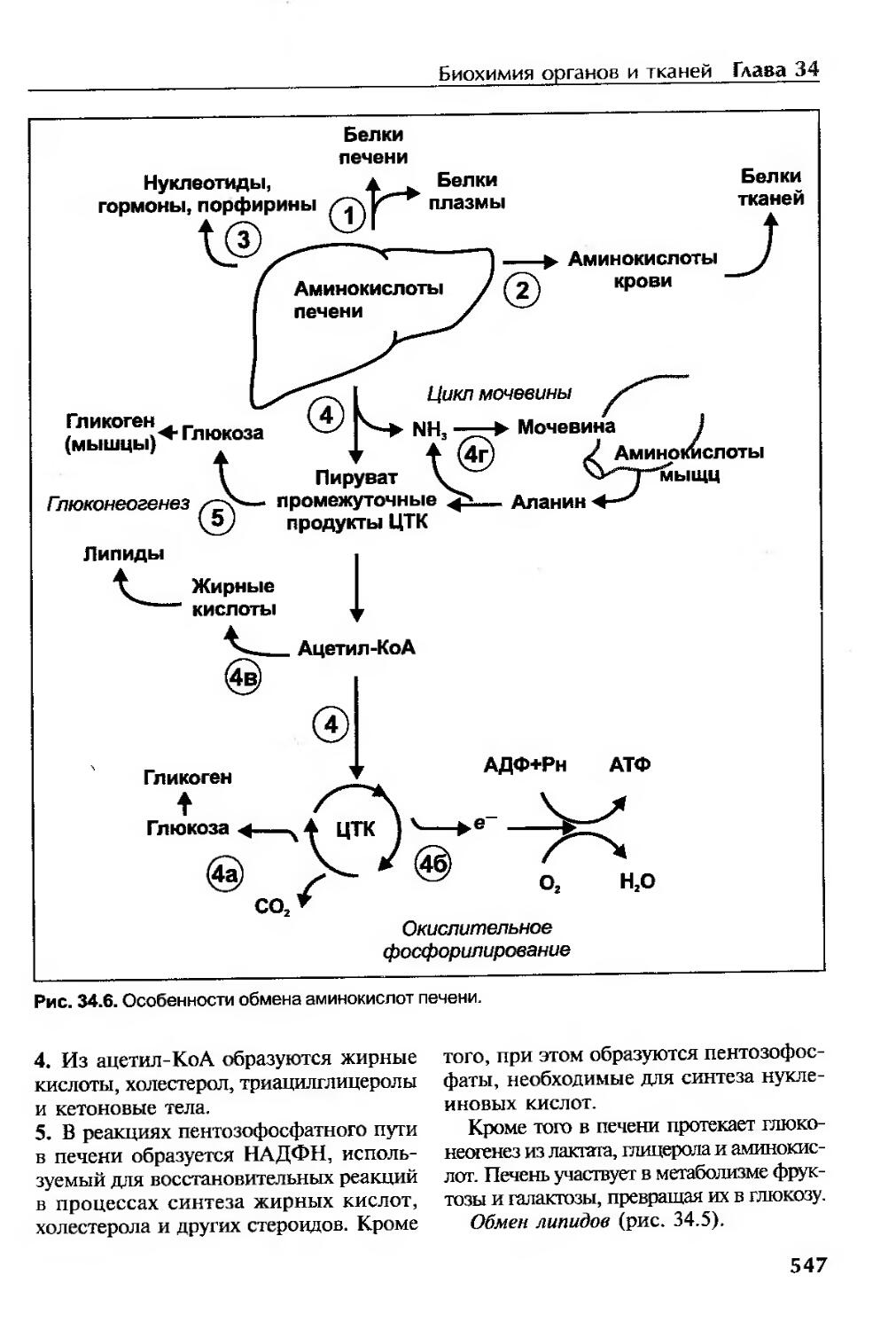
Роль печени.............................................................520
Роль кровеносного русла.................................................522
Роль эндокринной системы...................................................523
Интегральное представление о метаболизме...................................525
Основные биохимические скрининговые тесты..................................527
Основные биохимические лабораторные показатели.............................527
Глава 34
Биохимия органов и тканей .................................................. 535
Биохимия крови.............................................................535
Обмен железа............................................................535
Обмен меди..............................................................537
Функции крови......................................................... 537
Биохимические особенности метаболизма эритроцитов.......................538
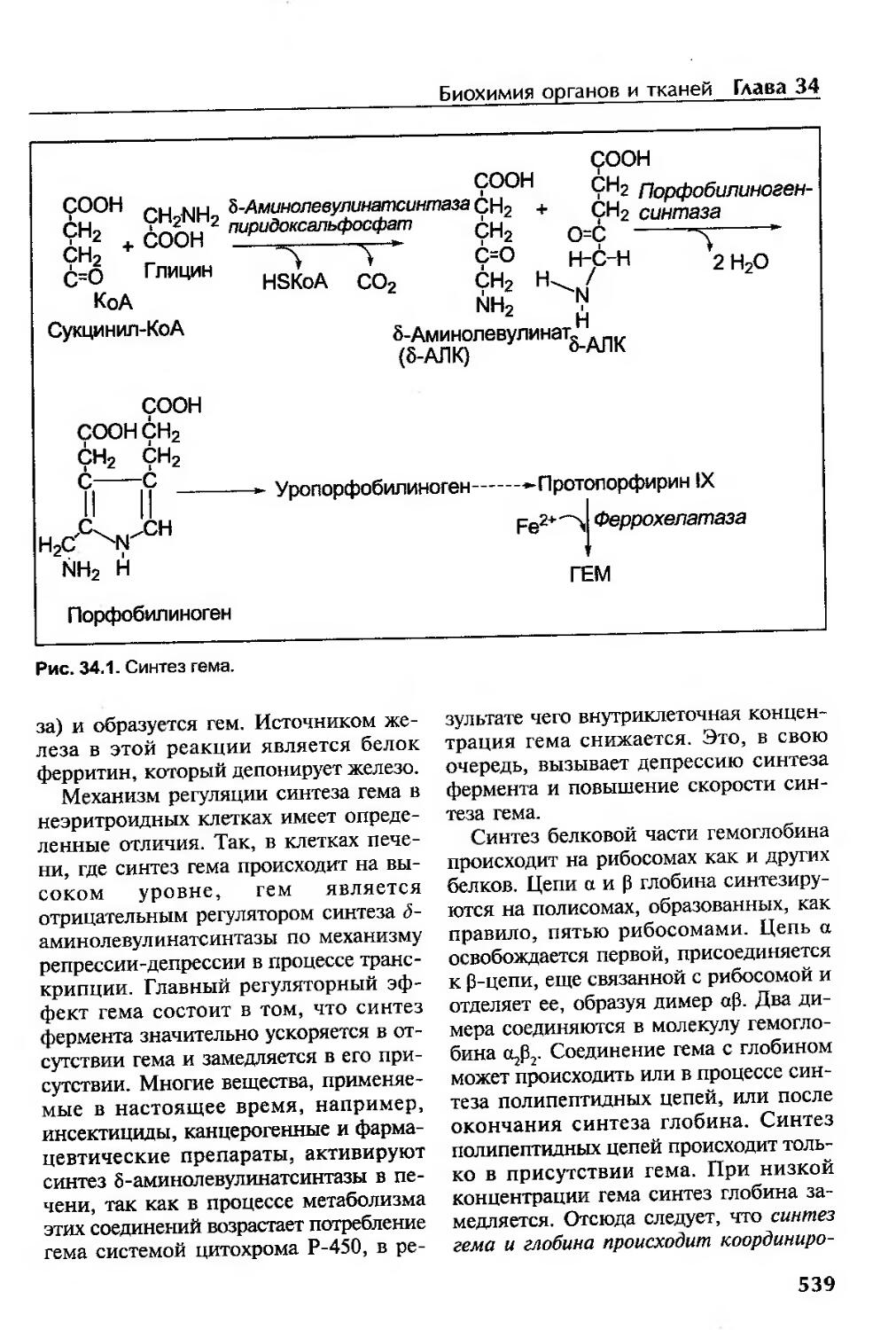
Синтез гемоглобина......................................................538
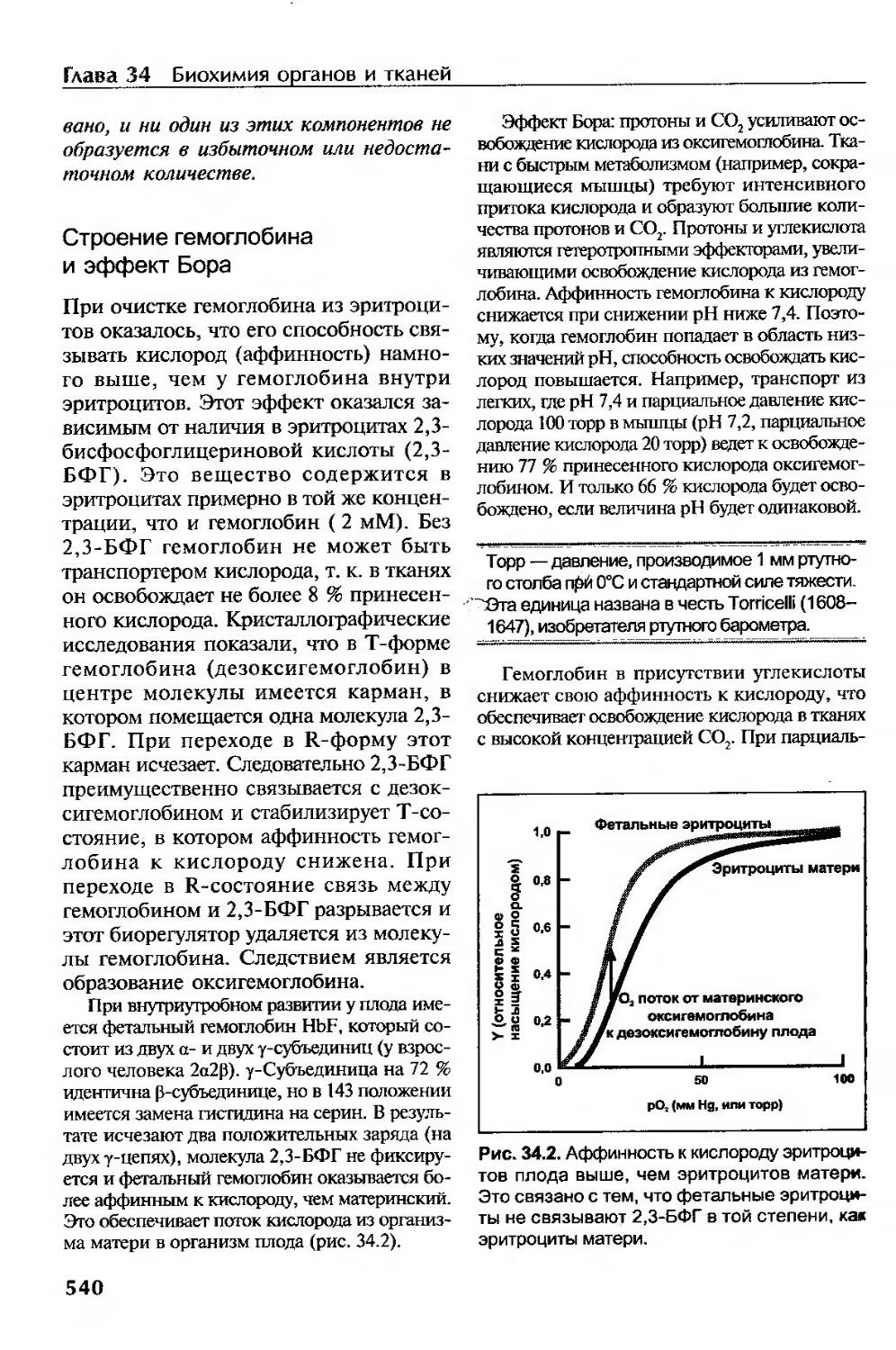
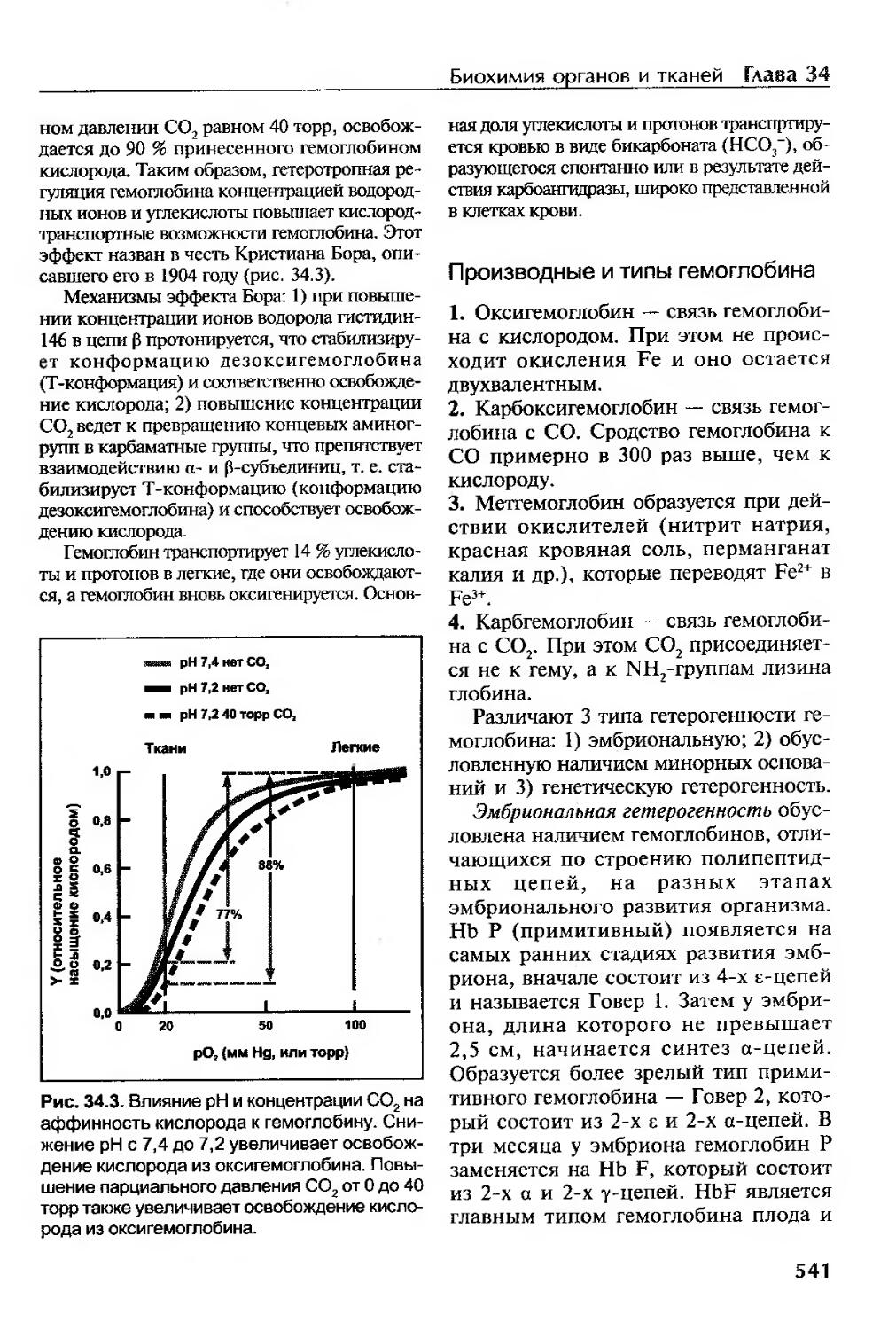
Строение гемоглобина и эффект Бора......................................540
Производные и типы гемоглобина..........................................541
Распад гемоглобина......................................................542
Белки плазмы крови......................................................543
Биохимия фагоцитоза.....................................................544
Биохимия печени............................................................544
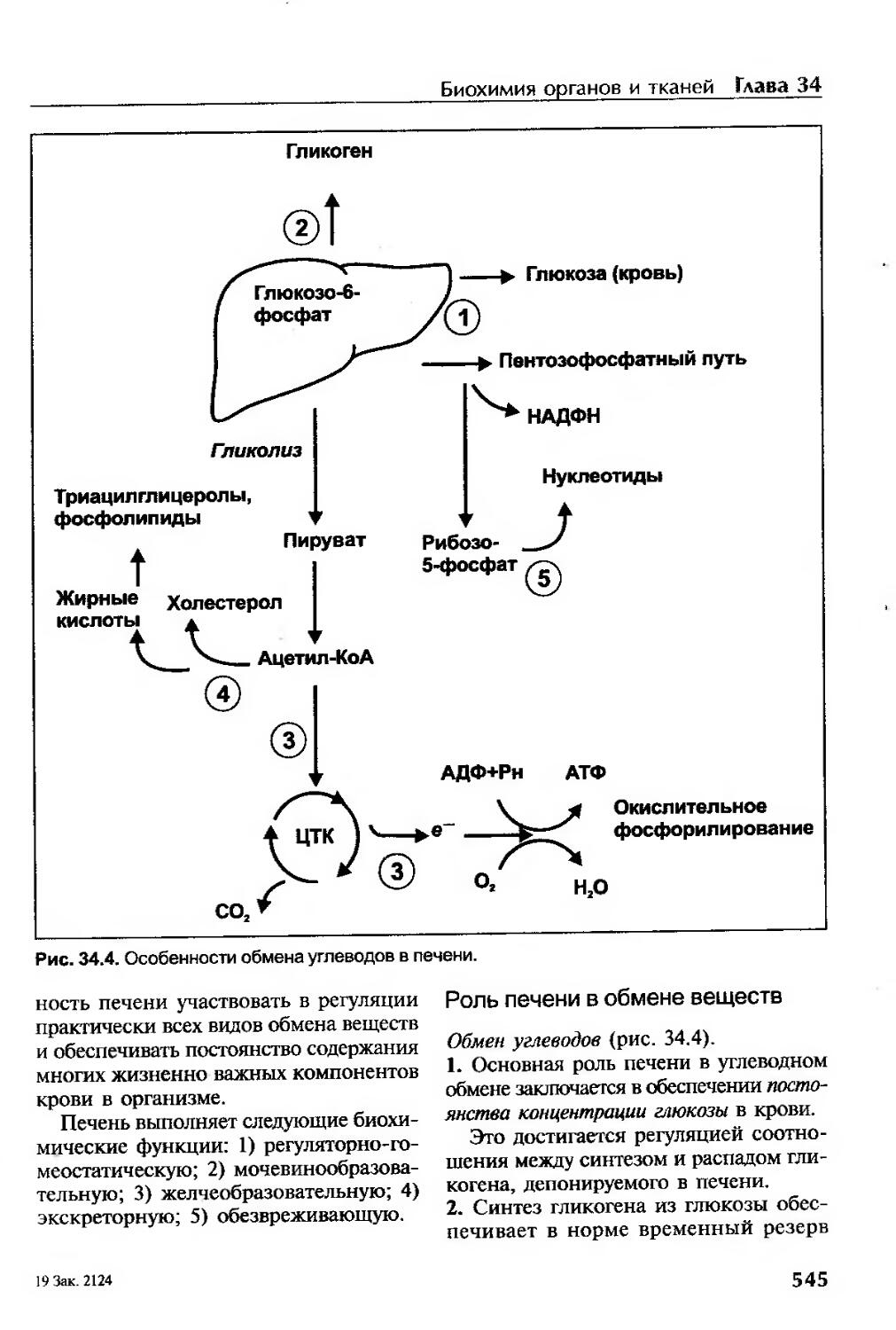
Роль печени в обмене веществ............................................545
Образование желчных пигментов.......................................,...548
Биохимия соединительной ткани..............................................549
Белково-углеводные комплексы межклеточного вещества.....................550
Специфические белки соединительной ткани................................551
xiii
Содержание
Изменения соединительной ткани при старении, заживлении ран, латиризме.554
Биохимия мышечной ткани...................................................555
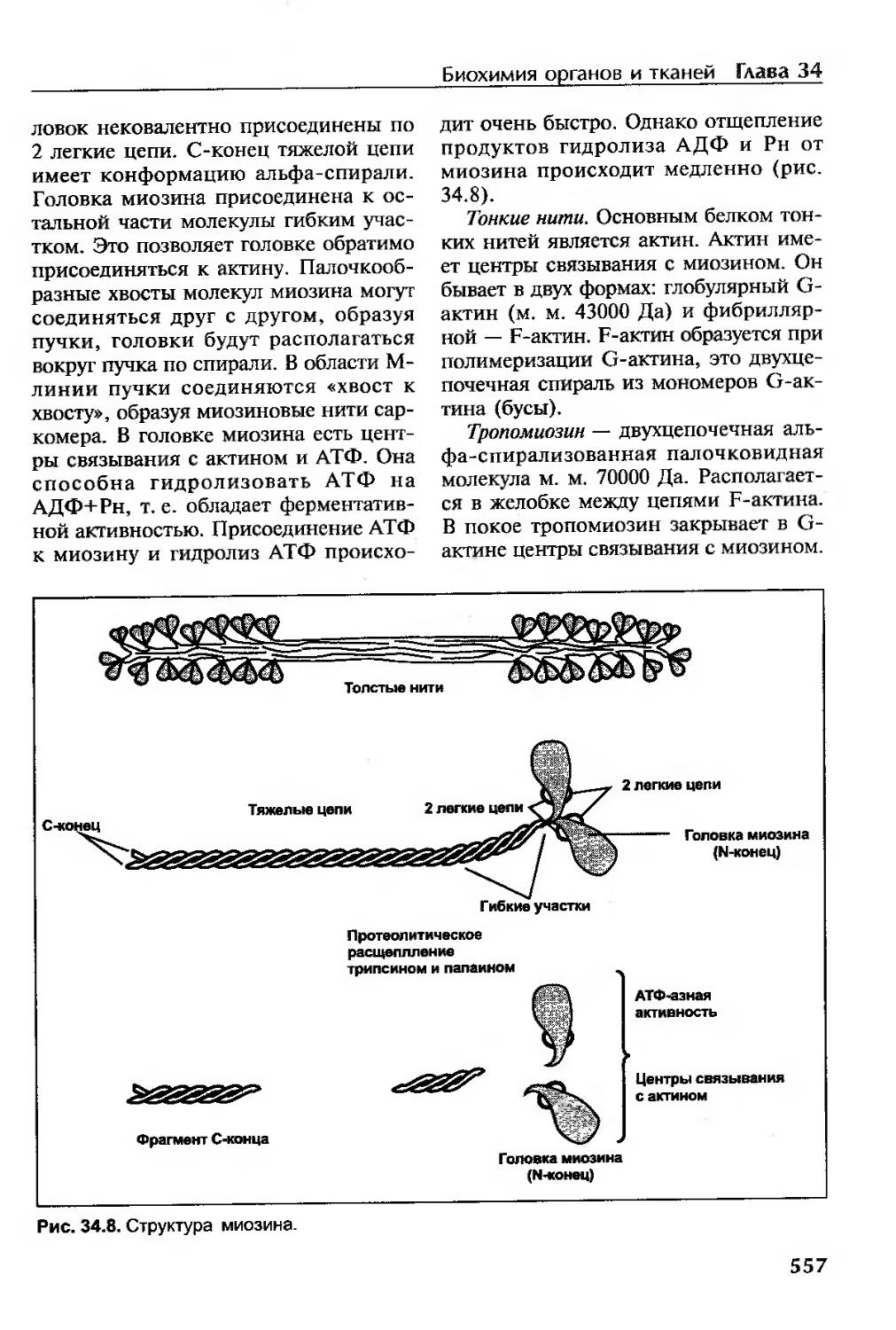
Характеристика мышечных белков.........................................555
Биохимические механизмы мышечного сокращения и расслабления............558
Энергетика мышц........................................................559
Молекулярные моторы....................................................560
Характеристика нервной ткани..............................................560
Патобиохимия клеток.......................................................569
Молекулярные механизмы гибели клеток...................................569
Биохимия опухолевого роста. Онкогены. Ростовые вещества................570
Глава 35
Фармацевтическая биохимия....................................................575
Виды лекарств.............................................................575
Биохимические методы, используемые в стандартизации и контроле качества лекарств 576
Биохимические механизмы токсичности лекарственных препаратов..............576
Фармакодинамика лекарств..................................................577
Фармакокинетика лекарств..................................................577
Факторы, влияющие на концентрацию лекарств.............................577
Факторы, влияющие на метаболизм лекарств...............................582
Понятие о фармакокинетических показателях..............................583
Глава 36
Биохимические аспекты остеологии и стоматологии..............................585
Химия костной и хрящевой тканей...........................................585
Белки костной и хрящевой тканей........................................586
Минеральные компоненты матрикса кости и процесс минерализации..........587
Единица костной структуры..............................................588
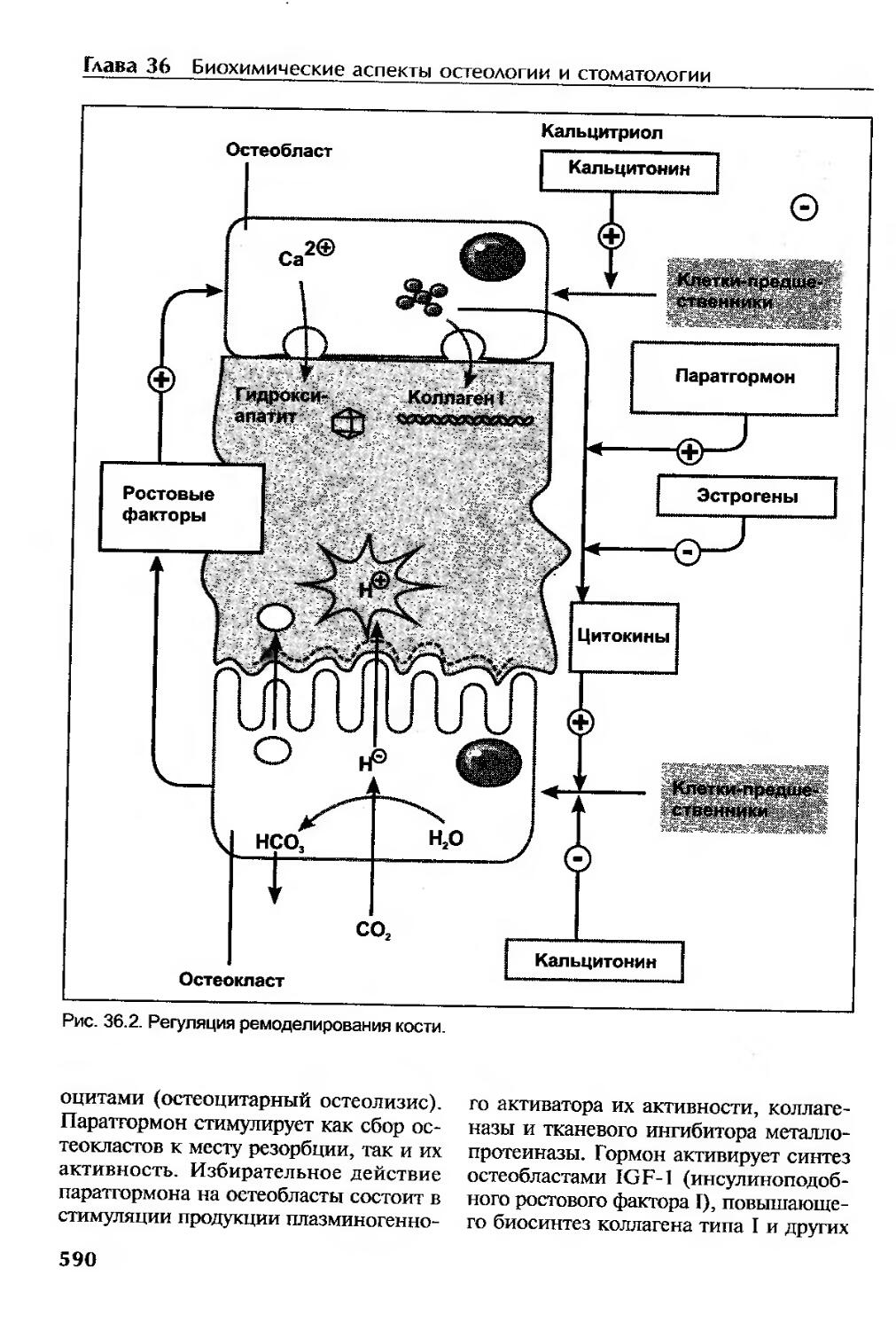
Регуляция метаболизма костной ткани....................................589
Химический состав хряща................................................592
Биохимия зубов............................................................593
Эмаль..................................................................593
Дентин.................................................................595
Цемент.............................................о...................596
Пульпа.................................................................596
Биохимия жидкостей полости рта............................................596
Функции смешанной слюны................................................596
Химический состав ротовой жидкости.....................................598
Десневая жидкость......................................................600
Зубной ликвор..........................................................600
Пелликула зуба.........................................................600
Зубной налет...........................................................601
Зубной камень..........................................................601
Биохимия кариеса..........................................................602
Основная литература........................-.................................604
xiv
Введение
Изучение биохимии является необходимым компонентом фундаментальноориентированной подготовки специалистов биологического и медицинского профилей. Эта задача сформулирована на I съезде ученых Республики Беларусь (1—2 ноября 2007 г.) — подготовка конкурентноспособного специалиста, умеющего в кратчайший срок внедрить в свою работу современные технологии. Поэтому в предлагаемом учебном пособии была сделана попытка скоординированного изложения фундаментальных и прикладных вопросов биохимии.
Учебное руководство построено в соответствии с действующими типовыми программами для студентов высших учебных заведений медицинского и биологического профиля. Излагаемый биохимический материал сгруппирован в 36 примерно равноценных по объему порциях. Из сформированных таким образом 36 глав 33 являются общими д ля всех обучаемых, глава 34 имеет преимущественное отношение к студентам-медикам, глава 35 — к студентам-фармацевтам и глава 36 — к студентам-стоматологам. В курсе предусмотрено количество глав (порций материала) на 2 семестра обучения (одна глава в неделю). Многолетний опыт преподавания биохимии в медицинском вузе и на биологическом факультете
университета показывает, что 1 глава + 1 лабораторное занятие на протяжении двух семестров — это оптимальная форма изучения биохимии. Порционное изучение материала может также с успехом применяться в случае уплотненного преподавания дисциплины на протяжении одного семестра.
В главе 1 представлены достижения ученых, удостоенных Нобелевских премий, имеющих отношение к биохимии, за последние 50 лет. На основе этих работ строится курс современной биохимии. В главе 2 приведены суммированные характеристики белков и аминокислот параллельно с описанием современных методов исследования белков. В главе 3 представлены методы изучения, первичной структуры белков. В главе 4 описаны современные методы выделения и количественного определения белков. В главе 6 для иллюстрации положения об активации проферментов представлена современная схема свертывания крови. В главе 10 изложены современные представления об активных формах кислорода, антиоксидантной системе и явлениях окислительного и восстановительного стресса. В главе 11 даны современные представления о сущности и количественной оценке биоэнергетических внутриклеточных процессов.
XV
Введение
В главе 17 изложены представления о первичных, вторичных и третичной желчных кислотах. В главе 24 приведены современные методы исследования нуклеиновых кислот и описана полимеразная цепная реакция. В главе 25 описана обратная транскрипция и технология рекомбинантных ДНК. В главе 27 представлены критерии нормальной обеспеченности организма витаминами. В главе 31 даны сводные данные о гормонах. В главе 32 описаны рекомендуемые витаминно-минеральные комплексы для коррекции метаболизма, представлены суммированные данные о сигнальных молекулах, белках для их транспорта, белках — участниках различных биологических контактов. Здесь же приведены референтные нормы для основных гормонов. В главе 33 представлены наиболее важные для лабораторной диагностики скрининговые биохимические тесты. В главе 34 даны биохимические особенности различных тканей и описаны механизмы апоптоза и опухолевой трансформации клеток. Глава 35 посвящена фармакодинамике и фармакокинетике лекарств и глава 36 включает материалы по стоматологической биохимии.
В учебном руководстве применены специальные приемы для идентификации излагаемого материала: в рамку взяты понятия, абсолютно необходимые для фундаментальной и прикладной подготовки специалиста; знаком обозначены медицинские приложе- х ния излагаемых вопросов. Представлены примеры современного описания химизма изучаемых процессов. Авторы придерживаются правила сокращенного обозначения нуклеотидов и других биологически важных молекул в русской транскрипции (НАД, ФАД, АТФ, КоА).
Крупным шрифтом представлен основной материал, обсуждаемый в аудиторное время. Мелким шрифтом приве
xvi
дены материалы для самостоятельного изучения студентами (при подготовке к лекциям и лабораторным занятиям, при оценке медико-биологической значимости изучаемых явлений, при понимании места изучаемого биохимического вопроса в изучении смежных дисциплин и применении этих знаний в научно-исследовательской и будущей практической деятельности).
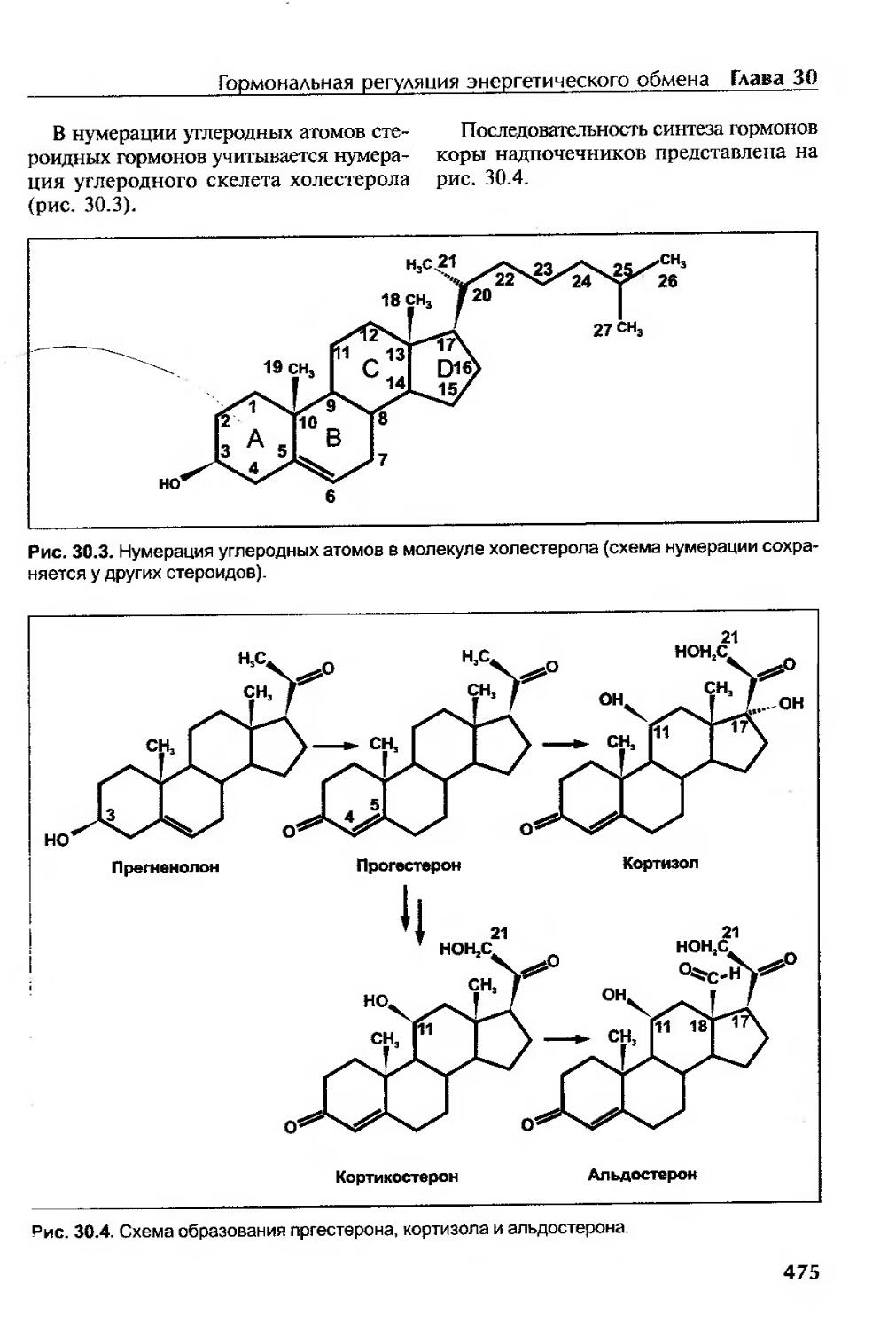
Учитывая потребности современной междисциплинарной терминологии, в учебном руководстве по биохимии введены понятия «сигнальные молекулы», «оксидативный стресс», «критерии обеспеченности организма питательными веществами», «опухолевая трансформация клеток» и др. Для описания сигнальных молекул использованы латинские аббревиатуры, принятые на основании их английского наименования. С целью усиления понятия иногда используется . прием его повторного изложения. Так, например, молекула холестерола приве-дена при описании мембран (акцент — , стабилизация мембран) и в разделе глюкокортикоидов (формула холестерола приведена с нумерацией атомов углерода) для понимания химической номенклатуры стероидных гормонов.
Для эффективного поиска необходимого материала в учебном руководстве приведено подробное содержание, что позволило отказаться от предметного указателя.
В учебном руководстве приведены 310 рисунков, 57 таблиц, 130 примеров использования данных биохимии в медицине.
Авторы надеются, что предлагаемое учебное руководство займет свое место в системе биохимического образования студентов биологического и медицинского профилей. Все замечания и предложения будут с благодарностью приняты.
Авторы
Определение
Биологическая химия — это наука, которая изучает: 1) химическую природу веществ, входящих в состав живых организмов; 2) их превращения и 3) связь этих превращений с деятельностью клеток, тканей, органов и организма в целом.
Задачи биохимии: 1) объяснить, как функционируют живые системы с точки зрения молекулярных процессов в состоянии «здоровья»; 2) объяснить молекулярные процессы, лежащие в основе заболеваний и их эффективного лечения.
Биохимия изучает химию живой природы в широком диапазоне: от человека и позвоночных до бактерий, а также молекулярные основы взаимодействия живых объектов с физическими (например, излучения), химическими (например, ксенобиотики) или биологическими (например, вирусы) факторами окружающей среды. В зависимости от объекта исследований условно выделяют: 1) биохимию микроорганизмов; 2) биохимию простейших; 3) биохимию растений; 4) биохимию
животных (ветеринарную биохимию); 5) биохимию человека (медицинскую биохимию). Однако, несмотря на определенные, порой принципиальные различия в химическом составе и обмене веществ тех или иных видов живых организмов, существует биохимическое единство всех форм жизни.
Основные разделы и направления в биохимии
Выделяют разделы биохимии по направлениям исследований: техническая биохимия (молекулярные основы хлебопечения, сыроварения, виноделия и пр.); медицинская биохимия (биохимические процессы в организме человека в норме и при патологии), эволюционная биохимия (эволюция обмена веществ в рамках эволюции живых организмов); квантовая биохимия (квантово-физические характеристики метаболитов и их превращений в живом организме); энзимология (структура, свойства и механизм действия ферментов) и др—________________
В медищ нскоб^лоя^ШЛ выделяют три основных pawuw:.-<Uапатическая дзяржеунпга | ушверсиэта j * А. А. Е’/ляою*»'
Глава 1 Введение в биохимию
биохимия — изучает химическую природу организма (биоорганическая химия); 2) динамическая биохимия изучает превращения химических веществ в организме (метаболизм); 3) функциональная биохимия — изучает роль превращений химических веществ в проявлении функций клеток, тканей, органов, организма.
В медицинской биохимии выделяют несколько направлений (частная биохимия): 1) биохимию систем органов (нервной, гепатобилиарной, сердечно-сосудистой, эндокринной и др.); 2) биохимию основных процессов (движения, пищеварения, размножения и др.); 3) прикладную биохимию (клиническая биохимия, биохимическая лабораторная диагностика и др.).
Биохимия и медицина
Место биохимии в подготовке врача: 1) биохимия базируется на неорганической, физической и коллоидной химии, биоорганической химии и биологии; 2) биохимия тесно связана с гистологией (цитология, цитохимия), микробиологией, вирусологией, иммунологией, токсикологией, патологией (патофизиология + патанатомия), клинической биохимией; 3) на основе биохимии формируются представления о молекулярных основах патогенеза, диагностики, лечения и прогноза заболеваний (терапия, эндокринология, хирургия и др. клинические дисциплины).
С биохимических позиций состояние здоровья обеспечивают многие тысячи внутри- и внеклеточных реакций организма, определяя его максимальную жизнеспособность в физиологических условиях. Все заболевания могут вызываться 8-ю причинами и все они реализуются через биохимические процессы: 1) физические агенты (травма, температура, давление, ради
ация, электричество); 2) химические агенты и лекарства (токсины, ксенобиотики); 3) биологические агенты (вирусы, риккетсии, бактерии, грибы, гельминты); 4) гипоксия (нарушения кровообращения, изменения транспорта кислорода, дыхательные яды); 5) генетические факторы (врожденные, приобретенные); 6) иммунологические реакции (анафилаксия, аутоиммунные заболевания); 7) дисбаланс питания (недостаточное, избыточное, гиповитаминозы); 8) эндокринный дисбаланс (гипо- и гиперфункция эндокринных желез).
Признаки живой материи и происхождение жизни
Выделяют следующие основные признаки живой материи:
1) способность к метаболизму, т. е. обмену веществ и энергией;
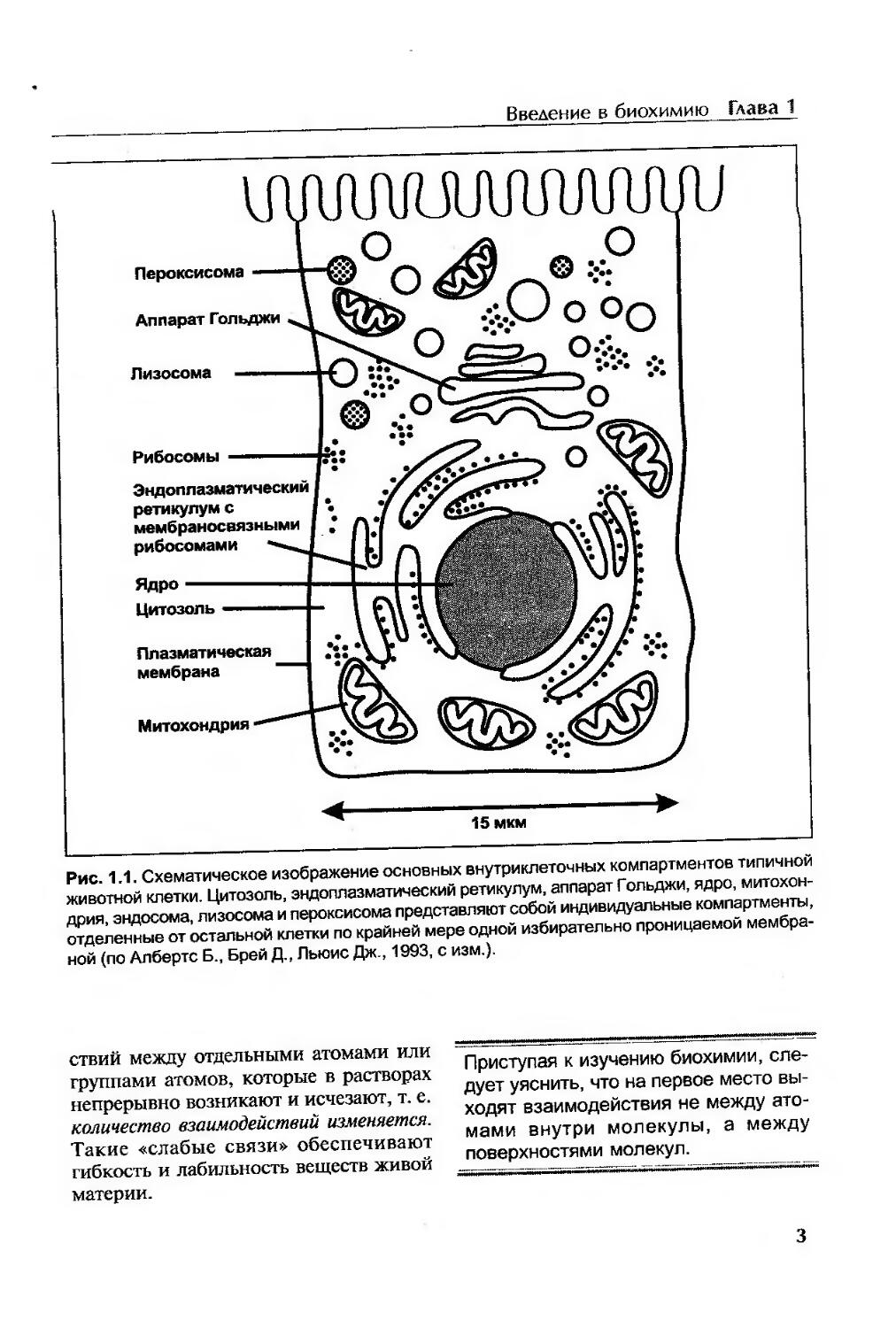
2) сложность, высокий уровень структурной организации живой материи. Единицей биологической активности организма считается клетка: молекулы -► мембраны, субклеточные органеллы -* клетки -* ткани -► органы + организм (рис. 1.1);
3) изменчивость — способность к самостоятельному реагированию на воздействие окружающей среды изменением химического состояния и функционирования;
4) способность к точному воспроизведению за счет передачи наследственной информации.
В основе этих признаков лежат химические превращения веществ. В «ковалентной» химии эти превращения сопровождаются перераспределением связей между атомами, однако суммарное число связей при этом сохраняется. В биологической химии также действуют правила «ковалентной» химии, но появляется комплекс слабых взаимодей-
2
Введение в биохимию Глава 1
Рис. 1.1. Схематическое изображение основных внутриклеточных компартментов типичной животной клетки. Цитозоль, эндоплазматический ретикулум, аппарат Гольджи, ядро, митохондрия, эндосома, лизосома и пероксисома представляют собой индивидуальные компартменты, отделенные от остальной клетки по крайней мере одной избирательно проницаемой мембраной (по Албертс Б., Брей Д., Льюис Дж., 1993, с изм.).
ствий между отдельными атомами или группами атомов, которые в растворах непрерывно возникают и исчезают, т. е. количество взаимодействий изменяется. Такие «слабые связи» обеспечивают гибкость и лабильность веществ живой материи.
Приступая к изучению биохимии, следует уяснить, что на первое место выходят взаимодействия не между атомами внутри молекулы, а между поверхностями молекул.
3
Глава 1 Введение в биохимию
В биохимии белков эти функции выполняют одна ковалентная дисульфидная связь, образованная при окислении двух сближенных в пространстве остатков цистеина полипептидных цепей, и три слабых взаимодействия: водородная, ионная связи и гидрофобное взаимодействие.
Слабые взаимодействия
Нековалентные связи играют важную роль в процессе репликации ДНК (спаривание комплементарных оснований нуклеотидов), фолдинга (складывания) белковой молекулы с це-лью достижения нативной структуры, взаимодействия субстрата и активного центра фермента, детекции управляющих гуморальных сигналов (взаимодействие гормон-рецептор), борьбы с чужеродной генетической информацией (взаимодействие антиген-антитело).
1. Электростатическое взаимодействие (ионная связь) зависит от электрического заряда атомов. Энергия ионной связи описывается уравнением Coulob’s:
ф г
E=kq1q2/Dr
где: Е — энергия, q, and q2 — заряды двух атомов (в единицах электрического заряда), г — расстояние между двумя атомами (в ангстремах), D — диэлектрическая постоянная (характеристика среды), и к — константа (к= 332, для выражения энергии в ккал/моль и к= 1389—кДж/моль).
Ангстрем (А) — единица длины 10~10 м = 10-8 см = 10-4 мкм = 10~1 нм
Итак, электростатическое взаимодействие между двумя атомами с простыми зарядами и разделенными на 3 А (0,3 нм) в воде (диэлектрическая константа 80) имеет энергию 1,4 ккал/моль (5,9 кДж/моль). При сближении заряженных частиц вдвое электростатическое
взаимодействие увеличивается вчетверо. Удаление молекул воды из пространства, разделяющего взаимодействующие аминокислотные остатки полипептидных цепей, приводит к значительному увеличению силы притяжения.
2. Водородные связи. Эти связи важны для многих веществ, растворенных в воде. Водородная связь возникает, если атом водорода оказывается между двумя электроотрицательными элементами (например, атомами азота и кислорода). При образовании связи реализуются донорно-акцепторный механизм и электростатическое взаимодействие. Атом, с которым водород связан ковалентно, служит донором водорода, а электроотрицательный атом другой молекулы — акцептором. Расстояние между двумя электроотрицательными атомами, соединенными водородной связью, находится в пределах 0,26—0,31 нм. Водородная связь намного слабее, чем ковалентная. Энергия водородной связи около 1,3 ккал/ моль (5,4 кДж/моль), тогда как энергия ковалентной углерод-водородной связи составляет 100 ккал/моль (418 кДж/моль). Характерной особенностью водородных связей является то, что они обладают наибольшей прочностью тогда, когда взаимная ориентация связанных между собой молекул обеспечивает максимальную энергию электростатического взаимодействия (например, стабилизация вторичных структур белков и ДНК). Удаление молекул воды из пространства, разделяющего взаимодействующие молекулы, увеличивает энергию связывания, поскольку при этом резко снижается диэлектрическая постоянная. Наиболее часто встречаются следующие типы водородных связей: -О-Н*«*О-; -O-H««»N-;
(обычно водородная связь обозначается тремя рядом стоящими точками).
3. Взаимодействие Ван дер Ваальса основано на изменении распределения электронного заряда во времени вокруг атома. Как правило, распределение зарядов не является строго симметричным. Это переходная асимметрия заряда вокруг атома через электростатическое взаимодействие индуцирует комплементарную асимметрию распределения электронного заряда вокруг соседнего атома, т. е. возникают диполи. В результате атомы (диполи) сближаются до определенной контактной дистанции. Энергия взаимодействия Ван дер Ваальса очень слабая 0,5—1,0 ккал/моль (2—4 кДж/моль) на
4
Введение в биохимию Глава 1
пару атомов. Смещенные электроны, возвращаясь в положение равновесия, «проскакивают» его, т. е. диполи осцилируют. Это взаимодействие становится значимым, когда сближаются поверхности больших молекул и взаимодействие Ван дер Ваальса возникает между многими атомами. Сила притяжения при этом обратно пропорциональна седьмой степени расстояния, т. е. она очень быстро возрастает при сближении взаимодействующих молекул. Чем больше площадь контакта, тем выше сила взаимного притяжения. Эти силы достигают значительной величины, когда в область контакта уже не могут проникнуть молекулы воды. Если же электронные облака двух молекул перекрываются, то возникают мощные силы отталкивания, и для их преодоления необходима затрата энергии.
4. Гидрофобные взаимодействия. Подобно слиянию капелек масла в воде с образованием одной большой капли, в водной среде стремятся сблизиться неполярные гидрофобные группы полипептидных цепей, например, боковые цепи валина, лейцина и фенилаланина. Такое гидрофобное взаимодействие обусловлено тем, что молекулы воды образуют между собой сетку водородных связей, и если в воду ввести гидрофобные молекулы, то число конфигураций, при которых будут образовываться водородные связи, уменьшится по сравнению с чистой водой. В результате энтропия такой системы будет ниже. Чем больше площадь поверхности между гидрофобными молекулами и контактирующими с ними молекулами воды, тем меньше энтропия и тем выше энергия системы. Если гидрофобные группы двух белков окажутся настолько близко друг к другу, что между ними не останется молекул воды, то общая площадь их контакта с водой уменьшится и энергия системы окажется ниже, чем до их взаимодействия. Иными словами, можно говорить о притяжении между белковыми поверхностями. Гидрофобные взаимодействия по некоторым оценкам могут обеспечивать, например, до 50 % всего сродства между антигеном и антителом.
Большинство химических реакций в организме происходит в водной среде. Поэтому следует учитывать роль воды не только как растворителя, но и как участника химических превращений. Выраженность и специфичность слабых взаимодействий напрямую зависят от водного окружения.
Роль ВОДЫ
Два свойства воды наиболее важны для биологических тканей:
1. Вода — это полярная молекула. Каждый из двух атомов водорода объединяет свой электрон с одним из электронов атома кислорода. Взаимное расположение возникающих при этом двух электронных пар обусловливает V-образную форму молекулы воды. Поскольку у атома кислорода имеются еще две неподелен-ные электронные пары, он несет частично отрицательный заряд. Более электроотрицательный атом кислорода оттягивает электронную плотность от ядер атомов водорода, что создает в области атомов водорода частично положительный заряд. Поэтому электронейтраль-ная молекула воды существует как полярный диполь.
2. Вода — высокоструктурированная среда. Поскольку расположение электронов вокруг атома кислорода близко к тетраэдрическому, каждая молекула воды может образовать водородные связи максимально с четырьмя (точнее 3,4) соседними молекулами воды. Такое взаимодействие имеется в структуре льда. Сеть водородных связей поддерживает эту структуру. В жидком состоянии часть водородных связей разрушается, а оставшиеся поддерживают ажурную (доле каэдричес кую) структуру воды. Благодаря динамичности формирования водородных связей (время полужизни каждой из них 1 х 10-9 с) вода является текучей жидкостью и прекрасным растворителем для полярных молекул. В то же время в присутствии воды могут проявляться конкурентные взаимодействия в отношении выбора атома, образующего водородную связь/ Например, в присутствии молекул воды может нарушиться водородная связь, образованная между элементами пептидных связей белков (рис. 1.2).
Поэтому, строго говоря, водородная связь между СО и NH группами может существовать только в отсутствии молекул воды. Диэлектрическая константа воды равна 80, что резко уменьшает электростатическое взаимодействие, сравнимое с таковым в вакууме. Формирование сольватных оболочек из диполей воды вокруг ионов уменьшает электростатическое взаимодействие между ионами.
Возникает вопрос, почему жизнь теплокровных связана с температурой около 37°С?
5
Глава 1 Введение в биохимию
Рис. 1.2. Молекулы воды нарушают образование водородных связей между СО- и NH-rpyn-пами.
По мнению авторов лекций, это температурная граница, при которой меняется надмолекулярная организация воды. Нарушения биохимических процессов при гипертермии (воспалительные заболевания), возможно, определяются изменением надмолекулярной структуры воды.
Итак, живая материя, возникшая в водной среде, требует высокой структурной и динамичной организации, что осуществляется благодаря слабым (нековалентным) взаимодействиям между молекулами. Максимальная выраженность нековалентных взаимодействий между молекулами требует удаления воды между ними. В этом можно видеть одно из фундаментальных доказательств второго закона термодинамики.
Законы термодинамики
Общим для всех взаимодействий, описанных выше, является понятие энергии. Обратимся к разделу физики, называемому термодинамикой, науки о превращениях энергии. Первый закон термодинамики — это закон сохранения энергии: энергия не появляется и не исчезает; всякий раз, когда энергия используется для выполнения работы или же переходит из одной формы в другую, общее количество энергии остается неизменным. Второй закон термодинамики гласит, что все физические или химические процессы стремятся идти в направлении, соответствующем необратимому переходу полезной энергии в хаотическую, неупорядоченную форму. Мерой такого перехода служит величина — энтропия. Процесс останавливается, когда наступает состояние равновесия, при котором энтропия имеет максималь
но возможное при данных условиях значение. Энтропия является количественной характеристикой или мерой неупорядоченной энергии в данной системе. Живые организмы сохраняют внутреннюю упорядоченность, получая свободную энергию в виде пищевых веществ (или солнечного света) из окружающей среды и возвращая в нее такое же количество энергии в менее полезной форме, главным образом в форме тепла, которое рассеивается в окружающей среде.
Жизнь на планете существует в виде особой оболочки — биосферы, которая определяется как: 1) высокоорганизованная, многоуровневая, открытая, гомеостазированная система с прогрессирующей в историческом масштабе времени степенью сложности, 2) состоящая из самоорганизующихся дискретных единиц, способных к согласованной эволюции, 3) «управляемая» естественным отбором на основе матричного синтеза (репродукции) с наличием «информационного шума», а также высокомолекулярных соединений углерода. Наиболее характерная черта биосферы (жизни) — наличие включенных в общепланетарные системы закономерно организованных и тонко регулируемых круговоротов веществ, а также потоков энергии и информации (В. Н. Ярыгин, 1999 -2002).
Возникновение жизни на Земле
Известны три основных подхода к решению проблемы происхождения жизни на Земле.
1. Идея панспермии, согласно которой жизнь, представляя собой явление космического масштаба, столь же вечна и повсеместна во Вселенной, как и материя (Г. Гельмгольц, С. Аррениус, В. И. Вернадский, У. Томпсон). Появление ее на Земле объясня
6
Введение в биохимию Глава 1
ется проникновением на планету зародышей, постоянно путешествующих в космическом пространстве.
2. Идея абиогенеза (Э. Геккель) связывает проблему происхождения жизни на Земле с решением задачи образования сложных органических макромолекул (белков, нуклеиновых кислот) из простых в отсутствие живых
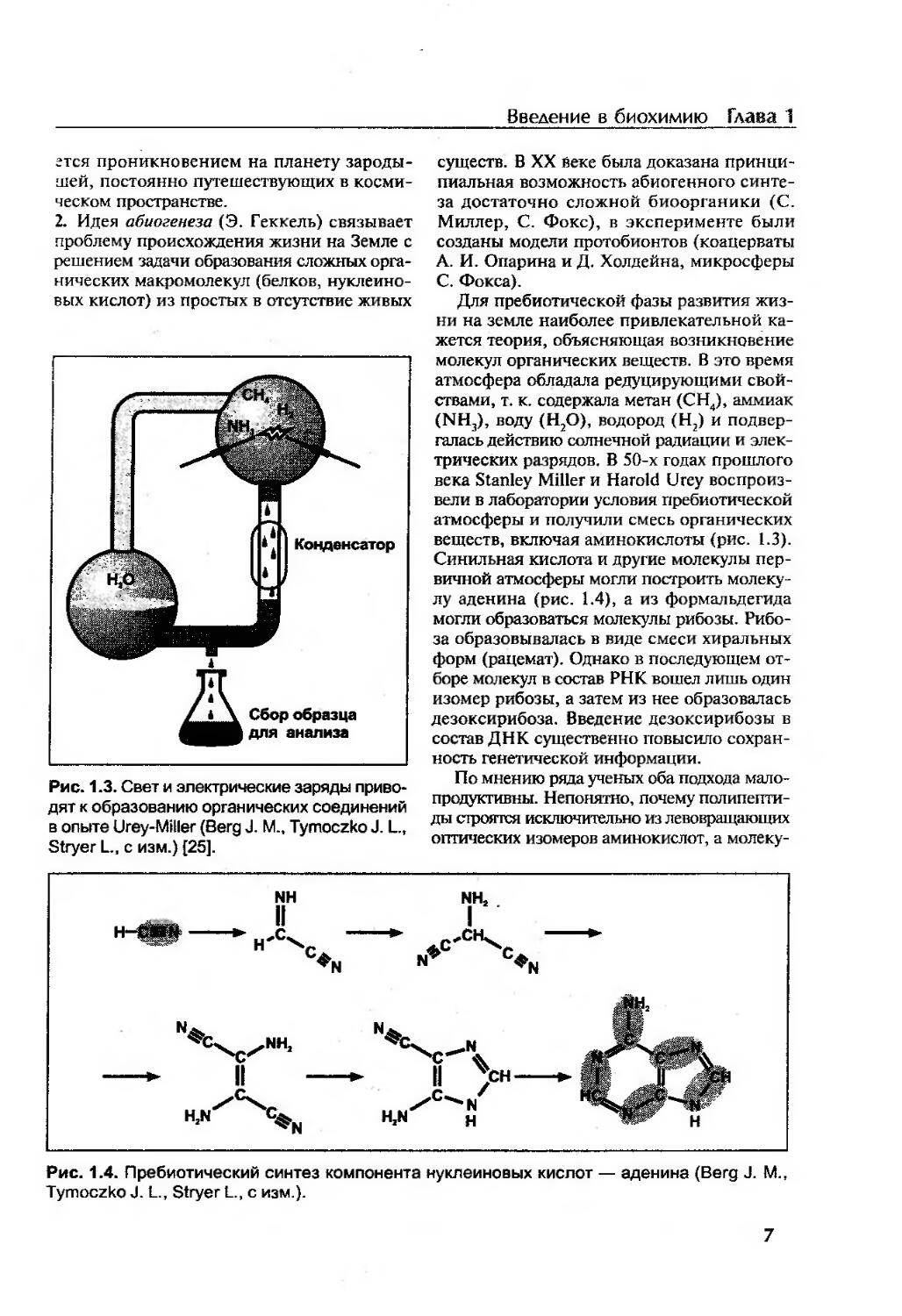
Рис. 1.3. Свет и электрические заряды приводят к образованию органических соединений в опыте Urey-Miller (Berg J. М., Tymoczko J. L., Stryer L., с изм.) [25].
существ. В XX Веке была доказана принципиальная возможность абиогенного синтеза достаточно сложной биоорганики (С. Миллер, С. Фокс), в эксперименте были созданы модели протобионтов (коацерваты А. И. Опарина и Д. Холдейна, микросферы С. Фокса).
Для пребиотической фазы развития жизни на земле наиболее привлекательной кажется теория, объясняющая возникновение молекул органических веществ. В это время атмосфера обладала редуцирующими свойствами, т. к. содержала метан (СН4), аммиак (NH3), воду (Н2О), водород (Н2) и подвергалась действию солнечной радиации и электрических разрядов. В 50-х годах прошлого века Stanley Miller и Harold Urey воспроизвели в лаборатории условия пребиотической атмосферы и получили смесь органических веществ, включая аминокислоты (рис. 1.3). Синильная кислота и другие молекулы первичной атмосферы могли построить молекулу аденина (рис. 1.4), а из формальдегида могли образоваться молекулы рибозы. Рибоза образовывалась в виде смеси хиральных форм (рацемат). Однако в последующем отборе молекул в состав РНК вошел лишь один изомер рибозы, а затем из нее образовалась дезоксирибоза. Введение дезоксирибозы в состав ДНК существенно повысило сохранность генетической информации.
По мнению ряда ученых оба подхода малопродуктивны. Непонятно, почему полипептиды строятся исключительно из левовращающих оптических изомеров аминокислот, а молеку
Рис. 1.4. Пребиотический синтез компонента нуклеиновых кислот — аденина (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
7
Глава 1 Введение в биохимию
лы нуклеиновых кислот содержат только правовращающие изомеры сахаров (феномен хи-ральной чистоты), тогда как полученные абиогенным путем из метеоритного вещества аминокислоты или полипептиды представлены смесью из примерно равного количества обоих оптических изомеров.
3. Создание теории самоорганизующихся систем с учетом неравновесной термодинамики И. Пригожина, принципиально отличительной чертой которой является способность корригировать свое поведение (т. е. эволюционировать) на основе предшествующего опыта, в том числе, путем создания новой информации, осознания принадлежности живых объектов к названной категории систем. Принципиальной с точки зрения существования и динамики самоорганизующихся систем представляется возможность образования упорядоченных (высоко информатизированных) макромолекул из неупорядоченной массы вещества-предшественника с использованием механизмов матричного синтеза и естественного отбора. Эволюционное поведение, базирующееся на самовоспроизведении (самокопирование — тиражирование информации) с «информационным шумом» (случайные искажения информации — мутации) и управляемое естественным отбором (выбор из случайного набора вариантов), обеспечивает появление в системе новой информации и, как следствие, реальность прогрессивного роста степени сложности.
Узловые моменты развития жизни
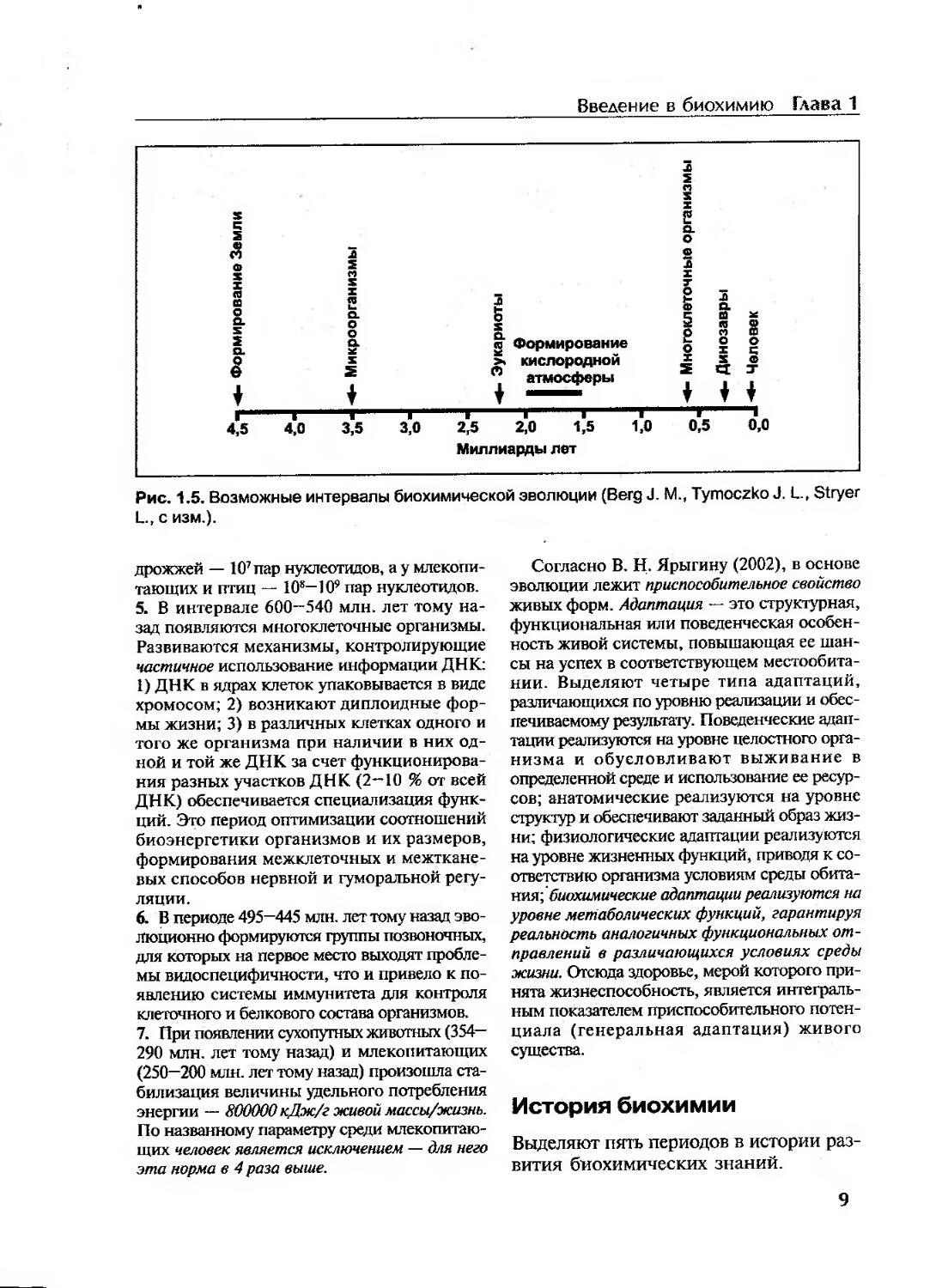
1. Предполагается, что при возрасте планеты в 4,5 " 4,6 млрд, лет, пригодные для жизни водоемы появились 4,0—3,8 млрд, лет тому назад (рис. 1.5). В этот период в абиогенных условиях функционируют отбирающиеся, самосохра-няющиеся и изменяющиеся в сторону увеличения сложности организации системы гиперциклы (по М. Эйгену). Для них реальны автокатализ (самовоспроизведение); закономерные взаимопереходы высоко- и низкоэнергетических соединений (круговороты энергии и вещества); принципиальная перспектива повышать свою сложность на основе вновь создаваемой информации (репродукция на фоне «информационного шума»); конкуренция за субстраты (норма отношений со средой); есте
ственный отбор за устойчивость и эффективность; объединение и коэволюция с другими системами (принцип экосистемы) с той же конечной «целью» — упорядоченности и стабильности (К. Ю. Еськов). На основании этих процессов могли сложиться основные атрибуты жизни — самовоспроизведение, самоорганизация, наследственность, случайная (мутационная) изменчивость, естественный отбор,
2. Появление прокариот 3,1 млрд, тому назад знаменует оформление жизни как проявление биосферы. В этот период возникают хемо- и фотоавтотрофы, гетеротрофы, детритофаги. Происходит стабилизация интенсивности мутационного процесса на уровне 10~5-10~7мутаций на 1 локус ДНК за поколение. Названный уровень сохраняется и сегодня от кишечной палочки до человека. Благодаря чрезвычайной точности при репликации генома человека, включающего 3* 109 нуклеотидных пар, возможно примерно 3 информационных искажения (мутации) на реплицирующий геном. В это же время формируются: I) системы репаративного синтеза ДНК; 2) системы формирования нативной структуры белков и выбраковки молекул с неправильной трехмерной структурой с помощью белков теплового шока (шаперонов) и протеолиза убиквитин-меченых аномальных белков. Таким образом, генетические основы здоровья были заложены на самых ранних этапах эволюции.
3. В интервале 1,9— 1,7 млрд, лет тому назад концентрация кислорода в атмосфере Земли превысила 1 % (точка Пастера), что позволило развивать механизмы аэробного гликолиза и тем самым поднять биоэнергетику живых организмов на качественно новый уровень. В это время развитие специализированных органелл — митохондрий — для реализации связанных с кислородом механизмов энергообеспечения функций клеток привело также к образованию вредных для мембран и макромолекул свободно-радикальных продуктов. Поэтому эволюция в дальнейшем обеспечила формирование системы неферментативной и ферментативной антиоксидантной защиты.
4. Период в интервале 2,0—1,5 млрд, лет тому назад — время становления эукариотических организмов. Произошло количественное и качественное увеличение возможности накопления информации в ДНК ядер клеток: если геном прокариот содержит в среднем 10s— 106 пар нуклеотидов, то у одноклеточных эукариот
8
Введение в биохимию Глава 1
гс Формирование кислородной ” атмосферы
2,5 2,0 1,5 1,0
Миллиарды лет
Рис. 1.5. Возможные интервалы биохимической эволюции (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
дрожжей — 107 пар нуклеотидов, а у млекопитающих и птиц — 108—109 пар нуклеотидов.
5. В интервале 600—540 млн. лет тому назад появляются многоклеточные организмы. Развиваются механизмы, контролирующие частичное использование информации ДНК: 1) ДНК в ядрах клеток упаковывается в виде хромосом; 2) возникают диплоидные формы жизни; 3) в различных клетках одного и того же организма при наличии в них одной и той же ДНК за счет функционирования разных участков ДНК (2—10 % от всей ДНК) обеспечивается специализация функций. Это период оптимизации соотношений биоэнергетики организмов и их размеров, формирования межклеточных и межтканевых способов нервной и гуморальной регуляции.
6. В периоде 495—445 млн. лет тому назад эволюционно формируются группы позвоночных, для которых на первое место выходят проблемы видоспецифичности, что и привело к появлению системы иммунитета для контроля клеточного и белкового состава организмов.
7. При появлении сухопутных животных (354— 290 млн. лет тому назад) и млекопитающих (250—200 млн. лет тому назад) произошла стабилизация величины удельного потребления энергии — 800000кДж/г живой массы/жизнь. По названному параметру среди млекопитающих человек является исключением — для него эта норма в 4 раза выше.
Согласно В. Н. Ярыгину (2002), в основе эволюции лежит приспособительное свойство живых форм. Адаптация — это структурная, функциональная или поведенческая особенность живой системы, повышающая ее шансы на успех в соответствующем местообитании. Выделяют четыре типа адаптаций, различающихся по уровню реализации и обеспечиваемому результату. Поведенческие адаптации реализуются на уровне целостного орга-низма и обусловливают выживание в определенной среде и использование ее ресурсов; анатомические реализуются на уровне структур и обеспечивают заданный образ жизни; физиологические адаптации реализуются на уровне жизненных функций, приводя к соответствию организма условиям среды обитания; биохимические адаптации реализуются на уровне метаболических функций, гарантируя реальность аналогичных функциональных отправлений в различающихся условиях среды жизни. Отсюда здоровье, мерой которого принята жизнеспособность, является интегральным показателем приспособительного потенциала (генеральная адаптация) живого существа.
История биохимии
Выделяют пять периодов в истории развития биохимических знаний.
9
Глава 1 Введение в биохимию
Первый период — с древних времен до XV века (эпоха Возрождения) —- это период практического использования биохимических процессов без знания их теоретических основ: получение лекарств из биологических объектов, пивоварение, хлебопечение, виноделие.
Второй период — от эпохи Возрождения до середины XIX века — период накопления биохимических знаний и становления науки. Леонардо да Винчи открыл, что живой организм способен существовать только в такой атмосфере, в которой может гореть пламя. Парацельс считал задачей алхимии создание лекарств. М. В. Ломоносов писал, что органы животных и растений состоят из более мелких частичек, и именно из неорганических. Биохимия как отдельная наука стала выделяться в начале XIX века с пионерских работ Фридриха Вёлера. До этого времени полагали, что вещества живых организмов отличаются от неживой материи и не подчиняются законам физики и химии. В 1928 г. Вёлер показал, что мочевина, вещество биологического происхождения, может быть синтезирована в лаборатории из неорганического вещества — цианата аммония. Спустя семьдесят лет Э. Бухнер доказал, что экстракты дрожжевых клеток переваривают крахмал так же эффективно, как и живые дрожжевые клетки. Обе эти работы нанесли существенный удар по витализму — учению, согласно которому химические вещества живой природы синтезируются только с помощью особой жизненной силы, и дали мощный импульс дальнейшему развитию биохимии. Так, в 50-х гг. XIX в. М. Бертло удалось синтезировать целый ряд органических соединений, свойственных живой природе. М. Шев-рель заложил основы химии липидов. Нуклеиновые кислоты были выделены в 1869 г. Ф. Мишером, но структура была изучена недостаточно, и в начале
90-х годов их рассматривали только как структурный компонент клетки.
Третий период в истории биохимии, начинающийся со второй половины XIX века, ознаменовался выделением биохимии как самостоятельной науки. К этому периоду относится деятельность А. Я. Данилевского, предсказавшего поли-пептидную теорию структуры белков, выдвинувшего идею об обратимости действия ферментов и создавшего первую в России кафедру биохимии в Казанском университете. Целые направления в биохимии открыли М. В. Ненцкий (биосинтез мочевины, строение гемоглобина), Н. И. Лунин (витамины), Э. Фишер (свойства аминокислот и открытие пептидной связи), О. Варбург, А. Н. Бах и В. И. Палладии (биологическое окисление), А. Гарден и В. Ионг (открытие НАД), Ф. Кнооп (бета-окисление жирных кислот), Д. Самнер и Д. Нортроп (выделение ферментов в виде кристаллов), Г. Кребс (описание первых биохимических циклов — синтез мочевины, 1932 г. и цикл трикарбоновых кислот, 1937 г.), В. А. Энгельгардт и М. В. Любимова (сопряжение дыхания и фосфорилирования), А. Е. Браунштейн и М. Г. Крицман (трансаминирование) и др. Это был период накопления и первичной систематизации знаний.
Четвертый период начался в 40—50-х годах прошлого столетия и связан с бурным развитием биохимии благодаря внедрению новых физических, физико-химических и компьютерных методов исследования. П. Перутц, Д. Кендрью, Л. Полинг широко применяли методы рентгеноструктурного анализа при исследовании биомолекул, Д. Уотсон и Ф. Крик предложили модель строения ДНК, А. Н. Белозерский использовал нуклеотидный состав ДНК как таксономический признак, Ф. Сенджер разработал методы анализа полипептидных и по-
10
Введение в биохимию Глава 1
линуклеотидных цепей, А. С. Спирин и П. Доти описали вторичную и третичную структуры рибосомальной ДНК, М. Ниренберг, С. Очоа, Г. Корана расшифровали генетический код, П. Митчелл сформулировал хемиосмотическую теорию окислительного фосфорилирования и др. Биохимия прошлого века решила две важнейшие задачи — 1) создание карты метаболизма и 2) расшифровка генома живых организмов.
Учитывая принципиальную значимость четвертого периода истории биохимии для развития биохимии XXI века, необходимо вспомнить ученых, которые получали Нобелевские премии на протяжении последних 50 лет за исследования, связанные с биохимией и медициной (таблица 1.1).
Направления исследований этих и многих других ученых формировали основное содержание биохимии. Практически каждая из перечисленных работ имела не только фундаментальную значимость (открытие и объяснение новых химико-биологических явлений), но и являлась инициатором практического применения установленного явления в медицине и биологии. Поэтому эти исследования, базируясь на работах предшественников, требовали создания принципиально новых методических подходов д ля достижения поставленных целей. Как правило, новые биохимические исследовательские технологии незамедлительно внедрялись в практическую деятельность медицинских и иных центров. Например, открытие термостабильной ДНК-полимеразы явилось поводом для создания метода полимеразной цепной реакции, без которой в настоящее время не мыслима работа инфекционистов, санитарных врачей, дерматовенерологов, экологов и других специалистов.
Биохимия XXI века, вероятно, пятый период развития биохимии, будет посвя
щена характеристике каждого живого организма путем использования методологии протеомики, т. е. науки об индивидуальных особенностях белкового состава живого организма. Протеомика находится между геномикой и транс-криптомикой, с одной стороны, и мс-таболомикой, с другой (см. лекцию 33).
Общие представления о химическом составе живых организмов
В живых организмах присутствует более 70 химических элементов. В. И. Вернадский в книге «Биосфера» (1926) писал, что жизнь теснейшим образом связана с химическим строением земной коры. Он предложил группировать химические элементы биосферы «декадами» в зависимости от содержания в живых организмах (таблица 1.2).
Высказано предположение, что химический состав живых организмов может явиться таксономическим признаком.
Существует определенная зависимость между распространением элементов в биосфере, их биологической ролью и положением в периодической системе Менделеева. Вещества живых организмов более чем на 99 % состоят из элементов первых трех периодов этой системы. Как правило, при переходе от легких к тяжелым элементам в пределах одной и той же подгруппы (например, Zn->Cd“*Hg) возрастает токсичность элементов и одновременно уменьшается содержание их в биомассе. Высокой биологической активностью обладают многие соединения переходных металлов, к которым относятся элементы 4-го периода (с 21 по 30): Мп, Fe, Со, Ni, Си, Zn и др., поскольку они способны к образованию комплексов, играя в них роль центральных атомов. Элементы некоторых подгрупп периодической системы могут в той или иной
11
Глава 1 Введение в биохимию
Таблица 1.1. Нобелевские премии, связанные с развитием биохимии за последние 50 лет
Год присуждения Автор, авторы Область исследований
1958 Sanger F. Первичная структура белков
1959 Kornberg A., Ochoa S. Синтез ДНК и РНК
1961 Calvin M. Биохимия ассимиляции СО2 в фотосинтезе
1962 Kendrew J.C., Perutz M.F. Третичная структура глобулярных белков
1962 Crick F.H.F., Watson J.D., Wilkins M.H.F. Пространственная структура ДНК
1963 Eccles J.C., Hodgkin A.L., Huxley A.F. Ионные основы нервных мембранных потенциалов
1965 Jacob F., Lwoff A.M., Monod J.L Бактериальные опероны и мРНК
1966 Rous P. Опухолевые вирусы
1968 Holley R.W. Структура тРНК
1968 Khorana H.G., Nirenberg M.W. Генетический код
1969 Delbruck M„ Hershey A.D., Luria S.E. Генетическая структура вирусов
1970 Leloir L.F. Роль сахаро-нуклеотидов в синтезе углеводов
1971 Sutherland E.W. Механизм действия гормонов и цАМФ
1972 Anfinsen C.B. Зависимость между первичной и третичной структурой белков
1972 Edelman G., Porter R.R. Структура иммуноглобулинов
1974 Claude A., de Duve C., Palade G.E. Структура и функция внутриклеточных компонентов
1975 Baltimore D., Dulbecco R., Temin H.M. Обратная транскриптаза и опухолевая вирусная активность
1976 Gajdusek D.C. Прионовые заболевания
1978 Mitchell P. Хемиосмотический механизм окислительного фосфорилирования
1978 Arber W., Nathans D., Smith H. Технологии рестрикционных эндонуклеаз
1980 Berg P„ Gilbert W., Sanger F. Технология рекомбинантных ДНК. Секвенирование ДНК
1983 McClintock B. Мобильные элементы генома
1984 Kohler G., Milstein C., Jerne N.K. Моноклональные антитела
1985 Brown M.S., Goldstein J.L. Регуляция обмена холестерола и эндоцитоз
1988 Deisenhofer J., Huber R., Michel H. Бактериальный фотосинтетический реакционный центр
1989 Cech T., Altman S. Рибозимы
1992 Fischer E., Krebs E. Регуляция активности ферментов фосфорилированием-дефосфорилированием
12
Введение в биохимию Глава 1
Продолжение табл. 1.1
1993 Mullis К. Полимеразная цепная реакция
1994 Gilman A., Rodbell М, Структура и функция ГТФ-связывающих (G) белков
1997 Skou J.C., Boyer Р., Walker J. №+/К+АТФаза. Механизм синтеза АТФ
1998 Furchgott R., Ignarro L., Murad F. NO - межклеточный мессенджер
2000 Carlsson A., Greengard P.t Kandel E. Синаптическая передача информации. Сигнальные молекулы
2001 Hartwell L., Hunt T., Nurse P. Регуляция клеточного цикла
2002 Brenner S., Suiston J., Horvitz H. Апоптоз
2003 Agre P.r MacKinnon R. Структура мембранных каналов (аквапорины)
Таблица 1.2. Элементарный состав тканей растений и животных
Номер декад Элементы Содержание в % на сырую ткань
Макроэлементы I О, Н 10
II С 1
III N, Р, К, Са, Si о,1
IV Mg, S, Fe, Na, Cl, Al 0,01
Микроэлементы V-VII Mn, B, Cu, Zn, Ba, Li, Ni, Rb, F и др. 0,001-1 о-5
Ультрамикроэлементы VIII-XIV Mo, I, As, Ag, Hg, Au, Pb, Ra и др. 10-М О-13
степени заменять друг друга в биологических процессах (например, кальций и барий, хлор и бром). Некоторые элементы могут конкурировать в биохимических процессах, например, известны антагонистические отношения в паре лантан-кальций. В 1993 г. в США был утвержден патент на новый класс противовоспалительных препаратов на базе лантана, поскольку этот элемент модулирует процессы переноса кальция в цитозоль клетки. Одним из последствий глобальной катастрофы — аварии на Чернобыльской атомной электростанции — оказалось проявление биологического антагонизма элементов в парах
цезий — калий, стронций — кальций, трансурановые элементы — железо.
Около 98 % массы биосферы составляют четыре элемента — водород, кислород, углерод и азот. Они легко спаривают электроны и образуют прочные ковалентные связи. Малые размеры атомов этих элементов также способствуют образованию коротких, прочных химических связей. Молекулы с такими связями более устойчивы к действию физических и химических факторов. Большое значение имеет также способность перечисленных элементов образовывать кратные связи (двойные, тройные), благодаря чему они превосходят
13
Глава 1 Введение в биохимию
многие элементы по числу и разнообразию соединений с уникальными свойствами. В качестве примера приведем примерный химический состав клетки кишечной палочки Е. coli (таблица 1.3).
В пересчете на сухую массу в организме человека содержится С — 50 %, О — 20 %, Н - 10 %, N - 8,5 %, Са - 4 %, Р - 2,5 %, К - 1 %, S - 0,8 %, Na -0,4 %, Cl - 0,4 %, Mg - 0,1 %, Fe -0,01 %, Мп - 0,001 %, J -0,00005 %. При недостатке йода и фтора в воде и пище возникают гипотироз (эндемический зоб) и кариес зубов. При недостатке железа — железодефицитная анемия.
Элементы-органогены (С, О, N, Н, Р, S) образуют две группы органических веществ живых организмов — биополимеры и низкомолекулярные биорегуляторы.
По химическому составу тело человека и животных включает 5 основных классов веществ (для человека массой 65 кг): 1) белки 11 кг (17 %); 2) жиры 9 кг (13,8 %); 3) углеводы 1 кг (1,5 %); 4) вода 40 кг (61,6 %); 5) минералы 4 кг (6,1 %).
В составе организмов находят карбоновые кислоты, углеводороды, амины, спирты, альдегиды. В отдельные группы должны быть выделены вещества, присутствующие в тканях живых организмов в небольших количествах, но играющих первостепенную роль в регуляции обмена веществ: пептиды, гормоны, витамины, простагландины, кинины, нуклеарные регуляторные факторы и Др.
Таблица 1.3. Химический состав бактерии Escherichia coli
Компонент Доля массы клетки, % Число молекул на клетку Число видов молекул
Неорганические компоненты клетки
Вода 70 4x1010 1
Неорганические ионы 1.0 2,5x10е 20
Низкомолекулярные метаболиты и биорегуляторы
Моносахариды и их производные 1.0 2,0x10е 250
Аминокислоты и их производные 0.4 3,0x107 100
Нуклеотиды и их производные 0.4 1,2хЮ7 100
Липиды 1.0 2,5*107 50
Другие низкомолекулярные 0.2 1,5x107 -300
соединения
Биополимеры
Белки 15 1,0x1 о6 -3000
РНК 6 3,0x1 о4 -1000
ДНК 1 4 1
Полисахариды 2 3,9хЮ4 50
Фосфолипиды мембран 2 - 40
Всего 100 - -3000
14
Введение в биохимию Глава 1
Единицы энергии и работы и значения некоторых физических постоянных (по
Д.Мецпер, 1980)
Джоуль, единица энергии в системе СИ
1 Дж=1 кгхм2хс ‘=1 Нхм (ньютон-метр)=1 Втхс (ватт-секунда)= 1 КдхВ (кулон-вольт)
Термохимическая калория 1 кал=4,184Дж
Большая калория 1 Кал -4 ккал=4,184 кДж
Работа, которую необходимо совершить, чтобы поднять груз весом 1 кг на высоту 1 м (над уровнем моря)=9,807 Дж
Свободная энергия гидролиза 1 моля АТФ при pH 7 и милли молярных концентрациях= -12,48 ккал=-52,2 кДж
Работа, которую необходимо совершить для повышения концентрации вещества в 1000 раз (например, от 10-6 до 10'3 М)=4,09 ккал=17,1 кДж
Число Авогадро — число частиц в одном моле вещества N=6,0220x Ю23
Число Фарадея 1 F=96485 Кд х молы1
Кулон I Кл1 Ахс (ампер-секунда) =6,241 х iols (элементарных зарядов)
Постоянная Больцмана к=1,3807 х
Ю^ДжХград’1
Газовая постоянная 7f=Nx£ А-8,3144 Джхград1 хмоль1 =1,9872 калх град-‘хмолы1 =0,08206 лхатмхград 'хмоль-1; при 25х /?Т=2,479 кДжхмоль-1
Единица измерения температуры, градус Кельвина, К; (УС=273,16К
lg х=2,3026 In х
Биохимия в Интернете
В настоящее время созданы глобальные информационные ресурсы, которые постоянно пополняются результатами исследования белков, нуклеиновых кислот, метаболитов и их превращений:
1) первичные структуры белков — Swiss Prot [http://au. expasy, org/sprot/]; UniProt[http;//www expasy. uniprot. org]; 2) пространственные структуры белков — Protein Data Bank [http://www. rcsb. org/pdb/home/home. do];
3) структурные формулы химических соединений — Chemi Dplus[http://chem. sis. nlm. nih. gov/chemidplus/J;
4) веб-страница номенклатурного комитета — http.//drnelson utmem. edu/ Cytocrome P450. html|;
5) структура генов, последовательности нуклеотидов ДНК — GenBankfhttp:// www. ncbi. nlm. nih. gov/Genbank/index, html];
6) локализация генов на хромосоме и средства визуализации структуры генов — HapMap[http://www. hapmap. org];
7) метаболические пути — KEGG[http:/ /www. genome, ad. jp/keg/];
8) литературные ссылки на биохимические исследования — PubMed[http://www. ncbi. nih. nih. gov/entrez/query. fegi? db=PubMed] или http://www. biomedcentral, com/; это одни из наиболее полных источников информации в области биологии и медицины.
Запросить необходимую статью можно по адресу http://www. molbiol. ш с регистрацией на страницах fulltext. Возможно получение полноразмерных статей из библиотеки Российского фонда фундаментальных исследований http:/ /www.’ elibrary, ru и ряда зарубежных агенств: http://www. inti, highware. org; http://www. medscape. com; http://www. content, nejm. jrg; http://www. thieme-connect. com.
15
Белки и аминокислоты
Определение
Белки являются основными биополимерами клеток, за счет которых осуществляются практически все функции организма. Термин «белок» происходит от немецкого слова «Eiweip«, что означает яичный белок или вообще белок. Другое название — протеины, происходит от греческого слова «протос» — первичный.
Белки являются линейными нераз-ветвленными полимерами построенными из аминокислот. Информация о структуре белка закодирована в ДНК. Все живые организмы используют 20 идентичных аминокислот и, за некоторым исключением, имеют одинаковый генетический код.
Краткая историческая справка', начало XIX века — открытие азота в белках (Мульдер); 1820 г. — выделение первой аминокислоты — глицин — из кислотного гидролизата желатина (Браконно); 1871 г. — установление факта расщепления белков до аминокислот пищева
рительными соками (П. Н. Любавин); 1902 г. — открытие пептидной связи (Фишер); 20-е годы XX века — определение молекулярной массы белков ультрацентрифугированием (Сведберг); 20-е годы XX века —- доказательство положения о том, что ферменты являются белками (Самнер, Нортроп, Ку-нитц); 1955 г. — описание первичной структуры инсулина (Сэнджер); 30—50-е годы — описание пространственной структуры белков с помощью рентгеноструктурного анализа (Перутц, Кенд-рью). Настоящее время — расшифровка первичной структуры и создание трехмерных моделей нескольких тысяч белков.
Функции белков
Функции белков могут быть разделены на 2 группы.
Структурные функции. Основными структурными белками являются коллаген, эластин (формируют костный матрикс, сосудистую систему и другие органы) и а-кератин (присутствует в эпидермальной ткани).
16
Белки и аминокислоты Глава 2
Динамические функции. Эти функции реализуют разнообразные белки: ферменты, гормоны, факторы свертывания <рови, иммуноглобулины, мембранные гецепторы, резервные белки, сократительные белки, дыхательные белки и др.
Элементарный состав белков
Белки преимущественно состоят из 5 - тавных элементов: С — 50—55 %, Н — --7,3 %, О - 19-24 %, N — 13-19 %, S — 0—4 %. Кроме вышеперечисленных. белки могут содержать также дру-ле элементы, такие как Р, Fe, Си, I, Mg, Zn и др. В большинстве белков имеется постоянное содержание азота, рав--ое 16 %. Поэтому количество белков когда выражают через азот: количество 'елка = содержание азота х 6,25. Различные ткани отличаются по содержа--:ию белков. В пересчете на сухую маету в селезенке 84 %, в легких 82 %, в мышцах 80 %, а в костях 24—28 % беЛ-кЭВ.
Молекулярная масса белков
Белки относятся к высокомолекуляр--ым соединениям, в состав которых зходят сотни и даже тысячи аминокислотных остатков. Молекулярная масса белков колеблется от 6000 до 1000000 Да и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры Зелка. Молекулярная масса пептидов меньше 6000 Да.
Для определения молекулярной массы Зелков используют следующие методы. 1. Химический метод требует точного знания количественного содержания аминокислоты в белке. Например, в простом белке содержится 0,6 % триптофана с молекулярной массой 204. Тогда М.
м. белка = 204x100/0,6= 34 000 Да. Применение метода ограничено.
Массы атомов и молекул выражаются в единицах массы изотопа углерода 12С, атомная масса которого принят равным 12. Масса одного атома 12С равна 12 дальтонам (Да), а 1 дальтон равен 1,661x1024 г. Массы молекул выражают в дальтонах, и численно они равны молекулярной массе. 1000 Да = 1 кДа (килодальтон).
2. Электронная микроскопия. Точная навеска навеска окрашивается осмиевой кислотой и подсчитывается количество частиц. Делят навеску на число частиц и находят массу одной молекулы.
3. Метод улътрацентрифугирования. В пробирке ультрацентрифуги создается центробежное ускорение, превышающее земное притяжение до 500000g. По мере перемещения молекул белка в таком центробежном поле они разделяются по молекулярной массе. При этом образуются границы белок-растворитель, которые регистрируют и рассчитывают скорость их перемещения. Вначале вычисляют константу седиментации белка (S), которая зависит от массы и формы белковой молекулы,
си2 3 хг
где: v—скорость перемещения границы белок-растворитель; to — угловая скорость ротора (рад/с); г—расстояние от центра ротора до середины пробирки с раствором белка, см.
Константа седиментации имеет размерность времени (ее выражают в секундах). Величина константы седиментации, равная 1 х Ю-13 с принята за единицу и названа Сведбергом (S).
Величина молекулярной массы вычисляется по уравнению Сведберга.
. Зак. 2124
17
Глава 2 Белки и аминокислоты
М.м.=
R *Тх S
D(1-vp)
где: R — газовая постоянная, эрг/(моль * град); Т—абсолютная температура (по шкале Кельвина); S—константа седиментации; р — плотность растворителя; v— парциальный удельный объем молекулы белка; D — коэффициент диффузии.
Константа седиментации является универсальной характеристикой молекул и надмолекулярных структур (таблица 2.1, рис. 2.1).
4. Гель-фильтрация и диск-электрофо-рез. Калибруют колонку, заполненную стандартными гранулами сефадекса (учитывается расстояние между гранулами и величина пор в гранулах), белками с известной молекулярной массой (рис. 2.2). Находят зависимость между элюционным объемом (Vs) и молекулярной массой. Чем меньше молекулярная масса, тем больше элюционный объем (т. е. объем растворителя, с которым белок выходит из колонки).
Через калиброванную колонку пропускают неизвестный белок, определяют его элюционный объем и по калибровочному графику определяют молекулярную массу. В методе диск-электрофореза сравнивают не элюцион-
ные объемы, а электрофоретическую подвижность белков.
В настоящее время для определения молекулярной массы нативного (находящегося в структурном состоянии для выполнения функции) белка используют методы гель-фильтрации (гельхро-матографии, гель-проникающий хроматографии) или аналитического ультрацентрифугйрования. Сочетание обоих подходов позволяет оценить как молекулярную массу белка, так и его протомеров. Однако эти методы не годны для решения современных задач протеомики. Точное определение массы белковых молекул осуществляется методом масс-спектрометрии.
Масс-спектрометрия белков
Этот метод давно применяется в анализе органических соединений. Анализ белков с помощью масс-спектрометрии казался нереальным в связи с низкой летучестью белковых молекул. Это ограничение было преодолено после введения техники эффективного диспергирования белка или других биомолекул в газовую среду с одновременной их ионизацией. Этот метод был назван MALDI (matrix-assisted laser desorptionionization, 1988 г.). Основные этапы метода определения молекулярной массы белков (рис. 2.3).
Таблица 2.1. Соотношение между величиной константы седиментации (S) и молекулярной массой белков (по Т. Creighton, 1993)
Белок Константа седиментации (S) Молекулярная масса
Панкреатический ингибитор 1 6520
трипсина
Цитохром С 1,83 12310
Рибонуклеаза А 1,78 13690
Миоглобин 1,97 17800
Трипсин 2,5 23200
Карбоангидраза 3,23 28800
Конканавалин А 3,8 51260
Малатдегидрогеназа 5,76 74900
Лактатдегидрогеназа 7,54 146200
18
Белки и аминокислоты Глава 2
Рис. 2.1. Плотность и константы седиментации клеточных элементов (Kleinsmith L. J., Kish V. М„ 1995).
Рис. 2.2. Калибровка хроматографической колонки.
1. Образец белка встраивают в подложку (матрикс) и производят ионизацию с помощью лазерного импульса.
2. Образовавшиеся ионы белка ускоряются в электрическом поле и направляются к детектору. Чем легче ион, тем быстрее он достигает детектора.
3. Ионизирующий лазерный импульс также включает регистратор времени полета ионов к детектору (time of flight — TOF).
4. На регистраторе отмечается время появления пиков в результате попадания ионов белков в детектор. На оси ординат отмечают интенсивность сигнала, а на оси абсцисс величины отношений масса/заряд.
В биологической и медицинской литературе такой подход исследования белков называют MALDI-TOF. С помощью этого метода были определены молекулярные массы
19
Глава 2 Белки и аминокислоты
Рис. 2.3. Масс-спектрометрия MALDI-TOF (Watson J. Т., 1997).
инсулина 5733,9 Да (расчетная величина 5733,5 Да) и р-лактоглобулина 18364 Да (расчетная величина 18388 Да). Для анализа этим методом достаточны концентрации белков в диапазоне пикомоли-фемтомоли. Именно такие концентрации находят в пятнах белков после двумерного электрофореза.
Если удается получать ионы белков из раствора, то такой метод называется масс-спектрометрия-ESI (electrospray ionization, 1988 г.). Перспективным для клинической биохимии является масс-спектрометрия-SELDI (surface-enhanced laser desorption and ionization, 2001 г.). В данном варианте используют для ионизации лазерным импульсом белки, сорбированные на различных поверхностях (в зависимости от специфичности связывания исследуемого белка) — гидрофобной, анионной, катионной, содержащей ионы металлов, антитела, антигены, рецепторы, лиганды, ДНК и др.
В лабораторной практике этот анализ называют SELDI ProtenChip-TexHononiR С помощью этого метода недавно была открыта группа белков, позволяющих с 90 % вероятностью диагностировать рак яичников.
Классификация белков
Различают несколько принципов классификации белков: 1) по функции, 2) по химической структуре и растворимости и 3) по биологической (пищевой) ценности.
Классификация по функции
В таблице 2.2 приведена классификация белков по их основным функциям.
20
Белки и аминокислоты Глава 2
Таблица 2.2. Классификация белков по функции
Функция Характеристика
Ферменты или Для белков-ферментов характерна высокая степень структурирования
катализаторы, молекулы, благодаря чему возможен катализ химической реакции в
активаторы и области активного центра и регуляция активности фермента через
ингибиторы взаимодействие эффекторов с аллостерическим центром. Известны
ферментов белки-активаторы (апопротеин Al, С//) и ингибиторы (ингибиторы трипсина из поджелудочной железы, соевых бобов; ингибиторы протеиназ из яда гадюки, ингибитор химотрипсина из картофеля).
Гормоны Как правило, белки (м. м. 20-30 кДа), которые содержат небольшие фрагменты определяющие гормональную активность; относятся к группе непроникающих в клетку гормонов, на поверхности клеток взаимодействуют с рецепторами, гормональный эффект реализуется через внутриклеточные посредники (гормоны гипоталамуса, гипофиза, поджелудочной железы, паращитовидных желез, кальцитонин).
Регуляторные Гистоны стабилизируют структуру ДНК и регулируют
i белки функционирование генома (проявление матричной активности ДНК при ослаблении связей с гистонами); гетерогенная группа негистоновых белков (м. м. 5-200 кДа) участвует в формировании нуклеосом и взаимодействии с хроматином гормон-рецепторных комплексов, в регуляции процессов репликации, транскрипции и трансляции; белки теплового шока (стрессовые белки); G-белки, регулирующие синтез циклических нуклеотидов; онкобелки и антионкобелки, определяющие малигнизацию клетки.
Защитные Антитела (иммуноглобулины) вырабатываются в ответ на введение
белки антигенов; белки системы свертывания крови; белки системы комплемента; ферменты обезвреживания ксенобиотиков; интерфероны, интерлейкины, лизоцим; белки-антифризы рыб; антивирусные белки растений; антибактериальные белки насекомых.
Токсические Высокомолекулярные белковые токсины микроорганизмов и растений
белки I I представлены тремя типами белков. Мультимерные дифтерийный и холерный токсины, токсин шигеллы (АВ5 протеины) построены из одной субъединицы типа А (20, 28 и 32 кДа, соответственно) и пяти субъединиц типа В (25,12 и 7,7 кДа, соответственно); субъединицы В связываются с клеточной поверхностью, а субъединица А проникает внутрь клетки, где блокирует синтез белков на рибосомах. Аналогично действуют растительные токсины — рицин, абрин, модецин, лектин. Энтеротоксин стафилококка или гемолизин кишечной папочки, встраиваясь в плазматическую мембрану, образуют в ней поры, через которые теряются важные компоненты цитоплазмы клеток. Токсины ядов змей представлены малыми белками — 6,7-7 кДа (примерно 60 аминокислотных остатков). Токсические пептиды ядов скорпиона, пчелы и осы состоят в среднем из 45 аминокислотных остатков. Эти токсины связываются с холинергическими белками и оказывают нейротоксическое действие.
Транспортные Альбумины и глобулины — переносчики различных веществ в
белки плазме крови. Порины — образуют поры для переноса веществ через клеточные мембраны. Транслоказы — обеспечивают обмен компонентами различных компартментов клеток.
21
Глава 2 Белки и аминокислоты
Продолжение табл. 2.2. Классификация белков по функции
Структурные белки Структурные белки мембран являются их структурными компонентами, склонны к агрегации и специфическим взаимодействиям (процессы самосборки), содержат в своем составе до 20 % гидрофобных аминокислотных остатков и до 40 % приходится на долю а-спиральных участков. Эти белки легко взаимодействуют с фосфолипидами мембран. Структурные функции выполняют также белки межклеточного матрикса (коллаген, ретикулин, кератин), кристаллины, белки ядерного матрикса, белки цитоплазматического скелета.
Сократительные белки Участвуют в механическом сокращении для осуществления движения (обладают, как правило, аденозинтрифосфатаз ной активностью): актин и миозин мышц, белки центральных и периферических фибрилл жгутиков и ресничек простейших, жгутиков сперматозоидов, тубулин аппарата движения хромосом в процессе митоза, миксомиозин —• нитевидный белок из плазмодия гриба физариума и др.
Рецепторные белки Во внутренней среде организма служат для взаимодействия с молекулами-биорегуляторами (сигнальными молекулами). Локализуются в мембранных структурах клеток, а также могут быть в растворенном состоянии. Клетка, содержащая рецептор, является клеткой-мишенью для управляющего химического сигнала, а также для взаимодействия с липопротеинами или вирусами. Для восприятия сигналов внешней среды известны фоторецепторные белки (олеин), для оценки вкуса сладкочувствительный белок, для восприятия запаха обонятельный белок, для восприятия звука холинорецепторные белки; в жизнедеятельности живых организмов важное место занимает рецепция ферромонов, аттрактантов, репеллентов, стрессогенных веществ ран.
Классификация по химической природе и растворимости
Эта классификация наиболее распространенная. Она основана на аминокислотном составе, структуре, размере и растворимости. Различают 2 группы: простые и сложные (конъюгированные).
1. Простые белки (альбумин, кератин и др.) состоят только из аминокислот и делятся на:
а) фибриллярные белки имеют палочкообразную вытянутую форму, нерастворимы в воде и физически прочные (отношение длины молекулы к диаметру больше 10); они выполняют структурные и защитные функции;
б) глобулярные белки представляют собой компактные сферические молеку-
лы, водорастворимы (отношение длины молекулы к диаметру не превышает 4); глобулярные белки выполняют динамические функции (ферменты, иммуноглобулины и транспортные белки гемоглобин и альбумины).
2. Сложные (конъюгированные) белки состоят из простого белка комбинированного с небелковым компонентом. Небелковая часть называется простети-ческои группой (или конъюгированной группой). Белок без простетической группы называется апопротеином. Белковая часть с простетической группой называется холопротеином. Простатическая группа играет ключевую роль в функционировании белка.
В соответствии с действующей классификацией в таблице 2.3 приведены примеры простых и сложных белков.
22
Белки и аминокислоты Глава 2
Таблица 2.3. Примеры простых и сложных белков
Белок Характеристика
Простые белки (деление по растворимости белков)
Альбумины Водорастворимые белки, осаждаются сульфатом аммония при 100 % насыщении. В плазме крови человека и животных альбумины составляет 50 % от всех белков; в белке яиц овальбумина — до 50 %; в молоке — лактальбумин-, альбумино-подобными белками богаты растения. Поддерживают онкотическое давление и осуществляют транспорт многих веществ, включая ксенобиотики.
Глобулины Растворимы в слабых растворах нейтральных солей; осаждаются сульфатом аммония при 50 % насыщении. В воде нерастворимы, поэтому выпадают в осадок при очистке от солей диализом. Глобулины составляют большую часть белков семян многих растений, особенно бобовых и масляничных, например, легумин в семенах гороха, фазеолин — фасоли, эдестин — конопли. Отдельные фракции являются специфическими транспортерами веществ (транскортин — переносит глюкокортикоидные гормоны). Концентрация увеличивается при воспалении — белки острой фазы, участвуют в гуморальном иммунитете — иммуноглобулины.
Проламины Хорошо растворимы в 60-80 % этиловом спирте, в их составе много
। глу и про и мало л из, арг и гли. Являются запасными белками злаков: глиадин — зерна пшеницы и ржи, гордеин —
зерна ячменя, зеин — зерна кукурузы.
Глютелины Хорошо растворимы в 0,2-2 % растворах щелочей. Содержатся в
семенах злаков и зеленых частях растений. Комплекс щелочнорастворимых белков семян пшеницы — глютенин, риса — оризенин. Глиадин + глютенин образуют клейковину, которая определяет качество муки и теста.
Гистоны Щелочные белки (12-30 кДа) содержат 20-30 % щелочных аминокислот. Растворимы в слабых кислотах (0,2 нормальные растворы), осаждаются аммиаком, спиртом. Не содержат триптофана, а также цистеина и цистина. Входят в состав хроматина, поэтому имеются во всех ядросодержащих клетках. В процессе эволюции — консервативные белки.
Протамины Щелочные белки (12 кДа) содержат 80 % щелочных аминокислот;
1 отсутствуют или содержатся в малом количестве цис, три, асп, тир, фен. Являясь поливалентным органическим катионом, легко образуют комплексы с нуклеиновыми кислотами. Образуют хроматин, в связи с чем представлены во всех ядросодержащих клетках. В большом количестве встречаются в сперме рыб — сальмин у лососевых и клупеин у сельди.
Протеиноиды Труднорастворимые белки, содержат много серы. Фибриллярные белки: фиброин шелка, кератины волос, рогов, копыт, коллагены — белки соединительной ткани, спонгин — белок морских губок и др.
Сложные (конъюгированные) белки
Г ликопротеины Содержат в своем составе гликозидные компоненты различной структуры. Гпикопротеинами являются многие структурные белки, ферменты, рецепторы и т. д. Большинство белков, расположенных на внешней поверхности животных клеток являются гликопротеинами. На долю углеводного компонента приходится от 1-3 % (овальбумин} до 80-90 % (групповые вещества крови}.
23
Глава 2 Белки и аминокислоты
Продолжение табл. 2.3
В составе гликопротеинов обнаружено 10 различных моносахаридов: D-галактоза, D-манноза, D-глюкоза, N-ацетилглюкозамин, N-ацетилгалактозамин, дезоксисахара (L-фукоза, L-рамноза), D-ксилоза, L-арабиноза. Типичным компонентом гликопротеинов является нейраминовая кислота (чаще в форме сиаловых кислот). Протеогликаны состоят из небольшой белковой части, к которой ковалентно присоединяется несколько десятков гетерополисахаридных цепей, содержащих в своих молекулах остатки аминосахаров и уроновых кислот. Углеводные компоненты — гликозамингликаны — представлены гиалуроновой кислотой, хондроитинсульфатами, гепарансульфатом, кератансульфатами.
Липопротеины В качестве небелковой части содержат молекулы липидов. Эти макромолекулы в значительных количествах находятся в митохондриях, из них в основном состоит эндоплазматический ретикулум, их обнаруживают в плазме крови и молоке. Инозитолдифосфатсодержащий липопротеин выделен из белого вещества мозга, в состав липопротеинов серого вещества мозга входят сфинголипиды. У растений значительная часть фосфолипидов в протоплазме находится в форме липопротеинов. Протеолипиды — комплексы липидов и белков, белковая часть которых содержит преимущественно гидрофобные аминокислоты.
Нуклеопротеины Содержат нуклеиновые кислоты — РНК и ДНК — в качестве простетических групп.
Метал лолротеины Содержат ионы какого-либо одного или нескольких металлов. К таким белкам принадлежат белки, содержащие негеминовое железо (ферритин, трансферрин и др.). К медьсодержащим белкам относят цитохромоксидазу, пластоцианин (переносчики электронов), белок крови — церулоплазмин; к железосодержащим — лактоферрин (белок молока), трансферрин (белок крови), ферритин и др. Кроме того известны: никелеплазмин (переносчик никеля в плазме крови), селенопротеины (кровь, мышцы), ванадохром (у морских животных переносчик кислорода).
Фосфопротеины В качестве простетической группы содержат фосфорную кислоту. К фосфопротеинам относят многие питательные белки, например, основной белок молока казеин, белки яичного желтка — вителлин и фосвитин, икры рыб — ихтулин. Они содержат 1-10 % фосфора. Фосфопротеины найдены в мозге. Кратковременное фосфорилирование-дефосфорилирование ферментов является способом регуляции их активности.
Хромопротеины В составе белка имеются окрашенные небелковые компоненты. Наиболее распространенными представителями хромопротеинов являются флавопротеины и гемопротеины, красное окрашивание которых обусловлено наличием гема с включенным в него атомом железа. К хромопротеинам относят транспортные белки: гемоцианины (моллюски, ракообразные, паукообразные, мечехвосты), гемэритрины (кольчатые черви), хлорокруорины (многощетинковые черви).
24
Белки и аминокислоты Глава 2
Кроме этого, выделяют группу белков, которая образуется в результате денатурации или деградации простых и конъюгированных белков.
Классификация на основе биологической (пищевой) ценности белков
Пищевая ценность белков определяется наличием незаменимых аминокислот. Согласно этой классификации белки делятся на 3 группы:
1. Полноценные белки. Содержат 10 незаменимых аминокислот в необходимых пропорциях для обеспечения нормального роста (например, яичный белок, казеин молока).
2. Частично полноценные белки. Эти белки содержат сниженное количество одной или более незаменимых аминокислот и могут обеспечивать только умеренный рост (например, белок пшеницы и риса содержат недостаточное количество лизина, триптофана). Известно правило, что скорость синтеза белка зависит от незаменимой аминокислоты, концентрация которой наименьшая.
3. Неполноценные белки. Эти белки не содержат одну или более незаменимых аминокислот. Не могут обеспечить нормальный рост организма (например, желатин не содержит аминокислоту триптофан).
Характеристика аминокислот
Аминокислоты являются структурной единицей белков. Аминокислоты содержат аминогруппу (-NH2), карбоксильную группу (-СООН), атом водорода и боковую цепь, связанную с а-углеродным атомом. Одна из 20 аминокислот, пролин, является, иминокислотой (-NH-), остальные 19 являются а-аминокислотами.
В природе выявлено около 300 аминокислот. Из них 20 являются стандартными (протеиногенными) аминокислотами, которые обнаружены в структуре белков, полученных из различных организмов — животных, растений и микроорганизмов. Это — результат универсальной природы генетического кода, обеспечивающей включение 20 аминокислот при биосинтезе белков.
Классификация аминокислот
Классификация протеиногенных аминокислот по строению радикала:
1) алифатические (глицин, аланин, валин, лейцин, изолейцин, метионин, пролин);
2) ароматические (фенилаланин, тирозин, триптофан);
3) алифатические, содержащие гидроксильную группу (серин, треонин);
4) алифатические, содержащие сульфгидрильную группу (цистеин);
5) основные (лизин, аргинин, гистидин);
6) кислые (аспарагиновая и глутаминовая кислоты);
7) алифатические, содержащие карбоксамидную группу (аспарагин, глутамин).
Аминокислотные остатки в полипептидной цепи имеют сокращенные названия: аланин (ала, А), глицин (тли, G), валин (вал, V), лейцин (лей, L), изолейцин (иле, 1), аспарагиновая кислота (асп, D), глутаминовая кислота (глу, Е), серин (сер, S), треонин (тре, Т), цистеин (цис, С), метионин (мет, М), аргинин (арг, R), лизин (лиз, К), гистидин (гис, Н), пролин (про, Р), фенилаланин (фен, F), тирозин (тир, Y), триптофан (три, трп, W), аспарагин (асн, N), глутамин (глн, Q).
Существует несколько специальных классификаций аминокислот, основанные на структуре и химической приро
25
Глава 2 Белки и аминокислоты
де, заменимости, путях метаболизма и т. д.
Классификация аминокислот по полярности радикалов
1. Неполярные аминокислоты (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин). Эти аминокислоты гидрофобны (рис. 2.4). Имеют незаряженный радикал. При сближении в пространстве радикалы этих аминокислот обеспечивают гидрофобное взаимодействие.
2. Полярные, гидрофильные, незаряженные аминокислоты (глицин, треонин, цистеин, тирозин, серин, аспарагин,
глутамин). Содержат такие полярные функциональные группы как гидроксильная, сульфгидрильная и амидогруппа (рис. 2.5). При сближении в пространстве радикалы этих аминокислот образуют водородные связи. Связанные дисульфидной связью два остатка цистеина называют цистином.
3. Кислые аминокислоты (отрицательно заряженные аминокислоты) имеют отрицательный заряд при pH 7,0 (аспарагиновая и глутаминовая кислоты) (рис. 2.6).
4. Основные аминокислоты (положительно заряженные аминокислоты) имеют положительный заряд при pH 7,0. (аргинин, гистидин, лизин) (рис. 2.7).
H2N“CH-СООН СНз
Аланин (Ала)
h2n-ch-cooh
СН—СН3 СН3
Валин (Вал)
h2n-ch-cooh сн2 СН—СН3 СНз Лейцин (Лей)
h2n-ch-cooh
СН2
сн2
S I СНз
Метионин (Мет)
>— СООН
N
Н
Пролин (Про)
H2N-CH~COOH
СН—СНз сн2 СН3
Изолейцин (Иле)
h2n-ch-cooh СН2
H2N-ch-cooh
СН2
Н
Триптофан (Три)
Фенилаланин (Фен)
Рис. 2.4. Неполярные аминокислоты.
26
Белки и аминокислоты Глава 2
1 h2n-ch-cooh н H2N-CH'COOH сн2 H2N-CH'COOH сн-он
он СН3
Глицин (Гли) Серин (Сер) Треонин(Тре)
! H2N-CH'COOH h2n-ch-cooh H2N-(pH-COOH h2n-ch-cooh
СИ2 СН2 сн2 СН2
1 SH А conh2 сн2
0 conh2
Цистеин (Цис) Jh Тирозин (Тир) Аспарагин (Асн) Глутамин (Глн)
Рис. 2.5. Полярные гидрофильные незаряженные аминокислоты.
Г" ............
h2n—сн—соон z 1 H2N—сн—соон
сн2 сн2 1
соон сн2 1
соон
Аспарагиновая Глутаминовая
кислота (Асп) кислота (Глу)
Рис. 2.6. Отрицательно заряженные аминокислоты.
h2n—сн-соон
СН2
СН2
СН2
СН2
NH2
Лизин (Лиз)
h2n~ch-cooh I сн2 .
сн2
сн2
NH I C=NH
NH2
Аргинин (Apr)
h2n-ch-cooh
Гистидин (Гис)
Рис. 2.7. Положительно заряженные аминокислоты.
27
Глава 2 Белки и аминокислоты
Радикалы аминокислот 3 и 4 групп участвуют в образовании ионных связей.
При растворении в воде а-амино-группа и а-карбоксиальная группа диссоциируют с образование — NH3+ и СОО-. Кроме того подвергаются диссоциации функциональные группы радикалов кислых и основных аминокислот.
Классификация по биологической (пищевой) ценности
Аминокислоты классифицируются на заменимые и незаменимые (эссенциальные). 1. Незаменимые (эссенциальные) аминокислоты не могут синтезироваться в организме и должны поступать с пищей. Они необходимы для обеспечения и поддержания роста: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин (шесть аминокислот 1-й группы, одна — второй и три — четвертой). 2. Заменимые аминокислоты. Организм может синтезировать около 10 аминокислот для обеспечения биологических потребностей, поэтому строгое поступление их с пищей не обязательно (аланин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин, тирозин).
Классификация на основе метаболических превращений
Углеродный скелет аминокислот является предшественником для синтеза глюкозы или гликогена (гликогенные аминокислоты: аланин, аргинин, аспарагиновая кислота, глутаминовая кислота, глицин, гистидин, метионин, пролин, серин, треонин, валин, цистеин), липидов (кетоген-ная аминокислота: лейцин) или глюкозы и липидов (гликогенные и кетогенные аминокислоты — изолейцин, лизин, фенилаланин, триптофан, тирозин).
Кроме 20 стандартных аминокислот, присутствующих в составе белков, существуют аминокислоты, имеющие важное биологическое значение.
1. Производные аминокислот. 20 стандартных аминокислот могут включаться в белки из-за универсальности генетического кода. Некоторые из них подвергаются специфической модификации после биосинтеза белка. Эти производные аминокислот являются важными для структуры и функции белка. Например, коллаген содержит гидроксипролин и гидроксилизин; гистоны — метилированные, фосфорилированные и ацетилированные аминокислоты.
2. Непротеиногенные аминокислоты не обнаруживаются в составе белков, но выполняют важные функции в организме. Например, орнитин, цитруллин являются промежуточными метаболитами в биосинтезе мочевины.
3. D-аминокислоты. Аминокислоты животных и растений являются L-ами-нокислотами. D-аминокислоты обнаружены в антибиотиках или в бактериальных стенках.
Характеристика отдельных аминокислот
В таблице 2.4 представлена функциональная роль стандартных аминокислот.
В природе имеется объект — куколка, содержащая биологическую жидкость между стадиями двух эукариотических организмов — гусеницы и бабочки. Очевидно, что в этой жидкости должен содержаться оптимальный для синтеза белков эукариотического организма спектр аминокислот. По данным нашей лаборатории, общее количество свободных аминокислот в жидком содержимом куколок китайского дубового шелкопряда (Antheraea Pemyl G.-M.) составляет 14,6 г/л, в том числе обнаружены (М+т, ммоль/л) глутамин (19,1 + 1,89),. аланин (18,3±2,60), глицин (17,2±0,91), серин (13,1+1,71), треонин (10,3+0,27), гистидин (10,3+0,37), лизин (8,7±0,59), валин (8,2+0,19),
28
Белки и аминокислоты Глава 2
Таблица 2.4. Функциональная роль стандартных L-аминокислот
Аминокислота Функциональная роль
Глицин Единственная оптически неактивная аминокислота; широко распространена, особенно много в желатине; является предшественником пуринов, гемоподобных структур и коллагена; используется для построения клеточных стенок бактерий; является тормозным медиатором ЦНС.
Аланин Является исходным продуктом для синтеза каротиноидов, каучука, жиров и углеводов.
Валин Радикал способен к гидрофобным взаимодействиям; участвует в синтезе алкалоидов, некоторых циклических пептидов, пантотеновой кислоты,пенициллина.
Лейцин, изолейцин Серин Радикалы способны к гидрофобным взаимодействиям; являются источниками сивушных масел при брожении. Входит в состав фосфолипидов (фосфатидилсерины), полипептидов брадикинина и каллидина; участвует в построении активного центра сериновых протеиназ, синтезе аминоспирта сфингозина; в казеине молока или вителлине яичного желтка содержится в виде серинфосфорной кислоты; у растений образуется из глицина в процессе фотодыхания.
Треонин Цистеин Участвует в синтезе витамина В12, антибиотика актиномицина D. Является источником серы; входит в состав глутатиона, в виде амина — в кофермент А, присутствует в активном центре цистеиновых ферментов; образует дисульфидные связи, важные для формирования нативной структуры белков; при окислении двух молекул возникает цистин, содержащийся в белках волос, рогов, копыт; система 2 цистеин •-►цистин является важнейшей окислительно-восстановительной системой живых организмов; является формой метаболизирования сероводорода микроорганизмами и растениями.
Метионин Является основным донором метильных групп в биосинтезах (в виде S-аденозилметионина); из него образуются другие серусодержащие аминокислоты; отмечено высокое содержание в молоке; является липотропным фактором, необходимым для поддержания функции печени и обмена липидов.
Лизин Высокое содержание в протаминах и гистонах (молоки рыб); является исходным продуктом для синтеза алкалоидов (анабазин, никотин, кониин); участвует £-аминогруппой в образовании комплекса между белковой частью фермента и коферментом (биотин-зависимые ферменты).
Аргинин Высокое содержание в протаминах и гистонах (молоки рыб); участвует в синтезе мочевины, креатина; в виде фосфоаргинина в мышцах беспозвоночных выполняет функцию, аналогичную функции фосфокреатина у высших животных.
Аспарагиновая кислота, аспарагин В большом количестве асл содержится в растительных белках; участвует в реакциях трансаминирования и синтезе мочевины, креатина, циклических пептидов; при декарбоксилировании образуются а- или (3-аланин, необходимый для синтеза мышечных дипептидов карнозина, ансерина и кофермента А; амид аспарагиновой кислоты — аспарагин накапливается при прорастании семян бобовых растений в темноте или при избытке аммиака; у высших животных асп и асн участвуют в синтезе пуриновых и пиримидиновых оснований, никотиновой кислоты, а у растений являются запасной и транспортной формой азота.
29
Глава 2 Белки и аминокислоты
Продолжение табл. 2.4
Аминокислота Функциональная роль
Глутаминовая кислота, глутамин Гпутаминовая кислота входит в состав фолиевой кислоты и глутатиона; участвует в реакциях трансаминирования, непрямого дезаминирования и реаминирования; при декарбоксилировании глутаминовой кислоты образуется у-аминомасляная кислота — тормозной медиатор ЦНС; является предшественником в синтезе порфиринов; глутамин является транспортной формой азота у животных и растений, исходным соединением в синтезе пуриновых и пиримидиновых оснований, никотиновой кислоты; глутамат натрия является вкусовой приправой.
Фенилаланин Радикал способен к гидрофобным взаимодействиям; участвует в биосинтезе флавоноидов, алкалоидов; D-фенилаланин входит в состав антибиотиков грамицидинов и тироцидина.
Тирозин Является исходным веществом для синтеза гормонов (тироксин, адреналин), алкалоидов (морфин, кодеин, папаверин), меланинов (пигмент кожи, волос, перьев).
Триптофан Отсутствует в спектрах свободных аминокислот растений; служит для синтеза индолилалкиламинов (серотонин), никотиновой кислоты, гетероауксина.
Г истидин Высокое содержание в глобине — белковом компоненте гемоглобина; при декарбоксилировании образуется гистамин (воспаление, иммунные реакции); входит в состав активных центров некоторых протеолитических ферментов.
Пролин, оксипролин Высокое содержание в белках семян злаков (проламины), в коллагене, эластине и в белках эмали зубов; входит в состав ряда антибиотиков — циклических пептидов (грамицидины, лихен иформин, актиномицин D).
пролин (5,6+0,41), лейцин (4,8+0,13), аспарагиновая кислота (4,7+0,56), изолейцин (4,3+0,14), тирозин (2,5+0,23), цитрулин (2,1+0,14), фенилаланин (1,0+0,07), таурин (1,0+0,11), глутаминовая кислота (0,9+0,08), метионин (0,7+0,08), бета-аланин (0,5+0,03), этаноламин (0,2+0,01), орнитин (0,04+0,004). Методом высокоэффективной жидкостной хроматографии не выявлены аминокислоты аспарагин, цистеин и триптофан. По сравнению со спектром свободных аминокислот растений в жидком содержимом куколок содержится больше глицина, лизина, гистидина, пролина и глутамина, а также снижено содержание глутаминовой кислоты и фенилаланина.
Аминокислоты — структурные единицы полипептидов
Аминокислоты, соединенные пептидной связью, образуют полипептид-
ную цепь и каждая аминокислота в ней называется аминокислотный остаток. В полипептиде выделяют N-ko-нец (терминальная а-аминогруппа) и С-конец (терминальная «-карбоксильная группа). Большинство природных полипептидных цепей, содержащих от 50 до'2000 аминокислотных остатков, называют белками (протеинами). По-липептидные цепи меньшей длины называют олигопептидами или просто пептидами. В некоторых белках поли-пептидные цепи связываются поперечными дисульфидными связями, образованными окислением двух остатков цистеина. Внеклеточные белки часто содержат дисульфидные связи, а внутриклеточные белки часто утрачивают их. В некоторых белках образуются поперечные связи при
30
Белки и аминокислоты Глава 2
взаимодействии радикалов других аминокислотных остатков (коллаген, фибрин).
Физико-химические свойства белков
1. Растворимость. Белки формируют коллоидные растворы, что обусловлено размером частиц (размеры частиц 0,1— 0,001 мкм). Для растворов белков учитывают следующие характеристики: низкое осмотическое давление, высокая вязкость, низкая способность к диффузии. В лабораторной практике используют 2 свойства коллоидных растворов белков: нефелометрическое определение количества белка на основе эффекта Тиндаля; диализ — очистка белков от низкомолекулярных примесей.
2. Амфотерность белков. Белки обладают кислыми и основными свойствами из-за присутствия карбоксильных и аминогрупп. Изоэлектрическая точка белков (р!) — значение pH, при котором суммарный заряд белка равен нулю. В р! белок электронейтрален с минимальной растворимостью, максимальной преципитацией и наименьшей буферной способностью. Изоэлектрическая точка определяется количеством NH2 и СООН групп в молекуле белка. Если количество NH2 и СООН групп равно, р[ лежит в слабокислой среде (ионизация карбоксильных групп несколько выше, чем аминных) при рН<7. Если количество NH2>COOH, то р! лежит в щелочной среде. Если количество NH2<COOH, то р! лежит в кислой среде. При рН>р! заряд белка всегда отрицательный, так как карбоксильные группы переходят в форму СОО , а аминные группы в форму NH2. При рН<р! заряд белка положительный, т. к. при уменьшении pH все больше аминогрупп переходит в форму NH/, а диссоциация карбоксильных групп подавляется.
3. Способность к осаждению (преципитации). Существуют два фактора устойчивости белков в коллоидном растворе: заряд и гидратная оболочка. Белки могут быть преципитированы путем дегидратации и/или нейтрализации полярных групп.
Преципитация в pl. Белки мало растворимы в изоэлектрической точке. Например, белок молока казеин сворачивается, если молоко кислое. Это объясняется тем, что молочная кислота, образуемая бактериями, снижает pH, приближая его к изоэлектрической точке казеина (р!= 4,6).
Высаливание. Процесс преципитации добавлением нейтральных солей (сульфата аммония или сульфата натрия) называется высаливанием. Этот процесс объясняется дегидратацией молекул белков солями, что приводит к молекулярной агрегации и преципитации. Количество соли, необходимой дня преципитации, зависит от молекулярной массы белка. Чем больше молекулярная масса белка, тем меньше соли необходимо для преципитации. Например, глобулины сыворотке осаждаются полу-насыщенным раствором сульфата аммония, в то время как альбумин — насыщенным раствором. Высаливание используется для разделения белков сыворотки крови.
Добавление незначительного количества нейтральных солей повышает растворимость белков.
Осаждение солями тяжелых металлов. Ионы тяжелых металлов (РЬ2 ’, Hg2+, Ее2', Zn2+, Cd2+) вызывают осаждение белков. Металлы имеют положительный заряд и в щелочной среде вызывают преципитацию белков.
Осаждение анионами или алкалоидными реактивами. Белки осаждаются трихлоруксусной кислотой, сульфосалициловой кислотой, пикриновой кислотой, таниновой кислотой. Белки являются катионами и добавление анионов кис
31
Глава 2 Белки и аминокислоты
лот приводит к образованию комплексов белок-анион.
4. Электрофорез белков. В методе электрофореза белков сыворотки используют слабощелочные буферные растворы (т. е. рН>р1), чаще pH 8,6- При этом белки заряжаются отрицательно и перемещаются к анолу. Подвижность заряженной молекулы в электрическом поле называют электрофоретической подвижностью р. Этот показатель для сферической молекулы рассчитывают д—Q/ 6 я т| гxV, где Q — суммарный заряд молекулы, г — радиус молекулы, ц — вязкость жидкой среды, в которой движется заряженная частица, V — приложенное напряжение. Принято, что в среде с постоянной вязкостью и напряжением движение заряженной частицы определяется величиной отношения заряда к радиусу частицы. С увеличением этого отношения подвижность частиц растет. Если частицы близки по радиусу, то их электрофоретическая подвижность будет пропорциональна заряду. Величина р растет с повышением значения Q.
Изоэлектрическое фокусирование. Метод основан на том, что в изоэлектрической точке белок теряет заряд и теряет подвижность в электрическом поле. Трубку заполняют гелем, содержащим амфолины, которые создают градиент pH. В электрическом поле белок будет передвигаться до того значения, где он войдет в свое изоэлектрическое состояние и, потеряв заряд, остановится.
Наибольшее распространение и развитие получил метод электрофореза в полиакриламидном геле.
Электрофорез в полиакриламидном геле
Существенные успехи в изучении заряженных молекул получены с помощью метода электрофореза. В этом методе за
ряженные частицы распределяются в электрическом поле в зависимости от заряда. Электрофорез может производиться в буферном растворе с регистрацией границы между фракцией белка и буферным раствором (капиллярный электрофорез) или на носителях. Электрофорез может осуществляться как в «нативных», так и в «денатурирующих» условиях. В случае «нативного» электрофореза разделение белков происходит в зависимости от их заряда, а при «денатурирующем» электрофорезе в присутствии додецилсульфата натрия белки распределяются в геле в зависимости от их молекулярной массы. Для изучения белков чаще используют электрофорез в полиакриламидном геле (рис. 2.8).
Электрофорез в присутствии додецил-сульфата натрия (SDS-PAGE) обладает высокой разрешающей способностью, а именно, используя краситель Кумасси голубой, можно выявить 0,1 мкг (2 пмоль) белка, а при серебрении — чувствительность повышается в 5 раз (выявление 0,02 мкг белка). При доступной технике SDS-PAGE удается разделить белки, отличающиеся только на 2 % по молекулярной массе (например, белки с молекулярными массами 40 и 41 кДа, имеющие различие только по 10 аминокислотным остаткам полипептидных цепей).
Изоэлектрическое фокусирование позволяет разделить белки, отличающиеся по изоэлектрической точке только На 0,01. Комбинация изоэлектрического фокусирования с SDS-PAGE дает весьма чувствительный метод разделения белков — двумерный электрофорез (Two-Dimensional Electrophoresis). Этот способ разделения белков использовался при рождении протеомики. По этому способу 1) производят в горизонтальном направлении разделение белков методом изоэлектрического фокусирования (по pl), а затем 2) вертикально в двух на-
32
Белки и аминокислоты Глава 2
Рис, 2.8. Электрофорез е полиакриламидном геле (Berg J. М., Tymoczko J. L., Stryer L, с изм.). А — аппарат для вертикального электрофореза. Верхняя и нижняя камеры заполнены буферным раствором и присоединены к источнику постоянного тока — к катоду и аноду, соответственно. Электрический ток протекает через блок полиакриламидного геля, расположенного вертикально. В верхней части блока имеются углубления, в которые наносятся образцы белка объемом несколько мкл. К образцу белков добавляют додецилсульфат натрия (SDS) для разделения субъединиц, и отрицательно заряженный комплекс SDS-белок (в буферном растворе с pH 8,6) мигрирует к аноду (Б). Благодаря наличию пор в полиакриламидном геле происходит разделение белков по размеру молекул и их заряду.
Рис. 2.9. Препарат белков родоначальника метода двумерного электрофореза доктора Patrick Н. O’Farrell (Berg J. М., Tymoczko J. L, Stryer L).
правлениях производят электрофорез разделившихся белков методом SDS-PAGE (по молекулярной массе). Так удалось выделить более тысячи белков Е. coli (рис. 2.9).
Каждое из пятен может быть изучено методом MALDI-TOF. Это одно из наиболее важных методических направлений, лежащих в основе протеомики.
33
Глава 3 Структура белковой молекулы
слои располагаются параллельно друг другу, образуя многочисленные пласты. Так как в складчатых структурах боковые цепи аминокислотных остатков ориентированы вертикально вверх и вниз, в промежутках между отдельными слоями могут поместиться лишь компактные группировки. Фактически фиброин состоит на 80 % из глицина, аланина и серина, т. е. трех аминокислот, характеризующихся минимальными размерами боковых цепей. Молекула фиброина содержит типичный повторяющийся фрагмент (гли-ала-гли-ала-гли-сер)п. Такая структура оптимальна для создания шовного материала для хирургических операций.
Неупорядоченная конформация
Участки белковой молекулы, которые не относятся к спиральным или складчатым структурам, называют неупорядоченными.
Надвторичная структура
а-Спиральные и 0-структурные участки в белках могут взаимодействовать друг с другом и между собой, образуя ансамбли. Встречающиеся в нативных белках сверхвторичные структуры — энергетически наиболее предпочтительны. К ним относят суперспирализованную а-спираль, в которой две а-спирали скручены относительно друг друга, образуя левую суперспираль (бактериородопсин, гемэритрин); чередующиеся а-спиральные и 0-структурные фрагменты полипептидной цепи (например, 0а0а0-звено по Россману, найдено в НАД+-связывающем участке молекул ферментов дегидрогеназ); антипарал-лельная трехцепочечная 0-структура (000) называется 0-зигзаг и обнаружена в ряде ферментов микроорганизмов, простейших и позвоночных.
Третичная структура
Третичная структура — способ укладки полипептидной цепи в трехмерном пространстве. Третичная структура стабилизируется связями между боковыми радикалами аминокислот. К ним относятся ковалентная (дисульфидная) и нековалентные (водородная, ионная связи и гидрофобное взаимодействие). По форме третичной структуры белки делятся на глобулярные и фибриллярные. Глобулярные белки имеют эллипсовидную форму, а фибриллярные ~~ нитевидную, вытянутую форму (форма палочки, веретена). При образовании глобулярных белков гидрофобная часть полипептидной цепи располагается внутри структуры, а гидрофильная — снаружи.
Формирование третичной структуры
Каким образом линейная структура полипептида приобретает уникальную конформацию белка, способного выполнять свою функцию? Как долго длится этот процесс?
Цирус Левинталь (Cyrus Levinthal) оценил время, необходимое для создания энергетически оправданной конформации белка, состоящего из 100 аминокислотных остатков. Он подсчитал, что если каждый аминокислотный остаток может быть в трех различных конформациях, то общее количество структур будет З'00, или 5* 1047. Если время отличия одной структуры от другой принять За К)13 с, то время всего поиска будет 5х 1(р7х Ю-13 с, что равно 5* 1034 с, или 1,6* 1027 лет. В то же время известно, что на образование нативной конформации белка в клетке требуется несколько десятков минут. Такое чудовищное различие во времени перебора возможных конформаций полипептидной цепи и ее реального фолдинга (складывания) в клетке получило название парадокса Левинталя.
Для стимуляции образования биологически активной структуры в клетке существуют специфические белки, которые называются шаперонами. Шапероны обладают сродством к экспонированным гид
42
Структура белковой молекулы Глава 3
рофобным участкам полипептвдной цепи. Связывание с шаперонами препятствует агрегации с другими белками и тем самым создает условия д ля нормального сворачивания растущего пептида. Взаимодействие с шаперонами — процесс энергозависимый: при освобождении шаперонов гидролизуется АТФ. Шапероны принадлежат к трем белковым семействам, так называемым белкам теплового шока («heat shock proteins», hsp60, hsp70, hsp90). Свое название эти белки получили потому, что их синтез возрастает при повышении температуры и других формах стресса (радиация, тяжелые металлы, свободные радикалы, токсины и т. д.) и поэтому также называются белками стресса («stress proteins»). При этом они выполняют функцию защиты белков клетки от денатурации. Белки — представители семейства hsp70 — связываются на начальной фазе образования растущего пептида. Одни из них контролируют процесс сворачивания белка в цитоплазме, другие — участвуют в переносе белков в митохондрии. Белки hsp60 (шаперонины) охватывают синтезированный полипептид наподобие бочонка, тем самым обеспечивая условия для принятия правильной конформации.
Шапероны влияют на канцерогенез и активируют систему иммунитета (Srivastava Р. К., 2008)
Нативная структура белка
Многие белки в третичной структуре имеют спирализованные, складчатые и неупорядоченные сегменты. При этом в функциональном и структурном отношениях важно взаимное расположение аминокислотных радикалов.
Домены — анатомически выделяемые участки третичной структуры белка, отвечающие за выполнение определенной функции белка.
Гидрофобные карманы — полости в третичной структуре, выстланные радикалами гидрофобных аминокислот и необходимые для погружения в молекулу белка гидрофобных лигандов.
Гидрофобные кластеры — участки поверхности белка, где сконцентрированы радикалы гидрофобных аминокислот и служат для взаимодействия с гидрофобными кластерами других молекул.
Каждый белок в нативном состоянии имеет уникальную трехмерную структуру (конформация белка), в которой белок выполняет функцию.
Белок приобретает нативную структуру для выполнения функции путем складывания полипептидной цепи.
Однако многие белки могут модифицироваться путем ковалентного присоединения определенных групп к аминокислотным остаткам полипептидной цепи: 1) присоединение ацетильной группы к концевым аминокислотным остаткам делает белок устойчивым к деградации; 2) присоединение гидроксильной группы к остаткам пролина в коллагене делает коллагеновые фибриллы более прочными; при недостатке витамина С в пище нарушабтся процесс гидроксилирования коллагена и возникают повреждения сменок мелких кровеносных сосудов; кровоточивость и петехии — типичные симптомььцин-ги; 3) для свертывания крови необходимо образование у-карбоксиглута-мата в протромбине, а при недостатке витамина К этот процесс нарушен, что ведет к кровоточивости; 4) присоединение олигосахаридных единиц к остаткам аспарагиновой кислоты в белках повышает их гидрофильность и служит для специфического взаи
43
Глава 3 Структура белковой молекулы
модействия с другими белками; 5) присоединение жирных кислот к о-аминогруппам аминокислот или сульфгидрильной группе цистеина увеличивает гидрофобность белковой молекулы; 6) многие гормоны (адреналин, глюкагон) регулируют активность ключевых ферментов, запуская процессы фосфорилирования -дефосфорилирования остатков серина и треонина; инсулин запускает процессы фосфорилирования остатков тирозина.
Интересно, что некоторые медузы содержат флуоресцирующий зеленый протеин (GPF). За флуоресценцию отвечает трипептид в центре этого белка сер-тир-гли при спонтанном развертывании и окислении. Такое свойство белка медузы нашло широкое применение при исследовании нативного состояния белков различных клеток в медицине.
Многие белки теряют часть полипептидной цепи при переходе в активное состояние: 1) протеолитический фермент поджелудочной железы трипсин активируется в двенадцатиперстной кишке при отщеплении от трипсиногена 6 аминокислотных остатков; 2) при свертывании крови расщепление пептидных связей ведет к превращению растворимого фибриногена в нерастворимый фибрин; 3) ряд гормонов передней доли гипофиза образуются при расщеплении предшественника проопиомеланокортина.
Денатурация
Денатурация — разрушение третичной и частично вторичной структуры белка с сохранением первичной структуры, т. е. потеря нативной структуры. Денатурация отличается от гидролиза белка тем, что при гидролизе необратимо разрушается первичная структура путем разрыва пептидных связей.
1. В зависимости от степени денатурации потеря биологической активности может быть частичной или полной.
2. При денатурации изменяются физические свойства белка, например, снижается растворимость и белок выпадает в осадок, поскольку теряются основные факторы устойчивости — заряд и гидратная оболочка. Если после удаления денатурирующего агента восстанавливается нативная структура белковой молекулы, то это называется ре-натурация (ренативация).
3. При денатурации первичная структура не изменяется, т. е. не происходит разрыва пептидных связей.
4. Денатурированные под действием соляной кислоты белки в желудочно-кишечном тракте более легко перевариваются под действием пищеварительных ферментов.
Факторы, вызывающие денатурацию
1. Химические факторы: сильные кислоты или щелочи, органические растворители, детергенты, восстанавливающие агенты, концентрированные соли, тяжелые металлы.
2. Физические факторы: температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучение.
Четвертичная структура (
Представляет собой организацию нескольких полипептидных цепей, каждая из которых имеет третичную структуру, в единую функциональную молекулу белка. Четвертичной структурой обладают белки с молекулярной массой более 50000 Да. Протомер — отдельная полипептидная цепь в третичной структуре, не выполняющая функцию белка. Субъединица — протомер или объединение нескольких
44
Структура белковой молекулы Глава 3
Протомеров, способных выполнять часть функций белка. Олигомер (мультимер) — сочетание протомеров или субъединиц в четвертичной структуре белка, несущих полную функциональную активность белка. Четвертичная структура стабилизируется нековалентными связями между протомерами (водородные, электростатические, гидрофобные взаимодействия). При разрушении связей, стабилизирующих четвертичную структуру, происходит разделение субъединиц и потеря функции белка.
Взаимосвязь структуры и функции
Рассмотрим на примере 2-х белков: миоглобина, который имеет третичную структуру и способен запасать кислород и гемоглобина, который имеет четвер
тичную структуру (4 субъединицы, каждая из которых напоминает глобулу миоглобина) и способен как связывать, так и транспортировать кислород.
Миоглобин
1. Миоглобин является белком мышечной ткани, который депонирует кислород и транспортирует его к митохондриям. Для выполнения этой функции миоглобин должен обладать способностью связывать кислород при низком парциальном давлении кислорода, когда гемоглобин его отдает. Кривая насыщения миоглобина кислородом имеет вид гиперболы (рис. 3.5). Парциальное давление кислорода рО2 в ткани, окружающей легочные капилляры составляет 100 мм рт. ст. Поэтому миоглобин в легких мог бы весьма эффективно на
100
Миоглобин
Гемоглобин
I I I I I I
0 20 40 60 80 100
Ткани Легкие
РОг
Р50(МЬ) Р 50 (НЬ)
Рис. 3.5. Кривая насыщения миоглобина и гемоглобина кислородом.
45
Глава 3 Структура белковой молекулы
сыщаться кислородом. В венозной крови рО2 равно 40 мм. рт. ст., а в активно работающей мышце — около 20 мм. рт. ст. Но даже при таком рО2 степень насыщения миоглобина кислородом будет весьма высокой (около 80 %) и поэтому миоглобин не может отдавать кислород тканям. Однако при кислородном голодании (тяжелая физическая нагрузка) рО2 уменьшается до 5 мм рт. ст. и миоглобин может отдавать связанный кислород.
2. Структура миоглобина. Миоглобин является глобулярным белком (м. м. 17 000 Да), который состоит из 153 аминокислотных остатков. Около 75 % полипептидной цепи спирализовано и образует 8 правых а-спиралей (обозна
чается буквами от А до Н). Полярные гидрофильные фрагменты расположены снаружи спирали, а неполярные гидрофобные — внутри молекулы (рис. 3.6).
Гем является простетической группой миоглобина и гемоглобина. Без гема миоглобин кислород не связывает. Гем состоит из пропопорфиринового кольца (протопорфирин IX) и атома железа (Fe2+), связаного 4 координационными связями с пиррольными кольцами протопорфирина IX. Гем находится в гидрофобном кармане молекулы миоглобина. Пятая координационная связь образуется между атомом железа и остатком гистидина F8 (проксимальный гистидин). Шестая координационная связь образуется с молекулой кислоро
46
Структура белковой молекулы Глава 3
да, который встраивается между атомом железа и дистальным гистидином Е7. В неоксигенированном миоглобине атом железа на 0,03 нм выступает из плоскости кольца в направлении гис F8. При связывании молекулы О2с шестой координационной связью железа (оксигенированный миоглобин) атом железа втягивается в плоскость гема и выступает из нее только на 0,01 нм.
Таким образом, связывание О2 с молекулой миоглобина приводит: 1) к перемещению атома железа и 2) перемещающийся атом железа будет изменять положение проксимального гис F8, а, следовательно, и конформацию а-спирали F и всей глобулы миоглобина.
Г емоглобин
1. Гемоглобин находится в эритроцитах и участвует в транспорте кислорода от легких к тканям и углекислого газа от периферических тканей к легким. Гемоглобин обладает способностью связывать кислород при высоком парциальном давлении кислорода (в легких) и высвобождать его в периферических тканях.
2. Гемоглобин — тетрамер, состоящий из четырех нековалентно связанных субъединиц, каждая из которых по структуре напоминают миоглобин (гемоглобин А, состоит из а2р2). Подобно миоглобину, каждая субъединица имеет гидрофобный карман, в котором находится гем. Кривая насыщения гемоглобина кислородом имеет S-образный (сигмоидный) характер (рис. 3.5). В сравнении с миоглобином, гемоглобин связывает кислород при высоком парциальном давлении кислорода в легких и отдает его в мышцах, где миоглобин связывает кислород.
3. Кооперативный эффект. При связывании кислорода с шестой координационной связью железа атом железа втягивается в плоскость кольца. Это
приводит к изменению положения проксимального гис F8 и конформации всей полипептидной цепи: поворот пары а/p на 15°. Такие изменения конформации облегчают связывание второй молекулы О2. В итоге кривая связывания кислорода гемоглобином имеет S-образный вид. Такой тип зависимости определяется кооперативным (совместным) действием всех субъединиц в интересах молекулы гемоглобина. Наличие кооперативного эффекта дает гемоглобину новое свойство транспорта газов: при 100 мм. рт. ст. (в легких) молекула гемоглобина полностью оксигенируется (получает 4 молекулы О2). Ниже 80 мм рт. ст. молекула гемоглобина отдает Ог Например, при рО2 = 20 мм рт. ст. гемоглобин насыщен примерно на 20 % кислородом, а миоглобин на 82 %. Т. е. очевидно, что оксигемоглобин будет отдавать О2, а миоглобин его связывать.
Большинство внутриклеточных белков относятся к олигомерным; внеклеточные белки, как правило, являются мономерами с небольшой молекулярной массой, а белки плазмы крови — крупные мономеры. Почему? Внутри клеток преобладают олигомерные белки, поскольку они: 1) снижают осмотическое давление; 2) хорошо регулируются эффекторами; 3) при наличии идентичных протомеров для их синтеза требуется меньшее количество генетического материала, а, следовательно, прогнозируется меньшее число ошибок; 4) устранение дефектных молекул возможно методами диссоциации — повторной ассоциации протомеров. Внеклеточные белки, например, эктоферменты пищеварительных органов мономерны, так как из-за неопределенности их судьбы вне клетки требуется большое количество молекул с относительно низкой молекулярной массой. И, наконец, белки плазмы крови относятся к крупным мономерам, включающим несколько доменов,
47
Глава 3 Структура белковой молекулы*
в связи с необходимостью сохранения их в кровеносном русле (такие белки в норме не преодолевают гисто-гематические барьеры).
Методы исследования первичной структуры белка
После выделения белка и определения его молекулярной массы обычно следует изучение первичной структуры, т. е. последовательности аминокислот в полипептидной цепи,
В автоматизированном варианте используют метод Эдмана. Рассмотрим данный процесс на примере простого гексаиептида: асп-гли-ала-фен-арг-гли. Необходимы следующие этапы: 1. Гидролиз пептида в 6N растворе НС1 при 110°С продолжительностью 24 часа,
2. Разделение аминокислот гидролизата методом колоночной ионообменной хроматографии на сульфонированном полистирене (Дауэкс-50); аминокислоты идентифицируют по их выходу с определенным элюционным объемом (рис. 3.7),
3. Концентрацию аминокислот определяют по реакции с нингидрином (открывает a-аминогруппы); метод позволяет открыть 1 мкг (10 нмоль) протеиногенных аминокислот, кроме пролина; если требуется повысить чувствительность метода до открытия 1 нг (10 нмоль), то добавляют флюорескамин, связывающийся с а-аминогруппами и дающий флуоресцирующий продукт.
В результате хроматографического анализа получается аминокислотный состав пептида: асп-2гли-ала-фен-арг.
4. Определяют N-концевую аминокислоту путем добавления FDNB (1 -фтор-2,4-динитро-бензол, или флюородинитробензол) по Ф, Сенджеру. В настоящее время используют дабе ил хлорид или дансил хлорид, которые реагирует с незаряженной «-аминогруппой с образованием флуоресцирующего сульфонамидного деривата. После гидролиза в 6N растворе НС1 производят хроматографическое разделение аминокислот и выявляют флуоресцирующую аминокислоту в виде дабсил(дансил)-производ-ного. Этот метод по чувствительности намного превосходит метод с использованием фтординитробензола. Однако полный гидролиз пептида не позволяет вести последовательный анализ аминокислотной последовательности (рис. 3.8). 5. Эдман предложил технику мечения N-концевой аминокислоты и ее отделения без гидролиза остальных пептидных связей в пептиде. Для этого добавляется фенилизотиоцианат, который реагирует с незаряженной a-аминогруппой с образованием фенилтиокарбамоилового производного, отделяемое при мягком кислотном гидролизе. Отделившееся циклическое фенилти-опщантоин-производное концевой аминокислоты определяется хроматографическим методом. Затем вся процедура повторяется с укороченным на 1 аминокислоту пептидом. Этот метод автоматизирован, и на 1 цикл затрачивается примерно 60 мин. Автоматизированный метод Эдмана позволяет анализировать аминокислотную последовательность 50-звенного пептида.
Для расщепления полипептидов на фрагменты, доступные для автоматизированного анализа по Эдману используют:
1) химическое расщепление пептидных связей, образованных карбоксильной группой метионина, с помощью бромциана (CNBr); из белка, содержащего 10 остатков метионина, будет получено 11 пептидов;
2) ферментативный гидролиз трипсином, расщепляющим пептидные связи, образованные карбоксильными группами аргинина или лизина; белок, содержащий 9 остатков лизина и 7 остатков аргинина, гидролизуется трипсином на 17 пептидов;
3) применение второго фермента, например, химотрипсина, катализирующего гидролиз других пептидных связей, образованных карбоксильной группой ароматических и с объемным неполярным радикалом аминокислот, позволяет оценить последовательность расположе-
48
Структура белковой молекулы Глава 3
Рис. 3.7. Хроматографическое разделение аминокислот (Berg J. М., Tymoczko J. L., Stryer L., г изм.).
Рис. 3.8. Вещества для определения N-концевых аминокислот.
Зак. 2124
49
Глава 3 Структура белковой молекулы ния в белке пептидов, которые получены после гидролиза трипсином.
Если анализируется олигомерный белок, то вначале изучают количество цепей, например, с помощью метода двумерного электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE). Определяют также количество N-концевых аминокислот. Для разделения полипептидных цепей в олигомерном белке (не связаны ковалентными связями) применяют денатурирующие агенты — мочевину или гуанидин гидрохлорид. Полипептидные цепи, связанные дисульфидными связями разделяют путем их восстановления до сульфгидрильных групп SH-содер-жащими реагентами — 0-меркаптоэтанолом или дитиотреитолом. Для предотвращения повторного образования дисульфидных групп производят алкилирование с помощью йодацетата с образованием S-карбоксиметил-про-изводных.
Важной задачей анализа структуры белка является определение положения дисульфидных связей. Для этого используют технику диагонального электрофореза изолированных пептидов, содержащих дисульфидные связи:
1. Расщепляют белок на пептиды с сохраненными дисульфидными связями.
2. Смесь пептидов наносят на угол хроматографической бумаги и производят электрофорез в одном направлении.
3. После завершения электрофоретического разделения выдерживают бумагу в парах надмуравьиной (пероксимуравьиной) кислоты, которая окисляет остатки каждого цистина до двух остатков цистеиновой кислоты; пептиды (R-CH2-S-S-CH2-R') разделяются из-за разрыва дисульфидных связей и становятся более кислыми из-за образования остатков цистеиновой кислоты (R-CH ,-SO, + R'-CH,-SO,) (рис. 3.9).
4. Смесь пептидов подвергают второму электрофоретическому разделению в направлении
перпендикулярному первому разделению. Пептиды, в которых не было дисульфидных связей, сохраняют свою электрофоретическую подвижность и располагаются вдоль диагональной линии, а пептиды, содержавшие дисульфидные связи, будут иметь иную электрофоретическую подвижность и будут располагаться вне диагональной линии (рис. 3.10).
5. Выделяют пептиды, локализованные вне диагональной линии, определяют последовательность аминокислот в каждом из них и по положениям остатков цистеина находят положение дисульфидных связей.
Использование высокоэффективной жидкостной хроматографии существенно повысило разрешающую способность метода исследования последовательности аминокислотных остатков в поли-пептидной цепи. Современные газофазовые секвенаторы предназначены для анализа пептидов и белков в пикомолярных концентрациях. Это позволяет определять аминокислотную последовательность пептидов, разделенных техникой SDS-PAGE при решении различных задач протеомики.
Применение методов рекомбинантных ДНК (генной инженерии) явилось революционным этапом в исследовании первичных структур белков, содержащих более 1000 аминокислотных остатков. Знание последовательности нуклеотидов в генах позволяет с помощью генетического кода определять исходную первичную последовательность аминокислот в синтезируемой полипеп-тидной цепи. Это важно знать, поскольку после трансляции белок может подвергаться различным модификациям.
50
Структура белковой молекулы Глава 3
R’-CH2-SO3
Рис. 3.10. Диагональный электрофорез. По оси ординат: электрофорез после обработки надмуравьиной кислотой: по оси абсцисс: первое направление электрофореза (Berg J. М., Tymoczko J. L, Stryer L., с изм.).
51
Глава 4
Специфичность белков
Способность к специфическому узнаванию и специфическому взаимодействию является основой биологических функций всех белков. Специфически узнать молекулу — это значит найти поверхность молекулы с такой мозаикой радикалов, с которой можно образовать максимально возможное количество связей. Специфически взаимодействовать — это значит образовывать между участками поверхностей молекул максимально возможное число связей. Поверхности молекул, которые при создании связей дополняют друг друга, называются комплементарными', положительному заряду должен соответствовать отрицательный, группе с поляризованным протоном должен соответствовать атом с неподеленной парой электронов, одной гидрофобной группе стерически должна соответствовать другая.
Правило: две молекулы, поверхности которых комплементарны, находят друг друга и взаимодействуют.
Уникальность белков в том, что они могут менять свою конформацию, де
лая поверхность комплементарной лиганду. Например: взаимодействие активного центра фермента с субстратом (по Кошланду). Различные лиганды связываются с белковыми молекулами по центрам связывания. Очевидно, что эти центры связывания должны быть комплементарны функциональным группам лиганда. Связи между лигандом и центром связывания белка нековалентные (водородные, ионные, гидрофобные). Поэтому такое связывание обратимо. Мономерные белки связываются с лигандом по гиперболической зависимости; мультимерные — по сигмоидной зависимости из-за кооперативного эффекта. Связывание белка с лигандом зависит от числа мест (центров) связывания и количества лиганда. Если количество молекул лиганда превышает число центров связывания на белке, дальнейшего связывания не происходит (белок насыщен лигандом). Специфическое взаимодействие за счет комплементарных поверхностей объясняет большинство функций белков (фермент — субстрат; гормон — рецептор; антиген — антитело и т. д.)
52
Специфичность белков Глава 4
Самосборка белков
_ тецифическое взаимодействие опреде-• ет уникальное свойство белков — их лсобность к самосборке. Например, :сле обработки молекулы гемоглобина гчевиной, она распадается на функци--зльно неактивные протомеры. После _!сния мочевины эти протомеры само-гоизвольно объединяются в нативную . гуктуру гемоглобина. Возьмем более : разительный пример — гигантскую .'скулу вируса табачной мозаики с м, - 40000000 Да. Она состоит из одной ?лекулы РНК и 2130 белковых субъе-: ниц, м. м. каждой из которых 17500 Да. - _ли РНК и субъединицы разделить до-злением детергента, а затем убрать де-тргент, то нативная структура молекулы • -руса полностью восстановится. При - ?м вновь восстановятся все биологичес-
свойства вируса. Самосборка не тре-' ст никакой дополнительной информа-, происходит самопроизвольно путем : зглмодсйствия комплементарных повер-астей молекул. Подчеркнем, что комле ментарность поверхности молекулы определяется мозаикой радикалов -чинокислот (поверхность третичной .”?>ктуры). Последовательность же ами--: кислот детерминирована генетически и «тлисана в первичной структуре. Следо-ззтельно, многообразие структурно и 2 -нкционал ьно различных белков определяется двумя причинами: 1) возможно-.—образования различных первичных . ~г}ктур из 20 аминокислот; 2) явлени-; ч самосборки, основанной на принципе салмодействия комплементарных повер-• - сетей.
Завершая изложение материала о .-руктуре и функции белков, остано-• гмся на двух важных в практическом “ношении аспектах: количественном “ределении белков и выделении инди-- ^дуальных белков.
Количественное определение белков
Различают две группы методов:
1. Определение количества белков в растворе на основе физико-химических свойств', биуретовый метод (основан на образовании окрашенного в фиолетовый цвет комплекса пептидных связей белка с ионами двухвалентной меди в щелочной среде); рефрактометрический и нефелометрический методы; поглощение ультрафиолетового излучения (при 280 нм поглощают УФО остатки ароматических аминокислот, при 180—210 нм — пептидная связь и ряд конформационных факторов). Используют закон Ламберта-Бэра А=ес1, где с — коэффициент экстинкции (М'1 см1); с — концентрация вещества в растворе (М); 1 — длина пути светового луча в кювете (см). Для триптофана максимум абсорбции при 280 нм и коэффициент экстинкции равен 3400 М*1 см1, а для тирозина максимум абсорбции при 276 нм и коэффициент экстинкции составляет 1400 М'1 см1 (рис. 4.1). Определение поглощения света длиной волны 280 нм используется для анализа концентрации белка в растворе (если известно количество остатков триптофана и тирозина в белковой молекуле).
2. Количественное определение индивидуальных белков на основе их биологических свойств (радиоиммунный, имму-ноферментные методы).
Задача: в биологической жидкости имеется смесь белков (А+В+Х). Необходимо определить количество белка X. Здесь общее определение количества белка не годится. Для количественного определения индивидуального белка X в смеси белков предложен радиоиммунный метод. Рассмотрим его суть.
Первый этап: приготовление реагента для определения. Чистым препаратом белка X, полученным заблаговременно, иммунизируют животное. Против этого бел-
53
Глава 4 Специфичность белков
Рис. 4.1. Спектры поглощения триптофана и тирозина. Только эти аминокислоты поглощают свет при 280 нм (рис. G. Gatto).
ка в организме животного образуются антитела. Их выделяют из крови и метят 1251. Этот этап осуществляется на предприятиях, производ ящих наборы реагентов для радиоиммунного определения белка.
Второй этап; анализируют смесь белков, добавляя к ним меченое антитело в избытке. Меченное антитело связывает из-за специфического взаимодействия только белок X. Этот комплекс выделяют, подсчитывают радиоактивность и определяют количество метки. По количеству метки определяют количество антитела X, т. е. искомого белка. Метод весьма чувствителен, поскольку основан на специфичности белков, т. е. специфическом комплементарном взаимодействии индивидуальных белков.
В настоящее время нашел широкое распространение иммуноферментный анализ (ИФА) индивидуальных белков, основанный на сродстве антитела к конкретному антигену.
Напомним, что антитела продуцируют В-клетки (В-лимфоциты). Каждая клет
ка системы иммунитета вырабатывает одно антитело, которое распознает отдельный участок (эпитоп, антигенную детерминанту) молекулы антигена. Поскольку в молекуле антигена присутствует несколько разных эпитопов, антитела против каждого из них вырабатываются отдельными клетками системы иммунитета. Различают моноклональные и поликлональные антитела. Поликлональные антитела образуются при иммунизации животного, вариабельны по количеству и поэтому не нашли применения в ИФА. Известно, что В-клетки не воспроизводятся в культуре. Но после слияния с миеломными клетками удалось получить гибридомы - растущие и делящиеся в культуре клоны клеток, которые продуцируют высокоспецифичные моноклональные антитела. Моноклональные антитела направлены только против одной антигенной детерминанты и широко применяются в настоящее время при определении полипептидных гормонов, маркеров опухолей, цитокинов,
54
Специфичность белков Глава 4
дарственных препаратов, различных - зкомолекулярных биорегуляторов, воз-' жителей инфекционных заболеваний гисунок 4.2).
По типу проводимых реакций методы 4 ФА подразделяются на гомогенный Е М1Тк-анализ, от англ. Enzyme М Jnplied Immunoassay Technique) и ге-;»генный (твердофазный) ИФА(££А$>1 — Enzyme-Linked ImmunoabSorbant ну). При твердофазном иммунофер-- г гном анализе антитела или антигены - чмобилизируют на твердом носителе.
Классическим вариантом твердофаз-: го иммуноферментого анализа явля-. метод «сэндвича», который вклю-- „гг следующие основные этапы: ।.. В лунках планшетов фиксируют ан-тела, специфичные к определяемому .чтигену («первое антитело»).
2. Образец, в котором хотят обнаружить специфическую молекулу или микроорганизм (антиген), вносят в лунки планшета.
3. Образуется комплекс «первое антитело-антиген».
4. Для удаления не связавшихся антигенов, проводят промывку лунок планшета.
5. К комплексу «первое антитело-анти-ген» добавляют конъюгат, представляющий собой антитело против другой антигенной детерминанты антигена («второе антитело»), связанное с ферментом (пероксидаза, каталаза, щелочная фосфатаза и др.).
6, Образуется тройной комплекс «первое антитело-антиген-второе антитело-фермент»). Для реализации такой схемы ИФА-анализа необходимо, чтобы
Поликлональные антитела
Моноклональные антитела
»ис. 4.2. Поликлональные и моноклональные антитела. Большинство антигенов имеют несколь-.: эпитопов (специфических мест связывания). Поликлональные антитела являются смесью раз---*~<ных антител, каждое из которых специфически связывается с одним из эпитопов антигена. ’ *:-оклонапьные антитела идентичны и продуцируются одним клоном клеток. Они связываются ".~=ко с одним специфичным для их поверхности эпитопом антигена (по Goldsby R. A. et al., 2000).
55
Глава 4 Специфичность белков
антиген имел две антигенные детерминанты.
7. Если «второе антитело» не связано с ферментом, то в лунку дополнительно вносят антивидовые антитела («вторичные антитела»).
8. Для визуализации взаимодействия антитела и антигена после отмывки не связавшегося конъюгата в среду добавляется хромогенный субстрат и окрашенные продукты ферментативной реакции регистрируют фотометрически. В качестве субстратов используется перекись водорода в комбинации с хромогенами о-фенилендиамином (ФДА) или тетраметилбензидином (ТМБ). Продукт окисления ФДА окрашен в золотистокоричневый цвет и поглощает свет при длине волны 490 нм. Продукт окисления ТМБ (диаминобензен) имеет желтый цвет, который меняется на голубой после добавления кислоты и поглощает свет при длине волны 450 нм.
9. Интенсивность окраски продукта ферментативной реакции прямо пропорциональна количеству антигена в исследуемом образце.
В ряде случаев требуется определить наличие низкой концентрации белка, находящегося в окружении многих белков, например, наличие вирусного протеина в сыворотке крови. Очень низкие концентрации белка в различных белок-содержащих жидкостях определяют, используя технику Вестерн блоттинга'. 1. Белки исследуемого образца разделяют методом электрофореза в блоке полиакриламидного геля (SDS-PAGE).
2. После завершения электрофоретического разделения на поверхность блока накладывают полимерную пленку и под давлением или с помощью электрического тока (электроблотгинг) обеспечивают переход разделившихся белков в пленку.
3. На поверхность пленки наносят первое антитело, специфичное к определя
емому белку; оно может связаться со своим антигеном, образуя комплекс антиген-антитело.
4. Затем детектируют этот комплекс путем добавления специфичного к первому антителу второго энзимсвязанно-го антитела и красителя (как в методе ELISA), часто второе антитело метят радиоактивным элементом и детектирование места положения белка производят путем анализа ауторадиограммы. Техника Вестерн блоттинга лежит в основе тестов определения корового антигена вирусного гепатита С, а также широко применяется при оценке белковых продуктов при экспрессии клонированных генов (рис. 4.3).
Наряду с количественным и качественным анализом белков в биологических жидкостях, необходимо знать их локализацию и функционирование в клетке. Для этих целей используют флуоресцентные маркеры, которыми метят специфические антитела. Затем обрабатывают клетку мечеными антителами и с помощью флуоресцентного микроскопа оценивают локализацию белка в клетке. Например, с помощью зеленого флуоресцирующего белка (GPF) из тканей медузы был помечен рецептор к стероидным гормонам. Оказалось, что в отсутствие гормона рецептор локализуется в цитоплазме, а при наличии стероидного гормона рецептор перемещается в ядро и связывается с ДНК. Разрешающая способность метода около 200 нм, или 2000 ангстрем. Она может быть повышена в 20 раз (10 нм, или 100 ангстрем) в методе иммуноэлектронной микроскопии. Для этого используют специфические антитела, включающие частички золота (по аналогии с ферритином, содержащим атомы железа).
Для реализации методов радио- и иммуноферментного анализа требуется предварительно получить индивидуальные белки.
56
Специфичность белков Глава 4
°ис. 4.3. Вестерн-блоттинг (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
Методы выделения индивидуальных белков
При выделении индивидуальных белов обычно сталкиваются со следующими трудностями: 1) низкое содержание белка в исходном материале (часто 0,1 % от сухой массы); 2) лабильность белков, что не позволяет применить традиционные методы органической химии (t°, перегонка, кристаллизация и др.); 3) связь белков :о структурными элементами клеток -'.ли наличие их в белково-липидных, ? едко во-углеводных и других комплексах биологических жидкостей; 4) наличие близких физико-химических свойств у разделенных белков.
Этапы выделения
X. Перевод белков ткани в раствор.
1. Гомогенизация — перевод исследуемого материала в гомогенное состояние. При этом используются ступки, ножевые, пестиковые гомогенизаторы, ультразвук, замораживание — оттаивание и прочие методы для разрушения структур тканей.
2. Экстракция белков проводится обычно параллельно с гомогенизацией. Используют для экстракции: 8—10 % растворы солей (NaCl, КС1 и др.), в которых хорошо растворимы большинство белков тканей; буферные растворы; органические растворители и детергенты, нарушающие гидрофобные взаимодействия при выделении мембранных белков; сахароза, глицерин и другие специальные экстрагенты.
3. Осветление гомогената (экстракта) путем центрифугирования или фильтрации. В результате получаем раствор тканевых белков.
Б. Групповое разделение белков.
1. Высаливание — разделение белков на фракции по их растворимости. Принцип метода заключается в дегидратации белков (обычно с помощью сернокислого аммония) при pH близком к изоэлектрической точке. Различные белки выпадают в осадок при разных концентрациях соли. Это грубый метод разделения на группы. Например, глобулины выпадают в осадок при полунасыщении, а альбумины при полном насыщении (NH4)2SO4.
57
Глава 4 Специфичность белков
2. Избирательная денатурация — многие белки денатурируют и выпадают в осадок при нагревании раствора до 50°С или при подкислении среды до pH 5,0. Если выделяемый белок устойчив к нагреванию и изменению pH, то часть ненужных белков можно удалить таким простым способом.
3. Органические растворители при низких температурах используются для щадящего группового разделения белков. По методу Кона фракционируют белки плазмы крови спиртом при — 3 5 °C: альбумины — спирт 40 %, pH 4,8, 1—5 °C; 0, у-глобулины — спирт 25 %, pH 6,9, 1—5 °C; а-глобулины — спирт 18 %, pH 5,2, 1-5 °C; фибриноген — спирт 8 %, pH 7,2, 1~3 °C; а2-глобулин — спирт 40 %, pH 5,8, 1-5 °C.
4. Диализ — освобождение белковых растворов от низкомолекулярных соединений (например, от сернокислого аммония (NH4)2SO4). Принцип: белки не проходят через полупроницаемую мембрану, а низкомолекулярные вещества проходят, что и позволяет очистить раствор белков от низкомолекулярных примесей. Получаем группу (смесь) белков, обладающих близкими физико-химическими свойствами.
В. Выделение индивидуального белка. Для выделения индивидуального белка из смеси белков с близкими физико-химическими свойствами используют: 1) различия по молекулярной массе (методы ультрацентрифугирования и гель-хроматографии); 2) различия в заряде (методы электрофореза и ионообменной хроматографии); 3) способность белков к специфическим взаимодействиям (аффинная хроматография).
1. Разделение по молекулярной массе. а) Ультрацентрифугирование позволяет получить в центрифужных пробирках, вращающихся со скоро
стью до 85000 об/мин, ускорение силы тяжести 300000—500000 g, при этом белки с разной молекулярной массой будут двигаться к дну пробирки с разной скоростью. На дно осядут самые тяжелые белки, затем средние и легкие (рис. 4.4).
б) Гель-фильтрация осуществляется с помощью молекулярных сит, например, сефадексов. Это нитевидные молекулы полисахарида декстрана, сшитые через определенные промежутки поперечными связями и свернутые в гранулы. В зависимости от размеров пор выпускают ряд марок сефадексов: G-200; G-100; G-75 и др. (рис. 4.5).
2. Разделение по заряду.
а) Электрофорез. Белки, имеющие разное количество ионогенных радикалов в полипептидной цепи имеют в растворе разные заряды, а поэтому в электрическом поле будут двигаться с разной скоростью. Обычно используют электрофорез в полиакриламидном геле. Перспективен метод изоэлектрического фокусирования.
б) Ионообменная хроматография заключается в ионном обмене между полимером, заполнившим колонку, и заряженным белком, пропускаемым через колонку. Различают два типа ионообменников:
Катионобменник — КМ (карбоксиме -тилцеллюлоза) — это полимер целлюлозы, к которой по ОН- группе пришита карбоксиметильная группа.
Ц—О-СН2 ~ СООН
Подготовка смолы к работе — пропускание через нее NaOH.
Ц—О—СН2—COO‘...Na+
Образуется солевая форма с катионами Na+. Теперь пропускаем через ко-
58
Специфичность белков Глава 4
Раствор низкой
Раствор высокой
Градиент плотности
Нанесение образца
Сбор фракций через отверстие в дне центрифужной пробирки
Рис. 4.4. Ультрацентрифугирование (Freifelder D., 1982). А — формирование градиента плотности растворителя (растворы сахарозы или хлорида цезия) в центрифужной пробирке; Б — нанесение смеси белков на поверхность градиента; В — помещение центрифужных пробирок в ротор и вращение в вакууме до 75000 об/мин; Г — прокалывание дна центрифужных пробирок и сбор вытекающих фракций белков (Berg J. М., Tymoczko J. L, Stryer L., с изм.).
59
Глава 4 Специфичность белков
Рис. 4.5. Г ель-хроматография. Смесь белков в малом объеме наносится на колонку, заполненную частицами с порами. Крупные частицы не проникают внутрь частицы и элюируются первыми (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
лонку катионы белка. Эти катионы вытесняют Na+ и становятся на его место.
Ц—О—СН2—СОО*...Белок*
Прочность связи (электростатической) зависит от величины (+) заряда, т. е. числа ионизированных NH3+ групп.
Анионообменник — ДЕАЕ (диэтилами-ноэти лцеллюлоза).
+ ,СН2—СН3
Ц—О—СН2—сн2—\
I СН2—СН3
Н 3
Подготовка — обработка анионооб-менника щелочью или кислотой, что приводит к образованию солевой формы:
+ сн2—сн3 ц-о-сн2—сн2—\
I сн2—сн3 н
СГ(ОН’)
Ионы СГ или ОН обмениваются на анионы белка
+/СН2—СН3 ц-о-сн2—сн2—г/
I сн2—сн3
Белок’
В случае ионного обмена прочность связи белка с ионитом определяется величиной заряда белка. Для разделения кислых и нейтральных белков используют анионообменники, для разделения основных белков — катионообменники.
60
Специфичность белков Глава 4
Элюцию осуществляют:
• Буферными растворами с изменяющимися значениями pH (возрастающими или убывающими). При этом белки разделяются в соответствии с их зарядами (т. е. отходят от заряженной группы ионита в изоэлектрической точке).
• Буферным раствором того же pH, но содержащим катионы (анионы) с большим сродством к ионообмен-нику (вытеснение по величине заряда).
3. Разделение на основе специфического связывания. Аффинная хроматография, или хроматография по сродству. Метод основан на специфическом взаимодействии молекулы белка с определенным лигандом. Готовят матрицу, с которой сшивают соединение । лиганд), обратимо и специфично связывающийся с искомым белком. Затем через колонку пропускают смесь белков. С лигандом матрицы свяжется только искомый белок за счет специфического взаимодействия, а другие белки будут удалены с растворителем. Затем не представляет труда снять этот белок. Для этого через колонку пропускают раствор с высокой концентрацией свободного ли
ганда. Часто используют вариант свободного лиганда, имеющего более высокое сродство к белку, чем у фиксированного на матрице лиганда.
Для выделения каждого белка требуется своя последовательность этапов (схема выделения и очистки белка, таблица 4.1). Успешность выделения белков контролируется на каждом этапе путем определения специфической активности белка и SDS-PAGE анализа (рис. 4.6). Обычно на каждом этапе оценивают: 1) количество общего белка; 2) общую активность белка (если выделяют фермент, то активность фермента); 3) специфическую активность (общая активность/об-щее количество белка); 4) выход продукта — на каждом этапе в % от общей активности гомогената; 5) степень очистки — повышение специфической активности на каждом этапе по отношению к специфической активности исходного гомогената.
Определение гомогенности выделенного белка: кристаллизация (у чистого белка кристаллы одного типа); кривые растворимости (у чистого белка один перелом кривой растворимости); аналитическое ультрацентрифугирование (чистый белок дает один узкий пик); электрофорез в ПААГ, изоэлектрофокусирование (чис-
Таблица 4.1. Схема выделения белка (Berg J. М., Tymoczko J. L., Stryer L., с изм.)
Этап Общий белок (мг) Общая активность (ВД Специфическая активность (Ед/мг) Выход, % Степень очистки
"омогенат 15000 150000 10 100 1
Высаливание 4600 138000 30 92 3
/онообменная хроматография 1278 115500 90 77 9
'ельхромато-г рафия 68,8 75000 1100 50 110
Аффинная хроматография 1,75 52500 30000 35 3000
61
Глава 4 Специфичность белков
Гель- Аффинная
Высали- хромато- хромато-
Рис. 4.6. Электрофоретический анализ в процессе очистки белка. В соответствие со схемой очистки белка из смеси проводится SDS-PAGE на каждой стадии. На дорожку наносилось по 50 мкл образца. При переходе от 1-й к 5-й стадии очистки видно постепенное обогащение одной белковой фракции и исчезновение других белков (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
тый белок дает одну полосу); иммунохи-мический (чистый белок дает одну полосу преципитации со смесью антител).
Протеомика
Термин «П роте ом» возник от протеин, т. е. белков, полученных при экспрессии генома, и определяет системный
профиль белков клеток, тканей и органов на основе биохимических, молекулярно-клеточных и генетических методов исследования. Протеомика изучает белковый спектр биологических систем в различных условиях. Если исследование генома (геномика) было основным направлением биологических научных исследований XX века, то протеоми-
62
Специфичность белков Глава 4
о — это наука XXI века. Протеомика сковывается на 2-х этапном анализе: 1) *.зк можно детальное разделение белков ' 'о.тогического объекта и 2) их коли--. ственная оценка. Протеомика возник-
на основе двумерного электрофореза - юлиакриламидном геле, когда удается задеть белковый спектр биологическо-; объекта в виде отдельных пятен. -Игом вперед явилась комбинация это-. метода с чувствительным методом ггтекции масс-спектрометрией. Проте-м лка изучает не только изоформы бел-’ ?з. но и особенности их фолдинга, т. е. - гиобретания нативной конформации. Ь общем, протеомика изучает локали-2дию белков в клетке, обеспечивает „ентификацию отдельных белков, определение их структуры и определяет лрактер белок-белковых взаимодействий.
Развитие техники исследования последовательности нуклеотидных остатков е составе ДНК привело к расшифровке генома клетки. Оказалось, что кругли червь Caenorhabditis elegans имеет - геноме 96 миллионов оснований и коло 19000 генов, кодирующих белки, л геном мушки Drosophilia melanogaster содержит 180 миллионов оснований и коло 14000 генов. Геном человека ока
зался больше — 3 миллиарда оснований и около 40000 генов. Однако эта статичная информация, похожая на перечень деталей локомотива. Чтобы понять, как движется локомотив, необходимо знать характер взаимодействия всех деталей устройства, то есть необходимо от статичной информации перейти к функциональной. Такую информацию дает протеомика, изучающая продукты экспрессии генов — белки. Если на языке геномики мы говорим о том, что возможно, то язык протеомики демонстрирует как это происходит. Протеомика в отличие от геномики не является зафиксированной наукой, поскольку она описывает белки, лежащие в основе всех функций клетки. Хорошо известно, что во всех клетках организма содержится идентичная ДНК, но каждая клетка отличается от другой по белковому составу, поскольку экспрессируются разные гены. Протеомика намного больше геномики, так как механизмы альтернативного сплайсинга РНК, посттрансляционной модификации белков, различных механизмов регуляции белкового синтеза и белок-белковых взаимоотношений делают мир белков богаче и многообразнее, чем мир нуклеиновых кислот.
63
Глава 5
Ферменты. Кинетика ферментативного катализа
Одной из важнейших функций белков является катализ химических реакций. Подавляющее число химических превращений в организме носит каталитический характер. Именно благодаря белкам-катализаторам удалось на Земле реализовать генетическую информацию, записанную в виде нуклеотидного кода, в разнообразные структуры и функции живых организмов.
Определение и историческая справка
Ферменты — биологические катализаторы белковой природы (от греч. enzyme — в дрожжах или от лат. fermentatio — брожение).
Представления о том, что в живых системах химические реакции протекают при помощи каких-то факторов, возникло более 200 лет назад. В начале XIX века господствовало мнение о наличии «жизненных сил», управляющих процессами жизнедеятельности. Более четкие и однозначные химические представления сформировались в связи с развитием те
ории химического катализа, выдвинутой шведским химиком Й. Я. Берцелиусом, который первым отметил высокую производительность биологических катализаторов на примере диастазы.
В 50-х гг. XIX столетия Л. Пастер показал, что сбраживание дрожжами сахара в спирт катализируется веществами белковой природы — ферментами. Ошибка Пастера заключалась в том, что он считал ферменты неотделимыми от живых клеток (в данном случае дрожжевых). Это представление разделялось многими учеными, его современниками. Поэтому открытие Э. Бухнера, который первым показал, что в водных экстрактах дрожжевых клеток находится набор ферментов, катализирующих превращение сахара в спирт, является началом формирования науки энзимологии. В 20-х гг. XX в. Р. Вильштеттер впервые получил ряд ферментов в высокоочи-щенном состоянии. Однако химическую природу ферментов он не идентифицировал из-за ошибочного исходного представления о том, что ферменты — особый класс низкомолекулярных веществ,
64
Ферменты. Кинетика ферментативного катализа Глава 5
.троированных на белках. В 1926 г. Дж. Самнер впервые получил растительную уреазу в виде белковых кристаллов. Че-'=jpe года спустя Дж. Нортроп и М. к.нити представили данные о получе--/и кристаллов пепсина и трипсина, : казав их исключительно белковую природу. В конце прошлого века появи-/сь сведения о каталитических антитеза (абзимы) и РНК (рибозимы).
Идея W. Jencks (1969) о способности гелков-антител катализировать химические реакции была подтверждена в конце j-x годов прошлого века. Были введены термины «каталитические антитела» лли «абзимы» (от antibody enzyme). В настоящее время известны несколько клас-.о в химических реакций, катализируемых антителами: ацилтрансферазные, изомеразные, бимолекулярной ассоциации и окислительно-восстановительные.
Каталитические РНК (рибозимы) были описаны в 80-х годах прошлого зека (Т. R. Chech et al., 1981; С. Guerrier-Takada et al., 1983). Рибозимы достаточно широко представлены в природе и играют важную роль в эволюции живых организмов, поскольку они могут обеспечивать репродукцию и процессинг РНК без участия белков-ферментов. В частности, рибозимы участвуют в удалении неинформативных интронов из пре-м-РНК, на этапе синтеза белков путем созревания тРНК с помощью рибонуклеазы рРНК, а также в процессе саморепликации вирусного РНК генома (патогенные вирусы для растений и человека). Ранее неоднократно сообщалось, что синтез белка в рибосомах зависит от уровня рРНК.
Активность рибозимов может контролироваться антибиотиками, что открывает новую страницу в профилактике и лечении вирусных заболеваний, включая вакцинацию.
Ферменты ускоряют реакции в миллионы раз. Многие реакции не могут протекать в организме в отсутствие ферментов. Например, гидратация углекислоты, катализируемая карбоангидразой, является одной из наиболее быстрых реакций. Каждая молекула фермента гидрирует 106 молекул СО2 за секунду! Эта катализируемая реакция протекает в 107 раз быстрее, чем не катализируемая. Ферментативный гидролиз пептидной связи происходит за миллисекунды, а без фермента для разрыва пептидной связи при нейтральном значении pH потребуется от 10 до 1000 лет.
Для выделения ферментов используют методы препаративной химии белков в специальных щадящих условиях (низкая температура, отсутствие эффектов необратимой денатурации). Оптимальным способом выделения ряда ферментов является биоспецифичная аффинная хроматография. Из более 3800 ферментов, включенных в список, 3/4 выделены и очищены, у 500 ферментов изучена первичная структура и охарактеризованы гены и только у десятков из них постулирована третичная структура.
Характеристика ферментов
Сходства между ферментами и химическими катализаторами:
1. Не расходуются и не образуются в процессе реакции.
2. Катализируют только энергетически возможные реакции.
3. Не изменяют свободную энергию субстратов и продуктов реакции.
4. Не смещают равновесия реакции, а ускоряют его наступление.
Различия между ферментами и химическими катализаторами:
1, Ферменты являются белками и поэтому катализируют реакции в «мягких» условиях (давление 1 атм, температура 37 °C и нейтральное значение pH).
65
Глава 5 Ферменты. Кинетика ферментативного катализа
2. Ферменты обладают физико-химическими свойствами, характерными для белков: высокой молекулярной массой, амфотерностью, не способны к диализу, подвергаются высаливанию и денатурации.
3. Для ферментов характерна более высокая эффективность. Например, энергия активации разложения перекиси водорода Н2О2 -* Н2О + !/2О2 равна 75,2 кДж/моль. При добавлении неорганического катализатора платины энергия активации снижается до 50,2 кДж/моль. Фермент каталаза снижает энергию активации до 8,3 кДж/моль.
4. Активность фермента регулируется и контролируется на генетическом уровне (на этапе синтеза белка-фермента и его фолдинга) и посредством низкомолекулярных соединений (субстратов, продуктов реакции и других низкомолекулярных эффекторов).
5. Ферменты обладают специфичностью. Различают 4 вида специфичности ферментов:
• Абсолютная специфичность —- фермент катализирует превращение только одного субстрата. Например, аргиназа расщепляет аргинин, уреаза -мочевину.
• Относительная специфичность — фермент расщепляет определенный тип связи. Например, липаза гидролизует жиры по месту сложноэфир-ной связи на глицерол и жирные кислоты.
• Относительная групповая специфичность — фермент расщепляет определенный тип связи, но в ее образовании участвуют определенные функциональные группы. Такие ферменты обычно участвуют в процессе пищеварения. Например, пищеварительные ферменты, гидролизующие пептидную связь в белках, относятся к протеиназам (относительная специфичность), но среди
них пепсин расщепляет пептидную связь, образованную аминогруппой ароматических аминокислот; трипсин —• пептидную связь, образованную карбоксильной группой основных аминокислот, а химотрипсин — карбоксильной группой ароматических аминокислот (относительная групповая специфичность).
• Стереохимическая специфичность — фермент катализирует превращение определенного стереоизомера. Например, оксидаза L-аминокислот превращает только L-аминокислоты.
6. В организме действуют, как правило, полиферментные системы, в результате чего происходит многоэтапное превращение вещества с допустимыми для организма перепадами энергии.
Полиферментные системы (комплексы) представляют собой несколько ферментов, катализирующих ряд согласованных реакций, причем конечные продукты одной ферментативной реакции являются субстратами для следующей. Различают три типа полифермен-тных комплексов:
а) ферменты растворены в цитоплазме и контакт субстратов с ними осуществляется посредством диффузии;
б) ферменты соединены друг с другом за счет белок-белковых взаимодействий;
в) ферменты соединены друг с другом и иммобилизованы на внутриклеточных или цитоплазматических мембранах.
Классификация и номенклатура ферментов
1. Ферменты называются добавлением суффикса ~аза к названию субстрата, на который данный фермент действует. Например, уреаза катализирует гидролиз мочевины; ферменты, гидролизующие крахмал (амилон), были названы
66
Ферменты. Кинетика ферментативного катализа Глава 5
амилазами; гидролизующие жиры (ли-пос) — липазами; ферменты, гидролизующие белки (протеины) — протеиназами.
2. Используются названия для групп ферментов, катализирующих сходные по механизму реакции. Их название строится по принципу — «субстрат-тип реакции». Например, ферменты, которые переносят остаток фосфорной кислоты от АТФ на другую молекулу, называются киназами (глюкокиназа катализирует перенос фосфорильного остатка от АТФ на глюкозу).
3. Тривиальные названия не показывают механизма действия, но они широко используются. Например, пепсин, трипсин и др.
4. Международный Совет Биохимиков (IUB) предложил систематическое название и классификацию ферментов по типу и механизму катализируемой реакции.
Реакции и ферменты их катализирующие делят на 6 классов, каждый из которых состоит из 4—13 подклассов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы).
• Оксидоредуктазы. К классу оксидоредуктаз относятся ферменты, катализирующие окислительно-восстановительные реакции с участием двух субстратов А и В: А восстан. + В окислен «--* А окислен. + В восстан. Систематические названия их составляют по форме «донор: акцептор-оксидоредуктаза». Например: ЛДГ — лактат: НАД+ - оксидоредуктаза (тривиальное название лактатдегидрогеназы). Различают следующие основные оксиредуктазы: оксидазы (аэробные дегидрогеназы), которые катализируют перенос протонов (электронов) на кислород (на атом кислорода — с образованием Н2О, на молекулу кислорода — с образованием Н2О2); анаэробные дегидрогеназы, катализирующие перенос протонов
(электронов) на промежуточный субстрат, но не на кислород; цитохромы, обеспечивающие перенос только электронов; включение кислорода в другой субстрат (включение атома кислорода — образование ОН-группы, монооксигеназы; включение молекулы кислорода — диоксигеназы); каталаза и пероксидаза, катализирующие реакции с участием перекиси водорода (перенос протонов и электронов на молекулу кислорода).
• Трансферазы. К классу трансфераз относятся ферменты, катализирующие реакции межмолекулярного переноса групп X (отличной от атома водорода) с субстрата А на субстрат В: А-Х + В «-*А + В-Х. Катализируют перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Наименование этих ферментов составляется по форме: «донор: транспортируемая группа — трансфераза». Например, Ацетил-КоА + Холин *-► КоА + Ацетил-холин. Эту реакцию катализирует фермент ацетил-КоА: холин-О-ацетилтрансфераза (короче — холин-ацетилтрансфераза). Используется ряд специальных терминов для названия ферментов этого класса: киназы — перенос фосфатного (фосфорильного) остатка от нуклеозидтрифосфата (например, АТФ) на другую молекулу или наоборот с образованием нуклеозидтрифосфата; фосфомутазы — внутримолекулярный перенос фосфатного остатка.
• Гидролазы катализируют гидролиз эфирных, сложноэфирных, пептидных и гликозидных связей, кислородных ангидридов, связей С-С, С-галоген и P-N, т. е. расщепление внутримолекулярных связей с участием воды. Наименование их состав
67
Глава 5 Ферменты. Кинетика ферментативного катализа
ляется по форме: «субстрат — гидролаза». Например, Ацетилхолин + Н2О «—►Холин + Уксусная кислота. Фермент называется ацетилхолин-ацил-гидролаза. К этому классу относят эстеразы (гидролиз и синтез сложных эфиров); гликозидазы (разрыв гликозидных связей); фосфатазы и пеп-тидгидролазы (разрыв фосфоангид-ридных и пептидных связей), пептидазы (гидролиз пептидных связей) и др.
• Лиазы (синтазы) — это ферменты, отщепляющие группы от субстратов по негидролитическому (без участия воды) механизму, с образованием двойных связей. Ферменты действуют на связи С-С, С-О, C-N, С-S и С-галоген. Название ферментов: «суб-страт-лиаза». Например, L-малат «-► фумарат + Н2О. Этот фермент называется L-малат-гидролиаза (тривиальное название — фумараза). К этому классу относят декарбоксилазы (карбокси-лиазы, амилазы-лиазы и др.). В рекомендуемых названиях используются термины «альдолаза», «декарбоксилаза».
• Изомеразы катализируют различные типы оптических, геометричеких и позиционных изомеров. Название этих ферментов составляется с учетом типа реакции: «Субстрат-цис-транс-изомераза (например транс-рети-наль — 11 цис-транс изомераза катализирует превращения транс-ретиналя в 11-цис-ретиналь при восприятии света); «альдегид-кетон-изомераза» (D-глицеральдегид-3-фосфаткетон-изо-мераза катализирует превращение D-глицеральдегид-3-фосфата в дигидроксиацетонфосфат); если изомеризация включает внутримолекулярный перенос группы, то фермент получает название мутазы. К классу изомераз относят так же рацемазы и эпимеразы.
• Лигазы (синтетазы) катализируют соединения двух молекул, сопряженное с разрывом пирофосфатной связи АТФ или другого макроэргического соединения. Систематическое название этих ферментов составляют по форме «А: В лигазы», где через А и В обозначают исходные вещества. В этот класс включены ферменты, катализирующие реакции образования связей С-О, C-S, С-N, С-С. Например, образование С-N связи при синтезе глутамина катализирует фермент L-глутамат: аммиак лигаза, тривиальное название глутаминсинтетаза: АТФ + L-глутамат + NH4+ -<-*АДФ + ортофосфат + L-глутамин.
5. Каждый фермент имеет специальный шифр, состоящий из 4-х кодовых чисел, разделенных точками; первая цифра характеризует класс реакции, вторая — подкласс, третья — подподкласс, четвертая указывает порядковый номер фермента в его подподклассе. Например, лактатдегидрогеназа имеет шифр 1.1.1.27, т. е. фермент относится к 1-му классу (оксидоредуктазы), к 1-му подклассу (оксидоредуктазы, действующие на СН-ОН-группировки в качестве доноров атомов водорода), к 1-му подподклассу (акцептором атомов водорода служит никотина-мидадениндинуклеотид) и занимает 27-ю позицию в перечне ферментов упомянутого подкласса (таблица 5.1.).
Название класса указывает на тип химической реакции, катализируемой ферментами. Классы делятся на подклассы, а те, в свою очередь, на подподклассы. Подкласс уточняет действие фермента, т. к. указывает на природу химической группы субстрата, атакуемой ферментом. Подподкласс уточняет природу атакуемой связи субстрата или природу акцептора, который участвует в реакции. Дополнительная информация, если она необходима для уточнения, заключается в скобки. Например, фер-
68
Ферменты. Кинетика ферментативного катализа Глава 5
Таблица 5,1. Примеры номенклатуры ферментов
шифр Рабочее название Реакция Систематическое название
1.1.1.1. Апкогольдегидрогеназа Алкоголь + НАД* *“* альдегид (кетон) + НАДН+Н* Алкоголь: НАЦ* оксидоредуктаза
2.4.1.1. Гл икогенфосфори лаза (1,4-а-О-глюкозил)г + Н3РО4 -* (1,4-а-0-глюкозил)п1 + а-6-глюкозо-1 -фосфат 1,4-а-0-глюкан: ортофосфат гликозилтрансфераза
3.1.1.7. Ацетилхолинэстераза Ацетилхолин + Н20 * холин + ацетат Ацетилхолин-ацетилгидролаза
4.1.3.7. Цитрат-синтаза Цитрат + КоА * ацетил-КоА + Н2О + оксалоацетат Цитрат - оксалоацетат-лиаза
5.3.1.9. Глюкозофосфат-изомераза D-глюкозо-б-фосфат *-► D-фруктозо-б-фосфат D-Глюкозо-6-фосфат кетолизомераза
6.2.1.3. Ацил- КоА-с и нтетаза АТФ + кислота + КоА -> АМФ + ацил-КоА + Н4Р2О7 Кислота: КоА лигаза (образующая АМФ)
мент, катализирующий реакцию L-ма-лат + НАД+ = пируват +СОг +НАДН + Н+ называется L-малат: НАД+ оксидоредуктаза (декарбоксилирующая).
В связи со значительным усложнением названий ферментов в новой номенклатуре и живучестью тривиальных названий иногда допускается использование последних в публикациях.
Структурная организация ферментов
По строению ферменты делятся на простые (однокомпонентные) и сложные (двухкомпонентные) белки. Простые белки-ферменты состоят из аминокислот. Сложные белки-ферменты состоят из белковой части — апофермента и небелковой части — кофактора. Кофактор, прочно связанный с апоферментом, называется простетической группой. Комплекс апофермента и прочно связанного кофактора называется холоферментом. Кофактор, который связан с апоферментом нековалентными связями и легко отделяется при диализе, называется коферментом. Кофермент присоединяется
во время реакции к молекуле фермента подобно субстрату, химически изменяется и затем снова освобождается.
Роль коферментов выполняют 2 группы веществ: витамины и их производные и вещества невитаминной природы. Ко второй группе веществ относятся нуклеотиды (УД Ф-глюкоза), фосфаты моносахаридов (2,3-бисфосфоглицерат), металлопорфирины (гем, хлорофилл) и пептиды (глутатион). Кофактором могут быть неорганические ионы, например, Mg2+. Роль металлов: 1) обеспечивают образование фермент-субстратного комплекса; 2) металлы с переменной валентностью участвуют в транспорте электронов; 3) способствуют формированию нативной структуры фермента; 4) облегчают образование связи между апоферментом и коферментом.
Примеры кофакторов ферментов представлены в таблице 5.2.
Кофакторы ферментов должны поступать с пищей, а апофермент синтезируется в организме.
Апофермент определяет специфичность фермента
69
Глава 5 Ферменты. Кинетика ферментативного катализа
Таблица 5.2. Кофакторы некоторых ферментов
Кофактор Фермент
Т иаминлирофосфат Пируватдегидрогеназа
Флавинаденинмононуклеотид (ФМН) Моноаминооксидаза
Никотинамидадениндинуклеотид (НАД) Лактатдегидрогеназа
Пиридоксальфосфат Г ликогенфосфорилаза
Кофермент А (КоА) Ацетил-КоА-карбоксилаза
Биотин (витамин Н) Пируваткарбоксилаза
5'-дезоксиаде ноз ил кобалам и н Метилмалонилмутаза
Тетрагидрофолиевая кислота (витамин В9) Т имидилатсинтаза
Zn2+ Карбоксиле птидаза
Mg2+ Г ексокиназа
Ni2+ Уреаза
Se Г лутатион пероксидаза
Мп2* Супероксиддисмутаза
K+ Пропионил-КоА-карбоксилаза
Функциональная организация ферментов
Вещества, вступающие в ферментативную реакцию, называются субстратами. В результате ферментативных превращений получаются продукты реакции.
В трехмерной структуре фермента выделяют несколько участков, несущих определенную функцию. В молекуле фермента выделяют активный центр, т. е. участок, с которым связывается субстрат и где протекает каталитическая реакция. Характеристика активного центра:
1. Активный центр фермента формируется при образовании третичной структуры белка за счет пространственного сближения радикалов аминокислот (чаще сер, гис, тре, цис, глу, асп, арг). Потеря конформации фермента в результате денатурации приводит к разрушению активного центра.
2. Активный центр образуется боковыми радикалами аминокислот, которые могут располагаться на значительном расстоянии в первичной структуре. Например, в
активный центр химотрипсина входят гис-57, асп-102 и сер-195, а всего фермент образуют 246 аминокислотных остатков. Лизоцим осуществляет разрушение клеточных стенок некоторых бактерий благодаря активному центру, образованному 35, 52, 62, 63, 101 и 108 остатками аминокислот полипептидной цепи, которая включает 129 аминокислот.
3. Активный центр представляет собой полость, щель или карман, который занимает малую область фермента. Большинство ферментов состоят из более, чем 100 аминокислотных остатков, имеют молекулярную массу более 10 кДа и диаметр более 2,5 нм. На область активного центра приходится всего лишь 25— 100-часть от объема фермента.
4. Активный центр не является жесткой структурой. Его конформация изменяется при связывании субстрата. При связывании субстрата со структурами активного центра вода обычно не участвует, за исключением случаев, когда она является реактантом.
5. У сложных ферментов в состав активного центра входят кофакторы.
70
Ферменты. Кинетика ферментативного катализа Глава 5
о. В активном центре выделяют контак-~-.ый (якорный) участок, связывающий . убстрат и каталитический участок, где гоисходит превращение субстрата.
". Субстрат связывается с активным литром фермента нековалентными свя-: > ми. Фермент-субстратны с комплексы ^растеризуются константами равнове-от 10”2 до 10 8 молей, что соответ-.твует свободной энергии взаимодействия всего от -3 до -12 ккал/моль (от - .3 до -50 кДж/моль), Напомним, что ковалентных связей свободная энер-"тя связи составляет от -50 до -ПО < <ал/моль (от -210 до -460 кДж/моль).
Единицы энергии: калория (кал) эквивалентна количеству тепла для подъема емпературы 1 г воды от 14,5 до 15,5°С. • /локалория (ккал) равна 1000 кал. Джоуль (Дж) равен работе, совершаемой силой 1 Н при перемещении точки ее приложения на 1 м в направлении действия силы. Килоджоуль (кДж) равен 1000 Дж. 1 ккал = 4,184 кДж.
Взаимодействие между ферментом и г стивным центром является необходимом для формирования переходного - .стояния. Взаимодействие субстратов и ^.ст'явного центра ферментов требует их .'лижения {для реализации слабых взаи-
* действий) и наличия комплементарных функциональных групп. Субстраты .-зываются с активным центром с образованием фермент-субстратного ком-текса. Продукт высвобождается и фер-"; н г снова используется для реакции.
Кроме активного центра у ряда фер-гитов имеется регуляторный, или алло-. "*ерический (от греч. alios — иной, чу-# центр, который в молекуле сегмента, как правило, пространственно селен от активного центра. К аллосте---- вескому центру присоединяются веще-за — эффекторы, которые делятся на >.т.иваторы и ингибиторы. Присоедине-
ние эффектора к аллостерическому центру приводит к изменению третичной и/ или четвертичной структуры молекулы фермента и соответственно конфигурации активного центра, вызывая снижение или повышение ферментативной активности. Ферменты, имеющие аллостерический центр, называются аллостерическими.
Механизм действия ферментов
Изменение свободной реакции при катализируемой и некатализируемой реакции представлено на рис. 5.1.
Энергия активации — это дополнительное количество энергии, которое необходимо дать молекуле для преодоления энергетического барьера (или для достижения переходного состояния), т. е. это энергия, необходимая для перевода всех молекул моля вещества в активированное состояние. Ферменты ускоряют реакцию путем снижения энергии активации за счет увеличения числа активизированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне.
Стадии ферментативного катализа
Ферментативный катализ идет в 3 стадии:
ki k3
Е + S * * ES-* (EZ- ЕР)—►£ + Р кг
I стадия — присоединение молекулы субстрата к молекуле фермента и образование фермент-субстратного комплекса: Е + S *-► ES
Изменение энергии активации на этой стадии незначительно. В образовании фермент-субстратного комплекса участвуют водородные связи, электростатические и гидрофобные взаимодействия.
71
Глава 5 Ферменты. Кинетика ферментативного катализа
Рис. 5.1. Изменения свободной энергии катализируемой и некатализируемой реакции. S — исходный субстрат; Р — продукт; ДЕнф — энергия активации неферментативной реакции; ДЕф — энергия активации ферментативной реакции; AG — стандартное изменение свободной энергии.
Для этой стадии важно сближение и правильная ориентация фермента и субстрата. Сближение и необходимая ориентация реагентов значительно повышают вероятность образования продуктивного фермент-субстратного комплекса. Кроме того, связывание субстрата в активном центре приводит к удалению гидратной оболочки субстрата. В результате удаления молекул воды в активном центре фермента во время катализа создаются совершенно другие условия, чем в растворе. В сумме эти факторы дадут ускорение реакции в 104 раз.
Существует 2 теории объясняющие взаимодействие фермента и субстрата.
1. В соответствии с теорией Э. Фишера (1890) фермент и субстрат подходят друг другу как ключ к замку. Это озна
чает, что структура фермента и субстрата строго комплементарны.
2. Согласно гипотезе Д. Кошпанда (1958) «индуцированного» или «вынужденного» соответствия фермент изменяет конформацию активного центра при присоединении субстрата. Кроме того, в процессе присоединения происходит перестройка молекул субстрата.
Доказательства существования фермент-субстратного комплекса:
1. При одинаковой концентрации фермента скорость реакции повышается с повышением концентрации субстрата по гиперболической зависимости, а не-катализируемая ферментом реакция не дает такого эффекта насыщения. Наличие эффекта насыщения свидетельствует в пользу образования дискретного ES-комплекса; если все каталитические центры фермента
72
Ферменты. Кинетика ферментативного катализа Глава 5
будут заняты скорость реакции не будет повышаться, а останется постоянной.
2. При современных вариантах рентгеновских кристаллографических исследований доказано наличие фермент-суб-стратных комплексов при действии многих ферментов.
3. Методы спектроскопического анализа доказали наличие фермент-субстрат-ных комплексов по изменению спектров поглощения или флуоресценции в процессе катализируемой реакции.
// стадия — преобразование фермент-субстратного комплекса в один или несколько последовательных (переходных) комплексов с образованием на поверхности фермента конечного продукта реакции:
ES •* EZ* ЕР
На этой стадии происходит образование переходных состояний, продолжительность жизни которых составляет К)-14 — 10 13 с. При этом важным фактором является стабилизация переходного состояния вследствие взаимодействия между функциональными группами субстрата и фермента. Переходное состояние в случае ферментативной реакции требует меныпей энергии активации.
Механизмы действия ферментов на этой стадии объясняются эффектом
деформации субстрата, кислотно-основным и ковалентным катализом. Эффект деформации субстрата (или так называемая теория «дыбы») объясняет действие гидролаз, лиаз и трансфераз. После связывания с активным центром молекула субстрата как бы растягивается на активном центре фермента. Чем больше длина межатомной связи в субстрате, тем меньше энергия ее разрыва.
Многие ферменты во время катализа переносят специфические группировки от субстрата или на субстрат. Особенно часто осуществляется перенос протонов. Этот ферментативный кислотно-основный катализ более эффективен, чем обмен протонов с кислотами и основаниями в растворе. При закреплении субстрата в активном центре на его молекулу влияют электрофильные и нуклеофильные группы каталитического участка, что вызывает перераспределение электронной плотности на участках субстрата, атакуемого кислотно-основными группами.
Итак, кислотно-основной катализ заключается в том, что молекулы, отличные от воды, могут играть роль доноров или акцепторов протонов в процессе катализа. Так в активном центре химотрипсина остаток гистидина повышает нуклеофильную мощность остатка серина (рис. 5.2).
Разрыв пептидной связи белка химотрипсином начинается с взаимодействия остатка серина-195 активного центра фермента с кар
Рис. 5.2. Каталитическая триада. В активном центре химотрипсина — 3 аминокислотных остатка (асп 102, Гис 57 и сер 195) (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
73
Глава 5 Ферменты. Кинетика ферментативного катализа
бонильной группой пептидной связи. Атакующая гидроксильная группа серина активируется через взаимодействие с имидазольной группой гистцдина-57, который связан с остатком аспартата-102. Такое сближенное в пространстве взаимодействие остатков сер-гис-асп называется каталитической триадой, служащей для обеспечения нуклеофильной атаки на пептидную связь. Аналогично протекает каталитическое действие трипсина и эластазы.
Часто химические группировки ковалентно присоединяются к остаткам фермента. Это явление называют ковалентным катализом. Ковалентные фер-мент-субстратные комплексы очень неустойчивы и легко распадаются. Ковалентный катализ подразумевает наличие реакционных групп в активном центре, чаще всего нуклеофильного типа, которые вступают во временные ковалентные связи с субстратом в процессе катализа (так реализуется протеолитическое действие химотрипсина).
Роль ионов металлов заключается в том, что они могут 1) быть электрофильными участниками превращений; 2) участвовать в стабилизация отрицательного заряда в промежуточном метаболите; 3) обеспечивать связывание субстрата и др. Например, карбоангидраза катализирует образование угольной кислоты из Н2О и СОГ Для осуществления этой быстрой реакции необходимы ионы цинка: каждый ион цинка связывает молекулу воды и способствует ее депротонированию с образованием гид-роксидного иона при нейтральном pH. Этот гидроксидный ион атакует СО2 с образованием бикарбонатного иона НСО, (рис. 5.3).
Высокий уровень субстратной специфичности ферментативных реакций играет ключевую роль в функционировании рестриктаз, т. е. ферментов, катализирующих точный разрыв полинуклеотидных цепей ДНК. Для образования фермент-субстратного комплекса между рестриктазой и ДНК необходимы ионы магния. Ионы магния связывают и активируют молекулы воды, которые и атакуют фосфодиэфир-ные связи между нуклеотидами. Местом каталитического разрыва фосфодиэфиряых связей рестриктазами являются области палиндромов в структуре ДНК (рис. 5.4). В этих участках
двуспиральной молекулы ДНК чтение нуклеотидов на цепях ДНК от точки (оси) симметрии одинаково в обоих направлениях (как в слове «шалаш»). Метилирование азотистых оснований препятствует действию рестриктаз.
Правильная ориентация двух разных субстратов путем связывания их с соответствующими функциональными группами активного центра существенно повышает скорость ферментативной реакции.
Для функционирования других ферментов, например, нуклеозидмонофосфаткиназ, ионы металлов служат д ля образования фермент-суб-стратных комплексов, но сама реакция зависит от конформационных изменений ферментов. Нуклеозидмонофосфаткиназы катализируют реакцию переноса конечной фосфорильной группы от нуклеозидтрифосфатов (чаще от АТФ) на фосфорильную группу нуклеозидмонофосфата. Этот перенос происходит без гидролитического отделения конечного фосфорильного остатка нуклеозидтрифосфата. У этих ферментов имеется структурная особенность — так называемая Р-петля, которая во время катализа располагается над фосфодиэфирной связью нуклеозидгрифосфата, приближая ее к фосфорильному остатку нуклеозидмонофосфата. Такое сближение субстратов реакции позволя-
Рис. 5.3. Роль цинка в функционировании карбоангидразы (ион цинка в активном центре фермента связан с имидазольными кольцами остатков гистидина в 94,96 и 119 положениях) (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
74
Ферменты. Кинетика ферментативного катализа Глава 5
Рис. 5.4. Место разрыва полинуклеотидных цепей ДНК рестриктазой EcoRV. А — Последовательности оснований цепей ДНК, имеющих ось вращения (точка между цепями), являющиеся мишенью для действия фермента. Б — инвертированные последовательности цепей ДНК (палиндромы) являются местом атаки рестриктаз (Berg J. М., Tymoczko J. L, Stryer L., с изм.).
ет активному центру фермента перенести фосфорильную группу без гидролитического расщепления нуклеозидтрифосфата.
Вторая стадия лимитирует скорость всего катализа. Скорость катализируемого процесса очень чувствительна к величине энергии активации. Ее изменение, соответствующее образованию всего одной водородной связи, может ускорить реакцию в миллион раз.
На этой стадии возможно разделение реакции на 2—3 этапа, каждый из которых требует меньшей энергии активации, чем если бы процесс осуществлялся в один этап. При такой разбивке суммарная энергия активации будет такой же как и при одноэтапном процессе, но энергетический барьер будет уменьшен. В результате всех механизмов второй стадии катализа скорость реакции может увеличиться до 10'° раз.
/// стадия — отделение продукта реакции от фермента: ЕР -* Е+Р.
Стадия непродолжительна и определяется скоростью диффузии продуктов реакции в окружающую среду. Фермент освобождается без изменений. Суммарное повышение скорости катализируемой реакции может достигать 10 й—1016 раз.
Кинетика ферментативных реакций
Основная функция ферментов заключается в повышении скорости химических реакций в соответствии с потребностями живого организма. Для понимания функционирования ферментов изучают кинетику их действия.
В 1913 г. Леонор Михаэлис и Мауд Ментен предложили простую модель расчета кинетических характеристик катализируемых ферментами реакций. По их представлениям для ферментативного катализа необходимо введение понятия фермент-субстратного комплекса (ES). Скорость ферментативных
75
Глава 5 Ферменты. Кинетика ферментативного катализа
реакций зависит от концентрации фермента, субстрата, температуры, pH, наличия активаторов и ингибиторов.
Зависимость скорости реакции от концентрации фермента
В условиях избытка субстрата скорость реакции прямо пропорциональна концентрации фермента (рис. 5.5).
Рис. 5.5. Зависимость скорости реакции от концентрации фермента.
Зависимость скорости реакции от концентрации субстрата
Зависимость скорости реакции от концентрации субстрата представлена на рис. 5.6. А — в координатах V (скорость реакции) и [S] (концентрация субстрата) согласно уравнения Михаэ-лиса-Ментен; Б — в координатах обратных величин (1/V и 1/[S]) согласно уравнения Лайнуивера-Бэрка.
На гиперболической кривой графика А выделяют три участка. При низкой концентрации субстрата (участок а) скорость реакции прямо пропорциональна концентрации субстрата и подчиняется кинетике первого порядка. На участке b (реакция смешанного порядка) эта зависимость нарушается. На участке с скорость реакции максимальна и не зависит от концентрации субстрата.
Ферментативная реакция характеризуется формированием фермент-субстратного комплекса [ES], который распадается с образованием свободного фермента и продукта реакции.
Рис. 5.6. Зависимость скорости реакции от концентрации субстрата.
76
Ферменты. Кинетика ферментативного катализа Глава 5
В этом уравнении к, — константа скорости образования фермент-субстратного комплекса, к2 — константа диссоциации фермент-субстратного комплекса с образованием свободного фермента и субстрата и к. — константа скорости диссоциации фермент-субстратного комплекса до свободного фермента и продукта реакции.
Л. Михаэлис и М. Ментен предложили уравнение, которое описывает зависимость скорости реакции от концентрации субстрата.
Vmax x[S] v =------или
Ks+[S]
Vmax
[SI
где: v — скорость реакции при данной концентрации субстрата; Ks—константа диссоциации фермент-субстратного комплекса; Vmax — максимальная скорость реакции.
Ks=k2/k1 т. е. отношение константы обратной реакции к константе прямой реакции.
Однако данное уравнение описывает только участок а на гиперболической кривой графика А и не учитывает влияния на скорость ферментативного процесса продуктов реакции.
Математическая обработка кривой превращения субстрата в продукт реакции дает значение константы Михаэлиса (Кт):
k, + k, Km=^—-k.
Холдейн и Бриггс заменили в уравнении константу диссоциации на константу Михаэлиса.
Vmax v--------или
Km+[S]
Vmax
V"r“Km
1 [SI
Константа Михаэлиса имеет два определения.
1. Величина Кт равна концентрации субстрата [S], при которой половина мест связывания в активном центре фермента заполнена субстратом. Или, Кт численно равна концентрации субстрата [S], при которой скорость реакции равна половине максимальной. Для ряда ферментов установлено, что величина Кт близка к концентрации субстрата in vivo. Если величина Кт известна, то можно рассчитать количество мест связывания для субстрата
(fES): fES = V/Vmax = [S]/[S]+Km
Такой подход можно использовать при анализе других взаимодействий между молекулами и лигандами, характеризующихся гиперболической зависимостью (эффект насыщения мест связывания). 2. Величина Кт соответствует константе диссоциации фермент-субстратного комплекса (ES), если к3 « к2. В этих условиях Кт характеризует прочность ES комплекса (аффинность, сродство субстрата к ферменту): высокое значение Кт свидетельствует о слабом связывании субстрата с активным центром фермента, низкое значение Кт указывает на сильное связывание (высокое сродство субстрата к ферменту). Поскольку ситуация, когда к3 « к2 не характерна для большинства ферментов, утверждение о характере сродства субстрата к ферменту должно быть экспериментально доказано.
Использование графика, предложенного Михаэлисом и Ментен, не позволяет точно определить величины Vmax и Кт. Для более удобного графического представления Г. Лайнуивер и Д. Бэрк преобразовали уравнение Холдейна и Бриггса по методу двойных обратных величин.
1 Кт 1 1
_ =-----X --+------
v Vmax [S] Vmax
Vmax зависит от константы к3 (ккат) и общей концентрации фермента. Ки
77
Глава 5 Ферменты. Кинетика ферментативного катализа
нетическая константа ккат, называемая числом оборотов, отражает количество молекул субстрата, превращенных в продукт за единицу времени простым активным центром фермента, полностью насыщенным субстратом. Число оборотов большинства ферментов от 1 до 104 за секунду. Величина отношения £Аот/Лю используется для оценки эффективности фермента.
Аллостерические ферменты не подчиняются кинетике Михаэлиса-Ментен. У таких ферментов зависимость начальной скорости от концентрации субстрата носит S-образную (сигмоидную) форму. Для аллостерических ферментов полунасыщающую концентрацию субстрата обозначают не Кт, а
Физиологические концентрации субстратов обычно близки к величинам Кт и So5. Небольшие изменения величин полунасыщающих концентраций субстратов сопровождаются большими изменениями в мощности катализа.
Зависимость скорости реакции от pH среды
Графическое изображение зависимости скорости реакции от величины pH имеет
колоколообразную форму (рис. 5.7А). Значение pH, при котором фермент проявляет максимальную активность, называется оптимумом pH. Для большинства ферментов оптимум pH равен 6~8. Исключение составляет пепсин, оптимум которого равен 1,5—2,0. При изменении pH в ту или другую сторону от оптимума скорость реакции уменьшается, вследствие ионизации функциональных групп фермента и субстрата, что нарушает образование фермент-суб-стратного комплекса.
Зависимость скорости реакции от температуры
Скорость химической реакции повышается в 2 раза при повышении температуры на 10°С. Однако вследствие белковой природы фермента при дальнейшем повышении температуры наступает денатурация фермента. Температура, при которой скорость реакции максимальна, называется температурным оптимумом (рис. 5.7Б). Для большинства ферментов оптимум температуры составляет 37—40°С. Некоторые ферменты термостабильны. Например, миокиназа мышц, которая выдерживает нагревание до 100°С.
Рис. 5.7. Зависимость скорости реакции от pH (А) и температуры (Б).
78
Ферменты. Кинетика ферментативного катализа Глава S
Ключевое значение для широкого распространения метода полимеразной цепной реакции (ПЦР) в медицине и биологии имеет использование термостабильного фермента ДНК-полимеразы, полученной из термофильных бактерий (см. лекция 24).
Управляемое изменение свойств ферментов
Рассмотрим некоторые подходы к управляемой модификации свойств белков-ферментов:
L Повышение термостабильности белковой молекулы за счет введения дополнительных дисульфидных связей делает ее более технологичной (длительность использования, устойчивость к действию органических растворителей, экстремальных значений pH и др.). Рассмотрим эффективность получения термостабильной мутантной ксиланазы Bacillus circuIans — фермента, который можно использовать при производстве бумаги. Одним из этапов этого процесса является удаление гемицеллюлозы из пульпы с целью ее отбеливания. При этом образуются большие количества токсических отходов. Обработка дре -весной массы ксиланазой позволяет использовать меньше отбеливающих химикатов. К сожалению, перед добавлением фермента пульпу обрабатывают горячей щелочью. Поэтому ксиланаза должна оставаться активной при относительно высоких температурах. Для модификации белка-фермента был вначале использован метод компьютерного моделирования пространственной структуры ксиланазы. В результате были получены восемь производных ксиланазы. Все они обладали более высокой термостабильностью, чем нативный фермент; три сохраняли активность при 60°С. Одно из производных ксиланазы, содержащее дисульфидную связь между концевыми аминокислотами, оказалось в два раза более активным и сохраняло свыше 85 % активности после 120-минутного прогревания при 60°С.
2. Замена аспарагина на другие аминокислоты. Известно, что при высоких температурах остатки аспарагина и глутамина могут дезамидироваться, в результате чего конформация полипеп-твдной цепи изменяется. Это является причиной изменения функциональной активности белка. Рассмотрим роль этих остатков на примере три-озофосфатизомеразы Saccharomyces cerevisiae. Этот фермент состоит из двух идентичных субъединиц, каждая из которых содержит два остатка аспарагина. При помощи слитонуклеотцд-направ-ленного мутагенеза были заменены остатки аспарагина в положениях 14 и 78. Замена одного из них на остаток треонина или изолейцина приводила к повышению термостабильности фермента, на аспарагиновую кислоту — к понижению. Фермент, получающийся при замене обоих остатков, оказался нестабильным при нормальной температуре. Кроме того, была выявлена положительная корреляционная зависимость между термостабильностью полученных форм фермента и его устойчивостью к протеолизу. Следовательно, одним из путей к повышению термостабильности ферментов, используемых в промышленных технологиях, является замена некоторых остатков аспарагина на другие остатки аминокислот.
3. Уменьшение числа свободных сульфгидрильных групп. При синтезе в клетках Е. coli человеческого p-интерферона установлено, что белковый продукт обладал в 10 раз более низкой противовирусной активностью из-за возможности образования димеров. Оказалось, что остатки цистеина в 17 положении молекулы участвуют в образовании дисульфидных связей, что ведет к созданию олигомерных форм с низкой противовирусной активностью. После замены цистеина в 17 положении на серин был получен рекомбинантный интерферон сер-17-интерферон-p, не отличимый по активности от естественного. Этот интерферон был более стабильным при хранении, чем природный. Таким образом, с помощью направленного мутагенеза можно повышать стабильность ферментов.
4. Повышение ферментативной активности возможно осуществлять также с помощью направленного мутагенеза. Для этого необходимо иметь представление о третичной структуре области активного центра фермента. С помощью компьютерного моделирования подбирается вариант замен аминокислотных остатков, который может дать повышение активности фермента. Затем вносятся изменения в
79
Глава 5 Ферменты. Кинетика ферментативного катализа
клонированный ген и получают фермент — продукт его функционирования с заданным повышением активности. Реальные исследования были проведены с использованием тиро-зил-тРН К-синтетазой.
5. Изменение потребности ферментов в кофак-торах-металлах. Промышленное использование металлозависимых ферментов ограничено применением различных, необходимых по технологии, хелатирующих агентов (агентов, связывающих металлы). Так, сериновые протеиназы субтилизины требуют присутствия кальция и служат как биодеградируемые детергенты. Однако, используемые в технологическом процессе хелатирующие вещества быстро инактивируют субтилизины. Для решения этой проблемы методом олигонуклеотид-направлен-ного мутагенеза был создан мутантный ген, в котором отсутствовал участок, кодирующий калыщйсвязывающий домен белка-субтилизи-на. Мутантный субтилизин обладал той же ферментативной активностью и не боялся хелатирующих агентов, т. е. оказался более устойчивым, чем естественный фермент.
6. Изменение специфичности фермента с помощью олигонуклеотид-направленного мутагенеза. Это направление генной инженерии нашло наиболее эффективное применение в создании ферментов, обладающих специфичной рестриктазной активностью.
7. Повышение стабильности и специфичности фермента. Фермент активатор тканевого
плазминогена (tPA) используется в клинике для растворения тромбов. Однако он быстро выводится из кровеносного русла. Для . клиники необходимо создать фермент, обладающий тремя эффектами: 1) долговременным пребыванием в кровеносном русле; 2) высоким сродством к фибрину в тромбах; 3) не вызывать кровотечения. Белок с такими свойствами был создан путем внесения специфических мутаций в ген естественного tPA. При экспрессии этого мутантного гена был получен фермент, сохраняющийся в крови в 10 раз дольше, с повышенным сродством к фибрину и сохраненной фибринолитической активностью.
Таким образом, технологии генной инженерии позволяют придавать новые свойства существующим белкам и создавать новые белки-ферменты с уникальными свойствами. Многие из таких разработок еще не вышли из стадии экспериментальных исследований, дороги и требуют специального оборудования и высоко профессионального персонала. Однако, бурное развитие молекулярной биотехнологии делает эти; подходы реальными для воплощения в практическую деятельность промышленности, медицины, ветеринарии и фармации в ближайшие годы.
80
Глава 6
Регуляция и оценка активности ферментов
Главным в регуляции жизнедеятельности клетки является ее способность адаптировать активность ферментов к изменяющимся условиям внутренней и знешней среды. Скорость биохимических реакций внутри организма регулируется поступлением питательных веществ и потребностями в метаболитах тля деления, роста и функционирования <леток.
Активность ферментов в клетке мо-кет регулироваться двумя основными глтями: 1) присоединением эффекторных молекул, которые повышают или понижают активность ферментов и 2) путем ковалентной модификации ферментов (фосфорилирование, ацетилирование, метилирование). Регуляция активности ферментов путем связывания эффекторных молекул является универсальным и основным механизмом контроля метаболической активности клеток. Эффекторными молекулами являются низкомолекулярные органические молекулы, ионы металлов и белки. Связываясь со специфическими ферментами эффекторы активиру
ют или ингибируют ферментативную активность.
Активаторы
Активаторы ферментов — это вещества, 1) формирующие активный центр фермента (Со2+, Mg2+, Zn2+, Fe2+, Са2+); 2) облегчающие образование фермент-субстратного комплекса (Mg2+); 3) восстанавливающие SH-группы (глутатион, цистеин, меркаптоэтанол); 4) стабилизирующие нативную структуру белка-фермента. Активируют ферментативные реакции обычно катионы (в таблице Менделеева с 19 по 30). Анионы менее активны, хотя ионы хлора и анионы некоторых других галогенов могут активировать пепсин, амилазу, аденилат-циклазу. Активаторами могут быть белки: апопротеин A-I (лецитин-холестеролацилтрансфераза — ЛХАТ), апопротеин С-II (липопротеинлипаза — Л ПЛ), вторичные внутриклеточные посредники (табл. 6.1).
- Згк. 2124
81
Глава 6 Регуляция и опенка активности ферментов
Таблица 6.1. Активаторы сериновых (треониновых) протеинкиназ (D. Fell, 1997)
Вторичный мессенджер Фермент
Циклические нуклеотиды цАМФ-зависимая протеинкиназа цГМФ-зависимая протеинкиназа
Ионы кальция и кальмодулин Са2+-кальмодулин-протеинкиназа Киназа фосфорилазы или киназа 2 гликогенеинтазы
АМФ АМФ-активируемая киназа
Диацилглицерол Протеинкиназа С
Ингибиторы
Ингибиторы ферментов — это соединения, которые взаимодействуя с ферментом, препятствуют образованию нормального фермент-субстратного комплекса, уменьшая тем самым скорость реакции или прекращая ее.
Ингибиторы делят на две группы — неспецифические и специфические. Неспецифические ингибиторы вызывают денатурацию белка-фермента (соли тяжелых металлов, кислоты, щелочи и др.) и их действие не связано с механизмами ферментативного катализа. Действие специфических ингибиторов связано с механизмами ферментативного катализа. Специфические ингибиторы делятся на 2 группы: необратимые и обратимые.
При необратимом ингибировании происходит непрерывная модификация молекул фермента, в результате чего фермент частично или полностью теряет свою активность. Такое действие оказывают вещества, которые прочно и необратимо связывают функциональные группы активного центра или препятствуют изменению валентности металла активного центра. К ним относятся: 1. Ингибиторы металлосодержащих ферментов (HCN, RCN, HF, СО и др.). Эти соединения связываются с металлами с переменной валентностью (Си или Fe), в результате чего нарушается процесс переноса электронов по дыха
тельной цепи ферментов. Поэтому эти ингибиторы называются дыхательными ядами.
2. Ингибиторы ферментов, содержащих SH-группу в активном центре (монойодацетат, дийодацетат, йодацетамид, соединения мышьяка и ртути).
3. Ингибиторы ферментов, содержащих ОН-группу в активном центре (фосфороорганические соединения, инсектициды). Эти ингибиторы тормозят, прежде всего, активность холинэстеразы — фермента, играющего первостепенную роль в деятельности нервной системы.
Обратимое ингибирование поддается количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимые ингибиторы делятся на конкурентные и неконкурентные.
Конкурентные ингибиторы ~ это молекулы, настолько похожие на молекулы субстратов реакций, что ферменты «не могут их различить». В результате связывания конкурентного ингибитора с активным центром фермента уменьшается количество истинных фермент-субстратных комплексов и падает скорость катализируемой реакции. Классическим примером конкурентного ингибирования является торможение сукцинатдегидрогеназы малоновой кислотой. Сукцинатдегидрогеназа катализирует окисление янтарной кислоты (сукцината) путем дегидрирования в фумаровую кислоту (рис. 6.1).
82
Регуляция и оценка активности ферментов Глава 6
СОО' СОСГ
СН2 НС СОО’
। --------► и JL
СН2 СН ?н2
I I I
СОО’ СОО- СОО’
Малонат-ингибитор
Сукцинат Фумарат
Рис. 6.1. Малонат-ингибитор сукцинатдегидрогеназной реакции.
Рис. 6.2. Влияние конкурентных ингибиторов на скорость ферментативной реакции.
Если в среду добавить малонат (ингибитор), то в результате структурного сходства с истинным субстратом — сукцинатом он будет реагировать с активным центром и образовывать фермент-ингибиторный комплекс, который не может подвергаться дальнейшим превращениям. Связывание конкурентного ингибитора не приводит к повреждению структуры активного центра фермента. Действие такого ингибитора устраняется путем увеличения концентрации субстрата. Таким образом, конкурентный ингибитор дает эффект «разбавления» субстрата. Поэтому при конкурентном ингибировании увеличивается значение Кт (концентрация субстрата, при кото
рой скорость реакции равна половине максимальной), но величина Утах остается постоянной (рис. 6.2).
Метод конкурентного ингибирования нашел применение в медицинской практике в виде использования антиметаболитов. Многие лекарственные вещества ингибируют ферменты человека и животных по конкурентному типу. Примером являются сульфаниламидные препараты, которые имеют структурное сходство с парааминобензой-ной кислотой (ПАБК) (рис. 6.3).
83
Глава 6 Регуляция и оценка активности ферментов
Бактериальная клетка использует ПАБК для синтеза фолиевой кислоты, необходимой для образования нуклеиновых кислот. Благодаря структурному сходству сульфаниламид ингибирует ферменты метаболизма парааминобензойной кислоты, что приводит к снижению синтеза фолиевой кислоты, нуклеиновых кислот и гибели микроорганизма.
Неконкурентные ингибиторы — вещества, не имеющие структурного сходства с субстратами. Неконкурентные ингибиторы связываются не с активным центром, а в другом месте молекулы фермента, в том числе и в области аллостерического центра. Обратимые неконкурентные ингибиторы понижают
Vmax за счет уменьшения количества действующих молекул фермента. Ингибиторы этого типа не мешают связыванию субстрата с активным центром сохранившихся молекул фермента, в результате величина Кт не меняется. Механизм ингибирования состоит в снижении скорости реакции за счет уменьшения количества нормальных фермент-субстратных комплексов. Таким образом, при неконкурентном ингибировании: Vmax уменьшается, а Кт не изменяется (рис. 6.4).
Чаще встречается смешанный тип ингибирования, когда снижение Vmax сочетается с одновременным увеличением Кт. Это означает: при соединении ин
84
Регуляция и оценка активности ферментов Глава 6
гибитора с ферментом сохраняется возможность последующего присоединения субстрата с образованием тройного комплекса, что обеспечивает медленное превращение в продукт реакции.
В редких случаях возможно бесконкурентное ингибирование, обнаруживаемое при повышении концентрации субстрата. Один из возможных механизмов этого эффекта связан с соединением ингибитора с фермент-субстратным комплексом, что ведет к образованию неактивного или медленно реагирующего тройного комплекса.
Специфическую группу ингибиторов ферментов составляют ингибиторы белковой природы. Они блокируют действие фермента за счет белок-белковых взаимодействий, в результате чего закрывается активный центр фермента. Особенно энергично белковые ингибиторы регулируют деятельность протеиназ клетки, поскольку в результате их действия тормозится переход проферментов в ферменты, отщепление сигнальных пептидов и других пептидных фрагментов при созревании белков, блокируются реакции протеолиза, ведущие к образованию биологически активных пептидов.
Активация проферментов
Происходит путем отщепления части полипептидной цепи от молекулы предшественника с образованием активного центра фермента. Этот путь характерен для агрессивных протеолитических ферментов, которые синтезируются в неактивной форме (проферменты) в желудке и поджелудочной железе и участвуют в переваривании белков. Синтез в виде проферментов исключает са-мопереваривание органов. Например, в поджелудочной железе вырабатывается химотрипсиноген. В кишечнике под
действием трипсина происходит последовательно отщепление 2-х дипептидов, и образуются три полипептидныс цепи, соединенные дисульфидным мостиками. Это изменяет конформацию молекулы и формирует ее активный центр, в состав которого входит серин, гистидин и аспарагиновая кислота.
Специфический частичный протеолиз является распространенным способом активации ферментов и других белков в биологических системах. Рассмотрим некоторые примеры.
1. Свертывание крови является каскадом протеолитических реакций, обеспечивающим быстрый и усиленный ответ на повреждение тканей и кровеносных сосудов (см. «Свертывание крови»).
2. Многие гормоны пептидной природы синтезируются в виде предшественников (проинсулин, проопиомеланокор-тин), после частичного протеолиза которых образуются гормоны.
3. Нерастворимые в воде фибриллы коллагена возникают после частичного протеолиза водорастворимого проколлагена.
4. Запрограммированная гибель клеток — апоптоз опосредуется протеолитическими ферментами каспазами, которые синтезируются в виде прокаспаз.
Свертывание крови
Свертывание крови является каскадным процессом, благодаря которому на каждом этапе усиливается образование факторов свертывания крови (рис 6.5).
На примере свертывания крови наиболее отчетливо видна регуляторная роль частичного протеолиза ферментов-предшественников.
В биохимическом отношении наиболее интересной является стадия превращения фибриногена в фибрин под действием протеолитического фермента тромбина.
85
Глава 6 Регуляция и опенка активности ферментов
ВНУТРЕННИЙ ПУТЬ
Поврежденная поверхность
I
Кининоген
Поперечно сшитый фибриновый сгусток
Рис. 6.5. Каскад свертывания крови. Образование фибринового сгустка — это конечный этап внешнего, внутреннего и общего путей свертывания крови. Внутренний путь начинается с активации фактора XII (фактор Хагемана) при контакте крови с поврежденной поверхностью. Внешний путь запускается травмой, которая активирует фактор VII и освобождает липопротеин, называемый тканевым фактором, из стенок сосудов. Неактивные формы факторов свертывания’без подстрочных индексов; их активные формы с индексом «а». Суть процесса в последовательной активации факторов свертывания крови (Berg J. М., Tymoczko J. L, Stryer L., с изм.).
86
Регуляция и оценка активности ферментов Глава 6
Места разрыва пептидных связей
Рис. 6.6. Строение протромбина. После разрыва двух пептидных связей образуется тромбин. Все у-карбоксиглутаматные остатки относятся к gla-домену.
1. Тромбин синтезируется в виде профермента протромбина, который включает четыре больших домена. Первый домен называется gla-домен, 2 и 3 домены обозначают как kringle-домены и четвертый домен серин-протеиназа на С-конце (рис. 6.6).
Эти домены сохраняют протромбин в неактивном состоянии и обеспечивают его активацию либо фактором Ха (сериновая протеиназа) или фактором Va (стимулирующий белок). Активация происходит при протеолитическом расщеплении пептидной связи арг(274)-тре(275), что приводит к высвобождению фрагмента, содержащего первые три домена и после разрыва пептидной связи арг(323)-иле(324) образуется активный тромбин.
2. Витамин К необходим для синтеза протромбина, а также еще трех факторов свертывания в крови. Поэтому при его дефиците возникает кровоточивость. Антагонистом витамина К являются дикумаролы и препарат варфарин (рис. 6.7).
Первые 10 остатков глутамата на N-конце протромбина карбоксилируются в у-карбокси-глутамат с помощью витамин К-зависимой карбоксилазы. В результате происходит превращение слабого хелататора ионов кальция глутамата в сильный хелататор — у-карбоксиглутамат (рис. 6.8).
3. Связывание кальция с протромбином прикрепляет этот профермент к фосфолипидной мембране в области повреждения (тромбоциты) и тем самым приближает его к активирующим факторам Ха или Va. Такое превращение протромбина в тромбин сопровождается удалением кальций-связывающего домена и освобождает тромбин для расщепления фибриногена.
4. Фибриноген является глобулярным белком с молекулярной массой 340 кДа, состоящий из шести цепей 2Аа, 2Вр и 2у. Тромбин расщепляет четыре аргинин-глициновые пептидные связи в центре глобулярной области фибриногена. В результате отщепляется по 18 остатков аминокислот от каждой Аа-цепи и по 20 остатков аминокислот от каждой Bp-цепи. Эти А и В пептиды называют фибринопептидами. Молекула фибриногена, лишенная этих пептидов.
87
Глава 6 Регуляция и оценка активности ферментов
Рис. 6.8. Кальцийсвязывающая область протромбина. Протромбин связывает ионы кальция с помощью остатков у-карбоксиглутамата (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
называется фибрин мономер и имеет субъединичную структуру (ару)2. Фибрин мономер спонтанно организуется в фибриллярную структуру, называемую фибрин. Гомологичные р и у цепи имеют на С-конце глобулярные домены с местами связывания в виде углубления (домен p-цепи связывается с H3N+-гли-гис-арг, а домен у-цепи с Н3К+-гли-про-арг). Именно эти последовательности находятся на N-концах а и р цепей после действия тромбина. Фибрин является Периодической структурой с повторами через каждые 23 нм (рис. 6.9).
5. Образованный сгусток стабилизируется благодаря образованию поперечных амидных связей между радикалами лизина и глутамина. Эта реакция катализируется ферментом трансглутаминаза {фактор ХИ 1а), который активируется из ферментного предшественника про-трансглутаминазы тромбином.
При классической гемофилии А отсутствует или имеет сниженную активность фактор VIII (анти гемофильный фактор) внутреннего пути свертывания крови. Этот фактор не является протеолитическим ферментом, но через сериновую протеиназу фактор 1Ха активирует фактор X, играющий важную роль в активации общего пути свертывания крови. Для лечения этого наследуемого заболевания используют рекомбинантный фактор VIII.
Химическая (ковалентная) модификация
Заключается в присоединении к ферменту или отщеплении от него низ-
88
Регуляция и оценка активности ферментов Глава 6
— j Фибринопептиды
гли-про-арг последовательности
эис. 6.9. Формирование фибринового сгустка. 1. Тромбин разрывает фибринопептиды А и В
= центральной глобуле фибриногена. 2. Глобулярные домены с С-конца р и у цепей взаимодействуют с выступающими группами на N-конце аир цепей с образованием сгустка (фиб-:.*новой сети) (Berg J. М., Tymoczko J. L., Stryer L, с изм.).
чомолекулярной молекулы, при котором происходит активация или ингибирование фермента. Например, фермент, участвующий в синтезе гликогена — гликогенсинтаза — при присоединении фосфорной кислоты становится неактивным, а фермент распада гликогена — фосфорилаза — активным.
Фосфорилирование-дефосфорилирова--:ие является наиболее эффективным способом контроля активности белков по следующим причинам:
1. Фосфорильные группы приносят два отрицательных заряда в молекулу белка, что изменяет характер электростатических взаимодействий (например, изменяется связывание субстрата и каталитическая активность).
2. Фосфатная группа может участвовать в образовании трех или более водородных связей. Тетраэдрическая геометрия фосфорильной группы делает водородные связи строго направленными, что важно для межмолекулярных отношений.
3. Величина свободной энергии фосфорилирования белков достаточно высока: в макроэргической связи АТФ имеется -12 ккал/моль (-50 кДж/моль). Примерно половина тратится на фосфорилирование, а вторая половина депонируется в фосфорилированном белке. Такое фосфорилирование может изменить конформационное равновесие между двумя состояниями белка в 10э 4 раз.
4. Фосфорилирование-дефосфорилирование занимает примерно секунду, что по скорости увязывается с физиологическими процессами.
5. Фосфорилирование носит, как правило, каскадный характер с увеличением концентрации продукта на каждом этапе в 10 или более раз (амплифика-ционный эффект фосфорилирования).
6. АТФ является энергетической валютой клетки. Фосфор освобождается в прямой реакции АТФ ♦—► АДФ + Рн; фосфор потребляется в обратной реакции. Следовательно, процесс фосфорилирования-де-фосфорилирования белков связан с концентрацией Рн и регуляцией метаболизма.
89
Глава 6 Регуляция и оценка активности ферментов
Таблица 6,2. Примеры белков, активность которых изменяется при ковалентной модификации
Модификация Молекула —донор модифицирующей группы Модифицируемый белок Функция белка
Фосфорил и рован ие АТФ Гликогенфосфорилаза Распад гликогена
Ацетилирование Ацетил-КоА Г ИСТОНЫ Упаковка ДНК; транскрипция
Миристоиляция Миристоил-КоА Src (онкоген) Передача сигнала
АДФ-рибозилирование НАД РНК-полимераза Транскрипция
Фарнезиляция Фарнезил пирофосфат Ras (онкоген) Передача сигнала
Гамма-карбоксилирование нсо3- Тромбин Свертывание крови
Сульфатирование З’-Фосфоаденозил-б’-фосфосульфат Фибриноген Образование сгустка крови
Убиквитинация Убиквитин Циклин Контроль клеточного цикла
Виды ковалентной модификации ферментов представлены в табл. 6.2.
Аллостерическая регуляция
Происходит путем присоединения к аллостерическому центру фермента эффекторов — активаторов и ингибиторов. Если в роли активатора выступают молекулы субстрата — гомот-ропная активация, если какой-то другой метаболит — гетеротропная. Для аллостерических ферментов кривая насыщения субстратом представляет собой сигмоидную кривую, а не гиперболу как для нерегуляторных ферментов.
Для аллостерической регуляции характерны следующие признаки:
1. Аллостерические ферменты состоят из 2-х или более, часто симметричных, субъединиц, т. е. имеют четвертичную структуру.
2. Субъединицы фермента могут находиться в 2-х конформациях: R и Т.
Конформация R (relax — расслабление) обладает высоким сродством к субстрату, конформация Т (tense — напряжение) — низким сродством. Формы R и Т могут переходить друг в друга.
3. Эффекторы связываются с Т и R-конформациями фермента. Аллостерический ингибитор связывается преимущественно с Т-конформацией и ее стабилизирует. В присутствии ингибитора большая часть молекул находятся в Т-конформации, что снижает сродство фермента к субстрату. Аллостерический активатор связывается преимущественно с R-конформацией.
4. Субъединицы аллостерических ферментов связаны между собой нековалентными связями. Изменение конформации одной субъединицы приводит к изменению конформации соседних субъединиц (кооперативный эффект).
Предложено 2 модели кооперативного эффекта.
Симметричная модель', субъединицы должны находиться в одном и том же конформационном состоянии, т. е. воз-
90
Регуляция и оценка активности ферментов Глава 6
чложны состояния RR и ТТ и невозможно состояние RT. В отсутствие субстрата почти все молекулы фермента находятся 5 Т-конформации. Добавление субстрата приводит к переходу Т-конформации з R-конформации одновременно всех субъединиц.
Последовательная модель. Согласно этой модели каждая субъединица может существовать в одном из возможных конформационных состояний (R или Т). Связывание субстрата с одной субъединицей может вызвать последовательное изменение конформации соседней субъединицы или соседних субъединиц и в результате увеличивать (положительная кооперативность) или уменьшать (отрицательная кооперативность) их сродство к субстрату (рис. 6.10).
Регуляция активности по принципу обратной связи (ретроингибирование)
Во многих биосинтетических процессах основным типом регуляции скорости многоступенчатого процесса является ингибирование по принципу обратной связи, когда конечный продукт связывается с активным центром фермента и ингибирует его. Такие ферменты называются ключевыми, находятся на первых этапах метаболического пути и определяют скорость всего процесса.
E-i Е2 Ех Еп
А---> В - > Y—> Z
Например, фермент аспартат-транс-карбамоилаза осуществляет первый этап синтеза пиримидиновых нуклеотидов и ингибируется продуктом этого биосинтеза цитидинтрифосфатом (ЦТФ) по принципу обратной связи.
Активация предшественником (форак-тивация) — первый метаболит в многоступенчатом процессе активирует фермент, катализирующий первую или последнюю стадию.
Единицы измерения активности ферментов
Для выражения концентрации фер-мента используют стандартную международную единицу и катал.
Стандартная международная единица (Е или U) — количество фермента, которое в оптимальных усло-
Рис. 6.10. Простая модель для тетрамерного аллостерического белка. Связывание лиганда (L) z одной субъединицей изменяет ее конформацию из Т (напряженная, квадрат) в R (расслабленная, способная связывать лиганд, окружность). Это повышает эффективность связывания лиганда другими субъединицами белка.
91
Глава 6 Регуляция и оценка активности ферментов
виях катализирует превращение 1 мкмоль субстрата в минуту (мкмоль/мин).
Ферменты применяются в медицине
Катал — количество фермента, которое в оптимальных условиях катализирует превращение 1 моль субстрата в секунду (моль/с). 1 Е фермента соответствует 16,67 нкат; 1 кат - 6x107 Е
Для выражения активности фермента используют удельную и молярную активности.
Удельная активность — число единиц ферментативной активности на 1 мг ферментативного белка.
Молярная активность (число оборотов) — число молекул субстрата, подвергающихся превращению одной молекулой фермента в секунду (табл. 6.4).
Применение ферментов
Ферменты в течение многих лет применяются в различных областях практической деятельности человека: в кожевенной, пищевой, текстильной, фармацевтической и других отраслях промышленности, а также в медицине, сельском хозяйстве, химическом синтезе. Эффективность действия ферментов многократно выше по сравнению с химическими катализаторами, однако их промышленное применение затруднено из-за неустойчивости при хранении и температурных воздействиях.
Энзимодиагностика
Энзимодиагностика — исследование ферментов в биологических средах организма с диагностической целью.
Нормальные уровни активности ферментов в сыворотке крови отражают соотношение между биосинтезом и высвобождением ферментов (при обычном обновлении клеток), а также их клиренсом из кровотока. Повышение скорости обновления ферментов, повреждения клеток или индуцирование синтеза обычно приводят к повышению активности ферментов в сыворотке крови. В сыворотке крови выделяют три группы ферментов: клеточные, секреторные и экскреторные.
Клеточные ферменты в зависимости от локализации в тканях делят на несколько групп:
1. Неспецифические ферменты, которые катализируют общие для всех тканей реакции обменов белков, углеводов, липидов и находятся в большинстве органов и тканей. При повреждении мембран клеток и гистогемати-ческих барьеров эти ферменты появляются в крови или повышается их количество. Определение повышенного количества этих ферментов в крови не позволяет локализовать патологический процесс.
2. Органоспецифические, или индикаторные, ферменты, специфичные только для определенного типа тканей. Как правило, эти ферменты катализируют реакции, обеспечивающие специфические функции органа. В клетках других органов этих ферментов нет или находят следы. Выход органоспецифических ферментов
Таблица 6.4. Взаимосвязь между числом оборотов и величиной Км
Фермент Субстрат Км (мкмоль) Число оборотов (с)
Лизоцим Г екса-N-ацетил гл юкозамин 6 0,5
Пенициллиназа Бензилпенициллин 50 2000
Карбоангидраза С02 8000 600000
92
Регуляция и оценка активности ферментов Глава 6
z кровь сигнализирует о поражении определенного органа.
3. Изоферменты — группа или семейство ферментов с четвертичной структурой, которые катализируют одну и ту же реакцию, но отличается по строению (т. е. первичной структуре) с'.тгьединиц и физико-химическим свойствам. Например, фермент лактатдегидрогеназа состоит из 4-х субъединиц 2-х типов: Н (от heart — сердце) и М (от muscle — мы ища). Возможно 5 зариантов, т. е. изоферментов (рис. 6.11).
В зависимости от физиологического состояния, возраста, особенностей среды обитания =. организме устанавливаются определенные соотношения изоферментов, что оптимизирует катализируемые превращения веществ. Следовательно, изменение соотношения изоферментов во всем организме или в отдельных тканях и органах является способом регуляции действия ферментов. Исследование множественных молекулярных форм ферментов и изоферментов используется в медицине для диагностики поврежденных тканей.
4. Ферменты, локализованные в органеллах клеток (окислительно-восстановительные в митохондриях; кислые гидролазы в лизосомах и др.), выходя в кровь, сигнализируют о глу-Фоком поражении клетки.
В сыворотке крови активность клеточных ферментов низкая или вообще отсутствует. При патологических процессах активность Ферментов этой группы в сыворотке крови зависит от скорости высвобождения из клеток, которая, в свою очередь, определяется скоростью и степенью повреждения клетки.
Секреторные ферменты (псевдохолинэстераза) поступают непосредственно в кровь и выполняют в ней специфические функции. Эти □ерменты синтезируются в печени и постоянно высвобождаются в кровь. Их активность в с ыворотке крови выше, чем в клетках или тканях. При нарушении функции печени их активность в сыворотке крови становится ниже нормы.
Экскреторные ферменты образуются органами пищеварительной системы (поджелудочной железой, слизистой оболочкой кишечника, печенью, эндотелием желчных путей). К ним относятся а-амилаза, щелочная фосфатаза. В норме их активность в сыворотке крови низкая и постоянная. Однако при патологии, когда блокирован любой из обычных путей экскреции, активность этих ферментов в сыворотке крови значительно увеличивается.
Для диагностики заболеваний используют также оценку эндогенных ингибиторов ферментов. В тканях и крови человека имеются ингибиторы протеолитических ферментов пептидной природы, например, панкреатический ингибитор трипсина (ингибирует трипсин) или al-антитрипсин плазмы крови (ингибирует эластазу, продуцируемую нейтрофилами при поглощении бактерий). Поэтому al-антитрипсин правильнее называть антиэластаза. Оба ингибитора блокируют действие ингибируемых ферментов путем присоединения в непосредственной близости от активных центров.
Заболевание легких эмфизема связана с наследственными дефектами ингибитора эластазы. Курение усиливает вероятность развития эмфиземы, поскольку происходит окисление метионина-358 в той части молекулы ингибитора эластазы, которая необходима для связывания активной формы фермента. Для лечения эмфиземы легких используют рекомбинантный al-антитрипсин (2 - 4 г), полученный генноинженерным путем с помощью эукариотических клеток — дрожжей.
Наследственные энзимопатии
Ряд пороков обмена веществ является результатом наследственного дефицита определенных ферментов. В этом случае диагноз ставится, главным образом, на основе исследования показателей обмена этих ферментативных реакций (биохимический диагноз).
1НННН 2НННМ ЭННЫМ 4НМММ 5 М М М М СЕРДЦЕ -----------------ЛЕГКИЕ ---------------------- ПЕЧЕНЬ
Рис. 6.11. Изоферменты лактатрегидрогеназы.
93
Глава 6 Регуляция и оценка активности ферментов
Энзимотерапия
Энзимотерапия — использование ферментов и метаболитов в качестве лечебных средств: 1) заместительная терапия ферментами используется при болезнях желудочно-кишечного тракта (пепсин, трипсин, химотрипсин, амилаза, липаза);
2) для очистки ран и воздействия на избыточно разрастающуюся соединительную ткань применяют гиалуронидазу, трипсин, химотрипсин;
3) нашли применение регуляторы (активаторы и ингибиторы) ферментов. Например, ингибиторы моноаминооксидазы используют при нервных и психических заболеваниях; тканевые ингибиторы протеиназ (трасилол, инип-рол, контрикал др.) эффективны при лечении панкреатита, энфиземы легких, инфаркте миокарда.
Ингибиторы протеолитических ферментов играют важную роль в медицине. Эти ингибиторы похожи по строению на истинные субстраты ферментов. Например, каптоприл является ингибитором металлопротеазы ангиотензин-превра!дающего фермента (АПФ, АСЕ) и используется для лечения артериальной гипертензии; криксиван является ингибитором HIV-протеазы и используется при лечении СПИДА (AIDS); ингибитор трипсина животного и растительного происхождения используют при лечении панкреатита.
Для пролонгированного действия используют иммобилизованные ферменты — это ферменты, связанные с твердым носителем или спрятанные в полимерную капсулу. При введении в кровь такие ферменты не разрушаются, а, накопившись в патологическом очаге (например, у тромба), оказывают эффект. Для получения иммобилизованных ферментов используют многочисленные носители различной природы. Носители должны быть устойчивы к воздействию химических и биологических факторов, иметь высокую проницаемость для ферментов и субстратов, а также переходить в активированное состояние. Органические полимерные носители разделяют на природные
и синтетические. К природным носителям относятся полисахариды, белки и липиды. Наиболее часто для иммобилизации на основе полисахаридов применяют агарозу, целлюлозу, декстран и их производные. Нередко для целей иммобилизации используют хитин. Белки как носители представляют наибольший интерес для медицины, однако они обладают высокой иммуногенностью и быстро деградируют при применении in vivo. Наиболее часто для иммобилизации ферментов применяют фибриллярные белки, например, кератин и коллаген.
Для транспорта ферментов наиболее эффективны капсулы из липидов — липосомы. Ферменты внутри липосом транспортируются через клеточные мембраны и оказывают действие в клетке.
К синтетическим полимерным носителям относятся полимеры на основе стирола, производные акриловой кислоты, а также полиамидные носители.
Ферменты как аналитические реагенты
Широко применяются в практике лабораторных исследований при определении субстратов, нуклеотидов и пр. В настоящее время выпускается ряд наборов для определения глюкозы, этанола, молочной кислоты, АТФ и пр. Принцип: в исследуемом материале содержится неизвестное количество субстрата. Чтобы определить его количество, вводят фермент, катализирующий превращение только этого субстрата, создают оптимальные условия реакции (pH, t° и др.) и регистрируют скорость реакции (по образованию продукта или изменению кофермента). Затем определяют концентрацию искомого субстрата по скорости реакции, используя калибровочный график.
94
Глава 7
Мембраны
Мембраны — это высокоорганизован-«е структуры, отграничивающие внут-7-е инее пространство клетки или ее от-.еков, построенные из белков, липидов углеводов.
Функции мембран
1. Отделяют клетки от окружающей геды. Обладают избирательной проницаемостью, содержат специфические г экспортные системы. Внутренние - ембраны клеток ограничивают орга--еллы и формируют обособленные «три клеточные отсеки — компарт--енты. Они обеспечивают функцио-- ильную специализацию клетки.
2. Мембраны играют центральную роль 1 системе межклеточных взаимодей-."зий. В них располагаются рецепторы, «принимающие химические, физичес-
и другие внешние сигналы. Неко-~?рые мембраны сами способны генери-г : вать сигнал (химический или .’.ектрический).
Мембраны участвуют в процессах гевращения энергии (фотосинтез, числительное фосфорилирование).
Структура мембран
Характеристика мембран
Все биологические мембраны имеют общие признаки строения.
1. Мембраны являются сложными структурами, построенными из липидов, белков и углеводов. Основу мембран составляет липидный бислой, имеющий толщину 6—10 нм.
2. Соотношение белков и липидов в мембранах варьирует от 1: 4 до 4:1 и зависит от типа клеток и органелл.
3. Мембраны являются асимметричной структурой с наружной и внутренней поверхностями.
4. Мембрана стабилизируется нековалентными связями и является термодинамически стабильной и метаболически активной.
5. Специфические белки встроены в мембраны и выполняют специфические функции рецепции управляющих сигналов, межклеточного взаимодействия, транспорта веществ и пр.
6. Мембраны — это жидкостные структуры.
95
Глава 7 Мембраны
Таблица 7.1. Структура глицерофосфолипидов
Глицерофосфолипид Спирт
Фосфатидилэтаноламин ho-ch2-ch2-nh2
Фосфатидилхолин HO-CH2-CH2-N+(CHs)3
Фосфатидил се рин ho-ch2-chnh2-cooh он он
Фосфатилилинозитол Ы “_ К” \н он/1 н _L< ОН ОН н сн2-он
Фосфатид и л гл и церол
НС—он сн2-он
Рис. 7.1. Строение глицерофосфолипидов. X — спирт.
7. Большинство мембран способны к поляризации (для внутренней поверхнос-ти мембран типично 60 мВ). Мембраны играют ключевую роль в транспорте, преобразовании энергии и хранении энергии.
Липиды мембран
Основными липидами мембран являются фосфолипиды, гликолипиды и холе-стерол.
1. В мембранах присутствуют 2 основных класса фосфолипидов'.
ХЛ.Глицерофосфолипиды являются основным компонентом большинства мембран и состоят из спирта глицерола, 2-х остатков жирных кислот, остатка фосфорной кислоты и спирта-. холина (фосфатидилхолин), этанола-мина (фосфатидилэтаноламин), серина (фосфатидилсерин), глицерола (фосфатидилглицерол), глицеролфос-фата, треонина или инозитола (рис. 7.1, табл. 7.1).
Жирные кислоты содержат четное число атомов углерода (чаще 16 и 18). Жирные кислоты неразветвленные и могут быть насыщенными (чаще в 1 положении глицерофосфолипида) и ненасыщенными (чаще во 2 положении глицерофосфолипида) .
Жирные кислоты — это углеводородные цепи различной длины и степени насыщенности, заканчивающиеся карбоксильной группой. Системное наименование происходит от родительского
96
Мембраны Глава 7
углеводорода с окончанием —овая. Например, С18 насыщенная жирная кислота называется октадекановая кислота, поскольку родительский углеводород — октадекан. С|8 ненасыщенная жирная кислота с одной двойной связью называется октадеценоевая кислота, с двумя двойными связями — октадекадиеновая кислота, а с тремя двойными связями — октадекатриеновая кислота. Запись 18:0 означает Ctg жирную кислоту без двойных связей; запись 18:2 означает, в жирной кислоте есть две двойные связи. Нумерация углеродных атомов начинается от карбоксильной группы. По другой классификации углеродные атомы 2 и 3 обозначают как аир углеродные атомы, соответственно. Наиболее отдаленный от карбоксильной группы концевой атом углерода называют со-углеродный атом. Положение двойной
(СНг)н I
u ю-атом углерода
Н cj-З двойная связь
Н
I
СОО“
Рис. 7.2. га-3 жирная кислота.
связи обозначают символом А. Например, цис-Д9 означает наличие двойной связи между 9 и 10 углеродными атомами.
В медицинской литературе часто обозначают положение двойной х связи по отношению к дистальному атому углерода, которому придается номер 1. Например, ш-З жирная кислота (рис. 7.2).
Жирные кислоты ионизированы при физиологическом значении pH, поэтому они получают суффикс -ат, например, пальмитат, олеат.
1.2. Сфингомиелины содержат спирт сфингозин. Жирная кислота присоединяется амидной связью к аминогруппе сфингозина. Первичная гидроксильная группа сфингозина эстерифицируется фосфорилхолином. Сфингомиелины находятся преимущественно в миелиновых оболочках (рис. 7.3).
2. Гликолипиды являются сахаросодержащими липидами и делятся на ганглиозиды и цереброзиды. Цереброзиды вместо фосфорилированного спирта содержат остаток гексозы (глюкозу или галактозу). Ганглиозиды содержат цепь из 3 и более остатков углеводов (например, сиаловые кислоты), которые присоединяются к первичной спиртовой группе сфингозина.
3. Стероиды. Основным стероидом в мембранах является холестерил (рис. 7.4),
СН3—(СН2)12—CH =СН—СНОН—СН—СН2"О—Р—О—СН2—СН2—М(СНз)3
О
R—СО—NH
Вст. 7.3. Сфингомиелин.
97
Глава 7 Мембраны
который находится преимущественно в плазматической мембране клеток.
Холестерол, в основном, встречается в наружном слое плазматической мембраны. Молекула холестерола встраивается в фосфолипидный бислой, причем гидроксильная группа в положении 3 образует водородные связи с полярными головками фосфолипидов, а сочлененные кольца палочкообразной формы располагаются в гидрофобной зоне ацильных остатков фосфолипидов бислоя.
Мембрана является амфипатической структурой
1. Все молекулы липидов, входящих в состав мембран, имеют гидрофильную
и гидрофобную области и поэтому являются амфипатическими.
2. Амфипатические липиды мембран имеют полярную головку и неполярные гидрофобные хвосты (рис. 7.5). Полярные головки нейтральны или имеют отрицательный заряд.
3. Насыщенные жирные кислоты имеют прямые хвосты, ненасыщенные жирные кислоты имеют цис-конформацию и изогнутые хвосты, что делает мембрану менее жесткой и более текучей.
4. Липиды формируют бислой, в котором гидрофобная область фосфолипидов защищена от воды, а гидрофильная область обращена к воде (рис. 7.6). Липидный бислой получают in vitro в виде липосом.
Неполярные гидрофобные хвосты
Полярная гидрофильная головка
Рис. 7.5. Структура липидов мембран.
Гидрофильная область
Гидрофобная область
Гидрофильная область
Рис. 7.6. Строение липидного бислоя.
98
Мембраны Глава 7
Для формирования бислоя необходимо наличие двух гидрофобных хвостов у каждого фосфолипида. Утрата одного из них превращает данный фосфолипид в детергент (вещество, разрушающее фосфолипидный бислой). Например, возникает гемолиз эритроцитов при действии яда гюрзы за счет отщепления фосфолипазой А2 остатка жирной кислоты во втором положении глицерофосфолипида.
Липосомы
Образование липидного бислоя из амфифильных молекул фосфолипидов в зодной среде сыграло важнейшую роль в формировании живых организмов, поскольку возникла возможность отграничения биологически важных молекул от окружающей среды. В отличие от мицелл, размер которых менее 20 нм, из фосфолипидного бислоя можно формировать макроскопические образования размером 106мм, т. е. мембраны. В основе их строения лежит структура липосомы (рис. 7.7).
Липосомы нашли применение в медицине и косметике. Питательные и лекарственные вещества вводят в составе липосом. Липосомы могут перемещаться через плазматические мембраны многих клеток и тем самым доставлять биоактивные вещества в клетку. При встраивании белка в бислой липосомы получают протеолипосомы. Про-теолипосомы используют для направленного транспорта лекарств в определенные клетки, а также для осуществления гетерогенного катализа, когда субстрат и фермент имеют различную растворимость (фермент — липаза водорастворим, а субстрат — триацилглице-рол гидрофобен).
Протеолипосомы — это модель мембран.
Для жизнедеятельности клетки важна проницаемость фосфолипидного слоя для различных веществ (рис. 7.8).
Рис. 7.7. Строение липосомы (Berg J. М., Tymoczko J. Stryer L, с изм.).
99
Глава 7 Мембраны
Триптофан Мочевина
Na* К* Cl
глицерол
Глюкоза
Р(СМ/с'’)
Повышение проницаемости
Индол Н2О
I ill
104 Ю2
Рис. 7.8. Коэффициенты проницаемости липидного бислоя (Р) для ионов, воды и органических веществ (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
Белки мембран
По расположению белков в мембране, способу ассоциации с липидным бислоем их можно разделить на: поверхностные (периферические) мембранные белки, связанные с гидрофильной поверхностью липидного бислоя; интегральные мембранные белки, погруженные в гидрофобную область бислоя.
Прошивающие мембрану белки имеют конформацию а-спирали во внутренней части мембраны. В этой части белка преобладают гидрофобные аминокислотные остатки. Такая структура была впервые установлена при исследовании бактериородопсина (7 тесно упакованных а-спиралей, пересекающих мембрану размером 4,4 нм).
Поры или каналы в мембранах образуются p-структурами белков. Антипа-раллельные p-структуры связаны водородными связями и извиваясь формируют полый цилиндр, который выполняет функции поры. Важно, что остатки гидрофобных аминокислот взаимодействуют с гидрофобными группами внутримембранного окружения канала, а внутренняя поверхность канала образуется радикалами гидрофильных аминокислот (рис. 7.9).
Белки, необходимые для формирования субклеточных компартментов (митохондрии, пероксисомы, ядра и др.), имеют специфические последовательности аминокислот, определяющие «адрес» их перемещения. Например, белки, используемые для построения пероксисом, на С-конце имеют последовательность сер-лиз-лей-СОО-; при удалении этого фрагмента белок не будет встраиваться в структуру пероксисом. Белки, необходимые для образования митохондрий содержат в N-концевой части молекулы 15 35 аминокислотных остатков содержащих радикалы положительно заряженных аминокислот, а также серина и треонина. Белки, необходимые для формирования ядер, содержат внутренние последовательности лиз-лиз-лиз-арг-лиз. Есть специальные последовательности, определяющие выход белка из ядра. Обнаружен ядерный белок — а-кари-оферин (а-импортин), обеспечивающий узнавание белков с такими последовательностями.
Характеристика мембранных белков: 1. Периферические белки связаны с гидрофильной областью интегральных белков или с полярными головками липидного бислоя мембраны силами электростатического взаимодействия или водородными связями. Периферические белки могут быть выделены без разрушения мембраны концентрированными солевыми растворами или изменением pH. Многие рецепторы для гормонов являются периферическими белками.
100
Мембраны Глава 7
Рис. 7.9. Снизу — бактериородопсин (энергопреобразующий фотозависимый белок мембран); сверху — организация поры в мембране бактерии. А — вид сбоку, Б — вид сверху (Berg J. М., Tymoczko J. L, Stryer L., с изм.).
2. Интегральные белки погружены в мембрану на определенную глубину или пронизывают мембрану насквозь (прошивающие). Такие белки могут быть экстрагированы только при разрушении мембраны органическими растворителями или детергентами.
Интегральные белки, подобно липидам, обладают амфипатическими свойствами и у них есть гидрофобные области, взаимодействующие с гидрофобными радикалами липидных молекул внутри
бислоя, и гидрофильные, обращенные с обеих сторон мембраны к воде.
Если основные структурные особенности биологических мембран определяются свойствами их липидного бислоя, то специфические функции мембран — белками.
Мембранные белки по функции можно разделить на две группы: структур
ах
Глава 7 Мембраны
ные и динамические белки. Структурные белки поддерживают структуру всей мембраны. Это, как правило, периферические белки, выступающие в роли «молекулярного бандажа». Динамические белки непосредственно участвуют в процессах, происходящих на мембране. Выделяют три класса таких белков:
1) транспортные — участвующие в трансмембранном переносе веществ;
2) каталитические — это ферменты, интегрированные в мембрану и катализирующие происходящие там реакции;
3) рецепторные — это мембранные рецепторы, специфически связывающие такие соединения, как гормоны, нейромедиаторы, токсины на наружной стороне мембраны, что служит сигналом для изменения метаболичес
ких процессов в мембране или внутри клетки.
Наиболее распространенный тип мембранных рецепторов — это рецепторы, построенные из полипептидной цепи, 7 раз пересекающей мембрану (the seven-transmembrane-helix, 7ТМ) (рис. 7.10).
Согласно J. S. Gutkind (1998) эти рецепторы участвуют в восприятии запаха, вкуса, зрительных образов, в нейротрансмиссии, секреции гормонов, хемотаксисе, экзоцитозе, контроле артериального давления, эмбриогенезе, росте и дифференциации клеток, развитии, вирусных инфекциях и канцерогенезе. Известно несколько тысяч таких рецепторов. Наиболее изученным рецептором является родопсин, который воспринимает кванты света. Примером рецепторов этого типа, воспринимающими химические сигналы, например, гормон адреналин, являются p-адрснорецег п оры. По своему строению имеется сходство (гомология) между родопсином и р-адренорецеп-торами.
Рис. 7.10. 7ТМ-рецептор. А — полипептидная цепь рецептора семь раз пересекает мембрану. Б — трехмерная структура родопсина, 7ТМ-рецептора, принимающего участие в акте зрения (с рецептором связана воспринимающая фотон света молекула ретиналя) (Berg J. М., Tymoczko J. L, Stryer L., с изм.).
102
Мембраны Глава 7
Углеводы мембран
В составе мембран углеводы находятся только в соединении с белками (гликопротеины и протеогликаны) и липидами (гликолипиды). В мембране гликозилировано около 10 % всех белков и 5—25 % липидов. Углеводные цепи белков колеблются по составу от двухчленных структур до разветвленных 18-членных полисахаридов.
Функции углеводов:
1) определяют межклеточное взаимодействие;
2) участвуют в системе иммунитета (антигенные детерминанты групп крови); 3) входят в состав рецепторов.
Свойства мембран
Итак, подытожим основные свойства мембран:
1. Текучесть (жидкостность) мембраны. Текучесть мембраны характеризуется способностью компонентов мембраны к движению. Текучесть мембраны определяется липидным составом, процентом полиненасыщенных жирных кислот и холестерола. Особое влияние на текучесть мембраны оказывают молекулы холестерола, погруженные в липидный бислой. Бактерии регулируют жидкостность своих мембран числом двойных связей в цепях жирных кислот фосфолипидов. Например, отношение насыщенных к ненасыщенным жирным кислотам Е. coli уменьшается от 1,6 до 1,0 при снижении температуры инкубации от 42°С до 2ТС. У эукариотических клеток при температуре 37°С холсстерол ограничивает текучесть мембраны, а при более низких температурах он, наоборот, способствует поддержанию их текучести, препятствуя слипанию углеводородных цепей. Текучесть влияет на функцию мембраны. При повышении текучести увеличива
ется проницаемость для воды и других гидрофильных молекул.
У животных и человека ненасыщенные жирнокислотные остатки глицеро-фосфолипидов и холестерол играют ключевую роль в поддержании жидко-стности мембран.
2. Избирательная проницаемость. Это свойство обеспечивает регуляцию транспорта в клетку необходимых молекул, а также удаления из клетки продуктов метаболизма, т. е. активный обмен клетки и ее органелл с окружающей средой. Избирательный транспорт необходим также для поддержания трансмембранного градиента ионов, служит основой всех биоэнергетических механизмов, определяет эффективность процессов рецепции, передачи нервного возбуждения и т. п.
3. Асимметричность мембраны. По химическому составу наружная поверхность мембран отличается от внутренней. Мембраны ассиметричны по липидному составу. Существует асимметрия расположения фосфолипидов в мембране. Фосфатидилхолин и сфингомиелины локализованы в наружном слоя мембран, фосфатидилсерин и фос-фатидилэтаноламин — во внутреннем. Холестерол находится преимущественно в наружном слое. Белки в мембранах расположены также асимметрично (расположение периферических белков, различная степень погружения интегральных белков). Наиболее асимметрично распределены в плазматической мембране гликолипиды и гликопротеины. Углеводные части гликолипидов и гликопротеинов выходят на наружную поверхность, иногда образуя сплошное покрытие на поверхности клетки — гли-кокаликс.
4. Динамичность мембран. Молекулы белков и липидов с высокой скоростью двигаются в плоскости мембраны (латеральная диффузия). Они легко меняют
103
Глава 7 Мембраны
ся местами с соседними молекулами в пределах одного монослоя примерно 10 раз в секунду. Перемещение мембранных белков в латеральной плоскости может быть ограничено вследствие притяжения между функционально связанными белками и образования кластеров, что в конечном счете приводит к их мозаичному распределению в липидном слое.
Перемещение мембранных белков визуализируют с помощью флуоресцентного микроскопа, используя технику возврата флуоресценции после фоторазрушения (fluorescence recovery after photobleaching, FRAP): 1) метят все компоненты поверхности клеток специфи
ческими флуоресцентными хроматофорами; 2) визуализируют малую область клеточной поверхности с помощью флуоресцентного микроскопа ( 3 мкм2); 3) флуоресцентные молекулы этой области разрушают с помощью очень интенсивного лазерного импульса; 4) исследуют время восстановления флуоресценции обработанного лазерным импульсом участка мембраны (рис. 7.11).
Коэффициент диффузии липидов в разных мембранах примерно 1 мкм2/с. Молекулы фосфолипидов могут перемещаться на расстояние 2 мкм в секунду. Следовательно, от одного конца бактерии к другому молекула фосфолипида перемещается за 1 секунду. Белки практически не диффундируют вдоль мембраны. Например, коэффициент диффузии для весь
Рис. 7.11. Возвращение флуоресценции после фоторазрушения: А. Поверхность клетки флуоресцирует равномерно после мечения. Б. Часть поверхности обработана интенсивным лазерным импульсом (разрушены меченые молекулы). В. Флуоресценция восстанавливается за счет латеральной диффузии меченых молекул из соседних областей мембраны. Г. Зависимость скорости восстановления флуоресценции от коэффициента диффузии мембраны (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
104
Мембраны Глава 7
ма лабильного фоторецепторного белка родопсина не превышает 0,4 мкм2/с, а для периферического мембранного белка фибронектина, =заинедействующего с внеклеточным матриксом, этот коэффициент меньше 10-4 мкм2/с.
Кроме того, молекулы белков и ли-лидов очень быстро вращаются вокруг гвоих продольных осей (вращательная Уаффузия).
Перескок липидных молекул из одного монослоя в другой (поперечная диффузия, flip-flop) осуществляется редко, а белки к такому перескоку вообще не способны. Причина исключительно медленного flip-flop заключается в его энергетической невыгодности, поскольку необходимо перенести полярную головку молекулы липида через гидрофобную область бислоя.
Модели строения мембран
С. Дж. Сингер и Л. Г. Никольсон в 1972 г. предложили «жидкостно-мозаичную модель» строения мембраны. Согласно этой
модели мембрана представляет собой липидный бислой, в котором расположены глобулярные белки. Каждая молекула липидов расположена так, что ее неполярная углеводородная часть направлена внутрь бислоя, а полярные головки находятся на поверхности, контактируя с водой. По этой модели, мембрана представляет собой динамическую систему, в которой молекулы белка относительно свободно «плавают в липидном море в виде айсбергов». Прямые измерения показали, что белки движутся в сотни раз медленнее из-за переплетения углеводных цепей на поверхности мембраны (глико-каликс). Кроме того, компоненты мембраны с внутренней стороны связаны с системой белков цитокаркаса.
Существует решетчато-мозаичная модель. Молекулы белков, которые связаны с питокаркасом, малоподвижны. Те белки, которые с цитокаркасом нс связаны, могут относительно свободно перемещаться в плоскости мембраны (рис. 7.12).
Рис. 7.12. Строение плазматической мембраны эукариотической клетки.
105
Глава 7 Мембраны
Так в мембране эритроцитов интегральный анионпереносящий белок связан с белками цитокаркаса — спектрином, анкирином. При гемолизе эти связи нарушаются.
Механизмы мембранного транспорта
Липидные бислои в значительной степени непроницаемы для подавляющего большинства веществ, и поэтому перенос через липидную фазу требует значительных энергетических затрат.
Различают пассивный транспорт (диффузию), активный транспорт и везикулярный транспорт.
Пассивный транспорт
Пассивный транспорт — это перенос молекул по концентрационному или электрохимическому градиенту, т. е. он определяется только разностью кон
центраций переносимого вещества на противоположных сторонах мембраны или направлением электрического поля и осуществляется без затраты энергии АТФ. Возможны два типа диффузии: простая и облегченная (рис. 7.13).
1. Простая диффузия. Происходит без участия мембранного белка. Скорость простой диффузии хорошо описывается обычными законами диффузии для веществ, растворимых в липидном бислое. Скорость движения молекулы определяется концентрационным градиентом и растворимостью молекулы в липидах. Механизм диффузии водорастворимых веществ менее изучен. Перенос вещества через липидный бислой, например, такого соединения, как этанол, возможен через временные поры в мембране, образованные разрывами в липидном слое при движении мембранных липидов. В мембранах также существуют каналы, образованные белками, через которые могут двигаться молекулы. По механизму простой диффузии
Рис. 7.13. Механизмы пассивного транспорта.
106
Мембраны Глава 7
осуществляется трансмембранный пере--ос газов (например, О2, СО2, N2, метан), некоторых простых органических :онов и ряда низкомолекулярных жирорастворимых соединений. Простая диффузия осуществляется не избирательно и отличается низкой скоростью. Транспорт воды через мембрану простой тлф фузией происходит очень медленно. В тканях, где необходим быстрый перенос воды (почки), вода диффундирует через специфические интегральные бел-чл (аквапорины).
2. Облегченная диффузия — движение молекул по градиенту концентрации с использованием специфических мембранных белков-переносчиков. Следова--ельно, облегченная диффузия — это диффузионный процесс, сопряженный с химической реакцией взаимодействия -ранспортируемого вещества с белком-переносчиком. Этот процесс специфичен протекает с более высокой скоростью, -ем простая диффузия. Скорость пере--оса определяется концентрационным радиентом через мембрану и количе-..вом молекул переносчика.
Известны два типа мембранных транспортных белков: белки-переносчики, называемые транслоказами или пермеазами, и каналообразующие белки.
Для объяснения механизма облегченной диффузии используют модель «пинг-понг». В этой модели переносчик существует в 2-х конформационных состояниях (рис. 7.14). В состоянии «понг» белок открыт на стороне высокой концентрации переносимого вещества и связывает это вещество. Затем происходит изменение конформации («пинг») и белок со связанным веществом открывается на сторону с низкой концентрацией переносимого вещества.
Транспортные белки имеют ряд свойств: обладают высокой специфичностью и имеют участки связывания для транспортируемой молекулы; насыщаемы при высокой концентрации переносимого вещества; ингибируются конкурентными и неконкурентными ингибиторами.
Облегченная диффузия обычно характерна для водорастворимых веществ: углеводов, аминокислот, метаболически важных органических кислот, некоторых ионов. Путем облегченной диффузии осуществляется также транспорт стероидных гормонов, ряда жирорастворимых витаминов и других молекул этого класса. Практически направленные потоки веществ в клетку путем простой и облегченной диффу
энс. 7.14. Механизм «пинг-понг».
107
Глава 7 Мембраны
зии практически никогда не прекращаются, поскольку вещества, поступившие в клетку, вовлекаются в метаболические превращения, а их убыль постоянно восполняется путем трансмембранного переноса по градиенту концентрации.
Аквапорины (по Э. П. Титовец, 2007). В 2003 году была присуждена одна из самых «стремительных» Нобелевских премий Питеру Огрею (Peter Agre) за открытие аквапоринов — водных каналов. Примерно 15 лет до этого, изучая групповые резусные антигены мембран эритроцитов, группа П. Огрея случайно столкнулась с белком, который не окрашивался обычными красителями (Кумасси голубой), а выявлялся только с помощью серебрения. Оказалось, что в мембране одного эритроцита было до 200000 молекул этого белка. Дальнейшие исследования показали, что этот белок является каналом для переноса воды, и он получил название AQP1 (aquaporin от лат. aqua — вода и poms — канал). В настоящее время у млекопитающих обнаружено 13 аквапоринов (AQP0- AQP12). Эти каналы в различных органах переносят воду, а некоторые из каналов — дополнительно глицерол и другие небольшие молекулы. Аквапорины образуют в мембране тетрамеры, мономеры которых представлены полипептидными цепочками, состоящими примерно из 270 аминокислот. Полипептидная цепочка мономера формирует 6 внутримембранных а-спиральных доменов. Пронизывая плазматическую мембрану 6 раз, она образует также 3 внеклеточных и 2 внутриклеточных петли, причем N- и С-кон-цевые аминокислотные остатки остаются на цитозольной поверхности мембраны. Все мономеры аквапорина функционируют как независимые водные каналы. Транспорт воды через мономеры одинаково легко осуществляется в обоих направлениях. Общее направление водного потока определяется ориентацией осмотического или гидростатического градиента. Механизм переноса воды включает ориентирующий эффект аспарагина-76 и аспарагина-192. При участии водородных связей остатки этих аминокислот обеспечивают оптимальную структурную организацию молекул воды в узком пространстве тоннеля. В результате молекулы воды выстраиваются в ряд, заполняя весь тоннель, протяженность которого 2 нм. Аквапорины обратимо ингибируются соединениями ртути путем связывания цистеина-189. Аквапорины не способны транспортировать протоны.
Аквапорины вовлекаются в патогенетические механизмы развития ряда заболеваний. Повышение водной проницаемости гематоэнцефалического барьера за счет AQP4 (инсульт, травмы, инфекционные и онкологические заболевания) ведет к отеку мозга. При злокачественных глиомах, характеризующихся выраженным перифокальным отеком, повышена продукция AQP1 в эндотелии микрососудов опухоли. Аквапорин AQP9 обеспечивает перенос лактата из цитозоля в митохондрии, что ведет к снижению образования АТФ за счет разобщения дыхания и фосфорилирования. Различные аквапорины необходимы для восприятия света, звука, процессов пищеварения, мочеобразова-ния и мочевыведения и других функций. Полагают, что аквапорины участвуют в запуске механизмов запрограммированной гибели клеток — апоптоза (AQP8 вызывает набухание митохондрий и выброс цитохрома с).
Активный транспорт
Активный транспорт — транспорт веществ против градиента концентрации (незаряженные частицы) или электрохимического градиента (для заряженных частиц), требующий затрат энергии.
Известны три основных типа первичного активного транспорта:
1. Натрий-калиевый насос — Na+, К+-аденозинтрифосфатаза (Na+, К+-АТФ-аза) переносит ионы натрия из клетки, а калия — в клетку.
2. Кальциевый насос — Са2+-АТФ-аза, который транспортирует Са2+ из клетки или цитозоля в саркоплазматический ретикулум.
3. Н+-АТФ-аза — протонный насос, функционирующий в сопрягающих мембранах, в том числе в митохондриальной мембране.
При нарушении снабжения АТФ активный транспорт останавливается.
Выделяют два вида активного транспорта: 1) первичный активный транс-
108
Мембраны Глава 7
7орт использует энергию АТФ или . кислительно-восстановительного по-енциала; 2) вторичный активный “7 а нс порт использует градиент ионов
Н\ К+, Na+, и др.), созданный на мем-'ране за счет работы системы первичного активного транспорта.
Примером первичного активного транспорта является транспорт К+ и Na+ _ри участии Na+, К+-АТФ-азы. Клетка : одержит низкую концентрацию Na+ (в . j раз ниже) и высокую концентрацию (в 30 раз выше), чем в окружающей :реле. Поэтому считают, что Na+ это внеклеточный катион, а К4 — внутри-«щеточный катион. Na+, К+-АТФ-азы обеспечивают выведение 3 ионов Na+ из «тетки в обмен на введение в клетку _зтх ионов К+ против градиента концен-рации с затратой 1 молекулы АТФ.
Ха', К+-АТФ-аза была открыта в . 957 г. Й. Скоу во фракции плазматических мембран нервов краба. Затем она =ыла обнаружена во всех исследованных «летках животных, особенно велико ее удержание в органах, осуществляющих .Tie вой обмен (почки) или выполняющих электрическую работу (мозг, нервы).
Строение Na+, К+ -АТФ-азы. Это тет-тзмер а2р2; м.м 270 кДа. Субъединица г 195 кДа) пронизывает мембрану насквозь и содержит на внутренней сто-роне участки связывания АТФ и Na+, а - а внешней стороне — для К+ и сердечных гликозидов, р-субъединицы (40 кДа) содержат углеводные группы, расположенные на наружной стороне плазматической мембраны. Она способствует правильной ориентации фермента в ипидном бислое. Перенос ионов происходит за счет изменения конформации фермента при его фосфорилирова--ии — дефосфорилировании за счет ХТФ. В присутствии Na+ активируется ларолиз АТФ и происходит фосфори-лрование фермента, дефосфорилирова-
-:ие происходит в присутствии К+.
Описание химизма по этапам:
1) присоединение 3 Nah вызывает активацию АТФ-азы, т. е. происходит гидролиз АТФ;
2) фосфорилирование фермента;
3) изменение его конформации с открытием канала снаружи;
4) уменьшение сродства к Na+ и присоединение К+ приводит к дефосфорилированию фермента;
5) изменение конформации фермента с открытием канала изнутри;
6) снижение сродства к К+ и выход его в цитозоль и вновь присоединение АТФ и 3 Na+ (сердечные гликозиды могут конкурировать с К+ за места связывания и ингибируют Na+, К+-АТФ-азы).
Неравнозначный перенос заряженных ионов (частиц) через мембран)/ вызывает ее поляризацию: появление «+» снаружи и «-» изнутри, поэтому Na+, К+ насос называют электрогенным.
Создаваемый градиент Na+ используется для вторичного активного транспорта глюкозы в клетки. Например, рассмотрим всасывание глюкозы из просвета кишечника.
1. Переносчик глюкозы обеспечивает транспорт глюкозы в цитозоль энтероци-та за счет входа в клетку ионов Na: под действием электрохимического градиента (концентрация Na+ высокая в просвете кишечника и низкая в цитозоле клеток).
2. Глюкоза из клетки переходит во внеклеточную жидкость по механизму облегченной диффузии. Скорость переноса глюкозы зависит от величины градиента Na+: она увеличивается при повышении разности концентраций Na+ в просвете кишечника и цитозоле энтероцита.
3. Na+, К+-АТФаза поддерживает эту разность концентраций Na+ за счет его откачки в межклеточное пространство в обмен на К+ с затратой АТФ.
Итак, глюкоза переносится в клетки одновременно с ионами натрия. Вход натрия обеспечивает запасание свобод
109
Глава 7 Мембраны
ной энергии переноса 2,2 ккал/моль (9,2 кДж/моль) при типичных характеристиках клетки (концентрация ионов натрия снаружи 143 ммоля, изнутри 14 ммолей и мембранный потенциал -50 мВ). Этой свободной энергии переноса достаточно для формирования 66-крат-ного градиента концентраций незаряженных молекул типа глюкозы и их переноса через мембрану.
Виды переноса веществ через мембраны
Согласованный перенос двух веществ называют котранспортом: при симпор-те имеет место перенос обоих веществ в одном направлении, а при антипорте — в противоположных направлениях (рис. 7.15).
Унипорт — движение одного типа молекул в одном направлении. Наиболее простой вид переноса какого-либо растворенного вещества с одной стороны мембраны на другую, осуществляемый по механизму простой или облегченной диффузии.
Котранспорт — вид транспорта, при котором перенос одного вещества зависит от переноса другого. Осуществляется с помощью транспортных белков, которые имеют центры связывания для переноса обоих веществ.
Симпорт — перенос вещества зависит от одновременного (или последовательного) переноса другого вещества в том же направлении.
Например, транспорт протонов и сахаров у бактерий, транспорт Na+ и глюкозы у животных.
Антипорт — перенос одного вещества по градиенту концентрации приводит к перемещению другого вещества, присоединенного к этому переносчику с другой сторон мембраны в противоположном направлении против градиента концентрации.
Натрий-кальциевый обменник в плазматических мембранах представляет собой антипорт, который использует электрохимический градиент Na+ для выталкивания Са2+ из клетки. Этот электрохимический градиент создает Na+, К+-АТФ-аза. Концентрация ионов кальция внутри клетки строго контролируется,
Рис. 7.15. Транспортные системы.
110
Мембраны Глава 7
поскольку они являются вторичными посредниками ряда гормонов. Поэтому натрий-кальциевый обменник имеет более низкую аффинность к ионам кальция, чем Са2+-АТФ-аза, но ^ошность его намного выше (натрий-кальци-свый обменник может удалить из цитозоля 2’300 ионов кальция за секунду, высокоспеци-ричная Са2+-АТФ-аза — только 30).
Ион-селективные каналы являются механизмом транспорта неорганических ионов через мембрану. Ионные каналы определяют проницаемость мембраны для специфических ионов и, вместе с лонными насосами, такими как Na*', К-ЛТФ-аза, регулируют цитозольную концентрацию ионов и мембранный потенциал. В нейронах быстрое изменение активности ионных каналов вызывает изменение мембранного потенциала (потенциала действия), который передает сигнал от одного конца нейрона к другому. В миоцитах быстрое открытие Са2+ каналов эндоплазматического ретикулума высвобождает Са2+, что вызывает сокращение мышц.
Ионные каналы отличаются от ионных переносчиков, по меньшей мере, 3 признаками. Во-первых, скорость потока через каналы значительно выше, чем перенос с помощью переносчика — IO7—108 ионов на канал в секунду, что близко к теоретическому максимуму скорости для неограниченной диффузии. Во-вторых, ионные каналы нена-сыщаемы, их скорость не достигает максимума при высокой концентрации субстрата. В-третьих, они являются «воротами», открывающимися или закрывающимися в ответ на некоторые внутриклеточные факторы.
Транспорт макромолекул (везикулярный транспорт)
Крупные макромолекулы (белки, полисахариды и полинуклеотиды) могут как поглощаться, так и секретироваться.
При их переносе происходит последовательное образование и слияние окруженных мембраной пузырьков (везикул), т. е. перенос веществ вместе с частью плазматической мембраны.
Фагоцитоз (от греч. фагос — пожирать, цитос — клетка) наблюдается в специальных клетках (макрофагах и гранулоцитах). При фагоцитозе происходит захват крупных молекул (вирусы, бактерии, клетки). Пиноцитоз (от греч. пинос — пить) характерен для всех клеток. Происходит захват жидкости или растворенных компонентов. Пиноцитоз бывает неизбирательный и селективный рецепторно-опосредованный. При эндо-цитозе поглощенное вещество окружается небольшим участком мембраны, который вначале впячивается, а затем отщепляется, образуя внутриклеточный пузырек, содержащий захваченный клеткой материал. Большинство частиц, поглощенных при эндоцитозе, попадает затем в лизосомы, где они подвергаются деградации.
Вещества, высвобождаемые путем экзоцитоза, делят на 3 группы: 1) вещества, связывающиеся с клеточной поверхностью как периферические белки — антигены; 2) вещества, включающиеся во внеклеточный матрикс —- коллаген, гликозаминогликаны; 3) вещества, входящие во внеклеточную среду, как сигнальные молекулы (инсулин, катехоламины, паратгормон) или ферменты (экзокринные железы, эктоферменты).
Состояние мембран и здоровье
1. Мутации рецептора к инсулину или переносчиков глюкозы приводят к развитию диабета, мутации ионных каналов — к патологии сердца и нервной системы.
111
Глава 7 Мембраны
2. Неблагоприятные факторы внешней среды способны инициировать процессы пероксидного окисления липидов мембран, что изменяет их свойства и ведет к развитию болезней.
3. Возраст, нарушения принципов здорового образа жизни (гипокинезия, избыточное потребление легко усвояемых углеводов, холестерола и насыщенных жирных кислот и др.) ведет к накоплению холестерола в мембранах, что снижает их жидкостность и ведет к развитию заболеваний атеросклеротической природы.
4. Опухолевая трансформация клеток и инвазивность опухолей связаны с повышением жидкостности мембран и приобретением клетками округлой формы. 5. Некоторые токсины действуют на ионные каналы. Тетродотоксин и сакситоксин являются ядами нервно-паралитического действия, которые действуют на Na+ каналы мембран нейронов и нарушают образование потенциала.
Тетродотоксин (tetrodotoxin) продуцируется некоторыми представителями морских рыб. Наиболее опасной является рыба-собака, или тетродон, из семейства иглобрюховых (Tetraodontidae) отряда иглобрюхообразных (Tetraodontiformes). Тетродотоксин содержится в органах и тканях рыбы — печень, икра, молоки. В отличие от прочих рыбных ядов, тетродотоксин не относится к белкам. В Японии эта рыба, называемая фугу (род Spheroides), высоко ценится за ее вкусовые качества, но ее приготовление разрешено только в специализированных ресторанах и только поварами, прошедшими особую подготовку. Действие тет-родотоксина в 10 раз сильнее действия знаменитого кураре, более чем в 400 раз — стрихнина, в 160 тыс. раз — кокаина. Благодаря своей способности избирательно блокировать передачу нервного импульса, тетродотоксин является превосходным обезболивающим средством. В растворимой форме тетродотоксин применяется в медицине как анальгетик при невралгиях, артритах и др. заболеваниях. В Японии уже сейчас продают тетродотоксин в качестве болеутоляющего. На Востоке давно применяют этот яд для лечения астмы, голов
ных болей, кашля, столбнячных судорог и даже некоторых стадий проказы. Антидот против тет-родотоксина неизвестен. Сакситоксин (saxitoxin) продуцируется морскими динофлагеллятами Gonyaulax. Поступление с пищей устриц или крабов, которые питаются динофлагеллятами Gonyaulax, может быть фатальным. Сами устрицы или крабы не чувствительны к сакситоксину, но они накапливают его в мышцах, которые становятся опасными для остальных звеньев пищевой цепи.
Яд зеленой азиатской кобры, содержащий дендротоксин (dendrotoxin) ингибирует К+ каналы. Тубокурарин (tubocurarine), активный компонент кураре (используется в качестве яда д ля стрел в Амазонке), и два токсина яда змей, кобротоксин (cobrotoxin, змеи Naja naja atra) и бунгаротоксин (bungarotoxin, змеи Bungarus multicinctus), блокируют рецепторы ацетилхолина и предотвращают открытие ионных каналов. Блокируя передачу сигналов от нервной системы к мышцам, эти токсины вызывают паралич, и при высокой концентрации возможна смерть. Тубокурарин используется при оперативных вмешательствах, при которых требуется релаксация скелетных мышц на период более 1 ч.
Из наперстянки (Digitalis purpurea), ландыша, горицвета были получены стероидные гликозиды, способные в малых дозах усиливать работу сердца. Эти препараты дигиталиса впервые были применены в 1785 г. В. Витерин-гом. Гликозиды дигиталиса ингибируют Na+, К+-АТФ-азу, что повышает концентрацию ионов натрия в цитозоле кардиомиоцитов. Ослабление натриевого градиента на мембране (натрий — внеклеточный катион) уменьшает выход кальция посредством натрий-кальциевого обмена. В результате повышается внутриклеточная концентрация ионов кальция, которые усиливают сокращение сердечной мышцы.
Мембраны или гели?
В 2001 году Джеральд Поллак выпустил книгу «Клетки, гели и движущие силы жизни: новый унифицированный подход
112
Мембраны Глава 7
к функционированию клетки». Эта книга эросает вызов традиционной мембрано-гогии, то есть науке, согласно которой <7етка является микроскопическим резервуаром с жидкостью, целостность ко-“арого поддерживается благодаря мембране. Мембрана обладает свойством полупроницаемости, а перенос веществ через мембрану осуществляется с помощью каналов и насосов. Повреждения мемб-ганы — это путь к гибели клеток из-за тотери растворенных в воде важнейших чугри клеточных компонентов. Вода рас-. матривается как универсальный растворитель (см. лекцию 1).
Дж. Поллак утверждает, что роль иембран гипертрофирована; для объяс--ения новых фактов, связанных с ~рансмембранным переносом веществ, генерацией потенциалов, взаимодействием с лигандами и пр. строятся все 'олее сложные схемы, зачастую уводя-лие от беспристрастных законов физики л химии.
Дж. Поллак считает, что внутриклеточная вода связана с белками и напоминает гель. Такие представления согла-л. ются с взглядами известных ученых прошлого века Альберта Сцент-Дьерди, Г.Н.Линга, Д.Н.Насонова. Физико-химическая природа геля объясняет основ-ные функции клетки. Радикальные
изменения структуры клеточного геля запускаются относительно малыми изменениями температуры, давления, pH, механического давления. Такие изменения называют фазовыми переходами (гель — золь) и на их основе можно унифицировать многие свойства клеток (секреция, транспорт веществ, деление, механическое движение и др.).
Дж. Поллак задает вопрос, что позволило клетке на ранних этапах эволюции сохранить свою индивидуальность в отличной от нее среде? И вспоминает две точки зрения: первая — это гелеобразный комочек протоплазмы, не смешивающийся со средой и вторая это водный раствор соединений, не смешивающихся с окружающей клетку водой, благодаря наличию на ее границе тонкой полупроницаемой мембраны, избирательно пропускающей вещества.
Судя по материалам текущей лекции, победила вторая точка зрения, а согласно представлениям Дж. Поллака и ряда его единомышленников предпочтительна первая точка зрения. На наш взгляд, истина где-то между обеими точками зрения, поэтому врачу и биологу необходимо считаться с двумя научно-методическими подходами при трактовке тех или иных свойств и функций клеток.
5 Зак. 2124
113
Глава 8
Введение в обмен веществ и энергии
Метаболизм (metabole — греч, изменение, превращение) — это совокупность процессов превращения веществ и энергии в организме, происходящих с участием ферментов. В наиболее употребительном значении термин «метаболизм» равнозначен «обмену веществ». В точном смысле «метаболизм» означает промежуточный обмен, т. е. превращение веществ внутри клеток с момента их поступления до образования конечных продуктов. Вещества, участвующие в метаболизме, называются метаболитами.
Функции метаболизма
1. Обеспечение организма энергией, полученной при расщеплении богатых энергией пищевых веществ или путем преобразования энергии солнца.
2. Превращение пищевых молекул в предшественники, которые используются в клетке для биосинтеза собственных макромолекул.
3. Сборка макромолекулярных (биополимеры) и надмолекулярных структур живого организма, т. е. пластическое и
энергетическое поддержание его структуры.
4. Синтез и разрушение биомолекул, выполняющих специфические функции в организме (мембранные липиды, внутриклеточные посредники и пигменты).
Основные типы химических реакций в метаболизме представлены в табл. 8.1. Эти реакции носят ферментативный характер, поэтому классификация типов химических реакций совпадает с классификацией ферментов.
Ферментативная цепь химических реакций называется метаболическим путем. Метаболические пути связаны друг с другом общими метаболитами и образуют единую сетку реакций — карту метаболизма. В метаболическом пути продукты одной реакции становятся субстратом для следующей реакции. Большую роль в ферментативных реакциях метаболизма играют переносчики (табл. 8.2).
Некоторые метаболические пути являются линейными, некоторые — разветвленными, позволяя получать несколь-
114
Введение в обмен веществ и энергии Глава 8
Таблица 8.1. Типы химических реакций в метаболизме
Тип реакции Описание
Окисление-восстановление Перенос электронов
Присоединение с использованием энергии гидролиза АТФ Образование ковалентных связей (например, углерод-углерод)
Изомеризация Изменения расположения атомов, ведущие к образованию изомеров
Перенос групп Перенос функциональных групп от молекулы к молекуле
"идролиз связей Разрыв связей в присутствии воды
Добавление или удаление функциональных групп Присоединение функциональных групп к двойным связям и удаление функциональных групп с образованием двойных связей
Таблица 8.2. Активные переносчики в метаболизме
Переносчик в активной форме Переносимая группа Витамин-предшественник
АТФ пАДН и НАДФН Фосфорильная группа Электроны Ниацин
омнн2, фадн2 Электроны Витамин В2
КоА Ацильные остатки Пантотеновая кислота
Липоевая кислота ’иаминпирофосфат Ацильные остатки Альдегидная группа Тиамин
Биотин СО2 Витамин Н
’етрагидрофолиевая кислота Одноуглеродные Фолиевая кислота
5 -аденозилметионин .-ДФ-глюкоза шпидиндифосфатдиацилглицерол -'уклеозидтрифосфаты группы Метильная группа Глюкоза Фосфатидная кислота Нуклеотиды
э конечных продуктов из одного предшественника или превращать несколь-з исходных веществ в один продукт, ’шествуют циклические метаболические ти, в результате которых одно из веществ, вступающих в метаболический уть, регенерирует в серии последова-е.тьных реакций, которые превращают тугое вещество, вступающее в метаболический путь в конечный продукт.
Метаболический ответ организма — ззокупность биохимический реакций
организма, скорости и направленности их протекания при воздействии какого-либо фактора.
По форме усвояемого углерода все живые организмы делятся на две группы:
1. Автотрофные клетки («сами себя питающие») усваивают СО2 воздуха в процессе фотосинтеза и из него строят все свои органические вещества (фотосинтезирующие бактерии, зеленые растения).
115
Глава 8 Введение в обмен веществ и энергии
2. Гетеротрофные клетки («питающиеся за счет других») получают углерод из сложных органических соединений (клетки высших животных и большинства микроорганизмов), т. е. они питаются продуктами жизнедеятельности других клеток,
В биосфере автотрофы и гетеротрофы являются участниками кругооборота углерода и кислорода между животным и растительным мирами: автотрофы используют атмосферный СО2 для синтеза органических молекул и многие из них выделяют кислород из воды в результате этого процесса; гетеротрофы используют органические продукты автотрофов как источник питания и выделяют СО2 и воду.
Все живые организмы нуждаются в азоте, который используется для синтеза аминокислот, нуклеотидов и других веществ. Растения в качестве источника азота используют аммиак или растворимые нитраты; позвоночные получают азот в форме аминокислот или других органических компонентов. Только некоторые организмы (цианобактерии и почвенные бактерии), которые живут на корнеплодах растений, способны фиксировать атмосферный азот и образовывать мочевину. Некоторые бактерии (нитрифицирующие бактерии) окисляют аммиак до нитритов и нитратов или превращают нитраты в Nr Таким образом, кругооборот углерода, кислорода и азота, в который вовлечены все живые организмы, зависит от баланса между активностью продуцента (автотрофы) и потребителя (гетеротрофы) в биосфере.
По отношению к кислороду гетеротрофы делятся на:
1) аэробы — требуют наличия кислорода для окисления веществ;
2) анаэробы — для окисления питательных веществ кислород не требуется;
3) факультативные анаэробы — существуют в кислородной и бескислородной среде;
4) облигатные анаэробы — живут только в бескислородной среде. Большинство гетеротрофов — факультативные анаэробы, которые при наличии кислорода используют аэробные метаболические пути.
Регуляция метаболизма
Регуляция метаболизма необходима по следующим причинам:
1. Регуляция каждого метаболического пути обеспечивает синтез веществ, необходимых для сохранения структуры и функции клеток, в оптимальных количествах.
2. Регуляция процессов образования энергии в клетке обеспечивает контроль количества поступающих питательных веществ, необходимых для ее продукции.
3. В результате увеличения или уменьшения скорости специфических реакций, клетка относительно быстро реагирует на изменение условий окружающей среды (температуру, pH, ионный состав, концентрацию питательных веществ).
Основные механизмы регуляции метаболизма
Существуют следующие механизмы регуляции метаболизма: изменение активности ферментов, количества ферментов, проницаемости клеточных мембран. 1. Изменение активности ферментов — самый распространенный способ регуляции метаболизма. Регуляции подвержены «ключевые» ферменты, которые определяют скорость всего полифермен-тного процесса. Как правило, такие ферменты состоят из субъединиц —
116
Введение в обмен веществ и энергии Глава 8
олигомерны. Активность фермента зависит от количества, доступности и химического строения субстрата катализируемой реакции, от условий протекания ферментативной реакции в клетке {pH, температуры и др.), от наличия эффекторов (активаторов, ингибиторов), от строения фермента (наличие химической модификации, доступности кофакторов) и др. Изменение активности ферментов играет принципиальную роль в регуляции метаболизма конечными продуктами (ретроингибирование) и реже первыми продуктами t форактивация).
2. Изменение количества фермента в клетке осуществляется путем индукции дли репрессии генов, а также его протеолитической деградации в клетке. Ферменты, которые присутствуют в клетке в относительно постоянном количестве, называются констшпуитивны-чи. Ферменты, количество которых резко изменяется в зависимости от метаболической ситуации, называются адаптивными или индуцибельными. Ин-гуцибельные ферменты и их изоферменты чувствительны к протеолизу, Индукция или репрессия генов регулируется гормонами или другими субстра-ами.
к Изменение проницаемости мембран, сти точнее изменение целого комп-[екса функций мембран (изменение коростей потоков метаболитов, газов в летку и из клетки; компартментализа-1ия метаболических процессов, измене-[ие электрохимического потенциала, передача нервных импульсов, функци-нирование рецепторов). Эти три основ-ых механизма лежат в основе действия ормонов.
В организме человека координация метаболизма осуществляется нервной и ндокринной системами. Нервная система отвечает за быструю реакцию на из-енение окружающей среды путем пе
редачи информации в виде электрических сигналов. Отростки нервных клеток, достигнув соседних клеток или клеток-исполнителей, посредством секреции медиаторов в синапсы обеспечивают специфический ответ этих клеток. В эндокринной системе секретируются гормоны, которые поступают в кровь. Большинство гормонов изменяют метаболизм за счет влияния на активность или количество ферментов.
Фазы метаболизма
Метаболизм складывается из двух фаз — катаболизма и анаболизма.
Катаболизм — это ферментативное расщепление крупных пищевых или депонированных молекул (углеводов, липидов, белков) до более простых (лактат, Н2О, СО2, NH3) с выделением энергии и запасанием ее в виде АТФ или восстановительных эквивалентов (НАДН, НАДФН, ФАДН2). Катаболизм включает 3 стадии.
7 стадия — превращение полимеров в мономеры (крахмал и гликоген — в глюкозу, белки — в аминокислоты, триацилглицеролы — в жирные кислоты и глицерол, нуклеиновые кислоты — в нуклеотиды и т. д.). Первая стадия превращения пищевых молекул протекает в желудочно-кишечном тракте и называется перевариванием.
2 стадия (специфические пути катаболизма) — мономеры превращаются в общие промежуточные продукты — пируват и ацетил-КоА.
3 стадия (общий путь катаболизма) — окисление ацетильной группы ацетил-КоА до СО2 и Н2О. 3 стадия катаболизма включает: 1) цикл трикарбоновых кислот, 2) цепи переноса электронов и 3) окислительное фосфорилирование.
Анаболизм — ферментативный синтез крупных полимерных молекул из про
117
Глава 8 Введение в обмен веществ и энергии
стых предшественников с затратой АТФ или восстановительных эквивалентов НАДН, НАДФН и ФАДНГ
Стадии анаболизма:
/ стадия — третья стадия катаболизма, т. е. цикл трикарбоновых кислот;
2 стадия — образование мономеров по реакциям, обратным реакциям катаболизма;
3 стадия — синтез полимеров из мономеров.
Амфиболические пути расположены в точках переключения метаболизма и связывают анаболизм и катаболизм.
Амфиболическим путем метаболизма является цикл трикарбоновых кислот
Анаболизм и катаболизм не являются простым обращением реакций. Катаболические и анаболические пути должны отличаться хотя бы одной из ферментативных реакций, чтобы регулироваться независимо. Например, специфический путь распада глюкозы до лактата (анаэробный гликолиз) включает И реакций; обратный процесс — синтез глюкозы из лактата (глюконеогенез) включает 8 обратимых реакций и 3 дополнительные реакции с новыми наборами ферментов. Именно на этих стадиях за счет направленного изменения активности ферментов регулируются суммарные скорости распада и синтеза глюкозы. Кроме того, реакции катаболизма и анаболизма часто разделены мембранами и протекают в разных компартментах клеток. Например, распад жирных кислот протекает в митохондриях, а синтез — в цитозоле. Локализация специфических
метаболических процессов в различных отсеках клеток облегчает независимую регуляцию этих процессов.
Метаболический статус (status — состояние на какой-либо момент време
ни) — взаимоотношение анаболических и катаболических процессов в организме на определенный момент времени.
Введение в биоэнергетику
Биоэнергетика, или биохимическая термодинамика, занимается изучением энергетических превращений, сопровождающих биохимические реакции.
Изменение свободной энергии (AG) — это та часть изменения внутренней энергии системы, которая может превращаться в работу. Иначе говоря, это полезная энергия и выражается уравнением
AG = AH —TAS,
где: AH — изменение энтальпии (теплоты), Т—абсолютная температура, AS — изменение энтропии. Энтропия служит мерой неупорядоченности, хаотичности системы и возрастает при самопроизвольных процессах.
Если значение AG отрицательное, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими. Если значение AG положительное, то реакция будет протекать только при поступлении свободной энергии извне; такая реакция называется эндергонической. При AG равном нулю система находится в равновесии. Величина AG при стандартных условиях протекания химической реакции (концентрация веществ-участников 1,0 М, температура 25°С, pH 7,0) обозначается AG°' и называется стандартной свободной энергией реакции.
Зная величину AG0' можно вычислить константу равновесия реакции K'eq, которая выражается отношением произведений равновесных концентраций продуктов реакции и исходных веществ (штрих означает, что константа равновесия отвечает pH 7,0). Для реакции А+В C+D константа K'eq вычисляется из концентраций компонентов реакции,
118
Введение в обмен веществ и энергии Глава 8
измеренных в условиях равновесия, когда их концентрации перестали изменяться:
K'eq = [C]x[D]/[A]x[B].
2вязь между величинами AG0' и K'eq описываемся уравнением:
AG°' = -R х Т х in K'eq = -2.303R х т х |Og10 K'eq, где R — газовая постоянная (8,315 кДжхмолы’ «< J, Т — абсолютная температура е градусах •ельвина (298К- 25 °C). При 25 °C R*T= 2,478 <Дж*мольД
Если дС°'= 0, то K'eq = 1. При увеличении значений ДО°'до +5,7; +11,4; +17,1 величины K'eq будут соответственно уменьшаться 0,1;
.01; 0,001. И, наоборот, при уменьшении значений ДО°'до-5,7; -11,4; -17,1 величины K'eq будут соответственно увеличиваться до 10; .00: 1000.
Жизненно важные процессы в организме — реакции синтеза, мышечное сокращение, проведение нервного импульса, транспорт через мембраны — толучают энергию путем химического сопряжения с окислительными реакциями, в результате которых происходит высвобождение энергии. Это значит эндергонические реакции в организме сопряжены с экзергоническими (рис. 8.1).
Для сопряжения эндергонических реакций с экзергоническими реакциями необходимы аккумуляторы энергии з организме, в которых запасается примерно 50 % энергии.
Аккумуляторы энергии в организме
1. Внутренняя мембрана митохондрий — это промежуточный аккумулятор энергии при получении АТФ. За счет энергии окисления веществ происходит «выталкивание» протонов из матрикса в межмембранное пространство митохондрий. В результате создается электрохимический потенциал (ЭХП) на внутренней мембране митохондрий. При разрядке мембраны энергия электрохимического потенциала трансформируется в энергию АТФ: Еокисл -* Еэхп -* Еатф. Для реализации этого механизма внутренняя мембрана митохондрий содержит ферментативную цепь переноса электронов на кислород и АТФ-син-тазу (протонзависимую синтазу АТФ). 2, АТФ и другие макроэргические соединения. Материальным носителем свободной энергии в органических веществах являются химические связи между атомами. Обычным энергетическим уровнем возникновения или распада химической связи является 12,5 кДж/моль. Однако имеется ряд молекул, при гидролизе связей которых выделяется более 21 кДж/моль энергии (табл. 8.3). К ним относятся соединения с макроэргической фосфоангидридной связью (АТФ), а также ацилфосфаты (ацетил-фосфат, 1,3-
Экзергонические реакции
Мышечное сокращение
Нервное возбуждение
Синтез
Активный транспорт
Рис. 8.1. Сопряжение экзергонических процессов с эндергоническими.
119
Глава 8 Введение в обмен веществ и энергии
Таблица 8.3. Стандартная свободная энергия гидролиза некоторых фосфорилированных соединений
Соединение AG0' (кДж/моль)
Фосфоенолпируват -61,9
1,3-Бисфосфоглицерат -49,4
Ацетил-фосфат -43,1
Фосфокреатин -43,1
Пирофосфат (РРн) -33,5
АТФ (-АМФ+РРн) -32,2
АТФ (-АДФ+Рн) -30,5
Гл юкозо-1 -фосфат -20,9
Фруктозо-6-фосфат -13,8
Г люкозо-6-фосфат -13,8
Г лицерол-3-фосфат -9,2
Вст. 8.2. АТФ-аденозинтрифосфорная кислота.
бисфосфоглицерат), енол-фосфаты (фос-фоенолпируват) и фосфогуанидины (фосфокреатин, фосфоаргинин).
Основным макроэргическим соединением в организме человека является АТФ (рис. 8.2).
В АТФ цепочка из трех фосфатных остатков связана с 5-ОН группой аденозина. Фосфатные (фосфорильные) группы обозначаются как а, р и у. Два
остатка фосфорной кислоты соединены между собой фосфоангидридными связями, а a-остаток фосфорной кислоты — фосфоэфирной связью. При гидролизе АТФ в стандартных условиях выделяется -30,5 кДж/моль энергии.
При физиологических значениях pH АТФ несет четыре отрицательных заряда. Одной из причин относительной нестабильности фосфоангидридных свя
120
Введение в обмен веществ и энергии Глава 8
зей является сильное отталкивание отрицательно заряженных атомов кислорода, которое ослабевает при гидролитическом отщеплении концевой фосфатной группы. Поэтому такие реакции являются высоко экзергоническими.
В клетках АТФ находится в комплексе с ионами Mg2+ или Мп2+, координационно связанными с а- и р-фосфа-том, что увеличивает изменение свободной энергии при гидролизе АТФ до 52,2 кДж/моль.
Центральное место в приведенной шкале (табл. 8.3) занимает цикл АТФ
► АДФ + Рн. Это позволяет АТФ быть как универсальным аккумулятором, так и универсальным источником энергии для живых организмов.
В клетках теплокровных АТФ как универсальный аккумулятор энергии возникает двумя путями:
1) аккумулирует энергию более энергоемких соединений, стоящих выше АТФ в термодинамической шкале без учас
тия О2 — субстратное фосфорилирование: S-Р + АДФ -► S + АТФ;
2) аккумулирует энергию электрохимического потенциала при разрядке внутренней мембраны митохондрии — окислительное фосфорилирование.
АТФ является универсальным источником энергии для совершения основных видов работы клетки (передача наследственной информации, мышечное сокращение, трансмембранный перенос веществ, биосинтезы): 1) АТФ+Н2О-*АДФ+Рн; 2) АТФ + Н2О АМФ + РРн
Во время интенсивных упражнений скорость использования АТФ может достигать 0,5 кг/мин. Использование АТФ при работе представлено на рис. 8.3.
В первые секунды физические упражнения обеспечиваются энергией гидролиза АТФ и креатинфосфата. АТФ способна регенерироваться в метаболических путях. АТФ — это немедленный источник энергии для работающих клеток. В типичной клетке молекула АТФ
Рис. 8.3. Источники АТФ в процессе физической нагрузки (Berg J. М., Tymoczko J.L, Stryer L., с ИЗМ.).
121
Глава 8 Введение в обмен веществ и энергии
потребляется в течение минуты после ее образования. Общее количество АТФ в организме человека около 100 г. Обмен АТФ весьма интенсивен. Например, человек в состоянии покоя потребляет за сутки 40 кг АТФ. В процессе 2-х часового бега расходуется 60 кг АТФ. При более длительных нагрузках необходимое количество АТФ образуется в анаэробных и аэробных метаболических процессах. Образование АТФ является основной целью реакций катаболизма.
Если ферментативная реакция термодинамически невыгодна, она может осуществиться при сопряжении с реакцией гидролиза АТФ. Гидролиз молекулы АТФ изменяет равновесное отношение субстратов и продуктов в сопряженной реакции в 10я раз.
Энергетический заряд может колебаться от 0 (все АМФ) до 1 (все АТФ). Согласно Д. Аткинсону, образующие АТФ катаболические пути ингибируются высоким энергетическим зарядом клетки, а утилизирующие АТФ анаболические пути стимулируются высоким энергетическим зарядом клетки. Оба пути функционируют одинаково при энергетическом заряде, близком к 0,9 (точка перекреста на рис. 8.4). Следовательно, энергетический заряд, подобно pH, является буферным регулятором метаболизма (соотношения катаболизма и анаболизма). В большинстве клеток энергетический заряд колеблется в пределах 0,80-0,95.
Для количественной оценки энер-сР, гетического состояния клетки ис-х пользуют показатель — энергетический заряд. Многие реакции метаболизма контролируются энергетическим обеспечением клеток, который контролируется энергетическим зарядом клетки.
Рис. 8.4. Регуляция метаболизма энергетическим зарядом клетки.
[АТФ] + 1/2[АДФ] Энергетический заряд =
г [АТФ] + [АДФ] + [АМФ]
Дополнительным индексом энергетического статуса является потенциал фосфорилирования, который зависит от концентрации неорганического фосфата и используется при фосфорилировании-дефосфорилировании ферментов, связанных с резервированием или использованием краткосрочного резерва энергии — гликогена.
Потенциал фосфорилирования » [АТФ]!
[АДФ]х[Рнеорг.]
К макроэргическим соединениям относят также нуклеозидтрифосфаты, которые обеспечивают энергией ряд биосинтезов: УТФ — углеводов; ЦТФ — липидов; ГТФ — белков. В биоэнергетике мышц важное место занимает креатинфосфат.
3. НАДФНЧТ — никотинамидаденин-динуклеотидфосфат восстановленный. Это специальный аккумулятор с высокой энергией, который используется в
122
Введение в обмен веществ и энергии Глава 8
клетке (цитозоль) для биосинтезов. R-СН3 + НАДФН2 + О2 - R-CH2OH + Н.О + НАДФ+ (здесь показано образование ОН-группы в молекуле).
Фазы извлечения энергии из питательных веществ
Освобождение энергии в живой клетке осуществляется постепенно. Благодаря этому на различных этапах ее выделения она может аккумулироваться в удобной для клетки химической форме в виде АТФ.
Различают три фазы, которые совпадают со стадиями катаболизма.
Первая фаза — подготовительная. На этой стадии происходит распад полимеров до мономеров в желудочно-кишечном тракте или внутри клеток. Освобождается до 1 % энергии субстратов, которая рассеивается в виде тепла.
Вторая фаза — распад полимеров до общих промежуточных продуктов. Для нее характерно частичное (до 20 %) освобождение энергии, заключенной в исходных субстратах. Часть этой энергии аккумулируется в фосфатных связях АТФ, а часть рассеивается в виде тепла.
Третья фаза — распад веществ до СО2 и Н2О с участием кислорода. Примерно 80 % всей энергии химических связей веществ освобождается в данной фазе, которая сосредотачивается в фосфатных связях АТФ.
Введение в биохимию питания и пищеварения
Компоненты пищи
Человек и животные являются гетеротрофами, т. е. получают питательные вещества и энергию извне в виде органических соединений.
Выделяют основные компоненты пищи — белки, липиды, углеводы, и минорные компоненты — витамины и микроэлементы. Соотношение основных компонентов в пище должно составлять 1:1 : 4, т. е. 100 г белков, 100 г липидов и 400 г углеводов. Энергетическая ценность 1 г белков — 4,1 ккал (17,1 кДж), 1 г жиров — 9,3 ккал (39 кДж), 1 г углеводов — 4,1 ккал (17,1 кДж). Эти компоненты определяют энергетическую ценность пищи, и их соотношение в зависимости от выполняемой работы может временно изменяться. Одной из причин злоупотребления алкоголем является достаточно высокая энергетическая ценность этанола: при окислении 1 г этого спирта освобождается 7,1 ккал (29,7 кДж).
Биологическая ценность пищи определяется ее компонентами, не способными синтезироваться в организме. Из 100 г белков 50 % должны составлять белки животного происхождения, так как в них содержатся незаменимые аминокислоты. Из 100 г жиров — 25 % растительные масла, так как в них находятся полиненасыщенные жирные кислоты (линолевая, линоленовая), которые не синтезируются в организме. Из 400 г углеводов 30 г должно приходиться на клетчатку, необходимую для перистальтики кишечника. Витамины сохраняют свою роль как внутриклеточные регуляторы метаболизма, но высшие животные и человек утратили способность к их биосинтезу в процессе эволюции. Например, для жизнедеятельности Е. coli достаточно глюкозы и органических солей, а для человека необходимо, чтобы в пище содержалось как минимум 12 витаминов.
В настоящее время для коррекции структуры питания широко применяются биологически активные добавки к пище (БАД). БАД — это концентраты натуральных или идентичных натуральным биологически активных веществ, предназначенные для непосредственного при
123
Глава 8 Введение в обмен веществ и энергии
ема или введения в состав пищевых продуктов. В соответствии с действующим законодательством, БАД относятся к пищевым продуктам, а не к лекарственным средствам. В РФ выделяют три группы БАД:
1. Нутрицевтики — природные компоненты пищи, такие как витамины или их близкие предшественники (например, p-каротины), по-линенасыщенные жирные кислоты семейства ш-3, ш-6, некоторые моно- и дисахариды; пищевые волокна (целлюлоза, пектины) и др., предназначенные для коррекции химического состава пищи человека.
2. Парафармацевтики — это БАД, применяемые для профилактики, вспомогательной терапии и поддержки в физиологических границах функциональной активности органов и систем.
3. Эубиотики (или пробиотики) — это БАД, в состав которых входят живые микроорганизмы и (или) их метаболиты, оказывающие нормализующее воздействие на состав и биологическую активность микрофлоры пищеварительного тракта.
Переваривание пищи
Весь процесс переваривания пищи представляет собой последовательное ферментативное расщепление пищевых макромолекул. В процессе эволюции в желудочно-кишечном тракте образовались «полости» (ротовая, желудок, 12-перстная кишка, тонкий кишечник), в которых при различных условиях происходит поэтапный гидролиз химических связей пищевых веществ. Каждая полость имеет специфический набор ферментов и систему регуляции процесса пищеварения.
В зависимости от расположения ферментов пищеварение у животных и человека может быть 3-х видов: полостное (гидролиз ферментами, находящимися в свободном виде), мембранное, или пристеночное (гидролиз ферментами, находящимися в составе мембран) и внутриклеточное (гидролиз ферментами, находящимися в органоидах клетки). Для
пищеварительного тракта характерны полостное и мембранное пищеварение. Мембранное пищеварение имеет место в ворсинках кишечника. При этом гидролиз небольших молекул (например, дипептидов и дисахаридов) происходит на поверхности клеточной мембраны кишечного эпителия и одновременно сочетается с транспортом продуктов гидролиза внутрь клетки. Внутриклеточный гидролиз осуществляется ферментами лизосом.
Регуляция пищеварения
Регуляция пищеварения у животных и человека осуществляется рефлекторно и с помощью биорегуляторов. На молекулярном уровне в регуляции участвуют гормоноподобные вещества, которые вырабатываются в одних отделах желудочно-кишечного тракта, а действуют через кровь на другие. Выделение регуляторов происходит под действием пищи и определяется ее составом.
При поступлении пищи в желудок клетками слизистой выделяется гистамин и гастрин, которые обеспечивают секрецию НС1 и пепсиногена. Переход желудочного содержимого в двенадцатиперстную кишку служит сигналом к выделению энтерогастрона, который тормозит секрецию НС1 и пепсиногена в желудке. Поступление кислого содержимого желудка в 12-перстную кишку способствует выделению регуляторов из слизистой кишечника — секретина и холецистокинина (панкреозимина). Секретин действует на поджелудочную железу и стимулирует выделение сока, богатого бикарбонатами, Н2О, но не ферментами. Холецистокинин действует на поджелудочную железу и желчный пузырь, стимулирует выделение панкреатического сока, богатого ферментами и сокращение желчного пузыря. Энтерокринин действует на слизистую
124
Введение в обмен веществ и энергии Глава 8
кишечника и стимулирует секрецию желез кишечника. Вилликинин стимулирует движение ворсинок слизистой кишечника и способствует продвижению пищи.
Всасывание продуктов пищеварения
Всасывание продуктов пищеварения и компонентов пищи у человека в желудке незначительно (за исключением этанола). Более 90 % продуктов переваривания всасывается в тонком кишечнике. Большая часть воды всасывается в толстом кишечнике. Существует 2 пути поступления продуктов переваривания пищи во внутреннюю среду организма: водорастворимые компоненты поступают в печеночную портальную вену и в печень; жирорастворимые вещества поступают в лимфатические сосуды и затем в кровь через грудной лимфатический проток. В дистальных отделах тонкого кишечника в области пейеровых бляшек возможно всасывание крупных молекул в лимфатические сосуды, окружающие скопления лимфоидных клеток.
Запасание и распределение пищевых молекул
Запасаемые молекулы должны быть нерастворимыми, компактными и нетоксичными
Многие витамины и минеральные вещества, включая железо, токсичны, поэтому запасаются в малых количествах, обычно в связи со специализированными белками в печени; в скелете запасаются кальций и фосфор. Различия между биохимическими процессами запасания энергоемких молекул
(гликоген, триацилглицеролы) и биохимическими процессами в состоянии покоя не являются абсолютными.
Человек способен не только получать глюкозу с продуктами питания, но и синтезировать ее в глюконеогенезе из аминокислот, освобождающихся при распаде белков. Глюконеогенез (см. обмен углеводов) из аминокислот достаточно медленный и расточительный процесс, поскольку при этом увеличивается выведение аминных групп из метаболизма. В печени небольшие количества белка и свободных аминокислот (глутамин) создают резервный фонд предшественников для синтеза как белков и нуклеиновых кислот, так и глюкозы. Животные, которые используют белки для энергетических нужд, быстро истощаются.
К энергоемким молекулам, которые могут запасаться в больших количествах, относятся гликоген, триацилглицеролы, эфиры глицерола, свободные жирные кислоты (12—24 С). Резервирование углеводов сопровождается задержкой воды. Углеводы и глицерол метаболизируются в аэробных и анаэробных условиях, а длинноцепочечные жирные кислоты окисляются только в присутствии кислорода. В связи с этим резервирование и использование липидов возможно только у живых организмов с эффективным потреблением и транспортом кислорода.
Полный распад ненасыщенных жирных кислот сопровождается меньшим освобождением энергии (примерно на 1—2 % на каждую двойную связь), чем насыщенных с тем же числом углеродных атомов. Триацилглицеролы, содержащие остатки насыщенных жирных кислот, упакованы более плотно и имеют более высокую температуру плавления по сравнению с содержащими остатки ненасыщенных жирных кислот. У человека наличие ненасыщенных жир
125
Глава 8 Введение в обмен веществ и энергии
ных кислот в триацилглицеролах и фосфолипидах определяет жидкостность липидсодержащих структур при нормальной температуре тела. Животные и человек могут синтезировать насыщенные (пальмитиновая, стеариновая, миристиновая) и мононенасыщенные жирные кислоты (пальмитолеиновая и олеиновая). Они не могут синтезировать жирные кислоты с 2 и 3 двойными связями (линолевая, линоленовая). В клетках нет десатураз, катализирующих процесс введения двойных связей в жирные кислоты.
Липиды и крахмал, сконцентрированные в зернах, орехах и семенах, являются пищевыми молекулами для животных. Часто семена защищаются от травояд
ных животных специальными белками, алкалоидными токсинами или жирными кислотами. Так, в бобах растения Ricinus communis, производящего касторовое масло, содержатся белок рицин и рицинолевая кислота, которая входит в состав 90 % триацил глицеролов растения. Пищеварительные липазы животных не способны гидролизовать липиды, содержащие рицинолевую кислоту. Это способствует быстрому перемещению таких липидов по пищеварительному тракту. На этом основано применение касторового масла как слабительного средства.
Соотношение основных компонентов пищи при физических нагрузках приведено в таблице 8.4. Сбалансирование питание включает витамины и минеральные вещества.
Таблица 8.4. Формула сбалансированного питания (по А.А.Покровскому).
Пищевые вещества Суточная потребность Пищевые вещества Суточная потребность
Вода, в том числе: 1750-2200 г цистеин 2-3 г
питьевая 800-1000 г тирозин 3-4 г
в супах ' 250-500 г аланин Зг
в продуктах питания 700 г серин Зг
Белки, в том числе: 80-100 г глутаминовая кислота 16г
животные 50 г аспарагиновая кислота 6г
Незаменимые аминокислоты: пролин 5г
триптофан 1 г глицин Зг
лейцин 4-6 г Углеводы, в том числе: 400-500 г
изолейцин 3-4 г крахмал 400-450 г
валин 3-4 г сахар 50-100 г
треонин 2-3 г Органические кислоты 2г
лизин 3-5 г клетчатка 25-30 г
метионин 2-4 г - Липиды, в том числе: 80-100 г
фенилаланин 2-4 г растительные 20-25 г
Заменимые аминокислоты: Линолевая,
линоленовая кислоты 2-6 г
гистидин 1,5-2 Г холестерол 0,3-0,6 г
аргинин 5-6 г фосфолипиды 5 г
126
Глава 9
Биологическое окисление. Цепь переноса электронов
Перенос фосфатной группы на АДФ с образованием АТФ является основной реакцией биоэнергетики. Важным источником энергии для этой реакции служит поток электронов при окислительно-восстановительных реакциях. Эти реакции включают потерю электронов одной молекулой, которая окисляется, и получение электронов другой молекулой, которая восстанавливается. Движение электронов при окислительно-восстановительных реакциях необходимо для выполнения любого вида работы. У нефотосинтезирующих организмов источником электронов являются восстановленные компоненты (пища); у фотосинтезирующих организмов донором электронов служат химические молекулы, которые переходят в возбужденное состояние под действием света.
Путь движения электронов в метаболизме сложен. Электроны движутся от различных метаболитов к специальным переносчикам электронов; переносчики затем отдают электроны акцепторам, обладающим высоким сродством, что
сопровождается выделением энергии. Клетки содержат различные молекулярные преобразователи энергии, которые превращают энергию транспорта электронов в полезную работу.
Пути потребления кислорода (биологическое окисление)
В основе биологического окисления лежат окислительно-восстановительные процессы, определяемые переносом электронов. Вещество окисляется, если теряет электроны или одновременно электроны и протоны (водородные атомы, дегидрирование) или присоединяет кислород (оксигенирование). Противоположные превращения — восстановление.
Способность молекул отдавать электроны другой молекуле характеризуется окислительно-восстановительным потенциалом (редокс-потенциалом, Е°', или ОВП). Редокс-потенциал определяют путем измерения электродвижущей силы в вольтах. В качестве стандарта
127
Глава 9 Биологическое окисление. Цепь переноса электронов
принят редокс-пстенциал реакции при pH 7,0: Н2 ♦--* 2Н+ + 2с~, равный -0,42 В. Чем меньше потенциал окислительно-восстановительной системы, тем легче она отдает электроны и в большей степени является восстановителем. Чем выше потенциал системы, тем сильнее выражены ее окислительные свойства, т. е. способность принимать электроны. Это правило лежит в основе последовательности расположения промежуточных переносчиков электронов от водородов субстратов до кислорода.
Редокс-потенциалы Е°' связаны с изменением свободной энергии AG0' уравнением Нернста: Л(г' - -zF х Д£°', где z — число перенесенных в реакции электронов, F — постоянная Фарадея (96,5 кДжхВ 'хмоль '), А£°' — разность редокс-потенциалов электронно-донорной и электронно-акцепторной пар. Промежуточные переносчики электронов располагаются так, что А£°' постоянно уменьшается, а редокс-потенци-ал, соответственно возрастает. Таким образом, на каждом этапе передачи электрона соседнему по цепи переносчику высвобождается свободная энергия.
При изучении окислительных процессов в клетках целесообразно придерживаться следующей схемы использования кислорода (табл. 9.1).
Здесь рассматриваются три основных пути: 1) окисление субстрата путем дегидрирования с переносом двух атомов водорода на атом кислорода с образованием Н2О (энергия окисления аккумулируется в форме АТФ, на этот процесс расходуется более 90 % кислорода) или молекулу кислорода с образованием Н2О2; 2) присоединение атома кислорода с образованием гидроксильной группы (повышение растворимости субстрата) или молекулы кислорода (метаболизм и обезвреживание устойчивых ароматических молекул); 3) образование кислородных свободных радикалов, служащих как для защиты внутренней среды организма от чужеродных макромолекул, так и для повреждения мембран в механизмах окислительного стресса.
В биохимии и клеточной биологии под тканевым (клеточным) дыханием понимают молекулярные процессы, в результате которых происходит поглощение клеткой кислорода и выделение
Таблица 9.1. Основные пути использования кислорода в клетках
Окисление субстрата (R)
Дегидрирование Оксигенирование Свободнорадикальное окисление
-2Н -2Н +1/2О2 д о- НО* NO* ONOO-030Н
на ’/7 О2 на О?
н2о НД R-OH ro2
Тканевое дыхание Простые окислительные системы Монооксигеназный путь Диоксигеназный путь
АТФ Обезвреживание Обезвреживание Разрыв ароматических колец
Тепло Тепло
128
Биологическое окисление. Цепь переноса электронов Глава 9
углекислого газа. Клеточное дыхание включает 3 стадии. На первой стадии органические молекулы — глюкоза, жирные кислоты и некоторые аминокислоты — окисляются с образованием ацетил-КоА. На второй стадии ацетил-КоА вступает в ЦТК, где его ацетильная группа ферментативно окисляется до СО2 и выделяется HS-KoA. Энергия, высвобождающаяся при окислении, накапливается в восстановленных переносчиках электронов НАДН и ФАДН2. На третьей стадии электроны переносятся к О2, как конечному акцептору, через цепь переносчиков электронов, которая называется дыхательная цепь или цепь переноса электронов (ЦПЭ). При переносе электронов по дыхательной цепи выделяется большое количество энергии, которая используется для синтеза АТФ путем окислительного фосфорилирования.
Процесс тканевого дыхания оценивают с помощью дыхательного коэффициента:
RQ = число молей образованного COJ число молей поглощенного О2.
Этот показатель позволяет оценить тип топливных молекул, используемых организмом: при полном окислении углеводовдыхательный коэффициент равен 1, белков — 0,80, жиров — 0,71; при смешанном питании величина RQ= 0,85. Газометрическим методом Варбурга изучают тканевое дыхание в срезах органов: при окислении углеводных субстратов коэффициент СО2/О2 стремится к 1, а при окислении липидных субстратов — 0,4—0,7.
ЦПЭ встроена во внутреннюю мембрану митохондрий. Электроны перемещаются по цепи от более электроотрицательных компонентов к более электроположительному кислороду: от НАДН (-0,32 В) до кислорода (+0,82 В).
ЦПЭ — это универсальный конвейер по переносу электронов от субстратов окисления к кислороду, построенный в соответствии с градиентом окислительно-восстановительного потенциа
ла. Главные компоненты дыхательной цепи расположены в порядке возрастания их окислительно-восстановительного потенциала. В процессе переноса электронов по градиенту окислительно-восстановительного потенциала высвобождается свободная энергия.
Строение митохондрий
Митохондрии (MX) являются органеллами клеток (рис. 9.1). Наружная мембрана проницаема для многих малых молекул и ионов, поскольку содержит много митохондриальных поринов — белков с молекулярной массой 30—35 кДа (называются также VDAC). Электрозависимые анионные каналы VDAC регулируют поток анионов (фосфаты, хлориды, органические анионы и адениловые нуклеотиды) через мембрану. Внутренняя мембрана митохондрий не проницаема для большинства ионов и полярных молекул. Имеется ряд специальных переносчиков для АТФ, пирувата и цитрата через внутреннюю мембрану митохондрий (рис. 9.2). Во внутренней мембране митохондрий выделяют матриксную (N) поверхность и цитозольную (Р) поверхность.
Митохондрии содержат собственную кольцевую ДНК, которая кодирует синтез ряда РНК и белков. Человеческая митохондриальная ДНК содержит 16569 пар оснований и кодирует 13 белков цепей переноса электронов. Митохондрии также содержат ряд белков, которые кодируются ядерной ДНК.
Существует мнение, что реально в клетках существует митохондриальный ретикулум, посредством которого формируется одна гигантская разветвленная митохондрия. При электронномикроскопическом анализе клеток выявляется общепринятая картина отдельных митохондрий, получаемая в результате поперечных срезов разветвленной структуры митохондрии. При гомогенизировании тканей выделяются отдельные митохондрии как результат
129
Глава 9 Биологическое окисление. Цепь переноса электронов
Рис. 9.1. Строение митохондрии.
АТФ-АДФ Дикарбокси- Трикарбокси- Переносчик Переносчик транслоказа латный латный пирувата фосфата переносчик переносчик
Рис. 9.2. Транспортеры веществ через внутреннюю мембрану митохондрий (Berg J. М., Tymoczko J. L., Stryer L., с изм ).
замыкания разрушенных мембранных структур митохондрии. Единая для клетки мембранная структура митохондрии может служить для транспорта энергии в любые отделы клетки. Такие митохондрии обнаружены, например, в мышцах.
Представим информацию о классической функциональной компартмента-лизации митохондрий:
1. Внешняя мембрана MX отграничивает внутреннее пространство; проницае
130
Биологическое окисление. Цепь переноса электронов Глава 9
ма для О2 и ряда низкомолекулярных веществ. Содержит ферменты метаболизма липидов и моноаминов.
2. Межмембранное пространство (ММП) содержит аденилаткиназу (АТФ + АМФ * 2 АДФ) и ферменты фосфорилирования АДФ, не связанные с дыхательными цепями.
3. Внутренняя мембрана митохондрий (ВМП): 20~25 % от всех белков составляют ферменты цепей переноса протонов и электронов и окислительного фосфорилирования. Проницаема лишь для малых молекул (О2, мочевина) и содержит специфические трансмембранные переносчики.
4. Матрикс содержит ферменты цикла трикарбоновых кислот,
р-окисления жирных кислот (основные поставщики субстратов окисления). Здесь находят ферменты автономного митохондриального синтеза ДНК, РНК, белков и др.
Компоненты дыхательной цепи
Митохондриальная дыхательная цепь состоит из серии последовательных переносчиков электронов, большинство из которых являются интегральными белками с простетическими группами, способными принимать и отдавать один или два электрона. Различают три типа переноса электронов: 1) прямой перенос электронов, например, за счет восстановления Fe3+ в Fe2+; 2) перенос атомов водорода (Н+ и е); 3) перенос гидрид-иона (: Н) , который содержит два электрона.
Электроны для дыхательной цепи образуются в результате действия ферментов дегидрогеназ — пиридинзависимых дегидрогеназ и флавиновых ферментов, которые собирают электроны от субстратов катаболических путей и аккумулируют их в универсальных акцеп
торах электронов — никотинамидных нуклеотидах (НАД+ или НАДФ+) или флавиновых нуклеотидах (ФМН или ФАД).
Пиридинзависимые дегидрогеназы
1. Пиридинзависимые дегидрогеназы — сложные ферменты, у которых в качестве кофактора выступает НАД' или НАДФ+.
2. НАД+ или НАДФ+ являются водорастворимыми коферментами, которые свободно диссоциируют от апофермента. Их специфичность определяется апоферментом.
3. Ферменты локализованы в матриксе митохондрий и цитозоле. Для некоторых их них имеются митохондриальные и цитозольные изоферменты.
4. Уравнение реакции, катализируемой пиридинзависимыми дегидрогеназами, можно изобразить следующим образом:
ЗН2 + НАД+*-*5 + НАДН + Н*
SH2 + НАДФ* *-S + НАДФН + Н+
5. Активной частью НАД+ (НАДФ+) является никотинамидное кольцо (витамин РР, ниацин), которое в окисленном состоянии является ароматическим и имеет положительный заряд (поэтому окисленная форма кофермента обозначается НАД+(НАДФ+), хотя суммарный заряд отрицательный).
6. Под действием пиридинзависимых дегидрогеназ от субстрата отщепляются 2 атома водорода. В пара-положение (по отношению к атому азота) никотинамидного кольца переносятся протон и 2 электрона (гидрид-ион, Н ). Второй протон остается в среде. Восстановленную форму НАД+ обозначают НАДН+Н* (рис. 9.3).
7. НАД+ может получать восстановительные эквиваленты от субстратов, которые окисляются НАДФ-зависимы-
131
Глава 9 Биологическое окисление. Цепь переноса электронов
Рис. 9.3. Структура НАД+ (НАДФ+). Перенос протонов и электронов.
ми дегидрогеназами в реакции, катализируемой никотинамиднуклеотид-трансгидрогеназой\
НАДФН + НАД* *-* НАДФ* + НАДН
8. Суммарная концентрация НАД+ +НАДН в тканях составляет около
10-5 моль, НАДФ++НАДФН в 10 раз меньше. В большинстве клеток и тканей отношение НАД+/НАДН является высоким, что способствует окислению субстратов и переносу гидрид-иона к НАД+. В то же время, количество НАДФН превышает коли
132
Биологическое окисление. Цепь переноса электронов Глава 9
чество окисленной формы, что обеспечивает перенос гидрид-иона от НАДФН к субстрату.
Метаболическая роль коферментов: НАД* используется в окислении, которое является частью катаболических процессов, НАДФН используется как восстановитель в анаболических реакциях (биосинтезы, обезвреживание).
Некоторые ферменты могут использовать оба кофермента, но большинство ферментов имеют один из пиридинза-висимых коферментов.
9. НАДН и НАДФН не проходят через внутреннюю мембрану митохондрий, но могут передавать электроны в митохондрию через специальные механизмы.
Флавиновые ферменты (флавопротеины)
1. Флавопротеины содержат очень прочно связанный нуклеотид — флавинмононуклеотид (ФМН) или флави-надениндинуклеотид (ФАД). ФМН — нуклеотид, который состоит из 6,7-ди-метилизоаллоксазина, спирта рибитола и остатка фосфорной кислоты. ФАД — ФМН + аденозинмонофосфат (рис. 9.4). 2. Окисленный флавиновый нуклеотид принимает один электрон (атом водорода) с образованием семихинона (полухинона), или два электрона (атома водорода) с образованием ФМНН2 или фадн2.
3. Присоединение электронов (атомов водорода) происходит к I и 10 атомам азота 6,7-диметилизоаллоксазина.
4. Поскольку флавопротеины участвуют в одно- или двуэлектронном транспорте, они являются посредниками между реакциями, в которых передаются два электрона (дегидрирование), и реакциями, в которых принимается только
один электрон (например, восстановление хинона в гидрохинон).
5. ФАД-зависимые дегидрогензы являются первичными акцепторами электронов и окисляют сукцинат или ацил-КоА; ФМН-зависимая дегидрогеназа входит в состав НАДН-дегидрогеназы и окисляет НАДН.
Убихинон (кофермент Q)
Название убихинон произошло из-за его повсеместного распространения в биологических системах,
1. Кофермент Q — хиноновое производное с длинным изопреноидным хвостом. Число изопреновых единиц в коферменте Q зависит от вида живых организмов. У млекопитающих его наиболее распространенная форма содержит 10 изопреновых единиц и обозначается как Q10. Изопреновый хвост обусловливает высокую степень неполярности кофермента Q, которая способствует его быстрой диффузии в липидном бислое внутренней мембраны митохондрий. Поэтому убихинон выполняет роль посредника в переносе восстановительных эквивалентов между другими менее подвижными переносчиками электронов в мембране.
2. Убихинон может присоединять один или два электрона и превращаться в семихинон радикал (QH*) или убихинол (QH2), соответственно (рис. 9.5).
3. Поскольку убихинон переносит электроны и протоны, он выполняет важную роль в сопряжении потока электронов и протонов.
4. После кофермента Q следует одноэлектронный перенос, в котором участвует система цитохромов.
Цитохромы
1. Различают 5 типов цитохромов: b, с, с а и Указанные цитохромы отличаются
133
Глава 9 Биологическое окисление. Цепь переноса электронов
по структуре и свойствам. Все цитохромы — белки, у которых простетической группой является гем. Гем — комплекс тетрапиррольного порфирина и железа.
2. Простетической группой цитохромов Ь, с1 и с является железосодержащий протопорфирин IX, который также служит простетической группой в миогло-
134
Биологическое окисление. Цепь переноса электронов Глава 9
бине, гемоглобине и каталазе (рис. 9.6). 3. Гем цитохромов с и ср в отличие от цитохрома Ь, ковалентно связан с белковой частью за счет образования ти-оэфирных связей между сульфгидрильными группами остатков цистеина и винильных радикалов гема (рис. 9.7).
4. Цитохромы а и й? имеют иную про-стетическую группу, которая отличается от цитохромов с и с/ 1) в 8-м положении вместо метильной группы находится формильная группа; 2) во 2-м
положении вместо винильной группы находится углеводородная цепь фар-незила (С15); 3) гем присоединен к белку нековалентной связью (рис. 9.8).
5. Суммарно отличия в строении гемов цитохромов представлены в табл. 9.1.
6. Цитохромы айв являются интегральными белками внутренней мембраны митохондрий, цитохром с является растворимым протеином, который связан силами электростатического взаимодей-
135
Глава 9 Биологическое окисление. Цепь переноса электронов
136
Биологическое окисление. Цепь переноса электронов Глава 9
Рис. 9.8. Гем а.
Таблица 9.1. Строение гемов у различных цитохромов
Тип Заместители
Гем а R2 “ ~СН(ОН)-СНг-фарнезил Rd = -СН=СН, Re = -CHO
Гем b R2 = - СН=СНг R =-СН-СН, RB = -CH3
Гем с R2 = — CH(CH3)-S-R R4 = — CH(CH3)-S-R RB = -CH3
137
Глава 9 Биологическое окисление. Цепь переноса электронов
ствия с наружной стороной внутренней мембраны митохондрий.
7. Перенос электронов цитохромами осуществляется за счет изменения валентности атома Fe (Fe3' <—► Fe2').
Железо-серные (FeS) белки
FeS-белки содержат атомы Fe, которые не входят в состав гема (негемовое железо). Внутри железо-серных белков находятся FeS кластеры (центры). Известно несколько типов FeS кластеров. FeS кластеры содержат один или несколько атомов железа, связанных с SH-группами остатков цистеина или неорганическим кислотолабильным сульфидным ионом. Наиболее простой тип FeS кластера содержит один атом железа, координационно связанный с сульфгидрильными группами остатков цистеина белка (рис. 9.10а). Второй тип, обозначаемый [2FeS-2S], содержит 2 атома железа и 2 неорганических сульфида и 4 остатка цистеина (рис. 9.106). Третий тип, l4Fe-4S], содержит 4 атома железа, 4 неорганических сульфида и 4 остатка цистеина (рис. 9.10в).
Rieske FeS-белки являются разновидностью FeS белков, в которых атом Fe
связан координационными связями с двумя остатками гистидина.
Окислительно-восстановительный потенциал FeS-белков в зависимости от структуры белковой части колеблется от -0,65 В до +0,45 В.
Перенос электронов в FeS кластерах осуществляется за счет изменения валентности железа Fe2+ *—► Fe3!.
Организация цепи переноса электронов
Переносчики электронов в дыхательной цепи организованы в надмолекулярные комплексы. Обработка внутренней мембраны митохондрий детергентом позволяет выделить четыре комплекса, каждый из которых катализирует перенос электронов от одной части цепи к другой (табл. 9.2).
Комплекс I и II катализирует перенос электронов от различных доноров электронов: комплекс I — от НАДН, комплекс II — от сукцината; комплекс III переносит электроны от убихинона к цитохрому с, комплекс IV переносит электроны от цитохрома с на О2.
Рис. 9.10. Железо-серные кластеры (центры) (D. L. Nelson, М. М. Сох, с изм.).
138
Биологическое окисление. Цепь переноса электронов Глава 9
Таблица 9.2. Комплексы митохондриальной цепи переноса электронов
Ферментативный I комплекс Молекулярная масса (кДа) Число субъединиц Простатические группы
I НАДН-дегидрогеназа (НАДН-КоО-оксидоредуктаза) 850 42 (14) ФМН, FeS
II Сукцинатдегидрогеназа 140 5 ФАД, FeS
III Убихинон: цитохром с-оксидоредуктаза (цитохром Ьс1 комплекс) 250 11 Гемы, FeS
Цитохром с* 13 1 Гем
IV Цитохромоксидаза (цитохром с-оксидаза) 160 13 (3-4) Гемы, Си. Си„ ’ А, В
Примечание: цитохром сне входит в состав комплекса; цитохром с является растворимым белком и перемещается между комплексами III и IV.
Комплекс I (НАДН-дегидрогеназа)
Комплекс I катализирует перенос электронов от НАДН к коферменту Q |KoQ). На рис. 9.11 представлена взаимосвязь между комплексами I, II и убихиноном.
1. Комплекс представляет собой фермент, состоящий из 42 полипептидных пепей, связан с внутренней мембраной митохондрии и пересекает ее поперечном направлении (рис. 9.12).
2. Простетическими группами являются ФМН-содержащий флавопротеин и шесть FeS-центров.
3. Комплекс I катализирует 2 сопряженных процесса: 1) экзергонический транспорт к убихинону гидрид-иона от НАДН и протона из матрикса (НАДН - Н+ + Q - НАД+ + QH2) и 2) эндергонический перенос 4-х протонов из .матрикса в межмембранное пространство.
4. Комплекс I катализирует перенос гидрид-иона от НАДН к ФМН, от которого 2 е~ движутся через ряд FeS-центров к FeS-белку N-2 в матриксной части комплекса. От N-2 электроны переносятся к убихинону на мембран
ной части комплекса с образованием QH2.
5. Движение протонов в межмембранное пространство приводит к образованию электрохимического потенциала на внутренней мембране митохондрий, который накапливает энергию, высвобождаемую при переносе электронов. При этом наружная сторона мембраны, обращенная к межмембранному пространству, заряжается положительно, а внутренняя сторона, обращенная к матриксу, отрицательно.
6. Суммарное уравнение реакции, которое показывает локализацию протонов можно записать следующим образом: НАДН + 5 H+N + Q -* НАД+ + QH2 + 4Н+р, где N (negative) —• отрицательно заряженная сторона мембраны (матрикс), Р (positive) — положительно заряженная сторона внутренней мембраны митохондрий (межмембранное пространство)
7. Убихинол (QH2) диффундирует во внутренней мембране митохондрий от комплекса I к комплексу III, где окисляется до Q.
С помощью электронной микроскопии установлено, что НАДН-дегидрогеназа состоит из
139
Глава 9 Биологическое окисление. Цепь переноса электронов
Межмембранное пространство
Гпицерол-3-фосфат Глицерол-З-фосфат-(цитозоль) дегидрогеназа
Ацил-КоА
Рис. 9.11. Движение электронов от НАДН, сукцината, ацил-КоА и глицерол-3-фосфата к убихинону (D. L. Nelson, М. М. Сох, с изм.).
2-х частей (имеет L-образную форму). Гидрофобный горизонтальный фрагмент находится в толщине липидного бислоя и содержит субъединицы, которые кодируются митохондриальной ДНК. Вертикальный фрагмент содержит периферические мембранные белки и обращен к матриксу митохондрий. НАДН связывается с вертикальным фрагментом и переносит электроны на ФМН. Затем электроны перемещаются внутри вертикального фрагмента через три [4Fe-4S] центра на прочно связанный KoQ. Пара электронов от KoQ переносится на [2Fe-2S] центры и на мобильный KoQ гидрофобного слоя мембраны.
Комплекс II (сукцинатдегидрогеназа)
1. Комплекс II является интегральным белком, связанным с внутренней мембраной митохондрий и окисляет сукцинат (янтарную кислоту — промежуточный продукт цикла трикарбоновых кислот).
2. Простатические группы: ФАД, FeS-центры с четырьмя атомами Fe. Электроны транспортируются от сукцината к
140
Глава 9 Биологическое окисление. Цепь переноса электронов
Q ^цит Ь (+2) у QH Fe-S (+2) QH. АцитЬ(+3) >*QH2^ Fe-S (+3)
. цитс7 (+3)
* ** цит Cf (+2)
ЦИТ с (+2)
X
4 цит с (+3)
Рис. 9.13. Перенос электронов.
Рис. 9.14. Цитохром Ьс} комплекс (комплекс III) (D. L. Nelson, М. М. Сох, с изм.).
электронов и протонов через этот комплекс — Q цикл.
Комплекс III представляет собой димер, состоящий из 2-х идентичных мономеров, каждый из которых включает 11 субъединиц (рис. 9.14). Димерная структура необходима для функционирования комплекса III.
1. Структура мономера. Функциональное ядро состоит из 3-х субъединиц: цитохром b с двумя гемами (Ьн и Z>L), Rieske FeS белок с 2Fe-2S центрами и цитохром с, с гемом. Гемы цитохрома Ь имеют различное сродство к электронам из-за различной структуры полипептид ной цепи, которая их
окружает. Гем bL, который локализован возле цитозольной стороны внутренней мембраны митохондрий, имеет низкое сродство к электрону по сравнению с гемом Лн, который находится в мембране со стороны матрикса.
2. Функциональная единица. Цитохром ct и Rieske FeS-белок защищены от Р стороны и взаимодействуют с цитохромом с (не является частью функционального комплекса) в межмембранном пространстве. Комплекс имеет два различных центра для связывания убихинона — Qnh Qp, которые являются сайтами действия ингибиторов окислительного фосфорилирования. Антимицин А, который
142
Биологическое окисление. Цепь переноса электронов Глава 9
блокирует движение электронов от гема bit к Q, связывается с Qnh закрывает гем Ьв на матриксной стороне мембраны. Миксотиазол, который предотвращает движение электронов от QH2 к Rieske FeS-белку, связывается с Qfl вблизи 2Fe-2S центра и гемом Ь{ на Р стороне мембраны.
3. Взаимодействие между мономерами формирует два кармана, каждый из которых содержит Qp сайт от одного мономера и QN сайт другого мономера.
Механизм переноса электронов в Ш комплексе достаточно сложен (рис. 9.15).
Убихинол переносит один из 2-х электронов на FeS-центр редуктазы. Этот электрон затем переносится на цитохромы с, и с, который забирает электрон от комплекса.
Этот одноэлектронный перенос превращает убихинол (QH2) в семихинон анион (Q*“). Q* переносит электрон к Л, и превращается в Q. Гем \ восстанавливает /?н, который затем восстанавливает прочно связанный KoQ возле цитозольной стороны мембраны и превращает его в Q*~. На этой стадии только один из электронов переносится на цитохром с.
Затем вторая молекула QH? взаимодействует с комплексом аналогично описанному выше механизму (рис. 9.16). Один из электронов переносится к FeS кластеру и на цитохромы ct и с. Второй электрон переносится на цитохромы Ьп Ьн и восстанавливает Q' (Q-цикл). Таким образом, в результате полного цикла две молекулы QH2 окисляются с образо
Рис. 9.15. Механизм переноса электронов в комплексе III (первая стадия).
Рис. 9.16. Механизм переноса электронов в комплексе HI (вторая стадия).
143
Глава 9 Биологическое окисление. Цепь переноса электронов
ванием двух молекул Q и одна молекула Q восстанавливается до QH2. Значение такого механизма заключается в переносе 2-х электронов от одной молекулы QH2 к двум молекулам цитохрома с.
На Р стороне мембраны 2 молекулы QH2 окисляются до Q в Qp сайте, высвобождая 4 протона в межмембранное пространство. Каждая молекула QH2 отдает один электрон (через Rieske Fe-S-центр) к цитохрому с\ и один электрон (через цитохром Ь) к молекуле Q на QN сайте, восстанавливая его в две стадии до QH2. В процессе восстановления используется 2Н+ из матрикса (рис. 9.17).
Суммарное уравнение восстановительных реакций Q цикла можно представить следующим образом:
QH2 + 2 цитС; (окисленный) + 2 H*N-* Q + 2 цит Cj (восстановленный) + 4 Н\
Q цикл обеспечивает связь между переносчиком двух электронов убихиноном и одноэлектронными переносчиками цитохромами (Ь, с{ и с) и объясняет выталкивание 4-х протонов в межмембранное пространство на каждую пару электронов, транспортируемых через комплекс к цитохрому с. Несмотря на то, что путь электронов через этот участок дыхательной цепи сложный, суммарный эффект переноса достаточно простой: QH2 окисляется до Q и две молекулы цитохрома с восстанавливаются.
Цитохром с является растворимым белком межмембранного пространства. После принятия электрона от комплекса III, цитохром с движется к комплексу IV и отдает электроны к атому меди этого комплекса.
Комплекс IV (цитохром с-оксидаза, цитохромоксидаза)
Комплекс IV катализирует перенос электронов от цитохрома с к молекулярному кислороду, как конечному акцептору. Для полного восстановление
кислорода до Н2О необходимо 4 электрона и 4Н+.
4 цит с (восстановл.) + 4 Н4 + 02 * 4 цит с (окислен.) + 2 Н20
Комплекс IV представляет собой большой фермент (13 субъединиц, м. м. 204 000 Да) внутренней мембраны митохондрий. Известно, что 3 субъединицы кодируются митохондриальной ДНК. Содержит две молекулы гема а и а3 и два иона меди (СиА и Сив), которые принимают электрон и восстанавливаются (Си2+ *—►Си,+) (рис. 9.18).
Электроны передаются: цитохром с * СиА + Fe гема а -* Fe гема а3- Спв. Гем а3 вместе с атомом меди Сив образует «бинуклеарный центр», с которым связывается кислород. Кислород остается связанным между планарной структурой гема а. и Сивдо полного восстановления. Это препятствует образованию токсичных свободных радикалов.
Для каждых 4-х электронов, проходящих через комплекс, фермент использует 4 «субстратных» Н+ из матрикса (N сторона), превращая кислород в Н2О. Энергия восстановительной реакции используется для выталкивания в межмембранное пространство (Р сторона) одного Н+ на каждый транспортируемый электрон.
Суммарное уравнение, катализируемое комплексом IV можно представить следующим образом:
4 цит с (восстановл.) + 8 H+N + О2 -* 4 цит с (окислен.) + 4Н+р + 2 Н2О
К 6-й координационной связи железа цитохрома а могут присоединяться HCN, H2S, СО. При этом валентность железа (Fe3+) становится постоянной и поток электронов прекращается. Это механизм действия дыхательных ядов.
144
Биологическое окисление. Цепь переноса электронов Глава 9
Окисление первого QH2
Окисление второго QH2
= ис. 9.17. Q цикл (D. L. Nelson, М. М. Сох, с изм.).
2124
145
Глава 9 Биологическое окисление. Цепь переноса электронов
Рис. 9,18. Движение электронов через комплекс IV (D. L. Nelson, М. М. Сох, с изм.).
Суммарная схема движения электронов и протонов через дыхательную цепь ферментов
Итак, общая схема движения электронов и протонов через 4 комплекса дыхательной цепи представлена на рис. 9.19.
Электроны поступают к Q через комплексы I и II. QH2 является подвижным переносчиком электронов и протонов. QH2 отдает электроны ком
плексу III, который передает их другому мобильному переносчику — цитохрому с. Комплекс IV транспортирует электроны от восстановленного цитохрома с к О2. Движение электронов через комплексы I, III и IV сопровождается выталкиванием протонов из матрикса в межмебранное пространство. Окисление высших жирных кислот также поставляет электроны в дыхательную цепь ферментов через Q (см. рис. 9.11).
146
Биологическое окисление. Цепь переноса электронов Глава 9
НАДН+Н’ НАД’
Рис. 9.19. Суммарная схема движения электронов через дыхательную цепь ферментов (D. L kelson, М. М. Сох, с изм.).
Мутации НАДН-KoQ редуктазы, которая кодируется митохондриальной ДНК, вызывают наследственную зрительную нейропатию Лебера, наследуемую по материнской линии форму слепоты. Мутации гена приводят к нарушению использования НАДН или блокируют перенос электронов к KoQ. Нейропатия является одним из многочисленных митохондриальных заболеваний, которые вы
явлены в настоящее время. Органы и ткани, функционирование которых зависит от окислительного фосфорилирования и продукции энергии, такие как, нервная система и сердце, наиболее уязвимы к мутациям митохондриальной ДНК. Митохондриальные мутации могут способствовать развитию возрастных и дегенеративных процессов.
147
Глава 10
J
ИИ
Окислительное фосфорилирование
Определение окислительного фосфорилирования
Синтез АТФ из АДФ и неорганического фосфата, сопряженный с переносом протонов и электронов по дыхательной цепи от субстратов к кислороду, называется окислительным фосфорилированием.
Энергия окисления, достаточная для образования молекулы АТФ, выделяется в дыхательных цепях в следующих участках: 1) НАДН-дегидрогеназа; 2) убихинон: цитохром с-оксидоредуктаза; 3) цитохром c-оксидаза. На этих стадиях изменения ОВП превышают 0,22 В, что достаточно для образования макроэрги-ческой связи АТФ (> 30,2 кДж/моль). Уменьшение свободной энергии, сопровождающее перенос протонов и электронов на кислород в результате одного дегидрирования, составляет примерно 220 кДж/моль. При этом на синтез АТФ в полной дыхательной цепи может быть израсходовано 30,2x3 = 90,6 кДж/ моль. Отсюда КПД ЦПЭ около 40 %. Остальная энергия рассеивается в виде тепла (поддержание температуры тела).
Механизм окислительного фосфорилирования
Известны три основных гипотезы окислительного фосфорилирования.
1. Механохимическая, или конформационная (Грин, Бойер, 60-е гг. XX в.). В процессе переноса протонов и электронов изменяется конформация белков-ферментов. Они переходят в новое богатое энергией состояние, а затем при возвращении в исходную конформацию отдают энергию для синтеза АТФ. Гипотеза частично подтверждена: Еокисл.-* Еконформ. сдви-гов - ЕДТФ.
2. Гипотеза химического сопряжения (Липман, Слейтер, Ленинджер, 30—40-е гг. XX в.). В сопряжении дыхания и фосфорилирования участвуют сопрягающие вещества, например, вещество X. Вещество «X» акцептирует протоны и электроны от первого фермента в пункте сопряжения, и взаимодействует с Н3РО4. В момент отдачи протонов и электронов второму ферменту пункта сопряжения связь становится макроэрги-ческой. Далее макроэрг передается на АДФ с образованием АТФ. До настоя-
148
Окислительное фосфорилирование Глава 10
шего времени не выделены сопрягающие вещества.
3. Хемиосмотическая гипотеза П. Митчелла (1961). В 1961 году Питер Митчелл предположил, что синтез АТФ сопряжен с протонным градиентом поперек внутренней мембраны митохондрий. Согласно его модели, перенос электронов вдоль компонентов дыхательных цепей внутренней мембраны митохондрий обеспечивает перенос протонов через (поперек) внутреннюю мембрану митохондрий на ее цитозольную сторону. В результате на внутренней мембране митохондрий формировался электрохимический градиент. Эта идея П. Митчела была названа хемиос-мотической гипотезой. Установлено, что
величина pH снаружи мембраны была на 1,4 единицы ниже, чем на внутренней поверхности мембраны, а мембранный потенциал составил 0,14 В. Этот потенциал соответствовал свободной энергии 5,2 ккал (21,8 кДж) на моль протонов.
По современным представлениям дыхание и фосфорилирование связаны между собой электрохимическим потенциалом (ЭХП) на внутренней мембране митохондрий (рис. 10.1). Для объяснения необходимы следующие понятия: а) внутренняя мембрана митохондрий непроницаема для Н+ и ОН ; б) во внутреннюю мембрану митохондрий вмонтирована АТФ-синтаза {комплекс Р), катализирующая обратимую реакцию:
НАДН+Н
НАД
АТФ
Межмембранное пространство
Сукцинат Фумарат
Цит cj к
АДФ+РН
Матрикс
Рис. 10.1. Хемиоосмотическая гипотеза Митчелла (О. L. Nelson, М. М. Сох, с изм.).
149
Глава 10 Окислительное фосфорилирование
АТФ + Н2О <•— АДФ + Рн. АТФ-син-таза состоит из следующих компонентов: Fo (oligomycin-sensitive) — гидрофобный сегмент из 13 полипептидных цепей, связанный с внутренней мембраной митохондрий; Fo — это протонный канал, по которому в норме через мембрану могут перемещаться только протоны; F, (первый фактор, который был определен как необходимый для окислительного фосфорилирования) — периферический мембранный белок (сопрягающий фактор), катализирующий синтез АТФ при перемещении протонов; в) синтез АТФ осуществляется при перемещении протонов через АТФ-синтазу в направлении от ММП (межмембранное пространство) к матриксу.
Суть окислительного фосфорилирования: за счет энергии переноса электронов в ЦПЭ (Еокисления) происходит движение протонов через мембрану в ММП и создается электрохимический потенциал (Еэхп). При возвращении протонов назад через АТФ-синтазу энергия ЭХП трансформируется в энергию АТФ — Еатф.
Итак” F F "► F hi юл. 1-окисл 1_эхп и.дТф.
НАДН-дегидрогеназа, убихинон: цитохром с-оксидоредуктаза и цитохром с~ оксидаза выталкивают протоны в межмембранное пространство. Протоны берутся из Н2О матрикса или за счет конформационных изменений в ферментах. Со стороны матрикса на мембране будет преобладать отрицательный заряд (избыток ОН ), а со стороны ММП положительный (за счет НО- Возникает ЭХП, который состоит из двух компонентов: химического (разности концентраций ионов Н+) и электрического (разности электрических потенциалов): ДрН+ = дар + ДрН Эта величина
измерена, она равна -0,14 В. При обратном токе протонов через канет АТФ-синтазы (разрядка мембраны) синтезируется АТФ.
Структура АТФ-синтазы
Митохондриальный F, компонент состоит из 9 субъединиц пяти типов: аф3у4Е. р-субъединицы имеют один каталитический сайт для синтеза АТФ. Головка каталитического Ff компонента представляет собой сферу высотой 8 нм и шириной 10 нм, состоящей из а и р-субъединиц, расположенных подобно долькам апельсина (рис. 10.2). Полипептиды, которые образуют стебель Fp расположены асимметрично: один домен у-субъединицы образует центральный ствол, который проходит через Fp второй домен у-субъединицы связан с одной из трех р-субъединиц, которая обозначается р-«пустая».
Хотя аминокислотная последовательность 3-х р-субъединиц идентична, они отличаются по конформации и поэтому у-субъединица может связываться только с одной из р-субъединиц. Конформации р-субъединиц обозначаются, как р-АТФ, р-АДФ и р-«пустая», показывая, какие нуклеотиды с ними связаны в данный момент. Это важно для механизма действия комплекса.
Fo компонент образует протонный канал и состоит из субъединиц 3-х типов а, Ь и с в соотношении ab2cw_n (рис. 10.2). с-Субъеди-ница представляет собой небольшой (м. м. 8000), гидрофобный полипептид, состоящий из 2-х трансмембранных спиралей, локализованных почти полностью в мембране с небольшой петлей, выступающей из матриксной стороны мембраны. Кристаллическая структура FoFj у дрожжей, установленная в 1999 г., показала, что трансмембранные спирали с-субъе-диницы строго перпендикулярны плоскости мембраны и формируют два концентрических круга: внутренний круг образован N-концевы-ми участками каждой е-субъединицы, внешний круг — С-концевыми участками спирали. s и у-субъединицы Fj связаны с
150
Окислительное фосфорилирование Глава 10
Рис. 10.2. Структура FoF1 комплекса (D. L. Nelson, М. М. Сох, с изм.).
лииндром, образованным с-субъединицами, нормируя своеобразный «ствол» структуры. Ответим, что Ь субъединицы Fo связаны сайр--Абъединицами Fp обеспечивая их ориентацию относительно мембраны. При движении прогонов через Fo из межмембранного пространства в матрикс цилиндр и ствол поворачиваются и р-субъединицы Ft изменяют конформацию, поскольку у-субъединица связывается с каждой из них при повороте.
Механизм синтеза АТФ
Механизм синтеза АТФ был предложен Р. Boyer и включает 3 стадии, в результате которых происходит изменение конформации р-субъединицы: 1) р-
субъединица находится в 0-АДФ конформации и связана с АДФ и Рн; 2) субъединица изменяет конформацию, способствующим образованию р-АТФ формы, которая прочно связывает и стабилизирует АТФ; 3) субъединица меняет конформацию на р-«пустая», которая имеет низкое сродство к АТФ и вновь синтезированная молекула освобождается с поверхности фермента. Следующий цикл начинается, когда 0-субъединица снова переходит в конформацию р-АДФ и связывает АДФ и Рн.
Механизм синтеза АТФ представлен на рис, 10.3. F, комплекс имеет 3 центра для связывания с адениловыми нуклеотидами, один на каждую пару ар-субъединиц.
151
Глава 10 Окислительное фосфорилирование
Рис. 10.3. Механизм синтеза АТФ (D. L. Nelson, М. М. Сох, с изм.).
В данный момент один из этих центров находится в р-АТФ конформации (связан прочно с АТФ), второй центр находится в р-АДФ конформации и третий центр пустой (р- «пустая» конформация). Конформационные изменения происходят при движении протонов через Fo компонент АТФ-синтазы. Движение протонов через Fc канал вызывает поворот центрального ствола у-субъединицы, ко
торая перпендикулярна плоскости мембраны, вокруг оси на 120°. у-Субъедини-ца проходит через центр а3р3-сфероида, который ориентирован неподвижно относительно поверхности мембраны Ь2 и 8-субъединицами. Этот вызывает кооперативные конформационные изменения, при которых р-АТФ центр превращается в конформацию «р-пустая» и АТФ диссоциирует; р-АДФ центр превращается в
152
Окислительное фосфорилирование Глава 10
7 - АТФ конформацию, которая обеспечи-нгет реакцию АДФ+Рн с образованием \ТФ: р-«пустой» центр превращается в р-ЧДФ центр, который связывает АДФ и ?н. Таким образом, полный поворот у-:убъединицы вызывает прохождение *дждой р-субъединицы через все возможные конформационные состояния и за чин поворот головки синтезируются 3 молекулы АТФ.
эоль протонного градиента в активном транспорте
Тля синтеза АТФ используется энергия протонного потенциала на мембране ч ипохондрий. Однако эта энергия используется также для процессов обме--а АТФ матрикса на АДФ цитозоля. Внутренняя мембрана митохондрий непроницаема для заряженных молекул, но в ней находятся две специфические системы транспорта АДФ и Рн в матрикс и АТФ из матрикса в цитозоль.
Адениннуклеотидтранслоказа (интегральный белок внутренней мембраны) рис. 10.4) связывает АДФ3- в межмембранном пространстве и транспортирует его в матрикс в обмен на молекулу АТФ4, одновременно транспортируемую из матрикса. Поскольку при этом транспорте перемещаются 4 отрицательных заряда наружу и три внутрь, образуется электрохимический трансмембранный градиент, который заряжает матрикс отрицательно. Электрохимический градиент обеспечивает обмен АТФ-АДФ. Транслоказа специфически ингибируется атрактилозидом — токсическим гликозидом, выделяемым чертополохом. Если транспорт АДФ и АТФ ингибируется, цитозольный АТФ не может синтезироваться из АДФ.
Второй транспортной системой, необходимой для окислительного фосфорилирования является фосфаттранслока-за (рис. 10.4), которая обеспечивает
симпорт Н2РО4’ и одного Н+ в матрикс. Этот процесс обеспечивает образование протонного градиента.
Количественная оценка окислительного фосфорилирования
Для количественного выражения окислительного фосфорилирования введен коэффициент окислительного фосфорилирования, который представляет собой отношение числа молекул неорганического фосфата, перешедших в состав АТФ в процессе дыхания, на каждый поглощенный атом кислорода.
Возникает вопрос, какое количество протонов необходимо для синтеза 1 молекулы АТФ? Количество протонов, выталкиваемых в межмембранное пространство, равно 10 Нт для НАДН и 6 Н для сукцината. Большинство исследователей считает, что для синтеза 1 молекулы АТФ необходимо 4Н+, один из которых используется для транспорта Рн, АТФ и АДФ через митохондриальную мембрану. Следовательно, коэффициент P/О равен 2,5 (10/4) доя НАДН и 1,5 (6/4) для сукцината. Считают, что примерно 2,5 молекулы цитозольной АТФ образуется в процессе переноса пары электронов от НАДН на О2. Для электронов, поступающих от убихинон: цитохрам С-оксидо-редуктазы, равно как и от сукцината или цитозольного НАДН, образуется 1,5 молекулы АТФ на пару электронов.
Итак, поток двух электронов через НАДН- Q-оксидоредуктазу, Q-цитохром-с-оксидоредуктазу и цитохром-с-оксида-зу обеспечивает синтез 1,1 и 0,5 молекул АТФ, соответственно.
Образуется 2,5 молекулы АТФ при окислении молекулы НАДН и 1,5 молекулы АТФ при окислении молекулы ФАДНг.
153
Глава 10 Окислительное фосфорилирование
Образованная в результате окислительного фосфорилирования в митохондриях АТФ обменивается на внеми-тохондриальную АДФ с помощью специальных белков транслоказ (транслоказы составляют до 6 % от всех белков внутренней мембраны митохондрий).
Дыхательный контроль и нарушения клеточного дыхания
Дыхательный контроль — это регуляция скорости переноса электронов по дыхательной цепи отношением АТФ/ АДФ. Чем меньше это отношение (преобладает АДФ), тем интенсивнее идет
дыхание (что обеспечивает реакцию АДФ + Рн -* АТФ). Это видно по увеличению потребления кислорода митохондриями после добавки АДФ (эксперименты Чанса) или по усиленному дыханию бегущего человека.
Ингибиторы дыхания
Вещества, прекращающие поток электронов по дыхательной цепи ферментов, называют ингибиторами дыхания.
1. Ингибиторы транспорта электронов от НАДН к коферменту Q: ротенон (инсектицид), барбитураты (амобарбитал, секобарбитал), пирицидин (антибиотик). Предотвращают генерирование протонного градиента в комплексе Г. В
154
Окислительное фосфорилирование Глава 10
? же время указанные ингибиторы не эушают окисление сукцината.
2. Антимицин А тормозит поток элект-~снов от KoQ к цитохрому с, предотвращая синтез АТФ, сопряженный с ге-- ерированием протонного градиента в омплексе III. Этот блок можно обой-добавлением аскорбиновой кислоты, *. вторая непосредственно восстанавливает цитохром с.
3. Транспорт электронов может быть ^локирован между цитохромоксидаз--ым комплексом и кислородом под цгйствием CN , N3 и СО. В присут--твии этих ингибиторов из-за прекра-_ения тока электронов не происходит фосфорилирования, сопряженного с ге--ерированием протонного градиента в комплексе IV,
4. Олигомицин и дициклогексилкарбо-.щимид (DCCD) предотвращают поток т ротонов через АТФ-синтазу,
5. АТФ-АДФ-транслоказа специфически ингибируется очень низкими концентрациями атрактилозида или бон-•:рековой кислотой (антибиотик), Хтрактилозид связывается с транслоказой на цитозольной поверхности мем-Зраны, а бонкрековая кислота —- на стороне матрикса. Блокада транслоказы ведет к остановке окислительного фосфорилирования.
Разобщение дыхания и окислительного фосфори рован ия
Возникает при повышении проницаемости мембраны митохондрий для протонов в любом месте, а не только в канале АТФ-синтазы. При этом не создается электрохимический потенциал, и энергия окисления рассеивается в виде тепла. Так действуют ионофоры (2,4-динитрофенол, валиномицин и др.). Они переносят обратно протоны через мембрану, выравнивая градиенты pH и .мембранного потенциала. Лекарствен
ные препараты (аминобарбитал), продукты жизнедеятельности микроорганизмов, избыток тироидных гормонов (вызывают накопление ненасыщенных жирных кислот, являющихся ионофорами) и др. приводят к разобщению дыхания и фосфорилирования, обеспечивая гипертермию.
На разобщении дыхания и фосфорилирования базируется терморегуляторная функция тканевого дыхания. Тканевое дыхание, протекающее в митохондриях и не сопровождающееся образованием макроэргов, называют свободным или нефосфорилирующим окислением.
Природным разобщающим агентом является термогенин, протонный канал в митохондриях бурых жировых клеток. Бурый жир обнаружен у новорожденных и животных, впадающих в зимнюю спячку, и служит для теплообразования. При охлаждении организма норадреналин активирует гормонзависимую липазу. Благодаря активному липолизу в организме образуется большое количество свободных жирных кислот, которые распадаются в результате ₽-окисления и в дыхательной цепи. Так как жирные кислоты одновременно открывают протонный канал термогенина, их распад не зависит от наличия АДФ, т. е. протекает с максимальной скоростью и генерирует энергию в форме тепла.
Г ипоэнергетические состояния
Гипоэнергетические состояния возникают при нарушении:
1) поступления субстратов для дегидрирования (на всех этапах от пищи до матрикса митохондрий);
155
Глава 10 Окислительное фосфорилирование
2) поступления О2 в митохондрии (на всех этапах дыхания, связывания кислорода с гемоглобином, транспорта и пр.); 3) мембран митохондрий, композиции липидного бислоя и ферментативных ансамблей внутренней мембраны митохондрий.
Напомним, что предложено вычислять энергетическое состояние клетки, вычисляя «заполнение» системы АТФ-АДФ-АМФ макроэргами. Если все три компонента представлены АТФ, то система энергетически полностью заполнена и ее энергетический заряд равен 1,0. Если же система представлена только АМФ, то ее энергетический заряд равен 0. Энергетический заряд клетки является важной величиной, определяющей соотношение катаболических и анаболических процессов в ней. В тканях животных важную регуляторную роль выполняет величина отношения АТФ/АДФ.
В сутки человек потребляет в среднем 27 моль кислорода. Основное его количество (примерно 25 моль) используется в митохондриях в ЦПЭ. Следовательно, ежесуточно синтезируется 125 моль АТФ, или 62 кг (при расчете использован коэффициент Р/О = 2,5, т. е. среднее значение коэффициента фосфорилирования). Масса всей АТФ, содержащейся в организме, составляет примерно 20-30 г. Следовательно, каждая молекула АТФ за сутки 2500 раз проходит процесс гидролиза и синтеза.
Окислительные системы, не связанные с запасанием энергии
Пероксидазный путь
Другой тип дегидрирования субстратов, заключающийся в переносе двух атомов
водорода на молекулу кислорода, называется пероксидазным: RH2 I О , -* R + Н2О2. Энергия окисления выделяется в виде тепла. Это простые окислительные системы, представленные ФМН- и ФАД-содержащими ферментами, а также металлопротеинами. Они более широко распространены в растительных клетках, чем в клетках животных и человека. В клетке около 80 % этих ферментов сосредоточено в пероксисомах. Кроме того, они встречаются в мембранах, граничащих с цитозолем. Так происходит окисление альдегидов, аминов, L- и D-аминокислот, пуринов и др. Некоторые из названных веществ являются токсическими. В лейкоцитах, гистиоцитах и других клетках, способных к фагоцитозу, пероксидазный путь окисления субстратов очень активен. Образующаяся Н2О2 используется для обезвреживания болезнетворных бактерий и распада инфекционного материала, поглощенного клетками. Однако избыточное накопление перекиси водорода токсично, особенно для нефагоцитирующих клеток. Накопление пероксидов и генерация свободных радикалов может приводить к повреждению мембран (рак, атеросклероз).
Для предотвращения повреждающего действия пероксидов служат две ферментативные системы. Первая — фермент пероксидаза, простетической группой которой является протогем. Ферменты этого типа широко представлены у растений, а также встречаются в молоке, лейкоцитах, тромбоцитах и тканях, продуцирующих эйкозаноиды: Н2О2 + RH2 -* 2Н2О + R, где RH2 — аскорбиновая кислота, хиноны, цитохром С, глутатион. В эритроцитах и некоторых других тканях присутствует глутатионпероксидаза, содержащая Se в качестве простетической группы. Этот фермент защищает мембраны и гемоглобин от окисления пероксидами. Второй фер
156
Окислительное фосфорилирование Глава 10
мент — каталаза, являющийся гемопротеином (4 гема): 2Н2О2 -► 2Н2О + О2. Эта реакция напоминает пероксидазную, только вместо RH2 используется Н ,О,. Каталазу находят в крови, костном мозге, слизистых оболочках, печени, почках, т. е. в клетках, где происходит интенсивное окисление с образованием Н2О2.
Оксигеназный путь
Оксигеназы — это ферменты, катализирующие включение атома или молекулы кислорода в субстрат окисления. Служат для синтеза и деградации различных метаболитов. Оксигеназы представлены двумя типами ферментов.
Монооксигеназы (оксигеназы со смешанной функцией, гидроксилазы, микросомальное окисление) катализируют присоединение одного атома кислорода к молекуле субстрата. При этом возникает гидроксильная группа, повышается растворимость вещества и проявляются новые фармакологические свойства. Для работы монооксигеназной системы необходимы следующие основные компоненты: неполярный субстрат R-CH3; кислород О—О; дополнительный субстрат НАДФН+Н+ — донор атомов водорода; цитохром Р-450.
Связанный с СО цитохром Р-450 имеет максимум поглощения при 450 нм (отсюда название — цит Р-450). Выполняет две функции: 1) связывание субстрата гидроксилирования; 2) на цит Р-450 происходит активация молекулярного кислорода.
Монооксигеназный путь окисления локализован в мембранах эндоплазматического ретикулума (после разрушения клеток эти мембраны замыкаются в микросферы — микросомы). Микросомальное окисление представляет короткую цепь, включающую НАДФ, ФАД, Fe2S2 — белки (адрено-
доксин), цитохромы Р-450, Ь5. В общем виде микросомальное окисление неполярных ксенобиотиков (лекарств) осуществляется с помощью гидроксилазного цикла.
Процесс микросомального гидроксилирования можно представить следующим уравнением:
КСН3+НАДФН+Н+ + о2 * rch2oh + надф* + н2о,
где: RCH3 — окисляемый субстрат.
Следует отметить, что окисление органических соединений в микросомальных монооксигеназных реакциях, в отличие от реакций митохондриального окисления, как правило, не решает никаких энергетических задач, а выполняет защитную (детоксикационную) и пластическую функции. Окисленные продукты могут быть использованы в качестве пластического материала или сразу же удаляются из организма.
Весь каталитический процесс микросомального окисления может быть разбит на 6 основных стадий.
1, Вещество, подвергающееся биотрансформации (RCH3), на этой стадии взаимодействует с окисленной формой цитохрома Р-450 (Fe3+) с образованием фермент-субстратного комплекса RCH3 -Р-450 (Fe3+). Трехвалентное железо не может связывать кислород.
2. НАДФН+Н+ передает 2 атома водорода на ФАД. ФАД восстанавливается в ФАДН2.
3. С помощью FeS белков происходит разделение потоков протонов и электронов. 1-й электрон связывается с комплексом RCH3 — Р-450 (Fe3+) и переводит его в RCH3 — Р-450 (Fe2+).
4. Восстановленный фермент-субстрат-ный комплекс взаимодействует с молекулярным кислородом с образованием тройного оксигенированного фермент-субстратного комплекса RCH3-Р-450 (Fe2+) - О2.
157
Глава 10 Окислительное фосфорилирование
5. Происходит восстановление кислорода за счет второго электрона и превращение его в свободный радикал — RCH3-P-450 (Fe2+) - О2* .
6. Стадия характеризуется внутримолекулярными превращениями восстановленного тройного комплекса и его распадом с высвобождением воды и гидроксилированного субстрата (RCH2OH). При этом цитохром Р-450 переходит в исходную форму, готовую к взаимодействию со следующей молекулой субстрата.
В митохондриях содержится монооксигеназная система, локализованная на внутренней стороне внутренней мембраны митохондрий, которая выполняет биосинтетическую функцию, т. е. введение ОН-групп при биосинтезе стероидных гормонов (кора надпочечников, семенники, яичники, плацента), холестерола, при образовании кальцитрио-ла (витамин Д3) из 25-гидроксихоле-кальциферола в почках и при синтезе желчных кислот в печени.
Диоксигеназный путь
Включение двух атомов кислорода в молекулу субстрата R + О2 -► RO2 катализируется ферментами диоксигеназами. Этот путь служит для превращения молекул, содержащих ароматические кольца, например, гомогентизиновую кислоту. Одной из биологически важных диоксигеназных реакций является разделение молекулы p-каротина на 2 молекулы ретиналя (одна из форм витамина А).
Свободно-радикальное окисление
Под свободными радикалами понимают молекулу или ее часть, имеющую неспаренный электрон на молекулярной или на внешней атомной орбите. Появление неспаренного электрона — реализация у молекулы свободной валентности. Свободные радикалы реакционноактивны и вступают в химические реакции для приобретения недостающего электрона. Полное восстановление О, до Н2О требует присоединения 4 электронов: О2 + 4е’ + 4Н+ * 2Н2О (рис. 10.5).
При неполном восстановлении (т. с. присоединении 1, 2 или Зе ) образуются свободно-радикальные формы кислорода: О2*“ — супероксидный анион-ра-дикал; НО* — гидроксильный радикал (RO* — алкоксидьный радикал), НО2* — гидропероксильный радикал.
К реактивным формам кислорода относят оксид азота (NO*), пероксинитрит (ONOO-) и озон. По L. Flohe и Н. Budde (2006) в клеточной биологии под свободными радикалами понимают малые высоко реактивные О-, N-, S- и С-центровые радикалы, которые участвуют в оксидативном или нитросативном стрессе. Нитросативный стресс характеризуется суперпродукцией NO*, который часто усугубляет эффекты избыточной продукции супероксидного аниона.
Супероксидный радикал может возникать в процессе биохимических реакций (окисление с помощью флавопротеинов, в цепях монооксигеназных реакций и др.).
О2 е->о;~ е>2н+> Н2 О2 —НО" + НО*—e’2bL->2Н2 О
Рис. 10.5. Восстановление кислорода.
158
Окислительное фосфорилирование Глава 10
Свободные радикалы инициируют цепные реакции. Если в реакцию вступают ненасыщенные жирные кислоты, то говорят о пероксидном окислении липидов (ПОЛ). Этот процесс важен для развития патологических состояний, связанных с повреждением мембран. Схема цепных реакций:
1. Инициация при действии R*, металлов, излучений: X*+RH-*R*+XH.
2. Удлинение, разветвление: R* + О2-> ROO* (пероксидный радикал). ROO* + RH •* R* + ROOH (гидроперекись) и т. д.
3. Терминация (обрыв цепи): ROO* + R,’ -* ROORp R* + R/-> RR,
Применительно к фрагменту ненасыщенной жирной кислоты можно показать ранние, средние и поздние продукты пероксидного окисления. Во всех полиненасыщенных жирных кислотах присутствует дивинилметановая структура, которая легко вступает в реакцию отрыва протона, сопровождающуюся образованием свободного радикала. Ранние продукты ПОЛ — диеновые конъюгаты; средние продукты ПОЛ — гидроперекиси; конечный продукт ПОЛ — малоновый диальдегид. Эти процессы лежат в основе повреждения мембран клеток.
организма, определяемой специальными клетками тканей и крови.
Типичным свободнорадикальным процессом является защитная функция фагоцитов. Свободнорадикальный процесс при окислительном стрессе начинается от НАДФН оксидазы — трансмембранного цитохром b содержащего флавопротеина (gp91)phox: НАДФН+(Х->2О* +НАДФ++ Н+. Супероксидный анион является не очень агрессивным радикалом. Как слабое основание он ассоциируется в супероксидный радикал с рК 5. При низких значениях pH в вакуолях фагоцитов происходит спонтанная дисмутация: но2* + о; + н+- н2о2+ о2и но2* + НО2* -* Н2О2 + О2 При нейтральном значении pH для превращения супероксидного аниона требуется су-пероксиддисмутаза. Это завершение свободнорадикального процесса. Однако образованная перекись водорода или гидропероксиды (ROOH) могут вновь образовать агрессивные гидроксильный или алкоксильный радикалы: Н2О2 * 2НО* и ROOH * НО* + RO*.
Для лабораторной диагностики ряда патологических состояний перспективно определение в выдыхаемом воздухе этана, который выделяется при окислении со3-жир-ных кислот, например, а-линолено-вой 18:3, Д9-12-15, а также пентана — при окислении оо6-жирных кислот, например, линолевой 18:2, Д9-12 или арахидоновой 20: 4, д5-8-1114.
Свободнорадикальные процессы лежат в основе биохимических механизмов неспецифической резистентности
Возникает вопрос, сколько в клетке содержится О’” ? Подсчитано, что в оптимальных условиях при 37'С клетки кишечной палочки (£. coll) поглощают примерно 6 хЮ6 молекул кислорода в секунду. Около 0,1 % кислорода превращается в супероксидный анион. Клетка может аккумулировать 240 мкмоль/ мин супероксидного аниона. 95 % О’” обезвреживается с помощью суперок-сиддисмутазы и 5 % остается для взаимодействия с молекулами-мишенями (I. Fridovich, 2001).
В полиморфноядерных лейкоцитах при окислительном стрессе миелопероксида
159
Глава 10 Окислительное фосфорилирование
за приводит к образованию гипохлорита: Н2О2 + СГ * ОСГ + Н2О. Затем возможны превращения: СГ + ОСГ+ ГГ “► С12 + ОН“ и С1, СГ + СГ. Эти молекулы оказывают бактерицидное действие. Кроме этого гипохлорит и перекись водорода могут генерировать синглетный кислород при ультрафиолетовом облучении, который способен окислять ненасыщенные жирные кислоты.
В макрофагах возможна синхронная продукция двух радикалов О* и NO*, которые могут образовать пероксинитрит: О* + NO’ -♦ ONOO”. Пероксинитрит, не являясь радикалом, участвует в бактерицидном эффекте. При закислении среды он может вновь создать аг-рессивные свободные радикалы: hoono- но* + no;.
Патологии, связанные с повреждениями свободно-радикального генеза: атерогенез, бронхит, эмфизема, болезнь Паркинсона, мышечная дистрофия Дюшена, рак шейки матки, алкогольное повреждение печени, диабет, острое повреждение почек, синдром Дауна, цереброваскулярные заболевания, ишемия, реперфузионные нарушения.
Антиоксидантная защита
Сдерживание процессов свободно-радикального окисления осуществляется с помощью неферментативных и ферментативных механизмов.
1. Неферментативная защита включает: комплексоны, связывающие металлы (этилендиаминотетрауксусная кислота); в водной фазе — витамин С, ураты, ароматические амины, SH-соединения; в липидной фазе — жирорастворимые витамины А (р-каротин), Е, гормоны стероидной природы, тироксин.
2. Ферментативная защита включает фермент супероксиддисмутазу (в цитозоле, ядрах и лизосомах простатическая группа — Cu2+, Zn2+, в митохондриях и у бактерий — Мп2+): О2*“ + О;~ + 2Н+->Н2О2 + О2. Перекись водорода обезвреживается в каталазной илй пероксидазной (чаще глутатионпероксидаз-ной) реакциях. Активатор реакции — Se. В продукты питания добавляют антиоксидантные добавки: p-каротин, «-токоферол, ВНА — бутиловый гидроксианизол, В НТ — бутиловый гидрокситолуен. Для профилактики радиационных поражений используют комплексы витаминов А, Е, С и р-каротин, Е, С.
В заключение лекции приведем материалы об окислительно-восстановительных процессах в биологических системах с позиций биофизики.
Редокс-потенциал
Редокс-потенциал (по Г. Г. Мартинович, С. Н. Черенкевич, 2007). Стандартные редокс-потен-циалы участников основных биохимических реакций при pH 7,0 располагаются в диапазоне от -420 мВ (2Н+/Н2) до +820 мВ (О2/Н2О). Эти значения можно рассматривать как два крайних состояния воды при стандартных условиях: предельная оксигенация с Е — +820 мВ и деоксигенация с предельным насыщением газообразным водородом с Е= —420 мВ. Стандартные восстановительные потенциалы некоторых участников биохимических реакций в организме представлены в табл. 10.1. Восстановители или вещества, являющиеся донорами электронов в биологических системах, имеют высокое отрицательное значение восстановительного потенциала. Окислители или акцепторы электронов имеют высокие положительные значения восстановительного потенциала.
Установление величины восстановительного потенциала редокс-реакции позволяет определить преимущественное направление переноса электронов между участниками реакции. В любой окислительно-восстановительной реакции участвует две пары веществ. Например, в реакции KoQ- + О2 -* KoQ + О2“ первая ре-
160
Окислительное фосфорилирование Глава 10
Таблица 10.1. Редокс-пары и их стандартные восстановительные потенциалы (при pH 7,0)
Редокс-пара Е°(мВ)
О’Н, Н7НгО’ +2180
о’Н /но- +1900
о3, Н7но; +1800
RO’, H7ROH +1600
NO7 NO’ +1200
о3/о;- +1040
ROO’, HVROOH +1000
О3’-, 2Н7НгОг +940
ГБ’, HVrSH +900
О2, 2Н7Н2О +820
ТО’, Н7ТОН +500
Н2О2, Н7Н2О, О’Н +320
АК’, ИТАК +282
KoQ, 2Н+ /KoQH2 +100
ДАК, Н7АК +58
KoQ/KoQ’" -40
о2/о2- -137
ДАК/АК* -174
Г58Г/2Г5Н -240
НАД7НАДН -320
НАДФ7НАДФН -320
2Н7Нг -420
NOV 'NO -1700
докс-пара состоит из восстановленной формы _ KoQ (анион-радикала семихинона) и окисленной формы KoQ (убихинона), вторая ре-докс-пара состоит из восстановленной формы О2“ и окисленной формы О2.
Стандартное значение редоке-потенциала для пары KoQ/KoQ*- при pH 7,0 составляет — 40 мВ. Стандартное значение редокс-потенциала для пары О2 /О’” при pH 7,0 составляет — 137 мВ. Значение разности редокс-потенциалов (Д£ = £°'кислорода — £”' убихинона ~ ~~97 мВ < 0) между этими двумя редокс-парами указывает на то, что при стандартных условиях в соответствии с вышеприведенным уравнением будет протекать обратная реакция, т. е. перенос электронов будет происходить с кислорода на убихинон.
Анализ уравнения Нернста указывает на то, что изменение концентрации окисленной или
восстановленной форм участников окислительно-восстановительных реакций может существенно изменить скорость и направление переноса электронов. Следует отметить, что знание значений восстановительных потенциалов позволяет предсказать направление переноса электронов в системах только при стан-дартных условиях. Редокс-потенциал представляет собой меру свободной энергии реакции окисления-восстановления для любой замкнутой окислительно-восстановительной системы, находящейся в состоянии равновесия.
Живой организм принципиально отличается от такой системы. В организме протекают не отдельные, изолированные окислительно-восстановительные реакции, которые рассматриваются в классической физической химии, а существует система таких реакций. Однако,
161
Глава 10 Окислительное фосфорилирование
хотя организм и является открытой системой, поскольку он постоянно обменивается веществом и энергией с окружающей средой, но ряду показателей он характеризуется постоянством ряда своих свойств во времени, т. е. находится в стационарном состоянии.
Активные формы кислорода
(по Г. Г. Мартинович, С. Н. Черенкевич, 2007)
Во всех живых клетках, которые используют кислород для дыхания, образуются активные формы кислорода, обладающие высокой биологической активностью. В настоящее время термин «активные формы кислорода» объединяет целый ряд образующихся в организме промежуточных продуктов метаболизма кислорода, таких как синглетный кислород (1О2), супероксидный (О*“), гидроксильный (НО*), гидропероксильный (НО*), пероксильный (RO*) радикалы, монооксид (NO*) и диоксид азота (NO*), пероксинитрит-ион (ONOO), гипохлорит (CIO), озон (О3), пероксид водорода (Н2О2), монооксид углерода (СО) и другие. К этому классу высокореакционных соединений относят различные химические соединения: свободные радикалы, бирадикалы, ионы и кислоты. В некоторых случаях NO’, NO* и ONOO- выделяют в отдельную группу веществ, объединяемую термином
«активные формы азота». Однако, из-за сходства строения и механизмов действия в биологических системах целесообразно использовать один термин. И хотя с физико-химической точки зрения термин АФК не вполне удачен, широкое использование его не вызывает сомнений. Основные формы АФК и их времена жизни при физиологических условиях среды представлены в табл. 10.2.
Первичным свободным радикалом в большинстве биологических систем является супероксидный анион-радикал, основным источником которого в неактивированных клетках служат митохондрии. В организме человека, вес которого составляет 80 кг, за счет перехода электронов в митохондриальной электронтранспортной цепи на кислород образуется 215—430 мМ супероксидных анион-радикалов в сутки. Наряду с этим внешняя мембрана митохондрий содержит источник генерации Н2О2, не относящийся к дыхательной цепи, — фермент моноаминоксидазу, катализирующий окислительное дезаминирование биогенных аминов. Следует отметить, что скорость генерации Н2О2 моноаминоксидазой при окислительном дезаминировании катехоламинов на 2 порядка выше, чем скорость генерации Н2О2 электронтранспортной цепью (4,5* 10-5 М с-1 и 2,8* L0-7 М с-1, соответственно).
Таблица 10.2. АФК и время их жизни при физиологических условиях
Название Обозначение Время жизни, с
Молекулярный кислород о2 > 100
Синглетный кислород А 10-6
Супероксидный анион-радикал о2- 10-6
Гидроксильный радикал но* 10-9
Гидропероксильный радикал ног 10 в
Пероксид водорода НА 10-100
Монооксид азота NO* 1-100
Диоксид азота NO* 10-7-10-а
Нитрозоний (нитрозильный катион) NO’ 10-ю
Нитроксил (нитроксильный анион) NO Ю-з
Пероксинитрит-ион ONOO" 0,05-1
Карбонатный анион-радикал COf ю-m о-8
Монооксид углерода СО 10
162
Окислительное фосфорилирование Глава 10
Время жизни, химическая активность, и, следовательно, расстояние, которое успевают пройти молекулы АФК до взаимодействия с мишенью, зависит от их типа. Вследствие высокой химической активности время жизни радикалов НО' в клетке составляет около ;0-9с, а расстояние, которое они успевают пройти от места их образования, не превы-иает 3 нм. Поэтому действие гидроксильного эадикала обычно рассматривается только лишь на те мишени, в непосредственной близости-от которых они образованы. С дру-ой стороны, Н2О2, являясь наиболее стабильной формой АФК, может вступать в эеакции с мишенями, удаленными на расстояние в несколько клеточных диаметров от места образования окислителя.
Среди различных АФК можно выделить две руплы: первичные и вторичные. Первичные ХФК — это те АФК, которые образуются непосредственно в ферментативных реакциях, протекающих в клетках. Вторичные АФК — jTo те АФК, которые образуются в результате взаимодействия АФК между собой или другими молекулами. В табл. 10.3 представлены некоторые первичные и вторичные АФК и их возможные механизмы образования. Принципиальная разница в биологическом действии первичных и вторичных АФК состоит в том, что первичные АФК выполняют прежде всего регуляторные функции и участвуют в процес
сах внутриклеточной и внеклеточной сигнализации, в то время как вторичные АФК вызывают повреждение биомолекул и несут ответственность за развитие многих заболеваний.
Молекулярный кислород в основном триплетном состоянии содержит два неспаренных электрона с одинаковым спином на различных тг*-разрыхляющих орбиталях. Молекула в этом состоянии обладает меньшей свободной энергией, чем в синглетном состоянии, где электроны имеют противоположно направленные спины и находятся на одной ('Ду) или на разных (]Zg+) 2р—я*торбиталях. В отличие от молекулы кислорода в основном триплетном состоянии, синглетный кислород (1О2) обладает высокой химической активностью по отношению к ненасыщенным жирным кислотам, ароматическим аминокислотам и основаниям. Основными реакциями образования синглетного кислорода в живых системах являются реакции фотосенсибилизированного окисления биологических молекул.
Для присоединения пары электронов к молекуле кислорода в основном состоянии необходимо, чтобы спин одного из электронов изменил направление. Обращение спина электрона — процесс медленный по сравнению со временем жизни комплексов, образующихся в момент соударения реагирующих частиц. В результате спинового запрета окисление по одноэлектронному механизму про-
Таблица 10.3. Первичные и вторичные АФК
Первичные АФК Ферменты, участвующие в образовании АФК
07 НАДФН-оксидаза, NO-синтаза, НАДН-убихинон оксидоредуктаза, убихинол-цитохром с оксидоредуктаза, ксантиноксидаза и др.
: "А Супероксиддисмутаза, NO-синтаза, моноаминоксидаза, тирозингидроксилаза, фумаратредуктаза, сукцинатдегидрогеназа, аспартатоксидаза и др.
NO* NO-синтаза
сю- Миелопероксидаза
: со Гемоксигеназа
( Вторичные АФК Реакции образования АФК
НО' hoono- но'+ no;
' no;- hoono-* но' + no;
со;- onoo- + со2- no; + со;
163
Глава 10 Окислительное фосфорилирование
те кает предпочтительнее, чем по двухэлектронному.
Продукт одноэлектронного восстановления кислорода в реакции О2 + е -* О*“ называют супероксидным анион-рддикалом (сокращенно супероксидом) в его ионизированной форме и гидропероксильным радикалом в его протонированной форме. Гидропероксильный радикал НО" является слабой кислотой с рКа= 4,8 и подобно другим кислотам диссоциирует в воде. Гидропероксильный радикал является более сильным окислителем, чем супероксидный ани-он-радикал и может непосредственно реагировать с линолевой, линоленовой и арахидоновой кислотами с образованием гидроперекисей. При физиологических pH (7,4) количество НО" в среде составляет лишь незначительную часть (0,25 %) от концентрации О"’. Супероксидный анион-радикал обнаружен практически во всех клеточных структурах, хотя в ряде случаев источники его возникновения не ясны. Супероксид обладает электрическим зарядом и его движение через мембрану клеток осуществляется по анионным каналам. Наличие проницаемых для О’” каналов продемонстрировано на эритроцитарной мембране. В отличие от О’” его протонированная форма НО* не несет заряда и поэтому сравнительно легко проникает через биологические мембраны.
Антиокислительная система клеток
(по Г. Г. Мартинович, С. Н. Черенкевич, 2007)
Организм человека обладает многоуровневой системой защиты от повреждающего действия окислителей. Существуют различные классификации компонентов антиокислительной системы (АОС). По молекулярному строению в составе АОС выделяют ферменты и органические соединения, не обладающие ферментативной активностью. По отношению к действию в водной или липидной фазе восстановители делят на полярные и неполярные (или водо- и жирорастворимые). По локализации действия относительно клеточных структур компоненты АОС разделяют на мембранные, внутриклеточные и внеклеточные. Традиционно к ферментам АОС клеток относились только те ферменты, которые принимали непосредственное участие в утилизации окислителей, т. е. су-пероксиддисмутазы, пероксидазы и каталазы.
Следует обратить внимание на то, что при восстановлении супероксиддисмутазой одного окислителя супероксидного анион-радикала — образуется другой окислитель — пероксид водорода. При утилизации Н2О2 миелопероксидазой образуется гипохлорит. Восстановление Н2О2 глутатионпероксидазой увеличивает внутриклеточную концентрацию TSSr. В свою очередь, при восстановлении TSSr глутатионредуктазой увеличивается концентрация НАДФ+. Таким образом, в работе АОС клеток участвует целый комплекс ферментов, в который наряду с супероксиддисмутазой, каталазой и пероксидазой необходимо включать различные редуктазы (глутатионре-дуктазу, метионинсульфоксидредуктазу, диас-корбатредуктазу и т. д.).
Помимо ферментов к АОС относят ряд метаболитов клетки, включая липоевую, аскорбиновую и мочевую кислоты, семейство токоферола, каротиноиды (около 500 соединений), флавоноиды и полифенолы (около 4000—5000 соединений), ураты и другие соединения. Следует отметить также антиокислительные свойства аминокислоты таурина, присутствующей в большинстве клеток эукариот и в жидких средах организма. В настоящее время внимание исследователей привлекают антиокислительные свойства гистидинсодержащего дипептвда карнозина, который способен нейтрализовать практически все активные формы кислорода. Жиро-растворимый продукт катаболизма гемсодержащих белков — билирубин также является эффективным антиокислителем при физиологических условиях. Важным полифун-кциональным антиокислителем является мелатонин (N-ацетил-5-мстоксигршггамин) — индольный гормон эпифиза. Отдельные элементы АОС в клетке действуют комплексно, часто усиливая эффекты друг друга. Представления об этих взаимодействиях и об АОС в целом в настоящее время окончательно не сформированы и постоянно расширяются.
Окислительный и восстановительный стресс
(по Г. Г. Мартинович, С. Н.
Черенкевич, 2007)
В настоящее время не вызывает сомнения факт образования различных АФК при нормальных
164
Окислительное фосфорилирование Глава 10
физиологических условиях. В большинстве работ, посвященных изучению регуляторной и токсической роли АФК, термин «окислитель-ный стресс» используется для обозначения •чрезмерного» образования АФК в клетке. Однако практически нигде в литературе не обсуждается величина «нормы» образующихся АФК. В клетке постоянно протекают процессы и образования и утилизации АФК. В результате сопряженного функционирования систем генерации АФК и антиокислительной защиты, а также мембранных систем транспорта различных типов окислителей и восстановителей, в клетке устанавливается определенный окислительно-восстановительный баланс или редокс-состояние. Поддержание этого баланса является жизненно необходимым как для отдельных клеток, так и для организма в целом. Параметры этого баланса, определяемые типом и концентрацией различных АФК и антиоксидантов, для разных клеток и тканей организма значительно различаются.
При окислительном стрессе концентрация АФК повышается и может поддерживаться на новом уровне постоянно. Такое повышение концентрации АФК может быть вызвано активацией систем генерации АФК или снижением активности АОС. АФК в высоких концентрациях играют важную роль в развитии старения и многих заболеваний человека, в том числе кардиомиопатии, атеросклероза, нейро-дегенеративных заболеваний, инфаркта и инсульта и многих других. В литературе описано свыше 200 заболеваний, при которых окислительный стресс наблюдается на начальных стадиях или имеет место в течение всего периода протекания заболевания.
Становится очевидным, что кратковременное повышение концентрации АФК может
иметь различные сигнальные функции, как, например, индуцирование изменения концентрации несвязанных ионов кальция. Постоянно повышенный уровень внутриклеточной концентрации несвязанных ионов кальция может приводить к гибели клеток. С другой стороны, кратковременные скачки концентрации ионов кальция в цитоплазме выполняют сигнальную функцию и регулируют многие клеточные процессы. Следует отметить, что про-цессы изменения внутриклеточной концентрации свободных ионов кальция и концентрации АФК могут быть взаимосвязанными. Тип функционального ответа клеток, опосредованного изменениями амплитуды и продолжительности внутриклеточного кальциевого сигнала, может кодироваться амплитудой и временным интервалом увеличения внутриклеточной концентрации окислителей. В свою очередь, постоянно высокое значение концентрации восстановителей или восстановительный стресс также может иметь драматические последствия для жизнедеятельности клеток. Показано, что антиоксидант L-сщетил-цистеин вызывает апоптоз гладкомышечных клеток мыши и человека. В настоящее время получен ряд данных, указывающих на увеличение концентрации глутатиона в крови онкологических больных и в клетках опухолевой ткани. Также показано повышение содержания аскорбиновой кислоты в раковых клетках. Таким образом, функции окислителей и восстановителей в организме разнообразны и определяются их концентрацией. Весь набор окислителей и восстановителей формирует редокс-состояние клеток и тканей, для количественной характеристики которого необходимо определение ряда физико-химических параметров.
165
Глава 11
.. 1- . - -
Общий путь катаболизма
Общий путь катаболизма включает: 1) окислительное декарбоксилирование пирувата до ацетил-КоА; 2) окисление ацетильной группы ацетил-КоА (2 и 3 углеродные атомы пирувата) в цикле трикарбоновых кислот (ЦТК); 3) выделение и аккумулирование энергии при дегидрировании метаболитов общего пути катаболизма в митохондриальных цепях переноса электронов.
Пируват образуется из углеводов (глюкоза), глицерола, гликогенных аминокислот и лактата. Ацетил-КоА занимает центральное место в общем пути катаболизма и образуется в митохондриях: 1) при окислительном декарбоксилировании пирувата; 2) при 0-окислении жирных кислот; 3) из кетогенных аминокислот.
Окислительное декарбоксилирование пировиноградной кислоты
Пировиноградная кислота связывает гликолиз с циклом трикарбоновых кислот. Пируват переносится из цитозоля в матрикс митохондрий с помо
щью переносчика по механизму сим-порта с протоном. В матриксе митохондрий пируват превращается в аце-тил-КоА. Этот процесс называется окислительное декарбоксилирование пирувата и катализируется пируватдегид-рогеназным комплексом (пируватдегид -рогеназной системой). Высокая концентрация пируватдегидрогеназно-го комплекса обнаружена в сердечной мышце и почках.
Пируватдегидрогеназный комплекс является классическим мультифер-ментным комплексом, в котором промежуточные продукты остаются связанными на поверхности молекулы фермента до образования конечного продукта.
В состав пируватдегидрогеназного комплекса входят 3 фермента и 5 кофакторов. 1-й фермент — пируватдегидрогеназа содержит кофактор тиаминпирофосфат (производное витамина В(); П-й фермент • дигидролипоилтранса-цетилаза содержит кофакторы липое-вую кислоту (ЛК, 6,8-дитиооктановая кислота) и кофермент A (HS-KoA), причем остаток липоевой кислоты присоединен к апоферменту путем образо
166
Общий путь катаболизма Глава 11
вания амидной связи между карбоксильной группой ЛК и с-аминогруппой лизина белка (образуется длинная «рука», состоящая из 13 атомов углерода); Ш-й фермент — дигидролипоилде-гидрогеназа содержит кофакторы ФАД и НАД+(рис. 11.1).
Механизм окислительного декарбоксилирования пирувата
7 этап. Пируват взаимодействует с кофактором пируватдегидрогеназы тиаминпирофосфатом. Основную роль играет второй углеродный атом тиазольного кольца ТПФ, который легко теряет протон, превращаясь в карбанион. Карбанион атакует частично положительно заряженный а-углерод-ный атом пирувата с возникновением связи С—С. Сильно электрофильный атом азота в карбоксиэтил-ТПФ способствует его декарбоксилированию с образованием гидроксиэтил-ТПФ (рис. 11.2).
7/ этап. В следующей реакции, катализируемой дигидролипоилтрансаце-тилазой, гидроксиэтил-ТПФ взаимодействует с липоевой кислотой. Происходит перенос гидроксиэтильной группы на один из атомов серы ЛК. При этом гидроксиэтильная группа окисляется в ацетильную. В процессе окисления гидроксиэтильной группы и восстановления SH-группы ЛК возникает макроэргическая связь. Затем ацетильный остаток переносится на второй кофермент дигидролипоилтрансацети-лазы — HS-KoA, а ЛК полностью восстанавливается. Образованный ацетил-КоА отделяется от полиферментного комплекса.
/7/ этап. Восстановленная форма ЛК окисляется дигидролипоилдегидрогена-зой.
Регуляция пируватдегидрогеназного комплекса
Превращение пирувата в ацетил-КоА — процесс необратимый. Поэтому синтез глюкозы из ацетил-КоА невозможен. Обычно ацетил-КоА далее превращается 2-мя путями: 1) ацетильная группа ацетил-КоА окисляется до СО2 и Н2О через ЦТК и сопряженные цепи переноса электронов с выделением и запасанием энергии в виде АТФ; 2) используется для синтеза кетоновых тел, холестерола и жирных кислот.
Пируватдегидрогеназный комплекс регулируется методом фосфорилирования-дефосфорилирования. Повышение величин отношений НАДН/НАД1, ацетил-КоА/КоА или АТФ/АДФ способствует фосфорилированию фермента про-теинкиназой и инактивации комплекса. Следовательно, пируватдегидрогеназный комплекс инактивируется, если клетка богата энергией и биосинтетическими предшественниками.
Пируват и АДФ, наоборот, активируют пируватдегидрогеназный комплекс посредством ингибирования протеинкиназы.
Вазопрессин активирует пируватдегидрогеназный комплекс путем повышения концентрации ионов кальция в митохондриях, которые активируют протеинфосфатазу (дефосфорилирование фермента). Инсулин также усиливает превращение пирувата в ацетил-КоА через дефосфорилирование пируватдегидрогеназного комплекса.
У людей с недостаточностью про-теинфосфатазы глюкоза превращается до пирувата, а дальнейшие превращения пирувата в ацетил-КоА резко ослаблены, так как пируватдегидрогеназный комплекс фосфорилирован, т. е. не активен. Поэтому пировиноградная кислота
167
Глава 11 Общий путь катаболизма
С-СН3 О О
и ° и и
С-СН2”СН2~О-Р-О-Р-О-6. 6.
Тиаминпирофосфат (ТПФ)
Пантотеновая кислота
р-Аланин
а,у-дигидрокси,р,р-диметилмасляная кислота
СН3 О О
I 4 II II
о—сн2—С-СНОН—C-NH—сн2—СН2~C--NH—сн2—СН2—SH
О=Р-О- СН3 4-------V------
I d Т
РО32'
З'-Фосфоаденозиндифосфат
Кофермент А
S
Н2С“СН2~СН—сн2-сн2-сн2-сн2—соо*
/ S.
( I лк
Х S'"
Липоевая кислота (ЛК)
Рис. 11.1. Кофакторы пируватдегидрогеназного комплекса.
168
Общий путь катаболизма Глава 11
©
-Nt— ОСН3 _ и* и
c.s,c-r2
Пируватдегидрогеназа
Пируват тиф
©
R N----С-СНз
1 fi и Л
НО.
Н3с СОСУ
Карбоксиэтилтиамин-пирофосфат
©
R r'N-С-СН3
'ни л
н3сх \
Дигидролипоил-трансацетилаза
ТПФ
СНз
С;О
XS +HSKoA
ЛК
HS
Гидроксиэтилтиамин- Липоевая
! пирофосфат кислота
Ацетил-липоевая кислота
сн3
— С=О SKoA
Ацетип-КоА
HS
HS
Дигидролипоевая кислота
HSX
ЛК +ФАД HS
Дигидролипоил-дегидрогеназа
S
ФАДН2 + НАД+
-► ФАД + НАДН+Н
НАД++ Н20 + 2,5 АТФ
Рис. 11.2. Окислительное декарбоксилирование пировиноградной кислоты.
преимущественно превращается в молочную кислоту. У людей это ведет к повторяющемуся лактатному ацидозу (подъемы концентрации молочной кислоты в крови), что повреждает многие ткани и особенно центральную нервную систему.
Цикл трикарбоновых кислот
Вторым компонентом общего пути катаболизма является ЦТК. Этот цикл был открыт в 1937 г. Кребсом и Джонсоном. В 1948 г. Кеннеди и Ленинджер доказали, что ферменты ЦТК локализованы в матриксе митохондрий.
169
Глава 11 Общий путь катаболизма
Химизм цикла три карбоновых кислот
1. Свободную уксусную кислоту невозможно окислить путем дегидрирования. Поэтому она в активной форме (ацетил-КоА) предварительно связывается с ок-салоацетатом (ЩУК, щавелевоуксусной кислотой), в результате чего образуется цитрат. Ацетил-КоА соединяется с окса-лоацетатом в реакции альдольной конденсации, катализируемой цитратсин-тазой. Образуется цитрил-КоА. Цитрил-КоА при участии воды гидролизуется до цитрата и HS-KoA (рис. 11.3). 2. Аконитат-гидратаза (аконитаза) катализирует превращение цитрата в изоцитрат через стадию цис-аконитовой кислоты. Аконитаза по механизму действия одновременно гидратаза и изомераза.
3. Изоцитратдегидрогеназа (деарбокси-лирующая) катализирует дегидрирование изолимонной кислоты в оксалосук-цинат (щавелевоянтарную кислоту), которая затем декарбоксилируется в 2-оксоглутарат (а-кетоглутарат). Коферментом является НАД+ (в митохондриях) и НАДФ+ (в цитозоле и митохондриях).
4. 2-Оксоглутаратдегидрогеназный комплекс (а -кетоглутаратдегидрогеназный комплекс) катализирует окислительное декарбоксилирование 2-оксоглутарата в сукцинил-КоА. Мультиферментный 2-оксоглутаратдегидрогеназный комплекс похож на пируватдегидрогеназный комплекс и процесс протекает аналогично окислительному декарбоксилированию пирувата.
5. Сукцинилтиокиназа катализирует расщепление сукцинил-КоА на янтарную кислоту и кофермент А. Энергия расщепления сукцинил-КоА накапливается в виде гуанозинтрифосфата (ГТФ). В сопряженной реакции перефосфорилиро-вания АДФ фосфорилируется в АТФ, а освобождающиеся молекулы ГДФ могут
вновь фосфорилироваться (субстратное фосфорилирование). У растений фермент специфичен к АДФ и АТФ.
6. Сукцинатдегидрогеназа катализирует превращение сукцината в фумаровую кислоту. Фермент стереоспецифичен, является интегральным белком, так как вмонтирован во внутреннюю мембрану митохондрий и в качестве простетичес-ких групп содержит ФАД и железосерные белки. ФАДН2 не отделяется от фермента, а два электрона далее передаются на кофермент Q цепи переноса электронов внутренней мембраны митохондрий.
7. Фумарат-гидратаза (фумараза) катализирует превращение фумаровой кислоты в яблочную (малат) с участием воды. Фермент стереоспецифичен, образует только L-малат.
8. Малатдегидрогеназа катализирует окисление яблочной кислоты в оксало-ацетат. Кофермент малатдегидрогеназы — НАД+. Далее оксалоацетат вновь конденсируется с ацетил-КоА и цикл повторяется.
Биологическое значение и регуляция цикла трикарбоновых кислот
Цикл трикарбоновых кислот — компонент общего пути катаболизма, в котором происходит окисление топливных молекул углеводов, жирных кислот и аминокислот. Большинство топливных молекул поступают в ЦТ К в виде аце-тил-КоА (рис. 11.4). Все реакции ЦТК протекают согласованно в одном направлении. Суммарная величина AG°' = -40 кДж/моль.
В среде врачей давно бытует крылатая фраза «Жиры горят в пламени углеводов». Ее надо понимать как окисление ацетил-КоА, основ-
170
Общий путь катаболизма Глава 11
СОО’ С-О сн2 + РН3 с~о Цитратсинтаза £00 +Н20 сн2 Аконитаза -Н20
СОО’ SKoA ► n(J U UvU > СН2
Оксалоацетат Ацетил-КоА HS-KoA соО’
Цитрат
СОО' Аконитаза
СН2 +Н2О
С-COO' ' -
СН
СОО’
гпп- Изоцитратдегидрогеназа д// (декарбоксилирующая) । и
СН2 Мд2+ СН2
н-с-соо-
СН-ОН
СОО’
НАД* НАДН+Н
н-с-соо-с=о СОО’
Цис-аконитат
Изоцитрат
Оксалосукцинат
НАД*+Н2О+2,5 АТФ
соо-
СН2 2-оксоелутаратдееидрогеназа
- СО2 с=о
СОО’ 2-оксоглутарат
СОО' Сукцинилтиокиназа СН2 сн2
- СО2 НАД* НАДН+Н* O'CxSKoAHS-KoA ГДФ г^ф+АДф Сукцинил-КоА
Мд2*
Рн
НАД*+Н2О+2,5 АТФ
ГДФ +
Нуклеозид-дифосфат-киназа
АТФ
СОО’ СУкЦинат~ СОО" Фумараза
u дегидрогеназа « +н„о
СМ2 ____________г*-' z
СН2 V > сн -
СОО’ ФАД фДдн2 СОО’
Сукцинат
Фумарат
СОО’ но-с-н
СН2
СОО-
Мапат
Малатдегидрогеназа
НАД* НАДН+Н*
t
ФАД+Н2О+1,5 АТФ
t
НАД*+Н2О+2,5 АТФ
СОО’
^С^О сн2 СОО’ Оксалоацетат
Рис. 11.3. Цикл трикарбоновых кислот.
171
Глава 11 Общий путь катаболизма
Рис. 11.4. Роль ЦТК в клеточном дыхании. 1 стадия (ЦТК) извлечение из молекулы ацетил-КоА 8 электронов; 2 стадия (цепи переноса электронов) восстановление двух молекул кислорода и формирование протонного градиента (36 Н+); 3 стадия (АТФ-синтаза) использование энергии протонного градиента для образования АТФ (9 АТФ) (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
ным источником которого является Р-окисление жирных кислот, после конденсации с оксалоацетатом, образуемой, главным образом, из углеводов (при карбоксилировании пирувата). При нарушениях обмена углеводов или голодании создается дефицит оксалоацетата, ведущий к уменьшению окисления ацетил-КоА в ЦТК.
Основная метаболическая роль ЦТК может быть представлена в виде двух процессов: 1) серия окислительно-восстановительных реакций, в результате которых ацетильная группа окисляется до двух молекул СО2; 2) четырехкратное дегидрирование, ведущее к образованию 3 молекул НАДН+Н' и 1 молекулы ФАДН3. Кислород необходим для функционирования ЦТК опосредованно как акцептор электронов в конце цепей переноса электронов и для регенерации НАД+ и ФАД.
Основное значение для регуляции ЦТК имеет синтез и гидролиз АТФ.
1. Изоцитратдегидрогеназа аллостеричес-ки активируется АДФ путем повышения сродства фермента к субстрату. НАДН ингибирует этот фермент, замещая НАД+. АТФ также ингибирует изоцитратдегидрогеназу. Важно, что превращения метаболитов в ЦТК требуют на нескольких стадиях НАД+ и ФАД, количество которых достаточно только в условиях низкого энергетического заряда.
2. Активность 2-оксоглутаратдегидроге-назного (а-кетоглутаратдегидрогеназно-го) комплекса регулируется аналогично регуляции пируватдегидрогеназного комплекса. Этот комплекс ингибируется сукцинил-КоА и НАДН (конечными продуктами превращений, катализируемых 2-оксоглутаратдегидрогеназным комплексом). Кроме того, 2-оксоглута-ратдегвдрогеназный комплекс ингибируется высоким энергетическим зарядом клетки. Итак, скорость превращений в
172
Общий путь катаболизма
Глава 11
ЦТК уменьшается при достаточной обеспеченности клетки АТФ (рис. 11.5). У ряда бактерий цитратсинтаза аллостери-чески ингибируется АТФ посредством повышения Км для ацетил-КоА.
Схема регуляции общего пути катаболизма представлена на рисунке 11.5.
Энергетическая роль общего пути катаболизма
В общем пути катаболизма из 1 молекулы пировиноградной кислоты образуется 3 молекулы СО2 в следующих реакциях: при окислительном декарбоксилировании пировиноградной кислоты, при декарбок
силировании изолимонной кислоты и при декарбоксилировании 2-оксоглутаровой кислоты. Всего при окислении 1 молекулы пировиноградной кислоты отнимается пять пар атомов водорода, из них одна пара — от сукцината и поступает на ФАД с образованием ФАДН2, а четыре пары — на 4 молекулы НАД+ с образованием 4 молекул НАДН+Н* при окислительном декарбоксилировании пировиноградной, 2-оксоглугаровой кислот, дегидрировании изоцитрата и малата. В конечном итоге атомы водорода переносятся на кислород с образованием 5 молекул Н2О, а выделившаяся энергия аккумулируется в реакциях окислительного фосфорилирования в виде молекул АТФ.
Рис. 11.5. Регуляция общего пути катаболизма. Основными молекулами, регулирующими функционирование ЦТК, являются АТФ и НАДН. Основными пунктами регуляции являются изоцитратдегидрогеназа и 2-оксоглутаратдегидрогеназный комплекс.
173
Глава 11 Общий путь катаболизма
Общий итог:
1. Окислительное декарбоксилирование пирувата ~2,5 АТФ.
2. В ЦТК и сопряженных дыхательных цепях ~9 АТФ.
3. В реакции субстратного фосфорилирования ЦТК -1 АТФ.
В ЦТК и сопряженных реакциях окислительного фосфорилирования образуется примерно 10 АТФ при окислении ацетильной группы одной молекулы ацетил-КоА
Итого в общем пути катаболизма в результате превращений 1 молекулы пировиноградной кислоты выделяется примерно 12,5 молекул АТФ.
Амфиболическая функция
Амфиболическая функция цикла трикарбоновых кислот включает катаболические и анаболические реакции.
Катаболические реакции — это окисление ацетил-КоА с выделением и запасанием энергии.
Анаболические реакции (рис. 11.6):
1. Ацетил-КоА является исходным соединением для синтеза жирных кислот и, следовательно, жиров, изопреноидов (включая стероиды), кетоновых тел. Ацетил-КоА служит донором ацетильной группы в синтезе различных эфиров (ацетилхолин, ацетилглюкозамин и др.).
2. Соединения, участвующие в ЦТК, образуют фонд промежуточных веществ, дающих начало ряду биосинтетических процессов. 2-Оксоглутарат является важнейшим акцептором аминогрупп в реакциях трансаминирования и превращается в глутаминовую кислоту, из которой затем синтезируются глутамин, пролин, орнитин, цитруллин, аргинин и другие метаболиты. Оксалоацетат является ключевым соединением для глюконеогенеза (синтеза углеводов). Путем трансаминирова-
Рис. 11.6. Биосинтетическая роль цикла трикарбоновых кислот.
174
Общий путь катаболизма Глава 11
-:ия из оксалоацетата образуются аспарагиновая кислота, аспарагин. Аспарагиновая кислота необходима для получения пиримидиновых нуклеотидов и некоторых аминокислот. Сукцинил-КоА может образовывать с глицином 5-ами-нзлсвулиновую кислоту, которая конденсируется в порфобилиноген; последний далее используется в синтезе гема, цитохромов. Фумарат является одним из продуктов разложения ароматических аминокислот, и образуется из аспарагиновой кислоты в цикле мочевины.
Главной задачей ЦТК является бесперебойное обеспечение субстратами процесса продукции энергии в митохондриях. Поэтому особое значение имеет так называемая анаплеротическая реак-.шя, заключающаяся в синтезе оксалоацетата из пирувата, сопряженном с гидролизом АТФ:
Пируват + АТФ + НСО3-* оксалоацетат + АДФ + Рн + Н+
Эту реакцию катализирует пируват-карбоксилаза, кофактором которой является биотин.
Итак, общий путь катаболизма обеспечивает: 1) продукцию энергии в дыхательных цепях, поставляя в нее протоны и электроны; 2) ряд биосинтетических процессов, начинающихся от ацетил-КоА и метаболитов ЦТК.
Известно, что основными причинами свободно-радикальных процессов при окислительном стрессе являются значительное увеличение выработки активных форм кислорода и высвобождение ионов железа из вне- и внутриклеточных депо. Увеличение внутриклеточной концентрации ионов железа может происходить в результате распада Fe-содержащих белков, в частности аконитатгидратазы (аконита
за, КФ 4.2.1.3). Снижение содержания железа, а, следовательно, и Fe2+, участвующего в реакции Фентона, может достигаться за счет увеличения содержания цитрата. Повышенная продукция активных форм кислорода происходит при работе митохондрий в условиях высоких значений отношений НАДН/НАД*, АТФ/АДФ и величин мембранного потенциала. Для предупреждения таких изменений необходимо блокирование цикла трикарбоновых кислот на уровне аконитазы. Митохондриальный изофермент аконитазы играет ключевую роль в опухолевом перерождении простаты (нормальные цитратпродуцирующие эпителиальные клетки простаты превращаются в цитратокисляющие) и развитии ожирения (торможение цикла трикарбоновых кислот вследствие ингибирования митохондриальной аконитазы). Обнаружено снижение активности аконитазы и увеличение концентрации цитрата в тканях при гипоксии, ишемии и гипероксии. В последние годы определение активности аконитазы вводится в панель тестов для оценки уровня окислительного стресса. Снижение активности аконитазы выявляют при нейродегенеративных заболеваниях, связанных с развитием окислительного стресса, в частности болезнях Паркинсона и Альцгеймера.
В физиологических условиях регуляция активности, скорость синтеза и распада аконитазы находится под контролем внутриклеточного содержания Fe2+. Этот контроль осуществляется посредством Fe-чувствительных цитозольных РНК-связывающих белков (iron regulatory proteins - IRP), которые
175
Глава 11 Общий путь катаболизма
регулируют трансляцию и стабильность мРНК, кодирующих аконитазу. IRP1 представляет собой цитоплазматический изофермент аконитазы, лишенный лабильного Fe2+. IRP2 гомологичен с IRP1 на 62%, не имеет [FeSJ-кластера и лишен аконитазной активности в силу отсутствия цистеиновых остатков, связывающих [FeSJ-клас-тер в активном центре фермента. При накоплении железа в клетке IRP1 восстанавливает структуру [FeSJ-кластера, который препятствует связыванию с мРНК, и приобретает аконитазную активность. 1RP2 при повышении концентрации ионов железа связывает их и подвергается деградации в протеасо-мах. Существует мнение, что обмен железа в клетке сводится в основном к переходу железа между свободным и связанным с РНК IRP1. В большинстве клеток человека преобладает железосвязанная форма IRP1 (цитоплазматическая аконитатгидратаза). Кроме внутриклеточного уровня железа существует еще ряд факторов, способствующих переходу цитоплазматической аконитазы в IRP1. Это NO, окислительный стресс, фосфорилирование, гипоксия/ре-оксигенация. Считают, что IRP2 главенствует в регуляции метаболизма железа у млекопитающих (Л.В.Матасова, Т.Н.Попова, 2008).
Роль витаминов в регуляции общего пути катаболизма
Семь витаминов выполняют функ-ции кофакторов ферментов общего пути катаболизма.
1. Пируват- и 2-оксоглутаратдегидроге-назные комплексы: В( — необходим для синтеза ТПФ; липоевая кислота (витаминоподобное вещество); пантотеновая кислота — необходима для синтеза HS-КоА; В2 — необходим для синтеза ФАД; РР — необходим для синтеза НАД.
2. Биотин катализирует реакцию карбоксилирования пирувата с образованием оксалоацетата.
3. В6 необходим для синтеза пиридоксальфосфата, являющегося кофактором аспартат- и аланинаминотрансфераз, катализирующих превращение аспарата в оксалоацетат и аланина в пируват, соответственно. Перечисленные выше витамины должны составлять основу сбалансированных поливитаминных препаратов.
Глиоксилатный цикл
В клетках высших растений, плесневых грибов, ряда бактерий обнаружен глиоксилатный цикл (Г. Кребс, 1957), который служит механизмом пополнения промежуточных продуктов ЦТК. Глиоксилатный цикл — это видоизмененный ЦТК, в котором изоцитратдегидрогеназа и 2-оксоглутаратдегидрогеназный комплекс заменены изоцитрат-лиазой, которая расщепляет изолимонную кислоту до янтарной и глиоксиловой кислот. Другой ключевой фермент цикла — малат-синтаза, которая катализирует реакцию конденсации ацетил-Ко А с глиоксиловой кислотой с образованием L-малата и HS-KoA. Итак, в глиоксилатном цикле идут следующие превращения: Оксалоацетат + ацетил-КоА -* лимонная кислота -+ цис-аконитовая кислота -► изо-лимонная кислота (выделяется сукцинат) -* глиоксиловая кислота + ацетил- КоА-»-яблочная кислота (выделяются 2Н) * оксалоацетат. Таким образом, при каждом обороте цикла в него включаются две молекулы ацетил-КоА и выделяется
176
Общий путь катаболизма Глава 11
одна молекула янтарной кислоты. На последнем этапе цикла в малатдегидро-геназной реакции выделяются 2 атома водорода, которые в цепях переноса электронов дадут 2,5 молекулы АТФ.
Глиоксилатный цикл найден у микроорганизмов и дрожжей, использующих в качестве энергетического и пластического материала двухуглеродные соединения, например глицин или гликолевая кислота. Если уксусная кислота и этанол включаются в ЦТК в виде ацетил-КоА, то глицин и гликолевая кислота окисляются до глиоксиловой кислоты. В тканях растений с помощью глиоксилатного цикла протекает превращение жиров в углеводы. Особенно активно этот процесс реализуется в про
растающих семенах масличных растений. Резервные триацил гл и неролы расщепляются до жирных кислот, окисление последних ведет к образованию ацетил-КоА, который в реакциях глиоксилатного цикла дает янтарную кислоту. Последняя превращается в углеводы через реакции ЦТК и глюконеогенеза. Глиоксилатный цикл локализуется в микротельцах растений, называемых глиоксисомами. Глиоксилатный цикл найден у беспозвоночных нематод и трематод (Fasciola hepatica). Появляются отдельные сообщения о выявлении ключевых ферментов глиоксилатного цикла в тканях позвоночных на стадии эмбриогенеза и в печени голодавших крыс.
7 Зак. 2124
177
Глава 12
Углеводы и лектины
Функции и строение углеводов
Все углеводы условно делят на две группы.
Углеводы с преимущественно энергетической функцией
При окислении 1 г углеводов выделяется примерно 17,0 кДж энергии.
1. Моносахариды (глюкоза, фруктоза, галактоза). При полном окислении одной молекулы глюкозы образуется 30— 32 молекулы АТФ.
2. Олигосахариды (в пище чаще используются дисахариды сахароза — свекловичный сахар, при гидролизе образуются глюкоза и фруктоза и лактоза — молочный сахар, при гидролизе образуются глюкоза и галактоза) (рис. 12.1).
3. Гомополисахариды. Крахмал в растениях, гликоген в животных клетках), состоят из остатков a-D-глюкозы, соединенных а(1-*-4) и в местах ветвления а(1-*6)-гли-козидными связями (рис. 12.2).
В растениях глюкоза запасается в виде крахмала, который может быть в двух
формах: 1) амилоза — неразветвленный тип крахмала, в котором остатки глюкозы связаны а-1,4-гликозидными связями; 2) амилопектин — разветвленная форма крахмала, в которой на тридцать а-1,4-гликозидных связей приходится одна а-1,6-гликозидная связь. В молекулах гликогена количество ветвлений, т. е. наличие а-1,6-гликозидных связей, встречается примерно в три раза чаще. Молекулы гликогена и крахмала за счет большого количества концевых остатков глюкозы служат для быстрого резервирования'или освобождения большого числа свободных молекул глюкозы. Более половины углеводов в организме человека имеют происхождение из крахмала пищи.
У человека в печени и мышцах содержится до 450 г гликогена. В гепатоцитах гликоген запасается в виде розеток (a-агрегаты), состоящих из р-частиц. Малые р-частицы находятся в цитоплазме мышечных клеток и содержат до 60000 остатков глюкозы. Гомополисахариды — это способ сохранения миллионов молекул глюкозы без увеличения осмотического давления.
178
Углеводы и лектины Глава 12
Сахароза (а-0-глюкопиранозил-(1-*2)-р-0-фруктофураноза)
Лактоза (р-О-галактопиранозил-(1-»4)-а-О-глюкопираноза)
Мальтоза
(а-0-глюкопиранозил-(1-*4)-а-0-глюкопираноза)
12.1. Строение дисахаридов.
—«воды с преимущественно :~'уктурной функцией
"змополисахариды. Целлюлоза наи- лее распространенный структурный ..--«сахарид растительного мира; на ее
долю приходится более половины всего органического углерода биосферы. Примерно 1015 кг целлюлозы обменивается на Земле за год. Целлюлоза представляет собой линейный неразветвлен-ный полисахарид, состоящий из
179
Глава 12 Углеводы и лектины
Рис. 12.2. Типы гликозидных связей в крахмале и гликогене: а-1,4-гликозидные связи в цепях остатков глюкозы и а-1,6-гликозидные связи в точках ветвления.
Рис. 12.3. Тип гликозидной связи определяет форму молекулы и функцию гомололисахари-да — структурную для целлюлозы и резервирующую для крахмала и гликогена.
180
Углеводы и лектины Глава 12
З-О-глюкопиранозных звеньев, соединенных р(1-*4) гликозидными связями. Эти линейные молекулы располагаются параллельно друг другу, между ними возникают водородные связи, образуются прочные микрофибриллы |рис. 12.3).
Микрофибриллы целлюлозы вместе с сопровождающими веществами (гемицеллюлоза, лигнин, пектины) образуют клеточную стенку растений. Млекопитающие утратили фермент целлюлазу и не могут переваривать волокна целлюлозы в отличие от крахмала. Целлюлоза является незаменимым компонентом пищи 130 г/сутки), поскольку она необходима для перистальтики кишечника.
2. Гетерополисахариды.
В состав олиго- и гетерополисахаридов входят модифицированные формы углеводов (рис. 12.4).
Наиболее часто используемые сокращения при названии углеводов: Fuc — фукоза, Gal — галактоза, GalNAc — N-ацетилгалактозамин, GIcNAc — N-аце-тилглюкозамин, Мал — манноза, Sia — сиаловая кислота, NeuNAc — N-ацетилнейраминовая кислота (сиаловая кислота)
Гликозамингликаны (ГАГ, старое название — мукополисахариды) содержат че
Рис. 12.4. Модифицированные моносахариды. Включают дополнительные группы, отличные ст гидроксильной группы. Эти моносахариды выделяются на поверхность клетки.
181
Глава 12 Углеводы и лектины
редующиеся парные звенья, состоящие из остатков аминосахаров и гексуроновых кислот, реже моносахаридов; обладают большой молекулярной массой и всегда связаны с белками (за исключением гиалуроновой кислоты); образуют основное вещество внеклеточного матрикса соединительной ткани. Все ГАГ, кроме гиалуроновой кислоты, сульфатированы. Гиалуроновая кислота построена из повторяющегося дисахарида p-D-глюкуроновая кислота и P-N-ацетил-D-глюкозамин, соединенных 0(1-*3) гликозидной связью. Диса-харидные единицы соединены р(1-*4) гликозидной связью. Это самый высо-кополимерный ГАГ (м. м. 105—107 Да). Как полианион, гиалуроновая кислота обладает способностью связывать большое количество воды, а также ионы кальция, натрия, калия. Входит в состав протеогликанов, содержится в пупочном
канатике, стекловидном теле, внутрисуставной жидкости; у многих бактерий содержится в защитной капсуле, определяя вирулентность бактерии. Хондрой-тинсулъфаты являются основным компонентом хрящей, сухожилий, роговицы глаза; содержатся также в коже и костях. Хондроитинсульфаты А и С состоят из повторяющихся звеньев дисахарида р~ В-глюкуронозил-( 1 ’+3)-p-N-aneTM-D-галактозамина, соединенных р(1->4) гликозидной связью. Хондроитинсульфат А содержит сульфогруппу в С-4 положении N-ацетил-D-галактозамина, а,хондроитинсульфат С сульфатирован при С-6. В эту группу входят также дерматансульфат, кератансулъфаты, гепарин и гепарансульфат (рис. 12.5).
Гликозамингликаны обычно входят в состав гликопротеинов. Они присоединяются О-гликозидной связью к ОН-группам боковых радикалов серина или
Рис. 12.5. Дисахаридные единицы основных представителей гликозамингликанов.
182
__________________________ Углеводы и лектины Глава 12
CH2OSO3H Н X— О г
Кон
нNHCOCH3
О
Кератансульфат
п
Остаток D-галактозы
Остаток N-ацетилглЮкозамин-6-сульфата
Остаток
N-ацетилглюкозамина
Остаток D-глюкуроновой кислоты
Остаток L-идуроновой кислоты
Остаток N-ацетилгалактозамин-4-сульфата
Дерматансульфат
л
Остаток
О-глюкуронат-2-сульфата
Остаток
N-ацетилглюкозамин-б-сульфата
Продолжение рис. 12.5.
183
Глава 12 Углеводы и лектины
треонина корового (от лат. «сог» — сердце) белка, реже — к аминогруппе аспарагина.
В протеогликанах до 95 % от массы приходится на углеводные компоненты и 5% — на белки. Протеогликаны различных тканей имеют свои специфические особенности строения, разный состав ГАГ, но принцип химического строения одинаков: коровый, или сердцевинный, белок занимает срединное положение, и к нему по всей его длине присоединяются молекулы ГАГ. Коровые белки протеогликанов представлены одной полипептидной цепью разной молекулярной массы. ГАГ присоединяются к коровому белку ковалентными связями. Протеогликаны являются структурными компонентами соединительной ткани, опосредуют адгезию клеток к экстрацеллюлярному матриксу и стимулируют пролиферацию клеток.
Присоединяясь к линейной структуре гиалуроновой кислоты, протеогликаны образуют очень крупные надмолекулярные структуры — протеогликановые агрегаты (ПГА), составляющие основу (матрикс) соединительной ткани, в который погружены клетки и волокна. Присоединение протеогликанов к гиалуроновой кислоте осуществляется при помощи особых связывающих белков, обладающих гидрофобными свойствами. Гиалуроновая кислота может объединить в ПГА до 200 молекул протеогликанов. Полимерные цепи ГАГ в составе ПГА за счет наличия одноименных зарядов и связывания молекул воды полярными группами ГАГ образуют структуру наподобие щетки для мытья бутылок.
Больше всего протеогликанов содержится в анатомических структурах, подвергающихся механической нагрузке и деформации: межпозвоночные диски, хрящи, сухожилия, связки, мениски, кожа (см. лекцию 36).
Агар-агар — смесь агарозы и агаро-пектина. Агароза состоит из чередующихся остатков D-галактозы и 3,6-ан-гидро-Ь-галактозы, соединенных поочередно 0(1-»-4)- и а(1-*3) гликозидными связями. Агаропектин содержит цепочки, образуемые остатками D-ra-лактопиранозы, часть которых сульфатирована. Агар-агар растворяется в воде при нагревании, при остывании образуются гели (в микробиологии используется для создания питательных сред, а в кондитерской промышленности для приготовления желе, пастилы, мармелада). Агар-агар добывают из морской багряной водоросли анфелъции.
Гликопротеины и гликолипиды принимают участие в построении клеточных мембран и выполнении некоторых клеточных функций, таких как рост, адгезия и др. В состав клеточных стенок бактерий входит пептидогликан — муреин. Он образует каркас стенок бактерий. Муреин стенки Staphylococcus aureus включает муропептид — дисахарид, в котором Ы-ацетил-Э-глюкозамин соединен 0(1 ~>4) гликозидной связью с N-ацетилмурамовой кислотой.
Лектины
Название происходит от латинского legere, что значит «выбор». Лектины — белки, способные связывать специфически моно- и олигосахариды; не являются ферментами или антителами; участвуют в реакциях преципитации или агглютинации клеток (например, эритроцитов), в развитии митогенетической стимуляции лимфоцитов и проявлениях цитотоксичности. Это весьма гетерогенная группа олигомерных протеинов, отличающихся по структуре и молекулярной организации. Эти белки встречаются от вирусов до высших млекопитающих.
Для животных и человека характерен С-класс лектинов, требующих для
184
Углеводы и лектины Глава 12
взаимодействия с углеводами наличия ионов кальция. Важными представителями этого класса лектинов являются селектины, имеющие отношение к иммунному ответу. L-, Е- и Р-селек-тины специфично связывают углевозы в сосудах лимфоузлов, эндотелии или тромбоцитах, соответственно (по первым буквам английских названий этих клеток). Исследование селекти-нов углубляет представление о воспалении.
Специфическое поражение клеток вирусами связано с наличием на поверхности клеток специфических рецепторов, содержащих углеводы. Например, вирус гриппа узнает в составе гликопротеина поверхности клеток нейраминовую (сиаловую) кислоту. Вирусный белок, соединяющийся с нейраминовой кислотой, называют гемагглютинином. После связывания вирус проникает внутрь клетки, используя второй фермент нейраминидазу. Нейраминидаза катализирует разрыв гликозидной свйзи, удерживающей нейраминовую кислоту в составе гликопротеина поверхности клетки. Очевидно, что лекарства, подавляющие активность этого фермента, могут оказыват антигриппозное действие.
Лектины делят на 5 групп в зависимости от афинности связываемого моносахарида:
1) связывают маннозу лектины бобов iconA), сыворотки крови крыс (МБР) и тип 1 фимбрий Е. coli;
2) связывают N-ацетилглюкозамин лектины из зерен пшеницы (WGA) и из печени птиц;
3) связывают галактозу/N-ацетилгалак-тозамин лектины из семян кораллово
го дерева (ECorL), соевых бобов, печени крыс (НВР, RHL), позвоночных (га-лектины), садовых улиток, амеб;
4) связывают фукозу лектины из аспарагуса и печени крыс;
5) связывают сиаловую кислоту лектины из бузины, крабов, лобстера, вирусов гриппа и полиомы. Лектины способны связывать олигосахариды (фитогемаглютинин) и др.
Выделенные и очищенные лектины являются реагентами, которые используются в исследованиях межклеточных взаимоотношений, изучении иммунного статуса организма.
Синтез олигосахаридов
Олигосахариды синтезируются благодаря действию группы ферментов с различной специфичностью — гликозилт-рансфераз, которые катализируют образование гликозидных связей и образование полигликозидных цепей. Для образования гликозидных связей требуется активация определенного атома в структуре присоединяемого моносахарида. Такая активация достигается в соединениях моносахаридов с уридинсодержащими нуклеотидами. Например, остатки глюкозы включаются в олиго-сахаридные цепи из УДФ-глюкозы. Образование таких полимеров принципиально отличается от образования дочерних цепей ДНК (при репликации), молекул РНК (при транскрипции) и белков (при трансляции), поскольку в перечисленных процессах требуется матрица, по которой формируется полимер.
Значение специфичности глико-зилтрансфераз можно продемонстрировать на примере человеческих групп крови АВО(Н). Углеводы входят в состав антигенов — гликопротеинов и гликолипидов на поверхности эритроцитов (рис. 12.6).
185
Глава 12 Углеводы и лектины
Fuc . .. Gal
|р.1.з GlcNAc
I р.1.3
Gal
I
В антиген
Рис. 12.6. Структуры А, В и О опигосахаридных антигенов.
Как показано на рисунке для каждой из групп крови имеются характерные олигосахаридные структуры гликопротеинов на поверхности эритроцитов, названные А, В и О антигены. Одинаковая для всех групп крови структура олигосахаридной цепи получила название О (иногда называют Н) антиген. А антиген отличается добавлением N-аце-тилгалактозамина, В антиген — добавлением галактозы, связанных с остатком галактозы О антигена а-1,3 гликозидной связью. Специфичные гликозилтрансферазы катализируют присоединение моносахаридных остатков к О антигену.
Каждый человек наследует от родителей один тип гликозилтрансферазы: тип А гликозилтрансферазы катализирует присоединение N-ацетилгалактозамина, а тип В —
присоединение галактозы. Эти ферменты отличаются всего по позиции 4-х аминокислотных остатков из 354. У лиц с О фенотипом синтезируется неактивный фермент гликозилтрансфераза. Эти различия обязательно учитываются при переливании крови и трансплантации органов.
Синтез гликопротеинов (гликозилирование белков)
В гликопротеинах моносахаридные остатки присоединяются к радикалам аминокислотных остатков полипептидной цепи через азот амидной группы аспарагина (N-гликозидная связь) и через кислородный атом серина или треонина (О-гликозидная связь). Такие гликопротеины на поверхности клеток
186
Углеводы и лектины Глава 12
участвуют в межклеточных взаимодействиях (рис, 12.7).
N-гликозидные связи с остатком асн возникают только в последовательностях аминокислотных остатков асн-х-сер или асн-х-тре, где х — любой остаток протеиногенных аминокислот. Поэтому потенциальные места гликозилирования в белке могут быть предсказаны при анализе аминокислотной последовательности первичной структуры белка. Многие белки, секретируемые клеткой гликозилированы, в связи с чем отдельные белки сыворотки крови являются гликопротеинами. Некоторые внутриклеточные белки содержат N-ацетил-глюкозамин, связанный О-гликозидной связью с белками.
Гликозилирование белков происходит в эндоплазматическом ретикулуме и аппарате Гольджи. Эти органел
лы определяют пути дальнейшего транспорта синтезированных и модифицированных белков (рис. 12.8).
Роль долихолфосфата
Для присоединения олигосахаридных фрагментов к белку требуется долихолфосфат, построенный из 15—19 изопреновых единиц (рис. 12.9). Благодаря такому строению долихолфосфат располагается в мембране эндоплазматического ретикулума, причем фосфатная группа локализована на цитоплазматической поверхности мембраны. Последовательность этапов: 1) к фосфатной группе долихола присоединяется 2 остатка N-ацетилглюкозамина (из УДФ-N-ацетилглюкозам ина) и 5 остатков манозы; 2) этот олигосахарид пере-
187
Глава 12 Углеводы и лектины
Рис. 12.8. Аппарат Гольджи контролирует транспорт белков. Цис-сторона аппарата Гольджи собирает белки из эндоплазматического ретикулума, а транс-сторона аппарата Гольджи определяет направление транспорта белков (в виде частиц, окруженных плазматической мембраной, секреторных гранул или в случае присоединения маннозо-6-фосфата к гидролитическим ферментам — для функционирования в лизосомах).
носится в полость эндоплазматического ретикулума и удлиняется до 14 остатков моносахаридов; 3) олигосахарид присоединяется к аспарагиновым остаткам синтезируемой полипептидной цепи с освобождением долихолпирофосфата (перед повторением цикла превращений с помощью фосфатазы из долихолпирофосфата вновь образуется долихолфосфат).
Перед выходом образовавшегося гликопротеина из эндоплазматического ретикулума в аппарат Гольджи от
олигосахаридного компонента отделяются три остатка глюкозы. При неправильной конформации белок не поступает в аппарат Гольджи, а с помощью белков-шаперонов — мембраносвязанного калънексина и растворимого калъ-ретикулина — после повторного гликозилирования происходит формирование правильной третичной структуры белка. Это своеобразный «контроль качества» формирования правильной конформации молекулы гликопротеина через глюкозные остатки в белке.
188
Углеводы и лектины Глава 12
Рис. 12.9. Структура изопрена и долихолфосфата.
Известны 2 антибиотика, которые блокируют синтез гликопротеинов х у бактерий. Туникамицин блокирует присоединение N-ацетилглюко-замина к долихол фосфату, а бацитрацин подавляет процесс превращения долихолпирофосфата в долихолмонофосфат.
189
Глава 13
Г ликолиз
Глюкоза — это центральный метаболит обмена углеводов.
Основными источниками глюкозы являются: 1) пища; 2) распад гликогена; 3) синтез глюкозы из не углеводных предшественников (глюконеогенез).
Основные пути расходования глюкозы: 1) распад глюкозы с целью получения энергии (аэробный и анаэробный гликолиз); 2) синтез гликогена; 3) пен-тозофосфатный путь распада для получения других моносахаридов и восстановленного НАДФ; 4) синтез других соединений (жирные кислоты, аминокислоты, гетерополисахариды и др.).
В кровь поставляют глюкозу: 1) кишечник из пищи; 2) печень и почки посредством дефосфорилирования глюкозе-6-фосфата, так как только в этих органах имеется в достаточном количестве фермент глюкозо-6-фосфатаза. Остальные ткани потребляют глюкозу.
Переваривание углеводов
Главными углеводами пищи являются полисахариды (крахмал, гликоген, целлюлоза), дисахариды (лактоза, сахароза)
и, в меньшей степени, моносахариды (глюкоза, фруктоза).
Крахмал, широко распространенный резервный полисахарид растений, относится к наиболее важным углеводным компонентам пищевого рациона. В растениях крахмал содержится в хлоропластах листьев, плодах, семенах и клубнях. Особенно высоко содержание крахмала в зерновых культурах (до 75 % от сухой массы), клубнях картофеля (примерно 65 %) и других запасающих частях растений. Гликоген, важнейший резервный полисахарид животного мира, содержится в печени и мышцах. Целлюлоза является самым распространенным органическим соединением. В клеточных стенках растений на долю целлюлозы приходится 40" 50 %, а в таком важнейшим сырье, как хлопковое волокно, — до 98 %.
Лактоза (молочный сахар) является важнейшим углеводным компонентом молока млекопитающих. В коровьем молоке содержится до 4,5 % лактозы, в женском молоке — до 7,5 %. В растениях сахароза служит растворимым резервным дисахаридом, а также той транспортной формой, которая легко
190
Гликолиз Глава 13
:эеносится по растению. Человека са-дэоза привлекает своим сладким вку-.: ч. Источником сахарозы служат рас-. чия с высоким содержанием сахарозы, '.кие, как сахарная свекла и сахарный тчстник. Мед образуется при фермен-ивном гидролизе цветочного некта-_ з пищеварительном тракте пчелы и : чержит примерно равные количества о козы и фруктозы. Фруктоза в сво-'< зной форме содержится во фруктовых
<ах (фруктовый сахар) и меде.
Углеводы пищи, содержащие а-(1,4)-
1,6)-гликозидные связи, перевари-._-?тся ферментами пищеварительного такта (крахмал, гликоген). Углеводы с - '. .4)-гликозидными связями (клеточка, целлюлоза) ферментами челове- _ че перевариваются. Основным типом ечрментов, переваривающих углеводы АКТ, являются а-гликозидазы (рас-тление а-гликозидных связей). Эти т.рменты специфичны по отношению связи, структуре и конфигурации мо-зсзхариДных единиц.
Расщепление крахмала и гликогена у :.-.овека начинается в ротовой полости, ..е содержатся ферменты а-амилаза и •>-:ьтаза. а-Амилаза (S-амилаза) рас--хтляет в полисахаридах внутренние а---связи, т. е. является эндоамилазой. Фермент активен в нейтральной или обощелочной среде и активируется нами хлора.
V высших растений имеется фермент ~милаза, который отщепляет от крах-__ч1 дисахарид мальтозу и выполняет .«.нею роль в мобилизации крахмала.
-Амилаза клеток животных и чело-«а отщепляет один за другим глюкоз-- е остатки от конца полигликозидной . - точки. Различают кислые и нейтральнее /-амилазы в зависимости от того, какой области pH они проявляют -ксимальную активность. В органах и -днях человека и млекопитающих кис---амилаза локализована в лизосомах,
а нейтральная — в эндоплазматическом ретикулуме и цитозоле.
В результате действия а-амилазы образуются декстрины (содержат около 8 остатков глюкозы с одной или более а-1,6-гликозидными связями), мальтотриоза и мальтоза. Мальтаза расщепляет мальтозу на 2 молекулы глюкозы и действует при длительном жевании пищи. 2. В желудке нет ферментов, расщепляющих углеводы. Действие а-амилазы слюны прекращается, так как желудочное содержимое имеет кислую реакцию. Переваривание углеводов происходит некоторое время в глубоких слоях пищевого комка под действием а-амилазы слюны.
3. В двенадцатиперстной кишке переваривание углеводов происходит под действием ферментов панкреатического сока: панкреатической a-амилазы (Р-амилаза), расщепляющей а-1,4-глико-зидные связи в молекулах декстринов, и амило-1,6- и олиго- 1,6-гликозидаз, расщепляющих а-1,6-гликозидные связи. .
При недостаточности этого фер-мента в кале находят зерна непереваренного крахмала.
4. В кишечном соке содержатся дисаха-ридазы, которые расщепляют дисахариды: мальтаза — мальтозу на 2 молекулы глюкозы, сахараза — сахарозу на глюкозу и фруктозу, лактаза — лактозу на глюкозу и галактозу, трегалаза — трегалозу (а-1,1-гликозидные связи, дисахарид, находящийся в грибах) — на 2 молекулы глюкозы, изомальтаза — изомальтозу (а-1,6-гликозидные связи) на 2 молекулы глюкозы. Эти ферменты действуют на щеточной кайме кишечного эпителия — пристеночное пищеварение.
Растительная пища богата пищевыми волокнами (целлюлоза, гемицеллюлоза,
191
Глава 13 Гликолиз
пектины, легнины), которые не перевариваются ферментами желудочно-кишечного тракта. Некоторые из них (целлюлоза) перевариваются ферментами бактерий толстого кишечника: целлюлаза расщепляет целлюлозу до целло-биозы; целлобиаза расщепляет целлобиозу на две молекулы 0-D-глюкозы. 0-D-Глюкоза затем превращается в органические кислоты: молочную, пировиноградную и др.
Пищевые волокна выполняют ряд важных функций в организме: 1) необходимы для нормальной перистальтики кишечника; 2) адсорбируют вещества, продуцируемые кишечными бактериями (например, токсины); 3) предупреждают развитие опухолевых процессов в кишечнике; 4) снижают всасывание холестерола из кишечника и способствуют выведению желчных кислот из организма.
Таким образом, в процессе переваривания углеводы пищи распадаются на моносахариды (преимущественно глюкоза, фруктоза и галактоза), которые всасываются кишечной стенкой и поступают в кровь.
Всасывание моносахаридов
Глюкоза составляет около 80 % образовавшихся моносахаридов. Скорость всасывания отдельных моносахаридов различна и в сравнении с глюкозой составляет: глюкоза — 100 %, галактоза — НО %, фруктоза — 43 %, манноза — 20 %, ксилоза — 15 %, арабиноза — 9 %. Видно, что глюкоза и галактоза всасываются быстрее, чем другие моносахариды. Всасывание маннозы, ксилозы и арабинозы осуществляется преимущественно путем простой диффузии; глюкоза и галактоза всасываются путем вторичного активного транспорта, сопряженного с переносом Na+; фруктоза всасывается путем облег
ченной диффузии. Только в клетки печени и мозга транспорт глюкозы может осуществляться по механизмам пассивной диффузии и скорость поступления регулируется ее концентрацией в крови. Во всех других тканях транспорт глюкозы осуществляется по механизмам облегченной диффузии, который стимулируется инсулином.
Поступление глюкозы из крови в клетки у млекопитающих осуществляется с помощью специальных переносчиков глюкозы — GLUT1, GLUT2, GLUT3, GLUT4, GLUT5 (glucose transporter). Переносчики глюкозы представляют собой семейство структурно близких мембранных белков (до 12 типов) с различными функциями. Распределение этих белков-переносчиков в тканях отражает их роль и особенности метаболизма глюкозы.
GLUT1 находится в эритроцитах и почти во всех клетках. Кт для глюкозы 1—2 ммоль/л, что обеспечивает захват глюкозы при небольших изменениях концентрации в крови. Величина Кт для глюкозы значительно ниже содержания глюкозы в плазме крови (3,33— 5,55 ммоль/л). Этот переносчик обеспечивает поступление глюкозы в клетки с относительно постоянной скоростью.
GLUT2 имеет меньшее сродство к глюкозе (Кпт= 15—20 ммоль/л), находится в печени, тонком кишечнике, почках, 0-клетках поджелудочной железы, обеспечивает быстрый захват глюкозы печенью и стимулирует секрецию инсулина 0-клетками поджелудочной железы.
GLUT3 обнаружен в нейронах и имеет относительно низкую Кт для глюкозы (1~~2 ммоль/л), что позволяет обеспечивать глюкозой мозг в условиях гипогликемии.
GLUT4 (Кт = 2—10 ммоль/л) является переносчиком глюкозы, который стимулируется инсулином и обеспечи
192
Гликолиз Глава 13
вает захват глюкозы мышечной и жировой тканями. Повышение скорости поступления глюкозы происходит в результате транслокации молекулы переносчика из внутриклеточных везикул к плазматической мембране.
GLUT5 синтезируется клетками кишечного эпителия. Этот переносчик обеспечивает симпорт глюкозы с ионами Na\ По некоторым данным GLUT5, находящийся в тонком кишечнике, выполняет функцию транспортера фруктозы.
Гликолиз
Гликолиз {греч. glucose — сахар, lysis — разрушение) — последовательность реакций превращения глюкозы до пирувата. В процессе гликолиза часть свободной энергии распада глюкозы превращается в АТФ и НАДН. Гликолиз — это анаэробный процесс, игравший ведущую роль в энергетическом обеспечении клеток до аккумуляции в атмосфере определенных количеств кислорода. Исследования гликолитического превращения глюкозы были суммированы в 1940 г. Г. Эмбденом, О. Мейергофом и Я. Парнасом и эти метаболические превращения получили альтернативное название «путь Эмбдена-Мейергофа-Парнаса».
Суммарная реакция гликолиза: Глюкоза + 2 Рн + 2 АДФ + 2 НАД*-*-2 пируват + 2 АТФ + 2 НАДН + 2Н+ +
2 Н2О
В анаэробных превращениях глюкозы до 2 молекул пирувата освобождается -21 ккал/моль (-88 кДж/моль) энергии.
Основные признаки гликолиза.
1. Протекает во всех клетках организма. Ферменты локализованы в цитозоле клеток.
2. В анаэробных условиях (в отсутствии кислорода) образующийся пируват превращается в лактат. В аэробных условиях (присутствие кислорода) пируват окисляется до ацетил-КоА, который затем вступает в ЦТК, где его ацетильная группа окисляется до СО2 и Н,О.
3. В клетках, 'лишенных митохондрий (эритроциты, роговая оболочка глаза, хрусталик глаза), гликолиз является главным источником образования АТФ. В клетках, имеющих митохондрии, гликолиз является этапом аэробного окисления углеводов.
4. Наиболее активно протекает в мозге, поскольку окисление глюкозы является основным источником энергии для нервной ткани. У взрослого человека около половины глюкозы используется мозгом.
5. В анаэробных условиях гликолиз — единственный процесс в организме животных, растений и многих микроорганизмов, приводящий к образованию АТФ\ в организме человека и животных гликолиз позволяет поддерживать интенсивную работу скелетной мышцы в условиях недостатка кислорода.
6. Промежуточные продукты гликолиза используются для биосинтеза заменимых аминокислот и глицерола.
Гликолиз как специфический путь катаболизма глюкозы
Гликолиз как специфический путь катаболизма глюкозы включает 10 реакций и протекает в цитозоле одинаково в аэробных и анаэробных условиях (рис. 13.1).
1. Фосфорилирование глюкозы осуществляется ферментами: неспецифической гексокиназой с низкой константой Михаэлиса (10-5М), и, присутствующей преимущественно в печени специфической глюкокиназой (Кт = 10“3 М). Активность глюкокиназы индуцируется глюкозой пиши. Оптимальная концен-
193
Глава 13 Гликолиз
грация глюкозы крови для глюкокиназы 5 ммоль/л. Реакция фосфорилирования глюкозы необратима. Оба фермента фосфорилируют глюкозу с помощью Mg-АТФ комплекса. Глюко -зо-6-фосфат не проходит через клеточные мембраны и является ключевой молекулой различных внутриклеточных путей обмена углеводов — гликолиза, гликогенолиза, глюконеогенеза и пен-тозофосфатного пути.
2. Изомеризация Г-6-Ф во фруктозо-6-фосфат катализируется фосфогексоизо-меразой. Реакция обратима. Изомеризуется только а-аномер Г-6-Ф. Это один из наиболее активных ферментов гликолиза.
3. Фосфорилирование Ф-6-Ф во фруктозе-1,6-бисфосфат (Ф-1,6-БФ), фермент фосфофруктокиназа (ФФК-1). Реакция требует АТФ и Mg2+. Это самая медленная реакция специфического пути катаболизма глюкозы и поэтому лимитирует скорость всего процесса. Реакция необратима. ФФК — аллостерический регуляторный фермент.
4. Расщепление Ф-1,6-БФ на две фосфотриозы катализируется ферментом фруктозобисфосфат-альдолазой. В реакции образуются глицеральдегид-3-фосфат (ГАФ) и диоксиацетонфосфат (ДАФ).
5. Изомеризация триозофосфатизоме-разой. Равновесие сдвинуто в сторону ДАФ (95 %) и 5 % ГАФ. Однако в последующие реакции вступает только ГАФ. Итак, 1 молекула гексозы распалась на 2 молекулы фосфотриоз, которые далее превращаются одинаково.
6. Окисление ГАФ. Обе молекулы ГАФ дегидрируются с одновременным присоединением неорганического фосфата с помощью фермента глицералъдегид-3-фосфатдегидрогеназы (ГАФ-ДГ) в 1,3-бисфосфоглицериновую кислоту. Фермент состоит из 4-х субъединиц. В активном центре фермента находится
SH-группа (цис-149) и связанный кофермент НАД+. Вначале ГАФ присоединяется к ферменту по SH-группе с образованием тиополуацеталя. При его окислении (дегидрировании) образуется богатый энергией тиоэфир. Затем протоны и электроны переносятся со связанного с ферментом НАД на цитоплазматический, а присоединяющийся Рн ведет к образованию 1,3-бисфосфог-лицериновой кислоты. Таким образом, альдегид окисляется в кислоту, а энергия окисления аккумулируется в виде ~Р (макроэргического фосфата, 49,4 кДж/моль). Существует обязательный порядок связывания с ферментом субстратов и отделения от него продуктов реакции: 2 ГАФ + 2 Н3РО4+ 2 НАД+-> 2 1,3-БФГК + 2 НАДН+Н+.
7. Фермент фосфоглицераткиназа обеспечивает субстратное фосфорилирование АДФ с образованием АТФ.
8. Перенос фосфата в положение С2 катализируется фосфоглицератмутазой. В качестве «косубстрата» участвует 2,3-бисфосфоглицерат и необходимы ионы Mg2+.
В большинстве тканей содержание 2,3-бисфосфоглицерата незначительное, но в эритроцитах количество этого вещества достигает 4 мМ. Это связано с участием 2,3-бисфосфоглицерата в транспорте кислорода гемоглобином, он снижает сродство гемоглобина к кислороду.
9. Енолизация. Фермент енолаза. Требует обязательного присутствия ионов Mg2+, Мп2+.
Енолаза блокируется флюоридом. Это используется для сохранения глюкозы в консервированной крови.
194
Гликолиз Глава 13
При енолизации происходит образование макроэргической связи (61,9 кДж/моль) в составе фосфоенолпирува-та (ФЕП).
10. Фермент пируваткиназа обеспечивает субстратное фосфорилирование АДФ с образованием АТФ.
Итогом 10 реакций специфического пути катаболизма глюкозы в цитозоле клеток является: 2 молекулы пирувата; 2 молекулы НАДН+Н+; 4 молекулы АТФ образовалось, но израсходовано 2 молекулы АТФ (+2 молекулы АТФ).
Необратимые реакции гликолиза
Большинство реакций гликолиза является обратимыми. Три реакции, катализируемые ферментами гексокиназой i глюкокиназой), фосфофруктокиназой и шруваткиназой необратимы. На этих этапах осуществляется регуляция гликолиза.
Регуляция гликолиза
1. Первый фермент гликолиза — гексо-киназа ингибируется продуктом реакции (глюкозо-6-фосфат).
Высокая внутриклеточная концентрация глюкозо-6-фосфата сигнализирует о том, что не требуется поступление глюкозы в клетку для получения энергии или запасания в виде гликогена. Ингибирование фосфофруктокиназы зедет к повышению концентрации ±>руктозо-6-фосфата, а, следовательно, и глюкозо-6-фосфата и ингибированию гексокиназы. Для контроля уровня гликемии в печени существует специальный изофермент гексокиназы — глюкокиназа. Поскольку фермент имеет в 50 раз меньшее сродство к глюкозе. он функционирует при синтезе гли
когена или жирных кислот из избытка глюкозы. Низкая аффинность глюкокиназы печени к глюкозе позволяет обеспечивать мышцы и мозг энергией при низких концентрациях глюкозы в крови.
2. Высокий уровень АТФ аллостеричес-ки ингибирует активность фосфофрукто-киназы в печени (тетрамер с молекулярной массой 340 кДа), уменьшая его сродство к фруктозо-6-фосфату. Высокая концентрация АТФ превращает гиперболическую кривую связывания фруктозо-6-фосфата в сигмоидную. Этот эффект АТФ оказывает, связываясь с молекулой фермента вне зоны активного центра.
3. А МФ отменяет ингибиторный эффект АТФ и активность фосфофруктокиназы повышается, если отношение АТФ/АМФ уменьшается. Иными словами, гликолиз активируется при уменьшении энергетического заряда клетки.
Почему АМФ, а не АДФ, является положительным регулятором фосфофруктокиназы? Если АТФ утилизируется быстро, имеется возможность поддержания ее концентрации с помощью аденилаткиназы, катализирующей реакцию образования АТФ и АМФ из двух молекул АДФ. Следовательно, АМФ является своеобразной информацией о гипоэнергетичес-ком состоянии. Однако этот регулятор требует специального контроля. Содержание адениловых нуклеотидов [АТФ] + [АДФ]+[А МФ] в клетке относительно постоянно. При этом концентрация АТФ выше концентрации АДФ, а концентрация АДФ больше концентрации АМФ. Поэтому небольшие изменения [АТФ] сопровождаются большими изменениями в концентрации АМФ, что и позволяет А МФ быть аллостерическим регулятором фосфофруктокиназы.
195
Глава 13 Гликолиз
/-'Ll z~»LJ
Гэксокиназа Глюкокиназа
АТФ АДФ
Фосфогексо-изомераза
Фруктозо-6-фосфат
а -D-Глюкоза
D-Глюкозо-6-фосфат
Фосфофруктокиназа, Мд2+
АТФ АДФ
^Н2ОРО32’
С=О
|но-с-н Н-С-ОЙ н-с-он
СН2ОРО32"
Альдолаза
Фруктозо-1,6-бисфосфат
Фруктозо-1,6-бисфосфат
С=О
СН2ОН
Диоксиацетонфосфат (ДАФ, 95%)
Триозофосфат-изомераза
Н-С-ОН
сн2оро32-
Гл ицерал ьдегид-3-фосфат (ГАФ, 5%)
Гпицеральдегид-3-фосфат-дегидрогеназа (HS-ферм-НАД*)
2
2 Н-С-ОН сн2оро32-
Гл ицерал ьдегид-3-фосфат
н ОН
(J)—8“ферм‘НАД* н-с-он
СН2ОРО32'
Фермент-субстратный комплекс (тиополуацеталь)
Рис. 13.1. Специфический путь распада глюкозы.
196
Гликолиз Глава 13
н он
(j) ~ З'ферм’НАДН+Н
2 Н-С-ОН
сн2оро32-
+2НАД+цитозоля
+2 НзРО4
2 НАДН+Н*
ЦИТОЗОЛЯ
РО32-
2 Н-С-ОН +2 АДФ
сн2оро32-
1,3-бисфосфоглицерат
Фосфаалицераткиназа
2АТФ
г Фосфоглицератмутаза I „
2 н-с-он - - — 2Н-С-ОРО32 ^
СН20РО32- J СНгОН
3-фосфоглицерат V 2-фосфоглицерат
Енолаза
-Н2О, СОО"
Mg2+,Mn2* 2 С-О~РОз2’
_-------------- н ъ
СН2ОН
2-фосфоенолпируват
Пируваткиназа
2АТФ
(JXDO-
2 C-OH ”
II
СН2
Енолпируват
СОО"
2 С=О I СН3
Пируват
Ацетил-КоА
Продолжение рис. 13.1.
4. Снижение величины pH также ингибирует активность фосфофруктоки-чазы. Инибирование фермента протонами предупреждает избыточное образование молочной кислоты и развитие ацидоза.
5. Фосфофруктокиназа ингибируется аитратом, первым метаболитом цикла трикарбоновых кислот.
6. В 1980 г. был открыт новый регулятор активности фосфофруктокиназы — фруктозе-2,6-бисфосфат. Фрук-
Рис. 13.2. Фруктозо-2,6-бисфосфат.
197
Глава 13 Гликолиз
тозо-2,6-бисфосфат активирует фосфофруктокиназу путем повышения ее сродства к фруктозо-6-фосфату и уменьшения ингибиторного эффекта АТФ.
Фруктозо-6-фосфат является аллостерическим активатором мультимерного фермента фосфофруктокиназы, обеспечивая переход от Т-состояния в R-состояние (рис. 13.2).
Внутриклеточную концентрацию фруктозо-2, 6-бисфосфата определяют два фермента: синтез определяет фосфофруктокиназа-2, а распад — фруктозо-2,6-бисфосфатаза. Обе активности присутствуют в одной полипептидной цепи (бифункциональный фермент) с молекулярной массой 55 кДа в виде двух доменов: киназный с N-конца и фосфатаз-ный с С-конца полипептидной цепи (рис. 13.3).
Бифункциональный фермент представлен 5 изоформами, в том числе в печени — L-изо-форма и М-изоформа в мышцах. L-изоформа служит для сохранения гомеостаза глюкозы в кровеносном русле. В печени концентрация фруктозо-6-фосфата повышается при гиперг
ликемии, а избыток фруктозо-6-фосфата ускоряет синтез фруктозо-2,6-бисфосфата, который активирует фосфофруктокиназу (активация предшественником).
Активирование-инактивирование бифункционального фермента осуществляется фосфо-рилированием-дефосфорилированием остатка серина полипептидной цепи. Если содержание глюкозы в крови низкое, выделяется в кровь гормон глюкагон, который посредством аденилатциклазного каскадного механизма обеспечивает фосфорилирование бифункционального фермента с помощью активной протеинкиназы А. Эта ковалентная модификация через активацию фруктозо-2,6-бисфосфа-тазы и ингибирование фосфофруктокиназы-2 ведет к снижению концентрации фруктозо-2,6-бисфосфата. И, наоборот, при гипергликемии бифункциональный фермент дефосфорилиру-ется, что через активацию фосфофруктокиназы-2 и ингибирование фруктозо-2,6-бисфосфатазы ведет к повышению концентрации фруктозо-2,6-бисфосфата и активации гликолиза.
7. Пируваткиназа контролирует поток метаболитов из гликолиза. Имеется несколько
1 32
Регуляторная область
Рис. 13.3. Доменная структура бифункционального фермента фосфофруктокиназы-2 (Berg J М., Tymoczko J. L., Stryer L, с изм.).
198
Гликолиз Глава 13
изоферментов пируваткиназы (тетрамерный '•-с.юк с субъединицами молекулярной массой го 57 кДа): L-тип характерен для печени, а М-тип — для мышц и мозга. Фруктозо-1,6-j исфосфат активирует оба изофермента пи-ру ваткиназы, а АТФ и аланин — ингибируют их (рис. 13.4).
При гипогликемии глюкагон посредством аденилатциклазного механизма обеспечивает фосфорилирование пируваткиназы и уменьшение активности фермента. Это (подобно контролю концентрацией фруктозо-2,6-бисфосфа-та) служит для предотвращения потребления глюкозы печенью при условии экстренной потребности в ней мышц и мозга.
Накопление аланина ингибирует фермент и сигнализирует о том, что имеется избыток строительных блоков для полимерных молекул.
Метаболизм глюкозы в аэробных условиях
Аэробный распад глюкозы является основным путем катаболизма глюкозы у человека и включает следующие про
цессы: 1) распад глюкозы до пирувата (гликолиз или специфический путь распада глюкозы); 2) перенос пирувата в митохондрии и окислительное декарбоксилирование с образованием ацетил-КоА; 3) окисление ацетильной группы ацетил-КоА в ЦТК и сопряженных цепях переноса электронов до СО2 и Н2О.
На стадии окисления глицеральдегид-3-фосфата в 1,3-бисфосфоглицерино-вую кислоту образуется цитозольный НАДН+Н*. Перенос восстановительных эквивалентов от НАДН+Н+ в митохондрии происходит с помощью малатного челночного механизма (рис. 13.5.)
Молекула восстановленного НАД не может проникать в митохондрии. Поэтому от цитозольного НАДН+Н+ восстановительные эквиваленты сначала при участии малатдегидрогеназы переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью переносчиков проходит че-
Рис. 13.4. Контроль активности пируваткиназы (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
199
Глава 13 Гликолиз
СОО-6=0 Малатдегидрогеназа . - . СОО’ но-с-н сн2 СОО’ Малат и ООО" но-с-н -сн2 СОО’ Малат —►
сн2 ( \ СОО’ НАДН+Н* НАД* Оксалоацетат II
соо- Малатдегидрогеназа
НАД* НД СН2 4Н+Н* соо- Оксалоацетат
1 Г
НАД*+Н2О+2,5 АТФ
Рис. 13.5. Малатный челночный механизм (упрощенная схема).
рез внутреннюю мембрану митохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД+ восстанавливается в НАДН+Н+, который передает электроны в ЦПЭ внутренней мембраны митохондрий. В результате окислительного фосфорилирования образуется 2,5 молекулы АТФ.
Оксалоацетат выйти из митохондрий не может, поэтому он вначале превращается в аспартат, который транспортируется переносчиком в цитозоль. Здесь аспартат дезаминируется, превращаясь в оксалоацетат, и челночный цикл замыкается. Часто его называют малат-аспартатный челночный цикл. Результатом этого цикла является окисление цитоплазматического НАДН митохондриальным НАД+.
В некоторых тканях функционирует глице-рофосфатный челночный механизм. В цитозоле электроны от НАДН передаются на диоксиацетонфосфат с образованием глицерол-З-фос-фата; реакцию катализирует глицерол-3-фос-
фатдегвдрогеназа. Глицерол-З-фосфат достигает внутренней мембраны митохондрий, где глицерол-3-фосфатдегидрогеназа, встроенная в мембрану и в качестве простетической группы содержащая ФАД, передает электроны от глицерол-3-фосфата в митохондриальную цепь переноса электронов. Образующийся при этом диоксиацетонфосфат возвращается в цитозоль, замыкая тем самым челночный цикл. Следует заметить, что в этом цикле переносчик электронов глицерол-З-фосфат не проникает в матрикс митохондрий, а лишь передает электроны от цитоплазматического НАДН через ФАД->ФАДН2 на цепь переноса электронов во внутренней мембране митохондрий. В этом случае образуется 1,5 молекулы АТФ.
Энергетический баланс аэробного распада глюкозы
1. В специфическом пути распада глюкозы образуется 2 молекулы пирувата, 2 АТФ (субстратное фосфорилирование) и 2 молекулы НАДН+Н+.
200
Гликолиз Глава 13
2. Окислительное декарбоксилирование каждой молекулы пирувата — 2,5 АТФ; декарбоксилирование 2 молекул пирувата дает 5 молекул АТФ.
3. В результате окисления ацетильной группы ацетил-КоА в ЦТК и сопряженных ЦПЭ — 10 АТФ; 2 молекулы ацетил-КоА образуют 20 АТФ.
4. Малатный челночный механизм переносит НАДН+Н+ в митохондрии — 2.5 АТФ; 2 НАДН+Н* образуют 5 АТФ. Итого: при распаде 1 молекулы глюкозы в аэробных условиях образуется 32 молекулы АТФ.
В тканях, где действует глицерофос-ратный челночный механизм переноса восстановительных эквивалентов в митохондрии с помощью глицерол-3-фосфатдегидрогеназы, кофактором которой является ФАД, образуется 2 молекулы ФАДН2, которые в ЦПЭ дадут 3 молекулы АТФ. Тогда при полном окислении глюкозы будет образовываться 30 АТФ.
Судьба пирувата, образуемого при гликолизе, зависит от наличия или отсутствия кислорода. В анаэробных условиях в результате одиннадцатой реакции происходит восстановление пировиноградной кислоты в молочную кислоту (лактат). Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН+Н+, образованного при окислении глицеральдегид-3-фосфата в 1,3-бисфосфоглицериновую кислоту. Образование лактата позволяет регенерировать НАД+, который затем снова используется в реакции, катализируемой глицеральдегид- 3 -фосфатдегидрогеназой (рис. 13.6).
В гликолизе выделяют центральную окислительно-восстановительную реакцию гликолиза (гликолитическую окси-дорёдукцию), которая состоит в окислении глицеральдегид-3-фосфата с образованием НАДН+Н+ и последующим переносом атомов водорода от НАДН+Н+ на пируват (рис. 13.7).
Аэробный распад 1 молекулы глюкозы до СО2 и Н2О сопряжен с аккумулированием 30-32 молекул АТФ
Метаболизм глюкозы в анаэробных условиях
В анаэробных условиях распад глюкозы до пирувата происходит аналогично, как и в аэробных условиях.
Значение гликолиза велико в тканях и органах, где ограничен доступ кислорода или возможно внезапное и резкое возрастание скорости потребления АТФ. Например, в работающей сердечной мышце скорость потребления АТФ может возрасти в несколько раз, а в работающей скелетной мышце — в несколько десятков раз. Когда аэробных возможностей для
201
Глава 13 Гликолиз
Рис-13.7. Центральная окислительно-восстановительная реакция гликолиза.
обеспечения повышенной потребности в АТФ становится недостаточно, дополнительное количество АТФ будет поступать из гликолиза.
Гликолиз до лактата происходит только в анаэробных условиях и в клетках, лишенных митохондрий (эритроциты).
Энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы
Катаболизм глюкозы в опухолевых тканях
Известно, что по мере развития опухоли активируется гликолиз и усиливается потребление глюкозы. Поступление глюкозы и гликолиз в опухолевых клетках протекает приблизительно в 10 раз интенсивнее, чем в обычных клетках. Опухолевые клетки испытывают гипоксию, поскольку капиллярная сеть не может обеспечить увеличенное количество клеток кислородом. В результате
опухолевые клетки, расположенные на расстоянии более 100-200 мкм от ближайших капилляров получают энергию за счет гликолиза. Опухолевые клетки интенсивнее захватывают глюкозу и превращают ее в пируват, а затем в лактат. Высокая скорость гликолиза частично может быть результатом малого количества митохондрий в опухолевых клетках: низкая скорость синтеза АТФ путем окислительного фосфорилирования приводит к активации гликолиза. В середине прошлого века В. С. Шалот называл опухолевые клетки ловушками для глюкозы. Рост опухоли опережает рост сосудов ее питающих, что приводит к местной гипоксии. В результате гликолиз делается основным источником АТФ при накоплении лактата. Гликолиз становится более эффективным в опухолевых клетках благодаря действию индуцированного гипоксией транскрипционного фактора HIF-1. При дефиците кислорода HIF-1 повышает экспрессию (ДНК-зависимый синтез) большинства ферментов гликолиза и переносчиков глюкозы GLUT1 и GLUT3. Формируются положительная корре-
202
Гликолиз Глава 13
ляционная зависимость между потреблением глюкозы, агрессивностью опухоли и плохим прогнозом. Кроме того, HIF-1 усиливает рост опухоли за счет экспрессии различных сигнальных молекул типа сосудистого эндотелиального фактора роста (VEGF), который содействует росту кровеносных сосудов (рис. 13.8).
Гликогенолиз
.Анаэробному расщеплению могут подвергаться глюкозные остатки, отщепленные от концов цепей гликогена фосфоролитическим путем — гликогенолиз. Включение гликогена в процесс анаэробного распада осуществляется с помощью трех ферментов; 1) гликоген-фосфо-рилаза катализирует расщепление концевых а-1,4-гликозидных связей с зыделением глюкозо-1-фосфата; 2) деб-раншинг фермент катализирует расщепление а-1,6-гликозидных связей с выде
лением свободной глюкозы; 3) фосфоглюкомутаза катализирует превращение глюкозо-1-фосфата в глюкозо-6-фосфат. Поскольку при гликогенолизе на образование глюкозо-6-фосфата АТФ не тратится, в процессе гликогенолиза накапливаются не две, а три молекулы АТФ на каждый отделенный глюкозный остаток. Однако это не означает, что гликогенолиз энергетически более выгоден, чем гликолиз, так как на синтез гликогена из глюкозы также расходуется АТФ.
Эффект Пастера
Эффект Пастера — ингибирование гликолиза (накопления лактата) кислородом. Механизмы эффекта:
1. При аэробном распаде углеводов не функционирует окислительно-восстановительная реакция гликолиза, поскольку восстановительные эквиваленты НАДН + Н+ из цитоплазмы переносятся в митохондрии. Поэтому НАДН+Н+ не может служить для восстановления пирувата в лактат.
Рис. 13.8. Изменения экспрессии генов, вызванные гипоксией. Гипоксия внутри опухоли активирует HIF-1, который 1) вызывает адаптационные изменения в виде увеличения экспрессии гликолитических ферментов и 2) активирует ангиогенные факторы, стимулирующие рост сосудов.
203
Глава 13 Гликолиз
2. При наличии аэробных условий об* разуются цитрат и АТФ, которые алло-стерически тормозят активность фосфофруктокиназы (реакция лимитирует скорость всего процесса).
3. Дыхание подавляет гликолиз из-за конкуренции за АДФ между митохондриальной цепью переноса электронов, с одной стороны, и фосфоглицераткиназной и пируваткиназной реакциями гликолиза в цитоплазме, с другой. АДФ преимущественно используется в реакции окислительного фосфорилирования в митохондриях, а не субстратного фосфорилирования в гликолизе.
Брожение
Гликолиз лежит в основе ряда процессов брожения, т. е. катаболических превращений углеводов микроорганизмами в анаэробных условиях (табл. 13.1).
Брожение, как и анаэробное расщепление углеводов, — это внутренние окислительно-восстановительные процессы, в результате которых роль конечного акцептора электронов и протонов играет не кислород, а органические соединения.
Гомоферментативное молочнокислое брожение идентично по химизму реакциям гликолиза в анаэробных условиях. В результате из глюкозы образуется молочная кислота с почти 100 %-м выходом, при гетероферментативном (смешанном) молочнокислом брожении из глюкозы, кроме молочной кислоты, образуются другие продукты в процессе ее метаболизма.
Спиртовое брожение
Спиртовое брожение осуществляется так называемыми дрожжеподобными
Таблица 13.1. Виды брожения
Вцд брожения Микроорганизмы, вызывающие брожение Конечный продукт
Молочнокислое, гомоферментативное Streptococcus sp., Lactobacterium ps. Молочная кислота
Молочнокислое, Бактерии из родов Escherichia, Молочная, муравьиная,
гетероферментативное Proteus, Salmonella, Scnigella янтарная кислоты, этанол
Спиртовое Некоторые грибы, преимущественно дрожжи Saccharomyces sp. Этанол
Маслянокислое Butyribacterium sp., Sarcina maxima, некоторые виды из родов Clostridium Neisseria Бутанол, изопропанол, этанол, ацетон, уксусная и масляная кислоты
Бутиленгликолевое Некоторые виды из родов Aeromonas, Bacillus, Enterobacter Ацетон, бутиленгликоль, молочная и муравьиная кислоты
Пропионовокислое Clostridium propionium, Propionibacterium sp., Corynebacterium diphtherias, некоторые виды из родов Micromonospora, Neisseria, Veillonella Пропионовая, янтарная, уксусная кислоты
204
Гликолиз Глава 13
организмами, а также некоторыми плесневыми грибами. Суммарную реакцию спиртового брожения можно изобразить следующим образом:
С6Н12Ов •* 2 СгН,ОН + 2 СО2 О 14 О 4 9 4
Процесс спиртового брожения протекает по пути гликолиза до образования пирувата.
В дрожжевых клетках (спиртовое брожение) пируват вначале подвергается декарбоксилированию, в результате чего образуется ацетальдегид. Данная реакция катализируется пируватдекарбоксилазой, которая требует наличия ионов Mg24 и кофермента тиаминпирофосфата (рис. 13.9).
Затем образовавшийся ацетальдегид присоединяет к себе водород, отщепляемый от НАДН+Н+, восстанавливаясь при этом в этанол. Реакция катализируется ферментом алкогольдегидрогена-зой.
Таким образом, конечными продуктами спиртового брожения являются этанол и СО2, а не молочная кислота, как при гликолизе.
Метаболизм экзогенного этанола
Утилизация этанола происходит с участием 3-х ферментативных систем: 1) алкогольдегидрогеназа (80 %), 2) микросомальная этанолокисляющая система (15 %) и 3) каталаза (около 5 %).
1. Алкоголь окисляется в печени цитозольным ферментом алкогольдегидрогеназой до ацетальдегида, что сопровождается накоплением избыточного количества НАДН. С2Н5ОН + НАД4-* СН3СНО + НАДН + Н4. НАДН+Н4 конкурирует с восстановительными эквивалентами, образованными при окислении других субстратов, за дыхательные цепи.
2. Далее ацетальдегид окисляется до ацетата митохондриальной альдегиддегидрогеназой. СН3СНО + НАД++Н2О-* СН,СОО + НАДН + Н4.
3. Ацетат превращается в ацетил-КоА, ацетильная группа которого окисляется в ЦТК для получения энергии.
4. Ацетил-КоА может быть использован для биосинтеза липидов в печени.
205
Глава 13 Гликолиз
5. Этанол может быть окислен микросомальной этанолокисляющей системой С2Н5ОН + НАДФН + Н+ + О2-> СН3СНО + НАДФ+ + 2 Н2О. Этанол может ингибировать метаболизм некоторых лекарств, например, барбитуратов, конкурируя за цитохром Р-450.
Алкоголь всасывается в желудке (20 %) и в кишечнике (80 %). Всасывание замедляется при одновременном потреблении жирной пищи.
В последние два десятилетия интенсивно изучалась роль эндогенного этанола и эндогенного ацетальдегида во внутренней среде организма (школа Ю. М. Островского).
Этанол, определяемый в крови и тканях, если человек или животное не потребляли алкоголь, получил название эндогенного. При определении уровня эндогенного этанола методами газовой хроматографии с идентификацией масс-спектрометрическим методом оказалось, что его концентрация в крови человека находится в пределах 0,1-0,3 мкг/мл; максимальное содержание эндогенного этанола в крови не превышало 0,75-1,6 мкг/мл. Для сравнения отметим, что при концентрации экзогенного этанола в крови менее 1,5 г/л определяется слабое опьянение, 1,5-2,5 г/л — среднее опьянение и более 2,5 г/ л — сильное опьянение. Следовательно, эндогенный этанол существует, но его концентрация меньше, чем при потреблении алкогольных напитков, примерно на 6 порядков.
Эндогенный этанол образуется 1) микрофлорой кишечника при сбраживании углеводов (вначале синтезируется ацетальдегид, который в энтероци-тах превращается в этанол); 2) в клетках, различных тканей организма в реакциях метаболизма. В опытах на безмик-робных животных показано, что в крови воротной вены содержание этанола равно 2 мкмоля, а в артериальной крови обычных (не стерильных) крыс - 1 мкмоль. Возможно, что энтероциты могут сами нарабатывать ацетальдегид и в алкогольдегидрогеназной реакции синтезировать эндогенный этанол. Показано, что у безмикробных крыс в крови содержится 2-3 мкмоль этанола, а в тканях 3-30 мкмоль эндогенного этанола. Высказано предположение, что восстановление ацетальдегида в эндогенный этанол является физиологической функцией алкогольдегидрогеназы клеток.
В экспериментах на лабораторных животных была выявлена зависимость между мотивацией к потреблению этанола и содержанием эндогенного этанола в тканях: количество потребляемого этанола отрицательно коррелировало с уровнем эндогенного этанола. Все факторы, которые увеличивают потребление этанола, снижают уровень эндогенного этанола, а воздействия, снижающие потребление этанола, увеличивают концентрацию эндогенного этанола (П.С.Пронько, 2004, В.И.Сата-новскЛ, 2004).
206
Глава 14
Пентозофосфатный путь обмена углеводов. Глюконеогенез
Пентозофосфатный путь распада глюкозы (ПФП) называется также гексо-зомонофосфатным шунтом или фос-фоглюконатным путем. Этот альтернативный гликолизу и ЦТК путь окисления глюкозы был описан в 50-х годах XX века Ф. Дикенсом, Б. Хорекером, Ф. Липманном и Е. Рэ-кером.
Ферменты пентозофосфатного пути локализованы в цитозоле. Наиболее активно ПФП протекает в почках, печени, жировой ткани, коре надпочечников, эритроцитах, лактирующей молочной железе. В большинстве из этих тканей происходит процесс биосинтеза жирных кислот и стероидов, что требует НАДФН.
Выделяют две фазы ПФП: окислительную и неокислительную (рис. 14.1).
Окислительная фаза ПФП
1. Глюкозо-6-фосфатдегидрогеназа является НАДФ-зависимым ферментом и дегидрирует глюкозо-6~фосфат в 6-фос-фоглюконолактон (рис. 14.2).
2. 6-фосфоглюконолактон —- нестабильное соединение, которое либо спонтанно, либо с помощью фермента лактоназы гидролизуется с образованием 6-фосфоглюконовой кислоты (6-фос-фоглюконата).
3. 6-фосфоглюконатдегидрогеназа (декарбоксилирующая) дегидрирует и декарбоксилирует 6-фосфоглюконат. В результате образуется рибулозо-5-фосфат.
4. Под действием эпимеразы из рибуло-зо-5-фосфата образуется ксилулозо-5-фосфат.
5. Фермент изомераза превращает рибу-лозо-5-фосфат в рибозо-5-фосфат. Если рибозо-5-фосфат вовлекается в анаболические процессы, пентозофосфатный путь на этом этапе может быть завершен. В этом случае рибозо-5-фосфат превращается в 5-фосфорибозил-1 -пирофосфат (ФРПФ) в реакции, катализируемой рибозофосфат -пирофосфокиназой.
Глюкозо-6-фосфатдегидрогеназа лимитирует превращения в окислительных реакциях пентозофосфатного пути. Активность окислительных реакций пентозофосфатного пути оценивают по трем
207
Глава 14 Пентозофосфатный путь обмена углеводов. Глюконеогенез
Рис. 14.1. Пентозофосфатный путь обмена углеводов. Состоит из окислительной фазы образования НАДФН и неокислительной фазы превращений фосфорилированных сахаров (Berg J. М., Tymoczko J. L, Stryer L, с изм.).
показателям: 1) активности глюкозо-6-фосфатдегидрогеназы; 2) по количеству ФРПФ; 3) объему биосинтеза пуриновых нуклеотидов. По степени выраженности окислительных реакций пентозофосфат-
ного пути на основании количественной оценки этих трех показателей органы располагаются в последовательности: почки > печень > сердечная мышца > скелетная мышца.
Н\ /он С------[
Н-С-ОН I з но-с-н о . н-с-он н-с--------1 г
СН2ОРО32-
Глюкозо-6-фосфат-дегидрогеназа
3 НАДФ+ 3 НАДФН+Н
Глюкозо-6-фосфат
О и
С-----1
н-с ОН I но-с-н о ~ н-с-он н-с------'
СН20Р032' 6-Фосфоглкжонолактон
Лактоназа
+ ЗН2О
Рис. 14.2. Пентозофосфатный путь.
208
Лентозофосфатный путь обмена углеводов. Глюконеогенез Глава 14
СОО-н-с-он з но-с-н н-с-он н-с-он
СН20Р032' 3 НАДФ+ з НАДФН+Н'
3 СО2 6-Фосфоглюконовая кислота
6-Фосфоглюконат- qH
дегидрогеназа д_2
(декарбоксилирующая) д
Л Л н-с-он
СН2ОР032-
ЗСО2
D-рибулозо-б-фосфат
Эпимераз1
Изомераза
СН2ОН С=О
2НО-С-Н Н-С-ОН сн2оро32-Ксилулозо-5-фосфат
О
С-Н
Н-С-ОН н-с-он неон
СН2ОРО32-
Рибозо-5~фосфат
О
С-Н Н-С-ОН н-с-он н-с-он
СН20Р032’
СН2ОН С=О I н(э—с-н н-с-он
СН2ОРО32'
Ксилулозо-5-фосфатриб030_5_фОСфат
СН2ОН с-о
И ,Р
ТПФ
Н-С-ОН
Н-С-ОН
СН2ОРО3:
Седогептулозо-7-фосфат
2-
Н-С-ОН СН2ОРО32-
Глицеральдегид
-3-фосфат
СН2ОН
Трансальдолаза С=О но-с-н + н-с-он н-с-он
СН2ОР032'
Фруктозо-6-фосфат
н-с-он СН2ОРО32*
Эритрозо-4-фосфат
Н zP
СН2ОН транскетолаза с=0 I р ТПФ 9=0 с-н --------------► НО-С-Н +
н-с-он н-с-он
СН20Р032-
Н-С-ОН СН2ОРО32-
н-с-он
СН2ОРО32-
О с-н
Н-(^-ОН 4
Н-С-ОН
СН2ОРО32-
Эритрозо -4-фосфат Ксилулозо-5-фосфат
Фруктозо-6-фосфат
продолжение рис. 14.2.
2124
209
Глава 14 Пентозофосфатный путь обмена углеводов. Глюконеогенез
Неокислительная фаза ПФП
Неокислительные реакции могут начинаться от фруктозо-6-фосфата и завершаться образованием пентозофосфатов или они могут быть продолжением окислительных реакций, включая превращения пентозофосфатов до фрукто -зо-6-фосфата (последний вариант превращений ранее назывался «пентозный цикл»).
Процесс включает взаимопревращения моносахаридов, содержащих 3, 4, 5, 6 и 7 углеродных атомов.
6. Под действием транскетолазы (кофактор тиаминпирофосфат) происходит взаимодействие ксилулозо-5-фосфата и рибо-зо-5-фосфата. В результате переноса гликоальдегидной группы образуется семиуглеродный моносахарид — седогептулозо-7-фосфат и глицеральдегид-3-фосфат.
7. Фермент трансальдолаза катализирует перенос остатка диоксиацетона от седогептулозо-7-фосфата на глицеральдегид-3-фосфат с образованием эритро-зо-4-фосфата и фруктозо-6-фосфата.
8. Затем снова действует транскетола за и переносит гликоальдегидную группу от ксилулозо-5-фосфата на эритро-зо-4-фосфат. В результате образуется фруктоза-6-фосфат и глицеральдегид-3-фосфат.
9. Фруктозо-6-фосфат и глицеральдегид-3-фосфат могут в дальнейшем метаболизироваться через гликолиз и ЦТК, а также использоваться в синтезе глюкозы (фруктозо-6-фосфат-*глю-козо-6-фосфат-* глюкоза).
Регуляция ПФП
По классическим представлениям в результате пентозофосфатного пути из 3 молекул глюкозо-6-фосфата образуется 2 молекулы фруктозо-6-фосфата и 3 молекулы С02. Суммарное уравнение окислительной и неокислительной фаз
пентозофосфатного пути можно представить в следующем виде:
ЗГ-6-Ф + 6НАДФ+ + ЗН2О •* 6НАДФН + 6Н* + ЗСО2 + 2Ф-6-Ф + ГАФ
Пентозофосфатный путь отличается крайней гибкостью. Основной способ его регуляции — это доступность метаболитов и соотношение коферментов. Известно, что в норме отношение [НАД+]/[НАДН] равно 1000, а отношение [НАДФ+]/ [НАДФН] близко к 0,01. Избыток НАДФН может превращаться в НАДН в трансдегидрогеназной реакции и сбрасываться в митохондриальные цепи переноса электронов. Если в клетке потребности в рибозо-5-фосфате и НАДФН сбалансированы, то неокислительной фазы не нужно. Но если, например, жировым клеткам НАДФН необходимо значительно больше, чем рибозо-5-фосфата, то избыток последнего через неокислительные реакции и реакции глюконеогенеза превращается в глюкозо-6-фосфат. В этом случае молекулы глюкозы вступают повторно (до 6 раз) в окислительные реакции и могут полностью окисляться до СО2. Следовательно, неокислитсльные реакции пентозофосфатного пути служат гарантом для удовлетворения потребности клетки в НАДФН или ФРПФ.
Поток метаболитов через ПФП и образование НАДФН контролируется на уровне глюкозо-6-фосфатдегидрогена-зы. Активность фермента определяется концентрацией НАДФ+: если клетка потребляет НАДФН, то увеличивается концентрация НАДФ+, который повышает молекулярную активность фермента и тем самым восстанавливает количество НАДФН.
Связи пентозофосфатного пути и гликолиза
Связи пентозофосфатного пути и гликолиза определяют течение биоэнергетичес
210
Пентозофосфатный путь обмена углеводов. Глюконеогенез Глава 14
ких и биосинтетических процессов в клетках (по Berg J. М., Tymoczko J. L., Stryer L., 2002 с изм.).
Для многих клеток потребность в НАДФН для восстановительных биосинтезов превышает расход рибозо-5-фосфата ыя биосинтеза нуклеотидов и нуклеино-зых кислот. В этих условиях рибозо-5-фосфат превращается в глицеральдегид-3-фосфат и фруктозо-6-фосфат посредством превращений, катализируемых транскетолазой и трансальдолазой. Эти ферменты выполняют важную роль "о формированию связей между гликотазом и пентозофосфатным путем обмена глюкозы (рис. 14.3),
Суммарный итог реакций — образование двух гексоз и одной триозы из трех пентоз (рис. 14.4).
Взаимосвязи между пентозофосфатным путем и гликолизом можно рассмотреть в следующих метаболических ситуациях.
Ситуация 1. Требуется больше рибозо-5-росфата, чем НАДФН (быстрое деление кле- ок). Большая часть глюкозо-6-фосфата превратится во фруктозо-6-фосфат и лицеральдегид-3-фосфат в гликолизе. Тэансальдолаза и транскетолаза превратят z зе молекулы фруктозо-6-фосфата и одну молекулу ГАФ в три молекулы рибозо-5-зосфата:
5 глюкозо-6-фосфат + АТФ * 6 рибозо-5-фосфат + АДФ + Н*
Ситуация 2. Потребности в НАДФН и ри-эо-5-фосфате сбалансированы. В этих усло-ггях необходимо образовать 2 молекулы Н ХДФН и 1 молекулу рибозо-5-фосфата из
Транскетолаза
С5 + С5 Сз + С7
Трансальдолаза
Сз + Су . Cg + С4
Транскетолаза
С4+ С5 ... — С6 + Сз
эис. 14.3. Связь между гликолизом и пенто-2 гоосфатным путем.
одной молекулы глюкозо-6-фосфата в окислительной фазе пентозофосфатного пути:
Глюкозо-6-фосфат + 2 НАДФ* + Н2О -* рибозо-5-фосфат + 2 НАДФН + 2 Н* + СО2
Ситуация 3. Требуется больше НАДФН, чем рибозо-5-фосфата (синтез жирных кислот в адипоцитах). В этих условиях глюкозо-6-фосфат полностью окисляется до СО2 и Н2О. При этом активны три группы реакций: 1) в окислительной фазе пентозофосфатного пути образуются 2 молекулы НАДФН и 1 молекула ГАФ; 2) рибозо-5-фосфат с помощью транскетолазы и трансалвдо-лазы превращается во фруктозо-6-фосфат и ГАФ; 3) глюкозо-6-фосфат ресинтезируется от фрукто-зо-6-фосфата и ГАФ в реакциях глюконеогенеза:
6 Глюкозо-6-фосфат +12 НАДФ* + 6 Н2О * 6 рибозо-5-фосфат +12 НАДФН +12 Н* + 6 СО2
6 рибозо-5-фосфат -* 4 фруктозо-6-фосфат + 2 глицеральдегид-3-фосфат
4 Фруктозо-6-фосфат + 2 глицеральдегид-3-фосфат + Н2О * 5 глюкозо-6-фосфат + Рн
Суммарно:
6 Глюкозо-6-фосфат + 12 НАДФ* + 7 Н2О + 5 глюкозо-6-фосфат + 6 СО2 + 12 НАДФН +
12Н* + Рн
Ситуация 4. Требуются НАДФН и АТФ. Рибозо-5-фосфат, образованный в окислительной фазе пентозофосфатного пути может превратиться в пируват. Фруктозо-6-фосфат и ГАФ, образованные из рибозо-5-фосфата, вступают в гликолиз быстрее, чем в глюконеогенез. При этом будет достигаться одновременный синтез НАДФН и АТФ, а 5 атомов углерода из шести, входящих в состав глюко-зо-6-фосфата, окажутся в молекулах пирувата:
3 Глюкозо-6-фосфат + 6 НАДФ* + 5 НАД* +
5 Рн + 8 АДФ * 5 пируват + 3 СО2 + 6 НАДФН + 5 НАДН + 8 АТФ + 2 Н2О + 8 Н*
Образованный в этих реакциях пируват окисляется для образования АТФ (окислительное декарбоксилирование-* ЦТК-*цепи переноса электронов-*окислительное фосфорилирование АДФ) или может использоваться как строительный блок в биосинтезах.
3С5 2С6+С3
Рис. 14.4. Суммарный итог ПФП.
211
Глава 14 Пентозофосфатный путь обмена углеводов. Глюконеогенез
Функции пентозофосфатного пути
1. Образование НАДФН+Н+ (50 % потребности организма), необходимого 1) для биосинтеза жирных кислот, холестерола и 2) для реакции детоксикации (восстановление и окисление глутатиона, функционирование цитохром Р-450 зависимых монооксигеназ — микросомальное окисление). Особенно важен НАДФН для функционирования эритроцитов. В этих клетках НАДФН необходим для сохронения отношения (глутатион восстановленный): (глутатион окисленный) на уровне 1: 500. Восстановленный глутатион служит для поддержания остатков цистеина в гемоглобине и других белках в восстановленном состоянии.
2. Синтез рибозо-5-фосфата, используемого для образования 5-фосфорибозил-1-пирофосфата, который необходим для синтеза пуриновых нуклеотидов и присоединения оротовой кислоты в процессе биосинтеза пиримидиновых нуклеотидов.
3. Синтез углеводов с различным числом атомов углерода (С3-С7).
4. У растений образование рибулозо-1,5-бисфосфата, который используется как акцептор СО2 в темновой стадии фотосинтеза.
Медицинское значение пентозофосфатного пути обмена углеводов
1. В разных тканях активный пентозо-фосфагный путь выполняет отличающиеся функции: в корковом веществе надпочечников — синтез стероидных гормонов; в печени — синтез жирных кислот и холестерола; в тестикулах — синтез поповых гормонов; в жировой ткани — синтез жирных кислот; в яичниках — синтез стероидов; в молоч
ной железе — синтез жирных кислот; в эритроцитах — поддержание глутатиона в восстановленном состоянии. 2. Активные формы кислорода (АФК) образуются в окислительных реакциях и способны повреждать (окислительный стресс) все классы макромолекул, вести к гибели клеток и вызывать ряд заболеваний человека. Восстановленный глутатион необходим для предупреждения окислительного стресса и восстановления нормального окислительно-восстановительного состояния клеток. Окисленный глутатион восстанавливается за счет НАДФН. Клетки со сниженной активностью пентозофосфатного пути весьма чувствительны к окислительному стрессу. Особенно он опасен для эритроцитов.
3. После завершения лечения маля-, рии некоторыми противомалярийными препаратами (например, примахином) у ряда больных развивалась гемолитическая анемия, определяемая недостаточностью глюкозо-6-фосфатде-гидрогеназы. Этот дефект, связанный с X хромосомой, обнаруживается у 400 миллионов людей. Функционирование фермента связано с продукцией НАДФН, который в эритроцитах поддерживает восстановленное состояние глутатиона. Восстановление сульфгидрильных групп глутатиона катализирует глутатионредуктаза. Восстановленная форма глутатиона — это своеобразная буферная система, позволяющая поддерживать остатки цистеина в гемоглобине и других эритроцитарных белках в восстановленном состоянии. Нормальное соотношение восстановленного глутатиона с окисленным глутатионом в эритроцитах позволяет поддерживать гемоглобин в ферро-состоянии (Fe2+). Кроме того, восстановленный глутатион служит для обезвреживания пе-
212
Пентозофосфатный путь обмена углеводов. Глюконеогенез Глава 14
роксидов (пероксидазная реакция). Клетки со сниженным уровнем восстановленного глутатиона весьма чувствительны к гемолизу, так как недостаточный потенциал к восстановлению гемоглобина ведет к перекрестному связыванию молекул гемоглобина за счет окисления сульфгидрильных групп и образования дисульфидных мостиков с формированием агрегатов на мембране (тельца Гейнца). Тельца Гейнца способствуют повреждению мембран и гемолизу, особенно, если пациент получал любые ксенобиотики, активирующие окислительный стресс (лекарства и др.). Это пример того, как атипичная фармакодинамика лекарств реализуется на генетическом уровне.
4. Лица с дефицитом глюкозо-6-фос-фатдегидрогеназы в эритроцитах (11 % населения Америки и Африки) более устойчивы к малярии, поскольку из-за дефекта фермента глюкозо-6-фосфатдегидрогеназы эритроциты гемолизируются раньше, чем пройдет внугриэритроцитарный этап развития малярийного плазмодия. Однако эти люди чувствительны к действию ксенобиотиков.
Гл юконеогенез
Глюконеогенез — синтез углеводов из неуглеводных предшественников (гликогенных аминокислот, глицерола, лактата, пропионовой кислоты). Глюконеогенез протекает в цитозоле клеток печени и почек, хотя некоторые предшественники образуются в митохондриях. Глюконеогенез необходим для синтеза глюкозы, которая является источником энергии, особенно для нервной ткани и эритроцитов. При голодании более I суток за счет глюконеогенеза поддерживается базальный уровень глюкозы в крови, и метаболизм обеспечивается промежуточными продуктами ЦТК. При интенсивной физической работе синтез глюкозы происходит из лактата и глицерола', при голодании — из глицерола, образующегося при распаде жиров и аминокислот, освобождающихся в процессе катаболизма белков мышц.
Большинство стадий глюконеогенеза представляет собой обращение реакций гликолиза. Величина AGO/ при образовании пирувата из глюкозы в стандартных условиях клетки равно -20 ккал/моль (-84 кДж/моль). Основное уменьшение свободной энергии имеет место в трех необратимых реакциях, катализируемых гексокиназой, фосфофруктокиназой и пируваткиназой (рис. 14.5).
Гексокиназа
Глюкоза + АТФ —----------► Глюкозо-6-фосфат + АДФ
AG = -8,0 ккал/моль (-33 кДж/моль)
Фосфофруктокиназа
Фруктозо-6-фосфат + АТФ------------► Фруктозо-1,6-бисфосфат + АДФ
AG = -5,3 ккал/моль (-22 кДж/моль)
. . . Пируваткиназа „
Фосфоенолпируват+ АДФ_____Li_______► Пируват + АТФ
AG = -4,0 ккал/моль (-17 кДж/моль)
Рис. 14.5. Необратимые реакции гликолиза.
213
Глава 14 Пентозофосфатный путь обмена углеводов. Глюконеогенез
В процессе глюконеогенеза для обращения этих трех необратимых этапов используются другие ферменты.
1. При интенсивной мышечной работе образуется лактат, который током крови поступает в печень. В цитозоле под действием лактатдегидрогеназы лактат окисляется в пируват, который поступает в митохондрии (рис. 14.6а).
Прямой синтез фосфоенолпирувата из пирувата невозможен из-за необратимости пируваткиназной реакции, поэтому используется обходной путь из нескольких ферментов. Вначале пируват поступает в митохондрии и при участии биотин-зависимой пируваткарбок-силазы, СО2 и АТФ карбоксилируется с образованием оксалоацетата. Это ключевой момент для энергетического преодоления пируваткиназной реакции в обходных реакциях (рис. 14.66).
Для транспорта из митохондрий в цитозоль оксалоацетат восстанавливает
ся в малат с участием фермента НАД-зависимой малатдегидрогеназы (рис. 14.6в).
В цитозоле происходит обратный процесс окисления малата в оксалоацетат под действием цитозольной малатдегидрогеназы с коферментом НАД+ (рис. 14.6г).
Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенол-пируваткарбоксикиназы превращается в фосфоенолпируват. Донором фосфатного остатка служит ГТФ. На этом завершается путь обхода необратимой пируваткиназной реакции (рис. 14.6д).
Фосфоенолпируват в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бисфосфат.
2. Превращение фруктозо-1,6-бисфос-фата во фруктозо-6-фосфат катализируется специфической фосфатазой — фруктозо-1,6-бисфосфатазой (обход
214
Пентозофосфатный путь обмена углеводов. Глюконеогенез Глава 14
СОО' СОО-
но-с—н Малатдегидрогеназа с-о
сн2 сн2
СОО- СОО'
НАД+ НАДН+Н*
Малат Оксалоацетат
Рис. 14.6 г. Окисление малата.
СОО' I С-О I СН2
СОО'
Оксалоацетат
Фосфоенолпируваткарбокси-киназа
(роо
С-О ~РО32'
II сн2он
ПФ
ГДФ со2
Фосфоенолпируват
Рис. 14.6 д. Синтез фосфоенол пирувата.
необратимой фосфофруктокиназной реакции).
3. В последующей обратимой стации биосинтеза глюкозы фруктозо-6-фосфат превращается в глюкозо-6-фосфат, который дефосфорилируется под влиянием фермента глюкозо-6-фосфатазы (обход необратимой гексокиназной реакции).
В большинстве тканей на этом завершается глюконеогенез, и свободная глюкоза
не выделяется. Глюкозо-6-фосфат далее превращается разными путями, в том числе и в гликоген. Только два органа — печень и почки, в которых имеется фермент глюкозо-6-фосфатаза, связанный с мембранами эндоплазматического ретикулума, способны освобождать глюкозу в кровь (рис. 14.7).
Транспортер глюкозы в цитозоль по строению такой же, как и в плазмати-
215
Глава 14 Пентозофосфатный путь обмена углеводов. Глюконеогенез
Рис. 14.7. Освобождение глюкозы из глюкозо-6-фосфата. В процессе участвуют белки эндоплазматического ретикулума (ЭПР): Т1 транспортирует глюкозо-6-фосфат в просвет ЭПР, Т2 и ТЗ транспортируют неорганический фосфат и глюкозу в цитозоль. Глкжозо-6-фосфатаза стабилизируется Са2+-связывающим белком (SP).
ческой мембране клеток. Неорганический фосфат и глюкоза выделяются в цитозоль вместе. Таким образом, необходимо 5 белков для превращения глюко-зо-6-фосфата в свободную глюкозу.
В организме существует взаимосвязь гликолиза и глюконеогенеза на органном уровне. Основным субстратом для глюконеогенеза является лактат, образованный активной скелетной мышцей. Плазматическая мембрана обладает высокой проницаемостью для лактата. Поступив в кровь, лактат переносится в печень, где в цитозоле окисляется в пируват. Пируват затем превращается в глюкозу по пути глюконеогенеза. Глюкоза поступает далее в кровь и поглощается скелетными мышцами. Эти превращения составляют цикл Кори.
Регуляция глюконеогенеза
Превращения метаболитов в глюконеогенезе и гликолизе скоординированы так, что один процесс активен, а второй неактивен. Если одновременно активны оба процесса, то следует гидролиз четырех молекул нуклеотидтрифосфатов (2 АТФ и 2 ГТФ) в каждом цикле. Оба процесса экзергоничны, поэтому термо
динамически невыгодна одновременная их активация.
1. Ацетил-КоА активирует, а АДФ ингибирует пируваткарбоксилазу (первый фермент глюконеогенеза). Когда в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается.
Скорость гликолиза зависит от концентрации глюкозы, а скорость глюконеогенеза — от концентрации лактата и других предшественников глюкозы.
2. Фруктозо-1,6-бисфосфатаза ингибируется АМФ. В то же время АМФ является аллостерическим активатором фосфофруктокиназы. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина АТФ/АМФ низкая, в клетке наблюдается расщепление глюкозы. Высокий уровень АМФ показывает, что энергетический заряд снижен и требуется синтез АТФ. Высокий уровень АТФ и цитрата демонстрирует высокий энергетический заряд и возможность биосинтетических процессов.
216
Пентозофосфатный путь обмена углеводов. Глюконеогенез Глава 14
3. Активность фосфофруктокиназы и Ьруктозо-1,6-бисфосфатазы регулируется концентрацией фруктозо-2,6-бисфос-рата в печени. Фруктозо-2,6-бисфосфат активирует фосфофруктокиназу (гликолиз) и ингибирует фруктозо-1,6-бисфос-ратазу (глюконеогенез).
4. При голоде преобладает глюконеогенез, поскольку концентрация фруктозо-2,6-бисфосфата очень низкая. Освобождение глюкозы в этих условиях <райне необходимо для питания мозга и мышц. Высокие уровни А ТФ и аланина ингибируют пируваткиназу (гликолиз) в печени. АДФ также ингибирует росфоенолпируваткарбоксикиназу глюконеогенез). Следовательно, глюконеогенез преобладает, если в клетках оного АТФ и предшественников био-с интетических процессов.
5. Инсулин, выделяющийся после еды, повышает проницаемость клеток для люкозы и усиливает экспрессию клю--евых ферментов гликолйза: фосфо-рруктокиназы и пируваткиназы, а так-ке стимулирует превращение глюкозы г резервные молекулы. Глюкагон, выде-.чемый при голоде, ингибирует экспрессию этих ферментов и стимулирует образование двух ключевых ферментов гюконеогенеза — фосфоенолпируват-< зрбоксикиназы и фруктозо-1,6-бис-z эсфатазы.
э. Регуляция при физической работе. 1) -.ДФ и сами гексозы, которые накапливаются в мышцах в начале работы, ал- истерически активируют ферменты рас-’ола глюкозы; 2) глюкокортикоиды и юкагон, выделяющиеся при длительна работе и голодании стимулируют в .ечени синтез ферментов глюконеогенеза. 3) жирные кислоты, которые мобилизуются из жировой ткани при длительной работе и голодании и продукты обмена (АТФ, ацетил-КоА, цитрат) _глостерически ингибируют в мышцах и ечени ферменты синтеза глюкозы.
Итак, в гликолизе глюкоза превращается в пируват, а в глюконеогенезе — пируват в глюкозу. Регуляция этих процессов представлена на рисунке 14.8.
Уровень фруктозо-2,6-бисфосфата высокий при питании жирами и низкий при голоде. Другим важным контролирующим агентом является ингибирование пируваткиназы фосфорилированием при голоде.
Парные реакции типа образования фруктозо-1,6-бисфосфата из фрук-тозо-6-фосфата (фосфофруктокиназа) и превращения фруктозо-1,6-бисфосфата во фруктозо-6-фосфат (фруктозо-1,6-бисфосфатаза) называют субстратными циклами. Как правило, одновременно оба превращения не могут быть активными, поэтому эти реакции подвержены аллостерической регуляции. При патологии, например опухолевой гипертермии, возможна активация обоих реакций, что сопровождается избыточным расходованием АТФ. Поэтому такие циклы называют футильными (расточительными) субстратными циклами.
Метаболизм гексоз
Среди гексоз, абсорбируемых в Ж КТ человека, преобладают глюкоза, фруктоза и галактоза. В тканях, в первую очередь в печени, функционируют специальные пути превращения фруктозы и галактозы в глюкозу.
Метаболизм фруктозы
В сутки в организм человека поступает около 100 г фруктозы. 80 % поступившей фруктозы метаболизируется в печени и превращается в глюкозу.
217
Глава 14 Пентозофосфатный путь обмена углеводов. Глюконеогенез
Рис. 14.8. Регуляция гликолиза и глюконеогенеза (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
В печени, почках и кишечнике фермент фруктокиназа фосфорилирует фруктозу с использованием АТФ до фруктозо-1-фосфата (рис. 14,9). Этот фермент не катализирует фосфорилирование глюкозы и на его активность (в отличие от глюкокиназы) не влияют голодание и инсулин. Поэтому фруктоза
может использоваться у больных сахарным диабетом и при поражении печени.
Распад фруктозы в печени по пути гликолиза происходит быстрее, чем глюкозы, так как фруктоза минует стадию, характерную для метаболизма глюкозы, катализируемую фосфофруктокиназой.
218
Пентозофосфатный путь обмена углеводов. Глюконеогенез Глава 14
Фруктоза может быть фосфорилирована с образованием фруктозо-6-фос-фата в реакции, катализируемой гексо-киназой — ферментом, который также катализирует реакции фосфорилирования глюкозы и маннозы. Однако сродство данного фермента к фруктозе гораздо ниже, чем к глюкозе, поэтому этот путь не является основным при усвоении фруктозы и протекает медленно.
Наследственные нарушения обмена фруктозы.
1. Дефект фруктокиназы. В крови накапливается фруктоза (фрукто-земия), которая поступает в мочу (фруктозурия). Это состояние называется эссенциальная фруктозурия. Протекает бессимптомно.
2. Дефект альдолазы фруктозе-1 -фосфата. Непереносимость фрук
Фруктоза,
Фруктокиназа Мд2*
АТФ АДФ
СН2°НО СН2ОРО32'
ОН
ОН
Фруктозо-1 -фосфат
Альдолаза фруктозо-1 -фосфата
(jJH2OPO32-с=о -•
СН2ОН
Триозокиназа
н-с-он
СН2ОН
АТФ АДФ
Н-С-ОН
СН2ОРО32-
Диоксиацетон- Глицеральдегад Глицеральдегид-З-фосфат
фосфат
Альдолаза s'
^-^фруктозо-1,6-бисфосфата^"^
Ж I
Фруктозо-1,6-бисфосфат Гл икол из
Фруктозе-1,6-бисфосфатаза и
Фруктозо-6-фосфат
Изомераза
Т
Глюкозо-6-фосфат
Гпюкозо-6-фосфатаза V
Глюкоза
эис. 14.9. Превращение фруктозы в глюкозу.
219
Глава 14 Пентозофосфатный путь обмена углеводов. Глюконеогенез
тозы. Накопление фруктозо-1-фосфата ингибирует ряд ферментов, а именно — фосфорилазу гликогена, фосфоглюкомутазу и альдолазу фруктозо-1,6-бисфосфата, что приводит к резко выраженной гипогликемии и поражению органов и тканей, зависимых от концентрации глюкозы (печень, мозг, почки и др.). Может приводить к летальному исходу.
Метаболизм галактозы
Галактоза образуется при гидролизе дисахарида лактозы (молочного сахара) в кишечнике. В печени галактоза легко превращается в глюкозу.
Галактоза фосфорилируется ферментом галактокиназа с использованием АТФ и образуется галактозо-1-фосфат. Галактозо-1-фосфат реагирует с УДФ-глюкозой с образованием УДФ-галак-тозы и глюкозо-1 -фосфата. Фермент: гексозо-I-фосфат -уридилтрансфераза. На этой стадии галактоза занимает место в УДФ-глюкозе. УДФ-галактоза под действием 4 '-эпимеразы превращается в УДФ-глюкозу (рис. 14.10).
Нарушение метаболизма галактозы наблюдается при наследственном дефекте уридилтрансферазы. Прием молока вызывает тошноту и рвоту. Происходит накопление галактозы в тканях. В ткани глаза галактоза восстанавливается, что приводит к развитию катаракты. В печени галактозо-1-фосфат вызывает снижение содержания неорганического фосфата. Развиваются нарушения функции печени и психики. Характерна триада симптомов: умственная отсталость, катаракта (помутнение хрусталика),
гепатоспленомегалия (увеличение печени и селезенки).
Детям с дефектом этого фермента назначают диету, из которой исключают галактозу до 2—4 лет. В этом возрасте появляется второй путь, который менее интенсивный, но количество молока в питании резко падает (рис. 14.11).
Глюкуроновый путь обмена глюкозы
Это незначительный по мощности, но важный в функциональном отношении путь превращений глюкозы, приводящий к образованию глюкуроновой кислоты, которая используется:
• в синтезе гликозамингликанов;
• во второй фазе обезвреживания ксе-' нобиотиков;
• выведении ряда эндогенных соединений в виде конъюгатов;
• в биосинтезе витамина С у млекопитающих, за исключением человека, приматов и морских свинок.
Схема глюкуронового пути превращения глюкозы представлена на рисунке 14.12.
Вначале глюкоза превращается в УДФ-глюкозу (см. лекцию 15). Затем УДФ-глюкоза окисляется по шестому атому углерода с образованием глюкуроновой кислоты. У млекопитающих, способных к синтезу витамина С, глюкуроновая кислота восстанавливается НАДФН-зависимой дегидрогеназой до L-гулоновой кислоты. Последняя и является предшественником аскорбиновой кислоты. Гулоновая кислота далее окисляется до З-оксо-Ь-гулоната, который декарбоксилируется с образованием L-ксилулозы. Ксилулоза может включаться в пентозофосфатный путь. Для реализации этой возможности
220
Пентозофосфатный путь обмена углеводов. Глюконеогенез Глава 14
Галактоза
Г алактозо-1 -фосфат
Гексозо- 1-фосфат-уридилтрансфераза
+ УДФ-глюкоза
Фосфоглюкомутаза 4'-эпимераза
1 v
Глюкозо-6-фосфат УДФ-глюкоза
Пируват
Г Гликоген
Рис. 14.10. Превращение галактозы в глюкозу.
Галактозо-1 -фосфат-уридилтрансфераза
Галактозо-1-фосфат+утФ -----------------------► УДФ-галактоза + Н4Р2О7
4-эпимераза т
УДФ-глюкоза
Рис. 14.11. Альтернативный путь метаболизма галактозы.
221
Глава 14 Пентозофосфатный путь обмена углеводов. Глюконеогенез
Рис. 14.12. Глюкуроновый путь обмена глюкозы (В.К. Кухта и др., 2008). ДГ - дегидрогеназа, ДК - декарбоксилаза.
предварительно происходит превращение L-изомера в D-ксилулозу в реакции, катализируемой НАДФ+-зависи-мыми дегидрогеназами через стадию образования ксилитола.
При редком наследственном заболевании, обусловленном отсутствием данных ферментов, в моче появляется большое количество L-ксилулозы (идиопатическая пенто-зурия).
Некоторые микроорганизмы (бактерии рода Pseudomonas) получают энергию с помощью специального метаболического пути Энтнера-Дудорова,
связанного с пентозофосфатным путем превращений углеводов через 6-фосфоглюконовую кислоту, а с гликолизом — через глицеральдегид-3-фосфат. Первые две реакции пути Энтнера-Дудорова идентичны началу пентозофосфатного пути. Затем следуют специфичные для этого пути метаболизма реакции образования кетодезоксифосфоглюконовой кислоты с последующим ее альдолазным расщеплением на две триозы — глицеральдегид-3-фосфат и пируват. В этом пути образуется 1 молекула АТФ, 1 молекула НАДН и 1 молекула НАДФН. Это кратчайший путь образования пирувата (4 реакции) у прокариот, тогда как в гликолизе требуется 9 реакций.
222
Слава 15
Синтез и распад гликогена
Гликоген —- основная форма запасания •глеводов у животных. Гликоген запасается, главным образом, в печени (до ? % от массы печени, 150 г) и в мышцах. где его содержание редко превышает 1 % (300 г).
Гликоген печени используется для тэддержания физиологических концентраций глюкозы в крови, прежде всего между приемами пищи. Поэтому содер--дние гликогена в печени изменяется в широких пределах. Через 12—18 часов -деле приема пищи запас гликогена - ечени практически полностью истощаемся, после чего начинается снабжение рганизма глюкозой, полученной с по-зщью реакций глюконеогенеза. Фун- лия мышечного гликогена состоит в ?м. что он является легкодоступным сточником глюкозы, используемой для иколиза в самой мышце и не участву-в регуляции уровня глюкозы в кро-- •• Содержание мышечного гликогена еметно истощается только после про-. /.жительной и напряженной физичес-:и работы.
Напомним, что гликоген является * - .ветвленным полимером с молекуляр-
?: массой несколько миллионов Да.
Полимерная структура облегчает запасание глюкозы без возникновения осмотической проблемы, которую создают свободные молекулы глюкозы. В молекуле гликогена остатки глюкозы связаны а-1,4-гликозидными связями; в точках ветвления, которые расположены в среднем через 10 остатков глюкозы, связь между молекулами глюкозы а-1,6-гликозидная. Высокая степень разветвленности позволяет ферментам, участвующим в расщеплении гликогена, одномоментно отщеплять большое количество свободной глюкозы.
Синтез гликогена (гликогенез)
Синтез гликогена начинается через 1— 2 ч после приема пищи, содержащей углеводы.
Синтез гликогена включает 3 стадии: 1) образование активной формы глюкозы (УДФ-глюкозы); 2) синтез линейной цепочки гликогена, т. е. образование а-1,4-гликозидных связей и 3) образование ветвления, т. е. образование а-1,6-гликозидных связей.
223
Глава 15 Синтез и распад гликогена
Образование активной формы глюкозы (УДФ-глюкозы)
1. Глюкоза фосфорилируется с затратой молекулы АТФ до глюкозо-6-фосфата. Это та же реакция, которая является первой в процессе гликолиза: фосфорилирование глюкозы катализируется в мышцах ферментом гексокиназой, а в печени — глюкокиназой.
2. Под действием фосфоглюкомутазы
глюкозо-6-фосфат превращается в глюкозо-1 -фосфат.
3. Ключевой реакцией синтеза гликогена является образование активной формы глюкозы — УДФ-глюкозы с участием фермента УДФ-гдюкозопирофосфорилазы (глюкозо-1-фосфат-уридилтрансфераза) и УТФ. Реакция необратима, т. к. пирофосфат расщепляется ферментом пирофосфатазой до 2-х молекул неорганического фосфата (рис. 15.1).
Рис. 15.1. Образование УДФ-глюкозы.
224
Синтез и распад гликогена Глава 15
Образовавшаяся УДФ-глюкоза является переносчиком и донором активированных остатков глюкозы в последующей реакции синтеза гликогена. Эта функция нуклеозиддифосфатсахаров была установлена аргентинским биохимиком Л. Лелуаром, удостоенным Нобелевской премии.
Образование а-1,4-гликозидной связи
Для образования а-1,4-гликозидной связи необходимо наличие затравки гликогена (праймера) — а-1,4-полиглю-козная цепь или ветвь молекулы гликогена, состоящая из не менее 8 остатков глюкозы.
Под действием фермента гликогенсин-^азы образуется гликозидная связь меж-лу С] атомом активированной глюкозы, находящейся в составе УДФ-глюкозы, и С4 атомом остатка глюкозы нередуци-руемого (внешнего) конца разветвленной молекулы гликогена.
УДФ-глюкоза + (С6Н12О5)п * УДФ +
<c6h12o5U
Образование а-1,6-гликозидной связи
Присоединение остатка глюкозы к - затравочной» цепи гликогена происходит на внешнем конце молекулы. «Вет-5и» гликогенового «дерева» удлиняют-: ч путем последовательного образования
1,4-гликозидных связей. После того, как длина линейного участка цепи достигнет как минимум 11 остатков глю-чозы, ветвящий (браншинг) фермент змило[ 7,4/-* /1,6]-трансгликозидаза) "ереносит фрагмент (1-*4) цепи из 6“ “ остатков глюкозы на ту же или сосед--::юю цепь, присоединяя переносимый фрагмент а-1,6-гликозидной связью гас. 15.2). Таким образом, образуется
точка ветвления в молекуле.
Синтез новых молекул гликогена
При полном исчерпании молекул гликогена в клетке для инициации его синтеза требуется белок гликогенин. Этот белок одновременно выполняет функцию затравки, на которой начинают синтезироваться новые цепи гликогена и обладает ферментативной активностью, катализируя этот процесс (рис. 15.3).
Гликогенин — белок, состоящий из двух идентичных субъединиц с молекулярной массой 37 кДа.
Первым этапом синтеза новой молекулы гликогена является ковалентное присоединение молекулы глюкозы к остатку тирозина (Тир194) гликогенина, катализируемое гликозилтрансферазной активностью белка (I). Затем гликогенин образует прочный комплекс с гли-когенсинтазой (2) и несколько следующих этапов происходят внутри этого комплекса. Синтезируемая цепь удлиняется последовательным присоединением остатков глюкозы из УДФ-глюкозы (3). Реакция происходит аутокаталитически за счет гликозилтрансферазной активности гликогенина. Когда присоединится более 7 остатков глюкозы, гликогенсин-таза начинает удлинять синтезируемую цепь и отделяется от гликогенина (4). Гликогенсинтаза и браншинг-фермент (5) синтезируют молекулу гликогена. Гликогенин остается внутри молекулы гликогена ковалентно связанный с одним редуцирующим концом молекулы гликогена (рис. 15.4).
Распад гликогена (гликогенолиз)
Гликогенолиз — это процесс расщепления гликогена, приводящий к вовлече-
225
Глава 15 Синтез и распад гликогена
УДФ-глюкоза Гпикогенсинтаза
— Остатки глюкозы, соединенные «-1,4 и «-1,6 связями соответственно
Рис. 15.2. Ветвление структуры гликогена (В.П. Комов, В.Н. Шведова, 2004).
нию глюкозных остатков этого запасного полисахарида в гликолиз.
Существует 2 пути распада внутриклеточного гликогена: гидролитический или амилолитический (более древний) и фосфоролитический. При гидролитическом пути распад гликогена осуществля
ется под действием фермента у-амила-зы в печени в присутствии воды и выделяется свободная глюкоза.
Фосфоролитический путь является основным путем распада гликогена у животных и катализируется ферментом фосфорилазой.
226
Синтез и распад гликогена Глава 15
Рис. 15.3. Поперечный срез молекулы глико-ена. Буквой G обозначен гликогенин
(C6H12O5)n + H3PO4-(C6H12O5U + Глюкозо-1 -фосфат
Гликогенфосфорилаза является димером из двух идентичных субъединиц с молекулярной массой 97 кДа. Каждая губъединица компактно уложена в N-терминальный домен (480 аминокислотных остатков, содержит гликогенсвязы-ззющее место) и С-терминальный домен 360 аминокислотных остатков). Активный центр локализован в щели между двумя доменами белка. Для функционирования фермента необходимо производное витамина В6 пиридоксаль-5-фос-t-am. Альдегидная группа этого <офсрмента образует Шиффово основание с остатком лизина полипептидной лепи фермента. Этот кофактор участвует в кислотно-основном каталитическом процессе, связанным с отщеплением конечного остатка глюкозы от цепи гликогена и его выделения в виде глю-козо-1-фосфата.
Фосфоролитическое расщепление пникогена энергетически выгодно, к. высвобождается фосфорилированная глюкоза. Фосфорилированная
Рис. 15.4. Инициация синтеза молекулы гликогена гликогенином (D. L. Nelson, М. М. Сох, с изм.).
глюкоза в мышечной ткани не может высвобождаться в кровь вследствие отсутствия фермента глюкозо-6-фосфатазы.
Фосфоролитическое расщепление гликогена включает несколько стадий.
227
Глава 15 Синтез и распад гликогена
1. Фермент фосфорилаза специфично катализирует расщепление а-1,4-глико-зидных связей гликогена. Остатки глюкозы отщепляются от концов молекулы гликогена до тех пор, пока на ветвях, идущих от точки ветвления не останется примерно по 4 остатка глюкозы.
2. Фермент а-1,4-*-1,4-глюкантрансфе-раза переносит трисахаридный фрагмент с одной цепи на другую, открывая а-1,6-гликозидную связь.
3. Гидролитическое расщепление а-1,6-гликозидной связи осуществляет фермент амило-1,6-гликозидаза (деветвящий, дебраншинг-фермент), что приводит к отщеплению одной молекулы свободной глюкозы и открывает для действия гликогенфосфорилазы новый участок, состоящий из остатков глюкозы, соединенных а-1,4-связями (рис. 15.5).
4. Из глюкозо-1-фосфата образуется глюкозо-6-фосфат. В печени имеется специфический фермент глюкозо-6-фосфатаза, который отщепляет фосфат от глюкозо-6-фосфата. Образовавшаяся глюкоза диффундирует из клеток в кровь и поглощается преимущественно мозгом и мышцами. Это заключительная стадия гликогенолиза в печени, приводящая к повышению содержания глюкозы в крови.
Регуляция гликогенеза и гликогенолиза
Главные ферменты, контролирующие метаболизм гликогена, — гликогенфос-форилаза и гликогенсинтаза — регулируются аллостерически и ковалентной модификацией путем фосфорилирования и дефосфорилирования фермента (рис. 15.6).
1. В печени фосфорилаза находится в активной и неактивной форме. Активная фосфорилаза {фосфорилаза а) — фосфорилированный тетрамер. Под дей
ствием специфической фосфатазы фосфорилаза а переходит в неактивную фосфорилазу Ь (димер) в результате гидролитического отщепления фосфата от остатка серина. Переход неактивной фосфорилазы b в фосфорилазу а проис-. ходит путем фосфорилирования под действием киназы фосфорилазы.
Соотношение между неактивным Т-со-стоянием фосфорилазы b и активным R-состоянием фосфорилазы а определяется энергетическим зарядом мышечной клетки. Глюкозо-6-фосфат и АТФ стабилизируют неактивное Т-состояние фермента (фосфорилаза Ь). Фосфорилаза а всегда активна, независимо от концентраций АМФ, АТФ и глюкозо-6-фосфа-та. В покое преобладает фосфорилаза Ь, а при работе АМФ переводит фермент в активную форму а.
2. Киназа фосфорилазы существует в 2-х формах — активной — фосфорилированной и неактивной — дефосфорилиро-ванной. Переход активной формы в неактивную осуществляется при отщеплении фосфорной кислоты. Активация киназы фосфорилазы происходит при участии фермента протеинкиназы.
3. Гликогенсинтаза может находиться в фосфорилированном и нефосфорилиро-ванном состоянии. Активна дефосфори-лированная форма фермента — гликогенсинтаза а, которая переходит в неактивную гликогенсинтазу b (зависима от концентрации глюкозо-6-фосфата) путем фосфорилирования гидроксильных групп остатков серина под действием протеинкиназы. Превращение глико-генсинтазы b в активную форму а происходит под действием протеинфос-фатазы путем отщепления фосфатных групп от остатков серина.
4. Протеинкиназа состоит из 4-х субъединиц (тетрамер) — 2-х регуляторных (R) и 2-х каталитических (С). В комплексе 1<2С, фермент неактивен и активируется под действием циклического АМФ
228
Синтез и распад гликогена Глава 15
Глюкантрансфераза
> (Х-0*6)-глюкозидаза молекула свободной глюкозы Ц)
0000000000000— Гликоген
| Фосфорилаза
Глюкоза, соединенная (1- [1*-4]-гликозидными связями
/Ц — Глюкоза, соединенная а - (1*-6]-ГЛИКОЗЦДНЫМИ связями
Рис. 15.5. Расщепление гликогена (В.П. Комов, В.Н. Шведова, 2004).
кАМФ). 2 молекулы цАМФ присоединяются к каждой регуляторной субъединице протеинкиназы, что вызывает его диссоциацию с высвобождением каталитических субъединиц.
R2C2 + 4цАМФ 2 С + 2 (R — 2 цАМФ)
Активная протеинкиназа переносит остаток фосфорной кислоты от АТФ на тле пифические белки (ферменты), что “риводит к изменению их активности.
5. Образование цАМФ (3'5'-АМФ) происходит из АТФ под действием фермента аденилатциклазы, который находится на внутренней поверхности мембраны и связан с рецептором для гормонов на внешней стороне мембраны.
6. Фермент фосфодиэстераза разрушает цАМФ путем разрыва фосфодиэфир-ной связи с образованием АМФ (рис. 15.7).
229
Глава 15 Синтез и распад гликогена
Глюкагон (печень)
Адреналин (печень, мышцы)
Аденилат-®/ Аденилат-циклаза *” Никлаза (неактивная) (активная)
Плазматическая мембрана
АТФ-
Фосфодиэстераза цАМФ ----------► АМФ
АТФ
Киназа фосфорилазы b (неактивная) Рн
Протеин-киназа (неактивная)
(+) Протеин-
——* киназа (активная) АТФ | АДФ
АДФ
Фосфатаза
Н2О
Гликоген-синтаза а (активная)
(активная)
Рн Н2О
Протеинфосфатаза
Гликоген-синтаза b (неактивная)
Гликоген-фосфорилаза b (неактивная)
Н2О
Протеинфосфатаза
Гликогенфосфорилаза а (активная)
Рн
Рис. 15.6. Регуляция синтеза и распада гликогена.
При голодании или в стрессовых ситуациях увеличивается потребность в глюкозе.
1. В мышце под действием адреналина, а в печени — глюкагона и адреналина происходит активация аденилатцикла-зы, которая приводит к образованию цАМФ; цАМФ, связываясь с R-субъединицей протеинкиназы, активирует ее. Протеинкиназа фосфорилирует киназу фосфорилазы b и переводит ее в активную форму (киназу фосфорилазы а). Киназа фосфорилазы а фосфорилирует фосфорилазу b и переводит ее в фосфорилазу а, что активирует рас
пад гликогена. Ранее полагали, что инсулин ингибирует аденилатциклазу и активирует фосфодиэстеразу; это уменьшает концентрацию цАМФ. Протеинкиназа, киназа фосфорилазы и фосфорилаза остаются в неактивной форме, что тормозит распад гликогена. Таким образом, происходит каскад ферментативных реакций, который создает высокую степень амплификации. При распаде гликогена — 3 ферментативных стадии контроля, при синтезе — 2.
2. В мышцах фосфорилаза b может активироваться аллостерически под дей-
230
Синтез и распад гликогена Глава 15
Аденилатциклаза О- g, ------V------► О=Р-О-СН2
Н4Р2О7
О
Н
2 Н3РО4
3'
NH2
'NX^n
ОН цАМФ
Фосфодиэстераза
АМФ
Вст. 15.7. Образование и разрушение цАМФ.
ствием АМФ, оставаясь при этом дсфос-форидированной. АТФ действует как отрицательный аллостерический эф-ре ктор.
3. В мышцах сразу после мышечного сокращения гликогенолиз возрастает в несколько сотен раз. Процесс включает быструю активацию фосфорилазы через ионы кальция. Ионы Са2+ активируют киназу фосфорилазы, связыва-- сь с субъединицей киназы фосфорилазы Ь, идентичной Са2+-связывающему челку — кальмодулину.
4. Гликогенсинтаза b может активироваться аллостерически под действием люкозо-6-фосфата. Инсулин стимули-?ует синтез гликогена в мышце, способствуя дефосфорилированию и актива-тли гликогенсинтазы.
Регуляция распада гликогена носит -исканный характер (рис. 15.8).
Роль протеинфосфатаз
Ъ.гь протеинфосфатаз (по Berg J. М., moczko J. L., Stryer L.} 2002)
В последние годы получены новые данные, повышающие роль протеинфосфатаз в регуляции обмена гликогена. Эффекты протеи нкиназ при фосфорилировании ферментов отменяют протеинфосфатазы, дефосфорилирующие фосфорилированные ферменты. Протеинфосфатаза I (РР1) играет ключевую роль в регуляции обмена гликогена. PPI инактивирует киназу фосфорилазы и фосфорилазу а путем их дефосфорилирования и уменьшает распад гликогена. Более того, этот фермент дефосфорилирует гликогенсинтазу Ь, превращая ее в активную гликогенсинтазу а, что активирует синтез гликогена. Таким образом, PPI является ферментом, регулирующим процесс резервирования гликогена. PPI состоит из трех компонентов: каталитическая субъединиц с молекулярной массой 37 кДа; ЯС1-субъединица (123 Да) с высокой аффинностью к гликогену и ингибитор 1 — малая регуляторная субъединица, фосфорилирование которой ингибирует весь фермент (рис. 15.9).
При действии адреналина или глюкагона по каскадному механизму активируется протеинкиназа А. Протеинкиназа фосфорилирует два компонента протеинфосфатазы. Фосфорилирование R(,r компонента предотвращает его связывание с каталитической субъединицей про-
231
Глава 15 Синтез и распад гликогена
Алоеналин Э-Адренергический Аденилатциклаза
Адреналин рецептор
цАМФ
АТФ
Протеинкиназа А
Протеинкиназы Аа
Киназа фосфорилазы
Киназа фосфорилазы а
Фосфорилаза Ь
Фосфорилаза а
Рис. 15.8. Регуляторный каскад распада гликогена (Berg J. M.f Tymoczko J. L, Stryer L, с изм.).
теинфосфатазы 1. Поэтому активация аденилатциклазного механизма ведет к инактивации протеинфосфатазы (не может связываться с молекулой гликогена). Фосфорилирование ингибитора I протеинкиназой А блокирует каталитическую субъединицу протеинфосфатазы 1.
Распад гликогена контролируется цАМФ и фосфорилированием ингибитора I протеинфосфатазы, что поддерживает фосфорилазу а в активной форме, а гликогенсинтазу b — в неактивной.
При высокой концентрации глюкозы в крови (после еды) инсулин стимулирует синтез
гликогена посредством активации протеинфосфатазы I (рис. 15.10).
Этапы процесса:
1. Инсулин связывается рецептором, обладающим в цитозольной части тирозинкиназной активностью, что сопровождается волной фосфорилирования различных белков.
2. Активация инсулин-чувствительной протеинкиназы ведет к фосфорилированию RC( субъединицы протеинфосфатазы I в области, отличной от места фосфорилирования протеинкиназой А. Это ведет к ассоциации протеинфосфатазы и молекулы гликогена.
3. Следствием дефосфорилирования гликоген-синтазы, киназы фосфорилазы и фосфорилазы является усиленный синтез гликогена и прекращение его распада.
232
Синтез и распад гликогена Глава 15
Активная фосфатаза
(Неактивная фосфатаза)
Рис. 15.9. Регуляция протеинфосфатазы I (Berg J. М., Tymoczko J. L., Stryer L., с изм.). Фосфорилирование Rgi протеинкиназой А приводит к диссоциации каталитической субъединицы ст частицы гликогена (субстрата PPI). Ингибирование полное, когда ингибиторная субъединица । фосфорилирована и связана с PPi.
Регуляция обмена гликогена в печени концентрацией глюкозы крови
После еды, богатой углеводами, в крови повышается уровень глюкозы, что ведет к активации синтеза гликогена в печени. Этот эффект опосредуется действием инсулина и особыми механизмами регуляции в печени. Печень отслеживает уровень глюкозы в крови и изменяет активность регуляторных
ферментов. Так, количество активной фосфорилазы а быстро уменьшается после введения раствора глюкозы в кровь. Через некоторое время (лаг-период) количество гликогенсинтазы а повышается, что и определяет синтез гликогена (рис. 15.11).
Фосфорилаза является сенсором глюкозы в клетках печени
233
Глава 15 Синтез и распад гликогена
Активация рецепторной тирозинкиназы
Активация и нсул ин -чувствительной протеинкиназы
АТФ
АДФ
Активированная протеинфосфатаза I
Рис. 15.10. Активация протеинфосфатазы I инсулином (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
Минуты
Рис. 15.11. Глюкоза крови регулирует метаболизм гликогена в печени (W. Stalmans и со-авт, с изм.). Инфузия глюкозы в кровоток ведет к инактивации фосфорилазы и последующей активации гликогенсинтазы в печени.
Связывание глюкозы с фосфорилазой а сдвигает равновесие от активного R состояния в неактивное Т-состояние. Эти конформационные изменения облегчают связь фермента с протеинфос-фатазой I и перевод фосфорилазы в неактивное состояние. Неактивная фосфорилаза b не связывается с проте-инфосфатазой 1. Протеинфосфатаза I освобождается и получает возможность дефосфорилировать гликогенсинтазу b и перевести ее в активное состояние гликогенсинтазу а (рис. 15.12). В норме на 10 молекул фосфорилазы а приходится одна молекула протеинфосфатазы 1. Поэтому лаг-период для начала синтеза гликогена связан с необходимостью перевода большого количества молекул фосфорилазы а в фосфорилазу b для освобождения необходимого количества молекул протеинфосфатазы I.
Отметим, что равновесие R-Т состояний для мышечной фосфорилазы а не
234
Синтез и распад гликогена Глава 15
Рис. 15.12. Регуляция глюкозой метаболизма гликогена в печени (Berg J. М., Tymoczko J. L., Stryer L., с изм.). Глюкоза связывается и ингибирует гликогенфосфорилазу а в печени. Это =ведет к отделению протеинфосфатазы I от гликогенфосфорилазы в конформации Т. Свобод--ая протеинфосфатаза 1) дефосфорилирует гликогенфосфорилазу а в неактивную гликоген-тосфорилазу Ь, 2) дефосфорилирует неактивную гликогенсинтазу b в активную гликогенсин- азу а. Итог: подавление распада и активация синтеза гликогена.
Таблица 15.1. Врожденные заболевания накопления гликогена в органах
Тип Дефект фермента Ткань Название болезни Структура гликогена
Глюкозо-6-фосфатаза Печень Болезнь Гирке Нормальная
а-1,4-Гликозидаза Все лизосомы Болезнь Помпе Нормальная
И! Амило-1,6-гликозидаза Все органы Болезнь Кори Внешние цепи
(дебраншинг- отсутствуют или
фермент) очень короткие
V Амило-(1,4-*1,6)- Печень, Болезнь Андерсена Очень длинные
трансгликозидаза возможно неразветвленные
(браншинг фермент) все органы цепи
Гликогенфосфорилаза Мышцы Болезнь Мак-Ардла Нормальная
Д Гликогенфосфорилаза Печень Болезнь Херса Нормальная
/II Фосфофруктокиназа Мышцы Нормальная
VIII Киназа фосфорилазы Печень Болезнь Таруна Нормальная
X Гликогенсинтаза Печень Нормальная, нарушено качество синтеза
висит от концентрации глюкозы в •чрови. Гл икогенозы
Примечание: Некоторые исследовате- Заболевания, связанные с накопле-
*и неактивную гликогенсинтазу b назы- с нием гликогена, носят врожденный
shot гликогенсинтаза D, а активную гли- х характер и зависят от недостаточно-
•.ггенсинтазу a — гликогенсинтазой I. сти ферментов обмена гликогена или глюкозы (таблица 15.1).
235
Глава 16
Фотосинтез
Фотосинтез — это совокупность процессов, в ходе которых солнечная энергия запасается в виде химических связей органических соединений, синтезируемых из неорганических веществ. В процессе фотосинтеза на земле запасается 1017 ккал (4,18 х 1017 кДж) свободной энергии, что соответствует ассимиляции более чем 1010 тонн углерода в углеводы и другие органические молекулы.
Фотосинтез состоит из двух фаз: световой (фотофизический и фотохимический этапы) и темновой.
Световая фаза: свет + 12 Н2О -► 12
НАДФН + 18 АТФ + 6 О2
Темновая фаза: 12 НАДФН + 18 АТФ +
6 СО -> СНО + 6 Н О Z О 12 О 2
Фотосинтез происходит в клетках эукариот (высшие зеленые растения и низшие их формы — зеленые, бурые и красные водоросли) и одноклеточных (эвгленовые, динофлагелляты и диатомовые водоросли), а также в клетках
прокариот (сине-зеленые водоросли, зеленые и пурпурные бактерии). Примерно половина фотосинтеза на Земле осуществляется высшими зелеными растениями, а остальная половина — главным образом одноклеточными водорослями.
Фотосинтезирующие бактерии кислород не образуют. В качестве доноров водорода некоторые бактерии используют неорганические соединения. Например, зеленым серным бактериям донором водорода служит сероводород и вместо молекулярного кислорода выделяется сера. Другие фотосинтезирующие бактерии используют в качестве доноров водорода органические соединения, например, лактат. Такой фотосинтез получил название бескислородного, в отличии от кислородного фотосинтеза, который осуществляют растения и аэробные бактерии.
В. Эллиот и Д. Эллиот, считая появление фотосинтеза самым важным событием с момента возникновения жизни, дали ему следующее определение. «Фотосинтез — это биологический процесс, осуществляющий кругооборот
236
Фотосинтез Глава 16
электронов. Он имеет несколько явных преимуществ:
• неисчерпаемость источника энергии — солнца;
• неисчерпаемость донора электронов — воды;
• выделяющийся кислород является неисчерпаемым резервуаром для стока электронов, позволяющим осуществлять высвобождение энергии из высокоэнергетических электронов пищевых молекул».
Фотосинтезирующие структуры
У бактерий фотосинтезирующие структуры представлены мезосомами — впя-чивания клеточной мембраны с образованием пластинчатых органоидов. Хроматофоры — это изолированные из разрушенных бактерий мезосомы. У эукариот имеются специализированные органеллы для осуществления фотосинтеза — хлоропласты (рис. 16.1). Счита
ют, что хлоропласты — это далекие потомки прокариотических фотосинтезирующих одноклеточных организмов, вступивших в симбиоз с эукариотическими клетками.
Подобно митохондриям, хлоропласты способны делиться в собственном ритме (содержат необходимые для деления ДНК, РНК и аппарат синтеза белка). Хлоропласты крупнее митохондрий: их длина 3~10 мкм, диаметр 0,2—2,0 мкм. В клетках высших растений содержится несколько десятков хлоропластов. Помимо хлоропластов, в них имеются и митохондрии, которые обеспечивают клетки энергией в темноте за счет дыхания. По структуре хлороггласты напоминают строение митохондрий: они окружены двумя мембранами — наружной и внутренней. Внутренняя мембрана уложена в виде стопок уплощенных пузырьковидных дисков — ламеллы. Уплощенные пузырьки ламелл называют тилакоидами (замкнутая полость с поперечником 15 нм); внутри тилакоида — внутритилакоидное
Рис. 16.1. Строение хлоропласта.
237
Глава 16 Фотосинтез
пространство (thylakoid lumen). Тилакоиды уложены поперек хлоропласта стопками, называемыми гранами. В клетке высших растений содержится до 50 гран, которые соединены между собой мембранными перемычками. Водная среда между гранами является стромой хлоропласта. В гране от 10 до 20 тилакоидов. Элементарной структурной и функциональной фотосинтетической единицей мембран тилакоидов, содержащей аппарат улавливания и трансформации солнечной энергии, является квантосома (величина около 17,5 нм, м. м. порядка 2 млн Да).
В ламеллярной системе протекают световые процессы фотосинтеза, в строме — темновые ферментативные реакции, связанные с фиксацией СО2 (рис. 16.1). Транспорт веществ через внутреннюю мембрану хлоропласта осуществляется с помощью транслоказ, например, перенос АТФ в обмен на АДФ.
Фазы фотосинтеза
Световая фаза фотосинтеза протекает в квантосомах мембран тилакоидов, а темновая — в строме хлоропласта.
Световая фаза протекает на свету. На этой стадии энергия света трансформируется в химическую энергию АТФ, а относительно бедные энергией электроны воды переходят в богатые энергией электроны НАДФН. Побочным веществом, образующимся в ходе световой стадии, является кислород.
Световая фаза включает три процесса:
1. Начальной реакцией является фото-физический процесс восприятия квантов солнечной энергии и фотохимический процесс окислительного расщепления воды — фотоокисления\
hv
2 Н2О * 4Н* + 4 е+ О2
2. Энергия электронов воды используется специализированной мембранной системой для фосфорилирования АДФ и образования АТФ в системе фотосинтетического фосфорилирования.
3. Часть энергии электронов восстанавливает НАДФ+ в реакции фотовосстановления:
НАДФ*+ 2 ё + 2Н+* НАДФН +Н*
Продукты световой фазы (АТФ и НАДФН) используются в темновой стадии, где происходит восстановительный синтез глюкозы из СО2. Без световой стадии темновая стадия невозможна.
Пигменты фотосинтеза
К пигментам фотосинтеза относятся: зеленые — хлорофиллы а, в, с, d; желтые, красные, пурпурные — каротиноиды, а также красные и синие — фикобилины.
1. Все фотосинтезирующие организмы содержат хлорофиллы —- зеленые магний-порфириновые пигменты. Известно свыше 10 видов хлорофиллов, различающихся природой химических групп, присоединенных к пиррольным структурам порфиринового ядра, окраской, распространением среди живых организмов, В молекуле хлорофилла а, присутствующего в хлоропластах всех клеток зеленых растений, содержится четыре замещенных пиррольных кольца. Пятое, непиррольное кольцо, представлено остатком малоновой кислоты, этерифицированной метиловым спиртом. Длинная изопреноидная боковая цепь в молекуле хлорофилла а представляет собой остаток спирта фитола, присоединенного сложноэфирной связью к карбоксильной группе пропионовой кислоты в кольце IV. Четыре центральных атома азота в молекуле хлорофил-
238
Фотосинтез Глава 16
Рис. 16.2. Структура хлорофилла а.
ла а координационно связаны с ионом Mg2+ (рис. 16.2).
В фотосинтезирующих клетках высших растений всегда присутствуют хлорофиллы двух типов. Один из них — хлорофилл а, а второй представлен у многих видов хлорофиллом Ь, отличающимся от хлорофилла а тем, что вместо метильной группы в кольце II в нем содержится альдегидная группа. Атом Mg способствует образованию агрегатов молекул хлорофилла, что облегчает улавливание света.
Длинная гидрофобная боковая цепь служит не только для закрепления молекул хлорофилла в липидном бислое, но и для придания им определенной ориентации.
У всех зеленых растений содержатся хлорофиллы а и Ь, в диатомовых водорослях — хлорофилл с, в красных водорослях — хлорофилл d. Все хлорофиллы являются фоторецепторами, так как интенсивно поглощают видимый свет (в спектрах поглощения имеются четыре полосы — три в красно-желтой и одна в синей областях).
2. Среди вспомогательных пигментов наиболее распространен Q-каротин — изопреноидное соединение, которое служит у животных предшественником витамина А, и желтый каротиноид ксантофилл. Каротиноиды поглощают свет в ином диапазоне длин волн, передают поглощенную энергию на молекулы хлорофилла и поэтому функционируют как световые рецепторы, дополняющие хлорофиллы. Каротиноиды предохраняют молекулы хлорофилла от разрушения в процессе фотоокисления.
3. Фикобилины (фикоэритрины, фикоцианины), построенные из линейно связанных четырех пиррольных структур, поглощают энергию в зеленой и желтой областях спектра и передают ее на хлорофилл.
Характеристика фотосистем
Светопоглощающие пигменты тилакоидных мембран собраны в функциональные ансамбли, которые называются фотосистемами. Различают фотосистемы I и II. Все пигментные молекулы фотосистем поглощают фотоны, но только одна молекула в каждом ансамбле обладает способностью превращать световую энергию в химическую. Эта специализированная трансформирующая энергию пигментная молекула представляет собой молекулу хлорофил
239
Глава 16 Фотосинтез
ла п, соединенную с особым белком и называется фотохимическим реакционным центром. Все прочие пигментные молекулы в фотосистеме называются светособирающими или антенными молекулами. Их функция заключается в поглощении световой энергии. Эту энергию они затем передают реакционным центрам, в которых и происходит фотохимический акт. Функции реакционных центров выполняют пигмент Р700, поглощающий свет с длиной волны 700 нм и пигмент Р68О, поглощающий свет с длиной волны 680 нм. На долю этих фотохимически активных форм хлорофилла приходится 1/400 часть общего количества хлорофилла в клетке. Энергетический уровень возбужденного состояния Р700 и Р680 ниже, чем у других хлорофиллов-фоторецепторов, поэтому они способны забирать поглощенную энергию фотонов от фоторецепторов в виде экситонов. При поглощении этой энергии пигменты-реакционные центры теряют электроны.
Функциональная единица фотосистемы I содержит около 100 молекул хлорофилла а, 50 молекул каротиноидов и одну молекулу пигмента Р700. Фотосистема II включает 200 молекул хлорофилла а, 200 молекул хлорофилла Ь, фикобиллины или ксантофиллы и одну молекулу пигмента Р680.
Механизм световой стадии фотосинтеза
При поглощении кванта света фотосборщиками фотосистемы 1, происходит их возбуждение и энергия возбуждения в виде экситонов передается на реакционный центр фотосистемы — пигмент Р700. Окислительно - восстановительный потенциал пигмента Р700 в невозбужденном состоянии равен +0,4 В. При по
глощении экситонов, Р700 переходит в возбужденное состояние, что сопровождается изменением окислительно-восстановительного потенциала до -0,60 В (т. е. изменение потенциала на 1,0 В). В результате один из электронов этой фотосистемы приобретает большое количество энергии, покидает реакционный центр и переходит через ферредоксин связанный, ферредоксин свободный, НАДФ-редуктазу на молекулу НАДФ с величиной ОВП — 0,32 В. Два электрона транспортируются двумя молекулами ферредоксина.
Но так как пигмент Р700 отдал электрон, у него образовалась «электронная дырка», подлежащая восстановлению. В заполнении «электронной дырки» принимает участие фотосистема II.
При попадании света экситоны поглощаются пигментом Р68о, который переходит в возбужденное состояние. Это сопровождается изменением ОВП от + 1,0 В (в темноте, основное состояние) до — 0,06 В (в возбужденном состоянии). В итоге электрон перемещается от пигмента Р680 к пигменту Р700 (ОВП = + 0,46 В) с целью заполнения «электронной дырки» через цепь переносчиков: прочно связанный пластохинон -* подвижный пластохинон -+ цитохром Ь559 * цитохром Ь552 -► пластоцианин (Си) -* окисленная форма Р700. В результате у пигмента Р680 возникает «электронная дырка», которая заполняется за счет электронов воды (ОВП воды + 0,82 В, а ОВП окисленного пигмента Р680 + 1,0 В). При фотолизе воды выделяется кислород и протоны. Эти протоны присоединяются к НАДФ, принявшему 2 электрона от возбужденного пигмента Р700.
Перенос электронов идет против градиента ОВП за счет энергии света. Такой перенос электронов, сопряженный с восстановлением НАДФ, носит название нециклического переноса. Возможен
240
Фотосинтез Глава 16
циклический перенос электронов: пигмент Р700 -► цитохром Ь563 * цитохром •:552 ** пластоцианин + Р7(ЯГ
Механизм фотосинтетического фосфорилирования
При циклическом и нециклическом путях переноса электронов происходит высвобождение энергии, которая аккумулируется в АТФ. Этот процесс называется Фотосинтетическим фосфорилированием, три циклическом переносе происходит циклическое фосфорилирование, при нециклическом — нециклическое.
1. При переносе электронов на пигмент в мембране тилакоида из стромы хлоропласта внутрь тилакоида перено-2 ЯТСЯ Протоны.
2. Внутри тилакоида происходит фото-:из воды и накапливаются протоны.
5. В результате на мембране тилакоида - зздается электрохимический потенци-
величиной 0,25 В.
4. Протоны выходят из тилакоида в .трому хлоропласта через протонный днал (CF0) АТФ-синтазы. При возвращении протонов через протонный канал
сопрягающую часть АТФ-синтазы ZF.) синтезируется АТФ. В строме хло-? : пласта вышедшие протоны и элект-?<ны от пигмента Р7М восстанавливают -АДФ.
CF1 состоит из пяти субъединиц, чуждая CF] содержит три сф димера, ко- гыс вместе образуют 3 каталитичес- х сайта. Каждый димер может связать - ДФ и фосфат с образованием АТФ. каждый из димеров отличается по аф-z лнности к нуклеотидам; при возвра-_ении протонов из тилакоида в стро-хлоропласта через канал CF0 : меняется конформация одного из со- тягающих сайтов CFt субъединицы -ТФ-синтазы, что обеспечивает синтез :<вобождение молекулы АТФ. Согласил ной из моделей, предполагается,
2124
что перенос протонов через CF0 вызывает вращение CF} для оптимизации образования АТФ.
Отличия фотосинтетического фосфорилирования от окислительного фосфорилирования в митохондриях: 1) в тилакоидах направление переноса протонов и электронов через мембрану противоположно направлению его в митохондриальной мембране; 2) внутри тилакоида сконцентрирован положительный заряд из-за накопления протонов, а на внешней стороне мембраны тилакоида концентрируется относительный отрицательный заряд; 3) основная доля электрохимического потенциала создается за счет градиента pH; 4) протоны выталкиваются из внутритилако-идного пространства наружу через про-тон-зависимую АТФ-синтазу.
Подводя итог вышеизложенному, приведем современные представления о световой фазе фотосинтеза, которые представлены на рис. 16.3.
Фотосистема II использует энергию света для окисления воды (фотолиз Н2О) и восстановления пластохинона (PQH2). В этот процесс вовлечен марганец (компонент окисляющего воду комплекса) и более 26 белков 33, 23,17, D2, D1 и другие), феофитин a (Pheo), хиноны (Qah QB), цитохром Ь559. Электроны от Рш переносятся поперек мембраны тилакоида к QB (каждая молекула аккумулирует 2 электрона); QB отделяется от комплекса фотосистемы II и мигрирует к Ьб/f комплексу. Фотосистема I катализирует перенос электрона от пластоцианина (PC) к ферредоксину (Fx) и затем к НАДФ. Фотосистема I состоит из 13 индивидуальных белков и 100 молекул хлорофилла а. Считают, что фотосистема I включает 2 цепи переносчиков электронов между Pw и Fx. Показано, что Р70й является димером и между Р700и Fx находятся 4 молекулы хлорофилла а.
В последние десятилетия разрабатывается гипотеза, согласно которой преимущественным источником кислорода в световой фазе фотосинтеза является пероксид водорода (Г.Г.Комиссаров, 2008). В природной воде всегда присут-
241
Глава 16 Фотосинтез
Внутритилакоидное Цитохром b6f
пространство [Фотосистема II] [Фотосистема I]
Рис. 16.3. Современная Z-схема вызванного светом переноса электронов в мембране тилакоида (по Andrev N. Weber., 2001, с изм.).
ствуют устойчивые молекулы пероксида водорода в концентрации около 106М. В процессах движения воды в капиллярной системе стебля и транспирации (испарение воды растениями) в листьях увеличивается концентрация Н2О2. Полагают, что если в фотосинтетической системе есть два потенциальных источника кислорода (вода и пероксид водорода), то предпочтительным источником будет пероксид водорода по соображениям экономного расходования энергии:
Н2О2 * О2 + 2Н* + 2е (Е° = -0,69 В)
Н2О * 1/2 02 + 2Н+ + 2е (Е° = -1,23 В)
Итак, в одном акте световой фазы образуются 12 молекул НАДФН, 18 молекул АТФ и 6 молекул кислорода.
Темновая фаза фотосинтеза
Продукты световой стадии АТФ и НАДФН2, образующиеся в строме хло
ропласта, используются для синтеза глюкозы из СО2. Ассимиляция диоксида углерода представляет циклический процесс, который называется циклом Кальвина, который состоит из трех стадий — карбоксилирование, восстановление и регенерация.
Синтезированные на свету АТФ и НАДФН используются для связывания СО2 и восстановления его до углеводов. СО2 присоединяется к рибулозо-1,5-бис-фосфату при участии фермента рибулозе- 1,5-бисфосфаткарбоксилаза/оксиге-наза (Rubisko, КФ 4.1.1.39), который локализован на внешней поверхности мембран тилакоидов.
Фермент составляет 1/6 часть всех белков хлоропласта и 50 % от растворимых белков листьев С3 растений. Он характеризуется молекулярной массой 550 кДа и состоит из 8 идентичных больших и 8 идентичных малых субъединиц; активный центр фермента локализуется в каждой большой субъединице. Это наиболее распространенный белок на Земле. Высокая концентрация фермента определяет
242
Фотосинтез Глава 16
ся его низкой каталитической активностью. Число оборотов фермента ниже в !()• 105 раз по сравнению с другими ферментами, например, дегидрогеназами. Концентрация активных центров Rubisko около 4 ммоль/л, а концентрация субстрата реакции СО2 составляет 10 мкмоль/л, что создает необычную ситуацию, когда концентрация активных центров существенно превышает концентрацию субстрата.
Фермент катализирует реакции карбоксилирования с образованием двух молекул 3-фосфоглицерата и оксигенации с образованием
молекулы 3-фосфоппщерата и молекулы 2-фос-фогликолата (токсический для растения продукт) (рис. 16.4).
Специфическая фосфатаза превращает фос-фогликолат в гликолат, который переносится в пероксисомы (иногда называют микротельцами). Гликолат окисляется в глиоксилат гли-колатоксидазой, имеющей в качестве простетической группы ФМН. Образованная перекись водорода разрушается до Н2О и О2 каталазой. В процессе трансаминирования из глиоксила-та образуется глицин. Две молекулы глицина могут образовать молекулу серина, потенци-
Хлоропласт
—*• Рибулозо-1,5-бисфосфат
СО,
3-фосфоглицерат
оосх ох
Фосфогликолат
Глутамин
Глутамат
Глутамин-синтетаза
<*-АДФ
АТФ
£
Пероксисома Митохондрия
Рис. 16.4. Фотореспираторные реакции. Фосфогликолат образуется как продукт оксигеназной оеакции в хлоропласте. После дефосфорилирования гликолат транспортируется в пероксисомы, где он превращается в глиоксилат и затем в глицин. В митохондрии две молекулы глицина превращаются в серин.
243
Глава 16 Фотосинтез
ального предшественника глюкозы, с освобождением СО2 и NH4+. Аммоний, используемый в синтезе азотсодержащих молекул, резервируется в процессе глугаматсинтазной реакции. Этот путь возвращает в метаболизм три из четырех углеродных атомов двух молекул гли-колата. Один углеродный атом теряется в виде СО2. Поскольку этот процесс включает потребление кислорода и выделение углекислоты, его называют фотореспирацией. Фотореспирация расточительна из-за превращения органического углерода в углекислоту без продукции АТФ, НАДФН или других богатых энергией молекул. Этот путь присутствует в тропических растениях, т. к. оксигеназная активность быстрее увеличивается, чем карбоксилазная активность, при повышении температуры. В процессе эволюции фермент Rubisco сохранялся в основном для карбоксилирования.
Аффинность фермента существенно отличается для двух субстратов: Ктдля СО2 составляет 9 мкмоль/л, а Кт для О2 составляет 535 мкмоль/л. Однако концентрация кислорода в атмосфере — 21 %, а С02~0,0316 %; в процессе фотосинтеза в листе при 25°С отношение оксигенирования к карбоксилированию находится в пределах 1 : 4—1 : 2. Фиксация 1 молекулы СО2 требует расходования 3 молекул АТФ и 2 молекул НАДФН, в то время как реакция оксигенирования требует 5 молекул АТФ и 3 молекул НАДФН. Считают, что Rubisco может фиксировать одну молекулу кислорода на каждые три молекулы углекислого газа.
По классической схеме присоединение СО2 к рибулозо-1,5-бисфосфату под действием фермента рибулозо-1,5-бис-
фофаткарбоксилазы ведет к образованию 3-фосфоглицерата (рис. 16.5).
Далее 3-фосфоглицерат восстанавливается с помощью НАДФН и АТФ до глицеральдегид-3-фосфата. Восстановление 1,3-бисфосфоглицериновой кислоты в глицеральдегид-3-фосфат катализирует фермент НАДФ-зависимая глицеральде-гид-3-фосфатдегидрогеназа (рис. 16.6).
Дальнейшие стадии приводят к образованию молекулы глюкозы и 6 молекул рибулозо-5-фосфата, на фосфорилирование которых затрачивается еще 6 молекул АТФ. Таким образом, регенерируются все 6 молекул рибулозо-1,5-бисфосфата. В итоге на каждую молекулу СО2 расходуется 2 НАДФН и 3 АТФ. Первичным продуктом при ассимиляции СО2 является 3-фосфоглицери-новая кислота, а другие органические вещества являются продуктами ее преобразований. Пять из каждых шести молекул 3-фосфоглицериновой кислоты используется в стадии регенерации, а одна молекула в листе растения либо экспортируется в цитозоль для синтеза сахарозы, либо в хлоропласте вступает в реакции синтеза крахмала.
Итак, современная трактовка фотосинтеза представлена на рис. 16.7.
Рисунок иллюстрирует концепцию, согласно которой вызванный светом поток электронов через белковые комплексы фотосистем II и I (PSII, PSI)
2 Рибулозо-1,5-бисфосфат-СН2ОРО3 карбоксилаза СОО'
С=О 6 СО2 н-с-он
6 Н-С-ОН ► 12 СН2ОРО32’
н-с-он
СН2ОР032'
З-Фосфоглицерат
Рибулозо-1,5-бисфосфат
Рис. 16.5. Карбоксилирование рибулозо-1,5-бисфосфата.
244
Фотосинтез Глава 16
СОО' 12 АТФ 12 АДФ
12 Н—С—ОН —^=.—>.
СН2ОРО32'
О
И СО~РО32-н-с-он
СН2ОРО32-
12НАДФН+Н* 12НАДФ
3-Фосфогпицерат
1,3-Бисфосфоглицерат
12 Н-С-ОН СН2ОРО32‘
Глицеральдегид-3-фосфат
Рис. 16.6. Синтез гл и це рал ьдегид-3-фосфата.
Рис. 16.7. Схема фотосинтеза в хлоропластах (по Donald R., 2001, с изм.).
Пояснения: PQ и PQH2 — пластохинон и восстановленный пластохинон: PC — пластоцианин; Fd — ферредоксин; FNR — ферредоксин-НАДФ редуктаза.
245
Глава 16 Фотосинтез
сопряжен с аккумуляцией протонов во внутритилакоидном пространстве, возвращение которых через АТФ-синта-зу ведет к образованию АТФ. Дополнительно энергия поглощенного света в тилакоидной мембране аккумулируется при образовании НАДФН. Фотосинтетическое восстановление углерода идет в три стадии в строме хлоропласта: 1) карбоксилирование — СО2 ковалентно связывается с углеродным скелетом; 2) восстановление — энергия АТФ и НАДФН используется для образования простого углевода; 3) регенерация — энергия АТФ используется для регенерации углеродного скелета для карбоксилирования.
Регуляция темновой фазы фотосинтеза
1. На свету функционирует тиоредок-син-опосредованный механизм регуляции ряда ферментов хлоропласта. Восстановленный ферредоксин активирует фосфатазу фруктозо-1,6-бисфосфата, бисфосфатазу седогептулозы, киназу рибулозофосфата и НАДФ-глицераль-дегид-дегидрогеназу; образующийся фруктозо-6-фосфат стимулирует рибу-лозо-1,5-бисфосфаткарбоксилазу.
В темноте', фосфатаза фруктозо-1,6-бисфосфата неактивна, накапливающийся фруктозо-1,6-бисфосфат ингибирует рибулозо-1,5-бисфосфат-карбоксилазу. Благодаря этому механизму АТФ-синтаза на свету не катализирует гидролиз АТФ, происходящий в темноте. В последние годы описан другой белок — активаза Rubisco, который активируется светом по тиоредоксин-опосредованному механизму.
2. В регуляции ключевых реакций цикла Кальвина играют роль снижение концентрации протонов во внутритилакоидном пространстве и повышение концентрации ионов магния в строме;
важную роль играет также концентрация неорганического фосфата, за использование которого конкурируют ферменты цикла Кальвина и АТФ-синтаза.
3. В последние годы появились доказательства того, что некоторые ферменты цикла Кальвина образуют временные мулътипротеиновые комплексы, обеспечивающие регуляцию цикла. Кроме того, отдельные ферменты цикла (седо-гептулозо-1,7-бисфосфатаза, альдолаза) играют определенную роль в регуляции фиксации СО3.
4. Известно, что большая субъединица Rubisco кодируется геномом хлоропласта, а остальные белки цикла Кальвина кодируются генами ядра клетки. Поэтому импорт синтезированных белков из цитоплазмы клеток в хлоропласты может быть объектом разнообразных регуляторных воздействий. Гены ферментов цикла Кальвина и процессы их экспрессии чувствительны к внешним воздействиям. Например, высокий уровень глюкозы или сахарозы ведет к уменьшению количества мРНК ферментов цикла, включая малую субъединицу Rubisko, седогептулозе-1,7-бисфос-фатазу и фруктозо-1,6-бисфосфатазу. Такой тип обратной отрицательной регуляции перспективен для понимания процессов регуляции жизнедеятельности растений.
Эволюция рибулозо-1,5-бисфосфаткарбоксилазы
Фермент Rubisko появился, когда концентрация СО2 в атмосфере была высокой, а кислород практически отсутствовал. Поэтому использование кислорода вместо СО2 в качестве субстрата на ранних этапах эволюции фермента было не актуально. На протяжении 2 миллиардов лет после начала эволюции Rubisko концентрация СО2 упала почти на 90 %, но концентрация кислорода повысилась несущественно. Однако 1,5 миллиарда лет тому назад
246
Фотосинтез Глава 16
-тачалось накопление кислорода в атмосфере. 5<Э0 миллионов лет до настоящего времени концентрация кислорода достигла сегодняшнего уровня, однако содержание СО2 оставалось -ысоким. Поскольку на уровне Rubisko име-?1тся конкурирующие отношения между субстратами (СО2и О2), то фотодыхание (фотореспирация, photorespiration), т. е. работа Rubisko <ак оксигеназы с более энергоемким синтезом 'эксичного для растения 2-фосфогликолата, . гало играть лишь вспомогательную роль у г отосинтезирующих организмов. В периоде ’••ежду 450 и 500 миллионами лет до настоящего времени появились растения на суше <лед за снижением концентрации СО2 в атмосфере. Между 30 и 50 миллионами лет тому а зад отмечалось существенное уменьшение ровня СО,, в результате чего фотореспирация f эгла существенно ингибировать рост расте-- ни. В это время СО2 стала накапливаться в : иле четырехуглеродных карбоновых кислот. - ли С4 путь фиксации кислорода послужил с новой для независимого развития ряда семейств растений в условиях эволюционного звления на процессы фотореспирации — С4 л-стения.
У С4 растений первичная фиксация атмосферной СО2 происходит в мезо-глльных клетках и включает карбокси--фование фосфоенолпирувата (ФЕП) с томощью ФЕП-карбоксилазы до оксало-...етата (С4 кислота) (рис. 16.8). Такого Фермента у животных нет.
В отличие от Rubisco, кислород не конкурирует с СО2 за активный центр фермента. Оксалоацетат далее превращается в четырехуглеродную аспарагиновую или яблочную кислоты, которые транспортируются в клетки обкладки и там декарбоксилируются малик-фермен-том с освобождением СО2. В результате в хлоропласте клеток обкладки за счет увеличения концентрация СО, (в 10 60 раз) Rubisco катализирует превращения по пути карбоксилирования, а не фотореспирации, т. е. функционирует С3 цикл превращений, ведущий к образованию углеводов. Оставшиеся после декарбоксилирования аспарагиновой или яблочной кислот С3 кислоты возвращаются в мезофильные клетки и служат для регенерации фосфоенолпирувата. Синтез фосфоенолпирувата из пирувата идет у растений с затратой АТФ (напомним, что у животных пируват превращается в фосфоенолпируват иным путем через стадию образования оксалоацетата). Итак, в С4 растениях фотосинтетический путь подавляет фотореспирацию. Этот путь фиксации СО2 зарегистрирован примерно у 5 % растений из-за большего расходования АТФ; такие растения произрастают в
= /с. 16.8. С4-путь (Berg J. М., Tymoczko J. L, Stryer L., с изм.). СО2 концентрируется в клет-- - обкладки при расходовании АТФ в клетках мезофилла.
247
Глава 16 Фотосинтез условиях горячего и сухого климата (кукуруза, сахарный тростник). Для пустынного климата характерны САМ (Crassulacean Acid Metabolism) растения (кактусы, агава, эпифиты и др.), которые используют С4 механизм фиксации углекислого газа в условиях крайнего дефицита воды. Особенности строения этих растений позволяют фиксировать молекулу СО2 при потере только 50 молекул воды.
Растения, которые не использовали С4 путь фиксации СО2 называются СЗ растениями и они должны компенсировать процессы фотореспирации. Эта компенсация включает около 10 ферментативных реакций в трех органеллах растительных клеток (хлоропласты, митохондрии, пероксисомы), благодаря которым две молекулы 2-фосфогликола-та могут превратиться в одну молекулу 3-фосфоглицерата (так называемый С2 цикл). Благодаря С2 циклу 75 % фотореспираторного углерода возвращается в С3 цикл, а остаток удаляется в виде углекислоты.
За последнее столетие концентрация СО2 повысилась на 20 % и это привело к снижению процессов фотореспирации на 20 %. Такая тенденция сохранится и это приведет к повышению урожая, например, зерновых культур. Однако, повышение роста растений в связи с уменьшением фотореспирации может
нивелироваться накоплением углекислого газа в атмосфере и за счет этого ухудшением погодных условий. Дальнейшая эволюция Rubisko будет лежать в основе конкурентных отношений между СЗ и С4 растениями на Земле. В то же время начаты работы по клонированию методами генной инженерии белка Rubisko, лишенного фотореспира-торной активности.
Резервные формы сахаров
Растения содержат две основных резервных формы сахаров: крахмал и сахарозу. Крахмал это разветвленный полимер из остатков глюкозы, связанных а-1,4- и а-1,6-гликозидными связями. Крахмал синтезируется и запасается в хлоропластах. Сахароза (свекловичный или тростниковый сахар) — дисахарид, который синтезируется в цитозоле. Растения утратили способность транспортировать гексозофосфаты через мембрану хлоропласта, но имеют переносчик триозофосфата в цитозоль в обмен на неорганический фосфат. Фруктозо-6-фосфат, образованный из триозофосфатов, соединяется с остатками глюкозы из УДФ-глюкозы с формированием са-харозо-6-фосфата. После отщепления фосфата освобождается сахароза, способная транспортироваться и запасаться в клетках растений.
248
Глава 17
Обмен липидов
Липиды — это группа соединений, не гастворимых в воде, но растворимых в органических растворителях (спирт, ?фир и др.).
Общая характеристика липидов
хлассификация липидов
Типиды делят на 2 группы: неомыляемые :-е содержат жирных кислот) и омыляемые. К неомыляемым липидам относят : цероиды, каротиноиды и терпеноиды построены из изопреновых остатков).
Омыляемые липиды делят на простые . сложные. К простым липидам отно-. -:т жиры — триацилглицеролы, или триглицериды (резерв энергии) и вос-.< — эфиры одноатомного спирта с «ирной кислотой (кожное сало).
В большинстве эукариотических кле-“ок, триацил глицеролы образуют жировую каплю в цитозоле, выполняя фун-«.пию резерва энергии. У позвоночных . не диализированные клетки называют-. адипоциты, липоциты или жировые «летки, которые содержат большое ко
личество триацилглицеролов. В адипоцитах имеется фермент липаза, который катализирует гидролиз накопленных липидов, высвобождая жирные кислоты для экспорта к местам, где требуется энергия.
Использование триацилглицеролов в качестве источника энергии имеет 2 преимущества по сравнению с гликогеном. Во-первых, атомы углерода в жирных кислотах более восстановлены по сравнению с сахарами и поэтому окисление триацилглицеролов дает в два раза больше энергии по сравнению с углеводами. Во-вторых, триацилглицеролы — неполярные молекулы, поэтому запасаются в безводной среде. В то же время для запасания 1 г гликогена требуется 2 г связанной воды. Следовательно 1 г безводного жира дает в 6 раз больше энергии, чем 1 г гидратированного гликогена. Поэтому эволюционно жиры стали наиболее предпочтительным резервом энергии живых организмов.
У мужчины массой 70 кг имеются следующие энергетические резервы (топливные молекулы): 100000 ккал
249
Глава 17 Обмен липидов
(420000 кДж) в форме триацилглице-ролов (нейтральный жир), 25000 ккал (100000 кДж) в белках (преимущественно в белках мышц), 600 ккал (2500 кДж) в гликогене и 40 ккал (170 кДж) в глюкозе.
На триацилглицеролы приходится 11 кт от массы тела человека. Если бы это количество энергии зарезервировать в виде гликогена, то общая масса тела увеличилась бы на 55 кг. Энергетические резервы в виде глюкозы и гликогена расходуются за 24 часа, а для расхода энергетических резервов триацилглице-ролов потребуется несколько недель.
При умеренном ожирении с количеством триацилглицеролов 15—20 кг энергетические потребности организма могут поддерживаться в течение нескольких месяцев, в отличие от запасов гликогена, которого хватает на одни сутки. Углеводы (глюкоза и гликоген) имеют преимущества быстро мобилизуемого источника энергии, растворимого в воде.
Триацилглицеролы могут быть простыми или смешанными. К простым триа-цилглицеролам относятся те, в которых все три кислотных радикала принадлежат одной кислоте, например трипальмитин, триолеин. В состав смешанных триацилглицеролов входят остатки разных высших жирных кислот. В природных жирах, представляющих собой
смесь разнообразных триацилглицеролов, доля простых мала. Например, жир коровьего молока является олеопальми-тобутирином. Для характеристики нейтральных жиров продолжительное время используют константы:
1) Кислотное число — количество миллиграммов КОН, необходимое для нейтрализации свободных жирных кислот, содержащихся в 1 г жира. Увеличение кислотного числа свидетельствует о гидролизе триацилглицеролов.
2) Йодное число — количество граммов йода, связываемое 100 г данного жира. Поскольку присоединение йода происходит по месту двойных связей, йодное число дает представление о содержании в жире ненасыщенных жирных кислот. Растительные масла, например, оливковое, содержат триацилглицеролы с ненасыщенными жирными кислотами и поэтому являются жидкими при комнатной температуре. Их превращают в твердые жиры путем ферментативного гидрирования, которое восстанавливает некоторые двойные связи. Если пищу, содержащую жиры, долго хранить на воздухе, она портится и прогоркает. Неприятный запах и вкус, обусловленные прогорканием, являются результатом окислительного разрыва двойных связей в ненасыщенных жирных кислотах, что приводит к образованию альдегидов и карбоновых кислот с короткой углеродной цепью и более летучих.
250
Обмен липидов Глава 17
Сложные липиды делят на фосфолипиды и гликолипиды.
Фосфолипиды широко распространены в растительных и животных тканях, -- микроорганизмах они являются пре-опадающей формой липидов. Фосфо-: ипиды содержатся, главным образом, е мембранных структурах. Значительное *. хшчество фосфолипидов содержится в .зрдце, печени животных, в семенах “астений и в яйцах птиц. Высоким содержанием фосфолипидов отличается -зрвная система позвоночных.
Тромбоцитарный активирующий фактор (ТАФ) является фосфолипидом, принимающим участие в ряде аллергических и воспалительных реакций.
Субнаномолярные концентрации этого 1 -алкил-2-ацетилового эфира, аналога фосфатидилхолина индуцируют агрегацию тромбоцитов крови, сокращение гладких мышечных волокон и активацию клеток системы иммунитета. Это вещество является также медиатором анафилактического шока, тяжелых и часто летальных аллергических реакций. Наличие ацетильной группы, а не длинноцепочечного ацильного радикала при С-2, повышает растворимость этого липида, позволяя ему функционировать в водной среде крови. ТАФ действует посредством связывания с мембранными рецепторами (7-ТМ рецептор).
В зависимости от спирта фосфолипиды зд разделяются на глицерофосфолипиды (на зове трехатомного спирта глицерола) — досфатидилхолин, фосфатидилэтанола-:лн, фосфатидилсерин, фосфатидилино-дстол, плазмапогены (вместо одного остат-*д жирной кислоты включен ее альдегид) - сфингофосфолипиды — на основе одно
атомного спирта сфингозина (входят в состав мембран и липопротеинов). Гликолипиды делят на ганглиозиды — аминоспирт сфингозин, жирная кислота, гексозы, N-ацетилнейраминовая кислота (плазматические мембраны нервных и глиальных клеток, серое вещество); цереброзиды — аминоспирт сфингозин, жирная кислота, галактоза; сульфатиды — цереб-розидсульфаты (миелиновые оболочки, белое вещество).
Функции ЛИПИДОВ
1) пластическая — липиды входят в состав мембран и определяют их свойства (проницаемость, жидкостность, передача нервного импульса и др.);
2) энергетическая — липиды служат энергетическим материалом для организма; при окислении 1 г жира выделяется 39 кДж/моль энергии, что в 2 раза больше, чем при окислении 1 г белков или углеводов {липиды — долгосрочный резерв энергии);
3) защитная —- липиды предохраняют тело и органы от механического повреждения и сохраняют тепло (подкожный жир, жировая капсула почек, сальник в брюшной полости);
4) регуляторная функция (эйкозаноиды, стероидные гормоны);
5) эмульгирование жиров (пищеварение), стабилизация липидсодержащих жидкостей (желчь) и транспорт гидрофобных молекул (мицеллы, липопротеины). С нарушениями обмена липидов связаны такие заболевания как атеросклероз, ожирение, желчнокаменная болезнь и др.;
6) являются растворителем для жирорастворимых витаминов.
Характеристика жирных кислот
Жирные кислоты, входящие в состав омыляемых липидов, могут быть насы-
251
Глава 17 Обмен липидов
щепными и ненасыщенными, как правило, содержат четное число углеродных атомов (14—20) и являются неразветв-ленными. Наиболее распространенными являются пальмитиновая (16С) и стеариновая (18С) кислоты.
Жирные кислоты выполняют 4 функции:
1. Жирные кислоты являются строительными блоками для фосфолипидов и гликолипидов. Эти амфипатические молекулы являются важнейшими компонентами мембран.
2. Многие белки модифицируются при ковалентном связывании с жирными кислотами, определяя тем самым свое положение в мембранах.
3. Жирные кислоты являются топливными молекулами. Они запасаются в виде триацилглицеролов. При их освобождении и окислении освобождается много энергии.
4. Жирные кислоты и их производные выполняют регуляторную функцию (например, эйкозаноиды).
Незаменимыми (эссенциальными) являются линолевая, линоленовая и арахидоновая кислоты. При достаточном поступлении с пищей линолевой кислоты имеется адекватный синтез арахидоновой кислоты. Незаменимые жирные кислоты выполняют три важные функции:
1) из них образуются биорегуляторы — эйкозаноиды',
2) необходимы для построения мембран (обеспечивают текучесть мембраны);
3) участвуют в транспорте холестерола и образовании липопротеинов.
Уже в XX! столетии были опубликованы данные об открытии у млекопитающих амидов арахидоновой кислоты с глицином, у-аминомасляной кислотой и аланином. В настоящее время оформляется новый класс липидов — аминокислоты, ацилированные арахидоновой или другими жирными кислотами. По мнению сотрудников ИБОХ НАН Беларуси О. Л. Шарко и М. А. Кисель (2007), такие вещества смогут модулировать активность фосфолипаз с целью коррекции пищеварения, лечения острого и хронического панкреатита.
Эйкозаноиды
Эйкозаноиды — это производные эйкозаполиеновых жирных кислот, т. е. С20-жирных кислот (арахидоновой кислоты) (рис. 17.2).
Их делят на простаноиды и лейкотриены. Термин простагландины часто используют для обозначения всех простаноидов (рис. 17.3).
Синтез эйкозаноидов
Источником арахидоновой кислоты являются фосфолипиды мембран (рис. 17.4). В клетках содержится малое количество свободной арахидоновой кислоты. Из фосфолипидов она освобождается под действием фосфолипазы А2.
В активации фосфолипазы принимает участие Са2+, тромбин, ангиотензин II, брадикинин, липопероксиды, адреналин.
Рис. 17.2. Арахидоновая кислота.
Глюкокортикоиды тормозят актив-ность фосфолипазы Az, тем самым ингибируют синтез всех эйкозаноидов. Поэтому их применяют как противовоспалительные лекарства.
252
Обмен липидов Глава 17
Эйкозаноиды
Простаноиды Лейкотриены
Простагландины Тромбоксаны Простациклины
Рис. 17.3. Классификация эйкозаноидов.
Фосфолипиды мембран
Фосфолипаза А ___________ Глюкокортикоиды
фосфолипаза а2 ---------- (ингибируют)
Арахидоновая кислота 20:4 (д5-8-11-14)
Липоксигеназа^ ^ооксигеназа ------------------ЩТ™4"
Лейкотриены - LT Простаноиды (тромбоксаны - ТХ простациклины - PGI простагландины - PG)
Рис. 17.4. Синтез эйкозаноидов.
Рис. 17.5. Простаноевая кислота.
Арахидоновая кислота может вступать в циклооксигеназный и липоксигеназный пути превращения.
Простагландины
Этот класс веществ был вначале открыт в семенной жидкости в 1930 г. Сейчас известно, что они содержатся практически во всех тканях и их иногда называют «местные гормоны».
Структура простагландинов. Простагландины являются аналогами простано-евой кислоты и в своей структуре содержат циклопентановое кольцо (образуется 8 и 12 атомами углерода), и две боковых цепи с карбоксильной группой на одной из них (рис. 17.5).
Номенклатура. Простагландины делятся на группы А. В. Е. D. F в зависимости от строения пятичленного кольца и характера заместителей. В за
253
Глава 17 Обмен липидов
висимости от числа двойных связей все простагландины делят на группы 1,2, 3. Группа указывается цифрой справа внизу от названия, например PGE,, PGF2a(pnc. 17.6).
Метаболизм простагландинов. Циклооксигеназный путь превращения арахидоновой кислоты приводит к образованию эндоперекиси, из которой далее синтезируются простагландины. Для реакции необходимы 2 молекулы кислорода. Инактивация простагландинов происходит при участии фермента 15-гидрокси-простагландин-дегидрогеназы, который встречается во всех тканях, но больше всего в легких. Время жизни простагландинов короткое — один оборот крови.
Известны 2 изофермента циклооксигеназы: ЦОГ-1 (конституитивный изофермент) и ЦОГ-2, изофермент, который экспрессируется при воспалении. Ингибирование ЦОГ-2 является важным механизмом противовоспалительного и анальгетического действия несте
роидных противовоспалительных препаратов (Нимесумед, Целекоксиб, Ме-локсикам). Подавление активности ЦОГ-1 рассматривают как механизм развития побочных реакций (поражения пищеварительного тракта, нарушение агрегации тромбоцитов, функции почек, кровообращения).
Функции простагландинов. Простагландины действуют как локальные сигнальные молекулы. В мембранах клеток различных тканей есть рецепторы для простагландинов. После связывания PGE с рецепторами в клетках увеличивается содержание цАМФ, а в случае PGF — цГМФ. Поэтому часто эффекты разных простагландинов могут быть противоположными. Например, PGE вызывает расслабление, a PGF — сокращение гладких мышц матки (т. е. PGE способствует оплодотворению, a PGF — вызывает аборт). PGE индуцируют аллергические реакции, a PGF — их подавляют. PGE] является мощным пирогеном (повышает температуру тела).
254
Обмен липидов Глава 17
эостациклины
Простациклины образуются в эндотели-_льных клетках эндокарда и сосудов. >ни препятствуют агрегации тромбоци-?в. расширяют коронарные сосуды и .нижают давление крови, действуя на падкие мышцы сосудов.
’□омбоксаны
~эомбоксаны образуются в тромбоцитах. Вызывают сужение сосудов и способствуют агрегации тромбоцитов. Эффекты противоположны простациклинам гис. 17.7).
Лейкотриены
Лейкотриены образуются в лейкоцитах, мастоцитах, тромбоцитах, легких, сердце, селезенке (рис. 17.8).
Липоксигеназа вводит кислород в 5, 12 и 15 положения арахидоновой кислоты, образуя гидропероксиды. Только 5-липоксигеназа образует LT (LTA4 -* LTB4(C4) - LTD4, lte4.
Лейкотриены участвуют в воспалительных и аллергических реакциях, суживают мускулатуру бронхов.
Низкие концентрации аспирина, принимаемые регулярно, снижают вероятность приступов стенокардии за счет уменьшения продукции тромбоксанов.
Переваривание липидов
Основными липидами, поступающими с пищей в организм человека, являются триацилглицеролы (60—80 г/сутки), фосфолипиды (1—2 г/сутки), холестерол и его эфиры (300—500 мг/сутки).
255
Глава 17 Обмен липидов
Переваривание триацилглицеролов
Из поступающих триацилглицеролов более 85 % подвергаются расщеплению в желудочно-кишечном тракте. В ротовой полости нет ферментов и условий для переваривания триацилглицеролов.
С желудочным соком выделяется желудочная липаза, однако ее роль в гидролизе триацилглицеролов невелика. Это обусловлено тем, что:
1) содержание этого фермента в желудке незначительно;
2) pH желудочного сока не соответствует оптимуму pH для фермента (оптимальное значение для липазы 5,5—7,5);
3) в желудке отсутствуют условия для эмульгирования триацилглицеролов.
Поэтому у взрослых людей неэмульги-рованные триацилглицеролы проходят через желудок без изменений.
У новорожденных детей величина pH в желудке около 5 и липиды молока находятся в эмульгированном состоянии. Поэтому процесс переваривания их в желудке идет активно. Переваривание липидов у детей происходит в желудке под действием лингвальной липазы, которая синтезируется слизистой оболочкой корня языка в ответ на сосательные и глотательные движения при кормлении. Активность лингвальной липазы не успевает проявиться в полости рта и главным местом ее действия является желудок.
Основная масса пищевых триацилглицеролов подвергается расщеплению в тонком кишечнике высших животных и человека при действии липазы панкреатического соки. Она расщепляет триацилглицеролы, находящиеся в эмульгированном состоянии, т. к. фермент действует на границе между водной и липидной фазами.
Эмульгирование
Эмульгирование является процессом разделения липидов на маленькие капли при снижении поверхностного натяжения. В эмульгировании липидов принимает участие ряд факторов:
1. Желчные кислоты, поступающие в кишечник с желчью в виде конъюгатов с глицином или таурином.
Желчные кислоты, синтезируемые в организме человека, являются С24 насыщенными карбоновыми кислотами — производными холановой кислоты, имеющими в основе строения циклопентанпергидрофенантрен. Синтезируются в печени из холестерола и являются главным путем выведения холестерола из организма. У человека из холестерола синтезируются 2 первичные желчные кислоты: холевая кислота (3,7,12-тригидроксихолановая) и хеноде-зоксихолевая (3,7-дигидроксихолановая) кислота. Эти желчные кислоты конъюгируются с таурином или глицином (R) до секреции в желчь. Желчные кислоты накапливаются в желчи, секретируются в тонкий кишечник, активно абсорбируются в терминальной части ileum специфическими транспортными системами и возвращаются в печень через портальную вену. Таким образом, желчные кислоты подвергаются кишечно-печеночной рециркуляции несколько раз в день.
Пул желчных кислот включает конъюгаты дезоксихолевой (3,12-дигидрокси-холановая) кислоты (20 25 %) и лито-холевой (3-гидрокси-холановая) кислоты (1—3 %). Эти вторичные желчные кислоты образуются из холевой и хенодезоксихолевой кислот под действием кишечной микрофлоры. Следовательно, конечный состав желчных кислот определяется биосинтетическими процессами в печени и кишечной бактериальной биотрансформацией. У
256
Обмен липидов Глава 17
человека литохолевая кислота сульфатируется в печени до секреции в желчь сульфолитохолевая кислота — третичная желчная кислота). Кроме того, ли-
тохолевая кислота может подвергаться 6-гидроксилированию и 6-О-глюкуро-нидации до секреции в мочу (рис. 17.9).
257
Глава 17 Обмен липидов
Процесс эмульгирования жиров пищи включает следующие этапы:
1. Соли желчных кислот адсорбируются на поверхности капелек жира, снижают поверхностное натяжение, тем самым, обеспечивая дробление крупных капель жира на мелкие капли. Кроме того, желчные кислоты стабилизируют эмульсию, адсорбируясь на поверхности капелек жира в виде тончайшей пленки.
2. Перистальтика кишечника механически разбивает жир на капли.
3. Пузырьки углекислого газа, которые образуются при нейтрализации кислого содержимого желудка бикарбонатами, поступающими из поджелудочной железы (эффект секретина), дробят капли жира.
4. Поверхностно активные вещества (пептоны, лизофосфолипиды и др.) способствуют эмульгированию пищевых жиров.
Панкреатическая липаза вырабатывается в неактивной форме и в 12-перстной кишке происходит активация липазы путем образования комплекса с низкомолекулярным белком — колипазой в молярном соотношении 2:1. Комплекс адсорбируется на поверхности капелек жира и гидролизует сложноэфирные связи триацилглицеролов. Специфичность действия липазы определяется положением эфирных связей в триацилглицероле. Фермент активен по отношению к гидролизу внешних эфирных связей в а(1)-и а(3)-положениях, в результате чего образуется р(2)-моноацилглицерол. Гидролиз эфирной связи в 0-положении 2-мо-ноацилглицерола идет уже более медленно и преимущественно катализируется липазой, секретируемой железами тонкого кишечника. Таким образом, гидролиз триацилглицеролов идет ступенчато, и только часть 2-моноацилглицеролов (не более 50 %) гидролизуется до глицерола и жирных кислот.
Если продукция желчных кислот в печени нарушена, то при поступлении в организм более 30 г/сутки липидов обнаруживаются капли непереваренных жиров в кале (стеаторея).
Переваривание гл ицерофосфол и п идов
Распад глицерофосфолипидов происходит в кишечнике при участии фосфолипаз, секретируемых поджелудочной железой. Известно несколько типов фосфолипаз.
Фосфолипаза Aj гидролизует эфирную связь в первом положении глицерофос-фолипида.
Фосфолипаза А2 катализирует гидролитическое отщепление жирной кислоты во втором положении глицерофос-фолипида. В результате действия фосфолипазы образуются лизофосфолипиды и жирные кислоты.
Высокая активность фосфолипазы А2 в яде некоторых змей и скорпионов приводит к тому, что при их укусе происходит гемолиз эритроцитов. Фосфолипаза А2 поджелудочной железы поступает в полость тонкого кишечника в неактивной форме и активируется трипсином. Накопления лизофосфолипидов в кишечнике обычно не происходит, поскольку одновременно на глице-рофосфолипиды действуют обе фосфолипазы А1 и А2.
Фосфолипаза С вызывает гидролиз связи между фосфорной кислотой и глицеролом, что ведет к образованию диаиилглицеролов.
Фосфолипаза D расщепляет эфирную связь между азотистым основанием и
258
Обмен липидов Глава 17
тосфорной кислотой с образованием .вободного основания и фосфорной ‘Лслоты.
Таким образом, в результате действия тюсфолипаз глицерофосфолипиды расцепляются до глицерола, высших жир--ых кислот, азотистого основания и госфорной кислоты.
Эфиры холестерола
Эфиры холестерола гидролизуются панкреатической холестеролэстеразой на .элестерол и жирную кислоту.
Всасывание продуктов переваривания
лдрофильные продукты переваривания -.иицерол, жирные кислоты с длиной угле- /дородной цепи менее 12) легко всасываются в тонком кишечнике и поступа-*?т через воротную вену в печень. Фосфорная кислота всасывается кишечной стенкой главным образом в виде на-“риевых или калиевых солей. Азотистые -.новация (холин и этаноламин) всасывается в виде своих активных форм.
Гидрофобные продукты переварива--ия липидов (жирные кислоты, моно-:иилглицеролы) всасываются с участием чицелл, в состав которых входят желчные кислоты, фосфолипиды и свободный С'Лестерол. Структура мицелл такова, -то гидрофобное ядро липидов окружается снаружи гидрофильной оболочкой, . эстоящей из желчных кислот и фосфо-ипидов. Мицеллы путем пиноцитоза проникают внутрь эпителиальных кле-эк кишечника и распадаются. Желчные кислоты поступают в кровь и с током к зови через воротную вену доставляют-.« в печень, где снова переходят в состав желчи.
Фосфолипиды и лизофосфолипиды, которые участвуют в образовании
мицелл, всасываются в составе мицелл, не подвергаясь расщеплению. Остальная их часть подвергается ферментативному гидролизу. При этом всасывание жирных кислот, образовавшихся при гидролизе фосфолипидов, лизофосфолипидов и эфиров холестерола, происходит также как и всасывание жирных кислот, образовавшихся при расщеплении триацилглицеролов.
После всасывания в клетках слизистой кишечника возможен частичный ресинтез триацилглицеролов, фосфолипидов и эстерификация холестерола. Биологический смысл этого процесса сводится к тому, что в стенке кишечника синтезируются жиры, более специфичные для данного вида животных и отличающиеся от пищевого жира. Это обеспечивается тем, что в синтезе триацилглицеролов, фосфолипидов и эсте-рификации холестерола в кишечной стенке принимают участие, наряду с экзогенными (пищевыми), и эндогенные жирные кислоты.
Т ранспорт липидов
Жиры гидрофобны, поэтому существуют специальные механизмы их транспорта в крови. Свободные (неэстерифици-рованные) жирные кислоты переносятся кровью в виде комплексов с альбуминами. Холестерол, его эфиры, триацил-глицеролы, фосфолипиды транспортируются в составе липопротеинов.
Липопротеины
Липопротеины являются молекулярными комплексами, состоящими из липидов и белков.
Существует несколько классов липопротеинов (ЛП), но всех их объединяют следующие особенности:
259
Глава 17 Обмен липидов
1) поверхностный слой липопротеинов состоит из фосфолипидов, свободного холестерола и белков;
2) каждый липопротеин содержит особый набор поверхностных белков — аполипопротеинов (апо), которые обозначаются буквами латинского алфавита (А, В, С);
3) сердцевина (ядро) липопротеина состоит из гидрофобных триацилглицеролов и эфиров холестерола.
Аполипопротеины выполняют следующие функции:
1) являются структурными компонентами липопротеинов;
2) участвуют в узнавании и взаимодействии с рецепторами мембран;
3) активируют ферменты метаболизма липопротеинов (табл. 17.1).
Липопротеины подразделяются на 4 основные класса в зависимости от плотности (определяемой с помощью ультрацентрифугирования) и электрофоретической подвижности (табл. 17.2).
Хиломикроны (ХМ) — самые крупные частицы. ХМ синтезируются в слизис
той кишечника и участвуют в экзогенном транспорте пищевых липидов к различным тканям. Диаметр хиломикронов 180—500 нм; их плотность очень низкая (d<0,94 г/см3), поскольку эти частицы состоят до 99 % из триацилглицеролов. Аполипопротеин В-48 (апоВ-48) является большим белком (240 кДа), который образует сферическую оболочку вокруг жировой глобулы. Наружная поверхность такой глобулы гидрофильная. Триацилглицеролы из хиломикронов освобождаются при действии ли-попротеинлипаз. Эти ферменты локализуются в сосудах микроциркуля-торного ложа мышц и других тканей, использующих в качестве топлива нейтральные жиры.
Липопротеины очень низкой плотности (ЛПОНП) синтезируются в печени. Основная функция — транспорт эндогенных липидов из печени е периферические ткани-, синтезированные в печени триацилглицеролы и холестерол выводятся в кровеносное русло в составе ЛПОНП (d< 1,006 г/см3). Эти частицы
Таблица 17.1. Аполипопротеины липопротеинов плазмы
Аполипопротеин Молекулярная масса Липопротеин Функции (если известны)
АпоА-1 28331 лпвп Активатор ЛХАТ
АпоА-Н 17380 лпвп
AnoA-IV 44000 Хиломикроны, ЛПВП
АпоВ-48 240000 Хиломикроны
АпоВ-100 513000 ЛПОНП, ЛПНП Связывается с рецептором ЛПНП
АпоС-1 7000 ЛПОНП, ЛПНП
АпоС-11 8837 Хиломикроны, ЛПОНП, ЛПВП Активатор липопротеинлипазы
АпоС-111 8571 Хиломикроны, ЛПОНП, ЛПВП Ингибитор липопротеинлипазы
AnoD 32500 ЛПВП
АлоЕ 34145 Хиломикроны, ЛПОНП, ЛПВП Активирует клиренс ремнантов ЛПОНП и хиломикронов
260
Обмен липидов Глава 17
Таблица 17.2. Классификация липопротеинов по методу разделения
Класс Ультрацентрифугирование Электрофорез
' Хиломикроны Хиломикроны Липопротеины очень низкой плотности ЛПОНП (VLDL) Липопротеины низкой плотности ЛПНП (LDL) Липопротеины высокой плотности ЛПВП (HDL) Хиломикроны преф-ЛП р-лп о-ЛП
стабилизируются двумя аполипопротеинами апоВ-100 и апо Е (34 кДа). АпоВ-100, один из крупнейших из известных белков (513 кДа), является более длинным вариантом апоВ-48. Оба апоВ протеина кодируются одним и тем же геном и продуцируются при трансляции одной и той же мРНК. Триацилглицеролы ЛПОНП, как и в составе хиломикронов, гидролизуются липопротеинлипазами на поверхности капилляров.
Липопротеины промежуточной уютности (ЛППП) образуются из ХМ и ЛПОНП в результате действия ли-лопротеинлипазы в капиллярах жировой и мышечной тканей. ЛППП содержат избыток эфиров холестерола (1,006 d < 1,019 г/см3). Судьба этих частиц л всякая: 1) половина из них будет захвачена гепатоцитами для дальнейших превращений, 2) вторая половина превратится в ЛПНП (1,019 < d < 1,063 г/ гм3).
Липопротеины низкой плотности Л ПИГГ) образуются в кровеносном рус-:е из ЛПОНП. Содержат много холес-’ъерола, который транспортируется в периферические ткани.
ЛПНП — главная транспортная форма холестерола в кровеносном русле
ЛПНП имеют диаметр 22 нм и молекулярную массу около 3 млн Да. Каждая частица ЛПНП содержит в ядре 1500 молекул эфиров холестерола, содержащих остатки линоленовой и дру
гих полиненасыщенных жирных кислот. Слой фосфолипидов покрывает гидрофобное ядро из остатков эфира холестерола. В покрывающем слое содержится апоВ-100, который служит для узнавания клеток-мишеней. Роль ЛПНП заключается в транспорте холестерола к периферическим тканям и регуляции синтеза холестерола в них.
Липопротеины высокой плотности (ЛПВП) образуются в печени, содержат много фосфолипидов и белков; у этих ЛП компоненты оболочки преобладают над сердцевиной. ЛПВП (плотность 1,063 < d < 1,21 г/см3) подхватывает холестерол, освобождаемый из отмерших клеток. Лецитин-холестерол-ацил-трансфераза эстерифицирует этот холестерол и отправляет его к ЛПНП и ЛППП с помощью специального транспортного белка. Затем ЛПВП возвращаются в печень.
Суммарные сведения о липопротеинах представлены в таблице 17.3
Различают экзогенный (транспорт пищевых липидов) и эндогенный (транспорт липидов, синтезированных в организме) транспорт.
Экзогенный транспорт
Продукты переваривания липидов всасываются в клетки слизистой оболочки кишечника в составе мицелл. Жирные кислоты с числом углеродных атомов меньше 12 всасываются в кровь и по воротной вене транспортируют-
261
Глава 17 Обмен липидов
Таблица 17.3. Состав липопротеинов
Липопротеины Молекулярная масса, Да Диаметр, нм Состав, %
белок ТГ ФЛ ХС
Хиломикроны 1-10 млн. 100-1000 1-2 88-90 4-7 5-6
ЛПОНП 5-100 тыс. 30-90 7-10 50-56 18 20-23
лпнп 2-4 млн. 20-25 20-21 10-13 21-24 45-47
лпвп 200-400 тыс. 10-15 35-50 5-8 30-43 20-35
ТГ —триацил глицеролы, ФЛ — фосфолипиды. ХС — холестерол
Триацилглицеролы и эфиры холестерола
Рис. 17.10. Структура хиломикрона (D. L. Nelson, М. М. Сох, с изм.).
ся в печень. Длинноцепочечные жирные кислоты (С> 12) в клетках кишечника реэстерифицируются в триацилглицеролы, которые по составу напоминают пищевые жиры. Получен
ные триацилглицеролы вместе с фосфолипидами, холестеролом и белками (2 %) образуют хиломикроны. Хиломикроны содержат апопротеин В-48 и апоА (рис. 17.10).
262
Обмен липидов Глава 17
Хиломикроны поступают в лимфу. В крови встречаются с частицами ЛПВП, содержащими апоЕ и апоС. Хиломикроны отдают апоА частицам ЛПВП, а взамен приобретают апоЕ и апоС. Один из аполипопротеинов группы С — апоС-II — служит активатором фермента липопротеинлипазы (ЛПЛ). Этот фермент синтезируется и секретируется жировой и мышечной тканями, клетками молочных желез. Секретируемый Фермент прикрепляется к плазматической мембране эндотелиальных клеток капилляров тех тканей, где он синтези-
ровался. АпоС-П, находящийся на поверхности ХМ, активирует Л ПЛ. Она гидролизирует триацилглицеролы в составе ХМ до глицерола и жирных кислот. Эти жирные кислоты либо поступают в клетки жировой и мышечной ткани, либо соединяются с альбуминами плазмы. В результате действия Л ПЛ хиломикроны резко уменьшаются в размерах и их называют ремнанты (остаток). Ремнанты ХМ рецепторным путем захватываются печенью (рис. 17.11).
Жиры пищи
Миоциты и адипоциты
8 Жирные кислоты окисляются или реэстерифицируются для депонирования
АпоС-II
3 Жирные кислоты и другие продукты переваривания всасываются и превращаются в триацилглицеролы
4 Триацилглицеролы, холестерол и аполипопротеины
у Жирные кислоты поступают в клетку
Л ипопротеинл ипаза
6 ЛПЛ активируется АпоС-Il в капиллярах и высвобождает жирные кислоты и глицерол
gХиломикроны через лимфатическую систему попадают в кровь
Тонкий кишечни
j Желчные кислоты эмульгируют липиды в тонком кишечнике
2 Кишечная липаза расщепляет
триацилглицеролы
включаются в
хиломикроны
Капилляр
Слизистая кишечника
5 ис. 17.11. Экзогенный транспорт липидов (D. L Nelson, М. М. Сох. с изм.).
263
Глава 17 Обмен липидов
Эндогенный транспорт
Если содержание пищевых триацилглицеролов больше, чем необходимо для получения энергии, в клетках печени ресинтезируются триацилглицеролы и фосфолипиды, которые характерны для данного организма. Они включаются в состав ЛПОНП. В состав ЛПОНП входят апоВ-100, апоС-I, апоС-11, апоС-Ш, апоЕ. Это основная транспортная форма триацилглицеролов. В другой класс липопротеинов, образуемых в печени — ЛПВП, входят холестерол, фосфолипиды, апо А. Эти частицы плоские и их
называют насцентные ЛПВП. В их ядре нет гидрофобных молекул. Эти ЛПВП играют большую роль в обратном транспорте холестерола из клеток периферических тканей в печень.
В капиллярах жировой и мышечной тканей апоС-П ЛПОНП активирует Л ПЛ, которая катализирует гидролиз триацилглицеролов ЛПОНП и превращает их в ЛППП (липопротеины промежуточной плотности). Жирные кислоты захватываются адипоцитами, где используются для ресинтеза триацилглицеролов, которые депонируются в виде жировой капли; в миоцитах жир-
Рис. 17.12. Структура ЛПНП (D. L. Nelson, М. М. Сох, с изм.).
264
Обмен липидов Глава 17
;ые кислоты используются преимущественно для получения энергии.
ЛППП под действием синтезирован--:ой в печени циркулирующей печеночной триацилглицероллипазы, теряют еще часть триацилглицеролов и превращаются в ЛПНП. Основным липидом ЛПНП становится холестерол, который i составе ЛПНП переносится к клеткам = сех тканей. Следовательно, ЛПНП образуются непосредственно в сосудистом русле (рис. 17.12).
Общие представления о транспорте липопротеинов представлены на рис. 17.13.
Итак, в результате экзогенного и эндогенного транспорта в капиллярах жировой и мышечной тканей освобождаются жирные кислоты и глицерол. Жирные кислоты связываются с альбуминами и транспортируются к тканям-потребителям. Около 95 % энергии освобождается при окислении жирных кислот, 5% — при окислении глицерола.
Печень
Жирные кислоты (жировая, мышечная ткани, молочная железа)
Рис. 17.13. Липопротеины и транспорт липидов (D. L. Nelson, М. М. Сох. с изм.).
265
Обмен жирных кислот
Обмен жирных кислот включает их распад и синтез. Это основные по емкости процессы резервирования и освобождения энергии.
С балансом синтеза и распада жирных кислот связано основное патологическое состояние людей — метаболический синдром, который включает ожирение, ин-сулинорезистентность, снижение концентрации ЛПВП и повышение содержания триацилглицеролов на фоне артериальной гипертензии. Это состояние выявляется у каждого четвертого жителя планеты Земля и является платой за гипокинезию, избыточное питание и другие особенности жизни человека постиндустриального общества.
Как отмечено в предыдущей лекции жирные кислоты и глицерол освобождаются при гидролизе триацилглицеролов в адипоцитах и переносятся в печень, мышцы для окисления.
Окисление жирных кислот
Окислительное расщепление жирных кислот — универсальный процесс, протекающий у всех видов живых организмов.
1. У млекопитающих окисление жирных кислот с энергетической целью происходит в печени, почках, скелетной и сердечной мышцах. В мозге, эритроцитах и мозговом слое надпочечников жирные кислоты не окисляются.
2. Ферменты окисления жирных кислот локализованы в матриксе митохондрий. Первые предположения о путях окисления жирных кислот высказал Ф. Кно-оп еще в 1904 г., выдвинув свою гипотезу «р-окисления», в соответствии с которой происходит последовательное отщепление двухуглеродных фрагментов с карбоксильного конца молекулы.
Процесс окисления условно делят на 3 этапа:
1) активация жирных кислот в цитозоле и их транспорт в митохондрии;
2) процесс окисления;
3) окисление ацетильной группы образующегося ацетил-КоА в ЦТК и сопряженных цепях переноса электронов.
266
Обмен жирных кислот Глава 18
Активация жирной кислоты
Активация жирной кислоты происходит в цитозоле под действием ферментов ацил-КоА-синтетаз (тиокиназ). Известен ряд тиокиназ, специфичных к жирным кислотам с разной длиной углеводородной цепи. Эти ферменты в клетках прокариот прикреплены к клеточной мембране. У эукариот — к внешней мембране митохондрий.
Реакция протекает в 2 этапа и требует АТФ, HS-KoA и Mg-4. Вначале жирная кислота взаимодействует с АТФ. Образуется ациладенилат, который реагирует с HS-KoA. Для активации используется энергия 2-х макроэргических связей, так как от АТФ отщепляется пирофосфат, гидролизуемый далее пирофосфатазой до неорганического фосфата (рис. I8.1).
Образованный ацил-КоА переносится через мембрану митохондрий с помощью <арнитина (р-гидрокси-у-триметил-зминомасляная кислота) и ферментов, локализованных в цитозоле и митохондри
ях — карнитин-ацилтрансфераз. В цитозоле под действием карнитин-ацилтран-сферазы 1 образуется ацил-карншпин, который транспортируется через мембрану митохондрий облегченной диффузией с использованием ацил-карнитин/карнити-нового переносчика.
В митохондриях происходит обратный процесс: под действием митохондриального фермента карнитин-ацил-трансферазы II (локализован на внутренней стороне внутренней мембраны митохондрий) ацил-карнитин взаимодействует с HS-KoA и освобождается ацил-КоА (рис. 18.2).
При некоторых заболеваниях страдает система переноса ацильных остатков в матрикс митохондрий. При карнитиновой недостаточности отмечают мышечные судороги и слабость. Это патологическое состояние, связанное с дефицитом карнитина, может заканчиваться смертью. Первично поражаются
267
Глава 18 Обмен жирных кислот
О
11 © Карнитин- ©
R SKoA +(CH3)3N-CH2CH-CH^OO ацилтрансфераза I (CH^N-CH^CH-CF^COO’
Ацил-КоА Карнитин
O-CR
Ацил-карнитин б
Митохондрии
Карнитин-ацилтрансфераза II *
HS-KoA
______________Ацил-карнитин
О
II
Карнитин + R — С — SKoA
Ацил-КоА
Рис. 18.2. Транспорт жирной кислоты через мембрану митохондрий.
мышцы, почки и сердце. Мышечная слабость при физической нагрузке является важной характеристикой дефекта карнитин-ацилтрансфера-зы. Постепенное развитие этого состояния связано с тем, что среднецепочечные жирные кислоты (С8-С10) не требуют карнитина для переноса в митохондрии и могут свободно окисляться, являясь источником энергии.
р-Окисление жирной кислоты
В результате каждого цикла р-окисле-ния, включающего 4 реакции, происходит высвобождение ацетил-КоА и жирная кислота укорачивается на 2 углеродных атома.
1. Дегидрирование. Ацил-КоА подвергается дегидрированию под действием фермента ацил-КоА-дегидрогеназы, содержащей в качестве простетической группы ФАД. Образуется двойная связь между аир углеродными атомами. Фермент обладает стереоспецифичностью, поэтому в результате этой реакции образуется тданс-Д2-еноил-ацил-КоА. В процессе окисления ФАД восстанавли
вается и передает электроны в дыхательную цепь посредством ЭТФ-KoQ-оксидоредуктазы (см. лекцию 9). Окисление, катализируемое ацил-КоА-дегидрогеназой аналогично окислению сукцината в ЦТК.
2. Гидратация. Еноил-КоА-гидратаза присоединяет молекулу воды и образуется L-p-гидроксиацил-КоА.
3. Дегидрирование. р-гидроксиацил-КоА-дегидрогеназа (НАД-зависимая дегидрогеназа) катализирует второе окисление. Образуется р-кетоацил-КоА и НАДН.
4. Под действием тиолазы (ацил-КоА-ацетилтрансфераза) с использованием свободного HS-KoA р-кетоацил-КоА расщепляется до ацетил-КоА и ацил-КоА, укороченного на два углеродных атома (рис. 18.3).
Окисление ацетил-КоА в ЦТК
Ацетил-КоА вступает в цикл трикарбоновых кислот, конденсируясь с оксалоа-цетатом. При окислении ацетильной группы ацетил-КоА в ЦТК и сопряженных цепях переноса электронов образуется 10 АТФ. Укороченный ацил-КоА вступает в следующий цикл р-окисления.
268
Обмен жирных кислот Глава 18
О r-ch2-ch2-ch2-c~skoa
Ацил-КоА
Н О
Аирл-КоМешдрогеназа r-ch^-C-SKoA -z 4 н
Т ранс-Д2-еноил-ацил-КоА
ФАД ФАДН2
t
ФАД+Н2О+1,5 АТФ
Еноил-КоА -гидратаза
R-CH2-C~C~C~SKoA
н н
+Н2О
ОНИ О
0-гидроксиацил-КоА-дегидрогеназа
L-0-гидроксиацил-КоА
НАД* НАДН+Н
НАД*+Н2О+2,5 АТФ
О R-CH2-&- СН2 р-кетоацил-КоА
О II
Тиолаза
C~Qi<nA HS-KoA ь ----------->. R—СН2—C~SKoA + CH3-C-SK0A
Ацил-КоА Ацетил-КоА
О II
О II
Рис. 18.3. р-окисление жирных кислот.
Энергетический баланс окисления жирных кислот
В результате одного акта р-окисления высвобождается одна молекула ацетил-КоА, две пары электронов и 4 протона ' Н ). Например, уравнение одного акта j-окисления пальмитиновой кислоты можно представить следующим образом:
Пальмитоил-КоА + HS-KoA + ФАД + НАД* +
Н2О •» миристоил-КоА + ацетил-КоА + ФАДН2 + НАДН + Н+
Миристоил-КоА снова вступает в зкисление и укорачивается еще на два углеродных атома. После семи актов р-зкисления одна молекула пальмитиновой кислоты окисляется до 8 молекул знетил-КоА. Тогда общее уравнение зкисления пальмитиновой кислоты гы глядит следующим образом:
Пальмитоил-КоА + 7HS-KoA + 7ФАД + 7НАД+ + 7Н2О * 8 ацетил-КоА + 7ФАДН2 + 7НАДН + 7Н*
Каждая молекула ФАДН2, образующаяся при р-окислении, отдает электроны через ЭТФ-КоО-оксидоредуктазу в дыхательную цепь и в процессе транспорта электронов к О2 образуется 1,5 молекулы АТФ. Одна молекула НАДН отдает электроны к НАДН-дегидроге-назе и в процессе транспорта электронов к О2 образуется 2,5 молекулы АТФ. Таким образом, 4 молекулы АТФ образуется при каждом акте р-окисления.
Расчет выделяемой энергии при окислении жирной кислоты производится по формуле:
[4 (п/2-1) + п/2 х 10] — 2
где: 4 — число молекул АТФ, образуемое при одном акте 0-окисления: п — число атомов углерода в жирной кислоте; rV2-1 — число
269
Глава 18 Обмен жирных кислот
актов ft-окисления; п!2 — число молекул ацетил-КоА; 10 — число молекул АТФ при полном окислении ацетильной группы молекулы ацетил-КоА; 2—количество высокоэнергетических фосфатов, используемых на активацию жирной кислоты (при активации АТФраспадается на АМФ и пирофосфат).
Расчеты при окислении пальмитоил-КоА: 10,5 молекул АТФ из 7 молекул ФАДН2, 17,5 молекул АТФ из 7 молекул НАДН, 80 молекул АТФ из 8 молекул ацетил-КоА; в сумме 108 молекул АТФ. Эквивалент двум молекулам АТФ был потрачен на активацию пальмитата, в котором молекула АТФ распалась на АМФ и 2 Рн. Таким образом, полное окисление молекулы пальмитиновой кислоты дает 106 молекул АТФ, По В. Эллиот и Д. Эллиот коэффициент полезного действия р-окисления жирных кислот равен 33 %. Теоретически при полном окислении 256 г пальмитиновой кислоты образуется 45 кг АТФ. Разумеется, такого количества АТФ никогда не бывает из-за постоянного расходования АТФ на энергетические нужды организма.
Окисление жирных кислот в пероксисомах
р-Окисление может происходить в пероксисомах. Отличия заключаются в первой стадии: в пероксисомах флавопротеины, которые вводят двойную связь передают электроны прямо на О2 с образованием Н2О2 (рис. 18.4). Перекись водорода расщепляется каталазой на Н2О и О2.
Энергия, высвобождаемая при окислении жирных кислот в пероксисомах, не аккумулируется в АТФ, а рассеивается в виде тепла. При высоком содержании жиров в диете увеличивается синтез ферментов р-окисления жирных кислот в пероксисомах печени. В пероксисомах печени не содержатся ферменты ЦТК и ацетильная группа ацетил-КоА не окисляется до СО2 и Н2О. Предполагают, что в пероксисомах преимущественно окисляются жирные кислоты, содержащие более 18-ти углеродных атомов. Ацетат, продуцируемый при окислении жирных кислот, экспортируется из пероксисом и, возможно, поступает в митохондрии для окисления.
Рис. 18.4. Первая реакция пероксисомального окисления жирных кислот. Первое дегидрирование жирных кислот в пероксисомах требует ФАД-содержащей дегидрогеназы, которая переносит электроны на О2 с образованием Н2О2.
270
Обмен жирных кислот Глава 18
При синдроме Цельвегера не функционируют пероксисомы, что ведет к поражению печени, почек, мышц и смерти до 6 лет. В основе патогенеза этих фатальных изменений лежит дефект важнейших пероксисомальных ферментов.
Окисление ненасыщенных жирных кислот
Ненасыщенные жирные кислоты до ме-_та двойной связи окисляются так же, .чак насыщенные. Однако двойные свя-: и природных ненасыщенных жирных кислот имеют цис-конфигурацию, а в КоА-эфирах жирных кислот, являющихся промежуточными продуктами при -окислении насыщенных жирных кис-эт. двойные связи имеют /и/ил/с-конфи-" рацию. Кроме того, последовательное каление двухуглеродных фрагментов ри окислении ненасыщенных жирных кислот до первой двойной связи дает Д3-4-^-ил-КоА, а не Д23-ацил-КоА, который ;зляется промежуточным продуктом р-кисления насыщенных жирных кислот.
В организме имеется фермент, кото-гый. во-первых, осуществляет перемещение двойной связи из положения 3— - з положение 2—3 и, во-вторых, вменяет конфигурацию двойной свя-. • из цис- в транс-, т. е. катализирует _киию двойной изомеризации: Д3’4-• - Д2'3-/ярй//с-еноил-КоА-изомераза. 2._:ее процесс идет обычным путем.
Скорость окисления ненасыщенных •ирных кислот выше, чем насыщенных.
Окисление жирных кислот с нечетным числом атомов углерода
ёслыиинство липидов содержат жир-кислоты с четным числом атомов
углерода. Однако в липидах растений и некоторых микроорганизмов содержатся жирные кислоты с нечетным числом атомов углерода. Небольшое количество пропионата добавляют к хлебу и злаковым как ингибитор плесени и, таким образом, пропионовая кислота поступает в организм. Кроме того, у рогатого скота и других жвачных животных, большое количество пропионовой кислоты образуется в результате превращения углеводов в кишечнике. Эта пропионовая кислота всасывается в кровь и окисляется в печени и других тканях.
При окислении жирных кислот с нечетным числом углеродных атомов образуется не ацетил-КоА, а пропионил-КоА, который превращается в сукцинил-КоА (рис. 18.5).
Регуляция окисления жирных кислот
При регуляции окисления первостепенное значение имеет доступность жирных кислот. Поступление жирных кислот определяется содержанием жиров в пище и скоростью липолиза эндогенных липидов, р-гидроксиапил-КоА дегидрогеназа ингибируется высоким отношением [HAjHj/ !НАД+Г, тиолаза ингибируется ацетил-КоА.
Концентрация малонил - КоА. первого промежуточного пролук i а биосинтеза жирных кислот из ацетил-КоА, повышается, если поступает избыток углеводов с пищей: глюкоза не может быть окислена или депонирована в виде гликогена и превращается в жирные кислоты для синтеза триацилглицеролов. Малонил-КоА ингибирует карнитин-ацилтрансфсразу I и, следовательно, ингибируется окисление жирных кислот.
271
Глава 18 Обмен жирных кислот
снз сн2 C"SKoA
Пропионил-КоА -карбоксилаза (биотин), СО2
АТФ АДФ
Пропионил-КоА Н3РО4
-оос-сн Uo ci SKoA
D-Метилмалонил-КоА
Метилмалонил-КоА эпимераза
ЦТК-*
Ск ^с—1рн2
KoA-S СН2
СОО-
Метилмалонил-КоА мутаза (витамин В12)
КоА-S'*
Os 9Нз чс-сн
соо-
Сукцинил-КоА
L-Метилмалонил-КоА
Рис. 18.5. Окисление жирной кислоты с нечетным числом атомов углерода.
Окисление глицерола
При липолизе триацилглицеролов жировых клеток или ХМ и ЛПОНП кроме жирных кислот образуется глицерол (глицерин). Глицерол свободно транспортируется кровью. В почках, печени, яактиру-ющих молочных железах имеется фермент глицеролкиназа, катализирующий в цитозоле фосфорилирование глицерола в глицерол-З-фосфат, который превращается в глицеральдегид-3-фосфат (рис. 18.6.).
Дальнейшие превращения глицеральдегид-3-фосфата (ГАФ) могул быть двоякими:
1. По реакциям глюконеогенеза:
ДАФ + ГАФ * Ф-1.6-БФ * Ф-б-Ф * Г-6-Ф * глюкоза
2. По реакциям гликолиза (см. главу 13):
ГАФ*1,3-БФГК->3-ФГК* 2-ФГК * ФЕП * пируват * ацетил-КоА * ЦТК
Энергетический баланс окисления глицерола до СО2 и Н2О:
• на стадии глицеролкиназы -1 АТФ;
• на стадии глицерол-3-фосфатдегидрогеназы + 1,5 АТФ;
• на стадии ГАФ дегидрогеназы -* НАДН+Н+- + 2,5 АТФ;
• на стадии фосфоглицераткиназы + 1 АТФ (субстратное фосфорилирование);
• на стадии пируваткиназы + 1 АТФ; • при окислительном декарбоксилировании пирувата в ацетил-КоА + НАДН+Н+ -* + 2,5 АТФ
• окисление ацетильной группы ацетил-КоА в ЦТК и сопряженных цепях переноса электронов -* + 10 АТФ. Итого: 18,5—1 — 17,5 АТФ, на две молекулы глицерола — 35 молекул АТФ.
Для синтеза липидов используется ацетил-КоА. Напомним, что основными источниками ацетил-КоА являются: 1) /?-окисление жирных кислот', 2) окислительное декарбоксилирование пирувата', 3) некоторые (кетогенные) аминокислоты.
Синтез жирных кислот
По сравнению с гликогеном жиры представляют более компактную фор-
272
Обмен жирных кислот Глава 18
Митохондрии
Н-С-ОН
СН2ОН
Глицеролкиназа
АТФ АДФ
СН2ОН
Н-С-ОН "
СН2ОРО32-
Н-С-ОН
СН2ОРО32’
Глицерол
Глицерол-З-фосфат
Гл ицерол-3-фосфат
Гпицерол-3-фосфат-деаидроаеназа
ФАД ФДДН2
^Н2ОН С=О СН2ОРО3
4
Диоксиацетонфосфат
Цитозоль
ы пы Триозофосфат-
и2ип изомераза
+ С=О -
СН2ОРО32-
Диоксиацетон-фосфат
ФАД+Н2О+1,5 АТФ
Н-С-ОН -----------ПИРУВАТ
СН2ОРО32'
Ацетил-КоА
СО2
Н2О
Г лицеральдегид-3-фосфат
Глюконеогенез (до глюкозы)
Рис. 18.6. Окисление глицерола (глицерина).
му хранения энергии, поскольку они менее окислены и гидратированы. При этом количество энергии, резервированное в виде нейтральных липидов в жировых клетках, ничем не ограничивается в отличие от гликогена. Центральным процессом в липогенезе является синтез жирных кислот, поскольку
они входят в состав практически всех групп липидов. Кроме того, следует помнить, что основным источником энергии в жирах, способным трансформироваться в химическую энергию молекул АТФ, являются процессы окислительных превращений именно жирных кислот.
10 Зак. 2124
273
Глава 18 Обмен жирных кислот
Общая характеристика биосинтеза жирных кислот
1. Жирные кислоты синтезируются из ацетил-КоА, который образуется из пирувата (распад углеводов пищи) или при катаболизме аминокислот (при их избыточном поступлении) и накапливаются в виде триацилглицеролов. Ацетил-КоА, образуемый при окислении жирных кислот, не является основным источником биосинтеза жирных кислот, поскольку существует реципрокная регуляция этих двух процессов.
2. Основное место синтеза — печень. Кроме того, жирные кислоты синтезируются во многих тканях: почки, мозг, молочная железа, жировая ткань.
3. Ферменты синтеза локализованы в цитозоле клеток в отличие от ферментов окисления жирных кислот, которые находятся в митохондриях.
4. Синтез жирных кислот происходит из ацетил-КоА.
5. Для синтеза жирных кислот необходимы НАДФН, АТФ, Мп2", биотин и СО2.
Синтез жирных кислот происходит в 3 этапа:
1) транспорт ацетил-КоА из митохондрий в цитозоль; 2) образование малонил-КоА; 3) удлинение жирной кислоты на 2 атома углерода за счет малонил-КоА до образования пальмитиновой кислоты.
1. Транспорт ацетил-КоА из митохондрий в цитозоль осуществляется с помощью цитратного челночного механизма (рис. 18.7).
1.1. Цитратсинтаза катализирует реакцию взаимодействия оксалоацета-та и ацетил-КоА с образованием цитрата.
1.2. Цитрат траспортируется в цитозоль с помощью специфической транспортной системы.
1.3. В цитозоле цитрат взаимодействует с HS-KoA и под действием
цитратлиазы и АТФ образуется ацетил-КоА и оксалоацетат.
1.4. Оксалоацетат не может вернуться в митохондрии поскольку отсутствует специфический переносчик. Оксалоацетат восстанавливается до малата под действием НАД+-зависи-мой малатдегидрогеназы.
1.5. Малат декарбоксилируется НАДФ-зависимой малатдегидрогена-зой (малик-фермент). Образующийся НАДФН+Н+ (50 % потребности) используется для синтеза жирных кислот. Кроме этого генераторами НАДФН+Н (50 %) являются пентозофосфатный путь и изоцитратдегидрогеназа.
1.6. Пируват транспортируется в митохондрии и под действием пиру в аткарбоксилазы с использованием АТФ и СО2 образуется оксалоацетат.
2. Образование малонил-КоА. Ацетил-КоА карбоксилируется под действием ацетил-КоА-карбоксилазы. Это АТФ-зависимая реакция, для которой необходим витамин Н (биотин) и СО2 (рис. 18.8).
3. Удлинение жирной кислоты. Процесс протекает при участии мультиферментно-го синтазного комплекса. Он состоит из двух полипептидных цепей. Каждая поли-пептидная цепь содержит по 7 ферментов синтеза жирных кислот (ацетил-КоА-АПБ-трансацетилаза, малонил-КоА-АПБ-трансфераза, [>-кетоацил АПБ-синтаза, /?-кетоацил-А ПБ-редуктаза, fi-гидроксиацил-А ПБ-дегидратаза, еноил-А ПБ-редуктаза. тиоэстераза). Ферменты связаны между собой ковалентными связями. Ацилпереносящий белок (АПБ) является также частью полипептидной цепи, но это не фермент. Его функция связана только с переносом ацильных радикалов. В процессе синтеза важную роль играют SH-rpyn-пы. Одна из них принадлежит 4-фосфо-пантетеину, входящему в состав АПБ и вторая — цистеину фермента кетоацил-
274
Обмен жирных кислот Глава 18
Матрикс митохондрий
43
S
Е к gO
СОО
Аы ООО
—*т_ 2 О Цитрат-синтаза сц2
+ ch,h!:~skoa *н2О ______ но-с-соо-
Оксалоацетат Ацетал-КоА НЪ-КоА СОО
Цитрат
НАДН+Н*
Малатдегидрогеназа
' НАД*
Пируват
Т____
I
Малат
Цитозоль
Цитрат + АТФ + HSKoA
Малат-
СОО" дегидрогеназа
СН2 НОС-Н
СО° НАД* НАДН+Н
Малат
НАДФ+
соо-СН2 с=о + СОО-
Оксалоацетат
Цитратпиаза
о
CH3-&~SKoA + АДФ + Рн
Ацетил-КоА
Малик-фермент
С*НАДФН+Н
,, со2
сн3 СО соо-
Пируват
Рис. 18.7. Упрощенная схема цитратного челночного механизма и образования НАДФН
.интазы. Первую называют центральной, а вторую периферической SH-труппой.
Функционалышя единица синтеза жирных кислот состоит из половины одного мономера, взаимодействующей с комплементарной половиной второго
мономера. Следовательно, на синтазном комплексе одновременно синтезируются 2 жирные кислоты. Активной является только димерная форма комплекса. Перенос субстрата от фермента к ферменту происходит при участии АП Б.
275
Глава 18 Обмен жирных кислот
Реакции синтеза
1. При участии фермента ацетил-КоА-А ПБ-трансацетилазы ацетильная группа ацетил-КоА переносится на SH-rpynny fj-кетоацилсинтазы (периферическую); малонильная группа от малонил-КоА переносится на SH-группу АП Б под действием фермента малонил-Ко А-А ПБ-трансферазы (центральную) (рис. 18.9).
2. Фермент р-кетоацил-АПБ-синтаза переносит ацетильный остаток с периферической SH-группы на остаток малонила. Это реакция конденсации. Энергия для нее освобождается при одновременном декарбоксилировании. Образуется р-кетоацил-А ПБ.
3. При участии фермента 0-кетоацил -АПБ-редуктазы с коферментом НАДФН, происходит восстановление оксогруппы в спиртовую и р-кетоацил-АПБ превращается в fl-гидроксиацил-АПБ.
4. Фермент [>-гидроксиацил-А ПБ-дегид-ратаза удаляет Н2О из р-гидроксиацил-АПБ и образуется еноил-АПБ.
5. Еноил -А ПБ-редуктаза восстанавливает двойную связь с использованием НАДФН. Образуется ацил-АПБ (масляная кислота после первого цикла).
6. Если нужна масляная кислота (бутират), то тиоэстераза (деацилаза) отщепляет масляную кислоту с центральной SH-группы на цитоплазматический HS-КоА.
276
7. Если необходима жирная кислота с более длинной цепью, остаток масляной кислоты переносится на периферическую SH-группу, а к центральной SH-группе вновь переносится малонил-КоА и процесс присоединения 2-х углеродных атомов повторяется.
8. Этот процесс продолжается до образования пальмитиновой кислоты (часто весь комплекс называют пальмитатсинтазный комплекс). Она отщепляется тиоэстеразой и соединяется с цитоплазматическим HS-KoA. Полученный пальмитоил-КоА может ингибировать паль-митатсинтазу, вызывая диссоциацию комплекса на две полипептидных цепи.
Дальнейшая судьба пальмитоил-КоА двоякая: 1) участие в процессах эстери-фикации с образованием ацилглицеро-лов и эфиров холестерола; 2) дальнейшее удлинение цепи (элонгация и десатурация).
Удлинение жирной кислоты
Дальнейшее удлинение пальмитиновой кислоты может происходить с участием 2-х систем.
Митохондриальная система удлинения жирной кислоты. Остаток пальмитиновой кислоты карнитином переносится в митохондрии, где происходит удлинение за счет присоединения аце-
Обмен жирных кислот Глава 18
о Ацетил-КоА-АПБ-
V трансацетилаза
(периф) CH3-C'~SKoA Малонил-КоА-АПБ Ацетил-КоА трансфераза
+ О
“OOC“CH2C~SKoA
Малонил-КоА 2 HS-KoA
\i-S~tci-h Р-Кетоацил-АПБ-
|\1 синтаза
О -------------v-----►
s~c-ch/:oo- -со2
s~c-ch2-c-ch3
р-Кетоацил-АПБ
р-Кетоацил-АПБ-редуктаза
НАДФН НАДФ+
&SH
I ° а 9Н
S'-C-CH2CJ?CH3 н
$-гидроксиацил-АПБ-дегидратаза
р-Г идроксиацил-АПБ
I II а Р S-CCH-CHCH
Еноил-АПБ
Еноил-АПБ-редуктаза Г\~1_g|_|
н Л Л / То
.НАДФН НАДФ+ I II
1з S~C-CH2-CH2CH3
Бутирил-АПБ
Рис. 18.9. Синтез жирных кислот.
тил-КоА по пути, обратному 0-окисле-нию. Для восстановления используется НАДФН.
Микросомальная система удлинения жирной кислоты является более активной. Удлинение происходит в мембране эндоплазматического ретикулума за счет малонил-КоА. Напоминает функционирование синтазного комплекса в цитоплазме. Отличие состоит в том, что промежуточные продукты не связываются с АПБ.
Синтез ненасыщенных жирных кислот
1. В мембране эндоплазматического ретикулума (микросомах) с помощью оксидаз происходит введение двойных связей в насыщенные жирные кислоты
с образованием мононенасыщенных жирных кислот: пальмитолеиновая (16: 1, Д9) синтезируется из пальмитиновой кислоты; олеиновая (18 : 1, Д9) — из стеариновой кислоты). Для реакции используется НАДФН+Н* и О2.
Пальмитоил-КоА + НАДФН+Н* + 0г * пальмитоолеил-КоА + 2 Н2О + НАДФ*
Согласно классическим представлениям у млекопитающих этот процесс осуществляется с помощью ферментов десатураз (десатурация — получение ненасыщенного продукта). Термин «десатуразы» широко используется в англоязычной биохимической литературе. 2. Полиеновые жирные кислоты — линолевая и линоленовая не синтезируются, а поступают с пищей (незаменимые). Остальные полиненасыщенные синтези
277
Глава 18 Обмен жирных кислот
руются из них. Особенно важен синтез арахидоновой кислоты, являющейся предшественником эйкозаноидов.
В организме человека могут синтезироваться жирные кислоты только с 1 двойной связью — пальмитолеиновая и олеиновая. Жирные кислоты с 2 и 3 двойными связями не синтезируются и являются незаменимым компонентом пищи. Жирные кислоты с 4 двойными связями (арахидоновая) могут синтезироваться, если с пищей поступило достаточное количество (25 г/сутки подсолнечного масла) линолевой и линоленовой кислот.
Разветвленные жирные кислоты синтезируются из продуктов деградации аминокислот с разветвленным радикалом (вал, иле, лей) через ацильные производные с КоА путем удлинения цепи и при участии АПБ.
Регуляция синтеза жирных кислот
Скорость синтеза жирных кислот регулируется кратковременными и долговременными механизмами контроля.
1. Кратковременная регуляция осуществляется аллостерически на уровне ацетил-КоА -карбоксилазы.
Эта реакция лимитирует скорость всего процесса синтеза жирных кислот:
активаторы — цитрат и инсулин, ингибиторы — синтезированная жирная кислота и глюкагон.
При повышении концентрации митохондриального ацетил-КоА и АТФ, цитрат транспортируется из митохондрий и активирует ацетил-КоА карбоксилазу. Одновременно цитрат ингибирует фосфофруктокиназу-1 и, тем самым, снижает скорость гликолиза.
Ацетил-КоА-карбокс ил аза регулируется ковалентной модификацией. Глюкагон и адреналин запускают механизм фосфорилирования фермента, что приводит к его инактивации. Инсулин активирует ацетил- КоА-карбоксилазу путем дефосфорилирования фермента.
2. Долговременная регуляция осуществляется через синтез ферментов и их деградацию при участии гормонов. Инсулин способен вызывать долговременную индукцию синтеза фермента. Глюкагон и адреналин оказывают противоположное действие.
3. Если синтез и fj-окисление жирных кислот протекали бы одновременно, два этих процесса могли образовать футиль-ный цикл, что приводит к потере энергии. 0-Окисление ингибируется мало-нил-КоА, который ингибирует карнитин-ацилтрансферазу I. Таким образом, во время синтеза жирных кислот, малой ил-КоА снижает 0-окисление на уровне транспортной системы внутренней мембраны митохондрий.
278
дапава 19
Синтез липидов, ожирение, атеросклероз
Синтез кетоновых тел
Ацетил-КоА включается в ЦТК в условиях, когда расщепление жиров и углеводов сбалансировано. Ускоренный катаболизм жирных кислот или сниженный уровень использования углеводов (как по отдельности, так и в сочетании) могут приводить к накоплению ацетил-КоА и синтезу из него кетоновых тел. Синтез кетоновых тел протекает в печени. Ферменты локализованы в матриксе митохондрий.
1. 2 молекулы ацетил-КоА конденсируются с образованием ацетоацетил-КоА. Фермент — тиолаза. Эта реакция является простым обращением последней реакции р-окисления.
2. Ацетоацетил-КоА взаимодействует с третьей молекулой ацетил-КоА. Образуется fl-гидрокси-р-метилглутарил-КоА ГМ Г-КоА). Фермент — ГМГ-КоА синтаза.
3. ГМГ-КоА-лиаза расщепляет ГМГ-КоА то ацетоацетата и ацетил-КоА.
4. Ацетоацетат спонтанно декарбоксилируется с образованием ацетона или
восстанавливается с помощью fi-гидро-ксибутират-дегидрогеназы до р-гидроксибутирата (рис. 19.1).
Ацетоацетат, ацетон и р-гидроксибути-рат — кетоновые тела.
Использование кетоновых тел
В норме образуется небольшое количество кетоновых тел. Кетоновые тела являются водорастворимыми молекулами и транспортируются к различным органам. Ацетоацетат и р-гидроксибутират рассматриваются как важные источники энергии для скелетных мышц, сердечной мышцы и мозга. В тканях, где отсутствуют митохондрии (эритроциты) кетоновые тела не используются.
В печени ацетоацетат не может окисляться, поскольку отсутствует фермент тиофораза, необходимый для метаболизма кетоновых тел.
В периферических тканях р-гидро-ксибутират превращается в ацетоацетат, который активируется в ацетоацетил-
279
Глава 19 Синтез липидов, ожирение, атеросклероз
$ Тиолаза
2 СН3_С -SKoA м-Ацетил-КоА
HS-KoA
О О
II н
CH3-C-CH2-C~SKoA
Ацетоацетил -КоА
О
+ CH3-C~SKoA Ацетил-КоА
ГМГ-КоА-синтаза
О II
HS-KoA
сн3
-OOC-CH2’C-CH2-C-SKoA
он
р-Г идрокси-р-метил-глутарил-КоА
(ГМГ-КоА)
ГМГ-КоА-лиаза
1 о
II
О II СН3-С-СН2-СОО- + CH3-C~SKoA Ацетоацетат р -Гидроксибутират- // дегидрогеназа НАДН+Н
Ацетил-КоА
ОН НАД' сн3-с-сн2соо*
Н
₽ -Гидроксибутират
О
II СН3“С-СН3 Ацетон
Рис. 19.1. Синтез кетоновых тел.
КоА митохондриальным ферментом тиофо ризой. Источником HS-KoA является сукцинил-КоА (промежуточный продукт ЦТК). Тиолаза расщепляет ацетоацетил-КоА до 2-х молекул ацетил -КоА (рис. 19.2).
Таким образом, одна молекула ацетил-КоА — своеобразная плата за доставку энергии из печени к периферическим тканям: в печени на синтез кетоновых тел потребовалось три молекулы ацетил-КоА, а в периферических тканях освободились только 2 молекулы ацетил-КоА.
Регуляция кетогенеза
1. Биосинтез кетоновых тел активируется только при увеличении в крови
свободных жирных кислот, т. е. для регуляции кетогенеза важны факторы, контролирующие стадию мобилизации свободных жирных кислот из жировой ткани.
2. Свободные жирные кислоты в печени используются для биосинтеза либо триацилглицеролов, либо включаются в процесс р-окисления. Расхождение путей метаболизма жирных кислот регулируется скоростью их транспорта через митохондриальную мембрану в матрикс, где и происходит р-окисление. 3. Ацетил-КоА в матриксе митохондрий может либо окисляться в ЦТК, либо метаболизироваться по пути кетогенеза, т, е. образовывать кетоновые тела.
4. Кетогенез регулируется гормонами: глюкагон — активирует, инсулин — ингибирует.
280
Синтез липидов, ожирение, атеросклероз Глава 19
i
ОН I СН3—С-СН2—СОО‘
н
р-Гидроксибутират-дегидрогеназа
р-гидроксибутират
СН3—С-СН2—СОО'
Ацетоацетат
Тиофораза
О
II
ООС—СН2—СН2—С- SKoA
Сукцинил-КоА
'ООС—СН2—СН2—СОО'
О о Сукцинат
II II
СН3—С—СН2—С - SKoA
Ацетоацетил-КоА
Тиолаза
О
HSKoA
О
СН3—С ~ SKoA Ацетил-КоА
СН3—С ~ SKoA Ацетил-КоА
Рис. 19.2. Превращение кетоновых тел в тканях.
281
Глава 19 Синтез липидов, ожирение, атеросклероз
При голодании и диабете в клетках печени снижено содержание глкжо-зо-6-фосфата, следствием чего может быть: 1) дефицит НАДФН+Н+ из-за ослабленных превращений в окислительных реакциях пентозофосфатного пути и 2) дефицит оксалоацетата из-за ослабленных превращений в реакциях гликолиза. В этих условиях создается избыток ацетил-КоА, который не может в достаточной степени окисляться в общем пути катаболизма из-за недостатка оксалоацетата. Накапливающийся ацетил-КоА способен превращаться по трем направлениям: использоваться для синтеза жирных кислот, холестерола и кетоновых тел. Но для синтеза жирных кислот и холестерола необходим НАДФН+Н+, а его количество снижено из-за ослабленных превращений глюкозо-6-фосфата в окислительных реакциях ПФП. Поэтому избыток ацетил-КоА будет преимущественно превращаться в кетоновые тела. Это приводит к их накоплению в крови и развитию метаболического ацидоза. Выраженный ацидоз может привести к коме и смерти. При большом избытке кетоновых тел они выводятся почками, т. е. возникает кетону-рия. В тяжелых случаях ацетон выводится через легкие и может быть обнаружен в выдыхаемом воздухе.
Синтез холестерола
Холестерол (холестерин) может поступать с пищей или синтезироваться de novo. Синтез холестерола осуществляется в клетках почти всех органов и тка
ней, однако в значительных количествах — в печени 80 %, в пищеварительном тракте — 10 % и коже — 5 %. За сутки в организме взрослого синтезируется около 500 мг холестерола.
Функции холестерола:
1. Структурный компонент клеточных мембран.
2. Предшественник для синтеза всех других стероидов в организме (стероидных гормонов, витамина D и желчных кислот).
3. Структурный компонент липопротеинов, участвующих в транспорте липидов в организме.
Ферменты синтеза холестерола локализованы в цитозоле и микросомальной фракции клеток. Синтез происходит из ацетил-КоА с затратой АТФ, Mg2+, НАДФН+Н+. В синтезе выделяют 5 стадий (рис. 19.3):
1. Синтез ГМ Г-КоА (Р-гидрокси-р-метил-глутарил-КоА). 2 молекулы ацетил-КоА под действием тиолазы конденсируются с образованием ацетоацетил- КоА, к которому затем присоединяется третья молекула ацетил-КоА и синтезируется ГМГ-КоА. Данные реакции аналогичны реакциям при синтезе кетоновых тел. Однако, эти пути различаются, поскольку кетоновые тела синтезируются в митохондриях, а синтез холестерола происходит в цитозоле. Таким образом, существует 2 пула ГМГ-КоА в клетках.
2. Синтез мевалоната. ГМГ-КоА-редукта-за катализирует восстановление ГМГ-КоА до мевалоновой кислоты с использованием НАДФН+Н\ ГМГ-КоА-редуктаза является интегральным белком гладкого эндоплазматического ретикулума и главным ферментом, регулирующим скорость синтеза холестерола.
3. Синтез изопреновых единиц. В результате 3-х реакций, катализируемых киназами с затратой 3 молекул АТФ, мевалонат превращается в З-фосфо-5-пирофосфомевалонат, который декар-
282
Синтез липидов, ожирение, атеросклероз Глава 19
боксилируется и дефосфорилируется с образованием изопентенилпирофосфа-та. Изопентен ил пирофосфат изомеризуется в диметияаллилпирофосфат. Оба соединения являются 5-утлеродными изопреновыми единицами.
4. Синтез сквалена. Три молекулы ди-метилаллилпирофосфата конденсируются (соединение «голова к хвосту*) и образуется фарнсзил пирофосфат (150. Из двух единиц фарнезилпирофосфата соединением «хвост к хвосту» синтезируется сквален (ЭОС).
5. Превращение сквалена в холестерол. Свален подвергается гидроксилированию и циклизации с использованием О2 и НАДФН+ГГ и превращается в ланостерол. Синтез холестерола из ланостерола является многоэтапным процессом, который включает:
а) удаление 3-х метильных групп;
б) насыщение двойной связи в боковой цепи;
в) перемещение двойной связи в кольце из положения 8,9 в положение 5,6.
Синтез холестерола является частью метаболического пути синтеза некоторых других изопреновых соединений, например, убихинона в митохондриальной цепи переноса электронов и долихола в гликопротеинах.
Регуляция синтеза холестерола
ГМ Г-КоА редуктаза — необратимая реакция, которая определяет скорость синтеза холестерола.
1. Механизм обратной связи. Конечный продукт холестерол контролирует синтез г. о механизму обратной связи. Повышение внутриклеточной концентрации хо-тестерола снижает синтез фермента ГМГ-КоА-редуктазы. Эго происходит за гчет снижения транскрипции гена, ответственного за синтез фермента. Актив -ость ГМГ-редуктазы и скорость синтеза
холестерола ускоряются при снижении содержания холестерола в печени, пище, при действии радиации.
Детали механизма:
1.1. ГМГ-редукгаза контролируется белком, связывающимся со стерол-регуляторным элементом ДНК (SREBP). Этот фактор транскрипции связывается с коротким отрезком ДНК, называемым стерол-регуля-торным элементом (SRE). В неактивном состоянии SREBR ассоциирован с мембраной эндоплазматического ретикулума или ядерной мембраной. Когда содержание хо-лестерола уменьшается этот фактор протео-литически отщепляется от мембран и мигрирует к стерол-регул игорному элементу гена ГМГ-редуктазы. Вновь синтезированная ГМГ-редуктаза увеличивает скорость синтеза холестерола. Когда количество холестерола повышено, протеолитическое освобождение SREBP прекращается, a SREBP в ядре деградирует. Таким образом, скорость синтеза холестерола регулируется на уровне синтеза и распада ГМ Г-редуктазы.
1.2. Скорость трансляции мРНК ГМГ-редуктазы ингибируется несгероловыми .метаболитами, освобождаемыми при превращениях мевалоната, а также пищевым холестеролом.
13. Деградация ГМГ-редуктазы строго контролируется. Фермент имеет два домена: цитозольный домен определяет активность фермента, а мембранный домен отслеживает сигнал к деградации фермента. Стеролы, включая холестерол, способны изменять олигомеризацию мембранного домена и делать фермент чувствительным к протеолизу. Аналогичная стерол-чувствительная область имеется в протеазе, активируемой SREBP. Редуктаза далее деградирует путем связывания с убиквитином в 26S протеасо-мах. Комбинация эгих трех путей позволяет регулировать количество фермента в 200 раз.
2. Гормональная регуляция. ГМГ-редуктаза существует в двух формах. Дефос-форилированная форма фермента активна, фосфорилированная форма — неактивна. Этот фермент подобно ацетил-КоА-карбоксилазе (катализирует образование маионнл-КоА в биосинтезе жирных кислот) контролируется
283
Глава 19 Синтез липидов, ожирение, атеросклероз
АМФ-зависимой протеинкиназой. Синтез холестерола прекращается при низком уровне АТФ.
Гормоны глюкагон и глюкокортикоиды способствуют формированию неактивной ГМГ-КоА-редуктазы и, следовательно, снижают скорость синтеза холестерола. Инсулин и тироксин повышают продукцию холестерола, способствуя образованию активной ГМГ-КоА-редуктазы.
Все регуляторные механизмы реализуются через рецепторы, отслеживающие концентрацию холестерола в кровеносном русле.
Судьба синтезированного холестерола
Значительная часть холестерола синтезируется в печени. Небольшая фракция холестерола включается в мембраны гепатоцитов; основное количество холестерола экскретируется в виде одной из трех форм: холестерол желчи, желчные кислоты или эфиры холестерола.
Метаболизм триацилглицеролов и фосфолипидов
Липиды составляют около 15 20 % массы тела человека. Триацилглицеролы (триглицериды, нейтральный жир) являются основными липидами тела человека и составляют 85—90 % всех липидов. Большая часть триацилглицеролов накапливается в жировой ткани и является основным источником энергии организма, в отличие от углеводов и белков, которые не могут накапливаться в значительных количествах.
Запасов триацилглицеролов хватает на несколько недель для обеспечения организма энергией. Примером являются животные, впадающие в спячку на
зиму. Медведи находятся в спячке около 7 месяцев, в течение которых энергия образуется при распаде триацилглицеролов.
Биосинтез триацилглицеролов
Большинство синтезированных или поступивших с пищей жирных кислот используются по двум путям: включаются в триацилглицеролы для депонирования метаболической энергии или включаются в фосфолипидный компонент мембран, что определяется потребностями организма. Во время быстрого роста, синтез новых мембран требует синтеза фосфолипидов; если в организм поступает избыточное количество пищи, но не происходит активного роста, жирные кислоты накапливаются в виде триацилглицеролов.
Триацилглицеролы синтезируются во многих органах и тканях, но наиболее важную роль в их синтезе играют печень, стенка кишечника, лактирующая молочная железа и жировая ткань. Для синтеза необходимы активная форма глицерола — глицерол-З-фосфат и активные формы жирных кислот — ацил-КоА (рис. 19.4).
Активация глицерола:
1. В стенке кишечника и почках есть активная глицеролкиназа. Фермент отсутствует в жировой ткани.
2. В жировой ткани, мышцах предшественником глицерол-3-фосфата является диоксиацетонфосфат, который образуется из глюкозы при гликолизе. Фермент глицерол-3-фосфатдегидрогеназа.
3. В печени имеют место оба пути образования глицерол-3-фосфата.
Синтез триацилглицеролов:
1. Глицерол-З-фосфат, образованный любым из этих путей, взаимодействует с двумя молекулами активированных жирных кислот с образованием фосфатидной кислоты.
284
Синтез липидов, ожирение, атеросклероз Глава 19
О Тиолаза^ II _ К ?
2CH3-C~SKoA ---------- СН3-С-СН2-С ~SKoA + CH3-C~SKoA
Ацетил-КоА HSKoA Ацетоацетил-КоА
СН3 О
ГМГ-КоА-синтаза I II
* ------ OOC-CH2-C-CH2-C-SKoA
jjoiz д ОН
мькоа р_|-Идрокси-р-метилглутарил КоА (ГМГ-КоА)
ГМГ-КоА-редуктаза
2 НАДФН+Н* 2 НАДФ+Н8-КоА
Мевалонаткиназа /Мд^ч
3 АТФ 3 АДФ
СН3 о- О-
ООС-СН2-С-СН2-СН2ОР—Р-О’
О 0 0
-О-р-СГ
сн3 оос-сн2-с-сн2-сн2он он Мевалонат (6С)
б
Пирофосфомееалонат- З-фосфо-5-
декарбоксилаза СН3 пирофосфомевалонат
* A ZCH2 О- О-
СО2 Н3РО4 Н2С СН2 сн=—р-о-
о о
Изопентенилпирофосфат (5 С)
Изопентенилпирофосфат-изомераза
СН3
Ck ZCH2 О' О-
СНз СН 'tWH?"cr о о
Диметилаллилпирофосфат (5С)
i
Фарнезилпирофосфат (15 С)
эис. 19.3. Синтез холестерола.
285
Глава 19 Синтез липидов, ожирение, атеросклероз
Глюкоза
Кишечник Почки Печень
Жировая ткань Мышцы Печень
♦
Глицерол-З-фосфат
Глицералкиназа дегидрогеназа fHjOH
но-с-н -------► но-с-н ------ С-° 2
СНгОН АТФ w СНгОРОз^идд. нАДННГ д^Хгон
Глицерол Глицерол-З-фосфат фосфат
2HS-
О
q ^Н2О—C-R-j
О R^C-SKoA
О
R2-C~SKoA
СН2ОРО32-Фосфатндная кислота
Фосфатаза
НзРОг' ч
О
q (рН2О~ C-R-i
r2-c-o-c-h
СН2ОН
Диацил глицерол О
R3C~SKoA
О
0 (JzHjO С-R^
r2-c-o-c-h о
CH2O-C-R3
Триацилтлицерол
Рис. 19.4. Синтез триацилглицеролов (триглицеридов).
286
Синтез липидов, ожирение, атеросклероз Глава 19
2. Фосфатидная кислота дефосфорили-руется под действием фермента фосфатазы с образованием диацилглицерола.
3. К диацилглицеролу присоединяется третья молекула ацил-КоА и образуется триацилглицерол.
Основное место синтеза триацилглицеролов, характерных для данного организма, является печень. Из печени триацилглицеролы транспортируются в мышцы как источники энергии или в адипоциты для резервирования энергии.
Промежуточные продукты синтеза — фосфатидная кислота и диацилглице-рол — могут использоваться для биосинтеза фосфолипидов.
Биосинтез глицерофосфолипидов
Фосфатидная кислота является ключевым промежуточным соединением в синтезе практически всех фосфолипидов, входящих в состав биомембран. Особенностью этих биосинтетических процессов является участие цитидинтрифосфата (ЦТФ) в синтезе и переносе активированных интермедиатов для реакции конденсации либо с фосфатидной кислотой, либо с продуктом ее дефосфорилирования 1,2-диацилглицеролом рис. 19.5).
1. Фосфатидная кислота взаимодействует с ЦТФ. Образуется цитидинди-фосфатдиацилглицерол (ЦДФ-ДАГ).
2. ЦДФ-ДАГ реагирует с серином и синтезируется фосфатидилсерин.
3. Фосфатидилсерин декарбоксилируется в фосфатидилэтаноламин.
4. С использованием S-аденозилметио-нина происходит метилирование фосфа-гидилэтаноламина и синтезируется фосфатидилхолин.
5. ЦДФ-ДАГ + инозитол фосфатидилинозитол + ЦМФ.
Фосфатидилинозитол + АТФ * фосфа-. лдилинозитол-4-фосфат + АДФ.
Фосфатидилинозитол-4-фосфат + АТФ -* фосфатидилинозитол-4.5-бис-фосфат + АДФ.
Фосфатидилхолин является основной молекулой, образующей бислой мембран, внешний слой липопротеинов. Инозитол-4,5-бисфосфат мембран является субстратом для фосфолипазы С, что ведет к образованию вторичных внутриклеточных посредников, регулирующих фосфорилирование-дефосфорилирование белков (ферментов).
В последние годы интенсивно исследуются белки, способные осуществлять транспорт фосфолипидов. Этот процесс принципиально важен для обновления мембран.
В животных тканях преобладает другой путь синтеза фосфатидилхолина и фосфатидилэтаноламина, включающий активацию и взаимодействие ЦТФ с холином и этаноламином и последующим переносом фосфорилированных спиртов на 1,2-диацилглицерол (рис. 19.6).
Фосфатидилсерин в организме млекопитающих не синтезируется из ЦДФ-диашсл-глицерола. Он синтезируется в реакции обмена этаноламина, входящего в состав фосфатидилэтансламина, на L-серин. Фосфатидилэтаноламин + L-серин *-*• '«—►Фосфатидилсерин + Этаноламин
Наиболее интенсивно синтез происходит в печени, стенке кишечника, семенниках, молочной железе. Реакции синтеза локализованы в эндоплазматической сети.
Дыхательный дистресс-синдром — патологическое состояние, возникающее в результате повреждения пути биосинтеза дипальмитоилфос-фатидилхолина. Этот фосфолипид совместно со специфическими протеинами и другими фосфолипидами находят в межклеточной жидкости, окружающей альвеолы легких, где он снижает поверхностное натяже-
287
Рис. 19.5. Синтез глицерофосфолипидов (из-за экономии места не приведены стереоформы глицерофосфолипидов).
288
Синтез липидов, ожирение, атеросклероз Глава 19
Холин (этаноламин)
АТФ
АДФ
О CHzO-C-R-i
о r2-c-o-c-h о.
СН2О-Р“О-О
Фосфатидная кислота
П2О
Н3РО4 Z хЪ CHjrO-C-R,
О
r2-c-o-c-h
Фосфохолин (фосфоэтаноламин)
СН2ОН
Диацилглицерол
ЦТФ
РРн
ЦМФ
ЦДФ-холин (ЦДФ-этаноламин)
/ЦТФ
\ Н4Р2О7
0 CH2-O-C-R! r2-c-o-c-h о-
СН2 О-Р-О-Р-О-Цитидин
6 6
ЦДФ-диацилгл ицерол Инозитол
О
ch2o-c-r1
о
r2-c-o-c-h
СН2О-Р-О—1
6
О
CHyO-C-R-i
О | z 1
r2-c-o~c-h
I ?
СН2 О-Р-О-Холин (этаноламин)
О
Фосфатидилхолин (фосфатидилэтаноламин)
ЦМФ
ОН ОН н нхн
н >----< он
он H
Фосфатидилинозитол
Рис. 19.6. Альтернтивный путь синтеза глицерофосфолипидов.
289
Глава 19 Синтез липидов, ожирение, атеросклероз
ние жидкости и препятствует слипанию стенок альвеол на выдохе. Недоношенные дети могут страдать от дистресс-синдрома, поскольку их незрелые легкие не могут обеспечить достаточный синтез дипальми-тоилфосфатидилхолина.
Сфинголипиды
Сфинголипиды находят в мембранах эукариотических клеток, но наибольшая их концентрация отмечается в клетках центральной нервной системы. Эти липиды построены на основе спирта сфингозина. Одноатомный спирт сфингозин образуется при конденсации пальмито-ил-КоА и серина с образованием дегидросфингозина, который затем превращается в сфингозин (рис. 19.7). Ферменты, катализирующие эти реакции в качестве простетической группы содержат пиридоксальфосфат.
Во всех сфинголипидах аминная группа сфингозина ацетилирована. Длинноцепочечные ацил-КоА взаимодействуют со сфингозином с образованием церамидов (N-ацилсфингозинов). Концевая гидроксильная группа замещена. В сфингомиелине компоненты миелина покрывают нервные волокна и заместителем является фосфорилхолин, который образуется из фосфатидилхо-лина. В цереброзидах заместителем является глюкоза или галактоза. УДФ-глю-коза или УДФ-галактоза являются донорами соответствующего сахара. В ганглиозидах олигосахаридная цепь связана с концевой гидроксильной группой церамида через глюкозный остаток.
В ганглиозидах, основных представителях сфинголипидов, олигосахаридные цепи, присоединяющиеся к церамиду, содержат хотя бы один кислый моносахарид: N-ацетилнейраминовую или N-гли-колилнейраминовую кислоты. Эти кислые
моносахариды получили общее название сиаловые кислоты. Их девятиуглеродный скелет образуется из фосфоенолпирувата (3 атома углерода) и N-ацетилманозами-на-6-фосфата (6 углеродных атомов).
Ганглиозиды синтезируются путем последовательного присоединения моносахаридов к церамиду. Синтез этого комплекса требует активных форм сахаров — УДФ-глюкозы, УДФ-галакто-зы и УДФ-N-галактозамина, а также ЦМФ производного N-ацетилнейрами-новой кислоты. ЦМФ-М-ацетилнейра-миновая кислота синтезируется из ЦМФ и N-ацетилнейраминовой кислоты. Структура полученного ганглиозида определяется активностью специфи-ческиз гликозилтрансфераз в клетках. К настоящему времени охарактеризовано более 60 различных ганглиозидов.
Структуры сфинголипидов и большинства глицерофосфолипидов близки. В функциональном отношении они отличаются. Если глицерофосфолипиды образуют фосфолипидный бислой мембран, то сфинголипиды чаще выполняют роль вторичных внутриклеточных посредников. Например, церамид, освобожденный из сфингофосфолипида, способен включать реакции программированной гибели (апоптоз) клеток некоторых типов.
Заболевание Тей-Сакса (Tay-Sachs) связано с нарушениями в деградации липидов, а именно, с нарушениями распада ганглиозидов. Ганглиозиды образуются в высокой концентрации в нервной системе, особенно в сером веществе, где они составляют до 6 % от липидов. Ган-глиозиды распадаются в норме в лизосомах путем последовательного отщепления сахаров, начиная с конечного остатка. При болезни Тей-Сакса этот процесс не идет. В нейронах накапливаются заполненные ганглиозидами лизосомы. Это прояв-
290
Синтез лиггилов, ожирение, атеросклероз Глава 19
^ис. 19.7. Биосинтез сфингозина
ляется в слабости и замедленном психомоторном развитии в течении первого года жизни. У таких детей развивается деменция к 2 годам и на 3-м году жизни они ушфают. Содержание ганглиозидов в мозге у детей с болезнью Тей-Сакса увеличено. Особенно повышается концентрация ганглиозида GM2 во много раз, поскольку его терминальный остаток
N-ацетилгалактозамин либо не удаляется, либо отщепляется крайне медленно. Причиной заболевания является дефект B-N-ацетилгексозаминидазы. Развитие заболевания Тей-Сакса у плода диагностиоуют при исследовании амниотической жидкости на наличие P-N-аиетилгек-созаминидазной активности.
291
Глава 19 Синтез липидов, ожирение, атеросклероз
В животных клетках синтез мембранных липидов осуществляется на поверхности гладкого эндоплазматического ретикулума. Синтезированные липиды транспортируются по назначению либо в виде мембранных пузырьков, которые отпочковываются от мембран аппарата Гольджи, либо с помощью специальных белков-переносчиков.
Метаболизм жировой ткани
Жировая ткань — депо жира. Липоци-ты метаболически активны. Они обладают способностью синтезировать жирные кислоты при поступлении пищи и освобождать их между приемами пищи.
Для синтеза жиров в жировой ткани важное значение имеет гликолиз. В жировых клетках нет глицеролкиназы, поэтому они должны получать глице-рол-3-фосфат, необходимый для синтеза фосфатидной кислоты, путем восстановления образующегося при гликолизе диоксиацетонфосфата. Помимо синтеза жиров из глюкозы крови, жировая ткань может использовать жирные кислоты, освобождающиеся из липопротеинов крови после действия липопротеинлипазы.
Жировая клетка не способна к образованию липопротеинов и, следовательно, не может экспортировать свои жиры в кровоток. Все образуемые в жировой ткани триацилглицеролы резервируются в виде жировой капли. Жировая ткань помимо внеклеточной липопротеинлипазы, содержит внутриклеточную липазную систему, действующую на депонирование триацилглицеролов (рис. 19.8).
Гэрмончуествителъная триацилглицер-лолипаза существует в неактивной b форме и активируется (фосфорилируется) цАМФ-зависимой протеинкиназой в активную липазу а. Гормоны — адреналин, глюкагон, тироксин — повышают активность аденилатциклазы и уве
личивают липолиз. Инсулин снижает концентрацию цАМФ и инактивирует аденилатциклазу. В результате действия триацилглицероллипазы триацилглицеролы расщепляются до диацилглицеро-лов. Диацилглицероллипаза и моноацил -глицероллипаза катализируют полный гидролиз триацилглицеролов до глицерола и жирных кислот. Их активность в несколько десятков раз выше, чем активность триацилглицероллипазы.
Судьба глицерола: глицерол в жировой ткани не может фосфорилироваться. Он транспортируется в печень, где активируется до глицерол-3-фосфата, который используется для синтеза триацилглицеролов и глицерофосфолипидов.
Судьба жирных кислот: жирные кислоты, образуемые при липолизе, высвобождаются в кровоток, транспортируются в комплексе с альбуминами и используются различными тканями для получения энергии.
Если в адипоцитах преобладают процессы липогенеза, развивается ожирение. Современная классификация ожирения основана на размерах и количестве адипоцитов. При повышении общего числа адипоцитов — гиперпластическое ожирение (развивается в младенческом возрасте при перекармливании). При увеличении размеров адипоцитов говорят о гипертрофическом ожирении (переедание в зрелом возрасте). Возможно сочетание гиперпластического и гипертрофического ожирения.
Жировые клетки продуцируют пептид лептин, который через гипоталамические пептиды регулирует выделение инсулина, энерготраты, чувство аппетита. Считают, что фактор некроза опухолей а запускает процессы, ведущие к ожирению, адипонектин препятствует включению механизмов ожирения.
292
Синтез липидов, ожирение, атеросклероз Глава 19
рис. 19.8. Мобилизация триацилглицеролов в жировой ткани (D. L. Nelson, М. М. Сох с изм.).
293
Глава 19 Синтез липидов, ожирение, атеросклероз
Метаболизм холестерола
Конрад Блох предположил, что ацетат вначале превращается в изопреновые единицы, которые после коцденсации и циклизации формируют молекулу холестерола. Холестерол образуется из основного метаболита общего пути катаболизма — ацетил-КоА. Поэтому его концентрация теоретически может отражать состояние метаболизма. Холестерол входит в состав мембран и служит для синтеза гормонов продления рода (половые стероиды) и приспособления организма (глюкокортикоиды).
Все реакции превращения холестерола бывают двух типов: I) реакции эстери-фикации и 2) реакции окисления. Реакции эстерификации повышают гифо-фобность молекулы и приводят к накоплению холестерола. В реакциях окисления (например, образование желчных кислот) полярность молекул увеличивается и холестерол удаляется из организма.
Основное место синтеза холестерола — печень, в остальные органы и ткани он поступает в составе ЛПНП. На поверхности периферических и печеночных клеток есть специальные рецепторы к основному аполипопротеину ЛПНП - апоВ.
Поступление холестерола в клетку включает следующие этапы (рис. 19.9): 1) связывание ЛПНП с рецептором; 2) эндоцитоз комплекса ЛПНП-рецептор в клетку;
3) расщепление лизосомальными ферментами апоВ до аминокислот, эфиров холестерола до холестерола и жирной кислоты;
4) возвращение молекулы рецептора на поверхность клетки.
Поступивший холестерол клетка использует для построения мембран. Избыток холестерола приводит к 3-м последствиям.
1. Ингибируется фермент синтеза холестерола — ГМГ-редукгпаза.
2. Активируется внутриклеточный фермент ацил-КоЛ~холестерол-ацил~транс-фераза (АХАТ), который катализирует реакцию: холестерол 4- ацил-КоА -* ацил-холестерол + HS-KoA. Этот фермент переводит холестерол в полностью гидрофобную запасную форму — эфиры холестерола, содержащие чаще насыщенную жирную кислоту.
3. Подавляется синтез рецепторов для ЛПНП.
Такой рецепторно-опосредованный путь поступления холестерола в клетку предохраняет ее от перегрузки холесте-ролом.
Другие пути поступления холестерола в клетку: 1) неспецифический эвдо-цитоз; 2) рецепторный путь с помощью рецепторов, не имеющих высокой специфичности к отдельным аполипопротеинам; 3) путь физиологического обмена холестеролом между мембраной клетки и ЛПНП. Эти пути транспорта холестерола в клетку не регулируются, что может привести к накоплению холестерола в клетке.
Холестерол из клеток периферических тканей удаляется с помощью ЛПВП. Они синтезируются в печени в виде дисков, богатых лецитином и аполипопротеинами AI и АП (насцен-тные ЛПВП). Кроме того, подобные частицы образуются в капиллярах во время липолиза ХМ и ЛПОНП. Перенос холестерола из клеток на дисковидные частицы ЛПВП происходит по градиенту концентрации. При контакте ЛПВП с клеткой апоА~1 связывает свободный холестерол мембраны клетки. Фермент лецитин-хоаестерш-ацил-трансфераза (ЛХАТ), находящийся на поверхности ЛПВП, присоединяет остаток жирной кислоты из лецитина к холестеролу: лецитин + холестерол лизолецитин + эфир холестерола (в
294
Синтез липидов, ожирение, атеросклероз Глава 19
=хс. 19.9. Поступление холестерола рецепторно-опосредованным путем (D. L. Nelson, М. М. 7 сх с изм.).
лире чаще ненасыщенная жирная слота). Образуется гидрофобная ? л скула эфира холестерола, которая гремещается в центр диска насцент-
„х ЛПВП.
В результате эстерификации частица ’ ПВП из диска превращается в сфери-z скую молекулу и в таком виде захва-лвается рецепторно-опосредованным оцитозом печенью. В печени и в ‘.2нях, где происходит стероидогенез, ПВП могут захватываться с помощью :.;епторных белков, которые называ
ются SB-BI. Эти рецепторы частично и селективно транспортируют холестерол и другие липиды ЛПВП в ткани. Разгруженные ЛПВП затем поступают в циркуляцию и забирают большее количество липидов из ремнантов хиломикронов и ЛПОНП.
В печени «отработанный» холестерол, поступивший в составе ЛПВП. используется для биосинтеза желчных кислот и в конечном итоге выводится из организма.
295
Глава 19 Синтез липидов, ожирение, атеросклероз
Итак: прямой транспорт холестерола из печени в периферические клетки осуществляется ЛПНП. Обратный транспорт холестерола из периферических клеток в печень осуществляется ЛПВП. Существует несколько путей обратного транспорта холестерола.
В крови человека найден белок, переносящий эфиры холестерола между липопротеинами. Этот белок ассоциирован с ЛПВП и переносит эфиры холестерола к ЛПОНП, ЛПНП и редко ХМ, а также позволяет перенос триацилглицеролов в обратном направлении.
Атеросклероз
Высокое содержание холестерола в плазме крови сопряжено с формированием атеросклеротических бляшек в артериальных сосудах и смертью от клинических осложнений атеросклероза. Этот процесс связан с повышением уровня ЛПНП («плохой» холестерол). Этому процессу препятствуют ЛПВП («хороший» холестерол). Функция ЛПВП заключается в выведении холестерола из орга-низма. ЛПВП связывают эфиры холестерола, освобождаемые в периферических тканях и затем транспортируют их в печень или ткани, синтезирующие стероидные гормоны. Специфический рецептор обеспечивает поступление ЛПВП в эти ткани. Механизмы антиатеро-генного действия ЛПВП недостаточно ясны.
Метаболизм холестерола в связи с опасностью развития атеросклероза должен очень четко регулироваться. Холестерол пищи уменьшает активность ключевого фермента синтеза холестерола — ГМГ-редуктазы. Результаты исследований Михаела Брауна и Йозефа Гольдштейна показали особенности метаболизма холестерола в непеченочных клетках. Непеченочные клетки получают холестерол из плазмы крови предпочтительнее, чем синтезируют
его de novo. Непеченочные клетки получают холестерол путем рецептор-опосредованного эцдоцитоза. Специфичность и выраженность этого пути определяется ЛПНП. Это типичный пример поступления ряда молекул в клетку. Выделяют несколько этапов рецепторноопосредованного эндоцитоза ЛПНП:
1) апоВ-100 на поверхности ЛПНП связывается со специфическим рецептором на поверхности непеченочной клетки, который локализован в «покрытой ямке» плазматической мембраны, выстланной специальным белком клатрином;
2) комплекс ЛПНП-репептор погружается в цитозоль клетки в виде везикулы, покрытой отшнурованной частью плазматической мембраны и клатрином (рис. 19.10);
3) везикулы, содержащие липопротеины, сливаются с лизосомами, кислые гидролазы которых расщепляют белки до аминокислот, эфиры холестерола до холестерола и жирных кислот, а освободившийся рецептор возвращается на поверхность клетки (этот кругооборот рецептора занимает 10 мин);
4) освободившийся принесенный свободный холестерол может использоваться при построении мембран; в реакции, катализируемой ацил-КоА-холестерол-ацилтрансферазой (АХАТ) холестерол может превратиться в эфиры, которые содержат остатки пальмитоолеи-новой и олеиновой кислот и формируют внутриклеточные капли липидов; в стероидпродуцирующих клетках холестерол используется для синтеза соответствующих стероидов;
5) высокая концентрация холестерола внутри клетки подавляет синтез рецептора ЛПНП и поступление новых молекул ЛПНП в клетку заблокировано. Ген ЛПНП-рецептора, подобно гену ГМГ-редуктазы, регулируется SREBP, который связывается с регуляторным элементом ДНК и контролирует синтез соответствующей мРНК.
Молекула рецептора ЛПНП человека имеет молекулярную массу 115 кДа и состоит из нескольких доменов.
1. На N-конце молекулы располагается цистеиновый домен (40 остатков цистеина) для связывания ЛПНП. Набор радикалов отрицательнозаряженных аминокислот этого домена связывает Са2+, а за счет цистеиновых остатков формируются дисульфидны связи, что вместе поддерживает третичную структуру до-
296
Синтез липидов, ожирение, атеросклероз Глава 19
Рис. 19.10. Эндоцитоз ЛПНП. А — электронномикроскопическая картина связывания ЛПНП меченых ферритином, темные точки) в покрытых клатрином ямках мембраны культивируемых фибробластов. В — электронномикроскопическая картина эндоцитозной везикулы, пере--осящей в цитозоль меченые ЛПНП (по R. G. W. Anderson, и соавт., 1977).
мена. Протонирование остатков глутамата и аспартата этого домена внутри лизосом обеспечивает освобождение ионов кальция и части-ды ЛПНП.
2. Во второй области рецептора содержится домен, гомологичный эпидермальному фактору роста (пропеллероподобная структура, поддерживаемая водородными связями радикалов аспарагиновой кислоты). В кислой среде лизолом эти водородные связи разрушаются.
3. В третьей области выделяют богатый серином и треонином домен, связанный с олигосахаридом. Этот домен определяет наиболее выгодную локализацию рецептора в мембране для связывания ЛПНП.
4. В четвертой области рецептора содержатся 22 остатка гидрофобных аминокислот для связывания с гидрофобной областью мембраны летки.
5. Цитоплазматическая часть рецептора содержит 50 остатков аминокислот, принимающих частие во взаимодействии рецептора с покрытой клатрином ямкой и процессе эвдоцитоза. Ген рецептора ЛПНП состоит из 18 экзонов, которые определяют мозаичную структуру рецептора.
Физиологическая роль рецептора ЛПНП была доказана на примере семейной гиперхолестеролемии. Концен
трация общего холестерола в плазме крови существенно возрастает у больных с генетическим дефектом — мутацией в простом аутосомном локусе. При нормальной концентрации < 5 ммоль/л у гомозигот уровень холестеролемии превышает эту норму в 2 и более раз. при гетерозиготной форме патологии — в 1,5 раза. У этих пациентов холестерол скапливается в ксантомах, локализованных в коже и на сухожилиях. Показано, что при повышении концентрации ЛПНП формируются малые плотные молекулы окисленных ЛПНП (ок-ЛПНП). Эти частицы захватываются макрофагами нерегулируемым эндоцитозом. что приводит к образованию пенистых клеток, нашпигованных эфирами холестерола. Такие клетки накапливаются в ранней стадии формирования атеросклеротических бляшек в артериях. Многие гомозиготы погибают от поражения коронарных сосудов в молодом возрасте. Это заболевание у гетерозигот встречается относительно часто (I на 500 людей) и имеет полиморфную клиническую кар-
297
Глава 19 Синтез липидов, ожирение, атеросклероз
тину. Сывороточная эстераза, способная разрушать окисленные липиды, ассоциирована с ЛПВП. Поэтому усилия исследователей сосредоточены на создании лекарственных препаратов, повышающих ЛПВП-зависимый потенциал крови. В большинстве случаев молекулярный дефект при развитии семейной гиперхолестеролемии связан с дефектом ЛПНП-рецелторов. У гомозигот полностью отсутствуют ЛПНП-рецепторы, а у гетерозигот отсутствует половина ЛПНП-рецепторов. Итак, при поражении ЛПНП-рецепторов в крови накапливаются ЛПНП и ЛППП. ЛППП сохраняются большее время в кровеносном русле, поскольку их захват клетками также опосредуется ЛПНП-рецепторами.
В 1977 г. А. Н. Климов предложил рассчитывать холестероловый коэффициент атерогенности, представляющий собой отношение суммы холестерола ЛПНП и ЛПОНП к холестеролу ЛПВП. Удобным оказалось рассчитывать этот коэффициент на основании определения всего лишь двух показателей — общего холестерола — ОХС и холестерола ЛПВП — ХС ЛПВП: (ОХС-ХС
ЛПВП)/ХС ЛПВП). Величина этого отношения у здоровых лиц 3—3,5; у больных ишемической болезнью сердца величина этого коэффициента достигает 5—6 и более единиц.
Гомозиготная семейная гиперхолесте-ролемия лечится путем трансплантации печени. При гетерозиготных формах и иных типах гиперхолестеролемии используют консервативные подходы:
1. Поскольку холестерол превращается в печени в желчные кислоты, которые выделяются в кишечник, но могут вновь всосаться (кишечно-печеночная рециркуляция желчных кислот), используют смолы (например, гуарем), которые связывают желчные кислоты и препятствуют их повторному всасыванию.
2. С возрастом ГМГ-редуктаза постепенно ускользает от ингибирующего влияния вновь синтезированного холестерола, поэтому используют специальные ингибиторы фермента — статины (ловастатин, симвастатин и др.). Это пожизненная терапия, т. к. при прекращении лечения уровень холестерола крови вновь повышается за две недели до исходного.
3. Мероприятия, позволяющие контролировать концентрацию и использование ацетил-КоА, необходимого для синтеза холестерола (диеты, полиненасыщенные жирные кислоты, физическая активность).
4. Использование регуляторов транспорта холестерола в крови и клетках (регуляторы активности ЛХАТ и АХАТ, переносящего эфиры холестерола белка, индукторы синтеза ЛПНП-рецептора). По мнению отечественных ученых В. 3. Ланкина, А. К. Тихадзе, В. В. Кухар-чука и Ю. Н. Беленкова (2002) статины подавляют не только биосинтез холестерола, но и убихинона (кофермента Q10), поскольку пути биосинтеза этих веществ расходятся на стадии фарнезил-
298
Синтез липидов, ожирение, атеросклероз Глава 19
пирофосфата. Поэтому разработаны ингибиторы скваленсинтазы, которые ингибируют биосинтез только холестс зола. Синтез убихинона сохраняется, что важно д ля патологии сердца атеросклеротической природы: 1) будучи компонентом ЦПЭ, убихинон обеспечивает достаточный уровень тканевого дыхания и продукции АТФ в клетках сердечной мышцы; 2) убихинон является эндогенным антиоксидантом, препятствующим процессам пероксидного зкисления липидов в поверхностном слое ЛПНП, что уменьшает их атероген-чость.
Примерно 3/4 заболеваний человека связано с нарушениями транспорта липидов в кровеносном русле. Поэтому едя лечащего врача, кроме обычных референтных значений показателей, необходимы данные о зависимости данного показателя от возраста, пола и индекса массы тела. Для жителей северо-восточного региона Республики Беларусь, в наименьшей степени постра
давших от аварии на ЧАЭС, такие данные были получены при анализе результатов лабораторного обследования более 20000 человек.
На рисунке 19.10 приведены данные об изменениях содержания общего холестерола (общий ХС) сыворотки крови в зависимости от возраста и пола.
Видно, что содержание холестерола в сыворотке крови у мужчин изменяются по близкой к гиперболе зависимости, а у женщин — S-образной зависимости. Такие изменения формируют два возрастных интервала с достоверными отличиями в содержании общего ХС в сыворотке крови мужчин и женщин: в интервале 20-50 лет уровень общего ХС выше у мужчин, а старше 50 лет — у женщин. Таким образом, на фоне возрастного накопления холестерола в кровеносном русле, имеются половые различия, что, вероятно, и определяет возможность мужчин заболеть холестерол-зависимыми заболеваниями на 20 лет раньше, чем женщины.
Рис. 19.10. Зависимость изменений общего холестерола (ммопь/л) от возраста и пола.
299
Глава 20
Обмен белков
Белки являются наиболее распространенными органическими веществами организма, которые составляют большую часть сухой массы тела (10—12 кг). Метаболизм белков рассматривается как метаболизм аминокислот.
Переваривание белков
Перевариванию и всасыванию подвергаются пищевые и эндогенные белки. Эндогенные белки (30—100 г/сутки) представлены пищеварительными ферментами и белками слущивающегося эпителия кишечника. Переваривание и всасывание белков происходит очень эффективно и поэтому только около 5—10 г белков теряется с кишечным содержимым. Пищевые белки подвергаются денатурации, что облегчает их переваривание.
Ферменты переваривания белков (гидролазы) специфически расщепляют пептидные связи в белках и поэтому называются пептидазами. Они делятся на 2 группы: 1) эндопептидазы — расщепляют внутренние пептидные связи и образуются фрагменты белков (пепсин, трипсин); 2) экзопептидазы действуют на
пептидную связь концевых аминокислот. Экзопептидазы подразделяются на карбоксипептидазы (отщепляют С-концевые аминокислоты) и аминопептидазы (отщепляют N-концевые аминокислоты).
Протеолитические ферменты переваривания белков продуцируются в желудке, поджелудочной железе и тонком кишечнике.
В ротовой полости белки не перевариваются из-за отсутствия ферментов в слюне.
Желудок. Переваривание белков начинается в желудке. При поступлении белков в слизистой оболочке желудка вырабатывается гормоноподобное вещество гастрин, которое активирует секрецию НС1 париетальными клетками желудка и пепсиногена — главными клетками желудка (рис. 20.1).
Соляная кислота (pH желудочного сока 1,0—2,5) выполняет 2 наиболее важные функции: вызывает денатурацию белков и гибель микроорганизмов. У взрослого человека ферментами желудочного сока являются пепсин и гас-триксин, у грудных детей реннин.
1. Пепсин вырабатывается в главных клетках слизистой оболочки желудка в
300
Обмен белков Глава 20
Проток поджелудочной железы
Поджелудочная железа
Желудок
7
Ворсинки
Тонкий кишечник
Слизистая кишечника (всасывание аминокислот)
Гранулы ферментов
Главные клетки (секретируют пепсиноген)
Собирательный проток
Париетальные клетки секретируют HCI)
Низкое
pH
пепсин
Пепсиноген
Слизистая желудка (секретирует гастрин)
Шероховатый ЭПР
Рис. 20.1. Переваривание белков.
неактивной форме в виде пепсиногена (м. м. 40000 Да). Пепсиноген превращается з активный пепсин в присутствии НС1 и аутокаталитически под действием других молекул пепсина: с N-конца молекулы отщепляется 42 аминокислотных остатка в виде 5 нейтральных пептидов (м. м. около 1000 Да) и одного щелочного пептида (м. м. 3200 Да). М. м. пепсина 32700 Да, оптимум pH 1,0~~2,0. Пепсин катализирует гидролиз пептидных связей,
образованных аминогруппами ароматических аминокислот (фен, тир), а также аспарагиновой, глутаминовой кислот, лейцина и пар ала-ала, ала-сер.
2. Из пепсиногена образуется другой пепсиноподобный фермент — гастрик-син (м. м. 31500 Да), оптимум pH 3.0— 5,0. В нормальном желудочном соке соотношение пепсин/гастриксин 4:1.
3. Реннин содержится в желудочном соке грудных детей; оптимум pH 4,5.
301
Глава 20 Обмен белков
Фермент створаживает молоко, т. е. в присутствии ионов кальция переводит растворимый казеиноген в нерастворимый казеин. Его продвижение по пищеварительному тракту замедляется, что увеличивает время действия протеиназ.
В результате действия ферментов в желудке образуются пептиды и небольшое количество свободных аминокислот, которые стимулируют высвобождение холецистокинина в двенадцатиперстной кишке.
Двенадцатиперстная кишка. Содержимое желудка поступает в 12-перст-ную кишку и стимулирует секрецию секретина в кровь. Секретин активирует секрецию в поджелудочной железе бикарбонатов, которые нейтрализуют соляную кислоту и повышают pH до 7,0. Под действием образованных свободных аминокислот в верхнем отделе 12-перстной кишки вырабатывается холецистокинин, который стимулирует секрецию ферментов поджелудочной железы и сокращение желчного пузыря.
Переваривание белков осуществляет группа сериновых (в активном центре ОН-группа серина) протеиназ панкреатического происхождения: трипсин, химотрипсин, карбоксипептидаза, эластаза.
1. Ферменты вырабатываются в виде неактивных предшественников — проферментов. Синтез протеолитических ферментов в виде неактивных предшественников защищает экзокринные клетки поджелудочной железы от разрушения. В поджелудочной железе синтезируется также панкреатический ингибитор трипсина, который предотвращает синтез активных ферментов внутри поджелудочной железы.
2. Ключевым ферментом для активации проферментов является энтеропептидаза (энтерокиназа), секретируемая клетками слизистой кишечника.
3. Энтерокиназа отщепляет гексапептид от N-конца трипсиногена и образуется активный трипсин, который затем активирует остальные протеиназы.
4. Трипсин катализирует гидролиз пептидных связей, в образовании которых участвуют карбоксильные группы основных аминокислот (лизин, аргинин).
5. Химотрипсин — эндопептидаза, вырабатывается в поджелудочной железе в виде химотрипсиногена. В тонком кишечнике при участии трипсина образуются активные формы химотрипсина — а, 5 и я. Химотрипсин катализирует гидролиз пептидных связей, образованных карбоксильными группами ароматических аминокислот.
6. Специализированные белки соединительной ткани — эластин и коллаген — перевариваются с помощью панкреатических эндопептидаз — эластазы и коллагеназы.
7. Панкреатические карбоксипептидазы (А и В) являются металлоферментами, содержащими ионы Zn2+. Обладают субстратной специфичностью и отщепляют С-кон-цевые аминокислоты. В результате переваривания в 12-перстной кишке образуются небольшие пептиды (2—8 аминокислот) и свободные аминокислоты.
В тонком кишечнике происходит конечное переваривание коротких пептидов и всасывание аминокислот. Здесь действуют аминопептидазы кишечного происхождения, отщепляющие N-koh-цевые аминокислоты, а также три- и дипептидазы.
Острый панкреатит является заболеванием, вызванным обструкцией путей секретов поджелудочной железы в кишечник. Проферменты превращаются в активные формы внутри поджелудочной железы, что вызывает ее повреждение, сопровождающееся сильными болями.
302
Обмен белков Глава 20
Гниение белков в кишечнике
При избыточном потреблении животных телков в нижних отделах тонкого ки-лечника возможно развитие гнилост--ых и бродильных процессов. При дей-. твии микрофлоры кишечника происходят превращения аминокислот, т заучившие название гниения белков в ^шечнике. Так, в процессе распада сс-г. содержащих аминокислот (цистина, _астеина и метионина) в кишечнике бразуется сероводород H2S и меркаптан ZH.SH. Диаминокислоты, в частности рнитин и лизин, подвергаются процес-
-У декарбоксилирования с образование . м диаминов, иногда называемых труп-- ыми ядами, поскольку они образуются ^кже при гнилостном разложении тру-?в. Из орнитина образуется путресцин,
; из лизина — кадаверин. Из фенила-^нина, тирозина и триптофана при ' зктериальном декарбоксилировании бразуется соответствующие биогенные 1пины — фенилэтиламин, п-гидрокси-генилэтиламин (или тирамин) и индо-ля этиламин (триптамин); при посте-енном разрушении боковых цепей -иклических аминокислот, в частности розина и триптофана, образуются -яовитые продукты обмена: соответ-.твенно крезол и фенол, скатол и ин--1зл. Индол и скатол обезвреживаются t печени, предварительно окисляясь . ^ответственно в индоксил и скатоксил, вводятся из организма в виде парных :: единений, вступая в реакцию конъ-сгации с 3-фосфоаденозин-5-фосфо-. льфатом или уридиндифосфатглюку-~тновой кислотой.
Всасывание аминокислот
Е тонком кишечнике всасываются сво-дные аминокислоты, дипептиды и -’большое количество трипептидов, би- и трипептиды после всасывания
гидролизуются на свободные аминокислоты в цитозоле эпителиальных клеток. После приема белковой пищи только свободные аминокислоты обнаруживаются в портальной вене. Максимальная концентрация аминокислот в крови достигается через 30~50мин после приема пищи.
Свободные L-аминокислоты переносятся через клеточные мембраны вторичным активным транспортом, сопряженным с функционированием Na+, К+-АТФазы. Перенос аминокислот внутрь клеток осуществляется чаще всего как симпорт аминокислот и ионов натрия. Считают, что существует, по меньшей мере, шесть транспортных систем (транслоказ), каждая из которых настроена на перенос близких по строению аминокислот: 1) нейтральных аминокислот с небольшим радикалом (ала, сер, три); 2) нейтральных аминокислот с объемным радикалом и ароматических аминокислот (вал, лей, иле, мет, фен, тир); 3) кислых аминокислот (асп, глу), 4) основных аминокислот (лиз, арг), 5) пролина, 6) р-ами-нокислот (таурин, р-аланин). Эти системы, связывая ионы натрия, индуцируют переход белка-переносчика в состояние с сильно увеличенным сродством к аминокислоте; Na+ стремится к транспорту в клетку по градиенту концентрации и одновременно переносит внутрь клетки молекулы аминокислоты. Чем выше градиент Na+, тем выше скорость всасывания аминокислот, которые конкурируют друг с другом за соответствующие участки связывания в транслоказе.
Известны другие механизмы активного транспорта аминокислот через плазматическую мембрану. А. Майстером предложена схема трансмембранного переноса аминокислот через плазматические мембраны, получившая название у-глутаминильный цикл.
303
Глава 20 Обмен белков
В соответствии с гипотезой у-глутамильного цикла транспорта аминокислот через клеточные мембраны, роль переносчика аминокислот принадлежит широко распространенному в биологических системах трипептиду глутатиону.
1. Главную роль в этом процессе играет фермент у-глутаминилтрансфераза (транспептидаза), который локализован в плазматической мембране. Этот фермент осуществляет перенос у-глута-мильной группы внутриклеточного трипептида глутатиона (у-глу-цис-гли) на внеклеточную аминокислоту.
2. Образовавшийся комплекс у-глута-мил-аминокислота проникает в цитозоль клетки, где аминокислота освобождается.
3. у-Глутамильная группа в виде 5-оксопролина через ряд ферментативных стадий и участии АТФ соединяется с цис-гли, что ведет к восстановлению молекулы глутатиона. При переносе следующей молекулы аминокислоты через мембрану цикл превращений повторяется. Для транспорта одной аминокислоты используется 3 молекулы АТФ.
Все ферменты у-глутамильного цикла обнаружены в высоких концентрациях в разных тканях — почках, эпителии ворсинок тонкого кишечника, слюнных железах, желчном протоке и др. После всасывания в кишечнике аминокислоты через воротную вену поступают в печень, а затем разносятся кровью во все ткани организма.
Всасывание интактных белков и пептидов
В течение короткого периода после рождения в кишечнике могут всасываться интактные пептиды и белки путем эндо-цитоза или пиноцитоза. Этот механизм важен для переноса иммуноглобулинов матери в организм ребенка. У взрослых
всасывание интактных белков и пептидов не происходит. Тем не менее, у некоторых людей наблюдается этот процесс, что вызывает образование антител и развитие пищевой аллергии. В последние годы высказывается мнение о возможности переноса фрагментов полимерных молекул в лимфатические сосуды в области пейеровых бляшек слизистой дистальных отделов тонкого кишечника.
Аминокислотный фонд организма
В организме взрослого человека присутствует около 100 г свободных аминокислот, которые составляют аминокислотный фонд (пул). Глутамат и глутамин составляют 50 % аминокислот, эссенциальные (незаменимые) аминокислоты — около 10 %. Концентрация внутриклеточных аминокислот всегда выше, чем внеклеточных. Аминокислотный фонд определяется поступлением аминокислот и метаболическими путями их утилизации.
Источники аминокислот
Обмен белков организма, поступление белков с пищей и синтез заменимых аминокислот являются источниками аминокислот в организме.
1. Белки находятся в динамическом состоянии, т. е. обмениваются. В организме человека ежесуточно обменивается примерно 300—400 г белков. Период полураспада белков различен — от минут (белки плазмы крови) до многих суток (чаще 5—15 суток) и даже месяцев и лет (например, коллаген). Аномальные, дефектные и поврежденные белки разрушаются, поскольку не могут использоваться организмом и ингибируют процессы, для которых необходимы функциональные белки. К факторам, влияющим на скорость раз
304
Обмен белков Глава 20
рушения белков относятся: а) денатурация (т. е. потеря нативной конформации) ускоряет протеолиз; б) активация лизосомальных ферментов; в) глюкокортикоиды, избыток тироидных гормонов повышают протеолиз; г) инсулин снижает протеолиз и повышает синтез белков.
2. Пищевые белки. Около 25 % обменивающихся белков, т. е. 100 г аминокислот подвергается распаду, и эти потери восполняются пищей. Поскольку аминокислоты являются главным источником азота для азотсодержащих соединений, эни определяют состояние азотистого баланса организма. Азотистый баланс — зто разность между азотом поступающим в организм и азотом, выводимым из организма. Азотистое равновесие лаблюдается, если количество азота, поступающего в организм равно количеству азота, выводимого из организма > взрослых здоровых людей). Положительный азотистый баланс наблюдается, если количество азота, поступающего = организм больше количества азота, выводимого из организма (рост, введе--ие анаболических препаратов, развитие тлода). Отрицательный азотистый ба-лнс наблюдается, если количество азо--д. поступающего в организм меньше > лличества азота, выводимого из орга--лз.ма (старение, белковое голодание, шокинезия, хронические заболевания, : коги). Коэффициент изнашивания Руб-ера — при 8—10 дневном белковом
ода нии в тканях расщепляется при-еэно постоянное количество белков — 1 -. 2 г, или 53 мг азота в сутки на 1 кг - зссы тела (0,053 х 6,25 х 70 = 23,2, где 25 — коэффициент, показывающий, тз в белках содержится около 16 %
?та: 70 кг — масса тела человека), i .ли в пище будет содержаться 23,2 г с'.ков в сутки, то развивается отрица-ч.’ьный азотистый баланс. Физиологи-;.кий минимум белков (около 30—45 г
2124
в сутки) ведет к азотистому равновесию (но на короткое время). При средней физической нагрузке человеку требуется в сутки 100—120 г белка.
Резервные белки. В отличии от углеводов и липидов, белки не накапливаются в организме. Избыток аминокислот метаболизируется — окисляется для получения энергии, превращается в глюкозу или жиры. Резервные белки — это не депо, а легко мобилизуемые при необходимости белки плазмы крови, мышц, соединительной ткани.
Протеолиз тканевых белков животных
Осуществляется с помощью протеолитических (лизосомальных) ферментов — катепсинов. По строению активного центра выделяют цистеиновые (SH-группа цистеина), сериновые (ОН-группа серина), карбоксильные (СООН-группа асп или глу) и металлопротеиновые катепсины. Роль катепсинов: 1) создание биологически активных пептидов путем ограниченного протеолиза белковых предшественников; 2) разрушение «состарившихся» и аномальных белков; 3) участие в фагоцитозе и делении клеток; 4) участие в автолизе (при ишемии или вне организма в стерильных условиях); 5) участие в патогенезе заболеваний, связанных с изменением функции лизосом. Действие катепсинов ограничивают их ингибиторы — экзогенные и эндогенные вещества преимущественно полипептидной природы.
В то же время следует учитывать, что функциональные белки клетки должны быть защищены от преждевременного протеолиза. Для этого внутриклеточные протеолитические ферменты представлены в двух видах: 1) иммобилизованные в лизосомах и функционирующие при pH 5,0; 2) связанные с протеасома-
305
Глава 20 Обмен белков
ми (молекулярная масса 2000 кДа).
Для мечения подлежащих уничтожению белков используется убиквитин — высококонсервативный белок у эукариот, состоящий из 76 остатков аминокислот, отличается у дрожжей и человека только по 3 остаткам. Остаток глицина на С-конце убиквитина ковалентно связывается с е-аминогруппой остатка лизина в предназначенном для разрушения белке (рис. 20.2). Для образования такой «изопептид-ной связи» (изопептидная, поскольку образована не с а-аминогруппой, а е-аминогруппой) требуется гидролиз АТФ.
Для присоединения убиквитина к белку требуются 3 фермента: убиквитин-активирующий фермент (Е1), убиквитин-конъюгирующий фермент (Е2) и убиквитин-протеин-лигаза (ЕЗ). Последовательность реакций: 1. С-концевая карбоксильная группа убиквитина связывается
Рис. 20.2. Убиквитин (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
с сульфгидрильной группой Е1 тиоэфирной связью. Эта АТФ-зависимая реакция напоминает активацию жирных кислот. 2. Активированный убиквитин переносится на сульфгидрильную группу Е2. 3. ЕЗ катализирует перенос убиквитина от Е2 на ^-аминогруппу остатка лизина белка, предназначенного для деградации. Присоединение одной молекулы убиквитина — это всего лишь слабый сигнал для деградации белка. Затем следует прогрессирующая убикви-низация путем образования связей между е-аминогруппой лизина-48 одной молекулы убиквитина с С-карбоксильной группой другой. Цепь из 4-х и более остатков убиквитина является достаточным сигналом для деградации меченого белка.
Как определить, будет ли белок подвергаться убиквинизации? Время полужизни цитозольных протеинов определяется длительностью существования N-концевых аминокислотных остатков (N-терминальное правило): 1) период полужизни более 20 часов, если на N-koh-це белка ала, про, цис, сер, гли, тре, мет, вал; 2) период полужизни от 2 до 30 минут, если на N-конце молекулы белка арг, лиз, гис, фен, иле, три, лей, тир (по J. W. Tobias et al., 1991). Вторая группа белков в большей степени подвергается убиквитинизации. Фермент ЕЗ определяет N-концевой аминокислотный остаток.
Другим сигналом для идентификации белков, подлежащих деградации, является специальная последовательность аминокислот в цик-лин-зависимых белках клеточного цикла (PEST-последовательность, включающая про, глу, сер и тре), подлежащих уничтожению в процессе деления клеток.
Некоторые патологические состояния связаны с нарушениями распада белков. Например, вирус папилломы человека (HPV) кодирует белок, который активирует фермент ЕЗ. Этот фермент обеспечивает убиквитинизацию белка-супрессора (ингибитора) опухолевого роста р53 и других белков репаративного синтеза ДНК, что и ведет к развитию опухоли. Активация ЕЗ найдена в 90 % случаев при раке шейки матки.
Рассмотрим как происходит разрушение «неправильного» белка (по Berg J, М., Tymoczko J. L., Stryer L., 2002). Если убиквитин являет
306
Обмен белков Глава 20
ся меткой гибели молекулы белка, то как белок разрушается? Функцию разрушения выполняет большой протеазный комплекс, называемый протеасомой (26S протеасома для разрушения меченого убиквитином белка). Протеасома состоит из двух компонентов: 20S протеасома, обладающая каталитической активностью, и 19S регуляторная субъединица. 20S комплекс построен из двух копий, каждая по 14 субъединиц и имеет молекулярную массу 700 кДа (рис. 20.3).
Все 14 субъединиц гомологичны и образуют 4 кольца по 7 субъединиц, формируя структуру бочонка. Компоненты двух колец на концах бочонка называют а-субъединицами, а компоненты двух центральных колец — р-субъединицы. Активные протеазные центры находятся в N-концевой области р-субъединиц внутри бочонка. N-концевыми аминокислотами этих p-цепей являются треонин и серин. Гидроксильные группы этих аминокислот при-
=ис. 20.3. Протеасома (по W. Baumeister, ??8, с изм.).
обретают нуклеофильные свойства с помощью своих собственных аминогрупп. В результате становится возможной нуклеофильная атака карбонильных групп пептидных связей с образованием ацил-ферментных промежуточных соединений. Эта активность проявляется при поступлении белковой молекулы в протеасо-му. Промежуточные продукты деградации не выделяются пока не сформируются пептиды, состоящие из 7—9 аминокислотных остатков. Поступление белков внутрь протеасомы контролируется 19S субъединицами. Эти субъединицы специфически связывают полиубиквитиновые цепи. Ключевым компонентом 19S комплекса являются 6 АТФаз. Считают, что эти ферменты участвуют в изменении конформации белковой молекулы для поступления ее внутрь протеасомы. Кроме того, в 19$-субъе-динице имеется изопептидаза, катализирующая отделение интактных молекул убиквитина. Образованные в протеасоме пептиды в дальнейшем расщепляются до аминокислот клеточными протеазами.
Деградация белков играет важную роль в iSP' процессах транскрипции генов, клеточного деления, формирования органов, реализации циркадных ритмов, воспаления, роста опухолей, метаболизма холестерола, процессинга антигенов. В качестве примера рассмотрим контроль воспалительного ответа Транскрипционный фактор, называемый NF-кВ, инициирует экспрессию ряда генов, кодирующих синтез белков воспалительного ответа. Он активируется при деградации ингибиторного протеина (/-кВ). NF-кВ находится в цитоплазме в неактивном состоянии благодаря ассоциации с /-кВ. При наличии воспалительного сигнала I-кВ фосфорилируется по двум остаткам серина, связываясь с ЕЗ. Это ведет к убик-витинизации и деградации I-кВ. В результате освобождается транскрипционный фактор NF-к В и запускается транскрипция генов белков воспалительного ответа.
Обязательным условием является мечение «неправильного» белка путем ковалентного связывания с небольшим белком убиквитином.
307
Глава 20 Обмен белков
Пути расходования аминокислот
Основные пути расходования аминокислот: 1) синтез пептидов и белков (основной путь); 2) синтез небелковых азотсодержащих соединений (пуринов, пиримидинов, НАД, фолиевой кислоты, КоА и др.), тканевых биорегуляторов (гистамин, серотонин), медиаторов (норадреналин, ацетилхолин); 3) синтез углеводов (глюконеогенез) с использованием углеродных скелетов аминокислот; 4) синтез липидов с использованием
ацетильных остатков углеродных скелетов аминокислот; 5) окисление до конечных продуктов с выделением энергии (рис. 20.4).
Аминокислоты в норме не резервируются (как глюкоза или жирные кислоты) и не выводятся с мочой. Редко аминокислоты используются для энергетических целей как топливные молекулы.
308
Обмен белков Глава 20
Типичные реакции обмена аминокислот
Аминокислоты, не использованные для биосинтетических процессов, подвергаются катаболизму, а из углеродных цепей аминокислот синтезируются вещества, способные резервировать энергию — глюкоза (гликоген) и липиды.
Основное количество аминокислот метаболизируется в печени. Аммиак, эбразующийся при метаболизме аминокислот, используется для биосинтетических процессов; избыток аммиака выделяется непосредственно или превращается в мочевину или мочевую кисло-ту в зависимости от организма. Избыток аммиака, образующийся в периферических тканях, транспортируется в печень, где превращается в форму, в виде которой он выводится из организма.
«-Аминокислоты являются бифункциональными соединениями, содержащими аминную и карбоксильную группы. Реакции по этим группам являются тощими для различных аминокислот: 1) о аминной группе — реакции трансаминирования и дезаминирования; 2) по ‘.лрбоксильной группе — реакции декарбоксилирования, образования амино-шиладенилатов; 3) реакции по радика-у являются специфичными для каждой -минокисл ОТЫ.
Для освобождения аммиака аминокислоты подвергаются реакциям ".рансаминирования с последующим де-аминированием. Аминогруппы амино
кислот утилизируются для синтеза мочевины, которая экскретируется как конечный продукт метаболизма белков. Углеродный скелет аминокислот сначала превращается в кетокислоты, которые используются для получения энергии, синтеза глюкозы, кетоновых тел и заменимых аминокислот.
Трансаминирование
Трансаминирование является первым этапом и основным путем метаболизма аминокислот. Трансаминирование (пе-реаминирование) — реакции межмолекулярного переноса аминогруппы от аминокислоты на а-кетокислоту без промежуточного образования аммиака. Этот процесс открыт в 1937 году Е. А. Браунштейном и М. Г. Крицман. По меньшей мере 11 аминокислот способны вступать в реакции трансаминирования (рис. 20,5).
1. Реакции трансаминирования являются универсальными у всех живых организмов. Трансаминирование катализируют ферменты аминотрансферазы (трансаминазы). Для каждой пары аминокислоты и кетокислоты существует свой фермент, Аспартатаминотрансфе-раза (АсАТ) и аланинаминотрансфераза (АлАТ) являются основными трансаминазами.
2. Коферментом трансаминаз является пиридоксальфосфат — производное витамина В6 (пиридоксол, пиридоксин). Пиридоксальфосфат функционирует
I1 Ro ^1 ^2 1 1 1
CH—NH3+ + С=о =5=5^ С=о + CH—NH3+ । ।
СОО' СОО- СОО- СОО-
гис. 20.5. Трансаминирование аминокислот.
309
Глава 20 Обмен белков
как переносчик аминогруппы в активном центре трансаминаз. Трансаминазы обеспечивают обратимые превращения альдегидной формы пиридоксальфосфата, которая является акцептором аминогруппы от аминокислоты, и аминированной формы пиридоксаминфосфата, являющейся донором аминогруппы для а-кетокислоты.
3. Ферменты содержатся в цитозоле и митохондриях клеток.
4. Реакции трансаминирования обратимы.
5. Основными кетокислотами, принимающими участие в трансаминировании, являются пируват, оксалоацетат и 2-оксоглутарат.
6. Трансаминирование происходит при катаболизме и анаболизме аминокислот и является пунктом «переключения» метаболических превращений. В процессе трансаминирования происходит перераспределение аминогрупп и синтез заменимых аминокислот.
7. Происходит накопление a-аминогрупп в форме одной аминокислоты — глутаминовой кислоты, которая затем подвергается дезаминированию.
1) a-АК + 2-оксоглутарат «—► а-ке-токислота + ГЛУТАМАТ
2) a-АК. + оксалоацетат * а-кетокислота + аспартат
аспартат + 2-оксоглутарат *-► оксалоацетат + ГЛУТАМАТ (АсАТ)
3) a-АК + пируват «—► а-кетокисло-та + аланин
аланин + 2-оксоглутарат *—* пируват + ГЛУТАМАТ (АлАТ)
8. Для лабораторной практики особое значение имеет определение активнос
ти АлАТ и АсАТ. Их активность в клетках превышает активность в сыворотке крови. Эти ферменты появляются в сыворотке крови при повреждениях тканей. При поражении сердца преимущественно повышается активность сывороточной АсАТ, а при повреждениях гепатоцитов — АлАТ.
Механизм трансаминирования включает образование Шиффовых оснований в результате обратимой реакции между карбонильной группой альдегида или кетона со свободной аминогруппой: 1. Аминогруппа аминокислоты переносится на пиридоксальфосфат, который превращается в пиридоксаминфосфат. 2. Пиридоксаминфосфат переносит аминогруппу на кетокислоту с образованием новой аминокислоты.
Дезаминирование аминокислот
Дезаминирование — процесс удаления аминогруппы из аминокислот и выделение ее в виде аммиака. Углеродный скелет аминокислоты превращается в кетокислоту. Трансаминирование и дезаминирование протекают в клетке одновременно и часто ключевой молекулой является глутамат.
В природе известны четыре основных типа дезаминирования: 1) восстановительное дезаминирование (рис. 20.6), 2) гидролитическое дезаминирование (рис. 20.7), 3) внутримолекулярное дезаминирование (рис. 20.8), 4) окислительное дезаминирование (рис. 20.9).
R-CH—COO- r—СН2—СОО’ +NH3
NH3+
Рис. 20.6. Восстановительное дезаминирование.
310
Обмен белков Глава 20
R—СН~СОО-I +2Н2О ► R-CH—СОО' । + NH3
NH3+ ОН
Рис. 20.7. Гидролитическое дезаминирование.
i R—СН2“СН“-СОО- R—CH—CH—COO’ + NH3
i NH3+
Рис. 20.8. Внутримолекулярное дезаминирование.
R—CH—COO' +1/2O2
NH3+ II 0
Рис. 20.9. Окислительное дезаминирование.
Первые три типа дезаминирования характерны для ряда микроорганизмов, иногда встречаются у растений. Для животных, растений и большинства аэробных микроорганизмов преобладающим типом реакции является окислительное дезаминирования аминокислот.
Окислительное дезаминирование аминокислот
Значение окислительного дезаминирования состоит в выделении аммиака, который используется в синтезе мочевины и образовании а-кетокислот для различных метаболических процессов: глюконеогенеза, синтеза жирных кислот, заменимых аминокислот и окисления до углекислоты и воды с образованием энергии.
1. У животных и человека процесс локализован в пероксисомах клеток, главным образом, печени и почек.
2. Реакции дезаминирования катализируются ферментами L- и D-оксида-зами.
3. L- и D-оксидазы являются флавопротеинами с простетическими группами ФМН м ФАД, соответственно.
4. Оксидазы L-аминокислот активны при pH 10 и при физиологических значениях pH (7,4) их активность в десять раз ниже (рис. 20.10). Поэтому прямого окислительного дезаминирования L-аминокислот в пероксисомах практически не происходит (за исключением L-лизина).
5. В тканях при физиологических значениях pH активны оксидазы D-аминокислот. Но в клетках млекопитающих нет D-аминокислот. Роль оксидаз D-аминокислот не понятна. Предполагают, что эти ферменты необходимы: 1) для обезвреживания D-аминокислот, случайно проникших во внутреннюю среду организма с микроорганизмами;
311
Глава 20 Обмен белков
СОО-I
сн2
сн2
Н-с—NH3‘
СОО'
сосен, СН2 C-NH СОО-
+Н2О
-Н2О
соо-сн2 сн2 с~о COO-
+ NH3
L-Глутамат
а-Иминоглутарат
2-Оксоглутарат
Рис. 20.11. Окислительное дезаминирование и восстановительное аминирование глутаминовой кислоты.
2) при развитии опухолей возможно появление D-аминокислот в тканях, а, следовательно, появление аномальных белков после включения D-аминокислот в первичную структуру синтезируемых белков.
Глутаматдегидрогеназа
В митохондриях клеток обнаружена высокоактивная оксидаза L-глутамино-вой кислоты. Она имеет специальное
наименование — глутаматдегидрогеназа (ГлДГ).
1. Коферментами этого фермента являются НАД+ и НАДФ+.
2. Реакция обратима и широко представлена в различных клетках (рис. 20.11).
3. Фермент ГлДГ играет ключевую роль во взаимосвязи метаболизма аминокислот и общего пути катаболизма. Это олигомерный фермент с мол. массой 312000 Да, состоящий из 6 субъединиц
312
Обмен белков Глава 20
по 52000 Да каждая. Фермент активен в виде мультимера.
4. Активаторы — АДФ, ГДФ\ ингибиторы — АТФ, ГТФ, НАДФ восстановленный, тироксин, эстрогены. В присутствии ингибиторов фермент подвергается химической модификации, т. е. диссоциирует на субъединицы и теряет основную активность (хотя может катализировать дезаминирование других аминокислот, например, аланина).
Мутации, которые изменяют аллостерический центр для связывания с ГТФ, приводят к перманентной активации глутаматдегидрогеназы, что вызывает генетическое заболевание, называемое гиперинсулине-мический-гипераммониемический синдром, характеризующийся повышением уровня аммиака в крови и гипогликемией.
Процесс синтеза L-глутамата из 2-оксоглутарата и аммиака называется восстановительным аминированием (кофермент чаще НАДФН).
Если аминогруппы большинства аминокислот переносятся на 2-оксоглутаро-вую кислоту перед удалением, то аминогруппы серина и треонина могут прямо превращаться в NH4+. Этот процесс прямого дезаминирования катализируется сериндегидратазой и треониндегидратазой с использованием пиридоксальфосфата в качестве простетической группы.
Серин**пируват + NH4*
Треонин-»2-оксоглутарат + NH4*
Непрямое дезаминирование аминокислот
Непрямое дезаминирование аминокислот открыто А. Е. Браунштейном и Т.
Эйлером (другое название процесса — трансдезаминирование). Процесс идет в два этапа: 1) в результате реакций трансаминирования аминные группы собираются в составе глутаминовой кислоты; 2) глутамат поступает в митохондрии, где подвергается прямому дезаминированию в глутаматдеги дроге-казной реакции. 2-Оксоглутарат, образующийся при дезаминировании глутаминовой кислоты, используется в ЦТК или для синтеза глюкозы.
Обратная последовательность реакций, при которой происходит синтез аминокислот из а-кетокислот (2-ок-соглутарата) и аммиака был назван трансреаминированием.
Декарбоксилирование аминокислот
Отщепление карбоксильной группы аминокислот в виде СО2 катализируется декарбоксилазами, кофактором которых является пиридоксальфосфат. Декарбоксилирование широко представлено в живой природе. Среди различных типов декарбоксилирования аминокислот для организма человека и животных наибольшее значение имеет а-декарбокси-лирование, т. е, отщепление карбоксильной группы при а-углеродном атоме. В результате декарбоксилирования образуются биогенные амины. Специфичность фермента зависит от апофермента.
Биогенные амины обладают разнообразной биологической и фармакологической активностью.
1. Не обладающая строгой субстратной специфичностью декарбоксилаза ароматических аминокислот катализирует декарбоксилирование L-изомеров триптофана, 5-гидрокситриптофана и 3,4-диоксифенилаланина (рис. 20.12). 5-Гид-рокситриптамин, или серотонин обладает сосудосуживающим действием, регулирует ряд центральных вегетативных
313
Глава 20 . Обмен белков
функций (температура тела, артериальное давление, дыхание), является медиатором ЦНС (часто тормозного типа), повышает неспецифическую резистентность организма. Накопление серотонина в центральной нервной системе обеспечивает зимнюю спячку ряда животных и определяет биохимический фон резистентности организма при беременности.
2. Синтез катехоламинов (дофамина, норадреналина и адреналина).
Дофамин является предшественником медиатора симпатической нервной системы норадреналина и гормона мозгового вещества надпочечников — адреналина, т. е. катехоламинов, обеспечивающих регуляцию функций сердечно-сосудистой системы, быструю реакцию метаболизма на действие стрессорных агентов (рис. 20.13).
При недостатке дофамина в центральной нервной системе (болезнь Паркинсона) нарушается координация движений. Повышенная продукция дофамина в мозге может быть связана с психическими заболеваниями (например, шизофренией).
3. Гистамин образуется из гистидина в коже, слизистых и некоторых других тканях под действием гистидиндекарбоксилазы (рис. 20.14).
Гистамин — единственный биогенный амин, который в физиологических концентрациях расширяет кровеносные сосуды, обладает провоспалительным действием, стимулирует секрецию НС1 в желудке, участвует в иммунологических реакциях, является медиатором боли. Антигистаминные препараты нарушают синтез гистамина или взаимодействие его с рецепторами. Например, циметидин является структурным аналогом гистамина и используется при лечении язв 12-перстной кишки, ингибируя секрецию НС1 в желудке.
4. Высокоспецифичная глутаматдекарбоксилаза катализирует образование у-аминомасляной кислоты (ГАМК) из глутаминовой кислоты в сером веществе коры головного мозга. ГАМК является медиатором, вызывающим торможение ЦНС (рис. 20.15).
5. Орнитиндекарбоксилаза катализирует декарбоксилирование орнитина с обра-
314
Обмен белков Глава 20
СОО- СОО'
сн2 * Гпутаматдекарбоксилаза Url2 Н—С NH3+ СОО’ со2 сн2 сн2 Н2С NH3+
_-Г лутамат у-Аминомасляная кислота
=ис. 20.15. Синтез ГАМК.
315
Глава 20 Обмен белков
зованием путресцина: орнитин -►1,4-тетраметилдиамин (путресцин) -* спермидин -► спермин. Полиамины (спермидин и спермин), а также путресцин участвуют в пролиферации клеток на уровне регуляции синтеза полимерных молекул (нуклеиновые кислоты, белки) (рис. 20.16).
Обезвреживание биогенных аминов необходимо, поскольку в высоких дозах большинство из них обладают токсическим действием. Поэтому в тканях имеются ферментативные системы их обезвреживания путем окислительного дезаминирования с образованием альдегидов и аммиака (рис 20.17).
Выделяют ФАД-содержащие аминооксидазы, или моноаминооксидазы — МАО и медьсодержащие аминооксидазы, или диаминооксидазы — ДАО. Дезаминирование тирамина, норадреналина, адреналина, алифатических моноаминов катализируют МАО; окисление гистамина и алифатических диаминов с короткой цепью углеродных атомов (путресцин, кадаверин) катализируют ДАО. Ингибиторы МАО (ипраниазид, гармин, паргилин) используют при лечении гипертонической болезни, депрессивных состояний.
NH3+
I (СН2)3
CH—NH3+ I СОО-
Орнитин
Орнитиндекарбоксиалаза
NH3+
(СН2)3 ch2-nh3+
Путресцин
Рис. 20.16. Синтез путресцина.
Аминоксидаза О
R-СН2—NH3+ * R-c-H +H2O2 + NH3 и2
Амин Альдегид
Рис. 20.17. Обезвреживание биогенных аминов.
316
Глава 21
Источники и пути обезвреживания аммиака в организме
В процессе эволюции сформировались тззличные типы азотистого обмена, спорые классифицируются по основному конечному продукту: 1) аммонио-е.шческий тип, главный конечный родукт — аммиак (рыбы); 2) рикотелический тип, главный конеч--ый продукт— мочевая кислота пептилии, птицы); 3) уреотелический /п, главный конечный продукт — эчевина (млекопитающие).
Подсчитано, что в состоянии азотис- его равновесия организм здорового = рослого человека потребляет и выдерет около 15 г азота в сутки. Из декретируемого с мочой количества . ога на долю мочевины приходится < %, креатинина 5 %, аммонийных .лей 3—6 %, мочевой кислоты 1 % и i-угие формы 3—6 %. В образовании чсвины и аммонийных солей главную --. ль играет аммиак.
Основные источники аммиака:
. поступление аммиака из кишечника портальную вену;
2 трансдезаминирование аминокислот; ’ дезаминирование биогенных аминов,
пуриновых и пиримидиновых оснований;
4) дезамидирование глутамина и аспарагина;
5) окислительное дезаминирование аминокислот.
Функции аммиака. Аммиак вовлекается (непосредственно или через глутамин) в синтез многих компонентов организма: заменимые аминокислоты, пурины, пиримидины, аминосахара и т. д.
Токсичность аммиака. Несмотря на постоянную продукцию NH3 в различных тканях, его концентрация в кровотоке низкая (100—200 мкг/л). Это связано с тем, что в организме существуют эффективные механизмы транспорта и обезвреживания аммиака.
Аммиак токсичен. Он всасывается из кишечника в портальную венозную кровь, где уровень его намного выше, чем в общем кровотоке. В норме печень быстро захватывает аммиак из портальной крови, и кровь, покидающая печень, практически свободна от аммиака.
Молекулярные механизмы токсичности не до конца понятны. Терминальные
317
Глава 21 , Источники и пути обезвреживания аммиака в организме
интоксикации аммиаком характеризуются коматозным состоянием. Поэтому основное внимание при объяснении токсичности аммиака сконцентрировано на головном мозге.
Одной из главных причин токсичности аммиака на молекулярном уровне является его способность восстановительно аминировать 2-оксоглутарат в глутамат и превращать глутамат в глутамин. Ферменты глутаматдегидрогеназа и глутаминсинтетаза, участвующие в этих реакциях, находятся в мозге в большой концентрации. В результате 2-ок-соглутарат отвлекается из цикла трикарбоновых кислот. Это может привести: 1) к замедлению регенерации оксалоацетата и, как следствие, к накоплению ацетил-КоА и через него к кетонемии и ацидозу; 2) к ослаблению потока протонов и электронов в митохондриальные дыхательные цепи и снижению продукции АТФ прежде всего для клеток головного мозга.
Снижение концентрации глутамата в результате глутаминсинтетазной реакции приводит к уменьшению концентрации у-аминомасля ной кислоты, которая является важным нейромедиатором.
Поэтому в организме есть системы обезвреживания аммиака, в результате функционирования которых в крови поддерживается низкая концентрация аммиака (около 0,01 ммоль/л, что в пятьсот раз меньше концентрации глюкозы). Условно выделяют местные (временное связывание) и общие (конечные) механизмы обезвреживания аммиака.
Местное обезвреживание аммиака
Осуществляется в тканях (мозг, сетчатка, мышцы, печень, почки и др.), продуцирующих аммиак, тремя путями: 1. Основной путь — это связывание аммиака с глутаминовой и реже аспарагиновой кислотами с образованием соответствующих амидов — глутамина и аспарагина (фермент глутаминсинтетаза). Глутамин является нетоксичсской транспортной формой аммиака и его концентрация в крови значительно выше концентрации других аминокислот (рис. 21.1).
2. Амидирование остатков глутаминовой и аспарагиновой кислот в составе белков.
318
Источники и пути обезвреживания аммиака в организме Глава 21
3. Восстановительное аминирование 2-эксоглутарата в глутамат. Глутамат в реакциях трансаминирования с пируватом образует аланин (особенно в чышцах).
Глутамин и аланин являются резервными и транспортными формами аммиака.
Общая схема местного обезвреживания аммиака представлена на рис. 21.2.
Следовые количества аммиака присутствуют в сыворотке крови в виде ионов аммония. Транспортные формы аммиака — глутамин и аланин — выполняют две основные функции. Глутамин является донором амидной группы для биосинтеза пуриновых азотистых оснований, карбамоилфосфата, птюкозамина, триптофана и др. соединений в тканях с выраженной пролиферативной активностью (кишечник, опухоли и др.), а также является основным источником амидной группы тля конечного обезвреживания аммиа-<а в почках в виде аммонийных солей. Бланин транспортирует аммиак в виде .минной группы в печень, где исполь-и.ется для синтеза мочевины, а остав
шийся углеродный скелет служит для образования глюкозы в реакциях глюконеогенеза.
Описан глюкозо-аланиновый цикл в системе мышцы-печень (в мышцах освобождается около 50 % от общего пула свободных аминокислот, а печень выделяет около 85 % от выводимого азота в виде мочевины).
На на рис. 21.3 представлены глюко-зо-лактатный и глюкозо-аланиновый циклы.
В глюкозо-аланиновом цикле глутамат, образующийся при трансаминировании, переносит аминогруппу на пируват (продукт гликолиза) с участием фермента АлАТ. Синтезированный аланин поступает в кровь и затем в печень. В цитозоле гепатоцитов АлАТ переносит аминогруппу от аланина на 2-оксоглутарат, образуя пируват и глутамат. Глутамат затем поступает в митохондрии, где под действием глутаматдегидрогеназы высвобождается аммиак, или подвергается трансаминированию с оксалацетатом с образованием аспартата (донор атома азота для синтеза мочевины).
NH3, НАДФН
2-оксоглутарат----------
Глутамат
Пируват
NH3, АТФ
Глутамин
АлАТ
Аланин (50% из мышц)
=ис. 21.2. Транспортные формы аммиака.
2-оксоглутарат
319
Глава 21 Источники и пути обезвреживания аммиака в организме
ПЕЧЕНЬ Г-6-Ф * Глюкоза н Глюконеогенез Пируват ► Пяктят КРОВЬ Глюкоза Цикл Кори МЫШЦА —*- Глюкоза *• Г -6-Ф Гликолиз |
А ГлДГ Глу —NH3 АлАТ Мочевина 2-ог Лактат —► Мочевина 1 Почки (моча) Лактат * Пируват х Глу Трансаминирование ( (АлАТ) . \ 2-ог V
Аланин
Рис. 21.3. Глюкозо-лактатный и глюкозо-аланиновый циклы (2-ог-2-оксоглутарат).
Общее обезвреживание аммиака
Общее (конечное) обезвреживание аммиака включает два процесса: образование аммонийных солей в почках и мочевины в печени.
Образование и выведение аммонийных солей
В тканях, преимущественно в почках, есть фермент глутаминаза, который катализирует освобождение аммиака из глутамина. Фермент активируется в присутствии протонов. Глутамин + Н2О * Глутамат + NH3.
Аммиак удаляется с мочой в виде ионов аммония'. NH3+H+-*NH4+; соединение с анионами щавелевой, фосфорной, мочевой и др. кислот ведет к образованию солей — оксалатов, фосфатов, уратов и т. п. В сутки с мочой выделяется около 1,2 г аммонийных солей. Это позволяет выводить из организма не только аммиак, но и протоны, образующиеся в метаболизме.
Поэтому выведение солей аммония является важным механизмом регуляции кислотно-основного равновесия, при котором нейтрализация неорганических и органических анионов катионами аммония сберегает важные для организма катионы калия, натрия, магния и др.
Биосинтез мочевины
Основным механизмом обезвреживания аммиака является синтез мочевины в печени. Из исследований школы И. П. Павлова следует, что мочевина синтезируется в печени, так как при выключении печени из кровотока (фистула Экка-Павлова) в крови растет фонд свободных аминокислот, аммиака и резко уменьшается содержание мочевины. М. В. Ненцкий и С. С. Салаз-кин доказали, что в печени происходит образование мочевины из аммиака и углекислоты. Г. Кребс и К. Гензелейт (1932) показали, что инкубация срезов печени с различными аминокислотами дает малый выход мочевины. Однако.
320
Источники и пути обезвреживания аммиака в организме Глава 21
если добавить одну из трех аминокислот — орнитин, цитруллин и аргинин — образование мочевины резко возрастает. При этом другие аминокислоты также становятся предшественниками мочевины. На основании этих данных Г. Кребс создал первый в биохимии метаболичес-кий цикл мочевинообразования. Г. Коен и С. Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоилфосфата.
Из мышц и других тканей аммиак доставляется в печень в виде аланина и глутамина. Из кишечника по воротной вене поступает всосавшийся аммиак. В митохондриях гепатоцитов в реакциях трансдезаминирования освобождается аммиак. Аммиак включается в метаболизм двумя путями.
1. В цитозоле гепатоцитов и других клеток имеется глутаминзависимая карбамоилфосфатсинтетаза II (КФ 6.3.5.5.): Ь-Глн-NH, + СО2 + АТФ + Н2О карбамоилфосфат + L-Глу + АДФ. Этот карбамоилфосфат используется при синтезе пиримидиновых азотистых основании.
2. В митохондриях гепатоцитов аммиак конденсируется с углекислотой, также образуя карбамоилфосфат; Ьермент — аммиакзависимая <арбамоилфосфатсинтетаза I (КФ 5.3.4.16.). При этом расходуются две молекулы АТФ, и требуется специфический активатор — N-ацетилглутамат: \Н3 + СО2 + 2 АТФ + Н2О -* карбамоилфосфат + 2 АДФ + Н3РО4. Это лервая реакция синтеза мочевины.
3. Карбамоилфосфат вступает в цикл мочевины и взаимодействует с орнитином фермент орнитинтранскарбамоилаза) с эбразованием цитруллина. Орнитин играет такую же роль, как оксалоацетат в ЦТК. Цитруллин транспортируется из ’•ипохондрий в цитозоль.
4. Енольная форма цитруллина при уча--тии аргининосукцинатсинтетазы
(третий фермент цикла) взаимодействует с аспарагиновой кислотой: процесс требует затраты одной молекулы АТФ. 5. Аргининосукцинатлиаза (четвертый фермент) катализирует распад аргининосукцината на аргинин и фумарат.
6. Аргиназа (пятый фермент) расщепляет аргинин на мочевину и орнитин. Аргиназа обнаружена только в печени, в то время как остальные ферменты присутствуют в других тканях. Поэтому аргинин может синтезироваться во многих тканях, но синтез мочевины происходит только в печени (рис. 21.4).
Регуляция синтеза мочевины: карбамо-илфосфатсинтетаза является ключевым ферментом и определяет скорость всего процесса. Аллостерически активируется N-ацетилглутаматом, который синтезируется из глутамата и ацетил-КоА. Скорость синтеза мочевины коррелирует с концентрацией N-ацетилглу-тамата. Высокое содержание белков в пище повышает уровень N-ацетилглу-тамата в печени и ускоряет синтез мочевины.
Мочевина простой диффузией по градиенту концентрации выходит из клеток в кровь и выделяется с мочой (около 30 г в сутки). Небольшое количество мочевины поступает в кишечник, где распадается до СО2 и Н3О под действием фермента уреазы.
Человек экскретирует 10 кг мочевины в год.
Суммарное уравнение реакций синтеза мочевины:
СО2 + NH/+ 3 АТФ + аспартат + 2 Н2О -* мочевина + 2 АДФ + 2 Рн + АМФ + РРн + фумарат
Взаимосвязь цикла синтеза мочевины и ЦТК. Синтез мочевины связан с ЦТК тремя путями.
321
Глава 21 Источники и пути обезвреживания аммиака в организме
Карбамоилфосфатсинтетаза N-ацетилглутамат О NH3+CO2 + H2O * NH2C-O~PO32' + 2 АТФ 2 АДФ Карбамоилфосфат Н3РО4 NH2 NH Орнитинтранс- с=О С-ОН карбомоилаза ' t сои ► NH NH + +HoN“CH NH3+ <<РН2)з CH-NH3+ соо-Орнитин Аргининосукцинат-синтетаза
> (СН2)3 Н3р°4 CH-NH3* СОО' Цитруллин (кето-форма) (<рн2)з СН2 CH-NH3* СО° соо- Цитруллин Аспартат (енольная форма) АТФ АМФ Н4Р2О7 Н2О
NH2 |СОО-C-NHiCH
NH ?Н2 । СОО' (СН2)з
CH"NH3+ СОО' Аргининосукцинат
Аргининосукцинат- ^Н2 + лиаза C-NH2
NH
(СН2)3 CH-NH3+ соо-
Аргинин Аргиназа
соо-НС
СН соо-
H2N-C-NH2 6
Фумарат
Н2О
Мочевина
NH3+ (СН2)3
CH'NH3 СОО'
Орнитин
Фумарат-х гидратаза
V соо-но-с-н сн2 СОО-
Малат
Малатдегидрогеназа
НАД
НАДН+Н
соо-С=0 ?Н2 соо-
Оксалоацетат
Рис. 21.4. Синтез мочевины.
322
Источники и пути обезвреживания аммиака в организме Глава 21
1. Фумарат, который образуется в ар-гининосукцинатлиазной реакции, является метаболитом цикла мочевины и цикла трикарбоновых кислот. Поэтому эти два цикла связаны (двухколесный «велосипед» Кребса). Тем не менее, каждый цикл функционирует независимо, и взаимосвязь между ними зависит от транспорта промежуточных продуктов между митохондрией и цитозолем. Некоторые ферменты ЦТК (фумаратгид-ратаза и малатде гидрогеназа) имеют изоферменты в цитозоле. Фумарат, образуемый в цитозоле, превращается в малат и затем в оксалоацетат (ЩУК), которые либо далее метаболизируются в цитозоле, либо транспортируются в митохондрии для использования в ЦТК.
Аспартат, который образуется в митохондриях в результате трансаминирования оксалоацетата и глутамата, транспортируется в цитозоль, где является донором азота в реакции, катализируе
мой аргининсукцинатсинтетазой (рис. 21.5).
2. СО? образующийся в ЦТК, используется для синтеза мочевины.
3. Для синтеза одной молекулы мочевины необходимо 4 высокоэнергетических фосфатных группы: 2 АТФ используется для синтеза карбамоилфосфата и 1 АТФ — для синтеза аргининсукцината (при этом АТФ распадается на АМФ и Н4Р2О7, который гидролизуется до 2-х молекул Н3РО4). Цикл мочевины способствует превращению оксалоацетата в фумарат (через аспартат), регенерации оксалоацетата с образованием НАДН в малатдегидрогеназной реакции. Каждая молекула НАДН в результате переноса электронов по ЦПЭ образует 2,5 АТФ, уменьшая, тем самым, энергетические затраты для синтеза мочевины.
Происхождение атомов азота в молекуле мочевины. Один атом азота поступает из кишечника или периферических тканей и включается
Фумарат
Малат
Аргинин ^Мочевина
Орнитин
Цикл 1 синтеза мочевины Оксалоацетат Аргинино-Сукцинат
Рис. 21.5. Связь ЦТК и цикла мочевины.
323
Глава 21 Источники и пути обезвреживания аммиака в организме
через карбамоилфосфат; второй атом азота поступает в цикл мочевины в составе аспартата, а аспартат, в свою очередь, получает атом азота при трансаминировании глутамата с окса-лоацетатом. Как известно, атом азота аминогруппы глутамата происходит из аминогрупп аминокислот печени. Поэтому второй атом азота мочевины поступает из фонда аминокислот печени.
В клинико-лабораторной практике оценивают содержание небелковых азотсодержащих компонентов, называемых остаточным азотом. В норме остаточный азот составляет 15—25 ммоль/л и включает азот мочевины (50 %), аминокислот (25 %), мочевой кислоты (4 %), креатина (5 %), креатинина (0,5 %), аммиака и индикана (0,5 %).
Гипераммониемии
Гипераммониемии бывают врожденные или развивающиеся при циррозе печени, катаболических состояниях. Лимитирующими реакциями синтеза мочевины являются реакции, катализируемые карбамоилфосфатсинтетазой (1), орни-тинтранскарбамоилазой (2) и аргиназой (5). Поскольку цикл мочевины переводит токсичный аммиак в нетоксичную мочевину, все нарушения синтеза мочевины вызывают аммонийную интоксикацию. Эта интоксикация наиболее выражена при дефектах 1 и 2 реакций. Клинические симптомы: рвота в раннем детстве, избегание богатой белками пищи, атаксия, сонливость, отставание в умственном развитии. Для лечения используют диеты, не приводящие к росту аммиака в сыворотке крови. Известны следующие дефекты ферментов цикла мочевины (орнитинового цикла): 1) гипераммониемия типа I (дефект кар-бамоилфосфатсинтетазы, семейное заболевание); 2) гипераммониемия типа II (дефект орнитинтранскарбамоилазы,
связан с Х-хромосомой); 3) цитрулине-мия — редкое рецессивно наследуемое заболевание, связанное с дефектом ар-гининсукцинатсинтетазы и сопровождается выделением с мочой 1—2 г цитруллина в сутки и повышением его содержания в крови и спинномозговой жидкости; 4) аргининсукцинатациду-рия — редкое рецессивно наследуемое заболевание, характеризуется повышенным выделением с мочой и повышенным содержанием в крови и спинномозговой жидкости аргининосукцината (дефект аргининосукцинатлиазы); 5) ги-пераргининемия — дефект аргиназы, вызывающий повышение количества аргинина в крови и спинномозговой жидкости.
Все дефекты ферментативных превращений в цикле мочевины сопровождаются гипераммониемией, т. е. повышением концентрации NH4+ в плазме крови.
Некоторые из этих дефектов проявляются в первые двое суток после рождения ребенка. Эти дефекты ведут к необратимым поражениям мозга и развитию коматозного состояния. Почему же увеличенная концентрация NH/ в крови оказывает токсический эффект? Возможно, что повышенный уровень глутамина, образованного из глутаминовой кислоты и NH4+, за счет осмотических эффектов вызывает отек мозга.
Терапия таких врожденных состояний требует поиска дополнительных биохимических путей вывода избытка NH4+ из организма.
1. Для лечения недостаточности аргининосукцинатлиазы используют избыток аргинина в пище при уменьшении потребления белков. В печени аргинин распадается на мочевину и орнитин; орнитин затем реагирует с карбамоилфосфатом с образованием цитруллина. Цитруллин конденсируется с аспартатом, что ведет к образованию аргининосукцината, который выводится с мочой. В этом случае на каждую мо-
324
Источники и пути обезвреживания аммиака в организме Глава 21
Фенилацетат
Фенилацетил-КоА
Фенил ацетилглутамин
Рис. 21.6. Лечение дефицита карбамоилфосфатсинтетазы и орнитинтранскарбамоилазы.
325
Глава 21 Источники и пути обезвреживания аммиака в организме
лекуду аргинина пищи удается удалить два атома азота из организма (один из карбамоилфосфата, а второй из аспарагиновой кислоты).
2. Лечение дефектов карбамоилфосфатсинте-тазы и орнитинтранскарбамоилазы использует иную стратегию борьбы с гипераммониемией. Цитруллин и аргининосукцинат не могут использоваться для связывания атомов азота, поскольку их синтез нарушен. В этих условиях избыток азота аккумулируется в виде глицина и глутамина. Эти две аминокислоты удаляют из организма путем введения больших количеств бензойной кислоты или фенилуксусной кислоты на фоне малобелковой диеты. Бензойная кислота превращается в бензоил-КоА, который затем взаимодействует с глицином и азот с мочой выводится в виде гиппуровой кислоты. Аналогично фенилуксусная кислота активируется в фенилацетил-КоА, который взаимодействует с глутамином и азот выводится с мочой в виде фенилацетилглутамина (рис. 21.6.).
В общем виде приобретенные гипераммониемии возможны в двух ситуациях: 1) поступление аммиака, как при состоянии здоровья, но печень поражена; 2) функция пече
ни не нарушена, но увеличено поступление аммиака.
При анализе первой ситуации следует учитывать, что все ферменты цикла мочевины, за исключением аргиназы, могут быть во внепеченочных тканях. Но ни в одной из них нет синтеза мочевины. Поэтому при поражении печени возникает гипераммониемия. При циррозе печени из-за порто-кавальных анастомозов содержание аммиака в крови повышается дополнительно, что усугубляет интоксикацию. При катаболических состояниях (травмы, опухоли, кахексия) печень перегружается поступающим аммиаком, который не успевает превратиться в мочевину. Если это состояние отягощается поражением гепатоцитов, возможно развитие печеночной комы. В лечении используют малобелковую пищу, обменное переливание крови и стимуляторы цикла мочевины (аргинин, протамины, не гидролизуемый аналог N-ацетилглу-тамата — N-карбамоилглутамат).
326
Г лава 22
Обмен отдельных аминокислот
Превращение углеродного скелета аминокислот
3 состав белков входят 20 аминокислот, которые различаются по строению радикалов. Во второй стадии катаболизма существует, как минимум, двадцать наборов ферментов, катализирующих превращение этих радикалов. Из общего количества энергии, потребляемой орга-низмом, на долю этих превращений приходится не более 10 %.
Азот аминокислот, отщепляемый, как правило, на ранних стадиях катаболизма, включается в общий метаболический дул. В зависимости от потребностей организма он может реутилизироваться ? анаболических процессах или включаться в конечный продукт обмена азота — мочевину и экскретироваться из ?рганизма. Безазотистые углеродные :статки аминокислот образуют чаще г сего кетокислоты, которые далее превращаются по общим путям катаболизма. Метаболиты, образующиеся из уг-еродных скелетов аминокислот, либо -е посредственно включаются в цикл -? «карбоновых кислот, либо превращается в пируват и через ацетил-КоА раз
рушаются до конечных продуктов — СО2 и Н2О.
В зависимости от потребностей организма безазотистые метаболиты аминокислот могут использоваться в анаболических реакциях для синтеза глюкозы («гликогенные аминокислоты» — аланин, аргинин, аспарагиновая кислота, цистеин, глутаминоваая кислота- глицин, апарагин, гистидин, метионин, пролин, серин, треонин, глутамин, валин», синтеза липидов («кетогенная аминокислота» лейцин), либо синтеза углеводов и липидов («гликогенные» и «кетогенные» аминокислоты изолейцин, лизин. фенилаланин, тирозин, триптофан). Таким образом, классификация аминокислот по признаку кетогенности или гликоген кости достаточно условна, поскольку промежуточные продукты обмена некоторых из них могут включаться как в синтез углеводов, так и жиров (рис. 22.1).
Метилирование и трансметилирование
Введение метильной группы в молекулу называется метилированием. Перенос
327
Глава 22 Обмен отдельных аминокислот
метильной группы с активного метионина на акцептор называется трансметилированием.
Значение метилирования:
1) синтез некоторых низкомолекулярных соединений (холин, адреналин, креатин, тимидиловые нуклеотиды и др.);
2) инактивация биологически активных веществ (например, катехоламинов);
3) созревание ДНК, всех видов РНК, ряда белков и предотвращение разрушения некоторых веществ в организме, например, белков.
Ферменты, участвующие в реакциях трансметилирования называются метил-
трансферазами. Универсальным донором метильной группы выступает S-адено-зилметионин. Переносчиком метильных групп является метилтетрагидрофоли-евая кислота. Источниками метильной группы могут быть холин и бетаин.
Процесс трансметилирования требует следующих реакций. ;
1. Активация метионина. Синтез S-аде-нозилметионина происходит путем переноса аденозильной группы от АТФ на j атом серы метионина. Реакция катали- | зируется метионинаденозилтрансферазой ; (рис. 22.2).
Своеобразие данной реакции заклю- ' чается в том, что СН3-группа метиони-
328
Обмен отдельных аминокислот Глава 22
1Ч5-МетилТГФК
соо-
H-C-NH3+
СН2 сн2 s-ch3
Метионин
S-Аденозил метионин
Гомоцистеин-метилтрансфераза
В12
СОО'
H-C-NH3+
СН2 сн2 S-H
Акцептор (R)
Метилированный продукт (R-CH3)
соо-
H-C-NH3+
СН2
СН2
S-Аденозин
Гомоцистеин
Аденозилгомоцистеиназа
Аденозин Н2О
S-Аденозилгомоцистеин
Рис. 22.2. Трансметилирование.
на активируется под действием соседнего атома серы и поэтому S-аденозилме-тионин из-за наличия положительного заряда является высокореакционной молекулой.
2. Метилирование субстрата. S-адено-.илметионин переносит метильную руппу на акцептор и сам превращает-:ч в S-аденозилгомоцистеин. Выделение - вободной энергии в этой реакции де-зет ее необратимой.
3. Распад S-аденозилгомоцистеина на аденозин и гомоцистеин.
4. Гомоцистеин может быть метилиро-=ан в метионин с использованием №-^гтилтетрагидрофолиевой кислоты и с частием метилкобаламина (кофермент-•зя форма витамина В12). Таким образом, -этионин может быть регенерирован для г вторного использования. Необходимо “метить, что это не синтез метионина * организме, т. к. метионин является не-зменимой аминокислотой.
Наиболее важные реакции метилирования
1. Синтез креатина и креатинина.
Креатин присутствует в тканях (мышцы, мозг, кровь и т. д.) в виде высоко энергетического вещества — креатинфосфата или свободного креатина. Для синтеза креатина необходимы три аминокислоты — глицин, аргинин и метионин.
Первая реакция происходит в почках и поджелудочной железе и включает перенос гуанидиновой группы аргинина на глицин. Фермент — аргинин-глицин трансамидиназа. Образуется гуанидоаце-тат. В печени и поджелудочной железе происходит метилирование гуанидоацета-та с использованием S-аденозил метионина и образуется креатин. Креатин разносится кровью к другим органам, особенно к мышцам, где обратимо фосфорилируется в креатинфосфат ферментом креа-тинкиназой. Креатинин является ангид
329
Глава 22 .Обмен отдельных аминокислот
ридом креатина. Образуется путем спонтанной циклизации креатина или креатинфосфата. Креатинин выводится с мочой. Оценка уровня креатинина сыворотки вместе с мочевиной является тестом на функцию почек (рис. 22.3).
2. Синтез адреналина. Происходит в мозговом веществе надпочечников из фениаланина и тирозина. Метилирование норадреналина с участием S-адено-зилметионина приводит к синтезу адреналина (рис. 22.4).
Благодаря метилированию молекула адреналина приобрела устойчивость, необходимую для транспорта в крови и выполнения функций гормона.
3. Синтез фосфатидилхолина. Метилирование фосфатидилэтаноламина при
водит к образованию амфифильной молекулы фосфатидилхолина (полярная головка и два гидрофобных хвоста), используемого для построения мицелл, липосом, мембран (рис. 22.5).
4. Метилирование нуклеиновых кислот. В клетках печени и других органов есть фермент полинуклеотидметилтрансфе-раза, который катализирует метилирование оснований, входящих в состав нуклеиновых кислот. Метилированные основания служат маркерами специфических участков полинуклеотидных цепей и защищают ДНКи РНК от воздействия ферментов — нуклеаз.
5. Метилирование чужеродных соединений. В тканях человека, особенно в печени, происходит метилирование чуже-
+NH2 c-nh2 NH + (СН2)3 CH—NH3+ СОО'
NH3-CH2-COO' Г лицин
Аргинин-елицин-трансамидиназа С-N Н2
------------- NH
> СН2
Орнитин coo'
S-Аденозил- S-Аденозил-метионин гомоцистеин
Гуанидоацетат-метилтрансфераза
Аргинин
Гуанидоацетат
’nh2
С-N Н2 Креатинкиназа
N-CH3 —-----------*
СН2 АТФ АДФ соо-
+NH2 C-NH-РОз2' N-CH3 СН2 СОО'
Креатинин------------►
Моча
Рис. 22.3. Синтез креатина и креатинина.
330
Обмен отдельных аминокислот Глава 22
S-Аденозил- S-Аденозил
метионин гомоцистеин НО>—ч ч~СНзу Н°>^\
но-/~Усн-сн2-кнз* ~ „ HOH(J^CH-CH2W-CH3
\—/ Aw Фенилэтаноламин- N- '—' ОН
ин метилтрансфераза
Норадреналин
Адреналин
Рис. 22.4. Синтез адреналина.
О СНр-С-R!
О
R2C-O'C-H о- —
' CH2O-P-O-CH2CH2NH3'
6
Фосфатидилэтаноламин
S-Аденозил- S-Аденозил-метионин гомоцистеин ~3 СНз, о —* r2-c-o-c-h О" +
CH2O~P-O-CH2CH2N(CH3)3 о
Фосфатидилхолин
О CH^O-C-R!
Рис. 22.5. Синтез фосфатидилхолина.
годных и лекарственных соединений с збразованием N-, О- и S-метиловых конъюгатов. При этом изменяется биологическая активность.
Метаболизм фенилаланина и тирозина
Фенилаланин и тирозин являются ароматическими аминокислотами. Фенилаланин относится к незаменимым аминокислотам, поскольку ткани кивотных не обладают способностью синтеза его бензольного кольца. Тирозин полностью заменим при достаточном поступлении фенилаланина с пи-лей.
Основное количество фенилаланина метаболизируется через тирозин. Тиро-:ин используется для биосинтеза белков > необходим для образования биологически активных веществ — адреналина, -орадреналина, дофамина, тироидных
гормонов и пигмента меланина. В процессе метаболизма фенилаланин и тирозин превращаются в метаболиты, которые являются предшественниками для синтеза глюкозы и жиров. Таким образом, эти аминокислоты относятся к кетогенным и гликогенным.
Изучение превращений этих аминокислот важно по 2-м причинам: 1) в процессе метаболизма происходит синтез биологически активных веществ; 2) в результате дефектов ферментов обмена этих аминокислот развиваются метаболические нарушения.
1. У здорового человека почти весь фенилаланин, который не был использован для синтеза белков, превращается в печени в тирозин. Фенилаланин гидроксилируется в пара-положении ферментом фенилаланингидроксилазой, который является микросомальной оксигеназой со смешанной функцией и включает один атом молекулярного кислорода в
331
Глава 22 Обмен отдельных аминокислот
пара-положение фенилаланина, а второй атом кислорода восстанавливается в Н2О. Фенилаланингидроксиалаза в качестве кофактора использует тетрагид-робиоптерин, который переносит электроны от НАДН к О2 и окисляется в дигидробиоптерин. В своем составе тетрагидробиоптерин имеет птеридин как в фолиевой кислоте, но он не используется для переноса одноуглеродных радикалов.
Далее метаболизм фенилаланина и тирозина происходит вместе (рис. 22.6). 2. Тирозин подвергается трансаминированию с образованием п-гидроксифе-нилпирувата. Реакция катализируется тирозин трансаминазой.
3. п-Гидроксифенилаланинпируват гидроксилаза (диоксигеназа) является медьсодержащим ферментом и катализирует декарбоксилирование и гидроксилирование фенольного кольца п-гидроксифенилпирувата с образованием гомогентизата. Эта стадия требует аскорбиновой кислоты.
4. Гомогентизатоксидаза (Fe-содержащий фермент) расщепляет гомогентизат и через ряд промежуточных стадий образуется фумарат и ацетоацетат. Фумарат является промежуточным продуктом ЦТК и может использоваться как предшественник глюконеогенеза. Ацетоацетат является кетоновым телом.
5. Синтез меланина происходит в мела-носомах, которые присутствуют в меланоцитах — пигмент-продуцирующих клетках кожи, радужки глаза, волосах. Тирозиназа (Cu-содержащая оксигеназа) гидроксилирует тирозин с образованием 3,4-дигидроксифенилаланина (ДОФА). ДОФА через несколько промежуточных стадий превращается в меланин. Цвет кожи определяется соотношением черного и красного меланина. Это зависит от многих факторов, в частности, генетических и окружающей среды.
6. Биосинтез тироидных гормонов. Ти-роидные гормоны — тироксин и трий-одтиронин — синтезируются из тирозиновых остатков белка тироглобулина и процесс активируется йодом.
7. Биосинтез катехоламинов. Тирозин гидроксилируется в дигидроксифенилаланин (ДОФА) ферментом тирозингид-роксилазой. ДОФА подвергается декарбоксилированию с образованием дофамина и затем норадреналина. Метилирование норадреналина с участием S-аденозилметионина приводит к синтезу адреналина.
Нарушение обмена фенилаланина (тирозина)
1. Дефект гена фенилаланингидроксилазы, встречается 1:10000 новорожденных. В результате фенилаланин превращается по альтернативному пути, который приводит к накоплению фенилпирувата, фенилацетата и фениллактата (рис. 22.7).
Все метаболиты экскретируются с мочой в большом количестве, поэтому заболевание характеризуется ведущим признаком — фенилкетонурией и называется фенилпировиноградная олигофрения. Накопление фениаланина и его метаболитов в раннем возрасте нарушает нормальное развитие мозга, вызывая умственную отсталость. Это может быть обусловлено тем, что фенилаланин по конкурентному механизму влияет на транспорт других аминокислот через гематоэнцефалический барьер, приводя к изменению процессов метаболизма в мозге. Половина больных умирает до 20 лет. При выявлении дефекта назначается диета с низким содержанием фенилаланина, но с достаточным содержанием тирозина. Ранняя диагностика и диета в первые 4—5 лет жизни предотвращает повреждение мозга.
2. Алкаптонурия. Аутосомно-рецессивное заболевание с частотой 1 : 25000. Де-
332
Обмен отдельных аминокислот Глава 22
Фенилаланин NH3
О2 НАДН+Н^
Тетрагидробиоптери!
НАД*-^ Н2О н2о о2
\/т\Фенилапанин-гидроксилаза
6
СН2-СН-СОО' -------------
Тирозиназа + Тирозин-
@ Тирозин 3 гидроксилаза
2-оксоглутарат ~
ДОФА
(7.
НО
@ Тирозинтрансаминаза
Дофамин
сн2-с-соо* 6
п-Г идроксифенилпируват
Норадреналин
Аскорбиновая кислота >
Дегидроаскорбиновая*^ pH кислота + Н2О + СО2
/3) п-гидроксифенилпируват-диоксигеназа (Си2*)
Адреналин
-соо-
НО
Гомогентизат
@ Гомогентизатоксидаза
СОО'
RO
J СН2-СОО'
4-Мапеилацетоацетат
i
Фумарилацетоацетат
Фумарилацетоацетат-гидроксилаза
г------ -------\
Фумарат Ацетоацетат
ЦТК
Глюкоза Жиры
эис. 22.6. Метаболизм фенилаланина и тирозина.
333
Глава 22 Обмен отдельных аминокислот
фектным ферментом является гомоген-тизатоксидаза. Гомогентизат накапливается в тканях и крови и экскретируется с мочой. Гомогентизат окисляется оксидазой до бензохинона ацетата, который подвергается полимеризации с образованием темного пигмента алкапто-на. Алкаптон накапливается в соединительной ткани, костях и различных органах, приводя к охронозу. Изменяется цвет мочи на коричневый или черный. Моча дает положительный тест с хлоридом железа и нитратом серебра. Заболевание не является опасным для жизни и поэтому не требует специального лечения.
3. Альбинизм развивается в результате нарушения синтеза пигмента меланина. Аутосомно-рецессивное заболевание с частотой 1 : 20000. Причиной альбинизма является дефект тирозиназы. Наиболее важной функцией меланина является защита кожи от солнечной радиации. Потеря меланина у альбиносов делает их кожу чувстви
тельной к солнечным лучам, что повышает риск развития рака кожи. Фотофобия (боязнь солнечного света) обусловлена отсутствием пигмента в сетчатке, хотя это не нарушает зрения у альбиносов.
4. При дефекте пара-гидроксифенилпи-руватгидроксилазы накапливается тирозин. Заболевание называется тирозиноз. У детей обнаруживается отставание в развитии.
Белковая недостаточность
Проявляется при полном и частичном голодании, а также однообразном белковом питании. При преобладании белков растительного происхождения, биологическая ценность которых ниже, развивается отрицательный азотистый баланс, нарушение коллоидно-осмотического и водно-солевого баланса. При тяжелых формах пищевых дистрофий, например, при квашиоркоре наблюдаются тяжелые поражения печени, останов-
334
Обмен отдельных аминокислот Глава 22
:<а роста, нарушения водно-солевого збмена, снижение неспенифической резистентности организма.
Аминокислоты-----
предшественники биологически активных веществ
Из 20 протеиногенных аминокислот 10 являются незаменимыми для человека. У бактерий и растений предшественни-<ами всех 20 протеиногенных аминокислот являются 3-фосфоглицерат, фос-jоснолпируват, пируват, оксалоацетат, 2-оксоглутарат и два моносахарида пен-эзофосфатного пути обмена углеводов.
Завершая изложение материала по .бмену аминокислот отметим, что они •з.тяются предшественниками ряда низкомолекулярных биорегуляторов. Призеры таких молекул приведены на тис. 22.8. Приведено написание формул, принятое в англоязычной литературе. Видно, что производные аминокислот гогут выполнять структурную, динами-ескую и регуляторную функции.
Синтез порфиринов. Порфирии
Согласно Девиду Шемину и сотр. (1945), первым этапом биосинтеза порфиринов у животных является конденсация глицина и сукцинил-КоА с образованием 5-аминолевулиновой кислоты. Реакция ка-тализируется 5-аминолевулинат-синтазой, митохондриальным ферментом, содержащим пиридоксальфосфат. Две молекулы 8-аминолевулината конденсируются в порфобилиноген. Четыре молекулы порфобилиногена соединяются «голова к хвосту» в линейную тетра-пиррольную структуру в реакции, катализируемой порфобилиноген-дезаминазой. Затем эта линейная структура циклизу
ется с образованием уропорфириногена II!с участием косинтазы. Уропорфириноген lit является ключевым интермедиа-том для синтеза витамина В12у бактерий и хлорофилла у растений и некоторых бактерий. Последующие реакции касаются изменений боковых цепей и сатурации порфиринового кольца. Копропорфи-риноген III образуется при декарбоксилировании ацетильных остатков боковых цепей. Десатурация порфиринового кольца и превращение двух остатков пропионовой кислоты боковых цепей в винильные группы дает протопорфирин IX. Хелатация последнего железом приводит к образованию гема, простетической группы миоглобина, гемоглобина, каталазы, пероксидазы, цитохрома Ь. Введение двухвалентного железа катализируется феррохелатазой. Железо транспортируется в плазме крови трансферрином и запасается в тканях внутри молекул ферритина. Большая внутренняя полость (8 нм в диаметре) ферритина может запасать до 4500 ионов железа.
Продолжительность жизни эритроцитов человека 120 дней. На первом этапе деградации гема происходит разрыв метеновых мостиков и образуется зеленый пигмент биливердин. Далее центральный метеновый мостик биливердина восстанавливается биливердинре-дуктазой и образуется красный пигмент билирубин (рис. 22.9). Изменение цвета кровоизлияния под кожей является индикатором этих превращений.
Порфирии — врожденные нарушения, связанные с недостаточностью ферментов биосинтеза гема. Порфирин синтезируется в эритроцитах и печени. Врожденная эритропоэтическая порфирия связана с преждевременным разрушением эритроцитов. Это заболевание — результат недостаточности косинтазы. При этой порфирии синтез уропорфириногена III сопряжен с избыточным образованием уропорфириногена I, физиологически незначимого изомера. При этом накапливаются уропорфирин I. копропорфирин I, и другие симметричные производные. Моча у таких пациентов красного цвета из-за экскреции большого кагичества уропорфириногена I. Их зубы при ультрафио-
335
Глава 22 Обмен отдельных аминокислот
Никотинамид единица НАД+
Рис. 22.8. Биомолекулы — производные аминокислот (фрагменты молекул, показанные пунктиром, и атомы кружочках происходят из аминокислот).
336
Обмен отдельных аминокислот Глава 22
=“4€. 22,9. Превращения гема. Обозначения: М — метил; В — винил; П — пропионил.
гт>вом облучении дают красную флуоресцен-..оо. Кожа весьма чувствительна к свету. Ост-перемежающаяся порфирия связана с нару-нием обмена порфиринов в печени. Для этой офирии характерна избыточная продукция
порфобилиногена и 8-аминолевулиновой кислоты. У таких пациентов имеются сильные абдоминальные боли и неврологические нарушения. Дополнительная информация представлена в главе 34.
2:24
337
Глава 23
Обмен нуклеотидов
Нуклеотиды — это низкомолекулярные вещества, которые выполняют функции биорегуляторов (НАД, НАДФ, ФМН, ФАД, АТФ, АДФ, АМФ и др.), либо входят в состав полимерных молекул ДНК и РНК (пуриновые и пиримидиновые рибо- и дезоксирибонуклеотиды).
Азотистые основания, нуклеозиды и нуклеотиды
При гидролизе нуклеиновых кислот образуются пуриновые (аденин, гуанин) и пиримидиновые (тимин, цитозин, урацил) основания, углевод (рибоза или дезоксирибоза) и фосфорная кислота. Отличиями в строении ДНК и РНК являются: в ДНК углевод дезоксирибоза, в РНК — рибоза; в ДНК содержится тимин, в РНК — урацил. В составе ДНК и РНК открыты так называемые минорные азотистые основания. Основные азотистые основания представлены на рис. 23.1.
Азотистое основание соединяется с углеводным компонентом гликозидной связью. В образовании гликозидной связи в пуриновых нуклеотидах принимает участие N-9 пурина и С-Г пентозы,
а в пиримидиновых нуклеотидах — N-1 пиримидина и С-Г пентозы. Для того, чтобы отличить углеродные атомы рибозы или дезоксирибозы от углеродных атомов, входящих в состав пуриновых или пиримидиновых оснований, первые принято обозначать символом «штрих». Нуклеозид состоит из азотистого основания и углеводного компонента. Нуклеозиды являются не заряженными молекулами, поэтому могут вводиться в организм парентеральным путем.
К 5'-углеродному атому углевода присоединяется остаток фосфорной кислоты (от 1 до 3), и образуются нуклеотиды (таблица 23.1).
Нуклеазы
Ферменты, катализирующие распад нуклеиновых кислот называются нуклеазами: ферменты, расщепляющие ДНК — дезоксирибонуклеазы (ДНКазы); ферменты, гидролизующие РНК — рибонуклеазы (РНК-азы).
В тонком кишечнике под действием ДНК-аз и РНК-аз, секретируемых поджелудочной железой, происходит гидро-
338
Обмен нуклеотидов Глава 23
Таблица 23.1. Номенклатура нуклеозидов и нуклеотидов
Основание Пурины Пиримидины
Аденин (А) Гуанин (Г) Цитозин (Ц) Урацил (У) (Тимин ГЛ)
Нуклеозиды Аденозин Дезоксиаденозин Гуанозин Дезоксигуанозин Цитидин Дезоксицитидин Уридин Дезоксиуридин
Нуклеотиды Аденилат (АМФ) Дезоксиаденилат (дАМФ) Гуанилат (ГМФ) Дезоксигуанилат (ДГМФ) Цитидилат (ЦМФ) Дезоксицитиди-лат (дЦМФ) Уридилат (УМФ) Тимидилат (ТМФ)
.из экзогенных нуклеиновых кислот до . Лиго-, ди- и мононуклеотидов. Полное гзсщепление нуклеиновых кислот до мононуклеотидов может завершаться под действием других ферментов тонкого «ишечника, например, фосфодиэстераз, образовавшиеся мононуклеотиды могут: расщепляться под действием неспец и-
фических фосфатаз (кислой и щелочной), которые гидролизуют фосфоэфирную связь («нуклеотидазное» действие) с образованием нуклеозидов и фосфорной кислоты, и в таком виде всасываются; 2) всасываться и распадаться в клетках слизистой оболочки кишечника. Имеются также доказательства существования в
339
Глава 23 Обмен нуклеотидов
стенке кишечника нуклеотидаз, катализирующих гидролитический распад мононуклеотидов. Дальнейший распад образовавшихся нуклеозидов осуществляется внутри клеток слизистой преимущественно фосфоролитическим, а не гидролитическим путем (таблица 23.2).
Как следует из таблицы, разрушение ДНК и РНК осуществляется под действием гидролитических и фосфоролитических нуклеаз.
Синтез пуриновых нуклеотидов
Пуриновые азотистые основания, образующиеся в процессе переваривания
нуклеиновых кислот в кишечнике, в дальнейшем практически не используются. Поэтому их синтез осуществляется de novo из низкомолекулярных предшественников, продуктов обмена углеводов и белков.
1. Для биосинтеза пуринового кольца необходимы следующие предшественники: N, образуется из аспартата', С2 — из углерода N1C— формил-ТГФК; N3 и N9 — из амидной группы глутамина’, С4, С5 и N7 - из глицина; Сб — из СО? Cg — yys ^ю_метенил_тгФК (рис. 23.2).
2. Основное место синтеза — печень. В эритроцитах, лейкоцитах и мозге синтез не происходит.
Таблица 23.2. Ферментативное расщепление нуклеиновых кислот
Фермент Субстрат Конечные продукты
Нуклеаза ДНК, РНК Нуклеозидмонофосфат
Полину клеотидфосфорил аза ДНК, РНК Укороченная на один нуклеотид РНК и ДНК
3’- или 5’-нуклеотидаза Нуклеозидмонофосфат Нуклеозид, ортофосфорная кислота
Нуклеозидаза Нуклеозид Азотистое основание, рибоза
Нуклеозид-фосфорилаза Нуклеозид Азотистое основание, рибозо-1 -фосфат
340
Обмен нуклеотидов Глава 23
?. Синтез пуриновых нуклеотидов начи-- -г гея с промежуточного продукта пенто-оэосфатного пути — рибозо-5~фосфата, -л который переносится пирофосфатная туппа АТФ. Фермент — фосфорибозилпи-ууфосфатсинтетаза (рис. 23.3).
4. Образовавшийся 5'-фосфорибозил-1-лрофосфат (ФРПФ) под действием -чидотрансферазы взаимодействует с .:утамином, который является донором '»Н2-группы и образуется 5-фосфо-р-^бозиламин. В этой реакции происхо-2-'т освобождение пирофосфата, глута-лновой кислоты и изменение
* знфигурации из а- в р-. Эта стадия - зляется ключевой в синтезе пуринов.
5. Через ряд промежуточных соединений оществляется синтез всего пуринового . келета, и образуется первый нуклео- и — инозинмонофосфат (инозиновая » л слота, ИМФ), которая является предшественником пуриновых нуклеотидов, о. Синтез АМФ и ГМФ осуществляет-. из ИМФ. Для синтеза ГМФ необходим НАД+, АТФ, глутамин и фермен-
ш — ИМФ-дегидрогеназа и ' ЧФ-синтетаза. В ферментативном .лнтезе АМФ из ИМФ принимает уча-шле аспарагиновая кислота, являюща-<я донором NH2-группы, ГТФ как ис-?чник энергии и ферменты - ^енилосукцинатсинтетаза и аденило-
. киинатлиаза.
Превращение АМФ и ГМФ в соответствующие нуклеозидди- и трифосфа-* ы протекает в две стадии при участии . лецифических нуклеозидмонофос-zam — и нуклеозиддифосфаткиназ:
ГМФ + АТФ ** ГДФ + АДФ
ГДФ + АТФ ***ГТФ + АДФ
-льтернативный путь синтеза ‘уриновых нуклеотидов
Приведенные выше реакции являются гневным путем синтеза пуриновых
нуклеотидов. Однако этот процесс требует затраты значительного количества энергии в виде АТФ: на синтез циклической структуры пуринов затрачивается 5 молекул АТФ на каждую молекулу АМФ и ГМФ.
Известен другой путь — путь реутилизации пуриновых оснований, образовавшихся в процессе распада эндогенных или экзогенных пуриновых нуклеотидов. Эти реакции можно рассматривать как реакции «сбережения», использующие пуриновые кольца до их превращения в ксантин и затем в мочевую кислоту до экскреции.
Существует два фермента: гипоксан-тин-гуанинфосфорибозилтрансфераза (ГГФРТ) и аденинфосфорибозилтрансфе-раза (АФРТ), утилизирующие свободные пурины, превращая их вновь в нуклеотиды при взаимодействии с фосфорибозилпирофосфатом (ФРПФ) (рис. 23.4).
Регуляция синтеза пуриновых нуклеотидов
Регуляция осуществляется по механизму обратной связи (рис. 23.5).
1. Синтез пуриновых нуклеотидов тормозится конечными продуктами АМФ и ГМФ по принципу обратной связи путем ингибирования амидотрансферазной реакции.
2. Избыток ГМФ в клетках аллостери-чески тормозит синтез ГМФ и не влияет на синтез АМФ и, наоборот, накопление АМФ ингибирует синтез АМФ и не ингибирует синтез ГМФ.
3. Для синтеза АМФ необходим ГТФ, для синтеза ГМФ — АТФ, что обеспечивает баланс синтеза этих нуклеотидов.
Синтез пиримидиновых нуклеотидов
Особенностью синтеза пиримидиновых нуклеотидов является то. что вначале
341
Глава 23 Обмен нуклеотидов
9'
О=Р-О-Н2С
ОН
Фосфорибозил- Q-пирофосфат-синтетаза
АТФ АМФ
О=Р-О-1
6.
Н2С
Ч-----fO-P-O-P-O-
ОН он 6_ о.
а-О-рибозо-5-фосфат
5-Фосфорибозил-1 -пирофосфат
Амидотрансфераза
о-
О=Р-О-Н2С 0
О- ki
Глутамин Глутамат +Н2О -РРн
9
ОН
5-фосфо-Р-рибозиламин
Гуанозинмонофосфат (ГМФ)
Аденозинмонофосфат (АМФ)
Рис. 23.3. Синтез пуриновых нуклидов.
АФРТ
Аденин + ФРПФ------------АМФ + РРн
ГГФРТ
Гуанин + ФРПФ------------^ГМФ + РРн
ГГФРТ Г ипоксантин + ФРПФ----------► ИМФ + РРн
Рис. 23.4. Реутилизация пуриновых оснований.
342
Обмен нуклеотидов Глава 23
Пиримидиновые
Гистидин нуклеотиды
фрпф 4
Рибозо- j | 5-фосфат у
Ингибирование
ИМФ, АМФ, ГМФ
Ингибирование АМФ Аденило-^*Мф сукцинат
Фосфо рибозиламин
Ксантилати^-ГМФ
Ингибирование ГМФ
Рис. 23.5. Регуляция биосинтеза пуриновых нуклеотидов. Ингибиторы синтеза пуриновых нуклеотидов.
происходит синтез пиримидинового основания, а затем остаток рибозы присоединяется к уже сформировавшемуся пиримидиновому кольцу.
1. Происхождение атомов пиримидинового кольца представлено на рис. 23.6.
2. Из глутамина, СО2и АТФ под действием фермента карбамоилфосфатсин-тетазы II в цитозоле практически всех клеток синтезируется карбамоилфосфат (рис. 23,7).
3. Карбамоилфосфат взаимодействует с аспартатом и образуется N-карбамоиласпарагиновая кислота. Фермент — аспартаттранскарбамоилаза.
4. N-карбамоиласпарагиновая кислота подвергается циклизации с отщеплением молекулы воды и дегидрированию. Ферменты: дигидрооротаза и дигидро-эротатдегидрогеназа. Синтезируется кротовая кислота.
5. Оротовая кислота реагирует с ФРПФ с образованием оротидин-5'-монофос-фата (ОМФ). Фермент: оротатфосфо-рибозилтрансфераза.
6. Оротидинмонофосфат необратимо декарбоксилируется под действием оро-тидинмонофосфатдекарбоксилазы (ОМФ -декарбоксилаза) и образуется пиримидиновый нуклеотид — уридинмонофосфат (УМФ).
7. Превращение УМФ в УДФ и УТФ осуществляется, как и в случае пуриновых нуклеотидов, путем фосфорилирования:
УМФ + АТФ +-+УДФ + АДФ
УДФ + АТФ «-►УТФ + АДФ
8, Предшественником цитидиловых нуклеотидов является УТФ. который превращается в ЦТФ с участием фермента ЦТФ-синтетазы, АТФ, Mg2* и глутамина.
343
Глава 23 Обмен нуклеотидов
Карбамоилфосфат-синтетаза ™Н2
С02 + Глутамин +АТФ q=q +
Глутамат 0~Р032
АДФ Карбамоилфосфат
ООС сн2 сн-соо* +H3N
Аспартат
Аспартаттранскарбамоилаза ООСЧ ----------► NH2 i 2
О=СХ /CH-COO" ( \
N НАД* НАДН+Н
ы Н2О
N-карбамоиласпартат е-
9‘ HN
О=Р-О-СН2 0=(1 о.
Оротат-фосфорибозил-трансфераза
Дигидрооротаза Дигидрооротатдеаидрогеназа А НК "СН I 11 z х
О=Ск хС-СОО' ( \
й ФРПФ РРн
О
Оротат
О II HNxC^CH и , /С-СОО-_ N
ОМФдекарбоксилаза*
О=Р-О-СН2 О.
со2
О
А
HN" ''СН Киназа
О=С^.^СН <^*"УДФ
АТФ ддф
ОН ОН
Оротидин-5’-монофосфат (ОМФ)
ОН он
Уридинмонофосфат (УМФ)
Киназа
^7^УТФ
АДФ <1
Глутамин, АТФ
ЦТФ-синтетаза
’о
Глутамат, АДФ, Рн
NH2
/С^ ОН и
0 9
“О-Р-О-Р-О-Р-О-СН2 О_А о. о. о.
ЦТФ ОН ОН
Тимидилат-синтаза удф----► дудф —► думф———
о-
* о=р-о-сн2 o=i
О
Nt-FxC-CH3 и J
№,М10-метилен- Дигидрофолат
тетрагидрофолиевая кислота
О.
Дигидрофолат-редуктаза
ОН Н
ТМФ
Рис. 23.7. Синтез пиримидиновых нуклеотидов.
344
Обмен нуклеотидов Глава 23
Синтез дезоксирибонуклеотидов
Для синтеза ДНК в качестве субстратов необходимы дезоксирибонуклеотиды: дАТФ, дГТФ, дЦТФ, дТТФ. Де-зоксирибонуклеозидтрифосфаты образуются путем восстановления соответствующих рибонуклеозиддифосфатов в ходе процесса, для которого необходимы:
1) субстраты для восстановления — рибонуклеозиддифосфаты: АДФ, ГДФ, ЦДФ, УДФ;
2) восстановитель рибонуклеотидов — белок тиоредоксин’,
3) ферменты — рибонуклеотидредуктаза и тиоредоксинредуктаза’,
4) наличие НАДФН — донора восстановительных эквивалентов в реакции регенерации дисульфидной формы тиоре-доксина в сульфгидрильную.
Восстановление рибонуклеотидов в дезоксирибонуклеотиды заключается в восстановлении рибозы в дезоксирибозу, что требует наличия двух атомов водорода и источника восстановительных эквивалентов — белка тиоредоксина, содержащего две свободные SH-группы (рис. 23.8).
Тиоредоксин представляет собой небольшой термостабильный белок (11,7 кДа), состоящий из полипептидной цепи с одной внутрицепочечной дисуль-
фидной связью
Фермент тиоредоксинредуктаза катализирует НАДФН-зависимое восстановление: -S—S- -SH+HS- с образованием восстановленного тиоредоксина.
Образующиеся в процессе биосинтеза дАДФ, дГДФ, дЦДФ фосфорилируются в нуклеотидкиназной реакции до дАТФ, дГТФ, дЦТФ.
Для синтеза тимидиловых нуклеотидов требуется метилированное производное урацила — тимин. В клетках имеется фермент — тимидилатсинтаза, который катализирует метилирование дезоксиУМФ.
Донором метильной группы в тимидилатсинтазной реакции является N5, М10-метилен-ТГФК, которая превращается в дигидрофолиевую кислоту (ДГФК). Последняя восстанавливается до ТГФК под действием НАДФН-зави-симой дигидрофолатредуктазы. Из обра
Рис. 23.8. Превращение рибозы в дезоксирибозу.
345
Глава 23 Обмен нуклеотидов
зовавшегося ТМФ путем фосфотрансфе-разных реакций образуются дТДФ и дТТФ.
Регуляция синтеза пиримидиновых нуклеотидов
1. Карбамоилфосфатсинтетаза ингибируется УТФ и УДФ и активируется фосфорибозилпирофосфатом и АТФ.
2. Аспартаттранскарбамоилаза аллосте-рически ингибируется ЦТФ.
3. Скорость биосинтеза пиримидиновых нуклеотидов коррелирует со скоростью синтеза пуриновых нуклеотидов через фермент фосфорибозилпирофос-фатсинтетазу, который ингибируется по принципу обратной связи пуриновыми и пиримидиновыми нуклеотидами.
Распад пуриновых нуклеотидов
1. Нуклеотидмонофосфаты превращаются в соответствующие нуклеозиды под действием нуклеозидаз; последние подвергаются ферментативному распаду в организме животных до образования конечного продукта — мочевой кислоты, которая выводится из организма с мочой. Мочевая кислота является антиоксидантом.
2. Аминогруппа из аденозина удаляется под действием дезаминазы и образуется инозин.
3. Инозин и гуанозин превращаются в гипоксантин и гуанин, соответственно.
4. Гуанин подвергается дезаминированию под действием гуаназы до ксантина.
5. Ксантиноксидаза превращает гипоксантин в ксантин и ксантин в мочевую кислоту (рис. 23.9).
Нарушения обмена пуриновых нуклеотидов
Подагра. При pH 5,75 в растворенном состоянии находят мочевую кислоту и ее натриевую соль (урат натрия) в эквимолярных количествах. При рН< 5,75 основной формой является мочевая кислота, при рН> 5,75 — урат натрия. О величине растворимого уратного пула можно судить по содержанию урата натрия в сыворотке крови (в норме 20-60 мг/л). При повышении этого показателя (гиперурикемия) и сдвиге pH в кислую сторону образуются кристаллы, чаще всего ведущие к острому или хроническому подагрическому артриту. В водных растворах мочевая кислота в 17 раз менее растворима, чем ее натриевая соль. При pH 5,0 насыщенный раствор уратов достигается при концентрации 150 мг/л, а при pH 7,0 в моче может раствориться в 10 раз больше уратов. Следовательно, интенсивность образования камней мочевой кислоты в мочевыводящих путях можно уменьшить, смещая pH мочи в щелочную сторону.
Ксантиноксидаза, молибден- и железосодержащий флавопротеиновый фермент, окисляет гипоксантин в ксантин и затем в мочевую кислоту. Молекулярный кислород, оксидант в обеих реакциях, восстанавливается в Н2О2, которая обезвреживается каталазой. Мочевая кислота теряет протон при физиологическом значении pH и формирует ураты.
У человека ураты являются конечным продуктом обмена пуринов, экскретируемым с мочой.
346
Обмен нуклеотидов Глава 23
347
Глава 23, Обмен нуклеотидов
В лечении подагры используют диету, бедную пуринами, а также аналог гипоксантина — аллопуринол (рис. 23.10). Этот препарат вначале действует в качестве субстрата ксантиноксида-зы, а затем в качестве ее ингибитора (фермент гидроксилирует аллопуринол, превращая его в аллоксантин, который остается прочно связанным с активным центром). Это пример самоубийственного ингибирования, когда фермент превращает какое-то соединение в мощный ингибитор, который сразу же инактивирует фермент.
Рис. 23.10. Аллопуринол.
Синдром Леша-Нихана (Lesch-Nyhan) — отсутствие гипоксантин-гуанин-фосфорибозилтрансфера-зы — ГГФРТ. Синдром Леша-Нихана был первым описанным психиатрическим заболеванием, обусловленным дефектом специфического гена. Наследуется как сцепленный с Х-хромосомой рецессивный признак. Болезнь характеризуется корковым параличом, стремлением к членовредительству, тяжелой гиперурикемией, склонностью к образованию камней мочевой кислоты в мочевыводящих путях. Избыточное образование пуринов у пациентов с недостаточностью ГГФРТ связано с увеличенной внутриклеточной концентрацией
фосфорибозил пирофосфата, что является результатом уменьшения его потребления на пути регенерации пуриновых нуклеотидов. Биохимические механизмы неврологических отклонений при этом синдроме не известны. Больные умирают в возрасте до 30 лет. В настоящее время не существует эффективного лечения.
Циркулирующая ксантиноксидаза. Ксантиноксидаза является цитозольным ферментом, локализованным в основном в печени и кишечнике. Различные патологические состояния приводят к высвобождению ксантиноксидазы в системный кровоток, где фермент связывается и концентрируется на сосудистом эндотелии. Циркулирующая ксантиноксидаза осложняет патологические ситуации при повреждениях тканей, вызванных окислительным стрессом (ишемия-реперфузия, острая легочная недостаточность, атеросклероз, гипертензия, хронический алкоголизм).
Ксантинурия, дефицит молибдена и циркулирующей ксантиноксидазы. Наследственная ксантинурия классифицируется на 3 группы: классическая ксантинурия I и II типов и дефицит молибденового кофактора. При классической ксантинурии I типа отмечается снижение активности только ксантиноксидазы, при классической ксантинурии II типа — дефицит ксантиноксидазы и альдегидокси-дазы, при дефиците молибденового кофактора снижается активность всех молибденсодержащих ферментов — сульфитоксидазы, ксантиноксидазы и альдегидокси-дазы. I и II типы ксантинурии встречаются редко. Это аутосом-
348
Обмен нуклеотидов Глава 23
но-рецессивное заболевание, характеризующееся образованием камней в мочевом тракте, острой почечной недостаточностью и миозитами из-за накопления мочевой кислоты в тканях. У лиц с гомозиготными мутациями заболевание часто протекает бессимптомно. Дефицит молибденового кофактора обычно сопровождается тяжелыми неврологическими расстройствами, задержкой умственного развития и нарушениями хрусталика глаза. Патология обусловлена токсичностью сульфитов и/или недостаточным количеством неорганического сульфата, необходимого для синтеза сульфатных ком-понентов мозга. Дефект характеризуется низким уровнем мочевой кислоты (низкая активность ксантиноксидазы и альдеги-доксидазы) и неорганического фосфата.
Синдром лизиса опухоли. Синдром лизиса опухоли является серьезным осложнением химиотерапии или радиотерапии и включает гипе-рурикемию, гиперкалиемию, гиперфосфатемию и гипокальциемию из-за массивного лизиса клеток.
Развивается острая почечная недостаточность как следствие нефропатии, обусловленной накоплением мочевой кислоты. К факторам риска синдрома лизиса опухоли относятся тяжелые осложненные опухоли, быстрый распад клеток и поражение почек опухолевыми клетками. Терапия включает адекватную внутривенную гидратацию для сохранения объема мочи, повышение pH мочи введением бикарбонатов и ингибирование продукции мочевой кислоты высокой дозой аллопуринола.
Распад пиримидиновых нуклеотидов
Конечными продуктами распада пиримидиновых нуклеотидов является водорастворимые продукты: СО2, NHp р-ала-нин и ft-амино изомасляная кислота.
Последовательность ферментативных реакций гидролиза пиримидиновых нуклеотидов можно представить в виде схемы (рис. 23.11).
Продукты катаболизма пиримидинов либо выводятся из организма, либо повторно утилизируются в других метаболических процессах. Например, р-ала-
+Н2О
-NH3 -NH3
+Н2О -СО2
Цитозин--------Урацил ..........р-аланин
-NH3
-СО2
Тимин --------► р-аминоизомасляная кислота
Рис. 23.11. Катаболизм пиримидинов.
349
Глава 23 Обмен нуклеотидов
нин используется при биосинтезе пантотеновой кислоты, которая необходима для синтеза кофермента А и ацилпереносящего белка, участвующего в синтезе жирных кислот.
Использование ингибиторов синтеза нуклеотидов
Опухолевые клетки характеризуются более быстрым ростом, чем клетки нормальных тканей. Поэтому в этих клетках потребности в нуклеотидах для синтеза ДНК и РНК значительно выше, чем в нормальных клетках и, следовательно, они более чувствительны к ингибиторам биосинтеза нуклеотидов.
Первая группа ингибиторов включает вещества, которые ингибируют амидо трансферазу. Глутамин является донором азота для более, чем половины реакций синтеза нуклеотидов. Наиболее сильными ингибиторами фермента являются аналоги глутамина азасерин и ацивицин. Азасерин, описанный в 1950 г., был одним из первых ингибиторов ферментов. Ацивицин используется как препарат в химиотерапии.
Другой мишенью для фармацевтических препаратов являются ферменты тимидилатсинтаза и дигидрофолат редуктаза. Ингибитором тимидилатсинта-зы является фторурацил — наиболее важный химиотерапевтический препарат. Фторурацил сам не является ингибитором фермента, но в клетках он превращается в фтордезоксиуридиловую кислоту (F-дУМФ). Этот аналог дУМФ необратимо ингибирует тимидилатсин-тазу. Известно, что образование ТМФ требует удаления протона от С-5 нуклеотида. Поскольку фермент не может
удалить протон из F-дУМФ, то реакция блокируется.
К ингибиторам дигидрофолатредук-тазы относятся метотрексат и аминоптерин. Метотрексат является аналогом фолиевой кислоты и действует как конкурентный ингибитор; сродство метотрексата к ферменту в 100 раз выше, чем дигидрофолата (рис. 23.11).
Метотрексат является лекарством для лечения быстрорастущих опухолей (острая лейкемия, хорионкарцинома, рак из клеток плаценты). Метотрексат убивает быстро реплицирующие клетки независимо от того малигнизированы они или нет. Стволовые клетки костного мозга, эпителиальные клетки кишечника и клетки волосяных фолликулов уязвимы при введении метотрексата, что вызывает осложнения в виде подавления системы иммунитета, рвоты, облысения.
Фолиевая кислота необходима для синтеза пуриновых нуклеотидов. Сульфаниламидные препараты являются структурными аналогами парааминобен-зойной кислоты и ингибируют ее синтез у микроорганизмов. Сульфаниламиды не действуют на организм человека, поскольку фолиевая кислота не синтезируется у человека, а поступает с пищей.
Аналоги фолиевой кислоты типа триметоприма (рис. 23.12) являются потенциальными антибактериальными и анти-протозойными препаратами. Триметоприм связывается в 105 раз менее прочно с ди-гидрофолатредуктазой тканей млекопитающих, чем с редуктазой чувствительных к препарату микроорганизмов. Это позволяет препарату оказывать селективное антимикробное действие. Комбинация триметоприма с сульфамидными препаратами используется при лечении инфекций.
350
Обмен нуклеотидов Глава 23
Рис. 23.11. Ингибирование ферментов в противоопухолевой терапии.
351
Глава 24
Нуклеиновые кислоты
Нуклеиновые кислоты были впервые выделены Ф. Мишером в 1869 г, из ядер клеток гноя в виде соединения с белком — нуклеина (от лат. nucleus — ядро); термин «нуклеиновые кислоты» предложен А. Косселем в 1889 г. К концу XIX века нуклеиновые кислоты были получены Р. Альтманом в свободном от белка состоянии из животных тканей и дрожжей, а в 1936 г. А. Н. Белозерским и сотрудниками были выделены нуклеиновые кислоты из растительных тканей.
Нуклеопротеины
Нуклеопротеины — сложные белки, которые состоят из белковой части и небелковой части — простетической группы, которая представлена нуклеиновыми кислотами. Существует 2 типа нуклеопротеинов, которые отличаются по составу, размеру и физико-химическим свойствам: дезоксирибонуклеопротеины (простетическая группа ДНК) и ри-бонуклеопротеины (простетическая группа РНК). Дезоксирибонуклеопротеины преимущественно локализованы
в ядре клеток и в митохондриях. Рибонуклеопротеины — в цитоплазме, ядре и ядрышках.
Функция ДНК состоит в хранении генетической информации, РНК — передаче наследственной информации.
Белковая часть нуклеопротеинов представлена гистонами и негистоновыми белками. Различают 5 классов гистонов (Hl, Н2А, Н2В, НЗ и Н4), которые различаются по размерам, аминокислотному составу и заряду. Гистоновые белки имеют положительный заряд, который обусловлен наличием положительно заряженных аминокислот — аргинина и лизина. Негистоновые белки представлены сложными белками-ферментами, а также регуляторными белками и являются кислыми, т. е. имеют отрицательный заряд.
ДНК и геном
Нуклеиновые кислоты — полимеры, мономерами которых являются нуклео
352
Нуклеиновые кислоты Глава 24
тиды. Важной характеристикой природной ДНК являемся ее длина. ДНК вируса полиомы, вызывающего раковую опухоль, составляет 5100 нуклеотидов. Можно подсчитать информационную мощность такой молекулы. В каждой позиции ДНК может быть один из четырех нуклеотидов, что соответствует двум битам информации (22= 4); для цепи из 5100 нуклеотидов информация соответствует 2x5100= 10200 битам, или 1275 байтам (1 байт= 8 бит). Геном Е. coll представлен молекулой ДНК, включающей 4,6 миллиона нуклеотидов, что соответствует 9,2 миллиона бит, или 1,15 мегабайт информации (одна дискета). У высших организмов ДНК больше. В геноме человека примерно 3 миллиарда пар нуклеотидов, разделенных между 24 различными молекулами ДНК, входящими в состав 22 аутосомных, а также X и Y половых хромосом разного размера.
Виды и функции ДНК
Основные функции ДНК по А. Ленинджеру: 1) хранение запаса генетической информации, необходимой для кодирования структуры всех белков и всех РНК каждого вида организма; 2) регуляция во времени и пространстве биосинтеза компонентов клеток и тканей; 3) определение деятельности организма в течение его жизненного цикла; 4) обеспечение индивидуальности данного организма.
Различают следующие основные виды ДНК: 1) ядерные (хромосомные) ДНК; 2) ДНК плазмид; 3) ДНК хлоропластов; 4) ДНК митохондрий; 5) ДНК вирусов.
Ядерная ДНК локализована в ядре эукариотической клетки. Аналогом ядерной ДНК у бактерий служит гено-фор, или нуклеоид, который представляет собой кольцевидно замкнутую ДНК, не отделенную от цитоплазмы мембра
ной. Нередко генофор называют бактериальной хромосомой.
Молекулы ядерных ДНК содержат основной объем информации обо всех наследственных признаках организма. Их функция — хранение этой информации, обеспечение ее экспрессии и рекомбинации, а также воспроизводство при делении клетки и передача последующим поколениям организма.
ДНК плазмид — это обычно кольцевидно замкнутые молекулы ДНК небольшого размера, находящиеся в цитоплазме. Несмотря на небольшой объем содержащейся в них наследственной информации, ДНК плазмид играют важную роль в явлениях наследственности и изменчивости организмов, прежде всего бактерий и грибов. Плазмидные ДНК — это относительно автономные структуры: они способны реплицироваться независимо от ядерной ДНК, а также переходить из одной клетки в другую в процессе их контактов. Эту способность используют инженеры-генетики для переноса наследственной информации из одних организмов в другие.
ДНК хлоропластов находятся в пластидах растений. Они несут информацию о белках и РНК, необходимых для нормальной работы фотосинтетического аппарата растительной клетки. Поскольку хлоропласты растений обладают автономным аппаратом для синтеза белка, то роль этих ДНК отчасти аналогична функциям ядерной ДНК.
ДНК митохондрий, подобно ДНК хлоропластов, обеспечивают автономный синтез белка, который протекает в митохондриях. Несмотря на известную автономность, функционирование ДНК хлоропластов и ДНК митохондрий четко координировано с деятельностью ядерной ДНК. Эти виды ДНК в совокупности образуют единый наследственный аппарат эукариотической клетки
ДНК вирусов. Значительная часть вирусов бактерий (бактериофагов), животных и человека принадлежит к ДНК-содержашим вирусам. Например, возбудители оспы человека, герпеса, гепатита В — ДНК-содержашие вирусы. Гораздо меньше их (не более 3 ЯЕ) среди вирусов растений и грибов.
Вирусные ДНК несут относительно небольшой объем наследственной информации (от 10 до 150 генов), обеспечивающей циркуляцию
353
Глава 24 Нуклеиновые кислоты
этих паразитов в природе, в частности инфицирование клетки-хозяина.
Подобно плазмидным ДНК, вирусные ДНК обладают способностью «путешествовать» между клетками и встраиваться (интегрироваться) в их ДНК. Поэтому ДНК-содержащие вирусы находят применение в качестве носителей наследственной информации в генно-инженерных разработках.
Первичная структура нуклеиновых кислот
Нуклеотиды в нуклеиновых кислотах связаны 3',5'-фосфодиэфирной связью, которая возникает между З'-ОН группой углевода одного нуклеотида и 5'-ОН группой углевода другого нуклеотида (рис. 24.1).
РНК — одноцепочечная молекула. Однако при наличии в цепи РНК участков с комплементарной последовательностью единичная цепь РНК способна сворачиваться с образованием так называемых «шпилек», структур, имеющих двуспиральные характеристики.
Вторичная структура ДНК
Для понимания ряда особенностей вторичной структуры ДНК важное значение имеют закономерности количественного содержания азотистых оснований, установленные впервые Э. Чаргаффом в 1949 г. и названные правилами Чаргаффа:
1. Количество пуриновых оснований равно количеству пиримидиновых оснований
А + Г = Ц + Т или
ц+т
2. Количество аденина и цитозина равно количеству гуанина и тимина:
А + Ц « Г + Т или
3. Количество аденина равно количеству тимина, а количество гуанина равно количеству цитозина:
А = Т и Г = Ц; соответственно
4. Коэффициент специфичности, который отражает
Г + Ц.
А+Т’
для эукариот этот коэффициент ниже единицы (0,54—0,94), для прокариот — выше единицы.
В соответствии с моделью Дж. Уотсона и Ф. Крика, предложенной в 1953 г. на основании ряда аналитических данных, а также рентгеноструктурного анализа, молекула ДНК состоит из 2-х цепей, образуя правовращающую спираль, в которой обе полинуклеотид-ные цепи закручены вокруг одной и той же оси. Удерживаются полинуклеотид-ные цепи водородными связями, образующимися между комплементарными азотистыми основаниями: между А и Т — две водородные связи, Ци Г — три водородные связи.
Азотистые основания расположены внутри спирали, а фосфорные остатки и углеводные компоненты — снаружи. Кроме водородных связей в стабилизации молекулы ДНК принимают участие силы гидрофобного («стэкинг») взаимодействия, образующегося между плоскостями оснований внутри двойной спирали ДНК (рис. 24.2).
Обе цепи в молекуле ДНК имеют противоположную полярность (антипарал-лельны). Это означает, что одна цепь имеет направление 5'“* 3', а другая 3’->5'. Подобная направленность цепей играет важную биологическую роль при репликации и транскрипции молекулы ДНК.
354
Нуклеиновые кислоты Глава 24
Конфигурация двойной спирали ДНК меняется в зависимости от количественного содержания в ней воды и тонной силы окружающей среды. В настоящее время известно шесть форм ДНК (от А до Е и Z-форма). При фи
зиологических условиях доминирующим структурным типом ДНК является В-форма. Расстояние между витками спирали (или шаг спирали) равно 3,4 нм. На этом участке укладывается 10 нуклеотидных остатков, размер одного
355
Глава 24 Нуклеиновые кислоты
нуклеотида составляет 0,34 нм, диаметр биспиральной молекулы 1,8 нм. В структуре ДНК различают большую и малую бороздки, закрученные вокруг оси молекулы параллельно фосфоди-эфирному остову (рис. 24.3). Расположение пар нуклеотидов со стороны большой и малой бороздок представлено на рис. 24.4. В этих бороздках белки могут специфически взаимодействовать с определенными атомами нуклеиновых оснований.
В молекуле ДНК встречаются последовательности, которые называются
Рис. 24.3. Большая и малые бороздки В-фор-мы ДНК.
палиндромами. Палиндром — это слово, фраза или предложение, которые читаются одинаково слева направо и справа налево. Например, «ротатор», «я иду с мечем судия». Этот термин используется к области ДНК с обратимой последовательностью нуклеотидов, имеющих двойную симметрию внутри двухцепочечной ДНК. Такие последовательности комплементарны сами себе внутри каждой цепи и поэтому в этих местах могут образовываться шпильки или крестообразные структуры (рис. 24.5. и 24.6).
Если обратимая последовательность наблюдается внутри каждой цепи, такая последовательность называется зер-
356
Нуклеиновые кислоты Глава 24
Сторона большой бороздки
Сторона большой бороздки
Сторона малой бороздки Аденин-Тимин
Сторона малой бороздки Гуанин-Цитозн
Рис. 24.4. Расположение пар нуклеотидов со стороны большой и малой бороздок (Berg J. М., Tymoczko J. L., Stryer L, с изм.).
Зеркальная последовательность
Рис. 24.5. Палиндром и зеркальная последовательность.
кальной последовательностью. Зеркальные последовательности не комплементарны внутри одной цепи и не могут образовывать шпильки или крестообразные структуры. Такие последовательности образуются обычно в очень больших молекулах ДНК и могут
включать от нескольких до тысяч пар оснований.
Среди разнообразных конформаций ДНК различают линейную ДНК и кольцевидно замкнутую ДНК. Кольцевидная структура ДНК характерна для бактерий и некоторых вирусов.
357
Глава 24 Нуклеиновые кислоты
Рис. 24.6. Образование шпилек и крестообразной структуры.
358
Нуклеиновые кислоты Глава 24
Третичная структура ДНК
ДНК в клетке имеет длину 1,74 м, поэтому понятно, что в ядре происходит упаковка ДНК.
Третичная структура ДНК прокариот может образовываться в результате дополнительного скручивания в пространстве двуспиральной молекулы с образованием суперспирали или супер-колъца.
У высших организмов ДНК находится в хромосомах, которые при митозе видны в световой микроскоп. В каждой хромосоме находится молекула ДНК, которая составляет основу хроматина. Хроматин — комплекс ДНК с РНК и белками (ДНК 30—45 %, гистоны 30— 50 %, негистоновые белки 4—30 %, РНК до 10 %). Структурная организация хроматина такова, что позволяет использовать одну и ту же генетическую информацию ДНК по-разному в специализированных клетках. При этом основная часть хроматина не активна. Активный хроматин составляет в разных клетках от 2 до 11 %. Различают несколько уровней укладки (компактиза-лии) ДНК.
1. Нуклеосомы. В электронном микроскопе изображение хроматина напоминает бусы: шаровидные утолщения размером около 10 нм, разделенные перемычками. Каждая нуклеосома содержит отрезок двуспиральной ДНК, равный по протяженности примерно 145—150 парам оснований, обернутый в 1,5 оборота вокруг ядра, состоящего из гистонов (2 Н2А, 2 Н2В, 2 НЗ и 2 Н4). Свободные от контакта с белками участки ДНК называют линкерными (или связующими). Их длина варьирует в за-зисимости от типа клеток (от 15 до 100 нм). Линкерные участки ДНК либо свободны, либо контактируют с гистонами Н1. Степень компактизации в 5 :аз. Примерно 90 % ДНК входит в состав нуклеосом, 10 % содержится в пе
ремычках между нуклеосомами. Считают, что нуклеосомы содержат фрагменты «молчащего» хроматина, а перемычки — активного. При развертывании весь хроматин активный.
Межнуклеосомный разрыв ДНК — способ запрограммированной гибели клеток — апоптоз.
Из нуклеосом образуются фибриллы (рис. 24.7).
2. Фибриллы толщиной 10 нм состоят из ряда нуклеосом, касающихся друг друга своими краями и ориентированных плоскими поверхностями вдоль оси фибриллы. Эта структура называется соленоид. Компактизация в 40 раз.
3. Фибриллы скручиваются в спираль, на виток которых приходится 6—7 нуклеосом. Этому способствуют гистоны Н1, которые сближают соседние нуклеосомы, формируя регулярную структуру. В результате образуется хроматиновое волокно диаметром 30 нм.
4. Для того, чтобы образовалась митотическая хромосома нормального размера, волокно диаметром 30 нм должно подвергнуться дополнительной компактизации с результирующим уменьшением длины еще в 100 раз. В этом процессе участвуют ДНК-связывающие белки.
Транскрипционно-неактивный хроматин (гетерохроматин) плотно упакован и поэтому соответствующие области интенсивно окрашиваются. Участки транскрипционно-активного хроматина (эухро-матина) имеют более слабую окраску.
Денатурация и ренатурация ДНК
Двухцепочечные структуры ДНК при нагревании, экстремальных значениях pH, обработке мочевиной и др. могут переходить в форму
359
Глава 24 Нуклеиновые кислоты
Н1
Гистоновый октамер
] ДНК
Рис. 24.7. Нуклеосомы.
неупорядоченных клубков — денатурация ДНК. Раствор нативной ДНК при 260 нм имеет оптическую плотность на 40 % ниже оптической плотности смеси нуклеотидов или отдельных цепей ДНК. Это явление называют гиперхромным эффектом. Поэтому о денатурации ДНК судят по увеличению поглощения ультрафиолета при 260 нм. Гиперхромный эффект проявляется в узком диапазоне температур — точка плавления (80~85°С). Денатурация обратима, если остались спирализованные участки ДНК. Восстановление структуры ДНК после удаления денатурирующего фактора (за счет комплементарного
спаривания оснований нуклеотидов) называется ренатурацией (ренативация ДНК, отжиг ДНК). На явлении денатурации-ренативации основан метод гибридизации. Известны гибридные двухцепочечные молекулы: РНК-ДНК, образуются как промежуточные формы при действии обратной транскриптазы: ДНК-РНК на короткое время в процессе транскрипции ДНК. В процессе трансляции и транскрипции происходит разделение цепей ДНК.
Виды и функции РНК
Все типы РНК предназначены для снятия информации о структуре белка с
360
Нуклеиновые кислоты Глава 24
ДНК и обеспечения биосинтеза белка в соответствии с этой информацией. РНК является одиночной полинуклеотидной цепью, построенной из четырех основных типов рибонуклеотидов — АМФ, ГМФ, ЦМФ и УМФ. Для РНК характерны минорные нуклеотиды с необычными азотистыми основаниями — ди гидроурацил, 3-метилурацил, 1-метил-гуанин и др. (до 50 типов). Особенно их много в аминоацил-т-РНК (до 10 % от всех нуклеотидов). В РНК содержание аденина и гуанина не соответствует содержанию урацила и цитозина.
Различают следующие типы РНК:
1. Матричные, или информационные, РНК (м- или и-РНК), м. м. 25000— 1000000 Да, состоят из 75—300 нуклеотидов, синтезируются в ядре из пре-м-РНК; составляют 5—7 % от всей клеточной РНК. Период полужизни несколько минут. На 5'-конце всех эукариотических мРНК имеется особая структура, называемая «кэпом». Кэп представляет собой 7-метилгуанозинтри-фосфат. Образование кэпа происходит ферментативным путем в ядре еще до завершения транскрипции. Считается, что кэп, с одной стороны, предохраняет S'-конец мРНК от ее расщепления 5'-эк-юнуклеазами, с другой стороны, используется для специфического узнавания в . лстеме трансляции. За кэпом следует не-лранслируемый участок (от 3—15 нукле-
7 илов до инициирующего кодона), в котором располагается последовательность клеотидов, комплементарная последовательности рРНК. Ее роль — обеспечение правильного взаимодействия 5'-кон-_т с рибосомой. Завершается рзнслируемый участок терминирующим - удоном, за которым часто следует гек-. ^нуклеотид ААУААА. У большинства
РНК 3'-конец содержит полиаденилат--ую цепочку из 20—250 адениловых - .клеотидов, не являющуюся результа-?м транскрипции, а присоединяющую
ся ферментативным путем к мРНК в ходе ее созревания в ядре. Предполагается, что полиаденилатная последовательность отвечает за поддержание внутриклеточной стабильности мРНК, определяет ее время существования. Кодовым элементом является триплет нуклеотидов (кодон), кодирующий аминокислоту. Показано, что в линейной молекуле мРНК формируется несколько двухспиральных шпилек, на концах которых располагаются «знаки» инициации и терминации транскрипции. Во вторичной структуре — изогнутая цепь; по некоторым данным в третичной структуре полинуклеотидная цепь связана (намотана) с транспортным белком информофером.
2. Транспортные РНК (тРНК) — около 15 %. Транспортные РНК обладают небольшой молекулярной массой (25 000) и содержатся в растворимой фракции цитоплазмы, выполняя функцию переноса аминокислот к месту синтеза белка — рибосоме. Первичные структуры тРНК содержат около 75 нуклеотидов. В клетке насчитывается не менее 20 видов молекул тРНК. Каждый или несколько видов тРНК соответствуют одной из 20 аминокислот, необходимых для биосинтеза белка. Вторичная структура всех тРНК напоминает «клеверный лист» (рис. 24.8.) и имеет 4 основных участка и добавочную петлю: 2.1. Акцепторный участок имеет на 3' конце последовательность нуклеотидов ЦЦА. К 3'-гидроксильной группе рибозы аденозильного остатка происходит присоединение карбоксильной группы аминокислоты. Транспортные РНК, соединенные с аминокислотами, называют аминоацил-тРНК (аатРНК). Они выполняют адаптерную функцию при переводе трехбуквенного кода нуклеиновых кислот в 20-буквенную последовательность аминокислот в полипептидной цепи (всего 61 аминоацил-тРНК).
361
Глава 24 Нуклеиновые кислоты
3’
Антикодоновая петля
Рис. 24.8. Строение тРНК.
2.2. Антикодоновая петля содержит специфический для каждой тРНК триплет нуклеотидов (антикодон) и служит для спаривания с соответствующим кодоном мРНК.
2.3. Псевдоуридиновая петля (ТУС) состоит из 7 нуклеотидов и содержит остаток псевдоуридина; служит для связывания тРНК с рибосомой.
2.4. Дигидроуридиновая петля (D) состоит из 8—12 нуклеотидных остатков. Необходима для связывания с амино-ацил-тРНК-синтетазой, которая участвует в узнавании аминокислотой своей тРНК.
2.5. Добавочная петля представляет собой наиболее вариабельную структуру и служит основой классификации тРНК: тРНК класса 1 (75 % от их общего числа) обладают дополнительной петлей в 3-5 пар оснований, тРНК класса 2 в этой петле содержат 13—21 пару оснований и часто включают неспаренную петлю.
Третичная структура представлена пространственной структурой в виде локтевого сгиба (L-форма).
3. Рибосомные РНК (р РНК) - 80-85 %, имеют разную и значительно большую молекулярную массу (35000—1000000.
362
Нуклеиновые кислоты Глава 24
что соответствует 100—3100 нуклеотидам), являются структурными компонентами рибосом. Вторичная структура представлена спиральными участками, соединенными изогнутой одиночной цепью. Третичная структура рРНК — скелет рибосомы, имеет форму палочки или клубка; снаружи находятся рибосомальные белки.
Рибосомы обеспечивают специфический контакт мРНК и тРНК, в результате которого и происходит трансляция нуклеотидной последовательности, считанной с определенного гена, в аминокислотную последовательность соответствующего белка. Рибосомы млекопитающих состоят из 2-х нуклеопротеиновых субъединиц — большой с константой седиментацией 60S и малой — 40S (у прокариот — соответственно 50S и 30S). 605-субьединица содержит 58-ри-оосомную РНК (рРНК), 5,8S-pPHK и 28S-рРНК. Малая, 408-субъединица включает единственную 18S-pPHK и около 30 полипептидных лепей. Все рибосомные РНК, за исключением 5S РНК, имеют общего предшественника — 45S-PHK, локализованную в ядрышке. В ядрышке происходит упаковка высокометилированных рибосомных РНК с рибосомными белками.
Прокариотические рибосомы и рибосомы читохондрий содержат меньше компонентов, чо структурно и функционально очень сходны с эукариотическими. Вторичная структура □РНК образуется за счет коротких двуспиральных участков молекулы — шпилек. Около 2/3 □РНК организовано в шпильки, 1/3 — представлена однотяжевьтми участками, богатыми "уриновыми нуклеотидами, с которыми пре-'мущественно связываются белки. Белки ри-5осом, подобно гистонам, обладают основным характером, выполняют как структурную, так и ферментативную роль.
4. Гетерогенные ядерные РНК (предшественник цитоплазматической мРНК), которые являются первичными транскриптами, образуются в эукариотических клетках, подвергаются процессингу в ядре. В результате образуются зрелые мРНК, которые поступают в цитоплазму и служат матрицей для биосинтеза белка. Молекулярная масса 107Да.
5. Малые ядерные РНК (мяРНК), которые непосредственно не участвуют в синтезе белка, но могут оказывать влияние на процессинг РНК, в частности на этапе вырезания неинформационных участков пре-мРНК.
Содержание основных типов РНК в клетке: рРНК>тРНК>мРНК. В качестве примера приведены характеристики бактериальных РНК (табл. 24.1).
Методы исследования нуклеиновых кислот
(по Berg J. М., Tymoczko J. L., Stryer L., 2002)
Быстрый прогресс молекулярной биотехнологии основан на использовании основных пяти биохимических технологий.
1. Рестрикционный анализ ДНК. Рестрикта-зы — специфичные ножницы, разрезающие полинуклеотидные цепи в строго определенных местах.
2. Блоттинг. Саузерн- и Нозерн-блоттинг технологии используются для выделения и анализа ДНК и РНК, соответственно.
3. Секвенирование ДНК Точная последовательность нуклеотидов в полинукаеотидных цепях ДНК позволяет знать строение генов, контроль
Таблица 24.1. РНК кишечной палочки (Е. coli)
Тип Относительное содержание, % Коэффициент седиментации (S) Масса, кДа Количество нуклеотидов
□РНК 80 23 1200 3700
16 550 1700
5 36 120
-°нк 15 4 25 75
мрНК 5 гетерогенная
363
Глава 24 Нуклеиновые кислоты
их экспрессии и структуру синтезированного по программе определенного гена белка.
4. Синтез нуклеиновых кислот. Знание по-линуклеотидных последовательностей позволяет синтезировать фрагменты нуклеиновых кислот.
5. Полимеразная цепная реакция (ПЦР) позволяет в миллиард раз увеличивать концентрацию сегмента ДНК. Одна молекула ДНК может быть амплифицирована (размножена) до концентрации, когда ее можно будет изучать физико-химическими способами.
Все эти технологии требуют шестого компонента, а именно мощного компьютерного обеспечения.
Рестриктазы
Рестриктазы — это эндонуклеазы, которые узнают специальные последовательности в двойной спирали ДНК и катализируют гидролиз связей между строго определенными нуклеотидами на обеих цепях. Они необходимы для анализа структур хромосом, секвенирования очень длинных молекул ДНК, изоляции генов и создания новых рекомбинантных молекул ДНК. Эти ферменты были открыты в конце 60-х годов прошлого века у прокариот. Их биологическая роль заключается в уничтожении чужеродных ДНК. Собственная ДНК не расщепляется, поскольку места узнавания для собственных рестриктаз на ДНК метилированы. Обычно рестриктазы расщепляют фосфо-диэфирные связи между нуклеотидами в па-линдромных областях (рис. 24.9).
К настоящему времени выделено, очищено и изучено более 100 рестриктаз. Их название состоит из 3-х букв из названия микроорганизма (например, Есо от Escherichia coll), характеристики культуры (если необходимо) и номера (если содержится несколько рестриктаз), в итоге £coRI.
Методы исследования продуктов расщепления рестриктазами
Часто молекула ДНК подвергается последовательному действию ряда рестриктаз. Так, кольцевая ДНК туморогенного вируса SV40 расщепляется в 1 месте EcoRI, в 4-х местах Нра! и в 11 местах Hindlll. Образующаяся смесь
♦
5’ ГГАТЦЦ 3’
З’ЦЦТАГГ 5’
♦ 5’ ГААТТЦ 3’
З’ЦТТААГ 5’ 4
I 5’ГГЦЦЗ’
3’ЦЦГГ5’ I
I 5’ ГЦГЦЗ’ 3’Ц1*ЦГ5’
♦ 5’ЦТЦГАГ 3* ЗТАГЦТЦ5’ 4
ВатН1
EcoRI
НаеШ
Hhal
Xhol
Рис. 24.9. Специфичность некоторых рестриктаз. Пары оснований узнаются рестриктазами по отношению к оси симметрии. Две цепи ДНК могут вращаться вокруг этой оси (помечено точкой) на 180°. Симметричные места разрыва цепей помечены стрелками.
фрагментов может быть разделена и визуали-зована методом, который называется фингер-принт (отпечаток пальцев) ДНК. Разделение основано на том, что электрофоретическая под вижность фрагментов пропорциональна логарифму числа пар оснований. Метод позволяет разделить одинаковые фрагменты длиною 100 нуклеотидов и отличающиеся по одному нуклеотиду. Наиболее эффективен двумерный электрофорез в пульсирующем электрическом поле (pulsed-field gel electrophoresis, PFGE). Электрофореграммы окрашивают этидием бромидом, после чего выявляются флуоресцирующие полосы фрагментов ДНК в концентрации более 50 нг (рис. 24.10).
364
Нуклеиновые кислоты Глава 24
₽ис. 24.10. Гель-электрофорез фрагментов ДНК. Показана флуоресценция фрагментов, -слученных при расщеплении разными рест-гиктазами, после окрашивания этидием бромидом (препарат Jeffrey Sklar).
Саузерн-блоттинг
Рестрикционные фрагменты, содержащие спе--лфические последовательности нуклеотидов дентифицируют при гибридизации с меченой элинуклеотидной цепью ДНК с известной хледовательностыо нуклеотидов (рис. 24.11.).
Этот метод позволяет находить мутации С и имеет медицинское значение в вариан-те RFLP (restriction-fragment-length polymorphism) для диагностики генетических заболеваний серповидноклеточной анемии, cystic fibrosis, хорея Гантингтона.
С помощью рестриктаз создают карты хромосом, включающие сотни миллионов пар оснований. После разрыва двух цепей ДНК возникают «липкие концы». Поэтому если обработать две молекулы ДНК одной и той же рестриктазой, можно затем сконструировать гибридную молекулу, благодаря спариванию липких концов.
Секвенирование ДНК
Секвенирование ДНК — это определение нуклеотидной последовательности полинуклеотид-ных цепей. Без знания нуклеотидной последовательности генов невозможно осуществлять молекулярное клонирование. Для секвенирования используют несколько методов.
1. Дидезоксинуклеотидный метод, разработанный Ф. Сэнджером. Дидезоксинуклеотид — это полученный искусственным путем нуклеотид, лишенный 2'- и 3’-гидроксильных групп при углеродных атомах сахара. У дезоксирибонуклеотидов, входящих в ДНК, отсутствует только 2*-гидроксильная группа (дезоксирибоза). Как известно, удлинение цепи во время репликации ДНК происходит в результате присоединения очередного нуклеозидтрифосфата к З'-гидроксильной группе дезоксирибозы последнего нуклеотида растущей цепи. Если же присоединяемым нуклеотидом является дидезоксинуклеотид, то синтез ДНК останавливается, поскольку следующий нуклеотид не может образовать фосфодиэфирную связь. Остановка синтеза ДНК — ключевой этап дидезоксиметода. Для секвенирования в разных пробирках одновременно проводят четыре реакции синтеза ДНК, каждая — в присутствии одного из четырех дидезоксинуклеотидов (ддАТФ, ддГТФ, ддЦТФ и ддТТФ). Продукты реакций разделяют с помощью гель-элект-рофореза, проводят радиоавтографию и «считывают» с радиоавтографа нуклеотидную последовательность синтезированного фрагмента ДНК. Таким методом была впервые описана последовательность нуклеотидов в двойной спирали кольцевой ДНК митохондрий человека (16569 пар оснований), которая кодирует 2 молекулы рРНК. 22 молекулы тРНК и 13 белков. Геном человека включает 3 миллиарда пар оснований.
2. Для секвенирования более пинных генов используют систему на основе фага М13. В ДНК
365
Глава .24 Нуклеиновые кислоты
гель пленка
Рис. 24.11. Саузерн-блоттинг. Показаны четыре этапа. На первом этапе производят электрофорез фрагментов ДНК и их денатурацию (т. е. разделение цепей двойной спирали). На втором этапе разделенные цепи переносят на пленку из нитрата целлюлозы. На третьем этапе добавляют меченый 32Р-фрагмент ДНК-зонд с известной последовательностью нуклеотидов. Происходит гибридизация комплементарных участков разделенной и добавленной ДНК-зонд. На четвертом этапе проводят ауторадиографию и находят положение меченого гибрида разделенной ДНК и меченого ДНК-зонда.
фага встраивают фрагмент ДНК длиной до 500 нуклеотидов, который хотят секвенировать. Эту рекомбинантную ДНК легко получить в одноцепочечной форме и использовать ее в качестве матрицы для секвенирования вставки. Можно использовать также двухцепочечные плазмиды, содержащие клонированную ДНК.
3. Для определения нуклеотидной последовательности протяженных клонированных сегментов сначала подбирают синтетический олигонуклеотидный праймер, комплементарный участку, расположенному рядом со вставкой. Затем с помощью дидезоксиметода секвениру-ют первые 250—300 нуклеотидов. Затем по результатам секвенирования синтезируют второй праймер и определяют последовательность следующих 250—350 нуклеотидов клонированного участка и т. д. Этот метод, называемый «праймер-опосредованной прогулкой» (или «блуждающей затравкой»), позволяет секвенировать протяженные фрагменты ДНК без их субклонирования, как в случае системы на основе фага М13.
Единица измерения 1 kb — это 1000 пар оснований двойной спирали ДНК или 1000 оснований одиночной полинуклеотидной цепи. 1 kb двойной спирали ДНК имеет длину 0,34 мкм и массу около 660 кДа.
В табл. 24.2 представлена история секвенирования генов.
Химический синтез ДНК
Химический синтез ДНК используют для получения 1) одноцепочечных цепей дезоксирибонуклеотидов (олигонуклеотиды) и 2) двухцепочечных цепей ДНК (синтез генов).
Синтез олигонуклеотидов длиной около 5Q нуклеотидов осуществляется с помощью ДНК-синтезаторов с использованием фосфорами-дитного метода. В отличие от биологического синтеза ДНК (присоединение каждого последующего нуклеотида по З'-ОН группе дезоксирибозы), в химическом синтезе каждый новый нуклеотид присоединяется к 5-ОН группе.
366
Нуклеиновые кислоты Гланд 24
Таблица 24.2. Историческая справка о секвенировании ДНК генов (S. В. Primrose, R. М. Twyman, 2003)
Секвенированный ген Год Размер гена Комментарий
i Бактериофаг фх174 1977 5,38 kb Первый ген
! Плазмида pBR322 1979 4,30 kb Первая плазмида
Бактериофаг А 1982 48,5 kb
, Вирус Эпштейн-Барра 1984 172 kb
| Дрожжевая хромосома III 1992 315 kb Первая хромосома
Haemophylus influence 1995 1,8 Mb Первый геном организма-клетки
Saccharomyces cerevisiae 1996 12Mb Первый геном клетки-эукариота
Ceanorhabditis elegans 1998 97 Mb Первый геном многоклеточного организма
Drosophila melanogaster 2000 165 Mb
Arabidopsis thaliana 2000 125 Mb Первый геном растения
Homo sapiens 2001 3000 Mb Первый геном млекопитающего
Pufferfish (Fugu rubripes) 2002 400 Mb Наименьший геном позвоночных
Мышь (Mus musculis) 2002/3 2700 Mb Генетическая модель человека
т. е. 5'-концу олигонуклеотида. Синтезированные олигонуклеотиды используются:
• для конструирования фрагментов или целых енов;
• для амплификации (усиление синтеза) специфических фрагментов ДНК;
• для направленных мутаций изолированных ДНК;
• в качестве зондов при гибридизации (нуклеотидную последовательность зондов длиной 2 j—40 звеньев находят из данных об аминокислотной последовательности соответствующих белков);
• в качестве линкеров, облегчающих клоните вание (линкер — синтетический олиго ну к-еотцд, содержащий сайт рестрикции; исполь-
; ется для соединения векторной и зонируемой ДНК, к концам которой по ме-
?ду сшивания тупых концов присоединены линкеры);
• олигонуклеотиды длиной 17—24 звеньев зужат праймерами при секвенировании ДНК проведении полимеразной цепной реакции ПНР).
Синтез генов из химически синтезирован-- ъгч отдельных комплементарных цепей оли- ’ нуклеотидов: как правило, синтетические г-;-\iieiючечные гены собирают из модулей — тноцепочечных фрагментов длиной от 20 до
60 нуклеотидов с перекрывающимися концами. Нуклеотидные последовательности цепей задают так, чтобы после отжига (образование комплементарных двухцепочечных фрагментов) концевые сегменты гена имели тупые концы. Каждый внутренний сегмент имеет выступающие 3'- и 5'-концы, комплементарные таковым соседнего сегмента. После сборки гена остается сшить одноцепочечные разрывы с помощью ДНК-лигазы Т4. Синтетические гены могут быть сконструированы так, чтобы помимо белок-кодирующих последовательностей они содержали концевые участки, обеспечивающие:
• встраивание в клонирующий вектор (сайты для рестриктаз);
• сигнальные последовательности для правильной инициации и терминации транскрипции и трансляции.
Полимеразная цепная реакция
Полимеразная цепная реакция (ППР) — это эффективный способ получения in vitro большого числа копий специфических нуклеотидных последовательностей (Kary Mullis; США, патент 4683202). Их амплификация (иногда в миллионы раз) осуществляется в ходе трехэ
367
Глава 24 , Нуклеиновые кислоты
тапного циклического процесса. Для ПЦР необходимы:
• два синтетических олигощжлеотидных праймера (длиной примерно по 20 нуклеотидов), комплементарные участкам ДНК из противоположных цепей, фланкирующим (ограничивающим) отрезок последовательности-мишени; 3'-гидроксильные группы праймеров после отжига с ДНК должны быть ориентированы навстречу друг другу (таким образом, отмечаются начальный и конечный участки нужного фрагмента на ДНК-матрице);
• ДНК-мишень длиной от 100 до 35000 п. н.;
• термостабильная ДНК-полимераза Taq, выделенная из бактерий Thermus aquaticus, которая не теряет своей активности при темпе-ратере 95°С и выше;
• четыре дезоксирибонуклеотида;
• буфер, содержащий ионы магния.
Этапы ПЦР (рис. 24.12.):
1. Денатурация (плавление). Для денатурации ДНК (расхождение цепей) ее выдерживают до 1 мин при 95°С. Помимо ДНК, в реакционной смеси содержатся в избытке два праймера, термостабильная ДНК-полимераза и четыре типа дезоксирибонуклеотидов.
2. Ренатурация (отжиг). Температуру смеси медленно понижают до 55°С, при этом праймеры спариваются с комплементарными последовательностями ДНК.
3. Синтез (элонгация). Температуру повышают до 75°С, т. е. температурного оптимума для ДНК-полимеразы Taq. Начинается синтез комплементарной цепи ДНК, инициируемой 3’-гидроксильной группой праймера. Все реакции проводятся в регулируемом термостате с повторением циклов, продолжительностью 3—5 мин. Эти циклы повторяют до 30 раз.
Применение метода ПЦР:
• Идентификация патогенных микроорганизмов и вирусов, возбудителей заболеваний человека, животных и растений. Для синтеза праймеров, специфичных в отношении исключительно ДНК-мишени, необходимо знать нуклеотидную последовательность ДНК предполагаемого патогенного микроорганизма. В этом случае в ходе ПЦР будет амплифициро-ваться только фрагмент ДНК, длина которого равна суммарной длине двух праймеров и фрагмента ДНК между ними.
• Получение кДНК (ДНК, комплементарные информационной РНК, мРНК). Метод называют RACE (rapid amplification of cDNA ends).
Обычно получают кДНК, комплементарные 3’-и 5'- концам мРНК (3'RACE и 5'RACE). В случае 3’RACE праймером для синтеза первой цепи кДНК является олиго(дТ) с присоединенным к нему вторым праймером (Р). Олиго(дТ) спаривается с поли(А)-хвостом мРНК (З'-ко-нец молекулы). С помощью обратной транскриптазы на матрице мРНК синтезируется цепь кДНК. На матрице синтезированной цепи кДНК синтезируется вторая цепь и затем в последовательных циклах ПЦР с введением «внутренних праймеров» накапливаются значимые количества кДНК, комплементарной З’-концу мРНК.
• Синтез генов с помощью ПЦР.
• Выделение делеций или вставок в генах, ответственных за то или иное наследственное заболевание. Например, определение мутаций с помощью аллельспецифических проб производится следующим образом. Синтезируются 2 коротких 32Р-олигодезоксирибонуклеотида, один из которых содержит ДНК-последовательность, включающую мутацию, а другой не изменен. С помощью этих аллельспецифич-ных проб ДНК пациентов проверяют на носительство исследуемой мутации. Для этого область гена, содержащую интересующий участок, амплифицируют с помощью ПЦР. Образцы наносят на узкие полоски нитрата цел-люлозы и обрабатывают мечеными олигонуклеотидами, содержащими нормальную или мутантную последовательность. Радиоавтографически оценивают, с какой из проб преимущественно связывается ДНК пациента. • Исследование индивидуального паттерна (спектра, соотношения) генов при диагностике и контроле лечения опухолевых заболеваний и отборе тканей (органов) для трансплантации.
ДНК как носитель генов
Ген — единица наследственности, представляющая собой часть молекулы ДНК, кодирующей последовательность аминокислот одной полипептидной цепи. Экспрессией гена называют синтез белка или РНК по программе гена. Большинство генов относят к «стандартным» кодирующим белок генам. В результате дупликации гена в процессе эволю-
368
Нуклеиновые кислоты Глава 24
Ограничивающие Целевая последовательность последовательности подлежащая амплификации
Добавление праймеров и нагревание для разделения цепей ДНК
Охлаждение (отжиг) и присоединение праймеров
Синтез дочерних цепей ДНК с помощью ДНК-полимеразы Taq
Рис 24.12. Первый цикл ПЦР.
иии возможны множественные копии одного и того же гена для более быстрого синтеза белка. Известны псевдогены, не способные к экспрессии или кодирующие синтез нефункциональных 5елков. Транспозоны (прыгающие гены) способны изменять свое место расположения в хромосоме. Говоря о генах, следует заметить, что в составе ДНК существуют также повторяющиеся тысячи раз и состоящие из нескольких . этен оснований Alu-последовательно-:ти. Их роль не установлена. Имеется
еще один вид повторяющихся последовательностей ДНК — сателлитная ДНК (короткие тандемно повторяющиеся последовательности оснований). Эти последовательности образуют более легкую фракцию, сопровождающую основную фракцию ДНК при градиентном ультрацентрифугировании. Отсюда и название — сателлитная ДНК. Повторы нуклеотидных последовательностей используются как объективный критерий для установления родственных связей.
Так. 2124
369
Г лава 25
Репликация. Транскрипция
Существуют 3 вида передачи наследственной информации (матричных синтезов): 1) ДНК + ДНК — репликация; 2) ДНК •* РНК — транскрипция и 3) РНК + белок — трансляция.
ДНК является макромолекулой, которая переносит генетическую информацию от поколения к поколению. Одна клетка млекопитающих содержит только несколько пикограммов (10 12 г) ДНК.
Репликация
Репликация — процесс передачи генетической информации от ДНК к ДНК. Протекает в S-фазу клеточного цикла.
Репликация происходит полуконсер-вативным способом. Полуконсерватив-ный способ означает, что цепи материнской молекулы ДНК расходятся и каждая служит матрицей для синтеза новой комплементарной последовательности. Две образовавшиеся двуспиральные молекулы ДНК, каждая из которых состоит из одной родительской и одной вновь синтезированной комплементарной цепи, распределяются между дву
мя дочерними клетками. Таким образом, каждая из дочерних клеток получает информацию, идентичную той, которой обладала родительская клетка.
Полуконсервативный механизм репликации у бактерий Е. coli был однозначно продемонстрирован в классическом эксперименте Л/. Мезелъсона и Ф. Сталя в 1957 г. с применением тяжелого изотопа азота в сочетании с градиентным ультрацентрифугированием. £. сой выращивали в течение ряда поколений на среде, содержащей в качестве единственного источника азота хлористый аммоний (NH4C1) с «тяжелым» изотопом ,5N. Вследствие этого все азотсодержащие соединения, в том числе и основания ДНК, включали этот изотоп в свой состав. Затем Е. сой переносили на среду, в которой находился NH4CI с изотопом l4N. После первого деления обе молекулы ДНК содержали одну «легкую» и одну «тяжелую» цепи (рис. 25.1). После второго удвоения образовались две молекулы «легкой» ДНК и две гибридные (одна «легкая» и одна «тяжелая» цепи).
Механизм репликации. Механизм репликации у прокариот изучен лучше.
370
Репликация. Транскрипция Глава 25
Рис. 25.1. Разделение 14N ДНК и 15N ДНК методом градиентного ультрацентрифугирова-ния— денситометрия двух полос ДНК fMeselson М., Stahl F. W., 1958).
чем у эукариот. Основные условия и компоненты репликации ДНК одинаковы у прокариот, таких как Е. coli, и эукариот, включая человека. Основное функциональное значение процесса репликации ДНК заключается в снабжении потомства генетической информацией. Лля обеспечения генетической стабильности организма и вида ДНК должна реплицироваться полностью и с очень высокой точностью.
Условия, необходимые для □епликации
1. Матрица, которой является неспаренная цепь ДНК.
2. Субстраты синтеза, которыми являются дезоксирибонуклеозидтрифосфаты лАТФ, дГТФ, дЦТФ, ТТФ). Синтез идет по схеме: <5(НМФ)п + 2НТФ=д(НМФ)п+1 + РРн, где :(НМФ)п — ДНК до удлинения, 5 НМФ)п+1 —- ДНК после удлинения, :НТФ — дезоксирибонуклеозидтрифос-раты, РРн — пирофосфат. Нуклеозид-рифосфаты необходимы в качестве уточника энергии, т. к. при расщепле
нии пирофосфата выделяется энергия для образования фосфодиэфирных связей.
3. Ферменты и белковые факторы, участвующие в синтезе ДНК:
3.1. ДНК-полимеразы I и /// (у прокариот), которые участвуют в образовании 3',5‘-фосфодиэфирных связей и обладают 3'-*5’ и 5’-*,3' экзонуклеазными активностями; ДНК-полимераза II является минорной ДНК-полимеразой, которая может участвовать в процессе репарации; ДНК-полимеразы IV и V, идентифицированные в 1999 г., участвуют в специфической репарации; у эукариот найдено пять типов ДНК-по-лимераз: а, е, 0, у и 5.
3.2. DnaA-белок — узнает участок начала репликации.
3.3. DnaB-белок (хеликаза) — расплетает двойную спираль ДНК.
3.4. DnaC-белок — необходим для присоединения хеликазы к месту инициации синтеза.
3.5. Гистоноподобный белок — стимулирует инициацию.
3.6. ДНК-связывающий белок — стабилизирует расплетенные одноцепочечные участки ДНК и повышает активность хеликазы.
3.7. ДНК-гираза (топоизомераза II) вводит отрицательные супервитки в ДНК, выполняя функцию шарнира при продвижении репликационных вилок.
3.8. Праймаза (ДНК-зависимая РНК-пол имераза, dnaG-белок) синтезирует РНК-затравку (праймер).
3.9. ДНК-лигаза — соединяет концы фрагментов ДНК.
3.10. Dew метилаза — метилирует (5')УАТЦ последовательность в оНС.
Все ферменты и белковые факторы, участвующие в репликации, образуют макромолекулярный комплекс, называемый реплисомой.
Различают 3 стадии репликации: инициации, элонгации и терминации.
371
Глава 25 Репликация. Транскрипция
Стадия инициации
1. Репликация ДНК у Е. coli начинается в области начала репликации, который называется oriC и состоит из 245 пар оснований: три повторяющиеся последовательности из 13 пар оснований и четыре повторяющиеся последовательности из 9 пар оснований (рис. 25.2А).
2. Основным белком, участвующим в инициации является DnаА-белок. DnaA-белок (состоит из 20 молекул) связывается с четырьмя повторяющимися последовательностями нуклеотидов из 9 пар оснований, узнает и расплетает ДНК в области, состоящей из трех повторяющихся последовательностей из 13 нуклеотидов, богатой А-Т парами. Для этого процесса требуются АТФ и гистоноподобный белок (рис 25.2Б).
3. Два гексамера dnaB-белка присоединяются к каждой цепи ДНК и действуют как хеликазы (helix — спираль), расплетая в обоих направлениях ДНК. На разделение каждой пары оснований расходуется энергия гидролиза двух молекул АТФ (рис. 25.2В).
4. Как только небольшой участок ДНК оказывается расплетенным, к каждой из разделившихся цепей прочно присоединяются несколько молекул ДНК-связы-вающего белка (SSB белок — single strand binding), которые препятствуют образованию комплементарных пар и обратному восстановлению цепей (рис. 25.5).
В процессе инициации происходит метилирование ДНК и взаимодействие с плазматической мембраной. OriC метилируется Dam метилазой (Dam означает DNA adenine methylation), которая метилирует N6 аденина в палиндромной последовательности (5')ГУИД. OriC область у Е. coli содержит большое количество ГУТЦ-последовательно-стей - 11 из 245 пар оснований, в то время как средняя частота ГУТЦ в хромосоме Е. coli составляет 1 на 256 пар оснований. Сразу
после образования репликативной вилки в течение короткого периода времени (несколько секунд или минут) ДНК полуметилирует-ся: oriC родительской цепи метилируется, вновь синтезируемая дочерняя цепь — нет. Полуметилирование oriC последовательности сохраняется в течение периода взаимодействия с плазматической мембраной и позволяет отличить синтезированную цепь от материнской цепи. После этого oriC отделяется от плазматической мембраны и происходит метилирование дочерней цепи Dam метилазой до повторного связывания с DnaA-белком и инициации репликации.
5. У прокариот хеликазе помогает фермент ДНК-гираза (семейство топоизомераз). Гираза выполняет функцию шарнира: он обеспечивает кратковременный разрыв одной из цепи ДНК, быстро восстанавливаемый с высокой точностью после одного или нескольких оборотов вокруг второй цепи. Этот фермент не только позволяет ДНК вращаться, но и активно закручивает ее в направлении, благоприятствующем расплетению цепей матрицы. В результате расплетения молекулы ДНК образуется репли-кационный пузырь, который состоит из 2 репликативных вилок. Процесс репликации происходит в обеих репликативных вилках, но имеет противоположное направление, что обусловлено антипараллельностью двух полинукле-отидных цепей ДНК.
Бактериальная топоизомераза II (часто называемая ДНК-гираза) является мишенью для некоторых антибиотиков, которые ингибируют ферменты у прокариот в большей степени, чем у эукариот. Новобио-цин блокирует связывание АТФ с гиразой. Налидиксовая кислота (рис. 25.3) и ципрофлоксацин мешают воссоединению цепей ДНК после их разрыва. Эти два типа ингибирующих гиразу антибиотиков широко используются для лечения
372
Репликация. Транскрипция Глава 25
Суперспирализованная ДНК
I
Репликация
Рис. 25.2. Инициация репликации у Е. coli. ГПБ — гистоноподобный белок (D. L. Nelson, М. М.
Сох, с изм.).
373
Глава 25 Репликация. Транскрипция
Рис. 25.3. Налидиксовая кислота.
инфекций мочевыводящих путей. Камптотецин, противоопухолевое вещество, ингибирует человеческую топоизомеразу I путем стабилизации ковалентных связей ДНК.
6. В каждой репликативной вилке выделяют 3' и 5' концы. Синтез дочерних нитей ДНК происходит всегда в направлении 5’->3’. Стадия инициации завершается синтезом праймера — короткого фрагмента РНК, состоящего из 10—60 рибонуклеотидов, комплементарных одной из цепи матричной ДНК. Синтез праймера осуществляется ферментом ДНК-зависимой-РНК-полимера-зой или праймазой. Синтез праймера необходим для фермента ДНК-полиме-разы III, который не может начать синтез дочерней нити ДНК на «пустом» месте; З'-ОН группа концевого рибо
нуклеотида праймера служит затравкой ддя синтеза ДНК под действием ДНК-полимеразы III.
Стадия элонгации
1. К З'-ОН группе праймера присоединяется ДНК-полимераза III, которая по принципу комплементарности синтезирует дочернюю цепь ДНК в направлении 5'-*3'. Точность синтеза определяется тем, что фермент ДНК-полимераза III катализирует образование фосфоди-эфирной связи только в том случае, если основание предыдущего нуклеотида комплементарно соответствующему основанию матрицы. Если не произошло образование водородных связей между присоединенным нуклеотидом и матрицей, фермент возвращается, вырезает неправильный нуклеотид с З'-конца
374
Репликация. Транскрипция Глава 25
цепи за счет экзонуклеазной активности, после чего ДНК-полимераза продолжает присоединять правильные нуклеотиды в направлении В
результате достигается высокая точность матричного синтеза. У Е. coli частота ошибок составляет 1 на 10у10'° присоединенных нуклеотидов. Хромосомы Е. coli содержат 4,6 х 10б пар нуклеотидов. Следовательно, частота ошибок составляет 1 на 1000—10 000 репликаций.
Если направление синтеза дочерней цепи ДНК и направление движения репликативной вилки совпадают, то цепь синтезируется непрерывно и называется лидирующей. Если направление синтеза ДНК и движение репликативной вилки не совпадают — цепь синтезируется фрагментами и называется запаздывающей. Фрагменты,
синтезированные в запаздывающей цепи, называются фрагментами Рейджи Оказаки и состоят из 1000—2000 нуклеотидов у прокариот и 100—200 нуклеотидов у эукариот. Возможно, что после синтеза праймера дальнейшее образование ДНК на обеих дочерних цепях осуществляет один и тот же фермент — ДНК-полимераза III, благодаря образованию петли на запаздывающей цепи (рис. 25.4).
2. После завершения синтеза фрагмента Оказаки (рис. 25.5) РНК-затравка (праймер) удаляется нуклеотид за нуклеотидом с помощью 5'-*У экзонуклеазной активности ДНК-полимеразы I. По мере отщепления рибонуклеотидных мономеров каждый из них замещается на соответствующий дезоксирибонуклеотид в ходе полимеразной реакции, осуществляемой ДНК-полимеразой I (при этом в качестве затравки используется 3’-конец предыдущего фрагмента Оказаки). Новый фрагмент Оказаки присоединяется к запаздывающей цепи ДНК с помощью фермента ДНК-лига-зы. Источником энергии для этой
реакции у эукариот служит АТФ. ДНК-лигаза не может соединить две молекулы одноцепочечной ДНК. Цепи ДНК, соединяемые ДНК-лигазой, должны быть частью двухцепочечной молекулы ДНК.
Стадия терминации
Терминация синтеза ДНК наступает вследствие исчерпания матрицы. У хромосомы Е. coli две репликативные вилки содержат область терминации, состоящую из копий 20 пар нуклеотидов и называемую Ter (terminus). Репликаци-онные пузыри сливаются, молекулы до-
Рис. 25.4. Координация синтеза лидирующей и запаздывающей цепей ДНК. Образование петли запаздывающей цепью позволяет димерному холоферменту ДНК-полимеразы П1 одновременно и в одном направлении синтезировать обе дочерних цепи ДНК (на запаздывающей цепи после синтеза праймера) (по А. Корнбергу).
375
Глава 25 Репликация. Транскрипция
Синтез лидирующей цепи
РНК-праймер предыдущего фрагмента Оказаки
Синтез запаздывающей цепи (ДНК-полимераза III)
Рис. 25.5. Синтез фрагментов Оказаки (D. L. Nelson, М. М. Сох, с изм.).
черней цепи ДНК сшиваются ДНК-ли-газой, и на каждой матрице образуется дочерняя цепь ДНК.
Репликация у эукариот
Общие механизмы репликации у эукариот аналогичны таковым у прокариот. Как и у прокарит, репликация у эукариот происходит одновременно на обеих цепях.
Единицей репликации у эукариот является репликон, размеры которого колеблются от 50 до 120 мкм. В клетках млекопитающих содержится от 10 000 до 100 000 репликонов.
Эукариотические клетки содержат несколько типов ДНК-полимераз. В репликации ядерных хромосом участвует ДНК-полимераза а и ДНК-полимераза 5. ДНК-полимераза а состоит из нескольких субъединиц с одинаковой структурой и свойствами во всех эукариотических клетках. Однако, ДНК-полимераза а не обладает 3'-*5' экзонуклеазной активностью и поэтому не может проверять точность репликации. Поэтому предполагают, что ДНК-полимераза а участвует в синтезе праймера для фрагментов Оказаки запаздывающей цепи.
376
Репликация. Транскрипция Глава 25
Основным ферментом синтеза ДНК у эукариот является ДНК-полимераза 6. Этот фермент связан и стимулируется белком, который называется пролиферативный клеточный ядерный антиген (proliferating cell wuclear antigen, PCNA) и обнаружен в большом количестве в ядрах пролиферирующих клеток. ДНК-полимераза 8 обладает 3'-*5' экзонуклеазной активностью и участвует в синтезе лидирующей и запаздывающей цепей ДНК.
ДНК-полимераза р заменяет ДНК-полимеразу 6 в некоторых ситуациях, например, при репарации. ДНК-полимераза р может также функционировать на репликационной вилке, возможно, играя роль аналогичную ДНК-полиме-разы I, удаляя праймер фрагмента Оказаки на запаздывающей цепи.
Функции ДНК-полимеразы р подобны таковым для ДНК-полимеразы I прокариот. ДНК-полимераза у катализирует процессы полимеризации нуклеотидов в митохондриях.
Для репликации генома человека необходимо около 8 ч. Скорость репликации у Е. coli составляет 1000 нуклеотидов в секунду. Репликация у эукариот происходит в 10 раз медленнее, чем у прокариот и составляет 100 пар оснований в секунду. Каждый репликон синтезируется приблизительно 1 час. Низкая скорость репликации у эукариот обусловлена, вероятно, формированием нуклеосом и наличием хромосомных белков. Гетерохроматин реплицируется медленнее, чем эухроматин. Кроме того, ДНК-полимеразы эукариот менее активны по сравнению с прокариотическими ферментами.
Теломеры
В отличие от прокариот, эукариотическая ДНК линейная. Как указано выше, репликация происходит в двух направ
лениях от одной точки инициации (хромосома эукариот имеет много таких точек). 5'-Концевая область лидирующей цепи реплицируется полностью. Но этого не происходит при синтезе запаздывающей цепи, потому что участвующий в образовании фрагментов Оказаки РНК-праймер расположен у З'-конца матричной цепи. После удаления праймера эти концы оказываются нерепли-цированными, и не существует механизма, позволяющего восполнить их, используя ДНК-синтезирующий комплекс, описанный выше. Для восполнения теряемых частей требуются РНК-праймер, но матриц, с которых их можно было бы образовывать, нет. Это означает, что с каждым клеточным делением хромосомы будут последовательно укорачиваться. Решение проблемы состоит в том, что на концах хромосом эукариот находятся специальные повторяющиеся последовательности ДНК, которую называют теломерной ДНК (содержащие ее концы хромосом — теломеры).
Теломеры млекопитающих представляют собой короткую последовательность нуклеотидов ТТАГГГ. Число теломерных последовательностей различно в клетках разных тканей. Специфическая ДНК полимераза (ДНК-теломераза) добавляет эти последовательности (одну за другой) к 3'-концу предшествующей теломерной ДНК и таким образом удлиняет ее. Теломераза имеет две особенности: 1) использует РНК в качестве матрицы для синтеза ДНК — это обратная транскриптаза и 2) матрица включена в структуру фермента. У человека РНК имеет последовательность, включающую 1,5 повтора, комплементарных ТТАГГГ. Матрица РНК гибридизируется с концом теломерной ДНК, затем постепенно (по одном)' нуклеотиду) добавляется еще один фрагмент. После
377
Глава 25 Репликация. Транскрипция этого фермент перемещается и связывается с концом нового, только что образованного фрагмента. Таким образом теломер непрерывно достраивается. На удлиненном теломере одной цепи затем формируется комплементарная цепь, так что теломер имеет двухцепочечную структуру. Однако пока не ясно, как это происходит. По-видимому, в этом процессе участвует ДНК-полимераза.
Теломераза обнаружена в эмбриональных клетках, которые быстро делятся, в результате чего требуется компенсировать укорочение хромосом. В соматических клетках, делящихся редко, теломераза не обнаружена. Считают, что соматические клетки в момент возникновения получают такое количество теломерной ДНК, которое определяет количество возможных делений клетки. Этот эффект рассматривается как важный фактор продолжительности жизни живого организма. При неограниченном делении опухолевых клеток постоянное удлинение хромосом осуществляет теломераза.
Повреждения ДНК
При исследовании процессов повреждения ДНК в живой клетке следует учитывать, что ДНК в них связана с белками и в эукариотических клетках организована в виде нуклеосом с последующими уровнями компактизации до стадии хромосом. При нормальных значениях pH, температуры и давления в клетке возможны несколько типов повреждения ДНК.
1. Гидролитическое отщепление аминогрупп от цитозина, аденина и гуанина с образованием урацила, гипоксантина и ксантина, соответственно. Наиболее часто происходит дезаминирование цитозина с образованием урацила: примерно 1000 на животную клетку в сутки (дезаминирование пуринов происходит в 50—100 раз реже). Дезаминирование цитозина выше на два порядка в одноцепочечной ДНК. Гидролиз N-гликозидных связей ведет к образованию свобод
ных от оснований сайтов за счет отщепления пуриновых и пиримидиновых оснований. Пурины менее устойчивы к гидролизу возможно до 10 000 депуринизаций на животную клетку в сутки (депиримидинация в 20 раз реже). Апуриновые и апиримидиновые сайты не участвуют в матричных синтезах.
2. Оксидативные повреждения связаны с действием свободно-радикальных форм кислорода, синглетного кислорода и пероксидов. Основные пути образования свободно-радикальных форм кислорода локализованы в митохондриях и осуществляются при окислительном фосфорилировании, а также при синтезе оксида азота, образовании пероксидов в процессе фагоцитарной активности лейкоцитов. Ультрафиолет, ионизирующее излучение и ряд ксенобиотиков активируют реакции свободно-радикального окисления. Их действие выявляется, когда интенсивность воздействующего фактора превышает возможности защитных и репаративных систем клетки. Оксидативные повреждения могут приводить к разрыву по-линуклеотидной цепи за счет повреждения дезоксирибозы, разрыв конечных 3', 5'-фосфодиэфирных связей, что нарушает присоединение следующего нуклеотида ДНК-полимеразой III. В настоящее время описано 40—60 различных типов повреждений азотистых оснований (насыщение двойных связей в циклических структурах, разрывы колец, присоединение новых групп к кольцам оснований и т. п.). Особенно мутагенным является 8-оксогуанин. Все эти изменения могут привести к серьезным нарушениям информационной роли полинуклеотидных цепей ДНК.
3. Метилирование ДНК в клетке происходит ферментативным и неферментативным путями. Малые молекулы (пептиды, полиамины и S-аденозилметионин) способствуют неферментативному метилиро-
378
Репликация. Транскрипция Глава 25
ванию с образованием 7-метилгуанина и 3-метиладенина. Если 7-метилгуанин нетоксичен, то 3-мстиладенин способен блокировать репликацию. Считают, что в сутки может образовываться 600 остатков 3-метиладенина на человеческую клетку. Бактериальные и животные ферменты — метилтрансферазы обеспечивают метилирование цитозина с образованием 5-ме-тилцитозина. Это основание в полинук-леотидой цепи является одним из маркеров для действия рестриктаз.
ДНК является мишенью для действия многих неблагоприятных факторов внешней среды.
1. Действие ультрафиолетовых лучей. Солнечный ультрафиолет подразделяют на три вида по длинам волн: УФ-А (длинноволновой), УФ-В (средневолновой) и УФ-С (коротковолновой). УФ-С абсорбируется в стратосфере озоновым слоем. У человека УФ-В может вызывать рак кожи. При действии ультрафиолета возможно образование тиминовых димеров (УФ-С или при хроническом действии УФ-В).
2. Ионизирующее излучение повреждает ДНК посредством образования свободных радикалов. Ионизирующее излучение способно вызывать «летальные» разрывы обеих цепей ДНК. Особенно опасны трансурановые элементы, альфа-частицы которых при тесном контакте с молекулами ДНК способны повреждать различные химические связи поли-туклеотидных цепочек. Отметим, что максимальное влияние трансурановых элементов, загрязнивших территории после аварии на ЧАЭС, предсказывается через 25~40 лет.
3. ДНК является мишенью для эндогенных химических веществ и ксенобиотиков. Это вещества, определяющие неферментативные превращения
метаболитов в «реактивные» молекулы, чаще всего обеспечивающие электрофильную атаку нуклеофильных центров в дуплексах ДНК. К неферментативным повреждающим ДНК веществам относят алкилирующие агенты (например, метил-метановые сульфонаты). В результате их действия возникают фосфотриэфиры и весьма мутагенное соединение О6-метилгуа-нин. Бифункциональные алкилирующие агенты имеют две реактивные группы, способные создавать перекрестные связи в дуплексе ДНК через остатки гуанина. Положительный эффект этого используется в действии противоопухолевого препарата cis-du-аминодихлорплатиума. Другим примером метаболической активации ДНК является повреждение бензапиреном, который является ароматическим углеводородом, поступающим в организм при курении и употреблении в пищу копченостей. В организме он гидроксилируется микросомальной монооксигеназной системой (цитохром Р-450) и превращается в продукт, повреждающий ДНК.
Повреждения ДНК выявляют с помощью эндо- и экзонуклеаз с последующим анализом нуклеотидных последовательностей образованных коротких полинуклеотидов автоматизированным секвенированием, методом иммунологического анализа, газовой хроматографией с масс-спектрометрией, полимеразной цепной реакции, методом капиллярного электрофореза с лазероиндуцированной флуоресценцией.
Репаративный синтез ДНК
Как сказано выше, множество химических и физических агентов (ионизирующая радиация. У ФО. алкилирующие агенты) вызывают в ДНК повреждения 4 основных типов.
379
Глава 25 ,Репликация. Транскрипция
1. Затрагивающие единичные нуклеотиды: депуринизация; дезаминирование цитозина до урацила; дезаминирование аденина до гипоксантина; алкилирование оснований; вставка или делеция нуклеотида; включение основания-аналога.
2. Затрагивающие пару нуклеотидов: УФ-индуцируемое образование тиминовых димеров; поперечные сшивки бифункциональным алкилирующим агентом.
3. Разрывы цепей: ионизирующая радиация; радиоактивная дезинтеграция каркаса ДНК.
4. Поперечные сшивки: между основаниями одной цепи или разных цепей; между ДНК и молекулами белка (например, гистонами).
Поврежденные участки могут быть подвергнуты репарации, замещены путем рекомбинации или остаться без изменений. В последнем случае возникают мутации, потенциально ведущие к гибели клетки.
Основной путь репарации включает
3 этапа:
1) измененный участок ДНК распознается и удаляется при помощи ферментов ДНК-репарирующих эндонуклеаз;
2) ДНК-полимераза I связывается с 3'-концом поврежденной цепи ДНК и заполняет брешь, присоединяя нуклеотиды друг за другом комплементарно неповрежденной цепи ДНК;
3) ДНК-лигаза сшивает фрагменты ДНК и, тем самым, завершает восстановление структуры ДНК.
Приведем пример исправления структуры ДНК по следующей схеме: узнавание повреждения, вырезание и удаление поврежденного фрагмента цепи и синтез исправленной последовательности, используя вторую цепь как матрицу. Как указывалось ранее, цитозин в ДНК способен спонтанно дезаминироваться в урацил. Это явление му-тагенно, поскольку при репликации возможно возникновение новой пары АУ вместо ГЦ (рис. 25.6).
Эта мутация исправляется под действием репаративной системы, узнающей чужеродный урацил в молекуле ДНК (рис. 25.7).
Вначале урацил-ДНК-гликозидаза гидролизует гликозидную связь остатка урацила с дезоксирибозой. Затем специфичес-
| Дезаминирование Г Ц у 1 1 | Репликация Г У > 1 ~ L 1 + 1 1 А 1
Рис. 25.6. Замена нуклеотида.
380
Репликация. Транскрипция Глава 25
кая эндонуклеаза узнает этот дефект и удаляет несколько оснований. ДНК-полимераза I и ДНК-лигаза восполняют дефект по матрице второй цепи ДНК.
При действии ультрафиолетового излучения возможно образование тиминовых димеров. Такой димер не укладывается в двойную спираль ДНК, что нарушает репликацию и экспрессию генов. В механизме репарации данного повреждения участвуют 3 ферментативных активности: 1) белковый комплекс, содержащий УФ-специфичную эндонуклеазу узнает место повреждения и вырезает 8 нуклеотидов от димера с 5' положения и 4 нуклеотида с 3’ положения;
2) ДНК-полимераза синтезирует правильную последовательность дезоксирибонуклеотидов по матрице интактной цепи ДНК;
3)ДНК-лигаза соединяет
синтезированную и интактную цепи ДНК (рис. 25.8).
Системы репарации могут восстановить повреждения ДНК только при наличии интактной комплементарной цепи ДНК.
рафиолет способен индуцировать образование тиминовых димеров. В фибробластах больных людей обнаружена недостаточность ферментов репаративного синтеза ДНК: в норме половина вызванных ультрафиолетом тиминовых димеров уничтожается менее чем за 24 часа, а у больных они только накапливаются и ведут к клиническому проявлению заболевания.
Дефекты системы репаративного синтеза ДНК повышают частоту возникновения рака, например, некоторых видов колоректального рака. Это заболевание развивается у людей с наследственным дефектом генов hMCH2 и hMLHl. Мутации этих генов дадут накопление других мутаций вдоль ДНК, включая гены, контролирующие пролиферацию клеток, что и ведет к развитию рака.
Причиной некоторых генетических заболеваний является наличие в ДНК последовательностей нуклеотидов, склонных к возникновению ошибок в процессе репликации. Целая группа таких заболеваний связана с присутствием длинных повторяющихся последовательностей из трех нуклеотидов. Например, при болезни Huntington — аутосомно-доминантном неврологическом расстройстве в мозге синтезируется белок huntingtin, который содержит
Считают, что рак связан с мутаци-ями генов, контролирующих рост. Дефект системы репаративного синтеза ДНК увеличивает вероятность развития мутаций, включая инициирующие малигнизацию клеток. Например, редкое заболевание человека Xeroderma pigmentosum передается генетически по аутосомно-рецессивному признаку. Кожа повреждается ярким светом у гомозигот. Кожа у таких пациентов сухая и дерма истончена. Пациенты могут погибать до 30 лет от метастазов опухоли кожных покровов. Известно, что ульт-
5' АТГЦАТГЦАЦТ-ТГАТГЦАТГЦАТЗ'
3' ТАЦГТАЦГТГА АЦТАЦГТАЦГТА5' ^Удаление 12 нуклеотидов
5'АТГ АТГЦАТЗ'
3' ТАЦГТАЦГТГА АЦТАЦГТАЦГТА5' ^Синтез недостающего полинуклеотида
5' АТГЦАТГЦАЦТ ТГАТГЦАТГЦАТЗ'
I I I I I I I I I I I I f I I I I I i I I I !
3' ТАЦГТАЦГТГА АЦТАЦГТАЦГТА5'
Рис. 25.8. Вырезание тиминовых димеров.
381
Глава 25, Репликация. Транскрипция
продолжительные последовательности остатков глутамина. Эти остатки глутамина кодируются повторяющимися последовательностями ЦАГ. У здоровых людей этот триплет повторяется от 6 до 31 раза, при заболевании — от 36 до 82 или более раз.
Транскрипция
Синтез РНК на матрице ДНК называется транскрипцией. Последовательность рибонуклеотидов в молекуле РНК комплементарна последовательности дезоксирибонуклеотидов одной из цепей ДНК. Та из двух цепей ДНК, по которой непосредственно идет транскрипция РНК-молекул, называется кодирующей цепью. Другую цепь называют некодирующей цепью соответствующего гена.
Единицей транскрипции является оперон (у прокариот) и транскриптон (у эукариот). По функциональному признаку в опероне выделяют регуляторные и структурные области:
1) промотор — место инициации транскрипции, к которому присоединяется фермент РНК-полимераза; в ДНК Е. coli имеется 2000 промоторов на 4,8 к 106 пар оснований;
2) ген-оператор (или акцепторная зона у эукариот) — место связывания регуляторных белков, например, белка-репрессора;
3) структурные гены, включающие информативные участки — экзоны и неинформативные участки — интроны;
4) терминатор — последовательность нуклеотидов, сигнализирующая о завершении транскрипции.
РНК-полимераза должна найти и транскрибировать гены на протяженной молекуле ДНК. Для этого она находит промотор и связывается с ним (рис. 25.9). 1. У бактерий функцию промотора выполняют две последовательности нуклеотидов на 5'-конце молекулы. Одна из них называется блок Прибнова (ТАТА-АТ), центр которого располагается в положении -10 (10 нуклеотидов на 5'-кон-це от первого транскрибируемого нуклеотида, обозначаемого +1). Другая последовательность, называемая -35 область, имеет последовательность ТТГАЦА. Это идеализированные последовательности, более характерные для промоторов клеток-прокариот. Первым транскрибируемым нуклеотидом является пуриновый нуклеотид.
-35 -10 +1
-35 регион блок Прибнова —►
начало синтеза РНК
Цепь ДНК ' '
Промотор у прокариот
Промотор у эукариот
Начало синтеза РНК
ЦААТ-блок ТАТА-блок
(присутствует не всегда) (блок Хогнесса)
Рис. 25.9. Премоторная зона гена.
382
Репликация. Транскрипция Глава 25
Эукариотические гены, кодирующие белки, имеют блок Хогнесса (ТАТААА) в положении -25, а также ЦААТ-блок (ГГМД/МТЦТ) в положении -75. Транскрипция у эукариот регулируется эн-хансерными (усиливающими) последовательностями, которые могут отстоять на несколько kb от стартового нуклеотида.
2. Промоторы отличаются по эффективности. Гены со строгими промоторами в клетке Е. соН транскрибируются каждые 2 секунды, а транскрибирование генов со слабыми промоторами происходит один раз за 10 минут. Мутации в областях -10 или -35 подавляют активность промотора. Расстояние между этими областями оптимально в 17 нуклеотидов. Эффективность промоторов регулируется особенностями их нуклеотидного состава, а также регуляторными белками, связывающимися с ДНК рядом с областью промоторов.
3. Терминацию синтеза РНК вызывают длинные блоки АТ-последовательностей нуклеотидов в ДНК — терминатор (стоп-сигнал); у ряда прокариот обнаружен белок, называемый р-фактором, который в участке терминации освобождает РНК от матрицы ДНК.
Факторы, необходимые для транскрипции
1. Матрица, которой является неспаренная цепь ДНК. В отличие от репликации транскрипция происходит на определенном фрагменте ДНК.
2. Субстраты. Для синтеза РНК необходимы четыре типа рибонуклеозидтрифосфатов: АТФ, ГТФ, ЦТФ, УТФ. Разрыв макроэргической связи между а и 0-остатками фосфорной кислоты обеспечивает процесс синтеза энергией.
3. Транскрипция происходит с участием фермента ДНК-зависимой РНК-поли-
меразы. Для синтеза РНК, комплементарной одной из цепей ДНК, спиральная молекула ДНК расплетается на коротком участке с формированием транскрипционного «пузыря» (рис. 25.10). Во время транскрипции у Е. соН расплетенный фрагмент составляет около 17 пар нуклеотидов. Поскольку ДНК является двуспиральной молекулой, движение транскрипционного пузыря вызывает закручивание молекулы ДНК. Спирализация ДНК ограничивается ДНК-связывающими белками. В результате движения РНК-полимеразы образуются положительные супервитки впереди транскрипционного пузыря и отрицательные супервитки позади (рис. 25.11). Этот процесс наблюдается in vivo и in vitro у бактерий.
РНК-полимераза Е. соН состоит из 5 субъединиц м. м. 390 000) и
шестой о-субъединицы. Фермент, состоящий из 6 субъединиц, называется холоферментом. Установлено, что 0-субъеди-ница участвует в связывании рибонуклеозидтрифосфатов, р'-субъеди-ница — в связывании фермента с ДНК-матрицей, а-субъединица участвует в инициации транскрипции; функция со-субъединицы не известна. Структура фермента без а-субъединицы называется кор-ферментом. Этот фактор находит строго определенные последовательности нуклеотидов в промоторе, способствует более прочному связыванию полимеразы со специфической премоторной последовательностью ДНК и участвует в раскрывании двойной спирали ДНК, так чтобы одна из цепей могла служить матрицей. о-Субъединица не участвует в стадии элонгации. Различные о-субъеди-ницы узнают различные последовательности нуклеотидов в промоторе. Большинство а-субъединиц являются о70 (м. м. 70 000).
В эукариотических клетках присутствуют 3 ядерные РНК-полимеразы — I,
383
Глава. 25 Репликация. Транскрипция
Рис. 25.10. Транскрипция у прокариот (Е. coli) (D. L. Nelson, М. М. Сох, с изм.).
Рис. 25.11. Суперспирализация ДНК в процессе транскрипции (D. L. Nelson, М. М. Сох, с изм.).
II, III. РНК полимераза I находится в ядрышке и участвует главным образом в биосинтезе рРНК; РНК-полимераза II — осуществляет синтез мРНК, а РНК-полимераза III отвечает за синтез тРНК и 5S-pPHK.
Механизм транскрипции
Синтез РНК включает 3 стадии: инициации, элонгации и терминации.
1. На стадии инициации РНК-полимераза с помощью о-субъединицы через
384
Репликация. Транскрипция Глава 25
серию случайных актов ассоциации-диссоциации находит промотор и происходит присоединение всей молекулы РНК-полимеразы. После синтеза цепочки РНК примерно из 8 рибонуклеотидов о-субъединица отделяется от холофермента и присоединяется к другой молекуле РНК-полимеразы. Синтезируемые цепи РНК имеют на 5'-конце обычно остаток ГТФ или АТФ (рррА, либо рррГ). В отличие от синтеза ДНК, затравка в этом случае не нужна. Следовательно, новообразованная цепь РНК имеет трифос-фатную группу на 5'-конце и свободную ОН-группу на З'-конце.
2. На стадии элонгации РНК полимераза синтезирует цепь РНК в направлении 5'-*3' антипараллельно матричной цепи ДНК (т. е. матричная ДНК копируется в направлении 3'-*5'). В ходе транскрипции новосинтезированная цепь РНК временно образует короткие отрезки гибридной спирали ДНК-РНК. По мере того, как расплетается очередной участок ДНК, транскрибированный участок восстанавливает свою двуспиральную конформацию.
Максимальная скорость элонгации составляет примерно 50 нуклеотидов в секунду. В отличие от ДНК-полимеразы, РНК-полимераза не проверяет правильности новообразованной полинук-леотидной цепи. В связи с этим надежность транскрипции значительно ниже, чем надежность репликации. Частота ошибок при синтезе РНК составляет примерно одну ошибку на 104— 10s нуклеотидов, что в 105 раз выше, чем при синтезе ДНК. Гораздо более низкую надежность синтеза РНК клетка обходит тем, что с одного гена синтезируется много копий РНК-транскриптов.
3. Сигнал терминации синтеза молекулы РНК представляет собой определенную последовательность нуклеотидов, расположенную в рамках кодирующей
цепи ДНК. Процесс терминации у эукариот не достаточно изучен. У Е. coli существует два механизма терминации: 1) с участием специфического белка, называемого р-фактором и 2) р-незави-симый механизм.
Механизм p-независимой терминации объясняется следующим: во-первых, в РНК-транскрипте существует последовательность, расположенная на расстоянии 15—20 нуклеотидов от конца РНК, которая способна образовывать структуры по типу «шпилек» за счет взаимодействия комплементарных нуклеотидов внутри цепи; во-вторых, существует короткий фрагмент аденилатов в кодирующей цепи, с которого по принципу комплементарное™ синтезируется последовательность уридиловых нуклеотидов на З'-конце РНК Когда РНК-полимераза достигает сайта терминации, она останавливается. Образование «шпильки» в РНК нарушает взаимодействие между РНК и РНК-полимеразой, что способствует отщеплению транскрипта.
р-Зависимые терминаторы не имеют посте-довательности повторяющихся адениловых нуклеотидов, но иногда имеют короткие последовательности, которые транскрибируются с образованием «шпилек», р-Белок присоединяется к специфическому участку РНК, перемещается в направлении 5'-*3' до достижения транскрипционного комплекса, который остановился на сайте терминации, и способствует освобождению РНК-транскрипта, р-Белок обладает АТФ-зависимой РНК-ДНК-хеликадной активностью, что обеспечивает транслокацию белка вдоль РНК. АТФ гидролизуется р~белком во время терминации.
После терминации синтеза данной цепи РНК кор-фермент отделяется ог ДНК-матрицы и, связавшись с новой молекулой о-фактора, может узнавать соответствующие премоторные участки и приступать к синтезу новой молекулы РНК. Одну и ту же кодирующую цепь могут одновременно считывать несколько молекул РНК-полимеразы, но процесс отрегулирован таким образом, что в каждый данный момент каждая молекула транскрибирует различные участки ДНК.
385
Глава 25 Репликация. Транскрипция
Посттранскрипционная модификация РНК
В результате транскрипции образуются три типа предшественников РНК (первичные транскрипты)', предшественник мРНК, или гетерогенная ядерная РНК (пре-мРНК или гяРНК), предшественники рРНК (пре-рРНК), содержащие 5,8S РНК, 18S РНК и 28S РНК у эукариот и, соответственно 5S, 16S РНК и 23S РНК у прокариот, предшественники тРНК (пре-тРНК). Они представляют собой копию оперона и содержат информативные и неинформативные последовательности. Образование функционально активных молекул РНК называется процессингом и продолжается после завершения транскрипции.
Процессинг включает в себя: вырезание неинформативных участков, сшивание информативных участков (сплайсинг) и модификацию 5' и З'-концов РНК.
1. Вырезание неинформативных участков пре-мРНК происходит с помощью рибонуклеаз и/или рибозимов (содержат РНК, обладающие ферментативной активностью). При вырезании интронов важную роль играют малые ядерные РНК (мяРНК), нуклеотидные последовательности которых комплементарны последовательностям на концах каждого из интронов. В результате спаривания оснований, содержащихся в мяРНК и на концах свернутого в петлю интрона, два экзона сближаются, интроны вырезаются, а экзоны сшиваются лигазой. Таким образом, молекулы мяРНК играют роль временных матриц, удерживающих близко друг от друга концы двух экзонов для того, чтобы сплайсинг произошел в правильном месте.
2. Далее в ядре происходит модификация 5' и 3е-концов мРНК. К 5'-концу мРНК присоединяется олигонуклеотид, называемый «кэпом» (cap) или колпач
ком, состоящий из 2—3 метилированных нуклеотидов, причем концевым является 7-метилгуанозин. Эти «колпачки» способствуют стабилизации мРНК, защищая 5'-концы от разрушения фосфатазами и нуклеазами, а также связываются со специфическим белком и могут участвовать в связывании мРНК с рибосомой для инициации трансляции.
К З'-концу фермент поли-А-полимераза присоединяет полиадениловую последовательность (поли-А), состоящую из 50—200 нуклеотидов. Функция полиаденилового «хвоста» мРНК неизвестна. Предполагается, что он также защищает мРНК от ферментативного разрушения. Затем мРНК связывается с белком информофером и транспортируется в цитоплазму к рибосомам.
Многие гены у высших эукариот, в том числе у млекопитающих, прерывистые, а у прокариот — непрерывные. Положение интронов в проанализированных генах постоянно, по крайней мере, 1 миллиард лет. Это консервативный процесс, например, экстракты клеток млекопитающих могут осуществлять сплайсинг (удаление интронов) дрожжевой РНК. Экзоны кодируют отдельные структурные и функциональные единицы белков. Привлекательной кажется гипотеза, что новые белки эволюционно возникали за счет перестановки экзонов, кодирующих структурные элементы, места связывания и каталитические центры. Этот процесс получил название «шафлинг (тасование) экзонов». В области интронов возможны изменения ДНК без последствий для синтезируемых белков; изменения же в области экзонов наверняка приведут к потере функции. Наличие разорванных генов позволяет осуществлять
386
Репликация. Транскрипция Глава 25
сплайсинг первичного транскрипта РНК разными путями. Например, процесс образования антител анти-телпродуцирующими клетками включает этапы: 1) связывание антигена с заякоренным в плазматической мембране антителом; 2) размножение этого клона клеток и выделение антител в окружающую среду для связывания антигена. Следовательно, на втором этапе необходимо, чтобы субъединицы антитела синтезировались без домена, обеспечивающего заякори-вание антитела на мембране. Это достигается методом альтернативного сплайсинга (удаление экзона мРНК, кодирующего домен заяко-ривания) (рис. 25.12).
3. В клетках прокариот и эукариот молекулы рРНК транскрибируются в виде большого общего первичного транскрипта (пре-рРНК). Процессинг рибосомных РНК происходит в ядрышке, где локализованы гены рибосомных РНК. У бактерий 16S, 23S и 5S рРНК образуются из 30S предшественника; у эукариот из 45S пре-рРНК синтезируются 18S,
28S и 5,8S рРНК. Синтезированная пре-рРНК (45S) подвергается ферментативной модификации и расщеплению и дает зрелые 18S, 5,8S и 28S-pPHK. Вначале примерно 100 нуклеотидов метилируется по 2'-гидроксильной группе рибозных остатков, более 100 остатков уридина изомеризуются в остатки псевдоуридина. Метилирование идет только на участках, формирующих в дальнейшем зрегые молекулы рРНК. Затем 458-предшествен-ник подвергается нуклеолитическому процессингу. В ходе процессинга РНК в ядрышках происходит дальнейшее метилирование. 5,8S-pPHK и 28S-pPHK, связываясь с рибосомными белками в ядрышках, формирует большую бОЙ-субъединицу рибосомы. Молекула 18S-pPHK в комплексе с соответствующими полипептидами образует малую субъединицу рибосомы. 5S РНК синтезируется отдельно.
4. Молекулы тРНК первоначально транскрибируются в виде больших предшественников, которые часто содержат более одной молекулы тРНК, подвергающихся нуклеолитическому процессингу при действии специфических рибонуклеаз. Дальнейшие модификации
Связанное с мембраной антитело
Цитозоль
Заякоривающий домен антитела кодируется отдельным экзоном гена
Снаружи клетки
Альтернативный сплайсинг РНК удаляет заякоривающий домен антитела
Секреция в
Рис. 25.12. Альтернативный сплайсинг мРНК для получения различных форм антител: А — мембраносвязанное антитело на поверхности лимфоцита (покой, нет антигена); Б — растворимое антитело (выделяется в кровь при иммунном ответе).
387
Глава 25 Репликация. Транскрипция
молекул тРНК включают алкилирование нуклеотидов и присоединение характерного ЦЦА-триплета к З'-концу молекулы (акцепторный участок), к которому будет присоединяться соответствующая аминокислота. Метилирование предшественников тРНК млекопитающих происходит, вероятно, в ядре, а расщепление и присоединение ЦЦА-триплета — в цитоплазме.
Обратная транскрипция
Некоторые РНК-содержащие вирусы (ретровирусы), которые инфицируют животных, имеют 2п2+-содержащий фермент РНК-зависимую ДНК-поли-меразу, часто называемую обратной транскриптазой или ревертазой. Существование обратных транскриптаз в РНК-содержащих онкогенных вирусах было предсказано еще в 1962 г. Говардом Теминым и Дэвидом Балтимором. Обратной транскриптазе приписывают 3 вида ферментативной активности: 1) РНК-зависимую ДНК-полимеразную (строит по матрице РНК дочернюю цепь ДНК); 2) рибонуклеазную (обеспечивает удаление цепи РНК); 3) ДНК-зависимую ДНК-полимеразную (строит на матрице
комплементарной ДНК вторую цепь ДНК) (рис. 25.13).
Ретровирусы имеют 3 гена: gag, pol и env. Транскрипт, который содержит gag, pol, транслируется в длинный полипептид, который расщепляется на 6 белков с различными функциями. Белки-продукты gag гена формируют внутреннее ядро вирусной частицы. Pol ген кодирует: 1) протеазу, которая расщепляет длинный полипептид; 2) интегразу, которая встраивает вирусную ДНК в геном хозяина и 3) обратную транскриптазу.
Обратная транскриптаза состоит из 2-х субъединиц ар. Pol ген кодирует р-субъедини-цу (м. м. 90 000); а-субъединица (м. м. 65 000) является протеолитическим фрагментом р-субъединицы. Env ген кодирует белки вирусной оболочки. Каждый конец линейного РНК генома представляет собой повторяющуюся последовательность из нескольких сотен нуклеотидов. При транскрипции в двуспиральную ДНК эти последовательности облегчают интеграцию вирусной хромосомы в ДНК хозяина и содержат промоторы для экспрессии вирусных генов (рис. 25.14).
После того как такой вирус попадает в клетку-хозяина, этот фермент способен катализировать синтез так называемой комплементарной ДНК (кДНК), для которой вирусная РНК играет при этом роль матрицы. Для начала синтеза ДНК необходим праймер. На ранней
Вирусная РНК
РНК-ДНК гибрид
ДНК-транскрипт по вирусной РНК
Двойная спираль ДНК
Рис. 25.13. Действие ретровируса на геном клетки. РНК генома ретровируса превращается а ДНК за счет трех активностей обратной транскриптазы.
388
Репликация. Транскрипция Глава 25
Рис. 25.14. Структура и продукты генов интегрированного генома ретровируса (D. L. Nelson, М. М. Сох, с изм.).
стадии инфекции в вирусе обнаруживается тРНК, которая образует водородные связи с комплементарной последовательностью на З'-конце вирусной РНК. Синтез ДНК идет в направлении 5'-*3' как любая полимеразная реакция.
Обратная транскриптаза не обладает 3'-*5' экзонуклеазной активностью и поэтому частота ошибок синтеза составляет 1 на 20 000 нуклеотидов, что является необычно высокой для синтеза ДНК и является характерным для большинства ферментов, реплицирующих геном вируса. Следствием этого явля
ется быстрая скорость эволюции вирусов, что может быть фактором появления новых признаков заболеваний, вызываемых ретровирусами. В результате этого этапа образуется гибридная молекула РНК-ДНК. На втором этапе происходит разрушение исходной вирусной РНК из комплекса гибридной молекулы под действием обратной транскриптазы. Наконец, на третьем этапе на матрице цепи ДНК комплементарно синтезируются новые цепи ДНК.
В результате образуется ДНК, которые содержит гены, обусловливающие
389
Глава 25 Репликация. Транскрипция
рак; эта ДНК часто встраивается в геном эукариотической клетки хозяина, где она может в течение многих поколений оставаться в скрытом, т. е. не-экспрессируемом состоянии. При определенных условиях такие бездействующие вирусные гены (онкогены) могут активироваться и вызывать репликацию вируса; при других же условиях они могут способствовать превращению такой клетки в раковую.
Большинство ретровирусов не вызывают гибели клеток хозяина, но остаются интегрированными в клеточную ДНК, реплицируясь при делении клетки. Некоторые ретровирусы, классифицируемые как РНК опухолевые вирусы, содержат онкогены, которые могут вызывать патологический рост клеток. Первым изученным ретровирусом был вирус саркомы Рауса.
Вирус иммунодефицита человека (ВИЧ), который вызывает синдром приобретенного иммунодефицита (СПИД), относится к ретровирусам. Идентифицированный в 1983 г., ВИЧ имеет РНК геном со стандартными ретровирусными генами. В отличие от других ретровирусов, ВИЧ вызывает гибель инфицированных клеток (особенно Т-лимфоцитов), что приводит к подавлению иммунной системы организма-хозяина. Частота ошибок обратной транскриптазы ВИЧ в 10 и более раз больше, чем других ретровирусов, что приводит к высокой скорости мутаций вируса. Одна или большее количество ошибок при каждой репликации приводит к появлению двух вирусных РНК, почти полностью отличных друг от Друга.
Вакцины для вирусных инфекций содержат один или более белков вирусных оболочек, которые не вызывают инфекций, но стимулируют иммунную систему. Из-за высокой частоты ошибок обратной транскриптазы ВИЧ, env— ген вируса (отвечает за синтез белков оболочки) подвергается мутации, что снижает эффективность вакцинирования. Поскольку повторный цикл клеточной инвазии и репликации необходим для размножения вируса, ингибирование вирусных ферментов является одним из механизмов эффективной терапии. Для лечения ВИЧ используются препараты-ингибиторы протеазы и обратной транскриптазы.
Первым лекарством, которое было использовано в клинике, был J -азидо-2, У -дидеокситимидин (АЗТ). АЗТ был синтезирован в 1964 г. Джеромом Хорвитцем. Вначале АЗТ использовался как противоопухолевый препарат, но в 1985 г. была обнаружена его эффективность при лечении СПИДа. АЗТ захватывается Т-лимфоцитами и превращается в АЗТ-трифосфат. АЗТ-трифосфат не может прямо использоваться, поскольку он не проходит через клеточные мембраны. Обратная транскриптаза имеет более высокое сродство к АЗТ-трифосфату, чем к ТТФ. Поэтому связывание АЗТ-трифосфата конкурентно ингибирует связывание ТТФ. Если АЗТ присоединяется к 3'-концу растущей цепи РНК, транскрипция прекращается и синтез вирусной РНК останавливается. АЗТ-трифосфат нетоксичен для Т-лимфоцитов, поскольку клеточная ДНК-полимераза имеет к нему бо-
390
Репликация. Транскрипция Глава 25
лее низкое сродство, чем для ТТФ. В концентрации 1-5 рМ АЗТ действует на обратную транскрипцию, но не влияет на репликацию ДНК. К сожалению, АЗТ оказался токсичным для клеток костного мозга, где образуются предшественники эритроцитов, и у пациентов, получающих АЗТ, часто развивается анемия. АЗТ увеличивает продолжительность жизни у пациентов, больных СПИДом, на несколько лет и задерживает развитие СПИДа у пациентов на ранних стадиях ВИЧ инфекции.
Другой препарат, дидеоксиинозин, имеет аналогичный механизм действия. Поскольку для обратной транскриптазы характерно наличие большого количества ошибок, что приводит к быстрой эволюции ВИЧ, эффективна комбинация лекарств, действующих на протеазу и обратную транскриптазу.
(ДНК - РНК - БЕЛОК) потоки информации могут обеспечить синтез ДНК на матрице ДНК (репликация), синтез РНК на матрице ДНК (транскрипция), синтез белка на матрице РНК (трансляция), синтез РНК на матрице РНК у некоторых вирусов (репликация РНК) и синтез ДНК на матрице РНК — обратная транскрипция (ретровирусы) (рис. 25.15).
Конструирование молекулы ДНК в лабораторных условиях
Конструирование ДНК (технология рекомбинантных ДНК, генная инженерия) включает следующие этапы.
1. Необходимо соединить ковалентно фрагмент ДНК (клонируемый ген), предназначенный для переноса, с фрагментом ДНК-вектором. Вектор должен обладать способностью автономно реплицироваться в клетке-хозяине, т. е. клетке, в которую планируется перенести ген. Для переноса клонируемого гена в клетки Е. coli используют плазмиды (природные кольцевые ДНК. явля-
Современная трактовка основного постулата молекулярной биологии
Согласно современной трактовке основного постулата молекулярной биологии
Рис. 25.15. Современная трактовка основного постулата молекулярной биологии.
391
Глава 25 Репликация. Транскрипция
Расщепление рестриктазой EcoRI
Смешивание фрагментов и соединение с помощью ДНК-лигазы
Рис. 25.16. Соединение концов фрагментов ДНК путем взаимодействия «липких концов».
ющиеся дополнением к хромосомам бактерий) и бактериофаг А.
2. Вектор готовят для акцептирования переносимой ДНК путем расщепления рестриктазой. Например, плазмида pSC101 — кольцевая двуспиральная молекула ДНК объемом 9,9 kb расщепляется с помощью рестриктазы EcoRI. Переносимый ген выделяют из ДНК, используя ту же рестриктазу (рис. 25.16).
Для образования комплементарных «липких концов» необходимо обрабатывать ДНК-клонируемый ген и ДНК-вектор одной и той же рестриктазой.
3. «Липкие концы» — это комплементарные окончания полученных фрагментов ДНК. Они спариваются при сближении фрагментов ДНК, содержащих их. Этот метод применяют, используя короткие синтезированные химическим путем линкерные фрагменты ДНК, имеющие места разрезания спе
цифическими рестриктазами. Такие фрагменты присоединяют к концам переносимого гена или вектора и после расщепления рестриктазой создают «липкие концы» (рис. 25.17).
4. Затем осуществляют перенос сконструированной (рекомбинантной) молекулы ДНК в бактериальные клетки. На этом этапе необходимо отобрать только те клетки, в которые осуществлен реальный перенос рекомбинантной ДНК. Для этого еще на втором этапе конструируют специальные плазмиды, например плазмида pBR322, В этой кольцевой молекуле ДНК имеются гены, ответственные за устойчивость к тетрациклину и ампициллину, причем в составе этих генов имеются места атаки разных рестриктаз, включая EcoRI. Используя эти рестриктазы, разрезают плазмиду на фрагменты и вставляют переносимый ген в разные места. В результате можно получить разные варианты рекомбинантных ДНК: 1) сохранившие оба гена устойчивости к антибиотикам (разрезание EcoRI); 2) встраивание переносимого гена в состав гена устойчивости к антибиотику создаст рекомбинантные ДНК,
392
Репликация. Транскрипция Глава 25
Фрагмент ДНК (ген) или вектор
3’ 5’
Рестриктаза EcoR1
Рис. 25.17. Создание липких концов путем присоединения десятичленного линкера ДНК.
Рис. 25.18. Генетическая карта плазмиды pBR322. Несет два гена устойчивости к антибиотикам.
которые не смогут кодировать белки устойчивости к тетрациклину или ампициллину (рис. 25.18).
Для переноса генов используют вирусы (бактериофаги и ретровирусы).
Наиболее перспективным является использование ретровирусов- На рисунке 25.19 представлен метод синтеза рекомбинантного проинсулина трансформированными бактериальными клетками.
393
Глава 25 . Репликация. Транскрипция
Подже лудоч ная железа
Человеческая Проинсу-мРНК линовая
проинсулина кДНК
Рекомбинантная плазмида
Трансформированная бактерия
Рис. 25.19. Синтез человеческого проинсулина бактериями (Berg J. М., Tymoczko J. L., Stryer L., с изм.).
Этапы синтеза проинсулина:
1) вьщеление мРНК из р-клеток островков Лангерганса поджелудочной железы;
2) синтез на матрице мРНК с помощью обратной транскриптазы кДНК (клонированная ДНК — ген проинсулина);
3) введение гена проинсулина в плазмиду (соединение с вектором) и получение рекомбинантной ДНК;
4) введение плазмиды в клетки Е. coli и экспрессия гена проинсулина;
5) выделение и очистка рекомбинантного проинсулина.
394
Глава 26
। Биосинтез белка (трансляция)
Генетическая информация, хранящаяся в ДНК, передается на РНК:
ДНК- нематричная цепь (кодирующая, или смысловая) 5'-ГГАТГЦАТ-3'
ДНК — матричная цепь (некодирующая, несмысловая) 3'-ЦЦТАЦГТА-5'
Цепь мРНК 5'-ГГАУГЦАУ-3'
У вирусов часто матричную цепь называют (-)-цепью, а нематричную (+)-цепью.
Биосинтез полипептида или белка на матрице РНК называется трансляцией.
Строение рибосом
Внутриклеточный компонент, в котором сходятся и взаимодействуют все элементы механизма трансляции белка, называется рибосомой. Несколько рибосом могут одновременно транслировать одну и ту же цепь мРНК, образуя полисомы (полирибосомы). Шероховатый эндоплазматический ретикулум — это компартмент клетки, в котором мембраносвязанные по-тисомы продуцируют как мембранные 'елки, так и белки, подлежащие
транспорту и экскреции. Рибосомы эукариот в 2 раза больше рибосом прокариот.
Химически рибосомы представляют собой нуклеопротеины, состоящие из РНК и белков в соотношении 1 : 1 у 80S рибосом эукариот и 2 : 1 у 70S рибосом прокариот. Рибосомные РНК синтезируются в ядрышке, белки образуются в цитоплазме и переносятся в ядрышко. Здесь спонтанно образуются рибосомные субчастицы путем объединения белков с соответствующими рРНК. Рибосомы состоят из 2-х субъединиц. Большая (50S у прокариот и 60S у эукариот) и малая (30S у прокариот и 40S у эукариот) субъединицы рибосом через поры ядерной оболочки переносятся в цитозоль. Большая субъединица рибосом эукариотической клетки содержит 41 белок, 5S, 5,8S и 28S рРНК, малая субъединица — 30 белков и 18S рРНК. Согласно представлениям Дж. Уотсона существует «рибосомный цикл»: в начале синтеза полипептидной цепи субъединицы рибосом объединяются в функционирующую рибосому на мРНК хтя осуществле
395
Глава 26 Биосинтез белка (трансляция)
ния трансляции, а в конце синтеза диссоциируют.
Г енетический код
Информация о последовательности аминокислот в полипептидной цепи записана на мРНК в виде трехбуквенного нуклеотидного кода.
Свойства генетического кода:
1. Триплетностъ — каждая аминокислота кодируется 3 нуклеотидами (кодоном).
2. Вырожденность (избыточность) — каждая аминокислота кодируется несколькими триплетами. Последовательность первых двух нуклеотидов определяет в основном специфичность каждого кодона, третий нуклеотид имеет меньшее значение. Данное свойство повышает устойчивость генетической информации к воздействию неблагоприятных факторов внешней и внутренней среды.
3. Специфичность — каждому кодону соответствует только одна аминокислота. 4. Неперекрываемость —• нуклеотид, входящий в состав одного триплета не может входить в состав соседнего.
5. Однонаправленность — считывание информации идет в направлении З'-Н'. 6. Коллинеарность — соответствие последовательности аминокислот в белке последовательности триплетов в мРНК. 7. Универсальность — соответствие аминокислот триплетному коду у всех живых организмов.
Среди 64 триплетов мРНК выделяют 3 типа: 1) инициирующий — АУГ: кодирует включение формилметионина у прокариот или метионина у эукариот, если стоит вначале мРНК, и определяет стадию начала (инициации) синтеза белковой молекулы; если находится в середине — то является смысловым; 2) смысловые кодоны — кодируют включение аминокислот в синтезируемую по-
Таблица 26.1. Генетический код мРНК
Первая буква (5') Вторая буква Третья буква (3’)
У Ц А Г
У Фен Сер Тир Цис У
Фен Сер Тир Цис Ц
Лей Сер СТОП СТОП А
Лей Сер СТОП Трп Г
Ц Лей Про Гис Apr У
Лей Про Гис Apr Ц
Лей Про Глн Apr А
Лей Про Глн Apr Г
А Иле Тре Асн Сер У
Иле Тре Асн Сер ц
Иле Тре Лиз Apr А
Мет Тре Лиз Apr Г
Г Вал Ала Асп Гл и У
Вал Ала Асп Гли Ц
Вал Ала Гл у Гли А
Вал Ала Глу Гли Г
Согласно Ю.Н.Журавлеву (2008), расположение аминокислот в таблице генетического кода зависит от их вкуса. В первом и третьем столбцах расположены преимущественно горькие, а во втором и четвертом - сладкие аминокислоты. По всей видимости, в процессе эволюции живых организмов произошло объединение двух отдельных систем кодирования.
396
Биосинтез белка (трансляция) Глава 26
липептидную цепь; 3) терминирующие кодоны не кодируют включение аминокислот, это нонсенс-кодоны, которые определяют завершение (терминацию) синтеза полипептидной цепи (табл. 26.1).
Биосинтез белка
В процессе биосинтеза белка выделяют 5 основных стадий.
Стадия 1 — активация аминокислот
Этот процесс протекает в цитозоле, а не з рибосоме. Каждая из 20 аминокислот ковалентно присоединяется к определенной тРНК, используя для этого энергию АТФ. Значение стадии: 1) активация СООН-группы аминокислоты, которая может участвовать в образовании пептидной связи; 2) аминокислоты сами не могут узнавать кодоны мРНК, а переносятся к рибосомам тРНК, которые посредством специфических антикодонов узнают кодоны мРНК и выполняют, таким образом, роль адапторных молекул.
Необходимые компоненты:
1. 20 аминокислот; 10 аминокислот являются незаменимыми и должны посту-лать с пищей; если отсутствует хотя бы одна аминокислота, процесс биосинтеза белка прекращается;
2. Ферменты аминоацил-тРНК-синте-'пазы;
3. тРНК;
4. АТФ;
5. Mg2+.
Активация аминокислот и их присоединение к тРНК осуществляется специфическими аминоацил-тРНК-синтетпаза-чи, которые называют активирующими рерментами.
Общий вид катализируемой реакции может быть выражен уравнением:
Аминокислота + тРНК +АТФ+ Мд2+-> Аминоацил-тРНК + АМФ + РРн
1. На первом этапе в активном центре фермента в результате взаимодействия АТФ и аминокислоты образуется связанное с ферментом промежуточное соединение аминоациладенилат.
2, На втором этапе аминоацильный остаток переносится с аминоациладенила-та, связанного с ферментом, на 3 '-гидроксильную группу концевого аденилового нуклеотида в молекуле тРНК (рис. 26.1).
3. Образующийся в процессе активации неорганический пирофосфат гидролизуется пирофосфатазой до 2-х молекул ортофосфата. Таким образом, на активацию каждой аминокислоты затрачиваются в конечном счете две высокоэнергетические фосфатные связи (одна на образование эфирной связи амино-ацил-тРНК, другая сдвигает равновесие реакции в сторону образования продук-
Рис. 26.1. Структура аминоацил-тРНК.
397
Глава 26 Биосинтез белка (трансляция)
та), что делает суммарную реакцию активации аминокислот практически необратимой.
Фермент аминоацил-тРНК-синтетаза обладает специфичностью к аминокислоте и к тРНК. Фермент имеет 4 центра связывания: 1) для тРНК; 2) для АТФ; 3) для аминокислоты; 4) для воды. Гидролитическая активность фермента необходима для удаления «неправильной» аминокислоты с последующим присоединением «правильной» аминокислоты к тРНК. Аминокислоты, для которых имеется две и более тРНК, активируются обычно одним ферментом.
Стадия II — инициация полипептидной цепи
Необходимые компоненты:
1) мРНК',
2) инициирующая аминоацил-тРНК (N-формилметионил-тРНК);
3) инициирующий кодон мРНК (АУГ) 4) 30S и 50S субъединицы рибосом;
5) ГТФ;
6) ЛГ^;
7) факторы инициации (IF-1, IF-2, IF-3).
На стадии инициации требуется разместить рибосому на 5'-конце мРНК и связать с инициирующим кодоном антикодон формилметионин-тРНК. Этот процесс включает следующие этапы: 1. 30S субъединица рибосомы связывается с 2-мя факторами инициации IF-1 и IF-3. Фактор IF-3 препятствует объединению 30S и 50S субъединиц рибосом с образованием непродуктивного 70S комплекса. К малой субъединице присоединяется мРНК (рис. 26.2).
Расположение инициирующего кодона мРНК (5')АУГ определяется специфической последовательностью Shine-Dalgamo в мРНК. Эта последовательность состоит из 4 9 пуриновых нуклеотидов и располагается на расстоянии 8—13 нуклеотидов от инициирующего
кодона. Нуклеотиды этой последовательности образуют водородные связи с комплементарными пиримидиновыми нуклеотидами вблизи З'-конца 16S рРНК в 30S субъединице рибосомы. Взаимодействие мРНК-рРНК определяет расположение инициирующего кодона мРНК в 308-субъединице рибосомы, где начинается трансляция.
2. Комплекс, состоящий из 30S субъединицы, IF-3 и мРНК связывается с комплексом ГТФ-1Р-2 и инициирующей N-формилметионин-тРНК. Антикодон тРНК образует водородные связи с инициирующим кодоном тРНК.
3. Образовавшийся комплекс взаимодействует с 508-субъединицей рибосомы. Белковый фактор IF-2 способствует соединению малой и большой субъединиц рибосом. После присоединения большой субъединицы рибосом происходит гидролиз ГТФ и высвобождение всех факторов инициации — IF-1, IF-2, IF-3.
Полностью собранная рибосома содержит 3 функциональных участка, образованных благодаря специфическому сочетанию областей 30S и 50S субъединиц рибосом.
Пептидильный участок (Р-участок) имеет сродство к пептидам и содержит в процессе синтеза растущую полипеп-тидную цепь. Аминоацильный участок (A-участок) содержит аминоацил-тРНК, соединенную с соответствующим кодоном мРНК. Е-участок является местом в 50S субъединице, откуда тРНК покидают рибосому во время элонгации.
Фактор инициации IF-1 связывается с A-участком и предотвращает присоединение к нему аминоацил-тРНК во время инициации синтеза полипептидной цепи.
Ы-Формилметионин-тРЯЛГ является единственной аминоацил-тРНК, которая
398
Биосинтез белка (трансляция) Глава 26
связывается с P-участком; во время элонгации остальные аминоацил-тРНК связываются вначале с A-участком и затем переходят в P-участок и Е-участок.
В результате стадии инициации синтеза полипептидной цепи образуется функциональная 70S рибосома, которая называется инициаторным комплексом.
Инициация у эукариот. Механизм трансляции у эукариот аналогичен трансляции у бактерий и основные различия касаются стадии инициации. Эукариотические мРНК связываются с рибосомой в виде комплекса со специфическими ферментами. Полагают, что некоторые из них связывают вместе 3' и 5' концы мРНК. 3' конец мРНК связывается белком, который называется поли(А)-связывающий белок (poly(A) binding protein, РАВ). Эукариотические клетки имеют не менее 9 факторов инициации. Комплекс называется eIF4F, включает белки eIF4E, eIF4G и eIF4 А и связывается с 5'-«кэп»- концом мРНК через eIF4E. Белок eIF4G связывается с двумя факторами eIF4E и РАВ. (рис. 26.3), Белок eIF4 А обладает РНК-хеликазной активностью. eIF4F комплекс связан с другим фактором eIF3 и с 40S субъединицей рибосомы. Эффективность трансляции определяется несколькими свой
ствами мРНК и белков в этом комплексе, включая длину 3' поли(А) последовательности. Взаимодействие 3' и 5' концов мРНК облегчает регуляцию экспрессии генов.
Инициирующий 5'АУГ триплет располагается внутри мРНК недалеко от Shine- Dalgamo-подобной последовательности. Комплекс eIF4F облегчает процесс сканирования мРНК. возможно за счет хеликазной активности e!F4 А, которая раскручивает вторичную структуру на 5'-конце нетранслируемой части мРНК. Сканирование облегчается белком eIF4B.
Роль факторов инициации у эукариот представлена в таблице 26.2.
Стадия Ilf — элонгация полипептидной цепи
Необходимые компоненты для элонгации:
1) инициаторный комплекс, образованный на предыдущей стадии;
2) полный набор аминоацил-тРНК:
3)
4) факторы элонгации (EF-Tu^ EF-Ts и EF-G у бактерий);
5) фермент пептидилтрансфераза:
6) ГТФ.
Таблица 26.2. Роль факторов инициации у эукариот.
Фактор Функция
elF2 elF2, elF3 Облегчает связывание инициирующей формилметионин-тРНК к 40S Первые факторы, которые связывают 40S субъединицу, облегчают последующие стадии
elF4 A РНК-хеликазная активность разрушает вторичную структуру мРНК для облегчения связывания с 40S; является частью elF4F комплекса
elF4B elF4E elF4G Связывается с мРНК; облегчает узнавание места расположения АУТ Связывается с 5’ «кэп» концом мРНК; является частью elF4F комплекса Связывается с elF4E и поли-А-связывающим белком; является частью e<F4F комплекса
elF5 Обеспечивает диссоциацию некоторых других факторов инициации от 4CS субъединицы, что необходимо для связывание с 60S субъединицей для образования 80S инициаторного комплекса
eiF6 Способствует диссоциации неактивной 80S рибосомы на 40S и 60S субъединицы
Примечание: префикс «е» означает эукариотические факторы
399
Глава 26 . Биосинтез белка (трансляция)
Рис. 26.2. Формирование инициаторного комплекса. (D. L. Nelson, М. М. Сох, с изм.).
400
Биосинтез белка (трансляция) Глава 26
Рис- 26.3. Белковые факторы при образовании инициаторного комплекса у эукариот (D. L. Nelson, М. М. Сох, с изм.).
Цикл элонгации включает 3 этапа: 1) связывание аминоацил-тРНК; 2) образование пептидной связи; 3) траслока-цию.
/ этап — связывание аминоацил-тРНК (рис. 26.4). Фактор элонгации EF-Tu образует комплекс с ГТФ, который связывается со всеми аминоацил-тРНК в цитоплазме. Тройной комплекс, аминоацил-тРНК— EF-Tu— ГТФ, взаимодействует антикодоном с кодоном мРНК в A-участке рибосомы по принципу ком-плементарности. Фактор элонгации EF-Tu обладает ГТФ-азной активностью и гидролизует ГТФ. Комплекс EF-Tu— ГДФ уходит из 70S рибосомы. Комплекс EF-Tu—ГТФ восстанавливается при помощи EF~Ts и ГТФ.
2 этап — образование пептидной связи (рис. 26.5). Пептидная связь образуется между двумя аминокислотами, которые связаны с тРНК в А- и Р-участках
рибосомы. Происходит перенос инициирующей N-формилметионильной группы от тРНК на аминогруппу второй аминокислоты, находящейся в А-участке. а-Аминогруппа аминокислоты в A-участке действует как нуклеофильная группа, замещая тРНК в P-участке для образования пептидной связи. В результате образуется дипептидил-тРНК в А-участке, и деацилированная тРНК остается связанной с Р-участком. Образование пептидной связи катализируется ферментом пептидилтрансфе-разой (составная часть 50S субъединицы рибосомы).
3 этап — транслокация. При участии фактора EF-G (транслоказа) и за счет энергии ГТФ происходит процесс транслокации — рибосома перемещается на один кодон мРНК в направлении 5'-*3', пептидил-тРНК перемещается в P-участок, а тРНК из
14 Зак. 2124
401
Глава 26 Биосинтез белка (трансляция)
Рис. 26.4. Первый этап элонгации (бактерии): связывание второй аминоацил-тРНК (D. L Nelson, М. М. Сох, с изм.).
402
Биосинтез белка (трансляция) Глава 26
P-участка перемещается в Е-участок, а затем высвобождается в цитозоль. В результате транслокации в А-участок рибосомы приходит следующий новый кодон мРНК. К нему методом случайного подбора присоединяется комплементарная аминоацил-тРНК. Между дипептидом P-участка и аминокислотным остатком в A-участке замыкается пептидная связь. Образующийся
трипептид транслоцируется в Р-учас-ток, а в A-участок приходит следующий новый кодон мРНК и т. д. Таким образом, процесс повторяется, пока в P-участок не придет один из терминирующих кодонов.
Элонгационный цикл у эукариот подобен циклу у прокариот. Факторы элонгации eEFla, eEFlpy и eEF2 выполняют функции, аналогичные функциям
Образование пептидной связи (2-й этап)
Транслокация(3-й этап)
Рис. 26.5. Образование пептидной связи (2-й этап) и транслокация (3-й этап) (D. L. Nelson, М.
Сох, с изм.).
403
Глава 26 Биосинтез белка (трансляция)
EF-Tu, EF-Ts, EF-G, соответственно. Эукариотические рибосомы не имеют Е-участка. Ненагруженная тРНК удаляется непосредственно из Р-участка.
Правильность синтеза на рибосоме. ГТФ-азная активность EF-Tu во время 1 -го этапа элонгации в бактериальной клетке является определяющей для скорости и точности всего биосинтетического процесса. Комплексы .EF-Tu ~ ГТФ и EF-Tu — ГДФ существуют в течение нескольких миллисекунд до диссоциации. Эти 2 периода необходимы для взаимодействия кодон-антикодон. «Неправильная» аминоацил-тРНК в норме диссоциирует от A-участка во время одного из этих периодов. Если ГТФ заменить на аналог ГТФу8 (гуанозин-5'-О-тиотрифосфат) гидролиз происходит медленно, обеспечивая точность синтеза, но снижая скорость синтеза.
Процесс синтеза белка в процессе эволюции оптимизирован и сбалансирован по скорости и точности. Необходимо отметить, что точность механизма синтеза на рибосоме основана на взаимодействии кодона и антикодона. Идентификации аминокислоты, которая присоединена к тРНК, на рибосоме не происходит. Если к тРНК присоединена «неправильная» аминокислота, она будет включена в белок, если кодон мРНК правильно соединится с антикодоном тРНК.
Стадия IV — терминация
Необходимые компоненты стадии: 1) АТФ;
2) терминирующий (нонсенс-кодон);
3) факторы терминации (релизинг-факторы) — RFP RF2 и RF3;
4) фермент пептидилтрансфераза;
1. После многих циклов элонгации, в результате которых синтезируется поли-пептидная цепь белка, в A-участке появляется терминирующий или нонсенс-кодон (УАА, УАГ, УГА) (рис. 26.6).
2. В норме отсутствуют молекулы тРНК, способные узнавать нонсенс-кодоны. Факторы терминации узнают данные кодоны: RF, узнает кодоны УАА и УАГ, RF2 - УАА и УГА.
Рис. 26.6. Терминация синтеза белка у бактерий (D. L. Nelson, М. М. Сох, с изм.).
404
Биосинтез белка (трансляция) Глава 26
3. Связывание релизинг-фактора с терминирующим кодонам в A-участке активирует пептидилтрансферазу, которая гидролизует связь между полипептидом и тРНК в P-участке. После гидролиза и высвобождения синтезированного полипептида и тРНК рибосома диссоциирует на малую и большую субъединицы, готовых к синтезу новой полипептидной цепи.
Специфическая функция RF3 установлена неточно и предполагают, что он участвует в диссоциации рибосомы на субъединицы.
У эукариот в терминации участвует фактор eRF, который узнает все три кодона терминации.
Выявлена оптимальная последовательность нуклеотидов (последовательность Kozak) для инициации трансляции: ЦЦ(А/Г)ЦЦААУГГ у высших эукариот: между пуриновыми нуклеотидными остатками А/Г и инициирующим кодоном АУГ необходимы три нуклеотидных остатка ЦЦА, а после инициирующего кодона — обязательно должен быть Г (гуаниловый нуклеотидный остаток). Завершение трансляции более эффективно, если за терминирующими кодонами будут следовать остатки пуриновых нуклеотидов.
Энергетические затраты белкового синтеза
1. При образовании каждой аминоацил-тРНК используется энергия двух высоко энергетических фосфатных групп.
2. АТФ затрачивается каждый раз, когда неправильно активированная аминокислота гидролизуется аминоацил-г Р Н К- синтетазой.
3. ГТФ расщепляется на ГДФ и Рн во время первого этапа элонгации и во время транслокации.
Таким образом, более 4-х высоко-зиергетических связей затрачивается на бразование каждой пептидной связи в лэлипептиде.
Стадия V — посттрансляционная модификация полипептидной цепи
Многие полипептиды, образующиеся при трансляции мРНК подвергаются модификации различными способами и включают следующие процессы:
1. Модификация N-конца и С-конца. Удаление формильной группы и фор-милметионина на N-конце бактериальных белков катализируется деформила-зами. Под действием аминопетидазы может произойти отщепление одного или нескольких N-концевых остатков. У прокариот и эукариот концевой метионин иногда отщепляется в то время, когда синтез остальной полипептидной цепи еще продолжается.
В настоящее время ведется разработка нового поколения антибиотиков, которые ингибируют де-формилазы. В этом случае в бактериальной клетке все белки будут начинаться с формилмети-онина и не смогут выполнять свои функции.
2. Удаление сигнальных последовательностей. Некоторые белки содержат на N-конце дополнительную полипептид-ную последовательность, которая направляет этот белок к месту, его назначения в клетке. Такие сигнальные последовательности удаляются с помощью особых пептидаз.
3. Образование дисульфидных мостиков, которые помогают уберечь нативную конформацию от денатурации.
4. Модификация боковых цепей аминокислот:
1) гидроксилирование остатков пролина и лизина в коллагене;
2) фосфорилирование гидроксильных групп серина, треонина и тирозина (увеличение отрицательного заряда,
405
Глава 26 Биосинтез белка (трансляция)
например, в казеине молока для связывания с ионами кальция или для активации некоторых ферментов, например, гликоген-фосфорилазы);
3) карбоксилирование (белок свертывания крови протромбин, содержит в своей N-концевой области несколько остатков у-карбоксиглутаминовой кислоты, которые включаются в белок при помощи фермента, зависимого от витамина К);
4) метилирование групп (мышечные белки и цитохромы);
5) присоединение боковых углеводных цепей (протеогликаны).
5. Присоединение простетических групп (например, молекула биотина, ковалентно связанная с ацетил-КоА-карбоксилазой).
6. Частичный протеолиз (например, при превращении проколлагена в коллаген и проинсулина в инсулин).
Согласно обобщениям Я. Кольман и К.-Г. Рем (2000), трансляция мРНК всегда начинается с помощью рибосом в цитозоле (1—3). Определенная последовательность из 15 '60 аминокислотных остатков с N-конца цепи называется сигнальный пептид (рис. 26.7). Если образующийся на рибосоме полипептид начинается с сигнального пептида, ориентирующего полипептид на шероховатый эндоплазматический ретикулум (ШЭР), с ним связывается РНК-содержащая сигнал-узнающая частица SRP и трансляция временно прерывается. SRP связывает рибосому с мембраной ШЭР посредством SRP-рецептора. Как только рибосома закрепится на мембране, SRP-частица диссоциирует от сигнального пептида и от SRP-рецептора (при этом гидролизуется ГТФ до ГДФ), и на рибосоме вновь начинается процесс трансляции (3— 5, 8). Полипептидная цепь на рибосоме растет и, еще не свернувшись, проходит через мембрану по каналу, называемому транслоконом, в просвет ШЭР. В просвете ШЭР соответствующая пептидаза отщепляет сигнальный пептид (6,7).
Рис. 26.7. Механизм поступления белков эукариот с соответствующим сигнальным пептидом в ЭПР (D. L. Nelson, М. М. Сох, с изм.).
406
Биосинтез белка (трансляция) Глава 26
Путем окисления радикалов цистеина образуются дисульфидные мостики, правильность положения которых контролируется протеин-дисулъфид-изомеразой. Пептидилпролил-изоме-раза контролирует цис-транс-изомеризацию X-Pro-связей в синтезируемом пептиде. Трансгликозидазы переносят олигосахариды в блоке с долихолом (длинноцепочечным изопреноидом) на определенные остатки аспарагиновой кислоты в белке, осуществляя N-глико-зилирование белка. Специальные гликозидазы отщепляют избыточные остатки глюкозы и маннозы. Затем происходит формирование третичной структуры (фолдинг) с помощью шаперонов. В аппарате Гольджи происходит фосфорилирование белков, перегруппировки остатков моносахаридов и олигосахаридов с помощью гликозилтрансфераз. В секреторных пузырьках возможно отщепление специальных пептидов, что обеспечивает формирование функционально активного белка (например, отщепление С-пептида от проинсулина ведет к образованию молекулы инсулина).
Сравнительная характеристика синтеза белков у прокариот и эукариот
Кратко подытожим особенности трансляции у эукариот и прокариот. Общий план биосинтеза белков у эукариот аналогичен таковому у прокариот. Однако у эукариот участвует большее количество факторов регуляции, и некоторые этапы являются более сложными. Основные признаки сходства и различий:
1. Рибосомы. Рибосомы эукариот больше по размеру по сравнению с рибосомами прокариот и имеют молекулярную массу 4200 кДа (рибосома 70S прокариот имеет молекулярную массу 2700 кДа).
2. Инициирующая аа-тРНК. У эукариот инициирующей аминокислотой является метионин, и инициириующей аминоацил-тРНК выступает метионин-тРНК.
3. Инициация. Инициирующим кодоном мРНК у эукариот всегда выступает АУГ. Эукариоты, в отличие от прокариот, не используют специфический обогащенный пуринами участок мРНК на 5'-конце мРНК дистальнее инициирующего кодона АУГ. Однако именно
с этого инициирующего кодона if РНК начинается процесс трансляции. Малая субъединица рибосомы (40S) связывается с кэпом на 5'-конце молекулы мРНК, и поиск инициирующего кодона АУГ идет при передвижении по мРНК к З'-концу молекулы. Этот процесс сканирования у эукариот обеспечивается энергией каталитического гидролиза АТФ (хетиказа), В большинстве случаев эукариотические мРНК имеют только одно место старта простой по-липептидной цепи одного белка. У прокариот имеется несколько последовательностей Shine-Dalgamo в мРНК и, следовательно, несколько мест начала синтеза полипептидных цепей. У эукариот используется большее количество белковых факторов инициации (elF), чем у прокариот. Например, elF 4Е является белком, который связывает напрямую 7-метилтуанозин (кэп), a elF 4 А является хеликазой. Различия механизмов инициации между прокариотами и эукариотами касаются и процессинга мРНК. У прокариот 5'-конец мРНК, синтезируемой при транскрипции, способен немедленно связываться с рибосомой для начала трансляции. У эукариот предшественник мРНК должен подвергнуться созреванию (сплайсинг, образование кэп, полиА), транспортироваться в цитозоль и лишь затем связываться с рибосомами для трансляции (рис. 26.8).
4. Элонгация и терминация. Факторы элонгации у эукариот EFla и EFipy аналогичны EFTu и EF-Ts у прокариот. ГТФ-EFla обеспечивает поступление аа-тРНК в А-участок рибосомы, а EFI|> у катализирует гидролиз ГТФ до ГДФ. Эукариотический фактор eEF2 опосредует ГТФ-зависимую транслокацию по механизмам, аналогичным действию EF-G у прокариот. Терминация эукариот определяет фактор eRFl, а у прокариот — 2 фактора. И. наконец, фактор eIF3, как и у прокариот IF3. препятствует реассоциации субъединиц рибосомы при отсутствии инициаторного комплекса, соответствующего инициирующему кодону мРНК.
Регуляция биосинтеза белка
Живые клетки имеют точно запрогра-мированные механизмы, регулирующие синтез различных белков таким образом, что в любой клетке присутствует
407
Глава 26 Биосинтез белка (трансляция)
Рис. 26.8. Сравнение транскрипции и трансляции. Эти два процесса строго взаимосвязаны у прокариот и разделены у эукариот. У прокариот первичный транскрипт является мРНК и используется тут же как матрица для синтеза полипептидной цепи. У эукариот предшественник РНК подвергается процессингу в ядре перед транспортом в цитозоль, где происходит синтез полипептидной цепи (по J. Darnell и соавт., с изм.).
определенное количество молекул каждого белка, позволяющее ей осуществлять свои метаболические процессы плавно и с максимальной эффективностью.
В клетке существует 7 процессов, которые определяют концентрацию белков и каждый из этих процессов подвергается регуляции:
1. Синтез первичного РНК транскрипта.
2. Посттранскрипционный процессинг.
3. Разрушение мРНК.
4. Синтез белка (трансляция).
5. Посттрансляционная модификация белка.
6. Разрушение белка.
7. Транспорт белка.
Основным механизмом регуляции биосинтеза белка является регуляции инициации транскрипции.
Гены для белков, которые требуют
ся постоянно, экспрессируются на относительно постоянном уровне в каждой клетке организма. Гены ферментов основных метаболических путей (например, цикла трикарбоновых кислот) относятся к этой категории генов и называются конституитивными генами. Неизменная экспрессия генов называется конституитивной экспрессией генов. Внутриклеточный уровень некоторых белков повышается или снижается под действием различных сигналов. Белки, концентрация которых повышается, называются индуцибелъными. Процесс повышения экспрессии генов называется индукцией. Например, экспрессия генов, кодирующих ферменты репарации ДНК, индуцируется при повреждении ДНК. Белки, концентрация которых снижается в ответ на молекулярные сигналы, называются репрессибельными. а процесс подавления экспрессии ге
408
Биосинтез белка (трансляция) Глава 26
нов — репрессия. Например, достаточное поступление триптофана приводит к подавлению генов для ферментов, которые участвуют в синтезе триптофана у бактерий.
Скорость и объем синтеза белка определяется концентрацией аминокислоты, присутствующей в наименьшем количестве.
Одним из факторов, влияющих на экспрессию генов, является связывание РНК-полимеразы ? промотором. На взаимодействие РНК-полимеразы влияет нуклеотидная последовательность промотора. В отсутствии регуляторных белков различия в нуклеотидной последовательности двух промоторов может изменять частоту экспрессии в 1000 и более раз. У большинства генов Е. coli промотор имеет строго определенную последовательность. Мутации генов после этой последовательности обычно снижают функцию промотора; мутации до промоторной последовательности обычно повышают функцию промотора.
Базальная скорость инициации транскрипции конституитивных генов определяется нуклеотидной последовательностью промотора, но в дальнейшем экспрессия этих генов контролируется регуляторными белками. Эти белки часто повышают или снижают взаимодей--твие между РНК-полимеразой и промотором. Нуклеотидная последовательность промоторов у эукариот более вариабельна. чем у прокариот. Как и у прокариот, балльный уровень транскрипции определяется влиянием промоторной последовательности -а функцию РНК-полимеразы и связывание факторов транскрипции.
Инициацию транскрипции регулируют 3 ~ша белков: 1) специфические факторы изменяют специфичность РНК-полимеразы для тоомотора; 2) репрессоры препятствуют доступу РНК-полимеразы к промотору; 3) актива-".оры повышают взаимодействие РНК-полиме-ггзы и промотора.
о-Субъединица РНК-полимеразы Е. соН -’ъляется специфическим фактором, за счет ко- эрого фермент узнает промотор и связывается . ним. Большинство промоторов Е. со/f распознается одной о-субъединицей (м. м. 70 000), ко-
торая называется о70. В некоторых ситуациях, например, при тепловом стрессе, о70-субъеди-ницы замещаются другим специфическим фактором (м. м. 32 000), который называется о32 и РНК-полимераза присоединяется к промоторам с другой последовательностью нуклеотидов. Эти промоторы контролируют экспрессию генов, которые кодируют белки теплового шока. Таким образом, через изменение сродства полимеразы к различным промоторам осуществляется координированная регуляция генов. У эукариот специфическими факторами являются ТАТА-связывающие белки.
Согласно теории Ф. Жакоба и Ж. Моно в биосинтезе белков у бактерий участвуют структурные гены, ген-оператор И ген-регулятор. Структурные гены определяют первичную структуру белков. Функционирование структурных генов контролируется геном-оператором. Процесс транскрипции начинается с промотора. Деятельность оперона находится под контролирующим влиянием другого участка ДНК, получившего название гена-регулятора. Структурные гены и ген-регулятор связаны специфическим белком — репрессором. Образование репрессора происходит в рибосомах на матрице специфической мРНК, синтезированной на гене-регуляторе. Репрессор имеет сродство к гену-оператору и обратимо соединяется с ним в комплекс. Если репрессор связан с геном-оператором, то блокируется связывание РНК-полимеразы или ее движение вдоль ДНК после связывания, в результате не может синтезироваться мРНК а, следовательно, белки. Если ген-оператор свободен, процесс транскрипции возможен и информация структурных генов используется для синтеза белков. Регуляция репрессорными белками, которые блокируют транскрипцию, называется отрицательной регуляцией.
Освобождение репрессора от гена-оператора происходит при его связывании с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами, В качестве индукторов часто выступают субстраты реакций.
В некоторых случаях молекулы репрессора не обладают способностью подавлять деятельность гена-оператора, но приобретают такую способность после образования комплекса с конечным или одним из конечных продуктов биосинтетического процесса. Конечный про
409
Глава 26 Биосинтез белка (трансляция)
дукт выступает в качестве корепрессора. В эукариотических клетках места связывания для репрессора могут располагаться на определенном расстоянии от промотора; связывание репрессора оказывает эффект аналогичный как у прокариот.
Активаторы оказывают противоположный репрессорам эффект; они связываются с ДНК и повышают активность РНК-полимеразы — положительная регуляция.
Регуляция синтеза белков в клетках эукариот намного сложнее: не характерна прямая субстратная регуляция, т. к. опероны (транскриптоны) у эукариот имеют обширные регуляторные зоны; у эукариот структурные гены разбросаны по геному; в ядрах дифференцированных клеток эукариот большинство генов находится в репрессированном состоянии. Активаторы в клетках эукариот связываются с сайтами ДНК (энхансерами), которые расположены на определенном расстоянии от промотора. Некоторые активаторы в норме связаны с ДНК, увеличивая транскрипцию до тех пор, пока активатор не отщепляется от ДНК под действием сигнальных молекул. В других случаях связывается с ДНК после взаимодействия с сигнальной молекулой. Следовательно, сигнальные молекулы могут повышать или снижать транскрипцию в зависимости от того, как они действуют на активатор.
Фолдинг и разрушение полипептидной цепи
Оценим характеристики биосинтеза белков в клетках кишечной палочки (Е. coli). Для удвоения числа клеток за 40 мин при 37°С требуется синтез примерно 1000 полипептидов со средней молекулярной массой 40 кДа за секунду. Эти полипептиды локализуются в минимальном объеме цитоплазмы, менее чем 1 мкм3. Общая концентрация макромолекул в цитозоле клеток Е. coli
достигает 340 г/л (напомним, что в сыворотке крови человека концентрация общего белка не превышает 85 г/л). Таким образом, синтезированная поли-пептидная цепь оказывается в пространстве, заполненном белками и другими макромолекулами, при наличии протеолитических ферментов, способных ее гидролизовать. Возможны три негативных варианта судьбы полипептидной цепи: 1) протеолитическая деградация; 2) преципитация со снижением растворимости белка и 3) неправильное складывание полипептидной цепи. Все вышесказанное позволяет утверждать, что в процессе эволюции должны были отобраться механизмы, способные 1) сформировать правильную третичную (нативную) структуру белковой молекулы и 2) гидролизовать белки с неправильной конформацией полипептидной цепи. Для реализации таких механизмов используются белки шапероны, которые относятся к белкам теплового шока (hsp6O, hsp70, hsp90, hsplOO). Свое название эти белки получили потому, что их синтез возрастает при повышении температуры и других формах стресса. Параллельно они выполняют функцию защиты белков клетки от денатурации. Шапероны участвуют в трех процессах: 1) hsp60, hsp70, hsp90 определяют зависимое от АТФ правильное формирование третичной структуры белковой молекулы; 2) hsp70 и hsplOO определяют процессы агрегации-дезагрегации поли-пептидных цепей и 3) hsp70 обеспечивает разрушение неправильных полипептидов после мечения их убиквитином в протеасомах (Consalvi V., Chiaraluce R„ 2002).
Разрушение белков предотвращает накопление патологических белков и поддерживает фонд аминокислот. Период полужизни эукариотических белков колеблется от 30 сек до нескольких дней. Большинство белков обмениваются быстрее, чем период полужизни клетки, хотя некоторые (например, гемоглобин)
410
Биосинтез белка (трансляция) Глава 26
существуют в течение жизни клетки (около 110 дней для эритроцитов). К быстро разрушающимся белкам относятся дефектные белки с неправильной последовательностью аминокислот, поврежденные белки, образующиеся в результате жизнедеятельности клетки, и ферменты, регулирующие ключевые реакции метаболических путей.
Дефектные белки и белки с коротким периодом полужизни разрушаются в бактериальных и эукариотических клетках с участием АТФ-зависимых цитозольных систем.
Вторая система у позвоночных включает лизосомы и обеспечивает обмен аминокислот мембранных и внеклеточных белков, а также белков с большим периодом полужизни.
В клетках Е. coli большинство белков разрушается под действием АТФ-зависимой протеазы, которая называется Lon («long form» белки обнаруживаются в клетке при отсутствии этой протеазы). Протеаза активируется в присутствии дефектных белков и быстро обменивающихся белков. На гадролиз каждой пептидной связи затрачивается 2 молекулы АТФ. Некоторые белки разрушаются до маленьких неактивных пептидов, другие — полностью до аминокислот.
В эукариотических клетках процесс разрушения белков происходит при участии белка убиквитина и включает 3 отдельных фермента. В настоящее время точно не известно, как связывание с убиквинином вызывает протеолиз белков. У эукариот АТФ-зависимая протеолитическая система представляет большой комплекс (м. м. 1 х 106Да) и называется про-еасомой (см. лекцию 20).
Препараты, влиящие на синтез белка
Индукторы применяются с целью стимуляции синтеза белка в поврежденных или ослабленных длительным бездействием (атрофичных) органах. Ингибиторы синтеза белка применяются в противоположных целях: для подавления деления и роста клеток.
Препараты, усиливающие биосинтез белков, относятся к так называемым анаболическим средствам. Анаболические средства бывают гормональные и негормональные. Наиболее выраженной способностью к индукции синтеза белка из гормонов обладают анаболические стероиды (производные мужских половых гормонов), которые используются для стимуляции биосинтеза белков и нуклеиновых кислот в организме. Анаболической активностью обладает инсулин, который активирует синтез белка на уровне трансляции.
К негормональным анаболическим средствам относятся предшественники нуклеотидов и нуклеиновых кислот. Например, калия оротат (стимуляция синтеза пиримидиновых нуклеотидов), инозин. Данные препараты используются в качестве структурного материала и служат индукторами синтеза белка.
Ингибиторы синтеза белка делятся на ингибиторы: 1) транскрипции; 2) процессинга и транспорта РНК и 3) трансляции.
Ингибиторы транскрипции по механизму делятся на три группы: 1) ингибиторы РНК-полимераз; 2) вещества, связывающиеся с матрицей ДНК и нарушающие работу РНК-полимеразы и 3) структурные аналоги нуклеотидов, включающиеся в мРНК.
Препаратом 1-й группы является а-аманитин (яд бледной поганки), избирательно ингибирующий РНК-полимеразу Ш (ответственную за транскрипцию мРНК); рифампицин, ингибирующий ядрышковую РНК-полимеразу I (отвечает за транскрипцию рРНК) и обратную транскриптазу.
Ко второй группе относятся актиномицин D (используется в биохимических исследованиях), антибиотики олигоми-цин, дактиномицин и растительные алкалоиды винбластин и винкристин, ко-
411
Глава 26 Биосинтез белка (трансляция)
торне применяются в медицине как противоопухолевые препарты.
К третьей группе относится, например, 5-фторурацил, включающийся в мРНК вместо природного нуклеотида и приводящий в негодность синтезируемую матрицу РНК.
Ингибиторы процессинга и транспорта РНК. К ним относятся ингибиторы внутриядерных РНК-аз, РНК-лигаз, осуществляющих различные фазы созревания РНК. Препятствует присоединению полиаденилового фрагмента к мРНК кордицепин.
Ингибиторы трансляции. К ним относятся антибиотики, применяемые как антибактериальные препараты.
Хлорамфеникол действует на 70S рибосомы и рибосомы митохондрий и хлоропластов эукариот. Хлормафеникол связывается с 50S субчастицей рибосом и блокирует пептидилтрансферазную реакцию, вызывая преждевременный обрыв синтезируемой полипептидной цепи.
Линкомицин действует на 80S рибосомы.
Эритромицин (и другие макролиды) ингибирует транслокацию пептидил-тРНК из участка А в P-участок 50S субъединицы бактериальных рибосом.
Тетрациклины блокируют связывание мРНК и аминоацил-тРНК с малой субъединицей рибосом, т. е. фазу инициации и элонгации синтеза белка в рибосомах.
Стрептомицин влияет на 70S рибосомы бактерий и не оказывает действия на 80S рибосомы. Специфически связывается с белком малой субъединицы и нарушает правильное считывание мРНК.
Подавление синтеза белков дифтерийным токсином
Дифтерия являлась важнейшей причиной смерти детей до открытия специфической вакцины. Летальные эффекты этого заболевания связаны с действием белкового токсина Corynebacterium diphtheriae, бактерий, обитающих в верхних отделах дыхательных путей больного ребенка. Гены, которые кодируют этот токсин, привнесены лизогенными фагами. Доза в несколько мкг дифтерийного токсина является смертельной для неим-мунизированных детей, поскольку токсин подавляет синтез белков. В клетках-мишенях токсин быстро разделяется на 2 фрагмента: фрагмент А 21 кДа и фрагмент В 40 кДа. Фрагмент А токсина катализирует ковалентную модификацию важнейших компонентов белоксинтези-рующей системы, а фрагмент В обеспечивает поступление фрагмента А в цитозоль клеток-мишеней. Фрагмент А, поступивший в цитозоль клетки, убивает ее. Мишенью для фрагмента А является фактор eEF2, катализирующий процесс транслокации мРНК при трансляции; eEF2 содержит diphthamide (дифтамид), необычный аминокислотный остаток с неизвестной функцией, который вызывает посттрансляционную модификацию гистидина. Фрагмент А катализирует перенос аденозиндифосфатрибозного остатка НАД+на атом азота дифтамидного кольца. Эго АДФ-рибозилирование остатка боковой цепи eEF2 блокирует способность eEF2 обеспечивать транслокацию и рост полипептидной цепи. Синтез белка прекращается, что и лежит в основе действия дифтерийного токсина.
412
Глава 27
Регуляция обмена веществ. Витамины
Во второй половине XIX века было установлено, что пищевая ценность продуктов питания определяется содержанием в них белков, жиров, углеводов, минеральных солей, воды. Однако практический опыт свидетельствовал, что даже самая обильная пища не всегда могла предотвратить некоторые заболевания, связанные с дефектом питания, а именно с недостатком или отсутствием витаминов.
Определение и классификации
Витамины — это 1) незаменимые компоненты пищи, которые, присутствуя в небольших количествах в пище, 2) ебеспечивают нормальное протекание 'иохимических и физиологических процессов путем участия в регуляции домена веществ в целостном организме;
при этом витамины не используются для пластических и энергетических нужд грганизма. Человек в сутки потребляет ?коло 600 г пищи в пересчете на сухое 5-ещество, из этого количества пищи на
витамины приходится 100—200 мг.
Все витамины называются тремя способами: 1) по предложению Мак-Коллума (1913 г.) их называют латинскими буквами А, В, С, Е, D, К и др.; 2) наименование по физиологическому эффекту — к названию болезни, которую предупреждает или излечивает витамин, добавляется приставка «анти» (антискорбутный, антигеморрагический, антистерильный и др).; 3) химическое наименование.
В 1974 г. принята временная классификация витаминов:
1. Витамины, растворимые в воде: В( — тиамин, антиневритный; В2 — рибофлавин, витамин роста; РР — никотиновая кислота, антипеллагрический; пантотеновая кислота, антидерматитный; В6 — пиридоксол, антидерматитный; В,, — цианкобаламин, антианемический; Вс — фолиевая кислота, антианемический; Н — биотин, антисеборрейный; С — аскорбиновая кислота, антискорбутный; Р — рутин, капилляроукрепляющий.
2. Витамины, растворимые в жирах: А — ретинол, антиксерофтальмический;
413
Глава 27 Регуляция обмена веществ
D — кальциферол, антирахитический; Е — токоферол, антистерильный; К — филлохинон, антигеморрагический.
3. Витаминоподобные вещества: холин; липоевая кислота; оротовая кислота; витамин Bt5; инозит; ПАБК (параами-нобензойная кислота); карнитин; витамин U.
Функциональная классификация витаминов:
1. Витамины, участвующие в ферментативных реакциях в качестве кофакторов ферментов (В,, В2, В6, В12, РР, фолиевая кислота, биотин, пантотеновая кислота, К); это направление интенсивно развивают школы Ю. М. Островского, В. Б. Спиричева, А. Я. Розанова и других ученых.
2. Витамины-антиоксиданты (С, Е, каротиноиды); это направление реализовано в виде антиоксидантного комплекса для реабилитации людей в постчернобыльском периоде (Т.С. Морозкина).
3. Витамины-прогормоны (A, D). Развиваются представления о гормональноопосредованном действии витаминов (ин-сулин-опосредованная стимуляция синтеза апофермента транскетолазы или стресс-подобные эффекты производных витамина РР) (В. В. Виноградов, 2007).
Недостаточное поступление витамина с пищей ведет к его дефициту в организме и развитию одного из трех состояний (по В. Б. Спиричеву и соавт., 2001):
1. Авитаминоз — практически полное истощение витаминных ресурсов организма с развернутой клинической картиной его недостаточности (цинга — авитаминоз С, рахит — авитаминоз D, бери-бери — авитаминоз Вр пеллагра авитаминоз РР). В настоящее время авитаминозы встречаются редко.
2. Гиповитаминозы — состояние выраженного снижения запасов витамина в организме, вызывающего появление ряда, в основном, неспецифических и
слабо выраженных клинических симптомов, нередко общих для различных видов гиповитаминозов, а также некоторых более специфических клинических проявлений.
3. Субнормальная обеспеченность витаминами представляет собой более раннюю доклиническую стадию дефицита витаминов, проявляющуюся, в основном, нарушениями метаболических и физиологических реакций, в которых участвует данный витамин. Ее можно выявить только биохимическими методами.
В таблице 27.1. систематизированы клинические проявления дефицита витаминов в соответствии с общепринятым описанием статуса.
При недостатке нескольких витаминов — полигиповитаминозы, а при их отсутствии в пище — полиавитаминозы.
Как сказал В. А. Энгельгардт: «Витамины проявляют себя не своим присутствием, а своим отсутствием». При чрезмерном введении витаминов (жирорастворимых, иногда Bt) могут развиваться гипервитаминозы.
Чаще всего встречаются гиповитаминозы, причинами которых являются:
1) недостаток витаминов в продуктах питания;
2) нарушения всасывания витаминов, в результате заболеваний желудочно-кишечного тракта;
3) нарушения метаболизма витаминов (нарушение синтеза транспортных белков, образования коферментов и др.);
4) подавление жизнедеятельности микрофлоры кишечника, вырабатывающей ряд витаминов, при пероральном применении антибиотиков и сульфаниламидных препаратов;
5) повышенная потребность в витаминах при росте, беременности, лактации, физической нагрузке;
6) повышенное выведение витаминов и ДР-
414
Регуляция обмена веществ Глава 27
Таблица 27.1. Некоторые наиболее часто встречаемые неспецифические клинические проявления недостаточности витаминов больного (по В. Б. Спиричеву и соавт.. 2001)
Проявления Недостаточность витаминов
Бледность кожи и слизистых С, В12, РР, ФК, биотин, А
Сухость кожи С, В„, биотин, А
Себорейное шелушение кожи В2, В6, биотин, А
Кожные высыпания (угри, фурункулы) В6, РР, А
Склонность к геморрагиям С, Е, К
Проблемы с волосами (сухость, тусклость, выпадение, В6, биотин, А
перхоть)
Конъюнктивит В2, В6, А
Светобоязнь, нарушение сумеречного зрения А, В2
Хейлоз Вг,В6,РР
Ангулярный стоматит вг.в6
Гипертрофия сосочков языка В2,В6,РР
Глоссит В2, В6, В12, РР, биотин, ФК
«Географический» язык вг, Ве, РР, РР
Диспептические расстройства, поносы, нарушения в12, РР, ФК, А
моторики кишечника
Снижение аппетита А, Вг В2, В6, В12, биотин
Тошнота
Парестезии, параличи BVB12
Периферические полиневриты в1.в6
Микроцитарная гипохромная анемия в6, В12,ФК
Высокая восприимчивость к инфекциям С, А
Повышенная утомляемость, слабость, снижение С, B„B2, В12, А, Е
работоспособности
Раздражительность, беспокойство С, В,, В6, В12, РР, биотин
Бессоница ВРР tr
Последствиями недостаточного потребления витаминов в современных условиях являются: снижение физической и умственной работоспособности, сопротивляемости различным заболеваниям, усиление отрицательного воздействия на организм неблагоприятных экологических условий, вредных факторов производства, нервно-эмоционального напряжения и стресса, повышение профессионального травматизма, чувствительности организма к воздей
ствию радиации, сокращение продолжительности активной трудоспособной жизни.
Недостаточное поступление витаминов в детском и юношеском возрасте отрицательно сказывается на показателях физического развития, заболеваемости, успеваемости, способствует постепенному развитию обменных нарушений, хронических заболеваний и, в конечном итоге, препятствует формированию здорового образа жизни.
415
Глава 27 Регуляция обмена веществ
Количественное определение витаминов
Биохимический показатель обеспеченности витамином — концентрация витамина или его метаболита (коферментной формы) в биологических жидкостях, величина экскреции с мочой, активность витаминзависимых ферментов и др.
Критерий адекватной обеспеченности витамином (нижняя граница нормы) — конкретная величина каждого показателя, относительно которой оценивают обеспеченность организма витамином.
Для количественного определения витаминов используют методы:
1. Физико-химические методы определения содержания витаминов как химических веществ (нг, мкг, мг).
2. Микробиологические методы — по скорости роста микроорганизмов в присутствии витамина судят об его количестве.
3. Биологические методы — определяют минимальное количество пищи или лекарственного препарата, способное предохранить животное (находящееся на диете, в которой отсутствует изучаемый
витамин) от заболевания. Это количество пищи или витаминного препарата принимают за витаминную единицу.
Определение витаминного статуса организма посредством биохимических методов анализа содержания витаминов является наиболее объективным способом идентификации лиц на ранней стадии развития витаминного дефицита, когда клинически гиповитаминоз еще не проявляется. Биохимические методы оценки витаминного статуса организма делят на 2 группы (таблица 27.2): 1) прямые, или статические методы — определение концентрации витамина или его метаболита в биологическом материале (традиционном — кровь, плазма/сыворотка крови, эритроциты, лейкоциты, тромбоциты, моча; нетрадиционном, полученном неинвазивным путем — слюна, грудное молоко, спер-моплазма, бронхиальные смывы, слезная жидкость, пот);
2) динамические (функциональные), подразумевающие измерение ответа in vitro или in vivo (например, активность витаминзависимых ферментов и степень их активации добавленным коферментом in vitro или оценка накопления продуктов метаболизма in vivo).
Таблица 27.2. Биохимические показатели обеспеченности организма витаминами (по В. Б. Спиричеву и соавт., 2001)
Витамин Статические Динамические
Кровь Моча Функциональный тест
С Аскорбиновая кислота Аскорбиновая кислота -
в, Тиамин, тиаминдифосфат Тиамин ТДФ-эффект
В2 Рибофлавин, ФМН, ФАД Рибофлавин ФАД-эффект, ФМН-эффект
В6 Пиридоксальфосфат (ПАЛФ) 4-пиридоксиловая кислота ПАЛФ-эффект
рр НАД+НАДФ 1 -метилникотинамид -
А Ретинол, каротиноиды -
Е Токоферол - —
416
Регуляция обмена веществ Глава 27
Физиологическая потребность в витаминах и рекомендуемые нормы их потребления
Физиологическая потребность — объективная реальность, предопределенная природой и условиями жизни человека. Она не зависит от уровня знаний на каждом отрезке времени существования человечества. Ее можно пытаться узнать, но ее нельзя «нормировать» или «рекомендовать». Физиологическая потребность индивидуальна и может относительно широко варьировать среди
представителей одной и той же половозрелой группы людей в зависимости от особенностей организма, условий внешней среды и труда отдельных индивидуумов.
Рекомендуемая норма (размер) потребления устанавливается с учетом индивидуальных потребностей людей, входящих в данную половозрелую группу, таким образом, чтобы гарантированно перекрыть разброс индивидуальных потребностей подавляющего большинства (обычно 97,5 %) ее состава (таблица 27.3).
Таблица 27.3. Критерии нормальной обеспеченности витаминами организма здоровых взрослых и детей разного возраста (по В. Б. Спиричеву и соавт., 2001)
Витамин Показатель Норма
С Концентрация аскорбиновой кислоты в плазме крови, мг/л Экскреция аскорбиновой кислоты с мочой, мг/ч: 4-15
Дети 5-10 лет >0,2
Дети старше 12 лет и взрослые >0,4
В, ТДФ-эффект 1,00-1,25
Экскреция тиамина с мочой, мкг/ч: >10
Дети 5-7 лет >11
Дети 9-11 лет Дети старше 12 лет и взрослые >12
В2 ФАД-эффект 1,00-1,25
Концентрация рибофлавина в эритроцитах, нг/мл >130
Концентрация рибофлавина в плазме крови, нг/мл 6,0-20,0
Экскреция рибофлавина с мочой, мкг/ч: >9
Дети 5-7 лет >10
Дети 9-11 лет Дети старше 12 лет и взрослые >13
В6 ПАЛФ-эффект 1,00-2,50
Концентрация ПАЛФ в плазме крови, нг/мл 8-20
Экскреция 4-пиридоксиловой кислоты с мочой, мкг/ч: 60-150
Дети 5-7 лет Дети старше 9 лет и взрослые 70-260
РР Концентрация НАД++НАДФ+ в эритроцитах, мкг/мл >40
Экскреция 1-метилникотинамида с мочой, мкг/ч >400
А Концентрация ретинола в плазме крови, мкг/л 300-800
Концентрация каротиноидов в плазме крови, мкг/л 800-2300
Е Концентрация токоферолов в плазме крови, мг/л 8-15
в12 Концентрация цианкобаламина в плазме крови, пг/мл >170
ФК Концентрация фолиевой кислоты в плазме крови, нг/мл >1.5
D Концентрация 25-ОН D в сыворотке крови, нг/мл 15-40
417
Глава 27 Регуляция обмена веществ
По определению, принятому Объединенной группой экспертов ФАО/ВОЗ в 1965 г., «рекомендуемые нормы (размеры) потребления являются такими количествами, которые достаточны для поддержания нормального здоровья почти у всех людей».
Эффективность витаминизации оценивают, определяя показатели витаминной обеспеченности до и после приема витаминов.
Антивитамины
Для витаминов, растворимых в воде, известны антивитамины. В настоящее время антивитамины принято делить на две группы:
1) антивитамины, имеющие структуру, сходную со строением нативного витамина, и оказывающие действие, основанное на конкурентных взаимоотношениях с ним;
2) антивитамины, вызывающие модификацию химической природы витаминов или затрудняющие их всасывание, транспорт, что сопровождается снижением или потерей биологического эффекта витаминов. Структуроподобные антивитамины по существу представляют собой антиметаболиты и при взаимодействии с апоферментом образуют неактивный ферментный комплекс со всеми вытекающими отсюда последствиями.
Помимо структуроподобных аналогов витаминов, введение которых обусловливает развитие истинных авитаминозов, различают антивитамины биологического происхождения, в том числе ферменты и белки, вызывающие расщепление или связывание молекул витаминов с потерей их физиологического действия. К ним относятся, например,
тиаминазы I и II, вызывающие распад молекулы витамина Bt; аскорбатоксида-за, катализирующая разрушение витамина С; белок авидин, связывающий биотин в биологически неактивный комплекс.
Действие антивитаминов следует учитывать при определении потребности организма в витаминах.
Жирорастворимые витамины
К жирорастворимым витаминам относят витамины A, D, Е, К.
Витамин А (ретинол, антиксерофтальмический)
1. Структура. Витамин А является полиизопреноидом, содержащим циклогек-сенильное кольцо. В группу витамина А входят ретинол, ретиналь и ретиноевая кислота. Только ретинол обладает полной функцией витамина А. Термин «ретиноиды» включает природные и синтетические формы ретинола. Растительный предшественник р-каротин обладает 1/6 активности витамина А (рис. 27.1).
2. Транспорт и метаболизм. Эфиры ретинола растворяются в жирах пищи, эмульгируются желчными кислотами и всасываются кишечным эпителием. Всосавшийся ft-каротин расщепляется на две молекулы ретиналя. В клетках эпителия ретиналь восстанавливается в ретинол, и небольшая часть ретиналя окисляется в ретиноевую кислоту. Большая часть ретинола эстерифицируется насыщенными жирными кислотами и в составе хиломикронов поступает через лимфу в кровь. После липолитической трансформации ремнанты хиломикронов захватываются печенью. В печени витамин А запасается в виде эфиров.
418
Регуляция обмена веществ Глава 27
Для транспорта к периферическим тканям эфиры ретинола гидролизуются, и свободный ретинол связывается в сыворотке крови с плазменным ретинолсвязывающим протеином (ПРСП). Ретиноевая кислота транспортируется альбуминами. Внутри периферических клеток ретинол связывается с клеточным ретинолсвязыеающим протеином (КРСП). Токсическое действие витамина А проявляется при появлении свободной формы витамина, т. е. после исчерпания мощности КРСП. Ретинол и ретиналь взаимопревращаются друг в друга с помощью НАДФ-зависимых дегидрогеназ или редуктаз. Ретиноевая кислота не может превращаться в ретинол или ретиналь, поэтому ретиноевая кислота может поддерживать рост и
дифференцировку тканей, но не может заменить ретиналь в зрении или ретинол в функционировании репродуктивных органов.
3. Биологическая роль.
3.1. Ретинол действует подобно гормонам, проникающим в клетку, — связывается с ядерными белками и регулирует экспрессию определенных генов. Ретинол необходим для осуществления нормальной репродуктивной функции.
3.2. Ретиналь участвует в акте зрения. В наружном слое сетчатки глаза располагаются 120 млн палочек (обеспечивают черно-белое зрение за счет наличия родопсина) и 4-6 млн колбочек (отвечают за цветное зрение, поскольку содержат сине-, зелено- и красночувствительные зрительные пигменты). Квант света поглощает молекула родопсина, которая содержит акцептор кванта света — цис-ре-тиналь, две олигосахаридные цепочки и водонерастворимый мембранный белок — опсин (348 аминокислотных остатков). В родопсине 11-цис-рети-наль связан с лизином-296 опсина. При восприятии кванта света происходит превращение 11-цис-ретиналя в 11-транс-ретиналь. Этот процесс фото-изомеризации происходит в течение 100-200 фемтосекунд (1 фс = 10*15 с). Далее следует каскадный процесс усиления принятого светового сигнала в 100000 раз. Для этого: 1) в течение миллисекунд происходят последовательные превращения родопсин *♦ фотородопсин -* батородопсин -► люмиродопсин -* метародопсин I -* метародопсин II; 2) одна молекула метародопсина II активирует 200 молекул трансдуцина (ГТФ-связываю-щий белок, G-белок); 3) каждая активированная молекула трансдуцина активирует одну молекулу фосфодиэстеразы; 4) каждая молекула фосфо
419
Глава 27 Регуляция обмена веществ
диэстеразы превращает до 1000 молекул цГМФ в ГМФ; 5) падение концентрации цГМФ ведет к закрытию специфических ионных каналов в клеточной мембране, через которые в темноте в цитозоль поступали ионы натрия и кальция; 6) в результате прекращения входа ионов на клеточной мембране фоторецепторных клеток палочек и колбочек увеличивается электрический потенциал (гиперполяризация); 7) гиперполяризация служит физиологическим ответом фоторецепторной клетки на поглощение молекулой родопсина кванта света. Далее возникший биоэлектрический сигнал через 2 синапса сетчатки по зрительному нерву отправляется в мозг для анализа (М. А. Островский, 2008). Для повторного восприятия (т.е. в темноте) транс-ре-тиналь восстанавливается алкогольде -гидрогеназой в транс-ретинол (здесь возможны потери витамина А). Транс-ретинол изомеризуется в цисретинол (здесь возможно восполнение убыли витамина А). Цис-ретинол окисляется в цис-ретиналь, который, соединяясь с опсином, образует родопсин. Система светоощущения готова к восприятию следующего кванта света.
3.3. Ретиноевая кислота участвует в синтезе гликопротеинов, усиливает рост и дифференцировку тканей.
3.4. Ретиноиды обладают антиопухо-левой активностью и ослабляют действие канцерогенов.
3.5. ф-Каротин — антиоксидант и способен обезвреживать пероксидные свободные радикалы (ROO*) в тканях с низким парциальным давлением кислорода.
4. Источники. Витамин А содержится только в продуктах животного происхождения (печень, почки, сливочное масло, рыбий жир). Из печени пресно
водных рыб выделен витамин А2, который отличается наличием еще одной двойной связи в 3—4 положении и называется 3-дегидроретинол. Биологическая активность витамина А2 для млекопитающих соответствует примерно 40 % активности витамина А,. В растениях есть пигменты - а-, 0- и у-каротины, которые могут превращаться в витамин А (морковь, томаты).
5. Суточная потребность. 1—2,5 мг витамина А (5000—7000 ME). 1 ME = 0,344 мкг ретинолацетата. Частично потребность в витамине А может покрываться за счет каротина (2—5 мг), причем 1 мг каротина — 0,67 мг ретинола.
6. Гиповитаминоз.
Проявляется в виде нарушения зрения при слабом освещении — куриной слепоты — гемералопия. Это наиболее ранний признак недостаточности витамина А: человек нормально видит при дневном освещении и очень плохо различает предметы при скудном освещении (в сумерках). Авитаминоз характеризуется падением массы тела, остановкой роста, пролиферацией и ороговеванием эпителия, сухости кожи и слизистых, слущиванием эпителия, нарушением репродуктивной функции. Сухость роговицы глаза называется ксерофтальмия (отсюда название витамина — ан-тиксерофтальмический). Повреждение эпителия мочевых путей, кишечника приводит к развитию воспалительных заболеваний. Важнейшей причиной недостаточности витамина А являются нарушения всасывания и транспорта липидов. При введении высоких доз витамина А развивается гипер-витаминоз А.
420
Регуляция обмена веществ Глава 27
Витамин D (кальциферол, антирахитический)
1. Структура. В растительных продуктах содержится эргостерол, который при действии ультрафиолетовых лучей превращается в витамин D2 (эргокальциферол). В животных тканях распространен 7-дегидрохолестерол, который в коже при облучении ультрафиолетовыми лучами превращается в витамин D3 (холе-калъциферол) (рис. 27.2).
2. Метаболизм. Витамин D пищи всасывается в составе мицелл. В крови транспортируется в связи со специфическим
транспортным глобулином. В гепатоцитах гидроксилируется в 25-гидроксихоле-кальциферол (25-ОН-D3). Это главная резервная в печени и транспортная в крови форма витамина D. Часть 25-OH-D3 участвует в энтеро-печеночной циркуляции (как желчные кислоты). При ее нарушении может возникать дефицит витамина D. В почках, плаценте и костях 25-ОН-D3 может гидроксилироваться в положении 1 с образованием 1,25-дигид-роксихолекальциферола или калъцитриола. Продукция калъцитриола регулируется собственной концентрацией, паратгормоном и сывороточными фосфатами.
Кальцитриол
Витамин Оз (холекальциферол)
Рис. 27.2. Схема образования витамина D и его активной формы кальцитриола.
421
Глава 27, Регуляция обмена веществ
3. Биологическая роль. Кальцитриол функционирует подобно проникающим гормонам. Кальцитриол — единственный регулятор перемещения кальция через мембрану знтероцитов против градиента концентрации. Кальцитриол стимулирует биосинтез в энтероцитах кальций-связывающего белка, что обеспечивает всасывание кальция и фосфатов в тонком кишечнике. Витамин D3 усиливает реабсорбцию фосфатов в почечных канальцах, что способствует поддержанию нормального соотношения Са2+ и ПРО.3 в плазме и внеклеточных жидкостях. Это необходимо для кальцификации молодой растущей костной ткани.
4. Источники, рыбий жир, печень рыб и животных, сливочное масло, яичный желток, молоко.
5. Суточная потребность. Потребность в витамине D зависит от возраста и состояния организма и составляет 12— 25 мкг (500—1000 ME) в сутки (1 мкг = 40 ME).
6. Гиповитаминоз.
При недостатке витамина D у детей развивается заболевание рахит: нарушение минерализации костей, позднее развитие зубов, гипотония
мышц. При недостатке витамина D у взрослых развивается остеопороз. Для профилактики D-гиповитаминоза используют ультрафиолетовое облучение кожи и пищи. При передозировке витамина D (в дозах, превышающих лечебные в 2-3 тысячи раз 1 500 000 ME) развивается гипереитаминоз: у детей остановка роста, рвота, исхудание, повышение артериального давления, возбуждение с переходом в ступор. В основе — гиперкальциемия и кальцификация внутренних органов.
Витамин Е (токоферол, антистерильный)
1. Структура. К витамину Е относится группа соединений — производных токола, обладающих витаминной активностью. Известно 8 видов токоферолов — а, р, у, S и т. д. Наибольшей активностью обладает а-то-коферол (5,7,8-триметилтокол) (рис. 27.3).
2. Транспорт и метаболизм. Витамин Е не метаболизируется в организме. Нарушение всасывания липидов мо
422
Регуляция обмена веществ Глава 27
жет приводить к дефициту токоферола, поскольку токоферол растворяется в жирах пищи, высвобождается и всасывается во время их переваривания. Токоферол всасывается в кишечнике и в составе хиломикронов через лимфу поступает в кровь. Токоферол попадает в ткани, в капиллярах которых хиломикроны подвергались действию липопротеинлипазы, а в печень витамин Е поступает в составе ремнан-тов хиломикронов. Токоферол транспортируется из печени к периферическим тканям в составе ЛПОНП. Депонируется витамин в жировой ткани, печени и мышцах.
3. Биологическая роль.
3.1. Витамин Е накапливается в мембранах клеток и действует как антиоксидант, прерывая цепи свободно-радикальных реакций. Анти-стерильный эффект связан с антиоксидантным действием витамина Е, когда он, препятствуя пероксид-ному повреждению мембран, обеспечивает нормальный контакт между клетками (предотвращает преждевременное отделение сперма-тогоний при созревании сперматозоидов или обеспечивает имплантацию оплодотворенной яйцеклетки в слизистую матки).
В отличие от других витаминов, витамин Е повторно не используется и после своего действия должен заменяться новыми молекулами токоферола.
Антиоксидантное действие токоферола эффективно при высокой концентрации кислорода, поэтому он находится в мембранах клеток с высоким парциальным давлением кислорода (мембраны эритроцитов, клеток респираторных органов). Потребность в витамине Е
повышается при увеличении потребления ненасыщенных жирных кислот.
3.2. Витамин Е и селен (Se) действуют как синергисты. Se входит в состав глутатионпероксидазы, которая обеспечивает обезвреживание перок-сидных радикалов. Se необходим для нормального функционирования поджелудочной железы. При нарушении ее функции нарушаются переваривание и всасывание липидов и вторично витамина Е.
3.3. Витамин Е может участвовать в функционировании SH-содержащих ферментов, влиять на биосинтез KoQ, участвовать в механизмах переноса электронов по дыхательной цепи митохондрий.
4. Источником витамина Е для человека являются растительные масла, а также зерновые продукты, ягоды шиповника, салат, капуста.
5. Суточная потребность. 20*30 мг.
6. Дефицит витамина Е.
При дефиците витамина Е нарушается образование сперматозоидов у мужчин и развитие плода у женщин. Отмечаются дегенеративные изменения клеток репродуктивных органов, мышечная дистрофия, дегенеративные изменения клеток спинного мозга, жировое перерождение печени, дислипопротеине-мии. У новорожденных может развиваться анемия, поэтому витамин Е необходимо добавлять к пище беременных и кормящих грудным молоком женщин. Анемия развивается из-за уменьшения продукции гемоглобина и сокращения продолжительности жизни эритроцитов. При нарушении переваривания и всасывания липидов развивается гиповитаминоз Е. ведущий к неврологическим заболеваниям.
423
Регуляция обмена веществ Глава 27
3. Биологическая роль.
3.1. Витамин К стимулирует биосинтез в печени четырех белковых факторов свертывания крови (П-про-тромбин; VII-проконвертин; IX-фактор Кристмаса, или антигемо-фильный глобулин В; Х-фактор Стюарта-Прауэра).
3.2. Витамин К действует как кофактор карбоксилазы на этапе посттрансляционной модификации глутаминовых остатков протромбина. Протромбин содержит 10 таких остатков, которые карбоксилируются витамин К-зависимой карбоксилазой. Образуется у-карбоксиглутамат, который затем хелатируется кальцием, что важно для свертывания крови.
3.3. Реакция карбоксилирования требует СО2 и восстановленной (гидро-хиноидной) формы витамина К. В эндоплазматическом ретикулуме есть цикл восстановления продукта карбоксилазной реакции витамина К (т. е. хиноидной формы в гидрохино-идную). Центральное место занимают две редуктазные реакции (в первой используются дитиоловый восстановитель, во второй — НАДФ-зависимая редуктаза).
3.4. Описано участие витамина К в окислительном фосфорилировании, его многостороннее анаболическое действие, функционирование в составе мембран.
5. Основной источник витамина К — микрофлора кишечника. Возможно поступление нафтохинонов с пищей (шпинат, тыква, капуста, ягоды рябины, печень животных).
6. Суточная потребность. Суточная потребность условно выражается 0,2— 0,3 мг.
7. Дефицит витамина К.
При нормальной микрофлоре кишечника у взрослых дефицита витамина К не бывает. Основная причина гиповитаминоза К — это стерилизация кишечника антибиотиками и сульфаниламидными препаратами. У новорожденных возможен дефицит витамина К, так как плацента его не пропускает, а кишечник стерилен. После родов содержание витамина К в плазме падает, но после еды восстанавливается. Если уровень протромбина низкий, возможно развитие геморрагического синдрома. Гипови-таминоз К бывает при мальабсорбции, дисфункции гелато-билиарной и панкреатической систем, при атрофии слизистой кишечника. Основные проявления гиповитаминоза К связаны с нарушением внутрисосудистого свертывания крови и кровоточивостью.
425
Водорастворимые витамины
К водорастворимым витаминам относят витамины группы В, С, Р, Н.
Витамин С (аскорбиновая кислота, антискорбутный витамин)
1. Структура. Витамин С по структуре представляет собой у-лакгон, имеющий 2 ассиметричных атома углерода. Биологически активной является L-форма аскорбиновой кислоты (рис. 28.1).
Кислые свойства аскорбиновой кислоты обусловлены наличием 2-х енольных гидроксильных групп. L-аскорбино-вая кислота обратимо подвергается окислению с образованием дегидроас-корбиновой кислоты под действием фермента аскорбатоксидазы. Восстановление дегидроаскорбиновой кислоты в аскорбиновую осуществляется с участием редуктазы и восстановленного глутатиона. Аскорбиновая и дегидроаскорби-новая кислоты являются биологически активными формами витамина. При гидратации в присутствии кислорода де-гидроаскорбиновая кислота необратимо
окисляется в 2,3-дикетогулоновую кислоту, которая не обладает биологической активностью и распадается до щавелевой и треоновой кислот. Скорость разрушения витамина возрастает с повышением температуры, в щелочной среде, под действием УФ-лучей, в присутствии солей тяжелых металлов (например, меди). Аскорбиновая кислота разрушается в процессе приготовления пищи и хранения продуктов.
2. Метаболизм. Аскорбиновая кислота всасывается путем простой диффузии на всем протяжении желудочно-кишечного тракта, но преимущественно в тонком кишечнике. В организме не накапливается.
3. Биологическая роль.
3.1. Окислительно-восстановительные реакции. Аскорбиновая кислота является сильным восстановителем с окислительно-восстановительным потенциалом +0,08 В и участвует в восстановлении молекулярного кислорода, нитратов и цитохромов а и с.
3.2. Гидроксилирование остатков пролина и лизина в процессе биосинтеза коллагена. ОН-группы гидроксипролина необходимы для стабилизации
426
Водорастворимые витамины Глава 28
НО—С о и О=С
II О - - I о
H°-f ? + 2Н °=f ?
н—с—' н—с—'
но—с—н но—с—н
сн2он сн2он
Аскорбиновая кислота
Дегидроаскорбиновая кислота
Рис. 28.1. Витамин С.
структуры коллагена, формируя водородные связи между цепями триплетной спирали зрелого коллагена. Гидроксилизин в коллагене служит для образования участков связывания с полисахаридами. Витамин С необходим для формирования костной ткани, поскольку основными компонентами костной ткани являются органический матрикс, коллаген, неорганический кальций и фосфаты.
3.3. Метаболизм тирозина. При синтезе катехоламинов норадреналина и адреналина из тирозина в надпочечниках и центральной нервной системе происходит окисление Си+ в Си2+; для обратного процесса восстановления меди необходима аскорбиновая кислота. Кроме того, аскорбиновая кислота требуется для окисления п-гидроксифенилпирувата в гомогенти-зиновую кислоту.
3.4. Гидроксилирование триптофана в гидрокситриптофан при биосинтезе серотонина.
3.5. Биосинтез желчных кислот из холестерола.
3.6. Синтез кортикостероидных гор
монов. В коре надпочечников витамин С содержится в высокой концентрации, особенно в период стресса. Предполагают, что витамин С необходим для синтеза кортикостероидов. 3.7. Метаболизм железа и гемоглобина. Аскорбиновая кислота повышает всасывание железа из кишечника пу -тем его восстановления в Fe~“: участвует в образовании ферритина и высвобождении железа из связи его с транспортным белком крови трансферрином; способствует восстановлению метгемоглобина в гемоглобин и участвует в деградации гемоглобина до желчных пигментов.
3.8. Метаболизм фолиевой кислоты. Активной формой фолиевой кислоты является тетрагидрофолиевая кислота (ТГФК). Витамин С необходим хтя образования ТГФК и вместе с ТГФК участвует в созревании эритроцитов. 3.9. Витамин С является водорастворимым антиоксидантом и защищает клетки от повреждения свободными радикалами. Антиоксидантная функция аскорбиновой кислоты объясняется ее способностью легко отдавать
427
Глава 28 Водорастворимые витамины
два атома водорода, используемых в реакциях обезвреживания свободных радикалов.
4. Источники. В организме человека, обезьян, морских свинок и некоторых птиц витамин С не синтезируется. Источником витамина С служит растительная пища. Особенно им богаты перец, черная смородина, укроп, петрушка, капуста, щавель, цитрусовые, земляника.
5. Суточная потребность 70—120 мг.
6. Гиповитаминоз.
Проявляется повышенным утомлением, снижением аппетита, сниженной устойчивостью к простудным заболеваниям, кровоточивостью десен. Авитаминоз приводит к заболеванию цингой (скорбутом). Главными симптомами цинги являются нарушение проницаемости капилляров, обусловленное недостаточностью гидроксилирования пролина и лизина в коллагене, расшатывание и выпадение зубов, отеки и боли в суставах, поражение костей, нарушение заживления ран. Смерть обычно наступает от кровоизлияния в полость перикарда. При гиповита-мизозе С развивается железодефицитная анемия из-за нарушения всасывания железа и использования его запасов при синтезе гемоглобина.
Витамин В1 (тиамин, антиневритный витамин)
1. Структура. Витамин В, был первым витамином, выделенным в кристаллическом виде К. Функом в 1912 г. Позже был осуществлен его химический синтез. Свое название — тиамин — получил из-за наличия в составе его молекулы атома серы и аминогруппы. Тиамин состоит из 2-х гетероциклических колец — аминопиримидинового и тиазолового. Последнее содержит каталитически активную функциональную группу — карбанион (относительно кислый углерод между серой и азотом) (рис. 28.2).
Тиамин устойчив в кислой среде и выдерживает нагревание до высокой температуры. В щелочной среде витамин быстро разрушается.
2. Транспорт и метаболизм. В желудочно-кишечном тракте различные формы витамина гидролизуются с образованием свободного тиамина. Большая часть тиамина всасывается в тонком кишечнике с помощью специального механизма активного транспорта, остальное количество расщепляется тиаминазой кишечных бактерий. С током крови всосавшийся тиамин попадает вначале в печень, где фосфорилируется, а затем переносится в другие органы и ткани.
тиаминпиро-фосфаткиназа АТФ+тиамин---------► ТПФ+АМФ
Рис. 28.2. Витамин Вг
------------------------------------------
nh2 !
CHrN—С-СН3 НС.о.С-СК2-СН2-0Н ' 14 Ь ,1
428
Водорастворимые витамины Глава 28
Витамин В! присутствует в различных органах и тканях как в форме свободного тиамина, так и его фосфорных эфиров: тиаминмонофосфата, тиаминдифосфата и тиаминтрифосфата. Основной коферментной формой (COSO % от общего внутриклеточного) является тиаминдифосфат, или тиаминпирофосфат (ТДФ или ТПФ). Роль тиаминмонофосфата и тиаминтрифосфата пока неизвестна. Возможно они и аденилированная форма тиаминтрифосфата участвуют в реакциях приспособительного характера, путем переключения метаболических потоков углеводов.
После распада коферментов свободный тиамин выделяется с мочой и определяется в виде тиохрома.
3. Биологическая роль
3.1. ТПФ является коферментом 3-х полиферментных комплексов, которые катализируют окислительное декарбоксилирование кетокислот:
• Пируватдегидрогеназный комплекс участвует в окислительном декарбоксилировании пирувата, что является одной из ключевых реакций в обмене углеводов. В результате этой реакции образуется ацетил-КоА, ацетильная группа которого включается в цикл трикарбоновых кислот, где окисляется до углекислоты и воды. Благодаря этой реакции создаются условия для полного окисления углеводов и утилизации всей заключенной в них энергии. Кроме того, образующийся ацетил-КоА служит источником для синтеза многих биологических продуктов: жирных кислот, холестерола, стероидных гормонов, кетоновых тел и т. д.
• 2 - Оксоглутаратде гидрогеназный комплекс входит в состав ЦТК и катализирует окислительное декарбоксилирование 2-оксоглутарата с образованием сукцинил-КоА.
• Дегидрогеназа кетокислот с разветвленным углеродным радикалом участвует в метаболизме валина, изолейцина и лейцина.
3.2. ТПФ является коферментом транскетолазы — фермента пентозофосфатного пути окисления углеводов, основными продуктами которого являются НАДФН и рибоза.
3.3. Витамин В] принимает участие в синтезе ацетилхолина, катализируя в пируватдегидрогеназной реакции образование ацетил-КоА.
4. Источники. Довольно много витамина содержится в пшеничном хлебе из муки грубого помола, в оболочке семян хлебных злаков, в сое, фасоли, горохе, дрожжах. Из продуктов животного происхождения наиболее богаты тиамином печень, нежирная свинина, почки, мозг, яичный желток.
5. Суточная потребность составляет 2— 3 мг.
6. Гиповитаминоз.
Проявляется слабостью, снижением аппетита, тошнотой, нарушением периферической чувствительности, онемением пальцев, ощущением ползанья «мурашек», болями по ходу нервов. При авитаминозе развивается заболевание бери-бери, что в переводе с индийского означает овца, так как походка больного человека напоминает поступь овцы. У больных бери-бери концентрации пирувата и 2-оксоглу-тарата в крови выше, чем в норме. Низкая активность транскетолазы в эритроцитах является лабораторным критерием бери-бери. Характерно поражение сердечно-сосудистой и нервной систем. Особая чувствительность нервной ткани к недостатку тиамина объясняется тем, что коферментная форма этого витамина необходима нервным клеткам для усвоения глюкозы.
429
Глава 28 Водорастворимые витамины
Аналогичные симптомы проявляются также при отравлении ртутью и мышьяком. Оба элемента связывают SH-группы липоевой кислоты в составе дигидролипоилдегидрогеназы. Для снятия токсических эффектов этих элементов используют сульфгидрильные соединения типа 2,3-меркаптоэтанола.
Жирорастворимые формы тиамина
Жирорастворимые формы тиамина (по О. А. Громовой и В. Г. Реброву, 2007). Жирорастворимые аналоги витамина 1 — аллитиамины (от лат. Allium — чеснок) — М. Fujiwara обнаружил еще в 1954 г. в известных своими иммуномодулирующими свойствами растениях — чесноке, луке и луке-порее. Оказалось, что полученные жирорастворимые дериваты тиамина многократно лучше проникают через бислой липидов клеточных мембран. Отметим, что с возрастом и при атеросклерозе жидкостность и проницаемость мембран уменьшаются за счет накопления в бислое насыщенных остатков жирных кислот и холестерола. Прием жирорастворимых форм поднимает уровни витамина В, в крови и тканях намного выше, чем растворимые в воде соли тиамина (тиамина бромид, тиамина хлорид). В последние десятилетия используется жирорастворимый и проникающий через липидный бислой клеточных мембран дериват витамина — бенфотиалшн. Биодоступность бенфотиамина составляет 600, фур-сулътиамина — около 300, а водорастворимого тиамин-дисульфида — менее 40 мг/ч/мл. Бен-фотиамин устойчив по отношению к тиаминазе, увеличивает активность транскетолазы на 250 % (в широко применяемом в лабораторной практике тесте активации транскетолазы тиамином, ТДФ-эффекг — всего лишь менее чем на 25 %). Среди жирорастворимых форм бенфоти-амин имеет лучший клинико-фармакологический профиль: наибольшую биодоступность, способность проникать в клетку и наименьшую токсичность (по сравнению с тиамином токсичность бенфотиамина меньше в 15 раз).
Витамин В2 (рибофлавин)
1. Структура. Витамин В2 отличается от других витаминов желтым цветом
(flavus — желтый). Рибофлавин впервые был выделен из кисломолочной сыворотки. Молекула рибофлавина состоит из гетероциклического изоаллоксазинового ядра, к которому в 9-м положении присоединен спирт рибитол (производное D-рибозы). Термином флавины обозначаются многие производные изоаллоксазина, обладающие В2-витаминной активностью.
Биосинтез флавинов осуществляется растительными и многими бактериальными клетками, а также плесневыми грибками и дрожжами. Благодаря микробному биосинтезу рибофлавина в желудочно-кишечном тракте жвачные животные не нуждаются в этом витамине. У других животных и человека синтезированных в кишечнике флавинов недостаточно для предупреждения гиповитаминозов. Витамин В2 хорошо растворим в воде, устойчив в кислой среде, но легко разрушается в нейтральной и щелочной, а также под действием видимого и УФ-света. Витамин В2 легко подвергается обратимому восстановлению, присоединяя водород по месту двойных связей (1 и 10), превращаясь из оранжево-желтого раствора в бесцветную лейкоформу (рис. 28.3).
2. Метаболизм. В пище витамин В, находится преимущественно в составе своих коферментных форм, связанных с белками —- флавопротеинов. Под влиянием пищеварительных ферментов витамин высвобождается и всасывается путем простой диффузии в тонком кишечнике. В клетках слизистой кишечника, крови, печени и других тканях рибофлавин фосфорилируется до флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД).
3. Биологическая роль. Основное значение витамина В2 состоит в том, что он входит в состав флавиновых коферментов — ФМН и ФАД. Различают два типа реакций, катализируемых флавопротеинами:
430
Водорастворимые витамины Глава 28
3.1. Простые дыхательные системы — это прямое окисление субстрата с участием кислорода, перенос на него атомов водорода с образованием Н2О2 и выделением энергии в виде тепла: оксидазы L- и D-аминокислот, ксантиноксидаза (разрушение пуриновых азотистых оснований), альдегиддегидрогеназа (деградация альдегидов).
3.2. Участие в сложных дыхательных системах
• ФАД во втором комплексе цепи переноса электронов во внутренней мембране митохондрий (сукцинатдегидрогеназа и ацил-КоА-дегидроге-наза — дегидрирование метаболита ЦТК сукцината и ацил-КоА при окислении жирных кислот);
• НАДН-дегидрогеназа (перенос протонов и электронов от НАДН+Н+ матрикса на ФМН первого комплекса цепи переноса электронов во внутренней мембране митохондрий);
• дигидролипоилдегидрогеназа (ФАД —- кофактор фермента окислительного декарбоксилирования а-кетокислот пирувата и 2-оксоглута-рата).
4. Источники. Основными источниками рибофлавина являются печень, поч-<и. желток куриного яйца, творог. В числом молоке витамина содержится
больше, чем в свежем. В растительных продуктах витамина В2 мало (исключение — миндальные орехи). Частично дефицит рибофлавина восполняется кишечной микрофлорой.
5. Суточная потребность 2—3 мг.
6. Гиповитаминоз.
Недостаток витамина В2, как и других витаминов, проявляется слабостью, повышенной утомляемостью, склонностью к простудным заболеваниям. К специфическим проявлениям недостаточности рибофлавина относятся воспалительные процессы в слизистых оболочках. Слизистая губ и полости рта становится сухой, язык приобретает ярко-красный цвет, в углах рта появляются трещины. Отмечается повышенное шелушение эпителия кожи, особенно на лице.
Витамин РР (никотиновая кислота, никотинамид, ниацин; анти пеллагрический витамин)
1. Структура. Витамин РР выделен К. Эвельгеймом в 1937 г. Его введение предохраняло от заболевания пеллаг
431
Глава 28 Водорастворимые витамины
ра или излечивало ее. РР означает противопеллагрический (preventive pellagra).
Никотиновая кислота является пири-дин-3-карбоновой кислотой, никотинамид — ее амидом. Оба соединения в организме легко превращаются друг в друга и поэтому обладают одинаковой витаминной активностью (рис. 28.4).
Витамин РР плохо растворим в воде, но хорошо в водных растворах щелочей. 2. Метаболизм. Поступающий с пищей витамин РР быстро всасывается в желудке и кишечнике в основном путем простой диффузии. С током крови никотиновая кислота попадает в печень и другие органы, несколько медленнее проникает в них никотинамид. В тканях оба соединения преимущественно используются для синтеза коферментных форм НАД* и НАДФ+. Часть никотинамидных коферментов синтезируется в организме животных из триптофана. Однако этот путь, в который вовлекается до 2 % метаболического пула триптофана, значительно уступает по эффективности первому (т. е. из прямого витаминного предшественника).
3. Биологическая роль. Значение витамина РР определяется ролью коферментов НАД+ и НАДФ+.
3.1. НАД* входит в состав дегидрогеназ, катализирующих окислительно-восстановительные превращения пирувата, изоцитрата, 2-оксоглутарата, малата и др. Эти реакции чаще локализованы в митохондриях и служат для освобождения энергии в сопряжен-
Никотиновая кислота
Никотинамид
Рис. 28.4. Витамин РР.
ных митохондриальных цепях переноса протонов и электронов.
3.2. НАДФ+ входит в состав дегидрогеназ (редуктаз), которые чаще локализованы в цитозоле или эндоплазматическом ретикулуме и служат для восстановительных синтезов (НАДФ-зависимые дегидрогеназы пентозофосфатного пути, синтеза жирных кислот и холестерола, митохондриальные монооксигеназные системы для синтеза желчных кислот, кортикостероидных гормонов) и обезвреживания ксенобиотиков (микросомальное окисление, оксигеназы со смешанной функцией).
3.3. НАД* и НАДФ* — аллостерические регуляторы ферментов энергетического обмена.
4. Источники. Продукты животного (печень, мясо) и растительного происхождения (рис, хлеб, картофель). Молоко и яйца содержат следы ниацина, но в них содержится триптофан, что может компенсировать недостаточное поступление никотинамида с пищей.
5. Суточная потребность составляет 15—25 мг.
6. Гиповитаминоз.
f-y Характерным признаком недоста-qF7 точности витамина РР является х симптомокомплекс «три Д»: дер-
матит, диарея и деменция. В основе заболевания лежит нарушение пролиферативной активност» и энергетики клеток. Дерматит чаще всего отмечается на открыл тых участках кожи, которая поя действием солнечных лучей краснеет, покрывается пигментным» < пятнами (на лице в виде крыльев бабочки) и шелушится. Язык ста- ; новится ярко-красным и болезненным, утолщается, на нем пояалв-ются трещины. Расстройств© пищеварения проявляется топхо
432
Водорастворимые витамины Глава 28
той, отсутствием аппетита, болями в животе. Нарушается функция периферических нервов и центральной нервной системы.
Симптомы гиповитаминоза развиваются:
1. У лиц с недостатком белка в диете. Объясняется это тем, что животные белки содержат оптимальное количество аминокислоты триптофана, витамина В6 и некоторые другие компоненты, необходимые для синтеза ниацина.
2. При постоянном питании маисом, где ниацин находится в связанной форме.
3. При постоянном питании сорго, зерна которого содержат высокую концентрацию лейцина — ингибитора ключевого фермента превращения триптофана в НАД+.
4. При дефиците витамина В6 и его коферментной формы пиридоксальфосфата, необходимого для синтеза из триптофана коферментных форм витамина РР.
Пантотеновая кислота
Пантотеновая кислота широко распространена в природе, название от panthos — повсюду. Витамин открыт Р. Вильямсом в 1933 г., спустя десятилетие от уже был синтезирован химическим путем.
1. Структура. Пантотеновая кислота состоит из пантоевой кислоты (а, у,-дигидрокси-0, р-диметилмасляная кислота) и р-аланина (рис. 28.5).
Пантотеновая кислота представляет собой вязкую светло-желтую жидкость, хорошо растворимую в воде. Она малоустойчива и легко гидролизуется по месту пептидной связи под действием слабых кислот и щелочей.
2. Метаболизм. Пантотеновая кислота с током крови поступает в ткани после всасывания на всем протяжении тонкого кишечника и в толстой кишке (в зависимости от концентрации путем простой диффузии или активного транспорта). Пантотеновая кислота фосфорилируется с использованием АТФ до 4'-фосфопан-тотената. Присоединение цистеина и его декарбоксилирование приводят к образованию тиоэтаноламина, из которого образуется 4'-фосфопантотеин —- про-стетическая группа кофермента A (HS-КоА) и ацилпереносящего белка (АПБ).
3. Биологическая роль. Тиоловая группа в HS-KoA и АПБ действует как переносчик ацильных радикалов.
HS-KoA участвует в важнейших метаболических процессах:
а) обмене углеводов — окислительное декарбоксилирование пирувата в ацетил-КоА и 2-оксоглутарата в сук-цинил-КоА;
б) р-окисление жирных кислот на этапах активации до образования ацил-КоА и тиолитическом расщеплении с выделением ацетил-КоА и укороченного на 2 углеродных атома ацил-КоА;
в) форме ацетил-КоА переносится остаток ацетила на холин с образованием медиатора ацетилхолина;
СИз О
но-сн2-с-снон-c-nh-ch2-ch2-cooh
СНз
Рис. 28.5. Пантотеновая кислота.
5 Зак. 2124
433
Глава 28 Водорастворимые витамины
г) сукцинил-КоА участвует в синтезе порфиринов;
д) биосинтез жирных кислот — функцию переносчика метаболитов в пальмитатсинтазном комплексе выполняет 4-фосфопантотеин;
ж) ацетил-КоА используется для синтеза кетоновых тел, холестерола и стероидных гормонов.
Ацетил-КоА занимает центральное место в процессах взаимосвязи обменов углеводов, аминокислот и жирных кислот.
4. Источники. Пантотеновая кислота широко распространена в продуктах животного (печень, почки, яйца, мясо, молоко и др.) и растительного (картофель, капуста, фрукты и др.) происхождения. Синтезируется кишечной микрофлорой.
5. Суточная потребность. 10“ 15 мг
6. Гиповитаминоз.
В связи с широким распространением витамина в продуктах питания авитаминоз не встречается. Симптомы гиповитаминоза не специфичны: дерматиты, невриты, язвы слизистых пищеварительного тракта, нарушения продукции стероидных гормонов и др.
Витамин В. (пиридоксин, пиридоксол, антидерматитный витамин)
1. Структура. Витамин В6 включает три природных производных пиридина, обладающих одинаковой витаминной активностью: пиридоксина, пиридоксаля, пиридоксамина, отличающихся друг от друга наличием, соответственно, спиртовой, альдегидной или аминогруп
пы. Витамин В6 открыт в 1934 г. А. Сент-Дьердьи. Пиридоксин хорошо растворяется в воде и этаноле, устойчив в кислой и щелочной среде, но легко разрушается под действием света при pH 7,0 (рис. 28.6).
2. Метаболизм. Всосавшись в тонком кишечнике, все формы витамина с током крови разносятся к тканям и, проникая в клетки, фосфорилируются с участием АТФ. Коферментные функции выполняют два фосфорилированных производных пиридоксина: пиридоксальфосфат и пиридоксаминфосфат.
3. Биологическая роль. Витамин В6 характеризуется широким спектром биологического действия. Он принимает участие в регуляции белкового, углеводного и липидного обменов, биосинтезе гема и биогенных аминов, гормонов щитовидной железы и других биологически активных соединений. Коферментные формы витамина В6 входят в состав следующих ферментов:
а) аминотрансфераз аминокислот, катализирующих обратимый перенос NH2-rpynnbi от аминокислоты на а-кетокислоту (образование заменимых аминокислот, непрямое дезаминирование и восстановительное аминирование аминокислот);
б) декарбоксилаз аминокислот, отщепляющих карбоксильную группу аминокислот, что приводит к образованию биогенных аминов;
в) ферментов, осуществляющих нео-кислителъное дезаминирование серина, треонина, триптофана, серусодержа-щих аминокислот;
г) мышечной фосфорилазы (распад гликогена).
4. Источники. Витамином В6 богаты бобовые, зерновые культуры, мясные продукты, рыба, картофель. Он синтезируется кишечной микрофлорой, частично покрывая потребность организма в этом витамине.
434
Водорастворимые витамины Глава 28
5. Суточная потребность. 2—3 мг
6. Гиповитаминоз.
Основными проявлениями недостаточности витамина В6 являются гипохромная анемия и судороги. Отмечается развитие сухого себорейного дерматита, стоматита и глоссита. Чаще всего пиридоксиновая недостаточность наблюдается:
а) у маленьких детей при искусственном вскармливании стерилизованным молоком (разрушается витамин В6), у беременных при токсикозах;
б) при групповой недостаточности витаминов группы В;
в) при подавлении микрофлоры кишечника антибиотиками;
г) у алкоголиков, поскольку ацетальдегид стимулирует дефосфорилирование пиридоксальфосфата.
Витамин Н (биотин)
Биотин — это первое вещество, которое было определено как необходимый ростовой фактор для микроорганизмов. Позже было показано токсическое действие сырого яичного белка на крыс. Употребление печени или дрожжей снимало этот эффект. Фактор, предотвращающий развитие токсикоза, был назван витамином Н или биотином (от греч. bios — жизнь).
1. Структура. Молекула биотина состоит из имидазольного и тиофенового колец и боковой цепи, представленной остатком валериановой кислоты. В пище биотин представлен биоцитином, который высвобождается путем протеолиза (рис. 28.7).
2. Метаболизм.
2.1. Биотин не модифицируется в организме, но ковалентно связывается с ферментами, в которых выполняет функцию простетической группы.
435
Глава 28 Водорастворимые витамины
2.2. Биотин связывается через свободную карбоксильную группу с остатком лизина апофермента. Комплекс биотин-фермент взаимодействует с СО2 в присутствии АТФ (источник энергии) с образованием комплекса карбоксибиотин-фермент.
2.3. Биотинидаза катализирует удаление биотина от фермента во время метаболизма белков, что позволяет использовать биотин повторно.
3. Биологическая роль. Биотин действует как кофермент реакций карбоксилирования, в которых служит переносчиком СО2. В организме 4 фермента используют биотин как кофермент.
• Пируваткарбоксилаза. В результате карбоксилирования пирувата образуется оксалоацетат, который используется в глюконеогенезе и ЦТК.
• А цетил-КоА-карбоксил аза катализирует карбоксилирование ацетил-КоА с образованием малонил-КоА. Реакция используется при биосинтезе высших жирных кислот.
• Пропионил-КоА-карбоксилаза превращает пропионил-КоА в D-метил-малонил-КоА, который превращается в сукцинат (вступает в ЦТК).
• Метил-кротонил-КоА-карбоксилаза, участвующая в катаболизме лейцина и веществ, имеющих в составе изопреноидные структуры.
4. Источники. Биотин в достаточном количестве синтезируется микрофлорой
кишечника. Пищевые источники: печень, сердце, яичный желток, отруби, бобы, соя, цветная капуста и др.
5. Суточная потребность. 150—200 мкг.
6. Дефицит.
Причинами гиповитаминоза являются:
а) применение антибиотиков, которые подавляют рост кишечной микрофлоры;
б) поступление в организм большого количества авидина — гликопротеина присутствующего в белке куриных яиц, который нарушает всасывание биотина из-за образования нерастворимого комплекса;
в) длительное парентеральное питание;
г) наследственный дефект фермента, который присоединяет биотин к лизиновым остаткам апофермента.
Симптомы гиповитаминоза включают себорейный дерматит, тошноту, выпадение волос, боли в мышцах.
Фолиевая кислота (фолацин, витамин Вэ, витамин Вс)
Витамин обнаружили в 1930 г., копа было показано, что люди с определенным типом мегалобластической анемии могли быть излечены включением № пищу дрожжей или экстракта печени. № 1941 г. фолиевая кислота была выделена из зеленых листьев (лат. folium — лист, отсюда и название витамина!. Витамином Вс это соединение назвали из-за его способности излечивать анемию у цыплят (от англ, chicken — цыпленок).
1. Структура. Фолиевая кислота состоит из птеридина, связанного с п-аминс-
436
Водорастворимые витамины Глава 28
бензойной кислотой (ПАБК) и глутаминовой кислотой (рис. 28.8).
Фолиевая кислота плохо растворима в воде и органических растворителях, но хорошо в щелочных растворах. Разрушается под действием света, при обработке и консервировании овощей.
2. Метаболизм. Фолат в пище присутствует в форме полиглутамата. Внешние остатки глутамата удаляются в кишечнике до всасывания, главным образом, в тонком кишечнике. Коферментной формой фолиевой кислоты является 5,6,7,8 -тетрагидрофолиевая кислота (ТГФК), которая образуется из фолиевой кислоты под действием фермента дигидрофолатредуктазы и с использованием НАДФН+Н+ как донора атомов водорода.
3. Биологическая роль.
3.1. Фолиевая кислота является переносчиком одноуглеродных радикалов (групп): метильного (-СН3), метиленового (=СН2), метенильного (СН), формильного (-СНО), оксиметильного (-СН2ОН) и формиминового -CH=NH). Одноуглеродные фрагменты связываются с ТГФК в положениях N5 или N10. Присоединение
формильного радикала в 5 положении приводит к образованию №-фор-милТГФК, которая известна как фо-линиковая кислота. МетиленТГФК образуется при взаимодействии ТГФК с глицином, серином или холином.
3.2. Фолат необходим для синтеза пуриновых нуклеотидов (2 и 8 атомы углерода) и синтеза тимина. Ns, №°-метиленТГФК вводит метильную группу при синтезе тимидилата, необходимого для синтеза ДНК и образования эритроцитов.
3.3. Участвует в метаболизме глицина, серина и этаноламина.
3.4. N-формилметионин является инициирующей аминокислотой в биосинтезе белка у прокариот.
3.5. В крови ТГФК присутствует как №-метилТГФК. Витамин В12 необходим для превращения К5-метилТГФК в ТГФК в реакции превращения гомоцистеина в метионин. Эта реакция необходима для освобождения свободной ТГФК и повторного использования в одноуглеродном метаболизме. При дефиците витамина В;2 блокируется превращение N'-метилТГФК в ТГФК («фолатная ловушка»).
437
Глава 28 Водорастворимые витамины
4. Источники: кишечная микрофлора, свежие овощи — салат, капуста, морковь, помидоры, лук.
5. Суточная потребность: 50—200 мкг.
6. Дефицит.
При дефиците ТГФК снижается синтез пуринов и тимина, что приводит к нарушению синтеза ДНК. Это проявляется развитием мегалобластической анемии, которая характеризуется появлением в крови незрелых ядросодержащих форм эритроцитов.
Витамин В12 (кобаламин, антианемический витамин)
Злокачественная анемия (болезнь Аддисона-Бирмера) оставалась смертельным заболеванием до 1926 г., когда впервые для ее лечения применили сырую печень. Поиски содержащегося в печени антианемического фактора привели к успеху и в 1955 г. Дороти Ходжкин расшифровала структуру этого фактора и его пространственную конфигурацию с помощью метода рентгеноструктурного анализа.
1. Структура. Структура витамина В12 отличается от строения всех других витаминов наличием в молекуле иона металла — кобальта. Кобальт связан координационными связями с атомами азота, входящими в состав четырех пиррольных колец, которые образуют планарную (плоскую структуру), называемую коррином. I, II, III пиррольные кольца связаны через метиленовые мостики, IV и I — непосредственно. Перпендикулярно плоскости коррина расположен нуклеотид, содержащий 5,6-диметилбензимидазол, a-D-рибозу и остаток фосфорной кислоты, который связан координационной связью с атомом кобальта (рис. 28.8). В пище коба
ламин содержит атом кобальта в окисленной форме (III). Для образования активных коферментных форм атом кобальта восстанавливается до Со (I).
В витамине В}2 атомы углерода пиррольных колец замещены метильными, ацетамидными и пропионамидными радикалами. Пропионамидный радикал в IV кольце через изопропиловый спирт связан с фосфатным остатком нуклеотида.
Атом кобальта трехвалентен и ковалентно связан с группой CN . Вся структура получила название цианокобаламина или кобаламина, поскольку считают, что цианид-ион является артефактом, зависящим от способа выделения.
Кобаламины растворимы в воде, термостабильны и устойчивы в присутствии растворов кислот при pH 4,0. 2. Транспорт и метаболизм
2.1. Витамин В12, содержащийся в пище, называют внешним фактором Кастла. Всасывается витамин в тонком кишечнике в комплексе с внутренним фактором Кастла (гликопротеин, секретируемый париетальными клетками желудка).
Витамин В]2 находится в пище в комплексе с белками. В желудке под действием соляной кислоты и пепсина витамин В12 высвобождается из комплекса с белками и связывается с кобалофили-ном (R-протеин, гаптокоррин) — белком, секретируемым слюной. В двенадцатиперстной кишке комплекс распадается, кобалофилин гидролизуется панкреатическими протеазами, витамин В12 связывается с внутренним фактором Кастла. Комплекс витамин В]2-внутренний фактор Кастла всасывается в дистальной части подвздошной кишки через рецепторы (кубилины}. которые связывают комплекс, но не связывают свободный фактор или свободный витамин. Другой белок — ме-
438
Водорастворимые витамины Глава 28
Рис. 28.8. Витамин В12.
439
Глава 28 Водорастворимые витамины
галин — связан с кубилином и обеспечивает процесс эндоцитоза для всасывания комплекса
2.2. Витамин транспортируется в крови в комплексе с белками, называемыми транскобаламинами и превращается в метилкобаламин и 5-дезоксиаденозилкобаламин в печени, клетках костного мозга и ретикулоцитах. Транскобаламин I участвует в хранении и резервировании водорастворимого витамина в печени и плазме крови (циркулирующий резерв). Транскобаламин II транспортирует витамин в крови. Комплекс транскобаламин П-витамин В12 поступает в периферические клетки путем эндоцитоза. В лизосомах клеток транскобаламин II разрушается, витамин высвобождается в виде гидроксикобаламина, который либо превращается в цитозоле в метилкобаламин, либо в митохондриях — в 5-дезоксиадено-зилкобаламин. В печени запасается около 4—5 мг витамина и этих запасов достаточно для обеспечения организма витамином в течение 4—6 лет.
3. Биологическая роль.
В организме человека витамин необходим для 2-х важнейших реакций:
3.1. 5-дезоксиаденозилкобаламин является коферментом метилмалонил-КоА -мутазы, которая превращает метилмало-нил-КоА в сукцинил-КоА. Метилмалонил-КоА образуется как промежуточный продукт катаболизма валина и карбоксилирования пропионил-КоА, синтезирующегося при катаболизме изолейцина, холестерола, жирных кислот с нечетным числом атомов углерода или прямо из пропионовой кислоты (продукт микробиологической ферментации в кишечнике). В результате этой реакции метилмалонил-КоА превращается в сукцинил-КоА.
3.2. Метилкобаламин является коферментом гомоцистеинметилтрансфера-
зы — фермента, катализирующего метилирование гомоцистеина в метионин. Кобаламин забирает метильные группы от ЪР-метилтетрагидрофоли-евой кислоты и превращает ее в тетрагидрофолат. Метаболическое значение этой реакции состоит в том, что сохраняются запасы метионина и тетрагидрофолата, что необходимо для синтеза пуриновых, пиримидиновых нуклеотидов и синтеза нуклеиновых кислот. При дефиците витамина В]Т фолат постоянно находится в форме К5-метил-ТГФК («фолатная» или метильная ловушка).
3.3. Витамин В12 требуется для превращения D-рибонуклеотидов в дезокси-D-рибонуклеотиды. Эту реакцию у прокариот катализирует специфическая рибонуклеотидредуктаза.
4. Источники. Основным источником витамина являются микроорганизмы. В растительной пище витамин В(2 отсутствует. В небольших количествах витамин образуется бактериями на поверхности фруктов. Значительное количество витамина содержится в печени, дрожжах, молоке, яичном желтке.
5. Суточная потребность. 2—5 мкг.
6. Дефицит.
1. Энтеропеченочная циркуляция витамина В12 обеспечивает организм достаточным количество*! витамина, и дефицит может развиваться при отсутствии витамина в диете в течение нескольких лет При заболеваниях желудка иля подвздошной кишки дефицит витамина может развиваться быстрее 2. Пернициозная анемия является следствием дефицита витамина В_ и характеризуется нарушением синтеза ДНК, образования эритроцитов и появлением незрелых ядерных форм эритроцитов (мегалобластов).
440
Водорастворимые витамины Глава 28
3. Длительное вегетарианство может приводить к дефициту витамина В12.
Витаминоподобные вещества
Кроме витаминов, описанных выше, в пище присутствуют другие компоненты, которые являются незаменимыми факторами.
Холин
Best и Huntsman (1934) обнаружили, что дефицит холина у крыс вызывает жировое перерождение печени. Тем не менее, холин может адекватно синтезироваться в организме (из серина) и содержится во многих продуктах (молоко, яйца, печень, злаковые и др.), 1. Структура. По химическому строению холин — аминоэтил овый спирт, содержащий 3 метильные группы у атома азота.
НО—СН2 СН2 N+(CH3)3
2. Биологическая роль.
2.1. Является компонентом фосфолипидов (лецитины), которые входят в состав мембран и участвуют в транспорте липидов.
2.2. Предотвращает накопление липидов в печени (липотропный фактор), что объясняется участием в синтезе фосфолипидов и липопротеинов, транспортирующих жиры из печени. 2.3. Участвует в метаболизме одноуглеродных радикалов из-за наличия в структуре трех метильных групп.
2.4. Предшественник для синтеза ацетилхолина, который участвует в передаче нервного импульса.
3. Суточная потребность. Источники.
Пищевым источником являются мясо и злаковые растения. Суточная потребность составляет в среднем 0,5 г.
4. Недостаточность. Проявления недостаточности холина у человека не описаны. У животных отмечаются жировая инфильтрация печени, повреждение кровеносных сосудов.
ИНОЗИТ
1. Структура. По химическому строению — шестиатомный циклический спирт циклогексана, хорошо растворимый в воде.
2. Биологическая роль.
2.1. Необходим для синтеза фосфатидилинозитола (компонент клеточных мембран).
2.2. Действует как липотропный фактор (вместе с холином) и предотвращает накопление жиров в печени.
2.3. Является посредником в действии некоторых гормонов (инозитол-1,4,5-трифосфат). Инозитолтрифосфат способствует высвобождению кальция из эндоплазматического ретикулума.
2.4. Высокая концентрация отмечена в сердечной мышце, хотя функция не известна.
3. Суточная потребность. Источники. Инозитол находится во всех продуктах животного и растительного происхож
441
Глава 28 Водорастворимые витамины
дения. Особенно много его в печени, мозге, мясе, яичном желтке, а также в хлебе, картофеле, зеленом горохе, грибах. Суточная потребность приблизительно 1,0—1,5 г.
4. Недостаточность инозитола у животных проявляется жировой дистрофией печени и падением содержания в ней фосфолипидов, облысением и анемией. У молодых особей наблюдается задержка роста.
Липоевая кислота (витамин N)
1. Структура. В 1951 г. было выделено вещество, которое активно участвовало в обмене пирувата и ацетил-КоА — ключевых метаболитов клетки. Оно было названо липоевая кислота, так как хорошо растворялось в неполярных растворителях (lipid — жир). По химическому строению липоевая кислота является серусодержа-щей жирной кислотой (6,8-дитиоок-тановая кислота). Существует в окисленной и восстановленной формах (рис. 28.9).
2. Биологическая роль.
2.1. Участвует в реакциях окислительного декарбоксилирования вместе с другими витаминами (тиамин, ниацин, рибофлавин и пантотеновая кислота), в результате которых пируват превращается до ацетил-КоА и 2-оксоглутарат до сукцинил-КоА.
2.2. Является антиоксидантом и эффективна при защите организма от повреждающего действия радиации и токсинов.
3. Гипо- и гипервитаминозы липоевой кислоты у человека не описаны.
4. Суточная потребность. Источники. Наиболее богаты липоевой кислотой дрожжи, мясные продукты, молоко. Суточная потребность предположительно 1—2 мг.
Парааминобензойная кислота (ПАБК)
1. Структура. Является структурным компонентом фолиевой кислоты. Химическое строение ПАБК:
ПАКБ плохо растворяется в воде, хорошо — в спирте и эфире, химически устойчива.
2. Биологическая роль.
2.1. Витаминные свойства ПАБК связаны с тем, что она входит в состав молекулы фолиевой кислоты и, следовательно, принимает участие во всех реакциях метаболизма, где необходима фолиевая кислота.
2.2. Оказывает антигипоксическое, антиатерогенное действие, препятствует окислению адреналина, положительно влияет на функцию щитовидной железы.
3. Суточная потребность. Источники. ПАБК содержится практически во всех продуктах питания. Наиболее богаты ею печень, мясо, молоко, яйца, дрожжи. Суточная потребность не установлена.
S-----s j
Н2б-СН2СН-СН2СН2СН2-СН2-СООН 1
Вст. 28.9. Липоевая кислота.
442
Водорастворимые витамины Глава 28
Витамин Р (рутин, биофлавоноиды)
1. Структура. В 1936 г. А. Сент-Дьер-дьи из кожуры лимона выделил действующее начало, уменьшающее ломкость, проницаемость капилляров. Оно получило название витамин Р (от permeability — проницаемость).
Биофлавоноиды — разнообразная группа растительных полифенольных соединений, в основе структуры которых лежит дифенилпропановый углеродный скелет.
В растениях обнаружено свыше 4000 флавоноидов с идентифицированной химической структурой. Они делятся на 6 групп: флавонолы, флавоны, флавононы, катехины, антрагликозиды, антоцианы. 2. Биологическая роль.
2.1. Биофлавоноиды могут использоваться для синтеза биологически важных соединений в клетке (например, убихинона).
2.2. Рутин и кверцетин — полифенолы, обладающие Р-витаминной активностью, являются эффективными антиоксидантами. Флавоноиды (катехины) зеленого чая способны оказывать выраженное цитопротективное действие, в основе которого лежит их свойство обезвреживать свободные радикалы. В отличие от витамина Е, биофлавоноиды кроме прямого анти-радикального действия могут также связывать ионы металлов с переменной валентностью, ингибируя, тем самым, процесс пероксидного окисления липидов мембран.
2.3. Достаточно изученным является капилляроукрепляющее действие витамина Р, обусловленное его способностью регулировать образование коллагена (синергизм с витамином С) и препятствовать деполимеризации основного вещества соединительной ткани гиалуронидазой.
3. Суточная потребность. Источники. Р-витаминные вещества содержатся в тех же растительных продуктах, что и витамин С. Наиболее богаты ими черноплодная рябина, черная смородина, яблоки, виноград, лимоны, чайный лист и плоды шиповника. Биофлавоноид цитрон придает кожуре лимона желтый цвет. Потребление флавоноидов в составе натуральных продуктов (фруктов, соков и виноградных вин), где они могут находиться в виде комплексов с металлами, может быть более эффективным, чем использование очищенных витаминных препаратов. Суточная потребность 25—50 мг.
4. Гиповитаминоз.
Симптоматика недостаточности биофлавоноидов сводится к явле-х ниям повышенной проницаемости и ломкости капилляров, петехиям (точечным ковоизлияниям). кровоточивости десен.
Витамин U
1. Структура. Витамин V был обнаружен в 1950 г. в сырых овощах. Поскольку сок сырых овощей, особенно капусты, обладал способностью предотвращать или задерживать развитие экспериментальных язв желудка, выделенный из него витамин назвали противоязвенным, или витамином U (от лат. ulcus — язва). По химическому строению он представляет собой S-ме-тилметионин:
443
Глава 28 Водорастворимые витамины
ноос—сн—сн2—CH2S\
Ън3
СГ
NH2
Витамин U хорошо растворим в воде. При варке пищи легко разрушается, особенно в нейтральной и щелочной среде.
2. Биологическая роль.
Подобно метионину витамин U является донором метильных групп в реакциях синтеза холина и креатина.
3. Недостаточность витамина у человека не описана. Цыплята, которым скармливался алкалоид цинкофен с целью моделирования язвы желудка, излечивались, если им в корм добавлялся свежий овощной сок.
4. Суточная потребность. Источники. Источниками витамина U являются свежая капуста, петрушка, морковь, лук, перец, зеленый чай, свежее молоко, печень.
Витамин F
В группу витамина F входят полиеновые жирные кислоты: линолевая, линоленовая, арахидоновая. При достаточном поступлении в организм линолевой и линоленовой кислот осуществляется синтез арахидоновой кислоты, являющейся предшественником эйкозаноидов (простагландинов, простациклинов, тромбоксанов и лейкотриенов). Одним из эффективных источников соЗ поли-ненасыщенных жирных кислот являет
ся льняное масло (а-линоленовая кислота — 52 %). Для стабилизации ненасыщенных жирных кислот в масле присутствуют лигнаны, обладающие антиоксидантным и эстрогенным действиями.
Кофермент Q
В группу кофермента Q относят убихиноны. Убихинон Qi0 может синтезироваться на конечных стадиях синтеза холестерола. Поэтому при применении классических статинов (ингибиторов ГМГ-редуктазы) могут проявляться эффекты недостаточности кофермента Q. В настоящее время разработаны статины второго поколения, которые блокируют синтез холестерола ниже места ответвления синтеза кофермента Q.
Кофермент Q находится в мембранах, является переносчиком электронов в липидной фазе мембран (цепи переноса электронов). Недостаточность кофермента Q проявляется в виде гипоэ-нергетического состояния я сопряженных с этим разнообразных функциональных нарушений.
Кофермент Q входит в состав многих биологически активных добавок к пище с целью оптимизации пищевом поддержки метаболизма.
444
Глава 29
Регуляция обмена веществ. Гормоны
В процессе изучения превращений веществ мы рассматривали каждый метаболический путь на уровне индивидуальной клетки, а регуляцию метаболических процессов — на уровне индивидуальных ферментов. Однако многоклеточный организм представляет собой единое целое, в котором существует строгая дифференцировка органов и тканей. Следовательно, существуют механизмы, осуществляющие интеграцию и координацию метаболической активности, обмена энергии, пролиферации, дифференцировки и Функции различных органов и тканей.
Основную роль в регуляции жизнедеятельности организма выполняют две системы:
1. Нервная система, которая координи-?ует функционирование организма чете з передачу электрохимических импульсов.
2. Эндокринная система, которая действует через различные химические посредники, которые называются гормо--ами.
Основные механизмы регуляции метаболизма
Известны три основных механизма регуляции метаболизма: изменения активности ферментов, количества ферментов в клетке, проницаемости клеточных мембран.
1. Изменение активности ферментов — самый распространенный способ регуляции метаболизма. Регуляции подвержены *ключевые» ферменты, которые определяют скорость всего полиферментного процесса.
2. Изменение количества фермента в клетке осуществляется путем игыукции или репрессии генов, а также протеолитической деградации белков в клетке.
3. Изменение проницаемости мембран, или точнее — изменение целого комплекса функций мембран.
Общая характеристика гормонов
По А. Н. Смирнову (2006), для координации функций клеток многоклеточно
445
Глава 29 Регуляция обмена веществ. Гормоны
го организма служат две группы веществ: утилизируемые молекулы и сигнальные молекулы. Необходимым условием существования, роста, развития, адаптации и воспроизведения многоклеточного организма является информационный обмен между его клетками с помощью сигнальных веществ. Сейчас известно несколько сотен сигнальных молекул, включая гормоны. Граница между утилизируемыми и сигнальными молекулами часто условна. Например, в р-клетках островков Лангерганса поджелудочной железы, секретирующих инсулин, глюкоза является как источником энергии, так и сигналом для усиления биосинтеза инсулина.
Термин «гормон» (от греч. hormao возбуждаю, побуждаю) был впервые предложен Э. Старлингом в 1905 г. применительно к секретину, образующемуся в клетках двенадцатиперстной кишки и воздействующему на функции поджелудочной железы.
Гормоны — вещества органической природы, которые 1) вырабатываются в специализированных клетках желез внутренней секреции, 2) поступают в кровь или лимфу и 3) взаимодействуют с клетками-мишенями, оказывая влияние на обмен веществ и физиологические функции.
Гормоны участвуют в поддержании гомеостаза внутренней среды организма, занимают промежуточное положение между нервной системой и действием ферментов, которые непосредственно регулируют скорость метаболизма. Гормоны вызывают либо быструю (срочную) ответную реакцию, повышая активность имеющихся ферментов, либо медленную реакцию, связанную с синтезом ферментов de novo.
Гормоны отличаются от других сигнальных молекул относительной стабильностью в организме, что лежит в основе их дистантного действия.
Динамика выработки гормонов
Гормоны циркулируют в крови в очень низких концентрациях (10-7-10_,2маль/л). Однако эти величины сильно варьируют. Концентрация гормонов подвержена периодическим колебаниям, цикл или ритм которых может зависеть от времени дня, месяца, времени года или менструального цикла. В качестве примера можно привести околосуточный (циркадианный) ритм кортизола (см. лекцию 30). Многие гормоны поступают в кровь импульсами и нерегулярно. Поэтому концентрация гормонов может меняться эпизодически, т. е. пульсировать. Концентрация других гормонов изменяется в зависимости от внешних факторов. Выброс гормонов является ответом на внешнее воздействие или на изменение внутреннего состояния организма.
Нейро-эндокринная регуляция синтеза гормонов
Импульсы, поступающие из внешне! или внутренней среды, воспринимаются специализированными рецепторами и поступают в ЦНС, а оттуда в гипоталамус, где синтезируются биологически активные гормональные вещества (рилизинг-гормоны) — либерины и статины (рис. 29.1). Гормоны гипоталамуса ж поступают в общий кровоток, а через портальную систему сосудов достигают специфических клеток гипофиза и стимулируют (либерины) или ингибируют (статины) выделение тропных гормонов гипофиза. Тропные гормоны гипофиза током крови приносятся в соответствующую периферическую эндокринную железу, стимулируя выработку гормона.. Это трансгипофизарный путь регуляции секреции гормона. Выделяют также парагипофизарный путь: импульсы п ЦНС активируют секрецию гормоне;
446
Регуляция обмена веществ. Гормоны Глава 29
Импульсы из внешней и внутренней среды
Парагипофизарный путь
4®
Ткани и орган ы-мишени
Трансгипофизарный путь
Рис. 29.1. Нейроэндокринная регуляция секреции гормонов, ф- активация
- ингибирование
447
Глава 29 Регуляция обмена веществ. Гормоны
периферическими эндокринными железами. Характерен для секреции катехоламинов в мозговом веществе надпочечников (адреналин), гипоталамических рилизинг-гормонов, гормонов нейрогипофиза и мелатонина эпифиза.
Гормон периферической эндокринной железы оказывает действие на органы и ткани-мишени и ингибирует синтез гормонов гипоталамуса или гипофиза (длинная петля обратной связи). Гормон гипофиза также может ингибировать выработку гормона гипоталамуса (короткая петля обратной связи). Кроме того, метаболиты или субстраты влияют на секрецию гормонов. Например, увеличение концентрации глюкозы в крови вызывает высвобождение инсулина, который усиливает потребление и утилизацию глюкозы в тканях; в результате уровень глюкозы возвращается к норме, что снижает секрецию инсулина. Регуляция уровня гормонов может осуществляться и по механизму положительной обратной связи.
Ткань-мишень (орган-мишень) — это ткань (орган), в которой гормон вызывает специфическую биохимическую или физиологическую реакции за счет связывания с клетками-мишенями. Клетки-мишени содержат специальные структуры — рецепторы, настроенные на специфическое связывание с определенным гормоном. Энергия взаимодействия сигнальной молекулы с рецептором обеспечивает конформационный переход рецептора в активное состояние, сопровождающийся прямыми или опосредованными изменениями активности определенных ферментов, ионных каналов и/или транскрипционных факторов.
Как правило, чем ниже концентрация сигнальной молекулы, тем выше ее сродство к рецептору.
В клетках может быть несколько рецепторов к сигнальным молекулам. Так в гепатоцитах найдены рецепторы инсулина, глюкагона, соматотропина, вазопрессина, пролактина, эстрогенов, тестостерона, глюкокортикоидов, а также ряда цитокинов, ростовых факторов, простагландинов и др. Такая регуляция в норме обеспечивает координацию функций клетки как структурной единицы, так и ее место в многоклеточном организме. Тканевая специфичность эффектов сигнальных молекул реализуется за счет существования нескольких рецепторов для одной и той же сигнальной молекулы.
Классификация гормонов
Гормоны классифицируются в зависимости от места их природного синтеза — гормоны гипоталамуса, гипофиза, щитовидной железы, надпочечников, поджелудочной железы, половых желез и др-
Гормоны могут быть классифицированы по месту синтеза и месту действия на 3 группы:
1) эндокринные гормоны (греч. endon — внутри, krinein — высвобождать) — синтезируются эндокринными железами и транспортируются кровью к клеткам-мишеням;
2) паракринные гормоны синтезируются вблизи места их действия;
3) аутокринные гормоны — действуют на те же клетки, которые их синтезируют.
По химической структуре гормоны классифицируются на:
1) пептиды и белки, которые синтезируются в виде больших предшественников и затем подвергаются процессингу и секреции;
2) производные аминокислот (катехоламины и тироидные гормоны —• производные тирозина, мелатонин — производное триптофана);
448
Регуляция обмена веществ. Гормоны Глава 29
3) стероидные гормоны (кортикостероиды и половые гормоны, которые являются производными холестерола);
4) производные жирных кислот (эйкозаноиды);
5) газы (оксид азота).
По растворимости гормоны классифицируются на:
1) гидрофильные (пептиды, белки, катехоламины);
2) липофильные (стероиды и тироид-ные гормоны).
Для транспорта липофильных гормонов требуются белки-переносчики, гидрофильные гормоны транспортируются самостоятельно. Транспортные белки создают резерв гормонов в крови, так как в связанном виде гормоны не подвергаются метаболизму и экскреции. Биологическая активность присуща только свободной форме гормона. Пептидные и белковые гормоны не имеют специальных транспортных белков в плазме крови, и поэтому период полужизни в крови намного меньше (секунды или минуты), чем у стероидных гормонов (часы).
Растворимость определяет механизм действия гормона.
По механизму действия гормоны классифицируются на 3 группы:
1. Гормоны, не проникающие в клетку и имеющие рецепторы на поверхности мембран. Действие этих гормонов на клетку осуществляется через вторичные посредники, образующиеся в клетке после связывания гормона с рецептором. К этим гормонам относятся гидрофильные гормоны — белково-пептидной природы и катехоламины.
2. Гормоны, проникающие в клетку (липофильные гормоны). Свободный гормон легко проходит сквозь плазматическую мембрану любой клетки и, попадая в клетку-мишень, связывается с рецепторами, локализованными в цитоплазме или ядре клетки. Комплекс
лиганд-рецептор рассматривается как внутриклеточный посредник действия гормонов этой группы. К этой группе гормонов относят стероидные и тироид-ные гормоны.
3. Гормоны смешанного действия. Рецепторы расположены на поверхности клеток. После связывание гормона с рецептором комплекс проникает внутрь клетки и оказывает эффект. К этой группе гормонов относится инсулин.
Неэндокринные клетки способны продуцировать сигнальные молекулы (чаще для паракринной регуляции):
• эйкозаноиды (простагландины, тромбоксаны, лейкотриены, простациклины);
• разные семейства факторов роста (EGF — эпидермальный фактор роста, FGF — фактор роста фибробластов, PDGF — фактор роста из тромбоцитов, TGFp — трансформирующий фактор р, NGF — фактор роста нервов);
• цитокины — регуляторы воспаления и гемопоэза (интерлейкины, интерфероны, хемо-кины).
Другие эндокринные железы (по А. Я, Смирнову, 2006). У рыб обнаружены дополнительные эндокринные железы: урофиз, расположенный у хвостового отдела позвоночника и секретирующий уротензин, контролирующий осморегуляцию, и тельца Станниуса, расположенные вдоль почек и секретирующие гипокальцин, регулирующий обмен кальция и водно-солевой обмен.
Высшие беспозвоночные имеют развитую эндокринную систему. У личинок насекомых она включает нейросекреторные клетки, кардиальные тела (связаны с головным ганглием нервами), прилежащие тела (связаны нервами с кардиальными телами) и проторакальные железы. Прилежащие тела секретируют ювенильные гормоны, стимулирующие рост и тормозящие линьку и метаморфоз у личинок и регулирующие гаметогенез у взрослых особей. Проторакальные железы секретируют физиологические антагонисты ювенильных гормонов — экдизоны, являющиеся инициаторами линьки и метаморфоза. Кардиальные тела служат нейрохемальным органом, т. е. местом хранения и высвобождения нейрогормонов, образующихся в головном мозге. Одним из таких гормонов является проторакотропный
449
Глава 29 Регуляция обмена веществ. Гормоны
гормон — формальный аналог рилизинг-гормо-нов позвоночных.
Характеристика рецепторов и механизмы действия гормонов
Во внеклеточной жидкости гормоны присутствуют в очень низкой концентрации — в 106— 109раз ниже содержания других структурно сходных соединений (стеролов, аминокислот, пептидов, белков) и иных веществ, которые находятся в крови в концентрации 10 5-10 3моль/л. Следовательно, клетки-мишени должны отличать данный гормон не только от других гормонов, присутствующих в малых количествах, но и от прочих соединений. Такую высокую избирательность обеспечивают рецепторы. Биологический эффект гормонов начинается с их связывания со специфическими рецепторами, а завершается, как правило, диссоциацией рецептора и гормона.
Свойства рецепторов:
1) по строению являются гликопротеинами;
2) обладают высоким сродством (10"11 —10"9 моль/л) к гормону;
3) характеризуются высокой специфичностью связывания гормона;
4) отличаются насыщаемостью при физиологических концентрациях гормона (гиперболический закон связывания);
5) характеризуются обратимостью связывания (гормон и рецептор связываются за счет сил гидрофобного и электростатического взаимодействия);
6) обладают способностью к трансдукции сигнала.
Механизм действия гормонов, проникающих в клетку
Липофильные гормоны (стероидные, ретиноевая кислота, тироидные гормоны) диффундируют через плазматическую мембрану и связываются со специфическими рецепторами,
расположенными в цитозоле или ядре клеток (рис. 29.2). В результате этой реакции, зависящей от температуры и присутствия солей, меняются величина, конформация и поверхностный заряд гормон-рецепторного комплекса, и он приобретает способность связываться с хроматином. Гормон-рецепторный комплекс связывается со специфической областью ДНК — гормон-чувствительным элементом (HRE, hormone response element) и активирует или инактивирует специфические гены. Гормон избирательно влияет на транскрипцию генов и продукцию соответствующих мРНК, изменяет через экспрессию генов количество специфических белков и, как следствие, скорость метаболических процессов (первичный ответ генов). В некоторых случаях продукты первичных генов могут активировать другие гены — вторичный ответ генов.
Лекарственный препарат тамоксифен используется для лечения рака легких. При некоторых типах рака легких деление опухолевых клеток зависит от наличия эстрогенов. Тамоксифен конкурирует с эстрогенами за связывание с эстрогеновыми рецепторами, но комплекс тамоксифен-рецептор не влияет на экспрессию генов; тамоксифен является антагонистом эстрогенов. Следовательно, применение тамоксифена после операции или во время химиотере-пии при гормонзависимых опухолях
450
Регуляция обмена веществ. Гормоны Глава 29
Рис. 29.2. Механизм действия гормонов, проникающих в клетку (D. L. Nelson, М. М. Сох, с изм ).
легких замедляет и прекращает рост оставшихся опухолевых клеток. Другой стероидный аналог, мифепристон, используется для прерывания беременности на ранних сроках. Мифепристон являет
ся антагонистом прогестерона, связывается с прогестероновыми рецепторами и блокирует действие гормона, необходимого для имплантации оплодотворенной яйцеклетки в матку.
451
Глава 29 Регуляция обмена веществ. Гормоны
Механизм действия гормонов, не проникающих в клетку
Передача гормонального сигнала в клетку не проникающих гормонов осуществляется через мембранные рецепторы.
Рецепторы для гормонов этой группы — интегральные мембранные белки, которые связывают сигнальные вещества на внешней стороне мембраны и за счет изменения пространственной структуры генерируют сигналы на внутренней стороне мембраны.
Типы рецепторов
Различают три типа рецепторов.
1. Рецепторы первого типа являются белками, имеющими одну трансмембранную полипептидную цепь. Это аллостерические ферменты (тирозинкиназа, протеин-фосфатаза, гуанилатциклаза), активный центр которых расположен на внутренней стороне мембраны. Внеклеточный домен этого рецептора связывается с гормоном. Ферментативной активностью обладает внутриклеточный домен, который активируется, когда гормон связывается с внеклеточным доменом. К такому типу рецепторов принадлежат рецепторы инсулина, ростовых факторов и цитокинов.
2. Ионные каналы. Эти рецепторы являются олигомерными белками, образующими лиганд-активируемый ионный канал. Каналы чаще всего находятся в закрытом состоянии и открываются на короткое время. Связывание лиганда ведет к открытию канала для ионов Са2+, Na+, К+, СР. По такому механизму осуществляется действие нейромедиаторов, таких как ацетилхолин и у-аминомасляная кислота.
3. Рецепторы третьего типа, сопряженные с ГТФ-связывающими белками (7ТМ-рецеп-торы). Такие рецепторы передают сигнал с помощью G-белков на белки-эффекторы, которые являются ферментами или
ионными каналами. В результате изменяется концентрация ионов или вторичных посредников (мессенджеров). Различают Gs (стимулирующий), Gi (ингибирующий) и G^-белки. Ферментами-эффекторами являются аденилатциклаза, фосфолипаза С, цГМФ-фосфодиэстераза.
Вторичные посредники
Выделяют 3 основных типа вторичных посредников:
1) циклические нуклеотиды (цАМФ и цГМФ); 2) метаболиты фосфатидилинозитола и 3) ионы Са2+.
Циклические нуклеотиды
цАМФ
1.1. Связывание гормона с рецептором третьего типа на наружной поверхности мембраны вызывает конформационные изменения внутриклеточного домена рецептора, который приобретает способность связываться с Gs-белком на цитозольной стороне мембраны.
1.2. G-белок в неактивном состоянии включает три субъединицы (а, Р, у), связанные с ГДФ (рис. 29.3).
Рис. 29.3. Структура G-белка (D. L. Nelson, М М. Сох, с изм.).
452
Регуляция обмена вешеств. Гормоны Глава 29
Обычно а и у субъединицы ковалентно соединены с жирнокислотными остатками мембраны. В геноме человека 15 генов кодируют а-субъединицы, 5 — 0-субъединицы и 10 — у-субъединицы. Очевидно, что при этом возможно формирование тысяч тримерных G-белков с разным соотношением субъединиц.
Ассоциация Gs-белка с рецептором приводит к обмену ГДФ на ГТФ; последовательность процессов проиллюстрирована на рис 29.4. При этом происходит активация G-белка (связанный с ГДФ
Gs белок неактивен). G-белок отделяется от рецептора и диссоциирует на а-субъединицу и 0,у-комплекс.
1.3. Комплекс ГТФ-а-субъединица движется в плоскости мембраны, связывается с аденилатциклазой и активирует ее.
1.4. Аденилатциклаза является интегральным белком с активным центром на цитозольной поверхности плазматической мембраны. Катализирует синтез цАМФ из АТФ. 1.5. цАМФ активирует цАМФ-зави-симую протеинкиназу (рис 29.5). Протеинкиназа состоит из 4-х субъе-
Гормон связывается со
Гормон специфическим рецептором
Связывание с рецептором вызывает замену ГДФ, связанного с Gs, на ГТФ, что активирует Gs
Gs (а-субъединица) движется к аденилатциклазе и
Аденитал циклаза катализирует
1 образование цАМФ
активирует ее
5
цАМФ активирует
6
Протеинкиназа фосфорилирует клеточные белки, что вызывает ответ на
протеинкиназу
действие гормона
7 цАМФ разрушается, снижая активность протеинкиназы
Рис. 29.4. Механизм действия гормонов, непроникающих в клетку (D. L. Nelson, ММ. Сох, с изм.).
453
Глава 29 Регуляция обмена веществ. Гормоны
диниц: 2-х регуляторных (R) и 2-х каталитических (С). Тетрамер проге-инкиназы R,C, неактивен. По 2 молекулы нА МФ присоединяются к R-субъединицам и вызывают диссоциацию комплекса с высвобождением С-субьсдиниц, которые обладают каталитической активностью.
Рис. 29.5. Структура цАМФ-зависимой проте-инкиназы.
1.6. Активная протеинкиназа фосфорилирует клеточные белки (таблица 29.1). Примеры белков, регулируемых фосфорилированием, представлены в таблице 29.2. Кроме того, комплекс R-субъединицы протеинкиназы и цАМФ может проникать в ядро и влиять на экспрессию генов.
Снятие гормонального сигнала осуществляется несколькими механизмами.
Диссоциация гормон-рецепторного комплекса вызывает изменение конформации рецептора и возвращение его в первоначальное состояние. Гормональноопосредованная активация рецепторов должна прерываться для предотвращения длительной активации G-белков. В организме человека это достигается двумя путями. 1. Посредством диссоциации гормон-рецепторного комплекса: а-субъедини-ца проявляет ГТФ-азную активность и происходит гидролиз ГТФ до ГДФ и Рн. Затем а-субъединица отсоединяется от аденилатциклазы и реассоциирует с 0-у-субъединицами.
2. Гормон-рецепторный комплекс инактивируется путем фосфорилирования остатков серина и треонина в С-терми-нальной части. Затем фосфорилированный рецептор связывается с белком Д-аррестином, что ведет к уменьшению активности G-белков (рис. 29.6).
Таблица 29.1. Белки, которые могут служить субстратами цАМФ-активируемой протеинкиназы
Белок Эффект фосфорилирования '
Компоненты мембран Изменение проницаемости
Ферменты, лимитирующие скорость метаболического процесса Активация или ингибирование ; ।
Белки рибосом Трансляция 1 или 1
Фактор инициации Ингибирование
Ядерные белки Транскрипция t или 1
Белки микротрубочек Секреторный, двигательный эффект или изменение конфигурации клетки
454
Регуляция обмена веществ. Гормоны Глава 29
Таблица 29.2. Примеры ферментов и белков, регулируемых цАМФ-зависимым фосфорилированием
Фермент, белок Процесс
Гликогенсинтаза Киназа фосфорилазы Пируваткиназа Пируватдегидрогеназный комплекс Гормон-чувствительная липаза Фосфофруктокиназа/фруктозо-2,6-бисфосфатаза Тирозин гидроксилаза Гистон Н1 Гистон Н2В Сердечный фосфоламбан Ингибитор протеинфосфатазы-1 CREB Синтез гликогена Распад гликогена Гликолиз Пируват •* ацетил-КоА Мобилизация триацилглицеролов и окисление жирных кислот Гликолиз/глюконеогенез Синтез ДОФА, дофамина, норадреналина и адреналина Конденсация ДНК Конденсация ДНК Регуляция внутриклеточной концентрации Са2+ Регуляция дефосфорилирования белков Регуляция цАМФ экспрессии генов
Концентрация цАМФ в клетке снижается в результате гидролиза цАМФ до АМФ под действием фермента фосфодиэстеразы. Фосфодиэстераза активируется ионами кальция. Некоторые лекарственные препараты, например, метилированные производные ксантина (кофеин, эуфиллин) ингибируют фосфодиэстеразу и тем самым потенцируют действие гормонов.
Дефосфорилирование ферментов катализируется протеинфосфатазами.
цАМФ является вторичным посредником в действии: кортикотропина (АКТГ), кор-тиколиберина, дофамина, адреналина, глюкагона, гистамина, фолликулостимулирующего гормона, лютеинизирующего гормона, меланоцитстимулирующего гормона, паратироидного гормона, простагландинов Е. (PGE^, Е2 (PGE2), серотонина, соматостатина, тиротропина.
Повышение концентрации цАМФ в клетке стимулирует распад резервных молекул, усиливает секрецию соляной кислоты в желудке, усиливает диспергирование пигментных гранул меланина, уменьшает агрегацию тромбоцитов и индуцирует открытие анионных каналов. Все эти процессы опосредуются активацией протеинкиназ.
Нарушения функции G-белков
Некоторые сигнальные молекулы ингибируют аденилатциклазу, снижая концентрацию цАМФ и подавляя фофорилирование белков. Например, связывание соматостатина с рецептором приводит к активации ингибиторного G белка (Gi) (по структуре аналогичен Gs), который ингибирует аденилатциклазу. Поэтому соматостатин оказывает эффект, противоположный глюкагону. В жировой ткани простагландин Е( ингибирует аденилатциклазу. снижает концентрацию цАМФ и уменьшает распад липидов, вызванный адреналином и глюкагоном.
Известны различные нарушения функции G-белков (табл. 29.3).
455
Глава 29 Регуляция обмена веществ. Гормоны
Диссоциация
Рис. 29.6. Отмена гормонального сигнала по двум путями: 1) отделение гормона; 2) фосфорилирование цитоплазматической части рецептора и связывание с ₽-аррестином (Berg J. М.. Tymoczko J. L, Stryer L., с изм.).
Таблица 29.3. Функции G-белков (по Farfel Z., Bourne Н. R., 1999)
Класс Ga и инициирующие сигналы Результат активации белков Ga
Gas — адреналин, глюкагон, паратгормон и др. Ga' — ацетилхолин, а-адренергические амины нейротрансмиттеры и др. Ga' — фотоны Ga^ — ацетилхолин, кальций, нейротрансмиттеры, a-адренергические амины Ga13 — тромбин и другие агонисты Активация аденилатциклазы Ингибирование аденилатциклазы Активация фосфодиэстеразы цГМФ Повышение инозитолтрифосфата и ионов внутриклеточного кальция । Активация Na+ и Н* обмена I - - - - - — _ 1
/—\ Нарушение трансмембранных механиз-мов передачи управляющих сигналов мо-жет вести к опухолевым и иным заболеваниям. Так, нарушение G-протеина сигнального пути наблюдается при холере. Токсин кишечной бактерии Vibrio cholera — холераген является белком, состоящим из двух субъединиц: В субъединица связывается с ганглиозидами клеток кишечного эпителия и каталитическая А-субъединица, проникающая в клетку. А-субъединица катализирует ко
валентную модификацию белка Gas — о-субъединица связывает АДФ-рибозу с аргининовым остатком. Эта модификащвя стабилизирует связь ГТФ с Gas, оставляя молекулу в активной конформации. В результате активный G-белок длительно активирует протеинкиназу А, которая открывает каналы для ионов хлора » ингибирует Na+, Н+-обменник при фосфорилировании. Результатом фосфорилу» вания этого канала является постоянный выход NaCI и воды в кишечник, понос »
456
Регуляция обмена веществ. Гормоны Глава 29
обезвоживание организма (двукратная потеря массы тепа за 4-6 суток).
цГМФ
Циклическая форма ГМФ образуется из ГТФ в реакции, катализируемой гуанилатциклазой. Гуанилатциклаза является рецептором-ферментом (рис. 29.7). При активации гуанилат-циклазы образуется циклический гуанозинмонофосфат (цГМФ). цГМФ связывается с цГМФ-зависимой про-теинкиназой и активирует ее, что приводит к фосфорилированию специфических белков. Например, фосфорилирование белков гладкой мускулатуры (легкая цепь миозина) приводит к расслаблению гладких
мышц и расширению сосудов; в почках и кишечнике цГМФ изменяет транспорт ионов и задерживает воду; фосфорилирование цАМФ-фосфодиэ-стеразы вызывает ее активацию и снижение концентрации цАМФ.
Цитозольный тип гуанилатциклазы содержит в своем составе гем и активируется оксидом азота (NO). Оксид азота образуется из аргинина под влиянием Са2+-зависимой NO-синтазы и диффундирует в рядом расположенные клетки. В клетках-мишенях NO связывается с гемом гуанилатциклазы и увеличивает продукцию цГМФ.
Рис. 29.7. Структура гуанилатциклазы.
457
Глава 29 Регуляция обмена веществ. Гормоны
В сердце цГМФ уменьшает силу сердечных сокращений, активируя ионный насос, который откачивает Са2+ из цитозоля. Расслабление сердечной мышцы под действием NO аналогично действию нитроглицерина и других нитровазодилататоров, которые применяются при приступах ишемической болезни сердца, обусловленных снижением поступления кислорода из-за спазма коронарных сосудов. NO является нестабильной молекулой, действует кратковременно (несколько секунд) и затем подвергается окислению в нитрит или нитрат.
Часто действие цАМФ и цГМФ противоположно. Через образование цГМФ действует, например, атриальный натрийуретический фактор.
Кишечный пептид гуанилин связывается с рецепторами мембран эпителиальных клеток, активирует гу-анилатциклазу и регулирует секрецию СГ в кишечнике. Эти рецепторы являются мишенью также для термостабильного пептидного эндотоксина, продуцируемого Е. соН и другими грам-отрицательны-ми бактериями. Повышение концентрации цГМФ, вызванное эндотоксином, повышает секрецию СГ и снижает реабсорбцию воды кишечным эпителием, приводя к диарее.
Метаболиты фосфатидилинозитолов
Рецепторы мембран через Gq белок (имеет аналогичное строение как Gs белок) могут быть связаны с ферментом плазматической мембраны фосфолипа
зой С, которая специфически катализирует гидролиз мембранного липида — фосфатидилинозитола-4,5 -дифосфата. Последовательность процессов показана на рис. 29.8. В результате образуется 2 вторичных посредника: инозитол 1,4,5-трифосфат (ИФ3ДР3) (рис. 29.9) и 1,2-диацилглицерол.
1. 1Р3 является водорастворимой молекулой, поступает из мембраны в цитозоль к эндоплазматическому ретикулуму, связывается со специфическими рецепторами и способствует высвобождению Са2+ из ЭПР. Концентрация Са2' повышается до 106 моля. Са2+ активирует протеинкиназу С.
2. Диацилглицерол (гидрофобная структура) латерально диффундирует в мембране и активирует протеинкиназу С, зависимую от концентрации ионов Са2+. Протеинкиназа С фосфорилирует специфические белки, изменяя их каталитическую активность. Инактивация 1Р3 осуществляется дефосфорилированием, диацилглицерола — гидролизом.
Действие промоторов опухолей опосредуется их влиянием на лро-теинкиназу С. Наиболее изученные из них — форболовые эфиры — синтетические соединения, которые являются мощными активаторами протеинкиназы С, действуя подобно диацилглицеролу. В отличие от диацилглицерола, промоторы опухолей не метаболизируются. Длительная активация протеинкиназы С нарушает нормальный рост и деление клеток.
Ионы Са2+
Во многих клетках, которые реагирутаг на внеклеточные сигналы, Са2+ является внутриклеточным посредником. Гор-
458
Регуляция обмена веществ. Гормоны Глава 29
Рис. 29.8. Активация фосфолипазы С.
459
Глава 29 Регуляция обмена веществ. Гормоны
Рис. 29.9. Инозитол 1,4,5-трифосфат.
мональный, нервный или другой сигнал вызывает либо поступление Са2+ в клетку через специфические кальциевые каналы в плазматической мембране или высвобождение секвенированного Са2+ из эндоплазматического ретикулума или митохондрий, что в обоих случаях повышает концентрацию цитозольного Са2+ и запускает внутриклеточный ответ. При этом концентрация Са2+ не просто повышается, а затем снижается. В клетке происходят колебания концентрации Са2+ в течение нескольких секунд, даже если внеклеточная концентрация гормона остается постоянной.
Ионы кальция выступают посредниками ряда внутриклеточных метаболических превращений. Инозитол-1,4,5-трифосфат открывает каналы для освобождения ионов кальция из внутриклеточных хранилищ (эндоплазматического или саркоплазматического ретикулума). Повышение Са2+ в цитозоле ведет к сокращению гладких мышц, распаду гликогена и освобождению везикул (пузырьков) от мембран. Действие 1Р3 длится несколько секунд и затем этот вторичный мессенджер де-фосфорилируется или фосфорилирует
ся в положении 3 с потерей активности. Диацилглицерол активирует протеин-киназу С, которая фосфорилирует многие белки. Обычно оба этих мессенджера действуют совместно, регулируя пути образования других сигнальных молекул, например, простагландинов.
Почему ионы кальция выполняют регуляторную роль? Комплексы кальция с фосфорилированными и карбоксилированными молекулами клетки являются нерастворимыми, но именно они играют ведущую роль в биохимических процессах клеток. Очевидно, что внутриклеточная концентрация Са2+ должна сохра-няться низкой, чтобы предотвратить преципитацию ряда молекул. Для транспорта кальция в эукариотических клетках существуют Са-1 -зависимая АТФаза и натрий-кальциевый обменник. Благодаря их функционированию концентрация Са2+ в цитозоле составляет 100 нмоль; концентрация Са2+ в плазме крови в среднем 2,5 ммоль. Внутриклеточная концентрация Са2+ в цитозоле может резко повышаться при передаче управляющих сигналов путем открытия кальциевых мембран в плазматической или внутриклеточных мембранах. Ионы кальция способны связываться с внутриклеточными белками: с отрицательно заряженными атомами кислорода (карбоксильные группы радикалов глутамата и аспартата) или незаряженными атомами кислорода радикалов глутамина и аспарагина. Такое связывание кальция с 6~8 атомами кислорода может создавать поперечные связи между отрезками полипептидных цепей и индуцировать тем самым конформационные изменения.
Са2+ в клетке связывается с кальций-зависимым регуляторным белком — кальмодулином.
Кальмодулин является кислым белком с молекулярной массой 17 кДа. Он имеет 4 кальций-связывающих места. Кальмодулин активируется, если концентра* ция цитозольного кальция уже превышает 500 нмоль. При связывании гидрофильных групп с ионом кальция
460
Регуляция обмена веществ. Гормоны Глава 29
происходит изменение конформации белка с выходом на поверхность гидрофобных радикалов (рис. 29.10). Это способствует взаимодействию кальмодулина с гидрофобными поверхностями других белков (ферментов, насосов и др.). Калъмодулин-зависимая протеинкиназа фосфорилирует ряд белков, регулирующих метаболизм, проницаемость мембран для ионов, синтез нейромедиаторов и освобождение нейротрансмиттеров. Комплекс Са2ь-кальмодулин активирует мембранную кальцийзависимую АТФазу, которая откачивает кальций из цитозоля и тем самым прекращается действие управляющего сигнала.
Гормоны гипоталамуса и гипофиза
Гормоны гипоталамуса вырабатываются в пульсирующем режиме. Эти гормоны регулируют выработку гормонов гипофиза. Вещества, влияющие на вы-
Рис. 29.10. Связывание иона кальция с кальмодулином. Слева схема связывающего домена (вертикальная спираль Е и горизонтальная спираль F), справа кисть (EF hand) — модель связывания ионов кальция семейством кальций-связывающих белков.
работку гормонов гипофиза, называются релизинг-факторами (от англ, release — освобождать). Релизинг-факторы делятся на либерины (стимулируют выработку гормонов гипофиза) и статины (угнетают высвобождение и. возможно, биосинтез) гипофизарных гормонов (рис. 29.11).
В гипоталамусе выделяют 7 либери-нов (кортиколиберин, тиролиберин, люлиберин, фоллилиберин. сомато.тибе-рин, пролактолиберин, меланолиберин) и 3 статина (соматостатин, пролактостатин, меланостатин). По химическому строению все гормоны гипоталамуса являются низкомолекулярными пептидами.
Нейропептиды гипоталамуса активируют высвобождение тропных гормонов гипофиза по аденилатциклазному механизму или через изменение концентрации ионов Са2+.
Гормоны гипофиза
В зависимости от места синтеза различают гормоны передней, задней и промежуточной долей гипофиза.
Гормоны передней доли гипофиза
1. Кортикотропин (АКТЕ КТ) — полипептид, состоящий из 39 аминокислот. Регулирует рост и функцию коры надпочечников. Для проявления биологической активности необходимы 24 N-концевые аминокислоты.
АКТГ 1) повышает синтез и секрецию стероидов надпочечников. 2) оказывает жиромобилизующий эффект и 3) обладает меланоиитостимулирующей активностью. Механизм действия — аденилатциклазный.
2. Соматотропин (СТГ. ГР), см. лекцию 31. СТГ состоит из 191 аминокислоты. Обладает видовой специфичнос-
461
Глава 29 Регуляция обмена веществ. Гормоны
Импульсы из внешней и внутренней среды
Центральная нервная система
Гипоталамус
Гормоны гипоталамуса (либерины, статины)
Задняя доля гипофиза
Передняя доля гипофиза
Многие ткани
Мышцы, печень
Гладкие мышцы, молочные железы
Артериолы почки
Репродуктивные органы
Печень, Молочные кости железы
Рис. 29.11. Центральные и периферические эндокринные железы.
тью. Обеспечивает рост до периода полового созревания (деление клеток, рост костей в длину, задержка кальция, увеличение массы внутренних органов). Оказывает прямое и опосредованное действие. Прямое действие СТГ связано с увеличением внутриклеточной концентрации цАМФ в тканях. Опосредованное действие обусловлено образованием в печени инсулиноподобных факторов (IGF-1 и IGF-2), которые обеспечивают анаболический эффект.
При недостатке СТГ у детей (гипофизарная карликовость) отмечается нарушение развития тела и сохранение нормальных пропорций ш психического развития. При гиперфункции в детском возрасте развивается гигантизм, у взрослых — акромегалия (увеличение отдельных участков тела).
3. Тиротропин (ТТГ). ТТГ представляет по химическому строению сложный белок — гликопротеин. Состоит из 2-1
462
Регуляция обмена веществ. Гормоны Глава 29
субъединиц -аир. р-Субъединица определяет биологическую активность, а необходима для проявления биологической активности р-субъединицы. Действует по аденилатциклазному механизму. Орган-мишень — щитовидная железа. ТТГ контролирует развитие и функцию щитовидной железы и регулирует биосинтез и секрецию в кровь тироидных гормонов.
4. Фоллитропин (ФСГ) и лютропин (ЛТГ). Являются сложными белками-гликопротеинами, состоящими из а и р-субъединиц. Фоллитропин вызывает созревание фолликулов в яичниках у женщин и сперматогенез у мужчин. Лютропин стимулирует секрецию эстрогенов и прогестерона, разрыв фолликулов у женщин, а также секрецию тестостерона и развитие интерстициальной ткани у мужчин. Оба гормона являются сложными белками-гликопротеинами, состоящими из а и р-субъединиц. Каждая из них в отдельности лишена биологической активности. Специфичность действия гормонов зависит от р-субъединиц (они отличаются), а а-субъе-диницы имеют сходное строение.
5. Пролактин. Состоит из 199 аминокислотных остатков. Является одним из самых древних гормонов. Основное действие — стимуляция развития молочных желез и лактации. Кроме того, стимулирует рост внутренних органов, секрецию желтого тела, оказывает гипергликемическое действие. Концентрация пролактина повышается в крови у женщин перед родами.
6. а- и р-липотропные гормоны. Биоло-ическое действие — мобилизация жира л депо. Кроме того, отмечают кортикотропную, меланоцитостимулирую-цую и гипокальциемическую активно--ти. Механизм действия — увеличение • онцентрации цАМФ.
В клетках переднего сегмента задней с эли гипофиза (у животных — средней
доли гипофиза) образуются а- и р-ме-ланоцитостимулирующие гормоны, а-МСГ состоит из 13 аминокислот, р- из 18—22 аминокислотных остатков. Биологическая роль — стимуляция синтеза меланина и увеличение количества пигментных клеток (меланоцитов) в коже, радужке, пигментном эпителии сетчатки глаза. В жировой ткани оказывает жиромобилизующее действие.
Гормоны задней доли гипофиза (окситоцин и вазопрессин)
Относятся к гормонам задней доли гипофиза условно, поскольку синтезируются в особых нейронах гипоталамуса, откуда переносятся в заднюю долю гипофиза и поступают непосредственно в кровь. Для транспорта синтезированных гормонов в секреторные гранулы гипоталамуса и в гипофиз существуют специальные белки — нейрофизины I и II. По химическому строению представляют собой пептиды, состоящие из 9 аминокислот. Период полужизни 2~4 мин.
1. Вазопрессин (антидиуретический гормон), см. лекцию 32. Орган-мишень — клетки дистальных канальцев почек, где вазопрессин связывается с клеточными рецепторами и увеличивает концентрацию цАМФ, что приводит к активации протеинкиназ и фосфорилированию мембранных белков почечных канальцев. Конечный эффект — увеличение реабсорбции воды. Вазопрессин стимулирует сокращение гладкой мускулатуры сосудов, оказывая сильное вазопрессорное действие.
При недостаточности секреции гормона развивается несахарный диабет — заболевание, характеризующееся выделением чрезвычайно больших количеств жидкости.
463
Глава 29 Регуляция обмена веществ. Гормоны
2. Окситоцин. Стимулирует сокращение гладких мышц матки и сокращение мышечных волокон, расположенных вокруг альвеол молочных желез, вызывающее секрецию молока. Усиливает синтез белка в молочной железе, оказы
вает инсулиноподобное действие на жировую ткань, усиливает потребление глюкозы и синтез триацилглицеролов. Механизм действия — увеличение внутриклеточной концентрации цГМФ и ионов кальция.
464
Глава 30
Гормональная регуляция энергетического обмена
Основным источником энергии в организме является глюкоза. Концентрация глюкозы в крови строго контролируется. Глюкоза необходима, прежде всего, как источник энергии для мозга. Одна из основных функций печени состоит в поддержании концентрации глюкозы в крови на уровне около 4,5 ммоль/л (округленные значения для лучшего запоминания 3,33—5,55 ммоль/л). Если уровень глюкозы в крови снижается, развиваются нарушения метаболизма в центральной нервной системе, которые могут приводить к коме, судорогам и при выраженной гипогликемии — к смерти. В поддержании уровня глюкозы в крови принимают участие инсулин,
глюкагон, адреналин и глюкокортикоиды, которые регулируют метаболизм во многих тканях, но особенно в печени, мышцах и жировой ткани.
Инсулин
1. Синтез инсулина. Синтез инсулина происходит в р-клетках островков Лангерганса поджелудочной железы (табл. 30.1).
Ген человеческого инсулина локализован в коротком плече 11 хромосомы. Инсулин синтезируется на рибосомах шероховатого эндоплазматического ретикулума в виде препроинсулина (м. м.
Таблица 30.1. Сигнальные молекулы, вырабатываемые инсулярным аппаратом поджелудочной железы
Типы клеток Продуцируемый гормон Относительный объем продукции
а (А) Глюкагон 25%
3(B) Инсулин 70%
3(D) Соматостатин <5%
- Панкреатический полипептид Следы
Зак. 2124
465
Глава 30 Гормональная регуляция энергетического обмена
11500), который на N-конце содержит сигнальный пептид, состоящий из 16 аминокислот и направляющий пептидную цепь в просвет эндоплазматического ретикулума. В ЭПР сигнальный пептид отделяется и после замыкания дисульфидных связей образуется проин-сулин (м. м. 9000). Биологическая активность проинсулина составляет 5 % биологической активности инсулина. Проинсулин поступает в аппарат Гольджи, где в секреторных везикулах происходит отщепление эквимолярного количества С-пептида, и образуется зрелый инсулин, который сохраняется в форме цинксодержащего гексамера вплоть до секреции. Мембраны секреторных пузырьков (гранул) в процессе секреции сливаются с плазматической мембраной клетки, а их содержимое высвобождается во внеклеточное пространство. Определение в крови концентрации С-пептида может быть использовано для определения функции поджелудочной железы (при введении экзогенного инсулина или при невозможности прямого определения инсулина в сыворотке крови из-за наличия про-тивоинсулиновых антител).
2. Структура инсулина. Молекула инсулина — полипептид, состоящий из 2-х цепей: А цепи (21 аминокислотный остаток) и В цепи (30 аминокислотных остатков). Цепи связаны между собой дисульфидными мостиками. Дисульфидные мостики локализованы между аминокислотными остатками А7-В7 и А20-В19. Третий дисульфидный мостик связывает между собой 6 и 11 аминокислотные остатки А цепи. Локализация всех трех дисульфидных мостиков постоянна.
Выделяют 3 консервативных участка в молекуле инсулина; 1) положение 3-х дисульфидных связей; 2) гидрофобные остатки в С-концевом участке В-цепи и 3) С- и N-концевые участки А-цепи.
Наиболее схожи по своему строению инсулины человека, свиньи (отличие по 1 аминокислоте) и быка (3 аминокислоты), что позволяет их использовать в качестве препаратов заместительной терапии при сахарном диабете.
Поджелудочная железа человека секретирует до 40—50 ед. инсулина в сутки, что соответствует 15—20 % общего количества гормона в железе.
3. Регуляция синтеза инсулина. Повышение концентрации глюкозы в крови — главный физиологический стимул секреции инсулина. Пороговой для секреции инсулина является концентрация глюкозы натощак 80—100 мг/дл (> 5,5 ммоль, л), а максимальная секреция наблюдается при концентрации глюкозы 300—500 мг/ дл (15—20 ммоль/л). Кроме того, стимулируют синтез и секрецию инсулина аминокислоты лейцин, глюкагон, гормон роста, кортизол, плацентарный лактоген, эстрогены и прогестерон. Ингибируется синтез инсулина адреналином.
4. Деградация инсулина. В крови инсулин не имеет белков-переносчиков. Период полужизни 3—5 минут. Катаболизм инсулина происходит, в основном, в печени, почках и плаценте. Около 50 % инсулина метаболизируется за один пассаж крови через печень. В деградации инсулина участвуют 2 ферментативные системы: 1) инсулин-специфическая протеиназа, расщепляющая инсулин до аминокислот и 2) глутатион-инсулин-трансгидрогеназа, которая восстанавливает дисульфидные мостики.
5. Формы инсулина в крови. Различаю® 3 формы инсулина в крови: 1) свободная форма инсулина — способствует утилизации глюкозы жировой и мышечной тканью; 2) связанная с белками форма инсулина — влияет только ни. жировую ткань; 3) форма А — проме
466
Гормональная регуляция энергетического обмена Глава 30
жуточная форма инсулина, появляется в крови в ответ на быструю, срочную потребность организма в инсулине.
5. Механизм действия инсулина. По механизму действия инсулин относится к гормонам со смешанным механизмом действия. Вначале инсулин связывается со специфическим гликопротеиновым рецептором, который содержит много гликозильных остатков на повер
хности клетки-мишени. Удаление сиаловых кислот и галактозы снижает способность рецептора связывать инсулин и активность гормона.
Рецептор инсулина состоит из 2-х а-и 2-х р-субъединиц, соединенных дисульфидными мостиками (рис. 30.1). а-Субъединица расположена вне клетки и осуществляет связывание инсулина, р-Субъединица обладает тирозинкиназной
Инсулин связывается с рецептором
Рис. 30.1. Структура рецептора инсулина (D. L. Nelson, М. М. Сох, с изм.).
467
Глава 30 Гормональная регуляция энергетического обмена
активностью и содержит участок ауто-фосфорилирования. При связывании инсулина с а-субъединицей активируется тирозинкиназная активность р-субъединицы, и каждый ар-мономер фосфорилирует остатки тирозина вблизи карбоксильных терминальных доменов p-цепи. Аутофосфорилирование открывает активный центр, позволяя ферменту фосфорилировать специфические белки-мишени. В результате активируются протеинкиназы и фосфатазы, оказывая биологическое действие.
В результате связывания инсулина с рецептором происходит изменение конформации рецептора, гормон-рецепгорный комплекс проникает в цитозоль путем эндоцитоза (интернализация), распадается и генерируется сигнал внутри клетки. Рецепторы могут подвергаться протеолизу или повторному процессингу и вновь встраиваться в мембрану. В качестве внутриклеточных посредников выступают сам инсулин, ионы кальция, циклические нуклеотиды, продукты распада фосфатидилинозитола, пептиды мембран.
Различные эффекты инсулина делятся на: 1) быстрые, которые проявляются через несколько секунд или минут (деполяризация мембран, транспорт глюкозы и ионов, фосфорилирование белков, активация или ингибирование ферментов, синтез РНК) и 2) медленные — от нескольких часов до суток (синтез белка, ДНК, пролиферация клеток). 6. Метаболические эффекты инсулина. Все органы делятся на инсулинчувствительные (мышечная, жировая ткани и частично печень) и инсулиннечувстви-тельные (нервная ткань, эритроциты).
Основное биологическое значение инсулина — превращение избытка глюкозы крови в две резервные формы — гликоген (печень и мышцы) и триацилглицеролы (жировая ткань).
Обмен углеводов. Инсулин — единственный гормон, который снижает уровень глюкозы в крови по следующим механизмам.
1. Инсулин повышает проницаемость мембран мышечной и жировой тканей для глюкозы, увеличивая количестве переносчиков для глюкозы и транслокацию их из цитозоля в мембрану. Гепатоциты хорошо проницаемы для глюкозы и инсулин способствует задержке глюкозы в клетках печени, стимулируя активность глюкокиназы и ингибируя глюкозо-6-фосфатазу. В результате быстро протекающего фосфорилирования концентрация свободной глюкозы в гепатоцитах поддерживается на очеш низком уровне, что способствует ее проникновению в клетки по градиент) концентрации.
2. Инсулин влияет на внутриклеточную утилизацию глюкозы следующими путями: 1) 50 % поглощенной глюкозы превращается в энергию (гликолиз); 2 30—40% —- в жиры и 3) 10% — в гликоген.
3. Инсулин усиливает интенсивности гликолиза в печени, повышая активность ферментов глюкокиназы, фосфофруктокиназы и пируваткиназы. Более интенсивный гликолиз способствует более активной утилизация глюкозы и, следовательно, способствует снижению выхода глюкозы к клетки.
4. В печени и мышцах инсулин стимул лирует синтез гликогена путем ингибирования аденилатциклазы и активации фосфодиэстеразы. В результате концентрация цАМФ уменьшается, что прнво дит к активации гликогенсинтазы л ингибированию фосфорилазы.
5. Инсулин ингибирует глюконеогеж в результате уменьшения концентрации фосфоенолпируваткарбоксикиназы (и» гибирование транскрипции генов и ое теза мРНК).
468
Гормональная регуляция энергетического обмена Глава 30
Обмен липидов.
1. Инсулин стимулирует липогенез в печени и жировой ткани путем:
а) увеличения концентрации ацетил-КоА и НАДФН+Н+, необходимых для синтеза жирных кислот в результате активации пируватдегидрогеназного полиферментного комплекса и пенто-зофосфатного пути распада глюкозы;
б) активации фермента ацетил-КоА-карбоксилазы, катализирующего превращение ацетил-КоА в малонил-КоА; в) активации полиферментного комплекса синтазы высших жирных кислот путем дефосфорилирования;
г) увеличения притока глицерола, необходимого для синтеза триацилглицеролов.
2. В печени и жировой ткани инсулин через снижение концентрации цАМФ ингибирует гормончувствительную липазу и липолиз.
3. Инсулин ингибирует синтез кетоновых тел в печени.
4, Инсулин стимулирует синтез ЛПОНП, которые транспортируют триацилглицеролы из печени в периферические ткани.
Обмен белков. Инсулин оказывает анаболический эффект на обмен белков, поскольку он стимулирует синтез и тормозит распад белков. Инсулин стимулирует поступление нейтральных ами
нокислот в мышечную ткань. Влияние инсулина на синтез белков в скелетных и сердечной мышцах проявляется, вероятно, на уровне трансляции мРНК.
Пролиферация клеток. Инсулин стимулирует пролиферацию клеток в клеточных культурах и, возможно, участвует в регуляции роста in vivo.
Суммарные эффекты инсулина представлены в таблице 30.2.
Нарушение метаболизма инсулина. При недостатке инсулина развивается сахарный диабет. Примерно у 90 % больных диабетом наблюдается инсулиннезависимый сахарный диабет II типа. Характерен для людей зрелого возраста. Для таких больных типичны ожирение, повышенное содержание в плазме инсулина и снижение количества инсулиновых рецепторов. У 10 % больных наблюдается диабет I типа (инсулинзависимый, ювенильный), который остро начинается в юношеском возрасте. Обусловлен поражением поджелудочной железы различными факторами и снижением количества инсулина в крови. Разрушение р-клеток может быть вызвано ксенобиотиками и лекарственными препаратами, вирусами, аутоиммунными процессами.
Таблица 30.2. Влияние инсулина на некоторые метаболические процессы
Метаболические эффекты инсулина Ферменты-мишени
t Поступление глюкозы в мышцы t Поступление глюкозы в печень * Распад гликогена (печень, мышцы) ‘Синтез гликогена (печень, мышцы) • Гликолиз, продукция ацетил-КоА (печень, мышцы) * Синтез высших жирных кислот (печень) • Синтез триацилглицеролов (жировая ткань) t переносчик глюкозы t глюкокиназа 1 гликогенфосфорилаза t гликогенсинтаза t фосфофруктокиназа t пируватдегидрогеназный комплекс t Ацетил-КоА-карбоксилаза t липопротеинлипаза
469
Глава 30 Гормональная регуляция энергетического обмена
Метаболические изменения при диабете. Основными признаками недостаточности инсулина являются: гипергликемия, кетоацидоз и гипертриацилглицеролемия. Гипергликемия обусловлена снижением утилизации глюкозы периферическими тканями и повышенной продукцией глюкозы за счет активации глюконеогенеза и гликогенолиза. Когда концентрация глюкозы превышает порог реабсорбции, глюкоза экскретируется с мочой (глюкозурия). Повышенная мобилизация жирных кислот приводит к повышенной продукции кетоновых тел и развитию кетоацидоза. При диабете повышаются превращение жирных кислот в триацилглицеролы и секреция ЛПОНП и хиломикронов, что приводит к увеличению их концентрации в крови.
На протяжении многих лет ведется поиск гипогликемических препаратов с новыми механизмами действия: секре-тогенов, сенситайзеров инсулина, ингибиторов скорости продукции глюкозы печенью и др. Одним из перспективных направлений является поиск модуляторов инкретинов: GIP и GLP, которые регулируют активность секреции 0-клеток путем оптимизации синтеза инсулина и способствуют пролиферации 0-клеток, неогенезу островков Лангерганса, а также препятствуют апоптозу 0-клеток.
Снижение чувствительности рецепторов к инсулину лежит в основе инсулинорезистен-тности. Инсулинорезистентность является ведущей причиной развития метаболического синдрома у каждого 4—6 жителя Земли. Метаболический синдром — это прогрессирующее состояние предболезни у людей постиндустриального общества. Напомним, что в самом общем виде метаболический синдром включает пять важнейших признаков: избыточная масса тела или ожирение, артериальная гипертензия, гипергликемия натощак, снижение концентрации ХС ЛПВП и повышение концентрации триацилглицеролов в плазме крови.
Глюкагон
Глюкагон — полипептид, состоящий из 29 аминокислот (м. м. 3500 Да). Был выделен в 1953 г. Штраубом. Основным местом синтеза глюкагона являются а-клетки островкового аппарата поджелудочной железы. Период полужизни около 15—20 минут. Инактивация гормона происходит в печени путем протеолиза.
Регуляция секреции. Через несколько часов после приема пищи, даже при отсутствии значительной физической активности или стресса, уровень глюкозы в крови начинает падать вследствие окисления глюкозы в мозге и других тканях. Снижение уровня глюкозы в крови вызывает секрецию глюкагона и ингибирует секрецию инсулина.
Метаболические эффекты глюкагона. Глюкагон — непроникающий гормон, рецепторы находятся на поверхности клеток. Основные органы-мишени — печень и жировая ткань, в меньшей степени — мышцы. Механизм действия гормона реализуется по аденилатциклаэ-ному каскадному пути.
Обмен углеводов.
1. Глюкагон является основным гормоном, который повышает уровень глюкозы в крови.
2. В печени глюкагон активирует расщепление гликогена (гликогенолизу путем активации гликогенфосфорилаза и инактивации гликогенсинтазы. Регуляция активности обоих ферментов осуществляется путем фосфорилирования ; через цАМФ. Глюкагон не влияет на. j распад гликогена в мышцах.
3. Глюкагон ингибирует гликолиз ж . печени и активирует глюконеогенез. Эти эффекты обусловлены снижением уровня фруктозо-2,6-бисфосфата, конто- -рый является аллостерическим ингибитором фруктозо-1,6-бисфосфатазы и активатором фосфофруктокиназы. Гдю-
470
Гормональная регуляция энергетического обмена Глава 30
кагон также ингибирует гликолитический фермент пируваткиназу, блокируя превращение фосфоенолпирувата в пируват и окисление пирувата в ЦТК.
Стимуляция глюкагоном распада гликогена в печени, ингибирование гликолиза и активация глюконеогенеза способствует поступлению глюкозы из печени в кровь и восстановление ее уровня до нормальных значений.
Обмен липидов.
1. В жировой ткани глюкагон активирует триацилглицероллипазу через цАМФ по аденилатциклазному механизму и увеличивает липолиз.
2. Образующиеся в большом количестве жирные кислоты транспортируются в печень и другие ткани, где используются в качестве источника энергии, сберегая глюкозу для мозга.
3. В печени жирные кислоты могут превращаться в кетоновые тела через ацетилКоА.
Обмен белков. Глюкагон активирует захват аминокислот печенью и стимулирует распад белков. Образованные аминокислоты используются для глю
конеогенеза и после дезаминирования — для биосинтеза мочевины.
Суммарные эффекты глюкагона представлены в таблице 30.3.
Гормоны мозгового вещества надпочечников (катехоламины)
В мозговом веществе надпочечников синтезируются норадреналин и адреналин. Роль этих гормонов заключается в адаптации к острым и хроническим стрессам.
Синтез катехоламинов происходит в хромаффинных клетках мозгового вещества надпочечников из аминокислоты тирозин. Свое название эти клетки получили потому, что содержат гранулы, окрашивающиеся под действием бихромата калия в красно-коричневый цвет. Главный продукт мозгового слоя надпочечников — адреналин, который составляет 80 % всех катехоламинов (1—3 мг/г адреналина и 0,2—0,6 мг/г норадреналина). Вне мозгового вещества адреналин не образуется. В отличие от него, норадреналин, обнаруживаемый в органах, иннервируемых симпатически
Таблица 30.3. Метаболические эффекты глюкагона
Метаболические эффекты Механизм влияния на метаболизм глюкозы Ферменты-мишени
t Распад гликогена (печень), первичный эффект, секунды Гликоген -* глюкоза t гликогенфосфорилаза
1 Синтез гликогена (печень), первичный эффект, секунды Меньше глюкозы запасается в форме гликогена 4 гликогенсинтаза
4 Гликолиз (печень) Меньше глюкозы используется как источник энергии в печени 4 фосфофруктокиназа
t Глюконеогенез в печени, Аминокислоты t фруктозо-1,6-
отсроченный эффект, Глицерол —^глюкоза бисфосфатаза
минуты Оксалоацетат-'^ 4 пируваткиназа
t Мобилизации жирных кислот (жировая ткань) Меньше глюкозы используется как источник энергии в печени и мышцах t триацилглицероллипаза
471
Глава 30 Гормональная регуляция энергетического обмена
ми нервами, образуется преимущественно in situ; остальная часть норадреналина образуется, главным образом, в окончаниях нервов и достигает своих мишеней с кровью.
Превращение тирозина в адреналин включает четыре последовательных этапа: 1) гидроксилирование кольца, 2) декарбоксилирование, 3) гидроксилирование боковой цепи, 4) N-метилировацие. Благодаря метилированию адреналин приобрел способность циркулировать в кровеносном русле (рис. 30.1).
Запасание и секреция катехоламинов. В мозговом слое надпочечников содержатся хромаффинные гранулы — органеллы, способные к биосинтезу, погло-щению, запасанию и секрердги катехоламинов. Нервная'стимуляция мозгового слоя надпочечников приводит к слиянию хромаффинных гранул с плазматической мембраной и, таким образом, обусловливает выброс норадреналина и адреналина путем экзоцито-за. Секретируемый надпочечниками адреналин попадает в печень и скелетные мышцы, но затем быстро метаболизируется. Катехоламины циркулируют в плазме в слабоассоциированном с альбумином виде. Период полужизни составляет 10—30 с. Гематоэнцефалический барьер является препятствием для катехоламинов. Может проходить через гематоэнцефалический барьер только ДОФА, что и определяет использование этого препарата при паркинсонизме. Концентрация адреналина в плазме крови составляет 2 нмоль/л. При стрессе количество катехоламинов увеличивается в 4—8 раз.
Метаболизм катехоламинов. Лишь очень небольшая часть адреналина (менее 5 %) выделяется с мочой. Катехоламины быстро метаболизируются под действием катехол-О-метилтрансферазы (цитозольный фермент, обнаруживается во многих тканях) и моноаминоок
сидазы с образованием О-метилирован-ных и дезаминированных продуктов, которые выводятся с мочой.
Механизм действия катехоламинов. Катехоламины действуют через 2 типа рецепторов: а-адренергические и р-ад-ренергические. Каждый из них подразделяется на а( и а2, pj и р2. Адреналин связывается (и активирует) как с а-, так и с p-рецепторами, и поэтому его действие на ткань, содержащую рецепторы обоих классов, зависит от относительного сродства этих рецепторов к гормо-1 ну. Норадреналин в физиологических I концентрациях связывается, главным образом, с «-адренорецепторами.
При связывании адреналина с /^-адренорецепторами активируется адени-латциклаза и увеличивается концентрация цАМФ. а-Адренорецепторы участвуют в процессах, ведущих к изменению внутриклеточной концентрации кальция или к изменению метаболизма фосфатидилинозитола.
Влияние на метаболизм. Адреналин действует на мышцы, жировую ткань и печень.
Обмен углеводов. Адреналин активирует распад гликогена (гликогенолиз) в мышцах и, в меньшей степени, в печени, стимулирует синтез глюкозы в печени (глюконеогенез) и понижает поглощение глюкозы в мышцах и других тканях.
Адреналин вызывает повышение концентрации глюкозы в крови при остром стрессе для работы мозга и экстренного сокращения мышц.
Адреналин уменьшает секрецию инсулина и увеличивает секрецию глюкагона. что приводит к повышению концентрации глюкозы в крови, которая используется в качестве источника энергии для мозга.
472
Гормональная регуляция энергетического обмена Глава 30
Рис. 30.1. Синтез катехоламинов.
Обмен липидов. В жировой ткани адреналин и норадреналин стимулируют распад триацилглицеролов за счет повышения содержания цАМФ и активации гормончувствительной липазы. Жирные кислоты используются в качестве источника энергии для мышечной активности и, кроме того, могут активировать глюконеогенез в печени.
Влияние на физиологические функции. Действуя на сердце, адреналин увеличивает минутный объем в результате повышения силы (инотропный эффект) и частоты (хронотропный эффект) сердечных сокращений и повышает артериальное давление, что обеспечивает повышенное поступление кислорода для окислительных процессов в тканях.
Катехоламины вызывают расслабление гладкой мускулатуры бронхов, желудочно-кишечного тракта и кровеносных сосудов скелетных мышц. С другой стороны, катехоламины стимулируют сокращение гладкой мускулатуры сосудов кожи и почек (табл. 30.4).
Глюкокортикоиды
К стероидным гормонам относятся гормоны коры надпочечников (глюкокортикоиды и минералокортикоиды) и половые гормоны (эстрогены, прогестерон и тестостерон).
Синтез стероидных гормонов происходит по обшей схеме и регулируется гормонами гипофиза. Стероидные гор-
473
Глава 30 Гормональная регуляция энергетического обмена
Таблица 30.4. Физиологические и метаболические эффекты адреналина
Физиологические
t Частоты сердечных сокращений
t Давления
t Расширение дыхательных путей
Метаболические эффекты
t Распад гликогена (мышцы, печень)
4 Синтез гликогена (мышцы, печень)
t Глюконеогенез (печень)
t Гликолиз (мышцы)
t Мобилизация жирных кислот
t Секреция глюкагона I Секреция инсулина
Повышение поступления О2 к тканям
Повышение продукции глюкозы для получения энергии
Повышение продукции АТФ для мышц Использование жирных кислот в качестве источника энергии
Усиление эффектов адреналина
Холестерол (С2,)
Прегненолон (С21)
Глюкокортикоиды (С21)
Прогестины (С21)
.. 1 Андрогены (С1в)
Минералокортикоиды (Сг,) w
Эстрогены (С,s)
Рис. 30.2. Общая схема биосинтеза гормонов стероидной природы.
моны образуются из холестерола, который поступает в периферическую эндокринную железу в составе ЛПНП или синтезируется внутриклеточно из аце-тил-КоА. Значительная часть холестерола подвергается эстерификации и накапливается в цитоплазме в виде эфиров. При синтезе гормонов происходит активация холестеролэстеразы и
образующийся свободный холестерол транспортируется в митохондрии, гж превращается в общий промежуточный продукт — прегненолон. Прегненолои транспортируется в ЭПР, где через ряж промежуточных метаболитов превращается в стероидные гормоны.
Общая схема биосинтеза стероидных гормонов представлена на рис. 30.2.
474
Гормональная регуляция энергетического обмена Глава 30
В нумерации углеродных атомов стероидных гормонов учитывается нумерация углеродного скелета холестерола (рис. 30.3).
Последовательность синтеза гормонов коры надпочечников представлена на рис. 30.4.
Рис. 30.3. Нумерация углеродных атомов в молекуле холестерола (схема нумерации сохраняется у других стероидов).
Рис. 30.4. Схема образования пргестерона, кортизола и альдостерона.
475
Глава 30 Гормональная регуляция энергетического обмена
Кортикотропин в коре надпочечников и лютропин в половых железах регулируют синтез стероидных гормонов: 1) увеличивают число рецепторов для ЛПНП на поверхности мембраны клеток; 2) активируют холестеролэстеразу и способствуют образованию свободного холестерола; 3) активируют ферменты превращения холестерола в прегненолон в митохондриях; 4) стимулирует распад углеводов и липидов, обеспечивая стероидогенез энергетическим и пластическим материалом.
В крови 90-95 % сфероидных гормонов связаны с белками.х
Активны только свободные формы стероидных гормонов.
По обратной связи стероидные гормоны тормозят продукцию тропных гормонов гипофиза. Период полужизни стероидных гормонов 0,5—1,5 часа. В печени, почках и других тканях гормоны модифицируются (восстановление двойных связей, гидроксилирование и др.), что приводит к потере биологической активности. Повышение гидрофильности достигается образованием парных соединений (глюкуронаты, сульфаты, фосфаты), которые выводятся с мочой.
Гормоны коры надпочечников. Кора надпочечников взрослого человека состоит из трех четко различимых слоев, или зон. Субкапсулярная зона называется клубочковой зоной; она связана с продукцией минералокортикоидов. Следующей идет пучковая зона; в ней, а также в сетчатой зоне вырабатываются глюкокортикоиды и андрогены. Из ткани коры надпочечников выделено и получено в кристаллическом виде около 50 стероидов. Большинство из них — промежуточные продукты; только немногие секретируются в значительном
количестве, и совсем малое число обладает определенной гормональной активностью. В целом наблюдается перекрывание их биологической активности; так, все природные глюкокортикоиды проявляют минералокортикоидный эффект и, наоборот, минералокортикоиды обладают глюкокортикоидной активностью.
Глюкокортикоиды — стероиды, состоящие из 21 углеродного атома. В основе строения — циклопентанпергидрофенантреновая структура, в 3-м и 20-м положении — кето(оксо)-группа, двойная связь в 4,5 положении. Основной глюкокортикоид человека — кортизол имеет дополнительно в 11 и 17 положениях гидроксигруппы; у грызунов — кортикостерон, имеет дополнительно в 11 положении гидроксигруппу. Кортизон дополнительно в 11 положении имеет оксогруппу, а в 17 положении — гидроксигруппу.
Глюкокортикоиды играют важную роль в адаптации к сильным и продолжительным стрессам.
Регуляция синтеза и секреции глюкокортикоидов осуществляется корти-колиберином гипоталамуса и кортикотропином гипофиза. В сутки синтезируется 20—25 мг кортизола. Существует циркадианный ритм выработки гормона. Увеличение синтеза происходит сразу после засыпания, Во врем» сна уровень кортизола продолжает возрастать, достигая пика вскоре после просыпания, затем постепенно падает до минимальных величин к концу дня в ранние вечерние часы.
Транспорт в крови. Кортизол в плазме крови находится в связанной с боками и свободной форме. Активно! является свободная форма гормона Основной связывающий белок плазмы
476
Гормональная регуляция энергетического обмена Глава 30
крови — а-глобулин — транскортин. Транскортин синтезируется в печени и синтез его стимулируется эстрогенами. Меньшее количество кортизола транспортируется альбуминами. Период полужизни кортизола 1,5 2 ч, у кортикостерона — < 1 часа (т. к. он слабее связывается с транспортными белками).
Метаболизм и экскреция. Метаболизм глюкокортикоидов, в основном, происходит в печени и включает восстанов-лениС двойных связей в первом кольце и 3-оксОгруппы. Восстановленные ме-таболиты\в печени подвергаются конъюгации с\глюкуроновой или серной кислотами, благодаря чему они становятся более гидрофильными и выводятся из организма. Около 70 % конъюгированных стероидов экскретируется с мочой, 20% — с калом, остальное — через кожу. Небольшое количество кортизола при отщеплении боковой цепи превращается в 17-кетостероиды.
Органы-мишени: печень, почки, лимфоидная ткань (селезенка, лимфоузлы, лимфоциты, тимус и др.), соединительная ткань (кости, подкожная клетчатка, жировая ткань), скелетные мышцы.
Влияние на обмен веществ. По механизму действия глюкокортикоиды относятся к гормонам, проникающим в клетку, и, следовательно, влияют на экспрессию генов и синтез определенных белков. Само название «глюкокортикоиды» обусловлено способностью стимулировать образование глюкозы. 1. Обмен углеводов. Глюкокортикоиды способствуют повышению концентрации глюкозы в крови по следующим механизмам: 1) стимулируют высвобождение аминокислот — субстратов глюконеогенеза — из периферических тканей (мышечная, лимфоидная) через активацию катаболических процессов; 2) увеличивают скорость глюконеогенеза в печени путем повышения количества (и активности) ключевых ферментов глюконео
генеза (пируваткарбоксилазы, фосфое-нолпируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы и глюкозо-6-фосфата-зы); 3) глюкокортикоиды тормозят потребление и использование глюкозы во внепеченочных тканях (мышцы). В результате увеличивается уровень глюкозы в плазме крови. У здоровых людей это влияние уравновешивается инсулином, оказывающим противоположный эффект; 4) глюкокортикоиды увеличивают запасы гликогена в печени путем увеличения активности гликогенсинтазы.
Регуляторное действие глюкокортикоидов, обеспечивающее длительное повышение концентрации глюкозы в крови, необходимо для питания клеток мозга при хроническом стрессе.
2. Обмен липидов. Глюкокортикоиды в мозговом веществе надпочечников индуцируют синтез метилтрансферазы, которая стимулирует образование адреналина из норадреналина и таким образом косвенно активируют липолиз в жировой ткани и увеличивают концентрацию свободных жирных кислот в крови. Избыточное количество глюкокортикоидов стимулирует липолиз в одних частях тела (конечности) и липо-генез — в других (лицо и туловище).
3. Обмен белков. Глюкокортикоиды в целом оказывают анаболическое действие на обмен белков в печени и почках и катаболическое — в других органах (мышцы, лимфоидная ткань, жировая ткань, кожа и кости). Механизм анаболического действия обусловлен активацией специфических генов и соответствующим возрастанием скорости биосинтеза специфических белков. Блокада синтеза белка в лимфоидной ткани и активный протеолиз в ней увеличивают фонд аминокислот, которые поступают в кровь. В печени и почках
477
Глава 30 Гормональная регуляция энергетического обмена
эти аминокислоты используются для биосинтеза белка.
4. Иммунная система. Глюкокортикоиды в высокой концентрации тормозят иммунологический ответ организма-хозяина. Они вызывают гибель лимфоцитов и инволюцию лимфоидной ткани, что полезно для подавления реакции отторжения при пересадке тканей.
5. Глюкокортикоиды обладают противовоспалительным действием. Механизм ^противовоспалительного действия обусловлен способностью подавлять синтез простагландинов через ингибирование фермента фосфолипазы Кроме того, глюкокортикоиды способствуют поступлению в костный мозг, лимфоидную ткань и селезенку лимфоцитов, моноцитов и эозинофилов и выходу полиморфноядерных лейкоцитов из костного мозга. Они тормозят накопление лейкоцитов в участках воспаления, но стимулируют высвобождение из лей
коцитов веществ, участвующих в воспалительных реакциях (кининов, плаз-миноген-акгивирующего фактора, простагландинов и гистамина). Сочетание указанных эффектов приводит к плохому заживлению ран, повышенной чувствительности к инфекции и снижению воспалительного ответа, что обычно наблюдается у людей с избытком глюкокортикоидов. В костной ткани глюкокортикоиды тормозят деление клеток и синтез коллагена. Продолжительное действие этих гормонов приводит к остеопорозу.
При длительном стрессе в крови обнаруживается повышенная концентрация глюкозы, аминокислот, жирных кислот, кетоновых тел, в моче — глюкозурия, кетонурия, аминоацидурия. Это состояние называется стероидным диабетом.
478
Регуляция анаболических процессов, связанных с ростом и морфогенезом
К этой группе гормонов относят соматотропин, тироидные гормоны и половые гормоны.
Соматотропин
Соматотропин (гормон роста, ГР) синтезируется в ацидофильных клетках гипофиза. По химической структуре — полипептид, состоящий из 191 аминокислоты, с молекулярной массой около 22 000 Да. Обладает видовой специфичностью.
Регуляция синтеза ГР осуществляется соматолиберином и соматостатином гипоталамуса.
На секрецию ГР влияет ряд стимулов: сон, стресс (боль, холод, тревога, хирургическое вмешательство), физические упражнения, острая гипогликемия или голодание, белковая пища или аминокислота аргинин. Реакции на стресс могут быть опосредованы катехоламинами, действующими через гипоталамус. Секреция ГР, как и многих гипофизарных . эрмонов, носит эпизодический, пульсирующий характер. В течение нескольких
минут уровень ГР в плазме может изменяться в 10 раз. Один из самых больших пиков отмечается вскоре после засыпания, что подтверждает поговорку: «Кто не спит, тот не растет».
Физиологические эффекты
ГР необходим для постнатального роста и нормализации углеводного, липидного, азотного и минерального обменов.
Различают прямое действие ГР (через образование цАМФ) и опосредованное через стимуляцию выработки инсулиноподобных факторов роста — IGF-1 и IGF-2.
Соматотропин как гормон белковой природы, после связывания с мембранным рецептором обеспечивает увеличение внутриклеточной концентрации цАМФ, а, следовательно, стимуляцию процессов мобилизации энергетических ресурсов организма (прямое действие).
479
Глава 31 Регуляция анаболических процессов
Ростовые эффекты ГР опосредуются главным образом через IGF-1 и IGF-2, которые синтезируются в печени. IGF-1 состоит из 70 аминокислот и по строению он сходен с проинсулином. Первоначально был известен как «сульфатирующий фактор», благодаря своей способности стимулировать включение сульфата в хрящ. Позднее его стали называть соматомедин С. В плазме крови обнаруживается еще один инсулиноподобный фактор — IGF-2 (пептид из 67 аминокислот), обладающий митогенной стимулирующей активностью. Содержание в плазме крови IGF-2 в два раз выше, чем IGF-1, но эффекты соматотропина тесно коррелируют с IGF-1. Некоторые авторы считают, что в печени образуются до 7 типов соматомединов, которые опосредуют действие соматотропина (А, В, С). К биологическим эффектам соматомединов в хрящевой ткани относятся стимуляция: 1) включения 3SSO4 в протеогликаны; 2) включения тимидина в ДНК; 3) синтеза РНК; 4) синтеза белков.
Метаболические эффекты
1. Обмен белков: 1) обладает анаболическим эффектом на метаболизм белков; 2) стимулирует транспорт аминокислот в мышечные ткани и усиливает биосинтез белка; 3) вызывает положительный азотистый баланс, что отражает общее повышение белкового синтеза и снижение содержания аминокислот и мочевины в плазме крови и моче. Это сопровождается повышением уровня синтеза РНК и ДНК. По эффекту на синтез белка гормон роста сходен с действием инсулина.
2. Обмен углеводов: 1) по влиянию на обмен углеводов является антагонистом инсулина; 2) снижает утилизацию глюкозы периферическими тканями, акти
вирует глюконеогенез, Что приводит к развитию гипергликемии; 3) может увеличивать содержание гликогена в печени в результате активации глюконеогенеза из аминокислот; 4) ингибирует гликолиз в мышцах, что связано с мобилизацией жирных кислот при липолизе. Поэтому при избыточной продукции ГР может развиваться сахарный диабет.
3. Обмен липидов: 1) активирует липолиз и повышает концентрацию свободных жирных кислот и глицерола в крови; 2) усиливает окисление жирных кислот в печени. При недостаточности инсулина (например, при диабете) может возрастать кетогенез.
4, Обмен минеральных веществ. ГР или. что более вероятно, IGF-1 способствует положительному балансу кальция, магния и фосфата и вызывает задержку Na+, К+ и СГ. Первый эффект, возможно, связан с действием ГР на кости: он стимулирует рост длинных костей в области эпифизарных пластинок у детей и акральный рост у взрослых. У детей ГР усиливает образование Хряща-S. Пролактиноподобные эффекты. ГР связывается с лактогенными рецепторами и обладает свойствами пролактина, в частности, способностью к стимуляции молочных желез и лактогенеза.
Нарушение синтеза ГР. Недостаточность ГР особенно опасна у детей, поскольку нарушает их способность к нормальному росту. При недостатке СТГ у детей (гипофизарная карликовость) отмечается нарушение роста, но сохранение нормальных пропорций и психического развития. Избыток ГР в детском возрасте приводит к развитию гигантизма. Избыточная секреция у взрослых — акромегалия. Акральный рост костей вызывает характерные изменения лица
480
Регуляция анаболических процессов Глава 31
(выступающая челюсть, огромный нос), увеличение размеров кистей, стоп и черепа. Другие симптомы включают разрастание внутренних органов, истончение кожи, метаболические расстройства (сахарный диабет).
Тироидные гормоны
Тироидные гормоны синтезируются в щитовидной железе. Основными тиро-идными гормонами являются 3, 5, 3', 5'-тетрайодтиронин (тироксин, Т4) и 3, 5, З'-трийодтиронин (Т3) (рис. 31.1).
481
Глава 31 Регуляция анаболических процессов
Биосинтез тироидных гормонов
Отличительная особенность тироидных гормонов состоит в том, что для их биологической активности требуется микроэлемент йод. Почти во всех регионах мира йод является следовым компонентом почвы и поэтому в малых количествах присутствует в пище. Более половины йода, содержащегося в организме, находится в щитовидной железе.
1. Синтез тироидных гормонов происходит в фолликулах щитовидной железы. Для синтеза гормонов необходим белок тироглобулин, который синтезируется в эпителиальных клетках щитовидной железы и хранится во внеклеточном коллоиде. Тироглобулин — гликозилированный белок с молекулярной массой около 660 000 Да. Каждая молекула тироглобулина содержит около 5500 остатков аминокислот, включая 140 остатков тирозина. Из этих 140 остатков только от 2 до 5 остатков тирозина превращается в Т3 или Т4.
2. Йод поступает в щитовидную железу против высокого электрохимического градиента активным транспортом. Процесс сопряжен с работой Na\ К4-АТФ-азы. Активный транспорт необходим, поскольку существует 500-кратный градиент йодида натрия снаружи и внутри фолликулярных клеток. Незначительное количество йода поступает в железу путем простой диффузии.
3. В фолликулярной клетке происходит окисление йодида в йодиниум (Г~-* Г) с помощью фермента йодпероксидазы с использованием перекиси водорода как кофактора. Щитовидная железа — единственная ткань, способная окислять йод.
Ряд соединений тормозит окисление йода и, следовательно, его включение в гормоны. Наибольшее значение имеют соединения тиомочевины (тиоурацил, метимазол и
др.), что используется для подавления биосинтеза гормонов щитовидной железы при ее гиперфункции. В последние годы показано, что избыточное введение йода может активировать свободнорадикальные процессы в щитовидной железе.
4, Окисленный йод реагирует с тирозильными остатками тироглобулина. Тирозин тироглобулина вначале йодируется в 3-м и 5-м положении и образуются моно- (МИТ) и дийодтирозилы (ДИТ). Конденсация 2-х молекул йодированного тирозина приводит к образованию Т3 и Т4 в составе тироглобулина. Образовавшиеся гормоны остаются в составе тироглобулина до начала его деградации.
Регуляция синтеза. Главными факторами, регулирующими выработку Т3 и Т4, является тиролиберин гипоталамуса и тиротропин гипофиза. Стимулом для повышенной секреции тиролиберина и тиротропина служит снижение содержания тироидных гормонов в крови. У маленьких детей стимулирующим фактором для синтеза тиролиберина является холод, поскольку известна роль тироидных гормонов в теплопродукции. Тиролиберин гипоталамуса стимулирует выделение тиротропина. Соматотропин ингибирует выделение тиротропина. Циркулирующие в крови Т3 и Т4 подавляют секрецию тиролиберина и тиротропина; Т4 подавляет синтез тироглобулина.
Тиротропин оказывает следующие эффекты: 1) стимулирует активный транспорт Г в полость фолликула за счет цАМФ-зависимого фосфорилирования белков клеточных мембран; 2) усиливает транскрипцию и трансляцию тироглобулина; 3) стимулирует рост эпителиальных клеток, формирующих фолликулы; в фолликулярном коллои-
482
Регуляция анаболических процессов Глава 31
де — йодирование тирозилов; 4) по аде-нилатциклазному механизму стимулирует синтез Т3, Т4 (аналогично действуют адреналин и ПГЕ2); 5) стимулирует секрецию йодированного тироглобулина путем пиноцитоза и отщепления Т3 и Т4.
Метаболизм тироидных гормонов
Преобладающей метаболически активной молекулярной формой гормона является Т3, поскольку он связывается с рецепторами клеток-мишеней со сродством, в 10 раз превышающим сродство Т4. Основное количество тироидных гормонов секретируется в виде Т4. Около 80 % циркулирующего Т4 превращается на периферии (в основном, в печени и почках) в Т3 или реверсивный Т3, и этот процесс служит главным источником Т3. Реверсивный Т3 представляет собой очень слабый агонист гормона.
Другие пути метаболизма тироидных гормонов включают дейодирование, дезаминирование или декарбоксилирование. Образование конъюгатов с глюкуроновой кислотой или сульфатом приводит к формирования гидрофильных молекул, которые выводятся с мочой.
Транспорт тироидных гормонов
Тироидные гормоны липофильны, поэтому 99 % гормона циркулирует в крови в комплексе с белками. Основные переносчики тироидных гормонов — тироксин-связывающий глобулин (ТСГ) — гликопротеин и тироксин-связываю-щий преальбумин. ТСГ синтезируется в печени. Белки-переносчики позволяют создать резерв гормона в организме, освобождение которого происходит в тканях-мишенях.
Биологическая активность тироидных гормонов обусловливается небольшой несвязанной (свободной) фракцией.
Период полужизни Т4 7 дней, Т3— 16 часов.
Механизм действия
Йодтиронины действуют на многие ткани организма, хотя наиболее чувствительны печень, сердце, почки, скелетные мышцы; в меньшей степени жировая и нервная ткани. В клетках-мишенях предполагают наличие цитозольных, митохондриальных и ядерных рецепторов (не исключены и мембранные рецепторы).
Последовательность проявления гормонального эффекта:
1. Т4 отщепляется от транспортных белков плазмы и переносится внутрь клетки. В случае связывания с мембранным рецептором усиливается поступление аминокислот в клетку.
2. На мембранах эндоплазматического ретикулума Т4 дейодируется в Т3.
3. Т3 связывается с хроматиновым рецептором (его сродство к рецептору в 100—1000 раз выше, чем у Т4).
4. Результатом связывания Т3 с хроматиновым рецептором является повышение активности РНК-полимеразы, синтеза мРНК и трансляция более 100 типов белков. В эмбриогенезе усиливается синтез специфических белков, обеспечивающих развитие и дифференцировку тканей.
Влияние на метаболизм
1. Основная метаболическая функция тироидных гормонов — стимуляция метаболической активности и повышение потребления кислорода в большинстве
483
Глава 31 Регуляция анаболических процессов
тканей (исключение мозг, легкие, семенники и сетчатка). Согласно гипотезе Эдельмана и соавторов, большая часть энергии клетки утилизируется при работе Ыа+,К*-АТФазного насоса. Тироидные гормоны повышают функцию этого насоса и увеличивают число единиц АТФазы. Повышение утилизации АТФ ассоциируется с повышением потребления кислорода через механизмы окислительного фосфорилирования. Повышенный обмен АТФ (образование и использование) определяет те плопродукцию.
2. Обмен белков. Тироидные гормоны действуют как анаболические гормоны, вызывают положительный азотистый баланс и обеспечивают рост и развитие. Однако, высокая концентрация Т3 ингибирует синтез белков и вызывает отрицательный азотистый баланс. Проявления действия йодтиронинов в норме: 1) на уровне клетки — пролиферация, рост, дифференцировка; 2) на уровне организма — нормальный рост и правильное развитие тканей, органов. Следует учитывать взаимоотношения тироидных гормонов и соматотропина. Т3 и глюкокортикоиды повышают транскрипцию гена соматотропина, что приводит к усиленной продукции гормона роста.
3. Обмен углеводов. Тироидные гормоны способствуют всасыванию глюкозы, активируют глюконеогенез и гликогенолиз, повышая уровень глюкозы в крови.
4. Обмен липидов. Тироидные гормоны активируют обмен и окисление липидов.
Нарушения функции щитовидной железы.
1. Гипофункция щитовидной железы в детском возрасте — кретинизм (снижение и замедление метаболизма, физического и умственного развития).
2. Гипофункция щитовидной железы в зрелом возрасте — микседема (нарушение водно-солевого, липидного обменов на фоне замедления метаболизма — ожирение и отеки). -
3. Недостаточность йода в воде и растениях в регионах — эндемический зоб (увеличение щитовидной железы преимущественно за счет разрастания соединительной ткани).
4. Радиационно-индуцированные поражения щитовидной железы преимущественно у детей (воздействие в первые две недели после аварии на Чернобыльской АЭС) — чаще гипотироидные состояния (уменьшение Т3), но возможны гипертироидные состояния, гиперплазии и рак (в Беларуси зарегистрировано более 700 случаев).
5. Повышение функции щитовидной железы — тиротоксикоз, Базедова болезнь. Избыток Т3 ингибирует синтез белков, вызывает отрицательный азотистый баланс, мобилизацию липидов, углеводов; усилена теплопродукция.
Мужские половые гормоны
Testes продуцируют тестостерон и сперматозоиды. Для этого требуются три типа клеток: сперматогонии (из них образуются сперматозоиды), клетки Лейдига (продуцируют тестостерон) и клетки Сертоли (создают условия для дифференцировки и созревания половых клеток). Тестикулярные андрогены синтезируются клетками Лейдига из холестерола.
484
Регуляция анаболических процессов Глава 31
Лимитирующей стадией синтеза всех стероидных гормонов в коре надпочечников и гонадах является стадия ферментативного освобождения холестерола из эфиров холестерола (холестеролэстераза) и расщепления боковой цепи (переход С-27-стероида в С-21-стероид) до прегненолона.
Эти стадии регулируются кортикотропином, лютропином и ангиотензином И; в гонадах эффективнее лютропин. Превращение прегненолона в тестостерон в микросомах требует 5 ферментативных систем: 3-р-гидроксистероид дегидрогеназа, Д-5,4-изомераза, 17-а-гидроксилаза, С-17-20-лиаза,17-р-гидроксистероид дегидрогеназа. При этом возможны 2 пути: Д4-путь через прогестерон (предпочтителен для testes человека) и Д5-путь через дегидроэпиандростерон. Лимитирующей стадией синтеза тестостерона является З-р-гидроксисте-роиддегидрогеназа. Ежесуточно в testes синтезируется 5 мг тестостерона. Содержание тестостерона в плазме крови мужчин составляет 7,3 мкг/л, что в 20 раз выше, чем у женщин — 0,37 мкг/л.
Регуляция синтеза мужских половых гормонов и мужских половых клеток. Лютропин стимулирует стероидогенез и продукцию тестостерона после связывания с рецепторами на плазматической мембране клеток Лейдига (аналогичные рецепторы найдены в яичниках на клетках желтого тела) по аденилатциклазному механизму. При этом стимулируется ферментативное расщепление боковой цепи холестерола (Сг7-*С21). Аналогично действует кортикотропин в коре надпочечников. Тестостерон по механизмам обратной связи тормозит продукцию и освобождение гонадолиберинов.
Регуляция сперматогенеза: фол-литропин связывается с клетками Сертоли
и усиливает синтез андроген-связываю-щего белка (это гликопротеин, связывающий тестостерон). Андроген-связываю-щий белок транспортирует тестостерон, образованный клетками Лейдига в очень высокой концентрации, к месту сперматогенеза. Это ключевая стадия, необходимая для сперматогенеза в норме. Отсюда следует, что воздействуя на содержание тестостерона в кровотоке, нельзя поддержать ослабевающий сперматогенез. Необходима высокая местная концентрация тестостерона в testes. Тестостерон транспортируется в плазме с помощью тестостерон-эстрадиол-связывающего глобулина (секс-гормонсвязывающий глобулин), который синтезируется в печени. Синтез стимулируется эстрогенами, поэтому содержание секс-гормонсвязывающего глобулина у женщин в два раза выше, чем у мужчин. Синтез этого глобулина уменьшается с возрастом, при гипотиреозе и вве-дении андрогенов. Большая часть циркулирующего в крови тестостерона (97-99 %) связана с секс-гормонсвязывающим глобулином; 1—3 % — активная свободная форма гормона.
Метаболизм тестостерона в тканях. 1. Окисление в 17-положении и образование 17-кетосгероцдов (андростерон, эгиохоланолон, эпиандростерон), при этом 30 % 17-кетостероидов семенникового происхождения и 70 % (андростендион, дегидроэпиандростерон) надпочечникового.
2. В печени 17-кетостероиды образуют конъюгаты с глюкуроновой кислотой и серной кислотой и выделяются с мочой, желчью и калом. Уровень 17-кетостероидов в моче является интегральным показателем секреции стероидных гормонов.
3. Восстановление двойной связи в кольце А и оксогруппы в 3-м положении происходит преимущественно в тканях-мишенях и ведет к образованию
485
Глава 31 Регуляция анаболических процессов
потенциальных метаболитов дигидротестостерона.
Ткани, чувствительные к тестостерону — эмбриональный Вольфов проток, сперматогонии, мышцы, кости, почки, мозг. Классические клетки-мишени — простата, семенные пузырьки, внешние гениталии, кожа гениталий — содержат высокую активность фермента 5а-редуктазы, который катализирует образование активной формы андрогенов —
дигидротестостерона (до 400 мкг в сутки). В плазме крови содержание дигидротестостерона составляет 10 % от уровня тестостерона (рис. 31.2).
Андрогены (тестостерон и дигидротестостерон) участвуют в процессах: 1) сексуальной дифференцировки; 2) сперматогенезе; 3) развитии вторичных половых признаков; 4) регуляции генов и стимуляции анаболических процессов; 5) определении психофизического статуса мужчины.
Андрогены — это проникающие гормоны и действуют по схеме:
1. Свободный тестостерон проникает через плазматическую мембрану пассив
ной или облегченной диффузией. Клетки-мишени удерживают гормон благодаря связи со специфическими внутриклеточными рецепторами.
2. В ряде клеток с помощью 5а-редуктазы тестостерон превращается в дигидротестостерон. Его сродство к внутриклеточным рецепторам выше, чем у тестостерона.
3. Гормон-рецепторный комплекс проникает в ядро и связывается с хроматином в области андроген-чув-ствительного элемента ДНК.
4. Тестостерон/дигидротестостерон-рецепторный комплекс активирует специфические гены, что обеспечивает синтез ряда белков, опосредующих практически все эффекты андрогенов. Например, тестостерон стимулирует синтез белков в мужских половых органах (андроген-связывающий глобулин), увеличивает размеры почек и синтез многих ферментов, стимулирует репликацию ДНК в клетках-мишенях.
Андрогены оказывают сложное влияние на рост. Рост в отрочестве связан с косвенным влиянием их через стимуляцию секреции соматотропина. Но
486
Регуляция анаболических процессов Глава 31
чрезмерная андрогенизация в периоде полового созревания может привести к раннему заращению эпифизарных зон роста и остановке роста.
Нарушения андрогенной функции: отмечают при отсутствии синтеза х тестостерона— гипогонадизм. Гипогонадизм до полового созревания нарушает развитие вторичных половых признаков, а после полового созревания ведет к их регрессии. Первичный гипогонадизм связан с нарушением процессов в самих testes. Вторичный гипогонадизм связан с дефектом секреции гонадотропинов.
Известны следующие врожденные дефекты: 1) дефекты 5 ферментов, ведущих к образованию тестостерона; 2) дефицит 5-а-редуктазы; 3) дефекты синтеза рецепторов к тестостерону и дигидротестостерону.
Анаболические эффекты андрогенов использованы при создании анаболических стероидов 19-нор-ряда, т. е. лишенных метильной группы в 10-м положении (19-го углеродного атома): отношение анаболические эффекты/ андрогенные эффекты для тестостерона
1 : 1, а для анаболических стероидов 20:1. Длительное пероральное применение их может вызвать поражение печени, опухоли и проблемы в сексуальной функции.
Женские половые гормоны
Яичники —• бифункциональные органы, продуцирующие женские половые гормоны — эстрогены и прогестины, а также женские половые клетки — яйцеклетки. Наиболее активные гормоны, вырабатываемые в яичниках — эстрадиол и прогестерон (рис. 31.3).
Общая схема образования женских половых гормонов представлена на рисунке 31.4.
Синтез гормонов. Эстрогены образуются путем ароматизации андрогенов. В синтезе участвуют 2 типа клеток — в клетках теки происходит синтез тестостерона, а в клетках гранулезы — происходит ароматизация тестостерона и образование эстрадиола. Прогестерон синтезируется желтым телом. Синтез гормонов осуществляется в рамках полового цикла.
\ Фолликулярная фаза. В конце мен-струации концентрация эстрогенов низкая. По механизму обратной связи происходит увеличение секреции ФСГ и ЛГ. Это ведет к росту группы фолликулов, продуцирующих эстрогены. Под влиянием ФСГ начинает увеличиваться один из фолликулов, остальные атрофируются. В первую неделю фолликулярной фазы содержание эстрадиола остается низкими, но по мере увеличения фолликула начинает прогрессивно повышаться. За 24 ч до пика ЛГ (ФСГ) уровень эстрогенов достигает максимума и сенсибилизирует гипофиз к действию
487
Глава 31 Регуляция анаболических процессов
488
Регуляция анаболических процессов Глава 31
гонадолиберинов. Выброс ЛГ обуславливается либо этим высоким уровнем эстрогенов по механизму положительной обратной связи, либо резким падением его уровня. Содержание прогестерона в фолликулярной фазе очень низкое. Лютеиновая фаза. После овуляции на месте лопнувшего фолликула образуется желтое тело — структура, которая начинает вырабатывать прогестерон и незначительное количество эстрогенов. Прогестерон необходим для формирования секреторного эндометрия, обеспечивающего необходимые условия для развития имплантированной яйцеклетки. На первых порах сохранение желтого тела требует присутствия ЛГ и гипофиз в течение примерно 10 дней выделяет этот гормон. Если имплантация произошла — функцию ЛГ берет на себя хорионический гонадотропин (ХГТ) — плацентарный гормон, очень близкий к ЛГ, вырабатываемый цитотрофобластными клетками имплантированного эмбриона на ранних стадиях развития. ХГТ поддерживает синтез прогестерона желтым телом до тех пор, пока плацента не начнет продуцировать большие количества прогестерона.
Секреция и транспорт гормонов. Уровень секреции гормонов яичников меняется в зависимости от менструального цикла и зависит от скорости образования их в яичниках. Эти гормоны не накапливаются, а секретируются по мере их синтеза.
Эстрогены транспортируются секс-гормонсвязывающим глобулином, прогестины — кортикостероидсвя-зывающим глобулином.
Биологической активностью обладают свободные формы гормона.
Связывающие белки обеспечивают резерв гормона в крови. Скорость метаболизма гормонов находится в обратной зависимости от сродства к белкам-переносчикам. Клиренс эстрона выше клиренса эстрадиола.
Метаболизм и экскреция. В печени эстрадиол и эстрон превращаются в эстриол. С помощью ферментативных систем происходит превращение эстрогенов в конъюгаты с глюкуроновой и серной кислотами. Конъюгированные стероиды выводятся с желчью, калом и, в меньшей степени, с мочой. Процесс метаболизма происходит очень быстро. Поэтому пероральное применение эстрогенов неэффективно.
Прогестерон в печени активно метаболизируется, образуя ряд соединений. Прегнандиол-20-глюкуронид натрия — основной метаболит прогестинов, обнаруживаемый в моче человека.
Некоторые синтетические стероиды обладают активностью прогестинов и не подвергаются в печени никаким превращениям. Поэтому они широко используются в качестве пероральных контрацептивов.
Механизм действия. Основные эффекты эстрогенов и прогестинов обусловлены их способностью присоединяться к внутриклеточным рецепторам. Образующийся гормон-рецепторный комплекс связывается со специфическими участками хроматина или ДНК, что приводит к изменению скорости транскрипции специфических генов.
Физиологические и биохимические функции эстрогенов. Основная функция яичниковых гормонов — подготовка
489
Глава 31 Регуляция анаболических процессов
структурных компонентов женской половой системы к размножению.
1. Влияние на репродуктивную систему: а) развитие органов половой сферы; б) формирование вторичных половых признаков; в) процессы в фоликулино-вую фазу цикла; г) психофизический статус женщины; д) протекание беременности, родов, лактации.
2. Биохимические функции: а) повышают липогенез в жировой ткани и поэтому содержание жиров в организме женщин на 5 % больше, чем мужчин; б) снижают уровень холестерола и ЛПНП в плазме крови и повышают уровень ЛПВП; в) в печени усиливают синтез ряда специфических белков: белков-переносчиков стероидных и тироидных гормонов, факторов свертывания крови II, VII, IX, X, субстрата ренина — анги-отензиногена, ЛПВП, ЛПОНП; г) для эстрогенов характерен анаболический эффект и положительный азотистый баланс; д) эстрогены активируют гликолиз, пентозофосфатный путь (восстановительные синтезы); е) способствуют кальцификации и росту костей; ж) оказывают тормозящее действие на Na+, К+-АТФазу, что вызывает деполяризацию мембран миометрия, повышение его возбудимости и сократимости.
Эстрогены и прогестерон как бы дополняют регуляторные эффекты друг друга на обмен веществ, рост, развитие тканей и органов. Как правило, эффекты прогестерона возможны на фоне
предварительного действия на ткани эстрогенов. Механизм действия этих проникающих в клетку гормонов связан с усилением матричных синтезов белков.
Функции прогестерона. Прогестерон действует только в период функционирования желтого тела и обеспечивает: 1) торможение сокращения матки и труб; 2) подготовку и имплантацию оплодотворенной яйцеклетки; 3) лактацию; 4) снижение возбудимости гиппокампа, центра терморегуляции и сексуальной реактивности.
Пролиферативные заболевания женской репродуктивной системы являются гормональнозависимыми. Основную роль играют не сами эстрогены, на долю которых приходится 10-15 % от всех эстрогеновых производных, а метаболиты эстрогенов (85-90 %). 2-Гидрокси-эстрон (2-ОНЕ) обладает антипро-лиферативным эффектом, а 16а-гидроксиэстрон (16-ОНЕ) поддерживает пролиферацию. Соотношение 2-ОНЕ/16а-ОНЕ менее 2 рассматривается как биомаркер риска рака молочной железы.
Сводные данные о гормонах
(таблица 31.1)
490
Регуляция анаболических процессов Глава 31
Таблица 31.1. Гормон продуцирующие структуры и гормоны
Железа Гормонпродуци-рующие клетки Гормон Функции
Классические эндокринные железы
Г ипоталамус Крупноклеточные ядра переднего гипоталамуса Вазопрессин, окситоцин Регуляция функций аденогипофиза
Мелкоклеточные ядра Либерины, статины Кортиколиберин (АКТГ-РГ) Урокортин Гонадолиберины (ЛГ/ФСГ-РГ) Тиролиберин (ТТГ-РГ) Соматолиберин (РГ гормона роста) П рол актол ибери н (РГ пролактина) Пептид, активирующий аденилатциклазу гипофиза — РАСАР Соматостатин (СТГ-ингибирующий фактор) Дофамин Вазоактивный интестинальный пептид — VIP Нейромедиаторы, нейромодуляторы Стимуляция биосинтеза и секреции АКТГ Стимуляция секреции гонадотропинов Повышение секреции ТТГ и пролактина Стимуляция секреции СТГ Стимуляция секреции пролактина Воспроизведение эффектов либеринов Торможение секреции гормона роста и пролактина Главный пролактостатин Рилизинг-эффекты
Г ипофиз Задняя доля Окситоцин Вазопрессин Хранение и высвобождение нейрогормонов Стимуляция родового акта, отделения молока, эякуляции Увеличение захвата воды из первичной мочи, вазоконстрикторное и гипергликемическое действие
Средняя доля гипофиза (у человека клетки передней части задней доли гипофиза) а-, р- и у-меланостимулирую-щие гормоны Регуляция пигментного обмена
Передняя доля гипофиза:
491
Глава 31 Регуляция анаболических процессов
Продолжение табл. 31.1.
Железа Гсрмонпродуци* рующие клетки Гормон Функции
Базофильные кортикотрофы Адренокортикотропный гормон (АКТГ) Фактор, ингибирующий подвижность макрофагов Стимуляция секреции глюкокортикоидов корой надпочечников Провоспалительный цитокин, физиологический антагонист действия глюкокортикоидов на иммунные процессы
Базофильные гонадотрофы Лютеинизирующий гормон (ЛГ) Фолликулостимулирующий гормон (ФСГ) Стимуляция секреции гормонов гонадами, индуктор овуляции Сенсибилизация гормонпродуцирующих клеток гонад к действию ЛГ; стимуляция гаметогенеза
Базофильные тиротрофы Тиротропный гормон (тиротропин, ТТГ) Стимуляция образования тироидных гормонов в щитовидной железе
Ацидофильные соматотрофы Гормон роста (соматотропный гормон, СТГ, ГР) Прямое и опосредованное IGF-1 ростовое и анаболическое действие
Ацидофильные лактотрофы Пролактин Стимуляция образования молока, регуляция функции гонад, водносолевого обмена, иммунных процессов
Эпифиз Мелатонин Пигментный обмен, регуляция циркадных ритмов и размножения
Яичники Клетки теки Тестостерон, андростендион Стимуляция репродуктивного тракта и полового поведения в фоликулиновую фазу цикла
Клетки зернистой оболочки Эстрадиол, эстрон, эстриол (из андрогенов клеток теки) Ингибин, активин АМН (мюллеров ингибирующий фактор) Определяют возможность овуляции, подготавливают репродуктивный тракт к коитусу и последующей беременности Формирование обратной связи в системе «Гонады-гипофиз»; паракринная регуляция Паракринная регуляция !
i
492
Регуляция анаболических процессов Глава 31
Продолжение табл. 31.1.
Железа Гормонпродуци-рующие клетки Гормон Функции
Желтое тело Эстрогены Прогестины Окситоцин Релаксин Сенсибилизируют ткани к действию прогестинов Возможность имплантации трофобласта и поддержка беременности Участие в терминации лютеиновой фазы цикла, а при беременности — в инициации родовой деятельности Подготовка родовых путей к продвижению плода при родах
Семенники Клетки Лейдига Андрогены Поддержание репродуктивного тракта, стимуляция сперматогенеза и полового поведения
Клетки Сертоли Эстрогены, активин, ингибин АМН (мюллеров ингибирующий фактор) Паракринные регуляторы, а также формирование обратной связи в системе «семенники-гипофиз» Определение в эмбриогенезе генетически мужского организма, дегенерация парамеэонефрического (мюллерова) протока, служащего в женском организме зачатком фаллопиевых труб, матки и верхней части влагалища
Кора надпочечников Наружная клубочковая зона Альдостерон Кортикостерон Минералокортикоид. Стимуляция захвата из первичной мочи ионов натрия и выведения с мочой ионов калия, регуляция кислотноосновного равновесия и ионного состава клеток Глюкокортикоид
Средняя пучковая зона Кортикостерон, кортизол Глюкокортикоиды. Регуляция углеводного, белкового и липидного обмена, опосредование ответов организма на стресс
493
Глава 31 Регуляция анаболических процессов
Продолжение табл. 31.1.
Железа Гормонпродуци-рующие клетки Гормон Функции
Внутренняя сетчатая зона Гидрокортизон Неактивные андрогены (ди гид роэ пиандро-стерон) Глюкокортикоид Могут быть пред шествен никами активных андрогенов, а у плода — предшественниками значительной доли эстрогенов матери
Мозговое вещество надпочечников Хромаффинные клетки Норадреналин, адреналин Адреномедуллин Регуляция углеводного и липидного обмена, деятельности сердечнососудистой системы, терморегуляции; посредники реакции организма на стрессорные воздействия Мощное сосудорасширяющее действие
Щитовидная железа Фолликулярные клетки Тироксин, трийодтиронин Стимуляция энергетического обмена, клеточной дифференцировки и процессов роста
Парафолликулярные С-клетки Кальцитонин Снижение уровня кальция в крови
Паращитовидные железы Паратгормон Повышение уровня кальция в крови и стимуляция выведения фосфатов с мочой
Поджелудочная железа а-клетки островков Лангерганса Глюкагон Регуляция углеводного и липидного обменов по пути мобилизации резервных молекул
р-клетки островков Лангерганса Инсулин Единственный гормон, снижающий уровень глюкозы в крови; стимуляция анаболических и ростовых процессов
D-клетки Соматостатин Панкреогастрин Секретин Паракринная регуляция а- и р-клеток Стимуляция секреции кислоты в желудке Стимуляция выделения богатого бикарбонатами секрета поджелудочной железы в кишечник
494
Регуляция анаболических процессов Глава 31
Продолжение табл. 31.1.
Железа Гор монп редуцирующие клетки Гормон Функции
Другие источники гормонов (биорегуляторов, выделяемых в кровь)
Тимус Тимол оэтины, тимопентин, тимозины Паракринная регуляция иммунных процессов
Почки Кальцитриол Г иперкальциемический фактор, стимуляция реабсорбции кальция и фосфатов из первичной мочи
Юкстагломерулярный аппарат Ренин Катализирует образование ангиотензина I
Белый жир Адипоциты Лептин Негативный контроль потребления пищи и стимуляция энергообмена
Резистин, адипонектин Регуляция чувствительности тканей к инсулину
Печень Г епатоциты Инсулиноподобный фактор 1 Анаболическое и ростовое действие на ткани, посредник эффектов гормона роста
Ангиотензиноген Предшественник ангиотензина I
Т ранс-ретиноевые кислоты Гормонально активные формы ретинола, стимуляция роста и дифференцировки клеток
Предсердия и желудочек сердца Натрийуретические пептиды (предсердный — ANP и мозговой — BNP) Стимуляция выведения ионов натрия с мочой и гипотензивное действие
Эндотелий сосудов Натриуретический пептид С (CNP) Стимуляция выведения ионов натрия с мочой
Эндотелины Вазоконстрикторное действие
Ангиотензин II Вазоконстрикторное действие, стимуляция секреции альдостерона корой надпочечников
Желудочно-кишечный Желудок Гастрин Стимуляция желудочной секреции
тракт Тонкий кишечник Глюкагон (глюкагоноподобный пептид, энтероглюкагон, глицентин) Регуляция обмена углеводов
Холецистокинин Активация желчеотделения
495
Глава 31 Регуляция анаболических процессов
Окончание табл. 31.1.
Железа Гормонп редуцирующие клетки Гормон Функции
Г астроингибирующий пептид (ГИП) Вазоактивный интестинальный пептид (VIP) Мотилин Торможение желудочной секреции Регуляция кровотока в пищеварительном тракте и секреции инсулина Стимуляция перистальтики кишечника
Матка Плацента Простагландины Прогестины, эстрогены Хорионический гонадотропин — ХГТ Гормон роста 2, хорионические соматомаммотропины (ХСМ, плацентарные лактогены) Кортиколиберин, АКТГ Релаксин Паракринная регуляция Стимулирует секрецию эстрогенов и прогестинов, гомолог ЯГ Обеспечение роста плода и поддержание функции желтого тела Участие в инициации родов Подготовка родовых путей к прохождению плода
496
Глава 32
Регуляция обмена воды и минеральных веществ
Минеральные вещества делятся на макро- и микроэлементы. Макроэлементы содержатся в организме в граммах и суточная потребность их составляет >100 мг, К ним относятся калий (К), натрий (Na), кальций (Са), магний (Mg), хлор (С1), фосфор (Р), сера (S). Микроэлементы содержатся в организме в миллиграммах и микрограммах. Суточная потребность составляет менее 100 мг. К ним относятся Fe, Zn, Си, Вт, Мп, Со, Al, I и др.
Функции минеральных веществ
1. Создание осмотического давления в тканях,
2. Образование буферных систем и поддержание pH.
3. Образование комплексных соединений с белками, нуклеиновыми кислотами, что приводит к изменению их конформации и физиологических свойств.
4. Компоненты некоторых биологически важных соединений (Hb — Fe, ти
роксин — I, инсулин — Zn, витамин В12 - Со);
5. Участие в ферментативном катализе: могут являться кофакторами (Mg, Мп, Си, Zn, К), входить в состав ферментов (Со, Mo, Se), фермент-субстратных комплексов или служить эффекторами.
Кальций
Кальций является наиболее распространенным минеральным веществом организма. Содержание кальция в организме составляет I—1,5 кг. Кальций — это внеклеточный катион: в плазме крови содержание кальция — 2—2,8 ммоль/л. 99 % кальция локализовано в костях и зубах, где вместе с фосфатом он образует кристаллы гидроксиапатита, составляющие структурный компонент скелета. Остеобласты — клетки, отвечающие за формирование костной ткани, остеокласты — за деминерализацию. Большая часть кальция кости не может свободно обмениваться с кальцием внеклеточной жидкости. Около 1 % кальция скелета составляет легкообме-
Зак. 2124
497
Глава 32 Регуляция обмена волы и минеральных веществ
нивающийся фонд, еще 1 % находится в периостальном пространстве (надкостнице), и эти два источника образуют мобильную фракцию Са2+.
Функции кальция: 1) построение костной ткани; 2) мышечное сокращение; 3) свертывание крови; 4) передача нервного импульса; 5) активатор ферментов; 6) внутриклеточный посредник в действии гормонов; 7) поддержание целостности мембран и транспорт через мембраны; 8) высвобождение гормонов; 9) секреторные процессы (экзоцитоз, эндоцитоз); 10) межклеточное взаимодействие.
Суточная потребность — 800 мг, женщины во время беременности и лактации — 1,5 г. Источники — молоко, молочные продукты, бобовые, рыба, яйца, капуста, зеленые части овощей.
В крови Са2+ присутствует в трех формах; 1) в комплексе с органическими и неорганическими кислотами; 2) в связанной с белками форме и 3) в ионизированном виде. В комплексы с цитратом, фосфатом и другими анионами вовлечено около 6 % общего кальция. Остальное количество Са2+ распределяется почти поровну между связанной с белками и ионизированной (несвязанной) формой. При падении концентрации альбуминов на 10 г/л содержание кальция падает на 8 мг/л.
Ионизированный кальций (Са2+), концентрация которого у большинства млекопитающих, птиц и пресноводных рыб поддерживается в пределах 1,1-1,3 ммоль/л, — это биологически активная фракция.
Организм обладает очень малой толерантностью к значительным отклонениям уровня Са2+ от указанных границ. В случае снижения уровня кальция у животных нарастают явления повышенной возбудимости (вплоть до возникно
вения тетанических судорог). Заметное повышение концентрации ионизированного кальция в плазме может привести к смерти из-за паралича мышц и комы.
Ион Са2+ и парный ему ион фосфата присутствуют в плазме крови в концентрациях, близких к пределу растворимости их соли. Поэтому связывание Са2+ с белками предупреждает возможность образования осадка и эктопической кальцификации. При изменении концентрации белков плазмы (альбуминов) изменяется уровень общего Са2+ в плазме крови.
Экскреция: Ca2F выводится из организма через почки (100 мг/сутки) и кишечник (слюна, желудочный сок. секрет поджелудочной железы, желчь) — около 750 мг/сутки. После 35 лет суммарная экскреция кальция из организма человека возрастает.
Фосфор
Содержание фосфора в организме около 1 кг. Более 80 % фосфора находится в комплексе с ионами Са2+ в костях и зубах, около 10% — в мышцах и крови в комплексе с белками, липидами и углеводами, остальные 10% — в составе других органических компонентах.
Функции: 1) компонент костей; 21» образование важнейших органических соединений (АТФ, ГТФ, креатинфосфат, фосфолипиды, фосфопротеины. нуклеиновые кислоты, коферменты — НАДФ+, пиридоксальфосфат и др.): Зчн участие в регуляции активности молекул путем фосфорилирования-дефосфорилирования; 4) образование фосфатной буферной системы.
Суточная потребность определяется поступлением кальция. Оптимальное i соотношение Са:Р-1:1 (т. е. по 800 иг i день) у взрослых и 2:1 у детей. |
498
Регуляция обмена воды и минеральных веществ Глава 32
Источники: молоко, злаки, зеленые части овощей, яйца, мясо.
Всасывание фосфора происходит в тонком кишечнике. Всасывание кальция и фосфора оптимально, если их соотношение в пище 1: 2—2 : 1.
В сыворотке крови фосфат существует в виде свободного иона (40 %), в виде комплексов с катионами Са2+, Mg2+, Na+, К+ (50 %), около 10 % связано с белками. Содержание фосфатов в клетках крови превышает их содержание в плазме в 30—40 раз. Концентрация органического фосфата в клетке выше, чем неорганического, почти в 100 раз. В плазме крови преобладает неорганический фосфат, который, поступая в клетки, используется для реакций фосфорилирования различных органических молекул. Показано, например, что поступление повышенного количества глюкозы в клетки сопровождается снижением содержания неорганического фосфата в плазме крови.
Экскреция: фосфор выводится из организма с мочой (64,4 %) и калом (35,6 %). Ничтожно малое количество фосфата экскретируется с потом. В извитых канальцах почек реабсорбируется до 90 % фосфора. Реабсорбция фосфора зависит от реабсорбции натрия. Усиление экскреции натрия с мочой сопровождается повышением экскреции фосфора. В составе мочи преобладают однозамещенные фосфаты (NaH2PO4), а в плазме крови — двузамещенные (Na2HPO4). В моче соотношение NaH2PO4/Na2HPO4 равно 50 : 1, а в плазме крови 1:4.
Регуляция обмена кальция и фосфора
В механизм, поддерживающий концентрацию кальция, вовлечены 3 гормона: паратгормон, кальцитриол и кальцитонин, которые действуют на три органа — кости, почки и кишечник.
Паратгормон — пептид, состоящий из 84 аминокислот (м. м. 9500 Да). Синтезируется в паращитовидных железах. Синтез и секреция ПТГ увеличивается при снижении концентрации Са2+ в крови. В паращитовидных железах мало накопительных гранул и количество гормона в них может обеспечить максимальную секрецию лишь в течение 1,5 ч. Концентрация гормона в крови подвержена суточным ритмам. Около 2 часов дня отмечается увеличение концентрации гормона в крови на 50 %, в 9 часов вечера отмечается снижение на 50 % концентрации гормона в крови.
Механизм действия. Паратгормон — гормон, не проникающий в клетку. В тканях-мишенях гормон связывается с рецепторами на поверхности мембран, что приводит к активации аденилатцик-лазы и увеличению концентрации цАМФ и фосфолипазы С (продукция 1Р3) с последующей мобилизацией кальция из внутриклеточного депо.
Различают 3 органа-мишени: кости, почки и кишечник.
В костной ткани паратгормон стимулирует остеокласты и усиливает деструкцию кости, сопровождающуюся высвобождением кальция, фосфора и органического матрикса.
В почках ПТГ оказывает прямое влияние на реабсорбцию ионов и опосредованное через стимуляцию образования активной формы витамина D — каль-цитриола. В нормальных условиях свыше 90 % Са2*, содержащегося в клубочковом фильтрате, подвергается реабсорбции. Паратгормон увеличивает эту величину до 98 % и более. Паратгормон тормозит реабсорбцию фосфора и транспорт натрия, калия и бикарбонатов.
ПТГ не оказывает прямого влияния на слизистую кишечника, но стимулирует всасывание Са2+ через образование активной формы витамина D в почках.
499
Глава 32 Регуляция обмена воды и минеральных веществ
Конечный эффект действия паратгормона — повышение концентрации Са2+ в крови.
Кальцитриол •— активная форма витамина D. Образуется из 7-дигидрохо-лестерола в коже или поступает с пищей. В печени подвергается гидроксилированию с образованием 25-гидроксихолекальциферола, а затем в почках по 1-му углеродному атому с образованием 1,25 дигидроксихолекальци-ферола или калъцитриола.
Основная биологическая роль каль-цитриола — стимуляция всасывания кальция и фосфата в кишечнике. Каль-цитриол — единственная сигнальная молекула, способствующая транспорту кальция против концентрационного градиента, существующего на мембране клеток кишечника. Кальцитриол усиливает: 1) захват и перенос кальция и фосфора через мембрану щеточной каемки и микроворсинок; 2) транспорт через мембрану клеток слизистой и 3) выведение через базальную мембрану во внеклеточную жидкость.
Кальцитриол повышает концентрацию кальция в сыворотке крови.
В почках кальцитриол способен усиливать действие паратгормона на реабсорбцию кальция в почках.
В костях кальцитриол способствует захвату кальция остеобластами и кальцификации костной ткани.
Кальцитонин — пептид, состоящий из 32 аминокислот. Синтезируется парафолликулярными С-клетками щитовидной железы и реже — паращитовидной железой или тимусом. Секреция кальцитонина возрастает при значительном увеличении концентрации кальция в крови. Является антагонистом паратгормона.
Органы-мишени', кости, в меньшей степени кишечник и почки.
Кальцитонин действует на кости, тормозит резорбцию матрикса и снижает высвобождение кальция и фосфата. Кальцитонин увеличивает концентрацию цАМФ и влияет, вероятно, на те клетки, которые не являются мишенями для ПТГ.
Кальцитонин снижает реабсорбцию и повышает экскрецию кальция с мочой.
Кальцитонин снижает концентрацию кальция в сыворотке крови.
Натрий, калий, йод, селен
Натрий — основной катион внеклеточной жидкости. Около 50 % натрия находится в костях, 40 % во внеклеточной жидкости и 10% — в мягких тканях. Содержание натрия в плазме крови 135—150 ммоль/л, в эритроцитах — 8—13 ммоль/л. В течение суток с пищей поступает 3—4 г натрия, практически такое же количество выводится почками. В 10 г соли содержится 4 г натрия.
Источники: соль, хлеб, зерновые, орехи, яйца, молоко.
Функции натрия'. 1) регуляция кислотно-щелочного баланса с хлоридами а бикарбонатами; 2) поддержание осмотического давления; 3) создание электрохимического потенциала на мембрана клетки; 4) всасывание глюкозы, галактозы и аминокислот в кишечнике.
Калий — внутриклеточный катиов. Содержание калия в плазме крови — 4— 4,5 ммоль/л, в эритроцитах — 115 ммоль/л.
Суточная потребность — 2—3 г.
Источники: бананы, апельсины, ананасы, помидоры, печень, бобовые, локо кокосового ореха.
500
Регуляция обмена волы и минеральных веществ Глава 32
Функции: I) создание внутриклеточного осмотического давления; 2) регуляция кислотно-щелочного и водного баланса в клетке; 3) вместе с натрием участвует в создании электрохимического потенциала (см. Na1, К+ — АТФа-за); 4) необходим для функционирования некоторых ферментов (пируваткиназа) и биосинтеза белков на рибосомах.
Повышенная концентрация калия в плазме — гиперкалиемия > 6 ммоль/л — может вызвать аритмию сердца, включая фибрилляцию желудочков и асистолию. При гипокалиемии применяют калия хлорид 1 %, калия хлорид 4 % и калия-магния аспарагинат. Их вводят, если концентрация калия в плазме крови падает ниже 3,0 ммоль/л.
Йод — эссенциальный микроэлемент, без которого невозможно нормальное функционирование организма.
Йод необходим для функционирования щитовидной железы и биосинтеза тироидных гормонов, интеллектуальной деятельности человека и нормального функционирования системы иммунитета.
По данным Всемирной организации здравоохранения, более 2 миллиардов жителей Земли подвергаются риску недостаточного потребления йода, у 740 миллионов человек имеется увеличенная щитовидная железа (эндемический зоб), а у 40 миллионов лиц — крайняя умственная отсталость в результате йодной недостаточности. Фактическое ежедневное потребление йода во всех регионах России и Республики Беларусь в 2-3 раза меньше рекомендуемых норм. Наиболее бога
тым источником йода в питании являются морепродукты, содержание йода в которых достигает 800-1000 мкг/100 г. Содержание йода в пищевых продуктах массового потребления не более 4-15 мкг/100 г (суточная потребность для взрослого человека 150-200 мкг). Верхний безопасный уровень ежедневного потребления йода 300 мкг/ сутки, что почти в 4 раза меньше, чем принято в США. Суточные нормы потребления йода у новорожденных — 40 мкг/сутки, у детей 3-7 лет — 80-100 мкг, у школьников и подростков — 80-130 мкг. Основным источником йода являются продукты и вода, обогащенные КЮ3.
В последние годы учеными НПЦ «Институт фармакологии и биохимии НАН Беларуси» показано, что хроническое введение 10—1000 кратных суточных доз йода ведет к торможению пероксидазы в тироцитах, активации окислительного стресса и неспецифическому йодированию тироглобулина. Эти исследования поднимают проблему степени перевода йода в органическую гормональную форму при постоянном поступлении добавочных к пище количеств экзогенного йода (Л. И. Надоль-ник и др., 2007).
Селен — эссенциальный микроэлемент, обладающий уникальными биологическими функциями и широким спектром антиоксидантных свойств. Согласно В. В. Ермакову (2007), в окислительных процессах принимают участие первые три элемента главной подгруппы VI группы периодической системы. Первый из них — кислород, является основой жизни большинства организмов, в которых он составляет до 70 % от их массы. Второй макроэлемент — сера участвует в образовании серусодержащих аминокислот, глутатиона, КоА и других важ
501
Глава 32 Регуляция обмена воды и минеральных веществ
ных соединений; на ее долю приходится 0,05 % от массы тела. Третьим является микроэлемент селен, входящий в состав селен-содержащих белков и определяемый в очень малой концентрации — 0,00002 % от массы тела. Селенсодержащие белки и пептиды контролируют в организме человека и животных уровень пероксидного окисления молекул, синтез нуклеиновых кислот и белков, обмен липидов, процессы сперматогенеза, остроту зрения и внимания; предупреждают развитие эндемической хондродистрофии, обладают карциностатическим эффектом.
Наиболее важными и изученными являются фермент глутатионпероксидаза, которая катализирует реакции:
НД, +2 Глутатион-SH * 2 НгО + Глутатион-S-S-гпутатион
2 ROOH +2 Глутатион-SH -* ROH + Н2О+ Глутатион-S-S-глутатион
Для восстановления окисленного глутатиона используется фермент глутати-онредуктаза:
2 ROOH + НАДФН + Н* -* 2 Глутатион-SH + НАДО’.
Известен ряд селен-содержащих белков: селенопротеины (W, Ph, Р), глутатионпероксидаза, формиатдегидрогеназа, глицинредуктаза, йодтиронин-дейодиназа и др. Эти селен-содержащие белки участвуют в патогенезе ряда заболеваний (совместно с другими химическими элементами) — опухолевые заболевания (цинк), сердечно-сосудистые заболевания и кешанс-кая болезнь (медь), эндемические нефриты (молибден), беломышечная болезнь животных (кальций), эндемический зоб, кретинизм (йод), Уровская Кашина-Бека бо
лезнь (кальций, фосфор, йод), ревматоидные артриты, мутации РНК-вирусов и др.
Суточная потребность в селене — 55 мкг. Наиболее эффективными являются государственные мероприятия по обогащению пищевой цепочки селеном посредством многолетнего использования селен-содержащих удобрений и премиксов для животных. Такая 30-летняя деятельность в Финляндии привела к десятикратному повышению концентрации селена в крови взрослых. Для лечения селен-дефицитных состояний разрабатываются препараты: селеноме-тионин, диметилпиразолилселенид (се-лекор), 2-фенил-октагидроселеноксан-тен (селенопиран) и др. (А. Г. Мойсеенок и соавт., 2002).
В последние годы в качестве маркера нарушений метаболизма используют спектрометрический элементарный анализ волос человека. Предложено определение ряда отношений: повышение коэффициентов Na/K (норма 2,4) и Na/Mg (норма 4,0) отображает увеличение биосинтеза альдостерона и адреналина; отклонения величины коэффициента Са/К (норма 3,6) характеризует дисфункцию щитовидной и паращитовидных желез; снижение величины коэффициента Fe/Co менее 440 указывает на нарушение функции щитовидной железы (Гресь Н. А.. Тарасюк И. В., Ставрова Е. Л., 2007).
С профилактической и лечебной целями используются комплексные препараты, содержащие витамины и химические элементы (табл. 32.1).
502
Регуляция обмена воды и минеральных веществ Глава 32
Таблица 32.1. Витаминно-минеральные комплексы НП ЗАО «Малкут», Республика Беларусь (шипучие)
Для сравнения Linie Vital, 1,45 г (шипучие) и Теравит (таблетки).
Наименование Vitus М, 4 г Крепыш-М, 4 г Gravitus, 4 г Linie Vital, 1,45 г Теравит, таблетки
Витамины С 75 мг 60 мг 75 мг 75 мг 90 мг
Е 10 мг 12 мг 10 мг 10 мг 30 ME аТФ
А 3000 ME 1440 ME 3000 ME 800 мкг RE 4000 ME
в, 2 мг 1,0 мг 2 мг 1,4 мг 3 мг
в2 2 мг 1,2 мг 2 мг 1,4 мг 3,4 мг
в6 2 мг 1,3 мг 2 мг 2 мг 3 мг
В12 5 мкг 2,0 мкг 5 мкг 1,0 мкг 9,0 мкг (ЦКАМ)
РР 20 мг 12 мг 20 мг 18 мг 20 мг
Вс (Фолиевая 200 мкг 100 мкг 400 мкг 200 мкг 400 мкг
кислота) Кальция 10 мг 4,8 мг 10 мг 6,0 мг 10 мг(пантотенат
пантотенат 0-каротин D3 100 мкг 100 мкг 190 ME 100 мкг 200 ME 5,0 пг кальция) 400 М Е (ХКФ)
к. Биотин 30 мкг 30 мкг 100 мкг 30 мкг 150 мкг 30 мкг
Минералы Кальций 10 мг 20 мг 26 мг 200 мг 40 мг (дикальция
Железо 2 мг 4 мг 15 мг 5,0 мг фосфат) 27 мг (железа
Цинк 2,4 мг 1,2 мг 500 мкг 5,0 мг фумарат) 15 мг
Медь 0,4 мг 0,4 мг 1,0 мг (оксид цинка) 2 мг(меди
Магний 8 мг 3,2 мг 20 мг 100 мг сульфат) 100 мг (магния
Марганец 1,2 мг 0,40 мг 500 мкг оксид) 5 мг (марганец
Молибден 14 мкг 1 мкг 140 мкг 80,0 мкг сульфат) 15 мкг (натрия
Калий Фосфор 30 мкг 7,7 мг 10 мг 4,5 мг 20 мг 125 мг молибдат) 7,5 мг (калия хлорид) 31 мг
Селен 20 мкг 10 мкг 20 мкг 30 мкг 10 мкг(натрия
Йод 100 мкг 100 мкг 100 мкг 100 мкг селенат) 150 мкг (Калия
Хром 60 мкг йодид) 15 мкг (хрома хлорид)
Примечание: аТФ — токоферол; ЦКАМ — цианкобаламин, ХКФ — холекальциферол.
503
Глава 32 Регуляция обмена воды и минеральных веществ
Распределение воды в организме
Вода составляет до 60 % массы тела (у мужчин 55—70 %, у женщин 45—60 %). Возможно, это связано с тем, что у мужчин выше процент белковых веществ (мышцы), а у женщин выше процент жировых веществ, которые обладают гидрофобными свойствами и в меньшей степени способны связываться с водой. При средней массе человека в 70 кг примерно 42 кг приходится на долю воды. Большая часть воды (около 40 % от общей массы тела — 28 л) входит в состав внутриклеточных жидкостей организма. Внеклеточная вода (14 л) относится к межклеточной и внутрисосудистой жидкости. Межклеточная жидкость включает неорганизованную воду, которая относительно свободно перемещается в межклеточном пространстве (около 10 % от массы тела — 7 л) и организованную воду, которая связана со структурами межклеточного пространства, например, с коллагеновыми волокнами, рыхлой соединительной тканью. Эта вода также составляет примерно 10 % от общей массы организма, т. е. около 7 л. На внутрисосудистую жидкость — плазму крови — приходится примерно 5 % массы, т. е. около 4 л жидкости.
Кроме того, всю воду делят на две фракции', фракцию, способную к обмену, и фракцию, связанную в коллоидных системах с молекулами органических веществ. Известно, что на каждый грамм откладывающихся в тканях гликогена и белка задерживается, соответственно, 1,5 и 3 мл связанной воды. В результате катаболизма в организме человека образуется ежедневно 300—350 мл воды. При окислении 100 г жира образуется 107 мл воды, 100 г белка — 41 мл воды и 100 г углеводов — 55 мл воды. Потеря 10 % воды приводит к состоя
нию дегидратации, а 20% — к смерти. Преобладающие ионы внутриклеточной жидкости — К', Mg2+, НРО42-, SO42. Преобладающие ионы межклеточной жидкости — Na+, Са2+, СГ, НСО/.
Функции воды:
1) является растворителем полярных и нейтральных молекул и диспергирует соединения, содержащие гидрофобные группы; 2) участвует в биохимических реакциях (гидролиза, гидратации и дегидратации, окисления, синтеза); 3) транспортирует к тканям и клеткам питательные вещества и удаляет продукты метаболизма; 4) терморегуляторная (путем испарения воды); 5) механическая роль (скольжение трущихся поверхностей суставов и т. д.); 6) участвует в формировании внутриклеточных гелей и фазовых преходах гель-золь. Содержание воды в различных тканях отличается: в сером веществе мозга составляет 84 %, в почках — 81 %, в сердце — 78 %, в печени и мышцах — 75 %, в цельной крови — 80 %, а в плазме крови — 92 %. Наиболее низко содержание воды в жировой ткани (25 %) и костной ткани (20—40 %). С возрастом содержание воды в тканях и органах снижается.
Суточная потребность взрослого человека в воде составляет примерно 40 г на 1 кг массы, т. е. около 2,5 л. Эта потребность покрывается за счет введения в организм различных жидкостей и пищевых продуктов. Кроме того, часть воды (около 400 мл) образуется в организме при окислении органических веществ (эндогенная вода). Выделяется вода из организма через почки (с мочой), кожу (с потом), легкие (с дыханием) и кишечник (с калом). Часть воды временно может депонироваться в коже и печени.
Обмен воды тесно связан с обменом минеральных веществ, образуя водноминеральный обмен.
504
Регуляция обмена воды и минеральных веществ Глава 32
Регуляция водноминерального обмена
В регуляции водно-минерального обмена принимают участие 3 системы: ренин-ан гиотензин - ал ьд остеро новая система, вазопрессин и атриальный натрийуретический фактор.
Ренин-ангиотензин-альдостероновая система
Снижение артериального давления, объема циркулирующей крови или концентрации ионов Na+ приводит к активации клеток юкстагломерулярного аппарата (ЮГА), локализованных в области приносящей артериолы почек. Клетки ЮГА вырабатывают ренин, который воздействует на ангиотензиноген — ^-глобулин, синтезируемый печенью, и отщепляет от него декапептид — ангиотензин /. От ангиотензина I под действием ангиотензинпревращающего фермента отделяется дипептид, и образуется октапептид — ангиотензин II.
Ангиотензин II — самый мощный сосудосуживающий фактор из всех известных вазоактивных агентов.
Он тормозит высвобождение ренина юкстагломерулярными клетками и оказывает действие на выработку альдостерона в коре надпочечников. Ангиотензин II превращается в гептапептид — ангиотензин HI. У человека уровень ангиотензина II в плазме крови в 4 раза выше, чем ангиотензина III, и поэтому именно октапептид оказывает основной эффект. Ангиотензины II и III инактивируются под действием ангио-тензиназ.
Ангиотензин II связывается со специфическими рецепторами клубочковой зоны коры надпочечников и стимулиру
ет выработку альдостерона через изменение концентрации внутриклеточного Сан и метаболитов фосфатидилинозитолов (рис. 32.1).
Альдостерон — проникающий в клетку гормон. Клетками-мишенями являются дистальные канальцы и собирательные трубочки почек,, где альдостерон усиливает реабсорбцию Na+. Гор-мон-рецепторный комплекс связывается с хроматином и регулирует транскрипцию специфических генов.
Альдостерон увеличивает: 1) число каналов на мембране апикальной стороны клеток, что повышает уровень внутриклеточного Na+; 2) активность митохондриальных ферментов (в частности, цитрат-синтазы) за счет индукции транскрипции генов, что способствует выработке АТФ, необходимой для работы Na+, К'-АТФ-азы и 3) количество Na+, К+-АТФ-азы. Альдостерон способствует выделению из организма ионов К+ и NH/. Na+ из жидкости, содержащейся в канальцах и омывающей апикальную поверхность почечных клеток, пассивно входит в клетки по Na'-каналам. Далее происходит перенос этого иона в интерстициальную жидкость, причем транспорт через мембрану на серозной стороне клетки осуществляется На+/К+-АТФ-азой.
Задержка Na+ имеет 2 следствия: 1. Увеличивается осмотическое давление, что вызывает продукцию вазоп-
505
Глава 32 Регуляция обмена воды и минеральных веществ
рессина. Это приводит к задержке воды. В результате восстанавливается объем крови.
2. Повышенная концентрация натрия придает мышечным стенкам большую чувствительность к вазоактивным веществам. Это приводит вместе с прямым действием ангиотензина II на сосуды к восстановлению артериального давления до стабильного уровня.
Ингибиторы ангиотензинпревраща-ющего фермента используют для лечения артериальной гипертензии.
Вазопрессин (антидиуретический гормон, АДГ)
Синтезируется в гипоталамусе и поступает в гипофиз, а оттуда — в кровь. Секрецию вазопрессина стимулируют: 1) повышение осмотического давления крови, которое воспринимается осморецепторами мозга; 2) уменьшение объема крови, которое воспринимается барорецепторами кровеносных сосудов; 3) боль, возбуждение. АДГ влияет на клетки трех типов: 1) клетки почечных канальцев; 2) гладкомышечные клетки сосудов; 3) клетки печени. В клетках почечных канальцев под действием вазопрессина увеличивается концентрация цАМФ, активируется протеинкиназа, и фосфорилируются белки мембраны клеток дистальной части извитых канальцев и собирательных трубок. Мембрана становится проницаемой для воды. Вода поступает из первичной мочи в клетку, а затем в кровь, увеличивая объем жидкости и уменьшая осмотическое давление. В настоящее время показано, что белками, которые участвуют в транспорте воды и на которые действует вазопрессин, являются аквапорины.
Реакция сосудов заключается в сокращении гладкомышечного слоя, суже
нии сосудов и опосредуется увеличением концентрации Са2+ в цитозоле.
В печени АДГ стимулирует гликогенолиз и глюконеогенез. Эти эффекты связаны с увеличением концентрации Са2+.
Предсердный (атриальный) натрийуретический фактор
Это полипептид, вырабатывающийся в клетках предсердий. Секреция активируется при увеличении объема циркулирующей крови. Состоит из 28 аминокислот. Является физиологическим антагонистом ангиотензина II. Механизм действия —- активация гуанилат-циклазы и увеличение концентрации цГМФ. Расширяет сосуды (снижает давление), стимулирует потерю натрия и, следовательно, воды.
Рецепторы к нему расположены на мембранах клеток клубочковой зоны, где он ингибирует секрецию альдостерона и на клетках пучковой зоны, где ингибирует выделение кортизола.
Сигнальные молекулы
За последние 25 лет эндокринология превратилась в междисциплинарную науку, «предметом которой служат межклеточные системы коммуникации, использующие разнообразные сигнальные соединения, включая такие специализированные на сигнальной функции соединения, как гормоны, и поступающие с пищей вещества (например, жирные кислоты и кальций). Развитие представлений о системах проведения сигнала внутри клетки привело к пониманию теснейшей связи эндокринологии с биологией клетки, а также того, что системы проведения сигнала формируют сложные сети, обеспечивающие, с одной стороны, взаимодействие разных си
506
Регуляция обмена воды и минеральных веществ Глава 32
стем сигнализации, а с другой — специфичность ответа на данный стимул» (А. Н. Смирнов, 2006). Примеры сигнальных молекул представлены в таб
лице 32.2. Следует обратить внимание на продукцию одной и той же тканью противоположных по характеру действия сигнальных молекул.
Таблица 32.2. Сигнальные молекулы (по А. Н. Смирнову, 2006)
Структура Представители Механизм действия
Стероидная природа: холестаны (С ), прегнаны (С21), андростаны (С19), эстраны (С18), а также С24 и С2в-стероиды Природные прогестины: прогестерон, 17-гидроксипрогестерон, 20а-дигидроксипрогестерон, 5а-дигидроксипрогестерон. Синтетические прогестины: промегестон, этистерон, мегестрол-ацетат, мифепристон (антипрогестин). Биологический эффект определяется заместителем при С17: ацетоновая группа обеспечивает взаимодействие с рецептором прогестерона, гидроксиацетоновая группа — с рецепторами кортикостероидов; эффект определяется 3-кетогруппой, сопряженной с двойной связью 4-5 в кольце А. Синтетические аналоги используют для контрацепции. Эффекторы — ядерные рецепторы.
Природные кортикостероиды: кортикостерон, кортизол, 11 -дезоксикортикостерон, 11-дезоксикортизол, 11-дегидрокортикостерон, кортизон, альдостерон. Синтетические кортикостероиды: преднизолон, дексаметазон, синалар, спиронолактон. Для биологической активности необходимы 17р-оксиацетоновая группа, 3-кетогруппа и 1 ip-гидроксильная группа. Синтетические кортикостероиды обладают противовоспалительным и антиаллергическим действием. Введение дополнительной двойной связи в кольцо А и атома фтора в положение 9а молекулы кортизола повышает сродство к рецепторам глюкокортикоидов и снижает сродство к рецепторам минералокортикоидов. Модификация кольца D дает пролонгирование эффекта. При гиперальдостеронизме применяют спиронолактон. Эффекторы — ядерные рецепторы.
Нейростероиды: За, 5а-тетрагидропроизводные прогестерона и 11 - дезокси кортикостерон а, прегненолонсульфат Эффекторы — ионные каналы
Природные андрогены: тестостерон, 5а-дигидротестостерон, андростендион, дигидроэпиандростерон. Синтетические андрогены: тестостеронпропионат, метандростенолон, метилтриенолон, флутамид 5а-дигидротестостерон, метилтриенолон — андрогенные функции, тестостерон, метандростенолон — анаболическое действие. 5а-андрост-16-ен-З-ОН является феромоном.
507
Глава 32 Регуляция обмена воды и минеральных веществ
Продолжение табл. 32.2.
Структура Представители Механизм действия
Природные эстрогены: эстрадиол, эстрон, эстриол, эквилинин, генистеин (фитоэстроген). Синтетические эстрогены: этин илэстради ол, диэтилстильбестрол, 4-гидрокситамоксифен (антиэстроген). Холестаны: 1а, 25-дигидроксивитамин D3> экдизоны (гормоны насекомых), хенодезоксихолевая кислота Кардиотонические стероиды: уабаин, маринобуфагенин Ретиноиды (С20 ,): трансретиноевая кислота, 9-цис-ретиноевая кислота Заместители в положении С17 необходимы для связывания с рецептором, эффекты молекулы определяет кольцо А. Желчные кислоты являются активаторами ядерных рецепторов печени. Уабаин ингибирует Na+, К+-АТФазу и индуцирует каскады протеинкиназ. Через ядерные рецепторы — дифференцировка и рост клеток.
Производные полиненасыщен ных жирных кислот Ювенильные гормоны С16-С1е. Простагландины (ПГ), простациклины (ПГИ). Через ядерные рецепторы тормозят линьку и метаморфоз, усиливают рост личинок, а у имаго стимулируют вителлогенез. ПГ действуют через рецепторы, сопряженные с G-белками, а также с ядерными рецепторами. Ингибиторы биосинтеза ПГ — противовоспалительное действие.
Эйкозаноиды Тромбоксаны (ТХ) Лейкотриены(ЛТ) Часто физиологические антагонисты ПГ. ПГ действуют через рецепторы, сопряженные с G-белками, а также с ядерными рецепторами. Ингибиторы биосинтеза.
Фосфолипиды Фактор, активирующий тромбоциты (PAF) Стимуляция агрегации, хемотаксиса, секреторной активности лейкоцитов, образование активных форм кислорода, адгезию лейкоцитов.
Производные Тирозин: адреналин, Действие через рецепторы,
аминокислот норадреналин (катехоламины) Тирозин: тироксин, трийодтиронин Триптофан: серотонин сопряженные с G-белками Действие через ядерные рецепторы: энергетика, дифференцировка । Нейромедиатор, действует через I ионный канал (5-НТЗ) и рецепторы, сопряженные с G-белками |
508
Регуляция обмена воды и минеральных веществ Глава 32
Продолжение табл. 32.2.
Структура Представители Механизм действия
Триптофан: мелатонин Гистидин: гистамин Глутаминовая кислота Г амма-аминомасляная кислота (ГАМК) Глицин Действует через рецепторы, сопряженные с G-белками: регуляция циркадных ритмов и системы иммунитета Паракринная регуляция через рецепторы, сопряженные с G-белками: провоспалительный эффект Возбуждающий нейромедиатор ЦНС. Действует через ионные каналы и рецепторы, сопряженные с G-белками Тормозной медиатор ЦНС. Действует через ионные каналы и рецепторы, сопряженные с G-белками Тормозной медиатор ЦНС. Действует через пентамерные рецепторы-ионные каналы.
Ацетилхолин Ацетилхолин Нейромедиатор. Действует через ионотропные (никотиновые) и метаботропные (мускариновые) рецепторы.
Нуклеозиды, нуклеотиды Аденозин Пуриновые нуклеотиды: АТФ, АДФ Пара/аутокринный регулятор. Действует через рецепторы, сопряженные с G-белками Нейромедиаторы и паракринные регуляторы. Действуют через ионотропные и метаботропные рецепторы, сопряженные с G-белками
Пептиды (примеры) Тиролиберин (pyro-QHP-NH2) Корти колиберин Урокортин Г онадолиберины (декапептиды) Пролактостатин (56 аминокислотных остатков) Соматостатин Кортистатин (экспрессируется подтипом ГАМК-ергических нейронов в коре мозга) Нейромедиатор. Стимуляция продукции ТТГ и пролактина Нейромедиатор. Стимуляция продукции АКТГ. Стресс. Регуляция поведенческих, нейроэндокринных и вегетативных реакций приматов Нейромедиаторы. Стимуляция продукции ЛГ и ФСГ Действует через рецепторы, сопряженные с G-белками Торможение секреции СТГ. Действует через рецепторы, сопряженные с G-белками Экспрессия пептида имеет циркадный ритм. Многие эффекты противоположны действию соматостатина. Подавляет секрецию СТГ.
509
Глава 32 Регуляция обмена воды и минеральных веществ
Продолжение табл. 32.2.
Структура Представители Механизм действия
Мотилин (экспрессируется Секрецию мотилина подавляют
в ЖКТ и мозге) желчные кислоты. Стимуляция перистальтики кишечника и опорожнения желчного пузыря.
Г релин (продуцируют Gr- Экспрессия пептида растет при
клетки желудка и кишечника) голодании и снижается после еды. Стимуляторы экспрессии грелина являются инсулин и лептин. Действует через рецепторы 1 типа стимуляторов секреции СТГ (GHSR-1). Контролирует потребление пищи и энергозатраты. Ингибирует репродуктивную систему. Является ведущим фактором, определяющим повышение продукции СТГ при голодании.
Семейство соматолиберина Вызывают зависимую от глюкозы секрецию инсулина в ответ на поступление пищи. Оказывают сосудорасширяющее действие. Стимулируют секрецию гипофизарных гормонов и, прежде всего, СТГ.
Глюкагон Вазоактивные пептиды: Стимуляция в печени гликогенолиза и глюконеогенеза, что ведет к гипергликемии.
Эндотелины 1, 2, 3 Вазоконстрикторы. При недостаточности эндотелина — аганглиоз кишечника, глухота и нарушение пигментации.
Ангиотензины (образуются Сосудосуживающий эффект, I
внеклеточно) стимуляция продукции альдостерона, питьевого поведения, секреции вазопрессина.
Брадикинины (образуются Сосудорасширяющий эффект.
внеклеточно) Пептиды тимуса: Действует через рецепторы, сопряженные с G-белками. Стимулирует натриурез, диурез, гипогликемию; посредники воспаления.
Тимопоэтины (а, р, у) Ауто/паракринное действие; регулируют функционирование ядер клеток
Тимозины Участие в пролиферации и подвижности клеток
510
Регуляция обмена воды и минеральных веществ Глава 32
Окончание табл. 32.2.
Структура Представители Механизм действия
Тимулин Участие в дифференцировке клеток системы иммунитета; потенцирование связывания цинка.
Гуморальный фактор тимуса 2 Иммуномодулирующее действие
Гуанилины (15-18 членные Стимуляция секреции ионов хлора и
пептиды), включая бикарбонатов, что сопровождается
энтеротоксины повышением содержания воды в просвете кишечника.
Амил ин (экспрессия в Отложение амилина в клетках в виде
р-клетках поджелудочной амилоида ведет к развитию
железы) инсулиннезависимого сахарного диабета
Адреномедуллин (экспрессия Сосудорасширяющее действие.
в мозговом веществе Уровень коррелирует с
надпочечников) артериальным давлением, повышается при гипоксии и шоке
Остеостатин Подавление резорбции кости остеокластами
Цитокины: интерлейкины Пара/аутокринная регуляция.
(более 30), интерфероны Действие через рецепторы,
(а, р, со, 6) ассоциированные с тирозинкиназами
Адипоцитокины: лептин, Регуляция потребления пищи,
резистин, адипонектин расходования энергии, продукции и чувствительности клеток к инсулину
Хемокины (CCL2, CCL13, Хемоаттрактанты для клеток в очаге
CCL16, CXCL1, CXCL116 IL-8, XCL1 и 2) воспаления
Факторы роста из тромбоцитов (PDGF-A, PDGF-B, VEGF-A, VEGF-B, VEGF-C, VEGF-D, PLGF) Митогенные эффекты
Семейство фактора некроза Регуляция пролиферации,
опухолей а (лимфотоксин дифференцировки и апоптоза
а, р, фактор некроза опухолей а, лиганд Аг CD40, LIGHT, TRAIL, APRIL, лиганд Ar Fas) клеток
Белки, транспортирующие сигнальные молекулы (по А. Н. Смирнову, 2006)
Белки, транспортирующие сигнальные молекулы, делят на 6 групп.
1. Белки, связывающие стероиды:
1.1. Кортикостероидсвязываюший глобулин, транскортин (КСГ, CBG); по связывающей способности стероиды располагаются в последовательности глюкокортикоиды > прогестины > андрогены > альдостерон.
1.2. Прогестеронсвязывающий глобулин, транспрогестин (ПСГ, PBG) — прогестины.
1.3. Сексстероидсвязывающий глобулин,
511
Глава 32 Регуляция обмена воды и минеральных веществ
тестостерон-эстрадиолсвязывающий глобулин (ССГ, SHBG, TeBG) — андрогены > эстрогены.
1.4. Ацдрогенсвязывающий белок (вариант ССГ семенников) (АСЕ, АВР) — андрогены > эстрогены.
1.5. Альфа-фетопротеин (АФП, AFP) у грызунов — эстрогены; у многих видов — ти-роидные гормоны, ретиноиды.
1.6. Витамин D-связывающий белок, транскалъциферин (DBP) — 25-гидроксиви-тамин D3.
2. Белки, связывающие тироидные гормоны и ретиноиды:
2.1. Тироксинсвязывающий глобулин (ТСГ, TBG), ТСГ-1 (беременность) — Т4 > Т3.
2.2. Транстиретин (TTR) — Т4 > Т3.
2.3. Ретинолсвязывающий белок плазмы (ПРСБ, PRBP) — ретинол.
3. Белки, связывающие белково-пептидные сигнальные соединения:
3.1. Белки 1—6, связывающие инсулиноподобные факторы роста (ИФРСБ, IGFBP) ---ИРФ I и II > инсулин.
3.2. Белки 1—9, родственные ИФРСБ — ИРФ I и II инсулин.
3.3. Растворимый ангиотензинсвязываю-щий белок (патология) (АСБ1, ABPI) — ангиотензины.
3.4. Адреномедуллинсвязывающий белок — адреномедуллин.
3.5. Кортиколиберинсвязывающий белок (КРГ-СБ, CRH-BP) — кортиколиберин, урокортин.
4. Белки, содержащие внеклеточные домены рецепторов:
4.1. Белок, связывающий гормон роста (СТГ-СБ, GHBP) — соматотропин.
4.2. Белок, связывающий пролактин (ПР31-СБ, PRLBP) — пролактин.
5. Растворимые СЕ рецепторы или их анал< ги:
5.1. СЕ а рецептор интерлейкина 6 (ИЗ 6Ра, IL-6Ra) - ИЛ-6.
5.2. СЕ а рецептор интерлейкина 2 (ИЗ 2Ра, IL-2Ra) - ИЛ-2.
5.3. СЕ а рецептор цилиарного нейротроф] ческого фактора (ЦНТФРа, CNTFRa) цилиарный нейротрофический фактор.
5.4. Остеопротегерин (OPG): RANK1 TRAIL — лиганды рецепторов семейсп фактора некроза опухолей a (TNFa).
6. Тканевые внеклеточные белки:
6.1. Утероглобин — прогестерон.
6.2. Простатеин — андрогены.
6.3. Фоллистатин и родственные белки -активины > ингибины, морфогенный беле кости 2.
Большинство транспортных белков, нахе дящихся в крови, синтезируется в печени. Од нако те же белки могут продуцироваться лс кально (например, в тканях-мишеня соответствующих лигандов).
Белки — участвующие в контактах
Известно не менее 5 типов мембранных бел ков, участвующих в контактах клеток с внсклс точным матриксом и другими клетками: ив тегрины, селектины, кадгерины, муцины иммуноглобулины, (таблица 32.3).
Концентрация некоторых гормонов в крови здоровогс человека
(по А. Н. Смирнову, 2006) (таблиц 32.4)
512
Регуляция обмена воды и минеральных веществ Глава 32
Таблица 32.3. Интегрины (по А. Н. Смирнову, 2006)
Тип Представители Функция
Интегрины. Структурные белки адгезии 18 типов а-интегринов и 8 типов р-интегринов Обеспечение двусторонней связи клеток с внеклеточным матриксом. Контролируют клеточную адгезию, форму клеток, их полярность, рост, дифференцировку и подвижность.
Талин-1, белок цитоскелета, локализующийся в местах контактов клетки с субстратом или другой клеткой Участвует в сборке актиновых нитей. Взаимодействие интегрина с талином увеличивает сродство интегрина к внеклеточному лиганду. Взаимодействие усиливается фосфатидил и нозитол-4,5-6 исфосфатом.
Винкулин Подавление подвижности клеток, снижение сродства интегринов к талину. Модулятором активности винкулина служит фосфатидилинозитол-4,5-бисфосфат.
Актинины 1-4 Связывание интегринов с актином и образование поперечных сшивок нитей актина. Модулятором активности служит фосфатидилинозитол-3,4, 5-трифосфат.
Тензины 1-2 Стимуляция клеточной миграции и участие в фибриллогенезе путем превращения растворимого фибронектина в фибриллярный матрикс. Комплексы точечной адгезии выполняют функцию якоря для фибронектина и актина. Перемещение интегринов и натяжение фибронектина осуществляются за счет сокращения актомиозинового комплекса.
Кавеолины 1-3 Интегральные мембранные связывающие холестерол белки и участвующие в проведении сигналов (через тирозинкиназную, ГТФазную активности).
Паксиллин Непосредственно связывается с а-интегринами и при фосфорилировании активируется.
Тирозинкиназа точечной адгезии FAK Фосфорилируется и активируется под действием лигандов интегринов. Участие в проведении сигнала 1) за счет фосфорилирования белков и 2) функционирования в качестве адаптера.
Кэдгерины (классические кадгерины, десмосомальные кадгерины, протокадгерины, кадгерины группы Flamingo, рецепторная протеинкиназа RET) Интегральные белки плазматической мембраны, важнейший фактор межклеточной адгезии. Сигнал о взаимодействии кадгеринов двух клеток передается внутрь каждой из них (в форме осцилляций Са2+, изменяя активности различных протеинкиназ или других посредников) и трансформируется в изменения обменных процессов. В свою очередь, изменения в характере метаболизма в соседних клетках могут через кадгерины отражаться на прочности межклеточных контактов.
513
Глава 32 Регуляция обмена воды и минеральных веществ
Окончание табл. 32.3.
Тип Представители Функция
15 классических Содержат места связывания цитоплазматических
кадгеринов: белков катенинов, которые служат мостиками
эпителиальный (Е), между кадгеринами и актиновыми нитями
нейрональный (N), цитоскелета. Непосредственно с кадгеринами
плацентарный (Р), взаимодействует р-катенин, который связан с
сосудистоэндотелиальный (VE) и др. актином через а-катенин.
Альфа-катенин Посредник взаимодействия кадгеринов с актиновым цитоскелетом
Дельта-катенин Взаимодействие с примембранной областью
(р120-катенин) внутриклеточного домена кадгеринов, регуляторное воздействие на межклеточную адгезию.
Бета-катенин Компонент клеточной адгезии, контролируемый паракринными сигнальными молекулами и коактиватор транскрипционных факторов в ядре клетки. Активирующие мутации р-катенина являются наиболее частой причиной инициации рака толстой кишки.
Протокадгерин CNR Обнаружен в точках роста аксонов, в активных зонах пре- и постсинаптической мембраны. Необходим для повышения эффективности синаптической передачи сигналов и долговременной памяти.
Кадгерины Flamingo, протокадгерины FAT Участвуют в механизмах поляризации клеток
Таблица 32.4. Примеры количественного содержания сигнальных молекул в крови человека
Гормон Мужчины Женщины
Фолликулиновая фаза Лютеиновая фаза
Стрессорные гормоны Адреналин, пмоль/л АКТГ, пмоль/л Дофамин, нмоль/л Гидрокортизон, нмоль/л Норадреналин, нмоль/л Гормоны вводно-солевого обмена Альдостерон, пмоль/л Вазопрессин, нг/л Регуляторы липидного и углеводного Лептин, мкг/л Инсулин, пмоль/л 0-600 1,3-16,7 0-196 138-690 0,41-4.43 0-444 1-13,3 обмена 7,5±8,5 0-208 33,9±17,3 i
514
Регуляция обмена воды и минеральных веществ Глава 32
Окончание табл. 32.4. Примеры количественного содержания сигнальных молекул в крови человека
Гормон Мужчины Женщины
Фоллихулиновая фаза Лютеиновая фаза
Репродуктивные гормоны Андростендион, нмоль/л 2,6-4,4 3,8-9,1
Дегидроэпиандростерон, нмоль/л 6-15 7-18
5а-Дигидротестостерон, нмоль/л 0,9-3,4 0,08-1,3
Тестостерон, нмоль/л 10,4-41,6 0,7-3,17
Тестостерон свободный, нмоль/л 0,11-1 0,003-0,06
Прогестерон, нмоль/л 1-4 30-80
17а-Гидроксипрогестерон, нмоль/л 0,61-6,1 0,61-2,42 2,72-9,2
Эстрадиол, пмоль/л 0-184 75-300 350-1800 (включая овуляцию)
Лютропин (ЛГ), ед/л 7-24 6-30 10-130 (включая овуляцию)
Фоллитропин (ФСГ), ед/л 0-22 0-20 5-40 (включая
овуляцию)
Хорионический гонадотропин, ед/л 0-3 0-3 30000-100000
(2-3 мес беременности)
Пролактин, мкг/л 0-10 0-15
Сигнальные молекулы пищеварительного тракта
VIP, нг/л 0-76
Гастрин, пмоль/л 0-95,3
Панкреатический полипептид, 50-250
нмоль/л Факторы роста Инсулиноподобный фактор 54-329 142-390
роста I, мкг/л Соматотропин (СТГ), пмоль/л 0-264 0-440
Эритропоэтин, ед/л 0-19
Регуляторы обмена кальция Кальцитонин, нг/л 0-20 0-28
Паратгормон, пмоль/л 1,1-6,6
1,25-дигидроксивитамин D3, пмоль/л Гормоны тироидной оси 38-182
Трийодтиронин, нмоль/л 1,2-3,5
Тироксин, нмоль/л 51-154
Тироксин свободный, пмоль/л 7,7-25,7
Тиротропин (ТТГ), мЕ/л Другие сигнальные молекулы 0,5-10
Мелатонин, нг/л 0-20
Серотонин, мкмоль/л (кровь) 0,22-2,05
Интерлейкин-6, нг/л 0-12,5
515
Г лава 33
Взаимосвязи в обмене веществ
В процессе изучения биохимии обмены углеводов, липидов, белков, нуклеиновых кислот, минеральных веществ и различные механизмы их регуляции рассматривались отдельно. Однако в целостном организме все эти процессы взаимосвязаны и условно могут быть представлены в виде карты метаболизма. Понимание интеграционных процессов в обмене веществ — это более высокая стадия изучения и освоения предмета. Интеграционные механизмы можно проследить на различных уровнях, начиная с биосферного и кончая межуточным метаболизмом. Так, в биосфере происходит постоянный обмен веществ и энергии. В зеленых растениях из углекислого газа и воды в процессе фотосинтеза образуется молекула глюкозы, в химических связях которой аккумулируется солнечная энергия. В организме животного или человека эта глюкоза подвергается распаду до углекислого газа и воды с выделением энергии, которая и используется для движения, трансмембранного транспорта и биосинтезов.
Интегрирующие системы
Все клетки организма имеют одно и то же количество ДНК, но в разных клетках активными являются разные участки и разное количество ДНК. Это позволяет разделить клетки на различные типы по метаболизму в зависимости от степени их дифференцировки. Например, узкоспециализированные клетки зрелых эритроцитов, которые потеряли ядро, митохондрии и предназначены для транспорта кислорода и углекислого газа, и мультифункциональные клетки печени. Клетки, являющиеся функциональной единицей организма, образуют сложную иерархически организованную систему: клетки * ткани * органы -* системы органов -*• организм. Такая организация обеспечивает рациональное разделение функциональной активности, но требует участия контролирующих инстанций, согласующих и координирующих работу различных органов и тканей.
Эту интегрирующую роль играют три важнейшие системы:
1. Нервная система, которая является центром обработки информации и при
516
Взаимосвязи в обмене вешеств Глава 33
нятия решений, воспринимающим импульсы, которые отражают воздействия на организм изменяющихся условий среды (гипоксия, голод, жажда, изменение температуры, стресс и др.), и передающим соответствующие команды дру-гим органам и тканям с целью приспособления их функционального состояния к этим изменениям условий среды.
2. Эндокринная система (или более общая система гуморальной регуляции) регулирует метаболизм с помощью дистантно действующих химических биорегуляторов (рост, размножение, развитие, стресс-реакция и пр.). Относительно быстрые адаптивные реакции эн-докринной системы способствуют поддержанию постоянства концентрации в крови таких веществ, как глюкоза, липиды, кальций, обеспечивают оптимальное соотношение между синтезом и распадом компонентов тканей в зависимости от энергетических потребностей.
3. Сердечно-сосудистая и лимфатическая системы, которые выполняют коммуникационные функции и служат для переноса всех химических соединений в организме. При помощи их транспортируются газы, пластические и энергетические молекулы, минеральные вещества из внешней среды в клетки тканей, между клетками и тканями и осуществляется выведение из организма проникших в него микроорганизмов, токсинов, ксенобиотиков, конечных продуктов обмена веществ.
Взаимосвязи обмена белков, жиров и углеводов
Между превращениями этих трех групп соединений в процессе обмена должны существовать целесообразные взаимосвязи. Существует несколько различных путей взаимодействия этих классов ме
таболитов. Это взаимодействие может осуществляться на уровнях общих предшественников, общих промежуточных метаболитов (пункты переключения), сходных источниках энергетического обеспечения, наличии общего пути катаболизма и образования общих конечных продуктов обмена.
На уровне превращений метаболитов
В качестве примера рассмотрим путь аэробного катаболизма глюкозы и отметим наиболее важные промежуточные метаболиты, являющиеся пунктами переключения: глюкоза -* Г-6-Ф -* Ф-6-Ф------► Фосфоенолпируват -* Пиру-
ват -* Ацетил-КоА -* Цикл трикарбоновых кислот Митохондриальные цепи переноса электронов и протонов + СО2 и Н2О.
Глюк.озо-6-фосфагп образуется из проникшей в клетку глюкозы в реакции, катализируемой гексо- или глюкокиназой. Присоединение отрицательнозаряженной фосфатной группы не позволяет Г-6-Ф покинуть клетку. Г-6-Ф может превращаться по следующим направлениям:
1, Наличие глюкозо-6-фосфатазы в клетках печени и почек обеспечивает выделение этими органами свободной глюкозы в кровеносное русло.
2. Г-6-Ф может превращаться в гликоген через Г-1-Ф и УДФ-глюкозу.
3. Г-6-Ф может превращаться в глюко-замин и глюкуроновую кислоту, которые необходимы для биосинтеза компонентов межклеточного вещества — гликозамингликанов, а глюкуроновая кислота участвует во второй фазе обезвреживания ксенобиотиков в виде УДФ-глюкуроновой кислоты (образование парных соединений для повышения гидрофильности выводимых веществ).
517
Глава 33 Взаимосвязи в обмене веществ
4. Г-6-Ф может превращаться в реакциях пентозофосфатного пути обмена углеводов. При этом образуются пентозофосфаты и затем фосфорибозилпирофосфат, необходимый для биосинтеза нуклеотидов и нуклеиновых кислот (процессы физиологической и репаративной регенерации тканей). Кроме того, образуемый НАДФН необходим для ряда биосинтезов (холестерола, жирных кислот и др.), а также используется в реакциях антиоксидантной защиты при свободнорадикальном повреждении клеток.
5. Г-6-Ф может превращаться в специфическом пути реакций от глюкозы до пирувата и затем в реакциях общего пути катаболизма.
Следующим важным пунктом переключения является пируват, который может метаболизироваться по следующим направлениям;
1. Реакции карбоксилирования пирувата ведут к образованию оксалоацетата (щавелевоуксусная кислота, ЩУК).
2. Реакции окислительного декарбоксилирования пирувата обеспечивают образование ацетил-КоА.
3. В реакции, катализируемой аланинаминотрансферазой (АлАТ), из пирувата образуется аланин.
4. От пирувата начинается комплекс ферментативных реакций первого обходного пути глюконеогенеза, ведущий к образованию фосфоенолпирувата (обращение пируваткиназной реакции).
Наиболее интересным пунктом переключения является ацетил-КоА:
1. Ацетил-КоА образуется из пирувата (углеводы), из жирных кислот ((3-окисление), из кетогенных аминокислот и из глицерола.
2. Ацетил-КоА, конденсируясь с окса-лоацетатом, вступает в цикл трикарбоновых кислот, в котором ацетильная группа полностью «сгорает», поставляя атомы водорода в митохондриальные
цепи переноса протонов и электронов, а также выделяя углекислый газ.
3. Ацетил-КоА может карбоксилиро-ваться и превращаться в малонил-КоА и далее в жирные кислоты.
4. Три молекулы ацетил-КоА конденсируются и ведут к образованию ГМГ-КоА, а затем кетоновых тел или через мевалонат-КоА обеспечивают синтез холестерола.
Синтез жирных кислот и холестерола требует НАДФН, а синтез кетоновых тел не требует восстановительных эквивалентов, т. е. НАДФН.
Среди метаболитов цикла трикарбоновых кислот большинство являются узлами переключения. Это неудивительно, исходя из того, что этот цикл является третьей стадией катаболизма и первой стадией анаболизма.
Особый интерес представляет 2-ок-соглутарат (а-кетоглютаровая кислота). Восстановительное аминирование 2-оксоглутарата ведет к образованию глютамата. Окислительное дезаминирование глутамата (фермент глутаматдегидрогеназа) ведет к образованию 2-оксоглутарата. Если учесть, что глутамат в реакциях трансаминирования собирает аминогруппы от различных аминокислот, можно констатировать роль 2-ок-соглутарата как триггера в системе общий путь катаболизма фонд аминокислот.
Оксалоацетат (щавелевоуксусная кислота) может получаться при карбоксилировании пирувата или при трансаминировании аспартата. Это соединение необходимо для включения ацетил-КоА в цикл трикарбоновых кислот или для превращений в реакциях глюконеогенеза.
Как правило, ферменты, катализирующие превращения метаболитов в пун
518
Взаимосвязи в обмене вешеств Глава 33
ктах переключения, являются регуляторными. Их активность может регулироваться аллостерически (если фермент имеет аллостерический центр) методами форакгивации или ретроингибирования, химической модификацией (чаще фос-форилированием-дефосфорилированием) гормонами и биорегуляторами. Кроме того, может изменяться количество ферментов (например, глюкокортикоиды стимулируют биосинтез ключевых ферментов глюконеогенеза).
Различные метаболические процессы, обеспечивающие движение, трансмембранный транспорт и биосинтезы, требуют источников энергии. Известно, что ГТФ чаще используется в биосинтезе белков, ЦТФ — липидов и УТФ — углеводов. Однако универсальным источником и аккумулятором энергии является АТФ. Для многих восстановительных синтезов используется НАДФН.
Общим конечным путем для всех систем метаболизма являются цикл лимонной кислоты, или цикл трикарбоновых кислот (ЦТК) и реакции цепей переноса электронов и протонов. Эти протекающие в митохондриях процессы используются для координации целого ряда метаболических реакций на различных уровнях. Цикл трикарбоновых кислот является в клетке главным источником двуокиси углерода для реакций карбоксилирования, с которых начинается синтез жирных кислот и глюконеогенез; та же двуокись углерода поставляет углерод для мочевины и некоторых звеньев пуриновых и пиримидиновых колец. Взаимосвязи между процессами углеводного и азотистого обмена также достигаются посредством промежуточных продуктов цикла трикарбоновых кислот (2-оксог-лутарат *--* глутамат; оксалоацетат *—* аспартат; сукцинат <--*• гем). Участие аспартата в цепи метаболических реакций от цитруллина до аргинина и в образовании фумарата обеспечивает непосред
ственную связь между участком цикла трикарбоновых кислот от фумарата до оксалоацетата (продукция 2,5 АТФ) и цикла мочевины, использующего эти молекулы АТФ для синтеза одной молекулы мочевины.
На уровне энергетического обмена
Для общего пути катаболизма особое значение имеют НАДН и адениловые нуклеотиды (АТФ, АДФ, АМФ). Высокое содержание АДФ и низкое содержание АТФ свидетельствует о малом запасе энергии; при этом НАДН вовлекается в реакции цепей переноса протонов и электронов, обеспечивая усиление сопряженных реакций окислительного фосфорилирования. Обратное явление наблюдается при низком содержании АДФ и высоком содержании АТФ; ограничивая работу системы переноса электронов, они способствуют использованию НАДН в других восстановительных реакциях — таких, как синтез глутамата или глюконеогенез.
Внутриклеточные регуляторы метаболизма — витамины, будучи незаменимыми компонентами пищи, являются агентами, поддерживающими взаимосвязанные превращения веществ в интересах клетки и организма в целом.
Количественная характеристика
Количественная характеристика взаимопревращений белков, жиров и углеводов представлены на рис 33.1.
Рассматривая степень взаимопревращений белков, жиров и углеводов, необходимо, прежде всего, рассмотреть взаимопревращения аминокислот, жирных кислот и глюкозы. Рассмотрим возможные пути превращений:
1) синтез глюкозы из аминокислот (глюконеогенез) идет через фосфоенол-
519
Глава 33 Взаимосвязи в обмене вешеств
пируват (гликогенные аминокислоты — арг, асп, асн, цис, глу, глн, гли, гис, мет, про, сер, тре, три, вал); глюконеогенез усилен при голоде, стрессе, диабете;
2) синтез жирных кислот из аминокислот идет через ацетил-КоА (кетогенные аминокислоты — лей, лиз, фен, тир); при этом возможен синтез кетоновых тел через ацетоацетил-КоА;
3) синтез заменимых аминокислот из глюкозы путем восстановительного аминирования и трансаминирования с тремя кетокислотами (пируват, оксалоацетат и 2-оксоглутарат);
4) синтез жирных кислот из глюкозы (через ацетил-КоА) и глицерол через глицеральдегид-3-фосфат, это путь депонирования энергии;
5) жирные кислоты весьма слабо превращаются в углеводы;
6) жирные кислоты практически не превращаются в аминокислоты.
Важно отметить однонаправленность потока веществ в сторону липогенеза от углеводных или белковых источников через ацетил-КоА. Это главная причина старения и развития возрастной патологии (атеросклероз).
Поскольку в организме человека не существуют механизма, обеспечивающего превращение этого двухуглеродного фрагмента (ацетил-КоА) в трехуглеродные соединения, необходимые для глюконеогенеза или для образования заменимых аминокислот (аланин), обратный переход углерода жирных кислот в глюкозу или белки практически невозможен. Таким образом, можно ранжировать пути взаимопревращений глюкозы, аминокислот и жирных кислот: 4> 2> 1> 3> 5,6.
Взаимосвязи тканей и органов
Различные ткани и органы выполняют специализированные функции. Выполнение этих функций зависит от белковых констелляций клеток, а также от пластического и энергетического обеспечения этих функций.
Роль печени
Важную роль в осуществлении функций различных органов и тканей организма играет печень. Продуктом внеш
520
Взаимосвязи в обмене вешеств Глава 33
ней секреции является желчь, выделяемая печенью в желудочно-кишечный тракт. Это жидкость, содержащая конечные продукты обмена (желчные пигменты — билирубин, желчные кислоты, холестерол). Метаболиты, которые разносятся током крови, могут использоваться другими клетками: 1) глюкоза, секретируемая преимущественно во время голодания, под влиянием стимуляции глюкокортикоидами или глюкагоном, а также при усиленной мышечной деятельности; этим обеспечиваются потребности гликолиза в тканях мозга и мышц; 2) триацилглицеролы, освобождаемые после поступления в желудочно-кишечный
тракт углеводов или стимуляции инсулином и вносящие свой вклад, главным образом, в осуществление процессов липогенеза в жировой ткани; 3) кетоновые тела, образующиеся в избытке при голодании, а также при потреблении пищи, богатой жирами или бедной углеводами; это соединения, пригодные для использования в мышечной и нервной тканях в качестве источника энергии. Кроме того, печень ответственна за синтез и секрецию альбумина, сывороточных липопротеинов, факторов свертывания крови, мочевины и др. Схематически можно представить себе следующие взаимодействия печени с другими органами (рис. 33.2):
521
Глава 33 Взаимосвязи в обмене вешеств
Глюконеогенез в почках составляет лишь 10 % от печеночного, но его значение возрастает при патологии печени.
Роль кровеносного русла
Роль кровеносного русла (некоторые механизмы управления микроциркуляцией). Известны многочисленные факты того, что изменение гемодинамики на микроциркуляторном уровне может существенно влиять на метаболизм в тканях. Рассмотрим некоторые факторы, способствующие релаксации гладкой мускулатуры обменных сосудов и, таким образом, изменяющие интенсивность обмена газов и биомолекул в системе кровь *—► ткани. Кининовую систему образуют каллидин, брадикинин и метионил-лизилбрадикинин. Они обеспечивают регуляцию местного и общего кровотока, расслабляют гладкую мускулатуру сосудов, повышают проницаемость капиллярной мембраны и других мембран сосудистой стенки, оказывают провоспалительное действие.
При действии ряда факторов (фактор Хагемана и др.) в тканях и крови происходит активация неактивного предшественника калликреиногена в калликреин. Калликреины являются протеиназами типа трипсина, они разрывают пептидные связи, в образовании которых участвуют карбоксильные группы аргинина или лизина (протеолиз белков в широком смысле этого слова для этих ферментов не характерен). Эти ферменты отщепляют от предшественников кининов, связанных с а-2-глобулинами плазмы крови, активные кинины — каллидин и брадикинин. Брадикинин — это полипептид из 9 аминокислотных остатков, каллидин — лизил-брадикинин (10 аминокислотных остатков). Часть брадикинина может образоваться в результате отщепления лизина от каллидина при участии аминопептидазы. Содержание кининов в
плазме крови очень низкое (например, брадикинина 118 нмоль/л). Их действие кратковременное. Кинины инактивируются семейством ферментов — кининаз, обнаруживаемых в плазме крови и практически во всех тканях.
Роль оксида азота (NO) как эндотелиального расслабляющего фактора. Вазодилататоры (например, ацетилхолин, брадикинин) действуют благодаря релаксации гладкой мускулатуры стенок кровеносных сосудов. Однако, они не действуют прямо на мышечные клетки. Было показано, что вазодилататоры вначале взаимодействуют с эндотелиальными клетками в малых кровеносных сосудах через рецепторы, которые сопряжены с фосфатидилинозитольным механизмом поступления ионов кальция в цитозоль (действие инозитол-3-фосфа-та). Повышение внутриклеточной концентрации ионов кальция сопровождается освобождением endothelium derived releasing factor (EDRF), который диффундирует в мышечные клетки и ведет к активации в цитозоле гуанилатцикла-зы, повышающей уровень цГМФ. Этот внутриклеточный посредник стимулирует активность ряда цГМФ-зависимых протеинкиназ, которые фосфорилируют специфические мышечные белки, ответственные за релаксацию. Известный коронарный вазодилататор — глицеролтринитрат, используемый для расширения коронарных сосудов при стенокардии, повышает внутриклеточный уровень EDRF. Оказалось, что EDRF — это газ NO (оксид азота). NO образуется при действии NO-синтазы, которая в цитозоле клеток эндотелия активируется ионами кальция.
NO-синтаза
Аргинин —► Цитруллин+NO
При введении глицеролтринитрата (нитроглицерина) NO образуется в цепи реакций: глицеролтринитрат нитрат -*
522
Взаимосвязи в обмене вешеств Глава 33
нитрит -* NO. NO является короткоживущим веществом, его период полужизни в тканях около 4 секунд (реагирует с кислородом и супероксидным радикалом). Его активность ингибируется гемоглобином и другими белками с которыми NO связывается прочной связью. Введение ингибиторов NO-синтазы ведет к выраженному вазоконстрикторному эффекту. NO играет важную роль в регуляции кровообращения. Дополнительно посредством повышения синтеза цГМФ он действует как ингибитор агрегации тромбоцитов и адгезии. Показано, что NO является важным мессенджером в нервной системе. Считают, что NO участвует в глутаматергических синапсах (образуется после синаптической передачи, диффундирует из синапса и в соседних структурах — пресинаптичес-кие терминали, отростки астроцитов — повышает уровень цГМФ). В определенных периферических нервах NO может быть нейротрансмиттером. Давно известно, что многие интермедиаты цикла мочевины присутствуют в ткани мозга. Однако, орнитинтранскарбамоилаза, которая катализирует синтез цитруллина из орнитина и карбамоилфосфата, отсутствует. Из вышеприведенного понятно, что в мозге цитруллин является продуктом NO-синтазной реакции.
Водорастворимые витамины модулируют сигнальные и токсические эффекты оксида азота. Показано, что тиольная форма тиамина и лей-ко-формы рибофлавина способны высвобождать оксид азота из состава S-нитрозоглутатиона, а также S-нитрозоальбумина и S-нитро-зогемоглобина. Тиамин и, особенно его гидрофобные производные тиохром и оксоди гидротиохром, являются ловушками пероксинитрита, разрушают токсичные оксоферрильные формы гемопро
теинов. Тиамин и его гидрофобные метаболиты, по мнению И. И. Сте-пуро (2007), могут выполнять важную защитную роль при окислительном стрессе. Тиамин и его метаболиты защищают сосуды и нейроны, ингибируют реакции NO-зависимого нитрования тирозина и образования дитирозина, а также межбелковых сшивок тирозин-ти-розин.
Уровень дитирозина и нитротирозина в составе сывороточного альбумина является долговременным маркером окислительного и нитрозильного стресса.
Заканчивая этот раздел, можно сделать еще одно заключение: газы внутренней среды организма могут выступать в качестве связующих интеграционных агентов. Так, на уровне целостного организма транспорт эритроцитами и плазмой крови углекислого газа и кислорода обеспечивает тип окислительных процессов в тканях (аэробные или анаэробные превращения). На межклеточном уровне информационную и запускающую роль выполняет NO. А внутри клетки двуокись углерода совместно с биотином обеспечивает функционирование ряда важнейших метаболических процессов (синтез мочевины, жирных кислот, азотистых оснований нуклеотидов и др.).
Роль эндокринной системы
Роль эндокринной системы (на примере регуляции внутриклеточной концентрации цАМФ). Инсулин — единственный гормон гипогликемического действия.
1. После связывания инсулина с мембранным рецептором повышается поступление в клетку мономерных молекул,
523
Глава 33 Взаимосвязи в обмене вешеств
необходимых для третьей стадии анаболизма, т. е. для биосинтеза биополимеров (глюкозы для биосинтеза гликогена, аминокислот для биосинтеза белков и жирных кислот для липогенеза).
2. После интернализации инсулина проявляется его активирующее действие минимум на две группы ферментов: а) на ферменты, обеспечивающие образование Г-6-Ф и его превращения в специфическом пути до пирувата и далее до конечных продуктов с образованием АТФ; б) на фосфодиэстеразу, приводящую к снижению внутриклеточной концентрации цАМФ (следствием является преобладание дефосфорилирован-ных форм ферментов, в том числе гли-когенсинтазы а, катализирующей удлинение цепей гликогена).
Пять основных факторов обеспечивают комплекс анаболических эффектов инсулина:
1) повышенный поток метаболитов в клетку (в норме после всасывания продуктов переваривания пищи);
2) эффективная деятельность пунктов переключения метаболических путей, что обеспечивает эффективную взаимосвязь разных обменов;
3) целесообразное сочетание запасания энергетических ресурсов клетки (глико-геногенез, липогенез) с выработкой АТФ;
4) усиление пентозофосфатного пути превращения углеводов дает повышенную продукцию пентозофосфатов, необходимых для биосинтеза нуклеотидов, а также НАДФН для восстановительных биосинтезов (холестерол, жирные кислоты) и борьбы с деструктивными эффектами свободных радикалов;
5) стимуляция процессов репликации ДНК (деление клеток), транскрипции и трансляции (биосинтез белков).
Глюкагон — гормон, который предназначен для мобилизации энергетических
и пластических ресурсов клетки. После его связывания с мембранными рецепторами в клетке повышается концентрация цАМФ. Это ведет к гликогенолизу, липолизу, преобладанию протеолиза над биосинтезом белков и относительному повышению интенсивности глюконеогенеза из освободившихся в результате протеолиза белков аминокислот. Гормон действует между приемами пищи, когда концентрация глюкозы, а вероятно, и других мономерных молекул, необходимых для биосинтеза биополимеров, снижается.
Повышение внутриклеточной концентрации цАМФ сопряжено с мобилизацией энергетических ресурсов клетки; снижение концентрации цАМФ клетки связано с депонированием топливных молекул.
Соматотропин обеспечивает рост организма до периода полового созревания. Для обеспечения роста необходимо:
1) увеличение размеров скелета, что зависит от наличия хрящевых зон роста в костях;
2) соответствующий увеличению скелета рост внутренних органов и коммуникаций (нервных стволов и кровеносных сосудов);
3) необходимое энергетическое и пластическое обеспечение роста организма
Исходя из этого можно утверждать, что теоретически соматотропин должен одновременно сочетать в себе функции глюкагона (мобилизация энергетических и пластических ресурсов клетки, сопряженная с повышением внутриклеточной концентрации цАМФ) и инсулина (комплекс анаболических эффектов, сопряженный со снижением внутриклеточной концентрации цАМФ).
Фактически соматотропин обладает двумя типами эффектов:
524
Взаимосвязи в обмене вешеств Глава 33
1. Прямое действие, связанное с активацией аденилатциклазного механизма {повышение внутриклеточной концентрации цАМФ) и ведущее к мобилизации жира в липоцитах. При этом образующиеся жирные кислоты в печени: а) при 0-окислении дают повышенное количество ацетил-КоА; б) тормозят гликолиз, что сохраняет подвижные резервы гликогена. Ацетил-КоА в общем пути катаболизма обеспечивает образование АТФ, а также может использоваться в различных биосинтезах.
2. Опосредованное действие через инсулиноподобные ростовые факторы IGF-1, IGF-2. 1GF-1 обеспечивает обмен хрящевой ткани и как следствие увеличение скелета; IGF-2 обладает большим комплексом митогенных и анаболических эффектов.
Интегральное представление о метаболизме
(по В. Н. Титову, С. Ф. Дугину и В. В.
Крылину, 2007)
Можно ли получить интегральное представление о состоянии метаболизма у конкретного человека? Для этого необходимо учесть следующие методологические подходы (табл. 33.1).
Геномика — это анализ генома, выявление спонтанных мутаций — замена нуклеотидов в структуре ДНК гена (субституция), отсутствие отдельных нуклеотидов и генов (делеция) или нарушение структуры гена путем инверсии фрагментов ДНК. Основу геномики составляет расшифровка генома человека. Геномика дала теоретическое обоснование и конкретные методические приемы, в том числе и автоматизированные, для поиска мутаций в отдельных генах (моногенная патология), которые являются этиологическими факторами врожденных нарушений метаболизма, формирующих фенотипические проявления — клинические симптомы. Геномика выявляет возможные дефекты на пре- и трансляционном уровне, которые предшествуют передаче генетической информации с ДНК на РНК, синтезу информационной мРНК. В одиночной диплоидной клетке содержится 6 пг геномной ДНК. Для работы с таким количеством ДНК требуется ее амплификация (применение методов полимеразной цепной реакции). Для изучения нуклеотидной последовательности генов применяют высокоспецифичные рестриктазы, позволяющие «разрезать» полинуклео-тидные цепи ДНК в строго определенных местах. Затем проводится анализ
Таблица 33.1. Современные подходы, позволяющие получить интегральное представление о состоянии метаболических процессов в организме
Изучаемые вещества и процессы Разделы современной биохимии
ДНК Геномика
1 4
РНК Транскрип томика
1 4
Белки Протеомика
4 4
Метаболиты Метаболомика
525
Глава 33 Взаимосвязи в обмене веществ
фрагментов ДНК с использованием различных аналитических физико-химических методов. Проверка правильности проведенного анализа производится путем изучения продуктов экспрессии изучаемых генов.
Наличие мутаций в генах еще не является условием того, что это найдет отражение в спектре и свойствах белков-исполнителей. При ненарушенном считывании генетической информации и синтезе мРНК (транскриптомика) последующие процессы репликации с мРНК белков-исполнителей физиологических функций (ферменты, транспортные протеины, регуляторные факторы белковой природы и др.) у всех индивидуумов количественно адекватны потребностям организма. Нарушения синтеза мРНК могут играть ключевую роль в изменении процессов трансляции, т. е. синтеза белков. В настоящее время производятся микрочипы, с помощью которых можно одновременно определять синтез мРНК более чем для тысячи индивидуальных протеинов.
Геном — это совокупность всех генов in vivo, протеом — совокупность всех белков. Набор генов в каждой клетке организма один и тот же; набор белков в каждой из клеток индивидуален.
Количество белков в клетках в тысячи раз превосходит число генов. В отличие от генома протеом меняется в соответствии с состоянием клеток, поскольку белки реагируют как на внешние воздействия, так и на изменения в самих клетках. Заболевание может быть инициировано внешними факторами, однако суть патологического процесса определяет нарушение функции белков. Протеомика это комплекс методических приемов, которые в клинико-диагностических лабораториях используют для оценки состава протеинов
в биологических средах (плазма крови, моча, спинномозговая жидкость, содержимое плевральных полостей, транссудат или экссудат): 1) определение количества того или иного белка в образце; 2) идентификация белка; 3) уточнение первичной структуры белка; 4) определение посттрансляционных модификаций.
Протеомика основывается на 2-х этапном анализе: 1) как можно детальное разделение белков биологического объекта и 2) их количественная оценка. Протеомика возникла на основе двумерного электрофореза в полиакриламидном геле, когда удается увидеть белковый спектр биологического объекта в виде отдельных пятен. Шагом вперед явилась комбинация этого метода с чувствительным методом детекции масс-спектрометрией. Протеомика изучает не только изоформы белков, но и особенности их фолдинга, т. е. приобретания нативной конформации. В общем, протеомика изучает локализацию белков в клетке, обеспечивает идентификацию отдельных белков, определение их структуры и определяет характер белок-белковых взаимодействий в норме и при патологии.
Метаболомика — комплекс методических приемов, которые позволяют оценить состояние метаболизма в клетках и на уровне целостного организма в норме и при патологии на основании одновременного количественного определения в биологических средах комплекса аналитов — субстратов, метаболитов и катаболитов. В рамках метаболомики используют технологии спектроскопии ядерного магнитного резонанса (ЯМР), позволяющие одновременно измерить множество различных молекул в биологических жидкостях. Так, при анализе образцов крови, полученных из коронарных артерий при ангиографии методом анализа спектров
526
Взаимосвязи в обмене вешеств Глава 33
600 МГц протонного ЯМР выявлены относительные уровни 32000 низкомолекулярных метаболитов. Их анализ требует применения регрессионного и дискриминантного методов обработки цифрового материала. Исследование включает 3 этапа: 1) сбор данных; 2) обработка данных (отбор значимых констелляций показателей — в приведенном примере до 256); 3) создание «метаболического портрета» и сравнение его с нормой.
Будущее контроля профилактики, диагностики и лечения заболеваний базируется на функциональном и диагностическом единстве геномики, транскриптомики, протеомики и метаболомики:
1) геномика позволяет получить весь объем биологической и медицинской информации, накопленной на разных ступенях филогенеза и сохраненной в генофонде, ее структурную и физиологические основы;
2) тран скриптом и ка (функциональная геномика) дает информацию о функциональной активности генов в плане синтеза специфичных белков;
3) протеомика в форме определения масс-спектров белковых молекул позволит оценить их количественно или ис-чезновение/появление новых белковых молекул;
4) метаболомика (функциональная протеомика) дает комплексную, количественную оценку субстратов, промежуточных продуктов метаболизма и биологических средах.
В настоящее время в клинико-диагностических лабораториях оценка метаболизма производится пока по ограниченному числу биохимических скрининговых тестов.
Основные биохимические скрининговые тесты
В настоящее время для выявления изменений в состоянии тканей или про
цессов используют следующие биохимические показатели (табл. 33.2).
Основные биохимические лабораторные показатели
Аланинаминотрансфераза (АлАТ, Ь-аланин-2-оксогл утарат-аминотрансфераза, КФ 2.6.1.2.) катализирует обратимый перенос аминогруппы аминокислот на пировиноградную кислоту с образованием аланина. Фермент локализован в микросомальной фракции гепатоцитов, присутствует в цитозоле и митохондриях клеток печени, мышц и почек. АлАТ— специфический маркер снижения функции печени. Отношение содержания в клетках и плазме крови 104:1. Повышение фермента в плазме крови начинается после поражения 2 % паренхимы печени.
Цель исследования-. 1) диагностика острого гепатита; 2) дифференциальный диагноз гепатита и инфаркта миокарда; 3) дифференциальный диагноз гепатита и панкреатита; 4) мониторинг хронического гепатита.
Сыворотка: 0,10—0,68 ммоль/(ч*л); (старые единицы 7—40 Ед/л)
Альбумин (группа белков) синтезируется в печени и составляет 55—65 % от общего белка плазмы крови. Функции: 1) резервный белок — источник аминокислот; 2) поддерживает онкотическое давление (при снижении — отеки); 3) неспецифический транспортер метаболитов, ксенобиотиков, лекарств (при снижении концентрации альбумина суживается терапевтический диапазон доз лекарств). Средняя продолжительность жизни альбумина плазмы 19— 21 сутки. Ежесуточный объем синтеза альбумина 200 мг/кг (около 14 г/сутки). Это соответствует ежесуточному катаболизму 200— 250 мг/кг. Общее содержание альбумина в организме 300 г, из которых 40 % находится в сосудистом русле. Скорость синтеза зависит от наличия и доступности протеиногенных аминокислот, онкотического давления плазмы, концентрации ингибирующих цитокинов (особенно интерлейкина-6) и числа функционирующих гепатоцитов. Концентрация альбумина — маркер декомпенсации и прогноза при циррозе печени.
Цель исследования'. 1) диагноз заболеваний печени, почек, пищеварительного тракта, развития опухолей; 2) выявление нарушений обмена белков.
527
Глава 33 Взаимосвязи в обмене веществ
Таблица 33.2. Скрининговые биохимические тесты
№ Показатель Ткань, процесс
1 АсАТ (аспартатаминотрансфераза) миокард
2 ЛДГ (лактатдегидрогеназа)
3 АлАТ (аланинаминотрансфераза) печень
4 Билирубин
5 Мочевина | почки
6 Креатинин
7 ГГТ (гама-глутамилтрансфераза) желчевыводящие протоки
8 ЩФ (щелочная фосфатаза)
9 альфа-Амилаза поджелудочная железа
10 Холестерин (холестерол) обмен липидов
11 альфа-Холестерин (холестерол-ЛПВП)
12 Триглицериды (триацилглицеролы)
13 Глюкоза обмен углеводов
14 Белки гидратация
15 Альбумин синтез белков
16 Мочевая кислота обмен пуринов, антиоксиданты
17 C-Реактивный протеин воспаление
18 Кальций метаболизм, кости, паратгормон,
19 Фосфаты кальцитонин
20 Натрий водно-солевой обмен
21 Калий
Примечание:
1. В диагностические лабораторные панели вносят показатели, характерные для пораженных тканей или процессов.
2. Для создания «метаболического портрета» обследуемого следует определить весь спектр тестов.
Сыворотка: 35—50 г/л (у новорожденных 28—44 г/л, за первую неделю жизни достигает 37—50 г/л, к 6 годам увеличивается до 45— 54 г/л).
«-Амилаза (1,4-а-D-глюкан-4-глю каногид -ролаза, КФ 3.2.1.1) секретируется слюнными железами (изоферменты S-амилазы) и поджелудочной железой (изоферменты Р-амилазы). На три S-изофермента амилазы приходится 57 %, на Р-фермент приходится 43 %. Фермент катализирует гидролиз а-1,4-гликозидных связей крахмала и олигосахаридов. Фермент обнаруживается в поджелудочной железе, слюнных железах, плаценте, печени, легких,
молоке, поте, фаллопиевых трубах. Воспалительные заболевания этих желез или обструктивные процессы в протоках вызывают выход фермента в кровь и повышают его экскрецию с мочой. Сыворотка: по Смиту, Рою 16—30 г (ч*л); 4,4—8,3 мг/(с*л); Phadebas Amylase Тей 70—300 ед/л. Моча: по Смиту, Рою до 160 г/ (чхд); до 44 мг/(схл). Дуоденальное содержимое: 1,7—4,4 г/(с*л).
Аспартатаминотрансфераза (АсАТ, L-acnap-тат:2-оксоглутарат-аминотрансфераза, КФ 2.6.1.1) катализирует обратимый перенос аминогруппы аминокислоты на шавелевоуксусную кислоту с образованием аспарагиновой кисло
528
Взаимосвязи в обмене вешеств Глава 33
ты. По убыванию концентрации фермента в цитозоле клеток органы располагаются в последовательности: сердце, печень, скелетные мышцы, почки, мозг, поджелудочная железа, селезенка, легкие. АсАТ гепатоцитов располагается в цитозоле (микросомах) — 60 % активности и в митохондриях — 40 % активности. В сыворотке крови в норме определяется микросомальный изофермент и не определяется митохондриальный. Фермент участвует в обмене аминокислот (первый этап непрямого дезаминирования аминокислот) и углеводов (глюконеогенез). Период полужизни общей АсАТ в кровеносном русле 17±5 ч, а митохондриального изофермента — около 87 ч. Поскольку АсАТ локализована в цитозоле и митохондриях, а Ал АТ — преимущественно в цитозоле, повышение активности первого фермента характерно для некротических поражений гепатоцитов, а второго — для заболеваний с нарушением проницаемости мембран гепатоцитов.
Цель исследования'. 1) для дифференциального диагноза острых и хронических заболеваний печени, потребления этанола; 2) лабораторное обоснование прогноза заболеваний печени и сердца; 3) для диагноза инфаркта миокарда (корреляция с активностью креатин-киназы и лактатдегидрогеназы); 4) диагноз миопатий; 5) дифференциальный диагноз заболеваний гепатобилиарной системы и поджелудочной железы.
Сыворотка: 0,10—0,45 ммоль/(ч*л); (старые единицы 5 ”30 Ед/л)
Белок общий включает сумму белков плазмы крови (сыворотка крови без фибриногена), мочи, спинномозговой жидкости и других биологических жидкостей.
Сыворотка, г/л: кровь из пуповины 47—80, недоношенные массой меньше 1,5 кг 32—56, больше 1,5 кг 36—60, доношенные новорожденные 48“73, 1 неделя 45—76, 1—6 месяцев
47—70, 7—12 месяцев 51—72, 1—4 года 61—75, 5—7 лет 52—78, 8—15 лет 58~76, взрослые 65— 85, старше 60 лет снижение на 2,0 (табл. 33.3).
Повышенное содержание, сыворотка — гипе-риммуноглобулинемия, макроглобулинемия, дегидратация, синдром Шегрена, венозный стаз.
Сниженное содержание: сыворотка — потеря белка при гастроэнтеропатиях, острых ожогах, нефротическом синдроме; снижение биосинтеза белка при тяжелой белковой недостаточности, хронических заболеваниях печени, синдроме нарушенного всасывания, агаммаглобулинемии; перитоните, пернициозной анемии.
Билирубин образуется из гема гемоглобина разрушенных эритроцитов (80 %), из гемсодер-жащих белков печени (15 %) и в результате неэффективного эритропоэза (5 %). Из I г гемоглобина возникает 36 мг билирубина; ежедневная продукция билирубина составляет 6,8 мкмоль/кг (4 мг/кг). Образованный непрямой билирубин транспортируется в комплексе с альбумином (1 : 1). В гепатоцитах непрямой билирубин конъюгируется с глюкуроновой кислотой (УДФ-глюкуронилтрансфераза, КФ 2.4.1.17) с образованием гидрофильных моно-и диглюкуронидов (прямой билирубин). Период полужизни непрямого билирубина меньше 5 минут.
Цель определения: 1) оценка функционального состояния гепатобилиарной системы и эритропоэза; 2) дифференциальный диагноз желтух и контроль их развития; 3) диагноз закупорки желчевыводящих путей и гемолитической анемии; 4) мониторинг развития ядерной желтухи у новорожденных при наличии гемолитического заболевания.
Сыворотка: конъюгированный, связанный, прямой билирубин 2,2—5,1 мкмоль/л, общий 8,5—20,5 мкмоль/л. В последние годы счита
Таблица. 33.3. Белковые фракции сыворотки крови
1 Фракция % (окраска - бромфеноловый синий) г/л
Альбумины 58 (53,9-62,1) 35-50
а,-глобул ины 3,9 (2,7-5,1) 2,3-4,2
аг-глобулины 8,8 (7,4-10,2) 5,4-10,0
р-глобул ины 13,0 (11,7-15,3) 6,0-12,0
/-глобулины 18,5 (15,6-21,4) 6,0-15,0
' Зак. 2124
529
Глава 33 Взаимосвязи в обмене вешеств
ют, что у здорового человека прямой билирубин не должен превышать 1,7 мкмоль/л (1,0 мг/л).
у-Глутамилтранефераза (ГГТ, глутамилтранспептидаза, КФ 2.3.2.2) катализирует перенос гамма-глутамильной группы от гамма-глута-мил-пептидов на другие пептиды, L-амино-кислоты или воду. Является ключевым ферментом трансмембранного переноса аминокислот и пептидов. Фермент локализуется в плазматических мембранах клеток, характеризующихся высокой абсорбционной или секреторной активностью: лейкоциты, эритроциты, печень, почки, кишечник, предстательная железа, мозг, а также в биологических жидкостях — плазме крови, спинномозговой жидкости, сперме. В сыворотке крови фермент связан ЛПВП и ЛПНП. Согласно V. Marks et. al. (2002), комплекс ГГТ-ЛПВП повышен при безжелтушных формах заболеваний печени, а при холестатических нарушениях — повышен комплекс ГГТ-ЛПНП. Водорастворимая форма ГГТ (20 %) повышается при других заболеваниях. Активность ГГТ изменяется аналогично изменениям щелочной фосфатазы, лейцинаминопептидазы и 5-нуклеотидазы. Наиболее чувствительный индикатор и надежный скрининговый тест при алкоголизме. ГГТ используется в качестве маркера рака поджелудочной железы, рака предстательной железы и гепатомы (оценка ремиссии и рецидивов). Определение ГГТ является более чувствительным индикатором заболеваний печени у детей, чем щелочная фосфатаза. ГГТявляется маркером поражения мембран гепатоцитов.
Цель определения: 1) оценка состояния печени; 2) диагноз и мониторинг алкогольной болезни; 3) дифференциальный диагноз между заболеваниями скелетных мышц и печени,
если повышена активность сывороточной щелочной фосфатазы.
Сыворотка: 0,6—3,96 ммоль/(чхл); м. 15— 106 мкмоль(минхд), 250—1770 нмоль/(с*л)), < 0,53 мккат/л; ж. 10—66 мкмоль/ (мин*л), 167—1100 нмоль/(схл), < 0,82 мккат/л; спинномозговая жидкость 0—0,005 ммоль/(схд). У новорожденных значения в 3—5 раз выше.
Глюкоза — транспортная форма энергии, поступает с пищей, синтезируется в клетках тканей человека в глюконеогенезе (из аминокислот), превращается в резервную форму — гликоген, а также в жир. Содержание глюкозы регулируется: снижение — инсулин и адреналин (2-я фаза эффекта); повышение — глюкагон, адреналин, глюкокортикоиды, тироксин, кортикотропин, соматотропин, соматостатин. Концентрация глюкозы изменяется при стрессе, возбуждении, травме, физических упражнениях; зависит от диеты. Пероральный тест толерантности к глюкозе представлен в табл. 33.4.
Цель исследования: 1) диагноз сахарного диабета; 2) мониторинг диетических и лекарственных воздействий при диабете; 3) контроль развития гипогликемии; 4) контроль интенсивной терапии.
Содержание глюкозы в капиллярной крови 3,3—5,5 ммоль/л, в венозной плазме 3,5— 6,4 ммоль/л.
Креатинин — продукт метаболизма креатинфосфата (метаболит энергетического обмена мышц), выделяющийся из организма путем фильтрации в почечных клубочках и не подвергающийся реабсорбции. Концентрация креатинина в крови и моче зависит от массы мышц, диеты и других факторов. Для оценки гломерулярной функции почек исследуют клиренс креатинина. Экскреторная функция почек повышается в вечерние и ночные часы; ежел-
Таблица 33.4. Значения концентрации глюкозы в тесте, толерантности
Заболевание и срок исследования Венозная кровь Капиллярная кровь Венозная плазма Капиллярная плазма
Сахарный диабет:
натощак, ммоль/л >6,7 >6,7 >7,8 >7,8
через 2 часа, ммоль/л >10,0 >11,1 >11,1 >12,2
Нарушение толерантности
к глюкозе:
натощак, ммоль/л <6,7 <6,7 <7,8 <7,8
через 2 часа, ммоль/л 6,7-10,0 7,8-11,1 7,8-11,1 8,9-12,2
530
Взаимосвязи в обмене веществ Глава 33
невные колебания уровня креатинина достигают 15—20 %.
Цель определения: 1) оценка фильтрационной функции почек при различных патологических состояниях; 2) мониторинг заболеваний почек, действия нефротропных веществ; 3) оценка усиленного синтеза белков (плазмоцитома); 4) до- и послеоперационный мониторинг метаболизма и функции почек; 5) осложненное течение беременности, развитие опухолей, урогенитальные заболевания.
Содержание в сыворотке крови SO-115 мкмоль/л (мужчины) и 53—97 мкмоль/л (женщины).
Кальций — внеклеточный катион, принимающий участие в регуляции обмена веществ в качестве внутриклеточного посредника непроникающих в клетку гормонов (адреналин, гормоны белково-пептидной природы). Концентрация кальция повышается паратгормоном и витамином D (активная форма — кальцитри-ол, образуется в почках) и снижается кальцитонином. Повышение концентрации кальция сопряжено с гипотонией, снижение — с повышением тонуса мышц вплоть до судорог. Половина циркулирующего кальция представлена активной ионизированной формой; 99 % кальция локализуется в костях, 1 % кальция составляет обменный фонд. Уровень кальция в плазме крови зависит от 1) поступления с пищей; 2) всасывания кальция в кишечнике (регулирует кальцитриол); 3) выделения с мочой; 4) обмена кальция в костной ткани. Диагностическое значение имеет определение ионизированного кальция.
Цель исследования: 1) оценка нарушений нервно-мышечного аппарата, скелета и гормональной регуляции; 2) уточнение механизма аритмий, нарушений свертывания крови и кислотно-основного состояния; 3) диагноз дисфункции паращитовидных желез; 4) определение гиперкальциемии в опухолевой трансформации тканей.
Содержание в сыворотке крови 2,15— 2,55 ммоль/л (общий кальций) и 1,13— 1,32 ммоль/л (ионизированный кальций).
Лактатдегидрогеназа (ЛДГ, L-лактат: НАД-оксидоредуктаза, КФ 1.1.1.27). Конечный фермент анаэробного превращения глюкозы до молочной кислоты (освобождение энергии). Этой же реакцией начинается глюконеогенез из молочной кислоты (синтез глюкозы). Состоит из 4-х субъединиц двух типов — М (muscle) и Н (heart).
Различное сочетание субъединиц образует 5 изоферментов, причем ЛДГ[ и ДДГ2 характеризуют повреждение сердечной мышцы, а ЛДГ4 и ЛДГ5 — мышц и печени (табл. 33.5). Повышение активности ЛДГ в инкубационной среде (при культивировании клеток) или в плазме крови in vivo является тестом клеточной гибели.
Цель исследования: 1) диагноз инфаркта миокарда, заболеваний печени; 2) дифференциальный диагноз заболеваний сердца и гепатобилиарной системы; 3) маркер злокачественных опухолей; 4) дополнительный диагностический признак при заболеваниях мышц, гемолизе; 5) мониторинг химиотерапии.
Мочевая кислота — конечный продукт распада пуриновых нуклеотидов. Является важнейшим компонентом антиоксидантной системы. При pH ниже 5,75 выпадает в осадок (например кристаллы в суставной жидкости при воспалении, симптом подагры; выпадение кристаллов в кислой моче — уратные камни); при pH выше 5,75 присутствует в виде растворимой натриевой соли (урат натрия). Основная причина подагры — заболевания почек, ведущие к гиперурикемии. При ежедневном анализе выявлена вариабельность в пределах 10 %. Летом содержание мочевой кислоты выше, чем зимой. Мочевая кислота является независимым фактором риска ИБС. Наиболее часто требуется определение мочевой кислоты в связи с гиперлипидемией, ожирением, гипертензией, атеросклерозом, сахарным диабетом, ишемической болезнью сердца. На втором месте — диагностика заболеваний печени и почек, злоупотребление алкоголем. И на третьем месте — процессы, связанные с пролиферацией и распадом тканей (опухоли).
Цель исследования: 1) оценка функции и диагноз заболеваний сердца, печени и почек; 2) оценка азотистого баланса; 3) тест, корригирующий дифференциальный диагноз кома-
Таблица 33.5. Изоферменты ЛДГ
Объект исследования ЛДГ, мккат/л
ЛДГ общая активность <7,5
лдг, 0.17-0,36
лдг2 0,30-0,50
ЛДГ3 0,19-0,25
ЛДГ4 0,09-0,10
ЛДГ5 0,06-0,13
531
Глава 33 Взаимосвязи в обмене вешеств
тозных состояний и тактику интенсивной терапии.
Содержание в сыворотке крови: ISO-JO мкмоль/л.
Мочевина — это конечный продукт обезвреживания аммиака, образуемый в гепатоцитах и выводимый с мочой из организма. Аммиак поступает из кишечника, а также образуется в процессе дезаминирования аминокислот и дезамидирования аминов. В молекуле мочевины имеется 2 атома азота, первый из которых — это азот обезвреживаемого аммиака, а второй атом азота — из фонда аминокислот печени. Поэтому синтез мочевины из аммиака будет нарушен, если нарушены ферментативные процессы метаболизма аминокислот в печени (аминотрансферазы и особенно Ал АТ и АсАТ, глутаматдегидрогеназа). Часть мочевины экскретируется с потом и калом. Концентрация мочевины зависит от степени использования глутамина для биосинтезов (быстроделягциеся клетки эпителия кишечника, опухолей и др.). Таким образом, содержание мочевины в крови является результирующей величиной трех процессов: обмена белков и аминокислот, метаболизма печени (взаимодействие цикла мочевины и цикла трикарбоновых кислот через фумарат и АТФ) и функционального состояния почек. Мочевина легко распределяется в клеточных и межклеточных пространствах.
Цель исследования: 1) оценка функции почек и диагноз почечных заболеваний; 2) характеристика процессов гидратации и азотистого баланса; 3) дифференциальный диагноз коматозных состояний (печеночная кома) и определение тактики интенсивной терапии
Содержание в сыворотке крови: 2,5— 8,3 ммоль/л.
Натрий — внеклеточный катион, который участвует в поддержании осмотического давления, функционировании внеклеточных буферных систем, в электрогенезе мембран и проведении нервных импульсов, является важнейшим компонентом транспорта веществ против градиента концентрации (Na*, К+-за-висимая АТФ-аза), например, совместный транспорт глюкозы и натрия при всасывании продуктов переваривания. Концентрация натрия является важной характеристикой водносолевого обмена и регулируется ренин-ангио-тензин-альдостероновым механизмом. Альдостерон обеспечивает задержку натрия в организме в ответ на снижение объема цирку
лирующей крови и артериального давления. С перемещением натрия между клетками, межклеточным пространством и плазмой крови связаны перемещения ионов хлора и воды. Эти процессы координируются антидиуретическим гормоном гипофиза и атриальными натрийуретическими факторами.
Цель исследования: 1) оценка водно-солевого обмена, осмотических свойств биологических жидкостей; 2) диагноз и дифференциальный диагноз нервно-мышечных поражений; 3) диагноз и дифференциальный диагноз заболеваний сердца, почек и мочевыводящих путей; 4) мониторинг состояния пациента при интенсивной терапии.
Содержание в сыворотке крови 136— 145 ммоль/л; в эритроцитах 13,5 — 22,0 ммоль/л.
С-реактивный протеин — является одним из реактантов реакции острой фазы воспаления. Концентрация острофазных белков может повышаться — позитивная острофазная реакция) или снижаться (отрицательная острофазная реакция). Острофазные белки появляются в крови в ответ на воспалительную реакцию — инфекции, травмы, ожоги, оперативные вмешательства, некроз тканей). Белки острой фазы продуцируются гепатоцитами в течение 90 мин после негативного воздействия (каждый гепатоцит имеет индивидуальный спектр острофазных белков, выделяемых в ответ на действие основного цитокина реакции острой фазы — интерлейкина-6). Реактанты синтезируются после снижения концентрации антиреакгант-ных белков (преальбумин, альбумин, трансферрин). С-реактивный протеин связывает фосфо-рилхолин, активирует систему комплемента и регулирует опсонизацию (обеспечивает гибель микроорганизмов). Обычно процесс синтеза белков острой фазы начинается в отдельных гепатоцитах и затем распространяется на все дольки, что обеспечивает быстрое нарастание концентрации острофазных белков в крови. Все реактанты острой фазы являются гликопротеинами, за исключением С-реактивного белка и сывороточного амилоида А. С-реактивны* белок принимает участие в реакции острой фазы как медиатор воспаления и регулятор клеточного иммунитета. Наряду с острыми воспалительными процессами, С-реактивный бежк. является маркером воспаления, начальных сяж-дий атеросклеротического поражения сосуда* предиктором обострения ИБС.
532
Взаимосвязи в обмене вешеств Глава 33
Цель исследования: 1) оценка наличия и степени выраженности воспалительной реакции; 2) предсказание инфаркта миокарда (табл. 33.6).
Сыворотка: реакция преципитации в капиллярах со специфической антисывороткой отрицательна. В норме содержание 0,07—8,2 мг/л.
Триглицериды (триацилглицеролы) — нейтральные жиры, в форме которых в адипоцитах сохраняются долгосрочные резервы энергии. Синтезируются в тонком кишечнике, печени и адипоцитах. От кишечника транспортируются в составе хиломикронов через грудной лимфатический проток в кровь, от печени — в составе ЛПОНП (липопротеины очень низкой плотности, или пре-р-липопротеины). Триацилглицеролы этих транспортных форм липопротеинов подвергаются ферментативному гидролизу (липопротеинлипаза эндотелия) в капиллярах мышечной и жировой тканей. При ежедневном мониторинге находят индивидуальную вариабельность содержания триацилглицеролов 30 %; содержание триацилглицеролов выше у женщин в середине цикла.
Желательные уровни для взрослых 0,45— 1,81 ммоль/л (мужчины) и 0,40—1,53 ммоль/ л (женщины); по V. Marks et al. (2002) — меньше 1,6 ммоль/л.
Фосфор присутствует в плазме крови в виде солей (фосфаты). Необходим для минерализации костной ткани (85 %), зубов; участвует в функционировании фосфатной буферной системы, построении фосфорсодержащих молекул (нуклеотиды, нуклеиновые кислоты, креатинфосфат, фосфатидилхолин и др.), участвует в метаболизме в виде фосфорных эфиров метаболитов и кофакторов (глюкозо-6-фосфат, глицералвдепадфосфат, фосфоенол-пируват, тиаминпирофосфат, пиридоксальфосфат и др.). Фосфор поступает в организм вместе с глюкозой. Уровень фосфора определяется регуляцией паратгормоном (снижение канальце
вой реабсорбции фосфора в почках). Уровень фосфора обычно оценивают в связи с активностью щелочной фосфатазы, уровнем кальция в сыворотке, содержанием кальция и фосфора в моче. Фосфор всасывается в тонком кишечнике; ежедневные колебания уровня фосфора 5—10 %; летом содержание фосфора выше, чем зимой; наиболее низкий уровень у женщин во время менструации.
Цель исследования: 1) оценка кислотно-основного равновесия; 2) оценка функции почек; 3) диагноз дисфункции паращитовидных желез; 4) диагноз нарушений минерализации костей, функций мышечной системы.
Содержание неорганического фосфора в сыворотке — 0,646—1,292 ммоль/л; содержание липоидного фосфора (фосфолипиды) в сыворотке — 1,97—4,68 ммоль/л.
Холестерол (холестерин) — конечная молекула метаболизма, по уровню которой можно судить о состоянии обмена веществ. Поступившие в организм белки, жиры и углеводы в процессе метаболизма превращаются в ацетил-КоА, который 1) «сгорает» в цикле трикарбоновых кислот и дыхательных цепях митохондрий, обеспечивая продукцию АТФ; 2) превращается в жирные кислоты и триацилглицеролы при сниженных энерготратах и 3) превращается в холестерол. На базе молекулы холестерола формируются мембраны (определяет жесткость мембран), минералокортикоиды (поддерживают водносолевой обмен), глюкокортикоиды (поддерживают уровень глюкозы для питания нервных клеток и обеспечивают неспецифическую резистентность) и половые гормоны (воспроизведение себе подобного). Выполнив эти фундаментальные функции, холестерол окисляется в печени до желчных кислот, которые выводятся с желчью. Холестерол пищи всасывается и поступает в кровь в составе хило
Таблица. 33.6. Содержание острофазных белков по V. Marks et al. (2002)
Время полужизни белков Острофазные белки Повышение (раз)
। | Очень коротко-живущие, 6-10 ч I Коротко-живущие, 24-48 ч С-реактивный белок, амилоид А, альфа- 10-500 1 -антихимотрилсин Ал ьфа-1 -кислы й гл икопротеин, альфа-1 - 2-3 антитрипсин, гаптоглобин, фибриноген
1 Средне-живущие, 48-72 ч СЗ- и С4-факторы комплемента, Меньше 2 церулоплазмин
533
Глава 33 Взаимосвязи в обмене вешеств
микронов. В крови транспортируется в составе ЛПНП (атерогенные липопротеины низкой плотности). Подвергается эстерификации в плазме крови (ЛХАТ) и в клетках (АХАТ) с образованием метаболически инертных эфиров холестерола.
Цель исследования: 1) оценка состояния обмена веществ; 2) диагноз и мониторинг заболеваний атеросклеротической природы; 3) оценка состояния печени, почек, поджелудочной железы, щитовидной железы.
Содержание в сыворотке 3,6—5,0 ммоль/л.
Алъфа-холестерол — главный антиатероген-ный класс липопротеинов высокой плотности (ЛПВП). ЛПВП синтезируются в печени и кишечнике, содержат 20—50 % циркулирующего холестерола. В печени образуются на-сцентные ЛПВП, содержащие до 50 % белков и 30 % фосфолипидов; с этими липопротеинами ассоциирован фермент ЛХАТ. Нас цент-ные ЛПВП забирают холестерол из периферических клеток (например, аорты, коронарных сосудов) с помощью ЛХАТ-реакции. Образовавшиеся при этом эфиры холестерола помещаются в ядро ЛПВП-часгиц, которые принимают шарообразную форму. В составе таких ЛПВП «отработанный» холестерол транспортируется в печень (обратный транспорт холестерола). Оптимальный антиатерогенный эффект ЛПВП достигается при соотношении общего холестерола и холестерола ЛПВП как 3:1. Имеется обратная корреляционная зависимость между уровнями триацилглицеролов и холестерола ЛПВП. Индекс атерогенности рассчитывают (Общий холестерол — Х-ЛПВП)/ Х-ЛПВП). Фактически, это отношение холес
терола ЛПНП (прямой транспорт холестерола) к холестеролу ЛПВП (обратный транспорт холестерола).
Цель исследования: 1) оценка риска ИБС; 2) определение типа дислипидемии; 3) диагностика наследуемых нарушений транспорта липидов.
Сыворотка: 0,91—1,81 ммоль/л (мужчины) и 1,21—2,20 ммоль/л (женщины).
Щелочная фосфатаза (ЩФ, КФ 3.1.3.1) — фермент, катализирующий гидролиз неорганических и органических фосфатов. Фермент находится в остеобластах, клетках печени и желчевыводящих путей, кишечнике, почках (проксимальные канальцы), лейкоцитах, а также в интенсивно делящихся клетках, плаценте. Щелочную фосфатазу находят плазме крови, желчи и молоке. Для каждого органа выделяют свой изофермент щелочной фосфатазы: билиарных путей, гепатоцитов, кишечника, костей, плаценты и опухолевый. Однако их специфичность достаточно низкая. Щелочная фосфатаза является неспецифическим маркером опухолей.
Цель исследования: 1) оценка остеобластной функции и минерального обмена костной ткани; 2) диагноз обструктивных заболеваний желчевыводящих путей и ограниченных поражений печени; 3) диагноз метастазов опухолей в печень и дополнительная информация о наличии опухолевой трансформации тканей; 4) исследование функционального состояния плаценты в III триместре беременности.
Сыворотка: 0,5—1,3 ммоль/(чхл) по Бодянскому и 0,24—0,60 ммоль/(чхд) по Бессею, Лоури и Броку, или 1—2,2 мМЕ/л.
534
Глава 34
Биохимия органов и тканей
Биохимия крови
С кроветворной системой и циркуляцией крови тесно связаны обмены железа и меди.
Обмен железа
Общее количество железа в организме взрослого человека составляет 3—5 г. Около 65— 70 % (2,5 г) железа содержится в эритроцитах в составе гемоглобина, 10 % (300 мг) — в миоглобине и других железосодержащих ферментах и белках. Остальные 20~25 % (1 г) депонируются.
Основное количество железа находится в составе гема, который входит в состав некоторых белков/ферментов (гемопротеины) — гемоглобин, миоглобин, цитохромы, ксантиноксидаза, каталаза, пероксидаза. Кроме того, некоторые белки содержат негеминовое железо (трансферин, ферритин, гемосидерин).
Суточная потребность’, мужчины — 10 мг/сутки, женщины — 18 мг/сутки, беременные и кормящие женщины — 40 мг/сутки.
Источники. Богаты железом печень, сердце, почки, злаковые, рыба, яблоки, сухофрукты, патока. Содержание железа невелико в молоке, хлебе, полированном рисе.
Всасывание. Железо всасывается главным образом в желудке и двенадцатиперстной кишке. У взрослых всасывается около 10 % железа пищи. В пище железо содержится в фсрри форме (Fe3+), связанной с белками или органическими кислотами. В кислой среде желудка, создаваемой НС1, Fe3+ высвобождается из пищи. Под действием аскорбиновой кислоты и цистеина происходит превращение ферри формы (Fe3+) в ферро форму (Fe2+). Компоненты пищи (аскорбиновая кислота, сахара и аминокислоты) образуют хелаты железа, что повышает его всасывание. Вещества, которые образуют нерастворимые комплексы железа, например, фосфаты (яйца, сыр, молоко), оксалаты или фитаты (овощи) и таннаты (чай), снижают всасывание железа.
В слизистой оболочке Fe2+ окисляется в Fe3+ под действием фермента фер-роксидазы. Fe3+ связывается с апоферритином с образованием ферритина,
535
Глава 34 Биохимия органов и тканей
который является временной резервной формой железа. Из клеток слизистой оболочки железо поступает в кровоток или теряется со слущивающимся эпителием.
Транспорт в крови. Железо высвобождается из комплекса с ферритином в слизистой оболочке и поступает в плазму в виде Fe2+. В крови под действием церулоплазмина и ферроксидазы происходит превращение Fe2+ в Fcu, которое связывается со специфическим белком трансферрином. Трансферрин — гликопротеин с мол. массой 79500 Да. Каждая молекула трансферрина имеет 2 места связывания с Fe3+, и в норме трансферрин насыщен на 20—50 %. Транспортные белки необходимы, т. к. свободное железо токсично и нерастворимо в воде. Около 3" 4 мг железа плазмы находится в связанной форме.
Трансферрин переносит железо к клеткам, где имеются специфические рецепторы для этого белка. После связывания с рецептором, рецептор-транс-ферриновый комплекс поступает в клетку путем эндоцитоза. В клетке происходит высвобождение железа, а рецептор- апотрансферрин возвращается на поверхность мембраны клеток. Внутри клеток железо используется для синтеза гема в митохондриях или накапливается в виде ферритина.
Регуляция поступления железа в клетки. Скорость поступления железа в неэритроидные клетки зависит от количества белков-рецепторов трансферрина в их мембране. Синтез апоферритина и рецепторов трансферрина регулируется на уровне трансляции этих белков. В соответствующих мРНК имеются шпилечные петли — железочувствительные элементы IRE. Эти участки мРНК могут взаимодействовать с регуляторным IRE-связывающим белком.
1. При низких концентрациях железа в клетке IRE-связывающий белок соеди
няется с IRE мРНК апоферритина и препятствует присоединению белковых факторов инициации трансляции. Это ведет к снижению концентрации апоферритина в клетке. Параллельно IRE-связывающий белок связывается с железочувствительным элементом мРНК рецептора трансферрина и предотвращает ее разрушение рибонуклеазой. В результате увеличивается количество рецепторов трансферрина, и ускоряется поступление железа в клетки.
2. При повышении железа в клетке в результате его взаимодействия с IRE-связывающим белком происходит окисление SH-групп активного центра этого белка и снижение сродства к железочувствительным элементам мРНК. Это ведет к ускорению трансляции апоферритина и снижению скорости синтеза рецепторов трансферрина, что проявляется снижением концентрации железа в клетке.
Депонирование железа. Железо депонируется в печени, селезенке и костном мозге в форме ферритина. Ферритин — мульмерный белок (апоферритин), имеющий ядро и связывающий 4500 атомов железа. Железо накапливается в ядре в виде гидроксифосфатных комплексов. Ферритин находится в большинстве клеток и рассматривается как легко мобилизуемый источник железа.
Гемосидерин является нерастворимым комплексом, образуемым из ферритина в результате агрегации. Представляет собой гранулы 1—2 мкм в диаметре. Гемосидерин имеет более высокую концентрацию железа, чем ферритин, но освобождает его более медленно. Около 1/3 резерва железа находится в печени, 1/3 — в костном мозге и остальная часть — в селезенке и других тканях.
При хронических потерях крови развивается железодефицитная
536
Биохимия органов и тканей Глава 34
анемия, при которой уменьшаются размер и пигментация эритроцитов (гипохромные малые эритроциты). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в плазме крови и тканях снижается концентрация ферритина.
Когда количество железа в клетках превышает объем ферритинового депо, железо откладывается в белковой части молекулы ферритина, что ведет к накоплению гемосидерина. Накопление гранул гемосидерина в печени, поджелудочной железе, селезенке приводит к повреждению этих органов — гемохроматозу. Гемохроматоз может быть обусловлен наследственным увеличением всасывания железа в кишечнике (в организме больных количество железа может достигать 100 г).
Обмен меди
Двухвалентный ион меди формирует комплексы с белками, многие из которых являются ферментами. К ним относятся: цитохромоксидаза (перенос электронов на кислород), церулоплазмин, супероксиддисмутаза (обезвреживание свободных радикалов), лизилок-сидаза (образование поперечных сшивок между полипептидными цепями коллагена и эластина), диаминоксидаза (обезвреживание биогенных аминов) и др. Приблизительно 50 % меди пищи всасывается в комплексе с аминокислотами. В плазме крови 95 % меди связано с а2-глобулином — церулоплазмином, 5% — с альбумином. Церулоплазмин содержит около 0,34 % меди (6—8 атомов меди на молекулу).
Источники — печень, почки, яичный желток, мясо, злаковые, орехи и зеленые листья растений.
Суточная потребность — 1,5—3 мг.
Функции крови
Кровь — жидкая ткань, состоящая из клеток (форменных элементов) и внеклеточной жидкой среды. При осаждении форменных элементов крови получается плазма. Сыворотка крови — это плазма, лишенная фибриногена. По объему клетки крови составляют около 45 %, остальное — плазма.
В крови около 83 % приходится на воду, остальное — сухое вещество. pH крови 7,36—7,40 и поддерживается буферными системами.
Функции крови:
1. Транспортная — перенос питательных веществ и газов (кислорода и углекислого газа).
2. Поддержание осмотического давления (белки крови и ионы Na+).
3. Создание буферных систем и поддержание кислотно-основного равновесия (белки, гемоглобин, гидрокарбонаты, фосфаты и др.).
4. Обезвреживающая функция за счет разведения токсических веществ и связывания их, главным образом, альбуминами плазмы. При этом снижается возможность проникновения вредных веществ в ткани и облегчается их выведение из организма. Кроме того, в крови происходит активное обезвреживание за счет ферментов, находящихся в плазме и клетках крови.
5. Защитная или иммунологическая функция обеспечивается клетками крови, участвующими в фагоцитозе, и антителами.
6. Регуляторная или гормональная функция. Клетки крови и плазма служат источником образования различных внеклеточных регуляторов обмена веществ и функций тканей и органов. Эти регуляторы являются сигнальными молекулами. В базофилах образуется гепарин и гистамин, в эозинофилах — гистамин и серотонин, в тромбоцитах — серотонин. Белки плазмы крови служат субстратом для образования биологичес-
537
Глава 34 Биохимия органов и тканей ки активных пептидов, получивших название кинины, которые регулируют скорость кровотока, давление и проницаемость капилляров.
7. Гемостатическая функция крови — свертывание крови.
Биохимические особенности метаболизма эритроцитов
Эритроциты составляют основную часть клеток крови. В организме человека образуется 160 млн эритроцитов в минуту. Время жизни эритроцита — 110— 120 дней. Зрелые эритроциты — это безъядерные клетки, не содержащие мРНК, рибосом и митохондрий.
В эритроцитах происходит анаэробный распад глюкозы, энергия которого используется, главным образом, на функционирование Na+, К+-АТФ-азы. В эритроцитах активно протекает пентозофосфатный путь распада глюкозы, в результате которого образуется восстановленный НАДФ, который участвует в инактивации перекисей мембраны эритроцитов.
Особенностью гликолиза в эритроцитах является наличие шунта, приводящего к образованию 2,3-бисфосфогли-церата. Это соединение снижает сродство гемоглобина к кислороду, что облегчает его отдачу периферическим тканям.
Синтез гемоглобина происходит в процессе развития эритроцитов из стволовых клеток костного мозга, на стадии образования незрелой безъядерной красной клетки — ретикулоцита, которая поступает в кровь. Ретикулоциты содержат много глобиновой мРНК и активно синтезируют гемоглобин до тех пор, пока клетки в процессе созревания не превращаются в эритроциты, утрачивающие мРНК, рибосомы и митохондрии. В результате зрелые эритроциты обла
дают упрощенным метаболизмом, нацеленным на сохранение целостности мембраны и предотвращение окисления гемоглобина. Эритропоэз стимулируется белком эритропоэтином, вырабатываемым в мозговом слое почек. При гипоксии выработка эритропоэтина увеличивается, а, следовательно, активируется эритропоэз, т. е. регуляция уровня красных кровяных клеток осуществляется автоматически и обратно пропорциональна парциальному давлению кислорода.
Синтез гемоглобина
С наибольшей скоростью гем синтезируется в костном мозге (для синтеза гемоглобина ретикулоцитами) и в печени (для образования цитохрома Р-450).
Синтез гема происходит в несколько стадий. На первой стадии в митохондриях сукцинил-КоА взаимодействует с глицином с образованием 5-аминолевулино-вой кислоты. Эту реакцию катализирует специфический пиридоксальзависимый фермент — б-аминолевулинатсинтаза — ключевой, аллостерический фермент синтеза тетрапирролов. Фермент активируется стероидами и ингибируется по типу обратной связи конечным продуктом — гемом. Продукт реакции из матрикса митохондрий переходит в цитозоль (рис. 34.1).
На второй стадии, в цитозоле, происходит конденсация 2-х молекул 5-ами-нолевулиновой кислоты с образованием порфобилиногена. Фермент — порфобилиногенсинтаза — ингибируется конечным продуктом.
В следующей многоступенчатой стадии из 4-х молекул порфобилиногена синтезируется протопорфирин IX, являющийся предшественником гема.
В заключительной стадии протопорфирин IX присоединяет молекулу Fe при участии феррохелатазы (гемсинта-
538
Биохимия органов и тканей Глава 34
£°он ch2nh2 + соон
Un2
q-q Глицин
КоА
Сукцинил-КоА
СООН
Ъ-Аминолевулинатсинтаза сн2 пиридоксальфосфат q^2
> V* С=О
HSKoA СО2 СН2
NH2 5-Аминолеву. (8-АЛК)
СООН
I
9^2 Порфобилиноген-
СН2 синтаза о=с ------Ч-------*
Н'С-Н 2 Н2О "N
Г8-АЛК
СООН СООНСН2 СН2 СН2 с—с ________
С< Jch Н2С
NH2 Н
Уропорфобилиноген----* Протопорфирин IX
Феррохелатаза
ГЕМ
Порфобилиноген
Рис. 34.1. Синтез гема.
за) и образуется гем. Источником железа в этой реакции является белок ферритин, который депонирует железо.
Механизм регуляции синтеза гема в неэритроидных клетках имеет определенные отличия. Так, в клетках печени, где синтез гема происходит на высоком уровне, гем является отрицательным регулятором синтеза <5-аминолевулинатсинтазы по механизму репрессии-депрессии в процессе транскрипции. Главный регуляторный эффект гема состоит в том, что синтез фермента значительно ускоряется в отсутствии гема и замедляется в его присутствии. Многие вещества, применяемые в настоящее время, например, инсектициды, канцерогенные и фармацевтические препараты, активируют синтез 8-аминолевулинатсинтазы в печени, так как в процессе метаболизма этих соединений возрастает потребление гема системой цитохрома Р-450, в ре
зультате чего внутриклеточная концентрация гема снижается. Это, в свою очередь, вызывает депрессию синтеза фермента и повышение скорости синтеза гема.
Синтез белковой части гемоглобина происходит на рибосомах как и других белков. Цепи аир глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь а освобождается первой, присоединяется к p-цепи, еще связанной с рибосомой и отделяет ее, образуя димер ар. Два димера соединяются в молекулу гемоглобина а2р2. Соединение гема с глобином может происходить или в процессе синтеза полипептидных цепей, или после окончания синтеза глобина. Синтез полипептидных цепей происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда следует, что синтез гема и глобина происходит координиро-
539
Глава 34 Биохимия органов и тканей
вано, и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
Строение гемоглобина и эффект Бора
При очистке гемоглобина из эритроцитов оказалось, что его способность связывать кислород (аффинность) намного выше, чем у гемоглобина внутри эритроцитов. Этот эффект оказался зависимым от наличия в эритроцитах 2,3-бисфосфоглицериновой кислоты (2,3-БФГ). Это вещество содержится в эритроцитах примерно в той же концентрации, что и гемоглобин (2 мМ). Без 2,3-БФГ гемоглобин не может быть транспортером кислорода, т. к. в тканях он освобождает не более 8 % принесенного кислорода. Кристаллографические исследования показали, что в Т-форме гемоглобина (дезоксигемоглобин) в центре молекулы имеется карман, в котором помещается одна молекула 2,3-БФГ. При переходе в R-форму этот карман исчезает. Следовательно 2,3-БФГ преимущественно связывается с дезоксигемоглобином и стабилизирует Т-со-стояние, в котором аффинность гемоглобина к кислороду снижена. При переходе в R-состояние связь между гемоглобином и 2,3-БФГ разрывается и этот биорегулятор удаляется из молекулы гемоглобина. Следствием является образование оксигемоглобина.
При внутриутробном развитии у плода имеется фетальный гемоглобин HbF, который состоит из двух а- и двух у-субъединиц (у взрослого человека 2а2р). у-Субъединица на 72 % идентична р-субъединице, но в 143 положении имеется замена гистидина на серин. В результате исчезают два положительных заряда (на двух у-цепях), молекула 2,3-БФГ не фиксируется и фетальный гемоглобин оказывается более аффинным к кислороду, чем материнский. Это обеспечивает поток кислорода из организма матери в организм плода (рис. 34.2).
Эффект Бора: протоны и СО2 усиливают освобождение кислорода из оксигемоглобина. Ткани с быстрым метаболизмом (например, сокращающиеся мышцы) требуют интенсивного притока кислорода и образуют большие количества протонов и СО2. Протоны и углекислота являются гетеротропными эффекторами, увеличивающими освобождение кислорода из гемоглобина. Аффинность гемоглобина к кислороду снижается при снижении pH ниже 7,4. Поэтому, когда гемоглобин попадает в область низких значений pH, способность освобождать кислород повышается. Например, транспорт из легких, где pH 7,4 и парциальное давление кислорода 100 торр в мышцы (pH 7,2, парциальное давление кислорода 20 торр) ведет к освобождению 77 % принесенного кислорода оксигемоглобином. И только 66 % кислорода будет освобождено, если величина pH будет одинаковой.
Торр — давление, производимое 1 мм ртутного столба при 0°С и стандартной силе тяжести. '"'£Эта единица названа в честь Torricelli (1608— 1647), изобретателя ртутного барометра.
Гемоглобин в присутствии углекислоты снижает свою аффинность к кислороду, что обеспечивает освобождение кислорода в тканях с высокой концентрацией СО2. При парциаль-
Рис. 34.2. Аффинность к кислороду эритроцитов плода выше, чем эритроцитов матери. Это связано с тем, что фетальные эритроциты не связывают 2,3-БФГ в той степени, как эритроциты матери.
540
Биохимия органов и тканей Глава 34
ном давлении СО2 равном 40 торр, освобождается до 90 % принесенного гемоглобином кислорода. Таким образом, гетеротропная регуляция гемоглобина концентрацией водородных ионов и углекислоты повышает кислород-транспортные возможности гемоглобина. Этот эффект назван в честь Кристиана Бора, описавшего его в 1904 году (рис. 34.3).
Механизмы эффекта Бора: 1) при повышении концентрации ионов водорода гистидин-146 в цепи 0 протонируется, что стабилизирует конформацию дезоксигемоглобина (Т-конформация) и соответственно освобождение кислорода; 2) повышение концентрации СО2 ведет к превращению концевых аминогрупп в карбаматные группы, что препятствует взаимодействию а- и р-субъединиц, т. е. стабилизирует Т-конформацию (конформацию дезоксигемоглобина) и способствует освобождению кислорода.
Гемоглобин транспортирует 14 % углекислоты и протонов в легкие, где они освобождаются, а гемоглобин вновь оксигенируется. Основ-
яяя» pH 7,4 нет СО, pH 7,2 нет СО, pH 7,2 40 торр СО,
Рис. 34.3. Влияние pH и концентрации СО2 на аффинность кислорода к гемоглобину. Снижение pH с 7,4 до 7,2 увеличивает освобождение кислорода из оксигемоглобина. Повышение парциального давления СО2 от 0 до 40 торр также увеличивает освобождение кислорода из оксигемоглобина.
ная доля углекислоты и протонов транспртиру-ется кровью в виде бикарбоната (НСО3“), образующегося спонтанно или в результате действия карбоангидразы, широко представленной в клетках крови.
Производные и типы гемоглобина
1. Оксигемоглобин — связь гемоглобина с кислородом. При этом не происходит окисления Fe и оно остается двухвалентным.
2. Карбоксигемоглобин — связь гемоглобина с СО. Сродство гемоглобина к СО примерно в 300 раз выше, чем к кислороду.
3. Метгемоглобин образуется при действии окислителей (нитрит натрия, красная кровяная соль, перманганат калия и др.), которые переводят Fe2+ в Fe3+.
4. Карбгемоглобин — связь гемоглобина с СО2. При этом СО2 присоединяется не к гему, а к ЫН2-группам лизина глобина.
Различают 3 типа гетерогенности гемоглобина: 1) эмбриональную; 2) обусловленную наличием минорных оснований и 3) генетическую гетерогенность.
Эмбриональная гетерогенность обусловлена наличием гемоглобинов, отличающихся по строению полипептид-ных цепей, на разных этапах эмбрионального развития организма. Hb Р (примитивный) появляется на самых ранних стадиях развития эмбриона, вначале состоит из 4-х е-цепей и называется Говер 1. Затем у эмбриона, длина которого не превышает 2,5 см, начинается синтез а-цепей. Образуется более зрелый тип примитивного гемоглобина — Говер 2, который состоит из 2-х е и 2-х a-цепей. В три месяца у эмбриона гемоглобин Р заменяется на Hb F, который состоит из 2-х а и 2-х у-цепей. HbF является главным типом гемоглобина плода и
541
Глава 34 Биохимия органов и тканей составляет к моменту рождения примерно 70 % всего гемоглобина. Hb F обладает большим сродством к кислороду, что позволяет извлекать его из организма матери. На поздних стадиях развития плода появляется гемоглобин взрослых — НЬА, который состоит из 2-х а и 2-х 0-цепей. В течение 3—4 месяцев после рождения происходит замена HbF на НЬА.
К минорным типам гемоглобинов относят НЬА? (2 а и 2 5-цепи), который составляет 2—3 %.
Генетическая гетерогенность связана с точечными мутациями в одном из генов, кодирующих синтез а, 0, у и 5 цепей. Выявлено более 300 вариантов гемоглобина, они называются аномальными гемоглобинами.
Транспорт кислорода эритроцитами создает условия для образования активных форм кислорода: супероксидного анион-радикала, пероксида водорода и гидроксильного радикала. Постоянный источник активных форм кислорода — неферментативное окисление гемоглобина в метгемоглобин:
Hb(Fe2+) | * е +02 + 02-Hb(Fe3+)
В течение суток до 3 % гемоглобина может окислиться в метгемоглобин. Обезвреживание активных форм кислорода:
1. Метгемоглобинредуктазная система восстанавливает метгемоглобин в гемоглобин.
2. Супероксидный радикал с помощью супероксиддисмутазы превращается в пероксид водорода.
3. Пероксид водорода разрушается каталазой и глутатионпероксидазой.
4. Окисленный глутатион восстанавли
вается НАДФН-зависимой глутатионре-дуктазой.
Эти процессы обеспечиваются реакциями гликолиза (донором водорода для восстановления метгемоглобина служит НАДН, образующийся в глице-ральдегиддегидрогеназной реакции) и пентозофосфатного пути (продукция НАДФН).
Распад гемоглобина
Продолжительность жизни эритроцитов составляет 120 дней, после чего происходит их разрушение и освобождение гемоглобина. Ежесуточно из разрушившихся эритроцитов освобождается 8— 9 г гемоглобина. При разрушении гемоглобина его белковая часть (глобин) гидролизуется до аминокислот, которые могут использоваться в белковом синтезе. Порфириновая часть гема (без железа) деградирует необратимо до образования желчных пигментов, которые выводятся из организма.
Главными органами, в которых осуществляется разрушение эритроцитов, являются печень, селезенка и костный мозг.
1. Распад гемоглобина начинается с разрыва метиновой связи между I и II кольцами порфиринового кольца, окисления метиленовой группы до СО и раскрытия тетрапиррольного кольца. Образуется зеленой пигмент вердоглобин. Реакция катализируется сложной ферментативной системой — гемокси-геназой (дециклизирующей) в присутствии НАДФН и О2.
2. От вердоглобина освобождается Fe-* и глобин и образуется биливердин, окрашенный в зеленый цвет.
3. НАДФН-зависимая биливердинре-дуктаза восстанавливает метенильный мостик между пирролами IV и III в метиленовую группу. В результате образуется желтый пигмент билирубин.
542
Биохимия органов и тканей Глава 34
который называется свободный или непрямой. Этот билирубин плохо растворим в воде, адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин вступает во взаимодействие с диазореактивом Эрлиха. Связывание билирубина предотвращает поступление его в ткани, где он может оказывать токсический эффект. Некоторые лекарства-анионы (сульфаниламидные антибиотики, барбитураты и салицилаты), а также свободные жирные кислоты конкурируют за места связывания с альбуминами. У взрослых это не является проблемой, но у новорожденных детей имеется низкое сродство билирубина к белку, в результате чего свободный билирубин может проникать через гематоэнцефалический барьер.
4. Непрямой билирубин поступает в печень и связывается с лигандином, который транспортирует билирубин в ЭПР. Билирубин взаимодействует с УДФ-глюкуроновой кислотой с участием фермента УДФ-глюкуронилтрансфе-раза. При этом образуется диглюкуронид (85—90 %) или моноглюкуронид (10—15 %) билирубина, которые хорошо растворимы в воде и дают прямую реакцию с диазореактивом. Поэтому этот билирубин называется прямой, связанный или конъюгированный билирубин. 5. У млекопитающих прямой билирубин поступает в кишечник с желчью (свыше 97 %). Часть прямого билирубина из печени всасывается в кровь и составляет 20—25 % от его общего содержания в крови. В кишечнике под действием глюкуронидазы анаэробной микрофлоры от него отщепляется глюкуроновая кислота, и освободившийся билирубин восстанавливается в бесцветное соединение уробилиноген.
6. Небольшая часть уробилиногена вса
сывается и поступает через воротную вену в печень и вступает в энтеропече-ночную циркуляцию или подвергается разрушению до моно- и дипирролов. Остальной уробилиноген фильтруется почками и поступает в мочу.
7. В кишечнике уробилиноген восстанавливается до стеркобилиногена, а затем до стеркобилина, который выводится с фекалиями.
Белки плазмы крови
Концентрация общего белка в сыворотке крови — 65—85 г/л.
Концентрация общего белка в сыворотке зависит, главным образом, от синтеза и распада двух основных белковых фракций — альбуминов и глобулинов. Физиологическая роль белков в сыворотке крови:
1) поддерживают коллоидно-осмотическое давление, сохраняя объем крови, связывая воду и задерживая ее, не позволяя выходить из кровеносного русла;
2) принимают участие в процессах свертывания крови;
3) поддерживают постоянство pH крови, являясь одной из буферных систем крови;
4) транспортируют вещества (жирные кислоты, липиды, стероидные гормоны, витамины и т. д.), лекарственные препараты;
5) поддерживают нормальный уровень катионов — кальция, железа, меди, магния в крови, образуя с ними недиа-лизируемые соединения;
6) играют важную роль в иммунных процессах (иммуноглобулины);
7) служат резервом аминокислот.
Синтез белков плазмы крови осуществляется в основном в клетках печени и ретикулоэндотелиальной системы.
Содержание альбумина в сыворотке крови составляет около 60 % общего бел
543
Глава 34 Биохимия органов и тканей
ка — 40—50 г/д. Альбумины синтезируются в печени (примерно 15 г/сут), время их полураспада составляет около 17 сут. Онкотическое давление плазмы на 65—80 % обусловлено альбуминами. Альбумины выполняют важную функцию по транспортировке многих биологически активных веществ, в частности, гормонов. Альбумины способны соединяться с различными лекарственными веществами.
Биохимия фагоцитоза
В фагоцитозе участвуют нейтрофилы и моноциты. Нейтрофилы (полиморфноядерные лейкоциты) поступают в кровоток из костного мозга и циркулируют в крови до 8 суток. Нейтрофилы и моноциты способны мигрировать в ткани. Здесь моноциты называются макрофагами. Макрофаги реализуют защитную функцию крови путем фагоцитоза микроорганизмов и состарившихся клеток. Фагоцитоз — особая форма эндоцитоза, при которой образуются большие эндоцитозные пузырьки, размеры которых определяются размерами поглощаемых частиц. Так, например, макрофаги поглощают за сутки 10” эритроцитов. Фагоцитарный ответ клетки включает:
1. Рецепторы на поверхности мембраны фагоцита в углублениях, покрытых белком клатрином, взаимодействуют с молекулами частиц, которые необходимо поглотить и уничтожить, и включают фосфатидилинозитольный механизм фагоцитоза.
2. Образуются выросты плазматической мембраны макрофага, окружающие поглощаемую частицу, и формируется фагосома.
3. В цитозоле макрофага фагосомы сливается с первичными лизосомами. Благодаря низким значениям pH внутри фаголизосомы происходит гидролиз органических молекул поглощаемой частицы гидролазами лизосом. Продукты гидролиза поступают в цитозоль и утилизируются макрофагами. Непереваренные молекулы в виде остаточных телец методом экзоцитоза возвращаются на поверхность клеток.
Для уничтожения микробов используются кислородзависимые бактерицидные механизмы, которые включают следующие процессы: 1. Ферментный комплекс мембраны фагосом — НАДФН-оксидаза восстанавливает
кислород с образованием супероксидного аниона. Супероксидный анион спонтанно или при участии фермента супероксиддисмутазы превращается в пероксид водорода. Под действием миелопероксидазы, проникающей в фагосому при ее слиянии с лизосомой, из пероксидов в присутствии галогенов (йодидов и хлоридов) образуются дополнительные токсичные окислители — гипойодид и гипохлорит, которые обеспечивают бактерицидный эффект.
Н2Ог + С1 +Н**НОС1 + Н2О
Резкое увеличение потребления кислорода фагоцитирующими клетками называется респираторным взрывом. Возникающие при этом активные формы кислорода запускают процессы свободнорадикального разрушения надмолекулярных структур и молекул.
2. Бактерицидное действие в макрофагах оказывает также оксид азота — NO, который образуется из аргинина при участии NO-синта-зы. Супероксидный анион взаимодействует с оксидом азота с образованием пероксинитрита и гидроксильного радикала, которые вызывают окислительное повреждение белков, нуклеиновых кислот и липидов бактериальных клеток.
NO + Of* ONOO НО’ + NO2
Оксид азота может непосредственно взаимодействовать с железосерными белками ЦПЭ, ингибируя дыхание и синтез АТФ в бактериях. Вспышка метаболической активности нейтрофилов заканчивается их гибелью и формированием гноя.
В нейтрофилах бактерицидное действие оказывает лизосомальный фермент лизоцим (гидролизует связи между ^'-ацстил-О-глюко-замином и N-ацетилмурамовой кислотой, что ведет к разрушению бактериальной стенки) и катионные белки гранул — дефензины (вызывают образование ионных каналов в мембранах микробных клеток и их гибель).
Биохимия печени
Печень занимает центральное место в. обмене веществ. Особенности ферментного аппарата печени и анатомические связей с другими органами даст возмож-
544
Биохимия органов и тканей Глава 34
Гликоген
®t
СО;
Рис. 34.4. Особенности обмена углеводов в печени.
ность печени участвовать в регуляции практически всех видов обмена веществ и обеспечивать постоянство содержания многих жизненно важных компонентов крови в организме.
Печень выполняет следующие биохимические функции: 1) регуляторно-гомеостатическую; 2) мочевинообразовательную; 3) желчеобразовательную; 4) экскреторную; 5) обезвреживающую.
Роль печени в обмене веществ
Обмен углеводов (рис. 34.4).
1. Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови.
Это достигается регуляцией соотношения между синтезом и распадом гликогена, депонируемого в печени.
2. Синтез гликогена из глюкозы обеспечивает в норме временный резерв
19 Зак. 2124
545
Глава 34 Биохимия органов и тканей
Рис. 34.5. Особенности обмена липидов в печени.
углеводов, необходимый для поддержания уровня глюкозы в крови в тех случаях, когда ее содержание значительно уменьшается. Для фосфорилирования глюкозы в печени имеется фермент глюкокиназа, активность которого почти в 10 раз превышает активность гек-сокиназы.
3. В печени происходит расщепление глюкозы до метаболитов-предшественнико®. необходимых для биосинтезов, а также ди функционирования цикла трикарбоновъо. кислот и сопряженных цепей переноса электронов, в которых путем окислительного фосфорилирования запасается энергия окисления субстратов в виде АТФ
546
Биохимия органов и тканей Глава 34
Белки
печени Белки плазмы
Нуклеотиды, а
гормоны, порфирины ЛЛр *
Глюконеогенез
Пируват промежуточные продукты ЦТК
Гликоген . _ (мышцы)^ Гпюкоза
печени
Цикл мочевины
---> Аминокислоты крови
Аминокислоты
Липиды
Белки тканей
NH3---► Мочевина у
V4r) X* Аминокислоты
^~"Г'мь|щц
Аланин
Жирные кислоты
Окислительное фосфорилирование
Рис. 34.6. Особенности обмена аминокислот печени.
4. Из ацетил-КоА образуются жирные кислоты, холестерол, триацилглицеролы и кетоновые тела.
5. В реакциях пентозофосфатного пути в печени образуется НАДФН, используемый для восстановительных реакций в процессах синтеза жирных кислот, холестерола и других стероидов. Кроме
того, при этом образуются пентозофосфаты, необходимые для синтеза нуклеиновых кислот.
Кроме того в печени протекает глюконеогенез из лактата, глицерола и аминокислот. Печень участвует в метаболизме фруктозы и галактозы, превращая их в глюкозу.
Обмен липидов (рис. 34.5).
547
Глава 34 Биохимия органов и тканей
В печени происходит:
1. Синтез триацилглицеролов, характерных для данного организма, а также фосфолипидов и холестерола.
2. Распад жирных кислот (p-окисление), глицерола до ацетил-КоА с образованием НАДН+Н+; превращения ацетил-КоА в общем пути катаболизма с освобождением и запасанием энергии окисления в виде АТФ.
3. Синтез кетоновых тел и выделение их в кровь как экспортной формы энергии с целью доставки в ткани и органы (мышцы, почки, мозг и др.), где они окисляются с участием соответствующих ферментов.
4. Биосинтез холестерола, желчных кислот и фосфолипидов de novo.
5. Секреция липидов в кровь в форме липопротеинов очень низкой плотности (ЛПОНП) и липопротеинов высокой плотности (ЛПВП).
6. Выделение свободных (неэстерифи-цированных) жирных кислот в кровь для транспорта к местам окисления (мышцы) или синтеза триацилглицеролов (жировая ткань).
Обмен аминокислот (рис. 34.6)
Аминокислоты, которые поступают в печень:
1. Являются предшественниками для синтеза собственных белков печени и большинства белков плазмы крови.
2. Выделяются в кровь из печени и транспортируются к другим тканям, где используются для синтеза тканевых белков.
3. Используются как предшественники при биосинтезе нуклеотидов, гормонов, порфиринов и других азотсодержащих соединений в печени и других тканях.
4. Аминокислоты, которые не используются в качестве биосинтетических предшественников дезаминируются и разрушаются до ацетил-КоА и промежуточных продуктов цикла трикарбоновых кислот. Промежуточные продукты ЦТК
могут превращаться в глюкозу или гликоген по пути глюконеогенеза (4а). Ацетил-КоА окисляется в ЦТК для получения энергии (46) или превращается в липиды для запасания (4в). Аммиак, высвобождаемый при разрушении аминокислот, превращается в конечный продукт мочевину, которая выделяется из организма (4г).
5. Печень метаболизирует аминокислоты, которые поступают из других тканей. Концентрация глюкозы в крови поддерживается за счет углеводов, поступающих с пищей, и расщепления гликогена. В период между приемами пищи, особенно длительный, мышечные белки расщепляются до аминокислот (5). Эти аминокислоты отдают аминогруппы (трансаминирование) пирувату (гликолиз) с образованием аланина, который транспортируется в печень и дезаминируется. Образующийся пируват превращается в гепатоцитах в глюкозу, которая поступает в кровь (глюконеогенез), а аммиак используется для синтеза мочевины. Глюкоза транспортируется в скелетные мышцы, где используется для синтеза гликогена (глюкозо-аланиновый цикл).
В печени осуществляется обезвреживание эндогенных и экзогенных токсических веществ и выведение в желчь гидрофобных молекул.
Образование желчных пигментов
Распределение желчных пигментов в норме у человека: кровь: общий билирубин 8,55-20,52 мкмоль/л; непрямой (свободный) билирубин 6,41—15,40 мкмоль/л; прямой (связанный.? билирубин 0 5,1 мкмоль/л; желчь: прямой (связанный) билирубин; кал: стеркобилиноген: моча: уробилиноген 0,5—3,4 мг/сутки.
Нарушения обмена билирубина. Нарушения обмена билирубина проявляется развитием желтухи — синдрома, харакгерж-
548
Биохимия органов и тканей Глава 34
зующегося желтой окраской кожи, слизистых, сыворотки в результате отложения желчных пигментов при нарушениях желчеобразования и желчевыделения.
Гемолитическая желтуха. При усиленном гемолизе эритроцитов в клетках ретикулоэндотелиальной системы происходит образование повышенного количества непрямого билирубина. Печень не способна связать весь билирубин с глюкуроновой кислотой. В крови и тканях накапливается непрямой билирубин. Поскольку в печень поступит повышенное количество непрямого билирубина, то образуется больше и прямого билирубина. Увеличенный поток прямого билирубина в желчь приведет к увеличению образования уробилиногенов и стеркобилиногена в кишечнике. Кал будет более интенсивно окрашен. Таким образом, в крови отмечается повышение общего билирубина за счет повышения непрямого билирубина, в кале — повышение стеркобилиногена, в моче — отсутствие билирубина, увеличение уробилиногена.
Паренхиматозная желтуха. Развивается в результате нарушения функции печени. Это приводит к нарушению экскреции прямого билирубина в желчные капилляры и он частично попадает в кровь, где увеличивается его содержание. Прямой билирубин растворим в воде, поэтому способен проходить через почечный барьер, и в моче определяется билирубин. Уменьшение содержания прямого билирубина в желчи приводит к уменьшению содержания стеркобилиногена. Нарушается процесс конъюгации свободного билирубина. Поэтому в крови увеличивается содержание непрямого билирубина. Нарушается процесс разрушения уробилиногена, который в большем количестве попадает в общий кровоток и выделяется с мочой. В результате в крови повышается содержание общего билирубина за счет повышения непрямого и прямого билирубина, в кале уменьшается стеркобилиноген (светлый кал), в моче обнаруживается билирубин и уробилиноген.
Обтурационная желтуха. При частичной или полной закупорке желчных протоков нарушается желчевыделение и составные части желчи попадают в кровь. В крови увеличивается содержание прямого билирубина, который поступает в мочу. В результате уменьшения поступления желчи в кишечник резко умень
шается количество стеркобилиногена. При полной закупорке кал обесцвечивается. В крови отмечается повышение общего билирубина за счет повышения непрямого билирубина и резкого повышения прямого билирубина. Кал ахоличный (резкое снижение стеркобилиногена). В моче обнаруживается билирубин, но отсутствует уробилиноген.
Биохимия соединительной ткани
Общая характеристика. Соединительная ткань состоит из клеток и межклеточного вещества. Межклеточное вещество определяет основные свойства соединительной ткани. Между эпителием и соединительной тканью располагается базальная мембрана.
Соединительную ткань отличает от других тканей преобладание межклеточного вещества над клеточными элементами. Клеточные элементы: фибробласты, тучные клетки, плазматические клетки и др. Межклеточное вещество включает три класса биомолекул: 1) структурные белки (коллаген и эластин); 2) специализированные белки (фибриллин, фибронектин и ламинин); 3) протеогликаны (включают гликозаминогликаны — ГАГ). Некоторые клетки соединительной ткани выделяют сигнальные молекулы (гепарин, гистамин, серотонин и др.), участвуют в иммунном ответе и неспецифической реактивности организма.
Функции соединительной ткани.
1. Опорная (соединительная) — хрящевая, костная ткани, сухожилия, связки. 2. Барьерная (защитная). Создает границу между внешней и внутренней средами организма (дерма), между кровью и клеточными элементами паренхиматозных органов. Клетки соединительной ткани способны к фагоцитозу, синтезу иммуноглобулинов — т. е. осуществлению иммунной защиты.
549
Глава 34 Биохимия органов и тканей
3. Депонирование — клетки соединительной ткани способны поглощать и депонировать разнообразные вещества. Например, гистиоциты, накапливая в цитоплазме капли жира, превращаются в пенистые клетки.
4. Метаболическая — клетки соединительной ткани обладают наборами ферментов, обычных для всех тканей, а также ферментов биосинтеза биомолекул межклеточного вещества. Фибробласты являются главным местом метаболизма кортизола, угнетающего пролиферативную и биосинтетическую активность соединительной ткани.
5. Репаративная — ликвидация последствий локальных инфекционных очагов, механических травм.
Соединительная ткань претерпевает возрастные изменения. С ней связаны важнейшие патологические процессы (воспаление, метастазирование, коллаге-нозы, мукополисахаридозы и др.)
Белково-углеводные комплексы межклеточного вещества
Различают протеогликаны (свыше 95 % углеводов), мукопротеины (10—15 % углеводов) и гликопротеины (менее 10 % углеводов).
Протеогликаны —- это сложные белки, в которых с молекулами белка ковалентно связаны гликозамингликаны (ГАГ). ГАГ делят на 1) гиалуронаты; 2) дерматан сульфат; 3) хондроитин 4- и 6-суль-фаты; 4) кератан сульфаты; 5) гепарин и гепаран сульфаты, причем гепараны сульфатированы меньше, чем гепарины.
ГАГ высоко гидрофильны, что позволяет им создавать гели при низкой концентрации (тургор тканей). Гиалуроновая кислота состоит из 250 тысяч несульфатированных дисахаридных единиц. Она образует свободные от клеток пространства для целлюлярной миграции в норме и при патологии. Хондро
итинсульфаты содержат цепи до 40 дисахаридных единиц и служат для кальцификации кости. Дерматансульфат поддерживает форму глаза за счет прочности склеры. Кератансульфат 1 и дерматансульфат обеспечивают прозрачность роговицы. Гепарин является антикоагулянтом (связывается антитромбином III, а также с факторами IX и XI), а также способствует отделению липопротеинлипазы от эндотелия и катаболизму хиломикронов.
В тканях ГАГ входят в состав протеогликанов, в которых они ковалентно связываются коровыми (сердцевинными) белками. Схематически: ГАГ — связывающий трисахарид (галактоза-галактоза-ксилоза) — серин корового белка. Протеогликаны входят в состав базальных мембран, являются рецепторами, интегральными белками плазматических мембран, компонентами внутриклеточных секреторных пузырьков.
Функции протеогликанов: 1) специфическое взаимодействие с коллагеном, эластином, фибронектином и др.; 2) являясь полианионами, они связывают катионы; 3) определяют форму и упруго-эластические характеристики органов; 4) участвуют в рецепции, эндо- и экзоцитозе, межклеточном взаимодействии; 5) регулируют процессы трансмембранного переноса (например, клубочковую фильтрацию), включая работу синапсов; 6) гомеостатическое действие (антикоагулянтное действие, функционирование тучных клеток и др.); 7) образуя структуры типа молекулярных сит (гель), обеспечивают барьерную функцию, защищая организм от проникновения микробов, чужеродных молекул, токсинов.
Мукопротеины и гликопротеины являются ковалентно связанными белково-углеводными комплексами. В их составе выделяют 7 моносахаридов: галактозу глюкозу, маннозу, N-ацетилнейраминс-
550
Биохимия органов и тканей Глава 34
вую кислоту, фукозу, N-ацетилглюко-замин, N-ацетилгалактозамин. Эти углеводно-белковые комплексы входят в состав клеточных и волокнистых элементов соединительной ткани (структурная функция). Динамические функции: 1) механическая (смазка соприкасающихся поверхностей тканей); 2) защитная (иммуноглобулины, антигены гистосовместимости, интерферон); 3) регуляторная (тиротропин, хорионический гонадотропин); 4) транспортная (транспортеры липофильных витаминов, липидов, гормонов); 5) каталитическая (гидролазы, гликозидазы); 6) межклеточные и клеточно-лигандные взаимодействия (специфические взаимодействия, лектины — специфическое взаимодействие с углеводами). Гликозилирование поли-пептидных цепей через О-гликозидные связи происходит в эндоплазматической сети и аппарате Гольджи (ферменты — гликозилтрансферазы); при образовании N-гликозиламиновой связи между углеводной и белковыми частями гликопротеинов отдельно синтезированный олигосахарид переносится на полипеп-тидную цепь (фермент — олигосахарид трансфераза). Для синтеза олигосахарида требуется полиизопреновое соединение долихол (15—19 изопреновых единиц). Распад белково-углеводных комплексов происходит вначале внеклеточно с помощью эктопротеиназ, а затем с помощью лизосомальных ферментов клеток соединительной ткани и печени. В реакциях катаболизма проте-ингликановых агрегатов участвуют катепсины, гиалуронидаза, гексозаминидазы, p-глюкуронидаза, р-галактозидаза, сульфатаза и др. Компоненты основного вещества соединительной ткани относительно быстро обмениваются, например, период полураспада гиалуроновой кислоты составляет 2—4 дня, хондроитинсульфатов — в 3—4 раза дольше.
При наследуемой недостаточности а-маннозидазы, а-фукозидазы, а-нейраминидазы и аспартил гл юко-заминидазы развиваются заболевания маннозидозы, фукозидозы, сиалидозы и аспартил глюкозам и-нурия. Их относят часто к группе муколипидозов.
Специфические белки соединительной ткани
Коллагены — фибриллярные белки межклеточного вещества (25—30 % от всех белков тела). Известны более 15 типов коллагеновых молекул (изоколлагены): тип I [а(1)]2а2(1) и тип II [а(П)]3— кости, дентин, роговица, гиалиновый хрящ; тип III [а(Ш)]3 — дерма, десна, клапаны сердца; тип IV [a(IV)]3 — базальные мембраны; тип V [a(V)]2a2(V) и тип VI «](VI), a2(VI) — кости, роговица, клапаны сердца, артериальные сосуды; тип VII aj(VII) и тип VIII a^VIII) — эндотелий сосудов; тип IX a/IX) a2(IX) и тип X а((Х) — хрящевая ткань. Изоколлагены типов I-III — образуют фибриллы; изоколлагены типов IV и VII являются сеть формирующими, например, в базальных мембранах, изоколлагены IX и XII участвуют в образовании фибрилл.
Полипептидная цепь молекулы коллагена содержит часто повторяющийся триплет аминокислотных остатков глицин -X-Y, где положения X и Y чаще занимают пролин (гидроксипролин) и лизин (гидроксилизин). Эта полипептидная цепь образует левозакрученную спираль с 3 аминокислотными остатками на каждый шаг спирали (водородные связи, стабилизирующие вторичную «-спиральную структуру белков, в коллагене не образуются). Три полипептвдные цепи сворачиваются в правозакрученную тройную суперспираль, образуя палочковидные молекулы длиной 300 нм и диаметром 1,5 нм — тропоколлаген (структурная единица коллагенового волокна). Тройная спираль тропоколлагена стабилизируется
551
Глава 34 Биохимия органов и тканей дисульфидными и водородными связями, возникающими между атомом водорода глицина и атомом кислорода карбонильной группы пептидных связей. При этом глицин оказывается внутри трехспирального жгута, а три цепи образуют жесткую структуру, похожую на кабель, слегка закрученную в правую суперспираль. Микрофибриллы состоят чаще всего из 5 рядов полипептидных цепей. Вместе с различными гликопротеинами они образуют фибриллы. Молекулы гликопротеинов находятся, как правило, на поверхности фибрилл и защищают их от действия коллагеназы. В зрелом коллагене мало серусодержащих и ароматических аминокислотных остатков.
Цепи коллагена после синтеза на полисомах переходят в эндоплазматическую сеть в виде предшественников, имеющих дополнительные пептиды на концах цепей (содержат много остатков цистеина). Эти телопептиды участвуют во внутриклеточном образовании тройных спиралей, но тормозят образование фибрилл. Тройная спираль проколлагена фиксируется дисульфидными связями между тремя С-кон-цевыми телопептцдами. Молекула проколлагена транспортируется по цистернам эндоплазматического ретикулума в аппарат Гольджи для дополнительного гликозилирования и последующего экзоцитоза во внеклеточное пространство. Вне клеток происходит фибриллогенез, в процессе которого специфические пептидазы отщепляют концевые телопептады (их можно обнаружить в кровотоке). Коллагеновые волокна образуются из отдельных молекул тропоколлагена, которые формируют перекрывающуюся структуру (поперечная исчерченность с периодом 67 нм за счет смещения каждой соседней молекулы в фибрилле на ‘/4 своей длины относительно соседней). Под действием фермента лизилоксидазы на определенных боковых цепях остатков лизина и гидроксилизина образуются реакционноспособные альдегидные группы и происходит конденсация остатков лизила и гидроксилизила соседних молекул с образованием поперечных сшивок. Это обеспечивает прочность волокон. Молекулы тропоколлагена не связаны «конец в конец», поэтому между ними есть промежутки, которые могут служить местом первичного накопления кальция и фосфора при минерализации кости. Коллаген — белок, который, как правило, гликозилирован. Для синтеза коллагена требуются витамин С, пиридоксальфос
фат, ионы меди и железа, 2-оксоглутарат, УДФ-глюкоза и УДФ-галактоза.
Коллагеновые фибриллы в физиологических условиях устойчивы к действию трипсина, пепсина, лизосомальных и нелизосомальных пептидаз, способных расщеплять только денатурированный коллаген. Катаболизм коллагена — это сложный многоступенчатый процесс, происходящий внутри- и внеклеточно с участием различных пептидаз и гликозидаз. Ключевую роль в этом процессе Hipaer семейство ферментов коллагеназ, катализирующих расщепление всех трех полипептидных цепей тропоколлагена на расстоянии 1/4 их длины от С-конца между глицином и лейцином (изолейцином). Образовавшиеся фрагменты растворяются в воде и расщепляются далее различными протеиназами (см. ниже — металлопротеиназы).
Различают микробные и тканевые коллагеназы. Микробные — вырабатываются микроорганизмами и способствуют их проникновению через соединительно-тканные барьеры хозяина. Тканевые коллагеназы имеют оптимум pH 8,5, активны в присутствии ионов цинка. Они проявляют наибольшую активность в тканях, претерпевающих реорганизацию, например, в матке после родов, а также при некоторых заболеваниях, сопровождающихся деструкцией межклеточного вещества соединительной ткани. Тканевая коллагеназа вырабатывается в виде проколлагеназы, которая переходит в активную форму путем отщепления N-концевого октапептида под действием катепсина D, других протеиназ или аутокаталитически. Активаторами тканевых коллагеназ являются плазмин, калликреин, катепсин В. Микробные коллагеназы расщепляют коллаген более, чем в 200 участках одновременно, что обусловливает быстрое разрушение соединительнотканных барьеров и проникновение бактерий вглубь тканей.
Растворимость коллагеновых волокон в 1000 раз меньше, чем молекул проколлагена. По мере старения в коллагене увеличивается количество поперечных связей и уменьшается растворимость в солевых растворителях. При гиповитам»-нозе С (цинга, скорбут) снижается когв»-чество гидрокси пролина, что повышает хрупкость стенки капилляров. Аналоп**-
552
Биохимия органов и тканей Глава 34
ные изменения и замедление роста наблюдается при недостаточности лизил-гидроксилазы и уменьшении количества гидроксилизина (синдром Элерс-Данло-са, тип VI). Гиперподвижность суставов возможна при уменьшении поперечных сшивок в коллагене (синдром Элерс-Данлоса, тип V) или недостаточности аминопроколлаген-пептидазы (синдром Элерс-Данлоса, тип VII). При синдроме Марфана уменьшено количество поперечных сшивок в коллагене, что отражается в виде деформаций скелета и развитии аневризмы аорты.
Белки семейства эластина отвечают за эластичность тканей. Эластин — гидрофильный белок, содержащий около 750 аминокислотных остатков (высокое содержание пролина и глицина и низкое содержание гидроксипролина и гидроксилизина). За эластичность коллагена отвечает структура, образованная поперечными связями между остатками лизина — десмозин (изодесмозин). В образовании связей десмозина участвуют 4 остатка лизина, 3 из которых предварительно окисляются до соответствующих альдегидов с участием медьсодержащего фермента лизилокси-дазы, в присутствии витаминов РР и В6, и затем объединяются с четвертым остатком лизина. При недостатке этих витаминов и меди образование десмозина нарушается. Эластиновый остов эластического волокна покрыт слоем микрофибрилл диаметром около 10 нм (гликопротеины интеграции эластических волокон).
Эластин синтезируется в фибробластах и гладкомышечных клетках в виде растворимого предшественника — тропоэластина, а затем полимеризуется, превращаясь в нерастворимую внеклеточную форму в результате образования поперечных связей типа десмозина. Эластическое волокно характеризуется высокой стабильностью, нерастворимостью в воде, высокой скоростью обмена. Нативные эластические волокна не перевариваются трипсином и химотрипсином, медленно гидролизуются пеп
сином. Поджелудочная железа выделяет фермент проэластазу, которая активируется трипсином, превращаясь в эластазу. Под действием эластазы нити эластина расщепляются до пептидов. В тканях эту функцию выполняет тропоэластаза, расщепляющая тропоэластин и не действующая на эластические волокна. В печени синтезируется ингибитор трипсина альфа-антитрипсин, защищающий эластин от избыточного протеолиза. Эластаза синтезируется макрофагами и полиморфноядерными лейкоцитами, она проявляет наибольшую активность в щелочной среде, обладает низкой специфичностью и расщепляет также коллаген, протеогликаны, гемоглобин, иммуноглобулины и другие белки.
В норме эластазу лейкоцитов ингибирует сц-антитрипсин, который синтезируется в гепатоцитах, макрофагах легких. Этот фермент защищает альвеолы от воздействия эластазы. Деградация эластических волокон при эмфиземе легких и других заболеваниях обусловлена повышением активности эластазы лейкоцитарного происхождения. Разрушенные эластические волокна не восстанавливаются. Процесс старения связан с потерей эластичности тканей.
Во внеклеточном веществе имеется ряд адгезивных неколлагеновых белков, имеющих последовательности арг-гли-асп (RGD) и служащих для белково-лигандных взаимоотношений. К адгезивным белкам относят фибронектин, ламинин, нидоген, фибриллярные коллагены и коллаген IV типа; их относят к белкам «зрелой» соединительной ткани.
Фибронектин — гликопротеин, состоящий из двух субъединиц, которые связаны на Оконцах двумя дисульфидными связями, в каждой субъединице до 15 раз повторяется аналогичная последовательность из 90 аминокислотных остатков. Эти домены являются местами специфического связывания с гепарином, коллагеном, поверхностями клеток. Фибронектин ус-
553
Глава 34 Биохимия органов и тканей коряет миграцию клеток в межклеточном веществе соединительной ткани.
Ламинин — это белок, состоящий из трех полипептидных цепей, организованных в виде крестообразной структуры. Домены ламинина связывают коллаген типа IV, гепарансульфат и гликопротеины поверхности клеток.
Нидоген — сульфатированный гликопротеин базальных мембран, образует с ламинином плотный, нековалентно связанный комплекс. Участвует в образовании тройных комплексов ламинин — нидоген — коллаген.
К анпшадгезивным белкам относят остеонек-тин, тенасцин, тромбоспондин.
Тенасцин — встречается чаще, чем фибронектин (особенно в эмбриогенезе); гликопротеиновый комплекс, состоящий из шести идентичных полипептидных цепей, связанных дисульфидными связями в виде морской звезды. Тенасцин способен как ускорять, так и ингибировать клеточную адгезию.
Коллаген типа IV, гепаран сульфат, ламинин и энтактин могут образовывать базальные мембраны. Коллаген типа IV на J/4 длиннее молекул других типов коллагена (при биосинтезе не теряются концевые телопептиды), что позволяет ему создавать двумерную сеточку к которой прикрепляются эндотелиальные и эпителиальные клетки и которая образует ложа для мышечных и жировых клеток. При резком уменьшении содержания коллагена типа IV эпидермис легко отделяется от дермы (пузырчатка).
Энтактин служит для связывания между ламинином и коллагеном. Для выполнения функции молекулярного фильтра в базальной мембране почек необходим гепарансульфат. Уникальное строение базальных мембран препятствует прямому контакту фибробластов и эндотелия, но позволяет перемешаться моноцитам и лимфоцитам.
Для распада белковых молекул межклеточного вещества служат металлопротеиназы матрикса (МПМ) и их тканевые ингибиторы (ТИМПМ). Металлопротеиназы — это цинк-зависимые ферменты, катализирующие распад протеогликанов, гликопротеинов и коллагена: 72 кДа желатиназа (МПМ-2, коллагеназа А) расщепляет денатурированный коллаген, коллаген типов IV, V, VII, X, эластин,
фибронектин; 92 кДа желатиназа (МПМ-9, коллагеназа В) расщепляет желатин, коллаген типа IV, V, фибронектин; нейтрофильная коллагеназа (МПМ-8) расщепляет коллагены типов I-Ш; строма-лизины (МПМ-3, МПМ-10, МПМ-11) расщепляют протеогликаны, фибронектин, ламинин; матрилизин (МПМ-7) расщепляет фибронектин, ламинин, протеогликаны, эластин, энтактин и др. Активация металлопротеиназ лежит в основе разрыва атеросклеротических бляшек. Для активации металлопротеиназ требуются плазмин, трипсин, калликреин (частичный протеолиз и аутокаталитическое удаление части молекулы с формированием активного центра фермента). Белково-углеводные комплексы межклеточного вещества соединительной ткани имеют периоды полужизни от нескольких суток (протеогликаны кожи) до нескольких месяцев (зрелый коллаген кожи).
Изменения соединительной ткани при старении, заживлении ран, латиризме
Старение. Процесс старения во всех видах соединительной ткани сопровождается следующими изменениями.
1. Уменьшается количество гиалуроновой кислоты.
2. Уменьшается количество воды и соотношение основное вещество/волокна.
3. Замедляется метаболизм гликопротеинов основного вещества.
4. Повышается структурная стабильность коллагена в результате увеличения числа и прочности поперечных мостиков.
5. Уменьшается растворимость эластина, замедляется его метаболизм, ухудшается его эластичность.
6. Увеличивается в соединительной ткани содержание кальция в связи с увеличением сродства к нему коллагена и эластина.
Заживление ран. В месте повреждения образуется грануляционно-фиброзная ткань. Это происходит в результате следующих процессов:
554
Биохимия органов и тканей Глава 34
1. Из разрушенных клеток освобождаются биологичски активные вещества, повышающие проницаемость капилляров.
2. Фибриноген в ране превращается в фибрин, блокирующий капилляры и лимфатические сосуды.
3. Нарушение кровообращения приводит к некрозу тканей, продукты некроза стимулируют накопление лейкоцитов, пролиферацию элементов соединительной ткани (воспаление). 4. Накопление фибробластов связано с усилением их биосинтетической активности (фаза пролиферации). Фибробласты синтезируют протеогликаны (3—4 дня) затем коллаген (с 5 6 дня). Интенсивность синтеза нарастает к 12—15 дню. 5. Формирование рубцовой ткани — уменьшается количество клеточных элементов, липидов, резорбция избытка коллагена. Уплотнение ткани.
Латиризм (cutis laxa, вялая кожа) — заболевание, связанное со снижением активности лизилоксидазы. Это заболевание может развиться при употреблении в пищу душистого горошка (.Lathyrus orodatus), в котором содержится ингибитор лизилоксидазы — р-аминоп-ропионитрил. Под влиянием этого ингибитора нарушается формирование поперечных связей в коллагене и эластине, в результате чего образуется непрочный, растворимый коллаген, снижается эластичность соединительнотканных образований, в том числе кожи, нарушается развитие скелета. При данной патологии с мочой выделяются пептиды, содержащие гидроксипролин.
Гидроксипролин и пролин являются маркерами соединительной ткани. За сутки с мочой взрослого человека выводится до 20 мг гидроксипролина, а у ребенка в 10 раз больше.
Латиризм возможен при врожденной недо-статочеости лизилоксидазы и при дефиците меди в организме.
Биохимия мышечной ткани
Характеристика мышечных белков
Различают 2 группы мышечных белков: саркоплазматические и миофибрилляр-ные. Саркоплазматические белки экст
рагируются из мышц солевыми растворами с малой ионной силой. К ним относятся миоглобин, способный связывать кислород, ферменты гликолиза, ферменты митохондрий, белки, участвующие в обмене Са — кальсеквестрин и белок «с высоким сродством к кальцию». Миофибриллярные белки экстрагируются из мышц солевыми растворами с высокой ионной силой. Эти белки составляют основу молекулярной структуры миофибрилл.
Молекулярная структура миофибрилл. Миофибрилла поперечно исчерчена и содержит: 1) A-диск, темный, сильное двойное лучепреломление (анизотропный диск) 1,5—1,6 мкм; 2) 1-диск, светлый, изотропный диск — 1 мкм. 3) Z-линия (ширина = 80 нм) пронизывает поперек все волокно, что обеспечивает удержание фибрилл в пучки и упорядоченное расположение А- и I-дисков многих фибрилл. Пучок миофибрилл от одной до другой Z-линии образует саркомер (Z-Z = 2,5~3,0 мкм). Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под прямым углом к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплазматический ретикулум, составляющий 8—10 % объема клетки; 3) несколько митохондрий. Миофибрилла скелетной мышцы состоит из сократительных элементов — саркомеров. Саркомеры содержат параллельными пучками белковые нити двух типов — тонкие и толстые (рис. 34.7).
Толстые нити содержат миозин, тонкие — актин, тропомиозин, тропонин. Каждая толстая нить окружена шестью тонкими. Толстые нити образованы белком миозином. Миозин, м. м. 500000 Да, состоит из двух тяжелых полипептидных цепей и четырех легких. N конец каждой тяжелой цепи имеет глобулярную форму, образуя «головку» молекулы. К каждой из го-
555
Глава 34 Биохимия органов и тканей
Рис. 34.7. Структура мышечного волокна.
556
Биохимия органов и тканей Глава 34
ловок нековалентно присоединены по 2 легкие цепи. С-конец тяжелой цепи имеет конформацию альфа-спирали. Головка миозина присоединена к остальной части молекулы гибким участком. Это позволяет головке обратимо присоединяться к актину. Палочкообразные хвосты молекул миозина могут соединяться друг с другом, образуя пучки, головки будут располагаться вокруг пучка по спирали. В области М-линии пучки соединяются «хвост к хвосту», образуя миозиновые нити саркомера. В головке миозина есть центры связывания с актином и АТФ. Она способна гидролизовать АТФ на АДФ+Рн, т. е. обладает ферментативной активностью. Присоединение АТФ к миозину и гидролиз АТФ происхо
дит очень быстро. Однако отщепление продуктов гидролиза АДФ и Рн от миозина происходит медленно (рис. 34.8).
Тонкие нити. Основным белком тонких нитей является актин. Актин имеет центры связывания с миозином. Он бывает в двух формах: глобулярный G-актин (м. м. 43000 Да) и фибриллярной — F-актин. F-актин образуется при полимеризации G-актина, это двухцепочечная спираль из мономеров G-актина (бусы).
Тропомиозин — двухцепочечная аль-фа-спирализованная палочковидная молекула м. м. 70000 Да. Располагается в желобке между цепями F-актина. В покое тропомиозин закрывает в G-актине центры связывания с миозином.
Г ибкие участки
2 легкие цепи
Протеолитическое расщеллление трипсином и папаином
Головка миозина (N-конец)
Фрагмент С-конца
АТФ-азная активность
Центры связывания с актином
Головка миозина (N-конец)
Рис. 34.8. Структура миозина.
557
Глава 34 Биохимия органов и тканей
Длина молекулы тропомиозина равна семи глобулам G-актина.
Тропонин — м. м. 76000 Да, состоит из трех субъединиц с глобулярной структурой, расположен на концах каждой молекулы тропомиозина. Субъединица Т обеспечивает связывание с тропомиозином, субъединица С образует связь с Са2+, субъединица I расположена таким образом, что в покое мешает взаимодействию актина с миозином. Между собой актин, тропомиозин и тропонин связаны нековалентными связями (рис. 34.9).
В последние годы широкое распространение получило определение тропонинов Т и I в сыворотке крови при диагностике инфаркта миокарда.
Биохимические механизмы мышечного сокращения и расслабления
Большую роль в этом процессе играют ионы Са и саркоплазматические белки кальсеквестрин и «белок с высоким сродством к Са». Эти белки расположены в цистернах саркоплазматического ретикулума. Саркоплазматический рети
кулум — это внутриклеточная мембранная система, окружающая мышечные нити. В цистернах ионы Са связаны с кальсеквестрином и «белком с высоким сродством к Са». Кальсеквестрин — кислый гликопротеин с м. м. 45000 Да, способен присоединять 45 молекул Са, второй белок — м. м. 55000 Да связывает 25 молекул Са. Эти белки расположены на внутренней мембране ретикулума. Перенос Са из цистерн происходит по градиенту концентрации простой диффузией; перенос Са2+ из цитоплазмы в цистерны против градиента при участии Са2+ зависимой АТФ-азы и затраты АТФ. В состоянии покоя система активного транспорта накапливает Са в цистернах. Сокращение мышцы начинается с прихода потенциала действия на концевую пластинку двигательного нерва. В синапс выделяется ацетилхолин, который связывается с постсинаптическими рецепторами мышечного волокна. Далее потенциал действия распространяется вдоль сарколемы к поперечным трубочкам Т системы. В области Z линий происходит передача сигнала от поперечных трубочек на цистерны саркоплазматического ретикулума.
Деполяризация мембран цистерн приводит к освобождению Са и началу мышечного сокращения.
Тропониновый
Актин
комплекс
Тропомиозин
Рис. 34.9. Строение тонкого филамента.
558
Биохимия органов и тканей Глава 34
1. Са2+ связывается с субъединицей С тропонина. Это изменяет конформацию всей молекулы тропонина — субъединица I перестает мешать взаимодействию актина с миозином; изменение конформации субъединицы Т передается на тропомиозин.
2. Тропомиозин поворачивается на 20° и открывает закрытые ранее центры в актине для связывания с миозином.
3. Головка миозина, которая в покое представляет собой комплекс М+АДФ+Рн, присоединяется к актину перпендикулярно. Причем актин обладает к этому комплексу большим сродством (образование поперечных мостиков).
4. Присоединение актина вызывает быстрое освобождение АДФ и Рн из миозина. Это приведет к изменению конформации и головка миозина повернется на 45 % (рабочий ход). Поворот головки, связанной с актином, вызовет перемещение тонкой нити относительно миозина.
5. К головке миозина, вместо ушедших АДФ и Рн, вновь присоединяется АТФ, образуя комплекс М + АТФ. Актин обладает к нему малым сродством, это вызовет отсоединение головки миозина (разрыв поперечных мостиков). Она вновь становится перпендикулярно около тонкой нити.
6. В головке миозина, не связанной с актином, происходит гидролиз АТФ. Вновь образуется комплекс АДФ + Рн + миозин и все повторяется с 3-его пункта. После прекращения действия двигательного импульса Са2+ с помощью Са2+-зависимой АТФазы переходит в саркоплазматический ретикулум. Уход Са из комплекса тропонина приводит к смещению тропомиозина и закрытию активных центров актина, делая его неспособным взаимодействовать с миозином. Мышца расслабляется.
Энергетика мышц
Мышца потребляет огромное количество энергии. То количество АТФ, которое имеется в мышце, может поддержать сократительную активность всего лишь на протяжении доли секунды. Однако в мышцах позвоночных богатые энергией фосфатные связи запасаются в виде креатинфосфата. Это соединение в термодинамической шкале стоит выше АТФ, поэтому при участии креа-тинкиназы может происходить перенос фосфата от креатинфосфата к АДФ.
Креатинфосфат + АДФ ** АТФ + креатин
В работающей мышце запас креатинфосфата быстро истощается, а, следовательно, снижается и содержание АТФ. При этом возрастает концентрация АДФ и Рн, а также уровень АМФ при участии миокиназы (аденилаткиназа).
2АДФ «-+АТФ + АМФ
Накопление АМФ, АДФ приводит к стимуляции гликолиза, ЦТК и окислительного фосфорилирования, что обеспечивает восстановление резервов АТФ и креатинфосфата. В скелетных мышцах, кроме адениловых нуклеотидов (АТФ, АДФ, АМФ), креатинфосфата, креатина содержатся и другие небелковые азотистые вещества — карнозин (бета-аланил-гистидин) и ансерин (N-метилкарнозин). Это имидазолсодержа-щие дипептиды. Синтезируются из конечного продукта распада пиримидиновых нуклеотидов — бета-аланина. Эти соединения активируют Na\ К+-АТФазу, а также увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением. Скелетные мыщцы содержат медленные (красные) — I тип и быстрые (белые) — II тип волокна. Для волокон I типа характерны окислительные процессы, они содержат миоглобин и ми-
559
Глава 34 Биохимия органов и тканей тохондрии. Тип II волокон получают энергию из анаэробного гликолиза. При тренировке можно изменить состав мышц: у марафонцев преобладает I тип, у спринтеров — II тип волокон. Спринт: работают волокна II типа (гликолитические). В первые 5 секунд тратится креатинфосфат как источник энергии. Затем используется глюкоза, полученная из гликогена и дающая энергию в гликолизе. Гликоген мышц быстро истощается. Марафон: работают волокна I типа (окислительные). Основной источник энергии АТФ. АТФ образуется при тканевом превращении глюкозы и жирных кислот крови. Гликоген мышц истощается медленно.
Молекулярные моторы
Молекулярные моторы — это ферменты, трансформирующие химическую энергию в механическую работу (Schliwa М., 2006). В эукариотических клетках выделяют три различных класса моторов: 1) миозин; 2) кинезин и 3) динеин. В этих моторах необходимы следующие условия: 1) протяженная полярная структура, вдоль которой в одном направлении перемещаются актиновые филаменты (миозин, см. мышечное сокращение) и микротрубочки (кинезины и динеины); 2) молекулярная организация взаимодействующих субъединиц должна обеспечивать однонаправленное движение; 3) энергию для движения получается при гидролизе АТФ и реализуется через конформационные изменения белков; 4) связывающие центры для АТФ и подвижных элементов локализуются в глобулярных каталитических доменах, называемых головками; 5) взаимодействие субъединиц молекулярных моторов обеспечивает перемещение структур в вязкой цитоплазме. В настоящее время известны 18 классов миозинов, 10 семейств кинезинов и 2 группы динеинов. Три типа моторов различаются по молекулярной массе; кинезины — 45 кДа, миозины — 100 кДа и динеины — 500 кДа. По структуре — кинезины и миозины. Молекулярные моторы используются различными живыми организмами для клеточной активности — контракция, транспорт органелл, подвижность клеток, клеточное
деление, передача информации, процессы развития и др. (табл. 34.1).
Характеристика нервной ткани
Нервная ткань — это основная ткань нервной системы, выполняющая в организме функции восприятия раздражителей и проведения возбуждения.
Основной структурой и функциональной единицей нервной ткани являются нервные клетки (нейроны). Их количество в центральной нервной системе высших животных составляет 1012—10'5. Они расположены в нейроглии, выполняющей опорную и транспортную функции. Нейрон состоит из тела клетки, многочисленных ветвящихся коротких отростков — дендритов и одного длинного отростка — аксона. Нервные волокна, образующиеся из аксонов нервных клеток, подразделяются на два типа: мякотные (или миелинизированные) волокна и безмякотные (или немиелинизиро-ванные) волокна. Проводниковая система соматической нервной системы, а также ЦНС относится к первому типу. Между участками аксона, покрытыми миелиновой оболочкой, остаются немиелинизированные зоны, называющиеся перехватами Ранвье. Сложнейшая система межнейрональных и периферических связей осуществляется через синапсы. На одном нейроне может быть от нескольких десятков до нескольких тысяч синапсов. Уникальное строение нейронов, для большинства из которых характерна значительная разница между размерами тела клетки и длиной отростков (в первую очередь, аксона), требует существования в нервных клетках специфических транспортных систем, осуществляющих перенос метаболитов, ионов и др. Прямой и обратный (ретроградный) аксональный ток является обязательным условием нормального функционирования нейрона.
Наряду с нейронами в функционировании нервной ткани большую роль играют различные нейроглиальные клетки — астроциты, олигодендроциты, клетки эпендимы и микроглии. Нормальное функционирование нервной -пани базируется на морфофункциональном и метаболическом взаимодействии нейронов и клеток нейроглии.
560
Биохимия органов и тканей Глава 34
Таблица 34.1. Использование молекулярных моторов в функционировании клеток (Schliwa М., 2006)
Функция клетки Кинезины Миозины Динеины
Транспорт органелл + + +
Эндоцитоз +
Митоз/мейоз + + +
Цитокинез + +
Транспорт РНК + +
Флагеллярная подвижность +
Динамика микротрубочек + +
Взаимодействие микротрубочек + +
Взаимодействия актина +
Левая/правая ассиметрия + +
Движение клеток, формообразование +
Микроворсинки и филоподии +
Передача информации + +
Связывание с другими моторами + + +
Воспринимающие функции + + +
Транспорт вирусов + +
Химический состав нервной ткани. Серое вещество головного мозга представлено в основном телами нейронов, а белое вещество — аксонами. В связи с этим указанные отделы мозга значительно отличаются по своему химическому составу. Химический состав периферических нервов близок к составу белого вещества мозга. В связи с многообразием морфологических компонентов, входящих в нервную ткань, более целесообразно рассматривать состав отдельных морфологических элементов нервной ткани.
Химический состав нейронов. В теле нейрона содержится около 65 % воды и 35 % плотных веществ. До 40 % плотных веществ составляют липиды, причем 25 % из них представлены фосфолипидами и ганглиозидами. На долю белков приходится около половины плотных веществ нервной клетки, на долю нуклеиновых кислот — 3—5 %;
остальная часть плотных веществ приходится на углеводы, метаболиты, электролиты и др. вещества.
В ядрах нервных клеток содержатся белки и вся ДНК. У человека в каждой диплоидной клетке мозга содержится около 6 пг ДНК (4х1012 Да или 6*109 пар нуклеотидов).
В последние годы появились данные об особой роли в функционировании мозга ряда монотонно повторяющихся тринуклеотидных последовательностей в ДНК (ЦГГ, ГЦЦ, ЦТГ). Например, в различных частях генома содержатся группы тринуклеотида ЦАГ по 8-33 копий. Увеличение числа копий в 3-10 раз ассоциируется с рядом тяжелых нервных болезней (болезнь Хантингтона, спинальная и бульбарная атрофия, спиноцеребеллярная атаксия).
561
Глава 34 Биохимия органов и тканей
Ядрышко бедно водой (около 30 %), богато белком, содержит РНК. Цитоплазма обладает плотностью приблизительно в 1,5 раза большей, чем ядро. Примерно от четверти до трети всех белков ее связано с РНК, причем эта часть белков сосредоточена в более плотной зоне, непосредственно прилегающей к оболочке ядра, и виде телец Нис-сля (состоящих из РНК и белков). Среднее отношение РНК/ДНК может достигать 50 (в паренхиматозных клетках 2—4,5). В мотонейронах головного мозга и в спинальных ганглиях количество РНК, приходящееся на одну клетку, достигает 500—2500 пг. Основная доля РНК приходится на рРНК, что связано с мощным рибосомальным бе-локсинтезирующим аппаратом нейронов. Более половины мРНК приходится на мозгоспецифичные формы (HI-IV).
Липиды составляют до 50 % сухого вещества и преимущественно содержатся в митохондриях, микросомах и в пространствах между тельцами Ниссля. Дендриты имеют состав, близкий к составу тела клетки, но содержание плотных веществ в них значительно ниже. Еще ниже содержание плотных веществ в плазме аксонов; здесь отсутствуют тельца Ниссля, мало митохондрий, которые становятся многочисленными в окончаниях аксонов. Миелиновые оболочки нервов представляют собой многослойные образования. Каждый слой состоит из чередующихся белковых и липидных слоев. В расчете на сухую массу содержание липидов в миелине составляет 70—80 %, а белков — 20— 30 %. На липиды миелина приходится около 65 % липидов всего белого вещества мозга. В зрелом миелине отношение холестерол: фосфоглицериды: галактолипиды составляют 4:3:2. Доминирующим фосфоглицеридом является фосфотидилэтаноламин, а доми
нирующими галактолипидами — цереброзиды. Миелиновая оболочка содержит два своеобразных белка:
1. Основной белок (около 30 % белка миелина); он способен при введении некоторым животным вызывает энцефалит.
2. Протеолипиды ( 50 % белков миелина) — это белки нерастворимые в воде, но растворимые в смеси хлоро-форм:метанол (из-за большого содержания липидного компонента и большого содержания гидрофобных аминокислот).
Ганглиозиды in vivo обладают уникальными свойствами: при введении в организм подкожно, внутримышечно или интраперитонеально они относительно длительное время сохраняются в кровеносном русле, лишены токсичности, в небольших количествах проникают через гематоэнцефалический барьер и активно встраиваются в нейрональные мембраны. Они способствуют репарации поврежденных аксонов, обладают выраженными терапевтическими эффектами при травмах головного и спинного мозга (например, введение моносиалоганглио-зидаСМ1).
Ганглиозидозы — наследственные заболевания, характеризующиеся распадом психических функций вплоть до идиотии, дегенерацией нейронов, демиелинизацией, прогрессирующим депонированием ганглиозидов в цитоплазме нейронов. Это заболевание Тей-Сакса. Признаки заболевания: 1) прогрессирующие умственные и двигательные расстройства с началом в детстве и летальным исходом; 2) аутосомно-рецессивное наследование; 3} нейрональный липидоз с накоплением GM1 и/или Gm2; 4) накопление структурнородственных гликолипидов, гликопротеинов, полисахаридов; 5) отсутствие или серьезный дефицит специфических лизосомальных гликогидролаз.
Особенности метаболизма нервной ткани. Обмен и функции нуклеиновых
562
Биохимия органов и тканей Глава 34
кислот клеток нервной системы характеризуется особенным разнообразием экспрессируемых уникальных генов. Среди них есть гены, определяющие синтез большого числа нейроспецифич-ных белков. Временные и стабильные перестройки систем экспрессии генов являются важным элементом механизмов памяти и других высших функций центральной нервной системы.
Следует отметить, что в мозге млекопитающих есть ряд генов, особенно быстро реагирующих на разнообразные экстремальные воздействия. Их включение в ряде ситуаций связано с повышением уровня цитоплазматического Са2+. Далее следует включение более специфичных участков генома. В число таких генов «первоочередного реагирования» (immediate-early genes) входят гены, открытые ранее в связи с исследованиями протоонкогенов (см. ниже). В частности, гены с-fas и c-jun кодируют факторы-регуляторы транскрипции других генов — белки Fos и Jun. Последние входят, в свою очередь, в состав белка АР-1, связывающегося с определенными локусами ДНК, например, возле 5'-конца гена, кодирующего фактор трофики нейронов — NGF. В экстремальных ситуациях — при эпилептических судорогах, требующих срочного усиления трофики нейронов, этот механизм включает синтез NGF. Аналогичные механизмы срабатывают под влиянием боли, включая каскады транскрипции генов, ведущие к синтезу противоболевых опиоидных пептидов. Возможно, именно эти биохимические процессы играют важную роль в механизмах запоминания.
Многочисленные нейроспецифичные белки, многие из которых представляют собой глико-или липопротеины, выполняют важные функции, в частности, участвуют в формировании рецепторных участков клеточной поверхности, в процессах адгезии клеток, в перестройке межклеточных контактов в онтогенезе. Некоторые
нейроспецифичные белки вовлечены в процессы синаптической передачи и формирования долговременной памяти. В настоящее время открыто более 200 нейроспецифичных белков. Кислые кальцийсвязывающие нейроспецифичные белки (например, цитоплазматический глиальный белок S-100), участвуют в транспорте ионов и в формировании памяти. Особую группу нейроспецифичных белков составляют сократительные белки нервной ткани (нейротубулин, нейростенин, актиноподобные белки — кинезин и др.), которые обеспечивают ориентацию и подвижность цитоструктурных образований (микротрубочек, нейрофиламентов), активный транспорт ряда компонентов нейрона и участвуют в нейромедиаторных процессах в синапсах. К нейроспецифичным белкам относят регуляторные гликопротеины гипоталамуса и нейрофизины, являющиеся носителями пептидных регуляторов. Диагностическое значение имеет выявление в сыворотке крови енолазы (белок 14—3—2).
Интенсивность обновления богатых энергией фосфорных соединений в головном мозге очень велика. Поэтому содержания АТФ и креатинфосфата в мозговой ткани характеризуется значительным постоянством. Прекращение доступа кислорода (даже 10—15 с вследствие нарушения кровоснабжения мозга) повреждает энергетику нервных клеток. Это выражается наступлением обморочного состояния. При нормальных условиях энергетические потребности зрелого мозга обеспечиваются почти полностью за счет гликолиза. У человека (в покое) на долю мозга приходится приблизительно 20 % потребления О2, в то время как масса мозга составляет лишь 2 % массы тела. Мозг эффективно поглощает глюкозу из крови. В расчете на всю массу головного мозга содержание глюкозы в нем составляет 750 мг. За 1 мин тканью мозга окисляется 75 мг глюкозы. Этого количества глюкозы достаточно лишь на 10 мин жизни человека. Следовательно, мозг нуждается в постоянном притоке глюкозы. 90 % потребляемой глюкозы в ткани мозга окисляется до СО2 и Н2О при
563
Глава 34 Биохимия органов и тканей участии цикла трикарбоновых кислот и сопряженных цепей переноса протонов и электронов. Известно, что мозг человека потребляет 20—25 % поступившего в организм кислорода и до 70% свободной глюкозы, выделяемой из печени в кровь. При кислородном голодании мозг может очень недолго получать энергию за счет процессов гликолиза, т. к. содержание глюкозы в головном мозге невелико. В пренатальный и неонатальный периоды (т. е. перед рождением и в ранние сроки после рождения), а также у голодающих (независимо от возраста) на долю окисляемого кетонового тела — ацетоацетата — может приходиться 1/4 потребляемого кислорода. В связи с тем, что аэробные превращения глюкозы являются главным источ-ником энергии, важное значение приобретает реакция окислительного декарбоксилирования пирувата.
Считается, что полиневриты и другие неврологические признаки недостаточности витамина Bv а следовательно и дефицита кофермента ТДФ, являются следствием неадекватного превращения пирувата в ацетил-КоА. Пируват накапливается, а высокие его концентрации токсичны для нервной системы.
Метаболизм аминокислот имеет в нервной ткани ряд специфических черт. Особую роль играют дикарбоновые аминокислоты, содержание и интенсивность метаболизма которых в мозге заметно выше, чем в других тканях. На долю глутаминовой кислоты, глутамина, аспарагиновой, N-ацетиласпарагино-вой и у-аминомасляной (ГАМК) кислот приходится 75 % от фонда свободных аминокислот. В митохондриях мозга 90 % глутамата превращается в аспартат с участием аспартатаминотрансферазы.
Это наиболее мощная аминотрансфераза мозга. Наряду с участием в биосинтезе пептидов и белков (глутамат и глутамин составляют вместе 8—10 % от аминокислотных остатков гидролизата белков мозга), глутаминовая кислота выполняет чрезвычайно важную функцию в энергетическом обеспечении головного мозга, которая заключается в поддержании метаболитов ЦТК на высоком уровне. Цикл превращений ГАМК в мозге включает три сопряженные ферментативные реакции, получившие название ГАМ К-шунта. ГАМ К-шунт представляет собой модификацию ЦТК на участке между 2-оксоглутаровой кислотой и янтарной кислотой: 2-оксоглутарат -* глутамат * ГАМК -* янтарный полуальдегид -► сукцинат. Ряд аминокислот выполняет особые функции, выступая в роли нейромедиаторов или их непосредственных предшественников.
Для нервной ткани характерна отчетливо выраженная компартментализация метаболизма, т. е. пространственная разобщенность отдельных метаболических процессов — как в разных отделах мозга, так и в различных субклеточных структурах нейрона или в элементах системы нейрон-нейроглия. Особенно ярко это продемонстрировано на примере метаболизма аминокислот и реакций энергетического обмена — существования «большого» и «малого» метаболических компартментов, отличающихся субстратами окисления, скоростью и направлением протекания отдельных реакций. Известен эффект Вэлша, согласно которому при определенных условиях в опытах с использованием меченых предшественников удельная радиоактивность продукта, об-разовавшегося за короткий промежуток времени, превышает радиоактивность предшественника. Смысл эффекта в том, что метаболизм имеет место в малом, высокоактивном пуле аминокислот, а меченый предшественник разбавляется при выделении большим количеством немеченого предшественника из другого, малоактивного пула. Важным примером компартментализации метаболических процессов служат специфические биохимические реакции, которые протекают в синаптических
564
Биохимия органов и тканей Глава 34
окончаниях и лежат в основе функциональной деятельности синапсов.
Мозг содержит чрезвычайно большое число регуляторных пептидов (нейропептидов); в настоящее время идентифицированы сотни пептидов-регулято-ров. Они являются участниками синаптической передачи сигналов и дистантными регуляторами, обеспечивающими широкий круг функций ЦНС и психосоматические взаимодействия.
Биохимия возникновения и проведения нервного импульса. Нервная система представляет собой сеть из волокон, взаимосвязанных друг с другом и с клетками других типов, например, сенсорными, рецепторными, мышечными, секреторными клетками и т. д. Клетки сообщаются друг с другом путем передачи сигналов от одной клетки к другой. Эти сигналы регистрируются в виде электрических процессов. Передача сигналов между клетками происходит путем освобождения и перехода через синаптическую щель органического вещества — медиатора. Медиатор вступает в связь с рецепторами по другую сто-рону синаптической щели и обеспечивает инициацию очередного этапа возбуждения.
Поддержание потенциала покоя нервной клетки определяется преимущественно избирательной проницаемостью мембраны для ионов калия, которые выходят из клетки по градиенту концентрации. Электрическая возбудимость нейрона и проведение импульса по аксону обеспечиваются интегральными мембранными белками — потенциалзависимыми ионными каналами, а также ионными насосами. В деполяризации мембраны нейрона во время генерации импульса участвуют натриевые или кальциевые каналы, а реполяризации мембраны — прежде всего калиевые каналы. Для поддержания трансмембранных электрохимических градиентов
в покое и их восстановления после нервного импульса необходим еще один вид трансмембранных белков — ионные насосы.
Нейротрансмиттеры. Нервная деятельность (особенно высшая) является результатом процессов, происходящих в синапсах. С морфологической точки зрения это те места, где контактируют две нервные клетки и где происходит передача возбуждения от одной клетки к другой. Передача возбуждения происходит с помощью медиаторов. Каждый тип синапса использует только определенный тип медиатора: холинергические синапсы — ацетилхолин, адренергические — катехоламины.
Существует два класса синаптических медиаторов', нейромедиаторы (опосредующие передачу сигнала) и нейромодуляторы (регулирующие передачу). В качестве медиаторов идентифицированы: ацетилхолин, моноамины, аминокислоты, пурины, пептиды. Синапсы обладают свойством пластичности — способностью к функциональным и морфологическим перестройкам в процессе синаптической активности. Различают кратковременные и долговременные формы синаптической пластичности. В обеспечении долговременной пластичности на пресинаптичес-ком и постсинаптическом уровне могут участвовать ретроградные межклеточные медиаторы (например, оксид азота NO). Обязательным звеном передачи нервного импульса в химических синапсах являются рецепторы — образования, состоящие из белков и гликолипидных компонентов, которые с высокой специфичностью связывают нейромедиатор. По типу вызываемых медиатором процессов рецепторы делятся на две категории: 1) быстродействующие, содержащие в своей структуре ионный канал, открытие которого ведет к изменению потенциала мембраны; 2) медлен-
565
Глава 34 Биохимия органов и тканей недействующие, состоящие из компонентов периодически связывающихся друг с другом, которые после взаимодействия с нейромедиатором запускают цепь реакций, образующих вторичные молекулы — посредники, циклические нуклеотиды, диацилглицерол, инозитолфосфаты и др. Одни и те же медиаторы в разных синапсах могут взаимодействовать с рецепторами разных типов.
Например, ацетилхолин синтезируется вблизи пресинаптического окончания аксона — путем переноса ацетильной группы от ацетил-КоА на холин, фермент холинацетилтрансфе-раза: ацетил-КоА + холин -» ацетилхолин + HS-KoA. Образовавшийся ацетилхолин попадает в синаптические пузырьки. Его высвобождение из пузырьков происходит порциями в ответ на возбуждение, передаваемое от аксона. После освобождения в синаптическую щель ацетилхолин взаимодействует с рецепторами на постсинаптической мембране. Они бывают двух типов: мускариновые и никотиновые, т. е. активируются соответственно мускарином и никотином. Связывание ацетилхолина с никотиновыми рецепторами приводит к изменению конформации рецепторов, которое передается аденилатциклазе, локализованной в постсинаптической мембране. Запуск аденилатциклазного механизма приводит к фосфорилированию белков натриевых и калиевых каналов и увеличению проницаемости мембраны для Na+ и К+. В постсинаптической мембране возникает потенциал действия. Мускариновые рецепторы действуют по гуанилатциклазному механизму. После диссоциации ацетилхолина из комплекса с рецептором он разрушается под действием ацетилхолинэстеразы. Ацетилхолинэстераза связана с наружной стороной постсинаптической мембраны. В среднем на каждый ацетилхолиновый рецептор приходится 1 молекула фермента.
лин, яд — кураре) ингибируют рецепторные белки и тем самым блокируют нервно-мышечное проведение. Лекарственные препараты (неостигмин, эзерин) ингибируют ацетилхолинэстеразу, тем самым они усиливают действие ацетилхолина. Еще более мощными ингибиторами фермента являются органические фторфосфаты. Они образуют прочную связь с ацетил-холинэстеразой и вызывают смерть от остановки дыхания. Это нервно-паралитические яды — табун, зарин.
Медиаторами адренергической передачи являются катехоламины — норадреналин, адреналин, дофамин. Механизм их синтеза в нервной системе такой же, как и в мозговом веществе надпочечников. Норадреналин встречается в основном в симпатической нервной системе, в стволе мозга и в гипоталамусе. Дофамин обнаруживается в полосатом теле и в базальных ганглиях. В адренергических синапсах нет систем, разрушающих медиаторы в синаптической щели. Вместо этого на пресинаптической мембране есть рецепторы для медиатора, взаимодействие с ними прекращает освобождение в щель новых порций медиатора. Кроме этого, в синаптической щели есть специальная транспортная система для выкачивания медиатора из синапса. Реабсорбированный норадреналин либо вновь повторно используется, либо инактивируется ферментами МАО. метилированием.
При заболевании миастения в крови находят антитела против собственных рецепторов ацетилхолина, что проявляется мышечной слабостью. Ряд лекарственных препаратов (атропин, сукцинил хо-
С нарушением дофаминергической передачи связана болезнь Паркинсона. У больных отмечается ригидность мышц, маскообразное лицо, задержка начала движений. Концентрация дофамина в хвостатом
566
Биохимия органов и тканей Глава 34
ядре и скорлупе снижена. Высказано предположение об избыточной дофаминергической передаче при шизофрении. Известно, что все лекарства, которые являются эффективными при шизофрении, вызывают блокаду дофаминовых рецепторов. Отсюда побочное действие этих препаратов — возникновение симптомов, характерных для болезни Паркинсона.
Главным тормозным медиатором в нервной системе является гамма-аминомасляная кислота. ГАМК увеличивает проницаемость постсинаптических мембран для ионов калия и тем самым отдаляет мембранный потенциал от порогового уровня, при котором возникает потенциал действия. Инактивация ГАМК осуществляется путем трансаминирования. Постсинаптический ГАМК-рецептор может связываться с фенобарбиталом, вальпроатом и бензодиазепинами. Глицин тормозной медиатор в спинном мозге и в большинстве структур ствола мозга. Торможение осуществляется в результате повышения проводимости постсинаптической мембраны для ионов хлора, что приводит к ее гиперполяризации. Серотонин образуется в пресинаптических серотонинергических нейронах из 5-гидрокситрип-тофана преимущественно в клетках ретикулярной формации. Серотонин связывается с постсинаптическим гидрокситриптофановым рецептором. Медиатор тормозного типа, регулирует вегетативные функции. В качестве нейротрансмиттеров могут также выступать глутамат, эндогенные опиоиды (эндорфины, энкефалины), субстанция Р (медиация боли), а также NO и СО (редко).
Нейропептиды представляют собой малые и средние по размеру пептиды, содержащие от 2 до 40—50 остатков аминокислот. Часть нейропептидов мо
дифицирована по концевым аминокислотам. Общее число известных нейропептидов превышает тысячу. Они образуют более 40 семейств. Нейропептиды синтезируются путем частичного протеолиза больших пептидных предшественников (например, проопиомелано-кортин) в нейронах и сосредотачиваются в везикулах нервных окончаний. Действие нейропептидов реализуется через систему рецепторов «медленного» типа, содержащих G-белки.
Энкефалины и эндорфины. Эндорфины — это родовое название эндогенных опиоидных пептидов. Эти пептиды назвали опиоидными из-за способности связываться с теми же рецепторами, которые связывают морфин и др. опиаты. Первыми были открыты два пентапептида, названные энкефалинами: мет-энкефалин и лей-энкефалин (остальные 4 аминокислоты одинаковые). Они, по-видимому, участвуют в интеграции сенсорной информации, имеющей отношение к боли. В гипоталамусе позже были обнаружены более длинные пептиды альфа, бета, гамма эндорфины, которые оказались в 12—100 раз активнее энкефалинов. Эти пептиды участвуют в регуляции эмоциональных ответов. Вырабатываются при мышечной работе. Имеющиеся данные позволяют предположить, что энкефалины и эндорфины могут синтезироваться в нервной ткани. Особый интерес к этим соединениям связан с надеждой найти аналгетики, к которым не возникает привыкания.
Шкала стабильности нейромедиаторов представлена в таблице 34.2.
Нейрохимические основы памяти (по И. П. Ашмарину, 1999). Единой теории пока не создано. По современным представлениям следы памяти (энграммы) фиксируются в мозге в виде изменений состояния синаптического аппарата, в результате которых возникает предпочтительное проведение возбуждения по оп-
567
Глава 34 Биохимия органов и тканей
Таблица 34.2. Место нейромедиаторов среди других надклеточных гуморальных регуляторов по стабильности в организме (по И. П. Ашмарину, 1999)
Время Место по средней продолжительности существования эффективной концентрации регулятора Место по периоду полураспада
Менее 1 с Ацетилхолин (никотиновый рецептор)
Минуты Катехоламины, серотонин, гистамин, ГАМК
1-30 мин Малые пептиды (2-14 аминокислотных остатков), катехоламины
10-100 мин Средние пептиды (20-50 аминокислотных остатков), стероиды
Часы Большие пептиды
2-5 суток Йодтиронины Т3, Т4
5-50 суток Антитела
Месяцы-годы Специфический иммунитет
Месяцы-пожизненно Нейрологическая память
ределенным нервным путям. После восприятия информации, в процессе ее запечатления и фиксации, в мозге протекает ряд последовательно сменяющихся нейрохимических процессов:
1) кратковременная память продолжительностью менее 1 с — изменение функций синапса, связанные с выбросом и сдвигом концентрации медиаторов;
2) кратковременная память продолжительностью секунды — десятки минут — первоначальные синаптические процессы, связанные с изменениями концентрации ионов кальция или циклазными системами, вызывают изменения в составе и структуре нейроспецифичес-ких белков, в частности степени их фосфорилирования;
3) долговременная память продолжительностью часы-сутки требует модификации синтеза нуклеиновых кислот и белка;
4) для пожизненной долговременной памяти необходим постоянный синтез новых биополимеров, который может быть осуществлен в результате либо структурных изменений ДНК, либо образования устойчивых циклов для постоянного синтеза репрессоров или дерепрессоров транскриптонов.
Улучшению долговременной памяти способствуют кортикотропин и вазопрессин. Имеются сведения, что при обучении в мозге животных вырабатываются определенные олигопептиды, которые способны при введении необученным животным стимулировать у них выработку аналогичного навыка.
Гематоэнцефалический барьер (ГЭБ). ГЭБ - это физиологический барьер, препятствующий смешиванию крови и спинномозговой жидкости (СМЖ). ГЭБ проницаем для воды, но не для электролитов. Требуются часы для уравновешивания концентраций в СМЖ Na+, К+, после изменения их концентраций в крови. Перенос веществ через ГЭБ зависит от их молекулярной массы, связывания с белками и липофильности. Для альбуминов соотношение плазма крови — СМЖ равно 200 : 1. Связанные с белками ионы, билирубин, лекарства и другие вещества не проникают через ГЭБ. Например, в крови 90 % препарата фенитоина связано с белками, а 10% — несвязанный фенитоин, который про
568
Биохимия органов и тканей Глава 34
никает через ГЭБ и оказывает терапевтический эффект. Проницаемость ГЭБ нарушается при воспалении, травме, опухоли, ишемии, действии токсинов.
Спинно-мозговая жидкость. Функции СМЖ: механическая защита мозга, удаление продуктов метаболизма из мозга, транспортирует биологически активные вещества. Общий объем СМЖ 150 мл, плотность 1,006—1,008; pH 7,31; содержание белков 200—400 мг/л, глюкозы 2,5—4,44 ммоль/л; Na 138—150 ммоль/ л, К 2,7—3,9 ммоль/л. Равновесие между глюкозой крови и глюкозой СМЖ устанавливается за 4 часа. При спинномозговой пункции требуется одновременная оценка уровня глюкозы в крови и СМЖ. Белки проникают в СМЖ из плазмы крови путем пиноцитоза через эндотелий капилляров.
Патобиохимия клеток
С биохимических позиций состояние здоровья обеспечивают многие тысячи внутри- и внеклеточных реакций организма, определяя его максимальную адаптационную способность. Все патологические процессы и заболевания могут вызываться экзогенными или эндогенными неблагоприятными факторами, причем действие всех их реализуется преимущественно через биохимические процессы.
Молекулярные механизмы гибели клеток
Клетка может погибнуть по механизмам апоптоза или некроза.
Апоптоз — это запрограммированная форма гибели клеток, позволяющая в интересах организма удалить 1) соста
рившиеся клетки, 2) клетки с повреждениями генома и поэтому потенциально опасные для организма и 3) предшественники клеток в процессе клеточной дифференцировки. Морфологически апоптоз характеризуется конденсацией хроматина, фрагментацией ядер, нарушением мембран (бле-бинг мембран), повреждением органелл клеток, потерей адгезивных свойств, приобретением округлой формы и сморщиванием клеток. Биохимически апоптоз характеризуется фрагментацией ДНК высокой молекулярной массы, межнуклеосомным разрывом ДНК, выделением фосфатидилсерина и активацией внутриклеточного протеолиза. Изменения мембран и выделение ряда субстанций в окружающую среду обеспечивают привлечение макрофагов и фагоцитоз клетки в состоянии апоптоза.
Апоптоз описан для многих клеток и малых организмов типа нематоды С. Elegans, является эволюционно консервативным механизмом гибели клеток.
Механизмы апоптоза (Ganten D., Ruckpaul К., 2006) включают комплекс структурных и биохимических изменений: рецепторы гибели клетки, аспартат-специфичные цистеиновые протеиназы (каспазы), митохондрии, семейство белковых факторов Вс1-2, семейство белков-ингибиторов апоптоза (IAP), ряд биорегуляторов. Апоптоз реализуется 2 путями:
1. Внешний путь запускается через рецепторы гибели клеток (действие фактора некроза опухолей — TNF, фактора роста нервов — NGF, индуцирующего гибель сигнального комплекса — DISC и др.) расположенные на поверхности клеток, что ведет к формированию прокаспазы-8 -* каспазы-8 -* активации эффекторных каспаз -3, -6, -7 -* расщеплению макромолекул и фрагментации ядер.
2. Внутренний путь регулируется митохондриями и включается токсическими повреждениями генома, гипоксией, свободными радикалами, нарушениями регуляции ростовыми факторами, что ведет к освобождению факторов, индуцирующих апоптоз (цитохрома с, Smac/DIABLO, HtrA2/Omi, апоптоз-индуци-
569
Глава 34 Биохимия органов и тканей
руютцего фактора — AIF) -► комплекс «апоп-тосома» -* прокаспаза-9 + каспаза-9 -► активации эффекторных каспаз -3, -6, -7 * расщеплению макромолекул и фрагментации ядер. Итак, оба пути ведут к активации эффекторных каспаз, обеспечивающих гидролитическое расщепление ряда макромолекул и проявления морфологических признаков апоптоза.
Белковые факторы Bcl-2, Bcl-Xj ингибируют апоптоз, предотвращая освобождение стимуляторов апоптоза из митохондрий. Активацию эффекторных каспаз предотвращают белки семейства IAP и сурвивин. Для снятия их действия существуют «ингибиторы ингибиторов» — Smac/DIABLO, HtrA2/Omi.
Некроз —- незапрограммированная гибель клеток, тканей или органов в живом организме. Гибель клеток наступает, когда ее защитные механизмы (микросомальное окисление, репаративный синтез ДНК, антиоксидантная система и пр.) не справляются с повреждениями макромолекул и биорегуляторов. Некроз вызывают механические повреждения, инфекции, опухоли, ишемия, воспаление, окислительный стресс, радиационное воздействие.
Биохимия опухолевого роста. Онкогены. Ростовые вещества
Рак занимает второе место после сердечно-сосудистых заболеваний как причина смерти. С возрастом количество опухолевых заболеваний увеличивается.
Опухолевая клетка характеризуется тремя особенностями: 1) не контролируемый рост, 2) инвазивность в соседние ткани, 3) способность к метастазированию в другие отделы организма.
Морфологические и биохимические изменения при опухолевой трансформации клеток. При действии ряда факторов клетки могут претерпевать опухолевую трансформацию: 1) приобретают более
круглую форму; 2) потеря межклеточного контакта, ингибирующего рост клеток, ведет к их неконтролируемому росту; 3) потеря межклеточного контакта, ингибирующего подвижность клеток, ведет к их инвазивности (в норме подвижность клетки прекращается при ее контакте с другой клеткой); 4) различные биохимические изменения, включая активацию гликолиза, повреждения клеточной поверхности из-за изменений композиции гликопротеинов или гликофосфолипидов, изменение секреции определенных протеолитических ферментов; 5) повреждение структур цитоскелета, таких как актиновые филаменты; 6) снижение потребности в ростовых факторах и часто повышение секреции определенных ростовых факторов в окружающую среду.
Физические, химические и биологические агенты в патогенезе рака. Известны три основных группы агентов, которые ведут к развитию рака: радиация, химические вещества, вирусы.
1. Различные типы радиационной энергии могут быть канцерогенными: ультрафиолетовое излучение, рентгеновское излучение, гамма-излучение. Эти типы излучения повреждают ДНК несколькими путями. Ультрафиолетовое излучение может приводить к образованию пиримидиновых (тиминовых) димеров. Апуриновые и апиримидиновые места могут формироваться при удалении соответствующих пар оснований. Это может привести к одно- и двуцепочным разрывам или к перекрестному связыванию цепей ДНК. Действие рентгеновского и гамма- излучений связано с появлением свободных радикалов в тканях: гидроксильный, супероксидный и другие радикалы могут взаимодействовать с ДНК или другими макромолекулами. Эти начальные изменения могут вести к малигнизации тканей и появлению клеток, характеризуемых тремя признаками опухолевых клеток.
S70
Биохимия органов и тканей Глава 34
2. Многие химические вещества являются канцерогенными, их делят на несколько классов (примеры): полициклические ароматические углеводороды, ароматические амины, нитрозамины, лекарства, природные компоненты (дактиномицин, афлатоксин Bf), неорганические компоненты (мышьяк, асбест, бериллий, кадмий, хром).
Считают, что в 80 % возникновения рака у человека виноваты химические вещества окружающей среды. Воздействие этих веществ связано с профессией (бензпирен, асбест), диетой (афлатоксин В^, образом жизни (курение), приемом лекарств и др. Различают прямые канцерогены (действуют непосредственно на молекулы-мишени) и непрямые канцерогены (требуют предварительной ферментативной активации): проканцероген -* проксимальные канцерогены (А, В,...) -* ультимативный канцероген -* молекула-мишень (ДНК).
Проканцерогены обычно химически неактивны. Метаболизм ксенобиотиков ведет к повышению их растворимости и выведению. Метаболизм химических проканцерогенов тоже ведет к повышению растворимости, но при этом увеличивается электрофильность. Метаболизм химических канцерогенов протекает аналогично метаболизму ксенобиотиков в системах микросомального окисления (цитохромы Р-450; Р-448). Интенсивность метаболизма химических канцерогенов зависит от генетических, половых, возрастных и прочих факторов. В результате ферментативной метаболической активации они приобретают свойства (например, электрофильность, т. е. молекула дефицитна по электронам — «+» заряд), позволяющие атаковать молекулы -мишени (электрофильная атака нуклеофильных, т. е. богатых электронами групп ДНК, РНК, белков — «-» заряд).
Основой действия химического канцерогена является ковалентное связывание с клеточными макромолекулами (ДНК, РНК, белки). Наиболее важным является ковалентное связывание канцерогена с ДНК: с пуриновыми, пиримидиновыми основаниями и с фосфоди-эфирными группами. Ковалентное связывание прямых и ультимативных канцерогенов приводит к различным типам повреждения ДНК. Благодаря системам репарации ДНК определенное время эти повреждения могут не оказывать канцерогенного действия.
Многие химические канцерогены являются мутагенами, т. е. способны вызывать ряд мутаций. Мутагенность химических канцерогенов определяют: 1) в бактериальной системе Salmonella typhimurium по мутации в гене, кодирующем ферменты синтеза гистидина (Ames assay); 2) в S-9 фракции (постмитохоцдриаль-ная фракция печени, содержащая системы микросомального окисления); 3) в целом организме животного. Наиболее дешевым и доступным является Ames assay, который открывает 90 % всех канцерогенов.
В развитии канцерогенеза выделяют, по крайней мере, две стадии.
1. Стадия инициации, быстрая, необратимая. Связана с действием химического канцерогена, вызывающего одну или более мутаций (например, нанесение на кожу бензпирена). Эти канцерогены называют инициирующими агентами.
2. Стадия промоции, содействия, когда вещество, называемое промотором, после действия инициатора при хроническом применении ведет к развитию опухоли.
Многие канцерогены способны действовать как инициаторы, так и промоторы. Большое число химических веществ, в том числе фенобарбитал (индуктор цитохрома Р-450), сахарин могут действовать как промоторы. Наиболее известными промоторами являются кротоновое масло и форболовые эфиры. Один из них — 12-О-тетрадеканоилфорбол-13-ацетат (ТРА) в качестве рецептора имеет протеинкиназу С, что ведет к фосфорилированию многих мембранных белков, влияя на транспорт и другие функции. Иными словами, некоторые промоторы действуют на трансмембранные сигнальные системы. Кроме того, после действия инициатора они способны повреждать экспрессию генов.
ДНК — критическая для канцерогенеза молекула-мишень.
1. Опухолевая клетка рождает опухолевую клетку, а это связано с репликацией ДНК.
2. Как излучения, так и химические канцерогены повреждают ДНК и способны вызывать мутации в ДНК.
3. Во многих опухолях найдены ненормальные хромосомы.
4. Очищенная ДНК из опухолевых клеток (онкогены) способна трансформировать нормальную клетку в опухолевую.
571
Глава 34 Биохимия органов и тканей 5. Некоторые ДНК и РНК вирусов являются канцерогенными. Наиболее хорошо изучены вирусы полиомы и SV40. Это малые вирусы (геном около 5 kb), циркулярный геном которых кодирует не больше 5—6 белков. При их попадании в клетку возможна ее малигниза-ция, поскольку белки этих вирусов (Т-и t-подтипы — от слова «tumor») способны тесно связываться с ДНК и нарушать экспрессию генов. Отдельно следует рассмотреть роль онкогенов РНК-содержащих вирусов.
Ведущая роль онкогенов в канцерогенезе. Онкогены — это гены, способные вызывать рак. Онкогены открыты у ретровирусов, в частности у вируса саркомы Рауса. Геном этого вируса содержит 4 гена: 1) (gag) — кодирует группо-специфические антигены вируса; 2) (pol) — кодирует обратную транскриптазу; 3) (env) —- кодирует гликопротеины вирусной оболочки; 4) (src) — sarcoma-causing gene — кодирует проте-ин-тирозин-киназу.
После инфицирования клетки вирусом саркомы Рауса, встраивания генома вируса в ДНК хозяина, онкоген src кодирует синтез протеин-тирозинкиназы, которая вызывает ненормальное фосфорилирование ряда белков, в том числе белка винкулина, отвечающего за межклеточное взаимодействие (адгезию). Это ведет к округлой форме клеток, что уменьшает межклеточное взаимодействие. Фосфорилирование некоторых ферментов гликолиза ведет к его активации. Фосфорилирование фосфатидилинозитола запускает фосфатидилинозитольный цикл, в котором образуется два мессенджера: инозитолтрифосфат (1Р3) — освобождает Са2+ из эндоплазматического ретикулума; диацил-глицерол (ДА Г) — стимулирует активность связанной с плазматической мембраной про-теинкиназы С, которая фосфорилирует ряд белков, в том числе белки ионных насосов мембран (активация Na+/H+ системы антипорта). Это ведет к слабому защелачиванию внутриклеточной среды, являющемуся стимулом к митотическому делению клеток. Таким образом, онкоген src через протеин-тирозин-киназу и фосфорилирование ряда белков и ферментов
ведет к опухолевой трансформации клетки.
Следует отметить, что во многих нормальных клетках имеются белки, обладающие тирозинкиназной активностью. Содержание фосфотирозина в нормальных клетках низкое, но резко повышается после инфицирования онкогенным вирусом. Рецепторы многих ростовых веществ обладают тирозинкиназной активностью, которая стимулируется при связывании ростового вещества с рецептором. Таким образом, тирозинкиназная активность играет важную роль в нормальных и трансформированных клетках.
Онкогены других ретровирусов. В настоящее время установлено более 20 онкогенов. Около половины белков, кодируемых ими, являются протеинкиназами, чаще всего тирозинового типа (abc, fes, src). Ростовой фактор из тромбоцитов кодирует онкоген sis, рецептор эпидермального ростового фактора — онкоген erb-B, макрофагальный колоний-стимулирую-щий фактор — онкоген fms. ДНК-связываю-щий белок, кодируемый myc-онкогеном, контролирует митотическое деление.
В ДНК нормальных клеток есть последовательности нуклеотидов, сходные или идентичные с последовательностью нуклеотидов вирусных онкогенов. Вероятно, они включались ранее при пассировании вирусов в клетках. Их находят у многих эукариотических клеток (консервативные последовательности). Белковые продукты, кодируемые ими необходимы на различных стадиях клеточного цикла. Такие гены, присутствующие в нормальных клетках называются протоонкогены. В опухолевых клетках присутствуют онкогены, способные трансфорилировать нормальные клетки в опухолевые.
Номенклатура: c-onc (cellular oncogene, например, C-ras) — онкоген, присутствующий в опухолевых клетках; с-опс протоонкоген, (например, C-ras-протоонкоген) --- протоонкоген, присутствующий в нормальных клетках; v-onc (viral oncogene, например, V-ras), присутствует в вирусе (если в виде протоонкогена, то пишут v-ras proto-oncogene).
Активация протоонкогенов — это повышение транскрипции гена от нулевого или крайне низкого уровня. При превращении прото-онкогена в онкоген, который кодирует синтез какого-то белка, необходимы управляющие участки ДНК (что-то вроде промоторной зоны • Этот процесс играет ключевую роль в канцерогенезе. Возможно 5 механизмов активации протоонкогенов, присутствующих в неактивном
572
Биохимия органов и тканей Глава 34
виде в геноме клетки: 1) и 2) вставка промотора или энхансера; 3) транслокация хромосом — перенос участка ДНК с одной хромосомы на другую; 4) амплификация гена (усиление до 1000 раз), в том числе и некоторых онкогенов (например, c-ras участвует в прогрессировании роста и усилении малигнизации); 5) точечная мутация. Белок, кодируемый c-ras протоонко-геном из нормальных клеток и c-ras онкогеном из опухолевых клеток отличается по одной аминокислоте. Но этого отличия достаточно, чтобы у белка — продукта c-ras онкогена опухоли исчезла ГТФ-азная активность. В результате сохранения ГТФ возникает хроническая активация аденилатциклазы, цАМФ-зависимых протеинкиназ, фосфорилирование белков и дисбаланс метаболизма, что ведет к опухолевой трансформации клетки.
Итак, можно суммировать 3 основных пути, которыми продукты онкогенов стимулируют рост:
1. Действие на ключевые внутриклеточные метаболические нуги, участвующие в контроле роста (src-протеин-тирозин-киназа, ras-стимуляция аденилатциклазы, тус-ДНК связывающий протеин). Все эти белки контролируют митоз, а первые два — через фосфорилирование регуляторных белков.
2. Продукты онкогенов могут имитировать действие полипептидных ростовых факторов.
3. Продукты онкогенов могут имитировать связывание с рецепторами ростовых факторов.
В настоящее время появились сообщения о том, что некоторые химические канцерогены могут действовать через онкогены.
Митогенетическая роль полипептидных ростовых факторов:
1. Эпидермальный фактор роста (EGF) (слюнная железа мыши) стимулирует рост эпидермальных и эпителиальных клеток.
2. Эритропоэтин (почки, моча) — регулирует развитие ранних эритропоэтических клеток.
3. Инсулиноподобные ростовые факторы, I, II (IGF I, IGF II, называемые также соматоме-дины С и А) (сыворотка) — стимулируют включение сульфата в коллаген, митотическое
действие на хондроциты, инсулиноподобное действие на клетки.
4. Фактор роста нервов (NGF) (слюнная железа мыши) — действие на симпатические и сенсорные нейроны.
5. Тромбоцитарный ростовой фактор (PDGF) (тромбоциты) — стимулируют рост мезенхимальных и глиальных клеток.
6. Трансформирующий фактор (TGF-p) (почки, тромбоциты) — стимулирующий или ингибирующий эффекты на клетки.
Ростовые факторы действуют по 3 путям: 1) действуют подобно гормонам через кровь на клетки-мишени (как эндокринная регуляция); 2) действуют на соседние клетки окружения (как паракринная регуляция); 3) действуют на клетки их образовавшие (как аутокринная регуляция).
Для действия ростовых веществ пептидной природы важно первоначальное связывание с мембранным рецептором. В результате связывания активируются различные пути (протеин-тирозинкиназа, фосфатидилинозитольный цикл, протеинкиназа С, фосфолипаза и др.), ведущие к изменению митотической активности ткани. Некоторые из них (PDGF) за короткое время (мин — 2 часа) ведут к активации некоторых клеточных проонкогенов (с-myc, c-fos).
Продукты ряда онкогенов являются или ростовыми факторами или частью их рецепторов. Например, В цепь тромбоцитарного ростового фактора (PDGF) состоит из 109 аминокислот. Онкоген v-sis кодирует 100 из 109 аминокислот В цепи PDGF. Можно предположить, что аутокринная стимуляция тромбоцитарным ростовым фактором — хронический митогенный стимул — является важнейшим фактором в механизме опухолевой трансформации клеток под влиянием v-sis.
Роль анти-онкогенов в канцерогенезе. В последние годы открыты гены, подавляющие рост — анти-онкогены (growth-suppressor genes). Потеря этих генов нарушает механизмы контроля роста клеток. Их изучали на модели опухоли ретинобластомы. Ретинобласты — предшественники фоторецепторных клеток. Из 13 хромосомы клеток ретинобластомы исчезает 17 ген Rb (делеция гена). Продукт этого гена ингибирует рост нормальных клеток, но из-за отсутствия гена Rb клетки ретинобластомы делятся неуправляемо. Генетические исследования показали, что ген Rb инактивируется при развитии рака. В настоящее время открыты
573
Глава 34 Биохимия органов и тканей другие гены, которые тормозят рост клеток и инактивируются при развитии опухолевой трансформации клеток (анти-онкогены, или гены-супрессоры опухолей). Наиболее часто потеря анти-онкогенов обнаруживается при раке молочной железы, почек, легких. В самое последнее время показано, что продукт кодирования гена Rb имеет ядерную локализацию и действует как модулятор экспрессии генов. Восстановление гена Rb — путь к лечению рака.
Биохимические изменения в опухолевых клетках при прогрессирующем росте. Прогрессирующий рост сопряжен с активацией анаболических процессов, используемых при делении клеток (повышение синтеза РНК и ДНК, повышение мощности аэробного и анаэробного гликолиза) и снижение катаболизма (снижение катаболизма пиримидинов), потеря способности к дифференцировке (появление ферментативных констелляций фетального типа, синтез фетальных белков — раковоэмбрионального антигена), уменьшение синтеза специализированных белков. При неуправляемом росте нарушается регуляция генов и извращается синтез ростовых факторов и гормонов.
Метастазирование — наиболее опасное свойство ростовых клеток. Метастазирование связано с изменением поверхности опухолевых клеток (снижение адгезии, подвижность). При этом ведущую роль играет изменение композиции гликопротеинов и гликосфинголипидов. Для метастазирования важны протеолитические ферменты (4 тип коллагеназы). Кроме того, определенную роль играет потеря одних и появление других антигенов.
Роль биохимических лабораторных тестов в диагностике рака. Биохимические лабораторные тесты иг
рают вспомогательную роль в диагностике рака. Многие виды рака ассоциируются с ненормальной продукцией белков, ферментов и гормонов. Их можно определять в сыворотке крови. Такие молекулы известны как маркеры опухолей. В настоящее время получило широкое распространение определение следующих молекул:
1. Карциноэмбриональный антиген (СЕА) — опухоли толстого кишечника, легких, грудных желез, поджелудочной железы.
2. а-Фетопротеин (AFP) — опухоли печени, зародышевых клеток.
3. Человеческий хорионический гонадотропин (hCG) — опухоли трофобласта, зародышевых клеток.
4. Кальцитонин (СТ) — опухоли щитовидной железы (медуллярная карцинома).
5. Простатическая кислая фосфатаза (РАР) — опухоли простаты.
Инактивация генов-супре’ссоров опухолевого роста в результате метилирования премоторных областей широко распространена в опухолях различного типа, в том числе и при аденоме преста-тельной железы. Одним из первых генов, для которых при данном заболевании было показано гиперметилирование промоторной области, является ген GSTPI, который кодирует фермент, отвечающий за детоксикацию электрофильных и кислых ксенобиотиков и выполняющий антиоксидантную функцию. Метилирование гена GSTPI является одним из наиболее ранних и частых событий при образовании аденокарциномы предстательной железы (Васильева Е.Б., 2008).
574
Фармацевтическая биохимия
Фармбиохимия — совокупность биохимических знаний и методов, используемых для решения задач фармации: 1) разработка рациональных лекарственных форм; 2) стандартизация и контроль качества лекарств; 3) анализ и производство лекарств; 4) оценка эффективности лекарств на основе изучения их метаболизма; 5) фармакодинамика лекарств с помощью биохимического мониторинга организма; 6) фармакокинетика лекарств с помощью биохимических методов определения действующих начал и метаболитов лекарств во времени.
Виды лекарств
Все лекарственные средства делят на природные (биогенные) и чужеродные (ксенобиотики).
Ксенобиотики (от греческого xenos — чужеродный) — это химические вещества, являющиеся чужеродными для организма: лекарства, химические канцерогены, вещества химического загрязнения окружающей среды в результате промышленной и сельскохозяйственной
деятельности и др. Ксенобиотики в норме отсутствуют в организме или находятся в следовых количествах.
Все вещества, включая ксенобиотики, проходят в организме ряд сходных этапов: поступление во внутреннюю среду, транспорт, распределение и метаболизм, выведение или накопление. Метаболическая судьба ксенобиотиков зависит от наличия ферментов, которые способны катализировать их превращения. При отсутствии таких ферментов ксенобиотики обычно инертны и их судьба в организме будет описываться только процессами всасывания, транспорта и выделения. Ферменты, катализирующие превращения ксенобиотиков, не должны обладать высокой специфичностью по отношению к субстратам, поскольку эти субстраты относятся к категории чужеродных. По всей видимости, в процессе эволюции ферменты с высокой специфичностью стали основой собственного метаболизма живых организмов, а ферменты с низкой специфичностью к субстратам стали средством защиты путем инактивации чужеродных веществ. Таким образом, большинство ксенобиотиков подверга-
575
Глава 35 Фармацевтическая биохимия ется ферментативным изменениям в организме (преимущественно в печени), но часть из них может выделяться в неизменном виде.
Природные являются естественными продуктами живых организмов и участвуют в биохимических процессах (аминокислоты, гексозы, жирные кислоты, витамины, гормоны, биорегуляторы, препараты плазмы крови и др.).
В европейских странах получили распространение природные препараты 5 групп: 1) Суис-органные препараты (препараты из различных тканей, органов и клеток). 2) Нозо-ды — препараты, приготовленные гомеопати-ческим путем из органов, продуктов метаболизма, микроорганизмов (ауто- и гете-ронозоды). 3) «Катализаторы», которые включают группу А — метаболиты цикла трикарбоновых кислот; группу В — убихиноны и другие компоненты цепей переноса электронов; группу С — гормоны, биогенные амины, растительные экстракты. 4) «Потенцированные аллопатические» препараты (АТФ, витамины, антибиотики и др.). 5) Сложные препараты биологического происхождения.
Для этих препаратов характерна биосовместимость и они служат для целей метаболической терапии. Ксенобиотики в норме отсутствуют в организме человека или находятся в следовых количествах. Они могут быть синтетическими или извлеченными из других организмов (микроорганизмы и растения). Являются объектом изучения фармакологии. Граница между биогенными препаратами и ксенобиотиками достаточно условна, поскольку конечные их эффекты реализуются на уровне молекулярных биохимических процессов и регуляции.
Биохимические методы, используемые в стандартизации и контроле качества лекарств
Для стандартизации и контроля качества лекарств используют три группы мето
дов. 1. Физические методы — спектрофотометрия, флуоресцентный анализ, масс-спектрометрия и др. 2. Химические методы неорганического, коллоидного и органического анализа состава лекарств и их метаболитов. Эти группы физико-химических методов позволяют установить структуру вещества и лишь сделать предположение о его биологической активности. 3. Биохимические исследования с использованием субклеточных фракций, клеток, тканей, органов и организмов позволяют оценить биологическую активность лекарств. Использование биохимических методов обеспечивает стандартизацию лекарств и контроль качества на этапах производства и хранения их. Широкое распространение получило использование свойства специфического взаимодействия белков в системах фермент-субстрат; лекарство — рецептор; антиген — антитело. На основе этого фундаментального свойства белков созданы специфичные и высокоточные методы радиоиммунного, иммуноферментного, хемилюминесцентного анализа, аффинной хроматографии и др.
Биохимические механизмы токсичности лекарственных препаратов
Знаменитый врач 16 столетия Парацельс учил, что все субстанции являются ядами. Важнейшей характеристикой различных веществ применительно к их действию на организм является токсичность. В зависимости от дозы, вызывающей летальный эффект, все вещества делятся на 6 групп: 1) практически нетоксичные >15 г/кг; 2) слегка токсичные — 5—15 г/кг; 3) средне токсичные — 0,5—5 г/кг; 4) очень
токсичные — 50—500 мг/кг; 5) экстремально токсичные — 5—50 мг/кг и 6) супертоксичные < 5 мг/кг. Для количе-
576
Фармацевтическая биохимия Глава 35
ственной характеристики токсичности веществ используют показатель LD50 (летальная доза у 50 % испытуемой популяции животных): этанол — 10 г/ кг; NaCl — 4 г/кг; сульфат морфина — 0,9 г/кг; фенобарбитал натрия — 150 мг/кг; сульфат стрихнина — 2 мг/ кг; никотин — 1 мг/кг; а-тубокура-рин — 0,5 мг/кг; диоксин — 1 мкг/кг; токсин ботулинуса — 10 нг/кг. Выделяют четыре основных молекулярных механизма токсичности веществ.
1. На уровне ферментативных систем: необратимое ингибирование ферментов (органические фосфаты); обратимое ингибирование ферментов (атропин); разобщение дыхания и фосфорилирования (2,4-динитрофенол); синтез летальных субстанций (фторуксусная кислота); хелатация металлов, необходимых для энзиматической активности (дитиокарбаматы).
2. Нарушение транспорта и использование кислорода: ингибирование цитохро-моксидазы (цианиды); ингибирование транспорта кислорода (окись углерода); гемолиз (хлорид аммония).
3. Нарушения функции клеток: взаимодействия с липидной фазой мембран, ведущие к их деполяризации (анестетики); вмешательство в процессы репликации, транскрипции и трансляции (5-фторурацил).
4. Гиперчувствительность, например, иммунные реакции на специфические химические вещества (диизоцианаты).
Фармакодинамика лекарств
С позиций биохимии фармакодинамика лекарств представляет собой описание в терминах биохимии молекулярных механизмов действия лекарства на организм. Лекарства могут действовать на уровнях химического состава метаболизма и биохимических механизмов функций организма. Классификации
лекарств связаны как с молекулярными особенностями систем организма (нервной, эндокринной, пищеварительной и др.), так и с молекулярными особенностями процессов (психическая деятельность, размножение, пищеварение, дыхание и др.).
Фармакокинетика лекарств
Фармакокинетика — это количественная оценка присутствия лекарства в организме. Фармакокинетика позволяет 1) дать математическое описание судьбы лекарства в организме после его введения; 2) сравнить судьбу разных лекарств и разных доз лекарства; 3) предсказать концентрацию лекарства в крови в зависимости от способа и дозы введения, с одной стороны, и состояния организма, с другой стороны. Для математического описания фармакокинетики используют три основных подхода: 1) исследование линейных процессов первого порядка; 2) исследование нелинейных процессов нулевого порядка; 3) исследование процессов, связанных с насыщением, используя модификации уравнения Михаэлиса-Ментен. Для многих лекарств описана взаимосвязь между клиническим эффектом и концентрацией лекарства в крови. Это связано с тем, что лекарство — активный лиганд должно для проявления эффекта взаимодействовать с определенными молекулами — мишенями на мембране или внутри клетки. Измерение концентрации лекарства в крови в процессе лечения называют терапевтическим мониторингом лекарств.
Факторы, влияющие на концентрацию лекарств
Существуют четыре основных способа поступления лекарственных веществ в
20 Зак. 2124
577
Глава 35 Фармацевтическая биохимия организм: 1) энтеральный — через пищеварительный тракт; 2) парентеральный — а) внутрисосудистый; б) через кожу и слизистые и в) через легкие.
На концентрацию вводимого лекарства оказывают влияние 5 основных факторов, описываемых LADME-систе-мой: 1) liberation — освобождение из лекарственной формы; 2) absorption — всасывание, поглощение; 3) distribution — распределение; 4) metabolism — обмен, превращения; 5) elimination — выведение.
Освобождение из лекарственной формы. Для того, чтобы всосаться лекарство должно быть в форме истинного раствора (растворы для внутривенного, перорального, ректального применения, глазные капли, капли в нос). Из некоторых лекарственных форм действующее начало должно перейти в раствор в жидкостях организма (лекарства из таблеток, капсул, суспензий растворяются в желудочном соке; лекарства из суспензий, введенных внутримышечно или подкожно растворяются в тканевой жидкости). Водорастворимые компоненты мазей проникают в кожу после распределения мази на поверхности. Создаются лекарственные формы, которые при поступлении в организм постепенно освобождают лекарство (липосомы, микросферы и другие иммобилизованные формы).
Всасывание — это процесс переноса лекарства в кровеносное русло. Выделяют экстраваскулярные способы введения препаратов (пероральный, внутримышечный, подкожный, ректальный и др.) и интраваскулярные (внутривенный, внутриартериальный, внутрисердечный способы). В последнем случае нет этапа всасывания. Для всасывания лекарств используются все известные механизмы переноса веществ через мембраны.
1, Пассивной диффузией всасывается 95 % всех лекарств (неионизированные
формы лекарств перемещаются по градиенту концентрации). Для слабых электролитов-лекарств pH среды введения влияет на их ионизацию (pH в желудке 1,5—3, в кишечнике 5—7, в прямой кишке 7—8, на коже 5). Ионизованные лекарства всасываются медленнее. Например, алкалоиды в кислой среде желудка ионизованы и не всасываются, а в кишечнике эти вещества становятся слабо ионизованными и легко всасываются.
2. Методом облегченной диффузии с помощью мембранных белковых транспортеров переносятся лекарства (например, витамин В12) по градиенту концентрации. Для описания этого вида переноса с насыщением используют уравнение, аналогичное уравнению Михаэлиса-Ментен:
V=ynii(yKs,,,+C, где Vmx - максималь-ная скорость транспорта, соответствующая условиям насыщения переносчика веществом; С — концентрация переносимого вещества (лекарственного препарата);
— константа, соответствующая концентрации, при которой скорость переноса равна половине максимальной.
3. Активным транспортом с затратой энергии переносятся лекарственные вещества против градиента концентрации (гексозы, аминокислоты, рибофлавин, сердечные гликозиды).
4. Конвекционный транспорт — это перенос малых молекул из клетки в кровь через заполненные молекулами воды поры в мембране (мочевина). Все эти четыре способа переноса требуют, чтобы на абсорбционной стороне мембраны лекарство было в виде истинного раствора.
5. Методом везикулярного чрезмемб-ранного транспорта переносятся жирорастворимые витамины А, К, Д, Е, жир, крахмал.
При наиболее распространенном энтеральном способе введения ле-
578
Фармацевтическая биохимия Глава 35
карств следует учитывать следующие факторы:
1. Секреция пищеварительных желез ведет к изменению pH и степени ионизации лекарства.
2. Ферменты пищеварительного тракта могут катализировать гидролитическое расщепление пептидных, гликозидных, сложноэфирных, фосфоангидридных и других связей лекарств.
3. При большом содержании пищеварительных соков возможно разведение лекарства, что препятствует развитию фармакотерапевтической концентрации. 4. Изменение перистальтики и скорости эвакуации может изменить скорость всасывания лекарств в определенных отделах пищеварительного тракта.
5. Усиление кровотока способствует всасыванию лекарств.
6. Взаимодействие лекарственных веществ с составными компонентами пищи может инактивировать их (алкалоиды образуют нерастворимые соли с танином чая, препараты кальция связываются с анионами щавелевой и других кислот, а также с тетрациклином).
7. Кислые напитки через ионизацию лекарств изменяют скорость их всасывания, а некоторые лекарства ускоренно разрушаются в кислой среде (эритромицин, пенициллин).
8. Сахарин напитков способен связываться с линкомицином.
9. Этанол ускоряет всасывание и потенцирует действие ряда нейро- и психотропных лекарств.
Липофильные вещества всасываются через кожу методом простой диффузии. Гидрофильные вещества всасываются медленно через волосяные луковицы и потовые железы. Через легкие в организм поступают летучие вещества и газы (ингаляции, аэрозоли, эфир).
Известны два специфических барьера организма: гематоэнцефалический и плацентарный. Большинство лекарств
не способно проходить через гематоэнцефалический барьер, т. е. через эндотелий капилляров нервной ткани. Этот барьер избирателен. Например, дофамин не проходит через барьер, а его предшественник ДОФА — проходит, что и применяется при лечении паркинсонизма. Плацентарный барьер могут преодолевать вещества с молекулярной массой менее 1000 Да. Поэтому многие вещества и лекарства (этанол, барбитураты, аминазин, антибиотики, сульфаниламидные препараты, никотин и др.) могут проникать через него и отрицательно влиять на развитие плода.
Распределение. Абсорбированное лекарственное вещество поступает в кровь и может 1) оставаться в кровеносном русле; 2) покидать кровеносное русло и поступать в межклеточное пространство; 3) мигрировать в клетки органов и тканей. Распределение — это поступление лекарства из крови в другие ком-партменты. Этот процесс обычно занимает 0,2~2,0 часа, но имеются исключения (распределение метотрексата требует 15 часов).
Известны две основные транспортные системы для веществ в крови: белки крови и форменные элементы. Специфическими транспортерами являются глобулины, неспецифическими — альбумины.
Биогенные вещества связываются и транспортируются как альбуминами, так и глобулинами, а ксенобиотики транспортируются преимущественно альбуминами. Взаимодействие лекарств с белками происходит посредством водородных связей, электростатического и гидрофобного взаимодействий. Связанные с белками лекарства 1) не проходят через мембраны и гисто-тематические барьеры; 2) не участвуют в фармакологических эффектах; 3) не подвергаются химическим превращениям, в связи с чем дольше циркулируют
579
Глава 35 Фармацевтическая биохимия
в крови. Разные лекарства могут конкурировать друг с другом за связывание с белками. Транспорт лекарств может осуществляться клетками крови (эритроциты, в меньшей степени лейкоциты; тромбоциты транспортируют биогенные амины). Активными являются несвязанные свободные формы лекарств. Для реализации их действия требуется связывание с макромолекулами, выполняющими роль клеточных рецепторов, или мишени — белки, нуклеиновые кислоты, сложные липиды. Лекарства накапливаются в тех тканях, где имеются рецепторы к ним.
Метаболизм — это процесс биотрансформации поступившей молекулы лекарства в один или более метаболитов. Метаболиты обычно более полярные и способные выделяться с мочой. Метаболизм лекарств происходит в печени, почках, а также в мышцах и плазме крови. Как правило, метаболиты менее активны и менее токсичны, чем сами лекарства. Однако, имеется группа пролекарств, которые при метаболизме превращаются в активные лекарства. Следует упомянуть о возможности превращения неактивных проканцерогенов в активные канцерогены. Кроме того, при метаболизме лекарств могут возникать активные метаболиты. Эти особенности обязательно учитываются при терапевтическом мониторинге лекарств.
Метаболизм ксенобиотиков происходит в 2 фазы.
Первая фаза — это специфическая перестройка молекулы ксенобиотика — лекарства с введением определенных функциональных групп, которые обусловливают увеличение гидрофильности вещества. Вторая фаза —- это конъюгация образовавшихся метаболитов с эндогенными веществами для транспорта и выведения. Иногда метаболизируемые препараты сразу вступают в реакцию конъюгации.
Биотрансформация лекарств ведет к их инактивации в первой фазе.
Гидроксилирование ксенобиотиков является наиболее важной реакцией первой фазы их метаболизма.
Эту реакцию катализирует семейство ферментов цитохрома Р-450. В современной литературе цитохром Р-450 обозначают СУР с добавлением буквенноцифрового шифра для каждой отдельной формы в соответствии с классификацией (номер - буква - номер - семейство - подсемейство - номер формы). Например, цитохром Р-450 ЗА4 (CYP3A4) эндоплазматического ретикулума клеток печени человека способен метаболизировать не менее 50% лекарственных веществ, находящихся в настоящее время на фармацевтическом рынке.
Наиболее исследован цитохром Р-450 2Е1 (CYP2E1), который метаболизирует малые молекулы эндогенного и экзогенного происхождения (этанол, ацетон, четыреххлористый углерод, нитрозамины, галотан и др.). Экспрессия мРНК и белка CYP2E1 в клетках печени увеличивается при голодании, диабете, высокожировой диете, ожирении, алкогольной интоксикации. CYP2E1 генерирует существенные количества активных форм кислорода, в связи с чем играет важную роль в патогенезе алкогольных и неалкогольных заболеваний печени. При увеличении содержания CYP2E1 в митохондриях существенно уменьшается содержание основного митохондриального антиоксиданта глутатиона.
Разные цитохромы Р-450 обладают весьма широкой субстратной специ
580
Фармацевтическая биохимия Глава 35
фичностью. Кроме реакций гидроксилирования они способны катализировать реакции N-, S-, О-дезалки-лирования, эпоксидирования, оксигенирования гетероатома, окислительного расщепления эфирной и амидной связей, пероксидного окисления, изомеризации, десатурации и др. Реакции, осуществляемые цитохромами Р-450 не подчиняются кинетике Михаэлиса-Ментен.
В процессе метаболизма возможны изменения специфической активности и токсичности лекарств:
1. Появление токсичности (синтез «летальных» молекул) — фторацетат превращается в фторцитрат, блокирующий аконитатгидратазу ЦТК.
2. Усиление токсичности — деацетилирование фенацетина ведет к образованию парафенетидина (индуцирует накопление метгемоглобина).
3. Потеря биологической активности — фенобарбитал при гидроксилировании превращается в неактивный метаболит параоксифенил — этилбарбитуровую кислоту.
4. Появление биологической активности — фталазол гидролизуется в организме с образованием активного норсульфазола.
5. Изменение биологической активности — антидепрессант ипрониазид при дезалкилировании превращается в противотуберкулезный препарат изониазид.
6. Усиление биологической активности: усиление антидепрессивной активности имипрамина при его деметилировании в дезметилимипрамин; деметилирование противокашлевого препарата кодеина ведет к образованию наркотического вещества морфин.
Кроме того, возможны еще 3 типа ферментативных реакций:
1. Реакции окисления включают диоксигеназы (расщепление ароматических колец).
2. Реакции восстановления — ферментативное превращение ароматических нитро- и азосоединений в амины.
3. Реакции гидролиза — ферменты эстеразы (например, гидролиз ипрониази-да на никотиновую кислоту и изопро-пил-гидразин).
В митохондриях есть простые ФАД-и ФМН-содержащие системы превращения аминов, альдегидов, спиртов.
Вторая фаза биотрансформации — конъюгация включает реакции двух типов: 1 тип реакций — активируется конъюгирующее вещество, которое затем взаимодействует с ксенобиотиком. Происходит во всех тканях. 2 тип реакций — активируется ксенобиотик, который взаимодействует с конъюгирующим веществом. Происходит в печени и почках. Встречается редко.
Первый тип реакций конъюгации.
1. Конъюгация с глюкуроновой кислотой. Источником остатков глюкуроновой кислоты является УДФ-глюкуроновая кислота. Глюкуронидной конъюгации подвергаются природные соединения (билирубин, стероидные гормоны и др.), ксенобиотики (фенолы, стероиды, ароматические амины и др.). В реакцию вступают субстраты, которые имеют гидроксильную, карбоксильную или аминогруппу. Ферменты — УДФ-глю-куронилтрансферазы, локализованы в эндоплазматической сети клеток печени, в меньшей степени в почках, пищеварительном тракте, коже.
RXH + УДФ-глюкуронат * RX-глюкуронид + УДФ
2. Сульфатная конъюгация. Активной формой серной кислоты является З'-фос-фоаденозин-5'-фосфосульфат (ФАФС). Сульфатной конъюгации подвергаются эндогенные токсические продукты гниения белков в кишечнике (индол, скатол, фенолы), а также стероиды, иодтирони-ны, токоферолы, нафтохиноны и др. Как
581
Глава 35 Фармацевтическая биохимия
правило, вещества должны быть циклическими соединениями, имеющими свободные аминные или гидроксильные группы. Происходит в основном в печени, Ферменты — сульфотрансферазы.
RXH + ФАФ~ SO3H * RX-SO3H + ФАФ
3. Ацетильная конъюгация. Происходит в печени а также в слизистой пищеварительного тракта и в ретикулоэндотелиальных клетках селезенки и легких. Источник ацетильных групп — ацетил-КоА. Ферменты — ацетилтрансферазы. Этому типу конъюгации подвергаются вещества, имеющие свободную аминогруппу (серотонин, гистамин, сульфаниламиды, гидразиды изоникотиновой кислоты и др.)
R-NH2 + ацетил-КоА * R-NH-CO-CH3 + HS-KoA
4. Метильная конъюгация. Источником метильных групп является S-аденозил-метионин, ферменты — метилтрансфе-разы. Метильной конъюгации подвергаются фенолы, амины, тиоловые соединения. Образуются соответственно О-, N- и S-метиловые конъюгаты. Процесс наиболее интенсивен в печени.
R-OH + CH3-S-AM * R-O-CH3 + S-ГМ
5. Тиосульфатная конъюгация используется при обезвреживании цианидов. Конъюгирующим веществом является сера тиосульфата. Источником тиосульфата в тканях являются серусодержащие аминокислоты. Конъюгация происходит с цианидами неорганического (синильная кислота, цианиды натрия, калия) и органического (ацетонитрил, акрилонитрил, бензилцианид и др.) происхождения.
6. Конъюгация с глутатионом. Подвергаются алифатические и ароматические соединения. Протекает в печени и почках. Глутатион-8-трансферазы, представляющие собой большое семейство как растворимых, так и мембранносвязанных белков, являются основными
ферментами ксенобиотик-обезврежива-ющих систем печени.
Второй тип реакций обезвреживания включает реакции конъюгации с аминокислотами. Предварительно происходит активация ксенобиотика (ароматических и гетероциклических карбоновых кислот). Глициновые конъюгаты обозначают как «гиппуровые» кислоты.
Бензойная кислота + АТФ + HS-KoA •* бензоил-КоА
Элиминация — выведение лекарства или его метаболитов из организма. Имеются два основных пути: с мочой через почки и с желчью через печень. Возможны и другие пути: через кожу (пот, кожное сало), легкие (выдыхаемый воздух), молочные железы (молоко), слюнные железы (слюна). Лекарственные вещества выводятся из организма: 1) в неизменном виде; 2) в виде метаболитов; 3) в виде конъюгатов; 4) в комплексе с биомолекулами.
Элиминационное время полужизни — это время, которое требуется для уменьшения концентрации лекарства на 50 %. Обычно требуется 7 элиминационных времен полужизни для выведения 99 % лекарства и 10 элиминационных времен полужизни для выведения 99,9 % лекарства.
Факторы, влияющие на метаболизм лекарств
Система LADME описывает поведение и судьбу лекарства в организме. Однако на ее параметры оказывают влияние генетические, физиологические, средовые и патологические факторы.
1. Генетические факторы включают конституитивные особенности метаболизма ксенобиотиков и наследуемые ферментопатии, связанные с метаболизмом лекарств.
582
Фармацевтическая биохимия Глава 35
2. Физиологические факторы (возраст, пол, состояние нсйрогуморальной регуляции, циркадные ритмы) влияют на метаболизм лекарств.
• Возраст: до 2-х месячного возраста метаболизм ксенобиотиков практически не происходит. В старческом возрасте замедляются и снижаются превращения ксенобиотиков в рамках LADME. Поэтому у детей чаще проявляются побочные и токсические эффекты лекарств, а у стариков повышена чувствительность к ряду лекарств.
• Пол: андрогены являются индукторами микросомального окисления и ферментов конъюгации; у мужчин лекарства обезвреживаются быстрее.
• Питание: голодание угнетает ферменты микросомального окисления и повышает вероятность интоксикации; при гиповитаминозах В, и В2 снижаются гидроксилирование ксенобиотиков в печени.
• Биологические ритмы: днем активность ферментов микросомального окисления снижается, а в ночное время увеличивается.
3. Факторы внешней среды (стресс, ионизирующая радиация, химические вещества и др.) оказывают влияние на метаболизм лекарств. Многие химические вещества-лекарства взаимодействуют между собой, а также способны индуцировать ферменты метаболизма лекарств. Ионизирующее излучение и эндотоксины снижают обезвреживающую способность монооксигеназной системы и глутатионтрансферазы. Стресс посредством глюкокортикоидов способен увеличивать активность ферментов метаболизма лекарств.
4. Патологические факторы, которые связаны с повреждением почек, печени, сердца, травмой, повреждением пищеварительного тракта, шоком.
Понятие о фармакокинетических показателях
Для фармакокинетического исследования важно определение скорости попадания лекарственного препарата в организм и скорость его удаления с учетом объема, в котором этот препарат распределен. В фармакокинетике чаще рассматриваются линейные модели, т. е. модели, когда все формализуемые ею процессы описываются кинетическими уравнениями первого порядка. При таком подходе соблюдается условие пропорциональности между скоростью переноса препарата из одного компартмента в другой и его количеством в этих компартментах. Обычно используются упрощения в виде однокамерной и двукамерной моделей фармакокинетики лекарственного препарата. Рассматривая фармакокинетические параметры, исследователь получает представление о судьбе лекарства в организме, во многом определяемой биохимическими процессами, описанными системой LADME. Фармакокинетическое исследование включает введение препарата (например, внутривенное) с отслеживанием его концентрации в крови (рис. 35.1).
Очевидно, что концентрация препарата в крови падает после введения до нуля. Некоторые принципы работы с такой кривой показаны на рисунке (метод дополнительных трапеций по Riviere, 1999). Определив коэффициенты а и р, можно оценить концентрацию лекарства (Ср) в данный момент наблюдения. При 24-часовом наблюдении оценивают следующие основные показатели:
1. AUC (area under the curve — площадь под кривой) — это суммарная площадь под кривой концентрации лекарственного препарата от момента его попадания в организм до удаления из него (рис. 35.1).
583
Глава 35 Фармацевтическая биохимия
Рис. 35.1. Зависимость концентрации лекарственного препарата в сыворотке крови (ось ординат) от времени (ось абсцисс).
N
AUC0.M = Z (С„ + С„, )/2 «(U, - О
П=1
2. AUMC (area under the moment curve — площадь под кривой момента) — суммарная площадь под кривой произведения времени на концентрацию лекарственного препарата в организме от момента его попадания в организм до удаления из него
N
Со.24 = <сп+с^уг^и-и +UV2
П=1
3. MRT (mean residence time — среднее время удержания) — это среднее время удержания лекарственного препарата в организме, представляющее собой отношение:
MRT = AUMC /AUC „ и—24 0-24
4. Константа ке1 — это показатель скорости падения концентрации лекарственного препарата в организме, определяющий интенсивность процессов метаболизма и элиминации (т. е. среднее время удержания обратно константе скорости элиминации):
kc,-1/MRT
5. Период полувыведения (при внутривенном введении лекарственного препарата) для двукамерной модели:
Т1Д= 0,693 х MRT
584
Глава 36
Биохимические аспекты остеологии и стоматологии
Химия костной и хрящевой тканей
Основная функция костной ткани заключается в формировании скелета для механической поддержки тела. Кость — это депо неорганических элементов и белков межклеточного матрикса. В костной ткани в норме координированы процессы разрушения и создания новой ткани. Эти процессы осуществляются остеобластами (формирование новой ткани и ее ремоделирование), остеокластами (резорбция костной ткани) и остеоцитами.
Минеральный и в большой мере белковый обмены в кости находятся в динамическом равновесии с кровью и регулируются системными эндокринными и местными паракринными факторами. Паратгормон и витамин D3 (кальцитриол) стимулируют резорбцию кости, а кальцитонин — подавляет ее. Резорбция кости остеокластами и образование кости остеобластами регулируются также факторами роста и цитокинами (интерлейкины, инсулиноподобные факторы роста I, II, фактор роста фибробластов, эпидермальный фактор роста, фактор роста тромбоцитов, трансформирующие факторы роста а и р и др.).
Известны два основных типа костной ткани: одна составляет губчатый (трабекулярный),
а другая — кортикальный слой кости. В обоих типах костной ткани остеобласты и остеокласты перемещаются свободно по поверхности, но остеобласты могут оказаться погруженными в минерализованную ткань и превратиться в остеоциты. Губчатая кость имеет большую поверхность и является более метаболически активной, чем кортикальная. Структурные различия, в основном, количественные: 80—90 % объема кортикальной кости кальцифицировано. Трабекулярная кость кальцифицирована лишь на 15—20 %. Остальной объем занимают костный мозг, сосуды и соединительная ткань. Зрелая кость состоит на 60—70 % из неорганических минеральных солей, остальная часть — органический матрикс и вода. Клеточные элементы занимают незначительный объем.
Костный матрикс образован коллагеновыми фибриллами, ориентированными в одном направлении. Они составляют 90 % всех белков кости. Веретенообразные и пластинчатые кристаллы гидроксиапатита находятся на коллагеновых волокнах и в их окружении. Как правило, они ориентированы в том же направлении, что и коллагеновые волокна. Основное вещество состоит из гликопротеинов и протеогликанов. Эго высокоионизированные комплексы обладают выраженной ионсвязыва-ющей способностью и потому играют важную роль в кальцификации и фиксации кристаллов гидроксиапатита к коллагеновым волокнам.
585
Глава 36 Биохимические аспекты остеологии и стоматологии
Белки костной и хрящевой тканей
Коллагены — фибриллярные белки межклеточного вещества (25—30 % от всех белков тела). Известны более 15 типов коллагеновых молекул.
Коллагеновые фибриллы, определенным образом ориентированы в кости взрослого человека, придают ей пластинчатое строение. Эти пластинки могут располагаться параллельно друг другу, если находятся на плоской поверхности (трабекулярная кость и периост), или концентрически, если находятся на поверхности каналов, в центре которых проходят кровеносные сосуды (гаверсова система).
Во внеклеточном веществе имеется ряд адгезивных неколлагеновых белков, служащих для белково-лигандных взаимоотношений.
Костный кислый гликопротеин имеет молекулярную массу 75 кДа, содержит производные нейраминовой кислоты (сиаловые кислоты) и фосфат. Относится к семейству анионных белков, богатых фосфатом. Участвует в минерализации костной ткани.
Костный сиалопротеин — маркерный белок дифференцированных клеток костной ткани; содержит производные нейраминовой кислоты и отличается характерной последовательностью арг-гли-асп (трипептид RGD) для связывания с интегринами, являющимися интегральными белками плазматических мембран и служащими для связывания с белками межклеточного вещества (матрикса). Молекулярная масса 59 кДа. Этот белок относят к фосфопротеинам, поскольку половина остатков серина связана с фосфатом. Участвует в минерализации кости. Синтез белка стимулирует дексаметазон и ингибирует кальцитриол. Может избирательно связывать стафилококки.
Остеокальцин имеет молекулярную массу 58 кДа. В молекуле содержит три
остатка гамма-карбоксиглутамата для связывания кальция. Белок прочно связан с апатитом и участвует в росте кристаллов. Из костной ткани выделяют семейство белков, подобных остеокальцину. Биосинтез регулируется кальци-триолом. Нарушения обмена остеокальцина занимают важное место в патогенезе заболеваний костей и зубов.
Остеонектин — белок с молекулярной массой 43 кДа, содержащий несколько участков, богатых остатками глутаминовой кислоты и кальций связывающий домен. Белок широко распространен и способен связываться с коллагеном и апатитом.
Остеопонтин имеет молекулярную массу 32,6 кДа, содержит трипептид арг-гли-асп, фосфорилирован по остаткам серина и является анионным белком. Кальцитриол стимулирует синтез осте-опонтина. Этот белок локализуется в светлой зоне остеокластов и служит, вероятно, для привлечения предшественников остеокластов и связывания их с минеральным матриксом кости.
Тромбоспондин — олигомерный белок (молекулярная масса 150 кДа), который через RGD-последовательность способен связываться с поверхностями клеток.
Морфогенетический белок кости (МФБ) — олигомерный белок, состоящий из 4—5 протомеров. Один из протомеров (м. м. 17,5 кДа) обладает способностью к остеоиндукции. В месте его введения возникает хрящ, который постепенно замещается костью.
Фактор роста скелета — белок, стимулирующий деление скелетогенных клеток и вызывающий их дифференцировку в остеогенные.
Содержание РНК в костной ткани в 1,5—2 раза превышает содержание ДНК, что является отражением высокой интенсивности биосинтетических процессов.
586
Биохимические аспекты остеологии и стоматологии Глава 36
Минеральные компоненты матрикса кости и процесс минерализации
Костная ткань, дентин, цемент и зубная эмаль содержат фосфорнокислые соли кальция и другие неорганические вещества. Высокая активность цитрат-синтазы в кости обеспечивает синтез значительного количества цитрата, общее содержание которого может достигать 1 % от общей массы органических веществ костной ткани. Цитрат образует легко растворимые соли кальция и выполняет функцию переносчика кальция в процессах минерализации.
Минеральный компонент кости обеспечивает ее механо-структурную функцию и является обмениваемым депо кальция (99 % кальция организма в виде гидроксиапатита сосредоточено в костях, обменивается 1 %). В составе тканей зубов, костей, дентина содержатся соли НРО42' или РО43. Пирофосфаты обнаруживаются в зубных камнях. Известно несколько природных форм фосфатов кальция.
Апатиты имеют общую формулу Са]0(РО4)6Х2, где X — фтор или ОН. Фторапатиты известны как почвенные минералы, а гидроксиапатиты являются основной формой фосфата кальция костей и зубов. В результате изоморфного замещения апатиты легко обмениваются ионами с окружающей средой при поддержании распределения зарядов в молекуле.
Фторапатит — Cal0(PO4)6F2 — наиболее стабилен из всех апатитов, образует гексагональные кристаллы с плотностью 3,2 г/см3. В водной среде взаимодействие фтора с фосфатами кальция зависит от концентрации фтора. При концентрации фтора до 500 мг/мл образуются кристаллы фторапатита, а при повышении концентрации выше 2000 мг/мл кристаллы не образуются, т. к. продуктом реакции будет CaF2. Известно, что фтор уменьшает растворимость гидроксиапатитов в кислой среде, а ионы цитрата, карбоната и магния повышают их растворимость.
Апатит карбонатный образуется при осаждении основной соли кальция фосфата ионами карбоната или гидрокарбоната. При этом увеличивается аморфность апатита. Получен
ная структура напоминает морфологию апатитов костей и эмали.
Апатит стронциевый образуется при замене кальция стронцием в кристаллической решетке апатитов, что нарушает структуру кристаллов. После аварии на ЧАЭС таким образом создается депо радиоактивного стронция в организме людей и животных.
Витлокит содержит |К2а/РО.), и Mg2+, Мп2+ или Fe3+; образует ромбовидные кристаллы. Обнаруживается в зубных камнях и зонах кариозного поражения эмали зубов.
Монетит (СаНРО4) и брушит (СаН-РО4х2Н20) — редко встречаются в организме. Монетит образует треугольные пластинки, палочки или призмы, кристаллы брушита имеют клиновидную форму. При нагревании брушит превращается в монетит. При хранении оба минерала гидролизуются в гидроксиапатит. Растворимость кристаллов увеличивается при рН< 6,0. Брушит обнаруживается в составе дентина и зубных камней.
Октокальций фосфат — Са8(НРО4)2(РО4)4 х5Н2О — промежуточное соединение между кислыми фосфатами (монетит, брушит) и основной солью гидроксиапатитом. Обнаруживается в составе зубных камней. Имеет слоистую структуру с чередованием слоев соли толщиной 1,1 нм и слоев воды толщиной 0,8 нм. Легко гидролизуется в апатит при рН> 7,0. Фтор в диапазоне концентраций 10—100 мкг/л ускоряет гидролиз. Считают, что ионы фтора необходимы для отложения апатитов в костной ткани.
В организме млекопитающих внеклеточная жидкость содержит пересыщенный раствор фосфата кальция. Осаждение фосфата кальция происходит в две стадии: образование плотного осадка (нуклеация) и рост кристаллов из ядра. В процессе нуклеации образуются небольшие кристаллы (диаметр 0,5—2,0 нм). При гомогенной нуклеации образование кристаллов идет в пересыщенном растворе без участия второй фазы, при гетерогенной нуклеации процесс образования кристаллов инициирует другая, часто твердая фаза.
Известно, что упруго-механические свойства костной ткани и эмали зуба зависят от величины кристаллов. Рост кристаллов происходит по механизмам спиралевидного роста. На образовавшиеся в первой стадии ядра формируются спиралевидные структуры, рост которых идет по принципу добавления новых ионов.
587
Глава 36 Биохимические аспекты остеологии и стоматологии
Шаг такой спирали равен высоте одной структурной единицы кристалла. Ингибиторы кристаллизации при низкой концентрации способны подавлять рост кристаллов (модификация скорости, формы и направления роста кристаллов). При растворении кристаллов эти вещества обычно не влияют на скорость растворения. Но гексаметафосфат натрия, а также пирофосфаты, полифосфаты и некоторые белки слюны тормозят нуклеацию гидроксиапатитов и рост кристаллов. В настоящее время выделяют семь типов кристаллов: моноклинные, триклинные, тригональные, тетрагональные, гексагональные, кубические и орторомбические.
В тканях инициаторами минерализации являются протеогликаны, гликозамингликаны, фосфопротеины и белки, содержащие у-карбок-сиглугаминовую кислоту: например, хондрокальцин в минерализующем фронте хряща связывает кальций, остеонектин одновременно связывает гидроксиапатит и коллаген для инициирования нуклеации апатита из раствора фосфата кальция.
Благодаря электронно-микроскопическим исследованиям установлено, что в зонах минерализации образуются внеклеточные связанные с мембранами пузырьки, которые содержат кристаллы апатита. Вероятно, эти пузырьки и являются зонами нуклеации, а коллагеновые волокна пространственно ориентируют рост кристаллов. В этих пузырьках содержатся липиды и активная фосфатаза. Последняя способна увеличивать локальную концентрацию фосфата, катализируя расщепление фосфолипидов и других фосфорсодержащих органических молекул. До сих пор такие пузырьки не обнаружены в процессе минерализации эмали, дентина и цемента зубов.
Единица костной структуры
Ремоделирование (образование и разрушение) кости происходит одновременно в единицах костной структуры. В кортикальной части костная структурная единица соответствует остеону. Трабекулярная кость также состоит из подобных, но не так четко определяемых единиц. Считают, молекулярные и структурные изменения в процессе перестройки кости тесно связаны друг с другом в рамках костной ремоде-яирующей единицы. Основная функция такой
единицы — поддержание метаболического и структурного баланса скелета. Костная'ремоделирующая единица (базисная многоклеточная единица кости) — участок костной ткани, в котором одновременно протекают последовательные процессы локальной резорбции и биосинтеза костной ткани. Размер такой единицы 0,05—0,1 мм3. В организме практически здорового взрослого человека одновременно функционируют 105—106 единиц. Абсолютный объем кости определяется количеством таких единиц и включает объем костной ткани без костно-мозговых и сосудистых пространств.
У человека в возрасте до 20 лет происходит рост и увеличение массы скелета. В дальнейшем скелет подвергается постоянной перестройке с удалением старой кости и созданием новой. Обычно этот процесс происходит на ограниченных участках кости. Обновление костной ткани начинается с локального разрушения минерализованной поверхности остеокластами на глубину 50 мкм. Остеокласты секретируют смесь кислых и нейтральных протеиназ, которые переваривают волокна коллагена. Затем остеобласты в процессе перемещения по наружному краю образованной остеокластами полости секретируют новый костный матрикс (остеоид) вплоть до заполнения всей полости (рис. 36.1).
У здорового человека каждая костная ремоделирующая единица является постоянной величиной во времени образования и по количеству. Например, 100 мкм кости резорбируется за 30 дней, а на замещение 100 мкм новой кости требуется около 90 дней, т. е. для полного цикла требуется 4 месяца. Такие циклические процессы происходят на эндостальной и трабекулярной костных поверхностях и формируют гаверсову систему. Новая кость не появляется там, где не было резорбции в субпериостальном пространстве.
Возрастное снижение интенсивности ремоделирования костной ткани лежит в основе физиологической атрофии костной ткани. Скорость потери массы кости зависит от возраста и пола. Для женщин после 35 лет она составляет 0,75-2,5 % в год, после менопаузы 3-4 % в год. После 80 лет женщина может потерять 30 % кортикальной кости и 50 % трабекулярной. У мужчин потери костной ткани
588
Биохимические аспекты остеологии и стоматологии Глава 36
Рис. 36.1. Ремоделирование кости.
начинаются с 50 лет и составляют 0,4-1,2 % в год. После 80 лет у мужчин компактная костная ткань уменьшается до 20 %, а губчатая — до 35 %. При старческом остеопорозе кость содержит много незаполненных гаверсовых систем, где не обнаруживается активность остеобластов.
Регуляция метаболизма костной ткани
Выделяют четыре основные группы факторов, которые контролируют метаболизм и ремоделирование костной ткани:
1) кальцийрегулирующие гормоны (паратгормон, кальцитонин и активный метаболит витамина D3 — кальцитриол); 2) другие гомоны (глюкокортикоиды, тироидные гормоны, соматотропин, инсулин);
3) ростовые факторы;
4) местные факторы, продуцируемые самими костными клетками (простагландины, остеокластактивирующий фактор и др.) рис. 36.2.
Паратгормон: стимулятором секреции гормона является снижение уровня ионизированного кальция. Основное действие на костную ткань заключается в стимуляции костной резорбции путем активации остеокластов (остеопластическая костная резорбция) и осте-
589
Глава 36 Биохимические аспекты остеологии и стоматологии
Рис. 36.2. Регуляция ремоделирования кости.
оцитами (остеоцитарный остеолизис). Паратгормон стимулирует как сбор остеокластов к месту резорбции, так и их активность. Избирательное действие паратгормона на остеобласты состоит в стимуляции продукции плазминогенно
го активатора их активности, коллагеназы и тканевого ингибитора металлопротеиназы. Гормон активирует синтез остеобластами IGF-1 (инсулиноподобного ростового фактора I), повышающего биосинтез коллагена типа I и других
590
Биохимические аспекты остеологии и стоматологии Глава 36
компонентов костного матрикса. Таким образом, паратгормон активирует как остеокласты, так и остеобласты.
Кальцитонин является функциональным антагонистом паратгормона. Основной биологический эффект — торможение костной резорбции за счет первичного угнетения активности и уменьшения количества остеокластов. Гипокальциемический эффект кальцитонина проявляется только тогда, когда костная резорбция замедлена до степени уменьшения выделения кальция из кости в кровь. Гормон замедляет спонтанную резорбцию кости и стимулированный остеолизис (действие паратгормона, витамина D).
Кальцитриол стимулирует активность остеокластов опосредованно через остеобласты. Он оказывает наибольшее влияние на дифференциацию остеобластов, изменяя экспрессию ряда генов, включая биосинтез коллагена типа I, остеопонтина, остеокальцина, щелочной фосфатазы.
Глюкокортикоиды повышают резорбцию костной ткани. В остеобластах глюкокортикоиды при хроническом применении замедляют биосинтез белков, в частности, коллагена.
Тироидные гормоны активируют линейный рост и действуют на хрящевую ткань, но они не стимулируют образование костного матрикса или клеточное деление. Тироидные гормоны способны стимулировать остеобластическую и ос-теокластическую активность как в трабекулярной, так и кортикальной костной ткани. Т3 стимулирует биосинтез IGF-I остеобластами. Тироидные гормоны стимулируют костную резорбцию: у пациентов с гипотирозом часто выявляют гиперкальциемию, а у женщин в менопаузе, принимающих тироидные гормоны, быстро развивается остеопения.
Эстрогены участвуют в формировании скелета и предотвращают потери костной ткани. Они предотвращают
резорбцию костной ткани путем подавления активности остеокластов (особенно в стадии ранней дифференцировки). Кроме того, эстрогены подавляют продукцию местных костнорезорбирующих факторов (интерлейкины 1 и 6, фактор некроза опухоли а, гранулоцито-макрофагальный колониеобразующий фактор). Эстрогены подавляют резорбцию костной ткани посредством увеличения продукции остеобластами фактора, ингибирующего резорбтивную активность остеокластов. Эстрогены могут стимулировать образование костной ткани через биосинтез IGF-I.
Андрогены действуют на клетки-мишени костной ткани через ростовые факторы; они способны стимулировать пролиферацию костных клеток и препятствуют резорбции кости. Как у женщин, так и мужчин при недостатке половых гормонов развивается остеопения.
Соматотропин действует на клетки костной ткани рецепторно-опосредовано и посредством стимуляции образования ростовых факторов типа IGF-I. Соматотропин оказывает стимулирующий эффект на пролиферацию хондроцитов внутри ростовой пластинки. Показано также, что соматотропин может стимулировать образование кальцитри-ола в почках.
Инсулин — гормон, активирующий нормальный скелетный рост, синтез матрикса кости и образование хряща. Гормон необходим для нормальной костной минерализации. Инсулин может действовать и опосредованно, через продукцию IGF-I в печени.
Простагландины: ПГЕ2 вначале ингибируют остеокласты, но затем усиливают резорбцию кости. Действие простагландинов дозозависимо — от стимуляции до угнетения биосинтеза коллагена.
Интерлейкин 6 стимулирует ранние этапы гемопоэза и остеокластогенеза, способствует резорбции кости.
591
Глава 36 Биохимические аспекты остеологии и стоматологии
Для характеристики резорбции костной ткани в последние годы определяют в суточной моче концентрации гидроксипролина, галактозилгидроксилизина, пири-динолина (структура из трех остатков гидроксилизина) и в сыворотке крови активность тартратрезистен-тной кислой фосфатазы.
Химический состав хряща
Основная механическая функция хряща определяется присутствием коллагена типа II и специфичного протеогликанового комплекса (рис. 36.3). Протеогликан образует объемный гель, а ориентация коллагеновых волокон определяется направлением сил, воздействующих на хрящ.
Коллаген типа II [aJ(II)]3 состоит из трех одинаковых a-цепей, имеющих одинаковый аминокислотный состав с
аналогичными цепями коллагена кожи. Такой тип коллагена образует прочные поперечно исчерченные фибрилы. Коллагеновые волокна имеют большое количество поперечных ковалентных связей. Кроме основного коллагена типа II в хрящевой ткани присутствуют минорные коллагены (10 % от суммарного коллагена) с неясной функцией.
На долю главного протеогликана хрящевой ткани приходится до 10 % от влажной массы хряща. Белковый компонент протеогликана имеет молекулярную массу, равную 210 кДа. К полипеп-тидной цепи присоединены до 100 цепей хондроитинсульфата и около 30 цепей кератансульфата. Такая структура, напоминающая ершик для мытья посуды, называется агрекан. На N-конце белковой молекулы имеется глобулярный домен (G,) для взаимодействия с гиалуроновой кислотой. Это взаимодействие усиливает специальный связывающий белок, гомологичный по аминокислотному составу с G,-доменом белка
Рис. 36.3. Протеогликановый комплекс хряща.
592
Биохимические аспекты остеологии и стоматологии Глава 36
протеогликана. Затем следует не связывающий гетерополисахариды G3-домен и участок полипептидной цепи, в которой остатки серина связаны О-гликозидными связями с кератансульфатом. Далее следует главная область протеогликанового белка, связанная с остатками хондроитинсульфатов. На С-конце молекулы белка расположен третий глобулярный домен, который гомологичен лектину печени и служит для специфического связывания с галактозой или фукозой. Конечный агрегат с молекулярной массой более 200* 106 Да состоит из одной молекулы гиалуроновой кислоты и примерно 100 молекул агре-кана. Координацию сборки таких агрегатов осуществляют хондроциты. В физико-химическом отношении протеогликановый комплекс является полианионом. Это позволяет обратимо присоединять или выталкивать молекулы воды, обеспечивая тем самым рессорную функцию хряща.
Минорные протеогликаны хряща составляют 1—2 % от массы всех протеогликановых комплексов. Богатый лейцином белок фибромодулин является важным регулятором фибриллогенеза. Белки бигликан и декорин содержат последовательности сер-гли. Декорин ингибирует фибринолиз и может связываться с коллагенами типов I и II. Из хрящевой ткани выделен ряд белков, охарактеризованных по молекулярной массе: белок 21 кДа синтезируется гипертрофическими хондроцитами и связывается с коллагеном типа X; белок 34 кДа (анхорин) — связывается с коллагеном типа II и обеспечивает его заяко-ривание к поверхности хондроцитов, что позволяет клетке воспринимать механическое напряжение; белок 35 кДа (хондрокальцин) — участвует в процессе минерализации; белок 36 кДа — не содержит углеводов, имеет последовательности асп, асн и лей и связывается
с хондроцитами; белок 58 кДа — имеет последовательности асп, асн и лей и способен связываться с поверхностью клеток; белок 148 кДа — олигомерный белок, имеющий домены, гомологичные эпидермальному фактору роста; высокомолекулярный олигомерный белок состоит из нескольких субъединиц по 100 кДа — выделен из суставного хряща.
Биохимия зубов
В состав зубов входят три вида плотных тканей (эмаль, дентин и цемент) и разновидность рыхлой соединительной ткани, входящей в пульпу зуба.
Эмаль
Эмаль — это твердая ткань, приближающаяся по твердости к кварцу и покрывающая коронку зуба; после формирования утрачивает клетки.
До прорезывания зубов эмаль покрыта мембраной, содержащей бесклеточный слой (около 1 мкм) и слой клеток, продуцирующих эмаль (около 10 мкм). После прорезывания мембрана разрушается и зубы покрываются кутикулой, которая состоит из органической матрицы слюнного происхождения и десквамированного эпителия. Погибшие микробы и продукты их жизнедеятельности могут образовывать бляшки, которые после кальцификации превращаются в зубной камень. Мельчайшими структурными единицами эмали являются кристаллы апатитоподобного вещества, формирующего эмалевые призмы. Основная масса эмали состоит из типичных палочковидных кристаллов, среди которых было обнаружено небольшое количество кристаллов иной формы. Относительным признаком различной минерализации эмали является четкость кристаллической структуры: чем четче границы кристаллов, тем степень минерализации выше. Из кристаллов формируются эмалевые призмы. Поверхность эмали изнутри (обращенная к дентину) имеет неровный рельеф, вклинивающийся в дентин своими структурными элементами. Между эмалью и дентином находится тонкая органическая обо
593
Глава 36 Биохимические аспекты остеологии и стоматологии
дочка, а также тонкие фибриллы или их пучки с поперечной исчерченностью, В наружном (поверхностном) слое эмали призмы частично доходят до поверхности, поэтому имеются призматические и беспризматические участки. Кристаллы в призмах ориентированы перпендикулярно к поверхности. Поверхность эмали покрыта органическими оболочками, что сглаживает ее рельеф. Строение и химический состав эмали меняются в процессе ее формирования. Органическая основа эмали постепенно приобретает фибриллярную форму. Формирование эмали — единый процесс развития органического матрикса и его минерализации. Фор-мирование и ориентация кристаллов минерального компонента определяется органическим матриксом эмали.
В эмали содержится два вида воды: свободная вода (0,8—1,0 %) и гидратная оболочка кристаллов апатитов (связанная вода 3,0—3,3 % массы эмали). В эмали имеются интер- и интрапризма-тические пространства размером 0,9— 2,5 нм, заполненные водой. Минеральную основу эмали составляют кристаллы апатитов: гидроксиапатит (75 %), карбонатапатит (19 %), хлорапатит (4,4 %), фторапатит (0,66 %), другие минеральные соединения (2 %). Кристаллы эмали в 10 раз больше кристаллов дентина и кости. Элементарная ячейка гидроксиапатита (структура I порядка) имеет молекулярную массу около 1000, в составе кристалла гидроксиапатита (структура 11 порядка) находится около 2500 таких ячеек (молекулярная масса 2,5х105). Эмалевая призма (структура III порядка) состоит из миллионов кристаллов. Эмалевые призмы собраны в пучки и идут поперек слоя эмали многократно изгибаясь в виде спирали (структура IV порядка).
Идеальный апатит содержит 10 атомов Са и молярное отношение Са/Р равно 1,67. За счет изоморфного замещения Са апатита на Сг, Ba, Mg и др. коэффициент Са/Р уменьшается, что способствует развитию кариеса. При взаимодействии с ионами фтора полу
чается гидроксифторапатит, который снижает растворимость эмали (профилактика кариеса). Состав и свойства кристаллов гидроксиапатита изменяются в зависимости от состава гидратного слоя, который в свою очередь определяется составом раствора, омывающего кристаллы гидроксиапатита. Изменяя состав этого раствора, можно влиять на состав и свойства кристаллов. Наружный (внешний) слой эмали более устойчив к действию кислот из-за более высокой концентрации кальция и фосфора. В поверхностном слое эмали содержание фтора в 10 раз больше, чем в подлежащем. По всей толще эмали равномерно распределяются стронций, медь, алюминий и калий, в глубоких слоях эмали увеличено содержание натрия и магния, а в поверхностных — кроме фтора содержатся цинк, свинец, сурьма, железо. К сильным кариостати-ческим агентам относят фтор, фосфор, средним — молибден, ванадий, медь, бор, литий, золото, сомнительными агентами считают бериллий, кобальт, марганец, олово, цинк, бром, йод; кариесогенными являются селен, кадмий, марганец, свинец, кремний.
Известно, что в животном организме процесс минерализации осуществляется только на белковых матрицах. Такой матрицей кости, дентина и цемента является коллагеновый белок во взаимодействии с неколлагеновыми белками. Эмаль характеризуется чрезвычайно низким содержанием белка (0,5—4 %). По аминокислотному составу белки эмали существенно отличаются от коллагена: низкое содержание пролина, оксипролина, глицина. Белки зрелой эмали являются гликопротеинами. Эти белки могут образовывать комплексы с липидами. Эмаль — единственная минерализованная ткань, минерализация которой сопровождается увеличением количества липидов. Бел
594
Биохимические аспекты остеологии и стоматологии Глава 36
ки эмали условно делят на две группы: амелогенины (30 кДа) и энамелины (50—70 кДа). По мере созревания эмали количество белков уменьшается более, чем в 100 раз; содержание амело-генинов падает, а энамелинов увеличивается. В эмали обнаружен каль-ций-связывающий белок (КСБЭ, молекулярная масса 20 кДа), По Ю. А. Петровичу растворимый КСБЭ при присоединении ионов кальция переходит в нерастворимую в воде форму за счет полимеризации. При этом создается трехмерная белковая сетка эмали, нерастворимая в нейтральной среде. Одна молекула белка может связать 8—10 ионов кальция. Трехмерная белковая сетка связана с гидроксиапатитом эмали. В результате образуется полиморфная нерастворимая белковая матрица эмали, связанная через кальций с гидроксиапатитом. Сеть, образованная молекулами Са-КСБЭ, фиксируется на волокнах амелогенинов. Белковая матрица инициирует нуклеацию и кристаллизацию гидроксиапатита. Этим достигается ориентация, упорядоченность и равномерность структуры эмали и последовательность ее формирования. Вокруг первичных ядер нуклеации происходит созревание и дальнейшее отложение кристаллов гидроксиапатита, расположение и ориентация которых уже запрограммированы предшествующей нуклеацией фосфата кальция.
Транспорт минеральных компонентов идет в двух направлениях: 1) пульпа — дентин — эмаль; 2) поступление минеральных компонентов из слюны. Проницаемость эмали зубов увеличивается от резца до моляра; язычная поверхность зубов более проницаема, чем губная. На проницаемость эмали оказывает влияние слюна, в составе которой открыто до 50 ферментов, включая гиалуронидазу, фосфатазы, калликреин и др. Важное значение в проницаемости эмали имеют ее
микропространства, заполненные водой, по которым способны проникать вещества в зависимости от радиуса ионов. Силой, обеспечивающей перемещение ионов в водной фазе эмали является осмотическое давление. Из-за отсутствия клеток эмаль не способна к регенерации.
Дентин
Дешин составляет основную массу зуба. Коронковая часть дентина покрыта эмалью, корневая цементом. В дентине содержится до 72 % неорганических веществ и около 28 % органических веществ и воды. Неорганические вещества представлены фосфатом, карбонатом и фторидом кальция, органические — коллагеном (преимущественно типа I). Дентин построен из основного вещества и проходящих в нем трубочек, в которых расположены отростки одонтобластов и окончания нервных волокон, проникающих из пульпы. Основное вещество содержит склеивающее вещество (гликозамингликаны, в частности, хондрой-тин-4-сульфат, хондроитин-6-сульфат, гиалуроновая кислота) и коллагеновые фибриллы, собранные в пучки. В склеивающем веществе имеется большое количество минеральных солей. К важнейшим неколлагеновым белкам дентина относят фосфопротеины. Эти белки богаты серином и за счет эстерифицированного фосфата обладают кислыми свойствами. Благодаря кислым свойствам эти белки способны связывать кальций. Эти белки, как и протеогликаны, появляются в предентине перед началом минерализации и располагаются на линии фронта минерализации. По сравнению с костью, в дентине намного меньше белков с остатками у-карбоксиглутаминовой кислоты, но в три раза больше концентрация магния. Содержание фтора больше в области, граничащей с пульпой. Его концентрация с возрастом увеличивается. Главный минеральный компонент дентина гидроксиапатит отличается от костного по величине отношения Са/Р (1,5—1,7). В дентине помимо гидроксиапатита присутствуют аморфные фосфат и карбонат кальция.
Процесс образования дентина происходит в течение всего периода функционирования зуба при наличии жизнеспособной пульпы. Дентин, образующийся после прорезывания зуба, на
595
Глава 36 Биохимические аспекты остеологии и стоматологии
зывают вторичным. Он характеризуется меньшей степенью минерализации и большим содержанием коллагеновых волокон.
Цемент
Цемент бывает двух типов: 1) клеточный, расположенный в верхушечной части корня и в области бифуркации корней и 2) бесклеточный, покрывающий остальную часть корня. Клеточный цемент по составу и строению напоминает грубоволокнистую кость и содержит цемен-тоциты. Бесклеточный цемент не имеет цементоцитов и состоит из коллагеновых волокон и матрикса. По химическому составу цемент является разновидностью плотных форм соединительной ткани. Цемент состоит на 68—70 % из неорганических веществ, представляющих разные формы апатитов; 17—20 % приходится на долю органических молекул (коллаген, протеогликаны, липиды и др.); 10— 15 % приходится на воду. Цемент прочно соединен с дентином, неравномерно покрывая его в области корня зуба. Снаружи цемент прочно связан с тканями связочного аппарата зуба.
В течение жизни постоянно происходит отложение цемента. При некоторых заболеваниях, например перидонтите, а также при повышении нагрузки на зуб происходит интенсивное отложение цемента, при этом формируется гиперцементоз.
Пульпа
Пульпа является разновидностью рыхлой соединительной ткани. Она уплотняется по направлению к корневой части зуба. В составе пульпы обнаружено около 5 % неорганических веществ, 40 % органических и около 60 % воды. Пульпа выполняет трофическую функцию, принимает участие в защитной и репаративной функциях тканей зуба. Плотная часть пульпы более устойчива к действию микроорганизмов и токсинов.
Биохимия жидкостей полости рта
В полости рта находится суммарный секрет слюнных желез, детрит полости
рта, содержимое десневых карманов, десневая жидкость, микроорганизмы и продукты их жизнедеятельности (мягкий зубной налет), клетки эпителия, лейкоциты и продукты их распада, остатки пищи и др. Необходимо различать понятия «слюна — секрет слюнных желез (околоушных, подчелюстных, подъязычных, малых желез полости рта)» и «ротовая жидкость, или слюна смешанная». Секреция слюны у человека не подвержена строгой гормональной регуляции. Слюноотделение может возникать условно-рефлекторно при виде или запахе пищи, а также под действием безусловных рефлексов (действие факторов механического характера). Образование слюны — активный энергозависимый процесс, связанный с высоким уровнем окислительных процессов в слюнных железах (по поглощению кислорода слюнные железы занимают промежуточное положение между почками и печенью).
Функции смешанной слюны
Минерализующая функция слюны состоит в том, что она является поставщиком минеральных веществ и микроэлементов для эмали зубов, поддерживает ее оптимальный химический состав. При насыщении слюны ионами кальция и фосфора происходит их диффузия из полости рта в эмаль зуба, что обеспечивает ее «созревание» (уплотнение) и рост. Эти же механизмы препятствуют выходу минеральных веществ из эмали зуба, т. е. ее деминерализации. За счет постоянного насыщения эмали веществами из слюны происходит повышение прочности эмали зуба с возрастом (механизм кариорезистентности зубов у пожилых людей). Минерализующая способность слюны обеспечивает регенерацию эмали после ее повреждения при ряде заболеваний.
596
Биохимические аспекты остеологии и стоматологии Глава 36
Защитная функция слюны состоит в том, что омывая поверхность зуба, ротовая жидкость постоянно изменяет (модифицирует) ее состав. Из слюны могут осаждаться на поверхность зуба кальциевые соли, белки (гликопротеины) и другие вещества, образуя тонкую пленку — пелликулу, служащую для защиты эмали от действия органических кислот. Наличие гликозамингликано-вых комплексов в составе слюны определяет защиту мягких тканей ротовой полости от механических повреждений. Слюна проявляет плазмосвертывающую и фибринолитическую способности, что обусловлено наличием в ней тромбопластина, протромбина, активаторов и ингибиторов фибринолиза. Наличие в ротовой полости соединений, обладающих гемокоагуляционной и фибринолитической активностью, способствует быстрому заживлению ран. В слюне содержится иммуноглобулин А (синтез в слюнных железах), определяющий защиту слизистых оболочек, а также в меньшем количестве остальные классы иммуноглобулинов (поступают из плазмы крови). Раны ротовой полости инфицируются реже, чем других тканей. В общем виде, смешанная слюна способствует поддержанию гомеостаза ротовой полости в условиях постоянных и изменяющихся внешних воздействий.
Очищающая функция слюны состоит в механическом и химическом очищении полости рта от остатков пищи, скопления микроорганизмов, детрита и др. В основе этой функции лежит высокая скорость образования и секреции слюны. За счет наличия в слюне лизоцима, лейкоцитов и их эктоферментов (ферментов, выделяемых во внешнюю среду клетки) осуществляется бактерицидное действие слюны. Известно, что кариес-резистентность напрямую зависит от выраженности антибактериального действия слюны.
Регуляторная функция слюны определяется тем, что в железистых клетках под действием нервных импульсов сразу вырабатываются белки, которые могут отображать состояние высшей нервной деятельности человека или регулировать биохимические процессы в тканях полости рта или пищеварительного тракта. Так, например, показано, что в слюне появляется белок с молекулярной массой 55 кДа при положительных эмоциях и исчезает — при отрицательных. Долгое время считалось, что слюнные железы вырабатывают S-паротин (са-ливапаротин), который, поступая в состав смешанной слюны, способствует минерализации твердых тканей зубов. Слюнные железы являются классическим источником ростовых факторов эпидермиса и нервов, что служит для ускорения регенерации тканей пищеварительного тракта, поврежденных механическими элементами пищи (острые кости и др.).
Пищеварительная функция связана с наличием пищеварительных ферментов в слюне (S-амилаза, мальтаза), создания оптимума pH для деятельности этих ферментов, биосинтеза и выделения активаторов (хлорид-ионы).
У взрослого человека за сутки выделяется 1—2 л слюны. Скорость секреции составляет 0,2—0,5 мл/мин днем и в 10 раз медленнее ночью. У детей скорость саливации выше, чем у взрослых. Самая высокая скорость слюноотделения отмечается у детей в возрасте 5—8 лет. Гипосаливация и ксеростомия (сухость во рту) способствует развитию кариеса. Известно, что при одностороннем прекращении поступления слюны (перевязка протоков, удаление железы) на этой стороне возникает поражение зубов кариесом. Различными стимулами можно повысить скорость саливации в 8—10 раз.
597
Глава 36 Биохимические аспекты остеологии и стоматологии
Химический состав ротовой жидкости
Слюна является коллоидной системой, включающей мицеллы фосфата кальция:
{[mCa3(PO4)2]nHPO/(n-x)Ca2+}2x“ хСа2*
Мицеллы окружены водно-белковыми оболочками, препятствующими их сближению. Наличие одноименных зарядов обусловливает отталкивание мицелл друг от друга. При этом имеется зависимость между структурой мицелл слюны и ее минерализующими свойствами. Мицеллярная структура фос-форно-кальциевых соединений в ротовой жидкости обеспечивает их устойчивость в пересыщенном состоянии, что необходимо для процесса реминерализации. Сдвиг pH в любую сторону от среднефизиологических значений (6,5—7,5) снижает устойчивость коллоидных мицелл. Слюна — это мутная вязкая жидкость, плотность которой составляет 1,002—1,017. Вязкость слюны (по методу Оствальда) определяется в пределах 1,2—1,4 ед; при множественном кариесе — повышается до 3 ед. Увеличение вязкости слюны снижает ее очищающие свойства и минерализующую способность. Мутность слюны связана с наличием в ней клеток эпителия, лейкоцитов и др. Осмотическое давление слюны 1,0—4,6 атм. Она гипотонична по сравнению с кровью. При максимальной саливации слюна может становиться изотоничной плазме крови. В слюне имеются буферные системы: бикарбонатная, фосфатная, белковая; буферная емкость слюны 8,21±0,51 мэкв/л по кислоте и 47,5±0,46 мэкв/л по щелочи. При снижении pH ниже 6,0 слюна становится ненасыщенной гидроксиапатитами и утрачивает свои минерализующие свойства. В полости рта осуществляются электрохимические процессы: в облас
ти контактов трех сред жидкость-зубы-десна возникает электрохимический потенциал (в норме от +5 до +150 мВ), а за счет разности электрохимических потенциалов в разных точках ротовой полости может возникать электрический ток. При кариесе и деминерализации величина электрохимического потенциала падает до отрицательных величин. После пломбирования зубов она вновь может стать положительной. Эти процессы следует учитывать при протезировании. Поверхностное натяжение слюны составляет 15—26 дин/см (15х]0 3— 26* 10-3 ньютон/м); этот показатель увеличен при кариесе.
Содержание минеральных и органических веществ в слюне и сыворотке крови (г/л) по Л. И. Забросаевой и Н. Б. Козлову (1992) приведено в таблице.
Общее количество плотных веществ в смешанной слюне составляет 3—8 г/л. На долю растворенных веществ приходится 80 %, на долю суспендированных — около 20 %.
В слюне содержатся большое количество белков, количество которых весьма вариабельно в зависимости от состояния высшей нервной деятельности, приема пищи и др.
Иммуноглобулины (1g А — 190 мг/л, 1g G — 14 мг/л, Ig М — 2 мг/мл) участвуют в процессах антибактериальной защиты. Эти белки образуют комплексы с гликопротеинами и муцинами. Гликопротеины определяют прочность присоединения бактерий к поверхности зуба.
Белки, богатые пролином (содержание пролина 16—33 %), включают кислые белки (концентрация — до 80 мг/л). Для этих белков характерно высокое содержание остатков фосфорной кислоты, благодаря чему они могут тормозить рост кристаллов в слюне, пересыщенной фосфатами кальция. Если удалить фосфатные группы, связанные с остатками
598
Биохимические аспекты остеологии и стоматологии Глава 36
Таблица 36.1. Сравнение химического состава слюны и сыворотки крови (г/л)
Химические компоненты Слюна Сыворотка крови
Кальций 0,04-0,08 0,08-0,11
Фосфор 0,06-0,24 0,03-0,04
Натрий 0,08-0,50 3,12-3,52
Калий 0,56-1,48 0,13-0,19
Белок 0,95-2,32 65,0-85,0
Глюкоза 0,01-0,02 0,6-1,0
Мочевина 0,10-0,15 0,20-0,30
Молочная кислота 0,03-0,05 0,08-0,16
Роданиды 0,025 -
серина, то способность подавлять рост кристаллов утрачивается. Этой активностью обладает даже фрагмент белка, имеющий в своем составе 30 аминокислотных остатков.
Статерин — пептид (молекулярная масса 5,38 кДа), содержит до 25 % остатков аминокислот третьей группы (отрицательно заряженных) и до 15 % пролина. Его функция состоит в торможении фаз нуклеации и роста кристаллов.
Лактоферрин — белок, связывающий ионы железа (впервые выделен из молока). Основная функция — создание железодефицитного состояния, ограничивающего рост бактерий. В смешанной слюне открыто более 100 ферментов различного происхождения: железистого, лейкоцитарного и микробного. К ферментам собственно железистого происхождения относятся амилаза, лизоцим, аминотрансферазы, лактатдегидрогеназа, кислая и щелочная фосфатазы и др.
Лизоцим — фермент, вырабатываемый слюнными железами. В минуту поступает в смешанную слюну около 5,2 мкг лизоцима. Бактерицидное действие лизоцима основано на ферментативном гидролизе р-гликозидной связи между N-ацетилглюкозамином и N-аце-тилмурамовой кислотой в полисахари
дах клеточной оболочки микроорганизмов. Наиболее чувствительны к нему грамположительные микроорганизмы и некоторые вирусы. Снижение продукции лизоцима является патогенетическим фактором ряда заболеваний полости рта (стоматиты, гингивиты, парадонтоз).
ДНК-азы и РНК-азы смешанной слюны бывают кислыми и щелочными. За сутки в ротовую жидкость секретируется 60 мкг кислой и 45 мкг щелочной РНК-азы, а также 3—4 мкг двух изоферментов ДНК-азы. Основным источником нуклеаз в слюне являются лимфоциты и лейкоциты. Эти ферменты участвуют в подавлении роста ряда микроорганизмов в ротовой полости.
Пероксидаза является обобщенным понятием, включающим миелопероксидазу полиморфноядерных лейкоцитов и слюнных желез и йодидпероксидазу, вырабатываемую в щитовидной и слюнных железах. Для действия этих ферментов необходима перекись водорода, поэтому продуцирующие ее бактерии более чувствительны к действию пероксидазы слюны. Для функционирования пероксидазы слюны необходим ион CNS-, а для лейкоцитарной — хлорид-ион. В результате действия пероксидазы образуется гипохлоритный ион
599
Глава 36 Биохимические аспекты остеологии и стоматологии
(НОСГ), который и определяет бактериостатическое действие.
Белковый состав чистых секретов различных слюнных желез имеет существенные различия, например, околоушная слюнная железа вырабатывает 1g А, а также лизоцим. Некоторые белки имеют плазменное происхождение (у-глобулины, трансферрин, церулоплазмин, альбумины и др.). Слюна содержит видоспецифичные антигены и антитела, которые соответствуют группам крови. По содержанию агглютининов в слюне можно подбирать доноров с определенной группой крови. В слюне имеется Са-связывающий белок, обладающий высоким сродством к гидроксиапатиту. Увеличение его концентрации в слюне способствует образованию зубного налета и зубного камня. В слюне имеются ферменты лейкоцитарного происхождения: лактатдегидрогеназа, мальтаза, лизоцим, хондроитинсульфатаза, липаза, протеиназы и др. К ферментам микробного происхождения относят каталазу, гексокина-зу, аминотрансферазы, гиалуронидазу, коллагеназу и др.
Небелковый азот слюны включает следующие вещества: мочевину, мочевую кислоту, аммиак, аминокислоты, креатинин и др. В слюне человека содержится небольшое количество липидов (холестерол, его эфиры, свободные жирные кислоты и др.). Углеводы представлены олигосахаридами, входящими в состав муцинов, свободных гликоза-мингликанов. В слюне содержатся витамины, гормоны и другие низкомолекулярные биорегуляторы.
Десневая жидкость
Жидкое содержимое десневого желобка называют десневой жидкостью. В ротовую полость поступает в сутки 0,5—2,5 мл десневой жидкости, содержащей эпителиальные клетки, лей
коциты, микроорганизмы, продукты их распада, белки, ферменты и др. У людей со здоровым парадонтом десневая жидкость является транссудатом плазмы крови. Микробный состав десневой жидкости как у зубного налета. Из десневой жидкости выделены ферменты, характерные как для эпителия слизистой, так и для плазмы крови. Через десневой желобок в ротовую полость поступают лейкоциты. Механическое удаление частиц из десневого канала с ее помощью предотвращает возможность образования камней в этой области. При поражении парадонта десневая жидкость формируется за счет осмотической экссудации. В результате в ней находят молекулы — продукты метаболизма бактерий и компонентов зубного налета. Воспалительные процессы, связанные с тканями — продуцентами десневой жидкости, могут служить причиной развития аутоиммунных процессов с последующим нарушением связочного аппарата зубов.
Зубной ликвор
Жидкость, которая заполняет все свободные пространства тканей зуба, называют зубным ликвором. Через ликвор в ткани зуба поступают необходимые питательные вещества. Состав зубного ликвора изучался при получении жидкости дентиновых канальцев. В этой жидкости содержится 92 мг/л солей кальция, 42 мг/л фосфатов и 28 мг/л хлоридов. Белковый состав аналогичен белковому спектру плазмы крови. Создается поток такой жидкости в сторону эмали со скоростью 4 мм/ч. Ощущение боли и чувство оскомины связаны с изменениями скорости перемещения десневой жидкости.
В эмали кристаллы гидроксиапатита создают молекулярные сита, через которые в эмалевую жидкость переносятся небольшие органические молекулы и ионы минеральных солей. С возрастом количество эмалевой жидкости уменьшается. В поверхностных слоях эмали содержится меньше жидкости.
Пелликула зуба
На поверхности зуба после снятия зубного налета остается органическая пленочка (тонкая, но прочная), содержащая небольшое количество бактерий — пелликула. Она выполняет
600
Биохимические аспекты остеологии и стоматологии Глава 36
защитную функцию, многократно снижая растворимость эмали и предохраняя эмаль зуба от повреждающего действия органических кислот. Пелликула не стирается при жевании, чистке зубов, а может быть удалена лишь при воздействии сильных абразивных агентов. Пелликула образуется на поверхности эмали зуба после его прорезывания. В ней содержатся белки с низким содержанием цистеина, метионина, гидроксипролина и гидроксилизина. Следовательно, эти белки отличаются от кератинов и коллагенов. Белки пелликулы скорее напоминают гликопротеины слюны, после отщепления остатков нейраминовой кислоты от олигосахаридных цепей. Кислые фосфопротеины слюны находят и в составе пелликулы. В состав пелликулы включаются фрагменты стенок бактерии.
Зубной напет
Зубной налет — это слой органической матрицы и бактериальных клеток, расположенных на поверхности эмали. В зубном налете содержится 80 % воды, 20% — сухой остаток. Более 40 % сухого остатка приходится на минеральные вещества, а 60% — органические. Содержание фтора в зубном налете может в 10 100 раз превышать его концентрацию в слюне (8— 160 мг/кг). Фтор включается в состав зубного налета из пищи, воды, слюны, но может поступать и из эмали зуба при снижении pH зубного налета и активации процессов деминерализации эмали. С возрастом содержание фтора в зубном налете увеличивается. Минеральные вещества зубного налета могут быть организованы в виде гидроксиапатитов и фторапатитов, фторида кальция и др, Матрикс зубного налета содержит денатурированные гликопротеины слюны и продукты жизнедеятельности бактерий. Последние представлены небольшими молекулами — конечными продуктами обмена. Они легко растворимы и поэтому не накапливаются в налете. В зубном налете имеются три типа полисахаридов (глюканы — при питании глюкозой, леваны — при питании фруктозой и гетерополисахариды). Если исключить углеводы из пищи хотя бы на неделю, то в матриксе зубного налета исчезнут полисахариды. В отличие от пелликулы зубной налет удаляется в процессе чистки зубов, но устойчив к связыванию
слюной и полосканию полости рта. Поверхность зубного налета покрыта слизистым полупроницаемым мукоидным гелем. В зубном налете имеются плохо ассоциированные комплексы гликопротеинов слюны и сложных белков стенки бактерий. В составе зубного налета содержатся в зависимости от химического состава пищи различные включения. После чистки зубов зубной налет начинает накапливаться уже через 2 часа. Сначала преобладают аэробные микроорганизмы, а затем — смесь аэробных и анаэробных. Быстрому развитию зубного налета способствует наличие в пище сахарозы. Присутствие на поверхности зуба бактериального зубного налета является обязательным условием развития кариеса.
Зубной камень
Пародонт включает комплекс тканей, имеющих генетическую и функциональную общность: периодонт, кость альвеолы, десну с надкостницей и ткани зуба. Основную массу десны составляют коллагеновые волокна. Межклеточное вещество тканей пародонта представлено протеогликанами. В патогенезе заболеваний пара-донта важную роль играет образование зубного камня, который возникает в результате осаждения из слюны солей — фосфатов и карбонатов кальция и магния в органическую матрицу зубного налета. С другой стороны, зубной камень рассматривают как минерализованную зубную бляшку, прикрепленную к эмали в области поверхности корня зуба. Зубной камень выявляют у 75 % обследованных лиц. При наличии гингивита зубной камень находят у 90 % обследованных. Усредненный зубной камень содержит 4— 10 % воды, 72—82 % минеральных веществ и 13—25 % органических веществ. В сильноминерализованных зубных камнях содержание кальция достигает 29 %, фосфатов — 16 %. В зубном камне находят микроэлементы, аминокислоты, моносахариды, фосфолипиды, холестерол, ферменты и другие компоненты пищи и продуктов распада эпителиальных клеток и лейкоцитов. Микрофлора зубного камня представлена сплетениями лептотрихий и актиномицетов, в которые вкраплены другие микроорганизмы. Зубной камень имеет слоистую структуру. Зубные камни чаще возникают на язычной поверхности зубов вблизи протоков слюнных желез.
601
Глава 36 Биохимические аспекты остеологии и стоматологии
Зубные камни могут иметь разную степень минерализации и разное количество ассоциированных бактерий. Для образования зубных камней требуется локальное повышение pH ротовой жидкости. Чаще всего этот эффект связан с ферментативным гидролизом мочевины. В составе зубных камней можно обнаружить все типы кристаллов фосфорнокислых солей кальция. Часто камни являются непосредственной причиной болезней пародонта. Образованию зубного камня способствуют изменения химического состава слюны, накопление на зубах бактериального зубного налета и наличие воспаления тканей пародонта. В свою очередь, образование зубного камня способствует поддержанию воспаления, что усугубляет течение имеющегося патологического процесса.
Биохимия кариеса
Кариес зубов — первичное заболевание зубов, которое встречается у 98 % людей. Начало кариеса выглядит как белое пятно на гладкой поверхности зуба за счет увеличения рассеивания света эмалью в местах повышения ее пористости. Эта пористость инициируется кислотой, проникающей из бляшки, связанной с эмалью. После достижения эмалево-дентинового контакта процесс идет в сторону пульпы и вокруг места повреждения. Постепенно интактность эмали нарушается и формируется дефект, в который проникают микроорганизмы. Дентин и пульпа имеют клетки, которые реагируют на повреждение путем образования вторичного дентина, минерализации дентиновых канальцев и воспаления пульпы. К ранним химическим изменениям в зоне повреждения относится потеря карбонатных ионов, а также ионов кальция и магния. Относительно увеличивается количество фтора и органических веществ. Одновременно
идет формирование новых кристаллов типа брушита (инициация процесса реминерализации).
По Л. И. Забросаевой и Н. Б. Козлову, зубной налет адсорбирует сахарозу пищи, которая наряду с углеводными остатками пищи может расщепляться до соответствующих моносахаридов. Ферменты аэробного и анаэробного распада глюкозы, полный набор которых представлен в зубном налете, продолжает распад глюкозы с образованием органических кислот. В местах скопления значительных количеств зубного налета микроорганизмы ферментативно расщепляют пелликулу, в результате чего образующиеся в зубном налете органические кислоты проникают к поверхности эмали зуба и инициируют появление локального очага деминерализации эмали. Если этот процесс продолжается, то происходит прогрессирующая деструкция твердых тканей зуба. Развитию кариеса способствуют а) снижение скорости слюноотделения и уменьшение объема саливации; б) увеличение вязкости слюны и повышение содержания в ней муцинов; в) снижение буферной емкости и сдвиг pH слюны в кислую сторону; г) активация ферментов катаболизма глюкозы в слюне и зубном налете микробного происхождения; д) снижение степени насыщенности слюны соединениями кальция и фосфора, возникающие вследствие сдвига pH слюны в кислую сторону. Наиболее благоприятная ситуация для развития кариеса складывается в ротовой полости во время сна, т. к. при анаэробном гликолизе накапливается молочная кислота. Известно, что промывание зубного налета 5 %
602
Биохимические аспекты остеологии и стоматологии Глава 36
раствором глюкозы вызывает падение pH уже в считанные минуты, создавая локальные условия для деминерализации. Наибольшее снижение величины pH достигается уже через 10-12 мин после про
мывания. На восстановление pH требуется больше 1 часа времени. Эта динамика вариабельна и служит своеобразным тестом для разделения людей по устойчивости к кариесу.
603
Основная литература
1. Ашмарин И. П., Стукалов П. В., Ещенко Н. Д., Ашапкин В, В. и др. Биохимия мозга: учебное издание / под ред. акад. РАМН И. П. Ашмарина, проф. П. В. Стукалова, д-ра биол. наук Н. Д. Ещенко. — СПб: изд-во С.-Петербургского университета, 1999. — 328 с.
2. Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник / Под. ред. акад. АМН СССР С. С. Дебоаа. — 2-е изд., перераб. И доп. — М.: Медицина, 1990. — 528 с.
3. Биохимия: Учебник / Под ред. Е. С. Северина. — М.: ГЕОТАР-МЕД, 2003. — 784 с.
4. Боровский Е. В., Леонтьев В. К. Биология полости рта. — М.: Медицинская книга, Н. Новгород: Изд-во НГМА, 2001. — 304 с.
5. Виноградов В. В. Стресс и патология. — Мн.: «Белорусская наука», 2007. — 351 с.
6. Гидранович В. И., Гидранович А. В. Молекулярная биология и биологическая химия: Учебное пособие — Витебск: ВГУ, 2006. — 353 с.
7. Гресь Н. А., Тарасюк И. В., Ставрова Е. Л. Микроэлементозы человека: метаболические и функциональные взаимодействия // Медицина. — 2007. — № 3 (58). — С. 43-47.
8. Громова О. А., Ребров В. Г. Витамины и канцерогенез: мифы и реальность//Трудный пациент. — 2007. — т. 5, № 3. — С. 5-13.
9. Забросаева Л. И. Биохимия тканей зуба и пародонта. Учебно-методическое пособие. — Смоленск: Изд-во СГМИ, 2007. — 72 с.
10. Кнорре Д. Г., Мызина С. Д. Биологическая химия. — М.: Высшая школа, 1998. — 479 с.
11. Кольман Я., Рем К.-Г. Наглядная биохимия: Пер. с нем. — М.: Мир, 2000. — 469 с.
12. Комов В. П., Шведова В. Н. Биохимия. — М.: Дрофа, 2004. — 638 с.
13. Мартинович Г. Г., Черенкевич С. Н. Окислительно-восстановительные процессы в клетках: Монография.- Мн.: БГУ, 2007.-154 с.
14. Морозкина Т. С., Мойсеенок А. Г. Витамины. Краткое руководство для врачей и студентов медицинских, фармацевтических и биологических специальностей. — Минск: Асар, 2002. — 112 с.
15. Кухта. В. К., Морозкина Т. С., Олецкий Э. И., Таганович А. Д., Биологическая химия: Учебник / под ред. А. Д. Тагановича.- Минск: Асар, М.: изд. БИНОМ, 2008. - 688 с.
16. Скальный А. В., Рудаков И. А. Биоэлементы в медицине. — М.: ОНИКС 21 век, 2004. — 271 с.
17. Смирнов А. Н. Элементы эндокринной регуляции: научное издание / под ред. акад. РАМН В. А. Ткачука. — М.: «Гэотар-Медиа», 2006. — 352 с.
18. Титов В. Н., Дугин С. Ф., Крылин В. В. Протеомика, метаболомика и будущее клинической лабораторной диагностики // Клиническая лабораторная диагностика. — 2007. — № 1. — С. 23-34.
19. Титовец Э. П. Аквапорины человека и животных. Фундаментальные и клинические аспекты. Минск: «Белорусская наука», 2007. — 237 с.
20. Филиппович Ю. Б. Основы биохимии. — М.: «Агар», 1999. — 512 с.
21. Элиот, Д Элиот. Биохимия и молекулярная биология. — М.: Изд-во НИИ Биомедицинской химии РАМН, ООО «Материк-альфа», 1999. — 372 с.
604
Литература
22. Чиркин А. А. Курс лекций по биологической химии:. Учебно-методическое пособие — Витебск: ВГМУ, 2002. — 312 с.
23. Чиркин А. А. Практикум по биохимии: Учебное пособие — Минск: Новое знание, 2002. — 512 с.
24. Чиркин А. А., Данченко Е. О. Биохимия с основами молекулярной биологии. Учебно-методический комплекс для студентов биологического факультета. Витебск: ВГУ, 2006. — 295 с.
25. Berg J. М., Tymoczko J. L., Stryer L. Biochemistry. N-Y: W. H. Freeman and Company, 2002.-1514 р.
26. Champe P. C., Harvey R. A., Ferrier D. R. Biochemistry. — Philadelphia: Lippincott Williams and Wilkins, 2005. — 534 p.
27. Davidson V. L., Sittman D. B. Biochemistry. — Baltimore: Lippincott Williams and Wilkins, 1999. — 479 p.
28. Ganten D., Ruckpaul K. Encyclopedic reference of genomics and proteomics in molecular medicine. Vol. 1-2. — Berlin: Springer-Verlag, 2006. — 4180 p.
29. Kaplan L. A., Pesce A. J., Kazmierczak S. C. Clinical chemistry. Theory, analysis, and correlation. — St. Louie, Baltimore: Mosby, 1996. —1211 p.
30. Karp G. Cell and molecular biology. Concepts and experiments. — John Wiley and Sons, 2005.—780 p.
31. Marshall W. J., Bangert S. K. Clinical Biochemistry. Metabolic and clinical aspects. — New York: Churchill Livingstone, 1995. — 854 p.
32. Murray R. K., Granner D. K., Mayes P. A., Rodwell V. W. Harper’s Biochemistry, twenty-third edition. Appleton and Lange, 1993. — 806 p.
33. Nelson D. L., Cox M. M. Lehninger principles of biochemistry. — New York: Worth Publishers, 2000. —1152 р.
34. Pollack G.H. Cells, gels and the engines of life. A new, unifying approach to cell function. Seattle WA: Ebner and Sons, 2001. - 305 p.
35. Voet D., Voet J. G. Biochemistry — New York: John Wiley and Sons. Inc., 1995. — 1360 p.
605