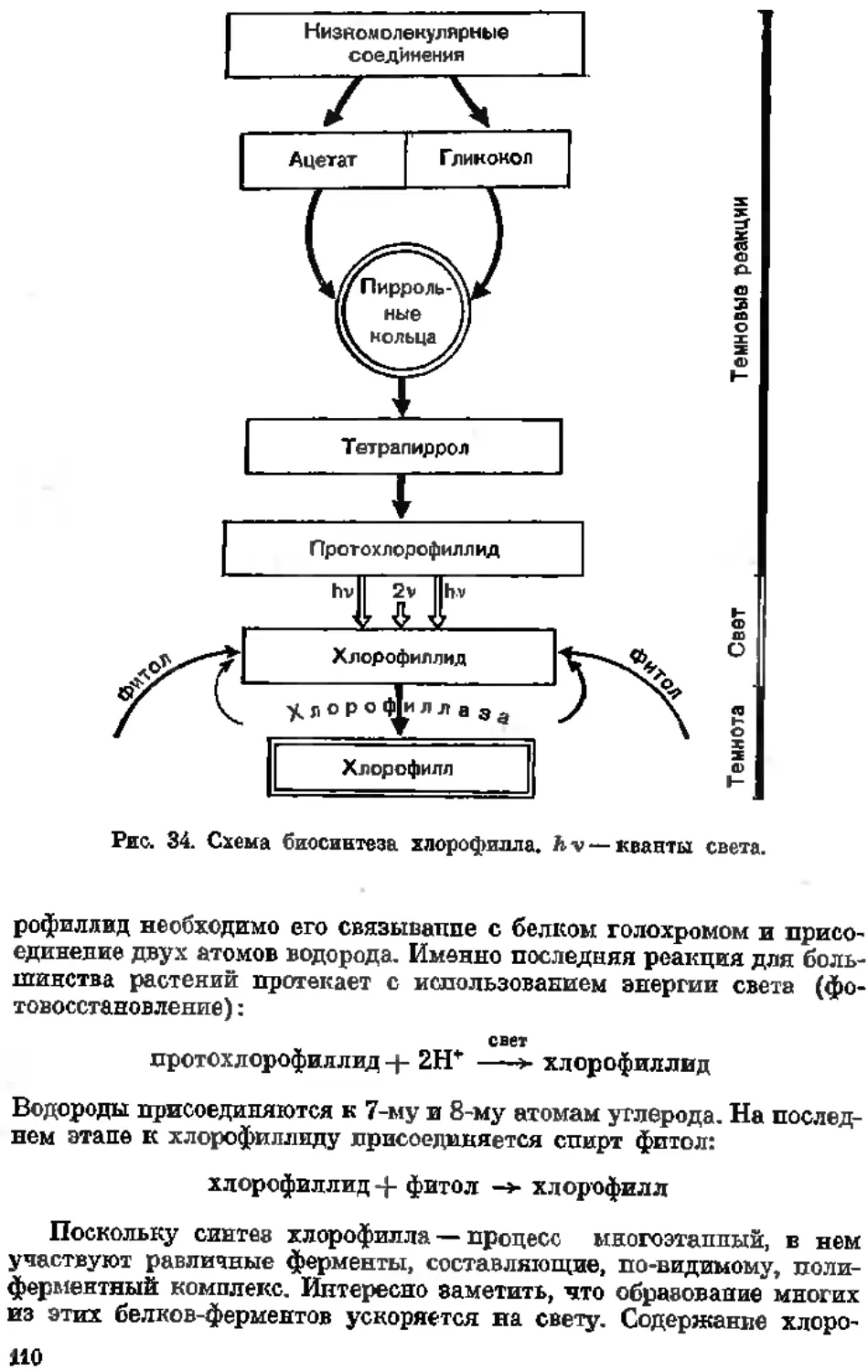
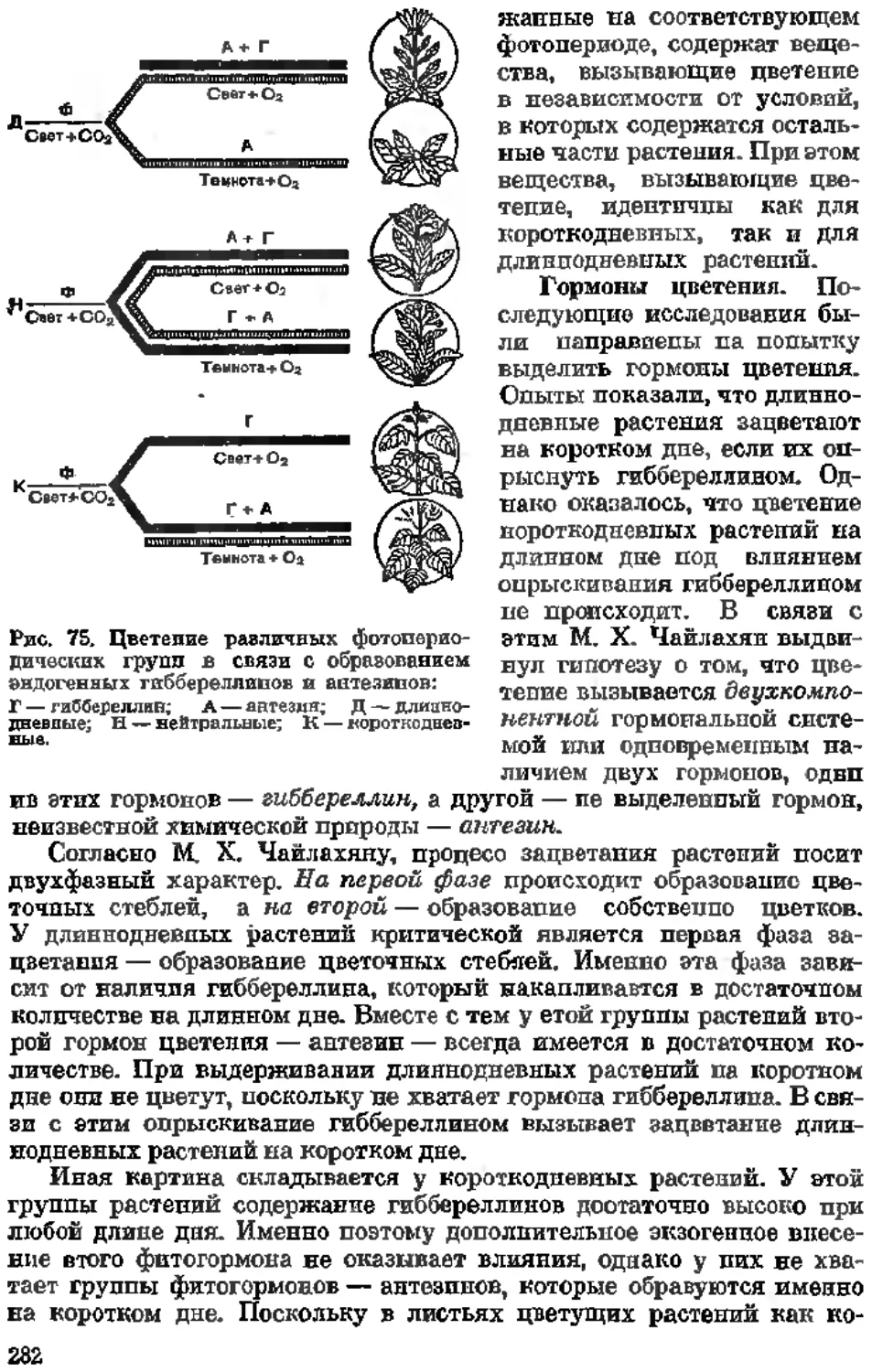
Текст
Н. И. «ПУШКИНА
ФИЗИОЛОГИЯ РАСТЕНИЙ
Допущено Министерством просвещения СССР в качестве учебного пособия для студентов биологических специальностей педагогических институтов
МОСКВА «ПРОСВЕЩЕНИЕ» 1980
ББК 28.57
Я49
Рецензенты: доктор биологических наук В. В. Апикиев, кафедра ботаники МГПИ им. В, И. Ленина
Якушкпна И. И.
Я49 Физиология растений: Утеб. пособие для студентов биол. спец. пед. ии-тов. — М.: Просвещение, 1980.— 303 с., ил.
Вее разделы пособия рассматриваются с позиций молекулярной биологии. Вскрыты механизмы регуляции физиологических процессов, лежащих в основе онтогенеза растений и адаптации к среде обитания. Показа-по, что растительный организм и все Протекающие в нем процессы являются результатом длительной эволюции. Уделено внимание связи физиологии растений с растениеводством.
Я в0602-512 50_80 4^)9021000 ВБК 28.57
103(03)—80 581.4
© Издательство «Просвещение», 1980 г.
ПРЕДИСЛОВИЕ
Биологическая паука непрерывно развивается, меняются не только взгляды на отдельные вопросы, по и общие подходы к ее изучению. Поэтому возникла необходимость в создании нового учебного пособия по физиологий растении.
В данном пособии в основном сохранена общепринятая последовательность в изложении отдельных вопросов физиологии. Вместе с тем, учитывая решающее значение для современного этапа развития физиологии растений достижений молекулярной биологии, мы сочли необходимым в первой главе остановиться па молекулярных основах клеточной организации, обратив внимание па связь между химической структурой и физиологическими функциями отдельных органических соединений. Одновременно в этом разделе даны основы современного попималия физиологических аспектов роли нуклеиновых кислот и белков-ферментов в передаче и реализации наследственных свойств. Этот раздел позволит студенту правильно попять современный уровепь развития физиологии растений. Во всех остальных главах, особенно посвященных росту и развитию, достижения молекулярной биологии пашин непосредственное отражение.
Одним из нейтральных вопросов современной биологической пауки является вопрос о механизмах, обеспечивающих регуляцию жизненных процессов. Именно регуляторные механизмы обеспечивают слаженность физиологических процессов, упорядоченность развития организмов, способность их к адаптации, к меняющимся условиям. В этой связи мы считали необходимым более подробно остановиться на механизмах регуляции как па молекулярном, так и па организменном уровне (гормональная регуляция).
Небольшой объем пе позволил достаточно подробно остановиться на всех разделах, и поэтому некоторые из них пришлось изложить конспективно.
Данное пособие рассчитано на студентов педагогических институтов — будущих учителей, именно поэтому большое внимание уделено рассмотрению взаимосвязи физиологических процессов, созданию целостного представления о растительном организме. Учитель средней школы должен обладать широким кругозором, в этой связи в руководстве частные вопросы физиологии рассматриваются как проявление общебиологических закономерностей.
Автор прппосит большую благодарность коллективу кафедры ботаники Московского областного педагогического института имени Н. К. Крупской и кафедре физиологии растений Воронежского государственного университета, в особенности доценту Д. П. Викторову п доцеиту Г. С. Эрделп за большую помощь, оказанную при написании данного пособия. Автор благодарен также своим бывшим аспирантам, преподающим в различных педагогических институтах страны, замечания и пожелания которых оказались весьма полезными.
Выражаю также большую признательность зав. кафедрой ботаники Ленинградского педагогического института имени Герцена, проф. В. В. Апикневу и коллективу кафедры ботаники МГПИ имени В. И. Лепина за внимательный просмотр рукописи п сделанные ими замечания.
Доктор биологических паук, профессор
Н. И. Якушкнда
ВВЕДЕНИЕ
Физиология растений относится к биологическим паукам. Биология — паука о жизни — издавна разделялась на два основных направления: анатомо-морфологическое и физиологическое. Как всякая классификация, такое разделение условно. Действительно, как изучать отдельные органы, не принимая во внимание их функции, или изучать процессы, не касаясь тех структур, где опн локализованы? В последнее время биологи стремятся теснее связать процессы с определенными внутренними структурами. Так, например, для понимания процесса дыхания важное значение имеет изучение микроскопической и субмикроскопической структуры митохондрий, где атот процесс локализован. Биологические функции многих макромолекул связаны с их формой. Хорошо известно решающее зпачепие двухцепо-чечиой структуры ДНК. Именно такая структура обеспечивает важнейшее свойство данного соединения — способность к самовоспроизведению. Не вызывает сомнений решающая роль конфигурации бел-ков-фермектов для осуществления их каталитической активности. Все же разделение биологии на указанные направления продолжает существовать, это вызвано как общими тенденциями к углублению специализации, так м различиями в методах исследования. Основной метод у анатомо-морфологов описательный, тогда как у физиологов — экспериментальный.
Физиологическое направление в биологии делится па физиологию животных и физиологию растений. Еще со времени Аристотеля мир живых существ делят па царство животных и царство растений. Это также’условно. Чем больше мы углубляемся в понимание сущности биологических явлений, тем больше пас поражает универсальность многих процессов. Действительно, все организмы используют соединения углерода как материал для построения своего тела, воду как универсальный растворитель, соединения фосфорной кислоты как источник знергии., пуклеиновые кислоты как хранитель наследственной информации, белки как катализаторы. Показано, что такой центральный процесс, протекающий во всех живых организмах, как синтез белка, сходен пе только в общих чертах, по и во многих деталях. В этом отношении интересны исследования советского ученого А. Спирина, показавшего возможность гибридиеации субъединиц рибосом, выделенных из растительных и животных организмов. Природа удивительно экономна, и, несмотря на внешнее огром псе разиооб-
разие, во многих процессах заложены один и те же механизмы. Все это приводит к выводу, что во многих случаях различия между растения мп и животными носят больше количественный характер. Однако существуют и качественные различия. Кановы же особенности растительного организма по сравнению с животным? Прежде всего эти особенности проявляются па клеточном уровне. Как правило, клетки растений имеют определенную форму благодаря наличию жесткой пектоцеллюлозной оболочки. Животные клетки такой твердой оболочки не имеют и могут легко изменять свою форму. Многие растительные клетки, в отличие от животных, обладают особыми органеллами — пластидами, а также системой вакуолей. Как правило, в них отсутствует центриоль. Есть существенные различия п в процессах, происходящих в растительном и животном организме. В отличие от животных растения в большинстве случаев фиксированы, способность к движению у них очень ограничена. Рост растений отличен от роста животного организма. Растения растут в течение всей жизни, тогда как большинство животных прекращает рост после того, как достигнет определенных размеров. Рост животных в основном происходит за счет увеличения размеров уже имеющихся органов, а рост растений сопровождается появлением новых органов, т. е. включает в себя формообразовательные процессы. Животные во время роста выделяют веществ во внешнюю среду значительно больше, чем растения. Наконец, важнейшее значение имеет тот факт, что зеленые растения обладают способностью строить органическое вещество из простых неорганических соединений, тогда как животные питаются за счет готовых органических веществ.
Итак, физиология растений — это паука о процессах, происходящих в растительном организма. Задача физиологии растений заключается в раскрытии сущности этих процессов для того, чтобы научиться управлять ими. К. А. Тимирязев писал: «Физиолог па может довольствоваться пассивной ролью наблюдателя, как экспериментатор, оп является деятелем, управляющим природой».
В атом определении заложена целая программа действия для каждого физиолога. Из пего впдпо, что, с одной стороны, физиология растений — это теоретическая наука, которая опирается па последние достижения физики, хиппи, молекулярной биологии; с другой сторо-иы, эта паука имеет большое практическое значение для земледелия.
Таким образом, в задачи физиологии растений еходит раскрытие сущности процессов, протекающих в растительном организме, установление их взаимной связи, изменения под влиянием среды, механизмов их регуляции. Для решения указанных задач важней идее значение имеет широкое примёпепие диелектпческого метода. Физиология растений изучает процессы, происходящие в организме па разных уровнях организации: организменном, органном, клеточном, субклеточном, малекулярпом и даже субмолекуляриом. При изучении процессов па любом уровне падо всегда иметь в виду, что как в клетке, так и в организме в целом, есе процессы теспо взаимосвязашя. Изменение любого процесса отражается па всей жизнедеятельности организма. Сложность биологических исследований заключается еще
и в том, что организм неотделим от среды и все физиологические процессы тесно взаимосвязаны с условиями среды. Любой физиологический процесс должен рассматриваться как продукт длительной эволюции, в течение которой выработалась способность растений к адаптации, приспособлению к изменяющимся условиям среды в процессе их онтогенеза. Растительный организм непрерывно развивается п в течение всей своей жизни. Это развитие расчленено па определенные этапы. Каждый этап развития имеет свои специфические особенности. Именно поэтому необходимо рассматривать растительный организм как непрерывно развивающуюсп систему.
При изучении растительного организма на разпых уровнях организации возможно два подхода. Первый — это переход от более высокого уровня к более низкому, сведение сложных биологических закономерностей ко все более и более простым физическим и химическим. Этот путь исследования, в последнее время широко применяемый биологами, привел к развитию молекулярной биологии—раскрытию наследственного кода, механизма биосинтеза белка, основных закономерностей поглощения и использования квантов света в процессе фотосинтеза и т. д. Однако, для того чтобы понять закономерности физиологических процессов, протекающих в целом организме, этот подход явно недостаточен. На основании имеющихся достижений в настоящее время начинает применяться иной путь — переход от изучения более простого ко все более сяожпому уровню организации. Этот второй подход был пазвак академиком В. А. Энгельгардтом «интегральным». В самом общем виде этот подход позволяет иросведить развитие отдельных физиологических процессов в целом организме на основе следующей общей схемы: ДНК — РНК — белок-фермент — биохимическая реакция — физиологический процесс — свойство клетки— свойство органа — свойство организма. По-видимому, на всех уровнях указанной схемы процессы регулируются. Регулируется активность репликации ДНК, образование РНК и белков, активность белков-ферментов, дифференциация клеток и т. д. Раскрытие механизмов регуляции па разных уровнях реализации генетической информации позволит подойти к пониманию того, каким образом оплодотворенная яйцеклетка превращается в целый многоклеточный организм. Это приблизит нас и к псипмапию механизма адаптации организмов к условиям внешней среды.
Достижения молекулярной биологии уже оказали заметное влияние па физиологию растений. Именно благодаря достижениям молекулярной биологии получкли новую интерпретацию известные ранее факты о роли фитогормонов в процессах роста и развития растений. Сейчас фитогормопам подобно гормонам жизотпых организмов отводится важнейшая роль как в регуляции различных физиологических процессов, так и в процессе приспособления к условиям внешней среды. В втой связи одна из важнейших задач, стоящих перед физиологами, заключается в раскрытии механизма гормональной регуляции.
Изучение на молекулярном уровне внесло мвого нового в объяснение процессов поступления питательных веществ в растение. Однако надо сказать, что вопросы поступления и особенно передвижение.
питательных веществ по растению во многом остаются еще неясными. По-видимому, широкое развитие применения удобрений в пашей стране выдвигает перед физиологами задачи дальнейшей разработки основ корневого питания растений.
За последние годы велики успехи в понимании первичных процессов фотосинтеза, хотя еще много вопросов требует дальнейшего изучения, для тою чтобы осуществить мечту человека — полностью воспроизвести етот процесс в искусственной обстановке.
Советская шкова физиологии растений всегда обращала пристальное внимание па управление растительными организмами с целью повышения их продуктивности. В настоящее время эта проблема стоит во всем мире чрезвычайно остро. Важно охранять природу и од-поврем'ёпно поднять общую продуктивность биосферы. Для этого перед физиологами стоит задача изучать поведение растений в сообществах, в ценозах. Особенно важным является то, о чем писал еще К. А. Тимирязев, — повысить коэффициент использования солнечной энергии.
Нет сомнений, что все более широкое применение принципов, открытых при молекулярно-биологических исследованиях в изучении процессов па уровне целого растения и растительных сообществ, позволит подойти к управлению ростом, развитием, а следовательно, и продуктивностью растительных организмов.
Изучение физиологии растений имеет большое значение для учителя. Оно поможет ему на уроках дать правильное представление о жизни растительного организма, о его огромной роли в жизни пашой планеты. Знание физиологии растений поможет также в работе по охрапе растений от равличных вредных воздействий.
Глава I.
ФИЗИОЛОГИЯ РАСТИТЕЛЬНОЙ КЛЕТКИ
Клетка — основная структурная п функциональная едпппца жизни, ограниченная полупроницаемой мембраной и способная к само-воспропзведепию. Клетки разных живых организмов имеют свои отличительные особенности. Как известно, все организмы делят ла прокариоты (бактерии, сине-зеленые водоросли), клетки которых не имеют оформленного ядра, л эукариоты, клетки которых обязательно содержат ядро. Существенные различия в структуре имеются и у клеток, входящих в состав одного и того же организма. В многоклеточном организме имеются высокоспециалпзироваппые клетки, которым присущи свои специфические функции. Клетка корня с корневым волоском пе похожа па клетку флоэмы млн клетку мезофилла листа. Одпако всякое изучение должно начаться пе с выявления различия между разными клетками, а с установления наиболее характерного для обобщенной клетки.
Для всех клеток характерны те же функции, которыми можно характеризовать и жизпь в целом. Они способны к самоеосвроизведе-пию, к использованию и превращению энергии, к синтезу больших и сложных молекул. Клетка, как и все живое, является результатом длительной эволюции и характеризуется высокой упорядоченностью своей структуры.
Открытие клеточного строения организма непосредственно связано с изобретением микроскопа. В 1665 г. голландский ученый Роберт Гук усовершенствовал простейший микроскоп и рассмотрел с его помощью срез пробки. На этом срезе оказались видимыми отдельные ячейки. Роберт Гук назвал их клетиами. Однако только в середине XIX в. этому открытию было придано надлежащее значение. На основе многочисленных наблюдений, главным образом благодаря работам ботаника М. Шлейдена (1838) и зоолога Т. Швапна (1839), была сформулирована клеточная теория строения организмов. Согласно-этой теории, все живое состоит из клеток и их производных. Трудно переоценить значение отого обобщения. Ф. Энгельс причислял открытие клеточного строения организмов к трем величайшим открытиям XIX в. (наряду с эволюционной теорией происхождения видов и законом сохранения анергии). Значение открытия клеточного строения организмов многогранно. Ойо дало основу для утверждения взгляда о единстве происхождения всего живого, открыло возможность изучения живого на уровне клетки. Вместе с тем при изучении
многоклеточных организмов надо помнить, что каждая клетка па-ходмтси в тесном взаимодействии с другими клетками п что организм — это единое целое, а пе сумма клеток.
СТРОЕНИЕ КЛЕТКИ
Долгое время считали, что клетка — это масса протоплазмы, которая окружена клеточной оболочкой п содержит ядро. Такое представление просуществовало до усовершенствования методов микроскопического исследования. Разрешающая сила самого сильного светового микроскопа составляет около 150—200 им и пе позволяет увидеть многие органеллы, а тем более рассмотреть их внутренне© строение. Последнее стало возможным лишь после изобретения электронного микроскопа. Известно, что электроны обладают волновыми свойствами, это позволяет их искользовать нодобпо енотовым волнам. Высокая разрешающая способность электронного микроскопа объясняется малой длиной волны, соответствующей влектропу. В связи с этим разрешающая способность электронного микроскопа примерно па 2—3 порядка выше светового микроскопа и составляет около 1 пм. Правда, ценность электронного микроскопа снижается из-за ряда технических трудностей. Низкая проникающая способность электропов заставляет использовать ультратопкие срезы — 300—500 пм. Кроме того, наблюдение в электронном микроскопе производится па фиксированных (умерщвленных) срезах. В связи с этим интерпретация картин, видимых в электронный микроскоп, должна проводиться с осторожностью. Пе исключена возможность, что та или иная картина представляет собой артефакт (следствие отмирания). И все же применение электронного микроскопа значительно продвинуло паши знания о структуре и ультраструктуре клетки. Рассмотрение с помощью электронного микроскопа показало, что клетка обладает чрезвычайно сложной структурной организацией и представляет собой систему, дифференцировавшую на отдельные органеллы (рис. 1, 2).
В растительной клетке прежде всего надо различать клеточную оболочку и содержимое. Основные жизненные свойства присущи именно содержимому клетки — протопласту. Кроме того, для взрослой растительной клетни характерно наличие вакуоли — полости, заполненной клеточным соком.
Протопласт состоит из цитоплазмы и включенных в нее крупных органелл, видимых в световой микроскоп: ядра, пластид и митохондрий. В ‘свою очередь, цитоплазма представляет собой сложную систему, включающую многочисленные субмикроскопические структуры, такие, как аппарат Гольджи, эндоплазматический ретикулум, микротрубочки, рибосомы и др. Все указанные органеллы погружены в матрикс цитоплазмы — гиалоплазму, или основную плазму. (Если отцентрифугировать цитоплазму, то опа разделится па две пример по равные части. В более плотной окажутся структурные образования, куда войдут все органеллы, а в менее плотной — гпалоплазма.) Каждая из органелл имеет свою структуру п ультраструктуру. Под уль-40
Рис. 1. Элситропио-микроскоюическая фотография молодой растительной клст-пи (по Н. В Парамоновой):
>1 ►
J — клеточная оболочка, а — пластиды; з — митохондрия; а — аппарат Гольджи; 0 -вндоплазматический ретикулум; S — ядро; ? — вакуоль; В—крахмал.
И
граструктурой понимается расположение в пространстве отдельных молекул, составляющих данную органеллу. Даже с помощью электронного микроскопа далеко не всегда можпо увидеть ультраструктуру более мелких органелл (рибосом). По мере развития науки открываются все новые структурные образования, находящиеся в цитоплазме, и в этой связи иашп современные представления о пей ни в коей мере пе являются окончательными. Клетки многоклеточного организма взаимосвязаны. Эта взаимосвязь осуществляется с помощью тяжей цитоплазмы — плазмодесм.
Выяснение физиологических функций отдельных оргапелл связано с разработкой метода их изоляции (выделения из клетки). Таков метод дифференциального центрифугирования, основанный па разделении отдельных компонентов протопласта по нх величине и плотности. В зависимости от ускорения удается выделить все более и более мелкие фракции оргапелл. Совместное применение методов влектроипой микроскопии и дифференциального центрифугирования дало возможность наметить связи между структурой и функциями отдельных оргапелл. В молекулярной биологии, пли пауке об особенностях строения и функциях отдельпых макромолекул (белков и нуклеиновых кислот), сомкнулись усилия биохимиков, физиологов и морфологов, и именно это дало триумфальный успех.
Соотношение между отдельными «ядами структур в растительной клетке представлено па следующей схеме:
Клетка
I
клеточная протопласт вакуоль
оболочка । '
микроскопические цитоплазма
структуры
ядро пластцды митохондрии субмикроскопическио гиало-структуры плазма
андоплазмати- аппарат рибосомы ческая сеть Гольджа в др.
Размеры клеток и отдельных органелл приблизительно следующие: клетка —10 мкм — 10 мм, ядро — 5—30 мкм, хлоропласты — 2—6 мкм, митохондрии — 0,5—5 мкм, рибосомы — 25 нм.
Рассмотрим основные свойства отдельных частей растительной клетки.
1. КЛЕТОЧНАЯ ОБОЛОЧКА
Характерной особенностью растительной клетки является наличие твердой клеточной стенки. Клеточная оболочка придает клеткам я тканям растений механическую прочность, защищает протоплазматическую мембрану ст разрушения под влиянием гпдоостатического давления, развиваемого внутри клетки. Однако такую оболочку нельзя рассматривать только сак механический карюю. Клеточная оболочка, особенно в молодых клетках, играет определенную физиологическую роль. Опа способов к росту, является протпвоппфекциоппым барьером, принимает участие в поглощении минеральных веществ, являясь своеобразным иопообменнпком. Клеточная оболочка обладает такими свойствами, которые позволяют противостоять давлению воды внутри клетки, и в то же время обладает растяжимостью и способностью к росту. Ока образуется из веществ, вырабатываемых компонентами протопласта. Первичная клеточная оболочка характерна для молодых клеток (рис. 5). По мере их старения образуется вторичная структура.
В состав клеточной оболочки входит целлюлоза, гемицеллюлоза, пектиновые вещества, липиды и небольшое количество белка. Процентное соотношение веществ в первичных клеточных оболочках сильно колеблется. Для примера приведем состав оболочки клеток колеоптилей овса: целлюлозы —25%, гемицеллюлозы — 54%, пектиновых веществ — 3—5%, белка — 10%, липидов — 4%. Остовкле-точной оболочки составляют переплетеплые микро- и макрофибриллы целлюлозы. Целлюлоза, или клетчатка (Сб11и|О5)п, представляет собой длинные пераз ветвленные цепочки, состоящие из 3—10 тыс. остатков глюкозы, соединенных 1,4-свявями. Макромолекулы целлюлозы не встречаются в свободном виде, 100 молекул целлюлозы объединены в мицеллу, 20 мицелл объединены в микрофибриллу, 250 микрофибрилл составляют макрофибриллу (рис. 3). Макрофибриллы, мицеллы п микрофибриллы соединены в пучки водородными связями. Надо сказать, что структура микро- и макрофибрилл неоднородна. Наряду с хорошо организованными кристаллическими участками имеются паракристаллические, аморфные. Диаметр мицеллы составляет 5 дм, диаметр фибриллы — 30 им. Микро- и макрофибриллы целлюлозы в клеточной оболочке погружены в аморфную желеобразную массу — матрикс. Матрикс состоит из гемицеллюло-вы, пектиновых веществ и белка. Гемицеллюлоза, или полуклетчатка,— это смесь веществ, в которую входят пентозаны и гексозаны. Степень полимеризации у этих соединений меньше по сравнению с клетчаткой (450—300 мономеров, соединенные 1.3- и 1,4-связями) . Пектиновые вещества — это полимерные соединения углеводного типа. Различают три вида пектиновых веществ. 1. Пектиновая кислота — представляющая собой цепочки, включающие от 5 до 100 остатков галактуроковой кислоты^С^^—(СН0Н)4— СООН^, образующихся при окислении гексоз. 2. Пектин — это также цепоч-
Рис. 2. Схема строения растительной клетки:
J—кл«-точиая оболочка; S — илаамалемм»; S — гглазмодеомы; ядро; в — аппарат Гольджи; ? — вакуоль; з — митохондрия, плазматический ретикулум.
4 — микротрубочки; 3 — о — пластида; 10 — эидо-
300 ни2
6,250 нм2
0,16 мкн2
Б
Рис. 3. Целлюлоза:
Л — структура молекулы целлюлозы; Б — ассоциации молекул целлюлозы: 1— мицелла; 2—микрофиСрилла; 8 — макрофибрилла.
ки галактуроповом кислоты, некоторые карбоксильные группы которой метилированы. Пектин дает коллоидные растворы и легко переходит в гель. 3. Протопектин, по-видимому, состоит из пескольких цепочек пектиновой кислоты, соединенных кальцием. Пектиновые вещества и гемицеллюлоза образуют трехмерную сетку.
В белке клеточных оболочек, получившем название экстепсипа, содержится имппокислота оксипролип. Именно белок придает матриксу оболочки определенную структуру и аластнчпость. Не все пространство между фибриллами целлюлозы занято матриксом. Остаются промежутки, заполненные водок, которые составляют так называемое свободное пространство клетки и представляют собой единую систему (все промежутки соединены друг с другом).
Толщина клеточной стенки колеблется у разных видов растений от десятых долей до 10 мкм. В первичной оболочке каждой клетки имеются топкие участки — первичные норовые поля, через которые обычно проходят плазмодесмы — цитоплазматические нити, обрам-леппые мембраной (плазмалеммой). На каждые 100 мкм2 клеточной оболочки имеется примерно 10—30 плазмодесм диаметром 0,2 мкм (рис. 4). Благодаря плазмодесмам протоплазма всех клеток объединена в единое целое — симпласт.
Между клеточными оболочками двух соседних клеток в местах их соприкосновения имеется так называемая срединная пластинка; в со-
став срединной пластинки входят пектиновые вещества, главным образом в виде пектатов квльция (кальциевая соль пектпповой кислоты). Эти вещества как бы цементируют, склеивают растущие клетки. При недостатке кальция пектиновые вещества превращаются в слизь, наблюдается ослизнение ткани и клетки разъединяются (мацерация ткани).
При созревании плодов пектиновые вещества срединных пластинок, склеивающие клетки, переходят в растворимую форму и благодаря этому плоды становятся мягкими.
Клеточная оболочка образуется при делении клеток. Она способна к эластическому (обратимому) растяжению. Эластическое растяжение происходит под влиянием развивающегося в плетке давления воды (тургорного давления). Макрофибриллы (рис. 5) целлюлозы не связаны между собой и скреплены только матриксом. Огги скользят друт около друга, клеточная оболочка становится тоньше, и это определяет ее эластичность. Пластическое необратимое растяжение — это собственно рост клеточной оболочки.
Клеточная оболочка способна к утолщению и видоизменению. JB результате этого образуется-ее вторичная структура. Утолщение оболочки происходит путей наложения новых слоев па первичпую оболочку. Ввиду того что наложение идет уже па твердую оболочку, фибриллы целлюлозы в каждом слое лежат парвллельно, а в соседних слоях — под углом друт к другу. Этим достигается значительная прочность и твердость вторичной оболочки. По мере того как число слоев фибрилл целлюлозы становится больше и толщина стенки увеличивается, она теряет эластичность и способность к росту. Во вторичной клеточной стенке содержание целлюлозы значительно вое-растает, в некоторых случаях до 60% и более. По мере дальнейшего старения клеток матрикс оболочки может заполняться различными веществами — лигнином, суберином (одревеснение или опробковение оболочки). Лигнин образуется из гемицеллюлозы п пектиновых веществ.
Клеточная оболочка легкопроницаема как для воды, таг; и для растворенных веществ. Одревеснение заметно снижает ее проницаемость, а опробковение делает ее непроницаемой, вследствие чего клетка отмирает.
Рис. 5. Электропио'-микроског1ичсск8Я фотография клеточной стопки с псупоря дочешшм расположением микрофибрилл целлюлозы к плазмодссмами.
2. ЦИТОПЛАЗМА
Химический состав цитоплазмы очень разнообразен и изменчив. Анализы показывают, что цитоплазма па 80—85% состоит из воды. Сухое вещество цитоплазмы примерно па 75% состоит из белков, простых пли сложных (нуклеопротеиды, глюкопротеиды и т. д.). Кроме того, цитоплазма содержит значительное количество жироно-добпых веществ — липидов (15—20%). Большое количество воды определяет многие свойства цитоплазмы. На каждую молекулу белка в цитоплазме приходится около 18 тыс. молекул воды-
Цитоплазма обладает высокой вязкостью. Вязкость цитоплазмы зависит от содержания воды в ней, от сил сцепления между отдельными молекулами белка, от конфигурации белковых молекул. Б зависимости от условий эти компоненты меняются и, следовательно, меняется вязкость. В среднем вязкость цитоплазмы в 18—25 раз выше вязкости воды. Вязкость цитоплазмы — важный признак, позволяющий судить о физиологическом состоянии клетки. Клетки молодых органов и тканей, как правило, обладают менее вязкой цитоплазмой. Вязкость цитоплазмы изменяется в процессе онтогенеза растительного организма, возрастая вплоть до бутонизации. В период бутонизации и цветения вязкость цитоплазмы в клетках вегетативных органов растений снижается, а после цветения снова увеличивается. Клетки генеративных органов растений отличаются обычно высокой вязкостью цитоплазмы. Понижение вязкости цитоплазмы
соответствует более интенсивному обмену, тогда как повышенная вязкость, по пе слишком высокая, коррелирует с большой устойчивостью организма против неблагоприятных условий. Особенно высокой вязкостью цитоплазмы обладают клетки покоящихся органов, например сухих семян. Повышенная и пониженная температура, низкая влажность — все это увеличивает вязкость цитоплазмы. Однако не всегда неблагоприятные условия повышают вязкость. Под действием внешних условий могут нарушаться связи между белковыми молекулами, и это уменьшает вязкость цитоплазмы. Так, анаэробные условия вызывают разрыв — S—S-мостиков в молекулах белка (присоединение водорода переводит дисульфидные группировки в сульфгидрильные), благодаря этому вязкость снижается.
Цитоплазма содержит много воды и обладает подвижностью. Ее движение зависит от температуры, от доступа кислорода. Под воздействием веществ, тормозящих дыхание, движение цитоплазмы приостанавливается, прибавление АТФ ускоряет движение. Все это приводит к выводу, что движение цитоплазмы идет с использованием энергии, выделяемой в процессе дыхания.
Важным свойством цитоплазмы является эластичность. Так, если в цитоплазму ввести микроскопические кусочки металла и с помощью магпита сдвинуть их, то после прекращения действия магнита они опять займут прежнее положение- Эластичность цитоплазмы доказывает, что ома обладает структурой, иначе говоря, составляющие ее молекулы расположены в пространстве определенным образом. Хотелось бы лишь заметить, что структура цитоплазмы очень мобильна. Благодаря структуре и прежде всего наличию мембрап осуществляется разделение веществ но разным участкам клетки (ком-партментализация). Отдельные химические.соединения, легко реагирующие друг с другом, могут находиться в цитоплазме одной и той же клетки и пе соприкасаться, а следовательно, не взаимодействовать. Вещества субстрата и соответствепиого фермента могут концентрироваться в определенных частях клетки, что облегчает их взаимодействие.
Для поддержания сложной структуры цитоплазмы необходима энергия. Согласно второму закону термодинамики всякая система стремится к уменьшению упорядоченности, к энтропии. Поэтому любое упорядоченное расположение молекул требует притока энергии извне.
Мембраны. Трудно переоценить значение мембран в жизни клетки и организма. Мембраны определяют возможность проникновения в клетку и в отдельные органеллы различных веществ (проницаемость) . На мембране пли даже в самих мембранах проходят важнейшие процессы жизнедеятельности (перенос электронов в дыхательной цепи, окислительное и фотосинтетическое фосфорилирование). Мембраны разделяют клетку па отдельные компаргменты (отсеки). На мембранах концентрируются, адсорбируются различные вещества и т.д.
Большинство мембран имеет сходный химический состав — это липопротеидные образования, содержащие около 60% белков и 40% 18
липидов, среди которых значительная доля принадлежит фосфолипидам. У фосфолипидов две гидроксильные группы в молекуле глицерина замещены жирными кислотами, а третья — фосфорной кислотой. К фосфорной кислоте могут быть присоединены различные соединения, чаще всего амппосппрты — этаполамнн или холин. Важнейшим свойством молекулы фосфолипидов является полярность, так как oim содержат полярпую гидрофильную головку (фосфорпая кислота, амипоспирт) п два гидрофобных углеводородных хвоста (рис. 6). От фосфолипидов во многом зависит проницаемость мембран; опи поддерживают ее структуру. Фосфолипиды влияют на активность белков-ферментов, входящих и состав мембран, изменяя их конформацию, а также создавая гидрофобную сроду, благоприятствующую их действию. Толщина мембран составляет 6—10 нм. Изучением мембран запиты многие ученью во всех странах. Тем пе менее структура мембран до настоящего времени ко может считаться раскрытой. Дело в том, что разрешающая сила электронного микроскопа недостаточна, чтобы увидеть расположение молекул внутри мембран, в связи с этим большинство гипотез о структуре мембран покоится па определенных допущениях. До недавнего времени предполагалось, что все мембраны имеют сходную структуру. Это допущение основыва-
? р
НгС—С—СНг
? "
’О— Р=о
нгс
Н3С —N-^-СНз
НэС
2
лось па том, что мембраны под электронным микроскопом имеют трехслойное строение. На основании этих данных Робертсоном с сотрудниками была предложена гипотеза элементарной мембраны. Согласно
Рис. 6. Структура фосфолипидов:
I — неполярные хвосты; 2 — полярная головка.
этой гипотезе, внутренний слой мембраны
состоит из двух рядов липидов, окруженных двумя рядами белков. В состав мембран входят полярные липиды, ориентированные определенным образом. Молекулы липидов расположены таким образом, что гидрофобные углеводородные группировки обращены друг к другу, гидрофильные направлены в сторону белков. Однако современные исследования показвли, что толщина различных мембран неодинакова. В связи с этим стало ясно, что и структура мембран может быть различна. В настоящее время имеются разнообразные модели структуры мембрап (рис. 7).
Для некоторых мембран, в частности для плазма леммы и для
з
Рис. 7. Модели структуры мембран:
I — модель двойного слоя с полхпентидпой цепью в углсводородпое фаге; S — модель двойного слоя с поллпептидной цепью, проходящей сквозь слои ивпкдов; В — глсСу-пярппя модель, в которой полхпептидпые цепи обволикшмиот липидине мицеллы.
мембран хлоропластов, запо наличие глобуляри»,1Х частиц. Методом замораин»**4’"' пня со скалыванием было н<*_ казано, что белки мембран1*1’ состоящие по преимуществу из гидрофобных аишюкш* " лот, могут находиться внутр11 двойного слоя липидов в у1 ловодородной фазе (рис. 7) -Предлагается также модел >*» согласно которой ЛПИИДП1»»** слой пе является иопреры»*-иым. Мембрана как бы прошивается белковыми молоку -ламп. Наконец, предложен4* модель, по которой мембр4* пы состоят из липопротеид пых глобул, в которых пол»* пептидные цепи обволакпн»* ют лшгвдпые мицеллы. Необ* ХОДИМ» ПОМНИТЬ, ЧТО ЛИПИД»»* различаются по размерам» конфигурации, заряду (фос--фоглмцериды, гликолипид »•* и др.). В разных мембран*«х возможно их различное сочетай®. Различны и мембран -пые белки. Вероятно, в завп-
симости от состава липидо» и белков, входящих в состажж» той или иной мембраны, характер ее структуры раз л и чен.
Исследования последим х лет выявили существенное»
различие в структуре внутренней и наружной поверхности мембран, их асимметричность. В частности, па наружной поверхности плазматической мембраны располагаются белки рецепторы тормолов, а также некоторые'белки, участвующие в транспор то веществ. Асимметричным может быть и расположение разных-лип и -дов. Именно асимметрия обусловливает то обстоятельство, что в большинстве случаев мембраны проницаемы для веществ в одном яапрах*-лении. Необходимо подчеркнуть динамичность мембран. Многие ком-поиенты могут изменять свое расположение в них. При этом миграции как белков, так и липидов может осуществляться как путем диффузии, так и активным путем, идущим с использованиям энергии. Предполагают, что молекулы некоторых белков-ферментов могут вращать—
ся в мембране и атому способствует изменение их конформации. Молекулы белков м липидов могут совершать перескок (флип-флоп) с одной стороны мембраны на другую. Этот перескок также требует обязательно затраты энергии. Обнаруженная способность к свободному передвижению в мембранах позволяет прийти к выводу о жидком состоянии мембран. Обработка мембран спиртом или хлороформом позволяет извлечь из них липиды. Если их затем снова добавить, то структура мембраны восстанавливается. Это дает основание полагать, что мембраны способны к самосборке.
Основная плазма, или гиалоплазма, представляет собой среду, в которую погружогая псе органеллы. По химическому составу это* в основном водный коллоидный раствор белнов, которые часто обладают ферментативной активностью Кроме того, в основной плазме в растворенном виде находятся различные неорганические и органические вещества, промежуточные продукты обмена. Как и всякая коллоидная система, гиалоплазма может переходить из золя в гель и обратно. Под электронным микроскопом видно, что гиалоплазма имеет зернистую, или гранулярную, структуру. По мнению А. Фрей-Вис-слинга, глобулярные белки соединяются в извитые фибриллы. Таким образом, фибриллы, пли цепочки, состоят как бы из отдельных бусинок (глобулярных белков). В образовании атих цепочек принимают участие разные связи. Это могут быть — S—S-мостики, или силы притяжения между кислотными и основными группировками в молекуле белка, гидрофобные взаимодействия и др. Переплетающиеся цепочки белков создают основу структуры гиалоплазмы. 'Кроме того, в гиалоплазме содержатся пяти PIIK. В плазме протекают многие важнейшие биохимические процессы, отсюда понятна локализация в ней многих ферментов. Гиалоплазма находится в тесном взаимодействии со всеми погруженными в нее органеллами, через нее осуществляется связь между отдельными органеллами. Гиалоплазма способна к движению.
Плазмалемма. Плазмалемма — ото поверхностная одинарная мембрапа, отграничивающая толщу цитоплазмы ст пектоцеллюлоз-пой оболочки. От свойств плазмалеммы во многом зависит характер обыска между внешней средой и клеткой. Толщина плазмалеммы около 7,5 ям. Показано, что в состав плазмалеммы входят глобулярные частицы. Возможно, входящие в состав плазмалеммы белки прерывают (пролизывают) липидный слой. Плазмалемма обладает полупроницаемостью, хотя и пе идеальной. Она хорошо проницаема для воды и значительно слабее для растворенных веществ. Через плазмалемму осуществляется избирательный активный транспорт ио-пов и некоторых других веществ. Имеются данные, что в периоды активного роста поверхность плазмалеммы становится волнистой. В процессе роста клетки происходит быстрое увеличение поверхности плазмалеммы, ее рост. Он происходит путем присоединения к ней уже сформированных участков мембрак, принадлежащих пузырькам аппарата Гольджи. Плазмалемма принимает участие в образовании клеточных оболочек. Вещества матрикса оболочки (гемицеллюлоза, пектиновые вещества) образуются аппаратом Гольджи и выделяются
через плазмалемму. Вместе с тем фибриллы целлюлозы образуются па наружной поверхности плазмалеммы. У прокариот (бактерии, сине-зеленых водорослей), которые ие имеют митохондрий, ипазмалемка может включать в себя ферменты дыхательной цепи.
Тонспласт. В молодой растительной клетке обычно имеется несколько мелких вакуолей (провакуолей). В процессе роста клетки из них образуется одна центральная вакуоль, отграниченная ет цитоплазмы одинарной мембраной — тонопластом. Тонопласт обладает меньшей проницаемостью по сравнению с плазмалеммой. Во многих случаях вещества, проникающие через плазмалемму, не проникают через тонопласт и пе попадают в вакуоль. Тонопласт, по-видимому» возникает из мембран эндоплазматической сети.
Эндоплазматическая сеть (эндоплазматический ретикулум) — это сложная система каналов (рис. 8), окруженных мембранами, пронизывающая всю толщу цитоплазмы. Каналы имеют расширения — цистерны, которые могут обособляться в более крупные пузырьки и далее сливаться в вакуоли. Каналы и цистерны эндоплазматической сети заполнены электроннопрозрачной жидкостью — энхилемой, содержащей растворимые белки и другие соединения. К мембране шдоплазматической сети могут быть прикреплены особые рибонук-геопротеидные частицы — рибосомы. Благодаря этому поверхность мембран становится шероховатой. Такие мембраны посят название гранулярных в отличие ст гладких — агранулярных.
Мембраны эндоплазматической сети связаны с мембраной ядра-Иыеются данные, что эндоплазматическая сеть возникает благодаря выростам, образующимся па наружной ядерпой мембране, Каналы эндоплазматической сети соединены с перинуклеарным пространством: (менаду ядерныыи мембранами). Все это указывает па важией-
Рис. 8. Шероховатый эндоплазматический ретикулум с прикрепленными рибосомами в меаофйлле листа (увел. 60000) (по fl. В. Парамоновой}:
1 — эндоплазматический ретикулум; е— хлоропласт.
шуго роль эндоплазматической сети в осуществлении взаимосвязи между разными частями клетки. Не исключено, что каналы эндоплазматической сети проходят через плазмодесмы и осуществляют связь и между отдельными клетками.
Физиологическое значеппе эндоплазматической сети многообразно. Каналы эндоплазматической сети могут использоваться для внутри- и межклеточного транспорта различных веществ. Образовавшиеся па рибосомах белки могут проникать в эпхилему, заполняющую каналы. Благодаря этому белки транспортируются внутри клетки и также между
клетками. Мембраны эндоплазматической сети разделяют клетку па отдельные отсеки (компартмепты) п тем самым предупреждают случайные взаимодействия веществ.
Эндоплазматическая сеть очепь лабильна, ола может возникать я разрушаться. В молодых, только что образовавшихся клетках эндоплазматическая сеть развита слабо. Сильное развитие эндоплазматической сети наблюдается в клетках в период их интенсивного роста.
Аппарат Гольджи представляет собой стопки цистерн, окруженных мембранами (рис. 9). Кроме цистерн, имеется ряд сферических пузырьков. Цистерны (уплощенные мешочки, окруженные мембранами) получили название дпктносом. Аппарат Гольджи имеет два копца, два полюса. На одном полюсе, формирующем, образуются новые -цистерны. На втором полюсе, секретирующем, происходит образование пузырьков. И тот и другой процесс происходит непрерывно; по мере того как одна цистерна образует пузырьки и, таким образом, расформировывается, ее место занимает другая цистерна- Расстояние между отдельными цистернами постоянно (20— 25 пм).
Одна из основных функций аппарата Гольджи — его участие в формировании плазмалеммы и клеточной оболочки. Одновременно цистерны аппарата Гольджи, по-вндпмому, могут служить для удаления некоторых веществ, выработанных плеткой.
Рибосомы — это компактные рибопуклеопротсидпые частицы, лишенные мембран, размером 10X15 пм, состоящие пз белка и особого типа рибонуклеиновой кислоты — рибосомальной (р-РНК). В каждой клетке несколько десятков тысяч рибосом. Оли расположены не только в цитоплазме, по и в ядре, в митохондриях, в пластидах, т. е. повсеместно. Функцией рибосом является синтез белка.
Рибосомы состоят из двух субъединиц: одна большая — 50S (14— 45 пм) и другая малая — 30S (7—9 пм). В большую субъединицу входит одна высокомолекулярная РНК и кизкомолекулярная. Низкомолекулярная содержит всего 120 нуклеотидов. В малую субъединицу входит одна молекула высокомолекулярной РНК. В состав рибосом входит также несколько десятков разных молекул белка. РНК и белки объединены в рибосомах в нуклеопротеидный тяж. Рибосомальная РНК представляет одинарную цепочку нуклеотидов. Однако в результате взаимодействия между отдельными звеньями цепочка частично спирализована. Спирализованные участки составляют
примерно 70% ст всей длины цепочки, они непостоянны, возникают и ралрушаются. Малый размер рибосом не позволяет рассмотреть их внутреннюю упаковку даже с помощью электронного микроскопа, поэтому нашп представления основаны преимущественно па косвенных данных. Предполагают, что тяж РНК определенным образом свернут п по песппрализоваппым участкам с ним взаимодействуют молекулы белка. В основном свявь между молекулами РНК и белками осуществляется с помощью иона Mg. Двухвалентные катионы магния и кальция обеспечивают также ассоциацию субъединиц рибосом.
Образование рабосом вдет путем самосборки. Работами А. С. Спирина показана возможность частичной реконструкции рибосомальных частиц из составляющих их РНК и белка. Составные части рибосом образуются в ядре. Так, р-РНК синтезируется в ядре, используя в качестве матрицы ядерную ДНК, а рибосомальные белки синтезируются в ядрышке. Синтез р-РНК и рибосомального белка строго скоординирован, благодаря чему в клетке никогда пе образуется избыточного количества этих соединений.
В дифференцированной клетке большинство рибосом прикреплено к поверхности мембран андоплазматической сети и образуют как бы цепочки—полисомы. Это позволяет одновременно синтезировать несколько десятков молекул одного и того же белка.
Лизосомы — органеллы диаметром около 2 мкм — окружены мембраной, возникшей из мембран эндоплазматической сети пли аппарата Гольджи. Внутренняя полость ливосом заполнена жидкостью — эпхилемой, в которой содержатся ферменты, главным образом гидролитические. Ферменты, катализирующие процессы распада, сосредоточенные в лизосомах, благодаря мембране оказываются изолированными от остального содержимого клетки. Это имеет большое значение, так как предупреждает распад веществ, в частности белков, находящихся вне лизосом. Вместе с тем в лизосомах может происходить разрушение чужеродных веществ, попавших в клетку.
Пероксисомы. Окруженные мембраной пузырьки сферической формы, более мелкие, чем лизосомы. Их диаметр равен 0,5—1,5 мкм. В пероксисомах содержится ряд окислительных ферментов (каталаза, гликолатоксидаза) и осуществляется окисление различных соединений с образованием перекиси. Именно в пероксисомах осуществляется процесс фотодыхания.
Микротрубочки. Цитоплазма большинства клеток содержит микротрубочки. Диаметр микротрубочки 20—25 нм, толщина степок 5—8 нм, а диаметр канала 10 нм. Предполагают, что степ ни микротрубочек состоят не цепочеи глобулярных белков тубулинов. Микротрубочки могут разрушаться и снова возникать. Важнейшая функция микротрубочек — участие в различного рода перемещениях. В частности, с микротрубочками связало движение цитоплазмы. Однако механизм действия микротрубочек неясен. Предполагается участие микротрубочек в синтезе клеточных степок.
3. МИТОХОНДРИИ
Митохондрии — «силовые» стапцин клетки, в них локализована большая часть реакций дыхания (аэробная фаза). В митохондриях происходит аккумуляция анергии дыхания в адепозпп-трпфосфате (АТФ). Энергия, запасаемая В АТФ, служит ОСНОВНЫМ источником для физиологической деятельности клетки. Мптохопдрпп обычно имеют уд-лгатеипуто палочковидную форму длиной 4—7 нкм и диаметром 0,5—2 мкм (рис. 1.0). Число митохондрий в клетке может быть различным, от 500 до 2000. Химический состав митохондрий несколько колеблется. Однако в основном это белковолипоидпие оргапеллы. Содержание белка в ппх составляет 60— 65%. В состав меибрап митохондрий входят 50% структурных белков и 50%
ферментативных. Около 30% липидов. Очень важно, что мнтохоод-рип содержат пуклекповые кислоты: РНК — 1% и ДИК — 0,5%. В митохондриях имеется пе только ДИК, по п вся система синтеза белка, в том числе и рибосомы. Свойства митохондрий (белки, структура) закодированы частично в ДНК митохондрий, а частично в ядре. Сопоставление размеров митохондриальной ДНК с числом и размером митохондриальных белков показывает, что в ней заложено информации мепыпе, чем для половины белков. Это и позволяет считать митохондрии полуавтодомпыми, т. е. не полностью зависящими ет ядра.
Митохолдрим окружены двойной мембраной. Толщина мембран составляет 6—10 им. Между мембранами — иеримптохопдриальное пространство, равное 10 им; оно заполнено жидкостью типа сыворотки. Внутреннее пространство митохондрий заполняет матрикс в виде студнеобразной полужидкой массы. Внутренняя ыеибрана даот выросты— кристы, расположенные перпендикулярно продольной оси оргапеллы и перегораживающие все внутреннее пространство митохондрий па отдельные отсеки (рис. 11.). Однако, поскольку выросты-перегородки пе полные, между этими отсеками сохраняется связь. Мембраны митохондрий обладают большой прочностью и гибкостью. Наружная мембрана характеризуется более высокой проницаемостью, особенно для большинства низкомолекулярных веществ. На внутренней поверхности внутренней мембраны митохондрий расположены грибовидные частицы. Опп расположены через правильные промежутки. Частицы состоят из головки диаметром 8—10 нм, короткого стержня (5 им) и базальной пластинки. Можно считать, что внутренняя мембрапа образована этими базальными пластинками. Каждая нитохопдрия содержит 104—1.05 таких грибовидных частиц.
3
Рис, 11. Схема строения митохондрии:
I — наружная мембрана; я — внутренняя мембрана; S — матрикс.
Митохондрии способны к движению. Это имеет большое значение в жизни клетки, так как митохондрии передвигаются к тем мес-' там, где идет усиленное потребление энергии. Они могут ассоциировать друг с другом как путем тесного сближения, так и при помощи связующих тяжей. Наблюдаются также контакты митохондрий с эндоплазматической сетью, ядром, хлоропластами.
Б митохондриях локализованы многочисленные дыхательные ферменты. Часть из этих ферментов находится в матриксе, а часть локализована в мембранах. В растущих клетках митохондриальный матрикс становится менее плотным, количество крист растет — это коррелирует с увеличением интенсивности дыхания. Известно, что митохондрии способны к набуханию и при потере воды — к сокращению. В процессе дыхания ультраструктура митохондрий меняется. Б том случае, если в митохондриях протекает активный процесс преобразования ввергни окисления в энергию АТФ, внутренняя часть митохондрий становится более компактной.
Митохондрии имеют свой онтогенез. В меристематических клетках можно наблюдать инициальные частицы, которые представляют собой округлые образования, окруженные двойной мембраной. Диаметр таких инициальных частиц составляет 50 нм. По мере роста клетки инициальные частицы увеличиваются в размере, удлиняются, и их внутренняя мембрана образует выросты, перпендикулярные оси митохондрий. Вначале образуются нромитохондрнп. Они еще не достигают окончательного размера п имеют мало крист. Из промито-хондрпй образуются митохондрии. Сформировавшиеся митохондрии делятся путем перетяжки или почкованием.
До спх пор не решен вопрос, возникают ли митохондрии de novo или они только размножаются. Не исключено, что в оплодотворенной яйцеклетке митохондрии образуются de novo. Вместе с тем, в дальнейшем они размножаются путем деления или почкования.
Широко обсуждается также вопрос, как рассматривать митохондрии и хлоропласты с эволюционной точки зрения. Еще в 1921 г. рус-
2G
ский ботаник Б. М. Козо-Поляиский высказал мнение, что клетка — это симбиотрофная система, в которой сожительствует несколько ор-ганизмол. В настоящее время эта гипотеза имеет много сторонников. Согласно гипотезе симбиогеяеза, митохондрии — это в прошлом самостоятельные организмы. На определенном этапе эволюции они внедрились в примитивную содержащую ядро клетку. Оказалось, что ДНК митохондрий и хлоропластов по своей структуре резко отличается ст ядерпей ДНК высших растении и сходна с бактериальной ДНК (кольцевое строение). Сходство обнаруживается и в величине рибосом. Однако доказательств еще недостаточно и окончательного вывода по этому вопросу пока сделать невозможно.
4. ВАКУОЛЬ
Вакуоль — это полость, заполненная клеточным соком и окруженная мембраной (тонопластом). В образовании вакуолей участвуют цистерны эндоплазматической сети. Вакуоль содержит ияеточ-пый сок, в котором растворены соли, органические кислоты, сахара и другие соединения. В связи с этим она играет важную роль в осмотических процессах поступления воды и поддержания тургора клет-кл. Вакуоли — это место, где могут аккумулироваться и сохраняться питательные вещества, если в даппый момент клетка в них не нуждается. В вакуоль также экскретируются различные клеточные отбросы, которые затем могут там перерабатываться и обезвреживаться при участии ферментов.
5. ЯДРО
Ядро открыто Брауном в 1831 г. В ядре сосредоточена большая часть наследственного материала. Лишение клетки ядра приводит к тому, что она перестает делиться и расти. В основе деления клетки лежит деление ядра. Обычно в клетке одно ядро. Однако бывают и мпогоядерпые клетки. Диаметр ядра колеблется от 5 до 20 мкм; благодаря относительно большому размеру ядро хорошо видно в световой микроскоп. Это сферическое тело, окруженное оболочкой. Расположение ядра в клетке непостоянно. В молодой растительной клетке чаще всего ядро расположено ближе к ее центру. Химический состав ядра представлен главным образом белками п нуклеиновыми кислотами. Изолированные ядра клеток гороха содержат дезоксирибонуклеиновой кислоты (ДНК) 14%, РНК—12%, основных белков — 22,6%, прочих белков — 51,3%.
Ядерная оболочка состоит из двух мембран толщиной около 7 нм каждая и разделенных между собой перинуклеарным пространством шириной 20—30 пм. Внешняя мембрана па поверхности имеет сложную складчатую структуру, местами соединенную с эндоплазматической сетью. На внешней мембране расположено большое количество рибосом. Внутренняя мембрана может давать впячпвання. Перинуклеарное пространство заполтгеио жидкостью типа сыворотки — эп-хилемой. Ядерпая оболочка имеет поры. На 1 мкм2 ядерпой оболочки
насчитывается от 10 до 100 пор диаметром около 20 пм. Поры — сложное образование; они имеют форму часового стекла, которое окружено как бы ободком. Ободок, по-видимому, состоит из отдельных гранул. В центре поры расположена центральная гранула, соединенная нитями с гранулами ободка. Поры ядра — динамичные образования, они могут открываться и закрываться- Таким путем может осуществляться регуляция обмена между ядром и цитоплазмой. Внутреннее строение ядра меняется в зависимости ст его состояния. Различают два периода жизни ядра: метаболический (между делениями) и период деления. В метаболический период илтерфазное ядро заполнено ядерпым соком — нуклеоплазмой-—п переплетенными скрученными хроматиновыми нитями. Кроме нитей, в ядре можно наблюдать глыбин хроматина. Хроматиновые нити состоят пз ДПК и белков, гистоновых п пегметоповых, небольшого количества РНК и липидов. Белки реагируют с ДПК, образуя дезоксипуклеопротеиды (ДНП). Возможно, что не всл ДНК хроматина связана с белками. В интерфазпом ядре имеется также одно или несколько сферических гранул-ядрышек. Вещество ядрышка состоит из сильно переплетенных нитей — нуклеопемы — и содержит около 80 % белка, 10—15% РНК и некоторое количество ДНК. В ядрышке имеются рпбосомы. Осповпея функция ядрышка состоит в том, что в нем синтезируются ядерные балки. Возможно также, в ядрышке синтезируются и специфические рибосомальные балки. Имеются данные, что и самосборка рибосом происходит в ядрышке. Разрушение ядрышка, например, с помощью ультрафиолетового облучения приводит к тому, что ядро тернет способность переходить к делению. Вместе с тем в период самого деления ядрышко исчезает и вновь возникает к концу деления. Образование ядрышка происходит за счет веществ нуклеоплазмы в контакте с одной из хромосом (ядрышковой).
Характерной чертой метаболического периода является процесс самовоспроизведения (удвоения) молекул ДНК. Лишь после удвоения молекул ДНК ядро переходит к делению. Упорядоченное деление ядра поепт название митоза. При переходе к делению ядрышко исчезает, ядерная оболочка распадается на отдельные фрагменты, а хроматиновые нити уплотняются я образуют особые тельца — хромосомы.
Форма хромосом разнообразна и специфична для данного вида организмов. Длина хромосом достигает 20 мкм. В период профазы хромосомы состоят из двух продольных половинок — хроматид. В свою очередь, каждая хроматида состоит из нитей — хромонем, расположенных параллельно продольной оси хромосомы. Основу хро-монемных нитей составляет одна или несколько нитей ДНК, связанных' с белками. Количество нитей ДНК, а также взаиморасположение ДНК и белков в хромосомах до настоящего времени пе ясно. Хромосомы дифференцированы по длине; в отдельных участках хромосом (локусах) расположены определенные гены, несущие информацию, соответствующую образованию одного белка.
Известно, что каждый вид имеет свое постоянное число хромосом. Так, диплоидный набср хромосом для риса равен 14, фасоли — 22, 28
кукурузы — 20. В настоящее время не вызывает сомнения, что в передаче наследственных свойств от материнской клетки к дочерней основная роль принадлежит хромосомам. Сущность митоза п заключается в равномерном распределении наследственного вещества между Двумя образовавшимися клетками.
МОЛЕКУЛЯРНЫЕ ОСНОВЫ ХРАНЕНИЯ И РЕАЛИЗАЦИИ НАСЛЕДСТВЕННОЙ
ИНФОРМАЦИИ
Раскрытие роли ДНК в передаче наследственных свойств представляется одним из основных достижений современной биологии. Перечислим основные факты, подтверждающие, что именно это соединение является носителем наследственной информации. 1. Содержание ДНК во всех соматических клеткал данного организма одинаково. В половых клетках содержание ДНК в два раза мепыпе, чем в соматических. 2. Большая часть ДНК содержится в ядре и локализована в хромосомах. 3. ДНК представляет собой очень устойчивое соединение. Вместе с тем воздействия, которые вызывают изменения в структуре ДНК (некоторые химические вещества, облучение и др.), изменяют наследуемые признаки организма. 4. ДНК —единственное из известных веществ, способное к самовоспроизведению. 5. Каждый вид организмов имеет свою специфичную ДПК. 6. ДНК ответственна за изменение (трансформацию) организмов. Это было доказано Эвери (1944) па эксперименте с двумя формами бактерий (пневмококков). Одна из пих обладала способностью образовывать капсулу и вызывать заболевание. Вторая форма пе образовывала капсулы и пе вызывала заболевания. Оказалось, что после проникновения ДНК, выделенной из вирулентных (вызывающих заболевание) клеток, некоторое количество клеток невирулептпой формы образовало капсулу, причем эта способность передавалась по наследству. Естественно, па целых организмах высших растепли такие опыты провести сложнее. Имеются лишь единичные результаты. Так была взята чистая линия растения петульн с цветками белого цвета. Это был мутапт, потерявший способность образовывать аптоциаи. Проростки этого растения обработали ДНК, выделенной из растения с краслыми цветками. Некоторые из обработанных растений приобрели способность к образованию антоциана. Цветки оказались розовыми, и эта способность передавалась ио наследству. Опыты с высшими организмами единичны, однако сам факт возможности трансформации организмов с помощью чужеродной ДЙК пе вызывает сомнений.
Все укаааипыс исследования полностью доказали уникальную роль ДЙК в передаче наследственных свойств. Параду с ядериой имеется цитоплазматическая наследственность, которая связана с ДНК, локализованной в органеллах. Однако механизм цитоплазматической наследственности изучен еще очень слабо. Количество ДНК в ядре во много раз превышает количество цитоплазматической ДНК.
ДНК — это полимер, мономерами которого являются дезоксири-бонуклеотпды. В их состав входят углевод дезоксирибоза, фосфорная кислота и азотистое основания четырех типов: два пуриновых — аденин и гуанин и два пиримидиновых — тимин и цитозин.
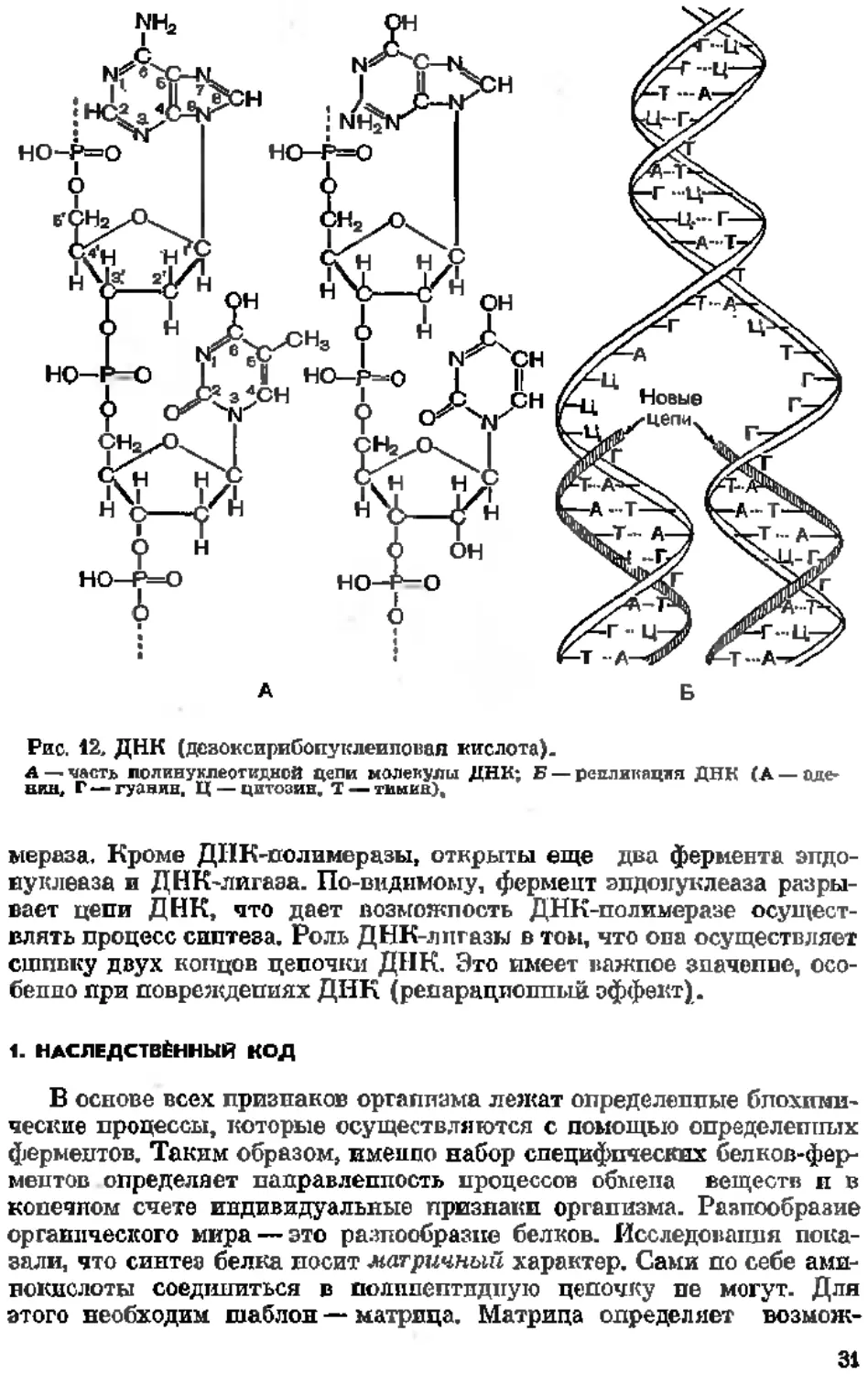
Приблизительные определения показывают, что молекулярная масса ДНК достигает величины 10®—10а,т.е. около 100 млн. Основные представления о структуре ДНК были сформулированы в 1953 г. Уотсоном и Криком. Молекула ДПК состоит из двух полинуклеотид-пых цепочек, скрепленных между собой водородными связями. Каркас полинуклеотидных цепочек, входящих в состав ДНК, представляет чередование дезоксирибозы и фосфорной кислоты. Азотистые основания, противостоящие друг другу в полинуклеотидных цепочках, парны, или комплементарны. Пуриновому основанию соответствует пиримидиновое, аденппу— тпмив, гуапииу — цптозип. Менаду аденином и тимлпом образуются две, а менаду гуанином и цитозином три водородные связи. Таким обравом, две волинуклеотидные цепочки, входящие в состав ДНК, соответственны, или комплементарны, Друг Другу, число пуриновых оснований равно числу пиримидиновых (правило Чаргаффа). У каяедой цепочки молекулы ДНК имеются два конца: одип конец заканчивается пятым, а другой — третьим углеродным атомами пентозы(они обозначаются 3'- и 5'-конец). Цепочки, составляющие молекулы ДНК, антипараллельиы. В одной цепочке нуклеотиды связаны в направлении 5Z3Z, а в другой — 3'5'. Полину-клеотидные цепочки имеют общую ось и обравуют двойную спираль. Каждый виток спирали включает 10 пар азотистых оснований. Шаг спирали составляет 3,4 пм, ширина спирали —- 2 нм, длила спирали — несколько десятков тысяч нанометров. Специфичность ДНК определяется последовательностью азотистых оснований в ее цепочке. Рассмотренная модель позволяет объяснить важнейшее свойство ДНК — способность к самовоспроизведению. Опыты Месельсопа и Сталя (1958) показали, что самовоспроизведение ДНК происходит полукопсервативиым способом. В этих опытах несколько поколений бактерий кишечной палочки (Escherichia coli) выращивали на среде, содержащей меченый азот (I5N). Через несколько поколаний- ДНК, входящей в состав клеток бактерий, содержала этот изотоп. Включение ,EN в ДНК повысило ее плотность (тяжелея ДНК). Клетки, содержащие тяжелую ДНК, помещали па среду, включающую ,4N. После удвоения клеток, т. е. в первом поколениии, вся выделенная ДНК оказалась полутяжелой (одна половина содержала ,6N, а другая половина MN). На основании этого была создана схема воспроизведения ДНК, согласно которой в определенный момент жизни клетки цепочки ДНК расходятся и ка каждой материнской, как на матрице, из веществ клетки строится соответственная (комплементарная) дочерняя цепочка (рис. 12). Образование полинуклеотидных цепочек ДНК происходит из трифосфонуклестпдов, находящихся в нуклеоплазме ядра. Поскольку вновь образованная цепочка ДНК связывается ДНК-матрицей, реакция практически осуществляется лишь в направлении синтеза. Синтез ДНК идет ет 5'—>3Z- концу и катализируется специальными ферментами. Главнейший из них ДНК-поли-
зе
Рис, 12. ДНК (дезоксирибопуклеиповая кислота).
А — честь лолинуклеотидиой цепи молекулы ДНК; Б — репликация ДНК (А — аденин, Г — гуавяв, Ц — цитозин, Т — тииив).
мераза. Кроме ДИК-полимеразы, открыты еще два фермента эндонуклеаза и ДНК-лигаэа. По-видимому, фермент эндонуклеаза разрывает цепи ДНК, что дает возможность ДНК-полимеразе осуществлять процесс синтеза. Роль ДНК-лпгазы в том, что опа осуществляет сшивку двух концов цепочки ДНК. Это имеет важное значение, особенно при повреждениях ДНК (репарационный эффект).
1. НАСЛЕДСТВЕННЫЙ КОД
В основе всех признаков организма лежат определенные биохимические процессы, которые осуществляются с помощью определенных ферментов. Таким образом, пмеипо набор специфических белков-ферментов определяет направленность процессов обмена веществ и в конечном счете индивидуальные признаки организма. Разнообразие органического мира — это разнообразно белков. Исследования показали, что синтез белка иосит матричный характер. Сами по себе аминокислоты соединиться в полипептпдпую цепочку пе могут. Для этого необходим шаблон — матрица. Матрица определяет возмож-
31
Первые нуклеотид кодона Второй нуклеотид кодона Третий иуклеотяд кодона
У УУУ1 УУЦ) УУА1 УУГ1 фен лей УЦУ УЦЦ УПА УЦГ сер J®- УГГ три У ц А Г
Ц ЦУУ ЦУЦ ЦУА ЦУГ лей ЦЦУ ццц ЦЦА ццг про »» Йаг} ЦГУ) ЦГЦ1 ЦГА |®₽г цгг J У ц А Г
А АУУ1 АУЦ АУА) АУГ ялей мет АНУ АЦЦ АЦА АЦГ тре ла- ААгга«р У ц А
Г ГУУ ГУЦ ГУА ГУГ вал ГЦУ1 гцц ГЦА гцг ала йй«» ггу] и™ ггг J У а
Рис. 13. Генетический код (А —аденип, Г — гуанин, У — урацил, Ц — цито-8ИВ).
поегь создания полипептидной цепочки, а также ее специфичность (последовательность аминокислот). Матрицей для синтеза белка служит нуклеиновая кислота. Последовательность аминокислот в белке (а следовательно, его специфика) определяется последовательностью азотистых оснований в пуклеиновой кислоте (матрице). Нирелберг и Маттеи (1961) выделили из клеток фракцию рибосом и в бесклеточной системе в присутствии ферментов, нуклеиновой кислоты и набора аминокислот осуществили синтез белка. При этом была взята полиурациловая РНК, содержащая в качестве азотистого основания только один урацил. Оказалось, что. несмотря ва присутствие в среде 20 аминокислот, синтезированная полипептидная цепочка состояла из повторяющихся остатков лишь одной из них, а именно фенилаланина. Таким образом, повторяющаяся последовательность азотистого основания урацила кодирует аминокислоту фенииалании. Отсюда было сделано заключение, что порядок оснований в нуклеиновой кислоте определяет порядок аминокислот в белке. Из поколения в поколение передается план построения белковых молекул, который записан в молекулах ДНК. Однако разнообразие ДНК определяется последова-32
тельпостыо четырех азотистых оснований, тогда таи разнообразие белка — последовательностью 20 аминокислот. Следовательно, запись информации о построении белковых молекул должна быть каким-то образом закодирована в молекулах ДНК. Действительно, генетическая информация записаиа в химическом коде, составленном из четырех букв. Роль этого кода в том, что он определяет особую структуру белков, специфических для Данного организма.
Исследования Крика показали, что наследственный код триплетный. В опытах, проведенных на бактериофаге воздействием различных химических веществ вызывалось выпадение нуклеотидов в молекуле ДИК. Оказалось, что при выпадении одного или двух нуклеотидов образуются белки с нарушенной последовательностью аминокислот по всей длине иолилептидиой цепочки. При выпадении трех нуклеотидов нарушения происходят только непосредственно в поврежденной зове, а далее последовательность аминокислот сохраняется. Следовательно, каждая аминокислота кодируется определенной последовательностью из трех азотистых оснований. Генетический код обладает еще рядом свойств: он пе перекрывающийся — каждый триплет следует один за другим, между триплетами пет промежутков (запятых), одна аминокислота может иодироваться несколькими триплетами (вырожденный). Последнее попятно, так как всего из четырех азотистых оснований по три можпо составить 64 комбинации, а аминокислот, входящих в состав белков (протеииогепных), всего 20. Вместе с тем одни и тот же триплет не может кодировать две разные аминокислоты. Было расшифровано большинство триплетов, или кодонов (рис. 13).
2. БИОСИНТЕЗ БЕЛКА
Белки — полимеры, мопомерами которых служат аминокислоты. Белки представляют собой цепочки остатков аминокислот, соединенных между собой пептидными связями. Иолипептцдиые цепочки состоят из повторяющихся елементов—СН—СО—НН—СН—СО—НН—.
R, R2
При атом к группировкам СН присоединяются радикалы. Получается как бы цепочка с радикалами различной длины. Белки содержат от 100 до 300 тыс. аминокислотных остатков. Молекулярная масса белков колеблется от 17 тыс. до 10 млн. Разнообразие белков определяется различной последовательностью аминокислотных остатков. Расчеты показывают, что из 20 аминокислот, входящих в состав белковой молекулы, можно составить примерно 2-101в комбинаций.
Белки, так же как составляющие их аминокислоты, — амфотерные соединения. Каждый белок имеет свою изоэлектрическую точку— зпачепие pH, при которой молекулы белка заряда не имеют. В зависимости от характера составляющих белой аминокислот изоэлектрическая точка белков различна. Молекула белка имеет первичную, вторичную, третичную и четвертичную структуру. Первпч-2—773 33
пая структура'—ато определенная последовательность аминокислотных остатков в белковой молекуле.
Между аминокислотами, входящими в полвпептидную цепочку, возможны различные взаимодействия: водородные связи между группами НН одной аминокислоты и СО другой, ван-дер-ваальсовы связи и др. Благодаря этому полипептидная цепочка приобретает особенное расположение в ирострапотве, особую конформацию (вторичная структура). Л. Поллинт и Р. Кори (1951) установили, что наиболее распространенной конформацией является а-ышраль. Оказалось, что шаг спирали равен 0,54 пм. Отдельные витки спирали стабилизированы водородными связями, диаметр спирали равен 1,05 пм. На каждый оборот спирали приходится 3,6 аминокислотных остатков. Спира лизованные участки в полипептидпой цепочке могут чередоваться с песпирализованными. а-спираль — ке единственная форма поли-пептидной цепи, которая встречается в природе. Некоторые белковые молекулы имеют форму p-спирали, в атом случае полипептидные цепочки свернуты как бы в виде гармоники. По конформации полипеп-тидной цепи различают фибриллярные и глобулярные белки. Фибриллярные белки сохраняют вытянутую форму а- и p-спирали. Однако большинство белков-ферментов имеет глобулярную форму. У таких белков а-спираль свернута в определенную глобулу. Форма свертывания спирали в глобулу представляет собой третичную структуру белка. Третичная структура поддерживается, кроме водородных связей, гидрофобными взаимодействиями, а также дисульфидными связями. возникающими между двумя сульфгидрильными (SH) группами. Белки могут состоять иа нескольких полипептидпых цепочек, их взаимное расположение представляет собой четвертичную структуру.
Белки отличаются исключительной реакционной способностью, они могут реагировать с самыми различными органическими и пеор-ганическими соединениями и с отдельными ионами. Важнейшая функция белков заключается в том, что многие из них обладают каталитическими свойствами. Все ферменты — это белки. Белки входят в состав мембран. Основное вещество цитоплазмы — это коллоидный раствор белка. Белки входят в состав клеточных стенок. Растительный организм использует белки и как запасное питательное вещество.
План построения белка зашифрован в ДНК и находится в ядре. Между тем сам процесс осуществляется на рибосомах, которые в основном расположены в цитоплазме. Молекулы ДНК слишком велики и через поры ядра выйти не могут. Передача информации от ДНК осуществляется с помощью информационной РНК (и-РНК). Показано, что в определенные моменты жизни клетки двойная спираль ДНК раскручивается и на оголенной нити ДНК, как на матрице, строится молекула и-РНК. Процесс этот получил название транскрипции, т. е. переписывания. В результате процесса транскрипции образуется РНК комплементарная, т. е. соответственная той цепочке ДНК, на которой оиа строится. Так, если в молекуле ДНК имеется азотистое основание гуанин, то в РНК — цитозин, и наоборот. В ДНК комплементарной парой является аденин — тимин. Одвако в составе 34
РНК тимин заменяется урацилом. Поэтому если в молекуле ДНК имеется азотистое основание аденин, то в молекуле РНК напротив аденина будет урацил. In vitro обе цепочки ДНК могут служить матрицей для построения РНК. Вместе с тем in vivo (в клетке) молекула и-РНК может строиться только на одной из двух цепочек ДНК.
Образование РНК на ДНК-матрице идет с помощью специального фермента — ДНК зависимой РНК-полимеразы. ДНК зависимая РНК-полимераза выделена и из клеток высших растений, в частности из проростков гороха и кукурузы. РНК-полимераза как бы считывает генетическую информацию и переводит ее на язык РНК. и-РНК представляет собой относительно короткие цепочки. Эти цепочки соединяются с белком и в таком виде (информосомы) через поры ядра поступают в цитоплазму и переносят информацию для синтеза белка.
Затем и-РНК высвобождается из информосомы и одноцепочечпая неспирализованная молекула прикрепляется к малой субъединице рибосомы, к тому ее участку, который примыкает к большой субъединице. При атом в каждый момент к рибосоме прикрепляется небольшой участок цепи и-РНК, содержащий один кодон. Таким образом, первый этап синтеза белка заключается в образовании комплекса между и-РНК и рибосомой.
Перепое аминокислот к рибосомам осуществляется с помощью транспортных РНК (т-РНК). В состав белков входит 20 аминокислот, каждой аминокислоте соответствует своя т-РНК, которая имеет сравнительно низкую молекулярную массу (25—30 тыс.), состоит из 70— 30 нуклеотидов.
Благодаря определенному расположению комплементарных нуклеотидов полинуклеотидпая цепочка т-РНК свернута в виде клеверного листа (рис. 14). Каждая т-РНК имеет двойную специфичность. Опа песет специфичный триплет (антикодон), ответственный аа прикрепление к определенному месту и-РНК (кодону). Вместе с тем т-РНК специфична по отношению к ферментам (амипоацилсин-тетазам), ответственным за их взаимодействие с определенной аминокислотой. В свою очередь, аминоацилсинтетаза (или кодаза) также имеет двойную специфичность. Каждой аминоацилсинтетазе соответствуют своя т-РНК и своя аминокислота.
Для того чтобы аминокислота вошла в состав полипептидной цепочки белка, нужна энергия. Активация, или обогащение энергией, аминокислоты (ЛК) происходит за счет ее реакции с АТФ: АК+АТФ= АК~АМФ+2Фп. Реакция идет при участии фермента аминоацилсиптетазы. Образовавшийся аминоациладенилат остается связанным с ферментом и далее вступает в реакцию с т-РНК, при этом образуется амипоацил-т-РНК:
АК ~ АМФ 4- т-РНК АК ~ т-РНК 4- АМФ амипоацил- амиаоаиил- адеяозия-
адваилат я-РНК иоаофосфат
Таким образом, аминоацилсиптетазы осуществляют оба этапа активации аминокислот: взаимодействие аминокислоты с АТФ и затем ее перенос па нолекуку т-РНК.
3S
Pirc. 14. Структура валиновой т-РНК.
т-РНК с висящей на ней аминокислотой с помощью антикодона присоединяется к кодоиу и-РНК па малой субъединице рибосомы (рис. 15).
После образования тройного комплекса рибосомы п-РНК — т-РНК — АК начинается процесс трансляции, или «перевода», нуклеотидной последовательности молекулы РНК в последовательность аминокислот белковой молекулы. Синтез белка начинается с определенного триплета (кодона)—АУГ, которому соответствует определенная аминокислота (процесс инициации). Инициаторной аминокислотой па Eschrichia coli является формилметиоиии (ф-мет):
СНз—SCHs—СНа—СН—N—Н—СООН Из-за формилпрования аминной группы эта аминокислота не может занимать место в середине полипептидной цепочки, а только в начале ее. т-РНК несет антикодон УАЦ. После того как инициаторная аминокислота (АК1)ф-иет с© своей т-PHKi вошла в малую субъединицу, происходит смыкание последней с большей субъединицей. После смыкания субъединиц Т-PHKi вместе с AKi переносится па большую субъединицу. Одно-
SB
iiju-Mfunu и-I’llli 1Н-[и-М1-1Цается_ш1 один кпдан. В результате в малую суГп.гД1ШИНУ нхолнт г-HMJ к»пшй кодон, кодирующий другую .амино-кш'.юту — Л1м«. К атому кодону г иомшцью антикодона присоединя-(чч-и komii.h,i;i‘ ч I’lHis <• Albin- В риГккчшс оказываются две аминокислоты. ирнснт^тяннме друг окна» друга таким образом, что карбок-си.1ьк«н группа норной «мишжпслоты (формилметиопвиа) оказывается рядом с ампиогруиион innpiiii аминокислоты. В результате сбли-женяя .«тих групп карникгил формнлмстпопина отщепляется от
г«. is. с««.й»»-™ «=w'-
т-РНКф-мет и реагирует с аминогруппой второй аминокислоты, при этом образуется пептидная связь. Образовавшийся дипептид присоединен к т-РНК?. Транспортная РНКф-не» высвобождается и уходит в цитоплазму. В результате дипептид с соответствующей т-РНК? оказывается связанным с большой субъединицей, а и-РНК перемещается еще на один триплет. Присоединение аминокислотных остатков (элонгация) повторяется многократно, пока не образуется полипеп-тидиая цепочка (белок). Окончание образования полипептвдной цепочки (терминация) связано с тем, что в малую субъединицу вступает бессмысленный кодон. Образовавшаяся полипептидная цепочка покидает рибосому. После завершения синтеза белка инициаторная аминокислота отщепляется с помощью специального фермента.
Показано, что цепочка и-РНК может нести информацию о нескольких молекулах белка. Участок и-РНК, несущий информацию для одного белка, носит название цистропа. Таким образом, и-РНК может быть полицистронной. Большое значение имеет объединение рибосомы в цепочки — полисомы. В этом случае одна молекула и-РНК может последовательно присоединяться к ним и служить матрицей для синтеза нескольких одинаковых молекул белка. Когда синтез белка закончен, и-РНК распадается.
Поскольку синтез белковой молекулы идет с большой скоростью — от нескольких секунд до одной минуты, время жизни и-РНК очень невелико. Правда, на определенных фазах развития растений синтезируются так называемые долгоживущие молекулы и-РНК. Так, например, они имеются в семенах. При набухании и прораотании семян новообразование белков-фермептов может идти с использованием этой предобразованной и-РНК.
Таким образом, в жизни клетки важнейшее значение имеет триада ДНК — РНК — белок. Надо сиазать, что у ряда организмов (вирусы, некоторые бактерии) наследственную информацию несет РНК, а не ДНК. Наконец, есть вирусы, у которых имеется обратная последовательность: па молекуле РНК строится ДНК, которая переносит информацию. Процесс носит назвавие обратной транскрипции.
Подводя итоги, можно сказать: из поколения в поколение каждого организма передаются специфические молекулы ДНК, которые несут в себе план построения белковых молекул. План построения белка записан в ДНК с помощью кода, представленного чередованием азотистых оснований. Участок ДНК, в котором закодирована информация для построения одного белка, иосит название ген. Геном — это сочетание всех генов организма. ДНК в процессе эволюции может претерпевать случайные изменения. Среди этих изменений, которые передаются по наследству, могут возникать полезные, дающие организмам преимущество в борьбе за существование. Эти изменения сохраняются естественным отбором. Новые номбинации, новые сочетания генов, новый геном создается также в процессе скрещивания. Наследственная информация реализуется путем образования белков, специфичных для каждого организма.
3. ОБМЕН ВЕЩЕСТВ.
ОСОБЕННОСТИ РЕГУЛЯЦИИ СИНТЕЗА БЕЛКА В КЛЕТКЕ
В основе специфических свойств каждой клетки, каждого организма, которые передаются по наследству, лежит специфика обмена веществ. Обмен веществ-—это совокупность всех происходящих в организме химических процессов. Химические реакции, составляющие обмен веществ, тесно взаимосвязаны п согласованы друг с другом. Обмен веществ внутри клетки тесно взаимосвязан со средой. Из внешней среды поступают вещества, пеобходимые для жизнедеятельности организма, и определенные вещества выделяются организмом в среду. Условия среды (температура, елажность, освещение), в которых осуществляется жизнедеятельность организма, оказывают глубокое влияние на скорость и направленность обмена. Организм обладает способностью регулировать обмен веществ.
Даже поверхностное рассмотрение особенностей химических процессов в живой клетке позволяет заметить, что оки протекают с огромной скоростью. И все оки являются каталитическими и осуществляются благодаря присутствию биологических катализаторов — ферментов.
Для осуществления химических реакций необходимо, чтобы молекулы были в активном состоянии. В самом общем виде катализаторы, повышая активиость реагирующих молекул, как бы снижают силы химического сопротивления. Вместе с тем катализаторы ке могут вызвать реакцию, которая в их отсутствии пе идет, они ускоряют лишь реакции, которые термодинамически осуществимы. Многие ферменты ускоряют реакции в 109—10’* раз.
По химической природе все ферменты — простые или сложные белки. Ферменты, состоящие только из белка, называют однокомпо-иентпыми. Ферменты, состоящие из белка и небелковой части,— двухкомпонентпыми. Небелковый компонент, прочно связанный, называют простетической труппой; слабо связанный, обслуживающий несколько ферментов, — коферментом. Часто кофермент соединяется с соответствующим белком только в иернод реакции. Состав простатических групп или коферментов разнообразен. Во многих случаях это витамины или их производные, в частности производные витаминов Bj, Bj, Вб, никотиновой кислоты и др. В простетическую группу ряда ферментов входят металлы (железо, медь, цинк). Металлы могут входить в состав простетических групп в виде особых соединений, например железо в соединении с 4 пиррольными группировками (ге-миновоз железо). Важнейшим свойством ферментов является их специфичность. Еще в 1911 г. крупный немецкий химик Эмиль Фишер выдвинул положение, что фермент должен подходить к субстрату, как «ключ к замку». Однако это положение оказывается справедливым пе всегда. Во многих случаях пространственное соответствие молекулы фермента и субстрата возникает в процессе их взаимодействия. Ферменты — ато не только патализаторы, по и регуляторы процессов обмена. В клетке содержатся сотни соединений и должны бы происходить бесчисленные реакции. Однако число реакций огра-
пичивается, поскольку специфичность ферментов позволяет различать определенные молекулы. Каждым организм имеет свой набор ферментов, обусловленный его наследственной основой.
Действие фермента проходит в несколько стадий. Начальной стадией является образование комплекса фермента с субстратом. При этом между ферментом и субстратом возникают связи разного характера (водородные, вая-дер-ваальсовы и др.). Образование фермент-субстратного комплекса требует высокой специфичности фермента. Как правило, молекула субстрата очень мала по сравнению с молекулой фермента. Поэтому при образовании фермеат-субстратного комплекса участвует лишь незначительная часть молекулы фермента, его активный центр. Активный центр — это совокупность функциональных групп, принимающих непосредственное участие в ферментативной реакции.
Образование фермент-субстратного комплекса вызывает переход субстрата в более реактивное состояние, его активацию. Известно, что при любом химичесном взаимодействии вступают в реакцию только те молекулы, которые обладают избытком энергии. Число столкновений между молекулами, приводящее к химическому взаимодей-.твию (число эффективных столкновений), составляет лишь некоторую долю (иногда очень малую) общего числа столкновений. Эффек-•ивпыми олазываются лишь столкновения между молекулами, которые в этот момент обладают некоторым избытком внутренней энергии по сравнению со средней (для данной температуры) величиной. Эпергия, которую необходимо придать молекулам вещества А для превращения их в В сверх той средней, которую молекулы А уже содержат, называют энергией активации. В самом общем виде фермент благодаря созданию фермент-субстратного комплекса проводит
Рис. 16. Вяергетичесцая схема векатализируемой (Л) и катализируемой (15) реакции.
Рис. 17. Схематическая иллюстраций напряжения ковалентной связи в фер-мент-субстратном комплексе (эффект с дыбы»).
реакцию обходным путем и тем самым снижает энергию активации или снижает энергетический барьер (рис. 16).
Можно привести следующие примеры. Энергия активации для процесса разложения сахарозы па мопосахара составляет в отсутствии фермента 107 520 Дж/моль, а в присутствии фермента инвертазы — 38 480 Дж/моль. Энергия активации гидролиза белка с помощью кислоты составляет 840000 кДж/моль, а при ферментном разложении — всего 5040 кДж/моль.
Повышение реакционной способности молекул или снижение анергии активации, по-видимому, для разных реакций проходит неодинаковыми путями. Точный механизм катализа для отдельных реакций до сих пор ле ясен. Вероятно, существуют разные возможности. Прежде всего фермент может связывать субстрат в напряженной конфигурации. Так, если функциональные группы фермента расположены таким образом, что после связывания две части молекулы субстрата А—В удерживаются несколько дальше друг от друга, чем тогда, когда оки находились в свободном состоянии, то в результате растяжения связь в молекуле А—-В легче поддается разрыву (эффект «дыбы»). Одновременно присоединяется молекула воды. Именно таким путем со-, вершается ферментативный распад (гидролиз) многих органических соединений. Реакция может идти и в обратном направлении. В атом случае вещества А и В, присоединяясь к активному центру фермента, сближаются и молекула воды как бы выжимается, образуется соединение АВ (рис. 17). Приведенная схема является несколько упрощенной. В более общем виде можно сказать, что при образовании фермент-субстратных комплексов происходит определенная ориентация молекул: илп сближение реагирующих молекул, пли создание напряженных слязей. Все это делает молекулы более реакционноспособными Продукты реакции отделяются от фермента, и молекулы фермента регенерируют в прежнем виде. Именно благодаря этой последней особенности одна в та же молекула фермента может катализировать большой объем превращений. Таким обравом, можно отметить следующие три фазы действия фермента: 1) образование фсрмент-субстратного комплекса; 2) преобразование промежуточного соединения в одни или несколько активных комплексов; 3) выделение продуктов реакции и регенерация молекулы фермента.
Ферменты проявляют свою активность при выделении из клетки. Однако в клетке их действие может отличаться от действия вне клет-
ин. Ферменты могут быть локализованы в определенных частях клетки, вплетены в мембраны, пространственно разделены или, наоборот, объединены с субстратом. Все это накладывает большой отпечаток на их работу.
Разнообразие ферментов в клетке чрезвычайно велико, однако все их можно разделить на шесть классов: 1) оксидоредуктазы — катализирующие окислительно-восстановительные реакции; 2) трансферазы — катализирующие перенос целых атомных группировок от одного соединения к другому; 3) гидролазы — осуществляющие распад различных органических соединений с участием воды (гидролиз); 4) лиазы — катализирующие присоединения какой-либо атомной группировки к органическим соединениям или отцепляющие от субстратов определенную группу без участия воды; 5) изомеразы — катализирующие превращение одних изомеров в другие; 6) лигазы, или синтетазы, — катализирующие синтез органических соединений, происходящий при участии АТФ (с использованием энергии этого соединения).
Один и тот же фермент может существовать в разных формах. Белки-ферменты, катализирующие одну и ту же реакцию, встречающиеся у одного вида организмов, но различающиеся по ряду физико-химических свойств (внутренней локализации, электрофоретической подвижности), называют изоферментами. Они различаются по реакции на внешние условия; их максимальная активность проявляется в различных условиях температуры и pH. По-видимому, наличие изоферментов позволяет организмам лучше приспосабливаться к меняющимся условиям среды.
Скорость и направленность ферментативных реакций клетки зависят от следующих причин: 1) условий, в которых протекает ферментативная реакция; 2) активности действующего фермента; 3) количества белка-фермента. Остановимся коротко на каждой из этих причин.
1. Как всякая химическая реакция, ферментативные реакции зависят от температуры. Влияние температуры на тот или иной процесс принято оценивать величиной температурного коэффициента. Температурный ковффициент фо показывает, во сколько раз данный 'роцесс ускоряется при повышении температуры па 10°С. Qto фер-септативных реакций довольно высок, однако еп пе остается постоянным. Температурные оптимумы также различаются для разных ферментов и даже для одного и того же фермента. По данным советского физиолога Б. А Рубина, один и тот же фермент, выделенный из растений в разное время года (ранней весной, летом и осенью), будет по-разному реагировать на повышение температуры. Ферменты, выделенные из растения в весенний период, будут иметь более низкий температурный оптимум но сравнению с ферментами, выделенными в летний период.
Поскольку ферменты являются белками, то повышение температуры свыше 35—40°С вызывает их частичную инактивацию, а дальнейшее повышение температуры приводит уже к необратимому их повреждению.
Большое значение для протекания ферментативной реакции имеет pH среды. У каждого фермента свой оптимум pH, при котором лучше всего проявляется его активность. Отклонение pH в сторону большей кислотности или большей щелочности приводит к снижению активности фермента. Это связано с тем, что в большинстве случаев функциональные группы белка-фермента, составляющие его активный центр, ионизированы и их заряд зависит от pH, а от заряда зависит возможность образования фермент-субстратного комплекса. Часто даже один и тот же фермент, выделенный из разных растений, имеет неодинаковое оптимальное значение pH.
2. Ферменты обладают весьма динамической структурой. Вместе с тем активность фермента, его способность оказывать каталитическое действие во многом определяются его конфигурацией, его формой. Это связано с тем, что фермент, а главное, группы, входящие в его активный центр, должны быть расположены так, чтобы они могли взаимодействовать с субстратом. Изменение вторичной в третичной структуры (конформации) белка-фермента под влиянием какого-либо агента носит название аллостерического эффекта.
Благодаря аллостерическим изменениям фермент может потерять активность или приобрести ее. Изменение конфигурации фермента происходит под влиянием веществ разного происхождения. В частности, это может быть конечный продукт данной реакции, который, накапливаясь, вызывает ее замедление.
3. Все клетки данного организма имеют идентичную ДНК, поэтому все клетки обладают одинаковым геномом. Иначе говоря, все клетки одного организма обладают способностью синтезировать одинаковые белки-ферменты и имеют равные потенциальные возможности. Вместе с тем разные клетки одного организма сильно различаются по форме и функциям (например, клетки листа или корня, клетки флозмы или камбия и т. д.). В процессе роста и развития происходит дифференциация клеток.
Следовательно, различные клетки данного организма, особенно специализированные, должны различаться по содержанию белков-ферментов. Экспериментальных доказательств этого положения пе много, так как чрезвычайно трудно выделить все ферменты из разных типов клеток. Интересные данные в этом отношении получены для корневых волосков. Показано, что корневые волоски образуются укороченными клетками, которые отличаются высоким содержанием фермента — кислой фосфотазой. Рядом расположенные клетки, не содержащие этого фермента, корневых волосков не образуют.
Одним из основных регуляторных механизмов, определяющих ту или иную специализацию клетки, должен быть механизм регуляции образования белков-ферментов. Регуляция образования белков-ферментов часто лежит и в основе приспособления организма к среде. Среда топко регулирует клеточный обмен. Известно, что достаточно прибавить определенное вещество в среду, где культивируются одноклеточные организмы, и у них появляются соответствующие ферменты. Такое явление называют индуцированным синтезом ферментов. Следовательно, способность к синтезу данного фермента
Олерон
Рис. 18. Схема регуляции синтеза белка.
была заложена в клетке, по она не проявлялась. Было показало, что в норме дрожжевые клетки пе используют лактозу. Однако если в среду, па которой выращивают дрожжи, добавить лактозу, клетки . приобретают способность синтезировать фермент галактозидазу и сбраживать этот сахар. Можно привести обратный пример, когда присутствие определенного вещества тормовит образование ферментов, катализирующих его синтез. Так, тифозная палочка в присутствии триптофана не способна к синтезу этой аминокислоты. Однако в среде, лишенной триптофана, в клетках атого микроорганизма появляется фермент триптофапсинтетаза. В клетках корня высших растений появляется фермент, восстанавливающий нитраты (нитретредуктаза) только в случае их присутствия в среде.
Регуляция синтеза белков-фермептов может происходить разными путями. Работами Жакоба и Mono установлено, что в клетке наряду со структурными генами, которые определяют структуру белка, имеются гены-регуляторы, которые ответственны за активацию или дезактивацию работы структурных генов. Предложенная Жакобом и Mono схема регуляции синтеза белка представлена на рисунке 18. Согласно этой схеме гены-регуляторы пространственно отделены от структурных генов и вырабатывают и-РНК, на которой, как на матрице, синтезируются определенные белки (репрессоры). Эти белки-репрессоры могут присоединяться к участием молекулы ДНК, носящим название операторов. В результате на определенном отрезке, включающем, как правило, несколько генов, молекула ДНК перестает раскручиваться, а следовательно, па пей невовможно образование соответствующих и-РНК. Участок ДНК, работа которого регулируется одним оператором, носит название одерона.
Важно отметить, что существуют низкомолекулярные вещества дерепрессоры или эффекторы, которые связывают белки-репрессоры, тем самым репрессия снимается и па ДНК-матрице образуется и-РНК, индуцируется синтез соответствующих белков-ферментов. В качестве эффекторов могут выступать или вещества, поступающие из внешней среды, или вещества, образующиеся в самом организме (какие-то метаболиты). Для высших животных и растений это могут быть гормоны (см. ниже). Схема Жакоба и Моно оказалась способной объяснить многие явления. Действительно, гены могут находиться в двух формах: активной и репрессированной. В специализированных клетках лишь от 5 до 20% ДНК служит основой для транскрипции, остальное количество ДНК репрессировано. Активность гепбма может регулироваться и внешними условиями. Схема Жакоба и Mono разработана для прокариот. У высших организмов гепбм значительно сложнее п регуляция его актпвпостп также более сложна и значительно менее изучена. К этому вопросу мы еще вернемся в разделе роста и развития растений.
Регуляция образования белков-ферментов может осуществляться пе только благодаря непосредственному влиянию репрессоров на молекулы ДНК. Интересны исследования, показывающие, что под влиянием различных воздействий меняется активность РНК-полимера-зы — фермента, катализирующего образование и-РНК на ДНК-матрице. Изменение активности этого фермента может оказать влияние на скорость процесса транскрипции. Следующим регуляторным механизмом может быть степень выхода уже образованных и-РНК из ядра. В случае, если под влиянием определенных воздействий поры в оболочке ядра закрываются, это может тормозить или даже прекращать выход и-РНК из ядра в цитоплазму, что, естественно, приостанавливает синтез белков-ферыептов. Как уже упоминалось, и-РНК поступает из ядра в цитоплазму и виде так называемых нп-форыосом, в которых опа связана с белком. Для того чтобы служить матрицей, и-РНК должна освободиться от окружающего ее белка. По-видимому, и этот процесс может меняться в зависимости от условий (регуляции па уровне трансляции). Наконец, количество образовавшихся идентичных белков может регулироваться путем изменения времени жпзпи и-РНК. Рассмотренные примеры показывают различные возможности регуляции новообразования белков-ферментов. Благодаря этой регуляции организм может приспосабливаться к различным условиям среды. В основе изменений обмена, происходящих под влиянием внешних воздействий, лежит прежде всего изменение направленности и скорости ферментативных реакций. Регуляция образования и активности белков-ферментов лежит также в основе процессов дифференциации.
В заключение важно подчеркнуть, что клетка имеет сложную организацию. В отдельных её комнартмептах осуществляются специфические взаимосвязанные физиолого-биохимические процессы. Взаимосвязь проявляется особенно хорошо па синтезе бвлка, Информация для этого процесса хранится в ядре, энергия поставляется митохондриями, материел образуется в цитоплазме, сам процесс происко-
дит на рибосомах. Синтез белка — это также пример регулируемого процесса.
Клетка, как и организм в целом, может существовать только при непрерывном обмене с внешней средой. Перейдем к рассмотрению закономерностей поступления в клетку воды и питательных веществ.
ПОСТУПЛЕНИЕ ВОДЫ В РАСТИТЕЛЬНУЮ КЛЕТКУ
Для осуществления всех процессов жизнедеятельности в клетку из внешней среды должны поступать вода и питательные вещества. Вода прямо или косвенно участвует во всех реакциях обмена. Вода является важнейшей составной частью растительной клетки.
1. ДИФФУЗИЯ и осмос
Прежде чем перейти к изучению поступления веды, остановимся на рассмотрении некоторых общих закономерностей.
Как известно, при температуре выше абсолютного 0°С все молекулы находятся в постоянном беспорядочном движении. Это показывает, что оки обладают определенной кинетической энергией. Благодаря постоянному движению при смешении двух жидкостей или двух газов их молекулы равномерно распределяются по всему доступному объему. Диффузия — это процесс, ведущий к равномерному распределению молекул растворепвюго вещества и растворителя. Диффузия всегда папраалепа от большей концентрации данного вещества к меньшей, от системы, обладающей большей свободной энергией, к системе с меньшей свободной энергией. Свободной энергией называется часть внутренней энергии системы, которая может быть превращена в работу. Свободная энергия, отнесенная к 1 моль вещества, носит название химического потенциала. Таким образом, химический потенциан — это мера энергии, которую данное вещество использует па реакции или движение. Чем выше концентрация данного вещества, тем выше его активность и его химический потенциал. Вследствие этого передвижение вещества идет от большего к мепьшему химиче-слому потенциалу. Наибольший химический потенциал у чистой воды. Добавление к воде молекул растворенного вещества уменьшает ее активность, ее свободную энергию, ее химический потенциал. Для воды вводится понятие водного потенциала. Водный потенциал (ф) —это способность воды в данной системе (в клетке) совершать работу по сравнению с той работой, которую совершала бы чистая вода. Когда система или клетка находится в равновесии с чистой водой, ее водный потенциал равен 0.
Б том случае, если диффундирующие вещества встречают на своем пути мембрану, движение замедляется, а в некоторых случаях прекращается. Диффузия воды по направлению от большего к меньшему водному потенциалу через мембрану носит название осмоса. Иначе говоря, осмос—это диффузия воды или другого растворителя 46
через полупроницаемую перепонку, вызванная разностью концентраций.
Идеальная полупроницаемая мембрана пропускает молекулы воды и не пропускает молекулы растворенного вещества. В 1877 г. немецкий физиолог Пфеффер приготовил искусственную полупроницаемую мембрану. Для этого в пористый фарфоровый сосуд валивали раствор медного купороса и помещали в другой сосуд, в свою очередь заполненный раствором ферроцианида калия. В порах первого фарфорового сосуда растворы соприкасались и реагировали друг с другом. В результате в порах образовалась пленка из ферроцианида меди (GuaFe (CN) 6), которая обладала полупроницаемостью. Таким образом была создана как бы модель клетки: полупроницаемая пленка имитировала цитоплазму, а стенки сосуда — пектоцеллюлозпую оболочку. Сосуд, в порах которого образовалась полупроницаемая мембрана, ваполиепный раствором сахарозы, помещали в воду. Присоединяя к сосуду манометр, измеряли силу давления, с которой вода поступала в раствор.
Таким образом, поступление воды в раствор через полупроницаемую перегородку обусловливается разностью между свободной анергией чистой воды п раствора и происходит по градиенту свободной энергии воды или по градиенту водного потенциала. Движение молекул воды в раствор можно приостановить, приложив к раствору определенное внешнее давление. Осмотическое давление раствора равно тому давлению, которое надо приложить к системе, чтобы предотвратить поступление в пее воды.
Пфеффер, измеряя осмотическое давление разных растворов, установил, что его величина зависит от концентрации. Изучение свойств растворов крупным физико-химиком Вапт-Гоффом показало, что осмотическое давление подчиняется законам, установленным для газов, прежде всего закону Бойля-Мариотта. Иначе говоря, осмотическое давление прямо пропорционально молярной концентрации раствора. Эквимолярные растворы педпссоциирующих веществ являются изоосмотическими или изотопическими, т. е. имеют одинаковое осмотическое давление. Согласно правилу Авогадро, раствор грамм-молекулы педиссоциироваппого вещества имеет осмотическое давление, равное 2,24 МПа. Осмотическое давление подчиняется также закону Гей-Люссака, т. е. возрастает с повышением температуры. Наконец, величина осмотического давления может быть вычислена в атмосферах по формуле Клапейрона p=RTC, где R — гавовая постоянная, равкая 0,8821, У — абсолютная температура (в °C) в. С — концентрация в молях).
Говоря об осмотическом давлении, надо помнить, что оно проявляется не всеща, а только в системе раствор — растворитель полупроницаемая перегородка. Раствор, помещенный в стакан, пе проявляет осмотического давления. Он имеет осмотический показатель, который проявляется лишь в определенных условиях.
2. КЛЕТКА КАК ОСМОТИЧЕСКАЯ СИСТЕМА
Растительная клетка представляет собой осмотическую систему. Пектоцеллюлозпая оболочка хорошо проницаема как для воды, так и для растворенных веществ. Однако плазмалемма и токопласт обладают полупроницаемостью, пропускают воду и слабопроницаемы, а в некоторых случаях совсем непроницаемы для растворенных веществ. В этом можно убедиться, рассмотрев явления плазмолиза и тургора. Если поместить клетку в раствор более высокой концентрации, чем в клетке, то под микроскопом видно, что протоплазма отстает от клеточной оболочки. Это особенно хорошо проявляется ка клетках с окрашенным клеточным соком. Клеточный сок остается внутри вакуоли, а между протоплазмой и оболочкой образуется пространство, заполненное внешним раствором. Явление отставания протоплазмы от клеточной оболочки получило название плазмолиза. Плазмолиз проислодит в результате того, что под влиянием концентрированного внешнего раствора вода выходит из клетки, тогда как растворенные вещества остаются в клетке. При помещении клеток в чистую воду или в слабо концентрированный раствор, вода поступает в клетку. Количестве воды в клетке увеличивается, объем вакуоли возрастает, клеточный сок давнт па цитоплазму и прижимает ее к клеточной оболочке. Под влиянием внутреннего давления клеточная оболочка растягивается, в результате клетка переходит в напряженное состояние (тургор).
Наблюдения за явлениями плазмолиза и тургора позволяют изучить многие свойства клетки. Явление плазмолиза показывает, что клетка жива и протоплазма сохранила полупроницаемость. По скорости и форме плазмолиза можно судить о вязкости протоплазмы (см. выше). Наконец, явление плазмолиза позволяет определить величину осмотического давления (плазмолитический метод). Этот метод основан на подборе иаоосмотического, пли изотонического, раствора, т. о. раствора, имеющего осмотическое давление, равное осмотическому давлению клеточного сока. Окружающий раствор, который вызывает плазмолиз данной клетки, а следовательно имеет более высокое осмотическое давление, называется гипертоническим. Раствор, при котором в клетке начался плазмолиз, имеет осмотическое давление, примерно равное осмотическому давлению клетки. Зпая концентрацию этого наружного раствора в молях, можно по формуле (см. с. 47) вычислить его осмотическое давление, а следовательно, осмотическое давление клетки. Необходимо учесть, что эта формула справедлива, если для определения осмотического давления был взят раствор неэлектролита, например сахарозы. В том случае, когда для определения осмотического давления берется раствор влектролита, капример какой-либо соли, в формулу определения осмотического давления необходимо ваодить дополнительный изотопический коэффициент (f). Это связапо с тем, что осмотическое давление пропорционально числу частиц, находящихся в определенном объеме раствора. При диссоциации число частиц, естественно, возрастает, сле-48
довательно, в этом случае осмотическое давление пужпо рассчитывать по формуле p=RTCi.
Определение осмотического давления может быть осповапо и па прямом определении концентрации клеточного сока. В большинстве случаев при етом клеточный сок выжимается. Наиболее точно концентрация клеточного сока может быть определена криоскопическим методом по понижению его точки замерзания пли по повышению точки кипения. Известно, что если к воде прибавить некоторое количество растворимых веществ, то давление ее паров уменьшается. Чем ниже давление пара воды, тем ниже точка замерзания и выше точка кипения раствора. Молярный раствор педиссоциированпого вещества снижает точку замерзания на 1,86°С.
Определение величины осмотического давления имеет большое значение, в частности, для экологических исследований. В известной мере величина осмотического давления позволяет судить о способности растения поглощать воду из почвы и удерживать ее, несмотря на иссушающее действие атмосферы. Осмотическое давление колеблется в широких пределах от 0,1 да 20,0 МПа. Осмотическое давление около 0,1 МПа наблюдается у водных растений. Осмотическое давление, равное 20,0 МПа, обнаружено у выжатого сока галофпта Atrip-lex Confertifolia. В 1 л сова этого растения содержится 67,33 г хлоридов. У большинства растений средней полосы осмотическое давление колеблется от 0,5 до 3 МПа. Вместе с тем необходимо отметить, что факторы, действующие па изменение осмотического давления, чрезвычайно разнообразны. Даже соседние, рядом расположенные клетки могут отличаться по величине осмотического давления. Обычно величина осмотического давления больше у мелких клеток по сравпепшо с крупными. Установлены определенные градиенты осмотического давления в пределах одном ткани. Так, в тканях стебля осмотическое давление возрастает от периферии к центру и от основания к верхушке. В корне осмотическое давление, наоборот, постепенно снижается от основания к верхушке. В проводящих элементах стебля л корня, как правило, осмотическое давление очень низкое (0,1—0,15 МПа). Сопоставление осмотического давления в разных органах показывает, что в листьях опо выше по сравнению с корнями.
Осмотическое давление различно у разных жпзпеппых форм. У древесных пород опо выше, чем у кустарников, а у кустарников выше, чем у травянистых растений. Разные экологические группы различаются по величине осмотического давления. Особенное значение имеет снабжение растений водой. У растений пустынь осмотическое давление больше, чем у степпых растений. У степных — больше, чем у луговых. Еще меньше осмотическое давление у растений болотных и водных местообитаний. У светолюбивых растений осмотическое давление больше, чем у теневыносливых.
Растение в определенной степени регулирует величину осмотического давления. Ферментативное превращение сложных нерастворимых веществ в растворимые (крахмала в сахара, белков в аминокислоты) приводит к возрастанию концентрации клеточного сока и повышению осмотического давления. Увеличенное накопление раство-
римых солей также повышает осмотическое давление. Несмотря на то что осмотическое давление меняется в зависимости от внешних условий, все же для каждого вида эти изменения происходят в своих определенных пределах. Величину осмотического давления многие физиологи считают одной из характеристик данного вида растепий.
Сосущая сила клетки. Величина осмотического давления имеет большое значение для определения силы, которая вызывает поступление воды в клетку. Одиако надо учесть, что клеточная оболочка, свободно пропуская воду и питательные вещества, обладает ограниченной растяжимостью. При поступлении в клетку воды в ией развивается гидростатическое давление, которое заставляет плазмалемму прижиматься к клеточной оболочке. Его называют тургорным давлением (Т). Клеточная оболочка растягивается и, в свою очередь, оказывает противодавление {id)‘, опо тем больше, чем больше поступает воды в клетку. Благодаря ограниченной растяжимости клеточной оболочки наступает такой момепт, когда давление оболочки целиком уравновесит силу осмотического поступления воды. При этом p—T=w. Насыщенная водой клетка находится в максимально растянутом состоянии. Однако у наземных растений такое состояние насыщенности крайпе редко. В обычных условиях осмотическое давление не уравновешено полностью противодавлением (р>ш). Это показывает, что клеточная оболочка еще пе полностью растянута и вода может поступать в клетку. Разница между осмотическим давлением клеточного сока и противодавлением клеточной оболочки определяет сосущую силу (S) — это сила, с которой клетка притягивает воду в каждый данный момепт. Имепно сосущая сила определяет поступление воды в клетку. Лишь в состоянии плазмолиза клетка всасывает воду с силой, равпой всей величине осмотического давления S=p. Это происходит потому, что в состоянии плазмолиза или завядапия вода не давит на клеточную оболочку. Тургорное давление (Г) =0 и соответствующее противодавление клеточной оболочки также равно 0. По мере поступления воды в клетку появляется тургорное давление, а следовательно, развивается и противодавление клеточной оболочки. В этом случае сосущая сила клетки будет равна разпости между осмотическим давлением и противодавлением оболочки S—p—w. Чем больше поступает воды в клетку, тем больше растет тургорное давление и противодавление оболочки. Наконец, наступает такой момепт, при котором клеточная оболочка растягивается до предела. В этом случае осмотическое давление целиком уравновешивается противодавлением оболочки p=T=w, а сосущая сила становится равной нулю.
Таким образом, клетка проявляет себя как саморегулирующаяся система. Величина сосущей силы определяется степенью насыщенности клетки: чем меньше клетка насыщена водой, тем больше ее сосущая сила. Изменения осмотических величин клетки в зависимости от ее насыщенности водой представлены на графике (рис. 19). Здесь по горизонтали отножен объем клетки, по вертикали — величина осмотического давления. В левой части графика клетка имеет наименьший объем (состояние плазмолиза). Осмотическое давление кле-50
точного сока при ятом паивысшее. сосущая сила (•$) равна всей величине осмотического давления. Тургорпое давление (21) и противодавление клеточной оболочки (и>) равны нулю. При поступлении воды в клетку объем ее возрастает. Появляется тургорпое давление и равное ему противодавление клеточной оболочки, сосущая сила уменьшается. В правой части схемы клетка занимает наибольший объем, осмотическое давление несколько умепыпается, поскольку в клеточный сок поступает вода и его концентрация снижается. Тур-горное давление и противодавление клеточпой оболочки возрастают и становятся равными всей величине осмотического давления. Сосу щая сила клетки в состоянии наивысшего тургора равна пулю. В не которых случаях сосущая сила может быть больше осмотического давления. Это проявляется при завядаиии клетки, тогда вся клетка уменьшается в объеме, цитоплазма ве отстает от оболочки, клеточная оболочка прогибается внутрь. Это явлешгс называется питор-ризом.
Как уже упоминалось с термодинамической точки зрения, направление движения воды определяется величиной водного потенциала (•фв). Когда данная система (клетка) находится в равновесии с чистой водой, то ее водный потенциал (фв) будет равен С.
Присутствие растворимых веществ в водном растворе или в клетке уменьшает концентрацию воды, снижает ее активность. По мере увеличения количества растворенных веществ водный потенциал (•фв) становится все более отрицательным. Когда па водный раствор действует давление (в случае клетки противодавление оболочки),
молекулы воды сближаются друг с другом и это приводит к увеличению энергии системы, к возрастанию активности воды. Водный потенциал клетки при этом возрастает. Таким образом клетки зависит прежде всего от концентрации осмотически действующих веществ — осмотического потенциала (фосы), который всегда отрицателен, и от потенциала давления (фд), в большинстве случаев положительного. Сказанное можно выразить следующим образом: —фв = — —фыли+фд. В состоянии полного тургора -фв=0, в состоянии плазмолиза фв = ФоСМ-
Следовательно, водный потенциал — это и есть сила, которая вызывает поступление воды в клетку при данных условиях, по величине он равен сосущей силе, но противоположен ей по знаку. В етой связи направление движения воды определяется нарастанием сосущем силы пли увеличением отрицательного водного потенциала.
Таким образом, энергетическое состояние воды, способность совершать работу и ее подвижность определяются водным потенциалом. Водный потенциал чистой воды приравнивается к пулю- Всякое присутствие растворенных веществ в клеточпом соке уменьшает способность воды производить работу. Водным потенциал клеточного сока всегда меньше потенциала чистом воды. При этом вода передвигается в сторону меныпего (более отрицательного) водного потенциала. Тургорное дааленпе увеличивает водный потенциал внутри клетки и при максимальном растяжении клеточпом оболочки делает его равным пулю (как в чистой воде), вода перестает поступать в клетку.
Говоря о поступлении воды в клетку, надо учитывать, что наряду с осмотическим давлением в клетках существует давление набухания. Давление набухания связано со способностью гидрофильных коллоидов притягивать к себе молекулы воды. Сила, с которой коллоиды притягивают воду, и представляет собой давление пабухапия. Хорошо известно, что если сухие семена положить в воду, то они будут всасывать воду и увеличатся в размере. Сила пабухапия у сухих семяп достигает 100 МПа. Большое значение давление набухания имеет пе только для семяп, по и для молодых меристематических клеток, в которых отсутствуют вакуоли и которые заполнены коллоидным веществом.
Наконец, имеется мнение, что наряду с осмотическим давлелием и давлением пабухапия существует еще активное поступление воды в клетки. Оно связано с затратой эпергип и идет против градиента свободной энергии воды в системе или против градиента химического потенциала.
Основанием к предположению о существовании активного поступления послужили опыты английского ученого Бенпет-Кларка. Было установлено, что у клеток, помещенных в раствор, концентрация которого была значительно выше концентрации клеточного сока, плазмолиз не обнаруживался. На этом основании бьшо установлено, что протоплазма активно секретирует определенное количество воды в вакуоль (против градиента концентрации).
Важно отметить, что поступление воды в клетку уменьшается при недостатке кислорода или введения дыхательных ядов (динитрофено
ла, цианистых соедипепнй), т. е. во всех тех случаях, когда заторможены процессы обмена. Это тоже может служить доказательством наличия активного поступления воды в клетку. Возможным механизмом является влектроосмос. Секреция воды является следствием разности электрштеских потенциалов, возникающих с наружной и внутренней стороны мембраны (тонопласта). Возможно, что движение воды может быть вызвано пакоплеппем катионов (К+, Na+), которое, в свою очередь, происходит под влиянием разности электрических потенциалов. Может иметь значение также заглатывали© воды клеткой в процессе пипоцитоэа.
ПОСТУПЛЕНИЕ ИОНОВ В РАСТИТЕЛЬНУЮ
КЛЕТКУ
Из внешней среды в клетку растения непрерывно поступают питательные соли. Это естественный процесс, без которого жизнедеятельность клетки была бы невозможна. Причем клетка осуществляет поглощение, несмотря на ограниченную проницаемость плазмалеммы, о чем говорит явление плазмолиза. Живая клетка в высокой степени обладает’способностью к избирательному накоплению питательных веществ. Явление избирательного накопления отдельных элементов хорошо вндпо из таблицы 1.
Таблица 1
Поступление ионов в растительную клетку
Нлеиент Содержание ионон, в миллиэквипалептах
порскан иода сок иалоиии
Хлор Натрии Калии 0,580 0,498 0,012 0,597 0,090 0,500
Рассмотрение приведенных данных показывает, что содержание солей в одноклеточной водоросли и в окружающей ее морской воде резко различно. Клетка накапливает калий в концентрации, превышающей его содержание в морской воде в десятки раз. Вместе с тем морская вода содержит зпачптельпо большее количество натрия по сравнению с клеткой. Таким образом, клетка, несмотря ка наличие полупроницаемой мембраны, обладает способностью к избирательному накоплению растворенных веществ.
На протяжении истории физиологии растений учеными были созданы многочисленные теории отпоентельио механизмов проникновения растворенных веществ в клетку. Многие из этих теорий оказались несостоятельными, в частности, в силу того, что под проникновением веществ в клетку понималось их поступление в клеточный сок.
В настоящее время пе вызывает сомнений, что поступление солей происходит в виде ионов и проходит несколько этапов. Питательные вещества могут поступать и накапливаться в клеточной оболочке, протоплазме, вакуоли. Особенно важным этапом является поступление веществ в цитоплазму. Экспериментально показано, что питательные вещества могут поступать в цитоплазму и не проникать в вакуоль. Это хорошо видно из опытов советского ученого Н. Г. Холодного по влиянию солей на форму плазмолиза. В растворах разных солей форма плазмолиза различна. Кальций повышает вязкость протоплазмы, и, как следствие, форма плазмолиза в растворах его солей вогпутая. Калий снижает вязкость — форма плазмолиза выпуклая. Изменение вязкости протоплазмы свидетельствует о том, что попы проникли в нее. Вместе с тем наличие плазмолиза показывает, что в вакуоль соли если и пропик та, то в малой степени.
1. ПАССИВНОЕ И АКТИВНОЕ ПОСТУПЛЕНИЯ
Поглощение питательных веществ клеткой, может быть пассивным и активным. Пассивное поглощение — ато поглощение, пе требующее затраты внергии. Оно связало с процессом диффузии и идет по градиенту концентрации данного вещества. Как уже рассматривалось ныше( см. с. 46), с термодинамической точки зрения направление диффузии определяется химическим потенциалом вещества. Чем выше концентрация вещества, тем выше его химический потенциал. Передвижение идет в сторону меньшего химического потенциала. Необходимо отметить, что направление движения ионов определяется не только химическим, но также электрическим потенциалом. Ионы, обладающие разноименным зарядом, могут диффундировать через мембрану с разпой скоростью. Благодаря этому создается разность потенциалов, которая, в слою очередь, может служить движущей силой поступления противоположно заряженного иона. Электрический потенциал может также возникать в результате неравномерного распределения зарядов в самой мембране. Таким образом, пассивное передвижение попов может идти по градиенту химического и электрического потенциала.
Наряду с пассивным имеет место активиый транспорт ионов в клетку, т. е. с ватратой энергии, выделяющейся в процессе метаболизма. Имеется ряд доказательств существования активного транспорта ионов. В частности, это опыты по влиянию внешних условий. Так, оказалось, что поступление ионов зависит от температуры. В определенных пределах с повышением температуры скорость поглощения веществ Клеткой возрастает. В отсутствии кислорода, в атмосфере азота, поступление иопов pe3ico тормозится и может даже наблюдаться выход солей из клеток корпя каружу. Под влиянием дыхательных ядов, таких, как KCN, СО, поступление ионов также затормаживается. С другой стороны, увеличение содержания АТФ усиливает процесс поглощения. Все это указывает на то, что между поглощением солей и дыханием существует тесная связь. Многие исследователи приходят к выводу о тесной взаимосвязи между поглощением солей
и синтезом белка. Так, хлорамфеникол— специфический ингибитор синтеза белка — подавляет и поглощение солей.
Способность клетки к избирательному накоплению питательных солей, зависимость поступления от интенсивности обмена служат доказательством того, что наряду с пассивным имеет место и активное поступление ионов. Оба процесса часто идут одновременно и бывают настолько тесно связаны, что разграничить их трудно.
Первый этап поступления солей в клетку (поступление в свободное пространство) — это пассивный процесс. Свободное пространство клетки это пространство, в которое попы могут проникать пассивно, путем диффузии по градиенту концентрации. О локализации свободною пространства в литературе единого мнения пет. По-видимому, прежде всего это заполненные водой межфибрплляриые пространства в клеточной оболочке, затем это промежутки между клеточной оболочкой и мембраной.
Клеточная оболочка обладает свойством накапливать, адсорбировать на своей поверхности ионы. Еще работами советских физиологов Д. А. Сабинина и И. И. Колосова (1940) было показано, что клеточные оболочки обладают способностью адсорбировать из раствора катионы и анионы. Адсорбция вначале происходит очень быстро, а затеи реако замедляется. Это связано с насыщением адсорбирующей поверхности.
Первичпвя клеточная оболочка — сложная структура. Пектиновые вещества, целлюлоза, гемицеллюлоза и другие соединения, входящие в состав клеточных оболочек, содержат карбоксильные группы, которые при диссоциации заряжают ее отрицательно. В составе оболочки имеются также белки, которые могут в зависимости ст pH сообщать поверхности клеток отрицательный или положительный заряд. В результате этого клеточная оболочка может выступать как ионообмен-иик, обратимо связывая катионы и аниопы. На поверхности клеточной оболочки оказываются адсорбированными иопы Н+ и НС0з~, которые в эквивалентных количествах меняются на ионы, находящиеся в свободном пространстве*. Благодаря тому что оболочка имеет значительное количество (межфибриллярных) промежутков, пе занятых матриксом, у нее имеется большая внутренняя поверхность, которая и участвует в адсорбции ионов из свободного пространства. Иопы могут, таким образом, накапливаться в клеточной оболочке, и она служит как бы их резервуаром.
Для того чтобы поступить в цитоплазму и включиться в метаболизм клетки, ионы должны иройти через мембрану — плазмалемму. Существует несколько гипотез, объясняющих проникновение ионов через мембрану. Наиболее распространенное мнение, что ионы проникают через мембрану с помощью переносчиков.
Опыты, проведенные на искусственных липидных мембранах, показали, что перенос ионов (например, К+) может проходить через по-
* Выделяющийся в процессе дыхания углекислый газ растворяется с образованием гидрата окиси углерода (НвСОа), которая, в свою очередь, распадается на ионы Н+ и НСОз-.
Рис. 20. Комплекс ионофор—К*\
ры, локалпзоваппые в мембране. Эти поры могут формироваться под влиянием некоторых антибиотиков, вырабатываемых бактериями и грибами, — ионофор. В некоторых- случаях катион входит во внутреннюю полость молекулы ионофора (рис. 20). Образованный комплекс диффундирует через мембраны во много раз быстрее по сравнению со свободным попом.
Аналогичные закономерности могут иметь место при переносе ионов через мембрану в живой клетке. Согласно концепции переносчиков, нон (М) реагирует со своим переносчиком (X) на поверхности мембраны или вблизи нее. Эта первая реакция может включать или обменную адсорбцию, или какое-то химическое взаимодействие. Ни сам перепосчик, ни его комплекс с ионом пе может перейти во внешнюю среду. Однако комплекс переносчика с ионом (MX) подвижен в самой мембране и передвигается к ее противоположной стороне. Здесь этот комплекс распадается и высвобождает нон во внутреннюю среду, образуя предшественник переносчика (X1). Этот предшественник переносчика снова передвигается к внешней стороне мембраны, где вновь превращается из предшественника в перепосчик, который иа поверхности мембраны может соединиться с другим ионом.
Подтверждением гипотезы переносчиков служит тот факт, что при увеличении концентрации минеральных солей в окружающем растворе скорость поступления солей сначала возрастает, а затем остается постоянной. Это объясняется ограниченным количеством переносчиков. Переносчики специфичны, т. е. участвуют в переносе только определенных ионов и чем самым обеспечивают избирательность поступления. Это иа исключает того, что один и тот же переносчик может обеспечивать перенос нескольких иопов. Относительно природы переносчиков высказываются различные соображения. Их
Б6
химическая природа пе установлена, по большинство исследователей считает, что это белки. Есть мнение, что перенос осуществляется особыми, сравнительно низкомолекулярными белками пермеазами. Благодаря разнообразию п специфичности белков осуществляется избирательная их реакция с поиамн, находящимися в среде, и, кап следствие, их избирательный перенос. Некоторые исследователи склоняются к тому, что переносчики — это липиды, тоже входящие в состав плазмалеммы. Катионы п анионы могут иметь разные переносчики. Вместе с тем не исключено, что с помощью переносчиков переносятся катионы, а анионы будут проникать в результате сил электростатического притяжения.
Относительно механизма передвижения переносчиков (рис. 21) в мембране существует несколько гипотез: 1. Переносчик диффундирующий. 2. Переносчик скользящим (предполагает наличие в мембране пор, в этом случае он мигрирует по стейкам поры). 3. Переносчик поворачивающийся в мембране.
Транспорт с участием переносчиков может идти по направлению химического или электрического 1радиента. В этом случае поступление ионов ие требует затрат энергии — это пассивный процесс. Однако ои идет с большей скоростью, чем обычная диффузия (облегченная диффузия). Процесс избирательного кокцентрироваиия ионов в клетке, идущий против электрохимического градиента, требует затраты анергии. Именно этот активный перенос имеет решающее значение для жизнедеятельности клетки. Энергия, используемая для активного поступления иопов, поставляется процессом дыхания и в основном аккумулирована в АТФ. Как известно, для использования энергии, заключенной в АТФ, это соединение должно быть гидролпзовапо по уравнению АТФ+НОИ—ИАДФ+Фн. Процесс этот катализируется ферментом адепозинтрпфосфатазой (АТФ-аза).
АТФ-аза обнаружена в мембранах различных клеток. Для животных клеток показано, что в мембранах локализована транспортная АТФ-ава. Этот фермент активируется в присутствии одновалентных катионов талия и натрия (К+, Na+, АТФ-аза) и ингибируется гликозидом уабаином. С наличием транспортной АТФ-азы связывают активный перенос исков через мембраны. АТФ-азная активность обнаружена и в растительных мембранах. Предполагается, что АТФ-аза располагается поперек мембраны. Освобождаемая при распаде АТФ энергия попользуется для изменения конфигурации самой АТФ-азы, благодаря чему участок фермента, связывающий определенный ион, поворачивается и оказывается по другую сторону мембраны (рис. 22). Таким путем может осухцествляться активный перенос иопов (с использованием эпергии) против градиента концентрации. Расчет показывает, что для того, чтобы 1 моль, соли диффундировал против градиента концентрации, необходимо затратить около 4600 Дж. Вместе с тем при гидролизе АТФ выделяется 30660 Дж/моль. Следовательно, этой энергии АТФ должно хватить для транспорта нескольких молей соли. Имеются данные, показывающие прямо пропорциональную зависимость, существующую между активностью фермента АТФ-азы и поступлением ионов.
Необходимость молекул АТФ для осуществления переноса подтверждается еще и тем, что ингибиторы, нарушающие аккумуляцию энергии дыхания в АТФ (нарушение сопряжения окисления и фосфорилирования), в частности динитрофенол, тормозят поступление ионов. Вместе с тем энергия дыхания может и непосредственно без предварительного накопления в АТФ испольвоваться на перенос ионов против градиента концентрации. Механизм этого явления заключается в том, что в результате процесса дыхания на одной стороне мембраны (наружной) накапливаются ионы водорода, при этом внутренняя сторона мембраны заряжается отрицательно. Катионы поступают внутрь, притягиваясь к отрицательно заряженной внутренней стороне мембраны.
Рис. 21. Схемы гипотетических механизмов действия мембранных переносчиков:
Л — диффундирующие; В — вращающиеся; В — скользящие; Г — пиноцигов,
Таким образом, перенос ионов через мембрану может осуществляться против градиента концентрации с затратой энергии, т. е. путем активного переноса. Специфические переносчики обеспечивают п избирательность поступления.
Наконец клетка может «заглатывать» питательные вещества вместе с водой (пиноцитоз).
Пиноцитоа — это впячивание поверхностной мембраны (см. рис. 21), благодаря которому происходит заглатывание капелек жидкости с растворенными веществами. Явление пнноцитоза известно для клеток животных организмов. Сейчас доказано, что ово характерно и для клеток растений. Процесс этот можно подразделить па несколько фаз: 1) адсорбция ионов па определенном участке плазмалеммы; 2) впячивание, ко
Рис. 22. Действие АТФ-азного насоса па цитоплазматической мембране (по Вахмистрову).
торое происходит под влиянием заряженных ионов; 3) образование пузырьков с жйдкостью, которые могут мигрировать по цитоплазме; 4) ферментативное разру-
шение мембраны, опружающей пипопитозиый пузырек, и включение веществ в метаболизм. С помощью пнноцитоза в клетки могут попадать пе только ионы, ио и различные растворимые органические ве-
щества.
Пройдя через мембрану, ионы поступают в цитоплазму, где они включаются в метаболизм клетки. Существенная роль в процессе связывания питательных веществ цитоплазмой принадлежит клеточным органеллам. Митохондрии, хлоропласты, по-видимому, конкурируют между собой, поглощая катионы и анионы, поступившие через плазмалемму в цитоплазму.
В процессе аккумуляции попов в разных органеллах цитоплазмы и включения в метаболизм большое значение имеет их внутриклеточный транспорт. Этот процесс осуществляется, no-видимому, по папалам эндоплазматического ретикулума.
В вакуоль попадают ионы в случае, если протоплазма уже насыщена имн. Это как бы излишки питательных веществ, не включенных в реакции метаболизма. Для того чтобы попасть в вакуоль, попы должны преодолеть еще один барьер — тонопласт. Выше уже упоминалось, что проницаемость тонопласта меньше по сравнению с плазма-леммой. В настоящее Время признано существование двух мехапиз-
мов перекоса попов в клетку: первого, который локализован в плаз-малемме и действует в пределах относительно низких концентраций, и второго, которой локализован в тонопласте и действует только при более высоких концентрациях, когда цитоплазма насыщена данным ионов. Именно второй механизм ответственен за передачу питательных веществ в вакуоль. Переноснонов через тонопласт совершается с помощью переносчиков и в большинстве случаев требует затраты энергии. Проникшие в вакуоль вещества обеспечивают осмотические свойства клетки.
Таким образом проникающие через плазмалемму ионы накапливаются и связываются цитоплазмой, и только их избыток десорбируется в вакуоль. Именно поэтому между содержанием ионов во внешнем растворе и клеточном соке пет и пе может быть равновесия.
Необходимо еще раз подчеркнуть, что большее значение для жизнедеятельности клетки имеет активное поступление. Именно оно ответственно за избирательное накопление ионов в цитоплазме. Поглощение питательных веществ клеткой тесно связано с обменом веществ. Эти саязн многосторонпи. Для активного переноса необходимы синтез беяков переносчиков и энергия, поставляемая в процессе дыхания. Надо учитывать также, что чем быстрее поступающие ионы включаются в метаболизм, тем интенсивнее идет их поглощение.
Для многоклеточного высшего растения пе меньшее значение имеет и передвижение питательных веществ из клетки в клетку. Чем быстрее проходит этот процесс, тем быстрее соли будут при прочих равных условиях поступать в клетку.
Список рекомендуемой литературы
Де Робертис 3., Новинский В., Сазе Ф. Биология клетки. М., Мир, 1973.
Корнеберг А. Синтев ДНК. М., Мир, 1977.
Нооел П. Физиология растительной клетки. М., Мир, 1973.
Роллер Э. Открытие основных законов жизни. М., Мир, 1978.
Сэджер Р. Цитоплазматические гены и органеллы. М., Мир, 1975.
Трошин А. С., Трошина В. П. Физиология клетки. М., Просвещение, 1979.
Фикс ан Дж., Колмен Р., Митчолл Р. Мембраны и их функции в клетке. М., Мир, 1977.
Глава II.
ВОДНЫЙ РЕЖИМ РАСТЕНИЙ
Вода является основной составной частью растительных организмов. Ее содержание доходит до 90% от массы организма, и опа участвует прямо иля косвенно во всех жизнеппых проявлениях. Вода — это та среда, в которой протекают все процессы обмена веществ. Опа составляет основную часть цитоплазмы, поддерживает ее структуру, устойчивость входящих в состав цитоплазмы коллоидов, обеспечивает определенную конформацию молекул белка. Высокое содержание воды придает содержимому клетки (цитоплазме) подвижный характер. Вода — непосредственный участник многих химических реакций. Все реакции гидролиза, многочисленные окислительно-восстановительные реакции вдут с участием воды.
ОБЩАЯ ХАРАКТЕРИСТИКА ВОДНОГО ОБМЕНА РАСТИТЕЛЬНОГО ОРГАНИЗМА
Водный ток обеспечивает связь между отдельными органами растений- Питательные вещества передвигаются по растению в растворенном виде. Насыщенность водой (тургор) обеспечивает прочность тканей, сохранение структуры травянистых растений, определенную ориентировку органов растений в пространстве. Рост клеток в фазе растяжения идет главным образом за счет накопления воды в вакуоли.
Таким образом, вода обеспечивает протекание процессов обмена, коррелятивные взаимодействия, связь организма со средой. Для нормальной жизнедеятельности клетка должна быть насыщена водой.
1. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
Вода играет важную роль в жизнедеятельности организма, благодаря своим уникальным физическим и химическим свойствам. Молекула воды состоит из двух атомов водорода, присоединенных к одному атому кислорода. Атом кислорода оттягивает электроны от водорода, благодаря этому заряды в молекулах воды распределены неравномерно. Одни полюс молекулы воды оказывается заряженным положительно, а другой — отрицательно. Иначе говоря, вода представляет собой диполь. Молекулы воды могут ассоциировать друг с другом. Положительный заряд атома водорода одной молекулы воды
притягивается к отрицательному заряду другой. Это приводит к возникновению водородных связей. Благодаря нал няню водородных связей вода имеет определенную упорядоченную структуру. Каждая молекула воды притягивает к себе еще четыре молекулы, которые стремятся расположиться как бы по вершинам тет[>аэдра. Число ассоциированных молекул может быть неопределенно большим. В жидкой воде упорядоченные участки чередуются с неупорядоченными — хаотически распределенными молекулами. Таким образом, ббльшая часть молекул организована в виде тетраэдров, меньшая часть заполняет волости этих тетраэдров.
В твердом состоянии (лед) все молекулы воды соединены водородными связями. При нагревании лед плавятся, и частично эти связи разрываются. При 0°С разрывается примерно 15% водородных связей. Даже при нагревании до 20°С остаются не нарушенными 80% водородных связей.
Высокая скрытая теплота испарения воды обусловливается наличием водородных связей. Для того чтобы в процессе испарения произошел отрыв молекул от водной поверхности, необходимо затратить, дополнительное количество энергии для разрыва водородных связей. Поэтому испарение воды растением (транспирация) сопровождается охлаждением трааспирирующих органов. Понижение температуры листьев ири транспирации имеет важное физиологическое значение.
Вода обладает очень высокой теплоемкостью, поэтому поглощение или потеря значительного количества тепла тканями растений сопровождается сравнительно небольшими колебаниями их температуры. Это позволяет растительному организму воспринимать колебания температуры окружающей среды в смягченном виде. Вода в растении находится как в свободном, так и в связанном состоянии. Свободной называют воду, сохранившую все илп почти все свойства чистой воды. Свободная вода легко передвигается, вступает в различные биохимические реакции, испаряется в процессе транспирации и замерзает при низких температурах. Связанная вода имеет измененные физические свойства вследствие взаимодействия с неводными компонентами. Эти взаимодействия представляют собой процессы гидратации, вследствие чего связанную воду нередко называют гидратной водой. Различают два основных процесса гидратации: 1) притяжение диполей воды к заряженным частицам (как к иопам минеральных солей, так и к заряженным группам белка СОО- и №Й2+); 2) образование водородных связей с полярными группами органических веществ — между водородом воды и атомами О или N.
Воду, гидратирующую коллоидные частицы (прежде всего белки, называют коллоидпо-связапной, а растворенные вещества (минеральные соли, сахара, органические кислоты и др.) — осмотически связанной.
Вода обладает исключительно высокой растворяющей способностью. В воде апиопы и катионы какой-либо соли оказываются разъединенными. Гидратные оболочки, окружающие ионы, ограничивают их взаимодействие. Положительно заряженные ионы притягивают полюс молекулы воды с отрицательно заряженными атомами кисло
рода, тогда как воем, несущие отрицательный заряд, притягивают полюс с положительно заряженными атомами нодо[юда. Одновременно нарушается н структура самой воды- При этом, нем крупнее ион, тем это нарушение сильнее.
2. РАСПРЕДЕЛЕНИЕ ВОДЫ В КЛЕТКЕ И В ОРГАНИЗМЕ
Содержание воды в различных органах растении колеблется в довольно широких пределах. Оно изменяется в зависимости от условий внешней среды, возраста и вида растений. Так, содержание воды в листьях салата составляет 65%, кукурузы — 77%. Количество воды неодинаково в разных органах растений: в листьях подсолнечника воды содержится 81%, в стеблях — 88%, в корнях — 71%. Содержание воды, равнее 6—11%, характере© главным образом для воздушно-сухих семян, в которых процессы жизнедеятельности заторможены.
Вода содержится в живых клетках, в мертвых элементах ксилемы и в межклетниках. В меягклетннках вода находится главным образом в парообразном состоянии. Основными испаряющими органами растения являются листья. В связи с этим естественно, что наибольшее количество паров воды заполняет межклетники листьев. В жидком состоянии вода находится в различных частях клетки: клеточной оболочке, вакуоли, протоплазме. Вакуоли — наиболее богатая водой часть клетки, где содержание ее достигает 98% - При наибольшей овод ценности содержание воды в протоплазме составляет 05%. Наименьшее содержание воды характерно для клеточных оболочек. Вода в клеточных оболочках заполняет промежутки между фибриллами целлюловы и удерживается силами поверхностного натяжения в менисках. Часть молекул воды находится в адсорбированном состоянии ва поверхности фибрилл, составляющих клеточную оболочку. Количественное определение содержания воды в клеточных оболочках затруднено; по-видимому, оно колеблется от 30 до 50%.
Формы воды в разных частях растительной клетки также различны. В вакуолярном клеточном соке преобладает вода, удерживаемая сравнительно низкомолекулярными соединениями (осмотически-свя-занная) и свободная вода. В оболочке растительной клетки вода связана главным обравом высокополимерпыми соединениями (целлюлозой, гемицеллюлозой, пектиновыми веществами), т. е. коллоидно-связанная вода. Кроме того, в оболочке есть и свободная вода в капиллярах, которые образуются между микрофибриллами целлюлозы.
В самой цитоплазме имеется вода свободная, коллоидно- и осмо-тически-связанная. Вода, находящаяся на расстоянии до 1 нм от поверхности белковой молекулы, связана прочно и имеет льдонодоб-ную структуру (коллоидно-связанная вода). Кроме того, в протоплазме имеется определенное количество ионов, а следовательно, часть воды осмотически связана.
Физиологическое значение свободной и связанной воды различно. Большинство исследователей полагает, что интенсивность физиологических процессов, в том чнеяе и темпов роста, зависит в первую 03
очередь от содержания свободной воды. Вместе с тем имеется прямая корреляция между содержанием связанной воды и устойчивостью растений против неблагоприятных внешних условий. Однако указанные физиологические корреляции наблюдаются пе всегда.
3. ВОДНЫЙ БАЛАНС РАСТЕНИЯ
Для своего нормального существования клетки и растительный организм в целом должны содержать определенное количество воды. Однако это легко осуществимо лпшь для растений, произрастающих в воде. Для сухопутных растения эта задача осложняется тем, что вода в растительном организме непрерывно теряется в процессе испарения. Испарение воды растением достигает огромных размеров. Можно привести такой пример. Одно растение кукурузы испаряет за вегетационный период до 180 кг воды, а 1 га леса в Южной Америке испаряет в среднем за сутки 75 тыс. кг воды. Огромный расход воды связан с тем, что большинство растений обладает значительной листовой поверхностью, находящейся в атмосфере, не насыщенной парами воды. Вместе с тем развитие обширной поверхности иистьев необходимо, в выработалось в процессе длительной эволюции для обеспечении нормального питания углекислотой, содержащейся в воздухе в ничтожной концентрации (0.03%). В своей знаменитой книге «Борьба растений с засухой» К. А. Тимирязев указывал, что противоречие между необходимостью улавливать углекислоту и сокращать расходование воды наложило отпечаток на строение всего растительного организма.
Для того чтобы возместить потери воды при испарепии, в растение должно непрерывно поступать большое ее количество. Непрерывно идущие в растении два процесса — поступление и испарение воды — называют водным режимом или водным балансом растений.
Для нормального роста и развития растений необходимо, чтобы расход воды примерно соответствовал приходу, или, иначе говоря, чтобы растение сводило свой водный баланс без большого дефицита. Для этого в растении в процессе естественного отбора выработались приспособления к поглощению воды (полоссалыю развитая корневая система), к передвижению воды (специальная проводящая система), к сокращению испарения (система покровных тканей и система автоматически закрывающихся устьичных отверстий).
Несмотря на все указанные приспособления, в растении часто наблюдается водный дефицит. Физиологические нарушения наступают у различных растений при разной степени водного дефицита. Есть растения, выработавшие в процессе эволюции разнообразные приспособления к перенесению обезвоживания (засухоустойчивые растения). Выяснение физиологических особенностей, определяющих устойчивость растений к обезвоживанию,— важнейшая задача, разрешение которой имеет большое не только теоретическое, по и практическое значение. Вместе с тем, для того чтобы ее решить, необходимо знание всех сторон водообмена растительного организма.
РАСХОДОВАНИЕ ВОДЫ РАСТЕНИЕМ —
ТРАНСПИРАЦИЯ
В основе расходования воды растительным организмом лежит физический процесс испарения — переход воды из жидкого в парообразное состояние, происходящий при соприкосновении органов растения с пе насыщенной водой атмосферой. Однако этот процесс осложнен физиологическими и анатомическими особенностями растения, и его называют транспирацией.
1. ЗНАЧЕНИЕ ТРАНСПИРАЦИИ
К. А. Тимирязев назвал транспирацию, в том объеме, в каком она идет, необходимым физиологическим алом. Действительно, в обычно протекающих размерах транспирация не является необходимой. Так, если выращивать растения в условиях высокой и низкой влажности воздуха, то, естественно, в первом случае транспирация будет идти со значительно меныпей интенсивностью. Однако рост растений будет одинаков или даже лучше там, где влаяшостъ воздуха выше, а транспирация меньше. Известно, что большая часть всей поглощенной солнечной энергии тратится па транспирацию, которая в определенном объеме полезна растительному организму. 1. Транспирация спасает растение от перегрева, который ему грозит на прямом солнечном свете. Температура сильно транспирирующего листа может быть примерно па 7°С ниже температуры листа завядающего, не трапспирирующего. Это особенно важно в связи с тем, что перегрев, разрушая хлоропласты, резко снижает процесс фотосинтеза (оптимальная температура для процесса фотосинтеза около 30—33°С). Именно благодаря высокой травспирирующей способности многие растения хорошо переносят повышенную температуру. 2. Транспирация создает пепрерывпый ток воды из корневой системы к листьям, который связывает все органы растения в единое целое. 3. С транспирационным током передвигаются растворимые минеральные и частично органические питательные вещества, прп этом, чем интенсивнее транспирация, тем быстрее идет процесс передвижения.
2. ЛИСТ КАК ОРГАН ТРАНСПИРАЦИИ
Основным транспирирутощим органом является лист. Средняя толщина листа составляет 100—200 мкм. Паренхимные клетки листа расположены рыхло, между ними имеется система межклетников, составляющая в общей сложности от 15 до 25% объема листа. Лист окружен покровной тканью — эпидермисом, состоящим ив компактно расположенных клеток, наружные стенки которых утолщены. Листья большинства растений покрыты кутикулой, в состаз которой входят оксимонокарбоновые кислоты, содержащие по 16—28 атомов углерода и по 2—3 гидроксильных группы. Эти кислоты соединены друг с другом в цепочки с помощью афирпых связей. Кутикула 3-773 65
Рис. 23. Структура устьиц у двудольных (Л) И ОДНОДОЛЬНЫХ (£) растений:
I — устьичная щель; В — ядро; в — хлоропласты; 4 — толстая клеточная стенка; 5 — вамыкающле клетки устьиц; в — побочные клетки; У — клетки впидермиса с многочисленными порами.
варьирует как по составу, так и по толщине. Более развитой кутикулой характеризуются листья светолюбивых растений по сравнению с теневыносливыми и засухоустойчивых по сршшению с влаголюбивыми. Кутикула вместе с клетками эпидермиса образует как бы барьер на пути испарения паров воды. При этом особенно значительную преграду составляет кутикула. Удаление кутикулы во много раз повышает интенсивность испарения. Сопротивление выходу паров воды оказывают в определенной мере и утолщенные степки клеток эпидермиса. Все эти особенности выработались в процессе эволюции как приспособление к сокращению испарения. Для соприкосновения листа с атмосферой имеются устьица. Устьица — одно из оригинальных приспособлений листа, обладающее способностью открываться и закрываться. Обычно устьичные отверстия ограничены двумя замыкающими клетками, стенки которых неравномерно утолщены. У двудольных растений замыкающие клетки бобовидной, или полулунной, формы, при этом их внутренние прилегающие Друг к другу стенки более толстые, а внешние — более тонкие. Когда воды мало, замыкающие клетки плотно прилегают друг к другу и устьичная
щель закрыта. Когда воды в замыкающих клетках много, то она давит на стенки и более тонкие степки растягиваются сильнее, а более толстые втягиваются внутрь, между’замыкаюшими клетками появляется щель. У однодольных растений строение замыкающих клеток несколько иное. Они представлены двумя удлиненными клетками, на концах которых стенки более тонкие. При насыщении водой более тонкие стенки на концах растягиваются и раздвигают замыкающие клетки, благодаря чему образуется щель (рис. 23).
Число устьичных отверстий колеблется в зависимости от вида растения от 1 до 60 тыс. на 1 см2 листа. Ббльшая часть устьиц расположена на пижней стороне листа. Диаметр устьичных щелей составляет всего 3—12 мкм.
Устьица соединяют внутренние пространства листа с внешней средой. Вода поступает в лист через сеть жилок, в которых расположены сосудистые элементы. Возможны два пути испарения: 1) через 66
наружные стеики клеток эпидермиса в атмосферу; 2) через стенки клеток мезофилла в межклеточное пространство листа и далее в парообразном состоянии через устьица. В связи с этим различают устьичную а кутикулярную транспирацию. В том, что действительно испарение идет пе только через устьица, по и через кутикулу, легко убедиться. Так, если взять листья, у которых устьица расположены только с нижней стороны (например, листья яблони), и намазать ату сторону вазелином, то испарение воды будет продолжаться, хотя и в значительно уменьшенном размере. Следовательно, определенное количество воды испаряется через кутикулу.
Кутикулярная транспирация обычно составляет около 10% от общей потери воды листом. Однако в некоторых случаях у растений, листья которых характеризуются слабым развитием кутикулы, доля этого вида транспирации может повышаться до 30%. Имеет значение также возраст листа. Молодые листья, как правило, имеют слабо [извитую кутикулу и, следовательно, более интенсивную кутикулярную транспирацию. Наименьшая кутикулярная транспирация наблюдается у листьев, закончивших свой рост. У старых листьев доля кутикулярной транспирации снова возрастает, так как, хотя кутикула и сохраняет достаточную толщину, в пей появляются трещины, через которые легко проходят пары воды.
Все же основная часть воды испаряется через устьица. Процесс устьичной транспирации можно подразделить па ряд этапов.
Первый этап — это переход воды из клеточных оболочек, где она находится в капельно-жидком состоянии, в межклетники (парообразное состояние). Это собственно процесс испарения. Важно подчеркнуть, что уже на этом этапе растение обладает способностью регулировать процесс транспирации (впеустьичпая регулировка). Это связано с несколькими причинами: 1. Между всеми частями клетни существует водное равновесие. Чем меньше воды в клетке, тем выше становится концентрация клеточного сока. А это, в свою очередь, будет уменьшать интенсивность испарения- 2. Между микро- п макрофибриллами целлюлозы, составляющими клеточные оболочки, имеются капиллярные промежутки. Вода испаряется именно из капилляров. Когда воды в клетках достаточно, клеточные оболочки насыщены водой, мениски в капиллярах имеют выпуклую форму, силы поверхностного натяжения ослаблены. В атом случае молекулы воды легко отрываются и переходят в парообразное состояние, заполняя межклетники. При уменьшении содержания воды мениски в капиллярах становятся более вогнутыми, это увеличивает силы поверхностного натяжении и вода с большей силой удерживается в клеточных оболочках. Чем более вогнут мениск, тем путь молекул воды до межклеточных пространств более длинен и извилист. В результате интенсивность испарения сокращается. Таким образом, уже па этом первом этапе растение испаряет тем меньше воды, чем меньше ее содержится.
Второй этап — это выход паров воды из межклетников через устьичные щели. Поверхность всех клеточных стенок, соприкасающихся с межклетными пространствами, превышает поверхность лис-
Рис. 24. Схема испарения водяного лара ив открытого сосуда (1) и через мелко продырявленную ыембра-ВУ (*)
та примерно в 10—30 раз. Все же если устьица закрыты, то все это пространство быстро насыщается парами воды и переход воды из жидкого в парообразное состояние прекращается. Иная картина наблюдается при открытых устьицах. Как только часть паров воды выйдет из межклетпилов через устьичные щели, так сейчас же этот недостаток восполняется за счет испарения воды с поверхности клеток. Поэтому степень открытости устьиц является основным механизмом, регулирующим интенсивность транспирации. При открытых устьицах общая поверхность устьичных щелей составляет всего 1—2% от площади листа. Казалось бы, это должно очень сильно уменьшать испарение по сравнению с испарением свободной водной поверхности той же площади, что и лист. Однако это пе так. Сравнение испарения листа с испарением со свободной водной поверхности той же площади показало, что оно вдет пе в 100 раз, как это следовало бы, исходя из разме-
ров открытой площади (1%), а всего в 2 раза медленнее. Объяснение этому явлению было дано в исследованиях английских физиологов Брауна и Эскомба, которые установили, что испарение из ряда мелких отверстий идет быстрее, чем из одного крупного той же площади. Это связано с так называемым явлением краевой диффузии. При диффузии из отверстий, отстоящих друг от друга па некотором расстоянии, молекулы воды, расположенные по краям, рассеиваются быстрое. Естестведно, что таких краевых молекул значительно больше в ряде мелких отверстий по сравнению с одним крупным {рис. 24). В связи с этим для малых отверстий интенсивность испарения пропорциональна их диаметру, а не площади. Это видно из данных таблицы 2.
Таблица 2
Диаметр пор. в ми (<О Площадь пор. В ОГИ. СД. (ltd*) Периметр, в отн. СД. (TdJ Испорепис поды, в ОТД. СД.
2,64 400 100 100
0,35 1 £3 14
Указанная закономерность проявляется в том случае, если мелкие поры расположены достаточно далеко друг от друга. Структура листа удовлетворяет указанным требованиям. Поры (устьица) имеют малый диаметр и достаточно удалены друг от друга. При открытых устьицах выход паров воды идет достаточно интенсивно, закрытие устьиц резко тормозит испарение. Именно па этом втапе вступает в действие устьичная регулировка транспирации. При недостатке воды в листе устыща автоматически закрываются.
Полное закрывание устьиц сокращает транспирацию примерно па 90%. Вместе с тем уменьшение диаметра устьичных щелей не всегда приводит к соответственному сокращению транспирационного процесса. Определения показали, что устьица должны закрыться больше чем на '/а, для того чтобы зто сказалось на уменьшении интенсивности транспирации.
Третий этап транспирации — это диффузия паров воды от поверхности листа в более далекие слои атмосферы. Этот этап регулируется лишь усвовиями внеш ней среды.
3. ВЛИЯНИЕ ВНЕШНИХ УСЛОВИЯ НА СТЕПЕНЬ ОТКРЫТОСТИ УСТЬИЦ
Различают три типа реакций устьичного аппарата на условия среды: 1) гидропассивная реакция — это вакрывапие устьичных щелей, вызванное тем, что окружающие паренхимные клетки переполнены водой и механически сдавливают замыкающие клетки. В результате сдавливания устьица пе могут открыться и устьичная щель не образуется. Гндропасснвпые движения обычно наблюдаются после сильных доящей или сильных поливов и могут служить причиной торможения процесса фотосинтеза; 2) гидроактивная реакция открывания и закрывания — это движения, вызванные изменением в содержании воды в замыкающих клетках устьиц. Механизм зтих движений рассмотрен выше (с. 66); 3) фотоактивная реакция. Фо-тоактивпые движения проявляются в открывании устьпц па свету и закрывании в темноте. Это имеет большое приспособительное значение, так как благодаря открытию устьпц па свету к хлоропластам диффундирует СОа, необходимая для процесса фотосинтеза. Механизм фотоактпвпых движений устьиц не является вполне ясным. По-видимому, свет оказывает косвенное влияние через изменение концентрации СО2 г замыкающих клетках устьиц. Если концентрация COg в межклетниках падает ниже определенной величины (эта величина зависит от вида растений и изменяется при недостатке влаги), устьица открываются. При повышении концентрации СОг устьица закрываются. В замыкающих клетках устьиц всегда имеются хлоропласты и происходит фотосинтез. На свету СОг ассимилируется в процессе фотосинтеза, содержание ее падает. Согласно гипотезе канадского физиолога У. Скарса, СОз «называет влияние па степень открытости устьиц через измелепие pH в замыкающих клетках. Уменьшение содержания COj приводит к повышению pH (сдвигу в щелочную сторону). Напротив, темнота вызывает повыше
ние содержания СОг и снижение pH (сдвиг в кислую сторону). Изменение pH приводит к изменению активности ферментных систем. В частности, сдвиг pH в щелочную сторону увеличивает активность ферментов, участвующих в распаде крахмала, тогда как сдвиг в кислую сторону повышает активность ферментов, участвующих в синтезе крахмала.
Распад крахмала на сахара вызывает увеличение осмотического показателя и сосущей силы. В замыкающие клетки начинает интенсивно поступать вода ив окружающих па^нхиьшых клеток. Устьица открываются. Противоположные изменения происходят, когда процессы сдвигаются в сторону синтеза крахмала.
Однако это пе единственное объяснение. В последнее время японский исследователь М. Фужино показал, что замыкающие клетки устьиц в открытом состоянии содержат значительно больше калия па свету по сравнению с темнотой. Прибавление АТФ к эпидермису, плавающему на растворе КС1, увеличивает скорость открытия устьиц на свету. На основании этих данных можно считать, что осмотическое давление замыкающих клеток устьиц воврастает благодаря усиленному поступлению калия, регулируемому АТФ. Причем для этого может быть использована АТФ, образованная в процессе фотосинтетического фосфорилирования, происходящего на свету (с. 12fi). Вов-иожно, что обе эти теории являются верными. Не вызывает сомпе-чий необходимость АТФ для осуществления движения устьичных члеток. Исследования советского ученого G А. Кибрика показали возрастание содержания АТФ в замыкающих клетках устьиц в процессе их открывания. Указанные процессы представлены в виде схемы.
Свет
фотосинтез в замыкающих клетках устьиц
уменьшение возрастание количества
содержания СО, АТФ
4 Повышение pH
распад крахмала 4
увеличение содержа- повышение поступления
ния сахаров К*
I повышение осмотического давления
I
открытие устьиц
Открывание устьиц предупреждается, а закрывание стимулируется фптогорыопом — абсцизовой кислотой. Интересно в связи с этим, что абсцизовая кислота тормозит образование ферментов, участвующих в распаде крахмала. Имеются данные, что под влиянием абсцизовой кислоты содержание АТФ падает.
Движение устьичных клеток оказалось зависимым от температуры. Высокая температура повреждает устьица, в некоторых случаях настолько сильно, что они теряют способность открываться и закрываться.
Наблюдения за степенью открытости устьиц имеют большое значение в физиологической и агрономической практике. Они помогают установить необходимость снабжения растения водой. Закрытие устьиц говорит ужо о неблагоприятных сдвигах в водном обмене и, как следствие, о затруднениях в питании растений углекислотой.
Л. ВЛИЯНИЕ УСЛОВИЯ НА ПРОЦЕСС ТРАНСПИРАЦИИ
Внешние условия не только регулируют степень открытости устьиц, по и оказывают влияние непосредственно па процесс транспирации.
Зависимость пнтепсявпостн испарения от условий среды подчиняется уравнению Дальтона. Тралспирация также подчиняется этой формуле, правда с некоторыми отклонениями. Согласно формуле ДальтонаГ=Я (F—f) 760 , где V—интенсивность испарения, ко-р
личсство воды, испарившейся с единицы поверхности; К — коэффициент диффузии; F— упругость паров воды, насыщающих данное пространство; f — упругость паров воды в окружающем пространстве при температуре испаряющей поверхности; р — давление в момент опыта.
Из приведенного уравнения видно, что прежде всего испарение пропорционально разности (F—/), т. е. ненасыщенности атмосферы парами воды, или дефициту влажности. Это в целом справедливо и для транспирации. Однако надо учесть, что при недостатке воды в листе вступает в силу устьичная и внеустьичпая регулировка, благодаря чему влияние внешних условий сказывается в смягченном виде и транспирация начинает возрастать медленнее, чем это следовало бы, исходя из формулы Дальтона. Несмотря на ато, общая закономерность зависимости транспирации от насыщенности водой атмосферы остается справедливой. Чем меньше относительная влажность воздуха, тем выше интенсивность транспирации.
Следующим фектором среды, оказывающим влияние на процесс транспирации, является температура. Влияние температуры можно проследить также исходя из уравнения Дальтона. С повышением температуры виачительно увеличивается количество паров воды, которое насыщает данное пространство (F) (табл. 3).
Возрастание F приводит к повышению дефицита влажности. В связи с зтим с повышением температуры транспирация увеличивается.
Таблица 3
Температура, в °C Насыщающее давлепио пара, а мм рт ст. (К )
10 9,21
20 17,54
30 31,82
Сильное влияние па транспирацию оказывает свет. Это связано с несколькими причинами: 1. На свету повышается температура листа и ато вызывает усиление процесса транспирации. На транспирацию влияют поглощенные лучи, которые и вызывают повышение температуры. В связи с атим действие света на транспирацию проявляется тем сильнее, чем выше содержание хлорофилла. У зеленых растений даже рассеянный свет повышает транспирацию на 30— 40%. 2. Под влиянием света увеличивается проницаемость цитоплазмы для воды, что также, естественно, увеличивает скорость ее испарения. 3. Под влиянием света устьица раскрываются (с. 69). Все это вместе приводит к тому, что на свету транспирация идет во много раз интенсивнее, чем в темноте.
На интенсивность процесса транспирации оказывает влияние влажность почвы. С уменьшением влажности почвы транспирация уменьшается. Чем меньше воды в почве, тем меньше ее в растении-Умеиьшение содержания воды в растительном организме автоматически снижает процесс транспирации, в силу устьичной и внеусть-ичпой регулировки. В этой связи имеет значение и величина осмотического потенциала почвенного раствора. Чем она выше, тем ниже при прочих равных условиях интенсивность транспирации.
Формула Дальтона выведена для спокойной атмосферы. Однако ветер, перемешивая слои воздуха, очень сильно увеличивает скорость испарения. Ветер оказывает влияние и на транспирацию, правда по сравнению с испарением в несколько ослабленной форме. Поскольку обычно ветер пе проникает внутрь листе, то под его влиянием возрастает в основном третий етап транспирации, т. е. перепое насыщенного водой воздуха от поверхности листа в более дальние слои атмосферы. В силу указанных причин при ветре усиливается прежде всего кутикулярная транспирация. Естественно поэтому, что более сяиьпое действие ветер оказывает на транспирацию тех растений, тде кутикула развита слабве. Сильнее, чем обычно, ветер сказывается на транспирации при суховеях. При суховеях ветер сгибает и разгибает листья и горячий воздух врывается в межклетники. Этим вызывается усиление транспирации уже па первом ее етапе.
Транспирация зависит как от нпенших, тан и от внутренних факторов, прежде всего от содержания воды в листьях. Всякое умеяьшв-вие содержания воды уменьшает транспирацию. Транспирация изменяется в зависимости от концентрации и осмотического давления: клеточного сока. Молекулы воды удерживаются осмотическими силами. Чем концентрированнее клеточный сок, тем слабее транспира—
щш. Интенсивность транспирации зависит от эластичности (способности к обратимому растяжению) клеточных стенок. Если клеточные стопки малоэластичны, то уже небольшая потеря воды приводит к сокращению объема клетки до минимума. В этот период клеточные оболочки пе растянуты и не оказывают сопротивления, сосущая сила резко возрастает и становятся равной всей величине осмотического давления. Возрастание сосущей силы клетки приводит к уменьшению транспирации.
Транспмрация изменяется в зависимости от величины листовой поверхности, а также при изменении соотношения во^ни .. т}ем побеги
больше развита нистовая поверхность, тем больше общая потеря воды. Одпако в процессе естественного отбора у растений одновременно с большей листовой поверхностью выработалась компенсирующая способность к меньшему испарению с единицы поверхности листа (меньшая интенсивность транспирации) - Вместе с тем с увеличением
корни „
отношения транспирация возрастает. Интенсивность транс-
пирации зависит и от возраста растения. С увеличением возраста интенсивность транспирации, как правило, падает.
Смепа дня и ночи, смена условий в течение суток наложила отпечаток и па процесс транспирации. Как устьичные движения, так и транспирация имеют свой определенный суточный ход. Английский исследователь Лофтфельд разделил все растения в отношении суточного хода устьичных движений на три группы: 1) растения, у которых ночью устьица всегда закрыты. Утром устьица открываются, и их дальнейшее поведение в течение дня зависит от условий среды. Мало воды — они закрываются. Достаточке воды — они открываются. К этой группе относятся в первую очередь хлебные злаки; 2) растения, у которых устьица утром открываются, а днем в зависимости от условий открыты или закрыты. Ночное их поведение зависит от дневного. Если днем устьица были закрыты, то ночью ови открываются- Если днем они были открыты, то ночью они закрываются. К этой группе относятся растения с топкими листьями — люцерна, горох, клевер; 3) растения, у которых ночью устьица всегда открыты (суккуленты), а днем, как и у всех остальных групп растений, открыты или закрыты в зависимости от условий.
Что касается суточного хода транспирации, то в печной период суток транспирация резко сокращается. Это связапо как с изменением внешних фекторов (повышенпе влажности воздуха, снижение температуры, отсутствие света), так и с внутренними особенностями (закрытие устьиц). -Измереная показывают, что ночная транеппра-дия составляет всего 3—5% от дневной.
Дневной ход транспирации обычно сиедует за изменением напряженности основных метеорологических факторов (освещенности, температуры, влажности воздуха). Максимум транспирация будет приходиться на 12—43 ч. Это подчеркивает сравнительно малую зависимость транспирации от физиологического состояния растения. Ведущим в этом комплексе внешних воздействий будет напряжен-
пость солнечной инсоляции. Интересно, что растения с разным расположением листьев несколько различаются по суточному ходу транспирационного процесса. На листья, повернутые ребром к горизонту, солнечные лучи начинают падать раньше. В связи с этим подъем транспирации у таких растений в утренние часы также иа-чппается несколько раньше.
В случае недостатка влаги кривая суточного хода транспирационного процесса из одновершинной превращается в двухвершинную. В полуденные часы транспирация сокращается, его позволяет растению восполнить недостаток воды, и тогда к вечеру транспирация слова возрастает.
При частом измерении транспирации можпо заметить, что это пульсирующий процесс, т. е. ему свойственно ритмичное увеличение я уменьшение интенсивности. По-видимому, это связано главным образом с колебанием содержания воды в растении. Увеличение транспирации приводит к уменьшению содержания воды, что, в свою очередь, сокращает трансплрацию. Как следствие, содержание водьт растет и транспирация также возрастает, и так непрерывно.
Напряженность транспирации, а также ее связь с другими процессами, в частности с фотосинтезом, принято выражать в следующих единицах.
Интенсивность транспирации — это количество воды, испаряемой растением (в мг) за единицу времени (ч) единицей поверхности листа (в дм2). Транспирационный коэффициент — количество воды (в г), испаряемой растением при накоплении им 1 г сухого вещества (транспирационные коэффициенты обычно колеблются от 300 до 1500). Продуктивность транспирации — величина, обратная транспирационному коэффициенту,— это количество сухого вещества (в г), накопленного растением за период, когда оно испаряет 1 кг воды. Относительная транспирация— отношение воды, испаряемой листом, к воде, испаряемой со свободной водной поверхности той же площади за один и тот же промежуток времени. Экономность транспирации— количество испаряемой воды (в мг) на единицу (1 кг) воды, содержащейся в растении.
ПОСТУПЛЕНИЕ И ПЕРЕДВИЖЕНИЕ ВОДЫ
ПО РАСТЕНКО
У вышедших на сушу растений должны были выработаться приспособления, позволяющие им сохранить насыщенность клеток водой, восполнить ее потерю, вызванную испарением. Это было достигнуто различными путями. Такие растения, как лишайники, сохранили способность всасывать воду всей своей поверхностью, а при недостатке влаги впадать в состояние анабиоза. У высших растений в процессе эволюции выработались специальные приспособления к поглощению воды. Наземные растения в основном поглощают воду из почвы. Однако некоторое количество воды может поглощаться из атмосферы. Есть даже растения, для которых атмосферная влага является основным источником. К таким растениям относятся прежде
всего эпифиты, живущие па поверхности других растений, по не являющиеся паразитами. Эпифиты принадлежат к различным семействам, особенно их много в тропической флоре. Они обладают воздушными корнями, в которых имеется многослойная ткань, состоящая из полых клеток с топкими стенками. Такое строение позволяет нм всасывать как парообразную влагу, так и воду осадков, подобно губке. У некоторых эоифитов дождевая вода собирается листьями и •затем поглощается с помощью волосков. Приспособления к обору дождевой воды листьями имеются и у ряда других растений. Например, у некоторых зонтичных растений вода собирается в листовых влагалищах и затем всасывается. Сбор и всасывание воды листьями имеет большое значение для растений засоленных почв, когда поступление воды из почвы затруднено. Так, у солянок на листьях имеются волоски, стенки клеток листовой паренхимы очень тонкие —- все это помогает всасывать влагу атмосферы. В определенных условиях способность использовать парообразную влагу проявляется у лястьев всех растений. Так, если корневая система растений находится в сухой почве, а листья соприкасаются с атмосферой, насыщенной парами воды, то вода будет поступать через листья, передвигаться по направлению к клеткам корня и даже выделяться в почву.
1. КОРНЕВАЯ СИСТЕМА КАК ОРГАН ПОГЛОЩЕНИЯ ВОДЫ
Основным источником влаги является вода, находящаяся в почве, и основным органом поглощения воды — корневая система. Роль этого органа прежде всего заключается в том, что благодаря огромной поверхности обеспечивается поступление воды в растение из возможно большего объема почвы. Сформировавщаяся корневая система представляет собой сложный орган с хорошо дифференцированной внешней и внутренней структурой.
Рост корни, его ветвление продолжаются в течение всей жизни растительного организма, т. е. практически он пе ограничен. Меристемы — образовательные ткали — расположены на верхушке каждого корня. Доля меристематических клеток сравнительно велика (10% по массе против 1 % у стебля).
Определение размеров корневых систем требует специальных методов. Очень много в этом отношении достигнуто благодаря работам русских физиологов В. Г. Ротмистрова, А. П- Модестова, И. В. Красовской. Оказалось, что общая поверхность корней обычно превышает поверхность надземных органов в 140—150 раз. Подсчитано, что число корней у однолетних сеянцев яблони достигает 45 тыс. Корневые системы даже однолетних хлебных влаков проникают в почву па глубину 1,5—2 м. При выращивании одиночного растения ржи было установлено, что общая длипа его корней достигает 300 км, при атом на них образуются 15 млрд, корневых волосков. Эти данные говорят об огромной потенциальной способности к росту корневых систем. Однако эта способность не всегда проявляется. При росте
Рис. 25. Схема строения корня:
А — продольный разрез: 1 — корневой чехлик; 4 — меристема; з — гопа растяжения; а—вона корневых волосков; 5 — вона ветвления; Б — поперечный разрез (па М. <₽. Даниловой): г — риэодерма; в — корневой волосок; з — па-ренхима; а — вндодерма; s — пояски Каспари; « — перицикл; 1 — флоэма; S — ксилема. Пунктирные стрелки — пути передвижения веществ, поглощаемых из наружного раствора. Сплошные стрелки — дуть растворов по сим-пласту; прерывистые — путь по апопласту.
растений в фитоцепозах, с достаточно большой густотой их стояния, размеры корневых систем заметно уменьшаю тся-
Рост корней отличается большой скоростью. Считается, что одно растение риса в благоприятных условиях может образовать до 5 км новых корней в сутки. За счет этого прироста корневой системы в растение может дополнительно поступить 1,5 л воды. Только благодаря таиому интенсивному росту корневые системы растения могут использовать скудно рассеянную в почве воду. Важное значение имеет явление гидротропизма, при котором по мере роста корневая система как бы вдет из белее иссушенных слоев почвы к более влажным.
С физиологической точки зрения корневая система неоднородна. Далеко не вся поверхность корня участвует в поглощении воды. В каждом корне различают несколько зоп (рис. 25). Правда, не всег-78
да псе зоны выражены одинаково четко. Окончание корпя снаружи защищено корневым чехликом, напоминающим округлый колпачок, состоящий из живых тонкостенных продолговатых клеток. Корневой чехлик служит защитой для точки роста. Клетки корневого чехлика слущиваются, что уменьшает трение и способствует проникновению корпя в глубь почвы. Под корневым чехликом расположена меристематическая зона. Меристема состоит из многочисленных мелких, усиленно делящихся плотпо упакованных клеток, почти целиком заполненных протоплазмой. Следующая зона — зона растяжении. Здесь клетки увеличиваются в объеме (растягиваются). Одновременно в этой зоне появляются дифференцированные ситовидные трубки, затем следует зона корневых волосков. При дальнейшем увеличении возраста клеток, а также расстояния от копчика корпя корневые волоски исчезают, начинается кутинизация и опробковение клеточных оболочек. Поглощение воды происходит главным образом клетками зоны растяжения а зоны корневых волосков.
Рассмотрим несколько подробнее строение корня в эоне корневых волосков. Поверхность корня в этой зоне покрыта ризодермой. Это однослойная ткапь с двумя видами клеток, формирующими и не формирующими корневые волоски. В настоящее время показапо, что клетки, формирующие корневые волоски, отличаются особым типом обмена веществ. У большинства растений клетки рпзодермы обладают топкими Степками. Вслед за ринодермой до перицикла идут клетки коры. Кора состоит из нескольких слоев паренхимных клеток. Важной особенностью коры является развитие системы крупных межклетников. На границе коры и центрального цилиндра развивается один слой плотно прилегающих друг к другу клеток — эндодерма. для которой характерно наличие ноясков Касиарп. Цитоплазма в клетках эндодермы плотпо прилегает к клеточным оболочкам. По мере старения вся внутренняя поверхность клеток эндодермы, за исключением пропускных клеток, покрывается суберином. При дальнейшем старении сверху могут накладываться еще слои. По-видн-мому, именно клетки эндодермы служат основным физиологическим барьером для передвижения как воды, так и питательных веществ. В центральном цилиндре расположены ироводащне ткани коркл. При рассмотрении структуры корпя в продольном направленна важно отметить, что начало роста корневых волосков, появление поясков Каспари в стенках эндодермы и дифференциация сосудов ксилемы происходят на одном и том же расстоянии от аникалыгой меристемы. Именно эта .юна является основной зоной снабжения растений питательными веществами. Обычно поглощающая зона составляет 5—10 см в длину. Величина ее зависит от скорости роста корпя в целом. Чем медленное растет корень, тем зола поглощения короче.
Надо отметить, что в целом корневые системы значительно менее разнообразны по сравнению с надземными органами, в связи с тем что среда их обитания болоо однородна. Это пе исключает того, что корневые системы кзмепяются под влиянием тех или иных условий. Хорошо показано влияние температуры па формирование корневых
систем. Как правило, оптимальная температура для роста корневых систем несколько ниже по сравнению с ростом надземных органов того ясе растения. Все ясе сильное понижение температуры заметно тормозит рост корней и способствует образованию толстых, мясистых, мало ветвящихся корневых систем.
Большое значение для формирования корневых систем имеет влажность почвы. Распределение корней по горизонтам почвы часто определяется распределением воды в почве. Обычно в первый период жизни растительного организма корневая система растет чрезвычайно пнтепсввпо и, как следствие, скорее достигает более влажных споев почвы. Некоторые растения развивают поверхностную корневую систему. Располагаясь близко к поверхности, сильно ветвящиеся корни перехватывают атмосферные осадки. В засушливых районах часто глубоко и мелко укореняющиеся виды растений растут рядом. Первые обеспечивают себя влагой за счет глубоких слоев почвы, вторые за счет усвоения выпадающих осадков.
Важное значение для развития корневых систем имеет аэрация. Именно недостаток кислорода является причиной плохого развития корневых систем па заболоченных почвах. Растения, приспособленные к росту на плохо аэрируемых почвах, имеют в корнях систему межклетников, которые вместе с межклетниками в стеблях и листьях составляют единую вентиляционную систему.
Большое значение имеют условия питания. Показано, что внесение фосфорных удобрений способствует углублению корневых систем, а внесение азотных удобрений — их усиленному ветвлению.
2. ОСНОВНЫЕ ДВИГАТЕЛИ ВОДНОГО ТОКА
Поглощение воды корневой системой идет благодаря работе двух концевых двигателей водного тока: верхнего концевого двигателя, или присасывающей силы испарения (транспирации), и нижнего концевого двигателя, или корневого давления. Основной силой, вызывающей поступление и передвижение воды в растении, является присасывающая сила транспирации, в результате которой возникает градиент водного потенциала (с. 51). Водный потенциал — это мера энергии, используемой водой двя передвижения. Водный потенциал и сосущая сила одинаковы по абсолютному значению, по противоположны по знаку. Чем меньше насыщенность водой данной системы, тем меньше (более отрицателен) ее водный потенциал. При потере воды растением в процессе транспирации создается ненасыщенность клеток листа водой, как следствие, возникает сосущая сила (водный потенциал падает). Поступление воды идет в сторону большей сосущей силы, или меньшего водного потенциала.
Таким образом, верхний концевой двигатель водного тока в растении — это присасывающая сила транспирации листьев, и его работа мало связаяа с жизнедеятельностью корневой системы. Действительно, опыты показали, что вода может поступать в побеги и через мертвую корневую систему, причем в этом случае поглощение воды даже ускоряется.
Кроме верхнего концевого двигателя водного тока, в растениях существует нижний копцевой двигатель. Это хорошо доказывается на примере таких явлений, как гуттация.
Листья растений, клетки которых насыщены водой, в условиях высокой влажности воздуха, препятствующей испарению, выделяют капельно-жидкую воду с набольшим количеством растворенных веществ — гуттация. Выделение жидкости идет через специальные водные устьица — гидатоды. Выделяющаяся жидкость — гутта. Таким образом, процесс гуттации является результатом одностороннего тока воды, происходящего в отсутствие транспирации, и, следовательно, вызывается какой-то иной причиной.
К такому же выводу можно прийти и при рассмотрении явления плач растений. Если срезать побеги растения и к срезанному концу присоединить стеклянную трубку, то по ней будет подниматься жидкость. Аналиа показывает, что это вода с растворенными веществами— пасока. В некоторых случаях, особенно в весенний период, плач наблюдается и при надрезе веток растений. Определения понавели, что объем выделяющейся жидкости (пасоки) во много раз превышает объем корневой системы. Таким образом, плач — это не просто вытекание жидкости в результате пореза. Все сказанное приводит к выводу, что плач, как и гуттация, связан с наличием одностороннего тока воды через корневые системы, не зависящего от транспирации. Силу, вызывающую односторонний ток воды по сосудам с растворенными веществами, пе зависящую от процесса транспирации, называют корневым давлением. Наличие корпезото давления позволяет говорить о пижнем копцевом двигателе водного тока. Корневое давление можпо измерить, присоединив манометр к концу, оставшемуся после срезания надземных органов растения, или поместив корневую систему в серию растворов различной концентрации и подобрав такую, при которой плач прекращается. Оказалось, что величина корневого давления равна примерно 0,1—0,15 МПа (Д. А. Сабинин). Определения, проведенные советскими исследователями Л. В. Можаевой, В- Н. Жслкевичем, показали, что концентрация наружного раствора, останавливающего плач, значительно выше концентрации пасоки. Это позволило высказать мнение, что плач может идти против градиента концентрации. Было показано также, что плач осуществляется только в тех условиях, в которых нормально протекают все процессы жизнедеятельности клеток. Не только умерщвление клеток корня, по и снижение интенсивности их жизнедеятельности, в первую очередь интенсивности дыхаппя, прекращает плач. В отсутствие кислорода, под влиянием дыхательных ядов, при пониженной температуре плач приостанавливается. Все сказанное позволило Д. А. Сабипипу дать следующее определение: плач растений— это прижизненный односторонний ток воды и питательных веществ, зависящий от аэробной переработки асскмилятов. Д. А-Сабинин предложил схему, объясняющую механизм одностороннего тока воды в корне. Согласно этой гипотезе, клетки корпя поляризованы в определенном направлении. Это проявляется в том, что в разных отсеках одной и той же клетки процессы обмена веществ раз-
личны. В одной части клетки идут усиленные процессы распада, в частности, крахмала иа сахара, вследствие чего попдептрация клеточного сока (Ci) возрастает. На противоположном конце клетки преобладают процессы синтеза, благодаря чему концентрация растворенных веществ (Сд) в этой части клетки уменьшается.
Исходя из этих положений. Ci больше С?. Поскольку осмотическое давление пропорционально концентрации, то pi больше ри, тогда Si=p>—Т, a Sz—pt—Т, величина Т одинакова па обоих концах клетки. Если клетка, с одном стороны, граничит с водой, то fit=О, тогда Р\—Т. В этом случае можно написать, что Si—ръ—р1. Поскольку pi больше pa, то S2 представляет собой отрицательную величину. Следовательно, если со стороны, где клетка обращена к внешней среде, она иесыщена водой, то, с другой стороны, наблюдается секреция воды, тургорпое давление (Т) превышает осмотическое и клетка будет выделять воду. Надо учитывать, что весь этот механизм будет работать только при достаточном количестве воды в среде и при ненарушенном обмене веществ.
Согласно другой гипотезе, зависимость плача растений от интенсивности дыхания является косвенной- Энергия дыхания используется для поступления попов в клетки коры, откуда они десорбируются в сосуды ксилемы. В результате концентрация солей в сосудах ксилемы повышается, что и вызывает поступление воды.
3. ПЕРЕДВИЖЕНИЕ ВОДЫ ПО РАСТЕНИЮ
Вода, поглощенная клетками корпя, под влиянием разности водных потенциалов, которые возникают благодаря транспирации, а также силе корневого давления, передвигается до проводящих элементов ксилемы. Согласно современным представлениям, вода в корневой системе передвигается пе только по живым клеткам. Еще п 1932 г. немецкий физиолог Мюнх развил представление о существовании в корневой системе двух относительно независимых друг от друга объемов, по которым передвигается вода,— апонласта и сим-пласта. Апопласт— это свободное пространство корня, в которое входят межклетные промежутки, оболочки клеток, а также сосуды ксилемы. Симпласт — это совокупность протопластов всех клеток, отграниченных полупроницаемой мембраной. Благодаря многочисленным плазмодесмам, соединяющим между собой протопласт отдельных клеток, симпласт представляет единую систему. Апопласт, невидимому, пе непрерывен, а разделен па два объема. Первая част1> апопласта расположена в коре корня до клеток эндодермы, вторая —-по другую сторону клеток эндодермы, и включает в себя сосуды ксилемы. Клетки эндодермы благодаря пояскам Каспари представляют как бы барьер для передвижения воды по свободному пространству (межклетникам и клеточным оболочкам). Для того чтобы попасть в сосуды ксилемы, вода должна пройти через полупроницаемую мембрану п протоплазму клеток апдодермы. Передвижение воды по коре» корпя идет главным образом по апопласту и лишь частично по сим-пласту. Однако в клетках эндодермы передвижение воды идет, по-80
видимому, по симпласту. Далее вода поступает в сосуды ксилемы. По вопросу о причинах, вызывающих секрецию воды в сосуды ксилемы, имеются различные суждения. Согласно одной гипотезе (Д. А. Сабинин), это вызвано противоположными изменениями в процессах обмена с разных сторон клеток. Согласно другой, это следствие секреции солей в сосуды ксилемы, в результате чего там создается повышенное осмотическое давление. Дальнейшее передвижение воды идет по сосудистой системе корня, стебля и листа. Проводящие элементы ксилемы состоят из сосудов (трахей) и трахеид.
Опыты с кольцеванием показали, что восходящий ток воды по растению движется в основном по ксилеме. В сосудах ксилемы вода встречает незначительное сопротивление, что, естественно, облегчает передвижение воды па большие расстояния. Правда, в настоящее время признается, что некоторое количество воды передвигается и вне сосудистой системы. Однако по сравнению с ксилемой сопротивление движению воды других тканей значительно больше (пе мепсе чем па три порядка). Это. приводит к тому, что вне ксилемы движется всего от 1 до 10% общего потока воды.
Из сосудов стебля вода попадает в сосуды листа. Вода движется из стебля через черешок или листовое влагалище в лист. В листовой пластинке водопроводящие сосуды расположены в жилках. Жилки, постепенно разветвляясь, становятся все более мелкими. Чем гуще сеть жилок, тем мепыпее сопротивление встречает вода при передвижении к клеткам мезофилла листа. Именно поэтому густота жилкования листа считается одним из важнейших признаков ксероморфной структуры — отличительной чертой растений, устойчивых к засухе.
Иногда мелких ответвлений жилок листа так много, что они подводят воду почти к каждой клетке. Вся вода в клетке находится в равновесном состоянии. Иначе говоря, в смысле насыщенности водой, имеется равновесие менаду вакуолью, цитоплазмой и клеточной оболочкой, их водные потенциалы равны. В связи с этим, как только в силу процесса транспирации возникает иепасыщеппость водой клеточных стенок-паренхимных клеток, она сейчас же передается внутрь клетки, водный потенциал падает, сосущая сила возрастает. Вода передвигается от клетки к клетке благодаря градиенту сосущей силы. По-видимому, передвижение воды от клетки к клетке в листовой паренхиме идет пе по симпласту, а в основном по клеточным стенкам, где сопротивление значительно меньше.
Таким образом, по сосудам вода движется благодаря присасывающей силе транспирации и создающемуся в силу этого градиенту водного потенциала. Однако пи один всасывающий пасос не может поднять воду на высоту больше 10 м (соответствующую 0,1 МПа нормального давления). Между тем есть деревья, у которых вода поднимается на высоту более 100 м. Объяснение этому дает теория сцепления, выдвинутая русским ученым Е. В- Вотчалом и английским физиологом Е. Диксоном. Для лучшего понимания этой теории рассмотрим следующий опыт. В чашку со ртутью помещают заполненную водой трубку, которая заканчивается воронкой из пористого фарфора. Вся система лишена пузырьков воздуха. По мере испаре-
4—773
81
Рис. 26. Путь воды в растении.
вин воды ртуть поднимается по трубке. При этом высота подъем» ртути превышает 760 мм. Это объясняется наличием сил сцеплепихс менаду молекулами воды и ртути, которые в полной мере проявляются при отсутствии воздуха. Сходное положение, только еще более ярко выраженное, имеется в сосудах у растепий.
Вся вода в растении представляет единую взаимосвязанную систему. Поскольку между молекулами воды имеются силы сцепленим (когезия), вода поднимается па высоту значительно большую 10 м. Сила сцепления увеличивается, так как молекулы воды обладают большим сродством друг к другу. Силы сцепления существуют и между водой и стенками сосудов. Стенки проводящих элементов ксилемы эластичны. В силу этих двух обстоятельств даже при недостатке воды связь менаду молекулами воды и стенками сосудов не нарушается. Это подтверждается исследованиями по изменению толщиш.х
£2
стебля травянистых растепий. Определения показали, что в подуден-пые часы толщина стебля травянистых растений уменьшается. Если перерезать стебель, то сосуды сразу расширяются и воздух врывается В них-
Степень натяжения водпых питей в сосудах зависит от соотношения процессов поглощения и испарения воды. Все это позволяет растительному организму поддерживать единую водную систему и не обязательно восполнять каждую каплю испаряемой воды.
В том случае, если в отдельные членики сосудов попадает воздух, они, по-ввдимому, выключаются из общего тока проведения воды. Таков путь воды по растению и его основные движущие силы (рис. 26).
Современные методы исследования позволяют определить' скорость передвижения воды по растеплю. Согласно полученным данным, скорость движения воды в течение суток изменяется. В дневные часы опа значительно больше. При этом' разные виды растений отличаются по скорости передвижения воды. Если скорость передви-жеппя у хвойных пород обычно пе превышает 0,5—1 см/ч, то у лиственных опа значительно выше. У дуба, например, скорость передвижения составляет -43,6 см/ч. Скорость передвижения воды мало зависит от напряженности обмена. Изменение температуры, введение метаболических ингибиторов пе влияют па передвижение воды. Вместе с тем этот процесс, как и следовало ожидать, очень сильно зависят от скорости транспирации и от диаметра водопроводящих сосудов. В более широких сосудах вода встречает меньшее сопротивление. Одпако надо учитывать, что в более широкие сосуды скорее могут попаси» пузырьки воздуха или произойти какие-либо иные нарушения тока воды.
4. ВЛИЯНИЕ ВНЕШНИХ УСЛОВИЙ НА ПОСТУПЛЕНИЕ ВОДЫ В РАСТЕНИЕ
Еще в 1864 г. 10. Сако уста повил, что поступление воды через корневые системы зависит от температуры. С понижением температуры скорость поступления воды резко сокращается. Это может оказать заметное влияние па жизнь растительного организма, особенно в осенний период, когда испарение идет еще достаточно интенсивно, а поступление воды задерживается из-за пониженной температуры. В результате растения завядают и даже могут погибнуть от обезвоживания. Причин, по которым понижение температуры вызывает уменьшение поступления воды, по-видимому, несколько: 1) повышается вязкость воды п, как следствие, снижается ее подвижность; 2) уменьшается проницаемость протоплазмы для воды; 3) уменьшается скорость всех метаболических процессов. Последнее обстоятельство; по-видимому, должно сказаться или непосредственно (ослабление активного поступления), или косвенно, через уменьшение поступления солей и, как следствие, уменьшение осмотического давления клеток корпя. Снижение аэрации почвы также тормозит поступление воды. Это можно наблюдать, когда после сильного дождя 4* 83
все промежутки почвы заполнены водой и вместе с тем на солнце при сильном испарении растения завядают. Все условия, снижающие метаболизм, такие, как недостаток кислорода, избыток СОг, дыхательные яды, уменьшают поступление воды. Однако все они в еще большей степени снижают поступление ионов.
Большое значение имеет содержание воды в почве, а также концентрация почвенного раствора. Естественно, вода поступает в корень только тогда, когда сосущая сила корпя больше сосущей силы почвы, иначе говоря, когда водный потенциал корня ниже водного потенциала почвы. Всякое уменьшение влажности почвы снижает поступление воды. Чем меньше воды в почве, тем с большей сплои опа удерживается и тем меньше ее водный потенциал. Для того чтобы в растение поступила вода, должен существовать градиент водного потенциала в системе почва — растение — атмосфера. Надо также учитывать, что уменьшение содержания воды в корне затрудняет ее дальнейшее продвижение к сосудам ксилемы. Это объясняется тем, что при уменьшении содержания воды сопротивление ее передниже-пию по клеткам корпя растет. Подсыхающие клеточные оболочки оказывают значительное сопротивление передвижению воды. Сопротивление корневой системы передвижению воды при ее недостатке настолько велико, что, по мнению Н. А. Максимова, это может снижать транспирацию, т. е. служит средством для ее регуляции.
С физиологической точки зрения удобно выделить следующие формы почвенной слаги, различающиеся по степени доступности их для растения. Гравитационная вода заполняет крупные промежутки между частицами почвы, она хорошо доступна растениям. Однако, как правило, она легко стекает в нижние горизонты под влиянием силы тяжести, вследствие чего бывает в почве лишь после дождей. Капиллярная вода заполняет капиллярные поры в почве. Эта вода текже хорошо доступна для растений, она удерживается в капиллярах силами поверхностного натяжения и поэтому вииз не стекает. Пленочная вода окружает коллоидные частицы почвы. Вода из периферических слоев гидратацнопиых оболочек может поглощаться клетками корня. Вместе с тем, чем ближе к коллоидным частицам располагаются молекулы воды, тем с большей силой опи удерживаются и, как следствие, менее доступны для растения. Гигроскопическая вода адсорбируется сухой почвой при помещении ее в атмосферу с 65% относительной влажности воздуха. Эта форма воды полпостью-недоступна для растения.
Количество воды в процентах, при котором растелие начинает завядать, называют коэф фи циент ом завядаиия, или влажностью завядания.
Влажность, при которой ияступает завадаиие на данной почве, мало зависит от вида растения. Это связано, по-видимому, с тем, что растения завядают в тот момент, когда вода в почве перестает передвигаться- Однако было показано, что если завядапие начинается при одной и той же влажности, то промежуток времени от завядапия до гибели (интервал вавядания) у растений может быть различным.
Так. ДО» рае гений бибоп интервал западания составляет несколько сую», тогда как д.ш проса — несколько педель. Все это сказывается на устойчивости рнетстш к .кцухк Основное значение при определении показатели влажности лаияданпя имеет тип почвы. Одно н то же растение на черноземе аапядает при значительно более высокой влажности, чем на подлые. Ито связано с тем, что черноземные почни (мыл* тонкого Mi*.\anii4rciior<i состава с большем силой удерживают почвенную n.iaiy. Влажное п. за тщания еще не дает представления о кеммчегтне поды, по.!пметъю недоступной растению, поскольку при завядавни какие то Ксммчестпо <юды продолжает поступать в растительный 1>р<янм.1м. В ciui.ui с этим было введено понятие мертвый мгше tt.ui.4i в пччм:— это количество виды, полностью недоступное растению. Мерный запас зависит исключительно от типа почвы, »ч! мехлинноского состава. что видно пз следующей формулы: д*=% пески (0,<>1) I-*X>iiij.iii (0,12)-Р % глины (0,57), где д —- мертвый запас. Чем болыпе глинистых частиц в почве, тем больше мертвый запас*. влаги. Почвы более тонкого меха 1шчнекого состава характеризуются и полыней вл.кчх'мкостыо. Количество доступной для растительного орышыма воды представляет разность между полной влатосмиог-тып (максимальное количество воды, удерживаемое почвой без стекания) и мертвым запасом. В связи со сказанным перегнойные суглинистые почвы обладают нс только наибольшим мертвым запасом. по н наибольшим запасом доступной влаги.
ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ УСТОЙЧИВОСТИ РАСТЕНИЙ К ЗАСУХЕ
Вопрос об устойчивости растений к засухе имеет очепь большое пе только теоретическое, но л практическое значение.
Па территории СССР имеются зоны избыточного увлажнения с годовым количеством осадков более 500 мм. Области пеустойчивого увлажнения с. годовым количеством осадков 250—500 мм и области с недостаточным увлажнением (засушливые), где количество оседков мепео 250 мм и год. Необходимо также учитывать, что для растепий важно во только п дажо не столько общее годовое количество осадков, сколько их распределение по месяцам. Для большинства сельскохозяйственных растений особенно важны дожди в первую половину лета (май, топь), между тем именно этот период часто бывает резко засупг.тппым
В понятно засухи «ходит целый комплекс метеорологических условий. Зигуга — это длительным период бездождья, сопровождаемый непрерывным падением относптслыюй влажности воздуха и повышением температуры. Различают засуху атмосферную и почвеп-вую. Атмосферная тасуха характеризуется низкой относительной влажностью воздуха. Почвенная — отсутствием доступной для растений воды в почве. Чаще всего эти виды засухи сопровождают друг друга. К очепь тяжелым последствиям приводят также такие явления, гак мгла и суховей. Мгла — это атмосферная засуха, сопровож-
даемая появлением в воздухе во взвешенном состоянии твердых частиц. Суховей — это атмосферная засуха, сопровождаемая сильным ветром, при котором перемещаются большие массы горячего воздуха.
1. влияние на растения недостатка воды
В естественных условиях очень часто даже в обычные ясные дни поступление воды в растение не угпевает за ее расходованием. Образуется водный дефицит, который легко обнаружить, определяя содержание воды в листьях в разные часы суток. Определения поназали, что в полуденные часы содержание воды в листьях примерно на 25—28% меньше по сравнению с утренними. Увеличение водного дефицита сопровождается возрастанием сосущей силы листьев. Именно поэтому в дневные часы сосущая сила листьев, как правило, наибольшая.
Полуденный водный дефицит представляет собой нормальное явление и особенной опасности для растительного организма пе представляет. Значительному увеличению водного дефицита при достаточном количестве воды в почве препятствует сокращение транспирации в ночные часы. В нормальных условиях водоснабжения перед восходом солнца листья растений насыщены водой. Одпако при определенном сочетании внешних условий водный дефицит настолько возрастает, что ие успевает восстанавливаться за ночь. В утренние часы листья растений уже недонасыщеиы водой, появляется остаточный водный дефицит. В последующие дни, если снабжение водой не улучшится, недостаток воды будет все больше и больше нарастать. В некоторых случаях может наблюдаться вавядапие растений и утрачивается тургор. Первые фазы завядания сходны с первыми фазами плазмолиза, так как в силу уменьшения содержания воды объем клетки сокращается. Однако в дальнейшем течение процессов завядания в плазмолиза различно. При плазмолизе наружный раствор проникает через клеточную оболочку и вызывает отставание протоплазмы; при вавядапии в силу потери воды сокращающаяся протоплазма тянет за собой оболочку. На оболочке образуются как бы складки, она теряет первоначальную форму, что if вызывает потерю прямостоячего положения тканей и организма в целом. Завядаппе пе означает, что растение погибло. Если своевремепио снабдить растение водой, то тургор восстанавливается, жизнедеятельность организма продолжается, правда с большими или меньшими повреждениями. Различают два типа завядания.
Временное вавядапие. Причиной временного завядания чаше всего бывает атмосферная засуха, когда доступная вода в почве есть, однако низкая влажность воздуха, высокая температура настолько увеличивают транспирацию, что поступление воды пе поспевает ва ее расходованием. При временном завядании в основном теряют тургор листья. Чаще всего это наблюдается в полуденные часы. В ночные часы растения оправняются и к утру вновь находятся в тургесцеатном состоянии. Временное завядание, конечно, пе проходит без последствий. При потере тургора устьица закрываются, фо-86
тогпптез резко замедляется, растение ire накапливает сухого веще-етпа, а только тратит его. Однако все же временное завядапие сравнительно легко переносится растением.
Глубокое завядание наступает тогда, когда в почве почти пе остается доступной для растения воды. В этих условиях даже небольшая транспирация вызывает нее возрастающий водный дефицит и глубокое западание, при котором происходит общее иссушение всего растительного организма. Растущие молодые листья оттягивают иоду от стебля и корневой системы. Последствия такого завядапия могут быть необратимыми и губительными.
Вместо с тем непродолжительное завядаипе может рассматриваться как одни на сиособои защиты растения от гибельного обезвоживания. Так, при завядавпн благодаря устьичным и впеустьпчвым регулирующим механизмам транспирация резко сокращается, это позволяет растительному организму в течение определенного промежутка промоин сохранить воду, необходимую для поддержания жизнеспособности, и не погибнуть от полного высыхания.
Завядапие может происходить при раиной потере воды. Есть рас-теппя тенистых местообитаний с малооластичпыми клеточными оболочками, у которых потеря воды, равная 3—5%, уже вызывает за-вядапие. Однако есть и такие растения, у которых завядапие наступает только при водном дефшщте, равном 20 и даже 30%.
Водный дефицит и завядапие вызывают сдвиги в физиологической деятельности растения. Эти изменения могут быть более или мепее сильными, обратимыми н необратимыми, в зависимости от длительности обезвоживания и от вида растительного организма.
За начало страдания растений от недостатка воды обычно принимается появление оста точного утреннего водного дефицита. Одновременно в этот >ко период прекращается плач растений. Последствия водного дефицита многообразны. Прежде всего в клетках попнжает-ся содержание свободной воды, одновременно возрастает концентрация клеточного сока. Происходят глубокие изменения в цитоплазме, сильно возрастает проницаемость мембран. Клетки перестают удерживать иопы и легко отдают их во впошпюю среду. Листья, подвергшиеся занядаипю при помещении в воду, выделяют значительное количество солей и других растворимых соединений. Усиленный выход солей (экзоосмос) наблюдается также из клеток корня, подвергнутых павядаиию. Одновременно эти клетки теряют способность к поглощению питательных веществ. Обезвоживание изменяет и другие свойства протоплазмы, в частности возрастает ее вязкость. В результате нарушения гидратных оболочек меняется конфигурация белков-ферментов п, как следствие, их активность. Особенно резко падает активность ферментов, катализирующих процессы синтеза. Вместе с тем активпость ферментов, катализирующих процессы распада, возрастает. Завядапие приводит к увеличению активности ферментов, катализирующих распад белков (протеолиз). Зто может быть связало с тем, что при обезвоживании устьица закрываются, что, в свою очередь, приводит к недостатку кислорода. В результате все процессы сдвигаются в анаэробную сторону, в частности накаплива
ются сульфгидрильные группировки (SH), которые являются активаторами протеолитических ферментов. Активация работы протеолитических ферментов приводит к тому, что при завядапии содержание белкового азота резко падает, тогда как небелкового возрастает-Распад белков при обезвоживании может быть настолько глубоким, что наступает гибель растения.
Согласно подробным исследованиям процессов обмена листьев табака, проведенным А. И. Смирновым, завяданне в первую очередь сказывается па более старых листьях. При этом в них усиливаются процессы распада сложных углеводов па более простые (крахмала на сахара), а также распад белков на аминокислоты и далее до аммиака.
За последнее время много внимания уделяется изучению влияния недостатка воды па нуклеиновый обмен. Показано, что при возрастании водного дефицита приостанавливается синтез ДНК, одновременно усиливаются процессы распада этого важнейшего соединения. Усиливается также распад РНК. Возможно, что изменение в нуклеиновом обмене является одной из причин остановки синтеза белкою.
При рассмотрении вопроса о влиянии происходящих при завяда-нпи процессов распада па жизнедеятельность организма надо, по-видимому, учитывать два обстоятельства. С одной стороны, этот процесс приводит к увеличению концентрации клеточного сока, повышению осмотического давления и сосущей силы и в этой связи представляет собой защитную реакцию организма. С другой стороны, усиление процессов распада приводит к тяжелым физиологическим нарушениям и даже к гибели организма.
Недостаток воды изменяет и такие основные физиологические процессы, как фотосинтез и дыхание. Прежде всего при обезвоживании устьица закрываются, это резко снижает поступление углекислоты в лист н, клк следствие, интенсивность фотосинтеза падает-Однако уменьшение содержания воды снижает интенсивность фотосинтеза и у растений, пе имеющих устьиц (мхи, лишайпики). По-видимому, обезвоживание, изменяя конформацию ферментов, участвующих в процессе фотосинтеза, уменьшает их активность. Что касается интенсивности дыхания, то в первый период заелдаппя опа даже возрастает. Это связано с тем, что в результате усиления под влиянием завядания процесса распада крахмала возрастает количество сахаров — этого основпого субстрата дыхания. Вместе с тем при недостатке воды в клетках энергия, выделяющаяся в процессе дыхания, не аккумулируется в АТФ, а в основном выделяется в виде тепла. Таким образом, при завядании энергия дыхания не может быть использована растением. В силу этого усиление дыхания, сопровождаемое распадом органических веществ, может принести вред растительному организму.
Из всех физиологических процессов наиболее чувствительным к недостатку влаги является процесс роста. Наблюдения показывают, что в самый начальный период, когда растение испытывает недостаток влаги, фотосинтез еще идет, дыхание осуществляется нормальным путем, а рост уже приостанавливается. Это объясняется несколь— 88
кими причинами. Уменьшение содержания воды прекращает редупликацию ДНК, а следовательпо, деление клеток. Вторая фаза роста клеток (фаза растяжения) идет за счет усиленного поступления воды. В условиях недостатка воды ата фаза резко тормозится. Клетки, образовавшиеся в условиях засухи, всегда отличаются малым размером.
Таковы общие закономерности страдания растительного организма под влиянием водного стресса. Надо заметить, что отдельные органы растения страдают пе в одинаковой степени и в определенной последовательности. При начинающемся водном дефиците в растении наблюдается перераспределение воды. Молодые листья оттягивают воду от более старых, а также от корневой системы. Отмирают корневые волоски. Усиливаются процессы опробковения корней. Указанные изменения приводят к значительному сокращению воны, участвующей в поглощении воды, к снижению проницаемости клеток корпя для воды. Именно это определяет тот факт, что после длительного завядания растения оправляются медленно. Более того, способность корневых систем к поглощению воды после завядания полностью не восстанавливается. После достижения растением полного тургора процессы обмена восстанавливаются не сразу, так как водный стресс вызывает нарушения в системах регуляции.
Затянувшееся вавядапие может привести растение к гибели. В крайних случаях при внезапном и очень большом напряжении всех метеорологических факторов растение гибнет буквально от высыхания (захват) или высоких температур (запал). Однако обычно гибель растения от водного дефицита наступает еще до их полного вы-сьгхапня, и причиной ее являются нарушения обмена веществ. Осо-беппо опасно в этом отношении нарушение нуклеинового и белкового обмена. Прекращение синтеза и усиление распада белка, снижение его содержания шоке критического уровня приводит к необратимым изменениям. Организм не может восстановить способность к новообразованию белка, а без этого невозможна жизнь. Глубокий распад сложных органических соединений ведет к образованию промежуточных продуктов распада (например, аммиака), которые, накапливг ясь, отравляют организм. Не исключено также, что обезвоживали приводит к повреждению из-за резкого повышения копцентраци» клеточного сока и сдвига pH в кислую сторону.
Необходимо отметить, что растения на протяжении оптогепеза относятся к недостатку воды неодинаково. У каждого вида растений существуют «критические» периоды, т, е. периоды наибольшей чувствительности к снабжению водой. Исследования показали, что именно периоды наибольшего роста данного органа или всего растительного организма в целом наиболее чувствительны к недостатку воды. С агрономической точки врепия критические периоды — это периоды, когда наиболее интенсивно растут и формируются те органы, ради которых данное растение возделывают. Особенно чувствительными к недостатку воды являются периоды формирования пыльцы и оплодотворения (Ф. Д. Скавкин, В. В. Аникиев).
1. ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ЗАСУХОУСТОЙЧИВЫХ РАСТЕНИЙ
По отношению к воде все растения делятся на три экологические группы: 1) водные растения, которые погружены в воду целиком или частично, а также растения увлажненных местообитаний — гигрофиты; 2) растения, обитающие в среде со средним уровнем обеспеченности водой, не имеющие ясно выраженных приспособлений к избытку или недостатку воды, — мезофиты; 3) растения, обитающие в среде, характеризующейся резким недостатком воды, — ксерофиты.
Остановимся иа физиологической характеристике ксерофитов.
Ксерофиты — растения засушливых местообитаний, которые в высокой степени обладают способностью к приспособлению в процессе онтогенеза к перерывам в водоснабжении.
Ксерофиты не представляют собой физиологически однородной группы. Некоторые ксерофиты обладают малой интенсивностью транспирации, вместе с тем есть ряд ксерофитов, которые характеризуются весьма интенсивной транспирацией (Н. А. Максимов). Возможность переносить резко засушливые условия достигается разными физиологическими средствами. В связи с этим ксерофиты можно разделить на ряд подгрупп:
1) растения, избегающие васуху (эфемеры). Эти растения обладают коротким вегетационным периодом, приурочивая весь жизненный цикл к периоду дождей;
2) растения, запасающие влагу (ложныексерофиты, по Н. А. Максимову). К этой группе растений относятся суккуленты, прежде всего кактусы — растения с толстыми и мясистыми стеблями (или толстыми листьями), испаряющая поверхность у которых сильно сокращена. Листья часто редуцированы, вся поверхность покрыта толстым слоем кутикулы. Благодаря этому кактусы являются ограниченно транспирирующими растениями. Кактусы обнадают неглубокой, по широко распространяющейся корневой системой. Клетки корня характеризуются сравнительно иязкой концентрацией клеточного сона, а следовательно, нвзким осмотическим давлением. Кактусы растут в районах, где периоды резко засушливые сменяются периодами дождей, их корневая система приспособлена к поглощению этой дождевой воды. В остальное время кактусы живут за счет воды, запасаемой в их мясистых органах, причем эту воду они тратят чрезвычайно медленно. По мере уменьшения содержания воды в клетках интенсивность транспирации падает.
Суккуленты, в частности кактусы, обладают своеобразным обменом веществ. У них днем устьица закрыты, однако ночью они открываются, чтобы обеспечить доступ в лист углекислого газа, который акцептируется органическими кислотами. В клетках кактуса благодаря неполному сгоранию углеводов в процессе дыхания накапливается большое количество органических кислот. Основное количество СОз поступает в ткани кактуса через открытые устьица в иочпой период и акцептируется этими органическими кислотами. В дневные часы акцептированный СОг вновь высвобождается и используется в ео
процессе фотосинтеза. Указанная особенность позволяет этим растениям осуществлять фотосинтез при закрытых днем устьицах. Все же фотосинтез идет у кактусов чрезвычайно медленно. Как следствие, для кактусов характерно крайне медленное накопление сухого вещества — низкие темпы роста. Кактусы пе являются устойчивыми к аасухе, к водному стрессу. Обезвоживание кактусы переносят сравнительно плохо, начинают страдать и погибают. Это растения, запасающие воду и экономно ее расходующие в процессе медленного роста;
3) растения, у которых сильно развиты приспособления к добыванию воды. У пих глубоко идущая, сильно разветвленная корневая система. Клетки корпя обладают, как правило, высоким осмотическим давлением, высокой сосущей силой.
Благодаря указанным особенностям эти растения могут использовать для сбора воды очень большие объемы почвы. Их корневые системы достигают даже грунтовых вод, если последние лежат пе слишком глубоко. Растения данного типа обладают хорошо развитой проводящей системой. Листья у них тонкие, с очень густой сетью жилок, что сокращает сопротивление передвижению воды к живым клеткам листа до минимума. Это растения с очень высокой интенсивностью транспирации. Даже в очень жаркие, сухие дни опи держат устьица открытыми. Благодаря высокой интенсивности транспирации, температура листьев значительно понижается, что позволяет осуществлять процесс фотосинтеза при высоких дневных температурах. К таким тонколистпым, высокотранспирирующим ксерофитам принадлежат степная люцерна, дикий арбуз, полынь и др. Листья некоторых из них покрыты волосками. Волоски создают как бы экран, который дополнительно защищает листья от перегрева. Очень важной особенностью данного типа ксерофитов является их способность переносить достаточно глубокое обезвоживание — длительное завядапие без необратимых повреждений. При улучшении водоснабжения этот тип растеппй быстро переходит к нормальной жизнедеятельности;
4) растения, переносящие засуху в состоянии анабиоза. Это рас тения с жесткими листьями (склерофиты), которые и в состоянии тургора характеризуются сравнительно малым содержанием воды. При завядании содержание воды в этих растениях может опускаться до 25% - В обезвоженном состоянии склерофиты впадают в анабиоз (состояние покоя). Эти растения характеризуются большим развитием механических тканей. Листья у них жесткие, что позволяет им при потере тургора избежать механических повреждений. Они отличаются исключительно высокой вязкостью протоплазмы. При достаточном количестве воды интенсивность транспирации у них высокая. Вместе с тем при недостатке воды у этих растений имеется ряд приспособлений к сокращению транспирации. Так, многие из них обладают способностью к свертыванию листьев в трубку, так что устьица оказываются внутри ее. У некоторых растений устьица находятся в специальных углублениях и сверху еще закрываются смоляными пробками. Иногда листья редуцированы. К этому типу ксерофитов относятся такие растения, как ковыль, типчак и др.
Таковы основные типы ксерофитов. Естественно, что в природе нет строгого разграничения и существует много переходных типов. Устойчивыми к засухе являются лишь последние два типа, которые действительно способны переносить обезвоживапие.
С агрономической точки зрения чрезвычайно важным является вопрос, чем определяется степень устойчивости к засухе растений среднего типа — мезофитов, к которым относятся и все паши культурные растения. В выяснении этого вопроса большую роль сыграли работы выдающихся русских физиологов В. Р. Заленского, Н. А. Максимова, П. А. Генкеля п др. Благодаря их исследованиям выяснилось, что засухоустойчивость — это комплексный признак, связанный с целым рядом физиологических особенностей. Основным, определяющим признаком является способность растений переносить обезвоживание без резкого снижения ростовых процессов и урожайности. В свою очередь, это свойство определяется, по-видимому, прежде всего устойчивостью цитоплазмы или ее способностью сохранять особенности структуры при уменьшении гидратных оболочек, окружающих молекулы белка, а также устойчивостью ферментных систем. Иначе говоря, засухоустойчивость определяется способностью растительного организма как можно меньше изменять процессы обмена веществ в условиях недостаточного водоснабжения. Так, засухоустойчивые сорта обладают способностью поддерживать синтетическую деятельность ферментов на высоком уровне даже при сильном завядапни (Н. М. Сисакян).
Большое значение имеют также анатомо-морфологические признаки. В 1904 г. известным русским физиологом В. Р. Заленским было показано, что анатомическая структура листьев правильно изменяется в зависимости от их яруспости. Оказалось, что, чем выше расположен лист, тем более в нем выражены определенные признаки: мельче клетки, мельче величина устьиц, большее число устьиц, большее число жилок на единицу поверхности листа, более сильно развита палисадная паренхима. Одновременно, чем выше расположен лпст, тем более высокой транспирацией и большей интенсивностью фотосинтеза он обладает. Указанные закономерности получили название закона Заленского. При изучении причин данного явления выяснилось, что оно является следствием худшею водоснабжения верхних листьев. Одновременно было показано, что у листьев растений, выращенных в более засушливых условиях, проявляются те же изменения, как н у листьев более верхнего яруса. В связи с этим совокупность наззанпых анатомо-физпо логических признаков получила назвение ксероморфной структуры. Растения, листья которых обладают ксероморфной структурой, более устойчивы к засухе.
Для характеристики устойчивости того пли иного растения к засухе имеет значение величина транспирационного коэффициента. Этот показатель может служить характеристикой, указывающей на более экономное расходование воды. Сравнение расходования воды с накоплением сухого вещества растением правомерно потому, что интенсивность того и другого процесса связана в определенной мере со степенью открытости устьиц.
в2
Подводя итоги, можно сказать, что при оценке и выведении засухоустойчивых сортов селекционеры могут использовать совокупность всех рассмотренных признаков. Наряду с селекционной работой в настоящее время предложены методы так называемого предпосевного закаливания растений к засухе. Было подмечено, что растения, перенесшие засуху, становятся более устойчивыми к обезвоживанию. Однако, если завяданию подвергается взрослое растение, темпы роста и продуктивность его снижаются. В этой связи П. А. Генкелем предложено проводить подсушивание намоченных семяп перед посевом. Из таких семяп вырастают растения, более устойчивые к аасу-хе. По-видимому, при подсушивании перестраивается характер белков-ферментов и опи становятся менее чувствительными к потере воды. Вместе с тем новые клетки п органы, возникающие на меристем, перенесших обезвоживание, характеризуются сравнительной мелко-клеточяостыо и другими ксероморфпыми признаками и, как следствие, большей устойчивостью.
3. ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ ОРОШЕНИЯ
Наибопее радикальным способом борьбы с засухой является орошение. Однако для правильного применения этого приема, установления сроков и норм полива необходимы методы, позволяющие определять нуждаемость растений в воде. Это особенно важно потому, что как избыточное, так и недостаточное орошение пе только пе лает положительного эффекта, во может привести к отрицательным результатам. При избыточном орошепип растение пе успевает использовать даваемую ему воду. Избыток воды уплотняет, а иногда даже заболачивает почву, и тем самым резко ухудшает снабжение корней кислородом. Недостаток кислорода приводит к накоплению в почве закисных соединений, ядовитых для растений, и одновременно уменьшается интенсивность дыхания клеток корня. В ревультате падения интенсивности дыхания поступление питательных веществ в клетки корпя тормозится. При избыточном увлажнении часто наблюдается также засоление почвы. Вода, проникая в глубокие слои почвы, богатые солями, растворяет их, раствор солей поднимается вверх по капиллярам. Как следствие концентрация солей в пахотном горизонте растет. Большинство культурных растений очень чувствительно к концентрации солей. В результате из-за неправильного пользования поливной водой и засоления приходится забрасывать обширные пространства плодородных земель с дорогостоящими оросительными сооружениями.
Недостаточные поливы также могут привести к нежелательным последствиям. При длительных межполивнах периодах растения периодически попадают в условия засухи. Растения, получившие полив, развивают большую листовую поверхность и теряют значительное количество воды в процессе транспирации, вся их структура уклоняется в сторону большей влаголюбивости. Такие растения требуют больше влаги и при перерывах в водоснабжении страдают сильнее по сравнению с растениями, совсем не получившими полива.
Из сказанного понятно, что сроки и нормы полива (схема орошения) должны быть таковы, чтобы растения не испытывали недостатка в воде и в то же время чтобы они успевали израсходовать почти всю данную им за полив воду. При йтом надо учитывать, что особенно важно обеспечить растения водой в так навиваемые критические периоды (см. с. 89). Схема орошения может быть заранее фиксирована только в тех районах, где осадков практически нет. В гоне неустойчивого увлажнения схема орошения должна изменяться в зависимости от метеорологических условий, а также от темпов роста растительных организмов. Наилучшие результаты дает определение сроков полива по физиологическому состоянию самого растительного организма (Н. С. Петипов). Для определения нуждаемости растений в воде могут быть использованы различные показатели: 1. Содержание воды в листьях. 2. Степень открытости устьиц. 3. Интенсивность транспирации. 4. Величина сосущей силы.
Надо учитывать, что орошение оказывает глубокое влияние не только на водный режим почвы, по и на приземный климат. С помощью орошения можно изменить микроклимат в сторону, благоприятную для растений. С этой точки зрения большое значение имеет введение освежительных поливов малыми нормами (дождевание). Эти поливы повышают влажность и снижают температуру приземного воздуха, что положительно влияет на растение. Применение орошения требует особенно тщательной регулировки питания растений.
Список ревоиеидуемой литературы
Жолкевич В. Н. Энергетика дыхания высших растений в условиях водного дефицита. М., Наука, 1968,
Козловский. Водный обмен растений. М-, Колос, 1969.
Максимов Н. А. Избранные работы по засухоустойчивости и зимостойкости растений. М_, Ивд-во АН СССР, 1952, т. 1.
П е т и а о в Н. С. Физиология орошаемых сельскохозяйственных растений. XIV Тимирязевское чтение. М., Изд-во АН СССР, 1962,
Сабинин Д. А. О значении корневой системы в жизнедеятельности рас-тевлй. IX Тимирязевское чтение. М., Иад-во АН СССР, 1949.
Скавклв Ф. Д. Критический период у растений к недостаточному водоснабжению. М., Неука, 1968.
Слейчер Р. Водный режим растений, м.. Мир, 1970.
Глава III.
ПИТАНИЕ РАСТЕНИЙ УГЛЕРОДОМ (ФОТОСИНТЕЗ)
Анализ органического вещества показывает, что оно состоит на 45% из углерода. Именно поэтому вопрос об источнике питания организмов углеродом чрезвычайно важен. Все организмы можно разделить на автотрофные и гетеротрофные. Автотрофные организмы характеризуются способностью синтезировать органическое вещество из неорганических соединений. Гетеротрофные организмы строят органическое вещество своего тела из уже имеющихся готовых органических соединений, только перестраивая их. Иначе говоря, гетеротрофные организмы живут за счет автотрофных. Для того чтобы осуществить синтиз органического вещества, необходима енергия. В зависимости от используемого соединения, а также от источников энергии различают следующие основные типы питения углеродом i построения органических веществ.
Таблица 4
Ten питания Источник углерода Неточная водорода Источвик еяедгия
I. Гетеротрофный Органическое вещество Органическое вещество Органическое вещество
11. Автотрофный
1. Фотосинтез СО, Н,0 Энергия клан тов света
2. Фоторедукция
(бактериальный фотосинтез) 3. Хемосинтез со£ H,S. Н4 и др. То же
соа Н20, NHS, HsS. Н2 Энергия химических реакций
ЗНАЧЕНИЕ ПРОЦЕССА ФОТОСИНТЕЗА
И ИСТОРИЯ ЕГО ИЗУЧЕНИЯ
Из всех перечне лепных типов питания углеродом фотосинтез, при котором построение органических соединений идет за счет простых неорганических веществ (СОз и 1ЬО) с использованием энергии сол-изчного света, занимает совершенно особое место. Фотосинтез характерен для всех зеленых растений.
Общее уравнение фотосинтеза:
6СО2 4- 12Н2О ——------> С£Н12Ов + 6Оа + 6Н4О
хлорофилл
Фотосинтез — это процесс, при котором энергия солнечного света превращается в химическую энергию. В самом общем виде это можно представить следующим образом: квант света (hv) поглощается хлорофиллом, молекула которого переходит в возбужденное состояние, при зтом электрон пераходит на более высокий энергетический уровень. В клетках зеленых растений в процессе эволюции выработайся механизм, при котором энергия электрона, возвращающегося па основной энергетический уровень, превращается в химическую энергию. Только с помощью зеленых растений энергия Солпца может накапливаться в виде энергии химических связей. Таким образом, органические вещества, которыми питаются животные и человек, первоначально создаются в зеленом листе. Большая часть той энергии, которая используется человеком иа заводах и фабриках, т. е. энергия, благодаря которой происходит движение различных механизмов, машип п самолетов,— это все энергия Солгща, преобразованная в зеленом листе.. Исследования показали, что весь кислород атмосферы фотосинтетического происхождения. Следовательно, процессы дыхания и горения стали возможны только после того, как возник фотосинтез. Все вто п позволяет говорить о космическом значении фотосинтеза. Чтобы лучше представить себе масштабы процесса фотосинтеза, приведем несколько цифр. Согласно данным французского исследователя Дювиньо (1972), ежегодно в процессе фотосинтеза растениями суши образуется 3,1 -1010 т органического вещества, в том чиспе на долю лесов приходится 2,04-1010 т, лугов, степей—0,3-•1010т, пустынь — 0,11-10“ т, культурных полей — 0,56-1010 т. Если учесть продукцию органического вещестза растений планктона, цифры значительно возрастут и достигнут величины примерно 5,8- 1010т в год. Энергия, накапливаемая в процессе фотосинтеза за один год, приблизительно в 100 раз больше энергии сгорания всего добываемого в мире за этот же период угля.
Казалось бы, что при таком колоссальном годовом потреблении углерода весь СОг воздуха должен быть израсходован в течение немногих лет. Однако содержание СОг в атмосфере непрерывно пополняется за счет растворенных в воде карбонатов и бикарбонатов. Кроме того, углекислый газ выделяется из ночвы в результате различных микробиологических процессов, связанных с окислением органических веществ (до 25—30 кт СОа на 1 га в сутни). Фотосинтез имеет важнейшее значение и в жизпи самого растительного организма. Согласно расчетам А. А. Ничипоревича, в период наиболее активного роста растений суточные приросты сухого вещества достигают 300 и даже 500 кг/га. При этом в течение суток растение усваивает 1— 2 кг N, 0,1—0,2 кг Р, 0,8—1,7 кг К и до 1000 кг СОа.
Учитывая значение процесса фотосинтеза, раскрытие его механизма является одной пэ наиболее важных и интересных задач, стоящих перед физиологией растений. Датой открытия процесса фотосин-S6
теза можно считать 1771 г. Английский ученый Д. Пристли обратил внимание на изменение состава воздуха вследствие жизнедеятельности животных. В присутствии зеленых растений воздух вновь становился пригодным как для дыхания, так и для горения. В дальнейшем работами ряда ученых (Мпгепгауз. Сенебье, Соссюр, Буссепго) было установлено, что зеленые растения из воздуха поглощают СОг, из которого при участии воды па свету образуется органическое вещество. Именно этот процесс в 1877 г. немецкий ученый Пфеффер назвал фотосинтезом. Большое значение для раскрытия сущности фотосинтеза имел закон сохранения энергии, сформулированный Р. Майером. В1845 г. Р. Майер выдвинул предположение, что энергия, используемая растениями, — это энергия Солнца, которую растения в процессе фотосинтеза превращают в химическую анергию. Это положение было развито и экспериментально подтверждено в исследованиях замечательного русского ученого К. А. Тимирязева.
ЛИСТ КАК ОРГАН ФОТОСИНТЕЗА.
ОСОБЕННОСТИ ДИФФУЗИИ СОа В ЛИСТЕ
Анатомическое строение листа приспособлено к тому, чтобы обеспечить поступление СОг к клеткам, содержащим зеленые пластиды. Наличие межклетников облегчает доступ СОг ко всем клеткам. К эпидермису, расположенному на верхней стороне листа, примыкает палисадная паренхима, клетки которой вытянуты перпендикулярно поверхности листа. Палисадная паренхима — это основная ассимиляционная ткань листа, особенно богатая хлоропластами. Густая сеть жилок в листе пе только облегчает снабжение клеток паренхимы водой, по и способствует быстрому оттоку из листа углеводов, образующихся в процессе фотосинтеза. Для того чтобы процесс фотосинтеза протекал нормально, в клетки к зеленым пластидам должен непрерывно поступать СО2. Небольшое количество СО2 образуется в самом листе в результате дыхания. Одпако основным поставщиком COj служит атмосфера. Количество COj в атмосфере составляет около 0,03%- В результате поглощения листом COj возникает градиент концентрации этого газа, что и вызывает непрерывную диффузию СО2 в направлении фотосинтезирующих органов растения. COj диффундирует из более дальних слоев атмосферы в блиаяежащие к листу и далее в межклетные пространства, из межклетников в клетки и далее к хлоропластам. Чем быстрее используется COi в процессе фотосинтеза, тем больше падает ее парциальное давление в межклетниках и тем быстрее поступает в них СОг- В процессе диффузия ток СО2 встречает сопротивление. Ойо особенно велико при диффузии СОг к листьям водных растений. Исследования показали, что в вода сопротивление диффузионному току СОг примерно в 1000 раз больг ше, чем в воздухе. Всякое перемешивание среды (воздуха или воды) способствует более быстрой диффузии СО2 к листу. Кроме внешнего сопротивления, которое встречает СОа при диффузии, до поверхности листа, существует еще внутреннее сопротивление (в самом листе).
СОг поступает в лист растении через устьица. Некоторое количество СОз поступает непосредственно через кутикулу. В последнем случае диффузия СО2 происходит в виде H2CO2 через клетки эпидермиса к хлоропластам клеток паренхимы листа. При прохождения через устьичные щели СОг может диффундировать в виде газа к любой части листа по.менсклеточиым пространствам. В этом случае водный диффузионный путь через мембрану внутрь клетки до хлоропласта будет минимальным, а следовательно, сопротивление меньшим.
Несмотря на то что при полностью открытых устьицех площадь устьичных щелей составляет всего 1/100 поверхности листа, диффу-вия С02 внутрь листа идет через иих сравнительно быстро. Опытным путем установлено, что свободная поверхность щелочи площадью 1 см2 погнощает sa 1 ч 0,12—0,15 см® СОг; 1 см2 поверхности листа поглощает всего в два раза меньше — 0,07 сма СОг, между тем его открытая площадь меньше в 100 раз. Такая высокая скорость связана с тем, что диффузия газов чериз мелкие отверстия идет пропорционально пе их площади, а их диаметру (см. с. 68). Естественно, что это положение правильно лишь при условии, что устьица открыты. При закрытых устьицах диффузия СО2 в лист сокращается примерно на 80%- При ветре основное значение приобретает сопротивление, которое встречает СО2 при диффузии через устьица, поэтому их закрытие оказывает еще большее относительное влияние и снижает диффузию СОг на большую величину (90%).
Закрытие устьиц сильнее уменьшает потерю паров воды из листа (транспирацию) по сравнению с диффузией СОг внутрь листа. Это обстоятельство имеет важное значение для выживания растений в крайних условиях существования (засуха).
ХЛОРОЛЛАСТЫ, ИХ СТРОЕНИЕ И ОБРАЗОВАНИЕ
Весь процесс фотосинтеза протекает в зеленых пластидах — хлоропластах. Различают три вида пластид: лейкопласты — бесцветные, хромопласты — оранжевые, хлоропласты — зеленые. Именно в хлоро-пластах сосредоточен зелепый пигмент хлорофилл.
Незеленые растения, например грибы, лишены пластид. Эти растения не обладают способностью к фотосинтезу. В процессе эволюции дифференциация пластид произошла очень рано. Правда, у фотосинтезирующих бактерий и сине-зеленых водорослей пластид еще нет, их роль выполняет окрашенная часть протоплазмы, прилегающая к оболочке. Это наиболее примитивная организация фотосинтетического аппарата. Однако уже у водорослей имеются специальные образования (хроматофоры), в которых сосредоточены пигменты, они разнообразны по форме (спиральные, ленточные, в виде пластинок или ввезд). Высшие растения характеризуются вполне сформировавшимся типом пластид в форме диска или двояковыпуклой линзы Приняв форму диска, хлоропласты становятся универсальным аппаратом фотосинтеза/
1. ХИМИЧЕСКИЙ СОСТАВ И СТРОЕНИЕ ХЛОРОПЛАСТОВ
Химический состав хлоропластов достаточно сложен и может быть охарактеризован следующими средними данными (% на сухую массу): белок—35—55; липиды — 20—30; углеводы—10; РНК — 2—3; ДНК — до 0,5; хлорофилл — 9; каротиноиды — 4,5.
Важно отметить, что многие белки хлоропластов обладают ферментативной активностью. Действительно, в хлоропластах сосредоточены все ферменты, принимающие участие в процессе фотосинтеза (окислительно-восстановительные, синтетазы, гидролазы). В настоящее время показано, что в хлоронластах, так же как и в митохондриях, имеется своя белоксиитезирующая система.
Многие из ферментов, локализованных в хлоропластах, являются двухкомпонентными. Во многих случаях простатическая группа ферментов— »то различные витамины. В хлоропластах сосредоточены многие витамины и их производные (витамины группы В, К, Е, D). В хлоропластах находится 80% Ре, 70% Zn, около 50% Си от всего количества этих элементов в листе. Размер хлоропластов колеблется от 4 до 10 мкм. Число хлоропластов обычно составляет от 20 до 100 на клетку.
Внутреннее строение хлоропластов, их упьтраструктура была раскрыта после того, как появился электронный микроскоп. Оказалось, что хлоропласты окружены двойной оболочкой (мембраной). Толщина каждой оболочки 7,5—10 нм, расстояние между ними 10— 20 нм. Внутреннее пространство хлоропластов пронизано мембранами (ламеллами). Мембраны, соединенные друг с другом, образуют как бы пузырьки — тилакоиды (греч. «тилакоидес»—мешковидный) -В хлоропластах тилакоиды двух типов. Короткие тилакоиды собраны в пачки (фаны) и расположены друг над другом, напоминая стопку монет. Длинные тилакоиды расположены параллельно друг другу. Короткие тилакоиды состоят из ламелл гран, длинные тилакоиды—ламеял стромы. Все ламеллы погружены в среду зернистого строения — строму.
Относительно связи между ламеллами грав и ламеллами стромы-имеются разные, точки зрения. Существует мление, что ламеллы гран как бы зажаты между ламеллами стромы. Т. Вейер предложил гранулярпо-ре-шетчатую модель, согласно которой внутренние пространства всех тилакоидов соединены между собой (рис. 27). У хлоропластов большинства водорослей гран нет, а ламеллы собраны в группы (пачки) по
2—8 штук. Не во всех случаях и у Рис. 27. Схема граяулярно-сетча-высших растений хлоропласты име- той структуры хлоропласта.
Рис. 28. Электронно-микроскопические фотографии хлоропласта в клетке мезофилла листа (увел. 100 000).
Рис. 29. Электронно-микроскопическая фотографии хлоропласта в клетке обкладки листа кукурузы (увел. 48000).
ют гранильную структуру. Так, в листьях кукурузы имеются два вида хлоропластов. В клетках мезофилла содержатся мелкие хлороппа-сты, гранальпого строения (рис. 28). В клетках обкладки, окружающих листовые сосудистые пучки, хлоропласты крупные и гран пе содержат (рис. 29).
Лайеллы хлоропластов состоят из глобулярных липопротеиновых субъединиц. При этом белки и липиды связаны друг с другом и об-равуют комплексы. По мпепию I. Вейера, каждая липопротеиновая субъединица включает пигменты, а также все компоненты электронно-транспортной цепи (см. с. 128). На наружной поверхности мембраны тилакоидов сосредоточены гидрофильные группировки белка и галакто- и сульфолипиды. Молекулы хлорофилла определенным образом ориентированы в мембранах. При этом их фитольная часть (хвост) погружена в глобулу и находится в контакте с Гидрофобными группами белковых
молекул. Порфириновые ядра (головка) молекул хлорофилла в оспенном локализованы в пространстве между соприкасающимися мембранами тилакоидов гран. Молекулы хлорофилла могут быть и в мембранах стромы. В этом случае они находятся внутри субъединиц.
2. ОНТОГЕНЕЗ ПЛАСТИД
Хлоропласты е клетках листа растут п развиваются, т. е. имеют свой овтогеиеа. Так же как и для митохондрий, начальной стадией роста хлоропластов являются инициальные частицы. Эти частицы глобулярные образования, окруженные двойной мембраной, значительно более плотной консистенции по сравнению с окружающей гиалоплазмой. По внешнему вцду инициальные частицы хлоропластом и митохондрий настолько сходны, что их различить можно, только проследив их дальнейшую судьбу.
По мере роста клетки, инициальные частицы увеличиваются в размере и приобретают форму двояковыпуклой линзы. Одновременно их внутренняя мембрана начинает разрастаться, образуя складки. От складок отшцуровываются пузырьки (тилакоиды), которые располагаются параллельно и пронизывают всю строму. На этой стадии развития частицы становятся видимыми в световой микроскоп (0,3— 0,5 мкм) — это уже пропластиды.
Для дальнейшего равпития структуры пропластид необходим свет. Па свету образуется хлорофилл. Молекулы хлорофилла локализуются в мембранах. Имеппо па свету образуются два типа тилакоидов. Длинные тилакоиды тянутся через псе продольное сечение пластид и образуют тилакоиды стромы. Короткие тилакоиды располагаются стопкой друг под другом и образуют тилакоиды гран. Пластиды достигают окончательного размера (рис. 30). Непосредственно из пропластид могут образовываться и бесцветные пластиды (лейкопласты-амилопласты) (рис. 31). Лейкопласты чаще всего локализованы в клетках запасающих ткапей. Подобно пропластидам они характеризуются слабо развитой ламеллярном структурой. Во многих случаях в лейкопластах ламеллы сохраняют связь с внутренней оболочкой. В строме лейкопластов располагаются крахмальные зерня, осмио-фильпые глобулы, белковые включения. Хромопласты — ато, по-видимому, результат деградации хлоропластов, образовавшиеся за счет частичного разрушения ламеллярной структуры. Одновременно происходит образование осмиофильных глобул, содержащих каротиноиды. Эти глобулы располагаются сплошным слоем под оболочкой пластид.
Как возникают пластиды? На этот счет единого мнения нет. Имеются наблюдения, что вся система, развивающихся клеточных органелл в яйцеклетке разрушается. Вокруг ядра в большом количестве можно видеть округлые образования, окруженные двойной мембраной, — инициальные частицы. Происхождение этих инициальных частиц ио установлено. До настоящего времени пе удавалось наблюдать их деления. Это позволяет предположить, что инициальные частицы возникают вповь (de novo) иэ оболочки ядра иди эндоплазма
тического ретикулума. Советский исследователь С. В. Тагеева наблюдала, что вокруг ядра яйцеклетки нарцисса располагаются пропластиды, при этом их оболочка соединена с ядерной. Затем из этих образований постепенно развиваются хлоропласты.
Однако есть и иная точка зрения, основанная на наблюдениях о существовании пластидной (виехромосомиой) наследственности. Как известно, у раздельнополых организмов женские и мужские гаметы вносят в зиготу одинаковый вклад в отношении генов. Женская гамета содержит во много раз больше цитоплазмы. Еще ранпие исследования Корренса показали, что окраска листьев у пестролистных растений наследуется исключительно по материнской линии. Так, окава-лось, что цветки, развившиеся на зеленых побегах, дают семена, из
Рис. 30. Онтогенез хлоропластов.
которых вырастают растения с зелеными листьями. Цветки па ветвях с пестрыми листьями дают семена, из которых вырастают пестролистные растения. Окраска листьев растений, с цветков которых собиралась пыльца для опыления, не имеет значения для потомства. Эти опыты и привели к предположению, что хлоропласты представляют собой генетически автономные образования и их свойства наследуются по материнской линия. Это подтверждается тем, что хлоропласты содержат специфические молекулы ДНК и обладают белокспптезирутощей системой. В втой связи рядом исследователей
Рис. 31. Лейкопласты, накапливающие крахмал (амилопласты) (по Н. В. Парамоновой).
выдвигается предположение о том, что пластиды возникают только путем самовоспроизведения, которое и происходит в аиготе. Правда, исследования показали, что хлоропласты нельзя отнести к полностью автономным образованиям. В самом деле, количество находящейся в пластидах ДНК пе может обеспечить все разнообразие пластидных белков. Частично белки хлоропластов обравуются под контролем ядра (Ю. С. Насыров). Таким обралом, окончательного вывода о первоначальном происхождении пластид пока нет.
В сформировавшейся клетке растущих листьев пластиды размножаются путем деления. Деление может происходить или па стадии пропластид (у высших растений), или на стадия уже сформировавшихся хлоропластов (у водорослей и папоротников). Пнастиды делятся или путем возникновения поперечных перегородок, или, реже, путем почкования. Поперечные перегородки образуются за счет образования складок на внутренней мембране. До тех пор, пока складка внутренней м:ембрапы ие поделила тело пластид, наружная мембрана сохраняется и объединяет обе дочерние пластиды. Дальнейшее поведение наружной мебрапы неясно. Она либо разрывается, либо обраву-ст складки.
Большой интерес представляет вопрос о возникновении хлоро-пластов в клетке в процессе эволюции. Поскольку хлоропласты представляют собой относительно независимое от ядра образование, способное к делению, росту, дифференциации, возникла гипотеза о том,
что на заре эволюции хлоропласты, так же как митохондрии, представляли собой самостоятельные организмы (с. 26). Согласно втой гипотезе хлоропласты возникли в результате симбиоза какого-то автотрофного микроорганизма, способного трансформировать энергию солнечного света, с гетеротрофной клеткой хозяина. В этой связи интересно, что в 1969 г. было показано, что изолированные клетки млекопитающих способны заглатывать путем фагоцитоза выделенные из листьев хлоропласты. Захваченные клетками хлоропласты выжи-
вали па протяжении тести клеточных делений. При этом они сохраняли структуру и делились. Вновь выделенные из этих клеток хлоропласты ие потеряли способности к фотосинтезу.
3. ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ХЛОРОПЛАСТОВ
Важным свойством хноропластов является их способность к движению. Хлоропласты передвигаются пе только вместе с цитоплазмой, но способны и самопроизвольно изменять свое положение в клетке. Скорость движения хлоропластов составляет около 0,12 мкм/с.
Хлоропласты могут быть распределены в клетке равномерно, однако чаще опи скапливаются около ядра и вблизи клеточных стенок. Большое значение для расположения хлоропластов в клетке имеют направление и интенсивность освещения. При малой интенсивности освещения хлоропласты становятся перпендикулярно к падающим лучам, что является приспособлением к лучшему их улавливанию. При высокой освещенности хлоропласты передвигаются к боковым Степкам и поворачиваются ребром к падающим лучам. В зависимости от освещения может также меняться и форма хлоропластов. При более высокой интенсивности света их форма становится ближе к сферической.
Основная функция хлоропластов — это процесс фотосинтеза-13 1355 г. Д. Арион показал, что в изолированных хлоропластах может быть осуществлен весь процесс фотосинтеза. Важно отметить, что хлоропласты имеются ие только в клетках листа. Они встречаются в клетках пе специализирующихся па фотосинтезе органов: в стеблях, колосковых чешуйках и остях колосьев, корнеплодах, клубнях кертофеля и г. д. В ряде случаев зеленые пластиды обнаруживаются в тканях, расположеппых не в наружных, освещенных частях растений, а в слоях, удаленных от света, в тканях центрального цилиндра, стебля, в средней части луковицы лилейных, а также в клетках зародыша семени многих покрытосеменных растений. Последнее явление (хлорофиллопосность зародыша) привлекает внимание систематикой растений. Имеются предложения разделить все покрытосеменпые растения иа две большие группы: хлороэмбриофиты и лейкоэмбрио-фиты, т. е. содержащие и не содержащие хлоропласты в зародыш© (Яковлев). Исследования покезали. что структура хлоропластов, расположеппых в других органах растения, так же как и состав пигментов, сходны с хлоропластами листа. Зто дает основания считать, что они способны к фотосинтезу. В том случае, если они подвергаются освещению, по-видимому, в них действительно происходит фотосинтез. Так, фотосинтез хлоропластов, расположенных в остях колоса, может составлять около 30% от общего фотосинтеза растения. Позеленевшие па свету корни способны к фотосинтезу. В хлоропластах, находящихся, в кожуре плода до определенного этапа его развития, также может идти фотосинтез. Согласно предположению А. Л. Кур-санова, хлоропласты, расположенные вблизи проводящих путей, выделяя кислород, способствуют повышению интенсивности обмена веществ ситовидных трубок.
К4
Вместе с тем роль хлоропластов пе ограничивается пх способностью к фотосинтезу. В определенных случаях опп могут служить источником питательных веществ (Е. Р. Гюббепет). Хлоропласты содержат большее количество витаминов, ферментов и даже фитогор-монов (в частности, гиббереллина). В условиях, при которых ассимиляция исключена, зеленые пластиды могут играть активную роль в процессах обмена веществ. Известно, что присутствие листьев, помо-щепных в условия, исключающие фотосинтез (закрывание землей), улучшает рост растений. Показано благоприятное влияние листьев на процесс сращивания привоя и подвоя.
Все сказанное еще раз подчеркивает многообразную роль, которую играют зеленые пластиды в жизни растительного организма.
ПИГМЕНТЫ ЛИСТА
Для того чтобы свет мог оказывать влияние ла растительный организм и, в частности, быть использованным в процессе фотосинтеза, необходимо его поглощение фоторецепторами-пигментами-
Пигменты — вещества, имеющие окраску. Видимая часть спектра представлена длинами воли от 400 до 800 ям. Органические вещества, поглощающие свет с длиной волны менее 400 пм, кажутся бесцветными.
1. ХЛОРОФИЛЛЫ
Важнейшую роль в процессе фотосинтеза играет зеленый пигмент— хлорофилл. Французские ученые Пелетье л Кавспту (1818) выделили из листьев зеленое вещество и назвали его хлорофиллом (от греч. «хлорос» —зеленый и «фнллоп»— лист). В настоящее время известно около 10 хлорофиллов. Они отличаются по химическому строению, окраске, распространению средл живых организмов. У всех высшпх веленых растений содержатся хлорофиллы а и Ъ. Хлорофилл с содержится в диатомовых водорослях, хлорофилл d— в краспыу водорослях. Кроме того, известны четыре бактериохлорофилла (а, I end), содержащиеся в клетках фотосинтезирующих бактерий В клетках зеленых бактерий содержатся бактериохлорофиллы с и с.. В клетках пурпурных бактерий — бактериохлорофиллы а и Ь. Основными пигментами, без которых фотосинтез не идет, являются хлорофилл а для зеленых растений м бактериохлорофилл для бактерий.
Впервые точное представление о пигментах зеленого листа было получено благодаря работам крупнейшего русского ботаника М. С. Цвета. Он выделил пигменты листа в чистом виде п разработал новый хроматографический метод разделения веществ. Метод этот в дальнейшем получил широкое .применение как в биохимии, так и в чисто химических исследованиях.
Хроматографический метод разделения веществ основан на их различной способности к адсорбции. М. С. Цвет пропускал вытяжку из листа через стеклянную трубку, заполненную порошком — мелом или сахарозой (хроматографическую колонку). Отдельные компонен
ты смеси пигментов различались по степени адсорбируемости и передвигались с разной скоростью, в результате чего они концентрировались в разных зонах колонки. Разделяя колонку па отдельные части (зоны), используя соответствующую систему растворителей, можно было выделить каждый пигмент.
Хлорофиллы а и Ъ различаются ио цвету. Хлорофилл а имеет сине-зеленый оттенок, а хлорофилл Ь — желто-зеленый. Содержание хлорофилла а в листе примерно в три раза больше по сравнению с хлорофиллом Ъ.
Химические свойства хлорофилла
По химическому строению хлорофилл — это сложный эфир дикарбоновой органической кислоты — хлорофиллина и двух остатков спиртов — фитола и метилового. Хлорофиллин представляет собой
азотсодержащее металлорганическое соединение, относящееся к маг-ний-порфиринам. Эмпирическая формула хлорофиллина следующая: ,соон
.В хлорофилле водород карбоксильных групп
замещен остатками двух спиртов — метилового СНзОН и фитола СаоНзэОН. На рисунке 32, А дана структурная формула хлорофилла а. Хлорофилл Ъ (рис. 32, Б) отличается тем, что содержит на два атома водорода меньше и на один атом кислорода больше (вместо _ лО
группы СНз группа Q ). В связи с этим молекулярная масса хло-ХН
рофилла а — 893 и хлорофилла Ь — 907-
13 центре молекулы хлорофилла расположен атом магния, который соединен с четырьмя азотами пиррольных группировок. В пиррольных группировках хлорофилла имеется система чередующихся двойных и простых связей. Это и есть хромофорная группа хлорофилла, обусловливающая его окраску.
Расстояние между атомами авота пиррольных группировок в ядре хлорофилла составляет 0,25 нм. Интересно, что диаметр атома магния равен 0,24 им. Таким образом, магний почти полностью заполняет пространство между атомами азота пиррольных группировок. Это придает ядру молекулы хлорофилла дополнительную прочность. Еще К. А. Тимирязев обратил внимание на близость химического строения двух важнейших пигментов: зеленого — хлорофилла листьев и красного— гемина крови. Действительно, если хлорофилл относится к магний-порфпринам, то гемин — к желевопорфпринам. Сходство это не случайно и служит еще одним доказательством единства всего органического мира.
Одной из специфических черт строения хлорофилла является наличие в его молекуле, помимо четырех гетероциклов, еще одной циклической группировки из пяти углеродных атомов — циклопепта-нопа. В циклопентанонном кольце содержится кетогрупда, обладающая большой реакционной способностью. Есть данные, что в резуль-
Рис. 32. Л — хлорофилл а; Б— хлорофилл Ъ.
|сно|
тате процесса эполизации по месту атой кетогруппы к молекуле хлорофил.па присоединяется вода.
Изелечеппый из листа хлорофилл легко реагирует как с кислотами, так и со щелочами. При взаимодействии со щелочью происходит омыление хлорофилла, в результате чего образуются два спирта и щелочная соль хлорофиллина. В интактном живом листе от хлорофилла мсжет отщепляться фитол под воздействием фермента хлорофиллазы.
При взаимодействии со слабой кислотой извлеченный хлорофилл теряет зеленый цвет, образуется соединение феофитин, у которого атом нашил в центре молекулы замещен па два атома водорода.
Хлорофилл в живой интактной клетке обладает способностью к обратимому окислению и восстановлению. Способность к окислителЬ-по-восстановительпым реакциям связана с наличием в молекуле хло
рофилла сопряженных двойных связей. Эти связи фиксированы не прочно, и при их перемещении азот пиррольных ядер может окисляться (отдавать электрон) или присоединять электрон (восстанавливаться).
Молекула хлорофилла полярна, ее порфириновое ядро обладает гидрофильными свойствами, а фитольный конец — гидрофобными. Это свойство молекулы хлорофилла обусловливает определенное расположение ее в мембранах хлоропластов.
Исследования показали, что свойства хлорофилла, находящегося в листе и извлеченного из листа, различны, так как в листе ои находится в комплексном соединении с белком подобно гемоглобину крови. Это доказывается следующими данными: 1. Спектр поглощения хлорофилла, находящегося в листе, иной но сравнению с извлеченным хлорофиллом. 2. Хлорофилл невозможно извлечь абсолютным спиртом из сухих лястьев. Экстракция протекает успешно, только если листья увлажнить пли к спирту добавить воды. 3. Выделенный ив листа хлорофилл легко подвергается разрушению под влиянием самых разнообразных воздействий (повышенная кислотность, кислород и даже сеет). Между тем в листе хлорофилл достаточно устойчив ко всем перечисленным фекторам. Следует заметить, что связь менаду хлорофиллом н белком несколько иного характера, чем между гемнном и белком. Установлено, что для гемоглобина характерно постоянное соотношение — па 1 молекулу белка приходится 4 молекулы гемина. Между тем соотношение менаду хлорофиллом и белком различно (от 3 до 10 молекул хлорофилла па 1 молекулу белка) Это соотношение претерпевает изменения в зависимости от типа растений, фезы их развития, условий среды. Согласно исследованиям Т. Н. Годнева, связь менаду молекулами белка и хлорофиллом осуществляется путем нестойких комплексов, образующихся при взаимодействии кислых групп белковых молекул и азота пиррольных колец. Чем выше содержание дикарбоновых аминокислот в белке, тем лучше идет их комплексирование с хлорофиллом. Блокирование карбоксильных групп в белке сильно уменьшает его слособность к связыванию с хлорофиллом. Белки, связанные с хлорофиллом, характеризуются низкой изоэлектрической точкой (3,7—4,9). Молекулярная масса этих белков порядка 68 тыс.
Важным свойством молекул хлорофилла является их способность к взаимодействию друг с другом. 13 результате этого происходит их переход из мономерной в агрегированную форму, которая может возникнуть в результате взаимодействия двух и более молекул при их близком расположении друг к другу. По данным А. А. Красновского, в процессе образования хлорофилла его состояние в живой клетле закономерно меняется. При этом и происходит его агрегация.
Физические свойства хлорофилла
Хлорофилл способен к избирательному поглощению света и к флюоресценции. Спектр поглощения данного соединения определяется его способностью поглощать свет определенной длины волны (оп-
Длина волны , нм
Гис. 33. Спектры поглощения хлорофаллов а и Ъ.
роделенпого цвета). Для того чтобы получить спектр поглощения, К. А. Тимирязев пропускал луч света сначала через раствор хлорофилла, а затем через призму. В этом случае часть лучей поглощалась. Было показано, что хлорофилл в той же концентрации, как в листе, имеет две основные линии поглощения в красных и сине-фиолетовых лучах (рис. 33). При этом- хлорофилл а в растворе имеет максимумы поглощения 429 и 660 пм, тогда как хлорофилл Ъ — 453 и 642 нм. Одпако необходимо учитывать, что в листе спектры поглощения хлорофилла меняются в зависимости от его состояния, степени агрега-цни, адсорбции на определенных белках. В настоящее время показано, что есть формы хлорофилла, поглощающие свет с длиной волны 700, 710 и даже до 720 нм. Формы хлорофилла, поглощающие свет с большой длиной волны, имеют особенно важное значение в процессе фотосинтеза. Хлорофилл обладает способностью к флюоресценции. Флюоресценция представляет собой свечение тел, возбуждаемое освещением и продолжающееся очень короткий промежуток времени (Ю-8—10-9 с). Свет, испускаемый при флюоресценции, имеет всегда большую длину волны по сравнению с поглощенным. Это связано с тем, что часть поглощенной энергии выделяется в виде тепла. Хлорофилл обладает красной флюоресценцией.
Биосинтез хлорофилла
Синтез хлорофилла происходит в две фазы: темновую —до про-тохлорофиллида и световую — образование из протохлорофиллида хлорофилла (рис. 34). Для превращения протохлорофиллида в хло-
рофиллид необходимо его связывание с белком голохромом и присоединение двух атомов водорода. Именно последняя реакция для большинства растений протекает с использованием энергии света (фотовосстановление) :
снег
протохлорофиллид -(- 2Н* -> хлорофиллид
Водороды присоединяются к 7-му и 8-му атомам углерода. На последнем этапе к хлорофиллиду присоединяется спирт фитол:
хлорофиллидфитол -> хлорофилл
Поскольку синтез хлорофилла — процесс многоэтапный, в нем участвуют равличные ферменты, составляющие, по-видимому, поли-ферментный комплекс. Интересно заметить, что образование многих из этих белков-ферментов ускоряется на свету. Содержание хлоро
филла в листе колеблется незначительно. Это связано с тем, что идет непрерывный процесс разрушения старых молекул и образование новых молекул хлорофилла. Причем эти два процесса уравновешивают друг друга. При этом предполагается, что вновь образовавшиеся молекулы хлорофилла пе смешиваются со старыми и имеют несколько шше свойства.
Условия образования хлорофилла
Проростки, выросшие в отсутствии света, называют этиолированными. Такие проростки, как правило, характеризуются измененной формой (вытянутые стебли, перазвившиеся листья) и слабой желтой окраской (хлорофилла в них пет). Вместе с тем, еще со времен Сакса (1864) известно, что в некоторых случвях хлорофилл образуется п в отсутствии света. Способность образовывать хлорофилл в темноте характерна для растений, стоящих на нижней ступени эволюционного процесса. Так, при благоприятных условиях питания пепоторые бактерии могут синтезировать в темноте желто-зеленый пигмент — бактериохлорофилл. Сине-зеленые водоросли при достаточном снабжении органическим веществом растут и образуют пигменты в тем-поте.
Способность к образованию хлорофилла в темноте обнаружена и у таких высокоорганизованных водорослей, как харовые. Лиственные и печеночные мхи сохраняют способность образовывать хлорофилл в темноте. Почти у всех видов хвойных при прорастании семян в темноте семядоли зеленеют. Более развита эта способность у теневыносливых пород хвойных деревьев. По мере роста проростков в темноте образовавшийся хлорофилл разрушается, и па 35—4О’-й день проростки в отсутствии света погибают. Интересно заметить, что проростки хвойных, выращенные из изолированных зародышей в темноте, хлорофилла не образуют. Однако достаточно присутствия небольшого кусочка нераздробленного эпдосперма, чтобы проростки начинали зеленеть.
Зеленение происходит даже в том случае, если зародыш соприкасается с эндоспермом другого вида хвойных деревьев. При этом наблюдается прямая корреляция между величиной. окислительно-восстановительного потенциала эпдосперма и способностью проростков аеленеть в темноте.
Б целом рассмотрение этого вопроса приводит к заключению, что в эволюционном плайе хлорофилл первоначально образовался как побочный продукт процесса темнового обмена. Однако в дальнейшем иа свету растения, обладающие хлорофиллом, получили большее преимущество благодаря возможности использовать энергию солнечного света, и ета особенность была закреплена естественным отбором.
Исследования влияния света на накопление хлорофилла в этиолированных проростках показали, что первым в процессе зеленепия появляется хлорофилл а. Нормальное соотношение хлорофилла а
к хлорофиллу b (3:1) наступает только через несколько часов после начала освещения. По мнению А. А. Шлыка, хлорофилл b образуется из хлорофилла а.
Спектрографический анализ показывает, что процесс образования хлорофилла идет очень быстро. Так, уже через 1 мин после начала освещения выделенный из этиолированных проростков пигмент имеет спектр поглощения, совпадающий со спектром поглощения хлорофилла а.
Прп исследовании влияния качества света па образование хлорофилла в большинстве случаев проявилась положительная роль красного света. Большее значение имеет интенсивность освещения. Существование пижнего предела освещенности для образования хлорофилла было показано в опытах В. Н_ Любимепко для проростков ячменя п овса. Оказалось, что освещение электрической лампой мощностью 10 Вт па расстоянии 400 см было пределом, ниже которого образование хлорофилла прекращалось. Существует и верхний предел освещенности, выше которого образование хлорофилла тормозятся.
Целый ряд исследований показывает, что образование хлорофилла идет интенсивнее на прерывистом свете. Это подтверждает, что в образовании хлорофилла имеется темповая и световая фазы. При этом световая фаза значительно короче темновой.
Образовапие хлорофилла зависит от температуры. Оптимальная температура для накопления хлорофилла 26—30°С. Как и следовало ожидать, от температуры зависит лишь образование предшественников хлорофилла (темповая фаза). При наличии уже образовавшихся предшественников хлорофилла процесс зеленения (световая фаза) идет с одинаковой скоростью независимо от температуры.
На скорость образования хлорофилла оказывает влияние содержание воды. Сильпое обезвоживание проростков приводит к полному прекращению образования хлорофилла. Особенно чувствительно к обезвоживанию образование протохлорофиллид».
Еще Б- И. Палладия обратил впимапие па необходимость углеводов для протекания процесса зеленения. Именно с этим связано то, что зеленение этиолированных проростков па свету зависит от их возраста. После 7—9-диевного возраста способность к образованию хлорофилла у таких проростков резко падает. При опрыскивании сахарозой проростки снова начинают интенсивно зеленеть.
Важнейшее значение для образования хлорофилла имеют условия минерального питания. Прежде всего необходимо достаточное количество железа. При недостатке железа даже листья взрослых растении теряют окраску. Это явление названо хлорозом. Железо — необходимый катализатор образования хлорофилла. Оно необходимо на етапе синтеза о-аминолевулиновой кислоты из глицина и сукци-пил-КоА, а также синтеза протопорфирина. Большое значение для обеспечения синтеза хлорофилла имеет нормальное снабжение растений азотом и магнием, так как оба эти элемента входят в состав хлорофилла. При недостатке меди хлорофилл легко разрушается. Это, по-видимому, связано с тем, что медь способствует образованию ус-
Рис. 35. Структура 0-каротина.
тойчивых комплексов между хлорофиллом и соответствующими белками.
Исследование процесса накопления хлорофилла у растений в течение вегетационного периода показало, что максимальное содержание хлорофилла приурочено к началу цветения. Есть даже мнение, что повышение образования хлорофилла может быть использовано как индикатор, указывающий на готовность растений к цветению. Синтез хлорофилла вависит от деятельности корневой системы. Так, при прививках содержание хлорофилла в листьях привоя зависит от свойств корневой системы подвоя. Возможно, что влияние корневой системы связано с тем, что там образуются гормоны (цитокинины). У двудомных растений большим содержанием хлорофилла характеризуются листья женских особей.
2. КАРОТИНОИДЫ
Наряду с зелеными пигментами в хлоропластах и хроматофорах содержатся пигменты, относящиеся к группе каротиноидов. Каротиноиды — это желтые и оранжевые пигменты алифатического строения, производные изоарена. Каротиноиды содержатся во всех высших растениях и у многих микроорганизмов. Это самые распространенные пигменты с разнообразными функциями. Каротиноиды, содержащие кислород, получили название ксантофиллов. Основными представителями каротиноидов у высших растений являются два пигмента — ^-каротин (оранжевый) С«Нзб и ксантофилл (желтый) СиНзбОг- Каротин состоит из 8 изопреновых остатков (рис. 35). При разрыве углеродной цепочки пополам и образовании на конце спиртовой группы, каротин превращается в 2 молекулы витамина А. Обращает на себя внимание сходство в структуре фитола — спирта, входящего в состав хлорофилла, и углеродной цепочки, соединяющей ци-клогексениловые кольца каротина. Предполагается, что фитол возникает как продукт гидрирования этой части молекулы каротиноидов. Каротиноиды имеют большое количество конъюгированных двойных связей, поэтому они способны к окислительно-восстановительным реакциям. Поглощение света каротиноидами, а следовательно, их окраска также обусловлены наличием конъюгированных двойных связей, p-каротин имеет два максимума поглощения, соответствующие длинам волн 482 и 452 нм. Красные лучи, поглощаемые хлорофиллами, каротиноиды не поглощают. Каротиноиды, в отличие от хлорофилла, не обладают способностью к флюоресценции. Подобно 5-773 113
хлорофиллу каротиноиды в хлоропластах вступают во взаимодействие с белками.
Физиологическая роль каротиноидов. Уже тот факт, что каротипоиды всегда присутствуют в хлоропластах, позволяет считать, что они принимают участие в процессе фотосинтеза. Однако пе отмечено ни одного случая, когда в отсутствии хлорофилла этот процесс осуществляется, поэтому считают, что роль каротиноидов вспомогательная.
В настоящее время предполагается, что каротиноиды, поглощая определенные участки солнечного спектра, передают энергию этих лучей па молекулы хлорофилла. Тем самым они способствуют использованию лучей, которые хлорофиллом не поглощаются.
Физиологическеп роль каротиноидов не ограничивается их участием в передаче энергии на молекулы хлорофилла. По данным советского исследователя Д. И. Сапожникова, на свету происходит взаимопревращение ксантофиллов (виолоксантин превращается в зеак-саптин), что сопровождается выделением кислорода. Спектр действия этой реакции совпадает со спектром поглощения хлорофилла, что позволило высказать предположение об ее участии в процессе фотосинтеза. г
Имеются данные, что каротипоиды выполняют защитную функцию, предохраняя различные органические вещества, в первую очередь молекулы хлорофилла, от разрушения да свету в процессе фото-окислепия. Опыты, проведенные на мутантах кукурузы и подсолнечника, показали, что они содеркат протохлорофиллид (темновой предшественник хлорофилла), который па свету переходит в хлорофилл а, по разрушается. Последнее связано с отсутствием способности исследованных мутантов к образованию каротиноидов.
Ряд исследователей указывает, что каротиноиды играют определенную роль в половом процессе у растений. Известно, что в период цветения высших растений содержание каротиноидов в листьях уменьшается. Одновременно опо заметно растет в пыльниках, а также в лепестках цветков. По мнению П..М. Жуковского, микроспорогенез тесно связан с метаболизмом каротиноидов. Незрелые пыльцевые зерна имеют белую окраску, а созревшая пыльца—желто-оратг-жевую. В половых клетках водорослей наблюдается дифференцированное распределение пигментов. Мужские гаметы имеют желтую окраску и содержат каротипоиды. Женские гаметы содержат хлорофилл. Высказывается мнение, что имение каротин обусловливает подвижность сперматозоидов. По данным В- Мевиуса, материнские клетки водоросли хламидомонады образуют половые клетки (гаметы) первоначально без жгутиков, в этот период они еще пе могут передвигаться в воде. Жгутики образуются только после освещения гамет длинноволновыми лучами, которые улавливаются особым каротиноидом --кроцином.
Образование каротиноидов. Синтез каротиноидов пе требует света. При формировании листьев каротипоиды образуются и накапливаются в пластидах еще в тот период, когда зачаток листа защищен в почке от действия слета. При начале освещения образованно хло-114
Рнс. 3(5. Хромофорная группа фикоэритринов (фикоэритробилин).
рофилла в этиолированных проростках сопровождается временным падением содержания каротинопдоп. Одпако затем содержание каротиноиды! восстанавливается и даже повышается с увеличением интенсивности освещения. Показана тесная зависимость образования каротиноидов от ааитншо обмена. Установлено, что между содержанием бойка и каротиноидов имеется прямая коррелятивная связь. Потеря белка ц каротиноидов к срезанных листьях идет параллельно. Образование каротинопдоп зависит от источника азотного питания. Более благоприятные результаты по накоплению каротиноидов получены при выращивании растений на нитратном фоне но сравнению с аммиачным. Недостаток серы резко уменьшает содержание каротиноидов.
Са „ _
Большое значение имеет соотношение -—-а питательной среде. От-Ми
иосителыюе увеличение содержания Са приводит к усилсппому накоплению каротиноидов по сравнению с хлорофиллом. Противоположное влияние оказывает увеличение содержания магния.
3. (ВИКОБИЛМНЫ
Фикобилины — красные и спило пигменты, содержащиеся в хро-матефорах некоторых тодорослой. Исследования показали, что багряные, спно-зелепые водоросли наряду с хлорофиллом а содержат фикобилины. В основе химического строения фикобилинов лежат четыре пиррольные группировки. В отличие от хлорофилла у фикобилинов пиррольные группы расположены в виде отгерытой цепочки (рис. 36).
Фикобилины представлены двумя пигментами: фикоцианином (у сипо-зеленых водорослей) и фикоэритрином (красные водоросли). Фикоэритрин—это окисленный фикоцианин. Фикобилины образуют соединения с белками, содержащимися в хроматсфорах. При этом связь между (фпкобилмпами и белками очень прочная. Эта связь разрушается только кислотой. Предполагается, что карбоксильные группы пигмопта связываются с аминогруппами белка.
S* 115
Фикобилины поглощают лучи в зеленой и желтой части солнечного спектра. Это та часть спектра, которая находятся между двумя основными линиями поглощения хлорофилла. Фикоэритрин поглощает лучи с длиной волны 495—565 им, а фикоцианин — 550— 615 нм.
Сравнение спектров поглощения фикобилинов со спектром, в котором проходит фотосинтез у водорослей (спектр действия), пока-вывает, что они очень близки. Это позволяет считать, что фикобилины поглощают энергию света и подобно каротиноидам передают ее на молекулу хлорофилла, после чего опа используется в процессе фотосинтеза.
Наличие фикобилинов у водорослей является примером приспособления в процессе эволюции к поглощению тех участков солнечного спектра, которые проникают сквозь толщу морской воды (явление филогенетической хроматической адаптации). Как известпо, красн ные лучи, соответствующие основной линии поглощения хлорофилла, поглощаются, проходя через толщу морской воды. Наиболее глубоко проникают зеленые лучи, которые поглощаются не хлорофиклом, а фикобилинами. Таким образом, наличие фикобилинов позволяет водорослям в процессе фотосинтеза использовать те лучи, которые к ним проникают.
ЭНЕРГЕТИКА ФОТОСИНТЕЗА
Важнейшей особенностью процесса фотосинтеза является то, что он протекает с использованием энергии солнечного света.
Лучистая энергия — это энергия электрона» шггшлх колебаний, которая характеризуется определенной длиной волны1, частотой колебания и скоростью распространения. Эти величины связаны между
собой следующим образом: » где X — длина волны;
с — скорость света, величина постоянная, равная 299 81010 см/с, и v — частота колебаний. Обычно длина волны измеряется в нанометрах, а частота колабаний — в герцах. Собственно свет или область электромагнитных колебаний, воспринимаемая человеческим глазом, лежит в пределах длины волн от 400 до 700 нм. Белее короткие волны характерны для ультрафиолетовых лучей, а более длинные для инфракрасных. Хорошо известно, что при пропускании луча света через призму он разлагается на отдельные участки, имеющие различную окраску (спектр). В пределах видимого света в зависимости от длины волны окраска лучей различна. Обладая волновыми характеристиками, свет проявляет и корпускулярные свойства. Лучистая энергия излучается и распространяется в виде отдельных дискретных единиц — квантов или фотонов. Квант света обладает энергией, которая прямо пропорциональна частоте колебаний и обратно пропорцио-
1 Длина волны — это расстояние между двумя последовательными пиками одного цикле.
пальпа длппс волны Е— frv = ——, где h — это постоянная Плапка.
Из этом формулы яспо видно, что величина энергии квантов для раз-пых участков спектра Судет различна: чем короче ддппа волны, тем больше энергия кванта. Энергия квантов разных областей сиектра может быть вычислена в элсктроповольтах или в килоджоулях на моль. 1 моль квантов, или 1 эппштойп, соответствует числу квантов, равному 6,02310й {число Авогадро). Соответствующие расчеты приведены в таблице.
Таблица 5
Характеристика отдельных участков спектра
Инет Длина полны Чпстдаа, и i’ll MllU{IUUt,*ll цЦж III I VOJII KItUtITOli
Ультра^'ШМмзговыЙ «Тцкиютовып Синий ЦрЛРний Желтый Орана; чмй Красны н Нн<].ракрасный 40(1 400—424 424—491 491 —550 590—585 585—847 647—740 740 И,«-lor* 7,81-10м 6,62- К)11 5,77-101* 5.17-Wi* 4,84-Ю1» 4.41-10“ 2,14-10“ -471,4 292,0 2G0.fi 230,5 193, li 85.5
1. ЗНАЧЕНИЕ ОТДЕЛЬНЫХ УЧАСТКОВ СОЛНЕЧНОГО
СПЕКТРА ДЛЯ ФОТО СИНТЕЗ А
Согласно первому закону фотохимии, только поглощенные лучв могут быть попользованы в химических реакциях. В том случае, если реагирующие молекулы бесцветны и пе поглощают свет, фотохимические реакции могут идти только в присутствии специальных веществ — соисибплвзаторов. Сенсибилизаторы — вещества, поглощающие энергию света и передающие ее иа ту пли иную бесцветную мо-лекуиу-
Иеложспио о том, что в процессе фотосинтеза могут быть использованы только поглощенные лучи солнечного света, впервые получило оксперимептальиоо подтверждение в опытах К. А. Тимирязева. До этого господствовало ошибочное представление, что наибольшее значение в процессе фотосинтеза имеют желтые лучи солнечного спектра, которые хлорофиллом пе поглощаются. Это заключение поддерживалось крупными немецкими физиологами Б. Пфоффером и 10. Саксом, утверждавшими, что свет действует как раздражитель. К. А. Тимирязев показал, что процесс усвоения СОа па свету представляет собой фотохимическим процесс п подчиняется законам фотохимии. В процессе фотосинтеза на место связей, обладающих малым запасом энергии, таких, как О—Н, С—О, создаются саязп С—С, благодаря этому свободная энергия системы повышается. Эта энергия представляет собой трансформированную солнечную энергию.
К. А. Тимирязевым был разработан более точный метод учета процесса фотосинтеза, оспованный на одновременном определении объема поглощенной углекислоты и выделенного кислорода в замкнутом сосуде (эвдиометре). Высокая чувствительность данного метода позволила определить фотосинтез в отдельных монохроматических участках спектра, в которых благодлря малой пх интенсивности фотосинтез шел очень слабо. Опыты К. А. Тимирязева ясно показали, что процесс фотосинтеза проходит именно в тех лучах, которые поглощаются хлорофиллом. Хлорофилл является оптическим сенсибилизатором, поглощающим энергию света и передающим ее на молекулы Н2О и СО2. Определяя интенсивность процесса фотосинтеза в различных лучах солнечного спектра, К. А. Тимирязев показал, что наиболее пптепсивное усвоение углекислоты наблюдается в красных лучах. Затем по направлению к зеленой части спектра процесс фотосинтеза постепенно ослабевает. Б зеленых лучах фютосинтез минимальный. Это и понятие, так как именно зеленые лучи хлорофиллом почти пе поглощаются. В сине-фиолетовой части спектра наблюдается второй подъем нятенсивности фотосинтееа. Таким образом, если представить себе интенсивность фотосинтеза в виде кривой, то опа будет иметь два максимума соответственно двум максимумам поглощения хлорофилла. Ряд пиков энергии фотоелнтеза соответственно отдельным линиям поглощения хлорофилла пе наблюдается, так как хлорофилл в хлоропхаотах находится в такой концентрации, при которой, линии поглощения частично сливаются и образуются два основных максимума. Интенсивность процесса фотосинтеза в различных участках спектра получила название спектра действия. Можно сделать вывод, что спектр поглощения хлорофилла и спектр действия совпадают. Дальнейшие исследования внесли определенные уточнения как в отношении лучей, поглощаемых разными формами хлорофилла, так и в отношении их влияния на процесс фотосинтеза. Одпако общие закономерности, установленные К. А. Тимирязевым, остались в силе.
Важное значение имеют исследования К. А. Тимирязева по эффективности использовании энергии в красном и сине-фиолетовом участках спектра. Тимирязев провел сравнение интенсивности и эффективности поглощения энергии в разных лучах солнечного спектра и получил следующие данные (в относительных единицах) (табл. 6).
Из приведенных данных видно, что .поглощенная энергия в красном участке спектра используется более полно. Из этого наблюдения К. А- Тимирязев сделал вывод, что поглощенная энергия лучей раз-
Таблица б
Луги Иитепсипиость
поглощения анергии нелепым листом фотосинтеза
Красные 100 100
Сине-фиолетовые 70 54
кого качества, разной длины волны используется в фотохимических реакциях с разной эффективностью. Зеленый цвет растений не случаен, в процессе естественного отбора растения приспособились к поглощению именно тех лучей, энергия которых используется в процессе фотосинтеза наиболее эффективно. На этом примере хорошо демонстрируется важность исторического подхода при объяснении тех или иных фиэиологических явлений. Мысли К. А. Тимирязева получили блестящее подтверждение после того, как Эйнштейном была сформулирована теория фотоэффекта. Из теории фотоэффекта следует, что интенсивность любой фотохимической реакции определяется не количеством поглощенной энергии, а числом поглощенных квантов. Между тем величина квантов в разных лучах солнечного спектра различна. В краевых лучах кванты характеризуются меньшей энергией. По мере того как уменьшается длина волны, растет энергия квантов. Б связи с этим на одно и то же количество поглощенной энергии в красных лучах по сравнению с сипе-фиолетовыми приходится большее число квантов и соответствэпно большее количество прореагировавших молекул в фотохимических реакциях, в том числе и при фотосинтезе. Могут быть кванты, несущие так мало энергии, что ее ие хватает па то, чтобы вызвать химический эффект. Иначе говоря, для фотохимических реакций существует нижний предел энергии, т. е. верхний предел длины волны, после которого они неосуществимы.
Фотохимические реакции возможны в пределах величины квви-гов от 147 до 587 кДж/моль. Таким образом, в квантах красного света (176 кДж/моль Av) заключено достаточное количество энергии для осуществления фотохимической реакции. Вместе с тем при поглощении квантов синего света (261 кДж/моль Av) реагирующие молекулы будут получать избыток энергии, который выделяется в виде тепла или света.
Таким образом, молекулы будут вступать в реакцию под влиянием разного количества энергии. Следовательно, использование энергии зависит ст качества света. Это было подтверждено исследованиями О. Варбурга. В этих исследованиях впервые была установлена величина фотосинтетической работы, производимой за счет 1 Дж поглощенной лучистой энергии. Эта величина возрастает по мере увеличения длины волны.
Таблица 7
Использование энергии света лучей различной длины при фотосинтезе клетками водоросли хлореллы
Длина волны. Использование лучистой анергии, в относительных величинах (экспериментальные данные) Использование лучистой енергия. в относительных величинах, исходя из величины квантов (теоретические данные)
680 100,0 100,0
580 80,0 87,5
546 76,0 82,5
436 61,5 63,0
Данные таблицы 7 показывают совпадение теоретических расчетов и экспериментально подученных величин.
Таким образом, количество прореагировавших молекул СОг и HjO в процессе фотосинтеза пропорционально числу поглощенных квантов. Однако число квантов, необходимое для протекания различных фотохимических реакций, неодинаково. Редкая фотохимическая реакция имеет квантовый расход, равный единице. Он может быть значительно больше единицы, так как ае все возбужденные молекулы вступают в реакцию; может быть и меньше единицы, если благодаря цепным взаимодействиям в реакцию вступают не только зозбужденные молекулы.
Квантовый расход процесса фотосинтеза, т. е. количество квантов, необходимое для того, чтобы одна молекула СОг восстановилась до углеводов, окончательно не установлен. Все же большинство исследований показывает, что для восстановления одной монекулы СОг до углеводов нужно 8—9 квантов света. Анализ квантового расхода, наблюдаемого в различных участках солнечного спектра, позволил также доказать роль каротиноидов в процессе фотосинтеза. Исследования А. А. Рихтера, а затем Р. Эмерсона показали, что в той части спектра, где лежит максимум поглощения каротиноидов, т. е. между синими и зелеными лучами, на их долю приходится 70% от всего поглощения и лишь 30% энергии поглощается хлорофиллом. Б этой части спектра расход квантов приближается к теоретически возможному, только еспи принять, что кванты света, поглощенные каротиноидами, передаются хлорофиллу и таким образом используются в процессе фотосинтеза. Правда, кванты света, поглощенные каротиноидами, используются, по-видимому, менее эффективно по сравнению с квантами, поглощенными непосредственно хлорофиллом.
Из того факта, что квантовый расход процесса фотосинтеза очень велик, следует, что вто сложный процесс. Какова же судьба поглощенных пигментами квантов света? Процесс фотосинтеза начинается с фотофизического этапа.
2. ФОТОФИЗИЧЕСКИЯ ЭТАП ФОТОСИНТЕЗА
Согласно законам фотохимии, при поглощении кванта света атомом или молекулой какого-либо вещества электрон переходит на другую, более удаленную, орбиталь, т. е. на более высокий энергетический уровень (рис. 37). Наибольшей энергией обладает электрон, отдаленный от ядра атома и находящийся ие бесконечно большом расстоянии от него. Вместе с тем. чем ближе к ядру, тем меньше апергия электрона. Каждый электрон переходит на более высокий энергетический уровень под влиянием одного кванта света.
В молекуле хлорофилла два уровня возбуждения. Именно с этим связано и то, что он имеет две основные линии поглощения. Первый уровень вовбуждения связан с переходом на более высокий энергетический уровень электрона в системе сопряженных двойных связей, а второй — с возбуждением неспаренных электронов атомов азота и кислорода в порфириновом ядре. При поглощении света электроны 120
Рис. 37. Изменения, вызываемые i атоме поглощением квантов света: 1 — поглощение кванта возбуждением атома; 8—возврат влетрона, выделение энергии в виде электрона ?по 9- Ли-берту).
переходят в колебательное движение. Наиболее подвижными в молекуле являются делокализованные электроны, орбитали которых как бы размазапы, обобщены между двумя ядрами. Особенно легко возбуждаются электроны сопряженных двойных связей. Электрон, кроме того, что он находится на определенной орбитали и вращается вокруг ядра, обладает еще спином — характеристикой, которую можно трактовать как направление вращения электрона вокруг своей оси. Спин электрона может принимать два значения. Спины двух электронов, находящихся па одной орбитали, различны. Когда в молекуле все электроны расположены попарно, их суммарный спин равен нулю. Это осиозное синглетное состояние (So). В основном энергетическом состоянии So молекула находится в тепловом равновесии со средой, все электроны попарно ванимают орбитали с наименьшей энергией. При поглощении света электроны переходят на следующую орбиталь с более высоким энергетическим уровнем. При этом имеются две возможности: если
электрон не меняет спина, то это приводит к возникновению первого и второго синглетного состояния (Si*, St*). Если же один из электронов меняет спин, то такое состояние называют триплетным (7’1*)-
Наиболее высоким энергетический уровень — это втором синглетный уровень Sa*. Электрон переходит на него под влиянием синефиолетовых лучей, кванты которых крупнее, содержат больше энергии. В первое возбужденное Si * состояние электроны могут переходить, поглощая более мелкие кванты (красного света).
Различные возбужденные состояния электронов характеризуются разным временем жизни’. Время жизни па Sy* уровне составляет 10"’2 с. Это время настолько мало, что па его протяжении энергия электронного возбуждения пе может быть использована. Через этот короткий промежуток времени электрон возвращается в первое синглетное состояние Si* (без изменения направления спина). Переход
1 Время жизни определяется ио времени, которое требуется, чтобы число молекул в данном состоянии уменьшилось на 63%.
ив второго синглетного состояния 8%* в первое $]* сопровождается некоторой потерей знергни 100 кДж в виде теплоты. Время жизни в первом синглетном состоянии немного больше 10-э или 10-8 с. Наибольшим временем жизни 10-4—10-2 с обладает триплетное состояние 71*. Переход на триплетный уровень происходит с изменением спина электрона.
Из возбужденного состояния молекула хлорофилла может переходить в основное. При этом ее дезактивация (потеря энергии) может происходить путем флюоресценции, без излучательного рассеивания анергии в виде теплоты, переноса энергии на другие молекулы, в частности на другие молекулы хлорофилла, потери возбужденного электрона — химического взаимодействия. При переходе электрона из триплетного состояния в основное энергия может выделяться в виде фосфоресценции (длительного свечения), в виде теплоты и использоваться на фотохимическую работу с потерей электрона.
Таким образом, энергия возбужденного состояния молекул может испускаться (в виде флюоресценции, фосфоресценции или теплоты), передаваться на другие молекулы или быть непосредственно использована в фотохимической реакции (рис. 38). В любом из указанных случаев молекула пигмента дезактивируется и переходит на основной энергетический уровень. Энергия, испускаемая в виде флюоресценции или в виде теплоты, не может быть использована.
В настоящее время показано, что в первичных процессах фотосинтеза, связанных с поглощением молекулой хлорофилла квзнта света, важную роль играют процессы передачи энергии. Исследования показали, что пе каждая молекула хлорофилла принимает участие в последующих фотохимических реакциях. Непосредственная связь с реакционным центром осуществляется примерно одной из 200—250 молекул хлорофилла. Остальные молекулы хлорофилла воспринимают энергию и передают ее этой молекуле-ловушке. Такое устройство позволяет зпачитэлыю полнее использовать энергию света. Подсчитано, что каждая моле-
кула хлорофилла на прямом солнечном свету поглощает квант света не чаще, чем через 0,1 с, а по некоторым данным еще реже. Между тем скорость последующих реакций фотосинтеза зна-чительно больше. Из сказанного следует, что при непосредственной связи каждой молекулы хлорофилла с последующей реакцией процесс фотосинтеза шел бы прерывисто. Необходимо учитывать также, что использование энергии света в химических реакциях требует большого количества ферментов. Если бы каждая молекула хлорофилла отдавала энергию света непосредственно на фотохимические процессы, то в листе пе хватило бы места для размещения всех необходимых для этого ферментных систем. В процессе эволюции в растениях выработался механизм, позволяющий наиболве полно использовать кванты света, падающие иа лист подобно каплям дождя. Механизм этот заключается в том, что энергия квантов света улавливается 200—250 молекулами хлорофилла и как бы стекается к одной особой его молекуле, являющейся ловушкой и связанной с реакционным центром (рис. 39). Эта молекула хлорофилла-ловушки со всеми вспомогательными молекулами пигментов, которые передают ей энергию, представляют собой фотосинтетическую еди ницу. В улавливании и передаче энергии па молекулу хлорофилле ловушки могут участвовать не только молекулы хлорофилла а и хлорофилла Ъ, по и такие пигменты, как каротиноиды и фикобилины.
Передача энергии между молекулами пигментов идет главным образом резонансным путем без разделения зарядов с большой скоростью и с большой эффективностью. Так, время переноса энергии от одной молекулы хлорофилла к другой составляет 1Х10-12— 2Х10"'2 с, а от молекулы каротиноидов к хлорофиллу 4Х1О-10 с. Таким образом, время переноса энергии значительно меньше временя жизни возбуйщенной молекулы (10~8 с). Вероятность резонаисиого переноса энергии обратно пропорциональна шестой части расстояния между молекулами. Следовательно, такой перенос может осуществляться только при близком расстоянии между молекулами пигментов. В этой связи становится понятпой необходимость весьма плотной упаковки молекул хлорофилла в ламеилах хлоропластов. Расчеты показали, что в одном хлоропласте до 1 млрд, молекул хлорофилла-Расстояпие между молекулами хлорофилла в мембранех составляет всего 1 пм. Перенос энергии происходит только от пигментов, поглощающих свет с мепыней длиной волны, к пигментам, поглощающим свет с большей длипой волны. Дело в том, что хотя передача энергии от
от одной молекулы пигмента к другой идет с большой эффективностью (от хлорофилла Ъ к хлорофиллу а— 90%, от каротиноидов к хлорофиллу— 40%), однако все же ато связзно с некоторой ее иотерей. Вместе’с тем кванты света с меньшей длиной волны обладают большей энергией. В этой связи потеря энергии приводит к превращению квантов в более ыэлкие (с большей длиной волны). Именно поатому основная форма хлорофилла, к которой стекается анергия, поглощает лучи с длиной волны 700 нм и обозначается как пигмент 700 (П/оо). Обратный перенос энергии невозможен. Таким образом, фотофизн-ческий этап фотосинтеза заключается в том, что кванты света поглощаются и переводят молекулы пигментов в возбужденное состояние. Затем эта энергия переносится на хлорофилл-ловушку, связанную с реакционным центром, где опа и используется в фотохимических реакциях. Дальнейшее превращение энергии света в химическую энергию проходит ряд этапов, начиная с окислительно-восстановительных превращений хлорофилла и включая как фотохимические (световые), так и энзиматические (темновые) реакции.
ХИМИЗМ ФОТОСИНТЕЗА
Фотосинтез — это сложный многоступенчатый окислительпо-вос-становительный процесс, в котором происходит восстановление углекислого газа до уровня углеводов и окисление воды до кислорода. Фотосинтез включает как световые, так и темновые реакции. Был проведен ряд экспериментов, доказывающих, что в процессе фотосинтеза происходят реакции, не требующие света (темновые). 1. Фотосинтез ускоряется с повышением температуры. Отсюда прямо следует, что какие-то атапы этого процесса непосредственно не связаны с использованием энергии света. Особенно резко зависимость фотосинтеза от температуры проявляется при высоких интенсивностях света. По-видимому, в этом случае скорость фотосинтеза лимитируется именно темповыми реакциями. 2- Эффективность использования энергии света в процессе фотосинтеза оказалась выше при прерывистом освещении. Для более эффективного использования энергии света длительность темповых промежутков должна вначительно превышать длительность световых.
В 1932 г. Эмерсону удалось непосредственно измерить продолжительность световых и темновых реакций фотосинтеза. Оказалось, что скорость световой реакции составляет 10~5 с и не зависит от температуры, тогда как скорость темновой значительно меньше и в зависимости от температуры изменяется от 4Х10"1 до 4Х10-2 с.
1. ПРОИСХОЖДЕНИЕ КИСЛОРОДА ПРИ «ВОТОСИНТЕЗЕ
Большое вначение для раскрытия вопроса о сущности реакций при фотосинтезе имело изучение особенностей бактериального фотосинтеза.
Впервые на свойство содержащих пигменты бактерий использовать анергию света для фотосинтеза указал Энгельман (1883). Дальнейшие исследования показали, что окрашенные бактерии содержат 124
пигменты, относящиеся к группе хлорофиллов, в именно бактериохлорофиллы, и синтезируют органическое вещество из неорганических соединений при участии энергии света. Однако этот процесс пе сопровождается выделением кислорода. Зто связано с тем, что в качестве источника водорода бактерии используют не воду, а сероводород или другие соединения. Такой тип ассимиляции СО3 получил название бактериального фотосинтеза или фоторедукции.
Наиболее распространены содержащие пигменты серные бактерии. Как установил Ван-Ниль, у бактерий (фотолитотрофные бактерии) ассимиляция СОг сопровождается разложением сероводорода с выделепнем серы:
С08 + 2HZS + Л* [СЩО] + 2S + Н2О,
где формула [СНзО] означает, что один атом углерода восстановлен до углеводов.
Есть песерные окрашенные бактерии, которые в качестве источника водорода используют различные органические соединения (фо-тооргапотрофные микроорганизмы). Процесс может идти по следующему типу:
С02 + 2СН3СНОНСНЭ 2СН3—С—СН3 + [СВД + Н2О
II О
Во всех разобранных случаях происходит восстановление СОа за счет водорода какого-либо другого соединения. Ван-Ниль высказал предположение, что при фотосинтезе происходит сходный процесс, а именно разложение воды и присоединение водорода к СОа. При зто~ кислород выделяется. Высказанное предположение получило зксш римептальпое подтверждение в работах академика А. П. Виноградов;
(194.4). Он провел анализ изотопного состава (соотношения ,8О, ,70.18О) кислорода разного происхождения. Оказалось, что кислород, выделенный из воды, воздуха и образующийся при фотосинтезе, имеет одинаковое соотношение изотопов, тогда как кислород СОа содержит относительно больше тяжелых изотопов. На основании этих исследований было сделано два вывода: 1. В процессе фотосинтеза разлагается вода и выделяется кислород. 2. Источником кислорода воздуха является процесс фотосинтеза.
Поскольку весь кислород фотосинтеза выделяется' из воды, общее уравнение фотосинтеза принимает следующий вид:
6СО2 + 12Ы2О 4- to -ь CeH„Oe + 6Ofi + 6Н20
Вода в правой части уравнения не подлежит сокращению, поскольку ее кислород имеет иной изотопный состав (из СОа).
Б последнее время точными опытами установлено, что изотопный состав кислорода, выделяемого в процессе фотосинтеза, несколько отличается от изотопного состава кислорода воды. Исследования, проведенные с использованием меченого кислорода, позволили Б. В. Вартапетяну прийти к выводу, что вода в хлоропластах неоднородна и состоит из двух компонентов: воды, поступающей из внешней
среды, и воды, которая образовалась в процессе самого фотосинтеза. Кислород этой (биосинтетической) воды, как мы видели, более тяжелый. В процессе фотосинтеза разлагаются оба типа воды. В силу етого кислород, выделяемый при фотосинтезе, несколько обогащен ,8О. Сказанное можно представить в виде следующей схемы:
600*+ 12Н.0 + Ь С„Н1ВОв + 60г + 6Н20*
Расчеты показывают, что для образования этого, более тяжелого кислорода на каждые 10 молекул обычной воды должна разлагаться (окисляться) одна молекула биосинтетической воды.
В 1S37 г. английский физиолог Р. Хилл показал, что изолированные хлоропласты на свету в присутствии какого-либо яегко восстанавливающегося вещества (акцептора водорода) окисляют воду, при втом кислород выделяется. В качестве акцептора водорода в опытах Хилла был использован хинон.. При этом выделение кислорода хлоропластами на свету протекает в отсутствии углекислоты (реакция Хилла):
Н20 -I- К» —»- 2Н+ +- — 08; хинон 4- 2Н+ —гидрохинон
Дальнейшие исследования показали, что те же самые ингибиторы, которые тормозят реакцию Хилла, приостанавливают и выделение кислорода в процессе фотосинтеза. Это дало основание считать, что световая фаза фотосинтеза включает разложение воды. Таким образом, в процессе фотосинтеза происходит разложение воды, на что в первую очередь затрачивается энергия света.
В 1S50 г. было покавано, что вместо искусственных акцепторов водорода, примененных Хиллом, можно использовать естественный кофермент никотинамидадениндипуклеотидфосфат — НАДФ. Изолированные хлоропласты на свету восстанавливают НАДФ, одновременно выделяется кислород. Однако сущность происходящих па свету реакций была выяснена лишь в 1954—1958 гг. благодаря работам Д. Ариона.
I. ФОТОХИМИЧЕСКИМИ ЭТАП ФОТОСИНТЕЗА. ЦИКЛИЧЕСКОЕ И НЕЦИКЛИЧЕСКОЕ ФОТОСИНТЕТИЧЕСКОЕ ФОСФОРИЛИРОВАНИЕ
Фотохимические реакции фотосинтеза — это реакции, в которых ввергия света преобразуется в энергию химических связей, и в верную очередь в энергию фосфорных связей АТФ.
Энергия поглощенных квантов света стекается от сотен молекул пигментов к одной, характеризующейся поглощением в наиболее длипнозолновой части солнечного спектра. Мовекула хлорофияла-ло-вуптки, сэлзапная с реакдионвым центром, отдает электрон (окисляется). Электрон поступает в электроипо^гранспортпую цепь. Перенос 126
электрона ио цепи переносчиков включает ряд окислительно-восстановительных реакций, в ходе которых выделяется энергия. Эта энергия может быть использована для синтеза АТФ. Процесс преобразования энергии квантов света в АТФ получил название фотосинтетического фосфорилирования (Д. Арпон).
Различают два основных типа фотосинтетического фосфорилирования: нециклическое и циклическое. Они свяэаны соответственно с нециклическим и циклическим потоками электронов. При циклическом потоке электроны, переданные от молекулы хлорофилла первичному акцептору, возвращаются к ней обратно. При нециклическом потоке происходит фотоокисление воды и передача электрона от воды к НАДФ.
Совокупность молекул пигментов (фотосинтетическая единица) совместно с определенными белками-переносчиками электронов составляет фотосистему. В процессе фотосинтеза принимают участие две фотосистемы. Эмерсон показал, что эффективность света с длиной волны 680—700 пм может быть значительно повышена добавлением света с более короткой длиной волны (% 650—660 им). Интенсивность фотосинтеза при освещении смешанным светом (с двумя длинами волн) оказалась выше суммы интенсивностей фотосинтеза, наблюдаемой при освещении светом каждой длины волны в отдельности. Это яэлепие называют эффектом усиления или эффектом Эмерсона. Был сделан вывод, что необходимо одновременное свэтовое возбуждение пигментов, различающихся по спектру поглощения. Именно это и привело к понятию о существовании двух фотосистем. Интересно, что эффект усиления наблюдается при изучении фотосинтеза у высших растений и водорослей. У бактерий этот эффект отсутствует.
Установлено, что первая фотосистема у высших растений вкию-чает 200 молекул хлорофилла в, 50 молекул каротиноидов и 1 молекулу хлорофилла (хлорофилл-ловугака), поглощающую свет с длиной волны X 700 нм (П?оо)- Вторая фотосистема включает 200 молекул хлорофилла а, 200 молекул хлорофилла Ъ и 1 молекулу хлорофилла, поглощающую свет с длипой волны X 680 вм (Пбао)- По-видимому, свет поглощается раздельпо этими двумя фотосистемами и нормальное осуществление фотосинтеза требует их одновременного участия.
Общая схема нециклического фотофосфорилирования представлена на рисунке 40- При нециклическом потоке электронов принимают участие две фотосистемы. Энергия квантов света стекается к молекуле пигмента П?оо. который и выступает в виде ловушки (фотосистема I). Электрон в молекуле П?оо переходит на более высокий энергетический уровень ($)*)- В основном состоянии О/В потенциал Птоо довольно высокий (+0,43 В). Следовательно, тенденция к потере электрона (окислению) выражена очень слабо. Однако при поглощении кванта света молекула Птоз переходит в возбужденное состояние и ее окислительно-восстановительный потенциал падает до —0,60 мВ. Поэтому в возбужденном состоянии молекула П?оо легко отдает электрон (фотохимическая реакция). Отдавая электрон, моле-
12?
Рис. 40. Схема нециклического транспорта электронов при фотосинтезе:
Фд — ферредоксин; ФП — флавопротепд; ПХ — пластохинон; ТЩ — пластопвашш; Z -неидентйфащпровавныИ переносчик.
куда Птоо окисляется и остается в виде положительно заряженной молекулы.
Хл + Av Хл* Хл* (ХлГ + е.
где Хл * —возбужденная форма хлорофилла, [Хл]+— окисленная форма хлорофилла.
Электрон передвигается по направлению к НАДФ (О/В потенциал — 0,32) через ряд переносчиков, расположенных в порядке возрастания О/В потенциала. Электроны спонтанно текут в сторону более высоких окислительно-восстановительных потенциалов. Переносчик, воспринимающий электрон от П?оо, имеет Ео — 0,55. Следующим переносчиком является железосодержащий белок ферредоксин .(Ео — 0,43). Ферредоксин содержит два атома железа в негеминовой форме. От ферредоксина электрон переносится на НАДФ (Ео—0,32). Этот перенос осуществляется с помощью специфического белка-фермента (ферредоксин-НАДФ-редуктазы), коферментом которого является флавинадениндинуклеотид (ФАД).
Отдав электрон, П7Оо остается в виде ионизированной молекулы. При этом О/В потенциал П?оо становится снова +0,43 (основное со-128
стояние). Благодари этому си является прекрасным акцептором электронов. Источником электрона, заполняющего эту «дырку», является фотосистема II. Она ответственна за реакции, связанные с разложением воды и выделением кислорода. Ловушкой квантов света в фотосистеме II является молекула хлорофилла, поглощающая свет с длиной волны—X 680 (Хлеао)- Под влиянием поглощенного кванта света возбужденный электрон молекулы Хлево воспринимается акцептором и передается дальше по цепи переносчиков. Образовавшаяся электронная «дырка» в молекуле Хлвзо действует как сильный окислитель п через ряд переносчиков при участии иона марганца отнимает электрон от воды. Этот электроп заполняет электронную «дырку» в молекуле Хлвзо- Происходит фотоокисление воды и выделяется кислород:
свет ~
2Н2О-------> 4Н+ + 4е + О2
Рассмотрим более подробно путь переноса электрона от фотосистемы II к фотосистеме I.
Полученный от Хл68п неизвестным акцептором Z электрон передается далее на пластохинон (Ео+0,11). Пластохинон (производное хинона) нмеет молекулярную массу 748. Считается, что в переносе электронов участвует 65 молекул пластохинона. От пластохинонов электрон воспринимается молекулой цитохрома f. Цитохром f относится к труппе цитохромов с (Е„+0,360). -Воспринимая электрон, цитохром восстанавливается: Fes+4-e *Fes+- Следующий переносчик — пластоцианин. Отдавая электрон пластоцианину, цитохром окисляется: Fe2+—ё—TFe®4. Пластоцианин — это медьсодержащий белок, в котором на каждую молекулу белка приходится два атома меди (Ео дластоциапина+0,370). От пластоцианина электрон заполняет электронную «дырку» уПтое-
Перепое электропа по цепи переносчиков от фотосистемы II « фотосистеме I сопровождается аккумуляцией энергии в АТ<3 (АДФ+Ф—'АТФ). Суммарное уравнение указанного процесса мс жет быть выражено следующим образом:
2 НАДФ + 2Н2О + 2 АДФ + 2НаРО,+ 8А» ->
->-2 НАДФ - Н+ + 2Н+ + 2 АТФ + 02
Таким обравом, отличительными особенностями нециклического фотослитетического фосфорилирования является: 1) окисление двух молекул воды, происходящее в результате воздействия 8 Av света, которые улавливаются двумя фотосистемами; 2) передача электронов от молекул воды через электронно-транспортную цепь на НАДФ. Продуктами процесса нециклического фотофосфорилирования являются восстановленный никотинамидаденипдинуклеотидфосфат (НАДФ-На) и АТФ. Эти соединения световой фазы в дальнейшем используются в темновой фезе фотосинтеза.
Общая схема циклического фотофосфорилирования дана па рисунке 41. Б этом процессе принимает участие лишь фотосистема I.
На схеме показано, что в результате поглощения квзн-та света молекула П?оо отдает возбужденный электрон сначала неидентифицированному переносчику, а затем от ферредоксина возвращается к Птоо. На участке электроннотранспортной цепи . между цитохромом Ь& ч цитохромом f энергия электрона аккумулируется в энергию АТФ. Таким образом в этом случае П?оо является и донором и акцептором электрона. Суммарное уравнение циклического фотосинтетического фосфорилирования выглядит следующим образом:
АДФ + Н3Р0, +
-> АТФ + Н.0
Нециклическое и циклическое фотосинтетическое фосфорилирование принято включать в световую фазу фотосинтеза, однако свет необходим только на первых этапах этих процессов. Перенос
Рис. 41. Схема циклического транспорта электронов при фотосинтезе.
электрона по цепи перепосчи-нов может происходить в темноте- При рассмотрении приведенных схем издо учитывать, что в зависимости от условий физического состояния хлоропластов расположение и пабор переносчиков в электронно-транспортной цепи могут меняться. Вопрос, как осуществляется связь между переносом возбужденного светом электрона по цепи переносчиков и обравовднием АТФ аа счет выделяющейся при этом энергии, до настоящего времени не выяслен. Наибольшее признание получила хемиоомотическая гипотеза, выдвинутая английским ученым Митчеллом. Переносчики электронов (алектронно-транспортная день) локализованы в мембранах в определенной последовательности. По мнению Митчелла, переносчики расположены перпендикулярно мембране. Благодаря этому происходит непрерывный перенос электрона с одной стороны мембрзны па другую. При этом последовательно чередуются переносчики электронов (цитохромы) с переносчиками электрона и протона (пластохиноны). В результате происходит односторонний перенос протонов с наружной оторспы мембраны тилакоидов на внутреннюю. Образуется градиент ионов водорода и соответственно на разных сторонах мем-
Рис. 42, Схема образования мембранного потенциала и переноса протонов во внутритилажоидпое пространство:
Фд — ферредоксин; ХЩ — пластоциавин; FX — пластохинон.
брани возникает разность потенциалов (рис. 42). Образование АТФ является результатом разрядки мембран. Электрохимическая энергия ири этом превращается в химическую энергию макроэргической свя-эн АТФ.
Продукты световой фазы, в которых аккумулирована энергия света,—АТФ и НАДФ-Нг — Арнон назвал ассимиляционной силой. Образование этих соединений идет в отсутствии СОг. При наличии АТФ и НАДФ-Hi восстановление СО2 цо уровня углеводов может происходить в темноте.
3. ТЕМНОВАЯ «ВАЗА ФОТОСИНТЕЗА —
ПУТЬ ПРЕВРАЩЕНИЯ УГЛЕРОДА
Сущность темновых реакций процесса фотосинтеза была раскрыта благодаря исследованиям американского физиолога Кальвина (цикл Кальвина). Успех работы, проведенной Кальвппом и его сотрудниками, определялся широким применением новых методов исследования.
«С-3» путь фотосинтеза (цикл Кальвина]
Первый метод, использованный Кальвином, — метод радиоактивного углерода. Радиоактивные изотопы по химическим свойствам практически не отличаются от стабильных. Принимая участие в реакциях, они как бы помечают те соединения, в которые входят- Ско
рость распада радиоактивных изотопов пропорциональна их количеству. Излучение, испускаемое ими в процессе разложения, может быть легко измерено. Все это создает исключительные возможности для использования метода радиоактивных изотопов (меченых атомов), в частности при изучении химизма фотосинтеза. Так, введение ,4С02 в атмосферу, где выращиваются растения, позволяет установить временную последовательность образования отдельных соединений на первых этапах фотосинтеза.
Второй метод—хроматография на бумаге. Если вещества, разогнанные на хроматограмме, содержат радиоактивные атомы, то их легко обнаружить с помощью радиоавтографии. Применяя указанные методы, можно определить, какие вещества и в какой последовательности образуются из 14С02. Наряду с этим использование коротких световых экспозиций позволило уловить первые этапы процесса. В качестве объекта исследований была взята зеленая водоросль хлорелла. После кратковременных экспозиций на свету в присутствии 14С02 растения фиксировались горячим спиртом. Спиртовой экстракт концентрировался, разделялся хроматографически и анализировался. Опыты показали, что через 5 с пребывания в атмосфере 14СО2 на свету ббльшая часть радиоактивного углерода- сосредоточивается в трехуглеродном соединении — 3-фосфоглицериновой кислоте (3-ФГК).
Кальвин выдвинул предположение, что в хлоропластах имеется какое-то вещество-акцептор, которое, взаимодействуя с СО2, образует фосфоглицериновую кислоту (акцептор +С02 *-ФГК). Для того чтобы установить природу акцептора, была проведена серия опытов с изменяющимися внешними условиями (смена света и темноты в присутствии и отсутствии ,4СО2). Оказалось, что поспе выключения света содержание ФГК продолжает расти. Одновременно наблюдалось быстрое исчезновение пятиуглеродного соединения, рибулезодифос-фата (РДФ). Через 30 с темноты РДФ не обнаруживался. Вместе с тем па свету количество РДФ оставалось постоянным. Иная картина наблюдалась в отсутствии С02. В этом случае ни в темноте, ни на свету содержание РДФ и ФГК не изменялось. Из полученных данных следовало, что в присутствии СО2 РДФ в темноте используется для образования ФГК. Дальнейшие превращения ФГК требуют света. В силу этого Кальвин выдвинул следующую предварительную схему процесса фотосинтеза:
продукты свет, фазы
6 АТФ + 6НЛДФ-Н,
ЗРДФ+ЗСО2+ ЗН,0 6ФГК----------------------> 6ФГА-»-1ФГА
t------В-«---------Б-е—---------А------sir А
Согласно этой схеме РДФ является акцептором, который присоединяет СО2, в результате чего образуется ФГК. Однако в отсутствии света РДФ быстро оказывается использованным и исчезает. При этом накапливается известное количество ФГК. Именно это и наблюдалось в эксперименте. На свету при участии продуктов свето
вой фазы происходит восстановление ФГК до фосфоглицеринового альдегида (ФГА). Судьба образовавшихся молекул ФГА различна. "Частично путем ряда превращений ФГА используется на регенерацию акцептора (РДФ). В силу этого количество РДФ на свету поддерживается на постоянном уровне. В каждом цикле принимают участие три молекулы акцептора (РДФ) и образуется 6 молекул триозы (ФГА). Пять молекул ФГА идет на регенерацию акцептора. Каждая шестая молекула ФГА выходит из цикла и используется для построения углеводов. Б связи с этим темновые реакции фотосинтеза можно представить как разветвленный цикл.
Цикл Кальвина можно разделить па три фазы.
Первая фаза — карбоксилирование. Эта реакция катализируется специфическим для процесса фотосинтеза ферментом РДФ-карбокси-лазой. Б листьях этот фермент содержится в больших количествах м является основной фракцией белка хлоропластов. По-видимому, его образование активируется светом
При взаимодействии РДФ с СОз образуется сначала промежуточное нестойкое шестиуглеродное соединение, которое затем распадается на две молекулы ФГК.
СО |
| + ЗСОа + ЗН2О -> 6СНОН
ЗСНОН f
I сида
снон фгк
<!нгО(Р)
рдф
Вторая фаза — восстановление. Дальнейшие превращения ФГК требуют участия продуктов световой фазы фотосинтеза: АТФ и НАДФ-Н++Н+. Прежде всего происходит реакция фосфорилирования 3-ФГК. Донором фосфатной группы является АТФ. При этом образуется 1,3-дифосфоглицериповая кислота. Реакция катализируется ферментом фосфоглицерокиназой:
СООН COO ~ (Р)
«!нон + 6АТФ6СНОН +6АДФ
СН,О(Р) СН,О(Р)
ФГК 1,3-диФГК
Образовавшееся в этой реакции соединение — дифосфоглицериновая кислота — обладает более высокой реакционной способностью, содержит макроэргическую связь. Карбоксильная группировка этого соединения восстанавливается до альдегидной с помощью триозофос-фатдегидрогенааы, коферментом которой служит НАДФ;
С00~(Р) сно
6СНОН + 6НА ДФ - Н+ + 6Н* -к 6СН0Н 4- 6Н3РО4 + 6 НАДФ
снйо(Р) chap)
1,3-дмФГК ФГА
Образовавшийся фосфоглицериновый альдегид (ФГА) претерпевает ряд превращений. Из шести молекул ФГА пять идут ва регенерацию акцептора — рибулезодифосфата, а одна молекула выходит из цикла.
Третья фаза — регенерации. В процессе регенерации акцептора используется пять молекул ФГА,_в результате чего образуются три молекулы рибулезо-5-фосфата. Этот процесс идет через образование 4-, 5-, 6-, 7-углеродных соединений. Прежде всего первая молекула ФГА изомеризуется до фосфодиоксиацетона. Процесс катализируется ферментом триозофосфатизомеразой:
СНО сн£он
I л 1
СНОН =Ft со
chap) снйО(Р)
ФГА ФДА
Фосфодиоксиацетон (ФДА) взаимодействует со второй молекулой ФГА с образованием фруктозодифосфата (ФДФ):
CILOH СНО СН^О(Р) со
1 СО )- СНОН - СНОН
СН2О(Р) СН2О(Р) СНОН
ФДА ФГА 1 СНОН
СН2О(Р) ФДФ
От ФДФ отщепляется фосфат и превращается в фруктозо-6-фос-фат (Ф-6-Ф). Далее от Ф-6-Ф (С^) отщепляется 2-углеродиый фрагмент (—СО—СНгОН), который переносится па следующую (третью) триозу. Эта транскетолазная реакция идет при участии фермента транскетолазы В результате образуется первая пентоза- (С6) -рибуле-зо фосфат. От Ф-6-Ф остается 4-углеродпый сахар аритрозофосфат (С«). Эрнтрозофосфат конденсируется с четвертой триозой с образованием седогептулезодифосфата (С?). После отщепления фосфата се-догептулезодифосфат превращается в оецогептулезофосфат. Далее
Рио. 43. Фотосинтетический цикл Кальвина.
снова происходит транскетолазная реакция, в результате которой от седогептулезофосфата отщепляется 2-углеродный фрагмент, которых! переносится на пятую триозу. Образуются еще две молекулы рибуле-зофосфата. Таким образом, в результате рассмотренных реакций образовались 3 молекулы рибулезофосфата. Для образования на них акцептора (РДФ) необходимо их фосфорилирование. Для этого используются три молекулы АТФ. Все реакции, входящие в цикл Кальвина, представлены на схеме (рис. 43).
При прохождении двух циклов из 12 молекул образовавшегося ФГА две молекулы выходят из них, образуя одну молекулу фруктозодифосфата (ФДф). Общее суммарное уравнение двух циклов имеет следующий вид:
6 РДФ + 6СО2 -J-18 АТФ + 12 НАДФ Н+ 4- 12Н* — 6 РДФ 4-
4- гексоза 4- 18ФН4- 18 АДФ-р 12 НАДФ.
На основании приведенных реакций можно рассчитать энергетический балапс цикла Кальвина. Для восстановления шести молекул СОа до уровня углеводов (глюкозы) требуется 18 молекул АТФ и 12 НАДФ-Нз. Соответственно для восстановления до уровня углеводов одной молекулы СОг необходимы три молекулы АТФ и две НАДФ-Нг- Как мы видели, для образования двух молекул НАДФ-Не и двух молекул АТФ необходимо 8 квантов света. Недостающее количество АТФ образуется в процессе циклического фотофосфорилирования. Следовательно, для восстановления одной молекулы С02 до уровня углеводов должно быть затрачено 8—9 квантов. Энергия квантов красного света равна 168 кДж/моль. Таким образом, при использовании квантов красного света па восстановление одной молекулы СО2 до уровня углеводов затрачивается примерно 1340—1508 кДж. Из этой энергии в ’/в -моль гексозы откладывается 478 кДж. КПД фотосинтеза в этом случае должен составить около 30—35%. Однако в естественных условиях коэффициент использования света значительно меньше.
В отличие от фарментов, принимающих участие в цепи переноса электронов (световая фаза фотосинтеза) фарменты цикла Кальвина локализованы в матриксе хлоропластов. Согласованному осуществлению всех реакций способствует то, что эти фарменты часто ассоциированы на поверхности мембран и составляют определенные ансамбли.
«С-4» путь фотосинтеза (цикл Хетча — Слэка}
Путь углерода при фотосинтезе, установленный Кальвином, является основным. Однако существуют отклонения от этого пути. Так, австралийские ученые Хетч и Слэк (1966) и советский ученый 10. С. Карпилов (1960) показали, что у некоторых растений, ио преимуществу тропических и субтропических (в том числе кукурузы, сахарного тростника), фотоспнтеа идет несколько по иному пути. На
первом этане происходит реакция карбоксилирования фосфоенолпи-ровивоградной кислоты (ФЕП).
СН2 СООН
СО ~ (Р) + со, + н,о Ан, + наро, СООН Ао
ФЕП 1
СООН
ЩУК
Реакция катализируется фармеитом фосфоенолпируваткарбоксилазой (ФЕП-карбоксилазой) с образованием щавелевоуксусной кислоты (ЩУК). Поскольку в этом случае первый продукт карбоксилирования — ЩУК содержит четыре атома углерода, его называют «С-4» путь, в отличие от цикла Кальвина, где образуется ФГК, содержащий три атома углерода («С-3» путь). Щавелевоуксусная кислота преобразуется в яблочную кнспоту. Б последующем проясходит реакция транскарбоксилирования, при которой COj снова отщепляется от органических кислот и вступает в цикл Кальвина — присоединяется к рибулезодифосфату (рис. 44). Таким образом, сущность «С-4» пути заключается в том, что реакция карбоксилирования происходит дважды. Это позволяет растению создавать запасы углерода в клетках. Как и во всяком биохимическом цикле, акцепторы (ФЕП и РДФ) регенерируют, что и создает возможность его непрерывного функционирования. Исследования показали, что в растениях, в которых процесс фотосинтеза протекает по «С-4» пути, имеются два типа хлоропластов: 1) крупные пластиды, часто лишенные гран, в клетках обкладки, окружающих сосудистые пучки; 2) мелкие гра-нальные пластиды в клетках мезофилла листа.
В клетках мезофилла с мелкими хлоропластами осуществляется карбоксилирование фосфоенолпировиноградной кислоты с образованием четырехуглеродного соединения — ЩУК (и в некоторых случаях аспарагиновой кислоты). Затем ЩУК передвигается в клетки обкладки, где происходит реакция транскарбоксилирования, в результате которой СОг отщепляется и вступает в цикл Кальвина. При атом фосфоенолпировиноградная кислота (ФЕП) регенерирует. Поскольку при таком механизме фотосинтеза принимают участие два типа клеток и два типа хлоропластов, этот путь называют кооперативным (10. С. Карпилов, 1970). Фиксация СОг по «С-4» пути имеет ряд преимуществ. Показано, что некоторые представители растений, ведущие ассимиляцию по «С-4» пути, осуществляют первые этапы этого процесса (образование органических кислот) в печной период суток. В последующий светлый период углекислота освобождается и реассимилируется в цикле Кальвина. Такая последовательность позволяет осуществлять фотосинтез днем при закрытых устьицах, что имеет большое значение, так как предохраняет растение от излишней потери воды. Возможно, именно с этим связана большая засухоустойчивость растений с таким типом фотосинтеза.
Рис. 44 Фотосинтетический цикл Хетча —Слэка:
А—в хлоропластах мезофилла листа; Н— в хлоропластах обкладки. ЯК—яблочная кислота; ПК — пировиноградная кислота.
У растений, осуществляющих фотосинтез по «С-4» пути, отсутствует процесс фотодыхания. Это последнее обстоятельство уменьшает непроизводительную трату органического вещества и увеличивает продуктивность растений. Открытие «С-4» пути позволило расшифровать особенности фотосинтеза у суккулентов. Оказалось, что суккуленты в ночное время фиксируют углерод в органических кислотах, по преимуществу в яблочной. По-ввдимому, ето происходит под действием фермента пируваткарбоксилазы. Далее эта фиксированная углекислота с помощью траискарбоксилирования переносится па пеидеп-тифицированный акцептор и используется для образования триоз. Осуществление фотосинтеза по такому пути позволяет суккулентам в течение дня держать устьица закрытыми и таким образом сокращать транспирацию.
В литературе имеются указания о наличии и других путей связывания COj. Однако они еще недостаточно охарактеризованы. Важно также подчеркнуть, что на всех этапах фотосинтетического цикла промежуточные продукты могут претерпевать различные превращения в зависимости от условий среды. Именно это является основой для образования разнообразных продуктов фотосинтеза.
4. ПРОДУКТЫ ФОТОСИНТЕЗА
Природа первичных продуктов фотосинтеза издавна интересует физиологов. Для решения этого вопроса исследователями были применены разные подходы. Прежде всего была сделана попытка определить фотосинтетический коэффициент. Под фотосинтетическим коэффициентом понимается отношение выделенного в процессе фотосинтеза кислорода к поглощенной СОг. Если в процессе фотосинтеза образуются углеводы, то, согласно приведенному суммарному уравнению, фотосинтетический коэффициент должен быть равен единице: 6°3- — 1. Если представить себе, что в процессе фотосинтеза обра-6С0а
зуются соединения более восстановленные (содержащие меньше кислорода) по сравнению с углеводами, то фотосинтетический коэффициент должен быть больше единицы. Так, расчеты показывают, что в случае образования белков фотосинтетический коэффициент равен 1,25, в случае жира — 1,44. Средняя величина фотосикгетиче-слого коэффициента для 27 видов растений оказалась равной 1,04. Расчеты показали, что такая величина фотосинтетического коэффициента указывает па образование паряду с углеводами некоторого количества белка (примерно 12%). Оказалось далее, что величина фотосинтетического коэффициента мепяется в зависимости от условий. Так, с улучшением азотного питания фотосинтетический коэффициент повышается. Из этого можно сделать заключение, что в процессе фотосинтеза образуются азотсодержащие соединения.
Окончательное разрешение данного вопроса было достигнуто благодаря обширным исследованиям, проведенным А. А. Ничнпорови-чем и Т. Ф. Андреевой. При проведении исследований с листьями, плавающими па растворе (|SNH»)2SO4 в атмосфере с “СОа, оказалось, что па свету в этих листьях образовывались белки, содержащие одновременно I5N и 14С. При выдерживании в темноте зтого не наблюдалось. Следовательно, па свету происходит новообразование аминокислот, а затем белков непосредственно из СОг. В настоящее время признано, что паряду с углеводами продуктами фотосинтеза могут быть аминокислоты и, как следствие, белки. При зтом в зависимости от условий соотношение продуктов фотосинтеза меняется. Так, преобладание синих лучей над красными приводит к увеличению доли образующихся белков, тогда как красный свет благоприятствует образованию углеводов (Н. П. Воскресенская). Усиление снабжения растений азотом, естественно, также приводит к увеличению первичного синтеза белка.
Каковы же особенности образования углеводов и белков в процессе фотосинтеза?
Фотосинтетическое образование углеводов
В результате двух циклов Кальвина образуется фруктозодифосфат. Из двух молекул фруктозодифосфата (Ф-1,6-диФ) образуются фруктозо-6-фосфат (Ф-6-Ф) и глюкозо-1-фосфат (Г-1-Ф). Глюкозо-
1-фосфат, взаимодействуя с уридинтрифосфатом (УТФ) дает урцдин-дифосфоглюкозу (УДФГ). В свою очередь, УДФГ, -реагируя с Ф-6-Ф, дает сахарозофосфат. Из сахарозофосфата путем дефосфорилирования образуется сахароза. Для образования одной молекулы сахарозы необходимо, чтобы прошли четыре цикла Кальвина:
।—2 молекулы Ф-1,6-диФ———-----------—
I
Ф-б-Ф Ф-&Ф
r-i® r-i®
УТФ----I-------------УДФГ-------------------> caxaposo-Ф
4. I
ф<₽н сахароза -J- Фв
В опытах А. Л. Курсапова и М. В. Туркиной растения с разными типами обмена помещали в атмосферу |4СОг на свету. Через короткие промежутки времени прослеживалось, в каком из углеводов по преимуществу находится ,4С. Были взяты растения, откладывающие в качестве запасного вещества различные углеводы: сахарозу (сахарная свекла), инулин (земляная груша), крахмал (табак), глюкозу (лук). Оказалось, что у всех изученных растений 14С прежде всего фиксировался в сахарозе. По-видимому, именно сахароза является первым свободным сахаром, образующимся в процессе фотосинтеза. Из Сахаровы образуются нефосфорилцровапные моносахара (глюкоза и фруктоза). Крахмал образуется из адекозиндифосфоглюкозы (АДФГ) пли уридипдифосфоглюкозы (УДФГ), процесс катализируется ферментом амилосинтетазой.
Фотосинтетическое образование аминокислот
Среди первых продуктов фотосинтеза обнаружены такие аминокислоты, как аланин, серин, глютаминовая кислота, глицин. По-видимому, ФГК, образовавшаяся па первом этапе цикла Кальвниа, может превращаться в пировиноградную кислоту. Этот процесс идет особенно интенсивно при недостатке НАДФ-На, из-за чего, задерживается преобразование ФГК в ФГА (обычный путь в цикле Кальвина) -Пировиноградная кислота в присутствии NHa дает аминокислоту аланин. Показано, что скорость включения 14СОг в аланин в клетках хлореллы при некоторых условиях может даже превышать скорость ее включения в сахарозу.
При взаимодействии пировиноградной кислоты с глютаминовой образуется аминокислота серин (реакция переаминирования). Из пировиноградной кислоты может образоваться еще ряд органических нислот (в цикле Клебса). Образовавшиеся органические кислоты в процессе аминирования или переаминирования дают аминокислоты-ПО
Сам по себе синтез аминокислот еще не означает образование белков. Однако было показано, что между этими двумя процессами имеется прямая связь. Так, под влиянием освещения синими лучами (458—480 нм) усиливается фотосинтетическое образование как аминокислот, так и белков. В присутствии ингибиторов синтеза белка действие синего света не проявляется.
ВЛИЯНИЕ УСЛОВИЙ НА ИНТЕНСИВНОСТЬ
ПРОЦЕССА ФОТОСИНТЕЗА
Интенсивность процесса фотосинтеза может быть выражена в следующих единицах: в миллиграммах СОг, ассимилированной 1 дм2 листа за 1 ч; в миллилитрах О2, выделенного 1 дм2 листа за 1 ч; в миллиграммах сухого вещества, накопленного 1 дм2 листа за 1 ч. Методы определения иптепснвпости сЬотосиптеза многочисленны. Рассмотрепие их дается в специальных руководствах.
При интерпретации данных, полученпых любым методом, следует иметь в виду, что на свету растения пе только фотосинтезируют, но и дышат. В связи с этим все измеренные тем или иным методом показатели представляют собой результат двух прямо противоположных процессов, или разность между показателями процессов фотосинтеза и дыхания. Это видимый фотосинтез. Так, например, наблюдаемое изменение содержания СО2 — это разность между тем его количест-пом, которое поглощено в процессе фотосинтеза, и тем, которое выделилось в процессе дыхания. Для того чтобы перейти к истинной величине фотосинтеза, во всех случаях необходимо вносить поправку, учитывающую интенсивность процесса дыхания.
1. ВЛИЯНИЕ ВНЕШНИХ УСЛОВИЙ НА ИНТЕНСИВНОСТЬ ПРОЦЕССА ФОТОСИНТЕЗА
В естествепп'ой обстановке все факторы взаимодействуют друг «. другом, т. е. действие одного фактора зависит от напряженности всех остальных. В общем виде это можно сформулировать так: изменение напряженности* одного фактора при неизменности прочих влияет на фотосиптоз, пачипая от минимального уровня, при котором процесс начинается, и кончая оптимумом, при достижении которого процесс перестает изменяться (кривая выходит на плато). Во многих случаях увеличение напряженности фактора после определенного уровия приводит даже к торможению процесса. Однако если начать изменять какой-либо другой фактор, то оптимальное значение напряженности первого фактора меняется в сторону увеличения. Иначе говоря, плато достигается при более высоком значении напряженности. Скорость процесса, в частности скорость фотосинтеза, зависит в первую очередь от напряженности того фактора, который находится в минимуме (ограничивающий фактор). В качестве примера можно привести взаимодействие таких факторов, кая интенсивность света и содержание СО2. Чем выше содержание углекислоты (в определенных пределах), тем при более высокой освещенности показатели фотосинтеза выходят па плато.
Влияние света
Увеличение интенсивности освещения сказывается на процессе фотосинтеза различно в зависимости от типа растения и напряженности других факторов. Растения в процессе исторического развития приспособились к произрастанию в различных условиях освещенности. В. Н. Любименко по этому признаку разделил растения па группы: светолюбивые, теневыносливые и тенелюбивые. Эти внелогические группы характеризуются рядом анатомо-физиологических особенностей. Они различаются по содержанию и составу пигментов.
Светолюбивые растения характеризуются более светлой окраской листьев, меныпим общим содержанием хлорофилла по сравнению с теневыносливыми. В листьях теневыносливых растений по сравнению со сеетолтобивыми относительно высокое содержание ксантофилла и хлорофилла Ь. Эта особенность в составе пигментов позволяет листьям теневыносливых растений использовать «отработанный свет», уже прошедший через листья светолюбивых растений. Светолюбивые растения — это растения открытых местообитаний, которые чаще испытывают недостаток водоснабжения. В связи с этим их листья по сравнению с теневыносливыми обладают более ксероморфпой анатомической структурой, отличаются большей толщиной, более сильно развитой палисадной паренхимой. У некоторых светолюбивых растений палисадная паренхима располагается пе только с верхней, по и с нижней стороны листа. Листья светолюбивых растений по сравнению с теневыносливыми характеризуются также более мелкими клетками, более мелкими хлоропластами, меньшей величиной устьиц при большем их количестве па единицу поверхности листа, более густой сетью жилок.
Светолюбивые и теневыносливые растения отличаются и по фи-виологическим признакам. Большое содержание пигментов позволяет теневыносливым растениям лучше использовать малые количества света. У светолюбивых растений интенсивность фотосинтеза увеличивается при возрастании интенсивности освещения в более широких пределах. Важной особенностью, определяющей возможность растений произрастать при большей или меньшей освещенности, является положение компенсационной точки. Под компенсационной точкой понимается та освещенность, при которой процессы фотосинтеза и дыхания уравновешивают друг друга. Иначе говоря, это та освещеп-пость, при которой растение за единицу времени образует в процессе фотосинтеза столько органического вещества, сколько оно тратит в процессе дыхания. Естественно, что рост эеленого растения может идти только при освещенности выше компенсационной точки. Чем ниже интенсивность дыхания, тем ниже компенсационная точка и тем при меньшей освещенности растения растут. Теневыносливые растения характеризуются более низкой интенсивностью дыхания, что и позволяет им расти при меньшей освещенности. Компенсационная точка заметно растет с повышением температуры, так как повышение температуры сильнее увеличивает дыхание по сравнению
с фотосинтезом. Именно поэтому при низкой освещенности повышение температуры может снизить темпы роста растений.
Для фотосинтеза, как и для всякого процесса, включающего фотохимические реакции, характерно наличие пижпего порога освещенности, при котором он только начинается (около одной свечи па расстоянии 1 м). В целом зависимость фотосинтеза от интенсивности освещения может быть выражена логарифмической кривой. Первоначально увеличение интенсивности освещения приводит к пропорциональному успиеишо фотосинтеза (зона максимального эффекта). При дальнейшем увеличении интенсивности света фотосинтез продолжает возрастать, но медленнее (зона ослабленного эффекта) и, наконец, интенсивность света растет, а фотосинтез не изменяется (зона отсутствия эффекта — плато). Наклон кривых, выражающих зависимость интенсивности фотосинтеза от освещенности, различен для разных растений. Есть растения, у которых фотосинтез возрастает вплоть до освещения их прямыми солнечными лучами. Вместе с тем для многих растений увеличение интенсивности освещения свыше 50% от прямого солнечного света оказывается уже излишним. Это обстоятельство связано с тем, что конечный выход продуктов фотосинтеза зависит от скорости не столько световых, сколько темповых реакций. Между тем интенсивность освещения влияет на скорость лишь световых реакций. Следовательно, для того чтобы интенсивность света оказывала влияние после достижения определенного уровня, необходимо увеличить скорость темновых реакций. В свою очередь, скорость темповых реакций фотосинтеза в большой степени зависит от температуры и содержания углекислоты. С повышением температуры или с увеличением содержания углекислоты оптимальная освещенность меняется в сторопу увеличения.
В естественных условиях из-за взаимного затенения па нижние листья падает лишь небольшая доля солнечной энергии. Так, в густом посеве растений вики в стадии цветения интенсивность света в приземном слое составляет всего 3% от полного дневного освещения. Часто нижние листья освещаются светом, близким к компенсационной точке. Таким образом, в посевах общая интенсивность фотосинтеза всех листьев растений может возрастать вплоть до уровня, соответствующего полной интенсивности солнечного света.
При очень высокой интенсивности света, прямо попадающего на лист, может наблюдаться депрессия фотосиптеза. На начальных этапах депрессии, вызванной высокой интенсивностью света, хлоропласты передвигаются к боковым стейкам клетки (фототаксис). При дальнейшем воврастанни освещенности интенсивность фотосинтеза может резко сокращаться. Причиной депрессии фотосиптеза ярким светом могут служить перегрев и нарушение водного баланса. Возможно, на ярком свету возникает избыток возбужденных молекул хлорофилла, энергия которых тратится на окисление каких-то ферментов, необходимых дпя нормального протекания процесса фотосинтеза.
Коэффициент использования солнечной энергии
В ясный солнечный день на 1 ди2 листовой поверхности за 1 ч падает около 30168 кДж. Из этого количества поглощается примерно 75%, или 22626 кДж, 25% падающей энергии проходят через лист и отражаются от него. Исходя из количества сухого вещества, накапливаемого листом за определенный промежуток времени, русский физиолог К. А. Пуриевич рассчитал количество запасаемой енергии и сопоставил его с тем количеством, которое лист получает. Согласно полученным данным, КПД фотосинтеза оказался равным 2,6%. Можно еще более просто подойти к расчету интересующей нас величины. Так, по данным Н. А. Максимова, одно растение кукурузы накапливает за сутки в среднем 18,3 г сухого вещества. Можно принять, что все это вещество — крахмал. Теплота сгорания 1 г крахмала будет 17,6 кДж. Следовательно, суточная прибыль энергии составит (18,3X17,6) 322 кДж. При густоте на 1 га 15 тыс. растений поле в 1 га за сутки накапливает 4 830 651-кДж, а получает ва день 209 500 000 кДж. Таким образом, использование энергии составляет 2,3%.
Следовательно, расчеты показывают, что КПД процесса фотосинтеза в естественных условиях ничтожно мал. Задача повышения КПД использования солнечной анергии является одной ив важнейших в физиологии растений. Эта задача вполне реальна, так как теоретически КПД процесса фотосинтеза может достигать значительно большей величины.
Влияние температуры
Влияние температуры на фотосинтез находится в зависимости от интенсивности освещения. При низкой освещенности фотосинтез от температуры не зависит (Qio=l). Это связано с тем, что при низкой освещенности интенсивность фотосинтеза лимитируется скоростью световых фотохимических реакций. Напротив, при высок&й освещенности скорость фотосинтеза определяется протеканием темновых реакций, и в этом случае влияние температуры проявляется очень отчетливо. Температурный коэффициент Qw может быть около двух. Так, для подсолнечника повышение температуры в интервале от 9 до 19°С увеличивает интенсивность фотосинтеза в 2,5 раза. Температурные пределы, в которых возможно осуществление процессов фотосинтеза, различны для разных растений. Минимальная температура для фотосинтеза растений средней полосы около 0°С, для тропических растений 5—10°С. Имеются данные, что полярные растения могут осуществлять фотосинтез и при температуре ниже ОдЗ. Оптимальная температура фотосинтеза для большинства растений составляет примерно 30—33°С. При температуре выше 30—33°С интенсивность фотосинтеза резко падает. Это связано с тем, что зависимость процесса фотосинтеза от температуры представляет собой равнодействующую противоположных процессов. Так, повышение температуры увеличивает скорость темновых реакций фотосинтеза.
Одновременно при температуре 25—30°С происходит процесс инактивации хлоропластов. Повышение температуры может вызвать также закрытие устьичных щелей.
Влияние содержания СО2 в воздухе
Источником углерода для процесса фотосинтеза является углекислый газ. Попытки заменить углекислый газ угарным (СО) не увенчались успехом. В основном в процессе фотосинтеза используется СОг атмосферы. Правда, имеются данные, что частично СОг может поступать в растения через корневую систему из почвы (А. Л. Кур-санов). Однако этот источник имеет сравнительно малое значение.
Содержание СОг в воздухе составляет всего 0,03%. Процесс фотосинтеза осуществляется прп содержании СОг на менее 0,008%. Повышение содержания СО2 до 1,5% вызывает прямо пропорциональное возрастание интенсивности фотосинтеза- При повышении содержания СОг свыше 1,5% фотосинтез продолжает возрастать, но уже значительно медленнее. При увеличении содержания СОг до 15—20% процесс фотосинтеза выходит на плато. При содержании СО2 выше 70% наступает депрессия фотосинтеза. Есть растения, более чувствительные к повышению концентрации СОг, у которых торможение фотосинтеза начинает проявляться уже при содержании СО2, равном 5%. Повышение концентрации СО2 оказывает ингибирующее влияние в силу разных причин. Прежде всего увеличение содержания СО2 вызывает закрытие устьиц. Вместе с тем высокие концентрации СО2 сказываются особенно неблагоприятно при высокой освещенности. Последнее заставляет полагать, что СО2 в определенных концентрациях ингибирует темновые ферментативные реакции.
В естественных условиях содержание СО2 настолько мало, что может ограничивать возрастание процесса фотосинтеза. Надо еще учесть, что в дневные часы содержание СОг в воздухе вокруг растений понижается.
В связи со сказанным увеличение содержания СОг в вовдухе является одним из важных способов повышения интенсивности фотосинтеза и, как следствие, накопления сухого вещества растением. Однако в полевых условиях регулирование содержания СОг затруднено. Частично это может быть достигнуто с помощью поверхностного внесения навоза или других органических удобрений (мульчирование). Легче достигается повышение содержания СОг в закрытом грунте. В этом случае подкормки СО2 дают хорошие результаты и должны быть широко используемы. Разные растения неодинаково используют одпи и те же концентрации СОг. Растения, у которых фотосинтез идет по «С-4» пути (кукуруза), обладают более высокой способностью к связыванию СО2 благодаря высокой активности фермента фосфоенолпируваткарбоксилазы.
6—773
145
Влияние снабжения водой
Небольшой водный дефицит (5—45%) в клетках листьев оказывает благоприятное влияние на интенсивность фотосинтеза (В. А. Бриллиант). При полной насыщенности водой клеток листа фотосинтез снижается. Частично это может быть связано с тем, что при полном насыщении клеток мезофнила замыкающие устьичные клетки оказываются несколько сдавленными, устьичные щели не могут открыться (гидропассивные движения). Однако дело не только в атом. Небольшое обезвоживание листьев сказывается благоприятно на процессе фотосинтеза и вне зависимости от степени открытия устьиц. Так, погружение листьев в раствор маннита в концентрации 0,2—0,4 М вызвало водный дефицит, равный 15—20%, и некоторое воврастание интенсивности фотосинтеза. Увеличение водного дефицита свыше 15—20% приводит к заметному снижению интенсивности фотосинтеза. Это связано в первую очередь с закрытием устьиц (гидроактивные движения), что резко уменьшает диффузию СО2 в лист. Кроме того, ето вызывает сокращение транспирации, как следствие, температура листьев возрастает. Между тем повышение температуры выше 30°С вызывает снижение фотосинтеза. Наконец обезвоживание оказывает влияние на конформацию, а следовательно, и активность ферментов, принимающих участие в темновой фазе фотосиптеза.
Снабжение кислородом и интенсивность фотосинтеза
Несмотря на то что кислород является одним из продуктов процесса фотосинтеза, в условиях полного анаэробиоза процесс фотосинтеза останавливается. Можно полагать, что влияние анаэробиоза косвенное, связано с торможением процесса дыхания и накоплением продуктов неполного окисления, в частности органических кислот. Это предположение подтверждается тем, что вредное влияние апа-эробиоза сказывается более резко в кислой среде. Повышение концентрации кислорода (до 25%) также тормозит фотосинтез (эффект Варбурга).
Тормозящее влияние высоких концентраций кислорода на фотосинтез проявляется особенно резко при повышенной интенсивности света. Эти наблюдения заставили обратить внимание на особенности процесса дыхания в присутствии света (фотодыхание). Химизм этого процесса отличен от обычного темнового дыхания. Фотодыхание— это поглощение кислорода и выделение СО2 на свету с использованием в качестве субстрата промежуточных продуктов цикла Кальвина. По-видимому, образующаяся в цикле Кальвина фосфоглицерииовая кисиота в процессе фотодыхания окисляется и декарбоксилируется до гликолевой кислоты, а гликолевая кислота окисляется до глиокси-левой кислоты. Образование гликолевой кислоты происходит в хлоропластах, однако там ие накапливается, а транспортируется в особые органеллы пероксисомы. В пероксисомах происходит превраще-146
пне гликолевой кислоты в глиоксалевую кислоту. Глиоксилевая кислота, в свою очередь, подвергается аминированию, а затем декарбок-ешшровапию, при этом выделяется углекислый газ.
CH20(P) СН2ОН СНаОН
I I -1-0, I f
СНОН -Ь Н3РО4 4- СНОН------------> C00H-|-C02-i-H20
СООН СООН
ФГК глицериновая гликолевая
кислота кислота
СН2ОН . ^о
—1 рн + н,оа
СООН СООН
гликолевая кислота
глиоксилевая кислота
Выделение СОг при фотодыхания может достигать 50% от всего СО2, усвоенного в процессе фотосинтеза. В связи с этим можно полагать, что уменьшение интенсивности фотодыхания должно привести к повышению продуктивности растений. Так, мутантные-формы табака, не обладающие слособдостыо к образованию гликолевой кислоты, отличаются повышенным накоплением сухой массы. Имеются данные, что некоторое уменьшение содержания кислорода в атмосфере сказывается благоприятно на темпах накопления сухого вещества проростками. У кукурузы и других растений, осуществляющих фотосинтез по «С-4» пути фотодыхание не идет. Не исключено, что такой тип обмена способствует большей продуктивности этих растений.
Влияние минерального питания
Влияние калия на фотосинтез многосторонне. При недостатке калия интенсивность фотосинтеза снижается уже через короткие промежутки времени. Калий может влиять на фотосинтез косвенно, через повышение оводненности цитоплазмы, ускорение оттока ассими-лятов из листьев, увеличение степени открытия устьиц. Вместе с тем имеет место и прямое влияние калия, поскольку он активирует процессы фосфорилирования.
Очень велико значение фосфора для фотосинтеза- На всех этапах фотосинтеза принимают участие фосфорилированные соединения. Энергия света аккумулируется в фосфорных связях.
В последнее время много внимания уделяется выяснению роли марганца. При изучении фотосинтеза штамма хлореллы, который может расти как в темноте за счет готового органического вещества, так и на свету, было показано, что марганец необходим только в последнем случае. Для тех микроорганизмов, которые осуществляют процесс фоторедукции, марганец не нужен. Вместе с тем отсутствие
6’ 147
марганца резко угнетает реакцию Хилла и процесс нециклического фотофосфорилирования. Все это доказывает, что роль марганца определяется его участием в реакциях фотоокисления воды.
Многие соединения, функционирующие как переносчики, содержат железо (цитохромы, ферредоксин) или медь (пластоцианин) -Естественно, что при недостатке этих элементов интенсивность фотосинтеза понижается.
2. ВЛИЯНИЕ ВНУТРЕННИХ ФАКТОРОВ НА ПРОЦЕСС ФОТОСИНТЕЗА
Влияние содержания хлорофилла. Интенсивность фотосинтеза возрастает с увеличением содержания хлорофилла. Однако прямой пропорциональности между этими двумя показателями нет. В 1918 г. Вильштеттер и Штоль ввели понятие ассимиляционного числа. Ассимиляционное число — это количество СОг в миллиграммах, усвоенное на единицу содержания хлорофилла в единицу времени-По данным В. Н. Любименко, с увеличением содержания хлорофилла ассимиляционные числа падатот. Так, например, при увеличении содержания хлорофилла с 0,7 до 15,6 мг на 1 г сырой массы, т. е. более-чем в 20 раз, интенсивность фотосинтеза увеличивается всего в два раза. Соответственно ассимиляционное число падает в 10 раз. Интересно заметить, что величина ассимиляционных чисел зависит от интенсивности освещения. При низкой освещенности, когда лимитирующей является скорость световых реакций, увеличение содержания хлорофилла не сопровождается падением ассимиляционного числа. При высокой освещенности повышенное содержание хлорофилла приводит к заметному уменьшению ассимиляционного числа. Из этого следует, что содержание хлорофилла и интенсивность света можно рассматривать как единый фактор, определяющий поглощение светя. При высокой интенсивности света даже сравнительно небольшое количество хлорофилла может поглощать его достаточно, для того чтобы было достигнуто световое насыщение.
Влияние оттока ассимилятов. А. Л. Курсанов экспериментально доказал, что депрессия фотосинтеза часто свяэана с нарушением процесса оттока ассимилятов. Так, при нарушении процесса оттока ассимилятов к ялоду путем кольцевания фотосинтез листа резко тор-моввтся. Известно, что зеленые створки плодов гороха обладают способностью к фотосинтезу. Оказалось, что можно заметно усилить их фотосинтез, если ослабить приток к ним ассимилятов яз листьев. В этой связи важное значение имеет то обстоятельство, что усиленное использование ассимилятов на ростовые процессы, как правило, повышает интенсивность фотосинтеза.
Влияние скорости оттока ассимилятов иа процесс фотосинтеза связано, пс-видимому, с несколькими причинами. Прежде всего, согласно закону действующих масс, накопление продуктов реакции всегда тормозит ее течение. Однако это проявляется только в том случае, когда продукты реакции находятся в растворенпом состояпии-Следовательно, вто справедливо для растений, накапливающих в ка-
честно продуктов фотосинтеза сахара (лук). Вместе с тем многие растении в процессе фотосинтеза накапливают крахмал. В этом случае крахмальные зерна могут настолько переполнять клетки, что создаются механические препятствия для их новообразования. А. Л. Кур-санов высказывает предположение, что продукты фотосиптеза (конечные или промежуточные) блокируют один шш несколько ферментов фотосинтетического цикла. Возможно, они вызывают конформационные изменения ферментов, из-за чего активность последних падает.
Влияние возраста листа. По мере роста листьев пнтеисппиость фотосинтеза попытаете». Наибольшая интенсивность характерна для вполне сформировавшихся листьси. По мере дальнейшего увеличения возраста листьев (процесс старения) интенсивность фотосиптеза падает. На интенсивность фотосинтеза оказывает влияние возраст всего растении. У большинства однолетник растений интенсивность фотосиптеза возрастает в процессе онтогенеза и достигает максимума в фазу бутонизации, цветения. После цветения интенсивность фотосинтеза в листьях снижается.
Влияние степени открытости устьиц. В том случае, если содержание воды поддерживается в листе на достаточно высоком уровне, увеличение ширины устьичных щелей, как правило, сопровождается увеличением интенсивности фотосинтеза. При полном закрытии устьиц фотосинтез протекает, но в очень слабой степени.
3. ДНЕВНОЙ ХОД ФОТОСИНТЕЗА
В осгоствеипых условиях происходит сложное взаимодействие всех внешних и внутренних факторов. В силу этого суточный ход фотосинтеза неустойчив и подвержен значительным изменениям. При умеренной дисплей томиоратуро и достаточной влажности дневпой ход фотосиптеза примерно соответствует изменению иитеисивпости солнечной инсоляции. Фотосинтез, начинаясь утром с восходом солнца, достигает максимума в полуденные часы, постепенно снижается к вечеру и прекращается с заходом солсда. При повышенной температуре и уменьшении влажности максимум фотосинтеза сдвигается па раппие часы. При еще большей напряжен нести метеорологических факторов кривая дневного хода фотосинтеза принимает двувершип-пый характер. В этом случае в полуденные часы фотосинтез резко снижается. В засушливых районах (Средняя Азия) в полуденные часы возможно даже превышение интенсивности дыхания над интенсивностью фотоепптеаа. Надо учесть при этом, что снижение содержания поды в листьях н высокая температура задерживают отток ассимилятов, что, в свою очередь, вызывает делрессию фотосинтеза. В этих усновпях выделение СОг превышает его использование в процессе фотосинтеза. В полярных условиях, несмотря на круглосуточное освещение, процесс фотосинтеза все же сохраняет определенный ритм, понижаясь в ночные часы суток.
4. ФОТОСИНТЕЗ И УРОЖАЙ
Фотосинтез является основным процессом, при котором образуется сухое вещество растений. Однако зависимость между фотосинтезом и урожаем далеко не простая. Л. А. Ивановым было предложено следующее уравнение, характеризующее отношение между накоплением сухой массы растением (биологическим урожаем) и интенсивностью фотосинтеза. M—aST—bSiTj, где Af — сухая масса растения; а — интенсивность фотосинтеза; S — фотосинтезирующая поверхность; Т — время фотосинтеза. Произведение aST — продуктивность фотосинтеза; Ъ — интенсивность дыхания; Si — поверхность клеток, осуществляющих дыхание, и Т\ — время дыхапия. Надо учитывать при зтом, что фотосинтез осуществляется лишь в зеленых клетках, тогда как процесс дыхания идет во всех ниетках без исключения. Время, в течение которого осуществляется фотосинтез, также меньше времени дыхания. В связи с этим, для того чтобы происходило накопление сухого вещества, интенсивность фотосинтеза должна примерно в 10 раз превышать интенсивность дыхания. Более подробно вопрос о связи между фотосинтезом и урожаем растений получил освещение в работах А А. Ничипоровича. Согласно Ничипоровичу, биологический урожай (Уоиол) равен сумме приростов сухой массы за каждые сутки вегетационного периода: Убиол= —Ci+Cz...Cni где С — прирост сухой массы (в кг/га) за сутки, ап — число суток:
фсо. хКэфхЛ
С ......!---—------- г/м* в сутки,
1000
Фсоз — это интенсивность фотосинтеза в граммах на 1 м2 листовой поверхности за сутки; Каф— коэффициент, позволяющий перейти от количества усвоенного СОа к величине накопленного сухого вещества.
Кэф включает несколько показателей. Для того чтобы перейти от массы усвоенного СОз к сухому веществу, необходимо ввести коэффициент 0,64 (1 кг усвоенного COs соответствует 0,64 г углеводов). Однако не все образовавшееся сухое вещество накапливается. Частично оно расходуется в процессе дыхания, теряется при опадении отдельных органов, а также при зкзоосмосе. Эти потери составляют около 25—30%. Вместе с тем определенное количество веществ поступает через корневую систему (5—10% от общей массы растения). Если все это учесть, то Кэф составит 0,50. Л — это площадь листьев.
Следовательно, общее накопление сухой массы растений вависит от интенсивности фотосинтеза, коэффициента эффективности (куда входит трата на процесс дыхания), размера листовой поверхности и суммы дней вегетационного периода. Необходимо учесть, что в агрономической практике важен не столько биологический, сколько хозяйственный урожай. Хозяйственный урожай (Ухоз) •—это доля полезного продукта, ради которого возделывают данное растение (зерно, корнеплоды, волокно и т. д.). Ухоз=УбиолХКхоз-Кхоэ может колебаться в зависимости от растений примерно от 50% (сахарная 150
свекла) до 1% (волокно хлопчатника). Для одного и того же растения К>ша также может значительно изменяться. Приведенные выкладки позволяют проанализировать зависимость урожайности растений от разных показателей. В большей степени биологический, а следовательно, и хозяйственный урожай зависит от площади листьев. Для получения максимального прироста сухой массы растений необходимо добиваться быстрого развития листовой поверхности в начале вегетационного периода, по чрезмерное развитие листьев нежелательно. В атом случае листья затеняют друг друга и их работоспособность уменьшается. Могут быть даже случаи, когда листья из снабжающих органов становятся потребляющими. Вместе с тем лист — это не только орган фотосинтеза, но и орган хранышрацпи. Следовательно, чем больше площадь листьев, тем больше растение теряет воды в процессе ис-парсппя.
По данным Л. Л. Ппчииороянча, лучшие результаты достигаются в том случае, когда общая площадь листьев растений равна примерно 30 тыс. м5/га. В этом случае солнечная энергия поглощается наиболее полно, одновременно в посеве сохраняются благоприятные условия освещения. Для получения наибольшего хозяйственного урожая важно, чтобы в конце вегетационного периода питательные вещества были как можно полнее использованы. В этой связи все приемы, которые усиливают отток ассимилятов и даже отмирание листьев в конце вегетационного периода, могут быть полезными. Как видно из приведенных уравнений, биологический урожай зависит пе только от площади листьев, по и от интенсивности фотосин теза. В этом отношении также имеются широкие возможпостп. Тео ретйческис расчеты показывают, что Фсоа может быть повышено дс 100 мг СОг на 1 дмг/ч. Наконец, для получения наибольшего хозяйственного урожая важное значение пмеот повышение Кхоз, иначе говоря, увеличение доли полезного продукта в урожае. Это может быть достигнуто прежде всего путем пзмепепия направления оттока ассимилятов из листьев и связанного с этим различной скорости щрета отдельных органов. В этом отношении важную роль должно сыграть умелое применение регуляторов роста — фитогормопов.
Список рекомендуемой литературы
Т а р ч с в с к и й И. Л. Основы фотосинтеза. М., Высшая откола, 1977.
Го д и о в Т- И. Хлорофилл, его стросмво и функции. Минск, 1963.
ПасыровЮ. С. <1>отоспитсз и генотипа хлоропластов. М., Наука, 1975. Хит О. Фотосинтез М., Мир. 1977.
Глава IV.
КОРНЕВОЕ ПИТАНИЕ РАСТЕНИИ
Аиализ элементарного состава растений показывает, что опи в среднем содержат С — 45%, О — 42%, Н — 6,5%, N —1,5%. В процессе сжигания эти элементы окисляются и улетучиваются. Остается вола. Растения черпают углерод из СО2 воздуха, кислород и водород из воды. Кислород также вовлекается в обмен в процессе дыхания. Авот и элементы, входящие в состав золы, поступают в растения через корневую систему из почвы в основном в виде минеральных соединений. Питание растений азотом и другими необходимыми элементами привлекало издавна внимание. Наши современные представления покоятся на результатах, добытых усилиями многих ученых, в том числе таких крупных русских исследователей, как Д. Н. Прянишников, Д. А. Сабинин и др. Управление питанием растения через корневые системы с помощью внесения удобрений в почву значительно легче по сравнению с регулированием поступления COs из воздуха. Именно поэтому пи в одном разделе физиология растений так тесно не соприкасается с земледелием, как в разделе корневого питания.
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ЭЛЕМЕНТОВ
МИНЕРАЛЬНОГО ПИТАНИЯ
Содержание волы в растениях колеблется в широких пределах, в вависимости от вида растений. Так, например, в составе листьев картофеля 5—13% волы, свеклы — 11—15%, репы — 8—15%. Содержание волы колеблется и в зависимости от органа растения. В семенах содержание золы составляет в среднем около 3%, в корнях и стеблях — 4—5%, в листьях — 3—15%, меньше всего содержится золы в мертвых клетках древесины (0,4—1 %). Уже ети цифры показывают, что зольные элементы сосредоточены в тех органах и клетках, уровень жизнедеятельности которых достаточно высок. Большое значение имеют и условия выращивания. Как правило, чем богаче почва в чем суше климат, тем выше содержание волы в растении.
Состав золы разнообразен. Анализы показывают, что почти пет елементов, даже из числа самых редких, которые не были бы найдены в воле того или иного растения. Многие элементы, рассеянные в земной коре, накапливаются в растении в значительном количестве. Это позволило В. И. Вернадскому указать на значительную роль 152
Средний элементарный состав растений в жйвотных
Таблица 8
декады Весовые проценты Названия элементов Декады весовые проценты Названия влеыентое
I 101 о, н v 10"» Мо, В, Sr
11 10» с VI 10-“ Си, Ti, Zti, Ва, В
III 10 1 P.Si, К. Ca.N VII 10-ь Fe, Rb, Sa, Ni
IV МТ® S, Mg, Fe, Na, Cl. Al VIII XIV 10"а «Г18 As, Mo, Co, I Ge, Pb, Bg, Ag. Au, Ra
живых организмов в общем круговорота веществ, в частности в круговороте редких элементов.
В таблице 8 среднее содержание отдельных элементов в теле растений и животных представлено в процентах от живой массы. Элементы расположены по декадам, т. е. по убывающим рядам, которые отличаются друг от друга по содержанию в живом веществе в 10 раэ. Для простоты цифры округлены. Элементы первых четырех декад В. И. Вернадский назвал макроэлементами, их содержание в организме не падает ниже 0,01%. Элементы V и VII декад, содержащиеся в организмах от 0,01 до 0,00001%, получили название микроэлементов. Наконец, элементы, содержание которых меньше-стотысячной доли процента,— ультрамикроэлементы.
1. ЭЛЕМЕНТЫ, НЕОБХОДИМЫЕ ДЛЯ РАСТИТЕЛЬНОГО ОРГАНИЗМА
Питательными веществами считаются вещества, которые необходимы для жизни организмов. Организм не может завершить свой жизненный цикл в отсутствии данного вещества, оно должно оказывать прямое влияние па организм и быть незаменимым.
Для того чтобы установить, является ли данное вещество питательным, необходимо выращивать растения на какой-либо нейтральной среде. В 1860 г. Сакс и Кноп, выращивая растения в сосудах на водном растворе минеральных солей, установили, что для жизнедеятельности растения, кроме С, О, Н, необходимы следующие 7 элементов: N, Р, S (неметаллы). It, Са, Mg, Fe (металлы). Если полностью исключить какой-либо из этих элементов, то при выращивании в водных культурах нормальных растений получить не удается. На основании исследований Кноп предложил питательную смесь для выращивания растений в водных культурах. После этого разные авторы неоднократно видоизменяли питательные смеси, но все они должны удовлетворять следующим требованиям: 1. Содержать все основные питательные элементы в доступной для растений форме. 2. Иметь близкий к нейтральному pH, который не должен сильно сдвигаться при выращивании растений. 3. Общая концентра* ция солей не должна превышать определенный уровень.
Сакс и Кноп раввили применение вегетационного метода, впервые предложенного французским ученым Ж. Буссеаго (1837). При вегетационном методе растения выращивают в специальных сосудах, заполненных водой, песком или почвой. Соответственно различают водные, песчаные или почвенные культуры. В зависимости от задач исследования в сосуды вносят определенную питательную смесь.
Вегетационный метод исследования широко используется в физиологических и агрохимических экспериментах. Сосуды обычно ставят на специальные вагонетки, которые помещают в вегетационный домик, имеющий застекленную и незастекленную часть. Вегетационный домик служит для растений укрытием и защищает от дождя, ветра и небольших заморозков. В последнее время широкое распространение получили лаборатории искусственного климата, где растения выращивают в контролируемых условиях влажности, температуры и освещенности.
Аналитические методы, применявшиеся Саксом и Кнопом, были довольно грубы и не позволяли достаточно очистить воду в сосуды, в которых выращивались растения, поэтому элементы, необходимые растению в микроколичествах, в то время не были открыты. В начале XX в. при современных методах очистки воды и реактивов была показана необходимость для растений, кроме перечисленных выше еще пяти элементов (микроэлементов), бора, марганца, цинка, меди и молибдена. Предполагают, что для нормального роста некоторых растений необходимы и такие элементы, как хлор, кобальт, натрий и др. Все необходимые элементы норневого питания подчиняются основным правилам, сформулированным еще 10. Либихом: 1. Все перечисленные элементы равнозпачпы и полное исключение любого из них приводит растение к глубокому страданию и гибели. 2. Ни один ив перечисленных элементов пе может быть заменен другим, даже близким по химическим свойствам, т. е. каждый элемент имеет свое специфическое физиологическое значение.
2. ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
МАКРО- И МИКРОЭЛЕМЕНТОВ
В растительном организме все процессы тесло взаимосвязаны. Исключение из питательной среды какого-либо необходимого элемента быстро вызывает изменение во многих, если не во всех, процессах метаболизма. В связи с этим выделить первичный эффект бывает чрезвычайно трудно. Сказанное относится в первую очередь к тем питательным элементам, которые не входят в состав определенных органических веществ, а играют скорее регуляторную или какую-то иную роль.
В общем вида можно сказать, что питательные элементы имеют следующее значение: 1) входят в состав биологически важных органических веществ; 2) участвуют в создании определенной ионной концентрации, стабилизации макромолекул и коллоидных частиц (электрохимическая роль); 3) участвуют в каталитических реакциях, 154
входя в состав или активируя отдельные ферменты. Во многих случаях один и тот же элемент может играть разную роль. Некоторые элементы выполняют все три функции.
Макроэлементы
Остановимся сначала на физиологической роли неметаллов — фосфора и серы. Роль азота будет рассмотрена в специальной главе.
Фосфор. Содержание фосфора в растениях составляет около 0,2% на сухую массу. Фосфор поступает в корневую систему растений в виде окисленных соединений, главным образом остатка орто-фосфорпой кислоты (Н3РО4). При всех превращениях в растительном оргаиизые фосфор сохраняет степень окнслеилости. Собственно все превращения сводятся лишь к присоединению или переносу остатка фосфорной кислоты (фосфорилирование и тралсфосфорилирование). фосфорилирование— это присоединение остатка фосфорной кислоты к какому-либо органическому соединению с образованием эфир-пой связи, например взаимодействие фосфорной кислоты с карбо-пильной, карбоксильной или спиртовой группировками. Трансфосфорилирование — это процесс, при котором остаток фосфорной кислоты, включенный в состав одного органического вещества, переносится на другое органическое вещество. Ряд важнейших в биологическом отношении фосфорных соединений содержат несколько остатков фосфорпой кислоты (полифосфаты). Фосфор входит в состав ряда органических соединений, таких, как нуклеиновые кислоты (ДНК и РНК), нуклеотиды, фосфолипиды, витамины и многие другие, играющие центральную роль в обмене веществ. Многие фосфорсодержащие витамины и их производные являются коферментами и принимают непосредствепное участие в каталитическом акте, ускоряющем течение важнейших процессов обмена. Для фосфора характерна способность к образованию связей с низким и высоким энергетическим потенциалом (макроэргические связи). Такие связи нестабильны, это облегчает их обмен п позволяет использовать энергию на самые различные биохимические и физиологические процессы.
Фосфорная кислота, поступая в живые клетки кория, быстро включается в состав нуклеотидов, образуя АМФ и АДФ. Далее в процессе субстратного и окислительного фосфорилирования (анаэробная и аэробная фазы дыхания) образуется АТФ. По данным A. JL Курсанова, уже через 30 с поступивший меченый фосфор (S2P) обнаруживается в АТФ. Образовавшаяся АТФ используется на активацию сахаров, аминокислот, синтеза нуклеиновых клспот и на другие процессы. Недостаток фосфора влияет практически на все процессы жизнедеятельности растений. Фотосинтез, дыхание, рост требуют для нормального протекания достаточного снабжения фосфором.
Сера содержится в растениях в среднем в количестве 0,17%. Однако в растениях семейства крестоцветных ее содержание горавдо выше. Поступает сера в растения в виде сульфатиона «SO<». Сера входит в состав органических соединений, играющих важную роль в
обмене веществ организма. Так, сера входит в состав трех аминопис-лот — цистина, цистеина и метионина. Почти все белки содержат серосодержащие аминокислоты, поэтому становится ясной роль серы в белковом обмене организма. Сера входит также в состав многих витаминов и коферментов, таких, как биотин, тиамин, коэнзим А, глютатион и др. В связи с этим сера принимает участие в многочисленных реакциях обмена (аэробная фаза дыхания, синтез жиров и др.). Сульфгидрильные группировки (SH) и дисульфидные связи (S—S) играют большую роль, обеспечивая взаимодействие между ферментами и их простетнчеспими группами, а также участвуя в создании определенной конфигурации белковых молекул. Так, SH-rpyn-пы связывают бенок с такими коферментами, как НАД или ФАД. Часто за счет дисульфидных связей сохраняется трехмерная структура белка, а следовательно, его активность.
Сера, поступая в растение в виде иона SOa, быстро переходит в органическую форму при участии АТФ и магния:
сулъфорплаза
SO?- 4- АТФ------------> ACS 4- Ф—Ф
м«'* аденозин-Ь-фосфорульфат
ACS + АТФ CACS + АДФ
Mg** дюсфоаденозинфосфостльфат
Такой активированный сульфат подвергается дальнейшему восстановлению при участия ферредоксина. В восстановленной форме сера включается в аминокислоты.
Восстановленная сера в растении может подвергаться снова окислению. Окисленная форма неактивпа. Показано, что в молодых органах сера находится главным образом в восстановленной форме, а в старых — в окисленной.
К макрозлементамгметаллам относятся К, Са, Mg, Fe. Участие в паталитических реакциях характерно главным образом для металлов. Металлы могут осуществлять влияние на процессы обмена различным путем: 1) непосредственно входя в активный центр фермента (в простетическую группу или в апофермент). Таковы ферменты, содержащие железо, медь и некоторые другие элементы. Функция металла ваклхочается чаще всего в переходе из окисленной в восстановленную форму, что сопровождается переносом электрона; 2) активируя тот или иной фермент путем изменения заряда бенка-фер-мента или его конфигурации; 3) являясь связующим мостиком между ферментом и субстратом и тем самым облегчая их взаимодействие; 4) нзмепяя константу равновесия ферментативных реакций; 5) изменяя разновесие между активной и неактивной формами фермента; 6) связывая ингибиторы тех или иных ферментативных реакций.
Кальций входит в состав растений в количестве 0,2%, поступает в виде иона Са®*. Роль кальция разнообразна. Кальций, соединяясь с пектиновыми веществами, дает пектаты кальция, которые являются важнейшей составной частью клеточных оболочек растений. Срединные пластинки, склеивающие клеточные оболочки соседних 156
клеток, состоят по преимуществу из пектатов кальция. При недостатке кальция клеточные оболочки ослизняются, что особенно ярко проявляется на клетках корня. Кальций плохо передвигается по растению, поэтому для предупреждения ослизнения необходимо, чтобы ионы Са2* непосредственно соприкасались с клетками норня. Сказанное было продемонстрировано в опытах, поставленных по методу изолированных водных культур. В этих опытах одну прядь корней помещали в питательный раствор, содержащий все необходимые питательные вещества; другую прядь корня того же растения — в раствор с исключением кальция. Очень скоро клетки корпи, которые находились в растворе без кальция, начали ослизняться и загнивать.
Кальций повышает вязкость цитоплазмы, что видно на опытах с формами плазмолиза. В солях кальция плазмолиз имеет вогнутую форму, так как более вязкая цитоплазма с трудом отстает от клеточных оболочек. Кальциевая соль лецитипа входит в состав мембран, поэтому присутствие кальция важно для нормального их функционирования. Кальций принимает участие в поддержании структуры хромосом, являясь связующим звеном между ДНК и белком. При недостатке кальция наблюдаются повреждение хромосом и нарушение митотического цикла. Кальций необходим также для поддержания структуры митохондрий и рибосом. Кальций является активатором таких ферментов, как фосфорилаза, адепозиптрифосфатаза и некоторые другие. Кальций реагирует с различными органическими кислотами, давая соли, и тем самым является в определенной мере регулятором pH клеточного сока.
Магний. Содержание магния в растениях составляет 0,17 % Маг-вцй поступает в растение в виде иона Mg2+. Магний входит в соста! основного пигмента зеленых листьев — хлорофилла. Магний поддер живает структуру рибосом, связывая РНК и белок. Большая и малая субъединицы рибосом ассоциируют вместе нишь в присутствии магния. Отсюда синтез белка пе идет при недостатке магния, а тем более в его отсутствии. Магний является активатором многих ферментов. Важной особенностью магния является го, что он связывает фермент с субстратом по типу хелатной связи. (Клешневидная связь между органическим веществом и катионом.) Так, например, присоединяясь к пирофосфатной группе, магний связывает АТФ с соответствующими ферментами. В связи с этим все реакции, включающие перенос фосфатной группы (большинство реакций синтеза, а также многие реакции энергетического обмена), требуют присутствия магния. Магний активирует такие ферменты, как ДНК- и РНК-полиме-равы, адепозинтрифосфатазу, глютаматсинтетазу, а также ферменты, катализирующие перенос карбоксильной группы,— реакция карбоксилирования и декарбоксилирования.
В ряде случаев- влияние магния па работу ферментов определяется тем, что он реагирует с продуктами реакции, сдвигая равновесие в сторону их образования, Магний может также инактивировать ряд ингибиторов ферментативных реакций.
Калий. Содержание калия в растении 0,9%. Он поступает в растение в виде иона К+. Физиологическую роль калия нельзя считать
полностью выясненной. Калий не входит ни в одно органическое соединение. Большая часть его (70%) в клетке находится в свободной ионной форме и летко извлекается холодной водой, остальные 30% в адсорбированием состоянии. В противоположность кальцию калий снижает вязкость протоплазмы, повышает ее оводненность. Эта особенность действии калия хорошо проявляется в том, что в его солях плазмолиз имеет выпуклую форму, протоплазма легко отстает от клеточной оболочии. Следовательно, калий является антагонистом кальция.
Калий активирует работу многих ферментных систем, например фермент, катализирующий фосфорилирование сахаров,— гекоокипа-ау, ферменты, катализирующие перенос фосфорной кислоты с пирувата на АДФ (пируваткиназа), а также ферменты, участвующие в образований АТФ в процессе окислительного фосфорилирования. В связи с втим, по данным Э. И. Выскребенцевой, при недостатке калия резко падает содержание макрозргических фосфатов. Калий активирует и ряд ферментов цикла Кребса. Многие ферменты, участвующие в синтезе белка, требуют для своего действия присутствия калия.
Несмотря на необходимость калия для проявления активности ряда ферментов, механизм этой активации до настоящего времени не представляется ясным.
Недостеток калия замедляет транспорт сахарозы по флоэме. Влияние калия на передвижение органических веществ но гипотезе Спаннера проявляется благодаря образованию градиента электрического потенциала на ситовидных пластинках, который возникает при циркуляции калия между ситовидной трубкой и сопровождающими клетками.
В последнее время появились данные, что открытие устьиц на свету связано с накоплением в замыкающих клетках попов каяия.
Железо входит в состав растения в количестве 0,08% Необходимость железа была показана в тот же период, что и остальных макроэлементов. Поэтому, несмотря на ничтожное содержание, его роль рассматривается вместе с макроэлементами. Железо поступает в растение в виде Fe3+. Роль железа в большинстве случаев связана с его способностью переходить из окисленной формы (Fe4*) в восстановленную (Fe®*) и обратно. Железо входит в состав каталитических центров многих окислительно-восстановительных ферментов. В виде геминовой группировки око входит в состав таких ферментов, как цитохромы, цитохромоксидаза, каталава и пероксидаза. Цитохромная система является необходимым компонентом дыхательной и фотосинтетической электронпо-транспортной цепи. В силу этого при пе-достатне железа тормозятся оба эти важнейшие процессы. Кроме того, целый ряд ферментов содержит железо в негемяновой форме. К таким ферментам относятся некоторые флавопротеиды и железосодержащий белой ферредоксин.
Железо необходимо для образования хлорофилла. При этом железо катализирует образование предшественников хлорофилла амино-левулиновой кислоты и протопорфпринов. Предполагают, что желе-158
ео играет роль в образовании белков хлоропластов. При недостатке железа нет условии для образования таких важнейших компонентов хлоропластов, как цитохромы, ферредоксин и некоторые другие. Возможно, это косвенно влияет на образование хлорофилла.
Микроэлементы
Практическая значимость исследований по микроэлементам связана с тем, что есть почвенные провинции, где остро недостает того или иного иг них. Кроме того, часто в почве микроэлементы находятся в веусвояемом для растительного организма состоянии, поэтому внесение микроудобрений (удобрений, содержащих микроэлементы) в почву очень полезно. Надо учитывать при этом, что высокие дозы микроэлементов могут оказать ядовитоэ влияние.
В изучении микроэлементов равличают два направления: 1. Изучение влияния па интенсивность физиологических процессов при их исключении из питательной среды. 2. Изучение специфической роли отдельных микроэлементов, главным образом участия их в определенных ферментных реакциях. Второй биохимический подход оказался более результативным.
Выяснилось, что микроэлементы в подавляющем большинстве активируют определенные каталитические — ферментативные системы. Это осуществляется различными путями — непосредственным участием в составе молекул ферментов или их активацией.
Важным моментом в действии всех микроэлементов является их способность давать комплексные соединения с различными органическими соединениями, в том числе и с белками. Разные микроэлементы могут давать комплексные соединения с одними и теми же органическими веществами, благодаря чему они могут выступать как антагонисты. Отсюда понятно, что для нормального роста растений необходимо определенное соотношение микроэлементов (железа к марганцу, меди к бору и т. д.).
Марганец поступает в растение в виде ионов Мп3*. Марганец активирует ферменты, катализирующие реакции цикла Кребса (дегидрогеназы яблочной кислоты, лимонной кислоты, декарбоксилазу щавелевоуксусной кислоты и др.). В связи с этим понятно большое значение марганца для процесса дыхания, особенно его аэробной фазы. Правда, имеются данные, что в некоторых из этих реакций марганец может быть заменен кобальтом.
Велико значение марганца для нормального протекания обмена азотистых соединений. Маргенец принимает участие в процессе восстановления нитратов до аммиака. Этот процесс проходит через этапы, катализируемые рядом ферментов, из которых два (гидроксил-амипредуктава и питритрадуктаза) зависимы от марганца, в связи с чем растения, испытывающие недостаток марганца, не могут использовать нитраты в качестве источника авотиого питания.
Марганец активирует ферменты, участвующие в окислении важнейшего фитогормона — ауксина (иидолилуксусная кислота).
Марганец необходим для нормального протекания фотосинтеза, ок участвует в этом процессе на этапе разложения воды и выделения кислорода (фоторазложение воды). Этот элемент играет специфическую роль в поддержании структуры хлоропластов. В отсутствии марганца хлорофилл быстро разрушается на свету.
Медь поступает в растение в виде иона Си2+_ Она входит непосредственно в состав ряда ферментных систем, относящихся к группе оксидаз, таких, как полифенолоксидаза, аскорбатоксидаза, цито-хромоксидаза. В этих ферментах медь соединена с белком, по-видимому, через SH-группы. Кроме того, медь активирует ряд ферментов, в частности нитратредуктазу, а также протеазы. Отсюда вытекает роль меди в азотном обмене. Ббльшая часть меди (75% от всего содержания меда в листьях) концентрируется в хлоропластах. В хло-ропластех сосредоточен и медьсодержащий бэлок синего цвета — пластоцианин. Содержание меди в пластоцианине составляет 0,57%. Пластоциашш занимает определенное место в цени переноса электронов менаду первой и второй фотосистемами. В связи с этим попятно значение меди для процесса фотосинтеза.
Цинк поступает в растение в виде ионов Zn2+. Он входит в состав ферментов — фосфатазы, карбоангидразы и др. Карбоангидраза катализирует разложение гидрата окиси углерода па воду и углекислый газ. Эта реакция важна для процесса фотосинтеза. Углекислый газ, поступая в клетку, растворяется в воде, образуя П2СО3. Фермент карбоангидраза, катализируя высвобождение СО2 из гидрата окиси углерода, способствует его использованию в процессе фотосинтеза. Кроме того, цинк активирует такие ферменты, как енолаза, альдолаза, гек-сокиназа, триозофосфатдегидрогеназа, алкогольглютаматлактатдегид-рогеназы. В этой связи понятно значение цинка для процесса дыхания.
Цинк играет важную роль при образовании фптогормопа ауксина. Это связано с тем, что цинк, поэышая активность триптофапспн-тетязы влияет на синтез аминокислоты триптофана — предшественника ауксина. Внесение цинка повышает содержание ауксинов и заметно сказывается на темпах роста растений.
Молибден поступает в растение в виде аниона М0О42-. При недостатке молибдена происходят заметные изменения в азотном обмен© растений — наблюдается уменьшение синтеза белка при одновременном падений содержания аминокислот и амидов. Нарушения в азотном обмене проявляются особенно иа фоне питания растений нитратами. Это связано с тем, что молибден входит в активный центр фермента, восстанавливающего нитраты до нитритов,— питратредук-тазу. Нитратредуктаза — это флавопротеид, простатической группой которого является флавииаденивдинуклеотид (ФАД). При восстановлении нитратов молибден действует как перепосчик электронов от флавинадениндинуклеотпда к нитрату, при этом МОз" переходит в NOs-, а Мо+5 переходит в Мо^. Образование нитратредуктазы является одним из немногих примеров ададтивпого синтеза ферментов, в растительном организме. Этет фермент образуется, когда в среде имеются нитраты и молибден. Активность пнтратредуктазы возрас-160
тает в 10 и более раз при питании растений нитратами по сравнению с аммиаком. Причем появление фермента происходит уже через 1—3 ч после внесения в среду нитратов.
Молибден активирует ферментные системы, участвующие в фиксации азота атмосферы различными микроорганизмами. По-видимому, он обладает и другими функциями, так как необходим растению и в условиях достаточного уровня аммиачного питания. При недостатке молибдена содержание аскорбиновой кислоты резко падает. При отсутствии молибдена наблюдаются нарушения в фосфорном обмене растений.
Бор поступает в растение в виде аниона борной кислоты. Роль бора выяснена далеко пе достаточно. Это связано с тем, что бор, в отличие от большинства других микроэлементов, не входит в состав пи одного фермента.
Большое значение для осуществления функции бора имеет его способность давать комплексные соединения. Комплексы с борной кислотой образуют простые сахара, полисахариды, спирты, фенольные соединения и др. В этой связи можно предположить, что бор влияет па скорость ферментативных реакций, активируя или инактивируя не сами ферменты, а субстраты, на которые действуют ферменты. Комплексы органических соединений с борпой кислотой могут иметь и ипое значение. Так, способность бора образовывать комплексы с углеводами оказывает влияние па клеточную оболочку, регулируя ориентацию мицелл целлюлозы, чго способствует ее большей эластичности (Е. В. Бобко). У растений, испытывающих недостаток бора, наблюдается быстрая потеря эластичности клеточных оболочек, что, в свою очередь, связано с более жесткой ориентацией мицелл целлюлозы.
Комплексы сахаров с бором — сахаробораты, по-видимому, легче проникают через мембраны и быстрее передвигаются по растению. При недостатке бора сахара накапливаются в листьях и их отток резко тормозится. Известно также, что при борном голодании происходит характерное отмирание точки роста у стебля и корня. Причина этого явления, по-видимому, в недостатке углеводов из-за торможения их передвижения. Определения, проведеппые с папесепием меченой сахарозы иа листья, показали, что при небольшом добавлении борпой кислоты отток сахарозы идет значительно быстрее. Сходные результаты были получены в опытах, в которых лист экспонировался в атмосфере, содержащей меченую углекислоту. Образовавшиеся при этом меченые продукты фотосинтеза оттекали значительно быстрее у растений, получивших бор. Показано (М. Я. Школьник), что при недостатке бора нарушается синтез нуклеиновых гшелот В борнедостаточиых растениях заторможен процесс амипировапия органических кислот. Бор может выступать как ингибитор активности ряда ферментов, в первую очередь катализирующих образование токсичных фенольных соединений. При недостатке бора наблюдается накопление кофейной и хлорогеновой кислоты, которые считаются ингибиторами роста растений. Первыми признаками борной недостаточности является загнивание и отмирание точек роста стебля
-и корпи; цветки пе образуются, листья становятся тонкими и темнеют, нарушается развитие сосудистой системы, клетки плохо дифференцируются. При недостатке бора у сахарной свеклы происходит загнивание центральной части корнеплода (гниль сердечка).
Недостаток бора меньше сказывается на семействе злаковых.
Другие микроэлементы. Имеются еще и такие элементы, которые усиливают рост определенных групп растений. Так, в последнее время установлено, что для зеленых фотосинтезирующих растений важное значение имеет хлор.
Благоприятное влияние оказывает кобальт на рост ряда растений. Установлена необходимость кобальта для сиые-зеленых водорослей. Кобальт входит в состав витамина В12 и некоторых связанных с ним соединений. Витамин В12, в состав которого входит кобальт, не поступает извне, а синтезируется в растениях даже в стерильных условиях. Это говорит в пользу необходимости кобальта. Кобальт наряду с молибденом необходим при фиксации азота атмосферы симбиотическими микроорганизмами. Трудность решения вопроса о необходимости кобальта для всех растений заключается в том, что потребность в нем чрезвычайно мала.
Для роста некоторых растений засоленных почв (галофитов) оказывается полезным натрий. Благоприятное влияние оказывает натрий на рост сахарной свеклы и сине-зеленых водорослей.
Для роста диатомовых водорослей необходим кремний. Кремний улучшает рост некоторых злаков, таких, как рис и кукуруза. Кремний повышает устойчивость растений против полегания, так как входит в состав клеточных стенок.
Показана необходимость еанадия для Scenedesmus (зеленая одноклеточная водоросль), причем это очень специфическая потребность, так как даже для роста хлореллы ванадий не нужен.
Не все растения одинаково нуждаются и в тех влементах, которые относят к необходимым. Так, уже упоминалось, что бор значительно меньше, нужен злакам. Bq) и кальций абсолютно необходимы для всех высших растений, что касается низших, то во многих случаях они могут расти и в отсутствии этих элементов. Для некоторых бактерий и грибов кальций может быть заменен стронцием или барием. Бобовые больше нуждаются в молибдене по сравнению с другими семействами. Калий в некоторых случаях и в небольших количествах может быть заменен рубидием или цезием. Бериллий может заменить магний для некоторых грибов и частично для томатов.
Не юсе элементы, необходимые для жизни растений, являются таковыми для животных. Так, по-вцдимому, для животных не нужен бор. Они больше нуждаются в натрии, чем в калии. Установлено, что для животных необходимы нод и кобальт. Такие различия в реакции на элементы питания различных организмов для физиолога очень важны, так как дают возможность выяснить, какую роль играет данный элемент. Так, если бор не нужен животным, то, следовательно, его функция должна быть связана со специфическими особенностями растительного организма.
3. АНТАГОНИЗМ ИОНОВ
Для нормальной жизнедеятельности как растительных, так и животных организмов в окружающей их среде должно быть определенное соотношение различных катионов. Чистые растворы солей одного какого-либо катиона оказывают на организм, в том числе я ка растительный, губительное влияние, т. е. являются ядовитыми. Причем зто влияние проявляется еще до того, как начинают обнаруживаться симптомы голодания растений относительно недостающих элементов питания. Так, при культивировании зародышей рыб в растворе хлористого патрия развиваются уродливые одноглазые особи. У морских ежей, помещенных в растворы хлористого натрия, на-баюдается партеногенез. Все это происходит несмотря на то, что NaCl взят в той же концентрации, как и в морской воде. Сходные результаты получены на корнях растений. Так, при помещении проростков пшеницы на чистые растворы КС1 или СаСЬ на корнях появлялись вздутия, а затем корни отмирали. Интересно, что в смешанных солевых растворах, содержащих два разных катиона, ядовитое действие не наблюдается. Смягчающее влияние, оказываемое одним катионом па действие другого катиона, называют антагонизмом ионов. Антагонизм иопов проявляется как между разными ионами одной валентности (например, Na+ и К+), так и между ионами разной валентности (К+ и Саг+). При этом в последнем случае, антагонистическое влияние сказывается более.резко. Так, для того чтобы устранить ядовитое влияние чистой соли КС1, надо прибавить МаС! 30%, a CaCla всего 5%.
Растворы, которые характеризуются определенным соотношением катионов, благоприятным для роста и развития организмов, называют уравновешенными. К естествеппым уравновешенным растворам относятся, например, морская вода, плазма крови. По-видимому, » основе антагонизма иопов лежит воздействие па коллоидно-химические свойства цитоплазмы, в частности па гидратацию белков, входящих в ее состав. Известно, что двухвалентные катионы (Са2*, Mg2+) дегидратируют коллоиды сильнее, чем одновалентные (Na+, К+). Неодинаково влияние па гидратацию коллоидов и катионов сходной валентности. Так, натрий оказывает болев сильное дегидратирующее влияние по сравнению с калием. Сходное влияние в действии отдельных катионов проявляется и па неживых отрицательно заряженных коллоидах. Коагуляция коллоидного раствора под влиянием чистой соли происходит при меньшей ее концентрации по сравнению с концентрацией смешанных растворов, содержащих две соли. Вопрос этот заслуживает дальнейшего научения, тем более что неблагоприятное влияние повышенной концентрации одного катиона может проявляться и в естественных условиях (в почве). Таким образом, для нормального роста растений необходимо определенное сочетание солей одно- и двухвалентных катионов.
ПОСТУПЛЕНИЕ МИНЕРАЛЬНЫХ СОЛЕЙ
ЧЕРЕЗ КОРНЕВУЮ СИСТЕМУ
Еще Клоп и Сакс показали, что растение хорошо усваивает питательные вещества из минеральных солей. Однако окончательно вопрос о возможности усвоения тех или иных соединений, в которые входят элементы пвтария, не мог быть разрешен в обычных водных или песчаных культурах, так как в них присутствуют микроорганизмы, которые легко переводят одну форму соединений в другую. В присутствии микроорганизмов пе может быть уверенности, что высшее растение поглощает соединения именно в той форме, в которой они первоначально введены в питательную смесь. Решение вопроса о доступных формах питательных веществ было осуществлено в опытах, проведенных в стерильных условиях. Впервые И. С- Шуловым в лаборатории Д. Н. Прянишникова был разработан метод, при котором в стерильных условиях находилась только корневая система. В таких условиях надземные органы растения развивались нормально. Было показано, что в отсутствии микроорганизмов корневые системы растений прекрасно усваивают вещества, внесенные в питательную среду, в минеральной форме в виде растворимых солей. Некоторые органические растворимые соединения, в частности соединения азота (аминокислоты), могут быть также усвоены растительным организмом. Более сложные нерастворимые органические соединения в отсутствии микроорганизмов усваиваться растением пе могут. Таким образом основными источниками питательных веществ для растений являются минеральные соли.
Катионы и анионы поступают в растения независимо друг от друга с разной скоростью. Скорость поступления того или иного иона определяется быстротой его использования. Эти закономерности были вскрыты путем определения изменения концентрации водородных ионов (pH) в водных культурах. Оказалось, что pH. раствора меняется, если в составе соли катион и анион используются растением неравномерно. Так, если в качестве источника азота используется хлористый аммоний (NH4CI), то при выращивании растения pH раствора сдвигается в кислую сторону. Это происходит в силу того, что аммоний необходим растению в значительно большем количестве, чем хлор, поступает быстрее, обмениваясь на водород, адсорбированный поверхностью корня. Выделяющийся водород с хлором образуют соляную кислоту. В результате среда подкисляется. Можно привести противоположный пример. Если в качестве источника азота используется нитрат натрия, то анион (NOs-) будет использоваться растением быстрее, а следовательно и поступать быстрее. В окружающем растворе будет накапливаться МаНСОз. Эта соль, подвергаясь гидролизу, образует МаОН (сильная щелочь) и Н2СО3 (слабая кислота), будет сдвигать pH раствора в щелочную сторону. Эти опыты привели к тому, что стали различать физиологически кислые (например, NH4CI, (NHOsSOi) и физиологически щелочные соли (например, NaNOa, Са (Н2РО4) 2) -
1. КОРНЕВАЯ СИСТЕМА КАК ОРГАН ПОГЛОЩЕНИЯ СОЛЕИ
На заре эволюции способность к поглощению воды и питательных веществ была присуща всем клеткам растительного организма. По-видимому, разделение функций между клетками отдельных орга-пов осуществлялось постепенно. Это подтверждается тем, что клетки листа сохранили в опредэлепной мере способность к поглощению пе только воды, но и питательных солей. Сформировавшаяся корневая система — сложный специализированный орган. Основной воной поглощения питательных веществ, снабжающей и наземные органы растения, является аопа растяжения клеток и зона корневых волосков. Подсчеты показывают, что па 1 мм2 поверхности корня развивается от 200 до 400 корневых волосков. Таким образом, корневые волоски увеличивают поверхность корпя в сотни раз. Опи обладают в повышенной способностью к поглощению (Д. Б. Вахмистров). Было установлено, что и клетки меристематической зоны корпя обладают способностью к поглощению ионов, однако поглощенные иопы используются в этих же клетках. Это связано как с физиологическими особенностями меристематических клеток, так и с особенностями анатомического строения корня. В меристематической’зоне еще нет дифференцированной сосудистой системы. При атом флоэма дифференцируется раньше и лишь несколько выше по длине корня образуется ксилема. Именно по ксилеме происходит передвижение воды с растворенными питательными веществами. Таким образом в корне различают зону, участвующую в поглощении питательных веществ (меристематическая зона), и зону, участвующую как в поглощении, тан и в снабжении питательными веществами надземных органов растений (зона корневых волосков). Поверхность корпя, участвующую в адсорбции питательных веществ, называют общей адсорбирующей поверхностью. Поверхность корня, которая участвует не только в адсорбции, но н в передаче питательных веществ в сосуды ксилемы и дальше в надземные органы, называют рабочей адсорбирующей поверхностью (]$. А. Сабипип).
2. ОСОБЕННОСТИ ПОСТУПЛЕНИЯ СОЛЕЙ В КОРНЕВУЮ СИСТЕМУ
Растительный организм обладает способностью к избирательному накоплению питательных элементов. Для выяснения механизма поступления минеральных веществ в растение большое значение имели исследования по влиянию на этот процесс различных условий.
Влияние внешних условии на поступление солей. При температуру близкой к О°С, поглощение солей идет очень медленно. Затем в пределах до 40°С поглощение усиливается. Увеличение температуры на 10°С может вызвать возрастание поглощения в два и даже три раза.
В темноте поглощение солей замедляется и постепенно прекращается, а нод влиянием освещения ускоряется. Так, при освещении
поглощение фосфора усиливается уже через 2—5 мин. Быстрота реакции указывает на прямое действие света. Вместе с тем свет может оказывать и косвенное влияние. На свету в процессе фотосинтеза образуются углеводы, которые необходимы для дыхания. Зависимость поглощения от интенсивности дыхания проявляется четко. При длительном выдерживании растений в темноте, после того как запас дыхательных субстратов исчерпан, поглощение солей пе только прекращается, но может даже наблюдаться нх выделение.
Интенсивность поступления солей остается на одном уровне при уменьшении содержания кислорода до 2—3%. Лишь снижение концентрации кислорода ниже 3% вызывает падение поглощения примерно в два раза. Необходимо учитывать, что и интенсивность дыхания сохраняется ка высоком уровне в широком диапазоне концентраций кислорода. Падение интенсивности дыхания наблюдается при той же концентрации кислорода, при которой поглощение солей уменьшается.
Концентрация ионов водорода (pH) сказывается на поглощении различными путями. Еще в опытах Д. А. Сабинина и И. И. Колосова было показано, что при подкислении раствора поступление катионов задерживается. Это происходит, по всей вероятности, в силу конкуренции, которая наблюдается между одинаково заряженными ионами, за возможность вступить в реакцию с переносчиками. Вместе с тем подкисление улучшает доступность ионов фосфорной кислоты. Наоборот, подщелачивание внешнего раствора снижает поступление фосфора благодаря переходу одновалентного иона НгРОл- в двухвалентный HPOi2- и трехвалентпый РО*3-, которые являются менее доступными для растения. Резкое изменение pH может также оказать влияние из-за повреждения мембран клетки.
Поглощение одного иона зависит от присутствия других ионов. Так, в присутствии легко поглощаемого аниона катионы той же соли поступают быстрее. Ионы с одинековым зарядом обычно конкурируют между собой. Одиако в некоторых случаях наблюдается противоположная закономерность. Так, при наличии в среде иона фосфора (РО<8-) поглощение нитратов (NOs~) ускоряется. Это может явиться косвенным результатом увеличения использования нитратов в присутствии фосфорной кислоты.
Влияние внутренних факторов иа поступление солей. Зависимость поступления солей от интенсивности дыхания является установленным фактом:. Прн замене кислорода азотом пе только прекращается поступление, но наблюдается выделение питательных иопов из корня. Ингибиторы процесса дыхания (в частности, цианистый калии) резко тормозят поступление солей. Процесс дыхания может оказывать влияние на поступление солей в нескольких направлениях. Так, н процессе дыхания выделяющаяся углекислота в водной среде диссоциирует на ионы Н+ и НСОз". Адсорбируясь ка поверхности корня, этн попы служат обменным фондом для поступающих катионов и анионов. В процессе переноса иопов через мембрану участвуют специфические белки-акцепторы, синтез которых находится в зависимости от интенсивности дыхательного процесса. Наконец, энергия,
выделяемая в процессе дыхания, непосредственно используется для поступления солей. В стой связи особенно важно, что вещества, нарушающие накопление энергии дыхания в макроэргических фосфор-» вых связях (динитрофенол), также тормозят поступление солей.
Поступление воды и солей во многих случаях идет независимо друг от друга. Сопоставление количества испаренной воды в процессе транспирации и количества поступивших солей показывает, что прямой зависимости между этими процессами обычно вет. Так, при выращивании растений в условиях высокой влажности воздуха транспирация резко падает, а поступление солей идет с достаточной интенсивностью. Все же в некоторых случаях увеличение интенсивности транспирации может сказаться положительно на поглощении солей. Опыты показали, что в молодом возрасте (до фазы выхода в трубку) растения пшеницы поглощают фосфора в 14 раз больше, а в фазу колошения поглощение фосфора в 2 раза меньше, чем это следовало бы, исходя из того количества, которое должно было бы содержаться в испаренной воде. Известно также, что усиление транспирации приводит к ускорению передвижения восходящего тока воды с растворенными солями, что способствует быстрейшему освобождению от них клеток корпя, а следовательно, косвенно ускоряет поглощение. Надо иметь в виду и трудность разграничения влияния транспирации от влияния фотосинтеза. Открытие устьиц вызывает усиление как того, так и другого процесса. Увеличение интенсивности фотосинтеза приводит к возрастанию содержания углеводов и, как следствие, к увеличению интенсивности дыхания и поступления солей.
Как правило, ускорение темпов роста увеличивает использование питательных веществ и тем самым усиливает их поступление. Наряду с этим быстрый рост корневой системы оказывает прямое влияние па поглощение благодари увеличению поверхности, соприкасающейся с почвой.
Механизм и пути поступления минеральных солей через корневую систему. Механизм поглощения солей растительной клеткой уже подробно был рассмотрен (с. 53). В данном разделе мы остановимся на особенностях поглощения солей, характерных для корневой системы в целом.
Способность растения к избирательному концентрированию веществ, относительная независимость поступления воды и солей, зависимость поступления от дыхания и фотосинтеза, ускорение поступления под влиянием температуры и света показывают, что поступление питательных солей в корневую систему носит частично активный, связанный с метаболизмом характер. Надо только иметь в вцду, что часто трудно провести границу между пассивным и активным поступлением и само понятие активного поступления рядом исследователей понимается по-разному.
Для разграничения пассивного и активного поступления солей в корневую систему важное значение имели опыты, в которых было показано, что, если корневые системы растений перенести из слабого раствора в концентрированный, скорость поглощения на короткое
время усиливается, а затем выравнивается. Эта первая фаза поглощения из более концентрированного раствора не зависит от температуры и не тормозится в присутствии ингибиторов. Если растение снова перенести в более слабый раствор, то некоторое количество ионох* выделяется во внешнюю среду, так как часть тканей корня открыта для свободной диффузии ионов. Наличие двух типов поступлениях пассивного — по градиенту концентрации и активного — против градиента концентрации, связанного с метаболической энергией, было доказано в исследованиях с меченой серой (9. Эпстайн). Отрезанные корневые системы ячменя погружали в раствор, содержащий сульфат (SO*2-), меченный по сере (*ь8). В одной пробе корней было определено количество S, поглощенной в течение одпого часа, другую-пробу после часового пребывания в растворе помещали в раствор CaSCU, не содержащий меченой серы. Сначала 35S быстро обменивалась и выходила в окружающий раствор, затем обмеп прекращался. В дальнейшем 3SS больше в раствор не выходила. Та часть серы, которая быстро обменивалась, была легко диффундирующая, поступившая пассивным путем. Оставшаяся часть ®sS в растении, очевидно, проникла внутрь клетки через мембрану. Проникновение веществ черев мембрапу (см. с. 58) идет с помощью переносчиков ле требует обычно затраты энергии (активное поступление). Эти иссие-дования привели также к установлению понятия свободного пространства корня, т. е. той части тканей, в которую вода с растворенными веществами может поступать путем свободной диффузии. Свободное пространство мо?кпо определить по количеству иопов, диффундирующих из ткани в воду. Предварительно ткань выдерживаю! в растворе соли известной концентрации. Однако надо иметь в виду, что часть солей, поступившая путем свободной диффузии, концентрируется (адсорбируется) на клеточных оболочках. Благодаря адсорбции обратная диффузия солей, естественно, уменьшается. Поскольку именно эгот показатель служит для определения величины свободного пространства, то ока сказывается преуменьшенной. Таким образом, при данной постановке опытов определяется пе истинное, а кажущееся свободное пространство. Эго тот объем, в котором идет свободная диффузия солей и который поддается определению. Большинство исследователей считает, что объем свободного пространства составляет 5—10% от всего объема корнавой системы. Дополнительно к свободному пространству, входящему в объем клетки, в свободное пространство корня входит система межклетников. Таким образом, свободное пространство тканей' является влекшим по отношению к протопласту клеток и внутренним по отношению к органу в целом или к окружающей среде.
В зоне поглощения каждого корня коны адсорбируются ка поверхности клеточных оболочек рнаодермы. Из адсорбированного состояния ионы могут по коре корпя передвигаться двумя путями: по апопласту п симпласту. Апопласт — это свободное пространство ткани. Симпласт — это совокупность протопластов всех клеток корпя, соединенных плазмодесмами. При поступлении в симпласт ионы должны проникнуть через мембрану и далее передвигаться но плаз-
модесмам к сосудам ксилемы. Механизм поступления солей через мембрану подробно разбирался выше (с. 59). Той воды с растворенными веществами, движущийся по свободному пространству (ано-пласту), как бы омывает все клетки коры. На всем этом пути может наблюдаться активное поступление ионов в клетки через соответствующие мембраны и включение их в обмен веществ. Необходимо учесть, что на пути движения ко апопласту имеется преграда в виде клеток эндодермы с поясками Каспари. Передвижение через клетни эндодермы вовможно, по-видимому, только через цитоплазму. Даже если признать, что в стенках клеток эндодермы остаются промежутки для свободной диффузии, то они настолько малы, что вещества не могут через них проникнуть. В связи с этим перепое иопов через мембраны клеток эндодермы необходим и осуществляется с помощью переносчиков. Все рассмотренные пути передвижения иопов по кора корпя представлены па схеме (рис. 45).
Вопрос, что является движущей силой, заставляющей клетки корпя секретировать ионы в сосуды ксилемы, является спорным. Име-етсл мнение, что клетки, расположенные около сосудов ксилемы, обладают более иизкой метаболической активностью по сравнению с более удаленными благодаря меньшему содержанию в пих кислорода. Эти каетки отдают соли в сосуды ксилемы. Затем соли вместе с водой благодаря присасывающей силе транспирации поднимаются по сосудам вверх.
3. РОЛЬ КОРНЕЙ В ЖИЗНЕДЕЯТЕЛЬНОСТИ РАСТЕНИЙ
В работах советских физиологов Д. А. Сабинина и А. Л. Курсано-еа обосновано представление о специфической физиологической роли клеток корпя. Корень является органом, регулирующим скорость поступления веществ в надземные органы. При выращивании растений в водных культурах на среде, содержащей все питательные элементы, оназвлосг», что в пасоке выделяется меньше фосфора по сравнению с тем количеством, которое поступает в корневую систему. При переносе растений иэ полной питательной среды в дистиллированную воду в пасоке продолжают выделяться соединения фосфора а течение длительного времени. Иначе говоря, в восходящем токе по сосудам ксилемы передвигаются не только питательные соли, поступившие непосредственно из почвы, но и предварительно аккумулированные в клетках корня. Это положение имеет большое значение. Известно, что к концу онтогенеза, по мере старения клеток корня, их поглотительная способность резко падает. В этот же период в почве уменьшается количество доступных питательных веществ. Тем пе менее клетки корня продолжают снабжать надземные органы питательными веществами.
В клетках корня происходят очень активные обменные процессы. Так, вне зависимости от того, какие соединения азота находились в питательной среде и поступали в клетки (аммиак или нитраты), в пасоке были обнаружены аминокислоты и амиды. Уже через несколько секунд посхе поступления неорганическая фосфорная кис-
Наружный раствор
Рис. 44. Пути передвижения веществ в корне (по М. Ф. Даниловой}.
Пунктир — предполагаемое непрерывное свободное пространство до сосудов ксиде— мы; простые стрелки — диффузионное передвижение веществ по алодласту; двойная стрелка — передвижение веществ по симпласту: прерывистая ливня с точками — места метаоолизации веществ в клетках; двойной пунктир — пассивное вытеканме-раствора в сосуды ксилемы; кружок с крестом — положение васоса, обеспечивающего активную секрецию веществ в проводящие влементы ксилемы; кружок с том—
летя оказывается в составе АТФ. Правда, при переходе из клеток корня в полость сосудов фосфорная кислота обычно вновь отщепляется.
Есть такие вещества, которые синтезируются только в клетках корня. В работах советского академика А. А. Шмука было показано, что образование таких азотсодержащих веществ, как алкалоиды, происходит в клетках корня. Французский физиолог де Ропп проращивал зародыши пшеницы на питательной среде в стерильных условиях, их корни не соприкасались с питательной средой, но находились во влажной атмосфере, благодаря чему сохраняли жизнеспособность, а питательные вещества поступали непосредственно через щиток. Проростки развивались нормально. Если корни обрывались, проростки погибали. Эти опыты показывают, что клетки корня необходимы для нормальной жизнедеятельности организма, они снабжают его какими-то специфическими веществами, возможно, гормонального типа. Немецкий ученый Мотес показал, что если изолированные листья табака поместить в питательную среду и на них образуются корпи, то они долгое время сохраняют зеленую окраску. Если корни обрывать, то при выдерживании на питательной смеси листья желтеют. При этом влияние корней оказалось возможным заменить нанесением на листья раствора фитогормона кинетина. Таким обрааом, живые клетки корпя являются источником многих важных и незаменимых органических веществ, в том чисие гормонов
ПОСТУПЛЕНИЕ И ПРЕВРАЩЕНИЕ СОЕДИНЕНИЙ АЗОТА В РАСТЕНИЯХ
Азот составляет около 1,5% сухой массы растений. Азот входит в состав таких важнейших макромолекул, как белки и нуклеиновые кислоты. Азот содержат фосфолипиды, играющие огромную роль как составная часть мембран клетки. Азот входит в состав соединений группы порфиринов, которые лежат в основе хлорофилла и цитохрома, многочисленных ферментов, в том числе НАД и НАДФ, а также во многие витамины. В связи с центральной ролью азота в метаболизме растительного организма вопросам азотного питания уделялось и уделяется большое внимание.
Формы азота в окружающей растения среде чрезвычайно разнообразны: в атмосфере — газообразный азот и пары аммиака, в почве — неорганические формы азота (азот аммиака, аммония, нитратов, нитритов) и органические (азот аминокислот, амидов, белка, гумуса и др.). Такое разнообразие форм азота ставило перед исследователями вопрос об источниках азотного питания для растительного организма. В растениях соединения азота также находятся в разнообразной форме. В силу этого для понимания особенности азотного питания требовалось установить основные этапы превращения его соединений. Большая роль в выяснении всех указанных вопросов принадлежит русской и советской школе физиологов, особенно работам академика Д. Н. Прянишникова и его учеников.
При выращивании растений на прокаленном песке было установлено, что они содержали лишь столько азота, сколько было в семени-Это показало, что высшие растения не могут усваивать азот атмосферы. Однако есть растения, обогащающие почву азотом, к ним относится семейство бобовых. Г. Гельригель установил, что на корпях бобовых растений образуются вздутия — клубеньки, заполненные живыми клетками бактерий. Эти бактерии живут в симбиозе с высшими растениями семейства бобовых и фиксируют азот атмосферы. Дальнейшие исследования показали, что способностью фиксировать-(усваивать) молекулярный азот атмосферы наделен ряд микроорга-вшамов.
1. ОСОБЕННОСТИ УСВОЕНИЯ МОЛЕКУЛЯРНОГО АЗОТА
Процесс фиксации азота атмосферы имеет важное значение. Благодаря атому процессу азот переходит в форму, которую могут использовать все растительные, а через пих и животные организмы.
Организмы, способные к усвоению азота воздуха, можно разделить на: а) симбиотические азотфиксаторы — это микроорганизмы, которые усваивают азот атмосферы, только находясь в симбиове с высшим растением; б) несимбиотические азотфиксаторы — микроорганизмы, свободно живущие в почве и усваивающие азот воздуха-
Наибольшее значение имеют азотфиксагоры, живущие в клубеньках корней бобовых растений (клубеньковые бактерии), относящиеся к роду Rhizobium. Связывание азота атмосферы возможно только при симбиотической ассоциации микроорганизмов зтого вида и высшего растения из семейства бобовых.
Существует большое количество видов и рас клубеньковых бактерий, каждая из которых приспособлена к заражению одного или нескольких видов бобовых растений. Корневые системы бобовых растений обладают специфическими корневыми выделениями. Благодаря этому клубеньковые бактерии скопляются вокруг корневых волосков, которые при этом скручиваются. Через корневой волосок бактерии в виде сплошного тяжа, состоящего из соединенных слизью бесчисленных бактерий, проникают в паренхиму корня. Возможно, бактеряи выделяют гормон ауксин и именно ато является причиной разрастания тканей, образуются вздутия — клубеньки. Клетки клубеньков заполняются быстро размножающимися бактериями, но остаются живыми и сохраняют крупные ядра. Клубеньковые бактерии заражают только полиплоидные клетки корня.
Ткань клубеньков, заполненная бактернями, приобретает розовую окраску, так как после заражения там образуется пигмент, сходный с гемоглобином,— легоглобнн. По-видимому, этот пигмент принимает непосредственное участие в усвоении азота воздуха. При отсутствии легоглобина азот не усваивается. Информация об образовании легоглобина содержится в ДНК ядра клетки высшего растения. Однако он образуется после их заражения.
Взаимоотношения между высшими растениями и клубеньковыми бактериями обычно характеризуют как симбиоз. Однако па первых
этапах заражения бакгерни питаются целиком за счет высшего растения, т. е. практически паразитируют на нем. В этот период рост зараженных растений даже несколько тормозится. В дальнейшем, азотфиксирующая способность бактерий увеличивается и они начинают снабжать азотистыми веществами растение-хозяина, вместе с тем бактерии получают от высшего растения углеводы. По мере дальнейшего развития наступает этап, когда высшее растение паразитирует на клетках бактерий, потребляя все образующиеся там азотистые соединения. В этот период часто наблюдается растворение (лизис) бактериальных клеток.
Благодаря деятельности клубеньковых бактерий часть азотистых, соединений из корней бобовых растений диффундирует в почву, обогащая ее азотом. Высев бобовых растешш ведет к повышению почвенного плодородия. Гектар бобовых растений в симбиозе с бактериями может перевести в связанное состояние от 100 до 200 кг азота за 1 г.
Существуют и другие виды высших растений, которые живут в. симйюзе с бактериями, фиксирующими азот (ольха, лох и др.). До настоящего времени пе выяснено, какие виды азотфиксирующих микроорганизмов развиваются на корнях этих растений.
Большое значение имеют свободно живущие бактерии — азотфик-саторы. В 1893 г. русским микробиологом С. Н. Виноградским была выделена анаэробная азотфикслрующая бактерия Clostridium Pasteurianum.
В 1901 г. голландский ученый М. Бейеринк выделил две аэробные азотфиксирующие бактерии — Azotobacter chroococcum, Azotobacter agile. Сейчас известен ряд видов Azotobacter. Для того чтобы эти-микроорганизмы осуществляли процесс фиксации азота, необходимо присутствие молибдена, железа и кальция. Особенно важно присутствие молибдена. Свободно живущие азотфиксаторы (Azotobacter) усваивают в среднем около 1 г аэота па 1 м2 в год.
Конечным продуктом фиксации азота является аммиак. В процессе восстановления азота до аммиака участвует мультифермептпый. комплекс — нитрогеназа. Нитрогеназа состоит из двух белков. Один из них содержит железо, а другой — молибден и железо. Источником водорода и электрона для восстаноэления азота служит пировиноградная кислота, которая образуется из углеводов в анаэробной фазе дыхания. Это указывает на связь усвоения азота атмосферы с процессами фотосинтеза (образование углеводов) и дыхания (образование пировиноградной кислоты).
Образовавшийся аммиак реагирует с п-кетоглютаровой кислотой с образованием глютаминовой кислоты, которая и вовлекается в дальнейший обмен. Фиксирование атмосферного азота может осуществляться и рядом фотосинтезирующих организмов (сине-зелеными водорослями, серными бактериями), в этом случае донором водорода и электронов может быть или вода, и^и сероводород.
г ПИТАНИЕ АЗОТОМ ВЫСШИХ РАСТЕНИЙ
Высшие растения поглощают соединения азота из почвы. Основным источником азотного питания для растений являются нитраты и аммиак. Однако эти формы не равноценны, каждая из них оказывает свое специфическое влияние на обмен веществ. Вопрос о сравнительном значении аммиака и нитратов как источников азотного пи--тания был выяснен благодаря классическим исследованиям Д. Н. Прянишникова по азотному обмену.
3. АЗОТНЫЙ ОБМЕН РАСТЕНИЙ
Изучение отдельных этапов превращения азотистых соединений, а также исследования, показавшие широкое распространение процессов реутилизации соединений азота, привели к представлению о пру-говороте азотистых веществ в растительном организме (рис. 46).
Корневые системы растений хорошо усваивают нитраты, которые, поступая в норни растения, подвергаются ферментативному восстановлению до нитритов и далее до аммиака. Этот процесс происходит главным образом в норнях, однако и клетки листьев обладают этой способностью.
Восстановление нитратов до аммиака идет через ряд зтанов. Нитраты восстанавливаются до нитритов при участии фермента нитрат-редуктазы (питратредуктаза — это флавопротеид, содержащий молибден) . Образовавшиеся нитриты восстанавливаются до гипонитри-та, гидроксиламина, наконец, до аммиака:
(N+5) (N+3) (N+1) (N-1) (N-S)
NO-S NO“S -> (NO)2 NHSOH -> NH3 нитрат —нитрит —► гипонитрит —*- гидроксиламин—>-аммиак Восстановление нитритов до гипонитрита катализируется ферментом нитритредуктазой. Нитритредуктаза активируется медью. Соответственно последующие реакции катализируются ферментами гипо-нитритредуктазой и гидроксиламинредуктазой. Последний фермент активируется марганцем. Надо, однако, сказать, что, начиная с восстановления нитритов, дальнейший процесс изучен недостаточно. Промежуточные соединения не выделены, не исключено, что они являются иными. Для восстановления нитратов необходимо присутствие донора водорода п электронов, которыми являются восстановленные никотинамиды (НАДФ-Hj или НАД-Нг). Поставщиком этих соединений является процесс дыхания. Именно поэтому восстановление нитратов тесно связано с дыхательным газообменом. Для нормального протекания процесса дыхания растение должно быть достаточно обеспечено углеводами. При усиленном поступлении нитратов содержание углеводов падает. При искусственном снижении содержания углеводов (выдерживание растений в темноте) нитраты не восстанавливаются, а накапливаются во всех органах растения. Интересно, что растения-нитратонаконители, к которым относятся
некоторые среднеазиатские солянки, содержат мело углеводов и большое количество органических кислот. Большое влияние па восстановление нитратов оказывает спот. По-впдпмому, для восстановления нитратов могут быть яепо-срсдстнснио попользованы продукты, образующиеся в процессе нециклического фотофосфорилирования (ПАДФ-Нз, АТФ). Восстановление нитратов стимулируется при освещении синим светом. Возможно, это связапо с тем, что флавин, который входит о состав пит-ратредуктазы, поглощает синий свет и активируется им.
Наряду с нитратами в растение могут поступать и нитриты, которые также подвергаются восстановлению до аммиака. Однако нитриты при накоплении могут оказаться ядовитыми. Аммиак также может служить источником
При атом ок поступает в растения даже быстрее, чем нитраты.
Более быстрое поглощение аммиака объясняется тем, что для его использования па построение органических веществ пе требуется предварительного восстановления, которые необходимы при питании растений нитратами. Аммиак представляет собой основное и, по-видимому, единственное соединение, вовлекаемое в процессы азотистого обмена. При этом аммиак может быть разного происхождения: непосредственно поступивший из почвы, образовавшийся в результате восстановления нитратов или в результате вторичного распада белка в стареющих органах и клетках. Накопление аммиака в клетках приводит к нежелательным последствиям; Однако растения обладают способностью обезвреживать аммиак путем присоединения его к органическим кислотам с образованием амидов (глутамина, аспарагина). Этот процесс апелогичеп обезвреживанию аммиака животными организмами в виде мочевиньь
Существует целая группа растений, накапливающая большое количество органических киспот и с их помощью обезвреживающая аммиак, образуя соли. Это позволило разделить растения на амидные, образующие амиды,— аспарагип и глутамин — и аммиачные, образующие соли аммония. Изменяя pH кпеточлого сока, можно менять направление азотистого обмена, превращать растения с амидным типом обмена в аммиачные, и наоборот.
Каковы же пути образования амидов в растениях? В процессе дыхания в качестве промежуточных продуктов образуются органические кислоты, в том числе а-иетоглутаровая и щавелевоуксусная.
Эти пислоты в результате реакции прямого восстановительного ани-
мирования присоединяют аймиак. соон I с=о । нлдф-н+н*
СН8 4- NHS (-----------
СНг I СООН
а-кетоглуторовая кислота
СООН
I chnh2 ^На + HSO + НАДФ
I сна
I соон
Катализируется реакция ферментом глутаматдегидрогеназой с активной группой НАД. Этот фермент локализован главным образом в митохондриях, так как именно в них образуются органические кислоты и восстановленные никотинамидные коферменты. Аспарагиновая кислота образуется по аналогии с глутаминовой кислотой путем восстановительного аминирования щавелевоуксусной кислоты.
Кроме того, аспарагиновая кислота может образовываться путем прямого аминирования фумаровой кислоты при участии фермента
аспартазы. СООН СООН CH CHNHa II 4-NH3^ | СН СН2 СООН СООН фумаровая асиарагииовая кислота кислота
Синтез аспарагиновой кислоты стимулируется светом и локализован глазным обравом в хлоропластах.
Глутаминовая и аспарагиновая аминокислоты, присоединяя еще -одну молекулу аммиака, дают амиды — глутамин и аспарагин.
Амидная группировка предохраняет глутаминовую и аспарагиновую кислоты от обратного отщепления аммиака при окислительном дезаминировании. Для того чтобы амиды образовались, необходима затрата энергии (АТФ) и присутствие ионов магния. Реакция катализируется ферментом глутаматсинтетазой.
СООН соон
I I
CHNH, CHNH,
I I
СН2 + КН3 4-АТФ СНа +АДФ4-ФН
I I
сн8 сна
I !
соон conh2
глутаминовая ' глутамин
Образование аспарагина происходит аналогичным путем.
Для образования амидов особенное значение имеет возраст растений. Как правило, чем моложе растение, тем больше его способность к образованию амидов. В более молодых органах (листьях) и даже в более молодых клетках одного и того же органа образование амидов идет интенсивнее. В пасоке и в соке гуттации обычно присутствуют амиды. Это показывает, что аммиак, поступивший в растения, может преобразовываться в форму амидов в живых клетках корня.
В тех случаях, когда углеводов но хватает или интенсивность дыхания ослаблена, амиды не образуются и аммиак накапливается, в результате может наступить отравление растений. Относительное количество образовавшегося аспарагина и глутамина и их роль различны в зависимости от вида растений и условий среды. Все же, по-видимому, образование аспарагина преобладает в том случае, когда происходит распад белков в семенах. В клетках корпя п листа растущего растения идет главным образом образование глутамина. Таким образом, аспарагин — форма обезвреживания аммиака, образовавшегося на пути распада белка (регрессивная ветвь азотпого обмена) , тогда как глутамин — форма обезвреживания аммиака, используемого на пути синтеза белка (прогрессивная ветвь азотного обмена).
Роль амидов в растении разнообразна. Это не только форма обезвреживания аммиака, это и транспортная форма азотистых соединении, обеспечивающая отток их пз одного органа в другие. Наконец, чрезвычайно важно, что амиды и их непосредственные предшественники — глутаминовая и аспарагиновая кислоты — являются материалом для построения многих других аминокислот в процессах переаминирования, а также перестройки их углеродного скелета.
Из 20 аминокислот, входящих в состав белка (протейного иных), только три могут образоваться в процессе прямого аминирования. Остальные аминокислоты образуются в процессе переаминирования и взаимопревращения. Каждая пз амипокиспот, образовавшихся путем прямого аминирования (глутаминовая, аспарагиновая и аланин), является предшественником целой группы аминокислот. Реакции пе-реамипироваиия были открыты в 1037 г. советскими биохимиками А. Е. Браутшггейпом и М. Г. Крипмая. Эти реакции катализируются специальными ферментами — аминотрансферазами и идут при участии кофермента пиридоксальфосфата (производное витамина Вс). Роль пиридоксальфосфата заключается в том, что оп связывает аминогруппу с образованием пиридоксаминфосфата и высвобождает кетокислоты. Затем пиридоксамипфосфат отдает аминогруппу другой кетокислоте, регенерируя в прежнем виде. Наибольшее распространение имеет реакция, в ходе которой аминогруппа отнимается от глутаминовой кислоты:
глутаминовая 4- пировиноградная —»- п-кетоглутаровая 4- аланин кислота кислота кислота
Полученные путем переаминирования различные аминокислоты за счет перестройки углеродного скелета дают остальные аминонислоты. 7—773 17?
Таким образом, амиды являются как бы донаторами аминогруппы. Д. Н. Прянишников называл их воротами, через которые должен пройти аммиак, для того чтобы включиться в остельные аминокислоты и белки. Это обстоятельство отражено на схеме (рис. 46).
Растительный организм, в отличие от животного, обладает способностью синтезировать все необходимые ему аминокислоты, которые могут образовываться в разных органах растений — в листьях, корнях, верхушках стебля. Некоторые аминокислоты образуются непосредственно в хлоропластах и здесь используются на образование белка. Наиболее интенсивно синтез белна ироисходит в меристематических и молодых развивающихся тканнх. Интересно, что в отрезанных листьях синтез белка полностью прекращается, это служит еще одним доказательством, что для синтеза белка нужен какой-то фактор, образующийся в кориях растений. Можно предположить, что это фито гормон, относящийся к группе цитокининов, или близкое к нему вещество.
Для нормального протекания синтеза белка в растительном организме нужны следующие условия: 1) обеспеченность азотом; 2) обеспеченность углеводами (углеводы необходимы и как материал для построения углеродистого скелета аминокислот, и как субстрат для дыхания); 3) высокая интенсивность и сопряженность процесса дыхания и фосфорилирования. На всех этапах преобразования азотистых веществ (восстановление нитратов, образование амидов, активизация аминокислот при синтезе белка и др.) необходима энергия, заключенная в макроэргических фосфорных связях (АТФ); 4) присутствие нуклеиновых кислот: ДНК необходима как вещество, в котором зашифрована информация о последовательности аминокислот в синтезируемой молекуле белка; и-РНК — как агент, обеспечивающий перенос информации от ДНК к рибосомам; т-РНК — как обеспечивающая перенос аминокислот к рибосомам; 5) рибосомы, структурные единицы, где происходит синтез белка; 6) белки-ферменты, катализаторы синтеза белка (амииоацил-ч-РПК-сиптетазы); 7) ряд минеральных элементов (ноны Mgs+, Са2+).
Образованием белка заканчивается прогрессивная ветвь азотистого обмена в растениях, которая преобладает главным образом в молодых растущих органах (первичный синтез белковых веществ). Однано в растениях идет и непрерывный распад белка. Опыты с использованием меченого азота ,EN позволили советскому исследователю Ф. В. Турчину подтвердить последовательпость включения азота в различные соединения, постулированную схемой Прянишникова, и одновременно показать, что обновление белка происходит чрезвычайно быстро. За 48 ч до 60% белка организма синтезируется вповь. Вторая половина схемы Прянишникова показывает последовательность появления соединений в процессе распада белков (регрессивная ветвь азотистого обмена). Белки распадаются до аминокислот и далее до аммиака. Аммиак вновь обезвреживается в виде ампдов (аспарагин и глутамин). На основе этих соединений образуются аминокислоты. Это позволяет организму синтезировать новый набор аминокислот, который обеспечит построение иных белков со свопм
специфическим набором и последовательностью аминокислот (вторичный синтез белковых веществ). Резюмируя все известные факты, Пряпипшиков подчеркнул, что аммиак — это альфа и омега азотистого обмена в растениях, т. е. его начальный и конечный етапы. В условиях, обеспечивающих достаточно высокий уровень синтетических процессов, аммиак представляет собой прекрасный источник азотного питания для растений.
Значение аммиака как источника азотного питания имеет не только теоретическое, но и практическое значение. Получение удобрений, содержащих аммиачные соли,— процесс более простой и дешевый по сравнению с удобрениями, где азот содержится в форме нитратов.
, Опыты, проведенные в стерильных условиях, показали, что в качестве источника азотного питания могут быть использованы растениями и растворимые органические соединения (аминокислоты, амиды и мочевина). В естественных условиях эти соединения редко могут быть источником питания, поскольку их содержание в почве, как правило, очень мало. Для некоторых растений с уклоняющимся типом питания (паразиты, полупаразиты, сапрофиты, насекомоядные растения) источником питания может служить органический азот.
ПОЧВА КАК ИСТОЧНИК ПИТАТЕЛЬНЫХ
ВЕЩЕСТВ
Важнейшим свойством почвы является ее плодородие, или способность снабжать растение водой и питательными веществами. Почва — это сложное природное тело, которое влияет на жизнь растений различными путями. Система почва — растение — сложный взаимодействующий комплекс. Расчеты показывают, что вапасы питательных веществ в пахотном горизонте достаточно велики, чтобы полностью удовлетворить потребность в них растений. Между тем известно, что во многих случаях внесение небольших доз удобрений оказывает положительное влияние па рост и продуктивность растений. Это объясняется тем, что абсолютное (валовое) содержание того или иного питательного элемента еще пе говорит о его доступности для растения.
1. ПИТАТЕЛЬНЫЕ ВЕЩЕСТВА В ПОЧВЕ И ИХ УСВОЯЕМОСТЬ
Какие же формы питательных веществ являются усвояемыми, доступными для растительного организма? Вопрос этот осложняется тем, что в почве непрерывно идут многочисленные химические и микробиологические процессы, быстро меняющие формы всех питательных веществ; кроме того, большое значение имеет и тип растения. Разные растения обладают различной усвояюхцей способностью. Это связало с их метаболической активностью и, что особенно важно, с
характером корневых выделений. В некоторых случаях корневые выделения метут переводить одну форму питательных веществ (плохо усвояемую) в другую (хорошо усвояемую).
Наиболее доступной формой питательных веществ в почве являются вещества, находящиеся в почвенном растворе. Однако их недостаточно для поддержания нормального роста растений. При выращивании растения на воде, профильтрованной через почву, рост его будет чрезвычайно ослаблен по сравнению с тем, которое выращивалось прямо на почве-
Для питания растений важнейшее апачение имеет физико-химическая, или обменная, поглотительная способность почвы. Это свойство почвы свяаапо с наличием в пей частиц почвенного поглощающего комплекса — ато мелкодисперсная коллоидная часть почвы, смесь минеральных (алюмосиликатных) и органических (гуминовых) соединений. Ббльшая часть коллоидов почвы заряжена отрицательно. На их поверхности в адсорбированном (поглощенном) состоянии находятся катионы. Некоторая часть коллоидов почвы в определенных условиях может быть ааряжена положительно, поэтому па них в поглощенном адсорбированном состоянии будут находиться анионы. Обменные катионы и анионы — ато одни из важнейших источников питания для растений. Катионы и анионы, находящиеся в поглощенном состоянии па частицах почвенного поглощающего комплекса, мотут обмениваться па копы, адсорбированные пе поверхности клеток корня. Особенно успешно проходит этот процесс при тесном контакте между коллоидами ночвы и клетками корпя (контактный обмен). Доступность поглощенных катионов зависит от ряда условий: 1) от степени насыщенности почвы данным катионом. Чем относительно больше данного катиона (по отношению ко всем другим поглощенным катионам) находится в почве, тем с меньшей силой он удерживается и легче поступает в клетки корпя; 2) от насыщенности данным катионом поверхности клеток корпя растения. Чем больше эта насыщенность, тем меньше способность клеток корня к его поглощению. Насыщенность клеток катионом зависит от быстроты его продвижения внутрь растения, а также от скорости его использования. Чем иптепспвмее процессы обмена веществ в растении, чем больше его темпы роста, тем выше его способность к поглощению катионов; 3) от содержания воды в почве. Показано, что обмен ионов между коллоидами почвы и клетками корпя осуществляется легче в том случае, когда поверхность соприкосновения увлажнена.
В некоторых случаях растения могут использовать питательные вещества из труднорастворимых соединений. Это относится прежде всего к фосфатам.
2. ЗНАЧЕНИЕ КИСЛОТНОСТИ ПОЧВЫ
Кислотность почвы влияет на растэоримость, а также усвояемость растением различных нитательных веществ. Такие питательные элементы, как фосфор (в определенных условиях), калий, железо, цинк,
марганец, бор и др., более усвояемы па кислых почвах. Вместе с тем большое увеличение кислотности почвы (низкое pH) может сильно тормозить рост и даже оказывать повреждающее влияние на растение. Для каждого вида растения существуют свои границы pH, при которых возможен его рост. Оптимальные значения pH для некоторых растений следующие: люпин — 4—5, картофель — 5, овес — 5— 6, рожь — 5—6, лен — 5—6, клевер — 6—6,5, горох — 6—7, свекла — 7.
Как видно из приведенных данных, для большинства растений наиболее благоприятной является слабокислая реакция (pH 5—6) или нейтральная (pH 7). Резкий сдвиг pH в ту или иную сторону оказывает вредное, а иногда и губительное влияние на растение. Менее вреден сдвиг pH почвы в щелочную сторону. Это происходит потому, что клетки корпя растения выделяют СОг, а иногда п органические кислоты, которые нейтрализуют избыточную щелочность, Резкий сдвиг реакции почвы в кислую сторону оказывает нежелательные последствия в силу нескольких обстоятельств: прямого повреждающего влияния па поверхностные слои протоплазмы, торможения поступления в клетки корпя питательных катионов, перехода в раствор солей алюминия п железа. Последнее переводит фосфорную кислоту в неусвояемую для растений форму, а также оказывает непосредственное ядовитое влияние на растительный организм.
Для устранения избыточной кислотности в агрономической практике широко применяется известкование.
3. ЗНАЧЕНИЕ ПОЧВЕННЫХ МИКРООРГАНИЗМОВ
Почва представляет собой благоприятную среду для развитая микроорганизмов. Приблизительные подсчеты показывают, что в 1 г почвы содержатся IX109 бактерий, 1X10® грибов, 1Х103 актипо-ыпцетов, 4X10® водорослей. Суммарная масса всех микробных клеток в пахотном слое составляет примерно 6—7 т на 1 га. Естественно, такое колоссальное количество живых клеток оказывает многообразное и разностороннее влияние па процессы, происходящие в почве, н на жизпь высших растений. Особенно много микроорганизмов развивается около корневых систем — ризосферные микроорганизмы. Число микроорганизмов в прикорневой зоне в 50—100 раз превышает их число вне сферы влияния корневых систем. Это и попятно, так как благодаря выделениям около корневых систем создаются благоприятные условия для их питания. Поскольку корневые выделения различны у разных растений, ризосферные микроорганизмы тоже специфичны.
Под влиянием микроорганизмов происходят как нежелательные процессы, так и полезные. Микроорганизмы могут вызывать заболевания растений п накопление некоторых токсичных веществ. Микроорганизмы могут выступать как конкуренты высших растений, поглощая усвояемые питательные вещества. Микроорганизмы участвуют в минерализации органических веществ, тем самым переводя их в усвояемую форму. В агой связи органическое вещество почвы
является важнейшим резервом питательных веществ для растения-Чрезвычайно полезное значение имеет усвоение азота атмосферы микроорганизмами, что является почти единственным источником азотистых соединений в почве. Микроорганизмы осуществляют превращение (окисление, восстановление) ряда неорганических соединении, переводя их в более или, наоборот, менее усвояемую форму. Важной особенностью микроорганизмов является выделение ряда биотических веществ (витамины, гормоны), которые способствуют росту высшего растения. Многие высшие растения живут в симбиозе с грибами, образуя микоризу, или грибокорень. Различают эктотроф-пую и .эндотрофную микоризу. При эктотрофной микоризе, свойственной главным обрезом древесным растениям, корень как бы плотно опутан гифами гриба, которые неглубоко проникают в межклетники коры корня. При эндотрофной микоризе (у травянистых растений) гифы гриба не только распространяются по межклетникам, но и внедряются внутрь клеток корня. Растения-микорпзсобразователи могут обходиться и без сожительства с грибом, все же образование микоризы улучшает рост растения. Грибной мицелий увеличивает рабочую поверхность корневой системы и тем самым способствует поглощению из почвы воды и питательных веществ.
На надземных органах растений развивается эпифитная микрофлора. Ее микроорганизмы способствуют росту высшего растения, в данном случае путем снабжения их гормональными веществами. В целом рост высших растений возможен на минеральной питательной среде в стерильных условиях. Однако в присутствии микроорганизмов он идет более интенсивно. Даже при полной обеспеченности всеми питательными веществами в стерильных условиях темпы роста растений снижаются- Это, по-видимому, связано с недостатком гормонов. Внесение извне таких фитогормонов, как ауксины и гиббереллины, в стерильных условиях оказывает особенно благоприятное влияние (А. А. Тарасенко).
Список рекомендуемой литературы
Данилова М. Ф. Структурные основы поглощения веществ корнем. Л., Наука, 1874.
Кларксон Д. Транспорт ионов и структура растительной клетки. М. Мир. 1878.
Прянишников Д. Н. Азот в жизни растений и в земледелии СССР.— Иэбр. соч. М., Изд-во АН СССР, 1855, т. IV.
Сабинин Д, А. Физиологические основы питания растений. М., Изд-во АН СССР, 1855.
Сатклвфф Дж. Ф. Поглощеяие минеральных солей растениями. М-,
ЧсрваввваИ. А. Физиология и биохимия микроэлементов. М., Высшая школа, 1870.
Школьник М. Я. Микроэлементы в жизни растений. Л., Изд-во АН СССР, 1874.
Саляев Р. К. Поглощение веществ растительной клеткой, М., 1889.
Глава V.
ПЕРЕДВИЖЕНИЕ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ ПО РАСТЕНИЮ
Передвижение минеральных п органических веществ по растению имеет очень большое значение, так как это процесс, с помощью которого осуществляется физиологическая взаимосвязь отдельных органов. В растениях существуют два основных тока питательных веществ — восходящий и нисходящий. Большую роль в выяснении путей передвижения отдельных питательных веществ сыграл прием кольцевания растений. Этот прием заключается в наложении кольцевых вырезок па стебель растения; при атом кора (флоэма) удаляется, а древесина (ксилема) остается неповрежденной. С помощью этого приема еще в конце XVII в. итальянским исследователем Мальпиги было показано, что восходящий ток воды с минеральными веществами идет по ксилеме. Нисходящий ток органических веществ из листьев идет по элементам флоэмы. Вывод этот был сделан Мальпиги на основании того, что над кольцевой вырезкой листья оставались тургесцептиыми, несмотря на удаление коры, в них продолжала поступать вода. Вместе с тем ток органических ееществ приостанавливался и это приводило к образованию над вырезкой утолщений (паллывов). Ряд уточнений в вопрос о путях п направлении передвижения веществ но растению внесли исследования с применением меченых атомов.
ПЕРЕДВИЖЕНИЕ ЭЛЕМЕНТОВ МИНЕРАЛЬНОГО ПИТАНИЯ (ВОСХОДЯЩИЙ ТОК)
Использование меченого фосфора позволило установить, что передвижение солей идет быстрее при усилепии транспирации и замедляется при уменьшении этого процесса. Если листья закрыть полиэтиленовыми пакетами, то транспирация задержится и скорость передвижения соответственно уменьшится. Эти опыты позволяют считать, что передвижение питательных веществ в восходящем па-правлении идет по сосудам ксилемы вместе с водой. Однако скорость передвижения растворенных веществ по ксилеме может быть отлична ст скорости передвижения воды. Это обстоятельство связано с тем, что растворенные вещества могут адсорбироваться стенками сосудов, а также передвигаться в радиальном направлении. В этом отношении интересные результаты были получепы в опытах, где на определенном промежутке стебля кору (флоэму) тщательно «тделяли от
ксилемы. Между корой и ксилемой прокладывали вощеную бумагу. Подготовленное таким образом растение помещали па питательную смесь, содержащую меченый калий. После пятичасовой экспозиции анализировались отдельные участки стебля. Оказалось, что передвижение калия в восходящем направлении идет главным образом по ксилеме. Вместе с тем в отщепленных участках флоэмы также было обнаружено некоторое количество калия. Из зтого следует, что в небольшом количестве восходящий ток идет п по ситовидным трубкам. Там, где расщепления пе проводилось, калий почти равномерно распределялся меязду ксилемой и флоэмой, что служит доказательством перемещения калия в радиальном направлении. Таким образом, основной ток минеральных солей из корневой системы идет но ксилеме. Поскольку между ксплемой и флоэмой существует постоянный обмен, часть веществ может передвигаться и по флоэме. Между проводящими элементами ксилемы и флоэмы располагаются живые клетки камбия и растворенные вещества из сосудов ксилемы частично поступают в клетки камбия. Последние оказываются своего рода регуляторами количества и состава растворенных питательных веществ, передвигающихся по ксилеме. Если какого-либо элемента слишком много в восходящем токе ксилемы, то ов аккумулируется клетками камбия. Они же могут служить п источником недостающих влементов питания, передавая их по мере необходимости в ксилемный сон.
Передвижение питательных веществ по ксилеме в восходящем направлении — ето пассивный процесс, мало связанный с процессами обмена. Понижение температуры и даже умерщвление стебля горячим паром пе прекращают передвижения по ксилеме и мало сказываются па его скорости. Направление и распределение питательных веществ, передвигающихся по сосудам ксилемы, по органам растения определяется не интенсивностью транспирации, а напряженностью процессов обмена веществ, происходящих в даппом органе. Опыты, проведенные с использованием меченого фосфора, показали, что, чем выше расположен лист, чем он моложе, чем интенсивнее в нем процесс обмена, тем больше в пего поступает питательных веществ. Одним ив факторов, влияющих па распределение питательных веществ, являются фитогормопы. Показано, что удаление верхушки растения вызывает равномерное распределение меченого фосфорапо всем листьям независимо от их возраста, что коррелирует с содержанием фитогормонов.
КРУГОВОРОТ МИНЕРАЛЬНЫХ ВЕЩЕСТВ В РАСТЕНИИ [РЕУТИЛИЗАЦИЯ]
Растительный организм, в отличие от животного, характеризуется большой экономностью в использовании питательных веществ. Это выражается в способности растений к реутилизации (повторному использованию) основных элементов минерального питания. Особенно подвижны в растепиях соединения фосфора.
Интересные результаты были получены в опытах с кукурузой. Проростки кукурузы в возрасте 10 суток переносили на питательную среду, содержащую 32Р. Затем в каждом вновь поввнвшемся листе определяли соотношение 3,Р и S2P. Оказалось, что оно во всех листьях одинаково, так как в молодые листья шел отток фосфора из листьев более старых. Дальнейшие исследования показали, что повторному использованию подвергается большинство елемептов минерального питания. Одиако есть элементы, которые практически не реутилизируются. К ним относятся кальций, бор и, по-впдпыому, железо. Это связано с малой подвижностью и плохой растворимостью соединений, в которые входят эти элементы.
Каждый лист растении проходит свой цикл развития. Лист растет, достигает максимального размера, затем начинаются процессы старения, и наконец лист отмирает. На протяжении всей жизни листа в него поступают питательные вещества. Одновременно какое-то количество вещества из него оттекает. В период физиологической молодости листа количество веществ, содержащих элементы минерального питания, в нем увеличивается, поскольку скорость притока веществ заметно превышает скорость оттока. Затем на короткий период эти два процесса (приток и отток) уравновешивают друг друга. И наконец, по мере старения листа начинает преобладать отток. Во время цветения и листопада отток питательных веществ идет интенсивно из всех листьев.
Таким образом питательные вещества передвигаются из корневой системы в надземные органы, в основном по ксилеме, а затем оттекают из листьев по флоэме до тканей стебля. Распространяясь в радиальном направлении из проводящих элементов флоэмы, питательные вещества переходят вновь в сосуды ксилемы и с восходящим током направляются к более молодым органам и листьям. Следовательно, злемепты питания совершают круговорот по растению. Переход из нисходящего тока (по флоэме) в восходящий ток (по ксилеме) может происходить в разных точках стебля. Для соединений азота показано, что передвижение в нисходящем направлении идет по флоэме до корневой системы. В проводящей системе корня соединения азота переходят в восходящий ток и движутся по сосудам ксилемы.
Повторное использование растительным организмом отдельных элементов оказывает влияние на их распределение. В растении существуют два ярпо выраженных градиента распределения минеральных веществ. Для элементов, подвергающихся повторному использованию, характерен базипетальный градиент распределения, т. е. чем выше расположен лист, чем ои моложе, тем больше в нем азота, фосфора, какия. Это особенно проявляется при недостатке данного элемента в почве. Для элементов, не подвергающихся повторному использованию (калий, бор, железо), характерен акропетальный градиент распределении. Чем старше орган, тем больше содержание в нем указанных элементов.
По отношению к элементам, подвергающимся повторному использованию, признаки голодания будут проявляться прежде всего набо-
лее старых листьях, тогда как по отношению к елемептам, пе подвергающимся реутилизации, признаки страдания проявляются в первую очередь на молодых органах. Иначе говоря, градиент страдания растений направлен в противоположную сторону градиента распределении. Указанные положения принимаются во внимание при отборе проб листьев для анализов, позволяющих судить о необходимости для растения внесения того или пиого питательного вещества в качестве удобрения.
ОСОБЕННОСТИ ПЕРЕДВИЖЕНИЯ
ОРГАНИЧЕСКИХ ВЕЩЕСТВ ПО РАСТЕНИЮ
Листья, а точнее, хлороцласты снабжают образовавшимися в них органическими веществами все органы растительного организма. Пути передвижения этих веществ неоднородны. Образовавшиеся в хлоропласте вещества должны прежде всего поступить в цитоплазму, затем по паренхимным клеткам в ситовидные трубки флоэмы п по ним к различным потребляющим органам растения.
Различают внутриклеточный, межклеточный паренхимный и флоэмный транспорт веществ (А. Л. Курсапов).
1. Внутриклеточный транспорт. Выход ассимилятов из хлороплао-тов. В каждом хлоропласте аа день количество образовавшихся в процессе фотосинтеза продуктов превосходит их собственную массу. В этой связи большое значение имеет отток асспмилятов в другие части клетки, т. е. внутриклеточный транспорт. Наиболее легко через мембраны хлоропластов проникают триозофосфаты (ФГА, ФДА), которые могут и выходить из хлоропластов, и вновь поступать в них. Проникновение через мембрану хлоропластов фосфорилированных гексоз затруднено. Предполагается, что образующиеся в хлоропластах более сложные углеводы распадаются па триозофосфаты и в таком виде передвигаются в цитоплазму, где могут служить материалом для ресинтеза гексов, сахарозы и крахмала. Благодаря указанным превращениям концентрация триовофосфатов в цитоплазме непрерывно снижается, что способствует их притоку по градиенту концентрации. Образовавшиеся в хлоропластах белки также распадаются и оттекают в цитоплазму в виде аминокислот. На свету проницаемость мембран хлоропластов повышается, что способствует оттоку из них различных веществ.
2. Межклеточный паренхимный транспорт. Поступившие в цитоплазму органические соединения не только используются па нужды данной клетки, но и направленно передвигаются к ситовидным трубкам. Межклеточный паренхимный транспорт может осуществляться двумя путями — по плазмодесмам (симпласту) или по свободному пространству (клеточным оболочкам и межклеточным пространствам паренхимы листа). В зависимости от густоты расположения проводящих злементов в листе (сети жилок) расстояния от паренхимной клетки, производящей ассимиляты. до ситовидных элементов флоэмы могут быть различными. Однако в среднем оно не превышает 3— 4 клеток и составляет сотые доли миллиметра. Скорость перемеще-
Рис. 47. Фрагменты паренхимных клеток флоэмы. Клеточная оболочка и плазмалемма имеют выросты. Электронно-микроскопическая фотография (по Н. В. Парамоновой).
вия ассимилятов в паренхимных тканях равняется примерно 10—' 60 см/ч. Это ваметпо выше скорости обычной диффузии. При передвижении веществ по плазмодесмам такая скорость может достигаться лишь при большой дополнительвой затрате энергии. Вместе с тем не у всех растепий плазмодесмы хорошо развиты. Все это позволяет считать, что паренхимный транспорт осуществляется не только через плазмодесмы.
В мевофилле листа к свободному пространству (открытому для свободной диффузии) можно отнести промежутки между мпкрофиб-риллаыи целлюлозы в клеточных стенках, а также систему межклетников. Показано, что клетки мезофилла листа обладают значительной секреторной способностью и легио выделяют сахара в свободное пространство. Клетки флоэмных окончаний (передаточные) усиленно абсорбируют сахара и аминокислоты Отличительной особенностью передаточных клеток являются многочисленные выросты клеточных степок (рис. 47). Благодаря этим выростам (направленным внутрь клеток) поверхность плазмалеммы возрастает, одновременно это увеличивает емкость свободного пространства и создает благоприятные условия для отдачи веществ во флоэму.
3. Передвижение веществ по флоэме — флоэмный транспорт. Дальний транспорт органических питательных веществ в нисходящем направлении осуществляется в основном по флоэме. Это положение получило подтверждение в опытах с мечеными атомами. Так;
при нанесении S2P па листья в случае, если флоэму отщепляли от ксилемы и между ними прокладывали вощеную бумагу, меченый фосфор обнаруживался только во флоэме. Эти опыты подтвердили, что нисходящий ток как органических, так и минеральных веществ осуществляется именно по флоэме.
В отличие от ксилемы флоэма представляет собой совокупность живых клеток. В ее состав входят собственно ситовидные трубки, сопровождающие клетки, клетки флоэмной паренхимы и лубяные волокна. Ситовидные трубки представляют собой вертикальные ряды вытянутых в большинстве случаев цилиндрических клеток с топкими клеточными оболочками. Отдельные клетки (членики) отделены друг от друга ситовидными пластинками, пронизанными многочисленными порами, через которые проходят цитоплазматические тяжи. К каждой киетке ситовидной трубки примыкает богатая цитоплазмой клетпа-спутница. Ситовидные трубки образуются из клеток камбия и в первое время не отличаются от других клеток флоэмы. Они содержат подвижную цитоплазму с многочиспенными рибосомами, пласти
ды, митохондрии. В центре имеется вакуоль, окруженная мембраной-тонопластом. По мере развития структура ситовидных трубок претерпевает значительные изменения. Распадается ядро; пластиды, митохондрии уменьшаются в размере; исчезает тонопласт. На месте вакуоли образуется центральная полость. Цитоплазма располагается в пристенном слое. Отдельные продольные тяжн цитоплазмы пронизывают центральную полость (рис. 48). В полости рас-полагаются сгустки округлой формы, по-видимому, это скопления микротрубочек. Одновременно с. этими изменениями в ситовидных пластинках образуются поры, через которые проходят тонкие тяжн цитоплазмы (филаменты); в некоторых случаях они принимают форму микротрубочек. По-видимому, имехпхо в этот период ситовидные трубки служат местом транспорта веществ. По мере старения в порах ситовидных пластинок откладывается углевод каллоза. Каллоза, сужая просветы пор, затрудняет передвижение веществ. У древесных растелий отдельнме влементы флозмы функционируют всего один год. По мере образования новых листьев отток из них идет по вповь образовавшимся ситовидным влементам.
Применение ряда методов позволило определить, в какой форме вещества передвигаются по флоэме. 1. Большое значение имела раз
работка метода получения флоэмного сока с помощью сосущих насекомых — афид, которые погружают хоботок в ситовидную трубку. Если тело насекомого отрезать, из хоботка будет вытекать флоэмный сок, который и подвергается анализу. 2. Использование иС0з позволило проводить анализ меченых соединений непосредственно в проводящих элементах флоэмы. Исследования показали, что 90% или более всех веществ, передвигающихся по флоэме, составляют углеводы. Основной транспортной формой углеводов служит сахароза (CiaHuOn). В опытах А. Л. Курсаиоваи М. В. Туркиной уже через 5 мин после начала ассимиляции 1<СОа в проводящих пучках обнаруживалась именно сахароза. Вместе с тем у некоторых видов наряду с сахарозой транспортной формой углеводов служат олигосахара (раффиноза, стахиоза), а также некоторые спирты (маппитол, сорбитол). Моносахара (глюкоза и фруктоза) составляют малую долю передвигающихся углеводов.
По-ввдимому, образование сахарозы происходит в паренхимных клетках флоэмы, откуда она поступазт в ситовидные трубни, которые лишены ферментов, разлагающих сахарозу (инвертазы), что и определяет сохранность этого соединения на всем пути его транспорта.
По флоэме в нисходящем направлении может идти передвижение и других питательных элементов как в виде минеральных, так и органических соединений нри их оттоке из стареющих органов в процессе реутилизации. Азотистые вещества при их повторном использовании передвигаются по флоэме в виде аминокислот и амидов. Транспорт по флоэме может идти в двух противоположных направлениях, образовавшиеся в листьях ассимиляты передвигаются как вверх — к точкам роста, цветкам и плодам, так и вниз — к корням, вместилищам запасных питательных веществ. Вопрос, идет ли встречный транспорт веществ по одним и тем же ситовидным элементам или по разным, остается пока открытым. Определение скорости пере; движения веществ по флоэме проводилось путем наблюдения за быстротой распространения меченых соединений. Оказалось, что скорость передвижения в ситовидных трубках достаточно высока и составляет в среднем 50—100 см/ч. У разных групп растений скорость передвижения может несколько варьировать. У одного и того же растения различные органические вещества могут передвигаться с разной скоростью. Значительное влияние па скорость передвижения оказывают условия внешней среды. В отличие от передвижения по ксилеме на транспорт веществ по флоэме влияют все факторы, изменяющие напряженность процессов обмена веществ. Передвижение по флоэме зависит or температуры. Это можно проследить на опытах, в которых пластинки листа погружали в раствор сахарозы, а черешки заключали в специальную муфту к подвергали воздействию различных темперетур. Оказалось, что оптимальнан температура колеблется между 20 и 30°С. Дальиейшее повышение температуры уже тормозит отток ассимилятов из пластинки листа. Отношение к резкому охлаждению флоэмы у разных растений неодинаково. Так, южные растения (фасоль) полностью приостанавливают транспорт при тем
пературе 1—2°С, тогда как у сахарной свеклы подобное охлаждение лишь замедляет передвижение.
Условия минерального питания оказывают заметное влияние па транспорт веществ по флоэме. Особенно много исследований поскя-щепо влиянию бора. Показано, что под влиянием бора скорость передвижения сахарозы заметно возрастает. Возможно, это связано с образованием комплексных соединений бора с углеводами. Скорость передвижения ассимилятов ускоряется также под влиянием фосфора. Фосфорилированные формы сахаров передвигаются быстрее. Скорость передвижения меняется нод влиянием калия. В последнее время появилась гипотеза, согласно которой калий поддерживает мембранный потенциал в ситовидных пластинках и тем самым способствует передвижению ассимилятов.
Передвижение веществ по флоэме тормозится в присутствии всех метаболических ингибиторов, таких, как азид натрия, иодацетат, динитрофенол и др. Транспорт по флоэме ускоряется при добавлении АТФ. Все эти данные указывают на тесную связь между передвижением веществ по флоэме и метаболизмом.
Наиболее сложен вопрос о механизме флоэмного транспорта. Еще в 1930 г. Е. Мюнх выдвинул гипотезу, согласно которой по ситовидным трубкам из одного членика в другой, через поры, движется жидкость с растворенными веществами. Движущей силой атого потока является тургорное давление. Клетки, в которых образуются сахара (донор), характеризуются высоким тургорным давлением, а клетки, в которых сахара потребляются,— низким тургорным давлением (акцептор). Если эти клетки соединены между собой, то жидкость должна перетекать из клеток с высоким давлением в клетки с низким давлением. Все сказанное можно представить в виде схемы (рис. 49).
Гипотеза Мюнха в последнее время приобрела сторонников, однако она не согласуется с многими фактами. Далеко не всегда передвижение идет по градиенту тургорного давления (в сторону его уменьшения). Так, эта гипотева не позволяет объяснить интенсивную переброску ассимилятов из опадающих листьев или завядающих лепесткпи цветка, ноторые обладают, естественно, низким тургорным давлением.
Расчеты показывают, что двя передвижения раствора сахарозы с той скоростью, которая наблюдается в ситовидных трубках, нужна сила, значительно превосходящая силу тургорного давления, развиваемую в клетках-донорах.
Альтернативной гипотезой является гипотеза, согласно которой передвижение органических веществ идет по тяжам цитоплазмы с затратой анергии. По данным А. Л. Курсанова существует взаимосвязь между флоэмным транспортом и напряженностью энергетического обмена. Источником энергии для транспорта веществ может быть АТФ, образовавшаяся как в самих ситовидных элементах, так и главным образом в клетках-спутницах. Показано, что клетки-спутницы характеризуются исключительно высокой интенсивностью дыхания и окислительного фосфорилирования. Однако механизм актив-
извлекаемая
Рис. 43. Схема перетекания раствора под давлением (по Мюнху)'.
2 — соответствует ткааям листа; г—тканям, потребляющим ассимияя флоэма; t — ксилема.
ного транспорта веществ, проходящего с затратой энергии, еще ие ясен. Периодические сокращения белковых тяжей ситовидных трубок могут способствовать перемещению веществ в определенном направлении. Электронно-микроскопические исследования показали наличие белковых питей и в порах ситовидных пластинок. Возможно, что эти белковые тяжи способны к перистальтическим сокращениям, что и вызывает проталкивание ими раствора или особых гранул-носителей, па которых сконцентрированы ассимиляты. Конечно, ати перистальтические сокращения требуют затраты энергии.
В 4972 г. Д. Фенсом выдвинута гипотеза, что транспорт ассимилятов по флоэме осуществляется с помощью нескольких механизмов. Основное значение при этом придается тем механизмам, которые были рассмотрены, т. е. протеканию раствора под давлением и передвижению, связанному с перистальтическим сокращением белковых тяжей.
Важное значение для роста растительных организмов имеет направление движения ассимилятов. Оно во многом определяется интенсивностью использования веществ, потребностями того или иного органа, интенсивностью его роста. Большое значение в распределении питательных веществ в растении имеют фитогормоны. Транспорт питательных веществ идет в направлении к тем органам, которые характеризуются большим содержанием фитогормонов, в частности ауксинов. Обработка отдельных растений ауксином вызывает усиление притока к ним различных органических веществ. Влияние фитогормонов па передвижение ассимилятов связано с усилением напряженности аиергетического обмена (Н И. Якупхкина).
Направление передвижения ассимилятов несколько ограничено расположепием производящих их органов, а именно листьев. Показа-
не, что листья, расположенные по разные стероны стебля, а также различные по ярусу (верхние и нижние), снабжают продуктами фотосинтеза разные части и органы растения. Так, известно, что плоды томатов снабжаются асспмилятами, главным образом образовавшимися в листьях, расположенных в непосредственной блпаости от них.
Список рекомендуемой литературы
Афанасьеве М. В. Передвижение питательных веществ в растениях. Иад-во ЛГУ, 1955.
Курсапов А. Л. Транспорт ассимилятов в растспин. М., Наука, 1976.
Либберт Э. Физиология растений. М., Мир., 1976.
Глава V].
ДЫХАНИЕ РАСТЕНИЙ
Живая илетка представляет собой открытую энергетическую систему, она обменивается энергией с внешней средой и живет ва счет притока анергии извне. Клетка организма может сохранять свою индивидуальность лишь при притоке свободной энергии из окружающей среды. Клк только этот приток прекращается, наступает дезорганизация и смерть организма.
Энергия солнечного света, запасенная при фотосинтезе в органическом веществе, вновь высвобождается и используется на свмые различные процессы жизнедеятельности. Энергетический цикл жизни можно представить в виде схемы (рис. 50). Как видно, энергия квантов света, аккумулированная в углеводах, вновь высвобождается в процессе их распада (диссимиляции). В самой общей форме можно отметить, что все живые клетки получают энергию за счет ферментативных реакций, в коде которых электроны переходят с более высокого энергетического уровня па более низкий.
В природе существуют два основных процесса, в ходе которых энергия солнечного света, запасенная в органическом веществе, высвобождается — его дыхание и брожение. Дыхание — это аэробны! окислительный распад органических соединений па простые, неорга иические, сопровождаемый выделением энергии. Брожение — ато анаэробный процесс распада органических соединений на более простые, сопровождаемый выделением энергии. При брожении степень окислеяности соединений не меняется.
В случае дыхания акцептором электрона служит кислород, в случае брожения — органические соединения. Процессы, входящие в энергетический цикл, имеют настолько важное значение, что в настоящее время возпиила наука биоэнергетика, изучающая молекулярные и субмолекулярные основы трансформации энергии.
ОБЩИЕ ВОПРОСЫ ДЫХАТЕЛЬНОГО ОБМЕНА
Суммарное уравнение реакции дыхании:
С8НИО$+ 6О2 -* 6СОа -+- 6НйО-|- 2824 кДж
Не вся энергия, высвобождаемая при дыхании, может быть использована в процессах жизнедеятельности- Используется организмом в основном та энергия, которая аккумулируется в АТФ и идет
на процессы синтеза (бедка, нуклеиновых кислот и других важнейших органических соединений), процессы поступления и передвижения питательных веществ и воды, процессы движения, роста и развития организмов. Энергия, не накопленная в АТФ, также частично может быть использована организмом, однако ббльшая ее часть рассеивается в виде тепла и для растения является бесполезной. Выделение анергии в виде тепла приводит к уменьшению упорядоченности структур, т. е. к возрастанию энтропии.
1. ЗНАЧЕНИЕ ДЫХАНИЯ В ЖИЗНИ РАСТЕНИЯ
Дыхание — один из центральных процессов обмена веществ растительного организма.
Значение дыхания не ограничивается тем, что это процесс, поставляющий энергию. Дыхание, подобно фотосинтезу, сложный окислительно-восстановительный процесс, идущий через ряд этапов. На его промежуточных стадиях образуются органические соединения, которые затем используются в различных метаболических реакциях. К промежуточным соединениям относят органические кислоты и пентозы, образующиеся при разных путях дыхательного распада. Таким образом, процесс дыхания — важнейший источник многих метаболитов. Как видно из суммарного уравнения, в процессе дыхания образуется вода. Исследования показали, что эта вода в крайних условиях обезвоживания может быть использована растением и предохранить его от гибели. Благодаря всем этим особенностям дыхание — это центральный метаболический процесс, переплетающийся
многочисленными связями с другими процессами обмена. Процесс дыхания противоположен фотосинтезу. Если фотосинтез — синтетический процесс образования органического вещества, то дыхание — процесс распада, т. е. траты органического вещества. В некоторых случаях, когда эпергия дыхания выделяется в виде тепла, дыхание ведет к бесполезной потере сухого вещества. В этой связи к рассмотрению процесса дыхания надо подходить диалектически, помня, что не всегда усиление процесса дыхания является полезным для растительного организма.
1. АДЕНОЗИНТРИФОСФАТ, СТРУКТУРА И ФУНКЦИИ
Процессы обмана веществ включают в себя реакции, идущие с потреблением энергии, и реакции — с выделением энергии. В некоторых случаях эти реакции сопряжены. Одпако часто реакции, в которых энергия выделяется, отделены в пространстве и во времени от реакций, в которых она потребляется. В процессе эволюции у растительных и животных организмов выработалась возможность храпения энергии в форме соединений, обладающих богатыми энергией связями. Среди них центральное место занимает адепозиитрифосфат (АТФ). АТФ представляет собой тринуклеотидфосфат, состоящий из азотистого основания (аденина), пентозы (рибозы) и трех молекул фосфорной кислоты. Две концевые молекулы фосфорной кислоты образуют макрозргичеслие связи. В клетке АТФ содержится главным образом в виде комплекса с ионами магния.
Аденозинтрнфосфат образуется в процессе дыхания из аденозиндифосфата и остатка неорганической фосфорной кислоты (Фн) с использованием анергии, освобождающейся при окислении различных органических веществ: АДФ+Фн—^-АТФ+НзО.
В 1939—1940 гг. Ф. Липман установил, что АТФ служит главным переносчиком энергии в клетке. Особые свойства этого вещества определяются тем, что конечная фосфатнвя группа легко переносится с АТФ иа другие соединения или отщепляется с выделением энергии, которая может быть использована на физиологические функции. Эта энергии представляет собой разность между свободной энергией АТФ и свободной энергией образующихся продуктов (AG). AG — это изменение свободпой энергии системы или количество избыто» ной энергии, которая освобождается при реорганизации химически связей. Распад АТФ происходят по уравнению АТФ+НдО-—>-АДФ-+Фн, при этом происходит как бы разрядка аккумулятора, пр pH 7 выделяется 30,6 кДж. Этот процесс катализируется ферментом аденозинтрифосфатазой.
Равновесие гидролиза АТФ смещено в сторону завершения реакции, что и обусловливает большую отрицательную величину свободпой энергии гидролиза. Это связано с тем, что при диссоциации четырех гидроксильных группировок, при pH 7, АТФ имеет около четырех отрицательных зарядов (рис. 51). Близкое расположение зарядов друг к другу способствует их отталкиванию, и, следовательно, отщеплению фосфатных группировок. В результате гидролиза
Рис. 51. Структура АТФ.
образуются соединения с одноименным зарядом (АДФ 3 и НРО<2 ), которые отталкиваются друг от друга, что препятствует их соединению.
Уникальные свойства АТФ объясняются не только тем, что при ее гидролизе выделяется большое количество анергии, по и тем, что АТФ занимает промежуточное положение по величине сзободпой энергии гидролиза — 30,6 кДж/моль. Благодаря этому АТФ может служить переносчиком фосфатных групп от фосфорных соединений с болве высокой энергией гидролиза, например фосфоеполпируват (53,6 кДж/моль), к соединениям с более низкой энергией гидролиза, например сахарофосфатам (13,8 кДж/моль). Таким образом система АТФ—АДФ является как бы промежуточной или сопрягающей.
J. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ.
РАБОТЫ А. Н. БАХА И В. И. ПАЛЛАДИНА
С химической точки зрения дыхапие — это медленное окисление. Прн окислительно-восстановительных реакциях происходят перепое водорода или электрона от донора ДНа (который окисляется) к акцептору А (который восстанавливается): ДНг+А—>-Д+АН2. Для того чтобы судить о направлении движения электронов между какими-либо двумя веществами, вводится понятие стандартного восстановительного потенциала (Eq) —это мера электронного давления. За нуль потенциала условно принят восстановительный потенциал реакции Н5—>-2Н++2ё. Чем более отрицательна величина восстановительного потенциала, тем больше способность данного вещества отдавать электроны (окисляться) или служить восстановителем. Наоборот, чем положительнее величина восстановительного потенциала
данного вещества, тем больше его способность воспринимать электроны (восстанавливаться или служить окислителем). Восстановительный потенциал кислорода равен 4-0,81В.
В создании современных представлений о биологическом окислении большое значение имели работы двух крупнейших русских ученых — В. И. Палладина и А. И. Баха.
В. И. Палладии первый стал рассматривать дыхание как ряд ферментативных реакций. Основное значение в процессе окисления оп придавал процессу отнятия водорода от субстрата.
Работы А. Н. Баха были посвящены возможности активации кислорода воздуха. Молекулярный кислород — достаточно инертное соединение. Бах выдвинул предположение, что имеются фермепты-оксидазы, активирующие кислород. Он считал, что ироцесс активации состоит в том, что происходит образование пероксидных соединений.
В настоящее время показано, что в процессе дыхания активируется как водород субстрата, так и кислород воздуха.
4. СУБСТРАТЫ ДЫХАНИЯ
Вопрос о веществах, используемых в процессе дыхания, издавна еапиман физиологов. Еще в работах И. И. Бородина было показано, что интенсивность процесса дыхания прямо пропорциональна содержанию в тканях растений углеводов. Это дало основание предположить, что именно углеводы являются основным веществом, потребляемым при дыхании. В выяснении данного вопроса большое значение имеет определение дыхательного коэффициента. Дыхательный коэффициент — это объемное или молярное отношение СОл выделившегося в процессе дыхания, к поглощенному за этот же промежуток времени Од. При нормальном доступе кислорода величина дыхательного коэффициента зависит от субстрата дыхания. Если в процессе дыхания используются углеводы, то процесс идет согласно уравнению СвН^Об+бО^бСОя+бНгО, в этом случае дыхательный
6СО, . п
коэффициент равен единице -g^-===l. Однако, если разложению в процессе дыхания подвергаются более окисленные соединения, например органические кислоты, поглощение кислорода уменьшается, дыхательный коэффициент становится больше единицы. При окислении в процессе дыхания более восстановленных соединений, таких, как жиры или белки, требуется больше кислорода и дыхательный коэффициент становится меньше единицы.
Определение дыхательных коэффициентов разных тканей растений показывает, что в нормальных условиях он близок к единице Это дает основание считать, что в первую очередь растение использует в качестве дыхательного материала углеводы. При недостатке углеводов могут быть использованы и другие субстраты. Особенно это проявляется на проростках, развивающихся из семян, в которых в качестве запасного питательного вещества содержатся жиры или белки. В этом случав дыхательный коэффициент становится меньше
единицы. При использовании в качестве дыхательного материала жиров происходит их расщепление до глицерина и жирных кислот. Жирные кислоты могут быть превращены в углеводы через глнокси-латный цикл. Использованию белков в качестве субстрата дыха пня предшествует их расщепление до аминокислот.
ПУТИ ДЫХАТЕЛЬНОГО ОБМЕНА
Существуют две основные системы и два основных пути превращения дыхательного субстрата, или окислеяня углеводов: 1) гликолиз +цикл Кребса (дихотомический), 2) нептозсфосфатпый (апото-мический). Относительная роль этих путей дыхания может меняться в зависимости от типа растений, возраста, фазы развития, а также в зависимости от условий внешней среды. Процесс дыхания растений осуществляется во всех внешних условиях, в которых возможна жизнь. Растительный организм не имеет приспособлений к регуляции температуры, поэтому процесс дыхания осуществляется при температуре от —50 до +50°С. Нет приспособлений у растений и к поддержанию равномерного распределения кислорода по всем тканям. Именно необходимость осуществления процесса дыхания в разнообразных условиях привела к выработке в процессе эволюции разнообразных путей дыхательного обмена и к еще большему разнообразию ферментных слстем, осуществляющих отдельные этапы дыхания. При этом: важпо отметить взаимосвязь всех процессов обмена в растительном организме. Изменение пути дыхательного обмана приводит к глубоким изменениям во всем метаболизме растительных организмов.
1. ГЛИКОЛИЗ 4- ЦИКЛ КРЕБСА
Данный путь дыхательного обмена является наиболее распространенным и, в свою очередь, состоит из двух фаз. Первая фаза — анаэробная (гликолиз) и вторая фаза — авробная.
Анаэробная фаза дыхания (гликолиз)
В процессе гликолиза происходит преобразование молекулы гексозы до двух молекул пировиноградной кислоты CeHisOe—>2СзН1О2+ 4-2Ца. Этот окислительный процесс протекает в анаэробных условиях (в отсутствии кислорода) и идет через ряд этапов. Прежде всего, для того чтобы подвергнуться дыхательному распаду, глюкоза должна быть активирована. Активация глюкозы происходит путем фосфорилирования шестого углеродного атома за счет взаимодействия с АТФ. Реакция идет в присутствии исков магния и фермента гексо-киназы:
глюкозаАТФ глюкоэо-6-фосфат + АДФ
*®В
Затем глюкозо-6-фосфат изомеризуется до фруктозо-6-фосфата. Процесс катализируется ферментом фосфоглюкоизомеразой: глюноао-бфосфат фруктозо-€-фосфат
Далее происходит еще одно фосфорилирование при участии АТФ. Фосфорная кислота присоединяется к первому углеродному атому молекулы фруктозы, процесс катализируется ферментом фосфофруктокиназой:
фруктозо-бфосфат 4- АТФ фруктозо-1,6-дифосфат 4- АДФ
Дальнейшие реакции, составляющие процесс гликолиза, складываются следующим образом: фруктозо-1,6-дифосфет расщепляется с образованием двух трноз, реакция катализируется ферментом альдолазой, которая состоит из четырех субъединиц и содержит свободные SH-группы. Реакция протекает по уравнению
СНгО(Р) I с=о
I но—С—н н—с-он
I н—с—он
I
СН20(Р)
СН2О(Р)
I
С-0
сн2он
фОСфОДИОКОИ-ацетои
СНО I + н—С-он
СН2О(Р)
вый альдегид
фруктозо-1.б-дифосфат
Молекула фосфодиоксиацетопа при участия фермента триозофос-фетизомеразы превращается также в 3-фосфоглицериповый альдегид (ФГА). Дальнейшим превращениям подвергается именно ФГА, который окисляется до 1,3-дифосфоглицериновой кислоты (ДФГК). Эго важнейший етап гликолиза. Сущность его заключается в окислении альдегидной группы в карбоксильную. Окисление идет с выделением энергии- Сопряженно с этим идет образование 1,3-дифосфоглицери-повой кислоты (процесс, требующий затраты энергии). Таким образом за счет энергии окисления при участии неорганического фосфата (Н3РО4) образуется макроэргическая фосфатная связь. Одновременно происходит восстановление кофермента НАД. Реакция катализируется ферментом глицералъдегид-З-фосфатдегидрогеназой. Молекула зтого фермента состоит из четырех идентичных субъединиц. Каждая субъединица представляет одиночную иолипептидную цепь приблизительно не 220 аминокислотных остатков. Фермент содержит SH-группы, которые играют важную роль в окислении ФГА. Кофермент НАД взаимосвязан с ферментом на всем протяжении процесса.
В целом реакции выглядят следующим образом;
0=С—н о
I II
Н—С—ОН + H-S-фермент-НАДС ~8-ферменг-НАД-Нч-Н+
I I
СН2О(Р) Н—С^ОН
З-фосфоглпдериновый
альдегид СНЁО(Р)
ацилмерналтановыВ комплекс
О
II
С~8-фермент.НАД-Н+ Н*
Н—А—ОН + Н3РО<
I
СН2О(Р) ацклмеркалтаиовый комплекс
О
II
с—О~(Р)
н—(Loh + HS-фермент-НАд-Нч- Н+
СН2О(Р)
1,3-дифосфоглмдериновая кислота
На следующем этапе за счет имеющейся макроэрптческой свяви в 1,3-дифосфоглицериновой кислоте образуется АТФ. Процесс катализируется ферментом фосфоыицераткиназой-.
О
II
с—О~(Р) соон
Н—А—ОН + АДФ -> Н—С—ОН + АТФ
СН2О(Р) СН20(Р)
l.S-пифосфсглицерк- 3-фосфоглицсриновая
новая кислота кислота (ФГК)
Таким образом, на этом этапе анергия окисления аккумулируется в форме энергии фосфатной связи АТФ. Затем 3-ФГК превращается в 3-ФГК, иначе говоря, фосфатная группа переносится пз положения 3 в положение 2. Реакция катализируется ферментом фосфогли-церсмутазой и идет в присутствии магния:
С0ОН СООН
Н—А—ОН Н—А—О(Р)
Ан2О(Р) Ан2он
Далее происходит дегидратация ФГК. Реакция идет при участии фермента енолазы в присутствии иопов Mg2* или Мп2+. Дегидратация сопровождается перераспределением энергии внутри молекулы', в результате чего возникает ыакроэргическая связь. Образуется фос-фоенолпировиноградная кислота (ФЕП) :
СООН СООН
I I
И—С-О(Р) С-0 ~ (Р) + Н2О
I 11
СН20Н СНа
Затем фермент пирувагкиназа переносит фосфатную группу па АДФ, при этом образуется пировиноградная кислота. Для протекания реакции необходимо присутствие ионов Mg2"1" или Мп2+:
СООН СООН
I I
С—О ~ (Р) + АДФ С=О + АТФ
Ан2 Ана
фЕП пировиноград-
ная кислота
Напишем суммарное уравнение гликолиза:
глюкоза 4- 2 АТФ + 2НАД* -J- 2Ф„ + 4 АДФ ->
2 пирувата + 4 АТФ + 2 НАД • Н2
Таким образом, в результате процесса гликолиза образуются четыре молекулы АТФ,- однако две из них покрывают расход па первоначальное активирование субстрата. Следовательно, накапливаются две молекулы АТФ. Кроме того, образуются 2 11АД-В& и две молекулы пировиноградной кислоты. Таков итог процесса гликолиза. Если считать, что при распаде АТФ на АДФ и Фн выделяется 30,6 кДж, то за период гликолиза накапливается в макроэргических фосфатных связях всего 61,2 кДж. Прямые определения показывают, что -распад молекулы глюкозы до пировиноградной кислоты сопровождается выделением 586,6 кДж. Следовательно, энергетическая эффективность гликолиза сравнительно невелика.
Аэробная фаза дыхания
Вторая фаза дыхания — аэробная — требует присутствия кислорода. В аэробную фазу дыхания вступает пировиноградная кислота. Общее уравнение этого процесса следующее:
сна
Ао + 2,5О8 + ЗН2О ЗСОс + 5Н2О
I
СООН
Процесс можно разделить из три основные стадии: 1) окислительное декарбоксилирование пировиноградной кислоты; 2) цикл трикарбоновых кислот (цикл Кребса). Стадия может идти в бескислородной среде; 3) заключительная стадия окисления — электровно-транспорт-ная цепь (ЭТЦ).
Первая стадия — окислительное декарбоксилирование пировиноградной кислоты. Общая формула данного процесса следующая;
СН3
СО + НАД* + КоА—SH СН3СО—S—КоА +
I СООН
+ И АД - И + Н+ + СОг
Процесс этот состоит из ряда реакций и катализируется слож-гой мультнферментной системой пируватдегидрогеназой. Пируватдегидрогеназа включает в себя три фермента и пять коферментов /гиаминпирофосфат, липоевая кислота, коэнзим A (KoA-SH). ФАД и НАД. Вся эта система имеет молекулярную массу 4,ОХ10Б. В ре-вультате этого процесса образуется активный ацетат — ацетилкоэн-зим А (ацетил-КоА), восстановленный НАД (НАД-Н+ГГ'), и выделяется углекислота (первая молекула). Восстановленный НАД поступает в цепь переноса электронов, а ацетил-КоА вступает в цикл трикарбоповых кислот. Важно отметить, что плруватдегидрогепазпая система ингибируется АТФ. При накоплении АТФ выше определенного уровня превращение ппровппоградпой кислоты подавляется. Это один па способов регуляции интенсивности протекания аэробной фазы.
Вторая стадия — цикл трнкарбоновых кислот (цикл Кребса). В 1935 г. венгерский ученый А. Сент Дьердьи установил, что добавление небольших количеств органических кислот (фумаровой, яб-ночной или янтарной) усиливает поглощение кислорода измельченными тканями. Продолжая эти исследования, Г. Кребс пришел к выводу, что главным путем окисления углеводов являются циклические реакции, в которых происходит постепенное преобразование ряда органических кислот. Эти преобразования и были названы циклом трикарбоновых кислот или циклом Кребса.
Общая схема цикла представлена на рисунке 52. В цикл вступает активный ацетат, пли ацетил-КоА. Сущность реакций, входящих в цикл, состоит в том, что ацетил-КоА конденсируется с щавелевоук-сусной кислотой (ЩУК). Далее превращение идет через ряд ди- и триларбоновых органических кислот. В результате ЩУК регенерирует в прежнем виде. В процессе цикла присоединяются три молекулы НаО, выделяются две молекулы СО^щ четыре пары водорода, которые восстанавливают соответствующие коферменты (ФАД и НАД).
Суммарная реакция цикла выражена уравнением
CH3CO=S—КоА + ЗНаО 2СО2 + 4Н2 + HS-KoA.
СН3СОСООН Пировиноградная кислота
Сукцйнил-КоА
Рас. 52. Цикл трикарбоновых кислот (цикл Кребса).
Отдельные реакции протекают следующим образом. Ацетил-КоА, конденсируясь с ЩУК, дает лимонную кислоту, при этом КоА выделяется в прежнем виде. Этот процесс катализируется ферментом цитратсинтетазой. Лимонная кислота превращается в изолимонную. На следующем этапе происходит окисление изолимонпой кислоты, реакция катализируется ферментом изоцитратдевидрогеназой. При этом водород переносится на НАД (образуется НАД-Ня). Для протекания этой реакции требуются ионы магния или марганца. Одновременно происходит процесс декарбоксилирования. За счет одного из атомов углерода, вступившего в цикл Кребса, первая молекула СОа. выделяется. Образовавшаяся кетоглутаровая кислота подвергается окислительному декарбоксилированию подобно тому, которое разбиралось по отношению к пировиноградной кислоте. Этот процесс также катализируется мультиферментом кетоглутаратдегидрогена-вой, содержащей тиамппггпрофосфат, липоевую кислоту, коэнзим А, ТАД и НАД. В результате за счет второго атома углерода, вступившего в цикл, выделяется вторая молекула СОа- Одновременно происходит восстаповлеиие еще одной молекулы НАД до НАД-На и образуется сукцинил-КоА. На следующем етане сукцинил-КоА расщепляется на янтарную кислоту (сукцинат) и HS-KoA. Выделяющаяся при этом энергия накапливается в макроэргической фосфатной связи АТФ. Этот этап важен, так как выделяющаяся энергия непосредственно накапливается в АТФ. Такой тип образования АТФ называют субстратным фосфорилированием. Образовавшаяся яптарпая кислота окисляется до фумаровой кислоты. Реакция катализируется ферментом сукцинатдегидрогеназой, простатической группой которого является ФАД. Одновременно выделяется третья пара водородов, образуя ФАД-Ня. На следующем этапе фумаровая кислота, присоединяя молекулу воды, превращается в яблочную кислоту. На последнем этапе цикла яблочная нислота окисляется до ЩУК. Эту реакцию катализирует фермент малатдегидрогеназа, активной группой которого является ЦАД, и происходит выделение четвертой пары атомов водорода — образуется НАД-Нц- Таким образом ЩУК регенерирует в прежнем виде и может реагировать со следующей молекулой активного ацетата, поэтому практически ЩУК в процессе цикла не расходуется. Одновременно в ходе каждого цикла выделяются две молекулы СОг п образуются три молекулы НАД-Н+Н* а молекула ФАД-Ня. Многие реакции цикла Кребса обратимы, и самое главное, что образовавшиеся в рассмотренных реакциях органические кислоты могут служить материалом для построения аминокислот, белков, жиров и углеводов и поэтому выводятся из цикла. Вместе с тем соединения, входящие в цикл, могут образовываться в ряде других реакций (например, при декарбоксилировании аминокислот) и вступать в цикл. Таким образом, рассмотренные превращения пе отделены от других реакций метаболизма, а тесно с ними взаимосвязаны. Для реакций цикла Кребса кислород не требуется. Кислород необходим для регенерации или окисления восстановленных коферментов (НАД-На и ФАД-Нг). Количество окисленных форм этих коферментов ограничено. В анаэробных условиях, когда регенерация кофер-
Нинотииамид
Никотинамидадениндинунлеотйд
(НАД) НАД.НЯ
Рис. 53. Окисленная и восстановленная форма пикотипамидадевивдинуклео-тида (НАД).
мептов невозможна, они быстро оказываются исчерпанными, и весь процесс прекращается. Окисление коферментов осуществляется в дыхательной цепи или цепи переноса водорода и електронов. Конечным акцептором в этой цепи является кислород воздуха. Энергия, высвобождаемая при окислении коферментов, накапливается в мак-розргических фосфатных связях АТФ.
Третья стадия — электронно-транспортная цепь (ЭТЦ). В процессе окисления пировиноградной кислоты в цикле Кребса образовались пары водорода 2Н, которые мы можем рассматривать как 2Н++2ё. Именно в таком виде они и передаются по цепи переносчиков. Движущей силой транспорта водорода в дыхательной цепи является разность потенциалов. В связи с'этим расположение отдельных переносчиков в дыхательной цепи, так же как и в цепп фотосинтетической, определяется величиной кх окислительно-восстановительного потенциала (О/В). В начале цепи расположен НАД, обладающий наибольшей отрицательной величиной О/В потенциала (—0,32 В), а в конце — кислород с наиболее положительной вепичипой (+0,82 В). Остальные переносчики расположены между ними в порядке последовательного повышения положительного потенциала. Это и позволяет электронам передвигаться по направлению к кислороду (наивысший положительный потенциал). В процессе переноса электронов и водорода важную роль играют ферменты, относящиеся к классу оксидоредуктаз. Оксидоредуктазы делятся па три главных подкласса.
Пиридиновые дегидрогеназы, у которых коферментом служит НАД пли НАДФ, отнимают два атома водорода от субстрета. При этом к коферментам присоединяется один водород и одпп электрон , (рис. 53). Коферменты НАД и НАДФ связаны с ферментом с помощью иопов металла и сульфгидрильных группировок. В зависимости от белкового носителя, к которому присоединен кофермент
(НАД или НАДФ), различают более 150 пиридиновых дегидрогеназ. Каждая из вих специфична по отношению к определенному субстрату. Необходимо учитывать, что НАД и НАДФ могут воспринимать водород и электроны лишь в том спучае, если субстрат имеет более отрицательное значение потенциала по сравнению с ними.
Флавиновые дегидрогеназы. Это также большая группа ферментов, катализирующая отнятие 2Н от различных субстратов. Просте-тической группой этих ферментов служат производные витамина Вз (рибофлавина) — флавинадепипдипуклеотид (ФАД) и флавинмононуклеотид (ФМН). Активной частью флавиновых дегидрогеназ служит изоаллоксазиновое кольцо (рис. 54). Простатическая группа у
Рис. 54. А —структурные формулы флавиновых нуклеотидов: ФМН (в рамке) а ФАД (вся формула); Б—восстановление и дегидрирование флавиновых нуклеотидов.
флавиновых дегидрогеназ прочно прикреплена к белковому носителю. Специфичность и в этом случае определяется белковой частью фермента.
Цитохромы. Простетическая группа цитохромов представлена железопорфиринами. Железопорфириновая труппа (гем) в цитохромах прочно связана с белком через атомы серы аминокислоты цистеина.
Известно около 20 цитохромов, которые делятся на четыре главных класса: а, Ь, с, d, отличающихся между собой природой простатической группы. Цитохромы а содержат железоформилпорфирины, цитохромы Ъ — железопротопорфирппы, цитохромы d — железогид-ропорфприпы. В каждую труппу цитохромов входит по нескольку различающихся между собой ферментов.
Роль цитохромов заключается в переносе электрона от флавиновых дегидрогеназ к кислороду воздуха. Одпако непосредственно с кислородом воздуха может реагировать только цитохроноксидаза, которая, кроме железа, содержит атомы меди.
Помимо перечисленных ферментов, в переносе электронов по дыхательной цепи принимает участие так называемый кофермент Q (убихипоп). Это производпое бепзохипона.
Путь переноса водорода и электрона представлен на схеме (рис. 55). Водород от НАД переносится па флавиновую дегидрогеназу и далее па кофермент Q. При этом НАД остается в окисленной форме и может воспринимать следующую пару водородов. В дальнейшем идет перепое электродов, а водороды в виде Н+ выбрасываются на наружную сторону мембраны, Присоединяя электрод, железо цитохрома переходит из окисленной формы (Fes+) в восстановленную (Fe2+). Переходя от одного цитохрома к другому, анектроны попеременно осуществляют окислптельпо-восстаповительпые превращения. На внутренней сторопе мембраны два электрона присоединяются к кислороду. Одновременно па наружной стороне мембраны накапливаются два Н+. Кислород (О 2) взаимодействует с водородом воды, находящимся внутри митохондриального пространства (0,5 О2'’2+2Н+). При переносе электронов свободная энергия системы постепенно уменьшается. Общео изменение энергии кри переносе пары водородов и пары электронов от НАД на кислород можно рассчитывать по формуле t\Gt)=nFЪ.Ео‘, Д<?о=2x96 633,97 ДжХ1»14= 220,8 кДж, п — число электроков =2, F — ферада=96 633,97 Дрк, ЕЕо — разность потенциалов между участком цепи от —0,32 до +0,82=1,14, ACq — стандартное изменение свободной энергии. Таким образом, изыепеппе свободной энергии системы составляет около 220,8 кДж.
Окислительное фосфорилирование. В 1939—1940 гт. советский биохимик В- А. Белицер указал, что выделяющаяся в процессе передачи по дыхательной цепи елсктропов энергия частично накапливается в АТФ. Накопление энергии окисления в АТФ при продвижении электрона по цепи переносчиков называют окислительным фосфорилированием. Свободная анергия гидролиза АТФ равна 30,6 кДж. Исходя из того, что уменьшение св ободной энергии системы
Ряс. 55. А — электронно-транспортпая цепь; Б — скислителъно-восстаповитель-ные потенциалы переносчиков ЭТИ
при переносе пары электронов с НАД на кислород составляет 220,8 кДж, можно было предположить возможность образования из АДФ+Фн семи молекул АТФ. Однако оказалось, что при переносе пары водородов и пары электронов образуется всего три молекулы АТФ. Были установлены и места в электронно-транспортной цепи, где образуется АТФ. Так, первая молекула АТФ образуется при перепоев пары водородов от пиридиновой к флавиновой дегидрогеназе. Вторая — при переносе пары електронов от цитохрома Ъ к цитохрому с, и третья — при переносе электронов от цитохрома а к цитохромо-ксидазе. Места образования АТФ в дыхательной цепи пе являются случайными. Именно на этих участках выделяется достаточное для образования молекул АТФ количество энергии. Таким образом про-
цесо окисления сопряжен с процессом фосфорилирования. Это и есть окислительное фосфорилирование. Степень сопряженности окисления и фосфорилирования может быть разной в зависимости от условий и от состояния клеток. Показателем сопряженности окисления и фосфорилирования служит коэффициент фосфорилирования Р/0. Это отношение связанного неорганического фосфора (АДФ+Фц—->-АТФ) к поглощенному в процессе дыхания кислороду. Перепое двух электронов к кислороду по дыхательной цепи сопровождается тремя фос-форилированиями. Следовательно, в этом случае коэффициент Р/О= =3. Существуют вещества, разобщающие процесс окисления и фосфорилирования. К таким разобщителям относится, например, динитрофенол. При его добавлении процесс окисления даже усиливается, количество выделенной углекислоты и поглощенного кислорода возрастает, однако фосфорилирование не идет. Вся энергия выделяется в виде тепла. Коэффициент P/О падает до 0- Ка величину P/О оказывают влияние внешние условия. При засухе дыхание усиливается, а накопления энергии в виде АТФ не происходит, коэффициент Р/О резко падает. Коэффициент фосфорилирования резко падает при заболевании организмов.
Механизм образования АТФ в процессе окислительного фосфорилирования до настоящего времени пе может считаться выясненным. Так же как и для фотофосфорилирования, наибольшее признание в последнее время получили хемио-осмотическая теория английского биохимика П. Митчелла. Переносчики дыхательной цепи сосредоточены в мембране митохондрий. При этом они как бы вплетены в митохондриальную мембрану и составляют дыхательные ансамбли. Дегидрогеназы НАД, ФАД присоединяют к себе водород, извлекая его из субстратов, образовавшихся в результате реакции цикла Кребса. При переходе на цитохромную систему осуществляется перенос электронов. При этом ион водорода (Н+) выбрасывается из внутри-митохондриального пространства паружу, благодаря этому создается градиент попов водорода — градиент pH. Мембрана оказывается поляризованной. С наружной стороны мембраны накапливаются воны Н+, а с внутренней — ионы ОН- (рис. 56). Возникающий электрохимический мембранный потенциал является движущей силой для синтеза АТФ. Синтез АТФ катализируется локализованной в мембране АТФ-азой. Согласно закону действии масс, ири удалении воды, реакция образования АТФ протекает с высокой скоростью (АТФ + 4-Фи-—*-АТФ+НОН). Митчелл предполагает, что в силу градиента pH ионы OIT* воды попадают в наружное пространство, а попы Н+ — во внутреннее. Это способствует непрерывному удалению воды и образованию АТФ. При переяосо пары электронов во внешнее пространство выбрасывается шесть ионов водорода, что и приводит к образованию трех молекул АТФ.
Наряду с фосфорилирующим существует окисление, не сопровождаемое фосфорилированием (В. П. Скулачев). Энергия этого окисления не накапливается в АТФ. Однако она может быть в определенных условиях использована на процессы транспорта ионов. Так ряд двухвалентных катнопов может с высокой скоростью транспортиро-8—773 209
Мембрана
Ряс, 5в. Схема образования АТФ согласно хемиосмотической теории Митчелла.
ваться против градиента концентрации внутрь митохондрий. Это происходит благодаря тому, что внутренняя сторона мембраны оказывается варяжена отрицательно, возникает трансмембранный потенциал. Катионы в силу электрического притяжения поступают и накапливаются во внутреннем пространстве митохондрий. Таким образом, анергия дыхания превращается в алектрическую и используется на осмотическую работу. В этом случае можно говорить о сопряжением нефосфорилирующем окислении.
Энергетический баланс процесса дыхания
Подведем итоги энергетики процесса дыхания. Подсчитаем, сколько всего молекул АТФ образуется при распаде одной молекулы глюкозы. В первую анаэробную фазу дыхапия при распаде молекулы глюкозы до двух молекул пировиноградной кислоты накапливаются две молекулы АТФ. Одновременно на этой фазе дыхания при окислении ФГА до ФГК образуются две молекулы восстановленных коферментов (2 ПАД-На). Они вступают в дыхательную цепь, что приводит к образованию еще шести молекул АТФ. В аэробной фазе дыхания при окислении пировиноградной кислоты образуются 4НАД-Нг. Их окисление в дыхательной цепи приводит к образованию 12 АТФ. Кроме того, в цикле Кребса восстанавливается одна молекула флавиповой дегидрогеназы — ФАД-Нг. Окисление этого соединения в дыхательной цепи приводит к образованию 2 АТФ. Одно фосфорилирование между НАД и ФАД пе происходит. При окислении молекулы а-кетоглутаровой кислоты до янтарной энергия непосредственно накапливается в одной молекуле АТФ (субстратное фосфорилирование). Таким образом, окисление одной молекулы пировиноградной кислоты до ССЪ и НаО сопровождается образованием пятнадцати молекул АТФ. Однако при распаде молекулы глюкозы образовались две молекулы пировиноградной кислоты. Следовательно, всего в аэробной фазе дыхапия образуется 30 молекул АТФ+2 АТФ в анаэробной фазе и +6 АТФ в результате окисления НАД-Нг, образовавшегося также в анаэробной фазе дыхапия. Итого 38 молекул АТФ образуется в процессе окислительного распада молекулы гексозы. На образование этих 38 молекул затрачено 38X30,6 кДж=1162,8 кДж. Всего в процессе распада глюкозы выделяется 2824 кДж:
СвН,20в + 6О2 6СО2 4- 6Н2О + 2824 кДж
Таким образом КПД процесса дыхания при самых благоприятных условиях составляет около 40%.
Подводя итоги, можно сказать, что биологическое окисление — это многоступенчатый ферментативный процесс, сопровождаемый выделением энергии.
Химизм процесса брожения
Брожение — это внутренний окислительно-восстановительный процесс, при котором акцептором электронов служит органическая молекула и при котором суммарная степень окисления образующихся продуктов пе отличается от степени окисления сбраживаемого вещества.
С. П. Костылев выдвинул положение о генетической связи процессов брожения и дыхания. При этом он опирался на следующие факты: 1. У высших растений был найден весь набор ферментов, который катализирует отдельные этапы процесса брожения. 2. При
8’
211
временном попадании в условия анаэробиоза высшие растепия определенное время существуют за счет энергии, выделяющейся в процессе брожения. Правда, поскольку процесс брожения энергетически значительно менее эффективен, в анаэробных условиях рост растений приостанавливается. Кроме того, продукты брожения, в частности спирт, ядовиты, и их накопление приводит к гибели растения. 3. При добавлении к клеткам факультативных анаэробов (дрожжи) полусброженных сахаров интенсивность дыхания у них резко возрастает, следовательно, полусброженные продукты являются лучшим субстратом дыхания по сравнению с неизмененными сахарами.
В настоящее время общепризпано, что первые этапы (гликолиз) протекают одинаково при процессах как дыхания, так и брожения. Поворотным моментом является образование пировиноградной кислоты. В аэробных условиях пировиноградная кислота распадается до СОа и воды (дыхание), тогда как в анаэробных она преобразуется в различные органические соединения (броженпе). Организм обладает способностью при изменении условий переключать процессы, прекращая брожение и усиливая дыхание и наоборот. Впервые в опытах Пастера было показано, что в присутствии кислорода процесс брожения у дрожжей тормозится и заменяется процессом дыхания. Одновременно резко сокращается распад глюкозы. Это явление оказалось характерным для всех факультативных анаэробных организмов, включая и высшие растения, и получило название эффекта Пастера. Сокращение расхода глюкозы в присутствии кислорода целесообразно, поскольку при дыхательном распаде выход энергии значительно выше, а следовательно, глюкоза используется более экономно. Однако осуществление разбираемого эффекта требует специальных механизмов, которые будут рассмотрены далее.
В зависимости от получаемого продукта различают разные типы брожения. При спиртовом брожении пировиноградная кислота, образовавшаяся в процессе гликолива, декарбоксилируется с образованием уксусного альдегида при участии фермента карбоксилазы, а ва-тем восстанавливается до этилового спирта ферментом алкогольдегидрогеназой:
СН8 ^0
СО -»-СН3С^ + С02; СН3С^
X ХН • ХН
СООН
СН3СН20Н -р.НАД*
Ни та, ии другая реакция не. сопровождается образованием АТФ. В сеязи с етим выход АТФ при спиртовом брожении такой же, как при гликолизе (первой фазы брожения и дыхания), и составляет две молекулы при распаде 1 моль глюкозы. Восстановленные никотинамидные коферменты (НАД-Иг), образовавшиеся в процессе глико-
виза, пе поступают в дыхательную цепь (у анаэробных организмов ее и нет), а используются для восстановления уксусного альдегида до спирта. Следовательно, энергетический выход процессов брожения крайне пиаок. Процесс брожения служит источником энергии для облигатных (обязательных) или факультативных анаэробных организмов.
Разные микроорганизмы осуществляют и разные типы брожения. Так, молочнокислые бактерии накапливают молочную кислоту. При втом пировиноградная кислота восстанавливается до молочпой кислоты. Для некоторых облигатных анаэробных микроорганизмов, например авотфиксирующей бактерии Clostridium paaleurianum, характерно образование в процессе брожения масляной кислоты.
Глиоксилатный цикл
В растительном организме существует большое разнообразие путей дыхательного обмвиа, проявляющихся в разных условиях среды. Так, в некоторых случаях цикл Кребса заменяется глиоксилат-иым циклом. При атом первые етапы превращений до образования изолпмонной кислоты идут тем же путем. Затем ход раакций меняется под влиянием фермента изоцитразы, происходит расщепление изолпмонной кислоты па янтарную и глиоксиловую:
СООН—СНОН—сн—соон-сн£—соон -> июяямонная пиелита
соон— сн2—сн2—соон + СНО—соон янтарная глиоксилевая
кислота кислота
Янтарная инслота выходит из цикла, а глиоксилевая кислота соединяется с ацетил-КоА и образует яблочную кислоту. Ацетил-КоА образуется при окислении жирных кислот. Яблочная кислота, в свою очередь, окисляется до щавелевоуксуспой иислоты, что и вавершает цикл (рис. 57).
При окислении яблочной кислоты одпа пара атомов водорода присоединяется к НАД и вступает в дыхательную цепь. Таким образом, в результате тлиоксилатного цикла образуются три молекулы АТФ и одпа молекула янтарной кислоты. Янтарная кислота служит материалом для образования различных органических веществ. Например, она может превращаться в пировиноградную киспоту, далее в углеводы. Особенное значение глиоксилатный цикл имеет в процессе превращения жиров в сахара. Ферменты, участвующие в реакциях этого цикла, всегда присутствуют в семенах растений, богатых жирами (клещевина, подсолнечник и др.). В »том случае жирные кислоты служат источником ацетил-КоА. Значение разбираемого цикла связано также с тем, что глиоксилевая кислота может служить
Рис. 57. Глиоксилатный цикл
материалом для образования порфиринов, а следовательно, и хлорофилла (чераз реакции гликолиза, идущие в обратном направлении). Необходимо также отметить, что глиоксилатный цикл осуществляется в особых органеллах — глиоксисомах.
J. ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ДЫХАТЕЛЬНОГО ОБМЕНА
Наряду с разложением глюкозы в процессе гликолиза существует другой пе менее распространенный путь — пентозофосфатный, или апотомический. В этом случае глюкоза также подвергается первоначальному фосфорилированию с образованием глюкозо-6-фосфата, затем пути расходятся. Монофосфорный эфир глюкозы подвергнется окислению при участии фермента глюкозо-6-фосфатдеги.дрогеназы. Коферментом является НАДФ, при этом образуется фосфоглюкопо-вая кислота. Процесс происходит следующим образом:
СНО СООН
неон hLoh
HOCH +НАДФ + Н80ч Н НОСН 4. НАДФ-На
неон неон
нЬон неон
СН40(Р) глюкозо-в-фосфат СН20(Р) в-фосфоглюкововая кислота
На следующем этапе происходит процесс окислительного декарбоксилирования фосфоглюконовой кислоты. В результате атой раакции отщепляется одна молекула углекислоты и образуется пятиуглеродный сахар рибулёао-5-фоофат. Отсюда в название — пентовофосфат-ный цикл, или апотомический путь (апотомия —усекновение). Реакция катализируется ферментом фосфоглюконатдегидрогеназой с коферментом НАДФ:
СООН
I
неон снйон
I 1
НОСН 4- НАДФ С=О + НАДФ • ГД + СОа
1 I
неон неон
неон н<1он
СН,О(Р) tll.20(P)
рпСулёво-5-фосфат
Для прохождения полного цикла реакций необходимы три молекулы гексозомонофосфата, которые превращаются в три молекулы рибулёзо-5-фосфата по уравнению 3 гексозомонофосфата+6Н АДФ 4 +ЗНгО~_>3 пентозофосфата+ 6НАДФ-Н2+ЗСО2. Три образовавшиеся молекулы пентозы (рибулёво-5-фосфата) претерпевают превращения. Вервая молекула рибулёзо-5-фосфат под влиянием фермента эпиме-равы превращается в ксилулозо-5-фосфат. Вторая молекула рибу-лёво~5-фосфата превращается в рибово-5-фосфат под влиянием фермента фосфопентоизомеразы.
Ксилулозо-5-фосфат реагирует с рибозо-5-фосфатом, в результате получается семиутлеродный сахар — седогептулозо-7-фосфат и фос-фоглицерииовый альдегид. Это последняя реакция идет под влиянием транскетолазы:
Рис. 58. Пептозофосфатпый никл.
снгон
СН20Н сно с=о
1 со СНОН НОСН сно
НОСН 4 . СНОН -> НСОН 4 неон
неон СНОН неон СНВО(Р)
Ан„О(Р) СН,О(Р) неон фосфогли цериаовий альдегид
»силулозо-5-фосфат ри5оао-5-фосфат Ан20(Р) ссЗогептулово-7-фосфат
Семиуглеродный сахар реагирует с ФГА, при этом образуется фрук-тозо-6-фосфат и еритрозофосфат. Фруктозо-6-фосфат изомеризуется до глюкозо-8-фосфата. Эритрозофосфат вместе с третьей молекулой рпбулёзо-5-фосфата также дает глюкого-б-фосфат и ФГА. В целом процесс представлен на рисунке 58, а также может быть суммирован в следующем виде:
3 гексозы + 6НАДФ 4- ЗН2О 3 пентозы 4 ЗСОа 4 6НАДФ • Н2
t 1
'------------;-----------------------2 гексозы 4 триоза
Триоза (ФГА) может претерпевать превращения по гликолитическому пути до пировиноградной кислоты и далее вступать в цикл Кребса.
Рассмотренный путь распада глюкозы снабжает растения непто-зами и восстановленным никотпнамидаденипдинуклеотидфосфатом (НАДФ-Нз). Окисление НАДФ-II: идет через дыхательную цепь, при этом первоначально НАДФ-Нг взаимодействует с НАД. Как видно из уравнения, в пентозофосфатном цикле из каждых трех молекул глюкозы распадается одна, при этом выделяются 3 молекулы СОг и образуются 6НАДФ-Н2 и ФГА. При включении 6НАДФ-Й2 в дыхательную цепь образуется 18 молекул АТФ. Если считать, что 1 молекула АТФ используется на предварительное фосфорилирование гексозы, то накапливается 17 молекул АТФ. Вместе с тем при превращении фосфоглпцерннового альдегида в пировиноградную кислоту и ее окислении через цикл Кребса образуется еще 20 молекул АТФ. Таким образом, при окислении по пентозофосфагному пути одной молекулы глюкозы выделяется 37 молекул АТФ. Следовательно, с энергетической стороны апотомический путь почти пе отличается от гликолитического. Однако они сильно различаются по промежуточным продуктам.
Существует ряд методов, с помощью которых можно установить соотношение путей дыхательного обмена (применение специфических ингибиторов, метод с использованием меченых атомов и др.). Однако все они имеют свои недостатки, и в силу этото к экспериментальным данным по атому вопросу надо подходить с большой осторожностью. Внимательное рассмотрение реакций окисления глюкозы, связанных с пептоэофосфатвым путем, показывает его большое сходство с превращением углеводов в фотосиптетическом цикле Кальвина. Возможно, что благодаря наличию одинаковых промежуточных продуктов, эти процессы в ряде пунктов взаимосвязаны.
ВЛИЯНИЕ ВНЕШНИХ И ВНУТРЕННИХ ФАКТОРОВ
НА ИНТЕНСИВНОСТЬ ДЫХАНИЯ
Показатели интенсивности дыхания прямо противоположны п каэателям интенсивности фотосинтеза. Интенсивность дыхания мож ио определить: 1) по количеству выделенной углекислоты, 2) по количеству поглощенного кислорода, 3) по убыли сухой массы. Все эти три показателя рассчитываются на единицу массы в единицу времени.
1. ВЛИЯНИЕ ВНЕШНИХ УСЛОВИЙ НА ПРОЦЕСС ДЫХАНИЯ
Температура. Дыхание у ряда растений осуществляется и при температуре ниже 0°С. Так, у хвои ели процесс дыхания идет даже при температуре —25eC. С повышением температуры интенсивность дыхания возрастает- Одиако это происходит лишь до определенного температурного предела, выше которого начинается инактивация ферментов и интенсивность дыхания снижается. При атом надо учитывать длительность выдерживания растения при данной темпера-
туре. При кратковременной экспозиции интенсивность дыхания возрастает при повышении температуры до 35°С и даже 40°С. При длительном выдерживании в такой температуре интенсивность дыхапия уменьшается. В процессе эволюции растения приспосабливаются к определенным температурным условиям. В этой связи на характер реагирования растений сказываются происхождение растений, географический ареал их распространепия.
Для суждения о влиянии температуры на какой-либо процесс обычно оперируют величиной температурного коэффициента. Температурный коэффициент (фо) процесса дыхания зависит от типа растений и от градаций температуры. Так, при повышении температуры от 5 до 15°С может возрастать до 3, тогда как повышение температуры от 30 до 40°С увеличивает интенсивность дыхапия менее значительно (фо около 1,5). Большое значение имеет фаза развития растений. По данным Б. А. Рубина, па каждой фазе развития растений для процесса дыхания наиболее благоприятны те температуры, на фоне которых обычно проходит эта фаза. Изменение оптимальных температур при дыхании растений в зависимости от фазы их развития связано с тем, что в процессе онтогенеза меняются пути дыхательного обмена. Между тем для разных ферментных систем наиболее благоприятным являются разные температуры. Так, температурный минимум работы цитохромов лежит выше по сравнению с флавиновыми дегидрогеназами. Б этой связи интересно, что в более поздние фазы развития растений наблюдаются случаи, когда флавиновые дегидрогеназы выступают в роли конечных оксидаз, передавав водород непосредственно кислороду воздуха.
Снабжение кислородом. Кислород необходим для протекания аэробной фазы дыхапия, именно кислород ивляется конечным акцептором элентронов, движущихся по дыхательной цепи. В отсутствии кислорода дыхание уступает место брожению. По мера увеличения содержания кислорода аэробное дыхание усиливается, а брожение ослабляется. Одиако при содержании кислорода ниже 5% брожение еще продолжается и выделение углекислоты несколько превышает поглощение кислорода. Это призоднт к тому, что дыхательный коэффициент, как правило, становится больше единицы. При дальнейшем повышении содержания кислорода процесс брожения полностью ингибируется (эффект Пастера) и дыхательный коэффициент становится равным единице. Увеличение содержания кислорода выше 5—3% обычно уже не сказывается на интенсивности дыхапия. Однако из зтого общего положения имеются исключения. Снабжение растительных тканей и клеток кислородом зависит пе только от его содержания зо внешней среде, но и от скорости его поступления. Между тем часто проникновение кислорода к тем или ипым тканям затруднено. Это обстоятельство может проявляться па Семенах и на плодах с плотной оболочкой. В атом случае увеличение концентрации; кислорода в среде до 20% и более повышает интенсивность дыхапия. Если семя гороха лишить оболочки, то интенсивность дыхапия возрастает с повышением содержания кислорода в среде примерно до 5—10_%. Однако дыхание неповрежденных евмян возрастает при уве-218
личения содержания кислорода до 20 % и более. Кислород оказывает стимулирующее влияние на процесс фотодыхания.
Содержание углекислого газа. СОа является конечным продуктом как брожения, так и аэробного дыхания. При довольно высоких концентрациях СОа, значительно превышающих те, которые обычно окружают растительный организм (выше 40%), процесс дыхания тормозится. Торможение вызывается несколькими причинами: 1. Высокая концентрация СО^ может оказывать общее анестезирующее влияние на растительный организм. 2. СОа тормозит активность ряда дыхательных фармеитов. 3. Повышение содержания СОг вызывает закрытие устьиц (с. 69), что затрудняет доступ кислорода и косвенно тормозит процесс дыхания.
Содержание воды. Небольшой водный дефицит растущих тканей увеличивает интенсивность дыхания. Это связано с тем, что водный дефицит и даже подвяданне листьев усиливает процессы распада сложных углеводов (крахмала) на более простые (сахара). Увеличение содержания сахаров этого основного субстрата дыхания усиливает сам процесс. Вместе с тем при водном дефиците нарушается сопряжение окисления и фосфорилирования. Дыхание в этих условиях представляет в основном бесполезную трату сухого вещества. При длительном завядании растение расходует сахара и интенсивность дыхания падает. Иная закономерность характерна для органов, находящихся в состоянии покоя. Увеличение содержания воды в семенах с 12 до 18% уже увеличивает интенсивность дыхании в 4 ра-ва. Дальнейшее повышение содержания воды до 33% приводит к увеличению интенсивности дыхания примерно в 100 раз. При перемещении растения или ткани из воды в раствор солей дыхание усиливается — это так называемое солевое дыхание.
Свет. Вопрос о впиянпи света па интенсивность дыхания изучался многими физиологами. Решение этого вопроса осложнено методическими трудностями. На свету трудно отделить процесс фотосинтеза от процесса дыхания. Трудно разграничить прямое и косвенное влияние света. Так, на свету идет фотосинтез, растет содержание углеводов — это сказывается па процессе дыхания. Все же применение метода меченых атомов позволило, хотя и не полностью, отграничить процесс фотосинтеза от дыхания. В настоящее время полагают, что внияпие света на процесс дыхания многообразно. Под влиянием света, особенно коротковолновых сние-фиолетовых лучей, интенсивность обычного темнового дыхания возрастазт. Активация дыхания светом хорошо показана на бесхлорофилльных растениях. Возможно, что свет активирует ферменты оксидазы. Свет может оказывать косвенное влияние на дыхание зеленых растений благодаря тому, что происходит процесс фотосинтеза. В свою очередь, влияние фотосинтеза па дыхание может быть различным и даже противоположным. Так, с одной стороны, в процессе фотосинтеза образуются основные субстраты дыхания — углеводы. Вместе с « промежуточные продукты, образовавшиеся при дыхании, могут в вдеваться в фотосинтетический цикл. Установлено, что свет стим лирует особый процесс фотодыхания (с. 146).
Питательные соли. Интенсивность дыхания сильно зависит от снабжения растения элементами минерального питания. Такие элементы, как фосфор, сера, железо, марганец, медь, принимают непосредственное участие в процессе дыхания, входя в промежуточные продукты этого процесса (фосфор) или являясь составной частью дыхательных ферментов.
Поранение. Поранение органов и тканей растения усиливает интенсивность дыхания. Возможно, это связано с разрушением клеток, из-за чего повышается соприкосновение дыхательных субстратов и ферментов. Частично поранение может вызывать переход клеток в меристематическую фазу роста. Интенсивность дыхания делящихся клеток всегда выше по сравнению с закончившими рост.
1. ВЛИЯНИЕ ВНУТРЕННИХ ФАКТОРОВ
Различные виды и экологические формы растений дышат с разной интенсивностью. Очень высокая интенсивность дыхания у бактерий и грибов. Как правило, светолюбивые растения характеризуются более высокой интенсивностью дыхания по сравнению с теневыносливыми. Растения северных широт дышат более интенсивно по сравнению с южными, особенно при пониженной температуре. Органы растения, закончившие рост пли находящиеся в состоянии покоя, характеризуются низкой интенсивностью дыхания. Очень низкое дыхание характерно для сухих семян, закончивших рост плодов, тканей, в которых имеется большой процент мертвых клеток. Низкая интенсивность дыхания у покровных тканей, проводящих элементов ксилемы. Высокой интенсивностью дыхания характеризуются цветки (особенно тычинки и пестики), клетки флоэмы, камбия.
Интенсивность дыхания зависит от возраста. Как правило, более молодые растущие органы и ткани дышат более интенсивно. Интенсивность дыхания проростков обычно резко возрастает в точение периода их наибольшего роста (первые 4—5 суток после начала прорастания), а затем начинает падать. По-видимому, это связано с образованием закончивших рост тканей. Определенным закономерным образом изменяется интенсивность дыхания листьев. После появления листа в первые дни его роста интенсивность дыхания возрастает, а затем резко падает, а в период пожелтения часто вновь немного повышается. Такое же явление наблюдается у плодов перед их соереванием (климактерический период). Перед отмиранием организма или органа обычно наступает кратковременное усиление процесса дыхании. Это связано, по-видимому, с какими-то необратимыми процессами дегенерации тканей, при которых сложные соединения распадаются на более простые, что увеличивает количество субстратов дыхания. В этот период дыхание пе сопровождается фосфорилированием. (Коэффициент P/О резко падает.) По-видимому, разрушается упорядоченное расположение окислительных и фосфорилирующих систем. Изменение возраста всего растительного организма также сказывается на интенсивности дыхания. Как правило, наивыс-
пей интенсивностью дыхания обладают растения перед началом цветения.
Различные органы и ткани растения сильно различаются по условиям снабжения их кислородом. В листе кислород свободно поступает практически к каждой клетке. Сочные плоды, корнеплоды, клубни вентилируются очень плохо; они слабо проницаемы для газов, не только для кислорода, но и для углекислого газа. Естественно, в этих органах процесс дыхания сдвигается в анаэробную сторону, дыхательный коэффициент возрастает. Возрастание дыхательного коэффициента и сдвиг процесса дыхания в анаэробную сторону наблюдаются в меристематических тканях. Таким образом, разные органы характеризуются не только различной интенсивностью, но и неодинаковым качеством дыхательного процесса.
ПУТИ РЕГУЛЯЦИИ ДЫХАТЕЛЬНОГО ОБМЕНА
1. ЛОКАЛИЗАЦИЯ В КЛЕТКЕ
РЕАКЦИЙ ДЫХАТЕЛЬНОГО ОБМЕНА
Отдельные этапы дыхания осуществляются в разных частях растительной клетки. Это определяется распределением ферментов по отдельным органеллам с характерными для них метаболическими функциями. Изучение локализации, топографии ферментных систем имеет большое значение и для понимания взаимодействия отдельных частей клетки, а также возможности взаимодействия отдельных метаболитов. В цитоплазме сосредоточены ферменты, катализирующие процесс гликолиза. Есть данные, что ферменты гликолиза имеются также в матриксе митохондрий. Ферменты цикла Кребса сосредоточены в основном в матриксе митохондрий. Ферменты дыхательной цепи (переносчики электронов) вплетены в определенной последовательности в митохондриальные мембраны. Внешняя мембрана митохондрий, по-видимому, не содержит ферментов дыхательной цепи и сравнительно легко проницаема. Приблизительно 20—25% общего белка во внутренней мембране митохондрий составляют белки ферментов, участвующих в переносе водорода и электронов в дыхательной цепи, остальные 75% представляют структурные белки. Предполагается, что ферменты-перенобчики сгруппированы так, что каждая группа представляет самостоятельную единицу — дыхательный ансамбль. В мембране митохондрий может быть несколько тысяч таких ансамблей, которые равномерно распределены в мембранах. Во внутренней мембране митохондрий локализованы ферменты, обеспечивающие процесс фосфорилирования, в частности АТФ-аза. Там же сосредоточен и переносчик аденозинтрифосфата. Благодаря этому образовавшаяся в митохондриях АТФ может выходить из них и использоваться в других частях клетки. Одновременно атот же переносчик осуществляет перенос АДФ во внутреннее пространство митохондрий. Через внутреннюю мембрану проникают также пировиноградная кислота и некоторые органические кислоты цикла Кребса. Специфический переносчик осуществляет перенос внутрь митохоцд-
рий фосфат-ионов. Вместе с тем для ряда веществ НАД и НАДФ и др. внутренняя мембрана непроницаема. Часть никотинамидных коферментов восстанавливается в цитоплазме в процессе гликолиза. Для того чтобы осуществить их окисление в процессе дыхания, существует специальный механизм (челночный), благодаря которому водород отнимается от НАДФ-Н2 и передается в дыхательную цепь. Суть етого механизма следующая. Образовавшийся в цитоплазме НАДФ-Hj реагирует с фосфодиоксиацетоном, восстанавливая его до глицерофосфата. Глицерофосфат проникает через мембрану и отдает водород флавиновой дегидрогеназе и через нее в дыхательную цепь. При этом глицерофосфат снова превращается в фосфодиоксиацетон, который выходит из митохондрии в цитоплазму и опять подвергается восстановлению НАДФ-Hs- Таким образом, в клетке одновременно осуществляется как разделение веществ по разным компартмен-там, так и взаимосвязь между ними.
Некоторые процессы дыхательного обмена протекают в пероксисомах, в них проходят реакции глиоксилатного цикла и локализованы соответствующие ферменты.
Важным является вопрос, как обеспечиваются энергией процессы, происходящие в ядре клетки. По-видимому, частично АТФ поступает в ядро из цитоплазмы. В последнее время показано, что в ядре имеются в собственные дыхательные ферменты, так в нуклеоплазме обнаружены ферменты гликолиза. Есть данные, что в ядре функционируют ферменты дыхательной цепи, подобные митохондриальным. Наконец, ферменты дыхапия обнаружены и в хлоро-пластах.
2. РЕГУЛЯЦИЯ ДЫХАТЕЛЬНОГО ОБМЕНА
Потребности организма в анергии и метаболитах непрерывно меняются в зависимости от этапа его развития и от условий среды, в которых он находится. В соответствии с этим па протяжении своего развития организм способен изменять метаболизм, приспосабливаясь к изменяющимся условиям. Вместе с тем в организме при всех условиях сохраняется взаимосвязанность всех процессов обмена. Все это достигается с помощью имеющихся в организме и клетке специфических регуляторных механизмов. Подобные механизмы существуют и для регуляции путей дыхательного обмела. Не регулируемое дыхание может привести к бесполезной трате сухого вещества.
Рассмотрим некоторые регуляторные мехапиамы. Так, в присутствии кислорода пировиноградпая кислота перестает служить субстратом для процесса брожения и претерпевает превращения по пути аэробного дыхания (эффект Пастера). Эго связано с тем, что для иропесса брожения необходим НАД-Hs. Между тем в аэробных условиях НАД-Нг окисляется в дыхательной цели в, следовательно, не может быть использован на восстановление пирувата до спирта. В результате под влиянием кислорода процесс брожения затормаживается. В аэробных условиях уменьшается и скорость гликолиза, так как образуются значительные количества АТФ в процессе окислительно-222
го фосфорилирования. Образовавшаяся АТФ тормозит активность фермента фосфофруктокиназы. По-видимому, иод влиянием АТФ меняется конфигурация данного фермепта. В связи с атим тормозится одна из первых реакций гликолиза, превращения фруктозо-6-фос-фета во фруктозо-1,6-дифосфат. Эта регуляция имеет большой биологический смысл, так как ставит расход сахара в зависимость от накопления АТФ. При большем расходе АТФ ее содержание падает и гликолиз ускоряется; при накоплении АТФ гликолиз тормозится. Отношение АДФ к АТФ имеет регуляторное значение и для реакций цикла Кребса. Многие дегидрогеназы активируются под влиянием АДФ и одновременно ингибируются высокими концентрациями АТФ. Здесь также проявляется способность организма к регуляции овоего энергетического обмена.
Важное значение имеет регулирование с помощью конечных продуктов реакций. Так щавелевоуксуспая кислота (начальный акцептор ацетил-КоА в цикле Кребса) при своем накоплении ингибирует активность фермента малатдегидрогепазы и тем самым приостанавливает работу цикла Кребса. Это происходит при замедлении подачи активного ацетата и предупреждает полное превращение всех интермедиатов цикла в ЩУК.
Физиологи придают большое значение регуляции соотношения распада глюкозы (гликолитический или пентозофосфатный путь). Исходным материалом как для того, так и для другого пути служит глюкоза, поэтому в большинстве случаез между этими двумя процессами имеются конкурентные взаимоотношения. Преимущественное осуществление того или иного пути связано с тем, какой из ферментов — дегидрогеназа глюкозо-6-фосфат или фосфогексокина-ва — образуется в первую очередь и в большем количестве. Возможно, что зтот тип регуляции осуществляется на уровне генома.
3. ВЗАИМОСВЯЗЬ ДЫХАНИЯ С ДРУГИМИ ПРОЦЕССАМИ ОБМЕНА
Процесс дыхания представляет собой центральное веемо обмена веществ организма, которое тесно связано с другими процессами метаболизма.
Несмотря па противоположную направленность двух центральных процессов растительного организма — фотосинтеза и дыхания — и на их рассредоточенность в разных органеллах клетки, между ними существует тесная взаимосвязь. Прежде всего для протекания процесса дыхания нужны органические вещества (субстраты). Такими субстратами в первую очередь являются углеводы, которые у зеленых растений образуются в процессе фотосинтеза. Особенно много сходного в превращениях между фотосинтетическим циклом Кальвина и реакциями пентозофосфатного пути дыхательного обмена. Как в том, так и в другом случае происходят взаимные превращения сахаров с разной длиной углеродной цепочки (3-, 4-, 5-, 6- и 7-утлерод-ных атомов). По видимому, несмотря на различное распределение (компартментализацию) этих метаболитов в клетке, между ними су-
шествует обмен. Иначе говоря, промежуточные продукты дыхания могут быть использованы в процессе фотосинтеза. Одновременно возможен и обратный процесс.
Некоторые промежуточные продукты цикла Кальвина могут окисляться, вступая в глиоксилатный цикл. Много общего в энергетике фотосинтеза и дыхания в процессах фотосинтетического и окислительного фосфорилирования. АТФ, образовавшаяся на свету при фотосинтетическом фосфорилировании, может служить основным источником энергии для различных биосинтетических процессов, заменяя АТФ, образовавшуюся в процессе дыхания. Не исключено, что АТФ, образовавшаяся в процессе дыхания, может быть испольэозала для реакций цикла Кальвина. Уже на протяжении первой анаэробной фазы дыхания (гликолиз) образовавшиеся промежуточные продукты могут быть использованы. Так, триозофосфат превращается в-глицерин и служит источником для синтеза жиров. Пировиноградная кислота путем аминирования может дать ананин.
Не менее важное значение имеют и промежуточные продукты цикла Кребса. Например, а-катоглютаровая и щавелевоуксусиая кислоты в процессе аминирования дают аминокислоты — глутаминовую и аспарагиновую. Благодаря реакции переамппировапия эти кислоты могут быть источником аминогруппы для других аминокислот и таким образом- являться важнейшими промежуточными продуктами для синтеза как белка, так и пуриновых и пиримидиновых азотистых оснований.
Янтарная кислота, образовавшаяся в цикле Кребса, дает основу для образования порфиринового ядра хлорофилла. Ацетил-КоА служит основой для образования жирных кислот. Поскольку имеется ряд реакций и процессов, благодаря которым отдельные компоненты извлекаются из цикла Крабса, должны быть и обратные процессы, поставляющие их в цикл. Если бы этого не было, скорость превращения в аэробной фазе дыхания заметно бы снизилась. Такими реакциями является окислительное дезаминирование аминокислот, приводящее к образованию органических кислот. Имеет значение также реакция карбоксилирования пировиноградной кислоты или ее фосфорилированной формы, в результате чего образуется щавелево-уксусная кислота.
Основной процесс, при котором образуются пентозы в растении,— это пентозофосфатный путь дыхательного обмена. Пентозы входят в состав нуклеотидов, нуклеиновых кислот и ряда коферментов, в том чиспе таких важных, как никотинамидные (НАД и НАДФ), флавиновые (ФМН, ФАД). Пентозофосфатный путь дыхания является также источником образования эритрозо-4-фосфата. Эритрозофосфат, взаимодействуя с фосфоенолпируватом:, образует шикимовую кислоту. Шикимовая кислота — материал для образования ряда ароматических аминокислот, например триптофана, а из триптофана образуется один из главных гормонов роста растений — ауксин (р-ин-долилуксусная кислота).
Рассмотренные связи дыхания и других процессов метаболизма растения не являются постоянными, раз навсегда данными. Они 224
возникают и нарушаются под влиянием как внутренних особенностей растения, так и внешних условий. Эти нарушепия могут быть временными, легко восстанавливаемыми. При неблагоприятных условиях эти нарушения могут быть значительными и даже летальными.
Список рекомендуемой литературы
Певзнер Л. Основы биоэнергетики. М., Мир, 1977.
Ригель Дж. Энергия, жизнь и организм. М., Мир, 1967.
Рубин Б, А., Ладыгина М. Е. Физиология и биохимия дыхапия растении, М., 1974.
Семихатова О. А. Смена дыхателытых систем. Л., Наука, 1069.
Сент-Дьёрдьи А. Введение в субмолекулярную биологию. М., Наука, 1964.
кулан ев В. П. Трапсформация энергии в бномсыбраиах. М., Нау-
Глава VII.
РОСТ И РАЗВИТИЕ РАСТЕНИЙ
Рост и развитие — неотъемлемые свойства всякого живого организма. Это интегральные процессы. Растительный организм поглощает воду и питательные вещества, аккумулирует энергию, в нем происходят бесчисленные реакции обмена веществ, в результате чего он растет и развивается. Процессы роста и развития тесно взаимосвязаны, так как обычно организм и растет, и развивается. Темпы »оста и развития могут быть равными, быстрый рост может сопро-ождаться медленным развитием или быстрое развитие медленным остом. Так, например, растение хризантемы весной (длинный день) ыстро растет, по не зацветает, следовательно, развивается медлен-:с. Подобное происходит с высеянными озимыми растениями, весной гаи быстро растут, но не переходят к репродукции. При осеннем высеве под воздействием пониженных температур озимые растения медленно растут, но в них проходит процессы развития. Из этих примеров видно, что критерии, определяющие темпы роста и развития, различны. Критерием темпов развития служит переход растений к воспроизведению, к репродукции. Для цветковых растений —это закладка цветочных почек, цветение. Критерии темпов роста обычно определяют скоростью нарастания массы, объема, размеров растения. Сказанное подчеркивает нетождественносгь этих понятий и позволяет рассмотреть процессы роста и развития последовательно.
РОСТ РАСТЕНИЙ
Существует много определений роста, однако ин одно из них полностью не может считаться удовлетворительным. Прежде всего рост — это необратимое увеличение размеров, объема, массы организма. Однако Д. А. Сабинин справедливо указывал, что это определение не полно и не точно. Дело в том, что у растений увеличение в процессе роста уже имеющихся органов все время сопровождается образованием новых органов (листьев, побегов). Иначе говоря, рост растений включает формообразовательные процессы. При этом вновь появляющиеся побеги, листья качественно отличаются друг от друга. Таким образом, рост растений нельзя рассматривать как чисто количественный процесс. Сказанное позволяет дать следующее определение этого процесса. Рост — это необратимое увеличение объема, массы растений, сопровождаемое новообразованием элементов структуре
ры организма. Под элементами структуры понимают — органы, ткани, клетки, а также отдельные клеточные органеллы.
В отличие от животных организмов растения в течение всей жизни растут и образуют новые клетки, хотя обычно с некоторыми перерывами (период покоя).
Из приведенного определения понятия роста видно, что дать общий критерий, который бы позволил определить темпы этого процесса, очень трудно. В качестве критериев можно брать: 1) высоту, 2) толщину (для стебля), 3) массу (сырую и сухую), 4) площадь-(для листьев), 5) число клеток, 6) содержание белка, 7) содержание ДНК. Однако ни один из этих показателей не дает подпой картины процесса роста. Нередно в зависимости от выбранного критерия мы получаем различные, а иногда и прямо противоположные результаты. Дело в том, что разные органы растения растут с разной скоростью. Не всегда увеличение высоты растения сопровождается увеличением массы, и изменение сырой массы не всегда аналогично изменению сухой. Нередки случаи, когда параметры роста изменяются прямо противоположным образом. Так, например, при прорастании семян увеличивается объем, но сухая масса уменьшается. Этиолированные проростки интенсивно растут в длину, но масса их не увеличивается. В покоящихся растениях идет скрытый рост, который выражается в новообразовании элементов структуры и может пе сопровождаться увеличением массы и даже объема. Говоря о росте, желательно уточнять, что именно имеется в виду — увеличение длины или массы, числа клеток или их размероз.
1. ОСОБЕННОСТИ РОСТА КЛЕТОК
В основе роста многоклеточных организмов лежит увеличение числа и размеров клеток, сопровождаемое их дифференциацией, т. е-возпикиовевием и накоплением различий между двумя клетками, образовавшимися в результате деления.
Еще со времени Ю- Сакса рост клеток принято делить на три фазы: вмбриональпую, растяжения, дифференцировки (рис. 59). Такое разделение носит условный характер. За последнее время внесены изменения в само понимание основных особенностей, характеризующих эти фазы роста. Если прежде считалось, что процесс деления клетки происходит лишь в эмбриональную фазу роста, то сейчас показано, что клетки могут иногда делиться и в фазу растяжения. Важно, что дифференцировка клетки отнюдь не является особенностью только третьей, последней фазы роста. Дифференцировка клеток, в смысле появления п накопления внутренних и физиологических различий между ними, проходит па протяжении всех трех фаз и является важной особенностью роста клеток. В третьей фазе эти внутренние физиологические различия лишь получают внешнее морфологическое выражение. Все же ряд существенных отличий между фазами роста имеется, и физиологи продолжают рассматривать их отдельно.
Рис. 59. Диаграммы, иллюстрирующие рост растительной клетки: 1 — деление клетки; а — растяжение клетки; 8 — дифференциация клетки.
Эмбриональна» фаза. Клетка возникает в результате деления из другой эмбриональной клетки. Затем она несколько увеличивается главным образом за счет увеличения веществ протоплазмы, достигает размеров материнской клетки п снова делится. Таким образом омбрионалытая фаза делится на два периода. Период между делениями и собственно деление клетки. Структура клетки в период между делениями (интерфаза) имеет ряд особенностей: густая цитоплазма с хорошо развитой эндоплазматической сетью, каналы которой узкие, с малым количеством расширений (цистерн), мелкие вакуоли; большое количество рибосом, многие из которых свободпо располагаются в цитоплазме и ие прикреплены к мембранам эндоплазматической сети; митохондрий много, но они еще не достигли окончательного размера, с мало развитыми кристами и густым матриксом. Имеются и промитохондрии и пропластиды, деление которых можно наблюдать. Ядро относительно небольшого размера, с крупным ядрышком. Первичная клеточная оболочка пронизана плазмодесмами. В период между делениями в клетке идут интенсивные процессы обмена веществ — активный синтез белка, высокая интенсивность дыхания, сопровождаемая образованием АТФ. Именно в этот период в ядре клетки происходит самовоспроизведение ДНК. Если процесс самовоспроивведения ДНК почему-то приостаноалвн, деление клетки не происходит. Таким образом основные синтетические и энергетические процессы в клетке происходят именно в период между делениями.
Существует несколько гипотез, объясняющих переход клетки к делению. Наиболее распространена гипотеза, согласно которой в меристематической клетке должно быть определенное соотношение 228
между размерами ядра и цитоплазмы (ядерно-плазменное отношение). Когда зге отношение ниже определенного уровня, ядро как бы уже не может управлять возросшей массой цитоплазмы и клетка переходит к делению.
Перед делением происходят заметпые изменения в энергетическом состоянии клетки. Во время иптерфазы клетка характеризуется очень высоким энергетическим потенциалом — отношением АТФ к АМФ. При переходе к митозу благодаря глубокой структурной перестройке наступает как бы энергетическая разрядка и, частично, энергия выделяется в виде коротковолнового излучения. В период деления интенсивность процессов обмена, в том числе и дыхания, падает.
Делению плетки предшествует деление ядра. Каждое ядро дочер-ней клетки получает ровно такое же число хромосом и такое же количество ДНК, как к материнская. Во время митоза движение цитоплазмы прекращается, митохондрии и пластиды распределяются примерно поровну между дочерними клетками.
На конечной фезе митоза, когда образовались два ядра, в эквато-
Рис. 60. Электропно-ьпгеросиопичсская фотография клеточной пластинки, состоящей из слившихся пузырьков аппарата Гольдки (увел. 41000) (по Н. В. Парамоновой).
риальаой области клетки формируется клеточная стенка. Начало образования клеточной стенки происходит в телофазе, когда хромосомы отошли к полюсам клетки и началась их деспирализация. На границе раздела двух клеток скопляются пузырьки, отделяющиеся от аппарата Гольджи и эндоплазматической сети. Эти пузырьки сливаются и обраауют капельки (рис. 60), впоследствии преобразующиеся в плаз-мод есмы. В результате образуется сплошной слов — межклеточная пластинка. Она удлиняется и смыкается с продольными оболочками клетки. Затем начинается нарастание межклеточной пластинки в толщину путем присоединения с обеих сторон новых пузырьков, отщепляющихся ст аппарата Гольджи. Возникает трехслойное образование, состоящее в основном из пектиновых веществ и гемицеллюлозы. Затем в него включаются фибриллы целлюлозы. В результате в каждой из дочерних клеток возникает первичная оболочка, состоящая из переплетенных фибрилл целлюлозы и сильно гидротировапного матрикса. В свяаи с большой гидротировапностью клеточная оболочка в этот период отличается высокой эластичностью. После образования в каждой из клеток первичной оболочки межклеточная пластинка сохраняется в виде межклеточного вещества. Из мембран аппарата Гольджи формируется плазмалемма.
Таким образом, в первой фазе роста увеличение объема клетки происходит за счет деления и возрастания массы протоплазмы. Одновременно идет формирование структурных компонентов клетки. Следовательно, рост уже в этой фазе сопровождается формообразовательными процессами. Образовавшаяся в результате деления клетка вновь увеличивается в объеме и снова делится. После того как кает-ка разделится 3—5 раз, она переходит во вторую фазу роста. Искаю-чение составляют лишь инициальные клетки, которые продолжают делиться в течение всего периода роста растительного организма.
Фаза растяжения. Переход к фазе растяжения сопровождается значительными структурными и физиологическими изменениями. Цитоплазма становится менее вязкой, более оводнепиой. Каналы эндоплазматической сети расширяются, в ряде мест они переходят в цистерны. Мембраны этой сети становятся шероховатыми, поскольку к ним прикрепляются рибосомы. Система внутренних мембран митохондрий (крист) хорошо развита. От аппарата Гольджи отгануровы-ваются многочисленные пузырьки. Ядро принимает неправильную форму, что увеличивает поверхность его соприкосновения с цитоплазмой. Размер ядрышка уменьшается. Мелкие вакуоли сливаются, и образуется одна центральная вакуоль. Относительное содержание цитоплазмы на единицу массы клетки падает, однако абсолютное ее содержание на клетку растет. При переходе к растяжению продолжается сиитев ДНК, что приводит к образованию тетраплоидпых клеток. В фазу растяжения скорость синтеза белка возрастает, усиливаются все процессы метаболизма в клетке. При переходе к растяжению клетки не теряют способности делиться. Наиболее характерным процессом для фазы растяжения является значительное увеличение объема клетки. Скорость роста (в смысле увеличения объема) в эту фазу роста чрезвычайно велика. В течение всей фазы объем
ЙЗО
Рис. Bl. Схематическое изображение миогосеточяого роста:
1» В, 3 — последовательно накладывающиеся слои микдофябрилл целлюлозы.
клетка возрастает в 20—50 раз. Это необратимое увеличение объема, идущее главным образом за счет усиленного поступления воды. Сосущая сила (S) клеток возрастает во много раз. Усиленное поступление воды вызывает, естественно, уменьшение концентрации клеточного сока и, как следствие, падение осмотического давления. Некоторое увеличение сосущей силы может происходить за счет пеосмотического (активного) поступления воды. Однако главным образом увеличение сосущей силы связано с уменьшением сопротивления клеточной оболочки. Клеточная оболочка растет, и, естественно, се сопротивление уменьшается. В эту фазу роста в клетках появляется гормон роста — ауксин, который увеличивает растяжимость клеточной оболочки. В процессе роста растяжением толщина клеточной оболочки не меняется. Согласно теории «сетчатого» роста, новые микрофибриллы целлюлозы синтезируются из веществ цитоплазмы и откладываются с внутренней стороны оболочки в виде сетки. В результате поверхность оболочки растет, а толщина ее остается прежней (рис. 61). В фазе растяжения усиливаются процессы физиологической дифференциации клеток.
Фаза диффереициации. На этой фазе процесс дифференцировки уже проявляется в определенных внешних признаках, т. е. меняют-сп форма и внешняя структура клетки. Протоплазма почти целиком расходуется ка утолщение клеточной оболочки. Вновь образовавшиеся слои фибрилл целлюлозы накладываются на старые (аппозиция).
При этом ориентация фибрилл целлюлозы в Каждом новом слое другая. В результате образуется вторичная клеточная оболочка. Клетки теряют способность к делению и растяжению.
Процесс функциональной дифференциации клеток, или накопление физиологических различий между ними, происходит на всех фазах роста. Уже между появившимися в период деления дочерними клетками, из которых в дальнейшем будут образовываться различные ткани, имеются определенные различия, проявляющиеся в их химическом составе, морфологических особенностях ядер и органелл.
J. ОСОБЕННОСТИ ПРОРАСТАНИЯ СЕМЯН
Рост семенного растения начинается с прорастания семени. Семена у покрытосеменных растений образуются из семяпочки в результате двойного оплодотворения. В пыльце сосредоточено большое количество физиологически активных веществ — фитогормопов (ауксинов), ферментов, много аминокислоты пролина. Все это приводит к тому, что уже сразу после опыления интенсивность обмена веществ в системе пыльца — пестик резко усиливается. Пыльцевая трубка песет два слермия. В результате слияния первого спермия с яйцеклеткой образуется зигота, дающая при последующем развитии зародыш семени. Анатомически ткани зародыша целиком состоят из первичной меристемы. При слиянии второго спермия со вторичным ядром зародышевого мешка образуется триплоидное ядро. Оно начинает делиться и вместе с цитоплазмой образует множество клеток, составляющих эндосперм. После опыления и особенно оплодотворения завязь начинает разрастаться. Вместе с пыльцой в зародышевый мешок привносятся как сами фитогормоны (ауксины), так и ферменты, катализирующие синтез гормонов. Дыхание развивающегося после оплодотворения семени идет очень интенсивно. Семя становится центром притяжения питательных веществ. В процессе развития и роста зародыша ткань вндосперма потребляется и к моменту созревания семян может частично или полностью исчезнуть. Некоторые семена лишены эндосперма, питательные вещества сосредоточены у них в тканях самого зародыша (в семядолях).
Процесс прорастания семян включает в себя и те процессы, которые происходят в семени до того, как появляются признакл видимого роста. Для прорастания необходимы определенные условия. Прежде всего нужна вода. Воздушно-сухие семена содержат от 5 до 20% воды. На первой фазе прорастания сухие семена быстро поглощают воду и набухают. Находящиеся в семени запасные питательные вещества (белки, углеводы) содержат большое количество гидрофильных группировок, таких, как ОН, СООН, NHz, которые притягивают к себе молекулы воды. Набухание обратимо. Если еще пе началось деление и растяжение клеток зародыша, то семена можно подсушить и они не потеряют жизнеспособности. Кроме воды, для процесса прорастания необходимы кислород, поддерживающий процесс дыхания, и определенная температура. Плохая проницаемость оболочки семени в отношении кислорода может быть причиной за
держки прорастания семян. Интенсивность дыхания в процессе про-растания быстро возрастает. Это естественно, поскольку процессы, происходящие на первых этапах прорастания, идут с затратой энергии. Оптимальные температуры для прорастания семян обычно соответствуют тем, которые характерны для ареала распространения данного вида растений. Семена некоторых растений лучше прорастают при сменной температуре. Есть растения, для прорастания семян которых необходим сеет.
Уже в процессе набухания семян начинается мобилизация питательных веществ — жиров, белков и полисахаридов. Это все нерастворимые, плохо -передвигающиеся сложные органические вещества. В процессе прорастания происходит перевод их в растворимые соединения, легко используемые для питания зародыша, поэтому необходимы соответствующие фарменты. Частично ферменты находятся в эндосперме или зародыше в связанном неактивном состоянии и под влиянием набухания переходят в активное состояние. Однако все же ферменты образуются и de novo. Показано, что уже через 3 ч после памачивания в клетках семени наблюдается образование и-РНК. Таким образом, становится возможным новообразование белков-ферментов. Крахмал распадается до сахаров в основпом под влиянием двух ферментов — а- к Р-амилазы. Еще работами А. И. Опарина показано, что р-амилаза находится в сухих семенах в связанном (неактивном) состоянии, вместе с тем а-амилаза вновь образуется в процессе прорастания. Одновременно происходит новообразование фарментов, катализирующих распад белков, протеаз. Оказалось, что если удалить зародыши, то а-амилаза и протеазы не образуются. Если эндосперм, лишенный зародыша, обработать гормоном гиббереллином, то в алейроновом слое появляются а-амилаза и протеазы. При этом установлено, что если эцдосперм замачивать в тяжелой воде 18Н2<), то белок а-амилаза содержит 16О- Следовательно, под влиянием гибберелкипа оп синтезируется ваново. Источником гиббереллина в семени является зародыш.
Под воздействием соответствующих фарментов крахмал семени распадается па сахара, белки расщепляются до аминокислот, а последние до органических кислот и аммиака. Образовавшийся аммиак обезвреживается в виде амндов. Более сложные превращения претерпевают жиры. При участии ферментов жиры расщепляются па жирные кислоты и глицерни. Жирные кислоты окисляются, и образуется ацетил-КоА, который накапливается в специальных органеллах — глиоксисомах. Ацетил-КоА может использоваться, для сиптева углеводов (глиоксилатный цикл). Так, две молекулы ацетил-КоА образуют янтарную кислоту, которая превращается в щавелевоуксусную и в присутствии АТФ в фосфоенолпировипоградпую (ФЕП) и далее в сахара. В эндосперме образуются также нуклеазы — ферменты, катализирующие распад нуклеиновых кислот до нуклеотидов.
Все образовавшиеся растворимые соединения либо используются как дыхательный материал, либо транспортируются в зародыш. Таким образом, при прорастании семяп идут многочисленные взаимосвязанные процессы — распад питательных веществ, их превращение,
транспорт и образование из них новых веществ, идущих иа построение клеток и органов. Энергия для всех атих процессов поставляется окислительными реакциями (дыханием).
Отдельные стапы процесса прорастания регулируются фитогормонами. Так, синтез белков-ферментов, катализирующих распад сложных соединений на более простые, регулируется гормоном гиббереллином, который поступает из зародыша в алейроновый слой. Благодаря действию образовавшихся ферментов нуклеаз и протеаз происходит распад нуклеиновых кислот и белка. В результате в семенах появляются нуклеотиды, из которых образуются гормоны, относящиеся к группе цитокининов, и аминокислоты, в частности триптофан, из которого образуются ауксины (ИУК). Под влиянием цитокининов и ауксинов начинается деление и растяжение клеток аародыша. Зародыш прорывает семенную оболочку.
Зародыш состоит из аародышевого корешка, стебля и почечки. Обычно прежде всего начинается быстрый рост зародышевого корешка, который дает начало корневой системе. Дальнейший рост проростков несколько различается в зависимости от типа растений. У однодольных растений после роста корпя начинает расти колеоптиль (первый свернутый лист). Затем, когда колеоптиль достигает поверхности почвы, его рост прекращается, из почечки начинает расти первый-настоящий лист, который прорывает колеоптиль. В этот период корень начинает ветвиться. У многих однодольных растений из нижней части стебля образуются придаточные корпи.
У двудольных растений, если семядоли выносятся па поверх-HOCTI-, после вытягивания корешка вытягивается гипокотиль — под-семядрльное колено. Семядоли выносятся на поверхность и зеленеют. После этого трогается в рост почечка, которая дает начало главному стеблю, и формируются надземные побеги. Если семядоли на поверхность на выносятся, то сначала вытягивается эпикотиль— надсемядольное колено. Такая последовательность роста частей зародыша выработалась в процессе эволюции, это позволяет в первый период прорастания обеспечить прикрепление растения к субстрату и снабжение его водой.
Для нормального роста а формообразовательных процессов проростка необходим свет.
В течение первых фаз прорастания проросток питается за счет готовых органических веществ, находящихся в эндосперме или семядолях, Как только появляются первые зеленые листья, начинается фотосинтез. На этом фаза проростка заканчивается и растение переходит в ювенильную фазу. На свету в клетках листьев из пропластид развиваются пластиды. Еще до завершения роста пластид с развитой гранулярно-ламеллярной структурой начинается образо->ание ферментов, участвующих в процессе фотосинтеза. Так, один гз основных специфических фарментов, катализирующий первую >еакцию темновой фазы фотосинтеза,— РДФ-карбоксилаза — присутствует в проростках еще до того, как листья приобретают зеленую окраску. Однако на сеету происходит новообразование этого фермента. Для начала фотосинтеза необходимо также наличие акцептора 234
углекислоты рибулёзодифосфата (РДФ). Это соединение образуется как промежуточный продукт апотомического пути дыхательного распада. Еще до прорастания в зародыше присутствует ключевой фермент апотомического пути дыхания — глюкозофосфат дегидрогеназа. В процессе прорастания активность этого фермента резко возрастает, что приводит к первичному накоплению акцептора углекислоты — РДФ. Затем начинает работать цикл Кальвина и активность глюкозофосфатдегидрогеназы падает.
3. ТИПЫ РОСТА ОРГАНОВ РАСТЕНИЯ
Характерной чертой ростовых процессов растительных организмов является их локализация в определенных тканях — меристемах. Клетки меристемы делятся, дочерние клетки достигают размеров материнской и снова делятся. Однако размер и объем меристем остают * ся постоянными. Это связано с тем, что большинство меристематических клеток через несколько делений (4—5) переходят к росту растяжением. Однако есть клетки, которые делятся в течение всей жизни органа. Таким образом, меристемы иорня и стебля состоят из двух типов клеток, резко отличающихся по функциям и по способности к делению. Меристематические клетки, расположенные на самом верху стебля или корпя, пе прекращают деления в течение всего периода роста. Эту зопу меристематических клеток называют попоащимся центром (для корня) или меристемой ожидания (для стебля). Более длительная способность к делению является следствием меньшей частоты делений и большей длительности нитерфазы. Одновременно данные клетки характеризуются и большей длительностью митотического цикла. Вместе с тем эти клетки более устойчивы к неблагоприятным воздействиям. Так, в них реже возникают хромосомные аберрации, что очень важно для сохранения жизнеспособности организма (В. Б. Иванов) Клетки меристемы ожидания стебля менее дифференцированы, что облегчает их последующую дифференциацию и имеет значение при переходе к образованию генеративных органов.
Меристемы различны по расположению в отдельных органах. Апикальные, или верхушечные, меристемы расположены в окончаниях (верхушках) стебля, растущих побегов и корня и обеспечивают верхушечный тип роста. Вставочные, или интеркалярные, меристемы, расположенные между двумя закончившими рост тканями, характерны для стебля (рост междоузлий у злака) и для некоторых листьев. Этим меристемам соответствует интеркалярный тип роста. Вазальные меристемы расположены у основания органа и характерны для листьев, которые растут основанием. Наконец, существуют меристемы, обеспечивающие рост стебля в толщину, расположенные в стебле между ксилемой и флоэмой (камбий).
Уже на первой фазе роста — фазе деления — клетни, находящиеся в нижней части меристемы, начинают дифференцироваться. В них постепенно накапливаются физиологические, а затем и морфологические различия. Эти различия обусловлены местоположением
клетки, взаимодействием ее с другими клетками, а также той генетической программой, которая в пее вложена. Вопрос о причинах дифференциации клеток — один из наиболее сложных вопросов биологии. Все клетки данного организма обладают одинаковым геномом, а следовательно, все клетки обладают и одинаковыми потенциальными возможностями (тотипотентны). Однако вти потенциальные возможности проявляются по-разному. Тотипотентность растительных клеток хорошо доказана на культуре изолированных тканей.
4. КУЛЬТУРА ИЗОЛИРОВАННЫХ ТКАНЕЙ
Методы выращивания изолированных тканей были разработаны Ф. Уайтом и Р. Готре. Сущность метода заключается в том, что выделенные кусочки ткани или отдельные клеткл выращивают на искусственной питательной среде в стерильных условиях. Если полностью дифференцированную клетку изолировать, то в стерильных условиях на соответствующей питательной среде она снова начинает делиться и затем из ное может развиться целый растительный организм. Так пз одной, полностью дифференцированной клетки флоэмы, выделенной пз поряеплода моркови или из клетки сердцевинной паренхимы табака, можно получить целое, полностью развившееся растение. В опытах советспого физиолога Р. Г. Бутенко с клетками флоэмы моркови при выращивании на питательной среде в стерильных условиях сначала удаяось заставить их делиться и получить недифференцированную массу клеток — каллюс. Затем в этой массе клеток возникли очаги дифференциации. Процесс вторичной дифференциации можно разделить на две фазы. Первая фаза — ето образование в массе однородных клеток очагов регенерационной меристемы и возникновение зародышевых структур, которые напоминают настоящие и имеют зачаточную почечку и зачаточный корешок. Для того чтобы зародышевые структуры появились, необходимо добавление фитогормонов цитокининов. На второй фазе происходит рост этих зародышевых структур, по для этого необходимо добавить в питательную среду ауксины. При этом в зависимости от соотношения ауксинов и цитокининов происходит преимущественный рост тех или иных органов.
В пастоягцое время ведутся исследования с изолированными протопластами, которые выделяют путем разрушения клеточных стенок специальными фарментами. Из протопласта, изолированного из диф-фаренцироваяной клетки мезофилла .чиста, получают целый растительный организм. Рост и дифференциация и в этом случае зависят от соотношения гормонов в питательной среде.
Из этйх опытов можно сделать несколько выводов: 1. Все клетки действительно имеют одинаковые потенциальные возможности. 2. Клетка, находящаяся в окружении других клеток, и клетка, выделенная из ткани, проявляют ати возможности по-разному. 3. Проявление возможности клетки определяется внутренними и внешними условиями. Большое значение имеют гормоны. 4. В основе регуляции дифференциации клетки лежит дифференциальная активность ге-236
Апикальная клетка
Рис. 62. Одни из возможных способов взаимосвязи элементов генетической системы переключения, обеспечивающих определенный путь раэвития (по Боннеру).
нома. 5. Не все клетки могут полностью проявить свои возможности. В некоторых случаях гены клетки настолько репрессированы, что эти возможности не проявляются. В этой связи гены клетки делятся па активные, потенциально активные и неактивные.
J. ДИФФЕРЕНЦИАЦИЯ ТКАНЕЙ
В обычных условиях активация генома, а следовательно, рост органа идет по заранее заданной программе, закодированной в ДНК. Дифференциация клеток органа может происходить благодари системе морфогенетических тестов (Д. Боннер). Так, клетки стебля образуют три вида тканей — эпидермис, нору и степь. В процессе роста клетка проходит как бы ряд тестов (испытаний). Сначала тестом служит расположение клетки (верхняя она или нижняя), затем размер органа. Клетка делится и растет, пока данный орган не достигнет определенных размеров. Наконец испытывается местоположение клетки в данном органе (на поверхности или в глубине). Каи видно из схемы (рис. 62), каждая клетка проводит как бы анализ. Если
.ото верхняя апикальная клетка, то она делится все время. Нижележащая клетка продолжает делиться до тех пор, пока растущий орган не будет состоять из определенного (заранее наследственно запланированного) количества клеток. По-видимому, это можно определить по концентрации какого-либо вещества. Когда размер клеточной массы достигает требуемой величины, клетка проводит другие тесты, из которых выясниет необходимый характер своей дальнейшей дифференциации. В зависимости от местоположения в клетке создается различная гормональная ситуация, что приводит к дереп-jieccuu определенных участков генов и биохимической,'а затем анатомоморфологической дифференциации. При этом меристема поставляет не только клетки, но и вещества, вызывающие ту или иную дифференциацию.
Большое значение в процессе дифференциации имеет явление полярности. Полярность — это свойственная растениям специфическая дифференциация процессов и структур в пространстве. При этом физиолого-биохимические или анатомо-морфологические различия изменяются в определенном направлении, в результате чего один конец отличается от другого. Явление полярности проявляется как па одной клетке, так и на ряде клеток. Так, меристематическая клетка уже поляризована благодаря своему положению. У нее есть верх и низ. И если деление пройдет перпендикулярно ося полярности, то, несмотря на одинаковое распределение наследственного материала (ДНК), дочерние клетки будут неодинаковыми по физиологическим и структурным особенностям, по факторам наследственности, расположенным в цитоплазме, и по веществам — гормонам, регулирующим активность генбма. Во многих случаях можно наблюдать и неравное .деление (образование устыщ). Таким образом, полярность и деление — это важнейшие факторы, приводящие к различиям в путях дифференциации клетки. Полярность проявляется в определенной направленности роста корпя и стебля, в определенном направлении передвижения веществ. Она может определяться неравномерным распределением зарядов. Верхушка побега заряжена положительно по отношению к основанию, сердцевина стебля — по отношению к по-верхности.
6. ВЛИЯНИЕ ВНЕШНИХ УСЛОВИЙ НА РОСТ
Скорость роста. Измерение скорости роста, проведенное немецким ’физиологом Ю. Саксом (1872), позволило установить определенные закономерности. В начальный период темпы роста, как правило, низкие. Затем рост усиливается и идет с большой скоростью (период -большого роста), а затем снова замедляется. В результате скорость роста растения и его отдельных органов может быть изображена в виде S-обравной кризой (рис. 63). Эта закономерность проявляется на разных уровнях организации.
Внешние условия оказывают на рост как прямое, так и косвенное влияние. Последнее связано с тем, что скорость роста зависит от интенсивности всех остальных физиологических процессов, воздуш-
Рве. 63. Большая кривая роста:
А— увелячетае длины междоузлия у фасоли; В — рост листа огурца.
кого и корневого питания, снабжения водой, напряженности процессов обмена веществ и анергии. В этой связи влияние внешних условий может сказаться на интенсивности роста через изменение-любого из указанных процессов. При этом далеко не всегда причины того или иного влияния можно с достаточной точностью установить, поскольку в естественной обстановке влияние отдельных факторов тесно взаимосвязано^
Температура. Рост растений возможен в сравнительно широких температурных границах. Растения раниевесенней флоры растут при температуре даже несколько ниже 0°С. Есть растения, для которых верхняя температурная граница роста несколько превышает 50°С. Для каждого вида растения в зависимости от его особенностей я> главным образом от географического происхождения характерны определенные температурные границы, в которых возможно протекание ростовых процессов. Для роста каждого вида растений различают три кардинальные температурные точки: минимальная температура, при которой рост только начинается, оптимальная — наиболее благоприятиав для ростовых процессов и максимальном, при которой рост прекращается. Некоторые примеры, иллюстрирующие это положение для ряда культурных растений, приведены в таблице 9.
Данные таблицы показывают, что растения сильнее всего различаются по минимальной температуре, при которой рост начинается. Оптимальные и особенно максимальные температуры для роста различных культур очень близки. С повышением температуры от минимальной до оптимальной скорость роста резко возрастает. В области более низких температур наблюдвется более быстрый подъем темпов роста при повышении температуры. Сказанное хорошо видно из данных по изменению температурного коэффициента (Сю) в раз-
Таблица 9
Зависимость роста растений от температуры
Растение Температура, в 'С
минимальная оптимальная максимальная
Ячмепь 0-5 25—31 31—37
Кукуруза 5—10 37—44 44-50
Огурцы 15—18 31—37 44-50
Тыква 10—15 37—44 44-50
ных интервалах температуры. Так, скорость роста проростков гороха при повышении температуры от 0 до 10° С возрастает в 9 раз, от 10 до 20°С — в 2,5 раза, а от 20 до 30°С — всего в 1,9 раза.
Повышение температуры выше оптимальной замедляет процессы роста и часто сокращает его период. Оптимальные температуры могут быть неодинаковыми для роста разных органов одного и того же растения. Как правило, оптимальная температура для роста корневых систем ниже по сравнению с надземными органами. Для .роста боковых побегов оптимальная температура ниже по сравнению с ростом главного стебля.
Установпено, что растения интенсивнее растут в ночной период суток. Для рсота многих растений благоприятной является сменная температура в течение суток; днем повышенная, а ночью пониженная. Это явление Ф. Вент назвал термопериодизмом. Явление термопериодизма хорошо проявляется на культуре томатов. Показано (Н. И. Якушкииа), что пониженные ночные температуры ускоряют рост корневой системы и боковых побегов у растений. Такое влияние может быть объяснено тем, что при понижении температуры более -активно работают ферменты, катализирующие распад крахмала на сахара. В листьях образуются растворимые транспортные формы чгл вводов, легко передвигающиеся к точкам роста корня и боновых гобегов, благодаря чему их рост усиливается.
Содержание воды. В процессе роста растения особенно чувствительны к недостатку воды. Уменьшение содержания воды в почве приводит, естествипно, и к уменьшению содержания ее в растении, а ато, в свою очередь, резко тормозит процессы роста. Снижается деление клеток и особенно их рост растяжением. Для различных физиологических процессов нужна разная насыщенность водой. Наибольшая насыщенность водой требуется для процессов роста. Насыщенность клетки или ткани растений водой называют гидратурой, опа выражается в процентах. За 100%-ную гидратуру принимается такая насыщенность, при которой данное тело находится в равновесии с атмосферой, имеющей 100%-ную относительную влажность. Рост клеток идет лишь в том случае, если гидратура ие падает ниже 95%). Для того чтобы поддержать такую гидратуру, точки роста надземных органов растения защищены смыкающимися листочками
<5 хорошо развитой кутикулой. Точки роста корня не имеют подобной защиты и поэтому требуют повышенной влажности почвы для своего роста.
Свет оказывает большое и разностороннее влияние па темпы и характер роста как отдельных органов, так и растительного организма в целом. При этом на разные стороны ростовых процессов влияние света проявляется неоднозначно. Так, свет необходим для протекания процесса фотосинтеза и поэтому накопление массы растения без свете не идет. Вместе с тем рост клеток растяжением и, как следствие, вытягивание растений тормозится на свету, в темноте же эти процессы ускоряются. Проростки, выросшие в темноте, всегда длиннее световых. Свет оказывает большое влияние и на формообразовательные процессы. Проростки, выросшие в темноте и на свету, имеют разную форму. Этиолированные проростки, выросшие в тем-жготе, характеризуются рядом анатомических и морфологических особенностей. В отсутствии света происходит упрощение анатомической структуры стебля. Слабо развиваются ткани центрального цилиндра, механические ткани. Растяжение клеток в темноте вдет очень иптен-сйвпо. В результате образуются длинные, вытянутые стебли. Листья редуцированы, вместо листовой пластинки образуются лишь небольшие чешуйки. Этиолированные проростки имеют слетка желтоватый оттенок. По-видимому, более быстрое вытягивание стебля и корня, этиолированных проростков выработалось в процессе эволюции, так как в большинстве случаев прорастание семяп происходит в почве в отсутствии света и эти особенности, а также отсутствие листьев облегчают проростку проникновение через слой почвы. Возможно, что вытягивание стебля в отсутствии света является следствием отсутствия ингибиторов роста. В темноте образуется много гормонов ауксинов. Нарушение соотношения ауксинов и ингибиторов вызывает несбалансированный рост.
При выходе проростков па поверхность почвы происходят их внутренние и внешние изменения. В темноте у проростков двудольных растений гипокотиль изогнут, что защищает точку роста в почве от повреждений. Под влиянием света этот изгиб выпрямляется. На свету рост стебля тормозится, рост листьев усиливается и они принимают обычную форму. Под влиянием света происходят анатомические изменения стебля, дифференцируется эпидермис, появляются волоски. Изучение влияния отдельных участков спектра из перечисленные изменения показали, что в основном они вызываются при воздействии красного света с длиной волны около 660 нм. Для того чтобы свет оказал какое-либо физиологическое влияние, он должен быть поглощен каким:-либо веществом. Таким веществом оказался пигмент фитохром. Быпо показано, что многие физиологические реакции, вызываемые облучением красным светом, можно снять при облучении дальним, красным светом (длина волны около 730 им). Эти исследования привели к заключению, что фитохром существует в двух формах, которые под влиянием облучения светом определенной длины волны могут переходить одна в другую. Фитохром, поглощающий красный свет, называют фитохром красный (Ф«), а погло-S—773 241
780
Рис. 64. Структура фитохромов.
щающий дальний красный — фитохром дальний красный (Фдк). При поглощении красного света (660 нм) Фк переходит в Фдк- А при поглощении дальнего красного света (730 нм) Фдк переходит в Фк:
красный свет
ф.. — ’ ф».
дальний неясный свет
Фдк может и самопроизвольно распадаться. В темноте Фдк или необратимо разрушается, или под влиянием дальнего красного света превращается в Фк.
Обе формы фитохрома выделены из растений — ато хромопротеиды с молекулярной массой около 120 тыс. Хромофорная часть (собственно пигмент) представляет собой вещество, близкое по структуре к фикобилинам (красным пигментам водорослей), состоящим из четырех пиррольных группировок, соединенных в открытую цепочку (рис. 64). Фдк представляет собой восстановленную форму Фк. Фк имеет голубую окраску, а Фпк — зелено-желтую. Кроме основных линий поглощения в красной и дальней красной части спектра, оба фитохрома поглощают еще синий свет с длиной волны 370 нм — Фк и 400 нм — Фдк-
Фитохромы можно обнаружить в равнинных органах растения. Физиологические проявления, которые регулируются фитохромной системой, можно отнести к фотоморфогенетическим. Основным критерием для этих реакций служит их обратимость (вызываются облучением красным светом и снимаются при облучении дальним красным светом). К реакциям, регулируемым фитохромной системой, относятся ингибирование роста стебля, открытие крючка гипокотиля,
развертывание семядолей, дифференциация эпидермиса и устьиц, образование элементов ксилемы, ориентация хлороплабтов, образование антоциана, прорастание светочувствительных семян и др. Важнейшая роль фитохрома заключается в том, что он стветстввл за фотопериодическую реакцию растений. Все процессы, регулируемые фитохромной системой, делят на два типа: 1) процессы, которые под влиянием освещения красным светом усиливаются (например, дифференциация эпидермиса, синтез антоциана, прорастание семян); 2) процессы, которые тормозятся (удлинение гипокотиля, рост стебля).
Особенности влияния красного и дальнего красного света видны при изучении прорастания светочувствительных семян (табл. 10).
Таблица 10
Прорастание семян салата после их экспозиции
на красном в дальнем краевом свете (по Бортсвику)
Экспозиции Прорастание, в %
Темнота 8,5
Красный 08,0
К, дк 54,0
К, дк, к 100,0
К, дк, к, дк 43,0
К, ЦК, к, дк, к 09.0
Рассмотрение данных таблицы показывает, что благоприятное действие па прорастание красного света снимается облучением дальним красным.
Механизм действия фитохрома до настоящего времени не разгадан. Активной формой фитохрома является Фдк, именно его образование, которое происходит под влиянием облучения красным светом, вызывает определенный физиологический эффект. В самом общем виде это может быть представлено следующим образом:
Красный свет
Фк —--------> Флк биологический эффект
Таким образом Фдк, образуется при облучении красным светом и вызывает определенную физиологическую реакцию. Однако и ФДк не весь участвует в реакциях, а лишь его определенная часть. Возможно, что вта активная> часть Фцн связана с мембранами и определенным образом ориентировала в них. В этой связи представляют интерес данные немецкого физиолога Гаупта, согласно которым хло-ропласты ориентируются под прямым углом по отношению к лучу красного света. При этом луч может быть диаметром всего 3 мк и прямо не попадать на хлорошгасты. Из этого можно сделать вывод, что фитохром локализован по преимуществу в плазмалемме, при этом каждая форма фитохрома определенным образом ориентирована в плазмалемме при освещении определенными лучами спектра. Эта
ориентация меняется, что и вызывает изменение ориентации хлор0-пластов.
Накопление Фдк в мембранах влияет на их проницаемость, заряд, что, в свою очередь, может вызвать определенный биологический эффект. Возможно, что дальнейшее действие фитохрома включает новообразование фитогормонов и активацию (дерепрессию) части генома. Эта точка зрения выдвигается немецким физиологом Мором п подтверждается тем, что при добавлении ингибиторов синтеза белка и РНК действие красного света ие проявляется. Показано также, что красный свет индуцирует образование ряда фермепто*!-Ответная реакция, вызываемая Фдк или его особой формой, зависит от состояния клетки или ткани, от ее компетентности.
Фитохромная система, по-видимому, очень древняя, так как она имеется даже у сипе-зелепых водорослей и у некоторых гетеротрофных организмов.
Говоря о воздействии света, необходимо остановиться на влиянии круглосуточного освещения иа процессы роста. Опыты по выращиванию растений при свете алектрвческих ламп (светокультура) доказали, что рост многих растений при круглосуточном освещении идет значительно интенсивнее, особенно при правильном подборе качества света (тип ламп). Так, ври выращивании сеянцев древесных культур (дуб, сосна) на непрерывном освещении темпы их роста возрастают в 1,5—2 раза (В. М. Леман). Такие однолетние растения, как горох и фасоль, также характеризуются очень интенсивным ростом в условиях круглосуточного освещения. Однако есть растения, па рост которых круглосуточное освещение оказывает отрицательное влияимо. К таким растениям относятся овес, ячмень и др. В некоторых случаях круглосуточное освещение вызывает явления, сходные с теми, которые обычно являются следствием недостатка света. Такие растения, как томаты, в условиях непрерывного освещения вытягиваются, листья становятся желтыми, хлорофилл разрушается. Это явление называют зеленой этиоляцией. Особенно вредное влияние круглосуточного освещения проявляется при высокой ночной температуре.
Снабжение кислородом. Процессы роста требуют затрат энергии, источником которой служит процесс дыхания. В этой связи понятна необходимость кислорода. При снижении концентрации кислорода ниже 5% рост тормовится. Это происходит не только из-за нарушения енергетического баланса, но и в силу накопления продуктов анаэробного обмена (спирт, молочная кислота).
Минеральное питание. Для нормального протекания ростовых процессов необходимо достаточное снабжение всеми необходимыми ми-перальвыми элементами. Особенно специфична роль снабжения растений азотом. Это снизано с тем, что образование двух основных групп гормонов, регулирующих ростовые процессы (ауксидов и цитокининов), зависит от содержании азота.
7. ГОРМОНЫ РОСТА РАСТЕНИЙ [ФИТОГОРМОНЫ)
Для многоклеточных организмов характерен такой тип регуляции, который связан с взаимодействием между отдельными клетками, тканями или даже органами. Для осуществления такой регуляции в организме растений вырабатываются гормоны. Гормоны растений получили название фитогормонов. Фнтогормоны — ато вещества, действующие в ничтожных количествах, образующиеся в одних органах и оказывающие регуляторное влияние па какие-либо физиологические процессы .в других органах растения. Большинство физиологических процессов, в первую очередь рост и развитие растении, регулируется гормонами. Гормоны играют ведущую роль в адаптации растений к условиям среды. Известны четыре группы фптогор-монов — ауксины, гиббереллины, кинины, ингибиторы роста (абсцизовая кислота, кумарин).
Ауксины
Ауксины — это вещества индольной природы- Основным фитогормоном типа ауксина является ₽-индолилуксусная кислота (ПУК). Открытие ауксинов связано с исследованиями Ч. Дарвина (I860). Дарвин установил, что, если осветить проросток влака с одной стороны, он изгибается к свету. Однако если на верхушку проростка надеть непроницаемый для света колпачок и после этого поставить в условия одностороннего освещения, изгиба пе происходит. Таким образом, органом, воспринимающим одностороннее освещение, является верхушка растения. Сам изгиб происходит в нижней части проростка. Из этого Ч. Дарвин заключил, что в верхушке проростка под влиянием одностороннего освещения вырабатывается вещество, которое передвигается внив и вызывает изгиб. Идеи Ч. Дарвина получили развитие лишь через 50 лет в работах датского исследователя П. Бойсен-Иенсена, который полазал, что если срезанную верхушку вновь наложить на колеоптиль через слой желатины, то при одностороннем освещении наблюдается изгиб к свету. Было показано также что удаление верхушки проростка (декапитация) резко замедляет рост нижележащих клеток, находящихся в фазе растяжения. При обратном накладывании верхушки проростка через слой желатины или агар-агара рост нижележащих клеток возобновляется. Далее оказалось, что, если срезанную верхушку поместить на блок из агар-агара, а затем наложить этот блок на декапитированный колеоптиль, рост возобновляется. Если агаровый блок, па котором в течение некоторого времени была помещена верхушка колеоптиля, наложить па обезглавленный колеоптиль асимметрично, то происходит изгиб, причем более интенсивно растет та сторона, на которую наложен блок. Все ати опыты привели к выводу, что в верхушке проростков вырабатывается особое вещество, которое, передвигаясь к нижележащим клеткам, регулирует их рост в фазе растяжения. Поскольку это вещество вырабатывается в одной части растения, а вызывает физио
логический эффект в другой, оно было отнесено к гормонам роста растения — фитогормонам.
Исследования, проведенные советским академиком Н. Г. Холодным, показали, что рост различных видов растений, а также различных органов одного и того же растения регулируется одним и тем же гормоном — ауксином. Оказалось, что фитогормоны типа ауксл-па — р-индолилуксусная кислота- (ИУК) и некоторые близкие к ней соединения — широко распространены в растениях. Наиболее богаты ауксинами растущие части растительного органиэма: верхушки стебля, верхушки корня, молодые растущие части листьев, почки, завязи, развивающиеся семена, а также пыльца. Образование ауксинов в большинстве случаев идет в меристематических тканях. Ауксины легко передвигаются из верхушки стебля вниз к его основанию, а из верхушки корня вверх, т. е. полярно. Полярное передвижение ауксинов идет по флоэме с большой скоростью, значительно превышающей скорость обычной диффузиц, следоватеньно, это активный процесс, требующий ватраты энергии. Недостаток кислорода, торможение процесса дыхания с помощью различных ингибиторов приостанавливают передвижение ауксинов. По-видимому, передвижение ауксинов и углеводов имеет сходный механизм. Во взрослом дифференцированном растении при высокой концентрации гормона может наблюдаться и неполярное передвижение ауксинов вверх по растению с током воды по ксилеме.
Основным ноточником для образования р-индолнлуксусной кислоты (ИУК) является аминокислота триптофан. В свою очередь, триптофан образуется из шикимовой кислоты (рис. 65). Шикимовая кислота является предшественником не только триптофана и через него ИУК, по и кумарина — одного из ингибиторов роста растений.
Содержание ИУК вависит ие только от скорости образования, но и ст быстроты разрушения. Основным ферментом разрушения ИУК является ИУК-оксидаза (ОИУК). Можно полагать, что в некоторых случаях отсутствие влияния ИУК, впесеиной извне, связано с быстрым ее окислением ИУК-оксидазой. Наряду с ферментативным окислением ИУК большое значение имеет ее разрушение на свету (фо-тооксислелие). Особенно сильное разрушающее действие на ИУК имеют ультрафиолетовые лучи с длиной волны около 280 им. Внешние условия оказывают значительное влияние на образование ИУК. Показано, что образование ИУК зависит от снабжения растения азотом, обеспечения растения водой. Растения, бесперебойно снабжаемые водой, содержат большое количество ауксинов. Содержание ауксинов различно у зеленых и этиолированных растений. Освещение уменьшает содержание ауксинов, а затемнение увеличивает. Большое влияние на содержание ауксинов оказывает эпифитнал микрофлора. Под влиянием микроорганизмов содержание ауксинов у высшего растения заметно возрастает. Таким образом, содержание ауксинов, как и других фитогормонов, сильно изменяется в эависимости от условий. По-видимому, именно через изменение содержания фитогормонов осуществляется первоначальное влияние условий внешней среды на процессы обмена веществ и рост. Содержание ауксинов
Триптофан
Индолилимино-пролионовая кислота
Индолйлпиро-
В ИИ оградная инслота
—СН2СНО
.«п
-CHjCOOFl
МН
Иидолилацетальдегид
,/МИндолилуксусная кислота
Рис. 65. Биосинтез ₽-инлолилуксуснои кислоты.
меняется и в процессе онтогенеза растительного организма. Обычно в листьях максимум содержания ауксинов наступает в фазу бутонизации или цветения. Распускающиеся почтой, прорастающие семена содержат большое количество ауксина. В период, когда процессы роста прекращаются (период покоя), содержание ауксинов падает (В. И. Кефели). Как правило, между содержанием ауксинов и скоростью роста клеток имеется прямая зависимость. Она хорошо проявляется и при внесении ауксинов извне. В целом регуляция образования и разрушения ИУК — это один из способов регуляции ее содержания, а следовательно, и процессов роста.
Согласно современным представлениям для проявления активности ауксинов необходимо создание комплекса с белком-рецептором ( гормонрецепторный комплекс). В этой связи большое значение имеет способность ауксинов (ИУК) обравовывать связи с различными соединениями, в частности с белками.
Наиболее ярким проявлением физиологического действия ауксина является его влияние на рост клеток в фазе растяжении, Под влиянием оптимальной концентрации ИУК рост в длину отрезков стеблей гороха увеличивается более чем в два раза. Ауксины в некоторых случаях стимулируют деление клеток, например, камбия. Под влия-
нием ауксинов может измелиться направление дифференциации клеток. Таким образом, все проявления роста клеток находятся в определенной зависимости от содержания природных ауксинов. Большую роль играют ауксины при разрастании завязи и плодообразовапии. Ауксины, так же как и другие фитогормоны, обусловливают взаимодействие отдельных органов растения (коррелятивный рост). Действие ауксина находится в зависимости ст его концентрации. Повышение концентрации ауксина выше оптимальной вызывает торможение роста. При атом для разных растений и для неодинаковых органов оптимальная концентрация ауксииа резко различна. Одна и та асе концентрация его может усилить рост одних органов и затормозить другие. Так, оптимальная концентрация для роста стебля составляет около 10 мг ИУК, тогда как для корня всего 0,01 мг на 1 кг массы растения. Сходная картина имеется для разных видов растопий. Кон-(ентрация ауксинов, усиливающая рост злаков, резко тормозит рост гегогих двудольных растений.
Имеются многочисленные данные, что ауксины являются регу-ъяторалш притока воды и питательных веществ. Увеличение притока воды под влиянием ауксина можно легко наблюдать при изучении его влияния на рост клеток в процессе растяжения.
Гормоны типа ауксина влияют на распределение питательных веществ в растении (Н. А. Максимоа, Н. И. Якушкина). При внесении извне ауксинов или их синтетических аналогов сии концентрируются в отдельных органах и клетках. Это вызывает приток к этим органам воды и питательных веществ и, как следствие, их усиленный рост. Одновременно рост других органов, содержащих меньше ауксипов, ослабляется, поскольку питательные вещества к пим поступают в меньшем количестве. Так, при обработке фитогормонами типа ауксина цветков томата происходит усиленное разрастание аавязей, приток к ним питательных веществ значительно повышается, а рост боковых побегов тормозится. Общий вынос питательных веществ при атом не изменяется. Из атих опытов следует, что’гормопы типа ауксина вызывают перераспределение питательных веществ в растении. В некоторых случаях ауксин может вызвать усиление притока питательных веществ и из внешней среды.
Существуют разные гипотезы, объясняющие действие ауксина на передвижение веществ. Нс вызывает сомнения, что транспорт веществ по растительному организму определенным образом связан с напряженностью енергетического обмена. Еще в 1933 г, появились исследования, показывающие, что под влиянием ауксина интенсивность дыхания растет. В отсутствии кислорода действие ауксина или не проявляется, или значительно ослабевает. На различных объектах установлено, что влияние ауксина на повышение интенсивности дыхания опережает во времени его действие на ростовые процессы. Под влиянием ИУК возрастает сопряженность окисления и фосфорилирования (коэффициент P/О) и содержание в клетках АТФ. Это дает основание считать, что ИУК увеличивает анергетическую эффективность дыхания растений (И. И. Якушкина, И. А. Кулакова). Под влиянием ИУК возрастает и энергетический заряд клетки (отноше-248
ние АТФ+АДФ к АМФ). Известно, что даже небольшие сдвиги в энергетическом потенциале клетки приводят к заметным изменвииям в скорости различных ферментативных реакций. Положительные сдвиги в энергетическом обмене вызывают усиление передвижения питательных веществ и воды, что является одной из причин усиления роста растений. Решение вопроса о причинах усиления образования АТФ под влиянием ИУК связало с изучением первичных механизмов регуляторного влияния этого фитогормона (с. 257).
Гиббереллины
Открытие гормонов растений — гиббереллинов — связано с изучением болезни риса. В юго-восточных странах, в частности в Японии, распространена болезнь риса «Баковое», или болезнь дурных побегов. У растений, пораженных этой болезнью, вытянутые бледные побеги. Японские ученые показали, что эта болезнь вызывается выделением грибка Cibberella fujikuroi. Из выделений этого грибка было получено кристаллическое вещество — гиббереллин. В дальнейшем гиббереллины оказались широко распространенными среди растений веществами, обладающими высокой физиологической активностью и являющимися подобно ауксинам естественными фитогормонами. В настоящее время известно более 40 веществ, относящихся к группе гиббереллинов. По химической структуре — это тетрациклические карбоновые кислоты. Наиболее распространенный гиббереллин As — гибберелловая кислота (ГК). Остальные гиббереллины различаются в основном по структуре боковых цепочек. Растения на разных этапах онтогенеза могут различаться по набору гиббереллинов. Хотя все гиббереллипы отличаются одинаковой направленностью фивыологического действия, однако их активность может быть различной. Гиббереллины могут образовываться в разных, по преимуществу растущих частях растительного организма. Все же основное место образования гиббереллинов — это листья. По-видимо-му, гиббереллины существуют в двух формах — свободной и связанной. Нередко наблюдаемое повышение содержания гиббереллинов саязано с переходом: их из связанной в свободную (активную) форму. В отличие от ауксинов гиббереллины передвигаются по растению как вверх, так и вниз, как по ксилеме, так и по флозме. Это пассивный процесс, не связанный с метаболизмом.
Образование гиббереллина идет путем превращения мевалоновой кислоты в- герапил-гераниол и далее через каурен в гибберелловую кислоту (рис. 66). Мевалоновая кислота является предшественником как гиббереллина, тая и важнейшего’ природного ингибитора роста абсцизовой кислоты. Внешние условия оказывают влияние на образование и содержание гиббереллиноподобных веществ (ГПВ) в растении. Во многих случаях под влиянием одного и того же внешнего фактора содержание ауксинов и ГПВ изменяется противоположным образом. Так, освещение увеличивает содержание ГПВ и уменьшает содержание ауксина. Большое влияние на содержание ГПВ оказывает качество света. При выращивании растений па крас-
он
Сю-гиббереллины (Аа) Сад-гиббереллины (А12)
Наурен
Рис. 66. Биосинтез Гиббереллинов.
пом свете в них содержится больше ГПВ по сравнению с выращиванием на синем свете. Улучшение питания растений азотом увеличивает содержание ауксинов, а содержание гиббереллинов при этом снижается. Противоположные изменения в содержании ауксинов и ГПВ позволяют предполагать, что и в образовании этих двух фито-гормонов имеется общий предшественник. Им может быть ацетил-КоА. При его участии образуется как мевалоновая, так и кетоглута-ровая кислота. Последняя является одним из предшественников при образовании ауксина. В некоторых случаях наблюдается одновременное падение содержания как ауксиноа, так и ГПВ. Уменьшение влажности почвы, выращивание растений в стерильных условиях снижают содержание как того, так и другого фитогормопа. Содержание ГПВ меняется в процессе онтогенеза растительного организма. Очень сильно возрастает содержание ГПВ в процессе прорастания семян. Возможно, что в отом случае гиббереллины переходят из связанного в свободное состояние. Содержание ГПВ в листьях разных растений (кормовых бобов, сои, картофеля) в процессе их онтогенеза изменяется в соответствии с одновершинной кривой, возрастая вплоть до цветения, а затем уменьшаясь.
Наиболее общим и ярким проявлением физиологического действия гиббереллина является его способность резко усиливать рост стебля у карликовых форм различных растекнй, Считается, что карликовость — это результат изменения (мутации) в одном гене. Возможно, что именно этот ген ответствен за образование гиббереллина,
или, точнее, за образование фермента, катализирующего одну из ступеней его синтеза. Однако некоторые исследователи полагают, что карликовые мутанты содержат ингибиторы роста и внесение гиббереллина лишь нейтрализует их действие. Обычно карликовость выражается в уменьшении длины междоузлий стебля при сохранении их числа. Обработанные гиббереллином карликовые растения выравниваются по высоте с нормальными, однако в последующих поколениях карликовость продолжает сохраняться.
Гиббереллины заметно усиливают вытягивание стебля у многих неповрежденных растений. Так, высота стебля конопли под влиянием опрыскивания гиббереллином увеличивается примерно на 30— 50%. Существует определенная зависимость между скоростью роста стебля растений и содержанием ГПВ. Так, содержание ГПВ и ход роста стебля конопли хорошо коррелируют друг с другом. Это свойство позволяет некоторым исследователям считать гиббереллин гормоном роста стебля. Увеличение роста стебля происходит как за счет усиления деления клеток, так и за счет их растяжения. С ростом стебля и выходом растения из розеточного состояния (стрелкованием) связано влияние гиббереллина на зацветание длиннодневных растений в условиях короткого дня. ГПВ накапливается в почках при выходе из покоящегося состояния. В соответствии с атим обработка гиббереллином вызывает прерывание покоя у почек. Сходная картина наблюдается па семенах. При выходе семян из покоящегося состояния в них накапливаются ГПВ. Обработка гиббереллином может заменить воздействие красного света при прорастании светочувствительных семян. По-видимому, при разных проявлениях гиббереллины действуют разным путем (поливалентно). При действи-гиббереллинов возрастает общая масса растительного организма, спс собствуя не перераспределению питательных веществ, а общему и накоплению. Гиббереллин усиливает процесс фотосинтетического фос форилироваяия. Показано, что листья, содержащие большое количество ГПВ, характеризуются более интенсивным фотосинтетическим фосфорилированием. Обработка гиббереллином повышает интенсивность фотофосфорилирования при одновременном снижении содержания хлорофилла. Следовательно, под влиянием гиббереллина повышается интенсивность использования единицы хлорофилла, возрастает ассимиляционное число. При рассмотрении процесса фотосинтеза указывалось, что имеются два типа фотофосфорилирования— циклическое и нециклическое. Оказалось, что гиббереллин повышает интенсивность нециклического фотофосфорилирования и, как следствие, основных продуктов этого процесса (АТФ и НАДФ-Hj) (Н. И. Янушкина, Г. П. Пушкина). Имеются данные, что ГПВ накапливаются в хлоропластах. На свету влияние гиббереллина, внесенного извне, смазывается сильнее. Все это указывает на значение гиббереллина для регуляции процесса фотосинтеза. Использование па процессы обмена АТФ, образовавшейся в митохондриях (окислительное фосфорилирование) и в хлоропластах (фотосинтетическое фосфорилирование), различно. С этим отчасти межет быть связано и различное влияние гиббереллина и ауксина.
В темноте гиббереллин воздействует лишь па растяжение клеток, не вызывая возрастания интенсивности их деления (К. 3. Гамбург). Можно полагать, что в темноте гиббереллин влияет косвенно через изменение уровня содержания ауксинов.
Цитокинины
Ауксины и гиббереллины могут при некоторых условиях стимулировать деление клеток, однако их скорее можно назвать гормонами, регулирующими рост растяжением. Цитокинины — это фитогорме-ны, регулирующие в первую очередь деление клеток. Открытие цитокининов связано с обширными исследованиями по выращиванию каллюса, образовавшегося иа изолированной ткани сердцевины стебля табака на питательной среде (Ф. Скуг и Миллер). Было показало, что клетки каллюса в стерильной культуре через определенный промежуток времени прекращают деление. Однако при добавлении к' питательной среде производных ДНК, получающихся после ее автоклавирования, деление клеток возобновляется. В 1955 г. было выделено активное начало — 6-фурфуриламинопурин, названное кинетином. 6-фурфурннаминопурни в растениях пе встречается. Однако в растениях были найдены близкие химические соединения, регулирующие процесс деления клеток, — цитокинины. Один из цитокининов, выделенный из кукурузы, был назван веатином. Все известные цитокинины — это производные пуриновых азотистых осиозалий, а именно адепина, в котором аминогруппа в 6-м положении замещена различными радикалами (рис. 67). Цитокинины образуются в корнях и передвигаются в надземные органы по ксилеме. Нанесенные па лист синтетические цитокинины передвигаются плохо.
О путях биосинтеза и распада цитокининов известно мало. Невидимому, пуриновое кольцо синтезируется и разрушается обычным путем. Изопентаииловый остаток может образовываться из мевалоновой кислоты.
В литературе мало даппых по влиянию условий среды па образование цитокининов. Имеются "лишь сведения, что отзывчивость па цитокинины выше, если' растения испытывают недостаток азота. Из этого можно заключить, что улучшение питания растений азотом усиливает образование цитокининов. Высказывается предположение, что цитокинины регулируют последнюю стадию делепия, а именно цитокинез (деление самой клеши). Цитокинины в определенных условиях стимулируют и рост клеток в фазу растяжения, Подобно ауксину они оказывают влияние на направление дифференциации плеток и тканей. Влияние цитокининов проявляется главным образом при нультуре изолированных тканей, причем в основном па фойе добавления в среду ауксина (ИУК).
В опытах К. Тимана обработка пазушных почек гороха растворами кинетина устраняла тормозящее влияние верхушечной почки, вызывая их рост. В этом случае цитокинины являются как бы антагонистами ауксинов, которые задерживают рост боковых побегов (апикальное доминирование). Цитокинины задерживают старение 252
3
Рис. 67. Основные представители цитокининов. Синтетическое:
I — кинетин; В—в-бепзилаывпоггурин. Природный: « — веатвн.
листьев. Одним из показателей процесса старения является разрушение хлорофилла. Так, если срезанные листья табака выдерживать во влажной атмосфере, они постепенно желтеют. Анализы показывают, что в пих происходит разрушение хлорофилла и белка. Обработанные кинетином листья остаются в течение долгого времени зелеными. Кинетин не только задерживает распад белка и хлорофилла, но и стимулирует синтез этих соединений (омолаживающее влияние).
Цитокинины, подобно ауксинам, усиливают передвижение веществ к обогащенным ими тканям (аттрагирующее влияние). Так, в опытах немецких физиологов К. Мотеса и Л. Энгельбрехт показано, что аминокислоты и углеводы перетекают из необработанной половины листа к половине, которая обогащена кинетином. Это проявляется как на изолированных листьях, так и на интактных растениях. Кинетин, в отличие от гиббереллина, вызывает усиление процесса циклического фотофосфорилирования, как следствие, содержание АТФ растет. Разный характер действия гиббереллина и кинетина проявляется и в ряде других особенностей. Так, цитокинины повышают содержание хлорофилла, ускоряя образование его предшественника — протохлорофиллида. Цитокинины оказывают влияние па
Рис. 68. Ингибиторы роста:
!— кумарин; В—авсцизоаая кислота^
ультраструктуру хлоропластов. Опыты советского физиолога О. Н. Кулаевой показали, что обработка кинетином ускоряет дифференциацию пластид, образование в них мембран и гран. Благодаря тому что гиббереллин и кинетин стимулируют разные типы фотосинтетического фосфорилирования, при их совместном применении ни-тепсяфикация этого процесса проявляется с большей силой, чем при применении каждого фитотормоиа в отдельности. Синергизм кинетина и гиббереллина проявляется во влиянии их па изменение фотосинтеза и сухой массы растений.
Ингибиторы роста
Существует ряд природных соединений, которые ингибируют рост растительных организмов. Присутствие ингибиторов роста предупреждает слитком сильное вытягивание растений. Именно их наличие приводит к сбалансированному росту (В. И. Кефели, Р. X. Турецкая). Накопление ингибиторов роста способствует переходу растений в состояние покоя, вызывает опадение листьев и других органов.
Ингибиторы роста можно разделять на две группы — терпеноидные и фенольные (рис. 66). Наибольшее значение имеет ингибитор роста, относящийся к терпеноидам, — вто абсцизовая кислота (АБК).
В растительном организме АБК образуется из мевалоновой кис-поты через изопентенилпирофосфат. Таким обравом, путь образования АБК идет вначале через те же этаны, что и образование фитогормона гиббереллина. Во многих случаях АБК и по своему действию является антагонистом гиббереллина. АБК содержится в различных органах растений, особенно в состоянии глубокого покоя. Она обнаружена в почках, сухих семенах, в клубнях картофеля. Баланс между фитогормонами и абсцизовой кислотой определяет способность данного органа к росту и морфогенезу. Имеются данные, что накопление АБК вызывает закрытие устьиц. Под влиянием АБК резко уменьшается проницаемость мембран, что, по-видимому, оказывает разностороннее тормозящее влияние на процессы обмена.
Фенольные ингибиторы роста были открыты при изучении прорастания семян равных растений. Было замечено, что в Семёнах, особенно в покровах семян и в плодах (мякоть плодов), имеются вещества, тормозящие процесс прорастания. Некоторые из этих веществ были выделены и идентифицированы. Это оказались кумарин, кума-ровая кислота, скополетин и др. Фенольные ингибиторы, в отличие от абсцизовой кислоты действуют в значительно более высоких концентрациях (примерно в 100—1000 раз больше). Подобно абсцизовой кислоте фенольные ингибиторы накапливаются в различных органах растения в период перехода их в состоянне покоя. Большее содержание фенольных ингибиторов характерно для стареющих организмов. Важнейшей физиологической особенностью ингибиторов этого типа является то, что они уменьшают содержание фитогормонов с положительным знаком действия, в частности подавляют биосинтез ИУК и стимулируют процесс ве разрушения.
Установлено, что фенольные ингибиторы, в частности кумарин, оказывают влияние и через изменение энергетического обмена, нарушая сопряжение окисления и фосфорилирования в митохондриях. На свету под влиянием кумарина нарушается процесс фотофосфорилирования (Н. И. Якушкина, В. Т. Старикова). При этом фенольные соединения обнаружены непосредственно в хлоропластах. Некоторые фенольные соединения в определенных концентрациях и при определенных условиях могут вызывать стимуляцию роста.
Взаимодействие Фитогормонов
Рост растений и формообразовательные процессы регулируются определенным соотношением фитогормонов. Если бы появление каждого нового органа, каждый морфогенетический процесс требовали бы своего гормона, то должно было бы быть множество гормонов. Вместе с тем из двух или трех веществ можно создать бесчисленное множество различных соотношений. При этом появление каждого органа, направление и темпы роста будут определяться именно этим определенным соотношением. Значение соотношений между ауксином и кинетином хорошо показано в опытах с выращиванием пволи-_ -г - ауксин
рованных тканей. Увеличение в питательной среде отношения----
кинетин приводит к тому, что из массы недифференцированных клеток (каллюса), выращиваемых в стерильных условиях, дифференцируется корень. Уменьшение указанного соотношения приводит к дифференциации побегов (рис. 69).
На разных этапах онтогенеза под влиянием различных условий внешней среды соотношение фитогормонов меняется и именно это изменяет скорость и направление роста и морфогенеза растительных организмов. Отдельные фитогормоны, а также фитогормоны и ингибиторы роста в процессе своего образования проходят через одни и те же реакции, имеют общих предшественников. Это приводит к существованию метаболических вилок, в результате чего в зависимости от условий идет образование одного или другого вещества. Нельзя
ИУК ЗхНГ6 ЗХ1О~Б Зх10~8
Кинетин 2х10~7 2*1СГВ fxfO ~8
Регенерация
Рас. 69. Зависимость регенерации культуры ткани сердцевины табака от соотношения фнтогормонов.
также не учитывать, что одни гормоны могут оказывать влияние на ферменты, катализирующие синтез или разрушение других гормонов, и тем самым изменять их содержание. Вместе с тем каждый иг* фитогормонов играет свою специфическую роль в процессах обмена, хотя внешнее проявление их действия может быть одинаковым (рост клеток растяжением, деление каеток и др.). В этой связи пе всегда бывает просто выяснить, является ли данное проявление прямым результатом действия определенного фитогормона или косвенным (через уменьшение или увеличение содержания другого фито— гормона). Природные ингибиторы роста также могут затормаживать какие-то звенья обмена веществ или уменьшать содержание фитогормонов.
Механизм действия фитогормонов
Все фитогормоны регуанруют в основном процессы роста (деление, растяжение или дифференциацию, новообразование отдельных, органов, накопление массы). Рост требует затраты энергии. Все фи— тогормоны оказывают влияние на напряженность энергетического обмена. Не исключено, что изменение энергетического обмена не единственное эвено, через которое фитогормоны влияют на ростовые процессы. Фитогормоны — это как бы звено, связывающее обмен веществ, обмен знергии и формообразовательные процессы.
Изменение любого процесса обмена, в том числе и эпергетическо-го, тесно связано с ферментами. По-видимому, фитогормопы регулируют новообразование белков-ферментов. Действительно, действие фитогормонов тесно связано с синтезом белков. Так, ингибиторы процесса синтеза белка (хлорамфеникол) тормозят влияние ИУК на рост клеток. Концентрации ауксина, стимулирующие ростовые процессы, увеличивают образование как РНК, так и белка, а концентрации, тормозящие рост, уменьшают содержание этих соединений. Необходимо отметить, что при погружении отрезков стеблей в раствор с такой концентрацией, при которой рост клеток невозможен, ИУК продолжает вызывать усиление образования РНК. Это доказывает, что влияние ИУК па РНК предшесгиует влиянию ее па рост. Прямые определения показали, что ИУК ускоряет процесс транскрипции и образование РНК на ДНК-матрице (Т. В. Лихолат).
Что касается гиббепеллина, то не вызывает сомнения, что под его влиянием происходит новообразование белков-ферментов. В опытах с семенами ячменя показано, что при намачивании в воде эндосперма, лишенного зародыша, пе происходит возрастания активности фермента а-амилазы. Добавление к эндосперму гиббереллина приводит к резкому повышению актизности как а-амилазы, так и протеаз-Добавление ингибитора синтеза и-РНК па ДНК-матрице актиноми-цина-Д полностью снимает влияние гиббереллина на активность ферментов. Под влиянием гиббереллина увеличивается количество и-РНК, ответственной за синтез белка а-амилазы.
Много данных и о связи действля цитокининов с синтезом белка. Обработка кинетином стареющих листьев пе только задерживает распад белка, но и увеличивает его образование. Показано, что под влиянием цитокининов возрастает количество всех видов РНК. Вов можно влияние цитокининов на уровне транскрипции. В исследовани ях О. Н. Кулаевой с сотрудниками показана прямая стимуляция под влиянием цитокинина активности выделенного хроматина. Поскольку новообразование белков-ферментов закодировано в генбме клетки, то ето позволяет предположить осуществление гормональной регуляции на уровне гена (транскрипция) или на уровне рибосом (трансляция). Возможно, что фитогормопы, подобно гормонам животных организмов, регулируют дифференциальную активность генома и тем самым влияют на новообразование соответствующих белков-ферментов.
Уточнение вопроса о механизме гормональной регуляции активности генов усложняется тем, что строение генбма для эукариот до сих пор не выяснено. Согласно гипотезе, выдвинутой севетским ученым Г. П. Георгиевым, каждый оперон состоит из нескольких структурных генов (рис. 70). Важной чертой предложенной схемы является то, что акцепторная зона (оператор) имеет сходное строение у разных оперопов Вместе с тем один опероп может иметь несколько операторов или акцепторных зон. В результате первой особенности один и тот же индуктор-гормоп может вызывать образование целого ряда белков-ферментов. Вторая особенность приводит к тому, что разные индукторы-гормолы могут дерепрессировать одни и
Рис. 70. Действие фитогормонов на уровне гена (по О. Я. Кулаевой):
ФГ — фитогормоны; а—акцепторные локусы;
С — структурные гены.
те же участки ДНК и, следовательно, вызывать образование одних и тех же белков-ферментов. Обе эти особенности проявляются при действии фитогормонов. Таким образом один и тот же фитогормон может являться дерепрессором различных участков генома и вызывать новообразование целого ряда белков-ферментов. Разные фито-гормоны могут индуцировать образование одинаковых белков-ферментов. Действие фитогормонов на процесс транскрипции может осуществляться не только путем регуляции дифференциальной активности генбма. Возможно, что фитогормоны влияют на структурную организацию генома, облегчая доступ к ДНК фермента РНК-полиме-разы. Некоторые гормоны изменяют активность самого фермента РНК-полимерезы. В частности, это показано для гиббереллина. Действие фитогормонов на новообразование белков-ферментов может осуществляться и на уровне трансляции. В последнее время проведен ряд исследований, показавших, что под влиянием цитокинина повышается функциональная активность рибосом, а также их число, что и приводит к возрастанию синтеза белков-ферментов на уровне тревсляции. Возможно, что фитогормоны могут регулировать процесс поступления в цитоплазму и-РНК, а также время ее жизни.
Для проявления активности фитогормоны должны предварительно взаимодействовать с определенными белками-рецепторами. По дан-258
ным Т. В. Лихо лат, ИУК повышает активность хроматина лишь после инкубации с фракцией мембран, так как в мембранах локализован белок-рецептор, после взаимодействия с которым фитоторыоны приобретают способность активировать определенные участки генома.
В настоящее время большое внимание уделяется возможности влияния фигогормонов через изменение свойств мембран, в частности для ауксина, через гиперполяризацию мембрен. Как известно, в дыхательной цепи создается градиент ионов водорода и одновременно разность влектрических потенциалов, по разные стороны мембраны. По данным советского физиолога В. В. Полевого, при взаимодействии ИУК с мембранами происходит увеличение выброса иопов водорода на их наружную поверхность или активация протонной помпы. Мембраны гиперполяризуются. Это может привести к различным последствиям.
1) Возможно непосредственное влияние водородных ионов на клеточную стенку. В результате подкисления тахеточной оболочки и обратного транспорта ионов Са активируются ферменты, ее разрыхляющие. Клеточная оболочка изменяется, становится более властич-пой и под действием тургорного давления растягивается. После разрыхления клеточной оболочки начинается собственно ее рост. Размягчение клеточной стенки под влиянием ауксина наступает очень быстро. Собственно рост оболочки требует довольно значительного времени и связан с биосинтезом полисахаридов. Полагают, что влияние ауксина на синтез веществ клеточной стенки осуществляется через регуляцию новообразования соответствующих ферментов. В этом случае действие фитогормопа проявляется на уровне генов.
2) Гиперполяризация мембран митохондрий может также явиться причиной увеличения синтеза АТФ в процессе окислительного фосфорилирования. Образовавшаяся АТФ, помимо непосредственного использования на различные синтезы, может служить источником обравования циклической аденозинмонофосфорной кислоты. Циклическая АМФ образуется из АТФ- при участии связанного с мембранами фермента аденилатциклазы. Циклическая аденозиимонофосфор-ная кислота по аналогии с животными организмами может явиться регулятором активности гепома у растений. При участии этого соединения происходит фосфорилирование гистонов. Между тем, по-видимому, именно белки гистоны являются репрессорами активности ДНК. Фосфорилирование меняет их конфигурацию, при этом теряется способность ингибировать процесс транскрипции. Есть данные, что циклическая АМФ может заменить гиббереллин при его действии на индукцию образования а-амилазы. Фитогормоны, по-видимому, могут оказывать различное влияние во времени. Некоторые проявления действия фитогормонов наступают очень быстро, уже через минуту после их внесения, когда их влияние через изменение активности генома не может еще проявиться. В этом случае основное значение приобретает их непосредственное влияние на мембраны. Однако есть гормональные эффекты, проявляющиеся через более длительные
промежутки времени, при осуществлении которых гормоны могут влиять уже как регуляторы генной активности.
Изложенный материал показывает, что под влиянием условий среды, а также в зависимости от свойств данной клетки (ее местоположения) в ней создается определенное соотношение гормонов. Это, в свою очередь, определяет темпы ее роста и дифференциацию. Сама клетка определенным образом реагирует на полученную ею генетическую информацию. На одной фазе роста и развития поступающие в клетки ферменты могут вызвать одну реакцию, а на другой фезе те же ферменты — иную.
Применение фитогормонов в практике растениеводства
Для успешного практического применения всех фитогормопов пли их синтетических ваменителей необходимо соблюдение определенных основных условий. 1. Фитогормоны оказывают влияние лишь тоцца, когда в растении их недостает. Это чаще всего наблюдается в особые, переломные моменты жизни растительного организма (прорастание семян, цветение, образование плодов), а также когда нарушена целостность растительного организма (черзики, изолированные ткани). В некоторых случаях условия внешней среды препятствуют образованию гормопов, тогда этот недостаток может быть восполнен их экзогенным внесением. 2. Клетки, ткапп, органы должны быть компетентны (восприимчивы) к фитогормопам. Компетенция связена с общим состоянием внутриклеточных процессов. Клетка может быть на одной фазе роста компетентна к внесению данного фнтогормопа, а па другой — пет. 3. Необходимо достаточное снабжение растения водой и питательными веществами. 4. Действие всех гормонов зависит от концентрации. Повышенная концентрация сверх •определенного уровня вызывает пе стимуляцию, а резкое торможение роста и даже гибель растений. 5- Эндогенные (естественные) фитогормоны определенным образом локализованы в отдельных ком-партмантах (отсеках) клетки. При внесении извне распределение -гормонов будет нным. В этой связи экзогенное внесение пе может полностью заменить гормоны, образовавшиеся при естественном метаболизме.
В настоящее время фитогормопы применяются в следующих направлениях.
Ауксины и их синтетические заменителя. 1. Для усиления корне-образования у черенков. Обработка пижних концов черенков ИУК в концентрации 50 мг/л вызывает их усиленное дыхание, приток к ним питательных веществ, при этом процесс корпеобразования усиливается. 2. Для образования партенокарпических плодов, повышения урожая томатов и некоторых других культур. Опрыскивание цветков томатов раствором синтетических регуляторов роста типа ауксяна ‘(например, трихлорфепоксиуксусной кислоты в концентрации 50 мг/л) приводит к образованию партенокарпических бессемянных плодов. Пря атом плоды растут быстрее и характеризуются более .260
высоким содержанием сахаров. Одновременно с усилением роста плодов в результате перераспределения питательных веществ рост веге-тгативвых органов (пасынков) замедляется. К недостаткам этого приема следует отнести большую подверженность образующихся плодов различного рода заболеваниям. 3. Для предохранения плодов от Предуборочного опадения. При большом количестве завязавшихся плодов определенная доля их опадает до созревания. Регуляторы тгипа ауксипа, вызывая дополнительный приток питательных веществ к плодам, препятствуют образованию отделительного слоя. Обработка деревьев проводится а-пафтплуксусной кисяогсй в коп-цептрацпп 10 мг/л за две педели до уборки. 4. Для ускорения прорастания семян некоторых растений. Этот прием дает благоприятные результаты лишь па мелкосеияниых растениях, поскольку крупные семена содержат достаточное количество собственных гормонов. Хорошие результаты получены при обработке семян сахарной свеклы ИУК в концентрации 10 мг/л. 5. В высоких концентрациях регуляторы роста типа ауксина, папример 2,4-дихлорфеноксиуксусная кислота (2,4 Д), могут применяться как селективные гербициды. Поскольку для разпых видов растений оптимальные концентрации фитогормонов различны, то это позволяет использовать 2,4 Д в качестве •селективного гербицида для борьбы с сорняками в посевах злаковых культур. Исследованиями (Ю. В. Ракитин, В. А. Земская) показано, что различная устойчивость растений к 2,4-дихлорфепоксиуксус-пой кислоте связана с различиями в скорости ее детоксикации (обезвреживания) в организме.
Гиббереллины. 1. Под влиянием гиббереллина заметно усиливается рост стебля копопли. Увеличивается выход волокла с гектара. 2. Опрыскивание в концентрации 25 мг/л повышает урожай зеленой массы кормовых бобов. Однако урожай семян при этом снижается. 3. Обработка в концентрации 50 мг/л цветков сортов винограда с функционально женскими цветками вызывает образование бессемян-иых плодов и повышение их урожая. 4. С помощью обработки гиббереллином можно прерывать период покоя клубней картофеля, а также семян некоторых растений. 5. В ряде случаев обработка гиббереллином заменяет процесс стратификации семян. 6- Гиббереллин заметно ускоряет процесс прорастания семян ячменя, что используется в пивоваренной промышленности при получении солода.
Цитокинины. С помощью кипетипа можно регулировать рост и морфогенез изолированных ткапей. Это приобретает все бблыпее практическое значение, поскольку таким путем удается получить большое количество тканей, содержащих определенные лекарственные вещества, а также получить чистые липни (однородного генетического потомства) в селекции.
Синтетические ингибиторы роста — ретарданты. Во многих случаях появляется необходимость задержать рост стебля с целью получения большей устойчивости растений против полегания, что, в свою очередь, повышает урожай и облегчает уборку. Задержпа роста вегетативных органов бывает иногда полезна для лучшего развития плодов и семян. В настоящее время синтезировано много веществ, ко-
торые обладают свойством задерживать рост растений. Упомянем некоторые из таких веществ: 1) хлорхолинхлорид (ССС). Этот препарат задерживает рост стебля, тормозит прорастание семян, тормозит цветение растений длинного дня. Возможно, что торможение роста стебля связано с тем, что ССС ингибирует образование гиббереллинов; 2) гидразид малеиновой кислоты (ГМК) тормозит рост растений. Особенно эффективно его применение на травах.
8. РОСТОВЫЕ КОРРЕЛЯЦИИ. РЕГЕНЕРАЦИЯ
При рассмотрении особенностей роста необходимо учитывать, что все органы растительного организма взаимосвязаны и оказывают влияние друг на Друга. Зависимость роста одной ткани от другой или роста одного органа от другого называют коррелятивным ростом. Корреляции роста проявляются на разных уровнях. Рост и дифференциация каждой клетки зависит от окружающих ее киеток и тканей. Именно поэтому клетка, выделенная из ткани, растет и дифференцируется по иному пути. Явление корреляции проявляется и на уровне отдельных тканей. Так, дифференциация ксилемы ycito-ряется в присутствии меристематических клеток. Деление камбиаль-ных клеток происходит наиболее интенсивно в зоне, расположенной непосредственно под листом. Особенно ясно взаимодействия (корреляции) проявляются при рассмотрении роста отдельных органов растения. Часто рост главного побега оказывает влияние на рост боковых В одних случаях под влиянием главного побега происходит только замедление роста боковых побегов, в других — полное его прекращение. Боковые почки растения при интенсивном росте верхушечной могут на протяжении всего вегетационного периода оставаться в покоящемся состоянии, однако достаточно удалить верхушечную почку, чтобы боковые начали интенсивно расти. Сходное положение -можно наблюдать и па корневой системе. Удаление копчика корня вызывает его усиленное ветвление. Торможение роста боковых побегов верхушечным органом называют апикальным доминированием. Оно особенно ярко проявляется у древесных растений. Так, у основания верхушечной почки сосны располагаются 4—5 боковых. Из верхушечной почки весной развивается вертикальный побег. Боковые почки трогаются в рост лишь при удалении верхушечной почки. Можно привести и другие примеры взаимного влияния органов. Так, удаление цветков стимулирует рост вегетативных органов. Удаление боковых побегов (пасынков) вызывает усиленный рост плодов и Др. Ростовые корреляции широко используются в практике растениеводства. Благоприятное влияние таких приемов, нак прищипывание копчика корня при высадке рассады овощных культур, пасынкование (удаление боковых побегов) при культуре томатов, чеканка (удаление верхушки) при культуре хлопчатника и др., основано яа корреляционных эффектах. Основное значение в обеспечении взаимного влияния органов растения принадлежит гормонам, в особенности относящимся к группе ауксинов. Одна и та же концентрация ауксина стимулирует рост верхушечного побега и подав
ляет рост боковых почек. Ауксины, образовавшиеся в верхушечной почке, передвигаясь вниз, тормозят рост боковых почек. Удаление верхушки побега приводит к уменьшению концентрации ауксинов в боковых почках, в результате чего они трогаются в рост. Если вместо удаленной верхушки на срез нанести пасту, содержащую гетероауксин (₽-ивдолплуксусную кислоту), то рост боковых почек приостанавливается. Этот эксперимент ясно показывает вначение ауксинов в явлениях апикального доминирования.
Нельзя пе учитывать также баланса питательных веществ, складывающегося в растительном организме. Естественно, что удаление одних органов вызывает усиленный приток питательных веществ к другим. Определенное значение имеет накопление в покоящихся почках ингибиторов роста (В. И. Кефели).
С ростовыми корреляциями тесно связана способность растительных организмов к регенерации, или восстановлению утраченных частей. Высшее проявление регенерационной способности растений проявляется при культуре изолированных клеток и тканей. Однако в этом случае для регенерационных процессов нужны особые стерильные условия, специальная питательная среда и определенное соотношение гормональных веществ, внесенных извне. Несколько иное положение наблюдается при черенковании растений. В етом случае регенерационные процессы не требуют особых условий. Регенерационная деятельность при черенковании начинается с усиленного деления клеток па месте среза, в результате чего образуется наплыв —-каллюс. Особенно энергично деление клеток происходит вблизи ситовидных трубок. Затем клетки каллюса дифференцируются, закладываются точки роста и развиваются придаточные корпи. Для развития стеблевого побега необходимо наличие почки. На черенках очень сильно проявляется влияние полярности. Келлюс образуется только па нижнем конце черенка. По-видимому, полярность связана с распределением гормонов, так как с помощью ауксина можно вызвать образование каллюса на морфологически верхнем конце черенка. Черенки сохраняют на себе отпечаток возраста растительного организма, от которого они отделены. Так, черенки, взятые с цветущего растения, раньше образуют цветочные зачатки. Способность растений к регенерации широко используется в практике растениеводства при вегетативном размножении растений.
9. ДВИЖЕНИЯ РАСТЕНИЙ. ТРОПИЗМЫ И НАСТИИ
Растительный организм обладает способностью к определенной ориентировке своих органов в пространстве. Меняя ориентировку своих органов, растения реагируют на те или иные внешние воздействия. Движения отдельных органов растения связаны с ростом — ростовые — и с изменениями в тургорном напряжении отдельных клеток и тканей — тургорные.
Ростовые движения, в свою очередь, бывают двух типов. Тропические движения, или тропизмы,— это движения, вызванные односторонним воздействием какого-либо фактора внешней среды (света,
Рис. 71. Тропиэмы и настии:
1 — геотропизм; s — фототропизм; а — термовастии; 4 — фотонцстии.
силы земного притяжения и др-)» настические бвижения, нни настии — это движения, вызванные общим диффузным изменением какого-либо фактора (света, температуры и др.).
В зависимости от фактора, вызывающего тропические движения, различают геотропизм, фототропизм, хемотропизм, тигмотропизм, гидротропизм (рис. 71).
Геотропизм — ©то движения, вызванные односторонним влиянием силы тяжести. Если положить проросток горизонтально, то через определенный промежуток времени корень изгибается вниз, а стебель — вверх. Еще в начале XIX в. был изобретен прибор клипостат. В атом приборе проросток в горизонтальном положении привязывается к вращающейся оси. Благодаря этому сила притяжения земли действует попеременно на нижнюю и верхнюю сторону проростка. И рост проростка идет строго горизонтально. Никаких изгибов пе наблюдается. Эти опыты доказали, что изгибы стебля и корня связаны с односторонним- действием силы земного притяжения. Изгиб корня вниз (по направлению действия силы притяжения) называют положительным геотропизмом, а изгиб стебля вверх — отрицательным геотропизмом.
Для того чтобы произошел изгиб, проросток должен быть выдержан в горизонтальном положении определенное время (время пре-264
зентации). Если проростки выдержать ©то время в горизонтальном положении, а затем поместить вертикально, то все равно изгиб произойдет. При строго горизонтальном положении проростка время презентации наименьшее. Чем ближе положение проростка к вертикальному, тем больше врамя презентации. Это попятно, так как сила земного притяжения наибольшая при горизонтальном положении. Время презентации составляет примерно 3—5 мин. Время, необходимое для проявления изгиба,— 45—60 мил. Направление геотропической реакции может изменяться в процессе роста организма, а также в зависимости ст условий среды. Так, для цветоножки мака до распускания бутона характерен положительный геотропизм, а после распускания цветков — отрицательный. При пониженной температуре отрицательный геотропизм стебля может переходить в диагеотропизм (стелющиеся формы).
Фототропизм — это движения, вызванные неравномерным освещением разных сторон проростка. Если свет падает с одной стороны, стебель проростка изгибается по направлению к свету — положительный фототропизм. Кории обычно изгибаются в направлении от света — отрицательный фототропизм. Ориентировку пластинок листьев перпендикулярно к падающему свету или ребром (при большой интенсивности света) называют диафотстроиизмом. Для восприятия одностороннего осяещения также необходимо определенное время презентации, которое зависит от силы одностороннего освещения.
В зависимости от возраста растения и ст условий среды направление фототропических изгибов может меняться. Так, у настурции до цветения для стебля характерен положительный фототропизм, а после созревания семян — отрицательный.
Хемотропизм — это изгибы, связанные с односторонним воздействием химических веществ. Хемотропические изгибы характерны для пыльцевых трубок и для корней растений. Если пыльцу положить на предметное стекло в среду, содержащую сахарозу, и одновременно поместить туда кусочек завязи, все пыльцевые трубки в процессе роста изогнутся по направлению к завязи.
Корпи растений изгибаются по направлению к питательным веществам. Если питательные вещества пе перемешаны со всей почвой, а распределяются отдельными очагами, корни растут по направлению к этим очагам. Такая способность корпей определяет большую эффективность гранулированных удобрений. Корни растут по направлению к отдельным гранулам, содержащим питательные вещества. При таком способе внесения питательных веществ создается также повышенная концентрация их около корня, что обусловливает их лучшую усвояемость.
Гидротропизм — ©то изгибы, происходящие при неравномерном распределении воды. Для корневых систем характерен положительный гидротропизм.
Аэротропизм — ориентировка в пространстве, связанная с неравномерным распределением кислорода. Аэротропизм свойствен в основном корневым системам.
Тигмотропизм — реакция растений на одностороннее мехапиче-
сиое воздействие. Тигмотропизм свойствен лазающим и вьющимся растениям.
Настические движения бывают двух типов: эпинастии — это изгиб вниз и гипонастии — изгиб вверх. Б зависимости от фактора, вызывающего те или иные настические движения, различают термо-настии, фотонастии, никтинастии и др.
Термонастии — движения, вызванные сменой температуры. Ряд растений (тюльпаны, крокусы) открывают и закрывают цветки в зависимости от температуры. При повышении температуры цветки раскрываются (эпинастическне движения). При снижении температуры цветки закрываются (гипонастические движения).
Фотонастии — движения, вызванные сменой света и темноты. Цветки одних растений (одуванчика) закрываются при наступлении темноты и открываются на свету. Цветки других растений (табака) открываются с наступлением темноты.
Никтинастии (никти — ночь) — это движения цветков и листьев растений; связанные с комбинированным изменением как сяета, так и температуры. Такое комбинированное вовдействие наступает при смене дня ночью. Для листьев многих растений характерны ритмические движения — поднятие листьев утром и опускание, складывание их ночью (клевер).
Сейсмонастии — зто движения, вызванные толчком или прикосновением, например, движение листьев у мимозы. В результате прикосновения листья мимозы опускаются, а листочки складываются. Реакция происходит чрезвычайно быстро, спустя всего 0,1 с. При зтом раздражение распространяется со скоростью 40—50 см/с. Сей-смонастические движения листьев мимозы могут происходить и под влиянием местных тепловых, электрических или химических воздействий.
Автонастни — это самопроизвольные ритмические движения листьев, не связанные с какими-либо изменениями внешних условий. Так, листья фасоли в течение 1 ч ритмически опускаются и снова поднимаются. Листья тропического растения десмодиум также претерпевают ритмические колебания.
10. ФИЗИОЛОГИЧЕСКАЯ ПРИРОДА ДВИЖЕНИЯ РАСТЕНИЙ
Все движения растений приводят к определенной ориентировке органов в пространстве. Они выработались в процессе эволюции как приспособление к лучшему использованию света, питательных веществ и других условий среды. Так, отрицательный геотропизм и положительный фототропизм стебля позволяют растению выносить листья к свету. Рост корня вниз и уклонение от света способствуют углублению его в почву и лучшему использованию питательных веществ. Изменение направления роста стебля при пониженной температуре приводят к обрявовепию более устойчивых стелющихся форм. Открывание и закрывание цветков в определенные периоды суток является приспособлением к лучшему опылению.
Все перечисленные движения растений, кроме сейсмо- и автона-стических, являются ростовыми. В основе их лежит неравномерный рост разных сторон органа. При геотрснических ивгибах у стебля быстрее растет ннжияя, а у корня верхняя сторона. При положительном фототроническом изгибе стебля быстрее растет затененная сторона и т. д. Эпннастические движения связаны с разрастанием морфологически верхней стороны органа листа или лепестка цветка, а гипоиастические — с разрастанием морфологически нижней стороны Все указанные движения характерны лишь дни молодых органов, пе потерявших еще способности к росту, и в таких условиях, в которых ростовые процессы осуществимы.
В 1928 г. Н. Г. Холодный и Ф. Вент выдвинули гормональную теорию тропизмов, которая в дальнейшем была подтверждена многочисленными экспериментами. Согласно этой теории, при нормальном освещении и вертикальном положении проростка ток гормона (ауксина), вырабатываемого в верхушке органа, распределяется равномерно, результатом чего является равномерный рост. При одностороннем освещении либо при горизонтальном положении ауксин распределяется неравномерно, результатом чего является неравномерный рост и изгиб органа. Так, в случае одностороннего освещения стебля ауксин концентрируется на затененной стороне, благодари чему она растет быстрее, и стебель изгибеется в сторону света. При горизонтальном положении проростка гормон концентрируется на нижней стороне органа. Это приводит к быстрому росту нижней стороны стебля, и он изгибается вверх. Ауксин концентрируется также и на нижней стороне корня. Однако оптимальная концентрация ауксина для корня примерно в 10 раз ниже, чем для стебля. В силу етого увеличение концентрации ауксвна на нижией стороне корня приводит к торможению ее роста, и корень изгибается вниз.
Существуют различные гипотезы, объясняющие первичный механизм восприятия геотропического раздражения. Согласно одной из них, под влиянием одностороннего влияния силы тяжести в клетках происходит перемещение более тяжелых частиц (главным образом крахмальные зерна, или, точнее, амилопласты). Под влиянием одностороннего воздействия земного притяжения статолиты скопляются на одной стороне органа. Крахмальные зерна присутствуют почти во всех гестропически чувствительных тканях. Интересно, что в результате голодания крахмальные зерна исчезают и геотропическая чувствительность ие проявляется. Мутанты кукурузы, характеризующиеся меньшим содержанием амилопластов, обладают меньшей гео-тропической чувствительностью. Однако в некоторых случаях геотропическая чувствительность сохраняется и при отсутствии амилопластов. Возможно, что в этих случаях роль статолитов выполняют другие частицы (митохондрии, диктиосомы). Можно предполагать, что именно скопление статолитов на нижней стороне органа, в свою очередь, вызывает передвижение ауксинов к клеткам, расположенным на нижней стороне органа, что и приводит к неравномерному росту и изгибу.
Для проявления реакции на неравномерное освещение (фототропизм) должен существовать какой-то фоторецептор. Природа такого фоторецептора (пигмента) не установлена. Одностороннее восприятие света фоторецептором вызывает электрическую поляризацию» тканей, и, как следствие, отклонение тока ауксинов и повышение их концентрации на затененной стороне.
ФИЗИОЛОГИЧЕСКИЕ основы покоя
РАСТЕНИИ
Рост растений пе является непрерывным процессом. У большинства растений время от времени наступают периоды резкого замедления или даже почти полной приостановки ростовых процессов, периоды покоя. В покоящееся состояние может вступать как растительный организм в целом, так и отдельные его части (семена, корни, клубни). В некоторых случаях растительный организм может находиться в растущем состоянии, а отдельные почки — в покоящемся (спящем). Переход растения или его отдельных органов в покоящееся состояние прежде всего является приспособлением к перенесению неблагоприятных условий. В большинстве районов земпого шара наблюдается периодическое наступление времен года, неблагоприятных для растений. Это периоды низкой температуры или попижеп-ной влажности. В этих случаях растение сохраняет жизнеспособность лишь при условии перехода в состояние покоя. Таким образом, переход растения в покоящееся состояние предохраняет его от гибели под влиянием мороза пли сильной засухи.
Переход в покоящееся состояние часто сопровождается утратой (опадением) отдельных органов (листьев) или даже целых побегов-Именно в таком состоянии многолетние растения переживают зимний период. Однако покой — зто ие только защитная реакция организма против неблагоприятных условий. Растения переходят в покоящееся состояние и при наличии всех условий, необходимых для роста. Временная приостановка ростовых процессов характерна и для тропических растений, несмотря на круглогодичные благоприятные условия. Если растение не прошло периода покоя, в последующем темпы роста его снижаются, ухудшается плодоношение. После периода покоя рост растений усиливается. Таким образом в период покоя, по-видимому, происходят определенные изменения, подготавливающие последующий рост. Все сказанное позволяет считать, что период покоя пе только приспособление к неблагоприятным условиям, но и необходимое звено онтогенеза растений.
Различают покой вынужденный и глубокий. Эти виды покоя находятся в разной зависимости от внешних условий. Вынужденный покой вызван неблагоприятными условиями. Обычно растительный организм вступает в вынужденный покой при отсутствии какого-то фактора, необходимого для ростовых процессов. Как только этот фактор изменяется в благоприятном направлении, ростовые процессы возобновляются. Сухие семена не прорастают до тех пор, пока не будет достаточного количества воды. Некоторым семенам для про-268
растапия необходим свет. Веспой почки не распускаются, пока температура ие поднимется до определенного предела. Таким образом, растение или орган как только будут обеспечены всеми необходимыми условиями для роста, легко выходят из вынужденного покоя.
Растения или органы, находящиеся в глубоком покое, не переходят к росту даже при наличии всех благоприятных условий. Из глубокого покоя растительные организмы выходят лишь по окончании определенных физиолого-биохимических изменений, подготавливающих последующий рост. Вынужденный и глубокий покой могут совпадать во времени. Так, в зимний период деревья находятся одновременно в выкуждеппом и глубоком покое. Если ветку дерева зимой перенести в благоприятные условия, то опа не распустится. Следовательно, покой ветки не только вынужденный, но и глубокий. Веспой при совдании благоприятных условий ветка распускается, так как в этот период глубокий покой ужо закончился
Характер покоя различен, различны и части растения, впадающие в состояние покоя. Однако есть и общие черты, характеризующие покоящееся состояние. Это отсутствие видимого роста. В период покоя может происходить скрытый рост. Так, наблюдения показывают, что в зимний период почки несколько увеличиваются в размерах. Наряду с замедлением роста в период покоя уменьшается интенсивность всех процессов обмена.
1. ПОКОЙ СЕМЯН
Покой семян может быть вызван рядом внешних и внутренних факторов. Семена могут быть в состоянии вынужденного и глубоко-^ го покоя.
Процесс прорастания семян проходит ряд этапов (с. 232), причем первые этапы пе сопровождаются видимыми проявлениями роста и требуют определенных условий. Однако иногда бывает, что все условия соблюдены, а семена пе прорастают. Это может быть связано с различными причинами. Семена многих растений, особенно относящихся к семейству бобовых, отличаются твердой оболочкой, непроницаемой для воды или кислорода. В зависимости от условий, в которых формируются семена, проницаемость их оболочки меняется. Например, если семена белого кдавера формируются в жаркий и сухой период, спи, как правило, имеют твердую оболочку, плохо проницаемую для воды. Наоборот, при влажной погоде формируются семена с мягкой, хорошо проницаемой оболочкой.
Семена некоторых растений имеют оболочку, проницаемую для воды, но непроницаемую для газов. Это корошо показано на семенах дурнишника. Плод этого растения имеет две семянки. Распопо-жеппая внизу семянка прорастает в первый год, верхняя — не ранее чем через год. Оказалось, что семейная кожура верхнего плода плохо проницаема для кислорода. На протяжении года семенная оболочка разрушается микроорганизмами и семена прорастают. Повышенная концентрация кислорода стимулирует раннее прорастание семян овсюга и некоторых других растений. Причина положительно-
го влиянии кислорода на прорастание семян может быть двоякой. С одной стороны, кислород необходим для поддержания на достаточном уровне процесса дыхания, а с другой—-для окисления каких-то веществ, тормозящих процесс прорастания. Наконец, бывают случаи, когда твердая семенная оболочка аадерживает рост самого зародыша. Если семена не про
растают из-за твердой оболочки, можно считать, что они находятся в состоянии вынужденного покоя. Однако у многих видов растений семена сразу после их созревания не способны к прорастанию, так как находятся в состоянии глубокого покоя, которое, в свою очередь, может быть связано с несколькими причинами. У некоторых растений ко времени высвобождения семян из плодов зародыш еще недоразвит. Развитие зародыша продолжатся в семени. В ©том случае семена становятся способными к прорастапию только после определенного промежутка времени и при наличии соответствующих условий (рис. 72) -
Большое значение в поддержании состояния глубокого покоя имеет наличие ингибиторов роста, которые могут содержаться как в самих семенах (в оболочке, эндосперме), так и в мякоти плодов. Именно благодаря наличию ингибиторов семена не прорастают внутри сочных плодов. Одновременно с повышенным содержанием ингибиторов роста семя в состоянии глубокого покоя содержит крайне мало фитогормонов, таких, как гиббереллины и цитокинины. Согласно данным американского физиолога А. Кана, семена выходят из состояния глубокого покоя (способны к прорастанию) в том случае, если в них отсутствуют ингибиторы роста и присутствует фитогормон гиббереллин. В присутствии ингибиторов роста для выхода из покоя необходимо наличие уже двух фитогормонов — гиббереллина и цитокинина (табл. 11).
Таблила 11 Гормональный контроль покоя и прорастания семян (по Кану)
Гиббереллин Цитокинин Ингибитор Результаты действия гормонов
+ — — Прорастание
+ + — В
+ + + ь
+ — + Покой
— —
— — + *
•— + —
— + +
У ряда рястений созревшие семена становятся способными к прорастанию только после определенного периода, в течение которого в них проходят сложные биохимические процессы (послеуборочное дозревание). В природе период послеуборочного дозревания длится обычно в течение всей зимы. Это имеет большое приспособительное значение, именно благодаря атому обмена прорастают тогда, когда создаются благоприятные условия для их последующего ростам
2. ПОКОЙ ПОЧЕК
Процессы роста сосредоточены в почках, поэтому они в первую очередь и вступают в покоящееся состояние. В покой могут вступать не все почки, расположенные на данном растении, а лишь отдельные. Покоящиеся почки (глазки) характерны ие только для всего организма, но и для его отдельных частей (клубней, корневищ).
Само покоящееся состояние почек приходится на период пониженных температур, и, следовательно, изменения, подготавливающие дальнейший рост, обычно также бывают при пониженных температурах. Вступление же в период покоя происходит еще при достаточно высоких температурах. По-видимому, сигналом для вступления в покой служит определенное соотношение дня и ночи (определенный, фотопериод). Растения вступают в покой под влиянием укороченного дпя в выходят из пего под влиянием длинного дня. Фотопериодическая реакция в случае вступления почек в покой сходна с фотопериодической реакцией, обусловливающей цветение растений (с. 279). Так оказалось, что именно длительность темнового периода (длинная ночь) определяет вступление растений в период покоя. Органом, воспринимающим фотопериодический стимул, являются или листья, или у некоторых растений почки. Под влиянием укороченного дня в растении вырабатываются ингибиторы роста (абсцизовая кислота, фенольные соединения), что и вызывает замедление физиологических процессов в почках. Одновраменно происходит уменьшение содержания фитогормонов. Противоположные изменения характерны для почек, переходящих из покоящегося состояния к росту: накопление фитогормопов и исчезновение ингибиторов (В. И. Кефели, Р. X. Турецкая). Поскольку фитогормоны и ингибиторы имеют общих предшественников, то в зависимости от условий (длины дня, температуры) может осуществляться преимущественное образование или ингибиторов роста (кумарина, абсцизовой кислоты), или фитогормонов (ауксина, гиббереллина). Продолжительность периода покоя связана со скоростью разрушения ингибиторов роста.
Покоящиеся почки растения характеризуются сниженным метаболизмом. Однако в иих идут определенные процессы обмена, в частности пе прекращается процесс дыхания. Имеются данные, что в этот период происходит накопление предшественников нуклеиновых кислот, идет определенная дифференциация клеточных структур. Именно ото подготавливает почву для последующей активации ростовых процессов.
Одновременно при вступлении в период покоя происходит ряд процессов, повышающих устойчивость клеток к неблагоприятный условиям. Так, по данным П. А. Генкеля при переходе в глубокий покой в клетках происходит процесс обособления протоплазмы. Это выражается в том, что плазмодесмы втягиваются внутрь клеток, а плазмалемма отстает ст клеточной оболочки. Поверхность цитоплазмы часто покрывается слоем липидов. Вязкость цитоплазмы возрастает. Благодаря отставанию цитоплазмы от клеточной оболочки скорость плазмолиза возрастает, несмотря на то что ее вязкость увеличивается. Процесс обособления цитоплазмы вызывает нарушение связей между клетками, что, в свою очередь, приводит к снижению интенсивности процессов обмена. Отставание цитоплазмы от клеточных оболочек, а также накопление липидов в поверхностном слое делают ее более устойчивой.
3. РЕГУЛЯЦИЯ ПРОЦЕССОВ ПОКОЯ
Регулирование процессов покоя имеет значение в практике растениеводства. Когда семена не прорастают из-за наличия твердой оболочки, то хороших результатов дает механическое перетирание (с песком) или обработка сильными химическими реагентами (сорная кислота, ацетон, спирт). Нарушение твердой оболочки семяп с помощью различных воздействий называют скарификацией. Для того чтобы проросли семена, находящиеся в состояний глубокого покоя, необходимо их подвергнуть определенным воздействиям, в частности выдерживанию при пониженной температуре (стратификация), при атом семена в большинстве случаев должны быть во влажном состоянии. Для семян некоторых растений необходимо подсушивание. Так, всхожесть семян кукурузы возрастает по мере того, как содержание воды в них падает. Подсушивание необходимо для прорастания семян томатов.
Обработка семян гиббереллином может заменить как пониженную температуру, так и облучение красным светом и вызвать выход семян из покоящегося состояния. К методам выведения растения мз состояния покоя относятся погружение веток растения в теплую воду и их выдерживание в парах серного эфира. Эти методы широко используются дли того, чтобы вызвать распускание и цветение различных растений в зимнее время, когда растение находится в состоянии глубокого покоя.
Известно, что свежеубраиные клубни картофеля находятся в состоянии глубокого покоя. Обработкой различными химическими веществами, в частности этиленхлоргддрином или тиомочевппой, можно вывести почки клубня картофеля из покоящегося состояния. Для хранения клубней картофеля бывает полезно задержать их в покоящемся состоянии, что достигается обработкой метиловым эфиром а-яафтилуксусной кислоты.
Б покоящихся клетках геном находится в репрессированном состоянии. Для того чтобы перейти в растущее состояние, необходима дерепрессия определенных участков генома, что, по-видимому, мо-272
жет осуществляться гиббереллином. Показано, что с помощью экзогенно введенного гиббереллина можно прерывать покоящееся состояние.
РАЗВИТИЕ РАСТЕНИЙ
На протяжении всей жизни, т. е. онтогенеза, растение растет и развивается. Развитие — ход качественных, последовательных изменений структуры, который проходит организм от возникновения из оплодотворенной яйцеклетки до естественной смерти.
Растения резко различаются но продолжительности жизни. Есть растения, которые заканчивают свой онтогенез па протяжении 10— 14 суток (зфемеры). Вместе с тем е.сть растения, продолжительность жизни которых исчисляется тысячелетиями (секвойи). Б независимости от продолжительности жизни все растения можно разделить на две группы —- монокарпические, или плодоносящие один раз па протяжении жизни, и поликарпические, или многократно плодоносящие па протяжении жизни. К монокарпическим стпосятся все однолетние растения, большинство двулетних, а также некоторые многолетние. Многолетние монокарпические растения (например, бамбук, агава) приступают к плодоношению после нескольких лет жизни, и после однократного плодоношения отмирают. Большинство многолетних растений относятся к поликарпическим.
1. ТЕОРИЯ ЦИКЛИЧЕСКОГО СТАРЕНИЯ И ОМОЛОЖЕНИЯ РАСТЕНИЙ
На протяжении жизни в растении, как и во всяком живом организме, непрерывно проходят возрастные изменения. Изучение возрастных изменений растительного организма позволило советскому физиологу Н. П. Кренке создать теорию циклического старения и омоложения растения. Согласно этой теории, возрастные изменения, которые претерпевает организм на протяжении жизни, можно в целом охарактеризовать как постепенное старение. Процесс старания характерен как для организма в целом, так и для отдельных его органов. Одпако у растительного организма, в стличпе от животного, процесс старения не является непрерывным, он замедляется или даже прерывается противоположным процессом — омоложения. Омоложение связано с тем, что на растении до самого конца его жизни появляются иовые органы — молодые листья, побеги. Эти новые вновь появляющиеся органы замедляют процесс старения и окааывают омолаживающее влияние на весь растительный организм. Правда, это омоложение лить частичное. Полное омоложение происходит лишь с возникновением нового организма при оплодотворении. На физиологическое состояние вновь появляющегося органа оказывает влияние возраст целого материнского растительного организма. Чем старше возраст целого растения, тем мелыпе физиологическая молодость вновь появляющегося органа. В силу втого различают ка-
10—773
273
лендарпый, или собственный, вовраст и общий, или физиологический, возраст органа (листа, иобега). Собственный, или календарный, возраст органа — ато время, исчисляемое ст его заложения до данного момента. Общий, или физиологический, возраст определяется календарным возрастом данного органа и возрастом материнского организма в целом к моменту его заложения. Так, листья одинакового календарного возраста, возникшие па молодом или старом организме, будут различаться по физиологическому возрасту. При определенном возрасте целого растения более пижпие листья, появившиеся раньше и характеризующиеся большим календарным возрастом, могут быть физиологически более молодыми, поскольку они возникли па более молодом материнском организме.
Для развития наиболее жизнеспособных побегов растение должно иметь определенный физиологический возраст. На самых молодых растениях вовпикают относительно слабые органы. По мере увеличения возраста материнского растения жизпеспособпость возникающих органов возрастает. Затем, после достижения какой-то оптимальной величины, увеличение возраота материнского растения начинает сказываться отрицательно на жизнеспособности вновь появляющихся органов.
Теория циклического старения и омоложения растений подтверждается наблюдениями за изменениями морфологических и физиологических процессов в листьях. Оказалось, что такие признаки, как форма и рассеченность листовой пластинки, длила черешка и др., претерпевают закономерные изменения в зависимости от яруса. При этом степень выраженности указанных признаков сперва возрастает, а затем падает.
Положения Н. П. Кренке оказались цепными для практики растениеводства. Так, при вегетативном размножении растений очень важно правильно установить физиологический возраст черенка, обеспечивающий его максимальную жизнеспособность. Известно, что качество чая зависит от возраста листьев. Оказалось, что для получения листьев нужного физиологического состояния и ед о брать с более старых кустов листья более молодого календарного возраста. Это же положение важно учитывать и при сборе листа с тутовых деревьев для выкормки шелковичных червей.
1. ЭТАПЫ РАЗВИТИЯ РАСТЕНИЙ
Развитие каждого растительного организма, так же как и животного, расчленнмо, т. е. оно проходит ряд этапов. Эта этапы характеризуются морфологическими и физиологическими признаками. Физиологические критерии этапов развития изучены слабо. При выделении этапов используют главным образом морфологические признаки.
Для' семенных растений можно выделить следующие этапы развития (М. X. Чайлахяп): 1) эмбриональный — от оплодотворепия яйцеклетки до прорастания зародыша. Этот этап можно разделить на два периода: а) эмбриогенез — период, в котором эмбрионы находятся на материнском растении; б) покой — период ст конца
274
Рис. 73. Основные этапы онтогенеза однолетнего семенного растения (по М. X. Чайлахяну):
I — гмбрионалызая жизнь; я—молодость; 4 — зрелость; 4
— размножение;
3 — старение.
формирования семени до его прорастания; 2) молодости (ювенильный) — от прорастания зародыша до закладки цветочных зачатков, характеризующийся усиленным ростом; 3) зрелости — ст момента закладки цветочных зачатков до оплодотворения (появления новых зародышей); 4) размножения — от оплодотворения до полного созревания семян; 5) старости — от периода созревания семян до отмирания (рис. 73).
Поликарпические растения этапы эмбриональный и молодости проходят один раз, однако часто эти этапы характеризуются большой продолжительностью (несколько лет), этапы зрелости и размножения наступают один раз, по осуществляются многократно. Этап старости у поликарпических растений также может продолжаться несколько лет. И. В. Мичурин для многолетних поликарпических растений выделил следующие этапы: 1) семенной — от оплодотворения яйцеклетки до прорастания семян; 2) молодости (ювенильный) — от прорастании до первого цветения (длительность этого этапа колеблется и может продолжаться до 10 лет); 3) возмужания — первые 3—5 лет цветения; 4) взрослого состояния — последующие годы плодоношения; 5) старения.
10* 275
На протяжении каждого из перечисленных этапов развития в растении возникают новые органы. Процесс формирования этих органов называют органогенезом. Этот процесс можпо изучить путем микроскопических наблюдений ва дифференциацией верхушечных меристем и изменениями в формирующихся органах. Такие исследования, проведенные в лаборатории МГУ, позволили Ф. М. Куперман выделить для одно- и двулетних растений 12 последовательных этапов органогенеза. При этом иа I и II этапах происходит дифференциация вегетативных органов, ва III п IV — дифференциация зачаточного соцветия, па V—VI11—формирование цветков, па IX — оплодотворение п образование зиготы, иа X—XII — рост и формирование семян.
На протяжении каждого пз этапов развития растения проходят физиолого-биохимические и морфологические изменения (появление зовых структур). Основой морфологических, структурных изменений является изменение физиолого-биохимических процессов. Именно поэтому, как правило, внутренние физиолого-биохимические изменения предшествуют морфологическим. Одиако проявляется и обрат-нвя зазпспмость. Вновь появившиеся структуры, органы оказывают влияние на уровень и направленность процессов метаболизма.
Таким образом, можпо считать, что есть едипый процесс физиолого-биохимических и морфологических изменений. При этом физиолого-биохимические изменения, определяющие наступление последующего этапа, происходят в структурах, образовавшихся на предыдущем этапе развития организма.
3. РЕГУЛЯЦИЯ ПРОЦЕССА РАЗВИТИЯ
Процесс развития — переход от одного этапа в другой — обусловливается внутренними причинами, заложенными в генетической основе организма В геноме каждого организма зашифрована общвя программа развития, которая делится на ряд подпрограмм. Одиако должны существовать особые переключатели, которые пераводят развитие организма с одной подпрограммы на другую. Иначе говоря, должны быть какие-то ппдукторы, вызывающие репрессию одних генов, вырабатывающих белки-ферменты, необходимые для осуществления предыдущего этапа и одновременно вызывающие дерепрес-спю других генов, ответственных за развертывание процессов метаболизма, необходимых для прохождения последующего этапа. Такими индукторами, по-видпмому, являются гормоны.
Таким образом, последовательность развертывания программы и сами подпрограммы строго детерминированы в наследственной основе. Однако продолжительность отдельных этапов, время наступления следующего этапа могут заметно варьироваться в зависимости от условий среды. Именно под влиянием определенного комплекса внешних условий возникает такое соотношение гормонов, которое вызывает дерепрессию определенных участков генома, как следствие, образуются белки-фермепты, изменяется течение обмена веществ, происходят морфогенетические изменения, характерные для следующего 276
этапа. Иначе говоря, развертывается следующая подпрограмма. Для развертывания программы и перехода к следующему этапу развития недостаточно наличия гормонов. Клетка должна быть восприимчива, компетентна к гормональному воздействию.
Влияние внешних условий на процесс развития
Центральным моментом развития растительного организма является переход от вегетативного роста к репродуктивному развитию (у цветковых растений — к цветению). Условия среды могут влиять на реализацию генетической информации и тем самым ускорять пли замедлять наступление определенных этапов развития, в первую очередь переход растения к цветению. Таким образом, развитие растений совершается при взаимодействии генетических потенций и факторов внешней среды. Основными факторами среды, оказывающими влияние на переход растения к репродукции — к цветению, являются температура и продолжительность дневного освещения. Зависимость перехода растений к цветению от температуры называют яровизацией; зависимость перехода растепли к цветению от соотношении длины дня и ночи в течение суток — фотопериодизмом. Оба эти явления выработались в процессе эволюции как приспособления, обеспечивающие переход к цветению в наиболее благопрпятное время. С помощью этих приспособлении растительный организм определяет время цветения.
Яровизация. Для ряда растений переход к этапу зрелости (образованию цветочных зачатков) происходит .лишь после воздействия в течение определенного периода пониженными температурами. При этом все растения можно разделить па три группы: 1) растения, которые не переходят к репродукции без вовдействия в течение определенного времени пониженными температурами, — это главным образом озимые формы, двулетника'и некоторые многолетники; 2) растения, у которых раазитие ускоряется при воздействии пониженными температурами, одпако это воздействие не является обязательным; 3) растения, которые не требуют для перехода к цветению пониженных температур. Особенно ясна зависимость развития от температуры (яровизация) проявляется на двулетних растениях, а также на овп-мых формах. Иазестно, что при весеннем высеве озимые растеиия (рожь, пшеница, ячмень) интенсивно растут, кустятся, по не переходят к репродукции, пе выколашиваются. Исследования ряда ученых показали, что для перехода к репродукции озимые растения нуждаются в течение определенного времени в воздействии пониженных температур.
В естественных условиях при осеннем высеве озимые растения подвергаются длительному влиянию пониженных температур и нормально выколашиваются. Именно эта особенность озимых растений позволяет им переносить зимние условия. Оказалось, что, если подвергнуть действию пониженной температуры наклюнувшиеся семена озимых культур в течение определенного времени, они пере
ходят к репродукции (выколашиванию) и при весеннем высеве. Именно это и дало основание для введения термина яровизация. Необходимо отметить, что яровизация пе вызывает непосредственно перехода растений к репродукции, а лишь подготавливает этот переход. Иначе говоря, для того чтобы в растении появились цветочные зачатки, необходимы определенные физиолого-биохимические изменения, которые проходят у некоторых видов растений под воздействием пониженных температур. Яровизационные изменения происходят в точках роста. Для того чтобы прошли яровизационные изменения, именно точка роста должна быть подвергнута действию пониженных температур. Оказалось, что достаточно выдержать изолированные зародыши при пониженных температурах, чтобы выросшие из них растения оказались подготовленными к цветению. Клетки, образовавшиеся из точек роста, подвергшихся действию пониженных температур, уже являются яровизированными. Если меристема-’лческие клетки находились при пониженных температурах и впих гроизошли соответствующие изменения в обмене веществ, то эти изменения передаются при делении к вновь появляющимся киеткам и, наконец, обусловливают переход растения от вегетативного роста к репродукции. Растения могут проходить яровизацию в разном возрасте, пачппая с наклют-увшпхся семян. Однако есть растения (двулетние), которые проходят яровизационные изменения тольпо при наличии листьев.
Пониженные температуры, которые необходимы разным растениям для прохождения яровизационных изменений, несколько равпи-чаются. Наиболее эффективными для озимой пшеницы являются температуры от 4 до 0°С. Длительность воздействия также колеблется. Для большинства сортов озимой пшеницы длителгшость воздействия пониженными температурами должна составлять 35—60 суток. Такой длительный срок показывает, что происходящие под влиянием пониженных температур изменения постепенно накапливаются. Для прохождения яровизационных изменений необходимо достаточное снабжение водой и кислородом. Последнее указывает па связь происходящих изменений с окислительновосстаповительпыми процессами, в частности с дыханием. Показано, что под воздействием пониженных температур в меристематических клетках сдвигается изоелектри-ческая точка белков в кислую сторону. Имеются сведения, что при яровизации происходят изменения в нуклеиновом обмене. Заметно увеличивается количество РНК. Одяако в целом сущность биохимических изменений, происходящих под влиянием попиженных температур и приводящих к тому, что в растепли может осуществляться переход к репродукции и развертываться соответствующая подпрограмма, не представляется ясной.
Яровизационные изменания обратимы. Под воздействием повышенных температур возможна разъяровизация, в результате чего готовность клеток к образованию репродуктивных органов теряется
В некоторых случаях действие пониженных температур может быть заменено выращиванием растений при непрерывном освещения 278
Фотопериодизм. В 1920 г. американские физиологи Гарнер и Ал-лар установили, что есть растения, которые переходят к цветению только в условиях короткого дия, т. е. когда день короче ночи. К таким растениям относятся табак сорта Мериленд Мамонт, соя, перилла, хризантема, иросо и др. В условиях, когда светлый период суток превышает темный (длинный день), эти растения не образуют репродуктивных органов. В дальнейшем были обнаружены растения, которые переходили к цветепиго лишь при воздействии длинного дня. Зависимость развития растения от соотношения длины для и ночи в течение суток называют фотопериодизмом.
Таким образом, сущность фотопериодической реакции заключается в том, что циклическое чередование света и темноты переводит растение из вегетативного в репродуктивное состояние. Изучением фотопериодической реакции растений занимались многие исследователи. Большой вклад в разработку этого вопроса внесли советские ученые (Б. Н. Любимепко, М. X. Чайлахян, В. И. Разумов, Б. С. Мошков и др.).
Фотопериодизм, так же как и яровизация, представляет собой приспособительную реакцию, позволяющую растениям зацветать в определенное, наиболее благоприятное время года. Как правило, длиннодпевпые растения северные, а короткодцевпые — южные. Для короткодпевных растений более благоприятны повышенные ночные температуры, тогда как для длипнодпевпых — пониженные. Фотопериодическая реакция затрагивает не только процесс раавития растений, но и вызывает некоторые изменения ростовых процессов.
По отношению к фотопериодической реакции все растения можно разделить на несколько групп. Короткодневные растения, которые зацветают при длине дня меньше определенной — критической продолжительности. Длиннодневные растения, зацветающие при длине дня больше определенной Критической продолжительности. Нейтральные растения, которые зацветают при любой длине дня. Кроме втого, в настоящее время выделены еще короткодлипяодпевные и длинпокороткодяевные группы растений, цветение которых происходит при смешанных фотопериодах.
Растения сильно различаются по числу фотопериодических циклов (числу суток с определенной длиной дня), которые вызывают затем переход к цветепиго. Одиям растениям достаточно одного цикла, иначе говоря, воздействия определенной длиной дня в течение одних суток. Другим растениям необходимо получить определенную длину дия в течение 25 суток (25 циклов). Таким образом фотопериодическое воздействме необходимо растительному организму лишь на протяжении определенного периода, после чего растение зацветает уже при любом соотношении дня и ночи. Это явление называют фотопериодической индукцией.
Исследования, проведенные на растениях короткого дня, показали, что для дх перехода к образованию репродуктивных органов (цветению) важна длительность но дня, а ночи. Иначе говоря. Для короткодпевных растений необходим темновой период определенной длины. Если в середине темнового периода дать хотя бы вспышку
света, то растение короткого дня к цветению уже ие переходит. Так, если 14-часовая ночь прерывается освещением иа 10 мин, то короткодневные растения не зацветают. Для длиннодпевпых растений, нужен именно длинный световой период.
Фотопериодическое воздействие вызывается светом малой интенсивности. Так, достаточно прервать темновой период суток вспышкой света интенсивностью в 3—5 люкс, чтобы короткодиевные растения пе зацвели. Даже лунный свет препятствует переходу к цветению короткодневных растений. Фотосинтез при таких интенсивностях освещения еще не идет. Эти данные показывают относительную независимость явления фотопериодизма от фотосинтеза. Вместе с тем, по мнению М. X. Чайлахяна, переходу растений к цветению должен предшествовать определенный период нормального протекания фотосинтеза.
Фотопериодическая реакция растений наиболее успешно проходит лишь в лучах определенной длины волны, что доказано опытами американских ученых Хендрикса и Бортсвина. Наиболее активными в смысле задержки цветения сои оказались красные лучи (длина волны 660 нм). Сине-фиолетовые лучи (используемые при фотосинтезе) оказались пе активными. Таким образом спектр действия фотопериодической реакции оказался совпадающим со спектром действия фитохрома (с. 24). Это подтверждается тем, что действие вспышки красного (660 нм) света на задержку цветения короткодпевных растений снимается действием дальнего красного света. В ночной период ФЛк под влиянием дальних красных лучей превращается в Фк, и это способствует началу реакций, приводящих короткодневные растения к цветению. Прп вспышке красного света Фк превращается в Фдк, и это ингибирует реакции, приводящие к цветению. Следовательно, для перехода к цветепию короткодпевных растений нужно меньшее содержание активного фитохрома, поглощающего дальние краевые лучи, тогда как для перехода к цветению длинподневных необходимо его более высокое содержание.
Для фотопериодического действия рецепторным (воспринимающим) органом является лист. В опытах, проведенных с короткодпев-пыми растениями, в частности хризантемой, воздействию короткого дня подвергали либо листья, либо обезлиотвепныс побеги. С этой целью указанные части растения закрывали иа определенное время пакетами из непроницаемой для света бумаги (рис. 74). Оказалось, что растение зацветало в том случае, если воздействию укороченно го дня подвергали только листья или листья вместе с точкой роста. Те растения, у которых воздействию короткого дня подвергапи только точку роста или обезлиствеппые побеги, пе зацветали.
Таким образом, именно листья являются органами, воспринимающими фотопериодическое воздействие, под влиянием которого происходят ответные изменения в точке роста. Результатом етих изменений является превращение вегетативной почки в цветочную. Это дало основание М. X. Чайлахяну предположить, что в листе вырабатываются вещества (гормоны), которые вызывают переход к цветению. Оказалось далее, что возникающие в листе вещества по пре-280
Рис. 74. Значение листьев в процессе фотопериодизма короткодневного вида — периллы красной:
т — растение, выращенное в условиях короткого дел; в — растение, выращенное е условиях длинного дня; Я— левый побег на растении рос при коротком дне, правый —
имуществу локализуются в том побеге, где они образуются, так как передвижение идет от листьев к точке роста, расположенной на том же побеге.
Интересные результаты дали опыты с прививками. Оказалось, что, если побеги с листьями короткодаевного растения (периллы или хризантемы), выдержанного па коротком дне, привить на растение этого же типа, выдержанное па длинном дне, то последнее зацветает. Это подтвердило положение, что в листьях первого растения образуются гормональные вещества, которые при прививке вызывают изменения — развитие цветочной почки — у второго растения. Важные результаты были получены при прививках длиннодпевных растений па короткодневпые и обратно. Оказалось, что при прививке растений топинамбура (растение короткого дня) на цветущее растение подсолнечника (растение длинного дня) топинамбур зацветал при длинном дне. Сходные результаты были получены в опытах, в которых длиннодпевное растение прививалось на цветущее короткодневное. Таким образом, исследования показали, что листья, выдер-
жанные на соответствующем фотопериоде, содержат вещества, вызывающие цветение в независимости от условий, в которых содержатся остальные части растения. При атом вещества, вызывающие цве-
Рис. 75. Цветение различных фотопериодических групп в связи с образованием ондогеняих гиббереллинов а антезипов: Г — гиббереллин; А—антезми; Д —длиано-дневпые; Н — нейтральные; К — короткоднев-
тепие, идентичны как для короткодневпых, так и для длинподневиых растений.
Гормоны цветения. Последующие исследования были паправиепы па попытку выделить гормоны цветения. Опыты показали, что длинно-дневные растения зацветают на коротком дне, если их опрыснуть гиббереллином. Однако оказалось, что цветение пороткодневпых растений на длинном дне под влиянием опрыскивания гиббереллином пе происходит. В связи с этим М. X. Чайлахян выдвинул гипотезу о том, что цветение вызывается двухкомпонентной гормональной системой или одновременным на
личием двух гормонов, однп ив этих гормонов — гиббереллин, а другой — пе выделенный гормон, неизвестной химической природы — антезин.
Согласно М. X. Чайлахяну, процесс зацветания растений носит двухфазный характер. На первой фазе происходит образование цветочных стеблей, а на второй — образование собствеппо цветков. У дляннодневных растений критической является первая фаза зацветания — образование цветочных стеблей. Именно эта фаза зависит от наличия гиббереллина, который накапливается в достаточном количестве на длинном дне. Вместе с тем у етой группы растений второй гормон цветения — антезин — всегда имеется в достаточном ко-
личестве. При выдерживании длиннодневных растений па коротком дне они не цветут, поскольку пе хватает гормона гиббереллина. В связи с этим опрыскивание гиббереллином вызывает зацветание длин-подневных растений на коротком дне.
Иная картина складывается у короткодпевных растений. У этой группы растений содержание гиббереллинов достаточно высоко при любой длине дня. Именно поэтому дополнительное экзогенное внесение этого фнтогормона не оказывает влияния, однако у пих не хватает группы фитогормонов — антезпнов, которые обравуются именно на коротком дне. Поскольку в листьях цветущих растений как ко
ротко-, так и длипнодневных растений есть оба фитогормона, то прививка их к пецветущим растениям во всех случаях вызывает их зацветание (рис. 75). На рисунке видно, что в любом случав, как для коротко-, так и для длиннодневных растений периоду собственно фотопериодической индукции должен предшествовать световой период, в котором протекает процесс фотосинтеза.
Таким образом механизм фотопериодического действия можно представить следующим образом. В восприятии фотопериодической реакции участвует фитохромная система, действие которой осуществляется через регуляцию образования гормонов цветения. В точках роста (апексах) под влияпием притекающих туда гормонов происходят физиолого-биохимические и структурные ивмепепия, перестройка апикальных меристем и переход к генеративному развитию. Одним ив первых признаков перехода растений к цветению являются повышение репликации и усиление сиитеза ДНК. Это может служить косвенным подтверждением, что гормоны регулируют процесс па ген-пом уровне, в результате чего почка переходит па репродуктивный этап морфогенеза. Для того чтобы гормоны оказали влияние на клетки апексов, они должны быть восприимчивы, или компетентны. Эта компетенция может быть достигнута, по-видимому, лишь при определенном возрасте растительного организма. Следовательно, развитие растений осуществляется по определенной программе. Развертывание етой программы может в определенной мере контролироваться внешними условиями, через внутреннюю (гормональную) систему регуляции. Гормональная регуляция позволяет также осуществлять взаимосвязь всех органов растения. Поэтому весь организм в целом вступает в определенный этап развития.
Список рекомендуемой литературы
Биология развития растепий/Под ред. М. X. Чайлахяна. М., Наука, 1975. Боннер Дж. Молекулярная биология раавятия. М., Мкр, 1967.
Кефели В. И. Природные ингибиторы роста и фитогормоны. М_, Наука, 1974.
Кулаева О. Н. Цитокинины, их структура и функция. М., Наука, 1973.
Леопольд А. Рост и развитие расгептгй. Мир, 1968.
Муромцев Г. С., Агвистикова В. Н- Гормопы растений гиббереллины. М., Наука, 1973.
Рост растений и природные регуляторы/Под ред. В. И. Кефели, М., Наука, 1977.
Рост растений. Первичные механизмы/Поп ред. В. И. Кефели. М_, Наука, 1978.
Сабинин Д. А. Физиология развития растений. М., Изд-во АН СССР, 1968.
Чайлахян М. X. Факторы генеративного развития растений. —XXV Тимирязевские чтения. М., Наука, 1964.
Глава VIII.
ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ
УСТОЙЧИВОСТИ РАСТЕНИЙ
На протяжении жизни каждого растительного оргапизма «процессе эволюции выработались определенные потребпости к условиям существовалин. Вместе с тем каждый организм обладает способностью к адаптации — приспособлению к меняющимся условиям. И то и другое свойство оргапизма заложено в его наследственной основе. Чем шире способность организма наменять метаболизм в соответствии с меняющимися условиями среды, тем шире его норма реакции и больше его способность к адаптации.
Способность растения переносить неблагоприятные условия может быть заложена в генетической паследственпой основе. Частично ата способность может вырабатываться организмом, пе затрагивая генетические механизмы. При воздействии на растение неблагоприятных условий в нем возникает напряженное состояние — стресс. Сила стресса зависит от скорости, с которой возникают неблагоприятные ситуации. При медленном развитии неблагоприятных условий организм легче приспосабливается к ним. Это может даже привести к повышению устойчивости оргапизма (закаливание). В целом реакция растения па изменившиеся условия является комплексной, включающей изменения как биохимических, так и физиологических процессов.
Устойчивоть растений против неблагоприятных условий имеет равный характер. Опа может быть осповена па том, что организм тем или иным путем пебегает их воздействия, например растения, запасающие воду (кактусы) и тем самым избегающие обезвоживания при засухе, или растения с очень коротким вегетационным периодом (эфемеры), приурочивающие жизнедеятельность ко времени выпадения осадков.
Значительно большое значение имеет устойчивость, основанная па выносливости клеток растений, т. е. способности в процессе адаптации перестраивать как скорость, так и направление метаболических реакций таким образом, чтобы и в изменившихся условиях среды вырабатывать все необходимые продукты.
Из неблагоприятных условий, которые вызывают стресс у растительных организмов, наиболее часто встречающимися являются недостаток воды, высокая температура, низкая температура, высокая концентрация солей. Устойчивость к каждому из этих воздействий определяется рядом физиолого-биохимичеслих особенностей орга-284
пиэма. Физиологические основы засухоустойчивости были рассмотрены выше. В настоящей главе остановимся иа рассмотрении физиологических основ жаростойкости, морозоустойчивости, зимостойкости и солеустойчивости.
ЖАРОСТОЙКОСТЬ РАСТЕНИЙ
Растения различаются по способности выносить повышенные температуры. Большинство растений начинают страдать при температуре 35—40°С. Однако есть высшие растения, главным образом растения пустынь (например, кактусы), которые переносят повышение температуры до 6(гС. Ряд пизшпх растений, некоторые водоросли, грибы и бактерии могут переносить еще более высокую температуру. Наиболее термофильными являются вулканические микроорганизмы, переносящие повышение температуры до 100°С.
Высокая температура оказывает губительное влияние па организмы, так как вызывает свертывание белка. Устойчивые к высокой температуре растения способны к синтезу более жароустойчивых белков-ферментов. Обычно жаростойкие растения обладают усиленной транспирацией, что позволяет им снижать температуру листа и избегать перегрева.
МОРОЗОУСТОЙЧИВОСТЬ РАСТЕНИЙ
Двулвтпие и многолетние растения, растущие в умеренной полосе, периодически подвергаются воздействию низких отрицательных температур. Разные растепия обладают неодинаковой устойчивостью к этому воздействию. Изучение физиологических основ морозоустойчивости показало, что у одного и того же растения она меняется в зависимости от условий, предшествующих наступлению морозов. Согласно современным представлениям, способпость растений переносить низкие отрицательные температуры заложена в наследственной основе организма.
Причины гибели растений от мороза
Установлено, что воздействие низких отрицательных температур изменяется в зависимости от оводпепности тканей организма. Так, сухие семена могут выносить понижение температуры до — 196°С (температура жидкого азота). Это показывает, что губительное влияние низкой температуры принципиально отлпчпо от влияния высокой тенпературы, вызывающей непосредственное свертывание белков протоплазмы. Основное повреждающее влияние па растительный организм оказывает льдообразование (Н. А. Максимов). При атом лед может образовываться как в самой клетке, так и в межклетниках. Образование льда внутри клетки обычно происходит при быстром погЛпкении температуры. В этом случае нарушается структура цитоплазмы и клетка погибает. Однако пе всякое образование льда приводит растение к гибели. При постепенном снижении температу
ры кристаллы льда образуются в первую очередь в межклетниках. Образование кристаллов льда в межклетниках само по себе пе оказывает губительного влияния. Гибель клетки и организма в целом может происходить в результате того, что образовавшиеся в межклетниках кристаллы льда оттягивают воду ив клетки и одновременно оказывают на цитоплазму механическое давление. Если клетка не прошла процесса закаливания, цитоплазма свертывается из-за совместного влияния обезвоживания и механического давления образовавшихся в межклетниках кристаллов льда. Механическое давление вы-вывает повреждение поверхностных слоев цитоплазмы, кристаллы льда проникают внутрь клетки, и опа погибает. Кроме того, определенное вредное влияние может оказать повышение концентрации и изменение pH клеточного сока, происходящее при обезвоживании.
Закаливание растений
Физиологическая природа процесса закаливания была раскрыта благодаря работам И. И. Туманова и его школы. Закаливание — это обратимое физиологическое приспособление к неблагоприятным воздействиям, происходящее под влиянием определенных внешних условий. В результате процесса закаливания морозоустойчивость организма резко повышается. Способностью к закаливанию обладают не все растительные организмы, она зависит от вида растения, его происхождения. Растения южного происхождения вообще к закаливанию не способны. У растений северных широт, переживающих значительное понижение температуры, процесс закаливания приурочен лишь к определенным этапам развития. Так, для приобретения способности к закаливанию древесные растения должны закончить процессы роста. Одновременно должен произойти отток различных веществ из надземных органов в корневые системы. Если в течение лета у древесных растений процессы роста ие успели закончиться, то это может вызвать массовую гибель растений зимой. Так, часто зимняя гибель вызывается летней засухой. Засуха приостанавливает рост летом, но позволяет древесным культурам завершить ростовые процессы к осе-пи. В результате растения оказываются не способны пройти процессы закаливания и гибнут даже при небольших морозах. Растения, выращенные при несоответствующем фотопериоде, ие успевают завершить летний рост и не способны к закаливанию. Исследования показали, что яровые влаки по сравнению с озимыми растут при более пониженных плюсовых температурах, из-за этого в осенний период они почти не снижают темпов роста и не способны к закаливанию. Способность к закаливанию утрачивается весной в связи с началом ростовых процессов. Таким образом, устойчивость растений к морозу, способность пройти процессы закаливания тесно связаны с резким снижением темпов роста, с переходом растений в покоящееся состояние.
Показано, что к закаливанию способен лишь организм в целом, при обязательном наличии корневой системы. Всякое нарушение процессов оттока (кольцевание) препятствует закаливанию. Роль корней 286
не сводится только к тому, что туда оттекают продукты обмена, гормоны, способствующие ростовым процессам. Важное значение имеет то, что клетки корня вырабатывают вещества, повышающие устойчивость организма против мороза.
Собственно процесс закаливания требует определенного комплекса внешних условий и проходит в две фазы.
Первая фаза закаливания проходит па свету при несколько пониженных плюсовых температурах (днем около 10°С, ночью около 2°С) и умеренной влажности. В эту фазу продолжается дальнейшее замедление и даже полная остановка ростовых процессов. Особенное значение в развитии устойчивости растений к морозу в эту фазу имеет накопление сахарозы и некоторых других олигосахаров. Показано, что накапливающиеся в процессе закаливания сахара локализуются в разных частях клетки: в клеточпом соке, цитоплазме, органеллах (особенно хиоропластах). Благодаря такому распределению часть сахаров прочно удерживается в клетках.
Влияние сахаров на повышение морозоустойчивости растений многосторонне. Накапливаясь в клетках, сахара повышают осмотическое давление. Чем выше нопцептрация раствора, тем ниже его точка замерзания, поэтому накопление сахаров предохраняет от замерзания большое количество воды и, следовательно, заметно уменьшает количество образующегося льда. Накопление сахаров стабилизирует клеточные структуры, в частности хлоропласты, благодаря чему они продолжают функционировать.
Имеются даппые, что при накоплении сахаров процесс фотофосфорилирования продолжается даже при отрицательных температурах. Особенное значение имеет защитное влияние сахаров па белки, сосредоточеппые в поверхностных мембранах клетки. Условия, необходимые для прохождения первой фазы закаливания, пониженная плюсовая температура и достаточное количество света способствуют накоплению сахаров. В этих условиях образование сахаров в процессе фотосиптеза идет с достаточной интенсивностью. Вместе с тем пониженная температура сокращает их трату как в процессе дыхания, так и в процессах роста. Более морозостойкие виды и сорта характеризуются большей способностью к накоплению сахаров именно при пониженной температуре. Защитное действие сахаров проявляется только в том случае, если оно происходит при одновременном понижении температуры и умеренной влажности. В первую фазу закаливания происходит уменьшение содержания свободной вода. Именно поэтому излишияя влажность почвы (дождливая осень) препятствует прохождению процесса закаливании. Чем меньше в клетках и тканях содержание воды, тем меньше образуется льда и тем меньше опасность повреждения. К концу первой фазы закаливания клетки растений переходят в покоящееся состояние. Происходит процесс обособления цитоплазмы, что, в свою очередь, снижает возможность ее повреждения образующимися в межклетниках кристаллами льда. В эту фазу начинается также перестройка процессов обмена веществ. Особенно интенсивно вта перестройка протекает в период второй фазы закаливания.
2М
Вторая фаза закаливания протекает при дальнейшем понижении темперетуры (около 0°С) и ие требует света. В связи с этим для травянистых растений она может протекать и под снегом. В течение второй фазы происходит перестройка белков цитоплазмы. Происходит новообразование специфических белков. В относительно больших количествах накапливаются водорастворимые белки, отличающиеся менее крупными молекулами, но большей устойчивостью к обезвоживанию.
Важное влечение имеет изменение межмолекулярных связей белков цитоплазмы. При обезвоживании, происходящем под влиянием льдообразования, происходит сближение белковых молекул. Связи между ними рвутся и не восстанавливаются в прежнем виде из-за слишком сильного сближения и деформации белковых молекул. В связи с етим большое значение имеет наличие сульфгидрильных и других гидрофильных группировок, -которые способствуют удержанию воды и препятствуют сближению молекул белка. Установлен нарал-лелиам между содержанием сульфгидрильных групп и морозоустойчивостью.
В результате изменении свойств белков, межмолекулярпых связей менаду ними постепенное обезвоживание приводит к тому, что в процессе закаливания цитоплазма переходит из состояния золя в гель. Перестройка цитоплазмы спосоиствует увеличению ее проницаемости для воды. Благодаря более быстрому оттоку воды уменьшается опасность внутриклеточного льдообразования.
Не для всех растений необходимо протекание процессов закаливания в две фазы. У древесных растений, обладающих достаточным количеством сахаров, сразу протекают изменения, соответствующие второй фаее закаливания.
Таким образом, в процессе закаливания возникает морозоустойчивость, котораи определяется рядом изменений. У закаленных растений благодаря высокой концентрации клеточного сока, уменьшению содержепия воды кристаллы льда образуются не в клетке, а в межклетниках. Количество образовавшегося льда в межклетпиках у вакаиенных растений также значительно меньше. Изменение свойств белков цитоиназмы приводит к тому, что они становятся более устойчивыми к обезвоживанию. Накопление сахаров оказывает дополнительное защитное влияние. Цитоплазма закаленных растений более устойчива и к механическому давлению. При закаливании происходит обратимые физиологические измзпеппя. Повышение температуры , весной сопровождается противоположными изменениями — происходит процесс раскаливания растений. Поэтому весной растения часто гибнут даже от небольших заморозков.
Повышение морозоустойчивости растений имеет большое практическое значепие. Для предохранения растений от повреждения морозом важно правильно организовать их питание в осенний период. Усиление фосфорного питания повышает устойчивость растений к морозу, тогда как азотные удобрения, способствуя процессам роста, делают растения более чувствительными.
ЗИМОСТОЙКОСТЬ РАСТЕНИЙ
В зимний период растительный организм, помимо прямого влияния мороза, подвергается еще ряду неблагоприятных воздействий. Особенно многочисленные неблагоприятные воздействия испытывают травянистые многолетние п однолетние растения. Так, озимые растения могут погибать от слишком большого спетого покрова (выпре-ваиие растений). Это связало с тем, что под снегом температура несколько повышается (около 0°С) и процесс дыхания идет довольно интенсивно. В результате происходит такая сильная трата сахаров, что растения могут погибнуть от истощения. В связи с этим в районах с очень глубоким снежным покровом необходимо выведение сортов с повышенным содержанием углеводов.
Частой причиной зимней гибели растений является повреждение, связанное с образованием ледяной корки (выпирание растений).При образовании в почве льда корни растения разрываются, что, естественно, приводит к их гибели. В этом случае важно, чтобы растения обладали большой устойчивостью корневых систем, большой способностью их к растяжению.
В весенний период растения погибают прежде всего от возврата холодов. Растения, перенесшие в зимний период температуру —30°С, могут погибнуть весной при небольших заморозках, так как у них прошли процессы раскаливания. Кроме того, весной в пониженных местах в период таяпия спсга накапливается вода и растепия могут пострадать от вымокания. В этом случае причиной гибели растений слуясит резкий недостаток кислорода. При недостатке кислорода в клетках растений, начинается процесс брожения, что может вызвать прямое отреелепие организма.
Теплолюбивые растения сильно страдают и даже погибают при положительных пониженных температурах. Это связало с нарушениями обменных процессов, из-за чего в организме накапливаются промежуточные продукты метаболизма. В нормальных для данного вида растений температурных условиях все реакции, протекающие в оргапизме, хорошо согласованы друг с другом, продукты одной реакции сейчас >ке перерабатываются. В том случае, если растения попадают в неблагоприятные температурные условия, эта согласованность нарушается. Дело в том, что различные биохимические реакции характеризуются разной зависимостью от температуры. Один реакции при снижении температуры резко замедляются, другие — кет. Именно это приводит к нарушению обмена и к накоплению вредных продуктов, что может вызвать даже гибель растеппй. Замечено, что у теплолюбивых растений при понижении температуры резко возрастает вязкость цитоплазмы, парушается сопряжение окис-непия и фосфорилирования, происходят п другие нарушения.
УСТОЙЧИВОСТЬ РАСТЕНИЙ К ЗАСОЛЕНИЮ
Большое количество почв характеризуется повышенным содержанием солей, которое может оказывать вредное и даже губительное влияние па растительный организм. Кроме того, неумелое орошение
часто приводит к засолению. Вредное влияние концентрации солей может пронвляться и при неоправданно повышенных дозах минеральных удобрении. В связи со сказанным вопрос о солеустойчивости растений приобретает большое значение.
Причины вредного влияния солей
Засоление связано главным обрезом с повышенным содержанием патрпи в почве. В зависимости от преимущественного накопления отдельных солей натрия засоление может быть сульфатным, хлорид-ныи, содовым пли смешанным. Наиболее вредное влияние оказывает содовое засоление, поскольку в почве сода распадается, образуя сильную щелочь (гидроксид натрия).
Засоление приводит к созданию в почве низкого водного потенциала, поэтому поступление воды в растение сильно затруднено. Важнейшей стороной вредного влияния солей является также нарушение процессов обмена. Работами советского физиолога Б. П. Строганова показано, что под влиянием солей в растениях нарушается азотный обмен, накапливается аммиак и другие резко ядовитые продукты. На фоне сульфатного васолепия накапливаются продукты окисления серосодержащих аминокислот (сульфоксиды и сульфоны), которые также являются ядовитыми для растений. Повышенная концентрация солей, особенно хлористых, может действовать как разобщитель процессов окисления и фосфорилирования и тем самым нарушать снабжение растений макроэргическими фосфорными соединениями. Под влиянием солей происходят нарушения ультраструктуры клеток, в частности изменения в структуре хлоропластов. Особенно это проявляется при хлоридпом засоления. Вредное влияние высокой концентрации солей связано с повреждением поверхностных слоев цитоплазмы, вследствие чего возрастает ее проницаемость, теряется способность к избирательному накоплению веществ. Соли поступают в клвтнп пассивно вместе с транспирационным током воды. Поскольку в большинстве случаев засоленные почвы располагаются в районах, характеризующихся высокой летней температурой, интенсивность транспирапии у растений очень высокая. В результате солей поступает много и ето усиливает повреждение растений.
Недо учесть также, что на засоленных почвах большая концентрация натрия препятствует накоплению других катионов, в том числе и таких необходимых для жизни растения, как калий и кальций.
Отрицательное действие высокой концентрации солей сказывается раньше всего на корневой системе растений. При этом в корнях отрадают наружные клетки, непосредственно соприкасающиеся с раствором соли. В стебле наиболее подвержены действию солей клет-нн проводящей системы, по которым раствор солей поднимается к надземным органам.
Солеустойчивость растений. Галофиты
По отношению к солям все растения делят па гликофиты, илп растения пресных мест обитания, не обладающие способностью к произрастанию на засоленных почвах, я галофиты — растения засоленных местообитаний, обладающие способностью, к приспособлению в процессе онтогенеза к высокой концентрации солей (П. А. Генкель). По признакам, позволяющим выносить засоление, выделяют три группы галофитов.
К первой группе относят растения, протоплазма которых устойчива к накоплению большого количества солей. Галофиты этого типа растут на наиболее засоленпых почвах (солерос). Исследования, проведенные советским ботаником Б. А. Келлером, показали, что галофиты этой группы настолько приспособлены к произрастанию па засоленных почвах, что при нормальном содержании солей добавление хлористого натрия оказывает благоприятное влияние па их рост. Клетки растепий этой группы характеризуются высоким осмотическим давлением, благодаря чему опи могут добывать воду из засо-лепиой почвы. Так, некоторые солянки накапливают до 7% солен от массы клеточного сока. Одновременно протоплазма этих растений обладает большой гидрофильностью, высоким содержанием белка. Она высокоустойчива к накоплению солей.
Вторая группа галофитов отличается тем, что соли поглощаются корнями, но пе накапливаются в клеточном соке. Поглощенные соли выделяются через специальные поры, имеющиеся иа всех надземных органах, благодаря чему листья этих растепий обычно покрыты сплошным слоем солей. Растения данной группы характеризуются очень высокой интенсивностью фотосинтеза, что создает у иих высокую концентрацию клеточного сока. Эта особенность позволяет им поглощать воду из засоленпых почв. Вместе с тем протоплазма их неустойчива и легко повреждается солями. К таким растениям относятся такие кустарники, как тамарикс, лох и др.
Третья группа галофитов характеризуется тем, что цитоплазма клеток корня малопропицаема для солей, поэтому они не поступают в растение. Высокое осмотическое давление в клетках растений этой группы создается за счет большой интенсивности фотосинтеза и па-копления растворимых углеводов.
Все приспособительпые особенности галофитов, хотя и заложены в их наследственной основе, проявляются в процессе их роста па заселенных почвах (А. А. Шахов). Из культурных растений известной способностью приспособления к засолению обладают хлопчатник и частично сахарная свекла. Солеустойчивость растений можно повысить, применив прием закаливания (П. А. Гепкель). Для этого набухшие семена различных растепий выдерживают в течение часа в 3%-пом растворе хлористого натрия, после чего промывают водой и высевают. Растения, выросшие из таких семяп, характеризуются более низкой интенсивностью обмена, по являются более устойчивыми к засолению.
Список рекомендуемой литературы
Генкель П. А. Фивиология устойчивости растительных организмов.— Физиология сельскохозяйственных растений. М., Изд-во МГУ, 1967, т. 3.
Самыгип Г. А. Причины вымерзания растений. М., Наука, 1974.
Строганов Б. П. Физиологические аспекты солеустойчивости растений. М., 1962.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсцизовая кислота 71, 254, 271
Автотрофы 95
Аденил 30, 195
Адепозиндпфосфат (АДФ) 195
Адеяозинмснофосфат (АМФ) 35
Адепозинтрифосфат (АТФ) 70, 71.
130, 195, 208, 209, 211, 217
Адеиозинтрифосфотаза (АТФ-аза)
57, 157, 195, 209, 221
Адсорбция 55
Азот 171, 174
— питапие авотом 174
— превращение в растении 175
— усвоение молекулярного азота 172
— физиологическая роль в расто-
пив 171
Азотофиксяторы 172—173
Аготофиксяцля 173
Аллостерический, эффект 43
Альдолаза 160
Амиды 175, 177—179
Амилаза 233, 257
Аминирование 176
Аминокислоты 34, 140
— дезаминирование 176
Амипотрапсфораза 177
Аммиак 173—175, 177—179
Анабиоз 91
Антагонизм попов 158. 163
Аптезип 282
Алексы 283
Апопласт 30, 168. 186
Анатомический путь дыхания 214—•
217
Аппарат Гольджи 23
Аппозиция 231
Аспарагин 175—177
Аспарагиновая кислота 176—177
Ассии илнционое число 148
Ауксины 160, 232, 234, 236, 241, 245—
249, 255, 257, 259-261, 263
Ацотил-КоА 202—204, 213, 223, 224,
233, 250
Бактериальный фотосинтез 96, 125
Бактериохлорофилл 111,125
Белки 33—38
— мембранные 20
— регуляция синтеза 39
— синтез 33—34,36
— хлоропластов 99
Бор, физиологическое значение в растении 161
Брожение 193, 211—213
Вакуоли 10, 27
Вегетационный домик 154
— метод 154
---водпьте культуры 154,157
---песчаные —154
------- почвенные —154
---стерильные —164
Верхний концевой двигатель 78
Витамины 39
Влажность завядания 84—85
Вода 46, 61
— ассоциации молекул 61, 62
— в почве 84—85
— гигроскопическая 84
— диполь 61
— значение в жизнедеятельности .растении 61
— недоступная для растений 85
— передвижение по тканям 81
— поступление 46, 52
— свободная 62, 63
— связанная 62, 63
— содержание в органах растений 63
— теория сцепления 81
— физические свойства 61
Водпый баланс 64
Водный дефицит 64, 86, 87, 89, 146
Водный потенциал 46.51,78, 81, 84
— градиент 78
Водпый режим 61—94
Водный стресс 89
— экологических групп растений 90—93
Водородные связи 40, 62
Восстановительный потенциал 196, 197
Время презентации 264, 265
Вымокание 289
Выпирание 289
Выпревание 289
Вязкость 17, 87, 157
Галактуроновая кислота 13
Галофиты 291
Гексоаы 136
Гексокиназа 158, 198
Геи 207
Гемицеллюлоза 13
Генетический код 33
Геном 33, 238
Гербициды 261
Гетеротрофы 95
Гиалоплазма 10, 21, 101
Гиббереллины 264, 249,252,254,261—
262, 257, 282
Гибберелловая кислота 249
Гигрофиты 90
Гидатоды 79
Гидролавы 42
Гипертонические растворы 48
Гликолевая кислота 146—147
Гликолиз 196, 212
Гликофиты 201
Глиоксилатный: цикл 213
Глиоксалевая кислота 147, 213 t
Глиоксисомы 213, 238
Глутамин 175, 177, 179
Глутаминовая кислота 173, 173, 177
Глюкоза 198
Глюкозо-В-фосфат 196, 215
Глюкозофосфат дегидрогеназа 235
Глтокопротепды 17
Голохром 110
""ормоны 282
'ормоны цветения 282—283
’раны 1С0
Гуттация 79
Давление пебухання 52
Движения растений 263
Дегидрогеназы 205
— пиридиновые 205
— флавиновые 206
Дезоксирибонуклеиновая кислота
(ДНК) 25,27—32, 34-35, 38, 103
ДНК-полимерааа 157
Диктиосомы 23
Динитрофеиол 167—209
Диссимиляция 193
1,3-Дифосфоглицериповая кислота
133, 199, 200
Дифференциальное центрифугирование 12
Диффузия 46
— облегченная 57
2,4-дихлорфепоксиуксуспая кислота (2,4Д) 261
Длиннодневные растения 279—282
Дождевание 94
Дыхание 193
•— анаэробное 198
— аэробное 196, 201
— влияние кислорода 218
----температуры 217
----питательных свяей 220
— — света 219
----содержание влаги в тканях 219
----углекислого газа 219
— значение 194
— генетическая связь с брожением 211
----фотосинтезом 224
— климактерический период 220
— пути дыхательного обмена 198
— субстраты 197, 198
— центральный процесс обмена веществ 194
— энергетический баланс 211
Дыхательные яды 54
Дыхательный коэффициент 197
Жаростойкость 285
Железо 15, 39, 148, 159, 173
— геминовое 39, 158
— физиологическая роль в растении 148
Завяданяо 86—87
Закаливание 96, 234, 286—288, 291
Закон Заленского 92
Засоление 289
Засуха 85
— атмосферная 85—86
— почвенная 85
Засухоустойчивость 92
Зимостойкость 289
Зааткн 252
Зеленые серобактерии 125
Зола растений 152
Изолииопиая кислота 203
Ивомеразы 42
Изотопы кислорода 125
— углерода 132
Изоэлектрическая точка 33
Ингибиторы роста 254—255
Мцдолилуксуспая кислота 245
Инициальные частицы 401
Ионофор 56
ИУК-оксидаза 246
Календарный возраст органа 273— 274
Калий 147, 157—158, 162—163
Каллюс 236
Кальций 156-157, 162-138, 173
Карбоангидраза 160
Каротиноиды 101, 113—115
Каталаза 24
Катализаторы 39
Квантовая теория света 116—117
Кетослутароаая кислота 173, 176— 177
Кинетин 252, 255
Клетка 9—60
— морфология 10
— структурные компоненты 12
Клеточная оболочка 10, 13
— сек 27
— строение 13—16
Клубеньковые бактерпи 173,173
Кобальт 162
Когезия 82
Колеоптиль 234
Компартмсптация 13
Компартмепты 18, 28
Компенсационная точка 142
Компетенция 260
Корневая система 75—77
— определение поглощающей поверхности 165
Корневое питапио растепий 152 — поступление солей 164, 165, 167, 163
•--активное 163
--- пессивное 168
— связь с водообменом 77
Корневое давление 79
Корневые волоски 77
Короткодпевпыо растспия 279—282
Корреляция у растений 262
Космическая роль зеленого растения 96
Кофермент Q (убпхипоп) 207
Коэффициент завядания 84
— диффузии 71
Ксаптофиллы 113
Кссроморфпая структура 81, 92, 142
Ксерофиты 90
Краевая диффузия 63
Кристы 25
Критический период 89—94
Культура изолированных тканой
236, 237, 252
Кумарин 255
Кутикула 65, 68
Ламеллы 160
Лейвоплзсты 96, 101
Лециткп 157
Лигпип 16
Лизосомы 24
Лимонная кислота 203
Липид I 13, 17
Липопротеиды 20
Магпий 157, 174, 176
Макроэлементы 158, 155, 156
Макроэргические связи 133, 200
Марганец 447, 159
Матрикс 13
Мевалоновая кислота 249, 250, 254
Медь 148, 160, 174
— физиологическое значение в растении 160
Мевофиты 90
Мембраны 18, 19
• — митохондриальные 25
— модели структуры 19, 20
— хлоропластов 100
— элементарные 19
— ддерпые 27
Меристемы 235
— ожидания 235
Мертвый взпас воды 85
Метаболические вилки 255
Метионин 156
Метод меченых атомов 132
Механизм фдоэмиого транспорта 190
Микориза 182
Микротрубочки 24
Микрофибриллы 13
Микрофлора 182, 246
Микроэлементы 133, 154,159, 162
Митохондрии 25
— оптогенез 26
— роль в энергетическом обмене 26
— строение 25
— ферменты 26
— химический состав 25
Мицеллы 13
Молибден 160, 161, 173, 174
Монокарпические растения 273
Морозоустойчизость 285
Морфогенез 283
Морфогенетические тесты 237
Насекомоядные растения 179
Наследственный код 31, 32
Настин 263, 266
Нефосфорилнрующее окислепко 210
Нижнпн концевой двигатель 78
Никотипамидаденипдипуклеотид
(НАД) 202—204, 209, 217, 222
НАД-На 211, 212, 217, 222
Никотинамидадепипдикуклсотид-
фосфат (НАДФ) 205, 218, 222
НАДФ-На 131, 136
Нитраты 174, 175
Нитратродуктаза 160, 174,175
Нитриты 174, 175
Нитрогеназа 173
Нуклеиновые нислоты 27
Нуклеопротеиды 17
Обезвоживание 87
Обмен веществ (метаболизм) 39
Озимые растения 277
Окислительно-восстановительный
потенциал 205, 128
Окислительное декарбоксилирование 202
Окислительное фосфорилирование
207, 209
Оксидазы 197
Оксидоредуктазы 42, 205
Онтогенез 274, 275
— этапы 274
Оплодотворение 232
Опробковение 16
Опыление 232
Органеллы клетки, функции 10, 22—
26
Органогенез 276
Орошение 93, 94
Осмос 46
Осмотический попезатель 47
Осмотический потенциал 52
Осмотическое давление 47, 42, 81
Относительная транспирация 77
Партенокарпические плоды 138, 260
Пасока 169
Пектиновые вещества 13
Пентозофосфатпый чуть 214—217
Псреамииировапие 140, 177
Передвижение органических веществ по растению 186
Переносчики 55, 57
Периодичность ростовых процессов
263
Пероксисомы 24, 146
Пигменты 105
— биосинтез в растении 109
Пиноцитоа 59
Пировиноградная кислота 173, 201, 211
Пиррольные группировки 106
Питательная смесь Кнопа 153
Плазмалемма 21, 59
Плазмодесмы 12, 15, 169
Плазмолиз 48, 50, 38, 157
Пластиды 98
— онтогенез 101
— происхождение 103
Пластохиноны 150, 131
Пластоцианип 160
Плач растений 79, 87
Покой 268—272
— рагуляция 272
— физиологические основы 268
Покоящийся центр 235
Поликарпические растения 273
Полив растений 96, 94
Полпсомы 24, 38
Полифеполоксидааы 160
Полярность 238
Порфины 106
Поступление ионов в растительную клетку 53—60
— активное 54, 57, 60
— пассивное 54, 57, 60
Потенциал давления 52
Почвепцый поглощающий комплепо 180
Поясок Каспари 77, 80
Прокариоты 9, 22
Проницаемость мембран 18, 19, 87
Пропластиды 101
Протеазы 87, 283
Противодавление клеточной оболочки 50
Протопласт 10
Протохлорофиллид 109, 110
Развитие 273—283
— влияние температуры 277
— регуляция 276
— свет 279
— связь с органогенезом 276
Разобщающие вещества 209
Реакционный центр 122, 123
Реакция Хилла 126
Рагеперация 262
Регуляция дыхательного обмена 222, 223
Рспрессоры-деропрессоры 45
Ретарданты 261
Реутилизация 184
Рибоза 195
Рибулсзодифосфат 122, 133, 235
Рибулезо-5-фосфат 136, 215
Рибонуклеиновая кислота 93,27,34—
38
Рибосомы 22, 36, 27, 26
Ризосферные микрооргапяамы 181
Рост 226—273
— ппешпио услоиия 239, 240
— периодичность 268
— спет 241—244
— скорость 238
— снабжение кискородом 244
— температура 239, 240
— типы 235—236
— фазы 227—232
Ростовые движения 263—268
Сахароза 287
Светокультура растении 244
Светолюбивые растения 142
Свободное пространство клетки 15, 55
— корпя 163
Сера 155
Сетчатый рост 231
Симбиоз 173
Симпласт 15, 80, 81, 133, 186
Сииглетпое состояние 121
Скарификация 272
Солеустспчивость 291
Сосущая сила 50, 73,78,81,24,94
Спектр солнечной радиации 117
Срединная пластинка 15
Стратификация 272
Суберин 16
Субстратное фосфорилирование 204
Суккуленты 90, 138
Сукцинил-КоА 203
Схема Жакоба и Моно 44
Температурный воэффициепт 42
— дыхания 218
— фотосинтеза 144
Теневыносливые растения 142
Тенелюбивые растения 142
Теория Септа—Холодного 267
Теория сцеплсппя 81
Теория хроматической адаптации 116
Теория циклического старения и омоложения растений 273, 274
Тилакоиды 190, 101
Тонопласт 22, 27, 59
Тотипотентность 236
Трансмембранный потенциал 210
Транспирация 65, 81, 88, 87, 90, 04
— биологическое вначение 65
— ввсустьичная регулировка 67
— единицы измерения 74
— кутикулярная 67, 72
— суточный ход 73
— устьичная 67
— физическая природа 68
— атапы 67—69
Триплетное состояние 122
Триптофан 246
Тропизмы 263
— геотропизм 264
— гидротропизм 265
— тягмотропизи 265
— фототропизм 265
— хемотропизм 265
Тургор 48
Тургорпое давление 50, 51, 80
Ультрамдкроэлементы 153
Уравнение Дальтона 71
Уравновешенный раствор 163
Устойчивость растепий 284
— к засухе 81
— к засолению 263
— к температурам 286
Устьица 86
Устьичиые движения 69
Фепольпые ингибиторы роста 255
Фсофитпп 107
Ферменты 39—45
— активность 40
— классификация 42
— однокомпонентные 39
Ферредоксин 128,158
Физиологическая кислотность и ще-почность солей 164
Физиологический возраст органа 273, 274
Фикобилины 115, 116, 242
Фикоцианин 115
Фикоэритрины 115
Фитогормоны 232, 245, 256, 258—260
Фитол 106
Фитохром 241, 280
Флавин 175
ФлавииаденЕпдипуклеотид (ФАД) 202-204, 208. 209
Флавинадениныонопуклеотид (ФМН) 206
Флоэма 188
Флюоресценция 108, 109, 122
Формула Дальтона 71
Фосфоглицериновый альдегид 133, 134, 196, 211, 216, 217
Фосфогиицерзновая кислота 132, 133, 200, 211
Фосфодиоксиацетон 134,199
Сосфоснолпировиноградная кислота
137, 201, 233
Фосфолипиды 19
Фосфор 447, 155
Фосфорилаза 157
Фосфорилирование 155
— окислительное 207, 209
— фотосинтетическое 127, 129
— — нециклическое 127, 128
---циклическое 127, 129, 130
Фотодыхание 24, 138, 148, 219
Фотоокяслепие воды 129
Фотопериодизм 277, 279
Фотопериодическая индукция 279
Фоторедукция 125
Фотосинтез 95—150
— ассимиляция 98
— видимый 141
— влияние внешних условий 141
---Н3О 146
---02 146
---минерального пптааия 147
---света 142, 143
— — температуря 144
---СО2 145
— дневной код 149
— значение 98
— истинный 141
— история развития учения 97
— урожай 150, 151
— как сочетание световых и темновых реакций 124
— квантовой расход 120, 136
— КПД 144
— нецшмичесЕое фотофосфорилирование 126—128
— отток ассимиляторов 143
— первичные продукты 139—141
— роль пигментов 105
— «Сз» путь фотосинтеза (цикл Кельвина) 131—136
— «С<» путь фотосинтеза (цикл Хатча-Слэка) 186—138
• — суммарное уравнение 125 — фотофивический этап 120—124 — фотохимический втап (енотовая фаза) 126,131
— циклическое фотофосфорилирование 130
— энергетика 116
Фотосинтетическая единица 193, 127
Фотосинтетический коэффициент 130
Фотосистеме I и II 127—129
Фруктозо-1,6-дифосфат 134, 136, 129, 196, 223
Фумаровая кислота 202—204
Хемио-осмотическая теория 209, 130
Хемосинтез 96
Химический потенциал 48, 54
Хиноны 126
Хлоропласты 98
— величина 99, 100
— мевофилла 137
— обкладки 137
— онтогенез 101
— структура 99
— химический состав 99
Хлорофиллы 105
— агрегированная форма 108
— биосинтез 109
— мономерная форма 108
— разрушение 110, 111
— связь с белком 108
— спектр поглощения 108, 109
---флюоресценции 109
— химическая природа 106—108
— хлорофилл а 105
— хлорофилл 6 105
— хлорофилл-ловушка 123, 126, 127
Хлорхолпнхлорид (препарат ССС) 262
Хроматографический метод 105
Хроматофор 98
Хромопласты 101
Хромосомы 28
Целлюлоза 13
Цикл Кальиипа 131—136
Циия Кребса (ципл трикарбоповых кислот) 202, 204, 224
Цинк, физиологическое значение в растении 160
Цистеин, цистин 156
Цитовкиины 234, 236, 252—254, 257, 261
Цитоплазма 10, 17
— вязкость 17, 18
— движение 18
— коллоиды 34
— свойства 18
— содержание воды 18
— строение 18
— химический состав 17
Цитоплазматическая наследственность 29
Циторриз 51
Цитохромоксидава 160, 208
Цитохромы 129, 207, 208
Шикимовая кислота 224, 246
Щавелсвояптарная кислота 203
Щавелевоуксусная кислота 137, 178,
202, 223, 224
Экстопсин 15
Электроино-травспортпая цепь дыхания 205
— фотосинтеза 126, 130
Электрохимический мембранный потенциал 209
Эндодерма 77
Эпдоплазыатичоский ретикулум 22
Эндосперм 270
Энергетический цикл жизни 193
Эпяфиты 75
Эритрозофосфат 134
Этиолированные проростки 241
Эукариоты 9
Эфомеры, сфсмороиды 90
Эффект Пастора 212, 213, 222
Яблочная кислота 202, 203
Ядро 27
— поры 27, 26
—- химический состав 27, 28
Ядрышво 28
Янтарная кислота 202—204, 213
Яровизация 277, 278
ОГЛАВЛЕНИЕ
Предисловие ...............................
Введение . . - ............... ...............
Глава I. Физио тогия растительной клетки .
Строение клетки........................ ...................
1. Клеточная оболочка............. - - •
2. Цитоплазма ........................................
3. Митохондрии........................................
4. Вакуоль............................................
5. Ядро ............................................
Молекулярные основы хранения и реализация наследственной информации ............................................... -
1. Наспсдствеппый код..................................
3. Биосинтез белка.....................................
3. Обмен веществ. Особенности регуляции синтеза бейка в клетке ...............................-................
Поступление воды в растительную клетку.....................
1. Диффузия и осмос....................................
2. Клетка как осмотическая система .... .........
Поступление ионов в растительную клетку....................
1. Пассивное и активное поступление ...................
Список рекомендуемой литературы ...........................
Глава П. Водный режим растений . .
Общая характеристика водного обмена раститеньпого организма .
1. Физические и химические свойства воды...............
2. Распределение воды в клетке и в организме...........
3. Водный баланс растения..............................
Расходование водах растением — транспирация.................
1. Зггачеппс транспирация..............................
2. Лист как орган транспирации............... . .
3. Влияние внешних условий па степень открытости устьиц . .
4. Влияние условий на процесс трапспирации .......
Поступление и передвижение воды по растению.................
1. Корневая система как орган поглощения воды..........
2. Основные даигатали водного тока...............
3. Передвижение воды по растению.....................
4. Влияние алешних условий на поступление воды в растение Физиологические основы устойчивости растений к засуха ....
1. Влияние иа растение недостатка воды ................
2. Физиологические особенности засухоустойчивых растений .
3. Физиологические основы орошения....................
Список рекомендуемой литературы...............
300
ssssMsssiaasi । assi । г gsaaiss sag i
Глава III- Питание растений углеродом (фотосинтез) ...... 95
Значение процесса фотосинтеза и история его изучения.......
Лист как оргии фотосинтеза. Особенности диффузии COs в листе Хлоропласты, их строение и образование ....................
1. Химический состав в строение хлоропластов ......
2. Онтогенез пластид....................................
3. Физиологические особенности хлоропластов . . ...
Пигменты листа ..........................................
1. Хлорофиллы .................................... ....
Химические свойства хлорофилла .... ...
Физическое свойства хлорофилла .... . .
Биссинтев хлорофилла................... -
Условии образования хлорофилла . . . . .
2. Каротиноиды ............................ • •
3. Фикобилины................................... -
Энергетика фотосинтеза.................................• -
1. Зпачение отдельных участков солнечного спектра для фото-
синтеза ......................-........................
2. Фотофиаический атап фотосинтеза . ....................
Химизм фотосинтеза ..................................... .
4. Происхождение кислорода при фотосинтезе.............
2. Фотохимический этап фотосинтеза. Циклическое и нецикли ческое фотосинтетическое фосфорплироиание................
3. Темповая физа фотосинтеза — путь превращения углерода «С-3» путь фотосинтеза (цикл Кальвина)...................
«0-4» путь фотосинтеза (цикл Хетча—Синка)............
4. Продукты фотосинтеза..................................
Фотосинтетическое образованно углеводов...............
Фотосинтетическое образованно аминокислот.............
Влияние условий иа интенсивность процесса фотосинтеза .... 1. Влияние впивших условий па интенсивность процесса фотосинтеза ..................................................
Влияние света ........................................
Коэффициент использования солнечной энергии ....
Влияние температуры..................................
Влияние содержания COs а воздухе.....................
Влияние снабжения водой..............................
Снабжение кислородом и интенсивность фотосиптаза
Влияние минерального питания................. ....
2. Влияние впутроппнх факторов на процесс фотосинтеза .
3. Дневной ход фотосинтеза ............................
4. Фотосинтез я урожай.................................
Список рекомендуемой литературы...........................
97
98
99
101
104
105
106
106
109
111
113
115
116
117
120
124
126
131
136
139
140
141
142
144
145
146
147
148
149
ISO
151
Глава IV. Корневое шпанке растений............................. 152
Физиологическая роль элементов минерального нпташш .... —
1. Элементы, необходимые для растительного организма . . 153
2. Физиологическое значение макро- и микроэлементов . . 154
Макроэлементы ........................................ 155
Микроэлементы ........................................ 159
3. Антагонизм ионов....................................., 163
Поступление минеральных солей через корневую систему . . . 164
1. Корневая система как орган поглощении солей .... 165
2. Особенности поступления солей в корневую систему . —
3. Роль корней и жизнедеятельности растепий ...... 169
Поступление и превращение соединений азота в растениях ... 171
1. Особенности усвоения молекулярного азота............... 172
2. Питание азотом высших растений......................... 174
3. Азотный обмен растений.................................. —
Почва как источник питательных веществ........................ 179
1. Питательные вещества в полно и их усвояемость ..... —
2. Значение кислотности почвы............................ 180
3. Значение почвенных микроорганизмов.................... 181
Список рекомендуемой литературы............................... *82
Г Л а В а V. Передвижение питательных веществ по растению .... 183
Передвижение элементов минерального питания (восходящий ток) —
Круговорот минеральных веществ в растении (реутилизация) 184
Особенности передвижения органических веществ по растению . . 186
Список рекомендуемой литературы.............................. 192
Г л а в в VI. Дыхание растений.................................... 193
Общие вопросы дыхательного обмена ............ —
1. Значение дыхания в жпзин растения...................... 194
2. Адснозиптрпфосфат, структура и функции ....... 195
3. Окислительно-восстановнтегаыше процессы. Работы Л. Н. Ба-
ха и В. И. Палладипа....................................... 196
4. Субстраты дыхания ................................... 197
Пути дыхательного обмена ................................. - 198
1. Гликолиз 4-цикл Кребса ................................... —
Анаэробная фаза дыхания (гликолиз)....................... —
Аэробная фаза дыхепия.................................. 201
Энергетический баланс процесса дыхания................. 211
Химизм процесса брожения................................. —
Глиоксилатный цикл..................................... 213
2. Пентозофосфатный путь дыхательного обмена............... 214
Влияние внешних я впутреиних факторов па интенсивность дыхания ......................................................... 217
1. Влияние внешних условий на процесс дыхания .... —
2. Влияние внутренних факторов ............................ 220
Пути регуляции дыхательного обмепа............................ 221
1. Локализация в клетке реакций дыхательного обмепа . . —
2. Регуляция дыхательного обмена.......................... 222
3. Взаимосвязь дыхания с другими процессами обмепа . . . 223
Список рекомендуемой литературы................................ 225
Глава VII. Рост и развитие растений .
Рост растений...............................................
1. Особенности роста клеток............................
2. Особенности прорастания семян . ....................
3. Тины роста органов растения ...... .
4. Культура изолированных тканей ..... ...
5. Дифференциация тканей...............................
6. Влияние внешних условий Па рост.....................
7. Гормоны роста растении (фитогормопы)................
Ауксины . ..........................................
Гиббереллины........................................
Цитокинины .............................
Ингибиторы роста ...................................
Взаимодействие фитогормонов.........................
Механизм действия фитогормоисв......................
Применение фитогормонов в практике растениеводства . .
3. Ростовые корреляции. Регенерация................ .
8. Движение растений. Тропнзмы и пастии................
10. Физиологическая природа движения растений..........
Физиологические основы покоя растений ..........
1. Покой семяп ....................
2. Покой почек..............l.ll.J' I
226
227
232
235
236
237
236
245
249
252
254
255
256
260
262
263
266
268
269
271
Bsgigsi iH gggiSaai
3. Регуляция процессов покоя............................. 272
Развитие растепли............................................. 273
1. Теория циклического старения и омоложения растений .
2. Этапы развития растений..........................
3. Регуляция процесса развития . . ...............
Влияние впеппшх условий па процесс развития . . . Яровизация ...............................
Фотопериодизм ............................
Гормоны цветения ..... . . ...
Список рекомендуемой литературы..........................
Глава VIII. Физиологические основы устойчивости растений . .
Жаростойкость растений...............................
Морозоустойчивость растений............... .
Лрпчипы гибели растений от мороза .... Закаливание растений ............................
Зимостойкость растений........................
Устойчивость растении к засолепню.............
Причины вредного ваииния солон................. .
Солеустоичивость растений. Галофиты . ....
Список рекомендуемой литературы..........................
Предметный указатель...........................................293
Наталья Ивановна Якушкина
ФИЗИОЛОГИЯ РАСТЕНИЙ
Редактор И. Н. Соловьева.
Художник Б. Л. Николаев.
Художественный редактор В. Г. Ежков. Технический редактор С. Н. Терехова.
Корректор О. В. Ивашкина.
ИБ № 4358
Сдано в вабор 15.11.79. Подписано к печати 23.04.80. бОХОО’/и. Бум. кн, акурв,-Гарн. об. новая. Печать высокая. Уел. печ. л. 18. Уч.-изд. л. 21,40. Тираж S3 ООО ак: Заказ М 778. Цена 90 коп.
Ордена Трудового Краевого Знамени издательство «Просвещение» Государственного комитета РСФСР по делам издательств, полиграфии и книжной торговли. МОСК' S-Я проезд Марьиной рощи, 41.
Ярославский полиграфкомбинат Союэполиграфпрома при Государственном номитетг СССР но делам издательств, полиграфии в книжной торговли. 1S0014, Ярославль ул. Свободы, 87.