Текст
РАБОТЫ С МИКРОСКОПОМ В СРЕДНЕЙ ШКОЛЕ
Я. А. Ц И Н Г Е Р
ПРОСТЕЙШИЕ
ПРАКТИЧЕСКОЕ РУКОВОДСТВО
ДЛЯ УЧИТЕЛЕЙ СРЕДНЕЙ ШКОЛЫ
Под редакцией
директора Болшевской биологической станции
А. С. БОГОСЛОВСКОГО
ГОСУДАРСТВЕННОЕ
УЧЕБНО-ПЕДАГОГИЧЕСКОЕ ИЗДАТЕЛЬСТВО
МИНИСТЕРСТВА ПРОСВЕЩЕНИЯ РСФСР
МОСКВА 1947
Утверждено
Министром просвещения РСФСР
к изданию 24 марта 1947 г., протокол № 158.
ОТ ИЗДАТЕЛЬСТВА
Книга предназначена для учителей средней школы в качестве
пособия при проведении занятий по простейшим животным в
классе и особенно в уголке живой природы, а также в кружках
юных натуралистов.
Отзывы и пожелания следует направлять по адресу:
Москва, Чистые пруды, 6, Учпедгиз, редакция естествознания.
ОТ АВТОРА
Опыт краткосрочных курсов, организованных Болшевской био-
логической станцией для учителей Московской области, показал,
что учитель в своей повседневной школьной работе нередко
испытывает затруднения, когда ему приходится демонстрировать
и ставить опыты с живым материалом.
Данная книжка — не учебник, это лишь практическое пособие
к учебнику. В своей работе я стремился дать учителю такие
указания, которые помогли-бы ему приобрести реальное и нагляд-
ное представление о мире простейших: об амёбах, инфузориях,
жгутиковых и некоторых паразитах. Наиболее подходящим объек-
том для работы в школьных условиях могут служить инфузории,
и поэтому им отведено места больше, чем представителям осталь-
ных групп.
Для удобства я счёл целесообразным разбить материал по
степени трудности на три категории.
Без всякого обозначения приведены наиболее простые
опыты, демонстрации и методы культивирования, до-
ступные для школы. Одной и двумя звездочками обоз-
начены более сложные методы культивирования и
опыты, технически более трудные или требующие более
длительных наблюдений. Этот материал отчасти можно
использовать для внеклассной работы в кружках юных нату-
ралистов, а главным образом для повышения квалификации
самого учителя.
Рисунки большей частью оригинальны — сделаны с живых
объектов. Они несколько примитивны, но я сознательно хотел
воспроизвести лишь то, что может быть уловлено глазом не-
специалиста.
В заключение сердечно благодарю товарищей по научно-
исследовательской работе Л. С. Пешковскую, В. П. Трофимович
и В. В. Чернову, а также рецензентов Л. Б. Левинсона и П. П.
Аполлонова за их ценные советы и указания.
Я. Цингер.
ВВЕДЕНИЕ.
Мир микроскопических существ — микробов — можно разде-
лить, подобно высшим организмам, на две группы: простейшие
растения (Protophyta), куда относятся бактерии, водоросли и
низшие грибы, и простейшие животные (Protozoa), куда от-
носятся корненожки, споровики и инфузории. Существует также
группа жгутиковых, совмещающая в себе как растительные,
так и животные признаки. Поэтому жгутиковых одинаково изу-
чают и зоология, и ботаника. Данная книжка посвящена только
простейшим животным. Их изучает отдел зоологии, который
называется протозоологией.
Тип простейших животных (Protozoa) разделяют на четыре
класса:
I. Жгутиковые (Flagellata). Двигаются при помощи жгутиков.
II. Корненожки (Rhizopoda). Двигаются при помощи ложно-
ножек (псевдоподий).
III. Споровики (Sporozoa). Движение во взрослом состоянии
обычно отсутствует. Размножаются спорами.
IV. Инфузории, или ресничные (Infusoria или Ciliata). Дви-
гаются при помощи ресничек.
Количество известных видов простейших достигает 15000, но
цифра эта ещё далека от действительной; об этом свидетельствуют
факты увеличивающихся с каждым годом описаний новых видов.
Несмотря на свою микроскопичность, простейшие также, как
высшие животные, различаются по размерам. Наименьшие из
них равны 3—4 ц (микронам)1 как, например, некоторые жгути-
ковые. В среднем же большинство достигает 50—150 ц. Встре-
чаются и сравнительно крупные организмы — до 1 и даже 2 мм:
инфузории трубач (Stentor) и спиростомум (Spirostomum), а
также жгутиковые — ночесветка (Noctiluca). Грегарина пороспо-
ра (Porospora gigantea) достигает до 16 мм в длину. Ещё крупнее
раковинки ископаемых корненожек (нуммулитов) — до Зсм в
диаметре, а недавно Кэшмэн описал раковинки современных
корненожек (Batysiphon) до 5 см длины. В природе встречаются
как свободно живущие, так и паразитические простейшие.
1 Микрон — Viooo Доля миллиметра, обозначается греческой буквой у.
5
Свободно живущие простейшие обитают в морских и пресных
водах (океаны, моря, реки, озёра, пруды, мелкие водоёмы). Даже
минимальное присутствие влаги создаёт уже благоприятные
условия для жизни простейших. Так, новейшие исследования
показали, что существует очень богатая фауна простейших (амёб,
жгутиковых, инфузорий) в различных почвах. Но даже и полное
отсутствие влаги многие простейшие могут переживать благо-
' даря способности образовывать цисты, в которых организм может
долго существовать в состоянии анабиоза. Паразиты частично
встречаются во всех классах простейших, но есть один класс
(споровиков), который 'представлен исключительно паразити-
ческими формами. При всех детальных исследованиях внутрен-
ностей высших животных почти всегда находят в них тех или
иных простейших — паразитов. Классическим примером в этом
отношении может служить обыкновенный чёрный таракан, во
внутренних органах которого находятся паразиты всех четырёх
классов простейших (амёба — Entamoeba blattae, жгутиконосец —
Lophomonas blattarum, споровик — Gregarina blattarum, инфузория
—Nyctotherus cordiformis, и др.). Масса инфузорий также живёт
в задней кишке лягушки. Несметное количество других ин-
фузорий обитает в желудке копытных.
Велико отрицательное значение паразитических простейших.
Достаточно указать на патогенную роль возбудителей малярии,
амёбной дизентерии, лейшманиоза и сонной болезни для человека,
пироплазмоза для лошадей и рогатого скота, кокцидиоза для
кроликов, микроспоридий для рыб и т. д.
Но вместе с тем те простейшие, которые питаются бактериями
(в том числе и болезнетворными), играют большую роль в так
называемой «биологической очистке» водоёмов. Так, например,
мелкие жгутиковые бодо (Bodo) способны в течение двух суток
снизить число тифозных бактерий с 200000 до 8000.
Сами простейшие являются пищей для мелких водных живот-
ных как дафнии, циклопы, мелкие черви, коловратки и т. д. и,
следовательно, в известной мере Определяют их численность в
водоёме, а через них — и других более крупных животных.
Кроме того, мальки рыб на самых ранних стадиях развития
питаются инфузориями, которые таким образом оказывают влия-
ние и на фауну рыб.
Простейшие играют крупную роль в образовании земной поверх-
ности. Скелеты и раковинки отмирающих морских и океанских
форм, падая на дно, с течением времени образовывают мощные
отложения. При геологических изменениях эти отложения под-
нимались на поверхность, и их-то теперь мы наблюдаем в виде
меловых и известковых пластов.
Часть первая
СБОР И РАСПОЗНАВАНИЕ ПРОСТЕЙШИХ
I. ВОДОЁМЫ
Простейшие (амёбы, инфузории и жгутиковые) — обитатели
пресных вод, однако не во всяком пресноводном водоёме можно
получить хорошую культуру простейших. Несмотря на все
старания, невозможно, например, получить достаточно материала
в середине реки или озера. Все свободно живущие простейшие
встречаются главным образом в стоячих, непроточных водах.
Это основное правило никогда не следует забывать в поисках
материала.
Различными простейшими обильно населены небольшие не-
проточные прудики с опавшей листвой или маленькие торфяные
болотца, загородные, деревенские и лесные ямы с гниющими ор-
ганическими веществами. Такие водоёмы нередко издают харак-
терный сероводородный запах и сплошь да рядом буквально
кишат множеством инфузорий (парамеции, стенторы, спиросто-
мумы, стилонихии, сувойки) и раковинных амёб (арцеллы, диф-
флюгии). В особенности населена прибрежная зона.
Итак, отметим первый, основной тип водоёма — маленький
прудик, прибрежная зона которого заполнена перегнивающей
опавшей листвой.
Второй тип —пруды более крупного размера, обычные пруды
средней полосы РСФСР, «цветущие» весной и летом из-за размно-
жения в них громадного количества жгутиковых. Такие пруды
большей частью заселены различными водными растениями
(элодеей, кувшинками, рдестом, лягушатником) и водорослями
(спирогирой и др.). Эти пруды уже не издают характерного
сероводородного запаха; вода здесь чище, богаче кислородом.
Здесь найдём богатую фауну жгутиковых: вольвокса, пандорину,
различных эвглен, а кроме того — голых амёб.
Третий тип — прибрежная зона глубоких заводей рек. Од-
нако здесь простейшие встречаются в меньшем количестве.
Четвёртый тип —мелкие водоёмы (лужи, канавы), пересыха-
ющие в жаркое время года. Здесь можно тоже найти богатую и
подчас очень своеобразную фауну простейших.
7
Нередко можно отыскать водоём, совмещающий все перечислен-
ыне четыре типа. Так, например, в одном и том же прудике можно
найти прибрежную зону с опавшей листвой, гниющими сучьями
и брёвнами. Эти места, издающие характерный сероводород-
ный запах, будут соответствовать водоёму первого типа (ин-
фузории, раковинные амёбы). В том же пруду, в другом месте,
встречается прибрежная зона с разнообразной водной раститель-
ностью — элодеей, ряской и спирогирой. Эта зона будет соот-
ветствовать второму типу (вольвоксы, пандорины, эвглены, амёбы).
Наконец, тут же можно найти мелководную тинистую зону, где
можно собрать материал по раковинным и голым амёбам. Оты-
скав такой водоём в окружающей школу местности, учитель в
любое время сумеет получить богатый материал для школьных
занятий1.
II. ТЕХНИКА СБОРА
Для сбора материала необходимо приобрести 2—3 высокие
цилиндрические банки (так называемые банки для варенья или
специальные, с притертой пробкой); к ним нужно привязать
верёвочные ручки. Банки лучше всего использовать новые, не
бывшие в употреблении; во всяком случае они должны быть
чисто вымыты. Такие банки нужно употреблять только для
сбора материала.
Перед взятием пробы необходимо споласкивать банки водой
данного водоёма.
Отыскав подходящее место, зачерпывают половину банки воды
у самого берега. Затем сачком, палочкой или просто руками
прибавляют в банку опавшей перегнившей листвы, ряски и обяза-
тельно немного ила со дна. В другом месте наполняют другую
банку, прибавляя на этот раз водяные растения: ряску, элодею,
спирогиру. Наконец, из третьего места можно взять пробу из
илистого мелководного места. Тем самым в трёх банках будут
созданы различные условия для жизни простейших, что вызовет
в свою очередь и развитие различных видов их. После сбора
банки тут же на месте осматриваю! на свет. Если в банке ока-
жется много дафний, циклопов, насекомых и их личинок, то
содержимое лучше вылить и налить снова, стараясь найти место,
где ракообразных и насекомых будет меньше. Не надо забывать
основного правила, что все мелкие животные — враги простей-
ших, так как питаются ими.
Можно взять пробу и из высохшего водоёма. Для этого со
дна достают комок ила с листвой и детритом (детрит — продукт
1 В частности, московские учителя могут найти такого рода водоёмы в Пе-
тровско-Разумовском, на территории парка Тимирязевской сельскохозяй-
ственной академии, недалеко от большого озера, в Ботаническом саду и др.
местах.
8
распада мёртвой ткани) и доливают водой (речной, дождевой или
водопроводной).
Ошибочно думать, что нельзя собрать материал зимой. Многие
простейшие прекрасно живут в описанных водоёмах под толстым
слоем льда в течение всей зимы. Для взятия пробы лёд скалывают
у берега и зачерпывают банкой так, как указано выше. Нередко
зимние пробы оказываются даже лучшими, чем летние, так как
в них всегда меньше дафний и других ракообразных — врагов
простейших.
Ш. ОСМОТР ФАУНЫ ПРОСТЕЙШИХ НА МЕСТЕ
Предварительный осмотр фауны на месте возможен при помощи
ручной лупы, однако для этого нужен некоторый навык.
На экскурсию берут 2—3 чистые химические пробирки. Перед
сбором в исследуемых местах водоёма эти пробирки наливают до
половины водой и, направив на свет, просматривают под ручной
лупой. Во-первых, при этом можно сейчас же определить, много
ли в данном месте мелких животных — врагов простейших. Во-
вторых, хорошо можно отличить и многих простейших, в особен-
ности таких крупных инфузорий, как, например, тёмные, похожие
на пакетик стенторы, червеобразные спиростомумы, бочонкообраз-
ныс бурсарии и шарообразные колониальные жгутиковые воль-
воксы. Но и более мелких, как, например, парамеций, тоже
можно различить в виде белых чёрточек, снующих в разных
направлениях.
Простейшие по внешности отличаются от ракообразных своими
меньшими размерами, однородной тёмной или беловатосерой
окраской и плавными движениями. У большинства же рако-
образных движения скачкообразны. Кроме того, у ракообразных
под лупой уже вполне заметны их членистые конечности, в то
время как тело простейших кажется вполне однородным, так как
под лупой, конечно, совершенно невозможно увидеть ни ресничек,
ни псевдоподий, ни жгута.
Если в пробирке замечают 5—6 каких-нибудь инфузорий, то
смело можно сказать, что данное место будет удачным для сбора.
При отсутствии в пробирке микроорганизмов следует произвести
осмотр несколько раз из разных мест, так как при однократном
просмотре инфузории могут и не попасть в пробирку. Не следует
делать и решающего вывода при отсутствии простейших даже при
многократном просмотре, так как нередко те или иные простей-
шие в данное время могут находиться в инцистированном состоя-
нии и по прошествии некоторого времени (5—6 дней) могут пре-
красно размножиться в лабораторных условиях.
9
IV. СОДЕРЖАНИЕ КУЛЬТУР В ЛАБОРАТОРИИ
И УГОЛКЕ ЖИВОЙ ПРИРОДЫ
В лаборатории или уголке живой природы содержимое банок
следует разлить по сосудам меньшей ёмкости. Проще всего исполь-
зовать обыкновенные стаканы. Очень удобны прямоугольные, так
называемые аккумуляторные банки. Вообще сосуды могут быть
самыми разнообразными; необходимо соблюдать одно условие,
чтобы'Они были из сплошного стекла и тщательно вымыты.
В каждый мелкий сосуд добавляют либо гниющей листвы, либо
водных растений, либо детрита и ила без растений, либо смесь этих
веществ. Вообще желательно разнообразить среду каждого сосуда,
так как каждая среда имеет своеобразную фауну (рис. 1а, б, в).
В среднем 10 стаканов, 2—3 аккумуляторные банки, какой-ни-
будь аквариум вполне достаточны для создания разнообразных
так называемых сырых культур простейших1.
Сосуды с культурами прикрывают стеклянными пластинками
(удобны старые фотографические пластинки) и помещают на
окне или на столике недалеко от окна. Следует избегать ярких
солнечных лучей, особенно в жаркое время года, так как силь-
ное нагревание в небольшом объёме жидкости может вызвать ги-
бель микроорганизмов. Наоборот, не следует опасаться понижен-
ной температуры. Большинство простейших прекрасно существует
при 10° и ниже. Однако при такой температуре организмы слабо
размножаются. При так называемой оптимальной (наиболее
благоприятной) температуре (25°) очень ускоряется процесс об-
мена и размножения, и поэтому культура вначале очень обога-
щается количественно, однако так же быстро она и исчезает.
Таким образом, наиболее удобна для культивирования простейших
температура от 12 до 15° (так называемая комнатная температура).
Культуры после того, как они отстоятся два-три дня, периоди-
чески просматривают при помощи ручной лупы. Для этого сосуд
берут в левую руку и, обратив к свету и слегка встряхнув, про-
сматривают с ручной лупой. При этом сразу замечают, много
ли в данной культуре простейших, какие из них преобладают
и имеются ли враги простейших — коловратки, дафнии и цик-
лопы. Культуры с большим количеством этих рачков и других
мелких животных нужно уничтожить и заменить новыми. Про-
сматривать культуры можно, нередко даже с лучшими резуль-
татами, пользуясь препаровальной лупой. Для этого пипеткой
(специальной для живого материала!) набирают из культуры
1-2 куб. см жидкости, в особенности из верхней части сосуда, по
краям, обращённым к свету, и наливают её в часовое стекло,
которое просматривают под препаровальной лупой. При этом
нужно изредка слегка встряхивать стекло для того, чтобы вызвать
1 Сырые культуры содержат различных простейших, в то время как чистые —
только представителей одного вида.
10
более интенсивное движение инфузорий, так как тогда они легче
распознаются. Кроме того, нужно время от времени вращать
винт лупы для того, чтобы обследовать всю толщу воды в стекле.
Рис. 1. Сосуды, содержащие сырые культуры простейших из природных
водоёмов (оригинал).
В сосуды, где простейших окажется мало или они с течением
времени исчезают, прибавляют 5—10 капель сырого молока,
которое прекрасно .стимулирует размножение многих простейших.
и
Молоко в указанном количестве можно прибавлять к культурам
периодически, но не более 2—3 раз в месяц.
Вместо молока можно прибавлять также 2—5 г крахмала (кар-
тофельной муки). Кроме того, хорошим стимулирующим сред-
ством служат отвары: овсяный, рисовый, пшеничный и пшённый.
Для приготовления отвара 50 г одной из этих круп кипятят в
1 л воды в течение 15—30 минут. Жидкость сливают в чистые
бутыли и закупоривают их. К культурам эту жидкость добавляют
по 5—10 куб. ст не более двух раз в месяц.
Кроме естественных, или сырых, культур уже давно употребляют
различные способы искусственного культивирования простейших
на питательных средах. Эти способы очень важны для учителя,
так как дают возможность заранее заготовить в массовом коли-
честве нужный материал. Методы культивирования инфузорий,
амёб и жгутиковых на искусственных средах изложены ниже,
при описании демонстраций и опытов.
Если по каким-либо причинам к началу занятий у учителя
отсутствуют сырые культуры из водоёмов, то необходимо ис-
пользовать ряд обычных лабораторных животных: чёрного тара-
кана, дождевого червя, ящерицу, кролика и в особенности ля-
гушку. В различных органах, например в кишечнике, этих живот-
ных массами обитают паразитические простейшие: амёбы, грега-
рины, жгутиковые и инфузории, которые с успехом могут быть
показаны на занятиях. При случае можно использовать и
более крупных животных: быка, овцу, лошадь, в желудке кото-
рых обитают интересные инфузории.
Способ вскрытия животных и демонстрация паразитических
простейших указаны ниже, в соответствующих местах главы
«Простейшие — паразиты и комменсалисты» (см. часть вторую, IV).
V. РАСПОЗНАВАНИЕ ПРОСТЕЙШИХ
Задача этой главы — помочь читателю разобраться в самых
обычных и часто встречающихся представителях мира простейших.
Предлагаемый метод распознавания не представляет собой
определения объектов, основанного на систематике тех или иных
групп, родов и видов. Такое определение для неспециалиста бу-
дет слишком громоздким и трудным. Здесь распознавание даётся по
наиболее доступным для глаза признакам: форме тела, характеру
движения, относительным размерам и окраске. При работе
необходимо пользоваться прилагаемыми полусхематическими ри-
сунками с живых объектов (рис. 2, 3, 4 и 6).
Распознавать простейших надо с малым увеличением микро-
скопа, лишь в крайних случаях употребляя большое. Необходимо
помнить, что чем меньше увеличение, тем больше поле зрения,
и поэтому тем легче увидеть объект и следить за ним. Кроме
того, при малом увеличении картина яснее, и поэтому тем легче
12
процесс наблюдения. После известного навыка надо научиться
распознавать простейших и под лупой, что наиболее просто и
удобно. Действительно, под лупой вполне можно различить
многих средних и крупных инфузорий, как, например, туфельку,
стилонихию, трубача, спиростомум, локсодес, бурсарию, дилеп-
туса, раковинных корненожек, арцелл и диффлюгий, а также
колониальных жгутиковых. Работа с простейшими, конечно, тре-
бует элементарного знакомства с микроскопической техникой
(см. главу о микроскопической технике, а также список литера-
туры).
Опишем процесс наблюдения и распознавания типичных про-
стейших.
Пипеткой в часовое стекло набирают жидкость (1—2 см3) сна-
чала из верхней части сосуда у его стенок (особенно обращённых
к свету), а затем из других мест и со дна. Нужно стараться за-
хватывать возможно меньше ила и других частиц, с тем, чтобы
легче можно было бы увидеть простейших. Стекло просматривают
поочередно под лупой и при малом увеличении микроскопа.
Инфузории
Из всех простейших легче всего узнать инфузорий по их бы-
строму плавному движению и относительно крупным размерам.
Рачки же, мелкие черви и другие многоклеточные, с которыми их
можно было бы спутать, больше инфузорий и движутся скачками.
Инфузории, за исключением трубача, либо полупрозрачны, либо
серого цвета с различными оттенками — от беловатого до почти
чёрного. Ниже приводятся описания инфузорий в порядке тех
номеров, которыми они помечены на рис. 2.
1. Трубач (Stentor coeruleus). Крупная инфузория, до 1 мм.
Окраска зелёная, сине-голубая, иногда бесцветен. В часовом
стекле после взятия пробы большей частью плавает свободно.
Тогда форма тела бочонкообразна или грушевидна (рис. 2, 1 б).
Под лупой выглядит как тёмный пакетик или овал, медленно
плавающий в разные стороны. И под лупой, и под микроскопом
хорошо видны реснички у переднего конца. Нередко можно
увидеть трубачей сидячих, прикрепленных нижним концом к
кусочкам водорослей, детриту и даже стеклу. Тогда инфузории
выглядят в виде красивой зелёной или светлосиней трубы, откуда
и происходит название трубач (рис. 2, 1а). На переднем конце
(ротовая воронка) хорошо заметны мерцающие предротовые
реснички, создающие токи частиц, находящихся около инфузории.
Ротовое отверстие помещается на дне воронки. При раздра-
жении (постукивание по стеклу, прикосновение проплывающих
мимо организмов) стентор быстро съёживается и затем снова
медленно вытягивается.
Вся картина наблюдения стентора очень эффектна и интересна.
13
Рис. 2. Инфузории при малом увеличении микроскопа (оригинал).
1 — трубач (Stentor coeruleus) (а — прикрепленные и б — свободноплавающие особи);
2 — спиростомум (а — Spirostomum ambiguum; б — Spirostomum minut); 3 — бурсария
(Bursaria truncatella); 4 — туфелька (a — Paramecium caudatum; 6 — Paramecium aure'la);
5 — локсодес (a — Loxodes magnus; 6 — Loxodes rastrum); 6 — дидиниум (Didinium nasutum);
7 — дилептус (Dileptus anser); 8 — фронтония (Frontonia leucas) — крупная и мелкая формы;
9 — прород он (Prorodon teres); 10 — трахелиус (Trachelius ovum); 11 — стилонихия (Stylo-
nychia mytilus); 12 — уростила (Urostyla graudis); 13 — эуплотес (Euplotes patella); 14 — cy-
войки (Vorticella): a — одиночные; 6 — колониальные (Carchesium); 15 — колепс (Coleps hir-
tus); 16 — уроцентрум (Urocentrum turbo); 17 — аскеназия (Askenasia elegans) 18 — колпи-
диум (Colpidium colpoda).
14
Рис. 3. Инфузории при большом увеличении (оригинал).
1 — спиростомум (Spirostomum ambiguum) -- по Штейну; 2 — трубач (Stentor coeruleus} —
по Дофлейну; 3 — туфелька (Paramecium caudatum) ; 4 — фронтония (Frontonia leucas)
б — локсодес (Loxodes rostrum); 6 — дидиниум (Didinium nasutum) — по Дофлейну; 7 — ди-
лептус (Dileptus anser); 8 — стилонихия (btylonychia m.stilus); 9 — прородон (Prorodon teres);
20 — уроцентрум (Urocentrum turbo); 11 — колепс (Coleps hirtus); 12 — аскеназия (Askenasia.
elegans); 13 — сувойки (Vorticella) одиночные по Эйферту; 14 — сувойка колониальная (Car-
chesium). Обозначения: Я — ядро (макронуклеус); Р —ротовое отверстие; ПВ —пище-
варительная вакуоля; СВ — сократительная вакуоля; ТР — трихоцисты.
15
У прозрачных особей просвечивает чётковидное ядро. Стен-
тор часто встречается в сосудах с гниющей листвой и принад-
лежит к самым обычным обитателям мелких водоёмов. Питается
бактериями и мелкими водорослями.
2. Спиростомум. Наиболее часто встречаются два вида спи-
ростомумов: один гигантский — Spirostomum ambiguum (до 1—2 мм)
и потому видный даже невооружённым глазом (рис. 2, 2а), другой
приблизительно вдвое меньшего размера (600 ,«) — Spirostomum
minus (рис. 2, 2 б).
Тело у особей обоих видов червеобразное. Окраска сероватая.
Движение медленное и плавное, большей частью по дну. При
малейшем раздражении так же, как и стентор, сильно сокра-
щается. По одному краю можно заметить ряд предротовых рес-
ничек, доходящих до задней трети тела, где помещается ротовое
отверстие. На заднем конце хорошо видно светлое пространство
— баллон сократительной вакуоли.
Часто встречаются в сосудах с гниющей листвой и нередко в
большом количестве. Питаются бактериями.
3. Бурсария (Bursaria truncatella). Также крупная инфузо-
рия (размером до 1мм). Тело широкое, бочонкообразное. Бес-
цветна и очень прозрачна, поэтому внутри можно заметить из-
гибающееся лентовидное ядро и резко выделяющиеся тёмные пи-
щевые вакуоли. На переднем конце хорошо видны реснички, окру-
жающие ротовую ямку, которая по внешнему виду напоминает
вершу. Тело несократимо.
Движения довольно быстрые, бросками в разные стороны, но
часто в часовом стекле инфузории подолгу остаются и непо-
движными.
Бурсария — хищница и питается другими инфузориями, а также
жгутиковыми и даже коловратками, которых она загоняет в рот
движением ресничек, окружающих ротовую ямку и создающих
сильный ток вокруг инфузории.
Трубач, спиростомум и бурсария относятся к отряду разно-
ресничных (Heterotricha). У них имеется зона длинных предрото-
вых, легко заметных при малом увеличении ресничек —мембра-
нелл. Всё остальное тело также покрыто ресничками, но более
короткими и потому незаметными при малом увеличении. (Об
обнаружении ресничек см. часть вторую, I, 4.)
4. Туфелька, или парамеция (Paramecium caudatum). Ин-
фузория среднего размера (250—300 р). Встречается в любой
сырой культуре с гниющими веществами и скопляется в массо-
вом количестве в верхней части сосуда. Относится к наиболее
часто встречающимся инфузориям. Тело стройное, веретеновид-
ное и по форме действительно отчасти напоминает подошву
туфли. Светлосерая прозрачная окраска. Заметна чёрточка,
идущая от переднего конца к середине тела — контур предро-
товой ямки (перистом). В теле заметны тёмные кружочки, — пи-
щевые вакуоли.
16
Движение очень быстрое, причём при движении вперёд вра-
щается вокруг своей оси. Инфузории часто массами останавли-
ваются у кусочка ила, детрита или бактериальной плёнки и
здесь питаются бактериями. Чаще всего встречаются два вида:
уже упомянутая Paramecium caudatum (рис. 2, 4 а) и другая по-
меньше (150/х) — Paramecium aurelia (рис. 2, 4 6).
5. Локсодесов (Loxodes) легко узнать по крючковидному
окончанию переднего конца. Тело сильно уплощено. Инфузории
медленно плавают по дну стекла. Встречаются крупный и мелкий
виды. Мелкий (200—250 ,ы) — Loxodes rostrum (рис. 2, 5 6) очень
прозрачен. Крупный (400/х) — Loxodes magnus (рис. 2, 5 а) с
серым оттенком. Оба вида питаются мелкими водорослями.
6. Дидин и ум (Didinium nasutum). Инфузории средней вели-
чины (до 200—300 /х). Форма тела бочонкообразная или цилиндри-
ческая. На переднем конце конический выступ, на котором
помещается рот. Хищная инфузория, нападающая на парамеций
и других инфузорий, которых высасывает или заглатывает широко
расширяющимся ртом. Реснички только в виде двух поясков
на переднем конце и посередине. Встречается довольно часто в
гниющих культурах.
7. Дилептус (Dileptus anser). Эту инфузорию легко узнать
по длинному хоботообразному выросту на переднем конце, ко-
торым дилептус при плавании размахивает в разные стороны.
Размер 300—500 /х. Окраска серая. Нередко в теле видны круп-
ные округлые пищеварительные вакуоли. Маленькое округлое
ротовое отверстие помещается у основания хобота. Хищная ин-
фузория, умерщвляющая свою добычу (других инфузорий) хобо-
том, снабженным множеством трихоцист1; встречается не во
всех сырых культурах, но иногда размножается в большом числе
и тогда уничтожает остальных инфузорий.
8. Фронтония (Frontonia leucas). Инфузория с уплощенной
бобовидной формой тела. Большей частью темно окрашена из-за
присутствия в эндоплазме различных пищевых частиц и вклю-
чений. Щелевидный рот помещается в передней части тела, но
увидеть его трудно. Попадаются крупные (до 600 /х) и мелкие
(до 200 /х) формы. Питается водорослями, а иногда раковинными
корненожками (арцеллами) и мелкими жгутиковыми. Встречается
в сырых культурах так же часто, как и парамеции, но обитает
чаще всего на дне культуры.
9. Прородон (Prorodon teres). Инфузория среднего размера
(300-400/х). Тело бочонкообразное, несколько суженное с перед-
него конца и расширенное с заднего. Окраска тёмносерая, иногда
прозрачная из-за присутствия в эндоплазме большого количества
светлых округлых включений. На переднем конце иногда можно
1 Трихоцисты — это мельчайшие стрекательные тельца — органоиды,
выбрасывающие при раздражении тонкие острые нити, парализующие и умерт-
вляющие добычу. У нехищных инфузорий они, наоборот, служат своеойраА-
ными защитными органоидами (об обнаружении и* ем. чжэть вторую, 1,7).
2
Цингер
17
заметить маленькое щелевидное ротовое отверстие. На заднем
конце’можно увидеть округлую сократительную вакуолю. В
сырых культурах встречается не всегда и редко размножается
в большом числе.
10. Трахелиус (Trachelius ovum). Своеобразные инфузории
с почти шаровидным или грушевидным телом и коротким подвиж-
ным хоботком на переднем конце. Размер до 400 у. Окраска
тёмная. Двигаются довольно быстро, вращаясь вокруг своей
оси. Попадаются довольно часто в культурах с гниющими ве-
ществами.
Туфелька, локсодес, дилептус, прородон и трахелиус относятся
к отряду равноресничных (Holotricha); у них все реснички одина-
ковой длины, очень коротки и при малом увеличении заметны е
трудом или совсем незаметны.
11. Стилонихия (Stylonichia mytilus, Stylonichia postulata).
Всегда встречается в водоёмах с гниющими веществами. Размер
средний или мелкий (120—200 р). Нередко встречаются и крупные
разновидности (300—400 р). Форма тела овальная или прямо-
угольная и притом уплощённая. Стилонихию распознают по
скользящему (ползающему) движению по стеклу, мельчайшим
песчинкам и ветрчкам. Но главный их признак — длинные, плот-
ные особые реснички-щетинки, при помощи которых инфузории
и передвигаются. Особенно хорошо видны 3—4 щетинки на зад-
нем конце тела. Заметен также и ряд более коротких ресничек
на переднем конце, загибающихся далее в виде каёмки в середине
тела, где помещается щелевидное ротовое отверстие.
12. Уростила (Urostyla grandis). Тело удлинённое, закруглён-
ное с обоих конпов. Размер до 400 р. Реснички на брюшной сто-
роне. На переднем конце венчик плотных ресниц-мембранелл,
охватывающих с одной стороны ротовое отверстие. На заднем
конце также выделяется группа длинных ресничек. Остальное
тело покрыто рядами более коротких ресничек, незаметных при
малом увеличении. Инфузории быстро двигаются между части-
цами детрита, изгибаясь и сокращаясь. Относятся к прожорливым
хищникам, так как питаются другими простейшими и даже ко-
ловратками. Часто размножаются в большом числе в гниющих
культурах.
13. Эуплотес. (Euplotes patella) похожа на стилонихию, но
имеет более широкое и округлое тело. Очень прозрачна, плотные
щетинки хорошо видны не только на заднем конце, но и в центре
тела. При внимательном наблюдении видно, как инфузория
перебирает этими щетинками, точно лапками.
Все эти особые реснички у трёх последних инфузорий располо-
жены только на нижней, брюшной, стороне тела. По этому приз-
наку данных инфузорий относят к отряду брюхоресничных
(Hypotricha).
14. Сувойки (Vorticella). Сидячие, большей частью мелкие
инфузории; их узнают по стебелькам, которыми они прикрепляют-
18
ся к стеклу или другому субстрату. Они часто встречаются в
сырых культурах с гниющими веществами. По виду сувойка
похожа на цветок колокольчика со стебельком. Ротовое отверстие
помещается на верхнем конце цветка. Некоторые сувойки оди-
ночные (Vorticella — рис. 2, 14а), другие — колониальные (Carche-
gium, Epistylis — рис. 2, 146). Многочисленная колония напоминает
маленький кустик или деревцо. Колонии заметны и невооружён-
ным глазом в виде беловатых пятнышек по стенкам сосуда или
на кусочках дерева, листа и т. п. Наблюдение их под микроско-
пом очень интересно. Как под микроскопом, так и под лупой
сразу видно, что сувойки не сидят спокойно. При раздражении
(постукивание по стеклу, сталкивание с другими организмами)
они то отскакивают назад, благодаря скручиванию стебелька, то
снова вытягиваются. В общем картина несколько напоминает
•движение китайских мячиков, подскакивающих на резинках.
Сувойки относятся к отряду кругоресничных (Peritricha).
Упомянем ещё о четырёх мелких инфузориях.
15. Колепс (Coleps hirtus). Быстро плавающая бочонкообраз-
ная инфузория. Тело покрыто панпырем из прямоугольников,
которые видны лишь при большом увеличении. Размер инфузории
160—80 у.
16. Уроцентрум (Urocentrum turbo). Тело составлено из
двух неравных полукруглых половинок. На задней половинке
заметны круглая, сократительная вакуоля и шип. Движение
быстрое в разные стороны с одновременным вращением вокруг
своей оси. Размер инфузории 50—70 /г. Встречается очень часто
в любых гниющих культурах и нередко размножается в массовом
количестве.
17. Аскеназия (Askenasia elegans). Овальная инфузория с
венчиком ресничек, при помощи которых она как бы «скачет» в
разные стороны. Размер 50 Очень обычная и часто встречаю-
щаяся инфузория.
18. Колпидиум (Colpidium colpoda). Напоминает парамецию,
но тело более широкое, передний конец несколько искривлён.
Примерно втрое мельче парамеции (100 /*). Прозрачна, с серо-
ватым оттенком. Часто хорошо заметно округлое ядро. Встре-
чается также часто и в тех же культурах, что и парамеция.
Жгутиковые
За исключением колониальных форм (вольвокс, пандорина,
гониум и др.) все жгутиковые значительно мельче инфузорий.
Кроме того, многие жгутиковые обладают зелёной, бурой или
Жёлтой окраской. Их органы движения (жгутики) можно увидеть
Только при большом увеличении и при суженной и затемнённой
Диафрагме микроскопа. Ниже приводим краткие описания их с
нумерацией по порядку рис. 4.
8»
19
1. Вольвокс (Volvox aureus). Самос крупное и сложно устроен-
ное колониальное жгутиковое зеленоватой окраски. Заметен и
невооружённым глазом в виде шарика величиной с булавочную
головку. При малом увеличении микроскопа и под лупой выгля-
дит как прозрачный полый шар с зелёными крапинками (хрома-
тофоры). Внутри такого шара у бесполых особей, размножа-
ющихся вегетативно, прекрасно видны тёмнозелёные дочерние
Рис. 4. Жгутиковые, при малом и среднем увеличении микроскопа (оригинал).
1 — вольвоксы (Volvox aurens): а — бесполая особь; б — женская половая особь; в — молодой
шарик, покинувший недавно материнскую особь; 2 — гониум (Gonium pectorale); 3 — эвдо-
рииа (Eudorina elegans); 4 — паидорина (Pandorina morum); 5 — эвглена зелёная (Euglena
viridiB); о — эвглена акус (Euglena acus); 7 — эвглена оксиурис (Euglena oxyuri=); 8 — эв-
глена спирогира (Euglena spirogyra); 9 — факус (Facus); 10 — бодо (Bodo).
шары от 2 до 6 шт. Наряду с бесполыми часто встречаются и
женские половые особи, содержащие 7—8 шт. небольших тёмных,
почти чёрных шариков-макрогамет (рис. 4, 76). Мужские половые
особи встречаются значительно реже, они содержат очень мелкие
микрогаметы. Выросшие бесполые особи вольвокса значитель-
но крупнее половых.
Кроме этих трёх групп, бывают видны ещё шарики меньшей
величины, имеющие более компактное зернистое строение и окра-
шенные в более тёмнозелёный цвет. Это различного возраста
20
дочерние шарики, недавно покинувшие материнскую особь после
разрыва её оболочки (рис. 4, 1в).
Движение шара вольвокса медленное, катящееся.
В небольших прудиках с зелёной растительностью, лесных
ямах и других водоёмах вольвоксы нередко размножаются в
таком большом количестве, что весь водоём буквально заполнен
ими, отчего вода кажется окрашенной в зелёный цвет. Зачерпнув
Рис. 5. Мелкие жгутиковые, при очень сильном увеличении микроскопа
(из Веньона и Павловского).
Л — эвглена зелёная (Euglena viridls); Б— эвглена оксиурис (Euglena oxyuris); В — эвглена
акус (Euglena acus); Г — эвглена спирогира (Euglena spirogyra); Д — факус (Phacus).
такой воды в ладонь, сразу можно увидеть невооружённым глазом
маленькие шарики — вольвоксы. В сосудах, в лабораторной
обстановке, вольвокс долго не держится, поэтому очень важно
заготовить для занятий консервированный материал (см. часть
Вторую, III, 4).
2. Гониум (Gonium pectorale). Колониальная форма, более
простого строения, чем вольвокс, и меньших размеров (100—150 /л).
Представляет собой маленькую, интенсивно движущуюся четы-
рехугольную пластинку тёмнозелёного цвета, в которой можно
21
и при малом увеличении микроскопа различить отдельные ок-
руглые клетки. Число этих клеток постоянно и равно 16.
3. Эвдорина (Eudorina elegans). Колония овальной формы.
Зелёные маленькие округлые клетки покрыты ясно видимой
прозрачной оболочкой. Движение медленное.
4. Пандорина (Pandorina morum). Похожа на предыдущую,
но тело состоит из клеток более крупных, тесно прилегающих
друг к другу и поэтому имеющих гранёную форму. Количество
клеток колеблется от 16 до 32.
На этих четырёх колониальных жгутиковых можно убедиться
в постепенном усложнении строения колонии от простой сово-
купности нескольких клеток (пандорина, гониум) до сложно
устроенного вольвокса.
Все одиночные жгутиковые очень мелки: под лупой едва разли-
чимы, а при малсм увеличение микроскопа выглядят как ма-
ленькие, медленно движущиеся веретеновидные и овальные
тельца.
5. Зелёная эвглена (Euglena viridis). Имеет веретеновидное
тельце, заострённое на заднем конце. Окраска яркозелёная.
Кроме поступательного и вращательного движений, при помощи
жгута способна и к медленному червеобразному движению при
значительном изменении тела. Размер 40 р.
6. Эвглена акус (Euglena acus). Имеет тело, сильно вытя-
нутое в длину и заострённое на обоих концах. Оно несократимо
и этим отличается от зелёной эвглены.
Эвглены в сырых культурах встречаются очень часто. Дви-
гаются они не прямо, а с покачиванием в стороны. К этому роду
относятся также изображённые на рис. 4, 7—8 эвглена оксиурис
(Euglena oxyuris) и эвглена спирогира (Euglena spirogira). Их
размер 100 р.
У некоторых из описанных эвглен на переднем конце можно
и при малом увеличении заметить красную точку — стигму, а
иногда и ядро, просвечивающее в виде белого пятнышка в середине
тела. Все остальные подробности строения эвглен видны лишь
при большом увеличении.
9. Факус (Phacus). По форме тела напоминает сердце. Ок-
раска зелёная. Движение очень медленное. Размер 50 р.
10. Бодо (Bodo). Тело короткое, эллиптической формы. Ок-
раска либо бурая, либо зелёная. Размер 20 р.
Из всех жгутиковых особенно нужны для школьной работы
вольвокс и зелёная эвглена.
Корненожки
Корненожки бывают двух родов: раковинные и так называемые
«голые», лишённые раковинки. Голых корненожек, или амёб,
начинающий микроскопист находит вначале с большим трудом.
22
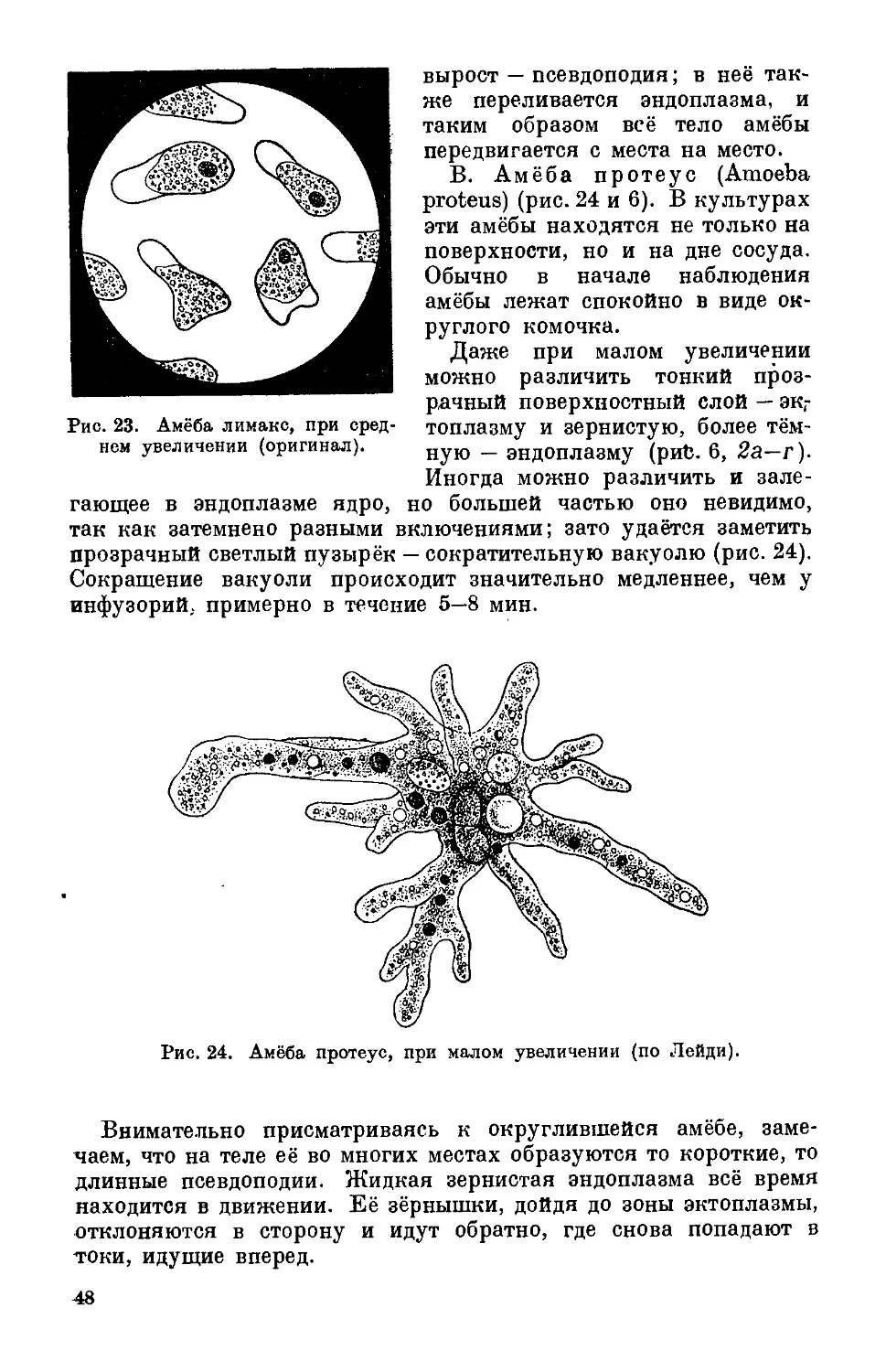
Рис. 6. Корненожки, при малом увеличении микроскопа (оригинал).
1 — пеломикса (Pelomyxa palustris); 2, а—г — амёба протеус (Amoeba proteus); 3 — амёба ли-
иякс (Amoeba Umax); 4 — амёба радиоза (Amoeba radiosa); 5 — амёба гуттула (Amoeba gut-
6 — арцелла (Arcella vulgaris); а — сбоку, остальные — снизу; по Эйферту; 7—8 — раз-
яичные виды диффдюгий (Difflugia); 9 — актииосфериум (Actinosphaerium eichhorni);
10 — актинофрис (Actinophrys sol).
23
так как эти организмы не обладают (за исключением амёбы ли-
макс) достаточно заметным движением и, кроме того, по своей
невзрачной сероватой окраске с трудом отличаются нашим глазом
от находящихся в стекле комочков ила, растений, камешков
и т. п. Поэтому при отыскивании амёб надо внимательно присма-
триваться к неподвижным частицам в поле зрения. Если на
каком-нибудь сероватом комочке замечается появление выступов
или вообще какое-либо еле заметное движение, то это, по всей веро-
ятности, амёба. При отыскивании амёб не забывайте диафраг-
мировать, т. е. суживать и расширять диафрагму микроскопа с
тем, чтобы добиться различения прозрачного объекта. Ниже мы
приводим описания амёб и других корненожек, соблюдая нуме-
рацию рис. 6.
1. Пеломикса (Pelomyxa palustris). Самая крупная амёба
величиной до 1 мм. Заметна и невооружённым глазом. f Пред-
ставляет собой бесформенный серый комочек, заполненный пище-
выми частицами (главным образом кусочками водорослей). Дви-
жение очень медленное. Псевдоподии очень короткие и неясно
отличаются от эндоплазмы. Встречается в культурах с водоро-
слями нечасто.
2. Амёба п роте у с (Amoeba proteus). Форма тела изменчива.
Очень часто в стекле выглядит как круглый неподвижный ко-
мочек (рис. 6, 2a) размером 300—600 р, т. е. величиной с туфельку
и даже с трубача. Движение начинается с медленного вытягива-
ния прозрачных выступов (рис. 6, 26—г). Иногда округлённая
амёба вытягивает во все стороны длинные псевдоподии и «висит»
в воде. Встречается не всегда, но в некоторых культурах размно-
жается в больших количествах.
3. Амёба лимакс (Amoeba limax). По размерам меньше
предыдущей. Образование псевдоподий и движение происходят
быстрее, чем у остальных амёб, благодаря чему её легче узнать
под микроскопом. Она выпускает обычно в одну сторону прозрач-
ную широкую псевдоподию, и, таким образом, у неё нет такой
большой изменчивости формы тела, как у амёбы протеус. Встре-
чается чаще других амёб в сырых культурах и мелких водоёмах
с опавшей листвой, водорослями и илом.
4. Амёба радиоза (Amoeba radiosa). Очень мелкая амёба
(100 р). Выпускает длинные псевдоподии наподобие лучей.
5. Амёба гуттула (Amoeba guttula). Ещё более мелкая амёба
(30 р). Форма тела постоянная, округлая. Одна очень широкая
и короткая псевдоподия всегда направлена в одну сторону. Дви-
жение скользящее и довольно быстрое.
Выше перечислены так называемые голые амёбы, лишённые
оболочки. Мелкие виды амёб питаются бактериями, а крупные,
кроме того, — инфузориями и водорослями.
Раковинных корненожек (Foraminifera) найти значительно
проще, так как сразу бросается в глаза более или менее сложная
21
структура раковинки-домика, заключающего амёбу; поэтому начи-
нающему микроскописту надо обратить на них особое внимание.
6. Арцелла (Arcella vulgaris). Раковина округлая, диаметром
100—200 р, с отверстием для выхода псевдоподии. Окраска рако-
винок светложёлтая, жёлтая, бурая и почти чёрная. У одних
арцелл раковины гладкие, у других — гранёные или с зубчиками.
7 и 8. Диффлюгия (Difflugia). Раковина построена из мель-
чайших песчанок различной формы, тесно прилегающих друг к
'другу- Форма раковины у одних видов овальная, у других гру-
шевидная (D. pyriformis); у Difflugia coronata (рис. 6, 8) — с длин-
ными зубчиками, которыми амёба прицепляется к водорослям.
Размеры 100—400 р.
Арцеллы и диффлюгии попадаются в большом количестве в
торфяных болотах и в сырых культурах с опавшей листвой,
водорослями, илом и т. п. Они массами скопляются как в верхней
части сосуда по стенкам, так и на дне его.
9 и 10. Актиносфериум и актинофрис (Actinosphaerium
eichhornii и Actinophrys sol). Шаровидные корненожки с тонкими
лучистыми псевдоподиями. Встречаются сравнительно редко, но
временами в некоторых сосудах с илом сильно размножаются.
Оба вида относятся к отряду солнечников (Heliozoa).
Размер актиносфериума — до 500 р. Виден даже под лупой.
Актинофрис мельче. Оба вида легко распознаются по шаровид-
ному ячеистому прозрачному телу, окружённому множеством
тонких лучей.
Из корненожек наиболее удобны для школьной работы рако-
винные амёбы — арцеллы и диффлюгии, а из голых — мелкие
амёбы лимакс и крупные амёбы протеус.
Часть вторая
ИСКУССТВЕННЫЕ КУЛЬТУРЫ. ДЕМОНСТРАЦИЯ.
НАБЛЮДЕНИЯ И ОПЫТЫ С ПРОСТЕЙШИМИ
Наиболее простые опыты, методы наблюдения и культивирования
не помечены звёздочкой; помеченные же одной (*) и двумя (**)
звёздочками более сложные и требуют большего навыка и вре-
мени. Это материал для внеклассной работы и повышения квали-
фикации учителя.
Сведения о посуде, инструментах и реактивах помещены в
главе «Оборудование для работы с простейшими» (часть третья, III).
L ИНФУЗОРИИ
1. Искусственные культуры. Если к началу занятий нет
достаточного количества туфелек в «сырой» культуре, то заранее
(примерно за 10 дней до начала занятий) приготовляют искус-
ственную культуру одним из следующих способов.
А. Молочный раствор. В чистые химические пробирки (лучше
новые, не бывшие в употреблении) наливают по 15—20 куб. см
воды (водопроводной, колодезной или дождевой). В каждую
пробирку прибавляют по 2—3 капли сырого снятого молока. Про-
бирки взбалтывают. Затем переходят к зарядке. В часовое стек-
ло наливают некоторое количество жидкости из природной культу-
ры, в которой были замечены туфельки. Просматривают под пре-
паровальной лупой. Если при этом в стекле окажутся различные
виды, то жидкость надо разбавить водой, с тем чтобы инфузории
распределились более редко. Затем также под лупой вылавлива-
ют отдельных парамеций (или другие желательные виды) при по-
мощи тонко оттянутой пипетки (см. часть третью, III, 4) и впуска-
ют их в заготовленные пробирки. В каждую пробирку впускают
примерно 10—20 парамеций. После зарядки пробирку неплотно
затыкают кусочком ваты. Это делается для того, чтобы в про-
бирку проникал воздух, но не проникали зародыши посторонних
простейших.
26
Заряжают не менее 10 пробирок, так как возможно, что в не-
которых пробирках инфузории не привьются из-за случайного
заноса вредных веществ. Пробирок можно заготовить по числу
учащихся.
Через 5—7 дней инфузории обычно сильно размножаются и
видны с помощью ручной лупы и даже невооружённым глазом в
виде массы беловатых подвижных точек в верхней части про-
бирки.
В одной и той же пробирке инфузории могут жить месяцами.
Если они начнут погибать или уменьшаться в числе, добавляют
1 каплю молока, и инфузории снова интенсивно размножаются.
Молоко добавляют не чаще двух раз в месяц.
Имея хоть одну населённую пробирку, можно произвести
бесчисленные перевивки в другие пробирки. Перевивку произво-
дят либо пипеткой, либо просто встряхнув пробирку, разливают
её на несколько новых с молочным раствором.
Конечно, указанный молочный раствор можно разливать не
только по пробиркам, но и в другие сосуды (маленькие стаканчики
и т. п.), которые нужно прикрывать стеклянными или бумажными
пдастинками. Следует’ лишь помнить, что чем больше объём
сосуда, тем больше времени пойдёт на его плотное заселение.
Концентрацию раствора следует соблюдать, исходя из пропорции
5—10 капель молока на 100 куб.см воды. Если нет необходимо-
сти в тщательной зарядке одним видом, то поступают проще: в
стаканчики с молочным раствором приливают немного жидкости
из той сырой культуры, где были замечены инфузории. При
этом в растворе почти наверняка размножатся разные инфузории,
в том числе и парамеции (рис. 7).
Кроме парамеций, на молочном растворе с таким же успехом
разводятся брюхоресничные инфузории — стилонихии (Stylonychia
pustulata). Можно разводить и крупных — спиростомумов (Spi-
rostomum minus et ambiguum)1. В молочном растворе инфузории
питаются размножающимися в громадном количестве молочно-
кислыми бактериями.
Культуры на молочном растворе (особенно в пробирках) наи-
более удобны, испытаны, на долголетней исследовательской прак-
тике и поэтому особенно рекомендуются для каждого учителя-
биолога.
Б. Сенной настой. В чистую кастрюлю или колбу кладут
пучок сена (около 10 г) удалив предварительно цветы; долива-
ют 1 л воды и кипятят в течение 15—20 минут. При кипячении
настой делается более крепким; при этом также погибают цисты
Других простейших и в то же время сохраняются споры бактерий,
необходимых для питания инфузорий. После остывания настой
фильтруют через воронку с ватой в колбы или чистые бутыли и
1 Спиростомумы прививаются хуже, чем парамеции, и поэтому надо зара-
жать большое количество пробирок с тем, чтобы затем отобрать наиболее засе-
лённые.
27
затыкают пробкой. Через 2 3 дня разливают по пробиркам или
другим мелким сосудам и заряжают парамециями, стилонихиями
или другими инфузориями так, как это указано в предыдущем
способе.
Настой в закупоренных бутылях можно сохранять до 1 месяца.
В сенном настое инфузории питаются бактериями — сенными
палочками.
Рис. 7. Инфузория-туфелька (Paramecium caudatum)
(оригинал).
1 — в пробирке с молочным раствором; 2 — та же пробирка при
рассматривании в ручную лупу (увеличение в 10—15 раз); 3 — ту-
фелька под малым увеличением микроскопа; 4 — туфелька под
большим увеличением микроскопа. Схематично (по Полянскому).
В. Настой салата. Листья салата помещают в небольшой
мешочек из марли, который опускают в сосуд с водопроводной
или речной водой. Сосуд оставляют стоять несколько дней за-
крытым стеклянной пластинкой. Затем впускают парамеции из
природной культуры. Инфузории обильно размножаются через
10—12 дней.
2. Демонстрация парамеций. А. Слегка встряхнув пробирку
с парамециями, её осматривают при помощи ручной лупы или в
28
часовом стекле под препаровальной лупой. Заметны отдельные
особи веретеновидной формы, снующие в разные стороны (рис. -7,
1 и 2).
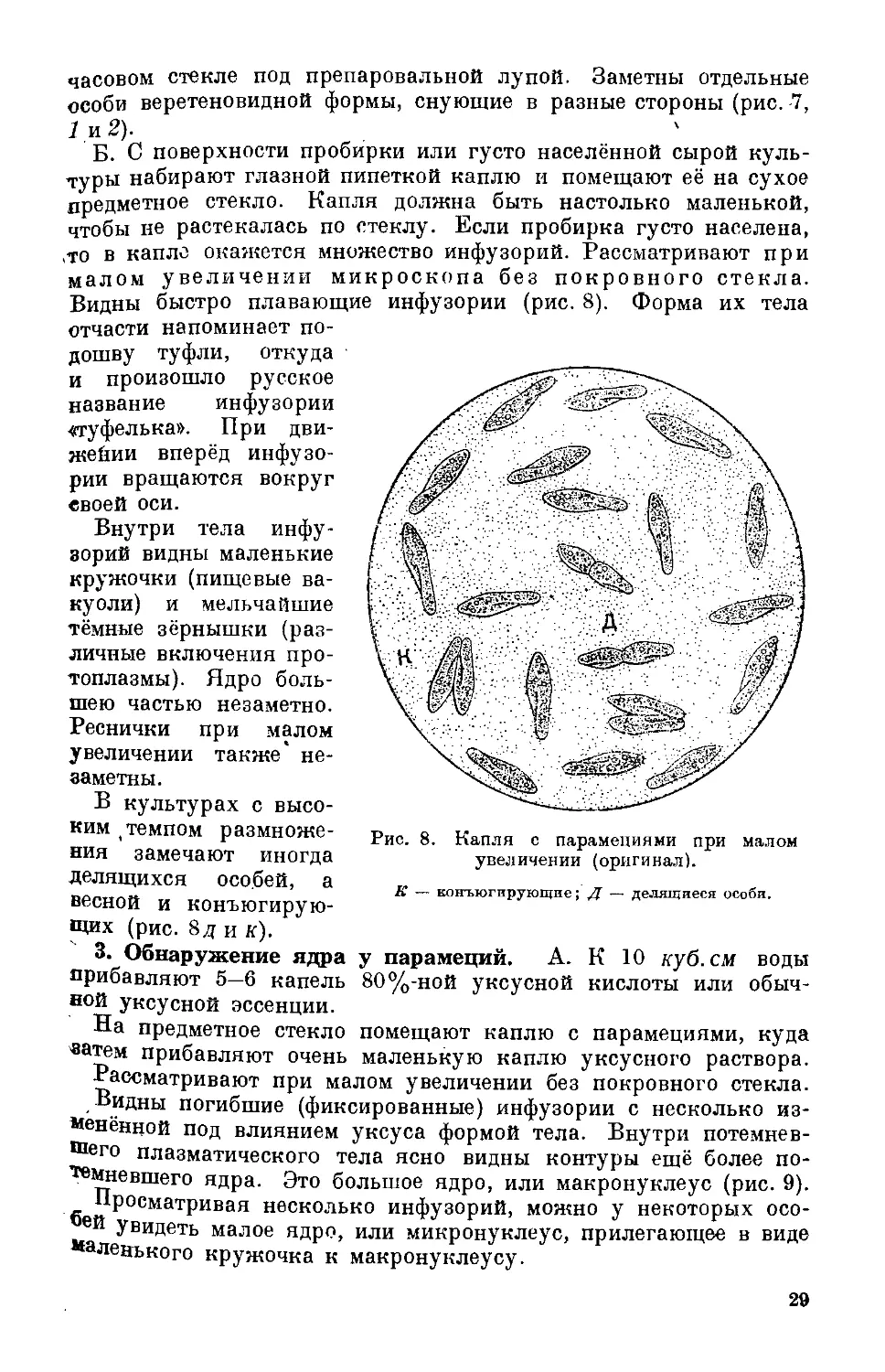
Б. С поверхности пробирки или густо населённой сырой куль-
туры набирают глазной пипеткой каплю и помещают её на сухое
предметное стекло. Капля должна быть настолько маленькой,
чтобы не растекалась по стеклу. Если пробирка густо населена,
,то в капле окажется множество инфузорий. Рассматривают при
малом увеличении микроскопа без покровного стекла.
Видны быстро плавающие инфузории (рис. 8). Форма их тела
отчасти напоминает по-
дошву туфли, откуда
и произошло русское
название инфузории
«туфелька». При дви-
жейии вперёд инфузо-
рии вращаются вокруг
евоей оси.
Внутри тела инфу-
зорий видны маленькие
кружочки (пищевые ва-
куоли) и мельчайшие
тёмные зёрнышки (раз-
личные включения про-
топлазмы). Ядро боль-
шею частью незаметно.
Реснички при малом
увеличении также’ не-
заметны.
В культурах с высо-
ким tтемпом размноже-
ния замечают иногда
делящихся особей, а
весной и конъюгирую-
щих (рис. 8д и к).
3. Обнаружение ядра
прибавляют 5—6 капель
ной уксусной эссенции.
На предметное стекло
Рис. 8. Капля с парамециями при малом
увеличении (оригинал).
К — конъюгирующие; Д — делящиеся особи.
у парамеций. А. К 10 куб.см воды
80%-ной уксусной кислоты или обыч-
помещают каплю с парамециями, куда
«атем прибавляют очень маленькую каплю уксусного раствора.
Рассматривают при малом увеличении без покровного стекла.
, Видны погибшие (фиксированные) инфузории с несколько из-
менённой под влиянием уксуса формой тела. Внутри потемнев-
тего плазматического тела ясно видны контуры ещё более по-
темневшего ядра. Это большое ядро, или макронуклеус (рис. 9).
Просматривая несколько инфузорий, можно у некоторых осо-
ей увидеть малое ядро, или микронуклеус, прилегающее в виде
Маленького кружочка к макронуклеусу.
29
После осмотра при малом увеличении на каплю накладывают
покровное стекло, передвигают предметное стекло так, чтобы
инфузория оказалась в центре поля зрения, и рассматривают при
большом увеличении.
краски метил! рюн на
заготовленной краски
Б. Приготовляют 0,25%-ный раствор
дестиллированной воде1. На 10 куб.см
прибавляют!—2 капли 80%-ной уксус-
ной кислоты или уксусной эссенции.
На предметное стекло помещают
каплю с инфузориями и прибавляют
Рис. 9. Парамеции, фиксированные уксус-
ной кислотой, при среднем увеличении
(оригинал).
Видна зернистая протоплазма и тёмное округлое
ядро (макронуклеус). В средней особи виден и
прилегающий к макронуклеусу микропуклеуе.
Рис. 10. Туфелька, окрашен-
ная метилгрюном, при боль-
шом увеличении (оригинал).
Интенсивно окрасились макро- я
микронуклеус. Сбоку -- ’выстре-
ленные* трихоцисты.
очень маленькую каплю краски. Осторожно накрывают покров-
ным стеклом. Избыток краски удаляют, прикладывая к краю
покровного стекла кусочек ваты или фильтровальной бумаги.
Сначала рассматривают при малом, а затем при большом увели-
чении.
Ядро окрашивается в тёмнозелёный цвет, а плазма и вклю-
чения — в синеватый (рис. 10).
Б*. Приготовляют 0,5 %-ный квасцовый кармин (см. часть
третью, III, 22), жидкость Шаудинна в пробирке (см. часть тре-
тью, III, 13), 50°-ный и 70°;ный спирт, глицерин, воду, часовые
стёкла (4—5 штук), покровное и предметное стёкла, тонко оття-
1 При отсутствии дестиллированной воды можно употребить и обычную.
30
лутую пипетку (см. часть третью, III, 4), пробирку с параме-
циями.
В часовое стекло помещает несколько капель с большим ко-
личеством инфузорий. .Затем подогревают в пробирке жидкость
Щаудинна приблизительно до 40° и быстро приливают к каплям
с парамециями. Фиксатора1 (т. е. жидкости Шаудинна) приливают
приблизительно в 3—4 раза больше, чем имеется жидкости с
инфузориями.
Вращают стекло пальцами, при этом зафиксированные ин-
фузории собираются в кучку; затем их захватывают тонко от-
тянутой пипеткой (под препаровальной лупой) и, по возмож-
ности с наименьшим количеством фиксатора, переносят в часовое
стекло с 50—70°-ным спиртом. Через 10—15 мин. переносят также
пипеткой в стекло с водой и уже отсюда в часовое стекло с 10—15-
каплями приготовленной краски кармина. В краске держат
15—20 мин. Из краски объекты переносят снова в воду с тем,
чтобы отмыть краску (иногда несколько раз, если захватывается
много краски), и из воды — на предметное стекло. С предметного
стекла удаляют по возможности больше воды, либо оттягивая
её пипеткой, либо просто дав слегка подсохнуть (не пересушить!).
Затем сверху капают каплю обычного глицерина и накрывают
нокровным стеклом. Все манипуляции переноса производят
тонко оттянутой пипеткой под препаровальной лупой.
Рассматривают сначала при малом, а затем при большом уве-
личении.
Большое и малое ядра окрашиваются в тёмнокрасный цвет.
Интенсивно окрашиваются и круглые пищевые вакуоли.
В глицерине объект значительно просветляется, и поэтому
ядро выделяется резче, чем при способах А и Б. Кроме того,
глицериновый препарат долго не высыхает и может сохраняться
несколько дней. Надо следить за тем, чтобы предметное стекло
находилось в горизонтальном положении, так как в противном
случае покровное стекло сползёт.
Форма макронуклеуса у различных видов инфузорий весьма
разнообразна: округлая у прородона, овальная у туфельки,
лентовидная у бурсарии. - Кроме того, макронуклеус может быть
сложным и состоять из ряда связанных члеников (Stentor, Spi-
xestomum) или отдельных фрагментов, не связанных между собой
и разбросанных по всему телу (Dileptus).
Микронуклеус всегда значительно меньше макронуклеуса.
В большинстве случаев он прилегает к макронуклеусу и даже
лежит в его углублении. Число микронуклеусов у различных
форм колеблется от одного до многих.
Макронуклеус необходим для вегетативной жизни, и поэто-
му
его называют также соматическим ядром. Отрезанная часть
' 1 Фиксатором называется жидкость, быстро убивающая организм • вов-
°Жно лучшим сохранением его прижизненной формы и отроения.
3»
Рис. 11. Парамеции, убитые иодом, при
большом увеличении (оригинал). По краю
тела выступают реснички.
инфузории без макронуклеуса не способна переваривать пищу и
не способна восстанавливать утраченные части.
Микронуклеус имеет большое значение при размножении,
поэтому его называют также генеративным ядром.
4. Обнаружение ресничек. Реснички у живых парамеций
можно различить лишь при большом увеличении и при затем-
нённой диафрагме. При малом увеличении их можно различить
у стентора или бурсарии, которых для этой цели помещают в
маленькой капле на предметное стекло. Рассматривают без по-
кровного стекла. Прекрасно видны длинные реснички у пара-
зитической инфузории опа-
лины (см. часть вторую,
IV, 6).
Реснички у парамеции
лучше всего можщо проде-
монстрировать на особях,
фиксированных иодной на-
стойкой.
Приготовляют раствор
иода в воде. Для этого
в маленькое часовое стек-
ло с водой прибавляют
15—25 капель иодной на-
стойки. Маленькую каплю
с парамециями помещают
на предметное стекло и
прибавляют 1—2 капли за-
готовленного иодного рас-
твора. Накрывают покров-
ным стеклом и рассматривают сначала при малом увеличении,
затем при большом. Инфузории окрасятся в тёмнобурый цвет.
По краю тела заметна каёмка из мельчайших коротких ресничек
(рис. 11). При рассматривании ресничек необходимо несколько
затемнить (т. е. сузить) диафрагму микроскопа.
Реснички служат главным признаком класса инфузорий. Они
покрывают у одних инфузорий всё тело (например, у туфельки),
у других только часть его (например, у дидиниума).
Функции ресничек разнообразны: одни реснички служат для
передвижения, другие — специальные ротовые — для доставления
пищи. У многих инфузорий существует группа осязательных
ресничек.
5. Питание инфузорий. А. Пищеварительные вакуоли у
парамеций. В часовом стекле растирают спичкой или рукоят-
кой скальпеля кусочек сухой туши (лучше всего чёрная тушь в
ванночке) или акварельной краски кармина. Величина кусочка
должна быть не больше булавочной головки. Приливают нес-
колько капель воды и растирают до образования мельчайшей
взвеси частиц, различимых под микроскопом (проверить!). Цвет
32
раствора должен быть серым для туши и светлорозовым для
кармина. В раствор впускают несколько капель с большим ко-
личеством парамеций из пробирки или природной культуры.
Через 10—15 мин. рассматривают при малом или среднем увели-
чении либо прямо в часовом стекле, либо вылавливают инфу-
зорию и рассматривают на предметном стекле.
В сероватом теле инфузорий ясно увидим округлые чёрные
(при туши) или красные
куоли (рис. 12), которые
возникли при заглатыва-
нии инфузориями мель-
чайших частиц туши или
кармина.
Б. Процесс поглоще-
ния частиц туши или
кармина лучше всего
может быть продемонстри-
рован на сувойках или
стилонихиях.
На поверхность культу-
ры из природного водоёма
с гниющей листвой кладут
плашмя 2—3 покровных
стекла так, чтобы они не
тонули и держались на по-
верхности. Через 5—10 мин.
вынимают пинцетом, быст-
ро поворачивают и кладут
(при кармине) пищеварительные ва-
Рис. 12. Пищеварительные вакуоли у пара-
меций в растворе туши (оригинал).
на предметное стекло «ли-
цом вверх» (т. е. смоченной стороной кверху, к объективу). Для
того чтобы покровное стекло не сползало с предметного, на пос-
леднее наносят маленькую каплю воды. Рассматривают при малом
увеличении. Если при этом обнаружатся сувойки или стилони-
хии, то к ним прибавляют 1—2 капли раствора туши или кармина,
заготовленного, как указано в опыте А1.
У сувоек ясно видим движение двух токов мелких взвешенных
частиц. Один ток (широкий) устремляется в тело сувойки через
ротовое отверстие. Другой (узкий и густой) непрерывной лентой
выходит из ротовой области. Нередко обратный ток попадает в
зону устремляющихся частиц, и тогда получается эффектная
картина кругового тока (рис. 13). В теле инфузорий ясно видны
окрашенные округлые пищевые вакуоли.
Наличие исходящего тока может быть объяснено либо тем, что
Инфузории выбрасывают обратно слишком крупные частицы
туши или кармина, либо тем, что не все частицы, так сказать,
* Если в природной культуре находятся колониальные сувойки, то колонию
“Оскабливают пипеткой и помещают на предметное стекло.
3 тт
Цингер
33
успевают проникнуть в тело и поэтому выбрасываются не пре-
кращающимся ни на минуту мерцанием предротовых ресничек.
У стилонихий таким же способом наблюдается только один
входящий ток.
Парамеции, сувойки, стилонихии и многие другие инфузории
питаются бактериями. Поглощение бактерий происходит точно
таким же способом, как и частиц туши. Мерцанием ротовых
ресничек создаётся мощный ток в тело инфузорий через ротовое
отверстие.
Вместе с током воды устремляются и все взвешенные в воде
частицы, в том числе и бактерии. Пройдя через рот, ток вступает
Рис. 13. Поглощение частичек туши одиночными
сувойками и образование пищевых вакуолей, при
малом увеличении (оригинал).
в соприкосновение с эндоплазмой, где отрываясь небольшими
порциями, образует пищеварительные вакуоли; в них происходит
переваривание попавших в вакуоль бактерий. Посторонние ча-
стицы и непереваренные остатки выбрасываются наружу через осо-
бое отверстие — порошицу (у парамеций) или прямо через рот (у
сувоек).
В**. Инфузории-хищники. Среди инфузорий встречаются
и такие, которые питаются не только бактериями, но и другими
инфузориями. Хищнический способ питания с биологической точ-
ки зрения представляет много интересных моментов, характери-
зующих сложное поведение микроскопических хищников.
34
1. На предметное стекло вылавливают пипеткой 2—3 бурсарии
(Bursaria truncatella) и к ним добавляют каплю с парамециями
или другими мелкими инфузориями. Наблюдают при малом
увеличении микроскопа без покровного стекла. Надо уловить
момент, когда бурсария останавливается; тогда ротовые реснич-
ки энергично мерцают, создавая ток в ротовую ямку инфузории.
Приблизившаяся парамеция, увлечённая током, попадает в рото-
вую ямку; она начинает усиленно вырываться, и иногда ей это
Рис. 14. Инфузории-хищники (оригинал).
А — бурсария и Б — гдилептус, заглатывающие других инфузорий.
Удаётся. Но если бурсария протолкнет её глубже к отверстию
глотки, то дело кончено: парамеция с силой втягивается в эндо-
плазму и здесь мгновенно умерщвляется, подвергаясь сильному
®Жатию и искривлению. Окружённая пищеварительной вакуолей,
"На постепенно переваривается (рис. 14, А).
2- На предметное стекло вылавливают из природной культуры
несколько дилептусов (Dileptus anser), к ним прибавляют каплю
’Гколпидиумами, парамециями, стилохиниями или другими мел-
"8Мй инфузориями. Наблюдают при малом увеличении без по-
*фовного стекла.
3*
35
Дилептусы, медленно плавая и размахивая, точно саблей,
своим хоботом, наносят страшные удары парамециям и стило-
нихиям, которые перестают двигаться и распадаются на куски.
Тогда рот дилептуса, лежащий у основания хобота, широко
раскрывается, и туда втягивается умерщвлённая добыча, тотчас
окружаемая ясно видимой пищеварительной вакуолью (рис. 14, Б).
Ротовой аппарат инфузорий состоит из ротового отверстия,
глотки и пищевода. У многих видов ротовой аппарат, кроме
ресничек, снабжён особыми элементами для схватывания, удержи-
вания и заглатывания пищи.
Пища, попавшая через пищевод в тело инфузории, окружается
пищеварительной вакуолью, в которую из плазмы проникают
Рис. 15. Звездообразные сократи-
тельные вакуоли у парамеции, при
большом увеличении (оригинал).
Рис. 16. Фазы пульсации сократи-
, тельной вакуоли парамеции (по Пют-
теру).
пищеварительные ферменты. В теле инфузории вакуоля прохо-
дит сложный путь, в течение которого меняется её химическая
реакция от кислой до щелочной.
6*. Сократительные вакуоли у парамеций. Каплю с пара-
мециями помещают на предметное стекло и накрывают покров-
ным. Под препаровальной лупой, прикладывая к краю покровно-
го стекла кусочек ваты или фильтровальной бумаги, отсасывают
жидкость настолько, чтобы инфузории, придавленные стеклом,
замедлили движение и остановились. Остановить движение
можно и другим способом: помещая под покровное стекло не-
сколько волоконец ваты, в которых инфузории запутываются.
При малом увеличении микроскопа отыскивают неподвиж-
ную, но ещё живую парамецию. Передвигают предметное стекло
так, чтобы инфузория оказалась в центре поля зрения. Наво-
36
дят большое увеличение. Отыскивают сократительные вакуоли,
которые вместе с приводящими каналами имеют характерную
звездообразную фигуру (рис. 15).
У парамеции две сократительные вакуоли: передняя и задняя.
Каждая вакуоля состоит из собственно вакуоли и 5—7 приводящих
каналов.
Деятельность вакуоли состоит в её наполнении (диастола) и
опорожнении (систола) (рис. 16). Приводящие каналы, вначале
узкие и незаметные, впитывая воду из окружающей протоплазмы,
наполняются и расширяются. Тогда они видимы как лучи звез-
.дообразной фигуры. Достигнув наибольшего набухания, они спа-
даются, изливая своё содержимое в собственно вакуолю. Послед-
няя при этом сильно раздувается (стадия диастолы), и перед
глазами наблюдателя появляется светлый прозрачный кружочек.
Ещё мгновенье — и вакуоля, быстро сокращаясь, выбрасывает
свое содержимое наружу (стадия систолы). После систолы при-
водящие каналы снова наполняются жидкостью, разбухают, и
процесс повторяется снова.
Обыкновенно у парамеции фазы в обеих вакуолях чередуются,
и если одна находится в стадии расширения (диастола), другая
в это время сокращена (систола).
Функция сократительной вакуоли состоит в удалении излиш-
ков воды и вредных продуктов обмена.
7. Раздражимость. А. «Выстреливание» трихоцист. У ряда
инфузорий (парамеция, фронтония, дилептус и др.) в наружном
эктоплазматическое слое залегают многочисленные мельчайшие
тельца — трихоцисты, которые при разного рода раздражениях
способны «выстреливать» — выпускать длинную стрекательную
нить (рис. 17Б). Такие стрекательные нити у хищников (дилептус)
служат орудием, умерщвляющим добычу, у парамеции же они
служат, повидимому, защитными органеллами.
На предметное стекло помещают каплю с парамециями или
.вылавливают из природной культуры фронтоний (лучше крупных).
На инфузорий капают каплю фиолетовых чернил, разбавленных
водой в 7—9 раз.
Рассматривают сначала при малом увеличении без покровного
стекла, затем, накрыв покровным,—при большом. Видны тела
убитых и сильно окрашенных чернилами инфузорий, окружённых
пучками «выстреливших» трихоцист (рис. 17А).
«Выстреливание» трихоцист происходит также и при прибавле-
нии капли 4%-ного формалина или 1—3%-ной уксусной кислоты.
Если живую инфузорию накрыть покровным стеклом и, наблюдая
под микроскопом, поместить у края покровного стекла маленькую
каплю с 4 %-ным формалином, то по мере проникновения фор-
малина под покровное стекло можно увидеть отдельные моменты
«выстреливания». Инфузории, двигаясь и попадая в область фор-
малина, то там, то здесь выбрасывают пучки трихоцист.
37
Б
В
Рис. 17. Трихоцисты туфельки.
Ч А — пучки «выстреленных» трихоцист вокруг
парамеций, убитых фиолетовыми чернилами.
Малое увеличение. Б — часть окрашенного
среза через парамецию при очень большом
увеличении. По краю тела залегают много-
численные трихоцисты. Б — нормальная и
«выстреленная» трихоциста при увеличении
в 1500 раз.
38
Б. Реакция «бегства» из раствора поваренной соли у
нарамеций. Отрицательный хемотаксис (рис. 18). На пред-
метное стекло помещают каплю с большим количеством пара-
меций, а на расстоянии 1 см от неё —каплю чистой воды. С по-
мощью отточенной спички соединяют обе капли водяным мости-
ком (рис. 18А). К краю капли с инфузориями прикладывают ма-
ленький кристаллик поваренной соли. Наблюдая под препаро-
вальной лупой, увидим, как парамеции по мере растворения соли
начнут переплывать по водяному мостику в каплю чистой воды
(рис- 18Б). Не успевшие уйти инфузории погибают от неблаго-
приятной для них концентра-
ции соли в первой капле. Этот
опыт показывает, что инфузо-
рии заметно реагируют на хими-
ческое изменение окружающей
среды. Инфузории также реаги-
руют на свет, температуру и
другие факторы. Эта реакция
обозначается как таксис: ре-
акция на химические факто-
ры—хемотаксис, реакция на
свет — фототаксис и пр. При
положительном таксисе инфузо-
рии устремляются к раздражи-
телю, при отрицательном, нао-
борот, удаляются от него. Таким
образом, скопление инфузорий
и в особенности жгутиковых на
освещённых участках обозна-
чают как положительный фото-
таксис.
Рис. 18. Отрицательный хемотаксис
у парамеций (по Полянскому).
Внд препарата под лупой. Парамеции уплы-
вают из капли, в которой растворяются кри-
сталлики поваренной соли.
В. Сократимость протоплазмы у спиростомумов и
сувоек.
1. На предметное стекло вылавливают из природной культуры
несколько инфузорий-спиростомумов. Наблюдают при малом
увеличении без покровного стекла. Длинное червеобразное тело
инфузорий, время от времени натыкаясь на какое-нибудь препят-
ствие или просто задевая за незначительные выступы стекла,
быстро съёживается в короткий овал и снова выпрямляется
(рис. 19, 1, 2).
Такое же съёживание можно вызвать слегка постукивая по
краю предметного стекла ногтем или рукояткой скальпеля.
Прекрасно видно сокращение тела у стентора. Прикреплённый,
вытянувшийся в трубу стентор моментально сокращается при
раздражении (например, при постукивании по стеклу или при
столкновении с другими инфузориями), после чего медленно
растягивается.
Сокращение тела спиростомумов и стенторов происходит бла-
39
годаря наличию сократимых нитей —мионем (своего рода «муску-
лов» инфузорий), расположенных в поверхностном слое. Мио-
немы видны и на живых инфузориях в виде тонких полосок; у
спиростомума они особенно ясны на заднем конце, на светлом
пространстве сократительной вакуоли.
2. На предметное стекло помещают одиночных или колониаль-
ных сувоек. Наблюдают при малом увеличении без покровного
стекла. При малейшем раздражении нить сувойки быстро скручи-
вается в спираль, подтягивая животное к субстрату (рис. 19, 3).
Скручивание стебелька происходит от сокращения мионемы,
Рис. 19. Сокращение протоплазмы инфузорий при раздражении (малое увели-
чение) (оригинал).
1 и 2 — спиростомум; 3 — сувойки; 4 — мускульные фибриллы (мионемы) в середине
стебелька.
проходящей по середине стебелька. Мионема заметна у крупных
сувоек и при малом увеличении (рис. 19, 4).
8. Размножение. А**. Деление. Инфузории размножаются
поперечным делением. Процесс деления начинается с некоторого
изменения формы тела, в середине которого появляется посте-
пенно суживающаяся перетяжка, благодаря чему видны как бы
две половинки, соединённые друг с другом. Наконец, перетяжка
суживается настолько, что между двумя дочерними особями
остаётся лишь узенький протоплазматический мостик. Инфу-
зории, дергаясь в разные стороны, разрывают его, и перед вами
две «молодые» дочерние инфузории, отличающиеся от нормаль-
ных лишь меньшими размерами. Затем они растут, достигают
размера «взрослых», снова делятся и т. д.
Для наблюдения деления парамеций тонко оттянутой пипет-
кой вылавливают под препаровальной лупой из часового стекла
40
6 инфузориями тех особей, которые находятся на различных
стадиях деления, руководствуясь рис. 20. Наблюдают при малом
увеличении без покровного стекла.
Еще лучше процесс деления наблюдается у крупных инфу-
зорий: бурсарий и спиростомумов. Их вылавливают из природ-
ных культур. Для спиростомумов очень удобны разводки в мо-
лочном растворе, где при массовом их развитии легче отыскать
делящихся особей. Заметим, что наибольший процент делящихся
особей попадается ранним утром или вечером.
Выловив одну-две делящиеся особи парамеций, бурсарий, спи-
ростомумов или стенторов (рис. 20), помещают их в маленькой
капле на предметное стекло и наблюдают при малом увеличении
без покровного стекла. Наблюдение ведут с перерывами в 5—10 мин.
Обязательно делают хотя бы грубые зарисовки стадий деления.
Парамеция и спиростомум делятся около 45—60 мин., бур-
сария — 30 мин. Процесс деления ускоряется при оптимальной
температуре (25°). За сутки при благоприятных условиях происхо-
дит 1—3 деления.
У бурсарии, а также спиростомума благодаря их прозрачности
заметно ядро; ядро в покоящемся состоянии имеет удлинённую
форму, перед делением оно собирается в овальный комок в сере-
дине тела, а затем, вытягиваясь, разделяется пополам между
дочерними особями.
В процессе деления ротовой аппарат и другие органеллы в
большинстве случаев резорбируются (рассасываются) у мате-
ринской особи и образуются заново у обеих дочерних особей.
Этот процесс мцжно изучить лишь при длительных наблюде-
ниях на живых инфузориях и на препаратах.
Б**. Темп размножения. Приготовляют пробирку с пара-
мециями, тонко оттянутую пипетку (см. часть третью, III, 4), чашки
Петри (2—3 шт.), маленькие часовые или предметные стёкла с
выемкой (2—3 шт.), молочный раствор, тушь и тетрадь для записи.
Из часового стекла с небольшим количеством парамеций
вылавливают пипеткой по одной инфузории и помещают их на
предметное стекло. Таким способом заготовляют на предметном
стекле несколько капель. Проверяют под препаровальной лупой.
Если при этом в капле окажутся две-три инфузории, то лишних
обязательно удаляют пипеткой, оставляя одну.
В маленькое часовое стекло или в выемку предметного стекла
наливают 5—15 капель молочного раствора (концентрация 1—2 кап-
ли молока на 10 куб. см воды), куда впускают заготовленную
одну парамецию. Затем стекло помещают в чашку Петри, на
Дно которой наливают немного воды и закрывают сосуд крыш-
кой1. На крышке отмечаются номер стекла, день и час зарядки.
На следующий день, примерно в тот же час, производят осмотр
1 Вода наливается для того, чтобы предотвратить испарение жидкости из
Часового стекла.
41
* Б
Рис. 20. Последовательные стадии деления инфузорий, при малом увеличении
(оригинал):
4 — туфельки; Б — бурсарии; Б — трубача и Б — спиростомума.
42
стекла под препаровальной лупой. Подсчитывают и записывают
количество инфузорий. Если при подсчете в стекле окажутся
две инфузории, то, очевидно, произошло одно деление (темп раз-
множения равен 1); если четыре, то —два деления (темп размно-
жения 2); при восьми особях произошло три деления, а при шест-
надцати особях — четыре (темп размножения 3 и 4). Затем одну
Инфузорию оставляют, а лишних удаляют пипеткой. Такую
процедуру повторяют 5—10 дней. На этом опыте можно получить
реальное представление о темпе размножения простейших.
Учащимся можно предложить ряд задач о количестве потомства
от одной инфузории через 10, 15 дней и т. д.
По вычислению математика В. М. Воинова при самом медлен-
ном темпе деления парамеции (1 раз в сутки) через месяц от
1 особи получится 1 073 741 824 новых инфузории.
При средней длине парамеции 200 /л через 38 суток «цепочка»
вытянувшихся в одну линию парамеций опоясала бы весь земной
шар по экватору (40000 км). Сколько инфузорий может произойти
от одной через год? Получается астрономическая цифра 75 X 10108.
Приблизительное представление об этой цифре будет следую-
щее1. Если представить себе полый шар, касающийся одним
боком Земли, а другим Солнца (расстояние от Земли до Солнца
150 млн. км), то этот шар оказался бы тесен для потомства ин-
фузории, так как его пришлось бы увеличить в 10м раз (1061 —
число, изображаемое единицей с 64 нулями). На деле такого раз-
множения не происходит потому, что инфузорий массами уничто-
жают мелкие водные животные (в частности мальки рыб), которые
питаются инфузориями. Кроме того, многие инфузории погибают
от изменяющихся и неблагоприятных условий существования.
9**. Инцистирование. Заряжают ряд пробирок молочным
раствором со стилонихиями (Stylonichia pustulata). В некоторых
пробирках после сильного размно-
жения при длительном культиви-
ровании в течение %—1 месяца
инфузории будут исчезать. Вни-
мательно осматриваяг пробирки
под ручной лупой, можно увидеть
на стенках массу маленьких пра-
вильных кружочков. Это цисты
етилонихий. Иногда инцистиро-
,.вание можно вызвать, помещая * V
Рис. 21. Цисты инфузорий
(оригинал):
пробирки на холод (температура А — стилонихии; Б — бурсарии.
•0—5°). Соскоблив цисты, рассмо-
трим их сначала при малом увеличении, затем при большом.
Увидим цисты етилонихий с толстой оболочкой (рис. 21). Иногда
1 Принимая средний объём парамеции за 0,002094 куб. мм, вычисляем по
л 1
. формуле — тс а Ь2, где а — длина инфузории = 0,2 мм, аЬ — ширина ее = 0,05 мм.
V
43
на дне сырых культур можно найти цисты бурсарий, спиро-
стомумов и других инфузорий.
Цисты долгое время могут находиться в высушенном состоянии.
Ветром они расселяются на значительные расстояния. Перенос-
Рис. 22. Регенерация инфузорий (оригинал).
А — бурсарии; Б — спиростомума. Кусочки разрезанной инфу-
зории превращаются в нормальных животных.
чиками цист из водоёма в водоём могут быть птицы, водяные
насекомые и т. д. Попав снова в благоприятные условия, цисты
раскрываются, и находящиеся в них инфузории выходят наружу.
Способность образовывать цисты объясняет тот факт, что боль-
шинство инфузорий — космополиты и распространены по всему
44
земному шару. Проф. Шевяков, совершивший кругосветное пу-
тешествие в конце XIX в., находил парамеций во всех обследо-
ванных им пресноводных водоёмах Азии, Африки, Америки и
Австр а л и и.
ю**. Регенерация. На предметное стекло в большой капле
жидкости помещают несколько крупных инфузорий — спиросто-
мумов. Тонким глазным скальпелем (так называемый «нож»
Грефе) или ребром тонкого покровного стекла разрезают инфузо-
рию на кусочки. Разрез, конечно, трудно сделать наверняка,
поэтому просто проводят стеклом или скальпелем несколько раз
по капле с инфузориями. При этом часть инфузорий обязательно
разрезается. Отдельные кусочки вылавливают тонкой пипеткой
и помещают по одному, по два в маленькие, чисто вымытые часо-
вые стекла, куда наливают немного жидкости из того сосуда, от-
куда были взяты инфузории.
Стёкла с кусочками хранят в чашках Петри, на дно которых
наливают немного воды. Кусочки рассматривают под лупой и
малым увеличением микроскопа и зарисовывают. На следующий
день снова просматривают и зарисовывают. Обычно кусочки к
этому времени превращаются уже в нормальных инфузорий,
только меньшего размера (рис. 22).
Таким же способом опыт с регенерацией можно произвести и
на бурсарии, и на стенторе.
11. Очерк экологии инфузорий. Количество известных науке
свободно живущих видов инфузорий составляет около 2000.
К этому надо прибавить не менее 1 000 паразитов и эктокоммен-
салистов (см. ниже).
Колебания размеров инфузорий также велики, как и у млеко-
питающих; можно наблюдать все переходы от карликов, раз-
мером 12 /j, (Aspidisea), до гигантов в 2—3 мм (Spirostomum),
т. е. первые меньше последних в 165—250 раз. Инфузории встре-
чаются и в морских, и в пресных водах.
Сравнительно немногочисленна фауна инфузорий чистых вод
с зелёной растительностью. Наоборот, значительно богаче фауна
водоёмов с разлагающимися органическими веществами, насе-
лённых бактериями — основным источником питания инфузорий.
Поэтому инфузории избегают текучих вод и предпочитают
мелкие стоячие водоёмы и прибрежные зоны больших прудов и
озер. Морские формы также предпочитают тихие бухты и лишь
Tintinnoidea живут в открытых морях.
Для жизни инфузорий важны растворённые в воде химические
составные части: кислород, углекислый газ, метан, сероводород,
а также соли и кислоты. В новейшее время большое значение
придаётся концентрации водородных ионов (pH). Многие ин-
фузории очень чувствительны к физико-химическому изменению
среды. Поэтому в одном и том же водоёме и сырой культуре
происходит частая смена форм: одни виды исчезают (погибают
или инцистируются), другие появляются.
45
Даже незначительные количества воды создают благоприятные
условия для жизни инфузорий. Поэтому, например, найдены
формы, обитающие в почвах и даже на мхах деревьев и скал.
Инфузории приспособлены к широким температурным гра-
ницам. Поэтому фауна тропических и умеренных стран пока-
зывает сходный видовой состав.
В противоположность жгутиковым инфузории мало чувст-
вительны к свету.
Кроме свободно живущих видов, существуют формы, посе-
ляющиеся на наружных покровах многоклеточных водных живот-
ных. Такие инфузории в редких случаях паразиты, и громадное
большинство их — эктокомменсалисты. Они найдены на наруж-
ных покровах рыб, амфибий, моллюсков, ракообразных, насеко-
мых, червей, мшанок и губок.
С каждым годом увеличивается список чисто паразитических
форм и энтокомменсалистов1. Конечно, они особенно распростра-
нены среди водных животных (рыбы, черви, насекомые). Но и
внутренности наземных животных часто населены инфузориями.
Особенно показательна фауна инфузорий желудка жвачных и
копытных. Инфузории обнаружены в кишечнике человека (бал-
лантидий, вызывающий заболевание), а также у обезьяны, слона,
ежа, лягушки, таракана и многих других животных (см. рис. 40,
41, 43 и 44).
П. ЛОЖНОНОЖКОВЫЕ, ИЛИ КОРНЕНОЖКИ
1. Искусственные культуры. Раковинные корненожки — ар-
целлы и диффлюгии — почти всегда развиваются в сырых куль-
турах с опавшей листвой, илом, водорослями и т. п.
Реже встречаются голые амёбы, поэтому для занятий жела-
тельна постановка искусственных культур. Ниже предлагаются
три способа, из которых первый наиболее простой.
А. Сенной настой. Приготовляется несколько иначе, чем
для инфузорий. 10 г сена (без цветов) или сенной трухи кипятят
в 1л воды в течение 10—20 мин. Затем, не фильтруя, вместе с
сеном помещают в большой сосуд или в несколько мелких; раз-
водят втрое дождевой или кипяченой водопроводной водой и
прибавляют немного жидкости из природной культуры. Кроме
того, полезно прибавлять в культуры два раза в месяц несколько
капель молока.
Через 7—10 дней в культурах обычно массами разводятся
(наряду с инфузориями) амёбы лимакс, а иногда и протеус. Амёбы
скопляются главным образом на поверхности жидкости, на
плёнке, отливающей металлическим блеском.
1 Энтокомменсалисты — безвредные сожители, поселяющиеся внутри тела
хозяина, в то время как эктокомменсалисты живут на его наружных покровах.
46
Питаются амёбы бактериями, мелкими жгутиковыми и инфу-
зориями которые размножаются как в сенном настое, так и в
следующих.
Б. Земляной настой. В любой сосуд на х/3 насыпают са-
довой земли с цветочной или другой хорошо удобренной грядки.
Затем до половины доливают водой (дождевой, речной, водопровод-
ной), и здесь через 7—10 дней на поверхности обычно разводятся
амёбы лимакс.
В*. Древесный настой. В сосуд с сырой водой кладут пучок
молодых веток лиственных деревьев. Настой выдерживают
7—10 дней.
Одновременно приготовляют, как указано в п. Б, земляной
настой, который также выдерживают 7—10 дней.
Затем в чистый сосуд сливают равные части заготовленных
настоев и заражают его амёбами протеус, выловленными из при-
родной культуры. Через несколько дней амёбы интенсивно раз-
множаются.
Пересевы на новую среду следует производить 1 раз в 2—3 ме-
сяца. Основное условие для удачной культивировки — полная
прозрачность среды.
2. Демонстрация голых амёб. При наблюдении голых амёб
необходимо суживать диафрагму микроскопа, так как
на очень светлом поле зрения прозрачные амёбы могут остаться
незамеченными.
Амёб достают из культуры либо пипеткой, либо кладут чистое
покровное стекло плашмя на поверхность культуры; при этом
амёбы обычно скопляются на стекле. Через 15—30 мин. стекло
вынимают и помещают «лицом вниз» (т. е. смоченной в культуре
стороной) на маленькую каплю той же жидкости на предметном
стекле.
Крупных амёб — протеус, пеломикус, диффлюгий — рассматри-
вают при малом увеличении, а мелких — лимакс, гуттулу и др.—,
отыскивают сначала при малом увеличении и, поместив в центр
поля зрения, рассматривают при большом.
А. Амёба лимакс (Amoeba limax) чаще остальных встре-
чается в сырых культурах, легко развивается на искусственных
средах и поэтому служит самым удобным объёктом для демон-
страции (рис. 23).
Хорошо видна, большей частью одна прозрачная широкая и
Длинная псевдоподия, резко отличающаяся от зернистой эндо-
плазмы. Зёрнышки и мелкие пузырьки эндоплазмы всё время
находятся в движении. В эндоплазме можно заметить тёмное
округлое ядро.
Движение амёбы начинается с выпячивания прозрачной эк-
топлазмы; образуется псевдоподия, в которую по мере её увели-
чения перетекает зернистая эндоплазма. Затем появляется новый
47
Рис. 23. Амёба лимакс, при сред-
нем увеличении (оригинал).
гающее в эндоплазме ядро,
вырост — псевдоподия; в неё так-
же переливается эндоплазма, и
таким образом всё тело амёбы
передвигается с места на место.
В. Амёба протеус (Amoeba
proteus) (рис. 24 и 6). В культурах
эти амёбы находятся не только на
поверхности, но и на дне сосуда.
Обычно в начале наблюдения
амёбы лежат спокойно в виде ок-
руглого комочка.
Даже при малом увеличении
можно различить тонкий проз-
рачный поверхностный слой — эк,-
топлазму и зернистую, более тём-
ную — эндоплазму (риб. 6, 2а—г).
Иногда можно различить и зеле-
но большей частью оно невидимо,
так как затемнено разными включениями; зато удаётся заметить
прозрачный светлый пузырёк — сократительную вакуолю (рис. 24).
Сокращение вакуоли происходит значительно медленнее, чем у
инфузорий, примерно в течение 5—8 мин.
Рис. 24.
Амёба протеус, при малом увеличении (по Лейди).
Внимательно присматриваясь к округлившейся амёбе, заме-
чаем, что на теле её во многих местах образуются то короткие, то
длинные псевдоподии. Жидкая зернистая эндоплазма всё время
находится в движении. Её зёрнышки, дойдя до зоны эктоплазмы,
отклоняются в сторону и идут обратно, где снова попадают в
токи, идущие вперед.
48
с амёбой прибавить каких-
Рис. 25. Амёба протеус захваты-
вает длинную нитчатую водоросль
(по Румблеру).
3*. Питание амёб. Для того чтобы наблюдать захватывание
пищевых частиц, необходимо к капле
дибудь мелких водорослей. При
этом можно заметить, как амёба
наползает на водоросли и обте-
кает их. Заглатывание происходит
очень быстро, в течение несколь-
ких секунд. Попав в эндоплазму,
водоросль окружается пищевари-
тельной вакуолей, где постепенно
переваривается.
Очень своеобразно амёба захва-
тывает кусочек длинной нитча-
той водоросли. Такой
постепенно втягивается
амёбы и скручивается в
комок (рис. 25).
Иногда амёбы протеус
ваюг не только водоросли, но и инфузорий и даже таких круп-
ных, как стентор.
4. Раздражимость (рис. 26). К капле с амёбами лимакс или
протеус прикладывают сбоку маленький кристаллик поварен-
ной (голи. По мере растворения соли амёбы замедляют движение,
кусочек
в тело
круглый
захваты-
Рис. 26. Раздражимость амёб (оригинал).
Амёба протеус (I) округляется в растворе соли (2) и снова образует псевдоподии
(З—о) при разжижении раствора.
перестают выпускать псевдоподии и, наконец, округляются и ос-
таются совсем неподвижными. Если теперь отсасывать воду и
подпускать свежей жидкости, то те амёбы, которые ещё не по-
гибли, по мере разжижения раствора снова начнут двигаться и
выпускать псевдоподии.
На этом опыте убеждаемся, что амёбы способны заметно ре-
агировать на изменение окружающей среды.
4
Цингер
49
5. Раковинные корненожки — арцеллы и диффлюгии (рис. 27
и 6). Демонстрация арцелл и диффлюгий не представляет за-
труднения, так как они встречаются в любой сырой культуре с
илом, опавшей листвой или водорослями. Достают корненожек
либо пипеткой со дна и боковых стенок сосуда, либо на поверх-
ность культуры кладут покровное стекло, на котором корненожки
Рис. 27. Арцеллы и диффлюгии, при среднем увеличении
(по Догелю и Ферворну).
и скопляются. Покровное стекло «лицом» вверх (смоченной сто-
роной к объективу) помещают на предметное и прибавляют каплю
жидкости.
Уже при малом увеличении заметны правильные округлые ра-
ковинки арцелл (рис. 6, 6). По окраске они разнообразны: проз-
рачные, жёлтые, коричневые, бурые. По форме раковинка пред-
ставляет как бы полую миску или тарелку, а у некоторых ви-
дов — полушар.
50
В середине раковины находится круглое отверстие, через ко-
торое высовывается одна псевдоподия или несколько. Однако
далеко не все раковины содержат корненожек — многие из них
пустые.
. При большом увеличении (покровное стекло «лицом» вниз)
можно рассмотреть тончайшую скульптуру раковины арцеллы.
Она пронизана массой мельчайших отверстий.
У диффлюгий уже при малом увеличении сразу заметно, что
раковина составлена из множества мельчайших песчинок, искусно
подогнанных друг к другу (рис. 6 и 27). Форма раковины у
Рис. 28. Актиносфериум, при среднем увеличении
(из Дофлейна).
разных видов различна: овальная, бочонкообразная, грушевидная.
На одном конце раковины находится отверстие, через которое
.высовываются одна-две короткие псевдоподии, при помощи кото-
рых корненожки очень медленно передвигаются.
6. Солнечники (Actinosphaerium eichhorni). Солнечники встре-
чаются главным образом весной в маленьких прудиках, в прибреж-
ной илистой зоне. Иногда в большом количестве развиваются в
'сырых культурах с илом.
Вылавливают солнечников под лупой. Они сразу бросаются
в глаза своим округлым прозрачным телом, окружённым снопом
лучистых псевдоподий (рис. 28).
Рассматривают солнечников на предметном стекле, без покров-
ного, при малом увеличении, с затемнённой диафрагмой.
4* 51
Округлое тело солнечника ясно разделяется на светлый на-
ружный слой и более тёмный — внутренний. Оба слоя состоят
из ячеек, причём ячейки наружного слоя значительно крупнее
внутренних.
Тело окружено длинными лучистыми псевдоподиями. В каж-
дой псевдоподии при большом увеличении (накрыть покровным
стеклом!) можно отличить внутреннюю осевую нить, покрытую
снаружи текучей протоплазмой.
Можно наблюдать и способ питания солнечника. Для этого к
капле прибавляют немного жидкости с эвгленами или другими
жгутиковыми.
Как только эвглены сталкиваются с псевдоподиями, они сейчас
же умерщвляются и токами протоплазмы продвигаются в тело
солнечника, где и перевариваются.
7. Ископаемые корненожки из мела и известняка.. Малень-
кий кусочек натурального (неспрессованного) мела или известняка
размачивают и растирают в воде или глицерине. Затем капельку
полученной мутной жид-
кости помещают на пред-
метное стекло и накры-
вают покровным. Рассма-
тривают под сильным
источником света (элек-
трическая лампа) сна-
чала при малом увели-
чении, а затем при боль-
шом.
Видны обломки и целые
раковины различных ис-
копаемых корненожек
(рис. 29).
В обычном школьном
мелу также можно иногда
найти обломки раковин,
но здесь они очень мелки
из-за размола и прес-
Рис. 29. Раковинки ископаемых корненожек СОВКИ, которым подвер-
из мела и известняка (из Цузмера). гается мел при обра-
ботке.
Так называемые меловые горы и громадные залежи известняка
представляют не что иное, как миллиардные скопления раковин
корненожек, которые в течение тысячелетий осаждались на дно
океанов и морей.
III. ЖГУТИКОВЫЕ
1. Искусственные культуры. Если в сырых культурах из
водоёма не будет массового количества жгутиковых, удобного
52
для демонстрации, то создают их искусственные культуры. Ниже
предлагаются два способа.
А. Сенной настой (см. часть вторую, I, Б), обычно упот-
ребляемый для разведения инфузорий, может служить также
подходящей средой для развития эвглен (Euglena viridis, Phacus
и др-)-
Настой наливают в пробирки или маленькие колбы. Так как
мелких эвглен трудно вылавливать пипеткой, то в настой просто
впускают немного жидкости из часового стекла, в котором под
микроскопом были замечены жгутиковые.
Б*. Жидкость Бенеке очень хороша для получения массо-
вых культур эвглен и колониального гониума, однако она тре-
бует наличия ряда химикалий.
Приготовление:
1) Сначала на дестиллированной воде приготовляют отдель-
но, примерно по 10 куб.см, следующие растворы: а) 4 %-ный
азотнокислый аммоний (NH4NO3), б) 2 %-ный хлористый кальций
(СаС12), в) 2 %-ный сернокислый магний (MgSO4), г) 2 %-ный
фосфорнокислый калий (К2НРО4).
Такие растворы могут сохраняться в течение многих месяцев.
. 2) К 196 куб.см дестиллированной воды прибавляют пооче-
рёдно по 1 куб. см заготовленных растворов, причём последним
по каплям прибавляют фосфорнокислый калий1.
Полученную жидкость разбавляют в 5 раз дестиллированной
водой. Это и будет готовая жидкость Бенеке, которую разливают
по пробиркам и мелким сосудам и заражают эвгленами или го-
ниумом из природных культур.
Через 5—7 дней прозрачная жидкость зеленеет из-за размно-
жения в ней громадного количества жгутиковых.
Культуры следует держать на свету. В практике культуры
прекрасно сохранялись и в зимние месяцы без дополнительного
искусственного освещения.
Переливку в другие сосуды со свежей жидкостью производят
раз в месяц или даже раз в два месяца. Можно и просто отлить
от старой культуры 3/4 жидкости и долить свежего раствора
Бенеке.
Упадок культуры замечают по порошкообразному осадку на
Дне сосуда. Это скопление инцистировавшихся эвглен.
2. Демонстрация эвглен. На предметное стекло помещают каплю
Жидкости с эвгленами из богато населённой сырой или искусст-
венной культуры. Сначала рассматривают при малом увеличении
без покровного стекла. Видна масса мелких удлинённых зелёных
телец — эвглен. По размеру они значительно меньше парамеций
(рис. 30, 1). Движение также медленнее, чем у инфузорий. При
Движении эвглены слегка покачиваются из стороны в сторону.
1 Если фосфорнокислый калий прибавляется раньше других и сразу, то
выпадает осадок, что нежелательно.
53
Зелёную эвглену можно узнать и при малом увеличении бла-
годаря её способности изменять форму тела, которое то удлиня-
ется, то сокращается. У всех остальных эвглен форма тела постоян-
на. Поместив на каплю несколько волоконец ваты и накрыв
предметным стеклом, отыскивают сначала при малом увеличении
остановившихся и запутавшихся в волокнах эвглен. Передвигая
предметное стекло так, чтобы эвглены оказались в центре поля
зрения, рассматривают при большом увеличении. На переднем
конце тела видно светлое пространство — сократительная вакуоля,
Рис. 30. Эвглены: a - эвглена зелёная; о - эвглена
акус (оригинал).
1 — при малом увеличении; 2 и 3 — npri* большом увеличе-
нии ; 3 — при окраске иодом (видны жгутики).
около которой находится красное светочувствительное зёрныш-
ко — стигма (рис. 30, 2 и рис. 5, А).
В теле разбросаны мелкие зелёные зёрна хлорофилла и крупные
тёмные парамиловые зёрна (запасные питательные вещества).
В середине тела-просвечивает округлое ядро.
3. Обнаружение жгута. К препарату с живыми эвгленами
прибавляют маленькую каплю иодной настойки. Накрывают по-
кровным стеклом и рассматривают при большом увеличении.
Видны погибшие эвглены, окрасившиеся от иода в тёмнобурый
цвет.
Просмотрев несколько особей, заметим окрасившийся жгут, от-
ходящий в виде изогнутой нити от переднего конца тела (рис. 30,3).
4. Демонстрация колониальных жгутиковых — гониумов и
вольвоксов. Весной в маленьких прудах многие жгутиковые,
54
запастись консер-
Рис. 31. Гониум, при большом увели-
чении (по Гартманну).
представляет четырёхугольную
в том числе гониум и вольвокс, размножаются в таком громадном
количестве, что вода приобретает яркозелёную окраску. Как го-
ворят, пруд «цветёт».
Если при взятии пробы из такого водоёма в нём окажется
много вольвоксов и гониумов, то очень важно
вированным материалом. Для
этого в баночки с 4% форма-
лином наливают воду с этими
видами жгутиковых, исходя из
расчета 2/3 формалина на 1/3 жид-
кости с вольвоксами. В фор-
малине вольвоксы и гониумы
прекрасно сохраняют свою фор-
му и зелёную окраску. Кон-
сервированный материал может
сохраняться годами и очень
удобен для демонстрации на
занятиях.
А. Гониум (Gonium pecto-
rale). На предметное стекло
помещают каплю с живыми или
консервированными гониумами
и рассматривают сначала при
малом увеличении. Колония
пластинку, состоящую из 16 клеток, причём 4 клетки располо-
жены в центре, а 12 — вокруг (по 3 с каждой стороны, рис. 31).
Колония довольно быстро плавает, покачиваясь и вращаясь.
В растворе Бенеке при длительном культивировании колонии
расщепляются на восьмиклеточные, четырёхклеточные и даже
одноклеточные. При пересеве на свежую среду такие однокле-
точные гониумы снова дают 16-клеточную колонию. Таким об-
разом, здесь мы можем представить себе как бы процесс воз-
никновения колонии.
Б. Вольвокс (Volvox aureus). Саман крупная и сложно
устроенная колониальная форма. Заметна и невооружённым
глазом в виде прозрачного шарика величиной с булавочную го-
ловку. (Местообитание и способ добывания см. часть первую,
I и V.)
Консервированных 4%-ным формалином вольвоксов рассмат-
ривают прямо в капле формалина под лупой и при малом увеличе-
нии микроскопа. Живых вольвоксов рассматривают в капле воды
также при малом увеличении и без покровного стекла. При этом
хорошо заметно медленное, катящееся движение колонии. Жгутики
при малом увеличении незаметны, но строение организма видно
, довольно ясно как на живом, так и на консервированном материале.
Отыскивают бесполых вегетативных особей, которые крупнее
половых и содержат в себе от 2 до 6 больших темнозелёных до-
черних шаров (рис. 4, 1а). В дочерних шарах в свою очередь
55
видны также выделяющиеся пятнышки — зачатки внучатых
особей.
Наряду с бесполыми особями очень часто встречаются и по-
ловые. Они несколько мельче бесполых. Одни содержат в себе
тёмные (почти чёрные) шарики — макрогаметы; это чаще встре-
чающиеся женские половые особи. Мужские особи содержат
мельчайшие микрогаметы. При малом увеличении мужские
Рис. 32. Вольвокс, при большом увеличении (из Беляева).
особи выглядят однородными. Для наблюдения при большом уве-
личении консервированных вольвоксов осторожно накрывают по-
кровным стеклом и рассматривают при суженной диафрагме. Тогда
поверхность шара кажется покрытой как бы частой сеткой (рис. 32).
Это соединённые друг с другом многочисленные отдельные клетки
вольвокса. В каждой клетке видно тёмное зелёное зёрнышко —
хроматофор. При затемнённой диафрагме можно отыскать и ядро.
Строение дочерних шаров представляется зернистым (мелкие
клетки).
56
Рпе. 33. Вольвоксы в ча-
совом стекле скопляются
у края, обращённого к
свету. Вид под лупой.
Пояснение в тексте,
(оригинал).
Бесполое размножение вольвокса протекает следующим об-
разом. Несколько клеток нижней половины шара начинают де-
литься и образуют пластинки из группы клеток. В дальней-
шем эти пластинки загибаются и, свертываясь своими краями,
образуют дочерние шары. При непрекращающемся делении
клеток эти шары растут, и в них также происходит образование
зачатков внучатых шаров. Достигнув предельного роста, дочерние
шары начинают энергично двигаться, прорывают материнскую
оболочку и начинают плавать и размно-
жаться самостоятельно.
При половом размножении микрога-
меты, покинув мужскую половую особь,
окружают женскую половую особь и, про-
никнув в неё, сливаются с макрогаметами.
В результате образуется зигота, покры-
вающаяся толстой оболочкой. Шар воль-
вокса в дальнейшем распадается и отми-
рает, а из зигот (которые способны пере-
зимовывать) возникают новые шары —
вольвоксы.
Вольвокса можно рассматривать как
пример переходной формы между одно-
клеточными и многоклеточными организ-
мами.
5. Влияние света на организм жгути-
ковых. Положительный фототаксис.Жгу-
тиковые подобно растениям способны ус-
ваивать углекислый газ, растворённый в
воде. Поэтому они так же, как и расте-
ния, нуждаются в свете и всегда устрем-
ляются к нему. Это можно продемон-
стрировать на следующем простом опыте.
В часовое стекло наливают жидкости с
большим количеством живых вольвоксов.
Поместив стекло недалеко от окна, заме-
чаем (под лупой и даже невооруженным
глазом), как вольвоксы скопляются у
края, обращённого к окну (рис. 33, 1).
Повернув стекло на 180° (рис. 33, 2), уви-
дим, как вольвоксы снова медленно переплывут к светлому краю
(рис. 33, 3).
Если теперь сзади зажечь электрическую лампу, то вольвоксы
направляются к более яркому электрическому свету. Потушив
лампу, увидим, как вольвоксы опять поплывут к окну. Словом,
всё время вольвоксы устремляются к наиболее освещённому
участку жидкости. Не только вольвоксы, но и все зелёные жгу-
тиковые (эвглены, факус) всегда скопляются на наиболее осве-
щённом участке культуры.
57
Жгутиковые организмы наряду с растительным способом пи-
тания могут поглощать и органические вещества, т. е. питаться
так же, как и животные.
Для демонстрации этого помещают культуру с эвгленами в
темноту. Через 7—10 дней увидим, что у эвглен значительно
ослабилась зелёная окраска, а у некоторых совсем исчезла. За
это время эвглены питались органическими веществами и поэтому
частично или полностью утратили ненужные при данных усло-
виях хлорофилловые зёрна.
Если культуру, бывшую в темноте, поставить на свет, то эвглены
снова позеленеют и перейдут на свой обычный растительный
способ питания.
IV. ПРОСТЕЙШИЕ — ПАРАЗИТЫ И КОММЕНСАЛИСТЫ1
1**. Амёбы из полости рта человека (Entamoeba gingivalis).
У человека на беловатом налёте кариозных зубов и дёсен встре-
чается мелкая амёба Entamoeba gingivalis. Для её наблюдения
надо просмотреть большое количество препаратов, так как сразу
найти амёбу очень трудно и, кроме того, у одного и того же че-
ловека она не всегда появля-
ется в большом количестве.
Гладкой деревянной па-
лочкой или спичкой соска-
бливают зубную слизь с ка-
риозного зуба и снаружи
под десной. Слизь помещают
на предметное стекло, смачи-
вают маленькой каплей слю-
Рис. 34. Амёба (Entamoeba gingivalis) НЫ’ накрывают ПОКрОВНЫМ
из полости рта человека. Большое уве- стеклом И рассматривают С
лпчение (по Гартманну). самым сильным увеличением
при затемнённой диафрагме.
Среди бактерий, лейкоцитов и эпителиальных клеток отыски-
вают амёб, которых узнают по коротким мешковидным псевдо-
подиям, довольно быстро возникающим и исчезающим (рис. 34).
Размер амёбы очень мал (25—30 /л). Светлая эктоплазма резко от-
личается от тёмной эндоплазмы. Последняя заполнена большим
количеством пищевых частиц (главным образом лейкоцитов).
Движение амёбы многообразно; часто выделяется одна большая
псевдоподия. Сократительной вакуоли нет. Ядра не видно — оно
заслонено пищевыми частицами.
1 Паразиты не только питаются за счёт хозяина, но и наносят ему безуслов-
ный вред, разрушая ткани и отравляя его ядами. Комменсалисты же отно-
сятся к безвредным сожителям, извлекающим известную пользу от хозяина
(питаясь, например, неиспользуемыми хозяином питательными веществами).
58
Эта амёба была открыта в 1849 г. врачом Гросом в Москве
при исследовании им бактерий полости рта. Амёба встречается
приблизительно у 60 % людей. Для человека она безвредна,
и потому её можно считать не паразитом, а комменсалистом.
2*. Грегарины моноцистис (Monocystis) из семенных пузырь-
ков земляного червя. Крупного дождевого червя вскрывают
в препаровальной ванночке или на дощечке. Разрез производится
ножницами по спинной стороне от середины тела к переднему
концу. Раздвигают боковые стенки и закрепляют их булавками.
На участках 10-го, 11-го и 12-го сегментов находят три пары
бело-жёлтых семенных пузырьков, лежащих по бокам кишечника
Рис. 35. Вскрытый дождевой червь.
Пунктиром показаны семенные пузырьки
(СП), где живут грегаряпы.
Рис. 36. Грегарина моноцистис
из семенного пузырька дожде-
вого червя (по Гартманну).
А — свободные грегарины в началь-
ной стадии инцистировапия; Б —
циста.
f (рис. 35, С/7). Пинцетом или иглой отрывают кусочек пузырька
' и помещают на предметное стекло в каплю физиологического
раствора (1 %-ный раствор поваренной солп). Накрывают по-
кровным стеклом и наблюдают при малом увеличении.
Хорошо заметны округлые цисты грегарин моноцистис на
разных стадиях развития. Попадаются и свободные особи в виде
: Удлинённых телец с ядром в передней части. Грегарины со всех
сторон окружены сперматозоидами червя и поэтому кажутся
«мохнатыми». Расчленение на прото- и дейтомерит отсутствует,
что считается главным признаком рода Monocystis. В препарате
’ встречаются также грегарины, склеенные друг с другом по две.
Это начальная стадия инцистирования (рис. 36).
В семенных пузырьках дождевого червя встречаются иногда
и другие грегарины — нематоцистис. По размеру они раз в семь
59
превышают моноцистис, достигая Зим в длину. Хорошо видно
их червеобразное движение. По окраске они беловато-серые.
Ядра не видно. Так же, как и у моноцистис, у них нет расч-
ленения на прото- и дейтомерит.
Рис. 37. Грега-
рина (Gregarina
cuneata) из ки-
шечника мучно-
го червя (по
Гартманну).
3. Грегарины из кишечника мучного червя.
Для наблюдения высших форм грегарин (Polycy-
stidae), т. е. таких, у которых тело расчленено на
эпимерит, протомерит и дейтомерит, следует вос-
пользоваться мучным червем1. В 80% случаев у
этого червя в кишечнике встречаются грегарины
(Gregarina cuneata, Gregarina polymorpha и неко-
торые другие).
Червя вскрывают со спинной стороны и выде;
ляют участки кишечника. Можно и просто от-
резать у червя голову и задний участок и'Затем
пинцетом вытащить кишечник сзади. Содер-.
жимое кишечника выдавливают на предметное
стекло и, смочив каплей воды, рассматривают
при малом увеличении. Удлинённые тельца гре-
гарин либо одиночны, либо соединяются попар-
но друг с другом (так называемая сизигия). Ясно
заметно расчленение тела на прото- и дейтомерит
(рис. 37).
Грегарины относятся к классу споровиков, жи-
вут в полости тела и кишечника беспозвоночных,
а в начальных стадиях своего развития (споро-
зоиты) — в клетках.
В эктоплазме на границе с эндоплазмой у гре-
гарин расположены сократительные волокна —
мионемы; благодаря волнообразному их сокра-
щению происходит передвижение грегарин. Кроме
того, движение связано с выделением на заднем конце затверде-
вающего столбика слизи.
4**. Кокцидии (Eimeria stiedae) у кролика. У кроликов часто
наблюдается заболевание кишечника и печени, вызванное па-
разитическими простейшими — кокцидиями.
Кролики, заболевшие кокцидиозом, худеют, страдают поно-
сом, становятся вялыми и при сильной инфекции гибнут в те-
чение нескольких дней. Кроме этих наружных признаков, болезнь
определяют по присутствию в кале ооцист кокцидий. Для это-
го несколько катышков свежего кала разбалтывают в пробирке
с насыщенным раствором поваренной соли, где ооцисты всплы-
вают на поверхность. Через 15—20 мин. пипеткой берут каплю
1 Мучной червь — ато личинка мучного жука Tenebrio molitor. Мучных
червей можно достать в зоомагазине или в мучном складе. Их следует держать
в баночке с отрубями. Баночку завязать марлей.
60
с поверхности жидкости и рассматривают её при малом Увели-
S' чении микроскопа и в положительном случае находят овальные
". ооцисты (рис. 38, 1).
? Накрыв препарат покровным стеклом, рассматривают ооцисты
; при большом увеличении (рис. 38, 2—5). Видна плотная тёмная
Рис. 38. Ооцисты кокцидий: 1 - при малом и 2-5 при большом увеличении
(из Беляева и Гартманна).
Рпс. 39. Вскрытый чёрный таракан (схематично).
<$ - самец, $ - самка.
оболочка. Содержимое ооцисты собрано большей частью в округ-
лую массу. В некоторых ооцистах эта масса начинает распа-
даться или же распалась на отдельные округлые или овальные
образования. Это образование споробластов и спорозоитов.
Кокцидии заражают не только кишечник, но и печень хозяина.
Кокцидии разрушают клетки заражённых органов; и так как
61
они очень быстро размножаются, то представляют серьёзную
опасность для животного. Поэтому кокцидии считаются настоя-
щими паразитами.
Борьба с кокцидиозом сводится главным образом к уничтоже-
нию ооцист, так как они представляют собой единственный источ-
ник заражения. Наилучший способ — обваривание кипятком по-
мещения, где содержатся кролики, тщательное его высушивание
и прожигание металлических частей паяльной лампой.
Некоторые виды кокцидий вызывают серьёзное заболевание
крупного рогатого скота, овец, коз, домашних птиц. Описаны
кокцидии и у диких животных.
5. Инфузории, амёбы, грегарины и жгутиковые из кишечника
чёрного таракана. Чёрный таракан служит одним из самых
типичных объектов для демонстрации паразитизма, так'как в
кишечнике хозяина встречается, по данным Засухина, до 23 Ьидов
паразитических простейших.
Таракана (лучше самку1, которую узнают по коротким, слабо
развитым крыльям) усыпляют эфиром и вскрывают (рис. 39).
Отыскивают заднюю и среднюю кишки, которые, кроме своего
расположения, отмечаются и окраской; задняя тёмная, а средняя
беловато-жёлтая, почти прозрачная. Кусочек кишки отрезают
ножницами или ланцетом и помещают в часовое (или на предмет-
ное) стекло с несколькими каплями воды или физиологического
раствора (0,8 %-ный раствор поваренной соли). Кусочек рас-
щипывают иглами или просто выдавливают егр содержимое. Рас-
сматривают сначала при малом увеличении без покровного стекла.
Затем, удалив крупные части, покрывают покровным и смотрят
при большом увеличении.
Громадное большинство простейших обитает в задней кишке
и только грегарины живут в средней.
А. Инфузория никтотерус (Nyctotherus ovalis), живущая в
задней кишке, встречается почти у каждого таракана и в большом
количестве. Её легко узнать по оживлённому движению и срав-
нительно крупной величине (250 /х, т. е. примерно с парамецию).
Форма тела яйцевидная. Окраска тёмносерая (рис. 40).
В самом заднем участке кишечника таракана, близ задне-
проходного отверстия, можно найти округлые и овальные цисты
никтотеруса (рис. 40). Цисты покрыты толстой оболочкой и
примерно в 2—3 раза меньше подвижной особи.
Никтотерус относится к разноресничным инфузориям (Hetero-
tricha). Его нельзя назвать паразитом, так как даже массовое
развитие инфузорий безвредно для таракана. Питается ник-
тотерус мелкими частицами содержимого кишечника.
1 Самки всегда заражены паразитами значительно сильнее, чем самцы, что
зависит от большей объёмистости кишечника, большей влажности и рыхлости
его содержимого у самки.
62
Рис. 40. Никтотерус (Nyctotherus ovalis) из кишечника чёрного
таракана, при малом и большом увеличении.
? Заражение происходит при заглатывании тараканом цист,
^Которые вместе с экскрементами выходят из заражённого живот-
ного.
Б*. Амёба. В задней кишке встречается иногда довольно
Крупная амёба (Entamoeba blattae), хорошо заметная и при ма-
63
лом увеличении (рис. 41, А). Размер её, примерно с амёбу про-
теус. Первые 2—5 мин. амёбы большей частью лежат неподвижно
округлыми комочками. Движение своеобразное и непохожее на
других амёб. Появляющиеся короткие псевдоподии как бы об-
текают тело амёбы, и таким образом создаётся впечатление круго-
вого движения. В теле амёбы заметны токи протоплазмы, идущие
в разных направлениях. В эндоплазме хорошо видны одно или
несколько округлых ядер.
Рис. 41. Простейшие из кишечника чёрного таракана (по Засухину).
А — амёба (Entamoeba blattae), при среднем увеличении; — жгутиковые, при большом
увеличении; В — бактерии, при очень сильном увеличении; Г — грегарина (Greganna
blattarum), при малом увеличении.
В. Грегарины (Gregarina blattarum) попадаются сравнительно
редко и только в средней кишке. При вскрытии кишки они выпа-
дают в виде удлинённых беловатых телец, заметных даже нево-
оружённым глазом. При малом увеличении ясно видно расчле-
нение на прото- и дейтомерит1. Эндоплазма тёмная и зернистая.
В дейтомерите просвечивает округлое ядро. Довольно часто попа-
даются две грегарины, соединённые цепочкой одна за другой (так
называемые сизигии) (рис. 41, Г).
Г. В средней кишке часто массами обитают различные жгу-
тиковые и бактерии (рис. 41, Б и В). Они очень мелки и их
следует наблюдать при очень большом увеличении с покровным
стеклом.
1 У молодых особей виден и эпимерит.
64
6. Инфузории из кишечника лягушки. В заднем участке
кишечника лягушки всегда обитает масса крупных инфузорий —
опалин (Opalina ranarum), которые могут служить прекрасным ма-
териалом для средней школы. Этот материал очень важен для
учителя, так как позволяет в любое время года иметь массовый и
удобный материал для демонстрации живых инфузорий, осо-
Рис. 42. Вскрытая лягушка (из Цузмера). Пункти-
ром указаны задняя кишка и клоака, где обитают
инфузории-опалины.
' бенно в тех случаях, когда отсутствуют искусственные и сырые
культуры каких-либо простейших.
’ Лягушку усыпляют эфиром или перерезают шейные позвонки
; и разрушают спинной мозг, вводя препаровальную иглу в спин-
номозговой канал. Можно поступить и проще. Взяв лягушку
за задние ноги и держа брюхом кверху, сильно и быстро ударяют
б Цингер
головой о выступ стола. Затем лягушку вскрывают с брюшной
стороны и вырезают самый задний участок кишечника —
прямую, кишку вместе с клоакой (рис. 42). Содержимое
кусочка выдавливают в часовом стекле с несколькими каплями
воды или физиологического раствора1. Демонстрируют либо
непосредственно в стекле, либо, захватив пинцетом смятый кишеч-
ник, прикладывают его к предметным стеклам. В получившихся
каплях всегда будет большое количество опалин. Опалины —
крупные инфузории (до 1 мм), а потому хорошо видны под лупой
и легко заметны невооружённым глазом. Под микроскопом их
рассматривают при малом увеличении без покровного стекла
(рис. 43).
Сильно уплощенное тело опалин овально, несколько сужено
с переднего конца и закруглено с заднего. Окраска беловато-
серая. Различной величины инфузории медленно проплывает це-
лой кучкой перед глазами наблюдателя, натыкаясь и наползая
друг на друга.
При затемнённой диафрагме очень хорошо видны длинные
тонкие реснички, равномерно покрывающие края тела. Реснички
всё время в движении. Группы их сгибаются и выпрямляются,
создавая впечатление легкого волнообразного движения, прохо-
дящего по краю тела.
Поверхность тела опалин исчерчена продольными штрихами.
Эти штрихи представляют собой места прикрепления ресничек,
проходящих по всему телу. В мелкозернистой протоплазме
опалин можно увидеть слабо выделяющиеся многочисленные
округлые ядра.
При внимательном наблюдении кучки опалин иногда можно
увидеть делящихся особей (рис. 43, А). Деление происходит не стро-
го поперечно, а несколько наискось. Опалины в часовом стекле
с водой вне тела хозяина могут жить 1—2 часа, а в том же стекле
с физиологическим раствором значительно дольше (до 24 часов).
Опалины резко отличаются от всех остальных инфузорий тем,
что ядра их однородны и не диференцированы на макро- и микро-
нуклеус. Кроме того, инфузории лишены рта, и пища осмоти-
чески всасывается всем телом (рис. 43). По этим признакам опа-
лин относят к наиболее примитивным инфузориям и объединяют
в особый подкласс протоцилиат (Protociliata). Наряду с опали-
нами иногда попадаются другие инфузории (рис. 43, Н) — никто-
терус (Nyctotherus cordiformis) (рис. 43, Н) и балантидий (Ba-
lantidium entozoon). Обе они меньше опалин, двигаются значи-
тельно быстрее и по своему строению относятся к высшим ин-
фузориям: у обоих имеются ротовое отверстие и перистом (ротовая
ямка), усаженные длинными ресничками. Ядерный аппарт их
также состоит из макро- и микронуклеуса.
1 Наиболее благоприятна концентрация 0,8%.
66
Рис. 43. Опалина (Opalina ranarum-O.) и никтотерус (Nyctothenis oordiformis-H.)
из задней кишки и клоаки лягушки, при малом (Л) и большом (Б) увеличении.
В круге одна инфузория в стадии деления.
б*
67
1. Инфузории из желудка жвачных. При убое скота учитель
может добыть очень интересный материал по инфузориям, обитаю-
щим в несметном количестве в желудке быка, овцы и козы; на
1 куб. см желудочной кашицы приходится до 1 млн. инфузорий.
Техника сбора проста. Взрезают передний отдел желудка
(так называемый рубец, или сетку) только что убитого животного.
Рио. 44. Инфузории из желудка быка и
овцы, при большом увеличении (по До-
гелю).
1 — энтодиниум (Entodinium caudatum); 2 — ано-
плодипиум (Anoplodinium denticulatum), 3 — дип-
лодиниум (Diplodinium multivesiculatum); 4 — оф-
риосколекс (Ophryoscolex purkynjei).
Затем рукой захватывают
горсть зелёной кашицы со-
держимого желудка и выжи-
мают в стакан или пробирку.
При этом крупные частицы
кашицы остаются в руке, а
мелкие вместе с инфузориями
попадают в пробирку.
Для заготовки консервиро-
ванного материала в банючку
наливают сначала 4% фор-
малина и уже туда выжи-
мают инфузорий. Формалина
должно быть приблизительно
втрое больше, чем кашицы
с инфузориями. Баночки
плотно закупоривают проб-
ками. Консервированный ма-
териал может сохраняться
много месяцев.
Живых инфузорий следует
рассматривать тотчас же, так
как вне тела хозяина ин-
фузории погибают уже через
несколько часов. Инфузории
гибнут из-за низкой темпе-
ратуры.
Для того чтобы задержать
несколько гибель инфузорий,
рекомендуется время от вре-
мени слегка подогревать пре-
парат с живым материалом
над пламенем спиртовой горелки. При этом сразу можно увидеть,
как замирающие инфузории снова начинают оживлённо дви-
гаться. Естественная температура для них 37°, т. е. температура
их хозяина.
При рассматривании под микроскопом и лупой сейчас же за-
мечают массу мелких быстро плавающих инфузорий.
Консервированный материал рассматривают прямо в капле
формалина или приготовляют окрашенный препарат (см. часть
третью, II).
68
Общее количество видов, встречающихся в желудке быка,
очень велико — свыше 60. У овцы — свыше 30. Упомянем о наи-
более часто встречающихся инфузориях (рис. 44).
1. Энтодиниум (Entodinium caudatum). Тело широкое и ко-
роткое. Размер 45 ц. Задний конец продолжается в три выроста.
Очень часто встречается в желудке быка, овцы и козы.
2. Аноплодиниум (Anoplodinium denticulatum). Размер 64 ц.
На заднем конце шесть шипов, длина которых доходит до 2/3 длины
тела. Часто встречается в желудке быка.
3. Диплодиниум (Diplodinium multivesiculatum). Тело про-
долговато-овальное, задний конец закруглён. Размер 160 ц. Встре-
чается очень часто в желудке быка, овцы и козы.
4. Офриоск олекс (Ophryoscolex purkynjei). Тело бочковид-
ное с усечённым передним концом. Размер 185 ц. Задний конец
снабжён тремя венчиками шипов. Часто встречается в желудке
быка.
Офриосколециды населяют тот передний отдел желудка хо-
зяина, где господствует щелочная реакция. При переходе в кишку
инфузории сразу исчезают, что можно объяснить тем, что в кишке
реакция меняется на кислотную.
Питаются инфузории клетчаткой. Некоторые из них — хищ-
ники и заглатывают других живущих здесь инфузорий.
У телят и ягнят, пока они питаются молоком матери, инфу-
зории отсутствуют. Но они сейчас же появляются при переходе
молодняка на растительный корм. Заражение происходит, по
исследованиям Полянского и Стрелкова, путём заглатывания
активных инфузорий, попадающих в корм со слюной из заражён-
ных животных. Цисты пока не обнаружены.
Всех офриосколецид следует рассматривать как симбионтов,
так как они не наносят никакого вреда своим хозяевам. Ленин-
градский зоолог проф. В. А. Догель считает, что инфузории оказы-
вают даже некоторую «услугу» хозяину, с одной стороны, тем, что
способствуют измельчению растительных частиц, а с другой — тем,
что, попадая в кишку и там погибая, служат дополнительным
источником питания своему хозяину.
Часть третья
МИКРОСКОПИЧЕСКАЯ ТЕХНИКА
I. МИКРОСКОП И ПРАВИЛА РАБОТЫ С НИМ
Для работы с простейшими необходимо уменье правильно
пользоваться микроскопом. Нужно научиться быстро устанавли-
вать зеркальце, наводить на фокус при помощи макро- и микро-
метрического винтов, суживать и расширять в зависимости от
прозрачности объекта диафрагму, знать силу увеличения объ-
ективов и окуляров и т. д.
Все эти навыки микроскопист приобретает главным образом из
личной практики. Чем чаще преподаватель и юные натуралисты
в своей работе будут иметь дело с микроскопом, тем скорее и
прочнее накопятся навыки микроскопирования. Они лишь вначале
кажутся сложными и трудными. С течением времени эти навыки
соблюдаются работающим автоматически, отнимая минимальное
количество времени.
В этой главе я кратко сообщаю и напоминаю читателю све-
дения о микроскопе и работе с ним.
В царское время в России не было отечественных микроскопов;
они ввозились из-за границы. Теперь у нас налажено произ-
водство своих, высококачественных советских микроскопов. Вы-
пускаются микроскопы трёх видов: упрощенные системы, так
называемые школьные., одногнёздные без микрометрического вин-
та; затем более сложные, так называемые студенческие, с револь-
вером (см. ниже), микрометрическим винтом и двусторонним
зеркальцем и, наконец, ещё более сложные для научно-исследо-
вательской работы.
Микроскопы служат не только для изучения объектов живой
природы (микроорганизмов, клеток и тканей), но имеются специаль-
ные микроскопы для тонкого исследования металлов, горных
пород и т. п.
1. Устройство микроскопа. Микроскоп состоит из следующих
частей (рис. 45).
Штатив — неподвижная, массивная часть микроскопа с раз-
двоенной ножкой. Штатив служит опорой для всего инструмента.
К нему привинчены или прикреплены все остальные части, а
именно:
70
Предметный столик — квадратная или округлая пластинка,
на которую помещается стекло с исследуемым объектом. В се-
редине столика находится отверстие, через которое проходит
свет, отражаемый зеркальцем и освещающий объект. Кроме того,
на столике имеются две гибкие металлические пластинки-клеммы,
А Б
Рио. 45. Микроскопы (из Кременецкого).
А — простой, школьный: 1 — зеркало; 2 — предметный столик; 3 — клем-
ма; 4 — объектив; 5 — тубус; 6 — окуляр; 7 — микрометрический винт,
Б — сложного устройства: 1 — ручка диафрагмы «ирис»; 2 — подвиж-
ной предметный столик; 3 — револьвер с тремя объективами; 4 — оку-
ляр; 5 — кремальера или макрометрический винт; 6 — микрометриче-
ский винт; 7 — иожка; 8 — осветитель АЬЬё; 9 — винт для поднимания
и опускания осветителя; 10 — клемма; 11 — обойма для синего стекла;
12 — винт для передвижения столика.
которыми можно закрепить неподвижно стекло с рассматриваемым
объектом.
В сложных микроскопах столик может вращаться при помощи
бокового винта.
Зеркальце находится внизу, у ножек микроскопа. Оно при-
креплено подвижно на шарнирах и его можно свободно вращать
во все стороны для улавливания света. В простых микроскопах
71
имеется только одно вогнутое зеркальце, а в сложных оно двусто-
роннее: плоское и вогнутое. Плоское зеркальце обычно употреб-
ляется при дневном свете, а вогнутое — при искусственном
(электрическая или керосиновая лампа).
Диафрагма помещается непосредственно под отверстием сто-
лика. Её назначение состоит в регулировании света, попадающе-
го на рассматриваемый объект. Расширяя или суживая диафраг-
му, мы тем самым увеличиваем или уменьшаем количество света,
попадающего на объект. Чем мельче и прозрачнее объект (амёбы,
жгутиковые), тем меньше света нужно для того, чтобы яснее
увидеть этот объект и поэтому тем уже должно быть отверстие
диафрагмы. И наоборот, чем крупнее и темнее объект (инфузо-
рии), тем больше нужно света и тем шире должна быть открыта
дифрагма.
Диафрагмы бывают различной конструкции. Плоская диа-
фрагма — круглая пластинка, по краю которой расположены отвер-
стия различного диаметра. Вращая такую пластинку, мы тем
самым подводим под отверстие столика то узкое, то широкое от-
верстие диафрагмы. Цилиндрическая диафрагма состоит из на-
бора колпачков с отверстиями различного диаметра. Колпачок
вставляется в гильзу, находящуюся под отверстием столика.
Ирисовая диафрагма состоит из нескольких подвижных металли-
ческих пластинок, заключённых в общую оправу. Передвигая
кнопку, находящуюся сбоку диафрагмы, вперёд или назад, мы
сближаем иЛи раздвигаем пластинки и тем самым получаем от-
верстие любого диаметра.
Ирисовая диафрагма наиболее удобна и совершенна. В слож-
ных микроскопах над ирисовой диафрагмой находится ещё так
называемый осветитель Аббе, состоящий из крупных линз, ко-
торые собирают в точке наблюдения (в отверстии столика) от-
брасываемые зеркальцем лучи.
Тубус, или трубка микроскопа, лежит в выемке верхней
части штатива — его колонке. Тубус в сложных микроскопах
поднимается и опускается при помощи двойного колесика —
кремальеры, или макрометрического винта. Этот макрометри-
ческий винт служит для грубой наводки на фокус при работе с
малым и средним увеличением.
В большинстве упрощенных школьных микроскопов имеется
только кремальера и поэтому здесь возможна лишь приблизительная
наводка для работы с малым или средним увеличением. В сложных
же системах возможна очень тонкая наводка на фокус, благодаря
микрометрическому винту, который помещается ниже макрометри-
ческого. Повороты микрометрического винта позволяют поднимать
и опускать тубус на очень незначительную величину — на милли-
метры и доли миллиметра. Микрометрический винт употребляют
главным образом при наблюдении с большим увеличением.
Окуляры и объективы — самые важные и самые ценные
части микроскопа, с которыми нужно обращаться очень осторожно
72
и бережно. В них заключены линзы, производящие увеличение
объекта. Окуляр вставляется в верхний конец ‘тубуса, и в него
смотрят, а объектив привинчивается к нижнему концу тубуса и
обращён непосредственно к исследуемому объекту.
В простых школьных микроскопах только одно гнездо для объек-
тива. Чтобы переменить объектив, нужно отвинтить его и при-
винтить на его место другой. В сложных микроскопах имеется
специальное приспособление, так называемый револьвер (двух-
или трёхгнёздный), на который сразу навинчиваются два или
три объектива. Простым поворотом револьвера мы сразу можем
заменить малое увеличение на большое, не вывинчивая объективов.
Окуляры сами по себе увеличивают немного (в 7, 10, 15 раз).
Цифры увеличения обозначены на верхнем конце (X 7, х 10,
X 15). Главное увеличение зависит от объектива, который увели-
чивает значительно больше. Микроскопы выпуска 1938 г. снаб-
жены тремя объективами, увеличивающими в 8, 40 и 90 раз. Эти
цифры выгравированы на оправе каждого объектива. Общее
увеличение в микроскопе зависит от совместной увеличивающей
силы объектива и окуляра. Если объектив, скажем, увеличивает
в 40 раз, а окуляр в 7 раз, то общее увеличение объекта будет
в 280 раз. Увеличительная сила комбинаций тех или иных объек-
тивов и окуляров указывается в табличке, приложенной к
каждому микроскопу. Для практики важно запомнить, что чем
меньше диаметр линзы объектива, тем больше его увеличиваю-
щая сила, и наоборот.
Для начальной работы с микроскопом нужно выбрать окуляр
слабой или средней силы (х 7 и X 10) и два объектива: один
для малого (х 8)* другой для большого увеличения (х 40). Для
наблюдений и опытов с простейшими достаточно малое уве-
личение— в 80—100 раз и большое — до 100 раз.
Для практики нужно напомнить, что изображение предмета
под микроскопом будет обратным, т. е. то, что лежит на самом
деле направо, под микроскопом будет казаться находящимся нале-
во; то, что мы видим сверху, помещается на самом деле внизу. По-
этому, например, когда мы хотим передвинуть рассматриваемых
инфузорий вправо, стекло нужно передвинуть влево и наоборот.
Это обстоятельство вначале путает работающего, но с течением
времени к правильному передвижению стекла приобретается бессо-
знательная привычка.
2. Работа с микроскопом. Протерев мягкой тряпочкой окуляр,
объектив и зеркальце, микроскоп ставят у источника света.
Наилучший источник света — дневной свет при облачном небе.
Следует избегать прямых солнечных лучей, так как этот свет
слишком ярок и опасен для зрения, особенно при работе с малым
увеличением. Поэтому в солнечный день окно нужно завешивать
белой шторой или занавеской. В вечерние часы употребляют
искусственный свет, электрическую лампочку с рефлектором или
керосиновую лампу с колпаком. Сила света должна быть при-
дя
мерно 50 свечей. При работе с очень большим увеличением упо-
требляют матовую электрическую лампу силой 100 свечей.
Расстояние источника света от зеркальца должно быть при-
мерно х/4 м.
Поставив самое малое увеличение и самую широкую диафрагму
и приблизив тубус примерно на 2 см к столику, начинают пере-
мещать зеркальце так, чтобы, смотря в окуляр, увидеть совер-
шенно равномерный яркий, белый круг при дневном свете и желто-
ватый-при искусственном. Делают ещё несколько лёгких перемен
шений зеркальца с тем, чтобы убедиться, что данное освещение
наиболее яркое и равномерное. Улавливание света кажется вна-
чале трудным и длительным. Поэтому начинающим нужно спе-
циально заняться этим, перед тем как перейти к наблюдению.
Поставив малое увеличение и приподняв тубус на 2—3 см,
помещают на столик исследуемый объект, скажем, каплю с инфу-
зориями. Каплю помещают как раз в освещённом отверстии
столика и диафрагмы. Затем, не отнимая глаза от окуляра, начи-
нают медленно опускать тубус макрометрическим винтом и, как
только увидят очертание инфузорий или дрожащие частички в
воде, сейчас же ещё медленнее опускают или приподнимают ту-
бус, останавливаясь на наиболее отчётливом и ясном изображении.
При наблюдении живых объектов приходится время от времени
слегка передвигать предметное стекло, отыскивая уплывающих из
поля зрения простейших.
Рассматривание объекта нужно обязательно начинать с малого
увеличения. Это замечание особенно относится к начинающим,
которые очень часто стараются использовать самое большое увели-
чение, имеющееся при микроскопе, и испытывают при этом из-
лишние трудности и разочарование. Нужно помнить, что при
большом увеличении труднее навести на фокус, поле зрения
мало и ясность изображения меньше. Кроме того, при этом
приходится очень приближать объектив к исследуемому пред-
мету, отсюда опасность раздавить препарат и испортить линзу.
Большое увеличение употребляют главным образом для рассма-
тривания деталей строения организма - ресничек, жгутиков, ва-
куоль ит.п. Узнать же простейшее, рассмотреть общее его строение,
форму и движение, поставить те или иные опыты вполне возмож-
но, довольствуясь малым увеличением.
Для смены малого увеличения на большое тубус снова при-
поднимают, меняют объектив (либо ввинчивая новый, либо дей-
ствуя револьвером), накладывают вЬ каплю покровное стекло и
медленно начинают опускать тубус макрометрическим винтом.
Как только показались неясные очертания объекта, оставляют
макрометрический винт и действуют только микрометрическим.
Последний слегка вращают в ту или другую сторону во все время
наблюдения, так как только тогда можно хорошо рассмотреть
все детали строения. При демонстрации нужно дать возможность
каждому пользоваться микрометрическим винтом, с тем чтобы
74
каждый мог увидеть ясное изображение объекта в зависимости от
индивидуальных свойств своего глаза.
' Относительно диафрагмирования сказано выше. Напомним
лишь, что узкая диафрагма употребляется при рассматривании
прозрачных и очень мелких объектов, а также тонких деталей
их строения. Для начальных работ при отсутствии ирисовой диа-
фрагмы нужно употреблять диафрагму с отверстием среднего
диаметра.
При работе: микроскопом, особенно при длительных наблю-
дениях, нужно выработать в себе привычку смотреть в окуляр по
очереди то правым, то левым глазом и, кроме того, не прищури-
вать свободный глаз. Соблюдение этих правил способствует рав-
номерной нагрузке обоих глаз и устраняет их быструю утомляе-
мость.
Всякое наблюдение в микроскоп будет более полным и ценным
при зарисовке объекта. Рисунок, хотя бы схематичный и несо-
вершенный, значительно облегчает наблюдение и уясняет от-
дельные детали строения организма. Поэтому при классной и
кружковой работе следует настоятельно рекомендовать зарисовы-
вание наблюдаемых простейших. Рисовать нужно мягким, остро
отточенным карандашом. Хорошие рисунки можно затем обвести
тушью.
3. Уход за микроскопом. Микроскоп, как и всякий точный
инструмент, требует бережного ухода. Его нужно предохранять
от сырости, в нерабочее время держать в ящике или под стек-
лянным колпаком, вытирать мягкой, сухой тряпочкой до и после
работы. В особенности тщательно нужно протирать объективы,
окуляры и зеркаЛьце, соблюдая при этом большую осторожность,
чтобы не попортить эти самые ценные части. Через запотевшие и
запыленные линзы объект кажется мутным и неясным.
Если на объектив попадёт какое-нибудь липкое вещество, то
его смывают тряпочкой, смоченной бензином. Так как при работе,
от дыхания работающего, на тубус и окуляр осаждается влага,
то очень полезно надеть на шейку окуляра кусочек бумаги или
клеёнки.
Следует предостеречь от попыток самому разбирать микро-
скоп. При этом можно попортить мягкие нарезы винтов, поцара-
пать нежные линзы объективов и окуляров. Кроме того, значи-
тельно труднее правильно соединить разобранные части, чем
разъединить их
Из правила бережного обращения с микроскопом вовсе не
следует, что его нужно «бояться» и что к нему нельзя допускать
школьников и кружковцев. Напротив, микроскоп может и должен
иметь максимальную нагрузку в школе. Его вполне можно
давать и для самостоятельных работ школьникам при кружко-
вых занятиях. Важно лишь помнить, что микроскоп — инструмент
точный и нежный и поэтому требует внимательного и бережного
ухода.
75
П**. ИЗГОТОВЛЕНИЕ МИКРОСКОПИЧЕСКИХ
ПРЕПАРАТОВ ПО ПРОСТЕЙШИМ
Изготовление микроскопических препаратов представляет труд-
ную задачу, в которой на первых порах неизбежны ошибки и
неудачи. Однако наличие хотя бы маленькой коллекции препа-
ратов на канадском бальзаме значительно дополнит демонстра-
ционную часть на живых объектах. Кроме того, эта работа может
быть полезной для кружковых занятий, так как здесь приоб-
ретаются навыки к аккуратной и тонкой технике микроскопиро-
вания.
Заранее приготовляют следующее:
1) Цилиндрические плоскодонные стаканчики с пробками (вы-
сота 30 мм, диаметр 20 мм), в которые наливают на 2/3: а) рас-
твор иода на 70°-ном спирту цвета крепкого чая — 1 стаканчик;
б) 70°-ный спирт -2 стаканчика; в) 96°-ный спирт — 1 стаканчик;
г) дестиллированную воду — 1 стаканчик; д) раствор краски ге-
малаун или кармин (приготовление см. ниже, раздел III, «Оборудо-
вание», 23) — 1 стаканчик; е) % объёма 96°-ного спирта-)- % объёма
бергамотового масла — 1 стаканчик; ж) бергамотовое масло —
1 стаканчик; з) ксилол или толуол — 1 стаканчик;
2) часовые стёкла — 5—10 шт.;
3) канадский бальзам;
4) предметные и покровные стёкла, тщательно протёртые мягкой
тряпочкой;
5) сулему-спирт (жидкость Шаудинна) (приготовление см. ниже,
раздел III «Оборудование», 13);
6) фильтровальную бумагу, пинцет, мягкую белую тряпочку
или полотенце;
7) несколько тонко оттянутых пипеток (см. ниже, раздел III, 4).
Лучше всего для каждого реактива завести свою пипетку. Обяза-
тельно должна быть отдельная пипетка для живого материала;
8) богато населенную сырую культуру простейших из природ-
ного водоёма или пробирку с парамециями (и другими инфузо-
риями).
Первый способ. Осторожно кладут покровные стёкла раз-
мером 18 х 18 мм на поверхность культуры. При этом различные
инфузории, жгутиковые и амёбы накапливаются снизу на стекле.
Через 10—15 мин. стекло вынимают пинцетом или пальцами,
быстро поворачивают и кладут «лицом» вверх на предметное
стекло, предварительно смоченное маленькой капелькой воды.
Просматривают при малом увеличении или под лупой и, если за-
мечают каких-либо простейших, приступают к фиксации.
Для этого в часовое стекло наливают подогретой (около 40°)
жидкости Шаудинна, куда «лицом» вниз плашмя с небольшой
76
высоты бросают стёкла с простейшими. При иом многие инфу-
зории и амёбы приклеиваются к стеклу. Через 1—2 мин. стёкла
вынимают из фиксатора1 и помещают стоймя в стаканчик с раство-
ром иода на 2-3 мин. Далее - в 70°-ный спирт (15-20 мин.),
затем — в дестиллированную воду (Тмин.) и, наконец, в краску.
В гемалауне держат 4—5 мин., в кармине 10—25 мин. Здесь нельзя
указать точное время, так как оно зависит от концентрации
краски и особенностей объекта. Поэтому лучше всего процесс
окраски контролировать под микроскопом. Для этого стекло с
объектами время от времени вынимают из краски, кладут «лицом»
вверх на предметное стекло и просматривают при малом увели-
чении. Как только замечают, что ядро более или менее ясно
отличается от протоплазмы, производят дальнейшую обработку.
Если же ядро совсем не выделяется и препарат светлый, то снова
кладут в краску. Наконец, если препарат сплошь закрашен
краской так, что ядро тоже не выделяется, то краску ослабляют,
прибавляя под микроскопом каплю подкисленного спирта1 2. Как
только контуры ядра начнут выступать, препарат быстро пере-
носят в воду.
Итак, после окраски препарат ополаскивают водой и про-
водят последовательно через стаканчики, содержащие 70°-спирт,
96°-ный спирт, смесь 96°-ного спирта с бергамотовым маслом,
чистое бергамотовое масло и ксилол. В каждом из этих реактивов
препарат держат не менее 5 мин.
При переносе препарата из стаканчика в стаканчик необ-
ходимо помнить, на какой стороне «лицом» находится объект.
Лучше всего условиться, чтобы объект в стаканчике всегда на-
ходился, скажем, на той поверхности покровного стекла, которая
обращена вправо от работающего. Стекло вынимают из стакан-
чика пинцетом и каждый раз прикладывают ребром к фильтро-
вальной бумаге, чтобы возможно больше удалить остаток пре-
дыдущего реактива (не высушить препарата, не дышать на
него, держать его на воздухе вне реактива возможно короткое
время).
Из ксилола препарат заключают в канадский бальзам. Для
этого на середину чисто вытертого (абсолютно сухого) предмет-
ного стекла помещают маленькую каплю канадского бальзама.
Если он слишком густ, то разбавляют небольшим количеством
ксилола настолько, чтобы консистенция бальзама была полужид-
кой.
Вынутое из ксилола покровное стекло с объектом накладывают
(под некоторым углом) на каплю. При этом надо стараться не
1 Удобно пользоваться спичкой, передвигая ею покровное стекло к краю
часового. Из-за вогнутости последнего объекты не стираются.
2 Подкисленный спирт приготовляют, прибавляя к 10 луб. см 70°-ного спирта
1—2 капли соляной или уксусной кислоты.
77
дышать на стекло с ксилолом, так как при малейшей влажности
ксилол мутнеет и поэтому препарат гибнет. Выступивший из-
под покровного стекла избыток бальзама удаляют прикладыванием
сухой тряпочки.
Препарат несколько дней держат в горизонтальном положе-
нии до полного затвердения бальзама. На предметном стекле
делают надпись (тушью) с указанием объекта, способа фиксации,
окраски и даты. Например: туфелька (Paramecium caudatum).
Ядро. Жидкость Шаудинна. Гемалаун, 3. 11. 47. Кроме того, и
самый объект можно обвести маленьким кружком туши (не раз-
давить объекта!). Это удобно для отыскания объекта под микро-
скопом.
Для изготовления препаратов паразитических инфузорий, амёб
и грегарин поступают следующим образом.
Пинцетом берут кусочек вскрытого зараженного кишечника и
прикладывают к чистым (промытым спиртом и водой и вытертым
насухо) покровным стеклам, слегка размазывая по стеклу. При
этом, конечно, часть паразитических простейших окажется на
стекле. Приготовленный таким образом мазок плашмя бросают
«лицом» вниз в горячий фиксатор (жидкость Шаудинна), а затем
проводят через остальные реактивы и окрашивают так, как это
указано выше.
Второй способ. 3—5 капель с большим количеством инфу-
зорий помещают в часовое стекло, куда затем приливают втрое
большее количество подогретой до 40г жидкости Шаудинна.
Через 1—2 мин. зафиксированных инфузорий вылавливают тон-
кой пипеткой и поочередно переносят в часовые стекла с раство-
ром иода и других жидкостей, указанных при предыдущем спо-
собе и соблюдая то же время. Вся процедура производится под
препаровальной лупой. Здесь все старания должны быть прило-
жены к тому, чтобы, при переносе захватывалось возможно мень-
шее количество реактива. Не надо при этом дышать на стекла
с бергамотовым маслом и ксилолом, иначе объекты замутнеют.
Из ксилола инфузорий вылавливают маленькими группами,
помещают в каплю с бальзамом и накрывают покровным стеклом.
Итак, последовательность обработки препарата при обоих
способах следующая:
1. Фиксация объекта. Жидкость Шаудинна — 1—2 мин.
2. Удаление из объекта фиксатора. Раствор иода на 70°-ном
спирту — 2 мин.
3. Удаление из объекта иода. 70°-ный спирт — 15 мин.
4. Удаление спирта. Вода — 1 мин.
5. Окрашивание. Краска — 5—25 мин.
6. Промывание объекта. Вода — 5 мин.
7. Обезвоживание объекта. 70°-ный и 96°-ный спирты, смесь
96°-ного спирта с бергамотовым маслом, чистое берйамото-
78
вое масло, ксилол; в каждом из названных реактивов по
5 мин.
8. Заключение объекта. Канадский бальзам.
9. Этикетирование объекта. Надпись на препарате.
Рис. 46. Вверху (из Гартманна и Павловского) - парамеция (Л), стадия
её деления (Б) и конъюгации (В), при большом увеличении (с окрашен-
ных препаратов на канадском бальзаме).
Внизу (оригинал) - последовательные стадии деления парамеции, при
малом увеличении (с препаратов, окрашенных кармином).
Удачные препараты парамеций и других простейших будут
служить прекрасной демонстрацией принципа одноклеточности
(протоплазма, ядро). Кроме того, можно приготовить препараты
конъюгирующих и делящихся инфузорий и на последних просле-
дить отдельные стадии деления ядра и протоплазмы (рис. 46).
79
III. ОБОРУДОВАНИЕ ДЛЯ РАБОТЫ С ПРОСТЕЙШИМИ
Оборудование, помеченное ниже звездочкой (*), нужно лишь
для более сложных опытов и методов окраски, которые не обя-
зательны для школьной практики; остальное — необходимо
в первую очередь.
1. Микроскопы. Кроме обычных одногнёздных школьных ми-
кроскопов с малым и большим увеличением, желательно иметь усо-
вершенствованный микроскоп с револьвером для двух объективов.
2. Лупы. Препаровальные штативные лупы (1—2 шт.) с увели-
чением в 10—20 раз необходимы для вылавливания и распознава-
ния крупных видов простейших, а также для подготовки опытов
Рис. 47. Приготовление тонкооттянутой пипетки для вылавливания
простейших (оригинал).
и демонстраций. Ручные лупы (5—10 шт.) для рассматривания в
пробирках крупных инфузорий. Ручных луп в виду их дешевизны
можно приобрести побольше с тем, чтобы большинство учащихся
могло пользоваться ими самостоятельно.
3. Инструменты для вскрытия лабораторных животных при
демонстрации паразитических простейших: пинцет, ланцет, нож
Грефе*, ножницы, препаровальные иглы.
4. Пипетки для вылавливания простейших. Проще всего
приобрести 10—15 шт. так называемых глазных пипеток, продаю-
щихся в любой аптеке. Для вылавливания простейших со дна
глубоких сосудов или аквариумов надо приготовить 2—3 пипетки
с резиновым наконечником. Размер пипеток по высоте сосуда.
Для вылавливания отдельных простейших из часовых стёкол
нужно приготовить 10—15 тонко оттянутых пипеток из тонко-
стенных стеклянных трубок диаметром 5—10 мм. На каждую
пипетку насадить грушевидный или цилиндрический резиновый
наконечник. Такие пипетки вообще очень удобны для работы
с простейшими. Приготовляют пипетки следующим образом
(рис. 47): над пламенем примуса или газовой горелки разогре-
80
вают тонкостенную стеклянную трубку диаметром в 3—5 мм.
Стекло разогревают докрасна, причём оно размягчается до кон-
систенции воска. Затем трубку высоко приподнимают над пламе-
нем и быстро растягивают в разные стороны. Далее, согнув,
надламывают и таким образом получают две трубочки с очень
длинными и тонкими концами. Широкие концы их надпиливают
маленьким подпилком и надламывают так, чтобы получились
трубочки длиной примерно 5—10 см- На широкий конец наде-
вают резиновый баллончик от глазной пипетки или просто кусо-
чек резиновой трубки с пробкой (рис. 47, внизу). Такие тонкоот-
тянутые пипетки нужны только в тех случаях, когда необходимо
выловить какое-нибудь отдельное простейшее для создания искус-
ственной культуры или для постановки опыта. Для массового
лова и демонстрации можно обойтись глазными пипетками.
Часть заготовленных пипеток выделяют специально и только
для ловли живых объектов, другую часть — только для реактивов.
Никоим образом нельзя вылавливать живых простейших пипет-
кой, которая хоть раз была погружена в какой-либо реактив.
От этого животные гибнут. Пипетки для вылавливания живого
материала следует держать в чистом стакане с чистой водой.
5. Часовые стёкла диаметром в 3—5 см употребляются для
наблюдения простейших под лупой и малым увеличением микро-
скопа, а также для постановки ряда опытов (10—30 шт.).
6*. Чашки Петри диаметром в 8—10 см. Это плоские и низкие
стеклянные сосуды с крышками для постановки тех опытов, где
необходимо создание влажной камеры (10—20 шт.).
7. Предметные стёкла (100шт.). Желательно приобрести
также несколько предметных стёкол с выемкой.
8. Покровные стёкла (25—50 шт.).
9. Большие стеклянные банки (так называемые банки для
варенья) для сбора материала (2—3 шт.).
К ним надо привязать верёвочные ручки.
10. Мелкие стеклянные сосуды для содержания культур
в''лаборатории. Например стаканы (10—15 шт.), прямоугольные
аккумуляторные банки (2—5 шт.), несколько маленьких хими-
ческих колбочек (на 100—150 куб. см).
11. Химические пробирки новые, не бывшие в употреблении
(100 шт.), для разведения инфузорий.
12*. Цилиндрические плоскодонные стаканчики диамет-
ром в 20 мм и высотой 30—35 мм с пробками (10—20 шт.) для
реактивов и красок. Такие стаканчики нужны для приготовления
микроскопических препаратов по простейшим.
13. Сулема-спирт (жидкость Шаудинна). Фиксатор пригото-
вляется из смешения двух объёмов насыщенного раствора сулемы
и одного объёма 96°-ного спирта.
Раствор сулемы приготовляется следующим образом. На
100 куб. см дестиллированной воды прибавляется 8—10 г сулемы.
Кипятят до полного растворения сулемы. Раствор должен осты-
в Циигер
81
вать в темноте. К жидкости добавляют 5—7 капель 80 %-ной
уксусной кислоты или уксусной эссенции.
Жидкость Шаудинна — наилучший фиксатор для простейших,
так как быстро умерщвляет объект и оставляет в целости соотно-
шение важнейших составных частей организма. Эта жидкость
нужна для демонстрации ядра и приготовления микроскопи-
ческих препаратов.
14. Формалин (25—200 куб. см). 5—10 %-ный водный раствор
обычного продажного формалина. Служит как фиксатор и, кроме
того, очень удобен для заготовки и сохранения консервированного
материала, в особенности вольвокса.
15. Уксусная кислота (15—20 куб.см). 80%-ная или обычная
продажная уксусная эссенция или уксус.
Употребляется как составная часть фиксатора, а также для
демонстрации ядра и трихоцист у инфузорий.
16. Иодная настойка (15—20 куб.см). Обычная настойка,
продающаяся в аптеках. Необходима для обнаружения ресничек
у инфузорий и жгута у жгутиковых. Кроме того, употребляется
при приготовлении микроскопических препаратов.
17. Глицерин (15—20 куб. см) обычный аптечный. Употреб-
ляется для просветления объектов после фиксации.
18*. Канадский бальзам (10—15 куб.см). Для приготовле-
ния постоянных препаратов.
19*. Бергамотовое масло (10—20 куб.см). Для просвет-
ления препаратов.
20*. Ксилол или толуол (25—50 куб. см). Для тех же целей.
21. Спирт 96°-ный (200—500 куб.см). 70°-ный спирт упо-
требляется для приготовления фиксатора (жидкость Шаудинна);
70°- и 96°-ный — для обезвоживания объекта при приготовлении
препаратов, для мытья и обезжиривания покровных и предметных
стёкол.
22*. Квасцовый кармин. Для окрашивания ядра простейших
и приготовления препаратов. Если имеется готовый порош-
кообразный квасцовый кармин, то для окрашивания приготовляют
0,5 %-ный раствор кармина на дестиллированной воде (с кипяче-
нием до полного растворения). Если нет готового, то 3—5 г аммиач-
ных или калийных квасцов растворяют в 100 куб. см дестилли-
рованной воды. Затем туда прибавляют 0,5 г кармина и кипятят
в течение 5—10 мин. до полного растворения.
Если краска заготовляется надолго, то к ней прибавляют
2—3 капли карболовой кислоты.
Краску после приготовления пропускают через воронку с филь-
тровальной бумагой1.
23. * Гемалаун. Для окрашивания ядра и изготовления пре-
паратов. Приготовление: на 100 куб.см дестиллированной воды
1 Способ окрашивания см. в разделах «Обнаружение ядра» и «Изготовление
микроскопических препаратов».
82
0,1 г гематоксилина, 5 г калийных квасцов и 0,02 г йодноватого
натрия NaIO3 или йодноватого калия К1О3. Растворяют при
слабом нагревании.
24. Метилгрюн (2—Зг). Очень удобная краска для быстро-
го окрашивания ядра1.
25. Кармин, обычная сухая акварельная краска. Для об-
наружения пищевых вакуоль и парамеций.
26. Тушь, сухая в тюбиках. Для тех же целей.
27. Фиолетовые чернила. Для демонстрации трихоцист у
инфузорий.
28. Два-три полотенца и несколько мягких тряпочек
для протирания посуды, стёкол и инструментов.
Надо строго отделять полотенца и тряпочки, которые сопри-
касаются с какими-либо реактивами, от полотенец и тряпочек,
которыми протирают посуду и стёкла для живых объектов.
IV. ЗАКЛЮЧЕНИЕ
Что следует принять учителю к постоянному руко
водству для работы с простейшими
1. Заведите необходимое оборудование для работы с про-
стейшими (см. часть третью, III).
2. Подыщите в окружающей местности водоём для сбора про-
стейших: маленький непроточный прудик с опавшей гниющей
листвой. Материал надо собирать за 10—15 дней до начала за-
нятий.
3. Материал собирайте в высокие, чисто вымытые банки. Помните,
что наиболее населена простейшими зона у самого берега.
Перед взятием пробы споласкивайте банки водой исследуемого
водоёма. Банку наполняйте водой и обязательно прибавляйте
гниющей листвы, ила и водных растений.
4. В лаборатории или в уголке живой природы приготовьте
сырые культуры (разводки) простейших, для чего разлейте со-
держимое банки по мелким сосудам.
5. Посуда для сырых и искусственных культур должна быть
чисто вымытой. Не употребляйте для культур посуды, в которой
находились реактивы.
6. Помните, что мелкие водные животные (коловратки, даф-
нии, циклопы, черви, насекомые и их личинки) питаются про-
стейшими. Поэтому уничтожайте культуры с этими врагами про-
стейших и отбирайте культуры без них.
7. В слабо населённые культуры один раз в десятидневку
прибавляйте по нескольку капель молока, которое способствует
сильному размножению инфузорий.
1 Способ окрашивания см. в разделах «Обнаружение ядра» и «Изготовление
микроскопических препаратов».
6* 83
8. Обязательно заведите и отделите часть посуды (стёкла,
пипетки), а также полотенце и тряпочки специально для работы
с живыми объектами.
Никогда не опускайте в культуру пипетку, которая была смочена
каким-нибудь реактивом. От этого культура погибает. Пипетки
для работы с живыми объектами держите отдельно в стакане
с чистой водой. Загрязнённые покровные и предметные стёкла
промывайте водой и спиртом и тщательно вытирайте мягкой и
чистой тряпочкой.
9. Приготовьте искусственные культуры простейших, в пер-
вую очередь парамеции, на молочном растворе (см. часть вторую,
I, А). Такие культуры наиболее удобны для школьной работы.
При недостатке в сырых культурах эвглен и амёб приготовь-
те их искусственные культуры на сенном настое или жидкости
Бенеке (см. часть вторую, I, Б и III, Б).
10. Для демонстрации и наблюдения простейших набирайте
их пипеткой особенно из верхней части сосуда, у стенок, обра-
щённых к свету, так как здесь они скопляются в большем коли-
честве, чем в середине или на дне сосуда. Помещайте их не-
большими порциями (каплями) на предметное стекло (чистое) и
рассматривайте при малбм увеличении без покровного стекла;
последним накрывайте объект лишь при рассматривании с боль-
шим увеличением.
11. При отсутствии сырых и искусственных культур используйте
обычных лабораторных животных, в первую очередь лягушку,
у которой в прямой кишке и в клоаке вы всегда найдёте крупных
и удобных для демонстрации инфузорий — опалин.
12. Научитесь пользоваться микроскопом и препаровальной
лупой.
13. Наблюдайте простейших главным образом при малом увели-
чении. Помните, что чем меньше увеличение, тем больше поле
зрения и тем яснее картина. Большое увеличение употребляйте
лишь для уяснения деталей строения. Распознавайте простейших
при помощи рисунков как данной, так и других книг.
14. Старайтесь зарисовывать то, что наблюдаете. Это очень
помогает уяснению деталей строения микроорганизмов-
15. Все рекомендованные в книге наблюдения и опыты пред-
варительно проделайте лично сами и только тогда вы с успехом
сможете показать и объяснить их учащимся.
СПИСОК ЛИТЕРАТУРЫ
А. ТЕОРЕТИЧЕСКИЕ РУКОВОДСТВА
1. Руководство по з о о л ог п и,. под редакцией проф. Л. А. 3 енк еви ча,
т. I. Беспозвоночные: простейшие, губки, кишечнополостные, плоские черви,
немертины, круглые черви и коловратки, Биомедгиз, М. — Л., 1937.
Тип простейшие описан проф. В. А. Догелем (Ленинград). Самая полная
и подробная сводка на русском языке. Дан общий морфологический и физио-
логический обзор типа, включая размножение, половой процесс, жизненный
цикл, регенерацию и генетику. Подробный систематический обзор классов
жгутиконосцев, саркодовых, споровиков и инфузорий с определительными
таблицами отрядов. Специальные главы посвящены экологии, распростра-
нению, хронологии и филогении простейших. Важна для учителя глава «Proto-
zoa» и вопрос о происхождении многоклеточных. Вся сводка в целом пред-
ставляет ценный справочник по современному состоянию науки о простейших.
2. Проф. Беккер Э. Г., проф. Ежиков И.И., проф. Левинсон Л. Б.,
п роф. Парам он ов А. А., Курс зоологии, т. I. Беспозвоночные, изд. 3-е
под редакцией проф. Б. С. Матвеева и проф. Л. Б. Левинсона, Учпедгиз, 1940.
Глава о простейших написана Л. Б. Левинсоном. Краткий, но вполне со-
временный и хорошо, изложенный обзор типа простейших. Изложено в эволю-
ционном духе с указанием происхождения классов, что особенно важно для
учителя. Подчеркнут принцип одноклеточное™. Подробно описаны важней-
шие и классические «педагогические» объекты: зелёная эвглена, амёба, маля-
рийный плазмодий и парамеция. Специальная глава об экологии простейших.
Книга хорошо издана и иллюстрирована, необходима для каждого педагога-
биолога.
3. Проф. Холодковский Н. А., Учебник зоологии под редакцией проф.
Е. Н. Павловского, изд. 6-е, Медгиз, 1933.
4. Проф. Догель В. А., Курс зоологии беспозвоночных, изд. 3-е,Учпед-
гиз, 1939.
В обоих руководствах читатель найдёт основные сведения о простейших.
5. Эпштейн Г. В., Патогенные простейшие, спирохеты и грибки. Основы
общей и медицинской протистологии, Медгиз, 1931.
Обширная исчерпывающая сводка о патогенных простейших. Хотя книга
в целом написана главным образом для медиков, отдельные главы её полезны
и для учителя, поскольку в программу средней школы входит ознакомление
школьников с простейшими — возбудителями болезней животных и человека.
Особенно можно рекомендовать главы о малярии, пироплазмозе и амебиазе.
В общей части хорошо изложены морфология и физиология непатогенных
простейших. В книге много хороших рисунков. Для учителя ценны графики
по борьбе с распространением малярии.
6. Проф. Якимов, Болезни домашних животных, вызываемые простей-
шими (Protozoa). Ветеринарная протозоология, Сельхозгиз, 1931.
Самая полная сводка по ветеринарной протозоологии. Отдельные главы
могут быть полезны для учителя, в особенности глава о пироплазмозе и клещах.
7. Бродский, История1 протозоологии, Учпедгиз, Ташкент, 1937.
85
Сжатая, популярно написанная книжка, отмечающая важнейшие этапы
развития науки о простейших со времен Геснера (XVI в.) до наших дней. По-
лезна для учителя, так как затрагивает материал, которого нет в учебниках
зоологии.
8. Поль де Крюи, Охотники за микробами, перевод с английского под
редакцией акад. Н. К. Кольцова, изд. 7-е, «Молодая Гвардия», 1938.
Популярная и увлекательно написанная книжка о Левенгуке, Спалланцани,
Пастере, Мечникове, Кохе и др. Книжка очень полезна для школьников и
юных натуралистов, так как возбуждает интерес к миру микроорганизмов,
знакомит читателя с выдающимися исследователями, их жизнью и борьбой.
9. Миленушкин Ю. И., Организм человека и микробы, Биомедгиз,
Москва, 1937.
Б. ПРАКТИЧЕСКИЕ РУКОВОДСТВА
10. Кремен'ецкий Н. Г., Микроскоп и работа с ним, пособие для пре-
подавателей средних школ, изд. 2-е, Учпедгиз, 1937.
Полезная для учителя маленькая книжка, знакомящая, с одной стороны,
с элементами микроскопической техники и, с другой, — дающая указаний по
изготовлению препаратов по анатомии растений, гистологии и микроорганизмам
самыми простыми средствами и на самом доступном материале.
11. Кременецкий Н. Г., Оборудование курса зоологии в педвузах,
Учпедгиз, 1938.
В этой книжке читатель также найдёт сведения и об устройстве микроскопа
и об организации и проведении работ с микроскопом.
12. Нем илов А. В., Курс практической гистологии, пособие для вузов,
Гиз, 1923.
Полезная глава о микроскопе и обращении с ним. Некоторые места из
гистологической техники могут быть использованы и для средней школы.
13. Аверин'цев С. В., Практические работы по зоологии, пособие для
вузов, Гиз, 1926.
Может быть использована глава о простейших, где приведена методика
наблюдения и приготовления препаратов.
14. Догель В. А., Как производить биологические наблюдения над про-
стейшими, Гиз, Л. 1925.
Единственная пока у нас книжка по постановке опытов с простейшими.
, К сожалению, в позднейшее время не переиздавалась. Некоторые из при-
водимых опытов могут быть поставлены в условиях средней школы.
15. Проф. Павловский Е. Н., Практикум по зоологии, изд. 2-е, Уч-
педгиз, 1938.
Практикум предназначен для биологических факультетов и педагогических
институтов. Глава о простейших, содержащая много ценного материала (осо-
бенно по инфузории-туфельке), может быть частично использована и для сред-
ней школы.
В. МЕТОДИЧЕСКИЕ РУКОВОДСТВА
16. Беляев М. М. и Кременецний, Н. Г., Методика зоологии, изд. 2-е,
Учпедгиз, 1938.
Главы о простейших — очень нужный и полезный для учителя справочник
по методике преподавания зоологии в средней школе.
ОГЛАВЛЕНИЕ
Стр.
От издательства............................................... 2
От автора.................................................... 3
Введение...................................................... 5
Часть первая
СБОР И РАСПОЗНАВАНИЕ ПРОСТЕЙШИХ
I. Водоёмы.................................................... 7
II. Техника сбора............................................. 8
III. Осмотр фауны простейших на месте......................... 9
IV. Содержание культур в лаборатории и уголке живой природы. ... 10
V. Распознавание простейших ................................12
Часть вторая
ИСКУССТВЕННЫЕ КУЛЬТУРЫ. ДЕМОНСТРАЦИЯ
НАБЛЮДЕНИЯ И ОПЫТЫ С ПРОСТЕЙШИМИ
I. Инфузории .................................................26
1. Искусственные культуры................................26
2. Демонстрация парамеций .................28
3. Обнаружение ядра у парамеций..........................29
4. Обнаружение ресничек..................................32
5. Питание инфузорий.....................................32
6. Сократительные вакуоли у парамеций ............36
7. Раздражимость.........................................37
8. Размножение...........................................40
9. Инцистировапие........................................43
10. Регенерация...........................................45
11. Очерк экологии инфузорий..............................45
II. Ложноножковые, или корненожки.............................46
1. Искусственные культуры................................46
2. Демонстрация голых амёб...............................47
3. Питание амёб..........................................49
4. Раздражимость.........................................49
5. Раковинные корненожки — арцеллы и диффлюгии.......50
6. Солнечники............................................51
7. Ископаемые корненожки из мела и известняка........52
87
Стр.
III. Жгутиковые .............................................. 52
1. Искусственные культуры.................................52
2. Демонстрация эвглен................................... 53
3. Обнаружение жгута......................................54
4. Демонстрация колониальных жгутиковых...................54
5. Влияние света на организм жгутиковых. Положительный фото-
таксис ...................................................57
IV. Простейшие — паразиты и комменсалисты ,...................58
1. Амёбы из полости рта человека...........................58
2. Грегарины моноцистис из семенных пузырьков дождевого червя . . 59
3. Грегарины из кишечника мучного червя....60
4. Кокцидии у кролика......................."..............60
5. Инфузории, амёбы, грегарины и жгутиковые из кишечника чёрного
таракана................................................' . 62
6. Инфузории из кишечника лягушки...................... . 65
7. Инфузории из желудка жвачных. ..........................68
Часть третья
МИКРОСКОПИЧЕСКАЯ ТЕХНИКА
I. Микроскоп и правила работы с ним..........................70
1. Устройство микроскопа.................................. 70
2. Работа с микроскопом....................................73
3. Уход за микроскопом.....................................75
II. Изготовление микроскопических препаратов по простейшим .... 76
Ш. Оборудование для работы с простейшими ..................i . 80
IV. Заключение......................'..........................83
Список литературы..............................................85
Редактор В. П. Герасимов. Техредактор Н. В. Сахарова.
Подписано к печати 5/IX 1947 г. А 05186. Объем 5г/а п- л.
Учетно-издат. листов 5,31
Набрано и отпечатано в типографии Н-10,