Текст
$. Ме^ вед обе кии
кандидат химических наук
КИСЛОРОД
Государственное Издательство Детской Литературы
Министерства Просвещения РСФСР
Москва 1953 Ленинград
Рисунки Е. Трунова
Scan AAW
ОТКРЫТИЕ КИСЛОРОДА
К величайшим событиям истории развития химической
науки относится открытие кислорода. Обычно принято
считать, что кислород был открыт в 70-х годах XVIII
столетия. Однако уже много тысяч лет назад человек, сам
того не сознавая, начал пользоваться кислородом,
входящим в состав воздуха.
В первобытные времена огонь согревал человека в
ненастную погоду, помогал ему питаться, защищал от
нападения хищных зверей. Постепенно с помощью огня
человек научился изготовлять различные орудия труда и
защиты.
Но уже в те далекие времена люди наблюдали, что
в глубоких ямах и узких пещерах дерево горит хуже, чем
на открытом месте, что на ветру огонь пылает ярче и
пламя его становится горячее. Когда огонь ослабевал,
у человека появлялось желание увеличить приток воздуха
к нему.
з
Сначала горение очага
усиливали взмахами
широких листьев растений,
затем листья заменили
шкурами животных.
Позднее из шкур люди
научились изготовлять
всевозможные приспособления
для раздувания огня,
увеличивая «чудотворную»
силу, которая долгое
время оставалась
неразгаданной.
Первые смутные
представления о том, что
происходит при горении, мы
находим в книге
китайского философа VIII века
нашей эры.
Китайский мудрец высказывает
мысль о том, что все
вещества состоят из двух
начал. Одно из них —
главное; его больше, чем
другого, оно сильнее и как
>бы определяет данное вещество. Это начало носит
название «янг». Второе начало — «ин»; его меньше, оно слабее
и имеет подчиненный характер. Чем больше в веществе
первого начала — «янга», тем оно лучше, совершеннее.
Воздух, как и любое другое вещество, также обладает
этими свойствами. Для того чтобы сделать воздух более
совершенным, по мнению философа нужно увеличить
в нем основное начало, то-есть «янг», и уменьшить
количество «ина». Уменьшить «ин» в воздухе можно путем
нагревания в нем металлов, угля и серы. При этом меньшая
часть воздуха — «ин» (кислород) — уйдет к
нагреваемому предмету, а большая часть воздуха — «янг»
(азот) — останется нетронутой. Хотя «ин», как полагал
китайский философ, нельзя получить в чистом виде, но
его можно наблюдать при прокаливании различных
каменистых пород.
Название этих пород расшифровать не удалось. Но
Первобытные люди у огня.
4
ученые-историки предполагают, что одна из них —
селитра, которую китайцы должны были знать давно, как
одну из составных частей пороха.
Семьсот лет спустя, в эпоху Возрождения, у
гениального итальянского художника, великого ученого и
выдающегося инженера того времени Леонардо да Винчи мы
находим более определенные высказывания о составе
воздуха и о его роли при горении.
Вопреки широко распространенному в то время
мнению, что воздух является однородным элементом,
Леонардо да Винчи на основании своих наблюдений считал, что
воздух состоит из двух различных составных начал, тан
как при горении и при дыхании воздух расходуется не
весь, а только частично.
В одной из своих рукописей Леонардо да Винчи
писал: «Огонь постепенно разрушает воздух, его
питающий; образовалась бы пустота, если бы не притекал
воздух, чтобы ее заполнить. Когда воздух не в
состоянии, необходимом для того, чтобы воспринять пламя,
в нем не может существовать
ни огонь, ни какое-либо
животное — земное или
воздушное». Далее Леонардо да
Винчи пишет: «Копоть в
центре пламени свечи
образуется потому, что воздух,
который входит в состав
пламени, не может
проникнуть до середины. Он
останавливается у поверхности
пламени и здесь
подвергается превращению». Эти строки
свидетельствуют о том,
насколько близко Леонардо да
Винчи подошел к
правильному пониманию той роли,
которую играет воздух, или,
вернее, часть его, в жизни
животных и при горении.
К сожалению, эти
понятия о процессе горения не на- Мехи _ приСпособление для
шли дальнейшего развития. по'дачи воздуха к огню.
Через два столетия широкое распространение получила
новая теория горения — «теория» флогистона, которую
примерно в 1700 году предложил немецкий ученый
Э. Шталь.
По «теории» флогистона все материалы, способные
гореть, состоят из элементарного вещества флогистона и
золы. Когда горит дерево, флогистон, который входит
в его состав, улетучивается, превращаясь в тепло и свет,
а зола остается в очаге. При горении металла флогистон
также исчезает, и в очаге остается металлическая
«зола» — окалина. Окалину можно вновь превратить в
металл, если «вселить» в нее флогистон. Для этого
необходимо прокалить ее с веществом, которое содержит много
флогистона. Таким веществом считался уголь.
Сейчас эта «теория» кажется нам фантастической,
неспособной помочь человеку развивать науку и познавать
явления природы. Однако для начала XVIII века, когда
зародилась «теория» флогистона, она являлась
определенным шагом вперед. «Теория» флогистона объединила ряд
химических процессов и явлений и дала им свое
объяснение. Это вызвало у ученых того времени стремление
к дальнейшим исследованиям в области химии и привело
к новым открытиям, обогатившим науку ценными
наблюдениями.
Казалось, что наконец найдена теория, которая
объясняет процессы горения. Но неожиданно было установлено,
что окалина, образующаяся при горении металлов, весит
больше, чем взятый для обжига чистый металл. Это
вызвало новое недоумение ученых.
Известно, что если отнять у какого-нибудь тела одну
из его составных частей, то вес оставшейся части должен
уменьшиться.
Почему же металл, из которого при горении
улетучился флогистон, весит больше?
Для объяснения пришлось допустить, что у некоторых
веществ флогистон обладает отрицательным весом,
то-есть весит меньше, чем «ничто». Находясь в куске
металла, флогистон как бы уменьшает его истинный вес,
то-есть облегчает его. Когда же при горении флогистон
покидает металл, образовавшаяся окалина приобретает
свой истинный вес, который больше веса чистого металла.
Такое объяснение не могло полностью удовлетворить
§
ученых, но другой
неправильно объясненный опыт
«рассеял» их сомнения и
усилил тем самым
заблуждения исследователей.
Было обнаружено, что
если к коромыслу весов
вместо одной чашки
подвесить стеклянный шар и
уравновесить его, положив
гири на другую чашку, то
при нагревании шара
равновесие нарушается и
шар поднимается кверху.
Это явление объясняли
тем, что при подогревании
шара находящийся в
пламени флогистон с
отрицательным весом
«вселяется» в шар и облегчает его.
В действительности же
это только кажущееся
уменьшение веса, так как
шар поднимается кверху
потоками теплого воздуха,
которые омывают его при
нагревании.
Как же правильно
объяснить увеличение веса
металла при прокаливании?
При высокой
температуре металл легко
окисляется, соединяясь с
кислородом воздуха. Образуется окисел, вес которого
складывается из веса самого металла и веса кислорода. При
прокаливании с углем окисел металла восстанавливается,
отдавая свой кислород углю. При этом образуются чистый
металл и двуокись углерода.
Многие ученые середины XVIII века не смогли
правильно объяснить процесс горения. Большинство крупнык
ученых, современников Михаила Васильевича
Ломоносова, придерживалось «теории» флогистона.
По «теории» флогистона все
материалы, способные гореть, состоят
из флогистона и золы. При
горении флогистон превращается в
тепло и свет. В очаге остается
зола.
7
Великий русский ученый не примирился с теорией,
которая противоречила здравому смыслу.
Считая, что «теория» флогистона не дает правильного
объяснения процесса горения и неверно истолковывает
причины, приводящие к увеличению веса металла при его
прокаливании, М. В. Ломоносов высказал
предположение, что такое увеличение веса нужно отнести за счет
соединения металла с частью воздуха.
«Нет никакого сомнения, — писал он еще в 1748
году, — что частички воздуха, текущего постоянно над
обжигаемым телом, соединяются с ним и увеличивают его
вес».
Это означало, что горение нужно было рассматривать
не как разложение горючих тел на составные части —
флогистон и золу, а как соединение горючего материала
с частью воздуха. Такое объяснение процессов горения не
могло быть сразу принято учеными того времени, так как
оно коренным образом отличалось от их взглядов.
Михаил Васильевич Ломоносов решил на опыте
доказать правильность своего предположения.
Ломоносов был глубоко убежден, что без опыта не
может существовать наука. Он считал, что каждое
«мысленное рассуждение» должно получать свое
подтверждение на опыте, а из надежных и многократно повторенных
опытов должны вытекать теоретические представления.
Мысль о сочетании теории с опытом привела
М. В. Ломоносова к выводу о необходимости создания
химической лаборатории.
Шесть лет упорно добивался он согласия Академии
наук на постройку лаборатории. Наконец в 1748 году
в Петербурге, на территории ботанического сада, по плану
Ломоносова была выстроена первая русская химическая
лаборатория.
М. В. Ломоносов не только стремился к лабораторным
исследованиям, но и первый провозгласил необходимость
точных количественных измерений, основанных на
наблюдении за «мерой и весом» изучаемых веществ.
Многие приборы для лаборатории были изготовлены
по его чертежам. По указаниям Ломоносова были
сделаны точные весы, при помощи которых он провел
целый ряд количественных исследований.
В 1756 году Ломоносов приступил к эксперименталь-
8
ной проверке своих представлений о процессе горения,
высказанных им еще восемь лет назад.
Точно взвешенный кусок олова он заложил в
стеклянную реторту и герметически запаял ее, чтобы во время
проведения опыта туда не проникал воздух. Взвесив
реторту вместе с содержимым, он прокаливал ее на огне
в течение нескольких часов. После охлаждения, не
вскрывая реторты, Ломоносов снова взвесил ее. Вес не
изменился.
Ломоносов повторил этот опыт и с другими металлами.
Вес запаянных реторт с металлом до прокаливания
и после прокаливания оставался неизменным.
Убедившись в постоянстве веса запаянных реторт,
Ломоносов вскрыл их одну за другой. Воздух с шумом
врывался в каждую из них. При взвешивании реторты
с прокаленным металлом перетягивали чашку весов.
Сомнений не оставалось, вес металла после
прокаливания увеличился. Это значит, что при прокаливании часть
воздуха, находившегося в реторте, вступила в соединение
с металлом. Образовался окисел, вес которого стал равен
сумме весов металла и кислорода. При этом вес воздуха
в реторте уменьшился настолько, насколько увеличился
вес прокаленного металла.
До тех пор пока реторта была запаяна и доступ
наружного воздуха в нее был закрыт, сумма весов реторты,
воздуха и металла оставалась постоянной. Как только
реторта была вскрыта и вместо использованного
кислорода в нее вошла новая порция воздуха, вес реторты
с содержимым увеличился.
Эти опыты не только подтвердили высказывание
Ломоносова, что вес металла при прокаливании
увеличивается за счет соединения его с частью воздуха, но
одновременно явились блестящим подтверждением открытого
им важнейшего закона природы — закона сохранения
материи.
Идеи о сохранении вещества при различных
процессах, происходящих в природе, Ломоносов четко
сформулировал еще за восемь лет до этих опытов. В 1748 году
в своем письме к известному математику, члену
Петербургской Академии наук Л. Эйлеру, с которым Михаил
Васильевич делился своими научными мыслями, он писал:
«Все изменения, случающиеся в природе, так происходят,
9
что если к одному телу что-нибудь прибавится, то столько
же отнимется от другого. Так, когда к какому-нибудь телу
прибавляется сколько-нибудь вещества, то точно столько
же убавляется от другого».
Эта смелая для того времени и гениальная по своей
глубине мысль не была принята современниками
Ломоносова. Его идеи и открытия вызывали озлобление и
ненависть к ученому, посмевшему открыто выступить против
укоренившихся взглядов, связанных с «теорией»
флогистона.
Семнадцать лет спустя знаменитый французский
ученый Лавуазье повторил опыты Ломоносова и пришел
к аналогичному выводу, что увеличение веса металла
при прокаливании происходит от соединения его с частью
воздуха. На основании этих опытов Лавуазье, не
упоминая имени Ломоносова, выводит закон сохранения
материи, который намного раньше его был не только
сформулирован Ломоносовым, но и блестяще подтвержден им
экспериментально. В 1756 году в толстом исписанном
лабораторном журнале Ломоносова была сделана еще
одна запись: «Делал опыты в заплавленных накрепко
стеклянных сосудах, дабы исследовать, прибывает ли вес
металлов от чистого жару. Оными опытами нашлось, что
славного Роберта Бойля мнение ложно, ибо без пропуще-
ния внешнего воздуха вес сожженного металла остается
в одной мере».
Английский ученый Бойль также прокаливал металлы
в запаянных ретортах, но взвешивал реторты с металлом
перед прокаливанием и после прокаливания в открытом
виде.
Установив, что вес металла после прокаливания
увеличивается, он объяснил это явление тем, что невидимые
частицы огня и пламени в виде «огненной материи»
проникли через стекло реторты к металлу, соединились с ним
и увеличили его вес.
Ломоносов экспериментально доказал
несостоятельность этой вымышленной теории «огненной материи» и
тем самым нанес первый сокрушительный удар по
«теории» флогистона.
Теория горения получила новое, научное обоснование
и почву для своего дальнейшего развития.
Меньше чем через два десятилетия после опытов Ло-
10
моносова шведский ученый
Шееле и английский ученый
Пристлей почти
одновременно и независимо друг от
друга выделили из азотнокислой)
магнезии (Mg(N03)2) и
окиси ртути (HgO) те самые
частички воздуха, которые,
по определению Ломоносова,
«постоянно текут над
обжигаемым телом, соединяются
с ним и увеличивают вес
его». Эти частички были
названы Пристлеем «дефло-
гистинизированным
воздухом», то-есть воздухом,
лишенным флогистона.
Пристлей получил
кислород 1 августа 1774 года.
Поместив в стеклянную л
пробирку над столбом ме- Получение ^Р°Д*- 0пыт
таллической ртути немного
красной окиси ртути, он
направил на нее через линзу пучок солнечных лучей.
Когда фокус пучка попал на окись ртути, она под
действием тепла разложилась. Выделился газ, который
вытеснил из пробирки металлическую ртуть.
Вначале Пристлей полагал, что получил обыкновенный
воздух. Но каково же было его изумление, когда он
обнаружил, что свеча в этом «воздухе» горит необычайно
ярким пламенем и что мышь, посаженная под колокол, в
котором находился полученный им «воздух», живет дольше,
чем в таком же объеме обычного воздуха.
Пристлей сам попробовал вдыхать полученный им
«воздух» и нашел, что им легко и приятно дышится.
Предполагая использовать «дефлогистинизированныи воздух»
в медицине, он писал: «Кто знает, через некоторое время
этот чистый воздух, может быть, сделается модным
предметом роскоши. До сего времени им насладились только
две мыши да я».
В октябре 1774 года Пристлей во время своего
пребывания в Париже рассказал Лавуазье о результатах своих
И
опытов с окисью ртути и о свойствах полученного им
«дефлогистинизированного воздуха».
Лавуазье воспроизвел опыты Пристлея и, кроме того,
провел количественные измерения взятых продуктов и
полученных веществ.
Эти опыты дали ему впоследствии возможность
установить, что выделяющийся при прокаливании окиси ртути и
других окислов газ содержится в обычном воздухе, что
этот газ входит в состав азотной, серной, фосфорной
кислот. Следовательно, этот газ способен творить — родить
кислоту. Отсюда и пошло его название «кислотвор» или
кислород.
Открытие кислорода и изучение его роли в горении
серы, фосфора, угля, масла и других веществ нанесло
окончательный удар по «теории» флогистона.
КИСЛОРОД В ПРИРОДЕ
Напрасно человек стал бы искать такой уголок в
природе, где бы не было кислорода. На земле, в ее недрах,
высоко над землей, в воде и под водой — всюду
встречается этот химический элемент как в свободном состоянии,
так и в соединениях. Нет другого элемента, который был
бы так широко распространен в природе, как кислород.
Этим и объясняется тот огромный интерес, который
вызывает кислород у исследователей различных областей науки.
Химики и геологи изучают различные соединения
кислорода почти со всеми встречающимися в природе
элементами. Ботаники исследуют участие кислорода в
процессах дыхания и питания растений. Физиологи выясняют
роль кислорода в жизни человека и животных, а физики
ищут новые пути использования кислорода для создания
высокой температуры.
Кислород в воздухе
Воздух жаркого, солнечного юга и сурового,
холодного севера содержит одинаковое количество кислорода.
Один литр воздуха всегда содержит 210 кубических
сантиметров кислорода, что составляет 21 объемный процент.
12
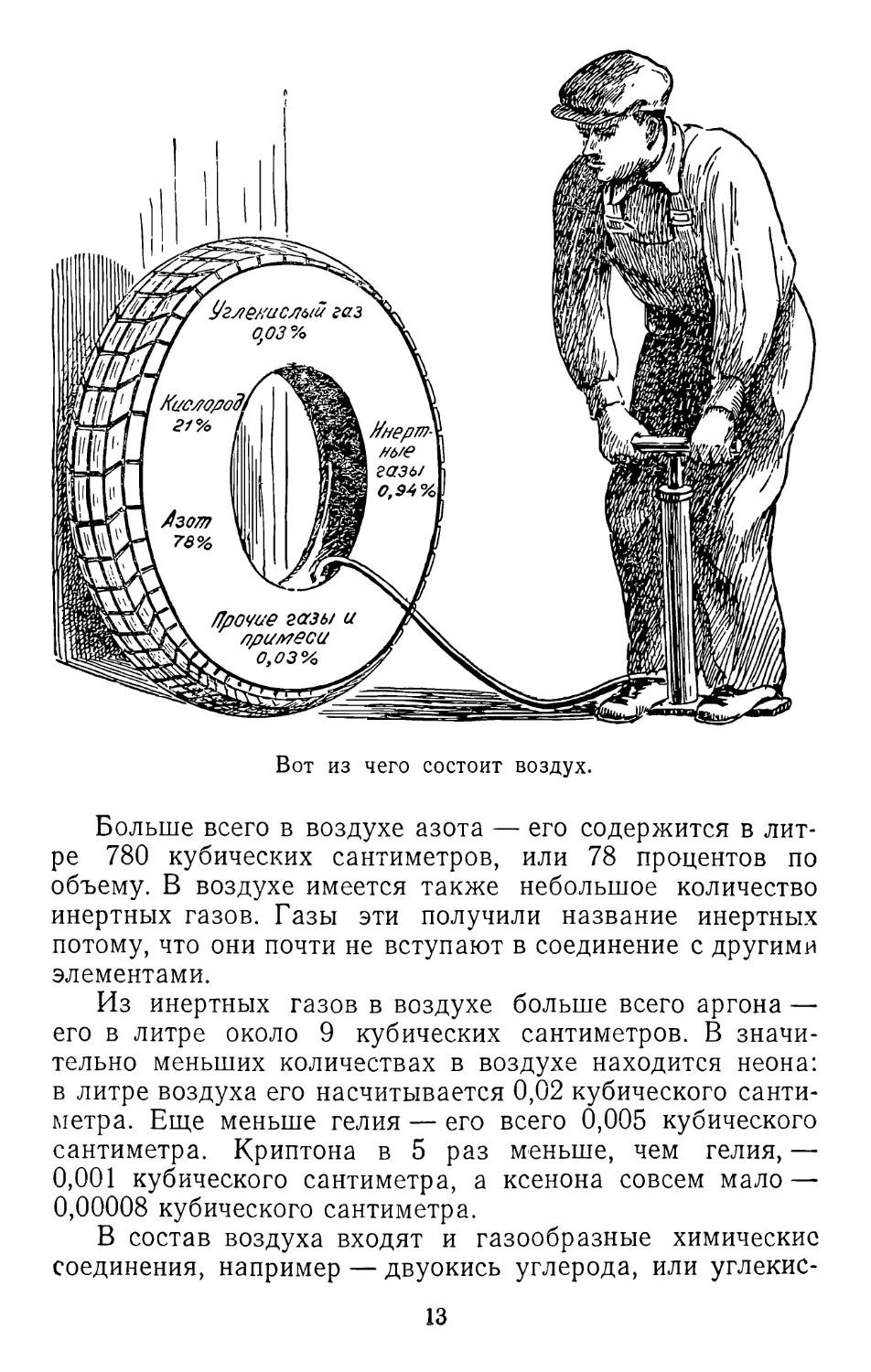
Вот из чего состоит воздух.
Больше всего в воздухе азота — его содержится в
литре 780 кубических сантиметров, или 78 процентов по
объему. В воздухе имеется также небольшое количество
инертных газов. Газы эти получили название инертных
потому, что они почти не вступают в соединение с другими
элементами.
Из инертных газов в воздухе больше всего аргона —
его в литре около 9 кубических сантиметров. В
значительно меньших количествах в воздухе находится неона:
в литре воздуха его насчитывается 0,02 кубического
сантиметра. Еще меньше гелия — его всего 0,005 кубического
сантиметра. Криптона в 5 раз меньше, чем гелия, —
0,001 кубического сантиметра, а ксенона совсем мало —
0,00008 кубического сантиметра.
В состав воздуха входят и газообразные химические
соединения, например — двуокись углерода, или углекис-
13
лый газ (С02). Количество углекислого газа в воздухе
колеблется от 0,3 до 0,4 кубического сантиметра в литре.
Непостоянно также содержание в воздухе паров воды.
В сухую и жаркую погоду их меньше, а в дождливую —
больше.
Состав воздуха можно выразить и в весовых
процентах. Зная вес 1 литра воздуха и удельный вес
каждого газа, входящего в его состав, легко от объемных
величин перейти к весовым. Азота в воздухе содержится
около 75,5, кислорода — 23,1, аргона— 1,3 и углекислого
газа (двуокиси углерода) — 0,04 весового процента.
Разница между весовыми и объемными процентами
объясняется различными удельньпуш весами азота,
кислорода, аргона и углекислого газа.
Содержание кислорода в воздухе можно определить,
соединив его с каким-либо другим элементом.
Кислород, например, легко окисляет медь при
высокой температуре. Поэтому, если пропустить воздух через
трубку, наполненную раскаленными медными стружками,
то при выходе из трубки он не будет содержать кислород.
Удалить кислород из воздуха можно также фосфором.
При горении фосфор жадно соединяется с кислородом,
образуя фосфорный ангидрид (Р2О5).
Налейте в банку с широким горлом немного воды, по-
Поглощение кислорода раскаленными медными стружками: / —
банка, из которой воздух вытесняется водой; 2 — металлическая
трубка, наполненная медной стружкой; 3—банка, в которую поступает
газ, не содержащий кислорода; 4 — сток для воды.
ставьте на воду
фарфоровую чашечку,
укрепленную на пробке, затем
положите в чашечку кусочек
фосфора. Подберите
пробку, которой можно плотно
закрыть эту банку,
вставьте в нее загнутую
стеклянную трубку и прямую
железную проволочку.
Накалите кончик проволочки
и закройте банку пробкой
так, чтобы горячим
концом проволоки коснуться
фосфора. Как только
фосфор воспламенится,
поставьте под наружный
конец стеклянной трубки
сосуд с водой.
Образующийся при горении
фосфорный ангидрид легко
растворится в воде,
поэтому в банке создастся
разрежение. Вода из
сосуда всосется через трубку
в банку и заполнит
пространство, занятое ранее кислородом. Объем воды,
вошедшей в банку, будет равен примерно Vs объема воздуха
в ней. Это значит, что 7б часть воздуха, находившегося
в банке до начала опыта, состояла из кислорода.
Где бы мы ни проводили этот опыт, результат будет
один и тот же. Поэтому считают, что весь воздух,
окружающий землю, на Vs часть состоит из кислорода.
Состав воздуха был определен в 1775 году Лавуазье.
Нагревая небольшое количество металлической ртути
в стеклянной реторте, Лавуазье подвел узкий конец
реторты под стеклянный колпак, который был опрокинут в
сосуд, наполненный ртутью. Двенадцать суток длился этот
опыт. Ртуть в реторте, нагретая почти до кипения, все
больше и больше покрывалась красной окисью.
Одновременно уровень ртути в опрокинутом колпаке стал заметно
подниматься над уровнем ртути сосуда, в котором на-
Определение состава воздуха
сжиганием фосфора: / — банка с
водой; 2 — пробка с укрепленной
на ней фарфоровой чашечкой;
3 — горящий фосфор; 4 — пробка;
5 — железная проволочка; 6 —
стеклянная трубка; 7 — стакан
с водой.
\%
Опыт Лавуазье по определению
состава воздуха.
ходился колпак. Ртуть в
реторте, окисляясь,
забирала из воздуха все
больше кислорода,
давление в реторте и колпаке
упало, и вместо
израсходованного кислорода в
колпак всасывалась ртуть.
Когда весь кислород
был израсходован и
окисление ртути прекратилось,
приостановилось и
всасывание ртути в колпак.
Объем ртути в колпаке
был измерен. Оказалось,
что он составлял V5 часть
общего объема колпака и реторты.
Газ, оставшийся в колпаке и реторте, не поддерживал
горения и жизни. Свеча в нем гасла, мышь быстро гибла.
Эта часть воздуха, занимавшая почти 4/б объема, была
названа азотом.
Более точными опытами в конце XVIII столетия было
установлено, что воздух содержит по объему 21 процент
кислорода и 79 процентов азота.
И только в конце XIX столетия стало известно, что
в состав воздуха входят аргон, гелий и другие инертные
газы.
Кислород в воде
Кислород вместе с другими газами, входящими в
состав воздуха, легко растворяется в воде.
Сколько же воздуха может раствориться в воде?
Говорить о растворимости воздуха в целом нельзя, нужно
говорить о растворимости каждой составной части воздуха
в отдельности.
Кислород, азот, аргон, двуокись углерода и другие
газы обладают различной растворимостью. При
одинаковых температуре и давлении чистого кислорода в воде
растворится почти в 2 раза больше, чем азота, а
углекислого газа —в 35 раз больше, чем кислорода.
Однако существуют общие закономерности для всех
газов. Чем выше температура жидкости, тем меньше рас-
16
творимость газов. В литре чистой воды при нормальном
атмосферном давлении, равном 760 миллиметрам
ртутного столба, и при температуре 0° растворяется около 50
кубических сантиметров чистого кислорода. А при
температуре 30° — примерно в 2 раза меньше. Чистого азота
при температуре 0° и нормальном атмосферном давлении
растворится 24 кубических сантиметра, а при
температуре 30°— 14 кубических сантиметров.
Чем выше давление газа над жидкостью, тем больше
его растворимость.
Если в закрытом сосуде, наполненном на одну треть
водой, создать давление в 2 атмосферы, то газа
растворится вдвое больше, чем при 1 атмосфере. И наоборот:
при пониженном давлении газа растворится во столько
же раз меньше, во сколько ниже давление.
Два равных объема различных газов, смешанных при
давлении в 1 атмосферу, растворяясь в воде, будут вести
себя как два самостоятельно существующих газа,
находящихся под давлением в 1/2 атмосферы. Растворимость
каждого из них будет в 2 раза меньше их растворимости
при нормальном атмосферном давлении.
Воздух — это смесь газов. Так как в воздухе
содержится 21 процент кислорода, то его парциальное давление,
то-есть та часть давления, которая падает только на
кислород, будет в 5 раз меньше давления воздуха. Поэтому
кислорода воздуха при нормальном атмосферном
давлении растворится в воде в 5 раз меньше, чем чистого
кислорода при том же давлении.
В самом деле, если при нормальном давлении и при
температуре 0° насытить воду не чистым кислородом,
а воздухом, то в литре воды растворится только 10
кубических сантиметров кислорода вместо 50, а азота из воздуха
растворится 19 кубических сантиметров вместо 24.
В воде, содержащей различные соли, растворимость
газов снижается. В речной воде кислорода растворяется
меньше, чем в чистой (дистиллированной), а в морской
меньше, чем в речной.
Чтобы растворить газ в воде, его нужно привести в
соприкосновение или перемешать с водой; чтобы вытеснить
газ из воды, воду нужно подогреть. Доведя температуру
воды до 100°, можно почти полностью вытеснить из
нее газ.
17
Возьмите колбу,
наполненную доверху водой,
закройте ее пробкой, в которую
вставлена загнутая
стеклянная трубка. Второй конец
этой трубки вставьте в
стакан с водой и наденьте на
этот конец трубки
наполненную водой пробирку.
Доведите воду в колбе до
кипения. В опрокинутой
пробирке появится газ, тот самый
газ, который был растворен
в воде до ее кипячения.
Хотя до кипячения вода
соприкасалась только с
воздухом, но в силу различной
растворимости кислорода и
азота состав вытесненного
газа будет существенно
отличаться от состава обычного
воздуха. В него входит
1 объем кислорода и 2
объема азота. А это означает, что в полученном газе
кислорода уже не 21, как в воздухе, а 33 процента.
В обыкновенной, неочищенной воде, кроме
растворенного газообразного кислорода, имеется еще кислород,
входящий в состав растворенных в ней солей. Этот кислород
вытеснить кипячением нельзя, так как он прочно связан
с каким-нибудь другим элементом.
Чтобы освободить воду от солей, ее нужно перегнать.
Прибор для перегонки состоит из колбы для кипячения
воды, холодильника, где конденсируются пары, и
приемника, куда стекает дистиллированная вода.
Полученная таким образом вода содержит только
растворенные газы, которые можно вытеснить кипячением.
Что же содержится в воде, в которой нет ни солей, ни
растворенных газов?
Вода, как и всякое химическое соединение, состоит из
однородных молекул.
В состав молекулы воды (Н20) входит 2 атома
водорода и 1 атом кислорода, тесно связанные между собой.
Вытеснение воздуха из воды
кипячением: / — колба с водой;
2 — загнутая стеклянная трубка;
3 — стакан с водой; 4 —
пробирка, в которую собирается вьь
тесненный воздух.
18
В cmо><
Разделить, разорвать
молекулу воды на ее
составные части нелегко, на это
нужно затратить энергию.
Молекулярный вес
воды равен 18. Он состоит
из 2 атомных весов
водорода, равных 2 единицам,
и атомного веса
кислорода— 16. Следовательно, в
молекуле воды содержится
около 89 процентов
кислорода и около 11
процентов водорода. В
килограмме воды насчитывается
890 граммов кислорода.
Это означает, что все реки,
моря и океаны состоят
главным образом из
кислорода.
Вода занимает три
четверти земной поверхности.
Но в природе вода
встречается не только в жидком виде. В полярных странах и на
высоких горах круглый год сохраняются огромные толщи
льда и снега. Большие количества воды мы встречаем
в воздухе в виде пара.
Животные и растения больше чем наполовину состоят
из воды. В человеческом организме, при среднем весе тела
65—70 килограммов, содержится до 40 килограммов
воды.
Кислород в недрах земли
Примкнем к геологической экспедиции, выехавшей для
исследования недр в один из районов нашей страны.
Экспедиция разбивается на отдельные партии —
отряды.
Рано утром расходятся геологи по заранее
намеченным маршрутам.
Геологи-разведчики при помощи буровых инструментов
извлекают образцы пород из различных глубин земной
коры и собирают на поверхности земли скальные породы.
Лабораторная установка для
получения дистиллированной воды:
1 — колба для кипячения воды;
2 — холодильник; 3 — приемник.
19
Гидрогеологи занимаются исследованием водоносных
горизонтов грунтовых и поверхностных вод. Вечером,
вернувшись в свои походные палатки-лаборатории, они
производят анализы добытых за день образцов.
Перед нами принесенные геологами образцы пород,
содержащих кремний. Кремний по распространенности
в природе занимает второе место, после кислорода. Около
30 процентов веса земной коры состоит из кремния. Но
в природе кремний встречается не в свободном состоянии,
а в соединении с кислородом (Si02), которое химики
называют кремнеземом, а геологи — кварцем.
Земная кора на 65 процентов состоит из кремнезема.
Известны многочисленные разновидности этого
соединения. Кремний, кварц, горный хрусталь, простой песок,
точильный камень,
различные драгоценные
камни — все это родные
братья кремнезема.
А как многообразно
используется кремнезем
в быту и в технике!
Чайная и столовая
посуда, сделанная из
стекла, хрусталя, фарфора
и фаянса, кирпичные
здания,
железобетонные сооружения и
перекрытия, мосты, широкие
полотна автострад,
гранитные облицовки
величественных зданий и
набережных состоят
главным образом из
соединений кремния и
кислорода.
Еще задолго до
того, как человек начал
использовать кремний в
технике, в природе
растения использовали его
для своей жизни.
Прочность стебля
Облицовку зданий и набережных
делают из гранита.
Хрусталь — соединение кремния и
кислорода.
растений обусловлена
наличием в нем
кремния и кислорода. В
золе сгоревшей соломы
или трубок бамбука мы
находим много
кремнезема, который при
жизни растений настолько
укрепляет их стебли,
что они способны
устоять против сильных
порывов ветра и
грозовых ливней.
Декоративные растения подкармливают специальными
растворами солей кремнезема, чтобы укрепить их стебли и
лепестки цветка. Такие растения можно перевозить на
далекие расстояния.
Часто геологи-разведчики приносят с собой в палатку
светлосерый камень — известняк, одну из
кристаллических разновидностей углекислого кальция (СаС03).
В состав углекислого кальция входит 48 процентов
кислорода, 40 процентов кальция и 12 процентов углерода.
Из этих же элементов состоят мел и мрамор — другие
разновидности углекислого кальция.
Рассматривая известняк через лупу, иногда на его
срезах можно заметить очертания раковин морских
животных.
На необъятных просторах земли идет постоянный
процесс превращения нерастворимого в простой воде
углекислого кальция в растворимый. Потоки воды, насыщенные
углекислым газом и
содержащие углекислоту
(Н20+ С02 — Н2С03),
встречают на своем
пути углекислый кальций
(СаСОз) и, вступая с
ним во взаимодействие
(СаСОз + Н2С03 —
-> Са(НСОзЬ),
образуют соль, которая
растворяется в воде и
уносится в море. Для бес-
Посуда из хрусталя.
Известняк широко используется в строительстве.
позвоночных животных, которые живут в морях и
океанах, соли служат материалом для построения их
наружного покрова — раковинок. Раковинки погибших
животных скопляются на дне моря, постепенно образуя мощные
слои известняка и мела.
Геологи считают, что те пространства земли, на
которых сейчас встречаются огромные массивы известняка и
мела, были когда-то морским дном.
При постройке зданий и сооружений известняк
используется как строительный материал. Из известняка можно
изготовить облицовочные плиты.
Большое количество известняка в СоветскОхМ Союзе
используется для получения другого ценного
строительного материала — негашеной извести. Если углекислый
кальций прокалить, он разлагается на известь и
углекислый газ (СаСОз—>СаО + С02). Всю негашеную известь
и почти весь углекислый газ получают из известняка,
прокаливая его в специальных печах.
22
Геологи-разведчики принесли в палатку-лабораторию
образцы невзрачной на вид, но чрезвычайно ценной
руды, состоящей из гидратов окиси алюминия: А1(ОН)3
и АЮ(ОН). Смесь этих кислородных соединений
алюминия носит название бокситов. Они состоят из
алюминия, водорода и кислорода. Из бокситов получают
окись алюминия (А1203), которую в технике называют
глиноземом.
Глинозем является основным сырьем для производства
алюминия.
Но чтобы получить алюминий, нужен еще и криолит —
фтористая соль натрия и алюминия. Криолит в природе
встречается редко, но его можно получить искусственным
путем.
Алюминий получают электролизом в специальных
ваннах, в которые загружают криолит и глинозем. Под
действием постоянного тока температура в ванне повышается
настолько, что криолит расплавляется, В расплавленной
массе криолита растворяется глинозем. В растворе
глинозема под действием постоянного электрического тока идет
электролиз. Алюминий выделяется на графитовых стенках
ванны, к которым подведен отрицательный полюс
источника тока, а кислород, выделяясь на положительных
графитовых электродах, постепенно сжигает их в двуокись
углерода. На дне ванны скопляется расплавленный
алюминий, который сливают через специальные отверстия.
Так из бокситов получают серебристо-белый металл,
который обладает ценнейшими свойствами.
Сплав из 95 процентов алюминия и небольшого
количества меди, магния и железа — дюралюмин — прочен,
легок, почти в 3 раза легче железа. Дюралюмин
покрывают очень тонким слоем чистого алюминия, чтобы
предохранить его от разрушения на воздухе — коррозии. Это
объясняется не тем, что алюминий вовсе не окисляется
кислородом воздуха в присутствии влаги, а тем, что при
своем окислении алюминий покрывается тонкой пленкой
окиси, которая и предохраняет его от дальнейшего
разрушения.
Из алюминиевых сплавов изготовляют детали
самолетов, части к автомобилям и другим машинам. Из них
делают кухонную посуду, мебель, применяют в жилищном
строительстве. Порошок алюминия входит в состав красок,
23
Ванна для получения алюминия электролизом: / — подвод тока к
катоду; 2 — подвод тока к аноду; 3 — аноды; 4 —катоды; 5—-
расплавленный электролит; 6 — застывший электролит; 7 —
расплавленный алюминий.
При нагревании алюминий жадно поглощает кислород,
образуя окись алюминия. Реакция происходит с большим
выделением тепла.
Этим свойством алюминия пользуются в технике.
Алюминиевый порошок смешивают с магнитной окисью
железа (Fe304) и поджигают. Образуется высокая
температура, при которой легко плавится металл. Такая смесь
носит название термита и применяется для сварки
трамвайных рельсов и других железных и стальных изделий.
Термит используется и для военных целей. Им
заполняют специальные зажигательные артиллерийские
снаряды и авиационные бомбы.
В виде металла алюминий нигде в природе не ветре*
24
чается. Но в различных кислородных соединениях он
находится во всей земной коре.
Не вся земная кора доступна изучению.
Современная геологическая техника позволяет исследовать ее на
глубине 16—18 километров.
Алюминий составляет примерно 10 процентов веса
земной коры, доступной исследованию. Он встречается
не только в виде бокситов — он входит в состав глины
(А120з. 2Si02. 2Н20), слюды (2К20 . А1203. 6Si02. H20) и
полевых шпатов (К2О . А1203. 6Si02; Na20 . A1203. 6Si02).
Во всех этих соединениях алюминий связан с
кислородом.
Окись алюминия часто встречается в природе в виде
минерала. К наиболее твердым минералам относится
корунд, из которого изготовляют точильные камни и
который входит в состав
наждака.
Корунд и
наждак—серые камки, мало
привлекающие взгляд человека.
Встречаются и очень
красивые природные
драгоценные камни, состоящие
из алюминия, кислорода и
незначительной примеси
хрома, титана или
железа. Прекрасный рубин
сверкает своим
яркокрасным светом потому, что к
природной окиси
алюминия примешаны
незначительные следы хрома.
Такие же ничтожные
количества других металлов,
подмешанные к
глинозему, превращают его в
природе в зеленый
изумруд или фиолетовый
аметист.
Сейчас человек уже
разгадал тайны природы
и научился искусственным
Дюралюмин и изделия из него.
Добыча железкой руды открытым способом.
путем в специальных печах при высокой температуре
изготовлять некоторые драгоценные камни, которые не
только идут на украшения, но и применяются в технике.
В недрах земли находится еще одно кислородное
соединение — магнитная окись железа (Fe304). В технике
эту руду называют магнитным железняком. В земной коре
его насчитывается до 5 процентов.
Магнитный железняк залегает огромными массивами.
На Урале из него состоят целые горы: Магнитная,
Высокая и Благодать. Руда эта составляет смесь закиси
железа (FeO) и окиси (Fe203). Поэтому часто магнитный
железняк называют закись-окись железа (FeO.Fe203).
В природе часто встречается и другая разновидность
железной руды — окись железа (Fe203), или красный
железняк. Почти вся донецкая металлургическая
промышленность снабжается этой рудой. Огромные запасы ее
находятся в районе Кривого Рога и Курска.
Окись железа входит в состав бурого железняка —
водной окиси железа бурого цвета. Залежи бурого
железняка разрабатываются на Южном Урале, в Керчи и
других местах Советского Союза.
СССР занимает первое место в мире по запасам же*
26
лезной руды. Больше половины всех мировых запасов
железа падает на территорию Советского Союза.
В состав большинства полезных ископаемых,
встречающихся в недрах земли, в том или ином виде входит
кислород. Его можно встретить в химическом соединении
с легкими элементами, включая магний и алюминий, в
соединении с тяжелыми элементами, включая уран, с
щелочными металлами — натрием и калием, с
щелочноземельными металлами — кальцием, стронцием и барием
и в соединении с редкими элементами.
Кислород — самый распространенный элемент на
земле.
Много труда положили ученые, чтобы определить,
сколько кислорода находится в природе. В настоящее
время принято считать, что половину веса земной коры,
воздуха, воды, животных и растительных организмов
составляет кислород, а вторую половину — все остальные
элементы периодической системы Менделеева.
СВОЙСТВА КИСЛОРОДА
Место кислорода в периодической системе
Менделеева
Когда в 1868 году молодому, но уже известному
профессору Петербургского университета Дмитрию
Ивановичу Менделееву было поручено читать курс
неорганической химии, он столкнулся с тем, что в существовавших
книгах по химии не только отсутствует система в
изложении материала, но нет и материала, который следовало
бы рекомендовать студентам для серьезного изучения
этого предмета.
Появилась необходимость в создании
фундаментального труда, который стал бы основой для глубокого
изучения химии.
Менделеев взялся за написание такого труда, который
он назвал «Основы химии». Работая над составлением
«Основ химии», он понимал, что известные в то время
химические элементы существуют не в отрыве друг от друга,
а что между ними имеется связь, которую нужно найти и
выразить в простой, но стройной системе.
27
Менделеев писал: «Предприняв составление
руководства к химии, названного «Основы химии», я должен был
остановиться на какой-нибудь системе простых тел, чтобы
в распределении их не руководствоваться случайными,
как бы инстинктивными побуждениями, а каким-либо
определенно точным началом».
Упорно трудясь над этим «началом», Менделеев
тщательно изучал свойства и атомные веса известных ему
элементов.
Расположив химические элементы в порядке
возрастания атомных весов, он установил, что через определенное
число элементов свойства их повторяются.
Это означало, что те или иные свойства присущи не
только какому-нибудь одному химическому элементу,
обладающему определенным атомным весом. Аналогичными
свойствами обладают и другие элементы, атомные веса
которых больше, чем у данного элемента, на
определенную величину.
Несмотря на многочисленные неясности и
противоречия, Менделеев не сомневался, что им открыт общий
закон природы — закон о периодической зависимости
свойств элементов от pix атомных весов. Это означает, что
через определенные промежутки — периоды —
индивидуальные свойства химических элементов повторяются.
Расположив все химические элементы в таблицу,
иллюстрирующую открытый им периодический закон,
Менделеев разослал 1 марта 1869 года некоторым
русским и иностранным ученым отдельный листок,
озаглавленный: «Опыт системы элементов, основанной на pix
атомном весе и химическом сходстве».
Это был первоначальный вариант периодической
системы Менделеева, над которым великому русскому
ученому пришлось еще много поработать.
Атомные веса некоторых химических элементов были
ранее установлены неверно. Поэтому эти элементы не ста-
новились в те места, которые им надлежало занять в
периодической системе. Твердо веря в правильность своей
системы, Менделеев делает смелый и решительный вывод:
атомные веса некоторых элементов (бериллий, торий, уран
и др.) следует изменить. Изменяя их, он располагает эти
элементы в своей системе в соответствии с их
химическими свойствами.
28
Встретились и другие трудности.
Известные в то время химические свойства некоторых
элементов (бор, рубидий, таллий) не позволяли поместить
эти элементы в те места периодической системы, куда
они должны были бы войти в соответствии с их атомными
весами. Менделеев решил, что свойства этих элементов
описаны неверно и нуждаются в проверке. Впоследствии
уточнение свойств этих химических элементов полностью
подтвердило правильность предположений великого
ученого.
Когда долгий и упорный труд ученого воплотился
в стройную периодическую систему элементов, в таблице
оказались незаполненные места. Менделеев предсказал
существование еще не открытых в то время элементов,
которые должны были занять эти места в таблице, и
одновременно с определением их приблизительных атомных
весов предусмотрел для некоторых из них даже цвет и
растворимость.
Ученые всего мира были удивлены смелыми выводами,
которые сделал Менделеев. Но больше всего они
поразились, когда были открыты некоторые новые химические
элементы, предсказанные великим русским ученым.
Свойства этих элементов совпали с теми, которые
Дмитрий Иванович вывел на основании своей
периодической системы.
В настоящее время в периодической системе элементов
Менделеева не осталось ни одного незаполненного места.
Все клетки заняты соответствующими элементами. Более
того, открыты новые элементы, которые располагаются
в конце таблицы и расширяют ее, не нарушая общей
стройности системы.
Посмотрите внимательно на периодическую систему
элементов Менделеева.
Все элементы расположены по порядку номеров в семи
горизонтальных рядах — периодах, которые разбиты
вертикальными линиями на девять групп.
В первом периоде находятся всего 2 элемента —
водород (Н) и гелий (Не), стоящие под номерами 1 и 2. Во
втором и третьем периодах — по 8 химических элементов.
В четвертом, пятом и шестом периодах — по 18. В
седьмом периоде Менделеев поместил 6 элементов, из которых
последним был уран.
29
Перио1
Ды
1
2
3
4 1
5
6
7
ГРУППЫ
1 1
Н 1
Водород
1,003 |
Li 3
Литий
6,9 |
Na 11
Натрий
23
К 19
Налий
39 1
29 CU
Медь
63,6
Rb 37
Рубидий
85,5
47 Ад
Серебро
107,9
CS 55
Цезий
13 2,9
79 Аи
Золото
197,2
Fr 87
Франций
(223)
[) |
Be 4
Бериллий
9
Мд 12
Магний
24,3
Са 20
Иальций
40,1
зо 2п
Цинн
66,4
Sr 38
Стронций
87,6
48 Cd
Надмий
112,4
Ва 56
Барий
137,4
80 Нд
Ртуть
| 200,6
Ra 88
Радий
| 226,1
ill
б В
5 0/)
10,8
13 AI
Алюминий
27
SC 21
Снандий
45.1
31 Ga
Галлий
69,7
Yt 39
Иттрий
68,9
49 In
Индий
114,8
La 57-71*
Лантан
138,9
81 TI
Таллий
204,4
Ас 89
Актиний
(227)
iv !
6 С
Углерод
12
14 Si
И рем ни и
28,1
Ti 22
Титан
47,9
32 Ge
Германий
72,6
Zr 40
Цирконий
91,2
50 Sn
118,7
Hf 72
Гафний
178,6
82 Pb
Свинец
207,2
Th 90
Торий
232,1
V
7 N
Азот
14
16 Р
фосфор
31
V 23
Ванадий.
3i
33 AS
Мышьяк
74,9
Nb 4i
Ниобий
92,9
51 Sb
Сурьма
121,8
Та 73
Тантал
180,9
83 В»
Висмут
209
Pa G!
Протактиний
231
* Редкоземельные
Се 58
Церий
Н0,1
ТЬ 65
Тербий
159,2
I Рг 59
Празеодим
| 140,9
Dy 66
Диспрозий
| 162,5
Nd 60
Неодим
144,3
Но 67
Гольмий
164,9
Pm 61
Прометий
(147J
Ег 68
Эрбий
167,2
Sm 62
Самарий
150,4
Ти 69
Тулий
169,4
* * Трансурановые
1 Np 93
Нептуний
1 (^37)
1 Ри 94
Плутоний
1 (239)
Am 95
Америций
(241)
Cm 96
Нюрий
(242)
Вк 97
Берклий
1 (243)
Периодическая система
¦ '
ЭЛЕМЕНТОВ 1
VI
8 0
Кислород
16
16 S
Сера
32,1
СГ 24
Хром
52
34 Se
Селен
79
МО 42
Молибден
96
52 Те
Теллур
127,6
W 74
Вольфрам
183,9
84 Ро
Полоний
(210)
U 92**
Уран
238,1
VII
9 F
Фтор
19
17 CI
Хлор
35,5
Мп 26
Марганец
54,9
35 Вг
Бром
79,9
Тс 43
Технеи,ий
(99)
53 J
Иод
{26,9
Re 75
Рений
186,3
85 At
Астатин
(211)
э л е м е кты
Еи 63
Европий
152
Yb 70
Иттербий
173
Gd 64
Гадолиний
156,9
Lu 71
Лютеций
175
элепе нты
Cf 98
Калифорний
i (244)
An 93
Афиний
(248)
VIII
Fe 26
Железо
55,9
Co 27
Кобальт
58,9
Ni 28
Нинель
58,7
Ru 44
101,7
Rh 45
Родий
102,9
Pd 46
Палладий
106,7
OS 76
190,2
Ir 77
Иридий
193,1
Pt 78
Платина
195,2
0 I
He 2
Гелий ]
4 j
Ne Ю
20,2 j
Ar 18 j
Аргон j
39,9 j
Кг 36
Криптон J
83,7 |
Xe 541
Ксенон 1
131,3 ]
Rn 86
Радон ]
222 j
Ct ioo
(248)
элементов Менделеева.
В настоящее время открыто еще 8 элементов,
входящих в семейство урана. Они получили название
трансурановых элементов.
Элементы, расположенные друг под другом в
вертикальных рядах, обладают близкими химическими
свойствами. Свойства эти прежде всего выражены в
одинаковой валентности, которую проявляют элементы данной
группы при своем соединении с кислородом. Поэтому
формулы высших солеобразующих окислов для
элементов каждой группы одинаковы.
Так, например, щелочные металлы первой группы —
литий, натрий, калий и др.— проявляют одну валентность.
Их окислы имеют общую формулу R20, где под знаком R
обозначается любой элемент данной группы.
Щелочноземельные элементы второй группы —
бериллий, магний, кальций, стронций и др. — проявляют две
валентности, и их окислы выражаются формулой RO.
Галогены седьмой группы — фтор, хлор, бром и иод —
проявляют при образовании кислородных соединений семь
валентностей, и формулы их высших окислов
записываются в виде R2O7.
Наивысшая валентность, которую может проявить
данный элемент, соответствует номеру группы периодической
системы, в которой он расположен.
Первым в шестой группе периодической системы, под
номером 8, расположен кислород. Подсчитаем все
стоящие впереди элементы. Их семь. Это водород с
атомным весом 1, гелий — 4, литий, — 6,9, бериллий — 9,
бор—10,8, углерод—12 и азот—14. Атомный вес
кислорода—16. Он самый тяжелый из первых восьми
элементов, а так как в периодической системе они
расположены по возрастанию атомных весов, его порядковый
номер, естественно, равен восьми.
Что означает порядковый номер элемента?
Для того чтобы ответить на этот вопрос, необходимо
хотя бы кратко ознакомиться со строением атома.
В современном представлении атом любого элемента
состоит из положительно заряженного ядра, вокруг
которого вращаются отрицательно заряженные электроны.
Ядра различных элементов отличаются друг от друга
числом входящих в них заряженных частиц.
Положительно заряженные частицы носят название протонов.
32
В атоме водорода,
который стоит под номером 1,
всего лишь 1 протон; вокруг
него вращается 1 электрон.
Гелий стоит под номером 2.
В ядре его атома 2
протона, и вокруг них
вращаются 2 электрона. Третьим в
периодической системе стоит
литий; в его ядре 3 протона,
вокруг которых вращаются
3 электрона. Под номером 8
расположен кислород. Ядро
атома кислорода содержит упр<ЯЦенная схема строения
8 протонов, и вокруг этого атома кислорода,
ядра вращаются 8
электронов.
Теперь уже нетрудно догадаться, что порядковый
номер в периодической системе Менделеева равен числу
протонов в ядре данного атома или числу электронов,
вращающихся вокруг ядра. Это относится ко всем элементам,
в том числе и к такому тяжелому элементу, как уран,
порядковый номер которого равен 92. Ядро атома урана
включает в себя 92 протона, вокруг которого на
различных расстояниях, в различных направлениях движутся
92 электрона.
Электроны в атоме вращаются вокруг ядра, в
определенном порядке, группами, в слоях, по-разному
удаленных от ядра. Слоев в атоме может быть не больше восьми.
Химические свойства атомов определяются зарядом
ядра и строением внешнего, последнего слоя атома. Чем
число электронов на этом внешнем слое ближе к восьми,
тем атом устойчивее.
Так как число электронов в атоме равно числу
протонов, атомы электрически нейтральны, они не заряжены ни
положительно, ни отрицательно.
Интересно было бы взглянуть на какой-нибудь атом
через мощный микроскоп и посмотреть, как ведут себя
в нем электроны и протоны. Но это сделать невозможно,
так как нет и не может быть оптического микроскопа,
в который можно было бы разглядеть частицы, размеры
которых меньше длины волны видимого света.
33
Длина волны лучей видимого света равна примерно
от 4 до 7 стотысячных сантиметра, а диаметр самого
простого из всех атомов — атома водорода — равен одной
стомиллионной сантиметра.
Как ни мала эта величина, однако она оказывается
огромной по сравнению с ядром атома. Ядро атома
водорода в 10 тысяч раз меньше самого атома.
Чтобы представить себе соотношение размеров и
расстояний между ядром и электроном в атоме водорода,
вообразите огромный пустой шар диаметром 50 метров.
В центре этого шара находится свинцовая дробь
диаметром 5 миллиметров, а по окружности с огромной
скоростью, превышающей 200 километров в секунду,
вращается полый алюминиевый шарик несколько большею
размера.
Чем дальше от водорода стоит элемент в
периодической системе Менделеева, тем сложнее строение его
атома.
Размеры электронов и протонов близки друг другу, но
массы их различны.
Масса электрона чрезвычайно мала — она равна 9,
деленным на 10 000 000 000 000 000 000 000 000 000 граммов
(9,1 X Ю-28 граммов), а масса протона в 1840 раз
больше. Поэтому вес атома определяется главным образом
массой его протонов.
Если принять вес 1 атома водорода, состоящего из
1 протона и 1 электрона, за единицу, то вес атома,
состоящего из 2 протонов и 2 электронов, должен быть в 2 раза
больше, а вес атома, состоящего из 8 протонов и 8
электронов, должен быть в 8 раз больше, чем вес атома
водорода.
Посмотрите еще раз на периодическую систему
элементов Менделеева. Под номером 2 стоит элемент гелий,
имеющий 2 протона. Его атомный вес равен 4. Он в 4 раза
больше атомного веса водорода, а по нашим расчетам он
должен быть больше только в 2 раза. Такое же
несоответствие мы наблюдаем и у кислорода, расположенного в
восьмой клетке. Атом кислорода оказывается в 16 раз
тяжелее атома водорода, а не в 8, как это вытекает из
сравнения числа протонов, входящих в состав их атомов.
Не вкралась ли в наши представления об атоме ошибка?
Нет, мы просто не всё еще узнали о строении атома.
34
Ядра атомов водорода
действительно состоят главным образом из
одних протонов. Ядра атомов всех
остальных элементов, кроме
протонов, содержат еще и другие
частицы — нейтроны.
Нейтроны электрически
нейтральны, поэтому они не влияют на заряд
атома. Но они влияют на атомный
вес элемента, так как их масса
примерно равна массе протонов. Таким
образом, атомный вес складывается
из массы всех протонов и нейтронов,
входящих в ядро атома данного эле- Схема атома кислорода,
мента.
Если атомный вес кислорода
равен 16, а протонов в ядре 8, то нейтронов в ядре атома
кислорода тоже 8. Следовательно, атом кислорода состоит
из ядра, содержащего 8 протонов и 8 нейтронов, а вокруг
этого ядра вращаются 8 электронов.
Вас, наверное, удивит, если вам скажут, что
существует кислород с атомным весом 14, 15, 16, 17, 18 и 19.
Это изотопы кислорода, которые встречаются в природе
или могут быть получены искусственно.
Слово «изотоп» означает — занимать одно и то же
место. Все изотопы одного элемента располагаются в
системе элементов Менделеева под одним номером.
Химические свойства изотопов одного и того же
элемента настолько близки, что разделить их даже самыми
сложными химическими методами почти невозможно.
Это объясняется прежде всего тем, что заряды ядер и
строение внешней электронной оболочки атомов изотопов
одного и того же элемента совершенно одинаковы. В ядрах
содержится одинаковое число протонов, вокруг которых
вращается одинаковое число электронов. Изотопы
отличаются лишь числом нейтронов в их ядрах.
В настоящее время точно установлено, что почти все
элементы представляют собой смеси изотопов. Так,
например, известны 3 изотопа водорода с атомными весами
1, 2 и 3. Особенно интересен изотоп водорода с атомным
весом 2. Он имеет свое особое название — дейтерий (D).
Вода, в состав которой входит дейтерий, называется тя-
35
желой водой (D20). Тяжелая вода встречается в природе.
Она входит в незначительном количестве в состав
дождевой воды — на каждые 5 тонн ее приходится около
килограмма.
Ядро изотопа водорода — дейтерия — содержит 1
протон и 1 нейтрон, а ядро изотопа водорода с атомным
весом 3 — трития (Т) — состоит из 1 протона и 2 нейтронов.
Из чего же состоят ядра изотопов кислорода? Они,
как и у обычного кислорода, имеют 8 протонов, а
следовательно, и 8 электронов вокруг ядра. В кислороде с
атомным весом 14 (О14) имеется всего лишь 6 нейтронов,
а с атомным весом 19 (О19) их насчитывается 11.
Изотопы кислорода О14, О15, О19 неустойчивы, их ядра сами
по себе разрушаются, переходя в атомы других
элементов.
Самопроизвольный распад атомов идет обычно с
выделением больших количеств энергии и носит название
радиоактивности.
Время, за которое распадается половина взятого
количества радиоактивного вещества, называется периодом
полураспада или продолжительностью жизни данного
элемента. Так, например, период полураспада изотопа О14
составляет 76,5 секунды. Это значит, что за это время
распадается половина первоначального веса изотопа. Изотоп
О15 живет 126 секунд, а изотоп О19 — 29,4 секунды.
Кислород с атомным весом 17 и 18 довольно устойчив.
В обычном кислороде содержится 99,757 процента
кислорода с атомным весом 16; 0,039 процента кислорода
с атомным весом 17; 0,204 процента изотопа О18.
Вода, воздух, соли и другие соединения, в которые
входит кислород, также содержат небольшое количество
тяжелого кислорода О18. Но если увеличить процентное
содержание О18 в обычном кислороде и приготовить из него
воду, соли или газы, у которых процентное содержание
тяжелого изотопа кислорода будет больше обычного,
можно при помощи этих соединений проделать опыты,
которые позволят раскрыть механизм отдельных процессов,
протекающих в животных организмах, в природе или
в лабораториях. Этим целям служат также некоторые
радиоактивные элементы.
При распаде радиоактивных элементов выделяются
невидимые лучи, которые действуют на фотопленку или фо-
36
топластинку, так же как
рентгеновские лучи, при помощи
которых делают снимки для
выяснения различных
заболеваний.
Ученые воспользовались
радиоактивным излучением
изотопов, чтобы выяснить, как
распространяются различные
вещества в живых организмах,
с какой скоростью они
продвигаются и в каких местах
концентрируются. До применения
радиоактивных элементов для
ответа на такие вопросы надо
было вскрыть подопытное ЖИ- Снимок с растения, под-
вотное или растение, нарушить кормленного радиоактив-
жизненные функции живого ным изотопом фосфора,
организма. Теперь
радиоактивные элементы помогают ученым сравнительно легко
получать исчерпывающий ответ на эти вопросы.
Например, чтобы определить распространение
фосфора в растении, его подкармливают радиоактивным
изотопом этого элемента. Одновременно к растению
подставляют фотопластинку, на которой фиксируются пути
продвижения фосфора и места, в которых он
концентрируется. Фотоснимок показывает, что фосфор собирается
главным образом в корнях, почках и цветках растения.
Ученым также удалось определить скорость
продвижения солей фосфора вдоль стебля растения. Оказывается,
что соли фосфора продвигаются в растении со скоростью
10 сантиметров в час.
Естествоиспытателей давно интересовал вопрос о
происхождении кислорода, выделяемого растениями при
питании. Разрешить эту интересную проблему помог
тяжелый изотоп кислорода с атомным весом 18.
Физические свойства кислорода
Где бы мы ни находились, нас всюду окружает
кислород воздуха. Почему же мы не замечаем и не чувствуем
его? Кислород, азот, аргон и другие газы, входящие в со-
37
став воздуха, бесцветны и не имеют ни запаха, ни вкуса.
Газообразный воздух нельзя ни видеть, ни ощущать.
Воздух из газообразного состояния можно перевести
в жидкое. Одновременно с основной массой воздуха —
азотом — в жидкое состояние перейдут кислород и
большинство других газов, входящих в его состав.
Чтобы газообразный кислород превратить в жидкость,
его нужно сжать до 50 атмосфер и охладить до —119°.
Жидкий кислород можно получить и при атмосферном
давлении, но для этого нужно газообразный кислород
охладить до температуры —183°. При более сильном
охлаждении, до температуры —220°, жидкий кислород
затвердевает и превращается в снегообразную массу.
Если на некоторое время в жидкий кислород
поместить кусочек резины, она потеряет свою эластичность и
под ударом разлетится на мелкие части.
Такую же хрупкость приобретает и цинковая
пластинка, охлажденная в жидком кислороде до температуры
—183°. Жидкая ртуть при такой температуре
превращается в твердую массу, которую можно ковать, как свинец,
а свинец приобретает способность звенеть, как бронзовый
колокольчик.
Жидкий кислород имеет голубоватый цвет. Его можно
легко переливать из сосуда в сосуд. При переливании
жидкий кислород «парит». Но это не пары кислорода,
а пары воды. Жидкий кислород, испаряясь, поглощает
много тепла из окружающего воздуха. Воздух сильно
охлаждается, и влага, находящаяся в воздухе,
конденсируется, образуя туман. Этот туман и создает впечатление
пара, исходящего из самой жидкости.
Температура кипения жидкого кислорода равна —183°.
Если фарфоровый стакан с жидким кислородом
вынести зимой на мороз 30—40°, он будет кипеть
более бурно, чем вода на самом сильном огне газовой
плиты.
При комнатной температуре испарение жидкого
кислорода идет еще энергичнее, и он быстро переходит в
газообразное состояние.
Чтобы использовать жидкий кислород, его необходимо
сохранить. Как же заставить эту бурно кипящую жидкость
не так быстро испаряться?
Для этого служат специальные сосуды, в которых лег-
38
ко удается «укротить» эту быстро
испаряющуюся жидкость.
Сосуд для хранения жидкого
кислорода представляет собой цилиндр с
двойными стенками. Внутренние
стороны стенок обычно покрывают тонким
слоем серебра. Воздух между стенками
сосуда выкачивается.
Разреженные газы плохо проводят
тепло, а зеркальная поверхность
серебра хорошо отражает его. Таким
образом, жидкий кислород, который
находится в сосуде, изолирован от внешнего
тепла, что обеспечивает сохранение
жидкого кислорода в течение одних-
двух суток.
При испарении жидкого кислорода
объем его увеличивается почти в
800 раз. Из кубического сантиметра
жидкого кислорода образуется около
800 кубических сантиметров
газообразного.
Хранить жидкий кислород в
закрытых сосудах опасно: внутри сосуда
может образоваться большое давление,
приводящее к взрыву. Поэтому сосуды
для хранения жидкого кислорода
сверху открыты. Воздух, находящийся над
жидкостью, сильно охлаждается и
предохраняет кислород от наружного
тепла, замедляя дальнейшее испарение.
Для перевозки небольших количеств
жидкого кислорода используют металлические сосуды
емкостью 15—25 литров.
Металлические сосуды состоят из двух шаров или
цилиндров, вставленных друг в друга. Внутренний шар или
цилиндр имеет высокое и узкое горло, через которое сосуд
заполняется жидким кислородом. Горло всегда остается
открытым. Из пространства между стенками сосуда
воздух выкачан, и создан высокий вакуум, то-есть сильное
разрежение.
Чтобы поддержать высокий вакуум, часть простран-
39
Стеклянный сосуд
для хранения
небольшого
количества жидкого
кислорода: /—жидкий
кислород; 2 —
разреженное
пространство; 3 — по»
верхности,
посеребренные внутри.
ства между стенками
заполняется силикагелем,
способным при низкой температуре
поглощать количество газа
в сотни раз больше своего
собственного объема. Если
через стенки или через места
спайки со временем
просочится небольшая часть
воздуха, он поглотится
силикагелем и разрежение не
уменьшится. Высокий вакуум
обеспечивает постоянную
изоляцию сосуда от
внешнего тепла и дает возможность
в течение двух и более
суток сохранять в нем жидкий
кислород. Такие сосуды
обычно помещают в
железные цилиндры.
Пространство между
сосудом и наружным
цилиндром заполняют
теплоизоляционным материалом. Для
переноски на наружном
цилиндре имеются ручки.
Большие количества
жидкого кислорода перевозятся
по железной дороге и
автотранспортом в специальных цистернах или танках. Они
хорошо изолированы от внешнего тепла. Емкость
транспортных танков различна: от 1 тысячи до 10 тысяч
литров. Цистерны, в которых жидкий кислород перевозят
по железной дороге, вмещают до нескольких десятков
тонн.
Жидкий кислород можно получить из жидкого
воздуха, который образуется при низких температурах и
высоком давлении.
Высокое давление создают в машинах, которые
называются компрессорами. Их приводят в движение
электродвигатели.
Ниже мы еще остановимся на получении кислорода из
Металлический сосуд для
перевозки жидкого кислорода: 1 —
жидкий кислород; 2 —
разреженное пространство; 3—си-
ликагель; 4 —
теплоизоляционный материал; 5 — железный
цилиндр.
40
воздуха, а пока зайдем в помещение, где работают
электродвигатели и в котором мы умышленно выключили
вентиляцию. Сами по себе эти двигатели не могут служить
источником загрязнения воздуха, так как они ничего из
воздуха не потребляют и ничего в воздух не отдают.
Однако при дыхании здесь чувствуется некоторое
раздражение в горле. Что произошло с воздухом, который был
чист до пуска двигателей?
В этом помещении работают так называемые
коллекторные моторы. На подвижных контактах мотора —
ламелях — часто образуется искра. В искре при высокой
температуре молекулы кислорода соединяются между
собой, образуя озон (03).
Молекула кислорода состоит из 2 атомов, которые
всегда проявляют две валентности (0 = 0).
Как же представить себе строение молекулы озона?
Валентность кислорода измениться не может: атомы
кислорода в озоне должны также иметь двойную связь.
Поэтому молекулу озона обычно изображают в виде
треугольника, в углах которого расположены 3 атома
кислорода
40-О/.
Озон — газ голубоватого цвета с резким
специфическим запахом. Образование озона из кислорода
происходит с большим
поглощением тепла (302 -f-
+ 69 000 кал^203).
Слово «озон» взято из
греческого «аллос» —
другой и «тропос» —
поворот и означает
образование простых веществ
из одного и того же
элемента.
Озон является
аллотропическим видоизменением
кислорода. Это простое
вещество. Его молекула
состоит из 3 атомов кис- Жидкий кислород перевозят в
лорода. В технике озон специальных сосудах — танках.
получают в специальных
приборах, называемых
озонаторами.
В этих приборах кислород
пропускают через трубку, в
которой помещен электрод,
подключенный к источнику
тока высокого напряжения.
Вторым электродом служит
проволока, намотанная на
наружной части трубки.
Между электродами создается
электрический разряд, в
котором из кислорода
образуется озон. Кислород,
выходящий из озонатора,
содержит около 15 процентов
озона.
Озон образуется также
при действии на кислород
лучей радиоактивного
элемента радия или сильного
потока ультрафиолетовых
лучей. Кварцевые лампы,
которые широко применяются
в медицине, излучают
ультрафиолетовые лучи. Вот
почему в помещении, где долго
работала кварцевая лампа,
воздух становится
удушающим.
и химическим путем —
действием концентрированной серной кислоты на мар-
ганцевокислый калий или окислением влажного
фосфора.
Молекулы озона очень неустойчивы и легко
распадаются с образованием молекулярного и атомарного
кислорода (03 = 02 + 0)- Так как атомарный кислород
чрезвычайно легко окисляет различные соединения, озон
является сильным окислителем. При комнатной
температуре он легко окисляет ртуть и серебро, которые в
атмосфере кислорода достаточно устойчивы,
42
Озонированный
кислород
<%
или воздух
у И источнику
высокого напряжения
У*
Иислород или воздух
\ И источник!/ высокого
напряжения
Простейший озонатор.
Можно получить озон
Санаторий в сосновом лесу.
Под действием озона органические красители
обесцвечиваются, а каучуковые изделия разрушаются, теряют
эластичность и трескаются при легком сжатии.
Такие горючие вещества, как эфир, спирт, светильный
газ, воспламеняются при соприкосновении с сильно
озонированным воздухом. Вата, через которую пропускают
озонированный воздух, также воспламеняется.
Сильные окислительные свойства озона применяются
для обеззараживания воздуха и воды. Озонированный
воздух, пропущенный через воду, уничтожает в ней
болезнетворные бактерии и несколько улучшает ее вкус и цвет.
Озонирование воздуха с целью уничтожения
вредоносных бактерий не находит широкого применения, так как
для эффективной очистки воздуха необходима значитель*
ная концентрация озона, а в большой концентрации он
вреден для здоровья человека — вызывает сильное
удушье.
43
В малых концентрациях озон даже приятен. Так
бывает, например, после грозы, когда в огромной
электрической искре блеснувшей молнии из кислорода воздуха
образуется озон, который постепенно распределяется
в атмосфере, вызывая легкое, приятное ощущение при
дыхании. То же мы испытываем в лесу, особенно в густом
сосновом бору, где под воздействием кислорода
происходит окисление различных органических смол с выделением
озона. Скипидар, который входит в состав смолы
хвойного дерева, окисляется особенно легко. Вот почему
в хвойных лесах воздух всегда содержит некоторое
количество озона.
У здорового человека воздух соснового бора вызывает
приятное ощущение. А для человека с больными легкими
этот воздух полезен и необходим для лечения. Советское
государство использует богатые сосновые леса в
различных районах нашей родины и создает там лечебные
санатории.
Химические свойства кислорода
Кислород вступает в соединения почти со всеми
элементами периодической системы Менделеева.
Реакция соединения любого вещества с кислородом
называется окислением.
Большинство таких реакций идет с выделением тепла.
Если при реакции окисления одновременно с теплом
выделяется свет, ее называют горением. Однако не всегда
удается заметить выделяющиеся тепло и свет, так как
в некоторых случаях окисление идет чрезвычайно
медленно. Заметить тепловыделение удается тогда, когда
реакция окисления происходит быстро.
В результате любого окисления — быстрого или
медленного — в большинстве случаев образуются окислы:
соединения металлов, углерода, серы, фосфора и других
элементов с кислородом.
Вам, вероятно, не раз приходилось видеть, как
перекрывают железные крыши. Перед тем как покрыть их
новым железом, старое сбрасывают вниз. На землю
вместе с железом падает бурая чешуя — ржавчина. Это
гидрат окиси железа, который медленно, в течение нескольких
44
лет, образовывался на железе
под действием кислорода, влаги
и углекислого газа.
Ржавчину можно
рассматривать как соединение окиси железа
с молекулой воды (Fe203. Н20).
Она имеет рыхлую структуру и не
предохраняет железо от
разрушения.
Для предохранения железа от
разрушения — коррозии — его
обычно покрывают краской или
другими коррозионно устойчивыми
материалами: цинком, хромом,
никелем и другими металлами.
Предохранительные свойства этих
металлов, как и алюминия, основаны
на том, что они покрываются
тонкой устойчивой пленкой своих Горение железной про-
окислов, предохраняющих покры- волоки в кислороде,
тие от дальнейшего разрушения.
Предохранительные покрытия значительно замедляют
процесс окисления металла.
В природе постоянно происходят процессы медленного
окисления, сходные с горением.
При гниении дерева, соломы, листьев и других
органических веществ происходят процессы окисления
углерода, входящего в состав этих веществ. Тепло при этом
выделяется чрезвычайно медленно, и поэтому обычно оно
остается незамеченным.
Но иногда такого рода окислительные процессы сами
по себе ускоряются и переходят в горение.
Самовозгорание можно наблюдать в стоге мокрого
сена.
Быстрое окисление с выделением большого
количества тепла и света можно наблюдать не только при
горении дерева, керосина, свечи, масла и других горючих
материалов, содержащих углерод, но и при горении
железа.
Налейте в банку немного воды и наполните ее
кислородом. Затем внесите в банку железную спираль, на конце
которой укреплена тлеющая лучинка. Лучинка, а за ней
45
и спираль загорятся ярким пламенем, разбрасывая во все
стороны звездообразные искры.
Это идет процесс быстрого окисления железа
кислородом. Он начался при высокой температуре, которую дала
горящая лучинка, и продолжается до полного сгорания
спирали за счет тепла, выделяющегося при горении
железа.
Тепла этого так много, что образующиеся при горении
частицы окисленного железа накаляются добела, ярко
освещая банку.
Состав окалины, образовавшейся при горении железа,
несколько иной, чем состав окисла, образовавшегося
в виде ржавчины при медленном окислении железа на
воздухе в присутствии влаги.
В первом случае окисление идет до закиси-окиси
железа (Fe304), входящей в состав магнитного железняка;
во втором — образуется окисел, близко напоминающий
бурый железняк, который имеет формулу 2Fe203. Н20.
Таким образом, в зависимости от условий, в которых
протекает окисление, образуются различные окислы,
отличающиеся друг от друга содержанием кислорода.
Так, например, углерод в соединении с кислородом
дает два окисла — окись и двуокись углерода. При
недостатке кислорода происходит неполное сгорание углерода
с образованием окиси углерода (СО), которую в
общежитии называют угарным газом. При полном сгорании
образуется двуокись углерода, или углекислый газ (С02).
Фосфор, сгорая в условиях недостатка кислорода,
образует фосфористый ангидрид (Р2О3), а при избытке —
фосфорный ангидрид (Р2О5). Сера в различных условиях
горения также может дать сернистый (S02) или серный
(S03) ангидрид.
В чистом кислороде горение и другие реакции
окисления идут быстрее и доходят до конца.
Почему же в кислороде горение идет энергичнее, чем
в воздухе?
Обладает ли чистый кислород какими-то особыми
свойствами, которых нет у кислорода воздуха? Конечно,
нет. И в том и в другом случае мы имеем один и тот же
кислород, с одинаковыми свойствами. Только в воздухе
кислорода содержится в 5 раз меньше, чем в таком же
объеме чистого кислорода, и, кроме того, в воздухе кисло-
46
Горение водорода в кислороде.
род перемешан с большими
количествами азота, который
не только сам не горит, но и
не поддерживает горение.
Поэтому, если
непосредственно около пламени
кислород воздуха уже
израсходован, то другой его порции
необходимо пробиваться
через азот и продукты горения.
Следовательно, более
энергичное горение в атмосфере
кислорода можно объяснить
более быстрой подачей его
к месту горения. При этом
процесс соединения
кислорода с горящим веществом идет
энергичнее и тепла
выделяется больше. Чем больше в
единицу времени подается к горящему веществу
кислорода, тем пламя ярче, тем температура выше и тем
сильнее идет горение.
А горит ли сам кислород?
Возьмите цилиндр и опрокиньте его вверх дном.
Подведите под цилиндр трубку с водородом. Так как водород
легче воздуха, он полностью заполнит цилиндр.
Зажгите водород около открытой части цилиндра
и введите в него сквозь пламя стеклянную трубку, через
которую вытекает газообразный кислород. Около конца
трубки вспыхнет огонь, который будет спокойно гореть
внутри цилиндра, наполненного водородом. Это горит не
кислород, а водород в присутствии небольшого
количества кислорода, выходящего из трубки.
Что же образуется в результате горения водорода?
Какой при этом получается окисел?
Водород окисляется до воды. Действительно, на
стенках цилиндра постепенно начинают осаждаться капельки
конденсированных паров воды. На окисление 2 молекул
водорода идет 1 молекула кислорода, и образуются 2
молекулы воды (2Н2 + 02—^2Н20).
Если кислород вытекает из трубки медленно, он весь
сгорает в атмосфере водорода, и опыт проходит спокойно.
47
Стоит только увеличить подачу кислорода настолько,
что он не успеет сгореть полностью, часть его уйдет за
пределы пламени, где образуются очаги смеси водорода
с кислородом, появятся отдельные мелкие вспышки, похо-
жие на взрывы.
Смесь кислорода с водородом — это гремучий газ.
Если поджечь гремучий газ, произойдет сильный взрыв:
при соединении кислорода с водородом получается вода
и развивается высокая температура. Пары воды и
окружающие газы сильно расширяются, создается большое
давление, при котором может легко разорваться не только
стеклянный цилиндр, но и более прочный сосуд. Поэтому
работа с гремучей смесью требует особой осторожности.
Кислород обладает еще одним интересным свойством.
Он вступает в соединение с некоторыми элементами,
образуя перекисные соединения.
Приведем характерный пример. Водород, как известно,
одновалентен, кислород двухвалентен: 2 атома водорода
могут соединиться с 1 атомом кислорода. При этом
получается вода. Строение молекулы воды обычно
изображают Н — О — Н. Если к молекуле воды присоединить
еще 1 атом кислорода, то образуется перекись водорода»
формула которой Н202.
Куда же входит второй атом кислорода в этом
соединении и какими связями он удерживается? Второй атом
кислорода как бы разрывает связь первого с одним из
атомов водорода и становится между ними, образуя при
этом соединение Н — О — О — Н. Такое же строение
имеет перекись натрия (Na — О — О — Na), перекись ба-
Ва
/ \
рия (О О).
Характерным для перекисных соединений является
наличие 2 атомов кислорода, связанных между собой одной
валентностью. Поэтому 2 атома водорода, 2 атома натрия
или 1 атом бария могут присоединить к себе не 1 атом
кислорода с двумя валентностями (— О —), а 2 атома,
у которых в результате связи между собой также остается
только две свободные валентности (— О — О —).
Перекись водорода можно получить действием
разбавленной серной кислоты на перекись натрия (Na202)
или перекись бария (Ва02). Удобнее пользоваться пере-
48
кисью бария, так как при действии на нее серной кисло-
той образуется нерастворимый осадок сернокислого бария,
от которого перекись водорода легко отделить путем
фильтрования (Ва02 + H2S04 —* BaS04 + Н202).
Перекись водорода, как и озон, — соединение
неустойчивое и разлагается на воду и атом кислорода (Н202 —>
—*Н20 + 0), который в момент выделения обладает
большой окислительной способностью. При низких
температурах и в темноте разложение перекиси водорода идет
медленно. А при нагревании и на свету оно происходит
значительно быстрее. Песок, порошок двуокиси марганца,
серебра или платины также ускоряют разложение
перекиси водорода, а сами при этом остаются без изменения.
Вещества, которые только влияют на скорость химической
реакции, а сами остаются неизмененными, называются
катализаторами.
Если налить немного перекиси водорода в склянку, на
дне которой находится катализатор — порошок двуокиси
марганца, разложение перекиси водорода пойдет с такой
быстротой, что можно будет заметить выделение
пузырьков кислорода.
Способностью окислять различные соединения
обладает не только газообразный кислород, но и некоторые
соединения, в состав которых он входит.
Хорошим окислителем является перекись водорода.
Она обесцвечивает различные красители и поэтому
применяется в технике для отбеливания шелка, меха и других
изделий.
Способность перекиси водорода убивать различные
микробы позволяет применять ее как дезинфицирующее
средство. Перекись водорода употребляется для
промывания ран, полоскания горла и в зубоврачебной
практике.
Сильными окислительными свойствами обладает
азотная кислота (HN03). Если в азотную кислоту добавить
каплю скипидара, образуется яркая вспышка: углерод
и водород, входящие в состав скипидара (Ci0Hi6), бурно
окислятся с выделением большого количества тепла.
Бумага и ткани, смоченные азотной кислотой, быстро
разрушаются. Органические вещества, из которых сделаны
эти материалы, окисляются азотной кислотой и теряют
свои свойства. Если шоченную азотной кислотой бумагу
49
или ткань нагреть, процесс окисления ускорится
настолько, что может произойти вспышка.
Азотная кислота окисляет не только органические
соединения, но и некоторые металлы. Медь при действии на
нее концентрированной азотной кислотой окисляется
сначала до окиси меди, выделяя из азотной кислоты двуокись
азота (2HN03 + Cu-+ CuO + Н20 + 2N02), а затем
окись меди переходит в азотнокислую соль меди (CuO -f-
-f 2HN03 — Си (N03) 2 + Н20).
Не только азотная кислота, но и некоторые ее соли
обладают сильными окислительными свойствами.
Азотнокислые соли калия, натрия, кальция и аммония,
которые в технике получили название селитры, при
нагревании разлагаются, выделяя кислород (2NaN03 —*
—> 2NaN02 -f- 02). При высокой температуре в
расплавленной селитре тлеющий уголек сгорает так энергично,
что появляется яркобелый свет. Если же в пробирку
с расплавленной селитрой вместе с тлеющим угольком
бросить кусочек серы, горение пойдет с такой
интенсивностью и температура повысится настолько, что стекло
начнет плавиться. Эти свойства селитры давно были
известны человеку; он воспользовался этими свойствами для
приготовления пороха.
Черный, или дымный, порох приготовляется из
селитры, угля и серы. В этой смеси уголь и сера являются
горючими материалами. Сгорая, они переходят в
газообразный углекислый газ (С02) и твердый сернистый
калий (K2S). Селитра, разлагаясь, выделяет большое
количество кислорода и газообразный азот.
Выделившийся кислород усиливает горение угля и серы.
В результате горения развивается такая высокая
температура, что образовавшиеся газы могли бы расшириться
до объема, который в 2000 раз больше объема взятого
пороха. Но стенки замкнутого сосуда, где обычно
производят сжигание пороха, не позволяют газам легко и
свободно расширяться. Создается огромное давление, которое
разрывает сосуд в его наиболее слабом месте. Раздается
оглушительный взрыв, газы с шумом вырываются наружу,
унося с собой в виде дыма размельченные частицы
твердого вещества.
Так из калийной селитры, угля и серы образуется
смесь, обладающая огромной разрушительной силой.
50
К соединениям с сильными окислительными
свойствами относятся и соли кислородосодержащих кислот
хлора. Бертолетова соль (КСЮ3) при нагревании
распадается на хлористый калий и атомарный кислород
(КСЮз — КС1 + 30).
Еще легче, чем бертолетова соль, отдает свой кислород
/С1
хлорная, или белильная, известь (Са<; ). Белиль-
\oci
ной известью отбеливают хлопок, лен, бумагу и другие
материалы. Хлорная известь употребляется и как
средство против отравляющих веществ: отравляющие
вещества, как и многие другие сложные соединения,
разрушаются под действием сильных окислителей.
Окислительные свойства кислорода, его способность
легко вступать в соединение с различными элементами
и энергично поддерживать горение, развивая при этом
высокую температуру, уже давно обратили на себя
внимание ученых различных областей науки. Особенно этим
заинтересовались химики и металлурги. Но использование
кислорода было ограничено, так как не было простого и
дешевого способа получения его из воздуха и воды.
На помощь химикам и металлургам пришли физики.
Они нашли очень удобный способ выделения кислорода из
воздуха, а физико-химики научились получать его в
огромных количествах из воды.
ОБРАЗОВАНИЕ КИСЛОРОДА В ПРИРОДЕ И ПОЛУЧЕНИЕ
ЕГО В ТЕХНИКЕ
„Зеленая фабрика кислорода"
Миллионы лет непрерывно происходит потребление
кислорода. Он в огромных количествах расходуется на
медленное и быстрое окисление, на горение и взрыв, а
состав воздуха остается неизменным, содержание кислорода
в нем не уменьшается.
Как же воздух пополняется кислородом?
Еще в конце XVIII века был поставлен опыт, который
поможет нам ответить на этот вопрос.
Под стеклянный колпак была помещена зажженная
свеча. Некоторое время свеча горела, но вскоре погасла:
51
кислород воздуха под колпаком был весь израсходован.
Время горения свечи было зафиксировано.
Предполагая, что растения играют какую-то роль
в образовании кислорода, опыт был повторен. Рядом
с зажженной свечой положили пучок мяты. Горящую
свечу и мяту накрыли тем же колпаком. Лучи солнечного
света, проникая через стекло колпака, падали на
растение, освещая его зеленые листья. Прошло много
времени — больше, чем в первом опыте, — но свеча не гасла
и продолжала гореть обычным пламенем. Так было
установлено, что зеленые листья растений изменяют состав
воздуха и на свету выделяют кислород. Одновременно
было открыто, что растения извлекают из воздуха
углекислый газ.
Никто в то время не мог еще объяснить суть этого
замечательного явления. Честь открытия роли растений
в жизни нашей планеты принадлежит великому
русскому ученому Клименту Аркадьевичу Тимирязеву.
Если посмотреть через микроскоп на срез зеленого
листа, то в клетках, похожих на пчелиные соты, можно
увидеть зеленые зерна — хлоропласты. Их также
называют хлорофилловыми зернами. В каждой клеточке листа
содержится от 25 до 50 хлорофилловых зерен. Это о них
говорил Тимирязев: «Хлорофилловое зерно — тот фокус,
та точка в мировом пространстве, где солнечный луч,
превращаясь в химическую энергию, становится источником
всей жизни на земле».
Что же происходит в зеленых листьях растений? В
листьях имеются многочисленные отверстия — устьица,
которые служат растению для дыхания и питания. Через эти
устьица из воздуха в листья проникает углекислый газ.
Своими корнями растение всасывает влагу из земли и
подает ее к листьям по тонким капиллярам ствола и стеблей.
Под влиянием света и тепла солнечных лучей в
хлорофилловых зернах листа между водой и углекислотой
происходит сложная химическая реакция — фотосинтез.
В результате образуются продукты, переходящие в
виноградный сахар и кислород.
Виноградный сахар имеет особое название — глюкоза,
которое произошло от греческого слова «глюкос»,
означающего «сладкий».
Молекулы глюкозы состоят из 6 атомов углерода,
52
12 атомов водорода и 6 атомов кислорода (C6Hi206).
На образование I молекулы глюкозы необходимо б
молекул углекислого газа (С02) и 6 молекул воды (НгО).
При этом должно выделиться 6 молекул кислорода.
Следовательно, когда образуется 1 грамм глюкозы,
освобождается более 1 грамма, или около 900 кубических
сантиметров, чистого кислорода.
Так под влиянием солнечного света и тепла в
хлорофилловых зернах растений, живущих на земле и под во-
дой, происходит образование кислорода, которым
непрерывно пополняется наша планета.
Растения являются неиссякаемым источником
необходимого для жизни кислорода, и их по праву можно
назвать «зеленой фабрикой кислорода».
До последнего времени считали, что кислород, который
выделяется из растений при фотосинтезе, отщепляется от
углекислого газа. Полагали, что в хлорофилловых зернах
под действием света происходит расщепление молекулы
углекислого газа на кислород и углерод. Углерод,
вступая в реакцию с водой, образует в конечном счете
глюкозу, а кислород выделяется в атмосферу.
В настоящее время существует другая теория.
Считают, что в хлорофилловых зернах под действием
солнечных лучей происходит распад не молекулы углекислого
газа, а молекулы воды. При этом образуется кислород,
который выделяется в атмосферу, и водород, который
в соединении с углекислым газом дает глюкозу.
Теория эта получила свое экспериментальное
подтверждение в 1941 году в опытах А. П. Виноградова, который
впервые применил для изучения фотосинтеза тяжелый
изотоп кислорода О18.
Поливая растение водой, содержащей тяжелый изотоп
О18, А. П. Виноградов наблюдал, что чем больше
тяжелого изотопа кислорода О18 содержалось в воде, которой
поливали растение, тем больше его находили в
выделяющемся кислороде.
Если поливать растение обычной водой и поместить
его в атмосферу углекислого газа, содержащего тяжелый
изотоп кислорода О18, то в выделяющемся при
фотосинтезе кислороде изотоп О18 не обнаруживается.
Эти опыты убедительно показали, что при фотосинтезе
в зеленых листьях растений кислород получается не за
53
счет углекислого газа, а за счет разложения воды.
Водород, входящий в состав воды, вместе с углекислотой идет
на образование глюкозы.
Глюкоза в листьях не остается. Она, как растворимое
питательное вещество, разносится по всему растению и
служит ему пищей и строительным материалом для
образования клетчатки. Из клетчатки состоят корни, стволы,
стебли и листья растений.
Часть глюкозы превращается в крахмал и
откладывается в плодах и зернах.
Для жизни и развития растения необходимы
солнечный свет и непрерывное поступление к нему углекислого
газа и воды. В процессе питания растения воздух вокруг
него обогащается кислородом и обедняется углекислым
газом. Благодаря работе ветра воздух перемешивается,
и таким образом у листьев растения поддерживается
постоянная концентрация углекислого газа.
А как же обеспечивается подача углекислого газа
к листьям в жаркую безветренную погоду? В такую
погоду молекулы углекислого газа, беспорядочно двигаясь
в воздушном пространстве, очутившись около зеленого
листа, вдруг резко поворачивают к нему.
Какая сила заставляет их свернуть к листу?
Если наполнить двумя различными газами сосуд,
разделенный перегородкой, и затем осторожно вынуть ее,
газы перемешаются, образуя однородную смесь. Такое
же явление можно наблюдать, если привести в
соприкосновение два различных раствора.
Если разделить между собой два различных газа или
раствора, поместив между ними перегородку из желатины,
кожи или другого мелкопористого материала, можно
заметить, как через некоторое время по обеим сторонам
перегородки концентрации газов или растворов будут
одинаковы.
Процессы самопроизвольного перемешивания газов
или жидкостей, а также проникновение их через
полупроницаемые перегородки называются диффузией.
Скорость диффузии тем больше, чем больше разница
в концентрациях диффундирующих веществ.
Вот почему, как только концентрация углекислого
газа у зеленого листа становится меньше, чем на
некотором расстоянии от него, воздух около листа пополняется
54
молекулами углекислого газа из
близлежащих слоев атмосферы. Их
места занимают сотни, тысячи и
миллионы молекул углекислого газа
из более отдаленных частей
пространства.
Одновременно с процессом
диффузии углекислого газа идет процесс
диффузии кислорода от зеленого
листа в более отдаленные пространства,
где концентрация его меньше.
Под водой, как и на суше,
растения питаются углекислым газом и
вырабатывают глюкозу и крахмал,
освобождая кислород.
Откуда же берется углекислый
газ в воде. Он образуется при
дыхании животных и растений,
живущих ПОД ВОДОЙ. Кроме ТОГО, ОН ПО- Растение, находясь
падает туда из воздуха, растворяясь под водой, при пита-
в поверхностных слоях воды. Пере- нии выделяет кисло-
мешиванием, или диффузией, угле- род*
кислый газ проникает вглубь.
Углекислый газ хорошо растворяется в воде. Его
растворимость при низких температурах в 35 раз больше
растворимости кислорода. В литре воды при температуре
0° и давлении 760 миллиметров растворяется 50
кубических сантиметров кислорода, а углекислого газа — более
1700 кубических сантиметров. Хотя при температуре воды
20° углекислого газа в литре растворится примерно
половина от этого количества, но и этого достаточно, чтобы
растения, находящиеся под водой, не испытывали
недостатка в углекислом газе. На зеленой поверхности
подводных растений происходит тот же процесс усвоения
углерода, что и на воздухе.
Налейте в стакан обыкновенной водопроводной воды
и пропустите через нее углекислый газ. Опустите в воду
растение и накройте его воронкой. На узкую часть
воронки наденьте пробирку, наполненную водой. Вынесите
стакан с растением на солнечный свет. Через несколько
часов в пробирке соберется заметное количество газа.
Снимите пробирку с узкой части воронки и под водой
55
заткните ее пробкой. Теперь можно вынуть пробирку из
воды и опрокинуть ее пробкой вверх. Оставшаяся в
пробирке вода опустится на дно, а газ окажется над водой.
Откройке пробку. Так как плотность кислорода несколько
больше плотности воздуха, кислород некоторое время
(пока не продиффундирует в воздух) останется в про-
бирке. Опустите в пробирку тлеющую лучинку, и вы
убедитесь в том, что газ, который выделился из растения, —
кислород.
Образующийся в воде кислород равномерно
распределяется по всей толще воды, насыщая ее. Если кислорода
окажется больше, чем его может раствориться в воде при
данной температуре, избыток его уйдет в воздух. Если его
будет меньше, то недостающее количество кислорода
дополнится из воздуха.
Не совсем верно утверждать, что кислород равномерно
распределяется по всей толще воды. На разной глубине
вода имеет различную температуру. А мы знаем, что чем
выше температура, тем меньше растворится в ней
кислорода. Поэтому в разное время года, на различных
глубинах концентрация растворенного в воде кислорода
различна. В неглубоких водоемах разница в количестве
растворенного кислорода в верхних и нижних слоях не
очень велика, и ею можно пренебречь.
Растения, живущие на земле или под водой, не только
выделяют кислород, но и поглощают его. Как и любой
живой организм, растения дышат. Часть кислорода,
которая образуется при питании растений, потребляется ими
при дыхании.
Если после долгой зимней ночи войти в закрытое
помещение, где находилось много цветов, чувствуется такая
духота, как будто здесь долгое время находилось много
людей. Растения израсходовали часть кислорода воздуха
на дыхание, и в помещении образовался избыток
углекислого газа.
Итак, кислород в природе совершает непрерывный
круг. При дыхании человека, животных и растений, при
горении твердого и жидкого топлива кислород
расходуется и образуется углекислый газ. Этот газ идет на
питание растений, которые возвращают кислород обратно
в воздух.
Растения играют важную роль в жизни человека. Они
бб
не только кормят и согревают нас — они веками
обеспечивают постоянное содержание кислорода в воздухе, без
чего невозможна жизнь на Земле.
А не меняется ли содержание кислорода в
воздухе зимой, когда остаются зелеными только хвойные
деревья?
Зимой количество кислорода, выделяемого растениями,
сокращается, но запасы его в атмосфере чрезвычайно
велики. Если бы в течение тысячи или даже двух тысяч
лет вообще не было никакого возвращения кислорода,
а происходило только его потребление, то общее
количество израсходованного кислорода не превысило бы
0,1 процента всего запаса кислорода в атмосфере. Запасы
кислорода в воздухе неисчислимы.
Получение кислорода из химических соединений
Химические соединения, в которые входит кислород,
в большинстве случаев образуются с выделением тепла.
Можно предположить, что если при образовании
окислов выделяется энергия в виде тепла, то при
возвращении окислам этого тепла путем прокаливания их они
распадутся на составные части, выделив обратно
кислород. В действительности это происходит не всегда так.
Некоторые окислы, как, например, окислы железа, не
разрушаются при прокаливании и кислорода своего не
отдают. Для того чтобы отобрать от окислов железа
кислород, их необходимо прокалить с углеродом. Однако,
отнимая кислород у железа, углерод прочно соединяется
с ним и образует углекислый газ. Чистого кислорода
в этом случае получить нельзя.
Окислы алюминия при прокаливании не отдают своего
кислорода даже углероду. Они являются еще более
устойчивыми, чем окислы железа.
Имеются такие химические соединения, которые при
прокаливании отдают не весь, а только часть кислорода,
переходя в более низкую степень окисления. К таким
соединениям относится двуокись свинца, которая, отдавая
кислород, переходит в окись свинца, или двуокись
марганца, которая выделяет только одну треть своего
кислорода, образуя при этом окись марганца.
Существуют и такие соединения, которые при прокали-
57
вании способны полностью отдать кислород. Если
прокалить 100 граммов бертолетовой соли (КСЮ3), можно
получить 39 граммов кислорода, что составляет при
комнатной температуре и нормальном давлении около 30
литров. После разложения бертолетовой соли остается белый
порошок хлористого калия (КС1).
Разложение бертолетовой соли без катализатора идет
медленно и требует высокой температуры. Прибавлением
небольшого количества двуокиси марганца как
катализатора резко ускоряют процесс разложения соли, который
идет до конца при умеренном нагревании.
В лабораторных условиях обычно пользуются этим
простым способом получения кислорода.
Получают кислород и из марганцевокислого калия,
который при нагревании разлагается на двуокись
марганца, окись калия и кислород (4КМп04 —> 4Мп02 +
-f- 2K2O + 302). Нагревание можно вести в простой
стеклянной пробирке, закрытой пробкой, в которую вставлена
стеклянная загнутая трубка; 100 граммов
марганцевокислого калия дают около 15 граммов (11,5 литра)
кислорода.
Получение больших количеств кислорода простым
прокаливанием бертолетовой соли, марганцевокислого
калия или окиси ртути (HgO) нецелесообразно, так как
после выделения кислорода эти соединения не могут быть
использованы вторично.
Еще в конце прошлого века кислород получали
прокаливанием при высокой температуре различных солей,
способных поглощать его из воздуха при более низкой
температуре.
К таким солям относится окись бария, которая при
температуре около 550° жадно поглощает кислород
воздуха, переходя в перекись бария. Перекись бария при
температуре около 900° отдает весь избыток кислорода и
восстанавливается в окись бария. Окись бария при
охлаждении до 550° вновь поглощает кислород воздуха и может
быть снова использована для получения кислорода.
Раньше широко использовался марганцево-натриевый
способ получения кислорода. Равные по весу количества
двуокиси марганца и едкого натра смешивают и
помещают в фарфоровую трубку, через которую пропускают
воздух. При нагревании трубки до температуры около
58
550° смесь эта
жадно поглощает кислород
проходящего через нее
воздуха. В этом легко
убедиться, если к концу
трубки поднести
горящую спичку. Так как
в выходящем газе нет
кислорода, спичка
погаснет. Спустя
некоторое время смесь в
трубке полностью насытится
кислородом, и
поглощение его прекратится.
Зажженная у конца
трубки спичка будет гореть
обычным пламенем.
Можно приступить к получению кислорода. Через трубку
пропускают перегретый водяной пар. Смесь, находящаяся
в трубке, разлагается и отдает кислород, поглощенный
ею из воздуха. Вещество в трубке возвращается к своему
первоначальному состоянию и снова может быть
использовано для получения кислорода.
Для получения кислорода в больших количествах
прежде всего нужно было найти дешевое сырье. Таким
сырьем в настоящее время являются воздух и вода. Но их
стали использовать сравнительно недавно.
Получение кислорода из
марганцовокислого калия.
Получение кислорода из воздуха
В больших количествах кислород получают из
жидкого воздуха.
Впервые жидкий воздух был получен в 80-х годах
прошлого столетия. До этого времени ученые — физики и
химики — тщетно старались получить его путем сжатия
газообразного воздуха до высоких давлений. Много энергии
и труда потратили они напрасно — жидкий воздух
получить им не удалось.
Почему даже при давлении в 200 атмосфер воздух не
сжижается, тогда как другие газы, например углекислый
газ или хлор, переходят в жидкое состояние при
значительно меньших давлениях? В чем же причина?
59
На этот вопрос ответил Менделеев. Он установил, что
каждый газ обладает своей особой критической
температурой, то-есть температурой, выше которой данный газ не
сжижается ни при каких давлениях.
Критическая температура воздуха равна —141°, а
критическая температура кислорода —119°.
С этим открытием стало ясно, почему многолетние
труды ученых не принесли положительных результатов.
Оказалось, что нельзя получить жидкий воздух только
при высоких давлениях, его нужно охладить до
критической температуры.
В то время таких низких температур еще получать не
умели, а пользовались различными охлаждающими
смесями, с помощью которых можно было понизить
температуру только до —80—90°. Естественно, что никаким
высоким давлением нельзя было компенсировать недостающий
холод.
Воздух, охлажденный до температуры —141°, может
быть превращен из газообразного состояния в жидкое при
давлении не ниже 37 атмосфер. Следовательно, для
получения жидкого воздуха газ необходимо сжать до 37
атмосфер и охладить до температуры —141°. Если охладить
воздух до температуры —195°, то он превратится в
жидкость и при атмосферном давлении.
Но как охладить воздух до такой низкой
температуры?
Поместите в стакан с холодной водой нагретую
металлическую пластинку. Она охладится, а вода в стакане
нагреется. Чтобы охладить тело, его нужно привести
в соприкосновение с более холодным телом. Чем больше
будет разница в температурах этих тел, тем больше тепла
перейдет от более теплого тела к более холодному — тем
больше будет теплообмен.
Приборы, в которых происходит обмен тепла,
называются теплообменниками.
Простейший тип теплообменника можно изготовить,
поместив одну цилиндрическую трубку в другую. Если по
наружной трубке снизу пропустить холодный воздух,
а навстречу ему по внутренней — теплый, то последний
охладится, отдавая свое тепло холодному воздуху,
идущему по наружной трубке. В таком теплообменнике даже
60
при низкой температуре хо- ТеПЛЬ/й воздух
лодного воздуха нельзя до-
стичь хорошего охлаждения
поступающего сверху газа.
Имеются более сложные
конструкции
теплообменников, в которых внутренняя
трубка сделана в виде
спирали или заменена большим
количеством трубок малого
диаметра. Это увеличивает
площадь соприкосновения
трубок с проходящим мимо
них холодным воздухом.
Теплообменники
изготовляются преимущественно из
красной меди. Она обладает
хорошей теплопроводностью.
Снаружи теплообменники
покрываются
теплоизоляционным материалом, который
предохраняет их от внешнего
тепла. В хорошем
теплообменнике можно охладить
воздух до очень низких
температур, но для этого нужен
еще более холодный воздух.
Откуда его взять?
Если быстро сжать газ,
то он нагреется; если же его
быстро расширить, то он
охладится.
Пропустите сжатый
воздух через пористую пробку,
вставленную в середину
небольшой трубки. Нажмите
на поршень. Левая сторона
трубки, где воздух
сжимается, нагреется. Одновременно
заметно охладится правая часть трубки, куда поступает
сжатый воздух, расширяясь при выходе через пробку.
Ученые-физики объясняют нагревание газа при его
Холодный Воздух
Теплообменник: 1 —
внутренняя трубка, в которой
охлаждается воздух; 2 — наружная
трубка, куда поступает
холодный газ; 3 —
теплоизоляционный материал.
61
сжатии тем, что при уменьшении объема сжатого газа
молекулы настолько близко подходят друг к другу, что между
ними начинают действовать силы притяжения, молекулы
газа еще больше сближаются — совершается работа,
которая как бы приводит к дополнительному сжатию.
Происходит выделение тепла, температура газа повышается.
При быстром расширении сжатого газа происходит
увеличение его объема. Молекулы газа стремятся отойти
друг от друга, но силы притяжения препятствуют этому.
На преодоление сил притяжения затрачивается работа,
расходуется часть тепла, и газ охлаждается.
Величина, на которую понизится температура газа при
расширении, зависит от начального и конечного давления.
В практике принято считать, что при понижении
давления на 1 атмосферу температура газа понижается на
]А градуса.
Если в специальной машине, называемой
компрессором, сжать некоторый объем воздуха до 200 атмосфер,
затем пропустить его через специальный кран —
расширительный вентиль — и дать ему быстро расшириться до
первоначального объема, температура его понизится
примерно на 50°. Если температура сжатого воздуха до его
прохождения через расширительный или дроссельный
вентиль была 10°, то после его расширения она станет —40°.
Чем ниже температура сжатого воздуха до его
расширения, тем ниже она будет после дросселирования, то-есть
после пропускания через узкую щель дроссельного
вентиля. Постепенно понижая температуру сжатого воздуха,
можно достичь температуры, при которой он начнет
сжижаться.
Но прежде чем приступить к получению жидкого
воздуха, его нужно очистить.
В воздухе обычно содержится много пыли — мелких
твердых частиц песка и угля. В среднем в кубическом
метре воздуха содержится до 0,01 грамма примесей.
Механические примеси, попадая между трущимися частями
компрессора, образуют царапины и приводят к
преждевременному износу машины. Поэтому воздух нужно
освободить от пыли.
Для очистки воздуха используют специальные
масляные фильтры, которые устанавливают на всасывающей
трубе компрессора.
62
Кроме механических
загрязнений, воздух содержит
влагу, углекислый газ и
другие газообразные примеси.
Количество влаги в воздухе
зависит от его температуры.
Наибольшее количество
влаги в 1 кубическом метре
воздуха при температуре
—30° составляет около
0,1 грамма, а при
температуре 30° — примерно
30 граммов. При небольшом
охлаждении воздуха пары Образование тумана при охла-
воды конденсируются и пре- ждении влажного воздуха.
вращаются в туман.
Налейте в банку немного воды и закройте ее пробкой,
в которую вставлена трубка. Наденьте на трубку
резиновую грушу и сожмите ее так, чтобы весь воздух из груши
перешел в банку. В банке создастся давление. Если после
некоторой выдержки быстро ослабить грушу, воздух з
банке расширится и охладится — в банке появится туман.
Это значит, что водяные пары, которые находились в банке
вместе с воздухом, сконденсировались. Мельчайшие
капельки воды равномерно распределились по всему объему.
При боле? низкой температуре влага вымораживается
и образуется иней, который может осесть в виде льда на
стенках аппаратуры.
Если в теплообменник или расширительный вентиль
пустить воздух, содержащий влагу, на их стенках
образуется сначала тонкий, а затем более толстый слой льда.
Чтобы лед не закупорил трубки, воздух, прежде чем
приступить к его охлаждению, нужно осушить.
Воздух можно осушить, пропуская его через пористые
вещества, способные поглощать влагу. Такими веществами
являются силикагель и специально обработанный —
активированный — глинозем. Когда эти вещества поглотят
столько влаги, что перестанут осушать воздух, их
прокаливают и снова используют для просушки.
Влагу из воздуха можно также поглотить
каустической содой или прокаленным хлористым кальцием. Эти
вещества загружают в специальные баллоны, через кото-
63
рые пропускают воздух. Пройдя через них, воздух
становится совершенно сухим.
На крупных установках, вырабатывающих кислород,
влагу вымораживают в специальных ловушках — вымо-
раживателях, где поддерживается температура —40—50°.
Когда в одной ловушке набирается много льда, воздух
переключают на другую ловушку, а первую нагревают.
Лед тает, и воду из нее сливают через специальный кран.
Очистив воздух от пыли и осушив его, нельзя еще
приступить к ожижению.
В воздухе имеется углекислый газ. При температуре
около —80° этот газ превращается в снегообразную
массу, которая при дальнейшем охлаждении образует
твердое вещество, похожее на лед.
Если кусочек такого льда положить на чистый лист
белой бумаги, лед постепенно начнет уменьшаться
в объеме, не оставляя после себя никаких следов. Вот он
окончательно исчез, а бумага попрежнему осталась
такой же чистой и сухой. Сухой лед — это твердая
углекислота. Он широко применяется в пищевой
промышленности.
Для получения жидкого воздуха нельзя обойтись без
очистки газообразного воздуха от углекислого газа. Иначе
через некоторое время в холодильной установке накопится
большое количество сухого льда, который может вывести
ее из строя.
Как же очистить воздух от углекислого газа?
Раствор щелочи помещают в колонку, через которую
пропускают воздух. Углекислый газ, находящийся в
воздухе, соединяется с едким натром и образует соль
(С02 -j- 2NaOH -* Na2C03 + Н20). Выходящий из
колонки воздух практически не содержит углекислоты.
Очистив газообразный воздух от всех примесей,
которые могут помешать его сжижению, можно приступить
к получению жидкого воздуха.
Для этого необходимо соединить между собой
компрессор, простой холодильник, теплообменник и
расширительный вентиль по схеме холодильного цикла с
дросселированием.
Предварительно очищенный воздух направляют в
компрессор и сжимают его до 200 атмосфер; так как воздух
нагреется, его следует охладить, пропустив через простой
64
Схема холодильного цикла с дросселированием: 1 — компрессор;
2 — холодильник; 3 — теплообменник; 4 — дроссельный вентиль;
5 — ожижитель; 6 — сливной кран.
холодильник с проточной холодной водой. Сжатый газ,
проходя в холодильнике по внутренней трубке, отдаст
свое тепло воде, которая омывает трубку снаружи. Из
холодильника газ выйдет более холодным, чем из
компрессора: его температура будет приблизительно 10°.
Сжатый воздух из холодильника направляют в тепло-
65
обменник. Но так как теплообменник еще ничем не
охлаждается, газ пройдет через него без изменения
температуры и, попав в дроссельный вентиль, расширится
в нем. При расширении газ охладится и перейдет в
ожижитель, из ожижителя — обратно в теплообменник. С
этого момента начинается работа теплообменника.
Воздух, идущий из ожижителя, будет охлаждать
сжатый воздух, поступающий из компрессора. Температура
сжатого воздуха после прохождения через
расширительный вентиль понизится еще больше и, уходя через
теплообменник в атмосферу, еще сильнее охладит свежие
порции поступающего сжатого воздуха.
Итак, ежеминутно автоматически все больше и больше
понижается температура воздуха, входящего в
расширительный вентиль. Наконец наступает момент, когда
воздух охладится настолько, что часть его ожижится.
Жидкий воздух собирается в ожижителе, откуда его
сливают через кран.
Неожиженная часть воздуха поступает в
теплообменник с температурой около —190°, а выходит из него с
температурой, близкой к комнатной. Идет непрерывное
ожижение небольшой части воздуха, проходящего через
холодильную установку.
В описанном цикле только 5 процентов пропускаемого
воздуха переходит в жидкое состояние, большая часть
его не сжижается и уходит обратно в атмосферу.
Это объясняется тем, что цикл с дросселированием
обладает малой производительностью холода, то-есть
расход энергии на сжатие газа до высокого давления
велик, а снижение температуры при дроссельном
расширении газа мало. Холодильный цикл прост по своему
устройству, но малоэкономичен.
Ученые стали настойчиво искать более экономичных
способов получения жидкого воздуха. Было установлено,
что если сжатый воздух расширить в цилиндре
поршневого двигателя или на лопатках ротора — вращающейся
части воздушной турбины — и заставить его при
расширении производить внешнюю работу, то воздух
охладится значительно сильнее, чем при расширении в
дроссельном вентиле, где производится только внутренняя
работа, которая идет на преодоление сил взаимного
притяжения молекул.
66
Машины, в которых происходит расширение сжатого
газа с получением внешней работы, называются
детандерами.
Охлаждение газа в детандере тем больше, чем больше
он производит работы при своем расширении. Для
охлаждения газа в детандере не требуется высокого давления.
Достаточно давления 50—60 атмосфер. Температура газа
при его наибольшем расширении понизится до —120—
125°. Таким образом, при снижении давления газа в
детандере на 1 атмосферу температура понижается
приблизительно на 2° — в 8 раз больше, чем при дросселировании.
Производительность холодильного цикла с детандером
в 2—3 раза выше производительности цикла с
дросселированием. Из всего воздуха, проходящего через такую
систему, ожижается не 5, а 10—15 процентов. Затрата
энергии на сжатие газа в холодильном цикле среднего
давления с детандером примерно в 3 раза меньше, чем
в холодильной установке с дросселем.
В установке с детандером воздух, сжатый до
40—50 атмосфер, поступает сначала в холодильник, где он
охлаждается водопроводной водой. Из холодильника весь
воздух поступает в первый теплообменник, где он еще
больше охлаждается.
При выходе из первого теплообменника сжатый воздух
пускают по двум направлениям. Большая часть газа
отводится в детандер, где он расширяется до 1 атмосферы и
сильно охлаждается.
Охлажденный в детандере воздух направляется через
теплообменники в атмосферу. По пути он отбирает тепло
от идущего навстречу воздуха, поступающего из
компрессора.
Оставшаяся часть сжатого воздуха охлаждается во
втором теплообменнике и поступает в расширительный
вентиль. При расширении воздух еще больше
охлаждается и, достигнув температуры сжижения, частично
ожижается. Жидкий воздух собирается в ожижителе. Неожи-
женная, холодная часть воздуха направляется через
теплообменники в атмосферу. По мере накопления
жидкий воздух сливают.
Сравнительно недавно в одном из институтов
Академии наук СССР был разработан способ получения
жидкого воздуха в установках с низким давлением.
67
Как же из жидкого воздуха получить кислород?
Принцип получения кислорода из жидкого воздуха
основан на том, что температура кипения основных
составных частей воздуха различна. Температура кипения
кислорода равна —183°, а температура кипения азота
—196°. Поэтому при медленном испарении жидкого
воздуха из него сначала улетучивается главным образом
азот. После того как основная часть азота испарится,
температура оставшейся жидкости повысится до —183°,
и кислород начнет кипеть.
На этом принципе основана любая дробная, или
фракционная, перегонка жидкой смеси, состоящей из
нескольких веществ, которые обладают различными
температурами кипения. Дробной такая перегонка называется
потому, что смесь жидкостей перегоняется по частям,
начиная от той жидкости, которая кипит при более низкой
температуре. До тех пор пока не перегонится основная
часть низкокипящей жидкости, температура всей смеси,
несмотря на подогревание, будет оставаться почти без
изменения. Как только жидкость, кипящая при более
низкой температуре, будет отогнана, температура быстро
повысится до точки кипения следующей части смеси, и так
до тех пор, пока не отгонится по частям вся перегоняемая
жидкость.
На этом принципе основана перегонка нефти, из
которой отгоняют сначала бензин, который кипит при более
низкой температуре, чем другие составные части нефти, за
ним — керосин, далее перегоняют более тяжелый вид
топлива — так называемое дизельное топливо, или соляровое
масло.
В перегонном аппарате после отгона бензина, керосина
и дизельного топлива остается мазут. Нагревая мазут до
еще более высокой температуры, получают различные
смазочные масла и гудрон.
При однократной фракционной перегонке нельзя сразу
получить чистые продукты отгона. После первой
перегонки полученные продукты загрязнены соединениями,
температуры кипения которых близки. Чтобы освободиться
от примесей, необходимы последующие перегонки.
При однократном испарении жидкого воздуха также
невозможно получить чистый кислород и азот. Вначале,
когда в жидком воздухе содержится 21 процент
68
Очищенши\
воздух
Жидкий .
воздух *
Схема холодильного цикла с детандером: / — компрессор; 2—
холодильник; 3 — первый теплообменник; 4— детандер; 5 — второй
теплообменник; 6 — расширительный вентиль; 7 — ожижитель;
8—сливной кран.
кислорода и 78 процентов азота, испаряется главным
образом азот. Однако чем меньше азота будет
оставаться в жидкости, тем больше одновременно с азотом
начнет испаряться кислорода. Так, например, когда в
жидкой фазе останется 50 процентов азота, в парах над
такой жидкостью будет уже около 20 процентов
кислорода. Чтобы получить чистый кислород и азот,
недостаточно испарить жидкий воздух один раз.
Газообразные продукты, полученные после испарения,
конденсируют — превращают снова в жидкость, которая
подвергается вторичной перегонке. Чем больше повторяют
процесс испарения и конденсации, тем чище получают
продукты отгона.
Конденсация и испарение являются двумя
противоположными процессами. При испарении жидкости
необходимо затратить тепло, при конденсации пара — тепло
выделяется. Если никаких потерь тепла нет, то теплота
испарения вещества будет равна теплоте его конденсации.
Для получения кислорода из жидкого воздуха
необходимо затратить некоторое количество тепла — скрытую
теплоту испарения.
Если газообразный кислород пропустить через жидкий
воздух, он сконденсируется и превратится в жидкость.
При этом выделится тепло, называемое скрытой теплотой
конденсации. Жидкий воздух, получив это тепло, сразу
же израсходует его на испарение азота, температура
кипения которого ниже температуры кипения кислорода.
Так как скрытая теплота конденсации кислорода почти
равна скрытой теплоте испарения азота, то из жидкого
воздуха выделится по объему приблизительно столько же
азота, сколько сконденсировалось кислорода.
На принципе многократной конденсации кислорода
с одновременным испарением азота из жидкого воздуха
основан процесс разделения жидкого воздуха на чистый
газообразный азот и чистый жидкий кислород.
Такой процесс разделения носит название
ректификации.
Он заключается в том, что газообразная смесь азота
и кислорода, которая образуется при испарении жидкого
воздуха, вновь пропускается через жидкий воздух. При
этом кислород конденсируется, выделяя тепло. За счет
этого тепла испаряется новая часть азота. Пропуская
70
вновь образовавшиеся газы
через жидкий воздух, можно в
конце концов получить чистый
газообразный азот и жидкий
чистый кислород.
Аппарат, в котором
разделяют жидкий воздух на азот и
кислород, называется
ректификационной колонной.
Ректификационная колонна
разделена перегородками на
камеры-тарелки. Сверху в
колонну медленно подают жидкий
воздух. По сливным стаканам
он постепенно стекает вниз,
заполняя все тарелки колонны.
Перегородки сделаны из
латунного листа, в котором на
расстоянии около 3 миллиметров
друг от друга в шахматном
порядке пробиты мелкие
отверстия диаметром 0,8—0,9
миллиметра. Газы, образующиеся при
испарении жидкого воздуха,
легко проходят через такие
отверстия, не давая жидкости
просочиться через них. Попадая
в жидкость, газы вспенивают
ее и перемешиваются с ней. Во
время перемешивания
газообразный кислород
конденсируется и переходит в жидкость, а
азот, испаряясь, уходит через
отверстия в перегородках вверх,
на следующую тарелку. Таким
образом, на каждой тарелке
газы обогащаются азотом и
обедняются кислородом.
По мере накопления
жидкость стекает через края сливных
Жидкий
воздух
Ректификационная колонна:
/ — корпус колонны; 2 —
латунные перегородки; 3 —
сливные стаканы; 4 —
сливной кран.
вниз, все
стаканов
больше и больше обогащаясь кислородом.
В результате наверху, на выходе из колонны, полу-
71
чается чистый газообразный азот, а внизу собирается
чистый жидкий кислород, который сливают через кран.
Так из атмосферного воздуха получают для
промышленности кислород.
Электролитическое получение кислорода
из воды
Большое количество кислорода получают
электролизом воды.
При электролизе воды одновременно с кислородом
выделяется другой ценный промышленный продукт —
водород.
При наличии дешевой электроэнергии чрезвычайно
выгодно получать кислород и водород из воды путем
разложения ее электрическим током на составные части.
Впервые кислород и водород были получены
электролизом воды примерно сто шестьдесят лет назад. Однако
этот метод не находил практического применения почти
в течение ста лет.
В 1888 году русский профессор Д. А. Лачинов
сконструировал несколько типов электролитических ванн для
получения кислорода и водорода. Через несколько лет
появились первые промышленные установки по
производству этих газов электролитическим путем. Это были
сравнительно небольшие установки, дававшие в сутки 100—
200 кубических метров Кислорода и водорода.
В настоящее время имеются установки, способные
вырабатывать в один час 20 тысяч кубических метров
водорода и 10 тысяч кубических метров кислорода.
Такие установки требуют много электроэнергии.
В нашей стране, где вырабатывается большое
количество дешевой электрической энергии, кислород
получают не только из воздуха, а широко используют
электролитический способ получения кислорода и
водорода из воды.
В настоящее время на крупных реках идет
строительство новых гигантских гидроэлектростанций. Через четы-
ре-пять лет они дадут свыше 22 миллиардов киловатт-
часов электроэнергии в год. Часть этой дешевой
электроэнергии пойдет на электрохимические предприятия, в том
числе и на заводы по электролизу воды.
72
Как же происходит процесс разложения воды
электрическим током?
Чистая, дистиллированная вода почти совершенно не
проводит электрического тока. Она обладает огромным
сопротивлением. Например, сопротивление кубического
сантиметра дважды перегнанной воды равно
сопротивлению медной проволоки сечением в квадратный миллиметр,
длина которой равна примерно 200 тысячам километров.
Таким количеством проволоки можно больше чем 20 раз
соединить между собой Москву и Владивосток. Для
электролиза дистиллированная вода не годится. Нужна такая
вода, которая бы хорошо проводила электрический ток,
то-есть была бы электропроводной.
Чтобы сделать воду электропроводной, в ней нужно
растворить какую-нибудь соль, кислоту или основание, ко<
торые дают ионы.
Большинство химических соединений, растворяясь
в воде, распадаются на части, которые приобретают при
этом тот или иной заряд. Образующиеся заряженные
частицы называются ионами, а разложение вещества на
ионы — электролитической диссоциацией.
Обыкновенная поваренная соль (NaCl) при
растворении в воде распадается на ион натрия (Na+ ),
заряженный положительно, и ион хлора (С1- ), заряженный
отрицательно. Ионы натрия и хлора, имеющие только по
одному заряду, называются одновалентными ионами.
Ионы, которые имеют два или три заряда, называются
двух- или трехвалентными. В качестве примера
двухвалентного иона можно привести ион кальция (Са ++ ).
Хлористый кальций (СаС12), диссоциируя на ионы, дает
два одновалентных отрицательных иона хлора (2С1~)
и один двухвалентный ион кальция (Са + ), заряженный
положительно. Треххлористое железо (FeCl3) при
диссоциации на ионы дает три одновалентных
отрицательных иона хлора (ЗС1-) и один трехвалентный положи-
тельный ион железа (геттт ).
Итак, при электролитической диссоциации соли
образуются отрицательно заряженные ионы, которые
называются анионами, и положительно заряженные ионы —
катионы.
73
Кислоты при диссоциации образуют положительно
заряженный ион водорода и отрицательно заряженный
кислотный остаток. Серная кислота (H2S04) распадается на
два положительно заряженных иона водорода (2Н+) и
кислотный остаток— анион (S04 —), обладающий двумя
отрицательными зарядами.
Щелочи при диссоциации образуют положительный
кон металла и отрицательный ион гидроксила (КОН —>
—»К+-|-ОН_). Положительные и отрицательные ионы,
образующиеся при растворении в воде солей, кислот и
оснований, переносят через раствор электрический ток.
Если в раствор, содержащий ионы, поместить две
металлические пластинки и подключить к ним постоянный
ток от аккумулятора, то положительные ионы —
катионы — сразу же начнут передвигаться к отрицательному
электроду, который называется катодом, а
отрицательные ионы — анионы — направятся к положительному
полюсу — аноду. Находящиеся у электрода анионы отдадут
ему свои отрицательные заряды — электроны (е) — и
разрядятся. В то же самое время разрядятся и катионы,
получив электроны от своего электрода. Их места тут же
занимают новые ионы, и через раствор начинает проходить
электрический ток. Чем больше ионов в растворе, тем
лучше через него будет проходить электрический ток и
тем больше электропроводность такого раствора.
Чтобы получить много ионов, недостаточно растворить
много вещества. Необходимо, чтобы взятая соль, кислота
или основание хорошо распадались на ионы, то-есть
хорошо диссоциировали. Имеются такие химические
соединения, которые диссоциируют очень хорошо, и почти все
молекулы растворенного вещества распадаются на ионы.
Но есть и такие, которые диссоциируют плохо: только
очень незначительная часть всех растворенных молекул
распадается на ионы, а остальные остаются в виде недис-
социированных молекул.
Отношение числа распавшихся молекул к общему
числу растворенных молекул называется степенью
диссоциации. Чем меньше степень диссоциации, тем хуже
электропроводность раствора.
К соединениям, обладающим плохой
электропроводностью, относится дистиллированная вода. Подсчитано,
что из 10 миллионов молекул воды на ионы распадается
74
только одна молекула,
образуя один положительно
заряженный ион водорода
(Н+ ) и один отрицательно
заряженный ион гидроксила
(ОН ~ ). Понятно, что при
такой малой диссоциации
электропроводность
дистиллированной воды должна
быть совершенно ничтожной
и она не может быть
использована для электролиза. Вот
почему для получения из
воды кислорода необходимо
иметь подкисленную или
подщелоченную воду.
Нам уже известно, что
кислота в воде диссоциирует
на ионы водорода и кислотный остаток, а щелочь — на
ионы металла и ионы гидроксила. Естественно было бы
ожидать, что в растворе, подкисленном серной кислотой,
на катоде будут разряжаться ионы водорода, а на
аноде — ионы S04 . Ионы водорода, разрядившись,
перейдут в атомы, которые, соединяясь попарно, дадут
молекулу водорода, а ионы S04 , отдав свой заряд
электроду, перейдут в раствор в виде незаряженного
кислотного остатка—радикала S04. Соединяясь с
водой, этот радикал образует серную кислоту и кислород
(2S04 — -4(e) — 2S04; 230, + 2Н20 — 2H2S04 + О,).
Можно было бы ожидать, что в щелочных растворах
ионы натрия разрядятся на катоде, переходя в атомы
натрия (Na+ + (е)—*Na), которые, соединяясь с водой,
дадут щелочь и водород (2Na + 2Н20—2NaOH + Н2). На
аноде ионы гидроксила, потеряв свои электроны,
соединятся попарно, образуя из радикалов воду, освобождая
кислород (40Н~~—4(e) —.2Н20 + 02).
Однако в действительности в кислых и щелочных
растворах процесс образования кислорода и водорода
происходит иначе.
Несмотря на то что в щелочных растворах имеется
Прохождение электрического
тока через раствор: /—катод;
2 — анод; 3 — положительно
заряженные ионы — катионы;
4 — отрицательно заряженные
ионы — анионы.
75
очень много ионов натрия и мало ионов водорода, на
катоде в первую очередь разряжаются ионы водорода.
В растворах, подкисленных серной кислотой, на аноде
прежде всего разряжаются ионы гидроксила, полученные
за счет диссоциации воды, а не ионы S04— , которых
неизмеримо больше. Это объясняется тем, что разряд
ионов водорода или гидроксила происходит легче, чем
ионов натрия или S04 . Поэтому в щелочных
растворах, которые обычно применяются для электролиза воды,
на катоде разряжаются главным образом ионы водорода,
а на аноде — ионы гидроксила. Как только эти ионы
разрядятся, немедленно образуются новые ионы за счет
диссоциации молекул воды.
Таким образом, при электролитическом получении
кислорода и водорода расходуется только вода. Литр воды
дает примерно 1360
литров водорода и 680 литров
кислорода.
Под руководством
учителя и соблюдая меры
предосторожности, можно
сделать опыт,
показывающий, как разлагается вода.
Возьмите банку с
широким горлом и наполните
ее на две трети
20-процентным водным раствором
щелочи. Плотно закройте
банку пробкой, в которую
вставлены две никелевые
проволочки с небольшими
пластинками на концах —
электродами. В середину
пробки вставьте коротким
концом загнутую
стеклянную трубку, через
которую будут выходить газы.
Второй, длинный конец
трубки опустите в чашку
с водой, чтобы в нее во
время опыта не попадал
воздух. Подключите к
Электролиз воды: / — банка с
электролитом; 2 — катод, на
котором выделяется водород;
3 — анод, на котором
выделяется кислород; 4 — трубка для
отвода газов; 5 — чашечка с
водой.
верхним концам электродов
постоянный ток от двухволь-
тового аккумулятора. На
электродах под раствором
сразу же появятся пузырьки
газа. Это кислород и
водород, которые, смешиваясь,
образуют гремучий газ.
Вспомним свойство этой
смеси газов. Если ее
поджечь, она легко взрывается.
Поэтому подходить с огнем
к банке опасно.
Чтобы убедиться, что в
банке образовались
кислород и водород, пропустите
сначала немного газа через
чашечку с чистой водой, а
затем поставьте вместо нее
чашечку с мыльной водой.
Образуются мыльные
пузыри, наполненные гремучим
газом. Выключите ток,
отставьте банку в сторону и
подожгите длинной лучинкой
один из летающих пузырей.
Раздастся легкий взрыв.
В пузыре была гремучая смесь — смесь одного объема
кислорода с двумя объемами водорода.
Мы пока только разложили воду, но не разделили
образовавшиеся газы и не получили кислорода.
Как же отделить кислород от водорода?
Для этого нужен более сложный прибор —
электролизер, который состоит из широкой загнутой трубки,
наполненной раствором щелочи, в которую погружены два
электрода из никеля.
Кислород будет выделяться в правом колене
электролизера, куда подключен положительный полюс источника
тока, а водород — в левом.
Это обычный тип электролизера, которым пользуются
в лабораториях для получения небольших количеств
чистого кислорода.
77
Стеклянный электролизер для
получения кислорода и
водорода: 1—трубка с
электролитом; 2 — катод; 3 — анод.
Монополярная ванна.
В больших количествах
кислород получают в
электролитических ваннах
разнообразных типов.
Войдем в один из
электрохимических заводов по
производству кислорода и
водорода. В огромных
светлых залах-цехах
строгими рядами стоят
аппараты, к которым по
медным шинам подводится
постоянный ток. Это
электролитические ванны.
В них из воды можно получить кислород и водород.
Электролитическая ванна — сосуд, в котором
параллельно друг другу расположены электроды. Сосуд
наполняют раствором — электролитом. Число электродов
в каждой ванне зависит от размера сосуда и от
расстояния между электродами. По схеме включения электродов
в электрическую цепь ванны делятся на однополярные
(монополярные) и двухполярные (биполярные).
В монополярной ванне половина всех электродов
подключается к положительному полюсу источника
тока, а вторая половина — к отрицательному полюсу.
В такой ванне каждый
электрод служит или
анодом, или катодом, и
на обеих сторонах его
идет один и тот же
процесс.
В биполярной ванне
источник тока
подключается только к крайним
электродам, один из которых
служит анодом, а
другой — катодом. С анода
ток поступает в
электролит, через который он
переносится ионами к
близлежащему электроду и
заряжает его отрицательно.
Биполярная ванна: 1 — катод;
2 — анод; 3 — биполярные
электроды.
Отделение кислорода от водорода
в электролитической ванне
металлическими колоколами.
Проходя через
электрод, ток снова входит в
электролит, заряжая
обратную сторону этого
электрода положительно.
Таким образом, проходя
от одного электрода к
другому, ток доходит до
катода.
В биполярной ванне
только анод и катод
работают как монополярные
электроды. Все же
остальные электроды, расположенные между ними, являются
с одной стороны катодами (—), а с другой стороны —
анодами (+).
При прохождении электрического тока через ванну
между электродами выделяются кислород и водород. Эти
газы нужно отделить друг от друга и направить каждый
по своему трубопроводу.
Существуют два способа отделения кислорода от
водорода в электролитической ванне.
Первый из них заключается в том, что электроды
отгораживаются друг от друга металлическими колоколами.
Образующиеся на электродах газы поднимаются в виде
пузырьков кверху и попадают каждый в свой колокол,
откуда через верхний отвод направляются в трубопроводы.
Этим способом кислород легко отделить от водорода.
Однако такое разделение приводит к излишним,
непроизводительным затратам электроэнергии, так как электроды
приходится ставить на большом расстоянии друг от друга.
Другой способ разделения кислорода и водорода прч
электролизе заключается в том, что между электродами
ставится перегородка — диафрагма, которая является
непроницаемой для пузырьков газа, но хорошо пропускает
электрический ток. Диафрагма может быть сделана из
плотно сатканной асбестовой ткани толщиной 1,5—2
миллиметра. Эту ткань натягивают между двумя стенками
сосуда, создавая тем самым изолированные друг от друга
катодные и анодные пространства.
Водород из всех катодных и кислород из всех анодных
пространств поступают в сборные трубы. Оттуда по
79
трубопроводам каждый газ направляется в отдельное
помещение. В этих помещениях под давлением 150
атмосфер полученными газами наполняют стальные баллоны.
Баллоны направляют во все уголки нашей страны.
Кислород и водород находят широкое применение в различных
областях народного хозяйства.
ПОТРЕБЛЕНИЕ КИСЛОРОДА В ПРИРОДЕ
И ПРИМЕНЕНИЕ ЕГО В ТЕХНИКЕ
Кислород и его роль в жизни на земле
Все живые существа в природе, за исключением
немногих микроорганизмов, при дыхании потребляют кислород.
Дыхание — одна из основных функций живого
организма. Оно основано на поглощении кислорода из
окружающей среды и возвращении в нее углекислого газа.
У небольших животных организмов, например
дождевых червей, у которых отношение поверхности тела к их
объему достаточно велико, дыхание совершается через
покровы. Обязательным условием этого простейшего вида
дыхания является постоянная влажность кожи. Кислород
воздуха, растворяясь в жидкости, смачивающей кожу,
проникает в организм путем диффузии.
У животных организмов с более энергичной
жизнедеятельностью газовый обмен с внешней средой совершается
через специальные органы дыхания. У большинства
насекомых таким органом служат трахеи — система тонких
трубок-капилляров, выходящих на поверхность кожи
парными отверстиями — дыхальцами. Внутри эти трубки
разветвляются, проникая во все части тела. При дыхании
насекомого создается как бы всасывание и выталкивание
газов из трахей, что обеспечивает постоянный приток
кислорода в организм.
Дыхание у рыб осуществляется при помощи жабер,
обладающих сильно развитой поверхностью. Жабры
состоят из выростов, густо оплетенных кровеносными
сосудами. Снаружи жабры защищены жаберными крышками.
Рыбы всасывают воду через ротовое отверстие и, омывая
жабры, выталкивают ее наружу из-под жаберных
крышек. Растворенный в воде кислород диффузией проникает
через тонкие пленки выростов жабер и, поглощаясь
80
кровью, разносится по всему организму. Происходит
окисление клеток. Образующийся углекислый газ
захватывается кровью и через жабры уходит в воду.
Потребление кислорода человеком и большинством
животных на земле происходит через легкие и частично
через кожу. Человек начинает потреблять кислород с
первого момента своего появления на свет. Первый вдох
у новорожденного обычно происходит самопроизвольно,
но иногда его приходится вызывать искусственно.
Шлепком по телу младенца вызывают соответствующее
раздражение дыхательных органов, которые после первого
вдоха не прекращают своей работы до конца жизни.
Как же происходит процесс дыхания у человека?
Ошибочно думать, что процесс дыхания у человека
происходит только в легких. Его можно разделить на три
основных этапа. Кислород, вдыхаемый легкими,
поглощается кровью. Легкие представляют собой как бы губку,
построенную из выростов в виде легочных пузырьков.
Концевые части этих пузырьков носят название альвеол.
Они оплетены густой сетью кровеносных сосудов. Общая
поверхность легочных альвеол огромна. На этой большой
поверхности и происходит соприкосновение кислорода
с кровью.
Через тонкие стенки альвеол диффузией кислород
проникает в кровеносные сосуды.
Далее наступает второй этап процесса дыхания. Кровь
разносит кислород по всему телу и доставляет его тканям.
Наконец, третий этап — клетки впитывают своей
поверхностью принесенный к ним кислород и употребляют его на
медленное горение, или окисление. В результате
образуется углекислый газ. Кровь захватывает углекислый газ и
уносит его в легкие, откуда он выделяется наружу при
выдохе. Обычно процесс дыхания воспринимается только
как ритмичное движение дыхательных органов.
Что же заставляет дыхательные органы — легкие —
ритмично двигаться, всасывая воздух при расширении и
выдыхая его при сжатии?
Дыхательные движения создаются специальными
дыхательными мышцами. Эти мышцы, сокращаясь,
вызывают уменьшение объема грудной клетки, а расширяясь,
увеличивают его. За короткий промежуток времени
между вдохом и выдохом в крови успевает произойти газо-
81
вый обмен, то-есть кровь отдает принесенный из
организма углекислый газ и захватывает свежую порцию
кислорода.
Сколько же воздуха поглощает человек при каждом
вдохе?
В спокойном состоянии каждым вдохом человек
вбирает в себя и выдыхает около 500 кубических сантиметров
воздуха. Максимально сильным вдохом человек может
вобрать в себя дополнительно 1500 кубических
сантиметров воздуха. При глубоком выдохе, кроме обычных 500
кубических сантиметров, человек может отдать еще 1500
кубических сантиметров запасного воздуха.
Но легкие человека никогда не остаются пустыми,
в них всегда содержится около 1500 кубических
сантиметров остаточного газа.
Таким образом, если после максимального выдоха
сделать сильный вдох, можно вобрать в себя до 3,5 литра
воздуха. Добавив к этим 3,5 литра воздуха еще 1500
кубических сантиметров газа, которые остаются в легких
даже при максимальном выдохе, получим общий объем
газа, который может поместиться в легких человека.
Этот объем составляет около 5 литров.
В спокойном состоянии и при нормальных
метеорологических условиях, когда температура воздуха держится
в пределах 18—22° и относительная влажность составляет
40—70 процентов, человек может пропустить через свои
легкие около 8 литров воздуха в минуту, то-есть около
500 литров в час. При этом человеческий организм
получает примерно 22 литра кислорода.
При выполнении тяжелой физической работы или при
быстрых движениях дыхание у человека учащается и
количество воздуха, пропускаемого через легкие,
увеличивается в 10 и более раз. Так, например, спортсмены при
беге или плавании вдыхают и выдыхают в минуту 120—
130 литров воздуха; соответственно увеличивается и
количество кислорода, получаемого организмом.
На что же расходуется в организме кислород?
Кислород в организме идет на окисление клеток.
Благодаря окислительным процессам, происходящим в
организме, образуется тепло. Количество этого тепла зависит
от количества и характера пищи, получаемой организмом,
а также от выполняемой работы.
82
У человека весом 70 килограммов количество тепла,
которое образуется в спокойном состоянии, составляет
примерно 70 больших калорий в час.
Этого тепла достаточно для того, чтобы поднять на
один градус температуру 70 килограммов воды или
вскипятить килограмм воды, начальная температура которой
составляла 30°.
У человека, выполняющего легкую физическую работу,
образуется 95—ПО больших калорий тепла в час; у
выполняющего работу средней тяжести—130—150 больших
калорий; у выполняющего тяжелую физическую работу
количество образующегося тепла превышает 180 больших
калорий.
Около 80 процентов тепла, образующегося в
организме, человек отдает в окружающую среду через кожу.
Одна треть всего отдаваемого тепла уходит путем
конвекции, то-есть путем нагревания протекающего мимо
человека воздуха. Около половины всего отдаваемого тепла
переходит в окружающую среду излучением. Через
одежду, температура которой обычно составляет 25—26°,
тепло переходит к более холодным предметам,
окружающим человека. Наконец, часть тепла уходит за счет
испарения и дыхания.
Если температура окружающей среды равна примерно
20°, то теплообмен идет нормально. Если же температура
воздуха значительно выше, отдача тепла путем излучения
и конвекции затрудняется, увеличивается отдача тепла за
счет испарения. У человека наступает усиленное
потовыделение и тягостное ощущение жары. Если, кроме того,
человек находится в закрытом помещении, к ощущению
жары прибавляется ощущение духоты, так как
количество кислорода в воздухе постепенно уменьшается, а
количество углекислого газа увеличивается за счет того, что
выдыхаемый человеком воздух содержит углекислого
газа в 100 раз больше, чем вдыхаемый.
В спокойном состоянии взрослый человек выдыхает
за один час около 20 литров углекислого газа.
Нормальное содержание углекислого газа в воздухе
составляет по объему 0,03 процента. Если в воздухе
содержится 0,3 процента углекислого газа, воздух считается
сильно загрязненным, но еще не опасным для жизни
человека. Трехпроцентное содержание углекислого газа в воз-
83
духе плохо отражается на самочувствии человека, а вось-
ми-десятипроцентное вызывает смерть.
Человек не может находиться в помещении, где
содержание углекислого газа в воздухе выше нормального,
а кислорода — ниже нормального. Такие помещения
необходимо проветривать — вентилировать. Естественной
вентиляции через поры стен и щели в притворах окон и
дверей обычно бывает недостаточно.
В жилых помещениях вентиляция осуществляется
через вентиляционные каналы, форточки и окна. В
общественных зданиях устанавливается механическая
вентиляция, позволяющая систематически обменивать воздух
в помещении и поддерживать в нем нужную температуру.
Для нормального самочувствия человека в аудиториях,
классных комнатах, кабинетах, театрах и кино
воздухообмен на одного человека должен составлять не менее
20 кубических метров в час.
В больничных палатах нормы эти увеличены до 30—
50 кубических метров в час на одного больного.
На производственных предприятиях при
разнообразных технологических процессах в воздух часто попадает
большое количество водяных паров, пыли, газов. Кроме
того, некоторые котлы, печи, машины и аппараты
излучают большое количество тепла, которое делает воздух
вредным для здоровья.
В нашей стране, где вопросам охраны труда уделяется
исключительное внимание, вентиляция производственных
помещений рассчитывается таким образом, чтобы
непрерывно обеспечивать в цехах нормальный состав воздуха
в течение всего рабочего времени. Для этого
устанавливают мощные приточные и вытяжные вентиляторы. В
зависимости от условий работы в цехах воздух подается
с соответствующим содержанием влаги и определенной
температуры. Обеспечение нормальных условий дыхания
и теплообмена при работе сохраняет здоровье рабочих и
увеличивает производительность труда.
Итак, помимо нашей воли, днем и ночью — во время
работы, отдыха и сна — непрерывно происходит газовый
обмен организма с окружающей средой, идет потребление
кислорода живым организмом.
В обычных условиях человек чистым кислородом не
дышит. Его иногда применяют в медицине. Больным,
84
у которых нарушена
нормальная деятельность органов
дыхания или кровообращения,
искусственно увеличивают
содержание кислорода в воздухе или
дают дышать
непродолжительное время чистым кислородом.
В больницах существуют
специальные палаты, в которых
к обычному воздуху добавляют
определенное количество
чистого кислорода, создают
нужный для больных состав
воздуха.
Для дыхания чистым
кислородом употребляются
кислородные подушки, представляющие
собой наволочки из
прорезиненного полотна. В одном из
углов такой наволочки имеется
резиновая Трубка С ВИНТОВЫМ Наполнение кислородной
зажимом. Через эту трубку по- подушки,
душка наполняется кислородом
из баллона, и через нее же больной дышит кислородом.
Кислород, который употребляется для медицинских
целей, особенно тщательно очищают от всех примесей. Его
содержат в баллонах с этикеткой «медицинский».
Чистый кислород употребляется не только в
медицине.
Воздух, как и всякое тело, притягивается к земле, ц
его плотность у земной поверхности больше, чем вдали от
нее. Чем дальше от земли, тем воздух становится
разреженнее и барометрическое давление его уменьшается.
Так, например, на высоте 10 километров от земли
давление воздуха составляет всего лишь 217 миллиметров
ртутного столба вместо 760 миллиметров на уровне
моря.
Какой же процентный состав воздуха на больших
высотах?
Еще до недавнего времени считали, что в атмосфере,
прилегающей к поверхности земли, преобладают более
тяжелые газы, а вдали от нее — более легкие.
85
При полете на большой
высоте летчик надевает
кислородную маску.
Многочисленные
исследования, проведенные за
последние годы, не
подтвердили этого предположения.
Не подтвердилось оно также
и анализом проб воздуха,
взятого на высоте 70
километров при помощи
специальных ракет.
Результаты анализа этих
проб и другие исследования
показали, что состав воздуха
в отдаленных от земли слоях
атмосферы почти не
меняется и процентное содержание
кислорода в нем такое же,
как и у поверхности земли.
Так как барометрическое давление воздуха по мере
удаления от земли падает, то падает и давление каждой
составной части воздуха в отдельности, то-есть падает
парциальное давление кислорода, азота и других газов,
входящих в состав воздуха.
Парциальное давление кислорода на высоте 10
километров почти в 4 раза меньше, чем у поверхности земли,
и составляет только 45 миллиметров ртутного столба
вместо 150 на уровне моря.
Скорость проникновения кислорода к кровеносным
сосудам путем диффузии определяется не процентным его
содержанием в воздухе, а парциальным давлением. Вот
почему, несмотря на то что содержание кислорода в
воздухе на больших высотах составляет 21 процент,
количество его по мере удаления от земли становится все
меньше и меньше и дыхание у людей затрудняется. На высоте
около 5 тысяч метров, где парциальное давление
кислорода падает до 105 миллиметров ртутного столба, у
человека уже появляются тяжесть в голове, сонливость,
тошнота, а иногда и потеря сознания. Такое состояние
характерно при кислородном голодании, которое
вызывается пониженным содержанием кислорода в воздухе по
сравнению с обычным его содержанием на уровне моря.
Снижение парциального давления кислорода до
50—70 миллиметров ртутного столба вызывает смерть.
86
Вот почему без искусственного добавления кислорода
к воздуху, который вдыхают летчики при высотных
полетах, было бы невозможно достичь современного потолка
полета.
На высоте 4,5—5 тысяч метров летчикам приходится
пользоваться дыхательными масками, в которые из
баллончика к вдыхаемому воздуху добавляется немного
кислорода. По мере увеличения высоты полета
количество кислорода, добавляемого в маску, увеличивается.
Это обеспечивает нормальное дыхание экипажу
самолета.
Водолазы при работе под водой также применяют
кислород для дыхания. В атмосфере удушливых газов
пожарники пользуются кислородными масками, в которые
воздух из окружающей среды совершенно не попадает.
Главными потребителями кислорода в природе
являются животный и растительный мир. Но растения и
животные потребляют кислород только для дыхания, человек
же использует его и для удовлетворения своих бытовых
потребностей и в промышленности.
Горючие газы
Во многих городах нашей страны газ широко вошел
в быт людей.
Кислород играет решающую роль при его горении.
Прикройте на минутку воздушную заслонку у горелки
газовой плиты. Пламя газовой горелки станет белым,
коптящим и недостаточно горячим. Это потому, что газ
Горелка газовой плиты.
сгорает не полностью, ему не хватает того кислорода,
который он встречает в воздухе при выходе из горелки.
Чтобы полнее использовать теплотворную способность
газа, горелка устроена так, что при входе в нее газ
подсасывает воздух и, смешиваясь с ним, подходит к пламени
с таким количеством кислорода, которого достаточно для
его полного сгорания. Пламя при этом получается
синеватое, короткое и очень горячее. Прикрывая кран газовой
горелки, вы уменьшаете приток газа и тем самым
уменьшаете подсос воздуха.
Газ, которым пользуются в быту, чаще всего
добывается из недр земли и называется природным газом.
Большинство природных газов — это смесь
органических соединений, главным образом углеводородов, то-есть
соединений, в состав которых входят углерод и водород.
Оба эти элемента при соединении с кислородом выделяют
огромное количество тепла.
В настоящее время открыто очень много крупных
месторождений природного газа. Особенно богата
природными газами Саратовская область.
По специальному газопроводу Саратов — Москва газ
поступает в столицу нашей Родины, где широко
используется в промышленности и для бытовых нужд населения.
Преимущества газообразного топлива перед твердым
огромны. К ним прежде всего относятся удобства
потребления, легкость подачи топлива в топку или газовую
горелку, чрезвычайная простота управления пламенем и
большая гигиеничность.
Но самым важным преимуществом газообразного
топлива является его высокая теплотворная способность.
Температура пламени горящего газа значительно выше
температуры пламени твердого топлива и в некоторых
случаях достигает 3000°.
Как же проходит процесс горения твердого и
газообразного топлива?
При горении твердое топливо вначале подсушивается,
а затем наступает так называемая сухая перегонка.
Образуются газообразные вещества, содержащие углерод.
Углерод этих горючих веществ соединяется с кислородом
воздуха.
Сгорая, углерод образует углекислый газ (С02). При
этом выделяется тепло. Часть этого тепла расходуется
38
на осушку и перегонку новых частей твердого топлива;
часть тепла забирает азот, который поступает в топку
вместе с кислородом.
Нагреваясь до высокой температуры, азот покидает
топку, бесцельно унося с собой тепло в атмосферу. Кроме
того, из-за плохого «перемешивания» воздуха с твердым
топливом не весь кислород, поступающий в топку,
участвует в горении; часть его, нагреваясь вместе с азотом,
также уходит в атмосферу. Большое количество тепла
уходит бесполезно, и вместе с ним уносится много мелких
частиц угля в виде дыма.
При использовании газообразного топлива часть этих
недостатков устраняется. Горючий газ еще до подхода
к пламени хорошо перемешивается с кислородом воздуха.
Подачу воздуха в топку можно отрегулировать так, чтобы
его было достаточно для полного сгорания газа и не было
лишней потери тепла.
При подаче в топку подогретого газа и горячего
воздуха потери тепла почти полностью устраняются. На
подогревание воздуха и газа обычно используется тепло газов,
выходящих из топки. Газообразное топливо экономичнее
к удобнее твердого.
Газообразное топливо можно получить и
искусственным путем. Для этой цели служат так называемые
газогенераторные установки.
В высокую колонку, снабженную внизу колосниковой
решеткой, загружают уголь. Загрузка угля производится
через верхнее загрузочное отверстие. Когда колонка
заполнена, отверстие закрывают, оставляя только узкий
выход для газов. Снизу колонки под решетку подают воздух
с определенным содержанием кислорода и поджигают
уголь. Нижние слои угля, сгорая в присутствии
кислорода, образуют углекислый газ и выделяют тепло. Это тепло
поднимается вверх по колонке и накаляет верхние слои
угля. Углекислый газ, полученный при горении нижних
слоев, проходит через раскаленные до 700° верхние слои
угля, отдает им часть своего кислорода и образует окись
углерода (С02 + С—»• 2СО). Окись углерода вместе с
азотом воздуха проходит через выходное отверстие и
собирается в газохранилищах.
Газ, получаемый в генераторных установках, называют
генераторным газом.
89
Если в генератор вместе с воздухом пустить водяной
пар, то одновременно с окисью углерода образуется и
водород (4С + 02 + 2Н20 —4СО + 2Н2). Смесь этих газов
носит название водяного газа и также используется как
газообразное топливо. При горении водяного газа окись
углерода соединяется с кислородом и образует углекислый
газ (2СО + Оо—^2С02). А водород, соединяясь с
кислородом, дает воду (2Н2 + 02—>2Н20).
Как генераторный, так и водяной газ содержит окись
углерода. Окись углерода — бесцветный газ, не имеющий
запаха, немного легче воздуха. Она ядовита и вызывает
угар, откуда и происходит другое ее название — угарный
газ. В общежитии мы часто подразумеваем под «угаром»
запах несгоревшего топлива. Однако запах этот
принадлежит не окиси углерода, а другим продуктам горения,
также содержащим углерод.
Если продолжительное время (3—4 часа) находиться
в помещении, где на каждые 100 тысяч частей воздуха
приходится только одна часть окиси углерода, можно
угореть. Примесь одной части окиси углерода к 800 частям
воздуха уже крайне опасна для жизни человека и за
полчаса может вызвать смерть.
Лучшим средством для пострадавшего является
чистый воздух, а при сильном отравлении — чистый
кислород.
Окись углерода обладает большой калорийностью. При
сгорании 1 граммолекулы окиси углерода (28 граммов)
выделяется 67 500 калорий; это на 29 500 калорий меньше
тепла, выделяемого при сгорании 1 грамматома углерода
(12 граммов):
(С + 02 = С02 + 97 000 кал.)
(СО + 7г02 = С02 + 67 500 кал.)
Казалось бы, что при таком соотношении тепловых
эффектов нецелесообразно уголь переводить в окись
углерода, с тем чтобы, в конечном итоге, при сжигании ее
получить меньше тепла. В действительности же это не так.
Если подсчитать все потери тепла при сгорании твердого
топлива, в том числе и потери на золу, которая составляет
5—30 процентов, то использование генераторного газа
окажется выгодным.
Еще более целесообразным является получение окиси
углерода на месте залегания угля без добычи его на по-
90
верхность. Такой способ получения газообразного топлива
носит название подземной газификации угля.
Идея подземной газификации угля впервые родилась
у великого русского химика Менделеева. В 80-х годах
Схема газогенераторной установки для
получения горючего газа из твердого топлива: / —
загрузочное отверстие; 2 — твердое топливо; 3 —
колосниковая решетка; 4 — отверстие для подачи
воздуха; 5 — выход генераторного газа.
прошлого столетия он писал: «Настанет, вероятно, со
временем даже такая эпоха, что угля из земли вынимать не
будут, а там, в земле, сумеют превращать в горючие газы
и их по трубам будут распределять на далекие
расстояния».
Эта смелая для того времени мысль была подхвачена
многими учеными. Начало осуществления идеи подземной
91
газификации было оценено В. И. Лениным в статье «Одна
из величайших побед в технике», опубликованной в
«Правде» в 1913 году. В. И. Ленин охарактеризовал
подземную газификацию как переворот в промышленности,
равносильный гигантской технической революции едва ли
не самой важной отрасли производства.
Однако в условиях царской России не удалось развить
подземную газификацию. Это стало возможным только
при советской власти.
В 1931 году Центральный Комитет Всесоюзной
Коммунистической партии принял решение по реализации
проблем подземной газификации угля. С тех пор в нашей
стране идет непрерывная работа по широкому внедрению
этого передового метода добычи топлива из недр земли.
Преимущества этого метода огромны.
Подземная газификация значительно упрощает и
удешевляет разработку каменноугольных месторождений и
облегчает труд горняков. Транспорт освобождается от
перевозок большого количества твердого топлива.
На чем основан принцип подземной газификации угля?
Получение горючего газа из угля на месте его
залегания ничем не отличается от получения газа в
генераторных установках. Уголь соединяется с кислородом, образуя
углекислый газ. На своем пути к выходу он встречается
с раскаленными частицами угля и, взаимодействуя с ними,
переходит в окись углерода.
При помощи буровых механизмов прорывают два
отверстия на глубину залегания угольного пласта. Эти
отверстия носят название шахт или выработок. Под
пластом угля шахты соединяются между собой узким
коридором — огненным забоем. В нем и происходит
газификация. Расстояние между шахтами в зависимости от
условий может быть от 100 до 500 метров. Через одну из
шахт в огненный забой опускают проволочную спираль,
через которую пропускают электрический ток. Спираль
накаляется. Одновременно через эту же шахту нагнетают
кислород. Уголь под землей загорается, и образующиеся
газы выходят на поверхность через вторую шахту.
Выходящие газы охлаждают, очищают от пыли и по
трубопроводам направляют потребителям.
При подземной газификации можно использовать
угольные пласты любой толщины.
92
Подземная газификация угля. 1 — поверхностный слой породы;
2 — шахта для подачи воздуха, обогащенного кислородом; 3 — пласт
угля; 4 — огненный забой; 5 — шахта для выхода горючего газа.
Газы, полученные при подземной газификации,
применяются в различных областях народного хозяйства.
Состав выходящего газа можно изменить, нагнетая в шахту
различные смеси газов. Так, например, если газ
направляют на заводы для синтеза жидкого горючего, в шахту
нагнетают чистый кислород с парами воды. Ести газ
хотят использовать для синтеза аммиака, в шахту подают
воздух с 50—60-процентным содержанием кислорода,
смешанный с парами воды. Для топливного газа в шахту
нагнетают воздух, обогащенный 25—30 процентами
кислорода.
Состав газа, нагнетаемого в шахту, а также
выходящие газы непрерывно контролируются
газоанализаторами. Температура в огненном забое измеряется
электроизмерительными приборами, соединенными с термопарами,
расположенными в забое. При помощи различных
сложных приборов производится управление процессом
газификации и непрерывный контроль за ним.
93
/т\*,.< поо°
Существуют различные приспособления для сжигания
газа. Наиболее простое из них — лабораторная горелка.
Горючий газ подается внутрь горелки через трубку. На
выходе из капсуля внутри горелки газ подсасывает
воздух и перемешивается с ним в цилиндрической трубке.
Смесь газа с воздухом сгорает, образуя пламя над
трубкой.
Пламя лабораторной горелки — вытянутый кверху
конус, состоящий из трех частей. Темная часть конуса
расположена у самой горелки и содержит несгоревшие газы.
Температура в этой части конуса небольшая — около 300°.
Вторая часть — светлая и имеет наибольшую температуру
пламени, которая достигает 1500°; здесь сгорает основная
часть газа. Наконец, третья, внешняя часть конуса имеет
температуру несколько меньшую, чем светлая; в ней
догорает оставшаяся часть
газа.
На пламени
лабораторной горелки можно
прокипятить или упарить раствор,
просушить или прокалить
соль, согнуть стеклянную
трубку.
Если внести в светлый
конус газовой горелки
стеклянную трубку, стекло
размягчится, и трубку можно
согнуть под любым углом.
Спаять две стеклянные
трубки в одну на такой горелке
почти невозможно. Для этого
нужно более горячее пламя.
Как его получить?
Чем больше кислорода
подается к пламени, тем
выше температура горения.
Если температура пламени
газовой горелки
недостаточно высока, значит мало того
кислорода, который газ
подсасывает с воздухом при
Газовая лабораторная горелка, входе в ГОрелку; необходимо
¦Ж 1,1;:'
lip
дополнительно подать воздух
насосом. В лабораторной
горелке этого сделать нельзя —
нужна паяльная горелка.
В паяльную горелку
через среднюю трубку под
давлением 3—4 атмосфер
подают воздух, а через
боковую трубку — газ. Газ
сгорает при большом
количестве кислорода, развивая при
этом более высокую
температуру. Регулируя кранами
приток воздуха и газа,
можно получить температуру,
достаточную для спайки
различных стеклянных изделий.
Однако кварц в пламени
такой горелки спаять нельзя.
Температура плавления кварца равна примерно 1700°.
Чтобы нагреть кварцевую трубку до температуры ее
плавления, недостаточно подавать в горелку воздух — нужен
чистый кислород. Для этого к центральной трубке
кислородной горелки из баллона подводят кислород. Пламя
в такой горелке превышает 2000°, и кварцевая трубка,
внесенная в него, плавится, излучая яркобелый свет,
ослепляющий глаза, поэтому мастера-стеклодувы при
работе с кварцем пользуются синими очками.
Пламя в газовых горелках можно легко регулировать,
увеличивая или уменьшая приток кислорода.
Настольная паяльная горелка.
Высокая температура и глубокий холод
Многие пористые горючие материалы, пропитанные
жидким кислородом, воспламеняясь в замкнутом
пространстве, дают взрыв огромной силы. Это объясняется
тем, что в присутствии большого количества
газообразного кислорода, полученного за счет испарения жидкого
кислорода, горючие вещества сгорают чрезвычайно быстро,
образуются газообразные продукты горения, которые при
высокой температуре сильно расширяются. Создается
огромное давление, происходит взрыв.
95
В качестве горючего материала могут быть
использованы древесный уголь, угольная пыль, прессованный мох,
торф, опилки, солома и другие пористые материалы,
содержащие углерод. Этими материалами набивают
бумажные или картонные патроны, в которых оставляют
отверстия для запала. Обычно патроны бывают
небольших размеров — примерно 35 миллиметров диаметром и
300 миллиметров длиной. Вес такого патрона от 70 до
100 граммов.
Перед тем как произвести взрывные работы, в породе
или грунте пробивают ряд небольших, но глубоких
отверстий. В эти отверстия должны свободно входить патроны.
Когда подготовительные работы закончены, подрывники
невдалеке от пробитых скважин погружают патроны
в сосуд с жидким кислородом. Температура патрона
понижается. Газообразный воздух, находящийся в порах
материала, сильно уменьшается в объеме, образуется
разреженное пространство, в которое всасывается
жидкий кислород.
Пористые вещества, пропитанные жидким кислородом,
называются оксиликвитами.
Чтобы не обморозить руки, оксиликвиты вынимают из
сосуда специальными щипцами. В отверстия патронов
вставляют взрыватели, к которым подключены
электрические проводнички.
Так как на воздухе жидкий кислород быстро
испаряется, патроны необходимо использовать сразу же после
пропитки. Подрывники быстро вставляют подготовленные
к взрыву оксиликвиты в заранее пробитые скважины,
соединяют между собой электрические провода от
взрывателей и покидают площадку.
Ток направляется по проводам к оксиликвитам.
Раздается оглушительный взрыв, и поднятые в воздух
огромные куски грунта с грохотом падают на землю.
Еще при строительстве Днепрогэса в Советском Союзе
начали широко использовать жидкий кислород для
производства взрывных работ. С тех пор оксиликвиты как
взрывчатое вещество применяются на строительстве
гидротехнических сооружений, при прокладке
железнодорожного полотна в пересеченной местности, в горнорудной
промышленности.
Взрывные работы при использовании оксиликвитов об-
96
ходятся значительно дешевле, чем при использовании
аммонала.
Оксиликвиты избавляют от необходимости перевозить
большие количества взрывчатых материалов, а также
отпадает необходимость их хранения, экономятся
ценные химические продукты для других отраслей народного
хозяйства.
У оксиликвитов есть еще одно преимущество: они
становятся совершенно безопасными через 15—20 минут
после их пропитки жидким кислородом. В случае если один
из патронов по какой-либо причине не взорвется
одновременно с остальными, он не может причинить
никакого вреда.
Итак, жидкий кислород находит применение при
производстве взрывных работ. Здесь используется свойство
кислорода мгновенно вступать в реакцию с углеродом
пористых веществ и создавать высокую температуру в
момент этой реакции.
Но жидким кислородом можно создать и очень низкие
температуры.
Температура жидкого кислорода равна —183°. Многие
вещества, охлажденные до этой температуры, сильно
меняют свои свойства.
Резина, которая полежит несколько минут в жидком
кислороде, приобретает хрупкость стекла. В
замороженном состоянии резину можно превратить в порошок. Для
этого ее нужно быстро растереть в ступке, не дав ей
согреться, так как при нагревании она снова приобретает
свое прежнее свойство — эластичность. Если резина
разморозилась и ее не удалось измельчить до конца,
можно еще раз налить в ступку немного жидкого кислорода
и, как только он испарится, продолжить растирание.
Таким же способом можно получить порошок из мяса
и фруктов.
Если охладить мягкое железо до температуры жидкого
кислорода или жидкого воздуха (—192°), оно делается
хрупким и при ударе разлетается на мелкие куски.
Высококачественные стали, охлажденные в жидком кислороде
или воздухе, совершенно не меняют своей хрупкости.
Изделия из стали, погруженные в жидкий кислород или
воздух, только уменьшаются в объеме.
Этим свойством воспользовались в производстве.
97
Для того чтобы плотно
насадить деталь на вал,
необходимо или увеличить
диаметр отверстия детали, или
уменьшить диаметр вала.
Раньше деталь нагревали.
Металл при этом расширялся
и отверстие увеличивалось —
в него свободно вставляли
вал. Затем деталь
охлаждали. При охлаждении
деталь уменьшалась в объеме,
и ее металл плотно
сжимался вокруг вала.
Этот способ применяется
для насадки сравнительно
небольших деталей. При
увеличении размеров детали
нагревание ее может
привести к деформации.
Поэтому целесообразнее
пользоваться другим способом
насадки.
Вал погружают в жидкий
азот или воздух и вскоре,
когда он достаточно охладится, его свободно вставляют
в отверстие подготовленной детали. Согреваясь, вал
расширяется и плотно прижимается к стенкам отверстия.
Применять жидкий кислород в этом случае опасно, так
как вместе с деталью в жидкий кислород может попасть
масло, которое вызовет взрыв.
На химических заводах, в заводских лабораториях и
в научно-исследовательских институтах жидкий кислород
и жидкий воздух широко используются для химических
реакций, требующих низких температур, а также для
очистки воздуха.
Чтобы очистить воздух от всевозможных примесей и
влаги, его пропускают через загнутую трубку,
вставленную в сосуд с жидким кислородом. Такая трубка
называется ловушкой. В ловушке задерживаются углекислый
газ, влага и некоторые инертные газы. Практически
остаются только азот и кислород.
Прибор для улавливания
газообразных примесей в воздухе: / —
сосуд с жидким кислородом;
2 — ловушка.
98
Выплавка металла из руды
Еще за две тысячи лет до нашей эры люди научились
получать железо из руды. В те далекие времена железо
получали в небольших плавильных печах — горнах.
Первые горны были крайне примитивны и
представляли собой ямы, вырытые в земле на склонах гор, откуда и
пошло их название. В горн закладывали дрова и, когда
они разгорались, насыпали руду, смешанную с древесным
углем. Внизу ямы вырывали дополнительное отверстие,
через которое проходил воздух. В таком горне, где воздух
поступал только естественной тягой, невозможно было
достичь температуры плавления железа. Вместо
расплавленной массы в нем получали спекшиеся куски железа,
засоренного шлаком и золой.
Много лет прошло, пока наши предки научились
искусственно увеличивать приток воздуха в горн. Для этой
Так получали железо в первобытные времена.
Схематическое изображение древнеегипетского горна.
цели они использовали шкуры животных, изготовляя из
них мехи. Сохранился схематический рисунок, на котором
изображено, как в древнем Египте производилась
выплавка металла в горнах с приспособлением для поддувания
воздуха. Однако такие приспособления лишь немного
улучшали качество получаемого металла.
Значительно позднее, в начале XIII века, когда люди
стали использовать энергию падающей воды для
вращения механизмов, появились устройства, которые
позволили усилить приток воздуха в плавильные печи и
достигнуть в них температуры плавления железа. С тех пор
стали строить печи — домницы — и получать расплавленный
металл в более чистом виде.
В чем же заключается процесс выплавки металла, как
получают чугун и какую роль играет кислород?
Чугун — это железо, которое содержит в небольших
количествах углерод, кремний, марганец и другие
примеси. Чугун получается в доменных печах из расплавленной
железной руды, а из чугуна варят сталь.
Роль кислорода в доменном процессе чрезвычайно
интересна и многообразна.
Основным сырьем для получения чугуна являются
окислы железа, отличающиеся друг от друга процентным
содержанием кислорода. Первый окисел, наиболее
богатый кислородом, — окись железа (Fe203). Он
содержит 30 процентов кислорода и 70 процентов железа. Вто-
100
рой — магнитная окись железа (Fe304) — имеет 27,6
процента кислорода и, наконец, третий — закись железа
(FeO) — на 22,3 процента состоит из кислорода. Для того
чтобы получить чугун, у этих окислов нужно отнять
кислород — восстановить их.
Процесс восстановления окислов идет обычно при
высокой температуре. Для получения высоких температур
требуется кислород. Поэтому отнять кислород у
окисленного железа можно только при участии газообразного
кислорода. В этом и заключается своеобразие доменного
процесса.
Для восстановления окислов железа можно
использовать различные восстановители. В доменном процессе
такими восстановителями служат окись углерода (СО) и
водород (Н2), а также раскаленный твердый уголь (С).
Основным восстановителем в доменном процессе
является окись углерода. Для получения окиси углерода
нужен уголь. При горении уголь, с одной стороны, обеспечи
вает нужную температуру, а с другой — окисляясь до
окиси углерода, становится
главным восстановителем.
Какой же уголь
используется в доменных печах?
Основным видом
топлива при выплавке чугуна
является кокс. Он
получается в коксовых печах
из специальных сортов
коксующихся каменных
углей,
На крупных
металлургических заводах кокс
вырабатывается в
коксохимических цехах, где 50—
70 печей или камер для
коксования объединены в
одну крупную батарею.
Управление такой
батареей полностью
механизировано.
Сущность процесса
коксования заключается в
Домница,
Воздух Газ
воздух Газ'
Схема работы коксовой батареи:
/ — камеры с углем; 2 —
межкамерные пространства.
том, что смесь
раздробленных коксующихся и
некоксующихся каменных
углей загружают в
камеры и подогревают без
доступа воздуха до
температуры 1000°. Камеры
обогреваются снаружи.
Чтобы температура внутри
печи достигла 1000°, в
пространствах между
камерами необходимо развить
температуру до 1400°.
Коксовая батарея
отапливается газом,
смешанным с подогретым
воздухом.
В процессе коксования
при нагревании каменного
угля до температуры 100°
из него медленно испаряется влага. При дальнейшем
нагревании до температуры 350° идет осушение угля
и удаление из него смолы. Повышение температуры до
450° приводит к размягчению частиц коксующегося угля.
Размягченные частицы обволакивают некоксующиеся
частицы угля, образуя сплошную массу. При температуре
480—650° из этой массы начинают выделяться
органические газообразные продукты сухой перегонки угля.
Выделяющиеся газы вспучивают сплошную угольную
массу и, покидая ее, оставляют ноздреватый уголь с
большим количеством мелких пор и трещин. Это полукокс.
При температуре 650—1000° он переходит в кокс,
который имеет серебристый, светловато-серый цвет.
Из 1 тонны каменного угля можно получить 750
килограммов кокса, около 300 кубических метров коксового
газа, 35 килограммов каменноугольной смолы, 12
килограммов бензола и около 3 килограммов аммиака.
Доменная печь представляет собой громадное
сооружение — до 20 метров высоты. Верхняя часть ее служит
для загрузки шихты, состоящей из руды, угля и флюсов,
и носит название колошника. Оно произошло от слова
«колоша» — так в старину на Урале называли плетеные
102
го м
корзины, в которых переносили древесный уголь для
загрузки его в домну. За колошником идет самая большая
по высоте коническая часть домны — шахта. Ниже
расположена цилиндрическая часть — распар, затем опять
конусообразная часть — заплечики и, наконец,
цилиндрическая часть — горн.
В горне собирается расплавленный металл — чугун.
В нижней части горна имеются отверстия: для
выпуска чугуна — чугунная летка и для выпуска шлака —
шлаковая летка.
На время накопления металла чугунную летку
забивают огнеупорной глиной, а шлаковую летку закрывают
конической пробкой из железа. В верхней части горна
имеются фурмы — отверстия для подачи воздуха,
необходимого для горения кокса. На уровне фурм
развивается температура, которая достигает 1600°. По мере
удаления от фурм вверх температура постепенно падает.
У колошников она не
превышает 300°.
Таким образом, в
доменной печи на различной
высоте устанавливается
соответствующая температура и
протекают различные
процессы перехода руды в
металл.
Каждый окисел имеет
свою собственную
температуру восстановления. Так,
окись железа начинает
восстанавливаться при
температуре 300—350°, магнитная
окись железа — при 450—
500°, а закись железа — при
750—800°.
До чистого железа
восстанавливается сразу только
закись железа (FeO -f- CO—>
—>Fe + CCM —весь кисло- „ л 0 гт ^
' Л Профиль доменной печи. Цифры
род переходит к окиси угле- слрев* _ высота в м^х;
рода, и образуется углекис- оправа —температура на этой
лый газ. В двух остальных высоте.
Шлаи
Чугун
окислах кислород переходит к окиси углерода не сразу,
а частями. Окись железа сначала восстанавливается до
магнитной окиси (3Fe203 + СО—^2Fe304 + С02), а
затем магнитная окись железа — до закиси (Fe304 + СО—>
-+3FeO + С02).
В то время как в верхних частях доменной печи —
у колошников — при температуре примерно 350° идет
восстановление окиси железа до магнитной окиси, в нижней
части печи — в горне — при температуре 1600°
происходит энергичное сгорание кокса. Образуется углекислый газ
(02 + С—*С02). Углекислый газ, покидая горн, встречает
на своем пути углерод верхних слоев кокса и при высокой
температуре взаимодействует с ним, переходя в окись
углерода (С02 + С —* 2СО).
Одновременно в горне кокс, догорая, превращается
в золу. Его место занимают лежащие над ним слои кокса.
Шихта медленно опускается вниз, проходя все области
температур — от 300 до 1600°.
На уровне 14—15 метров шихта попадает в область
температуры около 500°. Здесь идет дальнейший процесс
восстановления окислов железа.
В этой части печи магнитная окись железа, отдавая
часть кислорода окиси углерода, переходит в закись
железа. Продолжая опускаться вместе с флюсами, закись
железа на восьмиметровой высоте нагревается до 750—800°.
При этой температуре начинается процесс
восстановления закиси железа до металла. Так как окись углерода
не в состоянии проникнуть вглубь больших кусков руды,
не все окислы успевают до конца восстановиться в шахте.
Восстановление окислов железа продолжается в более
низких частях доменной печи — в распаре и даже в
верхней части заплечиков. В зоне температуры примерно 1100°
железо полностью восстанавливается и превращается
в твердую губчатую массу. Когда процесс восстановления
окислов железа завершается, начинается процесс
науглероживания: железо, соединяясь с углеродом, образует
железоуглеродистый сплав (3Fe + 2CO—>- Fe3C -\- C02).
Так как температура плавления сплава железа с
углеродом на 250° ниже температуры плавления чистого железа,
сплав, опускаясь до зоны температуры около 1250°,
начинает расплавляться. Капли чугуна собираются вместе и
струйками стекают в нижнюю часть горна.
104
Чугун сливают в ковши и увозят к разливочным машинам.
Через определенные промежутки времени бурильной
машиной вскрывают чугунную летку, накопившийся
в горне чугун сливают по жолобу в большие ковши и
увозят к разливочной машине. Затем выстрелом из
специальной пневматической пушки летка снова забивается
огнеупорной глиной, и расплавленный чугун опять
накопляется в горне.
Так благодаря кислороду из бесформенной массы
железной руды, периодически добавляемой вместе с коксом и
флюсами в однажды зажженную доменную печь,
непрерывно в течение нескольких лет выплавляют чугун.
Чугун содержит небольшое количество примесей
углерода, кремния, марганца и других элементов. Эти
элементы попадают в доменную печь с железной рудой
и в процессе выплавки чугуна сами восстанавливаются
и переходят в расплав.
Другие примеси, содержащиеся в железной руде, обла-
105
дают очень высокой температурой плавления. Флюсы
соединяются с этими примесями и образуют легкоплавкие
шлаки, которые всплывают на поверхность жидкого
чугуна и время от времени сливаются через шлаковую
летку.
В настоящее время доменные печи работают в
основном на воздушном дутье. Но ведутся исследования по
использованию в доменных печах кислорода. Хотя этот
вопрос еще полностью технически не разрешен, но уже
некоторые печи работают на воздухе, обогащенном
кислородом.
Объем воздуха, подаваемого в современную доменную
печь, составляет примерно 4 тысячи кубических метров
в минуту при давлении около 3 атмосфер.
Ученые-металлурги подсчитали, что продуваемый
воздух находится в доменной печи всего лишь 5,5 секунды.
Отсюда следует, что в течение минуты газ обменивается
более 10 раз. На горение кокса идет только кислород,
который составляет 21 процент всего проходящего воздуха,
а остальные 79 процентов составляет азот и другие газы,
которые, поступая в доменную печь, нагреваются и
бесполезно уносят с собой тепло. Учитывая это, металлурги
еще в середине прошлого века стали подавать в
доменную печь подогретый воздух.
Для подогрева воздуха используются
колошниковые газы, выходящие из доменной печи, и кислород
воздуха.
Колошниковые газы, сгорая в специальных
воздухонагревательных печах — кауперах, накаляют огнеупорные
кирпичи, выложенные в них в виде решеток. Когда
температура внутри такой печи достигает 1200—1350°,
нагревание прекращают и через воздухонагреватели
пропускают обычный воздух, который подогревается до
температуры 850°. Нагретый до такой температуры воздух
подается в доменную печь. Проходящие через нее огромные
объемы азота не только не уносят тепло, а, наоборот,
приносят его с собой, так как при выходе из домны их
температура не превышает 300°.
Воздухонагреватель обогревается в течение 2 часов,
а используется для нагревания воздуха в продолжение
часа. Поэтому для бесперебойного снабжения одной
доменной печи горячим воздухом необходимо иметь не ме-
106
Доменная печь.
нее трех воздухонагревателей. Для нагнетания воздуха
в доменную печь применяются мощные
турбовоздуходувки.
На современных металлургических заводах доменная
печь обслуживается целым рядом крупных агрегатов-
цехов. Среди них коксовые и воздухонагревательные цехи
занимают ведущее место.
Получением чугуна еще не завершается процесс
получения металла на крупном металлургическом
заводе.
В нашей стране только 10—12 процентов всего
выплавляемого чугуна идет на отливку различных деталей.
Остальной чугун идет в переработку на железо и сталь,
которые обладают более высокими механическими и
химическими свойствами.
В чем же заключается процесс переработки чугуна
в железо и сталь и какое участие в этом процессе
принимает кислород?
Среднее содержание углерода в чугуне составляет
примерно 4 процента, марганца — около 2 процентов, крем-
107
ния— 1,2 процента. Содержание этих элементов в стали
должно быть значительно меньше. Так, например,
углерода в ней должно содержаться в 8 раз, кремния в 4 раза,
а марганца в 3 раза меньше, чем в чугуне. Следовательно,
для того чтобы превратить чугун в сталь, необходимо
уменьшить в нем содержание примесей.
Как удалить углерод из чугуна?
Металлурги установили, что если через расплавленный
чугун пропустить некоторое количество кислорода,
углерод выгорит, то-есть окислится и вынесется кислородом
из расплавленной массы в виде углекислого газа.
Кремний и марганец также окислятся. Но так как их окислы
плохо растворяются в жидком металле и плотность их
меньше плотности чугуна, они всплывут на его
поверхность. Этот принцип удаления из чугуна вредных
примесей используется металлургами в различных
вариантах.
В настоящее время наиболее распространенным
процессом получения стали из чугуна является
мартеновский. В расплавленный чугун добавляют стальной лом и
руду, которые содержат в себе окислы железа.
Кислород этих окислов выполняет функции окислителя.
Изменяя количество лома и руды, можно изменить состав
стали.
В последнее время широкое распространение получила
электроплавка стали.
В специальных электрических печах плавится
железный лом, к нему добавляют нужное количество чугуна и
пропускают кислород; в результате получают сталь
нужного состава.
Расплавленная сталь разливается по чугунным
формам, называемым изложницами. Полученные слитки идут
на обработку в последний цех металлургического комби-
цата — прокатный.
Как сваривают металл
Кислород успешно применяется при сварке, резке
и огневой обработке металлов.
Пламя газосварочной горелки направляют на
сдвинутые вплотную или наложенные друг на друга сваривае-
103
мые детали. Под
действием высокой
температуры пламени металл
плавится и сливается в
общую массу, образуя лунку.
Лунка, в которой
накопляется расплавленный
металл, называется ванной.
Чтобы заполнить ванну,
в пламя вносят железный
пруток, который, расплав- Газопламенная сварка металла,
ляясь, сливается с
основной массой металла. Передвигая горелку вдоль стыка
свариваемы* деталей, получают прочный сварной шов.
Для газопламенной сварки металлов пользуются
горелкой, которая в принципе ничем не отличается от
горелки, применяемой для спайки кварца. В качестве
горючего при газопламенной сварке используют ацетилен,
водород, коксовый и другие газы. Чаще всего пользуются
ацетиленом.
При горении ацетилена в кислороде образуется темпе-
тура, которая выше температуры любого другого горючего
газа.
Часто ацетилен доставляют к месту работы в виде
твердой соли—карбида кальция (СаС2). Карбид
кальция состоит из кальция и углерода и получается из нега ¦
шеной извести (СаО) и угля.
Смешанные куски извести и кокса помещают в
электродуговую печь, где при температуре около 2500°
происходит соединение углерода с кальцием. При этом
образуются карбид кальция и окись углерода (СаО + ЗС—>
— СаС2 + СО).
В печи карбид кальция накопляется в виде
расплавленной массы, которую сливают в формы —
изложницы.
Застывший карбид кальция дробят на небольшие
куски и загружают в железные барабаны с герметически
закрывающимися крышками. В таких барабанах карбид
кальция доставляют к месту работы.
Как же из этого твердого серого куска камня получить
газ, который в соединении с кислородом способен
расплавить металл?
109
Возьмите какой-нибудь
широкий сосуд с плоским
дном, налейте в него
немного воды, так чтобы дно
было покрыто на^ 1 —
1,5 сантиметра водой.
Поставьте на дно сосуда
фарфоровую чашечку и
положите в нее кусочек
карбида кальция, а затем
полейте его водой.
Содержимое в чашечке зашипит.
Это значит, что идет
разложение карбида кальция
с образованием
ацетилена и гашеной извести
(СаС2 + 2Н20^ С2Н2 +
+ Са(ОН)2). В воздухе
сразу же почувствуется
неприятный запах
ацетилена. Накройте быстро
чашечку воронкой. Так как
ацетилен легче воздуха,
он поднимется по
воронке вверх. Поднесите к концу воронки горящую спичку;
выходящий из нее газ загорится белым, коптящим
пламенем.
Разве может коптеть газ, легко сгорающий в
воздухе?
Да, может. Мы уже наблюдали это, когда прикрыли
доступ воздуха к горелке газовой плиты. Эти явления
объясняются одной и той же причиной — недостатком
кислорода.
Ацетилену не хватает кислорода для его полного
сгорания. На каждый кубический сантиметр ацетилена
требуется 2,5 кубического сантиметра чистого кислорода
или 12,5'кубического сантиметра воздуха. При выходе
из воронки ацетилен не успевает смешиваться с
воздухом и сгорает только частично, образуя коптящее
пламя. При хорошем перемешивании с воздухом ацетилен
сгорает полнее, и температура его пламени
достигает 2300°.
Получение ацетилена из
карбида кальция.
ПО
В кислороде ацетилен сгорает полностью, создавая
при этом температуру 3250°. Другие газы не дают такой
высокой температуры, поэтому ацетилен и пользуется
преимуществом перед ними.
Для получения ацетилена на месте сварки карбид
кальция загружают в специальную камеру ацетиленового
генератора. Туда же автоматически подается вода.
Образующийся ацетилен поступает в газохранилище, где он
собирается под колоколом, плавающим в воде. Колокол
своей тяжестью давит на газ и вытесняет его. По
шлангам газ поступает в горелку.
Схема ацетиленового генератора: 1 — камера с карбидом
кальция; 2 — присиособление для автоматической подачи
воды; 3 — газохранилище, наполненное водой; 4 —
колокол, под которым собирается ацетилен.
Одновременно с газом в горелку подается
кислород. Регулируя кранами подачу кислорода и
ацетилена, можно получить различное по своим свойствам
пламя.
Для полного сгорания кубического метра ацетилена
требуется 2,5 кубического метра кислорода. Если подать
в газовую горелку сразу весь кислород, то свойства
111
отдельных частей пламени становятся невыгодными
для сварки, так как расплавленный металл может
окислиться.
Практика показала, что для сварки лучше всего в
газовую горелку подавать только половину необходимого
кислорода, то-есть 1,25 кубического метра на каждый ку-
Виешний вид ацетиленового генератора.
бический метр ацетилена. В этом случае горение
ацетилена происходит в две фазы. В первой фазе для горения
используется кислород, поступающий в горелку вместе
с ацетиленом. Так как кислорода мало, ацетилен сгорает
не полностью. Образуется зона неполного сгорания, в
которой появляются окись углерода и водород (С2Н2 + 02—>
—*2СО + Н2). Эти продукты неполного сгорания
ацетилена при высокой температуре способны еще дальше
окисляться, жадно поглощая кислород.
Таким образом, в зоне неполного сгорания ацетилена
появляются продукты, обладающие восстановительной
способностью.
112
Эту зону пламени обычно
называют восстановительной.
Свойства
восстановительной зоны пламени оказались
весьма полезными для сварки
металлов. Не полностью
сгоревшие газы отбирают
кислород и восстанавливают
железо, которое окисляется во
время сварки. Благодаря
этому железо не изменяет
своего химического состава и
сварной шов не загрязняется
окислами.
Во второй фазе горения Сварка труб ацетиленовым
окись углерода' и водород, пламенем,
оставшиеся после первой
фазы, соединяются с кислородом воздуха.
Это зона полного сгорания. Здесь образуются
углекислый газ и пары воды (2СО-f-02—^2С02; 2Н2 +
+ 02 —2Н20).
В конце восстановительного пламени развивается
наиболее высокая температура, достигающая 3000°.
В зоне полного сгорания температура постепенно
падает до 1000°.
Ацетилено-кислородное пламя: 1 — головка ацетиленовой
горелки; 2 — зона неполного сгорания ацетилена —
восстановительная зона; 3 — зона полного сгорания. Цифры внизу обозначают
температуру в различных частях пламени.
Как режется металл
Если металл очень тонкий, в виде фольги, его можно
разрезать обыкновенными ножницами. Если он несколько
толще, в виде кровельного железа, его режут
специальными ручными ножницами. Более толстое железо можно
разрезать механическими ножницами. Металлы толщиной
30 миллиметров и более механически уже разрезать
трудно, а иногда и вовсе невозможно. Для резки таких метал-
Режущий
,нислород
Резак.
лических деталей пользуются газокислородным пламенем.
В настоящее время этот метод резки металлов является
самым распространенным в технике и промышленности.
Вспомним химические свойства кислорода. Если в
атмосфере чистого кислорода нагреть железо до
температуры его воспламенения, оно вспыхнет ярким
пламенем и сгорит, разбрасывая во все стороны раскаленные
добела искры. Это свойство металла используют для его
резки.
Для резки металла применяют специальную горелку —
резак.
Резак отличается от обычной газовой горелки тем, что
в нем имеется дополнительная трубка с краном-вентилем
для подачи чистого кислорода. В резаке три вентиля.
Двумя из них регулируют подачу кислорода и газа
подогревательного пламени, а третьим регулируют приток
режущего кислорода.
В начале резки вентиль для подачи режущего
кислорода закрыт и резак работает, как обычная горелка.
Смесь ацетилена с кислородом выходит из горелки через
114
мундштук подогревательного пламени и, сгорая, нагревает
металл до температуры его воспламенения. При такой
температуре начинают появляться отдельные искры.
В этот момент сварщик быстро открывает вентиль и
направляет тонкую струю режущего кислорода на
раскаленное место. Металл загорается, разбрызгивая искры во все
стороны.
Если струю кислорода подержать на одном месте,
Газокислородная резка металла.
металл прогорит насквозь, образуется разрез. Передвигая
пламя горелки, можно разрезать металл в любом
направлении.
Давление, под которым подается кислород для резки,
не всегда одинаково: чем толще разрезаемый металл, тем
оно должно быть выше. Так, например, при толщине
разрезаемого листа в 5—25 миллиметров давление кислорода
может быть 2—4 атмосферы, а при толщине листа 200—
300 миллиметров давление кислорода должно составлять
не меньше 12—14 атмосфер.
Существует ручная и механическая газокислородная
резка металла. При ручной резке металла трудно
получить равномерную ширину разреза по всей длине. Даже
самый опытный резчик не может передвигать резак с
одинаковой скоростью и поддерживать постоянное расстояние
между резаком и металлом.
115
В Советском Союзе имеется много различных
автоматических и полуавтоматических машин для
газокислородной резки. Эти машины обеспечивают высокое качество
и большую точность вырезки деталей любой формы.
Советские инженеры создали автоматы, позволяющие
вырезать детали с отклонением от заданных размеров не
больше чем на 0,3—0,5 миллиметра. В большинстве
случаев вырезанные детали могут быть использованы без
последующей механической обработки, что особенно ценно
при массовом производстве.
С помощью газорежущих машин можно разрезать
детали толщиной до 1,5 метра.
Применение газокислородного пламени во многом
облегчает обработку деталей.
Этим пламенем можно не только быстро и легко
разрезать металл, но также производить поверхностную
очистку его, заменяя грубую механическую обработку на
строгальных и токарных станках.
Огневая строжка
Последней стадией мартеновского процесса является
разливка расплавленной стали. В изложницах сталь
застывает и образует слитки различного веса. Вес крупных
слитков достигает 20 тонн.
На стальных слитках часто встречаются трещины,
раковины, наросты и другие дефекты. Раньше отдельные
дефекты стальных заготовок вырубались
механическими зубилами. Заготовки с большими дефектами,
которые нельзя было устранить зубилом, шли обратно в
переплавку.
Черновая обдирка крупных стальных деталей является
чрезвычайно трудоемким процессом. Газокислородным
пламенем можно произвести такую обработку с меньшей
затратой времени и труда. Газокислородную очистку
поверхности металла — строжку — можно произвести
специальным резаком.
При резке пламя резака направляется почти
перпендикулярно к разрезаемой детали; при поверхностной
обработке металла пламя резака направляется под очень
116
малым углом к
поверхности, оно как бы скользит
по ней, образуя в металле
желобок небольшой
глубины. Если поставить
подряд, близко друг к другу,
несколько резаков, то
можно одновременно снять
слой металла со всей
обрабатываемой детали.
Толщина снимаемого слоя
при одинаковой скорости
движения резака ИЛИ ме- Огневая строжка газокислород-
талла зависит от угла, ным пламенем,
под которым резаки
направлены к поверхности металла: чем острее угол, тем
меньше глубина канавок и, наоборот, чем больше
приближается угол к прямому, тем толще слой снимаемого
металла.
Кислородная обдирка металла по принципу своему
ничем не отличается от механической обработки: с
поверхности ряд за рядом снимается слой металла. Разница
заключается лишь в том, что при механической обработке
металл снимается в виде стружки, а при кислородной он
выгорает в струе кислорода.
Ширина и толщина стружки при механической
обработке в 2—3 раза меньше ширины и глубины канавки,
которая образуется за один проход кислородным резаком.
Поэтому при обработке поверхности газокислородным
пламенем можно в 2—3 раза быстрее снять нужный слой
металла.
В нашем социалистическом государстве, где
ликвидируются существенные различия между умственным и
физическим трудом, открыты все пути к развитию широкой
инициативы трудящихся в деле повышения
производительности труда.
Новаторы производства применяют скоростные
методы резания металла и намного повышают
производительность металлорежущих станков. Их методы работы
позволяют снимать с поверхности деталей на одном
станке до 300 килограммов и более металла в час.
Применяя резаки высокой производительности, кото-
117
Огневая обработка стального слитка во время проката.
рые выпускает наша автогенная промышленность,
передовики производства снимают одним резаком до 600
килограммов металла в час. Поэтому при
предварительной, или черновой, обдирке крупных стальных деталей
целесообразнее пользоваться газокислородным
пламенем.
Этот метод обработки завоевал прочное место на
наших крупнейших металлургических заводах во
время проката стальных слитков на мощных прокатных
станах.
Специальная машина, предназначенная для
поверхностной обработки металла, устанавливается неподвижно
у прокатного стана. Слиток, раскаленный до температуры
1000°, проходя через валки стана, движется по
роликовому столу со скоростью 20—40 метров в минуту. На
своем пути он проходит через четырехугольное огненное
окно, образуемое пламенем плотно стоящих друг к другу
П8
резаков, закрепленных в машине. Пламя огненного окна
направлено против движения стального слитка и, как бы
скользя по нему, срезает со всех его сторон слой металла
примерно в 3 миллиметра.
Недалеко от этой «феерической» машины, за
прозрачной перегородкой, в полной безопасности сидит за пультом
управления оператор. Он управляет широко раскрытой
пастью обдирочной машины, мощное кислородное пламя
которой способно сжечь и превратить в поток искр весь
огромный слиток движущегося металла. Но человек за
пультом управления подчиняет своей воле действие огня.
При помощи механизмов уверенно и точно он управляет
пламенем, заставляя его снимать с поверхности слитка со
всех сторон слой металла строго заданной толщины.
Огонь под водой
На трапе специального судна, оборудованного для
производства разнообразных подводных работ, стоит
человек в водолазном костюме — скафандре, — с зажженной
горелкой в руке.
Глубоко под водой, на дне моря, лежит большое
затонувшее судно, опрокинутое вверх дном. Водолазы
тщательно обследовали его со всех сторон, но не нашли ни
одного лаза, через который можно было бы проникнуть
внутрь.
Для осмотра судна решено прорезать «окно» в
стальной обшивке его дна. Это поручено сделать опытному
водолазу-резчику.
Закончены последние приготовления. Проверена
работа компрессорных установок, газопроводные шланги
испытаны на герметичность, приборы на пульте
управления работают безукоризненно.
Отрегулировав подогревательное пламя горелки
кислородным и газовым вентилями, водолаз медленно
начинает опускаться под воду. Войдя в нее по пояс, он
постепенно погружает горящий резак, который продолжает
гореть в воде ровным, коротким, синеватым пламенем.
Опускаясь все глубже и глубже в воду, водолаз наконец
коснулся ногами твердого предмета. По телефону он
сообщает об этом на судно.
па
Разыскав место, где должно быть вырезано «окно»,
водолаз занимает удобное положение и приступает к
работе. Направив пламя резака, он прогревает стальную
обшивку судна до температуры воспламенения металла и
открывает вентиль режущего кислорода. Искры
вырываются из стали и, пролетев немного, гаснут в воде. В
металле образуется сквозная дыра. Передвигая резак,
водолаз вырезает в обшивке дна судна отверстие,
позволяющее проникнуть внутрь корабля.
Как же удалось сохранить огонь под водой и разрезать
им металл?
Всем хорошо известно, что вода и огонь несовместимы
друг с другом. Плотность воды в 850 раз больше
плотности воздуха, теплопроводность в 25 раз, а теплоемкость
в 4 раза выше, чем у воздуха. Это означает, что в воде
невозможно нормальное горение открытого пламени, его
как-то нужно защитить.
Еще сравнительно недавно для защиты пламени
применялись металлические закрытые колпаки в виде конуса
с отодвигающейся передней стенкой. Колпак этот узкой
своей частью плотно прикреплялся к резаку.
Впоследствии их заменили открытые колпаки, защищающие
пламя только с боков, впереди же доступ воды в колпак
преграждался воздухом, выходящим из колпака под
большим давлением.
Однако такие колпаки оказались неудобными для
работы. Они утяжеляли резак и не позволяли свободно
изменять угол и расстояние между резаком и металлом.
Кроме того, горелки с такими колпаками гасли при
обращении пламени вверх.
В настоящее время для резки металла под водой
применяются резаки, у которых роль защитного колпака
играет пузырь, образуемый воздухом, выходящим из
горелки под большим давлением. Такие резаки имеют три
мундштука. Внутренний находится в центре головки
резака и служит для подачи режущего кислорода. Средний
мундштук окружает внутренний и имеет кольцеобразное
отверстие для подачи горючей смеси, состоящей из газа и
кислорода.
Наружный мундштук расположен вокруг среднего и
также имеет кольцеобразное отверстие, через которое под
большим давлением вытекает воздух,
120
Газокислородная резка под водой.
Сжатый воздух, выходя сплошной струей из кольца,
оттесняет воду от головки резака, образуя вокруг
подогревательного пламени газовую защитную среду.
Пламя резака оказывается в воздушном колпаке,
надежно защищающем его от воды. Использование таких
резаков возможно на всех практически доступных в
настоящее время глубинах.
Резаки с воздушным колпаком имеют и свои
недостатки. Огромное количество воздуха, выходящего из
резака, охлаждает пламя и, разбиваясь на множество
мелких пузырей, мешает наблюдать за процессом резки.
Кроме того, вследствие реактивного действия выходящего
воздуха затруднено управление резаком.
Для резки металлов под водой применяются резаки
и другой конструкции, в которых защитный пузырь обра^
зуется из газообразных продуктов горения.
121
Резаки обычно зажигают до спуска водолаза под воду.
Но их можно зажечь и под водой. Для этого существуют
газовые и электрические зажигалки.
Газовая зажигалка представляет собой
вспомогательную горелку, зажженную до спуска в воду. Пламя ее
спрятано в камере горелки, из которой оно едва
выглядывает. Давлением газа вода не допускается в камеру, где
непрерывно горит огонь.
Электрическая подводная зажигалка работает на
аккумуляторах в 2,5—2,75 вольта.
Ток, проходя через индукционную катушку и
конденсатор, попадает через выключатель к свече, в
которой при нажиме кнопки выключателя образуется искра;
от этой искры зажигается резак. Все части
электрической подводной зажигалки, кроме свечи, герметически
закрыты. Они находятся в футляре, который водолаз
надевает на грудь.
Прочное место в подводной резке металлов заняла
электрогазовая резка.
К очищенной от ракушек поверхности металла
подключают один полюс электрического тока, а к элекгроду,
находящемуся в руках сварщика, — другой.
Приближением электрода к металлу возбуждают электрическую
искру, в которой металл накаляется до температуры
его воспламенения. В этот момент через отверстие в
электроде пускают струю кислорода, в котором металл
сгорает. Образуется разрез.
Передвигая электрод, разрез можно повести в
нужном направлении.
Электроды бывают металлические или графитовые.
Внутри их по всей длине имеется канал для подачи
режущего кислорода.
Снаружи электроды изолированы от воды тонкой
пленкой электроизоляционного материала. Электроды
сгорают довольно быстро: через каждые 20—30 минут
сварщик меняет их, вставляя новые в специальный
электрод одержатель.
Имеется много различных конструкций электрододер-
жателей. Кроме основного своего назначения — плотно
удерживать электрод, они должны позволять легко и
быстро производить их замену.
Газокислородная и электрогазовая резка металлов
122
применяется при разборке и удалении из русел рек
упавших и разрушенных ферм железнодорожных и шоссейных
мостов, при подъеме затонувших судов, при ремонте
и строительстве гидротехнических сооружений.
Заключение
Велика и многообразна роль кислорода в жизни
людей.
Различные кислородные соединения, встречающиеся
в природе — светлосерый известняк, невзрачный на вид
боксит, кремнезем, красный и бурый железняк, —
используются в нашей промышленности.
Богатые залежи железной руды, планомерное развитие
гигантов металлургической промышленности в Советском
Союзе обеспечили в 1952 году выплавку 25 миллионов
тонн чугуна и 35 миллионов тонн стали. Не менее
огромны цифры по производству меди, алюминия,
цемента, извести и других материалов, полученных из их
кислородных соединений. Из этих материалов сооружены
десятки огромных мостов, переброшенных через реки
и каналы, сотни километров новых железных дорог
проложены в различных уголках нашей необъятной Родины,
построены тысячи тракторов и комбайнов, являющихся
технической базой нашего колхозного хозяйства; десятки
и сотни тысяч автомобилей и вагонов, в которых
перевозятся миллионы пассажиров и десятки миллионов тонн
груза; воздвигнуты новые дома-гиганты, украшающие
столицу нашей Родины — Москву, и благоустроенные
дома, заселенные гражданами Союза Советских
Социалистических Республик.
Кислород широко применяется на крупных стройках
нашей страны, где создаются гигантские
гидротехнические сооружения.
Тысячи тонн металла разрезаются и свариваются
кислородным пламенем. Из этого металла и
строительных материалов создаются сооружения, которых не
видал еще мир.
Скоро эти сооружения вступят в строй действующих
предприятий нашей великой социалистической Родины.
Миллиарды киловатт дешевой электрической энергии
по густой сети проводов потекут в города, на фабрики
123
и заводы, в колхозы и совхозы. Часть энергии пойдет на
увеличение производства кислорода, который, по
директивам XIX съезда партии по пятому пятилетнему плану
развития СССР на 1951 —1955 годы, должен быть широко
внедрен «в технологические процессы различных отраслей
промышленности и, в первую очередь, в черной и цветной
металлургии, в производстве газа из углей, целлюлозной
и цементной промышленности».
ОГЛАВЛЕНИЕ
Открытие кислорода
Кислород в природе
Кислород в воздухе 12
Кислород в воде 16
Кислород в недрах земли 19
Свойства кислорода
Место кислорода в периодической системе
Менделеева 27
Физические свойства кислорода 37
Химические свойства кислорода 44
Образование кислорода в природе
и получение его в технике
«Зеленая фабрика кислорода» 51
Получение кислорода из химических
соединений 57
Получение кислорода из воздуха 59
Электролитическое получение кислорода из
воды 72
Потребление кислорода в природе
и применение его в технике
Кислород и его роль в жизни на земле . . 80
Горючие газы 87
125
Высокая температура и глубокий холод . . 95
Выплавка металла из руды 99
Как сваривают металл 108
Как режется металл 114
Огневая строжка .... 116
Огонь под водой 119
Заключение 123
К ЧИТАТЕЛЯМ
Отзывы об этой книге просим
присылать по адресу*. Москва 47,
ул. Горького, 43, Дол1 детской
книги.
ДЛЯ СТАРШЕГО ВОЗРАСТА
Ответственный редактор Г. Мальков а.
Художественный редактор О Демидова.
Технический редактор
Т. Добровольнова.
Корректоры Р. Мишелевич и
Е. Новикова.
Сдано в набор 23/111 1953 г. Подписано
к печати 8/VII 1953 г. Формат 84 X Ю87з*-
2,0 бум. = 6,57 печ. л (6,26 уч.-изд. л).
Тираж 30 000 экз. А03821. Заказ 291.
Цена 2 р. 90 к
2-я ф-ка детской книги Детгиза
Министерства просвещения РСФСР. Ленинград,
2-я Советская, 7.