Текст
химия и жизнь
Научно-лопу.шрныГг журнал Академии наук WW 1968
На 1-й стр. обложки: Рокуэлл
Кент. Из иллюстраций к роману
Германа Мелвилла «Моби Дик,
или Белый кит»
Соль — символ добра и дружбы.
Рассыпанная соль — к ссоре, к
измене, к предательству. Это
древнее поверье использовал
Леонардо да Винчи в своей
знаменитой фреске «Тайная
вечеря», фрагмент которой здесь
воспроизведен. Иуда
опрокидывает левой рукой солонку.
Произойдет предательство...
* . N*-^
>
4 .«•*■*%*>%
— Ш
.;*"• #>*
■**Ш*~
ЕЖЕМЕСЯЧНЫЙ
НАУЧНО-
ПОПУЛЯРНЫП
ЖУРНАЛ
АКАДЕМИИ
НАУК СССР
ХИМИЯ II ЖИЗНЬ
№2
ФЕВРАЛЬ 19в8
ГОД ИЗДАНИЯ 4-й
Редакционная коллегия:
И В. Петрянов-Соколов
(главный редактор),
П. Ф. Баденков,
Н. М. Жаворонков,
С. В. Кафтанов,
Л. И. Мазур,
Б. Д. Мельник,
B. И. Рабинович
(ответственный секретарь),
П. А. Ребиндер,
М. И. Рохлин
(зам. главного редактора),
C. С. Скороходов,
Б. И. Степанов,
A. С. Хохлов,
М. Б. Черненко
(зам. главного редактора),
Н. М. Эмануэль
Редакция:
Б. Г. Володин,
Д. А. Глейх,
B. Е. Жвирблис,
A. Д. Иорданский,
О. И. Коломийцева,
О. М. Либкин,
B. В. Станцо,
Т. А. Сулаева,
И. М. Чаплина,
B. К. Черникова
Художественный редактор
C. С. Верховский
Технический редактор
Э. С. Язловская
Корректоры
Ю. И. Глазунова, .
Е. И. Сорокина
При перепечатке ссылка на журнал
«Химия и жизнь» обязательна
Адрес редакции:
Москва В-333,
Ленинский проспект, 61,
Телефоны
АВ 7-52-29,
АВ 7-72-64,
АВ 7-66-23.
Подписано к печати 19/1 1968 г. Т 01446. Бума^
га 84 > 108' .е. Печ. л. 6,0. Усл. печ. л. 10,08 Ч 1 вкл.
Уч.-изд. л. 11,0. Тираж 142 500. Зак. 2203. Цена 30 коп.
Москсвская типография № 2 Главполиграфпрома
Комитета по печати при Совете Министров СССР,
Москва, проспект Мира, 105.
2
6
14
15
16
17
24
26
30
34
41
49
50
52
62
69
74
75
76
77
81
83
87
88
90
91
94
Советской Армии 50 лет
Шаровая молния: сто теорий и
гипотез
Шаровая молния о себе
Объявляется розыск
Как делали искусственные
шаровые молнии
Элемент № ...
Фосфор
Что вы знаете и чего не знаете
о фосфоре и его соединениях
Лаборатория в кашалоте
Золото без золота
Борьба с безумием
Классика науки
Атомы, лучи, кванты
Реальность электрона
Новости отовсюду
Что мы едим
Пуд соли
И. М. Имянитоз.
Д. Я. Тихий
Гены и гении
Ум и тесты
Клуб Юный химик
Что это такое?
Хотите подготовиться к
экзаменам получше? А вы бы
справились?
Викторина. Роковая опечатка.
Ответы на вопросы прошлого
номера
Секреты горения
Химические профессии
Технолог по переработке
пластических масс
Полезные советы химикам
многоуважаемый
«Дорогой
шкаф!..» -
Наш комментарий
Учитесь лереводить
Немецкий — для химиков
Ответы к тестам
Из лисем в редакцию
Безграмотное пособие
Люди и звери
Г. Г. Диогенов
М. В. Ивашин
Г. А. Балуева
И. Губерман
Л. Пономарев
О. Васильева,
И. Гладкий,
Б. Джуринский.
А. Крылов
Г. Григорьев
Г. В. Лисичкин
А. И. Харламож
О. Либкин
В. В. Станцо
И. В. ПетряновЕ
Р. Г. Синев
М. Филимоновг.
Не секрет, что и ракетное
топливо — тоже химический
продукт
m
S
1ГЫ
•н^ :
v >яЕ%
о
15 B8) января 1918 года Владимир
Ильич Ленин подписал декрет о
создании Рабоче-Крестьянской Красной
Армии. 23 февраля были
сформированы ее первые полки. Гот же день
стал днем первых успешных боев
нашей армии против интервентов под
Псковом и Нарвой. В этот день
ежегодно советская страна празднует
День Советской Армии и
Военно-Морского Флота.
Неизмеримо возросла мощь
Вооруженных Сил Советского Союза за
50 лет, прошедших со дня их первых
побед. Сегодня наша армия
располагает первоклассной и современнейшей
боевой техникой: стратегическими
ракетами, термоядерным оружием, сверх-
звуконымн самолетами, атомными
подводными лодками, танками,
бронемашинами, совершенными средствами
связи. Могущество Советской Армии -
одно из свидетельств коренных
экономических преобразований,
происшедших в нашей стране;
современная военная техника создана на
основе многочисленных достижений
советских ученых, в том числе и химиков.
Материалы, помещенные на этих
страницах, предоставлены нашему
журналу редакцией журнала Министерства
обороны СССР «Техника н
вооружение». О содержания этого издания
достаточно красноречиво говорит его
название. Журнал рассказывает своим
читателям о техническом оснащении
нашей армии и флота, о новых
конструкциях и материалах, о способах
сбережения и ремонта военной
техники.
Любой командир знает, что
такое ДДД. Эти три буквы
расшифровываются так:
дегазация, дезактивация,
дезинфекция — то есть специальная
обработка боевой техники,
личного оружия и местности. Для
проведения ее нужны многие
химикаты, в частности, хлорная
известь, гексахлормеламин, ди-
хлорамин Б, формалин и
многие другие. На нижней
фотографии показано проведение
специальной обработки на военном
корабле
В 1916 году выдающийся
русский химик Н. Д. Зелинский
вместе с инженером Э. Л. Кум-
мантом создал первый
противогаз. Содержащийся в нем
активированный уголь поглощал
вредные газы и боевые
отравляющие вещества.
Современные противогазы способны
защитить воинов от действия
любого из отравляющих
веществ. Такие аппараты
полностью изолируют органы
дыхания от окружающей среды,
в них создана автономная
система дыхания. Надевшему
такой противогаз человеку не
нужен в оздух извне, прич ем
запас кислорода в нем все
время пополняется, так как
одна из систем противогаза
поглощает выдыхаемую двуокись
углерода, другая вырабатывает
кислород. В таком
противогазе можно самостоятельно
всплывать из затонувшей
подводной лодки или боевой
машины, работать в отравленной
атмосфере, тушить пожары в
корабельных отсеках
/• К
4
Парашюты десантников — это
тоже синтетика
В современном самолете более
2000 деталей и узлов,
сделанных из полимерных
материалов. А чтобы погасить скорость
самолета на пробеге и тем
самым уменьшить длину
посадочных полос, используются
тормозные парашюты из
синтетических материалов. На нижнем
снимке показан такой парашют
в действии
5
доиноедн лампьшшм
валясь всемиц^еташраднга ..ЛяЛг,.Л лп ЛЛ
кош шарик шскочил,нак0нецтишппы, он шртяся сужас&шшм грохо^м,
который да олушен далеко е окрестностях.
л
rJ
■ас
п* 'тр U
it' "'
-к*-
<■ r(W 1',,
ш
\
и
Ч*1-'
Л^
* с
7
С lit V f v>, '-Л,3ч
t \
V
J
/.
X
Jft Щ
1ПЛРОВЛЯ
МОЛНИЯ:
СТО ТЕОРИЙ
II ГИПОТЕЗ
и. м. имянитов,
д. я. тихий,
Ленинград
Рисунки
Д. ЛИОНА
ПРИГЛАШЕНИЕ К ОТКРЫТИЮ ЭНЕРГИЯ ШАРОВОЙ МОЛНИИ
В январе 1948 г. на одной из американских
военно-воздушных баз был замечен в небе
предмет, по форме напоминавший «шарик
мороженого с красной верхушкой».
Летчик, который вел самолет,
поднявшийся для исследования непонятного
явления, погиб. До сих пор высказывается
мысль, что «шариком мороженого»,
ставшим причиной гибели летчика, могла быть
шаровая молния.
Что же известно сегодня науке о
шаровой молнии?
Шаровая молния — это возникающее во
время гроз светящееся тело шаровой или
грушевидной формы, размер которого
достигает 10—20 сантиметров, а в
отдельных случаях и нескольких метров.
Молния издает шуршащий или шелестящий
звук, порой она свистит, завывает,
жужжит и, разбрасывая искры, движется как
по ветру, так и независимо от его
направления. Цвет шаровой молнии меняется от
оранжево-красного до ослепительно
белого, он бывает голубым и зеленым.
Существует шаровая молния от 3—5 секунд до
нескольких минут. Исчезает она со
взрывом или, наоборот, беззвучно.
Наблюдатели обычно описывают
только те свойства шаровой молнии, которые
больше всего их поразили: цвет, звук,
размеры и тому подобное. Поэтому нам
ничего неизвестно о том, засвечивает ли она
закрытую фотопленку, намагничивает ли
железо, создает ли помехи
радиоприемнику или телевизору (то есть излучает ли
радиоволны). Одна из задач этой статьи —
подготовить читателей журнала к
возможной встрече с шаровой молнией, с тем
чтобы они помогли собрать более полные
данные об интереснейшем и пока плохо
изученном явлении природы.
Много вопросов хотелось бы задать
шаровой молнии. И один из самых сложных —
о характере и величине ее энергии.
Действительно, трудно, почти невозможно
понять, как может столь малое количество
вещества выделять энергию, которой
хватает порой на разрушение больших
предметов и даже целых зданий.
Не раз предпринимались попытки
подсчитать энергетический потенциал
шаровой молнии. Вот один из примеров
простейшего расчета.
Очевидцы утверждают, что шаровая
молния величиной с кулак перебила
телеграфный столб. Но известно, что для
подрыва столба диаметром 20 см применяют
четырехсотграммовую плашку тола
(тринитротолуола); количество тола в граммах
равно квадрату диаметра столба в
сантиметрах. Следовательно, энергия шаровой
молнии, перебившей столб, эквивалентна
энергии, заключенной в 400 граммах тола.
Конечно, энергии тола хватает на
разрушение столба с избытком, но, видимо,
и шаровая молния израсходовала далеко
не всю энергию на эту работу.
Многие другие косвенные подсчеты
показали, что в разных случаях энергия
шаровой молнии эквивалентна энергии
толового заряда весом от 500 граммов до
20 килограммов.
«Разве это много?» — скажут иные.
Конечно много. Очень много! Впрочем,
судите сами.
Шаровая молния диаметром 10—12 см
имеет объем около 1000 см3. Она «плавает»
в воздухе, следовательно, ее удельный
вес такой же, как воздуха. Литр воздуха
A000 см3) весит 1,3 грамма, значит, и
молния весит около 1 грамма. Итак, молния
весом около 1 грамма обладает такой же
7
Вот ока какая — спокойная,
безобидная на вид. Жаль только,
что фотограф не дал масштаба
снимка и огненный шар не с
чем сравнить по размерам
Порой за шаровой молнией
тянется огненный след, как
у кометы
энергией, как 500 граммов тола, то есть
ее удельная энергия в 500 раз больше!
Но вернемся к истории изучения
шаровой молнии. В ней есть страница,
заполненная, если можно так сказать, самим
объектом исследования. Однажды
экспериментальную проверку энергетического
потенциала провела сама шаровая
молния. 5 ноября 1936 года в английской
газете «Дейли Мейл» было опубликовано
коротенькое письмо редактору.
«Сэр! Во время грозы я видел большой
раскаленный шар, спустившийся с неба.
Он ударил в наш дом, перерезал
телефонные провода, зажег оконную раму и затем
исчез в кадке с водой, стоявшей под
окном.
Вода кипела затем в течение
нескольких минут, но когда она достаточно
остыла, чтобы можно было поискать шар,
я ничего не смог обнаружить в бочке.
У. Моррис. Дорстоун, Херфордшир».
Письмо сопровождалось пояснением
Королевского астронома, который
объяснял, что читатель газеты наблюдал
шаровую молнию, и уточнял, что «она не
представляет собой громовую стрелу и,
естественно, ваш корреспондент не мог найти
в кадке с водой какого-либо
материального предмета».
Английский ученый Ч. Бойс выяснил
у Морриса важные детали: оказалось, что
огненный шар был размером с большой
апельсин, что воды в кадке было
примерно 20 литров и что спустя 40 минут с того
момента, как молния исчезла в кадке,
вода, холодная до происшествия, была еще
слишком горяча, чтобы можно было
удержать в ней руку. На основании этих
данных другой исследователь, профессор
Б. Гудлет произвел подсчет:
«...Вода слишком горячая, чтобы
удержать в ней руку — вероятно, речь идет
о температуре более 60°С. Если начальная
температура воды была 10ЭС, то мы
получаем, что энергия шаровой молнии
составляла, как минимум, 3800
киловатт-секунд C,8 мегаджоуля). Если допустить,
что вся вода была нагрета до 100°С и
четыре фунта ее испарилось, энергия
становится равной 10 940 киловатт-секундам
A1 мегаджоулей)».
Шаровая молния размером с большой
апельсин весит примерно 1 грамм. Таким
образом, ее удельная энергия (энергия,
отнесенная к 1 грамму) составляет в
среднем 7,4 мегаджоуля/г. Попробуем
определить температуру молнии.
Допустим, что шаровая молния передала воде
тепло как более горячее тело более
холодному. Тело массой 1 грамм,
нагревшее 20 литров воды с 10 до 60 градусов,
должно иметь температуру... три миллиона
градусов!
Результат фантастический. Тем не
менее продолжим рассуждения.
При такой температуре давление (Р) в
шаровой молнии оказалось бы равным:
8
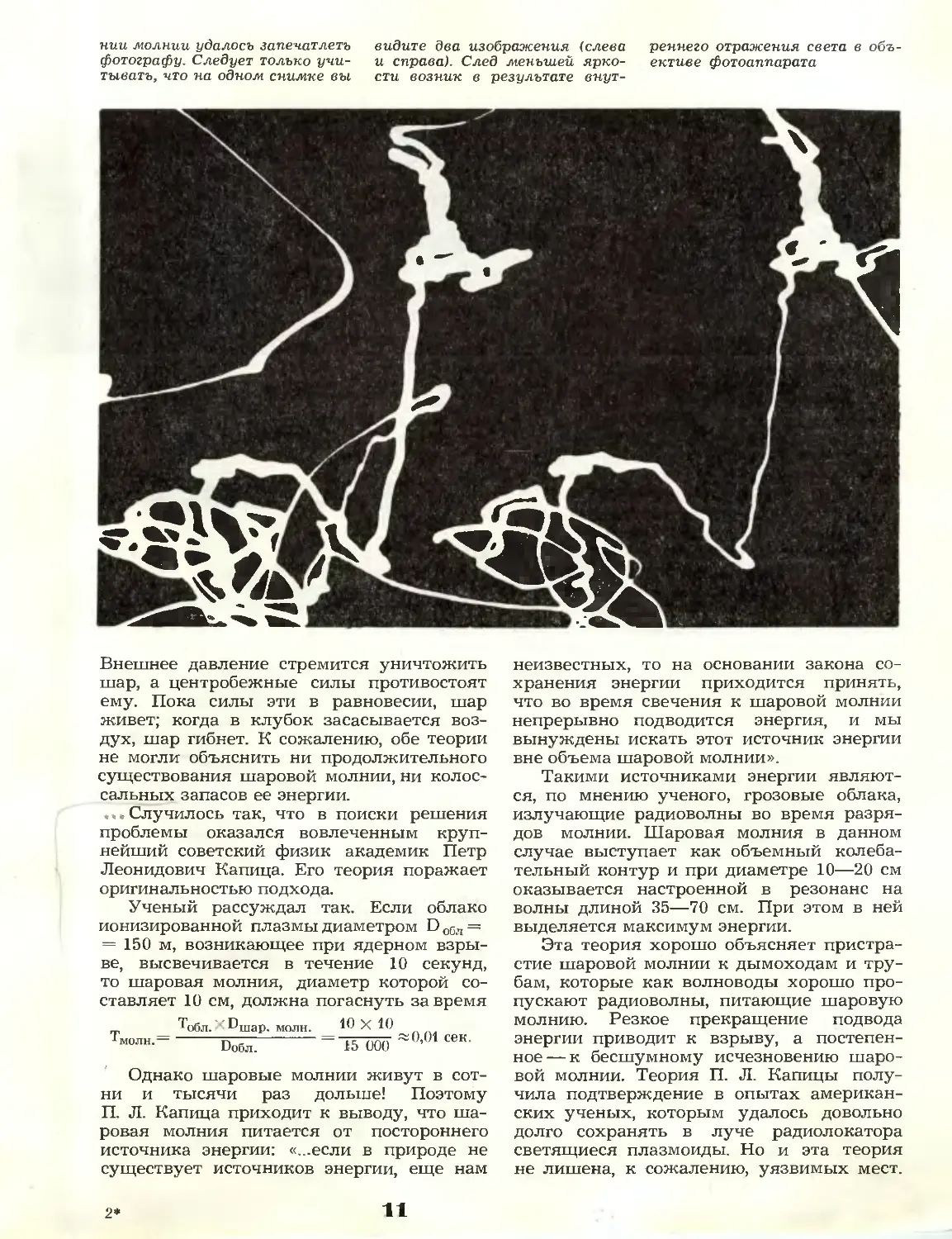
Глаз фотокамеры проследил
полет шаровой молнии
р = пкТ = 2,7- 10,9Х 1,38-КГ16 X 3 -106 =
= 10 000 атмосфер!
Здесь п — число молекул в 1 см3 газа
при нормальных условиях; к = 1,38 •
•10~16 эрг/градус — постоянная Больцмана,
коэффициент, связывающий
кинетическую энергию молекулы с ее
температурой; Т — абсолютная температура (в
нашем случае 3 миллиона градусов).
Совершенно очевидно, что, имея такое
внутреннее давление, шаровая молния
взорвалась бы много раньше, чем мы
успели докончить наши рассуждения. Но
может быть, в ней меньше вещества, чем
мы предположили, и тогда... Тогда,
во-первых, она не «плавала» бы в воздухе,
а стремительно поднималась вверх и, во-
вторых, температура ее должна была бы
быть еще выше, что и вовсе невероятно.
По-видимому, шаровая молния
отдавала энергию воде не как нагретое тело
холодному, а, скажем, как холодный газ,
который после сжигания в горелке плиты
вызывает кипение воды. Кстати, в письме
Морриса говорится, что «...вода кипела
затем в течение нескольких минут», то
есть тепло продолжало поступать в воду,
хотя молнии уже не существовало. Не
значит ли это, что в шаровой молнии
имеются какие-то твердые вещества,
аккумулирующие ее энергию?
Число известных гипотез и теорий
о природе шаровой молнии приближается
к ста. Не рассматривая все, разобьем их
на несколько групп.
ЕСЛИ ШАРОВАЯ МОЛНИЯ — ОГОНЬ, ТО В
НЕЙ СГОРАЮТ ИКС-ВЕЩЕСТВА С
ТЕПЛОТВОРНОЙ СПОСОБНОСТЬЮ В СОТНИ РАЗ
БОЛЬШЕЙ, ЧЕМ У ВСЕХ ИЗВЕСТНЫХ
ИСТОЧНИКОВ
Спросите человека, впервые увидевшего
шаровую молнию, почему она светится.
Горит, — скажет он, предложив самый
простой ответ. Исследователи начинали
с того же.
Когда-то считалось, что вещество
шаровой молнии имеет особую химическую
природу, а сами молнии суть горящие
клубки газа. Один из первых ученых,
описавших шаровую молнию, Франсуа
Араго и Р. Хильдебрансон предположили,
что шаровая молния — это шар с
гремучими газами, пропитанный «молниевой
материей». Шар зарождается в облаках
и падает на землю. Внутренняя и
наружная части шара наподобие конденсатора
заряжены электричеством
противоположных знаков. Между заряженными слоями
находится прослойка изолятора — сухого
воздуха. Электрический пробой
изолирующего слоя может поджечь гремучие газы,
и тогда происходит взрыв; тихое стекание
электричества кончается бесшумным
исчезновением молнии.
Другой французский исследователь
Э. Матиас считал, что в шаровой молнии
сгорают соединения, имеющие свойства
гремучести. Они возникают из воздуха
под действием разряда линейной молнии.
Силы поверхностного натяжения
стягивают в шар образовавшуюся в канале
линейной молнии «гремучую материю»,
а так как отношение поверхности шаровой
молнии к ее объему примерно в 30 раз
меньше, чем у линейной молнии, то
охлаждается она во столько же раз
медленнее и, следовательно, существует в
десятки раз дольше, чем линейная
молния: сотые, максимум десятые доли
секунды.
Как видим, эта теория не может
объяснить многочисленные случаи, когда
огненный шар жил в течение десятков секунд
и даже минут. Кроме того, сомнительным
представляется наличие поверхностного
натяжения у газового шара.
«При ударе молнии образуются
газообразные химически активные вещества», —
говорил известный советский
физик-теоретик Яков Ильич Френкель. В
присутствии катализаторов, например твердых
частиц дыма или пыли, они быстро дезак-
^ Химия и Жизнь, № 2
9
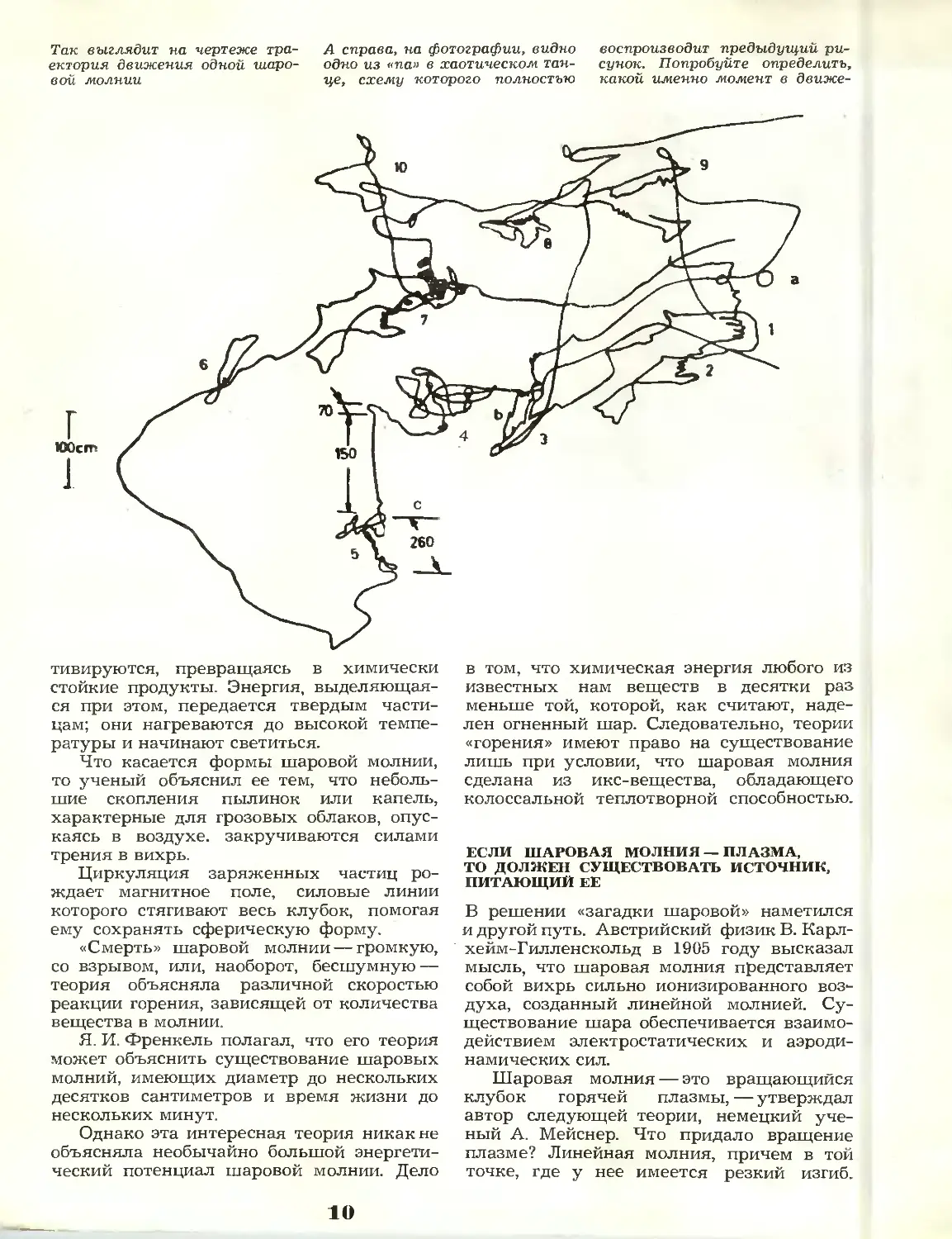
Так выглядит на чертеже
траектория движения одной
шаровой молнии
А справа, на фотографии, видно
одно из «па» в хаотическом
танце, схему которого полностью
воспроизводит предыдущий
рисунок. Попробуйте определить,
какой именно момент в движе-
Ю
г
ЮОст
1
¥1
150
1
тивируются, превращаясь в химически
стойкие продукты. Энергия,
выделяющаяся при этом, передается твердым
частицам; они нагреваются до высокой
температуры и начинают светиться.
Что касается формы шаровой молнии,
то ученый объяснил ее тем, что
небольшие скопления пылинок или капель,
характерные для грозовых облаков,
опускаясь в воздухе, закручиваются силами
трения в вихрь.
Циркуляция заряженных частиц
рождает магнитное поле, силовые линии
которого стягивают весь клубок, помогая
ему сохранять сферическую форму.
«Смерть» шаровой молнии — громкую,
со взрывом, или, наоборот, бесшумную —
теория объясняла различной скоростью
реакции горения, зависящей от количества
вещества в молнии.
Я. И. Френкель полагал, что его теория
может объяснить существование шаровых
молний, имеющих диаметр до нескольких
десятков сантиметров и время жизни до
нескольких минут.
Однако эта интересная теория никакие
объясняла необычайно большой
энергетический потенциал шаровой молнии. Дело
в том, что химическая энергия любого из
известных нам веществ в десятки раз
меньше той, которой, как считают,
наделен огненный шар. Следовательно, теории
«горения» имеют право на существование
лишь при условии, что шаровая молния
сделана из икс-вещества, обладающего
колоссальной теплотворной способностью.
ЕСЛИ ШАРОВАЯ МОЛНИЯ — ПЛАЗМА,
ТО ДОЛЖЕН СУЩЕСТВОВАТЬ ИСТОЧНИК,
ПИТАЮЩИЙ ЕЕ
В решении «загадки шаровой» наметился
и другой путь. Австрийский физик В. Карл-
хейм-Гилленскольд в 1905 году высказал
мысль, что шаровая молния представляет
собой вихрь сильно ионизированного
воздуха, созданный линейной молнией.
Существование шара обеспечивается
взаимодействием электростатических и
аэродинамических сил.
Шаровая молния — это вращающийся
клубок горячей плазмы, — утверждал
автор следующей теории, немецкий
ученый А. Мейснер. Что придало вращение
плазме? Линейная молния, причем в той
точке, где у нее имеется резкий изгиб.
10
нии молнии удалось запечатлеть
фотографу. Следует только
учитывать, что па одном снимке вы
видите два изображения (слева
и справа). След меньшей
яркости возник в результате
внутреннего отражения света в
объективе фотоаппарата
Внешнее давление стремится уничтожить
шар, а центробежные силы противостоят
ему. Пока силы эти в равновесии, шар
живет; когда в клубок засасывается
воздух, шар гибнет. К сожалению, обе теории
не могли объяснить ни продолжительного
существования шаровой молнии, ни
колоссальных запасов ее энергии.
Случилось так, что в поиски решения
проблемы оказался вовлеченным
крупнейший советский физик академик Петр
Леонидович Капица. Его теория поражает
оригинальностью подхода.
Ученый рассуждал так. Если облако
ионизированной плазмы диаметром 00бл =
= 150 м, возникающее при ядерном
взрыве, высвечивается в течение 10 секунд,
то шаровая молния, диаметр которой
составляет 10 см, должна погаснуть за время
£обл.
D
шар. молн.
Ообл.
10 X Ю
: 15 000 :
iOfli сек.
Однако шаровые молнии живут в
сотни и тысячи раз дольше! Поэтому
П. Л. Капица приходит к выводу, что
шаровая молния питается от постороннего
источника энергии: «...если в природе не
существует источников энергии, еще нам
неизвестных, то на основании закона
сохранения энергии приходится принять,
что во время свечения к шаровой молнии
непрерывно подводится энергия, и мы
вынуждены искать этот источник энергии
вне объема шаровой молнии».
Такими источниками энергии
являются, по мнению ученого, грозовые облака,
излучающие радиоволны во время
разрядов молнии. Шаровая молния в данном
случае выступает как объемный
колебательный контур и при диаметре 10—20 см
оказывается настроенной в резонанс на
волны длиной 35—70 см. При этом в ней
выделяется максимум энергии.
Эта теория хорошо объясняет
пристрастие шаровой молнии к дымоходам и
трубам, которые как волноводы хорошо
пропускают радиоволны, питающие шаровую
молнию. Резкое прекращение подвода
энергии приводит к взрыву, а
постепенное— к бесшумному исчезновению
шаровой молнии. Теория П. Л. Капицы
получила подтверждение в опытах
американских ученых, которым удалось довольно
долго сохранять в луче радиолокатора
светящиеся плазмоиды. Но и эта теория
не лишена, к сожалению, уязвимых мест.
2*
11
Молнии бывают и такие.
Только это не шаровая молния, а
«неточная», похожая на четки
Например, она не может объяснить
появление шаровых молний внутри
металлических самолетов, куда радиоволны
практически не могут проникнуть. Кроме
того, на волны длиной 35—70 см
приходится лишь одна десятитысячная, а то и
стотысячная часть всей излучаемой
облаками энергии, и само излучение это
длится всего лишь сотые доли секунды, то
есть гораздо меньше продолжительности
жизни шаровой молнии.
Не объясняет теория и «случай с
бочонком»— коснувшись воды, молния как
объемный резонатор, потребляющий
энергию, перестала существовать, но она (или
вещества, ее составляющие) продолжала
выделять энергию в воду («Вода кипела
затем в течение нескольких минут...»).
Но может быть, существуют
неизвестные пока науке виды излучения?
Американец А. Сартор открыл на
миллиметровых волнах радиоизлучение заряженных
капель, сталкивающихся в грозовом
облаке. Его соотечественник В. Андерсен,
сделав ряд допущений, подсчитал, что
энергии такого облака объемом 1 000 000
кубических метров достаточно для
поддержания жизни шаровых молний. Но Андерсен
преувеличил энергию грозового облака по
меньшей мере в сто раз, и еще одно «но»
(в который раз «но»!): миллиметровые
волны могут питать молнии размером не
более... горошины.
В 1966 году была сделана попытка
объяснить возникновение шаровой
молнии сгущением сил постоянного
электрического поля, но шаровые молнии
возникают и в таких местах (тот же
металлический самолет), куда постоянное поле
проникнуть не может.
Итак, шаровую молнию можно
рассматривать как комок плазмы, питаемый
посторонним источником энергии, но
пока этот источник в природе не
обнаружен.
МОЖЕТ БЫТЬ, ШАРОВАЯ МОЛНИЯ —
ЭТО КОНДЕНСАТОР ЭЛЕКТРИЧЕСКОЙ
ЭНЕРГИИ?
Очередная оригинальная модель шаровой
молнии появилась в 1960 году. Она
отрицала плазменную природу шаровой молнии
из-за малой величины энергии, которую
может запасти плазма. Автор
выдвинул гипотезу, что шаровая молния —
конденсатор электрической энергии,
маленькое подобие грозового облака. Но, как ни
странно, он не привел расчетов, которые
подтвердили бы, что такая шаровая молния
будет обладать большой энергией. Если
же проделать эти вычисления, то
окажется, что энергия 1 грамма шаровой молнии
равна всего лишь 300 джоулям! (Сравните
с цитированными выше расчетами Б. Гуд-
лета.) Вот что иногда получается, когда
начинаешь считать.
А ЧТО ЕСЛИ ШАРОВАЯ МОЛНИЯ
СОСТОИТ ИЗ АНТИВЕЩЕСТВА?
Связь между массой и энергией вещества
дана в известном уравнении Эйнштейна
Е = тс2.
Если один грамм вещества полностью
превратить в энергию, выделится 9*10!3
джоулей энергии. Но этого никогда не
происходит. Даже при ядерных реакциях
в энергию преобразуется лишь
незначительная часть вещества.
Полное превращение всей массы
в энергию возможно при соединении
частиц нашего мира с античастицами. Но
где взять античастицы?
12
Предполагается, что определенные
виды комет состоят из антивещества, значит,
в атмосферу Земли могут проникать
и античастицы. Энергию шаровой молнии
оценивают сейчас в пределах от 1 до
11 мегаджоулей. Такую энергию может
выделить комочек антивещества весом
в одну стомиллионную грамма!
Вторжение антивещества в атмосферу
не обязательно сопровождается
немедленным взрывом. В разреженной
атмосфере с антивеществом контактирует
слишком мало вещества, и поэтому
происходит лишь сильный разогрев
космического пришельца. При нагреве
уменьшается плотность газа, значит, и число
частиц, соприкасающихся с
антивеществом. Это уменьшает нагрев, и поток
частиц возрастает — нагрев увеличивается
снова. Система автоматически регулирует
расход вещества!
Нечто подобное происходит в капле
воды, попавшей на раскаленную плиту.
Окруженная паровой рубашкой она
испаряется не мгновенно, а сначала довольно
долгое время бегает по плите.
Взрыв шаровой молнии эта гипотеза
может объяснить резким увеличением
количества вещества, например при
встрече антивещества с пылинкой. Легко
объясняется также появление шаровой
молнии в цельнометаллическом самолете,
в корпусе которого комочку антивещества
достаточно прожечь ничтожно малое
отверстие. Все свойства шаровых молний
«укладываются» в гипотезу, кроме
одного: шаровые молнии появляются только
во время гроз или сразу же после них.
Почему? Ведь антивещество, если оно
приходит в атмосферу, никак не зависит
от ее состояния... Но может быть, именно
антивещество вызывает грозу? Увы,
метеорологи отвергают это предположение.
А что если сами облака готовят
антивещество? Разность потенциалов в
грозовых облаках может достигать 5—15
миллиардов вольт, что достаточно для
создания антиэлектрона и антипротона. Но как
это происходит (и происходит ли
вообще) — пока неизвестно.
ГАЗОВЫЙ КРИСТАЛЛ, КОСМИЧЕСКИЙ
ПРИШЕЛЕЦ, ИСТОЧНИК НЕИЗВЕСТНЫХ
ЯДЕРНЫХ РЕАКЦИЙ... ШАРОВАЯ МОЛНИЯ
РОЖДАЕТ НЕОБЫЧНЫЕ ПРЕДПОЛОЖЕНИЯ
Самый беглый обзор всех теорий и
гипотез, посвященных шаровой молнии, занял
бы еще очень много места. А ведь среди
тех, которые мы даже не упомянули,
немало интересных, смелых, непохожих.
Так, немецкий ученый Т. Нойгебауер
объяснял (в 1937 году) устойчивость
формы шаровой молнии тем, что она имеет...
«кристаллическую» структуру. Газовый
кристалл! В нем, как и в обычном
кристалле, ионы занимают строго
упорядоченное в пространстве положение.
Советский ученый В. И. Арабаджи
выдвинул идею «космического»
происхождения шаровой молнии. По его
мнению, грозовые облака фокусируют в своем
электрическом поле пришедшие на Землю
космические лучи. Те, в свою очередь,
вызывают сильнейшую ионизацию
воздуха, и в фокусах вспыхивают огненные
клубки шаровых молний.
Немало исследователей утверждают,
что в шаровой молнии происходят
ядерные реакции. Какие? «Пока неизвестные
нам», — поясняют авторы этих, возможно
и справедливых, предположений.
Для того чтобы подтвердить или
опровергнуть эти теории и гипотезы, нужны
факты, а их-то как раз пока мало.
Требуются новые наблюдения, новые данные.
Может быть, надо объявить всесоюзный
(всемирный?) розыск шаровой молнии?
В том, что с нею встретятся многие,
можно не сомневаться. Это для одного
человека шаровая молния редкость, а в
масштабе одной нашей страны — обычное,
заурядное явление.
Действительно, в наших широтах с
шаровой молнией хоть однажды в жизни
встречается один из 30—50 человек, то
есть 2—3 процента всего населения
страны. Если считать, что сознательная жизнь
человека длится 60 лет, то из более чем
230 миллионов жителей Советского Союза
каждый год шаровую молнию видит Убо
от 2—3 процентов — около ста тысяч
(от 76 000 до 130 000) человек! Не так мало,
как может показаться на первый взгляд.
Даже если учесть, что далеко не все
очевидцы захотят или смогут внести свою
лепту в эту «охоту», данные можно будет
получить совершенно исключительные.
Надо только уметь видеть, слышать и
сравнивать. Постарайтесь, читатель,
научиться этому — возможно, именно вам
доведется встретиться с таинственным
шаром, подробности о котором так важно
знать науке.
13
Шаровая молния о себе
■ ...10 сентября 1861 года
пассажиры поезда Марсель — Лион
увидели, как после сильного
разряда молнии на верхнем проводе
телеграфной линии возник
красный шар размером с кулак. Шар
докатился до столба и,
переломив его пополам, исчез.
Ц В конце июня 1В74 года
гроза застала старшего лесничего
Мейля в лесу. Он спрятался в
лесной избушке и вдруг увидел,
как мимо него по тропинке
с громким шуршанием покатился
голубоватый шар. За ним другой,
третий. Шары разбрасывали
искры и беззвучно лопались. При
этом они испускали такой
ослепительный свет, что лесничий
моментами ничего не видел.
Молнии имели размеры кегельного
шара и катились, будто пущенные
сильной рукой. За полчаса
лесничий насчитал более 25 шаров.
Щ ...22 марта 1914 года в
небольшом итальянском местечке Пог-
гио-Тре-Крочи неподалеку от
церкви возник светящийся
огненный шар. Спустя некоторое
время священник, дом которого
примыкал к церкви, вдруг заметил
такой же шарик, но поменьше, в
стекле керосиновой лампы. Снизу
шарик казался закопченным,
остальная его часть переливалась
всеми цветами радуги.
Этот шарик выскочил из
лампы, вылетел в окно и взорвался
с грохотом, который был слышен
далеко в окрестностях. Сильная
воздушная волна выбила все
стекла в поселке, с соседних
домов была сброшена и частично
побита черепица.
Ш —В один из июньских дней
1914 года шаровая молния
проникла на веранду гостиницы
в немецком городке Ганенклее.
14
Шел сильный дождь, и все
окна были закрыты. Тем не менее
светящийся шар «нашел»
маленькую трещинку в одном стекле.
Раздался звук, похожий на
пушечный выстрел.
В отеле зазвонили звонки и
погас свет. Электропроводка во
многих местах была повреждена.
Телефонные аппараты вышли из
строя. Большинство деталей в них
оказались оплавленными.
Ш —9 декабря 1956 года в
Майкопе разразилась сильная гроза.
Сверкнула молния и оставила
после себя три шаровых молнии.
Одна из них по
радиотрансляционной линии проникла в дом,
сожгла электропроводку,
разбила счетчик и, в свою очередь, со
взрывом разделилась на два
огненных шара. Взрыв был столь
силен, что приподнял потолок и
раздвинул стены здания. Один
шар проломил стену и вылетел
во двор. Там он опалил хвост
лошади и ушел под стог сена,
который тут же вспыхнул.
Н ...Это произошло на высоте
3300 метров. Самолет шел в
сплошной облачности.
Неожиданно началась болтанка. «Ил-14»
попал в грозовое облако. В слепом
полете пилот не мог ни
предвидеть, ни предотвратить встречу
с грозой. Послышался треск
разряда. Шаровая молния ударила
в нос самолета и прошла по
всему корпусу. У командира и еще
одного члена экипажа
парализовало ноги. Но пилот все же сумел
изменить курс и вывести машину
из облачности.
Щ ...Во время грозы в сентябре
1967 года молния попала в
дерево, растущее против проходной
одесского пивзавода № 1. Из
огня и дыма возник оранжевый
шар величиной с футбольный
мяч и медленно поплыл... на
территорию завода. Он миновал
настежь раскрытую проходную и на
глазах у притихших людей
взорвался, наткнувшись на дерево.
Объявляется розыск
\
Мы хотим пригласить каждого читателя
журнала «Химия и жизнь» принять
участие в наблюдениях за шаровой молнией.
Не исключено, что именно вы,
повстречавшись с шаровой молнией, пришлете в
редакцию подробный отчет об этой встрече.
Ваши впечатления поможет
систематизировать
АНКЕТА НАБЛЮДАТЕЛЕЙ
ШАРОВЫХ МОЛНИЙ *
1. Фамилия, имя, отчество, возраст
2. Профессия и образование . . .
3. Адрес, № телефона . . .
4. Район наблюдения
5. Краткое описание места, где возникла Ш. М.,
или места, с которого началось наблюдение .
6. Время и продолжительность наблюдения.
Ш. М. возникла (увидел) число . . .
месяц . год, . . час . . • мин . -
сек . . Исчезла (перестал видеть) . . час
. . . мин . . сек. Время жизни Ш. М.
мин. сек
7. Через сколько минут, секунд после удара
линейной молнии появилась Ш. М
8. Размеры Ш. М. и их изменения
9. Цвета НХ М
10. Яркость Ш. М., длина, цвет и направление
искр, вылетающих из нее
11. Прозрачность Ш. М .
12. Путь и скорость Ш. М
13. Описание места исчезновения Ш. М. или
причины прекращения наблюдений
14. Описание разрушений, вызванных Ш. М., и
следов, оставленных ею
15. Какие звуковые явления сопровождали
появление, существование и исчезновение Ш. М. .
16. Запах в месте исчезновения Ш. М
17. Засвечивание закрытой пленки или
фотобумаги
18. Дополнительные данные, полученные при
наблюдениях Ш. М. ..... -
19. Сколько человек, кроме заполняющего анкету,
наблюдало Ш. М. Их имена и адреса ....
* Для краткости шаровая молния будет
обозначаться двумя буквами: Щ. TV1.
15
Объявляется розыск
При заполнении анкеты особое внимание
надо обратить на место возникновения
молнии. Подробно опишите предмет, возле
которого она появилась, его материал,
форму; если это железо, проверьте ненамагни-
ченным гвоздем или стержнем его
намагниченность. Пришлите фотографию места,
где впервые возникла шаровая молния.
Самое главное в пункте 6 анкеты —
определение продолжительности жизни
шаровой молнии. Если у вас нет часов с
секундной стрелкой, размеренно считайте: «и раз,
и два...».
Определяя размеры шаровой молнии
для пункта 8, сравните ее с каким-нибудь
расположенным рядом предметом и затем
измерьте этот предмет.
Старайтесь сфотографировать шаровую
молнию, для чего во время грозы держите
наготове фотоаппарат.
Если вы не ответите на некоторые
вопросы анкеты, напишите, почему вы не
смогли это сделать.
Каждому участнику «розыска»
особенно важно знать и выполнять ПРАВИЛА
БЕЗОПАСНОСТИ.
Шаровая молния может убить
человека, поэтому при ее появлении соблюдайте
крайнюю осторожность.
— Не бегите от шаровой молнии — ток
воздуха может потянуть ее за вами.
— Держитесь подальше от нее, но не
поворачивайтесь к ней спиной и все время
держите ее под наблюдением.
— Старайтесь быть с наветренной
стороны молнии, а в помещении не стойте на
пути сквозняков.
— Не трогайте шаровую молнию
руками, не касайтесь ее никакими предметами
и не кидайте в нее ничем. Это может не
только уничтожить ее, но и лишить вас
возможности рассказать о виденном.
Как делали
искусственные
шаровые
молнии
Наиболее удачные опыты провел
советский ученый Г. И. Бабат со своими
помощниками И. Капраловым, Н. Айзенбергом и
Г. Левенцом.
Это было в октябре 1941 года в
осажденном Ленинграде. Г. И. Бабат
использовал генератор мощностью 20 киловатт и
частотой 60 мегагерц. В стеклянном
баллоне, из которого был откачан воздух,
возникало багровое кольцо, которое по
мере подачи в баллон воздуха и
повышения его давления превращалось в шар,
а цвет его изменялся от фиолетового до
зеленого. При давлении, близком к
атмосферному, в баллоне пульсировал
ослепительно белый шар, с поверхности
которого срывались языки пламени.
Вначале ученые считали, что Г. И. Ба-
бату действительно удалось получить
искусственную шаровую молнию, однако
отсутствие в природе источников энергии,
подобных тому, который использовался
в опыте, заставило отказаться от этого
предположения.
Образования, похожие на шаровые
молнии, наблюдал американский инженер
П. Зильберг. На подводной лодке при
случайном подключении заряженных батарей
к оставленному генератору сработало реле
и разомкнуло цепь тока силой 150 000
ампер при напряжении 260 вольт. С
контактов реле стали срываться зеленоватые
светящиеся шары диаметром 10—15 см.
Они плавали в машинном отделении и
существовали примерно в течение одной
секунды. Никакого заметного воздействия
на людей и предметы шары не
производили. Поэтому «плазм оиды» Зильберга
нельзя считать шаровыми молниями.
Сгустки светящейся плазмы получал
и другой американский исследователь
В. Бостик. Его шары «выстреливались»
в вакуум из плазменной «пушки» со
скоростью 200 км/сек. Устойчивость сгустков
обеспечивалась быстрым вращением их
вокруг оси, а также использованием
магнитных ловушек. Однако условия
существования полученных плазмоидов также
слишком отличались от тех, при которых
возникают реальные шаровые молнии.
10
15
атомный вес
30,9736
число электронов в
застраивающейся оболочке
3s*3p3
Массовые числа изотопов:
стабильного - 31
нестабильных - в природе нет
Число
электронов
в слое:
М
К
ЭЛЕМЕНТ № ...
ФОСФОР
Кандидат химических наук
Г. Г. ДИОГЕНОВ,
Иркутск
Рисунки
Е. СКРЫННИКОВА
«...Да! Это была собака, огромная, черная,
как смоль. Но такой собаки еще никто из
нас, смертных, не видывал. Из ее
отверстой пасти вырывалось пламя, глаза
метали искры, по морде и загривку
переливался мерцающий огонь. Ни в чьем
воспаленном мозгу не могло возникнуть видение
более страшное, более омерзительное, чем
это адское существо, выскочившее на нас
из тумана. ...страшный пес, величиной
с молодую львицу. Его огромная пасть все
еще светилась голубоватым пламенем,
глубоко сидящие дикие глаза были
обведены огненными кругами.
Я дотронулся до этой светящейся
головы и, отняв руку, увидел, что мои пальцы
тоже засветились в темноте. Фосфор,—
сказал я».
Узнали? Артур Конан-Дойл. «Собака
Баскервилей».
Вот в какой скверной истории оказался
замешан элемент № 15.
ЕЩЕ ОДНА СКВЕРНАЯ ИСТОРИЯ
Почти триста лет отделяют нас от того
момента, когда гамбургский алхимик Ген-
нинг Бранд открыл новый элемент —
фосфор. Подобно другим алхимикам, Бранд
пытался отыскать эликсир жизни или
философский камень, с помощью которых
старики молодеют, больные
выздоравливают, а неблагородные металлы
превращаются в золото. Не забота о благе
людском, а корысть руководила Брандом. Об
этом свидетельствуют факты из истории
единственного настоящего открытия,
сделанного им.
В ходе одного из опытов он выпарил
мочу, смешал остаток с углем, песком
и продолжил выпаривание. Вскоре в
реторте образовалось вещество, светившееся
в темноте. Правда, Kaltes Feuer (холодный
огонь), или «мой огонь», как Бранд его
называл, не превращал свинец в золоте и не
О Химия и Жизнь, № 2
17
изменял облика старых людей, но то, что
полученное вещество светилось без
подогрева, было необычно и ново.
Этим свойством нового вещества Бранд
не замедлил воспользоваться. Он стал
показывать фосфор различным
привилегированным лицам, получая от них подарки
и деньги. Хранить тайну получения
фосфора было нелегко, и вскоре Бранд продал ее
дрезденскому химику И. Крафту. Число
демонстраторов фосфора увеличилось,
когда рецепт его изготовления стал
известен И. Кункелю и К. Кирхмейеру.
В 1680 году независимо от
предшественников новый элемент был получен
знаменитым английским физиком и химиком
Робертом Бойлем. Но вскоре Бойль умер,
а его ученик А. Ганквиц изменил чистой
науке и вновь возродил «фосфорную
спекуляцию». Лишь в 1743 году А. Марграф
отыскал более совершенный способ
получения фосфора и опубликовал свои данные
для всеобщего сведения. Это событие
положило конец брандовскому бизнесу и
послужило началом серьезного изучения
фосфора и его соединений.
На первом — пятидесятилетнем —
этапе истории фосфора, кроме открытия
Р. Бойля, лишь одно событие отмечено
историей науки: в 1715 году Генсинг
установил наличие фосфора в мозговой ткани.
После опытов А. Марграфа история
элемента, приобретшего много лет спустя
номер 15, стала историей многих больших
открытий.
ХРОНОЛОГИЯ ЭТИХ ОТКРЫТИЙ
В 1769 году Ю. Ган доказал, что в костях
содержится много фосфора. То же самое
подтвердил через два года знаменитый
шведский химик К. Шееле, предложивший
способ получения фосфора из золы,
образующейся при обжиге костей.
Еще несколькими годами позже
Ж. Л. Пруст и М. Клапрот, исследуя
различные природные соединения, доказали,
что фосфор широко распространен в
земной коре, главным образом в виде
фосфата кальция.
Больших успехов в изучении свойств
фосфора достиг в начале семидесятых го-
18
дов XVIII века великий французский
химик Антуан Лоран Лавуазье. Сжигая
фосфор с другими веществами в замкнутом
объеме воздуха, Лавуазье доказал, что
фосфор — самостоятельный элемент, а
воздух имеет сложный состав и слагается
по крайней мере из двух компонентов —
кислорода и азота. «Таким образом он
впервые поставил на ноги всю химию,
которая в своей флогистической форме
стояла на голове». Так Ф. Энгельс писал о
работах Лавуазье в предисловии ко
второму тому «Капитала».
В 1799 году Дондональд доказал, что
соединения фосфора необходимы для
нормального развития растений.
В 1839 году другой англичанин, Лауз
впервые получил суперфосфат —
фосфорное удобрение, легко усвояемое
растениями.
В 1847 году немецкий химик Шрет-
тер, нагревая белый фосфор без доступа
воздуха, получил новую разновидность
(аллотропную модификацию) элемента
№15 — красный фосфор, а уже в XX
веке, в 1934 году, американский физик
П. Бриджмен, изучая влияние высоких
давлений на разные вещества, выделил
похожий на графит черный фосфор.
Таковы основные вехи в истории
элемента № 15. Теперь проследим, что
последовало за каждым из этих открытий.
«В 1715 ГОДУ ГЕНСИНГ УСТАНОВИЛ
НАЛИЧИЕ ФОСФОРА В МОЗГОВОЙ ТКАНИ...
В 1769 ГОДУ ГАН ДОКАЗАЛ, ЧТО В КОСТЯХ
СОДЕРЖИТСЯ МНОГО ФОСФОРА»
Фосфор — аналог азота. Хотя физические
и химические свойства этих элементов
очень сильно различаются, есть у них и
общее, в частности то, что оба эти
элемента совершенно необходимы животным
и растениям. Академик А. Е. Ферсман
называл фосфор «элементом жизни и
мысли», и это определение вряд ли можно
отнести к категории литературных
преувеличений. Фосфор обнаружен буквально во
всех органах зеленых растений: в
стеблях, корнях, листьях, но больше всего его
в плодах и семенах. Растения
накапливают фосфор и снабжают им животных.
3*
19
Выдающийся английский
ученый Роберт Бойлъ A627—1691)
вошел в историю химии
главным образом как человек,
первым установивший понятие о
химическом элементе. Но Бойлъ
был и одним из первых
ученых, получивших элементарный
фосфор
В организме животных фосфор
сосредоточен главным образом в скелете,
мышцах и нервной ткани.
Из продуктов человеческого питания
особенно богат фосфором желток куриных
яиц.
Тело человека содержит в среднем
около полутора килограммов элемента
№ 15. Из этого количества 1,4 килограмма
приходится на кости, около 130 граммов —
на мышцы и 12 граммов — на нервы
и мозг. Почти все важнейшие
физиологические процессы, происходящие в нашем
организме, связаны с превращениями фос-
форорганических веществ. В состав костей
фосфор входит главным образом в виде
фосфата кальция. Зубная эмаль — это
тоже соединение фосфора, которое по
составу и кристаллическому строению
соответствует важнейшему минералу фосфора
апатиту Ca5(P04K(F, C1).
Естественно, что, как и всякий
жизненно необходимый элемент, фосфор
совершает в природе круговорот. Из почвы его
берут растения, от растений этот элемент
попадает в организмы человека и
животных. В почву фосфор возвращается с
экскрементами и при гниении трупов. Фосфо-
робактерии переводят органический
фосфор в неорганические соединения.
Однако в единицу времени из почвы
выводится значительно больше фосфора,
чем поступает его назад. Мировой урожай
сейчас ежегодно уносит с полей больше
трех миллионов тонн фосфора.
Естественно, что для получения
устойчивых урожаев этот фосфор должен быть
возвращен в почву, и потому нет ничего
удивительного в том, что мировая добыча
фосфоритов достигла в 1964 году 58,5
миллионов тонн.
«...ПРУСТ И КЛАПРОТ ДОКАЗАЛИ, ЧТО
ФОСФОР ШИРОКО РАСПРОСТРАНЕН В ЗЕМНОЙ
КОРЕ, ГЛАВНЫМ ОБРАЗОМ В ВИДЕ
ФОСФАТА КАЛЬЦИЯ»
В земной коре фосфор встречается
исключительно в виде соединений. Это
главным образом малорастворимые соли орто-
фосфорной кислоты, катионом чаще всего
служит ион кальция.
На долю фосфора приходится 0,08%
веса земной коры. По распространенности
он занимает 13-е место среди всех
элементов. Фосфор содержится не менее чем
в 190 минералах, из которых главнейшие:
фторапатит — CasfPO^F, гидроксилапа-
тит — Са5(Р04)зОН, фосфорит —
Са3(Р04J- Реже встречаются вивианит —
Fe3(P04J-8H20, монацит — (Се, La)P04,
амблигонит — LiAl(P04)F, трифилит —
Li(Fe,Mn)P04 и еще реже ксенотим — YP04
и торбернит —Си (U02J[P04]2-12H20.
Минералы фосфора делятся на
первичные и вторичные. Из первичных особенно
распространены апатиты, часто
встречающиеся среди пород магматического
происхождения. Эти минералы образовались
в момент становления земной коры. В
отличие от апатитов фосфориты залегают
среди пород осадочного происхождения,
образовавшихся в результате отмирания
живых существ. Это вторичные минералы.
В виде фосфидов железа, кобальта,
никеля фосфор встречается в метеоритах.
Разумеется, этот распространенный
элемент есть и в морской воде F*10 60/о).
«ЛАВУАЗЬЕ ДОКАЗАЛ, ЧТО ФОСФОР —
САМОСТОЯТЕЛЬНЫЙ ХИМИЧЕСКИЙ
ЭЛЕМЕНТ...»
Фосфор — неметалл (то, что раньше
называли металлоид) средней активности. На
20
Немецкий химик Иоганн Кун- мецкий химик Андреас Сигиз- способ получения фосфора и тем
кель A630—1702) первым описал мунд Марграф A709—1782) опу- самым положил конец «брандо-
способ получения фосфора. Не- бликовал усовершенствованный ву бизнесу»
наружной орбите атома фосфора
находятся пять электронов, причем три из них не
спарены. Поэтому он может проявлять
валентности 3 ~, 3+ и 5 \ Для того чтобы
фосфор проявил валентность 5+,
необходимо какое-либо воздействие на атом,
которое бы превратило в неспаренные два
спаренных электрона последней орбиты.
Фосфор часто называют многоликим
элементом. Действительно, в разных
условиях он ведет себя по-разному, проявляя
то окислительные, то восстановительные
свойства. Многоликость фосфора
проявляется и в его способности находиться в
нескольких аллотропных модификациях.
Пожалуй, самая известная
модификация элемента № 15 — мягкий как воск
белый или желтый фосфор. Это ее открыл
Бранд, и благодаря ее свойствам элемент
получил свое имя: по-гречески «фосфор»
значит светящийся, светоносный.
Молекула белого фосфора состоит из четырех
атомов, построенных в форме тетраэдра.
Удельный вес 1,83, температура
плавления 44,1°С. Белый фосфор ядовит, легко
окисляется. Растворим в сероуглероде,
жидких аммиаке и S02, бензоле, эфире.
В воде почти не растворяется.
При нагревании без доступа воздуха
выше 250°С белый фосфор превращается
в красный. Это уже полимер, но не очень
упорядоченной структуры. Реакционная
способность у красного фосфора
значительно меньше, чем у белого. Он не
светится в темноте, не растворяется в
сероуглероде, не ядовит *. Плотность его
намного больше, структура
мелкокристаллическая.
Менее известны другие, еще более
высокомолекулярные модификации
фосфора — фиолетовый, коричневый и
черный, отличающиеся одна от другой
молекулярным весом и степенью
упорядоченности макромолекул. Черный фосфор,
впервые полученный П. Бриджменом
в условиях больших давлений B00 000
атмосфер при температуре 200°С), скорее
напоминает графит, чем белый или
красный фосфор. Эти модификации —
лабораторная экзотика и в отличие от белого и
красного фосфора практического
применения пока не нашли.
* Всегда содержит небольшие количества бе-
лото фосфора, вследствие чего может оказаться
ядовитым.
21
Кстати, о применениях элементарного
фосфора; главные его потребители —
производство спичек*, металлургия,
химические производства. В недавнем прошлом
часть получаемого элементарного фосфора
расходовалась на военных предприятиях,
его использовали для приготовления
дымовых и зажигательных составов.
Металлурги обычно стремятся
избавиться от примеси фосфора в металле —
он ухудшает механические свойства, но
иногда фосфор вводят в состав
умышленно. Это делается, когда нужно, чтобы при
затвердевании металл немного
расширился и точно воспринял очертания формы.
Широко используется фосфор и в
химии. Часть его идет на приготовление
хлоридов фосфора, нужных при синтезе
некоторых органических препаратов; стадия
производства элементарного фосфора есть
и в некоторых технологических схемах
производства концентрированных
фосфорных удобрений.
Теперь о его соединениях.
Фосфорный ангидрид Р2О5 —
превосходный осушитель, жадно поглощающий
воду из воздуха и других веществ.
Содержание Р2О5 — основной критерий ценности
всех фосфорных удобрений.
Фосфорные кислоты, в первую очередь
ортофосфорная Н3РО4, используются в
основной химической промышленности. Соли
фосфорных кислот — это прежде всего
фосфорные удобрения (о них разговор
особый) и фосфаты щелочных металлов,
необходимые для производства моющих
средств.
Галогениды фосфора (главным образом
хлориды РС1з и РС1б) используются в
промышленности органического синтеза.
Из соединений фосфора с водородом
наиболее известен фосфин РНз — сильно
ядовитый бесцветный газ с чесночным
запахом.
Среди соединений фосфора особое
место принадлежит фосфорорганическим
соединениям. Большинство их обладает
биологической активностью. Поэтому одни
фосфорорганические соединения
используются как лекарства, другие — как
средство борьбы с сельскохозяйственными
вредителями.
Самостоятельный класс веществ
составили фосфонитрилхлориды — соединения
* Подробнее об этом см. «Химия и жизнь»,
1967, № 4.
фосфора с азотом и хлором. Мономер фос-
фонитрилхлорида способен к
полимеризации. С ростом молекулярного веса
меняются свойства веществ этого класса,
в частности, заметно уменьшается их
растворимость в органических жидкостях.
Когда молекулярный вес полимера
достигает нескольких тысяч, получается каучу-
коподобное вещество — единственный пока
каучук, в составе которого совсем нет
углерода. Дальнейший рост молекулярного
веса приводит к образованию твердых
пластмассоподобных веществ.
«Безуглеродный каучук» обладает значительной
термостойкостью: он начинает
разрушаться лишь при 350 С.
«В 1839 ГОДУ АНГЛИЧАНИН ЛАУЗ ВПЕРВЫЕ
ПОЛУЧИЛ СУПЕРФОСФАТ — ФОСФОРНОЕ
УДОБРЕНИЕ, ЛЕ1 КО УСВОЯЕМОЕ
РАСТЕНИЯМИ»
Чтобы растения могли усваивать фосфор,
он должен находиться в составе
растворимого соединения. Чтобы получить эти
соединения, фосфат кальция и серную
кислоту смешивают в таких отношениях,
чтобы на одну грамм-молекулу фосфата
приходилось две грамм-молекулы кислоты.
В результате взаимодействия образуются
сульфат и растворимый дигидрофосфат
кальция: Са3(Р04J + 2H2S04 = 2CaS04 +
+ Са(Н2Р04)г. Смесь этих двух солей
известна под названием суперфосфата. В этой
смеси сульфат кальция с точки зрения
агрохимии — балласт, однако его не
отделяют, так как эта операция требует
больших затрат и сильно удорожает
удобрение. В простом суперфосфате содержится
всего 14—20% Р2О5.
Более концентрированное фосфорное
удобрение — двойной суперфосфат. Его
получают при взаимодействии фосфата
кальция с фосфорной кислотой:
Са3(Р04J+ 4Н3Р04- ЗСа (Н2Р04J.
В двойном суперфосфате содержится 40—
50% Р2О5. По сути, его правильнее было
бы называть тройным: он в три раза
богаче фосфором, чем простой суперфосфат.
Иногда в качестве фосфорного
удобрения используется преципитат СаНР04*
• 2Н20, который получается при
взаимодействии фосфорной кислоты с
гидроокисью или с карбонатом кальция:
Са(ОНJ+ Н3Р04—СаНР04-2Н20,
2СаС03 f 2II3P04=r- 2CaHP04.2H20 + 2С02.
В этом удобрении 30—35 % Р2О5.
23
Фосфор содержат и некоторые
комбинированные удобрения, например диамо-
фос (NH4JHP04, содержащие также и азот.
С разведанными запасами фосфорного
сырья в нашей стране, как и во всем
мире, дело обстоит не совсем благополучно.
Академик С. И. Вольфкович с трибуны
IX менделеевского съезда по общей и
прикладной химии заявил: «Если сырьевая
база азотной промышленности —
воздушный океан, вода и природный газ — не
ограничивает масштабов нового
строительства, а разведанные к настоящему
времени залежи калийных солей
обеспечивают развитие производства калийных
удобрений более чем на тысячелетие, то
изученных к настоящему времени запасов
отечественного фосфорного сырья при
намеченных больших объемах производства
удобрений хватит всего на несколько
десятилетий».
Это вовсе не значит, что человечеству
грозит голод и урожаи год от года будут
уменьшаться. Резервы есть. Много
дополнительного фосфора можно будет
получить при комплексной переработке
минерального сырья, донных морских
отложений и более детальной геологической
разведке. Следовательно, особых оснований
для пессимизма у нас нет, тем более что
по учтенным запасам фосфорных руд
СССР занимает первое место в мире. Мы
располагаем крупнейшими
месторождениями апатитов на Кольском полуострове
и фосфоритов в Южном Казахстане и ряде
других мест. Но искать новые
месторождения, разрабатывать способы получения
фосфорных удобрений из более бедных
руд необходимо уже сейчас. Это нужно
для будущего, потому что фосфор —
«элемент жизни и мысли» — будет необходим
человечеству всегда.
ИЗОТОПЫ ФОСФОРА
Природный фосфор в отличие
от подавляющего большинства
элементов состоит только из
одного изотопа Р31. В ядерных
реакциях синтезировано несколько
короткоживущих радиоактивных
изотопов элемента № 15. Один из
них — фосфор-30 оказался
вообще первым изотопом, полученным
искусственным путем. Это его
получили в 1934 году Фредерик и
Ирен Жолио-Кюри при облучении
алюминия альфа-частицами.
Фосфор-30 имеет период
полураспада 2,55 минуты и, распадаясь,
излучает позитроны
(«положительные электроны»). Сейчас известны
шесть радиоактивных изотопов
фосфора. Наиболее долгоживу-
щи-й из них Р33 имеет период
полураспада 25 дней. Изотопы
фосфора применяются главным
образом в биологических
исследованиях — в качестве «меченых
атомов».
НАЧАЛО СУПЕРФОСФАТНОЙ
ПРОМЫШЛЕННОСТИ
Первое в мире промышленное
производство суперфосфата было
организовано в 1842 году в
Англии. В России подобные
предприятия появились в 1868 и 1871
годах. До революции в нашей
стране было построено всего шесть
суперфосфатных заводов, их
общая производительность не
превышала 50 тысяч тонн в год. В
годы первой мировой войны,
иностранной интервенции и
гражданской войны четыре завода из
шести вышли из строя, и в 1918 году
в нашей стране было выпущено
всего 2,8 тысячи тонн
суперфосфата. А всего через двадцать лет,
в 1938 году, по производству
фосфорных удобрений Советский
Союз занял первое место в
Европе и второе в мире. В нашей
стране в 1967 году произведено
свыше 13 миллионов тонн фосфорных
удобрений и фосфоритной муки
для непосредственного
применения в сельском хозяйстве.
Что вы знаете
о фосфоре и е
СВИДЕТЕЛЬСТВУЕТ
Д. Н. ПРЯНИШНИКОВ
«...Как бы правильно ни хранился
и применялся навоз, он не может
вернуть почве того, чего он сам
не содержит, т. е. крупной доли
фосфора, отчужденного из
хозяйства в проданном зерне, костях
животных, в молоке и пр.; таким
образом, почва постепенно, но
неуклонно теряет свой фосфор (или,
по крайней мере, его усвояемую
часть), и за известным пределом
фосфор попадает в положение
того «минимального фактора»,
которого наиболее недостает для
получения хорошего урожая, как
это совершенно правильно было
подмечено еще Либихом».
«О значении фосфатов для
нашего земледелия и о
расширении возможности
непосредственного применения
фосфоритов». 1924 год
АПАТИТЫ ЗАПОЛЯРЬЯ
В 1926 г. А. Е. Ферсманом и его
сотрудниками были открыты
огромные запасы апатита на
Кольском полуострове. Спустя много
лет академик А. Е. Ферсман
писал об этом месторождении:
«...зеленый искристый апатит с
серым нефелином образует
сплошную стену в 100 метров. На 25 км
протягивается этот замечательный
пояс хибинских тундр, огибая их
кольцом. Исследования показали,
что апатитовая руда уходит в
глубину даже ниже поверхности
океана, и около двух миллиардов тонн
этих ценнейших ископаемых
накоплено здесь в Хибинах, не имея
себе равных нигде в мире».
(«Занимательная минералогия», 1937.)
На базе этого месторождения был
построен горнохимический
комбинат «Апатит» имени С. М.
Кирова. Незадолго до войны было
открыто еще одно очень
крупное месторождение фосфорного
сырья — фосфориты Кара-Тау в
Казахстане. Фосфориты есть и в
других районах нашей страны,
в частности, в Подмосковье. Но
чего не знаете
» соединениях
лучшее сырье для производства
фосфорных удобрений до сих пор
дает апатитовый «пояс хибинских
тундр».
КАК ВЫГЛЯДИТ АПАТИТ
Вновь обратимся к
«Занимательной минералогии». «Апатит — это
фосфорнокислый кальций, но
внешний вид его такой
разнообразный и странный, что недаром
старые минералоги назвали его
апатитом, что значит по-гречески
«обманщик»: то это прозрачные
кристаллики, до мелочей
напоминающие берилл или даже кварц,
то это плотные массы,
неотличимые от простого известняка, то
это радиально-лучистые шары, то
порода зернистая и блестящая,
как крупнозернистый мрамор».
КТО ЖЕ ПЕРВЫЙ?
Французский историк Ф. Гефер
утверждает, что общепринятое
мнение, будто фосфор впервые
получен алхимиком Г. Брэндом
в 1669 году, неверно. По его
данным, фосфор умели получать еще
в XII веке арабские алхимики,
причем технология получения
фосфора у них была такая же,
как у Бранда: выпаривание мочи и
нагревание сухого остатка с углем
24
и песком. Если так, то
человечество знакомо с элементом № 15
не триста, а почти восемьсот лет.
КРАСНЫЙ И ФИОЛЕТОВЫЙ
Самые известные модификации
фосфора — белая и красная, обе
они используются в
промышленности. Прочие разновидности
элемента № 15 — фиолетовый,
коричневый, черный фосфор — можно
встретить только в лабораториях.
Но фиолетовый фосфор стал
известен людям намного раньше,
чем красный. Русский ученый
А. А. Мусин-Пушкин впервые
получил его еще в 1797 году. В
некоторых книгах можно встретить
утверждение, что красный и
фиолетовый фосфор — одно и то же.
Но эти разновидности отличаются
не только цветом. Кристаллы
фиолетового фосфора крупнее.
Красный фосфор получается при
нагревании белого в замкнутом
объеме уже при 250°С, а
фиолетовый— только при 500°С.
«СВЕТЯЩИЙСЯ МОНАХ»
Из воспоминаний академика
С. И. Вольфковича:
«Фосфор получался в
электрической печи, установленной в
Московском университете на
Моховой улице. Так как эти опыты
проводились тогда в нашей стране
впервые, я не предпринял тех
предосторожностей, которые
необходимы при работе с
газообразным фосфором — ядовитым,
самовоспламеняющимся и
светящимся голубоватым цветом
элементом. В течение многих часов
работы у электропечи часть
выделяющегося газообразного
фосфора настолько пропитала мою
одежду и даже ботинки, что,
когда ночью я шел из университета
по темным, не освещенным тогда
улицам Москвы, моя одежда
излучала голубоватое сияние, а из-
под ботинок (при трении их
о тротуар) высекались искры.
За мной каждый раз
собиралась толпа, среди которой,
несмотря на мои объяснения,
немало было лиц, видевших во мне
«новоявленного» представителя
потустороннего мира. Вскоре
среди жителей района Моховой и по
всей Москве из уст в уста стали
передаваться фантастические
рассказы о «светящемся монахе»...
ЧУДЕСА БЕЗ ЧУДЕС
Церковь не раз пользовалась
белым фосфором для одурачивания
верующих. Известны, как
минимум, два вида «чудес», к которым
причастно это вещество. Чудо
первое: свеча, загорающаяся
сама. Делается это так: на фитиль
наносят раствор фосфора в
сероуглероде, растворитель довольно
быстро испаряется, а оставшиеся
на фитиле крупинки фосфора
окисляются кислородом воздуха
и самовоспламеняются. Чудо
второе: с<божественные» надписи,
вспыхивающие на стенах. Тот же
раствор, те же реакции. Если
раствор достаточно насыщен, то
надписи сначала светятся, а затем
вспыхивают и исчезают.
ФОСФОРОРГ АНИКА
И ЖИЗНЬ
О роли фосфорорганических
соединений в важнейших
биохимических реакциях организма
написаны многие тома. В любом
учебнике биохимии эти вещества не
только многократно упоминаются,
но и подробно описываются. Без
фосфорорганических соединений
не мог бы идти процесс обмена
углеводов в ткани мозга.
Фосфорсодержащий фермент фосфорила-
за способствует не только
распаду, но и синтезу полисахаридов
в мозгу. В процессе окисления
углеводов в ткани мозга важную
роль играют дифосфопиридинну-
клеотид и неорганический
фосфат. Другой важнейший
процесс— сокращение мышц
поддерживается энергией, выделяющейся
при реакциях с участием адено-
зинфосфатов. При сокращении
мышцы молекула аденозинтри-
фосфата (АТФ) распадается на
аденозиндифосфат и
неорганическую фосфорную кислоту. При
этом освобождается 12 000
калорий энергии. О важнейшей роли
этих веществ свидетельствует и
тот факт, что в мышечной ткани
всегда поддерживается
постоянный уровень АТФ.
ФОСФОРОРГ АНИКА
ПРОТИВ НАСЕКОМЫХ
Фосфорорганические
инсектициды — эффективное средство
борьбы с сельскохозяйственными
вредителями. В частности, препарат
М-81, разработанный несколько
лет назад в Институте элементоор-
ганических соединений АН СССР,
помогает бороться с вредителями
хлопчатника. Число
фосфорорганических соединений,
синтезированных в лабораториях мира,
измеряется многими тысячами. О
некоторых из них уже
рассказывалось в нашем журнале A965, № 1;
1967, № 8). Более полное
представление об этом своеобразном
классе веществ можно получить,
ознакомившись с брошюрой
академика М. И. Кабачника «Фосфор-
органические вещества»,
издательство «Знание», Москва, 1967.
4 Химия и Жизнь, №. £
25
Кашалоты на разделочной
палубе китобойной базы
«Советская Украина»
/
Редакция получила несколько писем, авторы которых спрашивают:
применяется ли сейчас природная амбра, каков ее химический состав, как ее
добывают?
О "зарождении", свойствах и добыче аморы рассказывает руководитель
научной группы китобойной базы "Советская Украина", кандидат
биологических наук М.В.ИВАШИН.
Это было в Антарктике, на китобойной
базе «Советская Украина», в январе
1961 года. Заканчивалась разделка
кашалота. На палубе громоздились сердце,
легкие, желудок животного. Вдруг в нижней
части брюшной полости
моряки-раздельщики обнаружили крупное шарообразное
образование. Может быть, опухоль?
Бывает и так... Один, другой удар фленшер-
ным — разделочным — ножом, и
показалась большая черная глыба. Это была
амбра. Ее доставили в лабораторию, сделали
анализ и первичную обработку. В
кишечнике самца-кашалота ростом 14,5 метра
26
Кусок природной амбры
* ' /
был найден кусок амбры весом в 102,5
килограмма. Так я познакомился с этим
интереснейшим природным продуктом.
В сезон 1964/65 годов моряками
антарктической китобойной флотилии «Юрий
Долгорукий» был обнаружен еще более
крупный кусок амбры, весивший 130
килограммов. А в 1967 году в теле кашалота
длиной 15,5 метра моряки китобазы
«Советская Россия» нашли глыбу амбры весом
в 270 килограммов.
РАЗНОВИДНОСТИ И СОСТАВ АМБРЫ
Амбра известна с незапамятных времен.
В древности думали, что она образуется из
выделений некоторых экзотических
растений. Была и другая идея — что это
пчелиные соты, попавшие в море и
подвергавшиеся долгому воздействию морской воды.
Существовало также мнение, что амбра —
помет огромной птицы, питавшейся
ароматными растениями...
В первой половине XVIII века наконец
было установлено, что амбра образуется
в теле кашалота. Обнаружили это по
«клювам» — остаткам челюстей головоногих
моллюсков, всегда присутствующим в
амбре. А биологам давно известно, что
головоногие моллюски — излюбленная пища
китов-кашалотов. Эти моллюски китами
быстро и легко перевариваются, и лишь
хитиновые «клювы» застревают в
кишечнике...
Так ученые добрались до разгадки
секрета: где находятся лаборатории,
вырабатывающие амбру.
Небольшие куски амбры A0—25
килограммов) часто находят на морском
побережье. Иногда они просто плавают в море...
Такие находки обычно случаются у
берегов Мадагаскара, Аравии, Японии, Мол-
лукских островов, Новой Зеландии, в
Персидском заливе. Именно там, в теплых
и умеренных водах, обитают большие
группы кашалотов.
Амбре приписывается много ценных
свойств, вокруг нее сложилось много
легенд. Больше всего ценится свойство
амбры закреплять естественный букет
ароматического вещества. ' Долгое время ее
использовали и для лечения самых разных
болезней — эпилепсии, тифа, астмы... В
некоторых странах амбру до сих пор
продолжают применять как антиспазматическое
и возбуждающее средство. Но с точки зре-
4*
27
ния научной медицины пользы от такого
лечения немного.
Сейчас этот редкий и довольно дорогой
продукт весьма ценится в парфюмерной
и пищевой промышленности. Несмотря на
то, что химики еще в 1946 году научились
получать амбру искусственным путем,
природная амбра остается необходимой
составной частью самых
высококачественных духов, тонких сортов ликеров, дорогих
сортов табака.
Именно на природной амбре
изготовляются прекрасные советские духи «Москва
белокаменная», «Комета», «Ярославна».
Химический состав амбры, %
пристан (С18Нзб) 2— 4
амбреин (С3оН520) 25—45
холестерол (С27Н4бО) 0,1
эпикопростерол (свободный или
связанный) 30—40
капростерол 1— 5
кетон 3— 4
капростанон 3— 4
свободные кислоты 5
омыленные кислоты 5— 8
остаток, нерастворимый в эфире .... 10—16
Как видно из этой таблицы, основу
амбры составляют высокомолекулярные
спирты. Из них наиболее пахучий — амбре-
28
ин, который медленно разлагается при
окислении.
Но в природных условиях, в море,
запах амбры формируется под воздействием
воды, воздуха, солнца. Запах ее зависит от
стадии созревания. Так, в товарной серой
амбре выделяют «морской» оттенок и запах
свежих водорослей. Для некоторых видов
характерен тонкий запах табака с оттенком
аромата, напоминающего ладан или
мускус. Самым необычным и приятным
ароматом обладает белая амбра.
Извлеченная из тела кашалота амбра
покрыта густой липкой темной массой.
Куски бывают шарообразной или овальной
формы, твердые на ощупь. В
необработанном виде амбра издает чрезвычайно
неприятный запах. Обычно до продажи амбру
тщательно обрабатывают: очищают от
примесей, сушат, а также дают ей
«созреть».
Качество товарной амбры определяется
главным образом по цвету и запаху.
Наименее ценной считается черная амбра,
несколько выше оценивается коричневая.
Шире всего в парфюмерной
промышленности используются светло- и темно-серая
амбра. Ценнейшими разновидностями
считаются золотистая и белая амбра.
По-видимому, эти виды амбры дольше всего
находятся в море. Они чрезвычайно
хрупки: при легком прикосновении кусок белой
амбры превращается в порошок.
Физические свойства амбры: она легче
воды (удельный вес 0,8—0,9, в зависимости
от стадии созревания); хорошо
растворяется в 95-градусном подогретом спирте,
плавится при 60° С, сгорает без пепла. Если
к куску амбры приложить раскаленную
проволоку, образуется темная смолообраз-
ная жидкость, которая, застывая, легко
вытягивается в тонкую блестящую нить.
ХИМИЧЕСКАЯ ЛАБОРАТОРИЯ В КАШАЛОТЕ
Как же «зарождается» амбра? На этот счет
есть несколько теорий.
Многие исследователи связывают
образование амбры с реакцией организма
кашалота на жизнедеятельность гельминтов,
в огромном количестве населяющих его
тонкий кишечник. Важное место
отводят также участию желчи: в составе амбры
встречаются некоторые ее производные.
По мнению некоторых биологов,
«вырастет» или «не вырастет» у кашалота амбра
зависит от того, чем питается кашалот.
А есть ученые, которые образование амбры
пытаются объяснить заболеванием
кашалота. Они утверждают, что кит, в котором
«вырабатывается» амбра, становится
худосочным, на теле его — язвы, издающие
неприятный запах.
Проведенные нами наблюдения
показывают, что киты с амброй по внешнему
виду ничем не отличаются от других
кашалотов...
Недавно появилась новая теория: амбра
в теле кита — это его приспособление для
удаления из организма холестерина!
Нам представляется, что амбра
возникает так. В процессе пищеварения
образуется липкая, похожая на смолу масса
темного цвета. Это исходный «материал»
для образования амбры. Масса имеет
тягучую, вязкую консистенцию. Постепенно
продвигаясь по кишечнику, она при
благоприятном стечении обстоятельств
сбивается в комок и обволакивает встречающиеся
на пути мелкие твердые образования
(остатки непереваренной пищи).
Постепенно в комке накапливаются посторонние
включения, к нему прилипают новые
комочки массы.
В каком именно месте туловища
кашалота происходит «рождение» амбры, до
сих пор точно установить не удалось.
Вначале мы предполагали, что это происходит
в толстых кишках, непосредственно
примыкающих к прямой кишке. Но в сезон
1965 года Ю. П. Голубовский и Г. А. Бу-
дыленко нашли небольшие кусочки амбры
в тонком кишечнике кашалота...
Отдельные куски движутся по
кишечнику, пока не достигают толстых кишок.
Здесь основная глыба задерживается и
растет, а остальные мелкие кусочки
выводятся из организма кита с остатками пищи.
До сих пор неясно, с какой скоростью
происходит процесс «роста» амбры. Куски
небольшого веса встречаются и у молодых,
и у старых животных. Известен случай,
когда китобои извлекли из туловища кита
глыбу амбры весом в 421 килограмм. Если
даже считать, что этот кит был очень
преклонного возраста — 30—35 лет, — а кусок
амбры «зародился» в его ранней
«молодости», то все равно средний ежегодный
прирост чрезвычайно велик: от 8 до 14
килограммов.
20
В магазинах кустарных изделий, в
сувенирных киосках, в отделах подарков вы
не раз, конечно, встречали различные
деревянные изделия, украшенные яркой
росписью в три цвета — золотой, черный,
красный. Это знаменитая хохломская
роспись, названная так по имени села
Хохломы, в котором она зародилась.
У прилавков с «хохломой» всегда
толпятся покупатели, и часто можно
услышать вопрос: а как это делают? Или даже
недоуменный возглас: сколько же на это
тратят золота?
Действительно, на Руси для
украшения дерева издавна использовали золото.
Во многих старинных церквах сохранились
резные по дереву позолоченные
иконостасы; они действительно покрывались
тонкими листиками золота*. Но с «хохло-
* См. «Химия и жизнь», 1966, № 6.
30
/
1 ' О
.■ ТА
Г. А. БАЛУЕВА
мой» этот способ не имеет ничего общего.
Скажем сразу — настоящего золота в
«Хохломе» нет и не бывало.
Так как же делают «хохлому»?
Будущий расписной стаканчик, ложку, бочонок
и т. д. вырезают вручную или вытачивают
на токарном станке из липы или березы,
тщательно A0—15 дней) сушат и затем
начинают готовить под роспись. Для этого
поверхность изделия грунтуют жидкой
глиной, несколько раз покрывают олифой,
сушат при 60—70° С и затем натирают
алюминиевой пудрой. По этому серебристому
фону вещь расписывают красной и черной
масляными красками (иногда вводят и
другие цвета). Затем вещь еще раз покрывают
олифой и сушат при более высокой
температуре. И вот тут-то происходит
маленькое химическое чудо — «серебро»
превращается в «золото».
Какие химические реакции идут здесь?
Почему образуется золоченая поверхность?
Оказывается, весь секрет в пленке олифы.
При высокой температуре олифа
«закаливается», приобретая золотистый цвет.
Сочетание желтоватого цвета пленки с
металлическим блеском порошка алюминия
очень хорошо имитирует настоящую
позолоту. Пленка не только превращает
дешевый невзрачный металл в «благородное
золото», но и надежно защищает роспись
и поверхность дерева — пожалуйста, если
хотите, наливайте в хохломскую миску
горячие щи, берите хохломскую ложку и
ешьте себе на здоровье... Ничего с посудой
не сделается.
Олифами называются
пленкообразующие вещества, получаемые специальной
обработкой растительных масел. Но не
любых, а лишь высыхающих, содержащих
глицериды ненасыщенных жирных
кислот, — например, льняного, конопляного.
Чтобы получить олифу, масло нагревают
до 120—150° С, иногда в присутствии
катализаторов — так называемых сиккативов,
ускоряющих высыхание масла. Слово
«высыхание» можно было бы брать в кавычки,
потому что, по сути дела, масло не
высыхает, а твердеет в результате сложных
процессов окисления и полимеризации.
При этом образуется прочная,
нерастворимая в воде пленка, хорошо прилипающая
к поверхности.
Цвет пленки олифы зависит от
толщины слоя и температуры нагрева. Поэтому
соблюдение нужного режима закалки
имеет очень большое значение. И качество
олифы тоже очень важно. Раньше каждый
кустарь готовил себе олифу сам, ревниво
охраняя секреты производства. Для
изготовления олифы брали самое чистое
льняное масло и долго, иногда несколько
недель, нагревали его: каждые сутки масло
несколько часов стояло в топящейся печи,
а остальное время в этой же печи
томилось. И сейчас в производстве хохломских
изделий, особенно посуды, применяется
самая высококачественная олифа.
Традиционная расцветка «хохломы» —
красно-черная. Она обусловлена и
художественным требованием гармонии цветов
с золотом, и особенностями технологии:
горячую закалку выдерживают очень
немногие краски. Поэтому в качестве красной
краски применяют киноварь, а черная
краска — это всем известная сажа.
Технология производства «хохломы»
с момента возникновения этого промысла
конечно не оставалась неизменной. Очень
важным новшеством конца XIX века было
использование алюминиевого порошка —
до этого изделия золотились
металлическим оловом или даже серебром.
С давних времен изготовление хохлом-
ских изделий носило промысловый
характер: одни деревни специализировались на
изготовлении деревянных изделий, так
называемого «белья», а другие деревни
расписывали «белье», причем, хотя весь
процесс росписи, от грунтовки до конечной
закалки, осуществлялся в пределах одной
семьи, внутри нее несомненно тоже
существовало известное разделение труда.
В начале XX века хохломской
промысел, подобно многим другим промыслам
России, стал приходить в упадок.
Сравнительная дешевизна и доступность
фабричной посуды привела к тому, что в быту
хохломская утварь была быстро вытеснена
изделиями из металла и фаянса. Кроме
того, сильно повредили попытки
«облагородить» это народное искусство, навязать
исполнителям рисунки и приемы росписи,
идущие вразрез с традиционной манерой
хохломского письма.
Новая история «хохломы» начинается
после Великой Октябрьской
социалистической революции. Уже в 1918 году в селе
(ныне городе) Семенове, одном из центров
промысла, была организована артель
«Экспорт», объединившая разрозненных до того
кустарей; с конца 20-х годов начинается
его быстрое возрождение. Этому немало
способствовало и создание в 1932 году
Научно-исследовательского института
художественной промышленности, который
наряду с работой по расширению
ассортимента изделий и созданию новых
рисунков, занимался и вопросами
усовершенствования технологии.
Сделано уже немало. Обычная русская
печь, где закаливали изделия, заменена
электропечью с точной регулировкой
температуры. Предложены новые составы для
грунтовки и новые лаки для покрытия
росписи. Нанесение грунта и лака вручную
заменено распылением из механических
пульверизаторов.
Современное производство хохломских
изделий сочетает в себе высокую
механизацию вспомогательных процессов с
творческой ручной работой по росписи. Так,
в Семенове имеются заготовительные
(токарный И СТОЛЯРНЫЙ), ГРУНТОВОЧНЫЙ, 1ПЛИ-
32
фовальный лакировочный цехи и цех
росписи. Разделение труда и механизация
позволяют, не ухудшая художественных
качеств изделий, значительно увеличить
их выпуск. А спрос на «хохлому» очень
велик и в нашей стране и особенно за
рубежом. Ведь нигде в мире нет ничего
подобного нашей «хохломе»!
И сейчас химики не прекращают
работу с «хохломой». Например, не так давно
в ассортименте хохломских вещей
появились и столярные изделия — журнальные
столики, шкафчики, скамеечки. Вначале
клееные изделия не выдерживали
высокотемпературной закалки, и поэтому
пришлось искать лаки, сохнущие при более
низкой температуре, но дающие такую же
золотую пленку. Сейчас химики ищут
лаки, которые будут сохнуть при
комнатной температуре. Это сильно удешевит и
упростит производство некоторых видов
изделий, для которых защитные свойства
пленки не так существенны: ведь даже
в электропечах закалка требует
непрестанного наблюдения опытного мастера, так
как иначе вся партия изделий может пойти
в брак. Другое направление поисков —
расширение ассортимента красок.
...Вот и окончен наш рассказ о «золотой
хохломе». И если на вашем письменном
столе стоит нарядный стаканчик для
карандашей, то, любуясь узорной росписью,
отдавайте должное не только искусству
художника, но с уважением подумайте и
о пытливых наблюдательных зачинателях
промысла, сумевших получить «золото»
без золота, и об их достойных
продолжателях, ставящих на службу старинным
народным ремеслам достижения
современной химии.
Из писем в редакцию Из писем в редакцию Из писем в редакцию
■ ЕЩЕ ОБ ЭПОКСИДНЫХ
КЛЕЯХ
В майском номере журнала за
1967 год в ответе Е. В. Грузинова
на вопрос об эпоксидных смолах
(стр. 63) допущен ряд серьезных
неточностей.
1. Эпоксидными смолами
нельзя склеивать не только олово и
фторопласт-4, как утверждает
автор, но и большинство полимеров:
оргстекло, полиэтилен,
полипропилен, полиизобутилен, капрон,
полихлорвинил, фторопласт-3 — в
общем, десятки современных
материалов, более
распространенных, чем олово и фторопласт-4.
Кроме того, автор явно
преувеличил стойкость эпоксидных клеев
к действию влаги.
2. Отечественные (как и
зарубежные) эпоксидные смолы
бывают не только жидкими, но
и твердыми — в виде блоков и
порошков.
3. На холоду эпоксидные
смолы под действием малеинового
ангидрида не отверждаются. В
приведенных в заметке
литературных источниках (К. И. Черняк
«Эпоксидные компаунды и их
применение», 1959, стр. 14;
Д. А. Кардашов «Синтетические
клеи», 1964, стр. 108) на это
указано довольно определенно.
К тому же малеиновый ангидрид
токсичен, раздражает слизистую
оболочку глаз.
4. Совершенно недопустима
рекомендация готовить
эпоксидные клеи смешением нагретой до
50—60°С эпоксидной смолы с
расплавленным гексаметилен
диамином. Если делать так, то смесь
будет твердеть буквально в
момент смешения. Но главное в
другом. Эта операция может стоить,
если не жизни, то во всяком
случае здоровья всем, кто
попытается ее воспроизвести. Даже если
просто открыть склянку с
гексаметилен диамином, находящимся
при обычной температуре, то в
нос ударит отвратительный запах.
При повышении температуры пары
гексаметилен диамина становятся
просто убийственными не только
по «вкусу», но и по действию на
организм. И вообще, рекомендуя
эпоксидные смолы, нельзя не
подчеркивать жирной чертой и
восклицательными знаками
исключительную токсичность большинства
применяемых для них отверди-
телей.
Гексаметилендиамин — один из
самых опасных, поэтому ныне он
применяется очень редко и то
только в виде 50%-ного
спиртового раствора, а не расплава или
порошка, как советует автор.
Безопаснее все же применять поли-
этиленполиамин или так
называемый кубовый остаток гексамети-
лендмамина. При работе с
эпоксидными смолами для защиты
рук надо обязательно употреблять
резиновые или так называемые
биологические перчатки.
Инженер В. ВОЙТОВИЧ
5 Химия и Жизнь, № 2
зз
БОРЬБА
С
БЕЗУМИЕМ
И. ГУБЕРМАН
Рисунок
Д. АНИКЕЕВА
34
ИСТОРИЯ ИЗДАЛЕКА
Летопись психических заболеваний
насчитывает тысячелетия. Еще древний
вавилонский царь Навуходоносор «скитался,
как вол, опустив голову, по пастбищам;
одичал, весь оброс и питался травой».
Спартанцы сажали на цепь и в колодки
своего царя Клеомена, обезумевшего от
пьянства. Появившиеся в разных веках
приюты для душевнобольных напоминали
скорее тюрьмы, чем больницы: пациентов
нещадно били, заковывали в цепи и
кандалы, устраивали мучительные «целебные»
процедуры, скармливали рвотное и
слабительное— все, чем обладала медицина.
Побои считались мероприятием лечебным.
Так, в Англии придворный врач без
всякого почтения колотил свихнувшегося
короля Георга III, который выскакивал из
коляски, чтобы раскланяться со
«знакомыми» деревьями.
Подлинную, человечную историю
психиатрии начать, пожалуй, надо с Филиппа
Пинеля — личности невероятного
мужества, врача, в котором поражаешься не
только (и не столько) таланту медика,
а куда более редкому таланту — высокой
способности быть человеком. Он первый
в мире снял с больных цепи. Было так.
Пинель стал главным врачом приюта
для умалишенных Бисетра в годы
Великой французской революции. То ощущение
освобождения, которое охватило тогда
Францию, без сомнения, владело и Пине-
лем — хочется думать, что именно чувство
свободы и вслух провозглашенного
равенства заставило его подумать о больных.
В то время предместье Бисетр было
огромной человеческой свалкой, где
содержались нищие и бродяги, проститутки и
уголовники всех мастей.
Снятие цепей было первым лечебным
шагом. Пинель, по точному выражению
психиатров, возвел сумасшедшего в ранг
больного. В других странах это было
сделано позже.
Но вообще-то истязания, которые
считались лечением, не были проявлением
массовой профессиональной жестокости
врачей, а являлись лишь следствием
тогдашних воззрений на причины и развитие
психических болезней. Еще до середины
прошлого века считалось, что психическое
расстройство — это собственная злая воля
больного, выбравшего общение с
внутренним демоном и не желавшего обращать
внимание на окружающий мир. И больных
истязали, чтобы вернуть это внимание.
Но оставим прошлое. События нашего
века все повернули по-иному в этой ранее
безнадежной и потому несколько
заброшенной отрасли медицины.
Умение лечить появилось в тридцатых
годах, неожиданно придя из совершенно
других областей. История этой эстафеты
полна случайностей, загадок и промахов.
В двадцать первом году молодой
деревенский хирург Фредерик Бантинг
буквально с голыми руками, не вооруженный
не только приборами, химикатами или
идеями, но даже основательными
знаниями, выступил против страшной болезни —
диабета. Может быть, у него был
огромный талант? Нет. «Он не был блестящ,
только упорен»,— впоследствии написал
о нем биограф. Впрочем, одна идея у Бан-
тинга была. Не идея даже, а наблюдение.
Собака, лишенная крохотной
поджелудочной железы, стремительно худела,
истощалась и погибала, несмотря на
буквально звериную, ненасытную
(удовлетворяемую) страсть к воде и пище. С людьми
происходило то же самое. Правда, при
некоторых других формах диабета они
жирели, но это была нездоровая полнота, она
так же, как истощение, неотвратимо вела
к смерти. Уже была известна основная
причина болезни: ткани (и в том числе
мозговые) не умели усвоить сахар без
какого-то неизвестного посредника.
Раньше клетки сжигали его, обретая энергию,
а теперь он выбрасывался впустую.
Голодный, непризнанный, чудом
пристроенный к лаборатории и воровством
добывавший собак Бантинг нашел вещество-
посредник. Оно выделялось не самой
поджелудочной железой (поэтому его не
находили раньше), а крохотными
островками особой ткани внутри этой железы. От
латинского слова «insula» — «остров»
посредник-гормон был назван инсулином.
Злоключения и победу Бантинга
блистательно описал Поль де Крюи. И
перейдя ко второму этапу инсулиновой истории,
я снова попадаю в след Поля де Крюи
(Бантингу посвящена одна из глав
книги «Борцы со смертью», а то, что было
дальше, есть в его книге «Борьба с
безумием»).
Метод доктора Закеля — ученого,
принявшего эстафету Бантинга, победно
прошел по клиникам, не устарев по сию пору.
Закель поставил на карту не только
5*
35
Каким бы явилось счастьем сколько веществ — психиче- подвижность, другое — в мрач-
сразу открыть вещество — при- ских ядов. Одно погружает ную тоску, третье пробуждает
чину трагедии! Пусть даже не- шизофреника в каменную не- взрыв движений и веселость
жизни нескольких больных, но и свою
собственную.
Это было уже в середине тридцатых
годов. Закель работал в Берлине. Фашисты
еще не приступили с целью очистки нации
к варварскому уничтожению больных.
(Это пришло чуть позже, в расцвете
духовного гниения третьего рейха. Буквально
оправдывалась старая мысль, что о
моральном уровне государства можно точно
судить по тому, как оно заботится о своих
душевнобольных.) Но зато уже
существовал закон, что врач отвечает собственной
головой за сохранность каждого арийца.
Путем каких-то сложных и не очень
основательных теоретических
рассуждений Закель пришел к мысли, что введение
инсулина может восстановить нарушенный
обмен веществ в мозгу шизофреников.
Первые опыты не дали результата, пока
вводимая доза не оказалась чересчур
велика для одного больного. Он стал биться
в судорогах, потом погрузился в тяжелое
бессознательное состояние, был спасен
вспрыскиванием сахара и... превратился
в здорового человека. Поль де Крюи
пишет: Закель вел свою игру у порога
смерти. И приводит наблюдение Закеля:
наилучших результатов тот добивался, когда
вплотную приближался к смертельно
опасной дозе.
Теперь логичен вопрос: инсулин или его
следствие — судороги просветляли
больное сознание? Часть ученых уверенно
отвечает: конечно же, инсулин (в
доказательство предлагаются длинные, стройные
и убедительные цепочки возможных
химических превращений, в которые
инсулин якобы целительно включается. Но
поскольку сама-то химическая цепочка,
приводящая к болезни, неизвестна, гипотезы
пока еще висят в воздухе). У сторонников
убеждения, что излечивает именно
«встряхивание», доказательство косвенное: такие
же просветляющие результаты приносит
иногда лечение с помощью судорог,
вызванных током — так называемая
электросудорожная терапия.
Так или иначе, еще не умея
окончательно объяснить, врачи уже лечат,
и часто успешно. Но главный подарок был
принесен психиатрам в начале
пятидесятых годов. Психиатрию буквально
потрясло лекарство, рекомендованное... хирургом.
Ища возможность оперировать при
низких температурах, хирурги натолкнулись
на яростное автоматическое сопротивление
36
у маниакального больного.
Четвертое, пятое, наконец, пусть
сотое, но найти каждый раз
конкретную, зримую, явственную
причину...
всего человеческого организма. В ответ на
охлаждение незамедлительно срабатывали
древние механизмы защиты: повышалось
кровяное давление, нервное возбуждение
работало на тревогу. Этих бдительных
стражей требовалось усыпить. Хирурги
применили сравнительно давно уже
известное врачам лекарство хлорпромазин
(или аминазин, что одно и то же),
угнетающее тепловые центры и вызывающее
общее снижение температуры (его
применяли раньше при лихорадках и
некоторых других болезненных состояниях).
Когда больным перед операциями вводили
аминазин, было замечено его побочное
действие: исчезал всегдашний вполне
понятный страх, наступало спокойствие,
граничащее с равнодушием. Хирурги и
палатные ординаторы не могли не заметить это,
а заметив, сообщили психиатрам. Те
попробовали аминазин на беспокойных,
взбудораженных, буйствующих или
постоянно напряженных больных.
Сенсация разносилась по миру с
ракетной скоростью. Это был, вероятно, один из
немногих в истории современной науки
случаев, когда ученые восторгались громче
и упоенней, чем журналисты. Больные
выписывались сотнями, у тысяч наступало
просветление, спадало нервное
возбуждение, исчезали навязчивые страхи и
буйные, неконтролируемые движения;
больные делались мягче, доступнее и
общительнее (многовековая мечта
психиатров — суметь воздействовать словом —
теперь становилась реальностью),
проявляли интерес к миру и осознанное
желание выздороветь. Исчезали
галлюцинации, стихал бред, на фоне успокоенной
психики лучше действовали другие
лекарства, энтузиазм врачей почти ежедневно
подкреплялся возвращением в мир
шизофреников, многие годы безнадежно и
тупо погруженных в темноту. Палаты
можно было открыть — больше не было
опасных вспышек необузданного гнева,
маньяки превращались в больных.
Психиатрические клиники впервые за долгие
столетия стали напоминать больницы.
Удача не приходит одна. В созданных
несколько тысячелетий назад, много веков
передаваемых устно, потом записанных
и ставших священными индийских книгах
«Веды» (в одной из них — «Аюр-Веда»)
упоминается о целебных свойствах корня
кустарника раувольфии. Эти высушенные
37
корни рекомендовалось жевать при укусах
змей и насекомых, при бессоннице и
головных болях. Врач и ботаник Раувольф еще
в XVI веке детально описал это растение,
но только спустя четыре столетия два
индийских химика выделили из корней смесь
из почти двух десятков алкалоидов. Еще
двадцать лет. В пятьдесят втором году от
смеси был отделен резерпин (искусственно
его синтезировали спустя четыре года).
И так же, как алкалоид морфин,
выделенный некогда из опиума, оказался в чистом
виде несравненно активней, чем в
родительской смеси. Примененный сначала
для снижения давления, он довольно
быстро перекочевал в клиники психиатров.
Однако в восторженном хоре похвал
в адрес аминазина и резерпина через год
зазвучали нотки тревоги. У больных,
принимавших аминазин и резерпин,
наступала подавленность, депрессия, чувство
тоски, безысходности, отчаяния.
Этот спад был, однако, куда менее
опасен, ибо стимулировать, возбуждать
угнетенную психику человечество научилось
гораздо раньше, чем укрощать
распоясанную. Такой «вздергиватель» нервов, как
кофеин, был известен еще в глубокой
древности. А другой стимулятор —
вечнозеленое растение эфедра (е честь
энтузиаста и пропагандиста этого средства
фельдшера Федора Кузьмича Мухавникова
названное в прошлом столетии «кузьмиче-
вой травкой») было помянуто под именем
«махуанг» еще в травнике знаменитого
китайского императора-фармацевта Шень-
Нуня. В прошлом веке из травы был
выделен эфедрин, будоражащий (но очень
ненадолго) нервную систему и затем
стремительно выводимый из организма.
Анализ его строения привел к созданию
мощного искусственного стимулятора
фенамина. Тут уже был поиск с открытыми
глазами, ибо предположения биохимиков
о том, что эфедрин работает не «личным»
вмешательством, а просто задерживая
распад норадреналина, продлевая действие
этого гормона возбуждения и
беспокойства, кажется, подтвердились.
В руках Ерачей оказался мощный
рычаг движения психики. Двойной рычаг.
Вверх — вниз, вниз — вверх. Балансируя
на этих спадах и подъемах, то натягивая,
то ослабляя вожжи, действие которых
становилось все рассчитанней и осознанней,
врачи то выволакивали больных из
пропасти мрачного отчаяния, то мягко
стаскивали с крутых скал маниакального
возбуждения.
Так поступали и поступают лечащие
врачи. Им нужен результат — психическое
здоровье, нормальное поведение, и то, что
они работают ощупью, наугад,
ориентируясь лишь на опыт и интуицию, мало
волнует их. Любой больной согласился бы
с их позицией.
Но ученые-биохимики думают иначе.
Чем отличается применение аминазина
от прежней смирительной рубашки?
Типичное связывание. Только более
гуманное (внешне) — химическое. Но ведь что
делает аминазин, мы еще не знаем
наверняка. Из запутанного узла проблем и
загадок выглядывает пока лишь несколько
разрозненных ниточек.
Возле каждой из них работает сейчас
группа исследователей.
ВРЕМЯ БОЛЬШИХ ОЖИДАНИЙ
Каким бы явилось счастьем сразу открыть
вещество — причину трагедии! Пусть даже
несколько веществ — психических ядов.
Одно погружает шизофреника в каменную
неподвижность, другое — в мрачную тоску,
третье пробуждает взрыв движений и
веселость у маниакального больного,
четвертое наглухо запирает от контрольного
аппарата разума несколько навязчивых идей
параноика, пятое замыкает порочную цепь
из группы нейронов, погружая эпилептика
в судороги. Шестое, седьмое, наконец,
пусть сотое, но найти каждый раз
конкретную, зримую, явственную причину.
Сенсация! В крови шизофреников
обнаружен особый ядовитый белок, названный
тараксеином. Введенный двадцати
добровольцам, тараксеин вызвал у них
временную картину шизофрении самых разных
вариантов: бред преследования,
болезненную неподвижность, автоматические
бессознательные движения, утрату чувства
личности. Неужели вот оно, недостающее
(или лишнее?) звено цепочки болезненного
обмена? Другие исследователи повторили
одыты. Безрезультатно. Это было уже лет
десять тому назад, тараксеин стал
принадлежностью истории биохимии, ее ошибок,
а не побед.
Сенсация! Сыворотка крови и
различные выделения застывших больных
вызывают такую же заторможенность у крыс,
прекращающих беготню, у кошек, обре-
38
Словно подстегиваемый чем-то, с детства. Но еще до того как мерной фантастичностью—ми-
больной Г. создавал тысячи вот Г. заболел шизофренией, его стикой, сюжетами из сновиде-
таких изображений. Рисовал он произведения отличались чрез- ний...
Г-
**?г Ъ*ГШ
ши
Kjo* V
m
* - 4 к;» -*-J !i:-л
тающих неподвижность, даже паук
ленивее и искаженно плетет свою охотничью
сеть. Снова неизвестное вещество?
Однако с людьми, которым вводят сыворотку,
ничего не происходит.
Больше сенсаций не будет. Вернее
будут, и еще какие, но повальное
увлечение химическими открытиями
пятидесятых годов убедило ученых, что приступом
эту крепость не взять. Началась
планомерная осада. Врачи продолжают лечить
больных набором из нескольких десятков
успокаивающих и стимулирующих
лекарств (число их все возрастает, и действие
все тоньше и прицельней), а биохимики
пытаются распутать клубок химического
обмена.
Очень перспективно предположение,
что значительная часть искажений
мозговой химии возникает на границах
нейронов, где происходит передача
информации * с помощью химических веществ,
главное из которых адреналин. Может
быть, искажение химического состава ад-
* Подробно о процессах, происходящих на
границах нейрона, можно прочесть в статье
«Нервная передача» («Химия и жизнь», 1967,
№8).
реналина и влияет на искажение психики?
Гонец — посыльный, подмененный по
дороге, приносит, как в детективных
романах, заведомо лживую информацию.
Группа исследователей пошла по пути
изучения продуктов распада адреналина.
Начало обещало многое: одним из
веществ-наследников разложившегося
адреналина оказался мескалин — известное
наркотическое средство, сильно влияющее
на психику. Естественно было
предположить, что вовремя не нейтрализованный,
не связанный адреналин производит некое
вещество, постоянно искажающее психику!
Продукты распада этого заподозренного
гормона — адренохром и адренолютин
исследователи попробовали на себе.
Комната незнакомо исказилась.
Появившаяся перед закрытыми глазами
цветная пустота заволновалась, как
внутренность бассейна. И вот уже по нему
поплыли разноцветные блистающие рыбы.
Ученый почувствовал себя в аквариуме,
и ощущение, что он сам — морской анемон,
сознание не смогло опровергнуть. Он
открыл глаза. Люди, друзья и сотрудники
раздражали его, вид их был неприятен.
Его привели в гости. Он просидел час, ни
30
Автор портрета на вклейке — рисовала, затем впала в суме- лезни никаких художественных
больная Ш. В начале заболева- речное состояние и более не воз- склонностей у нее не проявля-
ния (шизофрения) она много вращалась к искусству. До бо- лось
с кем не разговаривая и угрюмо глядя
в коврик на полу — для его обычного
характера это было более чем странно. На
глянце стеклянного прибора плясал и
подмигивал ему какой-то человек. Наутро все
прошло.
Трудность поиска биохимиков связана
с тем, что изучается черный ящик. В него
невозможно влезть, об устройстве можно
судить, только вмешиваясь в его работу
(электричеством ли, химикатами,
скальпелем) и изучая полученное на выходе.
Да и ввести вещество прямо в мозг
испытуемого человека очень трудно — дело
в том, что существует некое устройство,
охраняющее нас от прямого
вмешательства химикатов, находящихся в крови. Это
так называемый гемато-энцефалический
(крове-мозговой) барьер, спасительный
фильтр, во многом еще неизвестно как
сконструированный. Не будь этой заставы,
мы по меньшей мере трижды в день
сходили бы с ума, засыпали или
буйствовали— в пище, которую получает человек,
всегда есть вещества, которые могли бы
повлиять на психику, и не будь крове-моз-
гового барьера, десятки психогенных ядов
обрушились бы на наш мозговой обмен.
Над конструкцией барьера биохимики
бьются сегодня не только в целях
отвлеченного познания. Разгадать пароли и
шифры барьера — это значит не только
суметь повысить при надобности его
запирающие свойства, но при необходимости
ввести в мозг вещества, недостающие ему
для нормальной (или улучшенной) работы.
Уже давно было замечено, что при
повышении температуры, в лихорадочных
состояниях проницаемость барьера падает.
На этом свойстве строились даже
методики лечений: больных искусственно
заражали малярией, чтобы провести лекарства
через ослабевшие от жара заставы-
фильтры.
В те же пятидесятые годы, когда
рождалась психофармакология, в тканях
мозга человека и высших животных было
открыто вещество, имеющееся только
в мозгу. Это специфическое вещество
мозга: гамма-амино-масляная кислота
(сокращенно ГАМК). Наблюдения и
эксперименты установили, что ГАМК работает как
успокоитель. Одна из гипотез связала
недостаток этой кислоты с повышением
склонности мозга к активности,
рождающей судороги. Значит, введение ГАМК
могло бы уменьшить эту активность. Но
как провести ее через бдительные системы
крове-мозгового барьера? Троянского
коня— но во имя не разрушения, а
созидания, засылают фармакологи в крепости
мозга. Для того чтобы провести ГАМК
через неведомые охранные заставы, ее
молекулу присадили на вещество, о котором
заведомо известно: барьеры пропустят его
в мозг, что-то неизвестное пока в его
строении служит опознавательным актом. Так
родился еще один препарат.
В сегодняшних работах биохимиков
содержится обещание не только для
больных. Многочисленные средства,
снимающие усталость, бодрящие и
успокаивающие,— только первые плоды их поисков.
Но ученые говорят уже о значительно
большем — о благотворном вмешательстве
в человеческую психику с самого
рождения человека — о средствах, улучшающих
память, выправляющих характер,
повышающих работоспособность.
Препараты биохимии смогут создать
фон, почву, на которую общество будет
плодотворней сеять знания, и не только
знания, но и понятия о морали, чести,
справедливости и добре. Это не благодушная
утопия, для таких надежд сегодня уже
есть основания. И так же, как вошли в
нашу жизнь, став ее неотъемлемой частью,
лекарства и витамины, влияющие на тело,
появятся психические корректоры нашего
характера, способностей и памяти.
Некогда выделив человека из ряда своих
питомцев, природа оставила ему множество
животных черт. Жестокость и эгоизм,
варварство и подлость, вероломство и
ханжество— продукты не только плохо
устроенного пока человеческого общества, но и во
многом психический атавизм, придатки, от
которых человечество, разумно и
справедливо устраивая свой быт, могло бы
постепенно освобождаться. Конечно, никогда не
заполнят планету упитанные и
розовощекие, идеально положительные молодчики,
но правильное развитие личности со
своевременным устранением психических
загибов и поправкой характеров в сторону
отваги, разума и прямоты общество
сможет гарантировать не только своим
специальным устройством, но и с помощью
науки. И как значительно повысилась
в нашем веке средняя продолжительность
жизни, так, возможно, чище и выше станет
постепенно средний человеческий
рассудок. Очень хочется думать, что это
произойдет.
40
&ШШШв*Ш*т*штШ*ШШШтЛ»ш»слшяш*л
КЛАССИКА
НАУКИ
АТОМЫ,
ЛУЧИ,
КВАНТЫ
Кандидат физико-математических наук
Л. ПОНОМАРЕВ,
г. Дубна
ЛУЧИ
Солнечный луч (как мы убедились в
прошлый раз на примере теплового
излучения), если внимательно за ним проследить,
может привести к порогу квантовой
физики. Весьма вероятно, что вам этот
переход не кажется пока убедительным. Но
ощущение произвола, которое испытывает
человек при первом знакомстве с теорией
Планка, на самом деле обманчиво.
Формула Планка — не результат умозрения, она
появилась лишь после длительного
анализа точных опытов. Конечно, для того чтобы
придумать ее, одного анализа мало:
необходима еще и сила мысли, и взлет
фантазии, и смелость перед лицом неожиданных
следствий теории.
Ученые — Релей, Джине, Вин — и до
Планка предлагали различные формулы
для описания спектра «абсолютно черного
тела». Но каждый раз экспериментаторы
Отто Люммер A860—1925) и Эрнст Принс-
гейм A859—1917) с решительностью людей,
которые сами тщательно измерили этот
спектр, отвергали их, как несовершенные.
Только формула Планка удовлетворила
их: она поразительно совпадала с
результатами опытов, хотя и не становилась от
этого более понятной.
Последуем примеру этих физиков и
рассмотрим строение солнечного луча еще
внимательнее, чем мы это делали до сих
пор. В дальнейшем мы увидим, как много
информации он с собой несет. Надо только
научиться ее читать.
Если пропустить луч солнца через
призму, то на экране позади нее возникает
спектр луча — явление обычное, и за
Вторая статья из серии, посвященной
квантовой механике. Первая статья была напечатана
в № 1 за этот год.
200 лет к нему привыкли. На первый
взгляд, между отдельными частями
спектра нет резких границ: красный
непрерывно переходит в оранжевый, синий — в
голубой и т. д.
Так и думали до тех пор, пока в 1802 г.
английский врач и химик Уильям Волла-
стон A766—1828) не рассмотрел этот
спектр более пристально. Он обнаружил
при этом несколько резких темных линий,
которые без видимого порядка пересекали
спектр Солнца в разных местах.
Впоследствии эти темные линии назвали фраунго-
феровыми — как это часто бывает, по
имени их настоящего исследователя, а не
первооткрывателя.
Иосиф Фраунгофер A787—1826)
прожил недолго, но у него была удивительная
судьба. В 11 лет, после смерти родителей,
он пошел в ученье к шлифовальных дел
мастеру. Работать приходилось так много,
что на школу уже не оставалось времени,
и потому до 14 лет он не умел ни читать,
ни писать. Но однажды дом хозяина
рухнул, и пока Фраунгофера извлекали из-под
обломков, случилось так, что мимо ехал
наследный принц. Он пожалел юношу и
вручил ему значительную сумму денег.
Теперь Иосиф смог купить себе
шлифовальный станок и даже начать учиться.
То было время наполеоновских войн
и больших перемен в Европе. А
Фраунгофер между тем в заштатном городке Бене-
диктбейрене шлифовал оптические стекла
и тщательно изучал темные линии в
спектре Солнца. Он насчитал их там более 500,
дал главным из них названия и указал их
точное местоположение в спектре.
Положение это было строго неизменным, в
частности, всегда в одном и том же месте
желтой части спектра появлялась резкая
двойная линия, которую Фраунгофер
назвал линией D. И еще один важный факт
6 Химия и Жизнь, № 2
±1
Если на призму спектроско- видели спектр солнца и тем- пути луча горящую спиртов-
па падал только луч солнца, ную линию D натрия на своем ку — темная линия по-прежне-
то на шкале спектроскопа они обычном месте. Они ставили на му оставалась на месте. Но если
установил Фраунгофер: в спектре пламени
спиртовки на том же самом месте, что и
темная линия D в спектре солнца, всегда
присутствует яркая двойная желтая линия.
Сейчас, много лет спустя, всем ясно, что
факт этот — важный, но в 1814 году, когда
Фраунгофер опубликовал свои
исследования, так не думали. Однако мысли его не
пропали: прошло 43 года и Вильям Сван
A828—1914) установил, что двойная
желтая линия D в спектре пламени спиртовки
возникает в присутствии металла натрия.
(Его следы в составе поваренной соли
почти всегда можно найти в различных
веществах и в спиртовке — тоже.) Как и
многие до него, Сван не понял значения своего
открытия и потому не сказал решающих
слов: «эта линия принадлежит металлу
натрию».
К этой простой и важной мысли пришли
только два года спустя (в 1859 году) два
профессора: Густав-Роберт Кирхгоф
A824—1887) и Роберт-Вильгельм Бунзен
A811—1899). В Гейдельберге в старой
лаборатории они поставили несложный опыт.
До них через призму пропускали либо
только луч солнца, либо только свет от
спиртовки. Кирхгоф и Бунзен пропустили
и то и другое сразу и обнаружили при этом
явление, о котором стоит рассказать
подробно.
Если на призму спектроскопа падал
только луч солнца, то на шкале
спектроскопа они видели спектр солнца и темную
линию D натрия на своем обычном месте.
Они ставили на пути луча горящую
спиртовку— темная линия по-прежнему
оставалась на месте. Но если на пути луча
поставить экран и оставить только свет от
спиртовки, то на месте темной линии D
четко «проявится» яркая желтая линия D
натрия. Кирхгоф и Бунзен убирали экран —
линия D вновь становилась темной. Они
заменяли луч солнца светом от
раскаленного тела — результат был всегда тот же:
на месте ярко-желтой линии возникала
темная. То есть всегда пламя спиртовки
поглощает те же лучи, которые оно само
испускает.
Чтобы понять, почему это событие
взволновало двух профессоров, проследим
за их рассуждениями:
ярко-желтая линия D в пламени
спиртовки возникает в присутствии натрия;
в спектре солнца на этом же месте
находится темная линия неизвестной
природы;
42
спектр луча от раскаленного тела —
сплошной, и в нем нет темных линий.
Однако если его пропустить через пламя
спиртовки, то он не отличается от
спектра солнца — в нем также присутствует
темная линия D и на том же самом месте.
Но природу этой темной линии мы уже
почти знаем, во всяком случае мы можем
догадываться, что она принадлежит
натрию;
следовательно, в зависимости от
условий наблюдения линия D натрия может
быть либо ярко-желтой, либо темной на
желтом фоне. Но в обоих случаях
присутствие этой линии (все равно какой —
желтой или темной!) означает, что в пламени
спиртовки есть натрий;
а поскольку спектр пламени спиртовки
в проходящем свете совпадает с темной
линией D в спектре солнца, то и на
солнце есть натрий. Причем он находится
в газовом внешнем облаке, которое
освещено изнутри раскаленным ядром солнца.
Короткая заметка (всего две страницы),
которую написал Кирхгоф в 1859 г.,
содержала сразу четыре открытия: каждый
элемент имеет свой линейчатый спектр,
то есть строго определенный набор линий;
эти линии можно использовать для
анализа состава веществ не только на Земле,
но и на звездах; солнце состоит из
горячего ядра и сравнительно холодной
атмосферы раскаленных газов; на солнце есть
натрий.
Первые три открытия были вскоре
подтверждены, и гипотеза о строении
солнца в частности: экспедиция, которую
французская академия наук в 1868 году
послала в Индию, обнаружила, что при
полном солнечном затмении — в тот
момент, когда его раскаленное ядро закрыто
тенью луны и светит только корона, — все
на пути луча поставить экран нии D четко «проявится» яркая линия D вновь становилась
и оставить только свет от спир- желтая линия D натрия. Кирх- темной
товки, то на месте темной ли- гоф и Бунзен убирали экран —
темные линии в спектре солнца
вспыхивают ярким светом.
Вторую гипотезу сами Кирхгоф и
Бунзен уже в следующем году не только
подтвердили, но и применили для открытия
двух новых элементов: рубидия и цезия.
В дальнейшем из этого скромного
наблюдения над желтой двойной D-линией
натрия родился спектральный анализ,
с помощью которого мы сейчас можем
узнавать химический состав далеких
галактик, измерять температуру и скорость
вращения звезд и многое другое. Все это
действительно интересно, но сейчас нам
важно понять другое: что дали открытия
Кирхгофа и Бунзена для науки об атоме?
И какова их связь с нашими прежними
знаниями о нем?
Мы знаем теперь два вида спектров:
тепловой и линейчатый. Тепловой спектр
содержит все длины волн, излучается при
нагревании твердых тел и не зависит от
их природы. Его причина — коллективные
движения атомов при повышении
температуры тела.
Линейчатый спектр состоит из набора
отдельных резких линий, возникает при
нагревании газов и паров (когда малы
взаимодействия между атомами) и — что
особенно важно — этот набор линий
неповторим для любого элемента. Более
того, линейчатые спектры элементов не
зависят от вида химических соединений,
которые они образуют. Следовательно, их
причину надо искать в свойствах атомов.
То, что элементы однозначно и вполне
определяются видом линейчатого спектра,
вскоре признали все, но то, что этот же
спектр характеризует отдельный атом —
этот факт осознали не сразу, а лишь
в 1874 г. благодаря знаменитому
английскому астрофизику, глубокому
исследователю Норману Локьеру A836—1920).
А когда осознали — обнаружились новые
вопросы, новые предположения, и прежде
всего:
если линейчатый спектр возникает
внутри отдельного атома, то атом должен
иметь структуру.
АТОМЫ
В 1865 году после работ Йозефа Лошмид-
та об атомах знали немного: это твердые
шарики размером 1(Г8 см и весом от 10~24 г
до 10 ~22 г. Этих представлений было
достаточно для объяснения многочисленных
фактов из химии, теории теплоты и
строения материи. Однако уже к 1873 г. вполне
оформилась мысль, что атом состоит из
еще более простых частиц, и физики
принялись искать их. Прежде всего они стали
исследовать электрические свойства атома.
Все вещества, как правило,
электрически нейтральны (если, конечно,
специально не натирать стекло шерстью,
янтарь шелком и тому подобное). Однако
при некоторых условиях они
обнаруживают электрические свойства, например
в явлениях электролиза. Если в раствор
какой-либо соли (например, соли
поваренной NaCI) опустить два электрода и
подключить их к полюсам батареи, то в
растворе произойдут изменения: на катоде
(электрод, который подключен к
отрицательному полюсу батареи) начнет
выделяться чистый металл натрий, на
аноде— газ хлор. Это означает, что в
растворе атомы натрия заряжены положительно,
а атомы хлора — отрицательно, и поэтому
под действием электрического поля они
двигаются в противоположных
направлениях.
Майкл Фарадей A791—1867) в 1834 г.
6*
43
Если в раствор NaCI опустить
два электрода и подключить их
к полюсам батареи, то па катоде
начнет выделяться натрий, на жены
аноде — хлор. Это означает, что хлора ■
в растворе атомы натрия заря-
положительно,
— отрицательно.
а атомы
установил количественные законы этого
явления: оказалось, что если через
растворы различных веществ, молекулы
которых построены из одновалентных атомов,
пропускать одинаковое количество
электричества Q, то количества М веществ,
которые выделяются при этом на
электродах, относятся между собой как их
атомные веса А:
MNa ANa
МС1 ~АС1 '
Для отдельного элемента этот закон
можно переписать в другой форме:
М = — ■ А ,
F
причем число F выбрано таким, чтобы при
Q = F количество граммов вещества,
выделяющееся на электроде, было равно его
атомному весу. Ясно, что F — число Фа-
радея — это универсальная постоянная,
не зависящая от вида веществ.
Тщательные измерения дали для нее значение
F = 96500 кулонов.
Оба соотношения Фарадея легко
понять, если предположить, что в растворе
с каждым атомом связан определенный
заряд, причем для ионов Na и CI эти
заряды равны и противоположны по знаку.
Действительно, в этом случае равные
заряды переносятся разными массами,
причем вес выделившихся веществ будет
точно соответствовать закону Фарадея.
(Название ион — «путешествующий»
таким «заряженным» атомам дал Фарадей.)
Предположим, что на катоде
выделилось 23 грамма натрия. Поскольку
атомный вес Na равен 23, то это означает, что
выделился один грамм-атом натрия и
через раствор прошел заряд Q = F или —
что то же самое — ионы натрия перенесли
заряд Q = F. К этому времени уже знали,
что в грамм-атоме любого вещества
содержится N = 6,02-1023 атомов (число Аво-
гадро). Следовательно, заряд, который
переносит один ион, равен:
F 96500 кулонов
е = 7 = Т^Г, = 4,802-10"i°CGSE.
N 6,02-1023
С такой точностью чисел F и N тогда,
конечно, не знали и потому для е нашли
значение е ~ 3 •10 ~10 электростатических
единиц электричества.
Это значение очень мало, но мы уже
немного привыкли к таким малым
величинам. Более удивительно другое: заряда,
меньшего чем этот элементарный заряд е,
1 я
\
щ ■
■ " Z- *"*!
L
1 1 "*"
L* ^1 I
10 оВ
© еее~ 1
^ i ■! ■ ■ ■! *"
1
обнаружить не удалось. С легкой руки
Джонстона Стонея A826—1911) в 1891 г.
это наименьшее количество заряда
получило название электрон.
ЭЛЕКТРОНЫ
Первоначально с этим словом не
связывали понятие о частице — оно служило
лишь для обозначения того наименьшего
количества заряда, которое может
переносить с собой ион любого атома. Однако
подспудно мысль о том, что электрон —
частица, всегда жила. Действительно,
мысленно проследите процесс
электролиза: вот ион натрия Na+, двигаясь в
растворе под действием электрического поля,
подходит к катоду; на катоде избыток
отрицательных зарядов, поэтому в
момент, когда его касается ион Na+, он
забирает от катода один отрицательный
заряд и, не меняя веса, выделяется в виде
нейтрального атома натрия. Попробуйте
теперь вообразить сам момент перехода
отрицательного заряда от катода к иону
Na+ : что добавляется к иону, когда он, не
меняя веса, становится нейтральным?
Представить себе этот процесс довольно
трудно, если не предполагать при этом,
что элементарный заряд может
существовать и вне атома. Эту трудность
сознавали, конечно, все, но признать атомарное
строение электричества было еще труднее,
так как при этом рушились удобные
и привычные представления об электри-
44
Представьте себе стеклянную и запаянную с обоих концов обе эти проволочки присоеди-
трубку, наполненную каким- вместе с проволочками (обыч- ним к разным полюсам бата-
либо газом (например, неоном) по — платиновыми). Если мы реи, то по цепи пойдет ток
честве, как о неком тонком флюиде,
который без труда проникает во все тела.
Мысль о «молекулярном строении
электричества» впервые отчетливо
сформулировал Герман Гельмгольц A821—
1894) в 1881 г. в одной из своих
популярных лекций, посвященных Фарадею.
Конечно, сама по себе эта мысль даже
в то время не была новой: еще в 1749 г.
великий американец Бенджамен Франклин
подозревал нечто похожее, но тогда его
догадка в сущности ни на чем не была
основана, а потому и не привела к новым
следствиям. Сто тридцать лет спустя об
электричестве знали много больше и на
веру гипотез не принимали: знание
предполагает ответственность. Нужны были
экспериментальные доказательства идеи
об электроне. Их стали искать в явлениях
проводимости газов.
Представьте себе стеклянную трубку,
наполненную каким-либо газом
(например, неоном) и запаянную с обоих концов
вместе с проволочками (обычно —
платиновыми).
Если мы обе эти проволочки
присоединим к разным полюсам батареи: одну к
отрицательному (катоду), а другую —
к положительному (аноду), то по цепи
пойдет ток. Совершенно так же, как и в
случае с электролитом. Вероятно, именно
эта аналогия с явлениями электролиза и
побудила в свое время (в 1838 г.) Майкла
Фарадея построить прообраз такой трубки
(«электрическое яйцо» Фарадея).
Как мы увидим позднее, анология была
чисто внешней, но и само явление
проводимости газов было настолько интересным,
что многие исследователи посвятили
жизнь изучению его свойств.
Примерно в середине прошлого века
Юлиус Плюккер A801—1868) (это имя
знакомо теперь каждому математику)
оставил свои занятия геометрией, которые
не нашли признания среди современников,
и увлекся опытной физикой. Когда вы
следите за игрой световых реклам, вы
обязаны этим профессору математики
в Берлине и Бонне. Именно Плюккер
в 1858 г. изобрел эти светящиеся трубки.
(Обычно их называли гейслеровыми по
имени знаменитого стеклодува Гейслера,
который научился особенно искусно их
изготовлять; а еще полвека спустя их
повсеместно назвали трубками Крукса.)
Прежде всего Плюккер установил, что
проводимость газа возрастает, если часть
его откачать из трубки. При этом каждый
газ начинает светиться своим характерным
цветом, так что по цвету свечения можно
определить состав газа в трубке. (К этому
выводу Плюккер пришел даже раньше
Кирхгофа и Бунзена, но не понял его
значения.) Если увеличивать разрежение
в трубке, то вблизи катода появляется
темное пространство («катодное пятно»),
которое при дальнейшем откачивании
газа из трубки расширяется и наконец
заполняет ее всю: трубка перестает
светиться. Но это темное пространство живет:
+5
его пронизывают какие-то «лучи», хоть
и невидимые для глаза (как невидима
летящая пуля, пока не встретит препятствия
на своем пути).
Ученик Плюккера Евгений Гольдштейн
A850—1931) в 1876 г. дал им название:
«катодные лучи». Еще раньше, в 1869 г.,
другой его ученик Иоган Вильгельм Гит-
торф A824—1914) обнаружил отклонение
этих лучей в магнитном поле, и, наконец,
в 1879 г. Кромвель Вэрли A828—1883)
показал, что они заряжены отрицательно.
Поставьте себя на место этих
исследователей в 70-е годы XIX столетия: у вас
в руках набор интересных фактов, однако
связи между ними не видно. С одной
стороны, явление проводимости газов очень
напоминает процессы электролиза, но, с
другой стороны, происходят вещи совсем
непонятные: например, проводимость
растет с уменьшением концетрации газа в
трубке. Кроме того, обнаружен только
поток отрицательных «лучей» и не
обнаружено положительных.
Нужна была руководящая идея.
Такая идея возникла под влиянием
блестящих опытов, которые поставил
Уильям Крукс A832—1919) — английский
физик и химик. Это был интересный
человек, наделенный к тому же редким
даром — предвидеть фундаментальные
открытия. Крукс нигде не служил, всецело
был предан науке, что не помешало ему,
однако, верить в спиритизм, и в 1913
году стать президентом Королевского
общества.
Прежде всего, он гораздо сильнее
откачал воздух из трубки. При этом от катода
отделилось еще одно, более темное
пространство, которое также постепенно
заполнило всю трубку, после чего анод
вспыхнул зеленоватым светом. Тот день
1878 года, когда это произошло, можно
считать днем рождения
электронно-лучевой трубки — основной части
современного телевизора. Уже за одно это Круксу
обеспечено признание потомков. Но для
самого Крукса это было только началом —
он стал тщательно изучать свойства
излучения, которое он называл «лучистой
материей» (этот термин ввел все тот же
Фарадей еще в 1816 г.). Крукс понимал,
что столкнулся с совершенно новым
явлением и предлагал назвать его «четвертым
состоянием вещества», которое «ни жидко,
ни твердо, ни газообразно».
Чтобы оценить смелость мысли
Крукса, надо вспомнить, что в то время весь
мир разделяли на материю и эфир, причем
эти свойства считали противоположными
и несовместимыми: с материей
отождествляли частицы, а с эфиром — среду,
колебания которой мы воспринимаем как лучи
света. Таким образом, «лучистая материя»
Крукса должна была совмещать в себе
свойства несовместимые: луча и частицы.
Через полстолетия все могли убедиться,
насколько он был прав, но в то время (по
словам современника и соотечественника
Крукса, тоже физика Оливера Лоджа)
«...предположение Крукса имело судьбу
тех проблесков мысли, которые иногда
разрешаются автором, но подвергаются
насмешкам со стороны ортодоксальной
науки их времени».
Независимо от смысла, который Крукс
вкладывал в понятие «лучистая материя»,
он бесспорными опытами обнаружил у нее
46
такие свойства: она распостраняется
прямолинейно; вызывает свечение тел и
может их даже расплавить; отклоняется
в электрическом и магнитном полях;
проникает сквозь твердые тела, а в воздухе
проходит путь 7 см, в то время как
атомы— только 0,002 см.
Перед лицом этих фактов Уильям
Крукс утверждал: катодные лучи или
«лучистая материя»—это поток быстрых
отрицательных частиц, величина которых
значительно меньше размеров атомов.
Легко убедиться, что одна эта гипотеза
проясняла все свойства катодных лучей.
В частности, таким способом можно было
легко объяснить появление темного
пространства у катода: его величина
определялась просто средним расстоянием, которое
пролетают электроны, не сталкиваясь
с атомами газа. Это расстояние росло по
мере выкачивания газа из трубки. Но
главное значение гипотезы в другом: это
и была та руководящая идея, которая
позволила почувствовать себя устойчиво
в море фактов, накопленных к тому
времени.
Физики знали теперь, куда идти и что
искать: необходимо было выделить этот
гипотетический «атом электричества» и
определить его свойства: заряд, массу
и размеры.
На это понадобились почти 20 лет и
усилия таких больших физиков, как
Джозеф Джон Томсон A856—1940), Чарльз
Таунсенд A863—1944), Вильгельм Вин
A864—1928), Джордж Фитцжеральд
A851—1901), Эмиль Вихерт A861—1928),
Жан Перрен A870—1942), Роберт Милли-
кен. У нас нет возможности рассказать
сейчас об остроумии и тонкости опытов,
которые придумали эти и многие другие
ученые. Поэтому проследим просто, как
гипотетический «атом электричества»
обретал постепенно реальные свойства, пока
не стал, наконец, основой физики.
Прежде всего Жан Перрен в 1895 г.
окончательно доказал: заряд катодных
лучей отрицателен. В течение
последующих двух лет выяснили: их скорость
равна примерно одной десятой скорости света,
т. е. примерно в 10 000 раз больше
скорости ружейной пули и скорости теплового
движения атомов. Кроме того, эти и все
остальные их свойства не зависят от
состава газа в трубке. А это означало, что
катодные частицы — непременная
составная часть всех атомов.
И, наконец, в 1897 г. Дж. Дж. Томсону
удалось определить заряд е и массу m
отдельного «атома электричества»:
оказалось, что масса этих частиц m ^ 10 ~27 г
примерно в 2 000 раз меньше массы атома
водорода, а заряд е ~ 4 • 100CGSE, то есть
почти точно равен тому заряду иона
водорода, который найден при изучении
электролиза. Это было неожиданно. Посудите
сами: явления электролиза и
проводимости газов изучали разные науки,
которые развивались независимо друг от
друга, и в них на протяжении десятилетий
сформировались свои понятия. И вдруг
они оказались тесно связанными. «Такие
факты в истории науки, — говорил ученик
Планка и нобелевский лауреат Макс
Лауэ, — самое сильное доказательство ее
истинности». Для физиков это всегда
праздник, и мы еще не раз посетим эти
замечательные перекрестки науки.
47
История электрона — хороший способ
усвоить логику открытий нынешней
физики: исходя из наблюдений, она
выдвигает на их основе гипотезы, которые вновь
проверяет опытом, и, наконец,
завершается теорией, то есть сжатым объяснением
частных явлений на основе немногих
общих принципов. Гипотеза об электроне
возникла из наблюдений Фарадея, Плюк-
кера и Крукса. Плодотворность ее была
проверена и доказана в опытах
Дж. Дж. Томсона и других физиков.
И, наконец, Гендрик Антон Лоренц A853—
1928) настолько поверил в реальность
электрона, что создал на основе этой
гипотезы теорию, следствия из которой
вновь можно было проверить. Процесс
этот беспределен, но это — единственный
способ движения науки.
Возвратимся, однако, в 1897 год, когда
после сорокалетних усилий получила
права гражданства первая «элементарная
частица» — электрон. Это было самое
важное событие в физике со времени
открытия атома. В этот год узнали, что:
существуют частицы значительно меньше
атомов; эти частицы входят в состав всех
атомов; не только материя, но и
электричество имеет атомистическую структуру.
Все это означало, что реально существует
материальный носитель наименьшей
массы и наименьшего заряда в природе.
Как и атом, электрон признали далеко
не сразу: еще в 1902 году Оливер Лодж
писал, что «... электрон — это чисто гипо-
тический заряд, изолированный от атома»,
и даже в 1920 году великий Рентген
запрещал сотрудникам своего института
произносить это слово. Сейчас эти
сомнения трудно понять.
Физики, которые сразу поверили в
реальность электронов, тщательно
измеряли его характеристики: заряд е и
массу т. Благодаря их трудам (особенно
трудам Роберта Милликена, который с 1909
по 1940 год периодически возвращался
к этой задаче), мы сейчас знаем эти числа
с большой точностью:
m 9,1083-10-28 г,
е — 4,80274-10-i°CGSE.
А размер? Каковы размеры электрона?
Увы, нам это неизвестно до сих пор. Мы
не знаем даже, имеет ли вообще этот
вопрос четкий смысл. В самом деле,
о свойствах электрона мы узнаем, изучая
его взаимодействия с другими частицами
и полями. Но для понимания результатов
всех этих опытов нам достаточно знать
только массу и заряд электрона и
совершенно ни к чему знать его размеры. Не
исключено, что такого свойства у
электронов и вправду нет. Ведь нельзя же
указать толщину экватора, хотя длину его
измерить можно. Или, быть может,
величина электрона зависит от условий опыта?
Такую возможность тоже нельзя отрицать
заранее: ведь изменяет же комета свои
размеры, приближаясь к Солнцу, хотя
масса ее при этом остается постоянной.
Все это — не праздные вопросы, и мы
к ним еще возвратимся.
АТОМЫ, ЭЛЕКТРОНЫ, ЛУЧИ
Сейчас мы повторили тот сложный
участок пути, который прошли
исследователи в конце прошлого столетия. Это было
время, когда обилие новых явлений
заслоняло простые связи между ними. Когда
нужна была большая вера в гармонию
природы, чтобы не потеряться в хаосе
пестрых фактов и разноречивых гипотез.
И поэтому в конце прошлого века
положение в физике было не столь
благополучным, как о том говорил Уильям
Томсон, полагавший, что все основные
законы уже открыты и осталось только
уточнять известное.
Истинно великое открытие не только
отвечает на старые вопросы, но и
порождает новые. Открытие электрона вызвало
воодушевление физиков. Однако вскоре
на смену ему пришли новые заботы: как
электроны связаны в атоме? Сколько их
там? Покоятся они или движутся? Как
эти движения связаны с излучением
атомов? Форма и характер вопросов
менялись, но постепенно все они свелись к
задаче: необходимо узнать число, размеры,
расположение электронов в атоме и
влияние их на процессы излучения.
Никто при этом не задумывался, имеют
ли вообще такие вопросы смысл. Все
молчаливо представляли себе электрон
маленьким шариком диаметром 103 см,
который «как-то» закреплен внутри
атома.
Для начала хотели понять главное:
почему атом излучает спектральные линии
строго определенной длины волны и
почему этих линий так много (у атома
железа, например, только в видимой части
спектра свыше 3 000). Как всегда, если нет
±8
глубоких идей, мыслили аналогиями:
все хорошо помнили, что частота
колебаний пружины с грузиком зависит от ее
упругости, следовательно, — рассуждала
часть физиков, — и в атоме электроны
связаны «какими-то» пружинами
различной упругости. Когда мы возбуждаем
атом, электроны начинают колебаться и
при этом излучают свет с частотой
колебания пружинок. Отсюда, по мысли Локье-
ра, сразу следовало, что число
электронов в атоме равно числу линий в
спектре элемента. Кроме того, атом с подобным
устройством будет наиболее охотно
поглощать именно те лучи, которые он сам
испускает. Но ведь именно это и
обнаружили Кирхгоф и Бунзен в своем
знаменитом опыте с парами натрия!
Несмотря на эти успехи модели атома
с квазиупругим электроном, многие
понимали ее логическое или, точнее,
эстетическое несовершенство. А вскоре
обнаружили и прямые противоречия с опытом:
Дж. Дж. Томсон, изучая рассеяние
рентгеновских лучей на атомах различных
элементов, пришел к выводу, что число
электронов в атоме сравнительно
невелико и примерно равно половине атомного
веса элемента. В 1904 г. Дж. Дж Томсон
предложил свою модель атома, развив
гипотезу Уильяма Томсона (лорда
Кельвина): внутри положительного равномерно
заряженного шара диаметром 1СГ8 см
плавают отрицательные электроны, квази-
упруго с ним связанные. Число электронов
равно заряду шара, так что в целом атом
оказывается нейтральным, как это и
должно быть.
В начале нашего века почти все
физики приняли модель Томсона и лишь
немногие из них предлагали другие модели.
Но, несмотря на эти частные разногласия,
все чувствовали: в науке об атоме
наступает новая эпоха.
Реальность электрона
Доказательство реальности
электрона — настолько важное
событие, что просто необходимо
знать, как это произошло.
Уже за сто лет до этого было
известно, что газы, которые
выделяются при электролизе,
иногда заряжены, то есть
содержат ионы. Обнаружили
также, что в их присутствии
образуется облако тумана, то есть
мелкие капельки воды вокруг
этих ионов.
В 1896 г. Чарльз Таунсенд
сделал следующее:
1. Определил полный вес ?Л
и полный заряд Q одного
кубического сантиметра облака
тумана, состоящего из капелек,
образующихся на ионах.
2. Определил средний вес у*
капельки в этом облаке. Это
можно сделать, наблюдая
скорость ее падения.
3. Вычислил отсюда общее
число капелек п в 1 см3. По
предположению, каждая
капелька связана с ионом, заряд
которого равен заряду
электрона. Поэтому заряд электрона е
Q
равен просто: е — — ■
Незадолго до этого Дж. Дж.
Томсон, изучая в трубке Крук-
са поведение электронов при
одновременном действии
электрического и магнитного поля,
нашел отношение их заряда к
массе: q = —. Массу m элек-
m
трона, зная q и е, определить
уже несложно.
В дальнейшем придумали
более точные методы, но этот
первый и несовершенный
способ навсегда сохранил обаяние
непосредственности.
49
Новости отовсюду Новости отовсюду Новости отовсюду Новост
ВЗЛЕТНАЯ ПОЛОСА
ИЗ СТЕКЛОПЛАСТИКА
Журнал «Science News» A966,
№ 443) сообщает о новом
способе создания взлетной полосы
из стеклопластика.
Исходные материалы —
полиэфирную смолу и стекломате-
риал — распыляют с вертолета
прямо на голую землю. Через час
лолоса готова.
Во время одного из опытов
смесь распыляли в пустынной
местности на мягкий песок.
Распыление заняло полчаса,
затвердение массы — один час.
Покрытие не треснуло и не осело, после
того как на него садились
вертолеты весом до четырех тонн и
проходили автомашины весом до
семи тонн.
АНТИКОРРОЗИОННЫЙ
СПЛАВ
Как сообщает журнал «Japan
Chemical Quarterly» A967, № 2),
в Японии разработан новый сплав
HZ на основе свинца,
обладающий очень высокой стойкостью
против действия кислот.
Новый сплав стоек даже в
кипящей серной кислоте больших
концентраций.
Он может стать весьма
надежным конструкционным
материалом для химической
промышленности. В частности, его можно
использовать для изготовления
реакторов, трубопроводов,
электролизеров и других видов
оборудования, соприкасающегося
с серной и азотной кислотами,
растворами сульфида аммония
и другими агрессивными в
коррозионном отношении веществами.
ЖИВЫЕ АЭРОСТАТЫ!
18-го октября прошлого года
советская космическая станция
опустилась на поверхность Венеры
и передала на Землю
информацию о температуре, давлении и
составе ее атмосферы.
По-видимому, это замечательное
достижение доставило немало
огорчений писателям-фантастам: ведь
теперь уже кажется
несомненным, что на поверхности этой
планеты, в атмосфере
углекислого газа при давлении 1S
атмосфер, в вечных сумерках и при
температуре 280°С не может быть
никакой жизни...
И однако в принципе жизнь
на Венере все же может быть.
Причем гипотеза, звучащая
совершенно фантастически, исходит
на этот раз от ученых.
Дело в том, что условия,
пригодные для жизни, на Венере
имеются в верхнем облачном
слое: здесь достаточно света и
влаги, здесь не слишком высокое
давление и умеренная
температура, сюда могут заноситься
частички венерианских минералов.
Иначе говоря, здесь царят
условия, в которых в принципе могут
развиваться даже многие земные
микроорганизмы.
Однако ученые идут
значительно дальше: они
предполагают, что в облаках Венеры
могут жить и макроорганизмы,
подобные... воздушным шарам.
Дело в том, что в процессе
анаэробного фотосинтеза вода
может разлагаться на кислород и
водород; если предположить, что
живое существо имеет форму
полого шара наполненного
водородом, то такой шар мог бы
устойчиво парить на высоте,
пригодной для жизни. Минимальный
размер такого живого существа
определяется минимальной
толщиной клеточной стенки и
составляет около одной десятой
миллиметра; верхний предел не
ограничен, но наиболее вероятен
размер порядка нескольких
сантиметров.
ГЮРЗА В ИНКУБАТОРЕ
В инкубаторах можно выводить
не только цыплят, а и змей. Это
доказал опыт, проведенный в
конце прошлого года в Ташкенте,
в Институте зоологии и
паразитологии Академии наук
Узбекской ССР. В специальном
инкубаторе было получено потомство
одной из самых ядовитых змей —
гюрзы. В инкубаторе были
воспроизведены естественные
условия обитания гюрзы, днем
опилки, на которые поместили яйца,
подогревались до 29—32°С, ночью
обогрев отключали, и
температура падала до 24—26°С. Гюрза
любит влажные места, поэтому
искусственное гнездо постоянно
увлажняли кипяченой водой;
опилки дезинфицировали, чтобы
предотвратить загнивание яиц.
На 38—39-е сутки в инкубаторе
появились молодые гюрзы весом
от 4,5 до 9 граммов и длиной
около 20 сантиметров.
Получение потомства ядовитых
змей в искусственных условиях
имеет большое практическое
значение: спрос медицины и
фармакологической промышленности
на змеиный яд растет, а
количество змей уменьшается.
Об этом интересном
эксперименте сообщило Телеграфное
агентство Узбекской ССР.
^^
Новости отовсюду Новости отовсюду Новости отовсюду Новост
АЛЮМИНИЙ ИЗ КОСМОСА
Недавно в глубоководных
морских осадках был обнаружен
радиоактивный изотоп алюминия —
алюминий-26 с периодом
полураспада 7,4 млн. лет. Д-р Ф. Син-
гер пришел к выводу, что этот
изотоп был внесен в земную
атмосферу микрометеоритами,
которые, находясь в космосе,
подверглись воздействию
высокоэнергичных протонов солнечного
происхождения.
По мнению Сингера, наличие
алюминия-26 подтверждает
гипотезу о том, что зодиакальная
пыль состоит из частиц
диаметром в несколько десятков
микронов (а не менее микрона, как
предполагали ранее некоторые
исследователи). Пользуясь такой
моделью пыли, ученый подсчитал,
что на Землю выпадает ее около
1250 т в сутки. Он считает также,
«что присутствие алюминия-26
подтверждает предположение,
согласно которому значительная
часть космической пыли по
■своему составу и плотности
является «каменной».
ФОСФОРИТЫ
НА ДНЕ МОРЯ
По сообщению журнала «Science
News», недавно участники одной
океанографической экспедиции
обнаружили на дне Тасманова
моря, в 300 милях к востоку от
Брисбена (Австралия)
месторождение фосфоритов — ценного
сырья для производства
минеральных удобрений. Присутствие
фосфоритов установлено на трех
ранее не нанесенных на карту
подводных горах, плоские
вершины которых находятся примерно
на глубине 300 метров под
поверхностью моря.
В КОСМОСЕ НЕТ ОТХОДОВ!
На космическом корабле не
должно быть ни грамма
бесполезного груза — это закон
космонавтики. Но как быть с
различными отходами обитаемых
кораблей — бумагой, остатками пищи,
экскрементами?
Оказывается, их можно
использовать как топливо для
специальных ракетных двигателей,
предназначенных для выполнения
вспомогательных маневров:
перехода с орбиты на орбиту,
ориентации космического корабля и
т. д. Это топливо (получившее,
кстати, звучное название «мо-
некс») уже прошло испытания:
работающий на нем небольшой
ракетный двигатель (диаметром
примерно 10 сантиметров)
развивал тягу около шести
килограммов.
ГОРМОН ДЛЯ БОРЬБЫ
С НАСЕКОМЫМИ
В Гарвардском университете
синтезирован новый препарат для
борьбы с насекомыми. Этот
препарат — гормон, который в
естественных условиях выделяется
двумя крошечными железами,
расположенными в голове
насекомого. Этот гормон насекомому
необходим, но только в начале
развития. С наступлением
половой зрелости выделение гормона
полностью прекращается, и к
этому времени насекомое
становится чрезвычайно
чувствительным к его действию. Попадание
синтетического препарата в
организм взрослого насекомого
вызывает нарушение его нормального
развития и смерть.
НА РОДНОЙ ЗАПАХ...
Какой биологический механизм
позволяет лососям совершать в
океане тысячекилометровые
путешествия, чтобы возвратиться
для метания икры к месту своего
рождения? В поисках ответа на
этот вопрос был поставлен
эксперимент с двумя группами
лососей-самцов, выловленных в
разных реках. В носовой мешок рыб
зоологи вводили воду из разных
районов океана и снимали
электроэнцефалограмму. Когда
вводимая вода была взята поблизости
от родного нерестилища лососей,
нервная система рыб давала
выраженную реакцию, которой не
отмечалось, если вода была из
«чужой» реки. Пробы воды с
маршрута, по которому лососи
совершают свои плавания, тоже
вызывали хотя и слабые, но
отчетливые изменения
электроэнцефалограммы.
Из этих опытов можно сделать
вывод, что лососи ориентируются
в океане благодаря своему
обонянию, которое позволяет им
улавливать присутствие в воде
какого-то фактора и в
зависимости от этого следовать по
издревле проторенному пути. Какова
природа вещества, вызывающего
такие сдвиги в функциональном
состоянии нервной системы
лососей, — должны показать
дальнейшие исследования.
Рисунки
Р. МУСИХИНОЙ
51
что
мы
ЕДИМ
ПУД СОЛИ ^
Рисунки
Д. ЛИОНА
Соль везде.. В море, в хлебе, в нашем теле, на обеденном и
лабораторном столе. Соль, наконец, ищут даже в анекдоте. И потому тема соли
необъятна. А уже у Козьмы Пруткова было сказано: "Никто необъятного
обнять не может!"
Не решаясь нарушать завет Козьмы Пруткова и объять тему соли в одной
большой статье, мы печатаем серию маленьких заметок и надеемся, что
читатель извлечет из них что-то неизвестное ему раньше*
СКОЛЬКО ЛЕТ СОЛИ
Мы не знаем, когда и как соль
стала известна людям. Должно
быть, употреблению ее
человеком ровно столько лет, сколько
и самому человеку, поскольку
ни одно живое существо не
может обходиться без соли.
Археологические раскопки
свидетельствуют, что в
Прикарпатье добывали соль несколько
десятков тысячелетий назад,
на Кавказе — четыре-пять
тысяч лет назад, в Индии, в горах
Пенджаба — более трех тысяч
лет назад. Издавна был
известен и способ получения соли
из морской воды — китайцам,
грекам, римлянам.
История упоминает
открытые в третьем веке соляные
источники в Моэеле, соляные
фонтаны в Провансе. Может
быть, один из самых древних
способов добычи соли
изобретен галлами. Они сжигали
дрова и поливали горячие уголья
соленой водой из озера или
источника. Вода испарялась и
на углях белым налетом
выступала соль. Но еще до
изобретения такого способа добычи соли
люди умудрялись солить еду:
племена, жившие у соленых
озер, толкли озерные водоросли
и добавляли их в пищу.
ДРЕВНЯЯ РУССКАЯ СОЛЬ
О соляных варницах Скифии
и Сарматии писал еще Геродот.
Известна «Духовная
грамота Дмитрия Донского о добыче
соли в Галич-Мерьском в
1389 году».
Известна покупная скупого
Ивана Калиты, не пожалевшего
казны на присоединение к
Московскому княжеству города
Солигалича.
Известны уложение царя
Алексея Михайловича «О
посадских людях», разрешающее
иметь соляные варницы только
тяглым (платившим
государственную подать — тягло) людям,
указ о наказании за
разглашение о недостатке в казне соли,
о поимке таких разглашателей
и перекупщиков соли, указ
о наградах открывателям соли,
тайно провозимой с киргизских
земель, указ об открытии
с 1812 года вольной продажи
соли.
Даже одни названия
документов красноречиво говорят
о важности соляной проблемы
на Руси.
Об этом же свидетельствуют
и имена многих славных
древних русских городов: уже
упомянутый Солигалич,
Соликамск, Усолье, Сольвычегодск...
РОСКОШЬ В ДОМЕ
ПРОСТОЛЮДИНА
«Кому не известно, как
бережно обращается наш сельский
люд с солью? Как ревниво
хранится у него соль — в тряпках
и кубышках? Как скупо вы-
52
-tj-'i ' Its
*~#&7
■л У ' " yb
<?V ' -'-*.
t* f^i^i '**А: tzs.-
^r^y
<s
r-r» ^e^»^ -;*£-
7*.
^„?
'^5^
~Ъ72?ыс~
'Т7&-*С tjZ'fzS&nr^TZ^
дается хозяйкой на кухню и на
стол? Соление мяса и овощей —
роскошь в доме
простолюдина», — так писала в 1866 году
газета Поволжья «Восток», в то
время, когда в одной
Астраханской губернии было открыто
700 соляных озер и 1300
солончаков!
Крестьяне ели неочищенную
соль — лизунец,
предназначенную для скота, потому что она
стоила 2—3 копейки, а не сорок,
как пищевая.
ХЛЕБ БЕЗ СОЛИ
Ужасному наказанию
подвергали государственных
преступников по старинным законам
Голландии: им давали хлеб и
воду, но не давали соли.
Обреченные на «бессолевую диету»
умирали через несколько
месяцев в страшных мучениях, и
трупы их мгновенно начинали
разлагаться.
СКОЛЬКО
НУЖНО ЕСТЬ
СОЛИ
Сейчас, когда у каждого
человека появилась возможность
есть соли столько, сколько
хочется, оказалось, что излишек
ее вреден не меньше, чем
недостаток. С ростом количества
съедаемой человечеством соли
возросло и число больных
гипертонией, атеросклерозом,
ревматизмом, полиартритом и
другими болезнями.
Какова же нормальная
потребность в соли? Не так давно
существовали страны, где люди
ели без соли. В Африке,
например, зулусы обходились тем ее
количеством, что содержалось
в морской рыбе, в мясе
животных и в растениях.
Минимальное количество соли, которое
может потреблять человек в
сутки, 0,5 грамма в условиях
нежаркого климата. В среднем
же человек съедает ежедневно
10 граммов соли.
В странах с жарким
климатом или в горячих цехах, где
человек при потении выделяет
Это вещество шаг необходимо человеческому роду, что далее духовные
удовольствия не могут быть лучше выражены, пап еловом „соль66 — таково
пмя9 данное веем проявлениям острого ума...
Плиний
53
гораздо большое количество
соли из организма, потребность
в ней возрастает почти в два
раза. В общем 10—20 граммов
соли для взрослого человека —
нормальная доза, считают
врачи.
Но в США, например, 3Ti4
доза возросла до 24—25
граммов, и это уже не безопасно для
здоровья. Поэтому
американские врачи усиленно
рекомендуют сейчас своим
соотечественникам бессолевую диету.
ПОВАРА ЗДЕСЬ НЕ ПРИ ЧЕМ
Самый распространенный на
Земле солевой минерал — зто
галит. Он не только образует
мощные залежи, но и
присутствует чуть ли не во всех
прочих солевых минералах. Его
состав NaCl, иными словами,
это обычная поваренная
соль, которую мы привыкли
называть просто солью.
Вопреки распространенному
мнению название «поваренная
соль» обязано своим
происхождением не кулинарам, а тем,
кто соль добывал. Ведь один из
самых древних способов
добычи хлористого натрия —
выпаривание. Раствор из природных
соляных источников долгое
время «варили» на огне, и
такую соль вполне естественно
было назвать поваренной.
СОЛЬ СОЛИ РОЗНЬ
Поваренной соли на Земле
так много и встречается она
столь часто, что существует,
наверное, не один десяток
способов ее получения. Но
промышленных способов — лишь
четыре.
Несолоно есть — что с
Каменную соль добывают на
шахтах из соляных пластов
или куполов.
Озерную соль, как это
следует из названия, — из озер,
извлекая ранее отложившиеся
пласты соли.
Бассейновую соль получают
при естественном упаривании
морской воды — под
солнечными лучами.
Наконец, выварочную соль
извлекают из рассолов при
искусственном упаривании в
аппаратах с подогревом.
Все зти виды поваренной
соли, равно как и способы
добычи, известны уже давно.
Изменилась лишь техника.
Впрочем, если так рассуждать, то
можно сказать, что праща —
это та же баллистическая
ракета, только на низком уровне
техники...
ОЗЕРО СЛЕЗ
Долгие годы озеро Баскунчак
было поистине страшным
местом. Вокруг озера
располагались землянки, точнее
земляные ямы, покрытые от дождя
конусообразными камышовыми
связками. Их называли
«шишами». В этих землянках жили
рабочие.
Рабочие семьями, вместе
с детьми пилили, ломали и
раскалывали лежалую соль.
Потом «чекмарили» ее
деревянными колотушками. Работали
даже пяти-семилетние дети:
они гоняли груженых
верблюдов от места добычи соли к
берегу. И в летний зной, и в
осеннюю стужу стояли рабочие
босиком по колено, а то и по
пояс в рапе. Никакая обувь
действия соли не выдерживала.
в.иплы.п целоваться.
Ноги тем более — они были все
в язвах, шрамы от которых
оставались на всю жизнь.
Глаза от слепящей белизны соли
слезились, люди слепли.
Хотелось пить, а пресной воды не
было за много верст вокруг. Ее
привозили бочками на волах.
Промыслы на озере
Золотоцветном — так звучит в
переводе на русский калмыцкое
слово Эльтон — древнее бас-
кунчаковских. И условия
работы на них были еще более
тяжелыми.
Самое совершенное
орудие промыслов — искривленная
пешня с широким острием. На
конце ее костыль, чтобы
удобнее было налегать грудью.
Одному таким орудием соляную
глыбу не своротить, поэтому
работали артелями, человек по
пятнадцать.
Никакой казенной платы
рабочие не получали, питались
на выручку от продажи соли
возчикам. Привозная пресная
вода никуда не годилась. Почти
половину пришедших сюда
отработать по договору в самом
начале работ сваливала
болотная лихорадка.
Свирепствовали желудочные
заболевания, рапная экзема.
Медицинской помощи на
промыслах не было никакой.
Вольных работников на
Эльтоне постоянно не хватало и
пришлось «прикреплять» к
озерам крепостные деревни.
Сравнительно более легкой
была жизнь чумаков —
перевозчиков соли, но и им
приходилось несладко. На
протяжении всех 124 верст до
Камышина и 307 до Саратова они сами
гатили мосты на дорогах, сами
рыли колодцы, строили корч-
Русская пословица
S.
54
it& <^s*l С- .- - - -.£■-.: xfcx_^^—4- *~J-^j.
r>5
:-r*ir^s
r^i-4
>""
мы для сохранения съестных
припасов. Воду возили с собой
от колодца до колодца: три
пары волов везут соль, одна воду.
В 1805 году саратовские со-
леторговцы решили провести
рельсовый путь Астрахань —
Эльтон — Саратов. 36 лет
подряд рассматривались разные
проекты этой дороги, несколько
раз собирали по этому поводу
комитеты. Но дорога так и не
была построена. А в 1890 году
добыча соли переместилась на
озеро Баскунчак, и эльтонские
прииски были заброшены.
Но развитие эльтонского
промысла сильно повлияло на
рост и заселение городов
Поволжья. Из этих мест пошли
новые фамилии — типично
поволжские, происхождение
которых связано с промыслами:
Чумаковы, Шишовы, Шишвато-
вы, Корчмные, Чекмаревы.
Рабочие соляных приисков
оказались в рядах самых
активных забастовщиков начала
XX века. Об одной из таких
забастовок на соляных
мельницах Владимирской пристани,
главного складочного пункта
зльтонской соли, рассказывала
ленинская газета «Вперед»
в апреле 1905 года. Забастовка
лишила соли все Поволжье.
Прекратился лов рыбы. Уже
выловленную выбрасывали за
борт — без соли она на вторые
ITeil горнее, ешь солонее:
умрешь — сердцем здоров будешь.
Русская пословица
55
сутки начала портиться.
Рабочие грозили поджечь мельницы
и караван соляных судов.
Забастовку ликвидировали с
большим трудом.
СОЛЬ, КОТОРУЮ
ПРИХОДИТСЯ ВЗРЫВАТЬ
При добыче поваренной соли
на соляных шахтах
Советского Союза применяют, как
правило, так называемую
камерную систему разработки.
Сначала строят шахту. Для
этого соляной пласт вскрывают
на заданную глубину двумя
вертикальными стволами. Один
из них — главный. Он служит
для выдачи добытой соли на
дневную поверхность, для
спуска людей и машин в шахту
и выхода на поверхность.
Второй, вспомогательный ствол —
запасной. Он служит также для
проветривания шахты, и
поэтому его называют еще
вентиляционным стволом.
Глубина действующих в
нашей стране соляных шахт
лежит в пределах от 120 до
320 метров.
После того как закончена
проходка ствола, приступают к
сооружению так называемого
околоствольного двора — строят
под землей электростанцию,
склады, ремонтные мастерские,
медпункт и т. д. А затем
приступают уже к камерной
выемке соли. Камеры — это
огромные прямоугольные участки
шириной до тридцати метров
и высотой до сорока метров.
Длина кам ер достигает
нескольких километров — они
доходят до границы шахтного
поля. А чтобы не обрушилась
лежащая выше толща пород,
(начала попробуй, а п
ме;кду камерами оставляют
нетронутый соляной массив
необходимой ширины — в
зависимости от того, как глубоко
ведутся работы.
Отбитую взрывом соль
выдают на поверхность в
вагонетках и измельчают. Ту соль,
которая пойдет в пищу,
обеспыливают и автоматически
расфасовывают в бумажные
коробки. А соль, которая
пойдет на химические заводы,
насыпают в многослойные
бумажные мешки или просто
грузят навалом в вагоны и
отправляют потребителям.
БАСКУНЧАК И ДРУГИЕ
Озерную, или, как ее называют
еще, самосадочную, соль
добывают лишь в определенное
время года — с мая по
сентябрь. Эта соль не так плотна,
как каменная, и взрывать ее
нет необходимости. Озерную
соль добывают или
специальными соляными комбайнами
(например, на озерах
Баскунчак, Джаксы-Клыч, Большой
Калкаман), или роторными
экскаваторами (например, на
озере Баба-Ходжа).
Соляные комбайны, впервые
созданные в 1926 году
советскими инженерами,
устанавливаются на железнодорожные
платформы. В нашей стране
применяют соляные
комбайны двух видов — в зависимости
от мощности соляной залежи.
Если пласт толще 0,6 м (он
прикрыт, как правило, слоем
рапы), то применяют соляные
комбайны, работающие по
принципу землесосов. Этот
комбайн разрыхляет соляную
залежь цилиндрическим рых-
ото.ч говори, что это еол
56
лителем, оснащенным фрезами;
образующуюся солепульпу
(смесь раствора и соли)
засасывают насосами и подают на
промывку от илистых
загрязнений, а затем на
обезвоживание.
Если пласт тоньше 0,6 м, то
применяют соляные комбайны
с зубчатым барабаном. Соль,
разрыхленная этим барабаном,
подхватывается и уносится на
промывку ковшами элеваторов.
Так добывают сегодня соль
на «озерах слез»...
У ТЕПЛОГО МОРЯ
Бассейновую, или, иначе,
садочную, соль извлекают из
морской воды. На берегах
морей и морских лиманов
сооружают довольно большие (до
10 га), но неглубокие — около
полуметра — земляные
бассейны. Эти бассейны могут быть
трех видов: подготовительные,
запасные и садочные.
В мае или июне рапу из
лимана закачивают в
подготовительные бассейны, где она,
испаряясь, концентрируется.
При этом из нее выпадают
карбонаты кальция и железа, гипс,
механические примеси. Затем
рапу перекачивают в запасные
бассейны, где она хранится до
начала следующего
испарительного сезона, то есть до
очередного лета. И лишь тогда
рапа попадает наконец в
садочные бассейны. Здесь-то и
происходит садка соли, которая
продолжается до конца сезона,
обычно до сентября. Ко
времени уборки соли толщина пласта
в бассейне достигает пяти-ше-
сти сантиметров.
Пласт соли ломают (напри-
Персидская пословица
/'■
/л
а- ч. . < феи ^ - -
->, -.■<--**-^-w*- >--^?*i^ Л^/ ii; ^ 'L■• rJ£H- ^- -^ нл --*■ &-^/yCv^r c: <r, 1,/y?c,^«»
* i m&:
7 /}
lib-
1 ■!
OS
••<:.&
-„n-inf*—' n»i"*- ,■■>,?
мер, солеуборочным
комбайном) и соль укладывают в
бугры высотой метра в три. Иногда
ее сразу направляют на
промывку. Промывают соль рапой,
которая легко удаляет илистые
включения и примеси
магнезиальных солей.
КАК ВАРЯТ СОЛЬ
Пожалуй, один из самых
старых методов получения соли —
это выпарка рассолов. Тем не
менее в некоторых странах
(например, в СССР и США)
выварочную соль получают и
поныне. Основной агрегат при
этом способе — открытая
прямоугольная «сковорода»,
изготовленная из обычной
котельной стали толщиной до 8 мм.
Длина «сковороды» 15—20 м,
ширина 8—10 м, глубина около
0,5 м. Специалисты называют
эту «сковороду» чреном.
Когда рассол нагревается в
чрене до 80СС, из него
выделяются газы (например,
сероводород) и выпадает гипс. Как
только достигается
температура кипения рассола A05—108°С),
растворимый бикарбонат
кальция превращается в
нерастворимый карбонат. В это же
время продолжает выпадать в
осадок и гипс. Осадок — ч-ренный
камень — ложится на греющую
поверхность выпарных чренов
Женщина без стыда9 что пища без соли.
57
Арабская пословица
и сильно вредит производству:
снижает производительность,
повышает расход топлива,
вызывает остановки процесса.
Когда рассол становится
насыщенным, начинает
кристаллизоваться хлористый натрий.
Соли магния, которые также
концентрируются в рассоле, в
осадок не выпадают; однако
вместе с рассолом они
попадают в осевшую соль и
снижают ее качество. Правда, все
соли магния, осевшие на
поверхности кристаллов соли,
можно удалить, промывая соль
чистым насыщенным рассолом.
Осевшая на дно чрена соль
специальными гребками
подтягивается к борту, извлекается
из рассола и подается на
обезвоживание в центрифугу.
Выпаривать рассолы более
выгодно не в открытых чренах,
а в вакуум-выпарных
аппаратах. Так как температура
кипения при низком давлении
уменьшается, то тепло
греющего пара удается использовать
несколько раз. Чтобы
предотвратить образование накипи
на греющих поверхностях,
рассолы перед выпаркой можно
химически очищать от солей
кальция и магния. Многие со-
леварочные заводы оборудованы
не чренами, а вакуумными
аппаратами.
НА 1500 РУК МАСТЕР
Невозможно даже перечислить
все области, в которых находит
применение поваренная соль.
Их насчитывают примерно 1500.
Если в 1913 г. мировая
добыча соли была менее 20 млн. т, то
сегодня она равна сотне
миллионов. Из соли получают
Пресную пищу можно
а пересоленную выбраа
натрий, хлор, соду и
соляную кислоту, солью очищают
от воды скипидар и бензин,
добавляют ее в моющие
жидкости, используют в
производстве мыла, красителей, для
обогащения руд. Соль применяют
для осушения воздуха, для
борьбы с заболеваниями
древесины, в пиротехнике. Соль
используют как флюс при
плавке металлов, в качестве
смазки при производстве
проволоки, применяют ее и при
очистке поверхностных
загрязнений и для удаления пены
с расплавленного шлака.
Но по-прежнему шире всего
она используется в пищевой
промышленности: при засолке
овощей и рыбы, при хранении
молочных продуктов и мяса.
В творог, например, соль
добавляется не только для вкуса, но
и для удаления из него
сыворотки и для того, чтобы не
развивались бактерии.
Залежи соли расположены
равномерно на всех материках.
Она есть почти всюду. Сотни
лет Москва, например, питалась
чужой солью, а в 1942 году
геологи открыли залежи
«московской» соли.
Залежи соли на нашей
планете практически
неисчерпаемы. И кроме того, в воде
мирового океана растворено более
500 000 миллиардов тонн соли.
Одно Артемовско-Славянское
месторождение может
удовлетворить потребность Советского
Союза в соли на несколько
тысячелетий.
СОЛЬ ПОД ТОКОМ
Свыше 99% хлора,
вырабатываемого во всем мире, .получают
полить9
ьют.
электролизом растворов
хлористых солей, главным образом
поваренной соли. При этом
образуется не только хлор, но и
такие ценные продукты, как
едкий натр и водород, причем
в немалых количествах: на 1 т
хлора приходится 1,14 т
щелочи и до 300 м3 водорода.
Естественно, что перед
электролизом соль растворяют в
воде. Если же завод находится
вблизи соляного источника, то
рассол подают в цехи прямо по
трубам. Конечно, рассол
тщательно очищают, прежде чем
пустить в производство.
Водород выделяется сразу
в электролизере лишь в том
случае, если используют
твердый (стальной) катод: 2Н {-
+ е—^Нг. А ионы натрия
собираются возле катода и вместе
с ионами ОН образуют раствор
едкого натра. Хлор же
выделяется на аноде.
Когда при меняют жидкий
ртутный катод, то в
электролизере образуется сначала
амальгама натрия:
2NaCl 2nllg — Cl2 - 2NaHgn .
Амальгама перетекает из
электролизера в другой аппарат —
разлагатель, где она
обрабатывается водой:
2NaIIgn -, - 21J0 ► 2NaOH + Н2 +
-; 2niig.
Ртуть возвращается в
электролизер.
При этом способе из
поваренной соли сразу получают
концентрированную и чистую
щелочь, которую можно
использовать без дополнительной
обработки. Но и затраты при
ртутном способе намного
больше, а кроме того, работать со
ртутью нужно осторожно...
Арабская пословица
58
-4-
,4,
i \
*?
M££L^-'■■ yj^^ ^e "'*Р*1£^*У_}1 Jp&J*4*fi./*<K- iЪ *'*>"*> /V>v . /^ ^ <*'
*ti < *«*. ч/!Г**<
<X^^ '
л» /<ГЛ <-< ЛЧ^
^^-w*^W*.* <~**** '4*>^ <<
СОЛЬ И СОДА
В 1775 году Парижская
академия наук объявила конкурс на
лучший способ изготовления
соды. Было твердо оговорено,
что сырьем должна служить
поваренная соль — зто самое
дешевое сырье. Премию по
этому конкурсу получил
французский врач и химик Никола
Леблан. Он предложил
получать соду из сульфата натрия,
сплавляя его с известняком и
углем. А сульфат натрия
образуется при взаимодействии
поваренной соли с серной
кислотой.
Этот способ вошел в историю
техники под именем способа
Леблана. Примерно семьдесят
лет он главенствовал в
промышленности, а затем был
вытеснен более экономичным
способом Сольве. Но и в этом
способе сырье — соль. При ее
реакции с аммиаком и
углекислотой образуется бикарбонат
натрия (питьевая сода),
который при нагревании переходит
в карбонат натрия
(кальцинированную соду). Этот способ
широко применяется в наши
дни и известен под названием
аммиачного.
Побочный продукт при
аммиачном процессе — это
хлористый аммоний NH4C1. Но из
него можно регенерировать
аммиак, действуя известковым
молоком. А известковое молоко
получается при обработке
водой извести, которая образуется
из мела наряду с углекислым
газом — необходимым
компонентом исходной смеси. Таким
образом, аммиак находится все
время в круговороте и
теоретически не расходуется. А так
как запасы соли и мела (или
известняка) очень велики, то
сырьем аммиачный способ
обеспечен...
ВСЕГДА БЫ ТАКИЕ
«ПОБОЧНЫЕ»
Важнейший калиевый
минерал — сильвин КС1 —
встречается в природе обычно в сме-
Млади в меру соль, но не масло*
Немецкая пословица
59
си с поваренной солью. Эту
смесь, содержащую до 78%
хлористого натрия, называют
сильвинитом. Разумеется, для
дальнейшего использования смесь
приходится разделять. И тут на
помощь приходит то
обстоятельство, что КС] с повышением
температуры растворяется в
воде гораздо легче, а
растворимость NaCl почти не
изменяется.
Сильвинит обрабатывают
при нагреве насыщенным на
холоде раствором обеих солей.
При этом раствор насыщается
хлористым калием, а часть
хлористого натрия осаждается
и отделяется при
фильтровании. Когда раствор охлаждают,
из него кристаллизуется
хлористый калий.
Другой, более дешевый
способ разделения — флотация. Ее
проводят также в насыщенных
растворах солей. Из
флотационной машины хлористый калий
удаляется вместе с пеной, а
хлористый натрий остается
в виде шлама.
Конечно, сильвинит
разделяют главным образом для
того, чтобы получить ценное
удобрение — хлористый калий.
Но и поваренную соль,
разумеется, не выбрасывают —
такой «побочный» продукт
весьма полезен.
СОЛЬ И СПЕКТР
Кристаллы хлористого натрия
используются при изготовлении
оптических приборов, с
помощью которых исследуются
инфракрасные лучи.
Всем известно, как белый
свет, проходя через стеклянную
призму, распадается на
составляющие его части — лучи
разных длин волн. Обычные
стеклянные призмы нельзя
использовать в инфракрасной области
спектра, потому что стекло
поглощает инфрак расные лучи.
Хлористый натрий
инфракрасное излучение пропускает. Если
инфракрасный свет пропустить
сквозь призму, изготовленную
из большого кристалла соли, он
тоже разложится на отдельные
составляющие его лучи, даст
инфракрасный спектр.
ОТ СЕМИ НЕДУГ
Давно заметили, что человек,
пища которого лишена соли,
заболевает. Может быть,
поэтому ее стали применять как
лекарство от всех болезней.
Солью лечились от укусов змей
и ос, от нарывов, бородавок и
глазных болезней. Соль с
медом втирали в кожу для
уничтожения морщин. Солью
лечились даже от глистов.
Иудеи, родина которых
изобиловала солью, ввели в
обычай натирать солью кожу
новорожденных, чтобы укрепить ее.
По обычаю многих народов
соль следовало класть
новорожденным в рот. Турки
приговаривали при этом: «пусть
она поможет тебе не
предаваться земным искушениям».
В арсенале современной
медицины соляные ванны,
соленые полоскания и обтирания
применяют при частых
обмороках, приливах, головных
болях.
СТЕРИЛЬНАЯ СОЛЬ
В аптеках продают ампулы
с раствором поваренной соли —
для инъекций. Зачем же нужно
делать уколы поваренной соли,
когда человек и так ест ее
достаточно?
При некоторых тяжелых
заболеваниях (например, при
холере или неукротимой рвоте)
человек теряет слишком много
хлористого натрия. А без него
организм не может жить: ведь
именно соль поддерживает в
клетках постоянное
осмотическое давление. Стоит только
плазме крови потерять часть
соли, как давление на границе
клетки с омывающей ее
жидкостью отклоняется от нормы,
и обмен веществ в организме
нарушается. Позтому-то и
вводят в тяжелых случаях (в вену
или подкожно) 0,9%-ный раствор
поваренной соли в
дистиллированной воде. Без этого у
тяжело больного могут начаться
спазмы, судороги, а иногда
резкая потеря соли может
привести и к смерти.
Хлористый натрий входит
в состав кровезамещающих
жидкостей, которые применяют
при переливаниях вместо
крови. Такие жидкости легко
приготовить, и они могут
храниться очень долго. Их солевой
состав близок к солевому составу
крови.
А иногда соль дают пить —
не для лечения, а для
профилактики. Дело в том, что с
потом выделяется очень много
соли, и поэтому рабочим в
горячих цехах рекомендуют пить
слабый, всего лишь 0,2 % -ный
раствор поваренной соли вместо
обычной воды. Впрочем, этот
способ известен жителям
многих жарких стран: чтобы
быстрее утолить жажду, воду слегка
подсаливают.
Без хлеба несытно, а без соли несладко*
60
Русская пословица
<^Sll&kp&^
^C ^^f^i?J^&£^f^
&ггг. ^
ii^5^
■JSgggg^-ggsscsrrra
ОТ СОЛЕНОГО ДО
СЛАДКОГО — ОДИН ШАГ
Почти на всех индоевропейских
языках слово «соль» звучит
похоже. Это может означать
лишь одно — «соль» — древнее
слово.
Но вот что интересно: слово
«сладкий» — того же
происхождения, что и «соленый». Ведь
исконно русское написание не
«сладкий», а «солодкий»; теперь
общий корень бросается в
глаза. Эволюция значения была,
вероятно, такой: соленый —
вкусный — пряный — сладкий.
От соли пошли и многие
другие слова — иногда с очень
далеким значением. Среди них,
по всей вероятности, —
«солдат». Это слово восходит к
итальянскому «soldo» (монета,
деньги, жалованье). А римским
легионерам жалованье нередко
платили солью — в древности
соль и впрямь была на вес
золота. Отсюда же произошло
и английское слово «salary» —
жалованье. (Заметим кстати,
что даже в нашем веке в
некоторых африканских странах
были в ходу соляные деньги.)
Слова «сосиска» и «соус»
тоже обязаны своим
происхождением соли. Оба эти слова
образованы от латинского «sal-
sus» — соленый.
Заметки о соли подготовили
О. ВАСИЛЬЕВА, кандидат
технических наук И. ГЛАДКИЙ,
кандидат химических наук
Б. ДЖУРИНСКИЙ, А.
КРЫЛОВ.
Вез соли стол кривой. Русская пословица
01
ГЕНЫ И ГЕНИИ
Г. ГРИГОРЬЕВ
Рисунки В. СКОБЕЛЕВА
«ПРОПИСЬ ГЕНИЯ»
Можно ли путем неустанной работы над
собой стать Леонардо-да-Винчи,
Ньютоном, Бетховеном, Львом Толстым,
Эйнштейном, Марксом?
Каким требованиям, предъявляемым
к интеллекту, должны отвечать инженеры
и бухгалтеры, вагоновожатые и генералы,
редакторы научно-популярных журналов
и летчики?
Общеизвестно, что наше время
порождает особый спрос на познавательную
деятельность человека — его интеллект.
Поэтому естествен острый и все
возрастающий интерес к проблеме способностей.
Этой проблемой человечество
занимается очень давно — с позиций
медицины и психологии, философии и анатомии,
теологии и эстетики. Мы свидетели
бурного прогресса биологии, особенно ее
молекулярных аспектов, прогресса
настолько стремительного, что о нем часто говорят
как о революции в естествознании. Эта
революция дает нам право взглянуть на
проблему способностей сквозь призму
молекулярной биологии.
Все распространенные приемы
биологического исследования связаны с
выбором такого организма, с поиском такой
системы, у которой изучаемые признаки
выступают наиболее ярко, минимально
затушеваны другими проявлениями
жизнедеятельности. Человеческие способности
особенно наглядно выступают у гения,
который, по словам В. Г. Белинского,
«есть торжественнейшее
могущественнейшее проявление сознающей себя
природы».
Дают ли основание современная
молекулярная биология и генетика считать,
что в основе гения лежат биологические
особенности его организма?
Можно ли ожидать, что люди
научатся «штамповать» гениев в количестве,
потребном для цивилизации, и если да. то
как это будет происходить, какова
«пропись», как говорят химики?
Автор сразу же хочет сказать, что
согласен с теми, кто считает, что гения
создает труд, и с теми, кто утверждает,
что гений — это ответ на запросы эпохи.
Единственное, на чем автор настаивает,
так это на том, что, как говорится в быту,
«от бога», а по науке — от природы —
тоже нужно что-то. И это «что-то» нельзя
создать трудом, сформировать социальной
средой и произвести в ответ на запросы
эпохи.
Об этом «что-то» и будет речь.
У КОЛЫБЕЛИ ГЕНИЯ
Обостренный интерес к гениям наверное
возник в тот самый момент, когда на
земле появился первый гений. История не
сохранила нам его имени, может быть, это
был создатель первой ловушки для
мамонтов, а может быть, изобретатель
колеса.
Во всяком случае книга Хуана Уарте
«Исследование способностей к наукам»,
книга с таким совсем современным
названием, вышла в Испании еще в 1575 году.
В 1581 году инквизиция запретила
книгу Уарте. Талант — не результат
божественного вдохновения, утверждал Уарте,
его основы заложены в строении самого
человека. Он пытался даже описать те
анатомические особенности мозга,
которые, по его мнению, должны быть у
способных людей. Его предположения с
нашей точки зрения наивны, но на
протяжении всех последующих столетий, на
новых уровнях знаний люди искали нечто
особое в анатомии великих. Артур Шопен-
гауер, например, в трактате «О гении»
посвятил целый раздел предполагаемым
анатомическим и физиологическим
особенностям гения, в первую очередь его
мозгу. В последние годы прошлого века
анатомы непрерывно «открывали» на
черепе великих «математические шишки» и
«музыкальные выступы». Предметами этих
изысканий были черепа Баха и Гайдна,
Доницетти и Бетховена, многих
математиков и философов.
Конечно, мы и сейчас понимаем, что
анатомические особенности играют роль
в формировании талантов, особенно худо-
OS
жественных *. В программе концерта
девятилетнего Моцарта говорилось: «Будут
точнейше определены расстояния всех
тонов, которые могут быть даны отдельно
или в аккордах, на рояле или на
всевозможных инструментах, колоколах,
стаканах, часах». Только физически идеально
устроенное природой ухо способно к
такому восприятию.
В определенных пределах
анатомические особенности — плод труда, упорства,
воли, но только в определенных —
любому физическому совершенствованию есть
предел. Шопен, например, сделал себе
специальное приспособление между
пальцами, чтобы достичь нужного растяжения,
но кисть у него так и осталась
сравнительно небольшой.
Но никакие анатомические особенности
не объясняют темперамент таланта, его
волю, часто соразмерную таланту, его
одержимость. А какими анатомическими
особенностями можно объяснить природу
научного гения?
* Подробно об этом можно прочесть в
интересной книге А. Илиади «Природа
художественного таланта», Москва, 1966 г.
В сложнейшей системе, именуемой
человеком, все взаимосвязано. Если мы
хотим оценить такую всеобъемлющую
черту, как гениальность, включающую
в себя и психологию, и физиологию
личности, и многое другое, надо рассматривать
не отдельные особенности, тем более
анатомические, а человека в целом, как
связанный комплекс. С точки зрения
современной биологии, это прежде всего
комплекс .биохимический.
Этот биохимический комплекс
индивидуален и неповторим у каждого
человека. На множестве фактов современная
наука показывает, как велика
анатомическая изменчивость человека, как меняется
в его организме содержание белков и
витаминов, гормонов и низкомолекулярных
веществ. Десятки ферментов проявляют
разную активность, если они получены от
разных людей. Обмен и скорость роста,
половая функция и биотоки мозга — все
индивидуально и неповторимо, как
рисунок кожи.
Конечно, и у мозга биохимическая
индивидуальность должна проявляться по
крайней мере с той же силой, с какой она
существует во всем организме.
64
Например, такое неотъемлемое
свойство мозга, как память. В последнее
время память связывают с рибонуклеиновой
кислотой — РНК. Из одной популярной
статьи в другую кочует история о том, как
недрессированных червей кормили РНК
дрессированных и те «умнели», о том, как
воздействие на РНК меняет способность
подопытных организмов к запоминанию,
и т. д. РНК это или нет, но несомненно,
что есть у памяти какие-то материальные
носители. Тогда именно с ними должны
мы связать, например, поразительную
музыкальную память Моцарта, который
после однократного слушания записал по
памяти Miserere Аллегри — произведение
пяти- и четырехголосное с девятиголос-
ным хором в финале. Поразительной
памяти должно соответствовать и
поразительное количество РНК или
необыкновенные способности к синтезу, а может
быть, к распаду, а может быть,
необычайная структура РНК или длина
полимерной цепи? Во всяком случае
удивительной, уникальной памяти должна
соответствовать столь же уникальная система ее
материальных носителей.
Можно рассмотреть нервную систему,
и опять легко будет прийти к выводу, что
своеобразной нервной системе должно
соответствовать и своеобразие ее молеку-
лярно-химической организации.
Но, впрочем, мы уже говорили, что
нельзя расчленять гения на части.
Поэтому, возвращаясь к представлениям о
человеке, как о целостном комплексе, мы
вправе допустить, что уникальной
человеческой личности должен
соответствовать и уникальный биохимический
комплекс в целом: среди бесконечных
биохимических индивидуальностей вдруг
возникает и та комбинация, которая
может служить биологической основой
гения, пока только основой, из которой
труд и социальная среда должны, как из
глыбы мрамора, вырубить облик
будущего гения.
Пока мы очень мало знаем вообще
о человеческом организме как о
взаимосвязанной биохимической системе и не
можем еще написать «формулу гения», из
которой сразу было бы видно, чем
биохимически отличался Моцарт от Сальери.
Но одно достоверно известно: многое
в этом биохимическом комплексе, будь то
комплекс дурака или гения, определяется
генетической системой человека —
генотипом. Именно в генотипе содержится
информация об основных биохимических
реакциях, об их последовательности.
Генотип — основа индивидуальности
человека, правда, только основа: на пути от
первой клетки будущего организма —
зиготы, возникшей из слияния яйцеклетки
и сперматозоида, до взрослого организма
эту генетическую информацию будет
редактировать своим физико-химическим
карандашом среда... Но об этом потом,
а пока заглянем в колыбель гения, где
должна лежать уникальная генетическая
система.
Копилка фактов, связывающих гены
и гениев, пока невелика. Мы высыпаем из
нее только несколько примеров.
ИЗ КОПИЛКИ ФАКТОВ
Между «Идиотом» Достоевского и
«Гением» Драйзера огромная галерея героев
мировой литературы. Кто умнее или кто
глупее? Остап Бендер или Ходжа Насред-
дин, Пантагрюэль или Гулливер, Фауст
или Гамлет, Шейлок или Гобсек? На этот
вопрос ответить трудно прежде всего
потому, что мы не знаем, что такое ум.
Как отличить природный ум от
тренированной памяти, быструю
сообразительность от умения быстро извлечь
книжную мудрость, как распознать собственное,
индивидуальное под «шубой» культурных
навыков, привитых обществом? Пока
удовлетворительно сделать этого мы не
можем. Существует лишь одно довольно
скудное средство — тест, проба.
Собственно говоря, те логические задачи, которые
так часто печатают научно-популярные
журналы, уже в какой-то степени можно
считать тестами умственных способностей
человека.
Эти тесты измеряют по существу
способность испытуемого делать подходящий
выбор. Например, ребенку показывают
какой-нибудь обычный предмет и
спрашивают его название — из всех слов
ребенок должен выбрать нужное.
Распространенные тесты — лабиринты, через которые
нужно пройти с карандашом за
определенное время. И в этом случае всю
операцию можно разбить на несколько шагов,
при каждом из которых мы выбираем —
«сюда или не сюда». Совокупность самых
различных тестов образует программу
испытаний для определения умственных
способностей, и, в общем-то, вся эта про-
65
грамма оценивает наши способности к
выбору в каждой конкретной ситуации,
наше разумное поведение.
К элементарному (по сравнению с
мозгом человека) выбору способна и
электронная машина, разбивающая задачу на
этапы, в каждом из которых она выбирает
между «да — нет», и животное. И вот
здесь уже сделаны очень интересные
работы, которые показывают, что
способность к выбору, а также способность
к тому, чтобы научиться правильно
выбирать, у исследованных животных
действительно связана с генетической
системой. Довольно много таких работ
выполнено на мышах. Вот одна из них. У
мышей из 15 генетически различных линий
изучалась «исследовательская
активность», которая измерялась числом
тупиков в ходах лабиринта, куда мыши
забегали в поисках выхода, за которым их
ждал корм. Испытания повторялись
неоднократно. Мыши одних линий после
непродолжительной тренировки почти
безошибочно выбирали в каждом «хитром»
участке лабиринта путь к цели. Другие
мыши учились, совершая многочисленные
промахи. У каждой из линий были мыши
более и менее «сообразительные»—их
число распределялось, как говорят
математики, по нормальной кривой. Мыши
наиболее «способной» линии отличались
от мышей самой «тупой» линии в 23 раза.
Причем это различие сохранялось у детей,
внуков, правнуков, словом, во многих
мышиных поколениях. Позже сами
исследователи названия этих линий —
«способные» и «тупые»—заменили более
осторожными — «способные ориентироваться
в лабиринте» и «неспособные
ориентироваться в лабиринте». Мышиный «талант»
оказался специфическим: мыши,
получившие высокую оценку в лабиринте, могли
получить низкую оценку в каком-нибудь
другом месте, фигурально говоря, среди
мышей тоже обнаруживались свои
«физики» и «лирики».
Конечно, аналогия «люди и мыши»
в вопросах способностей далеко не
бесспорна, но сегодня в этих вопросах любая
новая модель кажется нам шагом вперед.
Мы вправе допустить, что в этих опытах
изучается генетическое наследование тех
элементарных актов выбора, которые
в феерическом усложнении участвуют в
решении любой задачи мозгом человека.
Наиболее оригинальные и новые
работы в области генетики поведения
принадлежат С. Бензеру, одному из виднейших
ученых в области структуры гена. Бензер
выполнил свою работу на
мухах-дрозофилах, этом классическом объекте всех
генетиков.
Вначале он попытался разделить мух
на тех, кто любит свет, и тех, которых
свет раздражает. Популяция мух
вводилась в цилиндрический сосуд, состоящий
из двух одинаковых половин,
соединенных стандартным шлифом. Половина
сосуда освещена, половина затемнена. Мухи
««
разделяются в этом сосуде по своему
отношению к свету: одни тянутся в
светлую половину, другие — в темную. Но и в
каждой из этих половин есть мухи,
случайно залетевшие, любительницы темноты,
оказавшиеся на свету, и наоборот. Поэтому
сосуд разбирают на две половины (в том
месте, где шлиф) и каждую половину
вновь объединяют со стандартной пустой
частью, так что вместо одного сосуда
становится два, и в каждом есть темная и
светлая половина. Мухи, попавшие в один
из этих сосудов после первого разделения
вместе со светлой половиной самого
первого сосуда, вновь делятся: те, кто залетел
случайно на свет, прячутся в темноту,
хотя небольшое количество таких мух все
же снова остается на свету. После
следующего разделения число «темных мух» на
светлой половине будет еще меньше и т. д.
В итоге после десяти ступеней мухи
оказываются разделенными по двадцати
сосудам, причем в одном из них —
«светлице» — наибольшее количество мух,
тянущихся к свету, а в другом —
«темнице» — собрано наибольшее число мух-
затворниц. Теперь можно было
экспериментировать с этими двумя типами мух.
Во-первых, оказалось, что любовь или
нелюбовь к свету — признак,
передающийся по наследству. Этот признак может
мутировать под действием химических
соединений — мутагенов. Бензер также
определил локализацию этого чувства на
одной из хромосом и затем попытался
проверить на любительницах света их
способности, а точнее их отношение к
обучению. Для этого Бензер в светлую
половину сосуда поместил пленку из
прозрачного пластика, на которую с помощью
проводящего лака нанес тонкую решетку
электродов и подал на них напряжение
50 вольт. Когда мухи, в наследственности
которых заложена тяга к свету, идут на
свет и попадают на решетку, они получают
электрический удар. После 10—20 минут
обучения часть мух запоминает урок на
отлично и очень четко выбирает между
«да» (идти к свету через удар током) и
«нет» (отсиживаться в темноте).
Но есть и упрямцы, которые упорно
продолжают тянуться к свету, — они-то и
соберутся в светлой части сосуда. Среди
них будут и случайно попавшие мухи,
которые, вообще-то говоря, выучили
правила «уличного движения» в сосуде, но,
как говорится, «с перепугу» залетели не
туда. Будут там и мухи, которые почти
обучились, и еще бы чуть-чуть, и они
сидели бы в темной половине. И снова шлиф
разнимается, сосуд разбирается на две
половины, и снова каждая из них соединяется
со стандартной пустой частью. Снова
подается напряжение. Теперь только
отъявленные упрямцы остаются в светлой
половине. Можно рассматривать этих мух как
дураков, совсем неспособных к обучению,
а можно как героев, готовых перенести
все, лишь бы добраться к свету — не в этом
дело. Важно, что после нескольких разде-
67
лений мух можно разделить на
«отличников» и «тупиц». Первые способны быстро
научиться тому, как осуществлять
правильный выбор, вторые — не способны.
Отобрав чистые линии таких мух, С. Бен-
зер показал, что эти свойства генетически
обусловлены. У мух-«отличников»
рождались и дети-«отличники». Можно было
скрестить папу-«отличника» с
мамой-«тупицей» и получить любые комбинации
способностей у деток. Используя методы
генетического анализа, Бензер определил
на хромосомной карте то место, где
расположен ген, ведающий способностью к
обучению. Чтобы поставить все «точки над i»,
оставалось попробовать как-то повредить
ген. Бензер сумел подобрать мутагены —
химические вещества, атакующие
хромосому, которые повреждали этот ген, и с их
помощью стал превращать «отличников»
в «тупиц», а в некоторых случаях с
помощью химического воздействия на
хромосомы можно было совершать и обратное
превращение.
Конечно, исследования на дрозофиле
имеют самое прямое отношение к общим
законам генетики вообще, и генетики
человека в частности, но однако же, когда
речь идет о таких свойствах человеческой
личности, как ум, талант, интеллект —
тут даже самый смелый исследователь не
решится проводить параллели сплошными
линиями. Только очень осторожно, чуть
заметным пунктиром! Поэтому двинемся
вверх по иерархической лестнице живого
мира, будем «искать человека».
С помощью программ, включающих
самые разнообразные тесты, ученые
подвергли исследованию близнецов. Такие
исследования — один из классических
методов генетики человека. Близнецы —
своеобразный золотой фонд генетики
человека, богатый экспериментальный
материал для сравнительных выводов. Ведь
генетический материал у них очень
близкий, особенно если близнецы
«однояйцевые» — произошли из одной и той же
оплодотворенной клетки. Близнецам
посвящают обширные монографии, за ними
«охотятся» ученые.
Немецкий ученый Готшальд в 1937
году собрал 90 пар детей-близнецов в
специальный лагерь, где наблюдал и
исследовал их. Среди этих исследований были
и многочисленные тесты умственных
способностей. Оценки по тестам у каждой
пары однояйцевых близнецов оказались
более близкими, чем у двуяйцевых.
Собственно, подобные данные получали и до
Готшальда и после — люди с близкой
наследственностью сходным образом
реагировали на тесты: проходили лабиринты
приблизительно за одно и то же время,
проявляли одинаковый подход к решению
логических задач, похожим образом
находили заданные простые геометрические
элементы в сложных фигурах. Но опыт
Готшальда интересен своим
продолжением. Прошло 13 лет, после того как ученый
собрал близнецов. Отгремели залпы второй
мировой войны, и неугомонный Готшальд
вновь собрал тех же близнецов в лагерь,
правда, на этот раз их собралось только
70 пар. И снова реакция на тесты
оказалась близка у каждого из партнеров в
близнецовой паре, причем у однояйцевых
это сходство по-прежнему было большим.
Это сходство близнецы пронесли через
13 лет, хотя каждого из них
обстоятельства ставили в самые различные условия,
и жизненный опыт одного из близнецов
часто сильно отличался от жизненного
опыта другого.
Все эти опыты — от мух до близнецов —
свидетельствуют о том, что способность
к выбору связана с генотипом (напомним
еще раз, что под этим термином в генетике
понимается сумма всех генов,
наследственная конституция организма). Если набор
таких способностей соответствует уму,
о чем говорилось выше, то это могло бы
означать, что ум тоже обусловлен
генотипом.
Могло бы... Но так ли это на самом
деле? Кроме того, можно представить, что
способность к выбору определяет ум
ученого, а как с этих позиций оценить ум
художественного гения? Способность к
выбору образа? Слова? Аккорда? Краски?
И в каком соотношении находится ум со
всем остальным в биохимической
индивидуальности организма? Словом, не нужно
гениального ума, чтобы понять: подобных
вопросов может быть задано бесконечно
много. И нужны гениальные умы, чтобы
ответить на эти вопросы. А пока сделаны
лишь первые шаги. Но об этом — в
следующем номере журнала.
68
Ум
II
тесты \
Тест — это задача,
предлагаемая человеку для решения, и
система оценок за это решение.
Встреча с тестом — не такое уж
редкое событие в нашей
жизни: это и любая народная
загадка, и экзамены в школе или
институте.
Психологические тесты на
интеллект должны проверять
мыслительные способности
человека. Но вопреки
распространенному мнению, ум
человека нельзя измерить никакой
существующей сейчас пробой,
даже если оценка ее и
называется коэффициентом
интеллектуальности. В решении
любой задачи проверяется
разумное поведение человека
применительно к условиям только
данной ситуации.
Понятно, что если каждая
задача измеряет какую-нибудь
сторону разумного поведения,
то даже тысяча задач еще не
охватит всех возможностей и
граней человеческого ума.
Однако для каждой профессии
можно выделить
десяток-другой особенностей разумного
поведения (умения решать
конкретные задачи), наиболее
важных в его профессии, и
подобрать соответствующую
программу в какой-то степени
моделирующую те требования
к интеллекту, которые
предъявляет зта профессия.
Система психологических
испытаний интеллекта в наше
время — одна из самых
серьезных и глубоко
разрабатываемых проблем психологии. В ней
можно выделить два
направления: разработка новых тестов,
решение которых моделирует
поведение человека в
определенных условиях, и
математическая обработка результатов
испытаний. Математики
подробно исследуют надежность
тестовых оценок и надежность
прогнозирования, пытаясь ответить
на вопрос — можно ли ожидать
от человека, успешно
решившего тесты, успешных действий
в близких, но реальных
ситуациях.
Теперь перейдем к вопросу,
занимающему многих.
Предположим, вы получили
программу тестов; можете ли вы сами
оценить свои способности в той
области, для которой
предназначена зта программа? Нет, не
сможете.
Вот, например, классическая
задача из серии
психологических испытаний — лабиринт.
Это задача, древняя как мир, —
уже лабиринт Миноса на Крите
был своеобразным тестом с
жестокой системой оценок: не
нашедшие выхода попадали в
лапы Минотавра. Прохождение
лабиринта на бумаге «может
служить прекрасным приемом
для экспериментирования над
людьми, особенно в детском
возрасте...», — писал академик
В. М. Бехтерев. В этом тесте
измеряется время прохождения
через лабиринт, но психолог
отмечает и общий подход
к решению, и число тупиков,
и ошибочные проходы через
«стенку», и даже почерк и т. д.
Все это не менее важно, чем
правильный ответ. Поэтому не
спешите делать выводы даже из
того факта, что вам удалось
решить все задачи — последнее
слово за психологом.
Мы предлагаем вашему
вниманию несколько тестов, либо
существующих самостоятельно,
либо заимствованных из
специальных программ,
составленных психологами в разные
годы. Еще раз хотим повторить,
что вне программы и без
помощи психолога решение их
представляет лишь чисто
спортивный интерес.
1
1916 г.
Коля левее Пети, Вася левее Коли. Кто из них
посередине?
Время на решение — 2 минуты (для детей
восьми — девяти лет).
в»
2
Скомбинируйте предлагаемые простые элементы
(несколько или все) в различные фигуры
Время на решение (нарисовать 20 узоров) —
10 минут.
л
1927 г.
Лабиринты Требью
Пройти все лабиринты за три минуты.
1
•J 1 HM—i 1
к
ча
h
i
ш
iP
Е
sj
Придумайте не менее 20 кодов для русского
алфавита, используя либо цифры, либо буквы,
либо комбинацию того и другого.
Время на решение — 5 минут.
70
5
1932 г.
Задача Бэлбрука
На нитке стеклянные бусы, черные и белые.
Нужно сделать так, чтобы по всей нитке две
черные чередовались с двумя белыми бусинками.
Разрывать нитку и снимать крайние бусинки
нельзя.
Время на решение — 1 минута.
6
1965 г.
Одним словом назовите, что символизируют эти
рисунки?
Время на решение — 1 минута.
7
1930 г.
Командир с 50 солдатами подходит к реке.
У берега лодка, в которой играют два
мальчика. Лодка может выдержать только одного
взрослого человека и никого больше.
Как были переправлены люди?
Время на решение — 1 минута.
За сколько рейсов лодки будут переправлены
все люди и мальчики вернутся на свой берег?
Время на решение — 3 минуты.
8
Добавьте к этой фигуре линии так, чтобы
получились значимые фигуры.
Время на решение A5 фигур) — 15 минут.
9
1897 г.
«Уникурсальная» головоломка Линдли
Нарисовать зту фигуру, не отрывая карандаш от
бумаги и не проходя дважды одну и ту же
линию.
10
Какая одна из пяти основных фигур спрятана
в предлагаемом образце?
Время на решение — 3 минуты.
11
Назовите пять учреждений, у которых может
быть такая эмблема.
Время на решение — 1 минута.
Ответа не дается
12
1935 г.
Найти слово, противоположное по значению, и
одновременно вычесть из цифры, стоящей рядом,
три.
Дорогой 41
Жесткий 38
Застенчивый 59
Бережливый 93
Мудрый 25
Задний 44
Шумный 62
Время на решение — 20 секунд.
13
Скомбинируйте из зтих элементов какие-нибудь
значимые изображения. (Размеры элементов
можно менять независимо друг от друга,
необязательно использовать все.)
Время на решение — 6 минут.
14
Как должен лететь самолет, чтобы написать
своими воздушными трассами буквы L, Z. (Нельзя
пролетать по одному и тому же направлению
дважды; летчик может по своему желанию не
оставлять следа на воздушных трассах.)
При решении задачи важно учесть, что самолет
не поворачивает под углом, а может лететь
только по плавной траектории.
15
Какую из приведенных фраз произносит
девушка, изображенная на этих портретах?
Я тебя люблю!
Ну, что ты еще можешь сказать?
Отстань!
Не может быть!
Ничего не выйдет!
За что?
В самом деле?
Ага, попался!
Примеры ответов на стр. 90
72
7a
КЛУБ
ЮНЫЙ
ХИМИК
Что
;>то
такое?
74
ХОТИТЕ ПОДГОТОВИТЬСЯ
К ЭКЗАМЕНАМ ПОЛУЧШЕ!
Л вы бы справились?
Химический факультет Московского
государственного университета в конце
сентября каждого года заполняют школьники.
Они приходят сюда для того, чтобы
поступить в химические кружки. К сожалению,
всех желающих принять невозможно, и
поэтому много лет назад был установлен
такой порядок: победителей городской
химической олимпиады принимают в
кружки вне конкурса, а все остальные должны
написать отборочную контрольную работу.
В этом номере вам предлагается несколько
задач из отборочной работы прошлого года.
Задачи 1 и 2 — для учащихся седьмого и
восьмого классов.
1. Сплав меди и никеля содержит х%
меди по весу. Рассчитать, на сколько
атомов никеля приходится один атом
меди.
2. Эта задача чуть сложнее. Сколько
молекул воды приходится на одну
молекулу сероводорода в х%-ной
сероводородной воде?
Задачи 3 и 4 гораздо быстрее решают
восьмиклассники и девятиклассники, чем
десятиклассники. Учтите это!
3. Составить структурную формулу и
назвать вещество, общая формула
которого СН20зСи2.
4. Условия четвертой задачи такие же,
как третьей, только брутто-формула
вещества С2Н206Са.
Чтобы решить задачи 5 и 6, достаточно
знания программы восьмого класса, но
помимо этого надо уметь логично мыслить
и иметь некоторый запас терпения.
Подобные задачи уже печатались в «Химии
и жизни».
5. На лабораторном столе находятся
четыре склянки под номерами I, II, III,
IV и штатив с чистыми пробирками.
Известно, что эти склянки наполнены
растворами Ва(ОНJ, ZnS04, Na2C03,
H2S04. Нужно определить содержимое
каждой склянки, не прибегая к
помощи никаких других реактивов.
6. Эта задача аналогична предыдущей, но
набор растворов другой: СаС12, Na2C03,
Na3P04, HCI.
Следующие две задачи доступны лишь
тем, кто освоил программу 9-го класса.
Ответьте, пожалуйста, хорошо ли
растворяются в воде
7. Сульфат бериллия.
8. Карбонат цезия.
Пользоваться справочником, конечно,
не разрешается.
И, наконец, последнюю пару задач
быстрее всего решат те, кто имеет хотя бы
небольшой навык работы в лаборатории.
9. На уроке химии десятиклассники
решили получить нитробензол. В
учебнике написано, что для этого требуется
концентрированная азотная кислота.
Однако в запасах химического
кабинета оказалась только 10%-ная азотная
кислота, с которой нитробензол, как ни
старайся, все равно не получится.
Не посоветуете ли вы, как найти
выход из положения?
10. Эта задача также имеет практическое
значение. Раствор хлористого железа
содержит примесь хлорного железа.
Как простейшим способом избавиться
от этой примеси?
Если вам удастся решить не менее семи
задач из десяти за два часа, то знайте, что
вы достойны быть членом одного из
химических кружкоз при МГУ (если, конечно,
вы примете участие в очередном
конкурсе). А таких кружков шесть: по
неорганической, органической, общей,
аналитической, физической химии и так называемый
теоретический кружок. Правда, для того
чтобы поступить в последний кружок,
нужно решить дополнительную задачу,
например такую:
11. Известно, что хлористый натрий
образует кубическую кристаллическую
решетку, в узлах которой находятся
катионы натрия и анионы хлора.
Считая для простоты, что радиус катиона
Na+ равен одному ангстрему, а аниона
С Г — двум ангстремам, вычислить
удельный вес кристаллического
хлористого натрия.
Г. В. ЛИСИЧКИН, А. И. ХАРЛАМОВ
Ответы — на стр. 79.
75
Викторина
Рисунок
С. ДОНСКОЙ
РОКОВАЯ ОПЕЧАТКА
В одном научно-фантастическом романе
рассказывается о профессоре, который
изобрел аппарат под названием
«атомный наборщик». У этого «наборщика» была
клавиатура, как у пишущей машинки. Когда
профессор нажимал клавиши, из кассы
поступал и соответствующие атомы, и они
могли соединяться между собой в
молекулы любого заданного вещества, подобно
тому как буквы соединяются в слова.
Закончив труд, профессор решил
отметить удачу и начал набирать: «С2Н5ОН...
С2Н5ОН... C2H5OH...» Чтобы не заниматься
такой однообразной работой, он включил
автоматику и улегся спать, надеясь, что к
утру наберется достаточное количество
вещества...
Но ночью случилось несчастье: клавиша
«Н» сработалась, и вместо желанного
С^НьОН «наборщик» начал выпускать «СО...
СО... СО...» Бедный профессор во сне
угорел насмерть...
А теперь —вопрос: ОЦЕНИТЕ
СКОРОСТЬ, С КОТОРОЙ АППАРАТ
«ОТСТУКИВАЛ» АТОМЫ. На первый взгляд, вопрос
вызывает недоумение — ведь данных для
расчета слишком мало!
Однако точный расчет и не требуется.
А для общей оценки данных вполне
достаточно: одни вам известны из школьного
курса химии, другие можно найти в книгах,
третьи задайте себе сами.
76
Ответы на вопросы викторины
прошлого номера
ЧТО Я ДУМАЮ О МЕДИЦИНЕ
Говоря «бром», «железо», врачи имеют
в виду не простые вещества, а соединения
этих элементов. Препараты, содержащие
бром, применяются при нарушениях
нервной деятельности. А соединения железа —
при истощении, малокровии.
«Кварц» медиков — это ртутная
газоразрядная лампа, изготовленная из
кварцевого стекла. Это стекло, в отличие от
обычного, хорошо пропускает
ультрафиолетовые лучи.
СПЛОШНОЕ НАДУВАТЕЛЬСТВО
С крепкой соляной кислотой цинк
реагирует очень энергично, с сильным
разогреванием. При этом вместе с водородом из
раствора выделяются капельки кислоты,
которые, попадая в резиновый шар,
сильно утяжеляют его.
Кислоту следует брать разбавленную,
а выделяющийся водород освобождать от
примеси соляной кислоты.
НЕ ПО ЗАКОНУ
Зеленые кристаллы — это железный
купорос, кристаллогидрат сернокислого железа.
КАК ГОРИТ СВЕЧА
1. В одной популярной книжке есть такое
объяснение: «Образующийся при
горении углекислый газ тяжелый.
Спускаясь вниз, он оттесняет кислород, и
горение прекращается». Подобное
объяснение несостоятельно. Этак, пожалуй,
не только спичка, но ни свеча, ни
костер гореть не должны.
Как же в действительности обстоит
дело?
Спичка горит по-иному, чем свеча:
у нее нет ни легкоплавкого горючего,
ни фитиля, тянущего это горючее
вверх, в зону горения. Но подобно тому,
как у свечи горит не твердый пара-
Его формула — FeS04'7H20. А так как
вес воды, вошедшей в состав кристаллов,
не был учтен, то и вывод получился
неверным.
КТО ПРАВ?
Прав все-таки друг. Дело в том, что в
воздухе 21% кислорода по объему, а не по
весу. Весовое содержание кислорода в
воздухе — 23 %. И, следовательно, кислорода
в 1 кг воздуха — 230 г, то есть больше, чем
в 250 г воды.
Рассчитать весовой процент кислорода
в воздухе можно очень просто.
Молекулярный вес кислорода равен 32, а средний
молекулярный вес газов, из которых
состоит воздух, равен 29. Значит, весовое
содержание кислорода в воздухе равно
32-0,21
—^ 10U%^23%.
фин, а продукты его газификации, так
и у спички древесина должна прежде
газифицироваться. Для этого
древесину нужно хорошенько прогреть. Однако
факел спички вытянут вверх.
Древесина под факелом не прогревается и не
газифицируется. Поэтому спичка горит
хорошо, когда пламя находится ниже
соломки и обогревает ее. При
повертывании спички головкой вверх пламя
лишается «питания» и гаснет.
2. По мере расходования кислорода при
горении снижается его концентрация
в сосуде. В результате этого
уменьшается скорость горения и понижается
температура пламени. Когда
температура станет достаточно низкой, пламя
Секреты горения
(Ответы к задачам прошлого помора)
77
Ж W
погаснет, хотя при этом значительная
часть кислорода остается
неизрасходованной.
На первый взгляд, характер
примесей к кислороду не должен иметь
значения. Но ведь понижение температуры
в зоне горения зависит не только от
концентрации кислорода. Значительная
часть тепла тратится на нагревание
всей газовой смеси. Поэтому
необходимо учитывать теплопроводность
отдельных газов (с какой скоростью они
будут отводить тепло от пламени) и их
теплоемкость (как много они смогут
отнять тепла). Теплопроводность азота
и углекислого газа при температуре
600—700е С примерно одинакова, а вот
теплоемкость углекислого газа выше,
чем у азота. Поэтому и гаснет свеча
скорее в присутствии углекислого газа.
3. Пламя спирта гаснет при несколько
меньшей концентрации кислорода, чем
пламя свечи. Поэтому, казалось бы,
разница заключается только в том, что
спирт должен гореть немного дольше
свечи, а вода в стакане — подниматься
несколько выше.
Однако попробуйте проделать опыт.
Разница окажется разительной: при на-
крывании поплавка спирт в отличие от
свечи погаснет почти сразу же, а вода
в стакане поднимется на 7г его высоты!
Дело в том, что спирт, быстро
испаряющийся со всей поверхности
комочка ваты, образует большой фронт
пламени. При этом в единицу времени
расходуется большое количество
кислорода, и газы, нагреваясь, сильно
расширяются. Прекращение притока
свежего воздуха сразу же приводит к тому,
что пламя гаснет, а горючие газы
быстро охлаждаются, засасывая в стакан
воду.
При горении свечи тоже,
разумеется, происходит аналогичное явление.
Однако очаг горения мал, и эффект,
соответственно, тоже невелик.
Чтобы избежать вмешательства в
ход опыта теплового расширения
газов, нужно поджигать горючее после
того, как поплавок будет накрыт
сосудом. Как это сделать — представляем
решить самим читателям.
КАК ГОРИТ ТОПЛИВО
4. В трубку горелки вместо свежего
воздуха будут засасываться продукты
горения лучины. Из-за недостатка
кислорода пламя сильно засветится.
5. В данном случае условия горения
схожи: оба вещества находятся в
газообразном состоянии и могут хорошо
смешиваться с воздухом; теплота не
должна расходоваться на испарение жидкого
спирта. Яркость пламени будет
зависеть от раскаленных несгоревших
частичек углерода, которые образуются
при разложении горючего. Но спирт
содержит кислород, и, следовательно,
часть углерода уже окислена. Поэтому
в пламени спирта свободных частичек
окажется меньше, и пламя его будет
менее ярким, чем пламя этана.
Продукты дальнейшего окисления спирта
(уксусный альдегид и уксусная кислота)
горят еще менее ярко.
6. Условий, при которых не будет
воспламеняться смесь окиси углерода с
воздухом, можно назвать несколько.
а) Объемное содержание окиси
углерода в смеси имеет свои пределы
горючести: от 12,5 до 75%. Если
концентрация окиси углерода окажется
вне зтих границ, смесь поджечь не
удастся, так как тот компонент,
который находится в большом избытке, в
реакцию вступить не может и лишь
поглощает теплоту.
б) Смесь газов не удастся поджечь
ни при очень низкой, ни при очень
высокой температуре. В первом случае
молекулы не придут в реакционноспо-
собное состояние, а во втором
обратимая реакция
2CO + 02^2COa+Q
78
может быть полностью смещена в
сторону исходных веществ.
в) При сильном разрежении и
сильном сжатии горение также не может
распространиться. При разрежении
уменьшается вероятность соударения
активных частиц, получивших
повышенный запас энергии, с реакционно-
способными частицами газовой смеси.
А при сжатии происходит слишком
много соударений активных частиц с
инертными молекулами, и это тоже
тормозит реакцию.
г) В смеси окиси углерода с
воздухом должны присутствовать следы
воды. Вода катализирует горение окиси
углерода. Совершенно сухая окись
углерода не горит.
7. Фтор — более сильный окислитель, чем
кислород, и когда металлы горят в нем,
развивается очень высокая
температура. Это важно для создания мощной
тяги. Но еще важнее другое
обстоятельство: фториды испаряются
значительно легче, чем окислы. В камере
сгорания температура доходит до
3000° С, при этом фторид магния
испаряется и может создать реактивную
тягу.
8. Электроды покрывают особым
составом, который, расплавляясь вместе
с проволокой, превращается в газ. Дуга
горит в газовой защите — пузыре,
который оттесняет воду от зоны сварки.
КАК ГАСЯТ ПОЖАРЫ
9. Нельзя погасить горящие металлы—■
натрий, магний и другие. Эти
металлы — очень сильные восстановители.
Они будут гореть, отнимая кислород
от углекислого газа и хлор от четырех-
хлористого углерода. С водой пожар
еще более усилится, так как начнет
гореть вытесняемый из воды водород.
10. Дело происходило в Антарктиде, во
время суровых холодов. Температура
упала ниже восьмидесяти градусов.
Авиационный бензин при этом
совершенно не испарялся, даже горящий
факел не мог его прогреть до
температуры воспламенения, когда образуется
горючая паровоздушная смесь.
11. При взрыве струя фонтана
разрывается взрывной волной на части. Нижняя
часть отбрасывается к земле,
верхняя— к зоне горения. Пространство
между ними заполняется продуктами
взрыва. Таким образом, горючее
вещество на некоторое время изолируется
от зоны горения. Здесь важно так
рассчитать силу взрыва, чтобы
отброшенная вверх часть струи за время
изоляции успела полностью сгореть.
Разбор «секретов» горения закончим
словами Менделеева: «В сказанном о
пламени виден пример той громадной
сложности какую представляют явления,
всюду нас окружающие в обыденной жизни».
Решение задам
(См. стр. 75)
\
Здесь разобраны решения нечетных задач.
К четным задачам даются лишь ответы
(если только существует однозначный и
краткий ответ).
1. Пусть кусок сплава весит 100 г. Тогда
в нем содержится х г меди и A00—х)г
никеля. В х г меди содержится ~т
грамм-атомов меди, а в A00—х) г ни-
100—х
келя —Fn— грамм-атомов никеля.
Ясно, что на TjT- грамм-атомов меди
100—\
приходится —эд— граммов-атомов
никеля. Поскольку грамм-атомы всех
элементов содержат равное число
атомов, то на один атом меди приходится
A00—х). 64
атомов никеля.
59-х
2. Ответ:
AМ —х)-34
18-х
3. Самое главное в решении этой
задачи— догадаться, что вещество,
скрывающееся за формулой СН2О5С112, —
неорганическое. Не торопитесь сразу
составлять структурную формулу. Сна-
79
чала приглядитесь внимательно к
исходной брутто-формуле. Давайте
попробуем переписать ее по-другому,
например так: С112О5Н2С. Не кажется
ли вам, что это какая-то соль меди?
Предположим, что соль угольной
кислоты. Тогда в формуле необходимо
выделить остаток СОэ: С112О2Н2СО3.
Теперь остается только выделить две
гидроксильные группы и назвать эту
соль: Си2(ОНJС03. Малахит! Его
структурная формула может быть
записана так:
О —Н
о/
V
О —Н
4. Ответ: кислый углекислый кальций,
О
О—С—О—Н
/
Са
О —С —О —Н.
\
О
5. Задачи на распознавание веществ без
помощи других реактивов лучше всего
решать с помощью таблицы. Вспомним,
что растворы пронумерованы так:
Ва(ОНJ — I, ZnS04 —II, Na2C03 — III,
H2SO4 — IV.
Посмотрим, как они будут
взаимодействовать попарно друг с другом.
Диагональ таблицы заштрихована
потому, что бессмысленно соединять
I
II
III
IV
I
(НИИ
Осадок
BaS04
Осадок
Ва0О3
Осадок
BaS04
II
Осадок
BaS04
91
Осадок
ZnC03
—
Ill
Осадок
ВаС03
Осадок
ZnC03
tlli!!1!
C02f
IV
Осадок
BaS04
—
co2f
lllllll ll
80
раствор сам с собой. В клетках
таблицы отмечаем изменение, происходящее
при взаимодействии растворов, а если
в клетке прочерк, значит, растворы не
реагируют друг с другом.
Итак, раствор I дает три осадка,
раствор II — два осадка, раствор III — два
осадка и один газ, раствор IV — один
осадок и один газ.
Таким образом, все четыре раствора
ведут себя по-разному, что и дает
возможность определить их. Заметим, что
совершенно безразлично, каким
способом мы нумеруем растворы.
7. Для решения этой задачи справочник
не нужен. Достаточно посмотреть на
периодическую систему. Бериллий —
элемент главной подгруппы второй
группы. В этой же подгруппе
находятся Mg, Ca, Sr, Ba и Ra. Как известно,
свойства элементов и их соединений в
группе меняются закономерно.
Известно, что BaS04— типичный пример
нерастворимой соли. О растворимости
SrS04 школьники ничего не знают.
Но известно, однако, что сульфат
кальция (гипс) — малорастворимое
соединение, a MgS04 растворяется в воде
хорошо. Значит, растворимость сульфатов
этих элементов увеличивается снизу
вверх, и поэтому BeS04 растворим в
воде, причем больше, чем MgS04.
8. Ответ: карбонат цезия растворим
в воде.
9. Получить концентрированную азотную
кислоту из разбавленной можно,
например, так. Нейтрализуем
разбавленную азотную кислоту раствором едкого
кали. Вьшарим воду из полученного
раствора нитрата калия. Если теперь
на твердый азотнокислый калий при
нагревании подействовать
концентрированной серной кислотой, то
выделятся пары чистой азотной кислоты,
которые достаточно охладить, чтобы
получить весьма концентрированную
азотную кислоту.
11. Удельный вес вещества — это вес
единицы его объема. Определим объем и
вес элементарной ячейки кристалла
хлористого натрия.
Ясно, что вес, приходящийся на одну
элементарную ячейку кристалла NaCl,
равен сумме весов половины катиона натрия
и половины аниона хлора, поскольку
каждый атом, находящийся в узлах
кубической решетки, принадлежит восьми смеж-
©се-
©Na,+
л
ным ячейкам, а в каждой ячейке четыре
узла заняты атомами натрия и четыре —
атомами хлора. Отсюда вес элементарного
кристаллика будет равен:
Так эта специальность значится в
официальных справочниках. А на инженерном
жаргоне она называется гораздо короче —
«переработчик пластмасс», а то и просто
«переработчик».
Лет сто назад, когда появились первые
целлулоидные воротнички и
искусственные шары для биллиарда, вряд ли нужна
была такая специальность — в те годы
химик был, что называется, и швец, и жнец.
Потом, уже в нашем веке, появилась
промышленность пластмасс, и она потребовала
специалистов. Но все пластики можно
было тогда пересчитать по пальцам, а
способов изготовления из них изделий было
и того меньше: разве что прессование,
штамповка да обработка резанием. Одним
словом, как перерабатывали металлы, так
стали перерабатывать и пластмассы.
А физико-химических процессов, которые
происходят в материале, когда он
превращается в изделие, никак не
учитывали.
Но в последние два-три десятка лет
было синтезировано множество новых
полимеров, на основе которых стали делать
пластические массы. Эти материалы
оказались настолько несхожими, что нельзя
было придумать какого-то единого способа
переработки их в изделия. Да и сами
изделия очень разные: что общего, скажем,
(-j--4.234.-f .4-35.5) =
Теперь найдем объем элементарной
ячейки:
C-Ш-8K = 2,7-10-23 смз.
Следовательно, удельный вес (а точнее
говоря — плотность) равен:
4,9-10-23
2,7.10-^ =1.8 г/си».
В действительности удельный вес
хлористого натрия немного больше: 2,165 г/см3.
Заниженный результат получился потому,
что для упрощения расчета радиусы ионов
Ыа + и С1~ были округлены в сторону
увеличения.
у гибкого полиэтиленового мешочка и
хрупкого электрического выключателя из
фенопласта? Впрочем, даже если бы и
нашелся какой-то универсальный способ,
вряд ли бы им стали пользоваться — ведь
гораздо разумнее найти для каждого
материала и каждого изделия наиболее
быстрый и выгодный процесс. А для этого
нужно изучить поведение материала во время
его переработки в изделие. Ведь может
случиться так, что при обработке материал
приобретет какие-то ценные свойства
(скажем, если изменится структура) или
наоборот— потеряет их. Поэтому нужно
заранее знать, как повлияет тот или иной
процесс переработки на свойства
пластмассового изделия.
И еще одно: очень уж широким стало
применение пластмасс. Понятно, что
корпус ракеты и корпус авторучки по одной
и той же технологии не сделать. Теперь
потребителя не удовлетворишь одними
штампованными да прессованными
изделиями. Ему, потребителю, нужны листы и
пленки, трубы и стержни, слоистые
пластики и массивные плиты. Он заказывает*
детали такой сложной формы, что
непосвященному остается только удивляться,
как такую деталь вообще можно сделать.
А ее делают.
Вот поэтому и появилась в последние
ХИМИЧЕСКИЕ \ /
ПРОФЕССИИ \^_^/
Технолог по переработке
пластических масс
81
годы самостоятельная специальность —
технология переработки пластических
масс.
Знать специалисту в этой области надо
многое. Помножьте изрядное число
выпускаемых сегодня пластических масс на
число несхожих друг с другом изделий из
них — это и будет совокупность отдельных
технологий, которыми должен владеть
инженер. Впрочем, справедливости ради
нужно отбросить невозможные или заведомо
невыгодные приемы. Но и тогда итог
останется весьма внушительным.
Конечно, от технолога по переработке
пластмасс никто не требует, чтобы он
выучил наизусть все технологические
параметры и режимы. Это невозможно pi не
нужно. Но он обязан знать, какими
свойствами обладают все промышленные
полимеры и как эти свойства меняются при
переработке и эксплуатации (значит,
нужно знать физику и химию полимеров). Он
должен легко ориентироваться во
множестве компонентов пластических масс
(а значит — знать органическую и
неорганическую химию). Любую пластмассу и
изделия из нее необходимо испытывать,
и инженер обязан знать десятки
своеобразных и порой весьма сложных способов
испытаний полимерных материалов.
«Инженерная механика полимеров» и
«сопротивление полимерных материалов» — так
все чаще называют те новые области
знания, которыми должен овладеть технолог
по переработке пластмасс. А поскольку все
пластмассовые изделия делают на маши-
Что
это
такое
(См. стр. 74)
Всего-навсего капуста — еще один пример
того, что удивительное, действительно,
находится рядом с нами
нах, большей частью — на современных
автоматах и полуавтоматах, — значит,
инженер должен разбираться в механике,
гидравлике, электротехнике, автоматике...
Ну и, разумеется, к этому надо прибавить
тонкое знание особенностей всех способов
переработки пластиков — а таких способов
не один десяток.
А теперь — о том, где готовят
специалистов по переработке пластмасс.
Во-первых, основательную подготовку по этой
дисциплине получают те, кто учится по
смежной, так сказать, исходной
специальности — «химическая технология'
пластических масс». Ведь вполне естественно, что
тот, кто синтезирует полимеры, составляет
сложные пластмассовые композиции,
должен представлять себе, как созданный им
материал будет воплощаться в готовые
изделия. А помимо этого в некоторых
вузах есть и особо выделенная
специальность— технология переработки
пластических масс. Назовем некоторые из этих
вузов: Белорусский технологический
институт им. С. М. Кирова (Минск),
Днепропетровский химико-технологический
институт им. Ф. Э. Дзержинского, Ереванский
политехнический институт им. К. Маркса,
Казахский технологический институт
(Чимкент), Киевский политехнический
институт, Львовский политехнический институт,
Московский институт тонкой химической
технологии им. М. В. Ломоносова, Рижский
политехнический институт.
О. ЛИБКИН
82
Так выглядит «фасад» вытяж- электроаппаратура вынесена из дюралевой плите электромо-
ных шкафов, установленных в шкафа. На верхнем снимке торы, внизу — коробки с
группе Н. П. Волынского. Вся справа видны укрепленные на ЛАТРами
ПОЛЕЗНЫЕ
СОВЕТЫ
ХИМИКАМ
„ДОРОГОЙ,
МНОГОУВАЖАЕМЫМ
ШКАФ!.."
Доказывать, что вытяжной шкаф — вещь химика менее вредной, предохранить его
совершенно необходимая химику, излишне, от воздействия ядовитых или обладающих
Приспособление, которое в химическом неприятным запахом газов и паров,
просторечии именуют тягой, используется И с этим стандартные вытяжные шкафы
химиками уже больше ста лет. Главное (немногим отличающиеся от тех, в кото-
назначение этой мудрой, но достаточно рых работали в конце прошлого века), в це-
громоздкой конструкции — сделать работу лом, справляются.
83
Закрывающаяся мойка с пово- воду в любое место вытяжного Мойка закрыта — полезная пло-
рачивающимся душем. Система шкафа, не пользуясь большим щадъ шкафа увеличилась
<(аппепдиксов» позволяет подать количеством резиновых трубок.
Обычная тяга — это, собственно, только
изолированное пространство, в которое
химик вносит все, что ему нужно:
аппаратуру» реактивы, мешалку с моторчиком
и ЛАТРом. В большинство тяг проведены
газ и вода, во многих шкафах есть мойки.
Но за это удобство (или, если хотите,
необходимость) химики расплачиваются: у
вытяжного шкафа, снабженного мойкой,
рабочая поверхность намного меньше, чем
у шкафа без мойки. Поэтому при сборке
аппаратов химикам (особенно тем, кто
работает в области органического синтеза —
их установки, как правило, сложнее и
больше, чем у неоргаников) часто
приходится выгадывать сантиметры, иначе
работать под тягой будет совсем неудобно.
Дополнительные сложности создают
нагромождения так называемых каучу-
ков — резиновых трубок разного диаметра;
по ним в установку и из нее идут вода,
воздух, инертные газы. Словом,
современная стандартная тяга — вещь далеко не
современная. А не современна она главным
образом потому, что не создает условий
для удобной и высокопроизводительной
работы.
Не идеальны наши тяги и с точки
зрения техники безопасности: ничто не
мешает случайно разлившейся жидкости —
даже если это очень ядовитая жидкость —
вытечь из шкафа на пол; вся
электроаппаратура монтируется под тягой, и
случайная искра может стать причиной пожара.
Но о видимых недостатках наших
стандартных тяг мы думаем и говорим крайне
редко, с ними сжились, к ним привыкли,
как привыкают к порокам и слабостям
близкого человека. Впрочем, последнее
утверждение распространяется не на всех
химиков. Недавно мне довелось побывать
в 317-й комнате главного корпуса
Института нефтехимического синтеза имени
А. В. Топчиева Академии наук СССР и
увидеть такие тяги, что при знакомстве
с ними любой химик, как бы ни была
чужда ему поза, вслух или про себя
повторит гаевское: «Дорогой, многоуважаемый
шкаф!..» А здесь их четыре, и все они
наредкость удобны и очень рационально
сконструированы. Не менее важно и другое:
в конструкции этих тяг нет дорогостоящей
автоматики, нет и дефицитных материалов.
Шкафы сделаны в основном силами
научных сотрудников Института
нефтехимического синтеза Наумом Петровичем
Волынским, Александром Борисовичем
Уриным и Нонной Ивановной Борисовой —
то есть теми, кто сегодня проводит свои
синтезы в этих шкафах. Рассмотрев как
следует тяги 317-й комнаты, убеждаешься,
что любая лаборатория в силах превратить
свое «стандартное оборудование» в
«Дорогой многоуважаемый шкаф».
Прежде всего замечаешь четыре
особенности зтих шкафов.
Они уже обычных.
У них нет задней стенки—«коробка»
прикреплена непосредственно к
кафельной стене. Стык, естественно,
загерметизирован.
Вся электроаппаратура — моторы,
ЛАТРы — смонтирована снаружи.
И последнее: крыша шкафов плоская,
нет традиционного пирамидообразного
колпака, а вместо него на крыше стоят
собранные установки и еще десятилитровая
бутыль с дистиллированной водой.
Н. П. Волынский поясняет:
— Ширина шкафа 85 сантиметров —
расстояние вытянутой руки. Если сделать
меньше, теряешь полезную площадь, а
больше — неудобно; чтобы достать,
например, колбу, стоящую у задней стенки,
84
Нижняя часть воздуховода. Че- в ходе реакции
рез припаянные медные па- В шкаф они не
трубки отводятся образующиеся
нужно лезть под тягу с головой.
А стоит ли?
Моторы и ЛАТРы мы вынесли из-под
тяги умышленно для предотвращения
пожара от случайной искры, как случилось
у нас три года назад. Тогда и возникла
идея вывезти все электрооборудование за
пределы шкафа. Так и сделали. На
«фасаде» шкафа, на самом верху, укрепили
дюралевые пластины. К ним через резиновые
прокладки (чтобы было меньше шума)
привинчены электромоторы. Вращение
передается к мешалке через гибкий трос.
Такие тросы промышленность выпускает
для спидометров автомобилей «Волга».
Трос достаточно длинен — мешалку можно
поместить в любой точке под тягой.
Для того чтобы при небольших
оборотах получить любой нужный крутящий
момент, достаточный для перемешивания
вязких жидкостей, пришлось немного
переделать и сами моторы (схему
переоборудования предложил В. С. Шифман).
Исходным «материалом» послужили стандартные
электромоторы УМТ-12. Работают они на
постоянном токе, причем якорь питается
независимо от обмоток. Переменный ток
преобразуется в постоянный
полупроводниковым выпрямителем размером в два
спичечных коробка. Выпрямитель состоит
из четырех диодов Д-215А или Д-215Б.
По обмоткам возбуждения идет ток силой
примерно 0,3 ампера и напряжением
50 вольт. Напряжение на якоре — от 0 до
50 вольт. Выпрямители, так же как и
моторы, установлены снаружи — на передней
стенке шкафа.
Чуть ниже края столешницы — еще
один «электродовесок»: коробки, в
которых спрятаны ЛАТРы. Это и есть пульт
управления всем нашим
электрохозяйством.
85
газы и летучие,
попадают
Плоская крыша дает выигрыш места,
стоящие на ней приборы — в полной
безопасности. Для улучшения тяги пришлось
кое в чем изменить и конструкцию
воздуховода. Эти изменения не очень велики,
но они видны и снаружи. Интересно,
заметите вы их или нет...
Воздуховод похож на букву Т,
перевернутую ногою вверх. Длина его
горизонтального основания — около метра, это
намного больше, чем в стандартных
шкафах. В основании есть створки, которыми
можно регулировать степень отсоса.
Вентилятор — стандартный № 4. Закрыв
створки полностью, можно превратить
столешницу шкафа в обычный лабораторный
стол. К «ноге» воздуховода припаяны
медные патрубки, на которые надевают
резиновые трубки, идущие от установки. Не
в пространство, ограниченное стенками
шкафа, а прямо в воздуховод
отправляются летучие и газообразные вещества,
образующиеся в ходе реакции (если,
конечно, они не нужны для исследования).
Таким образом, и это нехитрое
приспособление тоже работает на безопасность,
на улучшение условий труда. В
основании воздуховода можно хранить часть
реактивов. Сюда обычно помещают
небольшие склянки с наиболее пахучими
веществами.
Но, пожалуй, самая замечательная
деталь «дорогого, многоуважаемого
шкафа»— столешница с вделанной в нее
мойкой. В сущности, столешница представляет
собой корыто с невысокими, сантиметра
три, наклонными бортиками. И они, и
основание выложены кафельной плиткой.
Случайно разлитая жидкость не может
вытечь на пол — бортики мешают. А чтобы
жидкость не могла впитаться в цементные
швы между плитками и чтобы ее легче
было смыть, всю поверхность столешницы
периодически протирают раствором воска
в гептане. Большие швы (там, где в
столешницу врезан умывальник) поверх
цемента покрыты эпоксидной смолой. Из этих
швов торчат во все стороны загнутые
книзу концы медных трубок. Сами трубки
проходят под столешницей и выходят
наружу под тягой в разных местах, в
зависимости от длины трубки. Эта система
«подземных коммуникаций» позволяет
намного укоротить хвосты тянущихся по
шкафу резиновых шлангов. И значит, —
высвободить место, упростить сборку
установок.
Система трубок и «аппендиксов»
приводится в действие крайне просто.
Коротким отрезком резиновой трубки соединяют
два патрубка в мойке. Один из них идет
от водопроводного вентиля, другой — это
конец трубки, проходящей под
столешницей. Таких патрубков несколько, из них
выбирают окончание той трубки, которая
выходит под тягой ближе всего к
установке. Этот конец короткой резиновой
трубкой соединяют, например, с входным
патрубком обратного холодильника. А
выходной патрубок присоединяют к одному
из свободных «аппендиксов». Поворот
вентиля. Через холодильник и систему
невидимых трубок потекла вода. Пройдя весь
этот путь, она стекает в раковину.
Лишь один «аппендикс» не имеет
отношения ни к борту, ни к мойке. Им
заканчивается стальная трубка, спускающаяся
от бутыли с дистиллированной водой.
Сама мойка особого интереса не
представляет. Умывальник как умывальник.
Но он установлен так, что верхняя кромка
держащих раковину металлических
уголков находится точно на уровне
столешницы. Тремя металлическими панелями
можно закрыть мойку заподлицо и этим
намного увеличить рабочую поверхность
шкафа. Сверху остаются лишь три
водопроводных вентиля, по которым в
умывальник, в поворачивающийся на 120° душ
и в систему трубок подается горячая и
холодная вода. Мойка может работать и
будучи закрытой, панели не мешают
«подземной коммуникации». Когда приходит
время мыть лабораторную посуду, эти
панели (они не тяжелые), естественно,
снимаются — для этого сделан специальный
крюк, — а душ поднимается. Впрочем, он
может работать в любом — вертикальном,
наклонном и горизонтальном положении.
Несколько отличаются от обычных и
стены вытяжных шкафов, установленных
в группе Волынского. В передних
рамах обыкновенное четырехмиллиметровое
стекло, а в неподнимающихся рамах
торцевых стен стекло заменено
металлическими листами. Они не только
ограничивают пространство под тягой, но и отражают
свет двух стоваттных ламп,
прикрепленных к потолку шкафа. Стеклянная стена,
разделяющая соседние шкафы,
поднимается больше чем на метр, и тогда два шкафа
превращаются в один. На вопрос, почему
в тягах обычное стекло, а не органическое,
Волынский ответил, что это сделано ради
долговечности. Плексиглас быстро
стареет, растрескивается, мутнеет — обычному
стеклу это не свойственно. Если же есть
опасения, что под тягой может произойти
взрыв, то можно сделать опускающуюся
проволочную сетку, которая предохранит
персонал лаборатории от осколков.
В 317-й комнате такой сетки нет:
видимо, взрыва здесь не опасаются. Зато
противопожарная защита — отличная и в
высшей степени эффективная. Первая
гарантия безопасности — вынос
электроаппаратуры за пределы шкафа. Вторая —
приспособление для создания углекислотной
завесы: вдоль переднего края столешницы
проходит металлическая трубка с
отверстиями, к концу трубки присоединен угле-
кислотный огнетушитель. Система
приводится в действие одним поворотом вентиля.
Третье противопожарное приспособление
находится и в шкафах, и в самой комнате.
Между шкафами и в самих шкафах по
верху проходят несколько трубок
диаметром 1,5 сантиметра. Это водяные линии.
Они снабжены шестнадцатью
распылителями— по два в каждом шкафу и восемь
в пространстве между ними. Эта система
позволяет быстро создать в комнате
густой туман из мельчайших водяных
капель. Даже если в шкафу возникнет
пожар, он не сможет вырваться наружу.
Можно было бы рассказать еще о
нескольких очень несложных, но
остроумных приспособлениях, сделанных в этой
комнате, причем не только под тягой.
Но о них в другой раз. Этот же рассказ
хочется закончить одним утверждением
и одним предложением.
Утверждение. Если вы хотите получить
более полные сведения об этих удобных
вытяжных шкафах, если хотите сделать
подобные тяги в своих лабораториях, то
за советом и технической консультацией
обращайтесь к создателям «Дорогого,
многоуважаемого шкафа». Убежден, что они
вам помогут.
Предложение. Адресуется директору
ГИПРОНИИ товарищу Б. А. Савельеву и
главному инженеру этого института
товарищу М. А. Щусеву. Пусть сотрудники
возглавляемого вами института,
занимающиеся проектированием новых химических
лабораторий, побывают в 317-й комнате
главного корпуса Института
нефтехимического синтеза. Они почерпнут там немало
ценного. Усовершенствования, сделанные
Н. П. Волынским и его товарищами, по
86
сути очень просты, но совокупность этих
«мелочей» привела к созданию
качественно новой конструкции, рабочие
характеристики которой намного лучше, чем у
стандартных вытяжных шкафов. «Дорогой,
многоуважаемый шкаф» позволяет
значительно улучшить культуру работы в
химических лабораториях, увеличить
производительность труда, сделать работу
химиков безопаснее.
Инженер В. В. СТАНЦО
Наш комментарий
Лабораторный вытяжной шкаф,
сделанный Н. П. Волынским и его
сотрудниками, действительно
удобен. Авторы новой конструкции
предложили и испытали много
остроумных полезных
приспособлений, которые бесспорно,
облегчат тяжелый и опасный труд
химика. Но, к сожалению, и в этой
конструкции остался неустранен-
ным самый главный, на мой взгляд,
недостаток современных
вытяжных шкафов (точнее, большинства
их конструкций).
Дело в том, что химику в наши
дни приходится сталкиваться с
почти бесконечным
многообразием различных соединений.
Многие из них токсичны; свойства
новых веществ часто оказываются
отличными от того, что
ожидалось. В этих условиях уже никак
нельзя оставлять без внимания
воздуховод, идущий от шкафа
к вытяжному вентиляционному
центру здания или к вентилятору.
Изнутри этот воздуховод (обычно
достаточно большого сечения и
весьма большой протяженности)
во время работы быстро
покрывается слоем, состоящим иэ пыли
и веществ, с которыми работал
химик, — веществ, удалявшихся из
шкафа в виде паров и аэрозолей,
но сконденсировавшихся и осев/
ших на стенках воздуховода.
У осадка, образующегося в
воздуховоде, рыхлая и пористая
структура с сильно развитой
поверхностью. Он активно сорбирует
из потока воздуха все новые и
новые порции токсичных веществ,
с которыми имеет дело
работающий под тягой химик. А ведь
именно от этих веществ должен
защищать химика вытяжной шкаф.
Воздуховод, таким образом,
становится постоянным
«собирателем» токсичных веществ.
Пока работает тяга, пока
вентилятор включен, вредные
вещества, адсорбированные на стенках
загрязненного воздуховода, не
могут попасть в лабораторное
помещение. Но вытяжную систему
выключают и на ночь, и (к
сожалению, слишком часто) во время
работы, когда как будто бы и нет
необходимости пользоваться
тягой. При этом из-за перепада
температур, а еще чаще — из-эа
плохо рассчитанной или плохо
отрегулированной вентиляции
возникает интенсивный обратный поток:
наружный воздух через вытяжной
воздуховод устремляется обратно
в лабораторию, насыщаясь по пути
не только теми ядовитыми и
вредными веществами, с которыми
химик работал сегодня или вчера,
но и теми, о которых уже забыли,
но которые когда-то
накапливались в воздуховоде.
Нетрудно понять, что этот
обратный или, как его иногда
называют, «опрокинутый» воздушный
поток создает опасность
отравлений и профессиональных
заболеваний. Эта опасность тем
значительнее, что о ней, как правило,
не думают и не помнят, против
нее не предпринимают никаких
мер предосторожности. А
пренебрегать ею нельзя.
Наиболее надежным
средством защиты должна стать
тщательно продуманная и еще более
тщательно выполненная
герметизация, полностью изолирующая
рабочий объем вытяжного шкафа
от лабораторного помещения.
Возможность плотно закрыть
створки шкафа (или воздуховода,
как сделано в конструкции
сотрудников Института
нефтехимического синтеза) — это еще не
все. Необходима простая система
автоматики, которая не позволяла
бы открыть вытяжной шкаф при
выключенной вентиляции. Таким
путем можно устранить всякую
возможность постоянного,
«хронического» заражения атмосферы
лаборатории токсичными
загрязнениями.
И. В. ПЕТРЯНОВ
87
УЧИТЕСЬ
ПЕРЕВОДИТЬ
НЕМЕЩШИ —
ДЛЯ ХИМИКОВ
УКАЗАТЕЛЬНЫЕ МЕСТОИМЕНИЯ
ВМЕСТО СУЩЕСТВИТЕЛЬНЫХ
Начнем с примера (кстати, весьма характерного):
80. Eine Reihe von Stoffen zeigt das Verhalten,
das dem des Magneten analog ist.
На первый взгляд может показаться, что здесь
опечатка: не могут же стоять три артикля
подряд! Впрочем, быстро можно догадаться, что
das — союзное слово (запятая перед ним и глагол
на последнем месте явно указывают на
придаточное предложение), a des — артикль к Magneten.
Что касается dem, то оно вообще кажется
лишним, и им действительно часто пренебрегают.
Тогда делается такой перевод: «Ряд веществ
показывает поведение, которое аналогично
магниту». Этот перевод содержит элементарную
логическую ошибку: нельзя сравнивать поведение
с магнитом. Но в немецком предложении этой
логической ошибки нет; dem заменяет слово
Verhalten. Поэтому правильный перевод будет
таким: «Ряд веществ обладает свойствами магнита».
81. Verbindungen ha ben Spektren, die von donen
ihrer Elemente verschieden sind.
Неправильный перевод: «Соединения имеют
спектры, которые отличаются от их элементов».
Правильный перевод: «Спектры соединений
отличаются от спектров составляющих их
элементов».
Трудность перевода подобных предложений
в том, что в них употреблены указательные
местоимения вместо существительных.
Современному русскому языку это почти не свойственно.
Правда, некогда и по-русски писали так: «...к
точному и подробному познанию какой-нибудь вещи
должно знать части, которые оную составляют».
Это звучит старомодно и торжественно — так
писал М. В. Ломоносов в 1751 году. Местоимения
оный, сей, таковой, прежде широко
употреблявшиеся вместо существительных, устарели. А в не-
Последняя статья из серии «Немецкий — для
химиков» была опубликована в восьмом номере
журнала за 1967 г.
мецком языке указательные местоимения der
(стало быть, der не только артикль и союзное
слово) — «этот», «тот», dieser —«этот», jener—«тот»,
solcher — «такой», derselbe — «тот же самый»,
derjenige — «тот» используются не только как
определения, но и как заменители существительных.
А переводить эти заменители нужно либо
соответствующим существительным, либо словом
«последний», а иногда и личным местоимением.
82. In Festkorpern sind die Molekiile und mit
diesen der en Felder mehr oder weniger stark fi-
xiert.
Местоимение dieser обычно заменяет
существительное, стоящее в непосредственной
близости слева и переводится прилагательным
«последний» или личным местоимением. Здесь
diesen и deren заменяют Molekiile. Перевод:
«В твердых телах молекулы, а вместе с ними
и их поля более или менее прочно фиксированы».
Местоимения jener «тот» и dieser «этот» в
одном высказывании делят свои «обязанности» так:
jener заменяет ранее упомянутое понятие и
переводится как «первый»; dieser переводится как
«второй» или «последний». Например:
83. Von den chemisch einheitlichen Stof fen unter-
scbeiden sich die pliysikalischen Gemische dadurch,
dafl jene aus g-leiehartigen, diese aus versehiedenar-
tigen Molekiilen bestehen.
Jene заменяет Stoffe, a diese — Gemische.
Перевод: «От химически однородных веществ
физические смеси отличаются тем, что первые
состоят из однородных, а последние — из
разнородных молекул».
Местоимение solcher в роли заместителя
существительного легко принять за определение:
84. Der Molekillbegriff wird nicht nu* auf ein
Zusanimentreten verschiedenartiger Atome, sondern
audi auf solches gleicher Art angewondet.
Solches заменяет здесь Zusammentreten, а не
относится, как может показаться, к Art. Перевод:
«Понятие «молекула» применяется к сочетаниям
как однородных, так и разнородных атомов».
(См. также примеры 5, 6, 25 и 62).
88
ПРЕДЛОЖЕНИЯ, В КОТОРЫХ
СУЩЕСТВИТЕЛЬНОЕ ОПУЩЕНО
Языку свойственно быть экономным. И нередко,
чтобы избежать нагромождения
существительных, их просто-напросто опускают.
85. Die kleinen Кг ist alio zersetzen sich sfhnel-
ler als die groRen.
Вряд ли кто-нибудь сделает ошибку, переводя
это предложение: «Небольшие кристаллы
разлагаются быстрее, чем крупные».
А теперь попробуйте перевести такое
предложение:
86. Das Verhalten der ungesattigten Halogenide
ist mit Hilfe von Vorstellungen zu begreHen, die
den bei der Eriauterung des Begriffs Mesomerie
entwickelten wesensverwand t sind.
Перевод этого предложения дается с трудом:
«Свойства ненасыщенных галогенидов можно
понять с помощью представлений, близких по
своей сущности представлениям, развитым при
объяснении понятия мезомерии».
В этих двух примерах мы встретились с
одним и тем же грамматическим явлением —
в обеих фразах опущены существительные. А
обнаружить это можно по тому, что определения
стоят в склоняемой форме. И если даже
существительного после определения нет, мы должны
отыскать его в предшествующем тексте и
мыслить вместе с определением. В простых случаях
само существительное можно не повторять, а в
сложных — повторение его обязательно.
Особенно трудны случаи, когда
существительное опускается после распространенного
определения. Так, в примере 86 весь отрезок от den до
entwickelten — это определение к
существительному Vorstellungen.
Иногда возникает впечатление, что
существительное опускается, вовсе не будучи упомянутым.
87. Der Begriflf «Korrosion» uinfaftt die ehemische
und die elektrochemische Korrosion.
Существительное опущено после die ehemische;
очевидно, зто — Korrosion. Но зачем же одному
существительному два артикля? Для того, чтобы
разграничить самостоятельные понятия; поэтому
зто предложение имеет такой смысл: «Понятие
«коррозия» охватывает два вида коррозии:
химическую и электрохимическую». Может быть,
этот пример покажется очевидным. Тогда воз-
мем еще одно предложение.
88. Die Tabelle zeigt daft die k-Werte, die man
mit Losungen des neudargestellten und des bei
40°C vorgewarmten Salzes erhalt, praktisch zusain-
menfallen.
Если des dargestellten und des bei 40°C vorge-
warmten Salzes перевести просто как «свежеполу-
ченной и при 40°С подогретой соли», то смысл
предложения окажется неясным. Правильный
перевод, исключающий всякие недоумения:
«Таблица показывает, что константы, получаемые на
растворах свежеполученной соли с
предварительным подогревом соли при 40СС и без подогрева,
практически совпадают».
А теперь проверьте свои переводы примеров
из восьмого номера «Химии и жизни» за
прошлый год.
76. «Этот нитрид обладает поразительной,
крайне высокой устойчивостью. Он не имеет ни
малейшего химического сходства с нитридом
цинка и алюминия. Сравнения с нитридами
индия и таллия невозможны, так как эти нитриды,
будучи, по-видимому, неустойчивыми, либо вовсе
не обнаружены, либо обнаружены с
недостаточной достоверностью». В этом предложении
Nitrid заменяется пять раз: местоимением es,
указательными местоимениями dem, denen, diesel-
ben и относительным местоимением die.
77. В этом примере один раз существительное
заменено местоимением derjenige и три раза
опущено существительное. Перевод: «Пары первой
жидкости легко растворяются во второй
жидкости, в то время как пары второй жидкости с
трудом растворяются в первой (жидкости)».
78. Здесь die bei alteren, unter anderen Bedin-
gungen angestellten Versuchen gefundenen —
распространенное определение к опущенному
существительному Gesetzma^igkeiten. Перевод:
«Обнаруженные здесь закономерности аналогичны тем,
которые были найдены в результате экспериментов,
проведенных ранее в других условиях...»
79. Трудностей здесь более чем достаточно.
После gasformigen нужно мыслить Aggregatzustand;
als означает «в качестве» и вместе с das относится к
Gemeinsame («общее»); hinzustellen («представлять»,
«считать») зависит от zutreffend («правильный»), а
anzunehmen («принимать») зависит от Mangel des
Bestrebens («недостаток стремления»). Дословный
перевод: «Неправильно представлять в качестве
общего (момента) для жидкого и газообразного
агрегатного состояния в противоположность
твердому агрегатному состоянию недостаток
стремления принимать определенную форму».
Стилистически этот перевод неприемлем, поэтому
попытаемся улучшить его, скажем, следующим образом:
«Неправильно считать, что жидкому и
газообразному агрегатным состояниям в равной степени
присуще недостаточное стремление принимать
определенную форму, и на этом основании
противопоставлять их твердому агрегатному состоянию».
Старший преподаватель кафедры
иностранных языков АН СССР
Р. Г. СИНЕВ
89
Ответы к тестам, помещенным на стр. 69—72
ЛЕТ* К0Л>1
ВАС,Я
2.
A/MVXWX/^^
4.
Задача Бэлбрука
Нужно разбить лишние бусинки — запрета на это
в задаче нет.
Тяжесть
7.
Оба мальчика переплыли в лодке на
противоположный берег, где один из них остался, а другой
вернулся в лодке и вышел на берег. В лодке
переправился солдат. Лодка вернулась с другим
мальчиком, и снова два мальчика перегнали
лодку на берег, где один из них остался, а другой
вернулся, и т. д. Всего нужно 4X51 = 204 рейса.
8.
9.
«Уникурсальная» головоломка Линдли
Один из вариантов решения — указана
последовательность прохождения точек.
ia
в
12.
Дорогой 41, дешевый 38.
13.
14.
i
15.
1. В самом деле?
2. За что?
3. Я тебя люблю!
4. Не может быть!
5. Ага, попался!
6. Ну, что ты еще можешь сказать?
7. Ничего не выйдет!
8. Отстань!
00
Из писем в редакцию Из писем в редакцию Из писем в редакцию
Обычно под этой рубрикой печатаются короткие (или
сокращенные) письма читателей. Сейчас редакция вынуждена отступить от
этого правила. Почему — ясно из письма.
■ БЕЗГРАМОТНОЕ ПОСОБИЕ
Глубокоуважаемая редакция!
Посылаю вам экземпляр книги
Т. В. Клушиной «Упражнения и
задачи по химии» (Пособие для
учащихся, издательство
«Просвещение», 1966 г.)-
Мне кажется, что это
«Пособие» должно вас заинтересовать,
по крайней мере, по двум
причинам.
Во-первых, оно «предназначено
для выпускников средних школ,
собирающихся поступать в вузы,
где химия является
профилирующим предметом», а ваш журнал
постоянно уделяет внимание
подготовке учащихся к вступительным
экзаменам; в списке литературы
(«Химия и жизнь», 1967, № 5)
«Пособие» Т. В. Клушиной стоит на
первом месте среди
рекомендованных задачников.
Во-вторых, используя это
«Пособие», можно завести в журнале
новую рубрику «Исправьте
ошибку». Материалом вы будете
обеспечены на несколько лет вперед.
Например, в задаче № 17
черным по белому написано:
«Взорвали 15 мл смеси азота и
кислорода...» Заглянув в «Ответы к
задачам» можно узнать, что состав
смеси — 70% N2 и 30% 02f т. е.
довольно близок к составу
воздуха! Такая задача — настоящая
находка для писателя — фантаста.
Следующая задача — № 18:
«Смесь окиси и двуокиси
углерода весит при нормальных
условиях (!) 27,18 г. Сколько литров
каждого газа находится в смеси?»
Казалось бы, задача неразрешима,
но в «Пособии» сообщается ответ;
стало быть, автор знает способ
определения состава смесей только
по их весу (какие это открывает
возможности для аналитической
химии!).
Не приведены все
необходимые данные и во многих других
задачах: например, в № 96, 158,
163, 193, 194 не указаны удельные
веса растворов.
Особенно коварна задача
№ 40: «Колба емкостью 300 мл,
наполненная кислородом при 17°
и давлении 760 мм рт. ст., весит
112 г. Вес пустой колбы 110 г.
Определите давление газа в колбе».
Что же тут определять? Ведь в
условии сказано, что давление газа
760 мм рт. ст., а условия не
изменились. Ан нет! По ответу
давление равно 1488 мм рт. ст. или
1,96 атм.
Не о таких ли «решениях»
пишет сам автор в предисловии: «Не
редки случаи, когда не могут
объяснить, почему именно так
написали уравнение реакции или
решили задачу. А ведь именно это
ярче всего характеризует
химическую грамотность».
К сожалению, подобные
требования автор считает
обязательными только для учащихся: «Уровень
химической грамотности мы и
кладем в основу оценки ответа
абитуриента». Но, как говорится,
чтобы получить умный ответ, нужно
задавать умный вопрос...
Например, в задаче № 63
сказано: «Пользуясь таблицей
растворимости солей в воде,
назовите... малорастворимые кислоты».
А в задаче № 105 спрашивается,
сколько воды надо выпарить из
45,8%-ного раствора для
получения 10,1 %-ного!
В задаче № 138 «26,8 г
йодистого метила при нагревании с
медью дали 8,3 л газа». Поскольку
такая реакция еще неизвестна в
органической химии, трудно
догадаться, какой же это газ.
Напротив, реакция серной
кислоты с медью хорошо известна,
но она не пойдет в условиях
задачи № 167, «при растворении в
200 мл 88%-ного раствора серной
кислоты 80 г меди». Учащиеся (и
авторы задачников) должны знать,
что медь растворяется только в
концентрированной серной
кислоте (при нагревании), а в условиях
этой задачи к концу процесса
образовался бы раствор,
содержащий лишь 19,5%) серной кислоты.
Ясно, что реакция (если она и
начнется) до конца не пойдет.
Не только с медью, но и с
кислородными соединениями азота
автору все время «не везет».
Например, для получения 10 л
67%-ной азотной кислоты (задача
№ 185) «надо взять воздуха,
пропускаемого через электрическую
дугу» не 2,137 м3, а в десятки раз
больше; важнейшая особенность
этого процесса состоит в том, что
окись азота образуется с очень
низким выходом. Теоретическое
количество воздуха также
вычислено автором неверно: судя по
ответу, расчет производился по
азоту, а ведь его в воздухе
больше, чем кислорода.
В задаче № 174 спрашивается:
«Какое вещество и в каком
количестве образуется, если смешать
10 л кислорода с 25 л двуокиси
азота и смесь охладить в снегу,
смешанном с поваренной солью?»
Решительно непонятно, при чем
здесь кислород, ведь он не
реагирует с двуокисью азота! И почему
ответ дан в литрах, если N2O4 —
это жидкость, которая «в снегу,
смешанном с поваренной солью»,
скорее всего затвердеет
(температура плавления —9,3°). Наконец,
если бы даже четырехокись азота
N2O4 и была газом, его получилось
бы 12,5 л, а не 20 л, как сказано
в ответе.
Можно спорить о том, какая из
задач сборника «ярче всего
характеризует химическую грамот-
91
Из писем в редакцию Из писем в редакцию из писе'м в редакцию
ность» его автора. Кроме
рассмотренных выше, на эту роль
претендует еще и задача № 134.
В ней спрашивается, «каков объем
водорода, полученного из 1 кг
воды» четырьмя известными
способами. Необязательно писать
уравнения реакций, чтобы
догадаться, что весь водород воды
превращается в молекулярный и
что его количество
(теоретическое) не зависит от применяемого
восстановителя.
Однако, по мнению автора, из
1 кг воды одними методами
можно получить 1244 м3 водорода, а
другими — только 622 л (в
2000 раз меньше!). Кстати, оба от-
зать особо. Как ни странно то, что
автор «Пособия» допускает
грубые химические и логические
ошибки в условиях задач, еще
более удивительно, что он не умеет
решать свои собственные задачи!
Проверка «Ответов к задачам»
дала результат, которому и
поверить трудно: в 165 проверенных
нами задачах* было обнаружено
около 80 ошибочных ответов!
Что же, кроме вреда, может
дать «Пособие для учащихся», в
котором половина задач имеет
неверные ответы? Даже знающий
химию ученик, который
добросовестно готовится к поступлению в
вуз, после проработки данного
«Пособия» может прийти к
выводу, что стать химиком он
неспособен.
И опытный химик, перерешав,
например, задачи № 189—195
(десять неверных ответов подряд!),
теряет уверенность в себе и
начинает понимать старого учителя
географии из «Золотого теленка»,
который сошел с ума после
безуспешных попыток найти Берингов
пролив на новой карте
полушарий.
Вот список найденных нами
неверных ответов. Правильные
ответы даются с точностью до третьей
значащей цифры (вряд ли для ре-
вета неверны... . ^ 1у_2у
Вообще об ответах следует ска- 91 109 124 126
задачи Ответ в соорнике
17
18
19
20
21
22
27
36
40
67
70
74
78
79
91
95
98
100
105
124
134
135
138
139
141
142
144
146
70% и 30%
10,2 л СО и 4,8 л С02
26,67% 02 и 83,33% Н2
9,8 л
27,48 уг. ед.
148 уг. ед.
С2Н5ОН
9,167 л
1488 мм рт. ст. или
1,96 атм
20%
1,43 М
2,85 н
17,81%
47%
17,74 мл
31, 53%
5,13 г
а) 8,82%
б) 13,15%
61,70%
а) 2,33
б) 4,02
1,621 л
6,69-1023
а), б) — 1244 м»
в), г) — 622 л
0,6 г Н20; 1,5 л Но
74,11%
16,19 г С2Н4Вг2
69,72 мл
7,37 г
11,58 л
34,66 л
Правильный ответ
См. в тексте
См. в тексте
Данных для
решения недостаточно
19,6 л
125 уг. ед.
74 уг. ед.
с2н6о
9,40 л
См. в тексте
21,0%
1,54 М
3,08 н
37,5%
91,2%
27,8 мл
29,2%
5,43 г
а) 8,43%
б) 12,3%
76,7%
а) 4,65 н
б) 4,19 н
См. в тексте
6,02-1021
а), б), в), г) —
1,24 мэ
1,21 г Я20;1,5лН2
См. в тексте
16,8 г С2Н4Вг2
69,2 мл
7,26 г
2,23 л
34,0 л
36—43, 66—85, шения
, 131—234. большая
задачи
147
148
149
155
157
158
161
162
; 163
166
167
169
170
172
174
175
176
183
184
185
186
189
Ответ в сборнике
80,78 мл
38,98 л И2
38,98 л С12
622,06 г
71,01 л и 274,18
а) 33,3 моля
б) 43,91 моля
в) 83,26 моля
г) 46,8 моля
13,54 мл
69,28 м3
16,83 г
485,17 г
б) 24,89 л
б) 1,66 л
1,34 м3 воздуха
205,33 л S02
а) 20,59%
б) 82,35%
в) 36,67%
г) 32,56%
3,34 г NH4K03
20 л N204
33,43 мл HN03
477,88 мл
б) 37,48 л
а) 11.2 л
б) 11,76 л
в) 5,82 л
г) 3,47 л
а) 14,14 кг
б) 2,137 мз
2,01 мл
а) 8,43%
школьных задач нужна
точность).
Правильный ответ
93,6 ыл
121 л С12
121 л Н2
576 г
л 274 л и 70,9 л
а) 3,76 м3 воздуха
б) 4,72 м3 воздуха
в) 8,92 м3 воздуха
г) 5,02 м3 воздуха
1040 мл
69,0 м3
16,2 г
См. в тексте
б) 7,55 л
б) 8,31 л
135 м3 воздуха
20,5 ы3 S(J2
а) 82,4%
б) 20,6%
в) 46,7%
г) 35,0%
39,5 г XH4N03
См. в тексте
ЗОЛ мл HN03
442 мл
б) 3,75 л
а) 14,0 л
б) 13,2 л
в) 5,97 л
г) 6,90 л
а) 12,6 кг
б) 15,9 м»
20,1 мл
а) 19,8%
92
Из писем в редакцию Из писем в редакцию Из писем в редакцию
дчь
задачи
191
192
193
194
Ответ в сборни!
б) 8,49%
в) 5,86 %
30,19 кг
13,73 л H2S04
59,12 л
831,08 л
910,56 л
195
201
206
211
212
214
220
614,53 м3 водяного
газа;
1626,7 м3 воздушного
газа
536,3 кг
106 м3
22.4 л СН2 = СНС1
104,45 гСсН6
31,89 г C6H5N02
б) 587 г
СН2 = СН — СП = СН2,
486 л пара И20
Правильный ответ
б) 19,9%
в) 13,7%
302 кг
183 л Н2Ь04
29,6 л
666 л
1070 л (прп уд.
весе 0,910)
Зпб м3 водяного
газа;
809 м3 воздушного
газа
536 г
11,8 м3
99,0 г СН3СНС1а
116 г С6Н6 (при
100%-ном выходе)
24,6 г CcH5N02
б) 587 г дивинила,
391 г И20
и 243 л Н2
задачи
222
223
225
226
230
232
233
234
Ответ в сборнике
а) 486,74 мл Н2,
15,13 г C6H5ONa
б) 63,74 г C6H5ONa,
9,89 г Н20
37,54 г СНОН
64,22 г
10,45 г С2Н5ОН
в) 31,96 г
7,304 л
14,52 л
40,72 г С6Н1206
и 40,72 г CI2H22Ou
Правильный ответ
а) 1460 мл Н2,
15,2 г C6H5ONa
б) 8,71 г C6H5ONa,
1,35 г Н20
37.5 г
формальдегида СН20, или
Н2СО, или
НСНО (но не
СНОН!)
42,8 г
105 г С2Н5ОН
в) 64,2 г
72,9 л
8,06 л
52,6 г глюкозы
С6Н1206 и 52,6 г
фруктозы С6Н1206
Половину «Пособия» занимают
«Примеры решения задач».
Многие из этих примеров дают урок,
как не надо решать задачи.
В задаче 17 (стр. 21) вместо
очевидного вывода о том, что в
варианте 2 потребуется ровно
вдвое меньше кислоты, чем в
варианте 1, все расчеты
повторяются с самого начала (кстати, оба
ответа вычислены неверно).
Для решения задачи 19
(стр. 25), по мнению автора
сборника, «сначала необходимо
рассмотреть все реакции...,
определив в каждом случае изменения
степеней окисления вещества (?)».
Но проделав все это и
запутавшись с окисью азота, автор
вынужден прибегнуть к совсем не
очевидному и отнюдь не
вытекающему из написанных
уравнений утверждению, что «М ко —
— М нхо *• ^ ведь было бы
гораздо проще и логичнее прямо
из общей схемы сделать и более
общий вывод о том, что из одной
молекулы аммиака получается
одна молекула азотной кислоты.
Еще ярче видно желание
«танцевать от печки» в задаче 20
(стр. 27). Здесь опять «сначала
необходимо рассмотреть все
процессы..., определив в каждом
случае изменение степени окисляе-
мости (?) вещества». А между тем
эта задача легко (гораздо проще,
чем у автора) решается даже в
том случае, если формула
исходного вещества вообще неизвестна,
и следовательно, никаких
уравнений составить нельзя.
Автор путает понятия о том,
сколько вещества получится и
сколько должно получиться
теоретически (стр. 28); производит
вычисления с точностью до 5—
7 значащих цифр, ошибаясь уже
во второй цифре F70,15 л вместо
661,92 л на стр. 26; стоит ли
вычислять с точностью до 0,01 л,
если при этом ошибаешься на
8 л?).
«Примеры» пестрят такими
словесными шедеврами, как
«количество граммов спирта
является его процентом, вступившим в
реакцию» (стр. 12), «степень
окисляемости вещества» (стр. 27),
«коэффициент перед средой
ставим исходя из необходимости
иметь 6 ионов» (стр. 32) и т. п.
Этот список химических,
методических, арифметических,
стилистических и прочих ошибок
далеко не полон.
Как же случилось, что
составление «Пособия для учащихся»
было доверено автору, который
не умеет решать составленные им
самим задачи?
Как могло издательство
«Просвещение» выпустить столь
безграмотное учебное пособие, да
еще таким громадным тиражом
C25 тысяч экземпляров)? Как
случилось, что ни рецензент,
кандидат педагогических наук доцент
А. А. Грабецкий, ни редактор
Г. Л, Гемборек не заметили
многочисленных вопиющих ошибок?
И, наконец, как измерить тот
вред, который принесло это
издание делу подготовки учащихся?
В заключение выражаю
надежду, что ваш журнал поможет
химической общественности узнать
об истинных качествах этой книги
и предостережет учащихся от
пользования этим «Пособием для
учащихся».
Читатель К., Москва
От редакции. Что думает
об этом издательство
«Просвещение»!
03
Такие легкие прослушать
недолго...
Обычное лечебное учреждение.
Проходят люди в белых
халатах. Перед кабинетом
терпеливо ждут своей очереди
пациенты. Но только называется
учреждение не поликлиникой и
не больницей, а ветеринарной
лечебницей.
В регистрационной книге
запись: «Михайлова А. Н.,
собака, болонка, два года, Альма,
жалобы на отсутствие
аппетита, рвота». Жалобы, конечно,
излагает хозяйка, а собака си-
ЛЮДИ
и
ЗВЕРИ
дит рядом и только печально
закрывает глаза. Звери не
привыкли скрывать свои чувства —
болезнь написана у них на
морде.
Начинается подробное
обследование. Сначала мерят
температуру. На градуснике —
сорок один, а нормальная
собачья температура — тридцать
девять. Прослушивают легкие
обычным «человеческим»
фонендоскопом — в легких хрипов
нет. При пальпации врач
замечает, что печень сильно
увеличена. И анализ крови
подтверждает предположение
врача: у собаки Альмы
инфекционный гепатит (болезнь,
которую все, кроме медиков,
называют желтухой).
Теперь можно назначать
лечение — строгая диета, сульфо-
димезин, чтобы сбить
температуру, и внутривенные нливания.
И собаке ныписывают рецепт,
такой же, как и обычно, только
после «Ф. И. О.» стоит еще
94
Санитарный транспорт
слово «владельца». Пропись
рецепта совсем человеческая:
глюкоза 40%-ная, витамин В,
5%-ный, аскорбиноная кислота.
И 10%-ный раствор хлористого
кальция, который поможет
собаке бороться с
интоксикацией — отравлением крови.
Так лечат инфекционный
гепатит у животных — совсем
как у людей. Если
ветеринарный врач забыл, как
выписывается какое-то лекарство, к его
услугам на столе лежат три
рецептурных справочника. И
зто отнюдь не справочники
для четвероногих, ползучих и
пернатых, а три издания
справочника «человеческих»
рецептов: старое, дополненное и с
последними
фармакологическими новинками. Стали
людям вводить витамин Bi2, и вот
уже на рецепте со штампом
«ветеринарная лечебница»
появляется пропись —
витамин В,2 для внутримышечных
инъекций.
Тяжело больных
пропускают вне очереди. Это закон
всех медицинских учреждений.
Собаку, попавшую под машину,
прямо с улицы вносят в
кабинет. Собака тяжело дышит,
глаза у нее мутные, на лбу
запеклась кровь. Была сильная
рвота и, наверное, очень болит
голова. Врач уверен, что у
собаки — сотрясение мозга, и
сразу же направляет ее на
рентген, чтобы проверить, цела ли
лобная кость. А из
рентгеновского кабинета выносят
пациента с предполагаемым
переломом позвоночника. Этот
пациент — уж, которого
приняли за гадюку. Но перелома нет,
у ужа сильный ушиб спины.
И лечение простое — свинцовая
примочка на спину. У собаки
с сотрясением мозга лечение,
конечно, гораздо сложнее:
бромистые препараты, хлористый
кальций и витамины С и В\.
И теперь собаку начнут
каждый день носить в лечебницу»
где она стойко будет переносить
уколы (в этом отношении с
собаками легче, чем с людьми).
А птицам уколы делать
нельзя — для них велики
самые маленькие иглы.
Приходится растворять таблетки в
воде и давать лекарства из
пипетки.
Трудно делать внутривенные
вливания кошкам — слишком
тонкие у них вены. Им дают
пить раствор глюкозы, только
не двадцать граммов, как
собакам, а всего три. А витамины
вводят внутримышечно. При
тяжелых отравлениях нужно
еще поддерживать кошачью
сердечную деятельность. И
получают они свою порцию
кофеина или кордиамина, чтобы
сердце работало без перебоев.
Как пишут в популярных
медицинских книжках, роды —
не заболевание, а естественный
процесс. Но и тут может
потребоваться врачебная помощь.
Чтобы щенки родились
живыми, чтобы ни один не
задохнулся во время родов от
недостатка кислорода, иногда нужно
ускорить роды, делать
стимуляцию матки. И
акушер-ветеринар проводит стимуляцию по
методу Хмелевского, как
написано в учебнике акушерства
для медицинских вузов. Он
вводит дробными дозами мам-
мофизин с аскорбиновой
кислотой, вливает в вену глюкозу
с витаминами. А если роды
очень тяжелые, то собаку
направляют в стационар (в этом
!>5
Скажите «а-а-а»!
стационаре не кронати, а
клетки), и опытные хирурги делают
ей кесарево сечение. Так
благополучно появляются на свет
будущие четвероногие
чемпионы.
Много среди пациентов
лечебницы и кроликов. Приносят
ушастого страдальца на прием
и выписывают ему лекарства,
которые продаются во всех
аптеках. А возможно, какое-то из
этих лекарств проверяли
впервые на предке этого самого
кролика. Долгий путь проверки
на животных проходит каждый
лекарственный препарат,
прежде чем врачи убедятся, что им
можно лечить людей. А
ветеринары ищут в специальных
журналах новинки
человеческой медицины и смело
применяют их в своей практике.
То, что проверено на животных,
помогает человеку. То, что
помогает человеку, вылечит и
больного зверя.
Но, хотя, возможно, у вас
с вашей собакой и есть общий
отдаленный предок, эволюция
человека и собаки шла,
разумеется, разными путями.
Организм современной собаки
похож на человеческий, но есть
в нем свои, чисто собачьи
особенности. Поэтому
существуют, конечно, и специальные
«звериные» лекарства (их-то и
продают в ветеринарных
аптеках) и специфические
операции.
Нельзя оставаться доберман-
пинчеру или боксеру с
длинным хвостом — не позволяет
собачий стандарт. Хвосты
полагается отрезать, или, как
говорят специалисты, купировать.
А боксерам еще купируют и
уши, придавая им строго
предписанную правилами форму.
Чтобы собаке не было больно,
ей делают наркоз:
успокаивающее — аминазин, местное
обезболивающее — новокаин и
адреналин, чтобы избежать
сильного кровотечения. Поскольку
такие операции, по мнению
владельцев, украшают их
собак, называются они
косметическими.
Считается, что у зверей
существует своя «народная»
медицина. Пожевала кошка или
собака нужную, одной ей
известную травку — и выздоровела.
Или не выздоровела.
Когда у вас болят зубы, вы,
возможно, полощете рот
шалфеем. Иногда это приносит
облегчение. Или не приносит.
Куда надежнее пойти к
стоматологу.
Когда заболевает ваш
любимый зверь, можно выпустить
его на газон под окном. Иногда
зто помогает. Но лучше
отнесите его в ветеринарную
лечебницу]
М. ФИЛИМОНОВА
Фото И БЕКА и Л. ФОМИЧЕВА
Рисунки Б. АКУЛИНИЧЕВА
Подрастешь — тогда и дерись
с кошками
... Только вместо кроватей там
клетки
Издательство
«Наука»
Цена 30 коп.
Индекс 71050
Современные прически не
похожи на старинные. Если в давние
времена размер и форма
прически или парика
свидетельствовали об общественном
положении человека, то теперь
прическа стала «демократической»:
ее цель — сохранить, по
возможности, естественный вид волос,
придать им эластичность и
блеск. Вот уже двадцать лет
химики разных стран
разрабатывают наиболее совершенные
лаки для волос. Их основа —
пленкообразующие смолы
натурального и синтетического
происхождения, к которым
добавляют различные вещества,
придающие лакам блеск,
повышающие их влагоустойчивостъ. В
состав лаков входят также краски
и витамины. В Советском
Союзе разработаны новые лаки —
«Глория» и «Вивита». Скоро они
поступят в продажу. Читайте
о лаках для волос в мартовском
номере нашего журнала. В том
же номере вы сможете прочесть
о том, как с помощью
спектрографии раскрываются тайны
древних цивилизаций.
Например, обнаружение цинка в
слитках-браслетах из
Закарпатья, изображенных на снимке
(внизу справа), заставляет
ученых пересмотреть современные
взгляды на историю
использования этого металла