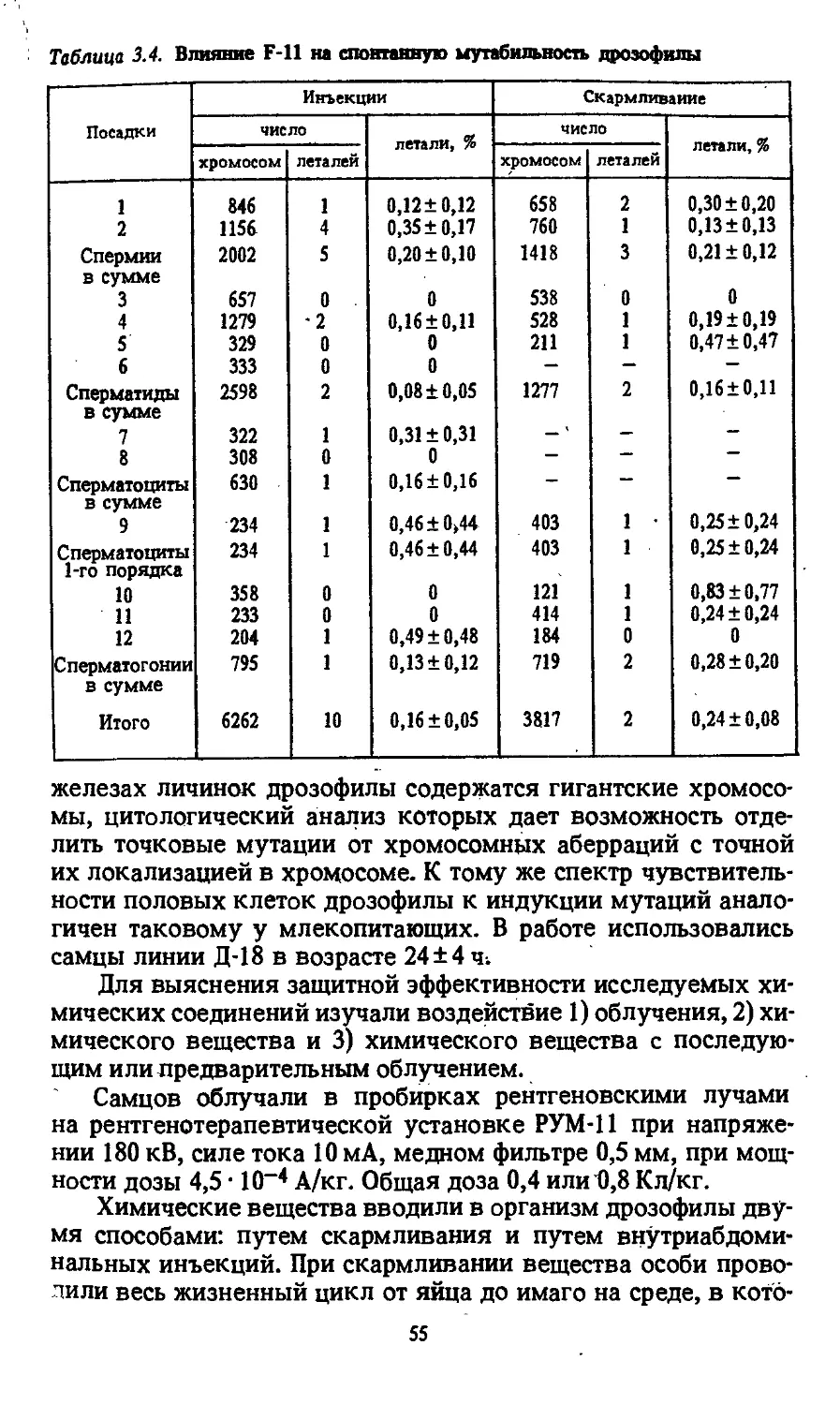
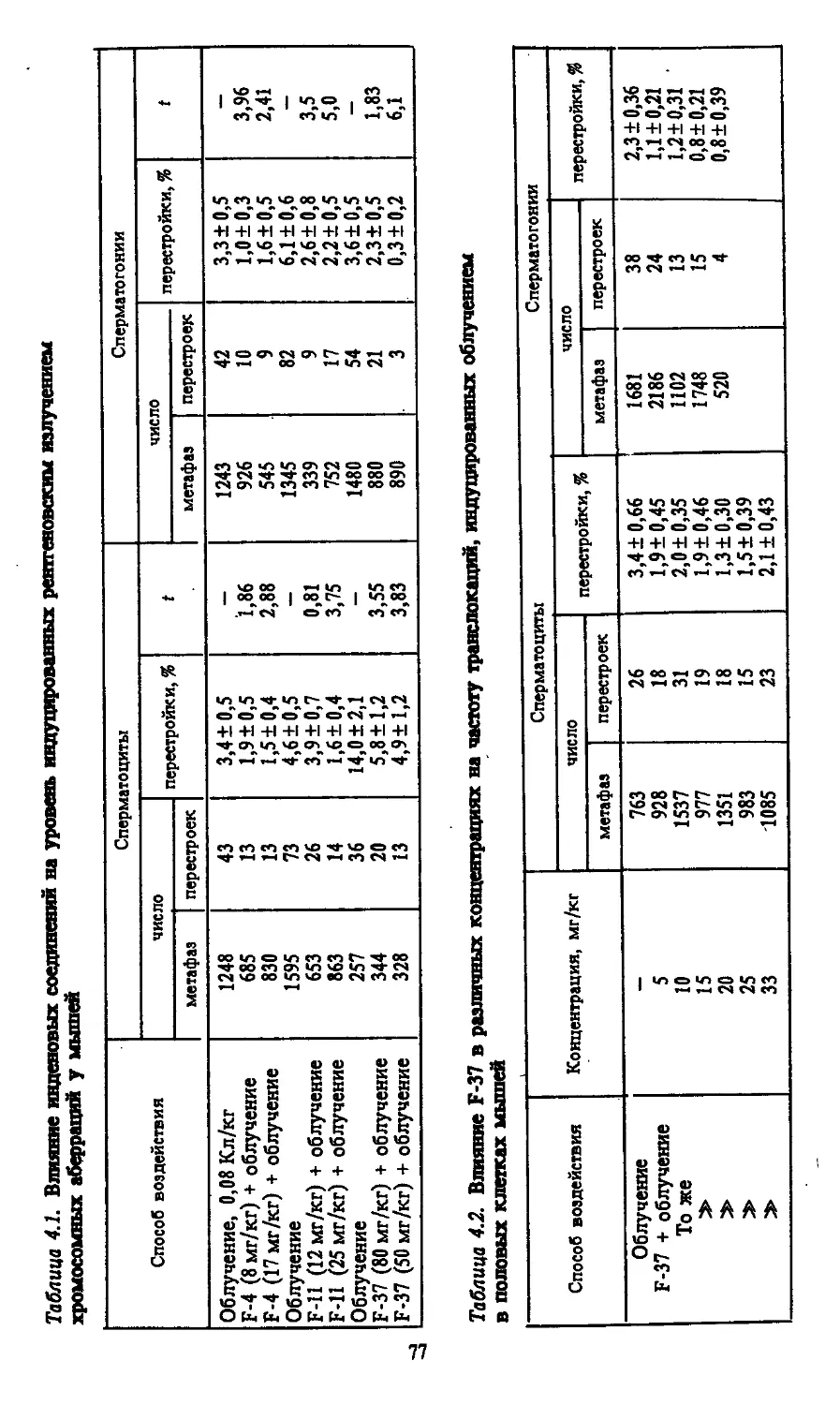
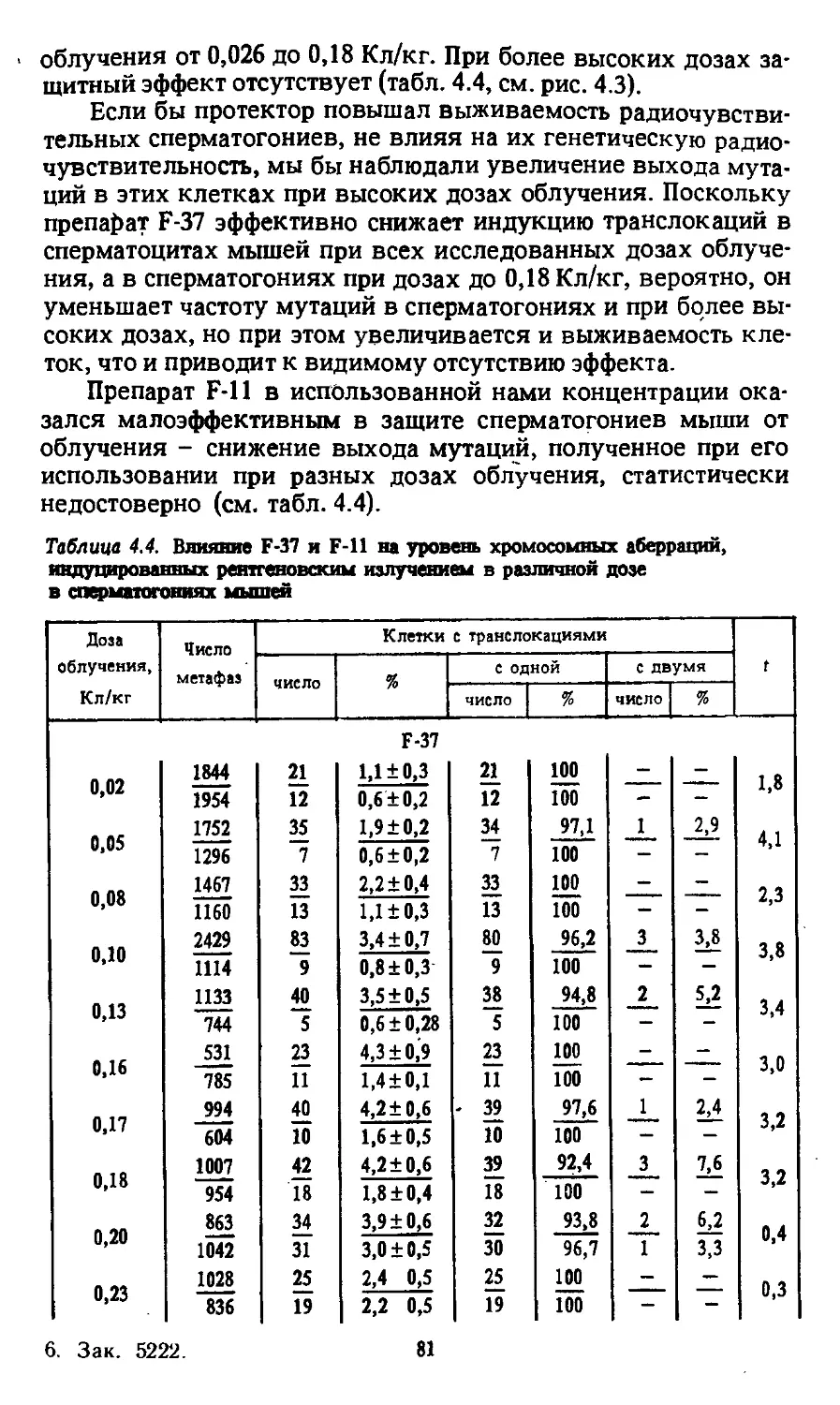
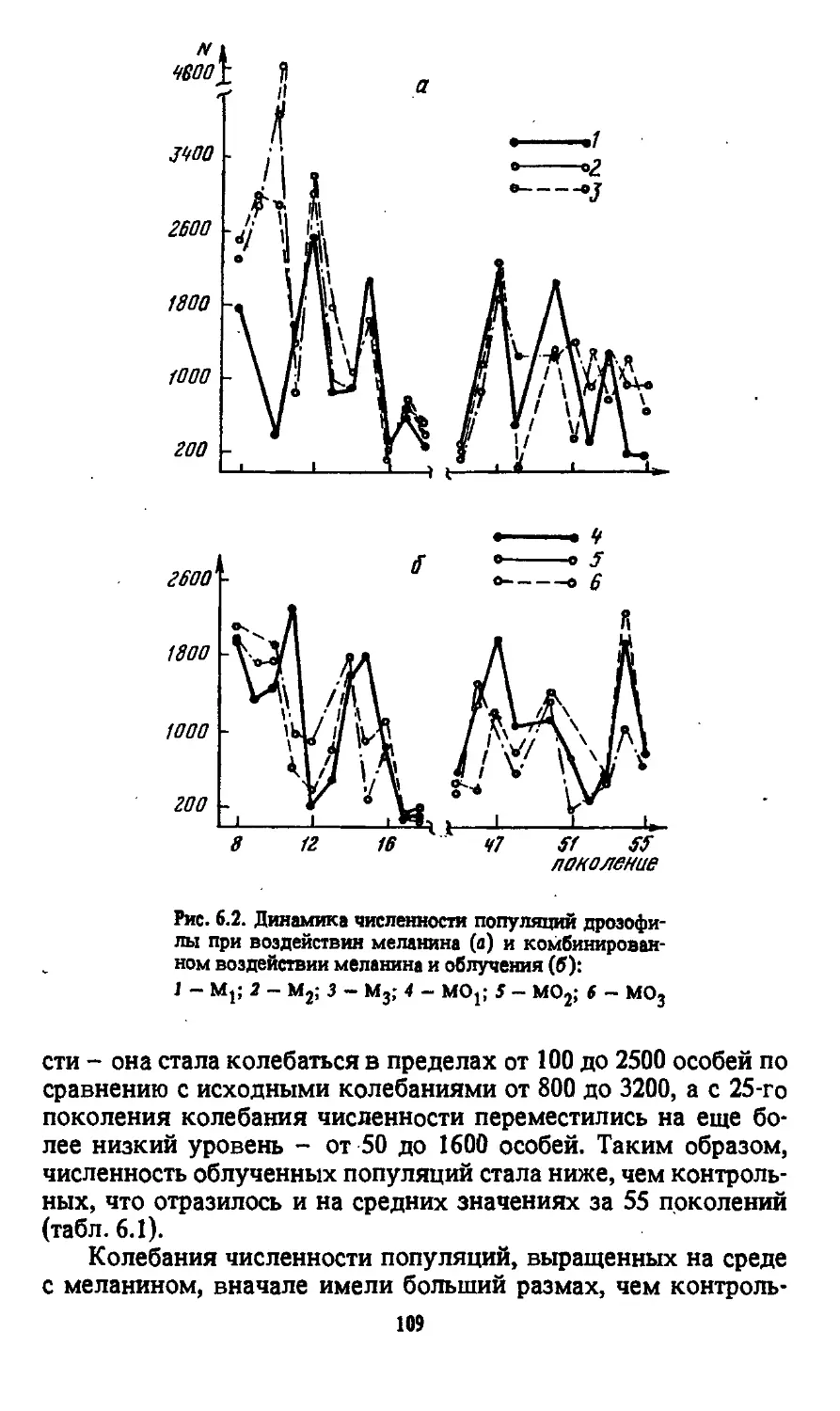
Автор: Моссэ И.Б.
Теги: общая генетика общая цитогенетика иммуногенетика эволюционное учение видообразование филогенез несчастные случаи риски опасность профилактика несчастных случаев индивидуальные средства защиты безопасность биофизика, биохимия и физиология животных и человека медицина генетика радиация
ISBN: 5-7855-0334-4
Год: 1990
БЕЛОРУССКИЙ КОМИТЕТ
ПО ПРОГРАММЕ ЮНЕСКО
„ЧЕЛОВЕК И БИОСФЕРА”
И. Б. Моссэ
РАДИАЦИЯ
И НАСЛЕДСТВЕННОСТЬ:
ГЕНЕТИЧЕСКИЕ
АСПЕКТЫ
ПРОТИВО-
РАДИАЦИОННОЙ
ЗАШИТЫ
&
МИНСК
„УНИВЕРСИТЕТСКОЕ”
1990
BYELORUSSIAN COMMITTEE
FOR THE UNESCO
PROGRAMME
“MAN AND THE BIOSPHERE’
I. B. Mossae
RADIATION
AND HEREDITY:
GENETIC
ASPECTS
OF PROTECTION
AGAINST
RADIATION
MINSK
UNIVERSITY
PUBLISHERS
1990
БЕЛОРУССКИЙ КОМИТЕТ
ПО ПРОГРАММЕ ЮНЕСКО
„ЧЕЛОВЕК И БИОСФЕРА”
И. Б. Моссэ
РАДИАЦИЯ
И НАСЛЕДСТВЕННОСТЬ:
ГЕНЕТИЧЕСКИЕ
АСПЕКТЫ
ПРОТИВО-
РАДИАЦИОННОЙ
ЗАШИТЫ
&
МИНСК
„УНИВЕРСИТЕТСКОЕ”
1990
ББК 28.901
М83
УДК 575.1+614.876
Рецензент:
доктор биологических наук, профессор В. И. Корогодин
Моссэ И. Б.
М83 Радиация и наследственность: Генет. аспекты
противорадиац. защиты. - Мн.: Университетское, 1990. -
208 с.
ISBN 5-7855-0334-4.
Рассматриваются первичные радиогеветические эффекты и отда-
ленные генетические последствия облучения. Приводятся литературные
н собственные экспериментальные данные о возможности защиты орга-
низмов и популяций от однократного и длительного .(на протяжении
десятка поколений) воздействия ионизирующей радиации. Обсуждает-
ся проблема адаптации популяций к облучению в малых дозах.
Для- генетиков, радиобиологов, медиков.
М
1903020000-025 .
— 1 42-90
М317(03)—90
ББК 28J01+51.26
Научное издание
Моссэ Ирма Борисовна
РАДИАЦИЯ И НАСЛЕДСТВЕННОСТЬ:
Генетические аспекты противорадиационной защиты
Зав. редакцией Л. Г. Лепило. Редактор Р. В. Махновец. Художественный ре-
дактор В. А. Макаренко. Художник В. И. Шолк. Технический редактор Т. К. Ро-
манович. Корректор 3. М. Машкевич. Оператор Б. Г. Полойко.
ИБ № 1505.
Подписано в печать 27.02.90. АТ 01005. Формат 84x1081/32. Бумага типографская № 2. Гар-
нитура Пресс Роман. Офсетная печать. Усл. печ. л. 10,92. Усл. кр.-отт. 11,22. Уч.-изд. л. 12,83.
Тираж 4250 экз. Заказ 52 2 2. Цена 1р. 90 к.
Издательство „Университетское” Госкомитета БССР по печати. 220048, Минск, проспект
Машерова, 11.
Отпечатано с оригинала-макета издательства „Университетское” в типографии „Победа”.
222310, Мололечно, уп. Тавлая, 11.
ISBN 5-7855-0334-4
© И. Б. Моссэ, 1990.
СПИСОК СОКРАЩЕНИЙ
АЭМ — аминоэтилизотиуромочевина
АЭТ — аминоэтилизотиуроний
БДУ - бромдезоксиурндин
ВМ - видимые мутации
ДЛМ — доминантные летальные мутации
ДНФ — 2,4-динитрофенол
ДОФА — диоксифенилаланин
ЛД50 — полулегальная доза
МГК — Международный генетический конгресс
МГЭ — мобильные генетические элементы
МЭА — меркатоэтиламин
ОБЭ — относительная биологическая эффективность
ПАБ — парааминобензойная кислота
ПЦ — парамагнитные центры
РЛМ — рецессивные сцепленные с полом летальные муз
СХО — сестринские хромосомные обмены
ТиоФЭТ — триэтилентиофосфорамид (тиофосфамид)
цАМФ — циклический аденозин - 3-5-монофосфат
ФГА — фнтогемоагглютнНнн
ФУДР — фтордезоксиуридин
ЭИ - этнленимин
ЭМС — этилметансульфоиат
ЭПР — электронный парамагнитный резонанс
ПРЕДИСЛОВИЕ
•Непрерывное расширение применения ионизирующих излучений
в различных областях науки и техники, сельского хозяйства и медицины неиз-
бежно приводит к облучению значительных групп людей. Такое облучение про-
исходит преимущественно в малых дозах, однако доказано, что малые дозы
радиации, ие оказывающие заметного физиологического влияния на организм,
повышают частоту i енетических* нарушений (мутаций) в облученных клетках»
И если повышение уровня мутаций у микроорганизмов и растений зачастую вы-
годно, поскольку позволяет создать новые ценные штаммы микроорганизмов и
сортов растений, то для животных н особенно дпя человека ускорение мутаци-
онного темпа крайне нежелательно, так как большинство мутаций у этих орга-
низмов отрицательно влияет на нх жизнеспособность.
«В связи с этим защита наследственности человека и других живых организ-
мов от повреждающего действия факторов внешней среды, в частности иони-
зирующей радиации, — одна из актуальных проблем современной биологии.
Актуальность этой проблемы определяется и тем, что роль естественного отбора
в современном человеческом обществе резко снижена, поэтому возрастание
уровня мутаций, вызываемое облучением, приводит к генетической „засорен-
ности” или „отягошенности” наследственности человека вредными мутациями.
Все это вызывает необходимость поиска возможностей защиты человека, а в ря-
де случаев и других организмов от мутагенного действия радиации.*
Реальной возможностью повышения радиоустойчивостн организма явля-
ется использование средств химической Зашиты. Возможность эффективной хи-
мической зашиты организма от лучевой гибели экспериментально установлена,
одиако поиски стабильных нетоксичных н эффективных протекторов еще не
увенчались успехом.
Что же касается защиты живых существ от мутагенного действия ионизи-
рующей радиации, то этот вопрос достаточно сложный. При исследовании наи-
более эффективных радиопротекторов с целью уменьшения генетического дей-
ствия облучения было показано, что они либо вовсе не способны защищать на-
следственные структуры, либо менее эффективны, чем при защите от лучевой
гибели.
‘Интерес-к проблеме генетической защиты обусловлен разными причинами.
С одной стороны, теоретические исследования, проводимые в этой области, яв-
ляются необходимой предпосылкой для разработки основ профилактики луче-
вого поражения наследственных систем, с другой — изучение механизмов защи-
ты от облучения помогает понять природу генетического действия ионизирую-
щей радиации. Кроме того, эти эксперименты иногда позволяют вскрыть неко-
торые общегенетические закономерности.*
ЛШрн рассмотрении мутагенного действия ионизирующей радиации необхо-
димо отличать радиационно-генетические эффекты, возникающие в соматиче-
ских клетках, от таковых в зародышевых (половых). Поражение генетических
б
структур соматических клеток привадит к возникновению лейкемия, лучевого
рака н преждевременному старения, т. е. затрагивает только облученный орга-
низм, а следующим поколениям не передается. Радиационные эффекты в заро-
дышевых клетках ведут к образованию генетически ненормальных гамет, вслед-
ствие чего может произойти гибель зиготы или эмбриона на разных стадиях раз-
вития, рождение особей с наследственными аномалиями или особей, несущих -
в гетерозиготном состоянии новые, часто неблагоприятные для организма гены.
Таким образом, мутагенный эффект, вызываемый облучением в половых клет- .
ках, передается ^.поколения в поколение, поэтому особенно важной задачей -
является уменьшение этого эффекта jt
•Нерегулируемое повышение естественного фона радиации на Земле, вызы-
ваемое радиоактивным загрязнением бносферы,_обусловливает длительное об-
лучение значительных групп живых организмов в среде нх обитания и создает
угрозу повышения уровня мутаций у населения. Поэтому важной задачей явля-
ется исследование отдаленных последствий, вызываемых длительным воздей-
ствием ионизирующей радиации в популяциях живых существу
Несмотря на большое значение, придаваемое популяционным исследова-
ниям, многие закономерности генетических процессов, происходящих в по-
пуляциях под влиянием облучении, раскрыты недостаточно. Кроме того, не бы-
ла исследована возможность модификации эффектов, возникающих в облучае-
мых популяциях. Мы впервые задались целью ие только провести мониторинг
генетических последствий длительного облучений популяций, ио н попытаться
уменьшить эти последствия с помощью антимутагенов.
Термин „антимутаген” используется для сфдинений, снижающих выход
мутаций, индуцированных мутагенами любой природы — физической, химиче-
ской, биологической. В научной литературе нет терминов, обозначающих фак-
торы, способные уменьшать мутационный процесс, индуцированный облучени-
ем, Так, радиопротекторами называются вещества, способные защищать клетку
или организм от любого действия ионизирующей радиации - летального, токси-
ческого и т. д. Поэтому в работе нами использованы оба термина дли того, чтобы
в каждом конкретном случае подчеркнуть разные стороны одного и того л^е яв-
ления — снижения частоты мутаций, вызванных ионизирующей радиацией^
Автор приносит глубокую благодарность сотрудникам ИГиЦ АН БССР
К. Г. Елисеевой, С. И. Плотниковой, Л. М. Михалевич, С. И. Касинской, И. П. Лях
за помощь н участие в проведении экспериментов, Я. Ф. Фрейманису (НОС АН
ЛатССР), А. И. Балаклиевскому (МГМИ) за предоставление использованных в
работе химических соединений, -а также В. И. Корогодину и В. К. Савченко за
ценные советы я замечания.
ГЛАВА 1
РАДИОГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ
В КЛЕТКАХ ЭУКАРИОТ
1.1. Первичные повреждения, вызываемые в ДНК
ионизирующей радиацией
Большинство механизмов повреждающего действия
облучения на биомолекулы ДНК изучены в модельных экспе-
риментах. Однако существующие литературные данные позво-
ляют представить некоторую схему событий, происходящих
в облученной ДНК.
^На первом этапе облучения в хромосомной ДНК образует-
ся сложный макрорадикал с двумя типами локализации неспа-
ренных электронов, которым соответствуют повреждения ос-
нований (потери и химические модификации) и повреждения
сахарофосфатных цепей (одиночные и двойные разрывы фос-
фодиэфирных и межуглеродных связей). Причем нуклеотид-
ные основания повреждаются чаще, чём сахарофосфатная часть
ДНК, примерно в 3 раэа|[1,2]. По данным работы [3], 80-90%
электронов и радикалов, образующихся при облучении, реа-
гируют с азотистыми основаниями - самыми лабильными час-
тями молекулы - и только 10-20% энергии расходуется на
разложение сахарофосфатного фрагмента ДНК. Наиболее ра-
диоустойчивыми являются углеродные связи, которые в 7,5 ра-
за стабильнее, чем фосфодиэфирные. Из азотистых оснований
большей радиочувствительностью обладают пиримидиновые,
из которых самый лабильный тимин, Пуриновые основания в
2 раза устойчивее пиримидиновых.
•Под действием ионизирующей радиации чаще повреждает-
ся одна нить ДНК. При этом образуются такие первичные по-
вреждения, как дезаминирование оснований, алкилирование,
возникновение оксимов цитозина, димеризация или гидрата-
ция пиримидиновых оснований и др. Вторичные реакции - это
разрывы водородных связей, конфигурационные изменения
надмолекулярных структур ДНК, а также внутри- и межмоле-
кулярные сшивки полимерных цепей. Разрушение надмолеку-
лярной структуры (деспиралиэация) обусловлено двойными
разрывами ДНК, которые возникают, если одиночные разрывы
нитей ДНК расположены на расстоянии не более 10 пар нуклео-
тидов друг от друга [1>
8
Попадание кванта энергии при облучении клетки — про*
цесс случайный, однако конечное повреждение образуется
преимущественно в определенных участках хромосом, в так
называемых „горячих' точках”<Это явление можно объяснить
миграцией энергии или заряда вдоль хромосомы к наиболее
„ранимым” местам. Существует миграция электронного воз-
буждения по молекуле ДНК на большие расстояния - 103-104
пар оснований [4]. Установлено, что если первоначально пора-
жается наиболее радиоустойчивая компонента в смеси „фос-
фат- сахар” или в сахарофосфате, то в конечном счете свобод-
ная валентность локализуется на сахарной компоненте этой
смеси [3].#{алефмиграция энергии или заряда идет в направ-
лении наиболее легко возбуждаемых азотистых оснований,
которые и являются преимущественными местами атаки элек-
тронов<С сахарным фрагментом ДНК электрон практически
не реагирует, а лишь стабилизируется и за счет этого принима-
ет участие в реакциях с азотистыми основаниями ДНК [3]. По
данным работы [5], образующийся под действием у-облучения
анион-радикаЛ может возникать случайно на любом из четы-
рех нуклеотидов, а затем неспаренный электрон передается на
тот нуклеотид, который обладает наибольшим электронным
сродством. После этого анион-радикал превращается в стабиль:
ный)|пиримидиновые ОСНОВАНИЯ кяк няиКппра ПРГ1ГГ1 плябуж- гJ
даемые и являются, и———в^тонкамишридожения '
повреждающего действия ряпмяпии с пуриновых же основа-
ний сигнал эДР полностью снимается. Таким образом, незави-
симо от места первоначального попадания кванта энергии пер-
вичные повреждения начинают формироваться на пиримиди-
новых нуклеотидахфБолее того, миграция энергии и заряда
возможна не только внутри молекулы ДНК, но и с ДНК на про-
тектор. При введении, например, профлавина - лучшего, чем
любой нуклеотид, акцептора электронов - конечное радиаци-
онное повреждение локализуется на профлавине. Если же вве-
сти гистамин, который является худшим акцептором электро-
нов, чем азотистые основания, то после у-облучения сигнал
передается-, наоборот, от гистамина к нуклеотидам [5].
уЬВещест'ва-радиопротекторы могут захватывать на себя и
электроны и возбуждение, чемвьйьщают снижение выхода
радикалов ДНК [3]. Предполагается, что тгцсой радиопротектор
образует с ДНК комплекс, в котором воэм&жна миграция за-
ряда или возбуждения с ДНК на защитное вещество, а реком-
бинация- этого заряда с зарядом пщ[ивоположного знака про-
исходит на фрагменте протектормГ
Таким образом, если квант энергии попадает на ДНК, не-
обязательно последует ее повреждение: при наличии в клетке
9
Рис. 1.1. Схема радиогенетических эффектов в клетке
эукариот
веществ-радиопротекторов возможна миграция энергии или
заряда полностью или частично на протектор (рис. 1.1). Если
' такой миграции нет, то первичное радиационное повреждение
локализуется на азотистых основаниях ДНК.
•Какова дальнейшая судьба этих повреждений? Во-первых,
первичные повреждения могут быть репарированы; во-вторых,
возможно образование точковых мутаций и, в-третьих, первич-
ные радиационные повреждения нуклеотидов могут дать на-
чало цепи событий, приводящих к формированию хромосом-
ных аберрациям, рис. 1.1).
Поскольку репарация радиационных повреждений ДНК
описана во многих работах, остановимся на вопросах образо-
вания толковых и хромосомных мутаций.
10
12. Особенности возникновения точковых
и хромосомных мутаций
^Термин „толковая мутация” долгое время понимал-
ся разными исследователями по-разному, поэтому следует
уточнить, что согласно современным представлениям толко-
выми мутациями мы называем стабильные изменения на уров-
не нуклеотидов ДНК. При образовании толковой мутации не
нарушается целостность хромосомы и не затрагивается ее бел-
ковый компонент. .
Предположение о разной зависимости выхода точковых и
хромосомных мутаций от эффективности репарационных сис-
тем было высказано нами в 1974 г. [6] и подтверждено рабо-
тами последних лет,}
Данные, свидетельствующие о независимости или слабой
зависимости формирования точковых мутаций от интенсивно-
сти процессов репарации, получены при исследовании различ-
ных факторов.
^Радиочувствительность стадий гаметогенеза. В радиобио-
логаи существует установившееся мнение о том, что радиочув-
ствительность разных стадий гаметогенеза различна. Такое
явление объясняется разной эффективностью репарационных
процессов на разных стадиях. Однако это положение верно
лишь для мутаций аберрантного происхождения. Что же каса-
ется точковых мутаций, то по этому типу повреждений радио-
чувствительность разных стадий как сперматогенеза, так и
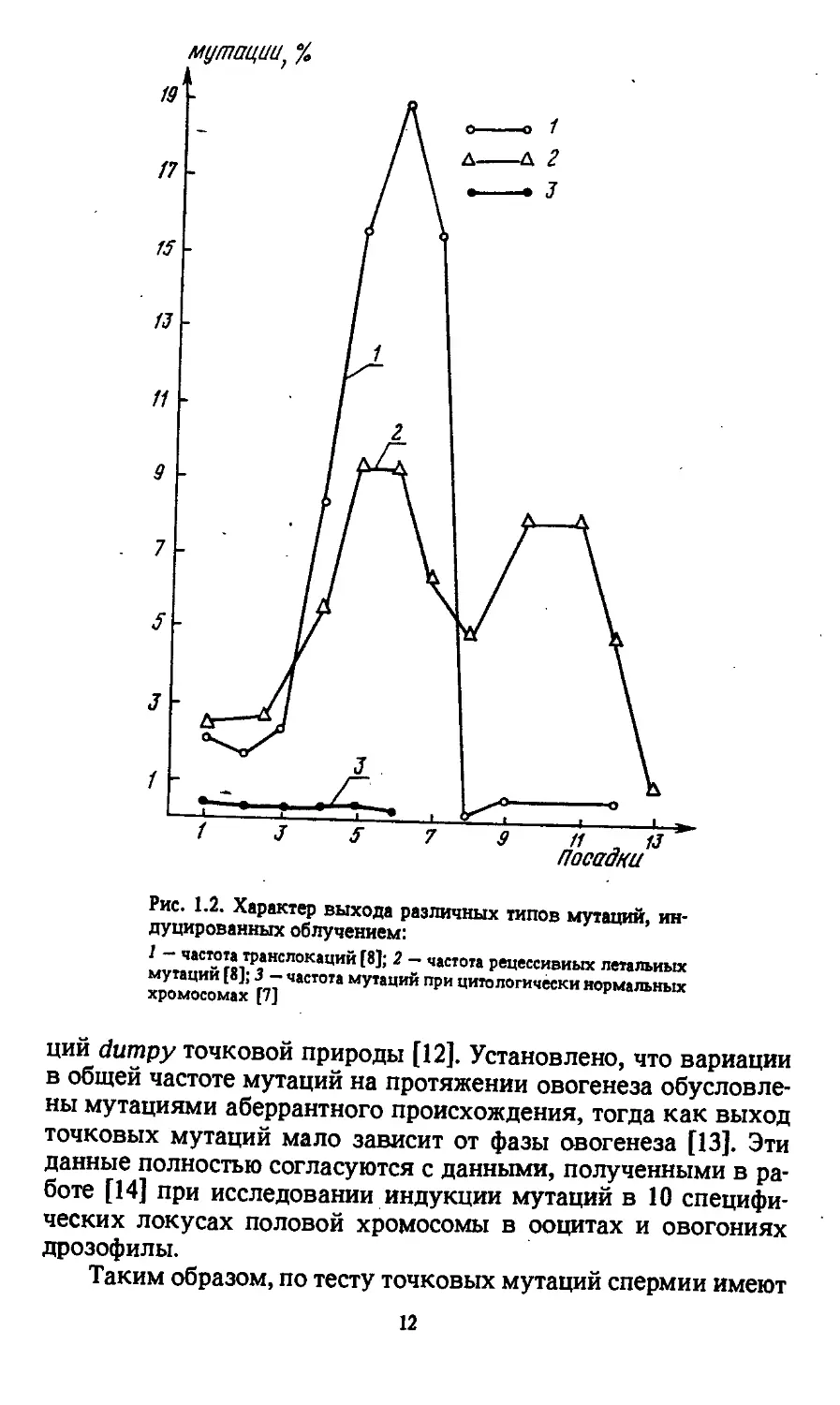
овогенеза сказывается одинаково^ Так, Лефевр [7] не обна-
ружил никаких различий в радиочувствительности постмейо-
тических половых клеток дрозофилы по тесту точковых му-
таций и пришел к выводу, что радиочувствительность сперми-
ев и сперматид по толковым мутациям одинакова/ Наряду с
этим выход транслокаций в сперматидах больше, чем в спер-
миях, в 11,6 раза, а рецессивных сцепленных с полом леталь-
ных мутаций (смесь хромосомных и точковых) - в 3,7 раза [8]
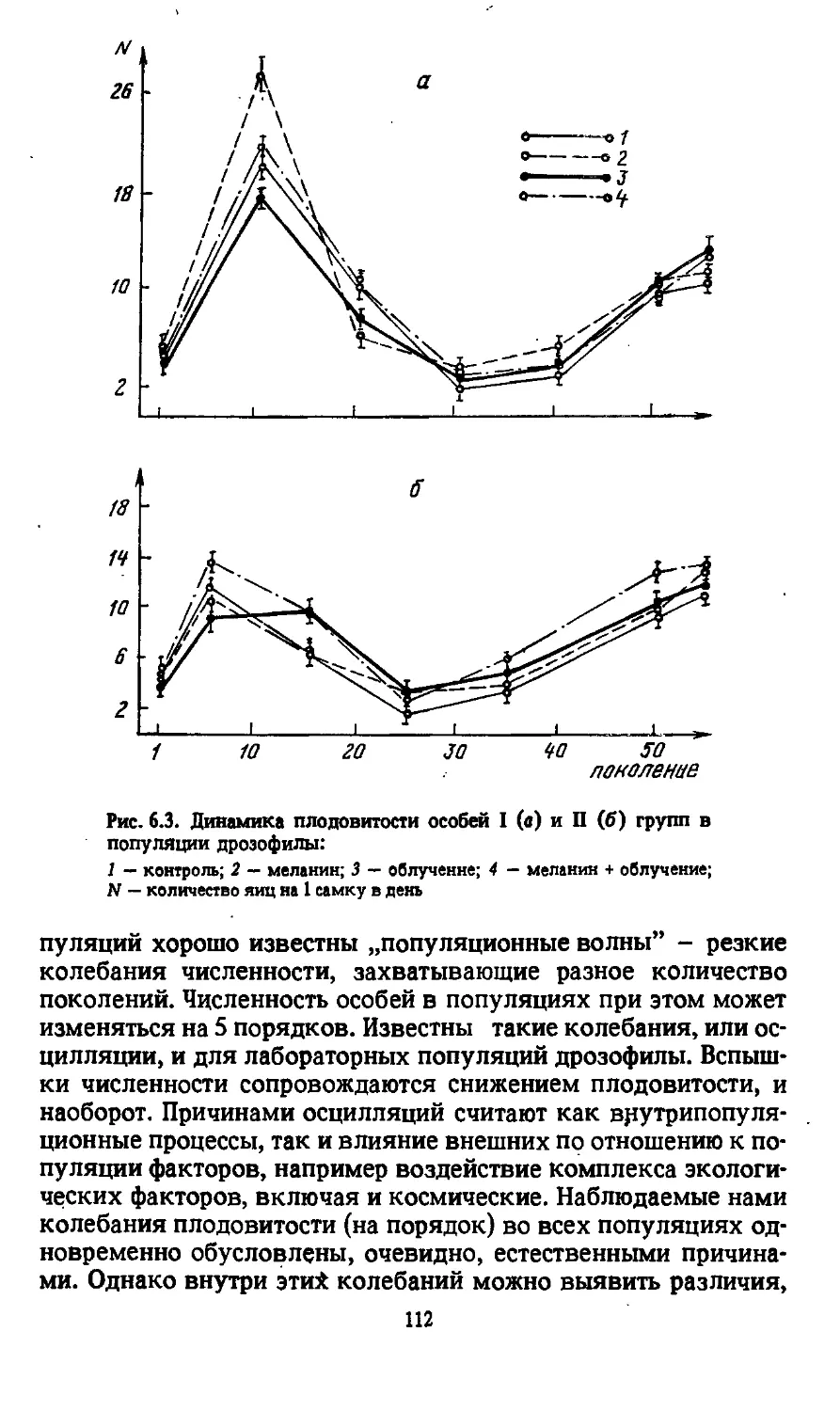
(рис. 1.2).
Группа японских исследователей при изучении на дрозо-
филе мутаций dumpy толкового и хромосомного происхожде-
ния неоднократно отмечала разницу в изменении частот этих
типов мутаций при различных воздействиях. Так, в работах
[9-11] показано, что при облучении выход мутаций dumpy тол-
кового происхождения одинаков на разных стадиях сперма-
тогенеза у дрозофилы, в то время как индукция мутаций dum-
py хромосомной природы различается.
Не обнаружено различий между зрелыми и незрелыми
ооцитами по чувствительности к индукции облучением мута-
11
мутации %
Рис. 1.2. Характер выхода различных типов мутаций, ин-
дуцированных облучением:
I — частота транслокаций [8]; 2 — частота рецессивных летальных
мутаций [8]; 3 — частота мутаций при цитологически нормальных
хромосомах [7]
ций dumpy точковой природы [12]. Установлено, что вариации
в общей частоте мутаций на протяжении овогенеза обусловле-
ны мутациями аберрантного происхождения, тогда как выход
точковых мутаций мало зависит от фазы овогенеза [13]. Эти
данные полностью согласуются с данными, полученными в ра-
боте [14] при исследовании индукции мутаций в 10 специфи-
ческих локусах половой хромосомы в ооцитах и овогониях
дрозофилы.
Таким образом, по тесту точковых мутаций спермин имеют
12
практически одинаковую радиочувствительность со сперма-
тидами, а овогонии с ооцитами, несмотря на огромную разницу
в метаболизме и эффективности репарационных процессов в
этих клетках.
Радиочувствительность разных линий. При изучении раз-
ных линий дрозофилы, отличающихся по своей радиочувстви-
тельности, показано, что выход точковых мутаций одинаков,
а различия обусловлены лишь неодинаковой индукцией хро-
мосомных аберраций [15].
Кислородный эффект. Известно, что кислород, присутству-
ющий во время облучения, подавляет работу репарационных
систем [16], При отсутствии кислородного влияния на выход
хромосомных перестроек у линий дрозофилы, дефектных по
эксцизионной и репликационной репарации, кислородный эф-
фект является модификацией способности к репарации [17].
Модификация кислородом частоты радиационных мутаций
показана лишь для хромосомных аберраций, а индукция облу-
чением точковых мутаций не изменяется при воздействии кис-
лородом или азотом. Например, по данным работы [18], обра-
ботка половых клеток дрозофилы азотом после облучения в
кислороде повышает частоту транслокаций в этих клетках, но
не изменяет выхода точковых мутаций (рецессивные леталь-
ные мутации в кольцевой Х-хромосоме). Аналогично воздей-
ствие кислородом после облучения в азоте уменьшает выход
аберраций хромосом, но не влияет на индукцию точковых му-
таций [13,19]. При этом если выход одиночных и двойных раз-
рывов при облучении в воздухе, азоте и кислороде различает-
ся существенно, то данные по изменению выхода поврежден-
ных оснований при облучении в кислороде отсутствуют [20].
Выдерживание в кислороде после облучения в азоте спо-
собствует репарации повреждений в сперматидах дрозофилы,
при этом уменьшается выход индуцированных облучением
аберраций, но частота генных мутаций в специфических локу-
сах половой хромосомы и аутосомы II не изменяется [21].
Влияние мощности дозы. Выход видимых мутаций и му-
таций dumpy у дрозофилы изучался при облучении у-лучами
с разной мощностью дозы - 3000 и 30 рад/мин* [22,23]. Оказа-
лось, что частота мутаций аберрантной природы была значи-
тельно ниже при малой мощности дозы, чем при высокой, но
выход точковых мутаций остался одинаковым при уровнях
мощностей дозы, различающихся в 100 раз. Таким образом, ин-
* Единицы измерений доз облучения в цитируемых работах нами не пере-
ведены в единицы СИ, так как не указано, являются ли эти дозы экспозицион-
ными или поглощенными.
13
дукция точковых мутаций не зависит от мощности дозы об-
лучения.
Влияние типа излучения. Репарация повреждений, инду-
цированных нейтронным облучением, не обнаружена. Такие
повреждения либо вовсе не репарируются, либо репарируются
с большим трудом. При изучении выхода мутации dumpy У
дрозофилы установлено, что ОБЭ нейтронов по сравнению с
рентгеновским излучением в 2 раза выше для мутаций хромо-
сомной природы, чем для точковых [23]. Аналогичные данные
получены и в работе [24].
Влияние ЭМС. Известно, что ЭМС вызывает преимуще-
ственно генные мутации. Выход генных мутаций у дрозофи-
лы под влиянием ЭМС не модифицируется даже кофеином
[25]. Показано также, что в клетках китайского хомячка по-
вреждения, индуцированные ЭМС, необратимы и. приводят к
индукции и экспрессии мутаций в отсутствие синтеза ДНК [26].
Частота генных мутаций в локусе HPRT в клетках китайского
хомячка, индуцированных этилнитрозомочевиной, не изме-
няется в разных послеэкспозиционных условиях, в которых
снижается частота СХО [27]. Авторы данной работы пришли к
выводу, что повреждения, ведущие к СХО, в отличие от нере-.
парируемых „мутагенных” изменений репарируются.
Влияние гена, нарушающего рекомбинацию. При исследо-
вании влияния у-лучей на индукцию мутаций у дефектной по
рекомбинации линии дрозофилы c3G было выявлено [28], что
частота точковых мутаций в сперматоцитах мутантной и дикой
линий одинакова, а индукция гиперплоидных самцов различ-
на. Автор предполагает, что сЗС-сен включается в процесс ин-
дукции ионизирующей радиацией больших структурных из-
менений и не связан с индукцией генных мутаций.
Для всех приведенных фактов возможно лишь одно объяс-
нение - отсутствие влияния вообще или слабое влияние ре-
парационных систем на выход точковых мутаций.
В отличие от точковых мутаций индукция хромосомных
аберраций не только эффективно изменяется под воздействи-
ем физических и химических модификаторов, но и-зависит от
многих факторов, зачастую не контролируемых эксперимен-
татором. Рассмотрим основные из них.
Известно, что разные виды живых существ обладают раз-
личной радиочувствительностью. Известно также, что разные
стадии и гаметогенеза, и клеточного цикла тоже обладают раз-
личной радиочувствительностью. Однако нельзя говорить о
радиочувствительности вообще, так как общая радиочувстви-
тельность, определяемая по лётальной или полулегальной до-
зе, не всегда коррелирует с цитогенетической радиочувстви-
14
тельностью разных органов, тканей и клеток, между которыми
часто отсутствует корреляция по индукции хромосомных абер-
раций. При определении генетической радиочувствительности
с помощью разных тестов можно получить противоположные
результаты, так как разные стадии клеточного цикла и гаме-
тогенеза, а также линии животных с разным генотипом и т. д.
различаются по радиочувствительности, выявляемой по тесту
хромосомных аберраций, но имеют одинаковую радиочувстви-
тельность по тесту точковых мутаций. Чтобы избежать получе-
ния противоречивых данных, надо учитывать специфику каж-
дого используемого теста, а также разнообразные факторы,
изменяющие или искажающие результаты оценки кластоген-
ного действия ионизирующей радиации (равно, как и любых
других мутагенов).
Генотип. Индукция облучением хромосомных перестроек
существенно отличается у особей разных генотипов. Так, на-
пример, у гибридных мышей (С3Н X 101) Fj при облучении воз-
никает более высокая частота врожденных аномалий и реци-
прокных транслокаций по сравнению с гибридами (SFCX
х C57BL) Fj [29]. Аналогичные данные получены и при исследо-
вании других линий мышей [30].
У мышей конгенных линий выявлены группы с высокой и
низкой частотой возникновения хромосомных аберраций [31].
Межлинейные различия радиочувствительности ряд авто-
ров связывает с неодинаковой эффективностью репарацион-
ных процессов у разных линий. В частности, различная степень,
восстановления ДНК в клетках млекопитающих разных линий
оказалась ответственной за различия в их радиочувствитель-
ности [31,32].
Известно, что радиочувствительность клеток зависит от
плоидности. Например, повышенная радиочувствительность
мутанта дрожжей rad 51 обнаружена лишь у диплоидов, а ана-
логичный гаплоидный мутант обладает такой же устойчиво-
стью к радиации, что и дрожжи дикого типа [34]. Такие же ре-
зультаты получены японскими исследователями при изучении
мутанта дрожжей rad 52 [35].
На цитогенетическую радиочувствительность клеток влия-
ют даже небольшие изменения генотипа. Так, показано, что
частота аберраций, индуцируемых в культивируемых фибро-
бластах человека, значительно выше в клетках с трисомией
хромосом по сравнению с диплоидными клетками [36], а час-
тота транслокаций в клетках мышей с нормальным кариоти-
пом оказалась вышё, чем у мышей, гетерозиготных по транс-
локации [37].
При этом межлинейные различия по цитогенетической ра-
15
диочувствительнрсти могут не коррелировать с общей радио-
чувствительностью. Так, мыши линии 101/Н оказались гораздо
более чувствительными в отношении вызываемой рентгенов-
ским излучением гибели сперматогониальных клеток, чем гиб-
риды (СЗН/НеН х 101/Н) Fj, но в то же время уровень транс
локаций у мышей 101/Н оказался существенно ниже [38].
Тканевая специфичность. Сравнение радиочувствитель-
ности по тесту хромосомных перестроек затрудняется тем, что
нет корреляции между различной частотой аберраций у раз-
ных линий и в клетках разных тканей животных, т. е. линия,
более чувствительная к индукции перестроек в каких-то со-
матических клетках, оказывается устойчивой к индукции
аберраций в половых клетках, и наоборот [39]. Так, в работе
[40] показано, что относительная радиочувствительность мы-
шей четырех генотипов, определяемая по выходу хромосом-
ных перестроек в сперматоцитах, обратна таковой в клетках
роговицы глаза.
По данным работы [41], при рентгенооблучении мышей в
дозе 400 рад в костном мозге возникает в 4,2 раза больше абер-
раций, чем в сперматоцитах. Предполагалось, что причинами
этого различия являются разные методы определения хромо-
сомных перестроек в указанных тканях, а также неодинаковая
элиминация и пролиферация клеток, несущих аберрации, в
пострадиационный период. В ней указывалось на отсутствие
корреляции между чувствительностью этих тканей по тесту
хромосомных аберраций и по клеточной гибели, что приводит
к выживанию клеток с перестройками в разных тканях [41].
Сравнительное изучение хромосомной радиочувствительности
лимфоцитов крови и сперматогониальных клеток у мыши и
макаки-резуса было продолжено в работе [36]. Полученные ре-
зультаты позволили сделать вывод об отсутствии фиксирован-
ного соотношения между частотой индуцированных радиацией
аберраций в соматических и половых клетках. Поэтому авторы
считают, что при определении степени генетического риска
воздействия облучения на человека решающую роль должна
играть прямая оценка частоты мутаций в половых клетках [36].
Сравнение радиочувствительности лейкоцитов перифери-
ческой крови и сперматогониальных клеток у мышей и китай-
ского хомячка показало, что частота хромосомных обменов,
индуцированных радиацией в половых клетках, ниже, чем
в лейкоцитах [42]. Обнаружено также [40], что частота абер-
раций, вызываемая облучением в роговице глаза, больше, а
в печени меньше, чем в половых клетках.
Кроме причин, обусловливающих разную индукцию абер-
раций в разных тканях организма, большую роль играют и раз-
16
личия в эффективности репарационных систем. Показано, на-
пример, что в клетках млекопитающих репарационные энзимы
обладают неодинаковой активностью в тканях разных орга-
нов [43].
Возраст и пол. Известно, что цитогенетическая радиочув-
ствительность увеличивается по мере старения организма.
Однако влияние возраста на индукцию мутаций не всегда
однозначно. Так, уровень реципрокных транслокаций и фраг-
ментов хромосом у мышей значительно Возрастает с увеличе-
нием возраста от 75 до 850 дней, а частота гипергаплоидных и
анеуплоидных клеток не изменяется [44].
У старых облученных самок мыши частота аберраций в
3 раза выше, чем у молодых. Интересно, что при этом играет
роль репродуктивный статус самок - после облучения дев-
ственных старых самок они давали помет меньшего размера,
чем повторнородящие самки того же возраста [45].
Возрастные различия в повреждаемости хромосом выяв-
лены и для культивируемых клеток человека [36, 46], и для
клеток печени плода мышей [47].
Увеличение частоты индуцированных мутаций при старе-
нии можно объяснить нарушением репарационных процессов.
Эффективность систем восстановления весьма лабильна, она
различна в клетках с разным уровнем метаболизма и может
быть подвержена воздействию самых разнообразных факторов,
с которыми соприкасается организм в течение жизни. Эффек-
тивность систем репарации изменяется с возрастом, а также
имеет видовую, органную и тканевую специфичность [48].
Хорошо известны и различия в работе репарационных си-
стем у особей разного пола. Например, в сперматозоидах дро-
зофилы ферменты репарации отсутствуют, а повреждения, воз-
никающие в этих клетках, репарируются после оплодотворе-
ния за счет репарационных ферментов самки. Однако различ-
ный выход структурных мутаций в клетках у особей разного
пола может определяться и разной чувствительностью этих
клеток к облучению [49, 50].
Специфика стадий клеточного цикла и гаметогенеза: Ра-
диочувствительность разных стадий клеточного цикла по тес-
ту хромосомных перестроек неодинакова [51], что обусловле-
но не различной чувствительностью самого генетического ма-
териала, а разной эффективностью репарационных процессов
на этих стадиях.
Еще в 1975 г. Н. В. Лучник писал, что на всех стадиях цик-
ла мишень имеет одну и ту же природу. Радиация вызывает
одно и то же или примерно одно и то же число потенциальных
повреждений, и природа этих повреждений также одна и та
2. Зак. 5222. 17
же. На всех стадиях клеточного цикла одинакова и возмож-
ность репарации [52].
Аналогичные выводы сделаны и в ряде, других работ [53,
54], в которых отмечается, что различия в выходе структурных
повреждений хромосом обусловлены разным вкладом репа-
рации [53].
Однако, кроме различий в эффективности репарационных
процессов, протекающих на разных стадиях клеточного цикла,
на индукцию облучением хромосомных перестроек может вли-
ять длительность протекания одной и той же стадии. Так, при
сравнении радиочувствительности нейробластов двух линий
кобылок, имеющих периоды клеточных циклов 2 и 4 ч, было
показано, что значительно большее число фрагментов хромо-
сом возникает в клетках с четырехчасовым циклом [55]. Ав-
торы связывают это явление с тем, что при Данной дозе облу-
чения начальное индуцирование у клеток с четырехчасовым
циклом больше, чем у клеток с двухчасовым циклом, хотя
кривые митотического восстановления одинаковы у обеих
линий;
Хорошо известна различная радиочувствительность по те-
сту хромосомных перестроек разных стадий гаметогенеза. Од-
ной из причин этого явления служит большая степень селек-
ции предмейотических клеток с нарушением хромосом по
сравнению с постмейотическими [56]. Что же касается послед-
них, то, безусловно, главную роль в изменении выхода струк-
турных мутаций играют различия в эффективности репараци-
онных процессов, протекающих в клетках разной степени зре-
лости. В экспериментах с четырьмя линиями дрозофилы, в том
числе с нарушенными системами репарации ДНК, изучалась
чувствительность разных стадий оогенеза к рентгеновскому
излучению и экспериментально показано, что работа систем
репарации ДНК стадиеспецифична [57].
Поскольку стадии клеточного цикла и гаметогенеза имеют
неодинаковую радиочувствительность по тесту перестроек
хромосом, то при обработке клеток необходимо учитывать,
не вызывает ли применяемый агент сдвиг стадий.
Многие физические и химические факторы вызывают из-
менения в скорости митотического цикла, при этом разные
клетки вступают в метафазу в разное время после обработки.
Это приводит к тому, что сравниваются метафазы клеток, про-
шедшие разное количество делений и имеющие разную частоту
аберраций, так как частота аберраций уменьшается с каждым
последующим делением. Например, при обработке лимфоци-
тов мутагеном и протектором с помощью метода „арлекино-
вой” окраски хромосом установлено, что при фиксации лим-
18 -
фоцитов через 54 ч от начайа культивирования лишь 25,5 %
клеток находятся в первом митозе, а 73,5 % - во втором [58].
При этом протектор не влиял на частоту аберраций, индуциро-
ванных в клетках первого митоза, но снижал число аберрант-
ных клеток, вступивших во второй митоз, деление которых
протекает быстрее. Эксперименты с 3Н-тимидином показали,
что часть клеток второго митоза во время добавления мута-
гена находилась в б2-стадии клеточного цикла, а следователь-
но, снижение частоты аберраций при действии протектора пе-
ред добавлением мутагена может быть артефактом клеточной
селекции [58].
Таким же артефактом оказался кажущийся синергизм
дальнего красного света и рентгеновского излучения [59].
Красный свет замедлял протекание клеточного цикла, и после
обработки им действие рентгеновских лучей приходилось на
клетки, оказавшиеся в самой чувствительной стадии.
Установлено, что введение в организм или культуральную
среду 3Н-тимидина приводит не только к задержке вступле-
ния клетки в митоз, но и перескакиванию из б2-фазы в Gj или
Go следующего митоза, к уменьшению периода деления клет-
ки, гибели клеток, индукции хромосомных перестроек и т. д.
[60]. Все это может привести к самым неожиданным и противо-
речивым результатам при исследовании выхода структурных
мутаций под действием ионизирующей радиации (равно, как и
любого другого мутагена), и особенно при изучении совмест-
ного действия двух и более факторов.
Размер (дифференцировка) клетки. Существует две суб-
популяции лимфоцитов - большие, и малые. Лимфоциты боль-
шого размера устойчивы к облучению, а малые чувствительны.
В процессе дифференцировки лимфоциты в значительной сте-
пени утрачивают способность к эксцизионной репарации.. Обус-
ловлено это тем, что при дифференцировке клетки возрастает
спирализация и плотность упаковки ДНК, что препятствует до-
ступу ферментов репарации к месту повреждения. При обра-
ботке клеток ФГА, который обычно используется при культи-
вировании лимфоцитов, происходит дедифференцировка кле-
ток, вследствие чего возрастает и их устойчивость к облуче-
нию [61]. Лимфоциты людей, больных красной волчанкой, те-
ряют свою суперспиралйзацию, и поэтому в них лучше репари-
руются повреждения, ведущие к хромосомным перестройкам
или гибели клеток. Все это приводит к различному выходу
аберраций хромосом при тестировании кластогенного дей-
ствия мутагенных факторов.
Диаметр и специфичность хромосомы. Радиочувствитель-
ность клеток, как оказалось, зависит и от диаметра хромосом
19
пронуклеуса. Такой вывод был сделан на основании изучения
двух популяций комаров, одна из которых обитает в Альпах,
а другая - в Берлине. ЧастЪта перестроек у этих популяций
различалась в 10-20 раз и коррелировала с числом витков в
хромосомной спирали [62]. По мнению автора, повышенная ра-
диочувствительность клеток с большим числом витков в хро-
мосомной спирали объясняется тем, что каждый виток явля-
ется единицей внутри- и межхромосомных контактов, веду-
щих к возникновению аберраций хромосом. Нам представля-
ется возможным и другое объяснение: чем более спирализова-
на ДНК (большее число витков), тем труднее осуществляется
репарация потенциальных повреждений й выше выход струк-
турных мутаций. Интересно, что по общей радиочувствитель-
ности эти популяции различались в 1,5 раза, что свидетель-
ствует об отсутствии корреляции между общей и цитогенети-
ческой радиочувствительностью.
На индукцию хромосомных перестроек влияет не только
величина диаметра хромосом, но и другие характеристики.
Существует мнение, что частота образования структурных
мутаций в хромосомах пропорциональна их длине. Действи-
тельно, чем хромосома длиннее, тем вероятнее в ней и возник-
новение первичных повреждений, и формирование хромосом-
ных перестроек. Однако обнаружено [63], что в разных парах
хромосом частота образования аберраций различается и при
этом не соответствует длине хромосомы.
К такому же выводу пришли и японские йсследователи
[64] при изучении с помощью Q- и ^-окрашивания хромосом-
ных перестроек, возникающих в костном мозге крыс и мышей
после у-облучения. Они показали, что частота аберраций в ин-
дивидуальных хромосомах распределена не случайным обра-
зом. Были выделены более ранимые и более резистентные хро-
мосомы, причем было установлено, что эти показатели не кор-
релируют с длиной хромосом. Особенно интересно, что среди
чаще всего поражаемых хромосом мыши и крысы три пары
оказались гомеологичными [64].
К выводу о неравномерности распределения хромосомных
повреждений во фракциях метафазных хромосом, различаю-
щихся по размеру, пришли и другие авторы [65].
Чувствительность участков внутри хромосомы. Все иссле-
дователи, изучавшие локализацию индуцированных хромо-
сомных перестроек, отмечали неравномерность распределения
разрывов по длине хромосомы. Это явление обычно связывают
с распределением эу- и гетерохроматина, структурная органи-
зация и биохимическая дифференциация которых различны
[66,67]. Показано, что при различных воздействиях (ионизи-
20
рующая радиация, химические вещества, температурная об-
работка) повреждения хромосом локализуются преимуще-
ственно в гетерохроматиновых районах хромосомы [66,68-71].
Однако, несмотря на то, что аберрации хромосом в большей
степени локализованы в гетерохроматиновых участках или на
стыках гетеро- и эухроматина, эухроматин сильнее подвержен
прямому действию повреждающих агентов (ионизирующая
радиация, химические канцерогенные соединения, ДНКаза I
и т. д.) [65]. Такое противорёчие может быть связано с тем, что
относительное количество первичных повреждений сущест-
венно выше в эухроматине, чем в гетерохроматиновых участ-
ках, но в последних затруднены процессы репарации [65].
Кроме того, были установлены и причины неравномерного
распределения аберраций по длине хромосом. Так, в работе
[72] отмечено, что „горячие” точки у многих видов выявляют-
ся в позднореплицирующемся гетерохроматине. На распреде-
ление хромосомных перестроек влияют также: 1) тип исполь-
зуемого мутагена; 2) относительное положение участка внутри
кариотипа; 3) наличие структурных перестроек хромосом до
воздействия; 4) число потенциальных „горячих” сегментов на
хромосому и т. д.
Используя предложенную Касперсоном окраску акрихин-
ипритом,с помощью флуоресцентного микроскопа Холмберг
[73] установил, что разрывы хромосом лимфоцитов человека
под действием облучения возникают преимущественно в R-об-
ластях хромосом и частота разрывов в каждой хромосоме про-
порциональна длине этих участков. При этом оказалось, что
структурные изменения хромосом не затрагивают С-облас-
тей [65].
Интересно, что существуют отдельные особенно „ломкие”
участки хромосом, причем они специфичны для разных гено-
типов. Например, при изучении двух инбредных генетически
чистых линий мышей для одной из них были обнаружены 3
„ломких” участка (12А2,15А2,19А2), а для другой - один (19В).
Частота клеток с „ломкими” участками 15А2 и 19В увеличива-
лась при добавлении ФУДР [74]. Существует мнение, что разры-
вы хромосом происходят в результате не только специфиче-
ского биохимического действия мутагена, но и биофизических
или физико-химических напряжений [75].
Сроки воздействия и фиксации. Результаты определения
уровня хромосомных перестроек в соматических клетках су-
щественно искажаются при длительном воздействии мутаген-
ных факторов. Одной из причин этого является элиминация
короткоживущих клеток, вместе с которыми элиминируются
и перестройки. Тем более что вероятность гибели клеток с по-
21
вреждениями выше, чем нормальных. Вторая причина - это
гетерогенность клеток по чувствительности к мутагенам. Так,
отмечено- [76], что популяции лимфоцитов обладают разной
чувствительностью, причем чувствительная субпопуляция ак-
тивно элиминируется и приводит к снижению клеток с хромо-
сомными нарушениями. При длительных воздействиях мута-
генных агентов происходит адаптация популяций к этим му-
тагенам. Популяции становятся более резистентными, что так-
же приводит к существенному занижению результатов оценки
генетической опасности мутагенных факторов по сравнению
с результатами исследования однократных мутагенных воз-
действий.
Необходимо учитывать и тот факт, что с увеличением сро-
ков культивирования клеток в них нарастает асинхронизация.
Так, даже в синхронизированной культуре лимфоцитов чело-
века уже через 5 ч культивирования появляются клетки вто-
рого деления [76], через 48 ч образуется смесь клеток двух де-
лений, а через 80 ч - пяти делений [77].
, При облучении гепаринизированной цельной крови индий-
ских мунтжаков через 48 ч культивирования обнаружена раз-
ная частота хромосомных аберраций в метафазах 1, 2 и 3-го ми-
тозов [78]. Автором установлено, что 50 % дицентриков и 12 %
колец переносится из первого цикла во второй. В первом цик-
ле после облучения в дозе 4 Гр было найдено 94 % аномальных
клеток, а во втором - 73 %. После третьего цикла частота хро-
мосомных нарушений существенно снижается [78]. Эти данные
неоспоримо свидетельствуют о том, что нельзя изучать коли-
чественные закономерности индуцирования цитогенетических
повреждений в клетке без идентификации первого и после-
дующих клеточных делений.
Роль условий проведения опытов. На результаты цитоге-
нетических исследований могут оказывать влияние условия
проведения опыта. Например, в лимфоцитах периферической
крови человека был обнаружен „эффект хранения” [79]. Для
изучения его влияния на частоту аберраций хромосом были
проведены исследования в двух вариантах. В первом варианте
обработанные мутагеном лимфоциты стимулировали к. деле-
нию с помощью ФГА и БДУ в течение 0-9 дней, а во втором ва-
рианте опытов ФГА и БДУ добавляли в культуру клеток сразу
же после обработки мутагеном. Оказалось, что в обоих вари-
антах опытов частота хромосомных перестроек хроматидного
и хромосомного типа интенсивно увеличивалась вплоть до по-
следнего срока культивирования, в то время как частота СХО
возрастала постепенно, достигая максимума на 6-й день, а за-
тем начинала снижаться.
22
Установлено, что на частоту аберраций в лимфоцитах вли-
яют не только сроки хранения, но и температура хранения и
посуда, в которой хранилась кровь перед облучением [80]. Так,
в клетках крови, хранившейся при t - 5 °C в течение 173 ч в
пластиковых сосудах, после облучения частота аберрантных
клеток была в 2 раза больше, чем в лимфоцитах свежей крови.
Статистически значимое увеличение уровня хромосомных пе-
рестроек наблюдалось и при хранении крови до облучения в
течение 24, 48 и 72 ч при t = 5 , 20 и 37 °C. Однако хранение
крови в течение 48 ч при 1 = 20 °C в стеклянных сосудах не
повышало частоты аберраций по сравнению со свежей кровью.
Был сделан вывод о сенсибилизирующем действии пластмассы
на наследственные структуры лимфоцитов [80].
Возможны и другие артефакты, влияющие на результаты
генетических исследований. Так, в работе [81] указывается,
что размер проб, количество повторностей, выбор метода ста-
тистической обработки данных, а также экспериментальные
артефакты и случайные ошибки могут быть причинами проти-
воречивости данных, получаемых в разных лабораториях при
исследовании одного и того же генотоксического агента. На-
пример, к артефактам может привести также отсутствие тща-
тельной отмывки культуры [82]. В некоторых опытах даже по-
казатели осмотического давления, концентрация ионов и pH
среды влияли на результаты цитогенетических исследова-
ний [83].
Таким образом, на индукцию хромосомных перестроек
в отличие от точковых мутаций влияют самые разнообразные
факторы. Зависимость уровня структурных мутаций от много-
образных кл.еточных характеристик свидетельствует о том,
что образование аберраций тесно связано с метаболическими
процессами в клетке, и в частности с репарационными.
Различия в индукции хромосомных и точковых мутаций,
очевидно, связаны с их разной природой и разными путями
становления. Так как толковые мутации - зто изменения на
уровне нуклеотидов ДНК, не затрагивающие белковый компо-
нент нуклеопротеида и не нарушающие в процессе своего фор-
мирования целостность хромосомы, а для образования струк-
турных перестроек обязательны разрыв в сахарофосфате и
участие белкового компонента, то и возможности для репара-
ции предмутационных повреждений при образовании точко-
вых и структурных мутаций различны.
Исследования роли белково-нуклеиновых взаимодействий
в репарации ДНК в клетках эукариот начаты недавно, но влия-
ние состояния хроматина на репарацию ДНК не вызывает со-
мнений [84, 85]. В частности, установлено, что кинетика репа-
23
рации на уровне ДНК и хромосом после у-облучения совер-
шенно различна [86]. Это объясняется тем, что доступ фермен-
тов репарации к ДНК в составе хроматина ограничен. Так, по
данным [87], структурное состояние хроматина влияет на рас-
пределение репаративного синтеза не только на уровне нук-
леосом, но и на более высоких уровнях его упаковки, а по дан-
ным работы [88], доступ нуклеозы к ДНК ограничен гистоно-
вой сердцевиной с одной стороны и прилегающим витком су-
перспирали ДНК - с другой. Установлено также, что измене-
ние организации хроматина в интерфазном ядре приводит к
нарушению репарационных процессов, причем упаковка ДНК
в эу- и гетерохроматине хромосом находится под разным ген-
ным контролем [89]. В некоторых случаях особенности строе-
ния хроматина могут ограничивать репарацию ДНК (например,
в нестимулированных лимфоцитах и высокодифференциро-
ванных клетках хрусталика глаза) [84].
По данным работы [90], плотная упаковка хроматина пре-
пятствует репарации радиационных повреждений, что способ-
ствует развитию индуцированных ядерных пикнозов. В ней
приводятся факты зависимости радиочувствительности от
структурных и топологических особенностей организации хро-
матина в интерфазных клетках и высказывается мнение, про-
тивоположное устоявшемуся в радиобиологии, о том, что ра-
диочувствительность клеток пропорциональна объему интер-
фазных хромосом. В то же время при постоянном количестве
ДНК радиочувствительность обратно пропорциональна объему
ядра. Например, объем ядер радиочувствительных лимфоци-
тов колеблется от 20 до 65 мм3, тогда как для клеток печени
ядерный объем достигает нескольких тысяч. Другими слова-
ми, радиочувствительность клетки прямо пропорциональна
'плотности упаковки ДНК при постоянном ее количестве |9(Jh
Процесс созревания хроматина сопровождается повыше-
нием устойчивости ДНК к нуклеазам [91]. На разных стадиях
мейоза хроматин в различной степени защищен от воздействия
нуклеаз, однако, по данным [92], эта устойчивость не пропор-
циональна степени конденсации хроматина. Следовательно,
кроме плотности упаковки есть и другие факторы, затрудняю-
щие доступ нуклеаз к ДНК.
Отмечено также, что поли(АДФ)рибозилирование хромати-
на имеет функциональное значение для репарации ДНК, вызы-
вает ослабление белково-нуклеиновых взаимодействий в уча-
стках репарации ДНК и обеспечивает их доступность для фер-
ментов эксцизионной репарации [85]. В работе [93] описан
антимутаген ПАБ, эффективность которого объясняется тем,
что он делает ДНК доступной для ферментов репарации. И на-
24
оборот, ингибиторы топоизомераз новобиоцин и налидиксовая
кислота предотвращают релаксацию суперспирализованной
ДНК, что приводит к ингибированию начального этапа репа-
рации [94, 95].
Следовательно, повреждения на уровне нуклеотидов мо-
гут быть недоступными для ферментов репарации, так как за-
щищены „белковым футляром” [96-100]. Повреждения репа-
рабельны или нерепарабельны в зависимости от их локализа-
ции [101]. Очевидно, часть изменений нуклеотидов ускользает
от репарации: они либо не узнаются репарационными фермента-
ми, так как не нарушают вторичную структуру молекулы, ли-
бо прикрыты белком и недоступны для репарационных фер-
ментов. Например, не удалось зарегистрировать репарации
метилированных пуринов в ДНК из экстрактов эмбрионов дро-
зофилы [102]. Авторы предполагают, что отсутствие ДНК-гли-
козилазной активности у дрозофилы свидетельствует о недо-
статочности системы эксцизионной репарации для удаления
модифицированных оснований в ДНК. Известно, что после хро-
нического облучения экспериментаторы фиксируют меньшее
'количество индуцированных мутаций, чем после острого. Объ-
ясняется это тем, что при длительном облучении с малой мощ-
ностью дозы системы восстановления имеют больше времени и
возможностей для репарации возникающих предмутационных
повреждений. Например, при хроническом УФ облучении в ко-
нидиях нейроспоры возникает в 4-7 раз меньше мутаций, чем
при остром.
Установлено, что при хроническом облучении у нейроспо-
ры образуются исключительно толковые мутации, а не муль-
тигенные делеции, как при остром [103]. Такие толковые мута-
ции названы „устойчивыми к репарации” и показано, что ве-
личина эффекта „доза - время облучения” (частота мутаций
при остром облучении, деленная на частоту мутаций при хро-
ническом облучении при равной общей дозе) различна для от-
дельных сайтов. Этот факт указывает на то, что толковые му-
тации могут быть связаны с определенными нуклеопротеида-
ми или конфигурацией ДНК.
О том, что толковые мутации могут формироваться без
участия репарационных ферментов, свидетельствует и работа
[104]. Авторами обнаружены вставки Р-транспозонов в сайтах
мутаций, индуцированных при синдроме дисгенезиса у гибри-
дов дрозофилы, и исследовано влияние нарушений систем ре-
парации ДНК (пострепликативной и эксцизионной) у разных
линий дрозофилы на активность Р-транспозонов. Оказалось,
что нарушения одного или двух путей репарации не влияют
на транспозицию P-элементов. Был сделан вывод о том, что
25
Р-транспозоны функционируют независимо от систем репара-
ции ДИК и сами кодируют продукты, необходимые для осуще-
ствления процесса их транспозиции, так же, как и мобильные,
элементы прокариот и низших эукариот [104].
Согласно современным представлениям о функционирова-
нии репаративных систем в клетках эукариот отдельные -био-
химические реакции репарации ДНК протекают не независимо,
а взаимосвязанно и некоторые из них позволяют клетке функ-
ционировать, несмотря на присутствие повреждения, причем
синтез ДНК может идти „в обход” нерепарированных повреж-
дений [105].
Очевидно, этим и объясняются факты отсутствия репара-
ции в клетках млекопитающих, обнаруженные в ряде работ.
Так, в работе [106] показано, что в некоторых линиях живот-
ных клеток димеры не вырезаются. В работе [107] отмечается,
что клетки почти всех млекопитающих вообще лишены фото-
реактивирующего фермента. В то же время в исследовании
[108] делается вывод о том, что в клетках роговицы глаза воз-
никают „не фоторепарируемые поражения”, хотя тесты in vitro
(при экстракции ДНК из этих же клеток) показывают, что фото-
реактивируемые поражения ДНК фактически полностью ре-
парируются.
Нерепарабельные или нерепарированные повреждения дд-
живакуГдо. синтеза ДНК и фиксируются в толковые мутации
редупликапионным механизмом 1107L
Ряд авторов считают, что измененные основания вызывают
мутации скорее путем неправильного спаривания, чем путем
склонной к ошибкам репарации [109-111]. Предполагается,.что
причиной возникновения ошибок спаривания является иони-
зация оснований ДНК 1112. 1131. В работе [1141 показано, что
частота образующихся ошибочных спариваний оснований не
согласуется с таутомерной моделью. Предполагается, что вы-
бор нуклеотидов управляется не Ферментом, а различиями
в свободных энергиях спаривания оснований, так как отдель-
ные водородные связи обладают различной связывающей спо-
собностью в зависимости от их расположения.
Механизм образования замены пар оснований путем не-
правильного спаривания описан в ряде работ [115-119]. Напри-
мер, в работе [120] приводится схема образования и фиксации
мутаций путем встраивания измененного основания при веге-
тативной репликации и делается вывод о том, что фиксация
мутаций определенного типа зависит не от эксцизионной ре-
парации, а от вегетативной репликации ДНК. При этом событи-
ем, фиксирующим мутации, является ошибка репликации на
данном участке ДНК.
26
Известно несколько типов процессов ошибочного спарива*
ния оснований. Среди них - таутомеризация, ионизация и кон-
формационные изменения (анти-син-вращение пуринов и не-
однозначное образование пар оснований). Ряд американских
исследователей [121] рассмотрели процесс образования водо-
родных связей между нормальными и модифицированными
азотистыми основаниями с новых позиций. Термодинамиче-
ские исследования ионизации и таутомеризации оснований
позволили авторам сделать вывод о важности ионизиррван-
ных структур для стабилизации модифицированной ДНК в фи-
зиологическихусловиях^Го связи между способностью к оши-
бочному спариванию измененных мутагеномГоснований и об-
разованием ионизированных пар основании," г
На репарацию ДНК у эукариот большое влияние оказывает
хроматин. Возможно, из-за этого число генов, контролирую-
щих репарацию у высших организмов, больше, чем у прока-
риот. По мнению Кимбелла [122], реальные процессы репара-
ции у эукариот еще требуют своего выяснения.
Таким образом, существуют различия в становлении точ-
ковых и структурных мутаций и, в частности, в зависимости
выхода этих двух типов мутаций от эффективности репараци-
онных процессов в клетке. Ряд авторов [23, 123] приходят к
выводу, что аберрации хромосом и толковые мутации являют-
ся следствиями разных типов первичных повреждений и репа-
рационных путей. Различие репарационных путей становления
этих двух типов мутаций не вызывает сомнений. Но различны
ли первичные повреждения, приводящие к толковым и хромо-
сомным мутациям? Мнлглчигп<»нны<» экспериментальные дан-
ные свидетельствуют об обратном.
13. Общность происхождения хромосомных
и точковых мутаций
Ряд современных данных свидетельствует о возможной
связи между первичными повреждениями азотистых основа-
ний и формированием хромосомных перестроек. Рассмотрим
некоторые из них.
1. Неионизирующие излучения и химические мутагены не
способны вызывать фосфодиэфирные и межуглеродные разры-
вы. Для них характерны лишь реакции, обусловливающие по-
тери и модификации оснований. Тем не менее эти мутагены
образуют такие же структурные перестройки хромосом, как и
ионизирующие излучения. _
2. При введении в пиримидиновое ядро заместителей Br, С1
и при включении В ДНК БДУ возникают спонтанные и увели-
27
чивается выход индуцированных УФ и рентгеновским излуче-
нием аберраций хромосом [124-126].
При этом радиочувствительность хроматид зависит от сте-
пени замещения тимидина ДНК на БДУ. При замещении более
чем на 60 % количество разрывов в облученных хроматидах
в 3 раза выше, чем при отсутствии замещения [127]. Установле-
но, что в бромурацильной ДНК под действием УФ и рентгенов-
ского излучения цепочка реакций начинается с диссоциации
атома брома, затем происходят свободнорадикальные превра-
щения сахарного остатка, что приводит в конечном итоге к
одиночному разрыву сахарофосфатного остова и образованию
структурных мутаций хромосом [128].
3. Химический распад оснований в ДНК, например дезами-
нирование, может содействовать разрыву водородных связей
[1]. Кроме того, „стопка” оснований может рассыпаться и без
разрыва полинуклеотидной цепи в тех местах, где межплоско-
стное взаимодействие оснований нарушается вследствие по-
тери или модификации одного из нуклеотидов. Эти факты ука-
зывают на то, что разрывы нити ДНК могут быть следствием
нестабильности цепи, создавшейся в результате потери или
модификации нуклеотидов.
4. К аналогичному выводу приводят и данные о реплици-
рующейся нестабильности хромосом, при которой разрывы
хромосом возникают спустя десятки клеточных поколений по-
сле облучения. Следовательно, имеет место репликация пред-
мутационных потенциальных изменений, ведущих к аберраци-
ям хромосом. Отсюда вытекает, что молекулярной сущностью
таких потенциальных изменений должны быть изменения ну-
клеотидной последовательности в ДНК, так как данных о том,
что в ДНК может реплицироваться что-либо другое, нет.
5. Ионизирующая радиация может вызвать активацию
транспозируемых элементов, находившихся ранее в неактив-
ном состоянии [129]. Транспозоны, меняющие порядок располо-
жения нуклеотидов, повышают темп образования как толко-
вых, так и хромосомных мутаций [130]. Транслокация транспо-
зонов сопровождается крупными делениями и инверсиями [72].
6. Определенные индуцированные повреждения ДНК -
межнитевые сшивки типа димеров тимина - служат причиной
образования аберраций хромосом [131].
Таким образом, можно сделать вывод о том, что при дей-
ствии облучения на ДНК первичные реакции начинаются с по-
вреждения азотистых оснований. Часть из них (возможно, не-
репарабельные или нерепарированные по разным причинам)
фиксируются в виде точковых мутаций. Другие могут быть
основой для появления структурных мутации хромосом, j
28
Мутационные Замены аминокислот бывают двух типов:
1) не нарушающие а- или р-спиральной конформации; 2) при-
водящие к их повреждению разной тяжести: разрушению N-
или С-концов, переходу из а- в р-спиральную конформацию
и наоборот или разлому исходной вторичной структуры с об-
разованием двух новых [132,133].
Может быть, мутационные изменения первого типа, не на-
рушающие конформации хроматина, не подвергаются воздей-
ствию репарационных ферментов и дают начало толковым му-
тациям, а повреждения второго типа приводят путем различ-
ных взаимодействий друг с другом и ферментами репарации
к образованию хромосомных перестроек?
В 1980 г. была выдвинута гипотеза, согласно которой в ос-
нове инициации хромосомных перестроек лежат нарушения
оснований ДНК [134]. Эта гипотеза - итог многолетних иссле-
дований механизмов образования аберраций хромосом, в ходе
которых было установлено, что при действии репарационных
ферментов на поврежденные основания ДНК образуются оди-
ночные разрывы хромосом, которые в свою очередь фермен-
тативно преобразуются в двойные разрывы, дающие начало
структурным мутациям [135].
Примерно 2 % всех повреждений ДНК инициируют хромо-
сомные аберрации [136, 137]. Поскольку в ядре 2 % всей ДНК
представлено якорной ДНК, предполагается, что молекуляр-
ные изменения именно в якорной ДНК являются причиной
хромосомного мутагенеза, а повреждения в других участках
не приводят К нарушению структурной целостности хромо-
сомы.
Молекулярные аспекты проблемы „горячих точек” в му-
тагенезе рассматриваются в работе [138], в которой указывает-
ся, что мутации типа замены пар оснований и типа сдвига рам-
ки считывания часто обнаруживаются в участках ДНК с повто-
рами и в асимметричных сайтах квазипалиндромов. Повторы
одного или нескольких нуклеотидов являются предпосылкой
для смещенного устраивания комплементарных нитей ДНК с
образованием свободных от водородных связей петель. Ква-
зипалиндромы имеют крестообразную структуру, в которой
сайты асимметрии также создают петли. Мутации, по мнению
автора, возникают по местам петель в результате либо эксци-
зионной репарации, либо аберрантной репликации.
Таким образом, индуцированные облучением толковые
мутации формируются в более короткий промежуток времени
и в меньшей степени, чем хромосомные перестройки, зависят
от различных внутриклеточных процессов, в том числе и репа-
рационных. К тому же в формировании перестроек хромосом
29
существенную роль Играет и белок как составная часть хромо-
сомы, что Несомненно влияет на репарацию предмутационных
изменений. '
^Сформированные мутации в зависимости от своего функ-
ционального значения приводят или к изменению генотипа,
Или к гибели клетки (см. рис. 1.1)^
.Следовательно, если первичные повреждения азотистых
оснований не подвергаются воздействию репарационных фер-
ментов (из-за нерепарабельности или недоступности для этих
ферментов), то они фиксируются в виде точковых мутаций.
Если же системы восстановления узнают измененное основа-
ние и взаимодействуют с ним, тр-повреждение либо восстанав-
ливается к норме, либо дает начало Формипонанию хромосом-
нойттерестройки.—
ГЛАВА 2
ВЛИЯНИЕ ХИМИЧЕСКИХ ВЕЩЕСТВ
НА ГЕНЕТИЧЕСКОЕ ДЕЙСТВИЕ ОБЛУЧЕНИЯ
У ЖИВОТНЫХ
2.1. Серосодержащие радиопротекторы
Первая попытка защитить от облучения наслед-
ственные структуры-половых клеток была сделана в 1953 г.
с помощью самого эффективного в то время' радиопротекто-
ра - цистеамина (МЭА). Было проведено две серии экспери-
ментов с дрозофилой и мышами, в результате которых умень-
шение мутагенного действия облучения не было обнаружено
[142, 143].
Попытка уменьшить с помощью цистеамина мутагенный
эффект облучения у тутового шелкопряда была предпринята
в 1955 г. [144]. Наряду с этим исследовался генетический эф-
фект цистеина, защитное действие которого против вызванной
облучением гибели было показано в 1949 г. на мышах [145].
Оказалось, что оба препарата не уменьшают частоту радиому-
таций у тутового шелкопряда. Одновременно [146] проводи-
лось генетическое изучение цистеина на дрозофиле. Защитный
эффект обнаружить не удалось.
В 1955 г. был выявлен еще один радиопротектор - гуани-
диновое производное цистеамина - АЭТ [147]. Этот препарат
оказался эффективным в защите от биологических эффектов
облучения и менее токсичным по сравнению с другими SH-npo-
текторами. Поэтому АЭТ неоднократно исследовали с точки
30
зрения его радиозащитного действия, в том числе от генетиче-
ского эффекта облучения. Так, уже в 1958 г. было изучено вли-
яние АЭТ на мутагенный эффект облучения у дрозофилы и
установлен эффект истинной сенсибилизации вместо защи-
ты [148].
Производное АЭТ - аминоэтилизотиуромочевина. В ре-
зультате ее испытаний [140] было обнаружено, что она не яв-
ляется защитным препаратом против индуцированных облу-
чением доминантных леталей у мышей. Авторы предполагали,
что причина полученных отрицательных результатов - низкая
концентрация препарата в зародышевых клетках в период
облучения. Действительно, при исследовании распределения
цистеамина в организме мыши с помощью S35 [150] наблюда-
лось неравномерное распределение протектора по органам -
через 20 мин после внутривенной инъекции концентрация пре-
парата в семенниках была очень низкой [150]. Вместе с тем су-
ществовали данные о снижении стерильности облученных жи-
вотных при обработке их протекторами. Так, в работе [151] об-
наружено уменьшение стерильности самок, а в работе [152] -
самцов облученных мышей, которым инъецировали цистеамин.
Показано, что инъекции цистеамина крысам до облучения за-
метно ослабляют процесс гибели сперматогониев [153]. Эти
факты свидетельствовали о том, что даже малое поглощение
протектора половыми клетками все-таки обеспечивает осуще-
ствление защиты их от гибели. Были основания полагать, что
агенты, защищающие зародышевые клетки от гибели, могут
защищать их и от генетических повреждений. Вот почему авто-
рами работы [154] были подвергнуты сомнению исследования
[141, 142] и проведено исследование по той же методике с це-
лью перепроверки результатов изучения генетической эффек-
тивности цистеамина. Им удалось показать, что цистеамин, не
влияя на гибель эмбрионов в необлученной группе, снижает
ее у облученных животных. При облучении мышей в дозе 300 Р
частота доминантных летальных мутаций уменьшается с 26,9
до 22,7 %, а при облучении в дозе 600 Р - с 41,4 до 34,5 %?
Такое расхождение результатов с результатами, получен-
ными в работах [142, 143], авторы объяснили различием $ сро-
ках введения препарата, который вводился ими за 15 &ин до -
облучения, в то время как в данных работах препарат вводил-
ся за 4-7 мин. Этот интервал мог оказаться недостаточным для
проникновения вещества в сперму.
Аналогичные результаты были получены и в работе [155]
при исследовании, проведенном на мышах и на обезьянах.
Внутрибрюшинное введение цистеамина за 10 мин до облуче-
ния различными дозами рентгеновского излучения снижало
31
частоту хромосомных перестроек в зародышевых клетках мы-
шей в среднем на 42,7%. Обезьян облучали в дозе 200 Р и так-
же обнаружили уменьшение числа хромосомных аберрации
в сперматоцитах первого порядка на 50,8 %.
Однако вслед за работами, показавшими защитный эффект
цистеамина против мутагенного действия облучения, появи-
лась целая серия генетических исследований, в которых серо-
содержащие препараты оказались либо неэффективными, либо
усиливали мутагенное действие облучения. Так, совместное
действие АЭТ и рентгеновского излучения исследовалось на
дрозофиле [156]. Введение АЭТ усилило радиочувствитель-
ность всех стадий сперматогенеза. К тому же АЭТ в этих опы-
тах оказывал и мутагенное действие, в 2 раза увеличивая час-
тоту сцепленных с полом летальных мутаций.
Наряду с этим было установлено, что цистеин, не уменьша-
ет выхода сцепленных с полом рецессивных деталей, а АЭТ
усиливает частоту таких радиомутаций у дрозофилы [157].
Возможности уменьшения мутагенного эффекта облуче-
ния детально исследовались с помощью сульфгидрильных со-
единений у дрозофилы [158]. Изучалось влияние трех препара-
тов - цистеамина, АЭТ и глютатиона на возникновение самых
разнообразных мутаций: РЛМ, транслокаций, делеций, ДЛМ, а
также потерь X- и Y-хромосом. Изучение проводилось с учетом
всех стадий сперматогенеза. Оказалось, что ни один препарат
не снизил частоты ни одного типа мутаций ни на одной стадии
развития зародышевых клеток. Более того, цистеамин увели-
чивал выход всех типов радиомутаций (кроме транслокаций)
на той или другой стадии сперматогенеза. Глютатион увеличи-
вал частоту потерь хромосом в сперматоцитах и доминантных
летальных мутаций в сперматидах. Автор предположил, что
изученные им препараты повышают частоту мутирования, за-
тормаживая восстановительные процессы или уменьшая вре-
мя, в течение которого происходит фиксация мутаций.
Полученные отрицательные результаты поставили под со-
мнение возможность генетической защиты от облучения [159].
Однако Кункель описал возможные физико-химические меха-
низмы генетической защиты и признал такую защиту теорети-
чески возможной. В то же время приведенные им данные гене-
тических исследований цистеина и АЭТ на дрозофиле показа-
ли, что цистеин не влияет на частоту индуцированных облуче-
нием рецессивных летальных мутаций, а усиливает мутаген-
ное действие облучения на 37 %. Вот почему вопрос о практи-
ческой возможности защиты от радиогенетических поражений
остался без ответа.
Тем не менее среди серии отрицательных результатов
32
были и положительные. Эксперименты выполнялись на мы-
шах. Так, в работах [160,161] показано, что и цистеин, и АЭТ
уменьшают на 6 % частоту ДЛМ, вызванных облучением в спер-
матидах мышей (защита на прочих стадиях не была сущест-
венной).
Защитный эффект при использовании АЭТ обнаружен и в
работах [162-164], в которых исследовалось его влияние на
эмбриональную гибель, обусловленную возникновением ДЛМ,
на разных стадиях сперматогенеза у мышей. АЭТ защищает
спермин мыши от возникновения в них радиомутаций при об-
лучении в дозе 1200 Р и неэффективен при дозе 400 Р. Что же
касается сперматид, то в них АЭТ снизил значительно предим-
плантационную гибель, вызываемую дозой 1200 Р, и незначи-
тельно постимплантационную гибель при дозе 400 Р. Влияние
АЭТ исследовалось на мутагенный эффект облучения у мы-
шей по тесту хромосомных перестроек в сперматоцитах [165].
Эффект АЭТ, как и в первом случае, зависел от дозы ра-
диации: при дозе 100 Р препарат вызывал статистически досто-
верную защиту (на 30 %), а при дозе 200 Р введение АЭТ, наобо-
рот, усиливало повреждающее действие облучения. Исследо-
вания влияния АЭТ на частоту доминантных летальных мута-
ций, индуцированных облучением у мыши, подтвердили спо-
собность этого соединения защищать от генетических повреж-
дений [166]. Правда, эффект был обнаружен только для спер-
матоцитов при облучении их в дозе 400 Р. Клетки, находящие-
ся на прочих стадиях сперматогенеза, защитить с помощью АЭТ
не удалось. Одновременно изучался и цистафос, но он не дал
никакого защитного эффекта.
Из описанных работ, в которых показана возможность за-
щиты мышей от мутагенного действия облучения с помощью
АЭТ, три проведены по одному и тому же тесту - частоте до-
минантных летальных мутаций. Попробуем их сравнить: в ра-
ботах [160, 161] показано, что АЭТ защшцает ранние спермати-
ды и неэффективен для других клеток сперматогенеза при об-
лучении в дозе 600 Р. В работах [162-164] этот препарат защи-
щал спермин и частично сперматиды при дозе 1200 Р и не давал
эффекта при дозе 400 Р. В работе [166] обнаружена возможность
защиты при облучении сперматоцитов в дозе 400 Р и отсутствие
защиты на прочих стадиях. Таким образом, даже при исследо-
вании одного и того же препарата на одном и том же объекте и
По одному и тому же тесту результаты трудносравнимы. Кон-
центрация препарата и время его введения относительно облу-
чения во всех трех работах почти одинаковы. Исследование
этого же соединения на крысах показало, что АЭТ не защищает
этих животных от возникновения индуцированных облучени-
з. Зак. 5222. 33
ем ДЛМ [167]. Такое же отсутствие эффекта было обнаружено
автором при исследовании цистеамина.
Препараты АЭТ и цистеамин изучались также и на кроли-
ках [168] с учетом частоты ДЛМ. Поскольку многие авторы свя-
зывали неудачи в осуществлении защиты половых клеток от
облучения с плохим проникновением протектора в гонады
через физиологические барьеры, в данном случае проводились
облучение л обработка спермиев кролика in vitro. Защитные
вещества вводились в эякулят, и спермин таким образом об-
лучались либо в физиологическом растворе, либо в растворе
протектора. Оказалось, что и в этом случае ни АЭТ, ни цисте-
амин не уменьшали мутагенного действия V -лучей. Получен-
ный результат уже нельзя объяснить непроникновением про-
тектора в гонады, поэтому авторы считали более вероятным,
что эти соединения не могут вступать в реакции, ведущие к
защитному эффекту, с соответствующими молекулами, и в пер-
вую очередь с ДНК, сосредоточенной в головке сперматозоида.
За последующие 10 лет появились еще 4, работы, В'которых
изучалось радиозащитное действие сульфгидрильных соеди-
нений против мутагенного эффекта облучения у животных.
В одной из них [169] исследовалось влияние цистеамина на
частоту РЛМ. У дрозофилы эффекта обнаружено не было. Эта
работа после исследований [142,143] еще раз показала, что цис-
теамин не способен защищать половые клетки дрозофилы от
возникновения в них радиомутаций. К такому же выводу при-
шли и авторы работы [170], показавшие отсутствие защитного
действия цистеамина против индуцированных облучением
рецессивных летальных мутаций у дрозофилы. Однако им уда-
лось показать, .что АЭТ снижает выход таких мутаций. Выяви-
лись некоторые специфические особенности этого препарата.
Так, АЭТ, снижая частоту хромосомных деталей, одновремен-
но увеличивает процент выхода хромосомных семилеталей.
Отсутствие защитного эффекта цистеамина против инду-
цированных рентгеновским излучением генетических повреж-
дений у дрозофилы было показано и в работе [171], хотя глута-
тион в их опытах проявил защитное действие.
Четвертая работа выполнена на мышах [172]. При исследо-
вании выхода доминантных летальных мутаций в постсперма-
тогониальных стадиях обнаружено, что при облучении в дозе
100 Р цистамин повышает постимплантационную гибель эмбри-
онов, при облучении в дозе 300 Р, наоборот, снижает ее, а при
облучении в дозе 600 Р оказывается неэффективным. На выход
реципрокных транслокаций в сперматогониях мышей циста-
мин не влияет.
Поскольку проникновению радиопротекторов в гонада
34
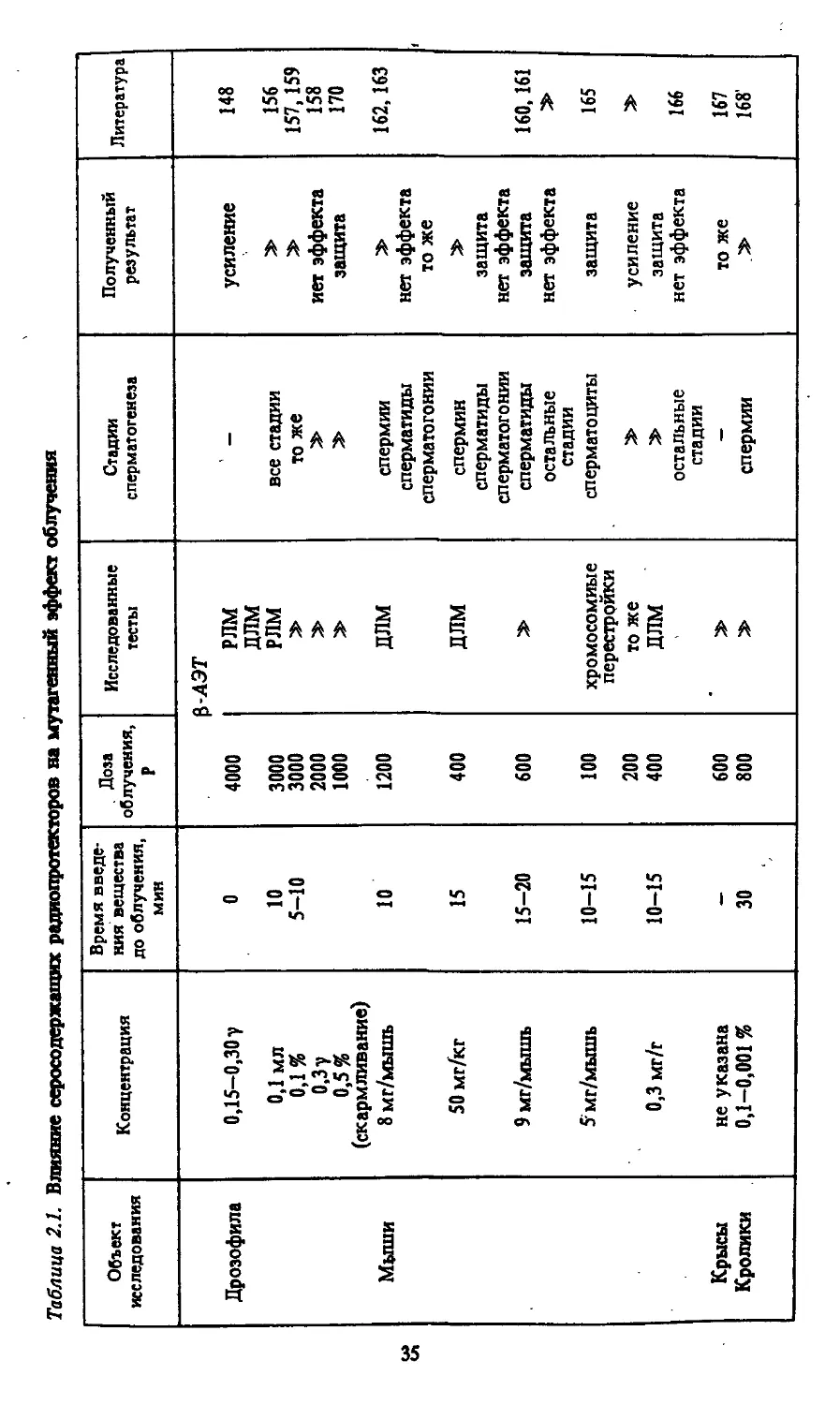
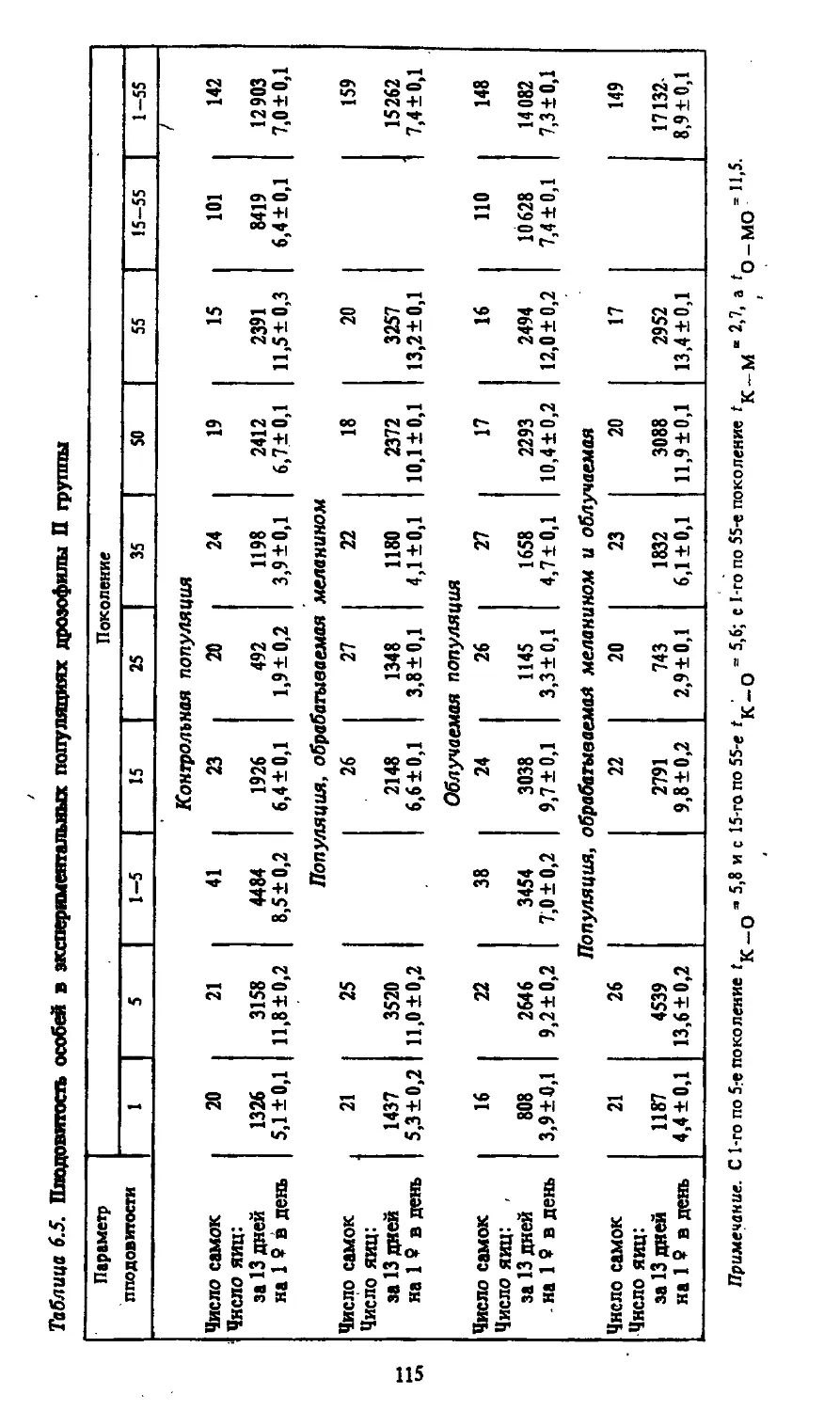
Таблица 2.1. Влияние серосодержащих радиопротекторов на мутагенный эффект облучения
Объект исследования Концентрация Время введе- ния вещества до облучения, мин Доза облучения, Р Исследованные тесты Стадии сперматогенеза Полученный результат Литература
Дрозофила 0,15—0,30у 0 4000 З-АЭТ РЛМ усиление 148
0,1 мл 10 3000 длм РЛМ все стадии 156
6,1% 5-10 3000 то же 157,159
Мыши 0,3 у 0,5% (скармливание) 8 мг/мышь 10 2000 1000 1200 длм спермии иет эффекта защита 158 170 162,163
50 мг/кг 9 мг/мышь 15 15-20 400 «00 длм сперматиды сперматогонии спермин сперматиды сперматогонии сперматиды нет эффекта то же защита нет эффекта защита 160,161
5'мг/мышь 10-15 100 хромосомные остальные стадии сперматоциты нет эффекта защита 165
Крысы 0,3 мг/г не указана 10-15 200 400 600 перестройки то же ДЛМ остальные стадии усиление защита нет эффекта то же » 166 167
Кролики 0,1-0,001 % 30 800 спермии 168'
Продолжение табл. 2.1
Объект исследования Концентрация Время введе- ния вещества до облучения, МИИ Доза облучения, Р Исследованные тесты Стадии сперматогенеза Полученный результат Литература
АЭМ
Мыши 0,25 мг/г 30 500 ДЛМ нет эффекта | 149
Цистеамин
Дрозофила 0,25? 15 2400 РЛМ — то же 142
ДЛМ —
0,4 и 1у — 2000 РЛМ сперматиды усиление 158
остальные нет эффекта
стадии
и» транслокации все стадии то же
9* делеции сперматиды усиление
прочие нет эффекта
потери X- и сперматоциты усиление
Y-хромосом остальные нет эффекта
стадии
ДЛМ постмейотические усиление
предмейотические нет эффекта
0,5у 1500 РЛМ все стадии то же 169
1,5% 1000 РЛМ то же 170
(скармливание)
0,25у — 2000 постмейотические 171
транслокации
Тутовый 0,01% 0 4215 ДЛМ — 144
шелкопряд 8430 видимые
Мыши 4мг/мышь 4-7 500. ДЛМ все стадии 143
4мг/мышь 15 600 — защита 154
150 мг/кг 10 200 хромосомные сперматоциты 155
400 перестройки
600
Крысы не указана — 600 ДЛМ — нет эффекта 157
Кролики 0,1-0,001% 5 800 спермин то же 158
Обезьяны 100 мг/кг 10 200 хромосомные перестройки сперматоциты зашита , 155
Цистеин
Дрозофила 5% 5-10 3000 РЛМ — нет эффекта 157,158
0,05—0,1 мл 5-10 .3600 — то же 146
Тутовый 0,01% 0 4215 ДЛМ — 144
шелкопряд 8430 видимые —
Мыши Эмг/мышь 15-20 600 ДЛМ — защита 160,161
Цистамин
150 мг/кг 10—15 100 постспермато- слабое усиление 172
гониальные
стадии
300 то же защита на 17,5 %
600 нет эффекта
100 транслокации сперматогонин то же
300
600
50 мг/кг 15 300 геноциты защита 173
Цистафос
I 0,3 мг/г 10-15 400 ДЛМ все стадии нет эффекта 172
Глутатион
Дрозофила 2,5-у 2000 РЛМ то же то же 158
транслокации
потери X- и Y-хромосом сперматоциты усиление
Продолжение табл. 2.1
Объект исследования Концентрация Время введе- ния вещества до облучения, мнн Доза облучения, Р Исследованные тесты Стадии сперматогенеза Полученный результат Литература
Дрозофила 2,5 у - 2000 длм РЛМ транслокации остальные стадии сперматиды остальные стадии постмеиотические нет эффекта усиление иет эффекта защита нет эффекта 171
Таблица 2.2. Влияние амиш» на мутагенный эффект облучения
Объект исследования Концентрация Время введе* ння вещестда до облучения, мин Доза облучения, Р Исследованные тесты Стадии сперматогенеза Полученный результат Литература
Дрозофила 1 % (по 1 мл) ' Се 3000 ротонин РЛМ усиление 175
1 % (по 0,1 мл) — 3000 — 176
0,5. % — 1000 все стадии нет эффекта 170
(скармливание) 0,5% 10-90 Мегафе 1500 и (аминозин) то же • то же 174
2000 3000 А А А А А А
Мыши 0,25% 0,08 мг/г 5 10-15 метокситрш 1000 400 600 200 гтамин (мексамиН) 3> ДЛМ все стадии сперматиды остальные стадии сперматоциты остальные стадии все стадии зашита нет эффекта защита нет эффекта то же 170 166
Таблица 2.3. Влияние антибиотиков на мутагенный эффект облучения
Объект исследования Концентр алии Время введе- ния вещества до облучения, мин Доза облучения, Р Исследованные тесты Стадии сперматогенеза Полученный результат Литература
Актиномицин Д
Дрозофила 1-10~3М (скармливание) - 3000 . РЛМ — защита 177
5-10-4М 25 1000 летали в кольцевой Х-хромосоме спермин сперматиды усиление защита 179
1 мг/мл 360 600 РЛМ сперматоциты остальные стадии нет эффекта 182
0,1 мг/мл — 2000 потери Х-хромосом все стадии усиление | 184
Продолжение табл. 1.3
Объект исследования Концентрация Время введе- ния вещества до облучения, мин Доза облучения, Р Исследованные " тесты Стадии сперматогенеза Полученный результат Литература
нерасхождение Х-хромосом ДЛМ все стадии усиление
Дрозофила 10 мг/мл - 2000 спермии 185
Мыши 1,75 мг/кг 30-40 200 190
сперматоциты аддитивность 191
мутации сперматогонии усиление
специфических
локусов
Пенициллин
Дрозофила 10000—80000 ед/мл (скармливание) - 3000 РЛМ . все стадии защита 178
0,1 % (по 0,1 мл) 30 1000 сперматиды 186
20000 ед/мл (скармливание) - 500 1000 остальные стадии спермии нет эффекта защита 187
2000
3000
Митомицин С
100? — 600 сперматиды 193
сперматоциты
сперматогонии усиление
остальные стадии нет эффекта
100 мкг/мл до и после 500-4000 видимые в 12 локусах частичные полные постмейотические защита нет эффекта 191,192
>> 0,1 % (по 0,1 мл) 30 Стре 1000 птомииин сперматиды то же 186
5-104у/мл 1000 остальные стадии все стадии 188
Мыши 0,5 мг/мышь 480 3000 150 хромосомные то же сперматоциты защита 189
Дрозофила 1,0 мг/мышь 3,0 мг/мышь 5,0 мг/мышь 0,04 мг/мл 480 480 480 90 Хлор 1200 перестройки то же амфеникол РЛМ спермии нет эффекта то же усиление 180
0,25 % (по 0,1 мл) 30 1000 сперматиды зашита 186
Мыши 1,5 г/кг 240 600 ДЛМ остальные стадии спермии нет эффекта усиление 190
сперматиды нет эффекта
Таблица 2.4. Влияние фенольных соединений на мутагенный эффект облучения
Объект исследования Концентрация Время введе- ния вещества до облучения, мин Доза облучения, Р Исследованные ' тесты Стадии сперматогенеза Полученный результат Литература
Дрозофила 0,05% 0,003 % (скармливание) 0,05% 0,5 мг/мл 0,5 мг/мл (скармливание) 0,15 мкг/муху 0,30 мкг/муху 0,45 мкг/муху 10 240 0 0 2,4-ди 1000 1000 1000 1000 1000 нитрофенол РЛМ транслокации ДЛМ > РЛМ » сперматоциты ранние стадии спермии сперматиды спермии остальные стадии спермии сперматиды сперматоциты сперматогонии все стадии защита нет эффекта то же защита нет эффекта защита > > нет эффекта то же 200 201 204 202 203 203 263 203
препятствует гематотестикулярный барьер, который начинает
функционировать у млекопитающих в первые недели постна-
тального периода, Померанцева [173] предположила, что сте-
пень защитного эффекта протектора можно увеличить, если
препарат ввести до начала функционирования этого барьера.
Для проверки данного предположения цистамин вводили бере-
менным самкам накануне родов за 15 мин до облучения в дозе
ЗГр. В этот срок половые клетки самцов являются гоноцита-
ми. Поскольку чувствительность эмбрионов к токсическому
действию протектора выше, чем у взрослых животных, то кон-
центрация вводимого цистамина составляла 50 мг/кг, т. е. в
три раза ниже, чем та, которая применялась для защиты взрос-
лых животных. Экспериментально было показано, что циста-
мин в такой дозе не снижал выхода реципрокных транслока.-
ций, индуцированных облучением в сперматогониях полово-
зрелых мышей. Оказалось, что использование цистамина для
защиты самцов, облученных в эмбриогенезе, существенно сни-
жает уровень реципрокных транслокаций, при этом степень
защитного эффекта выше, чем при введении цистамина в трех-
кратной концентрации взрослым животным.
Литературные данные о влиянии серосодержащих протек-
торов на мутагенный эффект облучения, полученные разными
авторами при испытании одних и тех же препаратов на одних и
тех же объектах по исходным методикам, достаточно неодно-
родны. При этом на насекомых положительные результаты в
подавляющем большинстве случаев не достигнуты. Что же ка-
сается исследований, проведенных на млекопитающих, то ре-
зультаты их крайне противоречивы (табл. 2.1). Таким образом,
эти сведения не дают возможности считать хотя бы какой-либо
из серосодержащих протекторов эффективным радиозащит-
ным средством против мутагенного эффекта облучения в по-
ловых клетках животных.
22. Амины
По своему радиозащитному действию против ле-
тального эффекта облучения некоторые амины соперничают с
серосодержащими препаратами. Протекторные свойства ами-
нов, очевидно, обусловлены создаваемой ими гипоксией. По-
скольку путем снижения концентрации кислорода можно
уменьшить генетический эффект облучения, казалось вероят-
ным, что препараты, вызывающие гипоксию, проявят защитное
действие и против мутагенного эффекта радиации. Однако при
генетическом исследовании аминов, наиболее эффективных
кзащиТГоГлучевой гибели, в большинстве случаев получены
43
отрицательные результаты. Так, в работе [174] инъекции ме-_
гафена перед облучением не оказали никакого влияния на
частоту рецессивных летальных мутаций у дрозофилы.
В то же время удалось показать [157], что инъекции серо-
тонина уменьшают частоту индуцированных облучением ре-
цессивных летальных мутаций в зрелых спермиях дрозофилы,
хотя в более поздней работе [175] получен противоположный
эффект: под влиянием серотонина частота радиомутаций в зре-
лых спермиях дрозофилы увеличивалась в 2 раза. Помимоэф-
фекта сенсибилизации авторы обнаружили и сильный мутаген-
тныи эффект серотонина - уровень спонтанных мутаций под
влиянием этого препарата повысился в 3 раза.
Аналогачныё~результаты получены в работе [176], в кото-
рой авторы использовали те же концентрации серотонина (инъ-
екции 1%-ного раствора) при облучении дрозофилы в той же
дозе и получили увеличение выхода рецессивных сцепленных
с полом мутаций в 2 раза.
Получен и другой результат: влияние серотонина на час-
тоту рецессивных летальных мутаций у дрозофилы не об-
наружено [170]. Авторы, исследовали и эффективный радио-
протектор - мексамин. Этот препарат также не защищал поло-
вые клетки дрозофилы от возникновения в них хромосомных
и хроматидных деталей и полулеталей [170]. Однако в работе
[166] показана защита половых клеток мышей от индуцирован-
ных генетических повреждений с помощью мексамина, но эф-
фективность защиты зависела от стадии развития зародыше-
вых клеток и дозы радиации. Так, при облучении сперматоци-
тов наблюдалось небольшое снижение частоты радиомутаций
лишь при дозе 600 Р. При воздействии на сперматиды защит-
ный эффект проявлялся лишь при дозе 400 Р, а при воздей-
ствии на сперматозоиды мексамин оказался неэффективным
при всех дозах облучения (200,400,600 Р).
Итак, все исследователи, изучавшие серотонин и аминазин
(мегафен), показали либо отсутствие эффекта, либо эффект
сенсибилизации (табл. 2.2). Действие мексамина проверено
только в двух работах, причем на различных объектах. В ра-
боте [166] показано, что этот препарат защищает от облучения
в дозе 400 Р только сперматиды, а при дозе 600 Р - только спер-
матоциты мышей. На дрозофиле защитного эффекта мексамина
не обнаружено [170].
Таким образом, амины, так же как исеросодержащие ра-
диопротекторы, малоэффективны (илИ совсем^неэффективны)
в защите половых клеток животных от мутагенного действия
ионизирующей радиации.
44
2.3. Антибиотики
Особую группу среди модификаторов метаболизма
представляют антибиотики. Их исследование в качестве воз-
можных протекторов против генетического эффекта облуче-
ния у животных началось в работах [177, 178] и [179, 180]. В ра-
ботах [177, 178] исследовано два антибиотика: актиномицин Д
и пенициллин. Актиномицин Д, вводимый с питательной сре-
дой, эффективно (на 40 %) уменьшал частоту рецессивных ле-
тальных мутаций в Х-хромосоме дрозофилы после рентгенов-
ского облучения в дозе 3000 Р. Пенициллин также снижал час-
тоту индуцированных облучением рецессивных летальных му-
таций на всех стадиях развития зародышевых клеток. Резуль-
таты эти были интересны, тем более что пенициллин не обла-
дает такой высокой токсичностью, как серосодержащие радио-
протекторы (однако в работах [177, 178] показано, что сам по
себе пенициллин несколько повышает частоту спонтанных му-
таций).
Такие антибиотики, как актиномицин Д и хлорамфеникол,
исследовались в работах [179-181]. Оказалось, что оба антибио-
тика уменьшали частоту индуцированных облучением мута-
ций на стадии сперматид и поздних сперматоцитов, увеличи-
вая их количество в зрелой сперме.
Аналогичные результаты при испытании актиномицина Д
получены в работе [182]: препарат способен уменьшать частоту
рецессивных сцепленных с полом летальных мутаций, вызыва-
емых у дрозофилы у-лучами в дозе 600 рад на стадиях сперма-
тид и сперматоцитов.
Однако после первых положительных результатов после-
довал ряд работ по радиозащитному эффекту антибиотиков,
в которых выявлена примерно такая же противоречивая кар-
тина, как и при исследовании генетической защиты SH-содер-
жащими протекторами. Так, при изучении актиномицина Д об-
наружен не защитный, а усиливающий эффект этого соедине-
ния. В 1965 г. вышла статья Оливьери [183], в которой был опи-
сан эффект сенсибилизации в сперматоцитах дрозофилы под
действием актиномицина Д (применялось p-излучение). При
изучении влияния этого соединения на частоту вызванных об-
лучением потерь и нерасхождения Х-хромосом у дрозофилы
было показано, что актиномицин Д усиливает индукцию обоих
типов мутаций на всех стадиях сперматогенеза, причем не
только у облученных, но и у необлученных особей [184]. При
этом частота Х-хромосом увеличивалась под действием акти-
номицина Д на два порядка по сравнению с контрольной
группой.
45
При введении актиномицина Д частота ДЛМ в зрелых спер-
миях самцов повышалась в 4 раза по сравнению с контрольной
группой [185]. Этот высокий сенсибилизирующий эффект был
статистически достоверен во всех проведенных экспериментах.
Что касается пенициллина, то при дальнейших исследова-
ниях оказалось, что он снижает частоту радиомутаций не на
всех [177], а лишь на некоторых стадиях сперматогенеза. При
этом в работе [186] показано, что пенициллин защищает только
сперматиды, а в [187] обнаружен радиозащитный эффект этого
препарата в спермиях дрозофилы. Оба автора исследовали час-
тоту рецессивных летальных мутаций в кольцевой Х-хромо-
соме. Методика проведения исследований в обеих работах раз-
личалась только способом введения веществ в организм - в
одном случае инъекции, в другом - скармливание с питатель-
ной средой. Это позволило предположить [187], что разница в
полученных результатах объясняется тем, что эффект пени-
циллина обусловлен не прямой защитой от облучения, а вто-
ричным влиянием на метаболическую активность развиваю-
щихся зародышевых клеток. Поэтому для проявления защит-
ного эффекта в зрелых спермиях пенициллин должен вводить-
ся в организм задолго до облучения, как это происходит при
выращивании мух на питательной среде с добавлением в нее
препарата.
Наряду с пенициллином исследовались и антибиотики -
хлорамфеникол и стрептомицин [186]. Все эти три препарата
одинаково (на 30-50 %) уменьшали частоту радиомутаций на
стадии сперматид. Однако, по данным [188], стрептомицин не
способен защищать зародышевые клетки дрозофилы от воз-
никновения радиомутаций. В обеих работах [186, 188] приме-
нялись инъекции препарата в близких концентрациях самцам
дрозофилы перед облучением их одинаковой дозой 1000Р и
исследовался один и тот же тест - частота рецессивных сцеп-
ленных с полом летальных мутаций на всех стадиях спермато-
генеза дрозофилы. Кроме того, в работе [188] стрептомицин
скармливался с питательной средой, но и этот метод не выявил
способности препарата уменьшать частоту индуцированных
облучением мутаций.'
Влияние антибиотиков на генетический эффект облучения
у млекопитающих впервые было изучено в работе [189]. Стреп-
томицин в низких концентрациях (0,5-1 мг/мышь) вызывал
уменьшение индукции хромосомных перестроек в половых
клетках в среднем на 50 %, а в более высоких (3-5 мг/мышь)
был неэффективным в защите от радиомутаций и повысил час-
тоту спонтанных мутаций.
Хлорамфеникол и митомицин С исследовались на мышах
46
[190] . В результате исследований установлено, что хлорамфе-
никол повышает выход ДЛМ в сперматозоидах более чем на
50 %, не влияя на радиочувствительность сперматид и не ока-
зывая мутагенного действия. В то же время митомицйн С ока-
зался мутагеном для всех стадий сперматогенеза и проявил
выраженный синергический эффект в сперматоцитах. Посколь-
ку митомицин является ингибитором биосинтеза ДНК, было
предположено, что синергический эффект в сперматоцитах
является следствием взаимодействия ионизирующей радиа-
ции и митомицина во время синтеза ДНК [190]. Показано так-
же, что внутрибрюшинные инъекции митомицина С увеличи-
вают частоту индуцированных облучением мутаций специфи-
ческих локусов в сперматогониях мышей [191].
Митомицин С исследовался и на дрозофиле [192]. Результа-
ты показали, что сам антибиотик вызывает высокую частоту
мутаций на всех стадиях сперматогенеза. Примененный _же
перед облучением, митомицин проявляет аддитивное дейст-
вие. Однако на стадиях поздних сперматид и ранних сперма-
тоцитов суммарная часть мутаций уменьшается, а на стадии
сперматогониев увеличивается. На основании этого автором
сделан вывод, что снижение уровня радиомутаций под влия-
нием митомицина С, как и актиномицина Д, на стадиях спер-
матид и сперматоцитов является следствием ингибирования
репликации ДНК [192].
Интересно, что полученный при исследовании митомици-
на С противоположный результат (синергический эффект на
стадии сперматоцитов) автор работы [190] также объяснял спо-
собностью данного антибиотика ингибировать биосинтез ДНК.
В этом случае синергический эффект, по мнению автора, явля-
ется следствием взаимодействия ионизирующей радиации и
митомицина во время синтеза ДНК. При дальнейшем исследо-
вании митомицина С было обнаружено, что он снижает частоту
частичных видимых мутаций в 12 локусах, но не влияет на
выход полных мутаций такого типа [193,194].
Результаты, полученные при испытании антибиотиков в
качестве возможных протекторов против генетического дей-
ствия облучения, трудносопоставимы, так как в большинстве
исследований применялись различные методики и, в частно-
сти, разные генетические тесты. Но даже в тех редких случаях,
когда условия эксперимента были достаточно однородными,
результаты оказывались разными (табл. 2.3) [186-188].
47
2.4. Фенолы
Первые исследования влияния кислорода на гене-
тическую радиочувствительность половых клеток показали,
что облучение в кислороде повышает частоту радиомутаций,
в то время как аноксия оказывает явное защитное действие
[195, 196]. В дальнейшем была тщательно изучена роль кисло-
рода и азота в радиационном поражении клеток, находящихся
на различных стадиях сперматогенеза у дрозофилы [197-199].
Возможность изменения радиочувствительности зароды-
шевых клеток под влиянием таких факторов, как гипоксия
или облучение в кислороде, явилась предпосылкой для иссле-
дования некоторых химических соединений - модификаторов
метаболизма.
Так, в 1961 г. появилась работа [200], в которой сообщалось
об исследовании ДНФ. Это вещество разобщает дыхание и окис-
лительное фосфорилирование, не прерывая транспорта элект-
ронов в дыхательной цепи. При введении ДНФ личинкам дро-
зофилы двумя способами (скармливание и инъекции) была
уменьшена частота рецессивных летальных мутаций, трансло-
каций и нехваток, индуцируемых облучением в дозе 1000Р
в сперматоцитах. В среднем защитный эффект составлял от 50
до 80 %.
Аналогичный эффект, хотя и меньший в количественном
отношении, получен в работе [201] при исследовании влияния
ДНФ. Работа провёдена также и на дрозофиле, препарат инъе-
цировали в той же концентрации, изучались также спермато-
циты, облученные в такой же дозе 1000 Р. Однако Стегер иссле-
довал частоту ДЛМ и получил уменьшение этого типа радио-
мутаций на 12 %.
Этот препарат исследовался для выяснения вопроса, не
влияет ли он на зрелые половые клетки дрозофилы [202]. Ока-
залось, что ДНФ эффективно защищает сперматиды (частота ре-
цессивных летальных мутаций снижается на 30 %), но не защи-
щает спермии. Однако в работе [203] защита спермиев была
осуществлена с помощью инъекции 2,4-динитрофёнола, причем
при увеличении концентрации препарата от 0,15 до 0,30 мкг на
муху эффективность защиты увеличивалась с 30 до 50 % [203].
При дальнейшем увеличении концентрации до 0,45 мкг защит-
ный эффект не был обнаружен. Интересно отметить, что ДНФ
в концентрации 0,30 мкг на муху оказал защитное действие не
только на спермии, но и на радиочувствительные стадии -
сперматиды и сперматоциты.
Таким образом, согласно [203] эффективность ДНФ меняет-
48
ся в зависимости от его концентрации. Поэтому отсутствие за-
щиты спермиев в работе [202] отнюдь не противоречит полу-
ченным позднее результатам. Сравнивать эти работы трудно,
несмотря на один и тот же объект исследования, одинаковые
тесты и дозы облучения. Дело в том, что авторы работы [203]
использовали инъекции препарата в строго определенной кон-
центрации - от 0,06 до 0,45 мкг на муху, в работе же [202] пре-
парат скармливался с питательной средой в концентрации
0,5 мг/мл среды, что не дает сведений о количестве препарата,
поступившего в организм дрозофилы.
Тем не менее в работах, выполненных по сходным методи-
кам, получены аналогичные результаты. Во всех этизс исследо-
ваниях показано, что 2,4-динитрофенол защищает от мутаген-
ного действия облучения радиочувствительные стадии дрозо-
филы, а в работе [203], кроме того, получено снижение частоты
радиомутаций в спермиях.
Исключение составляет работа [204], выполненная также
на дрозофиле, в которой ДНФ оказался неэффективным. Таким
образом, некоторые фенолы, такие, например, как ДНФ, спо-
собны защищать половые клетки дрозофилы от мутагенного
действия ионизирующей радиации (табл. 2.4). К сожалению, в
литературе нет сведений о влиянии этого препарата на гене-
тический эффект облучения у млекопитающих.
Противопоказанием применения ДНФ в качестве радиопро-
тектора служит его метаболическая активность, поскольку ве-
щество препятствует окислительному фосфорилированию и
является ассимиляторным ядом, так как может заменить нор-
мальное вещество в физиологических реакциях благодаря хи-
мическому сходству с ним [205]. Поскольку проводившиеся
более 20 лет (с 1953 по 1975 г.) исследования показали, что тра-
диционные радиопротекторы малоэффективны в защите поло-
вых клеток животных от мутагенного действия облучения,
поиски антимутагенных препаратов были перенесены в дру-
гую область. Внимание исследователей привлекли природные
соединения, представляющие интерес по двум причинам. Во-
первых, известно, что некоторые виды живых организмов об-
ладают высокой радиоустойчивостью. Следовательно, внутри
организма существуют какие-то факторы резистентности. По-
скольку в живой природе можно обнаружить такие совершен-
ные формы и реакции, которые'намного превосходят приду-
манные человеком аналоги, то поиски веществ, „созданных”
эволюцией для защиты организма от облучения, могут быть
весьма перспективными.
Во-вторых, естественные вещества для организма, даже
будучи использованы в больших концентрациях, чем в норме,
4. Зак. 5222. 49
окажутся менее токсичными по сравнению с синтезированны-
ми искусственно.
Все это побудило исследователей обратиться к таким со-
единениям, как ДНК и ее предшественники, АТФ и т. д.
2.5. Вещества естественного происхождения
В первых работах по изучению предшественников
ДНК было показано, что предварительное воздействие нуклео-
зидов уменьшает частоту радиационно-индуцированных сцеп-
ленных с полом рецессивных летальных мутаций в постмейо-
тическйх клетках дрозофилы [206]. Обработка же предмейоти-
ческих клеток галогеновыми производными пиримидина
(5-бромдиоксиуридином и 5-бромдиоксицитидином) увеличит,
ла частоту рецессивных летальных мутаций, но не повлияла на
выход транслокаций в сперматогониях дрозофилы [207].
Влияние препаратов ДНК на мутагенный эффект ионизиру-
ющей радиации в половых клетках самцов мышей было иссле-
довано в работе [208]. Анализировались частота ДЛМ в пост-
мейотических клетках и частота реципрокных транслокаций
в сперматогониях. Под влиянием ДНК частота доминантных
деталей в ранних сперматидах уменьшилась с 67,0 до 62,1 %.
В поздних, наоборот, наблюдалось усиление мутагенного эф-
фекта облучения. В сперматогониях частота транслокаций так-
же возросла с 4,4 до 5,8 %. Более эффективным оказалось ис-
пользование АТФ в смеси с радиопротекторами. Так, в работах
[209, 210] сообщается о защитной эффективности смеси АТФ с
ацетуроном и АЭТ против индукции облучением транслокаций
в сперматогониях мышей.
При применении АТФ в смеси с метионином и цистеином
получено снижение выхода рецессивных сцепленных с полом
летальных мутаций, индуцированных облучением у дрозофи-
лы [211,212].
Хороший защитный эффект против генетических повреж-
дений, вызванных облучением у мышей, был показан при ис-
пользовании АТФ [213-216]. Влияние смеси АТФ, АЭТ и серо-
тонина, вводимой самцам внутрибрюшинно за 8 мин до облу-
чения в дозе 400 Р, изучалось в соотношении 45:3:1. Частота
индуцированных реципрокных транслокаций в сперматогони-
ях мышей при этом снизилась примерно в 2 раза (с 8,65 ± 1,2 до
4,05 ±0,6 %). При исключении АТФ из смеси наблюдалась лишь
тенденция к снижению частоты мутаций. В отсутствие облуче-
ния АТФ снижал в 2 раза выход транслокаций, индуцирован-
ных смесью АЭТ и серотонина (статистически недостоверно из-
за малых величин).
50
Интересно, что при защите мышей от лучевой гибели вклад
АТФ незначителен - защитное действие смеси АТФ + АЭТ + се-
ротонин и смеси АЭТ + серотонин одинаково. Таким образом,
эти исследования показали, что радиопротекторы АЭТ и серо-
тонин, снижающие смертность облученных животных, малоэф-
фективны против генетического действия радиации и для за-
щиты от индуцированных облучением мутаций могут исполь-
зоваться вещества, малоспособные повышать выживаемость
облученных ^ивотных.
Внимание исследователей привлекла антимутагенная ак-
тивность а-токоферола (витамина Е). Это соединение оказалось
способным подавлять мутагенез, вызываемый химическими и
физическими мутагенами, вирусами, старением и т. д. [217-219].
Исследование радиозащитной эффективности а-токоферола в
половых клетках было предпринято в работе [220]. Самцов
дрозофилы, выращенных на среде с витамином Е, облучали
рентгеновским излучением и через 24 ч скрещивали с виргиль-
ными самками тесторной линии. При этом, если самки выращи-
вались на нормальной питательной среде, снижение выхода ре-
цессивных летальных сцепленных с полом мутаций не обнару-
живалось. Если же не только самцы, но и самки вскармлива-
лись питательной средой с токоферолом, то частота индуциро-
ванных облучением мутаций значительно снижалась. Авторы
предположили, что а-токоферол не влияет на образование пер-
вичных радиационных эффектов, но модифицирует репарацию
предмутационных повреждений, возникающих в зрелых поло-
вых клетках самцов и репарируемых после оплодотворения
ферментами самки.
Большое внимание уделяется исследованию антимутаген-
ного действия различных растений. Многочисленные позитив-
- ные результаты, полученные при испытании антимутагенного
действия растений, вызвали интерес к растительным экстрак-
там и у радиобиологов. В частности, исследовалось влияние
фитонцидов чеснока и вытяжки из листьев эвкалипта на мута-
ционный процесс, индуцированный ионизирующей радиацией
у дрозофилы [221]. Показано, что использование чеснока не
изменило индукции облучением рецессивных летальных мута-
ций и транслокаций между II и III хромосомами, а вытяжка из
эвкалипта оказала хорошее защитное действие против гене-
тического эффекта у-лучей.
Таким ббразом, поиски эффективных противолучевых ан-
тимутагенов продолжаются. Необходимо, чтобы они удовлет-
воряли трем критериям: 1) стабильности, 2) эффективности и
3) нетоксичное™. Однако ни один из известных нам радиопро-
текторов не удовлетворяет данным критериям. Так, большин-
51
ство традиционных радиопротекторов, имеющих стабильную
химическую структуру, эффективны лишь в высоких токсич-
ных концентрациях, а вытяжки растений практически неток-
сичны, но не имеют стабильной химической структуры. Все это
требует дальнейших теоретических и экспериментальных ис-
следований с целью поисков оптимальных радиозащитных
препаратов.
ГЛАВА 3
АНТИМУТАГЕННОЕ ДЕЙСТВИЕ
ИНДЕНОВЫХ СОЕДИНЕНИЙ У ДРОЗОФИЛЫ
3.1. Обоснование исследований и методика работы
С целью поиска средств, способных защищать на-
следственные структуры организма от мутагенного действия
ионизирующей радиации, нами были исследованы инденовые
соединения (табл. 3.1). Предпосылкой для исследования гене-
тической эффективности этих препаратов явилось то обстоя-
тельство, что инденовые соединения относятся к ароматиче-
ским соединениям, обладающим защитным эффектом на ра-
диолиз различных соединений [222-224].
Инденовые соединения содержат в молекуле группы, спо-
собные к образованию межмолекулярных водородных связей
или обеспечивающие встроение самих молекул в определен-
ные субклеточные образования, например в хромосомы. Ины-
ми словами, они способны к образованию различных ассоциа-
тивных или солеобразных надмолекулярных комплексов или
ковалентных связей с субстратом. Предполагалось, что инде-
новые соединения могут снизить радиационную повреждае-
мость хромосом, воспринимая и рассеивая лучевую энергию
с облученного нуклеопротеида [225].
При анализе действия любого модификатора важно иметь
данные по двум основным классам мутаций - хромосомным
аберрациям и точковым мутациям. Поскольку в радиобиоло-
гической литературе не решен вопрос о принципиальной воз-
можности модификации выхода точковых мутаций у высших
организмов, интересно было исследовать, обладают ли такой
особенностью инденовые соединения.
Удобным генетическим объектом для решения поставлен-
ной задачи является Drosophila melanogaster, которая позволя-
ет дифференцированно исследовать различного рода воздей-
ствия на разные стадии гаметогенеза. Кроме того, в слюнных
52
Таблица 3.1. 'Хтатюекяк строение инденовых соединений
Шифр соединения Общая формула Радикал
R1 r2 А
F-4 NHRi Н -с6н5 =nh2
AV-69 с Н -сн3 =nh2
АО-1 н ~С10Н7 =nh2
F-44 И I \ н -с2н5 =nh2
F-26 с6н5 -снз _ =NH2 .
F-25 \/ \ с6н5 -сн5 =nhc6h5
F-6 с с6н5 -с6н5 =nhc6h5
F-37 II А C6H4COONa -с6н5 =HC6H4COONa
F-38 с6н4соон -с6н5 =HC6H4COOH
V-93 с=о CHjCOONa -с6н5 =0
F-28 /К / \ CH=C-NHRt C6H4COONa -с6н5 =0
F-11 ( у \ / Н -С6Н4ОСН3 =nh2
с=с
F-23 х/\ / X Р-С6Н4СООН — —
с 1 |1
F-29 8 U О-С6Н4СООН — —
Таблица 3.2. Влияние некоторых инденовых соединений
на спонтанную и индуцированную облучением частоту
рецессивных легальных мутаций у дрозофилы
Шифр веще* ства Концен- трация, мг/мл Варианты воздействия t р
I II 1т II вари* анты III
Вещество Облучение Вещество + облучение
число хромо- сом мута- ции, % число хромо* сом мута- ции, % мута- ции, % число хромо* сом мута- ции, %
V-93 4 487 0,82 890 3 3,82 825 1.9 2,4 0,98
AV-69 0,8 1009 1,20 890 3 4,2 632 2,0 2,6 0,99
F-25 _* 338 0,29 518 3 3,29 554 3,1
F-4 12 1454 0,41 1590 3,3 3,71 1283 1,55 4,5 0,99
F-6 • —* 544 0,36 518 3 3,36 494 3,0 —
F-23 12*** 555 1,80 402 5,2** ' 7,0 531 7,3 — —
» 2,5*** 305 0,66 700 3,7 4,36 487 2,6 1,58 0,88
» 25-35 680 0,29 700 3,7 3,99 672 1,3 3,1 0,99
» 12* 327 0,61 402 5,2** 5,81 557 5,5
F-29 12* 538 0,37 518 3 3,37 592 . 2,5 — —
* Из-за нерастворимости препарата в воде применяли размешивание его в питатель-
ной среде; ** в этом опыте общая доза облучения 0,8, в остальных — 0,4 Кл/кг; *** препа-
раты растворяли в щелочи.
Таблица 3.3. Влияние ряда амино-яцденовых соединений
на спонтанную и индуцированную облучением частоту
рецессивных летальных мутаций у дрозофилы
Шифр веще* ства Концен- трация, мг/мл Варианты воздействии t Р
I II 1 + П вари- анты Ш
Вещество Облучение Вещество + облучение
число хромо* сом мута- ции, % число хромо- сом мута- ции, % мута- ции, % ЧИСЛО хромо- сом мута- ции, %
АО-1 0,2 604 0,17 725 2,3 2,47 653 1,3 1,5
F-44 0,25 2230 0,18 1816 1,76 1,94 1727 1,04 2,2 0,96
F-26 2,0 2597 0,15 684 3,5 3,63 617 1,4 2,6 0,99
F-25 3,0* 504 0,16 725 2,3 2;42 900 1,1 2 0,95
F-6 2,5* 2687 о,п 1525 1,8 1,91 1676 1,6
F-37 3,0 611 0 1105 2,6 2,60 830 1,2 2,2 0,96
F-38 4,5 1214 0,08 1105 2,6 2,68 544 0,55 3,6 0,99
F-28 1,5 672 0,15 725 2,3 2,45 832 1,8
F-51 0,7 502 0,40 367 1,3 1,70 765 2,3 —
F-11 0,25 1320 0,76 1140 3,2 3,96 1094 1,6 3,5 0,99
* Препараты растворяли в спирте.
54
Таблица 3.4. Влияние F-11 на спонтанную мутабильность дрозофилы
Посадки Инъекции Скармливание
ЧИСЛО летали, % число летали, %
хромосом леталей хромосом леталей
1 846 1 0,12± 0,12 658 2 0,30 ±0,20
2 1156 4 0,35 ±0,17 760 1 0,13±0,13
Спермии 2002 5 0,20 ±0,10 1418 3 0,21 ±0,12
в сумме
3 657 0 0 538 0 0
4 1279 2 0,16±0,11 528 1 0,19±0,19
5 329 0 0 211 1 0,47 ±0,47
£ 333 0 0 — — —
Сперматиды в сумме 2598 2 0,08 ±0,05 1277 2 0,16±0,11
7 322 1 0,31 ±0,31 — — —
8 308 0 0 — — —
Сперматоциты 630 1 0,16 ±0,16 — — —
в сумме 0,25 ±0,24
9 234 1 0,46 ±0,44 403 1
Сперматоциты 1-го порядка 234 1 0,46 ±0,44 403 1 0,25 ±0,24
10 358 0 0 121 1 0,83 ±0,77
11 233 0 0 414 1 0,24 ±0,24
12 204 1 0,49 ±0,48 184 0 0
Сперматогонии в сумме 795 1 0,13 ±0,12 719 2 0,28 ±0,20
Итого 6262 10 0,16 ±0,05 3817 2 0,24 ±0,08
железах личинок дрозофилы содержатся гигантские хромосо-
мы, цитологический анализ которых дает возможность отде-
лить толковые мутации от хромосомных аберраций с точной
их локализацией в хромосоме. К тому же спектр чувствитель-
ности половых клеток дрозофилы к индукции мутаций анало-
гичен таковому у млекопитающих. В работе использовались
самцы линии Д-18 в возрасте 24 ±4 41
Для выяснения защитной эффективности исследуемых хи-
мических соединений изучали воздействие 1) облучения, 2) хи-
мического вещества и 3) химического вещества с последую-
щим или предварительным облучением.
Самцов облучали в пробирках рентгеновскими лучами
на рентгенотерапевтической установке РУМ-11 при напряже-
нии 180 кВ, силе тока 10 мА, медном фильтре 0,5 мм, при мощ-
ности дозы 4,5 • 10-4 А/кг. Общая доза 0,4 или В,8 К л/кг.
Химические вещества вводили в организм дрозофилы дву-
мя способами: путем скармливания и путем внутриабдоми-
нальных инъекций. При скармливании вещества особи прово-
пили весь жизненный цикл от яйца до имаго на среде, в кото-
55
рой растворен исследуемый препарат. Для этого на такую сре-
ду помещали родителей, которых после откладки яиц и начала
вылупления личинок удаляли, а для опытов использовали
самцов, выросших на среде с препаратом. Использовали мак-
симальные концентрации препарата, не влияющие на жизне-
способность и плодовитость животных. Такой способ гаранти-
рует попадание и накопление вещества в достаточной концент-
рации в организме дрозофилы. Поскольку инденовые соедине-
ния являются красителями, то наблюдали окраску личинок,
куколок и даже имаго, выросших на среде с веществом. Это
свидетельствовало о хорошем проникновении вещества в тка-
ни дрозофилы.
В случае инъекций вещество, растворенное в 0,7%-ном рас-
творе NaCl, вводили под микроскопом стеклянным капилля-
ром, соединенным с микрошприцем, в брюшко дрозофилы с
правой стороны между 4 и 5-м стернитами [266]. Обычно вво-
дили 0,0006 мл раствора на муху. При изучении влияния пред-
радиационного воздействия вещества инъекции проводили за
2-0,5 ч до облучения. В случае пострадиационных инъекций
препарат вводили не позднее чем через 10 мин после начала
облучения.
В зависимости от способа поступления вещества в орга-
низм для контроля использовали самцов, которые развились
на нормальной питательной среде, или самцов, которым инъе-
цировали 0,0006 мл 0,7%-ного раствора NaCl.
С целью разделения разных стадий сперматогенеза исполь-
зовали методику перебросок. Известно, что семенники взрос-
лых самцов содержат зачатковые клетки, находящиеся на всех
стадиях сперматогенеза. Действию облучения подвергаются
все клетки одновременно, но в процессе оплодотворения бу-
дут участвовать по мере созревания и после расходования зре-
лых спермиев те клетки, которые были облучены на ранних
стадиях. Для того, чтобы обеспечить полную реализацию гамет,
каждого анализируемого самца в возрасте 24 ± 4 ч ежедневно
в течение 12 дней скрещивали индивидуально с пятью новыми
девственными самками из линии Мёллер-5. При такой методи-
ке посадок в 1-й и 2-й дни должна происходить реализация га-
мет, бывших в момент облучения на стадии зрелых спермиев;
в 3-6-й - расходование сперматид; в 7-8-й - сперматоцитов;
в 9-й - сперматоцитов первого порядка и частично спермато-
гониев; в 10-12-й дни - сперматогониев.
При сравнении влияния нескольких факторов на радио-
чувствительность стадий сперматогенеза необходимо учиты-
вать, что некоторые из них могут вызывать задержку или уско-
рение процесса созревания половых клеток. Одним из тестов,
56
определяющих изменение скорости развития гамет, может слу-
жить смещение периода сниженной плодовитости облученных
самцов. Поэтому параллельно с анализом частоты летальных
мутаций в последовательных посадках учитывали плодови-
тость самцов. Показателем плодовитости считали среднее чис-
ло самок дикого типа в Fj в данной посадке, приходящееся на
одного самца-родителя. Средние величины плодовитости на-
ходили на основайии подсчета потомства 30-40 самцов. Опре-
деляли частоту рецессивных сцепленных с полом летальных
мутаций по стандартной методике Мёллер-5 и частоту пере-
строек хромосом в слюнных железах личинок.
Для приготовления препаратов хромосом слюнных желез
личинок третьего личиночного возраста помещали в каплю
физиологического раствора и с помощью обычных препаро-
вальных игл извлекали слюнные железы, которые затем окра-
шивали в течение 2-3 ч в 1%-ном растворе уксусно-кислого ор-
сеина [227]. Затем окрашенные железы переносили на чистые
предметные стекла, избыток краски отсасывали фильтроваль-
ной бумагой, добавляли каплю 45%-ной уксусной кислоты, на-
кладывали покровное стекло и препарат раздавливали [228].
Готовые препараты просматривали под микроскопом.
Для определения цитологической природы рецессивных
летальных мутаций проводили их анализ на хромосомах слюн-
ных желез личинок, потомков гетерозиготных по данной му-
тации самок. Для того, чтобы отличить личинки, несущие хро-
мосому с рецессивной летальной мутацией, необходимо ис-
пользовать специальную тестерную линию. В наших опытах
использовали линию, имеющую в гомозиготном состоянии ген
white. При этом самки, несущие рецессивную мутацию, гетеро-
зиготны по гену white. Скрещивая таких самок с белоглазыми
самцами, получали личинок двух типов - с генотипом w/+ и с
генотипом w/w. Известно, что у личинок первого типа мальпи-
гиевы сосуды желтые, а у личинок второго типа - белые [229].
Для цитологического анализа отбирали личинок с желтыми
мальпигиевыми сосудами, т. е. личинок, несущих в Х-хромо-
соме исследуемую мутацию.
Статистическую обработку данных проводили стандарт-
ными методами (по критерию Стьюдента при уровне значимо-
сти 0,05 1 = 1,96).
3.2. Зависимость антимутагенного эффекта
от структуры препарата
При исследовании генетической эффективности ин-
деновых соединений различных классов были выявлены четы-
ре препарата - V-93, AV-69, F-4, F-23, эффективно снижающие
57
выход рецессивных сцепленных с полом летальных мутаций
(табл. 3.2). Дальнейшие исследования были предприняты с це-
лью выяснения двух вопросов. Во-первых, все ли индены дей-
ствуют в целом или расщепляются in vivo на более простые
вещества, действие которых и наблюдается в эксперименте.
Во-вторых, важно было установить влияние заместителей в
молекуле на генетическую активность соединений. Это мог-
ло бы дать дополнительные сведения о механизме действия
веществ и позволило бы отобрать наиболее перспективные Из
них для углубленных исследований. Для этого повторно было
проверено действие некоторых ранее изученных аминоинде-
нов на большом экспериментальном материале, а также иссле-
дован эффект семи новых инденовых соединений с различны-
ми заместителями в молекуле (табл. 3.3). Выявлены пять эф-
фективных радиопротекторов F-37, F-38, F-25, F-26 и F-44, сни-
жающие в два и более раза частоту рецессивных сцепленных с
полом деталей у дрозофилы при дозе облучения 0,4 Кл/кг
Изучение инденовых соединений с различными заместите-
лями в молекуле дало основание утверждать, что аминопро-
изводные инденов в целом не претерпевают в организме глу-
боких структурных изменений. Дело в том, что все аминоин-
дены в жестких химических условиях и, вероятно, в пищева-
рительном тракте насекомых могут гидролизоваться до 2-фе-
нилиндандиона-1,3 (F-51) по схеме:
NHR, 0
। 1 и
и п
А 0
В случае, если бы такое расщепление имело место до осу-
ществления защитного действия, то соединения АО-1, F-6, F-37,
F-38, V-93, F-28 действовали бы аналогично и их различная эф-
фективность могла бы варьировать только в узких пределах
и зависела бы, очевидно, только от различной скорости гидро-
лиза исходных аминоинденов в организме объекта. В то же
время при сравнимых эффективных концентрациях соедине-
ний F-6, F-37, F-38, V-93, F-28 они сильно различаются по свое-
му действию. Например, индены F-37, F-38 и V-93 эффективно
снижают частоту индуцированных облучением летальных му-
таций, однако их аналоги F-6, F-28 не уменьшают частоту ра-
диомутаций. Препарат F-4 применялся в низкой концентрации;
но он оказался эффективным радиопротектором. В то же вре-
58
мя препарат F-51 - конечный продукт предполагаемого гид-
ролиза аминоинденов - не оказался антимутагеном.
Для осуществления предполагавшегося механизма защи-
ты, связанного с рассеиванием энергии с облученной ДНК, тре-
буется близкий подход или даже адсорбция молекул протек-
тора нуклеопротеидом. Данные о влиянии заместителей в мо-
лекуле препарата на их защитный эффект подтвердили вывод,
что для проявления антимутагенного действия необходимо
проникновение молекул аминойндена непосредственно к нук-
леопротеиду хромосом. Защитная эффективность соединений
хотя бы с одним фенильным боковым заместителем снижается
по мере дальнейшего утяжеления молекул. При этом даже при
увеличении растворимости препаратов защитный эффект до-
стигается только при применении значительных концентраций
вещества в питательной среде, т. е. стерическая разветвлен-
ность молекул мешает их фиксации на генетическом материа-
ле, что вызывает снижение эффективности препаратов.
Препараты F-11 и F-44, проявившие эффективное антиму-
тагенное действие, были подвергнуты более тщательному ис-
пытанию с целью выяснения таких вопросов, как зависимость
антимутагенного действия от способа введения препарата
(скармливание или инъекции), времени введения относитель-
но облучения (до или после), влияние препаратов на радиочув-
ствительность разных стадий сперматогенеза, на соотношение
точковых и хромосомных мутаций, индуцированных облуче-
нием, на их локализацию и др.
3.3. Влияние инденовых соединений на выход
мутаций на разных стадиях сперматогенеза
При изучении влияния инденовых препаратов F-l 1
и F-44 на мутационный процесс у дрозофилы параллельно про-
водили проверку их эффективности при остром кратковремен-
ном введении в организм перед облучением путем внутриаб-
доминальных инъекций и в случае длительного постепенного
поступления препарата в организм через желудочно-кишеч-
ный тракт при скармливании в течение всего цикла развития.
Существует мнение, что одной из причин низкой эффективно-
сти традиционных радиопротекторов при защите половых кле-
ток от облучения может быть тот факт, что в ряде случаев про-
текторы накапливаются в половых клетках в значительно
меньшей концентрации, чем в клетках других органов, а так-
же могут выводиться из организма или подвергаться различ-
ным химическим превращениям еще до проникновения в го-
нады или до начала облучения. Исходя иэ этого при изучении
59
влияния инденовых соединений F-11 и F-44 на индуцирован-
ный мутационный процесс у дрозофилы предполагалось, кроме
исследования действия препаратов на разных стадиях сперма-
тогенеза, изучить их эффективность при разных способах вве-
дения в организм перед облучением.
Для объективного сравнения данных по отдельным посад-
кам, полученных при разных вариантах воздействия, проводи-
ли анализ плодовитости самцов, который показал, что при воз-
действии облучения хорошо выражена закономерность изме-
нения фертильности в зависимости от стадии сперматогенеза.
Исследуемые препараты не оказали влияния на плодовитость
облученных самцов и не сдвинули период максимального па-
дения фертильности, т. е.' не вызвали изменений в скорости
созревания половых клеток (рис. 3.1 и 3.2). Так как в 5-8-й по-
садках облучение вызывало почти полную стерильность сам-
цов, то во всех вариантах опыта с облучением учет мутаций
проводился только в 1 -4-й и 9-12-й посадках.
Анализ мутагенной активности препарата F-11 показал,
что как при скармливании, так и при инъекциях статистиче-
ски достоверных различий по выходу мутаций между отдель-
ными стадиями сперматогенеза не наблюдается. Частота мута-
ций, полученных по всем посадкам, в случае инъекций препа-
рата в сумме составляет 0,16+0,05% и при скармливании -
0,24 ±0,08 (табл. 3.4), что существенно не отличается от вели-
чины спонтанной мутабильности (0,22 ±0,05 %), полученной
для линии Д-18 [230] в условиях, в которых проводилось ис-
следование.
Результаты изучения влияния препарата F-11 на выход ин-
дуцированных облучением-рецессивных летальных мутаций
показали (табл. 3.5), что модифицирующий эффект исследуемо-
го химического соединения, так же как и эффект одного облу-
чения, различен на разных стадиях сперматогенеза. Так как
при сравнении действия одного облучения и облучения с пред-
варительными инъекциями физиологического раствора разли-
чий в выходе мутаций не обнаружено ни на одной из рассмат-
риваемых стадий сперматогенеза, то в качестве контроля мож-
но использовать суммарные результаты этих двух вариантов.
Наибольшее защитное действие препарат F-11 оказал на
клетки, находящиеся на стадии сперматогониев, снизив про-
цент летальных мутаций в 1,8-2 раза, меньшее - на стадии
сперматид. В то же время на зрелые спермии препарат F-11
оказал обратный эффект, значительно повысив в них частоту
мутаций.
На действие препарата способ его введения существенно
не повлиял: и в случае инъекций, и в случае скармливания
60
1 — облучение; 2 — скармливание F-11 + облучение; 3 —инъекции F-11 +
облучение; 4 — инъекции физиологического раствора + облучение
Рис. 3.2. Изменение плодовитости самцов дрозофилы
в последовательных посадках после облучения и сов-
местного действия препарата F-44 н облучения:
1 — инъекции F-44 + облучение; 2 — облучение + инъекции
F-44; 3 — облучение; 4 — инъекции F-44
радиочувствительность половых клеток изменялась аналогич-
но. Если в сперматидах защитный эффект скармливания почти
отсутствовал, то при инъекциях значительно снизился процент
мутаций. Следует отметить, что данные, касающиеся самых
61
радиочувствительных ранних сперматид, отсутствуют из-за по-
ниженной плодовитости облученных самцов в 5-6-й посадках.
При изучении эффективности инденового соединения F-44,
наряду с исследованием его способности модифицировать дей-
ствие облучения на разных стадиях созревания половых кле-
ток, была проверена возможность изменения генетического
эффекта радиации при введении препарата в организм после
облучения.
Как и препарат F-11, препарат F-44 не проявил мутагенного
действия ни на одной из стадий развития половых клеток
(табл. 3.6). В сумме по всем посадкам при инъекциях препара-
та процент мутаций равен 0,14 ± 0,03, что не превышает уровень
спонтанной мутабильности линии Д-18. Результаты совместно-
го действия препарата F-44 и облучения представлены в
табл. 3.7.
На основании результатов исследования можно заключил»
что как предрадиационные, так и пострадиационные инъекции
F-44 не влияли на эффект облучения зрелых половых клеток.
Что касается сперматид, то, по данным 3-й посадки (поздние
сперматиды и, возможно, примесь зрелых спермиев), препарат
F-44 не изменил радиочувствительность клеток, а результаты,
полученные в 4-й посадке, недостоверны из-за ограниченного
количества проанализированных семей F2 вследствие низкой
плодовитости в ней самцов.
В предмейотических клетках эффект вещества зависит от
времени введения его относительно облучения. Так, при пред-
радиационном введении препарат F-44, так же как и препарат
F-11, имел статистически достоверный защитный эффект (t =
= 2,3). В то же время инъекции препарата F-44 после облучения
противоположно влияли на выход индуцированных мутаций
в сперматогониях, увеличив процент летальных мутаций (t =
= 2,9).
Поскольку при введении модификатора после облучения
его влияние на процессы, происходящие во время облучения,
исключено, то напрашивается вывод о воздействии исследуе-
мого препарата на процессы восстановления потенциальных
повреждений хромосом. Но тогда непонятно противоположное
действие препарата при его введении до и после облучения.
При анализе изменения генетической радиочувствитель-
ности сперматогониев необходимо учитывать возможность
влияния модификатора на процесс селективной гибели этих
клеток. Существует гипотеза о наличии положительной корре-
ляции между генетической и физиологической радиочувстви-
тельностью сперматогониев [231], которая объясняет измене-
ние линейной зависимости выхода мутаций от дозы облучения
62
в сперматогониях дрозофилы [232, 233] и мыши [231, 234], по-
вышение выхода мутаций в сперматогониях при фракциониро-
вании дозы [234,235] и при пролонгированном облучении [232].
Можно предположить, что инденовые соединения- наряду
со способностью влиять на выход повреждений генетических
структур, т. е. способностью изменять генетическую радиочув-
ствительность клеток, могут изменять и их физиологическую
радиочувствительность. При этом степень влияния на ту или
иную радиочувствительность может быть разной. Конечный ре-
зультат будет определяться процессами селективной гибели,
зависящими от степени совпадения генетической и физиоло-
гической радиочувствительности клеток.
Возможно, что в обнаруженном нами случае предрадиаци-
онное применение инденовых препаратов уменьшает генетиче-
скую радиочувствительность клеток в большей степени, чем
физиологическую, поэтому и наблюдается защитный эффект.
В случае пострадиационной обработки исследуемое соедине-
ние, по-видимому, не способно уменьшать частоту генетиче-
ских повреждений (возможно, из-за ограниченного времени
становления мутаций), но способно повышать физиологиче-
скую радиорезистентность зародышевых клеток. Вследствие
этого выживают клетки с мутациями, которые в норме долж-
ны были погибнуть, что и, приводит к наблюдаемому увеличе-
нию частоты регистрируемых мутаций. Пострадиационная об-
работка препаратом F-44 зрелых спермиев и поздних сперма-
тид, для которых нехарактерно явление селективной гибели
наиболее радиочувствительных клеток, не изменяет генети-
ческий эффект облучения.
Отсутствие модифицирующего действия предрадиацион-
ных инъекций препарата F-44 в постмейотических клетках при
наличии эффекта защиты сперматогониев, возможно, в некото-
рой степени обусловлено его неспособностью при инъекциях
быстро проникать в достаточной концентрации в поздние спер-
матиды и зрелые спермии, характеризующиеся наиболее низ-
кой интенсивностью метаболизма. К тому же препарат F-44
обладает меньшей растворимостью в физиологическом раство-
ре по сравнению с препаратом F-11, что может также обусло-
вить его более низкую способность проникать в зрелые поло-
вые клетки.
63
Таблица 3.5. Влияние F-11 на выход рецессивных летальных мутаций,
индуцированных облучением на разных стадиях сперматогенеза
Посадки Показатели Способ воздействия
скармливание вещества + облучение облучение инъекции вещества + облучение
1 Число хромосом Летали: 1126 1487 976
ЧИСЛО 69 59 .57
% 6,13+0,71* 3,97 ±0,62* 5,84 ±0,74*
2 Число хромосом Летали: 1003 1239 1111
число 45 38 55
% 4,36 ±0,65 2,95 ±0,47 4,94 ±0,64**
3 Число хромосом Летали: 894 1443 1231
ЧИСЛО 44 70 44
% - 4,92 ±0,72 4,85 ±0,57 3,57 ±0,53
4 Число хромосом Летали: 785 994 831
ЧИСЛО 56 84 44
% 7,13 ±0,92 8,45 ±0,88 5,41 ±0,78**
10-12 Число хромосом Летали: 1878 3400 1972
число 19 62 19
% 1,01 ±0,23** 1,82 ±0,23 0,96 ±0,22**
* Величина, существенно отличающаяся от контрольной (облучение) при Р > 0,005;
** величина, существенно отличающаяся от контрольной при Р < 0,01.
Таблица 3.6. Влияние F-44 на спонтанную мутабильность дрозофилы
Посадки Число Летали, %
хромосом леталей
1 1480 2 0,14 ±0,13
2 960 1 0,10±0,10
Спермии в сумме 2440 3 0,12 ±0,07
3 1146 2 0,18± 0,13
4 1034 1 0,10+0,10
5 1069 3 0,28 ±0,16
6 1112 1 0,09 ±0,09
Сперматиды в сумме 4361 7 0,16±0,06
7 1078 1 0,11 ±0,10
8 1116 2 0,18 + 0,13
Сперматоциты в сумме 2194 3 0,14 + 0,08
9 1059 3 0,29 ±0,17
Сперматоциты 1-го порядка 10 721 0 0
11 383 0 0
12 627 1 0,16± 0,16
Сперматогонии в сумме 1731 1 0,06 ±0,06
Итого 11785 17 0,14 + 0,03
64
.°' Таблица 3.7. Влияние F-44 на выход рецессивных легальных мутаций, индуцированных облучением
на разных стадиях сперматогенеза
Зак. 5222.
Способ воздействия Посадки t
1 2 3 4 10*12
ЧИСЛО хромосом летальные мутации, % число хромосом летальные мутации, % число хромосом летальные мутации, % число хромосом летальные мутации, % число хромосом летальные мутации, %
Облучение 1490 4,36+0,53 1544 3,11 + 0,44 1307 4,89+0,59 192 8,12 + 1,97 3414 1,55 ±0,21
Вещество + облучение 1322 4,46 + 0,57 1495 2,67 + 0,42 1257 4,22 + 0,57 268 11,20 ±1,92 2957 0,95 + 0,18 2,3
Облучение + вещество 948 3,54 + 0,59 798 3,01 ±0,60 677 4,73 + 0,81 59 5,08 + 2,86 1815 2,82 ±0,39 2,9
Таблица 3.8. Влияние F-11 на соотношение точковых мутаций и хромосомных аберраций
среди рецессивных легален, вызванных облучением
Способ воздействия Посадки Число изученных легален Тип мутаций
точковые хромосомные
число % транслокации! инверсии делеции сложные всего %
Скармливание 1 62 44 69,35 8 8 2 1 19 30,65
вещества + облучение 2 42 32 76,19 5 4 1 0 10 23,81-
3 42 31 73,81 5 3 1 1 11 26,19
4 48 30 62,50 8 7 1 2 18 37,50
9-12 16 16 100 0 0 0 0 0 0
Инъекции вещества + 1 41 31 75,59 6 3 ' 1 0 10 24,41
облучение 2 53 38 71,70 6 5 2 1 15 28,30
Продолжение табл. 3.S
Способ воздействия Посадки Число изученных деталей Тип* мутации
точковые хромосомные
число % транслокации инверсии делеции сложные всего %
Инъекции вещества + 3 16 16 100 0 0 0 0 0 0
облучение 4 42 35 83,34 2 4 1 0 7 16,66
9-12 18 18 100 0 0 0 0 0 0
Облучение 1 54 42 77,78 5 5 1 1 12 22,22
2 35 28 80,00 5 2 0 0 7 20,00
3 60 44 73,40 6 8 2 0 16 26,66
4 76 48 61,53 14 10 2 4 30 38,47
9-12 28 28 100 0 ' 0 0 0 0 0
Инъекция вещества 1-12 8 8 100 0 0 0 0 0 0
Скармливанйе вещества 1-12 6 6 100 0 0 0 0 0 0
Таблица 3.9. Влияние F/1 на соотношение точковых и хромосомных
легальных мутаций по отношению к общему количеству
проанализированных хромосом в постмейотических клетках
Способ воздействия Число хромосом Мутации, %
сумма точковые хромосомные
Облучение 1-я посас 1487 >ка 3,97 ±0,62 3,15 0,82
Инъекции вещества + 976 5,84+0,74 4,39 1,45
облучение Скармливание вещества + 1126 6,43 + 0,71 4,25 1,88
облучение Облучение 2-я посас 1289 )ка 2,95 ±0,47 2,36 0,59
Инъекции вещества + 1111 4,94+0,64 3,54 1,40
облучение Скармливание вещества + 1003 4,36 ±0,66 3,32 1,04
облучение Облучение 3-я посас 1443 )ка 4,85 ±0,57 3,56 1,29
Инъекции вещества + 1231 3,57 ±0,53 3,57 0
облучение Скармливание вещества + 894 4,92 ±0,72 3,61 1,29
облучение Облучение 4-я посас 994 )кв 8,45 ±0,88 5,19 3,26
Инъекции вещества + 831 5,41 ±0,70 4,51 0,90
облучение Скармливание вещества + 785 7,13 ±0,92 4,46 2,67
облучение
3.4. Влияние инденовых соединений
на соотношение точковых и хромосомных
мутаций, индуцированных облучением
Для более детального выяснения модифицирующе-
го действия аминоинденов было интересно изучить их влия-
ние на индукцию мутаций разных типов. Результаты, получен-
ные при исследовании цитологической природы рецессивных
сцепленных с полом летальных мутаций, индуцированных об-
лучением, приведены в табл. 3.8-3.10.
Как видно из этих таблиц, наибольшая чувствительность
клеток на стадии сперматид (4-я посадка) обусловлена повы-
шенным количеством крупных аберраций хромосом. Эти дан-
ные соответствуют литературным и свидетельствуют о том, что
именно хромосомные перестройки - основная причина разли-
67
Таблица ЗЛО. Влияние F-44 на соотношение точковых мутаций и перестроек
среди индуцированных рентгеновским излучением рецессивных летальных мутации
Способ воздействия Посадки. Число изученных деталей Тип мутаций
точковые хромосомные
число % транслокации инверсии делеции сложные всего %
Вещество + облучение 1 53 42 79,24 3 7 1 0 11 20,76
2 36 28 77,78 3 4 0 1 8 22,22
3 48 39 77,08 5 3 2 0 10 22,92
4 22 11 59,10 3 3 2 1 9 40,92
9-12 17 17 100 0 0 0 0 0 0
Облучение + вещество 1 35 29 82,86 2 4 0 0 6 17,14
2 20 16 80,00 1 2 1 0 4 20,00
3 30 22' 73,34 3 4 0 1 8 26,66
4 3 3 100 0 0 0 0 0 0
9-12 29 29 100 0 0 0 0 0 0
Облучение 1 60 46 76,67 6 7 1 0 14 23,33
2 45 37 82,23 4 2 1 1 8 17,77
3 49 36 73,47 7 4 1 1 13 26,53
4 13 9 69,23 0 4 0 0 4 30,77
9-12 21 21 100 0 0 0 0 0 0
Вещество 1-12 12 12 100 0 0 0 0 0 0
Таблица 3.11. Влияние F-11 и F-37 на индукцию облучением
рецессивных легальных мутаций в сперматогониях дрозофилы
Способ воздействия Число изученных хромосом Мутации Г р
число %
Облучение 1580 15 0,90 2,65 0,99
F-37 (1,2 мг/мл) + 1494 3 0,20
облучение F-37 (0,2 мг/мл) + облучение 1170 6 1,23 2,36 0,78 0,98
0,51
F-11 (0,2 мг/мл) + облучение 1427 4 0,28
чия в количестве индуцированных рецессивных леталей на
разных стадиях сперматогенеза [7,236,237].
Анализ летальных мутаций, частота которых изменялась в
постмейотических клетках под действием препарата F-11, по-
казал, что его модифицирующий эффект здесь осуществляется
в основном за счет перестроек хромосом (см. табл. 3.8). Так, на
стадии зрелых спермиев препарат повысил процент перестроек
среди леталей. На стадии сперматид наблюдался обратный эф-
фект, т. е. уменьшение под влиянием препарата процента му-
таций, связанных с хромосомными перестройками, причем это
уменьшение очевидно только в том случае, когда существует
защитный эффект по общему выходу летальных мутаций (4-я
посадка, инъекции F-11 + облучение).
Оценка процента мутаций, связанных с перестройками не
по'отношению к числу цитологически проанализированных ле-
талей, а по отношению к общему числу проанализированных
хромосом в F2, более наглядно показывает, что при изменении
радиочувствительности постмейотических клеток с помощью
препарата F-11 частота леталей, связанных с хромосомными
аберрациями, меняется в большей степени, чем частота лета-
лей при цитологически нормальных хромосомах (см. табл. 3.9).
Так, в самых радиочувствительных клетках сперматидах (4-я
посадка) защитный эффект инъекций препарата F-11 связан с
уменьшением процента леталей, обусловленных перестройка-
ми, в 3,6 раза, а частота точковых леталей почти не изменилась.
На стадии же зрелых спермиев, где вещество увеличило радио-
чувствительность клеток, частота перестроек повысилась в
большей степени, чем частота летальных мутаций при цитоло-
гически нормальных хромосомах. Эти данные косвенно под-
тверждают наличие принципиальных различий в механизмах
становления точковых и хромосомных мутаций, индуцирован-
ных ионизирующими излучениями в клетках эукариот.
69
Цитологический анализ рецессивных летальных мутаций,
возникших в условиях применения препарата F-44, не оказав-
шего, влияния на частоту индуцированных облучением лета-
лей в зрельрс спермиях и поздних сперматидах, не выявил из-
менений и в соотношении точковых мутаций и хромосомных
аберраций (см. табл. 3.10).
В предмейотических клетках во всех случаях (см.
табл. 3.8-3.10) рецессивные летальные мутации не связаны с
хромосомными перестройками, что соответствует литератур-
ным данным [7,236, 237]. Это говорит о том, что модифицирую-
щий эффект инденовых препаратов на стадии сперматогониев
осуществляется за счет точковых мутаций.
Для того, чтобы еще раз проверить возможность защиты
сперматогониальных клеток от индукции облучением точко-
вых мутаций, были предприняты исследования по другой ме-
тодике. В отличие от работы, в которой для изучения мутаций
в сперматогониях применялась методика перекидок, в данном
случае использовалось облучение трехсуточных личинок, все
половые клетки которых являются сперматогониями [238].
Исследовали индукцию рецессивных сцепленных с полом
летальных мутаций, которые, как уже отмечалось, в сперма-
тогониях являются толковыми.
В качестве предполагаемых протекторов использовали ин-
деновые препараты F-U и F-37. Исследованные вещества скарм-
ливали мухам с питательной средой в следующих концентра-
циях: F-l 1 - 0,2 мг/мл; F-37 - 1,2 и 0,2 мг/мл. Поскольку личин-
ки более радиочувствительны, чем имаго, облучение проводи-
ли в дозе 0,2 Кл/кг. Полученные результаты представлены в
табл. 3.11. Как видно из таблицы, при облучении возникло
0,90 % мутаций, что вполне соответствует литературным дан-
ным. Препараты F-11 и F-37 оказали достоверное защитное дей-
ствие - препарат F-l 1 снизил выход индуцированных мутаций
в 3 раза, препарат F-37-- в 1,8-4,5 раза.
Как правило, максимальный защитный эффект известных
радиопротекторов достигается при концентрациях, которые
являются токсичными. Поэтому защитная эффективность ин-
деновых препаратов в Совершенно нетоксичных концентраци-
ях представляет особую ценность.
Таким образом, показана достоверная возможность защи-
ты с помощью инденовых соединений половых клеток живот-
ных от индукции облучением точковых мутаций.
70
3.5. Влияние инденовых соединений
на локализацию разрывов хромосом
При изучении хромосомных перестроек, выявлен-
ных цитологически среди рецессивных летальных мутаций в
постмейотических клетках, сравнивалась их локализация в
Х-хромосоме дрозофилы при облучении и действии инденовых
соединений. Дело в том, что характер действия модификато-
ров может зависеть от специфики химической и структурной
организации хромосом. Неравномерность в локализации вы-
званных облучением разрывов обычно связывают с распреде-
лением по длине хромосомы эу- и гетерохроматина. Структур-
ная организация и биохимическая дифференциация этих ком-
понентов различны [66, 67], и гетерохроматиновые участки
хромосом характеризуются большей лабильностью по отноше-
нию к различным воздействиям, чем эухроматиновые [66, 69].
Поэтому выяснение способности исследуемых веществ влиять
на локализацию разрывов, вызванных облучением, могло бы
дать некоторые сведения относительно механизма их дей-
ствия.
Локализация разрывов, выявленных при цитологическом
анализе леталей, возникших при облучении, а также при сов-
местном действии препаратов F-11 и F-44 и облучения, пред-
ставлена, на рис. 3.3 и 3.4. Гетерохроматиновые области под-
черкнуты согласно данным различных авторов, определявших
наличие гетерохроматина по трем критериям: высокому коэф-
фициенту разрывов, неспецифической конъюгации и высокой
концентраций повторов (рис. 3.5). Участками с высокой часто-
той повреждений мы считали только те, в которых на одно
буквенное субделение приходилось не менее 8 разрывов (ве-
роятность случайного совпадения 8 разрывов в одном участке
хромосомы при данном объеме опыта равна 2 • 10 6 [69]).
При сравнении полученных данных с литературными на-
блюдается хорошее соответствие в локализации повреждений,
индуцированных облучением. Как видно из рис. 3.3 и 3.4, наи-
большая частота разрывов обнаружена в районах, содержащих
согласно данным разных авторов участки интеркалярного
гетерохроматина. Причем и при одном облучении, и при воз-
действии перед облучением веществом, модифицирующим ко-
личество разрывов, наибольшее их число приходится на одни
и те же участки, расположенные в основном в гетерохромати-
новых областях.
Соотношение разрывов, вызванных облучением, и разры-
вов, полученных при совместном действии вещества и облу-
чения на стадии зрелых спермиев и сперматид, одинаково как
71
t—»• |~ « » I I i—। i >-i-t i i-н -i i >\ । i—i' iiii i-« ; :(..i
XI в C D E F A 8 CDEFABCDE.FABCDEFA В C 27 E F
1 2 3 4 5
I
, * 1 । |S 1
I I IS I ’IS I $ 1$ II
.U.SjlS : i| /5.44; I ilS'|S I ;l I US ;IS :IS;I$
Zг'с1271£,£1Х|'вГС,27,£Л1»,5 a'/I b'c'd'e'f
в 7 8 9 10
IS
A В CD EF A
! Hi
Sil US; ,,, ......
I I I I» I -I I I I I ( Il |4 i-j | | ! । J,—
в CD E F А вEBEFABCDEFA BCDEF
IS
IS I
15 5
5
S
П 12 13 14 I 15
•I •• 5 -I :'l -I : Il :| • :| :| .'Silf
K1IJJ I 1" I I I t I I I i I I I I 11 I S| '
Abcdefabcdefabcdefabcdefabcdef
16 17 1fl 19 20
I - / :~2 5-3 *—>< - 4
Рис. 3.3. Влияние препарата F-11 на распределение разрывов,
вызванных облучением, по длине Х-хромосомы дрозофилы:
1 — облучение (спермии + сперматиды); 2 — вещество + облучение
(спермии); 3 — вещество + облучение (сперматиды); 4 — гетерохро-
матиновые участки
в эу-, так и в гетерохроматиновых участках, т. е. исследуемый
препарат в равной мере модифицирует выход повреждений
как в гетерохроматиновой части Х-хромосомы, так и в эухро-
матиновой и не меняет локализацию по длине'хромосомных
разрывов, индуцированных облучением.
Таким образом, в результате экспериментальных исследо-
ваний антимутагенной эффективности инденовых соединений
72
• I :i I ।
= I I 0:| : .l H
, i1
A В CDE FA В CD E F A
I , I И I I ।
1 i i1 $ i" I3'1?1 i1 i1 i
BCDEFABCDEF
12 5 4
I
;:l
I
I
I
I
। in
।. । i;»i.
A В CD E F A В CD E F А В C D E F А В C D E F
5 6 7 8
I
I : ! ! J I I I
I : I I I Я I I I . ; I
I , 1,01, 5:01 ,;i, I , . , , /;!, , ;:l 5:1.1 /I , ,1 l;jO5;0l;0l
A BCD E F A BCD E FA В C D E F А В В D E F
9 . 10 11 12
। •[ -I .1 i I
Ж1.......ЦДчЛ , Ц
A В CD EFABCDEFA В C D E F А В C D E F
13 И 15 II 16
A В CD E FA В C D E F А В C D E F А В C D E F
17 18 19 20
I -1 \~2 l~J 0 S-E •—i-B
Рис. 3.4. Влияние препарата F-44 на распределение разрывов,
вызванных облучением, по длине Х-хромосомы дрозофилы:
1 — облучение (спермин + сперматиды); 2 — вещество + облучение
(спермии); 3 — вещество + облучение (сперматиды); 4 — облучение +
+ вещество (сперматиды); 5 — облучение + вещество (спермии); 6 —
гетерохроматиновые участки
на дрозофиле установлено, что изученные аминопроизводные
инденов не разлагаются и не претерпевают в организме глу-
боких структурных изменений. Важно, что в отличие от тра-
73
Рис. 3.5. Гетерохроматиновые районы в Х-хромосоме слюнных желез дрозофилы
по данным различных авторов:
а повторения; б — высокая частота разрывов; в — иеспецифическая конъюгация; г —
высокая частота разрывов (по результатам собственных исследований)
диционных радиопротекторов инденовые соединения эффек-
тивны в малых, нетоксичных концентрациях.
При изучении аминоинденов F-11 и F-44 показано, что эти
препараты не обладают мутагенной активностью - они не по-
вышают мутабильность ни одной из стадий сперматогенеза,
не влияют на скорость созревания половых клеток и не изме-
няют локализацию разрывов, индуцированных облучением,
в равной степени модифицируя выход повреждений как в ге-
теро-, так и в эухроматине.
Инденовые препараты эффективно снижают выход мута-
ций, индуцированных облучением в сперматогониях. Защит-
ное действие аминоинденов на стадии сперматогониев пред-
ставляет большой интерес, так как возникающие в них мута-
ции сохраняются в течение всего репродуктивного периода,
реализация же постмейотических клеток происходит в корот-
кий срок.
На примере препарата F-l 1 показано, что способ введения
в организм (скармливание или инъекции) существенно не вли-
яет на эффективность инденовых соединений.
Обнаружено, что инденовые препараты способны снижать
индукцию облучением точковых мутаций. Этот факт представ-
ляет несомненный интерес как с теоретической, так и с прак-
тической точки зрения, так как, во-первых, выход точковых
мутаций не модифицируется даже такими модификаторами
метаболизма, как кислород и азот (см. гл. 1), а во-вторых, точ-
ковые мутации, передаваясь из поколения в поколение, пред-
ставляют наибольшую генетическую опасность, в то время как
большая часть хромосомных аберраций элиминируется на раз-
ных этапах гаметогенеза и онтогенеза.
74
ГЛАВА 4
АНТИМУТДГЕННОЕ ДЕЙСТВИЕ
ИНДЕНОВЫХ СОЕДИНЕНИЙ У МЫШЕЙ И
В КУЛЬТИВИРУЕМЫХ КЛЕТКАХ ЧЕЛОВЕКА
4.1. Методика работы с мышами
Исследование выполнялось на мышах линии СЗН.
Воздействию подвергали самцов в возрасте 2-2,5 мес. Облуче-
ние проводили рентгеновскими лучами на аппарате РУМ-17
при следующих условиях: напряжение 180 кВ, сила тока 15 мА
и мощность дозы 1,3 • 10~4 А/кГ.
Мышей облучали в специальных плексигласовых короб-
ках с камерами, расположенными по кругу, для каждой мыши.
При дозах от 0,02 до 0,10 К л/кг проводили облучение всего те-
ла, а при более высоких дозах, являющихся летальными, -
локальное облучение семенников. Для этого с помощью спе-
циальных лигатур семенники выводили наружу, а остальную
часть туловища экранировали свинцовыми пластинками (жи-
вотное фиксировали брюшной стороной кверху и тубус рент-
геновского аппарата подводили непосредственно к семенни-
кам).
Инденовые соединения растворяли в физиологическом
растворе и вводили внутрибрюшинно за полчаса до облучения.
Контрольным мышам инъецировали физиологический раствор.
Определяли частоту реципрокных транслокаций в сперма-
тоцитах, находящихся на стадии диакинеза метафазы первого
мейотического деления. Препараты готовили по методу
А. П. Дыбана [246]. Операция нанесения взвеси клеток на пред-
метные стекла была нами несколько модифицирована. Взвесь
клеток обычно капают на предметное стекло микропипеткой.
При этом метафазные пластинки в значительной степени под-
вергаются механическим повреждениям, что, вероятно, отчас-
ти приводит к поломкам хромосом. Нами же клеточная взвесь
наносилась той же микропипеткой, но манипулировали ею при -
нанесении клеток на стекло, как микробиологической иглой
при посеве микроорганизмов на среду. Для этого пипетка
должна касаться предметного стекла и делать легкие штрихо-
образные движения. Клетки легко и свободно выходят на
предметные стекла. Равномерно распределившись-пб стеклу,
они быстро высыхают и меньше подвергаются деформации.
При сравнении результатов, полученных способом нанесе-
ния взвеси клеток, предложенным нами, и способом Ивенса,
клеток с повреждениями в виде фрагментов и унивалентов
75
оказалось примерно на 70-80 % меньше. Перед микроскопи-
рованием препараты окрашивались лактоацетоорсеином.
Частоту транслокаций, возникших под действием облуче-
ния в сперматоцитах, определяли на 7-10-й день после облу-
чения. Выход перестроек в сперматогониях подсчитывали в
семенниках животных спустя 2,5-3 мес. после облучения.
Статистическую обработку данных проводили с использо-
ванием критерия Стьюдента для малых выборок, при этом за
величину выборки п принимали число исследованных семен-
ников.
4.2. Зависимость антимутагенного эффекта
от концентрации инденовых препаратов
Влияние наиболее эффективных для дрозофилы
инденовых соединений F-4, F-11 и F-37 было исследовано на
радиочувствительность половых клеток мышей. Определяли
частоту возникновения реципрокных транслокаций в спер-
матоцитах и сперматогониях мышей, облученных в дозе
0,08 Кл/кг. Концентрация F-4 и F-11 составляла 1/3 и 1/6 ЛД50,
a F-37 - 1/6 и 1/10 ЛД50.
Изученные соединения существенно уменьшили выход
аберраций в сперматоцитах и сперматогониях мышей (табл. 4.1).
Эффективность препаратов варьировала в зависимости от кон-
центрации вещества и стадии развития половой клетки. В сред-
нем частота реципрокных транслокаций под действием этих
соединений уменьшилась в 2-4 раза. Наиболее эффективным
оказался препарат F-37.
Таким образом, была показана эффективная защита с по-
мощью аминозамещенных инденовых соединений половых
клеток мышей от мутагенного действия рентгеновского излу-
чения. Причем снижение выхода индуцированных облучением
мутаций в сперматогониях млекопитающих показано впервые
и имеет большое практическое значение.
Зависимость антимутагенного эффекта от концентрации
препарата исследовалась на самом эффективном препарате
F-37. Оказалось, что с увеличением концентрации от 5 до
33 мг/кг защитный эффект F-37 в сперматоцитах мышей снача-
ла увеличивался, а затем падал (табл. 4.2, рис. 4.1). Наиболее
существенно снижался выход транслокаций при использова-
нии препарата F-37 в концентрации 20 мг/кг, т. е. 1/25 ЛД50.
Аналогичные результаты получены и при исследовании защит-
ного действия разных концентраций F-37 в сперматогониях
мышей.
76
Таблица 4.1. Влияние инденовых соединений на уровень индуцированных рентгеновским излучением
хромосомных аберраций у мышей
Способ воздействия Сперматоциты Сперматогонии
число перестройки, % t ЧИСЛО перестройки, % t
метафаз перестроек метафаз перестроек
Облучение, 0,08 Кл/кг 1248 43 3,4+0,5 1243 42 3,3 ±0,5
F-4 (8 мг/кг) + облучение 685 13 1,9±0,5 1,86 926 10 1,0± 0,3 3,96
F-4 (17 мг/кг) + облучение 830 13 1,5 ±0,4 2,88 545 9 1,6 ±0,5 2,41
Облучение 1595 73 4,6 ±0,5 — 1345 82 6,1 ±0,6 —
F-11 (12 мг/кг) + облучение 653 26 3,9 ±0,7 0,81 339 9 2,6 ±0,8 3,5
F-1I (25 мг/кг) + облучение 863 14 1,6 ±0,4 3,75 752 17 2,2 ±0,5 5,0
Облучение 257 36 14,0±2,1 — 1480 54 3,6 ±0,5 —
F-37 (80 мг/кг) + облучение 344 20 5,8 ±1,2 3,55 880 21 2,3 ±0,5 1,83
F-37 (50 мг/кг) + облучение 328 13 4,9± 1,2 3,83 890 3 0,3 ±0,2 6,1
Таблица 4.2. Влияние F-37 в различных концентрациях на частоту транслокаций, индуцированных облучением
в половых клетках мышей
Способ воздействия Концентрация, мг/кг Сперматоциты Сперматогонии
число перестройки, % число перестройки, %
метафаз перестроек метафаз перестроек
Облучение — 763 26 3,4 ±0,66 1681 38 2,3 ±0,36
F-37 + облучение 5 928 18 1,9 ±0,45 2186 24 1,1 ±0,21
То же 10 1537 31 2,0 ±0,35 1102 13 1,2 ±0,31 ’
> 15 977 19 1,9 ±0,46 1748 15 0,8 ±0,21
> 20 1351 18 1,3 ±0,30 520 4 0,8 ±0,39
> 25 983 15 1,5± 0,39
> 33 1085 23 2,1 ± 0,43
Рис. 4. к Влияние различных концентраций F-37 на частоту
мутаций, индуцированных облучением в половых клет-
ках мышей:
1 — облучение сперматоцитов; 2 — облучение сперматогониев;
3 — F-37 + облучение сперматоцитов; 4 — F-37 + облучеиие спер-
матогониев
Таким образом, инденовые препараты эффективны в до-
статочно большом диапазоне концентраций и, главное, веще-
ства в этих концентрациях нетоксичны. Так, препарат F-37
проявляет антимутагенную активность даже в концентрации
5 мг/кг, т. е. 1/100 ЛД50.
4.3. Зависимость антимутагенного действия
инденовых соединений от дозы облучения
и способа введения в организм
Для изучения зависимости радиозащитного дейст-
вия аминоинденов от дозы облучения использовались препа-
раты F-37 и F-11. Облучение проводилось в диапазоне доз
от 0,026 до 0,234 Кл/кг. Исследована модификация мутаген-
ного действия облучения в сперматоцитах и сперматогониях
мышей.
Показано, что препарат F-37 в концентрации 50 мг/кг зна-
чительно снижает выход транслокаций в сперматоцитах мы-
шей при всех изученных дозах облучения (табл. 4.3, рис. 4.2).
Препарат F-11 (25 мг/кг) также оказал защитный эффект почти
при всех дозах облучения сперматоцитов. Интересно отметить,
что, хотя относительная степень защиты и снижалась с увели-
чением дозы облучения (так, например, при дозе 0,026 Кл/кг
препарат F-37 уменьшил выход мутаций в 6 раз, а при дозах
78
Таблица 4,3. Влияние F-37 и F-11 на уровень хромосомных аберраций,
индуцированных в сперматоцитах мышеи
рентпноваснм излучением и различной дозе
Доза облучения, Кл/кг Число метафаз Клетки с транслокациями t
ЧИСЛО % С одной с двумя
число % число %
F-37
0,02 1741 1450 33 5 1,8+ 0,3 0,3+ 0,1 33 5 100 100 — 4,3
0,05 2717 64 2,3+ 0,3 64 100 — — 4,6
1716 13 0,7+ 0,2 13 100
0,08 3713 87 2,4+ 0,2 85 97,7 2 2,3 5,2
1288 9 0,7 ±0,2 9 100 —
0,10 2655 109 4,0+ 0,4 105 96,2 4 3,8 4,9
2717 47 1,8+ 0,2 47 100 — —
0,13 1387 65 4,7+ 0,5 64 98,5 1 1,5 4,3
1147 21 1,8+ 0,4 21 100 — —
0,16 896 48 5,3+ 0,7 47 97,9 1 2,1 3,3
1346 34 2,5+ 0,4 32 93,8 2 6,2
0,17 879 1168 48 33 5,4+ 0,7 2,8+ 0,5 43 32 88,4 96,9 5 1 11,6 3,1 3,4
0,18 1739 102 5,8+ 0,6 98 96 4 4 3,8
1772 41 2,3+ 0,4 37 90,0 4 10,0
0,20 1585 1182 106 30 6,7+0,6 2,5+ 0,4 102 30 96,1 100 4 3,9 4,3
F-11 1
0,02 1741 33 1,8+0,3 33 100 — — 2,1
775 8 1,0+0,4 8 100 — —
0,05 2717 64 2,3+0,3 64 100 — — 3,6
1911 20 1,0 ±0,2 20 100 — • —
0,08 3713 87 2,4 ±0,2 85 97,7 2 2,3 1,0
1522 29 1,9 ±0,3 29 100 — —
0,10 2665 109 4,0 ±0,4 105 96,2 4 3,8 5,8
1552 21 1,3±0,3 20 95,2 1 5,0
0,13 1387 65 4,7±0,6 64 98,5 1 1,5 3,6
1488 36 2,6 ±0,4 36 100 — —
0,16 896 48 5,3 ±0,7 47 97,9 1 2,1 1,6
613 23 3,7 ±0,8 23 100 — —
0,17 879 48 5,4 ±0,7 43 88,4 5 11,6 3,2
841 22 2,6 ±0,5 21 95,3 1 4,7
0,18 1739 102 5,8 ±0,6 98 96 4 4 1,7
1273 55 4,4 ±0,6 51 92,1 4 7,9
0,20 1585 106 6,7± 0,6 102 96,1 4 3,9 3,1
1222 39 3,2 ±0,5 37 94,6 2 5,4
В числителе — облучение, в знаменателе — вещество + облучение.
79
Рис. 4.2. Влияние препаратов F-37 и F-11 на характер зависимости
между дозой облучения и выходом транслокаций в сперматоцитах
мышей:
1 - облучение; 2 - F-11 + облучение; 3 — F-37 + облучение
0,18-0,23 Кл/кг в среднем в 2 раза), абсолютная величина сни-
маемого количества мутаций не уменьшилась. Сам факт эф-
фективной защиты половых клеток от мутагенного действия
летальных доз облучения несомненно заслуживает внимания.
При облучении сперматогониев мышей получена характер-
ная зависимость выхода мутаций от дозы облучения (рис. 4.3).
Так, при возрастании дозы от 0,10 до 0,18 Кл/кг повышения вы-
хода транслокаций почти не наблюдалось, а при дальнейшем
увеличении дозы от 0,23 Кл/кг уровень мутаций снизился. В
литературе такое снижение выхода мутаций в сперматогониях
при высоких дозах облучения объясняется исходя из гипотезы
о существовании положительной корреляции между генетиче-
ской и физиологической радиочувствительностью спермато-
гониев [231]. Согласно этой гипотезе при высоких дозах облу-
чения происходит селективная гибель клеток, несущих мута-
ции, что и создает видимость снижения частоты мутаций с уве-
личением дозы облучения.
Показано, что инденовое соединение F-37 эффективно сни-
жает выход радиомутаций в сперматогониях мыши при дозах
80
облучения от 0,026 до 0,18 Кл/кг. При более высоких дозах за-
щитный эффект отсутствует (табл. 4.4, см. рис. 4.3).
Если бы протектор повышал выживаемость радиочувстви-
тельных сперматогониев, не влияя на их генетическую радио-
чувствительность, мы бы наблюдали увеличение выхода мута-
ций в этих клетках при высоких дозах облучения. Поскольку
препарат F-37 эффективно снижает индукцию транслокаций в
сперматоцитах мышей при всех исследованных дозах облуче-
ния, а в сперматогониях при дозах до 0,18 Кл/кг, вероятно, он
уменьшает частоту мутаций в сперматогониях и при более вы-
соких дозах, но при этом увеличивается и выживаемость кле-
ток, что и приводит к видимому отсутствию эффекта.
Препарат F-11 в использованной нами концентрации ока-
зался малоэффективным в защите сперматогониев мыши от
облучения - снижение выхода мутаций, полученное при его
использовании при разных дозах облучения, статистически
недостоверно (см. табл. 4.4).
Таблица 4.4. Влияние F-37 и F-11 на уровень хромосомных аберраций,
индуцированных рентгеновским излучением в различной дозе
в сперматогониях мышей
Доза облучения, Кл/кг Число метафаз Клетки с транслокациями г
ЧИСЛО % С одной с двумя
число % число %
F-37
0,02 1844 21 1,1 ±0,3 21 100 — — 1,8
1954 12 0,6+ 0,2 12 100 — —
0,05 1752 35 1,9 ±0,2 34 97,1 1 2,9 4,1
1296 7 0,6 ±0,2 7 100 — —
0,08 1467 33 2,2 ±0,4 33 100 — 2,3
1160 13 1,1 ±0,3 13 100 — —
0,10 2429 83 3,4 ±0,7 80 96,2 3 3,8 3,8
1114 9 0,8 ±0,3 9 100 — —
0,13 1133 40 3,5 ±0,5 38 94,8 2 5,2 3,4
744 5 0,6 ±0,28 5 100 — —
0,16 531 23 4,3 ±0,9 23 100 - — 3,0
785 11 1,4±0,1 11 100 — —
0,17 994 40 4,2 ±0,6 - 39 97,6 1 2,4 3,2
604 10 1,6+ 0,5 10 100 — —
0,18 1007 42 4,2 ±0,6 39 92,4 3 7,6 3,2
954 18 1,8 ±0,4 18 100 — —
0,20 863 34 3,9 ±0,6 32 93,8 2 6,2 0,4
1042 31 3,0 ±0,5 30 96,7 1 3,3
0,23 1028 25 2,4 0,5 25 100 — — 0,3
836 19 2,2 0,5 19 100 — —
6. Зак. 5222.
81
Продолжение табл. 4.4.
Доза облучения, Кл/кг Число метафаз Клетки с транслокациями t
ЧИСЛО % С одной с двумя
число % число %
. F-11 • *'
0,02 1844 21 1.1 ±0,4 21 100 — — 1,0
807 5 0,6 ±0,3 5 100 —
0,05 1752 35 1,9 + 0,2. 34 97,1 1 2,9 0,9
1118 16 1.2 ±0,5 16 100
0,08 1467 33 2,2+0,4 33 100 — — 1,0
1045 16 1,5 + 0,6 16 100 —
- 0,10 2429 83 3,4 ±0,7 80 96,2 3 3,8 1,3
1939 ' 54 2,7 ±0,4 54 100 — —
0,13 1133 40 3,5+ 0,5 38 94,8 2 5,2 0,2
796 30 3,7+ 0,6 28 92,9 2 7.1
0,16 531 23 4,3+ 0,9 23 100 — — 1,5
585 16 2,7+ 0,7 16 100 — —
0,17 994 40 4,2+ 0,6 39 97,6 1 2,4 1,6
842 24 2,8+ 0,6 23 95,7 1 4,3
0,18 1007 42 4,2+ 0,6 39 92,4 '3 7,6 2,1
939 24 2,5+ 0,5 24 100 — —
0,20 863 34 3,9 ±0,6 32 93,8 2 6,2 0,4
1053 39 3,5+0,6 37 94,6 2 5,4
0,23 1028 25 2,4+0,5 25 100 — — 0,1
896 23 2,5+ 0,5 22 95,5 1 4,5
В числителе — облучение, в анаменателе — вещество + облучение.
В работе [246] при исследовании влияния инденового пре-
парата F-37 на частоту индуцированных у-лучами ДЛМ в пост-
сперматогониальных стадиях и реципрокных транслокаций
в сперматогониях мыши защитного эффекта не обнаружено.
Очевидно, отсутствие эффекта F-37 в работе [247] связано с
использованием гибридных мышей. К такому выводу пришли
и авторы работы [248] при обнаружении неэффективности на
этих же гибридных мышах известных радиопротекторов циста-
мина и мексамина. Зависимость степени защитного эффекта от
линии мышей известна [173]. Нами еще раз исследовано на за-
шифрованных препаратах влияние соединения F-37 на мута-
генное действие облучения в половых клетках инбредных мы-
шей и показано достоверное антимутагенное действие этого
вещества как в сперматоцитах, так и в сперматогониях живот
ных (табл. 4.5).
82
Рис. 4.3. Влияние препаратов F-37 и F-11 иа характер зависимости
между дозой облучения и выходом транслокаций в спермато-
гонинх мышей:
1 — облучение; 2 — F-11 + облучение; 3 — F-37 + облучение
Радиозащитные препараты на практике удобнее вводить
перорально. Поскольку на дрозофиле было показано, что эф-
фективность препарата F-11 практически одинакова как при
его скармливании, так и при инъекциях, нами было изучено
влияние способа введения на генетическую активность пре-
парата у мышей.
Препарат F-37 вводили животным с помощью зонда через
рот в желудок в одном варианте за 30 мин до облучения по
100 и 200 мг/кг, в другом за 1 ч по 100,200 и 400 мг/кг (табл. 4.6).
Как видно из табл. 4.6, все варианты введения препарата сни-
зили выход мутаций, индуцированных облучением, но суще-
ственные различия наблюдались лишь в 7-м варианте воздей-
Таблица 4.5. Влияние F-37 на выход реципрокных транслокаций,
индуцированных облучением в половых клетках мышей
Способ воздействия Число t
Семен* ников метафаз транслокации на клетку (Зс+ $__), %
Облучение 0,08 Кл/кг F-37 (20 мг/кг) + облучение Сперматоциты 1 9 I 2278 8 | 2576 1,95 + 0,14 1,06+0,10 3,42
Облучение 0,08 Кл/кг 7перматогонии 11 I 730 3,06 + 0,40 3,31
F-37 (20 мг/кг) + облучение 11 798 1,27 + 0,37
83
ствия - при скармливании препарата по 200 мг/кг за 1,5 ч до
облучения. При суммировании данных, полученных при ис-
пользовании вещества в одной и той же концентрации
(табл. 4.7) или при одинаковом времени его введения, было
получено достоверное снижение мутагенного эффекта облуче-
ния при различных способах скармливания препарата F-37
(табл. 4.8). '
Необходимо отметить, что внутрибрюшинные инъекции
препарата (10-й вариант) оказались более эффективными, чем
скармливание (см. табл. 4.6), что не соответствует результатам,
полученным на дрозофиле (см. гл. 3). Однако на дрозофиле
применяли скармливание с питательной средой в течение все-
го жизненного цикла от яйца до имаго, что обеспечивало боль-
шее проникновение препарата в клетки гонад. Мышам же пре-
парат вводили в желудок с помощью зонда однократно, что,
очевидно, и явилось причиной меньшей эффективности инде-
нового препарата F-37 при пероральном введении, чем при
внутрибрюшинном.
4.4. Исследование возможности снижения
генетического эффекта
пролонгированного облучения
Согласно литературным данным возможность умень-
шения с помощью радиопротекторов биологического действия
пролонгированного облучения исследована преимущественно
по критериям выживаемости животных, поражения кроветвор-
ной ткани и некоторых физиологических и биохимических си-
стем организма. При этом установлено, что протекторы, защи-
щающие организм от кратковременного влияния излучения,
неэффективны при продолжительном его воздействии. Лите-
ратурных данных по вопросу химической защиты от мутаген-
ного действия пролонгированного облучения нет. В то же
время при использовании атомной энергии в мирных целях,
не говоря уже о последствиях атомных взрывов и аварий на
АЭС, живые организмы гораздо чаще подвергаются длитель-
ному воздействию излучения с малой мощностью дозы, чем
острому.
В связи с этим интерес представляет возможность умень-
шения генетического эффекта пролонгированного облучения с
немощью инденовых радиопротекторов. С этой целью изучал-
ся аминоинденовый препарат F-37, эффективно снижающий
мутагенное действие острого облучения, который сравнивался
с известным радиопротектором цистеамином.
84
Таблица 4.6. Зависимое» радиозащитного действия F-37
от способа его введения в организм мыши
Вариант Способ воздействия Время введения вещества до облучения» МИИ Способ введения Концен- трацня, мг/кг Число
семен- ников мета- фаз транслокации на клетку (x±S_),% X
1 Облучение — — — 10 2692 3,08 ±0,51
2 Вещество + облучение 30 перорально 100 4 598 2,51 ±0,32
3 То же 30 200 4 657 1,82 ±0,16
4 » 60 100 4 602 1,19± 0,20
5 » 60 200 4 59? 2,00 ±0,42
6 » 90 100 8 1015 2,05 ±0,14
7 » 90 200 8 1016 1,27 ±0,20*
8 9 3> Облучение 90 400 4 13 548 3713 2,26 ±0,18 2,40 ±0,24
10 Вещество + облучение 30 внутри- брюшинно 50 7 1288 0,70 ±0,20*
* Величина, отличающаяся от контрольной при Р < 0,01.
Таблица 4.7. Зависимое» радиозащитного действия F-37 от концентрации
при пероральном введении его в организм мыши
Способ воздействия Концент* грация, мг/кг Время введения вещества до облучения, мин Число
семей* ников метафаз транслокаций иа клетку (х±5_), % X
Вещество + облучение 100 30 4 . 598 2,51 + 0,32
То же 100 60 4 602 1,19 + 0,20
» 100 90 8 1015 2,05 ±0,14
£ 16 2215 1,95± 0,16*
> 200 30 4 657 1,82±0,16
> 200 60 4 593 2,00 ±0,42
» 200 90 8 1016 1,27 ±0,20**
Е 16 2266 1,59 ±0,14**
Облучение — — 10 2692 3,08 ±0,51
* Величина, отличающаяся от контрольной при Р < 0,05; ** величина, существенно
отличающаяся от контрольной при Р < 0,01.
Для того, чтобы на протяжении длительного времени об-
лучения в организме мышей поддерживалась нужная концент-
рация изучаемых соединений, их вводили внутрибрюшинно
перед облучением и дважды во время облучения через равные
промежутки времени: цистеамин 3 раза по 150 и F-37 - по
16,5 мг/кг. Облучение проводили в дозе 0,08 Кл/кг при мощно-
сти дозы 4 • 10~6 А/кг.
85
Таблица 4.8. Зависимость раДиозащитного действия F-37
от времени его введения (перорально) в организм мыши
Способ воздействия Время введения вещества до облучения, мнн Концент- грация, мг/кг Число
семен- ников метафаз транслокаций на клетку (х + $_), %
Вещество + облучение 30 100 4 598 2,51 ±0,32
То же 200 4 657 1,82±(Г,1б
X 8 1255 2,16+0,21
> 60 100 4 602 1,19 + 0,20
> 60 200 4 593 2,00 ±0,42
2 8 1195 1,59 ±0,19*
» 90 100 8 1015 2,05 ±0,14
90 200 8 1016 1,27 ±0,20**
> 90 400 8 548 2,26 ±0,18
£ 20 2579 1,78 ±0,14**
Облучение ~ — — 10 2692 3,08 ±0,51
* Величина, отличающаяся от контрольной при Р < 0,05; ** величина,.существенно
отличающаяся от контрольной прн Р < 0,01.
Таблица 4.9. Влияние F-37 и цистеамина на уровень транслокаций,
индуцированных в половых клетках мышей пролонгированным облучением
\ _ Способ воздействия Число
семенников метафаз транслокаций на клетку (*+$_),%
Сперматоциты
Облучение 9 2200 2,68 ±0,20
F-37 (16,5 мг/кг X з) + облучение 9 1608 1,61 ±0,39*
Цистеамин (150 мг/кг X 3) + облучение 4 828 2,60 ±0,50
Сперматогонии
Облучение 6 1015 1,85 ±0,13 .
F-37 (16,5 мг/кг X 3) + облучение 8 814 1,35 ±0,23
Цистеамин (150 мг/кг X 3) + облучение 4 301 1,50 ±0,60
* Величина, отличающаяся от контрольной при Р < 0,05.
Определяли частоту реципрокных транслокаций в сперма-
тоцитах и сперматогониях. Из исследованных соединений
лишь F-37 способен снижать мутагенное действие пролонгиро-
ванного облучения в сперматоцитах мышей: выход мутаций
уменьшился с 2,68 в контроле до 1,61 % в опыте (табл. 4.9).
Отсутствие защитного эффекта цистеамина в наших экспе-
риментах неудивительно, поскольку согласно литературным
данным этот препарат не способен защищать организм в тече-
86
Таблица 4,10, Блеяние F-37 при разных способах введения в организм
на уровень транслокаций, индуцированных в половых клетках мышеи
пролонгированным облучением
Способ воздействия Число
семенников метафаз транслокаций на клетку (x-i S_), %
Сперматоциты
Облучение 9 2198 1,65+0,12
F-37 (16,5 мг/кг X 3) + облучение 9 2928 0,75 + 0,09*
F-37 (25 мг/кг X 2) + облучение 8 1456 0,55 + 0,19*
F-37 (50 мг/кг) + облучение 9 3008 0,94 + 0,12*
Сперматогонии
Облучение 8 1038 . 0,88+0,10
F-37 (16,5 мг/кг X 3) + облучение 8 925 1,10 + 0,20
F-37 (25 мг/кг X 2) + облучение 8 1068 0,92+0,19
F-37 (50 мг/кг) + облучение 4 911 1,08 + 0,11
* Величия», отличающаяся от контрольной при Р < 0,01.
ние длительного времени. Очевидно, радиопротекторы такого
типа переводят биохимические системы организма в радиоре-
зистентное состояние лишь на какое-то ограниченное время.
Повторное введение препарата сказывается неэффективным.
Для F-37, обладающего высокой электроннодонорной ак-
тивностью, предполагался механизм радиозащитного действия,
основанный на передаче энергии излучения с молекул ДНК на
протектор. Такой процесс может осуществляться в течение
всего времени нахождения защитного соединения в клетке.
Поэтому, поддерживая нужную концентрацию протектора на
протяжении всего времени облучения, можно получить сни-
жение эффекта пролонгированного облучения, что мы и наблю-
дали в эксперименте с F-37.
Необходимо было установить зависимость защитного дей-
ствия F-37 от кратности его введения во время длительного
облучения: 1) трехкратно, как и в предыдущей серии опытов;
2) двухкратно (половину дозы вещества перед облучением и
половину во время облучерия); 3) однократно (всю дозу 50 мг
перед облучением).
Все способы введения F-37 уменьшали выход мутаций в
сперматоцитах (табл. 4.10). При трехкратном введении препа-
рата частота мутаций снизилась с 1,65 до 0,75 %, при двухкрат-
ном введении - до 0,55 и при однократном - до 0,94 %. Оче-
видно, это объясняется тем, что препарат F-37 достаточно дол-
го сохраняется в клетке. Это обеспечивает снижение пролон-
гированного действия облучения даже при однократном вве-
87
Таблица 4.11. Влияние F-37 и F-11 на частоту хромосомных перестроек, индуцированных в культуре лимфоцитов
периферической крови человека облучением на разных стадиях клеточного цикла
Способ воздействия Возраст культуры в момент воздействия, ч
0 1 20 40 46 51
число метафаз перестрой- ки, % число метафаз перестрой- ки, % ЧИСЛО метафаз перестрой- ки, % число метафаз перестрой- ки, % число метафаз перестрой ки, % число метафаз перестрой- ки, %
Облучение 850 36,4± 1,62 900 40,0 ±1,63 710 60,6± 1,83 810 31,0 + 1,65 838 78,0 ±1,44 800 83,0 ±1,32
F-37 + облучение 725 10,4+1,13 850 8,3 ±0,94 800 10,1 ±1,06 824 9,2 ±1,00 800 35,2 ±1,65 900 38,0+1,22
F-11 + облучение 700 16,4 ±1,39 780 12,5± 1,18 601 25,0 ±1,76 578 15,0 ±1,48 600 44,1 ±2,03 600 47,0 ±2,04
Таблица 4.12. Влияние наиболее эффективных инденовых соединений на мутагенный эффект облучения у животных
Объект исследования Концентрация Время введе- ния вещества до облучения, МИИ Доза облучения, Кл/кг Исследованные тесты Стадии сперматогенеза Полученный результат
Дрозофила 3,0 мг/мл (скармливание) , 1,2 мг/мл (скармливание) 0,2 мг/мл (скармливание) - F-37 0,4 РЛМ 0,2 Э> 0,2 3> постмейотические сперматогонии защита в 2 раза то же защита в 1,8 раза
Мыши 80 мг/кг 30 0,08 транслокации защита слабая
50 мг/кг 0,08 сперматоциты защита в 2,5 раза
30 0,08 сперматогонии защита в 12 раз
5,10,15, 33 мг/кг сперматоциты защита в 2,8 раза
30 0,08 защита в 1,7 раза
20,25 мг/кг 30 0,08 защита в 2,5 раза
5,10 мг/кг .30 0,08 сперматогонии защита в 2 раза
15, 20 мг/кг 30 0,08 » 1 защита в 3 раза
50 мг/кг 30 0,02-0,20 сперматоциты защита в 2,6 раза
0,02-0,18 сперматогонии то же
20 мг/кг 0,20-0,23 нет эффекта
30 0,12 длм постспермато гениальные то же
20 мг/кг 30 0,08 транслокации сперматогонии
30 0,08 сперматоциты зашита в 1,8 раза
100—400 мг/кг сперматогонии защита в 2,4 раза
30-90 0,06 ?5> сперматоциты защита
F-11
Дрозофила 0,25 мг/мл (скармливание) — 0,8 РЛМ постмейотические зашита в 2,5 раза
0,20 мг/мл (скармливание) — 0,8 спермии усиление
0,4 % (по 0,0006 мл) сперматогонии зашита в 1,8 раза
60-120 0,8 спермии усиление
0,2 мг/мл сперматогонии защита в 2 раза
— 0,2 то же
(личинкам)
Мыши 12 мг/кг 30 0,08 транслокации сперматоциты нет эффекта
сперматогонии зашита в 2,5 раза
25 мг/кг 30 0,08 сперматоциты защита в 3 раза
25 мг/кг » сперматогонии то же
30 0,02-0,20 сперматоциты защита
сперматогонии иет эффекта
дении протектора. В то же время в сперматогониях мышей ни
одно из изученных соединений не уменьшало мутагенного
действия пролонгированного облучения (см. табл. 4.9, 4.10).
Влияние интенсивности излучения на мутационный про-
цесс подробно исследовалось в работах [249-259]. При низких
мощностях дозы рентгеновского излучения в сперматогониях
животных возникает меньше мутаций, чем при более высокой
интенсивности излучения [249, 250, 254-256, 259, 260]. Ряд ав-
торов, наблюдавших такое уменьшение выхода мутаций в
сперматогониях и ооцитах при длительном облучении по срав-
нению с острым, объясняют этот эффект восстановлением пред-
мутационных повреждений хромосом при излучении с низкой
интенсивностью, предполагая, что при воздействии излучения
с высокой мощностью процесс репарации подавляется или по-
вреждается [249,250,255,256]. Однако зависимости выхода му-
таций от интенсивности излучения для постмейотических ста-
дий сперматогенеза не обнаружено [261]. Объяснить, почему в
постмейотических клетках не проявляется эффект снижения
мощности дозы, трудно. В то же время разница в реакции пред-
мейотических и постмейотических клеток на мутагенное дей-
ствие пролонгированного облучения коррелирует с результа-
тами, полученными нами при. модифицировании инденовым
препаратом F-37 генетического эффекта такого облучения в
сперматоцитах и сперматогониях мышей.
Однако, несмотря на отсутствие защитного эффекта инде-
нового препарата F-37 при облучении сперматогониев, его на-
личие при пролонгированном облучении сперматоцитов имеет
несомненный теоретический и практический интерес.
4.5. Антимутагенное действие
инденовых соединений
в культивируемых клетках человека
Инденовые препараты F-37 и F-11 как наиболее эф-
фективные исследовались на их способность запщщать клетки
человека от мутагенного действия излучения (табл. 4.11). Про-
вести такое исследование можно Т9лько на культивируемых
клетках человека. И хотя эти клетки не половые, а соматиче-
ские, к тому же культивируемые вне организма, их изучение
может дать дополнительную информацию об особенностях ан-
тимутагенного действия аминоинденов. Исследование право-,
дилось на культуре клеток периферической крови человека.
Культивирование крови клинически здоровых доноров
выполняли согласно методике Мурхеда [262]. Продолжитель-
ность культивирования составляла 54 ч. Колхицин вводили в
90
культуру за 3 ч до гипотонизации. Культуры гипотонизирова-
ли 0,95%-ным раствором цитрата натрия и фиксировали смесью
ледяной уксусной кислоты и этилового спирта.
Облучение проводили на аппарате РУМ-17 (мощность дозы
5-10-5 А/кг, общая доза 0,026 Кл/кг) через 1, 20, 40, 46, 51 ч с
момента культивирования.
Препараты F-37 и F-11 вводили за 30 мин до облучения,
затем дважды отмывали раствором Хенкса с последующей за-
меной на среду с ФГА. Концентрации препаратов выбирали на
основе предварительного анализа их цитогенетического эф-
фекта в культуре лимфоцитов периферической крови чело-
века на стадии метафазы. После испытания препаратов F-37 и
F-11 в разных концентрациях была выбрана концентрация
0,001 мг/мл, при которой они не оказывали существенного вли-
яния на частоту аберрантных клеток в необлученной культуре.
При анализе хромосомных аберраций учитывали одиноч-
ные и парные фрагменты, обмены хромосомного и хроматид-
ного типов.
Согласно литературным данным, полученным с использо-
ванием метода авторадиографии [263, 264], предполагалось,
что клетки крови человека через 0,20,40 и 46 ч от начала куль-
тивирования находятся на стадиях Go, Gj, S, G2 соответственно.
Естественный уровень появления аберраций хромосом в
наших исследованиях в среднем по циклу составил 1,15+0,26%.
Препарат F-37 не влиял на спонтанный темп мутирования лим-
фоцитов человека, но снижал частоту перестроек, вызванных
облучением на всех изученных стадиях клеточного цикла.
Суммарные данные по влиянию инденовых препаратов
F-37 hF-11 на частоту хромосомных перестроек, индуцирован-
ных рентгеновским излучением в культуре лимфоцитов пери-
ферической крови человека на разных стадиях клеточного
цикла,представлены в табл. 4.11 и на рис. 4.4. Наибольший за-
щитный эффект препарата F-37 обнаружен в клетках, находя-
щихся в момент облучения на стадии Gj. Так, при облучении
клеток, защищенных препара^МТ-37, Ч&рез 1 ч после начала
культивирования выход перестроек хромосом снизился с
40,0+1,63 до 8,3+0,94 %, т. е. почти в 5 раз, а через 20 ч - с 60,6+
±1,83 до 10,1 ± 1,06 %, т. е. в 6 раз.
В конце стадии S (облучение через 40 ч инкубации) защит-
ный эффект препарата F-37 был несколько меньше - процент
перестроек хромосом уменьшился в 3 раза (с 31,0+1,65 до 9,2+
±1,00 %), так же, как и на стадии Go (облучение до стимуляции
ФГА), на которой наблюдалось снижение выхода перестроек
(с 36,4 ±1,62 до 10,4 + 1,13%).
В культурах, облученных на стадии G2 (облучение через
91
Рис. 4.4. Влияние инденовых соединений на выход радиомутаций на
разных стадиях клеточного цикла в культивируемых лимфоцитах пе-
риферической крови человека:
1 - облучение; 2 - F-11 + облучение; 3 - F-37 + облучение
46 и 51 ч после начала культивирования), наблюдался макси-
мальный выход перестроек хромосом. Препарат F-37 снизил
выход перестроек хромосом с 78,0 ±1,44 до 35,2 +1,65 % (46 ч)
и с 83,0 ±1,32 до 38,0 ±1,22 % (51 ч), т. е. в 2 раза.
Препарат F-11 также защищал наследственные структуры
клеток человека от облучения, но в отличие от препарата F-37
он сам обладал слабым мутагенным действием (см. табл. 4.11).
Максимальное защитное действие препарата F-11 прихо-
дится на стадию Gp при облучении которой через 20 ч инкуба-
ции выход перестроек хромосом снизился с 60,6 ± 1,83 до 25,0 ±
± 1,76 %, т. е. в 2,5 раза, а при облучении через 1 ч - с 40,0 ± 1,63
до 12,5± 1,18 %, т. е. более чем в 3 раза.
На стадии Go применение препарата F-l 1 привело к умень-
шению частоты индуцированных облучением аберраций с
36,4 ± 1,62 до 16,4 ± 1,39 % (в 2,5 раза), а на стадии S (40 ч) и Go
(46 ч) примерно в 2 раза (с 31,0 ±1,65 до 15,0 ± 1,48 и с 78,0 ±1,44
до 44,1 ± 2,03 % соответственно).
Таким образом, препараты F-37 и F-11 оказались способны-
; ми защищать наследственные структуры лимфоцитов челове*
j ка, облученных на всех стадиях митотического цикла: Go, Gj,
S и G2. В этом их преимущество по сравнению с другими ра-
: диопротекторами, изученными в культуре клеток человека
. in vitro, способными защищать только отдельные стадии кле-
точного цикла.
Проведенные на клетках млекопитающих исследования
подтвердили ряд выводов, полученных и в опытах на дрозо-
филе (см. гл. 3).
92
Во-первых, показано, что изученные инденовые соедине-
ния способны защищать от мутагенного действия облучения
сперматогонии животных. Этот факт получен впервые и пред-
ставляет несомненный интерес как с практической, так и тео-
ретической точки зрения.
Во-вторых, подтверждено, что аминоиндены в отличие от
традиционных радиопротекторов эффективны в нетоксичных
концентрациях (для мышей вплоть до 1/100 ЛД50), что важно
в плане практического использования препаратов.
В этом же отношении интересна и возможность введения
препарата не только с помощью инъекций, но и перорально,
показанная и на дрозофиле и на мышах. Кроме того, на мышах
установлено, что исследованные инденовые соединения эф-
фективны в широком диапазоне концентраций, а также при
облучении в большом интервале доз - от 0,026 до 0,18 Кл/кг,
а в сперматоцитах и до 0,20 Кл/кг. Причем возможность умень-
шения генетических повреждений в половых клетках при об-
лучении их в дозах, летальных для целого организма, показа-
на впервые и важна с теоретической точки зрения.
Впервые обнаружена и возможность снижения мутагенно-
го действия пролонпфованного облучения, что актуально и
для теории и для практики.
Исследования, проведенные на культивируемых клетках
человека, показали, что изученные инденовые соединения эф-
фективно снижают генетическое действие радиации в сомати-
ческих клетках человека на всех стадиях клеточного цикла,
что выгодно отличает их от других радиопротекторов, способ-
ных защищать клетки лишь на отдельных стадиях клеточного
цикла [265].
Таким образом, полученные данные показывают, что неко-
торые аминоинденовые препараты обладают целым рядом пре-
имуществ по сравнению с традиционными радиопротекторами
[266]. Результаты, полученные при исследовании наиболее эф-
фективных инденовых соединений у животных, приводятся в
табл. 4.12. Но поскольку эти вещества являются синтетически-
ми красителями, была сделана попытка найти их природный
аналог. Перспективность использования природных соедине-
ний в качестве антимутагенов при спонтанном и химическом
мутагенезе обоснована в работах [267-270]. С точки зрения
радиационного мутагенеза внимания заслуживал меланин -
природный пигмент, обладающий сходными с инденовыми со-
единениями свойствами.
93
ГЛАВА 5
ВЛИЯНИЕ МЕЛАНИНА НА МУТАЦИОННЫЙ
ПРОЦЕСС, ИНДУЦИРОВАННЫЙ ОБЛУЧЕНИЕМ
У ЖИВОТНЫХ
5.1. Биологическая роль меланиновых пигментов
Меланины представляют собой конденсированные
фенольные соединения. Они присутствуют в тканях растений,
животных и многих микроорганизмов. В-организме человека
этот пигмент придает окраску волосам, бровям, ресницам, ра-
дужной оболочке глаза, коже. В коже животных и человека
присутствие и новообразование меланина представляет собой
защитную реакцию организма на действие ультрафиолетового
излучения.
Под влиянием ультрафиолета интенсифицируется процесс,
образования меланина из тирозина и других мономеров (за-
гар - защитная реакция организма на воздействие солнечных
лучей). Возникновение черной кожи у человека при продви-
жении первоначальной белой расы в тропические районы про-
изошло, по мнению Ленграйджа [271], в результате отбора мно-
гих мелких мутаций, обусловливающих формирование все бо-
лее и более темной кожи, что имеет большое адаптивное зна-
чение в этих районах.
Образование меланина в организме придает ему устойчи-
вость не только к ультрафиолету, но и ионизирующей ра-
диации.
Так, у многочисленных видов микроскопических грибов,
актиномицетов и некоторых бактерий бурые и черные мелани-
новые пигменты служат защитой от жестких электрдмагнит-
ных излучений и являются основной причиной высокой устой-
чивости пигментированных микроорганизмов не только к
ультрафиолетовому (в том числе и коротковолновому), но и
к рентгеновскому излучению.
Штаммы микроорганизмов, содержащих меланиновые пиг-
менты, настолько устойчивы к действию солнечного ультра-
фиолета и космических лучей, что живут и размножаются в
высоких слоях атмосферы, горах, пустынях, Арктике и Антарк-
тике - там, где другие микроорганизмы погибают. Меланин в
определенных условиях увеличивает выживание даже после
абсолютно летальной дозы (ЛД100) радиации [272].
Повышение естественного радиоактивного фона, обуслов-
ленное применением радиоактивных веществ, нарушением
хранения радиоактивных отходов и т. д., способствует преиму-
щественному развитию темнопигментированных грибов, неко-
94
торые из них выживают после облучения почвы дозой 6400 Гр
[273]. Имеются сведения о преимущественной встречаемости
меланинсодержащих видов грибов в почвенных образцах, ото-
бранных после взрыва атомной бомбы в районе атолла Би-
кини [274].
В ряде работ [275, 276] показана повышенная радиоустой-
чивость черных мышей- а также появление гиперпигментации'
у белых и серых в результате продолжительного облучения их
малыми дозами у-лучей.
При сравнении выживаемости у-облученных белых и чер-
ных штаммов дрожжей также выявлены различия, обуслов-
ленные присутствием в клетках черного пигмента меланино-
вой природы [277]. Клетки трансплантируемой меланомы хо-
мячка, содержащие меланин, в 2 раза более устойчивы к ле-
тальному действию радиации,, чем такие же клетки, лишен-
ные пигмента [278].
По данным работы [279], облучение аксолотлей дозами 500,
1500,3000 Р стимулировало процесс меланизации в печени, го-
лове и глазах. Автор указывает, что такая гиперпигментация
является защитной реакцией организма на облучение. Анало-
гичные данные получены и при облучении гипофиза лягушки
у-лучами: усилилось образование меланинов в меланофорах
кожи вследствие выделения интермедина из средней доли ги-
пофиза и изменения обмена тирозина [280]. В первые часы по-
сле облучения в тканях облученных животных наблюдается
усиление окисления тирозина [281].
Меланины животного происхождения способны взаимо-
действовать со многими радиоактивными элементами: цезием,
радием,1 кобальтом, рутением, стронцием, торием, а также с ра-
диоактивными изотопами цинка, кадмия, свинца, зфома, мар-
ганца и железа [282]. ^Що установлено, что меланин эффек-
тивно сорбирует ионы различных металлов [283]. Таким же об-
разом меланины грибного происхождения сорбируют ионы
Pb, Th, Hg, La, Zn, Cz [284]. По-видимому, аналогичные свойства
животного меланина ответственны за преимущественное на-
копление 226Ra в пигментированных тканях животных, а
также в меланоме [285]. Если в среде концентрация ^Ra со-
ставляёт“15,1 Ки/кг, то в меланоме накапливается до 40-
360 Ки/кг.
Как отмечал Н. И. Вавилов, в центрах формообразования
растений (центры происхождения растений - по Н. И. Вавило-
ву) преобладают сильно пигментированные формы. Отбор че-
ловеком светлоокрашенных форм растений при продвижении
их культуры в более северные районы означает, по мнению
Щербакова [286], отбор форм, менее защищенных от мутаген-
95
ных факторов по сравнению с пигментированными дикорасту-
щими формами.
Очевидно, не случаен тот факт, что ткани растений, окру-
жающие генеративные ткани, окрашены пигментами, которые,
вероятно, должны обеспечивать их защиту от мутагенов. На-
личие форм с высоким содержанием пигмента характерно для
высокогорных областей с повышенным уровнем ультрафиоле-
товой радиации и космических лучей.
В ряде экспериментов были сделаны попытки использо-
вать меланин для усиления биологической радиорезистентно-
сти. В работе [287] из гриба Pullularia prototropha было выделе-
но четыре фракции меланина, различающиеся растворимостью
в щелочи и этаноле. Две из них оказывали защитное действие
при облучении мышей рентгеновским излучением и увеличи-
вали среднюю продолжительность жизни мышей в 1,5 раза. До-
бавление меланина в питательную среду существенно повыша-
ло выживаемость облученных культивируемых клеток соеди-
нительной ткани мышей [288], а внутрибрюшинное введение
меланина белым мышам до облучения их в дозе 800 Р, кроме
того, значительно увеличивало и продолжительность жизни
[289].
Сведения о влиянии меланина на мутагенное действие ра-
диации до начала наших исследований отсутствовали. Однако
установлено, что фенолы могут связываться с ДНК, в частно-
сти с тимином [290]. Радиационное повреждение ДНК как раз
и начинается с тимина, а меланин способен не только улавли-
вать и обезвреживать свободные радикалы, но и регулировать
концентрацию неспаренных электронов [278]. Кроме того, для
ряда фенолов (Na-галлат, пропилгаллат, кумарины и катехи-
ны) показана антимутагенная активность [291-293]. В качестве
одной из гипотез, объясняющих их антимутагенную способ-
ность, предполагается взаимодействие фенолов с функцио-
нальными группами ДНК, которое может экранировать важ-
ные участки ДНК от действия мутагена или отводить избы-
точную энергию [292]. Это послужило предпосылкой для ис-
следования способноср! меланина защищать наследственные
структуры организма от индукции радиационных мутаций
[294,295].
Исследование проведено на дрозофиле и мышах с исполь-
зованием методик, описанных в гл. 3 и 4. Меланин получали
путем аутоокисления ДОФА in vitro при pH 7-7,5. В этих усло-
виях согласно работе [296] ДОФА спонтанно окисляется с об-
разованием меланина по схеме:
96
Меланин Индол-5,6-хинон 5,6-дигидронсииндол
5.2. Антимутагенный эффект меланина у дрозофилы
Для изучения антимутагенной активности мелани-
на у дрозофилы его вводили в питательную среду из расчета
0,66 и 0,90 мг/мл среды.
Воздействию подвергали личинок двух- и трехдневного
возраста, у которых все половые клетки находятся на стадии
сперматогониев. Для выравнивания возраста личинок на сре-
ду с меланином и нормальную пйтательную среду помещали
на короткий срок (5-6 ч) мух линии Berlin в избытке (для боль-
шей откладки яиц). На третий день личинок, питавшихся нор-
мальной средой и средой с меланином, одновременно облуча-
ли на гамма-установке в дозе 0,6 Кл/кг при мощности дозы
1,7 • 10-2 А/кг, после чего и тех и других помещали на нормаль-
ную питательную среду. После вылупления облученных сам-
цов их скрещивали с виргинными самками тестерной линии
Мёллер-5. Определяли частоту рецессивных сцепленных с по-
лом летальных мутаций у самцов, питавшихся: 1) нормальной
средой и необлученных (спонтанная частота); 2) средой с мела-
нином и необлученных; 3) нормальной средой и облученных
и 4) средой с меланином и облученных.
Прежде чем изучать влияние меланина на индукцию мута-
ций облучением, следовало выяснить, не обладает ли этот пиг-
мент мутагенным эффектом. Были определены нетоксичные
концентрации меланина, при внесении которых в питательную
среду наблюдалось нормальное размножение особей. В первом
опыте использовали концентрацию 0,66, а во втором -
0,90 мг/мл среды. В обоих опытах меланин снизил частоту
спонтанных мутаций: в первом с 0,31 ±0,10 до 0,07 ±0,04 %, а
во втором - с 0,29 ±0,10 до 0,14 ±0,11 % (табл. 5.1). Во втором
опыте снижение уровня мутаций статистически недостоверно.
При суммировании данных обоих опытов антимутагенный эф-
фект меланина оказался высокодостоверным. Таким образом,
7. Зак. 5222. 97
Таблица 5.1. Влияние меланина на частоту спонтанных рецессивных
летальных мутаций в сперматогониях дрозофилы
Способ воздействия Число изученных хромосом Мутация Р
число | %
Без воздействия (спонтанная частота) Скармливание меланина (0,66 мг/мл среды) Опыт 3208 2934 Опыт I 10 2 II 0,31 + 0,10 0,07 ±0,04 0,98
Без воздействия 2367 1 7 0,29 + 0,10 0,75
Скармливание меланина (0,9 мг/мл среды) 2018 | 3 Опыт I + II 0,14 ±0,08
Без воздействия "Окармливание меланина 5575 4952 17 5 0,30 ±0,07 0,10 ±0,04 0,89
Таблица 5.2. Влияние мелайика на частоту рецессивных летальных мутаций,
индуцированных облучением в сперматогониях дрозофилы
Число Способ воздействия изученных хромосом Мутация Р
ЧИСЛО %
Опыт I Облучение 2940 45 Меланин (0,66 мг/мп) + облучение 3498 35 Опыт II Облучение 2036 17 Меланин (0,9 мг/мл) + облучение 2287 9 1,53 ±0,23 1,00± 0,17 0,83 ±0,20 0,39 ±0,13 0,95 | 0,95
Таблица 5.3. Влияние меланина на выход реципрокных транслокаций,
индуцированных облучением в сперматоцитах мышей
Способ воздействия Число
семенников метафаз транслокация X
Облучение Опыт I 6 ’ 1 625 2,50 ±0,36
Меланин (50 мг/кг) + облучение 15 1 2053 1,18 ±0,27*
Облучение Опыт II 8 1 940 I 1,88±0Д7
Меланин (50 мг/кг) + облучение 10 | 2360 0,69 ±0,15**
* Величина, существенно отличающаяся от контрольной при Р < 0,05; ** величина,
существенно отличающаяся от контрольной при Р < 0,01.-
98
было показано, что меланин не только не обладает мутаген-
ными свойствами, но и является эффективным антимутагеном,
Снижающим уровень спонтанного мутирования.
При исследовании влияния меланина на выход мутаций,
индуцированных облучением, в первом опыте наблюдалось
незначительное, но достоверное снижение частоты мутаций с
1,53 + 0,23 до 1,00 ± 0,17 % (табл. 5.2). Во втором - антимутаген-
ный эффект меланина оказался более выраженным: индукция
мутаций уменьшилась с 0,83±0,20 до 0,39±0,13 %. Обращает на
себя внимание факт, что при одной и той же дозе облучения
0,6 Кл/кг в первом опыте было получено 1,53 ± 0,23 % мутаций,
а во втором - 0,83 + 0,23 % мутаций. Это можно объяснить не-
достаточно точной дозиметрией на гамма-установке с высокой
мощностью дозы. Для того, чтобы эти погрешности не сказа-
лись на результатах экспериментов, опытный и контрольный
образцы всегда облучались одновременно. Дальнейшие иссле-
дования проводились с использованием аппарата РУМ-17.
Разную эффективность снижения частоты индуцированных
мутаций в двух вариантах опытов можно объяснить двумя
причинами. Во-первых, во втором опыте концентрация мела-
нина была выше, чем в первом, а чем больше протектора в
клетке, тем большую эффективность защиты можно ожидать.
Во-вторых, более низкий исходный уровень мутаций во вто-
ром опыте (0,83 по сравнению с 1,53 % в первом) говорит об
облучении меньшей дозой. Для инденовых красителей было
показано, что они более эффективно защищают наследствен-
ные структуры клетки при низких дозах облучения, чем при
высоких (см. гл. 4). Таким же свойством, возможно, обладает
и меланин.
Из полученных на дрозофиле данных можно сделать вы-
вод, что природный пигмент меланин является таким же эф-
фективным радиопротектором, как и инденовые красители,
способным снижать выход точковых мутаций, индуцирован-
ных облучением в сперматогониях. Кроме того, меланин спо-
собен снижать спонтанную частоту рецессивных сцепленных с
полом летальных мутаций у дрозофилы, что также представля-
ет большую ценность с практической точки зрения.
5.3. Влияние меланина на индукцию мутаций
у мышей
Для изучения радиозащитной эффективности ме-
ланин вводили мышам внутрибрюшинно в концентрации
50 мг/кг за 30 мин до облучения в дозе 0,08 Кл/кг. Облучение
проводили при двух мощностях дозы - 6,5 • 10-3 А/кг (опыт I)
99
Таблица 5.4. Влияние ДОФА на уровень реципрокных транслокаций,
индуцированных облучением у мышей линии СЗН
Способ воздействия Число Транслокации (x±S_), %
семенников метафаз | транслокации
Сперматоциты
Облучение ДОФА (50 мг/кг) + облучение 1108 748 22 14 2,08 ±0,36 2,42 + 0,53
Сперматогонии
Облучение 12 1603 28 1,76 + 0,09
ДОФА (50 мг/кг) + облучение 10 1106 16 1,36+ U,lb
Таблица 5.5. Влияние меланина на выход реципрокных транслокаций,
индуцированных рентгеновским излучением в сперматоцитах
мышей разных линий
Линия мышеи Число Метафазы с транслокациями d
семен- ников изученных метафаз число %
Af 14 2045 39 2,08 ±0,20 -0,36
14 2282 38 1,73 ±0,17
СЗН 10 948 24 2,38 ±0,11 -1,16*
10 1553 20 1,22 ±0,24
С57В1 10 1256 36 2,59 ±0,26 -1,54*
10 1415 17 1,05 ±0,19
В числителе — облучение; в знаменателе — меланин + облучение. * Величина, суще-
ственно отличающаяся от контрольной при Р< 0,01.
Таблица 5.6. Влияние меланина на выход реципрокных транслокаций,
индуцированных рентгеновским излучением в сперматогониях
мышей разных линий
Линия мышей Число Метафазы с транслокациями d
семен- ников изученных метафаз число %
Af 8 1093 21 1,97 ±0,17 0,24
8 1054 18 1,73 ±0,14.
СЗН 8 1279 29 2,30 ±0,27 0,43
С57В1 12 8 1455 1021 28 21 1,87±0,15 2,06 ±0,13 0,69*
4 540 7 1,37 ±0,13
В числителе — облучение; в знаменателе — меланин + облучение. * Величина, суще-
ственно отличающаяся от контрольной при Р < 0,01.
100
и 4,5 • 10-4 А/кг (опыт II). Определяли частоту реципрокных
транслокаций, индуцированных в сперматоцитах мышей.
Данные, полученные^ при исследовании влияния меланина
на мутагенное действие облучения при разных мощностях до-
зы, приведены в табл. 5.3. При более высокой мощности дозы
облучения (опыт I) частота мутаций под действием меланина
снизилась в 2 раза - с 2,50±0,Зб до 1,18±0,27 %. При использо-
вании более низкой мощности дозы (опыт II) меланин умень-
шил выход транслокаций в сперматоцитах мышей с 1,88 ±0,27
до 0,69 ±0,15 %, т. е. в 2,7 раза.
Таким образом, данные, полученные при исследовании
мышей, подтвердили показанную на дрозофиле способность
меланина снижать уровень радиационного мутагенеза.
Проверить, способен ли меланин уменьшать частоту спон-
танных мутаций в половых клетках мышей, не представлялось
возможным, так как уровень спонтанного возникновения ре-
ципрокных транслокаций в генеративных клетках мышей низ-
кий. Так, перестройки в половых клетках здоровых мышей в
возрасте до 600 дней (в наших опытах использовались самцы в
возрасте 60-75 дней) практически не выявлены [297]. Анало-
гичные результаты получены и в нашей лаборатории при изу-
чении спонтанной частоты мутаций в сперматоцитах и сперма-
тогониях мышей линии СЗН [298], поэтому исследование влия-
ния меланина на уровень спонтанного мутирования у мышей
по данному тесту не имело смысла.
Возник вопрос, обладает ли антимутагенной активностью
сам меланин или, возможно, его предшественник ДОФА, кото-
рый может превратиться в меланин не полностью и присутство-
вать в используемых нами растворах в неокисленном виде.
Для ответа на этот вопрос в тех же условиях проверялась
способность ДОФА модифицировать выход транслокаций в
сперматоцитах и сперматогониях мышей (доза облучения
0,08 Кл/кг, мощность дозы 4,5 • 10-4 А/кг).
Как видно из табл. 5.4, при инъецировании мышам неокис-
ленного раствора ДОФА в той же концентрации, в которой ис-
пользовали меланин, уровень индуцированных облучением
мутаций ни в сперматоцитах, ни в сперматогониях мышей
практически не изменился. Это позволило заключить, что ан-
тимутагенными свойствами обладает не ДОФА, а меланин.
.Для выяснения зависимости радиозащитного эффекта ме-
ланина от эндогенного содержания пигмента в организме ис-
следование проводилось одновременно на трех линиях мы-
шей - Af (белые), СЗН (серые) и С57В1 (черные). Животных об-
лучали рентгеновскими лучами в дозе 0,08 Кл/кг при мощ-
ности дозы 1,3 • 10~4 А/кг. Меланин вводили внутрибрюшинно
101
в концентрации 50 мг/кг. Полученные данные представлены в
табл. 5.5 и 5.6. Из этих таблиц видно, что по тесту реципрокных
транслокаций мыши линии С57В1 наиболее чувствительны к
воздействию рентгеновского излучения, а мыши линии Af ме-
нее чувствительны, что не коррелирует с общей радиочувстви-
тельностью этих линий, определяемой по ЛД50/30» и не соответ-
ствует количеству пигмента у разных линий. Отсутствие кор-
реляции между генетической радиочувствительностью разных
тканей животных и уровнем выживаемости облученных осо-
бей показано и в других работах [39,299,300].
Что же касается отсутствия корреляции между количе-
ством эндогенного меланина и радиочувствительностью, то
оно может быть объяснено тем, что исследованные линии мы-
шей отличаются не только содержанием пигмента, но и други-
ми генетическими особенностями, которые могут также вли-
ять на радиочувствительность животных.
Экзогенное введение меланина оказалось наиболее эффек-
тивным у самой радиочувствительной линии С57В1 - частота
индуцированных облучением мутаций уменьшалась почти в
2,5 раза. У мышей линии СЗН инъекции меланина снизили му-
тагенный эффект облучения примерно в 2 раза, а у мышей ли-
нии Af защитный эффект практически отсутствовал.
Таким образом, радиозащитняя эффективность экзогенно-
го меланина у разных линий мышей коррелирует с их радио-
чувстВительидстьюТчём радиочувствительнее мыши, тем боль-
ший"ЗйЩИТ1Тыи эффект достигаетсядри-ввёпении меланина.^
—Корреляция активности экзогенного введения меланина с
нативным содержанием пигмента оказалась обратной тому,
что мы ожидали. Можно было ожидать, что у линии Af, не име-
ющей эндогенного пигмента, радиозащитное действие мелани-
на должно быть наиболее эффективным. ОднаКо результаты
показали обратное - экзогенное введение меланина снижает
мутагенное действие облучения существеннее у тех линии мы.;
шеиГ у которых выше содержание нативного пигмента. У аль-
биносов нарушен процесс меланогенеза и, в частности, инги-
бированы реакции тирозингидроксилирования и образования
дигидроксифенилаланина. Очевидно, ингибиторы этих реак-
ций способны инактивировать введенный извне меланин.
Поскольку альбиносы в природе встречаются редко и в
принципе являются патологией, то отсутствие антимутагенно-
го действия меланина у линии мышей Af представляет лишь
теоретический интерес.
Способность меланина снижать уровень радиационного
мутагенеза у дрозофилы и нормальных мышей, а также часто-
ту спонтанных мутаций у дрозофилы представляется важной с
102
практической точки зрения и может послужить предпосылкой
для дальнейшего более углубленного исследования этогб пре-
парата на популяционном уровне.
ГЛАВА 6
МОНИТОРИНГ ПРИСПОСОБЛЕННОСТИ
ЭКСПЕРИМЕНТАЛЬНЫХ ПОПУЛЯЦИЙ ДРОЗОФИЛЫ
ПРИ ДЛИТЕЛЬНОМ ВОЗДЕЙСТВИИ ОБЛУЧЕНИЯ
И МЕЛАНИНА
6.1. Влияние ионизирующих излучений на популяции
Большое практическое значение приобрела пробле-
ма влияния ионизирующей радиации на живые организмы в
среде их обитания. Причиной этому явилось поступление в
окружающую среду искусственных радионуклидов в резуль-
тате проведения экспериментальных ядерных взрывов, при-
менения атомной энергии в мирных целях, а также аварий
на АЭС.
Интенсивное загрязнение окружающей среды сделало ак-
туальным выяснение отдаленных биологических эффектов,
индуцируемых в природных популяциях мутагенными факто-
рами, а также поиск возможностей предотвращения или сни-
жения вредных последствий загрязнения биосферы.
Несмотря на значимость популяционных исследований,
многие закономерности генетических процессов в популяциях
живых организмов раскрыты еще недостаточно [301-303]. Осо-
бенно это касается проблемы влияния на популяции длитель-
ных воздействий мутагенных факторов.
Первые исследования влияния на популяции острого об-
лучения, выполненные на дрозофиле [304-306], в известной
мере были стимулированы проводившимися в то время испы-
таниями атомных бомб в атмосфере, что приводило к облуче-
нию больших групп живых организмов. Полученные результа-
ты показали, что под влиянием ионизирующей радиации в по-
пуляциях появляется большое количество мутаций разных ти-
пов - леталей, полулегален и других мутаций, способных сни-
жать жизнеспособность особей. После прекращения облучения
популяции постепенно „очищаются” от вредных мутаций. Бы-
стрее всего из облученных популяций элиминируются особи,
несущие хромосомные перестройки и ДЛМ. Остальные типы
мутаций, меньше влияющие на жизнеспособность их носите-
лей, могут оставаться в популяции на протяжении многих по-
колений, снижая ее приспособленность.
103
Таким образом, после прекращения острого облучения в
популяции в течение более или менее длительного времени
происходит процесс „очищения” от возникших вредных мута-
ций. Полезные мутации, которые возникают гораздо реже, чем
вредные, сохраняются, если дают несущим их особям какие-то
преимущества. Необходимо помнить, что элиминация мутаций
сопровождается гибелью особей на разных этапах онтогенеза.
При длительном или периодическом облучении ионизиру-
ющая радиация становится новым фактором среды с высокой
мутагенной активностью. При воздействии длительного облу-
чения, помимо увеличения генетического груза, в популяциях
наблюдается также возрастание частоты полезных для орга-
низма мутаций. При изменении направления отбора эти изме-
нения генетического материала могут быть положены в основу
нового адаптивного комплекса генов, т. е. в определенных
случаях радиационные мутации включаются в генофонд по-
пуляций и повышают их жизнеспособность. Это способствует
ускорению адаптивного сдвига в популяции при появлении
новых условий среды, в том числе и повышении фона радиа-
ции. В частности, таким адаптивным сдвигом является возрас-
тание радиорезистентности популяций при их длительном или
периодическом облучении.
За несколько поколений естественный отбор может со-
брать новые мутации в более неадаптированный генетический
пул [307]. Увеличение радиорезистентности облученных по-
пуляций наблюдалось у разных видов живых организмов. Бы-
ло обнаружено [308], что при периодическом облучении бакте-
рий высокими дозами их устойчивость к облучению увеличи-
вается в несколько раз.
Влияние ионизирующей радиации на популяции растений
исследовано в работах [309 -313]. Так, например, в работе [311]
при изучении природных популяций низших растений (одно-
клеточной зеленой водоросли хлореллы), обитающих на участ-
ках с высоким уровнем радиации, была выявлена более высо-
кая резистентность по выживаемости, чем в контрольной по-
пуляции (ЛД50 в 1,5-2 раза выше). В облучаемых лабораторных
(экспериментальных) популяциях хлореллы установлена адап-
тивная перестройка, связанная не только с общим увеличени-
ем устойчивости к радиации, но и с изменением уровня мута-
ционного процесса в этих популяциях (пигментные и морфо-
логические мутации).
Повышенная радиорезистентность установлена также и в
популяциях дикорастущих травянистых растений (василек
лесной, горошек мышиный, проломник северный, скерда и
др.), подвергавшихся на экспериментальных участках в тече-
104
ние свыше 20 лет хроническому облучению 0-излучением
стронция-90 при мощности дозы около 0,01 Гр/сут. Наблюда-
лось возрастание радиоустойчивости популяций приблизитель-
но в 2 раза по сравнению с соответствующим контролем по
тесту хромосомных аберраций [311].
Исследования адаптации популяции животных проводи-
лись в основном на дрозофиле как в природных, так и в экспе-
риментальных популяциях. Так, в работе [314] исследовалась
бразильская популяция дрозофилы, обитавшая в лесу, богатом
торием. Ее радиочувствительность сравнивалась с радиочув-
ствительностью популяции из экологически сходного леса, в
котором уровень радиоактивности был в 100 раз меньше. Ока-
залось, что при облучении обеих популяций рентгеновскими
лучами в дозе 1000 Р снижение плодовитости и жизнеспособ-
ности в первой популяции было меньше, а уровень доминант-
ных летальных мутаций ниже, чем во второй. Был сделан вы-
вод о том, что хронически облучавшаяся популяция в 2 раза
более радиоустойчива, чем контрольная.
Адаптация экспериментальной популяции дрозофилы, об-
лучавшейся на протяжении 220 поколений, выявлена в рабо-
тах [315-317]. Анализ устойчивости этой популяции к облуче-
нию показал, что по индукции мутаций ее радиочувствитель-
ность в 2 раза ниже, чем контрольной.
Таким образом, увеличение радиоустойчивости популя-
ций при хроническом или периодическом облучении в опреде-
ленных условиях возможно для различных видов живых су-
ществ.
Данные о влиянии каких-либо химических соединений на
мутационный процесс в облучаемых популяциях в литературе
отсутствовали, поэтому целью нашей работы было выяснение
возможности модификации спонтанного и радиационного му-
тационного процесса в длительно облучаемых популяциях с
помощью антимутагена меланина.
6.2. Методика работы
Методические подходы к генетическому монито-
рингу описаны в работах [318-324]. Особенность нашей мето-
дики заключалась в том, что как компоненты приспособлен-
ности (численность, плодовитость, жизнеспособность), так и
различные виды мутаций (доминантные летальные, рецессив-
ные летальные и видимые) анализировались одновременно
через каждые пять поколений на протяжении 55 поколений.
Кроме того, впервые была предпринята попытка модифициро-
105
вать генетические процессы в облучаемых популяциях с по-
мощью антимутагена. В качестве антимутагена был избран ме-
ланин.
Исследование проведено на экспериментальных популяци-
ях Drosophila melanogaster на протяжении четырех лет (с 1980
по 1984 г.). В 1980 г. было заложено 12 популяций. Для этого
использовали выборки по 200 особей (100 9 и 100 d) из панмик-
тической популяции, которая была создана в 1971 г. из 8 изо-
генных линий, взятых в равном соотношении, и поддержива-
лась с тех пор в равновесном состоянии.
Популяции были разделены на четыре группы: 1) контроль-
ные (К); 2) облучаемые (О); 3) обрабатываемые меланином (М)
и 4) обрабатываемые меланином и облучаемые (МО).
Все популяции содержались в одинаковых условиях в бан-
ках (0,8 л): популяции К и О - на стандартной питательной
среде, а популяции М и МО - на среде с добавлением мела-
нина. Меланин получали путем аутоокисления ДОФА и вво-
дили в питательную среду из расчета 0,5 мг/мл среды. Об-
лучение рентгеновскими лучами проводили в каждом поко-
лении дважды - на стадии трехдневных личинок в дозе
0,10 Кл/кг и на стадии имаго в дозе 0,15 Кл/кг. Для облучения
использовали РУМ-17: напряжение 200 кВ, сила тока 5 мА, фо-
кусное расстояние 30 см, мощность дозы 6 • 10-4 А/кг, без.филь;
тра. Взрослых особей и личинок облучали ненаркотизирован-
ными прямо в банках, через затянутое марлей горлышко бан-
ки. Дозу выбирали с учетом того, чтобы она была не слишком
высокой, позволяющей популяциям нормально существовать,
и не слишком низкой, вызывающей достаточное количество
генетических изменений.
Каждое поколение после полного вылупления всех мух
пересаживали в банки со свежей средой для откладки яиц на
сутки, после чего удаляли, взвешивали и подсчитывали чис-
ленность популяций.
Анализ плодовитости, жизнеспособности и мутационного
груза проводили через 5 поколений. Первый анализ был сде-
лан в первом поколении непосредственно после облучения
взрослых особей. Все последующие анализы проводили до об-
лучения имаго. Исследовали по две популяции каждого типа
на протяжении 55 поколений. Численность определяли в каж-
дом поколении, причем для подсчета числа особей использо-
вали по 3 популяции каждого типа.
Для определения плодовитости из популяций брали вы-
борки по 25-30 семей, каждая из которых состояла из 1 9 и 2 <s
односуточного возраста. Эти семьи перебрасывали на свежую
среду в течение 13 дней. Проводили подсчет яиц во всех клад-
106
ках, а затем определяли среднее число яиц, отложенных од-
ной самкой. Жизнеспособность потомства устанавливали в дни
максимальной плодовитости (с 5-го по 7-й день) как отношение
числа вылупившихся особей к числу отложенных яиц.
Статистическая обработка данных проводилась на ЭВМ
„Мир-2”. Достоверность различий экспериментальных данных
подтверждена по критериям Стыодента, Уилкоксона и крите-
рию знаков,
6.3. Динамика численности особей
Анализ экспериментальных данных показал, что ха-
рактер изменения численности во всех трех контрольных по-
пуляциях идентичен - резкие подъемы сменяются резкими
спадами от поколения к поколению. Характерная кривая ко-
лебания численности в контрольных популяциях приведена
на рис. 6.1, а. (На рис. 6.1, 6.2 приводятся те участки кривых
динамики численности, на которых произошло снижение или
повышение уровня колебаний численности)
Колебания численности популяций животных изучены
многими авторами. Так, в работе [325] автор, отмечала, что с
увеличением плотности популяций число взрослых потомков
падает. При содержании культур в бутылочках с искусствен;
ной средой после достижения популяцией наибольшего разме-
ра ее численность резко падает, вплоть до гибели культур.
Данные о регулярных колебаниях численности дрозофилы, не
связанных с каким-либо изменением внешней среды, приведе-
ны в работе [326]. Причем пары особей, взятые из популяции в
период депрессии, имели большую плодовитость по сравнению
с особями, изолированными в период пика численности. При
изучении 38 природных популяций, обитавших в Бразилии,
обнаружены 12-недельные циклы колебаний численности [327].
Каждый цикл имеет четыре четкие фазы: сокращение, подъем,
вспышку и снижение. В фазе вспышки число особей в популя-
ции в 10 раз больше, чем в фазе сокращения. Существование
флуктуаций численности экспериментальных популяций дро-
зофилы (как имаго, так и личинок) отмечают и другие авто-
ры [328].
Известно, что при чрезмерном увеличении общей числен-
ности особей в популяции происходит снижение плодовитости,
что приводит к снижению численности популяции в следую-
щем поколении. Полученные нами данные можно объяснить
этой закономерностью.
Обращав? на себя внимание факт, что характер колебаний
численности за 55 поколений мониторинга мало изменился, но
107
Рис. 6.1. Динамика численности контрольных (о) и облу-
чаемых (б) популяций дрозофилы:
1 -Kj; 2 -К2; 3 - к3; 4 - О,; 5 - О2; 6 - О3; N - количество
особей
если вначале эти колебания находились в пределах от 600 до
3500 особей, то начиная примерно с 13-го поколения числен-
ность контрольных популяций колеблется на более низком
уровне - от 100 до 2000 (см. рис. 6.1, а). Возможно, таким путем
популяции приспособились к тому объему, в котором им при-
шлось существовать (банки объемом 0,8 л), поскольку исход-
ная популяция содержалась в большом популяционном ящике.
Динамика численности в облученных популяциях имеет
такой же характер и тоже идентична во всех 3 популяциях (см.
рис. 6.1,6). Вначале численность популяций О колебалась в
тех же пределах, что и в популяциях К. В 10-м поколении в об-
лученных популяциях произошло первое снижение численно-
108
Рис. 6.2. Динамика численности популяций дрозофи-
лы при воздействии меланина (а) и комбинирован-
ном воздействии меланина и облучения (б):
1 - Mt; 2 - М2; 3 - М3; 4 - MOj; 5 - MO2; S - МО3
сти - она стала колебаться в пределах от 100 до 2500 особей по
сравнению с исходными колебаниями от 800 до 3200, а с 25-го
поколения колебания численности переместились на еще бо-
лее низкий уровень - от 50 до 1600 особей. Таким образом,
численность облученных популяций стала ниже, чем контроль-
ных, что отразилось и на средних значениях за 55 поколений
(табл. 6.1).
Колебания численности популяций, выращенных на среде
с меланином, вначале имели больший размах, чем контроль-
109
Таблица 6.1. Средняя численность популяций дрозофилы разных типов
за 55 поколений мониторинга
Популяция Поколение Среднее за 55 поколений
1-15 16-25 26—35 36-45 46-55 1 HI 1+ V) XI
К1 1754 1015 1531 768 1199 1230+117
К2 2131 696 1526 865 1124 1233 + 109
к3 1684 998 1036 946 1032 1137+114
кЛп ср 1856 903 1364 859 1118 1200 ±65
Ml 1610 1235 770 883 1047 1133+116
м. 2123 1077 454 683 1222 1142 + 132
м3 2084 817 925 969 912 , 1148 + 128
М,„ 1939 1043 716 845 1060 1141 ±73
°1 1222 1009 921 725 659 882 ±75
°; 1164 1106 841 763 845 948 ±93
°3 1464 1161 594 682 851 937 ±103
0^ ср 1283 1032 785 724 785 922 ±52*
М + О, 1425 969 759 521 1096 954 ±37
м + о2 1505 1042 482 574 753 871 ±89
м + о3 1411 872 1161 535 1033 1025 ±99
М + О.„ ср 1447 961 801 543 961 950 ±53
* t • 3,36. Здесь и далее значение t рассчитано по критерию Стыодента.
Кср °ср
Таблица 6.2. Коэффициенты корреляции при сравнении численности
исследованных популяций дрозофилы
Сравниваемые популяции Коэффициент корреляции Сравниваемые " популяции Коэффициент корреляции
К1-К2 K1-K3 K2-K3 Mj-M2 М1~М3 м2-м3 0,46 ±0,14 0,42 ±0,14 0,39 ±0,14 0,43 ±0,14 0,44 ±0,14 0,80 ±0,09 О1-о2 01 -о3 O2-O3 МО! - МО2 МО, - мо3 MOj - мо3 0,65 ±0,12 0,70 ±0,11 0,74 ±0,11 0,59 ±0,13 0,64 ±0,13 0,55 ±0,13
Таблица 6.3. Коэффициенты корреляции при сравнении численности популяций дрозофилы после разных воздействий
Популяции Контроль Меланин Облучение
м О М + 0 0,39 ±0,08 0,18 ±0,09 0,03 ±0,09 0,10±0,09 0,29 ±0,09 0,27 ±0,09
НО
ные. (Так, например, в 10-м поколении численность популяции
М2 достигла 4343 особей (см. рис. 6.2, а), тогда как самая высо-
кая численность в контрольных популяциях не превышала
3522 особей) Однако с 35-го поколения колебания численно-
сти популяций К и М сравнялись и до конца мониторинга оста-
вались на одном уровне.
В популяциях МО динамика численности имела более
сложный характер: до 32-го поколения она колебалась от 200
до 2300 особей, а затем до 45-го поколения наблюдалось резкое
снижение численности (колебания на уровне от 200 до 950) -
до более низкого уровня, чем в облученных популяциях, а за-
тем численность популяций МО стала выше, чем в облученных,
и достигла уровня контрольных (рис.‘ 6.2, б). В среднем за 55
поколений мониторинга численность популяций К и М, а так-
же О и МО оказалась примерно одинаковой (см. табл. 6.1).
Определение коэффициентов корреляции численности по-
пуляций показало наличие существенной степени корреляции
в изменении численности популяций одного и того же типа -
коэффициенты корреляции лежат в пределах от 0,39 до 0,80
(табл. 6.2). Это дает право объединить численность трех попу-
ляций каждого типа в одну и сравнить численность таких объ-
единенных популяций К, М, О и МО между собой. Как показа-
но в табл. 6.3, более высокая корреляция наблюдается между
численностью популяций К и М (коэффициент корреляции ра-
вен 0,39 ±0,08), на втором месте - пары О и МО, а также М и
МО (коэффициенты корреляции равны 0,27 ±0,09 и 0,29 ±0,09
соответственно). Самая низкая корреляция между К и О, а так-
же М и О.
Таким образом, численность особей в экспериментальных
популяциях в контроле и при воздействии облучением и мела-
нином колеблется волнообразно, причем сезонных изменений
в колебаниях численности не отмечено; периодическое облу-
чение популяций в дозе 0,25 Кл/кг в течение каждого поколе-
ния приводит к снижению численности популяций в 1-55-м по-
колениях примерно на 20 %, а в конце мониторинга (в 45-55-м
поколениях) - в среднем на 30 %; содержание популяций на
среде с меланином на колебания численности в популяциях
существенно не влияет.
6.4. Динамика плодовитости особей
Динамика плодовитости особей в популяциях раз-
ных типов показана на рис. 6.3. Плодовитость особей во всех
популяциях подвержена существенным колебаниям, не свя-
занным с экспериментальными воздействиями. В экологии по-
111
Рис. 6.3. Динамика плодовитости особей I (а) и II (б) групп в
популяции дрозофилы:
1 — контроль; 2 — меланин; 3 — облучение; 4 - меланин + облучение;
N — количество яиц на 1 самку в лень
пуляций хорошо известны „популяционные волны” - резкие
колебания численности, захватывающие разное количество
поколений. Численность особей в популяциях при этом может
изменяться на 5 порядков. Известны такие колебания, или ос-
цилляции, и для лабораторных популяций дрозофилы. Вспыш-
ки численности сопровождаются снижением плодовитости, и
наоборот. Причинами осцилляций считают как врутрипопуля-
ционные процессы, так и влияние внешних по отношению к по-
пуляции факторов, например воздействие комплекса экологи-
ческих факторов, включая и космические. Наблюдаемые нами
колебания плодовитости (на порядок) во всех популяциях од-
новременно обусловлены, очевидно, естественными причина-
ми. Однако внутри эти* колебаний можно выявить различия,
112
Рис. 6.4. Сравнение плодовитости особей О, М и МО и плодовитости
особей К I (а) и II (б) групп в популяции дрозофилы:
I — меланин; 2 — меланин + Х-лучи; 3 — Х-лучи
присущие популяциям разных типов и обусловленные нашими
экспериментальными воздействиями (рис. 6.3). Особенно это
заметно на рис. 6.4, где плодовитость особей в облучаемых по-
пуляциях и популяциях с меланином сравнивается с таковой
в контроле. Так, в начале мониторинга плодовитость особей в
обеих облученных популяциях была ниже, чем в контрольных.
Это вполне согласуется с общеизвестным положением о том,
что воздействие ионизирующей радиацией снижает плодови-
тость животных. Однако в дальнейшем этот показатель начи-
нает возрастать. В популяции Ц плодовитость особей к 25-
30-му поколениям достигает контрольного уровня, а затем не-
сколько превышает контроль. В популяции О2 уже к 10-15-му
поколениям плодовитость особей достигает уровня контроля
и затем превышает его. (Данные, полученные при анализе по-
пуляций I и П групп, приведены в табл. 6.4 и 6.5.)
Увеличение плодовитости особей в облученных популя-
8. Зак. 5222.
113
Таблица 6.4. Плодовитость особей в экспериментальных популяциях дрозофилы I группы
Параметр плодовитости Поколение
1 10 | 20 1-20 30 40 50 55 30-55 1-55
Число самок 20 20 25 Контроль 65 ноя популя 26 ция 34 16 19 95 160
Число яиц: за 13 дней 1326 5569 2276 9171 736 1394 - 2066 2463 6659 15830
на 1 9 в день 5,1 + 0,1 20,4+ 0,5 10,1 ±0,1 И,9 ±0,3 2,2 ±0,1 3,2 ±0,2 9,9 ±0,2 10,5 ±0,1 5,4 ±0,1 7,6+ 0,2
Число самок Число яиц: за 13 дней на Г? в день Число самок 21 1437 5,3 ±0,2 16 16 5727 27,5 ±0,4 24 Попу! 23 1844 6,2 ±0,1 28 ыция, обра Облучаа 68 батываемая 28 1391 3,8±0,1 4ОЯ ПОПУЛЯ! 27 меланином 33 2255 5,3 ±0,1 щя 35 19 2628 7,3 ±0,1 17 18 2493 11,4±0,1 16 95 158 17775 8,7 ±0,2 163 ’
Число яиц: за 13 дней 808 5505 2629 8942 1030 1690 2298 2677 7695 16637
на 1 9 в день 3,9 ±0,1 17,6 ±0,2 7,4 ±0,1 10,2 ±0,1 2,9 ±0,1 3,7 ±0,1 9,8 ±0,2 12,9 ±0,3 6,2 ±0,1 7,9 ±0,2
Число самок Число яиц: за 13 дней на 1 9 в день 21 1187 4,4 ± 0,1 I 24 5729 21,8 ±0,2 опуляция, 24 3187 10,2 + 0,2 збрабатывае мая мелани 29 1227 3,3 ±0,1 ном и облу 35 1724 3,8 ±0,1 •чаемая 20 2427 9,4 ±0,1 20 2946 12,6 ±0,2 173 18427 8,2 ±0,1
Примечание. С 1-го по 20-е поколение t„ _ - 5,4 н с 30-го по 55-е t - 5,1; с 1-го по 55-е поколение t » 5,0, at .“ 2,5.
К "“О К—-О е К-М о—ми
Таблица 6.5. Наодзвткгъ особей в экспериментальных популяциях дрозофилы П группы
Параметр ПЛОДОВИТОСТИ Поколение
1 5 1-5 15 25 35 50 55 15-55 1-55
Число самок 20 21 41 Контроль 23 ноя популя 20 ция 24 19 15 101 ) 142
Число яиц: за 13 дней 1326 3158 4484 1926 492 1198 2412 2391 8419 12903
на 1 9 в день 5,1 ±0,1 11,8±0,2 8,5 ±0,2 6,4 ±0,1 1,9 ±0,2 3,9 ±0,1 6,7 ± 0,1 11,5+0,3 6,4 ±0,1 7,0 ±0,1
Число самок Число яиц: за 13 дней на 1 9 в день 21 1437 5,3+0,2 25 3520 11,0 ±0,2 Ilonyj 1яция, обра! 26 2148 6,6 ±0,1 Зарываемая 27 1348 3,8 ±0,1 меланином 22 1180 4,1 ±0,1 18 2372 10,1 ±0,1 20 3257 13,2±0,1 159 15262 7,4 ±0,1
Число самок 16 22 38 Облучаы 24 4ОЯ ПОПУЛЯ1 26 27 17 16 110 148
Число яиц: , за 13 дней 808 2646 3454 3038 1145 1658 2293 2494 10628 14082
- на 1 9 в день 3,9 ±0,1 9,2 ±0,2 7,0 ±0,2 9,7 ±0,1 3,3 ±0,1 4,7+0,1 10,4 ± 0,2 12,0 ±0,2 7,4 ±0,1 7,3 ±0,1
Число самок Число яиц: за 13 дней на 1 9 в день 21 1187 4,4 ±0,1 Л 26 4539 13,6 ±0,2 опуляция, обрабатывав 22 2791 9,8 ±0,2 моя мелани 20 743 2,9±0,1 ном и облу 23 1832 6,1 ±0,1 ’чаемая 20 3088 11,9±0,1 17 2952 13,4 ±0,1 149 17132- 8,9±0,1
Примечание. С 1-го по 5ге поколение Г__ • 5,8 и с 15-гопо 55-е t' _ = 5,6; е I-го по 55-е поколение f__ .. в 2,7, a t ».Л = ИЛ
к — о к—о к м и —MU '
циях по сравнению с контрольными кажется неожиданным.
Однако в литературе есть сведения о плодовитости популяций
с „радиационной историей”. Так, в работе [315] подробно изу-
чена генетическая структура популяции дрозофилы, подвер-
гавшейся длительному воздействию рентгеновским излучени-
ем. Автор указывает, что вначале облучение вызывало умень-
шение фертильности популяции, но затем произошла адапта-
ция популяций к воздействию радиации. Эта адаптация обус-
ловлена повышенной скоростью яйцекладки: особи из попу-
ляции, подвергавшейся длительному облучению на протяже-
нии 220 поколений, вследствие высокой плодовитости давали
больше потомков, чем контрольные.
Аналогичные данные получены и при облучении восковой
моли: в 6-м поколении в опыте было получено больше бабочек,
чем в контроле [329].
Наблюдаемое в наших опытах увеличение средней плодо-
витости особей в облученных популяциях по сравнению с не-
облученными может свидетельствовать о наступлении резис-
тентности этих популяций к воздействию рентгеновских лучей.
Анализируя плодовитость особей в популяциях, получав-
ших с питательной средой меланин, можно заметить, что в обе-
их группах популяций воздействие меланина повышает пло-
довитость особей. Так, в популяциях М плодовитость выше,
чем в популяциях К, а в популяциях МО - выше, чем в по-
пуляциях О. В среднем за 55 поколений меланин повышает
плодовитость необлученных популяций в I группе с 7,7 до 8,7
яиц на самку в день (t = 3,6), а во II - с 7,0 до 7,4 яиц (t =
= 2,7). В облученных популяциях этот показатель увеличился
в I группе с 7,9 до 8,2 (t = 2,5), а во II - с 7,3 до 8,9 яиц на самку
в день (t = 11,5).
6.5. Динамика жизнеспособности особей
Динамика жизнеспособности особей в популяциях
разных групп значительно различается, причем не только в
популяциях, подвергавшихся экспериментальным воздействи-
ям, но и в контрольных (рис. 6.5).
Известно, что колебания жизнеспособности особей в по-
пуляциях зависят от изменений численности. При личиночном
перенаселении наиболее очевидное следствие, которое в по-
рядке обратной связи будет ограничивать численность популя-
ции, - смертность на предимагинальных стадиях развития. Во
многих опытах при увеличении числа личинок в культуре
наблюдалось уменьшение размера куколок и имаго, удлине-
ние времени развития (в основном на личиночной стадии), уве-
116
Рис. 6.5. Динамика жизнеспособности особей I (а) и II (б) групп
в популяции дрозофилы:
1 - меланин; 2 - контроль; 3 - меланин + облучение; 4 - Облучение
личение разброса вылупления мух и, наконец, повышение
смертности особей на разных стадиях развития [241].
Таким образом, влияние численности популяций на жиз-
неспособность особей может действовать в одном направлении
с эффектом облучения, и тогда их эффекты суммируются, а
иногда - в разных направлениях, нивелируя при этом влия-
ние облучения.
Данные по изменению жизнеспособности потомства в по-
пуляциях на протяжении 55 поколений мониторинга представ-
лены в табл. 6.6-6.8. Анализируя влияние облучения на жиз-
неспособность, можно заметить, что в популяции Oj (рис. 6.4, о,
табл. 6.6) этот показатель значительно ниже контрольного
уровня практически в течение всего периода мониторинга (за
исключением 50-го поколения). В то же время в популяции О2
117
(рис. 6.4, б, табл. 6.7) жизнеспособность особей сначала резко
уменьшается (5-е поколение), а затем столь же резко возраста-
ет и лишь с 30-го поколения устанавливается ниже контроль-
ного уровня. Необходимо отметить, что резкое падение жизне-
способности в 5-м поколении наблюдалось одновременно во
всех четырех популяциях данной группы (К2, О2, М2, МО2) и,
следовательно, было вызвано неучтенным нами фактором:
контрольная популяция вышла из этого кризиса позднее всех
других.
Влияние меланина в популяциях разных групп тоже неод-
нозначно: в I группе меланин повышает жизнеспособность осо-
бей в облученных популяциях с 74,1 ± 0,7 до 83,7 ± 0,6 % (t =
= 10,4), а во II, где жизнеспособность облучаемых популяций
выше, чем в контрольных, его влияние не проявляется. В не-
облучаемых популяциях, наоборот, благоприятное влияние
меланина обнаруживается во II группе, где жизнеспособность
контрольных популяций низкая (76,8 ± 0,7 % в популяции М2 и
71,5 + 0,8 % в популяции К2, t = 5,3), а в I группе нет. Однако,
исходя из рис. 6.5, можно заключить, что популяции М и МО в
обеих группах более стабильны, менее подвержены резким
спадам жизнеспособности, чем контрольные. Если суммиро-
вать данные по жизнеспособности в обеих группах, то получим
достоверное снижение этого показателя под влиянием облуче-
ния и достоверное повышение жизнеспособности облучаемых
и необлучаемых популяций под влиянием меланина (табл. 6.8).
Интересен обнаруженный нами факт повышения плодови-
тости и жизнеспособности особей под влиянием меланина.
Меланин обладает рядом физико-химических свойств, ко-
торые позволяют предположить, что его радиозащитное дей-
ствие связано с перехватом энергии облучения [330]. Этот ме-
ханизм может объяснить повышение плодовитости и жизнеспо-
собности особей в облучаемых популяциях. Не исключено, что
меланин обладает и другими свойствами, обеспечивающими
повышение плодовитости и „стабилизацию” жизнеспособности
особей в необлучаемых популяциях. Например, нарушение ме-
ланинообразования у животных снижает их жизнеспособность
и плодовитость, что объясняется участием меланина в гормо-
нальной регуляции [331].
6.6. Взаимосвязь элементов приспособленности
В популяциях существует обратная связь между
численностью особей, с одной стороны, и их жизнеспособно-
стью и плодовитостью - с другой [332,333]. При высокой плот-
ности популяций плодовитость и жизнеспособность особей
118
Таблица 6.6. Жизнеспособность (ЖЗН) особей в экспериментальных популяциях дрозофилы I группы
Параметр жизне- способности Поколение
1 10 20 30 40 50 55 1т-55
Число яиц 299 1063 Кон 835 •рольная nony/i 73 яция 193 603 539 3605
Число имаго 275 977 697 40 155 532 486 3162
ЖЗН. % 92,3 + 1,5 91,8 ±0,8 83,5 ±1,3 54,8 ±5,8 79,8 ±2,9 88,3 ±1,3 1 90,1 ±1,3 88,7 ±0,5
Число яиц 330 1055 Популяция, 650 обрабатываема! m 9 меланином 361 854 659 4086
Число нмаго 288 951 571 143 '271 730 627 3581
ЖЗН, % 87,0±1,8 90,1 ± 0,9 88,0 ±1,3 80,9 ±3,0 75,0 ±2,3 85,3 ±1,2 95,1 ± 0,8 87,6 ±0,5.
Число яиц 120 1177 Обл 788 учаемая популл 72 чция 302 657 > 588 3704
Число нмаго 101 853 604 21 134 577 454 2744 •
ЖЗН, % 84,0 ±3,3 72,4 + 1,2 76,9 ±1,5 29,2 ±5,4 44,3 ±2,9 87,9 ±1,3 77,1 ±1,7 74,1 ±0,7
Число яиц 280 Попу 1435 ляция, обрабаг 410 ываемая мела* 77 ином и облуч/ 315 гемая 769 823 4109
Число имаго 236 1229 332 43 214 645 739 3438
ЖЗН, % 84,2 ±2,2 85,6 ±1,0 81,0 ±1,9 55,6 ±5,7 67,7 + 2,6 83,9 ±1,3 89,8±1,1 83,7 ±0,6
Примечание. С 1-го по 55-е поколение »к_о = 15Л fo-MO = 10,4'
Таблица 6,7, Жизнеспособность особей в экспериментальных популяциях дрозофилы II группы
Параметр жизне- способности Поколение
1 5 15 25 35 50 55 1-55
Число яиц 299 903 Kohi 648 'рольная попул 46 яция 354 835 517 3602
Число имаго 275 469 338 30 280 772 413 2577
ЖЗН, % 92,3 ±1,5 51,9+1,6 51,1± 1,9 65,2 ±8,0 79,4 + 2,2 92,5± 0,9 79,9 ± 1,8 71,5± 0,8
Число яиц 330 1179 Популяция, 544 обрабатываема! 94 з меланином 378 818 698 4041
Число имаго 288 697 398 61 305 726 630 3105
ЖЗН, % 87,0 ±1,8 59,1 ±1,4 73,2 ± 1,9 64,7 ±5,6 80,7+2,0 88,8± 1,1 90,3 ±1,1 76,8+: 0,7
Число яиц 120 756 Обл 826 учаемая попул 148 яция 409 781 566 3606
Число имаго 101 413 687 109 321 624 453 2708
ЖЗН, % 84,0 ±3,3 54,7 ±1,8 83,1 ±1,3 73,6 ±4,3 78,3 ±2,0 80,0 ±1,4 79,9 ±1,7 75, Г± 0,7
Число яиц 280 Попу 1356 ляция, обрабат 680 ываемая мела!- 181 ином и облучс 453 1емая 927 763 4640
Число имаго 236 744 504 123 369 788 661 3425
ЖЗН, % 84,2+2,2 54,8± 1,3 74,1 ±1,6 67,1 ±4,0 81,8± 1,8 84,9± 1,2 86,6+1,2 73,8± 0,6
Примечание. С 1-го по 55-е поколение * 5,3.
К—М
Таблица 6.8. Жизнеспособность особей в экспериментальных популяциях
дрозофилы I и II групп суммарно за 55 поколений
Параметр жизнеспособности Группы популяции
I II 1 + П
Контрольная популяция
Число яиц 3605 3602 7207
Число имаго 3162 2577 5739
ЖЗН, % 87,7+0,5 71,5 ±0,8 79,6 ±0,5
Популяция, обрабатываемая меланином
Числа яиц 4086 4041 8127
Число имаго 3581 3105 6686
ЖЗН, % 87,6+0,5 76,8 ±0,7 82,3 ±0,4
Облучаемая популяция
Число яиц 3704 36Ю6 7310
Число имаго 2744 2708 5452
ЖЗН, % 74,1 + 0,7 75,1 + 0,7 74,6 ±0,5
Популяция, обрабатываемая меланином и облучаемая
Число ЯИЦ 4109 4640 8749
Число имаго 3438 3425 6863
ЖЗН, % 83,7+0,6 73,8 + 0,6 78,4 ±0,4
Примечание. Суммарно по двум группам популяций t , =4,2; t „=7,2;
_ с 7 К—М К—О
о-мо ’
снижаются, а при низкой увеличиваются. За счет этого и про-
исходит регуляция численности популяций.
Нами проанализирована связь между колебаниями чис-
ленности особей и динамикой элементов приспособленности в
экспериментальных популяциях. Для этого были вычислены
коэффициенты множественной корреляции R между динами-
кой количества особей в поколениях, предшествующих анали-
зу, и изменениями плодовитости и жизнеспособности выборок
особей, взятых для анализа из этих популяций, а также коэф-
фициенты парной корреляции г между численностью, плодо-
витостью и жизнеспособностью особей.
В контрольных популяциях коэффициент множественной
корреляции достаточно высок, что может свидетельствовать о
наличии корреляции между анализируемыми показателями
(табл. 6.9). Однако по F-критерию полученное значение недо-
стоверно, очевидно, из-за малой выборки (и “ 12). Между чис-
ленностью и жизнеспособностью наблюдается достоверная от-
рицательная корреляция, а между плодовитостью и жизнеспо-
собностью - положительная, что вполне согласуется с положе-
нием о существовании обратной связи между численностью
особей в популяциях, их плодовитостью и жизнеспособностью.
121
Таблица 6.9. Коэффициенты корреляции при сравнении численности,
плодовитости и жизнеспособности особей в популяциях резных тшыь
Сравниваемый Коэффициенты корреляции
* парной г множественной R
показатель Г (г г 1 R F*
численность жизнеспособность: численность
Контрольные популяции
Плодовитость Жизнеспособность -0,1646 -0,5936 0,56 3,04 0,5596 J 2,70 0,6271 2,92
Популяции, обрабатываемые меланином
Плодовитость Жизнеспособность -0,0301 0,1921 0,09 0,63 0,5135 | 2,21 0,2437 0,25
Облучаемые популяции
Плодовитость Жизнеспособность 0,1780 -0,1193 0,61 0>40 0,4386 | 1,80 0,2826 0,39
Популяции, обрабатываемые меланином и облучаемые
Плодовитость Жизнеспособность I 0,4385 | -0,1047 I 1.80 1 0,35 | 0,6580 | 3,85 | 0,6819 | 3,91
* При значении F • 4,10 Р = 0,05.
Однако корреляций между плодовитостью и. численностью в
предыдущем поколении нами выявлено не было.
В то же время визуально мы замечали, что при пересадке
на свежую среду популяций с высокой численностью особей за
сутки бывает отложено яиц меньше, чем в случае малочислен-
ных популяций. Возможно, при перенаселении главную ррль
играет эффект присутствия большого количества особей. Сам-
ки в таких популяциях могут обладать меньшей плодовито-
стью. В то же время показано [334], что влияние плотности на
плодовитость не связано с блокированием яйцекладки. ~При
перенаселении яичники популяций самок функционируют, од,-
нако интенсивность оогенеза снижается, уменьшается количе-
ство зрелых яий И ОВАриол. Кроме того, в откладке яиц может
принимать участие меньшее количество самок.
Известно, что в перенаселенной популяции возрастание
доли неоплодотвореиных самок может быть следствием как
стерильности самцов, так и рецептивности самок. Кроме того,
с увеличением плотности популяций возрастает интенсивность
соревнований самцов за спаривание и увеличивается разница
между успешными и неуспешными самцами. Когда же при ана-
лизе плодовитости каждая семья (1 9 и 2 б) помещалась в от-
дельный флакон со средой (согласно общепринятой методике),
122
то условия для откладки яиц были гораздо благоприятнее,
чем в перенаселенной популяции. Это может быть причиной
того, что определяемая при анализе плодовитость выборочных
семей не коррелирует с численностью особей в популяциях, из
которых эти особи взяты. Возможно и другое объяснение. Рез-
кий подъем численности не всегда сменяется резким спадом
(см. рис. 6.1 и 6.2). Наблюдаются и такие периоды, когда чис-
ленность популяций на протяжении 2-3 поколений держится
примерно на одном уровне или продолжает изменяться в од-
ном и том же направлении. Если исследование элементов при-
способленности попадает на такой период, то ожидаемой кор-
реляции между численностью и плодовитостью не будет. При
сравнении численности исследованных популяций в предше-
ствующих анализу поколениях и численности последующих
нами выявлено большое количество периодов „относительной
стабильности” численности популяций, как раз совпавших с
проводимыми каждые пять поколений анализами генетиче-
ского груза. Больше всего таких совпадений оказалось в по-
пуляции MOi - это поколения 9-10,14-15,29-30,44-45,50-51.
В остальных популяциях было обнаружено от 2 до 4 таких сов-
падений.
Совпадение времени анализа с периодами стабильности
может объяснить низкие коэффициенты корреляции между
численностью и плодовитостью в предшествующем поколении
в исследуемых популяциях.
В ряде литературных источников также приводятся сведе-
ния о слабой генетической корреляции между компонентами
приспособленности [335, 336]. В работе [335] изучены корреля-
ции между различными компонентами приспособленности и
их чувствительностью к плотности популяций. При этом ожи-
далось, что чувствительность этих компонентов к плотности
должна быть скоррелирована. Из 16 изученных случаев не бы-
ло обнаружено какой-либо корреляции. Следовательно, кор-
реляция между элементами приспособленности не всегда чет-
ко прослеживается. Еще сложнее ее обнаружить при воздей-
ствии на популяции экспериментальных факторов.
В облучаемых популяциях, исследованных нами, все ко-
эффициенты корреляции были низкие (см. табл. 6.9). Это ука-
зывает на нарушение корреляционных связей между числен-
ностью и элементами приспособленности при облучении. Инте-
ресно, что в популяциях МО коэффициенты корреляции при-
ближаются к таковым в контрольных популяциях, что свиде-
тельствует о нормализующем влиянии меланина на соотноше-
ние исследуемых параметров в облучаемых популяциях.
В то же время в популяциях М существенная корреляция
123
обнаружена только между плодовитостью и жизнеспособно-
стью особей. Поскольку меланин повышает оба этих показате-
ля, то положительная корреляция между ними понятна. Мож-
но предположить, что увеличение плодовитости и жизнеспо-
собности особей под действием меланина каким-то образом на-
рушает их корреляцию с численностью (t = 0,24). Облучение
тоже нарушает эту корреляцию. Так как облучение снижает
жизнеспособность и плодовитость, а меланин повышает их, то
в популяциях МО влияние этих двух факторов нивелирует
друг друга и величина корреляции близка к таковой в конт-
рольных популяциях.
Таким образом, динамика элементов приспособленности
популяций имеет сложный характер. Колебания численности,
плодовитости и жизнеспособности особей в популяциях зави-
сят от многих сопутствующих условий, что усложняет иссле-
дование влияния экспериментальных факторов на эти показа-
тели. Тем не менее можно сделать некоторые выводы об эф-
фектах, вызываемых в популяциях длительными воздействи-
ями рентгеновского излучения и антимутагена меланина. На-
пример, жизнеспособность особей в облучаемых популяциях в
среднем ниже, чем в контрольных. Плодовитость под влияни-
ем облучения сначала уменьшается, а затем повышается, пре-
восходя контрольный уровень. Однако это повышение плодо-
витости не полностью компенсирует сниженную жизнеспособ-
ность особей, что приводит к некоторому снижению численно-
сти облучаемых популяций по сравнению с контрольными.
Введение меланина в питательную среду способствует по-
вышению плодовитости особей, что проявляется как в облу-
чаемых, так и в необлучаемых популяциях. Жизнеспособность
популяций под влиянием меланина как бы „стабилизируется”:
в популяциях, получавших с питательной средой меланин,
жизнеспособность особей меньше подвержена резким коле-
баниям, чем в контрольных [337,338].
ГЛАВА 7
МОНИТОРИНГ МУТАЦИОННОГО ГРУЗА
В ЭКСПЕРИМЕНТАЛЬНЫХ ПОПУЛЯЦИЯХ
ДРОЗОФИЛЫ ПРИ ДЛИТЕЛЬНОМ ВОЗДЕЙСТВИИ
ОБЛУЧЕНИЯ И МЕЛАНИНА
7.1. Анализ рецессивных сцепленных с полом
летальных мутаций
Мутационный груз оценивали по трем типам мута-
ций - РЛМ, ВМ и ДЛМ. Поскольку определение частот РЛМ и
ВМ - процесс трудоемкий и длительный, для облегчения за-
124
дачи нами была синтезирована линия дрозофилы, обозначен-
ная буквой S. Эта линия дает возможность проводить генети-
ческий мониторинг одновременно (без дополнительной затра-
ты времени и труда) по двум типам мутаций - РЛМ и ВМ
(рис. 7.1).
В линии S Х-хромосома происходит от линии Мёллер-5 и
имеет маркерные гены yellow и white, вторая хромосома имеет
маркер vestigial, а третья - ebony. Все эти мутации хорошо раз-
личаются невооруженным глазом и находятся во всех основ-
ных хромосомах генома. Определение частоты рецессивных
летальных мутаций при использовании линии S производится
так же, как и с помощью линии Мёллер-5, при этом во время
скрещивания особей визуально выявляются и отбираются
для проверки мутации yellow, white, vestigial, ebony. Все четыре
мутантных гена хорошо изучены, интенсивно используются в
исследованиях, имеют четкую классификацию и точную ло-
кализацию. Линия S характеризуется хорошей жизнеспособ-
ностью.
Доминантные летальные мутации определяли по стандарт-
ной методике как отношение числа неразвившихся яиц к чис-
лу отложенных.
/>р
///
//
V9
F1 е
/// //
&
т // /
vg уд
линииз
у U
у у
и
Рис. 7.1. Определение частоты видимых и рецессивных леталь-
ных мутаций в геноме дрозофилы с помощью тестерной линии S
125
Статистическую обработку данных проводили обычными
методами. Для анализа частоты мутаций из каждой популяции
брали выборки по 200-250 самцов.
При исследовании частоты РЛМ в Х-хромосоме нами выяв-
лялись только те мутации, которые возникли непосредственно
от облучения анализируемых особей, так как для опыта берут-
ся самцы, свободные от РЛМ. Поскольку перед анализом облу-
чались не взрослые особи, а только личинки, все половые
клетки которых находятся на стадии сперматогониев, в каж-
дом анализе нами определялась индукция облучением РЛМ
в сперматогониях дрозофилы. Так как все РЛМ, выявляемые
в сперматогониях, являются толковыми, нами исследовалось
влияние меланина на индукцию облучением точковых му-
таций.
В популяциях МО частоты РЛМ почти во всех анализиру-
емых поколениях (в 13 случаях из 16) ниже, чем в популяциях
О (рис. 7.2 и 7.3). По критерию знаков достоверность защитного
влияния меланина на индукцию облучением точковых мута-
ций в нашем опыте Р = 0,05. Диалогично в популяциях М в
12 случаях из 14 частоты РЛМ ниже, чем в контрольных по-
пуляциях, что с достоверностью Р = 0,05 свидетельствует о сни-
жении с помощью меланина спонтанных РЛМ в популяциях
дрозофилы. Фактические данные по изучению РЛМ в популя-
циях разных типов приведены в табл. 7.1-7.3, из которых вид-
Рис. 7.2. Частота рецессивных сцепленных с полом летальных мутаций в об-
лучаемых (б) и иеоблучаемых (в) популяциях дрозофилы I группы, содер-
жащихся на нормальной питательной среде (I) и среде с меланином (2)
126
но, что антимутагенное действие меланина в облучаемых и
необлучаемых популяциях дрозофилы по критерию Стьюдента
также достоверно.
Хотя использованный метод определения РЛМ не дает воз-
можности проследить динамику накопления мутационного
груза в популяциях, однако из полученных данных можно
сделать вывод о постепенном снижении в ходе мониторинга
частот РЛМ, возникающих после облучения особей из облучае-
мых популяций обеих повторностей, что может свидетельство-
вать о постепенном нарастании радиорезистентности этих по-
пуляций.
Постепенное снижение уровня РЛМ обусловлено, с одной
стороны, отбором, направленным против особей, несущих РЛМ
(при этом возможен отбор w против гетерозигот, так как они
могут обладать сниженной жизнеспособностью), а с другой -
усиленным размножением более радиорезистентных особей,
что и обеспечивает адаптацию популяций к облучению.
Онтогенетическая и генотипическая адаптация организма
позволяет особи выжить и оставить потомство в экстремаль-
ных условиях, в которых неадаптированные особи гибнут.
Вновь возникающие мутации могут сохраняться в цепи поко-
лений лишь в том случае, когда несущие их особи способны
конкурировать с представителями исходной генетической ли-
нии. Сохранение летальных мутаций зависит от способности к
Рис. 7.3. Частота рецессивных сцепленных с иолом легальных мутаций в об-
лучаемых (б) и необлучаемых (а) популяциях дрозофилы II группы, содер-
жащихся на нормальной питательной среде (I) и среде с меланином (2)
127
Таблица 7.1. Частота РЛМ в экспериментальных популяциях дрозофилы I группы
Параметр РЛМ Поколение
1 10 20 30 40 50 55 1-55
Контрольная популяция
Число особей 649 1215 811 801 1414 486 552 5928
Число мутаций 1 2 1 1 0 1 0 6
РЛМ, % 0,15+0,15 0,16 ±0,11 0,12± 0,12 0,13 ±0,13 0 0,21 ±0,21 0 0,10 ±0,04
Популяция, обрабатываемая меланином
Число особей 867 940 816 645 2692 1011 1412 8383
Число мутаций 1 1 0 1 0 0 0 3
РЛМ, % 0,11 ±0,11 0,10±0,10 0 0,16 ±0,16 0 0 0 0,04 ±0,02
Облучаемая популяция
Число особей 768 1200 1039 917 2383 1051 1556 8914
Число мутаций 6 7 3 1 10 1 0 28
РЛМ, % 0,85 ±0,33 0,58 ±0,22 0,29 ±0,17 0,10± 0,09 0,42 ±0,10 0,10±0,10 0 0,31 ±0,06
Популяция, обрабатываемая меланином и облучаемая
Число особей 993 1350 1210 1030 1910 713 1721 8927
Число мутаций 3 2 10 0 0 0 0 15
РЛМ, % 0,34 ±0,18 0,15± 0,10 0,83 ±0,26 0 0 0 0 0,17 ±0,04
Примечание. С 1-го по 55-е поколение . -l,3;t„ • 2,9; ,,„ = 2,5.
К—М ’ К-0 О-МО
Зак. 5222.
Таблица 7.2. Частота РЛМ в экспериментальных популяциях дрозофилы □ группы
Параметр РЛМ \ Поколение
1 5 15 25 35 50 55 1-55
Число особей 649 1333 Контр 1692 элъная популя 1297 уия 1071 708 546 7296
Число мутаций 1 2 1 5 1 '2 0 12
РЛМ, % 0,15± 0,15 0,14 + 0,10 0,07 ±0,06 0,39 ±0,20 0,10 ±0,10 0,28 ±0,20 0 0,17 ±0,05
Число особей 867 1346 Популяция, о 1570 брабатываемая 907 меланином 548 1095 6363
Число мутаций 1 1 4 0 0 0 — 6
РЛМ, % 0,11 + 0,11 0,07 ±0,07 0,26± 0,13 0 0 0 — 0,09 ±0,04
Число особей 768 1305 Облу\ 1174 аемая популяг 1628 <ия 1459 1731 1164 9229
Число мутаций 6 9 5 1,5 2 2 6 31,5
РЛМ, % 0,85 ±0,33 0,77 ±0,24 0,42 ±0,19 0,09 ±0,07 0,10±0,10 0,12 ±0,08 0,50± 0,20 0,34 ±0,06
Число особей 993 Попул. 1650 яция, обрабаты 1456 ваемая мелани 1780 ном и облучае 1013 мая 1246 2044 10162
Число мутаций 3 4 3 2 0,5 3 1 16,5
РЛМ, % 0,34 ±0,18 0,24± 0,12 0,22 ±0,12 0,11 ±0,08 0,05 ±0,01 0,24 ±0,14 0,05 + 0,05 0,16±0,04
Примечание. С 1-го по 55-е поколение . *1,3; = 2,2; f .,„ = 2,5.
К —М К—О О-МО
Таблица 7.3. Частота РЛМ в экспериментальных популяциях
дрозофилы I и П групп суммарно за 55 поколений
Параметр Группы популяций
РЛМ 1 1 + П
Число особей Число мутаций РЛМ, % Число особей Число мутаций РЛМ, % Число особей Число мутаций РЛМ, % Папуля Число особей Число мутаций РЛМ, % Контрольна} 5928 б 0,10 ±0.04 Популяция, обрабат 8383 3 0,04 ±0,02 Облучаемая 8914 28 0,31 ±0,06 ция, обрабатываема 8927 15 0,17±0,04 популяция 7296 12 0,17 ±0,05 ываемая меланином 6363 6 0,09 ±0,04 популяция 9229 31,5 0,34 ±0,06 я меланином и обл 10162 16,5 0,16+0,04 13224 18 0,14±0,03 14746 9 0,06 ±0,02 18143 59,5 0,33 ±0,04 учаемая 19089 31,5 0,17 ±0,03
Примечание. Суммарно по двум группам популяций t ,,*Ц; t
. „jo к—м K.-W
О-МО ’ ’
спариванию гетерозиготных самцов и плодовитости гетерози-
готных самок, поэтому элиминация деталей определяется
главным образом конкурентной способностью самцов, несу-
щих летальные мутации, и жизнеспособностью гетерозигот.
В работе [339] показано, что мутации, обусловливающие
тяжелые повреждения, подвергаются быстрой элиминации из
популяций. Тесты на аллелизм летальных мутаций показали,
что вновь индуцированные летали в гетерозиготном состоянии
отрицательно влияли на жизнеспособность особей.
Помимо элиминации РЛМ, снижение уровня РЛМ при про-
должающемся облучении популяций можно объяснить возник-
новением генетической адаптации популяций к облучению.
7.2. Динамика видимых мутаций
При изучении динамики уровней ВМ установлено,
что в популяциях обеих групн наблюдается постепенное сни-
жение частот ВМ до контрольного уровня. Высокая частота ВМ
в популяции О2 в 25-м поколении обусловлена, очевидно, пуч-
ком мутаций (табл. 7.4-7.6 и рис. 7.4).
130
Таблица 7.4. Частота ВМ в экспериментальных популяциях дрозофилы I группы
Параметр ВМ Поколение
1 10 20 30 40 50 55 1-55
Контрольная популяция
Число особей 1358 2430 1622 1602 2828 972 1104 11916
Число мутаций 2 2 2 3 2 0 1 12
ВМ, % 0,14+0,10 0,08+0,05 0,12+0,08 0,19+0,11 0,07+0,05 0 0,09+0,09 0,10+0,03
Популяция, обрабатываемая меланином
Число особей 1734 1880 1636 1290 5384 2022 2824 16770
Число мутаций 2 3 1 6 15 0 0 27
ВМ, % 0,11+0,08 0,16+ 0,09 0,06+0,06 0,47+0,19 0,28+0,07 0 0 0,16+0,03
Облучаемая популяция
Число особей 1586 2400 2078 1834 4766 2102 3112 17878
Число мутаций ,12 15 5 9 5 2 2 50
ВМ, % 0,75+0,22 0,62± 0,16 0,24+0,11 0,49+0,16 0,10+0,05 0,10+0,07 0,06+0,04 0,28+0,04
Популяция, обрабатываемая меланином и облучаемая
Число особей. 1986 2700 2420 2060 3820 1426 3442 17854
Число мутаций 6 13 6 7 4 1 2 39
ВМ, % 0,30+0,13 0,48+0,13 0,25+0,10 0,34+0,13' 0,10+0,05 0,07+0,07 0,05+0,03 0,22 + 0,04
Примечание. С 1-го по 55-е поколение
Таблица 7.5. Частота ВМ в экспериментальных популяциях дрозофилы II группы
Параметр ВМ Поколение
1 5 15 25 35 50 55 1-55
Контрольная популяция
Число особей . 1358 2666 3384 2578 2142 1416 1092 14636
Число мутаций 2 3 7 2 1 0 0 15
ВМ, % 0,14± 0,10 0,11 ±0,06 0,21 ±0,08 0,08 ±0,06 0,05 ±0,05 0 0 0,10 ±0,02
Популяция, обрабатываемая меланином
Число особей 1734 2692 3140 1812 1156 2190 — 12724
Число мутаций 2 1 8 0 0 1 — 12
ВМ, % 0,11 ±0,08 0,04 ±0,03 0,25 ±0,09 0 0 0,05±0,05 — 0,09 ±0,03
Облучаемая популяция
Число особей 1586 2610 2352 3248 2918 3462 2328 18504
Число мутаций 12 8 10 29 2 0 0 61
ВМ, % 0,75 ±0,22 0,30±0,10 0,42±0,13 0,89 ±0,16 0,07 ±0,05 0 0 0,33 ±0,04
Популяция, обрабатываемая меланином и облучаемая
Число особей 1986 3300 2912 3496 2026 2492 4088 20300
Число мутаций 6 3 12 9 3 0 0 33
ВМ, % 0,30±0,13 0,09 ±0,05 0,31 ±0,10 0,26 ±0,09 0,15 ±0,09 0 0 0,16 ±0,03
Примечание. С 1-го по 55-е поколение t.. " 5,1; ..„"3,4.
К-О О-МО
Снижение частоты ВМ может быть вызвано как элимина-
цией мутаций, так и возникновением адаптации популяций к
облучению. В литературе имеются сведения о том, что ВМ
могут элиминировать вследствие их отрицательного влияния
на приспособленность особей. В частности, мутация white сни-
жает жизнеспособность на стадиях метаморфоза до выхода
имаго, а также уменьшает плодовитость, хотя эффект селек-
Рис. 7.4. Динамика видимых мутаций I (а) и П (б) групп в по-
пуляции дрозофилы:
1 — облучение; 2 — меланин + облучение; 3 — меланин; 4 —контроль
133
тивного скрещивания в случае мутации white относительнс
мал (340]. Показано, что биохимические мутации также не яв-
ляются нейтральными с точки зрения действия отбора [341].
Возникновение адаптации популяций к индукции облуче-
нием точковых (биохимических) мутаций показано в работе
[342].
Полученные нами данные позволяют сделать вывод также
и о снижении частоты ВМ в облучаемых популяциях под влия-
нием меланина. Так, в популяциях МО в среднем за 55 поко-
лений частота ВМ составила 0,19 + 0,02 %, а в облучаемых по-
пуляциях - 0,31 ±0,03 % (1 = 3,3). Снижения же спонтанного
уровня ВМ под влиянием меланина не наблюдалось.
Как отмечалось, литературных данных по модификации
мутационного процесса в облучаемых популяциях нами не об-
наружено, и только в одной работе исследовано влияние мо-
дификаторов на популяции, обработанные химическим мута-
геном. Влияние некоторых витаминов на мутационный эффект
химического мутагена ЭИ исследовано в популяциях однокле-
точной водоросли хлореллы [343].
Установлено, что пиридоксин и никотиновая кислота за-
держивают появление мутагенного эффекта ЭИ в течение не-
скольких поколений, причем пиридоксин усиливает его мута-
генное действие. Тиамин и цианкобаламин снижают частоту
мутаций, индуцированных химическим мутагеном. При этом
наблюдается „срезание” максимума мутаций под Действием
тиамина и цианкобаламина, аналогичное полученному нами
при действии меланина на частоту ВМ, индуцированных облу-
чением (см. рис. 7.4). Сложное взаимодействие модификаторов
и ЭИ (например, обнаружение „сверхзадержанного мутагене-
за”, „срезание” максимума мутаций и т. д.) еще раз показало,
что исследования действия антимутагенов на популяционном
уровне не только необходимы для практических целей, но и
позволяют раскрыть новые теоретические закономерности му-
тационного процесса и его модификации, которые в острых
опытах обнаружить невозможно.
73. Динамика доминантных летальных мутаций
Динамика ДЛМ в ряду поколений показывает чет-
кие различия между двумя облученными популяциями по это-
му тесту (рис. 7.5). Так, если в популяции Oj возросшая после
первого облучения частота ДЛМ остается все время выше конт-
рольной (рис. 7.5, а), то в популяции О2 она падает уже в 5-м
поколении, в среднем приближаясь к контрольному уровню
(рис. 7.5, б). При этом динамика ДЛМ в популяциях, питавших-
134
Рис. 7.5. Динамика ДЛМ I (а) и II (б) групп в популяции дрозо-
филы:
1 — облучение; 2 — меланин + облучение; 3 — контроль; 4 — меланин
ся меланином, а также облученных на фоне меланина в обеих
группах, практически идентична.
Если мы сравним кривые, отражающие изменение частот
ДЛМ в облученных популяциях, с кривыми жизнеспособности
особей в этих же популяциях, то увидим, .что они являются
зеркальным отображением друг друга (рис. 7.6,7.7).
Частота ДЛМ у дрозофилы по стандартной методике опре-
деляется как процент невылупившихся личинок (неразвив-
шихся яиц) по отношению к числу отложенных яиц. До недав-
него времени считалось, что причиной невылупления личинок
из яиц являются хромосомные перестройки. Однако бькло по-
казано [344-346], что в число неразвившихся яиц могут вхо-
дить 1) неоплодотворенные яйца, 2) яйца, погибшие из-за эко-
логических причин, и 3) яйца, погибшие по генетическим при-
135
Рис. 7.6. Динамика ДЛМ (в) и динамика жизнеспособности (б)
в популяциях дрозофилы К и О:
1 — облучение; 2 — контроль
чинам. Из этого следует, что тест ДЛМ можно использовать
лишь для вполне определенных целей, ясно сознавая, что он
выявляет не только генетические, но и физиологические на-
рушения. При тестировании мутагенных факторов тест ДЛМ
может служить лишь первой ступенью отбора. Например, в ра-
боте [346] исследовалось мутагенное действие промстоков у
дрозофилы. По тесту ДЛМ эффект был обнаружен, а по тесту
РЛМ - нет. Авторы сделали правильный вывод, что доля не-
развившихся яиц при воздействии промстоков - результат
токсического, а не мутагенного действия.
Комплементарность ряда методов учета мутаций изучена
на микроорганизмах, дрозофиле, млекопитающих и клетках.
136
Рис. 7.7. Динамика ДЛМ (а) и динамика жизнеспособности (б)
в популяциях М и МО:
1 — меланин; 2 — меланин + облучение
человека с помощью кластерного анализа [347]. Из восьми про-
анализированных тестов, используемых для оценки мутаген-
ной активности, семь оказались хорошо скоррелированными.
И только метод ДЛМ у дрозофилы не вошел в общий кластер
методов, так как данные, выявляемые этим методом, не кор-
релируют с данными других тестов.
Однако многие исследователи находятся под гипнозом са-
мого термина „доминантные летальные мутации” и продолжа-
ют считать его генетическим тестом. Более того, некоторые
даже делают выводы о мутагенной активности химических со-
единений на основе анализа одного лишь теста ДЛМ [348], счи-
тая, что гибель яиц (невылупление из них личинок) у дрозо-
филы обусловлена только генетическими причинами, однако
она не всегда зависит от летальных мутаций. Например, иссле-
дования влияния мутагена ЭИ показали, что он снижает поло-
вую активность самцов дрозофилы и приводит к зависимому
от дозы увеличению доли неоплодотворенных яиц [349]. Это
значит, что по крайней мере часть ДЛМ, вызываемых у дрозо-
137
Таблица 7.6. Частота ВМ в эксперимеитаплых популяциях дроаофшш
суммарно по двум группам популяций за S5 поколений
Параметр ВМ Группы популяций
I П . 1 + П
Контрольная популяция
Число особей 11916 14636 26552
Число мутаций 12 15 27
ВМ, % 0,10 ±0,03 0,10 ±0,02 0,10 ±0,02
Популяция, обрабатываемая меланином
Число особей 16770 12724 29494
Число мутаций 27 12 39
ВМ, % 0,16±0,03 0,09 ±0,03 0,13 ±0,02
' Облучаемая популяция
Число особей , - 17-878 18504 36382
Число мутаций 50 61 111
ВМ„ % 0,28 ±0,04 0,33 ±0,04 0,31 ±0,03
Популяция, обрабатываемая меланином и облучаемая
Число особей 17854 20300 38154
Число мутаций 39 33 72
ВМ, % 0,22 ±0,04 0,16 ±0,03 0,19 ±0,02
Примечание. Суммарно по двум группам популяций t_ „ - 5,8; ’ 3,3.
О—К О—МО
филы ЭИ, являются результатом гибели неоплодотворенных
яиц.
При облучении дрозофилы обнаружены морфологически
дефектные яйца, из которых личинки не вылупляются [350].
В работе [351] показано, что ДЛМ, возникающие у дрозофилы
при изменении направления вектора гравитации, обусловлены
нарушением метаболических процессов в клетках яиц. Анало-
гичный вывод сделан и в работе [352] при изучении радиочув-
ствительности ооцитов дрозофилы: ДЛМ в незрелых ооцитах -
следствие поражения ионизирующей радиацией цитоплазма-
тических мишеней. Более того, при использовании теста ДЛМ
нельзя быть уверенным, что мы имеем дело действительно с
мутациями даже у мышей, у которых можно подсчитать пред-
и постимплантационную гибель яиц, что с большей вероятно-
стью, чем у дрозофилы, позволяет судить о частоте генетиче-
ских событий.
Японскими исследователями обнаружено отсутствие кор-
реляции между эмбриональной гибелью и индукцией хромо-
сомных перестроек. Например, изопропиленметансульфонат
вызывает у мышей высокую постимплантационную смертность,
но при этом частота яиц с аберрациями хромосом, регистриру-
138
емыми в первом делении дробления, оказывается низкой [353].
Аналогичные данные получены и в работе [354] при испытании
трех химических мутагенов разной природы.
Мутаген азотнокислый уранил, наоборот, вызывает значи-
тельный выход хромосомных перестроек в клетках костного
мозга мышей, но не индуцирует^ДЛМ ни на одной стадии спер-
матогенеза [355].
Не обнаружено прямых корреляций между эмбриональной
гибелью половых клеток и наблюдаемой частотой хромосом-
ных нарушений и в работе [356].
Анализ ДЛМ, вызываемых у мышей бисульфоном, не вы-
явил увеличения числа аберраций хромосом [357]. Оказалось,
что разовая инъекция этого препарата приводит к стерилиза-
ции животных и вызывает долгоживущие морфологические
повреждения спермы. Авторы работ [358, 359] пришли к выво-
ду, что гибель яиц обусловлена как свойствами половых кле-
ток мышей, так и некоторыми физиологическими особенно-
стями самок. Аналогичное заключение сделано и в работе [360]:
эффекты, регистрируемые у мышей при внутрибрюшинном
введении растительных масел как ДЛМ, являются результатом
не мутаций, а непосредственного взаимодействия масла с по-
лостью матки, вызывающего отслоение оболочки.
Таким образом, те нарушения, которые выявляются при
использовании теста ДЛМ у дрозофилы и мышей, могут иметь
как генетическую, так и физиологическую природу.
Следует отметить, что и жизнеспособность особей в боль-
шой мере обусловлена генетическими причинами, т. е. эти два
теста (жизнеспособность и ДЛМ), хотя и попадают по существу-
ющей классификации один в элементы приспособленности, а
второй - мутационного груза, тесно скоррелированы; разли-
чие состоит лишь в том, что ДЛМ отражают гибель особей на
стадии от яйца до личинки, а жизнеспособность - от яйца до
имаго. В обоих случаях эта гибель вызывается как генетиче-
скими, так и экологическими причинами. Поэтому рассмотрен-
ные причины колебаний жизнеспособности, обусловленных из-
менениями численности особей в популяциях, очевидно, спра-
ведливы и для ДЛМ.
косвенным свидетельством того, что частота ДЛМ не явля-
ется чисто генетическим тестом, может служить и тот факт, что
динамика этих „мутаций” резко различается в двух облучен-
ных популяциях, в то время как динамика истинных мутаций
(ВМ) аналогична в обеих облученных популяциях (рис. 7.3,7.4).
Данные по динамике частоты ДЛМ на протяжении 55 поко-
лений идентичны данным по динамике жизнеспособности
(табл. 7.7 и 7.8).
139
Таблица 7.7. Частота ДЛМ в экспериментальных популяциях дрозофилы I группы
Параметр ДЛМ Поколение
1 10 20 30 40 50 55 1-55
Контрольная популяция
Число яиц 299 1063 835 73 193 603 539 3605
Число личинок 289 1032 752 65 180 596 529 3443
ДЛМ, % 3,0 ±0,9 2,8 ±0,5 9,9 ±1,0 11,0±3,7 7,0± 1,8 1,1± 0,4 2,1 ±0,6 4,5± 0,3
Популяция, обрабатываемая меланином -
Число ящ 330 1B5S «50 177 361 854 659 4086
Число личинок 327 1830 603 167 324 805 648 3904
ДЛМ, % 0,6 ±0,4 2,3 ±0,5 7,2± 1,0 5,7± 1,7 10,2 ±1,6 5,8±0,8 1,6±0,5 4,5 ±0,3
Облучаемая популяция
Число яиц 120 1177 788 72 302 657 588 3704
Число личинок 106 1044 694 54 245 638 555 3336
ДЛМ, % 12,0 ±2,6 11,2±0,9 11,7+1,1 25,2 ±5,1 19,0 ±2,3 3,0 ±0,7 5,7± 1,0 9,9±0,5
Популяция, обрабатываемая, меланином и облучаемая
Число яиц 280 1435 410 77 315 769 823 4109
Число личинок 263 1373 389 65 278 743 790 3901
ДЛМ, % 6,0 ±1,0 4,3 ±0,5 5,1± 1,1 15,8 ±4,2 11,8± 1,8 3,4 ±0,7 4,1 ±0,7 5,1 ±0,3
Примечание. С 1-гопо55-епоколение • 9,0; «8,0.
К-0 О-МО
Таблица 7.8. Частота ДЛМ в экспериментальных популяциях дрозофилы II группы
Параметр ДЛМ „ - ~ f <1 ' , Поколение
I 5 15 25 35 50 55 1-55
Контрольная популяция
Число яиц 299 903 648 46 354 835 590 3675
Число личинок 289 870 563 41 335 817 502 3417
ДЛМ, % 3,0+0,9 3,7±0,6 13,1+1,3 8,7±4,9 5,2 ±1,2 2,1+ 0,5 4,6+0,9 7,0 ±0,4
Популяция, обрабатываемая меланином
Число яиц 330 1179 544 94 378 818 698 4041
Число личинок 327 1133 511 82 369 773 674 3869
ДЛМ, % 0,6+0,4 , 4,0 ±0,6 5,7+1,0 11,7±3,3 2,1 ±0,7 5,5+0,8 3,4 ±0.7 4,3 ±0,3
Облучаемая популяция
Число яиц 120 756 826 148 409 781 566 3606
Число личинок 106 718 771 136 388 753 536 3408
ДЛМ, % 12,0 ±2,6 5,2+ 0,8 6,7±0,9 7,5 ±2,2 5,3± 1,1 3,5 ±0,7 5.4 ±1,0 5,5±0,4
Популяция, явреЛяаввемвя меланином и облучаемая -
Число яиц 280 1356 6М 181 453 927 763 4640
Число личинок 263 1260 615 163 425 882 728 4336
ДЛМ, % 6,0 ±1,0 7,1+0,7 9,4 ±1,1 10,1 ±2,2 6,1 ±1,2 5,0 ±0,7 4,7 ±0,8 6,6 ±0,4
Примечание. С 1-го по 55-е поколение t„ • 4,5; t_ 1,5.
К"—м о—ми
Действие облучения на популяции неоднозначно: в по-
пуляции Ох оно существенно увеличивает уровень ДЛМ, а в
популяции О2 влияние облучения не выявлено. Частоту инду-
цированных радиацией доминантных летальных мутаций в
популяциях I группы меланин снижает с 9,9 ±0,5 до 5,1 ±0,3 %
(t = 8,0), а во II, где частота ДЛМ в облучавшейся популяции
не превышает таковую в контроле, его защитное действие не
проявляется. В то же время в популяции П группы меланин
снижает частоту спонтанных ДЛМ с 7,0 ± 0,04 до 4,3 ± 0,3 %
(Г = 4,5).
Таким образом, анализируя динамику мутационного гру-
за, можно сделать следующие выводы.
1, В облучаемых популяциях вслед за резким повышением
частот мутаций наступает их постепенное снижение. Так как
анализы проводились через 5 поколений, то в период с 1-го по.
5-е поколение мог происходить не выявленный нами процесс
нарастания частоты ВМ. Снижение уровней РЛМ и ВМ в,усло-
виях продолжающегося облучения может свидетельствовать о
наступлении генетической адаптации облучаемых популяций
к мутагенному действию ионизирующей радиации [361,362].
2. Меланин благоприятно воздействует на мутационный
процесс в популяциях. Так, now влиянием меланина снижает-
ся выход всех исследованных типов мутаций, индуцирован-
ных рентгеновским излучением, а также спонтанная частота
РЛМ.
Таким образом, на примере меланина впервые показана
принципиальная возможность уменьшения мутационного гру-
за в облучаемых популяциях при помощи химических антиму-
тагенов. Особенно важно снижение с помощью меланина ин-
дукции облучением точковых мутаций в сперматогониальных
клетках. Эти результаты имеют большое теоретическое и прак-
тическое значение.
ГЛАВА 8
ИССЛЕДОВАНИЕ РЕЗИСТЕНТНОСТИ
ЭКСПЕРИМЕНТАЛЬНЫХ ПОПУЛЯЦИЙ
К МУТАГЕННЫМ ФАКТОРАМ
8.1. Сравнение радиочувствительности
популяций разных типов
Данные о повышении плодовитости облучаемых по-
пуляций дрозофилы и снижении частоты РЛМ и ВМ примерно к
25-30-му поколениям после начала облучения позволяют пред-
142
положить, что облучаемые популяции за данный период вре-
мени стали более радиорезистентными, т. е. возникла адапта-
ция этих популяций к действию ионизирующей радиации
[363,364].
Для проверки данного предположения необходимо было
оценить радиочувствительность облучавшихся популяций по
сравнению с контрольными, а также сравнить радиочувстви-
тельность популяций, подвергавшихся воздействию меланина.
Для этого в 48-м поколении были взяты выборки взрослых осо-
бей из экспериментальных популяций всех четырех типов из
обеих групп (I и II) и однократно облучены в дозе 0,6 Кл/кг.
Изучены элементы приспособленности (плодовитость, жизне-
способность потомков) и мутационного груза (частота ДЛМ и
РЛМ в выборках после дополнительного облучения (табл. 8.1 и
8.2)). После дополнительного облучения плодовитость особей
из ранее облучавшихся популяций оказалась на 50% выше,
чем из контрольных. По всем остальным тестам облучавшиеся
ранее популяции оказались более устойчивыми к дополни-
тельному облучению, чем все другие (рис. 8.1,8.2). Так, если
жизнеспособность особей, взятых из популяций К, М и МО,
снизилась под действием облучения на 12-17 %, то у дрозофил
из популяций О этот показатель не уменьшился вовсе, несмот-
ря на то что выборка взрослых особей из популяций О, под-
вергшихся дополнительному облучению, уже была облучена
на стадии личинки в дозе 0,10 Кл/кг, т. е. особи из этих популя-
ций получили большую дозу, чем все другие. Аналогично час-
тоты ДЛМ и РЛМ в выборках из облучаемых популяций воз-
росли значительно меньше, чем из всех других.
Если сравнивать радиорезистентность популяций О из каж-
дой группы отдельно, то заметна некоторая разница между
ними. Так, если плодовитость особей в облучавшейся популя-
ции I группы после облучения в дозе 0,6 Кл/кг составляла 7,5 ±
± 0,8 яиц на самку в день, то во II группе этот показатель был
равен 10± 1,4 яиц на самку в день. Еще более существенной
оказалась разница между этими двумя популяциями по тесту
РЛМ: в первой частота мутаций после дополнительного облу-
чения составила 0,86+0,09 %, а во второй — всего 0,11 + 0,01 %.
Эти данные хорошо согласуются с данными динамики приспо-
собленности и мутационного груза в популяциях Ох и О2. Так,
при периодическом облучении в дозе 0,25 Кл/кг плодовитость
и жизнеспособность особей в популяции О2 была намного вы-
ше, а частота ДЛМ и РЛМ ниже, чем'в популяции Ох (см. рис. 6.3,
6.4, 7.2, 7.4), т. е. популяция О2 оказалась более радиорезис-
тентной, чем популяция Ор
Обращает на себя внимание факт, что особи из популяций,
143
Формирование
оптимального генотипа
Существовавшие
в популяции
резистентные
формы
Возникновение
новых мутаций
повышенной
резистентности
Амплификация
генов, ответственных
за резистентность
Перемещение
мобильных
элементов
I
I
I
Отбор генотипов с повышенной резистентностью
_______£ZZ
Перестройка
генетической
структуры
популяций
Повышение устойчивости популяций <**
Стимуляция
репарационных систем
хроническим действием
малых доз мутагена
Рис. 8.1. Система механизмов, обеспечивающих повышенную резистент-
кость популяций к повреждающим факторам
Рис. 8.2. Влияние однократного дополнительного облучения в дозе
0,6 Кл/кг на приспособленность в популяциях дрозофилы (суммарно
по I и II группам):
а — плодовитость; б — жизнеспособность; 1 — до облучения; 2 — после облуче-
ния
облучавшихся и получавших с питательной средой меланин,
оказались менее радиорезистентными, чем особи из облучав-
шихся популяций. Вероятно, это объясняется тем, что меланин,
снижая на всем протяжении мониторинга повреждающее дей-
ствие периодического облучения, способствовал выживанию
менее устойчивых генотипов. Поэтому в популяциях МО отбор
144
Рис. 8.3. Влияние однократного дополнительного облучения на мутационный
процесс в популяциях дрозофилы (суммарно по I и II группам):
а — ДЛМ; б — РЛМ; 1 — до облучения; 2 — после облучения
радиорезистентных форм не происходил или был менее эффек-
тивным, чем в популяциях О.
При однократном облучении выборок из популяций М пло-
довитость и жизнеспособность особей снижались в меньшей
степени, чем из контрольных (см. табл. 8.1), что можно объяс-
нить защитным действием меланина. Однако частота мутаций
в популяциях М и К после облучения различалась незначи-
тельно (см. табл. 8.2).
Полученные данные позволяют сделать вывод, что при
длительном воздействии рентгеновскими лучами в дозе
0.25JCл/кг популяции адаптируются к облучению, что выража-
ется в повыттп»инлй по сравнению с контрольными популяция-
Mii*v5,f6Sn»pr‘‘~*M к токсическому и мутагенному действию ра-
диации. Скармливание меланина препятствует возникнове-
нию такой адаптации.
Обращает на себя внимание факт, что в исследованных на-
ми облучаемых популяциях дрозофилы повышенная радиоре-
зистентность обнаружена в 48-м поколении, в то время как в
работе [274] высокий уровень РЛМ сохранялся на протяжении
120-140 поколений. Литературные .данные по количеству по-
колений, необходимых для формирования адаптивной реак-
ции облучаемых популяций, весьма разнообразны - от 4-6 по-
колений у дрозофилы и у высших растений [307, 342, 365, 366]
до 120-140 поколений у дрозофилы по данным [274]. Этот диа-
пазон обусловлен, очевидно, не столько видовыми особенно-
стями, сколько условиями облучения и содержания популя-
ций (в частности, интенсивностью естественного отбора).
10. Зак. 5222. 145
Таблица 8.1. Влияние однократного дополнительного облучения на приспособленность в экспериментальных популяциях дрозофилы
(суммарно по двум группам популяций)
Популяции Плодовитость, количество яиц на 1 $ в сутки Жизнеспособность, %
до облучения после облучения d t* до облучения после облучения . d t*
к 8,3 ±0,2 6,2+ 0,6 2,1 3,3 79,6 ±1,9 62,5 + 2,3 17,1 9,72
м 8,7 ± 0,1 9,5 ±0,7 -0,8 8,2 77,9+2,1 65,7 + 2,0 12,2 9,16
О 10,1 ±0,2 9,1+ 0,8 1.0 56,9 + 1,3 57,4 ±2,0 -0,5
МО 10,6+0,1 9,0+ 0,8 1.6 2,3 71,1 + 1,1 58,3 + 1,7 12,8 11,1/
* Значение t вычислялось между показателями d в популяциях К, М или МО и показателем d в популяции О; d — разница значений признака до
и после облучения.
Й Таблица 8.2. Влияние однократного дополнительного облучения на мутационный процесс
в экспериментальных популяциях дрозофилы (суммарно по двум группам популяций)
Популяции длм, % РЛМ, %
до облучения после облучения d t* до облучения после облучения d t*
к 5,7 ±1,6 25,3 ±2,6 -19,6 2,6 0,09 ±0,07 0,69 ±0,16 -0,60 1.5
м 6,2 ±1,2 28,2 ±2,3 -22,0 4,0 0,08 ±0,06 0,94 ±0,23 -0,86 2,2
О 15,0 ±2,0 26,4 ±2,2 -11,4 0,21 ±0,09 0,50 ±0,16 -0,29
МО 10,7± 1,8 25,9 ±1,8 -15,2 1,7 0,03 ±0,02 1,19 ±0,27 -1,16 2,9
Значение t вычислялось так же, как и в табл. 8.1.
Таблица 8.3. Влияние ЭМС на приспособленность
в экспериментальных популяциях дрозофилы (суммарные данные двух групп популяций)
Популяции Плодовитость, количество яиц на 19 в сутки Жизнеспособность, %
до обработки ЭМС после обработки ЭМС d t* до обработки ЭМС после обработки ЭМС •> d t*
К 11,0+0,1 17,5 + 2,6 —6,5 4,0 79,6 ±0,5 24,8 ±0,9 54,8 14,4
М • 12,3 ±0,1 12,7+3,5 -0,4 15,0 82,3 ±0,4 6,0 ±0,9 76,3 23,4
О 12,5 ±0,2 17,4 + 2,6 -4,9 74,6 ±0,5 42,8 ±1,1 31,8
МО 13,0 + 0,2 20,8 ±2,8 -7,8 6,5 78,4 ±0,4 34,1 ±1,3 44,3 7,4
* Значение t вычислялось так же, как и в табл. 8.1.
Таблица 8.4, Влияние ЭМС на мутационный процесс
в экспериментальных'популяциях дрозофилы (суммарно по двум группам популяций)
Популяции длм, % РЛМ, %
до обработки ЭМС после обработки ЭМС d t* до обработки ЭМС после обработки ЭМС d t*
к 5,8± 0,3 49,8± 1,1 -44,0 15,5 0,14 ±0,03 11,8±1,5 -11,7 4,3
М 4,4± 0,2 83,3 ±1,4 -78,9 31,5 0,06 ±0,02 — — —
О 7,7 ±0,3 29,6 ± 1,1 -21,9 0,33 ±0,04 4,2 ±1,1 -3,9
МО 5,9 ±0,3 43,6 ±1,3 -37,7 9,8 0,17± 0,03 12,5 ±2,2 _ -12,3 4,9
•Значение t вычислялось так же, как и в табл. 8.1.
Методика нашей работы отличается от методики в работе
[274] и более сходна с методикой облучения и содержания по-
пуляций, использованной Маркусом [367], показавшим повы-
шенную радиорезистентность облучаемых популяций дрозо-
филы после 13 поколений облучения: 1) в работе [274] исследо-
вались популяции с перекрывающимися поколениями (особи с
низкой жизнеспособностью могут оставить потомство вскоре
после вылупления, т. е. естественный отбор в этих условиях
менее жесткий), а в работе [367] и нами исследованы популя-
ции с неперекрывающимися поколениями, так что потомство
могли оставить лишь особи, дожившие до следующей перекид-
ки, т. е. естественный отбор в этом случае гораздо более интен-
сивный; 2) в работе [367] и нами применялось периодическое
облучение (у Маркуса взрослые особи получали по 500 или
1000 Р один раз в поколение, у нас по 1000 Р за два раза в по-
коление: 600 Р взрослым и 400 Р личинкам, а в работе [274] ис-
пользовано хроническое облучение малыми дозами (0,9 Р/ч
или 5,1 Р/ч постоянно)).
Отмечено, что при хроническом облучении с постоянной
мощностью дозы устанавливается равновесие между давлени-
ем мутаций и действием отбора. В результате уровень мутаций
в популяции стабилизируется [313]. Однако такое равновесие
наблюдается не всегда. В работах, выполненных на высших
растениях, показана адаптация облучаемых популяций к 4-му
поколению [365, 366]. Этапы накопления или стабилизации му-
тационного груза при этом не выявляются, а наблюдается лишь
снижение частоты мутаций от Mj до М4. Адаптация хронически
облучаемых популяций растений после 5-7 поколений облу-
чения показана в работе [342], в которой отмечено, что отбор
радиорезистентных форм идет тем интенсивнее, чем выше
мощность дозы хронического облучения, т. е. чем интенсивнее
воздействие селектирующего фактора [368].
В ряде работ исследовались хронически облучаемые по-
пуляции полевок и лесных мышей. Анализировалась частота
хромосомных перестроек в семенниках и костном мозге жи-
вотных из популяций, обитающих в двух районах с повышен-
ным уровнем радиации разной интенсивности и в контрольном
районе. Повышенная радиорезистентность облучаемых по-
пуляций была обнаружена в 25-30-м поколениях [368].
Таким образом, можно сделать вывод, что в природных
популяциях, а также и в экспериментальных при жестком ес-
тественном отборе и при интенсивном воздействии селекти-
рующего агента адаптация облучаемых популяций происходит
довольно быстро. В лаборатории можно создать такие условия
облучения и действия естественного отбора, при которых бу-
148
дет наблюдаться длительное равновесие между давлением му-
таций и отбором. При этом длительность периода формирова-
ния адаптации популяций зависит от условий эксперимента.
8.2. Сравнение чувствительности популяций
разных типов к химическому мутагену ЭМС
Повторная проверка резистентности облучавшихся
популяций была проведена в 66-м поколении мониторинга от
начала облучения. Интересно было выяснить, является ли по-
вышенная резистентность облучавшихся популяций специфи-
ческой или нет. В качестве проверочного фактора было решено
испытать химический мутаген ЭМС.
Выборки взрослых особей из всех популяций обрабатыва-
лись химическим мутагеном ЭМС в концентрации 0,01 М. Му-
таген скармливали взрослым особям с 1%-ным раствором са-
харозы на бумажных фильтрах в течение 17 ч. Исследовались
элементы приспособленности (плодовитость, жизнеспособ-
ность) и мутационного груза (ДЛМ и РЛМ). В результате иссле-
дований были обнаружены резкие различия в чувствительно-
сти популяций к химическому мутагену по всем тестам, кроме
плодовитости (табл. 8.3, 8,4 и рис. 8.4). Так, жизнеспособность
облучавшихся популяций после обработки ЭМС оказалась по- '
чти в 2 раза выше, а частота ДЛМ и РЛМ почти в 2 раза ниже,
чем в контрольных.
Полученные данные подтвердили факт возникновения по-
вышенной резистентности популяций при их длительном об-
Рис. 8.4. Влияние ЭМС на приспособленность и мутационный процесс в популя-
циях дрозофилы:
й — жизнеспособность; б — ДЛМ; в — РЛМ; 1 — до воздействия; 2 — поспе воздействия
149
лучении, а также показали, что эта резистентность является
неспецифической, т. е. облучавшиеся популяции стали более
устойчивыми к воздействию факторов не только физической,
но и химической природы.
Популяции МО оказались более чувствительными, чем по-
пуляции О. к воздействию ЭМС. Это подтверждает вывод о
том, что меланин препятствует апаптяпии популяций.
Если по чувствительности к дополнительному облучению
популяции МО занимали промежуточное положение между об-
лучавшимися и контрольными популяциями (см. табл. 8.1,8.2),
то по чувствительности к ЭМС они не отличались от контроль-
ных. Очевидно, меланин хотя и способствовал сохранению ме-
нее жизнеспособных генотипов, но в какой-то степени защи-
щал их от однократного дополнительного облучения. Защи-
тить же от химического мутагена меланин, вероятно, не может,
судя по его предполагаемому механизму радиозащитного дей-
ствия, связанному с перехватом энергии облучения7~Поэт6му
чувствительность популяций ЙО к воздействию мутагена ЭМС
была на уровне контрольных популяций. Интересно, что по-
пуляции М оказались сверхчувствительны к токсическому и
мутагенному действию ЭМС Плодовитость особей из этих по-
пуляций, правда, снизилась незначительно, но зато жизнеспо-
собность составила всего 6,3 %, а уровень ДЛМ достиг 83 %. Час-
тоту РЛМ в выборках из популяций М определить вообще не
удалось, так как из-за большого токсического эффекта, выра-
зившегося в гибели дрозофил, обработанных ЭМС, высокой
стерильности и низкой жизнеспособности потомства выжив-
ших особей не удалось получить достаточное для определения
уровня РЛМ количество потомков. Это значит, что антимута-
ген, снижая вредные воздействия на приспособленность и му-
тационный процесс в популяциях, тем самым препятствует их
адаптации к повреждающим факторам. Очевидно, в благопри-
ятных условиях защиты меланином в популяциях сохраняют-
ся и размножаются менее устойчивые и жизнеспособные гено-
типы и отбор резистентных генотипов не происходит вообще
или происходит медленно.
Таким образом, в результате проверочного дополнительно-
го облучения и воздействия химического мутагена выявились
различия в радиорезистентности ранее облучавшихся и конт-
рольных популяций. Эти данные подтверждают предположе-
ние о том, что при периодическом воздействии рентгеновским
излучением в ходе естественного отбора в изученных нами по-
пуляциях возникла частичная адаптация популяций к повреж-
дающему действию облучения. Эта адаптация выражается в
повышении плодовитости особей, частично компенсирующей
150
сниженную жизнеспособность, а также в постепенном сниже-
нии мутабильности экспериментальных популяций, подвер-
гавшихся облучению. Показано также, что выявленная адап-
тация популяций является неспецифической и обеспечивает
устойчивость как к ионизирующей радиации, так и к химиче-
скому мутагену ЭМС [369,370].
В литературе существуют сведения о неспецифической
адаптации популяций к повреждающим факторам. Так, в ра-
боте [371] выявлено, что отселектированная по радиорезистент-
ности популяция дрозофилы, в прошлом облучавшаяся рент-
геновскими лучами на протяжении 220 поколений, оказалась
устойчивой к мутагенному действию химического мутагена
ЭМС. Были выделены три мутации, обеспечивающие устойчи-
вость популяции к облучению, и показано, что они ответствен-
ны и за устойчивость к химическому мутагену. Надтом осно-
вании авторы предположили, что мутации влияют на этапы,
общие для радиационного и химического мутагенеза [371].
Устойчивые штаммы хлореллы из популяций, подвергав-
шихся хроническому воздействию ЭИ, резистентны и к леталь-
ному действию у-излучения [372]. Следовательно, облучавшие-
ся или подвергавшиеся воздействию химического мутагена
популяции оказываются устойчивыми к обоим типам воздей-
ствий.
Установлена, что популяции по§сноводного моллюска пру-
довика~обыкновенного7*подВерггйшйёся перИбдическому ле-
ресыханию и ежегодному промерзаниюГбказались в З раза бо-
лее, устойчивыми по сравнению с Обычнбйтяечнби популяцией
^летальному действию облУчени^[Зб5]. в данном случае по-
вышение радиорезистентности явилось следствием увеличе-
ния общей неспецифической устойчивости популяций, сфор-
мировавшейся под действием жесткого естественного отбора в
условиях давления экологических факторов.
Аналогичные данные получены.и в работах [373, 374] при
исследовании влияния хронического облучения на мутацион-
ный процесс в природных популяциях растений. Показано, что
неблагоприятные условия произрастания горошка мышиного
(бедность почвы органическими и минеральными веществами,
ее сухость и токсичность, обусловленная присутствием тяжё-
лых металлов) оказывают не меньшее влияние на радиорезис-
тентность популяции, чем хроническое облучение.
Установлено также, что популяции лесных мышей, прожи-
вающих в условиях загрязнения ^uSr, значительно устойчивее,
чем контрольные, не только к дополнительному облучению,
но и к физической нагрузке (принудительное плавание). иЗк
неблагоприятным э1Олотическим фактооам13751.
151
На дрозофиле показано, что адаптация по теплоустойчиво-
сти сопровожпае.тея апяптапирй и плрадмпугтпЦчивости [37бТ.
А в работе [377] отмечается, что повышенная радиоустойчи-
вость мышей коррелирует с их устойчивостью к гипоксии, хо-
лоду, повышенной температуре, длительным физическим на-
грузкам, канцерогенам, стрихнину и чумному токсину. В част-
ности, полевки из Заполярья более радиорезистентны по тесту
хромосомных аберраций в селезенке, костном мозге и рогови-
це глаза по сравнению с полевками из Подмосковья.
Очевидно, что формирование неспецифической резистент-
ности популяций - это общая закономерность, проявляющая-
ся при длительных воздействиях самых разнообразных эколо-
гических и антропогенных факторов. Это явление необходимо
учитывать при оценке генетических эффектов загрязнения
окружающей среды. Обычно исследователи ориентируются в
основном на прямую оценку уровня мутаций в природных по-
пуляциях, что может привести к занижению результатов опре-
деления мутагенного потенциала загрязнителей. Например,
Леонард [76] считает некорректным использование „метода
лимфоцитов” для мониторинга популяций человека, длитель-
но контактирующих с мутагенами, так как популяции лимфо-
цитов состоят из клеток с разной чувствительностью, причем
менее резистентные клетки быстрее элиминируются при хро-
нических воздействиях мутагенных факторов, что приводит к
повышению устойчивости популяции лимфоцитов и заниже-
нию результатов мониторинга. Кроме того, время жизни лим-
фоцитов короткое, поэтому значительная часть аберраций эли-
минируется с погибшими клетками.
Аналогичное предостережение от возможного подхода к
созданию критериев качества воды на основе возрастающей
устойчивости водных организмов в условиях загрязнения со-
держится и в работе [378].
Накопленный огромный материал о быстрых и точных ге-
нетических изменениях под действием факторов внешней сре-
ды позволяет рассматривать эти изменения как индикаторы
адаптивного ответа популяций и использовать популяционные
сдвиги как критерии загрязнения среды [379].
8.3. Механизмы адаптации популяций
Одним иэ возможных путей формирования адапта-
ции популяций к хроническому воздействию повреждающих
факторов является отбор более резистентных генотипов. Из-
вестно, что популяции полиморфны по генам, контролирую-
152
щим радиочувствительность. И если в обычных условиях осо-
би, несущие гены повышенной радиоустойчивости, не имеют
селективного преимущества, то при хроническом облучении
такие генотипы приобретают особую ценность и закрепляются
отбором.
Каковы могут быть причины повышенной резистентности
того или иного генотипа? Устойчивость к облучению может
быть обусловлена увеличением содержания в клетках есте-
ственных радиопротекторов. В работе [311] предполагается,
что в условиях облучения происходит отбор мутантов, синте-
зирующих тиолов больше, чем в контрольной популяции. Для
проверки этой гипотезы было определено содержание эндоген-
ных тиолов у ряда природных радиорезистентных и чувстви-
тельных штаммов хлореллы и обнаружена четкая корреляция
между радиочувствительностью и концентрациями внутрикле-
точных тиолов [311].
При воздействии мутагенов, и в частности облучения, в
растениях происходит возрастание количества витаминов.
Экспериментально были получены данные о существовании
корреляции между эндогенным содержанием аутоантимутаге-
нов и устойчивостью к действию естественных и искусствен-
ных мутагенов [270].
Причиной повышенной устойчивости организма может
быть более эффективное функционирование систем репарации.
Так, при исследовании устойчивости популяций хлореллы к
хроническому воздействию химического мутагена ЭИ было
установлено, что резистентные штаммы хлореллы характери-
зуются более высокой эффективностью систем репарации [372],
чем чувствительные.
Адаптация популяций может осуществляться не только за
счет отбора существовавших в ней резистентных генотипов, но
и за счет формирования генотипа, наилучшим образом приспо-
собленного к новым экологическим условиям. В работе [365]
при биохимическом изучении соотношения специфических ло-
кусов в генофонде популяций пресноводного моллюска было
выявлено, что повышенная устойчивость популяций возника-
ет не за счет появления и размножения новых мутантных
форм, а за счет формирования оптимального генотипа. В то же
время под действием мутагенных факторов в популяциях мо-
гут возникать новые мутации повышенной резистентности. Та-
кие мутации будут закрепляться в ходе естественного отбора
как имеющие преимущество в новых условиях.
Разновидностью естественного отбора в популяциях явля-
ется половой отбор. Действие его изучено в основном на по-
пуляциях насекомых. Например, вытеснение из популяций
153
дрозофилы мутации vestigial, фенотипически проявляющейся
в недоразвитии крыльев, осуществляется не только за счет
низкой конкурентной способности мутантных особей по срав-
нению с нормальными (например, конкуренция за пищу и др.).
Помимо этого, существует поведенческая компонента, заклю-
чающаяся в ассортативном спаривании в пользу особей „дико-
го” типа, проявление которого связывается со специфически-
ми феромонами, выделяемыми нормальными особями. При
этом крылатые самцы безразличны к фенотипу самок, но кры-
латые самки предпочитают крылатых самцов [380].
Аналогичным образом вытесняется из популяции и мута-
ция white (белые глаза). Низкая половая активность белогла-
зых самцов приводит к тому, что при исходном соотношении
генов 1:1 полная элиминация мутации white происходит к 7-му
поколению [381]. (Кстати, столько же поколений требуется и
для вытеснения мутации vestigial [380].) В то же время разные
пигментные мутации по-разному влияют на конкурентную спо-
собность их носителей. Так, белый цвет глаз снижает приспо-
собленность особей, а желтый цвет тела (мутация yellow) не
влияет на конкурентные взаимоотношения [382].
У бабочек рода Colias самки осуществляют выбор партнера
по „летательной активности”. Особи, имеющие генотипы, обус-
ловливающие способность к продолжительному полету, чаще
других попадают в число партнеров по скрещиванию. Более то-
го, при повторном скрещивании самки выбирают самцов с
„лучшим” генотипом чаще, чем при первом спаривании [383].
Таким образом, половой отбор может благоприятствовать
генам, обеспечивающим общее адаптивное преимущество. Ма-
териалом для естественного отбора, являются также мутации,
возникающие при изменении окружающей среды.
В географически изолированных популяциях дрозофилы
наблюдаются одновременные изменения сайтспецифичной му-
табильности, которые объясняются флуктуациями частот ге-
нов-мутаторов. Предполагается, что при глобальных измене-
ниях условий среды, таких как пандемия или введение новых
мутагенов, селективная выживаемость устойчивых мутантов
создает преимущество для генов.-мутаторов, вызывающих му-
тации соответствующих локусов [384].
Подробное выяснение причин радиоустойчивости популя-
ции дрозофилы, долгое время подвергавшейся облучению,
проведено в работах [385, 386]. Вначале было установлено, что
повышенная радиорезистентность этой популяции обусловле-
на устойчивостью стадии 7 ооцитов. Затем с помощью дальней-
шей селекции получена еще более радиоустойчивая популя-
ция и изучена генетическая система, ответственная за ее по-
154
вышенную радиорезистентность. Показано, что радиационно
устойчивая мутация 1, локализованная в Х-хромосоме, конт-
ролирует процесс образования ДЛМ и РЛМ. Мутация 2, распо-
ложенная в аутосоме 2, независимо от мутации 1 снижает веро-
ятность образования ДЛМ и РЛМ и частоту потерь Х-хромосом.
Она снижает также вероятность межхромосомных обменов и
нерасхождения хромосом. Мутация 3 (аутосома 3) независимо
от двух предыдущих контролирует радиорезистентность в от-
ношении ДЛМ, РЛМ и интеробменов с нерасхождениями. Уста-
новлено, что мутация 3 связана с одиночным рецессивным ге-
ном, локализованным в 3-й хромосоме в положении 49.8.
Дальнейшие исследования радиорезистентности двух изу-
чаемых популяций показали, что она наследуется полудоми-
нантно, а радиочувствительность гибридов между этими по-
пуляциями соответствует радиочувствительности родитель-
ских популяций [387].
В работе [388] установлено, что адаптивная эволюция на
основе рецессивных мутаций невозможна и благоприятная му-
тация, вызывающая увеличение резистентности популяции,
должна быть доминантной или хотя бы полудоминантной.
Огромные преимущества в условиях длительного воздей-
ствия повреждающего фактора дает особям амплификация ге-
нов, ответственных за устойчивость к этому фактору. Так, по-
сле многошаговой селекции с возрастающими концентрация-
ми боррелидина были получены линии клеток яичника китай-
ского хомячка с резистентностью к боррелидину в 1000 раз
большей, чем у родительской линии [389]. В работе показано,
что эта устойчивость обусловлена амплификацией гена, коди-
рующего треонил-тРНК синтетазу, ингибитором которой явля-
ется боррелидин.
Линия клеток мышиной меланомы, устойчивость которой
к адриамицину в 50 раз превосходит исходную, описана в ра-
боте [390]. Цитогенетические исследования позволили авторам
сделать вывод, что адаптация этой популяции клеток осуще-
ствилась за счет амплификации генов, ответственных за про-
явление резистентности к адриамицину.
В линиях клеток китайского хомячка, отобранных с по-
мощью многоступенчатой селекции по резистентности к вин-
кристину, обнаружена амплификация соответствующего гена,
которая сопровождалась как увеличением синтеза белка VI9,
так и повышением количества полисом мРНК VI9. В резуль-
тате этих изменений клетки оказались устойчивее в 500-4000
раз по сравнению с исходными [391].
Показано, что 4-8-кратная амплификация гена обеспечи-
вает 20-кратную сверхэкспозицию мРНК гомологичного гена
155
[392]. Сверхрепликация ДНК наблюдалась и при возникнове-
нии резистентности клеток китайского хомячка к гипоксии
[393]. При этом содержание ДНК превышало 4 С. Обнаружено,
что клетки с высокой амплификацией гена происходили иэ по-
пуляции клеток, претерпевших сверхрепликацию ДНК [393].
На клетках джунгарского хомячка, обладающих высокой ус-
тойчивостью, показано, что амплифицированная ДНК, как и
митохондриальная, реплицируется асинхронно [394]. При этом
обнаружено, что количество копий повторяющихся последо-
вательностей ДНК коррелирует с уровнем резистентности кле-
ток и размер амплифицированного сегмента составляет 200-
250 тыс. оснований.
В последние годы появляется все больше данных о вкладе
в быструю адаптацию популяций к неблагоприятным внешним
факторам МГЭ, называемых также транспозонами. Приближе-
ние определенных МГЭ к некоторым генам про- и эукариот по-
вышает активность этих генов в десятки раз [395].
Многие МГЭ содержат различные знаки пунктуации и
управления считыванием (в частности, промоторы и термина-
торы транскрипции). В структуре МГЭ обнаружены также эн-
хансероподобные сайты. Активность всех этих знаков способ-
на изменять (активировать или подавлять) функции соседних
генов, причем влияние энхансеров может распространяться на
расстояния порядка тысяч нуклеотидов. Таким образом, ин-
серция МГЭ в отдаленный сайт способна существенно повы-
сить активность соответствующих генов. Отсюда понятно, что
перемещения МГЭ могут вызвать быструю адаптацию организ-
мов к меняющимся условиям внешней среды [396-398]. Раз-
работана математическая модель для системы „внешняя сре-
да - ген - МГЭ” [396, 399]. В результате анализа модели на
ЭВМ показано, что могут существовать режимы резких изме-
нений внешней среды, когда механизмы мутагенеза не способ-
ны обеспечить выживание популяции. Возможность адаптации
популяций в таких условиях могут обеспечить мобильные ге-
нетические элементы, причем с большой долей вероятности
МГЭ функционируют коррелированно с условиями внешней
среды.
Например, в работе [400] было показано, что чувстви-
тельность экспериментальных популяций дрозофилы к мута-
генному действию облучения ступенчато снижается при сту-
пенчатом повышении уровня облучения (0, 2, 4 и 8 кР на по-
коление). Выявлено, что адаптация популяций обусловлена
возникновением отдельных генетических элементов, которые,
по мнению автора, являются транспозонами. При каждом но-
вом повышении уровня облучения ступенчато включаются до-
156
полнительные генетические „элементы”. Так, при облучении
популяций в дозе 2 кР возникло два полудоминантных факто-
ра в I и II хромосомах. При увеличении дозы облучения до 4 кР
появился третий (рецессивный) фактор в III хромосоме, а при
повышении уровня облучения до 8 кР возник 4-й элемент, то-
же рецессивный, в I хромосоме. После прекращения облучения
один из факторов устойчивости исчез из популяции. Такие
явления могут быть объяснены только транспозициями МГЭ.
Аналогичные „элементы”, обладающие селективным пре-
имуществом и возникающие в разных хромосомах дрозофилы
при облучении популяций, описаны в работе [401]. При интен-
сивном давлении отбора в популяциях могут происходить рез-
кие перестройки за счет появления „элементов”, имеющих
преимущество в гетерозиготах. В работах [402-404] обнару-
жено, что при ступенчатой температурной обработке особей
дрозофилы в чувствительные периоды онтогенеза рисунки пе-
ремещения и локализации МГЭ оказываются аналогичными
в разных повторностях опыта.
Очевидно, не только ионизирующая радиация, но и любые
экстремальные воздействия, в том числе и температурные,
способны стимулировать транспозиции МГЭ в генеративных
клетках. Перемещения мобильных элементов наследуются, по-
этому наследуется и вызываемая ими активация генов, повы-
шающих приспособленность особей.
Особый интерес представляет неслучайность спектров пе-
ремещений МГЭ, адекватных внешним воздействиям. Форми-
рование нового генотипа может быть адекватным ответом на
стрессовое влияние окружающей среды, которое вызывает ак-
тивацию мобильных элементов генома, вырабатывающих об-
ратную транскриптазу, а также может нарушать автономность
созревания синтезируемой РНК. Обратная транскрипция неза-
конно сплайсированных РНК может формировать копии ДНК,
которые способны встраиваться в геном, обусловливая воз-
никновение новых функций [405].
Один из наиболее ярких примеров направленной реакции
популяций на изменения условий внешней среды - появление
генотрофов у растений, выращенных при различном содержа-
нии азота, калия и фосфора в среде [406]. Возникающие при
этом фенотипическйе различия сохраняются у потомков при
содержании их в одинаковых условиях. Оказывается, что при-
чиной таких фенотипических различий является амплифика-
ция генов, необратимо изменяющих геном. Другими примера-
ми направленных генетических изменений являются синтез
специфических антител в лимфоцитах В и индуцируемое не-
достатком восстановленного азота появление у синезеленой
157
водоросли способности к фиксации азота атмосферы, что также
сопровождается изменениями генома [406].
Очевидно, существует связь между МГЭ и амплификацией
генов. Поскольку МГЭ могут кодировать ревертазу, усиление
их транскрипции будет стимулировать амплификацию клеточ-
ных генов, что и приведет к изменению дозы генов или к ин-
серционному мутагенезу [407]. Таким образом, мобильные эле-
менты могут выполнять функцию рецепторов, обеспечиваю-
щих связь между изменением параметров внешней среды и ве-
личиной изменчивости, и тем самым приводить к быстрой адап-
тации популяций в экстремальных условиях.
Описанные механизмы адаптации популяций могут быть
объяснены перестройкой генетической структуры популяций.
Однако возможно и другое объяснение повышенной устойчи-
вости популяций к действию мутагенных факторов - это сти-
муляция или активация систем репарации хроническим воз-
действием малых доз мутагена [366].
Система механизмов, повышающих устойчивость популя-
ций к повреждающим факторам, представлена на рис. 8.1, из
которого видно, что в каждом конкретном случае их резис-
тентность может обеспечиваться каким-то одним, а может
быть, и несколькими путями. Стимуляция репарационных си-
стем малыми дозами мутагена и перестройка генетической
структуры популяций - -это пва принципиально разных меха-
низма повышения резистентности популяций, один из них при-
водит к физиологической адаптации популяций, а другой - к
генетической. Поэтому при выяснении причин устойчивости
популяций прежде всего необходимо решить вопрос, какой из
этих двух механизмов обеспечивает популяции ее устойчи-
вость.
Если резистентность популяции обусловлена стимуляцией
систем репарации под действием мутагена, то после прекраще-
ния мутагенных воздействий чувствительность популяции
должна вернуться к норме.
Для проверки этого предположения из облучавшихся в те-
чение 72 • поколений популяций дрозофилы нами выделены
субпопуляции О”, облучение которых прекратили. Через пять
поколений после прекращения облучения была исследована
чувствительность этих популяций к мутагенному действию
ЭМС.
Воздействие ЭМС привело к возникновению такой же час-
тоты доминантных и рецессивных летальных мутаций в по-
пуляциях О, как и в популяциях О (табл. 8.5). Причем и в тех
и в других частоты мутаций после обработки ЭМС были ниже,
чем в контрольных. Следовательно, популяции, облучение ко-
158
Таблица 8.5. Влияние ЭМС н* мутационный процесс в экспериментальных
популяциях дрозофилы К, О, О- (суммарно по двум группам популяций)
Популяция длм, % РЛМ, %
до обра- ботки ЭМС после обра- ботки ЭМС d t* до обра- ботки ЭМС после обра- ботки ЭМС d t*
К 5,5 57,4 -51,9 о,1 2,4 -2,3
О 10,8 43,4 -32,6 8,0 0 1.1 -1,1 1,4
о- 10,8 43,9 -33,1 8,0 0 1.2 -1,2 1,2
* Значение t вычислялось между показателями d в популяциях О, О" и показате-
лем d в популяции К.
торых было прекращено за 5 поколений до обработки ЭМС, со-
хранили свою повышенную резистентность. Это свидетельству-
ет о том, что в результате длительного воздействия излучения
в популяциях произошла генетическая перестройка, т. е. мы
имеем дело с генетической (или эволюционной) адаптацией
популяций.
Таким образом, при длительном воздействии рентгенов-
ским излучением в дозе 0,25 Кл/кг на поколение в популяци-
ях формируется адаптация к токсическому и мутагенному
действию облучения. Выявлен неспецифический характер та-
кой адаптации - адаптированные популяции оказались более
устойчивыми к воздействию не только ионизирующей радиа-
ции, но и химического мутагена ЭМС.
Показано, что повышенная резистентность облучавшихся
популяций обусловлена не стимуляцией репарационных сис-
тем малыми дозами радиации, а перестройкой генетической
структуры популяций, т. е. адаптация этих популяций явля-
ется генетической.
На примере меланина впервые установлено, что антиму-
таген, защищая популяции от вредных воздействий, тем са-
мым препятствует адаптации этих популяций к повреждаю-
щим факторам, по-видимому, за счет сохранения и размноже-
ния менее устойчивых и менее жизнеспособных генотипов.
ГЛАВА 9
МЕХАНИЗМЫ ЗАЩИТЫ
ОТ РАДИОГЕНЕТИЧЕСКИХ ПОРАЖЕНИЙ
9.1. Некоторые общие механизмы защиты
С момента установления возможности химической
защиты от облучения было выдвинуто много гипотез механиз-
мов радиозащитного действия химических веществ [408-417].
159
Рассмотрим некоторые гипотезы, которые могут представ-
лять интерес с точки зрения защиты генетических структур от
мутагенного действия излучения.
Концепция общего (единого) механизма защиты клеток от
ионизирующей радиации, основанная на представлениях о
скрытых радиационных повреждениях макромолекул и воз-
можности предотвращения их реализации путем множествен-
ной адсорбции на макромолекулах низкомолекулярных со-
единений разной химической природы (адсорбционный меха-
низм), изложена в работе [418]. Благодаря такой адсорбции
увеличивается период, в течение которого повреждения могут
быть репарированы. Предполагается, что молекулы различных
низкомолекулярных веществ, адсорбируясь в значительном
количестве на макромолекулах, скрепляют их структуру и
препятствуют тем самым конформационным изменениям. Чем
больше времени проходит после облучения, тем выше вероят-
ность разблокировки молекулы в результате флуктуации чис-
ла молекул примеси, адсорбированной на ней.
Неспецифичность рассматриваемого механизма защиты ка-
сается только природы основного физического процесса, его
обусловливающего, т. е. упрочения структуры макромолекул
в результате адсорбции больших концентраций примесей. Кон-
кретно же каждое вещество стабилизирует структуру данной
макромолекулы по-своему.
Возможно, что такой механизм защиты может предохра-
нять и от генетических повреждений. По мнению Л. X. Эйдуса,
для этого вовсе не обязательна адсорбция примесей на самих
наследственных структурах, достаточно защитить макромоле-
кулы, участвующие в каком-либо из процессов, связанных с
образованием хромосомных аберраций. Эти макромолекулы
могут находиться не только в ядре, но и в цитоплазме, и в
мембранах [415]. Такой механизм может быть эффективным и
для защиты самих ДНК и ДНП от повреждений, связанных с
нарушением строения этих молекул. Так, в работе [419] сделан
вывод о возможности предотвращения повреждений надмоле-
кулярных структур ДНК и ДНП с помощью „структурной защи-
ты”. Этот механизм защиты рассматривается Л. X. Эйдусом как
один из случаев проявления адсорбционного механизма [416].
Согласно работе [420] действие радиопротекторов незави-
симо от их химической природы является следствием повыше-
ния уровня тиолов как в изолированных клетках, так и в це-
лостном организме, а снижение содержания SH-групп с по-
мощью специфических блокаторов обусловливает сенсибили-
зирующий эффект этих соединений.
Большинство исследователей разделяют точку зрения о
160
том, что защитное действие радиопротекторов связано с „био-
химическим шоком” [421], вызываемым ими в клетке. Так или
иначе, действие радиопротекторов, защищающих от лучевой
гибели, связывают с их влиянием на клеточный метаболизм.
В связи с этим нам кажется интересной гипотеза Лангендорф-
фов, согласно которой существует прямая связь между радио-
протекторами и механизмом цАМФ (аденозин-З-5-монофосфат)
[422]. По мнению авторов, протектор транспортируется к эф-
фекторным клеткам, где взаимодействует с регуляторными
субъединицами или рецепторами аденил-циклазной системы.
Эта система имеет каталитические субъединицы внутри эффек-
торной клетки. Такое взаимодействие между рецепторами и
протекторами вызывает активацию аденил-циклазной систе-
мы, роль которой заключается в превращении АТФ в цикличе-
скую АМФ. Активация этой энзимной системы приводит к уве-
личению уровня цАМФ в эффекторной клетке [423]. Очевидно,
эффективность протекторов в защите животных обусловлена
их способностью стимулировать специфическую физиологиче-
скую активность эффекторных клеток, которая в противном
случае уменьшалась бы в результате облучения. Для того, что-
бы получить эффективную защиту, необходим уровень цАМФ
в клетке более высокий, чем в норме.
Следовательно, согласно этой гипотезе механизм дей-
ствия радиопротекторов самой различной химической приро-
ды сводится к стимулированию реакций, повышающих уро-
вень циклических АМФ в клетке. Как известно, именно моле-
кулам цАМФ обычно отводится роль регуляторов метаболиче-
ских процессов. Гипотеза Лангендорффов объясняет роль ра-
диопротекторов в защите от гибели облученных животных.
Возможно, эти же процессы, нормализующие состояние облу-
ченной клетки, могут играть роль и в защите от мутагенного
действия облучения, например благоприятствовать процессам
репарации.
Существует представление о комплексном механизме дей-
ствия аминотиолов, согласно которому после введения в ор-
ганизм радиопротектора происходит обратимое кратковремен-
ное ингибирование радиочувствительных биохимических про-
цессов репликации ДНК, биосинтеза РНК и белка, а также про-
цессов окислительного фосфорилирования [424]. В основе этих
явлений лежит способность аминотиолов образовывать адсорб-
ционные тиоэфирные, амидные и дисульфидные связи с фер-
ментами, что приводит к ингибированию биохимических про-
цессов и тем самым увеличивает возможность репарации.
Наряду с этим существует мнение, что радиопротекторы
оказывают защитное действие за счет мобилизации восстано-
11. Зак. 5222. 161
витальной системы клетки, поскольку объекты с хорошо ско-
ординированной системой репарации ДНК (например, клетки
Micrococus radiodurans) радиопротекторами не защищаются.
Причем радиопротекторы оказываются тем эффективнее, чем
сильнее осуществляют релаксацию ДНК [425,426].
В научной литературе нет единого мнения о механизмах
радйозащитного действия протекторов. Так, в работах [427-431]
, излагаются различные точки зрения на принципы радиопротек-
торной активности серосодержащих соединений. С одной сто-
роны, утверждается, что цистеамин стабилизирует структуру
ДНК за счет образования S-S-сшивок и предотвращает расхож-
дение концов поврежденной цепи, что требует для осуществ-
ления акта защиты высокой концентрации протектора. С дру-
гой - цистамин угнетает синтез ДНК, что создает условия для
ее наиболее полной репарации. Авторы даже предлагают ис-
пользовать способность химических веществ угнетать , процес-
сы синтеза ДНК в качестве ориентировочного критерия для от-
бора новых радиопротекторов [428].
По мнению авторов работы [429], все существующие радио-
протекторы являются донорами электронов и поэтому крите-
рием для отбора радиозащитных препаратов могут быть их до-
норно-акцепторные свойства.
Согласно работе [430] цистеамин увеличивает доступность
повреждений к ферментам репарации за счет релаксации ДНК
хроматина.
Совершенно противоположное мнение о влиянии цисте-
амина на релаксацию ДНК высказано в работе [431], в которой
отмечено, что цистеамин повышает конденсацию хромосом и
уменьшает доступность ДНК действию нуклеаз, вследствие
чего уменьшается выход ферментативных двунитевых раз-
рывов.
На первый взгляд многие из общепринятых гипотез меха-
низмов действия радиопротекторов противоречат друг другу,
однако это не так. Все они отражают разные стороны сложных
физико-химических и биохимических явлений, происходящих
в облученной клетке при введении в нее радиопротектора. Мы
прикасаемся с разных сторон к системе сложнейших механиз-
мов и процессов, происходящих в клетке, и делаем противо-
речивые выводы, если не видим целого. Разнообразные радио-
биологические эффекты, выявленные различными авторами,
могут быть взаимосвязаны и взаимозависимы. Например, в ра-
боте [432] показано, что мутация rad 51, ответственная в клет-
ках дрожжей за дефектность репарационной системы, обуслов-
ливает и нарушение регуляции синтеза SH-групп.-Следователь-
но, содержание эндогенных тиолов в клетке каким-то обра-
162
зом связано с протеканием в ней репарационных процессов. К
аналогичному выводу пришли и другие исследователи. Так, в
работе [433] отмечается, что тиолы, осуществляя свое защитное
действие, связывают кислород, увеличивают содержание SH-
групп и вызывают неспефицическую реакцию („биохимиче-
ский шок”), при которой возрастает объем ферментативной
репарации.
Согласно работе [434] радиопротекторы самой разной при-
роды вызывают в организме одни и те же биохимические из-
менения, поскольку действие протекторов опосредуется сис-
темой цАМФ. Эти наблюдения позволили объединить различ-
ные гипотезы механизмов радиозащитного действия в единый
„каскадный механизм”, состоящий из ряда ступеней. На пер-
вой ступени при введении радиопротектора происходит вы-
брос в кровь комплекса биогенных аминов. На второй ступени
под влиянием биогенных аминов активируется система цАМФ,
на третьей - запускаются цАМФ-зависимые метаболические
процессы, имеющие прямое отношение к радиочувствительно-
сти клетки [434].
Таким образом, гипотезы биохимического шока Бака [412],
увеличения уровня цАМФ [422] и повышения уровня эндоген-
ных биогенных аминов [435] взаимосвязаны.
Очевидно, процессы, рассмотренные в этих гипотезах, не
являются непосредственными исполнителями радиозащитного
действия, а лишь отражают происходящие в клетке изменения,
необходимые для увеличения в ней количества защитных
агентов, таких как аутоантимутагены, антиоксиданты и др.,
которые по своей химической природе могут быть свободными
небелковыми тиолами, фенолами (в частности, меланином).
Эти защитные агенты могут осуществлять свое действие на
основе донорства водорода или электрона, дезактивации сво-
бодных радикалов, стабилизации структуры макромолекул и
т. п. [417]. Такие процессы могут защищать от первичных по-
вреждений как саму ДНК, так и репарационную систему клет-
ки. Поскольку согласно гипотезе Бреслера [436] повреждения
в клетке возникают не в результате того, что система репара-
ции не справляется с полным объемом поражения, а из-за на-
рушения координации отдельных этапов репарационных про-
цессов, то более эффективная работа этой системы при дей-
ствии каких-либо факторов объясняется не „стимуляцией”, а
коррекцией ее деятельности. В свете этой гипотезы защита си-
стемы восстановления от повреждающего действия облучения
органически вписывается в общую картину физико-химиче-
ских и биологических реакций, происходящих под действием
протектора в облученной клетке.
163
В некоторых работах встречаются высказывания, что ра-
диопротекторы, защищающие организм от лучевой гибели,
должны обладать способностью уменьшать и мутагенное дей-
ствие облучения (причем вывод делается на основании изуче-
ния лишь хромосомных аберраций в соматических клетках).
Существует мнение, что поскольку индукция хромосомных
перестроек в клетках тела отражает общую картину лучевого
поражения организма и может служить биологическим „дози-
метром”, постольку механизмы физиологических и генетиче-
ских повреждений едины и, следовательно, едиными должны
быть и средства защиты от них.
Однако это далеко не так. Изменения, происходящие, на
уровне целого организма,'могут не оказывать влияния на хро-
мосомы и ДНК (особенно половых клеток). Соответственно и
радиопротекторы, уменьшающие смертность облученных жи-
вотных, могут не влиять на частоту индуцированных облуче-
нием мутаций. Более того, даже разные типы мутаций модифи-
цируются по-разному, особенно если сравнить толковые мута-
ции, представляющие собой изменения на уровне ДНК, и хро-
мосомные перестройки, связанные с повреждением белковых
структур (см. гл. 1). Возможность модификации мутационного
процесса различна на разных этапах радиобиологических про-
цессов, развивающихся в облученной клетке. Эти процессы
разделяются на четыре стадии:
1) физическая - в клетке возникают возбужденные и иони-
зированные молекулы, неравномерно распределенные в про-
странстве. Эти события происходят в первые 10~1Ь-10-13 с;
2) физико-химическая длится 10~13—1О~10 с и состоит из ре-
акций, приводящих к перераспределению возбужденными мо-
лекулами избыточной энергии. На этой стадии Образуются
ионы и радикалы;
3) химическая-~ионы и радикалы взаимодействуют друг с
другом и окружающими молекулами, формируя различные
структурные повреждения. Это могут быть разрушения нук-
леотидов в молекуле ДНК, образование разрывов в ДНК и хро-
матине, изменение конформации исходных молекул и т. д. По
мнению одних авторовJ416J, этастадия длится 10-6-10-3 с,
других Т437] - от (б-** с до долей минуты.
___Модификация азотистых оснований в ДНК и образование
сшивок протекают за время от долей секунды до долей мйну-
ты, регистрируются при облучении клетки и могут быть причи-
ной генных: мутаций [438]Г
ДУ биохимическая - работа репарирующих систем клетки
СВОДИТСЯ К ликвидации перечисленных последствий облуче-
ния за время от долей минуты до нескольких суток [437].
164
Отсюда возможны два пути модификации мутагенного
действия облучения:
1) снижение первичного поражения генетического мате-
риала - физико-химический уровень;
2) влияние на процессы формирования мутаций путем воз-
действия на репарационные системы в клетке - биохимиче-
ский уровень.
Второй способ осуществляется легче, хотя бы потому, что
четвертая стадия длится гораздо дольше, чем три первые. По-
этому факторы, влияющие на репаративные процессы в клетке,
способны модифицировать мутационный процесс и после об-
лучения. Кроме того, очевидно, не обязательно проникнове-
ние вещества в клетку [439,440]. Однако воздействия на мета-
болизм клетки, в том числе и на восстановительные процессы,
эффективно изменяют выход лишь хромосомных перестроек, а
индукция точковых мутаций при этом почти не модифицирует-
ся. Более радикальным является первый путь - экранирова-
ние ДНК или уменьшение числа первичных изменений ДНК.
В этом случае модифицируется индукция всех типов повреж-
дений, в том числе и точковых мутаций. Но осуществить этот
процесс гораздо труднее. Для такой защиты протектор должен
присутствовать в клетке во время облучения, т. е. быть вве-
денным до облучения. Кроме того, должна быть достигнута
достаточно высокая концентрация протектора в непосред-
ственной близости от защищаемых молекул. Необходимо так-
же, чтобы потенциал ионизации или энергия возбуждения мо-
лекул протектора были ниже, чем потенциал ионизации и
энергия возбуждения молекул субстрата, или чтобы протектор
обладал антирадикальной активностью. Причем защитный эф-
фект химического соединения определяется не только фак-
тором поглощения, но и дальнейшей судьбой поглощенной
энергии. Энергия, поглощенная молекулой, может реализо-
ваться тремя путями: а) переходом в энергию химических про-
цессов; б) высвечиванием (процессы люминесценции) и в) пре-
вращением в тепловую энергию. Для протектора наиболее же-
лателен последний путь преобразования энергии.
Процессы, связанные с внутримолекулярной компенсаци-
ей потерянных электронов или с передачей неспаренного элек-
трона от уникальной макромолекулы другому соединению -
акцептору электронов, иногда называют физико-химической
репарацией [1, 441, 442] в отличие от ферментативной репара-
ции, а химические вещества, защищающие облученные клетки
по этому принципу, - „ловушками энергии” [443]. Таким пу-
тем можно защищать и саму репарационную систему от разру-
шающего действия облучения.
165
Рассмотрим, обладают ли необходимыми для такой защи-
ты свойствами исследованные нами соединения.
9.2. Механизмы антимутагенного действия
инденовых соединений
По своей химической структуре аминоиндены резко
отличаются от радиопротекторов, известных своей способно-
стью защищать организмы от лучевой гибели. В грубом при-
ближении индены можно рассматривать как углеродные ана-
логи пуринов. Как и пурины, они имеют конденсированные
шести- и пятичлённыи циклы, а также азотистыёТруппйровки.
обладающие, подобно нативным гетероциклам ДНК, донорной
й одновременно акцепторной способностью образовывать меж-
мопеКулярные водородные й ионные^ связи. Это должно спо-
собствовать фиксации протектора на хромосоме, так как фик-
сация химического соединения в непосредственной близости
от ДНК должна осуществляться самыми дальнодействующими
и энергетически выгодными силами ион-ионного и ион-диполь-
ного взаимодействия и посредством межмолекулярных водо-
родных связей. (Эти типы взаимодействия наиболее часто
встречаются в молекулярных процессах живой клетки.)
. Инденовые соединения обладают более легкой возбуждае-
мостью по сравнению с нуклеотидами ДНК и~электронно-ло-
норной активностью. Аминоиндены имеют высокую проникаю-
щую/эторабность. Поскольку инденовые препараты ярко окра-
шены, ркраску органов и тканей животных можно наблюдать
при скармливании и внутрибрюшинном введении этих соеди-
нений, особенно при инъецировании больших концентраций
препарата. В частности, окрашенными оказывались и ткани се-
менников дрозофилы и мышей.
Все это послужило основанием для предположения о воз-
можности перехода энергии с облученной ДНК на молекулы
индена.
Аналогичный механизм действия предполагается для ин-
дола и его производных, например триптофана и др. [444]. С
помощью прямых биофизических измерений показано, что за-
щитная эффективность этих препаратов коррелирует со сте-
пенью молекулярного взаимодействйя ДНК и протекторов.
Предположено, что взаимодействие с ДНК может препятство-
вать образованию димеров, а протонная и электронная донор-
ная активность производных индола - способствовать переда-
че энергии (триплет - триплет) от возбужденной. ДНК к этим
соединениям.
Подтверждением предполагаемого механизма действия
166
инденов могут служить экспериментальные данные, получен-
ные при исследовании генетических эффектов этих веществ.
Сравнительное изучение аминоинденов в разных условиях
проведения эксперимента, в клетках с разным состоянием ме-
таболизма и по разным генетическим тестам свидетельствует о
неспецифическом и не связанном с изменением метаболизма
радиозащитном действии инденовых соединений.
В частности, нами показано, что исследованные аминоин-
дены почти одинаково защищают половые клетки дрозофилы
как от выхода рецессивных летальных мутаций, так и круп-
ных структурных нарушений, выявляемых в хромосомах
слюнных желез [455, 446]. Кроме того, индены уменьшают вы-
ход рецессивных леталей в сперматогониях дрозофилы. Как
уже указывалось, в предмейотических клетках среди РЛМ об-
наруживаются только толковые мутации, модификация кото-
рых наиболее трудна. Проведя цитологический анализ РЛМ,
вызванных облучением, а также комбинированным воздей-
ствием инденов и облучения в сперматогониях дрозофилы,
мы не обнаружили среди них ни одной хромосомной пере-
стройки, что согласуется с литературными данными. Следова-
тельно, уменьшение с помощью инденовых соединений выхода
рецессивных леталей в сперматогониях - явное свидетельство
способности этих соединений защищать половые клетки от ин-,
дукции в них точковых мутаций. Поскольку механизмы обра-
зования точковых и хромосомньиГмутаций различны, способ-
ность инденов уменьшать выход повреждений обоих типов го-
ворит не столько бб их йЛИЯНИИ наТГроцессы образования му-
таций, сколько о способности не допускать или частично сни-
мать энергию облучения с хромосом или ДПК. ~"
При изучении хромосомных перестроек, выявленных ци-
тологически среди рецессивных летальных мутаций в постмей-
отических клетках, сравнивалась их локализация в Х-хромо-
соме дрозофилы при облучении и при действии инденовых со-
единений (см. п. 3.5). Оказалось, что соотношение разрывов,
вызванных облучением, и разрывов, полученных при совмест-
ном действии вещества и облучения, одинаково как в эу-, так
и в гетерохроматиновых участках, т. е. исследуемый препарат
не меняет локализацию по длине хромосомы разрывов, инду-
цированных облучением, и с равной эффективностью модифи-
цирует их'выход в обоих компонентах Х-хромосомы. Посколь-
ку гетерохроматиновые участки хромосом отличаются боль-
шей чувствительностью к различным воздействиям, чем эухро-
матиновые, то полученные данные согласуются скорее с ме-
ханизмом защиты на физико-химическом уровне, чем на био-
химическом.
167
Неоднократно было замечено, что защитное действие ин-
деновых препаратов оказывалось одинаковым в разных усло-
виях эксперимента. Например, кривые, полученные при иссле-
довании радиозащитной эффективности препарата F-37 в раз-
ных концентрациях в сперматоцитах и сперматогониях мышей,
расположены параллельно друг другу (см. рис. 4.1). Очевидно,
в каждой концентрации препарат уменьшает в равной степени
количество повреждений в обоих типах клеток независимо от
их радиочувствительности. Поскольку исходная радиочув-
ствительность сперматогониев ниже, чем сперматоцитов, то,
уменьшая равным образом количество повреждений в обоих
типах клеток, препарат снижает мутагенный эффект облуче-
ния в сперматогониях более существенно, чем в сперматоци-
тах. Так, F-37 в концентрации 15 мг/кг снижает выход транс-
локаций в сперматогониях в 3, а в сперматоцитах - в 1,8 раза,
но в обоих случаях частота мутаций уменьшается на 1,5 % (см.
табл. 4.1), т. е. абсолютный защитный эффект инденовых соеди-
нений одинаков в обоих типах клеток.
Аналогичную картину можно видеть и при облучении in
vitro лимфоцитов периферической крови человека, находя-
щихся на разных стадиях клеточного цикла. Кривые выхода
мутаций при облучении и в условиях защиты инденовыми со-
единениями почти параллельны друг другу (см. рис. 4.4). Соз-
дается впечатление, что под влиянием протектора в культиви-
руемых лимфоцитах снимается равное количество поврежде-
ний независимо от стадии клеточного цикла, а эффективность
репарационных процессов на разных стадиях клеточного цик-
ла сильно различается. Эти данные говорят против возможной
связи протекторных свойств инденовых препаратов с их влия-
нием на системы биохимической репарации.
Кроме того, инденовые соединения эффективно защищают
половые клетки мышей от мутагенного действия летальных
доз облучения (см. п. 4.3). При таких высоких дозах биохими-
ческая система репарации должна быть повреждена [447, 448]
и не может (или может, но недостаточно эффективно) репари-
ровать наносимые повреждения. Поэтому сам факт зашиты от
летальных лоз уже свидртепьствует об ийом механизме защит-
ного действия инденов, основанного не на биохимической, а
скорее на физико-химической репарации^
Для того, чтобы проверить, объясняется ли радиозащитный
эффект инденов влиянием на репарационные процессы, было
предпринято специальное исследование. Очевидно, существу-
ет общность репарационных процессов, принимающих участие
в восстановлении мутационных повреждений, вызванных му-
тагенами разных типов (например, химическими и радиацион-
168
ными) [449, 450]. Кроме того, многие протекторы успешно сни-
жают выход мутаций, вызванных как облучением, так и хими-
ческими веществами. Поэтому, если бы инденовые соединения
оказались способными уменьшать частоту мутаций, индуциро-
ванных химическим мутагеном, это могло бы свидетельство-
вать об опосредованности такого эффекта через систему репа-
рации или через какие-то другие метаболические процессы.
По крайней мере, это доказало бы несправедливость гипотезы
о переходе энергии облучения с ДНК на молекулы индена.
Исследованйе было проведено на культивируемых лимфо-
цитах периферической крови человека. В качестве химиче-
ского мутагена использовали тиоТЭФ. Была использована та
же методика, с помощью которой показано защитное действие
серосодержащих соединений против индуцированных этим му-
тагеном аберраций [451]. Следует особо подчеркнуть, что эта
методика не допускает возможности прямого взаимодействия
мутагена с протектором, в результате которого могла бы про-
изойти инактивация химического мутагена.
Препарат F-37 в концентрации 0,001 мг/мл вводили за
30 мин до воздействия мутагенами, потом дважды отмывали
раствором Хенкса с последующей заменой среды с ФГА. Была
выбрана концентрация, при которой препарат F-37 существен-
но не влиял на частоту аберрантных клеток необлученной
культуры. Культивирование лимфоцитов периферической кро-
ви клинически здоровых доноров проводили обычным ме-
тодом.
Длительность культивирования составляла 54 ч. Колхицин
вводили в культуру за 3 ч до гипотонизации 0,95%-ным рас-
твором цитрата натрия и фиксировали смесью ледяной уксус-
ной кислоты и этилового спирта. Культуры обрабатывали му-
тагеном тиоТЭФ с одночасовой экспозицией в концентрации
10-4 М, при которой этот мутаген согласно литературным дан-
ным [451-453] вызывает достаточно высокий процент абер-
раций.
Облучение проводили на аппарате РУМ-17 (мощность дозы
2 • 10“2 А/кг, общая доза 0,026 Ки/кг) через 1, 20, 40, 46, 50 ч от
начала культивирования. При анализе хромосомных аберра-
ций учитывали одиночные и парные фрагменты, обмены хро-
мосомного и хроматидного типов.
ТиоТЭФ в концентрации fO-4 М индуцировал достаточно
высокий процёнт хромосомных перестроек на всех исследо-
ванных стадиях митотического цикла (табл. 9.1).,
Введение препарата F-37 в культуру лимфоцитов как
до воздействия химическим мутагеном, так и после не ока-
зывало влияния на частоту хромосомных аберраций, инду-
169
Таблица 9.1. Влияние F-37 на частоту хромосомных перестроек, индуцированных в культуре лимфоцитов
периферической крови человека облучением и химическим мутагеном тиоТЭФ
Показатель Способ воздействия
контроль F-37 облучение F-37 + облучение тиоТЭФ F-37 +тиоТЭФ тиоТЭФ+ F-37
Метафазы, количество Г 1600 1501 Кулыуры в в 900 озрасте 1 ч 850 982 725 787
Перестройки: число 17 21 360 71 627 451 472
% 1,1 + 0,26 1,3 + 0,29 40,0 + 1,63 8,3 ±0,94 63,8 ±1,53 62,2± 1,80 60,7 ±1,74
Метафазы, количество 1600 1500 Культуры в вв 716 зреете 20 ч 800 990 877 980
Перестройки: число 17 20 473 81 458 398 448
% 1,1±0;26 1,3 ±0,29 60,6 ±1,83 • 10,1 ±1,06 46,3 ±1,6 45,4 ±1,68 45,7 ±1,69
Метафазы, количество 1600 1501 Культуры ?в вс 810 зреете 40 ч 824 990 850 971
Перестройки: число 16 19 255 76 450 389 400
% 1,0 ±0,26 1,2 ±0,28 31,0±1,65 9,2 ±1,00 45,4 ±1,58 45,7 ±1,74 41,2 ±1,58
Метафазы, количество 1600 1501 (Сультуры в во 820 зреете 46 ч 800 987 877 950
Перестройки: число 17 21 638 282 468 401 421
% 1,1 + 0,26 1,3 ±0,29 78,0+1,44 35,2 ±1,65 46,4 ±1,58 45,4 ±1,68 44,2 ±1,61
Метафазы, количество 1600 1500 Культуры в во 800 зреете 50 ч 900 — — -
Перестройки: число 17 21 664 342 — - -
% 1,1 + 0,26 1,3 ±0,29 83,0 ±1,32 38,0 ±1,22 —• —
цированных тиоТЭФ (р < 0,1). Процент хромосомных аберра-
ций, индуцированных тиоТЭФ, на всех стадиях митотического
цикла при воздействии препарата F-37 оставался практически
без изменений. Одновременно под влиянием протектора F-37
наблюдалось резкое снижение частоты перестроек хромосом,
вызванных облучением на всех изученных стадиях митотиче-
ского цикла. Наибольший защитный эффект вещества получен
при введении его в культуру на 20-м ч от начала культивиро-
вания. Количество аберраций в этом варианте исследования
уменьшилось в 6 раз. В 5 раз снизилась частота хромосомных
перестроек в культуре лимфоцитов и на 1-м ч от начала куль-
тивирования при добавлении препарата F-37 (см. табл. 9.1).
Высокая степень защиты от перестроек, индуцированных об-
лучением, при полном отсутствии эффекта в случае воздей-
ствия химическим мутагеном является серьезным подтверж-
дением предполагаемого механизма радиозащитного действия
инденовых соединений, основанного на их способности вос-
принимать энергию с облученного субстрата.
9.3. Механизмы радиозащитного действия
меланина
Биологическая роль фенолов в организме растений
и животных, а также механизмы их биологического действия
описаны в ряде монографий [97, 272,454-456]. Рассмотрим те
из них, которые могут объяснить способность меланина умень-
шать мутагенное действие облучения.
Известно, что содержание фенольных соединений у горных
растений выше, чем у растений, произрастающих в долине
[457], и по сравнению с последними они обладают большей ра-
диоустойчивОстью [458, 459]. Например, при облучении в дозе
6 кР семян пленчатого ярового ячменя из низменной и горной
репродукции частота хромосомных аберраций у первых воз-
росла в 10 раз, тогда как у вторых она оставалась на уровне
контроля [459]. На существование прямой связи между радио-
устойчивостью и содержанием фенольных соединений в пре-
делах одного и того же вида растений указывается и в работе
[458]. Высокое содержание фенольных и токоферольных соеди-
нений у горных растений можно расценивать как ответную ре-
акцию растительного организма на постоянное воздействие
космических лучей и высокой радиоактивности горных пород.
У горных растений отмечено также повышенное содержание
аскорбиновой кислоты [460].
Была выдвинута и экспериментально проверена гипотеза о
возможном участии аутоантимутагенной системы в регуляции
171
темпов мутирования природных популяций [461, 462], Очевид-
но, что фенолы и витамины в этой системе взаимосвязаны:
1) практически во всех растительных источниках фенольные
соединения содержатся наряду с аскорбиновой кислотой; 2) в
тканях растений, растительных продуктах и в модельных рас-
творах они взаимозащищают друг друга от окисления; 3) по-
казан синергизм их биологических эффектов как в раститель-
ных, так и в животных тканях [266].
На участках, загрязненных радионуклидами 90Sr, в по-
пуляциях тысячелистника обнаружено увеличение числа ин-
тенсивно окрашенных форм [463]. Предполагается, что такие
пигментированные формы более радиоустойчивы и поэтому в
условиях хронического облучения отбор идет в их пользу.
Интересно, что на этих же участках наблюдалось и повышен-
ное количество пигментных мутаций у хлореллы [464].
Таким образом, можно сделать вывод, что фенольные со-
единения, и в частности меланин, созданы самой природой для
защиты организма от облучения.
Основной отличительной чертой меланина является его
полимерная структура, которая обеспечивает не только погло-
щение солнечного света в наиболее активной УФ области, но и
улавливание, стабилизацию и обезвреживание возникающих
при этом свободных радикалов. Этот процесс протекает в коже
животных и человека, где присутствие и новообразование ме-
ланина представляет собой защитную реакцию организма на
действие солнечного излучения, особенно ультрафиолетовой
его части. Сложная сетчатая структура молекул меланина де-
лает их идеальными „молекулярными ситами”, в ячейках ко-
торых и застревают активные осколки молекул, радикалы и
другие продукты фотолиза [97].
При облучении смеси меланина и яичного альбумина уста-
новлено, что пигмент принимает электроны от облученного
белка [465]. Адсорбционный спектр смеси этих веществ свиде-
тельствует о том, что интенсивность (высота) сигнала опреде-
ляется меланиновым пигментом, а его ширина - присутствием
альбумина. После облучения наблюдалось уменьшение мела-
ниновой части спектра, что свидетельствует о его переходе в
восстановленное состояние за счет адсорбции электронов с об-
лученного белка. Аналогичные данные получены при введе-
нии меланина растительного происхождения в неокрашенную
кожуру семян белой горчицы. Было зарегистрировано появле-
ние характерного сигнала ЭПР, который тоже уменьшался по-
сле облучения [466].
Ионизирующая радиация наряду с ультрафиолетовым из-
лучением является причиной возникновения свободных ради-
172
калов, в том числе и в биологических системах. Способность
меланина улавливать, стабилизировать и инактивировать воз-
никающие при этом свободные радикалы является одним из
основных механизмов его радиозащитного действия. В работе
[467] показано существование корреляции между содержани-
ем меланина и концентрацией парамагнитных частиц в клетке
и предположено, что защитные свойства меланина обусловле-
ны его полимерной структурой и способностью накапливать в
полимерных ячейках большое количество неспаренных элект-
ронов - ПЦ.
После у-облучения в дозах 300-600 Гр образцов белой ба-
раньей шерсти, а также белой шерсти с добавлением мелани-
новых гранул, выделенных из чернил осьминога, и коричневой
шерсти наблюдалось соответствующее увеличение количества
ПЦ во всех вариантах опыта [468]. Увеличение дозы у-облуче-
ния от 600 до 1000 Гр не влияло на количество образования
ПЦ. Характерно, что через 30 мин после облучения количество
свободных радикалов в белой шерсти увеличивалось в 12-15,
а иногда в 40 раз; в белой шерсти с добавлением меланина - в
3-3,5 раза и в коричневой - в 1,2-2,2 раза. Авторы предпола-
гают, что в меланиновых гранулах происходили захват и ре-
комбинация индуцированных ионизирующими излучениями
рАдикалов и мигрирующих возбужденных состоянии.
Подробное исследование механизмов радиозащитного дей-
ствия меланина у грибов проведено в работе [469]. Об участии
меланиновых пигментов в радиоустойчиврсти исследованных
грибов судили по существованию прямой корреляционной за-
висимости этого признака от концентрации ПЦ меланина. Эта
зависимость наблюдалась при сравнении таксономически раз-
личных темнопигментированных гифомицетов, штаммов С. da-
dos porioides и его цветных мутантов, радиоустойчивость и кон-
центрация ПЦ которых уменьшались с уменьшением их пиг-
ментации, а также при сравнении радиоустойчивости конидий
С. dados porioides разного возраста с накоплением пигмента в
клеточных стенках.
, Исследовались также процессы пострадиационного восста-
новления у мутантов грибов с разным содержанием пигмента.
Показано, что характер и уровень пострадиационного восста-
новления мутантов были сходными [469]. Соответствующие
кривые восстановления были идентичны между собой по ха-
рактеру, выходу кривой восстановления на плато и макси-
мально достигнутому уровню выживаемости после одноразо-
вого и фракционированного облучения. Таким образом, кони-
дии изученных штаммов грибов оказались в одинаковой мере
способными к восстановлению от радиационных поражений,
173
однако эти культуры существенно различались радиоустойчи-
востью и концентрацией ПЦ их меланиновых пигментов. Это
обстоятельство служит подтверждением гипотезы электронно-
акцепторного механизма защитного действия меланинового
пигмейта, впервые высказанной в работе [470] и впоследствии
расширенной в [471] и др.
Согласно этой гипотезе защитное действие меланина свя-
зывается с адсорбцией образовавшихся в клетке вторичных
электронов, что сопровождается уменьшением сигнала ЭПР,
т. е. чем выше у пигмента способность к восстановлению, тем
эффективнее защита от ионизирующих излучений.
Меланин является, в сущности, стабильным свободным ра-
дикалом, так как в ячейках его сетчатой структуры фиксиро-
ваны и длительно сохраняются свободнорадикальные группи-
ровки [272]. Обладая свойствами стабильного свободного ра-
дикала, меланин способен вступать в реакции образования
комплекса с переносом заряда и играет при этом роль акцеп-
тора электронов. Ряд авторов [472-474] полагают, что именно
эти свойства объясняют низкую чувствительность самого ме-
ланина к воздействию ионизирующей радиации. По мнению ав-
торов работы [475], такие реакции могут служить механизмом
защиты клеток от свободных радикалов, возникающих под
действием излучения.
Показано, что меланин создает буферную систему для из-
быточной энергии клеток, распределяя ее малыми дозами.
Квант энергии, попадая на молекулу мишени, мигрирует по
~ ~ изируется молекуДой МёЛАнййа. Поскольку
промежуточные метаболиты меланинового обмена благодаря
свободнорадикальному состоянию могут окисляться и восста-
навливаться, образующиеся бесконечные молекулы меланина
срабатывают как электронно-обменный полимер, который, при-,
няв на себя радиационный удар, распыляет его по всей моле-
куле, перераспределяя ее электронный заряд (одновременно
этот полимер является и донором электронов для других си-
стем) [331]
Благодаря наличию гидроксильных групп и особенностям
электронной структуры бензольного кольца фенолы имеют
склонность к легкой отдаче электронов. Они могут легко и об-
ратимо окисляться, отдавая электроны и ядра водорода и вы-
ступая тем самым в роли восстановителей, антиоксидантов.
Фенольное соединение постепенно расходует свои электроны и
протоны, превращаясь в хинон и защищая от окисления сосед-
нее вещество [272]. И только после того, как ресурсы фенола
исчерпаны, начинается окисление соседних молекул.
В работах [476, 477] исследован механизм радиозащитного
174
действия пигментов антоцианов, которые можно считать ана-
логами меланинов в силу того, что они образуются в растени-
ях под действием УФ излучения (своеобразный „загар” расте-
ний) и так же, как меланины, служат для защиты растительных
клеток от облучения. Показано, что антоцианы могут суще-
ствовать в окисленной и восстановленной формах и выпол-
нять функцию переносчиков водородатв окислительно-восста-
новительных реакциях, влияя на ход мутагенеза.
В тканях животных при у-облучении накапливаются ве-
щества полифенольно-хиноидной природы, которые способны
восстанавливать цитохром С [478]. Причем такой способностью
обладает как необлученный, так и у-облученный 3-4-диокси-
фенилаланин (ДОФА).
Интересно, что синтез меланина в клетке стимулируется
цАМФ [479], а ведь именно аденил-циклазной системе, по гипо-
тезе Лангендорффов [422],принадлежит ведущая роль в осуще-
ствлении радиозащитного действия химических веществ.
Согласно этой гипотезе механизм действия радиопротек-
торов самой различной химической природы сводится к сти-
мулированию реакций, повышающих в клетке уровень цАМФ,
которым обычно отводится роль регуляторов метаболических
процессов. И если цАМФ запускает синтез меланина, то, оче-
видно, меланин является одним из необходимых звеньев ра-
диозащитной системы клеток.
Подробное исследование механизмов радиопротекторного
действия фенолов позволило сделать неожиданные выводы
[272]: в условиях организма действуют не фенолы сами по себе,
а окислительно-восстановительная система фенол - семихи-
нон - хинон, компоненты которой постоянно переходят друг
в друга.
Действительно, синтез меланина в клетке идет через обра-
зование ряда сильно реактивных промежуточных продуктов.
Начинается он с окисления тирозина в ДОФА и затем в ДОФА-
хинон. Через ряд последовательных этапов образуется индол-
5,6-хинон, который, полимеризуясь и присоединяя молекулу
белка, превращается в меланин [475]. Под влиянием ионизиру-
ющей радиации в организме резко усиливаются окислитель-
ные процессы. Нейтрализуют свободнорадикальные реакции
окисления не только нейтральные молекулы фенола, но и се-
михинонные радикалы. При этом вместо двух радикалов, вза-
имно нейтрализующих друг друга, возникает нейтральная мо-
лекула - продукт сшивки радикала с фенолом. Семихинонных
радикалов несравненно меньше, чем исходных молекул вос-
становленного фенола, но они химически более реактивны и
по мере расходования возникают вновь за счет реакции между
175
фенолом и соответствующим хиноном. Согласно „семихинон-
ной гипотезе” Барабоя радиозащитные свойства - это свойства
не фенолов или хинона, а промежуточного нестойкого продук-
та, возникающего при переходе их друг в друга [272].
Показано, что фенолы эффективно взаимодействуют с азо-
тистыми основаниями ДНК и РНК [272,290], поэтому в качестве
одного Из механизмов генетического эффекта фенольных со-
единений предполагается их взаимодействие с функциональ-
ными группами ДНК, которое может или экранировать важные
участки ДНК от действия мутагена, или отводить избыточную
энергию [292]. В обоих случаях предотвращается образование
мутаций на самых ранних этапах, что может объяснить сниже-
ние под действием меланина выхода точковых мутаций.
В то же время фенольные соединения способны образовы-
вать непрочные временные связи с тиоловыми группами бел-
ков, защищая их бт необратимой окислительной инактивации
в условиях лучевого воздействия. В тканях человека, напри-
мер, более двух десятков ферментных систем содержат тио-
ловые группы.
Многогранность биологической активности фенолов поз-
воляет предположить их влияние (возможно, опосредованное)
и на репарационные процессы в клетке. Одним из методов про-
верки этого предположения является изучение способности
фенолов (в частности, меланина) снижать мутагенное действие
химических веществ. Такое исследование было нами прове-
дено на мышах.
9.4. Экспериментальное изучение механизмов
антимутагенного действия меланина
При исследовании резистентности популяций дро-
зофилы к химическому мутагену ЭМС нами обнаружено, что
популяции М и МО, получавшие с пищей меланин, намного
чувствительнее к этому мутагену, чем к облучению. Возникло
предположение, что меланин не только препятствует адапта-
ции популяций к повреждающим факторам, но и сам по себе,
как и индены, не защищает дрозофил от химических мутаге-
нов. Поэтому исследование влияния меланина на мутагенный
эффект ЭМС было предпринято для того, чтобы: 1) объяснить
более высокую чувствительность популяций дрозофилы М и
МО к химическому мутагену, чем к облучению; 2) проверить
возможную связь радиозащитного действия меланина с его
способностью влиять на репарационные процессы в клетке.
Конечно, это исследование не могло бы дать окончатель-
ный ответ на вопрос, опосредована ли антимутагенная актив-
176
ность меланина через системы репарации, но если бы оказа-
лось, что меланин защищает наследственные структуры от му-
тагенного эффекта ЭМС, то, безусловно, пришлось бы отказать-
ся от объяснения протекторного действия меланина отводом
энергии с облученной ДНК и признать возможным его участие
в стимуляции репарационных систем.
Исследование проведено на мышах линии СЗН в возрасте
2-2,5 мес. ЭМС, растворенный в дистиллированной воде, инъе-
цировали самцам в концентрации 240 мг/кг. Меланин вводили
в дозе 50 мг/кг за 30 мин до воздействия ЭМС.
Одновременно* для сравнения проверяли влияние мела-
нина на генетический эффект облучения. Самцов той же линии
и того же возраста облучали рентгеновским излучением в дозе
0,08 Кл/кг (мощность дозы 1,3 • 10-4 А/кг), меланин в той же
концентрации инъецировали за 30 мин до облучения.
Исследовали частоту реципрокных транслокаций, возник-
ших под действием облучения или ЭМС в сперматоцитах жи-
вотных (табл. 9.2). Как видно из таблицы, меланин достоверно
(Р = 0,99) снижает выход перестроек, индуцированных рентге-
' невским излучением (с 3,3 ±0,2 до 1,8+0,2 %), но практически
не изменяет частоту аберраций, вызванных ЭМС.
Если бы меланин стимулировал функционирование репа-
рационных систем, то, вероятнее всего, он защищал бы наслед-
ственные структуры от воздействия не только облучения, но и
химических мутагенов, как это имеет место для большинства
радиопротекторов. Отсутствие защитного влияния меланина
на генетический эффект ЭМС позволяет усомниться в его спо-
собности влиять на процессы репарации в клетке.
Полученные данные позволяют объяснить повышенную
чувствительность популяций дрозофилы, обрабатываемых на
протяжении многих поколений меланином, к мутагенному
действию ЭМС по сравнению с контрольными и облучавшими-
ся популяциями: меланин, защищая популяции от радиацион-
ных воздействий, а возможно, и от резких температурных ко-
лебаний, голода и т. п., способствует сохранению и размноже-
нию в популяциях менее жизнеспособных, менее устойчивых
особей. Поэтому популяции М менее резистентны к воздей-
ствию ЭМС, чем контрольные, а популяции МО - менее резис-
тентны, чем облучавшиеся. В то же время популяции МО более
устойчивы, чем популяции М, так как популяции МО все же
подвергались постоянному облучению и некоторый отбор ре-
зистентных генотипов в них шел, поскольку меланин лишь
частично защищает популяции от облучения.
По той же причине популяции М и МО более чувствитель-
ны к воздействию ЭМС, чем к дополнительному облучению:
177
несмотря на более слабую адаптацию этих популяций к повре-
ждающим факторам, меланин частично защищает их от допол-
нительного облучения, но не защищает от воздействия хими-
ческого мутагена.
Рассмотренные механизмы радиозащитного действия ме-
ланина позволяют объяснить снижение мутационного процес-
са, показанное в наших опытах на дрозофиле и мышах, на ор-
ганизменном и популяционном уровнях. Однако как объяс-
нить. повышение плодовитости и жизнеспособности особей в
необлученных популяциях? В литературе имеются сведения о
том, что вследствие нарушения процессов меланинообразова-
ния снижаются жизнеспособность, плодовитость и некоторые
Другие хозяйственно ценные качества животных [331]. Отмеча-
ется также, что фенолы, имеющие стероидную форму, обладают
свойствами эстрогенных гормонов и оказывают влияние на
рост и размножение животных [455]. Широкий диапазон прояв-
ления активности фенолов и их функциональная взаимосвязь
с аскорбиновой кислотой свидетельствуют о непосредствен-
ном участии этих соединений в процессах обмена веществ,
причем многие биологические эффекты фенолов (например,
витаминов Р) обусловлены стабилизацией аскорбиновой кис-
лоты, ее защитой от окисления [455]. На „витаминное действие”
фенолов, повышающее сопротивляемость организма до како-
го-то оптимального уровня, указывается в работе [272]. Отме-
чено также участие меланиновых пигментов в приспособляе-
мости, клеточной и эмбриональной дифференцировке, гормо-
нальной индукции, механике развития и т. д. [331]. В ряде ра-
бот подчеркиваются синергизм и функциональная взаимо-
связь витаминов Р (фенолов) и С [455, 480]. Это указывает на
важную биологическую роль фенолов в организме и на много-
гранность их эффектов, к наиболее важным из них автор ра-
боты [272] относит воздействие фенолов на нуклеиновые кис-
лоты и функции генетического аппарата.
Подытоживая обсуждение механизмов действия меланина,
следует подчеркнуть его высокую электронно-донорную и ан-
тиоксидантную активность, его связь с цАМФ и способность
защищать от инактивации тиольные группы ферментов, что
свидетельствует о важном месте меланина в радиозащитной
системе клетки.
Кроме того, меланин влияет на плодовитость и жизнеспо-
собность животных, обмен веществ, гормональную регуляцию
и клеточную дифференцировку, чем и объясняется широкое
распространение меланиновых пигментов в органическом
мире.
Интересно, что меланиновые пигменты грибов участвуют в
178
Таблица 9.2. Влияние меланива на выход реципрокных транслокаций,
индуцированных рентгеновским излучением и ЭМС в сперматоцитах мышей
Способ воздействия Число . Транслокации
семенников метафаз число % t
ЭМС 6 716 39 5,56 0,35
Меланин + ЭМС 6 833 39 4,71 0,14
Облучение 6 969 31 3,27 0,22
Меланин + облучение 8 1378 24 1,83 0,21 4,7
адсорбции ионов тяжелых металлов [481-483]. Биологическая
ценность этого явления несомненна. Связывая ионы тяжелых
металлов на поверхности клеточной стенки, меланин тем са-
мым не допускает их проникновения внутрь клетки. Установ-
лено, что 1 г сухой биомассы гриба Rhizopusarrhizus адсорби-
рует 180 и 160 мг урана и тория соответственно [484,485].
При исследовании 151 штамма Pyrenophora avenae была
установлена прямая зависимость между степенью пигмента-
ции этих грибов и их устойчивостью к повышенным концентра-
циям ионов ртути [486]..
Механизмам адсорбции ионов тория и урана биомассой
гриба Rhizopus arrhizus посвящены работы [487-489]. Деталь-
ное изучение процесса позволило предположить, а затем в экс-
перименте подтвердить многоступенчатость процесса адсорб-
ции Th2+. Этот процесс происходит в два этапа: а) адсорбция
ионов на хитине с образованием комплекса между металлом и
NH-радикалами клеточного хитина и б) образование гидроли-
затов тория и осаждение их на внешнюю часть грибной клеточ-
ной стенки. При этом если свободные радикалы 1 г хитина мо-
гут связывать только 8 мг тория, то количество гидролизато-
ров составляет 160 мг, обеспечивая 95 % адсорбции металла на
грибную биомассу.
Такая же многоступенчатость обнаружена при взаимодей-
ствии биомассы этого гриба с ионами урана.
Подробный анализ роли меланиновых пигментов в экстре-
мальных условиях жизни проведен в работе [469]. Биологиче-
ские функции меланиновых пигментов животного и грибного
происхождения, эволюционно удаленных друг от друга, реали-
зуются у грибов и высокоорганизованных животных практиче-
ски в одинаковой степени, несмотря на разную химическую
структуру меланинов (табл. 9.3). По мнению авторов, это обсто-
ятельство может свидетельствовать о древнейшем проис-
хождении меланина и высокой стабильности не только хими-
179
Таблица 9.3. Биологические функции меланиновых пигментов [469]
Животные меланины — гетерогенные Грибные меланины — гетерогенные
биополимеры на основе 5,6-индолхинона биополимеры полипептидной природы
Участвуют в защите кожных по-
кровов от излишнего светового и УФ
излучения, в функционировании ор-
ганов слуха, зрения, некоторых от-
делов головного мозга за счет транс-
формации’фотонов и фононов (звук),
электронов по одноквантовому ме-
ханизму
Участвуют в устойчивости организ-
мов к ионизирующему излучению,
осуществляют ковалентную модифи-
кацию, хранение и реализацию кле-
точной энергии за счет донорно-ак-
цепторных свойств меланина
Связывают разнообразные веще-
ства ароматической природы, ионы
тяжелых металлов» радиоактивные
элементы, что предполагает возмож-
ную регуляцию пигментом активно-
сти ряда ферментов и пептидов за
счет ионообменных свойств пигмента
Пигмент исключительно стабилен
in vivo и in vitro, в естественных ус-
ловиях лизису практически не под-
дается
Участвуют в УФ- и светоустойчи-
вости, выживаемости при продолжи-
тельном голодании грибов, усвоении
углерода из СО2 воздуха и NaHCO3.
Пигмент сорбирует фотоны по одно-
квантовому механизму в диапазоне
200—900 нм. Предложен механизм
взаимодействия пигмента со свето-
выми квантами
Участвуют в устойчивости грибов
к ионизирующему излучению, повы-
шенной сухости воздуха и субстрата,
недостатку кислорода в окружающей
среде за счет донорно-акцепторных
свойств пигмента
Сорбируют ионы РЪ2+, Th4+, La2*,
Zn2+, Сгб\ Hg2+, Си2*. Являются силь-
ными антиоксидантами и связывают
нестабильные состояния, синглетный
кислород, коротко живущие ради-
калы
Пигмент практически не лизиру-
ется при длительном культивирова-
нии в лабораторных условиях. Уча-
ствует в процессах гумусообразования
ческой структуры пигмента, но и его биологической функции
[469].
В ряде работ показано, что на участках, загрязненных ра-
дионуклидами, наблюдается увеличение числа интенсивно
пигментированных форм в популяциях низших и высших рас-
тений [463,464]. Установлено, что по мере развития индустриа-
лизации возрастает доля черных доминантных форм в популя-
циях насекомых, обитающих в крупных городах [488]. Это яв-
ление получило название „индустриальный меланизм”, кото-
рое употребляется в случае преимущественного распростране-
ния темноокрашенных особей животного и грибного царства
в сильно загрязненных промышленными отходами регионах.
В качестве одного из первых примеров такого рода следует
упомянуть преимущественное распространение темноокрашен-
ных божьих коровок Adalia bipunctata в районе Бирмингема,
березовых пядениц в промышленных районах Англии [489,
180
490]. Так как количество пигментированных форм божьих
коровок возрастало с увеличением содержания смога в возду-
хе, Грид [490] предположил, что меланин, находящийся в ку-
тикуле насекомого, вступает в реакцию с компонентами смога,
защищая тем самым организм от токсических веществ, нахо-
дящихся в промышленной пыли. Возрастание доли черных до-
минантных форм в популяциях божьих коровок наблюдается
и в крупных промышленных городах Советского Союза [488].
Распространение „индустриального меланизма”, по мне-
нию Берри [379], может быть мерой биологического эффекта за-
грязнения воздуха.
Способность экзогенного меланина снижать генетический
эффект облучения у животных на организменном и популяци-
онном уровнях свидетельствует о важной роли этого пигмента.
Тот факт, что антимутаген (в частности, меланин) препят-
ствует адаптации популяций к повреждающим факторам, яв-
ляется хорошим доказательством его защитного действия. Ис-
пользование меланина в популяциях дрозофилы можно срав-
нить с применением медицины у человека - в обоих случаях
резко снижаетсяГроль "естественного отбора, что позволяет вы-
живать и оставлять потомство менее жизнеспособным особям.
ОднЯагни узкого не вознйкает сомнений в целесообразности
использования медицинских мероприятий, и это абсолютно
справедливо. Необходимо защищать популяции живых орга-
низмов от Вредных воздействий, а не ждать, пока они адапти-
руются к этим неблагоприятным факторам. В тех случаях, ког-
да такая адаптация возможна, она возникает через десятки
поколений и сопровождается гибелью большого количества
особей. Поэтому показанная на примере меланина способность
антимутагенов благоприятно влиять на приспособленность и
мутационный процесс в популяциях представляет несомнен-
ный интерес.
ЛИТЕРАТУРА
1. Шальное М. И. Радиобиологические эффекты, связанные с повреждением
нуклеиновых кислот // Первичные радиобиологические процессы. М., 1973.
С. 275-322.
2. Шальное М. И. Структурно-функциональная организация хромосомы 'и
роль радиационных повреждений ее ДНК // Современные проблемы радиобио-
логии. М., 1972. С. 155-219.
3. Шариатый В. А. Первичные механизмы лучевого поражения биологиче-
ски важных макромолекул: ДНК, белка, ДНП, полисахаридов: Автореф. дис....
д-ра биол. наук. Черноголовка, 1972. 43 с.
4. Шафрановская Н. И., Трифонов Э. И., Лазуркин Е. С. и др. Дальняя ми-
грация энергии электронного возбуждения по молекуле ДНК // Письма в ЖЭТФ.
1972. Т. 15. № 7. С. 404—406.
5. Gregoli S„ Bertinchamps A. Free radical distribution in gamma-irradiated DNA
//. Int. J. Rad. Biol. 1972. Vol. 21. N 1. P. 65-72.
6. Моссэ И. Б. Проблема химической защиты в радиационной генетике. Мн.,
1974. 152 с.
7. Lefevre G. J. Sterility, chromosome breakages, X-ray-induced mutation rates
and detected mutation frequencies in Dros. mel. // Genetics. 1967. Vol. 55. N 2.
P. 263-268.
8. Ives P. T. Patterns of spontaneous and radiation induced mutation rates during
spermatogenesis in Drosophila melanogaster // Genetics. 1963. Vol. 48. N 8. P. 981-982.
9. Inagaki E., Miyamoto T., Damato T. The relationship between radiation expo-
sure and mutation rate at the dumpy locus in Drosophila // Jap. J. Genet. 1974. Vol. 49.
P. 333-378.
10. Inagaki E., Uchibori M., Miyamoto T. e. a. The frequency pattern of the dum-
py mutations induced by X-rays in different stages of spermatogenesis of Drosophila //
Jap. J. Genet. 1977. Vol. 52. P. 207-216.
11. Miyamoto T., Ikebuchi M., Terahishi J. The brood pattern of X-ray-induced
dumpy mutations in males of a wild type strain of Drosophila melanogaster // Jap. I.
Genet. 1981. Vol. 56. N 3. P. 301-308.
12. Fujikawa K. Relative sensitivity of mature Drosophila oocytes to the induction
of dumpy mutations by X-rays // Jap. J. Genet. 1980. Vol. 55. N 5. P. 409—413.
13. Miyamoto T., Nakao J. The frequency pattern of dumpy mutations induced by
X-rays in the successive stages of oocytes of Drosophila // Jap. J. Genet. 1978. Vol. 53.
N 3. P. 175-181.
14. Valencia R. M., Valencia 1.1. Induction of visible mutations in Drosophila
females // Rad. Res. 1961. Vol. 14. P. 513-517.
15. Александров И. Д. Сравнительная кинетика генных мутаций и аберраций
хромосом при облучении разных фаз спермиогенеза у Drosophila melanogaster //
Молекулярные механизмы генетических процессов. М., 1976. С. 68—75.
16. Ауэрбах Ш. Проблемы мутагенеза. М., 1978. 458 с.
182
17. Binz P., Buechi C., Cordt I. e. a. Cytogenetic and lethality tests in larvae of
DNA-repair deficient and proficient stains of Dr. mel. // lahresberr. Newslett. 1981.
P. 112.
18. Sobels FJi. Repair and differential radiosensitivity in developping germ cells
of Drosophila males // Repair from Genetie Radiation Damage. Oxf.; L; N. Y.; Paris,
1963. P. 179-185.
19. Miyamoto T. Dumpy mutations following X-irradiation of Drosophila melano-
gaster mature sperm in oxygen or in nitrogen // Genetics. 1982. Vol. 102. N 4. P. 783—794.
20. Ferro W. Studies on mutagen-sensitive strains of Drosophila melanogaster Ц
Mutat. Res. 1983. Vol. 107. NLP. 79-92.
21. Inagakl E., Sobels F. H. Post-radiation repair of specific loci in Drosophila sper-
matids // Mutat. Res. 1972. Vol. 15. N 2. P. 229-232.
22. Fujikawa K. Pilot experiments involving visible mutations induced in im-
mature Drosophila oocytes by X-rays at low dose rate // DIS. 1981. Vol. 56. P. 39-40.
23. Fujikawa K., Inagaki E. Mutagenic effectiveness of 14 Mev neutrons and
200 kv X-rays at the dumpy complex locus of Dros. mel. // Mutat. Res. 1979. Vol. 63,
P. 139-146.
24. Александров И. Д. Разная для генных и структурных мутаций ОГЭ про:
межуточных (Б_ = 0,35 МэВ) нейтронов при облучении спермиев Drosophila //
ДАН СССР. 1984. Т. 275. И» 275. С. 483-486.
25. Бондаренко Л. В., Ромашкина Т. Б., Шварцман Л. Я. Изучение скорости
рекомбинации и мутагенеза в половых и соматических клетках мутагенчувстви-
тельных линий дрозофилы при действии химических мутагенов // IV съезд
ВОГиС: Tes. докл., Кшпинев, 1-5 февр. 1982. Кишинев, 1982. Ч. 1. С. 36.
26. O'Neill Р. J. Induction and expression of mutations in mammalian cells in the
absence of DNA synthesis and cell division // Mutat. Res. 1982. Vol. 106. N1. P.113-122.
27. Stetka D. G., Bleicher W. T., Brewen J. G. SCE - inducing DNA lesions are
repaired by CHO cells, while potentially mutagenic lesions are not // Environ. Muta-
gpnes. 1982. Vol. 4. N 3. P. 346.
28. Miyamoto T. у-Rayinduced mutations in male germ cells of a recombination-
defective strain (c3G) of Drosophila melanogaster // Mutat. Res. 1983. Vol. 120. N 1.
P. 27-36.
29. Rutledge J. C., Cain К. T., Hughes L. A. e. a. Difference between two hybrid
stocks of mice in the incidence of congenital abnormalities following X-ray exposure of
stem-cell spermatogonia // Mutat. Res. 1986. Vol. 163. N 3. P. 299-302.
30. Bishop J. B., Kodell R. L., Domon О. E. Differential response in mouse domi-
nant lethal tests as a function of the strain of female and/or male used // Euviton.
Mutagenes. 1981. Vol. 3. N 3. P. 374.
. 31. Miyashita N., Migita S., Moriwaki K. Effects of H-2 complex and uon-H-2
background on urethane-indnced chromosomal aberrations in mice // Mutat. Res. 1987.
Vol. 176. N 1. P. 59- 67.
32. Fujiwara Y, Comparative studies on replicative bypass repair of UV damage
to DNA various lines of mammalian cells // Mutat. Res. 1977. Vol. 46. P. 119-120.
33. Lohman P. H. M., Paterson M. C., Zelle B., Reynolds R. J. DNA repair in
Chinese hamster cells after Irradiation with UV // Mutat. Res. 1977. Vol. 46. P. 138-139.
34. Петин В. Г. Связь между радиочувствительностью, радиозащитой и вос-
становлением у диких и радиочувствительных штаммов дрожжей // XIV МГК.
Секц. заседания: Tes. докл. Ч. 1. М., 1978. С. 211.
35. Накаи С., Матида И., Саэки Т. Генетическое исследование путей реком-
бинации, контролируемых генами дрожжей, обусловливающих чувствитель-
ность к радиации // XIV МГК. Секц. заседания: Tes. докл. Ч. 1. М., 1978. С. 211.
36. Waller Н., Waller М. Interindividual, ago dependent and ploidy dependent
differences in chromosome damages of human fibroblasts after treatment with N-me-
thyl-N-nitrosourea (MNU) // Eur. J. Cell Biol. Suppl. 1986. Vol. 42. N 15. P. 34.
37. Buul P. P.,W. van, Boer de P., Zwanenburg S. e. a. Comparison of the chromo-
somal radiosensitivity of blood lymphocytes and stemcell spermatogonia in the Rhesus
monkey and the mouse // Mutat. Res. 1980. Vol. 73. N 1. P. 221—226.
183
38. Cattanach В. M., Kirk М. J. Enhanced spermatogonia stem cell killing and
reduced translocation yield from X-irradiated 101/H mice // Mutat, Res. 1978. Vol. 176.
N 1. P. 69-79.
39. Madle E., Korte А., Веек B. Species differences in mutagenicity testing. П. Sis-
ter-chromatid exchange and micronucleus induction in rats, mice and Chinese hamsters
treated with cyclophosphamide // Mutagenesis. 1986. Vol. 1. N 6. P. 419-422.
40. Домарева О. П., Дмитриева T. И. Изучение радиочувствительности по-
ловых и соматических клеток мышей разных линий // Радиобиология. 1973.
Т. 13. № 1. С. 61-65.
41. Buul Р. Р. W. van, Comparison of frequencies of radiation-induced stable
chromosomal aberrations in somatic and germ tissues of the mouse // Mutat. Res. 1973.
Vol. 20. N 3. P. 369-376.
42. В re wen J. G., Preston R. J. Chromosomal interchanges induced by radiation in
spermatogonia! cells and leukocytes of mouse and Chinese hamster // Nature. New
Biol. 1973. Vol. 244. N 134. P. 111-113.
43. Margison S. P., Margison J. M., Montesano R. Methylated purins in the deoxy-
ribonucleic acid of various syrian-goldenhamster tissues after administration of a
hepatocarcinogenic dose of dimethylnitrosamine // Biochem. J. 1976. Vol. 157.
P. 627-636.
44. Pacchierotti F, Quaggia S., Russo A. Ageing effects on numerical and struc-
tural chromosome aberrations in mouse germ cells // Atti Assoc, genet, ital. 1984.
Vol. 30. P. 165.
45. Searle A. G., Beechev С. V. The influence of mating status and age on the
induction of chromosome aberrations and dominant lethals in irradiated female mice //
Mutat. Res. 1985. Vol. 147. N 6. P. 357-362.
46. Виленчик M. M., Хохлов A. H., Аксютина M". С., Обухова Л. К. и dp. Воз-
растные изменения способности культивируемых клеток человека и репарации
ДНК // Повреждение и репарация ДНК. Пущино, 1980. С. 56—67.
47. Harper В. L., Legator M.S. Gender and age difference in the micronucleum
test with benzene and cyclophosphamide // Environ. Mutagenes. 1987. Vol. 9. Suppl. 8.
P. 46.
48. Lohman P. H. M., Vijg J., Uitterlinden A. G. e. a. DNA methods for detecting
and analyzing mutations in vivo 11 Mutat. Res. 1987. Vol. 181. N 2. P. 227-234.
49. Guzman J. R., Cortinas de Nava C., Olvera R. 0. e. a. Radiation effect on the
Drosophila melanogaster genetic material // Environ. Mutagenes. 1987. Vol. 9. Suppl. 8.
P.43.
50. Ватти К. В. Сравнительный анализ' мутационного процесса у особей раз-
ного пола дрозофилы И 14 ежегод. конф. Европ. о-ва по мутагенам внеш, среды,
Москва, 11-14 сент. 1984. М., 1984. С. 546-547.
51. Okada S., Ono Т. Comparison of radiosensitivities of DNA molecules in situ in
spermatogonium, spermatid- and spermatozoon-rich populations of mouse testis in situ
// Mutat. Res. 1977. Vol. 46. P. 145.
52. Luchnik N. V., Morosov K. N., Fesenko E. V. Does repair of stage sensitivity
determine the shape of time-effect curves in radiation mutagenesis? // Mutat. Res.
1975. Vol. 28. N 2. P. 199-210.
53. Ганасси E. Э. Радиационное повреждение и репарация хромосом. М., 1976.
103 с.
54. Заичкина С. И., Егиазарян С. Е., Аптикаева Г. Ф. и др. Радиочувствитель-
ность фаз клеточного цикла Crepis capillaris И Клеточный цикл растений: Мате-
риалы I Всесоюз. совещ., Канев, сент. 1981. Киев, 1983. С. 168—174.
55. Gaulden М. Е., Weber N. В., Seibert G. В. Comparative radiosensitivity of
neuroblasts of two species of grasshoppers having 2- and 4-cell cycle times (38 °C):
relation of mitotic inhibition to observed chromosome aberration frequency // Environ.
Mutagenes. 1984. Vol. 6. N 3. P. 441.
56. Померанцева M. Д. Закономерности мутационного процесса, индуциро-
ванного хроническим воздействием а- и у-излучения у самцов мыши 1/5 съезд
184
ВОГиС, Москва, 24—28 нояб. 1978. Т. 1. Общая и молекулярная генетика: Тез.
докл. М., 1987. С. 219.
57. Тихомирова М. М. Связь дифференциальной чувствительности различ-
ных стадий оогенеза дрозофилы с процессами репарации ДНК Ц Генетика. 1984.
Т. 20. № 12. С. 1981-1985.
58. Wolff Arutyunyan R. The apparent decrease in thiotepa-induced chromo-
some aberrations in human lymphocytes caused by an effect of WR2721 on the cell
cycle as found by the definitively determined division method // Environ. Mutagenes.
1979. Vol. 1. N 1. P. 5-13.
59. VolffS., Luippold H. Mitotic delay and the apparent synergism of far-red
radiation and X-rays in the production of chromosomal aberrations // Photochem.
Photobiol. 1965. N 4. P. 439-445.
60. Козлов А. А., Туманишвили Г. Д. О возможных искажениях результатов
в авторадиографических исследованиях И Изв. АН ГрузССР. Сер. биол. 1980.
Т. 6. № 3. С. 277-279.
61. Филиппович И. В., Сорокина Н. И., Солдатенков В. А., Романцев Е. Ф.
Надежность систем репарации ДНК и интерфазная гибель клеток // Науч, совет
по пробл. радиобиологии. 1983. № 27. С. 34—35.
62. Israelewski N. The relation of radiation sensitivity to pronuclear chromosome
structure. II. Differences in radiation sensitivity between two stocks f Phryne cincta
characterized by low or high crossing-over frequency // Chromosome. 1979. Vol. 70.
N 2. P. 263-276.
63. Caspersson T., Haglung U., Lindel B., Zech L. Radiation-induced non-random
chromosome breakage // Exp. Cell Res. 1972. Vol. 75. N 2. P. 541-543.
64. Hayata I., Dutrillaux B. Non-random envolvement of rat and mouse chromo-
somes in the stable type chromosomal rearrangements observed in irradiated bone
marrow cells // Proc. Jap. Acad. 1985. B61. N 5. P. 180—182.
65. Горин А. И., Ермаков А. В., Спитковский Д. M. Выявление пострепара-
ционных повреждений ДНК и неравномерность их распределения во фракциях
метафазных хромосом, различающихся по размеру // Бюл. эксперим. биологии
и медицины. 1986. Т. 101. № 9. С. 279—281.
66. Прокофъева-Белъговская А. А. Строение хромосомы И Ионизирующие
излучения и наследственность. М., 1960. С. 7.
67. Прокофьева-Бельговская А. А. Репродукция хромосом И Успехи совре-
менной генетики. М., 1971. Т. 3. С. 80.
68. Kodani М. The structure of the salivary gland chromosomes of Drosophila
melanogaster. I. The eu- and heterochromatin // J. Heredity. 1941. Vol. 32. N 5. P. 147.
69. Христолюбова H. Б. Контролируемое изменение физиологической актив-
ности определенных участков гигантских хромосом слюнных желез дрозофилы
в результате воздействия версеном // ДАН СССР. 1961. Т. 138. № 3. С. 681.
70. Елисеева К. Г., Моссз И. Б., Рокицкий П. Ф. Цитологический анализ де-
талей, возникших на разных стадиях сперматогенеза дрозофилы в условиях сов-
местного действия рентгеновского излучения и инденового препарата F-11 И
Весщ АН БССР. Сер. б!ял. навук. 1973. N® 2. С. 37.
71. Прокофьева-Белъговская А. А. Гетерохроматические районы хромосом.
М., 1986. 431 с.
72. Schubert I. What features influence aberration clustering in a chromosome
region? // Clin. G-^iet. 1985. Vol. 28. N 5. P. 463.
73. Holmberg M., Jonasson J. Preferential location of X-ray induced chromosome
breakage in the R-bands of human chromosomes // Hereditas. 1973. Vol 74 N 1
P. 57-67.
74. SanzM., Jenkins E., Brown T. e. a. Strain specific fragile sites in mice // Amer.
J. Hum. Genet! 1984. Vol. 36. N 4. Suppl. P. 111.
75. Manna G. K. Induced breakage in chromosomes. Mechanical and/or chemical
// Symp. Struct, and Funct. Aspects Chromosomes. Bombay, 1975. P. 20.
76. Леонард А. Зависимость цитогенетического эффекта от дозы радиацион-
ного и химического мутагенного воздействия на соматические клетки in filo:
185
влияние длительности экспозиции и клеточной селекции // Цитология и гене-
тика. 1986. Т. 20. И» 2. С. 115-121.
77. Сапачева В. А. Взаимосвязь динамики клеточных циклов и частоты хро-
мосомных аберраций в культуре облученных лимфоцитов человека // Цитоло-
гия и генетика. 1986. Т. 20. № 2. С. 97—102.
78. Des В. С„ Sharma Т. The fate of X-ray-induced chromosome aberration in
blood lymphocyte culture 11 Mutat. Res. 1987. Vol. 176. N 1. P. 93-104.
79. Elans H. J., Vijayalaxmi A. Storage enhances chromosome damage after expo-
sure of human leukocytes to mitomycin C // Nature. 1980. Vol. 234. N 5754. P. 370—372.
80. honor B. A. Chromosome aberration production in X-irradiated lymphocytes
as affected by preradiation storage of blood in plastics or glassware // Acta med. bulg.
1979. Vol. 6. N 1. P. 63-67.
81. Mitchell I. G. The interaction of statistical significance, biology.pf dose —
response and test gesign in the assessment of genotoxicity data // Mutagenesis. 1987.
Vol. 2. N 2. P. 141-145.
82. Share Julie A., Wong Teresa K., Elans Bettie L.B. e. a. DNA repair studies
with sodium fluorige: comparative evaluation using density gradient ultracentrifuga-
tion and autoradiography // Mutat. Res. Rev. Genet. Toxicol. Test. 1986. Vol. 172.
N 1. P. 77-87.
83. Stankowski L. F., Godek E. G., Tuman W. G. e. a. Spontaneous variation and
sources of error in the cho/hprt assay // Environ. Mutagenes. 1987. Vol. 9. Suppl. 8.
P. 101.
84. Hanewalt P. S., Cooper P. K., Ganesan A. K. e. a. DNA repair in bacteria and
mammalian cells // Ann. Rev; Biochem. 1979. Vol. 48. P. 783—836.
85. Хансон К. П. Роль структурной организации генома в осуществлении про-
цессов репарации ДНК // Радиобиология. 1981. Т. 21. Выл. 5. С. 643—653.
86. Hittelman W. N., Pollan! М. A comparison of the DNA and chromosome repair
kinetics after y-irradiation // Radiat. Res.'1982. Vol. 92. N 3. P. 497—509.
87. Bodell W. I., Banerjee M. L. The influence of chromation structure on the
distribution of DNA repair synthesis studied by nudeas digestion // Nud. Adds Res.
1979. Vol. 6. N 1. P. 359-370.
88. Klug A., Luffer L. C. The helical periodidty of DNA on the nudeosome //
Nud. Adds Res. 1981. Vol. 9. N 17. P. 4267-4283.
89. Gatti M., Smith D. A., Baker B.S. A gene controlling condensation of hetero-
chromatin in Drosophila melanogaster // Sdence. 1983. Vol. 221. N 4605. P. 83—85.
90. Suciu D. Nudear volume and chromatin organization in some radiosensitive
and radioresistant mammalian cells // J. Theor. Biol. 1985. Vol. 117. N 4. P. 587-596.
91. Cusick M. E., Lee K.-S., DePamphilis M.L. e.a. Structure of chromatin at
deoxyribonudeio add replication fores: nudease hypersensitivity results from both
prenudeosomal deoxyribonudeic add an immature chromatin structure // Bioche-
mistry. 1983. Vol. 22. N 6. P. 3873-3884.
92. Строков А. А. Хроматин мейотических клеток // Генетика, биохимия и
цитология мейоза: Материалы рабоч. совещ. по мёйозу, Москва, 9—10 апр. 1981.
М„ 1982. С. 56-61.
93. Рапопорт И. А., Васильева С. В., Давниченко Л. С. Роль п-аминобензой-
ной кислоты в репарации повреждений, индуцированных УФ и у-излучениями //
ДАН СССР. 1979. Т. 247. И» 1. С. 231-234.
94. Mattern М. R., Paone R. F., Day R. S. Eukaryotic DNA repair is blocked at
different steps by inhibitors of DNA topoisomerases and of DNA polymerases a and В
// Biochim. et biophys. acta. 1982. Vol. 697. N 1. P. 6—13.
95. Mitchell Darid L., Clarkson Judith M., Adair Gerald M. The DNA of UV-ir-
radiated normal and exdsion-defident mammalian cells undergoes relaxation in an
initial stage of DNA repair // Mutat. Res. 1986. Vol. 165. N 2. P. 123-128,
96. Wilkins R. J., Hart R. W. Preferential DNA repair in human cells // Nature.
1974. Vol. 247. N 5435. P. 35-36.
97. Jackson D.A., Cook P. R. Active genes and their transcripts are dosely es-
sodated with the nudear cage // Biol. Cell. 1982. Vol. 45. N 3. P. 334.
186
98. Elgin Sarah C. R. Chromatin structure and gene expression in Drosophila //
Anat. Res. 1983. Suppl. 1. P. 103-143.
99. Daiis A. H., Reudelhuber T. L., Garrard W. T. Variegated chromatin structures
of mouse ribosomal RNA genes // J. Mol. Biol. 1983. Vol. 167. N 1. P. 133—155.
100. Prior Ch. P., Cantor Ch. R., Johnson E. M. e. a. Reversible changes in nucleo-
some structure and histone H3 accessibility in transcriptionally active and inactive
states or rDNA chromatin // Cell. 1983. Vol. 34. N 3. P. 1033—1042.
101. Abel H. Cell damage and DNA repair — introductory remarks // Stud, biophys.
1979. Vol. 76. N1. P. 3-7.
102. Green D. A., Deutsch W. A. Repair of alkylated DNA: Drosophila have DNA
methyltransferases but not DNA glycosylases // Mol. and Gen. Genet. 1983. Vol. 192.
N 3. P. 322-325.
103. Stadler D., Macleod H., Loo M. Repair-resistant mutation in Neurospora //
Genetics. 1987. Vol. 116. N 2. P. 207-214.
' 104. Slatko В. E., Mason J. M., Woodrufe R. C. The DNA transposition system of
hybrid dysgenesis in Drosophila melanogaster can function despite defects in host DNA
repair // Genet. Res. 1984. Vol. 43. N 2. P. 159-171.
105. Ganesan A. K., Cooper P. K., Hanawalt P. C. e. a. Biochemical mechanisms
and genetic control of DNA repair // DNA Repair, Chromosome Alterat. and Chromatin
Struct: Proc. Int. Meet., Noordwijkerhout, 23—25 Apr. 1981. Amsterdam e. a., 1982.
P. 313-323.
106. Meyn R. E., Vizard D. Z., Hewitt R. R. e. a. Deoxyribonucleic acid synthesis
in ultra-violet light irradiated Chinese hamster cells // Biophysical J. 1971. Vol. 11.
N3. P. 295-301.
107. Дубинин Н.П. Потенциальные изменения в ДНК и мутации. М., 1978.242 с.
108. Harm Н. Damage and repair in mammalian cells after exposure to non-ioniz-
ing radiations // Mutat. Res. 1980. Vol.'69. N1. P. 157-165.
109. Kimball R. F., Hirsch B. F. Fixation and loss of hydrazine-induced premuta-
tional damage in Haemophilus influenzae // Mutat. Res. 1976. Vol. 36. N 1. P. 39—47.
110. Thomas H. F„ Harriott R. M., HahnB.S. e.a. Thymine hydroperoxide as a
mediator in ionizing radiation mutagenesis // Nature. 1976. Vol. 259. N 5541. P. 341—342.
111. Brendel M., Kircher M., Ruhland A. Wie verteidigt die Zelle ihre "Daten-
bank?” MutationsauslOsung unter biologischer Kontrolle // Umschau Wiss. und Techn.
1980. Bd 80. N14. S. 418-424.
112. Lowley P. D., Brookes P. Acidic dissociation of 7;9-dialkylguanins and its
possible relation to mutagenic properties of alkylating agents // Nature. 1961. Vol. 192.
N'4807. P. 1081-1082:
113. Krieg D. R. Ethylmethansulfonate-induced reversion of bacteriophage T4r2
mutants // Genetics. 1963. Vol. 48. N 4. P. 561—580.
114. Goodman M. F., Watanabe S M., Branscomb E. W. Passive polymerase control
of DNA replicationfidelity: evidence against unfavored tautomer involvement in
2-aminopurine-induced basetransition mutations If Mol. and Cell. Meeh. Mutagenes:
Proc. Symp., Gatlinburg; Тепд., 5-9 Apr. 1981. N. Y.; L., 1982. P. 213-229.
115. Drake G. W., Boltz R. H. The biochemistry of mutagenesis // Ann. Rev. Bio-
chem. 1976. Vol. 45. N 1. P. 11-37.
116. Eisenstadt E., Warre A. J., Porter J. e. a. Carcinogenic epoxides of benzo(a)-
pyrone and cyclopenta(cd)-pyrene-induced base substitutions via specific transversions
// Proc. Nat. Acad. Sd. USA. Biol. Sci. 1982. Vol. 79. N 6. P. 1945-1949.
117. Тарасов В. А. Молекулярные механизмы репарации и мутагенеза. М.,
1982. 226 с.
118. Singer В. Mutagenesis from a chemical perspective: nucleic add reactions,
repair, translation, and transcription // Mol. and. Cell. Meeh. Mutagenes: Proc. Symp.,
Gatlinburg; Tenn., 5-9 Apr. 1981. N. Y.; L., 1982. P. 1-42.
119. Ionian C. Some problems of mutagenesis induced by baze analogues // Acta
biochim. pol. 1984. Vol. 31. N 1. P. 183-192.'
120. Дубинин H. Я., Филиппов В. Д. Репликация ДНК необходима для фик-
187
сации индуцированных мутаций к стрептомицин-устойчивости в УФ облученных
клетках Е. colt И ДАН СССР. 1986. Т. 289. № 5. С. 1244-1248.
121. Sowers L. С., Shaw В. R., Vieg М. L. е. a. DNA base modification: ionized
base pairs and mutagenesis // Mutat. Res. 1987. Vol. 177. N 2. P. 201-218.
122. Kimball R. F. The development of ideas about the effect of DNA repair on the
induction of gene mutations and chromosomal aberrations by radiation and by chemi-
cals // Mutat. Res. Rev. Genet. Toxicol. 1987. Vol. 186. N 1. P. 1-34.
123. Natarajan A. T., Simons J. W. I. M., Vogel RW, e. a. Relationship between
cell killing, chromosomal aberrations, sister-chromatid exchanges and point mutations
induced by monofunctional alkylating agents in Chinese hamster cells. A correlation
with different ethylation products in DNA 11 Mutat. Res. 1981. Vol. 84. N1. P. 125-132.
124. San S. J. S., O’Neill J. P., Johnson A. e. a. Induction of specific locus mutations
and sibling ("Sister”) chromatid exchanges by bromodeoxyuridine in Chinese hamster
ovary cells // 11th Ann. Mut. Environ. Mutagen Soc., Nashville, Tenn., March 16—19
1980: Program and Abstr. Bethesda, 1980. P. 125.
125. Natarajan A. T., Csukas J., Van Zeeland A. A. Contribution of incorporated
5-bromodeoxyuridine in DNA to the frequencies of sister-chromatid exchanges induced
by inhibitors of poly(ADP-ribose)-polymerase Ц Mutat. Res. 1981. Vol. 84. N 1.
P. 125-132.
1Я6. Obe L., Natarajan A. T. On the origin of chromosomal aberrations // Mutat.
Res. 1981. Vol. 85. N 6. P. 450.
127. Wollf S., Fijtman N. X-ray sensitization of chromatids with unifilarly and
bifilarly substituted DNA // Mutat. Res. 1981. Vol. 80. N 1. P. 133—140.
128. Hutchinson F., Hales H. B. Mechanism of the sensitization of bacterial trans-
forming DNA to ultraviolet light by the incorporation of 5-bromouracil // J. Mol. Biol.
1970. Vol. 50. N1. P. 59-69.
129. McClintock B. De betekenis van reacties van een genoom op plotselinge veran-
deringen // Vakbl. biol. 1984. Vol. 64. N f5. P. 324-333.
130. Голубовский M. Д. Эволюционные следствия непостоянства элементов
генома И 4съездВОГиС: Тез. докл. М., 1982. С. 39—40.
131. Liu V. W., Heddle J. Н. The genetic effects of specific DNA lesions in mam-
malian cells // Environ. Mutagenes. 1981. Vol. 3. N 3. P. 344.
132. Колчанов H. А. Условие структурной допустимости мутаций в глобуляр-
ных белках Ц 4 съезд ВОГиС: Tes. докп. Кишинев, 1981. С. 122.
133. Колчанов Н. А., Бохонов В. Б. Влияние мутационных замен аминокислот
на вторичные структуры в глобулярных белках // Вопросы теории молекуляр-
но-генетических систем. Новосибирск, 1977. С. 99-117.
134. Preston R. I. The effects of cytosine arabinoside on the frequence of X-ray-
induced chromosome aberrations in normal human leukocytes // Mutat. Res. 1980.
Vol. 69. Nl. P. 71-79.
135. Bender M. A., Grigga H. G., Bedford I. S. Mechanisms of chromosomal aber-
ration productions. III. Chemical and ionizing radiation // Mutat. Res. 1974. Vol. 23.
N 2. P. 197-212.
136. Ганасси E. Э., Заичкина С. И., Малахова Л.В. Молекулярные основы
хромосомного мутагенеза И Радиационный мутагенез и его роль в эволюции и
селекции. М., 1987. С. 5-17.
137. Заичкина С. И., Розанова О.М., Ганасси Е.Э. Соотношение между про-
цессами повреждения и репарации на молекулярном и цитогенетическом уров-
нях Ц Науч, совет по пробл. радиобиологии. 1986. № 32. С. 84—86.
138. Тоомпуу О. Г. Проблема горячих точек в мутагенезе // Современные
проблемы теории химического мутагенеза. Таллинн, 1987. С. 128-139.
139. Моссэ И. Б. К вопросу о модифицируемости радиационных мутаций раз-
ных типов Ц Современные во\юсы радиобиологии. М., 1980. С. 27—31.
140. Моссэ И. Б. О разной модифицируемости выходов точковых н структур-
ных радиационных мутаций у эукариот // Радиобиология. 1982. Т. 12. № 3.
С. 329-334.
188
141. Моссз И. Б. Радиогенетические эффекты в клетках эукариот // Радиа-
ционный мутагенез и его роль в эволюции и селекции. М., 1987. С. 73—83.
142. Karlan W. D., Lyon М. F. Failure of mercaptoethylamine to protect against
the mutagenic effects of radiation. I. Experiments with Drosophila // Science. 1953.
Vol. 118. N 3078. P. 776-777.
143. Karlan W. D., Lyon M. F. Failure of mercaptoethylamine to protect against
the mutagenic effects of radiation. II. Experiments with mice 11 Science. 1953.
Vol. 118. N 3078. P. 777-778.
144. Nakao Y., Tazima Y., Suigimura T. Failure of mercaptoethylamine and
cysteine to protect the silkworm against mutagenic and lethal effects of radiation //
Rad. Res. 1955. Vol. 3. N 4. P. 400.
145. Patt H. M., Tyree E. B., Straube R. L. e. a. Cysteine protection against X-ir-
radiation // Science. 1949. Vol. 110. N 2850/52; P. 213-215.
146. Honhe G., Kunkel H. A., Struckmann R. Die strahleninduzierte Mutations-
rate bei Drosophila nach Cysteinapplikation Ц Naturwissenschaften. 1955. Bd 42.
N 24. S. 637-641.
147. Doherty D. Y., Burnett W. T. Protective effect of S, p-aminoethylisothiuro-
nium Br-HBr and related compounds against X-radiated death in mice // Proc. Soc.
Exptl. Biol, and Med. 1955. Vol. 89. P. 312-314.
148. Edington C. W. The effect of S-2-aminoethylisothiuronium bromide hydro-
bromide (AET) on the induction of dominant and sex-linked recessive lethals in Droso-
phila melanogaster // Amer. Natur. 1958. Vol. 92. N 867. P. 371-373.
149. Такэда Й., Сугахара У. Влияние АЭМ (5,2-аминоэтилизотиуромочевины
ВгНВг) на индуцирование рентгеновыми лучами доминантных летальных му-
таций И Nippon acta radiol. 1960. Vol. 20. N 9 P. 1996-1997.
150. Nelson A., Ulberg S. Distribution of S” in mice after injection of S^-cyste-
amine // Acta Radiol. 1960. Vol. 53. P. 305-306.
151. Rugh R., Wolff S. Evidence of some chemical protection of the mouse ovary
against X-irradiation sterilization // Rad. Res. 1957. Vol. 7. P. 184—186.
152. Wang S. C., Kuskin S., Rugh R. Protective effect of cysteamine (p-mercapto-
ethylamine) against X-irradiation induced sterility in C F. male mice // Proc. Sec.
Exp. Biol, and Med. 1959. Vol. 101. P. 218-222.
153. Mandle A. M. The effect of cysteamine on the survival of spermatogonia after
X-irradiation // Int. J. Rad. Biol. 1959. N 1. P. 131-133.
154. Luning K. G., Frolen H., Nelson A. The protective effect of cysteamine against
genetic damage by X-rays in spermatozoa from mice // Rad. Res. 1961. Vol. 14. N 6.
P. 813-817.
155. Дубинин H. IL, Арсеньева M. А., Каляева Э. С. и др. Защитный эффект
цистеамина (p-меркаптоэтиламина) на хромосомные перестройки в тканях обезь-
ян и мышей И Радиационная генетика. М., 1962. 287 с.
156. Henke Н., Hohne G., Kunkel A. Uber die Wirkung von Aminoaethylisothi-
uronium (AET) auf die strahleninduzierte Mutationsrate bei Drosophila melanogaster
// Strahlentherapie. 1963. Bd 122. N 2. S. 2-5.
157. Kiinkel H.A., RosenerA. Experiments with chemical compounds which reduce
or increase mutagenic effects of ionizing radiation // Genetics Today: Proc. 2nd Intern.
Congr. Genetics. Hague. 1963. Vol. 154. N 4. P. 67.
158. Mittler S. The failure of sulphydryl compounds AET, MEA and glutatione to
protect against X-ray-induced chromosome aberrations in male Drosophila // Int. I.
Rad. Biol. 1964. Vol. 8. N 5. P. 405-407.
159. Kiinkel H. A. Gibt es einer genetischen Strahlenshutz? // Atompraxis. 1964.
Vol. 10. N 7. P. 301-309.
160. Ehling U. H. Schutzwirkung von Cystein und AET bei strahleninduzierten
dominanten Letalmutationen der Maus // Kurzfassung Biophysik. 1964a. Bd 1. N 4.
S. 427-430.
161. Ehling U. H. AET Schutzwirkung bei strahleninduzierten dominanten Letal-
mutationen der Maus // Strahlentherapie. 1964b. Bd 125. N 1. S. 128—131.
189
162. Leonard A., Meisin J. R. Effect of AET against the dominant lethality induced
by X-rays in male mice If Genetics Today: Proc. 2nd Intern. Congr. Genetics. Hague.
1963. Vol. 1. P. 82.
163. Leonard A., Maisin J. R. Effects de la p-aminoethylisothiouri (AET) sur les
mutations induites chez la souris par les rayon X. П. Diminution du taux de letalite
dominante induite chez les spermatozoides irradies avec les fortes doses de rayons //
Compt. Rend. Soc. Biol. 1963. Vol. 157. N 4. P. 913-915.
164. Leonard A., Maisin J. R. Effect of AET against genetic damage induced by
X-irradiation of male mice II Rad. Res. 1964. Vol. 23. P. 53—57.
165. Керкис Ю. Я., Науменко Ю. И. Радиозащитное действие аминоэтилизо-
тиурония Вг -НВг (АЭТ) на наследственные структуры различных тканей млеко-
питающих // Радиобиология. 1964. Т. 4. № 2. С. 221—227.
166. Померанцева М. Д. Химическая защита от доминантных летальных му-
таций, индуцируемых ионизирующей радиацией, у самцов мыши // Генетика.
1967. Т. 1. С. 102-111.
167. Sarcoric N. Effect of chemical protective agents (cysteamin, P-aminoethyliso-
tiuronium (AET), Cl; HC1 and homologous tests DNA) on the death rate of the progeny
of a first generation originating from male rates Irradiated in the infantile period //
Nature. 1964. Vol. 203. N 4948-4952. P. 1393. ‘
168. Нуждин H. И., Нижник Г. В. Защита сперматозоидов кроликов от гене-
тических повреждений, вызванных облучением их in vitro // Действие ионизи-
рующих излучений иа растительный и животный организм. М., 1965. С. 229—237.
169. Magdon Е., Winterfeld G. Uber die strahlenempfindidikeit verschiedener
Entwiclclungsstadien der Keimzellen von Drosophila melanogaster und ihre Beein-
flussung durch chemische Substanzen // Radiobiol. Radiotherap. 1969. Bd 10. N 3.
S. 413-414.
170. Глембоцкий Я. Л., Гроздова Т. Я. Опыты по антимутагениому эффекту
АЭТ (р-аминоэтилизотиуронийбромид) у Drosophila melanogaster // Генетика.
1971. Т. 7. № 2. С. 108-116.
171. Mercy J., Ra-Chaudhuri S. Р. Radioprotective effect of six chemicals against
X-ray-induced genetic damage in D. melanogaster II Mutat. Res. 1973. Vol. 18. N 3.
P. 279-285.
172. Померанцева M. Д, Вилкина Г. А. Влияние цистамина на частоту инду-
цированных радиацией генетических повреждений в половых клетках самцов
мышей // Науч, совет по пробл. радиобиологии. 1975. Т. 18. С. 36—37.
173. Шевченко В. А., Померанцева М. Д Генетические последствия действия
ионизирующих излучений. М., 1985. 279 с.
174. Liters Н. Megaphon-Vorbehandlung und strahleninduzierte Mutationsrate bei
Drosophila melanogaster // Atompraxis. 1959. Bd 5. N 7-8. S. 288-291.
175. Kunkel H.A., Trams A., Hanke H. Uber den Einfluss von S-Hydroxytryptamin
(serotonin) auf die strahleninduzierte Mutationsrate bei Drosophila melanogaster //
Naturwissenschaften. 1965. Bd 52. N 23. S. 650-652.
176. Sobels F. H., Michael Bi, Mukhergee R. e. a. Repair and radiosensitivity
phenomena in Drosophila males // Proc. 3d Int. Congr. Rad. Res. 1967. P. 502.
177. Burdette W. I. Alteration of mutation frequency by treatment adinomidn D
//Science. 1961. Vol. 133. N 3445. P. 40.
178. Burdette W. J. Influence of penicillin on frequency of induced mutations //
Proc. Nat. Acad. Sd. 1961. Vol. 47. N 111. P. 1813-1814.
179. Sobels F. H. Chemische Beeinflussung des rdntgeninduzierten Mutationspro-
cesses bei Drosophila // Naturwissenschaften. 1961. Bd 48. S. 6—9.
180. Sobels F. H., Tates A. D. Recovery from prepiutational damage of X-irradiation
in Drosophila spermatogenesis // 1. Cell and Compar. Physiol. 1961. Vol. 58. N 3. P.
189-192.
181. Sobels F.H. Modification of premutational radiation damage in Drosophila //
Strahlenwirk und Milieu. Miinchen; Berlin, 1962. S. 197-223.
182. Murkherjee R. Actinomydn D effects on the frequency of radiation-induced
mutations in Drosophila // Genetics. 1965a. Vol. 51. N 3. P. 363—367.
190
183. Olivieri G., Olivieri A. The mutagenic effect of tritiated uridine in Drosophila
spermatocytes // Mutat. Res. 1965. N 2. P. 381—385.
184. Rodolfo F. E., Felix E. P., Rosario R. A. e. a. Actinomycin D effects on the
frequency of X-chromosome loss and disjunction in Drosophila melanogaster females //
Ann. Inst. biol. Univ, nac auton. Mex. Ser. Biol. exp. 1968. Vol. 39. N 1. P. 13—18.
185. Proust J. Action d’un pre-traitment des femelles Drosophila melanogaster avec
de I’Actinomydne D sur la frequence de letaux dominants induits par les rayons dans
les spermatozoides murs // C. r. Acad. Sd. 1969. Vol. D269. N 1. P. 86-88.
186. Clark A. M. The effects of chloramphenicole, streptomydn, penicillin on the
induction of mutations by X-rays in Drosophila melanogaster // Z. Vererbungslehre.
1963. Bd 94. N 2. S. 121-125.
187. Shiomi Toshio. Effect of penicillin on the frequency of X-ray-induced muta-
tion in Drosophila // Genetics. 1966. Vol. 54. N 5. P. 1077—1081.
188. Дубинин H. П., Гроздова T. Я. Стрептомицин, радиация и естественная
мутабильность // ДАН СССР. 1963. Т. 148. № 6. С. 1397-1399.
189. Шао Вэй Ван, Ду Гул, Чтом Хань. Защитное действие стрептомицина на
радиационное повреждение хромосом половых клеток млекопитающих // Sci-
ence Sinica. 1964. Vol. 13. N 9. P. 1523-1525.
190. Ehling U. H. Modification of premutational radiation damage in male mice.
(Summary) // Stud. Biqphys. 1971. N 29. P. 151-152.
191. Ehling U. H. Dose-response relationships of spedfic locus mutations in mice fl
Arch. Toxikol. 1974. Bd32. N 1. S. 19-25.
192. Mukherjee R. Mutagenic adion of mitomycin C on Drosophila melanogaster
// Genetics. 1965. Vol. 51. N 6. P. 947-951.
193. Mandal S. K., Rahsman R., Mukherjee A. S. Fractional and whole body muta-
tions in Drosophila melanogaster: effect of mitomydn C and X-ray // Proc. Symp.
Mutagen. Carcinogen. and Teratogen, of CHem. Baroda; New Delhi, 1975. P. 129.
194. Mandal S. K., Rahsman R., Mukherjee A. S. Characterization of fradional
mutations in Drosophila melanogaster: effect of fractionation of dose rate of X-ray and
mitomydn C in postmeiotic broods // Indian J. Exp. Bid. 1977. Vol. 15. N 1. P. 8-11.
195. Baker W. K., Sgourakis E. The effect of oxygen concentration on the rate of
the X-ray-induced mutations in Drosophila // Proc. Nat. Acad. Sd. USA. 1950. N 36.
P. 176-178.
196. tuning K. G. Effect of oxygen on Irradiated males and females of Drosophila
// Hereditas. 1954. Vol. 4O.'N 3-4.. P. 29J-302.
197. Sobels F. H. Radiosensitivity and repair in different germ cell stages of Dro-
sophila // Genetics Today: Proc. II Int. Congr/of Genetics. Hague. 1963. Part 2. P. 235.
198. Sobels F. H. Postradiation reduction of genetic damage in mature Drosophila
sperm by nitrogen // Mutat. Res. 1964. Vol. 1. N 4. P. 472-475.
199. Sobels F. H. Processes underlying repair and radiosensitivity in spermatozoa
and spermatids of Drosophila // Genetical Aspects Radiosensitivity: Mechanisms
Repair. Vienna, 1966. P. 49—63.
200. Fritz-Niggli H. Beeinflussung der strahleninduzierten Mutabilitgt durch
2,4-Dinltrophenol bd Drosophila // Naturwissenschaften. 1961. Bd 48. N 20. S. 50-55.
201. Steger I. M. Der Einfluss von 2,4-Dinitrophend auf strahleninduzierte dorni-
nante Letalfaktoren bd Drosophila melaribgaster // Oncologia. 1962. Vol. 15. N 4.
P. 247-251.
202. Абелева 3. А. Влияние 2,4-динитрофенола на частоту мутирования в
спермиях и сперматидах дрозофилы, облученных гамма-лучами Ц Генетика.
1966. Т.1. С. 116-118.
203. Яеащенко Я. Я, Гроздова Т. Я., Халикова Т. А. Влияние 2,4-динитро-
фенола на частоту рецессивных летальных мутаций, индуцированных облучени-
ем в аэробных и анаэробных условиях у Drosophila melanogaster // Генетика.
1971. Т. 7. №4. С. 53—60. ±
204. Nickel £. Wirkung von 2,4-Dinitrophenol auf die strahleninduzierten dorni-
191
nan ten Letalfaktoren bei Drosophila melanogaster // Strahlentherapie. 1965. Bd 126.
N 2. S. 263-265.
205. Кребс Г. Влияние ингибиторов иа клеточный метаболизм // Ионизирую-
щие излучения и клеточный метаболизм. М., 1958. С. 122-148.
206. Rajaraman R., Катга О. Р. Modification of radiation-induced genetic damage
in Drosophila melanogaster male germ cells with nucleic acid precursors. II. Effects on
post-meiotic cells // Mutat. Res. 1973. Vol. 18. N 3. P. 289-299.
207. Rajaraman R., Катга О, P. Modification of radiation-induced genetic damage
in Drosophila melanogaster male germ cells with nucleic add precursors. III. Effects on
the premeiotic cells // Mutat. Res. 1974. Vol. 22. N 1. P. 47—53.
208. Рамайя Л. К., Померанцева M. Д. Влияние препаратов ДНК на мутаген-
ный эффект радиации в половых клетках самцов мыши II Радиобиология. 1978.
Т. 16. Выл. 1. С. 107-109.
209. Bayrakova A., Pantev Т, Nikolov Bokova N. Protection of mouse sperma-
togonia against X-ray-induced translocations // Mutat. Res. 1974. Vol. 25. P. 377—381.
210. Байракова А., Пантев T. Возможность противолучевой защиты адетуро-
иом АТФ, АЭТ и их комбинацией наследственных структур в сперматогониаль-
ных клетках мышей, подвергнутых облучению рентгеновскими лучами //
10 симп. по космич. биологии и медицине. Сухуми, 1977. С. 8.
211. Бердышев Г. Д., Зуй В. Д., Голда Д. М. и др. Антимутагеиное действие
АТФ, метиоиииа и цистеина на клетки ячменя, лука-батуиа и дрозофилы // Мо-
лекулярная генетика и биофизика. Киев. 1982. № 7. С. 76—86.
212. Благинина Е. В., Зуй В. Д., Бердышев Д. Антимутагеиное действие
средств, нормализующих метилирование ДНК у дрозофилы // Чувствительность
организмов к мутагенным факторам и возникновение мутаций: Тез. докл.
3-н конф, по теор. вопр. мутагенеза. Вильнюс, 1980. Т. 4. С. ПО—Ш.
213. Benova D. Radioprotective effectiveness and toxidty of ATP, AET and sero-
tonin applied individually or simultaneously to mice. II. Dose depending protection by
single agents // Strahlentherapie. 1976. Bd 151. S. 274-277.
214. Benova D„ Baev I. Protection of the mouse from genetic radiation damage by
an optimal dose-ratio combination of ATP, AET and serotonin // Experientia. 1978.
Vol. 34. N 7. P. 876-877.
215. Бенова Д., Баев И. Антимутагеиные свойства некоторых радиопротекто-
ров и их комбинаций И Наследственность человека и окружающая среда. М.,
1984. С. 189-194.
216. Benova D. К. Antimutagenic properties of selected radioprotectors and their
combinations with regard to reciprocal translocations in mouse spermatocytes // Mutat.
Rea. 1985. Vol. 147. N 5. P. 286-287.
217. Алиев А. А., Меджидов M. M., Асадова А. И. и др. Модификации а-то-
коферолом уровня генетической токсичности мутагенов, различающихся меха-
низмом образования первичных повреждений ДНК // Изв. АН АзССР. Сер. би-
ол. наук. 1987. № 3. С. 19-26.
218. Алиев А. А., Алекперов У. К., Шехтман А. Б. и др. Специфическая чув-
ствительность генетического аппарата хронически облученных линейных мышей
к воздействию различных мутагенов и универсальный защитный эффект а-то-
коферола // Докл. АН АзССР. 1987. Т. 3. № 4. С. 58-61.
219. Алиев А. А., Шехтман А. Б., Асадова А. И. и др. Нейтрализация биоаи-
тиоксидаитом вирусиидуцироваииого мутагенеза в культивируемых клетках
человека // Генетика. 1988. Т. 24. № 4. С. 655-662.
220. Beckman С., Roy R. М., Sproule A. Modification of radiation-induced sex-
linked recessive lethal mutation frequency by tocopherol П Mutat. Res. 1982.
Vol. 105. N 1-2. P. 73-77.
221. Папалашвили Э. Г. Изучение различных биологически активных веществ
иа наследственность дрозофилы (Drosophila melanogaster) /I 5 съезд ВОГиС,
Москва, 24—28 иояб. 1987. Т. 1. Общаи и молекулярная генетика: Тез. докл. М.,
1987. С. 206-207.
192
222. Багдасарьян X. С., Израилевич Н. С., Кронгауз В. А. Внутримолекуляр-
ная миграция энергии при радиолизе алкилбензолов // ДАН СССР. 1961. Т. 141.
№ 4. С. 887-891.
223. Молин Ю. Н., Чхеидзе И. И., Бубен К. Я. и др. Исследование методом
ЭПР передачи энергии к ароматическим группам при радиолизе некоторых ор-
ганических соединений // Кинетика и катализ. 1961. Т. 2. № 2. С. 192—194.
224. Кронгауз В. А., Васильев И. Н. Исследование процессов передачи энергии
методами люминесценции и радиационной химии // Кинетика и катализ. 1964.
Т. 4. № 1. С. 67-70.
225. Моссэ И. Б., Турбин И. В., Фрейманис Я. Ф. Действие сопряженных аро-
матических систем на наследственность. I. Мутагенный и аитимутагенный эф-
фект некоторых инденовых соединений // Докп. АН БССР. 1964. Т. 8. № 12.
С. 827-829.
226. Иващенко Н. И., Гроздова Т. Я. Точный метод инъецирования активных
веществ дрозофиле, использованный в химическом и радиационном мутагенезе
// Генетика. 1971. Т. 7. № 3. С. 182-183.
227. Oster 1.1., Balaban G. A modified niethod for preparing somatic chromosomes
// Dros. Inform. Sent. 1963. Vol. 32. P. 142.
228. Прокофьева-Бельговская А. А. Руководство по цитологии: В 2 ч. M., 1966.
4.2. 674 с.
229. Lindsley D. L., GrellE.H. Genetic variations of Drosophila melanogaster //
Carnegie Inst. Wash. Publ. 1968. N1. P. 627-629.
230. Пекарская Л. С. Изучение генетического действия ряда соединений с пси-
хотропной активностью: Автореф. дне.... канд. биоп. наук. Ми., 1971. 25 с.
231. Russel W. L. Lack of liniarity between mutation rate and dose X-ray-induced
mutations m mice // Genetics. 1956. Vol. 41. N 5. P. 658—661.
232 Oftedal P. Radiosensitivity of Drosophila spermatogonia. III. Comparison of
acute and protracted irradiation efficiencies in relation to cell killing // Mutat. Res.
1964. Vol. 1. N 1. P. 63-67.
233. Ватти К. В. О зависимости частоты мутаций от дозы облучения в связи с
чувствительностью предмейотических и постмейотических стадий сперматогене-
за // Генетика. 1965. № 3. С. 94-99.
234. Померанцева М. Д., Рамайя Л. К. Мутагенный эффект излучений разных
видов на половые клетки самцов мыши. [Сообщ.] 1. Сравнительная генетиче-
ская радиочувствительность сперматогониев и других стадий сперматогенеза //
Генетика. 1969. Т. 5. И» 5. С. 103-112.
235. Шапиро Н. И., Померанцева М. Д. Новое в радиационной генетике мле-
копитающих // Радиобиология. 1970. Т. 10. № 2. С. 167-187.
236. Wen R. Н. Cytogenetic studies of X-ray and injected P32 induced sex-linked
recessive lethals in Drosophila melanogaster /' Hereditas, ~ :
P. 123-127.
237. Хашим-Ахмед M. С. Цитогенетический анализ летальных мутаций, ин-
дуцированных на разных стадиях сперматогенеза дрозофилы // Генетика. 1965.
№>3. С. 49-55.
238. Kishin A. F. Б. The response of the immature tests of Drosophila to the muta-
genic action of X-rays // Z. Induct. Abst, und Vererb. 1955. Vol. 87. P. 97.
239. Bridges С. B. A revised map of the salivary gland X-chromosome of Drosophila
melanogaster // J. Heredity. 1938. Vol. 29. P. 11-15.
240. Kaufmann В. P. Organization of chromosome // I. Exptl. Zool. 1946. Vol. 102.
P. 293-298.
f 241. Прокофьева-Бельговская А. А., Хвостова В. В. Распределение разрывов
в Х-хромосоме // ДАН СССР. 1939. Т. 23. № 5. С. 269-277.
242. Prokofyera-Belgovskay A. A. Cytological properties of inert regions and their
bearing on the mechanisms of mosaicism and chromosome rearrangement // Dros.
Inform. Serv. 1941. N15. P. 34.
243. SUzynsky B..M. "Ectopic” pairing and the distribution of heterochromatin in
193
the X-chromosome of salivary gland nuclei of Drosophila melanogaster // Proe. Roy.
Soc. Edinb. 1945. B62. P. 114-116.
244. Елисееве К. Г., Моссз И. Б., Рокицкий П. Ф. Цитологический анализ де-
талей, возникших на разных стадиях сперматогенеза дрозофилы в условиях
совместного действия рентгеновского излучения и инденового препарата F-11 //
Becqi АН БССР. Сер. б!ял. иавук. 1973. № 2. С^37—42.
-245. Елисеева К. Г., Моссз И. Б., Рокицкий П?Ф. Изучение влияния индено-
вого препарата F-11 на частоту рецессивных леталей в половых клетках дрозо-
филы, облученных рентгеновскими лучами // Весш АН БССР. Сер. б!ял. навук.
1973. № 1. С. 68—74.
246. Дыбан А. П. Метод приготовления препаратов мейотических и митоти-
ческих хромосом из семенников млекопитающих // Цитология. 1970. Т. 12. № 5.
С. 687-690.
247. Померанцева М. Д., Рамайя Л. К. Отсутствие защитного действия инде-
нового соединения F-57 от мутагенного эффекта радиации // Генетика. 1976.
Т. 12. № 10. С. 161-163.
248. Померанцева М. Д., Рамайя Л. К., Жеребченко П. Г. и др. Эффективность
применения радиопротекторов для защиты половых клеток самцов мышей от
генетического действия радиации // Радиобиология. 1981. Т. 21. № 5. С. 722-729.
249. Russel W. L., Russel L. В., Kelly С. М. Radiation dose rate and mitation
frequency // Science. 1958. Vol. 128. N 3338/39. P. 1546-1550.
250. Russel W. L., Russel L. B., Kelly E. M. Dependence of mutation rate on radia-
tion intensity // Immediate and Low Level Effects of Ionizing Radiation: Proc. Symp,
Vienna, 1959. Vienna, I960. P. 311.
251. Russell W. L. The effect of radiation dose-rate and fractionation on mutation
> in mice // Repair from genetic radiation damage. Oxford, 1963. P. 205—217.
252. Searle A. G., Rewhey С. V., Evans E.P. e.a. Studies on the induction of
translocations in mouse. V. Effects of short-term fractionation // Mutat. Res. 1972.
VoL15. N 2. P. 169-174;
253. Searle A. G., Evans С. P., Ford С. E. e. a. Studies on the induction of trans-
locations in mouse spermatogonia. I. The effect of dose-rate // Mutat. Res. 1968.
Vol. 6. N 3. P. 421-436.
254. Searle A. G., Reechey С. V., Corp M. 1. e. a. Dose-rate effect on translocation
in induction by X-irradiation of mouse spermatogonia // Mutat. Res. 1972. Vol. 15.
Nl.P. 89-91.
255. Oakberg E. F„ Clare E. Effect of dose and dose-rate on radiation damage to
mouse spermatogonia and oocytes as measured by cell survival // J. Cell. Comp. Physiol.
1961. Vol. 58. Suppl. 1. P. 173-182.
256. Oakberg E. F. The effects of dose, dose-rate and quality of radiation on the
dynamics^ and survival of spermatogonial population of the mouse // Jap. J. Genet.
1964. Vol. 40. Suppl. P. 120-127.
257. Померанцева M. Д., Рамайя Л. К., Иванов В. И. Мутагенный эффект из-
лучений разных видов иа половые клетки самцов мыши. [Сообщ.] 7. Частота
возникновения реципрокных транслокаций в сперматогониях мышей, подверг-
шихся у-облучению- при разной мощности дозы // Генетика. 1972. Т. 8. № 12.
С. 128-134.
258. Померанцева М. Д., Вилкина Т. А., Иванов В. Н. Мутагенный эффект
излучений разных видов на половые клетки самцов мыши. (Сообгф.) 8. Частота
возникновения реципрокных транслокаций в сперматогониях мышей, подверг-
шихся хроническому гамма-облучению // Генетика. 1975. Т. 11. № 3. С. 81—86.
259. Байракова А. К. Геиетично увреждане в условията иа хронично гама-
облъчване // Съврем. медицина. 1976. Т. 29. № 11. С. 9-12.
260. Байракова А. К., Рупова И. М., Васильев Г. Г. Хромосомные транслока-
ции в половых клетках мышей при хроническом гамма-облучении с низкой
мощностью дозы // Генетика. 1977. Т. 13. № 9. С. 1561-1564.
261. Russel W. L. Evidence from mice concerning the nature of the mitation process
// Genetics Today. 1965. Vol. 2. P. 257-275.
194
262. Moorhead P. S., Nowell P. C., Mellmann W. J. e. a. Chromosome preparations
of leucocytes cultured from human peripheral blood // Exp. Cell. Res. 1960. Vol. 20.
N3. P. 613-615.
263. Brewen J. G. Cell-cycle and radiosensitivity of the chromosomes of human
leucocytes // J. Rad. Biol. 1965. Vol. 9. N 4. P. 391-395.
264. Джемилев 3. А. Радиочувствительность хромосом лейкоцитов перифе-
рической крови человека // Генетика. 1967. Т. 5. С. 67-78.
265. Кукушкина Л. М., Мосса И. Б. Сравнительное рзучение влияния радио-
протектора F-11 иа генетический эффект рентгеновских лучей и химического
мутагена тиоТЭФ II Bead АН БССР. Сер. б!ял. иавук. 1975. № 2. С. 72-75.
266. Мосса И. Б., Рокицкий П. Ф., Фрейманис Я. Ф. Генетические эффекты
ионизирующей радиации и возможность их уменьшения инденовыми соедине-
ниями // Генетические последствия загрязнения окружающей среды. М., 1977.
С. 182-187.
267. Алекперов У. К. Антимутагены и проблема защиты генетического аппа-
рата. Баку, 1979. 1И с.
268. Алекперов У. К. Особенности действия антимутагеиов и перспективы их
практического применения // Успехи современной генетики. М., 1979. № 8.
С. 168-181.
269. Alekperov V. К. The comparative analyses of the effectiveness of some anti-
mutagens // Mutat. Res. 1982. Vol. 97. N 3. P. 164.
270. Алекперов У. К. Антимутагеиез. М., 1984. 99 с.
271. Langridge J. The acquisition of inherited information // Repts Austral. Acad.
Sd. 1973. N 16. P. 8-15.
Т12. Барабой В. А. Растительвые фенолы и здоровье человека. М., 1984. 160 с.
273. Shields L. М., Durrell L. W., Sparrow А. Я. Preliminary observations on radio-
sensitivity of Algae and fungi from soils of the Nevada test site // Ecology. 1961.
Vol. 42. N 2. P. 440-441.
274. Wallace B., King J. C. A genetic analysis of the adaptive values of populations
// Proc. Nat. Acad. Sd. USA. 1958. N 38. P. 706-713.
275. Александров C.H. О зависимости рентгенотерапевтического эффекта
от обшей устойчивости животных — носителей злокачественных новообразова-
ний I/ ДАН СССР. 1957. Т. 113. № 1. С. 90-93.
276. Queredo W. С., Grahn D. Effect of daily gamma-irradiation on the pigmenta-
tion of mice // Rad. Res. 1958. Vol. 8. N 2. P. 254-264.
277. Рубан E. Л., Лях С. П. Устойчивость Nadsoniella nigra к действию корот-
коволновых электромагнитных излучений // Изв. АН СССР. Сер. биол. 1968.
Г 3. С. 402-407.
278. Lukiewich S. Interference with endogenous radioprotectors as a method of
radiosensitization // Modlfic. Radiosensitivity Biol. Syst. Vienna, 1976. P. 61-76.
279. Brunt V. V. New observations concerning roentgen sensitivity of pigment ceils
in young Axolotls // Amer. I. Roentgenology, Rad. Therapy a. Nud. Med. 1965.
Vol. 93. N 1. P. 222-237.
. 280. Холлендер А., Степлтон Дж. Ионизирующие излучения и клеточный
метаболизм. М., 1958. С. 154—172.
281. Hollaender A., Steplton G. Е. И Physiol. Rev. 1953. Vol. 33. Р. 77-81.
282. Brunger F. W., Storer B. J., Atherton D. L. Incorporation of various metal ions
into in vivo and in vitro produced melanin // Rad. Res. 1967. Vol. 32. N 1. P. 1-12.
283. Potts A. M., Au P. Ch. The affinity of melanin for inorganic ions // Exp. Eye
Res. 1976. Vol. 28. N 5. P. 487-491. T
. ‘284. A. c. 1063834 СССР, МКИ3 C 12 № 15/00. Штамм гриба Cladosporium clado-
spotiodes 396-продуцент меланинового пигмента / H. Н. Жданова, А. В. Мележик,
А. И. Василевская, М. С. Дяминов и др.; Опубл. 30.12.83. Бюл, № 48.
285. Taylor G. N„ Storer В. J., Gee W. S. S. e.a. Selective deposition of radium in
normal and neoplastic melanocytes // Rad. Res. 1964. Vol. 21. N 2. P. 285-298.
’ 286. Цит. по: Щербаков В. К. Общие эволюционные аспекты проблемы анти-
мутагенеза. М., 1968. С. 3.
195
287. Малама А. А., Буланов П. А. Влияние меланина на опухоль Эрлиха И
Докл. АН БССР. 1965. Т. 9. № 9. С. 627-629.
288. ffirobe Т. Genes involved in regulating the melanocyte and melanoblast-
melanocyte populations in the epidermis of newborn mouse skin // J. Exp. Zool. 1982.
Vol. 223. N 3. P. 257-264.
289. Бердышев Г. Д. О защитном действии меланина при облучении мышей
И Радиобиология. 1964. Т. 4. N° 4. С. 644—645.
290. Miranda V., Botti D., Pantani C. e. a. Effects of melanoproteins and their
precursors on cell proliferation. The problem of selectivity Ц Develop. Growth and
Differ. 1979. Vol. 21. N 5. P. 465-472.
291. Дубинин H. П., Щербаков В. К., Юкова Г. С. Мутагенный эффект пиро-
галлола иа фоне разных уровней естественного мутирования клеток II Генети-
ка. 1967. Т. 1. С. 47-52.
292. Барабой В. А., Винклер Г. Н. Растительные фенольные вещества и защита
генетического аппарата от повреждений // Цитология и генетика. 1970. Т. 4. № 4.
С. 359-376.
293. Барабой В. А., Юкова Г. С. Мутагенное и аитимутагенное действие нат-
рийгаллата // ДАН СССР. 1963. Т. 153. № 5. С. 1193-1195.
294. Моссэ И. Б. Некоторые подходы к проблеме поиска антимутагенов //
Генетические последствия загрязнения окружающей среда. М., 1980. С. 38—45.
295. Моссэ И. Б. Модификация мутагенного действия ионизирующей радиа-
ции в половых клетках животных II Успехи современной генетики. М., 1982.
№ 10. С. 70-103.
296. Raper Н. S. The aerobic oxidases // Physiol. Rev. 1928. N 8. P. 245—253.
297. Schleiermacher K. Frequency of spontaneuos chromosome mutations in sper-
matogonia of mice // Human genetik. 1972. Bd 16. N 1-2.: S. 115—117.
298. Плотникова С. И. Влияние некоторых радиоэащитных веществ на гене-
тический эффект облучения у мышей: Автореф. дис.... канд. биол. наук. Мн.,
1982. 188 6.
299. Плотникова Е. Д., Шапиро И. И. Радиочувствительность ядерного аппа-
рата клеток костного мозга различных видов млекопитающих в связи с общей
радиочувствительностью // Генетика. 1965. Т. 67. № 6. С. 67—72.
300. Oakberg Е. F. Differential spermatogonial stem-cell survival and mutation
frequency // Mutat. Res. 1978. Vol. 50. N 3. P. 327-340.
301. Шмалъгаузен И. И. Факторы эволюции. М., 1946. 396 с.
302. Гершензон С. М. Основы современной генетики. Киев, 1979. 505 с.
303. Айала Ф. Введение в популяционную и эволюционную генетику. М.,
1984. 230с. ,
304. Wallace В. Genetic changes within populations after X-irradiations II Genetics.
1951. Vol. 36. P. 612-618.
305. Wallace В Studies of populations exposed to radiation // Science. 1952. N 115.
< 487-492.
306. Wallace B„ King J. C. Genette changes in populations under irradiation //
Amer. Natur. 1951. Vol. 85. P. 209-223.
307. Ayala F. J. Evolution of fitness. I. Improvement in the productivity and size
of irradiated populations of Dr. serrata and Dr. birchii II Genetics. 1966. Vol. 53. N 5.
P. 833-895.
308. Жестяников В. Д. Восстановление и радиорезистентность клетки. Л., 1968.
345 с.
309. Шевченко В. А. Мутационный процесс в хронически облучаемых природ-
ных популяциях: Автооеф. дис.... д-ра биол. наук. М., 1974. 56 с.
310. Шевченко В. А н-севичюте А. 3., Рубенович А. В. Изучение генетиче-
ских эффектов, индуг. емых в популяциях разноактивными продуктами
ядериого депения 2"U // Генетика. 1978. Т. 24. № 7. С. 1221—1230.
311. Шевченко В. А. Радиационная генетика одноклеточных водорослей. М.,
1979. 256 с.
312. Шевченко В. А., Калъченко В. А., Рубенович А. В. и др. Изменчивость
196
изоферментов лейцинаминопептидазы в хронически облучаемых популяциях
Centaurea scabioza // Молекулярные механизмы генетических процессов.. М.,
1982. С. 159-167.
313. Шевченко В. А. Диализ мутационного процесса в хронически облучае-
мых природных популяциях растений // Наследственность человека и окру-
жающая среда. М., 1984. С. 82-112.
314. Cordeiro A. R., Marques Е. К., Veiga-Neto A. J. Radioresistance of a natural
population of Dros. willistoni living in a radioactive environment // Mutat. Res. 1973.
Vol. 19. N3.P. 325-329.
315. Ndthel H. Investigations on radiosensitive and radioresistant populations of
Drosophila melanpgaster. I. Decreased radiosensitivity in stage-7 oocytes of the irradia-
ted population RO I // Mutat. Res. 1970. Vol. 10. N 5. P. 463—474.
316. Nothel H. Investigations on radiosensitive and radioresistant populations of
Drosophila melanogaster. II. Restriction of the decrease in radiosensitivity of the ir-
radiated population R61 to stage-7 oocytes // Mutat. Res. 1972. Vol. 15. N 3. P. 277-286.
317. Ndthel H. Investigations on radiosensitive and radioresistant populations of
Drosophila melanogaster. VII. High relative radioresistance to the induction of sex-
linked recessive lethal in stage-7 oocytes of RO I4 II Mutat. Res. 1976. Vol. 36. N 2.
P. 245-248.
318. Алтухов Ю. П. Генетический мониторинг популяций в связи с мутаген-
ностью среды: Общий подход // Докл. МОИП. Общ. биол. М., 1979. С. 80—82.
319. Алтухов Ю. П. Генетический мониторинг популяций в связи с. состояни-
ем окружающей среды // Генетика и благосостояние человечества. М., 1981.
С. 205.
320. Алтухов Ю. И. Генетические процессы в популяциях. М., 1983. 279 с.
321. Алтухов Ю. П., Курбатова О. Л. Наследственность человека и окру-
жающая среда // Наследственность человека и окружающая среда. М., 1984.
С. 7-35.
322. Дубинин Н. П. Мутагены среды и наследственность человека // Гене-
тические последствия загрязнения окружающей среды. М., 1977. С. 3-20.
323. Дубинин Н. И., Алтухов Ю. П, Окружающая среда и генетический груз
популяций человека // Успехи современной генетики. М., 1982. Вып. 10. С. 3-27.
324. Савченко В. К. Интегральный генетический мониторинг в модельных
популяциях И Генетика. 1983. Т. 19. № 10. С. 1644-1653.
325. Лучникова Е. М. Регуляция численности и структуры популяций у дро-
зофилы // Дрозофила в экспериментальной генетике. Новосибирск, 1978.
С. 171-196.
326. Shorroks В, Population fluctuations in the fruit fly (Drosophila melanogaster)
maintained in the laboratory // 1. Anim. Ecol. 1970. Vol. 39. N 1. P. 229-253.
' 327. Tadei W. I., Abbade M. C. Cyclic oscillations in population size of Drosophila
sturtevanti // Rev. brasil. genet. 1981. Vol. 4. N-2. P. 149-164.
328. Codina M., Frutos R. de. Fluctuations en el tamano poblacional у variation
del polimorfismo cromosomico de Drosophila subobscura en poblationes experimentales
// Genet, iber. 1978-79. N 30-31. P. 71-90.
‘ 329. Nielsen R. A., Brister C. D. Induced genetic load in descendants of irradiated
greater wax moths // Ann. Entomol. Soc. Amer. 1980. Vol. 73. N 4. P. 460—467.
330. Lukiewich S. Interference with endogenous radioprotectors as a method of
radiosensitization H Modification of Radiosensitivity of Biological Systems. Vienna
1976. P. 61-76.
331. Коновалов В. С. Механизм плейотропного действия генов меланиновой
окраски у животных: Автореф. дис.... д-ра биоя. наук. Л., 1983. 38 с.
332. Гринько Р. А., Ануфриева 3. В., Артемьев Ю. Т. и др. Некоторые особен-
ности наследования величины кладки у дрозофилы. Казань, 1982. 8 с.
333. Brookfield J. У. Measurement of the intraspecific variation in population
growth rate under controlled conditions in the clonal parthenogen Daphia magna //
Genetica (Ned). 1984. Vol. 63. N3. P.161—174.
334. Никитин А. Я. Изучение некоторых физиологических основ селективио-
197
го действия перенаселения у дрозофилы // 4 съезд ВОГиС. Кишинев, 1981. Ч. 1.
С. 174.
335. ' Marks Н. W, Genetic variability for density sensitivity of three components
„of fitness in Drosophila melanogaster // Genetics. 1982. Vol. 101. N 2. P. 301-316.
336. Yamasaki T. Measurement of fitness and its components in six laboratory
strains of Drosophila melanogaster II Genetics. 1984. Vol. 108. N 1. P. 201-211.
337. Моссз И. Б., Савченко В. К., Лях И. П. Генетический мониторинг экспе-
риментальных популяций дрозофилы при воздействии облучением и антимута-
геном. I. Методика работы и динамика численности популяций // Радиобиоло-
гия. 1985. Т. 15. № 4. С. 474-478.
338. Моссэ И. Б., Савченко В. К., Лях И. П. Генетический мониторинг экспе-
риментальных популяций дрозофилы при облучении и. воздействии антимута-
геиов. II. Динамика элементов приспособленности // Радиобиология. 1986. Т. 16.
№ 1. С. 41-46.
339. Mutara М., Tobari I. Change in frequency of lethal second chromosomes in
experimental populations of Drosophila melanogaster with radiation histories // Jap.
J. Genet. 1974. Vol. 49. N 5. P. 349-359.
340. Bortolozzi J., MagalhaesL. Ed. Viability and selective mating in laboratory
populations of Drosophila melanogaster // Rev. brasil. genet. 1981. Vol. 4. N 4.
P. 526-536.
341. latter B. D. H. Influence of selection pressure on enzyme polymorphism in
Drosophila // Nature. 1975. Vol. 257. N 5527. P. 590-592.
342. Дубинин H. П., Калъченко В. A. Myttseses и уровни радиации в местах
обитания популяций И Изв. АН СССР. Сер. биоп. 1984. К® 5. С. 645-655.
343. Птицына С. Н., Шевченко В. А., Туманов Л. Л. Модификация мутацион-
ного процесса в популяциях хлореллы физиологически активными веществами
// Генетика. 1982. Т. 18. № И. С. 1835-1844.
344. Багги К. В., Тихомирова М М. Спонтанные и индуцированные радиа-
цией доминантные летальные мутации у самок и самцов дрозофилы // Иссле-
дования по генетике. Л., 1976. № 6. С. 32—43.
345. Литвинова В. М., Шварцман П. Я. Изучение инактивации н мутагенеза
при действии этнленимина иа половые клетки. III. Поздняя эмбриональная ги-
бель // Генетика. 1973. Т. 9. № 7. С. 74-79.
346. Засухине О. В., Грачаный Г. В., Никитин А. Н. Дрозофила как тест-систе-
ма для оценки мутагенного действия сточных вод целлюлозно-бумажной про-
мышленности II Проблемы экологии Прибайкалья: Тез. докл. респ. совещ. Ир-
кутск, 1979. С. 10—11.
347. Ревазова Ю. А., Бобринев Б. В. Изучение комплементарное™ ряда ме-
тодов определения мутагенной активности химических соединений // Генети-
ка. 1985. Т. 21. № 10. С. 1700-1704.
348. Левина А. Б., Кужир Т. Д., Пришивалко Л. И. Мутационная активность
диметилтерафталата в опытах на дрозофиле //.14 ежегод. конф. Европ. о-ва по
мутагенам внеш, среды, Москва, 11—14 сент. 1984. М., 1984. С. 291.
349. Литвинова Б. М, Пономарева Н.П. Роль неошюдотворенных яиц в ди-
намике выхода доминантных летальных мутаций, индуцированных в зрелой
сперме дрозофилы этиленимином // Химический мутагенез. Л., 1974. С. 71-79.
350. Варенцова Е. Р., Шарыеин В. И., Хромых Ю. М. Изучение радиочувстви-
тельных линий дрозофилы. [Сообщ.] 9. Анализ плодовитости и частоты доми-
нантных летальных мутаций у гамма-облученных самок мутантной линии
rad(2)201G1 // Генетика. 1985. Т. 21. Н° 9. С. 1464-1471.
351. Лаптева Н. Ш. Частота доминантных мутаций у Drosophila melanogaster
при изменении направления вектора гравитации II 5 съезд ВОГиС, Москва,
24-28 нояб. 1987. Т. 1. Общая и молекулярная генетика: Тез. докл. М., 1987.
С. 154-155.
352. WQrgler F. Б., LUtoif Н. V. Radiosensitivity of oocytes of Drosophila. I. Sen-
sitivity of dass-A oocytes of triploid and diploid females // Int. J. Biol. 1972. Vol. 21.
N 5. P. 455.
198
353. Katon M., Iwahara S. Relationship between chromosome aberrations at the
first cleavage metaphases and postimplantation loss in dominant lethal mutations
induced by isopropyl methanesulfonat // lap. I. Genet. 1983. Vol. 58. N 4. P. 345—351..
354. Tanaka N. Studies on chemical induction of chromosomal aberrations in post-
copulation germ cells and zygotes of female mice. I. Comparative studies on the
frequency of first-cleavage chromosomal aberrations and dominant lethal mutations //
Jap. J. Genet. 1981. Vol. 56. N 2. P. 117-129.
355. Арутюнян С. X., Шевчепко В. А. Генетический скрининг азотнокислого
уранила иа мышах // Биол. жури. Армении. 1986. Т. 39. № 11. С. 925—929.
356. Buul Р.Р. W. van, Goudzwaard J. Н. Dose-effect relationship for X-ray-induced
translocations in spermatogonia of normal and 170H translocation heterozygous mice //
Mutat. Res. 1986. Vol. 173. N 1. P. 41-48.
357. " Bucci L. R., Meistrich M. L. Effects of busulfan on murine spermatogenesis:
cytotoxicity, sterility, sperm abnormalities, and dominant lethal mutations // Mutat.
Res. 1987. Vol. 176. N 2. P. 259-268.
358. Anderson D., McGregor D. B., Weight T. The relationship between early
deaths and implants in control and mutagen treated CD-I mice in dominant lethal
assay If Environ. Mutagenes. 1980. Vol. 2. N 2. P. 231-232.
359. Anderson D., McGregor D. B., Weight F. M. The relationship between early
deaths and implants in control and mutagentreated CD-I mice in dominant lethal assay
// Mutat. Res. 1981. Vol. 81. N 2. P. 187-196.
360. Generoso W. M., Cain К. T., Hoskins J. A. e. a. Pseudo dominant-lethal
response in female mice treated with plant oils // Mutat. Res. 1984. Vol. 129. N 2.
P. 235-241.
361. Mossae I. B., Savchenko V. K., Kuzhir T. D. Monitoring of long-term genetics
effects of environment pollution in experimental populations // Proc. First Intern.
Biosphere Reserve Congress. Minsk, 1983. P. 32-44.
362. Савченко В. К., Косинская С. И., Добина А, И. и др. Отбор и мутацион-
ный процесс в популяциях. Мн., 1985. 224 с.
363. Mossae I. В., Savchenko V. К., Lyakh I. Р. Long-term genetical monitoring
of irradiated drosophila populations // Abstr. of 9th European Dros. Conf. Hungary.
1985. P. 97.
364. Mocco И. Б., Савченко В. К., Лях И. П. Генетический мониторинг экспе-
риментальных популяций дрозофилы при облучении и воздействии антимута-
генов. Ш. Динамика мутационного груза // Радиобиология. 1986. Т. 16. N° 1.
С. 47-51.
365. Дубинин Н. П., Шевченко В. А., Калъченко В. А. и др. Генетические
последствия действия ионизирующих излучений иа популяции I/ Мутагенез
при действии физических факторов. М., 1980. С. 3—44.
366. Калъченко В. А., Шевченко В. А., Федотов И. С. Изменение радиорезис-
тентности растений при хроническом воздействии радиации // Генетика. 1981.
Т. 17. № 1. С. 137-142.
367. Marques Е. К. The development of radioresistance in irradiated Dros. nebulosa
populations If Mutat. Res. 1973. Vol. 17. N 1. P. 59—72.
368. Дубинин H. П., Шевченко В. А., Алексеенок А. Я. и др. О генетических
процессах в популяциях, подвергающихся хроническому воздействию ионизи-
рующей радиации // Успехи современной генетики. М., 1972. Т. 4. С. 170—205.
369. Моссэ И. Б., Савченко В. К., Лях И. П. Генетический мониторинг экспе-
риментальных популяций дрозофилы при облучении и воздействии антимута-
генов. IV. Изучение адаптации популяций//Радиобиология. 1986. Т. 16. № 1.
С. 106-109.
370. Mossae I. В., Savchenko V. К., Lyakh I. Р. Study on antimutagenesis in
experimental drosophila populatins ff Abstr. XVI Intern. Congr. of Genetics. Toronto,
1988. P.32-A4.
-371. NBthel H., Strese B. Investigations on radiosensitive and radioresistant popu-
lations of Drosophila melanogaster. XIII. Effects of radioresistant mutants (rar) on
chemical (EMS) mutagenesis // Mutat. Res. 1982. Vol. 103. N1. P. 87-90.
199
372. Сергеева С. А., Птицына С. И., Семов А. Б. и др. Изучение природы устой-
чивости в популяциях одноклеточных водорослей к мутагенным факторам фи-
зической и химической природы // Генетика. 1984. Т. 20. № 9. С. 1480—1483.
373. Попова О. Н., Шершунова В. И., Коданева Р. П. и др. Проявление хлоро-
фильной недостаточности в природных популяциях горошка мышиного (V. сгас-
caL.) в зависимости от радиоэкологических условий произрастания // Генетика.
1985. Т. 21. К® 4. С. 670-672.
374. Попова О. И., Таскаев А. И., Шевченко В. А. Мутационные изменения в
природной популяции горошка мышиного (Vida cracca L.) при хроническом об-
лучении И Радиационный мутагенез и его роль в эволюции н селекции. М., 1987.
С. 110-127.
375. Ильенко А. И., Крапивко Т. П., Мажейките Р. Б. и др. Изучение влияния
загрязнения ,()Sr биогеоценоза иа популяции лесных мышей // Проблемы и
задачи радиоэкологии животных. М., 1980. С. 97—120.
376. Патти К. В., Тихомирова М. М. Адаптация и мутагенез // Радиационный
мутагенез и его роль в эволюции и селекции. М., 1987. С. 127—142.
377. Соколов В. Е., Попова М. Ф. Роль экстремальных факторов среды в ра-
диоустойчивости млекопитающих // Успехи современной биологии. М., 1981.
Т. 91. № 1. С. 90-98.
378. Klerks Р. L., Weis I. S. Genetics.adaptation to heavy metals in aquatic orga-
nisms // Environ. Pollut. 1987. Vol. 45. N 3. P. 173—205.
379. Berry R. I. Genes, poHutions and monitoring // Rapp, et proc.-verb. reun.
Cone. int. explor. mer. 1981. Vol. 179. P. 253-257.
380. Pezzoli C., Laporta D. G. G., Guerra D., Caricchi S. Fitness components in
a vestigial mutant strain of Drosophila melanogaster // Boll. Zool.1986. Vol. 53. N 4.
P. 351-354.
381. Chatterjee S., Singh B. N. Rapid elimination of white-eye gene in competition
with its wHd-type allele in Drosophila ananassae 11 Indian J. Exp. Biol. 1986. Vol. 24.
N 3. P. 195-196.
382. Eggleston P. The use of genetic markers in the analysis of competitive interac-
tions in Drosophila melanogaster // Genetics. 1987. Vol. 72. N 3. P. 181—186.
383. Watt W. B., Carter P. A., Donohue K. Females’ choice of “good genotypes”
as mates is promoted by an insect mating system // Science. 1986. Vol. 233. N 4769.
P. 1187-1190.
384. Berg R. L. Mutation rates in mutant and non-mutant Drosophila and their
bearing on mutability changes in local populations // Genetics. 1981. Vol. 97. N 1.
P. 10.
385. NSthel H. Investigations on radiosensitive and radioresistant populations of
Drosophila melanogaster. VIII. The system of relative radioresistance in immature
oocytes of the irradiated population RO I // Mutat. Res. 1981. Vol. 80. N1. P. 105-120.
386. NSthel H. Investigations on radiosensitive and radioresistant populations of
Drosophila melanogaster. ХП. The resistance factor rar-3: Stage specificity // Mutat.
Res. 1981. Vol. 84. N 2. P. 315-329.
387. NSthel H. Investigations on radiosensitive and radioresistant populations of
Drosophila melanogaster. XVI. Adaptation to the mutagenic effects of X-rays in several
experimental populations with irradiation histories // Mutat. Res. 1983. Vol. 111.
N 3. P. 325-340.
388. Charlesworth B. Adaptive evolution in the laboratory // Nature. 1982.
Vol. 302. N 5908. P. 479-480.
389. Gerken S. C., Arfin S. M. Chinese hamster ovary ceils resistant to borrelidin
overproduce threonyl-tRNA synthetase // J. Biol. Chem. 1984. Vol. 259. N14.
P. 9202-9206.
390. Slovak M„ Hoeltge G„ Grabowski D., Ganapathi R. Cytogenetic manifesta-
tions of adriamytin (ADR) resistant cells // Amer. J. Hum. Genet. 1984. Vol. 36. N 4.
Suppl. P. 37.
391. Meyers M. B., Spengler B. A.. Chang T. D. e. a. Gene amplification - as-
200
sociated cytogenetic aberrations and protein changes in vincristine - resistant Chinese
hamster, mouse and human cells // J. Cell Biol. 1985. Vol. 100. N 2. P. 588-597.
392. Cooper C. S., Tempest P. R., Beekmah M. P. e. a. Amplification and overex-
pression of the met gene in spontaneously transformed NIH 3T3 mouse fibroblasts //
EMBO J. 1986. Vol. 5. N 10. P. 2623-2628.
393. Rice G. С., Hoy C., Schimke R. T. Transient hypoxia enhances the frequency
of dihydrofolate reductase gene amplification in Chinese hamster ovary cells // Proc.
Nat. Acad. Sd. USA. 1986. Vol. 83. N 16. P. 5978-5982.
394. Gudkov A. V., Massino J. S., Chernova О. B. e. a. Gene amplification in Djun-
garian hamster cell lines possessing decreased plasma membrane permeability for
colchicine and some other drugs // Chromosoma. 1985. Vol. 92. N 1. P. 16-24.
395. Хесин P. Б. Непостоянство генома. M., 1985. 472 с.
396. Капитонов В. В. Возможное значение мобильных генетических элемен-
тов в повышении приспособленности популяции в условиях переменной внеш-
ней среды // 5 съезд ВОГиС, Москва, 24-28 иояб. 1987. Т. 1. Общая и молеку-
лярная генетика: Тез. докл. М., 1987. С. 113.
397. Гвоздев В. А., Кайданов Л. 3. Геномная изменчивость, обусловленная
транспозициями мобильных элементов, и приспособленность особей Drosophila
melanogaster // Жури. общ. биол. 1986. Т. 47. № 1. С. 51—56.
398. Беляева Е. С., Пасюкова Е. Г., Гвоздев В. А. и др. Транспозиция мобиль-
ных диспергированных генов у Drosophila melanogaster, выявляемая с помощью
селекции // Генетика. 1981. Т. 17. № 9. С. 1566-1580.
399. Капитонов В. В., Колчанов Н. А. Триггерная роль мобильных элементов
генома, эволюционирующего в условиях изменяющейся внешней среды // Мо-
лекулярные механизмы генетических процессов. 6 Всесоюз. симп., Москва,
3-6 февр. 1987: Tes. докл. М., 1987. С. 79-80.
400. Noihel Н. Adaptation of Drosophila melanogaster populations to high mutation
pressure: evolutionary adjustment of mutation rates // Proc. Nat. Acad. Sd. USA. 1987.
Vol. 84. N 4. P. 1045-1049.
401. Wallace B. Genetic changeover in Drosophila populations // Proc. Nat. Acad.
Sd. USA. 1986. Vol. 83. N 5. P. 1374-1378.
402. Ратнер В. А., Васильева Л. А. Количественный признак у дрозофилы: Ге-
нетические, онтогенетические, цитогенетические и популяционные аспекты //
Генетика. 1987. Т. 23. № 6. С. 1070-1080.
403. Васильева Л. А., Забанов С. А., Ратнер В. А. и др. Экспрессия количе-
ственного признака radius incompletus, температурные эффекты и локализация
мобильных элементов у дрозофилы. [Сообщ.] 2. Мобильные генетические эле-
менты Dt-412 // Генетика. 1987. Т. 23. № 1. С. 81-92.
404. Ratner V. A. Selection and stochastic trends in the theory of molecular micro-
and macroevolution // Proc. 2nd Intern. Conf, on Quantitative Genetics. 1988. Sunder-
land, Massachusetts, 1988. P. 104-123.
405. Соловьев В. В. Молекулярные механизмы блочных перестроек и их эво-
люционная роль в формирования геномов про- и эукариот // Молекулярные ме-
ханизмы генетических процессов. 6 Всесоюз. симп., Москва, 3-6 февр. 1987: Тез.
докл. М., 1987. С. 96-97.
406. Cebrat S. Kierunkowosc recombinacyjnych zmian wewnatrzgenomowych //
Kosmos. 1987. Vol. 36. N 3. P. 593-605.
407. Капитонов В. В. Мобильные генетические элементы как фактор эволю-
ций эукариотических популяций при экстремальных изменениях условий внеш-
ней // Молекулярные механизмы генетических процессов. 6 Всесоюз.
симп., Москва, 3-6 февр. 1987: Тез. докл. М., 1987. С. 79.
408. Коллендер А. Радиационная защита и восстановление. М., 1964. 400 с.
409. Hollaender A., Doherty D. G. Radiation damage and silphgydryl compounds.
Vienna, 1969. 253 p.
410. Корогодин S. Ч. Проблемы пострадиационного восстановления. M., 1966.
391 с. ' .
201
411. Семенов Л. Ф. Профилактика острой лучевой болезни в эксперименте.
Л„ 1967. 216 с.
412. Бек 3. Химическая защита от ионизирующей радиации. М., 1968. 263 с.
413. Романцев Е. Ф. Радиация и химическая защита. М., 1968. 248 с.
414. Ярмоненко С. П. Противолучевая защита организма. М., 1969. 264 с.
415. Эйдус Л. X. Физико-химические основы радиобиологических процессов
и защита от излучений. М., 1979. 216 с.
416. Кудряшов Ю. Б., Беренфелъд Б. С. Основы радиационной биофизики.
М., 1982. 302 с.
417. Рождественский Л. М. Механизмы радиозащитного действия протекто-
ров в аспекте индикации их эффективности // Науч, совет по пробл. радиобио-
логии. 1985. № 31. С. 34-37.
418. Эйдус Л. X. О молекулярных механизмах химической защиты нуклеи-
новых кислот от действия радиации // Радиобиология. 1971. Т. И. № 4. С. 595.
419. Спитковский Д. М., Мартынов Э. В., Писаревский А. Н. и др. К анализу
возможных структурных метаморфоз хромосом под действием некоторых био-
логически активных веществ на модели конденсированных надмолекулярных
систем дезоксирибонуклеопротеидов // 2 симп. по структуре и функции хро-
сом. Новосибирск, 1970. С. 69.
420. Граевский Э. Я., Тарасенко А. Г. Тиольная концепции радиочувствитель-
ности // Тр. IV Междунар. биофиз. конгресса. М., 1972. С. 54.
421. Boat Z. М., Alexander Р. Importance for radio-protection of the reaction of
cells to sulphydryl and disulphide compounds // Nature. 1964. Vol. 203. N 4941. P. 162.
422. Langendorff H., Langendorff M. Chemical radiation protection and the c-AMP
mechanism // Int. J. Rad. Biol. 1971. Vol. 19. N 5. P. 493.
423. Sutherland E. W., Rail T. W., Menton R. Adenyl Cydase. I. Distribution,
preparation and properties // J. Biol. Chem. 1962. Vol. 232. P. 1220.
424. Романцев E. Ф., Блохина В. Д., Жулонова 3. И. и др. Биохимические
основы действия радиозащитных средств // Радиобиология. 1977. Т. 17. № 5.
С. 672-686.
425. Филиппович И. В., Романцев Е. Ф. Модификация радиочувствительности
клеток и регуляторные механизмы биологических систем // Науч, совет по
пробл. радиобиологии. 1982. № 25. С. 11—15.
426. Восстановительные и компенсаторные процессы при лучевых поражени-
ях: Тез. докл. IX Всесоюз. науч, конф., Ленинград, окт. 1986. Л., 1986. 260 с.
427. Лебедев С. Н., Смирнова Ю. Д. Особенности пострадиационной кинетики
репаративных процессов в ДНК периферической крови крыс при модифициру-
ющем воздействии химич'еских агентов // Восстановительные и компенсатор-
ные процессы при лучевых поражениях. Л., 1986. С. 55-56.
428. Стрельников Ю. Е., Либикова Н. И., Чупахин О. Н. и др. Угнетение син-
теза ДНК под влиянием тиазолов и их радиозашитный эффект // Восстанови-
тельные и компенсаторные процессы при лучевых поражениях. Л., 1986. С. 84-85.
429. Изможерова Б. Л., Филаретов А. Н., Изможеров Н. А. Соотношение элект-
ронной структуры ДНК и химических модификаторов ее лучевого поражения //
Восстановительные и компенсаторные процессы при лучевых поражениях. Л.,
1986. С. 42-43.
430. Алферова Т. М., Сорокина Н. И., Филиппович И. В. Роль спонтанных
повреждений ДНК в радиезащитном действии радиопротекторов различных
классов иа тимоциты мышей // Восстановительные и компенсаторные процессы
при лучевых поражениях. Л., 1986. С. 6-7.
431. Гильяно Н. Я, Малиновский О. В. Репарация хромосом клеток млеко-
питающих в зависимости от состояния хроматина // Науч, совет по пробл. ра-
диобиологии. 1986. № 32. С. 79-80.
432. Симонян Н. В., Авакян Ц. М., Степанян Л. Г. и др. К вопросу о радио-
резистентности почкующихся клеток дрожжей // Науч, совет по пробл. радио-
биологии. 1983. № 27. С. 73-74.
433. Эйдус Л. X. Роль первичных и вторичных процессов в модификации ре-
202
" продуктивной гибели клеток кислородом и другими агентами // Науч, совет
по пробл. радиобиологии. 1983. № 27. С. 39—40.
4М . Соболев А. С., Кудряшов Ю. Б. Модификация радиочувствительности
клеток и регуляторные механизмы биологических систем // Науч, совет по
пробл. радиобиологии. 1982. № 25. С. 15-19.
435. Гончаренко Е. И., Кудряшов Ю. Б. Гипотеза эндогенного фона радиоре-
зистентности. М.» 1980. 176 с.
436. Бреслер С. Б. О решенных и нерешенных проблемах мутагенеза и репа-
рации // Повреждение и репарация ДНК. Пущино, 1980. С. 16—26.
437. Шарпюый В. А. Образование и превращение первичных нестабильных
продуктов в клетке. Возможности управления радиолитическими процессами //
' Науч, совет по пробл. радиобиологии. 1983. № 27. С. 46-47.
438. Шзрпотый В. А. Радиационная модификация ДНК и гистона в хроматине,
возможности управления этими процессами // Науч, совет по пробл. радиобио-
логии. 1985. № 31. С. 51-52.
439. Эйдус Л. X. О молекулярных механизмах, химической защиты нуклеи-
новых кислот от действия радиации // Радиобиология. 1971. Т. 11. №4. С. 595—598.
440. Граееский Э. Я., Тарасенко А. Г. Тиольная концепция радиочувствитель-
ности // Тр. IV Междунар. биофиз. конгресса. М., 1972. С. 54.
441. Парибок В. П. Природа пострадиационного восстановления. I. Определе-
ние и общая характеристика процесса // Защита и восстановление при лучевых
повреждениях. М., 1966. С. 20-35.
442. Hug О. Kinetic aspects of molekular and cellular radiation effects with special
reference to repair and recovery processes // Atomkemenergie. 1970. Bd 15. S. 59—67.
443. Фрадкин Г. Б. Возможность использования химических соединений в
качестве ловушек энергии при защите от проникающих излучений II Химиче-
ская защита организма от ионизирующих излучений. М., 1960. С. 127-135.
444. Tomlcic L, Pieber М„ Soto A., Toha IC. Radioprotection (UV- and Gamma-
груз) of DNA molekule by Indole and indolederivatives II Z. Naturforsch. 1973. Bd 28.
N7-b. S. 379-383.
445. Каминская Э. А., Мбссз И. Б., Фрейманис Я. Ф. Цитологический анализ
совместного действия рентгеновского излучения и некоторых инденовых соеди-
нений // Цитология и генетика. 1970. Т. 2. С. 168—171.
446. Рокиикий П. Ф., Моссз И. Б., Каминская Э. А. и др. Изучение защитного
действия инденовых соединений против генетического эффекта ионизирующих
излучений // Вопросы генетики и селекции. М., 1970. С. 121-134.
447. Парибок В. П. Репарационные системы клетки и вопрос об их чувстви- '
тельности к лучевым воздействиям // Цитология. 1967. Т. 9. № 12. С. 1449-1459.
448. Каркис Ю. Я Общая дискуссия // Первичные и начальные процессы
биологического действия радиации. М., 1972. С. 242—244.
449. Tafcebe И., Furuyama J., Miki Y., Kondo S. High sensitivity of xeroderma
pigmentosum cells to the cancerogen 4-nitroquinoline-l-oxide // Mutat. Res. 1972.
Vol. 15. N1. P. 98—103.
450. Payer J. F., Deering R. A., Freim J. O. Ir. Lethal effect of alkylating agents
or ultraviolet light on the gamma-ray resistant parent strain and gamma-ray sensitive .
strain ef cellular slime mould, Dictyostelium dicgrideum // Mutat. Res. 1972. Vol. 15.
N1. P. 82-87.
451. Арутюнян P. M„ Кулешов H. П. Модифицирующий эффект цистеина при
индуцировании тиоТЭФ хромосомных аберраций в культуре лейкоцитов чело-
века // Генетика. 1972. Т. 8. № 4. С. 148-153.
452. Gebhart Б. Die Wirkung von L-Cystefti auf die Aberrationsauslosung in
menschlichen ChrotnoBomen dutch chemische Mutagene. I. Dosiswirkungsbexiehungen
bei Verwendung von Trenimon als Aberrationsinduktor // Humangenotik. 1970. Bd 10.
N 2. S. 115-И9.
453. Gebhart Б. Die Wirkung von L-Cystein auf die Aberrationsauslosung in men-
schlichen Chramosomen dtirch chemische Mutagene. II. Zur Bedeutung des Zeitfaktors
203
bei Verwendung von Trenimon als Aberrationsinduktor // Humangenetik. 1971.
Bd 11. N 3. S. 237-242.
454. Фенольные соединения и их биологические функции. М., 1968. 344 с.
455. Кабиев О. К., Балмуханов С. Б. Природные фенолы — перспективный
класс противоопухолевых и радиопотенцирующих соединений. М., 1975. 190 с.
456. Запрометов М. Н. Биосинтез фенольных соединений и его регуляция //
Успехи соврем, биологии. 1971. Т. 72. № 2(5). С. 219—252.
457. Золотницкая С. Я., Акопян Г. О. Об изменении содержания токоферолов
в горных условиях в связи с УФ радиацией // Пробл. ботаники. 1965. Т. 7.
С. 183-191.
458. Норбаев Н. Содержание эндогенных фенольных соединений и радио-
устойчивость растений // Науч, совет по пробл. радиобиологии. 1984. № 29.
С. 49-50.
459. Нуждин Н. И., Пастушенко-Стрелец Н. А. Влияние экологических усло-
вий выращивания растений на частоту хромосомных аберраций у гамма-облу-
ченного растения // Тр. Ии-та генетики и селекции растений. София, 1968.
С. 47-54.
460. Кезели Г. А., Тарасашвили К. М. Изменчивость содержания витаминов
у луговых растений в связи с вертикальной зональностью // Пробп. ботаники.
1965. Т. 7. С. 176-182.
461. Алекперов У. К., Кульгавин А. Э. Спонтанная и индуцированная мута-
бильность растений, произрастающих в разных экологических условиях //
3 съезд ВОГиС: Тез. докл. Л., 1977. С. 15.
462. Алекперов У. К. Антимутагеиез в проблеме регуляции мутационного
давления среды // Наследственность человека и окружающая среда. М., 1984.
С. 163-180.
463. Криволуцкий Д. А., Смуров А. В., Снетков М. А. Влияние радиоактив-
ного загрязнения почвы стронцием-90 на изменчивость некоторых организмов //
Журн. общ. биол. 1972. Т. 33. № 5. С. 581-591.
464. Шевченко В. А., Визгин В. П., Алексеенко А. Я. Изучение мутационного
процесса в популяциях одноклеточных водорослей Chlorella и Chlamidomonas
при остром и хроническом облучении ионизирующим излучением // Генетика.
1969. Т. 5. № 9. С. 60-73.
465. Dain A., Kerkut G. A., Smith R. С. е. a. The interaction of free radicals of
protein and melanin // Experientia. 1964. Vol. 20. N1. P. 76—78.
466. Eidsinn M. 1. BinbHi радикали в опром!нених рослинах та набит. Ки!в,
1972. 205 с.
467. Pathak М. A. Photobiology of melanogenesis: biophysical aspects // Adv. Boil.
Skin. 1967. Vol. 8. P. 397-420.
468. Латыпов И. Ф., Всеволодов Э. Б., Голиченков В. А. Снижение выхода
индуцированных рентгеновским облучением долгоживущих парамагнитных
центров в шерсти при наличии в ней меланина // Радиобиология. 1979. Т. 19.
№2. С. 189-193.
469. Жданова Н. Н., Василевская А. И. Меланинсодержащие грибы в экстре-
мальных условиях. Киев, 1988. 195 с.
470. Commoner В., Townsend J., Раке G. С. Free radicals in biological materials //
Nature. 1954. Vol. 174. N 4432. P. 689-691.
471. Пюльман Б., Пюлымн А. Квантовая биохимия. M., 1965. 501 с.
472. Cobb J. Р. Effect of in vitro X-irradiation on pigmented and pale sleces of
Claudman S-91 melanomas as measured by subsequent proliferation in vivo // I. Nat.
Cancer Inst. 1956. Vol. 17. P. 657—661.
473. Commoner B., Townsedd J., Poke G. E. Free radicals in biological materials
// Nature. 1954. Vol. 174. P. 689-695.
474. Greenberg S. S., Корок M. J. Studies in gene action and melanogenic enzyme
activity in melanomatous fishes // Ann.' N. Y. Acad. Sci. 1963. Vol. 100. P. 887-890.
475. Святухин M. В., Ковалева В. Л. Теоретические и экспериментальные
основы терапии меланином. М., 1976. 168 с.
204
476. Пуцик Т. К., Ревина А. А. Пострадиационная регенерация кислородом
полифенольных соединений — антоциановых пигментов в кислой среде // Ра-
диобиология. 1985. Т. 25. № 3. С. 343—347.
477. Пуцик Т. К., Лысиков В. Н., Ревина А. А. Изучение промежуточных про-
дуктов радиолиза антоцианов как модифицирующего фактора мутагенеза //
2-й Всесоюз. конф, по прикладн. радиобиологии: Тез. докл. Киев, 1985. Ч. 3. С. 16.
478. Ревин А. Ф., Копылов В. А. Механизм действия полифенольно-хиноид-
ных соединений, образующихся в тканях гаммр-облученных животных, на ци-
тохром С Ц Науч, совет по пробл. радиобиологии. 1984. № 29. С. 34—36.
479. Wong G., Pawelek J. Control of phenotypic expression of cultured melanoma
cells by melanocyte stimulating hormones // Nature. New Biol. 1973. Vol. 241. N 111.
P. 213-215.
480. Шамрай E. Ф., Хмелевский Ю. В. Некоторые вопросы клинической ви-
таминологии // Врачеб. дело. 1964. № 2. С. 3—9.
481. Tsezos М., Volesky В. The mechanism of thorium biosorption by Rhizopus
arrhizus // Biotechnol. a. Bieongin. 1982. Vol. 24. N 4. P. 955—970.
482. Tsezos M., Volesky B. The mechanism of uranium biosorption by Rhizopus
arrhizus // Biotechnol. a. Bieongin. 1982. Vol. 24. N 2. P. 385—401.
483. Tsezos M. The role chitin in uranium adsorption by Rhizopus arrhizus //
Biotechnol. a. Bieongin. 1983. Vol. 25. N 8. P. 2025-2040.
484. Littefield N. A., Wankier B. N., Salnukhe D. K. e.a. Fungistatic effects of
controlled atmosphere // Appl. Microbiol. 1966. Vol. 14. N 4. P. 579—581.
485. Tribe H. T., Mabadeje S.A. Growth of moulds on media prepared without
organic nutrients // Trans. Brit.Mycol.’Soc. 1972. Vol. 58. N 1. P. 127-137.
486. Greenaway W. Relationship between meicury resistance and pigment produc-
tion in Pyrenophora avenae // Trans. Brit. Mycol. Soc. 1971. Vol. 56. N 1. P. 37—44.
487. Kimball R. F. The relation between repair of radiation damage and mutation
induction // Photochemistry and Photobiology. 1968. N 8. P. 515—520.
488. Луеис Я. Я. О возрастании доли черных доминантных форм в популяци-
ях божьих коровок Adalia bipunctata // Изв. АН ЛатвССР. 1987. № 9. С. 81—89.
489. Риклефе Р. Основы общей экологии. М., 1979. 424 с.
490. Creed Е. R. Industrial melanism in the twosport ladybird and smoke abatenunt
// Evolution. 1971. Vol. 25. N 2. P. 290-293.
SUMMARY
Primary radiogenetic effects and distant genetic consequences of
irradiation are considered. There are given literature and own experimen-
tal data on protection of organisms and populations against single and
long-term (over dozens of generations) action of ionizing radiation. The
problem of population adaptation to small doze irradiation is discussed.
The book is intended for geneticists, radiobiologists and physicians.
ОГЛАВЛЕНИЕ
Предисловие ........................................................ 6
Глава 1. tamaoreaenmeuan эффекты в клетках эукариот....... 8
1.1. Первичные повреждения, вызываемые в ДНК ионизирующей ра-
диацией ........................................................... 8
1.2. Особенности возникновения точковых и хромосомных мутаций .. И
1.3. Общность происхождения хромосомных и точковых мутаций .... 27
Глава 2. Влияние химических нянями на гснетнческое-дейпвие облу-
чения у животных .................................................. 30
11. Серосодержащие радиопротекторы........................— 30
2.2. Амины......................................................... 43
2.3. Антибиотики ..........................................-... 45
2.4. Фенолы........................................................ 48
2.5. Вещества естественного происхождения.......................... 50
Глава 3. Антнмутагенное действие инденовых соединений у дрозофилы 52
3.1. Обоснование исследований и методика работы.................... 52
3.2. Зависимость антимутагенного эффекта от структуры препарата ... 57
3.3. Влияние инденовых соединений на выход мутаций иа разных ста-
диях сперматогенеза ............................................... 59
3.4. Влияние инденовых соединений иа соотношение точковых и хро-
мосомных мутаций, индуцированных облучением........................ 67
3.5. Влияние инденовых соединений иа локализацию разрывов хромо- '
сом................................................................ 71
Глава 4. Антимутагеявое действие инденовых соединений у мышей
и в кужтявжруемых клетках человека ............................ 75
4.1. Методика работы с мышами...................................... 75
4.2. Зависимость антимутагенного эффекта от концентрации инденовых
препаратов ....................................................... 76
4.3. Зависимость антимутагенного действия инденовых соединений от
дозы облучения и способа введения в организм ...................... 78
4.4. Исследование возможности снижения генетического эффекта про- .
лонгированиого облучения .......................................... 84
4.5. Аитимутагениое действие инденовых соединений в культивиру-
емых клетках человека .............. 90
Глава 5. Влияние меланина на мушякииий1 процесс, • индуцированный
облучением у животных.............................................. 94
5.1. Биологическая роль меланиновых пигментов ..................... 94
5.2. Антимутагенный эффект меланина у дрозофилы.................... 97
53. Влияние меланина на индукцию мутаций у мышей............. 99
Глава 6. Моаворинг приспособленности згг г ирными аанныт популя-
Epril дроэофнлы ярт длигельвом воздвйспяв облучммя к мвмияпп 103
6.1. Влияние ионизирующих излучений и» популяции.................. 103
6.2. Методика работы.............................................. 105
6.3. Динамика численности особей.................................. 107
6.4. Динамика плодовитости особей................................... Ш
6.5. Динамика жизнеспособности особей ............................ 116
6.6. Взаимосвязь элементов приспособленности ..................... 118
206
Глава 7. Мониторинг мутационного груза в экспериментальных популя-
рна дрозофилы при дшпоьим воздействии облучения и меланина 124
7Л. Анализ рецессивных сцепленных с полом летальных мутаций ... 124
7Л Динамика видимых мутаций ................................... 130
7 3 Динамика доминантных летальных мутаций................... 134
Глава 8. Исследование резистентности экспериментальных популяций
к мутагенным факторам......................................... 142
8.1. Сравнение радиочувствительности популяций разных типов.. 142
ЪЛ. Сравнение чувствительности популяций разных типов к химиче-
скому мутагену ЭМС.............................................. 149
8.3. Механизмы адаптации популяций ............................. 152
Глава 9. Механизмы защиты от радиогенетических поражений....... 159
9.1. Некоторые общие механизмы защиты............................. 159
9.2. Механизмы антимутагенного действия инденовых соединений ... 166
9.3. Механизмы радиозащитного действия меланина .................. 171
9.4. Экспериментальное изучение механизмов антимутагенного дей-
ствия меланина ................................................... 176
Литература ....................................................... 182