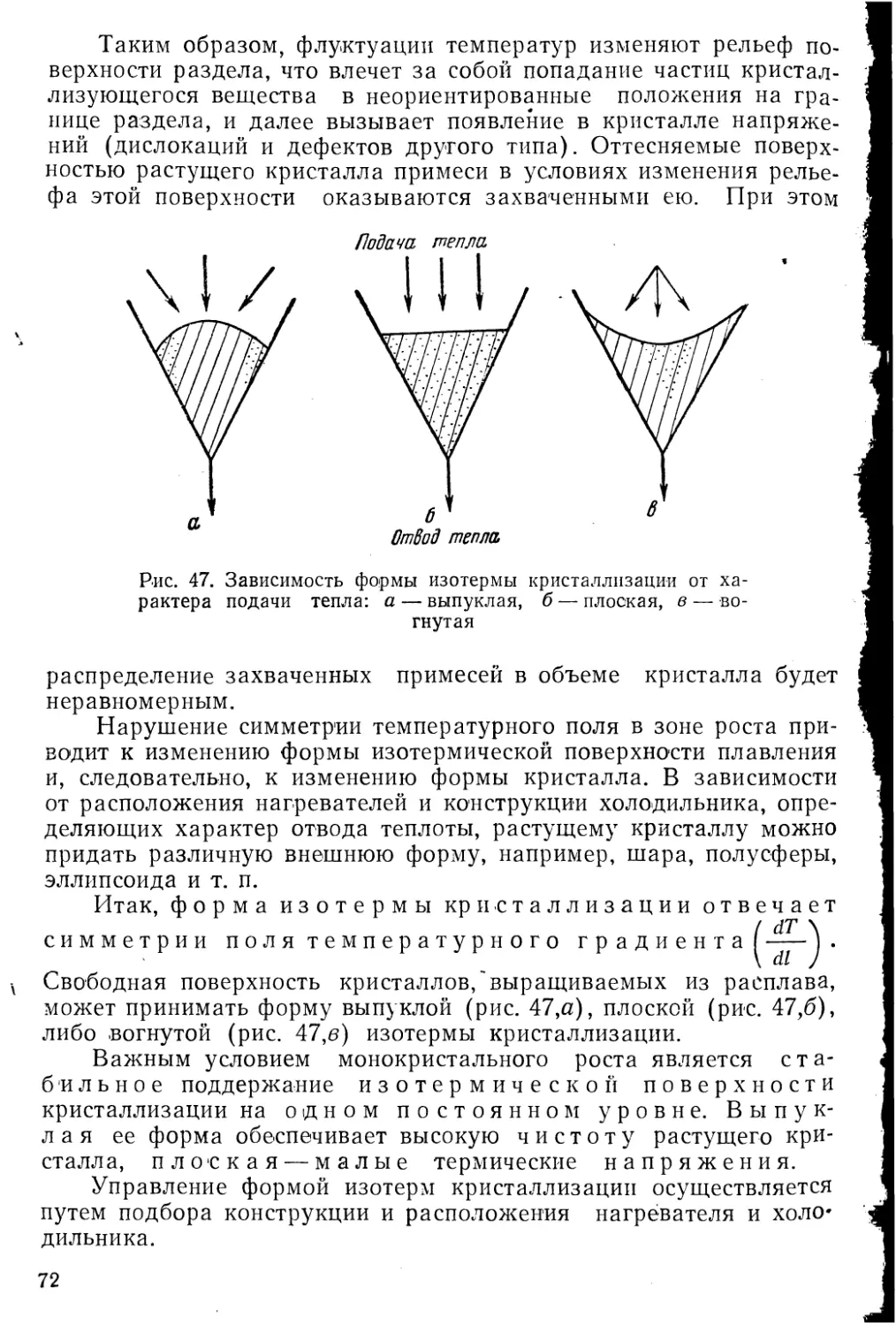
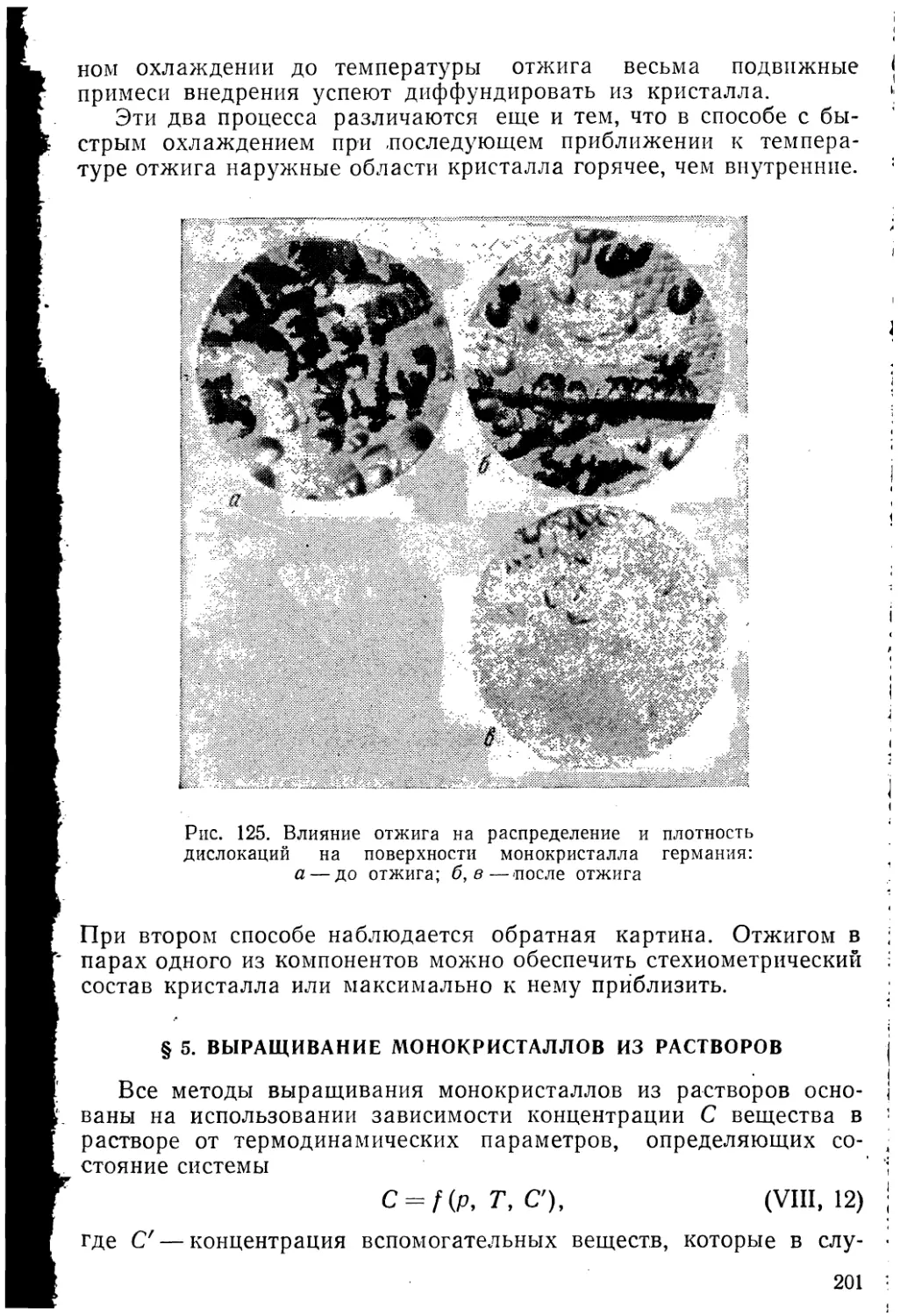
Автор: Козлова О.Г.
Теги: зарождение, рост и растворение кристаллов физика химия кристаллы
Год: 1967
Текст
o.r. нозлова
..... ...,....
I I
I
.....+...
I I
I
РОСТ
КРИСТАЛЛОВ
УДК 548.5
Издание рассчитано на студентов химических,
физических, геологических факультетов и вузов, где читается курс
роста кристаллов, а также на научных работников и
инженеров, интересующихся вопросами кристаллизации вещества.
Предлагаемое учебное пособие представляет собой первый
опыт краткого систематического изложения основных
положений роста кристаллов. В книге рассмотрены условия
зарождения и современные теории роста кристаллов. Подробно
описана макро- и микроморфология кристаллов, которые
следует рассматривать как ключ к решению генетических
проблем. Много места уделено описанию типов дефектов в
кристаллах, их связи с условиями роста и свойствами
кристаллов. Большую часть книги составляет описание практики
выращивания монокристаллов и закономерных
кристаллических сростков. В ней отражены способы очистки исходного
сырья, современные методы получения монокристаллов из
газовой, жидкой и твердой фаз.
\
2—9—3
167—67
ПРЕДИСЛОВИЕ РЕДАКТОРА
В 1962 г. на праздновании 50-летия знаменитого «эпохального»
открытия Лауэ — дифракции рентгеновых лучей на кристаллах —
многие из собравшихся в Мюнхене кристаллографов не
сомневались в том, что именно с этим открытием связана единственная
величайшая революция в кристаллографии, резко сместившая
центр тяжести нашей науки к внутреннему механизму кристаллов,
к их атомному строению в весьма малой связи с внешней формой.
Любопытно, что таковым же стало в то время отношение к форме
и размерам минерала со стороны полевых
минералогов-разведчиков, петрографов, «полезников». Но как раз в те же годы (конец
50-х — начало 60-х годов) совершалась в нашей науке еще более
мощная революция — смещение интереса в сторону
макрокристалла и притом достаточно крупного. Для минералога крупный
макрокристалл оказался открытой книгой, в которой записана его
собственная история и судьбы месторождения. Для
кристаллографа это объект проявления, изучения и использования
поразительных свойств кристалла, непрерывно революционизирующих науку
и технику. Цены на идеальные природные кристаллы сильно
возросли, оправдывая большие затраты на их искусственное
выращивание, которым занялось непрерывно увеличивающееся число
специальных лабораторий, институтов и кафедр кристаллографии.
Последние же стали особо популярными на геологических
факультетах.
Долгое время казавшиеся чисто теоретическими споры о
реальном и идеальном кристаллах сейчас, уже сами азбучные
истины. Специалист должен уверенно ориентироваться в
соответствующих разделах химической технологии и разбираться в основах
молекулярного роста кристаллов. Выходящее учебное пособие по
росту кристаллов О. Г. Козловой основывается на том курсе,
который она ведет в течение уже многих лет на кафедре
кристаллографии МГУ. Автор вносит в свою книгу почти все то, чем живут
московские ростовые лаборатории, с которыми кафедра
поддерживает непосредственную связь.
Н. В. Белов
\
ВВЕДЕНИЕ
Во многих областях физики, химии и геологии все чаще
приходится работать с различными кристаллами, иметь дело с их
образованием, разрушением, растворением и т. д. Вопросы роста
кристаллов приобрели актуальное значение в последние два
десятилетия, когда искусственно выращенные однородные
монокристаллы различных веществ получили широкое применение в
промышленности и технике в качестве заменителей природных
кристаллов — минералов; в ряде случаев синтетические
монокристаллы оказались лучшего качества, чем природные. Открылась
возможность получения монокристаллов с заданными свойствами.
С общей проблемой роста кристаллов непосредственно
переплетается ряд частных: возникновение кристаллической фазы из
жидкой и газообразной, процессы срастания, растворения
кристаллов, изменение облика кристаллов под влиянием примесей в среде,
где происходит кристаллизация, образование смешанных
кристаллов и изоморфизм, а также многие вопросы, связанные с
образованием кристаллов в природе.
Исходя из теории кристаллической решетки, возможно
вычислить ряд величин, характеризующих физические свойства
кристаллов: модуль сжимаемости, модуль упругости, модуль сдвига,
удельную поверхностную энергию и т. д. Эти вычисленные
значения для подтверждения правильности теории необходимо сравнить
с экспериментальными. Для этого нужны небольшие, но весьма
■совершенные кристаллы.
Практика же предъявляет к кристаллам свои требования,
которые чаще всего сводятся к получению кристаллов больших
размеров с заданными свойствами: кристаллов для регистрации
•ядерных излучений в сцинтилляционных счетчиках, различных
полупроводниковых материалов, кристаллов с высокими
пьезоэлектрическими и оптическими качествами. Металлургов и
металловедов интересуют физические процессы образования кристаллов,
4
ибо многие свойства металлов зависят от условий кристаллизации.
Проблемы роста кристаллов становятся центральными для
минералога во всех вопросах кристаллогенезиса. В их экспериментах
по кристаллизации минералов выясняются вопросы
растворимости, механизм перекристаллизации вещества и т. п. Иногда в
работах по кристаллизации минералов стараются имитировать
природные процессы путем их моделирования.
В 1954 г. появились приборы (мазеры и лазеры), работающие
по принципу генерации и усиления электромагнитных колебаний
с помощью кристаллов, получение которых приобрело сейчас
особую актуальность во всех странах мира. Большой интерес
вызывают закономерно построенные кристаллические агрегаты:
текстуры, пьезоэлектрические, оптические, ферриты и т. п.
В работах по выращиванию кристаллов неоценимую пользу
приносит огромный фактический материал кристаллохимии по
изоморфизму, политипии и т. п.
Укажем на некоторые кристаллы, имеющие наиболее широкое
применение в науке и технике. Кристаллы алмаза используются
в качестве фильер для волочения '.проволок, при бурении твердых
пород, при обработке закаленных сталей, -сверхтвердых сплавов
и т. д. Кристаллы флюорита стали обязательной частью в
оптических приборах, в микроскопах с высокой разрешающей
способностью, а также в приборах, работающих в невидимых областях
спектра. Активированные редкоземельными элементами (чаще
Sm), они используются в мазерах и лазерах. Микроподшипники
из .кристаллического корунда (рубина) играют основную роль в
часовых механизмах, электрических счетчиках, буссолях и
всевозможных точных приборах. Активированные хромом, кристаллы
корунда получили применение в квантовых генераторах. В
лабораторных и 'промышленных условиях их получают из расплава в
пламени гремучего газа при температуре, близкой к 2000° С.
Кристаллы кварца заняли исключительное положение в науке и
технике. Пьезокварцевые пластинки незаменимы для стабилизации
частоты колебаний радиоволн, измерения глубины моря, в
ультразвуковых устройствах, для связи между подводными лодками, в
качестве важных деталей многих технических и физических
приборов (весов, точнейших часов и т. д.). Прозрачность кристаллов
кварца в ультрафиолетовой части спектра — ценное свойство,
которое используется при изготовлении призм к спектральным
приборам и для многих других целей. Применение кристаллов кварца
связано и с его способностью вращать плоскость поляризации.
Кристаллы сегнетовой соли с исключительными
пьезоэлектрическими и диэлектрическими свойствами, носящими название сег-
нетоэлектрических (ферроэлектрических) свойств, употребляются
для конденсаторов, громкоговорителей, адапторов, микрофонов,
передающих устройств и других целей. Кристаллы кальцита или
•исландского шпата до сих пор незаменимы при изготовлении ни-
колей, являющихся основной частью поляризационных микроско-
5
пов, сахариметров и других приборов. Монокристаллы германия,
кремния и ряда соединений типа AnBVI (главным образом
сульфидов), AnlBv (фосфидов, арсенидов и др.) используются как
полупроводниковые материалы. Чаще всего такие кристаллы
получают в виде пленок из газообразной фазы.
Кристаллы шеелита, а также многих органических
соединений, активированные определенными элементами, обладают
способностью люминесцировать под действием радиактивных лучей и
используются в сцинтилляционных счетчиках, регистрирующих
эти излучения. Особую группу составляют кристаллы щелочных
•галогенидов, применяющихся в оптических приборах.
Мы назвали немногие из промышленно важных кристаллов.
Для получения 'Синтетических кристаллов необходимо знать
условия их зарождения и роста, возможные ростовые дефекты
кристалла и причины этих дефектов. Четкая картина процесса
кристаллизации необходима, чтобы так или иначе влиять на этот
процесс. Возросшее за последние 30 лет использование
монокристаллов способствовало развитию многочисленных теоретических
•и экспериментальных работ в 01бласти изучения закономерностей
роста кристаллов. Теория роста идеального совершенного, а
позднее возникшая теория роста идеального несовершенного
кристаллов дали ответ на многие важные вопросы, касающиеся механизма
роста и растворения кристаллов. При исследовании
кристаллической поверхности используются такие мощные приборы, как
электронный микроокоп, разнообразные интерферометры.
Несмотря на большие достижения в области теоретических
работ по кристаллизации вещества, в настоящее время еще нет
общепризнанной теории образования реального кристалла, и меж-'
ду теоретическими исследованиями по росту и практическими
работами по выращиванию существует большой разрыв.
Процесс роста кристаллов настолько сложен, что объяснить его
всесторонне с единой точки зрения пока трудно: одни вопросы
объясняются с позиций молекулярно-кинетических, другие — с
позиций дефектов, почти всегда имеющихся в кристаллах.
Предлагаемая попытка составления учебного поюобия по рос-, I
■ту кристаллов оказалась нелегким делом, поскольку имеющийся
богатый практический и литературный материал разобщен, мало
систематизирован и его не так легко использовать как в
вузовском, так и в индивидуальном обучении.
В основу этого руководства положены лекции, прочитанные 1
автором на геологическом факультете МГУ с 1956 по 1966 г.
Автор приносит благодарность Н. В. Белову за большую
работу в редактировании книги; рецензировавшим книгу проф. I
Л. С. Палатнику, докт. физ.-мат. наук В. П. Бутузову, доц. i
И. С. Резу и ст. науч. сотр. Л. И. Ковалевскому; акад. А. В. Шуб-
никову, доц. А. С. Строителеву, доц. В. А. Мокиевскому, ст. науч.
сотр. Т. Г. Петрову, научным сотрудникам А. П. Касаткину и
Е. Б. Трейвусу и доц. А. А. Майеру за ряд ценных замечаний.
6
Глава I
КРИСТАЛЛИЗАЦИЯ КАК ФАЗОВОЕ ПРЕВРАЩЕНИЕ
ВЕЩЕСТВА
§ 1. ОБЩИЙ СЛУЧАЙ ФАЗОВЫХ ПРЕВРАЩЕНИЙ.
КРИСТАЛЛИЗАЦИЯ ИЗ ТВЕРДОГО, ЖИДКОГО И ГАЗООБРАЗНОГО
СОСТОЯНИЙ
Помимо трех фазовых состояний вещества: газообразного,
жидкого и твердого приходится считаться с существованием еще
и межфазного состояния. В фазовой диаграмме (рис. 1) область
межфазного состояния лежит выше критической точки К. В ней
вещества характеризуются наименьшей термодинамической
устойчивостью. Здесь ни при каком давлении не происходит
конденсация пара в жидкость. В области пониженной устойчивости фазы
существуют, но не могут сосуществовать. Примером если не
теоретического, то практического межфазного состояния могут
служить жидкие кристаллы.
Превращения вещества из одного состояния в другое при
соответствующих термодинамических условиях, которые
сопровождаются возникновением границы раздела двух фаз, характеризую-
щиеся скачком теплосодержания О и обращением теплоемкости в
бесконечность, как известно, называются фазовыми
переходами первого рода. Фазовые переходы второго
рода, напротив, характеризуются отсутствием резкой границы
раздела и .скачка Q, при этом теплоемкость остается конечной
величиной. Фазовые переходы второго рода представляют собой
скачкообразное изменение лишь некоторых свойств жидкости или
твердого тела. Так, при плавном изменении внешних условий ряд
свойств жидкостей (поверхностное натяжение, показатель
преломления, плотность ..и другие), находящихся в квазикристаллическом
состоянии, может меняться скачком, что позволяет говорить об их
полиморфизме. В частности, для воды это постепенное изменение
заходит настолько далеко, что ее при температурах, близких к 0°
и 25—75° С, можно рассматривать как два различных по своей
7
природе растворителя. Примером фазового перехода второго рода
в кристаллических телах являются точки Кюри, ограничивающие
температурную область .существования ферромагнитного
превращения в магнетиках и спонтанной поляризации в сегнетоэлектр§и-
ках. Из всего многообразия фазовых превращений нас, прежде
всего, интересуют процессы перехода вещества из любого
состояния в кристаллическое (кристаллизация вещества).
Чтобы вырастить монокристалл из вещества,
находящегося в любом агрегатном состоянии, необходимы три условия:
Рис. 1. Р—V — изотермы С02 Рис. 2. Диаграмма состояния
■по экспериментальным данным воды
Л перевод системы в метастабильное состояние,
Наличие затравочного кристалла и
^.направленны йтеплоот во д. '
Метастабильное состояние — это относительно устойчивое
состояние пересыщенных растворов, переохлажденных расплавов
и т. д., которое перестает быть устойчивым, когда в систему
вводится затравка — кристаллик не меньше определенного, так
называемого критического размера. На затравке происходит
кристаллизация вещества, если при этом обеспечен постоянный
отвод тепла. Например, кристаллизация льда из переохлажденной
воды может быть осуществлена в области ВОД (рис. 2).
Протяженность метастабильной области зависит от природы
вещества, от степени загрязненности и других причин. При
перемешивании максимально возможное переохлаждение воды, при
котором еще не наступает самопроизвольная кристаллизация, не
превышает 0,4—0,5° С; вода, находящаяся в спокойном состоянии,
может быть переохлаждена до 30° С. Многие органические
вещества (тимол, салол и др.) допускают переохлаждение более чем на
8
20° С. Металлы характеризуются небольшим протяжением метаста-
бильной области.
Кристаллизация из метастабильного состояния может быть
вызвана, если предварительно затратить работу А на образование
поверхности раздела двух фаз, т. е. затравочного кристалла. При
этом вероятность образования зародыша а находится в
экспоненциальной зависимости от работы А.
I
где k — газовая постоянная Больцмана,
Т—абсолютная температура.
Как видно из фазовой диаграммы воды (см. рис. 2), вероят- '
ность образования зародышей возрастает по мере продвижения .
от кривой ОВ влево. Нет четкой границы метастабильной и обла- \
сти спонтанной (самопроизвольной) кристаллизации жидкости,
которая наступает, когда величина созданного запаса энергии
больше или равна работе, затраченной на образование зародыша.
Например, для кристаллизации
ортохлорнитробензола
необходимо затратить А = 22000 кал/г моль.
Кристаллизация, как и любой
фазовый переход, значительно
легче осуществляется на
примесях. Если систему особенно
тщательно очистить от примесей, то,
будучи в большой мере
переохлажденной, она потеряет
способность к кристаллизации.
Многочисленные опыты по выдержке
переохлажденных, предварительно перегретых, тщательно
очищенных и помещенных в герметически закрытых сосудах жидкостей,
показывают, что верхняя граница метастабильной области А'В'
(рис. 3) может быть сдвинута далеко влево.
Одним из параметров кристаллизации является время.
Процессы кристаллизации, рассматриваемые во времени, называют
кинетическими. Различают три типа кинетических кривых кристал- >
лизации.
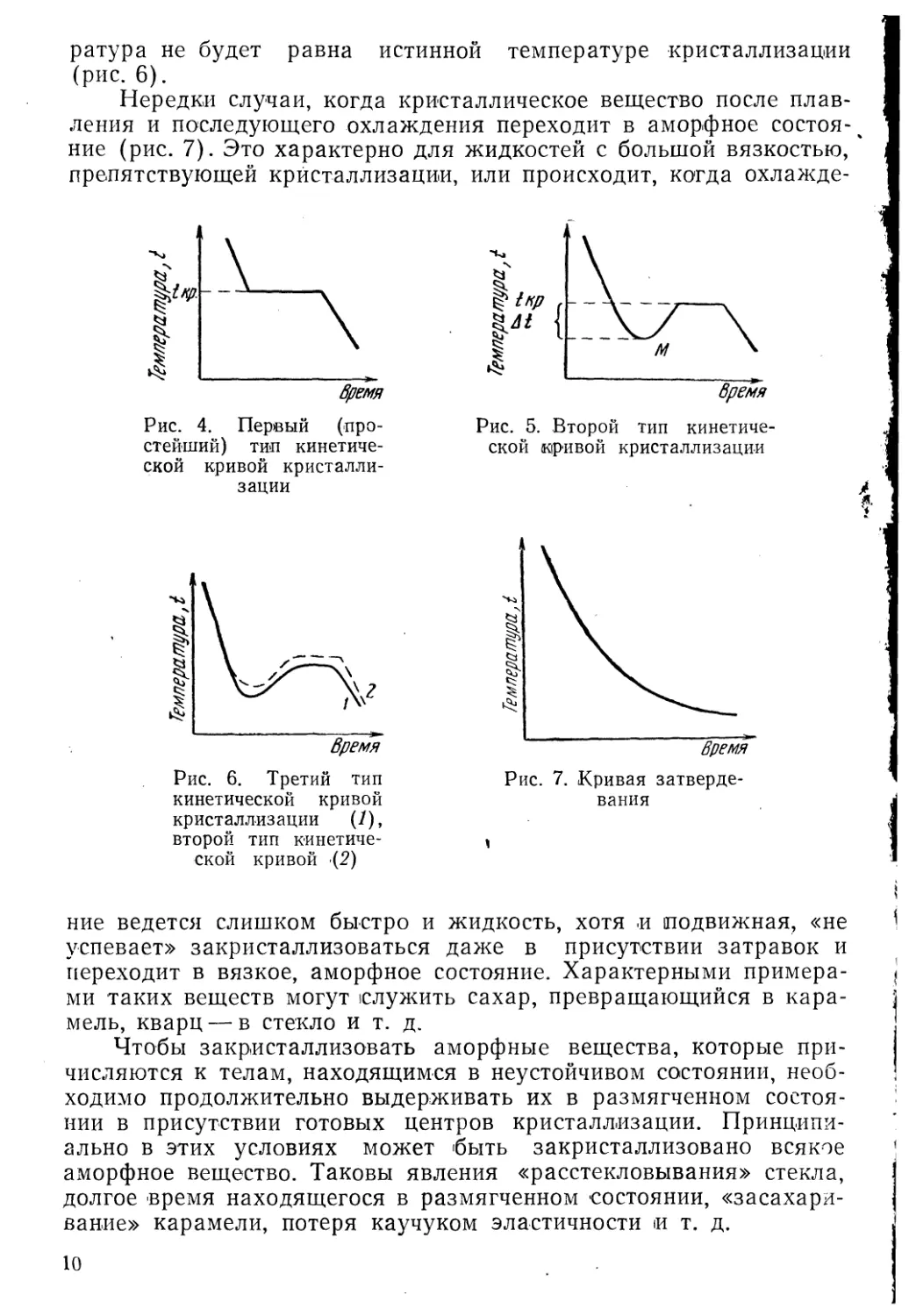
Простейший тип кинетической кривой показан на рис. 4. На
оси ординат отложена температура, на оси абсцисс — время, tKV —
температура кристаллизации. Кривая этого вида отражает
идеализированное представление о процессах кристаллизации. На самом
деле начало кристаллизации обычно имеет место при температурах
более низких, чем ^Кр (рис. 5). Тепло кристаллизации в М нагре-\
вает систему и она принимает температуру кристаллизации ^Кр f
(А^—степень переохлаждения). При значительном
переохлаждении и быстром процессе охлаждения подъем температуры может
ч не достигнуть этого уровня. В этом случае наблюдаемая темпе-
Абсолютно неу- В
в 'о/ стойчи6аягла- /Относительно
вес /о бильная 'устойчивая,
область s жтаста^ув
О
/\'у' "u"L^t*r стабильная область
д (Область ненасыщенных
растворов)
7°
Рис. 3. Простейшая фазовая
грамма растворимости
дна-
9
ратура не будет равна истинной температуре кристаллизации
(рис. 6).
Нередки случаи, когда кристаллическое вещество после плав-
ления и последующего охлаждения переходит в аморфное
состояние (рис. 7). Это характерно для жидкостей с большой вязкостью, а
препятствующей кристаллизации, или происходит, когда охлажде-
!
\
\
Время
Рис. 4. Переый
(простейший) тип
кинетической кривой
кристаллизации
1
{
время
Рис. 5. Второй тип
кинетической кривой кристаллизации
1
Время
Рис. 6. Третий тип
кинетической кривой
кристаллизации (/),
второй тип
кинетической кривой (2)
I
Время
Рис. 7. Кривая
затвердевания
ние ведется слишком быстро и жидкость, хотя и иодвижная, «не
успевает» закристаллизоваться даже в присутствии затравок и
переходит в вязкое, аморфное состояние. Характерными
примерами таких веществ могут служить сахар, превращающийся в
карамель, кварц — в стекло и т. д.
Чтобы закристаллизовать аморфные вещества, которые
причисляются к телам, находящимся в неустойчивом состоянии,
необходимо продолжительно выдерживать их в размягченном
состоянии в присутствии готовых центров кристаллизации.
Принципиально в этих условиях может быть закристаллизовано всякое
аморфное вещество. Таковы явления «расстекловывания» стекла,
долгое время находящегося в размягченном состоянии,
«засахаривание» карамели, потеря каучуком эластичности и т. д.
Ю
Температура плавления остается неизменной только при
постоянстве внешнего давления. При увеличении давления
температура плавления может либо повышаться, либо понижаться. Для
изменения температуры плавления на несколько градусов необхо- (
димо изменить давление на тысячи атмосфер.
Удельный объем, как правило, претерпевает резкое изменение
при переходе вещества из жидкого состояния в кристаллическое.
Знак этого изменения зависит от кристаллической структуры
вещества. Большинство кристаллических тел при кристаллизации
уменьшается в объеме, особенно сильно — железо, олово, свинец.
Вода, висмут, кремний и другие вещества при кристаллизации
расширяются. В практике кристаллизации знак и величина
изменения объема, конечно, очень важны.
Кристаллизация из растворов и расплавов
Растворами называются такие системы, в которых одно
вещество равномерно распределено в среде другого или других
веществ. В .общем случае этот термин может относиться к любому
агрегатному состоянию системы. Сюда входят смеси газов, жидкие
растворы и твердые растворы или смешанные кристаллы. Процесс
растворения связан с различными взаимодействиями химического
и физического характера между частицами растворенного
вещества и растворителя.
Частицы, образующие раствор, могут быть атомами,
молекулами или ионами. В соответствии с этим различают атомные,
молекулярные, ионные растворы (электролиты), которые часто
называются истинными растворами. Если растворенное вещество не
находится в состоянии молекулярной (атомной, ионной)
дисперсности, то тогда говорят о коллоидных растворах. И, наконец, более
крупные частицы (агрегаты) составляют механические смеси.
Сейчас в вопросах о строении жидкостей, в частности
растворов, преобладает- та точка зрения, которая рассматривает
жидкость ближе к кристаллу, чем к газу. Отсюда следует активная
роль жидкости то отиьшению к растущему в ней кристаллу. Это
можно проиллюстрировать на примере воды и некоторых водных
растворов, структуры которых в последнее время подвергаются
детальному изучению.
В агрегировании молекул воды основную роль играют
осуществляемые протонами водородные связи, энергия которых
(5—10 ккал/моль) зависит от длины. Она невелика по сравнению
с энергией ионной и ковалентной (сотни ккал/моль), но
значительна по сравнению с энергией вандер-ваальсовских .связей. Без
водородных связей, судя по тенденции изменения температур у
аналогичных веществ, вода имела бы ^Пл — —100° С и Wi——80° С.
Направленность водородной связи роднит ее с ковалентной,
поэтому среди кристаллов с водородными связями часто
встречаются рыхлые структуры. Такова и структура льда. О ней обычно
roll
ворят, что она аналогична структуре тридимита с тем отличием,
что протон колеблется между двумя атомами кислорода. Молекула
воды связана с четырьмя ближайшими соседями, в результате
чего образуется ажурная постройка.
Увеличение (плотности при переходе лед—вода составляет
10%. Уплотнение происходит за счет того, что часть молекул
воды (10%) приобретает координационное число 6. Такое состояние
воды неустойчиво. Меняющееся соотношение между разного рода
молекулами (в отношении координации) объясняет целый ряд
аномалий воды.
Структуру воды можно также сравнить со структурой алмаза,
в котором, однако, состояние атома связано парами ковалентных
электронов, тогда как в воде связь осуществляется единственным
осциллирующим протоном.
Растворение в воде сводится к внедрению в ее структуру
ионов посторонних веществ, что приводит к целому ряду
эффектов, величина которых зависит от размера иона, его заряда,
концентрации.
, Процесс растворения есть процесс химический, т. е. он
происходит при непременном взаимодействии растворяемого вещества
и растворителя. Это всегда сопровождается тепловыми,
объемными и другими явлениями. Последние рассматривают как
следствие возникновения в растворах группировок (в большей ,или
меньшей степени неустойчивых во времени), 'Состоящих из иона (Me)
растворенного вещества и окружающих ионов (молекул)
растворителя. Прочность группировки или комплекса определяется типом
связи ион—кислород воды i(Me—О). Экспериментально доказано,
что в случае побочных подгрупп связь Me—О имеет ковалентный
характер. Степень ковалентности -(прочности) связи Me—О
помимо индивидуальных свойств самого иона будет зависеть от
концентрации других ионов с соответствующим значением
электроотрицательности. В щелочных растворах связь в гидратных
комплексах прочнее, чем в растворах с большой концентрацией ионов
и с высоким значением электроотрицательности водорода, хлора
и др. Так, в водных растворах едкого натра кремнезем существует
в виде комплексов i[Si04]-aq, алюминий в виде [AlOJ-aq, цинк в
виде [Zn04]-aq, марганец в виде [Mn06]-aq и т. д. Все эти
комплексы являются основным «строительным материалом» при
синтезе алюмо-цинкосиликатов и силикатов марганца в водных
растворах NaOH. Впервые Н. В. Беловым показано для цеолитподобных
фаз, что алюмо-кремнекислородные тетраэдры в силу своей
химической инертности -строят каркас вокруг активных центров
«затравок». Роль таких затравок играют крупные ассоциации молекул
воды или натриевые, гидратированные центры.
Можно говорить о ближней и дальней сольватации
(гидратации). Под ближней — понимают прочное, постоянное связывание
ионом молекул растворителя, под дальней — изменения, происхо-
; дящие с остальной частью молекул растворителя (изменение ско-
12
рости диффузии, плотности и пр.). Их различают по величине
скорости диффузии молекул воды, находящихся в непосредственной
близости от иона (.по О. Я. Самойлову).
Взаимодействие между ионом и растворителем не
ограничивается только ближайшими молекулами. В растворе вся масса
воды оказывается в сильном электростатическом поле ионов.
Образовавшиеся в растворе гидратные комплексы определяют
структурную характеристику кристаллизующейся фазы.
Весьма распространенно представление о сиботактическом
строении жидкости. В момент плавления исчезает единая
кристаллическая решетка, но взаимные расположения атомов не
становятся вполне произвольными. Таким образом, не только вода, но
и другие вещества при плавлении отчасти сохраняют структуру
(«ближний» порядок, но не «дальний») соответствующего
твердого тела. Показано, что способность жидкости к переохлаждению
зависит от различия структуры жидкости и твердого тела. Чем
меньше разница между этими структурами, тем больше склонность
жидкости к переохлаждению. Для воды показано, что, кроме того,
степень переохлаждения зависит от предыдущей истории жидкости
и до перегрева ~30° С переохлаждение пропорционально
предварительному перегреву. Последнее связано с тем, что в воде велико
время релаксации — время установления равновесного состояния
в данных условиях. При термической обработке нарушается
равновесие — ближний порядок, который затем лишь медленно
восстанавливается.
Все эти факты и соображения заставляют подходить к
изучению растворов, как структурных систем. Кристаллизация из
растворов есть прежде всего перегруппировка частиц. Ряд авторов,
начиная с П. П. Орлова и П. А. За,мятченского, описывая
кристаллизацию из растворов, выделяют процессы дегидратации (де-
сольватации), с одной стороны, и процесс взаимодействия
(«атаки») частиц раствора с кристаллической поверхностью, с другой.
Легко видеть, что структура грани играет важнейшую роль в
кристаллизации вещества из растворов.
При выращивании кристаллов из растворов мы .имеем дело
с многокомпонентными системами. В простейшем случае (двойной
системе) одной 'компонентой выступает растворяемое
кристаллическое вещество, другой — растворитель. Однако практически
приходится считаться с тем, что в растворах присутствуют
различного рода примеси, оказывающие заметное влияние на процесс
кристаллизации и свойства растущего кристалла. Полностью
исключить это влияние представляет собой очень сложную и трудоемкую
задачу. Во всяком случае, успешное выращивание идеальных
монокристаллов возможно при использовании достаточно чистых
реактивов.
Процесс кристаллизации из раствора состоит в отдаче
растворителем избытка растворенного в нем вещества. Отсюда следует,
что кристаллы могут выпадать только из пересыщенных растворов.
13
Пересыщение можно вызвать удалением (например, испарением)
растворителя или изменением (снижением или повышением)
температуры. Удаление растворителя можно осуществить также пу-
\ тем введения в раствор другого вещества, более растворимого,
чем -первое. Осаждение первоначально растворенного вещества
будет результатом частичного отнятия растворителя вторым вновь
введенным в раствор веществом. Так, добавление парафина к
раствору серы в сероуглероде обусловливает выделение из раствора j
кристаллов серы. Введение спирта в насыщенные водные раство- s
ры многих неорганических солей почти всегда приводит к
образованию в массе раствора облака мелких кристаллов растворенных
солей.
Для подавляющего большинства веществ растворимость
падает при снижении температуры. Это имеет место в отношении
сегнетовой соли NaKC4H406-4H2O, квасцов KAli(S04)2-|12H20,
медного купороса CuS04*5H20, сахара (в водных растворах)
и т. д. Путем понижения температуры насыщенных растворов
таких веществ можно перевести в пересыщенную, а затем и в
кристаллическую фазу определенное количество вещества из каждого
литра раствора. Наоборот, в солях, растворимость которых
понижается с повышением температуры (сульфат лития Li2S04-H20,
j KC1 и др.), определенное количество вещества можно выделить
I нагреванием раствора (рис. 8). Говорят, что вещества первой
группы имеют положительный температурный коэффициент рас- \
творимости (т.к.р.), а вещества
- отрицательный. Очевид-
вещества с ходом т.к.р.,
близким нулю, не пригодны для
выращивания монокристаллов по!
методу изменения температуру
К веществам этой группы
относится, например, поваренная соль
NaCl. В каких случаях бывает
рациональным применение того
или иного способа, показывает
форма кривой растворимости
(рис. 8).
Пересыщенные растворы, в которых во время их
приготовления тщательно уничтожены все зародыши, способны сохраняться
в герметически закрытых сосудах неопределенно долгое время, не
кристаллизуясь. Однако имеется некоторый предел, при переходе
которого в растворе наступает самопроизвольная 'Кристаллизация.
Достижимая степень пересыщения изменяется от вещества к
веществу в весьма широких пределах.
На рисунке 3 представлена простейшая фазовая диаграмма
реальных растворов. Стабильной области, расположенной ниже
кривой растворимости ЛВ, соответствуют ненасыщенные растворы,
которые могут оставаться однофазными неопределенно долгое
второй-
но, что
10 20 3D
Температура
Рис. 8. Температурный ход раство
римости в воде
14
время. В них кристаллы растворяются. Кристаллы же, введенные
в раствор, отвечающий, например, точке Д, могут неопределенно
долго оставаться без изменения. Это состояние определяется как
подвижное равновесие, когда скорости роста и растворения
кристалла одинаковы. В метастаб,ильной области теоретически
возможное начало кристаллизации практически никогда не
наблюдается. Однако кристалл, помещенный в раствор, отвечающий
метастабильной области, будет расти. Чем дальше точка Д
раствора от кривой насыщения, тем более неустойчив он. По достижении
кривой А'ВГ, за которой простирается лабильная область,
достаточно малейшего «толчка» для начала бурной кристаллизации.
При сильном охлаждении может сильно возрасти вязкость
раствора и в (связи с этим временное торможение процесса
кристаллизации растворенного вещества. Пр.и очень быстром
охлаждении раствора веществ, состоящих из длинных и сложных
молекул, образуется вязкая жидкость, в которой кристаллизация не
происходит, а получается стеклообразное вещество.
*
Кристаллизация из паров
Кристаллизацией из парообразного состояния можно
воспользоваться для получения правильно ограненных, либо особо чистых
кристаллов. Этот метод особенно пригоден для тех веществ,
которые шереходят из твердого состояния в парообразное и обратно,
минуя жидкую (фазу. Таковы «сухой лед» (СОг), иод, нафталин,
при определенных условиях обычный лед и ряд других веществ.
Для получения кристаллов из паров необходимо, чтобы при
данном давлении температура эксперимента была выше температуры,
при которой кристаллическое вещество находится в равновесии со
своим паром, т. е. выше температуры сублимации. Такие условия
осуществляются для сухого льда и иода при обыкновенном
давлении; поэтому иод при нагревании возгоняется в пар, из него на
холодных стенках сосуда осаждается кристаллический иод.
Кристаллы многих элементов и химических соединений можно
получить путем простой возгонки. Некоторые вещества достаточно s
нагреть в тигле в стеклянной трубке до начала испарения, чтобы
наблюдать кристаллы, осадившиеся на колодной части трубки, на
крышке тигля и т. д. Лучше, конечно, эту операцию проделывать
в вакууме и растить почти идеальные кристаллы серы, мышьяка,
киновари, сурьмяного блеска, свинцового блеска, нашатыря,
каломели, поваренной соли и ряда других веществ.
Кристаллизация из твердого состояния, или кристаллизация
путем полиморфного превращения
Полиморфизмом называется способность веществ кристаллы- \
зоваться в нескольких модификациях. Общеизвестен диморфизм f
углерода (алмаз и графит), три модификации фосфора (желтый,
15
красный и черный). Олово имеет две разновидности: серебряно-
белое и 1Свинцово-серое (оловянная чума). Лед — девять
модификаций, из которых речной является самым рыхлым, с ажурной
упаковкой молекул. Двуокись кремния имеет более девяти
модификаций.
Всякая модификация имеет в фазовой диаграмме свою
область существования, т. е. является индивидуальной фазой.
Модификации могут переходить друг в друга, изменение свойств при
этом совершается скачком.
Превращение .из одной модификации в другую во многом
аналогично переходу из твердого состояния в жидкое или обратно,
Рис. 9. Возможное сосущест- Рис. 10. Диаграмма состоя-
вование полиморфных модифи- ния серы
каций Ки /Сг
но в одном случае упорядоченное расположение частиц в
кристаллической решетке сменяется менее упорядоченным, а в другом
случае—одна пространственная решетка заменятся другой.
Переход вещества из одной модификации в другую
совершается обычно с поглощением тепла, если этот переход
происходит при нагревании, и с выделением тепла, если переход
совершается при охлаждении. Количество тепла, отнесенное к единице
массы, называется теплотой превращения. Так, переход
ромбической серы в моноклинную сопровождается выделением теплоты
превращения 3,12 кал/г. Если .переход из одной модификации в
другую может совершаться при определенной темлературе в
прямом и обратном направлении, т. е. если процесс перехода
обратим, то такие разновидности называются энантиотропными. К ним
относится ромбическая и моноклинная icepa, для которых точка
превращения равна 96,5° С. Монотропные формы характеризуются
необратимым переходом одной в другую.
При определенных условиях, когда разновидности могут
существовать одновременно и даже в соприкосновении друг с
другом, т. е. имеет место задержка в превращении, такое состояние
Годной неустойчивой фазы называется метастабильным (рис. 9).
16
На диаграмме состояния серы (рис. 10) кривая Вв, будучи
продолжением кривой ЕВ, представляет собой кривую метастабиль-
ного равновесия. Область СВв отвечает моноклинной
кристаллической сере и одновременно переохлажденному расплаву серы.
Задержка в «превращении наблюдается и в точках превращения двух
кристаллических модификаций серы. Отрезок Оа представляет
собой продолжение кривой ВО равновесия моноклинной серы и пара
и находится в поле устойчивой ромбической серы. Двигаясь по
кривой АО, можно, пройдя точку О, попасть в шле моноклинной
серы. Если при этом не наступит превращение ромбической серы
в моноклинную, то двигаясь дальше по кривой, можно дойти до
точки в, где метастабильная ромбическая сера будет находиться
в равновесии с паром и с расплавом. Кривая вС есть кривая
плавления метастабильной ромбической серы.
Явление полиморфизма иногда рассматривают как общее
явление, свойственное всем кристаллическим веществам (по
В. И. Вернадскому).
В полиморфных превращениях, как .и в любых фазовых
превращениях вещества, значительную роль играют примеси. Как
правило, растворимые примеси затормаживают полиморфное
превращение. У олова наблюдается обратный эффект. Растворимые
примеси могут о'казать воздействие на переход (Путем образования
«промежуточных» химических соединений с имеющимися в
системе примесями. Так, Bi в Sn оказывается химически активным
веществом, препятствующим полиморфному превращению олова.
Принципиально возможно введением дополнительной определенной
примеси стимулировать или стабилизировать полиморфное
превращение, вызванное наличием нерастворимых примесей.
:> Б. Я. Любов рассматривает влияние примеси на полиморфное
превращение следующим образом. Примеси на поверхности
раздела фаз твердая—жидкая притягиваются к дефектным участкам
кристалла, в результате чего раствор у поверхности обедняется
питательным материалом. Это вызывает повышение точки
превращения, за чем следует изменение взаимной ориентации
полиморфных модификаций.
Полиморфное превращение может зависеть от степени
размельчения вещества. Превращение белого олова в серое, алмазо-
подобное — «ажурное»—сопровождается увеличением объема,
поэтому увеличение пористости -способствует этому.
§ 2. ЭНЕРГИЯ КРИСТАЛЛИЗАЦИИ
Состояние химически чистого вещества определяется
температурой Г, давлением р и удельным объемом V. Если изменяется
хотя бы одна из этих величин, вещество переходит в новое
состояние. Если при переходе вещества из первого состояния во второе
одна из трех указанных величин претерпевает конечное изменение
при бесконечно малом изменении другой, то оба 'Состояния веще-
17
ства принадлежат к различным фазам. Переход сильно
переохлажденной жидкости, в которой 'коэффициент внутреннего трения
близок 1013 пуаз, в аморфное состояние сопровождается плавным
изменением ее свойств, хотя скорость изменения этих свойств
различна в различных температурных интервалах. На основании
этого аморфное и жидкое состояния часто относят к одной фазе.
Из трех величин Т, р, V независимы только две.
Математическая зависимость
O(T,p,V)=0, (1.2)
связывающая величины Г, р, V и позволяющая по двум из них
определять третью, называется уравнением состояния. Конкретная
математическая форма уравнения состояния, позволяющая
охватить все фазовые превращения, до настоящего времени не найдена
ни для одного вещества. Опыт позволяет, однако, построить
зависимость между Г, р, V для каждого вещества графически на
основании измерения этих величин в пределах, определяемых
условиями опыта. Графики или модели, устанавливающие
зависимость между этими величинами, называются фазовыми
диаграммами.
Энергию вещества, определяемую состоянием, т. е. величинами
Т, р, V, принято считать внутренней энергией:
U = f(T,p,V). (1,3)
Реальный смысл имеет не сама энергия, которая пока не
может быть определена опытным путем, а ее изменение при
переходе из одного .состояния в другое. Рассчитанное на 1 г вещества,
оно обозначается fcJJ или dU в зависимости от того, будет ли эта
величина конечной или бесконечно малой.
Дифференцирование уравнения (1,3) дает
dU=ELdT + ^Ldp+^LdV (I4)
дТ dp dV v ' '
или
dU = cdT + hdp + ldV. (1,5)
Таким образом, изменение внутренней энергии вещества при
изменении Г, р, V можно разбить на три части:
dQ = cdT,
dH — help,
dL = IdV.
При малой величине dU(AU) эти слагаемые независимы и
будут энергиями изменения температуры, давления и объема. Все
слагаемые должны выражаться в одинаковых энергетических
единицах.
Коэффициент пропорциональности
dQ
dT
18
х. е. теплоемкость приближенно равна числу малых калорий,
затрачиваемых при нагревании или охлаждении 1 г вещества на
ГС.
Особый интерес представляют теплоемкости cv и ср, т. е.
измеряемые при постоянном объеме и при постоянном давлении.
Если вещество переходит в новое состояние три постоянном
давлении (dp = 0), то уравнение (1,5) принимает вид
откуда
dU = cpdT + IdV,
dU — IdV
dT
dQ
dT
При (переходе вещества в новое состояние при постоянном объеме
(dV=0) имеем .
dU = cvdT + hdp,
_dU — hdp _ dQ
'V
dT
dT
На практике при измерении теплоемкости кристаллических
веществ при постоянном атмосферном давлении часто пренебрегают
малой величиной hdp и отождествляют dQ и dU. В этом случае
можно принять
ср =
dU
dT
dQ
dT
Общий закон зависимости теплоемкости от 'температуры (по
Льюису и Гибсону) показан на рис. 11. По оси х откладывается
т
выражение п lg —, где п и 6 — константы, характеризующие дан-
0
ное вещество. Для многих веществ я=1.
Величина 6 называется
характеристической температурой.
Если вещество переходит из одной
фазы в другую, то внутренняя энергия
вещества и величины с, Я, I испытывают
резкое изменение, вследствие этого для
новой фазы уравнение (1,4) принимает
вид
dU = c'dT + h'dp + l'dV.
Резкое изменение теплоемкости при
кристаллизации сопровождается всегда
выделением теплоты.
При кристаллизации всегда выделяется энергия; температура
может при этом оставаться постоянной. Энергия кристаллизации
1 г вещества называется тепловым эффектом кристаллизации.
При плавлении энергия поглощается. Приводим для примера зна-
-о,в -цч о
W
¥
Рис. 11. Общий закон
зависимости теплоемкости от
температуры
19
чения теплового эффекта кристаллизации для некоторых веществ
(табл. 1). С. Кромптон показал, что для чистых металлов
произведение теплового эффекта кристаллизации г на атомный вес А,
деленное на абсолютную температуру Т плавления,
приблизительно равно 2,2:
— - 2,2. 1
Таблица 1
Энергия кристаллизации
г для 1 г некоторых
веществ при нормальном
давлении
Вещество
NaCl
KF
Н,0
Fe
Sb
Sn
Hg
кал
г
СС
123,5
108,0
79,4
49,4
24,3
14,6
2,8
Для химических соединений с
молекулярным весом М, которые после плавления
образуют жидкость с ^ассоциированными
молекулами, П. И. Вальден дал
аналогичную зависимость: I
^- ^ 13,5. '
Сильные отклонения от этого правила
позволяют судить о степени ассоциации в
жидкости.
К. С. Кирхгоф установил более точную
зависимость теплового эффекта
кристаллизации от температуры следующим образом.
Пусть вещество в состоянии
переохлажденной жидкости до кристаллизации имеет
температуру Г, а после кристаллизации —
температуру T-\-dT. Процесс кристаллизации можно мыслить
происходящим двояко: сначала осуществляется кристаллизация
жидкости при температуре Г, и далее кристаллическое вещество
доводится до температуры T+dT, либо обратно, сначала нагревают
жидкость, а потом ее закристаллизовывают. Если процессы
происходят при постоянном давлении, то оба пути по первому закону
термодинамики ведут к одинаковому изменению энергии.
Обозначая тепловой эффект кристаллизации при температуре Т через г,
при температуре T + dT— через r + dr, а теплоемкости жидкости
и кристаллического вещества crv и ср, получим
- г + cpdT = c'pdT— (r + dr),
откуда
dr (1,6)
ср =
dT
Это и есть формула Кирхгофа, которая позволяет вычислить
тепловой эффект кристаллизации при повышении температуры от Т0
до Г, если известен закон или трафик зависимости теплоемкостей
от температуры. Интегрирование формулы Кирхгофа дает
т т т
.! c'PdT
J
cpdT = г
(1.7)
Tq Tq i о
Формула Кирхгофа применима также и для вычисления теплового
эффекта любого фазового превращения.
20
Р. Клаузиусом га Б. Клапейроном была получена более полная
зависимость теплового эффекта кристаллизации от всех
параметров, определяющих состояние 1 г чистого вещества.
' 1 г вещества подвергается-расплавлению при постоянной
температуре и постоянном давлении, далее — адиабатическому
сжатию, кристаллизации га, наконец, быстрому всестороннему
растяжению. В итоге вещество вернется в первоначальное состояние,
поэтому полное изменение энергии должно быть равно нулю:
0 = r-(V'-V)p + (p+-f-)dl/-(r + dr) +
+ (V'-V)(p + dp)-(p
Отсюда после сокращений и пренебрежения бесконечно малыми
второго порядка имеем
dr= {V'—V)dp.
Правая часть этого равенства представляет >собой «полезную»
работу кругового процесса. По второму закону термодинамики она
так относится к тепловому эффекту, как изменение температуры
к самой температуре.
(У — V) dp __ dT
г ~ Т '
отсюда
r = -T{V'-V)^-. 1(1,8)
dl
Как и формула Кирхгофа, формула Клаузиуса—Клапейрона
применима к любому процессу перехода вещества из одной фазы
в другую.
Важнейшей характеристикой энергии кристаллизации
вещества нужно считать наибольшую работу, которую можно получить
в результате изменения вещества. Пусть вещество претерпевает
любое изменение, сопровождаемое изменением внутренней энергии
Д£/, тепловым эффектом Q и работой А. Это изменение вещества
может быть переходом в новое состояние, новую фазу,'
разложением на элементы и т. д. По закону сохранения энергии
изменение внутренней энергии U должно быть равно алгебраической
сумме теплового эффекта Q и работы А:
Ш = Q + А
По второму же закону термодинамики
dA = dT
Q " Т '
Сопоставляя оба уравнения, получаем
A = MJ + ^T. (1,9)
dl
0
21
Величина А в этом уравнении Гиббса—Гельмгольца есть
наибольшая работа, которую в самых благоприятных условиях
можно получить в результате изменения состояния вещества (табл. 2).
На практике для того, чтобы все величины, входящие в уравнение
Гиббса — Гельмгольца, могли быть измерены, приходится иметь'
в виду процессы, происходящие при постоянной температуре и
одновременно при постоянном давлении или объеме.
Таблица 2
Наибольшая работа образования кристаллических веществ из элементов
в больших калориях при 25°С и 1 атм. на 1 г • моль вещества
Вещество
А1203 (корунд)
Н30 (лед)
Л, ккал
— 359,1
— 241,5
— 123,54
— 91,792
— 56,418
Вещество
HgO
Ag2S
С (алмаз)
CNI
А, ккал
— 13,808
— 2,206
0
+ 0,390
+ 42,79
Наибольшая работа кристаллизации или -вообще перехода
вещества из одной фазы в другую может быть определена по
упругости шара обеих фаз. В основу вычисления положен круговой
процесс из следующих этапов.
1. Испаряем одну молекулу чистого вещества три давлении р
и температуре Т. Пренебрегая весьма малым объемом жидкой
фазы в сравнении с объемом газообразной и принимая во внимание,
что работа расширения равна .произведению увеличения объема
на давление, получаем для. работы процесса величину pV=—RT
(уравнение для идеальных газов).
2. Сжимаем пар до давления р изотермически при той же
температуре Г, объем газа при этом уменьшится с V до V''.
Работа процесса равна
v
Г Pdv = - Г
V V
V V
— dV=~RT Г
v
dV
V
= — RT\n
YL
v
3. Конденсируем пар в 'кристаллическую фазу при новом
давлении р'. Пренебрегая объемом кристаллической фазы в
сравнении с объемом газообразной, иолучаем работу p'V'=RT.
Окончательная работа кристаллизации равна сумме работ
в трех этапах, т. е.
A = —RT In
V
(1,10)
ч
Глава II
ЗАРОЖДЕНИЕ КРИСТАЛЛОВ
§ 1. ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ ПО ЗАРОЖДЕНИЮ
КРИСТАЛЛОВ
Переохлаждение
Наибольшее число экспериментальных работ ио зарождению
кристаллов принадлежит Г. Тамману. '
Особо интересны его исследования способности
кристаллизация вещества, которую он определяет .почти
постоянным числом центров кристаллизации, возникающим в единицу
времени в единице объема при некоторой
температуре переохлажденной жидкости. <^
Определение способности кристаллиза- Ц
ции производилось следующим образом. |
Небольшое количество исследуемого
органического вещества расплавлялось и
быстро охлаждалось до температуры "^
экспозиции, при которой вещество
выдерживалось определенное время,
необходимое для образования центров
кристаллизации. После этого вещество
выращивалось при более высокой температуре,
близкой к температуре плавления. При
этих условиях новые центры уже не могли образовываться. На
рис. 12 по оси абсцисс откладывается переохлаждение, т. е.
разность между температурой плавления (Гпл) и температурой
экспозиции (ГЭк), а по оси ординат — число центров кристаллизации
(ЧЦ) в определенном объеме. При температуре плавления (0)
число зарождающихся центров кристаллизации равно нулю. По
мере увеличения переохлаждения ЧЦ растет, достигая максимума
при определенном переохлаждении, и далее вновь уменьшается
до нуля (Л). Точка А соответствует переохлаждению, при котором
вещество#уже не способно к самопроизвольной кристаллизации и
Рис. 12. Схема зависимости
числа центров
кристаллизации от переохлаждения
(по Г. Тамману)
23
при дальнейшем охлаждении застывает в стеклообразную,
аморфную массу.
Сейчас всеми признается ошибка Таммана в истолковании
этих по существу правильных экспериментов. Исследованные им
органические вещества не очищались от посторонних взвешенных
в них твердых частиц, и Тамман наблюдал не спонтанную
кристаллизацию, а кристаллизацию на этих частицах, служивших
зародышами. Известно, что наличие границы раздела двух фаз в
системе облегчает процесс фазового перехода вещества. Работы
Таммана, однако, представляют большой интерес, так как на
практике почти всегда имеют дело с веществами, в которых
присутствуют примеси.
По своей природе поверхность раздела двух фаз (затравка),
на которой осуществляется кристаллизация, может быть
разнообразной:
1) наиболее эффективна твердая кристаллическая пылинка
растворенного вещества;
2) хорошей затравкой может быть частица такого вещества,
которое способно давать с растворенным веществом твердый
раствор; например, для алюмо-калиевых квасцов затравкой служит
кристаллик хромовых квасцов;
3) затравкой может служить кристаллик такого вещества,
которое может давать с растворенным веществом закономерные
сростки или структура которого близка к структуре растворенного
вещества;
4) затравкой оказываются многие частицы, которые способны
на своей поверхности адсорбировать молекулы растворенного
вещества.
Однако затравка должна иметь не только определенное
строение или определенные свойства поверхности, но ее размеры
должны быть выше некоторой границы. Частицы, достигшие
критического размера и 'большего, чем критический, будут зародышами
кристаллизации. Частицы, не достигшие критического размера,
остаются термодинамически неустойчивыми; в результате
тепловых флуктуации они возвращаются в жидкую фазу. Критический
размер зародыша тем меньше, чем больше скрытая теплота
кристаллизации и степень (переохлаждения и чем меньше его
удельная поверхностная энергия:
г = —?Elo (И 1)
Q(T0-T) ' v ' '
где гк — критический размер зародыша, а — поверхностная
энергия, Q — скрытая теплота кристаллизации, (Го—Т) —степень
переохлаждения системы.
Частицы кристаллов некоторых веществ, достигшие примерно
десятых долей микрона, уже могут оказаться способными
«заразить» раствор (расплав), находящийся в метастабильном
состоянии.
24
Факторы, влияющие на зарождение кристаллов
1. Решающим фактором в зарождении кристаллов остается
переохлаждение. Чтобы обеспечить переохлаждение, необходимо
устранить из системы всякие твердые частицы. Это достигается
путем предварительного нагрева жидкости значительно выше
температуры плавления, ее тщательной фильтрации и защиты
жидкости от пылинок извне.
Опытами В. И. Данилова показано, что зависимость
переохлаждения жидкости от ее перегрева определяется наличием в
ней нерастворимых примесей. Нагреванием жидкости до
определенной температуры выше точки кристаллизации примеси могут
быть дезактивированы. В частности, при предварительном
нагревании жидкого олова до 80—90° С выше точки кристаллизации,
достигались максимальные переохлаждения. Полная дезактивация
примесей в висмуте происходит при перегреве на 40—50° С.
Для получения переохлажденных жидкостей, как следует из
кривой, полученной Тамманом (см. рис. 12), нужна большая
скорость переохлаждения.
Опыт показывает, что -способность к переохлаждению
жидкостей, содержащих ионы, возрастает при увеличении заряда ионов
и при уменьшении их радиусов. Присутствие ОН-группы в
органических вещества^ способствуют переохлаждению.
2. На зарождение кристаллов оказывают влияние
соприкасающиеся с жидкостью поверхности твердых тел, в частности,
стенки сосуда. Отдельные участки неоднородной поверхности
обладают различной активностью по отношению к образованию
новой фазы. Эта активность определяется как физико-химической
природой участка, так и (геометрической его формой и величиной.
Такие дефекты на поверхностях твердых тел, как трещины и
каналы почти молекулярного размера, способствуют зарождению
кристаллов.
3. Велика роль ионизирующего излучения, например, -у-излу-
чения радия. Его эффект сводится к увеличению числа центров
кристаллизации. За счет поляризующего действия возникших
ионов на нейтральные молекулы первые становятся центрами
окружения как ионов .противоположного знака, так и этих
молекул, и вокруг образующейся достаточно устойчивой системы
начинается рост кристаллов.
4. Электрическое и магнитное поля также способствуют
зарождению кристаллов. При этом возникающее число центров
кристаллизации находится в прямой зависимости от напряженности
поля. В электрическом или магнитном поле молекулы вещества
(переохлажденной жидкости), ориентируясь -в одном
направлении, образуют анизотропную среду, во многом аналогичную
кристаллической.
К изучению влияния электрического поля на зарождение
кристаллов повторно возвращаются многие исследователи. М. И. Коз-
25
ловским установлено, что v — скорость- появления новых центров
кристаллизации на единицу площади при некоторой температуре
прямо пропорциональна пересыщению раствора и квадрату
напряженности электрического поля, но, конечно, различается для
того или иного кристаллизуемого вещества
v = k(c-c0)E\ (11,2)
где k — коэффициент пропорциональности, (с—с0) —
пересыщение, Е — напряженность поля.
5. Влияние ультразвука на процесс кристаллизации металлов
впервые отметил С. Я. Соколов. Ультразвуковое поле настолько
ускоряет процесс кристаллизации, что в результате получаются
слитки с дендритной структурой. Механизм действия ультразвука
в ультразвуковом поле сводится к происходящему на границе
раздела двух фаз отщеплению мельчайших кристаллов, совершаю-'
щих колебательные движения и увеличивающихся в размерах.
Срастаясь с кристаллом, ' они образуют поликристаллический
слиток. Скорость этого процесса зависит от интенсивности
ультразвукового поля.
6. На зарождение центров кристаллизации, как установлено
Тамманом, влияет число «обработок», предшествующих опыту и
заключающихся в том, что выращенные из раствора кристаллы
растворяются в новой порции того же растворителя. Из
полученного раствора вновь выращиваются кристаллы, которые затем
подвергаются растворению и т. д. При увеличении числа
чередующихся операций скорость зарождения кристаллов падает.
В.И.Данилов рассматривает «обработку» как способ самоочистки
вещества от нерастворимых примесей, часть которых всегда оттесняется
поверхностью растущего кристалла.
Вопрос о том, можно ли предупредить способность вещества
к переходу в кристаллическое или аморфное состояние, Тамман
решает следующим образом. Каждое вещество характеризуется
определенной 'кривой зависимости числа центров и кривой
линейной скорости кристаллизации (СК) от степени переохлаждения.
Линейная скорость кристаллизации есть скорость,
с которой перемещается граница между расплавом и
закристаллизовавшимся веществом в направлении, перпендикулярном
поверхности раздела. В зависимости от взаимного расположения
кривой СК и кривой ЧЦ переохлажденный расплав может или за-,
кристаллизоваться или «просто затвердеть», перейти в
стеклообразное состояние. Тамман различает три типа зависимости числа
центров кристаллизации и скорости кристаллизации от
переохлаждения (рис. 13). Кривые ЧЦ .и СК, полученные Тамманом и
другими исследователями, до сих пор остаются
экспериментальными и не получили теоретического объяснения.
На рисунке 13 в первом случае (а) получается
мелкозернистый сросток при медленном охлаждении, так как температура Т\-
соответствующая максимуму ЧЦ, намного меньше Т2у определяю-
26
щей максимум СК. Наоборот, .при быстром охлаждении создается
крупнозернистый поликристаллический сросток. При таком
частичном перекрывании кривых ЧЦ и СК в зависимости от
скорости охлаждения вещество (например, селен) может быть получено
как в кристаллическом, так и аморфном состояниях.
В случае >(б) наложения или близости положений максимумов
обеих кривых вещество легко кристаллизуется, и его трудно или
невозможно получить при охлаждении расплава в аморфном
состоянии (например, металлы).
Когда же максимумы кривых (ЧЦ и СК) не совпадают и
кривые не перекрываются (в), вещество легко переходит в стекло-
Сте пень переохлаждения
Рис. 13. Три типа зависимости числа центров кристаллизации и
скорости кристаллизации от переохлаждения
образное состояние, его трудно получить в кристаллическом
состоянии (окись кремния и др.)-
По кристаллизационной 'способности вещества делятся на
группы. Хорошо кристаллизуются металлы со структурой типа
плотнейших и плотных шаровых упаковок. Металлы с
усложненными структурами (цинк, олово, сурьма, селен и др.) обладают
большей склонностью к переохлаждению. Многие молекулярные
органические вещества также легко образуют стекла, поскольку
образование «регулярной» кристаллической -структуры в этих
случаях требует не только периодического расположения центров
молекул, но и строго определенной взаимной ориентации молекул
в пространстве.
§ 2. ТЕОРЕТИЧЕСКИЕ ВОЗЗРЕНИЯ НА ЗАРОЖДЕНИЕ
КРИСТАЛЛОВ
Менее конкретны и менее обильны теоретические работы в
области зарождения и развития центров кристаллизации.
Из двух термодинамических теорий образования зародышей,
одна теория Гиббса, возникшая еще в конце XIX века, лежит в
основе современных теорий зарождения: флуктуационной Фольме-
ра и молекулярно-кинетической Странского.
По Дж. Гиббсу, изолированная система абсолютно устойчива,
стабильна, если при постоянстве энергии системы любое-конечное
27
изменение ее состояния оставляет неизменной ее энтропию (или
даже уменьшает ее). Если же при некоторых конечных
изменениях состояния энтропия возрастает, то система может быть лишь
относительно устойчивой. Такой системой будет, например,
пересыщенный раствор, энтропия которого возрастает на конечную
величину при кристаллизации. Таким образом, метастабильное,
состояние является одним из возможных устойчивых при данных
условиях состояний системы, которое не соответствует
наименьшему значению свободной энергии.
Как учит классическая термодинамика, относительно
устойчивая (метастабильная) (Система может быть выведена из состояния
метаустоичивости только при внешнем воздействии, при затрате
определенной работы Л. Эту работу Гиб б с называет мерой
устойчивости метастабильности системы. В метастабильном
состоянии данная фаза может существовать без изменений до тех
пор, пока в ней не появится зародыш другой фазы. При появлении j
зародыша метастабильная фаза превращается в более
устойчивую, стабильную фазу.
Итак, для того чтобы вызвать кристаллизацию из метаста-
бильной фазы, необходимо затратить свободную энергию,
работу Л, на создание зародыша новой поверхности раздела двух
фаз—стабильной и метастабильной. Если зародыш достигнет
величины, не менее критической, кристаллизация на его
поверхности совершается самопроизвольно, так как она сопровождается
уменьшением свободной энергии.
Величина работы Л, преодолевающей «порог неустойчивости»,
зависит прежде всего от размера зародыша, последний же — от
степени пересыщения системы. В случае конденсации паров
В. Томсон нашел, что для каждой степени пересыщения паров
существует определенный размер капель жидкости, остающихся
в равновесии с пересыщенным паром:
RT\n^-=^-, (11,3)
Р@
гд
где р — давление пересыщенного пара, ро — давление
насыщенного пара, а—поверхностное натяжение, М — молекулярный вес,
г — радиус жидкой капли (велик по сравнению с радиусом
действия молекулярных сил), б — плотность жидкости.
По Гиббсу, работа Л, необходимая для изотермического
обратимого образования «равновесной» капли из пересыщенного пара,
равна одной трети свободной поверхностной энергии капли:
3
A = — Sg =
яг2 о,
(И,4)
где S — поверхность капли.
Из этих уравнений следует, что с уменьшением пересыщения
радиус г «равновесной» капли возрастает и соответственно увели-
28
чивается работа Л, вследствие чего повышается устойчивость си=-
стемы. С увеличением пересыщения радиус г и работа А
уменьшаются; уменьшается и относительная устойчивость системы.
Аналогичные рассуждения применимы к образованию
кристаллической фазы в пересыщенном растворе или
переохлажденном расплаве. Гиббс показал, что образующийся кристаллический
зародыш для сохранения равновесия с жидкостью приобретает
форму, отвечающую минимальному
значению его свободной поверхности энер- j>
гии при постоянном объеме:
jcrX-irfn (И,5) б.
i
при V = const,
где бг—поверхностная энергия /-той
грани, a Si — ее площадь. Здесь
суммирование распространяется на все грани.
Работа А образования зародыша
равна
_1
3
i
М. Фольмер указал, что во всех
процессах образования новой фазы
отводится большая роль твердой стенке и любой
поверхности раздела, которые обычно
облегчают образование устойчивых
зародышей.
Пусть осевшая на стенке капля с
радиусом кривизны г находится в
равновесии с паром (рис. 14). Условием равновесия сил поверхностного
натяжения будет
А
Е»*
f"l
(11,6)
Рис. 14. Капля на твердой
стенке
<т2 — а3= аг cos 9,
(П,7)
где Q2—поверхностное натяжение твердой стенки на границе с
паром, аз — поверхностное натяжение твердой стенки на границе
с жидкостью и Gi—поверхностное натяжение капли, 9 — краевой
угол.
Согласно формуле * Гиббса (11,6), работа (А) образования
равновесной капли на твердой стенке равна
А
где Si — поверхность сегмента капли, S2 = S3 — площадь
основания сегмента капли. Поверхность шарового сегмента S\=2nrh,
где г — радиус шара, h — высота (Сегмента. Из рисунка 14 находим
А = г — OD = г — г cos 0,
29
следовательно,
Sx = 2nr2(l— cos 6).
Площадь основания капли
52 = S3 = n (AD)2 == nr2 sin2 6,
откуда
А = — [2яг2 (1 — cos 0) ст. + яг2 sin2 0сг3 — яг2 sin2 0a2],
или из формулы (11,7)
А = — яг2а[2(1 — cosB) — sin26 cos 6].
(11,8)
Сравнивая (11,8) с (11,6), видим, что энергия образования
зародыша на стенке всегда меньше энергии образования в
свободном пространстве. Первая настолько зависит от значения
краевого угла 6, что при 6 = 0 она равна
нулю, т. е. на ' абсолютно смачиваемой
поверхности конденсация ларов
начинается при незначительном
пересыщении. Энергия достигает
максимального значения при 8 = 90° С.
Необходимо учитывать, что
величина работы А определяется еще и
физическим состоянием поверхности.
Если на поверхности есть узкие
трещины, то работа А может сделаться
даже отрицательной, т. е.-конденсация
будет происходить уже в ненасыщенном паре (капиллярная
конденсация) .
Графическую зависимость работы образования
кристаллического зародыша А от его размера г дает рис. 15, на котором ги
есть радиус сферы, соответствующий, критическому размеру
зародыша.
Согласуя положения Гиббса с уравнением Томсона (11,3) для
кристаллов, находящихся в равновесии с пересыщенным паром,
получаем уравнение, выражающее связь между давлением паров
и размером кристалла:
Рис. 15. Работа образования
зародыша кристаллизации
kT\n
Ph
2V0
d
oo
hi
(11,9)
где k — константа Больцмана, Т — абсолютная температура, ph —
давление паров в равновесии с кристаллом конечных размеров,.
роо — то же для бесконечно большого кристалла (роо равно
давлению ро насыщенного пара), V0 — объем, приходящийся на
молекулу вещества в кристаллическом состоянии, hi — расстояние
/-той грани от центра. Это уравнение Томсона—Гиббса применяет-
30
ся при малых пересыщениях и теряет силу при больших пересы-
шениях. Уравнение имеет особое значение для рассмотрения всех
опросов о равновесии кристаллов, описанных в III и IV главах.
Б Таким образом, согласно теоретическим представлениям Гиб-
бса процесс кристаллизации может начаться пу-
теМ искусственного внесения или случайного
попадания готовых центров кристаллизации.
Вторая теория зарождения (кристаллов, теория Фольмера,
используя основные положения учения о термодинамических флук-
туациях, объясняет возможность кристаллизации
путем -самопроизвольного образования
зародышей. Как функция вероятностная, энтропия изолированной мета-
стабильной системы испытывает непрерывный ряд- малых
беспорядочных изменений — флуктуации, оставаясь тем самым все время
меньшей максимального значения, но близкой к нему.
Соответственно этому параметры системы '(концентрация, температура,
давление и др.) в отдельных ее частях не остаются постоянными,
а колеблются около некоторых средних значений, отвечающих
максимуму энтропии системы.
Флуктуации могут привести к образованию кристаллических
зародышей. При этом вероятность возникновения зародыша W в
значительной степени определяется энергетическим фактором и
мало зависит от параметров системы. При «изотермических» флук-
туациях можно положить
л
W^Ce kT , (11,10)
где А — работа образования зародыша -при данном пересыщении,
С — множитель, зависящий от продолжительности жизни
зародыша, который нельзя вычислить на основании термодинамических
соображений. Дело в том, что продолжительность жизни
возникшего в результате флуктуации зародыша, не достигшего
критического размера, мала. Возникнув, он в большинстве случаев вскоре
распадается. Для зародышей, которые не распадаются, т. е.
величина которых больше критической, удается выразить
пропорциональность между энергетическим фактором и вероятностью их
образования при помощи молекулярнонкинетических
представлений, изложенных ниже.
Теория Фольмера*дала точный физический смысл понятию о
границе метастабильности. Для образования устойчивой капли,
согласно Гиббсу, необходимо затратить работу
(II,11)
[-tr
где обозначения такие же, как в формуле (11,3). Эта величина
работы А подставляется в выражение вероятности (11,10). Таким
образом, установлена граница метастабильной области для водя-
31
ных паров при адиабатическом расширении, для случая
конденсации металлических паров на охлажденных .поверхностях и т. д.
Результаты подсчета указывают на 'большую зависимость
вероятности образования зародышей от пересыщения.
Фольмер ввел понятие о двумерном зародыше на поверхности
кристалла.
Представление Гиббса о скачкообразном росте
кри-сталла сводится к тому, что образование новой атомной
плоскости на растущем кристалле аналогично процессу
образования новой фазы, т. е. требует определенного конечного
пересыщения. Если степень пересыщения невелика, то скорость образовав
ния нового слоя настолько мала по сравнению со скоростью и
разрастания, что образование полной атомной плоскости
закончится, прежде чем возникнет новая атомная плоскость, т. е. рост
кристалла должен носить характер .правильно прерывистого
наслаивания одной атомной плоскости на другую.
Рост кристаллов с гладкими гранями, согласно Фольмеру',1
происходит путем образования на их поверхности двумерных за-]
родышей. Такой зародыш представляет собой как бы остров плос!
кой сетки на гладкой грани, который при данном пересыщении
жидкой или газовой фазы находится в (Состоянии равновесия. |
Форма двумерного зародыша определяется условием Гиббса]
записанным для двумерного случая: ]
V Xflt = min, при S = const, (И, 121
где Яг- — свободная удельная краевая энергия г'-го края, аг- —1
длина i-ro края, 5— площадь острова сетки. 1
Работа образования двумерного зародыша Ак равна 1
Ак=~^- = пХР, (11,13)1
где Ф — выигрыш свободной энергии на единицу площади прИ
присоединении молекул к острову, р —радиус круга (зародыши
можно считать островом в виде круга). I
Из уравнения (II, 13) видно, что работа образования двумер-|
ного зародыша пропорциональна -половине его периметра -и кри-|
тический размер двумерного зародыша равен ■
Рк=-£- (П,14|
Фольмер предложил формулу для скорости образования зароды-*:
шей: ]
/ = Сехр(-А-). (11,15)
п ля того чтобы кристалл рос с измеримой в лабораторных
, JSTx Тк°„ГостьЮ Грядка* . М .«Slk^SS^»"^*
1Г,епоар^НГг^ЬитР°оТ6олРьШо„ расхождении теории роста
ЦТГеГиГоГрГе п^стГиеред6 «сто термосами;
Киши теориями. Они помогают проникнуть в м опеку
о О; О
Рис 16. Плоские сетки,
отвечающие гладким (сплошные
линии) и шероховатым
(пунктирные и штриховые линии)
граням (-по И. Н. Странскому)
Рис. 17. Рост граней: а—куба
(ЮО); б — ромбододекаэдра
(ПО); в —октаэдра (111)
кристалла с простой кубической
решеткой
л я р н ы й меха ни м п ^ с £*. Р ож д ен - . ^ирост.
пеР0еЛксионентами ™выражениях для вероятности и скорости
обозов™ зародышей, а 'также для линейной скорости кристал-
ЛИЗаТеИвмодинамические теории бессильны в объяснении
скорости поста граней не связанных с образованием двумерного
зародыша так как термодинамически не удалось определить
одномерны"?/ нульмерные' зародыши. Этим явлениям впо-е
удовлетворительное объяснение дали молекулярно-кинетические теории Косе,
ля и Стравского, показавшие, что кристаллические гРани л° «°^
поверхностной структуре подразделяются на зеркально гладкие
грани и грани с более или менее ясно выраженн0и шероховато
стью (рис 16) Гладкие или «плотноупакованные», G-грани описы
ва^сГмальши индексами (/гИ),Рост таких граней связан с об-
разованием двумерных зародышей (рис. 17, «)• гРа™ ? ^ДРР™
ватой поверхностью образованы выступами (.субиндивидами) ко_
торые ограничены участками гладких граней. При этом субинди
виды могут иметь строение и величину либо одинаковые (штрихо
■дм Muiyi имс! у пячличные (пунктирные линии,
вые линии, см. рис. 16), лиоо различные \"У * - nv.
см. рис. 16). Грани со ступенчатой поверхностью растут пу
2 О. Г. Козлова
33
тем присоединения отдельных рядов одномерных зародышей
(рис. 17,6). Образование одномерных зародышей также связано
с преодолением, хотя и меньших, чем в предыдущем случае, энер*
гетичеоких барьеров.
Существуют грани, которые растут путем присоединения
отдельных частиц, нульмерных зародышей, в так называемые
изломы ступени (рис. 17,в). Излом ступени — это трехгранный угол,
который представляет собой энергетически наиболее выгодный
участок для увеличения поверхности растущего кристалла.
Вопросы, связанные с определением предэкспоненциального
множителя и подсчетом энергий нульмерных, одномерных и
двумерных зародышей, освещены в гл. III, § 6. Молекулярно-кинети^
ческая теория зарождения кристаллов имеет тот большой
недостаток, что остается теорией идеальных кристаллов и, несмотря на,
«принципиальную правильность», оказывается в большинстве
случаев неприменимой для реальных кристаллов. i
Еще раз приходится отметить, что пока нет единой теории
зарождения кристаллов. Характерными для всех теорий остаются
общие соображения без более конкретной связи с особенностями-
строения кристаллического вещества и с силами взаимодействия
между частицами этого вещества.
Глава III
ТЕОРИИ РОСТА КРИСТАЛЛОВ
§ 1. ОБЩИЕ СООБРАЖЕНИЯ
Как отмечалось, в настоящее время еще нет
удовлетворительной теории образования реального кристалла. Это результат
прежде всего больших сложностей, которые таят в себе реальные
кристаллы, содержащие множество самых разнообразных
дефектов. Будучи порожденными в процессе кристаллизации, дефекты
способны влиять на этот процесс. Поэтому следует рассматривать
теорию кристаллизации ,как частное выражение теории фазовых
переходов непременно с учетом всех особенностей
кристаллического состояния. Однако такой учет не осуществлен ни одной из
современных теорий. Все они исходят из ряда упрощающих
условия роста предпосылок, что обеспечивает определенную, часто
узкую область применения в практике кристаллизации. Каждая
теория объясняет только одну сторону процесса кристаллизации
(адсорбционную, диффузионную, дислокационную и т. п.). Одни
подходят к решению* данной проблемы кристаллизации только с
термодинамических позиций без учета особенностей
кристаллического строения вещества, другие, восполняя в некоторой степени
этот пробел, рассматривают кристалл как идеальную
ненарушенную «решетку». Современная дислокационная теория учитывает
только один тип дефектов — дислокации. Вероятно, можно
ставить под сомнение возможность создания «универсальной»,
всеохватывающей теории роста кристаллов, учитывающей все
явления, связанные с ростом кристаллов. Тем не менее есть основание
надеяться на то, что теория роста, максимально приближающая
нас к практике кристаллизации, со временем будет создана.
Еще задолго до открытия рентгеновых лучей Бравэ первым
высказал положение о зависимости 'скорости роста разных граней
кристаллов от плотности упаковки атомов (у Бравэ узлов
решетки) на различных плоских сетках, т. е. от ретикулярной
плотности граней. Он показал, как плоскости с максимальной плот-
f
ностью продвигаются во время роста вперед по нормалям с
наименьшими скоростями и, разрастаясь тангенциально, подавляют;
быстро нарастающие грани (рис. 18). Таким образом, следует
различать нормальную и тангенциальную скорости роста грани
кристалла. Нормальная скорость роста (Я) есть
скорость, с которой грань перемещается параллельно (самой себе в
направлении, перпендикулярном к своей
Л в ^ л поверхности. Та н генци а л ьн а я (Л) —
I ^ это скорость разрастания грани в
направив лениях, лежащих в плоскости грани.
6 Во времена Бравэ не было методов
для установления внутренней структуры
кристаллов, поэтому уже в то же время
имелись данные, указывающие на многие
ч> трудности в применении его теории. Пол-'j
ностью, однако, сохранилось основное
положение теории Бравэ, а именно, что
ретикулярные плотности различных плос-
Рис. 18. Выклинивание бы- костей решетки являются одним из важ-
стро растущей грани а гра- нейших факторов, определяющих конеч-
нями в ную форму кристалла.
Несколько позднее П. Кюри выдвинул
идею о зависимости скорости роста кристаллов от его
поверхностной энергии: с увеличением поверхностной энергии грани
кристалла увеличивается скорость ее роста и наоборот. Эта идея хорошо •
увязывается с положением Бравэ об обратной зависимости
поверхностной энергии грани от ее ретикулярной плотности.
§ 2. ТЕРМОДИНАМИЧЕСКАЯ ТЕОРИЯ ГИББСА
Первая количественная теория роста кристаллов разработана
Гиббсом в 1876 г. на термодинамической основе.
Из двух ее основных положений первое 'состоит в том, что
кристалл, находящийся в равновесии с
собственным раствором, должен иметь форму, которая
отвечает минимуму его суммарной
поверхностной энергии при постоянном объеме (11,5):
2 аД = ™п ПРИ У = const-
Это положение нуждается в следующем дополнении: для
освобождения (сброса) излишней поверхностной энергии кристалла
необходимо «сначала преодолеть энергетический барьер, т. е. затратить
дополнительное малое количество энергии для того, чтобы далее
процесс мог идти сам собой. Так, при получении равновесной
формы кристалла из раствора, последний периодически
подогревается. Тепловая энергия способствует предварительному
отрыванию от кристалла «неправильно сидящих» частиц, которые затем
самопроизвольно присоединяются к другим «энергетически» более
36
тгодным участкам .поверхности кристалла. При различных зна-
вь иях а для разных граней кристалл должен принимать форму,
4 которой преобладают грани с наименьшим значением
поверхностной энергии. При погружении кристалла с гранями,
удовлетворяющими условию (П,5), в насыщенный раствор того же
вещества он должен находиться в равновесии с раствором, не изменяя
своей формы. Если же кристаллу придать вынужденную форму,
неудовлетворяющую условию (11,5), он будет изменять форму;
причем его «искусственные» грани с большим значением о будут
быстро расти, т. е. удаляться от центра и выклиниваться. В этом
заключается явление регенерации кристаллов, т. е.
восстановления определенных, более устойчивых кристаллографических
форм.
Второе положение — идея Гиббса о скачкообразном росте
кристаллов — лежит в основе всех современных теорий роста.
Сущность ее в том, что рост кристалла сводится всякий раз к
возникновению двумерных зародышей. Последние же возникают
на грани только при достаточном пересыщении. Дальнейший рост
двумерного зародыша, заканчивающийся образованием новой
атомной плоскости, идет без преодоления каких-либо порогов, в
условиях уже весьма слабого пересыщения.
§ 3. ТЕОРИЯ РАВНОВЕСНОЙ ФОРМЫ КРИСТАЛЛОВ
(ТЕОРЕМА ВУЛЬФА)
В 1901 г. Г. В. Вульф независимо от Гиббса и Кюри вывел
формулы, связывающие -капиллярные постоянные, ретикулярную
плотность различных граней с длинами нормалей, проведенных к
ним из центра кристалла, т. е. со
скоростью роста грани.
Возьмем внутри кристалла (рис. 19)
точку О, которая совпадает с
зародышем кристалла, и из нее опустим
перпендикуляры на прани или на их
продолжения. Обозначим через пи по,
пз, ... длины перпендикуляров от О до
различных граней и через сгь сг2,
сгз, ... — удельные поверхностные
энергии этих граней, a Su S2, S3, ... —
площади граней. Теорема Вульфа
формулируется так: «Минимум
поверхностной энергии при данном объеме
многогранника достигается при таком
взаимном расположении его граней, когда
они удалены от одной и той же точки
на расстояния, пропорциональные их капиллярным постоянным».
Рис. 19. К теореме
Г. В. Вульфа
а5 : с2: а3
п-.пп: п.
... (111,1)
~>десь приводится одно из двух доказательств, предложенных
97
Вульфом. Пусть некоторый многогранник удовлетворяет условию
минимума поверхностной энергии при данном V. Очевидно, что и
все другие многогранники, подобные данному и отличающиеся от
него только объемами, также удовлетворяют этому условию. Эти
многогранники будут представлять собой один и тот же кристалл
в различных стадиях его роста. j
Общая площадь S всех граней многогранника выразится в
виде
S = p(n\ + nl + nl+ ...),
■
где р — некоторая постоянная, зависящая от формы
многогранника, щ, п2, п3,... — длины перпендикуляра от О до граней. j
Поверхностная энергия кристалла равна
U = р (охп\ + <уг| + о3п\ + ...),
а объем многогранника 1
V = q{n\ + n\ + nl+ ...),
где q — постоянный коэффициент. '{
К этому выражению приходим, если весь многогранник рас- \
членим на пирамиды с общей вершиной в точке О и с основания-
ми, равными отдельным граням.
Условия минимума поверхностной энергии при постоянном ]
объеме таковы:
dU = 2/7 ((TjAZjrf^ + o2n2dn2 + osti3dns +...) = О, \
dV = 3q (n^d^ + n\dn2 -f- n\dn3 +...) = 0,
что возможно лишь, если
a* ft * ПГ * — И ' И 'И '
Таким образом, для построения многогранника, удовлетворяющего
условию минимума поверхностной энергии, берется какая-нибудь j
точка О и из нее проводятся отрезки, перпендикулярные к воз- :
можным граням кристалла и .пропорциональные удельным
поверхностным энергиям этих граней; через концы отрезков
перпендикулярно к ним проводятся плоскости. Те плоскости, которые рас-
положены ближе к О, образуют при данных условиях естествен-
ную форму кристалла. Грани, более удаленные и не пересекаю- |
щиеся, оказываются только возможными, но реально не
существуют.
38
Принцип Гиббса—Кюри—Вульфа к формам роста в общем
учае не применим. Помимо полиэдрических, реальные криетал-
( ы имеют всевозможные другие формы роста: скелетные, дендрит-
л е и т п. Кристаллы дендритной (древовидной) формы
характеризуются завышенной поверхностной энергией. Объяснение этим
фактам следует искать в условиях роста кристалла: в
неодинаковом положении его элементов огранения в отношении питания,
кинетике роста и т. п. Как и во многих других протекающих во
времени .процессах природы, в явлениях роста кристаллов
существуют две до известной степени противоположные тенденции:
стремление к минимуму свободной энергии и стремление к
наибольшей быстроте завершения .процесса. Кристалл может достичь
минимума поверхностной энергии только в условиях равновесия,
т. е. при бесконечно медленном росте, а наибольшей быстроты
образования — при бесконечно развитой поверхности. В
реальных условиях осуществляются компромиссные формы,
приближающиеся к многогранным равновесным, или к ветвистым
неравновесным.
§ 4. АДСОРБЦИОННАЯ ТЕОРИЯ РОСТА И РАСТВОРЕНИЯ
КРИСТАЛЛОВ
В 1926 г. Фольмером разработана теория, объясняющая рост
кристаллов адсорбционным механизмом.
Адсорбция имеет место, когда энергия взаимодействия между
поверхностными частицами кристалла и контактирующей с ним
среды превышает энергию взаимодействия частиц среды друг с
другом. Согласно теории Фольмера, при соответствующем
пересыщении частицы кристаллизуемого вещества, достигнув
кристаллической поверхности, выделяют только часть своей скрытой
теплоты. Вследствие частичной .потери энергии, отлагающиеся на
твердой поверхности частицы, несмотря на >их сильное
взаимодействие с поверхностью 'кристалла, сохраняют значительную свободу
в отношении движения по поверхности кристалла, т. е. могут
перемещаться по поверхности. Совокупность
перемещающихся частиц.и представляет собой
адсорбционный слой, расположенный между
фиксированной «успокоенной» поверхностью растущего
кристалла и прилегающим слоем раствора. Фольмер
полагает, что равновесие между адсорбционным слоем и
раствором достигается почти мгновенно, т. е. лри любом нарушении
равновесного состояния между адсорбционным слоем и
нижележащей плоской сеткой, в частности, при переходе частиц из
адсорбционного слоя на кристалл мгновенно равновесие будет
восстановлено за счет поступления в слой частиц из окружающего
раствора. Согласно принципу Кюри, адсорбирующая способность грани
кристалла принимается Фольмером пропорциональной ее
поверхностной энергии.
39
В результате неупругих соударений между частицами
адсорбционного слоя могут образовываться двумерные зародыши, при-'
соединяющиеся в дальнейшем к лежащей ниже плоской сетке
кристаллической структуры. Скорость развития
кристаллизующейся части адсорбционного слоя предполагается приблизительно
пропорциональной квадрату плотности содержащихся в нем
частиц. Для усредненных плотностей адсорбционных слоев,
расположенных на двух различных плоских сетках, согласно уравнен
нию Больцмана, можно написать
С2
где Cj и С2 — плотности адсорбционных слоев, расположенных
около двух различных плоских сеток, Ах и А2 — потенциалы
внутри этих адсорбционных слоев. Принимая скорость роста
пропорциональной Сп, где п по меньшей мере рав-но единице,
получается отношение скоростей роста для двух различных граней
п{Ах—Аг)
^ = а(-^Х = ае RT , (111,2)
vt Ч Со У
где а — пространственный фактор, учитывающий легкость
проникновения частиц к -кристаллическим сеткам.
С уменьшением температуры отношение —- быстро возра-
стает. Если рост кристалла происходит в условиях, далеких от
равновесных, то >е .
щ
Придерживаясь воззрений Гиббса, Фольмер рассматривает
рост кристаллов как скачкообразный процесс. Для вывода
отношения скоростей растворения двух различных граней Фольмер
использует выражение, характеризующее способность частиц
вещества покидать решетку и присоединяться к адсорбционному
слою. Таким образом, он рассматривает процесс растворения как
процесс, обратный росту; переход вещества из адсорбционного
слоя в раствор, как и при росте практически мгновенен.
Отношение скоростей растворения зависит от тех же
факторов, которыми определяется отношение скоростей роста
соответствующих граней. Такой вывод, как показывают опытные данные,,
справедлив лишь в отдельных случаях. Точной обратимости
между ростом и растворением не существует.
■
§ 5. ДИФФУЗИОННАЯ ТЕОРИЯ РОСТА И РАСТВОРЕНИЯ
КРИСТАЛЛОВ
Большинство авторов исключает возможность
бездиффузионного роста кристаллов. Несомненно, диффузионные процессы
играют существенную роль в образовании кристаллов, что позволи-
40
л
~^~л
11
и
r~X.
1 1
v J
т ^
r
,
1 t
,Ж\
я
Рис. 20. Концентрационные
потоки в а — пересыщенном и
S — ненасыщенном растворах
И И. Андрееву объяснить процессы роста и
растворения кристаллов заколами диффузии.
Р для выявления диффузионного закона роста и растворения
кристаллов необходим маточный раствор, окружающий кристалл
«однородно», и устранение концентрационных потоков.
Концентрационные потоки, впервые наблюдающиеся Т. Е. Лови-
пем, образуются в результате изменения концентрации раствора
V поверхности кристалла. Они должны быть восходящими у
поверхности растущего кристалла и
нисходящими, когда кристалл
растворяется (рис. 20).
Однородности окружающего
кристалл раствора можно достигнуть
путем энергичного перемешивания
раствора. При этих условиях растущий
кристалл всеми своими гранями
соприкасается с однородным
пересыщенным раствором, имеющим
концентрацию с. Около кристалла в случае
его роста образуется активная
«рубашка», ограниченная с одной стороны
поверхностью кристалла, а с
другой— пересыщенным раствором. По толщине рубашки, зависящей
от объема движущейся жидкости, происходит падение
концентрации от с до се, концентрации насыщения раствора.
Предполагается, что концентрации се насыщенных растворов для различных
граней различны.
Если кристалл помещен в тщательно перемешиваемый
ненасыщенный раствор с концентрацией с, которая меньше
концентрации се насыщенного раствора, то происходит растворение.
Кристалл окружен со всех сторон рубашкой, по толщине которой
происходит падение концентрации от се до с\ происходит диффузия
кристалла к раствору. Рубашку вокруг растущего или
растворяющегося кристалла иногда называют «двориком кристаллизации».
Существование дворика и его толщину можно определить
оптическими методами.
Скорость роста грани кристалла или скорость ее растворения
будет определяться исключительно количеством вещества, про-
диффундировавшего в единицу времени через дворик
кристаллизации. Следовательно, закон роста или растворения грани
кристалла должен совпадать с законом диффузии:
^L = kS(c-ce), (111,3)
at
где dm — количество вещества, продиффундировавшее за время
через площадь S, _UL . скорость диффузии, к —
постоянен S
ная, определяемая интенсивностью притока к грани питательного
вещества.
41
Скорость роста грани кристалла обусловлена двумя
величинами: скоростью кристаллизации и скоростью диффузии.
Кажущееся противоречие между простым законом диффузии и различием
скоростей роста граней кристалла Андреев объясняет тем, что
концентрация насыщенного раствора различна для различных
граней. Этот вывод, по всей вероятности, правильный, был сделан
косвенным путем.
Теория Андреева дапускает ряд ошибочных представлений.
Неправильно рассматривать процессы роста и растворения как
обратимые. Еще менее правильно считать, что скорость
растворения зависит главным образом от недосыщения. Е. Б. Трейвус на
основании экспериментальных данных попытался связать скорость
растворения (/) с формой и размером кристалла (г — радиус
кривизны), скоростью движения раствора (и), недосыщением
раствора (Ас) и коэффициентом диффузии (D) формулой
/
~ 0,45 |/^
Ас,
(111,4)
В исследованной им области условий, когда процесс растворения
является диффузионно контролируемым, анизотропия кристаллов |
не выявляется.
Диффузионная теория, предложенная почти одновременно }
с теорией поверхностной энергии Гиббса—Кюри—Вульфа, в зна- 1
чительной степени способствовала выявлению недостатков
последней. Несмотря на большую «популярность более новых теорий
роста кристаллов, она сохраняет свое значение при исследовании
процессов роста кристаллов и в настоящее время.
В практике выращивания кристаллов часто используются ]
уравнения нормальной скорости кристаллизации z-гой грани ?.г- и
dm л.,
массовой скорости роста кристалла . Массовая ско-
dt
рость кристаллизации — это масса вещества,
отложившаяся на кристалл за единицу времени. Подсчет значений К{ и
dt •
производится при использовании уравнения диффузии и уравне- 1
ния баланса массы
dtm — — dc,
(Ш,5)
где drrii — масса вещества, отложившаяся на грань /, — dc — убыль
пересыщения раствора. Первая равна
dmL = р dlt dSL = рЦ dSt dt, (Ш,6)
где р — плотность вещества, Ц — расстояние, на которое
переместилась грань / по нормали, 5г- — поверхность /-той грани, Яг:—{
нормаль к /-той грани, t — время.
42
V
pj3 уравнения диффузии убыль концентрации раствора
выражается как
— dc = D ~^— dS, dt,
J^L градиент концентрации у /-той грани, D — коэффи-
пиент диффузии. Приравняв \ = г—— , получим уравнение
■^ Ci^l Clip
для теоретической нормальной скорости кристаллизации
Полный прирост объема кристалла состоит из dv = JiSidlu
таким образом,
= р >AV
4/
с
. dm
Подставляя значение Аг- в , получим уравнение для теорети-
dt
ческой массовой скорости кристаллизации:
^=DV_^L5.. (Ш)8)
dt *-* dli
В уравнении (111,7) и (111,8) следует ввести поправки на
теплоотвод и торможение.
Некоторая доля тепла, выделяемого растущим кристаллом,
отводится с его поверхности частицами растворенного вещестза
и растворителя; величина теплоотвода достаточно велика для
вязких сред.
dm
dt
=d£^ts<+t2>«^<. <вд
AT *
ГДе ~~w/ градиент температуры у f-той грани, г — теплота
кристаллизации, к.н — коэффициент теплопроводности.
Направленный поток частиц усваивается кристаллом не
полностью, поэтому вводится поправка на их торможение:
h^hj±. -^- = Ук * s(, (шло)
р dli dt <*-J dli
i
где Xi — наблюдаемая скорость роста г-той грани, она равна
теоретической нормальной скорости кристаллизации, умноженной на
поправочный коэффициент усвоения -у*, меньший единицы, к,- —
43
постоянная (111,3), определяемая интенсивностью притока к грат
ни i питательного веществе, Ki = yiD.
Уравнения (111,10) являются основными кинетическими
уравнениями для роста кристаллов из растворов.
§ 6. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ ТЕОРИИ РОСТА ^
И РАСТВОРЕНИЯ КРИСТАЛЛОВ
В 1927 г. В. Коссель и И. Н. Странский создали новое
направление в теоретических работах по росту кристаллов, которое no-J
ложило начало молекулярно-кинетической теории роста
кристаллов, особо успешно развиваемой в настоящее время Р. Каишевым.
Эта теория рассматривает рост идеально совершенных кристаллов
и исходит из ряда упрощающих предпосылок при анализе про-^
цессов роста. ]
Предполагается, что поверхность кристалла не деформирован
на, процесс роста идет при температуре абсолютного нуля и при
Рис. 21. Поверхность кристал- Рис. 22. Поверхность кристалла
ла при температуре абсолют- при температуре выше
абсолютного нуля ного нуля
незначительном пересыщении, влияние среды почти не
учитывается.
Только при температуре абсолютного нуля поверхность
кристалла может быть идеально гладкой (рис, 21), отличной от по-<
верхности реального кристалла. При температуре более высокой,
чем температура абсолютного нуля, грани кристалла будут
«шероховатыми» (рис. 22) вследствие термодинамических флуктуации
(по Я. И. Френкелю).
По сравнению с предшествующими термодинамическими
теориями, теория Косселя — Странского имеет преимущества^
заключающиеся в объяснении явлений роста с позиций атомно-
молекулярных свойств поверхности кристалла, которые, в
частности, позволили определить величину предэкспоненциального
множителя, оказавшегося более точно определенным коэффициентом
к, учитывавшим в диффузионной теории легкость присоединения
частиц растворенного вещества и расположение их соответствую-
44
образом в структуре кристалла. Теория Косселя и Странского
^^ясняет с помощью этого коэффициента к механизм роста кри-
° члов. Рост кристаллов рассматривается исходя из принципа ми-
CT^iyMa свободной энергии с помощью понятия энергии единичных
Нодов роста, т. е. энергии присоединения (отрыва — для случая рас-
х оренИя) единичных атомов, ионов или молекул, локализованных
Т различных положениях роста на поверхности кристалла.
Сопоставление этих энергий вскрыло детали молекулярно-кинетичеоко-
механизма идеализированного роста полярных и неполярных
кристаллов. Теория, основываясь на идее Гиббса о
скачкообразном росте кристаллов, дает объяснение полиэдрической форме
кристаллов. Собственно, имеется как теория Косселя, так и теория
Странского. Они сходны по многим основным выводам, но
существенно различны в истолковании отдельных вопросов проблемы
поста кристаллов. Теория Косселя менее математизирована, чем
теория Странского, что позволяет нам остановиться на более
подробном рассмотрении первой.
В целях облегчения описания механизма роста кристаллов
Коссель вводит следующее упрощенное положение: в
рассматриваемых теорией типах кристаллических структур потенциальная
энергия системы из двух частиц представляется простой функцией
расстояния, а энергия присоединения частицы в структуре
равняется сумме энергий ее взаимодействия со всеми соседними.
Указанные положения распространяются на гомеополярные и гете-
рополярные, ионного типа, кристаллы. Можно считать в этом
случае, что кристалл образовался в результате непрерывно
продолжавшегося повторения наиболее вероятных эквивалентных ступеней.
Энергия присоединения эквивалентной ступени ф составляется из
трех частей ф,ф ,ф , каждая из которых выражается в
«практических молекулярных единицах». Единица энергии по этой системе
определяется количеством энергии, выделяющейся при взаимодействии
двух соседних ионов (атомов, молекул). Для данной
эквивалентной ступени (рис. 23) ф = ф' + ф" + ф'". Две составляющие ф' и ф"
расположены в плоскости, перпендикулярной к направлению роста
(т. е. параллельны нарастающей грани кристалла), а третья ф"',
расположенная под прямым углом к данной поверхности,
совпадает с направлением нормальной скорости роста.
При фиксации, отложении на грань одной отдельной частицы,
начинающей образование нового слоя, выделяется только энергия
Ф (т. е. только вертикальная составляющая энергии
присоединения). При образовании нового ряда частиц, расположенного
вплотную с уже завершенным рядом, выделяется ф" + ф"', где ф"—
краевая энергия. При продолжении роста уже возникшего ряда
выделяющаяся энергия будет составляться из трех компонентов:
Ф +ф"+ф'"> Где q/ — составляющая энергия, параллельная
образующемуся ряду частиц.
Общее количество выделенной энергии остается одним и тем
е независимо от того, присоединяются ли частицы кристаллизуе-
45
мого вещества по рядам, параллельным диагонали куба, или
по рядам, параллельным ребру куба. Отсюда, очевидно, количест-J
во энергии, выделяющееся на одну ступень, должно быть один а-*
ново в обоих случаях.
Рис. 23. ■ Разложение энергии
эквивалентной ступени
решетки на три компоненты: ф', ф",
ф'"
О'
О V2
©Гз
Рис. 24. Вычисление ф', ф", Ф
///
Коссель вводит представление о «полукристалле» в связи с
определенным характером роста кристаллов, при котором
присоединяющаяся к поверхности частица испытывает силы
взаимодействия, равные половине сил вокруг сходной частицы,
заключенной внутри кристалла.
Гомеополярные кристаллы
В гомеополярных кристаллах за единицу энергии
принимается потенциальная энергия взаимодействия между двумя
соседними отдельными частицами. Вследствие того что силы
взаимодействия между частицами очень быстро падают с расстоянием, при
рассмотрении процесса роста могут приниматься во внимание
лишь частицы, расположенные в непосредственной близости друг
от друга. Коссель, как и Странский, ограничивается вычислением
сил взаимодействия между атомами, расположенными вдоль
ребер куба, по диагоналям его граней и по объемным диагоналям
куба. В качестве модели гомеополярного кристалла Косселем
взят несуществующий кристалл с кубической примитивной
решеткой Бравэ. Ближайшие расстояния между частицами по этим
направлениям в_случае простой кубической решетки
пропорциональны 1, "[/2, УЗ. Из рис. 24 видно, что максимальное количество
46
иболее близко расположенных атомов, расстояния от которых до
' нанНОГо атома пропорциональны 1, равно 6 (в «полукристалле»—
о) Количество атомов, расположенных от данного атома на рас-
I тоя иях, пропорциональных j/2, равно_12 (на рис. 24 равно 6),
на расстояниях, пропорциональных j/"3, равно 8 (на рис. 24—4).
Таким образом, для атомов в кристалле общее число более
близко расположенных соседних атомов достигает 26.
Для каждого компонента энергии эквивалентной ступени
(т е. для q/, ф" и ф'") Коссель определяет число соседних атомов,
обусловливающих данный эффект; первая вертикальная колонка
представляет число атомов, расположенных по ребру куба,
вторая диагоналям граней, а третья колонка — число атомов,
расположенных по объемным диагоналям куба.
В случае грани (100) направленное вниз притяжение
пропорционально составляющей ф'". Для одиночного атома,
расположенного на этой поверхности, число соседних атомов, удаленных от
него на расстояние a, a Y2 и а |/3, равно соответственно 1, 4, 4.
Иначе говоря, <р'" (100) = 1|4|4.
Краевое притяжение будет -создаваться соседними атомами,
расположенными в той же (частично образованной) плоской
сетке, т. е. ф" (100) = 1|2}0. Очевидно, что для ф' (100) остается один
из соседних атомов, опущенных при подсчете составляющих
Ф" и ф/,/.
Итак <р' = 1101 0
Ф" = 11 21 0
ф'" = 1 14 | 4
Ф(100) = 3|6|4
Энергия эквивалентной ступени на грани (100) равна 3|6|4. При
образовании следующего нового ряда, смежного с уже
завершенным, будем иметь ф//+ф///= 2|6|4.
Далее Коссель рассматривает грань (ПО) и полагает, что
выбор какой-либо плоской сетки не видоизменяет ни в каком
отношении окружение точки в пространственной решетке, так как
всегда для каждого атома внутри структуры имеется 26 соседних
атомов: 6_ атомов на каком-то расстоянии а, 12 атомов на
расстоянии а у 2 и 8 — на расстоянии а "j/З. Однако составляющие
энергии q/ (МО), ф" (ПО) и ф"' (ПО) будут отличаться от таковых для
грани куба и будут равны
Ф'(И0) = 1J 010
ф"(1Ю) = 0|1|2
Ф^(И0) = 2|5|2
Ф(110) = 3|6|4
47
В то же время ср (ПО) будет также равно 3|6|4, как и для граня
(100). 3
Таким образом, эквивалентная ступень во время роста остаетч
ся постоянной независимо от направления атомного ряда по одно^
или другой оси зон. \
Начало роста нового слоя для грани (100) и (ПО) обуслов-1
лено значениями <р'". Так как <р"' (100) = 1 |4| 4, а ср'" (110)=.
— 2|5|2, то присоединение атомов к грани (ПО) будет более лщ
ким, чем ,к (100), и перерывы между периодами быстрого танген^
циального роста грани (110) значительно меньше, чем при росте-
грани (100). Непосредственно после начала роста граней (т. ei
после присоединения первого атома к грани) атомные слои быстрс|
разрастаются до полного завершения. I
Еще раз следует отметить, что скорость роста грани больше
зависит от скорости присоединения первого атома на завершенной-
плоскости, чем от скорости последующего образования атомны^
рядов. Присоединение одиночного атома к завершенной плоскости'
представляет собой редкое явление при образовании каждого!
последующего слоя, но определяет темп дальнейшего роста кри-:
сталла.
Из изложенного следует, что по теории Косселя рост кристал]
ла — это прерывный .процесс, в котором период быстрого роста
сменяется сравнительно продолжительным периодом, в течение
которого кристалл претерпевает незначительные изменения.
Другой важнейший вывод, который сделал Коссель,
заключается в утверждении, что начало образования нового слоя на по-1
верхности уже заполненного слоя, т. е. присоединение одиночного-
атома, в кристаллах гомеополярного типа начинается в
большинстве случаев в местах, расположенных во внутренних частях
поверхности грани (завершенного слоя). Менее вероятно начало
роста нового слоя на ребрах кристалла и еще менее вероятно на]
углах кристалла. Действительно, в то время как величина q/" дл^
случая присоединения атома в средней части грани равна 1|4|4,.
при присоединении атома к ребру (не вблизи угла) и к вершине
она имеет соответственно следующие значения: 1|3|2 и 1|2|1.
Гетерополярные кристаллы
Коссель рассматривает гетерополярный кристалл как
совокупность положительных и отрицательных ионов, связанных меж-j
ду собой кулоновскими силами. Рост кристаллов состоит в noHl
следовательном наложении ионов и подобен реакции соединения..
Растворение, напротив, рассматривается как последовательный
отрыв ионов от кристалла. Коссель подробно рассматривает
механизм роста кристаллов типа NaCl.
За единицу энергии принимается энергия, необходимая для
разделения двух разноименных ионов, находящихся друг от друга
на нормальном расстоянии г0. По закону Кулона подсчет энергии,
48
яеляющейся при осаждении иона из раствора на кристалл, был
выполнен для следующих случаев:
1. Уже создана одиночная цепочка. Ион присоединяется к
тому из концов этой цепочки. При этом процессе выделяется
энергия (в единицах —, где е — элементарный заряд и г0 —
расстояние между двумя соседними разноименными ионами)
Ф' == 0,69315.
2. Создана готовая одиночная ионная плоскость. Ион
присоединяется к краю этой плоскости, поверхность плоскости
увеличивается, и выделяется энергия
Ф" = 0,1144.
3. Уже создан готовый кристалл NaCl. Ион осаждается на
внутренних частях поверхности грани куба с выделением
энергии
Ф'" = 0,0662.
Величины Ф', Ф", Ф'" позволяют составить следующее
представление о механизме зарождения и роста кристаллов типа NaCl.
В пересыщенном растворе ионы, притягиваясь друг к другу,
образуют ионные цепочки. Энергия, выделяющаяся при осаждении
иона на одном из концов цепочек, наибольшая (Ф'=0,69315).
Следовательно, образование и рост ионных цепочек составляют
первый этап кристаллизации. На втором этапе кристаллизации
ионные цепочки соединяются друг с другом и образуют ионные
плоскости.
Третьим этапом кристаллизации будет наложение плоскостей
друг на друга. Вычисление энергии осаждающихся ионов из
раствора на поверхность куба растущего кристалла NaCl дает
следующие результаты. Когда ион, оседая, продолжает цепочку,
указанную стрелкой 1 (рис. 25), выделяется энергия Ф'=0,69315; ион
продолжает ионную плоскость (стрелка 2), выделяется энергия
Ф"=0,Н44 и ион оседает на грань кристалла (стрелка 3) с
выделением энергии ф'" = 0,0662. В целом при оседании иона
выделяется энергия Ф0 = ф' + ф"+ф"' = 0,69315 + 0,1144 + 0,0662 =
= 0,8738, что соответствует Ф0 = 4,45 эв.
Подобным же образом можно подсчитать энергию, которая
выделяется при оседании иона на различных местах растущего
кристалла. Эта энергия пропорциональна тому потенциалу в точке
осаждения иона, который создают ионы кристаллической струк-
тУры. На рис. 26 указаны значения энергии, выделяемой при осе-
Дании иона на различных местах кристалла. В порядке убывания
получаем: 1) наибольшую энергию (0,8738), выделяющуюся при
°саждении иона в излом ступени; 2) энергию, равную 0,4941,
соответствующую случаю, когда ион оседает, образуя новый ряд
49
плоскости; 3) энергию, равную 0,2490, для случая, когда ион по-3
падает на грань около вершины трехгранного угла; 4) энергию/
равную 0,1806, когда ион садится где-либо сбоку растущей ионной
плоскости; 5) энергию, равную 0,0903, когда ион закрепляется на
плоскости около ребра куба, и 6) наименьшую энергию (0,0662),*
выделяющуюся, когда ион садится на грань куба. Такая последо^
вательность в росте кристалла соответствует только небольшому
пересыщению в условиях однородности окружающего кристаля'
раствора. Из приведенных цифр видно, что в случае гетерополяр-]
J
(10903
00661 I
! /
4
0Ч9Ч1
У 0,1806^0.2490
Рис. 25. Образование
нового ионного слоя
при оседании иона А
Рис. 26. Значения энергии,
выделяемой при оседании
иона в различных местах
кристалла NaCI
ных кристаллических поверхностей вероятность присоединения
атомов к различным местам завершенного слоя имеет порядок,
обратный тому, который наблюдается в гомеополярных
кристаллах.
Коссель рассматривает такой механизм растворения гетеро-
полярных кристаллов типа NaCI. При растворении для отрывания
иона от кристалла и перевода его в раствор требуется некоторая
затрата энергии. Очевидно, в первую очередь отрываются те ионы,,
которые слабее всего связаны с кристаллом. Например, для того,,
чтобы вырвать ион с грани (100), требуется энергия 1,6814
(рис. 27), тогда как при наложении иона на эту же грань
выделяется всего 0,0662. Это объясняется тем, что в первом случае
нарушается целостность грани, тогда ,как во втором — на готовую
грань налагается первый ион. На рис. 27 видно, что при
растворении ион легче всего удаляется с места, где требуется энергия
0,8738, т. е. несовершенная грань (100) последовательным
растворением переходит в совершенную. Растворение идет интенсивнее
всего с вершин трехгранных углов и с ребер. Кристалл
приобретает вследствие этого округленную форму. Из рассмотренного-:
механизма видно, что процесс растворения существенно
отличается от процесса кристаллизации.
Для объяснения роста и растворения кристалла Странский
находит работу, необходимую для отделения одной молекулы,
находящейся в различных положениях на поверхности кристалла.
Вычисление сделано для тридцати положений «молекулы» в кри-
50
таэтлах типа NaCI (рис. 28), причем эффект притяжения учиты-
°атся по Маделунгу и силы отталкивания по Борну. Результаты
оказали, что зеркально гладкую поверхность имеют только грани
куба (ЮО), грани же ромбического додекаэдра (МО) и октаэдра
(111) должны представлять собой не плоскости, а поверхности из
1,1872
'J,WO ~Ш9
Рис. 28. Расположение атомов
или ионов на поверхности
растущего кристалла кубической
формы
^%S9W
Рис. 27. Значения энергии,
необходимой для отрыва иона
от разных мест кристалла
микроскопических ступенек и три-
гональных пирамид, причем
грани этих ступенек и пирамид
представлены гранями куба. В
процессе роста кристалла молекулы
или ионы по преимуществу
присоединяются к вершинам куба,
затем к ребрам и только в исключительных случаях попадают на
середину грани (100). Это значит, что рост граней октаэдра и
ромбододекаэдра вообще не связан с образованием двумерных
зародышей в отличие от граней куба. Грани ромбододекаэдра растут
путем присоединения отдельных рядов, грани октаэдра — путем
присоединения ионов.
Растворение происходит в ином порядке. Присутствие
посторонних примесей может существенно изменить результаты теории.
Средняя работа отрыва
В 1943 г. Странскому и Каишеву удалось выяснить связь
между термодинамической статистической теорией Гиббса—Фоль-
мера и молекулярно-кинетической теорией Косселя—Странокого и
положить основание молекулярно-кинетической теории
образования и роста кристаллов, в которой используются преимущества
обеих теорий. Для этой цели оказалось недостаточным
использование только работы отрыва частиц от различных мест
поверхности кристаллов. Необходимо было подойти к вопросу
статистически, вводя и последовательно применяя так называемые средние
Работы отрыва.
Согласно теории Косселя—Странского, грани равновесной
формы обладают одинаковым давлением паров, и для всех граней
такой формы вероятности растворения или образования плоской
51
сетки сравниваются. В микромасштабе для всех поверхностны^
плоских сеток средняя работа отрыва на частицу имеет одну и ту
же величину. Соответственно уравнение Томсона—Гиббса примет*
форму
ЛГ1п-^ = фоо—ФЛ = Фу, —ФЛ. (И1,11)
где ф/г — средняя работа отрыва (по Каишеву), фоо = ф1/2—работа
отрыва частицы от положения у полукристалла. Для нахождения
средней работы отрыва нужно постепенно отделить все частицы
поверхностной плоской сетки (в любой последовательности),
сложить соответствующие работы отрыва и поделить сумму на число
частиц. Чтобы определить равновесную форму, соответствующую
газообразной фазе с давлением /?/г (ph>poo), поступают следующим
образом. Удаляют из любой формы кристалла поочередно все
частицы, для которых работа отрыва фг меньше средней работы
отрыва ф/г (фг <ф/г<ф1/2). Таким путем выявляют все грани,
принадлежащие к равновесной форме, и далее изменяют площади
граней до тех пор, пока средняя работа отрыва одной частицы от I
плоской сетки не будет иметь одинаковую величину для всех
граней. :
Метод средних работ" отрыва применим при температуое
т = о°к.
Согласно Фольмеру, при более высоких температурах
необходимо все ростовые вопросы разбирать с помощью химического
(термодинамического) потенциала \х\
[Х = kT In Vv = — ф-v — kT In V
где Vv—величина, обратная концентрации насыщения в газовой
фазе, соответствующая работе отрыва v-й частицы, Vv— объем,
занимаемый колеблющейся частицей кристаллической структуры.
Введя химический потенциал, уравнение Томсона—Гиббса.
можно записать так:
кТЛп-^- = 1Лг/2-рн, (III, 12)
где jLii/2—химический потенциал частицы в положении у
полукристалла, jii/г — средний химический потенциал частицы на грани,
находящейся на некотором расстоянии от центра кристалла
(начала роста).
К сожалению, до настоящего времени еще нет способа
нахождения объемов, занимаемых отдельными колеблющимися
частицами у поверхности кристалла, и поэтому попытки использования
этой формулы не всегда себя оправдывают.
52
§ 7. ДИСЛОКАЦИОННАЯ ТЕОРИЯ РОСТА КРИСТАЛЛОВ
Дислокационная теория роста кристаллов является современ-
й теорией, претендующей на наиболее полное описание роста
н сталЛов из газовой фазы. Ее основы заложены В. Бартоном,
Н Кабрерой и Ф. Франком в 1949 г. У нас в СССР феноменологи-
еская часть этой теории развивается А. А. Черновым. Эта теория
Чбъединяет в себе классические представления о росте
кристаллов созданные Гиббсом, Фольмером, Косселем, Странским, Каи-
шевым и дислокационную теорию Франка. Согласно классической
теории роста, скорость перемещения идеально гладкой (плотно-
упакованной) грани растущего кристалла пропорциональна
частоте появления на ней двумерных (плоских) зародышей (новых
атомарных или 'молекулярных слоев). Разрастание слоя, или
перемещение краев неукомплектованных зародышей происходит
достаточно быстро и считается, что оно не лимитирует скорости
кристаллизации. Как указано, вероятность образования нового
слоя является весьма чувствительной функцией пересыщения и
совершенно ничтожна при пересыщениях ниже 25—50%.
Однако реальные кристаллы растут с наблюдаемыми
скоростями при пересыщении в 1 % или ниже и большинство
правильных и хорошо образованных кристаллов получается в
действительности при низких пересыщениях. Все это указывает на то, что
реальные кристаллы не могут быть совершен-
к ы м и.
Идея Френкеля о наличии шероховатости естественной
грани, вызванной термодинамическими флуктуациями, была
пересмотрена Бартоном и Кабрерой. Они показали, что в обычных
условиях роста кристаллов ступени роста не могут образоваться
термодинамическими флуктуациями на поверхности низких
индексов. Термодинамическими флуктуациями они способны
образоваться только в непосредственной близости к точке плавления
кристалла.
Одним из несовершенств кристаллов, как было показано
Франком, являются дислокации, обеспечивающие
наличие готовых ступеней на поверхности грани
кристалла.
Бартон, Кабрера и Франк убедительно обосновали такой
механизм роста кристаллов, который требует, чтобы поверхность
оставалась ступенчатой независимо от того, как далеко ступеньки
продвинулись, благодаря чему рост кристаллической грани
становится непрерывным.
Дислокации представляют собой чисто геометрические
нарушения в кристаллической решетке. Этот тип дефектов характерен-
и Даже единственный в том отношении, что оказывает действие на
Решетку на расстояниях, больших, чем несколько межатомных
промежутков. Представление о дислокациях возникло в
результате изучения кристаллографической природы пластического
53
течения. Было обнаружено, что в деформированных металлах
линии скольжения выявляют важные кристаллические плоскости]
и нормальное скольжение возникает в направлении наиболее
плотной упаковки атомов в плоскости скольжения.
Различают краевую и винтовую дислокации. Краевую
дислокацию, впервые описанную Г. Тейлором, удобно представить себе
так, что в разрез кристаллической решетки вставлена добавочная
полуплоскость (рис. 29). Край полуплоскости образует линию
дислокации, которая простирается вдоль всего кристалла. Сами
дислокации различаются по знаку и по тому, как «сверху» или
«снизу» вставлена полуплоскость. Дислокации одинакового знака
/
v
i
i (
У
Рис. 29. Структура краевой
дислокации
1
Рис. 30. Образование
винтовой дислокации
(первый этап)
1
усиливают друг друга, противоположные же дислокации взаимно
уничтожаются.
Механизм винтовой дислокации впервые указан И. Бюргерсом
и может быть проиллюстрирован моделью кристалла. В ростовой
истории кристалла возникает разрез ABEF (рис. 30), вдоль него
кристаллический материал, расположенный справа от разреза,
сдвинут вниз (рис. 31) на один межатомный промежуток. На
поверхности кристалла при этом образуется ступенька так, что с
левой стороны поверхность кристалла выше, а с правой — ниже.
Линия EF, вдоль которой произошел сдвиг одной части кристалла
относительно другой, представляет собой линию дислокации,
которая, как видно на рисунке, выходит к поверхности кристалла
под прямым углом. Атомные плоскости в кристалле расположены
по спирали, по правому или левому винту вокруг стержня. На
расстояниях, больших чем несколько межмолекулярных
расстояний от линии дислокации, искажение кристалла -сглаживается
(рис. 32).
На любой плоскости идеальной решетки кристалла можно
провести линию через ближайшие соседние атомы таким образом,
что она образует замкнутую плоскую петлю. Такая линия назы-
54
ется контуром Бюргерса. Подобная линия в реальном кристалле,
веющем геометрический дефект дислокационного типа, не обра-
?ет замкнутой петли. Итак, винтовая дислокация — это линейное
^совершенство, для которого контур Бюргерса является разомк-
утым; вектор, замыкающий разомкнутый контур Бюргерса,
называется' вектором Бюргерса.
Винтовая дислокация может быть либо правой, либо левой.
В правой дислокации движение вдоль контура Бюргерса от более
i
i
\Е
//
//
В
iL
Рис. 31 Образование
винтовой дислокации
(второй этап)
Рис. 32. Выход винтовой
дислокации
высокого уровня к более низкому происходит по часовой стрелке,
в левой дислокации — против часовой стрелки. Винтовые
дислокации одинакового знака усиливают друг друга, а дислокации с
противоположными знаками взаимно уничтожаются. Правая и
левая винтовые дислокации дают начало спиралям роста,
закручивающимся соответственно по часовой или против часовой
стрелки (рис. 33). Это отличие важно в тех случаях, когда фронты
роста, возникающие от различных источников, пересекаются друг
с другом.
На рисунке 33 показано последовательное положение
ступеньки 1, 2, 3, 4, 5 и образование спирали роста (а, б, в). Вначале
ступенька перемещается параллельно самой себе. За счет большей
скорости перемещения ступеньки вблизи оси винтовой дислокации
произойдет искривление ступеньки и образование спирали.
Искривленная часть ступеньки менее устойчива и скорость
перемещения ее здесь уменьшится, пока не будет достигнуто
равновесное состояние, соответствующее такой форме спирали, при
которой все ее части перемещаются с одинаковой угловой
скоростью:
w
V
2Рк
(111,13)
55
\
здесь v—скорость роста ступени, р^—критический
ны двумерного зародыша.
радиус кривиз-
Pi
аФ
2kT In a
(Ш,14)
Р
где а = — степень пересыщения, р и р0— соответственно дав-
ления пересыщенных и насыщенных паров, 1/2Ф = оа — энергия
связи ближайших атомов, о = а—1, а —межатомное расстояние.
©
£
Рис. 33. Возникновение спирали роста
Скорость перемещения плоского фронта с изменением радиу-<
са кривизны определяется формулой
K = v(l
<
9к
У
(Ш, 15)
Различают круговые и полигональные -спирали. Круговые
спирали возникают в случае независимости скорости роста от
кристаллографического направления. Полигональные спирали
отражают зависимость скорости продвижения фронта роста v от
кристаллографического направления. Линии -ростовых фронтов
располагаются преимущественно параллельно плотно
упакованным направлениям на грани кристалла:
Более сложные формы рельефа грани возникают при
взаимодействии нескольких спиралей одинакового или противоположных
направлений. На рис. 34,а показано наложение большого числа
спиралей (104 на 1 см2) одинакового направления вращения, а на
рис. 34,6 показано взаимодействие двух одинаково развивавшихся
спиралей противоположных направлений вращения. При вращении
спиралей противоположного знака вокруг точек выхода их ветви
соединяются и образуют замкнутые петли. Спиральные ступени
роста хорошо наблюдаются на гранях берилла (рис. 35),
карборунда (рис. 36), парафина (рис. 37) и др. Как видно на рисунках
35 и 37, полигональная форма спирали соответствует симметрии
грани кристалла.
56
Рис. 34. Спирали роста: а —спирали одинакового направления
вращения, б —наложение двух спиралей разного направления
(карбид кремния)
Рис. 35. Замкнутая петля в форме лезвия бритвы на кристалле
берилла (внутренняя линия ступеньки проходит между двумя
дислокациями противоположного знака)
Образование спиралей на гранях кристаллов карборунда|
наблюдалось и было описано впервые Г. Г. Леммлейном, а теории
Франка связала спиральный рост с дислокацией в решетЫ
кристалла.
Рис. 36. Круговая спираль на
кристалле SiC, наблюдаемая в
фазоконтрастном микроскопе,.
Х90. Высота ступеньки 15А
Рис. 37. Электронно-микроскопический снимок кристалла п —
парафина (СзвН74) после натенения палладием (видна правая
спираль, начинающаяся от одной дислокации)
Г. Г. Леммлейном и Е. Д. Дуковой изучалась кинетика
спирального роста на легкоплавком (температура плавления 44°С) и
легколетучем органическом веществе паратолуидине СбН4-СНз*
• NH2. Был показан механизм возникновения винтовых дислокаций
58
спирального роста при кристаллизации паратолуидина из газо-
- » фазы на крышке замкнутой стеклянной камеры,
поставленной на предметный столик микроскопа. При помощи
миниатюрного нагревательного устройства тонко регулировалась
температура камеры, а следовательно, и скорость роста кристаллов на
конденсационной поверхности камеры. Покадровая микрокино-
-ъемка позволила проследить и изучить динамику спирального
поста. Было обнаружено, что морфологическая картина
поверхности растущего кристалла меняется в зависимости от
температуры кристаллизации. Паратолуидин растет послойно с толщиной
слоя, доходящей до бимолекулярной при небольшом
переохлаждении. Для измерения толщины слоя использовался метод Ковар-
ского, основанный на изменении интерференционной окраски
• тонких кристаллов.
В результате исследования были конкретизированы условия
возникновения спиралей. Из расплава при больших
переохлаждениях кристаллы обычно растут скелетно с ворончато
углубленными гранями. К кошцу роста с понижением переохлаждения
расплава происходит постепенное зарастание этого углубления с краев
грани. При смыкании слоев в центре грани всегда образуется шов
(след) не вполне точного совмещения решетки кристалла в месте
стыка слоев. Возникший таким образом дефект строения (т. е.
дислокация) и становится постоянно действующим активным
местом спирального нарастания слоев грани (рис. 38). Изучая
кинетику образования спиралей, авторы наблюдали их
возникновение лишь при определенных термодинамических условиях. При
малой концентрации паров и при температуре, отличающейся на
8—10°С от точки плавления, когда рост незаметен на глаз,
симметрия кристалла проявляется наиболее сильно. Симметрия
кристаллов паратолуидина ромбическая и спирали имеют форму
вытянутых четырехугольников. Если постепенно увеличивать
скорость роста, повышая концентрацию паров паратолуидина, то
спирали принимают все более изометрическую форму в результате
увеличения числа ребер; симметричные четырехугольники
переходят в восьмиугольники и далее спирали принимают округлые
формы.
Зависимость между тангенциальной скоростью роста Л(v) и
толщиной слоя спирали dl (рис. 39) выражена в виде
A(dl) = a+±-, (111,16)
dl
Ще а,Ъ — константы. Толщина слоев dl или 'высота ступенек
спиралей равна или кратна высоте элементарной ячейки.
В условиях опыта наблюдалось и вырождение спирали
(рис. 40). У легколетучих веществ форму спирали можно длительно
сохранить только в том случае, если внезапно прервать процесс
Роста. Если же рост кристаллов продолжается, то опирали на них
59
,;■.:*;:•■■
/I
4/h
dl(mji)
Рис. 38. Процесс образования
первого витка спирали в месте стыка
встречных слоев (по Е. Д. Дуковой)
Рис. 39. Зависимость
тангенциальной
скорости роста от
толщины спирального
слоя
Рис. 40. Последовательный распад спирального слоя
кристаллов паратолуидина (а, б, в, г) Х200 (по Е. Д. Дуковой)
временем вырождаются, образование новых витков прекращает-
с0 а последний виток спирали как бы отрывается от центра и на-
с 'ает перемещаться радиально. Если этот конец спирали
достигает фронта роста предыдущего витка, то он сливается с ним и
образует замкнутую окружность. Если оставить условия строго
стационарными, то дальнейший рост происходит в результате рас-
лространения полученных таким образом концентрических
окружностей. Вырождение спирали можно ускорить, увеличивая скорость
роста. За счет способности спиралей вырождаться они становятся
невидимыми на грашях даже тех кристаллов, которые росли по
спиральному механизму.
Спиральный рост некоторое время считался аномальной
особенностью кристаллов. Но за последнее время спирали роста были
обнаружены на большем числе естественных и искусственных
кристаллов различных систем, обладающих всевозможными
габитусами, в том числе и нитевидными, с различными типами связей: на
гомеополярных и ионных кристаллах, металлах и органических
соединениях. Поэтому можно думать, 'что при малых пересыщениях
дислокационный механизм роста, испарения, растворения и т. д.
является для кристаллов, если не единственным, то во всяком
случае достаточно характерным и всеобщим.
§ 8. ТЕОРИЯ ПОСЛОЙНОГО РОСТА КРИСТАЛЛОВ
Учение о послойном росте граней .кристалла создано Г. Г. Лем-
млейном и его учениками. Представление о спиральном росте
кристаллов — особо яркий пример элементарного процесса роста.
Между кристаллом и окружающей его средой всегда существует
переходный адсорбированный слой, который образует физическую
границу раздела и служит посредником при взаимодействии фаз.
При фазовых превращениях все атомы, или молекулы, переходящие
из одной фазы в другую, некоторое время находятся в этом слое.
Микропроцессы, протекающие в переходном слое и составляющие
кинетику роста, растворения и т. д., называются
элементарными.
Учение об элементарных процессах роста успешно развивается
А. А. Черновым. Согласно этому учению вся кинетика роста при
наличии уже готовых ступеней определяется движением этих
ступеней, их формой, взаимным расположением, высотой и
взаимодействием друг с другом.
Равновесное состояние поверхности кристаллов
Исследование А. А. Черновым поверхности кристалла,
находящегося в равновесии с окружающей газообразной средой,
показало, что поверхность граней его может быть плотноупакованной
и небольшое отклонение от ориентации составляющих такую грань
приводит к ступенчатой поверхности. Сами края ступеней не могут
61
быть гладкими и покрыты изломами А (см. рис. 22) в результат^
отрыва или присоединения молекул, находящихся в поверхностном
адсорбированном слое. Допустимо, что только при температуре
абсолютного нуля фронт ступени может быть гладким, и уже
небольшие тепловые флуктуации приводят к появлению изломов.
Измерив энергию сублимации (кристаллизации) или отрыва
молекул, а также фиксируя расстояние между изломами на гранях
(111) и (100) кубического кристалла, можно оценить и
поверхностную энергию кристалла.
Ц. Херрингом решена математическая задача 'вычисления
химического потенциала среды, находящейся в равновесии с
поверхностью кристалла, достаточно гладкой, т. е. без макроскопических
углов и ребер. Формула Херриега применяется Черновым для
решения задачи о равновесной форме кристалла при его постоянном
объеме (правило Вульфа). Когда форма кристалла отличается от
равновесной, химический потенциал среды над различными
участками поверхности неодинаков. Если, например, среда представляет
собой раствор, то его концентрация меняется вдоль поверхности
кристалла. В результате начинается диффузия, которая приводит
к растворению одних и росту других участков кристалла. Процесс
останавливается после того, как кристалл примет равновесную
форму и не концентрация раствора, а его химический потенциал
сделается одинаковым над его поверхностью.
Рост кристаллов из паров
Развивая далее теорию Бартона, Кабреры и Франка роста
кристаллов из паров, Чернов разбирает в своих работах процесс
перемещения ступеней во время роста кристалла и получает
выражения для скорости перемещения отдельной ступени, группы
ступеней, нормальной скорости роста кристалла и т. д.
Ступени, растущие на поверхности кристалла, имеют фронт,
изрезанный изломами. Адсорбированные на грани молекулы
образуют адсорбционный слой, находящийся в равновесии с изломами1
и окружающей кристалл средой. Если равновесие нарушается, то
в местах изломов начинается переход молекул в твердую фазу, что
ведет к возникновению на поверхности плоских потоков. Расход
вещества в адсорбционном слое пополняется за >счет оседания новых
молекул из окружающей среды. Таким образом, непосредственная
конденсация происходит только на боковых участках ступеней.
Франком, Бартоном и Кабрерой рассмотрено движение ступени;
элементарной высоты. Но непосредственные наблюдения за ростом
кристаллов показывают, что на поверхности могут быть ступени
различной высоты. Скорость роста ступени полимолекулярной вы-'
соты (h) должна определяться количеством вещества,
поступающего непосредственно из пара (объемная диффузия) и количеством
вещества, доставляемого из адсорбционного слоя путем
поверхностной диффузии.
62
В приближенном варианте скорость роста ступени в
зависимости от ее толщины (h) должна определяться выражением
Vh = V„ + -^L1 (111,17)
где Voo — количество вещества, поступающего непосредственно из
газовой фазы, / — плотность потока поверхностной диффузии, а3 —
объем молекулы. Такая зависимость скорости роста слоя от ее
толщины получила экспериментальное подтверждение. При малых
толщинах второго и третьего элементарных слоев эта зависимость
отклоняется от данного выражения из-за неустановившейся
поверхностной диффузии.
Чернов дает более точное, выражение зависимости V^h) для
слоев различной толщины с учетом времени релаксации (задержки)
перехода вещества в твердую фазу, средней жизни молекулы,
величины отклонения поглощающей поверхности от вертикали
и т. д. .
Рост изолированной ступени
Если кристалл окружен пересыщенным паром, то его
химический потенциал \iK меньше потенциала пара [iT. Для установления
равновесия ~ Мт~М* начинается диффузия в адсорбционном слое
и паре по направлению к ступени и будет идти непрерывно до тех
пор, пока не исчезнет пересыщение. Ступени малой высоты
«питаются» в основном за счет поверхностной диффузии в адсорбционном
слое. Формулы движения изолированной ступени учитывают поток
адсорбированных из газа частиц, время релаксации усвоения
ступенью частиц, ^-коэффициент, характеризующий скорость
обмена частиц между ступенью и адсорбционным слоем, давление
пара над кристаллом, истинное давление, время установления
равновесия между кристаллом и адсорбционным слоем. С учетом
всех этих величин решается задача о скорости роста ступени. Но
скорость перемещения ступени, согласно опытным данным,
значительно меньше, чем скорость диффузии, следовательно, ступень
можно рассматривать как непрерывный линейный сток для
адсорбированных частиц. Мощность стока считают пропорциональной
разности химических потенциалов. Из выражения скорости роста
ступени (оно здесь опускается) видно, что скорость перемещения
изолированной ступени не зависит от кристаллографической
ориентации ступени, так как определяется изотропным диффузионным
потоком. Бели учитывать анизотропию, то ее надо искать либо в
анизотропии коэффициента поверхности диффузии, либо в
величине |3. Если же имеется бесконечный эшелон параллельных
элементарных ступеней и расстояние между ними меньше длины
свободного пробега молекулы ArZA,s, то их диффузионные поля
перекрываются и скорость их должна уменьшаться с уменьшением Аг.
63
Нормальная скорость слоисто-спирального роста
Нормальная скорость роста спирального холмика К зависит отЗ
скорости роста ступени v и расстояния между ступенями Аг. По-^
следнее определяется мощностью источника этих ступеней. При
малых пересыщениях (oZoK), когда Аг велико и диффузионные
поля между ступенями не перекрываются, нормальная скорость
находится в квадратичной
зависимости от пересыщения (А,~о2). Если ж<
пересыщение увеличивается, то
расстояние между ступенями
уменьшается, перекрывая диффузионные поля,
питание ступеней ухудшается и
скорость роста становится прямо
пропорциональной пересыщению (Х~а)
(рис. 41). Такая зависимость получила
подтверждение в экспериментальны]
работах многих авторов.
На основании изложенного можно
утверждать, что лри определенных
(нестабильных), условиях, когда вы-*
ступающие участки кристаллической
поверхности (угловые и реберные) в
отношении питания оказываются в преимущественном положении,
возможна замена спирального механизма роста другим
механизмом. Исследования Чернова по формам роста кристаллов и их
кинетической устойчивости изложены в гл. IV, § 4.
Рис. 41. Зависимость нормаль
ной скорости роста от пересы
щения
ч.
Движение макроскопических ступеней
В работах Чернова рассмотрено также движение
макроскопических (более 100 параметров элементарной ячейки) ступеней.
Если торец ступени есть плотная макроскопическая грань
кристалла, то перемещение ее возможно за счет либо о^бразования
зародышей, либо выходов дислокаций на поверхности. Наиболее вероятно
появление зародышей во входящем остром углу между плотной
гранью и ступенью. При образовании зародышей, меньших по
толщине, чем ступени, можно наблюдать распад ступени в
процессе роста. При малых пересыщениях торец ступени может быть
размыт изломами и флуктуациями, стадия образования зародышей
перестает лимитировать движение ступени, рост и распад ее зави1;
сит от питания ее торца.
Черновым рассмотрено питание ступени от газовой фазы
мигрирующими частицами. Им показано, что вследствие того что торец
ступени питается частью непосредственно из газо'вой фазы, частью,
путем поверхностной диффузии, это питание становится при опреЗ
деленных пересыщениях неравномерным и ступень (ее торец)
может прогнуться (рис. 42), что может привести к распаду'ступени,
64
некоторых случаях к образованию дендритообразных пластин-
аатых кристаллов. Процесс распада ступени при увеличении пере-
4 тшения и при постоянном пересыщении экспериментально
доказан.
Рост кристаллов из растворов
При росте кристалла из раствора важнейшей проблемой
становится транспортировка питающего материала к поверхности
кристалла. Она определяется в основном «диффузией в объеме»,
т е. диффузионными процессами, происходящими в растворе. При
этом по сравнению с этими объемными процессами диффузия по
поверхности кристалла ничтожна.
Если весь раствор неподвижен, то лимитирует рост кристалла
диффузионное сопротивление раствора, пропорциональное линей-
>ч
Рис. 42. Прогибание торца
ступени с выделением более
низкой ступени
Рис. 43. Распад торца ступени
с образованием нависшего слоя
ному размеру объема, занятого раствором, и обратно
пропорциональное коэффициенту диффузии.
Если раствор перемешивается, то к диффузионным процессам
прибавляется гидродинамический перенос вещества. Скорость
роста кристаллов увеличивается. Однако у поверхности кристалла
всегда остается тонкий слой неподвижной жидкости и перенос
растворенного вещества происходит через него путем объемной
диффузии.
Учитывая эти особенности роста кристаллов из раствора,
Чернов выводит формулу скорости роста эшелона элементарных
ступеней, связывая коэффициент диффузии в растворе с р —
скоростью обмена частиц между ступенью и раствором и изменением
концентрации в растворе. Исследуется влияние изменения
концентрации в растворе на скорость роста и форму микроскопической
ступени и определяется распределение концентрации над
поверхностью ступени с учетом только объемной диффузии >в растворе в
предположении, что поверхностная диффузия пренебрежительно
мала. Исходя из данных предпосылок, Черновым показано, что
распад макроскопической ступени при росте из раствора должен
происходить не как в случае роста кристаллов из паров с
выделением более низкой ступени, а с образованием нависшего слоя, так
как объемная диффузия обеспечивает более высокую
концентрацию раствора вблизи выпуклого угла (рис. 43). Такие нарастаю-
3 О. Г. Козлова 55
щие встречные слои способны перекрывать маточный раствор
преимущественно в средней части грани. £
Еще О. М. Аншелес, изучая механизм роста реальных кристал!
лов из растворов, пришел к выводу, что в перекрытии нарастающие
ми слоями маточного раствора есть основная причина внутреннего!
несовершенства кристаллов, их неоднородности. У периферически^
частей грани, в углах и ребрах кристалла, раствор более
пересыщен, возобновление пересыщения происходит быстрее, чем в
средних частях граней. Зародыш слоя, возникший на угловых и
реберных участках поверхности грани, быстро разрастается танген-1
циально, по грани, перекрывая непересыщенный раствор. Толщина
нарастающих на грань слоев и прослоек маточного раствора
между ними находится в прямой зависимости от степени пересыщения
раствора и оказывается неодинаковой для различных граней^
кристалла. Для скоростного выращивания однородных кристаллов
необходимо искусственное ускорение равномерного притока пере-1
сыщенного раствора ко всем участкам поверхности растущего
кристалла, т. е. необходимо ликвидировать дворик кристаллизации:
Достигается это непрерывным перемедшванием раствора или дви^|
жением в растворе самого кристалла, в частности его вращением.
Следует иметь в виду, что полная ликвидация дворика невозможна.
Коллективные эффекты при движении ступеней
(ударные волны) 1
Исследования слоистого роста кристаллов и скорости
движения отдельных ступеней показывают, что ступенчатая структура
поверхности кристалла зависит от условий роста (пересыщения,
температуры и т. д.). Можно рассматривать не отдельно движение
каждой ступени или спирали, а коллективные эффекты,
сопровождающие движение некоторого количества ступеней. Тогда в
результате флуктуации плотности ступеней возможно возникновение
кинетических (ударных) волн.
Если на поверхности кристалла движется эшелон
элементарных ступеней, то скорость перемещения этого эшелона и его угол
наклона будут зависеть от плотности ступеней, т. е. от числа
ступеней на единицу поверхности. Скорость перемещения всего
эшелоиа зависит от расстояния между ступенями. Если оно не
меняется, то наклон и скорость остаются постоянными. Если в*
какой-либо момент времени возникает резкое увеличение
плотности ступеней в некотором участке эшелона (это может быть в
результате временного увеличения пересыщения, распада крупной
ступени и т. д.), то в данном месте ступени начнут влиять друг на
друга, появится почти истинная небольшая ступень и возникнет;
разрыв плотности с угловой точкой. Этот процесс получил матема-*
тическое выражение.
Образование ударных ступеней было предсказано Франком
и Кабрера. Черновым исследовано более подробно в рамках дан-
66
и теории возникновение разрыва плотности и эволюция ее во
Н° ени. 0М показано, что разрыв плотности возникает при самых
Базнообразных возмущениях, в результате которых на поверхности
издаются участки, где плотность ступеней по абсолютной величине
взрастает. В результате образования кинематической волны с
лгтовыми точками профили поверхности могут быть весьма
разнообразны.
Таким образом, на поверхности кристалла нужно считаться с
макроскопическими ступенями двух типов.
1. «Истинные» ступени. Их устойчивость определяется
анизотропией поверхностной энергии, для них достаточно постоянна
скорость и стационарна форма.
2. Макроступени, представляющие собой слабые кинетические
волны плотности элементарных ступеней и наклоненные под малым
углом к поверхности кристалла. На них возможны изменения
плотностей ступеней, связанные с флуктуациями пересыщения и
при резком увеличении плотности ступеней они могут переходить
в «истинные» ступени.
§ 9. СВЯЗЬ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ РОСТА
КРИСТАЛЛОВ С ДИСЛОКАЦИОННОЙ ТЕОРИЕЙ
Р. Каишев связал молекулярно-кинетическую теорию роста
идеальных кристаллов с дислокационной теорией роста
несовершенных кристаллов, оперируя средними работами отрыва. Им
использован пример образования спирального роста на грани куба
кристалла с простой кубической решеткой в результате выхода
на эту грань винтовой дислокации, образующей ступень на
поверхности кристалла.
Согласно теории Каишева, при данном пересыщении может
расти только та ступень, средняя работа отрыва (ф) от которой
всегда больше химического потенциала (д), т. е. |ф|>||ы|.
При учете одних лишь сил взаимодействия между ближайшими
атомами в структуре кристалла средняя работа отрыва от
ступени, составленной из п атомов, равна
ф = 31>—£-, (111,18)
п
где ф — работа разрыва одной связи между соседними атомами.
С другой стороны, химический потенциал паров равен средней
работе отрыва от ступени с длиной двумерного зародыша,
соответствующего данному пересыщению. На грани куба этот зародыш
можно считать квадратным со стороной, составленной из пк атомов,
тогда средняя работа отрыва равна
%
67
Отсюда следует, что необходимое условие роста ступени п>пк, т. ej
при данном пересыщении могут расти только такие ступени, длина
которых больше стороны двумерного зародыша, соответствующего
этому пересыщению.
Пусть длина ступени на грани несовершенного кристалла,
обусловленная выходом винтовой дислокации, />/к, где / — длина
стороны двумерного зародыша (рис. 44,а). За время роста t она,
сместится вперед параллельно себе на расстояние /к. Одновременно,
с этим от центра выхода дислокации отходит новая ступень, пер-
Рис. 44. Ступень,
обусловленная винтовой дислокацией (а);
вторая ступень,
перпендикулярная первой (б); фронт роста,
получивший вид по истечении
■времени (в)
пендикулярная первой, с длиной /к (рис. 44,6), которая также,
начнет участвовать в дальнейшем росте и т. д. Через малый отрезок
времени фронт роста получит вид, представленный на рис. 44,в,
т. е. закручивается в полигональную спираль с расстоянием между
ступенями Дг=4 /к. При дальнейшем росте эта спираль сохраняет
свою форму с углом поворота, равным 90°, с периодом вращения,
равным 4/, причем каждая ступень смещается вперед на расстояние
Аг=4 /к. Может быть определена связь между расстоянием и
пересыщением паров 5 = In
Согласно теории, разница между сред-
оо
ней работой отрыва бесконечного кристалла ф0о = 3,ф и средней
работой отрыва фп для стороны двумерного зародыша равна
фоо —фк
п
к
Поскольку 1к = пкау где а — параметр решетки, то для расстояния
Аг получается
4г|)а
Аг-=
kTS
(Ш,19)
68
расстояние между витками спирали обратно пропорционально
Тер'есыщению. В данном расчете не учтено влияние длины ступени
на скорость ее перемещения.
§ ю. КИНЕТИЧЕСКАЯ ТЕОРИЯ РОСТА КРИСТАЛЛОВ
ИЗ РАСПЛАВОВ
В практике кристаллизации из расплавов пользуются
кинетическими уравнениями. Рассматривается простой случай
кристаллизации вещества из расплава, представляющего собой однокомпо-
нентную систему. Выделяется на растущей поверхности кристалла
площадка dS. Если линейная скорость роста кристалла постоянна
и равна Я, то за время dt фронт роста переместится по нормали на
ласстояние dl = K dt. При кристаллизации слоя толщиной dl и
площадью dS выделяется теплота _
dQ± = рг dt dS = prl dt dS, (111,20)
где p — плотность кристалла, г — удельная теплота
кристаллизации, рассчитанная на единицу массы.
Выделившаяся теплота отводится от растущей поверхности
как через кристалл, так и через расплав, если температура в зоне
кристаллизации выше температуры расплава. Теплота, отводимая
от площадки dS за время dt, будет равна приблизительно
dQi =Kx—dtdS — к2 -^- dt dS, (111,21)
dli dl2
где Ki и к2 — соответственно коэффициенты теплопроводности
dTt dT2\
кристалла и расплава, а —- , температурные градиенты,
dli dl2
направленные в кристалле по внутренней нормали, а в расплаве —
по внешней нормали к dS. Знаки этих температурных градиентов
различны.
Рост кристалла происходит только в том случае, если вся
выделяющаяся теплота «непрерывно отводится от площадки dS.
Из условия баланса теплоты
dQ1 = dQ2 (111,22)
получаем
pr),dtdS = (K1-^- — Kt>-^-y)dtdSJ
\ dli dl2 J
или
Я = JL =. -L(Kl-^--Ko £*A . (111,23)
dt гр \ х dl± " dl, J \
Если расплав переохлажден незначительно и не
перемешивается, то отводом тепла в сторону расплава в уравнении (111,21)
69
можно пренебречь. Весь теплоотвод будет осуществляться тогда
через кристалл, и уравнение (111,23) принимает вид
X = -^- = JL.J^, (Ш,24)
dt $r dl '
dT
где температурный градиент в зоне роста, направленный
dl
по внутренней нормали к кристаллу.
В общем случае линейная скорость в данном направлении
зависит не только от температурного градиента, но и от выбранного
направления и размеров кристалла:
(/. f-) • (Ш.2Б)
Различные виды зависимости k = k(t) для кристаллов достаточно!
больших размеров сводятся к
*. = *(-£}. (Ш.2Й
Вывод основных кинетических уравнений роста кристалла из
расплава заключается в следующем. Допустим, что коэффициент
теплопроводности кристалла описывается сферой и что
холодильник точечных размеров, поглощающий выделяющееся в системе
тепло, помещен в центре кристаллической затравки сферической
формы. В этом случае симметрия поля температурного градиента
в зоне роста кристалла будет шаровой (рис. 45).
Пусть радиус кристалла, в некоторый момент времени равный
/ через время dt, становится l+dl=l+kdt. Количество вещества,-,
перешедшего в кристаллическую фазу за время dt, равно объему
шарового слоя, умноженному на плотность кристалла:
dm = 4яр/2 dl = 4пр12Х dt. (Ill,27)
Скорость перехода вещества в кристаллическую фазу равна
~ - 4щ>РК = kSX, (III,28)
dt
где 5 — суммарная поверхность растущего кристалла. Уравнение
(111,28) вместе с (111,24) определяет всю кинетику
кристаллизации из расплава. Комбинируя (111,24) и (111,28), мы получаем
формулу
to =kS—, (111,29)
dt dl
отличающуюся от формулы Андреева заменой градиента
концентраций градиентом температур. Исследование этой основной
рабочей формулы проводится точно так же, как и в случае растворов.
70
В некоторых заданных условиях рост кристалла будет
продолжаться до тех пор, пока фронт роста не подойдет к изотермической
поверхности температуры плавления, вдоль которой установится
равновесие между жидкой и кристаллической фазами, так что
кристалл не будет иметь формы многогранника. В форме
многогранника кристалл может расти только внутри области,
ограниченной изотермической поверхностью температур плавления
(рис. 46) из переохлажденного расплава. Таким путем Р. Наккен
впервые получал из расплава полиэдрической формы кристаллы
салола. При переохлаждении расплава ДГ>1,5°С кристаллы рос-
Охлаждающии
стержень
\
\
\
dl / Jt3=const
dl
У
/
Рис. 45. Сферическая симметрия
поля температур и
температурного градиента в зоне роста
кристалла
Рис. 46. Врастание
полиэдрического фронта роста в изотерму Ts
(Т\ — температура
холодильника; Гг — температура
перегретого расплава)
ли как полиэдры. По мере уменьшения разности температур
плавления и кристаллизации до 0,5°С вдоль ребер и по вершинам
начинали образовываться округленные области, которые в
дальнейшем расширялись и, наконец, кристалл рос, как шар. Если
разность температур снова повышалась до 1,5°С, то происходило
образование гранен: (010), (100), (ПО), (111) и (212). Этот эффект
объясняется ходом изотерм. В методе Наккена—Киропулоса
кристалл окружен сферическими изотермическими поверхностями. При
большом охлаждении изотерма температуры плавления отступает
от кристалла, окруженного областью переохлажденного
расплава, в результате чего происходит полиэдрический рост. При
уменьшении охлаждения или увеличения размера кристалла
изотерма Ts приближается к поверхности кристалла. В местах, где
кристалл касается изотермы Ts, скорость роста уменьшается, и
поверхность кристалла соответствует изотермической поверхности.
Изменяя степень радиального охлаждения, можно получить
кристалл с округленными ребрами и вершинами или с шаровой
поверхностью.
71
Таким образом, флуктуации температур изменяют рельеф по-]
верхности раздела, что влечет за собой попадание частиц
кристаллизующегося вещества в неориентированные положения на
границе раздела, и далее вызывает появление в кристалле напряже-<
ний (дислокаций и дефектов другого типа). Оттесняемые
поверхностью растущего кристалла примеси в условиях изменения
рельефа этой поверхности оказываются захваченными ею. При этом
Подача тепла.
Отвод тепла.
Рис. 47. Зависимость формы изотермы кристаллизации от
характера подачи тепла: а — выпуклая, б — плоская, в —
вогнутая
распределение захваченных примесей в объеме кристалла будет
неравномерным.
Нарушение симметрии температурного поля в зоне роста
приводит к изменению формы изотермической поверхности плавления
и, следовательно, к изменению формы кристалла. В зависимости
от расположения нагревателей и конструкции холодильника,
определяющих характер отвода теплоты, растущему кристаллу можно
придать различную внешнюю форму, например, шара, полусферы,
эллипсоида и т. п.
Итак, форма изотермы кристаллизации отвечает
/ dT \
симметрии поля температурного градиента ) .
v Свободная поверхность кристаллов,""выращиваемых из расплава,
может принимать форму выпуклой (рис. 47,а), плоской (рис. 47,6),
либо -вогнутой (рис. 47,в) изотермы кристаллизации.
Важным условием монокристального роста является
стабильное поддержание изотермической поверхности
кристаллизации на одном постоянном уровне.
Выпуклая ее форма обеспечивает высокую чистоту растущего
кристалла, плоская — малые термические напряжения.
Управление формой изотерм кристаллизации осуществляется
путем подбора конструкции и расположения нагревателя и холо*
дильника.
72
Глава IV
ФОРМЫ РАВНОВЕСИЯ, РОСТА И РАСТВОРЕНИЯ
КРИСТАЛЛОВ. СКУЛЬПТУРА ГРАНЕЙ
Главным содержанием учения о росте кристаллов остается
морфология кристаллов, под которой в настоящее время
понимают учение о конечной форме, поверхности кристалла и его
внутреннем сложении (степени совершенства).
Кристаллическая форма считается охарактеризованной, если
указаны ее огранение и габитус (облик). Огранение кристалла
представляет собой совокупность граней, которыми ограничен
кристалл. Если при описании кристалла делается упор на соотношение
между величиной этих граней, то говорят о габитусе. Форма
кристалла данного вещества определяется, с одной стороны, его
природой, с другой — конечными условиями его существования.
Каждый кристалл может быть представлен в одной из трех конечных
форм: в форме роста, равновесия или растворения. Между этими
формами существует конкретная связь.
Обширная литература, посвященная теоретическому и
экспериментальному изучению форм реального кристалла,
свидетельствует о большом их многообразии. В работах И. И. Шафранов-
ского и В. И. Михеева дается классификация
кристаллографических форм. Ими представлено несколько десятков так называемых
вершинных и гранных простых форм и несколько сотен реберных.
Вершинные и реберные мы впоследствии будем называть
недоразвитыми формами кристаллов.
Известно, что поверхность реального кристалла не идеально
гладкая, на ней всегда можно видеть (чаще вооруженным глазом)
определенную скульптуру: штриховку, спирали роста или
растворения, фигуры травления, вицинали и т. п. Тщательное изучение
поверхности кристалла и его внутреннего сложения (степени
совершенства) дает представление о последовательных этапах его
ооразования. Такие исследования выявили большую роль послой-
ного нарастания граней, сопровождающегося возникновением
характерного для кристаллов ступенчатого рельефа поверхности.
73
Рис. 48. Сечение
поверхности скоростей роста
кубического кристалла
§ 1. РЕАЛЬНЫЕ И ФИЗИЧЕСКИ ВОЗМОЖНЫЕ ГРАНИ
Согласно Кюри и Бравэ, скорость роста грани кристалла, как
и ее поверхностная энергия, находится в обратной зависимости от
ее ретикулярной плотности. Ограничиваясь такими
представлениями^ о существовании для каждой молекулярной (ионной,
атомарной) плоскости кристалла определенной скорости, можно построить
поверхность скоростей. Из одной точки откладывается по всевоз-'
можным направлениям соответствующие скорости роста. На этой
поверхности имеются резко выраженные
минимумы, которые соответствуют
скоростям роста наиболее часто встречающихся j
граней кристалла (рис. 48). В кубической
сингонии наиболее частыми формами явля- I
ются грани с наибольшими ретикулярными \
плотностями: гексаэдр, ромбододекаэдр,
октаэдр. Однако не всякая молекулярная
плоскость в кристаллической решетке
может быть гранью. Существуют грани ре-^
альные, действительно ограняющие
кристалл, и грани физически в о з м о ж-!
н ы е, т. е. такие, которые могут быть у
кристаллов данного вещества только при.=
определенных условиях роста. Большинство
плоскостей в кристаллической структуре — грани физически невоз- ■
можные, которыми никогда и ни при каких условиях кристалл
не может быть ограничен.
Следовательно, поверхность скоростей роста кристалла может
рассматриваться как форма кристалла с кривыми поверхностями,
которая в свою очередь представляет собой индикатрису скоростей
роста. Опыт показывает, что кристаллы с кривыми поверхностями
можно получить из сильно пересыщенных растворов (паров) и
переохлажденных расплавов в условиях равномерного
распределения концентрации питательного материала.
Опыты А. В. Шубникова по кристаллизации алюмо-калиевых
квасцов из водного раствора и салола из расплава указывают на
зависимость формы роста этих кристаллов от степени стабильности
системы. По мере увеличения пересыщения форма кристаллов
алюмо-калиевых квасцов, принадлежащих к кубической системе,
приближалась к сферической. С увеличением переохлаждения
расплава кристаллы салола, принадлежащие к ромбической системе,
приобретали форму лодочки.
§ 2. СВЯЗЬ ВНЕШНЕЙ ФОРМЫ КРИСТАЛЛОВ И ИХ СТРУКТУРЫ
Многочисленные опыты и наблюдения показывают, что каким |
бы богатством граней ни обладал кристалл, выросший под
влиянием внешней среды, можно выделить грани и комбинации форм,
I
74
торые упорно проявляются при любых условиях роста. Поэтому
К°обый интерес при изучении кристаллов данного вещества имеет
°С форма роста, которая «выводится» из его кристаллической
Ттпуктуры. Только на основе изучения этих форм можно успешно
и правильно толковать все закономерности влияния внешней среды
на форму кристалла.
Вывод о том, что поверхностная энергия и скорость нарастания
- граней обратно пропорциональны ретикулярным плотностям
граней во многих случаях подтверждается статистическими данными.
Но'систематические отклонения в развитии форм некоторых
кристаллов от их «теоретической» последовательности заставляют
полагать, что правило Бравэ не может быть применено
непосредственно в этом виде. У кварца первое место по ретикулярной
плотности занимает сетка пинакоида, однако грань пинакоида на
кристаллах кварца наблюдается редко. Попытку расширить закон
Бравэ с чисто геометрической точки зрения, заменив «голую»
решетку совокупностью элементов симметрии пространственной
группы, сделали X. Доннэй и Д. Харкер, показавшие, что
создаваемые симметрией добавочные узлы, рассматриваемые наравне
с узлами решетки, резко изменяют ретикулярную плотность всех
граней, перпендикулярных винтовым осям и плоскостям
скользящего отражения, и снижают морфологическое значение таких
граней. При этом принимаются во внимание лишь те винтовые
оси и плоскости скользящего отражения, которые не входят
в состав примитивной трансляционной решетки и не зависят от
нее.
Для символов граней, перпендикулярных винтовым осям и
плоскостям скользящего отражения, и граней в центрированных
решетках Доннэй предложил ввести усложненные индексы, при
использовании которых в формуле для расчета ретикулярных
плотностей представляется возможность сразу же вычислить их
значение с учетом дополнительных узлов. Доннэй и Харкер дают
следующую формулировку расширенного и обобщенного закона
Бравэ: «Морфологическое значение грани кристалла обратно
пропорционально площади элементарного параллелограмма сетки в
нецентриро'ванной решетке, при условии отсутствия винтовых осей
и плоскостей скользящего отражения в пространственной группе».
Эффект центрировки решетки, а также винтовых осей и плоскостей
скользящего отражения может быть учтен заменой в формуле для
площади элементарного параллелограмма индексов грани
индексами, увеличенными в 2, 3, 4, 6 раз. На основании этого
обобщенного закона Доннэй и Харкер приводят таблицу 97
кристаллографических аспектов для 230 пространственных групп, с помощью
которой удалось объяснить причину редкого появления граней
пинакоида на кристаллах кварца и циркона и ряд других
«парадоксов». Однако закон Доннэя и Харкера не считается с природой
зтомов, их весом, связями и т. д., поэтому также остается
приближенным.
75
Большое значение имеет учет плоскостной симметрии граней,
рассматриваемых как конечные многоугольники. Физические
свойства отдельных граней в ряде случаев подчиняются именно этой
симметрии (форма фигур травления, штриховка и т. д.). С учетом
плоскостной симметрии каждая из 47 простых форм
кристаллографически может иметь несколько разновидностей. Две одинаковые
простые формы будут физически различными в том случае, если
они различаются элементами симметрии или расположением
элементов симметрии относительно граней. Г. Б. Бокий вывел 146
кристаллографически различных простых форм.
Существует всего десять видов симметрии для плоских
конечных фигур:
CX{LX), C,(L2), C3{L3), CA(L& C6(LQ),
CS(P)9 C2V(2P), C3v(3P), C4U(4P), C6,(6P).
Наблюдения показывают, что частота встречаемости граней
падает с повышением симметрии. Но если принять во внимание
относительную величину граней на кристаллах, то преобладающее
значение имеют грани с высокой плоскостной симметрией. В редких
случаях грани с высокой величиной
симметрии не будут габитусными.
П. Ниггли впервые отметил
необходимость перехода от чисто
геометрических воззрений к новым
понятиям, связанным с реальными
структурами. Он предложил
учитывать не ретикулярную, а
«физическую» плотность сеток, учитывая
атомные веса, приходящиеся на
площадь элементарного
параллелограмма сетки. Ясно, что
необходимо считаться с анизотропией
химических связей, особенно в случае
ионных структур. Учитывая это,
В. С. Соболев придал правилу
Бра>вэ кристаллохимический смысл:
«Наиболее важные габитусные
грани (пояса) развиваются
параллельно направлению наиболее прочных химических связей в
кристаллической решетке».
П. Гартман и В. Пердок выдвинули положение, согласно
которому огранение кристалла должно определяться цепями сильных
связей. Эффективный период такой цепи связи назван «вектором
цепи связи» или РВС-вектором («Periodic bond chain vector»).
Выявляя эти векторы, грани кристалла можно разделить на три
группы: Р —грани (плоские сетки), которые проходят параллельно
двум или более РВС-векторам; S — ступенчатые грани, проходящие
Рис. 49. Грани F, S, К на модели
кристалла (по П. Гартману и
В. Пердоку)
76
параллельно только одному вектору; К — грани, образованные
вершинами, которые не параллельны ни одному РВС-вектору
(рис.49).
Удалось показать, что среди граней, определяющих форму
роста, преобладают f-грани, К-трапи встречаются редко, S-грани
занимают промежуточное место.
§ 3. РАВНОВЕСНЫЕ ФОРМЫ КРИСТАЛЛОВ
Из всех возможных форм кристалла равновесная форма
лучшим образом отражает его внутреннее строение. Напомним, что
равновесной называется форма с минимальной поверхностной
энергией, возникающая при равновесии между кристаллом и
окружающей средой.
Предложено несколько экспериментальных и теоретических
методов определения равновесной формы, основанных на
использовании связи между формой роста и равновесной формой. Связь
эта сводится к тому, что только грани, принадлежащие к
равновесной форме, могут появляться в качестве G-граней, граней с
зеркально гладкой поверхностью. В крупных кристаллах наблюдается
не сама равновесная форма, а только отдельные ее грани.
Экспериментально по формам роста можно определить огранение, но не
габитус равновесной формы.
Теоретически равновесные формы устанавливаются двумя
способами: по методу Гиббса—Вульфа, основанному на расчете
минимума свободной энергии, и методом Странского—Каишева,
в основе которого лежат представления о молекулярной работе
отрыва (средней работе отрыва).
Так теоретически определены равновесные формы для
веществ с гомеополярными и гетерополярными связями между
составляющими структуру атомами (ионами). Равновесные формы
кристаллов кубической сингонии состоят из одной простой формы:
для кристаллов со структурой типа NaCl — куб, для типа CsCl —
ромбический додекаэдр, для CaF2 — октаэдр, для NaN03 —
ромбоэдр, близкий к кубу. Такие кристаллы вырастают из чистых
водных растворов. Изучение их позволило Странскому сделать
замечание, что влияние молекул воды, по-видимому, качественно не
меняет ход процесса. На образовании других граней сказывается,
по-видимому, чередование роста и растворения.
У кристаллов с гетерополярными связями при выращивании
из газообразной фазы всегда наблюдаются только G-грани,
теоретически предсказываемые для идеального случая. Для неполярных
кристаллов априорно рассчитанные равновесные формы сложны.
Они сравниваются с формами кристаллов, полученных из шаровых
затравок медленным нарастанием в парах. Равновесная форма
металлического вольфрама, имеющего объемоцентрированную
решетку, составлена гранями ромбического додекаэдра в
комбинации с кубом, тригонтриоктаэдром и октаэдром. На практике
77
у кристаллов вольфрама возникают грани ромбического додека-j
эдра, куба, тригонтриоктаэдра и не появляются грани октаэдра^
Для некоторых типов структур принадлежащие к равновесной
форме G-грани были определены по методу Гартмана и Пердока..
Для ряда кубических структур они идентичны ^-граням.
Возможность экспериментального 'получения равновесной,
формы следует из зависимости давления пара, растворимости;
химического потенциала от размеров кристалла.
За величину кристалла условно принимают радиус г
вписанного в кристалл шара, при более точном анализе она определяется!
с учетом ширины граней или их расстояния (hi) от центра:
—— = const,
Ь \
где d — поверхностная энергия /-той грани. Зависимость давления
пара или растворимости от величины кристалла показана в урав*,
нении Томсона— Гиббса (11,9):
Poo hi
Как следует из этого уравнения, а также из экспериментальных,
данных, давление насыщенного пара у всех граней кристалла,
имеющего макроскопическую 'Протяженность, почти одинаково.
Равновесную же форму кристалла можно определить только с no-j
мощью процессов роста и растворения, что обусловливается раз-'
личием в давлении пара или растворимости. Следовательно, чтобь^
обнаружить разницу в давлении паров, нужно исследовать грани
самого малого размера, грани, которые обнаруживаются и на
больших кристаллах с кажущейся огранкой, состоящей из одного
типа граней. При помещении такого кристалла в замкнутый сосуд
при постоянной температуре за счет разности давлений паров над
субмикроскопическими и макроскопическими гранями первые нач^
нут растворяться и увеличиваться в размерах, в связи с чем
выравнивается давление пара над кристаллом. Вскоре разность давлений -
становится незначительной, процесс растворения прекращается до
того, как будет достигнута равновесная форма.
На малых кристаллах при соответствующих условиях будет
происходить не только образование граней, принадлежащих к
равновесной форме, но может возникнуть сама равновесная форма.
К сожалению, такие работы связаны с большими
экспериментальными трудностями, так как пространство, занятое паром или
раствором, должно быть настолько малым, чтобы объем насыщенной
фазы лишь незначительно превосходил объем самого кристалла
(в системе газ-кристалл должно быть устойчивое равновесие).
Работы по. получению равновесных форм небольших
отрицательных кристалликов осуществлены Леммлейном.
Отрицательный кристалл — это незаполненный кристаллическим
веществом многогранник, окруженный твердой монокристальной средой.
г*
тт^рт о микроскопически малых полостях в -кристаллах, кото-
РеЧЬ,яполнены насыщенными растворами. Опыты производились с
рЫе,тяплами NH4C1 при медленном повышении температуры с 18
*рИо£с Исходная форма представляла собой неправильный денд-
Д. который -вскоре после изолирования системы распался на не-
Р';1о самостоятельных кристаллов, из них м-еньшие
растворила больш.^ росли. В конечном результате в капле оставался
только один кристалл, форма которого все более приближалась к
равновесной.
Рис 50 Схема превращения кристалла с искусственно приданной ша
ровой формой в анизотропную форму
Весьма распространен метод 'получения равновесных форм
кристаллов кристаллизацией шаров, впервые предложенный
Е С Федоровым. Шарообразные кристаллы можно изготовить
различными способами, проще всего механической обточкой,
причем разрушенные части поверхности удаляются растворением и
травлением. ^
Другой способ состоит в том, что капле расплава при
соблюдении особых предосторожностей дают затвердеть в
полушарообразный или линзовидный кристалл. Округленные кристаллы
получаются также по способу Наккена—Кирапулоса. С учетом атомной
структуры кристалла монокристаллический шар в действительности
является полиэдром с чрезвычайно большим числом граней
(рис. 50). Из всех таких граней только немногие растут повторимо,
оставаясь гладкими, все остальные грани огрубляются. Так как
огрубленные грани (на рисунке они показаны волнистыми
линиями) растут быстрее, чем гладкие, последние начинают
образовывать плоские сечения шара, размеры которых непрерывно
увеличиваются. При дальнейшем росте кристалла площадь гладких граней
увеличивается до тех пор, пока сначала отдельные, а потом все
грани не пересекутся в ребрах. В результате образуется полиэдр,
79
габитус которого зависит от скоростей роста отдельных граней. На^
рис. 50 схематически представлены последовательные моменты
такого процесса.
Кристаллы с искусственно приданной формой исследовались]
с помощью метода колебаний температуры. Кристаллы различных
исходных форм вместе с запасом вещества помещались в насыщен-"1
ный раствор. Вся система подвергалась колебаниям температуры^
причем одновременно производилось перемешивание или встряхни
вание раствора. В таких условиях ра;Вновесные формы кристаллов^
алюмо-калиевых квасцов получала
М. П. Шаскольская. Из кристалла^
алюмо-калиевых квасцов вытачивался-
шар диаметром в 3 см и помещался в
насыщенный раствор той же соли, на--,
литый в резиновый мячик, который-1
герметически заклеивался и
приводился в медленное вращение вокруг гори-^
зонтальной оси и через каждые два
часа автоматически нагревался на 2—
3°С при помощи электрической
лампочки. При нагревании шар немного
растворялся, а при охлаждении рос
вследствие пересыщения. Через не-У
сколько месяцев шар приобрел форму;
правильного октаэдра, которая уже]
оставалась неизменной (рис. 51). j
Я. И. Френкель высказал предположение, что поверхность
кристалла в состоянии равновесия образована не одними только1
основными гранями, но и гранями, близкими к основным. Послед-,
ние возникают вследствие флуктуации. Поэтому при температурах
выше абсолютного нуля естественные грани кристалла должны
обладать шероховатостью, которая обусловлена ступеньками из
атомных слоев. Ширина ступеньки изменяется с течением времени
путем присоединения или удаления отдельных атомов, перемещаю-;
щихся по ступенькам независимо друг от друга. Вследствие таких*
перемещений атомов форма кристалла изменяется.
Существует мнение, что образование равновесной формы может
осуществляться двумя путями: или при помощи многократного
испарения и конденсации, или вследствие диффузии поверхностных
атомов. Последнее более вероятно, так как теплота активации
явления диффузии значительно меньше, чем теплота испарения.
Рис. 51. Превращение шара
•квасцов под влиянием
колебаний температуры в
равновесную октаэдрическую форму
(по М. П. Шаскольской)
§ 4. ФОРМЫ РОСТА КРИСТАЛЛОВ
Формы роста кристаллов отличаются большим многообразием.
Это становится понятным, если иметь в виду существование
большого числа внешних факторов, влияющих на формы роста крИ'
сталлов. Таковыми являются примеси, температура кристаллиза-
80
ции, пересыщение растворов или паров и переохлаждение
расплавов,' движение раствора (расплава) у поверхности растущего
кристалла, различная ориентировка растущего кристалла в сосуде и
форма затравочного кристалла.
Влияние примесей на форму роста кристаллов
В 1783 г. Роме-де-Лиль впервые отметил, что из водного
раствора хлористый натрий кристаллизуется в виде кубов, а из
раствора с мочевиной СО (NH2)2 выпадают октаэдры.
Сейчас уже никто не сомневается в том, что примеси или
химизм среды — основной после структуры фактор, определяющий
облик кристалла. Химизм среды является решающим фактором не
только в создании облика кристалла, но и в определении степени
однородности, а также в формировании скульптуры на его гранях.
Было высказано несколько точек зрения, объясняющих влияние
примесей к раствору на габитус кристаллов.
Одни исследователи (Орлов и Земятченский, 1903) полагали»-
что габитус кристаллов изменяется только тогда, когда в растворе
возникают неустойчивые химические комплексы, при распаде
которых образуется растущий кристалл. Придерживаясь этого
взгляда, В. С. Соболев и С. А. Строителев с позиций кристалло-
химических и современных представлений о природе растворов
пытались показать, что форма кристаллов зависит от степени
диссоциации вещества и характера взаимодействия его
компонентов с составными частями раствора.
Соболев полагает, что при неравномерном притоке
'компонентов вещества с большей скоростью растут грани, плоские сетки
которых состоят из разноименных ионов. При равномерном
притоке компонентов с большей скоростью растут грани, плоские
сетки которых состоят из одноименных ионов, при этом сетки из одних
катионов ложатся на слои анионов.
Основываясь на этом положении Соболева, Строителев
рассматривает образование кристаллов разной формы под влиянием
примесей, находящихся в растворе и адсорбированных
поверхностью кристаллов NaCl. При этом отмечается важность степени
диссоциации и гидратации соединений, так как большей скоростью
могут обладать только те грани, которые наиболее способны
вызывать разрушение химических соединений в растворе, извлекая из
них нужные ионы. Одноименные ионы слагают в NaCl грани
октаэдра, и химическая связь ионов в направлении, перпендикулярном
к этим граням, наиболее прочна. В чистом растворе, где
концентрация ионов Na+, С1~ одинаковая, грани (111) обладают наи-
оольшей скоростью роста. В присутствии хлоридов вьгсоковалент-'
ных металлов или НО на долю каждого Na+ приходится
большее число С1~, и вследствие этого ионы Na+ окружены в растворе
молекулами Н20, катионами примесей и ионами С1~. В связи с
избытком ионы С1~ легче адсорбируются поверхностью кристалла.
81
Возможность присоединения сетки из катионов Na+ зависит от
химической прочности или устойчивости окружения ионов Na+.
Но свободная доля энергии ионов С1~ на поверхности кристалла
не так велика, чтобы легко противостоять химической связи
внутри соединений в растворе. Уже фиксированным анионам С1~
приходится преодолеть усилия молекул воды вокруг катионов Na+ и
тех ионов С1~, которые входят в окружение ионов Na+. В этих **}
условиях скорость роста граней октаэдра оказывается
минимальной. Присоединение новых порций NaCl к сеткам (100) и (ПО) ^В
становится более возможным. Если в первом случае ионы С1~, I
входящие в состав окружения, «конкурировали» с поверхностными
ионами и вызывали торможение роста граней (Ш), то к сеткам
(100) и (ПО) они активно сами присоединяются и способствуют
присоединению ионов NaCl. To же можно сказать и относительно
избытка ионов Na+.
Примеси, химически сходные с кристаллизующимся
веществом и содержащие с ним общий ион, заметным образом не могут
влиять на форму кристаллов.- Для NaCl к таким веществам
относятся КС1, NH4C1. Ионы К+, Na+, NH4+ очень близки по своим
значениям энергий гидратации. В случае вхождения в раствор в
качестве примесей хлоридов вьгсоковалентных элементов,
например, Al, Fe, Cr они образуют гидраты и химические комплексы,
которые резко отличаются по своей устойчивости от гидратов
Na+ и С1-. - ,
Одним из эффективных примеров влияния примесей,
имеющих с растворенным веществом общий ион, и, следовательно,
влияющих на степень диссоциации раствора, является примесь
двузамещенного фосфата аммония (NH4)2HP04 к раствору одно-
замещенного фосфата аммония. Кристаллы последнего .в этих
условиях принимают утолщенный габитус. Приведенный пример
может служить иллюстрацией влияния рН среды на форму роста
(вернее, габитус) кристалла, поскольку оба замещенные фосфата
являются хорошими буферами — стабилизаторами рН. С
влиянием рН среды на форму роста кристалла всегда приходится
считаться в практике выращивания монокристаллов из растворов.
Раствор в процессе приготовления подщелачивается или
подкисляется в той мере, в какой это необходимо для получения
кристаллов нужного габитуса или формы. Оптимальное значение рН
определяется экспериментально.
Вторая точка зрения, поддерживаемая Н. Н. Шефталем
(1957), состоит в том, что примесь может влиять на скорость
роста грани только при вхождении ее в кристалл. Однако при рас- j
смотрении этого несомненно действенного фактора следует иметь
в виду, что вхождению примесей в кристалл всегда предшествует
акт адсорбции частицы примеси на той или иной грани.
Вхождение же примеси -в кристалл будет определяться сравнительной
энергией связей кристалл — примесь и кристалл —
кристаллизующееся ' вещество, большим или меньшим сродством структуры
82
имеси и Грани кристалла. Таким образом, разбираемый фактор
нельзя считать единственным.
Третья точка зрения, успешно развиваемая у нас и-за грани-
пей, объясняет воздействие примеси на форму роста кристаллов
адсорбционным механизмом.
Адсорбция —есть результат наличия на поверхности
кристаллического тела некомпенсированного электрического поля.
Различают два типа адсорбции: физическую и химическую.
При физической адсорбции взаимодействие осуществляется
водородными и другими более слабыми (1—5 ккал/моль) связями,
не приводящими к образованию новых химических соединений на
поверхности. С увеличением температуры (ростом энергии
колебательных движений) интенсивность физической адсорбции в среде
ослабляется.
Химическая адсорбция, или хемосорбция есть результат об- \
разования химического соединения между поверхностными иона- |
ми (атомами) адсорбента и частицами адсорбата. Для хемо- |
сорбции характерны большие значения теплот, соизмеримые
с теплотами обычных химических реакций (10—100 ккал/моль).
Повышение температуры, облегчая ход этих реакций, ведет к
усилению адсорбционных процессов.
*
В последнее время обращено внимание и на сам
растворитель как примесный агент. Поверхность кристалла избирательно
адсорбирует молекулы растворителя (сольватируется).
Сольватация эта зивисит от пересыщения раствора (химизма адсорбата)
и энергии некомпенсированных зарядов на поверхности граней
•(рода адсорбента). От этих условий зависит тепловой эффект
смачивания. В данном случае существенную роль играет величина
дипольного момента адсорбата, и энергия адсорбции падает с
уменьшением его.в Особенно хорошо адсорбируются -вещества,
имеющие малое поверхностное натяжение на границе с
адсорбентом, т. е. легко его смачивающие.
Самым распространенным растворителем для большого числа
веществ была и остается вода. Поскольку структура воды
в последнее время подверглась детальному изучению, становится
возможным говорить с некоторой небольшой определенностью о
ее адсорбционных свойствах. Поверхность молекулы воды
характеризуется наличием значительных ориентированных зарядов.
В связи с этим теплота адсорбции первого слоя воды достигает ч
большой величины (14 ккал/моль), характерной для хемосорбции.
Хемосорбция всегда мономолекулярна, поэтому последующие
слои воды должны адсорбироваться уже физически (Т. Г. Петров,
Хорошая растворимость в воде большого числа ионных
соединений связана с более энергичным взаимодействием между
ионами соли и молекулами воды по сравнению с силами
взаимодействия внутри кристаллической структуры. Это приводит к дис-
83
социации соли и образованию гидратов. Ионы, севшие на
поверхность кристалла, связаны не только с ионами кристаллической
структуры, но и сохраняют связь с молекулами, следствием чего
будет более или менее длительное закрепление молекул воды на
поверхности — поверхностная гидратация кристалла.
Изменение условий приводит к различным эффектам
сольватации и десольватации на разных гранях адсорбента, а это в свою
очередь приводит к непропорциональному изменению скорости
роста этих граней. Прибавление к раствору так называемых
поверхностно-активных веществ вызывает неодинаковое изменение
интенсивности адсорбции кристаллографически различных граней
растущего кристалла. Влияние таких -примесей может быть чисто
внешнее, ибо примесь не входит в состав растущего кристалла
и никакого изменения кристаллической решетки не вызывает.
Поэтому оказались удачными попытки получать химически чистые
кристаллы с определенной огранкой, изменяя поверхностную
энергию их граней. Если же причина влияния примеси на огранку
заключается исключительно в том, что примеси вступают в
химическое соединение с основным веществом, то этот вопрос не может
представлять особого интереса. Естественно, что всякие новые
активные соединения могут образовать иные, чем у основного
вещества, кристаллические структуры и их кристаллы будут иметь
иную огранку.
Обычно установившиеся процессы адсорбции динамически
равновесны, т. е. молекулы адсорбата лишь временно закреплены
на поверхности адсорбента и при данных условиях рано или поздно
покидают ее, освобождая место для таких же или иных молекул.
Крайний случай адсорбции, когда молекулы или ионы вещества
навсегда закрепляются на поверхности адсорбента, мы наблюдаем
в эпитаксии.
• Эпитаксией называется ориентированное наращивание
вещества на кристаллической поверхности. Эпита-ксия зависит от
двумерного подобия кристаллических решеток в составляющих
сетках и химических типов срастающихся веществ. Однако
наблюдаются случаи взаимной ориентации как при малом химическом"
сходстве, так и при полном его отсутствии (NaN03 и СаСОз —
кальцит, KI и MgS04-7H20 и т. д.).
Во многих работах установлено, что срастание в вакууме
происходит лучше, чем на воздухе или из раствора. Причина — в
отравлении части поверхности — адсорбции посторонних частиц из
воздуха и раствора, препятствующих возникновению закономерного
сростка. Той же причиной объясняется пассивирование свежеполу-
ченной поверхности, находящейся длительное время на воздухе
перед началом опыта по эпитаксии.
От эпитаксии можно формально перейти к изоморфизму, если
представить, что одно вещество закономерно отлагается на всех
гранях другого вещества.
84
Таким образом, эпитаксия и изоморфизм могут рассматривать-
я как-частные случаи общего явления адсорбции одного вещества
на ДРУГ0М-
Ра-ботами П. А. Ребиндера и др. (1940) показано, что на
границе раздела отмечается резкое возрастание .вязкости, объясняемой
наличием ориентировки в слое, прилегающем к подложке. Толщина
адсорбционного слоя (1(Н0—10-6 см). В адсорбированном слое
толщиной 10_6 см предполагается особое фазовое состояние.
Соответственно этому на некотором расстоянии от кристаллической
поверхности свойства жидкостей меняются скачком,
соответствующим фазовому переходу второго рода.
Особый интерес представляет влияние примесей —
модификаторов на расплавы и растворы металлов. Модификаторами
называются такие вещества, которые, будучи введены в весьма
малых количествах, резко влияют на процессы кристаллизации
металлов из растворов или расплавов. Прежде всего модификаторы
увеличивают число зародышей и тем способствуют получению
мелкозернистого слитка из расплава. Известно, что металлы и
сплавы с мелкозернистой структурой обладают значительными
преимуществами перед крупнозернистыми. Чем мельче зерно, тем
выше механические свойства металлов и сплавов, больше предел
упругости, предел прочности и ударная вязкость. Так, присадка
ванадия в количестве 0,10—0,15% сообщает литой стали очень
тонкое строение.
Такие модификаторы образуют в растворе или расплаве вьисо-
кодисперсную,иногда коллоидно-дисперсную взвесь. Ее отдельные
частицы являются зародышами, вокруг которых образуются и
растут кристаллы. Предполагается, что они химически не
взаимодействуют с расплавом или растворенным веществом. Для
металлических расплавов модификаторы должны быть тугоплавкими, чтобы
они сохранились как твердая фаза в расплаве модифицируемого
металла.
Ко второй группе относятся поверхностно-активные
модификаторы. Действие их совершенно иное, чем действие первой группы.
Поверхностно-активные молекулы этих модификаторов
адсорбируются на гранях зародившегося кристаллика и понижают скорость
роста его граней. Адсорбция не равномерна на всех гранях. На
одних адсорбция происходит более интенсивно, чем на других, и
возможно, на некоторых гранях она совсем не выражена. Таким
образом, грани оказываются -по-разному отделенными
адсорбционным слоем постороннего вещества от расплава или раствора.
Вследствие этого происходит задержка в развитии кристалла и из- \
менение его формы. В тех случаях, когда скорость роста замед- J
ляется, увеличивается промежуток времени от начала появления
зародышей до окончательного затвердевания расплава, следова- •
тельно, успевает возникнуть большое число центров кристаллиза-
Дии, в результате чего получается мелкозернистая структура
слитка.
85
В качестве поверхностно-активных по отношению к
расплавленному металлу выбираются обычно легкоплавкие металлы с
малым значением поверхностной энергии в расплавленном состоянии
на границе с воздухом. В основном это щелочные и щелочно-зе-
мельные металлы. В алюминиевых сплавах эффект щелочных
металлов проявляется уже в концентрациях от 0,001 до 0,7%.
Активными модификаторами в растворах могут служить органические
вещества с диполярными ориентирующимися молекулами: сапонин ;
желатин, красители. Такие модификаторы могут изменять форму',
сплошность и другие свойства металлических кристаллов при
кристаллизации их из 'растворов путем электролиза. Модификаторы '
этой группы не должны реагировать с кристаллизующимся веще- I
ством.
По Ребиндеру механизм эффективного влияния поверхностно-
активных модификаторов на рост кристалла сводится к следую-';
щему. В начале процесса кристаллизации из расплава каждый )
металл или сплав представляет собой коллоидно-дисперсную
систему. При дальнейшем росте зародышей происходит образование I
поликристаллического слитка. Решающим фактором для структуры .
слитка следует считать первую стадию кристаллизации, т. е. воз-
нцкщшение зародышей. При таком 'предельно дисперсном состоя- а
нии металл, начавший кристаллизоваться, обладает наибольшим
запасом свободной энергии на поверхностях, разделяющих
кристалл от расплава, т. е. зародыши в момент их образования явля- \
ются неустойчивыми. Величину поверхностной энергии можно
изменять путем адсорбции поверхностно-активных веществ.
При образовании зародыша, согласно термодинамическому
закону Гиббса
2 ViSt = я[) -* min,
где if — термодинамический потенциал, аг- — поверхностная
энергия. Развиваются преимущественно те грани кристалла, которые
имеют наименьшее значение поверхностной энергии ог-, т. е.
свободная энергия всей системы остается по возможности наименьшей.
Уравнение Гиббса
•^■ = i?ri (iv,i)
дс с
связывает поверхностную энергию аг-, концентрацию примеси £.
адсорбцию примеси Гг, газовую постоянную и абсолютную
температуру Т.
Из этого уравнения следует, что
с
в;(с) = О!0-1?Т^с1с, (IV.2)
о
86
а. —поверхностная энергия грани при отсутствии примеси в
расплаве или в растворе (с =0). Принцип Гиббса—Кюри—Вульфа
можно написать так:
«№(<№ = о,
где Si — площадь /-той грани кристалла.
Умножая (IV,2) на S{ и подставляя в последнее уравнение,
имеем
с
6 (2*А - *T%st j -7 dc) = °' (IV,3)
откуда вытекает
SJ
с
г,
С
О
• dc-ъ max. (IV, 4)
Уравнения (IV, 1) — (IV,4) являются основой адсорбционной
теории действия модификаторов.
В. К- Семенченко считает, что сплавы нельзя рассматривать с
точки зрения термодинамики фазовых равновесий, ибо в
большинстве случаев сплавы с высокими механическими свойствами — это
высокодиспер'Сные, термодинамически неравновесные системы
коллоидного типа. Свойства любого сплава так же, как свойства
коллоида, зависят, прежде всего, от способа его получения.
Поверхностные явления играют главную роль во всякой
высокодисперсной системе.
Семенченко в ряде работ развил молекулярную теорию
поверхностных явлений, принимая за характеристику свойств молекулы
«обобщенный момент».
Для ионов, из которых состоят металлы, обобщенный момент
т равен
т = — , (IV,5)
г
где е — элементарный заряд, равный 4,8-10~10 CGSE, z —
валентность иона, г — его радиус.
С позиции этой теории, все металлы, у которых обобщенный
ионный момент меньше обобщенного момента
металла-растворителя, понижают поверхностное натя1жение, а те, у которых
обобщенный момент больше, будут повышать его. Адсорбционная
способность зависит от разности обобщенных моментов примеси и
основного вещества. Примесь с меньшим обобщенным моментом
Располагается преимущественно в поверхностном слое
зародившихся кристаллов в расплаве основного металла с большим
обобщенным моментом и таким образом измельчает структуру
основного металла.
87
То обстоятельство, что модификаторами обычно берутся ме-
таллы Na, К, Rb и другие .с малым значением обобщенного момен-1
та, указывает на правильность такого объяснения. Вопрос о физи-J
ческом смысле обобщенного момента остается невыясненным.
Распределение примесей в кристалле. Гетерометрия *
Способность граней растущего кристалла к захвату примесей^
неодинакова и зависит от природы кристалла и примеси, от уело-,
вий кристаллизации: пересыщения, температуры, движения раствор
ра (расплава) у поверхности кристалла.
Часто захваченные примеси вызывают деформацию
кристаллической решетки. Величина деформации зависит от характера
распределения этих примесей в объеме кристалла. Как правило, грани j
кристаллов с искаженной структурой растут быстрее по сравнению
с теми же гранями «идеального» кристалла. Характер
распределения примесей в кристаллах зависит от природы примесей.
Примеси, дающие с основным веществом твердые растворы,
распределены беспорядочно относительно друг друга. В некоторых
случаях атомы или ионы примеси, занимающие узлы
кристаллической решетки основного вещества, создают новый мотив,
вписывающийся в основной с образованием сверхструктуры. Ион
постороннего вещества в смешанных кристаллах, попадая в структуру
на место иона основного вещества, искажает ее, так как связь
постороннего иона с ионами основного вещества отлична от связи
между этими последними, а ионный радиус примеси не равен
радиусу замещенного иона. Для получения сверхструктуры
необходимо, чтобы кристаллизация протекала очень медленно или за-
твердевала-сь продолжительным обжитом, необходимым для
равномерного перераспределения примесей в объеме кристалла.
Примеси, не дающие твердых растворов и химических
соединений с основным веществом, при кристаллизации обыкновенно
вытесняются решеткой основного вещества и только частично в ней
застревают. Если расплав достаточно медленно охлаждать € одной
стороны, то примеси имеют тенденцию скопляться в той части,
которая кристаллизуется последней. В том случае, когда
кристаллизация происходит настолько быстро, что зародыши кристаллов
образуются сразу во всем расплаве, примеси скапливаются между
кристаллами, а с ускорением роста — даже на границах мозаики,
из которой состоит каждый кристалл.
Характер распределения рассматриваемых примесей в
кристаллах, выращенных из расплава методом Стокбаргера (в тиглях),
зависит от вектора температурного градиента (см. рис. 47,а, б, в).
В том случае, когда симметрия теплопередачи описывается
сферой, в центре которой находится кристалл и тепло передается
в направлении, перпендикулярном к фронту роста, примеси
вытесняются из его внутреннего объема на периферию (а); если фронт
теплопередачи — плоскость, примеси распределены равномерно в
88
объеме кристалла (б); в случае (в), когда теплопередача
осуществляется из точечного источника, примеси скопляются в центральной
части кристалла. В практике кристаллизации широко пользуются
возможностью таким образом управлять характером распределения
примесей в объеме кристалла.
На свойстве кристалла вытеснять примеси во время своего
роста основаны способы очистки от примесей путем многократной
перекристаллизации. Процесс растворения (плавления)
кристаллов какого-либо вещества, сменяющийся процессом его медленной
кристаллизации, повторяют несколько раз и добиваются того, что
количество примеси постепенно уменьшается. Однако нельзя
забывать, что полное удаление примесей путем перекристаллизации
невозможно.
Впервые Леммлейн и его ученики занялись систематическим
изучением включений в кристаллах, выросших из водных растворов
в природных и лабораторных условиях. Включениями в
кристаллах называется полностью изолированный в результате
процесса роста участок, который имеет с кристаллом фазовую
границу. По своему агрегатному состоянию включения разнообразны: .
газ, жидкость, твердая фаза. В кристаллах, выращенных из {
раствора, — наибольшее число газово-жидких включений. Большей
частью включения являются остатками той среды, из которой
кристаллы выросли. Такие включения называются первичными. ^
В других случаях включения появляются в результате залечивания |
«наружных» трещин в кристаллах (вторичные включения). ]
Газовая фаза во включениях может быть по составу
разнообразной. Это либо воздух, либо какой-нибудь другой газ, который
может растворяться в растворе, а затем при определенных условиях
выделяться из раствора и оседать на поверхности всего
кристалла или его зерна.
Причина скопления включений главным образом в средней
части кристалла, состоит в неодинаковой концентрации раствора
у различных участков поверхности растущего кристалла (см.
гл. III, § 8). Новые нарастающие слои возникают на угловых и
реберных участках поверхности кристалла, где раньше, чем на
гранях, раствор становится пересыщенным. Слои быстро
разрастаются тангенциально по грани, перекрывая непересыщенный
раствор. Прослойки маточного раствора поэтому оказываются
параллельными наросшим на грань слоям.
Распределение включений, как и всех неоднородностей, в
кристалле зависит и от индивидуальных свойств каждой грани. Для
различных граней кристалла толщина нарастающих слоев и
прослоек маточного раствора неодинакова. В результате весь
кристалл оказывается разбитым на секторы — пирамиды роста с
основаниями — гранями кристалла, вершинами — в точках,
совпадающих с центром кристаллизации (рис. 52). Для упрощения
пирамиды роста какой-либо грани (hkl) обозначаются этими же
индексами в угловых скобках <hkl>.
89
,, ™Игтя тл захвативший жидкое включение,
Если впоследствии кристалл зах например, низко-
в иных термодина™«*их У^^ £азы на жид.
■емпературных, возможно РазидегЛаезообразную. При этом выделив-
Гнасыщенныи раствор) "^Р^ваться на внутренней
твердая фаза может ^акр тва т е. возникает отрицатель-
поверхности замкнутого пространс. ^^ подвергнуть нагреву
ная форма *№™nf-Jj™*li обеспечивающей гомогенизацию
До определенной т^пературы, гомогенизации со-
состава замкнутого пР0СТРа"™' может быть приблизительно
приравнена к температуре
кристаллизации данного вещества. На ™>м
явлении основан один из MeTOf ^ Зй
деления температуры кристаллизации
минералов гидротерм, развитый
Н П Ермаковым и получивший
название метод гомогенизации
Если в процессе роста на поверх
ности кристалла оседают
выделяющиеся из раствора газовые пузырьки т0
пои захватывании их гранью
кристалла они вытягиваются, образуя тонкие
каналы расположенные
перпендикулярно к грани. Так же располагаются
„ пузырьки включений маточного
раствора. Со временем под влиянием
колебаний температуры они могут при
нять .форму отрицательных кристал
лов Нередко в качестве механических
включений в кристаллах можно ветре
тить мелкие кристаллики посторонне
го вещества, образующие присыпку;S^ZlZ^T ocloZou
Иногда они бывают очень мелкими и наблюд сказывается в
^S^'-^^SSS^^V^^ -та по различ-
НЫМПНерПеРхоВДЛ дГдритной Ф°Р-р^^
ответствующих условиях п0^ТГ^бяеш1ш1 частями поверх- -
как прешло захватов^^SS^^W™-- в НеМ В ^
ности растущего кристалла, иыа ш.
включений. .ттппых до сих пор шла речь, сле-
От первичных включении 'J^P"x3^KaK)T B результате
продует отличать вторичные. Последние возника«> V у ая в
никновения жидкости ДьД^ включения окажут-
дальнейшем может <<залеч^^Яьн0 а п0 определенным законам,
ся расположенными не произвольно, а по о Р^ в свЯ-
РНеоднородности другого проищем* в потоками, в0Т-
зи с расслоением раствора и с концентраци
Рис 52 Пирамиды роста
кристалле ромбической синго
НИИ
в
!
90
пичие от ранее рассмотренных, необязательно приурочены к
средним частям граней. Распределение таких неоднородностей, в том
числе примесей, имеет более сложный характер.
Примеси, распределяющиеся неравномерно в объеме
кристалла иногда изменяют параметры решетки, вследствие чего
отдельные пирамиды и зоны роста перестают соответствовать друг дру-
гу по размерам. Эта разноразмерность, гетерометрия частей
кристалла, как было установлено А. А. Штернбергом, может быть
скомпенсирована упругими деформациями и, если предел
прочности кристалла превзойден, трещинами. Для появления такого
рода трещин достаточно весьма небольшое изменение параметров
решетки (на несколько десятитысячных ангстрема), которое может
быть вызвано незначительными изменениями в содержании
примеси.
Штернберг указал на большое разнообразие проявления гете-
рометрии. Чаще всего в условиях лабораторного выращивания
кристаллов на затравке гетерометрия возникает за счет изменения
параметров решетки, вызванных различием состава затравочных
пластин и наросшего материала (если это нарастание ведет к
изменению ориентировки кристалла). Например, если на толстой
пластине, вырезанной из пирамиды роста кристалла <001> почти
любого вещества не кубической сингонии в том же растворе
выращивать кристалл гранью <100>, то возникает гетерометрия,
вызванная неодинаковой «плотностью» пирамид роста <001> и
<100>. Гетерометрия проявляется далеко не во всех случаях
возникновения в кристалле участков с разными параметрами
решетки, а только при медленном бездефектном росте. Например, при
достаточно быстром ведении процесса можно без трещин
наращивать на затравке кварца материал, содержащий заметные
примеси Al, Ge, Fe.
Гетерометрия широко распространена в минералах, так как
кристаллы последних растут медленно в среде, непрерывно
изменяющейся по составу. Трещиноватостью, обусловленной гетеро-
метрией, вероятно, можно объяснить появление скрученных
кристаллов.
Влияние температуры, пересыщения (переохлаждения)
и движения раствора (расплава) на форму роста кристаллов
Несомненна зависимость формы роста кристаллов от
температуры кристаллизации, степени пересыщения (переохлаждения)
I раствора (расплава) и движения раствора (расплава). Однако до
сих пор еще окончательно не изучен механизм влияния этих фак-
[ торов.
Чем более пересыщен раствор, тем скорее протекает кристал-
| лизация, что отражается на однородности, симметрии и форме
I кристаллов. Кристаллы, вырастающие из более пересыщенных
растворов, менее однородны по сравнению с кристаллами, мед-
91
ленно растущими из слабо пересыщенных растворов. В то же вре-
мя первые внешне являются более симметричными. Так, Шефталь J
на кристаллах сахарозы и сегнетовой соли смог отметить, что
облик кристалла по мере увеличения степени пересыщения услож- \
няется. А. В. Шубников наблюдал кристаллы салола в виде ром- 1
бов, растущие при охлаждении до 30°С, и в виде «лодочек», появ- 1
ляющиеся при охлаждении ниже 23°С. Влияние температуры
на форму кристаллов, растущих из растворов, Шефталь I
объясняет изменением концентрации растворителя, играющего
роль примеси.
Работы, изучающие влияние вышеперечисленных факторов^
на форму роста кристаллов, делятся на несколько групп.
1. Физико-химические работы, не учитывающие огранку кристал- ?
лов и констатирующие, что растворение и рост кристаллов не под- I
чиняются закону Нернста—Андреева. Скорость растворения 1
вообще в 8—10 раз превышает скорости роста и лишь для
некоторых веществ при достаточно высокой температуре наблюдается
равенство скоростей роста и растворения.
2. Кристаллографические работы Шубникова, Клебера,
Петрова и других учитывают анизотропию кристалла. При росте
кристалла десольватация молекул происходит по-разному на разных
гранях кристалла. Облик кристалла по мере изменения степени
пересыщения изменяется, так как происходит перестройка
раствора, меняется характер сольватации.
Более полные и, вероятно, правильные выводы о -влиянии
пересыщения температуры и движения жидкости относительно
кристалла на форму роста сделаны Петровым. Эти выводы
основываются на кристаллохимической теории строения воды и совре- I
менном учении об адсорбции ее молекул гранями кристалла.
Эффекты пересыщения, меняющихся температур, скорости
движения жидкости относительно кристалла сказываются прежде |
всего на изменении характера самого раствора — степени его не- i
однородности, устойчивости. Существенно, что при этом изменяется
толщина адсорбционных слоев на поверхности кристалла и,
следовательно, скорость диффузии вещества через них.
Изменение пересыщения, температуры и прочее существенным •
образом сказывается на состоянии физически адсорбированного
полимолекулярного слоя воды, с его обычно слабыми силами свя-^
зи. Прочность и толщина физически адсорбированного слоя
определяется «узором» первого химически связанного
мономолекулярного слоя воды, а через него со структурой поверхности кристалла.
Изменение состояния (прочность и толщи-на) физически адсорби- 3
рованной рубашки влечет за собой изменение скорости диффузии I
вещества к грани.
На приреберных участках из-за несоответствия ориентировки
молекул растворителя в пространстве над соседними гранями
создаются более тонкие пленки (на ребре — мономолекулярные). Это
обеспечивает практически постоянное существование чистых участ-
92
ков вдоль ребер кристалла и зачинание новых слоев
преимущественно на этих участках.
Возрастание в различной степени скоростей роста граней с
увеличением пересыщения Петров объясняет частичной
специфической десольватацией поверхности граней кристалла, в
результате чего возрастает диффузионный потенциал и уменьшается
толщина рубашки, через которую происходит диффузия.
С повышением температуры обычно увеличиваются скорости
роста кристаллов, так как возрастает скорость диффузии вещества
к грани и вдоль нее, облегчается дегидратация как ионов, так и
поверхности кристалла.
Кристалл в перемешанном движением растворе теряет часть
физически адсорбированного слоя, благодаря чему скорость
диффузии ко всем граням через тонкую
пленку увеличивается, возрастает и
скорость роста кристалла. При
создании условий, в которых физически
адсорбированный слой полностью
ликвидируется и сохраняется только
адсорбированный МОНОМОлекулярный СЛОЙ Рис. 53. Кристалл с косоуголь-
воды, скорость диффузии ко всем ным сечением
граням в наибольшей мере будет
зависеть от структуры кристалла. Возможно, что в этом случае не
должно сказываться пересыщение.
Под словами «движение жидкости» у поверхности кристалла
имеются в виду иногда концентрационные или конвекционные
потоки.
Отмечая влияние потоков на форму роста кристалла, следует
указать и на существенную роль, которую играет положение
(ориентация) кристалла в сосуде. Если кристалл, растущий из
раствора, лежит на дне кристаллизатора, то его вертикальные грани
растут быстрее, чем верхние, ввиду более обильного снабжения
первых питательным материалом. Так может вырасти вместо
кубической формы кристалл в форме удлиненной призмы. Если
вертикальное сечение кристалла не прямоугольное (рис.53), то кристалл
при неподвижном растворе растет быстрее в сторону тупого угла а,
так как у «лежачего» бока в углу а раствор свободно циркулирует,
а у «висящего» — в углу р застаивается. На нижней грани,
прилегающей ко дну сосуда, можно наблюдать замкнутые линии, которые
окружают точку О — центр кристаллизации. Точка О всегда
расположена ближе к острому углу, чем к тупому. Если кристалл
подвешен на нити, то концентрационные токи омывают главным
образом _его нижние грани, вследствие чего нижняя часть
кристалла растет быстрее верхней.
Существованием концентрационных потоков объясняется тот
факт, что при прочих равных условиях крупные кристаллы растут
с большей скоростью, чем мелкие. Концентрационный поток имеет
-форму цилиндра, расположенного по отвесу над растущим кристал-
93
Шж
лом. Основание этого цилиндра определяется величиной кристалла..
При постоянной величине потока его омывающий эффект (трение)
пропорционален боковой поверхности цилиндра, т. е. радиусу
потока, а переносимое потоком количество жидкости пропорционально
площади сечения, т. е. квадрату радиуса. Для переноса одной
единицы питательного вещества с помощью более узкого потока
нужна большая затрата энергии, чем с помощью интенсивного потока,
образующегося у большого кристалла, и, таким образом, на
больших кристаллах отлагается в единицу времени на единицу
поверхности большее количество вещества, чем на малых.
В заключение следует отметить, что скорость роста
кристалла даже при высокой стабильности
внешних условий не остается постоянной. Для
кристаллической грани характерна некоторая периодичность колебаний
скорости ее роста. Изменение облика кристалла может происходить
при постоянном пересыщении в результате неодинаковой
нарушенное™ разных граней. Захват центром роста, например,
дислокационной природы порций питательного материала может привести к
образованию ударной волны плотности ступеней. Гребень ударной
волны находится в преимущественном положении в отношении i
диффузии к нему питательного материала. Получив у гребня волны
облегченный доступ к грани, избыток вещества в растворе
обеспечивает равномерное продвижение волны по грани. Колебания
концентрации, вызванные, например, концентрационными потоками,
также могут быть возможной причиной возникновения ударных
волн плотности ступеней, ведущих к временному увеличению
скорости роста грани. При повышении температуры колебания скоро-
сти роста грани увеличиваются.
Закон геометрического отбора
Если на дне стеклянной трубки, заполненной переохлажденной
жидкостью, и запаянной с одного конца, возникает большое число
произвольно ориентированных кристаллических зародышей, то в-»
процессе их дальнейшего роста выживает, как правило, только
один из них. Ось выжившего кристалла находится в выгодном гео-
. метрическом положении, параллельном образующей трубки (рис.
54). Это закон Гросса—Мёллера, названный по предложению "
Шубникова принципом геометрического отбора и являющийся
иллюстрацией зависимости формы кристалла от положения его в
сосуде. -
Принцип геометрического отбора умело используют на
практике в целях обеспечения монокристального роста и
поликристаллического ia-грегата.
Остроумное приспособление П. А. Полибина и А. И. Фроймана
впервые дало возможность выращивать кристаллы из расплава
с заданной ориентировкой (рис. 55). Капилляр трубки с расплавом
металла вставлен в небольшой сферический королек металла.
94
Образующиеся при затвердевании капель металла столбчатые
кристаллы располагаются по радиусам сферы (см. ортотропиче-
ский рост, гл. VI, § 1). На рис. 55 показаны столбчатые кристаллы,
один из которых, а именно кристалл А, направлен непосредственно
в устье капилляра (левая часть рисунка). Соответствующие грани
этого кристалла перпендикулярны к
поперечному сечению
кристаллизационной трубки. При небольшой
предосторожности расплав в
широкой части трубки будет
кристаллизоваться в виде кристалла, ориенти-
Рис. 54. Геометрическая
схема, иллюстрирующая закон
Гросса — Мюллера (по
А. В. Шубникову)
Рис. 55. Вынужденная
ориентировка монокристалла в
кристаллизационной трубке По-
либина и Фроймана
рованного, подобно кристаллу А. На правой части рисунка
показано направление капилляра по отношению к оси широкой трубки
для случая, когда необходимо получить кристалл,
ориентированный подобно кристаллу В.
Говоря о факторах, влияющих на форму роста кристалла,
следует упомянуть и о форме затравочного кристалла. В
практике выращивания монокристаллов используют затравочные
кристаллы такой формы, которая обеспечивает быстрый рост
кристалла, а также способствует тому, чтобы часть выращенного
кристалла, приходящаяся на регенерацию, была наименьшей.
Недоразвитые формы роста кристаллов
Весьма распространены так называемые недоразвитые
формы роста кристаллов, т. е. такие формы, в которых
отсутствуют какие-либо элементы охранения (грани, ребра, вершины).
95
К числу недоразвитых форм относятся, прежде всего, дендритные
формы (рис. 56). 1
Это «древовидные» кристаллы, вырастающие из одного центра
и имеющие одну общую кристаллографическую ориентировку. Ме_
ханизм дендритного роста кристаллов до сих пор не вполне ясен.
Некоторые авторы объясняют дендритный рост кристаллов
анизотропией теплопроводности кристаллов, в особенности металлов.
Как показывают многочисленные исследования, анизотропия
теплопроводности играет роль в образовании дендритной формы
кристалла, но ее нельзя считать
главной причиной.
Одно из объяснений
механизма образования дендрита дано
русским металлургом Д. К.
Черновым. Д. Д. Саратовкин,
'Придерживающийся его взглядов,
показал, что причины дендритной
кристаллизации надо искать в
примесях маточного раствора и в
большой скорости
кристаллизации. При этом частицы примесей
в расплаве играют ту же роль,
Рис. 56. Дендриты в слитке сурьмы чт0 и частицы растворителя в
растворе.
Исследования последних лет
дают основания утверждать, что не исключена возможность
образования дендрита в беспримесных (чистых) системах. Такой ход
кристаллизации объясняется тем, что особенно в условиях
значительного концентрационного или теплового переохлаждения
разнородные элементы огранения кристалла, имеющего первоначальную
полиэдрическую форму, будут в неодинаковом положении в
отношении литания путем объемной диффузии. В наилучшем
положении будут вершины, затем ребра, и наконец, грани. Возникающая
диффузионная неоднородность питания увеличивается с
размерами кристалла.
А. А. Черновым рассмотрено одновременное действие
диффузионной неоднородности и кристаллографической анизотропии на
грани кристалла. Распределение концентрации вокруг грани
приводит к тому, что пересыщение в центре грани минимально, а у
вершин и ребер максимально. В то же время на границе
кристалл—раствор должно выполняться условие равновесия
Я = -£-=Р(л)(с-св),
дп
где D — коэффициент диффузии, с — концентрация раствора,
находящегося в контакте с поверхностью кристалла, п — нормаль к
поверхности, р — коэффициент, характеризующий поглощательную
способность, се — концентрация насыщения. Это равновесие осу-
96
шествимо, если р неодинаково (р зависит от температуры,
концентрации и'в основном от кристаллографической анизотропии).
Расчет показал, что так как р минимальна для плотноупако-
ванных граней, то компенсация непостоянства концентрации
ic се) происходит за счет изгибания поверхности плотноупако-
Рис. 57. Переход от
изометрического роста к скелетному
/
/
/
<—
\
\
\
г--1х
ч
\
\
—*»
/
/
/
V
Рис. 58. Переход к
антискелетной форме
роста
ванной грани. Однако это происходит лишь в случае, когда
размер кристалла превышает некоторый критический /с. При еще
больших размерах теряют устойчивость формы, и изометричный
рост сменяется на скелетный (рис. 57). Величина р связана
также с «источниками» — отправными точками роста. Такими
источниками считаются дислокации и плоские зародыши. При малых
пересыщениях, когда действуют
только дислокационные источники роста,
расположенные, как травило, в
центрах, граней, кристалл будет иметь
антискелетную форму роста,
«лишенную» угловых и реберных участков
поверхности (рис. 58). Выгнутые
формы наблюдались на кристаллах
карборунда SiC и др. По мере
увеличивающегося пересыщения
дислокационный механизм сменяется механизмом
образования зародышей, которые в
силу диффузионной неоднородности
будут скорее образовываться на
ребрах и вершинах. Эти гранные, реберные и вершинные источники
при соответствующих условиях должны в конечном счете оказаться
более мощными и кристалл примет дендритную форму (рис. 59).
Черновым выведена формула для оценки критического размера
кр.исталла, при котором должно происходить его искажение. К
сожалению, в эту формулу входит коэффициент р, который не
определяется опытным путем.
Таким образом, дендритный рост следует рассматривать
скорее как видоизменение нормального роста, но не как совершенно
особый процесс.
Рис. 59. «Вершинная»
дендритная форма
О. Г. Козлова
97
Давно известно, что литые слитки и быстро затвердевшие в
условиях сильного переохлаждения металлы имеют дендритную
структуру, т. е. состоят из первичных дендритных ветвей, часто
параллельных направлению роста, и вторичных дендритных ветвей
которые растут под определенными углами, зависящими от струк'
туры кристалла, к первичным ветвям. Иглы дендрита растут па-2
■
т
ы
Рис. 60. Ленточный дендрнт
германия: а — кристаллографическая
схема; б — фотоснимок
В
раллельно тем граням, над которыми они
располагаются. В некоторых случаях
скорость двух соседних граней, имеющих
общее ребро, может меняться
неодинаково, что приводит к искривлению пути
перемещения ребра. Это можно наблюдать
на морозных узорах на окнах.
По Фогелю, дендритному росту
кристалла способствуют анизотропия формы
кристалла, низкая его теплопроводность,
высокое значение скрытой теплоты
кристаллизации, большая скорость
отложения вещества, легкость
самопроизвольного зарождения, вязкость и примеси.
Скорость роста дендрита определяется степенью
переохлаждения у верхушки дендрита или, что еще вероятнее, градиентом
переохлаждения. Она максимальна для дендрита, ось которого
ориентирована перпендикулярно плоскости холодильника
(параллельна направлению теплового потока). Такой дендрит растет
быстрее своих менее благоприятно ориентированных соседей,
подавляя их рост. Это обстоятельство используется в ряде случаев
для обеспечения преимущественной ориентации. Так, при
определенных условиях из расплава получают дендриты германия вдоль
98
иного кристаллографического направления. Полученные
кристаллы не будут настоящими дендритами в обычном смысле этого
слова, потому что ветви их представляют собой тонкие пластинки,
ограниченные кристаллографическими плоскостями {111}. Их
называют «дендритными лентами». Для лент характерны одна или
несколько когерентных двойниковых плоскостей, параллельных
внешним поверхностям. На рис. 60 показано кристаллическое
строение ленточного дендрита с единственной плоскостью двойни-
кования. Оба кристалла (А и В), разделенные плоскостью двойни-
кйвания (С), имеют общее направление [1 2 1]. Такой дендрит
обычно растет вертикально вниз в виде одной ветви. Из
переохлажденного (метастабильного) расплава непрерывно может расти
дендритная лента, состоящая по меньшей мере из трех
кристаллических индивидов. Входящие углы между пересекающимися
плоскостями {111} становятся постоянно действующим местом
прикрепления частиц кристаллизующегося вещества.
Дендритные ленты германия, используемые в
полупроводниковой технике, по сравнению с образцами, приготовленными из
кристаллов полиэдрической формы, имеют преимущество более
• совершенной поверхности по сравнению с обработанной.
Методом Чохральского (см. гл. VIII, § 4) удается получить и
дендритные нити германия за счет того, что в условиях ускоренного
вытягивания дендрита из менее переохлажденного расплава
первый не успевает приобрести огранку.
Переходные формы кристаллов от полиэдрической
к дендритной
Как показано выше, по мере изменения степени
переохлаждения (пересыщения) расплава (раствора) полиэдрическая форма
роста может перейти в дендритную и наоборот. Конечно, такие
переходы осуществляются через ряд промежуточных форм роста
кристалла. К числу промежуточных форм следует отнести
векториальное строение полиэдрической формы, скелетную и
антискелетную формы роста.
Ряд авторов полагает, что все реальные кристаллы
полиэдрической формы характеризуются секториальным строением,
которое определяется прежде всего индивидуальными поверхностными
свойствами каждой из развивающихся на кристалле граней,
неодинаково взаимодействующих с питающей средой.
Если иметь в ©иду, что во многих случаях кристаллы растут
путем тангенциального развития ступенек от вершин и ребер к
середине граней, то становится понятным скопление неоднородно-
стей на центральных участках пирамид роста. Если эти
неоднородности или другие факторы становятся препятствием для
полного образования граней, в центре которых возникают
воронкообразные углубления, то возникает скелетная форма роста. Те же
причины могут привести к образованию дендритных форм роста
4* 99
кристаллов, развивающихся только на угловых участках
поверхности кристалла. Вместе с тем многочисленные случаи указывают
на то, что образование слоев может начинаться не только с углов'
или ребер, но и в различных местах, на середине грани. Грани
в этих случаях получаются выпуклыми, образуя антискелетные
формы. Спирали, возникающие на винтовых дислокациях,
являются примером антискелетного роста кристаллов. Возникновение
скелетных и антискелетных форм
роста имеет общие причины. Но
только скелетные формы при
своем дальнейшем развитии
переходят в дендритные. Антискёлетный
рост (рис. 61) тоже может сопро-
Рис. 61. Нарост,
образовавшийся на винтовой
дислокации
Рис. 62. Образование
слоистого дендрита
Рис. 63. Чешуйчатый
дендрит
вождаться образованием чешуйчатых и слоистых дендритов
(рис. 62, 63).
Поскольку нет строгой границы между секториальным
строением и таким, которое переходит в дендритное, нет и
определенной границы степени переохлаждения (пересыщения),
концентрации примеси и скорости роста, которые определяли бы
переход от кристаллов в виде полиэдров к дендритам.
Некоторые формы кристаллов всегда будут промежуточными,
как бы тщательно мы ни отделяли скелетные формы от
дендритных. Сюда прежде всего относятся снежинки. Часть их имеет
типичную форму без следа каких бы то ни было ветвей, другие —
сильно развитые отростки. Кристаллизация хлористого аммония
из водного раствора служит характерным примером дендритной
кристаллизации. При наличии в растворе примеси мочевины
CO(NH2)2, дающей комплексное соединение с хлористым
аммонием, изменяется соотношение скоростей роста граней куба и
J оо
аэдра в пользу последней, в результате чего кристалл прини-
*iael°rf!v4ae дендритной кристаллизации иглы или ветви дендри-
ппявляются в вершинах куба. Дендрит хлористого аммония,
т0В отпрнный из пересыщенного раствора между двумя стеклами,
ВЫ^рт оставаться в этой форме недолго. Уже через 6 мин можно
М°^гъ что все вторичные иглы потеряли связь с первичными:
^пжка» каждой иглы исчезла, дендрит распался на отдельные
п? ?оис 64) ничем не связанные друг с другом. Постепенно
ппписходит полное распадение дендрита. Процесс этот имеет очень
простое объяснение. Дендрит является неравновесной формой
1
I Г
J I—L
J I 1
ГТТ
■ i 1 l I 1 I I I
a
б
Рис 64. Переход от неравновесной (я) к более
равновесной (б) форме кристаллов хлористого аммония
кристалла именно потому, что он не находится в равновесии с
раствором а растет в нем. В процессе роста наиболее выгодной
формой кристалла оказывается такая, при которой поверхность его
будет максимальной, поскольку при этом условии облегчается
отложение вещества на кристалл. Так как поверхностная энергия
пропорциональна суммарной поверхности, то, значит, к растущему
дендриту нельзя применять принцип Гиббса—Кюри—Вульфа.
Однако, когда кристаллизация закончена и раствор принял
комнатную температуру, должно установиться равновесие между
твердой и жидкой фазами. Вступающий в силу принцип Гиббса
Кюри—Вульфа изменяет огранку дендрита так, чтобы его
поверхностная энергия стала минимальной.
Леммлейн подчеркнул, что равновесная форма кристалла не
тождественна форме роста. Каждая грань кристалла равновесной
формы имеет такую же растворимость, как и другие грани.
Понятие насыщенного раствора может быть применено только к
раствору, окружающему кристаллы равновесной формы. Для
неравновесного кристалла' точно насыщенных растворов не существует.
Отсюда вытекает и новое определение понятия насыщенного
раствора: насыщенным раствором является такой, в котором кристалл
в равной мере и растворяется и нарастает, не меняя своей формы.
101
Нитевидные кристаллы
Одной из распространенных форм роста кристаллов является
нитевидная форма. Нитевидными кристаллами (вискер-
сами, усами, волокнами) называются такие кристаллы, у которых
отношение длины к диаметру составляет не менее чем 103. К
нитевидным относят кристаллы с диаметром до 20 мк.
Изучение свойств нитевидных кристаллов и их рост стало
предметом многочисленных исследований, главным образом
физиков, металлургов и кристаллографов. Свойства их оказались
необычными: а) совершенное, почти бездефектное ■
монокристаллическое строение; б) гладкая поверхность граней; в) прочность,
близкая к рассчитанной теоретически на основе сил межатомного
взаимодействия (она в десятки, а иногда и в сотни раз превосходит
прочность кристаллов тех же веществ, полученных обычным
способом) ; г) способность после деформации полностью
'восстанавливать свою форму и размеры при нагреве; д) малая скорость
растворения, окисления и испарения; е) высокая электропроводность
при низких температурах и др.
Рост нитевидных кристаллов может происходить из расплавов,
растворов, гелей, при конденсации паров и из твердой фазы.
Общим условием для роста нитевидных кристаллов в
природе является пористое основание (подложка), на котором они
нарастают. В лабораторных условиях чаще всего их получают при
конденсации паров на пористом основании, но также из расплавов
методом Чохральского.
Рост нитевидного кристалла на пористом основании, как впер-:
вые установил Р. Шмидт, происходит за счет действия
кристаллизационной силы (см. гл. VII § 1). Как вычислил Шмидт, ните--
видный кристалл округлого сечения, диаметром 0,02 мм может
развивать давление роста, достаточное для выталкивания своего
собственного веса до достижения длины 805 мм.
Рост нитевидного кристалла может происходить как с
основания, так и с вершины. Так, волокнистые кристаллы железного
купороса растут на пористом кирпиче, погруженном в водный
раствор сульфата железа, при этом питающий раствор
поднимается по порам капиллярными силами и испаряется у вершины.
Шмидт получал волокнистые кристаллы при медленном испарении j
раствора, пропитывающего пористую черепицу. Окрасив вершины
волокон фуксином, автор убедился, что рост нитей происходит
у основания.
Рост кристаллических усов из расплава можно
продемонстрировать ,на примере льда, пучки параллельных волокон которого
вырастают из почвы, когда обильные дожди сменяются
заморозками. Иногда ледяные кристаллы 'при своем росте могут
поднимать обломки породы.
Для некоторых веществ, получающихся конденсацией из паров
(Sb203, SeS2 и др.К нитевидная форма является наиболее обыч-
102
ой Таким же образом получены нитевидные кристаллы Hg, Zn,
rd " Ag, ZnS, CdS. Г. В. Бережковой осаждением из паров
' чены нитевидные кристаллы сапфира А1203. Усы серебра
Позникают при электролизе сильно концентрированного раствора
AgN03.
Механизм роста нитевидных кристаллов еще окончательно не
выяснен. Сначала представления о росте нитевидных кристаллов
основывались на идее Франка о росте кристаллов путем
осаждения вещества около выхода винтовой дислокации «а грань
растущего кристалла. Однако скорость роста нитевидного кристалла
почти в тысячу раз превышает рассчитанную на основе
указанных предположений. Это расхождение Г. Сирсом было устранено
предположением, что рост происходит также и за счет частиц,
поступающих на боковую поверхность растущего уса, мигрирующих
затем по поверхности к его концу, где они и встраиваются в
структуру- Утолщение нитевидного кристалла происходит от новых
слоев, зарождающихся у его основания.
Однако, отсутствие винтовых дислокаций в нитевидных
кристаллах свидетельствует о несоответствии теории Сирса
действительности.
За последние два—три года Р. Вагнером и В. Эллисом в
процессе их наблюдений за ростом усов кремния, осаждаемого из
паров галоидов, восстановлением водорода, был обнаружен новый
механизм роста нитевидных кристаллов. Оказалось весьма
важным участие в процессе роста усов определенных примесей.
Примесь, расплавляясь, образует каплю с относительно низкой
температурой затвердевания. Рост кристаллов из газовой фазы
происходит через тонкий промежуточный слой расплавленной примеси.
Авторы назвали его VLS — механизмом, т. е. механизмом пар—
жидкость—кристалл. В механизме VLS осаждение материала
происходит в две стадии. Сначала — осаждение из пара на расплав,
затем — осаждение материала из пересыщенного расплава на
границе кристалл — расплав. Наличие жидкого слоя в контакте с
растущим кристаллом обеспечивает быстрое осаждение частиц из
газовой фазы. Объясняется это тем, что жидкость, являясь
идеально шероховатой, удерживает все падающие на нее атомы.
Кроме того, жидкость действует каталитически, ускоряя реакцию
выделения материала. В результате капля становится
пересыщенной материалом, доставляемым из газовой фазы, и рост
происходит быстрым осаждением вещества ,на границе кристалл —
расплав.
Рост уса происходит в две стадии: быстрое первоначальное
Удлинение и последующее медленное утолщение, осуществляемое
слоевым ростом боковой поверхности. Слои зарождаются на
поверхности подложки и постепенно выклиниваются. "
Управление VLS-механизмом возможно при условии, если
Жидкий слой остается устойчивым в процессе роста, т. е. не
разбивается на капли. Это условие налагает ограничение на макси-
103
мальный диаметр кристалла, полученного таким путем. В свою
очередь, устойчивость жидкой капли зависит от величины радиуса
ее кривизны в собственном паре и от степени пересыщения.
Примесь, используемая в VLS-механизме, должна отвечать
определенным требованиям: 1) примесь должна образовывать с
кристаллизуемым веществом жидкий раствор при температуре-
кристаллизации; 2) растворимость примеси в твердой фазе по'
сравнению с растворимостью в жидкой должна быть меньше;
3) примесь должна быть инертной к продуктам химической
реакции; 4) важную роль играют поверхностные энергии межфазных
границ и т. д.
Природные нитевидные кристаллы встречаются в виде призм
или конусов, при этом они могут быть прямыми, искривленными
или скрученными. Форма кристалла определяется как его
структурой, так и условием роста (симметрией среды). Влияние
структуры вещества отчетливо проявляется в совпадении удлинения:
нитевидного кристалла с важнейшими кристаллографическими
зонами, которые соответствуют направлениям наиболее интенсивных
сил связей в структуре. Это еще одна иллюстрация известного^
правила Марка, устанавливающего совпадение удлинения
волокнистых кристаллов с направлением наименьшего параметра
ячейки. В случае ярко выраженных цепочек в мотиве структуры
удлинение совпадает с направлением этих цепочек (амфиболы,
волокнистые цеолиты, сера и др.). Наиболее интересно поведение
слоистой структуры в среде с симметрией, вызывающей нитевидный
рост. Слоистая структура взаимодействует со средой, в результате
чего слои закручиваются в спиральные трубки (галлуазит,
хризотил и др.).
Кристаллы нитевидной формы могут образовывать агрегаты,
принимающие разнообразную внешнюю форму, определяющуюся
различными соотношениями в пространстве скоростей роста
отдельных участков агрегата. И в данном случае внешняя симметрия
агрегата соответствует симметрии окружающей питающей
среды. Эта тенденция используется в практике при получении
ориентированных текстур — электретов, пьезоэлектрических
текстур и т. п.
Сферолиты
Своеобразные формы роста кристаллов возникают в
результате расщепления в процессе роста. Само по себе расщепление
кристалла вызывается его неоднородностью, обусловливающей не
строго параллельное расположение частей, из которых слагается
реальный кристалл.
Явление расщепления кристаллов 'подробно изучено О. Леман-
ном. Известно, что этому явлению благоприятствуют: примеси
к раствору или расплаву, быстрый рост, крупные размеры,
значительные колебания температуры, механические повреждения
104
'оисталла и т. д. Расщеплению подвергаются в соответствующих
Условиях многие кристаллические вещества.
Количественная интерпретация явления расщепления кристалла
по Бернауэру такова. Предположим, что выросший в
определенных условиях кристалл АВ (рис. 65) имеет удлиненную форму и
dS
может расти далее с постоянной скоростью только в направ-
лении своей длины, не утолщаясь или утолщаясь незначительно
в -поперечном направлении. С некоторого момента концы иглы
начинают расщепляться в стороны на ветви с постоянной скоростью
расщепления . Из чертежа видно, что dS = rda, где г — радиус
г dt
Рис. 65. Закон расщепления
Рис. 66. Расщепление
кристалла во время роста и
образование «двулистника»
окружности. Отсюда следует, что
расщепляющийся в процессе
роста иглообразный кристалл при
указанных условиях примет со
временем форму, которая в
сечении представляет собой
сочетание четырех равных между собой
окружностей и четырех
соответствующих эвольвент. В данном
примере эвольвентной
окружности АС будет кривая CD.
Расщепление начинается с образования расщелин у двух
противоположных концов кристалла. Такое расщепление может
привести к образованию оферолита с двулистником (рис. 66) более
или менее правильной формы в зависимости от толщины волокон
расщепленного кристалла. Сферолит с двулистником образован
радиальными волокнами двух сортов, граница между ними имеет
вид двух сросшихся листьев.
Другой тип сферолитов, сферокристаллы, составлены из
молекулярных тонких волокон, исходящих из одного центра по
радиусам; поверхность сферокристалла гладка и часто строго сферична.
При рассматривании сферокристаллов в поляризованном свете
при скрещенных николях виден черный крест, исчезающий при
наблюдении в обыкновенном свете.
Образование сферокристаллов с молекулярно-тонкими
волокнами можно также объяснить разветвлением одного зародыша,
105
однако это предположение пока еще не было развито и не
получило подтверждения.
Образование сферолита, как показали наблюдения, тесно
связано и с явлением ортотропизма и с принципом «выживания»
зародышей. Так, третий тип сферолитов, обыкновенный сферолит
возникает в вязкой переохлажденной жидкости из группы
обломков кристаллов.
Обыкновенный сферолит состоит из отдельных удлиненных
кристаллов или хорошо различимых монокристальных волокон,
расположенных радиально от одного центра. По внешней форме
этот кристаллический агрегат приближается к шару; поверхность
его неровна и покрыта множеством граней составляющих
кристаллов. Некоторые авторы принимают сферокристаллы за особый вид
твердых тел, отличающихся как от кристаллов, так и от
кристаллических агрегатов. На кристаллы они похожи тем, что
образуются из одного зародыша, а на кристаллические агрегаты тем, что;
имеют неоднородную структуру.
Появление скрученных кристаллов можно удовлетворительна
объяснить, например, расщеплением или трещиноватостью,
обусловленной гетерометрией. Так, например, если в призматическом
кристалле пирамиды роста граней призмы в результате
вхождения примесей будут иметь меньшие параметры решетки, они
смогут разрывать и развертывать веером головки кристалла.
Параллельная удлинению спайность в кристалле, очевидно, будет
особенно способствовать этому явлению.
В пластинчатых короткопризматических кристаллах .вызван-^
ное примесями сокращение параметров решетки пинакоидальных
граней поведет к отслаиванию нарастающих слоев и образованию
форм, аналогичных железной розе гематита.
§ 5. ФОРМЫ РАСТВОРЕНИЯ
Формы растворения представляют особый интерес потому, что
могут рассматриваться как один из источников сведений об
условиях образования кристаллов. При растворении иногда особенно
четко выявляются дефекты строения кристаллов.
Вывод возможных форм растворения до некоторой степени
аналогичен выводу форм роста. Минимумы скоростей
растворения, так же как и скоростей роста, отвечают направлениям,
перпендикулярным к плоским сеткам с небольшими индексами.
Минимуму скорости растворения соответствует вершина на форме
растворения, в то время как минимуму скорости роста отвечает
плоскость — грань кристалла. Задавая положение минимумов
скоростей растворения относительно элементов симметрии, можно
получить формы растворения. Были выведены 47 выпуклых (рис.
67, а), 47 вогнутых (рис. 67, б) кривогранных форм, а также
47 плоскогранных форм, совпадающих с известными простыми
формами.
106
1
Мысль о необходимости геометрического анализа форм рас-
прения впервые высказана В. А. Мокиевским. Выпуклые криво-
Тпанные формы принадлежат к наиболее распространенным
форам и неоднократно наблюдались на алюмокалиевых квасцах,
Шпинели, алмазе и других кристаллических образованиях, как
иродных, так и искусственно полученных. Геометрия их
подробно исследована И. И. Шафрановским.
Кривогранные формы обозначают кубоидом, додекаэдроидом
и подобными терминами, которые следует дополнять определением
«выпуклый» или «вогнутый». Вогнутые формы встречаются на
природных кристаллах алмаза, детально
описанных А. Е. Ферсманом. Вогнутые тет-
раэдроиды встречены на NaBr03, вогнутые
ромбододекаэдроиды и кубоиды — на
алюмокалиевых квасцах.
Как уже отмечалось, между формами
роста и растворения кристаллов можно
провести некоторую аналогию и
существенные различия. Сходство между ростом и
растворением прежде всего состоит в том,
что во внешней симметрии реального
кристалла (растущего или растворяющегося)
участвует симметрия окружающей среды, в
которой растет или растворяется кристалл.
Правда, эта зависимость в случае
растворения кристалла может быть менее
наглядной, чем в случае роста. Сходство между
ростом и растворением проявляется, если
ростовые формы выпуклых многогранников сравнивать с формами
отрицательных кристаллов. Примером отрицательных кристаллов
могут служить фигуры травления в виде микроскопических
многогранных углублений (см. ниже). Аналогию между ростом и
растворением можно провести и дальше. При росте образуются
скелетные формы, но то же может наблюдаться и при растворении или
плавлении кристаллов. Так, при действии солнечных лучей на лед,
т. е. на кристаллы воды, в результате внутреннего местного
оплавления образуются отрицательные кристаллы, так называемые
«водяные цветы», имеющие форму снежинок.
Весьма существенная даже принципиальная разница между
ростом и растворением выпуклых многогранников заключается в
том, что при росте кристалла на нем остаются грани, медленно
растущие, а при растворении кристалл оказывается покрытым
теми гранями, которые имеют наибольшие скорости растворения.
При росте каждая грань имеет определенную скорость роста, и
при переходе от одной грани к соседней скорость роста
изменяется скачком, а скорость растворения рассматривается как
непрерывная функция от направления; при растворении, особенно в
начале его, на гранях кристалла образуются фигуры травления,
Рис. 67. Примеры
растворения кристаллов:
а — выпуклые (кубоид
и ромбододекаэдроид);
б — вогнутые (кубоид
и ромбододекаэдроид)
107
\
-Ш
тогда как при росте на гранях иногда появляются выпуклые
холмики роста. Любопытно еще одно различие между ростом и рас^
творением, заключающееся в том, что при росте шаров, выточен^
ных из кристалла, появляются грани с минимальными скоростями
роста,.которые остаются гладкими и блестящими, тогда как при
растворении области с минимальными скоростями растворений
остаются матовыми.
Факторы, влияющие на растворение кристаллов
На растворение кристаллов и на возникающую форму
растворения их оказывают влияние такие факторы, как недосыщение
температура растворения, примеси, степень и
природа дефектности, положение и форма
растворяющегося кристалла. Роль перечисленных факторов в
растворении кристалла наиболее полно выступает при
рассмотрении механизма его растворения.
Молекулярно-кинетические представления о механизме
процесса растворения наиболее полное развитие получили в
теоретических работах Д. Хирса и Г. Паунда. Согласно теории,
подтвержденной экспериментом, выпуклые полиэдроиды образуются за
счет ступеней растворения от ребер кристалла. Наряду с ребрами,
источниками ступеней растворения должны быть дефекты
кристалла: винтовые и краевые дислокации, точечные дефекты. При
растворении на дефектах образуются ямки травления. Грубые
несовершенства поверхности кристалла (трещины и пр.) ведут себя
так же, как и края кристалла, т. е. служат источником ступеней.
Выпуклые полиэдры образуются тогда, когда ребра кристалла
являются более мощным источником ступеней растворения, чем
дефекты, и образующиеся вначале на грани ямки травления
исчезают по мере растворения кристалла и образования полиэдроида.
Немалая роль в процессах растворения отведена недосыще-
нию. Из теории Хирса и Паунда следует, что при малых недосы-
щениях наиболее мощным источником ступеней растворения
остаются ребра (кристалл приобретает форму округлого
полиэдроида). При больших недосыщениях значительную роль должны
играть дефекты в качестве источника слоев роста при условии,
что плотность дефектов достаточно велика. Кристалл в
последнем случае будет приобретать форму, целиком отвечающую
особенностям распределения дефектов в кристалле: их плотности'^
сравнительной мощности в качестве источников слоев
растворения и т. д. Скопление ямок травления над затравкой
свидетельствует об образовании большого количества дислокаций в период
регенерации затравки. Ямки травления имеют наибольшее
сгущение вблизи ребер, что может быть объяснено явлением гетеро-
метрии.
Итак, с увеличением недосыщения форма кристалла
изменяется от округлой через промежуточную форму, на которой сосед-
108
твуют плоские и округлые участки, до приблизительно плоской
и вогнутой, а далее — до грубо-ячеистой. Границы участков
зависят от дефектности исходного кристалла. Образование
вогнутых участков обязано, по-видимому, неравномерной плотности
фектов, их преимущественному расположению в центре грани.
Изучая алмазы, А. А. Кухаренко пришел к выводу, что
выпуклые октаэдроиды и додекаэдроиды получаются в условиях малых
недосыщений. При большом недосыщении возникают тригон-
тритетраэдроиды с искривленными и резко скульптурированными
гранями, т. е. формы, приближающиеся к плоскогранным формам
растворения.
На основании данных экспериментального исследования
кинетики растворения монокристаллов MgS04-7H20, E. Б. Трейвус
установил, что в диффузионно-контролируемых условиях кристалл
приобретает форму, отвечающую гидродинамическим
особенностям растворения. Грань кристалла, расположенная
перпендикулярно к движению кристалла в растворе, округляется больше,
чем грань, расположенная параллельно движению кристалла.
Автор делает предположение, что для граней, параллельных
движению кристалла, зависимость морфологических особенностей
растворения от недосыщения проявляется более четко, чем для
граней, перпендикулярных движению кристалла. При одном и том
же недосыщении формы растворения оказываются различными,
если кристаллы выращены в разное время или из различных
растворов.
Само собой разумеется, что при растворении кристалла
большую роль играют примеси. Скорость растворения грани зависит
от природы примесей и от характера их распределения в
кристалле. Особое внимание уделяется изучению влияния примесей при
растворении металлов. Различная способность металлов
(основного и примеси) растворяться в электролите приводит к
возникновению местных гальванических элементов, паразитных токов.
Для того чтобы сделать поверхность грани электропроводящего
кристалла однородной и уничтожить местные паразитные токи,
их покрывают другими веществами, например, цинк
амальгамируют ртутью и т. п. В свете этих дополнительных обстоятельств
результаты скоростей растворения граней кристаллов следует
рассматривать с известной осторожностью. Изучению скорости
растворения граней кристаллов в их маточном растворе посвящено
не большое число работ, дающих разноречивые результаты.
Наряду с обычным утверждением, что различные грани
кристаллов растворяются с различными скоростями, существует другое
(его защищает Г. В. Вульф), согласно которому скорость
растворения различных граней в маточном растворе одинакова.
Растворение кристаллов кварца в плавиковой кислоте
всесторонне изучал А. В. Шубников, исследовавший фигуры травления
нз различных гранях кристаллов кварца, в частности скорость
растворения этих граней. Опыты с травлением шлифованных пло-
1С9
скостей монокристального кварца крепкой плавиковой кислотой
при 20°С показали, что скорость растворения очень сильно
зависит от направления среза пластинки. Опыты ряда авторов
показали, что скорость растворения плоскости пинакоида (0001) квар-]
ца более чем в сто раз превышает скорость растворения грана
призм (1010). Таких сечений (рис. 68) в кристалле имеется три.
Все они .пересекаются в главной оси
кристалла и образуют между собой двугранные углы<
в 30°. •
Радиусы-векторы поверхности скорости,
растворения пропорциональны скоростям по
данным направлениям. Шубников растворял
в плавиковой кислоте шар диаметром около';
10 мм, приготовленный из кристалла кварца,
и для выявления фигур растворения его
поверхность затушевывалась карандашом,
который сильнее покрывал шероховатые участки.
Установлено, что шероховатые участки
поверхности по концам главной оси имеют
форму травильных треугольников, показывающих
существование оси симметрии третьего порядка. При растворении
полированного монокристального кварца диаметром около 25 мм
в неразбавленной плавиковой кислоте его форма становилась
близкой к форме эллипсоида.
Наблюдения многих авторов показали, что грань призмы из-^
весткового шпата в концентрированной азотной кислоте имеет
в семь раз большую скорость растворения, чем грань базиса. Шар,
выточенный из кристалла известкового шпата, под действием
кислоты превращается в гексагональную бипирамиду.
Рис. 68. Два сечения
поверхности
растворения кристаллов
кварца
(по А. В. Шубникову)
§ 6. СКУЛЬПТУРА ГРАНЕЙ КРИСТАЛЛОВ
Впервые проблему реального кристалла выдвинул русский
минералог М. В. Ерофеев еще в 1870 г., введя понятие о вициналях
роста, вициналях растворения и т. д. Грани реального кристалла
никогда не бывают идеальными плоскостями и носят на своей
поверхности ту или ,иную скульптуру: фигуры травления
(ямки травления), штриховку, вицинали, спирали
роста или спирали растворения. Скульптурованные грани
кристалла с давних пор интересовали минералогов с точки зрения
диагностики минералов. В настоящее время изучение
морфологических особенностей природных и искусственных кристаллов имеет
основной целью выяснение условий их образования, а также
степени и характера их дефектности.
Кристаллографически различные простые формы
характеризуются несхожими формами бугорков роста, ямок травления,
узоров штриховок.
110
Для изучения скульптуры граней используются новые тончаи-
методы исследования: интерферометрия, электронная микро-
Ш опия, специальные киносъемки и т. д.
Вицинали
Вицинальные образования весьма разнообразны. Часто они
выражены очень слабо и могут быть обнаружены только под мик-
лоскопом. В других случаях на гранях кристаллов неровности и
вицинали настолько велики, что видимы простым глазом. В
частности, грани турмалина иногда сплошь состоят из мелких вици-
налей, причем соседние вицинали #чень немного наклонены друг
к ДРУГУ» а в Целом грань турмалина представляет закругленную
поверхность. На гранях прекрасно образованных кристаллов
квасцов можно получить вицинали в несколько квадратных
сантиметров, если принять меры к тому, чтобы условия роста, а главным
образом степень пересыщения, оставались постоянными во все
время роста. Опыты А. В. Шубникова показали, что на
кристаллах квасцов вицинали образуются только на гранях октаэдра и
никогда не образуются на гранях куба. Из этих опытов следует,
что теоретическая (идеальная) грань октаэдра может возникнуть
на кристалле квасцов только при бесконечно малом пересыщении
раствора. Чем выше степень пересыщения, тем больше угол
между вициналями. Например, при пересыщении в 3% угол между
соседними вициналями октаэдрической грани квасцов достигает
30'.
Для объяснения сущности и происхождения вицинальных
граней до недавнего времени конкурировали две противоположные
группы теорий. В основном немецкие кристаллографы считали
вицинали закономерными плоскостями, выражающимися
определенными индексами, хотя и довольно сложными, причем относили все
простые и вицинальные грани к одной идеальной, нигде не
нарушенной пространственной решетке.
Иного мнения придерживалась большая группа русских и
советских ученых, к числу которых принадлежали Г. В. Вульф,
Е. С. Федоров, О. М. Аншелес и др. Они считали, что кристалл
есть реальное физическое тело, а не отвлеченный геометрический
многогранник. Кристалл никогда не бывает идеально однородным
или гомогенным. Можно предполагать, что во время роста
кристалла отдельные участки его граней не
располагаются в строго параллельном положении.
Поэтому и грани кристалла, имеющие простые индексы, не
занимают идеального теоретического положения, а образуют ви-
Цинали. Таким образом, вицинали не нужно считать
самостоятельными иррациональными гранями или гранями со сложными
индексами, а видеть в них истинные грани простых символов,
отклонившиеся целиком или участками от своего идеального
положения.
111
Самые разнообразные явления могут быть причинами
появления вициналей. Очень трудно, а порой и невозможно разграничить
влияние того или иного фактора на их возникновение. Правиль^
ность точки зрения советских ученых получила свое подтвержден
ние в опытах Г. Г. Леммлейна, одним из первых установившего
спиральное строение вициналей. Таким образом, говоря о причи-,
нах возникновения вициналей на гранях кристаллов, мы обязаны
иметь в виду и причины возникновения спирального роста, дислоЗ
каций в этих кристаллах.
А. В. Шубников полагает, что из множества причин,
вызывающих возникновения вициналей, следует выделить две главные:<
Рис. 69. Расщепление
кристалла
Рис. 70. Образование
канала в кристалле
а) расщепление кристалла во время роста и б) сращивание двух
кристаллов.
Механические примеси могут быть захвачены в кристалл при
его росте. Если какая-либо крупинка, включенная в кристалл,
находится недалеко от его поверхности, то при понижении
температуры эта крупинка действует как клин, расщепляющий кристалл.
Возникающая трещина может или зарасти, или остаться
свободной. В обоих случаях участки грани по разные стороны от
трещины остаются под некоторым углом друг к другу (рис. 69). К
каким результатам может привести такое многократно
повторяющееся расщепление, видно на рис. 66. Если инородная твердая
крупинка не захватывается, а оттесняется, то она оставляет на
своем пути включения маточного раствора в виде канала (рис.70).
Эти каналы как слабые места тоже могут являться источниками
трещин. Шубников подчеркивает, что расщеплению подвергаются
в известных условиях почти все кристаллы.
Вторая причина образования вицинальных граней состоит в
сращивании кристаллов. Идеальный рост кристалла предполагает,
что на его гранях отлагаются ионы, атомы и молекулы в строго
определенном порядке. При росте реального кристалла могут быть
различные нарушения такого порядка. Степень совершенства
кристалла определяется величиной тех агрегатов молекул, из которых
строится реальный кристалл. Пусть идеальная грань АВ (рис.71)
кристалла растет путем прилипания к ней молекулярных
агрегатов и рост ее происходит слоями. Так как эти агрегаты могут хотя
бы незначительно отличаться друг от друга по своим размерам,
то как бы плотно они не стремились расположиться на грани Ad,
112
„s
V
^-3
Рис. 71. Схема роста
кристалла из лабильного
раствора путем отложения
молекулярных агрегатов
сохраняя 'параллельность друг другу, все же без промежутков им
не удается покрыть плоскость АВ даже в первом слое. В
следующих слоях по той же причине кроме пустот будет наблюдаться и
непараллельность расположения агрегатов. С уменьшением
размеров агрегатов строение кристалла
должно приближаться к идеальному.
Нарисованная картина роста
кристаллов становится правдоподобной, если
принять во внимание, что в некоторых
случаях кристаллы растут почти
исключительно за счет прилипания к
ним самопроизвольно возникающих
зародышей.
Г. Г. Леммлейн изучал вицинали
на аметисте. Оказалось, что угол вици-
налей с основной гранью ромбоэдра
аметиста достигает 6—20°. На грани
октаэдра кристалла квасцов он
-проводил едва заметную царапину и
опускал кристалл в пересыщенный
раствор на несколько секунд. Около
царапины сначала вырастало
множество мелких вициналей, а затем число
уменьшалось и через 2—3 минуты
оставалось несколько крупных вици-
налей, покрывающих всю грань
октаэдра (рис. 72).
Итак, до сих пор нет ясного
представления о причинах образования вициналей. Вероятно, эти
причины различны в разных случаях и образованию вициналей нельзя
дать единое объяснение.
Рис
на
72. Шрамовые
грани октаэдра
вицинали
квасцов
Комбинационная штриховка
Комбинационную штриховку можно рассматривать как
штриховку роста, связанную с определенным механизмом роста граней.
Параллельная кристаллографическим ребрам, действительным или
возможным, комбинационная штриховка представляет
собой совокупность ребер, выводящихся друг из друга с помощью
элементов симметрии. По Шафрановскому в штриховке
сочетаются положительные и отрицательные реберные формы, к первым
относятся выпуклые валики, ко вторым — углубленные бороздки
(рис. 73). Комбинационная штриховка граней относится к числу
широко распространенных морфологических особенностей
природных и искусственных кристаллов. В. И. Вернадский считал, что
комбинационная штриховка на гранях кристаллов может
представлять интерес как в диагностическом, так и в генетическом
отношении. Однако в минералогической практике штриховка до сих
113
пор используется почти исключительно с диагностической целью
поскольку причины ее образования до сих пор трактуются
разными авторами по-разному. О. М. Аншелесу механизм образования
штриховки представлялся зависимым от послойного нарастания
граней. Возможность образования штриховки за счет
полицентрического разрастания слоев от многих точек продемонстрирована
Г. Г. Леммлейном на кристаллах кварца. С. А. Строителев,
развивая идею В. И. Вернадского, сопоставляет комбинационную
Рис. 73. Характерные штриховки на гранях кристаллов различных
минералов: а — кварца; б—алмаза; в — корунда; г — пирита; д и е —
халькопирита; ж — арсенопирита
штриховку с теми трансформациями облика кристалла, которые
он испытывает по ходу изменения условий кристаллизации.
Взаимоотношение между изменениями формы кристаллов и
образованием штриховки показано на рис. 74. Этот случай легко
воспроизвести экспериментально, если кубический кристалл квасцов,
выращенный в присутствии примеси буры, поместить в чистый
пересыщенный раствор. При дальнейшем росте кристалл приобретет
октаэдрическую форму, соответствующую условиям
кристаллизации квасцов из чистого раствора. Геометрически этот переход
совершается образованием комбинационной штриховки. На рис. 75
виден появившийся рельеф поверхности грани куба, выполненный
плоскими элементами простых форм куба, октаэдра и
ромбододекаэдра. Продолжая выращивание кристалла при высоком
пересыщении, можно получить его в октаэдрической форме. Подобное
явление наблюдается и в том случае, когда на обломках или при
шлифованных поверхностях кристаллов, помещенных в
пересыщенный раствор, происходит регенерация кристаллической формы.
114
«
Таким образом, хорошо известная штриховка кубических кри-
ллов пирита расшифровывается как усложненная их органка
стаполНенная элементами граней пентагондодекаэдр а (рис. 76).
Рис. 74. Схема образования ком
бинационной штриховки на
гранях куба при его ступенчатом
перерастании в октаэдр (по
А. С. Строителеву)
Рис. 75. Скульптура поверхности
грани куба в процессе заращивания
кристаллов квасцов в чистом
растворе
Рис. 76. Штриховка на гранях
пирита
Рис. 77. Штриховка на
призматических гранях кристаллов кварца
Поверхность ромбододекаэдрического облика кристалла
граната оформлена семейством граней тетрагонтриоктаэдров {211}.
Поверхности глубоких борозд на гранях призмы кварца, как вид-
115
но из рис. 77, отражают свет так же, как и грани ромбоэдра го
ловки кристалла. По существу поверхность призмы состоит из
плоских элементов, соответствующих ромбоэдрам. Опыты и
наблюдения показывают, что отчетливо выраженная комбинационная
штриховка характерна для кристаллов, претерпевших быструю
смену условий кристаллизации. При постепенном изменении внешних
условий уже невозможна быстрая смена форм роста кристаллов.
Возможно именно поэтому пириты, встречающиеся в осадочных
и метаморфических породах, не имеют штриховки, а пириты,
образованные в гидротермальных жилах и контактово-метасомати-
ческим путем, где условия кристаллизации меняются более резко
и быстро, всегда бывают резко исштрихованы.
Весьма часто приходится иметь дело с кристаллами,
образовавшимися в разных условиях и прекратившими свой рост на
различных стадиях. Поэтому отчетливость проявления и
морфологический характер комбинационной штриховки у одного и того же
минерала могут быть различны. Из приведенных рисунков следует,
что начальной стадии кристаллизации соответствовал куб пирита
и призматическая форма кристаллов кварца. В конечной стадии
кристаллизации формами роста оказались пентагондодекаэдр
пирита и ромбоэдра кварца, не получившие большого развития.
Фигуры травления
Фигуры травления на гранях кристаллов можно получить
путем подбора соответственного растворителя (травителя) и режима
травления. Так, при опускании кристалла хлористого натрия в
раствор метилового спирта на гранях куба появляются
углубления в виде квадратных пирамидок (рис. 78).
UOD)
Рис. 78. Фигуры травления на гранях {100}, {ПО}, {111}
кристаллов NaCl
Фигуры травления большей частью представляют
«отрицательные кристаллы», ограненные плоскостями, параллельными
действительным или возможным граням кристалла.
На рисунке 79 показаны фигуры травления на гранях (110),
(120) и (001) топаза, относящегося к ромбо-бипирамидальному
виду симметрии. Ромбоэдр исландского шпата, погруженный на
несколько секунд в разбавленную соляную кислоту и обтертый
116
Фильтровальной бумагой, покроется многочисленными
углублениями, имеющими плоскость симметрии. На основании этого
кальцит причисляется к голоэдрическому дитригонально-скаленоэдри-
ческому виду симметрии Ът (рис. 80, а). Для ромбоэдра
доломита получаются фигуры травления без плоскости симметрии (рис.
30 б) и следовательно, кристалл доломита принадлежит к геми-
рПческ0му ромбоэдрическому виду симметрии 3. По форме
фигур травления и их ориентации кристаллографы судят о при-
OcbZ
Ось 2
Рис. 79. Фигуры травления на гранях {ПО}, {120}, {001}
топаза
сутствии тех или иных элементов симметрии и о том,
представляет ли данное тело монокристалл, поликристалл или двойник.
Фигуры травления оказывают большую помощь, например, в
распознавании двойников кварца. >
Иногда фигуры травления настолько малы, что даже под
микроскопом трудно изучимы. В таких случаях о симметрии фигур
травления судят по световым ф'игурам, которые проектируются
на экран при отражении света от грани или при прохождении
света от точечного источника через пластинку, вырезанную
параллельно грани. А. В. Шубников получал фигуры астеризма в
пластинках кварца, травленных плавиковой кислотой с одной стороны
(рис.81).
Изучение световых фигур основано на принципе
максимального блеска. Соответствующий метод состоит во вращении под
микроскопом протравленного шлифа, освещенного косым
падающим светом и в определении угла между двумя максимальными
блеснами отдельных кристаллов. Максимальные вспышки
происходят в те моменты, когда свет будет отражаться от соответствую-
117
щей грани фигуры травления. По числу вспышек можно
определить ориентацию кристалла.
С 1953 г. изучение фигур травления стало также методом для
обнаружения дефектов строения кристаллов: краевых и винтовых
дислокаций, точечных дефектов, границы зерен и субзерен в моно-
и поликристаллах. В основе метода лежит предположение о
существовании связи между ямками, образующимися при травлении
на поверхности кристалла, с выходами на эту поверхность дефек-
г
Рис. 81. Астеризм в пластинах
кварца, травленных плавиковой
кислотой: а — правый кварц; б — дофи-
нейский двойник правого кварца;
в — бразильский двойник кварца
Рис. 80. Фигуры травления на
гранях ромбоэдра: с —-кальцита; б —
доломита
тов. Растворение и испарение
кристалла начинается прежде
всего с дефектных мест
структуры, так как здесь ионы,
атомы и молекулы обладают
повышенной химической
активностью. Фигуры травления,
возникающие на разных
дефектах, характеризуются
различными формами и
расположением. Фигуры, возникшие на точечных дефектах, имеют форму
плоскодонных ямок, располагаются на гранях хаотически и
существуют кратковременно. Фигуры, возникшие на дислокациях,
имеют форму пирамидальных ямок и для них, как правило,
характерно секториальное распределение. При травлении многих
кристаллов разных веществ обнаружено, что спирали роста быстро
стравливаются и остаются ямки. Расширяясь и углубляясь, они
принимают определенные формы и в конечном счете образуют
даже сквозные дырки. Ямки меньших размеров образуются также
на границах двойников, ступеньках и краях фронта роста
кристаллов.
Форма фигур травления зависит от примесей и от их
распределения в кристалле. Скопление примесей вблизи дислокаций в
одних случаях усиливает эффект преимущественного
растравливания кристалла в местах выхода дислокаций на поверхность, но
в других случаях наблюдается обратное явление.
Сейчас техника травления для выявления дислокаций хорошо
разработана. Для большого числа разнообразных кристаллов по-
118
побраны травители, изучено действие травителеи на различные
кристаллические плоскости.
Следует отметить, что основные данные об условиях
образования ямок травления на дислокациях получены пока
экспериментально, а не теоретическим путем.
И. Гилман, В. Джонстон и Г. Сире впервые сделали попытку
объяснить химическую сторону процесса избирательного
травления. Травитель должен удовлетворять определенным требованиям.
Его основа — вещество, слабо растворяющее кристалл (0,07—
0 02 г на 100 cmz). Например, в случае LiF основой травителя
служит вода, а в случае NaCl — ледяная уксусная кислота. К
растворителю необходимо добавлять нужное количество хорошо
растворяющегося в нем активатора. При этом катион добавки должен
образовывать с анионами кристалла либо устойчивые комплексы,
либо труднорастворимые соли. Радиус катиона добавки к травите-
лю должен быть близким к радиусу катиона кристалла. Для NaCl
допускается расхождение в радиусах до 15%. Степень
устойчивости комплекса или соли определяет качество травителя. Эти
соединения оседают на ступеньках растворения, экранируя их, и тем
самым замедляют дальнейшее продвижение ступеньки вдоль
поверхности.
Подбирая оптимальную концентрацию активатора, можио
обеспечить определенное соотношение нормальной vn и танген-
V,
циальной t's скорости растворения кристалла. При —— ^0,1
«Ъ
образуются наиболее четкие ямки травления на дислокациях. Так,
для NaCl оптимальная концентрация активной примеси CdCb
составляет 2-Ю-4 молярных частей. Дальнейшее повышение
концентрации ухудшает картину травления за счет выпадения осадка
на травимой поверхности.
Влияние других факторов на эффект травления можно
продемонстрировать на примере тех же кристаллов NaCl (по Н. Ф.
Костину и др.). При малом времени травления — 1—1,5 мин без
помешивания и до 0,5 мин при помешивании растворов,
содержащих оптимальные количества разных солей Cd, одинаково
образуются ямки, составленные гранями тетрагонтриоктаэдра. При
увеличении времени травления образуются еще и грани
пирамидального куба. Очень сильное перемешивание приводит к
образованию ямок конической формы. Скорость vn при спокойном
травлении уменьшается со временем, тогда как пр.и травлении с
перемешиванием она остается постоянной.
Наблюдение показывает, что грани различных простых форм
травятся по-разному. Небольшие отклонения в составе травителя
и режима травления приводят иногда к существенному изменению
результатов травления. Один состав травителя позволяет
различать «старые» и «новые» дислокации, поскольку старые
дислокации обычно оказываются окутанными облаком примесей, другой
состав травителя такой способности не проявляет.
119
Фигуры травления могут быть получены при «воздействии дру.
гих агентов: воздуха или инертных газов при повышенной
температуре, электротравления, ионной бомбардировки, осаждения
посторонних веществ или выделения примесей, имеющихся в
кристалле. Среди них метод травления остается самым
плодотворным, он более избирателен по отношению к разного рода
нарушениям.
Для доказательства однозначной связи ямок травления с
выходами дислокаций используются совместно метод травления и
метод декорирования линий дислокаций. Так, используя метод
диффузии металлического Na в кристалле NaCl, можно получить
окрашенные линии, пронизывающие весь кристалл, и показать,
что эти линии соответствуют дислокационным.
Метод травления позволяет увидеть движение дислокаций.
Благодаря этому было обнаружено происхождение дислокаций, в
частности, источник Франка—Рида, рождающий кольца
дислокаций за счет работы внешних сил.
§ 7. ТЕОРИИ ВНЕШНЕЙ ФОРМЫ КРИСТАЛЛОВ
Известно, что в отношении различных физических свойств один,
и тот же кристалл характеризуется разной симметрией. Наиболее
полное представление о симметрии какого-либо физического
явления составляют путем построения поверхности свойств. Для этого
из одной точки по различным направлениям откладывают
отрезки, пропорциональные измеренным значениям данной величины.
Так, для скорости света в кристаллах каменной соли поверхность
имеет форму шара, ибо скорость света во всех направлениях в
данном случае является постоянной величиной. Сама форма
кристаллов есть поверхность скоростей роста
кристалла в данных конкретных условиях.
Все виды симметрии разнообразных физических свойств
одного и того же кристалла могут быть расположены в ряд-таким
образом, что каждый предыдущий вид будет подчинен
последующему (все элементы симметрии младшего члена содержатся в
старшем).
Принцип Неймана утверждает, что самая низкая симметрия
(младший член ряда) выражается в явлении роста кристаллов.
Эта симметрия наиболее характерна для кристалла: обычно ее
имеют в виду, когда говорят, что кристалл принадлежит к
такому-то виду симметрии. Максимальная симметрия кристалла
выражается в оптических явлениях, в частности в скоростях
распространения света.
Все же принцип Неймана нельзя понимать в том смысле, что
при росте всегда проявляется самая низкая симметрия. На вненг-
нюю форму кристалла влияет симметрия кристаллизационной
среды. Этот факт находит свое выражение в универсальном
принципе П. Кюри: «Когда определенные причины порождают из-
120
вестные следствия, элементы симметрии причин должны
содержаться в порожденных -следствиях».
Принцип Кюри получил развитие в работах А. В. Шубникова,
й и. И. Шафрановского, указавших на необходимость учета
различной симметрии кристаллизационной среды и ее взаимодействия
с собственной симметрией кристалла.
Рассматривать симметрию многогранника вне влияния среды
можно только в том случае, если среда в идеале имеет в каждой
своей точке -симметрию шара. Реальные среды (раствор, расплав
и т. п.) обладают различной симметрией, отличающейся от
шаровой. Раствор, находящийся в поле земного тяготения, в том
случае, если можно констатировать влияние этого поля на изучаемое
явление, имеет в каждой своей точке симметрию конуса. Раствор,
помещенный в магнитное поле, имеет уже другую симметрию,
симметрию вращающегося около своей оси цилиндра. В каждом
случае реальный, выросший кристалл приобретает
соответствующую «наведенную» симметрию.
Примеры наведенной симметрии многочисленны. Кристалл,
растущий из перегретого расплава путем многостороннего отвода
тепла, как известно, приобретает форму, отвечающую симметрии
поля температурного градиента. Возможность получения
нитевидных кристаллов кубической сингонии нужно считать особо ярким
примером влияния симметрии среды на форму роста.
Правило взаимодействия собственной симметрии растущего
кристалла и кристаллизационной среды сводится к тому, что во
внешней форме кристалла сохраняются только элементы
симметрии, общие для среды и для идеального кристаллического
многогранника. То обстоятельство, что кристаллы по внешней форме
бывают обычно асимметричны, только подтверждает это правило
и указывает на отсутствие каких-либо элементов симметрии
раствора во время роста кристалла (беспорядочные
концентрационные потоки).
Более интересные случаи взаимодействия симметрии
кристалла и раствора дают нам фигуры травления. На фигуре травления
выступают только те элементы симметрии, которые являются
общими для кристаллических тел и -среды. В случае среды,
вращающей плоскость поляризации, на фигурах травления видны только
оси, но не плоскости симметрии.
Симметрия кристаллизационной -среды вызывает
возникновение ложных простых форм, которые в отличие от идеальных,
представляют собой часть истинной простой формы.
Тот факт, что мелкие кристаллы имеют более высокую
симметрию по сравнению с крупными, говорит о том, что последние
в большей мере подчинились симметрии внешней среды.
Глава V
ДЕФЕКТЫ В КРИСТАЛЛАХ
§ 1. КЛАССИФИКАЦИЯ ДЕФЕКТОВ
Начиная с тридцатых годов XX в. стал быстро возрастать
интерес к природе и свойствам дефектов в кристаллах. Интерес этот
определяется, с одной стороны, возрастающими требованиями к
чистоте и совершенству кристаллов, используемых в науке и
технике. Чтобы предупредить !возможность возникновения дефектов
в кристалле в процессе его выращивания и последующей
обработки, необходимо изучить эти дефекты. С другой стороны, давно
стало очевидным, что теория совершенных кристаллов не в
состоянии дать удовлетворительное объяснение так называемым
структурно чувствительным свойствам кристаллов. К таким свой-;
ствам относятся, например, поведение кристаллических веществ
(в особенности металлов) под нагрузкой, особенности роста
кристаллов и рекристаллизации, диэлектрические свойства,
фотопроводимость, люминесценция и многие другие механические,
оптические и электрические свойства. Структурная чувствительность
определяется несовершенствами (дефектами) структуры кристалла
или кристаллической решетки. Очень часто дефекты, связанные
с несовершенствами такого рода, бывают чрезвычайно сложны и
многообразны.
По Ван-Бюрену возможные дефекты классифицируются
следующим образом: 1) нуль-мерные, или точечные, дефекты: вакансии,
межузельные атомы, сочетания этих дефектов, центры окраски
и т. п.; 2) одномерные, или линейные, дефекты: дислокации;
3) двумерные, или поверхностные, дефекты: границы зерен и
двойников, межфазные границы, сама поверхность кристалла;
4) трехмерные, или объемные дефекты: лакуны (пустоты),
включения второй фазы и т. д.
Точечные дефекты, находящиеся в тепловом равновесии со
структурой, рассматриваются как равновесные.
122
К неравновесным дефектам с более крупными областями
нерегулярности относятся дислокации, границы тонкой
структуры, межзеренные и двойниковые границы, поверхность кристалла.
Эти области нерегулярности характеризуются высокой энергией
образования, так, например, энергия образования дислокаций
составляет величину от 10 до 100 эв. Такие дефекты уже не могут
находиться в равновесии со структурой. Но они способны к
взаимодействию с равновесными дефектами. Дислокации, например,
поглощают вакансии и вновь их создают. Кроме того, они могут
служить ловушками межузельных атомов. Сейчас существует
тенденция объяснять все возможные типы неравновесных дефектов
дислокациями.
§ 2. ТОЧЕЧНЫЕ, ИЛИ «РАВНОВЕСНЫЕ» ДЕФЕКТЫ
Наиболее распространенным типом дефектов в кристалле
является вакансия. Так называется узел решетки, в котором
отсутствует атом или ион. В чисто ионных кристаллах условие
нейтральности кристалла, если отсутствуют дефекты других типов,
требует равного количества анионных и катионных вакансий. Пара
вакансий разных знаков получила название дефекта Шоттки.
Часто равенство разноименных зарядов обеспечивается в
значительной мере присутствием дефектов других типов, например,
двухвалентных примесных ионов в кристалле, содержащем
нормально одновалентные ионы.
Нередко встречается в кристаллах межузельный атом
(внедренный атом). Такой дефект возникает при смещении атома
или иона в положение, которое не будет узлом решетки.
Нейтральность решетки и здесь обеспечивается добавочным электроном,
вакансией на месте иона того же знака или примесным ионом.
Если вакансии могут встречаться в любых структурах, то
межузельные атомы возникают легче в кристаллах, содержащих
большие межатомные промежутки. Межузельные положения чаще
занимают такие «мелкие» атомы, как бор, углерод и азот.
Точечные дефекты в кристалле возникают в процессе его
роста, остывания, при пластической деформации и при облучении
кристалла быстрыми частицами. Сочетание вакансии и межузельт
ного атома называется дефектом Френкеля.
В процессе роста кристалла на границе раздела, например,
твердая фаза — расплав, равновесная концентрация вакансий
составляет около 0,1 ат.%. При остывании твердого тела
концентрация вакансий становится выше равновесной. Если вакансии
обладают достаточной подвижностью, то они перемещаются к
положениям с минимальной энергией, где они могут либо рекомбини-
ровать с межузельными атомами, либо диффундировать к
имеющимся дислокациям или к поверхности кристалла. Вакансии
способны диффундировать и к границе раздела и там участвовать в
равновесной концентрации; некоторые из них объединяясь, обра-
123
зуют «полудиски». Если размеры последних превышают критиче-
скую величину, то они разрушаются, образуя пару дислокаций на ^Ш
границе. Образование дислокаций при слиянии вакансий делает
концентрацию вакансий «иже равновесной, вследствие чего в
кристалле образуются новые вакансии. Это положение способствует
непрерывному образованию дислокаций в растущем кристалле.
Оптимальные условия образования кристалла,
обеспечивающего минимальное содержание вакансий, сводятся к низкой
температуре и медленной равномерной скорости роста, а также к
созданию плоской поверхности раздела.
Концентрация вакансий зависит от температуры образования
кристалла экспоненциально. Для борьбы с этим кристалл вблизи
границы раздела следует поддерживать при температуре,
обеспечивающей перемещение вакансий к этой границе или свободной
поверхности. Аналогичные рассуждения распространяются и на
случай межузельных атомов. Малая скорость роста обеспечивает
низкую концентрацию вакансий и облегчает движение их к
свободной поверхности кристалла или к границе раздела.
Кристалл с плоской поверхностью раздела (изотермой
кристаллизации) меньше захватывает вакансий, которые либо
оттесняются в расплав, либо диффундируют через кристалл с более
низкой температурой и выходят на его поверхность. При 'наличии
плоской изотермы сокращается площадь поверхности раздела,
т. е. вблизи температуры плавления объем твердого тела имеет
минимальную величину.
На образование неравновесных концентраций точечных
дефектов влияют примеси. Так, даже наиболее тщательно
приготовленные кристаллы NaCl обычно содержат от 0,01 до 0,1%
ионов Са, которые легко соединяются с вакансиями
положительных ионов.
Дефекты, обусловленные электронами, обладающими способ- I
ностью переходить из зоны проводимости и обратно, получили
название тонких дефектов. Согласно квантовой механике,
локализованные положения отдельных электронов могут возникать
только вследствие нарушения периодичности кристалла. Такие
положения электронов называются ^-центрами. Например, в
щелочных галогенидах ^-центром называют электрон, заместивший 1
ион галогена в узле решетки. При появлении /^-центров возникает J
окраска кристалла и новая полоса поглощения. Исследуя
поляризованную люминесценцию, обнаруженную при изучении окрашен- 1
ных кристаллов искусственного флюорита, П. П. Феофилов I
отождествил центры видимой окраски с /^-центрами, т. е. парами 1
электронов, локализовавшихся в соседних вакантных анионных
узлах. В случае CaF2 имеются три взаимно перпендикулярных
направления, в которых могут ориентироваться /^-центры. Эти на- |
правления у CaF2 совпадают с осями симметрии четвертого порядка j
(рис. 82). Коротковолновая полоса поглощения (в ультрафиолете- \
вой части спектра) приписывается обычным ^-центрам.
Существование дефектных структур с F-, /^-центрами в
кристаллах синтезированного флюорита объясняется возникновением
их в условиях высоких температур (1350°С) и больших скоростей
роста кристаллов из расплава (8 мм/час). Более того, если
бесцветный и фотохимически нечувствительный природный кристалл
флюорита нагреть до температуры выше 600°С, он становится
после этого фотохимически чувствительным, т. е. окрашивается при
жестком облучении (^-облучении). П. П. Феофиловым найдена
возможность отвода электронов из вакантных узлов с помощью
так называемых акцепторов, роль которых могут выполнять гете-
ровалентные элементы. Такими
элементами для структуры
CaF2 являются
редкоземельные: Sm, Eu, Gd, Tb и т. д.
Некоторые трехвалентные ионы
редкоземельных элементов,
изоморфно" замещающие ион
кальция в структуре флюорита,
захватывают электроны и
переходят в двухвалентное
состояние. Свои
электронно-акцепторные свойства ионы редких
земель могут проявлять только
в сильно восстановительной
среде, препятствующей
изоморфному замещению фтора
кислородом.
Таким образом,
трехвалентные редкоземельные элементы создают «потенциальные ямы»,
куда устремляются лишние электроны в кристалле CaF2, их места
занимают ионы фтора, благодаря чему кристаллы растут
неокрашенными и фотохимически нечувствительными.
Способность некоторых кристаллов люминесцировать под
влиянием разного рода энергетических воздействий (трение,
нагревание, удар, радиоактивное излучение, ультрафиолетовые,
катодные и т. п. лучи) приписываются веществам с нарушенной
периодичностью структуры. Правда, в ряде случаев, когда сами
атомы или комплексные ионы, входящие в структуру, являются
фосфогенами (например, редкоземельные), такие структуры
также приобретают люминесцентные свойства.
Поглощение, например, ультрафиолетовых лучей при
возбуждении фотолюминесценции происходит по всей кристаллической
системе. Эта энергия передается по энергетическим уровням через
всю решетку, но излучение происходит только в местах, где
атомы или группы нарушают правильность и кристаллическую
непрерывность структуры. Отсюда следует, что спектральный состав
люминесценции одной и той же структуры может быть различным,
если качественно различны атомы, вызывающие нарушение.
oF
• Ctt
® Вакантный
анионный узел
•Рис. 82. Дефектная структура CaF2
125
Нарушение периодичности структуры обычно вызывается внед.
рением в структуру определенных посторонних атомов (или ионов,
обычно катионов). Характер этого внедрения избыточных атомов
или ионов может быть различным: 1) избыточной -компонентой
может быть атом, строящий структуру основного вещества
(например, Zn в ZnS, Na в NaCl), но занимающий в структуре
межузловую позицию; 2) избыточной компонентой является атом-при-:
месь (например, Си, Ag в ZnS, TR в шеелите, флюорите и т. д.).
Атом-примесь в структуре основного вещества может занимать"
либо межузельное положение, либо изоморфно замещать' его
атом.
Возможность первого рода нарушения (изоморфизма внедре-;
ния) наиболее вероятна в кристаллах с малой плотностью струк-~
туры. К таким относятся структуры каркасного, кольцевого типа
и т. п.
Второй случай нарушения кристаллической непрерывности,
структуры (изоморфизм замещения) более распространен, чем
первый.
Интересно отметить, что в случае изоморфизма внедрения у^
ряда соединений (например, А120з, активированной Pt и Мп)
возникает фосфоресценция (долгосвечение), в то время как
активация изоморфными примесями (А120з — хромом, ванадием) вызы-*
вает флюоресценцию.
По Н. В. Белову, существует еще изоморфизм доменного про-'
исхождения, когда имеет место вхождение неосновных элементов '
в отдельные области (домены) структуры основного элемента.
Примером доменного изоморфизма служит вхождение
трехвалентного железа в рутил ТЮг, с чем связано образование коленчатых
двойников рутила.
§ 3. «НЕРАВНОВЕСНЫЕ» ДЕФЕКТЫ (ДИСЛОКАЦИИ И ПОВЕРХНОСТИ).
ДИСЛОКАЦИИ, УСЛОВИЯ ИХ ОБРАЗОВАНИЯ
Дислокации играют существенную роль в процессах
кристаллизации и существенно влияют на физические свойства
кристаллов, электрические свойства полупроводников. С увеличением
плотности дислокаций, редко составляющей менее 104 на см2,
время жизни носителей тока уменьшается. Дислокации снижают
прочность металлов и увеличивают скорость диффузии атомов в
кристаллах в некоторых случаях в 106 раз.
Несовершенство строения кристаллов было впервые открыто^
с помощью рентгеновских лучей. Если бы кристалл был идеаль-
!ным, то его грань отражала бы монохроматический рентгеновский
луч по определенному закону под строго определенным углом.
Однако в реальных кристаллах часто такое отражение происхо- я
дит в некотором определенном интервале углов, который
изменяется от долей минуты до нескольких минут (рис. 83). При-этом
интенсивность отраженного рентгеновского луча оказывается на-
126
го повышенной по сравнению с вычисленной для идеального
писталла Эта особенность реального кристалла была объяснена
мозаичностью. Реальный кристалл состоит из отдельных блоков
(мозаик), меньших 0,5 мк и несколько дезориентированных
относительно друг друга.
Позднее, когда было введено понятие о дислокациях (краевых
винтовых) и доказана способность цепочки дислокаций
образовывать границу тонкой структуры в кристаллах, мозаичная струк-
Рис. 84. Граница зерен с
малой (утрированной)
угловой разориентацией
Рис. 83. Непараллельное
отражение (рентгеновских лу
чей от несовершенного
кристалла
тура стала сводиться к карте
распределений дислокаций. На
рис. 84 показана граница зерен с
малой угловой разориентацией,
состоящая вся из
последовательных краевых дислокаций.
Существует множество других границ
более сложного вида.
Нередко беспорядочно расположенные дислокации
перегруппировываются в правильные шеренги (ряды или стенки).
Перемещение дислокаций с образованием полосчатой тонкой
структуры, снижающей качество кристалла, называются полигониза-
ци'ей. Чтобы получить кристалл без границ тонкой структуры,
необходимо предотвратить в нем возникновение дислокаций.
Условия образования дислокаций разнообразны. По мнению
В. И. Архарова, дислокации возникают путем накопления
дислоцированных межузельных атомов и вакансий. При этом атомы
дают дислокации одного знака, а вакансии — противоположного.
Дислокации могут быть вызваны неравномерным ростом на
поверхности в условиях быстрого (даже дендрадного) роста.
Поэтому при выращивании монокристаллов местные переохлаждения
должны быть по возможности исключены, т. е. необходимо
избегать колебаний температуры, неравномерности движения тигля и
нагревателя, и вся аппаратура должна иметь максимальную
тепловую и механическую устойчивость. Объем, необходимый для
зарождения некоторого ЧЦ в переохлажденном расплаве, должен
быть минимальным.
127
Дислокации возникают также и в результате присоединения к
поверхности кристалла целых комплексов с некоторым
несовпадением. Наиболее часто дислокации образуются за счет
механических напряжений, которые могут возникать либо от случайных
вибраций, либо в результате теплового расширения или сжатия
кристаллической решетки.
Механизм образования дислокаций при пластической
деформации кристалла предложен Ф. Франком и Дж. Ридом.
Предполагается, что дислокации возникают при разрастании
располагающейся между двумя точками особой дислокации. Под действием
приложенного напряжения эта дислокация растягивается, в
результате чего образуется непрерывная дислокация с сохранением
действующего источника (рис. 85).
Рис. 85. Источник дислокации Франка—Рида
Дислокации в выращиваемом кристалле могут возникнуть за
счет термического напряжения, связанного с неодинаковостью
теплового расширения кристалла и тигля. Это особенно
существенно, когда материал смачивает стенки тигля и прилипает к ним
и поэтому желательны тигли с гладкими стенками. Смачивание
ослабляют и устраняют тщательным удалением из системы всех
следов кислорода и окислов (смачивание обычно происходит в
результате частичного химического взаимодействия с
поверхностью тигля), весьма часто тигли защищают прочным графитовым
покрытием. Термические напряжения могут быть следствием и
неплоской формы поверхности раздела кристалл—расплав,
обусловливающей различную степень сжатия по сечению кристалла.
Высокая плотность дислокаций возникает у боковой поверхности
кристалла, имеющей кривую форму. К термическим и
механическим напряжениям особенно чувствительны кристаллические
зародыши. Франк предположил, что уже одно тепловое движение
способно деформировать зародыш, благодаря чему возникает
дислокация. Отсюда следует необходимость в использовании
затравки в 'начальной стадии роста, причем особое взимание
должно быть уделено качеству затравок, так как дислокации затравок
■переходят в растущий кристалл.
Плотность дислокаций существенно уменьшается, если свести
к минимуму флуктуации условий роста. Лучшие условия в этом
отношении мы имеем при выращивании кристалла из пара, когда
колебания температуры достаточно малы (до 0,1%) и не нужно
механическое движение аппаратуры.
128
Плотность дислокаций в выращиваемом кристалле сильно
зависит от наличия примесей. Дислокации могут быть, например,
следствием обрастания структурой примесного включения.
Поэтому очевидна необходимость использования для выращивания
совершенных кристаллов чистых веществ.
Таким образом, можно еще раз подчеркнуть, что условия для
получения совершенных кристаллов сводятся в первую очередь к
медленной равномерной скорости выращивания и максимальной
чистоте исходного материала.
Двойниковые границы
Двойник — это кристаллический комплекс, две части которого
соединяются либо двойниковой плоскостью, либо двойниковой
осью. Иногда одна часть из другой получается путем и
отражения и поворота. Граница, разделяющая две симметричные части,
называется двойниковой границей. Двойниковая граница
регулярна, т. е. образована в кристаллах одинаковыми сетками
одной и той же простой формы, если совпадает, например, с
плоскостью зеркального отражения и т. п. Если граница отклоняется
от кристаллографической плоскости двойникования, она является
нерегулярной и содержит в себе двойникующие дислокации.
Двойникование кристаллов представляет очень
распространенное явление и часто вызывается теми же причинами, что и
образование дислокаций. Более того, в ряде случаев к двойникованию
может привести именно скопление дислокаций в кристалле.
Образование двойников могут вызвать термические
напряжения, примеси. Коленчатые двойники рутила Ti02 обязаны своим
происхождением (по Н. В. Белову) примесям трехвалентного
железа.
В процессе кристаллизации из расплава двойникование
кристалла может произойти, если направление его роста окажется
близким, но не совпадающим с направлением главного
температурного градиента.
Возникновению двойников способствует резкое изменение
условий роста, вызывающее переход одной кристаллической
модификации в другую. Примером могут служить двойники кварца. При
температуре выше 573±2°С образуется гексагональный кварц. При
падении температуры ниже 573±2°С этот кварц переходит в триго-
нальные кристаллы. Переход осуществляется путем распадения
гексагональной структуры на множество тригональных участков,
обычно сдвойникованных между собой. Наиболее распространены
Дофинейские двойники кварца — сростки двух правых или двух
левых кристаллов, где двойниковой осью служит их тройная ось
симметрии. На рис. 86 представлен разрез дофинейского двойника
кварца, протравленного плавиковой кислотой. Различно
протравленные (белые и заштрихованные) области соответствуют здесь
участкам двух индивидуумов, сросшихся по дофинейскому закону.
5 О. Г. Козлова 129
■
Дофинейские двойники кварца оказалось возможным (по
Е. В. Цинзерлинг) подвергнуть раздвойникованию при
температуре, близкой 575°С, называемой температурой а—Р-превращения,
методом кручения пластинок 0,8 мм толщины. При этом
обнаружено, что кристаллы раздвойниковываются значительно легче,
если они содержат небольшое количество примесей. Примеси,
которые не ощущаются рентгеновскими методами, достаточно четко
обнаруживаются во время раз-
двойникования. Большую роль
играют в свойствах
кристаллических материалов те двойники,
которые образуются в процессе
механической деформации кристалла.
\
Рис. 86. Разрез дофиней-
ского двойника кварца
77777X777777777777777777777777777,
Рис. 87. Краевой угол
расплав—кристалл
В практике выращивания монокристаллов следует иметь в
виду, что во избежание двойникования^кристаллизацию следует
проводить медленно и равномерно в условиях максимальной чистоты,
Свободная поверхность кристалла
В принципе дефектными участками кристалла являются гра-^
ницы раздела фаз кристалл—газ, кристалл—жидкость и
кристалл—твердое тело.
Особый интерес вызывает свободная поверхность самого
кристалла. Толщина взаимодействия частиц здесь равна 10~7—,
10~8 см. Частицы кристалла вблизи его поверхности находятся в
иных условиях, чем во внутренних участках, и характеризуются
потенциальной энергией. Суммированный избыток энергии
поверхностных частиц называется поверхностной энергией а. Она рас;;
считывается на единицу площади поверхностного слоя и
измеряется в эрг/см2 или дин/см.
Поверхностная энергия кристалла уменьшается по мере
возрастания сил взаимодействия поверхностных частиц с частицами
граничащей среды (газа, неемачивающей и смачивающей
жидкости).
Определение межфазной поверхностной энергии на границе
кристалл—расплав можно произвести по формуле Неймана
атж = сгг—^cos0» (V, lj
где 8 — краевой угол расплав—кристалл (рис. 87). Для
хлористого натрия 6 = 28° при температуре, близкой к температуре плав-1
130
пения NaCl. Поскольку хлористый натрий имеет отрицательный
температурный коэффициент, то атш его меньше для температуры
плавления, чем для комнатной температуры.
По формуле
и -б 03
1 = к0е kT-е т^2 (V, 2)
проверяется достоверность экспериментальной поверхностной
энергии атш. В уравнении (V,2), следующем из флуктуационной
теории, I — число центров кристаллизации, к0 — предэкспоненци-
альный множитель, U — работа обратимого и
изотермического образования двумерного зародыша, В — некоторая
константа, Т — температура кристаллизации, АГ — степень
переохлаждения.
Следует отметить, что вопрос о поверхностной энергии все же
разработан недостаточно хорошо теоретически и
экспериментально. Значения а, вычисленные и экспериментально определенные
разными авторами для одних граней кристалла одного и того же
вещества, весьма существенно разнятся друг от друга.
Тем не менее тот или иной учет поверхностной энергий
остается важной задачей, так как она играет существенную роль в
процессах кристаллизации. Активность поверхностей очень высока, о
чем свидетельствуют многочисленные явления (адсорбции веществ,
катализирование химических реакций и др.).
Поверхность способна оказывать влияние на физические
(прежде всего, электрические) свойства кристаллов. Поэтому перед
использованием кристаллического образца для того или иного
конкретного назначения поверхность его необходимо подвергнуть
специальной обработке, которая часто сводится iK удалению
поверхностного дефектного слоя разными путями: проще всего это
делается последовательным шлифованием в:се более тонкими
порошками вплоть до получения оптически гладкой поверхности. Но
даже в этом случае слой искаженной структуры простирается в
глубину кристалла на несколько десятков ангстрем. Более
совершенную поверхность получают с помощью химического или
электрохимического полирования, при котором поверхностные участки
удаляются послойно. Недостаток этой методики состоит в
возможности образования хемосорбированного слоя, природа которого
зависит от состава травящего или полирующего растворов. Часто
поверхностный слой, представляющий собой окисел, удаляют
обработкой в восстановительной газовой среде. Для целей травления
можно воспользоваться бомбардировкой элементарными
частицами, но такая обработка искажает структуру.
После обработки поверхность образца подвергается ряду
исследований: электрическим и оптическим измерениям, электронной
микроскопии, рентгеновскому сканированию и т. и.
b 131
Способы выявления дислокаций
Рассматриваются способы выявления всех возможных типов
«неравновесных» дефектов, которые сводятся к дислокациям.
Для выявления отдельных дислокаций, границ тонкой
структуры, двойников, дефектов поверхности наиболее прост и
достоверен метод травления, сущность которого описана в гл. VI, § 6.
Избирательное воздействие травителя на дислокации обусловлено
тем, что дислокации представляют собой области напряженности
в кристалле и у дислокаций часто скапливаются примеси..
Характер воздействия травителя зависит от типа и числа
дислокаций, располагающихся вдоль границы, от природы и
концентрации примесей, а также от характера распределения этих
примесей. Эффективность растворения, конечно, зависит от природы
травителя и от условий травления. В определенных случаях
разная скорость действия травителя позволяет отличать один вид
дислокаций от другого. Иногда с помощью травления удается
выявлять спиральное строение винтовых дислокаций, спирали
роста. Ступенька (шаг) спирали может иметь высоту одного
атомного слоя (простые винтовые дислокации) или достигать
величины в несколько сот ангстрем (сложные дислокации). Простые
винтовые дислокации наблюдаются на металлических кристаллах,
вторые чаще в слоистых структурах графита, карбида кремния,
йодистом кадмии и йодистом свинце.
Для определения плотности дислокаций пользуются методами
рентгеновской дифракции. Методы основываются на оценке
расхождения пучка рентгеновских лучей, претерпевших отражение
или дифракцию на кристалле. Расхождение пучка зависит от ра-
зориентации и может быть использовано для измерения последней.
Эти методы дают среднее значение плотности дислокаций, иногда
указывая и на характер их распределения по кристаллу.
Третий метод выявления дислокаций — метод декорирования,
основан на свойстве дислокаций притягивать примеси. Введенные
в кристалл примеси скапливаются у дислокаций и декорируют их.
При изучении дислокаций также их непосредственно
наблюдают в электронный микроскоп большой разрешающей
способности. Он позволяет просматривать «пластинки» толщиной около 40А.
§ 4. ТРЕХМЕРНЫЕ ДЕФЕКТЫ
Трехмерные дефекты наиболее четко отражаются в сектори-
альном и зонарном (Строении кристаллов.
Секториальное строение кристаллов
Представление о секториальном строении кристаллов дал Бек-"
ке: «Реальный кристалл сложен пирамидами роста его граней.
Пирамиды роста разных простых форм физически различны».
А 32
Секториальное строение определяется индивидуальными
свойствами каждого из элементов огранения кристалла и их
взаимоотношением с питающей средой. Различие в химическом составе
или тонком строении пирамид нарастания приводит к различию
свойствах этих пирамид внутри одного кристалла. Так, широко
известно секториальное распределение окраски в кристаллах
топаза, аметиста, барита, гипса (см. рис. 52). В толстых
пластинках 'вырезанных из прозрачных, совершенно бесцветных кристал-
"•VV*
-Ль ' >v
^t
A* X. ■ :^
>^v*:\'3i
&к\. jfc'tti
Ч&£
*.*^St
*Z[ ^W? *
'-'* V.
'jb?
-- Ль^Г
у
A .- ^
a
v'.j
-л F4
ri i^>
7r\ l^\.
• ?\ l\* •
%hJ>
Рис. 88. Секториальное
строение кристалла
типа «мальтийского»
креста с постоянным
соотношением скоростей
роста а, б-граней
(по Г. Г. Леммлейну)
Рис. 89. Секториальное
строение кристалла с
непрерывно
.уменьшающейся скоростью роста
б-грани, поглощающей
примесь (относительное
содержание примеси во
время роста
увеличивается) (по Г. Г.-
Леммлейну)
лов, граница между различными <hkl> может быть обнаружена
по полоске Бекке, возникающей в результате полного внутреннего
отражения. Повышенные различия показателей преломления
пирамид нарастания, слагающих кристалл, становятся причиной
технического брака (так называемых «свилей» кристаллооптического
сырья — кварца, исландского шпата, флюорита). Часто пирамиды
нарастания граней обнаруживают значительные различия в
твердости и в устойчивости против химических реагентов. Секториаль-
ную неоднородность кристаллов легко вскрывают явления
аномального двойного лучепреломления и плеохроизма. Свойства.эти
могут быть, например, результатом некоторого упорядоченного
распределения изоморфных или просто адсорбированных ионов в
структуре кристалла. В кристалле возникают напряжения,
следствием чего является двойное лучепреломление, а в случае
окрашенных ионов — и плеохроизм.
В кристалле с внутренними напряжениями особенно отчетливо
проявляется его секториальное 'строение. Напряжение можно снять
полностью или частично путем длительной термической обработ-
133
ки, нарушающей «ненужную» упорядоченность расположения
примесных ионов путем диффузии ионов по структуре с
выравниванием физических свойств. Этим самым стираются границы между
пирамидами нарастания разных граней
Учение о секториальном 'Строении кристаллов разработано
Г. Г. Леммлейном. Им, в частности, было показано, каким
образом, основываясь на изучении секториального строения, мож-нс^
определить относительные скорости роста различных граней
кристалла.
Строгое постоянство скоростей роста граней (а, б) кристалла
за весь период его образования сохраняется только в исключи-
£^г
•"■- V \
\г''
?V- ■ •
;• ^Ч.- " •
•?4>L
>Лк
■V....-.;. Л
ЧЗ&г*"
"^Ггуь,
ш
• /
* * л; J
г*
•■Э
\
Рис. 90. Секториальное Рис. 91. Прерывная пи- Рис. 92. Зонарное^
строение кристалла с
непрерывно увеличивающейся
скоростью роста б-грани,
поглощающей примеси
(относительное содержание
примеси в растворе <во
время роста уменьшается)
(по Г. Г. Леммлейну)
рамида роста
строение кристалла
тельных случаях (рис. 88). В
соответствии с изменением внешних условий грач
ница между пирамидами роста двух
соседних граней не остается плоскостью, а
получается изогнутой (рис. 89, 90),
ступенчатой или какой-нибудь более слож-5
ной формы (рис. 91).
В связи с этим изучение секториального строения кристаллов
важно также и для восстановления условий их роста, их истории—
онтогении кристаллов.
Зонарная структура
Зонарная структура кристалла может рассматриваться как
проявление изменяющихся во времени внешних условий роста
кристалла (рис. 92). Если на протяжении истории кристалла тот или
иной фактор, оказывающий влияние на степень однородности или
химический состав кристалла, меняется периодически, то кристалл
приобретает зонарную .структуру. В минералах зонарные струк-'
туры встречаются весьма часто. Так, в дымчатом кварце более
или менее интенсивная окраска нередко распределяется слоями—■
оболочками, параллельными определенным граням кристалла/
134
r кристаллах турмалина нередкое чередование розовой, зеленой
коричневой окрасок позволяет полностью воссоздать тот облик,
который имел растущий кристалл в отдельных стадиях своей исто-
и Зонарные .структуры очень легко могут быть получены
искусственно на кристаллах квасцов, если выращивать их из сильно
пересыщенного раствора при периодически меняющейся темпера-
туре. Прозрачные слои в таких кристаллах чередуются с менее
прозрачными.
Глава VI
ЗАКОНОМЕРНО ПОСТРОЕННЫЕ КРИСТАЛЛИЧЕСКИЕ
АГРЕГАТЫ
Закономерно построенные кристаллические агрегаты характе.-
ризуются некоторыми особенностями своих физических свойств,
отражающих способы их формирования. В образовании этих
агрегатов играет роль ряд явлений, с которыми следует
предварительно познакомиться.
§ 1. ОРТОТРОПИЗМ
Под термином «о ртотр оп из м» понимают рост кристаллов
в направлении, перпендикулярном к плоскости или линии
зарождения кристаллов. Это характеризует кристаллизацию как в
природных условиях (например,
в жеодах, жилах и т. д.),
так и при приготовлении
искусственного льда в
формах, получении
-пьезоэлектрических текстур. Ортотро-
пизм легко можно
демонстрировать на предметном
стекле. На каплю расплав-
Рис. 93. Ортотропический рост: а — круглой ленного салола кладется
формы; б —в форме конверта круглое или квадратное
покровное стекло. Препарат
зажимается между предметным и покровным стеклом, после чего
быстро обводят предварительно зараженной иглой окружность
или квадрат. Структура, которая получается иод круглым
покровным стеклом, напоминает -природные жеоды или секреции
(рис. 93,а). Под квадратным стеклом получается фигура,
напоминающая конверт (рис. 93,6). В результате'Столкновения
кристаллов, растущих перпендикулярно к сторонам квадрата, на его
диагоналях образуются швы.
136
Были попытки объяснить явление ортотропизма
ориентирующим действием направленной отдачи тепла. А. В. Шубников убе- '
дительно показывает, что причина в данном случае имеет чисто
геометрический характер. Возникшие на поверхности или ,на линии
центры кристаллизации могут расти в стороны только до момента
соприкосновения друг с другом. Дальнейший рост кристалла будет
возможен только вперед, т. е. по перпендикуляру к линии или
поверхности, на которой возникли центры кристаллизации.
§ 2. РИТМИЧЕСКИЙ РОСТ
Ритмический рост представляет собой мало распространенное
явление. Ритмические явления не однообразны. В данном случае
рассматривается только периодический рост кристаллов в тонких
слоях.
Если на поверхности предметного стекла в тонком слое
переохлажденного расплава салола вызвать кристаллизацию в одной
точке, то образуется агрегат многочисленных кристаллов,
представляющих собой ряд концентрических кольцевых валиков.
Периодичности при кристаллизации салола А. В. Шубников даег
следующее объяснение: «При росте кристаллов |Из одной точки,
поверхностное натяжение тонкого слоя жидкости уменьшается,
вследствие чего жидкость начинает отступать от растущих
кристаллов; верхняя поверхность кристаллов при этом оголяется и
начинается рост за счет капиллярного поднятия жидкости. В
результате оттока жидкости к центру и от центра, в кольцеобразном
пространстве, окружающем растущие кристаллы, вся или почти
вся жидкость оказывается израсходованной.
Дальнейший рост, очевидно, возможен только за этой
опустошенной полосой в области, где еще держится низкая температура
и куда кристаллизация может быть передана по тонкому слою
вещества через истощенную полосу или непосредственно или путем
отрывания зародышей от растущих кристаллов».
Периодические структуры впервые были изучены Лизегангом
и получили свое название по имени этого автора. Кольца Лизе-
ганга изучены в желатине. Прежде всего приготовляется смесь
определенных количеств растворов желатины, двухромокислого
калия и лимонной кислоты. Эту смесь в горячем виде наливают
на стекло. После застывания юмеси на середину пластинки
помещают каплю раствора азотнокислого серебра. Азотнокислое се*
ребро (AgN03), реагируя с двухромокислым калием (К2СГ2О7),
образует микроскопические кристаллы двухромокислого серебра
(Ag2Cr207), которые отлагаются концентрическими кольцами.
Лимонная кислота добавляется для увеличения растворимости
двухромокислого серебра; с возрастанием содержания кислоты
расстояния между кольцами увеличиваются. Опыт лучше удается
в темноте и при низкой температуре.
137
Видимо, два любых вещества при подходящих условиях могут
образовать кольца Лизеганга, если только при реакции этих
веществ возникает нерастворимый осадок. Многие факторы влияют
на форму структуры. Температура, влияя на скорость реакции, на
скорость диффузии растворов и на вязкость желатины, тем самым
оказывает действие на характер колец. Сама среда, в которой
происходит реакция, принимает участие в образовании
периодических структур. Например, кольца двухромокислого калия не
удается получить, если заменить желатину агар-агаром, хромат
свинца дает кольца в агар-агаре. Вероятно, среда не участвует
в самой реакции, так как кольца могут возникать и в среде, не
содержащей геля, в капиллярных трубочках или в тонком слое
между покровным и предметным стеклами. Эти факты служат
подтверждением волокнистой природы гелей. На структуру колец
оказывают влияние примеси, электрическое поле, давление и
время, истекшее после приготовления гелей. Периодические
структуры могут быть получены также без химических реакций.
Например, можно получить в
капиллярной трубке периодическую
структуру осадка NaCl, заставляя
диффундировать в раствор соли
соляную кислоту. Это случай
периодической кристаллизации, к
1
iT
ж
А*
',
оо
оо т оо:т
°°:2
v
/77- оо.'Ш
Рис. 94. Формы периодических
структур (по А. В. Шубнико-
ву)
Рис. 95. Группы симметрии
текстур (по А. В. Шубн-икову)
которому можно прийти от колец Лизеганга.
В зависимости от условий образования периодические
структуры могут иметь разнообразный вид (рис. 94).
§ 3. ТЕКСТУРЫ
Текстурами называются поликристаллические образования,
обладающие анизотропией, определяемой вынужденной
ориентировкой (полной или преимущественной) кристаллических единиц
в агрегате.
Примером текстур могут служить медные слитки, в которых
в сечении, параллельном поверхности, 6% кристаллов
ориентированы нормалями к граням октаэдра, 8%—нормалями к граням
ромбического додекаэдра и 86% —нормалями к граням куба.
Поверхность слитка железа состоит на 95% из граней куба и на 5%
133
из граней октаэдра. Лед на озерах и реках имеет столбчатую
структуру из гексагональных призм, оси которых расположены
вертикально.
Все текстуры обладают осями симметрии бесконечного
порядка, совпадающими с направлением ориентации кристаллов, т. е.
с осью текстуры. Среды с косыми осями симметрии бесконечного
порядка изотропны и потому к текстурам относиться не будут.
Для текстур могут быть применены только пять формул
симметрии: оо; оо-т; оо : т\ оо : 2; т-оо:т. Пять групп симметрии с
бесконечными осями легко запоминаются по простейшим фигурам,
обладающим соответствующей симметрией (рис. 95).
По морфологическому признаку выделяют два типа текстур:
пластинчатые, или чешуйчатые и волокнистые, или игольчатые.
По характеру ориентировки игольчатых и пластинчатых
кристаллов в агрегате различают текстуры первого и второго рода.
В текстурах первого рода игольчатые кристаллы ориентированы
параллельно или почти параллельно своими преобладающими
ребрами, а пластинчатые — нормалями к преобладающим граням.
Следовательно, осью текстуры первого рода -служит либо
преобладающее ребро, либо нормаль к преобладающей грани.
В текстурах второго рода преобладающее направление или
нормаль к преобладающей грани располагаются параллельно или
почти параллельно одной плоскости. Осью текстуры в обоих
случаях служит нормаль к этой плоскости.
По признаку наличия или отсутствия в текстурах особой
полярной прямой выделяют полярные и неполярные текстуры.
Различают также энантиоморфные и неэнантиоморфные текстуры.
Среди первых существуют правые и левые модификации текстур.
Текстуры с центром симметрии называются центрическими,
а не обладающие центром симметрии — ацентрическими. Пиро-
и пьезоэлектрические свойства следует искать только среди
ацентрических текстур.
Физические свойства текстур так же, как и кристаллов,
зависят от их симметрии. Будучи оптически одноосными, все текстуры
одноосны в отношении термического расширения,
электропроводности и т. п. Вообще же свойства текстур отличаются от
аналогичных (Свойств составляющих кристаллов как количественно, так
и качественно. Следует отметить, что по истечении некоторого
времени текстуры «стареют», в результате чего их свойства
ослабевают. Продолжительность «жизни» текстуры определяется
природой составляющих ее элементов и способом изготовления.
Способы получения текстур разнообразны, но в большинстве
случаев просты. Так, игольчатые текстуры первого и второго рода
легко получаются механическими приемами ориентировки
кристаллов во время их образования при затвердевании
расплавленных солей.
В науке и технике получили широкое применение текстуры
пьезоэлектрические, пьезокерамические, оптические (поляроиды),
139
полимерные типа электретов, ферромагнитные. К текстурам с
естественной ориентировкой кристаллитов в агрегате относятся так
называемые жидкие кристаллы.
Пьезоэлектрические и оптические текстуры
Пьезоэлектрические текстуры были впервые получены А. В. Шуб-
никовым из сегнетовой соли элементарным способом. На кипящей
водяной бане расплавляют определенное количество сегнетовой
соли и доводят температуру расплава до 100°С. В изредка
перемешиваемый расплав помещают жесткую цилиндрическую кисть
диаметром-10—15 мм или уплощенную кисть шириной 15—20 мм.
После того как кисть примет температуру расплава, последний
наносится ею на специально подготовленную поверхность, в
качестве которой может быть использована металлическая сетка,
сплошная металлическая предварительно очищенная поверхность,
натянутая на кольцо марля и т. д. Расплав 'наносится обычно
прямолинейными штрихами, 'непрерывно продолжающимися от
края до края поверхности в одном направлении. Начало
кристаллизации замечается по изменению блеска поверхности расплава,
и тогда до ее завершения расплав наносить прекращают. Затем
новая порция расплава наносится 1на поверхность такими же
штрихами, но в противоположном направлении. За каждый прием
наращивается слой толщиной в 0,1 мм. Так приготавливаются из
сегнетовой соли текстуры первого рода. Приготовление игольчатых
текстур второго рода отличается тем, что делают штрихи по
всевозможным пересекающимся прямым. В таком случае игольчатые
кристаллы располагаются параллельно плоскости, обрабатываемой
кистью.
Пьезоэффект в приготовленных таким образом текстурах
достигает 'своего максимального значения не сразу, а спустя
несколько суток. За это время происходит расстекловывание
межкристаллической аморфной массы, остающейся после нанесения
расплава, наряду с мелкими игольчатыми кристаллами
микроскопических размеров, что приводит к возрастанию
электропроводимости текстуры и ее пьезоэффекта.
А. В. Шубниковым было дано обоснование возможности
существования пьезоэлектрических текстур и их классификации.
Пьезоэлектрическими (свойствами обладают три ацентрических типа
текстур, принадлежащих к группам симметрии сю; оо-т\ оо : 2.
Различают полярные и неполярные пьезоэлектрические текстуры.
Оптические текстуры, <или поляроиды, впервые открыты в
Америке Лендом. Поляроиды — это пленки, представляющие собой
текстуру, состоящую из субмикроскопических иглообразных
кристаллов некоторых органических соединений, обычно содержащих
иод и ориентированных оптической осью параллельно друг другу.
Действие этих пленок основано на неодинаковом поглощении
обеих возникающих в результате двойного преломления поляри-
140
^зованных волн. Поляроидные пленки обладают обусловленной
сильным плеохроизмом способностью поляризовать свет.
Поляризация света поляроидами не бывает полной; пропускаемый ими
белый свет выходит слегка окрашенным. В этом поляроиды
уступают исландскому шпату, поляризующему свет на 100%.
Важно отметить, что оптические текстуры, подобные
поляроидам, принципиально неполярны; это означает, что оптические
свойства текстур будут одинаковыми, если одноименные концы
полярных кристалло'В направлены в одну сторону или в
противоположные стороны.
Способ изготовления поляроидов аналогичен способу
получения пьезоэлектрических текстур.
Ферромагнитные текстуры
Ферромагнитные текстуры представляют собой керамические
образцы ферритов. Формула простых ферритов имеет -вид
M(Fe02b, где М — любой двухвалентный металл.
: Ферромагнитные текстуры применяются как очень ценные
ферромагнитные материалы, в частности, в технике сверхвысоких
частот.
Современный .способ получения ферромагнитных текстур,
разработанный К. Г. Хомяковым, называется бездиффузионным. Он
полностью вытеснил прежний метод, по которому окислы
различных металлов перемалывают в шаровых мельницах, смешивают
и обжигают. Многие операции повторяют по несколько раз в
целях лучшего перемешивания окислов друг с другом.
Согласно новой методике, из водных растворов сульфатов тех
металлов, которые должны входить в состав феррита, путем
химической реакции получают изоморфный твердый раствор солей;
из которого под воздействием высокой температуры удаляются
летучие примеси. Такой полуфабрикат спрессовывают и спекают
в электропечах. Полезный выход продукции составляет почти
100%, тогда как предшествующий ему керамический метод давал
в лучшем случае лишь 25%.
Электреты
Электрет представляет собой текстуру из дипольных
элементов, размеры которых имеют порядок нескольких ангстрем.
Электрические оси диполей расположены в пространстве
параллельно друг другу, т. е. одноименными концами в одну сторону.
Благодаря этому электрет обладает постоянным электрическим
моментом подобно магниту — среде, обладающей постоянным
магнитным моментом.
Электреты впервые были получены и описаны японским
физиком Эгучи. Получаются они при затвердевании расплавленного
воска и различных -смол в сильном постоянном электрическом
141
поле. Ось электретной текстуры, т. е. ось симметрии бесконечного
порядка, совпадает по направлению с ориентирующим
электрическим полем.
Электреты обладают пиро- и пьезоэлектрическими свойствами.
В отличие от пьезоэлектрической текстуры ось электрета должна
быть обязательно полярным направлением.
f Жидкие кристаллы
Жидкие кристаллы впервые стали изучаться О. Леманном и
были названы так потому, что, будучи типичными жидкостями,
обладают некоторыми свойствами, характерными для кристаллов.
Так, при нагревании они «плавятся» в обыкновенную изотропную
жидкость при строго определенной температуре, обладают
двойным лучепреломлением, иногда могут иметь свою особую форму,
отличающуюся от форм капель жидкости, с настоящими
кристаллами дают закономерные сростки, ориентируются в магнитном и
электрическом полях и т. д. Но жидкие кристаллы имеют и
существенные отличия от типичных кристаллов. Главное — отсутствие
решетчатой структуры, и поэтому к ним <не применимы
геометрические законы кристаллографии, и второе — они имеют
одномерную или двумерную симметрию.
Почти полвека спорили о том, насколько допустимо называть
эти образования «жидкими кристаллами». В свое время этот спор
имел глубокое принципиальное значение. В нем решался вопрос
о возможности существования нового, четвертого «состояния», не
похожего ни на газообразное, ни на жидкое, ни на твердое. По
предложению Г. и Е. Фриделей конец этому спору был положен
путем установления двух понятий: «фаза» и «стаза». Всякое
вещество принципиально может быть при различных температурах
и давлениях в газообразной, аморфной (жидкой или
стеклообразной) и в нескольких анизотропных (жидких или твердых) фазах.
Понятие «фаза» связывается с обязательным существованием
резких границ перехода из одной фазы в другую. Понятие «стаза»
основано исключительно на различиях в тонкой молекулярной
структуре вещества. Фридели различают четыре стазы: аморфную,
нематическую, смектическую и кристаллическую.
1. Аморфная стаза характеризуется беспорядочным
расположением молекул (газ, обычные жидкости, стекла).
2. В нематической стазе все молекулы ориентированы какой-
либо из своих осей параллельно друг другу, образуя нити,
обладающие одномерной симметрией.
3. В смектической стазе молекулы образуют пластинки
двумерной симметрии; эти пластинки толщиной в одну или две
молекулы могут легко скользить относительно друг друга.
Две последние стазы характерны для жидких кристаллов.
Различают нематические и смектические жидкие кристаллы.
142
4. В кристаллической стазе молекулы расположены в решетке
. трехмерной симметрии.
Можно представить, например, такое жидкое тело, которое
будет находиться в кристаллической стазе. Осторожным плавлением
висмута такую стазу осуществляли на практике. Точно также
возможны совершенно твердые вещества, обладающие нематичесйим
или смектическим строением — своеобразные стекла -из жидких
кристаллов.
Одно из необходимых условий для того, чтобы вещество было
способно образовать жидкие кристаллы — низкая симметрия мо-
1лекул.
К жидким кристаллам относятся, например, красители,
полимеры, мыла. В последние годы было доказано, что миэлиновая
оболочка нервов обладает свойствами смектически-жидкого
кристалла.
Исследование жидкокристаллического состояния позволяет
изучить динамику перехода жидкости в кристалл для большой
группы органических соединений (около 3000 известных к настоящему
времени), поскольку жидкие кристаллы по своей структуре
образуют промежуточное звено между истинными жидкостями и
истинными кристаллами.
§ 4. ЭПИТАКСИАЛЬНЫЕ СРОСТКИ
Одно из проявлений закономерного срастания кристаллов
представляет собой эпитаксия (гл. IV, § 4). Эпитаксия — это
ориентированное наращивание вещества на .кристаллической поверхности.
Процесс ориентированного наращивания
вещества на своем монокристалле называется
автоэшитаксией.
Явления эпитаксии обнаружены очень
давно. Классическим примером служат
кубики йодистого калия KI, нарастающие на
пинакоид моноклинной слюды, мусковита
KAl2(OH)2'[AlSi30io] так, что одна из тройных
осей кристаллов располагается
перпендикулярно плоскости пинакоида слюды (рис. 96).
Такое строго закономерное срастание объяс- Рис 96. Кристаллы KI,
НЯетСЯ СХОДСТВОМ ОКТаЭДрИЧеСКИХ СетОК KI И закономерно нарос-
_„„ * г Тт шие на пинакоид
пинакоидальнои сетки мусковита. И в тех и слюды мусковита
Других можно выделить сходные треугольни- KAl2[AlSi3Oio](OH)2
ки, по вершинам которых располагаются ионы
калия.
Другим примером эпитаксии может служить закономерное
срастание кристаллов натриевой селитры NaN03 с кальцитом
СаСОз.
В настоящее время еще не создана полная теория эпитаксиаль-
ного выращивания из-за отсутствия необходимых сведений о силах
143
связи и энергии кристаллических решеток срастающихся веществ,
Поэтому все существующие объяснения закономерной
кристаллизации носят феноменологический характер.
В ранних исследованиях большое ;внимание уделялось
размерному соответствию параметров решеток в плоскости срастания/
Согласно правилу Руайе—Фриделя, ориентация возможна лишь
тогда, когда между срастающимися сетками решетки существует
геометрическое и размерное соответствие. Ориентированное
срастание происходит в случае, если разница в параметрах сеток
срастающихся соединений не превышает 10—15%. Однако было
замечено большое количество случаев эпитаксии и при
значительно большой разнице.
Наиболее значительные теоретические исследования в этой
области принадлежат Странскому, Данкову, Близнакову. По Дан-
кову, на поверхности подложки происходят два различных
кристаллизационных процесса: во-первых, образование двумерного
зародыша под влиянием направляющих сил 'поверхности
подложки и, во-вторых, образование трехмерного зародыша, который
не связан с определенной ориентацией по отношению к подложке.
Эпитаксия связана с образованием двумерного зародыша. Между
решетками подложки и кристаллизующегося вещества обычно не
существует полного соответствия, следовательно, двумерный
зародыш несколько деформируется. Если эта деформация достаточно
велика, энергетически более выгодным может оказаться
образование трехмерного зародыша. В этих случаях эпитаксия не
наблюдается.
Существует определенная температура, ниже которой
ориентация невозможна. Объясняется это присутствием различных
адсорбированных примесей, мешающих эффекту ориентации. При
нагревании подложки примеси устраняются. Было выдвинуто и
другое мнение, согласно которому температура ориентации
подложки обусловливает некоторую минимальную подвижность
частиц на поверхности, благодаря которой О'ни могут занять
наиболее благоприятные с энергетической точки зрения положения на
подложке.
Уже в ранних работах многие исследователи обратили
внимание на то, что при эпитаксии срастание осуществляется на
кристаллических плоскостях с низкими индексами, т. е. на плоскостях
с высокой ретикулярной плотностью. Несмотря на многочисленные
работы по эпитаксии, процесс образования зародышей,
определяющих ориентацию, изучен недостаточно.
Принципиально возможно два механизма образования
зародышей на кристаллической поверхности: непрерывный рост и
спонтанная кристаллизация. В первом случае процесс роста
осуществляется за счет присоединения атомов у активных центров
подложки: изломов, ступенек недостроенных атомных плоскостей,
дислокаций, скоплений дефектов и т. п. Спонтанное образование
зародышей облегчено, когда пересыщение превышает критическое
144
значение. При таком механизме в некоторый момент могут
образоваться зародыши приблизительно одинакового размера, и до
определенного момента число их будет увеличиваться без
существенного изменения размеров.
Сейчас широкое применение в технике находят тонкие от
единиц до нескольких десятков микрон эпитаксиальные пленки. С их
использованием в значительной мере связаны большие успехи,
достигнутые за последнее пятилетие в электродной и
полупроводниковой технике, технике сверхвысоких частот и т. д. Широкое
распространение получила микроминиатюризация электронных
устройств, основанная на использовании автоэпитаксии. Таким
путем получают ориентированные пленки с особыми свойствами,
а именно монокристаллические слои с различными типами
проводимости верхнего нарастающего слоя и нижнего -слоя подложки
(р—п-переходов). Способность пленок к переходу из одного типа
проводимости к другому определяется концентрацией примеси.
Двухслойные пленки с р—п-переходами идут на изготовление
диодов, трехслойные с р—п—/^-переходами для триодов и других
полупроводниковых устройств.
«
Выращивание эпитаксиальных пленок
Среди полупроводниковых материалов первыми, нашедшими
себе применение уже более десятка лет, были кремний и
германий. Значительно позднее стали использоваться
интерметаллические соединения типа A111 Bv, со структурой сфалерита,
аналогичной структуре алмаза (GaAs, GaSb, GaP, A1N, A1P, AlSb, AlAs,
ZnP, ZnAs, ZnSb). Эти соединения обладают смешанными кова-
лентно-ионными связями, благодаря которым они занимают
промежуточное положение между чисто ковалентными IV группы и
более ионными соединениями A11 BVI. Соединения A111 Bv не имеют
центра инверсии, т. е. оси [111] полярны.
Тетраэдрическая координация ионов структуры сфалерита
характерна также для многих других соединений, используемых в
качестве полупроводников; в частности, SiC и типа A11 BIV: ZnS,
ZnSe, ZnTe, CdSe, CdTe, HgSe, HgTe, Cul, Agl и др.
Эпитаксиальные полупроводниковые пленки выращивают из
газовой фазы конденсационным (из молекулярного пучка) и
химическими способами.
1. Один из химических способов наращивания
ориентированных слоев, например, кремния, использует реакцию
восстановления:
SiCl4 + 2H2-»Si + 4HCl.
Четыреххлористый кремний при комнатной температуре
представляет собой жидкость. Меняя температуру нагрева жидкости,
можно регулировать £ко;рость подачи паров четыреххлористого
кремния в вертикально или горизонтально расположенную кварцевую
145
трубку, где происходит восстановительная реакция. Подложка,
в данном случае кремниевая, может нагреваться печью
сопротивления или индукционным током высокой частоты. На
определенном участке трубки газовая смесь, состоящая ,из паров четырех-
хлористого кремния и водорода, реагируя, отлагает на подложке
кремний в виде поликристаллической или монокристаллической
пленки. При температуре, близкой к 1200°С, содержание
газообразного SiCl4 колеблется в пределах 0,01—1%. С увеличением
концентрации SiCl4 увеличивается скорость роста пленки, но
вместе с тем ухудшается ее качество. Необходимые примеси (вводятся
в среду в виде хлоридов. Предметы, соприкасающиеся со средой
(чехол термолары и др.), изготовляются из материалов, стойких
к действию соляной кислоты: кварца, фторопласта, хлорвинила.
Измерение температуры производится пирометром Курнакова.
Стабильность температуры, близкой к 1200°С, поддерживается
с* 2—3°С.
2. Наращивание полупроводниковых пленок на подложке
производится с использованием га з о-т ране'портных реакций.
Газо-транспортными реакциями называют обратимые при олре-
деленных температурах реакции, протекающие в газообразном
состоянии:
МХп^М + пХ,
где М — металл, X — галоген-«транспортер», п — целое число.
Такая реакция при температуре Т протекает, предположим, справа
налево, при более высокой Г+ДГ — в обратном направлении.
Кроме галогенов в качестве транспортирующих агентов
используются НС1, HI, H2S и др. 'Реакции в большинстве «случаев имеют
более сложный характер. Методом газо-транспортных реакций
получают, в частности, германиевые эпитаксиальные пленки.
Германий осаждается из паров дийодида германия Gel2 в результате
реакции разложения над поверхностью монокристалла Ge.
Соединение разлагается на Gel4 и чистый Ge. В запаянной ампуле в
отсутствие газа-носителя реакция 2Gel2=^ Gel4 + Ge протекает
слева направо при пониженных температурах (~400°С), и в
обратном направлении — при повышенных. Увеличивающаяся с
концентрацией йода 'скорость роста и вид наращенных слоев зависят
также от ориентации подложки, причем на плоскостях (111) слои
имеют лучшую структуру. Одним из недостатков этого метода
является то, что процесс роста не регулируется.
Процесс роста эпитаксиальных (слоев германия осуществляется
не только на германиевой подложке (автоэпитаксия), но и на
кремниевой, также на подложке из арсенида галлия и др.
Выращивание германия на кремниевых подложках, вырезанных по
плоскостям (111), (100), (ПО), производится сначала при
температуре 1100°С. На чистой кремниевой поверхности германий в этих
условиях осаждается легко, причем появляется тонкая жидкая
пленка сплава германий—кремний. Затем температура опускается
146
Се
'Ma As \njj/t
до 970°С и наращивается еще около 7 ммк германия.
Выращивание пленки производится в открытой трубке, которая
помещается в цилиндрическую печь с тремя зонами нагрева.
Температура каждой зоны поддерживается и регулируется. Осаждение
производится в токе водорода. В первой зоне (по току водорода)
помещается лодочка с навеской йода, во второй — германий —
источник, который взаимодействует с парами йода, образуя Geb,
в третьей помещаются подложки, на которые осаждается
германий. Для переноса паров Gel2 можно использовать также ток
инертного газа. Большой недостаток этого метода наращивания
германиевых пленок на кремниевой
подложке в том, что пленка
содержит только 60—80% германия (в
зависимости от температуры
подложки). Таким образом получают
трехслойную пленку с переходами
типа п—р —п.
Выращивание пленок арсенида
: галлия GaAs осуществляется в от-
\ крытой трубке (рис. 97) с
использованием реакции
GaAs + I, ;i Gal2 + As.
В левом конце трубки при
температуре— 100° С помещают
кристаллический йод, в правом — подложку
(лучше всего германиевую), имеющую температуру — 750°С.
Концы трубки разделяет так называемый объемный изолятор,
содержащий GaAs при температуре 800° С. Реакция здесь идет слева
направо. В правой части трубки при более низкой температуре
реакция протекает обратно и образуется GaAs, нарастающий на
. подложке.
Если в среднюю зону трубки ввести дополнительно фосфид
галия, то можно получить твердый раствор GaAs^Pi-^ с
использованием обратимой реакции
Рис. 97. Выращивание GaAs
GaP + Lz?GaL + P.
В рассматриваемых методах с химически обратимой реакцией
рост кристаллов приоб!ретает черты саморегулирующегося
процесса: при изменении параметров автоматически поддерживаются
условия, близкие к равновесным. При химическом процессе в
газовой среде чем выше эквивалентная концентрация вещества и
интенсивнее процесс роста, тем больше образуется продуктов
разложения и соответственно интенсивнее происходит процесс
растворения прежде всего дефектных участков поверхности кристалла.
3. Методы, основанные на конденсации, применяются
только для металлов с использованием любых подложек.
Лучшим до последнего времени остается метод испарения
металла в вакууме, или метод молекулярного пучка. Испарение про-
изводится путем нагревания испаряемого вещества в вакууме. При
этом сначала вещество плавится, а затем образуется пар.
Процессы, происходящие при испарении, определяются в первую
очередь степенью вакуума в системе (не выше 10~6 мм рт. ст.). Поток
испаренных атомов или молекул, не претерпевающих на своем
пути столкновений и рассеяний, и движущийся вследствие этого
прямолинейно, называется молекулярным пучком-. Если на пути
движения молекулярного потока испаренного вещества поместить
подложку, то на ее поверхности образуется пленка
сконденсированного вещества. В качестве подложек обычно используются
пластинки стекла, кварца, корунда, флюорита, поваренной соли,
магнезита и других материалов.
Было показано, что при 300—350°С на подложке происходит
переход германия из аморфного в кристаллическое состояние.
Монокристаллические пленки Ge толщиной 1500 А получены на
подложке из CaF2 в интервале температур от 450 до 700°С.
Кристаллическая структура, пористость, сложность несовершенств и
прилипание пленки к подложке зависят от скорости и температуры
осаждения. Г. Близнаковым были получены германиевые пленки
в вакууме 5 -10~6 мм рт. ст. с гладкой блестящей поверхностью и
высокой степенью ориентации на нагретой до 600°С подложке
я-типа, при скорости роста 1 мк/мин. При этом германий
легировался (вводилась примесь) галлием. Наличие р—n-перехода
обнаружено травлением в КОН.
Эпитаксиальные (монокристаллические) слои германия,
выращенные из газовой фазы методом химической реакции и в вакууме
методом молекулярных пучков в сходных условиях эксперимента,
обладают существенно различными свойствами. Вторые
монокристаллы по сравнению с первыми являются более дефектными,
если даже они выращиваются в условиях глубокого вакуума
(1 • 10~8 мм рт. ст.). Возникновение дефектов объясняют ростом
слоев при значительных пересыщениях. Процесс роста в случае
кристаллизации из паров в вакууме протекает в крайне
неравновесных условиях, так как плотность молекулярных пучков
соответствует многократному пересыщенному пару вещества, т. е.
улучшение структуры и свойств конденсатов может быть достигнуто
путем уменьшения интенсивности пучка (снижения пересыщения)
и увеличения температуры подложки. При таком условии метод
испарения в вакууме имеет явные преимущества перед
химическими методами.
4. Эпитаксиальные пленки получают не только из
парообразной фазы, но и (значительно реже) из жидкой: расплавов,
растворов. Так, показана возможность ориентированной
кристаллизации арсенида галлия из галлиевых растворов.
Одним из важнейших преимуществ кристаллизации из
растворов можно считать возможность использования низких темпера-
148
тур. Известно, что кристалл, выросший при более низких
температурах, обладает лучшими структурными свойствами.
Аппаратура, обеспечивающая кристаллизацию при низких температурах,
отличается простотой конструкции. Процесс получения эпитакси-
ального слоя из растворов протекает гораздо быстрее. При
соответствующем подборе состава раствора, состоящего из галлия,
арсенида галлия и какой-нибудь легирующей примеси,
кристаллизация арсенида галлия может быть обеспечена при температуре
ниже 900°С, тогда как температура плавления GaAs равна 1238°С.
В качестве подложки используется арсенид галлия. При
получении р—п — переходов на арсениде галлия особую роль играют
примеси. Адсорбируемые растущим слоем, они изменяют его тип
проводимости, создавая так называемые донорные и акцепторные
уровни. Наиболее распространенными примесями для арсенида
галлия являются медь, цинк, магний, углерод, кремний, германий,
олово, свинец, сера, селен и теллур. Многие из этих примесей
вводятся в структуру арсенида галлия искусственным путем для
создания определенного типа проводимости. Некоторые же
химические элементы являются постоянными спутниками,
способствующими появлению дефектов структуры. Поведение примесей в
арсениде галлия и их влияние на его свойства в каждом частном
случае бывает различно. Чаще всего атомы элементов II и VI групп
находятся в решетке как атомы замещения. Атомы элементов
II группы, замещая атомы III группы, дают акцепторные центры.
Атомы VI группы, замещая атомы V группы, создают донорные
уровни.
В арсениде галлия существует два типа плоскостей.
Плоскости, заселенные атомами галлия, называются плоскостями А,
а мышьяковые плоскости — X. Плоскости X имеют значительно
^больше свободных электронов, чем плоскости А. Следовательно,
адсорбционная способность их неодинакова. Благодаря наличию
подобных более полярных свойств арсенид галлия считается более
перспективным материалом, чем, например, германий и кремний.
Глава VII
ЯВЛЕНИЯ, СОПРОВОЖДАЮЩИЕ ОБРАЗОВАНИЕ
КРИСТАЛЛОВ, И НЕКОТОРЫЕ ОСОБЕННОСТИ
КРИСТАЛЛИЗАЦИИ
§ 1. КРИСТАЛЛИЗАЦИОННОЕ ДАВЛЕНИЕ
•
Явление отталкивания инородных частиц гранями растущего
кристалла было отмечено очень давно Лавалем. Однако до
последнего времени еще не существовало единого мнения «и о
природе этого явления, .ни о порядках величин давлений, которые
могут при этом возникнуть. Ряд авторов оценивает давление
цифрами порядка 10 кг/см2, другие считают его не превышающим
десятых долей г/см2. Такое расхождение привело и к различному
объяснению природы явления. Одни исследователи, считающие,
что давление мало, объясняют его взаимодействием поверхностей
(кристалл-расплав-частица). Другие, говорящие о высоком
давлении, связывают отталкивание с энергией фазового перехода.
Теоретические и экспериментальные работы последних лет
В. Я. Хаимоова-Малькова показали, что основные противоречия
между данными предыдущих авторов разрешаются б пользу
больших давлений.
Кристаллизационным давлением называется
максимально -возможное при данном пересыщении (или
переохлаждении) давление грани на препятствие. Численно оно равно
предельному давлению груза на «закрытую» грань площадью 1 см2, при
котором прекращается ее рост. Кристаллизационное давление
приложено только к препятствию и, следовательно, является
однофазным.
Критический обзор методик, используемых для измерения
кристаллизационного давления (метод Корренса и А. В. Шубникова
и др.)» позволяет сделать вывод, что занижение величины
кристаллизационного давления (в опытах Шубникова) вызвано его
неправильной оценкой, т. е. определенное им давление
представляет собой некоторое давление (не кристаллизационное), играю-
150
щее, вероятно, основную роль при захвате или отталкивании
инородных частиц в конкретных условиях опыта.
Определенная Корренсом и другими авторами величина
кристаллизационного давления на грани (111) квасцов по порядку
величины (давление ~20 кг/'см2 при пересыщении 1,2) находит
экспериментальное и теоретическое подтверждение.
Если не учитывать анизотропию кристалла и среды, то
кристаллизационное давление л; для роста из раствора выражается
формулой
зх =
КГ
In-
(VII, 1)
е
с
где
пересыщение, V — удельный объем.
Для роста кристаллов из расплава л: выражается формулой
я== AT
Q
TQV '
(VII, 2)
где Q — теплота кристаллизации, Т0 — обычная температура
плавления, АГ — переохлаждение.
с
Из формул следует, что при — =^= 1,1 (для квасцов) или
Се
АГя^0,7° (для NaCl) л; ~8 кг/см2. Если считать, что прочность на
разрыв тяжелых бетонов имеет порядок 30—40 кг/см2, то уже при
С - -
гГ~ ~ 1Д растущий кристалл может разрушить этот бетон.
Если при малых и средних пересыщениях
а <1*)
отмечается хорошее совпадение вычисляемых и экспериментальных
данных, то при больших пересыщениях рассчитанная зависимость
дает завышенные результаты. Кроме того, начиная с этих же
пересыщений, величина кристаллизационного давления по Корренсу
становится зависимой от символа грани, что также противоречит
теории.
Несогласие становится понятным, если учесть решающую роль
условий питания граней в процессе захвата или отталкивания ими
примесей. Оказывается, что в процессе отталкивания или захвата
растущим кристаллом инородных частиц играет роль, с одной
стороны, величина давления, которое может оказать кристалл на
такую частицу, с другой стороны — условия питания участков граниг
находящихся в соприкосновении с инородными телами.
Учитывая большое значение кристаллизационного давления,
можно полагать, что практически любая инородная частица,
попадающая в область роста кристалла, должна была бы им
оттесняться. Однако инородная частица далеко не всегда оттесняется
растущим кристаллом. Увеличение переохлаждения (пересыщения)
ведет к увеличению вероятности захвата кристаллом частиц, не-
151
смотря на то, что кристаллизационное давление с увеличением
переохлаждения (пересыщения) возрастает. Эти факты
объясняются тем, что в связи с разными условиями питания скорость
роста «закрытого» участка грани, находящегося под препятствием,
меньше, чем скорость роста «открытого» участка грани кристалла.
В связи с этим следует учитывать характер соотношений этих
скоростей в зависимости от изменения условий кристаллизации
(пересыщения, скорости перемешивания и т. п.).
Теоретическое рассмотрение показывает, что величина
кристаллизационного давления не должна заметно зависеть от природы
частицы, раствора (расплава) или кристалла. Однако известно,
что грань (111) квасцов отталкивает стеклянную пластину, а грань
(100) к ней прилипает. К слюдяной пластинке прилипает как та,
так и другая грань. Эти разногласия теории с экспериментом
могут быть также объяснены различными условиями питания
«закрытых» граней. Питание таких граней осуществляется через
физически тонкий слой раствора (расплава), находящийся между
частицей и гранью. Физические и химические свойства слоя, а
следовательно и условия питания грани, определяются зависимостью
поверхностного натяжения этого слоя от различных факторов:
природы кристаллизуемого вещества, концентрации вещества и
примеси, температуры кристаллизации, толщины слоя и т. п. Условия
питания сводятся «в конечном счете к зависимости скорости роста
«закрытого» участка грани от поверхностого натяжения слоя.
Когда скорость роста «закрытого» участка грани становится
равной нулю, к нему прилипает инородная частица.
Итак, величина кристаллизационного давления растущего
кристалла велика. При малых пересыщениях (переохлаждениях)
кристаллизационное давление практически не зависит от природы
вещества и природы препятствия и связано с энергией фазового
перехода.
§ 2. УСАДКА
Обычно объем кристаллического вещества меньше, чем объем
жидкого или газообразного, за исключением воды, висмута и
некоторых других веществ, которые в твердом состоянии занимают
больший объем, чем в жидком. Уменьшение объема называется
усадкой. При неумелом ведении кристаллизации металла,
налитого в изложницу, может образоваться очень глубокая
усадочная раковина, портящая весь слиток. В практике металлолитья
обычно ведут борьбу с вредным влиянием осадочной раковины.
Если в плоском сосуде расплавить свинец, и, когда на его
поверхности образуется тонкая корочка кристаллического металла,
коснуться тонкой стружкой олова в какой-либо точке, то так как
олово плавится 'при более низкой температуре, чем свинец, оно
расплавится и в точке касания растворится в свинце.
Образовавшийся сплав олова и свинца имеет еще более низкую температуру
152
кристаллизации, и таким образом на застывшей поверхности
свинца возникает участок, который будет оставаться жидким до
тех пор, пока не закристаллизуется весь свинец. Точкой
прикосновения олова к свинцу будет определяться и положение усадочной
раковины, которую таким приемом можно загнать в наиболее
благоприятное по условиям литья место отливки.
§ 3. КРИСТАЛЛИЗАЦИЯ НА ПОВЕРХНОСТИ РАСПЛАВА
Предполагается, что на поверхности всякой жидкости
существует тончайшая упругая пленка, которая, не отличаясь по
химическому составу от самой жидкости, обладает совершенно иными
физическими свойствами, обусловленными более регулярным
расположением в ней частиц. Дж. Бернал считает этот слой
кристаллическим, все утончающимся по мере приближения к критической
точке, где он, наконец, ликвидируется, и разница между двумя
молекулярноподвижными состояниями (жидкость—пар) исчезает.
Эти различия в строении самой жидкости и ее поверхностной
пленки определяют различия и в кристаллизации внутри
жидкости и на ее поверхности.
А. В. Шубников делал опыты по кристаллизации салола на
поверхности расплава. На поверхность расплава салола,
охлажденного до комнатной температуры, стряхивались кристаллические
пылинки салола. Зародыши, плавая на поверхности расплава,
быстро вырастали в отдельные кристаллы или лучистые сростки
(сферолиты), одновременно удаляясь друг от друга и от места
своего падения. Во время разбегания все центры кристаллизации
оказывались расположенными внутри окружности, диаметр
которой постепенно увеличивался. Через некоторое время разбегание
прекращалось и диаметр окружности оставался далее постоянным.
Скорость движения отдельных зерен, таким образом, сначала
возрастала от нуля до некоторого максимума и затем опять
уменьшалась до нуля. Это вызвано наличием плавающих зародышей,
уменьшающих поверхностное натяжение расплава. Уменьшение
поверхностного натяжения происходит за счет тепла, выделяющегося
при росте зародышей. Кроме того, уменьшение поверхностной
энергии расплава может быть вызвано зародышами,
разрушившими целостность жидкой пленки, что подтверждается опытом
только со свежеприготовленными расплавами. Прекращение раз-
бегания может быть объяснено выравниванием температуры и
поверхностного натяжения, которое наступает с течением времени.
Уплощенные сферолиты распределяются на поверхности расплава
равномерно.
§ 4. КРИСТАЛЛИЗАЦИЯ NaCI НА ПОВЕРХНОСТИ РАСТВОРА
Интересен случай кристаллизации на поверхности раствора
поваренной соли NaCI, когда она происходит вследствие нагревания
солнечными лучами и испарения соляных водоемов. Часто соль
153
выделяется в форме полой пирамидальной четырехгранной
воронки, состоящей из сросшихся друг с другом кубов. Такие сростки
плавают на поверхности озера, как лодочки (рис. 98). Это
явление, не наблюдающееся для других солей — характерная
особенность хлористого натрия, растворимость которого очень мало
зависит от температуры. Для
большинства веществ растворимость быстро
возрастает с повышением температуры и
плотность насыщенного раствора при
нагревании увеличивается. Поэтому
при нагревании сверху таких
растворов и при их испарении всегда
насыщающиеся верхние слои будут
опускаться на дно, где и будет
происходить кристаллизация. При нагревании
же сверху раствора NaCl наиболее
теплые насыщенные слои остаются на
поверхности и никаких конвекционных
потоков создаваться не будет. При нагревании сверху и при
испарении в верхнем насыщенном слое начинается кристаллизация.
Образовавшийся маленький кристаллик будет плавать на
поверхности. Со временем кристалл, разрастаясь по сторонам и
одновременно несколько погружаясь, примет форму кристаллической
воронки. Плавая на поверхности, воронка постепенно увеличивается
в объеме.
Рис. 98. Кристаллическая
воронка NaCl, выросшая на
поверхности раствора
§ 5. КРИСТАЛЛОЛЮМИНЕСЦЕНЦИЯ
Явление свечения при кристаллизации известно уже около ста
пятидесяти лет. Так, если приготовить пересыщенный раствор из
смеси сернокислого калия и сернокислого натрия с содержанием
этих солей, отвечающих отношению 2K2SO4: Na2S04- 10H2O, то
после выпадения довольно значительного количества двойной соли
состава NaK(S04) образование каждого 'нового кристалла
сопровождается появлением искры и одновременно сопровождается
звуком, который можно легко слышать. Кристаллолюминесценцию
можно наблюдать при выпадении кристаллов хлорноватокислого
бария Ва(СЮ3)2 из водного раствора, при быстрой
-кристаллизации поваренной соли из водного раствора (если к нему
прибавлять соляной кислоты) и при выделении кристаллов
мышьяковистого ангидрида (AS2S3) из солянокислого раствора. До сих пор
не известны причины свечения при кристаллизации.
§ 6. РАДУЖНЫЕ КРИСТАЛЛЫ БЕРТОЛЕТОВОЙ СОЛИ
Весьма интересны полисинтетические двойники кристаллов
бертолетовой соли КСЮ3, принадлежащие к классу 2/га.
Плоскостями срастания агрегатов служат (001), они состоят из тонких
154
пластинчатых'кристаллов, отстоящих один от другого на равных
расстояниях порядка световой волны, чем объясняется (Ф.
Редеем) радужная окраска двойников. Так как двойники КСЮ3
находят применение в качестве оптических фильтров, то можно
ожидать, что разъяснение условия их возникновения может привести
к интересным результатам.
Глава VIII
ПРАКТИКА ВЫРАЩИВАНИЯ МОНОКРИСТАЛЛОВ
§ 1. ОСНОВНБ1Е ПРИНЦИПЫ ТЕХНИЧЕСКОГО ВЫРАЩИВАНИЯ
МОНОКРИСТАЛЛОВ
Получение монокристалла возможно при создании следующих
условий: 1) перевода системы в метастабильное состояние; 2)
обеспечения зародыша; 3) обеспечения правильного отвода тепла из
кристаллизующейся системы.
Ниже приводится более подробный перечень общих условий,
используемых в практике кристаллизации вещества:
1) приготовление расплава, раствора и т. п. (имеется в виду
подбор легирующей примеси, придающей кристаллу определенные
физико-химические свойства), фиксирование рН раствора;
2) подбор состава среды, в которой происходит кристаллизация
(инертной, водородной и т. п.) ;
3) выращивание или приготовление затравочных кристаллов
необходимой формы и достаточной степени совершенства;
4) выбор материала сосуда (в частности тигля), в котором
происходит кристаллизация;
5) монтаж затравочных кристаллов;
6) перемешивание раствора или расплава;
7) выбор нагревательного устройства (печи);
8) обеспечение правильного отвода тепла;
9) выбор устройства для равномерного относительного
перемещения кристалла и печи;
10) стабилизация и управление температурой кристаллизации;
11) учет и использование закона геометрического отбора;
12) борьба с посторонними кристаллами («паразитами»);
13) поддержание стерильности на всех этапах подготовки и
проведения процесса кристаллизации;
14) извлечение выращенных монокристаллов.
Вышеперечисленные условия должны быть умело учтены для
успешного решения задачи получения кристаллов, отвечающих
156
^определенным требованиям. В общем случае требования сводятся
к тому, чтобы продукт был монокристаллом, содержал
минимальное количество дефектов, при равномерном заданном составе во
всем объеме, имел наименьшие напряжения и был
использованным в науке и технике.
В связи с ростом потребности науки и техники в
разнообразных по своим физико-химическим свойствам кристаллах наряду
с общими проблемами приходится решать ряд частных проблем:
4) проблему очистки исходного сырья; 2) объемной обработки;
3) обработки поверхности; 4) контроля дефектов затравок и
макрокристаллов (оптического, рентгеновского, химического и т.п.);
5) отжига кристаллов; 6) проблему автоматики и т. д.
Из вышерассмотренного становится ясным то обстоятельство,
что успешное решение проблемы получения монокристаллов иногда
^ожет оказаться под силу лишь большому коллективу научных и
^технических сотрудников целого ряда смежных специальностей.
К настоящему времени разработан ряд принципиально
различных методов выращивания кристаллов из растворов:
динамический, гидротермальный, кристаллизация
путем электролиза. Четвертый метод выращивания кристаллов
, из растворов в расплавах можно рассматривать как
комбинированный метод выращивания, включающий ib себя
одновременно некоторые элементы методов выращивания из растворов
и расплавов.
Особенно разнообразны приемы выращивания кристаллов из
расплавов: метод И. В. Обрей мова и Л. В. Шубников а,
методы Бриджмена и Стокбаргера, методы Ште-
[бера и Стронга, метод зонной кристаллизации.
Все они составляют группу методов кристаллизации вещества
путем одностороннего охлаждения расплава. Вторую группу
доставляют методы получения кристаллов путем вытягивания затравки
из расплава: метод Киропулоса, метод Чохраль-
' с к о г о и д р.
Впервые для получения кристаллов корунда Вернейлем был
разработан метод спекания порошка А1203 в пламени
гремучего газа. В последнее время он стал приобретать более
универсальный характер.
Кристаллизацией вещества из твердого состояния пользуются
значительно реже, чем кристаллизацией из жидкого состояния;
отчасти поэтому методы перекристаллизации вещества отличаются
меньшей разработанностью. Выгодное исключение представляет
метод собирательной рекристаллизации и метод
рекристаллизации обработки, т. е. рекристаллизации
предварительно деформированного поликристаллического образца.
Кристаллизацией из парообразного состояния получают
сравнительно совершенные кристаллы. В последние годы разработано
несколько методов кристаллизации из парообразного состояния:
зонный метод, метод молекулярного пучка, метод
157
транспортных реакций. Следует отметить способ
получения кристаллов путем химических реакций. Обыкновенно
кристаллический осадок выпадает в виде порошка, состоящего из
очень мелких кристаллов. Однако если замедлить реакцию, то
вновь выделяющееся вещество осаждается на уже готовые
кристаллики, и последние будут расти.
§ 2. ТРЕБОВАНИЯ К ЧИСТОТЕ КРИСТАЛЛОВ И МЕТОДЫ ОЧИСТКИ
ИСХОДНОГО МАТЕРИАЛА
Для каких бы целей ни выращивался кристалл, всюду
приходится сталкиваться с требованиями в отношении степени чистоты.
Требования эти возрастают с каждым годом в связи с
расширением области применения кристаллов в науке и технике.
В предыдущих главах разбиралась роль примесей в
процессах зарождения и формирования кристалла, <в совершенствовании
его строения и сообщения ему определенных физических и
химических свойств. Но и. теория и практика показывают, что
«истинные» свойства твердых тел нельзя изучить, не создав их в виде
чистых и совершенных монокристаллов.
Так, высокая механическая прочность нитевидных
монокристаллов («усов»), близкая к теоретической, обусловливается их
высокой чистотой. Только чистые кристаллы, используемые в
оптической аппаратуре, работающей в коротковолновой области
спектра, не имеют фотохимической чувствительности. Присутствие
железа в тысячных долях процента в кристаллах-фосфорах
оказывает тушащее действие на люминесценцию. Чистыми должны
быть кристаллы, необходимые для исследования
сверхпроводимости, ядерного и электронного резонанса. Самые высокие
требования предъявляются к полупроводниковым монокристаллам.
Ничтожные примеси, даже в концентрации одной миллионной,
оказывают заметное влияние на полупроводниковые свойства
материалов.
Разработано весьма большое число методов очистки вещества.
Одни из них не сопряжены с изменением химического
состояния вещества. Сюда обычно относятся процессы перегонки,
возгонки (сублимация), испарения и фильтрации. К этой группе
методов очистки относится и метод зонной плавки, подробно
описанный ниже. Все они используются для очистки как простых
веществ, так и органических и неорганических соединений.
Вторая группа охватывает методы очистки растворов. Хорошо
растворимые в жидкостях твердые тела очищают путем
многократного растворения с последующей кристаллизацией. Сюда
относятся метод адсорбционного со©саждения из раствора, хрома-
тографические методы, метод экстракции несмешивающимся
растворителем.
Третью группу составляют некоторые «химические» методы,
основанные на различной химической активности примесей.
158
Часто элементы или соединения, которые нельзя очистить
непосредственно, переводят в какое-либо промежуточное
соединение. Последнее подвергают очистке и в последующем
восстанавливают до исходного элемента. Промежуточное соединение может
оказаться менее тугоплавким, химически не столь активным, как
исходные элементы. Очень часто в качестве промежуточных
соединений используются галогениды элементов.
Перегонка и возгонка. В методах перегонки и возгонки
используются разности давления паров примеси и основного вещества.
Практическое осуществление их («фракционная перегонка»)
производится во фракционных колонках. Пары кипящей жидкости
поступают в колонку, где происходит его конденсация с
последующим многократным испарением. В результате вещество с
наивысшим давлением пара доходит до вершины колонки, где оно
конденсируется и отбирается.
Эффективность перегонной колонки высока, она может
разделять жидкости с разностью температур кипения менее 1°С.
Более тугоплавкие вещества очищают путем многократной
возгонки или испарения в специальном устройстве. При выборе
надлежащего положения и температуры нагревателя возгоняемое или
испаряемое вещество перемещается вдоль трубки. Процесс ведуг
в токе инертного газа при атмосферном давлении, иногда в
вакууме.
Фильтрация. Вещество плавится в воронкообразном тигле с
очень маленьким донным отверстием. Шлак собирается на
поверхности, а расплав вытекает через спускное отверстие.
Фильтрацию лучше проводить в атмосфере водорода или инертного
газа. Процесс иногда повторяют несколько раз. Такой процесс
фильтрации предшествует введению веществ в трубки для зонной
плавки.
Очистка растворением. Элемент или соединение растворяют в
подходящем растворителе, после чего раствор очищают от
примесей. Простейший способ очистки—перекристаллизация.
Образующиеся кристаллы исходного вещества отделяют от раствора
фильтрованием.
Очень часто перед кристаллизацией элементы переводят .в
растворимое соединение. Из раствора его можно извлечь
электроосаждением или с помощью химической реакции.
Перекристаллизация широко используется для очистки как
неорганических, так и органических 'веществ. В основе метода
перекристаллизации лежит способность растущего кристалла
вытеснять примеси. Путем многократной перекристаллизации можно
довести вещество до высокой степени чистоты.
Хроматография. Существует несколько видов хроматографии:
адсорбционная, распределительная, ионообменная, газовая и др.
Адсорбционная хроматография основана на использовании
селективного взаимодействия основного вещества с какими-либо
другими веществами. Это взаимодействие позволяет проводить
159
разделение с использованием подобранных растворителей.
Растворитель должен обеспечивать «распределение» или
относительную адсорбцию растворенного вещества между неподвижной
твердой фазой и самим растворителем.
В случае распределительной хроматографии распределение
растворенного вещества происходит между двумя жидкостями, а не
между твердой и жидкой фазами, как в адсорбционной
хроматографии.
В качестве неподвижной фазы в ионообменной хроматографии
применяются ионообменные смолы, которые составлены из
крупных полимерных молекул, синтезируемых из органических
молекул с кислотными и основными боковыми группами.
Простым примером использования ионообменных смол
является получение дистиллированной воды.
В методе газовой, или парофазной хроматографии основную
роль играет распределение между подвижной газовой или
паровой фазой и неподвижной жидкостью. Неподвижная жидкость
удерживается в колонке на подходящем адсорбенте, а исходное
вещество поступает в колонку в виде пара и обычно в смеси с
инертным газом.
Адсорбционное осаждение. В методе используется большая
адсорбционная способность поверхности свежеобразованного
осадка. Осадок адсорбирует ионы «а своей поверхности, тем самым
выделяет их из раствора. Природа адсорбированных ионов
определяется природой осадка и состоянием раствора.
Жидкостная экстракция. Смесь двух веществ, находящихся в
одном растворителе, часто можно разделить, проводя экстракцию
другим растворителем, не смешивающимся с первым. Так, если
смесь хлоридов железа и алюминия в 6 н. соляной кислоте
встряхивать с этиловым эфиром, насыщенным этой же кислотой, то
хлорное железо переходит в слой эфира, а алюминиевый хлорид
остается в слое воды. Отделяя водный слой и повторяя несколько
раз экстракцию, можно добиться почти полного разделения.
Электролитические методы. Принцип этих методов разделения
или очистки главным образом металлов хорошо известен. В
электролит опускаются два электрода: катод — пластинка чистого
металла и анод—неочищенный металл. Электролитом служит раствор
ионов того же металла. При пропускании тока происходит раство-
рение анода и эквивалентное осаждение металла на катоде.
Вещества с более высоким потенциалом выделения остаются в
растворе.
Электролитические методы пригодны и для очистки растворов
от следов примесей. Примеси собирают либо на платиновой
фольге, либо на поверхности жидкой ртути, используемых в
качестве катода.
Химические методы: выщелачивание химическими реагентами,
реакции замещения. В последнем случае происходит вытеснение
160
одного элемента другим, регулируемое электроотрицательностью
и другими показателями.
Химическими можно назвать диффузионные методы, в которых
удаление примесей осуществляют нанесением на поверхность
твердого тела или приведением в тесный контакт с ним такого
вещества, которое при нагревании взаимодействует с
диффундирующими на поверхность примесями, образуя с ними химические
соединения. г
\ Специальные методы. Один из наиболее сложных процессов —
разделение изотопов. Чаще всего для этого пользуются масс-сепа-
ратором. Заряженные частицы разделяются путем отклонения —
разветвления их путей — в электрическом и магнитном полях,
которое строго следует отношению е/т.
Разделение изотопов проводят также с помощью
термодиффузии и методов центрифугирования.
Очистка обычных газов. При возможности очистку потока газа
лучше вести при помощи не химических, а физических процессов
во избежание его загрязнения.
§ 3. АППАРАТУРА ДЛЯ НАГРЕВА, ИЗМЕРЕНИЯ И ПОДДЕРЖАНИЯ
ТЕМПЕРАТУРЫ
Источниками нагрева в аппаратуре для выращивания
монокристаллов служат разнообразные печи сопротивления.
Наиболее широкое распространение получили трубчатые печи,
которые выпускаются 'промышленностью, но их легко смонтировать
и самим.
Огнеупорную трубу с намотанным на нее нагревательным
элементом в виде проволоки или ленты засыпают слоем
теплоизолирующего материала соответствующей толщины. Таким образом,
печь представляет собой многослойный цилиндр (рис. 99).
При расчете простой печи тепло печи Q складывается из
полезного тепла, вспомогательного и потери тепла за время /:
Фпечи ~ Фпол- ~Ь Увспомог. + Qn0TepJ> (VIII, 1)
где
Quo*. = 1&с (Тг-Тг);
Увспомог. — Zj§iCi U 2 ' 1/»
g — вес нагревателя, с — теплоемкость материала нагревателя,
gi— вес футеровки (металлического вкладыша), сг- — теплоемкость
материала, Т — температура;
<?п„Те, = —, ~ *^-TiL , —• (VIII, 2)
L — длина печи (трубы); Du D2l D^ D4— соответственно
диаметры печи, обмотки, слоя тепловой изоляции, рубашки; Х\, Лг, >>з —
1
2%х
In
D2
»i
+
1
2Х%
In
D3
D2
+
1
2Я3
In
£>4
^3
6 О. Г. Козлова
161
коэффициенты теплопроводности материала футеровки, обмотки
и изолятора.
По достижении необходимой температуры Г2, подвод мощности
(Р) к печи должен быть отрегулирован так, чтобы потери тепла
в точности возмещались подводимой мощностью. Практически
мощность, потребляемая печью, определяется Qn0Tep
P=-~Qno^ (VIII'3)
где k — переводной коэффициент.
Потребляемая мощность тем меньше, чем медленнее
осуществляется разогрев и чем лучше термоизоляция печи. Тепловой поток,
идущий от нагревателя внутрь печи, меньше обратного. Величина
его Q* равна
2nlL (T2 — 7\)
Q* =
In—^
Удельная поверхностная мощность нагревателя W (мощность,
рассчитанная на 1 см2) равна
Dxln
#i
где nDL — внутренняя поверхность трубы.
Для проволочного нагревателя
w= ЬЖ^Ж, ■ (viii, 5)
я£2 In d
где d — диаметр проволоки, Л — шаг намотки. Имеются таблицы
h
рассчитанных поправок —.
d
Чем больше W, тем в более жестких условиях печь способна
работать.
Далее можно приступить к расчету всех других параметров:
P="L[Kem]f (VIII, 6)
н
где U — напряжение, поступающее из трансформатора, R —
сопротивление;
d = Л/ 4 ' 1Q5pP2 [мм], (VIII, 7)
162
шт
где d — диаметр обмотки, р — удельное сопротивление.
'=V^r[Mh (v,"'8>
где / — длина проволоки.
Обычно, определив мощность печи, выбирают материал. Выбор
материала для нагревательного элемента определяется
температурой, необходимой для эксперимента. Для получения температур
до 1250°С можно пользоваться нихромом, до 1500°С —платиной,
а до 2500°С — молибденом или вольфрамом. Однако работать на
максимальных режимах не рекомендуется. Поскольку молибден и
вольфрам при нагреве легко окисляются, то их можно
использовать только в 'инертной атмосфере или вакууме. Питание для них
подается через мощный понижающий трансформатор.
Трубы, приготовленные из кварца, годятся для нагрева до
1100°С; до 1500°С можно применять алюмосиликатные трубы; до
1900°С служат трубы из чистого глинозема, а до 2200°С —из
двуокиси циркония и двуокиси тория.
Наматывается лента на трубу либо вручную, либо на токарно-
винторезном станке. После нанесения обмотки ее обмазывают
огнеупорной смесью, предохраняющей витки от наползания друг
на друга в процессе нагрева. При изготовлении временных печей
для крепления и изоляции обмотки можно ограничиться
асбестовой лентой или асбестовым шнуром.
Чтобы облегчить процесс намотки на поверхности огнеупорной
трубы, предварительно прорезают винтовой желоб.
Для наблюдения за процессом можно воспользоваться
прозрачной кварцевой трубой, и тогда нагревательный элемент вставляют
в оболочку из стеклянного или кварцевого волокна. Выпускаемые
промышленностью стеклянные печи пригодны для использования
в температурном интервале до 350°С, а кварцевые — до 650°С.
Во избежание неравномерного нагрева печи шаг намотки
должен быть небольшим, а намотка — равномерной.
Существуют трубчатые печи сопротивления других типов: си-
литовые, графитовые. В них нагревательным элементом служит
сама труба. Силитовые печи могут работать на воздухе до
температуры 1350°С. Графитовые печи в бескислородной среде
выдерживают нагрев до 2600°С. Питание к таким печам подводят через
водоохлаждаемые латунные или стальные наконечники.
В другом типе печей нагревательный элемент представляет
собой огнеупорный стержень с намотанной проволокой или лентой.
Такими элементами, собранными в обоймы, обкладывают
разогреваемый объем. В качестве материала для стержней наиболее
пригоден пирофиллит. В зависимости от обстоятельств
нагревательные элементы можно располагать внутри или вне печной камеры.
Теплоизоляция печей обеспечивается материалами ячеистой
структуры (здесь используется низкая теплопроводность непо-
6* , 163
движного воздуха); огнеупорные кирпичи, брикеты и гранулы из
асбестовой ваты или мелкой огнеупорной щебенки.
Роль теплоизоляторов играют также отражатели тепла в виде
металлических поверхностей, подвергнутых полировке или
покрытых алюминиевой фольгой. nv,mra пгпбрннп
В ряде случаев используют вакуумные рубашки, особенно
пригодные там, где требуется обеспечить быстрый нагрев и
устойчивое поддержание высоких температур. ,^hpnaTvDH B
Естественное распределение температуры в
трубчатых печах такое, что в центральной части она достигает
Рис. 99. Схема
печи И. В. 06-
реимова и
Л. В. Шубни-
кова: / —
внутренний
фарфоровый цилиндр,
обмотанный ни-
хромоовой
проволокой; 2 —
слой
теплоизолирующей ин-
- фузорной
земли; 3 — толстая
медная трубка
(вкладыш); 4—
медный диск;
5 — пробирка
1
х
31
LL
,/..
С
х
\л-ъш&т?т&к&s
~чгу
JX
^
• • •
■ i
i i
i i
\
Рис. 100. Зонная плавка
соединения с летучей компонентой: 1 —
нагреватель источника; 2—
нагреватель слитка; 3 — зонный
нагреватель; 4 — источник летучей
компоненты
наибольшей величины, на концах - наименьшей. Чтобы
подравнять температуру, вводят дополнительный нагрев на концах печи
или делают неравномерный шаг намотки вдоль длины печи,
иногда вводят местную дополнительную экранировку. В этих целях
готовят секционированныепечи. На рис. 100 дана схема
секционированной трубчатой печи с *0™л™телънъ™3™™™^
гревателем и ее температурный профиль. На рис 101 показаны
типы дополнительных (зонных) нагревателей. Иногдаi * целях
выравнивания температуры вставляют металлический вкладыш с
высокой теплопроводностью (см. рис. 99).
Печи сопротивления получили широкое распространение ввиду
их надежности, простоты оформления и охвата широкого диапа-
пня температур от комнатной до 3000 С.
Недостатков печей накала является большая инерционность
(для их охлаждения требуется около двух часов), кроме того с
их стенок происходит загрязнение кристалла, следует считаться с
их плохой воспроизводимостью. „„„.„„„„„„в
Для более высокого нагрева пользуются радиационной
печью Ее можно сделать в виде цилиндра (в идеальном случае
Гвиде сферы), полированные стенки которого хорошо отражают
J 64
падающее на них излучение. Разогрев обеспечивают
нагревательным элементом в виде кольцеобразной обоймы из кварцевых или
пирофиллитовых стержней, на которых натянута проволока. 06-
\>>1>)>>>}>>ТТТ*
7ZZZZZZZZZZZL
« • • • • •
y&>S
а
^>w^
в
ШШШШ2Ш2^^ШШ^^^Ш^^2&
Рис. 101. Типы зонных нагревателей: а — трубчатая печь; б —
жесткая спираль из упругой проволоки; в — спиральный
нагреватель в пирофиллитовом или асбестовом патроне; г — наружный
нагреватель с отражателем для создания зоны; д — ленточный
нагреватель; е — нихромовые ленточные нагреватели жесткой
формы, последовательно соединенные
разец и термопару размещают вблизи центра цилиндра. Такая
печь имеет низкую теплоемкость и высокую чувствительность к
^изменению мощностей.
165
Существует много разнообразных промышленных печей для
высокого фагрева в вакууме. Одна из таких печей,
используемая для выращивания монокристаллов флюорита, описана
в § 11 настоящей главы.
В последние годы все чаще (в методах зонной плавки и др.)
используется аппаратура с индукционным, или
высокочастотным нагревом. При быстром изменении магнитного поля,
пронизывающего нагреваемый объект, на поверхности последнего
наводятся индукционные токи. Индуцированные токи протекают
преимущественно вдоль поверхности объекта и передаются вглубь
лишь за счет теплопроводности материала.
Индуктор получает высокочастотный ток, обеспечивающий
высокую концентрацию энергии в каком-то участке объекта. Стенки
нагревателя не обладают инерцией. В качестве тигля
используются металлы с хорошей теплопроводностью.
Индукционный, или высокочастотный нагрев в аппаратурном
оформлении не сложнее печей сопротивления. Преимущество
такого нагрева состоит и в том, что опасность загрязнения материала
сводится к минимуму.
Во всех системах необходимо надежное измерение
температуры, которое давало бы гарантию успеха в деле выращивания
монокристаллов.
Для этой цели существует много приборов: жидкостные
термометры (простые или контактные), термометры сопротивления,
термопары, пирометры.
Действие жидкостных термометров основано на
свойстве жидкости расширяться при нагреве. В интервале измеряемых
температур от —30 до +600°С используется ртуть, от —300 до
+ 100° — толуол, от —80 до +80° — этиловый спирт, от —80 до
+ 300° керосин, от +32 до +2000°С —галлий.
Принцип действия ртутного контактного термометра состоит в
следующем. При нагревании ртуть, расширяясь, поднимается по
трубке, касается подвижного контакта и замыкает цепь реле,
отключающего нагреватель. При остывании опускающаяся ртуть
размыкает цепь реле и включается электронагреватель. Для
изменения температуры достаточно поднять или опустить подвижный
контакт в капиллярной трубке терморегулятора. .
Действие термометров сопротивления основано на
зависимости электросопротивления от температуры. Эти
термометры определяют температуру с большой точностью и
используются с измерительными устройствами типа моста Уитстона.
"Используемые металлы должны иметь высокий температурный
коэффициент удельного сопротивления а = . Для большинства
металлов а = 4-10~3 1/гр, но на величину а влияют примеси.
Желательно, чтобы зависимость сопротивления от температуры
выражалась монотонной кривой (лучше — линейной). Металл должен
быть химически стойким и сохранять свои характеристики неиз-
166
менными. Лучшим остается платина, помимо дороговизны ее
недостаток состоит в невозможности использования ее в
восстановительной среде (платина становится хрупкой). В интервале от
—40' до 600°С
Rt = R0(l + At + Bt*), (VIII, 9)
где Ro — сопротивление термометра при 0°С, Rt — сопротивление
при соответствующей температуре t, Л, В — постоянные,
полученные при градуировке.
Искомая температура t определяется по формуле
t = tD + а—(——1\ (Vin, ю)
р юо V юо ) ■
где tp — «платиновая» температура, определяемая по
соотношениям:
f = Rt-R0
б — величина, связанная с А и В зависимостью
« 104В
~~ А+ 100 Б"
Градуировка термометров (и термопар) производится по ре-
перным точкам, основными из которых служат: 1) 0° — точка
плавления льда, 2) 100° — температура кипения воды, 3) 444,6° —
температура кипения серы, 4) 960,8° — точка плавления серебра,
5) 1063°С — точка плавления золота.
Измерение более высоких
температур производится с помощью
оптического пирометра (по излучению
идеально черного тела).
Наиболее широкое применение
получили термопары. Они
механически прочнее и проще в работе. Дей- Рис 102 термопара
ствие их основано на возникновении
э.д.с. в местах контакта (спая) двух
проводников различного состава и э.д.с. в проводнике, концы
которого поддерживаются при разных температурах (рис. 102).
Величина э.д.с. определяется природой металла и разностью температур
между холодным и горячим спаями и не зависит от длины
проводов. Для температур существуют градуированные таблицы или
кривые. Необходимо, чтобы температура свободных концов была
равна той, при которой производится градуировка термопар. При
градуировке холодный спай должен поддерживаться при
температуре 0° С.
Вообще говоря, для измерения температуры можно
воспользоваться любой парой металлов, однако практически важным ус-
167
ловиям — неизменности показаний во времени и
воспроизводимости— удовлетворяют лишь немногие из них. Желательно также,
чтобы величина возбуждаемой э.д. с. зависела от температуры
линейно.
Широко используются термопары хромель-алюмелевые (ХА),
пригодные для измерений температур не выше 1100°С. Хромель-
сплав, состоящий из 90% никеля и 10% хрома; в состав алюмеля»
сплава входит 90% никеля, 2% алюминия, 1% кремния и 2%
марганца. Хромель-алюмелевые термопары характеризуются высокой
механической прочностью, но малой химической стойкостью.
Чувствительность их составляет 4 мв на 100°С. Хромель-капелевые
термопары (ХК) используются при температуре не выше 700°С
(капель—медь с добавкой большого количества никеля). Они
характеризуются большой термической э.д.с. и, следовательно,
большой чувствительностью (7 мв на 100°С).
Сочетание благородных металлов представляет собой более
устойчивый материал в работе, благодаря чему ими чаще
пользуются при точных измерениях. Платину применяют в паре спла-
тинородиевыми сплавами, содержащими от 1 до 20% родия. Пла-
тина-платинородиевой термопарой (ПП) пользуются в интервале
температур от 600 до 1600°С. У них небольшая чувствительность
(1 мв на 100°С), и с ними нельзя работать в восстановительной
среде.
При температурах выше 1600°С пригодны лишь сплавы
вольфрама, молибдена, титана и тантала. При точных измерениях
температуру холодного спая следует тщательно контролировать.
Концы проводов термопар должны быть изолированы друг от
друга керамиковой или кварцевой трубочкой, во избежание
паразитных токов. В таких чехлах они обычно вводятся в печи. Для
ввода термопар в стеклянные камеры, в стенки последних ввари:
ваются часто коварные трубки (коэффициенты термического
расширения ковара и стекла равны).
Для приближенного измерения возбуждаемой э. д. с.
пользуются чувствительным гальванометром. Термопару соединяют
последовательно с сопротивлением и микроамперметром.
Стандартным термопарам обычно придается градуированный гальванометр,
показания которого отсчитывают непосредственно по
температурной шкале. Таким прибором может также служить любой
достаточно чувствительный микроамперметр, последовательно с
которым включено соответствующее сопротивление.
Для более точного измерения э. д. с. следует пользоваться
потенциометрами, специально приспособленными для использования
с термопарами и дающими отсчет непосредственно в
температурной шкале. Можно проводить измерения и с помощью любого
другого потенциометра, переводя его показания в температурные
значения на основании градуировочной кривой, построенной по
стандартным таблицам. Показания приборов можно также пода-
168
вать на записывающее, устройство и таким образом непрерывно
регистрировать изменение температуры во времени.
Термопарные спаи легко изготовить в лабораторных условиях.
С этой целью зачищенные концы проводов скручивают вместе и,
окунув предварительно в паяльный флюс, сплавляют в пламени.
При сплавлении платиновых проволок обходятся без флюса.
Следует иметь в виду, что в термопарной цепи по возможности
должны быть исключены соединения разнородных металлов.
Для высокотемпературных измерений можно воспользоваться
оптическим пирометром. Действие его основано на
изменении цвета излучения в зависимости от температуры. Ниже
500°С излучение находится за пределами видимости; тусклый
красный цвет соответствует 600; красный — 700; светло-красный — 800;
вишнево-красный — 900; оранжево-красный— 1000; оранжевый —
100; белое свечение — выше 1600°С. В большинстве случаев цвет
исследуемого тела сравнивают с эталоном. Для этой цели
изготавливаются специальные пирометры с исчезающей нитью. В
последнее время делаются попытки использования в этих целях
полупроводников (германия, кремния), сопротивление которых
изменяется с температурой.
В практике выращивания кристаллов особое значение
придается поддержанию постоянства температуры печи.
Стабильность температуры наряду с другими условиями
(максимальная ±0,5°С) обеспечивает монокристаллический рост,
совершенство кристалла и его стехиометрический состав.
* Колебания температуры печи могут вызываться непостоянст-
юм питающего напряжения, изменениями температуры
окружающей среды, повреждениями обмотки или теплоизоляции печи.
Если источник питания стабилизирован, то тем самым колебания
температуры в печи в зависимости от типа стабилизатора не
выходят за пределы от ±5 до ±10С. В лучших стабилизаторах
выходное напряжение второго трансформатора 'непрерывно и
автоматически корректируется посредством специальной схемы.
Для обеспечения более высокой точности поддержания
температуры применяют следящие системы — устройства, в которых
данные о температуре печи передаются питающему элементу. Если
температура печи ниже заданной, то устройство усиливает подачу
энергии; в обратном случае вся энергия или часть ее снимается.
В качестве контрольного элемента могут быть использованы
термометр сопротивления и термопара. Эффективность регулирования
температуры зависит от теплоемкости печи. Печь с очень большой
теплоемкостью в малой степени реагирует на изменение
температуры окружающей среды и более заметно, но медленно реагирует
на изменения силового питания. Лучше всего такая печь подходит
Для относительно низких температур. Печь с очень малой
теплоемкостью подвержена воздействию окружающей среды, но зато
обладает быстрой реакцией. Она более пригодна для
высокотемпературных процессов.
169
Тигли
Сосуды, заключающие расплав, называются тиглями,
лодочками, иногда изложницами. В ряде случаев выращиваемый из
расплава монокристалл принимает форму заключающего его сосуда.
Материал тигля должен отвечать ряду требований: 1)
кристаллизуемое вещество не должно при соприкосновении с материалом
тигля давать химической реакции; 2) вещество не должно
прилипать к стенкам сосуда; 3) материал тигля не должен
размягчаться при температуре, превышающей примерно на 100°С
температуру плавления кристаллизуемого вещества; 4) теплопроводность
тигля желательна по возможности большая, но она не должна
превышать теплопроводность кристаллизуемого вещества; 5)
упругость паров материала тигля должна быть в условиях
кристаллизации не очень высокой, в противном случае срок службы его
будет исчисляться немногими часами; 6) чистота тигля не
должна уступать чистоте кристаллизуемого вещества.
Наиболее употребительными материалами для изготовления
тиглей (изложниц) служат плавленый кварц, стекло, платина,
графит, окись алюминия, тугоплавкие окислы (окись бериллия, окись
магния, двуокись циркония, двуокись тория), железо, молибден и
другие тугоплавкие металлы, огнеупорные материалы. Наиболее
распространен в качестве тигельного материала плавленый
кварц. Он инертен к большей части элементов и соединений.
Исключение составляют основные окислы и фториды. Кварц вы- N
держивает нагрев до 1200°С. Исключительно малый коэффициент
расширения обеспечивает его хорошую термическую стойкость.
Толстостенные .кварцевые тигли выдерживают давление до 100 атм.
Кварц вообще очень чистый материал; лучшие сорта содержат
лишь десятитысячные доли 'процента натрия, кальция, алюминия,
фосфора, мышьяка, бора и иногда железа, меди и кобальта.
Поверхность кварца легко сделать очень чистой и гладкой.
Важнейшее преимущество плавленного кварца состоит в том, что
стеклодув может придать ему самую разнообразную форму, благодаря
чему возможно обеспечить при необходимости полную
герметизацию всей системы.
Кварц не взаимодействует со всеми обычными кислотами, за
исключением плавиковой, и сильно взаимодействует с
концентрированными щелочами, поэтому в контакте со щелочными
веществами его применять не следует. Некоторые расплавленные
металлы сильно прилипают к кварцу, однако смачивание металлов
можно ослабить, если кварц покрыть слоем сажи. Так, кварцевую
лодочку часто покрывают сажей, выдерживая ее в коптящем
пламени бензола или парафинового воска. Аналогичные результаты
можно получить /ополаскиванием трубки в ацетоне или спирте с
последующим ее нагреванием до 600—700° С. Органическое
вещество, сгорающее при ограниченном доступе воздуха, образует
тонкий, но очень стойкий и прочно удерживаемый слой углерода.
170
Помимо этого для футеровки кварцевых тиглей .применяют
графитовый порошок. Любое расширение передается слою графита,
легко деформирующемуся вследствие своей мягкости.
Стекло тоже широко распространенный тигельный материал.
Ему легко придать нужную форму. Из него можно изготовлять
полностью закрытые сосуды. Стекло прочнее кварца, но
размягчается при более низкой температуре. Боросиликатные стекла,
например пирекс, из которых обычно изготовляют лабораторную
аппаратуру, размягчаются уже при температуре около 600°С.
Самый большой недостаток стекол состоит в их значительной
загрязненности, некоторые из примесей переходят в обрабатываемые
вещества. Кроме того, при нагревании стекла из него выделяется
вода. Боросиликатное стекло, содержащее 96% двуокиси кремния
и почти 4% окиси бора, называется викором. По своей прочности
и теплостойкости оно родственно кварцу, но имеет более низкую
температуру размягчения.
Платина из числа благородных металлов применяется чаще
других. Ее преимущество заключается в термостойкости и
механической 'прочности. Платину можно нагреть на воздухе до 1500°С
без какого-либо разрушения. Она инертна к галогенидам и
окислам, но не в восстановительной атмосфере. Платина
взаимодействует с большей частью расплавленных металлов, а также с
серой, селеном, теллуром, фосфором, мышьяком и сурьмой в
расплавленном состоянии.
В качестве тигельного материала очень удобен графит. Он
инертен ко всем расплавленным металлам, за исключением
алюминия, бора, кремния и германия. В отсутствие кислорода он
применим вплоть до 2500°С. Графит очень удобно нагревать индукци-
гонно или непосредственно током. Он обладает высокой
термостойкостью. Пористость графита зависит от способа производства.
Однако выпускаемый в настоящее время графит вакуум не удер-
' живает.
Окись алюминия (глинозем) используется для нагрева до
1850°С. Изготавливают вполне вакуумноплотные сорта с очень
гладкой поверхностью. По механическим свойствам глинозем
уступает кварцу, в частности, имеет более высокий коэффициент
теплового расширения. Чистота большей части сортов технической
окиси алюминия составляет около 99,8%. Глинозем стоек в
отношении металлов и может быть использован в контакте со
щелочными металлами. Будучи устойчив по отношению ко всем
кислотам, легче взаимодействует с едкими щелочами. С окислами
металлов окись алюминия взаимодействует 'при температуре выше
800°С. Окись алюминия более пориста, чем кварц.
В настоящее время широко применяют в качестве тигельного
материала тугоплавкие окислы: окись бериллия, окись
магния, двуокись циркония и двуокись тория. Они выдерживают
более высокий нагрев, чем окись алюминия, некоторые из них до
2400°С. По сравнению с окисью алюминия они более пористы, осо-
171
бенно окись бериллия. По способу приготовления изделий,
механическим и термическим свойствам и чистоте все они близки к окиси
алюминия. Окись бериллия (сладкозем) чрезвычайно ядовита,
поэтому с ней следует обращаться осторожно.
В последние годы в качестве тигельных материалов
используют карбиды, нитриды и бориды. Но эти материалы проходят еще
стадию испытаний.
Так, нитрид бора BN — вещество со структурой графита
характеризуется и аналогичными ему свойствами. Карбид бора В4С
плавится при 2500, но окисляется ниже 1000°С и взаимодействует
с оасплавленными щелочами и металлами группы железа и
платиной. Тиглями из карборунда — карбида кремния SiC — обычно
пользуются металловеды, однако стойкость этих тиглей к
химическому воздействию невысока.
§ 4. ВЫРАЩИВАНИЕ МОНОКРИСТАЛЛОВ ИЗ РАСПЛАВОВ
Кристаллизация из расплавов имеет некоторые общие черты с
кристаллизацией из растворов, если первые представляют собой
поликомпонентные системы. Такие системы можно рассматривать
как растворы, кинетика кристаллизации из которых будет
определяться условиями подвода строительного материала к растущему
кристаллу и условиями отвода тепла от поверхности фазового
перехода. В случае, когда расплав представляет собой однокомпо-
нентную жидкую систему интересующего нас вещества, проблемы
транспорта материала к растущему кристаллу не возникает и
кинетика кристаллизации целиком определяется условиями тепло-
отвода.
Все методы выращивания кристаллов из расплавов
основываются на выводах из кинетической теории роста кристаллов. Рост
кристаллов возможен только тогда, когда вблизи поверхности
кристалла поддерживается постоянный градиент температуры
(111,22), что подразумевает наличие в кристаллизационной
установке нагревателя и холодильника.
Иначе говоря, после возникновения зародыша скорость роста
кристалла определяется лишь скоростью отвода скрытой теплоты
кристаллизации от поверхности раздела между твердой фазой и
расплавом. Тепло отводится либо через зародыш к какому-нибудь
источнику поглощения тепла, либо поглощается переохлажденным
расплавом. В последнем случае рост происходит очень быстро.
Используемое в практике кристаллизации уравнение теплового
баланса имеет вид
Ql = Q«^-QnoTep=Of (VIII, И)
где Qi — подводимое тепло, g — вес вещества, Qплg — скрытая
теплота кристаллизации.
172
Методы выращивания кристаллов из расплавов используются
для тех веществ, растворимость которых в практически
применяемых растворителях мала или имеет нулевой т. к. р., а также для
веществ, метастабильная область растворов которых узка.
Однако метод выращивания из расплавов неприменим для веществ,
обладающих высокотемпературными полиморфными
модификациями, также для веществ, расплавы которых имеют узкую мета-
стабильную область и не допускают значительных
переохлаждений, и частично для веществ, плавящихся с разложением.
Следует иметь в виду, что однородность кристаллов,
полученных из расплавов, вообще говоря, ниже, чем у кристаллов,
выращенных из растворов. Наиболее распространенными дефектами в
них являются напряжения. В то же время скорости роста
кристаллов из расплава в десятки раз превышают скорости
кристаллизации из растворов, что очень важно для промышленных условий.
Наблюдение при помощи микроскопа процессов роста
кристаллов из расплавов
I Процессы роста кристаллов из расплава легко наблюдать при
помощи микроскопа, на предметном столике которого помещается
препарат с каплями небольших размеров легкоплавких
органических веществ: салола, тимола, нафталина и многих других, а
также некоторых неорганических солей.
Очень интересны опыты с кристаллизацией салола, впервые
Проведенные А. В. Шубниковым. На чисто вымытое с мылом, а
затем высушенное предметное стекло насыпается небольшая
порция салола и расплавляется (температура плавления 42°С) на
пламени спиртовки или газовой горелки. Получающаяся капля
должна быть площадью около 0,5 еж2. Опыт с кристаллизацией
можно проводить многократно с одним и тем же препаратом.
Ра-сплавление надо вести осторожно, во избежание
растрескивания стекла. Для этого надо все время перемещать его над
пламенем спиртовки или горелки. Препарат равномерно разогревается
до полного расплавления всей порции веществ, после чего ему
дают несколько охладиться. Чтобы не произошла
преждевременная кристаллизация в момент установки препарата на столик
микроскопа, его кладут на листок бумаги с вырезанным в сере-
Дине круглым отверстием или на две спички.
Расплав не действует на поляризованный свет и поле зрения
остается темным. Он способен сильно переохлаждаться и без
внесения затравки самопроизвольно не кристаллизуется. Для
возбуждения кристаллизации достаточно прикоснуться к поверхности
апли иглой, которой предварительно коснулись кристаллов
салола. Если капля перегрета и не остыла, то затравки, внесенные
иглой, будут тут же расплавляться и кристаллизация не пойдет.
^Появившиеся в капле ромбовидные кристаллы сильно двупрелом-
173
ляют, в скрещенных николях просветляются и имеют яркую
интерференционную окраску. С разрастанием кристалла и увеличением
его толщины интерференционная окраска повышается. До
некоторой степени охлаждения препарата вырастающие кристаллы
остаются подобными самим себе. При дальнейшем росте вершины
ромба притупляются новыми гранями. Внося затравки через
разные промежутки времени (от 1 до 5 мин) после расплавления,
можно видеть, как влияет степень переохлаждения на форму
образующихся кристаллов. При малом переохлаждении растущие
8 10 6 5 Z
■1276
Рис. 103. Схема установки для микроскопического наблюдения
роста кристаллов из расплава:
I—печь; 2— фарфоровый цилиндр; 3— намотка печи из ни-
хромо»вой .проволоки; 4 — асбестовая прослойка; 5 —
прослойка из огнеупорной глины; 6—тигель; 7 — фарфоровая
трубка; 8 — автотрансформатор; 9 — термопара; 10 — защитная
трубка; // — милливольтметр МП-28; 12 — бинокулярный
микроскоп; 13 — лампа 20 вт; 14 — стеклянный диск; 15 — мотор
(220 об/мин)
кристаллы принимают ромбовидную форму, а при сильном —
очертания кристаллов напоминают форму «лодочки». В
небольшой капле переохлажденного расплава можно наблюдать, как от
выросших крупных кристаллов отрываются микроскопические
зародыши и, тут же разрастаясь, поднимаются -к поверхности капли
и быстро отплывают от первородившегося кристалла в разные
стороны.
174
На практических занятиях по росту кристаллов можно
пользоваться особой установкой для микроскопического изучения
роста кристаллов из расплава. Такая установка (рис. 103) может
■быть смонтирована студентами без особых затруднений. Ее
основную часть составляет печь (/), изготовленная из фарфорового
орсуда цилиндрической формы. Высота сосуда 100 мм, диаметр —
90 мм. Толщина стенок — 2 мм. В середине печи находится
фарфоровый цилиндр (2) длиной 50 мм, диаметром 20 мм, с
толщиной стенок 2 мм. Цилиндр обматывается нихромовой проволокой
(3) диаметром 0,6 мм. При пропускании тока проволока
раскаляется, создавая нужную температуру внутри полого цилиндра.
Все пространство между нагревательной частью и корпусом
печи наполняется асбестовой крошкой (4), служащей изолятором
•печи от окружающей среды. Полый цилиндр с намотанной
нихромовой проволокой обмазан небольшим слоем огнеупорной
глины (5), прикрывающей проволокуг В середине печи
располагается фарфоровый тигель (6), в котором происходит
расплавление солей. Выше нагревательного цилиндра помещается
фарфоровый цилиндр приблизительно такого же диаметра (7) во
избежание загрязнения тигля. Сверху печь закрывается асбестовым
кругом с отверстием, не меньшим диаметра внутреннего цилиндра.
Печь, применяемая в данной установке, предназначена для
создания высоких температур — до 1000°С. В соответствующей
таблице из книги В. С. Веселовского и И. В. Шманенкова
«Нагревательные приборы лабораторной практики» находим, что для
обеспечения искомой температуры (1000°С) при заданных
размерах цилиндра напряжение, приходящееся на 1 м такой проволоки,
равно 26 в. Если исходное напряжение .равно, например, 40 в, то
необходимая длина нихромовой проволоки—1,54 м (из
пропорции 26 в: 1 м = 40 в:х м). Для того чтобы проволока не спадала
с цилиндра, в верхней и нижней частях его делаются углубления.
:' Небольшие кончики (30 мм) нихромовой проволоки выводятся
наружу через два отверстия в корпус печи и посредством
стальной проволоки соединяются с автотрансформатором (§). Выводы
-нихромовой проволоки и места соединения со -стальной
проволокой изолируются с помощью фарфоровых колечек.
Для измерения температуры с целью регулирования процессов
кристаллизации служит термопара ПП (9).
Для точного измерения термопара предварительно
градуируется. Градуировка может быть двоякая: путем измерения точек
плавления каких-либо веществ (льда, свинца и других) и путем
сравнения 'показаний милливольтметра образцовой и исходной
.термопар. Термопара вводится в центр печи через боковое
отверстие в корпусе. Спай термопары касается обмотки печи. Чтобы
:спай не загрязнялся и для большей устойчивости термопары,
последняя вводится внутрь печи через фарфоровую трубку (10) и
подключается к милливольтметру МП-28 гр ПП (11), с помощью
которого определяется температура.
175
Основное затруднение в использовании микроскопа для
непосредственного наблюдения высокотемпературных процессов
заключается в том, что малое фокусное расстояние объективов
поляризационных и медицинских микроскопов не позволяет
защитить оптику от действия высоких температур. Поэтому в данной
установке по предложению И. Н. Аникина используется
бинокулярный микроскоп (12) с фокусным расстоянием 70 мм. Через
один тубус производится непосредственное наблюдение за
процессом кристаллизации или фотографирование, через другой —
пропускается свет от лампы в 20 вт, служащей для освещения
расплава (13).
Для предохранения объектива бинокуляра от воздействия
температуры и паров солей между объективом и печью вставляется
стеклянный диск (14) толщиной 2 мм и диаметром 20 см, который
медленно (2 об/мин) и равномерно вращается при помощи
мотора (15). Мотор соединяет со стеклом небольшой шкив, который
приклеивается к стеклу клеем БФ-2. Склеивание производится
при температуре около 200°С.
Включение собранной установки производится в следующем
порядке: 1) выводы нихромовой проволоки подключаются к
клеммам автотрансформатора; 2) автотрансформатор включается в
сеть с напряжением; 3) поворотом ручки автотрансформатора
напряжение постепенно доводится до 40 в.
Одновременно термопара подключается к милливольтметру.
С помощью этой установки можно произвести пробные опыты,
например, с бромистым калием. Тигель наполняется на 3/4 солью
и помещается в печь. При достижении точки плавления (730°С)
соль плавится, в микроскопе в это время наблюдается однородный
расплав. Освещение должно быть не очень сильным (при
объективе 7х и окуляре 6х).
После расплавления всей соли температура медленно
снижается. Кристаллизация начинается в верхней части тигля
(наиболее холодной) при температуре 700°С. В бинокулярном
микроскопе наблюдается кристаллизация дендритов, сливающихся
впоследствии и образующих поликристалл ячеистого строения.
Таким образом, собранная установка позволяет
непосредственно наблюдать за процессами кристаллизации, с ее помощью
можно проследить зарождение и рост кристаллов, процессы
плавления, измерять скорость роста различных граней кристаллических
веществ.
Методы вытягивания монокристаллов
Методы вытягивания из расплава берут начало от работ
Р. Наккена, С. Киропулоса и И. Чохральского. С помощью их
можно получить весьма совершенные кристаллы как по качеству,
так и по размерам. Так, метод Киропулоса позволяет достаточно
легко выращивать кристаллы ряда щелочных галогенидов ШаО,
176
NaBr, KC1, KBr, KI, RbCI, LiF). Методом Чохральского получают
монокристаллы германия и кремния, выращивают слитки таллия,
бромида и йодида таллия, бромида цезия, а также ряда
органических веществ (например нафталина). Этот метод эффективно
используется при .выращивании монокристаллов металлов:
висмута, олова, цинка, кадмия, алюминия, и многих
интерметаллических соединений: сурьмянистого индия, сурьмянистого галлия,
станнида магния и теллуристого висмута.
Качество кристалла, выращиваемого по этим методам, зависит
от ряда условий: стабильности температуры, скорости и
равномерности ее снижения, чистоты исходного вещества, качества
затравки, характера контакта между холодильником и затравкой,
Рис. 104. Схема установки для выращивания кристалла
по методу вытягивания:
/—электрическая печь; 2 — термопара; 3—электронный
терморегулятор; 4 — тигель; 5—вращающийся
холодильник; 6 — электродвигатель для вращения холодильника;
7—уравновешивающий груз; 8—нагревательный элемент
печи; 9 — ртутный подвижный контакт; 10 — реле
скорости циркуляции воды в холодильнике и т. д. Ряд условий не
поддается предварительному учету и выявляется только на
практике. При неудачном подборе скорости снижения температуры и
скорости циркуляции воды в холодильнике кристалл вырастает
мутный. При небрежно заправленной затравке может вырасти
поликристалл.
На рисунке 104 представлена схема простейшей установки,
сделанной в практикуме «по росту кристаллов на физическом
факультете МГУ, для выращивания монокристаллов по методу
О. Г. Козлова
177
Киропулоса. Электрическая печь (/) с нихромовым
нагревателем рассчитана на температуру 1000°С. Для регулирования
измеряемой хромель-алюмелевой термопарой (2) температуры
используется электронный терморегулятор (3). Исходное вещество
плавится в тигле (4), установленном на специальной подставке
внутри печи. Установка снабжена вращающимся холодильником
(5) ,в виде полого латунного цилиндра с .вмонтированной в него
трубкой (6), охлаждаемой проточной водой. Холодильник
подвешен на тросе и через блок уравновешен грузом (7), что позволяет
очень плавно перемещать холодильник по вертикали. Также имеет
важное значение приспособление для вращения холодильника
вместе с растущим кристаллом. При этом условии
неравномерности температурного поля вокруг растущего кристалла
сказываются в меньшей степени. Вытягивание вращающейся затравки также
происходит плавно. Вращение благоприятствует поддержанию
однородности расплава, что особенно важно при выращивании
легированных кристаллов. Однако вопрос о том, можно ли
достичь выращивания монокристаллов высокой степени чистоты при
таком вращении, ставится под сомнение.
Описанная установка 'применяется для выращивания
кристаллов, щелочных галогенидов. Так как кристаллы КВг, Nal вблизи
температуры плавления заметно разлагаются с выделением
ядовитых паров брома и йода, кристаллизационная установка
должна работать в вытяжном шкафу. Исходное вещество для опыта
берется в различном виде в количествах, в 2—3 раза больших,
чем вес кристалла, который желательно получить.
Очень часто выращивание кристалла кончается неудачей, если
не соблюдаются надлежащим образом необходимые условия
опыта. Прежде всего разогревание печи не должно быть слишком
медленным. Затем по достижении температуры плавления
пользуются терморегулятором. Его режим работы задается с таким
расчетом, чтобы температура была на 30—40° выше температуры
кристаллизации исходного вещества. Этот перегрев необходим для
того, чтобы устранить случайные центры кристаллизации и
оплавить поверхность кристаллической затравки. Затем несколько
снижают температуру для того, чтобы начался рост монокристалла.
Однако затруднительно вполне точно указать температурные
условия. В каждом конкретном случае они устанавливаются опытным
путем. Начало роста кристалла можно заметить по появлению
вокруг затравки «серебристого кольца». Очень важное значение
для успеха опыта имеет правильное приготовление
кристаллической затравки и ее крепление к торцу холодильника (рис. 105).
В качестве затравки берут спайный осколок из готового
кристалла небольших размеров. Она плотно прикрепляется к торцу
холодильника с помощью проволоки, либо жидкого стекла.
Поверхность затравки, соприкасающаяся с холодильником, должна быть
ровной с тем, чтобы обеспечить плотный контакт с торцом
холодильника. )
178
Холодильник вместе .с затравкой опускается в печь. Перед
погружением в тигель затравку несколько минут держат над
поверхностью расплава. После того как кристалл примет
температуру, близкую к температуре расплава, можно медленно ввести
затравку на глубину 2—3 мм ,в расплав. Нормальный рост
кристалла в начальный момент затрудняется, если температура
расплава слишком высока или если расплав находится в сильно
переохлажденном .состоянии. В первом случае может произойти
полное расплавление погруженной в расплав части затравки. В этом
случае необходимо, передвигая ограничитель терморегулятора,
понижать температуру расплава до тех пор, пока затравка
перестанет плавиться -и не начнется процесс кристаллизации. Во
втором случае от затравки будет расти поликристалл и необходимо
повысить температуру настолько, чтобы расплавить
образовавшийся поликристалл. Момент начала роста монокристалла, как
указывалось, можно заметить по появлению
вокруг затравки «серебристого кольца».
' При нормальном течении опыта кристалл
диаметром около 6 см вырастает за 3—4 часа.
Готовый кристалл извлекают из расплава,
соблюдая ряд предосторожностей. Прежде всего
выключают печь, затем выращенный кристалл
медленно поднимают из расплава. Щипцами,
обернутыми асбестом, отламывают кристалл
от затравки и оставляют на асбестовой сетке
в печи, которую плотно закрывают крышкой.
Затем кристаллу вместе с печью дают
охладиться до комнатной температуры. Только
после этого кристалл вынимается из печи без
риска, что он может растрескаться.
Часто при кристаллизации вещества
методом Киропулоса затравочным кристаллом
не пользуются. Кристаллизация начинается
на нижнем конце холодильника,
опускающегося в расплав. В качестве холодильника
может служить, например, платиновая
пробирка, в которую вставлена почти до дна
медная трубка для продувания воздуха.
После того как на конце пробирки образуется
сферолит (рис. 106), охладитель осторожно
поднимается так, чтобы сферолит касался
расплава. Из множества кристаллов,
составляющих сферолит, в таких условиях растет тот, который
находится в выгодном геометрическом положении.
Часто используют затравку, состоящую из нескольких
кристаллов. Ее погружают в расплав ,и затем вытягивают обычным
образом. При вытягивании температуру расплава сначала слегка
повышают, что приводит к образованию шейки (рис. 107). Когда '
Рис. 105. Способ
крепления кристалла —
затравки на торец
холодильника:
/ — кристаллическая
затравка; 2 —
устройство нижней части
холодильника
(разрез); 3 —
металлическая насадка для
равномерного
теплообмена; 4 —
проволочный держатель
кристалла — затравки
7*
179
сечение шейки станет достаточно малым (оно должно выдержать
вес готового монокристалла), температуру расплава снижают до
первоначального уровня, в результате чего диаметр затравки
возрастает.
Чохральский предложил метод, особенно пригодный для
выращивания металлических монокристаллов. Расплав
втягивается в капиллярную трубку, где обычно кристаллизуется в виде
монокристалла, который и служит затравкой для последующего
Рис. 106. Форма
кристалла,
выращиваемого из
расплава методом Ки-
ропулоса: / —сфе-
ролит; 2 —
монокристалл
Рис. 107. «Шейка»
для отбора
монокристаллической
затравки
Рис. 108. Приготовление
затравки с помощью
капиллярной трубки
вытягивания (рис. 108). Для предотвращения разрыва
образующегося кристалла, его вес должен находиться в соответствии с
капиллярной силой.
Скорость вытягивания монокристалла из расплава должна
быть равна скорости кристаллизации. Отставание скорости
подъема может привести к поликристаллическому росту, опережение—
к уменьшению диаметра образца (в 'предельных случаях — к
разрыву). Отсюда нетрудно понять необходимость равномерного
вытягивания монокристалла из расплава.
При изменении скорости вытягивания происходят изменения в
диаметрах образца, что приводит к большим температурным
напряжениям, особенно на границе раздела. Одновременно
изменяется коэффициент распределения примеси (см. зонную плавку
гл. VII, § 4), т. е. монокристалл становится «зональным» в
отношении легирующей его примеси. К аналогичным результатам
приводят колебания температур кристаллизации.
Равномерность вытягивания монокристалла и стабильность
температуры кристаллизации — важнейшие условия выращивания
180
t
L_
11
11
11
11
l/Bl
совершенных монокристаллов методом Чохральского.
Желательная стабильность скорости вытягивания должна составлять ± 1 %,
допустимые колебания температур — не больше ±0,5°.
„ Скорость роста (скорость вытягивания) зависит от величины
температурного градиента у фронта 'кристаллизации. Чем больше
градиент, тем больше допустимая скорость роста. Оптимальные
условия процесса роста обычно устанавливаются
экспериментально. Чаще всего скорость роста не выходит из пределов ОД —
4 см/час. Однако необходимо заметить, что совершенство
кристаллов тем. выше, чем меньше их скорость
роста.
Колебания температуры устраняются
точным регулированием степени нагрева,
либо обеспечением хорошей тепловой
изоляции. Температурный перепад и
форму фронта кристаллизации можно
регулировать посредством вспомогательных
нагревателей (рис. 109) или путем
охлаждения либо самой затравки, либо
ее держателя (холодильника).
Последний охлаждают водой или холодным
газом.
В аппаратуре, используемой в
местах вытягивания монокристалла,
предусматривается устранение механических
колебаний. При таких колебаниях
кристалл растет неправильно, с дефектами.
Механические колебания, т. е.
неравномерность скорости вращения и
вытягивания, можно устранить, тщательно
регулируя механическую систему.
Особенно важно, чтобы приводные механизмы
для вытягивания и вращения были
достаточно мощными и смогли
преодолевать трение в кольцевом уплотнении.
При нагревании держателя, а также
при конденсации пара на нем трение
возрастает. Установке необходимо
придать такое положение, которое бы исключало возможность ее
вибрации.
В методе Чохральского поддерживают плоский фронт
кристаллизации. Это ослабляет механические напряжения при
охлаждении и позволяет избежать деформации монокристаллов в
пластическом состоянии. Кроме того, плоский фронт кристаллизации
обеспечивает равномерное распределение легирующей примеси в
объеме кристалла.
Особое внимание уделяется качеству затравки. Чем оно выше,
тем совершеннее выращиваемый на ней монокристалл. Примером
/
Рис. 109. Приспособление
для создания плоского
фронта кристаллизации
(дополнительный нагреватель):
/ — основной нагреватель;
2 — дополнительный
нагреватель; 3 — вода или
холодный газ
181
Рис. НО. Нагреватель вместе с
вытянутым кристаллом
того, как выращиваемые кристаллы
наследуют дефекты затравки,
может служить кристаллизация
двойниковых дендритных лент и нитей
германия (см. рис. 60). Затравкой
такой кристаллизации из метаста-
бильного расплава служит
полисинтетический двойник, ;по меньшей
мере тройник. Входящие углы
тройника становятся
предпочтительными местами приложения частиц,
благодаря чему дендриты растут с
большой скоростью (10 см/мин) при
переохлаждении на 5—10° С.
Хрупкий германий в форме ленты
шириной 3—5 мм и толщиной 100—
300 мк становится гибким.
Поверхность ленты, совпадающая с гранью
(111), совершеннее по сравнению с
обработанной. Лучшая
механическая полировка дает величину
обработанного слоя в 1 мк.
Германиевая дендритная нить диаметром 25 мк представляет
собой тот же тройник округлой формы. В условиях быстрого
вытягивания из менее переохлажденного расплава германия образец
не успевает приобрести огранку.
За последние годы разработка и конструирование установок
для выращивания монокристаллов из расплава методом Чохраль-
ского достигли большой степени совершенства. Используются печи
либо с непосредственным, либо с индукционным нагревом. Это
малоинерционные печи, позволяющие вести гибкое управление
температурой. Материалом рабочей камеры служит нержавеющая
сталь. Внутренняя поверхность сосуда, содержащего расплав, по
чистоте не должна уступать выращиваемому кристаллу. Так, для
монокристаллов кремния материалом тигля служит кварц, как
единственно чистый материал (10_8% чистоты). Разработан
вариант бестигельного процесса кристаллизации кремния, где
источником нагрева является электронный луч.
При выращивании кристаллов методом Чохральского
желательны либо выкуум, либо инертная атмосфера. В случае, когда
расплав обладает особенно высокой упругостью пара,
используется инертный газ, давление которого должно превышать 1 ат.
Однако для нестабильных систем этот прием мало применим.
Многие окислы, сульфиды и особенно селениды начинают возгоняться
уже задолго до расплавления.
Растущий спрос на совершенные монокристаллы, особенно
полупроводниковые, делает необходимой полную автоматизацию
аппаратуры для их выращивания. На рис. ПО, 111 показана схе-
182
Рис. 11,1. Частичный разрез установки для
вытягивания кристаллов (по Чохральокому):
1 — нагреватель сопротивления; 2 —
радиационные экраны; 3— тигель; 4 — держатель тигля;
5 — кристалл; 6 — затравка; 7— держатель
затравки; 8 — шток 'вытягивания; 9 — ось
механизма вращения; 10— ось механизма вытягивания;
// — ручной механизм вытягивания; 12 —
механизм вращения тигля; 13 — рукоятка системы
отвода; 14 — корпус установки; 15—водяное
охлаждение; 16 — водоохлаждаемые электроды; 17 —
диффузионный насос с холодной ловушкой; 18 —
главный вакуумный затвор; 19 — заднее окно;
20—шток из нержавеющей стали; 21 —
кварцевый шток; 22 — отверстия для откачки; 23 —
ионизационный манометр; 24 — переднее
смотровое окно; 25—вентиль для выпуска газа; 26 —
выпуск газа; 27 — защитная кварцевая плита;
28 — вильсоновское уплотнение
ма одной современной установки. Весь процесс, включая отбор
при разращивании затравки и последующий рост, можно
запрограммировать.
Методы одностороннего охлаждения растущего кристалла
Методы одностороннего охлаждения растущего кристалла
составляют большую группу. Метод Бриджмена и метод Стокбар-
гера представляют собой развитие более ранних работ Г. Тамма-
на, И. В. Обреимова, Л. В. Шубникова и других авторов.
Сущность их состоит в том, что расплав помещают в тигель,
который медленно опускают из высокотемпературной части печи
в низкотемпературную через
сравнительно холодную диафрагму.
Кристаллизация начинается в
суженной донной части тигля в
момент прохождения его через
диафрагму. Из образовавшихся в этой
части нескольких затравочных
кристаллов выживет один, у которого
ось роста ориентирована
параллельно образующей тигля (рис. 112,а).
В иных случаях, чтобы обеспечить
выращивание монокристалла, на
некотором расстоянии от дна тигля
делают еще одно сужение
(рис. 112,6). На рис. 112,в показан
тигель, в котором были выращены
крупные монокристаллы
органических веществ: нафталина и антрацена.
Методы одностороннего охлаждения растущего кристалла
могут быть названы методами направленной кристаллизации.
Выращиваемые этими методами монокристаллы принимают
форму тигля, в результате чего в них неизбежны напряжения,
которые иногда приводят к растрескиванию монокристалла.
Второй существенный недостаток этих методов в
невозможности контроля ориентации кристалла.
Методы одностороннего охлаждения растущего кристалла
широко используются для выращивания монокристаллов различных
веществ.
Методом Обреимова и Шубникова впервые
научились выращивать монокристаллы металлов: олова, висмута,
кадмия, сурьмы, алюминия, магния, меди от 1 до 300 мм в диаметре
и до 30 см длины. Расплавленный металл в пробирке с тонко
оттянутым запаянным концом помещают в вертикальную
высокотемпературную печь. Из пробирки откачивается воздух до давления
около 1-Ю-2 мм рт. ст., чтобы металл заполнил капиллярную
часть трубки. Конец капилляра охлаждается холодной струей
Рис. 112. Приготовление
монокристаллической затравки методом
отбора: а — коническая верхушка
для «естественного» отбора; б —
отбор с помощью сужения; в —
кварцевый тигель с узкой трубкой
для отбора
184
воздуха. В нем возникает кристаллический зародыш, который при
дальнейшем охлаждении растет, постепенно заполняя собой
трубку.* Возможность образования новых центров кристаллизации
исключается, так как охлаждение происходит только через нижний
конец трубки. На рис. 99 схематически изображена печь,
используемая в методе Обреимова и Шубникова. Обмотка печи разде-
делена на две секции: высокотемпературную верхнюю и более
низкотемпературную нижнюю. Для измерения температуры
служат две термопары в верхней и нижней части печи. Пробирка с
кристаллизуемым веществом устанавливается в печи так, чтобы
ее капиллярный запаянный конец проходил через отверстие в
медном диске. Когда металл расплавится и заполнит конец
пробирки, открывается нижний конец печи, выключается
нижняя нагревательная обмотка и конец пробирки обдувается
холодной воздушной струей. Диаметр капилляра должен быть
1—1,5 мм.
В методе Бриджмена 'предусматривается перемещение
тигля с расплавом в трубчатой электрической печи. Иногда
поднимается печь, а пробирка остается неподвижной. Опускание
производится при помощи электромотора или часового механизма.
Кристаллизация начинается около дна пробирки и с
определенной скоростью продвигается вверх. Для получения
монокристалла необходимо подобрать такую скорость опускания, которая
обеспечит рассеивание тепла, выделяющегося при
кристаллизации. Очевидно, что эта скорость погружения должна быть
несколько меньше скорости роста кристалла вдоль трубки, в противном
случае верхние части расплава будут кристаллизоваться
самостоятельно, вне ориентирующего воздействия продвигающейся грани
монокристалла и в тигле могут появиться несколько кристаллов
различной ориентировки.
Отличие метода Стокбаргера от метода Бриджмена
состоит ,в иной (форме тигля, обеспечивающей получение
монокристаллов с определенной ориентацией. Этой же цели способствует
металлический опорный стержень, охлаждающий центральный
участок дна тигля. Расположенный непосредственно над
стержнем, он будет охлаждаться быстрее всего. По-видимому,
подставка-стержень, отводя тепло вдоль кристалла, тем самым
благоприятствует созданию плоского фронта кристаллизации, и поэтому
важно обеспечить между тиглем и подставкой хороший тепловой
контакт. Стержни обычно готовят из нержавеющей стали.
Охлаждение расплава в методе Стокбаргера, как и в методе
Бриджмена, достигается опусканием тигля с расплавом из одной
части печи в другую. В верхней части печи происходит плавление
вещества, которое остается в расплавленном состоянии в тигле.
Нижняя часть печи, низкотемпературная, отделена от верхней
специальной перегородкой (диафрагмой) с отверстием как раз
такого диаметра, который допускает прохождение через него тигля.
Использование двух печей, разделенных платиновой или какой-
185
Температура
Рис. ИЗ. Печь И. В.
Степанова с регулируемой формой
изотерм
либо другой металлической перегородкой, обеспечивает хороший
температурный градиент.
Опускание тигля в холодную область обеспечивает, если нужно,
и закалку кристалла или в случае 'необходимости последующий
отжиг при определенной температуре для снятия напряжений в
монокристалле, вызванных в значительной мере большим
температурным градиентом.
Опускать тигель можно различными способами, однако
удобнее механическая система опускания, которая должна быть
достаточно устойчивой и свободной от
вибраций и сотрясений.
По методу Стокбаргера печи
можно располагать и
горизонтально. Преимущество такой
установки заключается в возможности
хотя бы частичного регулирования
состава выращиваемого кристалла.
Оптимальные условия остаются
такими же, как и при вытягивании
из расплава (термическая и
механическая стабильность, плоский фронт
кристаллизации).
И. В. Степанов 1внес некоторые
конструктивные изменения в печи
Стокбаргера. Он упразднил нагрев
нижней части печи, а в верхней части наряду с боковым
нагревателем ввел кольцевой нагреватель вокруг диафрагмы (рис. ИЗ).
Благодаря этому во-первых, увеличивается температурный
градиент в зоне роста кристалла, во-вторых, можно регулировать форму
изотерм кристаллизации. Изменением соотношения мощностей
нагрева бокового нагревателя и нагревателя диафрагмы форма
изотермы кристаллизации может быть изменена от сильно вогнутой до
сильно выпуклой. При больших нагрузках на кольцевой
нагреватель (при одной и той же суммарной мощности) форма изотермы
кристаллизации становится выпуклой. Распределение температуры
ъ печи, указанное на рис. ИЗ, обеспечивает, таким образом,
выпуклый фронт роста монокристалла.
Обычно на установке Стокбаргера скорость роста
монокристалла изменяется в пределах от 10 до 1 мм)час.
Метод Стокбаргера был впервые использован для получения
монокристаллов оптического флюорита и фтористого лития и
остается наиболее удобным способом выращивания многих
полупроводниковых, щелочногалоидных кристаллов и сегнетоэлектри-
ков; он не пригоден для выращивания кристаллов веществ,
которые при затвердевании расширяются (германий, кремний и т. п.).
В настоящее время налажено промышленное
выращивание кристаллов оптического флюорита методом
Стокбаргера.
186
Повышенная температура плавления флюорита (1378°С),
высокая химическая агрессивность фтора и малая химическая
устойчивость самого флюорита при этих температурах, а также
большая гигроскопичность требуют для выращивания кристаллов
оптического флюорита создания особых физико-химических условий с
применением особой аппаратуры.
Аппаратура и технология выращивания монокристаллов
оптического флюорита разработана И. В. Степановым и П. П. Феофи-
ловым. Л. М. Шамовским была обоснована необходимость
выращивания флюорита в вакууме. В обычной атмосфере частичный
гидролиз плавленого флюорита под воздействием атмосферной и
адсорбированной влаги приводит к потере фтора и обогащению
расплава окисью кальция /
CaF3 + Н,0 -* СаО + 2HF ? .
Окись кальция не изоморфна с основным кристаллизуемым
веществом CaF2 и, попадая в последний в виде отдельной
мелкодисперсной фазы, вызывает большое внутреннее светорассеяние.
Получение высоких температур и высокого вакуума (Ю-5 мм
рт. ст.) возможно путем использования: 1) предельно малого
вакуумного объема; 2) хорошо обработанной внутренней
поверхности, лишенной пор и шероховатости (каждая пора является
местом адсорбции газа и отдача газа с нее затруднена); 3)
газонепроницаемых материалов с плотной структурой (непригодны
материалы с упругостью паров более Ю-5 мм рт. ст.); 4)
интенсивного водяного охлаждения всех деталей, нормальная работа
которых не требует повышения температур; это необходимо для
устранения газоотдачи большими массами металлов при их
нагревании.
В опытах по выращиванию кристаллов флюорита пользуются
тиглями, изготовленными из тонкой (0,15—0,20 мм) молибденовой
жести. Срок службы их исчисляется 70—80 час пребывания в них
расплавов чистого CaF2. Другие тигли термостойкие и фторо-
устойчивые из вольфрама, тантала и платины малопригодны для
работы в вакууме из-за высокой упругости паров.
Установка для выращивания кристаллов флюорита (рис.114)
в состоит из следующих частей: стальная вакуумная плита (/) с
водяным охлаждением, осуществляемым ,с нижней стороны плиты
через уложенную в кольцевые пазы медную трубку -с проточной
холодной водой (указано отдельно на рисунке в правом верхнем
углу); стальной вакуумный колпак (2) с напаянным оловянным
припоем (холодильником) в виде спиралей медной трубки;
высокотемпературная бескерамиковая электропечь (3) с молибденовым
нагревателем, навитым в виде бифилярной спирали и монтированным
на трех корундизовых опорах: А — верхняя «горячая» камера
печи, Б — нижняя, «холодная» камера и Д — разделяющая их
диафрагма. По электрическим характеристикам эта печь относится
к типу низковольтных, рассчитанных на питание большими тока-
187
Рис. 114. Высокотемпературная вакуумная
установка И. В. Степанова для
выращивания кристаллов:
/ — стальная вакуумная плита; 2—
стальной вакуумный колпак с холодильником;
3 — высокотемпературная электропечь с
молибденовым нагревателем (А — «горячая»
камера печи, Б — «холодная» камера, Д —
разделяющая их диафрагма); 4 —
молибденовые экраны; 5 — никелевые экраны; 6 —
клеммы; 7 — патрубки для клемм; 8 —
диффузионный насос; 9 — тигель; 10 —
подставка; 11 — сильфон; 12 — винт самоходного
приспособления; 13 — стеклянная трубка;
14 — железный якорь; 15 — молибденовый
пруток
ми. Так, при рабочей мощности 3 кет печь потребляет ток около
120 а, при напряжении 25 в; теплозащитные отражательные
экраны из полированных с обеих сторон молибденовой (4) и
никелевой (5) жести смонтированы в- виде двух отдельных многослойных
блоков; клеммы (2 шт.), охлаждаемые изнутри водой и служащие
для подводки тока к нагревателю печи (6); патрубки для клемм
с разборными герметическими уплотнителями, электрически
изолированными от плиты (7); диффузионный паромасляный насос
типа ММ-40А (5), работающий при предварительной откачке газа
до 10"1 мм рт. ст. форвакуумным насосом (не указан на
рисунке); тигель (9) с коническим дном, установленный на
охлаждаемой изнутри водой подставке (10); ,сильфон (металлический мех)
для передачи извне в вакуумное пространство вертикального
передвижения тигля в печи для выращивания кристаллов (11); винт
самоходного приспособления (12), жестко связанный с
подставкой для тигля; стеклянная трубка с запаянным .верхним концом
и нанесенной миллиметровой шкалой (13); железный якорь (14)
может свободно передвигаться в стеклянной трубе в
вертикальном направлении; молибденовый пруток (15), на верхний конец
которого укрепляется железный якорь, а нижний входит
внутрь тигля через небольшое -отверстие в крышке тигля. При
помощи сильного электромагнита, надевающегося на стеклянную
трубку, железный якорь может быть отключен и тогда
молибденовый пруток опускается в тигель до упора. По нанесенным на
стеклянной трубке делениям можно установить, что происходит
в тигле: плавление материала, рост кристалла и т. д.
В качестве исходного сырья при выращивании оптического
.флюорита нашли применение два материала: предварительно
очищенные технические плавиковые шпаты некоторых месторождений
Советского Союза, а также синтезированный фтористый кальций
весьма высокой степени чистоты (мелкие 0,1—0,3 мм кристаллики
CaF2).
Процесс выращивания происходит следующим образом.
В тигель загружают мелкокристаллический исходный
фтористый кальций с добавкой 0,25% по весу фтористого свинца.
Фтористый свинец вводится для насыщения фтором образовавшегося
небольшого количества СаО. -
СаО + PbF2 -> CaF2 + PbO f .
Образовавшаяся PbO вместе с избыточным PbF2 при
температурах плавления флюорита полностью возгоняются.
В исходную шихту вводят 10~2% фторидов редкоземельных
элементов.
Тигель с исходным материалом устанавливают на подставке в
верхней камере печи так, чтобы конус его дна был на несколько
миллиметров выше диафрагмы. После этого установку собирают,
производят откачку газа и медленно разогревают печь до полного
расплавления материала. Меняя нагрев печи, подбирают такую
189
Рис. 115. Лечь Штё-
бера для
выращивания монокристаллов
из расплава
мощность питания, при которой в конусе тигля начинает очень
медленно расти кристалл. Для дальнейшего роста кристалла
тигель с расплавом при помощи автоматически действующего
самохода медленно (со скоростью 10 мм/час) опускают из верхней
«горячей» камеры печи в «холодную». Охлаждение -выращенного
кристалла производится медленно, после чего он довольно легко
извлекается из тигля посредством слабых ударов перевернутым
тиглем по столу.
В синтетических кристаллах флюорита сохраняются весьма
большие внутренние натяжения, которые проявляются в виде ано-
;т мального двупреломления. Для устранения
натяжений в специальной безградиентной
печи производят тонкий отжиг кристаллов
при 1100°С с -последующим очень
медленным охлаждением до комнатной
температуры. Чтобы предотвратить помутнение
кристаллов флюорита вследствие гидролиза в
процессе отжига, кристаллы помещают в
большой платиновый тигель, засыпают их
флюоритовым порошком, слабо
увлажненным плавиковой кислотой, и тигель плотно
закрывают платиновой крышкой.
Получающиеся таким образом
кристаллы флюорита приближаются по своим
оптическим свойствам к лучшим образцам природного флюорита.
Аналогичным образом могут быть выращены монокристаллы
оптического фтористого бария, формального структурного
аналога флюорита.
Методы Стронга и Штебера. Фронт кристаллизации
можно перемещать не только путем движения тигля, но и
посредством регулируемого температурного градиента. В методе
Штебера и Стронга температурный градиент .регулируют с помощью
холодильника в нижней части печи. Скорость перемещения фронта
кристаллизации определяется .скоростью охлаждения,
осуществляемого холодильником.
Методом Штебера получают большие и чистые кристаллы.
В асбестовый цилиндр с асбестовой же крышкой Н с окном из
кварца для наблюдений (рис. 115) помещается сферическая
чашка S (из никеля, платины, фарфора) с веществом, из которого
нужно получить кристалл. Подставка для чашки имеет
приблизительно одинаковую с веществом теплопроводность. Сверху чашки
S помещается нагреватель О, а снизу — охладитель U. После
расплавления вещества приводят в действие охладитель U.
Изотермические поверхности t0, tu t2> U, ..., tn при такой постановке
опыта представляют собой горизонтальные плоскости.
Кристалл зарождается на дне чашки благодаря тому, что
отвод тепла охлаждающим змеевиком локализует кристаллизацию
близ самого донышка. Дальнейший рост кристалла определяется
190
темпом снижения температуры. Так как температура понижается
при переходе от верхних слоев к нижним, конвекционные токи,
вызывающие неправильный рост «кристалла, отсутствуют.
Все примеси, которые содержатся в расплаве, постепенно
вытесняются вверх, даже когда их удельный вес больше веса
растущего кристалла.
Разность ^о—tn устанавливается опытным путем. При очень
большой скорости охлаждения монокристалл не получается, и
! вертикальный температурный градиент оказывает только ориен-
I тирующее действие, в результате получаются параллельные
сростки столбчатых кристаллов.
Методом Штебера за короткое время получают крупные
монокристаллы NaN03 и металлического висмута. Любопытен факт, что
поликристалл очень трудно вынуть из чашки, тогда как
монокристалл легко выпадает после легкого постукивания по дну.
Зонная кристаллизация и очистка вещества методом
I зонной плавки
Методы зонной кристаллизации вещества вошли в практику
после того, как Бриджмен показал, что при направленной
кристаллизации примеси оттесняются растущим кристаллом и
сосредоточиваются в жидкой фазе (рис. 116). Бели отделить ту часть
../.
■—^—— щл
Рис. 116. Направленная кристаллизация:
/ — нагреватель; 2 — жидкая фаза; 3 — твердая фаза
образца, которая закристаллизовалась первой, и повторить
процесс, то можно достичь значительной очистки вещества.
Захваченные же кристаллом примеси распределяются при
соответствующих условиях равномерно.
В. Пфанн, используя принцип направленной 'кристаллизации,
разработал метод зонной плавки, считающийся одним из лучших
методов очистки исходных материалов, .которым можно
выращивать особо чистые кристаллы и получать материалы с
равномерным распределением примесей заданной концентрации.
Руководствуясь диаграммой состояния системы, этим методом можно
получить неустойчивые интерметаллические соединения или пери-
тектические сплавы. С помощью зонной плавки относительно
легко создавать в полупроводниках переходы типа р—п, п—р—п
■и т. д.
191
Сущность метода зонной кристаллизации или зонной плавки
состоит в следующем. На одном конце лодочки (рис. 117),
загруженной исходным поликристаллическим материалом, помещают
Рис. 117. Выращивание кристаллов методом зонной плавки:
1 — затравка; 2 — расплав; 3 — поликристаллический слиток;
4 — нагреватель
монокристаллическую затравку. Специальным нагревателем
слиток плавят на небольшом участке, в узкой зоне у затравки, до
плавления ее поверхности, далее зона расплавленного материала
перемещается с определенной скоростью вдоль слитка от
затравки, на поверхности которой начинается
кристаллизация. Перемещение зоны может происходить
как в результате движения нагревателя вдоль
слитка, так и движения слитка сквозь
нагреватель.
Зонную плавку можно вести и без лодочки
при расположении поликристаллического
образца и затравки на одной вертикали.
Расплавленная зона удерживается между затравкой и
слитком силами поверхностного натяжения (рис. 118).
Затравку и слиток закрепляют в металлических
зажимах или иным способом. Безтигельный
метод, или метод «плавающей зоны», особенно
пригоден для кристаллизации тех веществ, которые,
подобно кремнию, взаимодействуют с
материалом тигля. Этим методом с использованием
электроннолучевого нагрева были выращены
монокристаллы наиболее тугоплавких веществ:
вольфрама, молибдена и титана.
Иногда используют магнитное подвешивание
расплавленной зоны. Поликристаллическому
образцу придается форма цилиндрического
стержня, закрепленного с обоих концов и лежащего горизонтально.
Вдоль стержня пропускают постоянный ток и в том месте, где
должна плавиться зона, создают горизонтальное магнитное поле,
перпендикулярное стержню. При определенном соотношении силы
тока и напряженности магнитного поля подъемная сила в точности
уравновешивает силу тяжести.
Рис. 118.
Безтигельный метод
кристаллизации:
/ — держатель;
2 — стержень; 3—
зонный
нагреватель
192
Методы зонной кристаллизации многообразны и применимы к
широкому .классу веществ: металлам и неметаллам, органическим
и неорганическим соединениям. Исключение составляют вещества,
особенно органические, которые характеризуются крупными
размерами молекул, определяющими высокую вязкость и слабое
образование центров кристаллизации.
Методами зонной кристаллизации получают кристаллы из
паров, растворов, расплавов и твердого состояния.
Так, часто зонную плавку применяют для кристаллизации
соединений, обладающих при температуре плавления высокой
упругостью паров. Состав расплава, а следовательно, и кристалла в
любой момент времени определяется скоростью реакции пара с
жидкостью, а также осаждением его на кристалл и растворением
по мере движения зоны. При необходимости выращиванию
соединений с летучей компонентой способствует «подкормка» летучей
компонентой, чем регулируется стехиометрия материала.
Подкормку ведут с помощью дополнительной обмотки, окружающей
источник летучей компоненты (см. рис. 100). Так выращивают
кристаллы PbS, PbSe, PbTe, BiTe, а также ряда интерметалличе-
оких соединений.
Упругость пара летучих компонентов можно «подавить» с
помощью газовой рубашки, понижающей скорость испарения из
расплава. Доказано, например, что упругость пара мышьяка в
атмосфере водорода приблизительно в 100 раз меньше, чем в вакууме.
Для выращивания монокристаллов из растворов в расплавах
металлов Пфанн предложил метод зонной плавки с
температурным градиентом. Преимущество данного метода состоит в том, что
через слиток перемещается зона малой ширины.
Принцип этого метода состоит в том, что между двумя
слитками, например, кремния располагается узкий слой жидкого
сплава алюминия с кремнием (рис. 119), ^температурный градиент
(Г2—Т\) в этом случае направлен перпендикулярно слою сплава.
При температуре Т\ слева расположенный слиток кремния
находится в равновесии с жидким сплавом, т. е. сплав насыщен
кремнием. В этом случае у правой границы зоны при температуре Т2
сплав кремния не насыщен — слиток кремния здесь будет
растворяться в жидкой зоне. Благодаря этому расплав становится
пересыщенным для температуры Т2, в результате чего кремний
кристаллизуется у левой границы зоны. Зона через слиток
перемещается к более горячему концу. Состав кристаллического слитка
определяется кривыми солидуса и ликвидуса. Приближение линии
солидуса к вертикали указывает на малую растворимость
алюминия в кремнии, что дает возможность получения этим методом
достаточно чистых кристаллов. Как видно из рис. 119, скорость
движения зоны тем выше, чем больше температурный градиент и
коэффИцИент диффузии в жидкости и чем меньше линия ликвидуса
отклоняется от горизонтального направления. Скорость переме-
193
щения зоны может зависеть также от дефектов
монокристаллической затравки.
Одно из преимуществ метода зонной плавки состоит в
простоте его исполнения. Аппаратура состоит из печи, поддерживающей
температуру всего слитка, нагревателя, создающего
расплавленную зону длиной не более Vio длины слитка, приспособления для
поддержания слитка и устройства для перемещения зоны вдоль
слитка.
Зонным нагревателем может служить трубчатая печь,
заключенная в кварцевый, алундовыи, пирофиллитовый или асбестовый
Si Si Si+AL Si
Твердая Расплаб Твердая
(раза tpaea
Увеличение содержания А1 Перемещение зоны
Рис. 119. Выращивание кристаллов по методу зонной плавки
с температурным градиентом (по В. Пфанну)
кожух (см. рис. 101). Перемещение нагревателя обеспечивается
либо с помощью вала электропередачи, либо с применением
червячного привода.
- Дополнительный нагрев зоны иногда осуществляется
индукционными токами. Чтобы обеспечить снижение сопротивления,
производят предварительный разогрев образца, например, кремния,
некоторых стекол, карбида кремния и других полупроводников.
Для нагрева пользуются концентрацией лучистой энергии на
слитке с помощью зеркал. В этом случае ширину зоны и
температурный градиент можно регулировать соответствующим
фокусирующим устройством.
Для зонной плавки тугоплавких материалов, таких, как
вольфрам, молибден и тантал, используется нагрев путем электронной:
бомбардировки. Под действием высокого напряжения (несколько
киловольт) испускаемые катодом электроны ускоряются и
бомбардируют слиток в области анода, обеспечивая сильный местный
нагрев иногда до 3500°С (рис. 120). Этим способом
осуществляется зонная плавка окиси алюминия.
194
fO
Используемые в зонных плавках тигли имеют форму трубки
или лодочки. Более подходящим для них материалом является
•кварц. При выращивании окислов металлов, обычно смачивающих
кварц, лодочку покрывают тонким слоем сажи. Графит
используют для некоторых металлов (магния, алюминия и др.), окислы
которых особенно сильно разъедают кварц.
Оптимальные условия кристаллизации методом зонной плавки
сводятся к плоской изотерме кристаллизации, небольшому
температурному градиенту, т. е. малой скорости роста,
, и малым механическим и температурным
колебаниям. Большой температурный градиент
способствует равномерному распределению примесей в
выращиваемом кристалле. Регулировка фронта
кристаллизации и температурного градиента
осуществляется с помощью зонного нагревателя,
а также путем охлаждения затравки.
Оптимальная скорость перемещения зоны для разных
материалов изменяется в пределах от 1 до
20 см/час.
В целях очистки вещества осуществляется
многократный проход зоны вдоль слитка
(образца), причем всякий раз концы слитка, где
скопляются примеси, отрезают и зонной плавке
подвергают его срединную часть. Процесс этот
можно полностью автоматизировать. При этом вдоль
образца с помощью нескольких в ряд
расположенных нагревателей непрерывно
поддерживается несколько расплавленных зон. Такой процесс
непрерывной зонной плавки позволяет достигнуть
максимальные степени очистки материалов за
короткие сроки.
Метод зонной плавки теоретически и экспериментально
разработан Пфанном, в статьях которого показано, как результаты
очистки вещества этим методом зависят от условий опыта: длины
зоны, длины слитка, числа проходов, скорости перемещения зоны
и степени перемешивания расплава, а также от такой
характеристики материала, как коэффициент распределения К.
Коэффициент К представляет собой отношение
концентрации растворенного вещества в твердой фазе к отличающейся
концентрации его в прослойке жидкости (расплава). Для случая
равновесия между твердой и жидкой фазами отношение
концентраций примеси характеризуется равновесным коэффициентом
распределения Ко-
В процессе затвердевания может не хватить времени для
достижения полного равновесия между жидкой и твердой фазами.
В таком случае говорят об эффективном значении коэффициента
распределения К, зависящем от условий затвердевания.
Рис. 1.20. Зонная
плавка с
электроннолучевым
нагревом:
/ — твердая
фаза; 2 — жидкая
фаза; 3 — нижняя
фокусирующая
пластина (верхняя
пластина -не
показана); 4 — катод
(•вольфрамовая
проволока под
напряжением 2,5 кв)
195
Величина К может быть больше или меньше единицы в
зависимости от того, повышает или понижает примесь точку
плавления растворителя. Порядок величины К изменяется от значений
менее 10-3 до значений более 101,5.
Если величина К известна, то можно предсказать
распределение примеси («концентрационный профиль»), возникающее после
любого числа проходов зоны.
Равновесный коэффициент распределения может быть
определен из диаграмм состояния твердая фаза — жидкость, полученных
экспериментальным путем. На рис. 121 показана часть
диаграммы состояния металла Л, содержащего компоненту Б, понижаю-
Жидкая (раза
Тдердая
(раза
1
1
1
Жидкая /
(раза
9
~^<Р
<К-
Твердая
(раза
^_
Рис. 121. Часть диаграммы
состояния для /С<1
В
Рис. 122, Часть
диаграммы состояния для а>1
щую точку плаовления металла. Концентрация примеси В в
затвердевшей части будет меньше, чем в жидкой (К<1).
Только в равновесных условиях составу расплава,
определяемому линией ху, отвечает состав твердой фазы вдоль слитка,
характеризующийся линией xz. Так, при затвердевании расплава
состава С0 (точка Q) образуется твердая фаза состава Р,
равного КС0. По мере передвижения зоны вдоль слитка первая
обогащается компонентой В. Предельный случай отвечает составу
Q
жидкой фазы R = ——. В этой точке затвердевающая часть имеет
К
такой же состав, как и расплав.
Диаграмма, изображенная на рис. 122, отвечает растворам
с К>1. Здесь примесь перемещается в направлении,
противоположном движению зоны.
Поскольку зонной плавкой очищают вещества с содержанием
примесей меньше 10~3%, обычные диаграммы состояния
оказываются пригодными лишь на первом этапе изучения для
качественной оценки К и для ее сравнения с единицей. Для точного
определения величины К проводят специальные исследования.
Прежде всего используют выведенное Пфанном уравнение
концентрационного профиля для идеализированного случая: в двухфаз-
196
5
ч
id
0,8
V
0.5
0,2
0,1
от
ш
коз
0,03
от
0.01
*V
-1
w
ж
д.
ii-
-—T
Средняя
Лонцентраи,
ия
■ "
ной системе расплав в любой момент времени однороден,
диффузия примесей в твердой фазе пренебрежимо мала, а величина К
постоянна. Допущения эти справедливее, когда монокристалл
выращивают из хорошо перемешиваемого расплава.
Перемешивание и скорость движения зоны являются важным
условием зонной плавки. При отсутствии механического
перемешивания однородность определяется
диффузией примесей в расплаве и с
перемешиванием конвекционными
токами. Если эти процессы не
обеспечивают однородность расплава, то
у фронта кристаллизации
оттесняемые твердой фазой примеси
создадут обогащенный слой. Чем больше
скорость кристаллизации, тем
меньше время диффузии примесей в
расплав и тем резче будет скачок
на концентрационном профиле.
Скорость движения зоны должна быть
достаточно мала, чтобы
концентрационные токи смогли выровнять
неоднородность расплава по составу.
Увеличенная концентрация примеси
•в обогащенном слое может
привести к снижению температуры
затвердевания. Это явление, известное
• как «концентрационное
переохлаждение», может стать причиной
аномальной скорости роста и
образования в кристалле полос примесного
захвата.
Выражение для концентрационного профиля имеет вид
С =КС0(1-£)<*-!>, (VIII, 12)
где С — количество примесей в единице объема кристалла, С0 —
исходная концентрация растворенного вещества, g —
закристаллизовавшаяся доля первоначального объема.
Рассчитанное по этому уравнению распределение примеси для
различных значений величины К показано на рис. 123.
Подобное распределение примеси характерно для случая
кристаллизации по методу Стокбаргера и вытягивания кристаллов из
расплава.
Из формулы (VIII,12) при известных С и С0 можно
рассчитать К.
Пфанн показал, что в слитке, претерпевающем многократную
зонную плавку (большое число проходов), распределение
примесей изменяется. Однако после многих проходов распределение
примеси приближается к равновесному или конечному состоянию,
О 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
лносительная доля д затдердевшей
части образца
п
Рис. 123. Кривые
направленной кристаллизации
(по В. Пфанну)
197
которое будет предельным. Пфанн вывел уравнение предельного
распределения примесей
С = Аевхт (VIII, 13)
Постоянные А и В определяются из следующих соотношений:
В1
К =
ев1-\
eBL-\'
где I — длина жидкой зоны, L — общая длина слитка, X — длина
пройденного зоной участка.
Для ряда веществ получены кривые предельного
распределения примеси, рассчитанные на различные значения К-
Очистка вещества методом зонной плавки дает
высококачественную продукцию — содержание примесей может быть доведено
до 10~7%.
Наилучшую очистку может дать двухстадийный процесс.
В предварительной стадии используют длинный слиток, резкий
температурный перепад, возвратно-поступательный метод с
максимальным числом зон, перемещающихся со скоростью 10—20 см/час,
постоянное перемешивание расплава.
На второй стадии концы длинного слитка отрезают и плавят
его срединную часть. Условия здесь должны в большей мере
подходить для выращивания монокристаллов: скорость
перемещения зон мала (0,5 см/час), плоский фронт кристаллизации со
слабым температурным перепадом, минимальные механические и
температурные колебания в системе. Вторую стадию очистки лучше
проводить на монокристаллическом слитке.
Метод Вернейля
Техническое оформление и сущность метода Вернейля состоит
в следующем.
Латунная трубка (рис. 124) соединена с воронкой,
снабженной боковым отверстием для впуска кислорода. Эта трубка
вставлена в более широкую латунную трубку также с боковым
отростком для поступления водорода. Нижние концы концентрических
трубок помещены в муфель из огнеупорной глины, внутри
.которого имеется «свеча» из огнеупорного материала. Эта «свеча»
может перемещаться вертикально при помощи механизма. Внутри
воронки помещен сосуд С с сетчатым дном. Небольшой молоточек
периодически отклоняется зубчаткой и, слегка ударяя о воронку,
заставляет порошок окиси алюминия небольшими порциями
просыпаться через сетчатое дно сосуда С и падать на свечу, конец
которой омывается пламенем гремучего газа. Падающий порошок
198
,Г7ГД
н.
TTTTl,
расплавляется пламенем газа и на конце свечи спекается в
коническую затравку. Когда затравка достигает определенной
величины и формы, изменяют условия горения газа, чтобы расплавить
вершину конуса затрав,ки, и далее так регулируют температуру
пламени в вершине конуса, чтобы расплавленные пылинки,
попадая на затравку, могли прирастать. Эти условия обеспечивают
выживание одного кристалла, ориентированного по градиенту
температур. Ориентация нарастающей «бульки»
будет соответствовать ориентации зерна
шейки.
Шихтой для выращивания бесцветного
монокристалла корунда служит окись
алюминия, 'К которой «при выращивании красного
рубина добавляют небольшие количества
окиси хрома, а для получения сапфира — окись
ванадия и т. д. Порошок А1203 (у-А1203 в
отличие от выращиваемых кристаллов а-
АЬОз) изготовляется обычно путем
прокаливания в определенных условиях алюмо-амми-
.ачных квасцов.
Кристаллы, получаемые этим методом,
имеют вид опрокинутого конуса. Громадные
внутренние напряжения делают их
непрочными и легко рассыпающимися на мелкие
осколки. Непрочными оказываются и детали,
вырезанные из кристалла корунда, уже
анизотропного в отношении механических свойств. В
практике применения кристаллов корунда не
безразлично, как ориентирован кристалл.
Предварительно установить расположение
главных кристаллографических осей удается
только с большим трудом. В результате
распиловки и обработки деталей из кристалла
корунда 75—80% его идет в отходы.
Проблема получения ориентированных монокристаллов
корунда была решена С. К. Поповым. В результате изменения метода
монокристаллы корунда получались в виде цилиндрических
стержней.
В новой конструкции аппарата разработана точно
регулируемая подача шихты. Резервуар, в котором находится шихта,
подвешен на тонкой мембране, благодаря чему он может
продолжительное время вибрировать от слабых ударов молоточка и
просыпать через сито необходимое количество шихты.
Для получения корундовых стержней вершину монокристалла
необходимо держать в строго ограниченной зоне пламени, причем
можно задавать диаметр стержня, регулируя подачу кислорода.
Расширение кристалла производят за счет увеличения подачи
кислорода.
Рис.
124. Установка
Вернейля
199
Выращиванию высококачественных кристаллов корунда
способствовало успешное решение и третьей задачи: определение
положения растущего кристалла в зоне пламени гремучего газа.
Автоматический суппорт позволяет просто и точно
регулировать скорость опускания кристалла по мере его роста.
Аппарат системы С. К. Попова дает возможность получать
стержневые кристаллы диаметром от 2 до 3 мм со скоростью роста
в 10—15 раз больше скорости роста обыкновенной бульки.
Наблюдаемая средняя скорость роста кристаллов корунда при 2050°С
равна 13—18 мм/час. Выращивание осуществляется на затравке
с определенной ориентацией и хорошего качества. Соотношение
подаваемых водорода и кислорода на заданном режиме роста
равно три к одному (Н2 — 2700 л/час, 02 — 700 л/час). При таком
режиме размеры выращенного кристалла зависят от времени.
Корундовые стержни, диаметр которых по длине не строго
постоянен, обладают значительными внутренними напряжениями.
После роста кристаллы отжигают в течение нескольких часов до
температуры 1900°С в графитовых тиглях в вакууме Ю-3 мм рт: ст.
Методом Вернейля—Попова выращивают также некоторые
ферриты, гранаты и сегнетоэлектрические кристаллы.
Отжиг кристаллов
Кристаллы, выращенные из расплава, особенно при высоких
температурах, как правило, подвергаются последующему отжигу —
температурному воздействию при соответствующих условиях.
В процессе отжига происходит перераспределение некоторых
частиц основного вещества, дислокаций, примесных атомов и
вакансий. В результате такого упорядочения вызванные большими
скоростями роста кристалла напряжения частично или полностью
снимаются (рис. 125).
Температура отжига определяется экспериментально, при этом
она всегда остается ниже температуры образования кристалла.
В идеальном случае любой процесс отжига должен идти при
такой низкой температуре, чтобы обеспечивалась незначительная
равновесная концентрация дефектов (межузельных атомов и
вакансий), в противном случае подвижные примеси внедрения успеют
диффундировать из кристалла. И все же температура отжига
должна быть достаточно высокой для диффузии дефектов из кристалла.
Переход от температуры кристаллизации к температуре отжига
можно осуществить двумя способами. Кристаллы охлаждают
быстро до комнатной температуры, затем постепенно нагревают до
температуры отжига. Быстрое охлаждение ведет к
замораживанию примесей внедрения и вакансий, вследствие чего они реком-
бинируют при повышении температуры до температуры отжига.
Вторым способом кристаллы охлаждаются медленно от
температуры образования до комнатной, а затем постепенно
нагреваются до температуры отжига. При отсутствии закалки и постепен-
200
ном охлаждении до температуры отжига весьма подвижные
примеси внедрения успеют диффундировать из кристалла.
Эти два процесса различаются еще и тем, что в способе с
быстрым охлаждением при .последующем приближении к
температуре отжига наружные области кристалла горячее, чем внутренние.
Рис. 125. Влияние отжига на распределение и плотность
дислокаций на поверхности монокристалла германия:
а — до отжига; б, в—после отжига
При втором способе наблюдается обратная картина. Отжигом в
парах одного из компонентов можно обеспечить стехиометрический
состав кристалла или максимально к нему приблизить.
§ 5. ВЫРАЩИВАНИЕ МОНОКРИСТАЛЛОВ ИЗ РАСТВОРОВ
Все методы выращивания монокристаллов из растворов
основаны на использовании зависимости концентрации С вещества в
растворе от термодинамических параметров, определяющих
состояние системы
с = /(р,:>; с), (viii, 12)
где С— концентрация вспомогательных веществ, которые в слу-
201
чае многокомпонентной системы могут находиться в растворе.
Величиной пересыщения можно управлять, изменяя по уравнению
(VIII, 12) концентрацию С. В зависимости от того, какой
параметр (Г, р или С) определяет изменение концентрации С,
различают методы выращивания монокристаллов путем изменения
температуры, удаления растворителя, изменения давления,
концентрации вспомогательных веществ, или комбинированные
методы, когда одновременно изменяются два или три
параметра.
Рассмотрим один из методов, метод выращивания
монокристаллов из растворов, основанный на изменении единственного
параметра — температуры. Не все вещества могут быть выращены
таким путем. На рис. 8 показан температурный ход
растворимости при постоянном давлении для трех различных веществ. Сегне-
това соль KNaC4H406-4H20 характеризуется большим
положительным температурным коэффициентом растворимости в воде,
ЫгЭС^-НгО — большим, но отрицательным коэффициентом,
растворимость же NaCl слабо зависит от температуры. Кривые
растворимости, таким образом, указывают на различные условия,
при которых возможно выращивание кристаллов этих трех
веществ. Приступая к кристаллизации вещества, необходимо иметь
кривую температурной растворимости c=f(t) и на ней основывать
все технические расчеты кристаллизации.
Построение кривой растворимости
Под растворимостью принято понимать максимальное
количество вещества (предельная .концентрация), способное
растворяться при данных условиях .в определенном количестве
растворителя. Растворимость зависит от 'природы растворителя и
растворенного вещества и от термодинамических условий
растворения. Графическое представление уравнения (VIII, 12) является
простейшей фазовой диаграммой.
Существуют различные способы выражения концентрации —
величины, характеризующей количество данного вещества в
растворе. Наиболее распространено и принято в большинстве
справочников по растворимости солей выражение в весовых
процентах (вес. %), т. е. числом граммов растворимого вещества в 100 г
раствора.
концентрацию раствора обычно определяют косвенными
методами, например, измерением удельного веса или показателя
преломления раствора. Пересчитав результаты по соответствующим
таблицам, далее по графику или по таблице растворимости
находят, при какой температуре раствор данной концентрации
становится насыщенным. Все же такое определение не точно. Для
прямого установления температуры насыщения используется явление
концентрационных потоков, которое позволяет определить
температуру насыщения раствора с точностью иногда до 0,1°С.
202
Сущность метода концентрационных потоков,
предложенного А. А. Штернбергом, заключается в том, что о
состоянии раствора судят по направлению концентрационных
потоков, возникающих благодаря изменению плотности среды вокруг
кристалла, помещенного в собственный раствор. Нисходящие от
Рис. 126. Схема установки для наблюдения концентрационных
потоков и «дворика кристаллизации»
кристалла концентрационные потоки характерны для
ненасыщенного раствора (стабильная область), что указывает на
растворение. Восходящие от кристалла потоки имеют место в
пересыщенном растворе (метастабильная область), когда кристалл растет.
В насыщенном растворе, отвечающем, например, точке Д на
кривой растворимости (см. рис. 3), устанавливается динамическое
равновесие, исключающее концентрационные потоки.
Для определения температуры насыщения tH раствора данной
концентрации нагревают раствор до ненасыщенного состояния и
далее, поместив в него кристаллик соли, растворимость которой
исследуется, медленно охлаждают, отмечая температуру tu при
которой исчезают нисходящие потоки растворения кристаллов.
Продолжая постепенно охлаждение раствора, находят температуру
появления потоков роста t2. Среднее арифметическое 1 2 = *н
представляет собой температуру, в значительной мере
приближающуюся к истинной температуре насыщения раствора.
Наблюдение за концентрационными потоками лучше вести при помощи
установки, схема которой приведена на рис. 126. Луч света от
точечного источника света 5, переходя через линзу Lh образует
однородный пучок, на пути которого располагается
плоскопараллельная кювета G с исследуемым раствором, в который погру-
203
жается кристалл соли /С, растворимость которой определяется.
Линза L2 дает изображение нити лампы в плоскости щели N. При
этом условии любые неоднородности в исследуемом растворе,
в частности, концентрационные потоки вокруг помещенного в
раствор кристалла, вызывают искривление лучей света, которые
фокусируются линзой L3 на экране F, т. е. на нем получается
изображение как кристалла /С, так и возникших около него неоднород-
ностей среды.
Более точно температура насыщения определяется по
погасанию кристаллизационного «дворика». «Дворик» также
представляет собой оптическую неоднородность и четко виден на экране F.
При температуре /н разность концентраций на внутренней и
внешней поверхностях «дворика кристаллизации» равна нулю и он
исчезает.
Для построения кривой растворимости c = f(t) необходимо
около десятка точек. Фиксация каждой требует приготовления
раствора соответствующей концентрации и, следовательно, для
снятия всей кривой растворимости необходимо около десятка
растворов, которые проще всего получить разбавлением исходного
наиболее концентрированного раствора. Пусть т вес.
%—отношение твердого вещества к весу всего раствора; а — вес
всего раствора; b — вес твердого вещества; х — количество
растворителя, необходимое для получения разбавленного раствора
п вес. %.
Очевидно,
т. е., зная заранее весовые проценты начального раствора
(т вес %), можем определить количество растворителя (х),
необходимое для получения раствора п весовых процентов. Кристалл-
индикатор, который погружают в раствор для наблюдения кон-
центрационных потоков, должен быть приготовлен заранее. Для
этого берут небольшую порцию (80—100 г) насыщенного раствора
исследуемой соли при температуре на 4—5°С выше комнатной.
Затем профильтрованный раствор помещают в кристаллизатор |
(чашку Петри) и, когда температура раствора достигает комнат- '
ной, в него бросают несколько кристалликов. Через некоторое время
на дне кристаллизатора образуются достаточно крупные
кристаллы, вполне годные для использования.
Технический расчет кристаллизации
Кривая растворимости c = f(t) выбранного вещества и
уравнение баланса массы (III, 5) лежат в основе технического расчета
кристаллизации, производимого до начала и в процессе
кристаллизации.
204
Имея кривую растворимости, можно рассчитать:
1) необходимое количество растворителя и соли для
получения кристалла желаемого веса, если кристаллизация
производится в интервале изменения температур (/2, ^i);
2) вес кристалла, который можно получить из данного объема
раствора при изменении температуры от t2 до t\\
3) количество растворенного вещества, переходящего в кри-
щ сталлическую фазу из данного объема раствора при изменении
К температуры на доли градуса от заданной температуры. Эти рас-
Ш четы удобнее производить графически.
Технический расчет кристаллизации возможен, если предвари-
I тельно экспериментальным путем определено допускаемое
пересыщение раствора (верхняя граница метастабильной области).
Так, для сегнетовой шли экспериментально найдено, что в
каждом литре пересыщенного раствора может находиться около
одного грамма вещества на каждый квадратный сантиметр
растущей поверхности оформленного кристалла. Превышение этого
предела, когда dc станет больше dm, вызывает появление в
растворе новых центров кристаллизации или помутнение (порчу)
выращиваемого кристалла.
Используя уравнение баланса массы, в котором dm
определяется по формуле (III, 10), можно произвести расчет скорости
(программу) изменения температуры для поддержания в растворе
постоянного пересыщения. Как только будет исчерпано
первоначально заданное пересыщение раствора, т. е. dc станет меньше dm,
кристаллизация замедляется или приостанавливается. Такое на-
. рушение баланса масс в растворе может (вызвать порчу
выращиваемого кристалла. Для того чтобы вырастить большой кристалл,
приходится периодически изменять температуру, доводя
пересыщение до величины кристалла 5, допускаемого размерами
поверхности. Чтобы кристалл рос достаточно быстро, очередное
понижение температуры производят, когда пересыщение достигает
половины первоначального. В ряде случаев приходится также
вносить поправки на изменение концентрации вследствие
испарения раствора или выпадения паразитических центров
кристаллизации.
Для того чтобы судить о спаде пересыщения со временем,
можно использовать разнообразные методы контроля некоторых
величин (плотности, электропроводности, показателя преломления),
непосредственно зависящих от пересыщения раствора. Однако для
использования этих методов нужны предварительные трудоемкие
градуировочные измерения названных зависимостей.
В. А. Копцик предложил метод непрерывного контроля линей-
.ных скоростей роста кристалла, через которые можно выразить
полную поверхность, объем и массу кристалла в любой момент
времени. Эти величины размерности длины снимаются с
кристаллов, прошедших начальный период регенерации, когда они
начинают расти в неизменной фор^е выпуклого многогранника со
205
сравнительно небольшим количеством граней; При этом
используются кристаллографические данные, опирающиеся на закон
постоянства углов.
Динамические методы выращивания кристаллов из растворов
Динамический метод выращивания кристаллов из
раствора может быть определен как скоростной метод
выращивания сравнительно однородных кристаллов.
Впервые Г. В. Вульф пользовался вращающимися
кристаллизаторами и приспособлениями с часовым механизмом, которые все
время поворачивали кристалл и ставили тем самым различные его
8
I
П
15^
7
Рис. 127. Схема кристаллической установки для «выращивания
кристаллов из раствора:
/ — (кристаллизатор; 2 — кристаллоносец; 3 — нагреватель; 4 — блок
питания установки и регулирования температуры; 5 — контактный
термометр; 6 — реле; 7 — мешалка; 8 — катетометр
грани в одинаковые условия. Все это использовалось для
устранения конвекционных потоков и неправильностей в росте
кристаллов. Впоследствии О. М. Аншелес, А. А. Штернберг и В. Б.
Татарский разработали метод скоростного выращивания однородных
кристаллов сегнетовой соли и других воднорастворимых веществ.
Ими были выведены формулы, позволяющие рассчитывать
необходимый температурный режим в процессе роста кристаллов.
В целях обеспечения лучшего перемешивания раствора у
поверхности растущего .кристалла В. Б. Татарским был впервые
предложен способ планетарного движения кристалла.
Любая кристаллизационная установка, используемая для
динамического выращивания кристаллов, состоит из следующих
основных узлов (рис. 127): кристаллизатора (1) с платформой
206
для крепления кристалла — кристаллоносцем (2), блока питаиия
реей установки и регулирования температуры (4), мешалки с
электрическим приводом (7). В изображенной установке
нагревателем служит безынерционная электропечь с нихромовой
обмоткой (3), холодильником — помещение, в котором производится
кристаллизация. Блок терморегулировки состоит из реле (б), на
котором поступают сигналы от контролирующего температуру
контактного термометра (5). При замыкании и размыкании цепи
контактного термометра реле соответственно включает или
выключает нагреватель, поддерживая тем самым температуру
кристаллизации вблизи заданного уровня. Изменение температуры в
процессе роста кристалла производится подвижным контактом
терморегулятора.
Моторчик с мешалкой обеспечивает необходимое
перемешивание раствора. Температура раствора измеряется обычным
термометром.
В лабораторных учебных условиях полезно использование
катетометра (8) с вертикальной и горизонтальной шкалами и
точностью отсчета по обоим нониусам 0,02 мм. Катетометр позволяет
измерять линейные скорости роста кристалла без нарушения
режима кристаллизации.
Затравкой может служить маленький (3—5 мм) ограненный
кристаллик того вещества, раствор которого заполняет
кристаллизатор.
До начала кристаллизации производят микрометрический
замер линейных размеров кристаллической затравки и вычисление
ее активной поверхности и массы. Контролем правильности
проведенного расчета служит взвешивание затравки. Затравка
приклеивается парафином к платформе и помещается в пустой
кристаллизатор. Приготовление насыщенного при задаваемой
температуре раствора и определение его точки насыщения производятся
в отдельной посуде по правилам, изложенным выше. Для
расчетов необходимого количества соли, насыщающего раствор,
используется кривая растворимости данного вещества. Приготовленный
раствор перегревается на несколько градусов выше точки
насыщения и после получасовой выдержки осторожно без
разбрызгивания переливается в кристаллизатор, крышка которого, мешалка,
контактный и ртутный термометры хорошо пропариваются перед
этим для устранения возможных случайных центров
кристаллизации. На герметической крышке затем устанавливаются
термометры. Перемешивание раствора до полной регенерации
затравочного кристалла не допускается.
Так как кристаллизатор, заполненный раствором, имеет
цилиндрическую форму, следует определить коэффициент искажения
линейных размеров, измеряя катетометром кажущийся диаметр
стержня мешалки и относя полученную величину к известному
абсолютному размеру диаметра стержня.
207
Непрерывно ведется наблюдение за температурой раствора.
Отмечают начало роста кристалла, наблюдая первые признаки
регенерации кристаллической затравки (появление «шероховатостей»,
острых углов и плоских граней на ее поверхности). Установив
начало роста, прекращают понижение температуры, включая
терморегулятор. После полной регенерации затравки (восстановления
ее первоначальных размеров) соответствующим понижением
температуры создают необходимое пересыщение раствора,
допускаемое размерами поверхности кристалла и включают мотор
перемешивающего механизма со скоростью 60 об/мин. Далее через
каждые 15—20 мин производят измерения температуры и размеров
кристалла. Очередное понижение температуры производят с
учетом количества вещества, перешедшего в кристаллическую фазу,
когда пересыщение раствора^до^тигает половины от
первоначальной величины.
Во время работы необходимо вести журнал наблюдений, в
котором записывают все данные, относящиеся к подготовке и
проведению кристаллизации. Необходимо отмечать время заливки
кристаллизатора раствором, время очередного понижения
температуры, момент начала и конца регенерации затравки и момент
произведения очередных замеров линейных параметров кристалла.
Проверить правильность произведенных расчетов можно путем
взвешивания кристалла по окончании кристаллизации.
Закончив кристаллизацию, вынимают платформу-кристаллоно-
сец из раствора. Неиспользованный раствор переливают в чистый
сосуд и герметически закрывают. Кристаллизатор и все детали
установки, соприкасавшиеся с раствором, тщательно промывают
теплой водой.
Пересыщенный раствор, из которого ведется выращивание,
представляет собой неустойчивую систему. Помимо основного
кристалла в кристаллизаторе могут возникнуть добавочные
кристаллы— паразиты. Процесс образования их носит иногда
лавинообразный характер: при трении их о дно и стенки сосуда и при
столкновении между собой возникают новые центры
кристаллизации.
Вредность «паразитов» состоит в том, что, питаясь за счет
основного кристалла, они нарушают режим снижения
температуры и образуют с основным кристаллом всевозможные
сростки.
На практике, однако, можно создать условия, исключающие
источники «паразитов». Прежде всего, следует предохранить
раствор от попадания зародыша извне, для чего на всех стадиях
процесса подготовки к кристаллизации и ее проведения должна
соблюдаться полная чистота, загруженный же кристаллизатор
должен быть герметически закрыт. Источником «паразитов» может
стать сама затравка, вводимая в раствор. Чтобы избежать этого,
затравочный кристалл предварительно обрабатывают, обтачивают
мокрой тряпочкой неровные поверхности на гранях, его углы и
208
ребра. Возникшая в результате такой обработки на поверхности
кристалла тонкая кристаллическая пыль удаляется путем
кратковременного опускания кристалла в теплую воду.
Облегчает образование «паразитов» наличие острых краев и
выступов во всех предметах, соприкасающихся с раствором. Во
избежание «паразитов» не следует допускать соприкосновения
кристалла с предметами, имеющими весьма отличные
коэффициенты температурного расширения. Слишком быстрое движение
кристалла при высоком пересыщении приводит к возникновению
«паразитов». Этому способствует также сильная вибрация и
местные переохлаждения. В целях исключения источников «паразитов»
следует пользоваться чистой солью и дистиллированной водой.
Выращивание больших и совершенных монокристаллов из
растворов в исследовательских лабораториях и заводских цехах
осуществляется .в более сложных и вместе с тем автоматизированных
условиях.
Особое * внимание уделяется движению раствора и
кристалла, необходимому для выравнивания разности
пересыщения во весь период роста кристалла. Известно, что
монокристаллы растут по-разному при разных движениях кристалла или
раствора. Так, нельзя вырастить однородный кристалл однозаме-
щенного фосфата аммония в условиях вращения его в одном
направлении. В этих условиях фронтально обмываемые грани растут
быстрее, а грани, находящиеся в «тени», испытывающие
недостаток в питании, растут дефектно. Поэтому для выращивания
монокристаллов NH4H2PO4, как и многих других, применяется
реверсивное вращательное движение. На успешный рост кристаллов
оказывают влияние также и скорость вращения. Последняя в свою
очередь определяется длиной и формой кристаллоносца, вязкостью
и количеством раствора, а также формой и размером вращаемых
кристаллов. Очень важна правильно выбранная
продолжительность остановки между отдельными направлениями вращения
реи, во время которой движущийся раствор медленно
останавливается. Необходимо, чтобы при повторном разбеге мотора не
происходило резких движений. В этих целях иногда используют
сложный электронный переключатель.
Одной из разновидностей динамического метода выращивания
монокристаллов представляет собой метод, основанный «а
использовании постоянного пересыщения в растворе системой
циркуляции раствора. Два сообщающихся сосуда А и В соединены между
собой двумя горизонтальными трубками (рис. 128). Каждый сосуд
помещен в собственный водяной термостат, при этом
температура Т2 левого термостата выше температуры Тх правого. В
сосуд А подвешен мешочек с растворяемым веществом. Раствор,
протекая через сосуд с твердым веществом при температуре 7Y,
становится насыщенным. Затем он, проходя через сосуд с более
«изкой температурой Ти в котором находится кристалл,
оказывается пересыщенным. Затраченное на рост кристалла количество
8 О. Г. Козлова 209
вещества при повторном протекании пополняется за счет запасов
вещества и т. д. Раствор приводится в движение турбинной ме- I
шалкой. Если необходимо вырастить большой однородный кри- S
сталл без правильной внешней огранки, выгоднее поместить за- Г
травку на дно -кристаллизатора (неоднородность будет
наблюдаться у одной грани). Таким образом удалось вырастить очень |
крупные кристаллы однозамещенного фосфата аммония NH4H2PO4 ,
весом 18 кг приблизительно за 4 месяца. Г
Важнейшее значение в практике выращивания совер- Г
шенных монокристаллов придается поддержанию и В
программному понижению |
тем-пературы. При выращивании |
высококачественных кристаллов
колебания температуры раствора должны I
быть незначительными. Сохранение I
температуры в данных пределах за-ви- I
сит от чувствительности применяемых I
регулировочных элементов, от количе- I
ства раствора для выращивания и от Я
общего устройства кристаллизатора. I
Задача поддержания и программного I
понижения температуры успешно
решается путем использования термо-
статобЛ куда помещаются кристалли- !
заторы с раствором, с контактными
термометрами. Устройство и размер I
термостатов бывают самые разнооб- !|
Рис. 128. Выращивание кри- разные. Для заводского выращивания ;
сталлов -из циркулирующего кристаллов сегнетовой соли, например, \
раствора применяется большой воздушный
термостат— комната, содержащая до не- I
сколько десятков кристаллизаторов. Нагрев осуществляется
сопротивлениями, расположенными в полу термостата. Температура
регулируется автоматически системой контактных магнитных
термометров. Движения руководящих магнитов контактных
термометров управляются электронным импульсным датчиком при помощи J
шагового механизма. Этим путем достигается равномерное падение I
температуры на десятые доли градуса в сутки. |
Динамический метод выращивания кристаллов может быть
применим в случае зависимости концентрации раствора от объема
растворителя. При этом очень важно поддерживать постоянную
температуру насыщения перемешиваемого раствора. Испарение
растворителя можно регулировать током сухого воздуха, который
проходит над поверхностью раствора, увлажняется и удаляется .
через отверстие в крышке кристаллизатора. Улучшенный Нейхау- L
зом способ, обеспечивающий постоянное пересыщение в течение
недель с точностью до 0,001%, позволяет выращивать кристаллы
NaCl особо хорошего качества.
210
V
'Способы выращивания кристаллов Li2S04-H20 отличаются от
других способов этой группы тем, что испарение регулируется с
помощью охлаждаемой крышки, на которой конденсируется
испаряющийся растворитель, и тут же отводится из системы.
Статические методы выращивания монокристаллов
Несмотря на очевидные преимущества динамического метода
перед статическими, последние часто применяют для получения
затравочных кристаллов и для выращивания крупных монокристаллов.
Этим методом легко выращивают кристаллы, например
калиевых квасцор. Сначала приготавливается запас насыщенного
раствора путем растворения при нагревании 100 г квасцов в 1 л
дистиллированной воды. Раствор фильтруется в колбу и закрывается
куском ваты. Через некоторое время на дне колбы выпадает
осадок из кристаллов, которые всегда должны находиться в
насыщенном запасном растворе. Приготовленный холодный раствор
наливается в небольшой кристаллизатор до половины, плотно
прикрывается фильтровальной бумагой и ставится в спокойное
место с постоянной температурой. Через несколько суток на дне
стакана появляются небольшие кристаллы. Нужно выбрать
наиболее правильно образованный кристалл и перенести его в другой
чистый кристаллизатор со свежим раствором и прикрыть
кристаллизатор фильтровальной бумагой для предохранения от пыли.
Кристалл можно подвесить на шелковинке в стакан с раствором.
Хорошие результаты дает способ достаточно быстрого
выращивания кристаллов, растворимость которых падает при понижении
температуры. При нагревании приготовляется насыщенный
раствор соли и переливается в предварительно прогретый горячей
водой цилиндрический сосуд Дьюара. В горячем растворе
подвешивается кристалл. Сосуд плотно закрывают картонной крышкой
с глубокими краями и помещают в бочонок или деревянный ящик,
наполненный ватой или сухими древесными опилками (рис. 129).
Чем лучше изолирован сосуд, тем медленнее охлаждение и тем
более совершенным вырастает кристалл. Вскрывают ящик через
несколько суток, когда раствор принял температуру помещения.
Методика выращивания ориентированных блоков сульфата
лития в статическом режиме проста, но предъявляет высокие
требования к чистоте растворов, ибо в этих условиях все механические
примеси, находящиеся в растворе, осаждаются на растущем
кристалле и захватываются или оставляют в нем микроканалы.
Промышленное выращивание кристаллов сегнетовой соли,
фосфата аммония и сульфата лития
Кристаллы KNaC4H406-4H20, NH4H2P04, Li2S04H20
выращивают скоростным методом, основанным на вращении кристалла
в сильно пересыщенном водном растворе.
8*
211
Процесс получения монокристаллов сегнетовой соли
производится на основании эмпирической кривой растворимости и
расчетных данных В. Б. Татарского. Эмпирическая кривая
растворимости сегнетовой соли имеет вид параболы и выражается
уравнением
С =420+ 1,2/2.
Периоду выращивания предшествует период приготовления
раствора, приготовления и монтажа затравок.
При температуре 55—56° получают насыщенный раствор из
трех частей сегнетовой соли и одной части воды. После переме-
Рис. 129. Выращива- Рис 130. Кристалл сегнетовой соли
ние кристаллов в
сосуде Дьюара при
охлаждении
шивания в течение 2—3 суток раствор 5—6 часов отстаивается и
отфильтровывается в растворный бак.
Для получения кристаллов сегнетовой «соли нужного габитуса
раствор слегка подщелачивается едким натром или едким ^калием
(1—Зг на 1л раствора в пересчете на КОН) и перемешивается
в баке 20—24 часа при температуре 55—56°С.
Перед загрузкой термостата необходимо плотность раствора
довести прибавлением воды до 1,442 г/см3.
Затравка длиной примерно в 1 см вырезается в плоскости ab
(рис.130). Сегнетова соль кристаллизуется в ромбической синго-
нии и затравка представляет собой вырезанный из монокристалла
столбик (или целый кристаллик подходящих размеров),
удлиненный по оси с. Его вставляют в углубление так, чтобы
выступающий конец был длиной в 1—2 мм. Обычно заготовки для
зародышей (затравок) вырезают из отходов большого кристалла, в форме
прямоугольного параллелепипеда с ребрами, параллельными
главным осям, кристалла. Примерные их размеры: а = 0,4—0,5 см\
6 = 0,6 см\ с=1,2—1,0 см. Ребра заготовки закругляются.
212
После приготовления затравок заполняют стеклянные банки
раствором, пропущенным через фильтр при температуре 55—54°С.
При этом соблюдаются все меры предосторожности — брызги не
должны попадать на стенки банок. На банки надеваются крышки
с резиновым кольцом и прикрепляется кристаллоносец, на
котором с помощью воска закреплена затравка резиновой трубкой
к ведущему шпинделю, и температура снижается до 43°С. После
появления на затравке следов регенерации включается вращение
и поднимается температура до 45—45,5°С, которая
поддерживается постоянной в течение 2—5 суток. Снижение температуры
следует вести точно по разработанному графику до комнатной
температуры. Линейная скорость роста по мере увеличения кристалла
замедляется, а суточный весовой прирост кристалла имеет
некоторый предел.
Кристалл весом 5—6 кг вырастает в одной стеклянной банке
(а их может быть в термостате до сотни) в течение 23—27 суток.
Для того чтобы сохранить прозрачную поверхность выросшего
кристалла, его переносят из кристаллизатора в термостат с
керосином при одинаковой температуре.
При выращивании кристаллов однозамещенного фосфата
аммония особый интерес представляет приготовление затравок и их
монтаж. Большая скорость роста у кристаллов фосфата
аммония наблюдается на гранях тетрагональных тетраэдров,
минимальную скорость роста имеют грани призмы. Поэтому затравка
вырезается в форме стержня, параллельного ребру бипирамиды
(рис. 131). Этим достигается большая экономичность и меньшее
влияние затравки на кристалл. Затравка закрепляется на кри-
сталлоносце таким образом, чтобы длина ее совпадала с
направлением скоса на конце кристаллоносца. Стержень затравки с кри-
сталлоносцем располагаются в горизонтальной плоскости и ревер-
сивно вращаются вокруг вертикальной оси. Кристаллоносцы,
насаженные на ось и несущие затравочные стержни, помещаются
в баки с раствором однозамещенного фосфата аммония, слегка
подщелачиваемого солью двузамещенного фосфата аммония.
Кристаллы сульфата лития, относящиеся к сфеноидальному
классу моноклинной сингонии, выращивают динамическим и
статическим методами.
В целях получения более однородного материала и для
всестороннего исследования правильно ограненных монокристаллов
сернокислый литий выращивается в динамическом режиме. Однако
таким методом редко удается вырастить крупные и вместе с тем
однородные кристаллы сульфата лития из-за их большой
склонности к растрескиванию в процессе роста или во время съема.
Степень дефектности кристаллов ЫгЗО^НгО понижается по мере
повышения температуры кристаллизации. Ряд авторов считает,
что кристаллы, выращенные при комнатной температуре,
составлены из отдельных блоков и потому имеют на своей поверхности
Щели и углубления. Кристаллы, выращенные при температуре,
213
близкой к 100°С, не имеют этих дефектов. В
высокотемпературных растворах ионы и их комплексы обладают большей
подвижностью, благодаря чему создаются благоприятные условия для
регулярного расположения ионов в кристаллической структуре,
и поэтому выращивание кристаллов I^SCVIH^O производится при
Рис. 131. Кристалл фосфата аммония со стержневой
затравкой внутри
высокой температуре порядка 95—100°С. Ввиду малой и
отрицательной температурной зависимости растворимости Li2S04-H20 в
воде, температура кристаллизации поддерживается постоянной,
а пересыщение обеспечивается за счет регулируемого слива
конденсата.
Кристаллы одноводного сульфата лития выращивают из
слабокислых растворов (рН = 4,5—5,0).
При этом используются термостатированные стеклянные
кристаллизаторы емкостью около 9 л, схематически изображенные на
214
рис. 132. Отвод конденсата осуществляется по принципу
сифона 11). Кристаллы сульфата лития выращивают с подпиткой —
по мере слива конденсата добавляется свежий раствор. Для этого
кристаллизатор соединяют с сосудом, из которого по принципу
сообщающихся сосудов раствор постепенно поступает в
кристаллизатор. Доставку раствора
необходимо вести плавно, непрерывно
и в количествах, равных
количеству сливаемого конденсата. Крис-
таллоносцем служит
вертикальная титановая ось (2) с
ввинчивающимися в нее
горизонтальными отростками,
заканчивающимися цанговыми зажимами (3) для
крепления стержневых затравок
(4). Ось кристаллоносца проходит
через укрепленный на крышке
кристаллизатора стеклянный
шариковый холодильник (5),
применяемый для возврата конденсата.
В кристаллизаторе на высоте
2—3 см укреплено ложное дно
(6), в центре которого имеется
отверстие диаметром около 5 см..
Паразитические кристаллы
отбрасываются движением раствора
под ложное дно, где они имеют
ограниченную -возможность роста
и не мешают развитию основных
кристаллов.
Удлинение затравки (4—
5 см) совладает с осью z
кристалла (рис. 133). Сечение затравки
для облегчения регенерации
берется минимальным, обычно
около 3 мм. \
В собранный и нагретый
примерно до 70°С кристаллизатор
заливают подогретый раствор
сульфата лития (марки «хч» или «чда») в дистиллированной воде,
подкисленной 0,5—1,5 г серной кислоты на 1 л раствора.
Температура насыщения раствора (97—100° С) определяется по плотности
1,213—1,214 г/см3. Температура начала роста уточняется
визуальным наблюдением за регенерацией затравок и поддерживается
постоянной (±0,2° С) в течение всего цикла выращивания.
Исходя из размеров установленных затравок, габитуса
кристаллов и заданной скорости их роста, рассчитывается суточный
график слива конденсата на весь цикл выращивания.
Рис. 132. Схема
термостатированного кристаллизатора:
/ — сифон; 2 — титановая ось; 3 —
цанговые зажимы; 4 — стержневые
затравки; 5 — стеклянный
шариковый холодильник; 6 — ложное дно
215
Выращивание производится со скоростью ~3 мм/сут по оси у
в обоих направлениях. По окончании выращивания раствор
сливается и кристаллизатор медленно охлаждается до комнатной
температуры, после чего снимают кристаллы. Таким образом, за
40—60 суток выращиваются кристаллы весом до 400 г.
Выращиваемые динамическим методом ограненные кристаллы сульфата
лития редко свободны от трещин, что является отчасти следствием
Рис. 134.
лития в
Кристалл сульфата
вынужденной
(блочной) форме
Рис. 133. Кристалл сульфата лития
анизотропии скоростей роста
различных граней.
Крупные визуально однородные
кристаллы без трещин оказалось
возможным выращивать в форме
ориентированных блоков (рис.
134). Получение таких
кристаллов в вынужденной форме
производится в статическом режиме. В качестве затравки
используется пластинка, вырезанная параллельно одной из медленно
растущих граней (100) кристалла. Она укладывается строго
горизонтально на дно стеклянного круглого стакана и целиком его
покрывает. «В неподвижном растворе конвекционные потоки
устремляются вверх от любой точки горизонтальной поверхности
кристалла, непрерывно перемешиваясь по ней. В случае
возникновения микровозвышений рост их тормозится восходящим потоком,
который задерживается там до тех пор, пока соседние участки
грани не догонят их в росте. Такой механизм роста позволяет
получить визуально однородные кристаллы достаточно большого
сечения и нужной формы из неперемешиваемых сильно
пересыщенных растворов» (по А. А. Штернбергу).
216
В большом 10-литровом стеклянном цилиндрическом
кристаллизаторе может одновременно выращиваться до 10 кристаллов в
химических стаканах емкостью 150 см3, устанавливаемых на
решетчатой подставке из стеклянных трубок. Заполненный
кристаллизатор покрывают стеклянным диском и герметизируют клеем
БФ-4. В диске имеются отверстия для контактного и контрольного
термометра, трубки для слива конденсата и трубки, служащие
для уравнивания давления внутри и вне кристаллизатора.
Обогрев осуществляется обмоткой из нихрома, прилегающей
непосредственно к боковой поверхности кристаллизатора.
Скорость выращивания кристаллов регулируется количеством
сливаемого конденсата. После завершения периода регенерации
затравок слив конденсата остается постоянным, так как площадь
растущих поверхностей не меняется в продолжение всего цикла
выращивания. Скорость выращивания, равная 1,5—2 мм/сут,
рассчитывается по формуле
Sid • 1000
где Q — количество конденсата, сливаемого за сутки (в см3); S —
суммарная площадь форм (в см2)\ X—скорость роста кристаллов
по нормали к растущей грани (в см)\ d — удельный вес
кристалла; С — растворимость сульфата лития (в г/л) при температуре
выращивания. По окончании процесса выращивания раствор не
сливают, а отключают обогрев .кристаллизатора. В результате
медленного охлаждения раствора и кристаллов последние не
растворяются, а только слегка подтравливаются.
В практике выращивания совершенных монокристаллов следует
придавать особо важное значение качеству затравочных
кристаллов. Для получения совершенных монокристаллов необходимы
совершенные затравки. Это положение распространяется на все
случаи выращивания кристаллов на затравках из любого
агрегатного состояния. Растущий на затравке монокристалл, как
правило, наследует дефекты затравки. Наиболее устойчивой
«наследственностью» обладают дислокации.
С уменьшением размера затравки уменьшается ее влияние на
качество выращиваемого кристалла. Влияние это осуществляется
прежде всего через слой, приходящийся на регенерацию
поверхности затравки. Для обеспечения равномерной однородной
регенерации необходимо поверхность затравки подвергнуть
соответствующей предварительной обработке (например травлению). Плохая
регенерация является одной из причин растрескивания кристаллов
при их обработке. Вокруг затравок малого размера легче
обеспечить постоянные условия регенерации ее поверхности: постоянную
концентрацию основного и примесного вещества, постоянные
пересыщение и температуру.
Считается целесообразным использование затравки, выросшей
в тех же условиях, в которых на ее поверхности будет расти
кристалл.
217
Гидротермальный метод выращивания монокристаллов
Гидротермальный метод — это один из методов выращивания
4 монокристаллов из водных растворов, концентрация которых есть
функция двух переменных: температуры и давления.
Гидротермальный метод, применявшийся с момента своего
возникновения для выращивания .кварца, в настоящее время
становится универсальным. Преимущество его
состоит прежде всего в возможности
сочетания относительно низких температур
и активных растворителей. Благодаря
этому гидротермальный метод успешно
используется для кристаллизации
труднорастворимых и легколетучих
соединений, а также веществ, разлагающихся
вблизи температуры плавления.
Сущность гидротермального метода
состоит в следующем. Герметически
закрытый стальной сосуд (автоклав), в
донной части которого помещается
питательное вещество, заполняется водным
раствором до определенного объема
(рис. 135). При нагреве раствора
возникает давление, величина которого
определяется объемным процентом
заполнения сосуда. Так, например, при
беспроцентном заполнении автоклава водой он
оказывается совершенно заполненным
ею, еще не достигнув «критической
температуры воды (374,2°С). При
приближении к этой температуре плотность
водного раствора уменьшается примерно
вдвое и сохраняется4* неизменной при
дальнейшем повышении температуры.
Температура верхней и нижней части
автоклава поддерживается различной.
В нижней, более высокотемпературной
части, происходит растворение вещества
до насыщения. Благодаря
конвекционным токам насыщенный раствор
переносится в верхнюю часть, где он оказывается пересыщенным, а это
приводит к осаждению растворенного вещества на стенках
верхней части автоклава или специально подвешенной затравке.
Конвекция раствора в автоклаве осуществляется за счет того,
что обычно в качестве растворимого вещества используются
труднорастворимые, такие, как силикаты, сульфиды, вольфраматы
и т. д. При нагреве, в силу большого температурного коэффици-
ти
Рис. 135. Разрез автоклава:
/—питательная среда; 2—
щелочной водный раствор
под давлением 1050 ат\ 3 —
затравка;
кристалл;
кожух; 7
конечник;
трубка;
тельная
4 — 'выросший
5 — опора; 6 —
— конический на-
8 — внутренняя
9 —
предохранили афрагм а; 10 —
приваренный бортик
ента расширения воды и малой концентрации насыщения, раствор,
сравнительно легкий, поднимается вверх.
Таким образом, процесс роста кристаллов в гидротермальных
условиях включает несколько стадий: растворение вещества з
нижней зоне автоклава, перенос его в растворенном состоянии в
зону роста, диффузию к кристаллической поверхности и, наконец,
рост кристалла. Роль этих стадий при кристаллизации
определяется условиями эксперимента.
Перед тем как приступить к кристаллизации нужного объекта,
обычно изучается его растворимость, величина и знак
температурного коэффициента, для чего необходимо построение РГ-диа-
граммы. Получают изохоры из опытов в маленьких автоклавах
объемом в 50 см3 при известных температурах и объемах
заполнения.
Установлено, что в растворении и переносе окислов, сульфидов,
карбонатов, силикатов, молибдатов и вольфраматов большую роль
играют водные растворы хлоридов: NaCl, LiCl, NH4C1; из них
наиболее активен раствор NH4C1.
Автоклавы, используемые для получения кристаллов
вышеперечисленных соединений, предварительно 'футеруют титаном, не
разъедаемым раствором. В ряде случаев автоклав предохраняют
от химического воздействия растворов введением в него
тонкостенной металлической закрытой трубки (рис. 135).
Величина конвекционного движения раствора, следовательно,
и скорость роста кристаллов зависит от температурного градиента
по высоте тела автоклава. Разница температур достигается путем
соответствующего изменения слоя изоляции в верхней части
автоклава. Температура нижней, средней и верхней частей автоклава
контролируется с помощью термопар и измерительной
аппаратуры.
Величину температурного градиента внутри автоклава
невозможно регулировать одним изменением температурного градиента
на его внешних стенках, так как по мере увеличения
температурного градиента на стенках ускоряется конвекционное движение
раствора и вместе с тем уменьшается температурный градиент во
внутренней полости автоклава. Достаточный температурный
градиент, способствующий эффективному переносу растворенного
вещества, получают путем ввода во внутреннюю часть автоклава
специальных перегородок. Последние ограничивают конвекционное
движение жидкости.
Особое внимание уделяется окислительно-восстановительному
потенциалу среды, оказывающему влияние на рост кристаллов.
При получении количественных значений давлений для данных
коэффициентов заполнения автоклавов используются таблицы
Кеннеди и Вуколовича, рассчитанные для воды.
К настоящему времени гидротермальным методом получены
кристаллы кварца, кальцита, ряда окислов, молибдатов,
вольфраматов и других соединений.
219
Проблема получения пьезо-кварца считается сейчас в СССР
йолностью решенной. При этом следует отметить большие заслуги
В. П. Бутузова и А. А. Штернберга.
История совершенствования метода выращивания кварца
представляется весьма поучительной в том смысле, что выбор
растворителя, а также рабочей температуры кристаллизации были
найдены на основании изучения природных кристаллов кварца и
в особенности его газово-жидких включений. Эти данные и
определили направление работ по поискам путей искусственного
получения пьезо-кварца.
В качестве исходной шихты используется природный жильный
кварц. Известно более девяти кристаллических модификаций
двуокиси кремния и аморфная, называемая плавленым
кремнеземом. Все разновидности Si02 в той или иной степени
растворяются в воде, лучше — в водно-щелочных растворах. Эта
растворимость, вообще очень малая, возрастает при повышении
температуры. Легче всего растворяется плавленый кремнезем и тяжелее
всего кварц.
Первые работы Наккена показали, что применение плавленого
кремнезема в качестве питающей среды не дает положительных
результатов. Максимальный рост кристалла кварца происходит в
течение первых даух суток или "меньше, после чего наблюдается
замедление роста и даже растворение кристалла. Плавленый
кремнезем расстекловывается, переходя или в кварц или в смесь
кварца и кристобалита.
В заводских цехах пользуются автоклавами объемом в
несколько литров, .которые ставятся на продолжительное время
(несколько месяцев) в определенном режиме. Автоклав,
находящийся в вертикальном положении, нагревается снизу, и вдоль
автоклава создается температурный градиент. В донной части
автоклава помещают куски дробленого жильного кварца, а в верхней
части — монокристальные затравки. В качестве растворителя
кварца обычно применяют водно-щелочные растворы. Наиболее
эффективное выращивание кварца осуществляется из 5%-ного
водного раствора карбоната натрия при температурах 350—370°С,
давлении 150—300 атм, градиенте температур, равном 20°.
Затравками служат пластинки, вырезанные параллельно грани большого
ромбоэдра. Опыты показывают, что кристаллы кварца,
выращенные на пластинках, вырезанных по призме, чище кристаллов,
выращенных на пластинах пинакоида. Это становится понятным,
если иметь в виду, что грань пинакоида растет быстрее грани
призмы. В отношении скорости роста грань большого ромбоэдра
занимает промежуточное положение между гранями призмы и
пинакоида. Поэтому чаще других используются затравочные
пластинки {1011}, они обеспечивают одновременно оптимальную
скорость роста и чистоту кристалла кварца.
Гидротермальный метод стал широко применяться для
кристаллизации целых классов минералов гидротермального генезиса.
220
В некоторых случаях попытки кристаллизации этих веществ
включают элементы моделирования природных процессов. Однако идти
по пути моделирования возможно только на основании их
детального и всестороннего изучения. В природе кристаллизация многих
минералов происходила, вероятно, при более низких параметрах.
В связи с этим интересно сопоставление условий образования
кристаллов минералов в природе и лаборатории.
Кристаллизация металлов при электролизе
(электрокристаллизация)
Если взять раствор какой-либо соли и поместить в этот
раствор два электрода, причем анод непременно должен быть из того
металла, который входит в состав соли, то при пропускании тока
на катоде при определенных условиях оседает
крупнокристаллический осадок, из которого можно выделить правильно
ограненные кристаллы.
Электрохимическое выделение кристаллов иногда
осуществляется без внешней электродвижущей силы. Так, столбик из
.куска железного колчедана и свинцового блеска, погруженный в
раствор сернокислой меди, сам создает электродвижущую силу,
образует элемент и на стержне выделяется медь. Если палочка
меди до половины погружена в раствор азотнокислой меди, а
другая половина находится в воде, то часть меди, находящаяся в
растворе, покрывается кристаллами красной закиси меди.
Методами электрокристаллизации чаще пользуются для
получения кристаллов металлов. Различают «упорядоченное» и
«неупорядоченное» отложение металлов. «Упорядоченное»—когда атом
металла, получающийся после разрядки иона, выделяется в один
из узлов решетки уже имеющегося на катоде кристалла,
«неупорядоченное», когда такой атом выделяется в какое-нибудь
положение, отличное от узла. От того, какой тип отложения преобладает,
зависит структура осадка.
Рассмотрим следующую схему механизма отложений металлов
при электролизе, предложенную В. А. Кистяковским. В процессе
отложения металла^ на катоде играет роль не только электролит,
'но и состояние металлической поверхности катода. Согласно
теории Тейлора, поверхность металла покрыта бесчисленными
субмикроскопическими выступами, на которых при электролизе
сосредоточиваются электроны. При приближении положительных
ионов на расстояние «ионного выстрела» электроны срываются с
катода, и подошедшие ионы теряют свои заряды по закону Фара-
дея. Лишенные заряда, уже не ионы, а атомы, оседают на
поверхность кристаллической структуры катода. Под действием каких-
*дибо физических факторов атомы металла иногда не успевают
осесть на поверхность растущего кристалла, а подвергаются
агрегации. Эти агрегаты могут стать центрами образования новых
кристаллов.
221
Лодерхнасть катода
Подертность катода
Изучение структуры металлов, полученных путем электролиза,
показывает, что непосредственно у поверхности катода образуется
большое .количество мелких кристаллов, укрупняющихся по мере
удаления от поверхности катода. При этом часть кристаллов
растет как в направлении, перпендикулярном к катоду, так и в
направлениях, параллельных его поверхности. Такие кристаллы
имеют форму пирамид, обращенных
вершинами к катоду, а основаниями в сторону
электролита. Другая часть кристаллов,
достигнув некоторой величины, продолжает
потом расти только в направлении,
перпендикулярном катоду. Они -представляют
собой пирамиды с обратным расположением
вершин и оснований по сравнению с
первой частью кристалла. Эти кристаллы со
временем «вырождаются». Все кристаллы
не являются геометрическими правильными
телами, они сильно деформированы по
всем направлениям.
Согласно схеме Кистяковского (рис. 136)
при нормально идущем электролизе меди
новых самостоятельных кристаллических
центров фактически не наблюдается. В
случае вырождения новые кристаллы
начинают расти от вершин старых. Эта схема
связывается с представлением Тейлора о
состоянии поверхности металла. Обычно
разрастаются те кристаллы, у которых
поверхность слегка выпуклая.
Наряду с металлами
электрокристаллизацией получают окислы. Из работ К. М.
Горбуновой следует, что при
электрокристаллизации имеет место два процесса:
разряд и рост. После разряда происходит
частичная диффузия к месту роста. При невысоких пересыщениях
существенна поверхностная диффузия, при высоких — объемная.
На кристаллах наблюдается спиральная морфология.
Однако рост кристаллов при электролизе может существенно
отличаться от нормального роста,_гак как в этом случае на силы
решетки накладывается еще электрическое поле.
Соответствующие силы особенно велики на субмикроскопических остриях и
ребрах. В этих местах происходит наиболее интенсивный рост и часто
получаются иглообразные и нитевидные кристаллы.
Кристаллизация из растворов в расплавах
Кристаллизацией из растворов в расплавах пользуются всякий
раз, когда имеют дело с труднорастворимыми в воде, либо
разлагающимися при нагревании, или плавящимися при очень высокой
Рис. 136. Схема
кристаллов, разрастающихся и
вырождающихся
222
температуре веществами. К таким веществам относятся многие
ценные по своим свойствам кристаллы, применяемые в науке и
технике: (флюорит, кальцит, шеелит, 'ферриты, титанаты и цирко-
наты бария, окислы различных металлов (например А120з) и др.
Этот способ выращивания монокристаллов не требует ни
создания давления, ни специальной атмосферы.
Кристаллизация из растворов в расплавах происходит из двух-
компонентной системы, где растворителем берется расплав какой-
либо более легкоплавкой подвижной соли. Поэтому работа по
выращиванию кристаллов данным способом всегда начинается с
детального изучения диаграмм состояния я-компонентных систем.
А
А
А
а
^т Яп
Рис. 137. Фазовые диаграммы двухкомпонентной системы: а —
компоненты А и В не образуют химические соединения; б — образуют
химические соединения «в точке Е'
В литературе (И. Н. Аникин) дается указание на ряд общих
соображений, которыми следует руководствоваться при подборе
растворителя.
Во-первых, растворитель и растворимое вещество в жидком
состоянии должны смешиваться неограниченно, а в твердом
состоянии не образовывать твердых растворов (рис. 137, а). В таком
случае кристаллизация чистого .компонента В будет происходить
на всей кривой В'Е. Нежелательно, чтобы при этом
образовывались какие-либо соединения (р;ис. '137, б), очевидно,
затрудняющие кристаллизацию чистого компонента В. Возникающие
промежуточные соединения вообще могут портить растущие
кристаллы, образуя в них различного рода включения. Выгоднее
использовать тот растворитель, который образует с растворимым
веществом наиболее низкотемпературную и близкую к ординате
растворителя на фазовой диаграмме эвтектику. В этом случае
растворимость В в А будет наибольшей.
Растворитель должен быть таким, чтобы в случае вхождения
в растущий кристалл он не влиял на интересующие нас свойства
кристалла. Так, большинство люминесцирующих кристаллов
нельзя выращивать в растворах, содержащих железо и некоторые
другие тяжелые металлы, .которые обладают способностью «тушить»
люминесценцию. В этом случае в качестве растворителей следует
использовать хлориды, фториды, сульфаты, фосфаты и другие
соединения щелочных и щелочноземельных металлов.
223
Желательно, во избежание посторонних ионов, чтобы
растворитель имел одноименный ион с кристаллизуемым веществом. Если
этого осуществить не удается, тогда, чтобы избежать
изоморфизма, радиусы ионов растворителя должны по возможности макси-'
мально отличаться от ионных радиусов растворимого вещества.
Желателен расплав — растворитель с малой вязкостью, и
весьма существенно, что хлориды щелочных металлов имеют вязкость
примерно такую же, как вода, или даже меньше.
Упругость паров расплава растворителя также желательна
возможно более низкая, чтобы избежать интенсивного испарения
растворителя в процессе кристаллизации, следовательно,
изменения состава раствора и не допустить возможности кристаллизации
с поверхности. Для обеспечения этого, температуры плавления и
кипения растворителя должны сильно различаться.
Для того чтобы по окончании кристаллизации можно было
легко отделить синтезированные кристаллы от соли растворителя,
последняя должна растворяться в воде или в других доступных
растворителях.
Так, учитывая вышеотмеченные соображения, в качестве
растворителя при выращивании шеелита (CaWC^), флюорита (CaF2)
и .кальцита (СаСОз) выбирают хлористый литий, с минимальной
температурой плавления. Растворимость в хлористом литии
шеелита достаточно большая — 250 г CaW04 в 100 г LiCl при 600°С,
эвтектика при 480°С. Для корунда подобран растворитель —
расплав фтористого -свинца. Установлено, что А12Оз может расти как
из жидкой фазы PbF2—AI2O3, так и из газовой фазы в результате
того, что при увеличении процентного соотношения PbF2 в системе
PbF2—AI2O3 увеличивается тенденция к химическому
взаимодействию между PbF2 и А120з.
В качестве растворителей ферритов фигурируют фториды
некоторых металлов или бура.
Растворимость веществ в расплаве какой-либо соли и ее
температурную зависимость устанавливают, например, путем
качественного анализа исследуемого расплава и его пробы, закаленной
при определенной температуре, а также
визуально-политермическим методом.
Что касается кристаллизации вещества из растворов в
расплавах, то в принципе остаются возможными несколько методом
получения монокристаллов.
Кристаллизацию из растворов в расплавах можно осуществить:
1) путем медленного охлаждения насыщенного раствора при
«самопроизвольном» зарождении отдельных кристаллов; 2) на
затравке\ при снижении температуры по установленному режиму;
3) на затравке путем испарения растворителя при постоянной
температуре; 4) за счет переноса питательного материала со дна
кристаллизатора на подвешенной в верхней его части затравке при
определенном температурном градиенте. Пятый способ получения
монокристаллов из растворов в расплавах состоит в том, что за-
224
щ
рождение и рост кристаллов фиксируются в местах с искусствен-
1 ным отводом тепла.
Способ выращивания кристаллов из растворов в расплавах
очень часто используется в поисковых целях и пока еще мало
применяется в целях получения совершенных кристаллов.
Выращивание кристаллов ферритов
Ферриты M(Fe02b кристаллизуются в кубической системе и
имеют структуру обращенной шпинели. Они химически
устойчивы, не растворяются ни в воде, ни в других растворителях и
плавятся при очень высокой температуре (около 1700°С).
Керамические образцы ферритов научились получать
значительно раньше монокристаллов. Последние же выгодно
отличаются от керамики более ценными свойствами (например, узкой
полосой резонансной линии и т. п.), в связи с чем представляют
больший интерес.
Используются разнообразные способы получения
монокристаллов ферритов: из расплавов методом Вернейля или Бриджмена,
из растворов в расплавах и из газовой фазы.
Часто и достаточно успешно осуществляется кристаллизация
ферритов при медленном охлаждении насыщенных растворов
ферритов в расплавленном растворителе. Процесс растворения и
кристаллизации ферритов происходит в этом случае при сравнительно
невысоких температурах (1200—1300°С). Размер получающихся
монокристаллов зависит главным образом от условий взаимной
плавкости отдельных компонентов и от скорости охлаждения всей
системы.
Общеизвестными растворителями для ферритов служат бура
,и фториды некоторых металлов. Недостаток фторидов состоит в
том, что они интенсивно испаряются при высоких температурах.
Исходная шихта готовится смешиванием окислов с
определенным количеством обезвоженной буры в заданных отношениях,
которые устанавливаются экспериментально. Используемый в
опытах платиновый тигель с шихтой помещается в холодную
шахтную печь. Шихта доводится до расплавления, затем дается
выдержка при определенной температуре для полного плавления
исходных компонентов, после чего обеспечивается медленное
охлаждение смеси. Таким способом можно получить затравочные
кристаллы ферритов простых (кобальтового и марганцевого) и
смешанных ь (цинк-марганцевого и цинк-никелевого).
Монокристаллы ферритов из расплава буры растят на затравках путем
снижения температуры насыщенного раствора — расплава, либо-
испарением растворителя при постоянной температуре.
По первому способу опыты проводятся в специальных
сосудах, между верхней и нижней'частями которых создается
температурный градиент. При наличии температурного градиента в
условиях заметного пересыщения вырастают крупные несовершен-
225
ные кристаллы скелетной формы. Кристаллы, растущие в
условиях, близких к равновесным, получаются в виде правильных
октаэдров.
Применение метода испарения растворителя показало, что
ввиду весьма значительной упругости паров ферритов при
высокой температуре создаются благоприятные условия для роста
монокристаллов ферритов из газовой фазы. Ферритные вещества,
испаряясь вместе с растворителем, оседают в виде буль на краях
и стенках кристаллизатора.
Своей способностью легко расти из газовой фазы ферриты
похожи на различные шпинели, растущие из газовой фазы в
присутствии такого минерализатора, как фтор. В случае ферритов
веществом, обусловливающим легкую реакцию в газовой фазе, служит
элементарный бор, частично образующийся при высокой
температуре вследствие разложения буры.
Из растворов в расплавах получают кристаллы ферритов и
более сложного состава, в частности, феррит иттрия Y3Fe50i2 со
структурой гранатового типа. Это соединение плавится с
разложением, поэтому монокристаллы его могут быть получены только из
раствора. В качестве растворителя при выращивании кристаллов
ферритного граната используют смесь окиси свинца и борного
ангидрида. Из диаграммы состояния системы РЬО—В20з видно,
что в ней образуется несколько легкоплавких соединений, которые
могут использоваться в качестве растворителей. Кроме того,
добавки борного ангидрида или борной кислоты способствуют
кристаллизации. Образующиеся в растворе группы В03, имеющие
«плоскую форму», легко адсорбируются на гранях растущего
кристалла и блокируют их в моменты временной остановки роста.
Это предохраняет кристаллы от растворения в периоды
истощения питательной среды и в большинстве случаев приводит к
улучшению условий кристаллизации. В качестве исходных компонентов
используются окись железа (чда), окись свинца (чда), борная
кислота (хч) и окись иттрия Y203 (99,5—99,9) от суммы всех
редкоземельных элементов. Содержание В20з изменяется в пределах
от 7 до 80 вес. % по отношению к растворителю. Компоненты
тщательно перемешиваются в мокром виде в агатовой или
яшмовой ступке, высушиваются при Л 50—200°С и загружаются в ти- ,
гель. Лучшие результаты получаются при использовании смеси j
следующего состава: 7—14 В203-45—38 РЬО-44 Fe203: 3,5 Y203
молярный %.
Опыты проводятся в закрытых платиновых тиглях в печи с
карборундовыми нагревателями. Измеряемая платино-платино-
родиевой термопарой температура печи регулируется программой 4
с использованием потенциометра, контактов, жестко связанных со
стрелкой потенциометра, показывающей температуру печи, реле,
дополнительного сопротивления (реостата). Отступление от
заданной программы резко снижает свойства и размеры получаемых
кристаллов.
226
Нагревание исходных компонентов производится до 1340°,
кристаллизация— до 950°С. Кристаллы из тигля извлекаются путем
длительного кипячения расплава в 20%-ном водном растворе
HNO3. После растворения остаются кристаллы YsFesO^ и
PbFe^Og (магнетоплюмбита). Разделение их ведется визуально,
поскольку они имеют разные габитусы (кубические и
гексагональные). Кристаллы самого граната получаются разного габитуса.
В более вязкой среде (без борной кислоты или с борной кислотой,
но при пониженной температуре) кристаллы растут удлиненной
формы с появлением граней лейцитоэдра (211). В менее вязкой
среде при том же температурном режиме образуются кристаллы
только с гранями ромбододекаэдра (110).
При концентрации более 25% В20з в растворителе кристаллы
, граната практически не образуются. При этом поле
кристаллизации, очевидно, сдвигается в область образования кристаллов
окиси железа. В этом случае из расплава вырастают кристаллы
гематита а—Fe203.
Кроме кристаллов иттриевого граната таким образом
выращиваются кристаллы твердого раствора «следующего состава:
(Yo,75La0,25)3Fe50i2 со структурой типа граната.
§ 6. ВЫРАЩИВАНИЕ КРИСТАЛЛОВ ИЗ ПАРОВ
Механизм роста кристаллов из паров достаточно хорошо
изучен, что нашло свое отражение в современных теориях роста.
Кристаллизация из паров имеет ряд характерных преимуществ.
Во-первых, рост может идти при низких температурах, т. е. с
малым содержанием дефектов (малой плотностью дислокаций,
сниженной концентрацией вакансий). Во-вторых, воздействие тигля
на процесс получения кристалла становится, как правило,
наименьшим. В-третьих, для роста из пара требуется простая
аппаратура, обеспечивающая лишь поддержание необходимых
температурных условий и отпадает необходимость механического
движения. В-четвертых, при выращивании кристаллов с помощью
необходимой аппаратуры легко регулировать стехиометрический
состав соединения. Наконец, при выращивании из паров можно
получить кристаллы с правильной огранкой и совершенными
поверхностями граней.
Кристаллизации из паров свойственны и некоторые
ограничения. В настоящее время этим путем выращивают относительно
небольшие кристаллы. Но имеются все основания полагать, что
при стабилизации условий роста на длительное время можно
выращивать крупные кристаллы. Способ кристаллизации вещества из
паров особенно пригоден для тех веществ, которые в обычных
условиях сразу переходят из твердого состояния в парообразное
и обратно, минуя жидкую фазу. Однако он годится лишь для
материалов с подходящим давлением паров. Слишком малая
упругость пара исходного вещества или компонентов делает невозмож-
227
ным выращивание кристаллов из паров, но можно предполагать,
что эти трудности окажутся преодолимы при удачном подборе
условий кристаллизации.
Кристаллизацией из паров в настоящее время широко
пользуются для получения промышленно важных материалов в виде
монокристаллов или эпитаксиальных пленок, а также кристаллов
для теоретических исследований. Выращивание производится
преимущественно путем возгонки вещества в замкнутых
эвакуированных сосудах. Сосудами служат стеклянные или кварцевые трубки,
запаиваемые под вакуумом и облегчающие наблюдения за
процессами кристаллизации. Температура той части сосуда, в которой
находится запас вещества, для обеспечения пересыщения, должна
быть иной по сравнению с той, где
находится растущий кристалл. Тру-
*822Я "" ~~\ бочка может быть укреплена в термо-
Г стате — печи, разделенной на две час-
"L™—' ти: А и В (рис. J38). Сначала
нагревают обе части термостата до одинаковой
температуры Т2 и устанавливается
Рис. 138. Схема выращивания давление насыщенных паров, соответ-
■кристаллов из газовой фазы „ . „* о«
у * ствующее этой температуре. Затем
понижают температуру в травой части
термостата до значения Ти благодаря чему давление
пересыщенного пара здесь становится выше по отношению к давлению
насыщенных паров при температуре Г2. Путем медленного понижения
температуры увеличивают пересыщение до тех лор, пока не
возникнут зародыши кристаллов. Рост на поверхности зародыша
осуществляется при меньшем пересыщении, чтобы избежать
образования новых зародышей.
Так получают кристаллы йода, фосфора, нафталина и других
веществ величиной 3 мм! Для их зарождения требуется разность
температур порядка 2°С. При этом из нескольких образовавшихся
кристаллов остается один, остальные испаряются. Для
дальнейшего роста оставшегося кристалла устанавливается разность
температур меньше 0,1°С.
Второй метод выращивания кристаллов из паров,
принципиально отличающийся от первого, получил название метода
молекулярного пучка, или метода Векшинского. Сущность этого
метода и использование его для получения пленок металлов описаны
в гл. VI § 4.
Работы Л. С. Палатника по изучению механизма
конденсации металлического пара в вакууме указывают на
возможность образования кристаллической фазы либо
непосредственно из пара (по схеме п—*к), либо через жидкую фазу (по
схеме п—уж—нк). Начальную стадию образования конденсата
на нейтральной подложке можно представлять как «двумерную
кристаллизацию» или сжижение «двумерного металлического
пара», образующегося на подложке. Механизм конденсации в ваку-
228
уме определяется температурой подложки и плотностью
молекулярного потока.
Третий метод получения кристаллов из паров состоит в
использовании в качестве транспортирующего агента легколетучих
веществ.
Такими веществами служат прежде всего галогены: фтор, йод
и другие. Метод транспортных реакций получил наиболее широкое
применение для выращивания эпитаксиальных
полупроводниковых слоев (см. гл. VI § 4) и часто используется в целях
выращивания монокристаллов тугоплавких веществ. Так можно получить
кристаллы шпинели с применением фторидов, причем
используется свойство фтора переносить ионы магния и алюминия на
подожку или затравку, подвешенную над шихтой. Транспортировка
торидов происходит из шихты на подложку при соответствую-
ей температуре. Фториды магния и алюминия, взятые в экви-
олекулярных количествах, смешиваются, помещаются в графи-
овый тигель и неплотно прикрываются графитовой крышкой,
ихта прокаливается в шахтной печи типа ТГ-02 при температу-
•е 1000— 1100°С в течение 2,5 час.
Реакция, очевидно, протекает следующим образом. Ионы
магия и алюминия, вынесенные фтором из шихты, взаимодействуют
с кислородом воздуха и дают конечные продукты
4A1F3 + 302 = 2A12(V+^F2,
MgF2 + 2A1F3 + 202 = MgO • А1гО, + 4F2.
Диагностика кристаллов, образовавшихся на внутренней
поверхности крышки, устанавливает, что наряду со шпинелью
MgO-Al203 всегда образуется корунд А120з.
• Целый ряд соображений говорит в пользу того, что за
выращиванием монокристаллов из паров большое будущее
§ 7. КРИСТАЛЛИЗАЦИЯ ИЗ ТВЕРДОГО СОСТОЯНИЯ
Кристаллизация из твердого состояния, или
перекристаллизация вещества, не получила такого широкого применения как
кристаллизация из жидкого состояния, однако некоторые способы
перекристаллизации вещества — собирательная рекристаллизация
и метод рекристаллизации обработки для выращивания
монокристаллов в ряде случаев используются в технике.
Собирательная рекристаллизация
Под собирательной рекристаллизацией понимают то
увеличение размеров зерен, которое происходит при простом нагревании
пластически недеформированного металла. Система, обладающая
229
большим запасом свободной энергии, менее устойчива, чем
система с меньшим запасом энергии. Поликристаллический чистый
металл состоит из отдельных кристаллов, разделенных друг от
друга межкристаллическон прослойкой, которая обладает
избыточным запасом энергии. Эта система при благоприятных
условиях переходит из поликристаллической в монокристалл. При
нагревании металла атомы или молекулы становятся более
подвижными и этим облегчают переход металла из менее устойчивого в
более устойчивое состояние. Атомы от мелких зерен переходят к
крупным зернам и увеличивают их размеры. Чем
мельче -зерно металла, тем менее устойчиво его
состояние, вследствие чего быстрее происходит
укрупнение зерен при нагреве. С повышением
температуры скорость роста зерен возрастает.
Особенно сильный рост наблюдается при
температурах, близких к температуре плавления. На
результат собирательной рекристаллизации
оказывают значительное влияние примеси, которые
могут как способствовать росту зерен основного
металла, так и, наоборот, препятствовать
получению крупнозернистой структуры. Метод
собирательной рекристаллизации широко
применяется при изготовлении вольфрамовых и
молибденовых нитей для ламп накаливания. В. И. Лихт-
ман и Б. М. Масленников разработали
соответствующий метод получения металлических
монокристаллов (рис. 139).
Осуществлялась рекристаллизация
поликристаллической проволоки олова, свинца, цинка
или алюминия диаметром до 1 мм, помещенной
в тонкостенную кварцевую трубку. Кольцевая
электрическая печь из нихромовой проволоки
перемещалась вдоль трубки с помощью каретки.
Температура в центре кольцевой печи не
намного (Превышала температуру оглавления- металла.
После перекристаллизации проволока
извлекалась из кварцевой трубки и протравливалась.
При достаточно медленном перемещении печи
всегда получался монокристалл, так как в этом
случае успевала проходить собирательная
рекристаллизация, которая создавала
монокристаллическую затравку для следующих порций плавящегося
металла. Собирательная рекристаллизация лучше происходит при
медленном охлаждении расплава. Регулируя скорость охлаждения
металлического расплава и тем самым ускоряя или замедляя
процесс собирательной рекристаллизации, можно получить металл с
любой заданной дисперсностью вплоть до монокристалла,
независимо от формы сосуда и способа отвода тепла.
Рис. 139. Схема
выращивания
монокристаллов
металлов (Si —
катушка с
поликристаллической
проволокой, $2 — катушка
с
монокристаллической проволокой,
Т — печь)
230
Метод рекристаллизации обработки для выращивания
монокристаллов
Рекристаллизацией обработки называется такое явление,
когда в пластически деформированном образце под влиянием
высокой температуры, не доходящей до точки плавления, образуется
дювая зернистая структура. Новая структура может быть крупнее
или мельче исходной.
Пластическая деформация образца, предшествующая отжигу,
должна быть небольшой и равномерной. С повышением
пластической деформации в образце возрастают внутренние напряжения п
вместе с тем увеличивается и число зародышей.
I Равномерная деформация возможна только в образце с равное
мерной мелкозернистой структурой. Таким образом, для
получения монокристалла из данного поликристаллического образца
необходимо добиться равномерной мелкозернистой структуры, затем
Sero равномерно деформировать и нагревать более или менее
продолжительное время.
Мелкозернистую структуру можно получить, если образец
подвергнуть предварительной холодной обработке, например,
растяжению, а затем нагреть в течение небольшого промежутка
времени до сравнительно невысокой температуры. Если металл
обладает полиморфизмом, то для возникновения мелкозернистой
структуры достаточно нагреть образец выше точки превращения.
Пластически деформированный образец растягивается на
0,5—6% и подвергается длительному нагреву. Наиболее
благоприятная степень деформации находится опытным путем для
каждого металла и сплава, но нагревание производится очень
осторожно, чтобы по возможности уменьшить число зародышей.
Отжиг начинают ниже температуры рекристаллизации (когда
развивается интенсивная перестройка). Температура постепенно
повышается на 20—50°С в сутки, чем обеспечивается рост одного
центра кристаллизации и невозможность новых зарождений.
' С этой же целью полезно создать в образце некоторый
температурный градиент. Отжиг продолжается в течение нескольких дней,
цричем под конец повышение температуры ускоряется.
В заключение полезен кратковременный отжиг при более
высокой температуре, лишь немного ниже температуры плавления
(точки перехода в другую модификацию для чистых металлов,
точки солидуса или точки эвтектики для сплавов). Это
способствует энергичной собирательной рекристаллизации, уничтожающей
оставшиеся мелкие зерна.
После медленного охлаждения образец травится с
поверхности. Травлением, во-первых, уничтожается мелкозернистая
структура тонкого поверхностного слоя, во-вторых, намечаются
границы выросших монокристаллов.
Метод рекристаллизации для получения монокристаллов
обладает тем преимуществом, что будущему монокристаллу можно
231
заранее придавать желательную форму. Существенный его
недостаток заключается в том, что монокристаллу невозможно давать
определенную ориентацию.
Деформация и температура отжига, при которых в
мелкозернистом металле происходит весьма интенсивный рост зерен,
называются критической деформацией и критической температурой.
Значения критической деформации и критической температуры
можно определить из рекристаллизационной диаграммы.
Следует заметить, что рекристаллизация протекает хорошо
лишь в очень чистых металлах. Примеси даже в малых
количествах сильно влияют на ее ход. Более того, наличие примесей
может повысить температуру рекристаллизации или понизить.
Рост зерен настолько тормозится примесями, что структура после
рекристаллизации не будет существенно отличаться от структуры
до рекристаллизации.
Кристаллизация алмаза
Более ста лет продолжались безуспешные попытки получения
искусственных кристаллов алмаза. В начале XX в. после того, как
Г. Тамман установил термодинамические условия фазового
равновесия системы в области сверхвысоких температур (более 2300°С)
и сверхвысоких давлений (порядка 100 000 атм"), работы по
синтезированию алмаза приняли определенное направление.
Впервые синтетические алмазы удалось получить в 1954 г.
сотрудникам американской фирмы «Дженерал электрик» Ф. П. Бан-
ди и др. Позднее алмазы были синтезированы и советскими
исследователями во главе с Л. Ф. Верещагиным.
Синтетические алмазы образуются из графита и
высокоуглеродистых соединений в широком интервале давлений (от 55 000 до
100000 атм.) и температур (1200—2600°С) с обязательным
присутствием в качестве растворителя} некоторых металлов: железа,
никеля, кобальта, марганца," хрома, тантала, платины и др.
Техническое оформление экспериментов заключается в
следующем. Между плит гидравлического пресса достаточной
мощности помещается прессформа (рис. 140,а), состоящая из верхнего
и нижнего уплотняющих колец и наружного пояса (поддержки),
в котором находится ячейка, или реакционная камера (рис. 140,6).
Нагревателем служит графитовая (танталовая или титановая)
трубочка. В середину нагревателя помещается графит в смеси с
металлом-растворителем. Реакционная камера изолируется от
металлических частей прессформы каким-либо каменным
материалом.
Вся камера под прессом уплотняется. После создания
необходимого давления электронагрев включается до требуемой
температуры. Необходимые для проведения опыта интервалы давления
и температуры определяются предварительно. Алмаз образуется
преимущественно в виде поликристаллических сростков, среди
232
оторых иногда встречаются монокристаллы с размерами, не
превышающими 1—2 мм. При более высоких температурах
образуются светлые октаэдрические кристаллы, при сравнительно низких—
возникают кубические кристаллы темного цвета. Скорость роста
алмазов достигает 0,1 мм/мин.
Рис. 140. Схема пресоформы с ячейкой (а) и отдельно
ячейка (б) для синтеза при высоком давлении и высокой
температуре:
1 — титановый или танталовый торцевой диск; 2 — трубчатый
нагреватель из графита, тантала, титана и др.; 3 — куски
катализатора; 4 — гексагональный нитрид бора; 5 —
изолирующий каменный материал
Существующая технология синтеза алмазов не представляет
возможности управлять процессом зарождения и роста
кристаллов. Вследствие значительных температурных перепадов в реак1
ционной камере возникают большие пересыщения среды
углеродом, что приводит к спонтанному образованию зародышей
кристаллов алмаза и их неупорядоченному росту.
По своему качеству природные алмазы лучше 'синтетических,
полученных в настоящее время. По-видимому, в природных
условиях алмазы образовались иным путем, возможно, при более
низких температурах. Поэтому исследование природного генезиса
алмазов не теряет своей актуальности и после получения
синтетических кристаллов.
t В отношении природного генезиса алмазов до сих пор нет
единого мнения. После открытия в Южной Африке, а позднее у нас
в Якутии коренных алмазоносных пород-кимберлитов,
существующие гипотезы и предположения можно разбить на три основные
группы.
Представители наиболее распространенной точки зрения
считают, что основная масса алмазов образовалась в магматическом
очаге, и при извержении ультраосновной магмы кристаллы были
233
подняты на поверхность. В период инъецирования магмы сквозь
карбонатные вмещающие толщи происходила частичная
ассимиляция углерода, который под воздействием высоких давлений и
температур кристаллизовался в форме алмаза. Основоположником
этой гипотезы был А. Ф. Вильяме. В настоящее время ее
разделяют акад. В. С. Соболев и др.
В. И. Вернадский был сторонником гипотезы, по которой
алмазы образовались в кимберлитах в результате взрывов,
сопроводивших становление кимберлитовых трубок при воздействии на
углеродистый материал сверхвысоких давлений и высоких
температур.
Третья гипотеза предполагает, что алмазы возникли в
кимберлитовых телах после их формирования в условиях относительно
низких давлений и температур в результате
окислительно-восстановительных процессов. Последние привели к выделению из
карбонатных минералов, содержащихся в кимберлитах, свободного
углерода. При благоприятных условиях углерод кристаллизуется
в алмаз.
Последняя точка зрения была высказана А. И. Боткиным и
геологами, работающими на трубке «Мир». Изучение природных
процессов алмазообразования находит все больше фактов,
подтверждающих эту концепцию.
Возможность кристаллизации алмаза при низких температурах
и давлениях за счет окислительно-восстановительных процессов
энергично защищается В. С. Петровым, показавшим, что из всех
известных ультра-основных пород кимберлиты являются наиболее
окисленными, так как они ассимилировали из вмещающих пород
большое количество карбонатов. Восстановителями карбонатов
были железосодержащие компоненты кимберлитов, главным
образом железистый оливин и ильменит. В этих минералах железо
находится в основном в форме закиси, которая переходит в процесс
окисления в окисную форму.
В результате взаимодействия оливина и ильменита с кальцитом
р кимберлитах возможно образование свободного углерода в виде
графита и алмаза. Помимо этих минералов образовались энста-
тит, диопсид, перовскит, магнетит, гематит и др. Наличие этих
минералов характерно для алмазоносных кимберлитов. Например,
в результате взаимодействия ильменита с известняками возможны
следующие реакции:
FeTiOg + СаС03 ~ СаТЮ3 + FeCT+ C02,
3FeO + С02 = Fe304 + СО,
2СО = С02 + С.
Возможность осуществления подобных реакций
подтверждается петрографическими исследованиями.
234
При взаимодействии оливина с кальцитом или известняком
могут образоваться следующие минералы: ларнит, энстатит,
диопсид, гематит, магнетит и свободный углерод.
(Mg, Fe)2Si04 + CaC03 -> Ca2Si04 + Mg2 (Si206) +
+ CaMg (Si2G6) + Fe2Os + Fe304 + C.
Сравнительное постоянство качественного минералогического
состава кимберлитов для различных месторождений (оливин,
ильменит, магнетит, перовскит, диопсид, энстатит, гематит, алмаз)
указывает на возможность таких реакций в трубках, где
обнаруживаются алмазы.
Однако в достаточной мере не изучены сейчас те
термодинамические условия, при которых может существовать свободный
углерод с магнезиальными силикатами в кимберлитах.
ЛИТЕРАТУРА
Бак л и Г. Рост кристаллов. М., ИЛ, 1954.
:Б ю р е н В. Дефекты в кристаллах. М., ИЛ, 1962.
В а р м а А. Рост кристаллов и дислокации. М., ИЛ, 1958.
Кузнецов В. Д. Кристаллы и кристаллизация. М., Гостехиздат, 1953.
Леммлейн Г. Г. Секториальное строение кристаллов. М.—Л., Изд-во АН
СССР, 1948.
^Сонигман Б. Рост и форма кристаллов. М., ИЛ, 1961.
Чернов А. А. Слоисто-спиральный рост кристаллов. УФН, 1961, т. 73, вып. 2.
Шафрановский И. И. Кристаллы минералов. Изд-во ЛГУ, 1961.
Шубников А. В. Как растут кристаллы. М. — Л., Изд-во АН СССР, 1935.
}
ОГЛАВЛЕНИЕ
Предисловие редактора 3
Введение 4
Глава I. Кристаллизация как фазовое превращение вещества ... 7
§ (1. Общий случай фазовых превращений. Кристаллизация из
твердого, жидкого и газообразного состояний 7
Кристаллизация из растворов и расплавов 11
Кристаллизация из паров 15
Кристаллизация из твердого состояния, или кристаллизация
путем полиморфного превращения 15
§ 2. Энергия кристаллизации 17
Глава II. Зарождение кристаллов 23
§ 1. Экспериментальные данные по зарождению кристаллов ... 23
Факторы, влияющие на зарождение кристаллов ... 25
§ 2. Теоретические воззрения на зарождение кристаллов ... 27
Глава III. Теории роста кристаллов 35
§ 1. Общие соображения 35
§ 2. Термодинамическая теория Гиббеа 36
§ 3. Теория равновесной формы кристаллов '(теорема Вульфа) . . . 37
§ 4. Адсорбционная теория роста и растворения кристаллов . . 39
§ 5. Диффузионная теория роста и растворения кристаллов ... 40
§ 6. Молекулярно-кинетические теории роста и растворения
кристаллов , 44
Гомеополярные кристаллы 46
Гетерополярные кристаллы 48
Средняя работа отрыва 51
§ 7. Дислокационная теория роста кристаллов 53
§ 8. Теория послойного роста кристаллов 61
Равновесное состояние поверхности кристаллов ... 61
Рост кристаллов из паров 62
Рост изолированной ступени 63
Нормальная скорость слоисто-спирального роста ... 64
Движение макроскопических ступеней 64
Рост кристаллов из растворов 65
Коллективные эффекты при движении ступеней (ударные
волны) 66
§ 9. Связь молекулярно-кинетической теории роста кристаллов с
дислокационной теорией 67
§ 10. Кинетическая теория роста кристаллов из расплавов ... 69
236
Глава IV. Формы равновесия, роста и растворения кристаллов.
Скульптура граней 73
§ 1. Реальные и физически (возможные грани 74
§ 2. Связь внешней формы кристаллов и их структуры .... 74
§ 3. Равновесные формы кристаллов ^
§ 4. Формы роста кристаллов 80
Влияние примесей на форму роста кристаллов .... 81
Распределение примесей в кристалле. Гетерометрия . . 88
Влияние температуры, пересыщения (переохлаждения) и
движения раствора (расплава) на форму роста
кристаллов • 91
Закон геометрического отбора 94
Недоразвитые формы роста кристаллов 95
Переходные формы кристаллов от полиэдрической к
дендритной * 99
Нитевидные кристаллы 102
Сферолиты 104
§ 5. Формы растворения 106
Факторы, влияющие на растворение кристаллов .... 108
§ 6. Скульптура граней кристаллов ПО
Вицинали 111
Комбинационная штриховка 113
Фигуры травления 116
§ 7. Теории внешней формы кристаллов 120
Глава V. Дефекты в кристаллах 122
§ 1. Классификация дефектов 122
§ 2. Точечные, или «равновесные» дефекты 123
§ 3. «Неравновесные» дефекты (дислокации и поверхности).
Дислокации, условия их образования 126
Двойниковые границы .129
Свободная поверхность кристалла 130
Способы выявления дислокаций 132
§ 4. Трехмерные дефекты 132
Секториальное строение кристаллов 132
Зонарная структура 134
Глава VI. Закономерно построенные кристаллические агрегаты . . . 136
§ 1. Ортотропизм 136
§ 2. Ритмический рост . 137
§ 3. Текстуры 138
Пьезоэлектрические и оптические текстуры 140
Ферромагнитные текстуры 141
Электреты 141
Жидкие кристаллы 142
§ 4. Эпитаксиальные сростки 143
Выращивание эпитаксиальных пленок 145
Глава VII. Явления, сопровождающие образование кристаллов, и
некоторые особенности кристаллизации 150
§ 1. Кристаллизационное давление 150
§ 2. Усадка 152
§ 3. Кристаллизация на поверхности расплава 153
§ 4. Кристаллизация NaCl на поверхности раствора 153
§ 5. Кристаллолюминесценция . . . . . \ 154
§ 6. Радужные кристаллы бертолетовой соли . 154
Глава VIII. Практика выращивания монокристаллов 156
§ 1. Основные принципы технического выращивания монокристаллов 156
§ 2. Требования к чистоте кристаллов и методы очистки исходного
материала 158
§ 3. Аппаратура для нагрева, измерения и поддержания температуры 161
Тигли 170
237
§ 4. Выращивание монокристаллов из расплавов . . . . . . 172
Наблюдение при помощи микроскопа (Процессов роста
кристаллов из расплавов 173
Методы вытягивания монокристаллов 176
Методы одностороннего охлаждения растущего кристалла 184
Зонная кристаллизация и очистка вещества методом зонной
плавки 191
Метод Вернейля . ■ . . . . . . 198
Отжиг кристаллов . . . ■ . . 200
§ 5. Выращивание монокристаллов из растворов . . . . . . 201
Построение кривой растворимости ' 202
Технический расчет кристаллизации 204
Динамические методы выращивания кристаллов из растворов 206
Статические методы выращивания монокристаллов . . . 211
Промышленное выращивание кристаллов сегнетовой соли,
фосфата аммония и сульфата лития 211
Гидротермальный метод -выращивания монокристаллов . 218
Кристаллизация металлов при электролизе
(электрокристаллизация) 221
Кристаллизация из растворов в расплавах 222
Выращивание кристаллов ферритов 225
§ 6. Выращивание кристаллов из паров 227
§ 7. Кристаллизация из твердого состояния 229
Собирательная рекристаллизация 229
Метод рекристаллизации обработки для выращивания
монокристаллов 231
Кристаллизация алмаза 232
Ольга Герасимовна Козлова
РОСТ КРИСТАЛЛОВ
Тематический план 1967 г. № 167
Редактор Кривило Р. И.
Переплет художника Носовой М. М.
Технический редактор Тимашева И. Л.
Корректоры Стерина Н. П., Кудинова Г. И.
— - — — --- — - — —■ 1 - — i ■ ■—"
Сдано в набор 17/V 1967 г. Подписано к печати 24/XI 1967 г.
Л-42236 Формат 60X90Vi6 Физ. печ. л. 15,0 Уч.-изд. л. 16,02
Изд. № 210 Зак. 507 Бумага тип. 2 глазир. Тираж 5500 Цена 70 коп.
Издательство Московского университета. Москва, Ленинские горы
Административный корпус
Типография Изд-ва МГУ. Москва, Ленинские горы