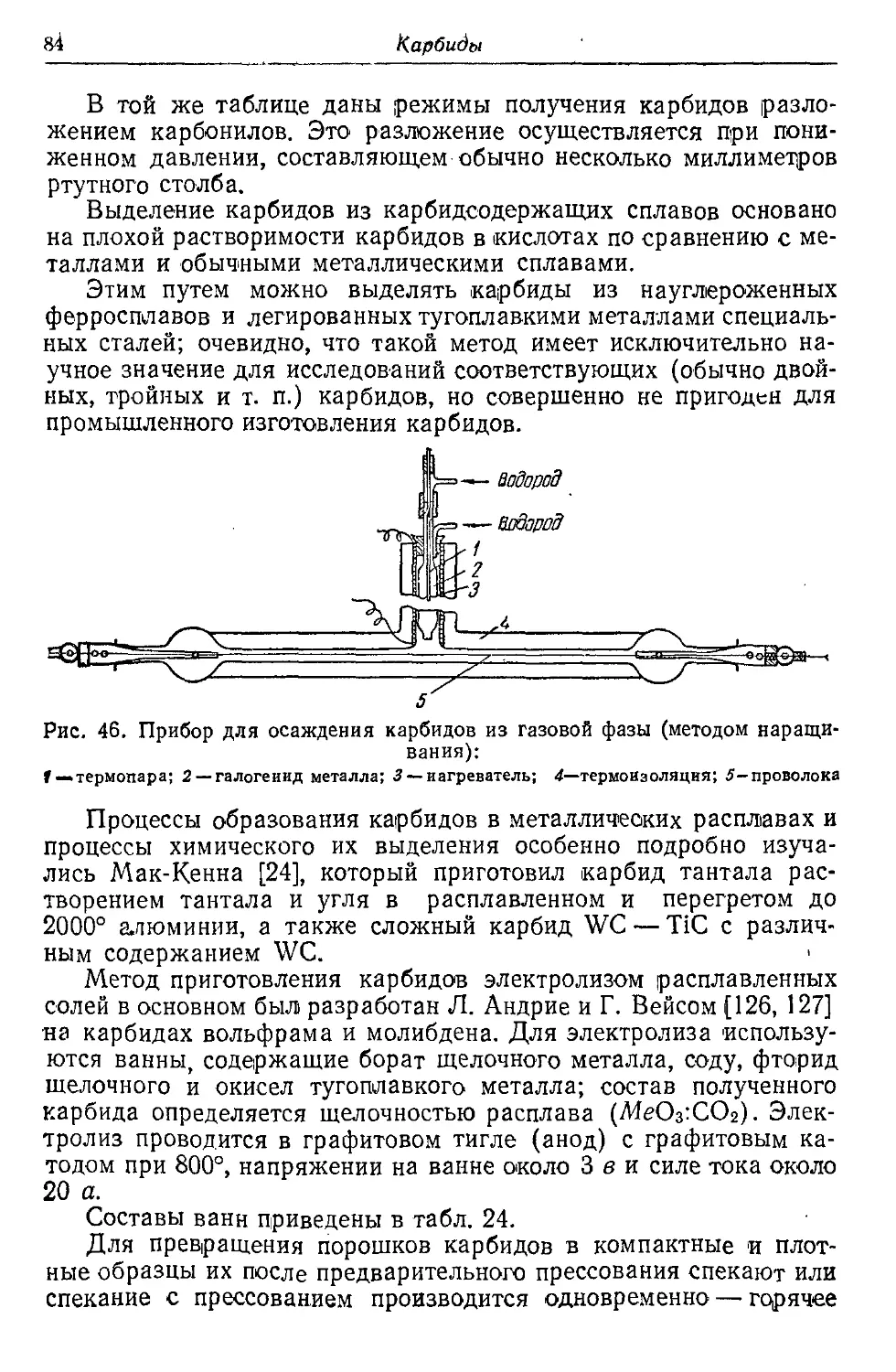
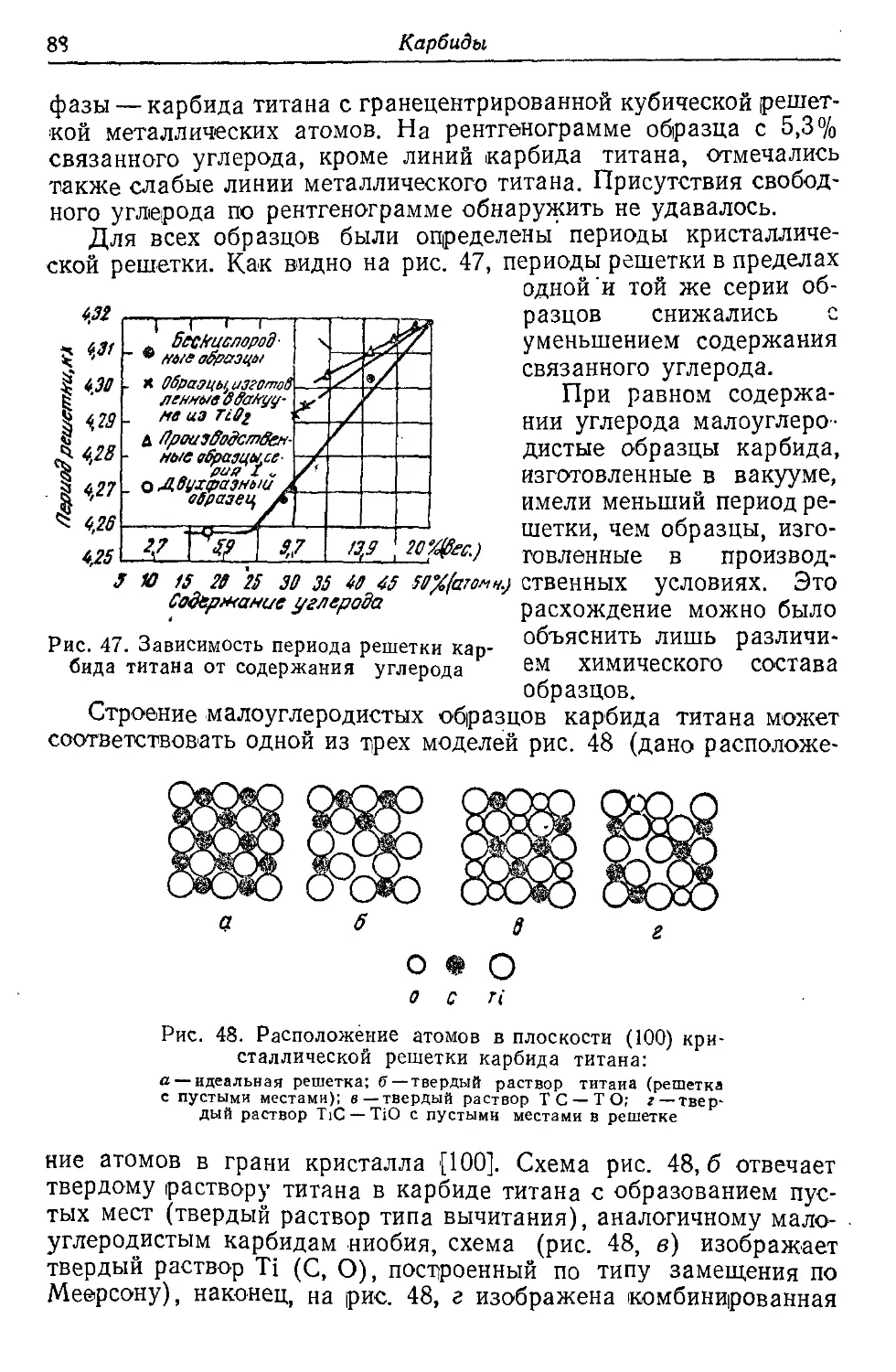
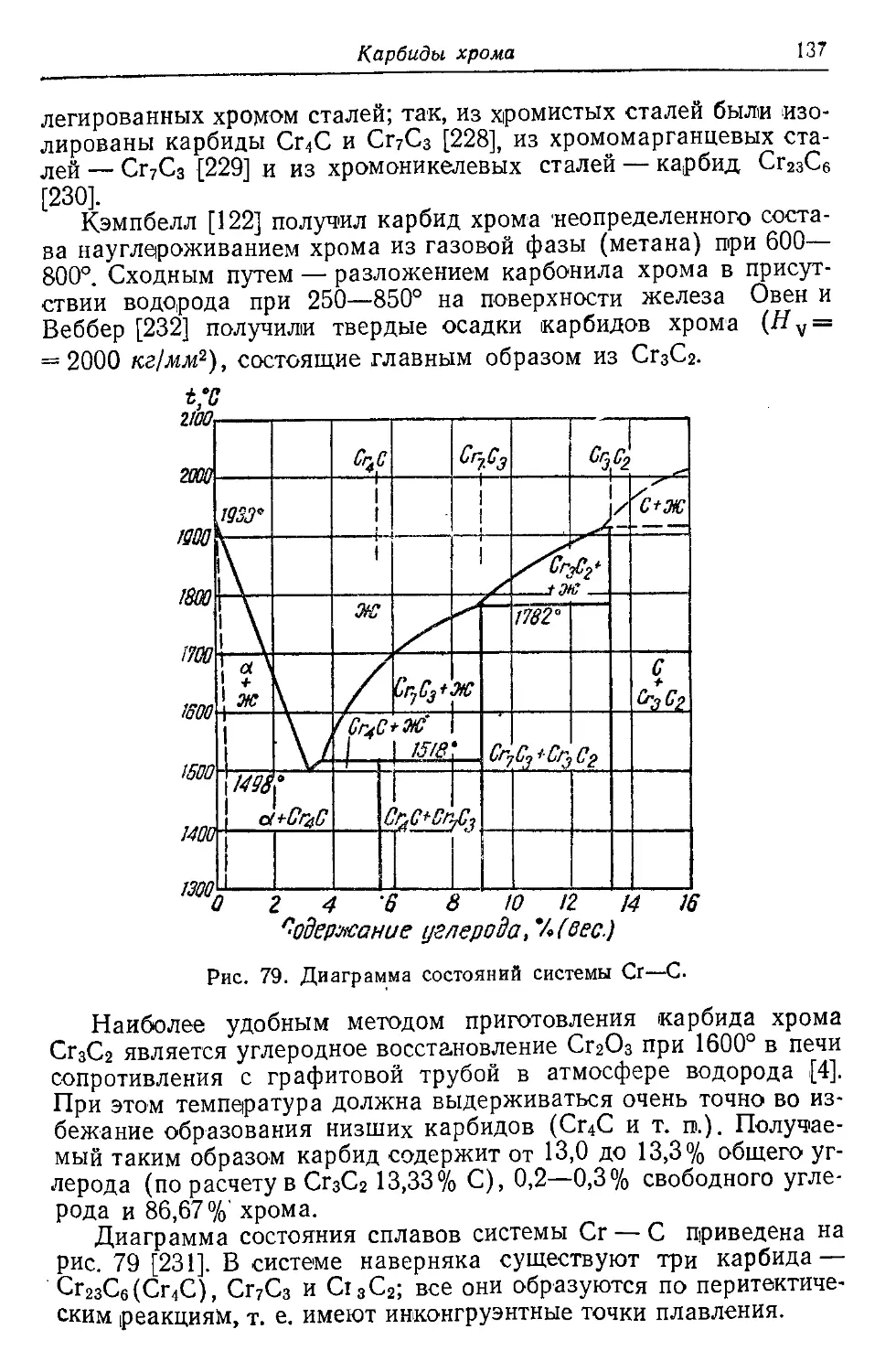
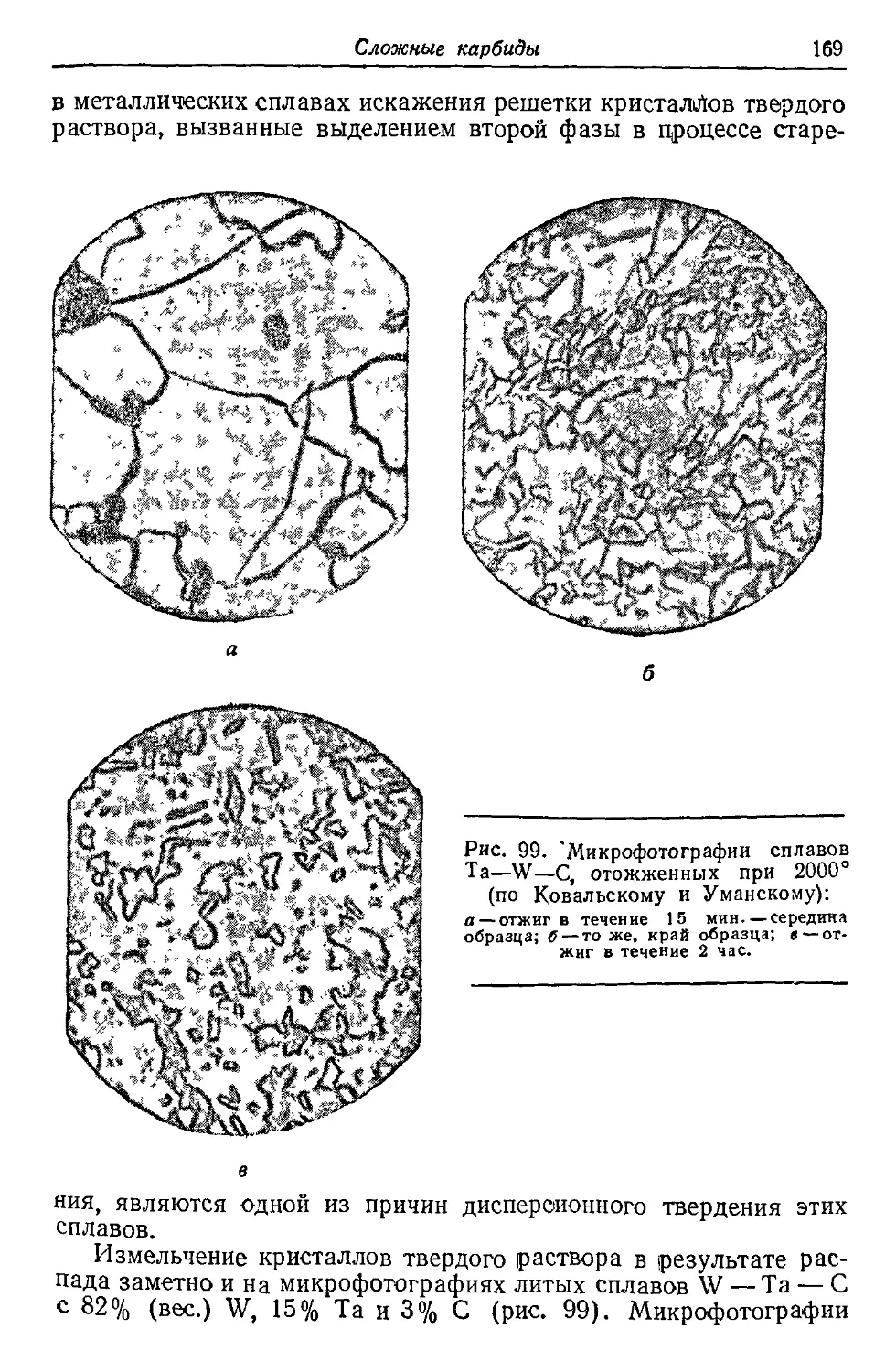
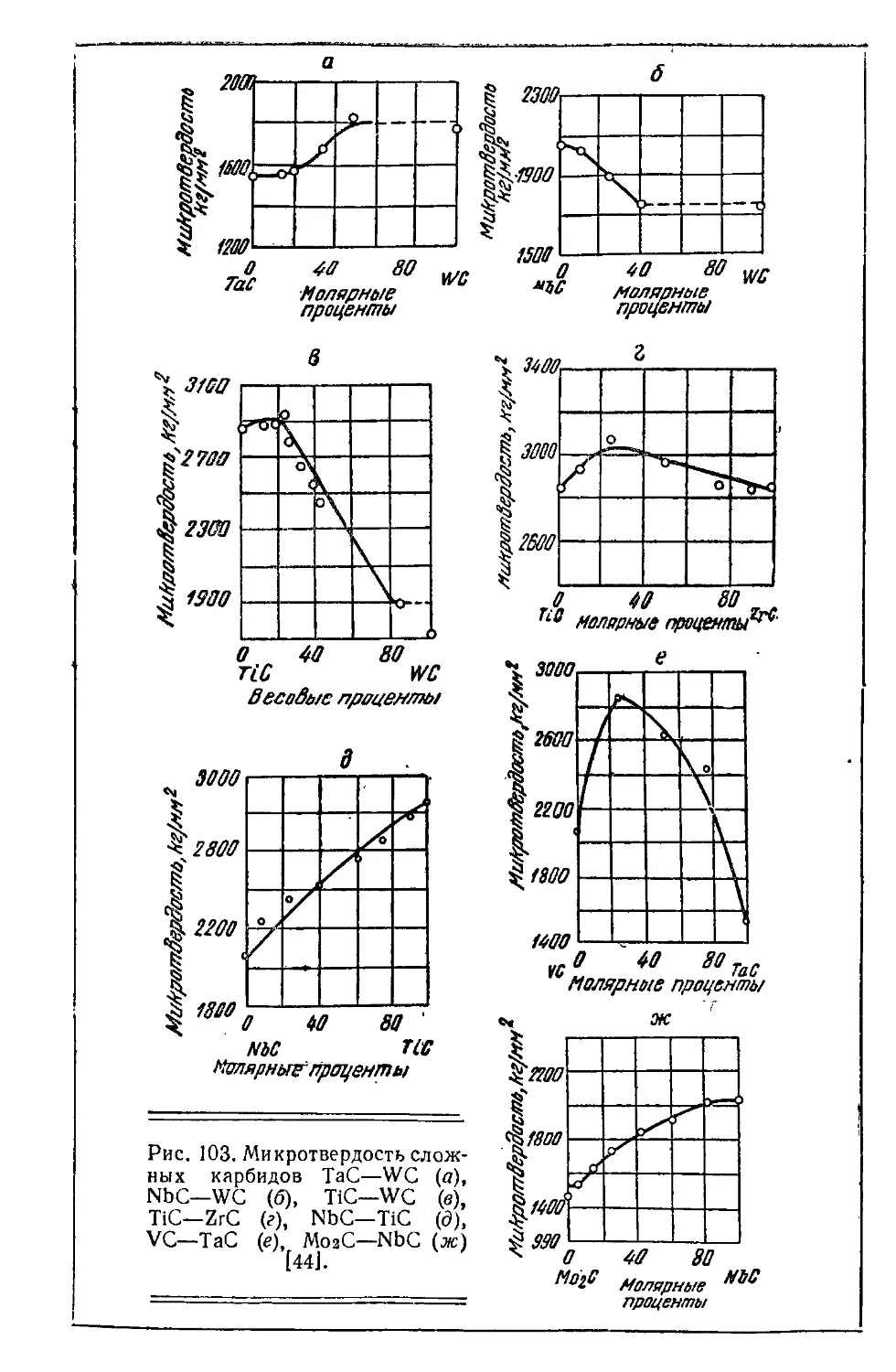
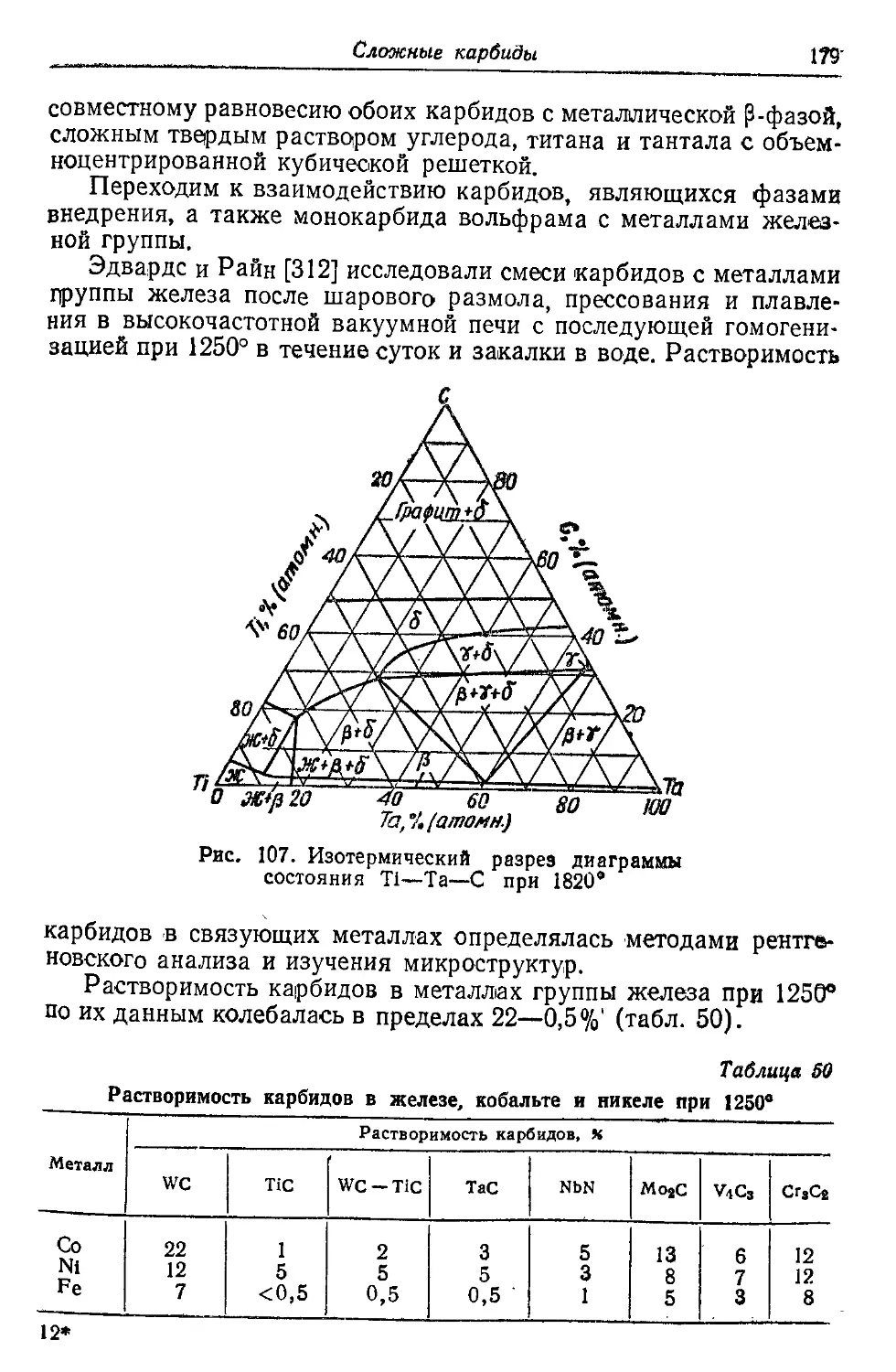
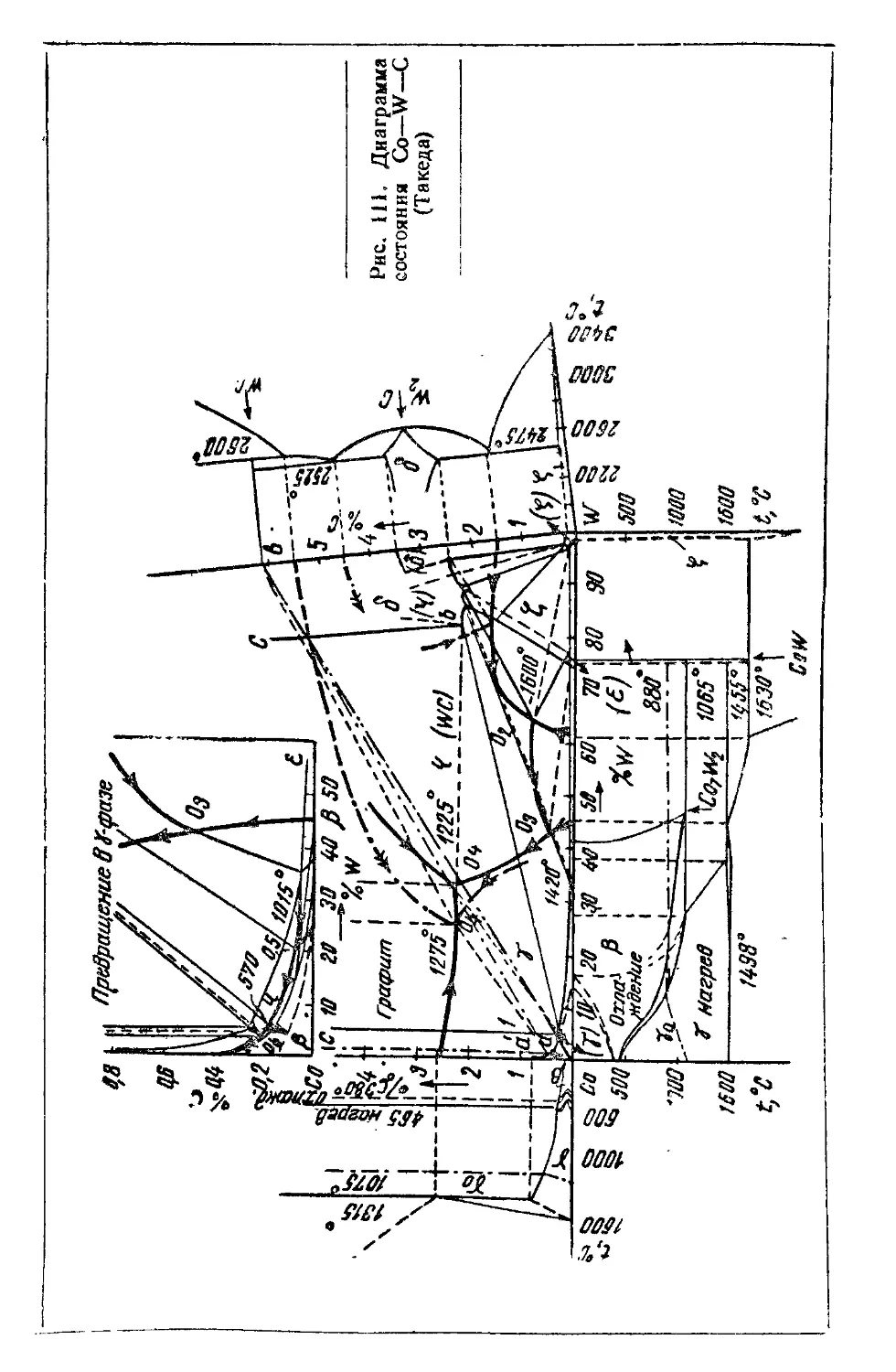
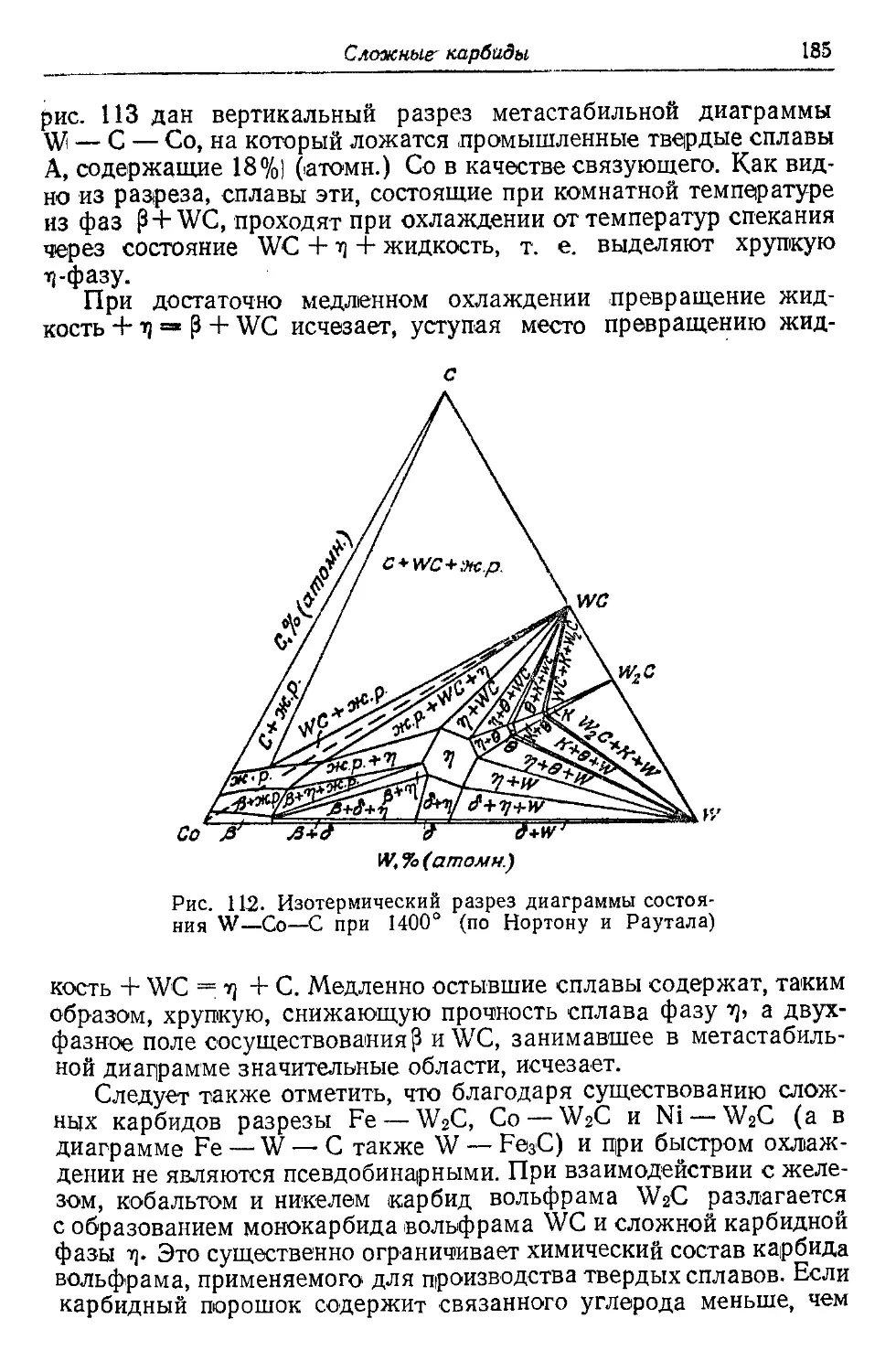
Автор: Самсонов Г.В. Уманский Я.С.
Теги: химия химическая промышленность металлургия металлургическая промышленность
Год: 1957
Текст
[ ________________
МЕТАМОБ
Г. В. САМСОНОВ и Я. С, УМАНСКИЙ
ТВЕРДЫЕ СОЕДИНЕНИЯ
ТУГОПЛАВКИХ МЕТАЛЛОВ
ГОСУДАРСТВЕННОЕ
НАУЧНО-ТЕХНИЧЕСКОЕ ИЗДАТЕЛЬСТВО
ЛИТЕРАТУРЫ ПО ЧЕРНОЙ И ЦВЕТНОЙ МЕ'ГАЛЛУРГИИ
Москва 1957
Рецензенты: проф-доктвр Б. Ф. ОРМОнТ,
канд. техн, наук В. И. ТРЕТЬЯКОВ
АННОТАЦИЯ
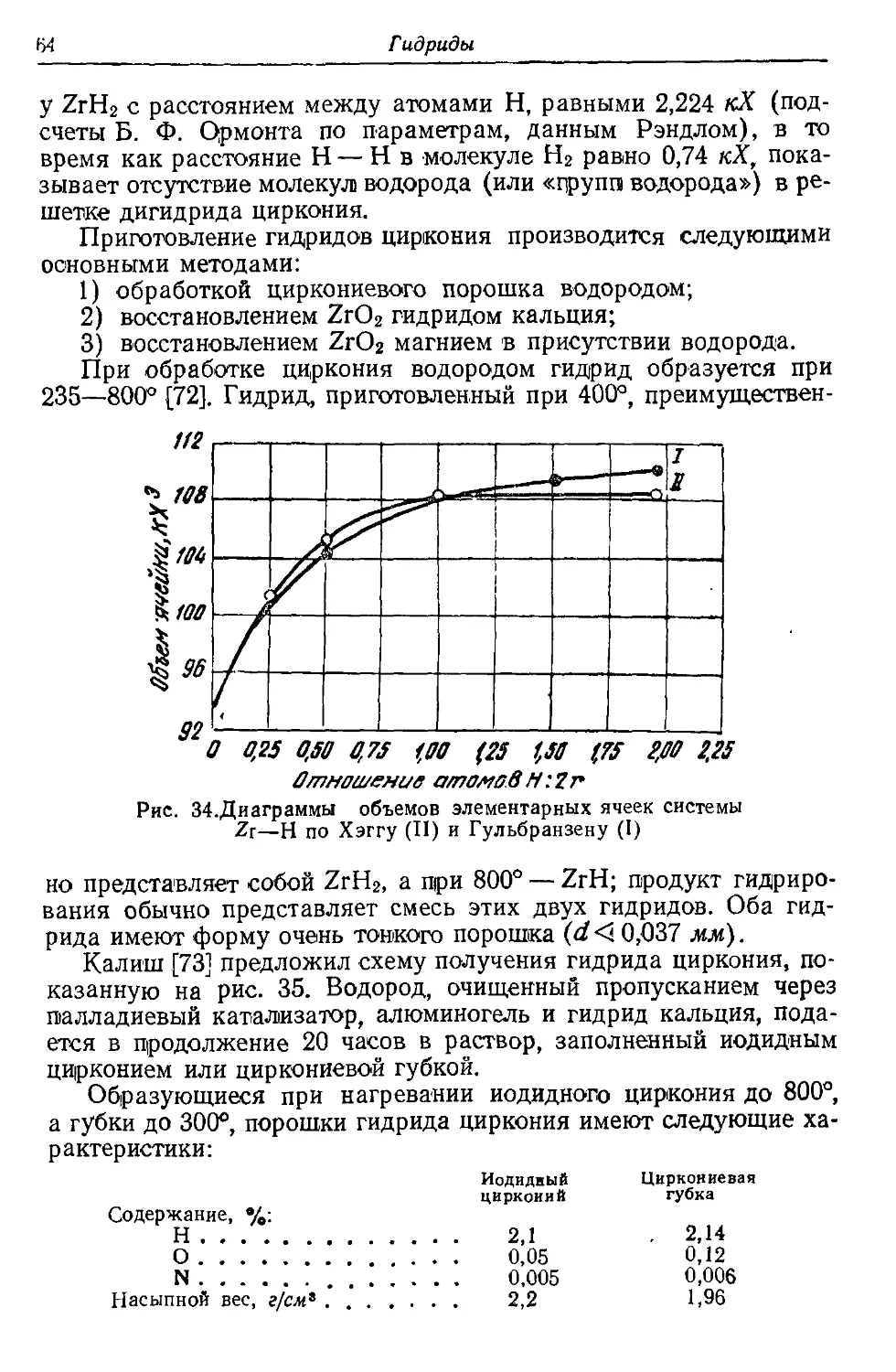
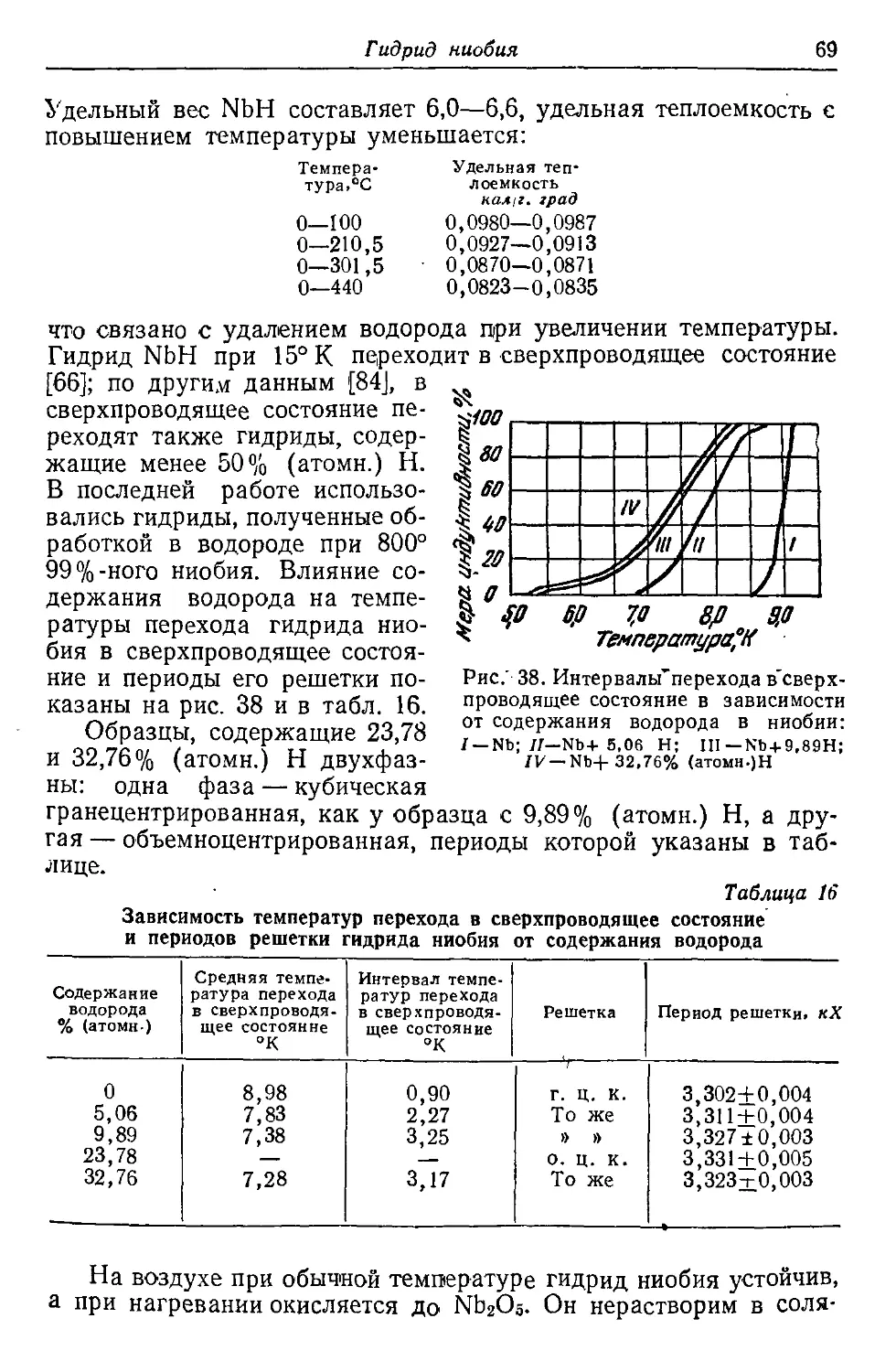
В книге описаны свойства, методы получе-
ния и области применения гидридов, карби-
дов, нитридов, боридов и силицидов тугоплав-
ких переходных металлов IV, V, VI, VII и
VIII групп периодической системы Д. И. Мен-
делеева (титана, циркония, ванадия, ниобия,
тантала, молибдена, вольфрама, железа и
др ), а также их сплавов, имеющих важное
значение как в металлургии специальных
сплавов, так и в технологии производства
твердых сплавов.
Книга рассчитана на инженерно-технических
работников и работников научно-исследова-
тельских учреждений металлургической про-
мышленности.
ПРЕДИСЛОВИЕ
В директивах XX съезда Коммунистической партии Советско-
го Союза определяется одна из главных задач шестого пятилет-
него плана: «...на базе преимущественного развития тяжелой
промышленности, непрерывного технического прогресса и повы-
шения производительности труда обеспечить дальнейший мощ-
ный рост всех отраслей народного хозяйства...»1
Большое внимание уделяется производству легированных ста-
лей, высокостойких огнеупоров, жаропрочных сплавов, дальней-
шему развитию электроники, радиотехники, модернизации и по-
вышению производительности металлообработки.
В решении этих задач существенная роль принадлежит ис-
пользованию твердых тугоплавких металлических соединений —
боридов, карбидов, нитридов и силицидов редких тугоплавких
металлов (вольфрама, молибдена, титана, циркония, ванадия,
ниобия, тантала, хрома), марганца, железа, кобальта и никеля,—
которые наряду с высокой твердостью и тугоплавкостью обла-
дают жаростойкостью, жаропрочностью, специфическими элек-
трическими, магнитными и химическими свойствами. Эти соеди-
нения в значительной мере определяют свойства разнообразней-
ших сплавов, начиная от углеродистой и легированных сталей
и кончая твердыми сплавами, применяющимися для металло-
обработки и бурения; их используют в качестве абразивных ма-
териалов, высокотемпературных специальных огнеупоров, в элект-
ро- и радиотехнике и т. д.
Тугоплавким боридам, карбидам, нитридам и силицидам по-
священы сотни журнальных статей, ряд советских и зарубежных
монографий [1—4], в том числе вышедшая в 1953 г. на англий-
ском и немецком языках ценная .монография Р. Киффера и
П. Шварцкопфа «Твердые -соединения и твердые сплавы».
Следует отметить, что в настоящее время в Советском Сою-
зе появился ряд публикаций, посвященных выяснению отдель-
ных вопросов теории строения и свойств твердых и тугоплавких
соединений переходных металлов с бором, углеродом, азотом и
кремнием, в том числе работы Г. С. Жданова, Г. А. Меерсона,
Б. Ф. Ормонта, А. Е. Ковальского, Г. С. Креймера, Г. Б. Бокия;
1 Директивы XX съезда КПСС по шестому пятилетнему плану разви-
тия народного хозяйства СССР на 1956—1960 годы, Госполитиздат,
1956, стр. 5.
4
П редисловиё
ряд принципиально важных соображений по прочностным свой-
ствам высказан академиком П. А. Ребиндером. Особенно сле-
дует отметить плодотворную деятельность в этом отношении по-
стоянного межинститутского коллоквиума по твердым фазам пе-
ременного состава, созданного по инициативе Физико-химиче-
ского института им. Л. Я. Карпова.
Авторы книги попытались обобщить имеющиеся литератур-
ные данные, используя определенные представления о физиче-
ской природе твердых и тугоплавких соединений. Для создания
цельной картины, кроме веществ, имеющих широкое промышлен-
ное применение, в книге рассматриваются и такие, например,
соединения, как гидриды металлов переходных групп, анализ
строения и физических свойств которых позволяют лучше разо-
браться в физической природе металлических нитридов и боль-
шинства металлических карбидов.
Авторы старались избегать ставших уже тривиальными тех-
нологических подробностей, кроме того, совершенно опущен
раздел технологии производства твердых сплавов, достаточно
полно описанной в многочисленных советских и зарубежных из-
даниях.
Описываемые в книге тугоплавкие соединения изучены не в
равной мере. Детально исследованы только фазы внедрения. Это
побудило авторов предпослать специальным главам II—VI,
каждая из которых посвящена подробному рассмотрению со-
единений металлов переходных групп с каким-либо одним неме-
таллом — водородом, углеродом, азотом, бором или крем-
нием,— главу I, в которой дана общая характеристика всех фаз
внедрения — гидридов, нитридов и карбидов..
Глава I написана Я. С. Уманским, главы III и IV —
Я. С. Уманским и Г. В. Самсоновым совместно и главы II, V и
VI — Г. В. Самсоновым.
Авторы будут признательны за все критические замечания и
указания по материалу, излагаемому в книге.
ВВЕДЕНИЕ
Водород, бор, азот и углерод образуют с металлами химиче-
ские соединения, обладающие различной физической природой.
Соединения этих элементов с металлами переходных групп1 не
удовлетворяют законам химической валентности и имеют явно
выраженный металлический характер, с остальными же метал-
лами эти элементы образуют солеобразные неметаллические
соединения, как, например, гидриды щелочных металлов LiH,
NaH и т. д., нитрид алюминия A1N и карбиды щелочноземель-
ных металлов СаС2, SrC2, ВаС2 (если гидриды и нитриды этого
типа имеют нормальные валентности, то неметаллические кар-
биды отклоняются от нормальных валентностей).
Металлические карбиды, бориды, нитриды и гидриды могут
быть в свою очередь разбиты на два класса веществ, обладаю-
щих кристаллическими структурами разных типов. Вещества
первого класса, к числу которых относятся все бориды металлов
переходных групп, карбиды железа, хрома и марганца, моно-
карбиды вольфрама и молибдена WC, МоС и нитриды тантала
TaN и молибдена MoN, имеют разнообразные, порой сложные
специфические кристаллические структуры. Гидриды, почти все
нитриды и многие карбиды металлов переходных групп имеют
очень простые «структуры внедрения».
В этих веществах, которые мы будем называть в дальнейшем
«фазами внедрения», атомы металла образуют одну из типич-
ных металлических решеток — гексагональную компактную, ку-
бическую гранецентрированную или объемноцентрированную, а
атомы неметалла располагаются («внедряются») в промежут-
ках между металлическими атомами.
Двойные карбиды, в состав которых входят, с одной сторо-
ны, вольфрам или молибден, а с другой — железо, кобальт или
никель, представляют собой своеобразную разновидность фаз
внедрения с усложненными структурами.
1 Напомним, что к переходным относятся металлы, расположенные в
средних частях длинных периодов периодической системы элементов, от
"1 (Sc) до 28 (Nit, от 39 (Y) до 46 (Pd,) от 57 (La) до 78 (Pt). Особенно-
сти строения электронных оболочек атомов и физические свойства этих ме-
таллов будут описаны ниже,
«6
Введение
Анализ опытных данных, проведенный Хэггом [5], показал,
что характер структуры того или иного карбида, нитрида, гид-
рида или борида металла переходной группы почти всегда опре-
деляется соотношением атомных радиусов металла гМе и неме-
талла гх. Если гж/гЛ1в< 0,59 (rMJrx > 1,7), то образуется фаза
внедрения, если же rx [гМе > 0,59, возникает фаза со сложной
решеткой.
Для расчета принимались значения атомных радиусов по
Гольдшмидту: гн = 0,46 A; rN = 0,71 А; гс=0,77 А и гв =
О
— 0,91 А. Атом бора столь велик, что во всех боридах rdrMe >
>0,59, и потому многие бориды имеют сложные кристалличе-
ские решетки. Во всех гидридах и нитридах металлов переход-
ных групп 0,59 — почти все они являются фазами внед-
рения. Наконец, для некоторых карбидов rxlrMe <0,59; они
имеют структуру внедрения, в карбидах же железа (гре =
= 1,27 А), марганца (гМп = 1,30 А) и хрома (гСг = 1,28 А) соот-
ношения Гх/г^^О,59 (rc/rFe = 0,605; гс/гМп = 0,593 и гс/гСг =
= 0,60), поэтому они имеют сложные кристаллические структуры.
Следует иметь в виду, что эмпирическое правило Хэгга имеет
исключения. Исследования последних лет показали, например,
что монокарбиды вольфрама и молибдена и нитриды молибдена
MoN и тантала TaN не являются фазами внедрения, хотя для
всех этих веществ гх/гме 0,59. С другой стороны, при низко-
температурном отпуске закаленной стали из твердого раствора
выделяется метастабильный карбид железа (е-карбид) со струк-
турой внедрения, хотя гс/гРе > 0,59.
Все изученные до сих пор твердые растворы водорода, азота,
углерода и бора на основе металлов переходных групп построе-
ны по типу внедрения (даже в тех случаях, когда Гх1гме > 0,59,
например при растворении углерода в у-железе с образованием
аустенита).
Особо следует остановиться на силицидах. В отличие от во-
дорода, азота, углерода и бора кремний образует с металлами
твердые растворы не типа внедрения, а типа замещения. Неко-
торые силициды с небольшим содержанием кремния не только
обладают металлическими свойствами, но и имеют типичные ме-
таллические структуры (например, силицид меди Cu6Si со струк-
турой Р-марганца, силицид никеля Ni3Si с решеткой Cu3Au, фаза
Fe3Si со структурой Fe3Al, соединения V3Si, Cr3Si, Mo3Si со
структурой р-вольфрама). Эти силициды' являются своеобраз-
Введение 7
ними аналогами фаз внедрения с той только разницей, что в
фазах внедрения атомы водорода, азота или углерода разме-
щаются в межатомных промежутках металлических решеток,
атомы же кремния участвуют в построении металлических
структур как «полноправные партнеры» атомов второго компо-
нента. Это различие — неизбежное следствие различного типа
растворения в металлах азота, углерода и водорода, образую-
щих растворы внедрения, и кремния, образующего растворы за-
мещения.
Богатые кремнием силициды металлов переходных групп, со-
храняя металлические свойства, имеют специфические, обычно
сложные кристаллические решетки.
ГЛАВА I
ПРИРОДА МЕТАЛЛИЧЕСКИХ КАРБИДОВ, НИТРИДОВ,
ГИДРИДОВ, БОРИДОВ и СИЛИЦИДОВ
Металлы переходных групп
К числу переходных металлов относятся химические элемен-
ты, в атомах которых происходит заполнение недостроенных
электронных групп элемента с порядковыми номерами 21—28
(Sc, Ti, V, Сг, Мп, Fe, Со, Ni), 39—46 (У, Zr, Nb, Mo, Тс, Ru,
Rh, Pd), 57—78 (La, металлы редких земель, Hf, Ta, W, Re, Os,
Ir, Pt) и 89—92 (Ac, Th, Pa, U).
Как известно, атом девятнадцатого элемента периодической
системы — калия — содержит один электрон в четвертой элек-
тронной группе, так называемый 45-электрон1, хотя третья груп-
па его электронной оболочки недостроена (в ней насчитывается
лишь 8 электронов из 18, отсутствует Sd-подгруппа). Причина
появления 45-электрона при отсутствии З^подгруппы заключа-
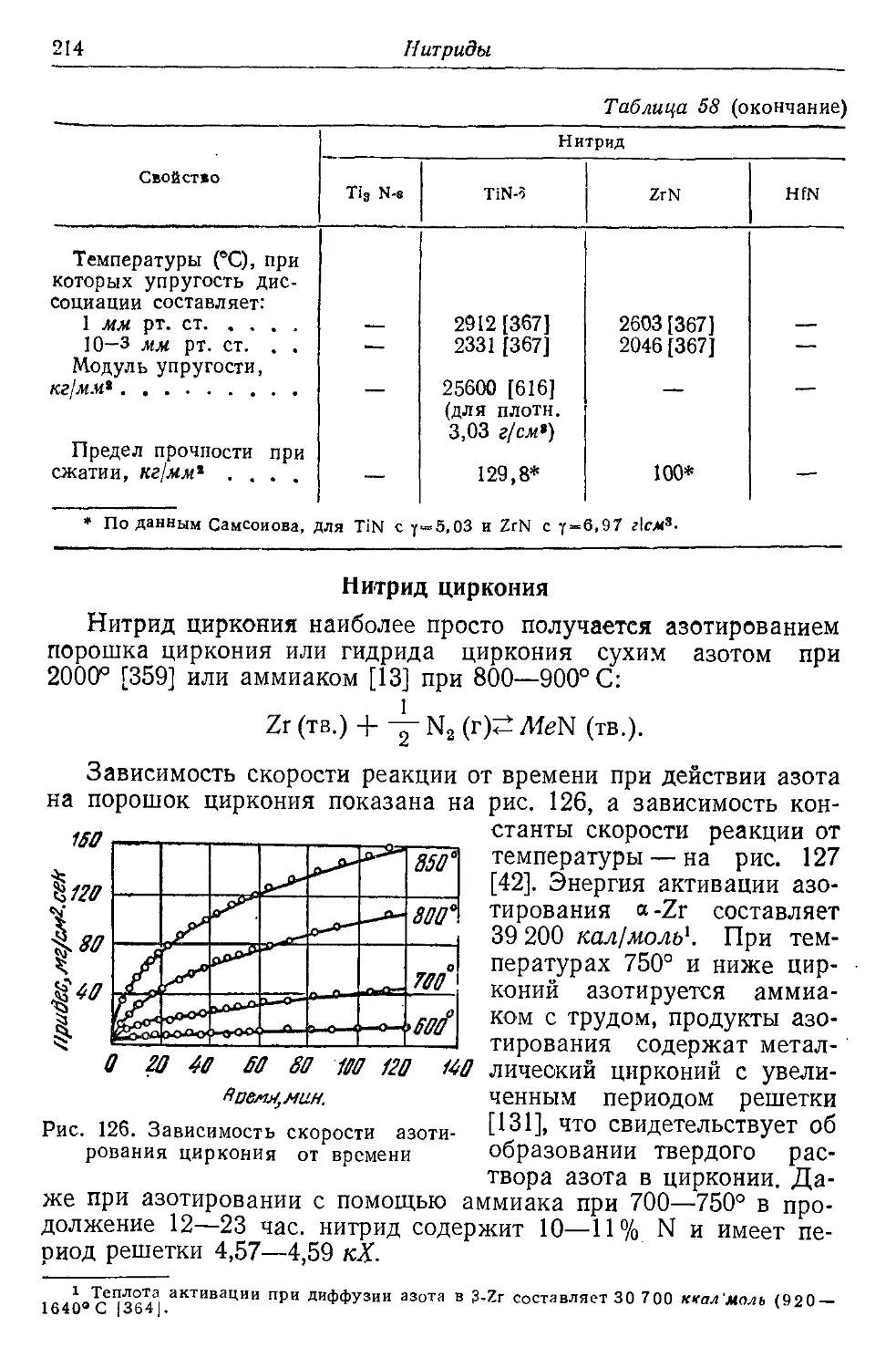
ется в том, что энергия d-электронов оказывается выше, чем
энергия s-электронов следующей группы (рис. 1). Лишь после
заполнения 45-подгруппы (Са, z = 20) начинается достройка
третьей группы (Sc, z = 21).
Достройка эта продолжается в интервале от 21 до 28-го эле-
мента периодической системы (никель). Медь (z = 29)—пер-
вый элемент с достроенной третьей электронной группой. Эле-
менты от скандия до никеля и образуют первую переходную
группу.
1 Напомним, что каждый электронный слой атома (электронная груп-
па) состоит из ряда подгрупп. Число подгрупп в группе равно ее порядко-
вому номеру. Первая, s-подгруппа, содержит не более 2 электронов, вто-
рая (р) — не более 6, третья (d) — не более 10, четвертая (f) — не более
14 электронов. Атом меди — 29-го элемента периодической системы с тремя
заполненными электронными группами можно описать с помощью такой
схемы:
№ группы 12 34
И н д е к с —
подгруппы s s р s р d s
электронов 2 2 6 2 6 10 1
Кратко эта схема записывается так: 1№2№2рс3№3р(13</1о451, т. е. числа элек-
тронов, принадлежащих той или иной подгруппе, ставятся вверху около
обозначения подгруппы.
10 Природа металлических карбидов, нитридов, гидридов, боридов
В металлах второй переходной группы (от Y, z = 39 до Pd,
z — 46) происходит заполнение 4<Аэлектронной подгруппы при
наличии 55-электронов. В металлах третьей переходной группы
заполняются электронные подгруппы 4/ . (металлы редких
земель) и 5<7 при наличии подгруппы 6s. В актинидах
(89—Ас—100—Ct) начинается заполнение подгруппы 5) при.
наличии 75-электронов.
лированных атомах
£
В табл. 1 приводятся данные о распределении электронов по
группам и подгруппам в изолированных атомах важнейших в
техническом отношении металлов переходных групп (металлы
редких земель и актиниды в таблицу не внесены).
Современная квантовая теория1 учит, что при сближении ато-
мов, приводящем к образованию кристаллов, уровни энергии
валентных электронов размываются (электроны, принадлежа-
щие к одной и той же подгруппе одной и той же группы, имев-
1 Мы в основном пользуемся представлениями так называемой «зон-
ной теории металлов», рассматривающей движение не взаимодействующих
между собой электронов в периодическом электрическом поле ридящих Ч
узлах решетки положительно заряженных ионов,
Металлы переходных групп
11
шие в изолированных атомах строго определенное значение
энергии, в кристалле могут иметь различную энергию). Валент-
ные электроны отдельных атомов становятся общим достоя-
нием всего металлического кристалла, непрерывно переходя ог
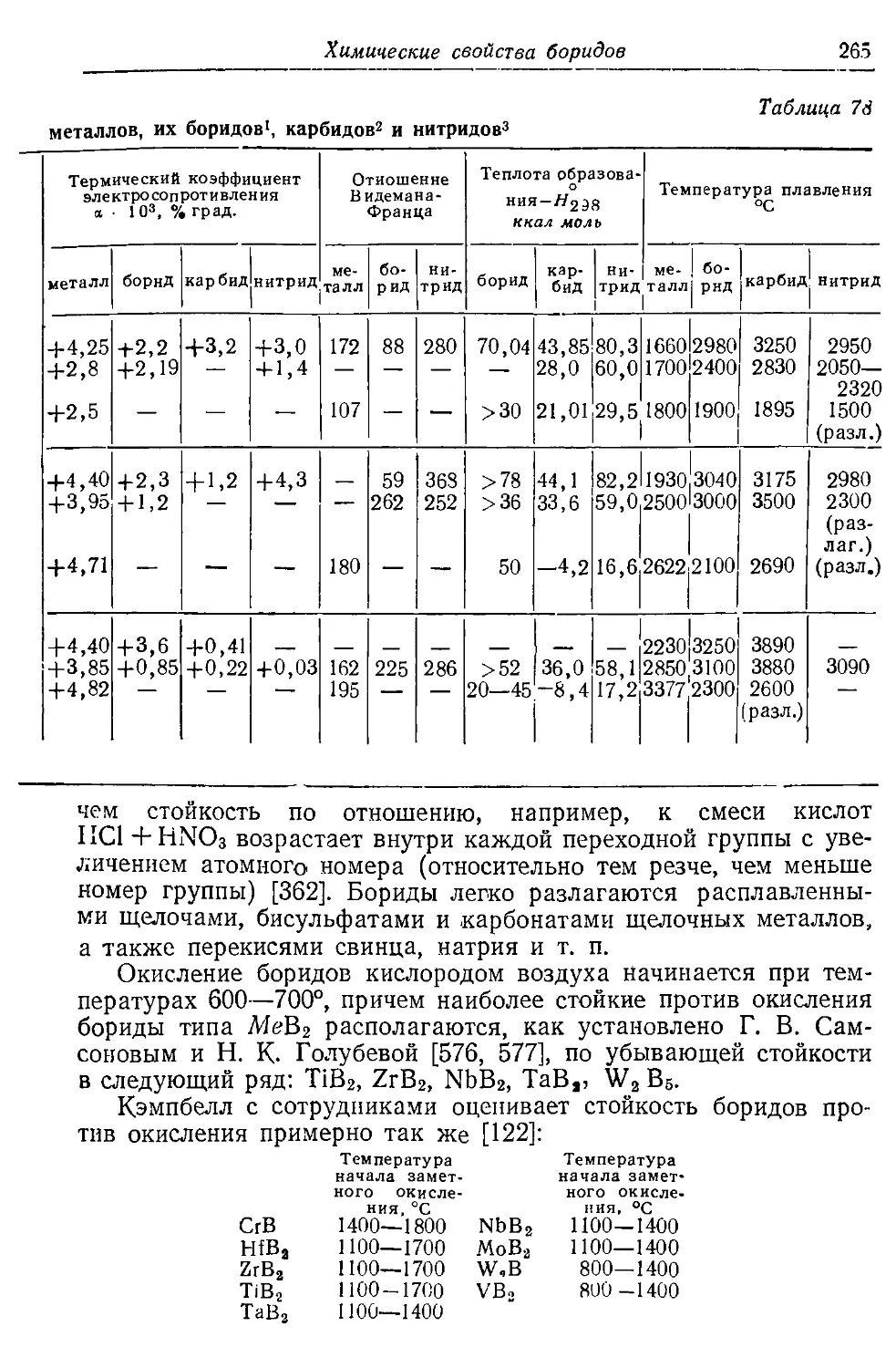
одного атома к другому.
Общая кинетическая энергия валентных электронов в метал-
ле (ее часто называют «энергией Ферми») возрастает с увели-
чением компактности решетки, в частности, при сжатии решетки,
и соответственно уменьшается при расширении последней. В ме-
таллах переходных групп несколько размываются также уровни
энергии незаполненных внутренних подгрупп (например, 3rf —
уровень в никеле).
На рис. 2 [6] показано размытие энергетических уровней 3d и
4s никеля при уменьшении межатомного расстояния R (по оси
Рис'. 2. Размытие энерге-
тических уровней 3d-
и 48-электронных под-
групп (по Мотту и Джон-
су [6])
Рис. 3. Распределение электронов
в никелевом и медном кристаллах по
подгруппам 3d и 4s (по Слейтеру)
1 )
величина
R
абсцисс графика отложена
Уровень энергии валент-
ных электронов 4s размывается сильнее, чем уровень 3d, и зна-
чения энергий 3d и 4s при расстояниях R, соответствующих нор-
мальной кристаллической решетке металла, перекрываются. На
рис. 3 приведена картина распределения электронов никелевого
и медного кристаллов по подгруппам (или «полосам») 3d и 4s.
Предельное количество электронов, могущих вместиться в
полосах 4s и 3d при их заполнении, пропорционально полным
площадям, ограниченным соответствующими кривыми л3(/(е)
и «т. (е), где е—энергия электрона, выраженная в «атомных
единицах» Ry (атомная единица энергии Ry равна 1 эв).
Числа электронов, реально имеющихся в этих полосах, про-
12 Природа металлических карбидов, нитридов, гидридов, боридов
Строение атома, кристаллическая структура и
1ый номер V я я еЗ Я © св Распределение электронов по группам Атомный радиус
3 4 5 6
S о »S х з £ р d s р d / s P d f £
20 Са* 2 6 — 2 — — — — — — — 1,96
22 Ti 2 6 2 2 1,46
23 V 2 6 3 2 1,35
24 Сг 2 6 5 1 1,285
25 Мп 2 6 5 2 1,36
26 Fe 2 6 5 2 1,26
27 Со 2 6 7 2 1,25
28 N1 2 6 8 2 —— — — — — — — 1,2
29 Си* 2 6 10 1 1,275
38 Sr* 2 5 10 2 6 — — 2 — — — 2,15
40 Zr 2 6 10 2 6 2 — — — — — 1,59
41 Nb 2 6 10 2 6 4 — I — — — — 1,47
42 Mo 2 6 10 2 6 5 — 1 — — — 1,40
44 Ru 2 6 10 2 6 7 — 1 — — — — 1,33
45 Rh 2 6 10 2 6 8 — 1 — — — — 1,34
46 Pd 2 6 10 2 6 10 — — — — — — 1,37
47 Ag* 2 6 10 2 6 Ю — 1 — — — — 1,442
56 Ba* 2 6 10 2 6 10 — 2 6 — — 2 2,24
72 Hi 2 6 10 2 6 10 14 2 6 2 — 2 1,58
73 Ta 2 6 10 2 6 10 14 2 6 3 — 2 1,47
74 W 2 6 10 2 6 10 14 2 6 4 — 2 1,41
75 Re 2 ' 6 10 2 6 10 14 2 6 5 — 2 1,38
76 Os 2 6 10 2 6 10 14 2 6 6 — 2 1,35
77 ir 2 6 10 2 6 10 14 2 6 7 — 2 1,36
78 Pt 2 6 10 2 6 10 14 2 6 9 1 1,39
79 Au* 2 6 10 2 6 10 14 2 6 10 — 1 1,439
*Эти элементы не являются металлами переходных групп, относящиеся к ним дав-
« 1 АХ-1.00202Л - 1,00202 . 10~8<ги.
*** Стоящая впереди буква характеризует кристаллическую систему,гк которой от
обози^ачает^ ооъемиоцеитрированную кубическую решетку, К12 — гранецеитрированную,
“"* Ориентировочные данные.
Металлы переходных групп
и
Таблица 1
некоторые физические свойства металлов переходных групп
Тип кристаллической решетки*** Температура плавления,°К Теплота сублимации ккал/г атом Модуль Юнга кг/лм»2 Характеристи- ческая темпера- тура 0°К <□ Ci. Ф 1 Удельная маг- нитная воспри- имчивость 10е, см5, г Удельное Элек- тр осо противле- ние, мном.см
К12, Г12 1083 42000 2000 230 3,5 0,040 4,3
Г12, К8 1933 112000 10500 350 8,6 3,19 47,5
К8 1993 120000 15000 — 4,5 26,0
К8, К сложная(58 атомов) 2173 93000 19000 485 19,9 3,7 15,25
К сложная (58 атомов) 1517 69000 20100 350 Н,1 9,9 Z10
К сложная (20 атомов)
Г12, К8, К12, К8 1808 97000 21600 420 16,8 — 10,0
Г12, К12 1751 105000**** 20400 385 14,1 1,1 5,06
К12 (Г12) 1728 102000 19700 385 14,0 — 7,24
К12 1356 82000 12500 315 10,6 —0,66 1,55
К12 1044 39000 — 170 4,4 -0,2 30,7
Г12, К8 2903 125000**** 7000 280 10,9 1,34 41,0
К8 2723 176000**** 16000 — — 2,28 13,1
К8 2902 155000 33600 380 22,8 0,95 5,2
Г12 2700 160000**** 44000 400 26,7 0,427 7,64
К12 2240 138000**** 39000 370 23,9 1,0 6,02
К12 1828 93000**** 12000 273 13,4 5,15 10,88
К12 1934 69000 8200 215 8,3 -0,18 1,50
К8 990 42000 1000 113 2,6 0,147 —
Г12 2503 170000**** 8000 213 13,5 — 30,0
К8 3259 186000 18800 245 18,2 0,93 12,41
К8 3660 202000 41500 310 29,2 0,284 5,03
Г12 3443 170000 53000 300 27,7 0,046 19,8
Г12 2970 174000**** 57000 250 19,8 0,052 9,66
К12 2727 165000**** 53800 275 24,6 0,133 4,85
К12 2047 134000 17300 225 16,8 0,982 11,6
К12 1336 91000 7900 170 9,4 -0,139 2,065
вые приведены здесь для сравнения,
носится данное вещество, цифра указывает координационное число. Таким образом, К8
1 12 —гексагональную (компактную). Для сложных решеток координационное число
14 Ilpupoda металлических карбидов, нитридов, гидридов, боридов
порциональны заштрихованным площадям. В никелевом кри-
сталле общее количество электронов 3d и 4s равно ЮЛ/, где N—
число атомов. Вертикальная линия на графике, отсекающая
площади 3d и 4s, равные в сумме ЮЛ/ (цифра 10 на графике),
проходит в данном случае так, что 9,4Л/ электронов приходится
на полосу 3d, а 0,6Л/— на полосу 4s. Так как электроны распре-
деляются между полосами, стремясь занять уровни с минималь-
ной энергией, изображенное здесь распределение электронов яв-
ляется равновесным: как переход части Sd-электронов на 48-по-
лосу, так и обратный переход привели бы, очевидно, к увеличе-
Рис. 4. Распределение электронов по подгруппам 3d u 4s
в железе (по Маннингу)
ная линия на графике распределения электронов должна быть
сдвинута по сравнению с графиком для никеля в сторону боль-
ших значений энергии. В результате этого, как видно из того же
рис. 3, Sd-полоса оказывается заполненной (в ней теперь ЮЛ/
электронов), число же электронов в 45-полосе достигает Л/.
Таким образрм, хотя при образовании никелевого кристалла
из атомов часть его 45-электронов и переходит в Зd-пoлocy, но
все же полоса эта остается незаполненной — в ней остается 0,6Л/
вакантных мест (или, как часто говорят, — 0,6 «дыры» на атом).
Сходные кривые характеризуют распределение электронов в
3d- и 45-полосах остальных металлов первой* переходной группы
(см., например, на рис. 4 график для железа, в кристалле кото-
рого 0,22zV электронов'4s и 2,22Л/ «дырок» в ^-полосе).
Следует иметь в виду, что графики рис. 3 и 4 построены на
основании грубо приближенных расчетов, критика которых дана,
например, в трудах С. В. Вонсовского [7, 8]. Для качественных и
Металлы переходных групп 15
«полуколичественных» суждений этими (и аналогичными) гра-
фиками пользоваться можно.
Перекрытие $- и d-электронных уровней в металлах переход-
ных групп обусловливает особые их свойства. Прежде всего
этим объясняется низкая электропроводность металлов переход-
ных групп (см. табл. 1).
У металлов переходных групп переменные химические ва-
лентности: с атомами других элементов их атомы могут взаи-
модействовать не только s-, но и d-электронами.
В комплексных соединениях металлов железной группы (на-
пример, в их комплексных цианистых солях) d-оболочка атомов
металлов переходных групп ведет себя, как электронные оболоч-
ки неметаллических атомов: она присоединяет к себе валентные
электроны реагирующих с этими металлами атомов.
Распределение электронов между s- и d-полосами при их пе-
рекрытии (в большой степени зависит от внешних воздействий
(температуры, давления, включенных в кристаллическую решет-
ку посторонних атомов). Так как изменение электронного рас-
пределения в твердом теле может вызвать изменение его кри-
сталлической решетки, многие металлы переходных групп поли-
морфны (15 из 25 исследованных), в то время как среди изучен-
ных рентгенографически нормальных металлов полиморфизм об-
наружен лишь у четырех: кальция, олова, таллия и лития.
Повидимому, свободные энергии основных структур (метал-
лов переходных групп) гранецентрированной и объемноцентри-
рованной кубических, а также гексагональной компактной мало
отличаются друг от друга. Это подтверждается прежде всего
тем, что очень многие из полиморфных металлов переходных
групп имеют модификации, отвечающие той или иной паре этих
решеток. Так, например, скандий, кобальт и многие редкоземель-
ные металлы при низких температурах имеют компактную гек-
сагональную решетку, при высоких — гранецентрированную ку-
бическую, у титана и циркония гексагональная решетка превра-
щается при нагреве в объемноцентрированную кубическую. Как
известно, у железа устойчивая в среднем интервале температур
гранецентрированная решетка превращается в объемноцентри-
рованную как при нагреве выше 1390°, так и при охлаждении
ниже 910°. Теплоты аллотропических превращений во всех этих
случаях малы; невелики и разности энтропий соответствующих
фаз. Это видно из данных табл. 2, где теплоты превращений и
соответствующие изменения энтропии для железа и кобальта со-
поставлены с аналогичными величинами для плавления этих ме-
таллов и для превращения в олове.
А. И. Бублик и Б. Я. Пинес [9] показали, что действие по-
верхностного натяжения приводит к тому, что ванадий в плен-
ках толщиной в несколько десятков ангстремов имеет метаста-
16 Природа металлических карбидов, нитридов, гидридов, боридов
Таблица 2
Некоторые термодинамические характеристики превращений в железе, кобальте
и олове и плавления железа и кобальта
Показатели S-T превраще- ние в Ре Т- ₽ превраще- ние в he 0 а превраще- ние в Со Плавление
Fe Со превраще- ние в Sn
ДЯ, кал!г-атом 140 370 90 3600 3900 1100
AS, кал'г-атом град 0,09 0,35 0,10 2,0 2,2 3,6
бильную гранецентрированную решетку, йсчезающую при утол-
щении пленки. Это явление также; несомненно, связано с малым
различием свободных энергий двух кубических решеток для ва-
надия (при комнатной температуре).
Сложный характер межатомного взаимодействия в металлах
переходных групп проявляется в существовании модификаций со
сложными кристаллическими решетками, характерными не для
элементов, а для металлических соединений.
Так, например, структуру а-марганца имеет так называемая
«Х-фаза» сплавов железо-хром-марганец Fe36Cri2Mo [10]. Очень
сходны с ней структуры так называемых «электронных соедине-
ний типа 7-латуни», структурой ^-марганца обладают р'-элек-
тронные соединения (Ag3Al, Cu5Si и т. д.), у у-марганца—
структура фазы СнАн. ^-уран имеет структуру а-фаз» спла-
вов Fe-Cr, Fe-V, Мп-Cr, Mn-V, Co-V, Co-Cr, V-Ni [11], ^-вольф-
рам — структуру, присущую ряду соединений металлов переход-
ных групп с кремнием и германием, например V3Si.
В межатомных связях кристаллов металлов переходных
групп участвуют не только валентные s-электроны, но и d-элек-
троны незаполненной оболочки, что приводит к возникновению
очень больших сил сцепления в этих кристаллах.
Эти силы характеризуются значениями модулей упругости и
величин т&, где m — масса атома, а 6 — «характеристическая
температура».
Как видно из данных табл. 1, почти у всех металлов переход-
ных групп (кроме титана, циркония, гафния и палладия) модуль
Юнга не меньше 15 000 кг/мм2, достигая у Mo, W, Ru, Rh, Re,
Os и Ir значений 33 000—57 000 кг!мм2, в то время как у «нор-
мальных» металлов он в большинстве случаев не превышает
10*000 кг/мм2, и только у меди составляет 12 500 кг!мм2. Точно
так же и величина /ий3 у металлов переходных групп превы-
шает ту же величину у нормальных металлов. В определенной
Металлы переходных ерупп
1?
степени характеризующие прочность межатомных сил темпера-
туры плавления у всех металлов переходных групп (кроме лан-
танидов и актинидов) превышают 1500° К (1227° С), в то время
как у самого тугоплавкого из «нормальных» металлов—меди —
она равна 1356° К (1093° С). Температуры плавления тантала,
вольфрама и рения превышают 3200° К (1927° С)
Обычно высоким значениям сил сцепления отвечают и высо-
кие значения энергии сцепления, характеризуемые теплотой суб-
лимации.
У металлов переходных групп, за исключением марганца,
теплоты сублимации превышают 100 ккал/г-атом, в то время
как среди «нормальных» металлов только у золота теплота су-
блимации равна 91 ккал/г-атом, у остальных же «нормальных»
металлов она меньше 90 ккал/г-атом. Теплота сублимации воль-
фрама 202 ккал/г-атом превышает теплоту, необходимую
для перевода алмаза в состояние одноатомного пара
(180 ккал/г-атом). Высокая прочность межатомных связей у
большинства металлов переходных групп обусловливает и высо-
кую их твердость, даже в отсутствии упрочняющих добавок до-
стигающую 200 Нв у молибдена и 400 у вольфрама.
, Характерны магнитные свойства металлов переходных групп.
В современной теории парамагнитных и ферромагнитных явле-
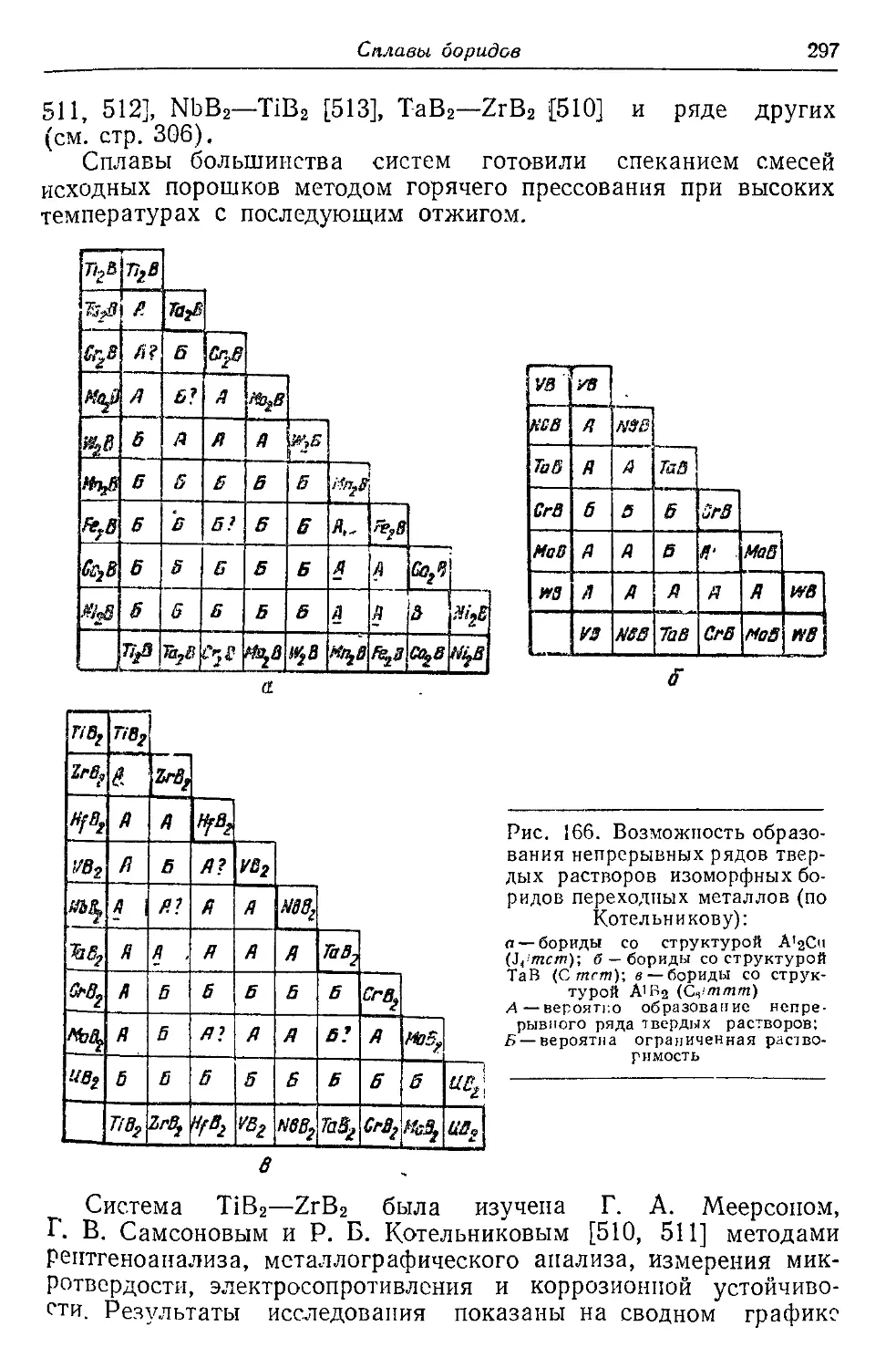
ний доказывается, что парамагнитная восприимчивость метал-
лов обусловлена преимущественно незавершенностью их элек-
тронных оболочек. Поэтому у металлов переходных групп пара-
магнитная восприимчивость обычно очень велика (см. табл. 1)
[12, 13, 6]. Парамагнетизм металлов переходных групп умень-
шается при растворении Металлов с. заполненными d-полосами
(например, меди, серебра, золота). Это объясняется переходом
s-электронов растворяемого металла на вакантные места в d-по-
лосе растворителя. В медноникелевых сплавах насыщение 3d-
полосы никеля происходит при 60%' (атомн.) Си; одновременно
с этим исчезает и парамагнетизм ( а также и ферромагнетизм)
сплава (рис. 5).
Двухвалентный цинк уничтожает магнетизм никеля при со-
держании, равном 30%' (атомн.), трехвалентный алюминий —
при 20% (атомн.). Все эти концентрации отвечают следующему
распределению электронов: Sd-полоса кристалла заполнена, в
45-полосе на каждый атом приходится в среднем 0,6 электрона.
Аналогичное явление происходит при растворении золота в
палладии, имеющем 0,557V вакантных мест в 4б/-полосе: пара-
магнетизм исчезает в сплавах, содержащих 55% (атомн.) Au
(рис. 6), магнитная восприимчивость сплава с 55% (атомн.) Au
равна нулю.
Поскольку процесс растворения Сопровождается в данном
учае перераспределением эдектцонрЕ в S- и 'd-полосах взаимо-
2 Г
1 • н. Самсонов
IS Природа металлических карбидов, нитридов, гидридов, боридов
действующих металлов, он является по существу своеобразной
химической реакцией. Действие атомов металла переходной
группы на атомы растворенного в нем металла с заполненной
с-полосой до некоторой степени подобно действию атомов неме-
талла при образовании ионных кристаллов. В ионных кристал-
лах неметалл отнимает валентные электроны металла, запол-
няя ими свои недостроенные валентные оболочки. В описанных
же нами твердых растворах кристалл металла переходной
группы (например, Ni) заполняет валентными 4$-электронами
второго металла (например, Си) свою незаполненную 3d-полосу.
Рис. 5. Изменение магнитного момен-
та атома никеля при растворении в
нем других металлов
Рис. 6. Изменение магнитного мо-
мента палладия при растворении в
ием золота при 20°
С. Д. Герцрикен и И. Я. Дехтяр (14] указывают, что в ряде
случаев заполнение незаполненной d-полосы при образовании
твердых растворов увеличивает прочность межатомных связей.
Так, например,' при растворении алюминия в кобальте растет
энергия активации самодиффузии кобальта.
Кристаллическая структура фаз внедрения
В фазах внедрения металлические атомы образуют следую-
щие кристаллические решетки:
1) кубическую гранецентрированную с координационным чис-
лом 12 (К12) (каждый металлический атом окружен 12 ближай-
шими соседями);
2) кубическую объемноцентрированную с координационным
числом 8 (К8);
Кристаллическая структура фаз внедрения
19
3) гексагональную компактную (Г 12) с отношением осей в
идеальном случае с/а=^ 1,633.
Решетка К8 встречается редко.
Атомы неметалла занимают свободные места в решетке, об-
разованной металлическими атомами; они внедрены в металли-
ческую решетку, это и дало основание назвать такие структуры
«структурами внедрения».
В некоторых случаях удалось определить местоположение
атомов неметалла рентгенографически (в фазах, состоящих из
относительно легкого металла и относительно тяжелого неметал-
ла, например в карбиде титана TiC), но чаще всего о местопо-
ложении неметаллических атомов судят на основании геометрии
ячейки.
В приводимой ниже таблице структур внедрения, составлен-
ной на основании последних исследований, предполагаемое рас-
Рис. 7. Меж-
fl томные проме-
жутки в компа-
ктной решетке:
о —тетраэдричес-
кий; б—октаэдри-
ческий
« Н О 2г
Рис. 8. Тетрагонально искажен
ная решетка гидрида цирко-
ния
положение атомов неметалла характеризуется их координацион-
ным числом (табл. 3). Так, например, структура гидрида титана
TiH описывается в этой таблице следующим образом: К12. 4—
в гидриде металлические «атомы образуют гранецентрированную
кубическую решетку, атомы же водорода предположительно раз-
мещаются в так называемых «тетраэдрических» порах решетки,
каждая из которых окружена четырьмя металлическими атома-
ми (рис. 7, а).
В некоторых случаях структуры внедрения характеризуются
незначительным искажением кристаллической решетки метал-
ла. Так, например, в гидриде тантала атомы тантала образуют
объемноцентрированную ромбическую решетку, которая отлича-
ется от кубической тем, что ребра ее элементарной ячейки не
Таблица f
Кристаллическая структура фаз внедрения1
Системы Отношение атомных радиусов Состав фазы при максимальном содержании неметалла (теоретически возможном)
Мег X Ме2Х Me X MeXt
идеальный тип решетки искажение период ре- шетки а, кХ. и от- ношение cla для фазы с наи- большим содержа- нием не- металла идеальный тнп решетки искажение период решет- ки а, кХ и отношение cfa для фазы с наибольшим содержанием неметалла идеальный тип решетки искажение период ре- шетки а, кХ и отно- шение с/а для фазы с наиболь- шим содер- жанием неметалла идеальный тип решетки искажение период ре- шетки а, *Х и отно- шение с/а для фазы с наиболь- шим содер- жанием не- металла
Zr —H 0,29 К12.4 — 4,664 Г12.4 а=3,339 К12.4 4,664 К12.4 Тетраго- 4,644
с/а= 1,625 нальное л М ✓ 1 с/а=0,894
Nb — H 0,32 — — — — — — К12.4 Ромбиче- -3,32 — Ъ [U I
ское
Та — H 0,32 — — — Г12.4 с/а <1,63 а=3,094 К8. 4 То же а—4,811 —
с/а= 1,591 6=4,781 с=4,434
Ti- - H 0,33 — — — Г12.4 cja <1,63 а=3,11 с/а=1,61 К12.4 — 4,397 К12.4 — 4,460
Pd — H 0,34 —— —. — — — —— К12.4 — 4,04 — ——
Ni — H 0,37 — — — Г12.4 аМ2,643 — — — —
—c с/а-1 ,63 1 а=5,54
La От 0,42 — — — — — — — — — К12 Тетраго- с/а=1,18
Ce -c — — — — — — —— — -— — нальное а=5,48
с/а > 1 с/а= 1,18
Pr — c до 0,34 — — — — — — — — К12 а=5,44
Nd —c — —• — — — — — — — К12 с/а= 1,17
Sm а=5,41
— c К12 1 с/а= 1,15 а=5,31 с]а= 1,18
Продолжение табл- S
Системы Отношение атомных радиусов I Состав фазы прн максимальном содержании неметалла (теоретически возмжоном)
Mei X Мег X Me X Me Xg
идеальный тнп решетки искажение период ре шетки а, кХ и отно шение с/а для фазы с наиболь- шим со- держанием неметалла идеальный тип решетки искажение период решет ки а, кХ и от ношение с/а для фазы с наибольшим содержанием неметалла идеальный тип решетки искажение период ре- шетки а, кХ и отно- шение с/а для фазы с наиболь- шим содер- жанием неметалла идеальный тип решетки искажение период ре- шетки а. кХ и от- ношение с/а для фа- зы с наи- большим содержа • нием не- металла
Th—С 0,43 — — — — — — __ — К12 Тетраго- нальное с/а < I а=5,85 с/а=0,903
Zr —N Sc — N 0,43 0,47 —- — . К12.6 К12.6 4,567 4,44 — —
и—С 0,48 — — — — —. — — — — К12 Тетраго- нальное а=4,99 с/а=1,19
Zr—С 0,48 — — — — — К12.6 — 4,683 — с(а> I —
Hf —С 0,49 — — — __ — — — — — — — —
Nb— N 0,49 — — — Г12.6 с/а> 1,63 <1=3,046 с/а-= \ ,624 К12.6 — 4,641 — — —
Та —N 0,49 — — — Г12.6 с/л<1,63 а=3,042 с/а= 1,615 Г12.6 — <7=5,185 с/«=0,561 — — —
Tl—N 0,50 — — — — — — К12.6 — 4,23 — —
W —N Mo —N 0,51 0,52 — — К 12.6 К12.6 Тетраго- нальное с/а< 1 <7 = 4,118 . а=4,160 Г12.6 <7=2,893 с1а=6,<4П / — __
V— N 0,53 — — — — — — К12.6 — 4,126 — — —
___________________________________________________________________________Продолжение табл. Л
Системы Отношение атомных радиусов Состав фазы при максимальном содержании неметалла (теоретически возможном)
Л1с2Х МеХ м«хг
идеальный тип решетки искажение период ре- шетки м» кА и отно- шение СП! для фазы с наиболь- шим со держанием неметалла идеальный тип решетки искажение период решет- ки кХ и от- ношение для фазы с наибольшим содержанием неметалла идеальный тнп решетки искажение период ре- шетки а, кХ и отно- шение (' а для фа ы с наиболь- шим со- держав ием неметалла идеальный тип I решетки j искажение период ре- шетки 1, кХ и отно- шение с la для фазы с наиболь- шим содер- жанием неметалла
Мп — N 0,53 К12.6 Тетрагон* г/а< 1 а=3,765 da-0,968 Г12.6 с/а< 1,63 <7=2,825 da— 1,601 К12.6 Тетрагональ- ное с а< 1 <2=4,207 с/а=0,97 — —
Nb —С 0,53 — — — Г12.6 <2=3,119 da= 1,619 К12.6 — 4,461 — — —
Та—С 0,53 — — — Г12.6 с/а< 1,63 <z=3,104 с/<2=1,59 К12.6 — 4,456 — —
Т1 —С 0,54 —— — К12.6 __ 4,313 — — —
W-C 0,55 — — — Г12.6 с/<2 <1,63 <2=2,986 с/<2=1,578 — — — — —
Сг - N 0,56 — — — Г12.6 <2=4,760 с/а=0,928 К12.6 — 4,148 — — —
Mo —С 0,56 -— — — Г12.6 с/а < 1,63 <2=3,002 с/а= 1,574 — — — — — —
Fe — N 0,56 К12.6 — 3,79 — С/<2<1,63 <2=2,76 fc=4,82 С = 4,42 — — — —— — —
Со — N 0,57 — — — Г12.6 — <7=2,666 с/<2= 1,635 — — — — — —
Ni — N 0,57 — — — Г12.6 —- <2=2,663 С/<2=1,63 — — — — — —
V — С 0,57 — — — Г12.6 с/а <1,63 <2=2,906 с/<2=1,578 К 12.6 — 4,15 — — —
1 В таблицах главы I, носящих иллюстративный характер» мы не ссылаемся на первоисточники* Соответствующие, ссы лки будут при
ведены в специальных главах П — VJ.
Кристаллическая структура фаз внедрения
23
равны между собой, а относятся как 0,995: 0,985: 1. В таблице
для каждого такого случая приводится идеальная решетка (в
случае гидрида тантала, например, решетка К8), а в соседнем
столбце таблицы описывается характер искажения.
По мнению некоторых исследователей, иногда, при особенно
большом различии величин атомных радиусов металла и неме-
талла (например, в гидриде циркония ZrH2), атомы неметалла
внедряются в поры решетки парами, что приводит обычно к ее
искажению; так, например, ре-
шетка ZrH2 (рис. 8) гранецентри-
рованная тетрагональная с с/а<1.
Искажения решетки в фазах, со-
держащих марганец, объясняют-
ся, по нашему мнению, своеобра-
зием природы этого элемента, ко-
торое проявляется в том, что гра-
нецентрированная решетка чисто-
го металла (1-модификация, ус-
тойчивая при высоких температу-
рах) является не кубической, а
тетрагональной.
При рассмотрении табл. 3 не-
обходимо иметь в виду, что почти
все фазы внедрения являются фа-
зами переменного состава, порой
с весьма широкими областями го-
могенности (табл. 4 и рис. 9).
Тем не менее мы считаем воз-
Мва Мьх Иек меЬ
rS.p.
MBOi
78.Р
NO Ft)
-----1____u_
UCi
ZrC
7iN '
Tic
is 20 30 40 SO SO 70
Неметалл, (атомн.}
Рис. 9. Области гомогенности
некоторых фаз внедрения
можным сохранить описание со-
става этих фаз с помощью обычных химических формул с индек-
сами в виде целых чисел. Эти формулы отвечают таким соста-
вам фаз, которые характеризуются наиболее правильным разме-
щением атомов неметалла в кристаллической решетке. Иногда
Таблица 4
Фазы внедрения, гомогенные в значительных интервалах
концентраций неметалла [16, 17]
Наименование фазы Содержание неметалла % (атомн.) Наименование фазы Содержание неметалла % (атомн.) Наименование фазы Содержание неметалла % (атомн.)
Fe2N(e) 17—33 PdH 39—45 Т12н 0—33
Mn2N 25-34 Т ЯгС 22—33 TiH — Т1Н2 47—62
MosC 30—39 ТаС 36—50 VC 43-50
Nb2C 26—33 ZrC 21—50
NbC 42—50 TiC 18—50
Ti N 30—50 иса 26—65
24 Природа металлических карбидов, нитридов, гидридов, боридов
такой условной формуле соответствует максимальное реальное
содержание неметалла в данной фазе [например, карбид титана,
содержащий 18—50% (атомн.) С, изображается формулой Т1С].
В некоторых случаях состав, отвечающий условной формуле фа-
зы внедрения, лежит за пределами области гомогенности этой
фазы на диаграмме состояния. Например, гидрид палладия, со-
держащий 39 — 45% (атомн.). Н изображается формулой PdH.
Согласно данным табл. 3 в фазах внедрения, состав которых
описывается формулой МеД (например, нитрид железа Fe4N),
металлические атомы образуют обычно кубическую гранецентри-
рованную решетку К12; в фазах Ме2Х (например, W2C) — гекса-
гональную компактную (за двумя исключениями) Г12; в фа-
зах МеХ— кубическую гранецентрированную К12 (например,
ТаС) или кубическую объемноцентрированную К8 (ТаН, NbH).
Октаэдрическую координацию, равную шести (см. рис. 7, б),
приписывают атомам неметалла при гх!гМе> 0,41; если же
гх!гме 0,41, то предполагают, что координация неметалличе-
ских атомов тетраэдрическая, равная 4: поры решетки, имеющие
октаэдрическую координацию, в данном случае слишком велики
и размещенные в таких порах атомы неметалла приг^/г^ <0,41
не соприкасались бы с соседними атомами металла.
Было обращено внимание на то, что число октаэдрических
пор в компактных решетках Г12 и К12 равно числу металличе-
ских атомов, а число тетраэдрических пор в два раза больше.
В соответствии с этим содержание неметалла в фазах внедрения
при размещении неметаллических атомов в октаэдрических по-
рах не может превышать того, которое соответствует формуле
МеХ (при одиночном внедрении атомов неметалла); фазы МеХ2
могут образовываться в этом случае лишь при парном внедре-
нии неметаллических атомов, приводящем к тетрагональному ис-
кажению решетки (по предположению некоторых авторов — кар-
биды металлов редких земель). Когда же атомы неметалла рас-
полагаются в тетраэдрических порах решетки (почти исключи-
тельно в гидридах), то возможно образование фаз МеХ2 и при
одиночном внедрении неметаллических атомов. Кубическая гра-
нецентрированная решетка металлических атомов при этом не
искажается (пример, TiH2).
Было указано, что средние значения расстояний между цент-
рами атомов металла и неметалла, найденные по данным рентге-
нографического анализа, для разных фаз внедрения, принадле-
жащих к одной и той же системе, имеют различные значения.
При описании наблюдаемой здесь картины атомный радиус ме-
талла считался постоянным, и было введено понятие «эффектив-
ного» радиуса неметаллического атома. При содержании неме-
талла в фазе внедрения, равном 50% (атомн.), эффективные ра-
Кристаллическая структура фаз внедрения
25
диусы неметаллических атомов близки к принятым обычно зна-
чениям, но чем меньше концентрация неметалла в фазе, тем
меньше его эффективный атомный радиус.
В табл. 5 сопоставлены эффективные радиусы атомов неме-
таллов в фазах разного состава.
Таблица 5
О
Эффективные радиусы атомов неметаллов, А
Состав фазы гс rN ГН
МеХ. . • 0,77 0,71 0,46
МегХ 0,73 0,69 0,42
Ме4Х . — 0,63 —•
Если исходить из приведенных в табл. 3 и 4 формул, сле-
дует считать, что фазы внедрения способны растворять в себе
металлический компонент. Поскольку при увеличении дефицита
неметаллического компонента с малым атомным радиусом рас-
стояния между металлическими атомами в фазах внедрения
уменьшаются (см. рис. 15), можно заключить, что при недо-
статке атомов неметалла в решетках этих фаз образуются пус-
тые места (это подтверждено для карбидов ниобия, титана и
тантала путем сопоставления данных рентгеноанализа с резуль-
татами измерения плотности).
В большинстве случаев при уменьшении содержания неме-
талла в фазе внедрения плотность последней уменьшается, так
что некоторые авторы вообще считали такую связь между этими
величинами общим законом для фаз внедрения.
В. И. Смирнова и Б. Ф. Ормонт [15] обратили внимание на то,
что эта закономерность справедлива лишь в тех случаях, когда
атомный вес металла не чересчур велик по сравнению с атом-
ным весом неметаллического элемента.
Действительно, плотность р фазы внедрения может быть вы-
числена по формуле:
р = 1,65-10-244xNa-3 (К+а). (I)
Здесь 1,65-10~24= 2. массы атома кислорода;
16
Ах — атомный вес неметалла;
N—число металлических атомов, приходящихся
на элементарную ячейку фазы;
а— период решетки;
К— отношение атомных весов металла и не-
металла;
а— отношение атомных концентраций неметал-
ла и металла.
26 Природа металлических карбидов, нитридов, гидридов, боридов
При изменении состава фазы, отвечающем изменению отно-
шения а на небольшую величину Да, изменение плотности Др
определится по формуле:
== 1,65 - 10~24Лх - ?7-а-4Да
rf Г 1
ДР= — 1,65 • 10~24ЛхМа_3 (/< + а) I Да =
=1,65 • 10-24 АхN|а~3—3 (К + а)а~4?1 Да=
1 аа j
da 1
[а-3(К+а)-].
(2)
Если принять, что а линейно зависит от а, то уменьшение содер-
жания неметалла вызовет при 3(К + а) Да < аДа— уменьшение
плотности фазы, а при 3(/< -Ь а)Да > аДа — увеличение плотности.
Смирнова и Ормонт сопоставили карбиды ниобия и тантала.
92 9
Для карбида ниобия = 7,7, у фазы с 10,6% С
(а — 0,920) а = 4,461 кХ, у фазы же с 8,8% С (а —Да= 0,745)
а — 4,454 кХ. Отсюда 3(Я+а) Да= 3(7,7 + 0,92) • 0,007 = 0,18,
аДа= 4,461 • 0,185 = 0,82, т. е. 3 (К + а) Да < аДа, а потому при
уменьшении содержания углерода плотность карбида ниобия
должна уменьшаться.
Для карбида тантала К = ~у— = 15,1. При а=1 а=4,466кХ,
При а—Да = 0,80 а — && = 4,444 кХ, 3(/( + а) Да = 3(15,1 + 1) •
• 0,022 = 1,06, а Да = 4,47 0,2 = 0,894.
4 Следовательно, 3 (К + а)Да> аДа, а поэтому плотность карбида
тантала с уменьшением содержания углерода увеличивается. Дей-
ствительно, при переходе от ТаС к ТаС0,5 она возрастает по рас-
чету с 14,38 до 14,42.
Можно показать, что для гидрида палладия уменьшение содер-
жания водорода также вызывает увеличение плотности. Действи-
тельно, здесь /С = 106, при а= 0,82 а = 4,04 кХ, при а—Да= 0,65
а—Д а = 4,02 кХ. В этом случае 3(К + а) Да = 3(106 + 0,82) •
• 0,02 = 6,4, и а Да = 4,04 • 0,17 = 0,69, т. е. 3(/к+а) Да много
больше, чем аДа.
Общий вывод в отношении связи плотности фаз внедрения
с соотношением компонентов таковД Все гидриды при уменьше-
нии содержания неметалла должны увеличивать плотность; то же
должно происходить и с карбидами и нитридами металлов третьей
переходной группы и актинидов. Плотность карбидов и нитридов
металлов первых двух переходных групп с уменьшением содер-
жания углерода должна уменьшаться.
Если число подходящих для внедрения мест в кристалличе-
ской решетке равно числу атомов неметалла, последние, очевидно,
размешаются упорядоченно. Так, например, при внедрении неме-
таллических атомов в октаэдрические промежутки гранецентриро-
Кристаллическая структура фаз внедрения
27
ванной решетки фазы, состав которых точно отвечает формуле
МеХ (например, TiC, TiN, ТаС), имеют структуру типа NaCl
(рис. 10, а). Взаимное расположение атомов неметалла в этой
структуре такое же, как и расположение металлических атомов:
атомы неметалла образуют гранецентрированную кубическую ре-
Рис. 10. Структура фаз внед-
рения:
а—структура фазы МеХ с заполнен-
ными октаэдрическими промежутка-
ми; б - структура фазылиЛ* (а< 1)
при статистическом распределении
незаполненных окта-дрических про-
межутков; «—структура т'-фазы
системы Те—N
шетку, смешенную по отношению к решетке металла на половину
телесной диагонали элементарной ячейки.
Очевидно, в фазах, близких по составу к формуле МеХ, но
с нехваткой атомов неметалла, решетка типа NaCl получается де-
фектной — часть октаэдрических промежутков бывает не заполне-
на (рис. 10, б). Если исходить из формулы МеХ, такие фазы с де-
фектными структурами следует рассматривать, как построенные
по типу вычитания твердые растворы металла в соответствующем
соединении. Пустые октаэдрические промежутки в таких кри-
сталлах размещены, невидимому, беспорядочно (см. рис. 10,6).
Если число атомов неметалла в несколько раз меньше мест для
внедрения (например, в фазах Fe2N, Fe4N), то, как показывают
простые термодинамические закономерности, также должна суще-
ствовать (по крайней мере при невысоких температурах) тенден-
ция к образованию упорядоченной структуры, если она возможна
для данного состава при данном расположении металлических
атомовЛВ таких упорядоченных структурах внедренные ато-
мы неметалла должны образовать решетку, отличную от решет-
ки металлических атомов. Так, например, неметаллические ато-
мы фазы Fe4N образуют простую кубическую решетку с тем же
периодом, какой имеет гранецентрированная решетка, построен-
28 Природа металлических карбидов, нитридов, гидридов, боридов
ная из атомов железа (атомы азота сидят в центрах ячеек по-
следней, как видно на рис. 10,в).
Причины стремления к упорядоченному размещению атомов
неметалла таковы. Прежде всего при неупорядоченном распре-
делении атомов неметалла в порах решетки последняя должна
быть искажена, расстояния между металлическими атомами в
соседних элементарных ячейках должны быть различны. Иска-
жения решетки должны вызывать упругие напряжения, с кото-
рыми должна быть связана упругая энергия. Упорядочение
уменьшает искаженность решетки и поэтому снижает внутрен-
нюю энергию системы. Как будет указано ниже, образование фаз
внедрения почти всегда является экзотермической реакцией.
Теория упорядочения учит, что в таких случаях атомы каждого
компонента стремятся окружить себя наибольшим числом ато-
мов второго компонента, что приводит к минимальному зна-
чению внутренней энергии. Это стремление удовлетворяется в ре-
зультате упорядочения. При невысоких температурах, когда ре-
шающую роль в выражении F = U — TS играет внутренняя энер-
гия системы U, равновесным и должно быть поэтому максималь-
но упорядоченное размещение атомов неметалла.
Об упорядоченности в расположении неметаллических ато-
мов можно было бы судить по электросопротивлению: у фазы,
имеющей упорядоченную структуру, электросопротивление долж-
но быть меньше, чем у фаз с неупорядоченным размещением
атомов неметалла. Однако до настоящего времени исследований
зависимости электросопротивления фаз внедрения переменного
состава от содержания в них неметалла не проводили.
Некоторые данные для суждения о порядке в размещении
атомов неметалла в фазах внедрения были получены при рент-
генографических, электронографических и нейтронографических
исследованиях.
Если решетка, образованная упорядоченно размещенными
внедренными атомами, отличается от решетки, сложенной из ме-
таллических атомов, на рентгенограммах и электронограммах
должны появиться дополнительные так называемые «сверхструк-
турные линии». Так, например, на рентгенограмме/-фазы си-
стемы Fe — N(Fe4N), кроме присущих рентгенограмме гране-
центрированной кубической решетки линий (111), (200), (220)
и т. д., присутствуют слабые «сверхструктурные» линии (100),
(110), (210), (211) и т. д. [16].
Интенсивность сверхструктурных линий на рентгенограммах
фаз внедрения с упорядоченным расположением внедренных ато-
мов тем выше, чем ближе атомный номер неметаллического ком-
понента фазы к атомному номеру образующего фазу металла.
Поэтому выявить порядок в гидридах по рентгенограмме не
представляется возможным, на рентгенограммах карбидов и ни-
Кристаллическая структура фаз внедрения
29
тридов можно обнаружить сверхструктурные линии только для
фаз, содержащих металлы первой переходной группы.
Рентгенографически установлено упорядоченное расположе-
ние атомов N в фазе Fe4N. Более чувствительные к выявлению
расположения легких атомов электронографические исследования
[17] показали, что в в -нитриде железа при составах, близких к
FesN и Fe2N, атомы азота чаще всего располагаются упорядо-
ченно. Однако при некоторых условиях образуется фаза Fe2N с
неупорядоченным расположением атомов азота в октаэдриче-
ских промежутках компактной гексагональной решетки (подроб-
нее см. главу IV, стр. 241).
Нейтронографически подтверждена упорядоченность распо-
ложения атомов дейтерия в решетках дидейтеридов гафния и
титана. Металлические атомы образуют гранецентрированный куб,
атомы дейтерия занимают тетрагональные поры ячейки, распо-
лагаясь в 3/4V/4, 3/43/41Л, 3/43/43/4, 3/4i/43/4, V43/43/4,
1/41/43/4,и 1li3l41li. Дидейтериды, таким образом, имеют структу-
ру CaF2, тетрагонально искажающуюся при приближении к сте-
хиометрическому составу. Расстояния D—D превышают соот-
ветствующие расстояния в молекуле D2. Объем пор свидетель-
ствует об ионизации атома дейтерия в кристалле [619].
Как уже указывалось, неупорядоченное размещение внедрен-
ных атомов должно приводить к искажению кристаллической
решетки, т. е. к тому, что расстояния между соседними метал-
лическими атомами делаются неодинаковыми.ЧДолжны быть ис-
кажения и в кристаллах с дефектными структурами. Эти «ста-
тические» искажения кристаллической решетки приводят
к уменьшению интенсивности интерференционных линий рентге-
нограммы. Если I — интенсивность линии на рентгенограмме ве-
щества, кристаллическая решетка которого лишена статических
искажений, а Г — интенсивность линии на рентгенограмме того
же вещества при наличии статических искажений, то отношение
этих интенсивностей характеризуется уравнением:
2L = е
I X2
где (7,—средний квадрат обусловленных неупорядоченностью
размещения атомов неметалла вариаций межатомных
расстояний;
(3)*
* В выражение (3) должны быть внесены поправки на изменение ряда
факторов, влияющих на интенсивность линий. Одна из этих поправок, учиты-
вающая изменение амплитуд тепловых колебаний, вносится на основании опыт-
ных данных, полученных из фотометрировання рентгенограмм, снятых при ком-
натной и повышенной (либо пониженной) температурах, остальные — чисто
расчетным путем>
30 Природа металлических карбидов, нитридов, гидридов, боридов
X — длина волны рентгеновских лучей;
8 —угол между направлением пучка лучей и отражающей
атомной плоскостью кристалла.
Как видно из формулы (3), чем больше угол &, т. е. чем
дальше интерференционная линия от центра рентгенограммы,
тем сильнее сказываются статические искажения на ее интен-
сивности.
С. М. Николаева и Я. С. Уманский [18] определили статиче-
ские искажения решетки в малоуглеродистом [32%’ (атомн.) С]
карбиде титана. В то время как на рентгенограмме карбида
с 48%’ (атомн.) С, почти не имеющего незаполненных октаэдри-
ческих промежутков, линии сохраняют заметную интенсивность,
вплоть до углов 8-, приближающихся к 90°, на рентгенограмме
малоуглеродистого карбида с неупорядоченно размещенными де-
фектами, уже при &«=45° линии исчезают1.
J Подсчеты показали, что среднеквадратичное значение стати-
ческих искажений решетки в малоуглеродистом карбиде со-
ставляет 0,116 А, что очень близко к среднеквадратичным зна-
чениям смещений атомов в кристаллах этой фазы из положений
равновесия при температуре 500° К.
Эти данные позволяют приближенно оценить упругую энер-
гию, связанную с искажениями решетки. Теплосодержание кар-
бида титана с 32%' (атомн.) С при 500°К составляет примерно
3000 кал/г-атом титана.
Упругая энергия, связанная с тепловыми колебаниями, со-
ставляет половину теплосодержания, т. е. 1750 кал/г-атом ти-
тана. Поскольку статические искажения в решетке по величине
такие же, как среднеквадратичные смещения атомов, вызванные
тепловыми колебаниями при 500° К, можно считать, что упругая
энергия статических искажений близка к 1500 кал/г-атом титана.
Некоторые физические свойства фаз внедрения
Как указывалось выше, фазы внедрения, хотя они содержат
до 50—60%' неметаллических атомов, обладают ярко выражен-
ными металлическими свойствами. Они имеют металлический
блеск, проводят электрический ток, причем в некоторых случаях
их электропроводность приближается к электропроводности
1 Как будет отмечено ниже, амплитуды тепловых колебаний атомов в ма-
лоуглеродистом карбиде титана выше, чем в высокоуглеродистом. Это также
приводит к ослаблению далеких линий рентгенограммы малоуглеродистого
карбида по сравнению с линиями, отвечающими малым ft- Однако при ком-
натной температуре эффект от статических искажений решетки этой фазы зна-
чительно выше, чем эффект от тепловых колебаний, поэтому именно стати-
ческие искажения и являются основной причиной изменения вида рентгено-
граммы карбида при уменьшении содержания углерода.
Некоторые физические свойства фае внедрения
31
соответствующих чистых металлов (у нитридов титана и цирко-
ния). С повышением температуры их электрическое сопротивле-
ние падает, как и у всех металлических проводников (рис. 11).
Вблизи абсолютного нуля почти все исследованные фазы внед-
рения переходят в сверхпроводящее состояние.
Все изученные в этом отношении фазы внедрения при высо-
ких температурах испускают с поверхности электроны; такая
способность также присуща лишь металлическим веществам.
Было обнаружено [19], что тела, спрессованные из порошко-
Рис. 11. Изменение электросопротивления некоторых металлов пе-
реходных групп и некоторых фаз внедрения в зависимости от тем-
пературы
образных карбидов вольфрама и титана, при высоких темпера-
турах очень быстро уменьшаются в объеме («дают усадку»),
что также характерно для металлов; по другим данным [20], те-
ла из порошкообразных солей и окислов при температурах,
приближающихся к температуре плавления, при малых выдерж-
ках объема не меняют.
Данные о температурах плавления, упругих модулях и коэф-
фициентах термического расширения, электрических и магнит-
ных свойствах некоторых фаз внедрения приведены в табл. 6,
твердость указана в табл. 7.
Карбиды, относящиеся к числу фаз внедрения, как видно из
таблиц, весьма тверды и тугоплавки, их модули Юнга велики,
32 Природа металлических карбидов, нитридов, гидридов, боридов
Таблица 6
Температура плавления, электрические и магнитные свойства
карбидов и нитридов, относящихся к числу фаз
внедрения и монокарбида вольфрама
Металлы, их карби ды и ни* триды Темпера- тура плавления °K Модуль упругости кг'мм2 Удельное электросо- противление при комнат- ной темпе- ратуре МКОМ, см Отноше- ние Р78°К | Температура перехода в сверх- проводящее состояние °К Молярная магнит- ная вос- приимчи- вость Я1Х10*
Р273°К
W 3660 41500 5,03 Не обнаружено +52
w,c 3130 42800 81,0 1, 2,0—3,5 —
WC1 2867 72200 53 — 2,5—4,2 4-10
WN I Честойкое соединение
Мо 2902 33600 5,2 — Не обнаружено +91 :
МоаС 2960±50» 97,5 —- 2,9 —
MoN Ь 1естойкое с о ед и зение
Та 3260 18800 12,4 4,38 + 150
ТаС 4150+150 29100 30,0 0,960 9,5 +78
TaN 3360 ±50 135,0 — — —~
Nb 2723 16000 13,1 9,22 +213
NbC 3770 ±125 34500 74,0 — 10,5 —
NbN 2300 — __ —
V 1993 15000 26,0 — 4,3 + 76
VC 3023 27600 156 — Не обнаружено —
VN —2320 —- 86,0 —— 3,2—1,6 —
Hf 2503 800 0,33 — 0,7 —
HfC 4160+150 109,0 0,429 <1,28 —
Zr 2203 7000 10,4 —. 0,3—0,4 +91
ZrC 3805 ±125 — 63,4 0,355 2,1—4,1 —26
ZrN 2985 . 13,6 0,170 3,2—7,8 +60
Ti 1933 10500 55,04 —- 1,77 +57
TiC 3410 32200 68,2 0,210 1,15 4-0,2
TIN 3220 ±50» — 11,1 0,229 1,2—1,6 +48
1 При этой температуре происходит перитектическое разложение моиокарбида воль*
фрама.
а Найденная температура плавления МоС (2965°) относится, очевидно, к Двухфазному
сплаву, содержащему М02С и карбид, богатый углеродом.
8 По имеющимся данным нитрид титана при плавлении частично разлагается с обра-
зованием металлического титана (сообщено в работе Брегера [23]).
4 Возможно, что столь высокое сопротивление металлического титана обусловлено
загрязненностью исследуемого препарата.
а коэффициенты термического расширения малы. Температуры
плавления некоторых из них и модули упругости превышают
температуры плавления и модули упругости соответствующих
чистых металлов, которые сами являются веществами туго-
плавкими.
Некоторые физические свойства фаз внедрения
ЗЯ
Таблица 7
Твердость некоторых фаз внедрения и соответствующих им металлов
Вещество Твердость (по минерало гической шкале) Микротвер- дость кг, мм2 Вещество Твердость (по минерало- гической шкале) Микротвер- дость
W 6,5—7,5 450 NbC 9 2050‘
w2c >9 — NbN 8 —
WC 9 17301 VC >9 20901
Мо 6—7 300 VN >9 —
Мо2С 7—9 14801 Zr 5—6 150
Та 6 150 ZrC 8—9 28401
ТаС 9 15501 ZrN 8-9 19802
TaN 8 32302 TiC 8-9 28501
Nb 6 — TiN 8 21802
1 См. 144).
2 См. [362].
Процессы образования большинства карбидов и нитридов,
относящихся к числу фаз внедрения, — реакции экзотермические,
как видно из табл. 8 (исключение составляют карбиды молибде-
на и вольфрама).
Теплоты образования некоторых карбидов
и нитридов (реакции металл — неметалл)
Таблица 8
Нитриды и карбиды Теплота образования — AHt кил!моль Нитриды и карбиды Теплота образования — Д//, кал1моль
TIN +80300 NbC +33600
TiC 4-43850 TaN +58100
ZrN + 82200 ТаС + 36700
ZrC +44100 1 32^-* + 17000
VN +60000 MoN + 17000
vc +2800 Мо2С — 4200
NbN +59000 WC — 8400
В. И. Смирнова и Б. Ф. Ормонт [21] обратили внимание на
то, что почти все исследователи определяли теплоты образования
карбидов и нитридов, считая последние химическими соедине-
ниями постоянного состава, что должно было привести к серьез-
ным ошибкам.
3 Г В. Самсовов
34 Природа металлических карбидов, нитридов, гидридов, боридов
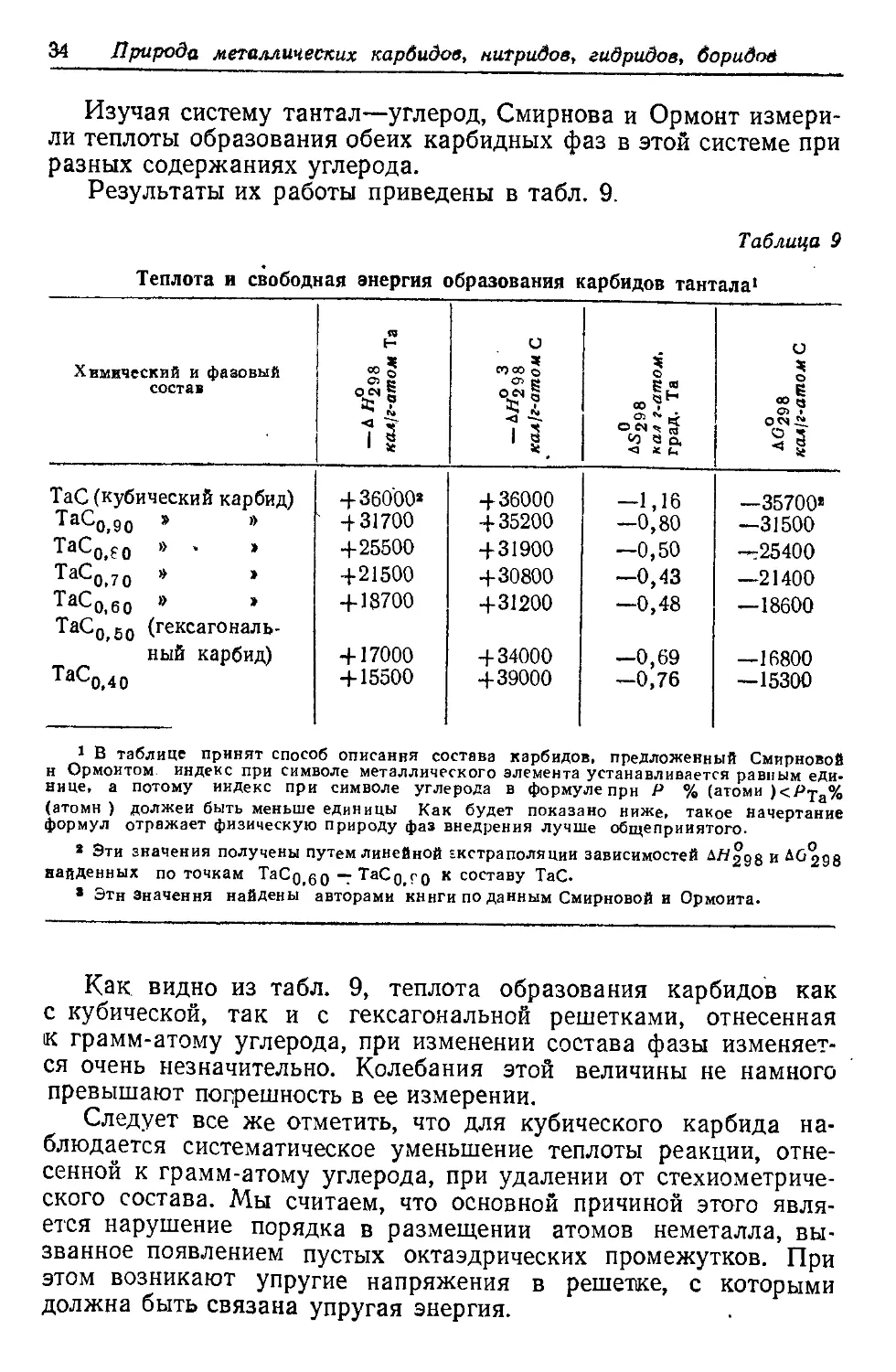
Изучая систему тантал—углерод, Смирнова и Ормонт измери-
ли теплоты образования обеих карбидных фаз в этой системе при
разных содержаниях углерода.
Результаты их работы приведены в табл. 9.
Таблица 9
Теплота и свободная энергия образования карбидов тантала1
Химический и фазовый состав «298 кал/г-атом Та АН° 3 ~д//298 кал 1г-атом С 1о0 Д5298 нал г-атом, град. Та АО298 кал1г-атом С
ТаС (кубический карбид) 4-36000» 4-36000 —1,16 —35700»
TaC0jg0 > » 4-31700 4-35200 —0,80 —31500
ТаСо,ео * • * 4-25500 4-31900 —0,50 —25400
^а^0.7 0 * * 4-21500 4-30800 —0,43 —21400
ТаС0,60 а * 4-18700 4-31200 —0,48 —18600
ТаС0 50 (гексагональ-
ный карбид) 4-17000 4-34000 —0,69 —16800
ТаСо,4о 4-15500 4-39000 —0,76 —15300
1 В таблице принят способ описания состава карбидов, предложенный Смирновой
н Ормоитом. индекс при символе металлического элемента устанавливается равным еди-
нице, а потому индекс при символе углерода в формуле прн Р % (атоми )<Р>ра%
(атомн ) должен быть меньше единицы Как будет показано ниже, такое начертание
формул отражает физическую природу фаз внедрения лучше общепринятого.
* Эти значения получены путем линейной экстраполяции зависимостей Д//298 и д^298
найденных по точкам ТаСд^О “Г^а(-О,ГО к составу ТаС.
8 Эти Значения найдены авторами книги по данным Смирновой и Ормоита.
Как видно из табл. 9, теплота образования карбидов как
с кубической, так и с гексагональной решетками, отнесенная
к грамм-атому углерода, при изменении состава фазы изменяет-
ся очень незначительно. Колебания этой величины не намного
превышают погрешность в ее измерении.
Следует все же отметить, что для кубического карбида на-
блюдается систематическое уменьшение теплоты реакции, отне-
сенной к грамм-атому углерода, при удалении от стехиометриче-
ского состава. Мы считаем, что основной причиной этого явля-
ется нарушение порядка в размещении атомов неметалла, вы-
званное появлением пустых октаэдрических промежутков. При
этом возникают упругие напряжения в решетке, с которыми
должна быть связана упругая энергия.
Физическая природа фаз внедрения
3S
Физическая природа фаз внедрения
По вопросу о физической природе фаз внедрения существует
несколько точек зрения.
Одни исследователи, не высказывая в четкой форме опреде-
ленных представлений о характере связи между металлом и не-
металлом в фазах внедрения, подчеркивают лишь, что структура
и свойства этих фаз определяются тем, что в них сохраняются
металлические связи между атомами металла. Бернал [22] до-
полняет это представление, указывая на то, что связи между ме-
таллом и неметаллом, заметно проявляющиеся в увеличении сил
сцепления в фазах внедрения по сравнению с чистыми металла-
ми, носят такой же характер, как и связи в молекулах и кри-
сталлах неметаллических элементов.
А. X. Брегер [23] развил некоторые положения о химической
связи в фазах внедрения, анализируя собственные и литератур-
ные данные о периодах кристаллической решетки карбидов, нит-
ридов и низших окислов титана и ванадия TiC, TiN, TiO, VC,
VN, VO.
Он сопоставляет найденные экспериментальные периоды ре-
шетки перечисленных веществ с периодами, которые они имели
бы при чисто ионной связи (т. е. если бы атомы металлов от
дали свои валентные электроны атомам неметалла, насытив их
валентные оболочки) и с периодами решетки при чисто атомной
связи (табл. 10).
Таблица 10
Периоды решетки соединений титана и ванадия,
найденные экспериментально и подсчитанные теоретически
Химическая формула Периоды решетки, кХ
найденные экспе- риментально вычисленные для чисто атомной связи вычисленные для чисто ионной связи
TiC 4,32 4,38 6,56
TiN 4,235 4,24 4,80
TiO 4,165 4,16 4,32
VC 4,23(4,16)* 4,16 6,40
VN 4,13 4,02 4,74
VO 4,08 3,94 4,22
4 оз ЕРеГеР> сам не изучавший карбид ванадия, принимает для него период, равный
<»_23 кХ, но в настоящее время твердо установлено значение 4,16 кХ.
На основании этих данных Брегер делает заключение, что хи-
мическая связь в карбидах имеет чисто атомный характер, в нит-
ридах появляются «следы» ионной связи между металлом и не-
металлом, в окислах TiO и VO ионная связь играет существен-
36 Природа металлических карбидов, нитридов, гидридов, боридов
ную роль. Вопрос о том, имеет ли атомная связь в карбидах и
нитридах металлический характер, Брегер не обсуждает.
Как мы уже указывали, атомные радиусы углерода и азота,
определенные на основании измерений межатомных расстояний
в фазах внедрения МеХ, колеблются в значительных пределах.
В соответствии с этим незначительное увеличение радиуса атома
азота в нитриде ванадия по сравнению с значением, предложен-
ным Паулингом, нельзя считать доказательством наличия ион-
ной связи.
Американский специалист в области технологии твердых
сплавов Мак-Кенна [24] развил особую теорию связей в фазах вне-
дрения. По теории Мак-Кенна связи между металлом и неметал-
лом в этих фазах носят преимущественно ионный характер, меж-
ду металлическими атомами — гомеополярный. Так, например,
связи в карбиде тантала ТаС характеризуются схемой С = Та-
• Та = С, а в сложном вольфрамотитановом карбиде, изготов-
вленном в особых условиях и имеющем состав WT1C2
Ti ' W:W Ti,
где черта означает ионную, а точка — гомеополярную связь.
Представления Мак-Кенна изложены очень бегло, обоснования
их весьма неубедительны.
В частности, как показали многочисленные, весьма тщатель-
ные рентгенографические исследования, сложный титановольфра-
мовый карбид является не химическим соединением, а твердым-
раствором WC в TiC.
В связи с необоснованностью представлений Мак-Кенна мы
их подробно рассматривать не будем.
Имеются данные, которые показывают, что по крайней мере
в некоторых фазах внедрения металл с неметаллом взаимодей-
ствуют весьма своеобразно. Наиболее характерным является в
этом отношении гидрид палладия. При поглощении водорода
палладием, как показал впервые Биггс [25], магнитная прони-
цаемость металла уменьшается так же, как и при растворении
в нем серебра или золота. Парамагнетизм исчезает в сплавах
палладия с водородом по данным различных исследователей
(рис. 12) при отношении H:Pd = 0,50—0,65. Таким образом, во-
дород ведет себя в гидриде палладия как металл, отдавая свои
электроны rf-полосе электронного комплекса кристалла.
По Розенхоллу способность палладия растворять водород •
уменьшается [26] при сплавлении с серебром. В серебропалла-
диевых сплавах, содержащих свыше 70% Ag, водород не рас-
Физическая природа фаз внедрения
3?
т-воряется вовсе. По данным той же работы, растворение 70% се-
ребра приводит к полному уничтожению парамагнетизма палла-
дия, т. е. к заполнению его d-полосы.
Отсюда можно заключить, что сродство палладия к водороду
определяется наличием вакантных мест в 4с?-полосе палладия,
которые и заполняются электронами водородных атомов.
Вопрос о металлическом состоянии водорода в гидриде пал-
ладия детально разработан Уббелоде [27]. Он базируется на тео-
ретической работе Вигнера [28], в которой доказывается, что во-
дород при давлении в 250 000 ат переходит в металлическое со-
Рис. 12. Магнитный момент атома палладия
в системе Pd—Н
ладия благодаря значительному расширению палладия при обра-
зовании гидрида.
По данным Розенхолла [29], растворимость водорода в палла-
дии при комнатной температуре около 3%' (атомн.) (в таком
a-твердом растворе период решетки палладия остается равным
3,884 кХ). Дальнейшее насыщение палладия водородом приво-
дит к возникновению новой фазы Р системы палладий — во-
дород. В гидриде палладия (3-фаза) металлические атомы об-
разуют ту же гранецентрированную кубическую решетку, что и
в металлическом палладии, но минимальный период решетки
гидрида при концентрации водорода 39% (атомн.) (равновесная
концентрация на границе с двухфазной областью а 4-р), равен
4,02 кХ (рис. 13). Увеличение периода с 3,886 до 4,02 кХ, т. е.
на 3,5%, отвечает увеличению объема примерно на 11%>. Так как
коэффициент сжимаемости палладия равен 0,4 • 10-6 см2/кг, то
увеличение объема на 11 % связано с возникновением «внутрен-
38 Природа металлических карбидов, нитридов, гидридов, боридов
него давления» в 2,75 ‘ 10 ~5 ат, что хорошо согласуется с ре-
зультатами теоретических расчетов1.
Такая деформация решетки должна была бы вызвать значи-
тельное увеличение ее потенциальной энергии, и процесс рас-
творения водорода в палладии был бы эндотермической реак-
цией, если бы это увеличение энергии не компенсировалось за
счет уменьшения других составляющих выражения внутренней
энергии системы. Источниками компенсации являются: 1) пере-
ход электрона, принадлежавшего водородному атому, на более
низкий
плекса
Рис. 13. Периоды решеток фаз
в системе Pd—Н
paXj, подчиняющихся закону
энергетический уровень в 4с?-полосе электронного ком-
кристалла; 2) уменьшение энергии валентных электро-
нов, обусловленное увеличением
межатомных расстояний в решет-
ке (переход электронов на более
низкие энергетические уровни).
Непонятному на первый взгляд
факту одновременного существо-
вания двух твердых растворов во-
дорода в палладии, аир, имею-
щих одну и ту же кристалличе-
скую решетку, Уббелоде дает
следующее термодинамическое
объяснение.
В идеальных твердых раство-
Вант-Гоффа, изменение свободной
энергии F при изменении концентрации растворенного вещества,
определяется уравнением:
dF RT
dC ~ С '
Гидриды палладия отличаются от твердых растворов, сле-
дующих закону Вант-Гоффа, тем, что теплота растворения во-
дорода в них изменяется за счет перехода s-электронов во-
дорода на более низкий 4^-уровень палладия и уменьшения
энергии валентных электронов палладия, обусловленного расши-
рением решетки. С учетом этого изменения внутренней энер-
гии Е сплава уравнение (4) можно представить в следующем
виде:
dF RT dE
dC = С + dC
(5)
1 «Внутреннее давление», конечно, не эквивалентно внешнему давлению,
приложенному к кристаллу. Однако деформация электронных оболочек атома
при наличии «внутреннего давления» имеет некоторое сходство с деформацией,
обусловленной внешним давлением. Расширение решетки при внедрении ато-
мов неметалла служит мерой этой деформации, хотя, конечно, проводимые на
этом основании расчеты носят условный характер. Термином «внутреннее дав-
ление» характеризуют влияние внедренных атомов многие металловеды н ме-
таллофизики. В таком смысле будем пользоваться этим термином и мы.
Физическая природа фаз внедрения
39
Равновесие двух фаз а и £ возможно лишь при соблюде-
нии равенства:
дС дС '
Для идеальных твердых растворов это уравнение не осуще-
ствимо, так какС» , и потому:
dF. ИТ dFa RT
л —______।__L =___
дС Сл дС Ср
Для осуществления уравнения (5) необходимо, очевидно,
следующее условие:
RT
1 1 \
дЕ? дЕа
дС дС ‘
(6)
dEs дЕа
Так как 1/Са>1/Ср, то и —- >---------,т. е. изменение энер-
дС dC
гии при растворении водорода в фазе Р с расширенной решет-
кой должно быть больше, чем при растворении его в a-фазе, имею-
щей нормальную решетку палладия.
Если бы концентрации находящихся в равновесии фаз а и Р,
С» и не зависели от температуры, очень мало должны были
дЕа дЕ$
бы зависеть от температуры и величины ----и —характерн-
ее дС
зующие изменение энергйи валентных электронов и энергетический
эффект перехода s-электрона водородного 'атома в 4с?-полосу
палладия. При этом условии мало изменялась бы с температурой
дЕз дЕа
и разность-^- ——.Тогда, в соответствии с уравнением (6), при
повышении температуры разность 1/С« —1/Q должна была бы
уменьшаться, т. е. должна была бы уменьшаться двухфазная об-
ласть а 4- Р • Но чем ближе концентрации находящихся в равно-
весии фаз а и р, тем меньше при однотипности решеток разность
дЕ$ дЕа „ *
—-----— . Это обстоятельство должно в свою очередь приво-
оС дС
дить к дополнительному уменьшению разности 1/Са—1/Ср .При
„ дЕл дЕа
достаточно высокой температуре разность ---------— должна
дС дС
стремиться к нулю. При этом предельная концентрация Са бу-
дет стремиться к С9 и области обоих гидридов должны при до-
статочно высокой температуре слиться.
Изотермы абсорбции и электросопротивления (рис. 14) пока-
зывают, что действительно с повышением температуры двухфаз-
ная область <* + ₽ сужается и при 310° исчезает вовсе; сплавы
Pd — Н вплоть до 45—47% (атомн.) Н остаются однофазными.
Благодаря расширению решетки палладия при внедрении водо-
рода должна уменьшаться степень перекрытия 4d- и 55-электрон-
4G Природа металлических карбидов, нитридов, гидридов, боридов
них подгрупп и должно изменяться распределение электронов
между ними, что приводит к изменению физических свойств
сплава.
Результаты работы по изучению диффузии водорода в палла-
дии под действием электрического поля [30] убедительно под-
тверждают правильность представлений о металлическом состоя-
нии водорода, растворенного в палладии. Доказано, что электри-
ческое поле вызывает в гидриде палладия явления электролиза:
водород перемещается по направлению к катоду, что может объяс-
Отнощенив conpomuB- Атомное отношение
пении pd+н м
~Рй~ 7%
а б
Рис. 14. Изотермы электросопротивления (а)
и изотермы абсорбции (б) сплавов Pd—Н
няться лишь ионизацией водородных атомов, т. е. тем, что водород
находился во время опытов в металлическом состоянии. В соот-
ветствии с увеличением скорости миграции атомов при повышении
температуры скорость водородных ионов (т. е. протонов) в гид-
риде палладия при градиенте потенциала в 1 в[см изменялась от
0,76 Ю-s см/сек, при 20° до 2,72 • 10 ~5 см/сек при 72°. Эти числа
значительно ниже скоростей протонов в водных растворах. Замед-
ление вызвано тормозящим влиянием электронов проводимости.
Изложенная здесь гипотеза о металлическом характере связей
между водородом и палладием в гидриде палладия — наиболее
обоснованное из всех представлений о химической связи в фазах
внедрения.
Я. С. Уманский [31] счел возможным распространить эти поло-
жения на весь класс «фаз внедрения». Конечно, столь исчерпываю-
Физическая природа фаз внедрения
4(
щих доказательств, какие даны для гидрида палладия, здесь
предложить еще нельзя, но все же то, что мы знаем о фазах
внедрения, делает представление о преимущественно металличе-
ском характере связей между металлом и неметаллом во всех
фазах внедрения более правдоподобным, чем представление о
чцсто ковалентном характере этой связи.
Однотипность кристаллических структур и физических свойств
всех фаз внедрения, а также принадлежность всех металлов, на ос-
нове которых эти фазы возникают, к одному и тому же специфиче-
скому классу химических элементов — к металлам переходных
групп, — делают предположение об общности природы этих ве-
ществ весьма вероятным.
Ближе всех к гидриду палладия гидрид титана Ti2H, изоморф-
ный с а-титаном и при низких температурах образующий с тита-
ном непрерывный ряд твердых растворов. Очевидно, следует счи-
тать все сплавы титана с водородом, содержащие до 33%
(атомн.) Н, твердыми растворами, построенными по типу внедре-
ния. С повышением температуры растворимость водорода в a -Ti
падает, что указывает на экзотермический характер процесса
растворения водорода в титане [32].
Нет никаких оснований предполагать, что характер связей в
этих твердых растворах отличен от характера связей в сплавах
палладия с водородом. Справедливы также, видимо, эти представ-
ления для гидридов тантала и ниобия, ТаН и NbH, в которых ме-
таллические атомы образуют кристаллические решетки, лищь не-
много отличающиеся от решеток чистых тантала и ниобия. То об-
стоятельство, что области гомогенности этих гидридов отделены
от областей «нормальных» твердых растворов водорода в тантале
и ниобия двухфазными областями, можно объяснить так же, как
было объяснено существование двухфазных сплавов палладия и
водорода. То же можно высказать и в отношении гидрида цирко-
ния Zr2H, имеющего изоморфную с а-цирконием гексагональную
компактную решетку металлических атомов.
В системе Zr—Н, кроме Zr2H, имеются еще три гидрида-
Zr4H, ZrH и ZrH2. Первые два — с гранецентрированной кубиче-
ской решеткой металлических атомов, третий — с гранецентриро-
ванной тетрагональной решеткой, лишь немного отличающейся от
кубической (с/а = 0,894). При сопоставлении всех четырех гидри-
дов обращает на себя внимание то, что межатомные расстояния
в этих гидридах практически линейно зависят от концентрации во-
дорода (рис. 15). Для уточнения представлений о природе тех гид-
ридов циркония, в которых кристаллическая решетка металличе-
ских атомов (гранецентрированная кубическая) отличается от ре-
шетки чистого металла (гексагональная компактная а и объемно-
центрированная кубическая ₽) вспомним некоторые высказывания
акад. Н. С. Курнакова о бертолидах.
42 Природа металлических, карбидов, нитридов, гидридов, боридов
Излагая теорию бертоллидов — химических индивидуумов пе-
ременного состава, которые имеют максимум на кривой плавко-
сти, не отвечающей рациональному соотношению компонентов,
Н. С. Курнаков [33] приводит гипотетическую диаграмму состоя-
ния, в которой фигурирует твердый раствор компонента А в алло-
тропической модификации компонента В, неустойчивой и нена-
&
3.3
л
Zr2H Л""
2.ГН
Zr,
Tao
-А
, 7аХ
-Та
7720@ M[)N
- ’ QCrN
МщИ й
ТагС
блюдаемой при отсутствии
примесей (рис. 16).
Как известно, многие ме-
талловеды, например Йенсен
[34], Шейль [35], Свечников
[36], Лебедев [37], утвержда-
ют даже, что полиморфизм
,Мл
§ 2J5Ksr Forf
X Fe2ti
fe2N‘
< J_______j----1--1---1---!-L
* О 10 20' 30 40 SO, 00 70
. Неметалл, %/атомн,)
Тг-Н
Та-С
Та-Н
w-c
мп-с
Cr-N
F-N
Рис. 16. Гипотетическая
диаграмма состояния с бер-
толлидом (по Куриакову)
Рис. 15. Расстояние между металличе-
скими атомами в фазах внедрения
§
р* 1 —
И
&
О
X
железа — результат влияния примеси. Не считая доказанными в
какой-либо мере утверждения этих исследователей о том, что
полиморфизм в чистых металлах невозможен, мы должны все
же признать справедливость мнения Курникова о возможности
появления новых аллотропических модификаций металла в ре-
зультате сплавления его с другим элементом.
То обстоятельство, что большинство металлов переходных
групп, образующих при сплавлении с неметаллами фазы внедрения
(в частности, цирконий и титан), характеризуется полиморфизмом
и что металлические атомы образуют в гидридах Zr4H, ZrH и ZrH2
гранецентрированные решетки, свойственные металлическим эле-
ментам, дает нам основание считать эти гидриды построенными по
типу внедрения твердыми растворами металлического водорода в
цирконии, испытавшем в результате этого растворения аллотропи-
ческое превращение.
Таким образом, по излагаемым здесь представлениям цирко-
ний образует с водородом серию твердых растворов, имеющих
Физическая природа фаз внедрения
43
компактные решетки металлических атомов — либо гексагональ-
ную, либо кубическую гранецентрированную.
Межатомные расстояния в этих решетках растут с увеличе-
нием содержания водорода по плавной кривой,, мало отличающей-
ся от прямой (см. рис. 15). Травимость всех гидридов совершенно
одинакова — под микроскопом они неразличимы.
То же справедливо и для гидрида титана TiH — TiH2 с гране-
центрированной решеткой металлических атомов, травящегося
так же, как и бедный водородом гидрид Ti2H. Межатомное рас-
стояние в гидридах титана так же растет с увеличением содер-
жания водорода, как и в гидридах циркония (см. рис. 15).
Можно дать следующее объяснение изменению кристалличе-
ской решетки циркония и титана при растворении водорода в слу-
чае образования гидридов Zr4H, ZrH, ZrH2 и TiH. Первая причина
аллотропического превращения — изменение энергетического со-
стояния электронов металла и их распределения в s- и tZ-полосах,
обусловленное увеличением межатомных расстояний и переходом
в эти полосы валентных электронов водорода. Вторая причина из-
менения структуры — то же «внутреннее давление», обусловлен-
ное внедрением атомов неметалла и расширением решетки, кото-
рое вызывает переход в металлическое состояние водорода в гидри-
де палладия. Как известно, многие металлы при высоких давле-
ниях испытывают аллотропическое превращение. В частности,
объем ноцентрированная решетка рубидия при давлении в
22 000 ат переходит в гранецентрированную.
Прямых экспериментов, доказывающих возможность возникно-
вения у металлов переходных групп полиморфизма под давле-
нием, нет. Однако косвенным доказательством такой возможности
является описанное выше возникновение новой модификации в
тончайших пленках ванадия [9]. Близость внутренних энергий и
энтропий компактной гексагональной, объемноцентрированной и
гранецентрированной кубических решеток у металлов переходных
групп (см. табл. 2) также говорит в пользу предположения
о склонности этих металлов к «полиморфизму под давлением».
Переходя от гидридов к нитридам и к карбидам металлов пе-
реходных групп, остановимся прежде всего на вопросе о том, могут
ли углерод и азот участвовать в металлической связи. Значения
ионизационных потенциалов этих элементов дают основания для
положительного решения этого вопроса; ионизационный потенциал
азота 14,47 в лишь немного превышает ионизационный потенциал
водорода (13,54 в), потенциал же углерода (11,24 в) даже ниже.
Если считать доказанным участие водородных атомов в металли-
ческой связи, следует, очевидно, распространить эту гипотезу на
атомы азота и углерода.
Благодаря увеличению межатомных расстояний при внедрении
атомов неметалла, вызывающему уменьшение энергии валентных
44 Природа металлических карбидов, нитридов, гидридов, боридов
электронов, в фазах внедрения имеются энергетические предпосыл-
ки для перехода по крайней мере одного из валентных электронов
неметаллических атомов в d-полосу металлического кристалла. Та-
кой переход вызывает уменьшение энергии переходящего элек-
трона.
Из приведенной выше табл. 8 видно, что, как и следовало
ожидать, тепловой эффект образования фаз внедрения тем выше,
чем менее заполнена d-оболочка металлического атома. Теплоты
образования карбидов и нитридов элементов IV группы — цирко-
ния и титана — выше, чем элементов V группы — ванадия и тан-
тала, а реакции образования карбидов молибдена (Мо2С) и воль-
фрама (WC) носят эндотермический характер.
Наличие в фазах внедрения химической связи между атомами
металла и неметалла не противоречит представлению об этих фа-
зах как о твердых растворах, и при образовании «классических»
твердых растворов замещения имеется определенная химическая
связь между растворителем и растворимым элементом.
Приведем еще некоторые факты, косвенно подтверждающие
правильность представления о «металлическом» состоянии атомов
азота и углерода в фазах внедрения.
В 1937 г. В. И. Просвирин [38] исследовал микроструктуру
стальной проволоки с 0,6% С, сквозь которую в течение 26 час.
пропускался постоянный электрический ток плотностью 2500 а!см2,
нагревавший ее до температуры 1050° (проволока во время опыта
находилась в вакууме). После опыта конец проволоки, прилегаю-
щий к катоду установки, приобрел чисто эвтектоидную структуру,
что указывало на содержание углерода, близкое к 0,9%, в то вре-
мя как, судя по микроструктуре анодного конца проводоки, здесь
содержание углерода упало примерно до 0,45 %. Данные Просви-
рина были подтверждены в 1939 г. Зейтцем и Кубашевским [39] и
в 1947 г. — Т. А. Лебедевым и В. М. Гутерманом [40].
Не вдаваясь в подробности этих опытов, укажем, что обнару-
женные в них эффекты могут быть объяснены лишь превращением
углеродных атомов аустенита в положительно заряженные ионы.
Посредством измерения электропроводности аустенита при темпе-
ратуре опыта было установлено, что скорость углеродных ионов
(предполагается, что заряд иона равен + е) составляет 1,6—2,2 •
10~5 см/сек (величина того же порядка, что и скорости прото-
нов в описанных выше опытах по электролизу водорода в гидриде
палладия).
Исследования [38, 39, 40] показывают, что углерод, растворен-
ный по принципу внедрения в у-железе, находится в металличе-
ском состоянии: по крайней мере один из его валентных электро-
нов прийадлежит электронной Sd-полосе металлического кристал-
ла. Вопрос о заряде углеродных ионов до конца не был решен. Во
всяком случае заряд этот должен превышать е, так как рассчитан-
Физическая itpupoda фаз внедрения
45
ная из коэффициентов диффузии скорость углеродных ионов
должна быть равна 0,8 • 10-5 см/сек-, цифры же, найденные в
предположении, что углерод однократно ионизирован, как указа-
но выше, равны 1,6—2,2 • 10-s см/сек, т. е. по крайней мере вдвое
выше.
В дискуссии по поводу работы Зейтца и Кубашевского было
высказано предположение, что атом углерода ионизирован в аусте-
ните четырехкратно, т. е. до структуры атома гелия. Во всяком
случае независимо от того, какой положительный заряд следует
приписать углеродному иону в аустените, факт ионизации доказан.
Такое же заключение делает Т. А. Лебедев [37, 40]. В. И. Просви-
рин указывает, что и азот, растворенный в Fe/, ионизирован поло-
жительно [38].
Гипотеза о металлическом состоянии углерода и азота, рас-
творенных в металлах переходных групп, позволяет объяснить
чрезвычайно высокую подвижность этих атомов. О том, насколько
велика эта подвижность, можно судить, сопоставляя приведенные
в табл. 11 данные о коэффициентах диффузии углерода, азота и
кислорода в железе.
Таблица it
Коэффициент диффузии некоторых элементов
в железе D 10 — 5 см.г/сутки
Температура °C Диффундирующий элемент
С N О Si S
1000 3220 47 6,5
1100 79230 127 — 100 8,5
По данным Ю. М. Лахтина [41], коэффициент диффузии азота
в фазе внедрения РегЫ уже при 800°составляет 156 • 10~5 см2/сутки,
а при 1000° он должен более чем в семь раз превысить коэффи-
циент диффузии азота в у-железе.
Как видно из табл. 11, коэффициенты диффузии углерода и
азота в железе, имеющие один и тот же порядок величины, в 200—
300 раз превышают коэффициент диффузии кислорода, в то вре-
мя как атомный радиус кислорода меньше атомных^адиусов азо-
та и углерода. Этот парадокс устраняется, если принять, что азот-
ные и углеродные атомы, растворенные в железе, лишены части
своих электронов и поэтому имеют уменьшенные размеры (такое
предположение сделано Лебедевым [37]).
В пользу того же представления говорят и данные о теплотах
активации при диффузии азота в нитридах, являющихся фазами
внедрения и характеризующихся очень большими энергиями сцеп-
46 Природа металлических карбидов, нитридов, гидридов, боридов
ления — 36,3 калл/г-атом в TiN [42], 39,2 ккал/г-атом в ZrN [42],
25,4 ккал/г-атом в NbN [42], 39,4 ккал/г-атом в TaN [42] и
35,2 ккал/г-атом в Fe2N [41], а также теплота диффузии углерода
в МогС, составляющая, по данным Г. В. Самсонова и В. П. Латы-
шевой [579], 33,4 ккал/г-атом. Эти теплоты несравненно меньше
теплот активации при диффузии любых элементов в фазах с та-
кими большими энергиями и силами связи (обычно теплоты акти-
вации при диффузии в подобного рода веществах превосходят
50—60 ккал/г-атом).
Не противоречат представлению о металлическом состоянии уг-
лерода и азота в фазах внедрения данные об электропроводности
последних.
Как видно из табл. 6, электропроводность фаз внедрения имеет
тот же порядок, что и электропроводность соответствующих метал-
лов. С понижением температуры электрическое сопротивление фаз
внедрения уменьшается в меньшей степени, чем сопротивление
чистых металлов. Это вполне понятно — ведь фазы внедрения яв-
ляются твердыми растворами и должны поэтому иметь меньший
температурный коэффициент электросопротивления.
Таким образом, многочисленными фактами подтверждается то,
что водород, углерод и азот в фазах внедрения отдают часть
своих валентных электронов электронной полосе кристалла, пере-
ходя при этом в металлическое состояние.
Это предположение хорошо согласуется с представлениями хи-
миков о том, что в комплексных (например, цианистых) солях ме-
таллов железной группы tZ-оболочка металлических атомов ведет
себя так, как обычно ведут себя электронные оболочки атомов не-
металлов; она присоединяет к себе валентные электроны реаги-
рующих с этими металлами атомов, так что металлические атомы
Превращаются в отрицательно заряженные ионы.
С представлениями о фазах внедрения как о твердых раство-
рах металлов переходных групп с перешедшими в металлическое
состояние неметаллами хорошо согласуются данные о фазовых
равновесиях и структурах нитридов.
Нитрид марганца Mn4N имеет ту же тетрагональную гране-
центрированную решетку, что и 7-модификация металлического
марганца. В этом случае можно, очевидно, говорить о двух одно-
типных твердых растворах азота в 7-марганце, отделенных двух-
фазной областью наподобие, например, системы Nb — Н. Инте-
ресно, что в физе Mn4N внедренный азот настолько мало изменяет
состояние атомов марганца, что решетка сохраняет присущую
-[-марганцу тетрагональность.
В системе железо — азот (см. диаграмму состояния на
рис. 135) также существуют два однотипных твердых раствора
с гранецентрированными кубическими решетками 7 и 7' (Fe4N).
Их фазовые области с повышением температуры сближаются, но
Физическая природа фаз внедрения
47
не сливаются (в отличие от системы Pd — Н), так как фаза 7' при
высоких температурах неустойчива. Как видно из диаграммы со-
стояния, фаза т' без изменения состава превращается в фазу е
с компактной гексагональной решеткой металлических атомов.
Превращение i' -»• е в системе железо — азот хорошо иллюст-
рирует представление о фазах внедрения с различными структу-
рами, как об аллотропических модификациях металла, раство-
рившего по типу внедрения водород, азот или углерод.
а-титан с компактной гексагональной решеткой растворяет азот
вплоть до концентрации (см. рис. 120), отвечающей формуле
TiNo,22, минимальное же содержание азота в нитриде титана ску-
Содеряанш! углерода, %(атанн]
Рис. 17. Твердость карбида титана (по Ковальскому),
величины /п02 и у4^2 (по Николаевой и Уманскому)
бической гранецентрированной решеткой металлических атомов
характеризуется формулой TiNo,43 [43]. С этой точки зрения,
в системе титан—азот существуют два твердых раствора внедре-
ния: Ti — TiNo.22 и TiNo.4з —TIN, причем неширокий разрыв
между TiNo,22-и TiNo.43 обусловлен переходом титана в модифи-
кацию с гранецентрированной решеткой.
Приведем некоторые данные о физико-химических характери-
стиках фаз внедрения, хорошо согласующиеся с развитыми здесь
положениями.
Как показали С. М. Николаева и Я. С. Уманский [18], характе-
ристическая температура тепловых колебаний атомов в кристал-
лах карбида титана и характеристика сил связи в решетке /пб8,
уменьшаются при уменьшении содержания углерода. В то время
как у фазы стехиометрического состава TiC 6 = 1130° и /и02 =
= 40,7«10-18 г.град2, для фазы TiC043 0= 840°, т 62 ==
29,6 • 10-18г.град2 (рис. 17).
Уменьшением сил сцепления при снижении содержания угле-
рода объясняются причины открытой Ковальским с сотрудниками
46 Природа металлических' карбидов, нитридов, гидридов, боридов
зависимости микротвердости карбидов титана и циркония от их
состава.
А. Е. Ковальский и Т. Г. Макаренко [157] установили, что мик-
ротвердость карбида титана падает практически по линейному за-
кону с 2600 кг/мм2 для 46% (атомн.) С до 1600 кг!мм2 для
25% (атомн.) С (рис. 18, а). Микротвердость карбида циркония
[45] изменяется от 2460 кг) мм2 при 47 %
при 35% (атомн.) С (рис. 18, б).
Экстраполяция обеих прямых к
С = 0 дает для микротвердости
(атомн.) С до 1860 кг!мм2
О 10 20 35i050°//ama^
02,75,99713320^33^
Содержание у го sped а
Рис. 18. Твердость карбидов титана (а) и циркония (6)
(по Ковальскому)
числа 200—300 кг/мм2, т. е. величины, близкие к твердости со-
ответствующих твердых чистых металлов. И этот факт, как ука-
зывает Ковальский, хорошо согласуется с развитыми здесь пред-
ставлениями о фазах внедрения.
Прекрасно иллюстрирует эти представления и установленная
В. И. Смирновой и Б. Ф. Ормонтом [21] практически линейная за-
висимость теплоты образования карбидов тантала от содержания
углерода. Интересно, что здесь на одну прямую (с приведенной
выше оговоркой) ложатся точки, относящиеся к двум карбидам —
как с кубической гранецентрированной, так и с компактной гекса-
гональной решетками металлических атомов.
Гипотеза о влиянии внедряющихся атомов азота и углерода
объясняет то, что растворение этих элементов в железе расширяет
область у-фазы, имеющей гранецентрированную кубическую ре-
Причины высокой твердости фаз внедрения
4&
шетку. Если внедрение в решетку металлов, не имеющих гране-
центрированной кубической модификации (титан, цирконий, гаф-
ний, тантал, ниобий), приводит к образованию гранецентриро-
ванных нитридов и карбидов, то растворение азота и углерода в
железе расширяет область у-фазы.
Растворение водорода, азота и углерода в кобальте увеличи-
вает устойчивость при низких температурах высокотемпературной
^-модификации с гранецентрированной кубической решеткой [46].
Очевидно, во всех этих случаях внедрение атомов неметалла
делает гранецентрированную решетку более устойчивой, сообщая
ей относительно меньшую потенциальную и свободную энергию.
Причины высокой твердости фаз внедрения
Изучение причины исключительно высокой твердости некото-
рых фаз внедрения — одна из важнейших проблем физики туго-
плавких соединений.
Несомненно, необходимой предпосылкой этой особенности ту-
гоплавких карбидов и нитридов являются громадные силы сцепле-
ния в кристаллах этих фаз.
Как известно, весьма простые теоретические положения приво-
дят к выводу, что максимальное значение критического скалываю-
щего напряжения, определяющего сопротивление кристаллическо-
го тела пластической деформации (и, следовательно, твердость),
составляет примерно 0,1 модуля сдвига.
Значения критического скалывающего напряжения для метал-
лических монокристаллов, определенные из опыта, не превышают
1 % от теоретических (а чаще всего составляют лишь доли процен-
та). Сопротивление пластической деформации у поликристалли-
ческих металлов несколько выше, чем у монокристаллов, но и оно
несоизмеримо с теоретическими значениями.
Упрочнить металл можно путем образования однофазного твер-
дого раствора на его основе, путем холодной деформации и, нако-
нец, путем специальных видов термической обработки, приводящих
к созданию микроструктуры, характеризующейся обычно высокой
дисперсностью кристаллов и мозаичных блоков образующих сплав
фаз («дисперсионное твердение»)1. Дисперсионное твердение —
наиболее эффективный путь упрочнения сплавов.
Хотя и после дисперсионного твердения критическое окалываю-
щее напряжение остается намного ниже теоретического, однако
сопоставление твердости различных дисперсионно твердеющих
сплавов качественно подтверждает общее положение теории о свя- 1 * * 4
1 Мы не рассматриваем здесь твердение стали при закалке, поскольку,
несмотря на исключительную важность этого явления для техники, вопрос о его
природе еще не решен.
4 Г. В. Самсонов
50 Природа металлических карбидов, нитридов, гидридов, боридов
зи между сопротивлением металла пластической деформации и
его модулем сдвига. Это положение иллюстрируют данные
табл. 12 и рис. 19.
Таблица 12
Модули сдвига и температуры плавления некоторых металлов
и максимальная твердость стареющих сплавов на их основе
Металл Темпе- ратура плав- леная °C Модуль сдвига О Название Дисперсион- но твердеющего сплава в О В пл
Магний . . 932 1700 Электрон-металл 90 0,053 0,10
Алюминий . 933 2700 Дуралюмин 140 0,052 0,15
Медь . . . 1356 4500 Бериллиевая бронза 400 0,088 0,29
Никель . . 1732 7300 Сплав Ni-Be 600 0,082 0,34
Железо . . 1800 8500 Отпущенная быстро- режущая сталь 750 0,088 0,42
Как видно из таблицы, отношение твердости максимально
упрочненного сплава к модулю сдвига основного металла колеб-
0 то 20003000400050006000.700080009000
Модуль сдвига металла, кг[ш&
Рис. 19. Твердость упрочненных спла-
вов в зависимости от модулей сдвига
соответствующих металлов—растворите-
лей
тивлением упрочненного сплава и
лется в узких пределах
0,052—0,089, причем, если
разбить сплавы на две груп-
пы — с низкими и средними
температурами плавления,
разброс оказывается еще
меньшим: для легкоплавких
сплавов 0,052—0,053, для
сплавов с Тпл >1300° 0,082—
0,088. Не исключена воз-
можность, что это расхож-
дение не случайно: легко-
плавкие сплавы на магние-
вой и алюминиевой основе,
в отличие от трех остальных
сплавов, способны разупроч-
няться в процессе пластиче-
ской деформации при ком-
натной температуре. Связь
между предельным сопро-
модулем сдвига основного ме-
талла является несомненной.
Как уже указывалось, значения упругих модулей (как модуля
сдвига, так и превышающего его примерно втрое для кубических
кристаллов модуля Юнга) определяются силами межатомного
взаимодействия. Те же силы определяют и величину mt)2, а также
(хотя и менее четко) температуру плавления. Я. С. Уманский [2]
Причины высокой твердости фаз внедрения
S1
ранее обратил внимание на связь между твердостью упрочненного
сплава и температурой плавления основного металла. Как видно
из табл. 12, действительно, чем выше температура плавления, тем
выше и твердость сплава. Однако в связи с тем, что температура
плавления значительно более сложная функция от сил связи, чем
упругие модули, зависимость сопротивления пластической дефор-
мации от температуры плавления не столь проста и однозначна.
Все фазы внедрения (особенно тугоплавкие карбиды) характе-
ризуются чрезвычайно большими энергиями межатомного взаи-
модействия. В ряде случаев это обусловлено большими энергиями
взаимодействия, господствующими в основном металле переход-
ной группы (соединения металлов групп VA и особенно VIA);
у соединений металлов группы IVA не очень большая энергия свя-
зи в основном металле существенно возрастает за счет энергии
реакции (см. табл. 8). В соответствии с этим в тугоплавких карби-
дах и нитридах должны быть велики и силы связи и, следователь-
но, упругие модули, что и подтверждено результатами работы
(3. М. Николаевой и Я. С. Уманского (см. стр. 47) и табл. 6*.
Модули упругости тугоплавких карбидов близки к
30 С00 кг/мм1 2, значительно превосходя модули упругости железа
и закаленной стали;'* характеристика сил связи /п6а у карбида
Читана стехиометрического состава превышает значение характе-
ристики сил связи всех исследованных веществ, кроме алмаза.
Таким образом, как было неоднократно отмечено [2, 47], по-
тенциальные возможности фаз внедрения в отношении сопротив-
ления пластической деформации чрезвычайно велики. Но твер-
дость чистых металлов, даже тех, которые имеют наибольшие
упругие модули, при комнатной температуре ниже твердости ста-
ли в состоянии наибольшего упрочнения.
В стали и других упрочняемых сплавах высокая твердость
достигается в результате термической обработки, приводящей к со-
зданию особой, чаще всего внутризеренной неоднородной струк-
туры, которая затрудняет развитие процессов скольжения. Уман-
ский [2] предполагает, что процессы скольжения вдоль плоскостей
сдвига в фазах внедрения затруднены вследствие неоднородно-
стей атомарного масштаба. То, что между смежными атомными
плоскостями, построенными из крупных атомов металла, разме-
щены меньшие внедренные атомы неметаллического элемента,
должно затруднять развитие плоскостей сдвига в фазах внедрения
и способствовать приближению реального значения сопротивления
пластической деформации к теоретическому. Фазы внедрения на-
ходятся в предельно упрочненном состоянии, как и сплавы, испы-
тавшие дисперсионное твердение при оптимальном режиме.
1 Причиной хрупкости упорядоченных фаз внедрения > может явиться
анизотропия связей металл-неметалл в решетке, претерпевшей 'искажение
внедрения [619].
ГЛАВА 11
ГИДРИДЫ
Физико-химическая природа гидридов, их структуры
Рис.
О 200 400 600 800 1000 1200 1400 1600
Температура, °C
20. Изобары растворимости водо-
рода в металлах
Гидриды — соединения элементов с водородом, принято под-
разделять на пять групп [48]: 1) солеобразные, 2) переходные,
3) металлообразные, 4) полимерные и 5) летучие.
Дьяконов и Самарин [49]
подразделяют системы ме-
талл — двухатомный газ на
три группы, отличающиеся
характером поведения газа
в металле:
1) системы, образующие
раствор газа в металле;
2) системы, образующие
соединения газа и металла;
3) системы, способные к
образованию химических со-
единений или растворов в за-
висимости от -температуры и
давления.
Как следует из изобар
растворимости водорода в
переходных металлах, приве-
денных на рис. 20, содержа-
ние водорода в титане, цир-
конии, тории, ванадии, нио-
бии и тантале с повышением
температуры понижается
(переходные гидриды), а в
хроме, никеле, железе, ко-
бальте увеличивается (ме-
таллообразные гидриды),
т. е. процесс растворения в последнем случае эндотермический.
Изотермы абсорбции водорода металлами, образующими ме-
таллообразные гидриды, соответствуют закону Сивертоа о про-
порциональности количества растворенного водорода корню квад-
ратному из давления водорода:
Физико-химическая природа гидридов, их структуры
53
т. е. в пределах каждой аллотропной модификации водород рас-
творяется в металле без образования химических соединений
(рис. 21). Изотермы же абсорбции водорода металлами, образую-
щими переходные гидриды,, прямолинейны лишь при низких дав-
Рис. 21. Изотермы растворимости водорода
в железе, никеле и кобальте
лениях, а затем при определенном значении давления, зависящем
от температуры, абсорбция параболически увеличивается до на-
сыщения (рис. 22).
Рис. 23. Общий вид изотермы аб-
сорбции газа металлами:
I —область раствора водорода в метал-
ле; II— область раствора гидрида в ме-
талле; III— область полного насыщения
металлической фазы гидридом
Рис. 22. Изотермы растворимости
водорода вТцирконии, тории и пал-
ладии
Изотермы абсорбции водорода металлом изображены на
рис. 23. Растворение водорода проходит, как видно на рис. 23,
в три стадии. При низких давлениях водород растворяется в ме-
талле с образованием твердого раствора; в следующей области
давлений некоторые металлы способны образовать соединение с
54
Гидриды
водородом; наконец, при дальнейшем увеличении давления на-
ступает полное его насыщение, связанное с образованием гидри-
да определенного предельного стехиометрического состава.
Взаимодействие водорода с переходными металлами III, IV и
V групп периодической системы и образование гидридов подчиня-
ются этой общей закономерности, т. е. р соответствующих систе-
мах Me— Н имеются области а-твердых растворов водорода в ме-
таллах, области смесей a-твердых растворов с гидридами и чистые
гидридные фазы, нередко представляющие соединения перемен-
ного состава, гомогенные в довольно широких пределах концент-
раций водорода.
Атомы водорода малы и удовлетворяют правилу Хэгга
(табл. 13); они внедряются в решетки переходных металлов этих
Таблица 13
Отношение радиуса атома водорода к радиусам
атомов переходных металлов
Металл Металл ' Rm? Металл Я H : #Me Металл) &Me 1 i
Sc 0,19 V 0,17 La—Lu 0,16—0,17 Ac —
11 0,20 Zr 0,19 Hf 0,19 Th 0,17
V 0,22 Nb 0,20 Ta 0,20 Pa —
Сг 0,24 Mo 0,22 W 0,22 U 0,20
Мп 0,24 Тс 0,22 Re 0,22
Fe 0,24 Ru 0,22 Os 0,22
Со 0,24 Rh 0,22 Ir 0,22
N1 0,24 Pd 0,22 Pt 0,22
групп с образованием фаз внедрения, причем вследствие малого
радиуса атомов водорода последние размещаются в порах кри-
сталлических решеток без их деформации. Поэтому гидриды в из-
вестном смысле подобны металлам, в частности, они тверды, ту-
гоплавки и отличаются некоторой пластичностью. Следствием
высокой проницаемости решеток металлов по отношению к ато-
мам водорода является неопределенность химического состава
гидридов, или во всяком случае их гомогенность в значительных
концентрационных пределах?*Водород в таких гидридах находится
в металлическом состоянии, т. е. отдает свой s-электрон в d-полосу
переходного металла с образованием sd-полосы гидрида.
Переход водорода в металлическое состояние (см. гл. I) до-
казывается миграцией водорода гидрида палладия под действием
электрического тока к катоду [30], а также термодинамическими
расчетами Уббелоде [27]. Переход водорода в металлическое со-
стояние происходит и в гидридах переходных металлов III—V
групп, но электронный дефект d-полос этих металлов меньше,
Гидриды титана
55-
а электронный коллектив смещен к ядру, поэтому поляризация
атома водорода уменьшается и соответствующие гидриды стано-
вятся менее прочными, что вызывает расширение областей «.-твер-
дых растворов водорода в этих металлах. У металлов VI, VII и
VIII групп эти области еще более увеличиваются, что и вызывает
эндотермичность реакций образования гидридов, например метал-
лов группы железа. Если даже эти соединения и образуются, то
они неустойчивы и легко теряют водород с образованием более
устойчивого a-твердого раствора.
Гидриды титана
Поглощение водорода металлическим титаном наблюдали еще
в 1910 г. Вайсс и Кайзер [i2], а также Сивертс и Киршфельд [2].
Растворимость *л
Рис. 24. Изотермы раство-
римости водорода титаном
в зависимости от давления
Рис. 25. Изменение абсорбции водорода
титаном, ванадием и ниобием в зависи-
мости от температуры при постоянном
давлении (р = 760 мм рт. ст.)
На рис. 24 приведены изотермы, а на рис. 25 изобара абсорб-
ции водорода титаном.
Хэгг, исследовавший в 1933 г. систему Ti — Н методами рент-
генографического анализа [5], подтверждает, несколько уточняя,
данные Киршфельда и Сивертса. По Хэггу титан растворяет до
33% (атомн.) Н, причем периоды гексагональной решетки твердо-
го раствора изменяются в пределах от а = 2,953 кХ и с = 4,723 кХ
(чистый титан) до а = 3,11 кХ и с = 5,02 кХ (насыщенный a-твер-
дый раствор). P-фаза с гранецентрированной кубической решеткой
металлических атомов и периодом, изменяющимся по мере увели-
чения содержания водорода от 4,397 до 4,460 кХ, гомогенна при
комнатной температуре в пределах 47,4—62,4% (атомн.) Н
(рис. 26). Хэгг приписывает этой фазе формулу TiH—TiH2.
Современная диаграмма состояний Ti — Н’(51, 52] приведена
на рис. 27. Для ее построения был использован метод измерения
5b
Гидриды
равновесных давлений в системе, состоящей из известного объема
водородй и иодидного титана. При комнатной температуре рас-
творимость водорода в титане составляет менее 0,14% (атомн.),
т. е. при низких температурах граница насыщения a-фазы чрезвы-
чайно резко изгибается к меньшим содержаниям Н. у-фаза близка
к TiH, а приготовить соединение TiH2 стехиометрического состава
при нормальных давлениях не
удается; эта фаза ниже 400° не-
устойчива.
Водород не оказывает замет-
ного влияния на периоды решет-
ки a-титана. у-фаза имеет куби-
ческую гранецентрированную ре-
шетку с периодом, изменяющим-
Ti о 10 20 30 40 00 60 70
Содержание водорова., °/а (атомн.)
Рис. 26. Фазовая диаграмма си-
стемы Ti—Н (по Хэггу)
(атомн.)
Рис. 27. Диаграмма состояния
системы Ti—J4
ся приблизительно в тех же пределах, которые были установле-
ны Хэггом.
Гибб и Крушвиц [53], исследовавшие систему Ti — Н в области
существования а- и P-фаз, сообщают следующие данные по изме-
нению периодов решеток фаз при насыщении титана водородом
(табл. 14).
Фазовый состав системы Ti—Н
Таблица 14
Атомный состав Фаза Периоды решетки, кХ
а С
Ti a-Ti 2,95 4,69
11Н0,66 a-Ti-f-a-ГИДриД 3,11 5,02
^1Н0,86 a-Ti+(5- гидрид 2,95(a) 4,68(a)
Т1Н0,95 ^-гидрид 4,395© 4,397
Т1Н1>25 То же 4,460
™1г8з » » 4,40
т*н» 3-гидрид-гТ1Н2 4,45
Гидриды титана
57
По этим данным ^-фазе можно приписать формальный состав
~TiH].5o, а области существования фаз приблизительно соответ-
ствуют таковым по диаграмме состояний (рис. 27) .*
Для приготовления гидрида титана обычно пользуются непо-
средственным насыщением титана водородом или восстановле-
нием двуокиси титана гидридом кальция.
В первом случае TiH2 готовится нагреванием порошка титана
в токе водорода при 900° [54]. Гидрид имеет состав 96,5% Ti
и 3,5% Н. Для гидрирования обычно используется губчатый
титан, приготовляющийся восстановлением двуокиси титана маг-
нием [55].
Г. А. Меерсон, Г. А. Кап. и А. В. Хохлова [56] исследовали
условия получения гидрида титана реакцией между гидридом
кальция (с 80—85% СаН2) и двуокисью титана.
Попытки провести восстановление TiO2 + СаН2 ->
-> TiHx +СаО + Н2 в вакууме 3—7 мм рт. ст. при 900—1000°
с шихтой, содержавшей 70% избытка СаН2, не дали удовлетвори-
тельных результатов; получались продукты, состоящие из TiO2 и
низших окислов титана.
При осуществлении той же реакции с 50% -ным избытком СаН2
в атмосфере водорода при давлении 1 ат при 950—1100° образу-
ется продукт, содержащий ~ 99%' суммы Ti+H, состоящий из
тонких частиц с крупностью зерен 1р,так как прослойки СаО пре-
пятствуют укрупнению зерен гидрида титана. Для получения бо-
лее крупнозернистого гидрида целесообразно восстанавливать
TiO2 гидридом кальция не в их смеси, а цри послойном располо-
жении (со слоями толщиной 1—2 мм). При этом гидрид титана
получается не только с большими размерами частиц, но и более
чистый; сумма Ti+H составляет~ 100%.
Содержание водорода в таком сплаве составляет ~ 3% (вес.)
или 56—58% (атомн.), что соответствует смеси TiH + TiH2 или,
точнее, ?- и у-фаз.
Г. А. Меерсон и О. П. Колчин [57] рассмотрели теоретические
основы восстановления химически прочных окислов гидридом
кальция. Установлено, что убыль свободной энергии для реакций
восстановления окислов атомарным водородом меньше, чем для
реакций восстановления тех же окислов кальцием (табл. 15).
Одновременно учитывая, что длина свободного пробега атомов
водорода при атмосферном давлении и 1000° ничтожна, Меерсон
и Колчин указали на ошибочность представления [58] о том, что
высокая восстановительная способность гидрида кальция вызыва-
ется действием атомарного водорода, образующегося при его дис-
социации.
Это было подтверждено оригинальными опытами, в которых
восстановителем вместо гидрида кальция являлся кальций, реа-
5»
Гидриды
Таблица 15
Значение изменения свободной энергии при 1000° С
для указанных в таблице реакций "57]
Реакция I AF[273 каЛ МОЛЬ
ZrO2+2CaH2=ZrH0>e35+ 2СаО+1,6825 Н2 . . . .
ТЮ2Ч-2СаН2 =TiH0’27 +2СаО+ 1,865Н2........
СаН2=Са(ж)Ч-2Н............................
ZrO2+4H=Zr+2H2O ..........................
TiO24-4H=Ti+2H2O .........................
Н2О+Са(ж)=СаО+Н2..........................
Zr-f-O,3175H2=ZrH0 635 ...................
Ti+O,135H2=TiHo2'7........................
ггОа+2Са(ж)=гг+2СаО.......................
ТЮ2+2Са(ж)=Т1+2СаО . . . .................
Zr+O,635H=ZrHo 635 .......................
Ti4-O,27H=TiHo 27 .......................
2Н=Н2 ............................
— 66132
— 118341
4- 70341
— 18458
— 72158
— 78241
— 31874
— 30383
— 33378
— 87078
— 54347
— 39938
— 70781
тирующий (по данным авторов) с окислами выше 1000° как в жид-
ком, так и в парообразном состоянии.
Гидрид титана TiH2 имеет следующие термодинамические ха-
рактеристики [59].
Теплота диссоциации, кал/моль Н2 . . . TiH2
при 25° С ... ...................5168
при 0°К • . . •................ 4870
Свободная энергия диссоциации при 25°С
и 1 ат, ккал/моль................709
TiH„7-—Т1Н
19150
18850
1>9S
Энтропия диссоциации при 25°, град/см' 14,9
10030
32,3
Константы диссоциации гидрида состава TiH2 (Л\) и
TiH 1,75—1,93 (Кг) выражаются соответственно уравнениями:
(4870—2,3 lg Т— 8,27 7)
lgKj=
—4,58 7’ ’
(18850—2,3 lg Т—23,9 Г)
•
Гидриды титана в порошкообразном состоянии напоминают по-
рошок титана. Они не гигроскопичны и хорошо сопротивляются
действию разбавленной соляной кислоты. При комнатной темпе-
ратуре кислород воздуха на них не действует, а при высоких тем-
пературах постепенно разлагает на титан и водород. В вакууме
разложение начинается при 100°, но и при 350° идет очень медлен-
но и лишь выше 400° идет быстрее. Более полное разложение про-
исходит при температурах выше 1000°, но даже расплавленный
Гидриды циркония
55
титан содержит небольшие количества водорода, хотя по некото-
рым данным [60] освобождение титана от водорода возможно при
гораздо более низких температурах.
Гидрид титана состава TiH 1,75 имеет удельный вес 3,91, тепло-
та его образования 35 ккал!моль. Гидрид TiHj имеет кубическую
Рис. 28. Зависимость
удельного веса гидрида
титана от атомного со-
держания водорода
гранецентрированную решетку с периодом 4,42—4,45 кХ [55]; его
плотность равна 3,96 г]см3', зависимость плотности гидрида ти-
тана от содержания водорода приведена на рис. 28 [53]. Магнит-
ная восприимчивость TiH 1,98 составляет 4,58 • 10-6 [598].
Гидриды циркония
Поглощение водорода цирконием изучалось в 1890 г. Винкле-
ром [27], а позднее — Вайсом и Нейманом [2].
Тивертс и Рель [63] в 1926 г. детально исследовали абсорбцию
водорода металлическим цирконием. Они установили, что количе-
ство абсорбированного водорода возрастает с увеличением давле-
ния и падает с повышением температуры.
При комнатной температуре цирконий растворяет без измене-
ния гексагональной решетки около 33% (атомн.) Н. При низ-
ких температурах (ниже 200°) скорость поглощения водорода
цирконием мала, она повышается с ростом температуры. Порошок
циркония при 300° растворяет водорода около 240 см3/г. Упру-
гость пара твердого раствора водорода в цирконии при темпера-
турах до 400° не превышает 10~6 мм рт. ст. С повышением темпе-
ратуры при низких внешних давлениях содержание водорода
в цирконии снижается (рис. 29).
Практически полное удаление водорода из порошкообразного
гидрида циркония в вакууме происходит при 800—1000°, а из
компактного циркония — при 1400°. При атмосферном давлении
водород не удаляется полностью из циркония вплоть до 1500° и
выше (рис. 30).
Кинетика поглощения цирконием водорода исследовалась при
температурах до 450° [64] (рис. 31 и 32). Энергия активации при
реактивной диффузии водорода в цирконий составляет в интерва-
ле 250—425° около 17 200 кал/моль, причем граница между слоем
Рис. 29. Изотермы абсорбции водорода компактным
цирконием — максимально абсорбируемое 1 г цирко-
ния количество водорода (в слР) в зависимости от
внешнего давления водорода рНг для различных
температур Т
Отношение атомоб н:ме
Рис. 30. Атомное содер-
жание водорода в метал-
лах в зависимости от тем-
пературы
Гидриды циркония
61
гидрида и цирконием образована выступами, свидетельствующи-
ми о преимущественной диффузии водорода по границам, а не по
объему зерен. Наличие пленок окислов на порошке циркония рез-
ко снижает скорость образования гидридов [65].
Растворимость водорода в ₽-Zr гораздо выше, чем в a -Zr. Этим
объясняется резкое повышение скорости поглощения выше 800°.
Рис. 31. Увеличение веса циркония при насыщении
водородом в зависимости от температуры и времени
При атмосферном давлении и температуре выше 1000° раствори-
мость водорода в Р-цирконии настолько велика, что может быть
сравнена с его поглощением палладием [66]. Растворимость водо-
рода в цирконии уменьшается эквиобъемно при растворении
в нем кислорода.
Хэгг [5] исследовал систему Zr — Н рентгенографически. Он
обнаружил в этой системе 5 фаз (рис. 33). a-твердый раствор во-
дорода в цирконии имеет гексагональную решетку металлических
атомов, а == 3,229 — 3,247 кХ, с = 5,141 — 5,173 кХ, с/а = 1,593.
Большие значения периодов отвечают раствору, содержащему
5% (атомн.) Н. Является ли эта растворимость максимальной,
62
Гидриды
Хэгг не установил.?-фаза с 33%| (атомн.) Н (Zr2H) имеет решетку
того же типа, но с периодом а — 3,335—3,339 кХ и с = 5,453—
5,455 кХ.
Рис. 32. Температурная зависимость поглощения
водорода цирконием (от 250 до 450°, Е= 17 200 ±200
кал/моль)
О 10 20 30 40 50 6S 70
Zi Содержание Oo8opoSa3 %(а/помн.)
Рис. 33. Фазовая диаграмма системы
Zr—Н (по Хэггу)
На рентгенограмме препарата с 9% (атомн.) Н, изготовленно-
го при 1050°, Хэгг обнаружил, кроме линий т-фазы, также слабые
линии P-фазы с гранецентриро-
ванной кубической решеткой
металлических атомов (а=
=4,664 кХ). Хэгг предполагает,
что ₽-фаза устойчива лишь при
высоких температурах и по хи-
мическому составу отвечает
формуле Zr4H 20% (атомн.)
Н. 8-фаза содержит около 50%
(атомн.) Н (ZrH) и имеет гра-
нецентрированную кубическую решетку металлических атомов с
периодом «=4,765—4,768 кХ.
Наконец, s-фаза с 65,5% (атомн.) Н (ZrH2) имеет гранецент-
рированную тетрагональную решетку с периодами а = 4,644 кХ и
Гидриды цирКониЯ
63
£
с = 4,440 кХ (— = 0,894). По другим данным [68], г-фаза имеет
а
периоды а = 4,87 кХ и с = 4,58 кХ.
Строение ZrH2, данное Хэггом, а также установленная им рас-
творимость водорода в твердом цирконии подтверждены и в более
поздних исследованиях [70].
Результаты работы Хэгга не согласуются с работами по иссле-
дованию упругости диссоциации гидрида циркония. Как следует
из рис. 30, в системе Zr — Н отмечаются не пять, а только две фа-
зы, как и в системе Ti — Н.
В последнее время подробное исследование системы было про-
ведено Гульбранзеном и Эндрью [69] в пределах содержаний во-
дорода, соответствующих условным формулам от ZrHo,o25 до
ZtHi,965- Для изучения системы измеряли упругости диссоциации
гидридов и проводили рентгеновский анализ соответствующих ис-
ходных и конечных фаз. При этом были подтверждены фазы В и е,
ранее установленные Хэггом, фазы же₽ и у обнаружены не были,
е-фаза имеет тетрагональную гранецентрированную решетку с пе-
риодами: а = 4,97 ± 0,01 кХ, с = 4,48 ± 0,01 кХ и область гомоген-
ности от ZrHi,64 до ZrHi,965- 8-фаза с кубической гранецентриро-
ванной решеткой и областью гомогенности от ZrH 1,44 до ZrH 1,56
имеет период (при максимальном содержании водорода)
а = 4,78 ± 0,01 кХ.
Одновременно была установлена у-фаза, по составу прибли-
зительно соответствующая 7-фазе Хэгга. Периоды решетки этой
фазы, имеющей тетрагональную гранецентрированную решетку,
при максимальном содержании водорода равны а = 4,61 ±0,01 кХ
и с = 4,97 ± 0,01 кХ. Данные Хэгга и Гульбранзена и Эндрью пред-
ставлены на рис. 34. Убыль свободной энергии при образовании
8-фазы определяется уравнением [69]:
AF0=34930—2,25 Т In 7'4-43,88 Т.
Б. Ф. Ормонт[67] рассмотрел вопрос о том, сохраняются ли в ре-
шетке ZrH2 молекулы водорода (пары атомов Н — Н), как это
предполагал Хэгг, и пришел к в'ыводу, что более вероятно образо-
вание связей Zr — Н за счет s-электронов с разрывом пар атомов
водорода, так как решетка циркония при внедрении водорода
значительно расширяется, что не может быть компенсировано
силами, возникающими между цирконием и молекулами водоро-
да. За счет образования s-связей Zr — Н Ормонт относит и тет-
р атональность решетки ZrH2.
Представления Ормонта об отсутствии существования пар Н2
в решетке дигидрида циркония подтверждаются нейтронографиче-
ским исследованием Рэндла, Шалла и Вулена [71], которые уста-
новили, что ZrH2 (г-фаза Хэгга) имеет деформированную струк-
туру плавикового шпата. Наличие структуры плавикового шпата
64
Гидриды
у ZrH2 с расстоянием между атомами Н, равными 2,224 кХ (под-
счеты Б. Ф. Ормонта по параметрам, данным Рэндлом), в то
время как расстояние Н — Н в молекуле Н2 равно 0,74 кХ, пока-
зывает отсутствие молекул) водорода (или «групп водорода») в ре-
шетке дигидрида циркония.
Приготовление гидридов циркония производится следующими
основными методами:
1) обработкой циркониевого порошка водородом;
2) восстановлением ZrO2 гидридом кальция;
3) восстановлением ZrO2 магнием в присутствии водорода.
При обработке циркония водородом гидрид образуется при
Рис. 34.Диаграммы объемов элементарных ячеек системы
Zr—Н по Хэггу (II) и Гульбранзену (I)
но представляет собой ZrH2, а при 800° — ZrH; продукт гидриро-
вания обычно представляет смесь этих двух гидридов. Оба гид-
рида имеют форму очень тонкого порошка (</< 0,037 мм).
Калиш [73] предложил схему получения гидрида циркония, по-
казанную на рис. 35. Водород, очищенный пропусканием через
палладиевый катализатор, алюминогель и гидрид кальция, пода-
ется в продолжение 20 часов в раствор, заполненный иодидным
цирконием или циркониевой губкой.
Образующиеся при нагревании иодидного циркония до 800°,
а губки до 300°, порошки гидрида циркония имеют следующие ха-
рактеристики:
Содержание, %:
Н............................
О.......................
N.......................
Насыпной вес, е/сл’...........
Иодидный
цирконий
2,1
0,05
0,005
2,2
Циркониевая
губка
2,14
0,12
0,006
1,96
Гидриды циркония
65
Плотность брикета, спрессованного
под давлением 7,8 т/смг, г/см* 4,9 4,45
Размер частиц, ..................10,3 6,8
Восстановление окиси циркония гидридом циркония проводит-
ся принципиально так же, как и в случае получения гидрида тита-
на [57], но с некоторыми изменениями режимов ввиду большей
прочности ZrO2 по сравнению с TiO2, а также большей устойчи-
вости гидрида циркония при высоких температурах.
Рис. 35. Установка для приготовления гидрида циркония
(по Калишу):
7— катализатор; 2 —установка'для осушки’газов; 3 — колонка сги-
дридом кальция; 4 —реактор для гидрирования; 5 — конденсатор;
6 — манометр; 7 и5 — фильтрующие и очистительные устройства;
9— вакуумный насос
Эспе [74] описывает метод восстановления ZrO2 магнием в при-
сутствии водорода до гидрида циркония ZrH4
Zr02+2Mg+2Ha=ZrH4+2MgO.
Схема установки приведена на рис. 36.
Гидриды циркония представляют собой металлоподобные по-
рошки, очень тонкозернистые. Они хорошо прессуются в брикеты
70—80 %-ной плотности, причем прессуемость гидридов циркония
лучше, чем порошка циркония. Так, по данным Хаузнера [75], они
прессуются в довольно прочные брикеты уже под давлением
— 4 т/см\ в то время как порошок циркония — только при
6—15 т/см3. Гидриды циркония при обработке в вакууме 10-5 —
Ю-4 мм рт. ст. полностью разлагаются при 800—1150° [76] в про-
5 Г. В. Самсонов
66
Гидриды
•--------------.----X
должение 2—3 час.; получающийся активный цирконий обладает
отличной спекаемостью — спекается на 700° ниже обычного цир-
кониевого порошка. Разложение гидрида ZrH2 при нагревании
идет последовательными ступенями: ZrH2 -> ZrH -> Zr [77]. Гид-
рид ZrH2 образуется с выделением тепла в количестве
40,5 ккал/моль, а гидрид ZrH i,92—39,8 ккал/моль.
Рис. 36. Установка для приготовления гидрида циркония (по Эспе):
1 — подвод водорода; 2 и 75 — резиновые пробки; 3 — бесшовная труба из нержавеющей
стали; 4 — конденсационная спираль из железной проволоки; 5— нагревательная спи-
раль; б —теплоизоляция; 7 н 77 — молибденовые крышки; 8 — «пробка» из магниевого
порошка; 9 —шихта; 70 —молибденовый патрон; 72 —железная лодочка; 13 — клубок
проволоки; 14 — отвод водорода; 76 —промывная склянка с водой; 77—вывод водорода
наружу
Все гидриды циркония легко воспламеняются при 200—500°,
причем температура воспламенения повышается с повышением со-
держания водорода [72].
Удельный вес гидрида циркония ZrHi,c2 5,67 г/см3.
Гидрид гафния
Приготовление и структура гидрида гафния описаны
Сидху [474].
Образцы готовились гидрированием металла в предваритель-
но эвакуированной кварцевой трубке при 1100° и имеЛи составы
HfH i,98 и HfH2,io- Для обоих образцов была обнаружена тетра-
гональная гранецентрированная решетка с положениями атомов:
Hf 000; 1/2 1/2 1/а и но 72 о 7г 74; 72 о 74; 7з о 3Д
и периодами:
а=3,461 +0,002 кХ
с=4,395±0,002£Х
с/а = 1,270
0=3,478+0,002^
с=4,361+0,002 кХ
с/а=1,254.
HfH 1,98
HfH2,I0
Гидрид ниобия
67
Объем элементарной ячейки HfH2 (HfHi,98 — HfH2jI0) колеб-
лется от 52,65 до 52,75 кХ3, плотность от 11,39 до 11,37 г! см3.
Предполагается, что нижней границей области гомогенности
HfH2 является HfH 1,87-
Гидр ид ванадия
Растворимость водорода в ванадии показана на рис. 25 [78].
При нагревании порошкообразного ванадия в атмосфере водо-
рода образование гидрида начинается при 1000° и заканчивается
при 1300° получением черного порошка, содержащего около 16%
(атомн.) водорода.
Гидрид ванадия с содержанием 1,2—2%! (вес.) [38,6 — 50%
(атомн.)] получают [56] восстановлением V2O3 гидридом кальция
в токе водорода при 1175°, в продолжение 45 мин. Такой гидрид
ванадия также имеет темносерый до черного цвет.
Гидрид ванадия имеет удельный вес 5,30 г!см3-, на него не дей-
ствуют ни вода, ни кипящая соляная кислота; окисляется азотной
кислотой.
Гидрид ниобия
Впервые NbH получен в 1907 г. [2].
Гаген и Сивертс [80] установили, что при атмосферном давле-
нии и комнатной температуре ниобий абсорбирует водород в коли-
честве, отвечающем соотношению H:Nb = 0,46% (атомн.). При
том же давлении и 1000° растворимость водорода в ниобии
в 50 раз ниже.
Изобара адсорбции водорода ниобием (94,8% Nb) приведена
на рис. 25 [81]. С повышением чистоты ниобия до 98,5% количества
адсорбированного водорода удваиваются [33]:
Темпера-
тура, °C
900
800
700
660
550
500
Растворимость
водорода, сл<3/г
4,0
6,1
9,7
18,5
29,7
47,4
Темпера- Растворимость
тура, “С водорода,см3/г
450 65,6
400 76,8
350 83,6
300 88,0
200 93,3
20 104
При температурах выше 450—500° растворимость водорода в
ниобии пропорциональна V Рн,-
Для растворимости в 98,5 %-ном ниобии дейтерия получены
близкие к этим цифры, но равновесие, особенно при температу-
рах ниже 500°, достигается медленнее.
По данным Гульбранзена и Эндрью [42], взаимодействие 'нио-
бия с водородом начинается при 250°, причем содержание водо-
5*
68
Гидриды
рода сначала быстро увеличивается (до 360°), а затем уменьша-
ется, невидимому в связи с разложением низкотемпературного
гидрида. В интервале температур с 560 до 900° ниобий снова по-
глощает водород (рис. 37). Последнее свидетельствует о сущест-
вовании двух гидридов ниобия с различными температурными
областями устойчивости.
По данным Я. С. Уманского [82], металлические атомы обра-
зуют в гидриде ниобия кристаллическую решетку, лишь немного
отличающуюся от кубической объемноцентрированной, с перио-
дом, равным 3,42 кХ. Можно предполагать, по аналогии с данными
Хэгга, о структуре гидрида тантала (см. рис. 70), что решетка эта
ромбически или тетрагонально искажена. Такое предположение
Рис. 37. Изменение веса ниобия при реакции с во-
дородом в зависимости от температуры и времени
(2,4 ел3 На)
хорошо объясняет сильную размытость всех линий, кроме (222)
на рентгенограмме гидрида ниобия. Этим же объясняется значи-
тельное расхождение величин периода его решетки, полученных
при промере линий с разными индексами.
Содержание водорода в гидриде ниобия было установлено
Уманским в 44% (атомн.), что приближенно соответствует фор-
муле NbH.
Для получения гидрида ниобия помимо обработки металла во-
дородом может использоваться восстановление водородом окси-
хлорида ниобия NbOQs, а также восстановление пятиокиси нио-
бия гидридом кальция [56]. В последнем случае, при восстанов-
лении в течение 45—60 мин. смеси Nb20s + СаН2 (с избытком
СаН2 в 50%^по сравнению с расчетным) при 950—1075° обра-
зуется достаточно чистый гидрид, содержащий 1—1,4% (вес) Н
[50—57% (атомн.)]. По данным патента [83] для восстановления
Nb2Os гидридом кальция до NbH достаточна Температура 675°
Гидрид ниобия
69
Удельный вес NbH составляет 6,0—6,6, удельная теплоемкость е
повышением температуры уменьшается:
Темпера- Удельная теп-
тура»°С лоемкость
кал:г. град
0—100 0,0980—0,0987
0—210,5 0,0927—0,0913
0—301,5 0,0870—0,0871
0—440 0,0823-0,0835
что связано с удалением водорода при увеличении температуры.
Гидрид NbH при 15° К переходит в сверхпроводящее состояние
[66]; по другим данным [84], в
сверхпроводящее состояние пе-
реходят также гидриды, содер-
жащие менее 50% (атомн.) Н.
В последней работе использо-
вались гидриды, полученные об-
работкой в водороде при 800°
99%-ного ниобия. Влияние со-
держания водорода на темпе-
ратуры перехода гидрида нио-
бия в сверхпроводящее состоя-
ние и периоды его решетки по-
казаны на рис. 38 и в табл. 16.
Образцы, содержащие 23,78
и 32,76% (атомн.) Н двухфаз-
ны: одна фаза — кубическая
Рис/ 38. ИнтервальГперехода в'сверх-
проводящее состояние в зависимости
от содержания водорода в ниобии:
I — Nb; И—Nb+ 5,06 Н; III — Nb + 9,89H;
ZV — Nb-f- 32,76% (атомн-)Н
гранецентрированная, как у образца с 9,89% (атомн.) Н, а дру-
гая— объемноцентрированная, периоды которой указаны в таб-
лице.
Таблица 16
Зависимость температур перехода в сверхпроводящее состояние
и периодов решетки гидрида ниобия от содержания водорода
Содержание водорода % (атомн ) Средняя темпе- ратура перехода в сверхпроводя- щее состояние °К Интервал темпе- ратур перехода в сверхпроводя- щее состояние °К Решетка Период решетки, кХ
0 8,98 0,90 г. Ц. К. 3,302+0,004
5,06 7,83 2,27 То же 3,311+0,004
9,89 7,38 3,25 » » 3,327 ±0,003
23,78 — — О. ц. к. 3,331 + 0,005
32,76 7,28 3,17 То же 3,323х0,003
На воздухе при обычной температуре гидрид ниобия устойчив,
а при нагревании окисляется до Nb2Os. Он нерастворим в соля-
70
Гидриды
ной, азотной, разбавленной серной кислотах и царской водке ни
на холоду, ни при кипячении, но, по некоторым данным, разла-
гается концентрированной серной кислотой.
Гидриды тантала
Поглощение водорода танталом было обнаружено в 1905 г. [2].
Сивертс и его сотрудники [87, 2] установили, что при давлении
1 ат и комнатной температуре тантал растворяет до 0,42%
(вес.) Н, что отвечает соотношению = 0,8. Растворимость эта
резко падает с увеличением температуры: при 1000° и давлении
1 ат соотношение — = 0,03. Уменьшается растворимость водорода
Та
в тантале и при уменьшении давления. По данным М. Эндрюса
[89] прокаливание насыщенного водородом тантала в вакууме при
1000° приводит к полному удалению газа.
Хэгг [5] исследовал рентгенографически систему тантал—во-
дород.
Он обнаружил, что тантал растворяет при 600° 12% (атомн.) Н
и, кроме того, образует два гидрида: Та2Н (р-фаза)с гексагональ-
ной компактной решеткой металлических атомов (а = 3,094 кХг
с = 4,923 кХ, —= 1,591) и ТаН (у-фаза) [46—47% (атомн.) Н]
а
со всесторонне гранецентрированной ромбической решет-
кой металлических атомов, имеющей периоды: а = 4,811 кХ,
Ь = 4,781 кХ и с = 3,434 кХ, а : Ь : с = 1,40 : 1,392 : 1. Эту решетку
можно рассматривать как слегка деформированную объемноцент-
рированную кубическую с периодами а' =—^=3,41 кХ, Ь' =
/2
= = 3,38 кХ и с' = с = 3,434 кХ (металлический тантал имеет
объемноцентрированную кубическую решетку с периодом
а = 3,29 кХ).
В 1934 г. Питш и Цель [90] подтвердили существование гидри-
да тантала, но приписали ему объемноцентрированную кубиче-
скую решетку с периодом 3,42 кХ. Повидимому, они не заметили
обнаруженного Хэггом ромбического искажения этой решетки.
С результатами Питша и Целя практически совпадают данные
М. А. Борисовой [91] и Горна [84], подтвержденные Сталинским
[446]. Горн получал гидрид тантала нагреванием порошка тантала
(30% >80 меш, 7,23% 80—100 меш, 30,32%' 100—200 меш,
58,94% <200 меш) чистотой 99,9%, со строго определенным ко-
личеством водорода при 800° (табл. 17).
Кинетика взаимодействия тантала с водородом изучалась
Гульбранзеном и Эндрью [42], которые установили, что реакция
Гидриды тантала
71
Таблица 17
Зависимость периода решетки гидрида тантала
и температур перехода в сверхпроводящее состояние от содержания водорода
Содержание водорода % (атомн ) Средняя темпе- ратура перехода в сверхпроводя- щее состояние °К Интервал температур пере- хода в сверхпро- водящее состояние» °К Решетка Период решетки, кХ
0 4,08 0,35 Г. Ц. к. 3,297+0,001
3,97 3,62 0,83 То же 3,314 + 0,002
7,54 3,26 1,31 » » 3,316+0,003
11,93 2,81 1,83 » » 3,331+0,004
25,33 1,9 — 3,365 x 0,004
34,37 •— — 3,399 ±0,005
образования гидрида начинается при 340° и скорость поглощения
водорода резко возрастает до 460? (рис. 39). Выше этой темпера-
туры начинается выделение водорода, повидимому, связанное с
Рис. 39. Изменение веса тантала при реакции
с водородом (200—643°)
разложением гидрида, устойчивого только при низких температу-
рах. Выше 539° вновь начинается поглощение водорода с образо-
ванием нового гидрида (до 643°). Гидриды тантала Та2Н и ТаН
обычно получают обработкой порошка тантала строго определен-
ным количеством водорода при 800—900°.
Гидрид тантала можно также получить восстановлением Ta2Os
гидридом кальция [56] при 1025—1100° при часовой выдержке. Со-
держание водорода достигает при этом 0^8 %', а сумма Та + Н
72
Гидриды
около 99,0%. Запатентован также аналогичный метод [83], реко-
мендующий более низкие температуры, около 675°.
Неоднократно были исследованы сверхпроводящие свойства
гидрида тантала [84] (см. рис. 40 и табл. 17). В. Р. Голик,
Б. Г. Лазарев и В. И. Хоткевич
[92] указывают, что если бы по-
Рис. 40. Интервалы перехода в
сверхпроводящее состояние в за-
висимости от содержания водоро-
да в тантале:
Г—Та; //—Та + 3.97Н; ///-Та-|-7-54Н;
IV— Та 4- 11.93Н;
К— Та + 25,33% (атомн ) Н
полного исчезновения
глощение водорода только меха-
нически расширяло решетку тан-
тала, то можно было бы ожидать
существенного повышения точки
перехода в сверхпроводящее со-
стояние, например при 12%
(атомн.) Н на 0,4° К (у тантала
изменение периода решетки при-
мерно на 0,02%, соответствующее
давлению 1,37 т!см2, понижает
точку перехода на 0,006°К) • Одна-
ко при насыщении тантала водо-
родом интервалы перехода в
сверхпроводящее состояние сдви-
гаются к слабым магнитным по-
лям и низким температурам, до
Водород изменяет
сверхпроводимости.
электронное распределение в металле, заполняя электронами
вакантные уровни тантала.
Гидриды хрома, молибдена и вольфрама
При обработке хрома водородом количество растворенного
водорода при температурах выше 800° быстро увеличива-
ется, как показано на
рис. 41 [93, 94]. Значитель-
ное поглощение водорода
происходит при электроли-
тическом получении хрома:
до 560 сл/3/100 г при 0° и
760 мм рт. ст. [95].
Хром с водородом обра-
зует, повидимому, два гидри-
да — СгН и СгН2. СгН име-
ет гексагональную решетку
типа вюрцита (ZnS), а
СгН2— кубическую типа фл
± 0,005 кХ [96].
Рис. 41. Изобара растворимости во-
дорода в хроме
зрита (CaF2) с периодом 3,8605 ±
Существование гидридов молибдена не установлено; водород
несколько растворяется в молибдене при высоких температурах,
но легко выделяется при охлаждении [66].
Гидриды железа, кобальта и никеля
73
Гидриды вольфрама, поводимому, также не обнаружены,
хотя в ряде работ сообщается о существовании гидрида WH2
[66, 67, 68].
Растворимость водорода в вольфраме до 1500° весьма незна-
чительна [88], поглощение водорода вольфрамом полностью обра-
тимо [99]. Теплота абсорбции при парциальном давлении водоро-
да 4- 10~‘‘мм рт. ст. составляет 2,8 • 104 кал! моль [100].
Гидрид марганца [66, 101]
Растворимость водорода в электролитическом марганце при
500° и атмосферном давлении составляет 11,4, а при 240°
21,6 слР/100 г металла. Температурный коэффициент раство-
римости водорода в марганце при температурах ниже 500° имеет
отрицательное значение.
Водород, растворенный в а-Мп увеличивает период решетки
металла в линейной зависимости от содержания водорода
[102, 103].
Максимальная растворимость водорода в Мп равна 50%
(атомн.), что вероятно соответствует образованию неустойчивого
гидрида марганца МпН.
Гидриды железа, кобальта и никеля
Растворимость водорода в железе в зависимости от давления
по данным Сивертса показана на рис. 21 и от температуры — на
рис. 42. Как следует из этих данных, растворимость Н2 в железе
пропорциональна И^одПо И. И. Корнилову [104] при комнатной
температуре железо растворяет 0,005% Н.
Абсорбция водорода кованым железом идет значительно мед-
леннее, чем отожженным, составляя при 18? и атмосферном дав-
лении соответственно 27 и 53 см3. Растворимость водорода в рас-
плавленном железе по М. М. Карнаухову и А. Н. Морозову [105]
при температуре Т и давлении р может быть выражена уравне-
нием:
lgu=0,5 Igp— ~у^+0,888 сл43/1ОО г,
т. е., как и для твердого железа, пропорциональна квадратному
корню из давления водорода.
Растворение водорода в железе повышает его твердость (на
7—15 единиц по Бринелю) и модуль упругости (с 20 665 до
22 600 кг!мм2 [106]). При отжиге поликристал1лического железа
большая часть водорода выделяется при 900?, а при отжиге моно-
кристалла — при 300°. Водород удаляется из железа и при ионной
бомбардировке на холоду, без изменения твердости; напряженное
74
Гидриды
состояние решетки, вызванное растворением водорода, при этом
сохраняется.
Железо образует, невидимому, один гидрид FeH с поглоще-
нием при этом около 7,2 ккал/моль гидрида.
Кобальт растворяет наименьшее количество водорода из всех
металлов железной группы (см. рис. 20). Способность кобальта
растворять водород существенно зависит от метода его получения.
Например, кобальт, восстановленный из бромистой соли, вообще
не поглощает водород, а вос-
становленный из окислов при
400° содержит примерно 100-
кратный объем водорода. При
нагревании до 200° в вакууме
водород полностью удаляется
из кобальта. Предполагается,
что кобальт с водородом образу-
ет нестойкий гидрид СоН2 [78].
Никель, наоборот, является
наиболее активным поглотите-
лем водорода, образуя с ним
твердый раствор. Количество
поглощенного никелем водоро-
да пропорционально корню
квадратному из давления [107];
Рис. 42. Изобара растворимости во- поглощение водорода при на-
дорода В железе гревании резко увеличивается,
что является причиной «водо-
родной болезни» никеля. Изменение растворимости водорода в
никеле с температурой характеризуется следующими цифра-
ми [78]:
Температура, °C 200 400 600 800 1000 1200 1400 1500 1600
Растворимость
водорода, см»/100 г 4,0 6,5 10,7 16,0 21,6 27,7 34,0 81,0 86,0
Растворимость дейтерия в никеле при прочих равных условиях
в два раза ниже, чем растворимость водорода.
Электролитический никель, полученный при комнатной темпе-
ратуре и атмосферном давлении, способен поглощать 4,3—
13,6 объема водорода на 1 объем металла. Содержание водорода
уменьшается по мере увеличения кислотности и повышения темпе-
ратуры электролита.
Для никеля предполагается существование гидридов NiH [78],
установленного спектральным анализом, а также NiH2 и NiH4
[108], которые получаются восстановлением хлористого никеля
растворами органических соединений магния в присутствии во-
дорода. Однако существование и составы этих гидридов одно
значно не установлены.
Использование гидридов в технике
75
Использование гидридов в технике
Рис. 43. Кривые постоянной плотности,
равной 6,6 г',см3 (теоретическая плот-
ность) для трех значений давления
пресования
В технике нашли практическое использование главным обра-
зом гидриды титана и циркония, которые применяются в качестве
геттеров, а также для пайки неметаллических материалов с ме-
таллами [109]. В некоторой степени используются также пирофор-
ные свойства некоторых гидридов. Кроме того, гидриды циркония
и титана часто применяются для приготовления из них компакт-
ных и ковких титана и циркония.
Гидрид циркония удобно использовать в качестве геттера
в электровакуумной технике вследствие его меньшей пирофор-
ности по сравнению с тонкими порошками циркония; возможность
окисления деталей радиоламп при впаивании снижается, а так как
гидрид циркония не абсорбирует газов до своего разложения при
800°, то создается возмож-
ность дополнительной откач-
ки газов насосом до начала
действия гидрида циркония
как геттера [74, 76, ПО]. Гид-
рид циркония наносят на со-
ответствующие детали ра-
диоламп или напылением с
помощью парафина и наф-
талина, или катафоретиче-
Ьким осаждением, используя
в качестве проводящей соли
нитрат алюминия.
Гидрид титана употреб-
ляется главным образом в
качестве припоя для соеди-
нений металлов с керамиче-
скими материалами [111,
112], карбидов, стекла с ме-
таллом [113, 114] и т. п. Получающийся при пайке шов гермети-
чен, что особенно важно в электровакуумной технике. Иногда
для пайки используют смеси гидридов или смеси гидридов с ме-
таллами?! Описаны, например, методы пайки ряда неметалличе-
ских огнеупорных материалов друг с другом или с металлами с
помощью смесей порошков Си и TiH2 или ZrH2 с последующим
нагреванием при_400° в вакууме [115] или чистом, сухом водоро-
де, получающемся при диссоциации гидрида.
Приготовление компактных и ковких титана и циркония неред-
ко осуществляется прессованием и последующим спеканием в ва-
кууме гидридов этих металлов.
Ковкий цирконий, например [116], получается прессованием 'ю-
рошка гидрида циркония под давлением 6—12 т/см2 с последую-
76
Гидриды
щим спеканием в вакууме при 1050—1260° (рис. 43); выше
(стр. 65) отмечались преимущества этого метода перед прессо-
ванием и спеканием порошка циркония, приготовленного восста-
новлением ZrO2.
Аналогичным образом, спекая спрессованный порошок гидри-
да титана при 850—1200° в вакууме, получают плотный и ковкий
титан [55].
Гидриды титана, циркония, гафния, тория, ванадия, ниобия и
тантала можно использовать также для получения очень чистых
соединений этих металлов с бором, углеродом, азотом или крем-
нием, а также их сплавов. Описано получение твердого раствора
WC в TiC прессованием смеси TiH2, W и С с последующим нагре-
ванием при 1450° в атмосфере водорода, выделяющегося при раз-
ложении гидрида в продолжение 3 час. при 1500° [117].
Довольно значительное применение нашли гидриды титана и
циркония в порошковой металлургии.
4 Гидрид титана может служить источником получения чистей-
шего водорода, а также удобен для получения водорода в полевых
условиях, например, для атомно-водородной сварки и т. п.
Комплексный гидрид Ti(AlH4)4, устойчивый до температуры
—85°, используют для приготовления тончайшего порошка ти-
тана [118].
ГЛАВА Ш
КАРБИДЫ
Карбиды переходных металлов являются типичными представи-
телями класса неорганических соединений, называемых металли-
ческими соединениями. При отношении атомных радиусов неме-
талла и металла гх: гме < 0,59 карбиды эти являются обычно фа-
зами внедрения. Эти фазы представляют собой решетки из метал-
лических атомов, в поры которых внедрены малые атомы неме-
таллов (Н, N, С).
Структуры карбидов
А. Фазы внедрения. Металлические атомы образуют в карби-
дах— фазах внедрения — плотную кубическую упаковку (К12)
или плотную гексагональную упаковку (Г 12). Атомы углерода
размещены во всех фазах внедрения в октаэдрических промежут-
ках решетки с координационным числом 6.
Б. Металлические карбиды, не являющиеся фазами внедрения.
В настоящее время принята следующая классификация структур-
ных типов таких карбидов [119]:
1) структурные типы с изолированными атомами углерода,
2) структурные типы с цепями из атомов углерода.
Структурные типы с изолированными атомами углерода.
К числу таких структурных типов относятся:
а) тип никельарсенида (WC, МоС) — гексагональная решетка
(рис. 44);
б) тип Fe3C[Mn3C, Fe3C, Со3С, Ni,C (?)] — ромбическая ре-
шетка (атомы Fe образуют трехгранные призмы, в центре кото-
рых расположены атомы углерода, рис. 45);
в) тип Сг23С6 (Сг23С6, Мп23С6) — кубическая решетка, по-
строенная из кубооктаэдров и усеченных тетраэдров из атомов хро-
ма; внутри кубооктаэдров находятся кубы из атомов хрома, в об-
разующихся при этом антипризмах помещены атомы углерода;
г) сложные карбиды типа Fe2W2C(Fe3W3C) и Fe6W6C.
Структурные типы с цепями из атомов углерода:
а) типа Сг3С2 — ромбическая ячейка, весьма схожая с ячей-
кой FeB;
б) тип Сг7С2 (Сг7С3 и Мп7С3) — гексагональная ячейка.
78
Карбиды
В табл. 18 приведены основные структурные типы карбидов пе-
реходных металлов IV, V, VI, VII и VIII групп периодической
системы .
Таблица 18
Структурные типы карбидов
Карбид Структурный тип Обозначение Симметрия Отношение Г х : ГМе
Фазы внедрения
TiC NaCl K12 • 6 Кубическая 0,53
ZrC To же K12 • 6 » 0,48
HfC » » K12 • 6 » 0,48
VC » » K12 • 6 » 0,57
NbC » » K12 6 » 0,53
ТаС » » K12 • 6 » 0,53
Mo2C Mo2C П2 • 6 Гексагональная 0,55
W2C To же Г12 • 6 » 0,55
V2C » » Г12 • 6 > 0,57
ТагС » » Г12 • 6 » 0,53
Fe3C* Г12 • 6 » 0,60
(e -карбид)
Фазы с изолированными атомами углерода
MoC ' WC NiAs To же Г6 • 8 Г6 • 8 Гексагональная » 0,55 0,55
Мп С Fe3C Г6 . 8 Ромбическая 0,60
Fe3C To же Г6 8 » 0,60
Со С » » Г6 • 8 » 0,61
Ni3C? » » Г6 • 8 » 0,62
Cr23C Кубическая 0,60
Cr23Ce To же » 0,60
Фазы с цепями из атомов углерода
Сг,С3
Мп,С3
Сг7С3
То же
Гексагональная
0,60
0,60
* Этот карбид метастабилен. образуется при низкотемпературном отпуске закален-
ной стали- При температурах 200 — 300° превращается в стабильный карбид ГегС (це-
ментит)-
Физико-химическая природа карбидов
79
Г. Гольдшмидт [120] обращает внимание на своеобразное за-
кономерное расположение структур карбидов основных переход-
ных металлов по группам и периодам системы элементов
Д. И. Менделеева. Закономерность эта, однако, весьма поверх-
ностна.
Рис. 44. Элементарная
ячейка монокарбида
вольфрама ШС
Рис. 45. Расположение атомов в кри-
сталлической решетке цементита
Fe3C (• —атомы С)
Физико-химическая природа карбидов
В табл. 18, кроме данных о структурах, приведены также отно-
шения гх: гМг,которые по Хэггу определяют геометрическую воз-
можность образования фаз внедрения; например, для октаэдриче-
ских пор гх: гЛ1е >0,59; нижняя граница стабильности этих фаз
определится, как rx: r^e>0,41. Для карбидов хрома, марганца,
железа и кобальта гх : Гме > 0,59; их стабильные структуры соот-
ветственно существенно отличаются от структур фаз внедрения.
Однако отношение гх- Гме— 0,59 является условной границей.
Монокарбиды вольфрама и молибдена, WC и МоС пригг:Гме
< 0,59 имеют структуру никельарсенида и не являются фазами
внедрения, метастабильные карбиды железа и никеля Fe3C
( е-карбид) и Ni3C — фазы внедрения.
Среди стабильных фаз типичные структуры внедрения имеют
только карбиды переходных металлов IVA и VA групп периодиче-
ской системы, а также фазы W?C и Мо2С.
Вопрос о природе физико-химических свойств карбидов и дру-
гих фаз, построенных по типу внедрения атомов неметаллов в ре-
шетки переходных металлов, подробно рассматривался Я. С. Уман-
ским [31, 121].
80
Карбиды
Химические свойства карбидов
Карбиды являются стойкими соединениями, особенно против
действия кислот на холоду и в отдельных случаях, при нагревании;
соответствующие сводные данные приведены в табл. 19.
Таблица 19
Химическая стойкость карбидов переходных металлов
по отношению к минеральным кислотам (14)
Карбид Кислота
HCl Н2=О4 HNO3 HFJ-HNO3 HCi+HaSOj
TiC H н р
ZrC H р р —
VC Н н р —
NbC Н р н р н
ТаС н н н —- —-
н н н р н
Mo2C н — р — р,
WC н н н н
W2C н н р р —
Примечание. Н — не растворяется, Р — растворяется.
При сплавлении с щелочами и обработке горячими растворами
щелочей карбиды легко разлагаются; водяным паром онц окисля-
ются йри красном калении. Стойкость карбидов против окисления
кислородом воздуха убывает в следующей последовательности:
TiC — ZrC — VC — ТаС — NbC — М02С — WC (по данным Сам-
сонова и Голубевой). Кэмпбелл [122] определяет стойкость карби-
дов против окисления следующими температурными пределами
(табл. 20).
Таблица 20
Стойкость карбидов против окисления иа воздухе
Карбид Температура начала активного окисления, °C
TiC 1100—1400
ZrC 1100-1400
ТаС 1100—1400
NbC 1100—1400
VC 800—1100
Мо2С 500—800
WC 500-800
Зависимость привеса образцов от времени окисления является
параболической, несмотря на хорошую проницаемость окисных
Методы получения карбидов
St
пленок; по данным Самсонова и Голубевой, это связано с образо-
ванием непосредственно на карбиде плотной пленки твердого рас-
твора низшего окисла металла в карбиде (TiC—TiO, VC—VO,
NbC— NbO, TaC — TaO, ZrC — ZrO). Подробный обзор данных
по окислению карбида титана и некоторых других карбидов при-
веден в монографии Еременко [123].
Хлор и другие галоиды действуют на карбиды при темпера-
турах 500—700°.
Все карбиды IV и V групп периодической системы, как уже
указывалось, являются термодинамическими устойчивыми соеди-
нениями [607].
Методы получения карбидов
Получение карбидов из смесей металлов с углем, основанное
на прямом соединении металла с углеродом Me -ЬС -> МеС, явля-
ется исторически первым методом приготовления карбидов, особо
разрабатывавшимся Муассаном в его классических исследова-
ниях.^ Этот способ может осуществляться сплавлением металлов
с углеродом или, как это сейчас чаше практикуется, спеканием
предварительно спрессованных смесей Me + С, а также горячим
прессованием. В последнем случае непосредственно получаются
плотные компактные образцы карбидов.
При использовании метода спекания процесс образования кар-
бида заключается в реактивной диффузии в твердой фазе, кото-
рая пока изучена недостаточно. Поэтому для гомогенизации об-
разцов при спекании делается большая выдержка при высоких
температурах.
Углеродное восстановление окислов является одним из наибо-
лее распространенных методов получения карбидов и основано на
реакции:
МеО+С —МеС+СО.
Шихта при этом должна содержать количество углерода, доста-
точное для восстановления окиси и образования карбида требуе-
мого состава.
Этот способ обычно осуществляется в печах сопротивления
с графитовой трубой при нормальном давлении или в вакууме.
В последнем случае удается довольно резко снизить температуру
реакции восстановления и увеличить скорость ее течения за счет
удаления окислов углерода, т. е. смещения реакции в сторону обра-
зования карбида. Кроме того, при получении карбидов в вакууме
достигается высокая их чистота, особенно от газов. Чтобы уско-
рить реакцию и добиться более полного восстановления и карби-
дообразования, в атмосферу печи нередко вводят галоидосодер-
жащие вещества, образующие галоидные соединения соответ-
ствующих металлов. Науглероживание происходит при этом че-
рез активную газовую фазу.
6 Г. В. Самсонов
82
Карбиды
Обычно же в атмосфере печи содержатся углеводороды в
смеси с водородом или окислы углерода, которые и обеспечива-
ют восстановление, а затем науглероживание металла:
МЮ + СОг: МефСО,;
Me + 2СО МеС+СО2;
G + СО2 2СО
или
МеО + Н25 Me + Н2О;
Ме+СпНт^МеС+Нг;
С + На^С„Нт.
В табл. 21 приведены оптимальные температуры приготовле-
ния карбидов методом восстановления окислов углеродом в атмо-
сфере СО, Н2 или в вакууме [4].
Таблица 21
Температуры образования карбидов из шихты МеО + С
Карбид Шихта Атмосфера печи Температура, °C
TiC T1O2 + 3C H2, CO, C„Hm 1700 — 2100
TiOa 4* 3C Вакуум 1500— 1600
ZrOs 4" 3C H2, CO, C„Hm 1800 — 2200
ZrC ZrO2 + 3C Вакуум 1700— 1900
HfC HfO, + 3C Нз, CO2, CnHm 1900 — 2300
VC V2Or, + 7C To же 1600— 1200
или
V2O, + 5C » »
NbC Nb2O„ + 7C » » 1300—1400
или
TaC Nb.O, + 5C
Ta2O5 4- 7C 1300—1400
Cr 0,4- C 1400—1800
Mo2C МоОз 4“ C » » 1100— 1300
wc wo, 4- C > > 1400—1600
Науглероживание металлов из газовой фазы производится уг-
леводородами, подаваемыми в печь или образующимися в газовой
фазе при взаимодействии водорода с углем, цапример:
W+CH4^WC42H2;
2W+CH4^W2C-]-2H2;
2WC-|-2H2^IV2C+CH4.
Методы получения карбидов
S3
Этот метод, исследование которого было начато Беккером [124],
в последнее время подробно разработан Кэмпбеллом [122]; ре-
зультаты его исследования сведены в табл. 22.
Таблица 22
Температуры науглероживания металлов из газовой фазы [122]
Карбид Реакция науглероживания Температура
МоС Мо+Н2+СН4— МоС4Н2+(СН)* 700
Мо,С Мо + Н2+СН4—»Мо2С+Н2+(СН) . • 800
WC W + 3N2+Н2-»-СтНп**—► WC+H2 + N2+(CH) . . . 1000—2200
a-W2C W + H2^CmH„—a-W2C+H2+(CH) 2100—2400
₽-W2C w+H3+cmH„—P-Wkc+H2-+(CH) 2440-2550
NbC Nb +H2 NbC * H2+ (CH) 1300
ТаС(Та2С) Та+Н2+СотН„—TaC(Ta2C) + H2+(CH) 1300—2900
Сг^Са Cr+H»+CH4-*Cr3C2 + H24 (CH) 600—800
Продукты разложения углеводородов.
Метан, бензол, ацетилен, смесь СО ±Нз и т. п*
Осаждение карбидов происходит либо в результате реакции
взаимодействия паров галоидных соединений с углеводородами и
водородом:
ЖеС1+СтН„4-Н2^7ИеС+НС1+Н2,
либо в результате разложения карбонилов металлов:
2Л1еСО^Л1е..С+СО2.
Реакция взаимодействия галоидных соединений с металлами
совершается на накаленной нити, состоящей из того металла,
карбид которого осаждается. Последний наращивается на нити,
образуя слой той или иной толщины.
На рис. 46 показана схема аппарата для осуществления нара-
щивания, подробно изучавшегося Моерсом [125], а затем Кэмп-
беллом [122] (см. табл. 23).
Таблица 23
Режим получения карбидов методом наращивания
из газовой фазы и разложением карбонилов
Карбид Реакция осаждения Температура °C Давление, am
TiC TiCl4+ H2+CmH„*-»TiC+HC1 + (CH)** 1300—1700 1
ZrC ZrCI4 + H,-t CmHn—ZrC+ HCI4 (CH) 1700—2400 1
HfC HfCU+H24COTH„— HfC4 HCI • (CH) 2100—2500 1
VC VCl4+H24CmHn—*VC4HC14(CH) . 1500—2000 1
Mo,C Mo(CO)e+H2—*MO2C+(C, H, O)** . . 300—800 0,1—Змм рт.ст.
W2C W(CO)e + H2— W2C+(C, H,O) . . . 300—800 10 мм рт ст.
* СНъ С-Н(, С-НЬ OH, С2Н2, СО4-Н2 и т. п.
** Продукты разложения углеводородов-
84
Карбиды
В той же таблице даны режимы получения карбидов разло-
жением карбонилов. Это разложение осуществляется при пони-
женном давлении, составляющем обычно несколько миллиметров
ртутного столба.
Выделение карбидов из карбидсодержащих сплавов основано
на плохой растворимости карбидов в кислотах по сравнению с ме-
таллами и обычными металлическими сплавами.
Этим путем можно выделять карбиды из науглероженных
ферросплавов и легированных тугоплавкими металлами специаль-
ных сталей; очевидно, что такой метод имеет исключительно на-
учное значение для исследований соответствующих (обычно двой-
ных, тройных и т. п.) карбидов, но совершенно не пригоден для
промышленного изготовления карбидов.
Рис. 46. Прибор для осаждения карбидов из газовой фазы (методом наращи-
вания):
f —термопара; 2 —галогенид металла; 3 — нагреватель; 4—термоизоляция; 5-проволока
Процессы образования карбидов в металлических расплавах и
процессы химического их выделения особенно подробно изуча-
лись Мак-Кенна [24], который приготовил карбид тантала рас-
творением тантала и угля в расплавленном и перегретом до
2000° алюминии, а также сложный карбид WC — TiC с различ-
ным содержанием WC.
Метод приготовления карбидов электролизом расплавленных
солей в основном был разработан Л. Андрие и Г. Вейсом [126, 127]
на карбидах вольфрама и молибдена. Для электролиза использу-
ются ванны, содержащие борат щелочного металла, соду, фторид
щелочного и окисел тугоплавкого металла; состав полученного
карбида определяется щелочностью расплава (Л4еОз:СОа). Элек-
тролиз проводится в графитовом тигле (анод) с графитовым ка-
тодом при 800°, напряжении на ванне около 3 в и силе тока около
20 а.
Составы ванн приведены в табл. 24.
Для превращения порошков карбидов в компактные и плот-
ные образцы их после предварительного прессования спекают или
спекание с прессованием производится одновременно — горячее
Карбид титана
85
Таблица 24
Составы ванн для получения карбидов вольфрама
и молибдена электролизом расплавленных сред
Карбид Состав ванны (в молях) Щелочность ванны (МгО3 : CO2)
w2c NaaO • ВаО3 4-0,5 Na2CO84-3LiF4-1Д} б^^з • • * V3, З-Чв
WC Na2O • B,O3 + 2Na,CO,+4,5LiF+i/6-i/8WOs . > 1/ia
Мо2С Na2<J • B2Os-bl4Na2CO3 4- j—i/g,5MoO3 Vs.b-v,
МоС . Na2O • B20,+3Na3COs+6LiF-f-»/7Mo08 V21—V28
прессование. Для улучшения условий спекания или горячего прес-
сования— образования жидкой фазы — к порошку карбида реко-
мендуется добавлять металлические порошки железа, кобальта
или никеля, которые затем удаляются через поры прессформы,
так что содержание их в спеченных образцах не превышает деся-
тых долей процента.
Метод горячего прессования карбидов без добавок разработан
для карбида титана Глазером [128]. Известны также методы горя-
чего прессования карбида циркония [129], карбида вольфрама
[130] и карбида тантала [131], последний — с добавками метал-
лов «протекторов».
Карбид титана
Карбид титана впервые был получен в 1897 г. Синнером [2], вы-
делившим его из титанистого чугуна, растворив железо в соляной
кислоте. Через восемь лет Муассан [2] изготовил этот карбид, рас-
плавляя в пламени вольтовой дуги шихту из двуокиси титана TiO2
с углем, рассчитанную на восстановление двуокиси и образование
TiC. Он приписал карбиду формулу TiC, что отвечает 20%' (вес.) С.
Реакция образования протекает, по Муассану, согласно формуле
TiO2 + ЗС = TiC + 2СО. Этот же метод изготовления карбида из
смеси ТЮ2 с сажей с теми или иными незначительными изменения-
ми (прокаливание смеси TiO2 с сажей при 1800—2000° вместо
плавления шихты, применение водородной атмосферы для предо-
хранения карбида от нитрации, получение TiC в вакууме и т. д.)
применялся и в большинстве последующих работ. Им же пользу-
ются и в настоящее время в производстве твердых сплавов.
Фридрих и Зиттиг [134], Беккер [1], Брантлей и Бекман [135],
Агте и Моэрс [136], изготовлявшие указанным способом карбид
титана, приписывают ему, так же как и Муассан, формулу TiC.
Беккер на основании металлографического исследования предпо-
лагает, что твердый карбид титана растворяет при высоких темпе-
ратурах углерод, выделяющийся при охлаждении сплава. Темпе-
ратура плавления TiC по Фридриху и Зиттигу [134] 3400—3500° К,
88
Карбиды
по Агте [136] — 3410 ± 90°К. Кроме TiC, никаких карбидов титана
экспериментально не обнаружено.
В 1933 г. Вестгрен [137] предположил, что в системе Ti — С су-
ществует карбид Ti2C с гексагональной компактной решеткой ме-
таллических атомов. Получить такой карбид впоследствии нико-
му из исследователей не удалось.
В 1934 г. Бургере и Базарт использовали для получения кар-
бида титана реакцию взаимодействия четыреххлористого титана
с раскаленной угольной нитью в атмосфере, содержащей водород
и окись углерода:
TiCl4 ф 2Н.г + С = TiC + 4НС1.
По данным Бургерса и Базарта карбид титана растворяет в се-
бе титан вплоть до состава, отвечающего условной формуле Tii.iC.
Никаких предположений о типе твердого раствора они не при-
водят.
В 1924 г. Ван-Аркель нашел, что карбид TiC имеет кристалли-
ческую решетку типа NaCl с периодом 4,29 кХ. В последующих
работах его данные о типе решетки были подтверждены; периоду
же решетки разные исследователи приписывали различные зна-
чения. Эти значения приведены в табл). 25.
Таблица 25
Период кристаллической решетки карбида титана
по данным разных исследователей
ГоД Авторы Период решетки кХ Содержание ^связ • * (вес*)
1924 Ван Аркель [138] 4,29 Неизвестно
1925 Беккер и Эберт [139] .... 4,60 »
1931 Брант лей [140] 4,310 t
1932 Шварц и Сумма [141] . . . Э 0,002 4,311 »
1934 Бургере и Базарт [142] . . . 4,30—4,32 18-20
1940 Давиль и Рикс [143] 4,31 48—50% (атомн.)
1940 Меерсон, Зверев, Осиновская [144] 4,317 19,32
1949 Эрлих [145] , 4,319 20,00
Данные Беккера настолько отличаются от всех остальных, что
их приходится признать ошибочными.
Первые советские работы по изучению карбида титана были
проведены на заводе твердых сплавов в 1933—1935 гг. По резуль-
татам химических анализов содержание связанного углерода в об-
разцах карбида титана колебалось в широких пределах от 12 до
19,5%, ни в одном случае не достигая значения, отвечающего фор-
муле TiC, т. е. 20%.
Карбид титана
87
Период кристаллической решетки также имеет различные зна-
чения для различных образцов карбида титана (от 4,29 до
4,32 кХ). Как правило (в соответствии с данными Бургерса), пе-
риод решетки увеличивается с ростом содержания связанного уг-
лерода. Очевидно, расхождение данных о периоде в работах Арке-
ля, Шварца и Суммы, Брантлея было вызвано тем, что авторы
исследовали карбиды с разным содержанием связанного углерода.
Меерсон [146], анализируя эти данные, а также результаты
собственных экспериментов, высказал предположение, что про-
дукт, полученный в результате взаимодействия двуокиси титана с
углеродом, не является чистым карбидом, а представляет твердый
раствор карбида и изоморфного с ним низшего окисла титана ТЮ,
так что химический состав этого вещества можно выразить форму-
лой Ti(С, О).
Так как период решетки окисла ТЮ равен 4,24 кХ*, то прини-
мая для чистого карбида титана TiC найденное Бургерсом значе-
ние периода решетки а — 4,32 кХ, следует, по Меерсону, ожидать,
что период решетки твердых растворов с преобладанием углерода
по сравнению с кислородом будет лежать в пределах 4,25—
4,32 кХ.
Детальное рентгенографическое исследование малоуглероди-
стых образцов карбида титана было проведено в 1938—1940 гг.
Я. С. Уманским и С. С. Хидекелем [147]. Исследованные ими об-
разцы, содержавшие от 19,9 до 5,3% связанного углерода, можно
разбить на четыре группы:
1) образцы, изготовленные из двуокиси титана в условиях,
принятых в производстве твердых сплавов, т. е. в печи сопротив-
ления с графитовой трубой в токе водорода при температуре
1900—2000° и выдержке до 20 мин.;
2) образцы, изготовленные из двуокиси титана в вакууме (дав-
ление 0,01 мм рт. ст.) при температурах до 1450°;
3) образцы, изготовленные из гидрида титана в вакууме при
тех же температурах;
4) образцы, изготовленные в вакууме из металлического ти-
тана.
Для всех образцов были Определены методом Престона перио-
ды кристаллической решетки. Вопрос о химическом составе три-
надцати образцов был разрешен путем анализа интенсивностей
линий на рентгенограммах, снятых по Дебаю (о методике см. ни-
же). Результаты рентгенографического анализа были проверены
для трех наиболее характерных образцов пикнометрическими из-
мерениями плотности.
Все образцы, кроме одного, с 5,3% связанного углерода, по
данным рентгенографического анализа, состояли из одной только
* По данным, опубликованным после появления работы Меерсона [146],
период решетки окисла ТЮ еще меньше, а именно 4,154 кХ.
8?
Карбиды
фазы — карбида титана с гранецентрированной кубической решет-
кой металлических атомов. На рентгенограмме образца с 5,3%
связанного углерода, кроме линий карбида титана, отмечались
также слабые линии металлического титана. Присутствия свобод-
ного углерода по рентгенограмме обнаружить не удавалось.
Для всех образцов были определены периоды кристалличе-
ской решетки. Как видно на рис. 47, периоды решетки в пределах
одной и той же серии об-
разцов снижались с
уменьшением содержания
связанного углерода.
При равном содержа-
нии углерода малоуглеро-
дистые образцы карбида,
изготовленные в вакууме,
имели меньший период ре-
шетки, чем образцы, изго-
товленные в производ-
ственных условиях. Это
расхождение можно было
объяснить лишь различи-
ем химического состава
образцов.
Строение малоуглеродистых образцов карбида титана может
соответствовать одной из трех моделей рис. 48 (дано расположе-
ГТ<’г—
л оес/гислород-
~ 9 mie образцы
. х Обраэцы,изгот>8.
ленные Лбам#/-
не из П8г
А Лроизбодс/пвен-
ные вбразцы.се-
рил I „
О Двухфазный
образец
¥
S,7
HL.,
28
х 431
ч
I 4.38
В
34,27
4,25
4,25
5 Ю 15 28 25 3D 35 48 45 58%(атомн.)
Содержание углерода
»
Рис. 47. Зависимость периода решетки кар-
бида титана от содержания углерода
о. б a
о ® О
о с п
Рис. 48. Расположение атомов в плоскости (100) кри-
сталлической решетки карбида титана:
а— идеальная решетка; б— твердый раствор титана (решетка
с пустыми местами); в —твердый раствор ТС — ТО; г—твер‘
дый раствор TiC — TiO с пустыми местами в решетке
ние атомов в грани кристалла [100]. Схема рис. 48,6 отвечает
твердому раствору титана в карбиде титана с образованием пус-
тых мест (твердый раствор типа вычитания), аналогичному мало-
углеродистым карбидам ниобия, схема (рис. 48, в) изображает
твердый раствор Ti (С, О), построенный по типу замещения по
Меерсону), наконец, на рис. 48, г изображена (комбинированная
Карбид титана
89
структура: часть атомов углерода замещена кислородными (азот-
ными), но, кроме того, в решетке имеются и пустые места. Очевид-
но, при одном и том же содержании углерода каждой из этих мо-
делей соответствует разный химический состав. Так, например,
в карбиде, содержащем 10% (вес.) С, кристаллы, построенные по
типу, представленному на рис. 48, б, содержат 90% Ti, кристал-
лы типа в (рис. 48) —менее 80% Ti и свыше 10% О, наконец,
кристаллы типа г имеют промежуточный состав между бив.
Для выяснения вопроса о строении и химическом составе ма-
лоуглеродистых карбидов титана Уманский и Хидекель провели
анализ интенсивностей линий на рентгенограммах четырнадцати
образцов, перечень которых приведен в табл. 26.
Исследование базировалось
на том, что при наличии пусг
тых мест в решетке карбида
титана значение одного из
факторов, определяющих ин-
тенсивность линий на рентгено-
граммах, фактора атомно-
структурного, должно отли-
чаться от значений того же
фактора для решетки, в кото-
рой все узлы заполнены.
Кристаллическая решетка
карбида титана (типа NaCl)
состоит из двух кубических гра-
нецентрированных решеток,
Рис. 49. Интерференция? рентгенов-
ских лучей, рассеянных атомами
кристаллической решетки л карбида
титана:
а — интерференционные линии с четными
индексами; б — интерференционные линии
с нечетными индексами
вставленных одна в другую и
смещенных вдоль пространственной диагонали элементарной
'ячейки на половину ее длины. Одна из этих решеток построена
из атомов титана, вторая — из атомов углерода (и кислорода и
азота, если эти элементы растворены в карбиде).
Результаты интерференции рентгеновских лучей, рассеянных
этими решетками, таковы. Для линий с четными индексами (на-
пример, 200 или 222) лучи, рассеянные обеими решетками, совпа-
дают по фазе и амплитуды их складываются (рис. 49, а), для ли-
ний с нечетными индексами (например, 111 и 311) лучи эти ока-
зываются в противоположных фазах и амплитуды их вычитаются
(рис. 49, б). Если обозначить рассеивающую способность титано-
вых атомов через Fti и углеродных — через Fc (величины эти
в первом приближении, как известно, пропорциональны порядко-
вым номерам соответствующих элементов в периодической систе-
ме), то структурный фактор интенсивности линии с четными ин-
дексами |Х|2Четн выразится для идеальной решетки (рис. 48, а) так:
£|2четН = (Fti+Fc линии же с нечетными индексами будут иметь
| структурный фактор |5|2нечетн = (FTi — Fc )2-
Таблица 26
Характеристики образцов карбида титана, структура которых изучалась Уманским и Хидекелем
путем измерений интенсивностей линий на рентгенограммах
Номер образ- ца Исходные материалы Способ изготовления Темпера- тура, °C Период кристалли- ческой решетки кХ Содержание угле- рода по данным химического анализа Суммарное содержание кислорода и азота по данным рентгеноана- лнза, % (вес j Рс PQ р
% (вес-) % (атомн-)
1 В графитово-труб- 1900 4,313 16,0 43,3 4,5 0,81 0,16 0,01
2 чатой печи 1900 4,316 17,0 45,0 3,65 0,86 0,14 0,00
3 в токе водорода 1600 4,316 18,1 46,9 2,9 0,89 0,10 0,01 0,00
4 Двуокись 1600 4,299 11,5 34,2 10,5 0,59 0,41
5 титана То же, без водорода 2600 4,318 19,0 48,5 0,9 0,95 0,03 0,02
6 1400 4,318 18,4 47,0 0,0 0,90 0,00 0,10
7 В вакуумной 1600 4,320 19,6 49,4 0,25 0,98 0,01 0,01
8 печн 1400 4,295 10,2 31,1 2,1 0,47 0,07 0,46
9 Гидрид титана 1600 4,293 9,9 30,2 6,2 . 0,46 0,2 0,32
10 1400 4,296 10,8 32,5 6,3 0,58 0,23 0,24
11 Металличе- 1400 4,271 9,5 29,2 2,75 0,43 0,09 0,48
12 ский титан 1400 4,268 9,0 28,3 1,8 0,41 0,06 0,53
13 1400 4,259 5,1 17,3 — — —
14 1400 4,303 14,4 40,4 — — — —
Карбид титана
91
Для карбида, содержащего кислород и имеющего пустые места
в решетке (рис. 48, а), нужно вместо величины Fc подставить в
предыдущую формулу сумму P^Fc-\-P^Fo, где Д©— рассеиваю-
щая способность кислородных атомов, величины же Рс и Ро соот-
ветственно равны:
Пг ПС1
р —______5___и Р —
с пс4-по+п ° пс + л04-л’
где пс — число узлов кристаллической решетки, занятых углерод-
ными атомами;
по—число узлов, занятых атомами кислорода;
п — число пустых мест в решетке.
При и = 0 (твердый раствор Ti (С, О) без пустых мест в ре-
шетке (рис. 48, в), Рс+^о = 1 и Fc + ро Д0'>^с,так как
F >Е .
При по= 0 и Рс < 1 (твердый раствор титана в его карбиде
TiC, построенный по типу замещения, т. е. с образованием пустых
мест, как показано на рис. 48, б) имеет, очевидно, значение струк-
турного фактора Рс‘ EC<F с.
Таким образом, при замещении углеродных атомов в решетке
карбида титана кислородными (и азотными, рассеивающая спо-
собность которых близка к рассеивающей способности атомов кис-
лорода) интенсивность линий с четными индексами на дебаеграм-
ме возрастает, интенсивность линий с нечетными индексами умень-
iSI2
I 1 четн
шается и соответственно увеличивается отношение |—------ .
нечетн
Для сложной структуры, изображенной на рис. 48, г (карбид
титана, растворивший окись TiO и титан с образованием пустых
|S|2
мест) отношение -—— может принимать различные значе-
'^1 нечетн
ния в зависимости от соотношения между количествами углерод-
ных атомов ис, кислородных атомов пои пустых мест.
2
— можно опреде-
нечетн
Is!
Отношение структурных факторов —
151
лить, измерив интенсивности линий рентгенограммы и исключив
все прочие факторы, влияющие на интенсивность. Зная, далее, со-
держание углерода в карбиде (по данным химического анализа)
/<$|2четн
и учитывая, что Рс +PQ + Р = 1, можно из соотношения —-------
1^1 нечетн
определить Рс, PQ и Р, т. е. относительные значения количеств уг-
леродных и кислородных атомов и пустых мест в решетке карбида.
По этому пути и шли Уманский и Хидекель.
92
Карбиды
Результаты их анализа приведены в последних столбцах
табл. 26 (величины Рс, Ро и Р, а также процентное содержание
кислорода). Частичное присутствие азота уловить было затруд-
нительно — величина Ро характеризовала по существу суммар-
ное содержание кислорода й азота.
Результаты рентгенографического анализа были проконтроли-
рованы для трех наиболее характерных образцов — № 4, 7 и 8
пикнометрическими измерениями плотности. Как видно из
табл. 27, данные рентгеноанализа хорошо согласуются с пикно-
метрическими измерениями.
Таблица 27
Плотность образцов карбида титана
№ об- разца Химический состав % Пери- од ре- шетки кХ Плотность, г/см3
изме- ренная вычисленная
по данным химического анализа по дан- ным рент- гено- аналн- за О для состава, найденного рентгеногра- фически в предположе- нии, что кис- лород отсутст- вует (О—О) в предполо- жении, что отсутствуют пустые места Р=О, так что С~О«25 %(атомн.)
Ссвяз Ссвоб
4 11,5 1,1 10,5 4,299 4,7 4,95 4,3 5,0
7 19,6 0,3 0,25 4,320 4,7 4,8 4,8 4,8
8 10,2 0,2 2,1 4,295 4,3 4,4 4,3 5,1
На основании этого исследования можно заключить, что мало-
углеродистые образцы карбида титана имеют различный химиче-
ский состав и различную структуру, в зависимости от исходных
материалов и от условий изготовления.
В образцах 1—4, изготовленных в производственных условиях
(печь Таммана, продуваемая водородом), дефицит углерода цели-
ком покрыт кислородом и азотом — пустых мест в решетке этих
образцов нет. Кристаллическая решетка малоуглеродистых образ-
цов карбида титана, изготовленных в вакууме, содержит значи-
тельное количество пустых мест; в образцах, полученных из дву-
окиси титана, количество пустых мест примерно равно суммарно-
му количеству кислородных и азотных атомов; в образцах же, по-
лученных из гидрида титана, количество пустых мест превышает
количество кислородных атомов в 5—6 раз.
Результаты работы Уманского и Хидекеля приведены на диа-
грамме рис. 50. Заштрихованная на этой диаграмме область кон-
центрационного треугольника TiC — TiO — Ti является областью
однофазных сплавов с кристаллической решеткой TiC. Повиди-
мому, на бинарной диаграмме Ti — С однофазная область карбида
простирается до 25—30% (атомн.) С, т. е. до составов, отвечаю-
щих формулам Ti2C—TisC (в то время как по Бургерсу и Базар-
Карбид титана
93
ту лишь до TiijC). Предположение Вестгрена о существовании
карбида Ti2C с решеткой, отличной от TiC, не подтвердилось.
Причины образования карбида титана с пониженным содер-
жанием углерода изучались Г. А. Меерсоном и Я. М. Липкесом
[148, 149]. Эти авторы указывают прежде всего, что процесс вос-
становления двуокиси титана и образования карбида, описывае-
мый по Муассану уравнением TiO2 +ЗС^ TiC т 2СО2, на самом
деле идет в три стадии: TiO2 -> Ti2O3; Ti2O3 TiO и TiO-+ TiC.
Если не учитывать участия газовой среды, содержащей водород,
то эти стадии можно представить уравнениями:
2TiO2 + С-> Ti2Os+ СО;
Ti2Os + С-> 2ТЮ + СО;
TiO + 2С-> TiC + СО.
То, что восстановление TiO2 углеродом проходит именно в ста-
дии окислов Ti2O3 и TiO, было показано в дальнейшем Г. В. Сам-
соновым [150] на основании
простейшего термодинами-
ческого анализа тензиметри-
ческих кривых. Пренебрегая
в первом приближении таки-
ми кинетическими фактора-
ми, как объем брикета (из
шихты TiO2 + 3C), подвер-
гающегося нагреву, его пори-
стость (кстати, весьма зна-
чительная) , однородность
шихты и т. п., можно утвер-
ждать, что переход плавной
линии повышения давления
к скачку происходит при
температуре, необходимой
для создания давления СО,
превышающего давление в
печи до скачка, т. е. при
температуре, практически
близкой к равновесной тем-
пературе соответствующей
реакции, идущей с выделени-
ем СО.
Если известны все тер-
мические константы исходных
ПС
30 во 70 60 50.40 30 20 10
О Двуокись Ti ссамейргрувчатая
графитовая печатал
л. Та же, но вакуумная печь
— Гидрид Ti с сажей, вакуумная печь
ф Металлический Г с сажей,
вакуумная печь
© Двухфазный образец Ti+TiC
Рис. 50. Однофазная область в системе
TiC — TiO—Ti (по Уманскому и Хиде-
келю)
и конечных веществ, кроме тепло-
содержания получающегося окисла, можно определить послед-
нее, пользуясь значениями рсо непосредственно до скачка давле-
ния и значениями Т в момент перехода плавной линии повышения
давления к скачку.
94
Карбиды
Для расчета были использованы данные по рсо и Т для трех
скачков давлений, наблюдавшихся в работах Меерсона с Липке-
сом и Самсоновым (рис. 51); кроме того, были поставлены еще
два опыта по снятию тензиметрических кривых реакций TiO2 + ЗС
и вакуумнотермичеокого получения борида титана, выражаемого
уравнением:
2TiO2 + В4С + ЗС = 2TiBa + 4СО.
ISO
80
$ 40b-
%
§ 320-
£ Ж-
I
§3
'7*%'
f300§
- ----- -------------900
а я x ы а и to to
Вреня^ин.
Рис. 51. Тензиметрический ана-
лиз реакций восстановления и
карбидизации двуокиси титана
(по Меерсону и Липкесу):
/ — кривая давлений; // — кривая
температур
О
В последнем случае также наблюдались три скачка давления,
которые были предварительно объяснены прохождением реакций:
2TiOa + В4С + С = Ti2Os + В4С + СО;
TiaOg + В4С + С = 2TiO 4- В4С + СО;
2TiO +В4С + С = 2TiBa + 2СО.
Значения рсои Т, полученные в опытах различных авторов
Номер скачка Предполагаемое конечное соедине- ние Работа Меерсона и Липкеса — нагрева- ние шихты ТЮа + ЗС в угольнотрубчатой печи 1149] Работа Меерсона и Самсонова — нагревание шихты TiOa-f- ЗС в вакууме [148]
и о X о Ь р, мм вод. ст. р, у. рт. ст. дЯ ккал,моль и о Т. ’К р, р. рт. ст. дЯ ккал,моль
I Ti2O3 1000 1273 20 1470 —344,68 900 1173 16 —339,98
II TiO 1400 1673 80 5880 — 136,40 1020 1293 44 —129,02
III TiC 1600 1873 90 6500 — 19,03 1260 1533 80 — 29,23
III TiBa — — — — — — — — —
Карбид гитана
95
Соответствующие данные для рсо и Т, снятые с тензиметриче-
ских кривых, а также вычисленные с их помощью значения ДА/
приведены в табл. 28. При расчетах использовались следующие
численные данные: Д//ТЮа = —219,0 ккал/моль-, Д//со = 26,27
ккал)моль-, ДЛ/В)С = —66,0 ккал/моль-, STi02= 12,4 ккал/моль-,
5т12о3 = 18,83 кал/град-, STio==8,31 кал/арад;5с= 1,36 кал/град-,
Sco = 47,28 кал/град-, STC = 5,80 кал/град.
Как следует из данных табл. 28, значения Д Н низших окислов
титана Т120з и ТЮ, рассчитанные по результатам разных работ,
удовлетворительно совпадают между собой и средние их значения
ДЯт1,о8 =— 350,16 и АНтю = 139,37 кал/моль довольно близки
к табличным (Д//по8 =—388,07и ДЛ/то = —145,00ккал/моль}.
Это убедительно показывает, что реакция восстановления TiO2 уг-
леродом действительно проходит через стадии низших окислов
Ti2O3 и ТЮ. : ; 1 ! 1
Значение ДЯтю существенно меньше табличного, что совер-
шенно естественно, так как образуются твердые растворы
TiC — ТЮ и константа равновесия, выражавшаяся ранее как
Кр = Р со, становится равной 7<р=Рсо^НЗ]' ’
Поэтому значение ДЯ = — 27,03 ккал/моль вероятно соответ-
ствует теплосодержанию твердого раствора TiC в ТЮ в начальном
периоде третьей стадии реакции, т. е. раствора, бедного карбидом
титана.
Таблица 28
и рассчитанные по ним величины ДН
Работа Самсонова [150] Среднее значение дЯ из опыта ккал/моль Табличное значение ДЯ ккал моль
нагревание шихты TiOg + ЗС в вакууме нагревание шихты 2ТЮз Т ВдС г ЗС в вакууме
и Mo ‘J. 1 ё а, а дя ккал моль и о К О к р р- рт- ст. дя ккал/моль
700 973 400 —358.03 800 1153 30 —357,96 —350,15 -388,07
1080 1353 1000 — 142,20 S60 1233 280 —149,84 —139,37 —146,00
1150 1423 1850 — 33,03 — — — — — 27,03 — 43,85
— — __ — 1120 1393 2200 —70,04 — 70,04 —
96
Карбиды
В соответствии с правилом, фаз система Ti — С — О из трех
компонентов не может содержать больше пяти фаз даже при нон-
вариантном равновесии, поэтому начальный и конечный продукты,
ТЮ2 и TiC, сосуществовать не могут (тогда в реакции участвова-
ло бы шесть фаз: TiO2, Ti2O3, TiO, TiC, С и СО) и реакция Муас-
сана нереальна. Учитывая процессы, протекающие в газовой
фазе, можно дать следующее стадиальное описание процесса:
2С + Н2 = С2Н2;
TiO + С2Н2= TiC 4- СО + Н2;
TiO + 2С = TiC + СО.
Суммарная реакция через газовую среду (с образованием аце-
тилена) изображается так же, как и реакция в твердом состоянии.
По Брантлею и Бекману, принимающим муассановское урав-
нение процесса восстанрвления TiO2 и получения карбида, кон-
станта равновесия этой реакции К отвечает формуле:
lg K=lgpc0=-+ 3,829.
Однако, поскольку TiC и TiO образуют непрерывный ряд
твердых растворов, необходимо воспользоваться, в первом при-
ближении, законом Генри, из которого следует, что константа рав-
новесия реакции в твердом состоянии отвечает уравнению:
где TiC и TiO — концентрации этих веществ в твердом состоянии.
Для реакции, протекающей через газовую среду:
Рсо'Рн ' ITiC]
РС2»2 ’ [TiOl
Таким образом, конечный состав (содержание углерода в кар-
биде) твердой фазы Ti (С, О) зависит от концентрации углево-
дородов, образующихся в угольном патроне, загруженном шихтой.
Эта зависимость изображена схематически на рис. 52. Истинный
ход кривой зависимости между содержанием ССВЯз и концентрацией
C2H2 неизвестен, количественных данных для ее построения нет.
По данным Меерсона и Липкеса, совпадающим с вышеприве-
денными результатами, в карбиде, полученном прокаливанием
смеси TiO2 с сажей в графитовотрубчатой печи в токе водорода
при 1800—1900°, максимальное содержание связанного углерода
равно 18,5—19%. Очевидно, концентрация углеводородов в печи
не достигает той величины, которая обеспечила бы образование
карбида, свободного от кислорода (рис. 53).
Карбид титана
97
Больше всего связанного углерода содержат образцы, получен-
ные прокаливанием при постепенно повышающейся температуре
в течение 30—40 мин., без выдержки при максимальной темпера-
туре (рис. 53, II).
Выдержка при максимальной температуре вызывает уменьше-
ние содержания углерода в карбиде, сопровождающееся увели-
Рис. 52. Кривые упругости:
—упругость СО йад твердым раствором TiC —TiO; б —упру-
гость углеводородов над системой Ti —О —С —Н
Рис. 53. Зависимость содержания углерода в карбиде ти-
тана от длительности нагревания (по Меерсону и Липкесу)
чением содержания свободного углерода (см. рис. 53, I; III
и табл. 29).
Меерсон и Липкес дают вполне убедительное, хотя, как мы
покажем ниже, не совсем полное объяснение декарбонизации
карбида титана при длительном его прокаливании.
7 Г. В. Самсонов
98
Карбиды
Таблица 2S
Химический состав образцов карбида титана, изготовленных
путем прокаливания смеси Т1О2 с ламповой сажей
Режим изготовления карбида Содержание в карбиде1, %
Собщ Ссвяз Ссвоб
Нагрев до 1050—1900° 40—45 мин. (без выдержки) 19,9 18,5 1,4
Нагрев и выдержка при 1900° 1/2 часа 19,2 17,2 2,0
Нагрев и выдержка при 1900° 1 час 19,7 16,9 2,8
Нагрев и выдержка при 1900° 11/2 часа • . . 19,1 15,1 3,7
Нагрев и выдержка при 1900° 3 часа 18,7 14,5 4,2
Нагрев и выдержка прЬ 1900° 4 !/2 часа 18,5 14,3 4,2
1 Авторы приводят данные химического анализа с точностью до сотой доли про-
цента- Мы округлили эти цифры, так как точность анализа карбида титана на углерод,
несомненно, не превышает десятой доли процента-
Давление науглероживающего газа (С2Н2 при прокаливании
шихты ТЮ2 + С в токе водорода, СО — в отсутствии водорода)
зависит от степени дисперсности угля, находящегося в шихте: чем
дисперснее сажа, тем выше давление СО и С2Н2 над ее поверх-
ностью (точно! так же возрастает в соответствии с уравнением
Томсона упругость пара какого-либо вещества над каплей этого
вещества при уменьшении ее радиуса).
Свежая непрокаленная ламповая сажа высокодисперсна, вели-
чина ее кристалликов не превышает 10-6 см. При прокаливании
шихты, содержащей TiO2 и сажу, самые мелкие кристаллики осо-
бенно активно реагируют с водородом, образуя ацетилен, до высо-
кой концентрации насыщающий атмосферу печи. Этот ацетилен
восстанавливает двуокись титана и производит науглероживание,
одновременно выделяя углерод на поверхности крупных кристал-
ликов углерода и вызывая, тем самым, их рост — таким образом
происходит перегонка мелких кристалликов углерода на крупные,
т. е. постепенная графитизация сажи. Графитизация сажи, умень-
шение ее активности, вызывает падение концентрации ацетилена,
в атмосфере печи ниже равновесной для карбида с максимальным
содержанием углерода. Если к концу подъема температуры кар-
бид содержал 18,5%. Ссвяз, то после получасовой выдержки, вслед-
ствие огрубления сажи, концентрация ацетилена в 'атмосфере печи
упала настолько, что для нее равновесное содержание углерода в
Карбид титана
99
карбиде было равно лишь 17,2% Ссвяз- Если бы окись углерода,
образовавшаяся в процессе протекающего при подъеме темпера-
туры восстановления ТЮ2, осталась в печи, атомы углерода, выде-
лившиеся при разуглероживании карбида титана, заместились бы
атомами кислорода и процесс перехода TiO — TiC пошел бы в об-
ратном направлении. На самом же деле окись углерода уносится
из печи током водорода, так что узлы кристаллической решетки
карбида, освободившиеся после выделения углеродных атомов,
останутся свободными — образуется решетка, отвечающая схеме г
рис. 48, т. е., твердый раствор TiC — TiO с дефицитом неметалла,
иначе говоря, твердый раствор TiC — TiO—Ti. Образование та-
кого твердого раствора поясняет схема рис. 52.
При наличии азота в атмосфере печи вакантные места в решет-
ке твердого раствора могут занять атомы азота. Вследствие слож-
ности расчетов для процесса, протекающего при участии азота,
Меерсон и Липкес [149] рассмотрели влияние дисперсности угле-
рода на равновесие в системе Ti(C, О) —С — СО при давлении
газа 1 атм, сопоставив результаты расчетов с опытными данными,
полученными в атмосфере чистой окиси углерода.
Для реакции TiO + 2С TiC + СО с участием углерода в фор-
ме графита, протекающей с образованием твердых растворов
Ti (С, О), зависимость константы равновесия от температуры вы-
разится в этом случае так:
[TiC]' ДЕ0
^p = 1g [TiO]' 4,571 Т ’
где ДЕ0 — свободная энергия реакции.
Для той же реакции с участием сажи («аморфного» угля)
[TiC]"__________________________АЕ0—2Д/0
lg ЛР g [TiO]" 4,571 • Т ’
где Д/о — свободная энергия графитизации сажи.
Вычитая первое уравнение из второго, авторы получили для
принятой в производстве температуры карбонизации (1900°)
ig *;-ig
Подставив в это уравнение приближенное значение свободной
энергии графитизации, при 1900° равное примерно 9000 кал, и учи-
тывая, что равновесное содержание углерода в карбиде, получен-
ном из смеси TiO2 с графитом в атмосфере чистого СО при нор-
мальном давлении, составляет примерно 17%, авторы получили
для максимального содержания углерода в карбиде, полученном
при 1900°, с участием сажи, значение Ссвяз, равное 19,9%,
(вместо 20%,, отвечающих формуле TiC). Эта величина близка
значению 19,2%^ полученному авторами экспериментально.
7*
100
Карбиды
Одним из доказательств правильности основных положений
развитой в работе Меерсона и Липкеса теории авторы вполне об-
основанно считают тот факт, что при восстановлении и наугле-
роживании ТЮг в атмосфере СО углеродом в форме графита
они наблюдали иную зависимость содержания Ссвяз в карбиде
от времени прогрева, чем при прокаливании смеси ТЮг с сажей.
При участии в реакции графита содержание углерода в ка.рбиде
сперва непрерывно росло, достигая примерно 17%; а в дальней-
шем оставалось неизменным.
Мы подробно остановились на работе Меерсона и Липкеса, так
как они сделали первую серьезную попытку проанализировать тер-
модинамику процесса получения карбида титана.
Обеднение углеродом карбида титана при продолжительном
прокаливании наблюдалось многократно и инженерами-цроизвод-
ственниками. Понимание причин этого явления чрезвычайно важ-
но для установления режимов технологического процесса получе-
ния титановольфрамовых твердых сплавов. Высказанное Меерсо-
ном и Липкесом предположение, что обеднение карбида углеро-
дом вызывается снижением активности угля в шихте, сопровож-
дающимся огрублением и графитизацией сажи, несомненно пра-
вильно. Однако количественные расчеты, приведенные в работе,
как признают и сами авторы, крайне схематичны. Кроме того,
эти расчеты не учитывают очень важного фактора — участия азо-
та. На самом деле обедненный углеродом карбид является твец-
дым раствором Ti (С, О, N), причем содержание азота бывает,
как указывалось, весьма велико. Расчеты нужно проводить для
весьма сложного равновесия между указанным твердым раство-
ром, азотом, всегда присутствующим в печи сопротивления с гра-
фитовой трубой, СО и СгН2. Качественное указание Меерсона и
Липкеса о роли графитизации сажи остается справедливым и при
учете нитрации.
Последняя стадия процесса образования карбида титана вос-
становлением ТЮ2 углеродом была подробно изучена Меерсоном
и Крейн [151]. Ими установлено, что при получении карбида титана
в вакууме последняя стадия процесса протекает в зависимости от
условий с образованием твердых растворов TiO — TiC,
TiO — TiC — Ti или Ti — TiC по реакциям:
TiO + 2C TiC 4- CO;
TiO + C^Ti + CO;
Ti + C TiC.
При давлениях CO, больших 100 мм рт. ст. происходит науг-
лероживание титана по реакции TiO + 2С TiC + СО, причем
СО является окислителем, а дальнейшее уменьшение давления СО
приводит к удалению части кислорода из твердого раствора и вое-
Карбид титана
101
становлению титана, который входит в остающийся твердый
раствор TiC — TiO—Ti. В области давлений, меньших
10 мм рт. ст. при температурах выше 1300°, кислород удаляется
полностью; уменьшение при этих давлениях упругости СО приво-
дит к потере карбидом части углерода по реакции TiC + СОг
5? Ti + 2СО, причем СО служит науглероживателем.
В. С. Куцев и Б. Ф. Ормонт [156] исследовали процесс восста-
новления TiO2 углеродом в пределах 1600—2000° К при давлениях
СО от 150 до 800 мм рт. ст. и установили, что восстановление
идет через стадии образования окислов TiOi,7 (TisOs) и TiaOs;
при избытке углерода окислы TiO 1,7 и Ti2O3 полностью восста-
навливаются в оксикарбиды TiCx Оу. Окисел TiO в сосущество-
вании с карбидом обнаружен не был.
Хюттиг и Фаттингер [152] предложили вводить в атмосферу
печи газы, содержащие хлор, например СС14, хлорирующие окись
титана с последующим образованием карбида:
TiClx + х/2Н2 + С TiC + х НС1.
При этом скорость реакции образования карбида титана возра-
стает, а науглероживание протекает более полно.
Аналогичные наблюдения были сделаны Шулером [4], полу-
чившим при добавке к предварительно науглероженному до
19,2%' Ссвяз TiC 9% поливинилхлорида и нагревании в продол-
жение 3 мин. при 2000° карбид с 19,55% ССВяз. Им же предло-
жено получать карбид титана по реакции:
TiSa + 2CSt TiC + CS2.
При 2000° и продолжительности реакции 3 мин. по этому мето-
ду был получен TiC, содержавший 19,9% Ссвяз и 0,04% ССВОбПри
практическом отсутствии серы.
Подробное исследование реакции образования карбида ти-
тана по реакции:
TiCl4 + 2Н2 + C=TiC + 4НС1
было проведено Мюнстером и Руппертом [153], нашедшими, что
убыль свободной энергии при образовании карбида этим путем
составляет AF° = 44 000—33,5 Т; реакция, следовательно, про-
ходит активно только при температурах 1100—1200° и выше
(рис. 54).
Образование TiC проходит значительно активнее при исполь-
зовании железа, вместо водорода:
TiCl4 + 2Fe + С TiC -ф 2FeCl2
( AF° = — 28 800 + 25,55 Т). Пользуясь этой реакцией, Мюнстер
и Рупперт [154] получали защитные слои карбида титана на се-
ром чугуне уже при температуре около 1000°,
102
Карбиды
Приготовление карбида титана науглероживанием металли-
ческого титана было тщательно изучено Эрлихом (145), который
нагревал кусочки листового титана (~ 99,9 % Ti) с беззольной
дегазированной ацетиленовой оажей.
Температура, 7f
Рис. 54. Изменение свободной
энергии при образовании кар-
бида титана:
1 — Т С14 + 2Н3 + С - TiC + 4НС1;
II — TiCl4 + 2Fe + С = TiC+ 2FeCl2
Науглероживание проводилось в две стадии: в первой стадии
кусочки титана становились хрупкими; они измельчались и на-
правлялись на вторую стадию науглероживания.
Рис. 55. Диаграмма состояний Ti—С
Температура, необходимая для получения гомогенного TiC,
достигает 2400°; при получении карбида титана с меньшим со-
держанием углерода (Т1Сх,где х<1) температуры гомогениза-
ции соответственно снижаются.
Наиболее полно система Ti — С исследована Кадоффом и
Нильсеном [155] (рис. 55). В системе существует только один
карбид с предельным содержанием углерода, отвечающим фор-
Карбид титана
103
муле TiC, гомогенный, по Эрлиху до 18% (атомн.) С. Раствори-
мость углерода в титане составляет около 7,4%' (атомн.)
(TiCо,о8 ). Зависимость периода кубической гранецентрирован-
ной решетки TiC от содержания углерода показана по Эрлиху
на рис. 56; период TiC составляет 4,31 кХ, что хорошо согласует-
ся с данными, полученными другими исследователями.
По данным А. Е. Ковальского и Т. Г. Макаренко [157] микро-
твердость карбида титана находится в области гомогенности
фазы TiC в линейной зависимости от состава (см. рис. 18).
Экстраполяция прямой микротвердости на нулевое содержание
углерода дает приблизительно величину твердости титана, отку-
да Ковальский делает вывод, что определяющим фактором твер-
дости карбида титана является не
перестройка решетки и не измене-
ние при этом характера сил сцепле-
ния, а процесс внедрения атомов
углерода в металлическую решетку.
Карбид титана имеет светлосе-
рый цвет, химически весьма устой-
чив против действия соляной и сер-
ной кислот. В азотной и плавиковой
кислотах, а также царской водке он
легко растворяется, разлагается так-
же сплавлением с перекисями и
щелочами.
Л томные доли дглерда
Рис. 56. Зависимость периода
решетки TiC от содержания
углерода (по Эрлиху)
Азот при высоких температурах реагирует с карбидом тита-
на, с образованием твердых растворов TiC—TiN [158]. Водород
при температуре более 1500° очень медленно обезуглероживает
карбид титана, водяной пар при высоких температурах окисляет
карбид.
Карбид титана легко хлорируется с образованием хлоридов,
хлорокисей или сульфохлоридов [159]. Фтор -реагирует с TiC на
холоду, а остальные галоиды—при нагревании до 400—700° [123].
Закись азота окисляет карбид титана при 1200° по уравнению:
TiC 4- 3N2O TiO2 + СО + 3N2;
такое же действие оказывает углекислый газ [160]. Окисление
порошкообразного карбида титана происходит при температуре
500—600°, компактный карбид титана не окисляется до 800°
[123]. Продуктом окисления карбида титана считают ТЮг.
Наиболее совершенно смачивается кобальтом карбид титана,
приготовленный в вакууме, т. е. содержащий максимальное ко-
личество ССВяз и наименьшие примеси TiN и ТЮ [144]. Кремний
плохо смачивает карбид титана и взаимодействует с ним с обра-
зованием новой, еще не идентифицированной фазы [123].
Рис. 57. Изменение теплосодержания карбида
и нитрида титана с температурой
Рис. 58.'Микроструктура горячепрессованного кар-
бида титана (температура 2100°, плотность 96%,
травление раствором 20% K3Fe(CN)6 + 20% КОН
Карбид циркония
105
Теплоемкость TiC по Найлору [167] в пределах 298—1800° К
выражается как Ср = 11,83 + 0,00080 Т — 358 000 • Т-2; измене-
ние теплосодержания с температурой показано по тем же дан-
ным на рис. 57. TiC обладает свойствами полупроводника [594].
Сжимаемость карбида титана по данным Бриджмена [168]
при 30° составляет A V7IZ0 = 4,72 • 10~7р—2,16 • 10~12 р2,
а при 75° ДГ/Г0 = 4,78 • Ю~7 р — 2,19 • 10~12 р2.
Глазером и Иваником [128] были проведены опыты по горя-
чему прессованию порошка карбида титана, содержащего 18,4—
19,3% Ссвяз и измерялись свойства горячепрессованных образ-
цов из TiC в зависимости от температуры и выдержки при спе-
кании. При этом было установлено, что при температуре спека-
ния около 3000° в продолжение 25—30 сек. TiC становится прак-
тически плотным, что вообще, повидимому, ошибочно, так как
карбид титана должен спекаться при гораздо более низких тем-
пературах, порядка 2000—2200°.
Структура горячепрессованного карбида титана показана на
рис. 58 [169]). В литературе [593, 596] описады его технологиче-
ские свойства. Свойства карбида титана приведены в табл. 34.
Карбид циркония
Карбид циркония впервые был получен в 1893 г. Троостом.
Муассан [2]. приписал ему формулу ZrC (11,62% С); получали
карбид также Руфф и Мартин [2] и Ведекинд [2].
В дальнейшем карбид циркония получали либо в газовой фа-
зе, содержащей четыреххлористый цирконий ZrCl4 [138], [175],
либо прокаливанием смеси ZrO2 с сажей при температуре
1900—2100° [134], [176]. Фридрих и Зиттиг [134] реакцию, проте-
кающую при восстановлении двуокиси циркония углем, предста-
вили уравнением
ZrO2 + ЗС ZrC + 2СО.
Основываясь на уравнении Фридриха и Зиттига, Прескотт
следующим образом определил константу равновесия реакции:
При 1930° равновесное давление СО по Прескотту равно 1 аг.
Никаких доказательств того, что реакция восстановления дву-
окиси циркония и образования карбида протекает в соответствии
с формулой Фридриха и Зиттига, ни в их работе, ни в работе
Прескотта не было.
Агте и Моэрс [136] уточнили методику изготовления хими-
чески чистого карбида циркония (как и других тугоплавких кар-
бидов). Они прокаливали несколько раз при 2500—3000° штаби-
ки, спрессованные, из порошка карбида, изготовленного обыч-
106
Карбиды
ным методом (путем взаимодействия окисла с сажей), а затем
прогревали их электрическим током в атмосфере аргона вплоть
до плавления. По их данным карбид циркония при высоких
температурах (вблизи точки плавления) растворяет значитель-
ное количество углерода, так что его состав не удовлетворяет
формуле ZrC. Температура плавления карбида при этом пони-
жается.
Рентгенографическое исследование карбида циркония, полу-
ченного из паров ZrCU, было проведено впервые в 1924 г. Арке-
лем {138], карбид же, изготовленный восстановлением и наугле-
роживанием двуокиси циркония сажей, исследовали в 1925 г.
Беккер и Эберт [139]. По данным Аркеля карбид циркония имеет
кристаллическую структуру типа NaCl, период решетки по Арке-
лю 4,71 кХ [175]. Беккер и Эберт нашли, что период решетки
карбида циркония равен 4,76 кХ, причем оказалось, что изме-
ренная ими плотность ZrC (7,90 г/см^) значительно превышает
плотность вычисленную (6,51 а/сж3).
Бургере и Базарт [142] в 1934 г. получили карбид циркония,
прокаливая угольную нить в атмосфере четыреххлористого цир-
кония ZrCh. Химический состав образцов, полученных ими, из-
менялся в пределах ZrC—Zri,3 С, период же кристаллической
решетки соответственно от 4,687 кХ до 4,67 кХ.
Эти цифры существенно отличаются от значений периода,
найденных Аркелем и особенно Беккером и Эбертом.
Учитывая несовершенство методики измерения периодов ре-
шетки в 1924—1925 гг. и многочисленные грубые ошибки рабо-
ты Беккера, частично уже отмеченные, следует признать наибо-
лее достоверными данные Бургерса и Базарта, полученные на
очень чистых препаратах. Эти данные неплохо согласуются с
проведенными Беккером и Эбертом измерениями плотности кар-
бида. Плотность, вычисленная нами для найденного Бургерсом и
Базартом значения периода решетки, равна 6,82, а измеренная
Беккером и Эбертом — 6,90 г/см3.
Уманский, Шукст и Петрусевич [2] рентгенографически иссле-
довали в 1940/41 г. карбиды циркония с разным содержанием
связанного углерода, изготовленные науглероживанием порошко-
образного металлического циркония сажей. Смесь циркония с са-
жей прокаливалась полчаса в вакуумной печи при 1700°. Изготов-
ленные Уманскими его сотрудниками образцы содержали от 4,4
до 10,6% связанного углерода. Образца с 11,6% С,что соответст-
вовало бы формуле ZrC, Уманскому получить не удалось. Сплав
с 4,4% С оказался, по данным рентгеноанализа, двухфазным:
он состоял из карбида, металлические атомы которого образуют
кубическую гранецентрированную решетку, и из твердого рас-
твора углерода в гексагональном цирконии. Все остальные спла-
вы содержали один только кубический карбид, период решетки
Карбид циркония
107
которого, как видно из рис. 59, а, практически линейно увеличи-
вался с содержанием связанного углерода. Область существова-
ния карбида простирается в системе Zr — С от состава, близкого
к формуле ZrC, до 4,8—5% (вес.) С [27—28%' (атомн.)], что от-
вечает примерно формуле Zr3C. Структура малоуглеродистых
карбидов циркония, изготовленных
циркония, аналогична описанной
ниже структуре малоуглероди-
стых карбидов ниобия (рис. 75).
Исследуя образцы карбида
циркония, изготовленные в печи
сопротивления с графитовой тру-
бой в токе водорода, Уманский
установил, что при заданной вы-
держке (5 мин.) период кристал-
лической решетки и содержание
связанного углерода возрастали с
повышением температуры получе-
ния карбида от ^,673 кХ и соот-
ветственно 7,1%' Ссвяз при 1900°
до 6,689 кХ и 10,5%' Сс вяз При
2300^. По данным химического
анализа, дефицит углерода в этих
карбидах частично покрывался за
счет азота: образец с 10,5% Ссвяз
содержал до 1 %iN, образец с
7,1% Ссвяз—около 2% N.
Насыщение азотом происходи-
ло одновременно с науглерожива-
нием, очевидно за счет воздуха,
подсасывающегося в печь.
Оказалось далее, что увеличе-
ние продолжительности науглеро-
живания при 1900° не только не
ослабляет, но даже усиливает эф-
фект насыщения карбида цирко-
ния азотом, что следует из данных
табл. 30 (образцы 7, 8 и 9). При-
чины этого были проанализирова-
ны выше, при изложении работ
Меерсона по получению карбида
титана.
в вакууме из металлического
Рис. 59. Зависимость периода ре-
шетки карбида циркония от содер-
жания углерода:
а — по Данным Уманского; б —по дан-
ным Ковальского н Макаренко; « — по
данным Самсонова и Розиновсй
Сплав, изготовленный Уман-
ским и Шукст в печи сопротивления с графитовой трубой
сплавлением смеси металлического циркония с сажей, состоял из
эвтектики ZrC+C и первичных кристаллов графита (рис. 60).
108
Карбиды
№ образца
1
2
3
4|
5
6
7
8
9
10
11
12
Таблица 30
Характеристики образцов карбида циркония,
исследованных Уманским, Шукст и Петрусевичем
Исходный материал Условия спекания Содержание углерода, о/ /О Период ре- шетки а кХ Примеча- ние
С общ Ссвоб Ссвяз Ссвяз, % (атомн)
Металли- ческий То же Вакуумная печь, температура до 1700°, выдержка при 1700° Р/г часа То же 11,3 10,5 1,7 1,5 10,6 9,0 47,4 43,3 4,6795 4,6732
» » » 7,2 0,2 7,0 36,8 4,6672
А 5,8 0,2 5,6 30,6 4,6581
» » » » 5,4 0,3 5,1 28,2 4,6553
» » >> » 4,6 0,2 4,4 25,3 4,6545 Двух-
» » » » » » » ». » » » » Г рафитово-тр убч а- тая печь в токе Н2, 1900°, выдержка 30 мин То же, 1900°, вы- держка 15 мин. . . То же, 1900°, выдерж- ка 5 мин . . . • . То же, 2300°, вы- держка 5 мин. . . . Плавленый обра- зец Карбид, выкрис- таллизовавшийся из расплавленного ни- келя 9,0 9,6 9,8 11,0 12,9 2,9 3,2 2,7 1,5 2,8 6,1 6,4 7,1 10,5 10,1 II III 1 4,661 4,665 4,673 4,679 4,678 4,675 фазный сплав , Содер- жал свы- ше 4% N Содер- жал око- ло 4% N Содер- жал око- ло 2% . N Содер- жал ме- нее 1% N Эвтек- тика и первич- ные вы- деления графита
Карбид циркония
109
Период решетки карбида в этом сплаве 4,678 кХ почти сов-
падал с периодом решетки карбидов с 10,5% Ссвяз > изготовлен-
ных в вакууме без расплавления. Следует предполагать, что
карбид в плавленом образце также содержал около 10,5% С.
Таким же периодом решетки и, повидимому, тем же составом
обладал карбид циркония, изготовленный кристаллизацией из
расплавленного никеля (расплавлялась в угольном тигле при
температуре 1900° шихта, содержавшая около 60%, Ni, 30% дву-
окиси циркония и 10%' сажи).
В работе А. Е. Ковальского и Т. Г. Макаренко [45] сплавы цир-
кония с 5,68—10,21 %] связанного углерода получались при взаи-
Рис. 60. Структура литого карбида циркония
модействии порошкообразного циркония с сажей с последующей
перекристаллизацией полученных сплавов через расплавленный
никель (спеканием с 3%' Ni в вакууме) при 2000° в течение
2,5 час. Химические и рентгеновские анализы этих образцов по-
казали, что в пределах от 36 до 50% (атомн.) С [7,08—10,2%
(вес.) С] образуется только одна фаза — карбид циркония с пе-
риодом, изменяющимся с повышением содержания углерода от
4,652 до 4,681 кХ (рис. 59, б). При содержании углерода менее
7,08% наряду с кубическим ZrC появляется вторая фаза, являю-
щаяся, повидимому, твердым раствором углерода в цирконии.
Условия получения карбида циркония в вакууме были изу-
чены Г. А. Меерсоном и Г. В. Самсоновым [177]. При этом на
110
Карёиды
тензиметрической кривой реакции ZrO2 + ЗС = ZrC + 2СО отме-
чаются три скачка (рис. 61), реакция, следовательно, проходит
через стадии промежуточных окислов:
2ZrO2 + С = Zr2O3 + СО;
Zr2O3 4-С = 2ZrO 4-СО;
ZrO + 2С = ZrC + СО.
В связи с этим суммарная реакция вообще не может рас-
сматриваться с точки зрения равновесных условий, как это де-
6рамя/ мин.
Рис. 61. Тензиметрическая кривая реакции восстановления ZrOa
углем (по Меерсону и Самсонову)
видом фаз ZrO2 и ZrC не могут сосуществовать в равновесных
условиях.
Содержание углерода в полученных при разных температурах
продуктах восстановления ZrO2 углеродом в вакууме приведено
в табл. 31 и на рис. 62, а полные анализы карбида, приготовлен-
ного при 1900—1950°— в табл. 32.
Теоретическое содержание углерода в карбиде циркония со-
ставляет 11,62%.
На основании данных табл. 31 можно сделать вывод, что
кислород в решетке карбида циркония в вакууме при 1900—
1950°, повидимому, не сохраняется.
Температура восстановления и науглероживания окислов и
тем самым получения карбида циркония в вакууме сильно сни-
жается по сравнению с процессами, происходящими при атмо-
Карбид циркония
111
Таблица 31
Химические анализы продуктов восстановления окиси циркония
углеродом в вакууме при различных температурах
Температура, °C Время подъема температу- ры, час* Время выдержки до полно- го паде- ния дав- ления, час* Содержание углерода, % Содержа- ние Zr в расчете на Ссвяз, % Содержание карбида циркония в продукте реакции, %
Собщ Ссвоб Ссвяз
1400 1,о 3,0 17,90 12,90 5,00 38,10 43,10
1550 1,25 2,5 12,80 4,48 8,32 64,30 72,62
1650 1,5 1,0 11,83 1,13 10,70 81,60 92,30
1700 2,0 0,5 12,89 1,52 11,37 86,40 97,77
1950 2,0 0,25 11,98 0,17 11,81 88,58 100,39
Таблица 32
Результаты полного анализа карбида циркония,
полученного в вакууме при 1900—1950°
№ по по- рядку Химический состав, % Сумма Zr + собщ
Собщ Ссвоб Ссвяз Zr
1 11,17 1,01 10,16 88,84 100,01
2 11,79 1,30 10,49 88,23 100,02
3 11,98 0,17 11,81 87,92 99,90
сферном давлении. Так, налример, температура получения карби-
да циркония при атмосферном давлении принимается равной
1900—2100°, в то время как из данных табл. 31 следует, что для
получения карбида циркония в вакууме совершенно достаточна
температура 1650—1700°.
В работе Г. В. Самсонова и Н. С. Розиновой [179] для приго-
товления сплавов циркония с углеродом был использован поро-
шок циркония с содержанием 99,3% Zr и тщательно прокален-
ная ламповая сажа.
Порошки циркония и сажи смешивали в расчете на получе-
ние сплавов с содержанием от 0,22 до 15,4% С (от ZrCo.oi ДО
ZrCi.i), смесь прессовали в брикеты и нагревали при разреже-
нии 10“5— 10-4 мм рт. ст. в графитовом патроне вакуумной пе-
чи, предложенной Суздальцевым.
Для исследования условий науглероживания циркония была
выбрана смесь, отвечающая формуле ZrC0,6 (7,31% С), брике-
ты из которой нагревались при 1500—1900° в продолжение 1—
3 час. При этом было установлено, что наиболее полное связы-
вание углерода происходит при нагревании смеси при 1900° в
112
Карбиды
продолжение 1 часа (СобЩ =7,75%; ССВЯз =6,97%), а при
1600° — в продолжение трех часов (СОбщ =7,46%; С Связ =
= 7,00%). Нагревание при 1600° смесей всех составов обеспечи-
вает достаточно полное связывание углерода только до составов
ZrC о,5— ZrC о.б ; при больших расчетных содержаниях углерода
связывание прекращается.
Практически то же происходит и при температуре
1800—1900°, только в этом случае начинает более существенно
оказываться распыление уг-
лерода из брикета. Для обе-
спечения наибольшего соот-
ветствия расчетным соста-
вам смеси Zr+C прокалива-
ли в продолжение 1—3 час.,
а затем, после протирания,
вновь брикетировали и на-
гревали при- 1800° в продол-
жение 1 часа.
Полученные при этом по-
рошкообразные сплавы со-
держали от 0,64 до 10,03%
Ссвяз- Большего содержания
связанного углерода в спла-
вах получить не удалось:
смесь, рассчитанная на полу-
чение Zr Ci,5 (15,4% С), со-
держала связанный углерод
в соответствии с формулой
3,12% С двухфазны. Основной
Рис. 62. Зависимость содержания уг-
лерода в карбиде циркония от темпе-
ратуры
ZrCьо. Сплавы с содержанием до
является гексагональная фаза с решеткой, близкой к металли-
ческому цирконию, второй фазой — кубический карбид цирко-
ния. Начиная с 3,5 и до 10,03%, С в сплавах обнаруживается
только кубическая гранецентрированная решетка карбида цир-
кония. Период решетки исходного циркониевого порошка уста-
новлен равным 3,125 кХ (по последним данным [72] для весьма
чистого циркония а = 3,16 кХ). При содержании 0,88% С период
решетки снижается до 3,06 кХ,'а затем медленно повышается
при содержании 2,06% С до 3,07—3,08 кХ. Изменение периода
решетки в области от 3,5 до 10,03%i С показано на рис. 59, в.
Для металлографического исследования и измерений микро-
твердости порошки сплавов спекались горячим прессованием с
последующим отжигом и медленным охлаждением для снятия
внутренних напряжений и завершения фазовых превращений.
Шлифы подготовляли общепринятым для твердых соедине-
ний методом с использованием в качестве травителя смеси
Na2SiF6+HNO3 или анодного травления в 35%-ном водном
Карбид циркония
ИЗ
растворе КОН. Уже в образцах, содержащих 0,86% С, было
установлено наличие двух фаз — светлой, представляющей собой
карбид Циркония, и темной — твердого раствора углерода в цир-
конии, на что указывают также результаты измерения микро-
твердости, составляющей для твердого раствора 900—
1000 кг) мм?, а для карбидной фазы в образцах с содержанием до
2% Ссвяз —около 1900—2000 кг!мм?. Следует отметить, что
твердость гексагональной фазы
лерода от 0,8 до 2,09% возра-
стает от 950 до 1330 кг!мм?.
Начиная с 3,5% С, на шли-
фах выявляется только одна
фаза —карбид циркония, твер-
дость которой с увеличением
содержания углерода изменяет-
ся, как показано на рис. 63.
Микрофотографии некото-
рых сплавов в двухфазной и
однофазной областях показаны
на рис. 64—67.
Область гомогенности куби-
ческой фазы карбида циркония
сказывается несколько шире
установленной Уманским и
значительно больше области,
установленной Ковальским и
Макаренко, как это показано в
табл. 33.
Плавления образцов с со-
держанием 3—4% С при ука-
занной ГольдЩмидтом [120]
температуре эвтектики 1800—
1900° в работе не наблюдалось,
кроме того, сплавы с содержа-
нием 1—3%'С плавились при
температурах выше 2000°, что
при увеличении содержания уг-
0 # 3J S.2 8Р USlteec}
Содержание углерода
Рис. 63. Зависимость микротвердости
карбида циркония от содержания уг-
лерода:
а —по Ковальскому и Макаренко; б — по
Самсонову и Резиновой
ъе позволяет принять для этого участка диаграмму, предложен-
ную Гольдшмидтом (рис. 68).
На основании всего сказанного, имея в виду известную ана-
логию между поведением циркония и титана при их взаимодей-
ствии с неметаллами типа бора, углерода и азота, можно ориен-
тировочно полагать, что диаграмма участка цирконий — карбид
циркония построена по перитектическому типу.
Порошкообразный карбид циркония серого цвета нераство-
рим в соляной кислоте, растворяется в смеси концентрированных
азотной и плавиковой кислот и в концентрированной серной кис-
6 Г. В. Самсонов
Рис. 64. Микрошлиф сплава
с 1,16%С, травленый. X ЮО
Рнс. 65. Микрошлиф сплава
с 1,90% С, травленый. X 100
Рис. 66. Микрошлиф сплава
с 8,93% С, травленый. X100
Рис. 67. Микрошлиф сплава
с 10,05% С, травленый. X 100
Карбид циркония
IIS
Таблица 33
Некоторые характеристики области существования кубической фазы
в системе Zr—С по разным данным
Данные Нижняя гра • ница фазы Период решетки, kX Микро- твердость, т1ммА Верхняя граница фазы Период решетки, kX ' Микро- твердость,
% (вес ) о/ /о (атоми ) % (вес ) % (атомн.)
Ковальского 7,08 36 4,652 1908 11,62 50 4,681 2700*
Уманского 4,8 27 4,652 ’ — 11,62 50 4,683 __
Самсонова и Розиновой 3,50 21 4,582 2000 11,62 '50 4,683 2900*
* Экстраполированные значения.
лоте. Водяной пар при красном калении на карбид циркония не
действует. Галоидами и щелочами он легко разлагается.
Азот на карбид циркония действует
при температурах выше 800—900°. Кис-
лородом карбид циркония до 1100—
1400° мало окисляется [122].
Толщина окисленного слоя на ZrC по-
сле окисления при 880° составляет за
50 час. 87,5 р, а за 100 час. около 175 р
[123]. ZrC несколько уступает TiC в стой-
кости против теплового удара (выдержи-
вает 22 теплосмены при 980° по сравне-
нию с 25 теплосменами для TiC; при
температурах выше 1000° не выдержива-
ет тепловых ударов вообще). Тонкий по-
рошок карбида циркония пирофорен.
При взаимодействии карбида цирко-
ния с металлическим ниобием [181] обра-
зуется сложный карбид ниобия и цирко-
ния, сцементированный металлической
фазой. Полученный таким образом сплав
имеет Довольно высокое сопротивление
разрыву, до 40—42 кг/мм2, линейно
ная диаграмма состоя-
ний системы Zr—С (по
Гольдшмидту)
уменьшающееся с повышением температуры испытаний до
12 кг!мм2 при 1300°. По указанию авторов, высокая горячая
прочность этого сплава позволяет использовать его в технике
высоких температур, в условиях действия агрессивных газов.
Измерение микротвердости сплавов показало, что в пределах
гомогенности фазы ZrC микротвердость изменяется по прямой
(рис. 65), экстраполяция которой на состав ZrC дает значение
18*
116
Карбиды
около 2700 кг/мм2, а на нулевое содержание углерода — значение
твердости того же порядка, как и для чистого металла.
Изменение свободной энергии образования ZrC из циркония и
углерода [182] составляет Д F° = —40 000—7,7 Т кал!моль
(в интервале 1500—2000°К).
Для удаления свободного углерода из карбида циркония
предложено «флотировать» сажу с помощью мыльного раствора
концентрацией 0,1—1,5%' (лучше всего 0,25—0,50%) [183].
Для превращения порошка карбида циркония в компактные
плотные образцы обычно используется горячее прессование [129].
Свойства карбида циркония приведены в табл. 34.
' ' Таблица 34
Свойства карбидов титана, циркония и гафния
Свойство Карбид
Tie ZrC HfC
Содержание углерода в предельно насыщенных не- 20,1
металлом фазах, % ... Область гомогенности, % 11,62 6,3
(атомн.) С Кристаллическая струк- 18-50 [145] 21-50 [179] 36—50 [184]
тура ... Период решетки (для мак- симального содержания С). г. ц. к. [145] г. ц. к. [2] г. ц. к. [184]
кХ Плотность, г/см*-. 4,313 [145] 4,683 [2,179] 4,641 [184]
расчетная 4,92 6,76. 12,67
экспериментальная . . . Микротвердость (50 г), 4,93 [145] 6,9 [2] 11,8-12,6 [184]
кг/мм1 .......... 2850—3200 [44,186] 2836 [44] 2830 (100 г) [184]
Модуль упругости, кг!ммг Предел прочности, кг/мм2: 35000 [187] 35500 [616] —
при сжатии , . , • 385 [593] - _ —
при изгибе при разрыве: 59,5-66,5 [128] “““
20° 800° 1300° Температура плавле- 56—105 [593] 38 0,21 [593]
ния, °C 3250 [190] 3175±50 [4] 3890+150° [184]
Температура кипения, °C Теплота образования из металла и углерода—ДЯ°д8> ккал моль ..... . . 4300 [191] —
43,85 [609] 44,1 + 0,8 [610] ~81 [615]
Карбид гафния
117
Продолжение табл. 34
Свойство Карбид
TiC ZrC HfC
Теплопроводность, кал!см сек. град: 0,058 [193] 0,022 0,015
при 100° при 510° при 810° . . Теплоемкость (298°К), 0,049 [186]
кал!моль • град , . Удельное электросопро- 12,07 [167] — —
тивление при 25°, мком - см. Термический коэффициент электросопротивления, 68,2 [128] 63,4 [125] 109,0 [125]
% град +3,2 [128] + 1,2 [136] 4-0,41 [136]
Термический коэффициент линейного расширения, при 22° при +204-930° при 4-204-1150°
%/град Молярная магнитная вое- 7,42 • 10~6 [194] 6,73 • 10~6' —•
приимчивость {т. 10е) . . . Энтропия $2дд +8 [195] —26 [195] —
кал/град. • моль Термоэмиссионные кон- 5,8 + 0,1 [182] 8,5±1,5 [182]
станты: у, эв ...... 3,35 [196] 2.18 [196] ——
А, а!см* град* Температура перехода в сверхпроводящее состояние, 25 [196] 31 [196] <1,28 [198]
°К . . . . 1,15 [197] 2,1-4,! [198]
* По данным Г. В. Самсонова.
полученным на кварцевом дилатометре.
Карбид гафния
Карбид гафния аналогично карбидам циркония и титана мож-
но получать взаимодействием НЮ2 с углем при 2100—2500°
[136], а по другим данным [184] при 1500—1700°. По последним
данным [184] для получения HfC использовалась очень чистая
HfO2 (0,02%' Si, 0,075% Al, 0,001% Fe, 0,05% Ti, 0,0002% Zr,
0,0025% Mg и < 0,01 % P) и ламповая сажа, содержащая 0,05%
золы (главным образом Ре20з). Полученный в графитово-труб-
чатой печи при указанных температурах карбид гафния содержал
6>2% С против 6,3% С по расчету для HfC.
118
Карбиды
Моерс [125] получал карбид гафния разложением смеси
HfCl4 + Н2 + толуол на вольфрамовой нити при 2400—2800°, а
Кэмпбелл [122] — осаждением из смесей HfCl4 + Н2 + углеводо-
роды при 2100—2500°.
Можно также получать карбид гафния науглероживанием
[185] предварительно осажденного на нити гафния из газовой
фазы, что не удается произвести для карбида циркония вслед-
ствие низкой температуры его плавления.
Гипотетическая диаграмма состояний сплавов системы Hf — С
построена Гольдшмидтом (рис. 69) [120]. При 2800° наблюдалась
4000\ ^3900
3600-
3230-
2300
2W0- •
2230-
-Ж?
С,% (атом}.
4640
4630
I
§ 4 610
Й 4600
$
4,590
4,580
ар 0,9 1,8 27 3,8 4,5 5,4 68
Север члние связаннееуглереЭа,%
Рис. 69. Ориенти-
ровочная диаграм-
ма состояний си-
. стемы Hf—С
Рис. 70. Зависимость периода ре-
шетки карбида гафния от содержа-
ния углерода
эвтектика между HfC и С [184]. Период решетки карбида гафния
изменяется линейно1 с увеличением содержания углерода (от 3,6 до
6,3%) от 4,623 до 4,641 кХ (рис. 70). Область гомогенности фа-
зы HfC точно не установлена, возможно, что она простирается в
указанных пределах от HfCo.56 до HfCi.o- Теплота образования
HfC составляет около 81 ккал/моль [615].
Карбиды ванадия
Впервые карбид ванадия был получен в 1893 г. Муассаном
[2] в электрической дуговой печи.
Карбиду с 18,4% С Муассан приписал формулу VC (теорети-
ческое содержание углерода в-VC 19,05%).
Карбиды ванадия
119
Николардо [200] и Маурер [201] на основании химического
анализа карбидов, выделенных из сталей с 30% V и 1,6 и
0,8% С, предлагали формулы V4C3 или V3C2.
С 1925 г. возобновляются работы по изучению карбидов ва-
надия, полученных непосредственным науглероживанием метал-
лического ванадия и его окислов и продолжаются исследования
карбидов, выделенных из сталей.
Руфф и Мартин [2] получили карбид ванадия, прокаливая
смесь пятиокиси ванадия с сахарным коксом. Один из сплавов
Руффа и Мартина содержал 19% СОбщ- Этому сплаву они при-
писали формулу VC, хотя анализа на свободный углерод не про-
изводили, что ставит под сомнение их выводы. То же замечание
относится и к образцам, изготовленным Фридрихом и Зиттигом.
[134].
Беккер и Эберт [139], исследовавшие рентгенографически по-
лученный Фридрихом и Зиттигом карбид, нашли, что он имеет
кристаллическую решетку типа каменной соли.
Период решетки этого карбида по Беккеру и Эберту равен
4,39 кХ, что недостоверно, так как измеренная плотность VC,
равная 5,36 г!см\ превышает плотность вычисленную 5,25 г/сл3.
Ольдман и Фишль [202] приписывают карбиду ванадия фор-
мулу VC. По их мнению, основанному на химических особенно-
стях карбида, его кристаллы построены из молекул VC, что оши-
бочно, так как кристалл с типичной координационной решеткой
типа NaCl не может состоять из молекул.
В 1930 г. Осава и Ойа [203] попытались построить диаграм-
му V — С. Исходными материалами были металлический вана-
дий 98,5% чистоты (остальное в основном — железо, мышьяк,
кремний), с периодом решетки а = 3,024 кХ, и сахарный кокс.
Шихта прокаливалась в печи сопротивления с графитовой
трубой при температурах до 2000°, атмосфера печи (окись уг-
лерода) являлась науглероживающей для малоуглеродистых об-,
разцов и окисляющей для образцов с высоким содержанием уг-
лерода.
Были изготовлены сплавы, содержащие от 1,5 до 8% С и от
15 до 16% С. Кроме того, исследовали карбид, выделенный пу-
тем электролитического травления из сплава железо-ванадий-
углерод и содержащий 4,5% С, 84,2% V и 1,3%' Fe.
В сплавах ванадий-углерод они обнаружили три фазы: а-твер-
дый раствор углерода в ванадии с. малой областью гомо-
генности, имеющцй решетку металлического ванадия; (3-фазу, по
составу отвечающую формуле VjC (металлические'ТатОмНйО'бр'а^
зуют в (J -фазе гексагональную компактную решетку' с периода-
ми а = 2,86 кХ и с 4,545 кХ, с/а = 1,59) иу^фдзу {УХД .с^гране-
центрированной кубической решеткой металлических атомов и
периодом а =* 4уГ34 кХ.
120
Карбиды
Данные о химическом составе фаз Р и у Осава и Ойа прове-
рили, сопоставив с результатами измерений плотности сплавов.
Так, например, измеренная экспериментально плотность сплава,
содержащего 6,81%' С, равна 4,50, а вычисленная теоретически
плотность p-фазы, содержащей 4,44% Ссвяз , составляет
4,55 г/см3.
Те же фазы (и тех же примерно составов) даны Фогелем и
Мартином [204] в 1930 г., исследовавшими тройную диаграмму
V — С — Fe (сторона ванадий — углерод этой диаграммы при-
ведена на рис. 71). В отличие от Осава и Ойа, Фогель и Мартин
считают, что карбид с гексагональной решеткой (они обозна-
чают его через у', а не через ₽) при температурах ниже 1100°
неустойчив.
Хэгг [205] и Вестгрен [206] выступили с возражениями про-
касающихся химического со-
става карбидов ванадия. По
мнению Хэгга и Вестгрена,
кристаллохимически пра-
вильнее приписать карбидам
ванадия формулы V2C (вме-_
сто V5C) и VC (вместо
V4C3). Дефицит углерода,
содержащегося в карбидах
Осава и Ойа (по сравнению
с формулами V2C и VC),
Вестгрен и. Хэгг объясняют
нитрацией и окислением об-
разцов, приготовлявшихся не
тив выводов работы Осава и Ойа,
Рис. 71. Диаграмма состояния системы
V—С (по Фогелю и Мартину)
в вакууме, так что реальным
карбидам можно приписать формулы Уг(С, О, N) и V(C, О, N).
Моретт и Урбен [207] в 1938 г. исследовали образцы карбида
ванадия с содержанием от 7,3 до 27%' Собщ. изготовленные плав-
лением смеси пятиокиси ванадия с сахарным коксом. Часть об-
разцов была изготовлена в вакуумной, часть — в дуговой печи.
В вакуумной печи удалось получить только малоуглеродистые
карбиды.
Авторы заметили, что температура плавления смеси повыша-
лась с содержанием углерода в сплаве.
Металлографическое исследование показало, что при содер-
жании связанного углерода, отвечающем формуле V4C3 (15% С),
сплавы были гомогенны. В менее науглероженных образцах,
кроме гомогенной фазы, присутствовала эвтектика из V4C3
и менее богатого углеродом карбида (или твердого раствора уг-
лерода в ванадии), более науглероженные сплавы содер-
жали графит. Период решетки V4C3, по данным Моретта, равен
4,15 кХ.
Карбиды ванадия
121
Моретт и Урбен обнаружили максимальную твердость по
Моосу у сплавов, по составу близких к V4C3. Это, по мнению ав-
торов, подтверждает, что карбид ванадия — химическое соеди-
нение с формулой V4C3. Следует заметить, однако, что в данном
случае точка на кривой состав — свойства, отвечающая карбиду
V4C3, не может считаться сингулярной в том смысле, как опре-
деляет акад. Курнаков, так как она лежит на границе с двух-
фазной областью, причем появление второго компонента — гра-
фита — неизбежно должно приводить к уменьшению твердости
сплава. В карбидах, полученных из пятиокиси, может содержать-
ся как кислород (при неполном восстановлении, очень характер-
ном, например, для полученного из окисла карбида титана), так
и азот (что также наблюдается в карбиде титана). Анализы на
ванадий не решают вопроса, так как точность подобных опреде-
лений невелика и по отсутствию разности в общем балансе в дан-
ном случае еще нельзя судить об отсутствии третьего компонен-
та (кислорода или азота), тем более, что в ряде случаев V 4-С ¥
=/=100%, например анализ одного из образцов показал, что
V +С = 98,8 %'.
Мауреру, Дерингу и Пулевке [214] взаимодействием пяти-
окиси ванадия с сажей удалось получить как карбид VC (с пе-
риодом решетки, равным 4,157±0,005 кХ), так и карбид V4C3
с периодом 4,152 кХ. Следует отметить, что поскольку карбиды
изготовлялись не в вакууме, полной уверенности в том, что вто-
рой карбид V4C3 не содержит азота и не может быть описан
в соответствии с представлениями Хэгга — Вестгрена формулой
V (С, О, N), работа Маурера, Деринга и Пулевки не дает.
По Давилю и Риксу [143] период решетки VC равен 4,15 кХ.
Уманский и Голованова одновременно с Маурером исследо-
вали рентгенографически серию образцов карбида ванадия
с различным содержанием углерода, изготовленных в разных ус-
ловиях из пятиокиси и гидрида ванадия (последний содержал не
больше 1% кислорода). Два образца были подвергнуты рент-
гено-химическому структурному анализу методом, примененным
ранее при исследовании карбидов титана по интенсивностям ли-
ний на дебаеграммах. Перечень образцов и результаты исследо-
вания приведены в табл. 35.
Из табл. 35 видно, что Уманскому и Головановой не удалось
получить карбида ванадия с 19% С (состав, отвечающий форму-
ле. VC), но максимальное содержание углерода в изготовленных
ими карбидах достигало 17,5% (вес.), в то время как формуле
V4C3 соответствует 15% С.
Период решетки карбида возрастал с увеличением содержа-
ния углерода от 4,147 кХ у образца с 14,9% Ссвяз до 4,159 кХ
у образца С 17,5% Ссвяз-
122
Карбиды
Таблица 35
Результаты рентгеноаналнза карбидов ванадия
Исходный материал Условия спекания Содержание, % (вес ) Период ре- шетки. kX Данные рент- геноструктур- ного анализа1
Ссвяз Ссвоб рс pv ро ру
Графитово-трубчатая печь, ток водорода, 1200°, 1 час . ... 14,6 2,1 4,152
Пяти- окись ва- То же, ток водорода, 1600°, 1 час 16,5 0,22 4,157 —
надия То же2 15,6 0,4 4,158 0,83 0,16
То же, но 2000°, 1 час .... 16,0 1.4 4,156 — —
Вакуумная печь, максимальная температура 1470°, общая выдерж- ка 29 час 4,156
Гидрид То же 17,4 0,9 4,159 — —
ванадия То же2 14,9 о.з 4,147 0,75 0,03
1 Pv > Pq и Pq —относительные числа узлов кристаллической решетки, занятых
атомами ванадия, углерода и кислорода-
2 Эти образцы были зашнхтоваиы в расчете на пониженное содержание углерода.
Как и для карбида титана, дефицит углерода по сравнению
с формулой VC покрывается в малоуглеродистом образце, изго-
товленном не в вакууме, за счет кислорода (или азота), так что
состав этого образца можно описать формулой V (С, О, N).
В малоуглеродистом образце, изготовленном в вакууме, около
25% узлов решетки, которые должны занимать углеродные ато-
мы, не были заполнены, так что область гомогенности карбида
с гранецентрированной решеткой действительно простирается в
сторону сплавов с низким содержанием углерода по крайней ме-
ре до составов, отвечающих формуле V4C3.
М. А. Гуревич и Б. Ф. Ормонт [209] исследовали систему
V — С — О методами рентгеновского и химического анализов.
При этом были обнаружены: a-фаза (УСо.ог — УСо.оз ) с перио-
дом, колеблющимся в пределах 3,016—3,013 кХ, гексагональная
Т фаза с границами гомогенности от VC0.41 Оо.о-о.ю до
VC o.5oOo.o-o,i с соответствующим изменением периодов от а —
=2,876; с ~ 4,552 до а'=2,894; с = 4,572 кХ, 6-фаза, кубическая
гранецентрированная с границами гомогенности otVC0i|5Oo,o_0,2
до VCo,63 Oo,o_0il7 и периодами от 4,115 до 4,130 кХ, е-фаза,
также кубическая гранецентрированная с периодами 4,150 до
4,160 кХ и областью гомогенности от УСо.вз Oo.o-o.is до VCo.se и
С -фаза-графит.
Карбиды ванадия
123
Обнаружен также скачкообразный переход двух кубических
гранецентрированных фаз 3 -> е без разрыва по составу, но
с разрывом в периоде решетки от 4,13 до 4,15 кХ, сходный со
скачком в системе Pd — Н между а- и ^-фазами. Данные работы
недостаточно достоверны как вследствие низкой чистоты вана-
дия, так и в связи с загрязнением образцов сплавов в вакуум-
ной установке (или за счет исходного ванадия) кислородом.
Наиболее достоверные, по нашему мнению, данные о составе и
областях гомогенности фаз в системе V — С были получены
Шенбергом [294], который приготовлял сплавы V — С наг-
реванием смесей 99,7% порошка ванадия и сажи в вакуумной
печи.
По данным Шенберга, растворимость углерода в ванадии
при 1000° составляет около 0,2% (вес.) [1 %i (атомн.)]. Растворе-
ние углерода в ванадии сопровождается увеличением периода
решетки с 3,026 до 3,037 кХ и соответственным увеличением
объема элементарной ячейки с 27,71 до 28,00 кХ3. В системе
V — С Шенбергом обнаружены две карбидные фазы — V2C и
VC. Гексагональная фаза V2C имеет область гомогенности от
VC0.3718,0% (вес.), или 27% (атомн.) С] с периодами решетки
а = 2,881; с = 4,547 кХ\ с1а=\,Ь73 до УСо.зо [10,5% (вес.), или
33% (атомн.)] с периодами о = 2,906; с = 4,597 к,Х\ с1а=Л,Ъ1Ъ.
Межатомные расстояния V — 6V = 2,83 кХ, V — 6V = 2,89 кХ,
С — 6V = 2,02 кХ по сравнению с расстоянием V — V в ванадии,
равным 2,62 кХ (восьмерная координация).
Фаза VC имеет область гомогенности от VC[15,1% (вес.),
или 43% (атомн.) С] с периодом а=4,\36кХ (V=70,75 кХ3), пови-
димому, до VCi.oot однако Шенбергу карбид состава VCi.oo полу-
чить не удалось; науглероживание было доведено до состава V(.;0.q6
[18,5%' (вес.), или 49% (атомн.) С] с а = 4,182 кХ (V = 73,14 кХ3).
Межатомные расстояния: V — 12V = 2,94 кХ и С — 6V = 2,08 кХ.
На рис. 72 показана фазовая диаграмма системы V—С по рабо-
те Шенберга.
Данные Гуревича и Ормонта о наличии двух кубических
( 8 и е ) фаз в этой работе не подтверждаются, что, повидимому,
следует отнести за счет более чистого исходного ванадия, исполь-
зованного Шенбергом.
Для приготовления карбида ванадия расчетного состава в бо-
лее или менее значительных количествах смешивают V2O5 с са-
жей, брикетируют и нагревают брикеты при 1800° в печи сопро-
тивления с графитовой трубой в атмосфере водорода [4]
При этом происходит восстановление V2O5 до V2O3 и частично
образуется карбид, содержащий 16,8—17%' общего углерода
(в том числе 0,1—1 %' Ссвоб)- Затем этот карбид подвергается на-
греванию в вакууме при 1600—1700°, после чего получают 18,5—
19%' СОбщ (0—0,5 % С свое). Еще лучше проводить предваритель-
124
Карбиды
ное восстановление V2O5 до V2O3 при 900° водородом, а затем
сразу получать карбид VC в вакууме:
V2O,+5C = 2VC+3CO.
Карбид ванадия VC химически весьма устойчив, минеральные
кислоты, за исключением HNO3, на него на холоду не действуют,
a H2S и НС1 не действуют даже при красном калении; хлор реа-
гирует с VC при температурах порядка 300—500°. На воздухе на-
чинает окисляться при 800—1100°.
Крайнер и Конопицкий [208] исследовали условия получения
карбида ванадия восстановлением V2O5 сажей при 1500° в
Содержание углерода
Рис. 72. Фазовая диаграмма системы V—С (по Шенбергу)
атмосфере водорода. Состав полученных ими карбидов и перио-
ды их решеток приведены в табл. 36.
Таблица ЗЬ
Состав и периоды решетки карбида ванадия
Содержание, % Период решетки, kX
V ^Общ ССвоб Ссвяз о
82,25 11,50 11,50 6,25 4,136
82,07 12,85 0,0 12,85 5,08 4,137
82.37 15,08 0,07 15,01 2,55 4,148
80,23 18,49 0,33 18,16 1,28 4,157
Карбиды ниобия
Как следует из этих данных, некоторые узлы углерода в решет-
ке карбида остаются незанятыми.
Убыль свободной энергии при образовании VC из металла и уг-
лерода составляет, по данным Ричардсона [210], Д F° — — 12 500 +
+ 1,6 Т (при 298—2000° К), а теплоемкость [211] С =9,18 +
+ 3,30 Ю-ЗУ — 1,96 105 Г"2 (при 298—1611° К).
На рис. 73 показана зависимость
теплоемкости VC и VN от темпера-
туры.
Данные о свойствах карбида ва-
надия помещены в табл. 42.
Рис. 73. Зависимость теплоем-
кости VC и VN от температуры
Карбиды ниобия
Карбид ниобия впервые получен
в 1876 г. Жоли.
Фридрих и Зиттиг [134] получи-
ли в 1925 г. карбид ниобия, восста-
навливая и науглероживая углем
при 1200—1600° трехокись ниобия
Nb2O3 (трехокись была получена в
результате восстановления пятиоки-
си водородом). По данным Фрид-
риха и Зиттига полученный ими
карбид содержал 11,37% С, что от-
вечает формуле NbC.
Беккер и Эберт [139] нашли в
1925 г., что изготовленный Фридри-
хом и Зиттигом карбид ниобия имеет решетку типа NaCl с пе-
риодом 4,40 кХ.
Значение плотности карбида, вычисленное Беккером и Эбер-
том на основании этих данных (8,20 г/см3), намного превышает
плотность, найденную ими экспериментально (7,56 г/см3). Мак-
Кенна {213] получил карбид ниобия с 11,37% С (т. е. точно отве-
чающий формуле NbC) кристаллизацией из расплавленного алю-
миния, который после охлаждения сплава выщелачивался.
Рентгенографическое исследование карбида, изготовленного
Мак-Кенна, подтвердило данные Беккера и Эберта о типе его кри-
сталлической решетки, но период решетки по Мак-Кенна оказался
намного больше—4,4578 кХ вместо 4,40 кХ.
Экспериментально найденная Мак-Кенна плотность карбида
7,80 г/см3 была близка к теоретической.
Маурер и др. [214] приписывают карбиду ниобия формулу
Nb4C3.
Подробное рентгенографическое исследование карбидов нио-
бия с разным содержанием углерода проведено в 1940 г. Уман-
126
Карбиды.
4,46
4,45
Ч
\ 4,44
| 4,43 •
s 4.4г-
Ч 4,41
§ 4.40
^4^-
. 4,38
<771---->- ______
О Ю 20 30 40 50
Содержание С, 7. faтоми)
Рис. 74. Зависимость периода ре-
шетки карбида ниобия от содер-
жания углерода (по Уманскому)
i
ским [215]. Порошкообразный «металлический» ниобий, служив-
ший исходным материалом, содержал около 0,6% Та, около
0,25% Ti, до 0,5%' О и около 0,4% Н. Пересчет на атомные про-
центы показал, что порошок состоял! наполовину из ниобия, напо,-
ловину из его гидрида NbH, давшего весьма заметные линии на
рентгенограмме. Гидрид разлагался при 800—900°, выделяя во-
дород.
Уманский получал карбид, прокаливая смесь порошкообраз-
ного ниобия с сажей. Из 11 исследованных образцов карбида с со-
держанием связанного углерода от 2,5 до 10,6% (вес.) 17—47%
(атомн.) 7 были изготовлены при 1200° с выдержкой 4—5 час.
в вакуумной печи при давлении 0,01—0,001 мм рт. ст., остальные
4 в печи сопротивления с графи-
товой трубой в атмосфере СО
или в токе водорода при 1400—
1500°.
Содержание углерода ни в од-
ном из изготовленных Уманским
образцов не достигало 11,4% —
количества, отвечающего форму-
ле NbC. Карбиды имели корич-
невато-серый цвет, причем корич-
невый оттенок был тем ярче, чем
богаче карбид углеродом.
При 1500° реакция науглеро-
живания металлического ниобия
практически заканчивалась в те-
чение 1 часа, при 1200°—за 3—
4 часа (очевидно, для науглеро-
живания порошков иной зернисто-
сти необходимы другие выдерж-
ки). Науглероживание в алун-
довой печи в токе водорода сопровождалось выгоранием углеро-
да^в печи сопротивления с графитовой трубой в токе водорода
ниобий интенсивно науглероживался из газовой среды; атмо-
сфера СО при 1500° являлась, повидимому, для смеси ниобия с
сажей практически нейтральной. Насыщение азотом ниобия,
смешанного с сажей, за счет азота, присутствовавшего в графи-
тово-трубчатой печи, не наблюдалось.
На рис. 74 дан график зависимости периода решетки фазы
NbC от содержания углерода. В пределах точности опыта она вы-
ражается двумя прямолинейными отрезками. На эти прямые ло-
жатся точки для образцов, полученных в различных газовых сре-
дах — в вакууме, в атмосфере СО и в атмосфере углеводородов.
Ни один из образцов не имел решетки с периодом, лежащим
между 4,434 и 4,450 кХ.
Карбиды ниобия
127
На рентгенограммах образцов, содержащих 6,4 и 7,2% С [35 и
37% ( атомн.)], присутствовали одновременно линии двух карби-
дов с периодами 4,434 и 4,450 кХ, в то время как однофазные спла-
вы этих составов должны были, в соответствии с рис. 74, иметь
периоды 4,436 и 4,440 кХ. Отсюда можно заключить, что на диа-
грамме состояния сплавов ниобия с углеродом при 1200° имеются
две области существования однородных карбидов, разделенные
двухфазной областью; ниобий при 1200° образует два карбида раз-
ных составов, но с одним и тем же расположением металлических
атомов. Первому из них, содержащему 33% (атомн.) С, можно
О ® О ® О ® О о © о • о ® о
• о © о ® о ® ©о О • О ©.
о © о ® о ® о о ♦ о • о о
Ф О Ф О Ф О Ф © О ® О ® О ®
О Ф О Ф О • О О О Ф о • о
Ф О Ф О • О Ф © о © о о ©
О Ф о Ф о © О О • о • о © о
а б
Рис. 75. Расположение'атомов в плоскости (100) кристаллической’решетки
карбида ниобия:
а —идеальная решетка; б —решетка малоуглеродистого карбида.
О—ниобий, «—углерод
приписать условно формулу Nb4C или NbsC (первая более удобна
с точки зрения систематики рассматриваемых фаз).
Второй карбид описывается предельной формулой NbC.
Большинство образцов карбида ниобия изготовлялось в вакуу-
ме из металлического ниобия, содержащего лишь некоторое коли-
чество водорода, который выделялся уже при 800—900°, и около
0,5% О, который при взаимодействии пятиокиси ниобия с углеро-
дом при 1100—1200° выделяется полностью уже за 1—2 часа. Поэ-
тому сразу же отпадает предположение, что сплавы с дефицитом
углерода по сравнению с формулой NbC могут быть твердыми
растворами карбида NbC с гипотетическими нитридом NbN или
окислом NbO, т. е. веществами, описываемыми формулой
Nb (С, О, N).
В кристаллической решетке малоуглеродистых карбидов нио-
бия имеются незаполненные (по сравнению с идеальной решеткой
NbC, изображенной на рис. 75, а) узлы (см. рис. 48, б). Это под-
128
Карбиды
тверждено данными рентгеноанализа и результатами измерений
плотности образцов карбида с 2,5; 8,8 и 10,6% С с периодами ре-
шетки соответственно 4,402; 4,454 и 4,461 кХ (табл. 37).
Таблица 37
Плотность образцов карбида ниобия с разным содержанием углерода
Содержание углерода Плотность измеренная, г/сл<8 Плотность вычисленная
% (вес.) % (атомн.) в предположении наличия незаполнен- ных узлов в решетке (рис. 74, о) в предположении замещения атомов углерода атомами ниобия (рис. 74, а)
8,8 42,8 7,6 7,66 —
10,6 48,3 7,6 7,77 —
.Третьяков получил карбид ниобия восстановлением пятиокиси
ниобия сажей в печи Таммана при 1600° в продолжение 2 час.,
т. е. при режиме, аналогичном режиму получения ТаС, разрабо-
танном Л. П. Мольковым и А. В. Хохловой [216]. Содержание
углерода, связанного в карбид, не
превышало при этом 8—9,5%.
Детальное исследование си-
стемы Nb—С проведено недавно
Брауэром, Реннером и Бернетом
[217]. Образцы сплавов готовили
из листового и порошкообразного
ниобия (чистотой соответственно
99,9 и 99,4% Nb) и карбида нио-
бия, получавшегося двукратным
Рис. 76. Фазовая диаграмма системы
Nb—С
If 0'9 0,8 07 0,6
Я тонные доли углерода в
НЬС
Рис. 77. Зависимость периода
решетки карбида ниобия от
содержания углерода
нагреванием NbOj с сажей в вакууме при 1600°, каждый раз по
два часа. Опекание смесей порошков NbC + Nb производилось
трехкратно, каждый раз также под два часа в печи сопротивления
с графитовой трубой в вакууме. Рентгеновским исследованием
этих образцов, содержавших от 0,68 до 11,40% С (табл. 38),
были обнаружены две фазы — NbsC и NbC.
Фазовая диаграмма системы Nb — С показана на рис. 76. Рас-
творимость углерода в Nb очень мала; микроскопическим исследо-
ванием она установлена равной 0,02% (атомн.). В области от Nb
до NbCo.35 расположена двухфазная область смесей а-твердого
Карбиды тантала
123
Таблица 33
Фазовый состав образцов сплавов в работе Брауэра [217]
Химический состав, % Формула Плотность, г см* Фазы по рентгенограмме
Nb С Nb+C определен-'Рассчитаи'
ная пик- нометриче- ски ная по рентгенов- ским данным
88,60 11,40 100,00 Nbci.oo — 7,82 NbC
89,97 10,07 100,04 NbC0>R7 7,78 7,74 NbC
91,44 8,49' 99,93 NbC0.72 7,77 7,74 NbC
91,91 8,10 100,01 NhCpgg — — NbC + Nb2C
92,12 7,80 99,92 ^Ь^0,65 — — NbC 4- NbjC
93,41 6,51 99,92 ^Ь^0,54 7,86 — NbC + Nb2C
93,98 5,97 99,95 Nbcjj — 7,85 Nb2C
94,36 5,46 99,82 NbC0.45 7,83 7,82 Nb2C
95,81 4,06 99,87 NbC0.33 8,00 — Nb2C + Nb
96,84 2,92 99,76 ^b^0,23 8,52 — Nb,C + Nb
99,15 0,68 99,83 NbC0,05 8,52 — NbjC + Nb
99,88 — 99,88 Nb 8,62 8,62 Nb
раствора с карбидом NbaC, область существования которого про-
стирается от NbC0>35 до NbC0>E0,T. е. от 26 до 33% (атомн.) С.
Фаза NbsC имеет гексагональную решетку с периодами, изменяю-
щимися от а = 3,1166; с = 4,945 (на нижней границе фазы) до
0=3,1191 и с,=| 4,953 кХ (на верхней границе). Фаза NbC гомо-
генна в пределах составов, отвечающих формулам NbC0 72 до
NbC 1,ооГ42—50% (атомн.)], что совпадает с данными, ранее по-
лученными Уманским. Изменение периода решетки этой фазы
внутри области гомогенности показано на рис. 77. Существование
малоуглеродистого карбида Nb4C с кубической решеткой, отмечен-
ное Уманским, не подтверждено. Область гомогенности, припи-
санная им Nb4C, соответствует области гомогенности NbaC. Дол-
жна быть совершенно отвергнута эвтектическая диаграмма уча-
стка Nb—NbC, предложенная Гольдшмидтом [120]. Карбид
ниобия NbC представляет собой серокоричневый порошок
с фиолетовым оттенком, весьма стойкий против действия кис-
лот, за исключением серной и плавиковой, а также против
окисления на воздухе (до 1100—1400°); он склонен к образова-
нию нитридов при действии на него азота или аммиака.
Свойства карбидов ниобия приведены в табл. 41.
Карбиды тантала
Карбид тантала с 6,2% С (ТаС) был получен впервые Жоли
[2] еще в 1876 г.
® Г. В. Самсонов
130
Карбиды
В 1924—1926 тт. Аркель [138] и Аркель и Боэр [175] получили
весьма чистый карбид тантала из пятихлористого тантала, осаж-
дая его на поверхности вольфрамовой нити.
'Фридрих и Виттиг [134] получили карбид тантала, науглерожи-
вая при 1200—1600° порошкообразный металлический тантал и
пятиокись тантала чТа2О5, и нашли, что абсолютная температура
его плавления равна 4000—4100°. Такие же цифры дают и после-
дующие исследователи. Аркель [138] установил, что карбид ТаС
имеет кристаллическую решетку типа NaCl с периодом, равным
4,56 кХ. Беккер и Эберт [139] тогда же нашли для образцов, изго-
товленных Фридрихом и Зиттигом, период, равный 4,49 кХ. Все
эти авторы считали монокарбид тантала химическим соединением
постоянного состава.
Работы Беккера и Эвеста [219] в 1930 г., Агте и Моэрса [136]
в 1931 г., уточнившие технологический процесс получения карбида
тантала из металла и пятиокиси, ничего нового в отношении хими-
ческого состава карбида тантала и его кристаллической структуры
не дали. Шварц и Сумма в 1932 г. вновь определили период ре-
шетки карбида тантала и нашли, что а = 4,446 кХ [141].
Чрезвычайно существенна работа Бургерса и Базарта [142],
получивших в 1934 г. образцы карбида тантала с разным содер-
жанием углерода. Они использовали для этого несколько видоиз-
мененный метод Аркеля и Боэра, прокаливая угольную нить в ат-
мосфере, состоящей из водорода и пятихлористого тантала TaClg.
У поверхности нагретой нити пятихлористый тантал восстанавли-
вался водородом и, реагируя с углеродом, образовал карбид. Про-
цесс лучше всего протекал при 2000—2500°.
Бургере и Базарт представили эту реакцию в следующем виде
2ТаС16 + 5На + 2С 2ТаС + 5С12 + 5Н2,
отметив, что, вероятно, в действительности в реакции участвовал
не углерод, >а углеводороды.
Бургере и Базарт установили прежде всего, что тантал обра-
зует два карбида ТаС и Та2С, а не один монокарбид, как считали
ранее.
Карбид Та2С (3,2 %: С) существует в двух модификациях, обо-
значенных в их работе а и р (с целью унификации мы будем обо-
значать первую рр вторую Р2); ргмодификация имеет гексагональ-
ную компактную кристаллическую решетку металлических атомов
с периодами а = 3,091 ± 0,001 кХ и с = 4,93 ± 0,007 кХ, с/а = 1,59.
Кристаллическую структуру Р2-Та2С установить не удалось.
Она, повидимому, очень сходна со структурой Р, -модификации,
так как рентгенограмма р2-Та2С отличается от рентгенограммы
рх-Та2С лишь тем, что в ней отсутствуют некоторые линии послед-
ней, а часть сохранивщихся линий ослаблена.
Карбиды тантала
131
На поверхности нити, содержавшей Та2С, Бургере и Базарт об-
наружили р2-Та2С и незначительное количество монокарбида;
после измельчения нити в порошок на рентгенограмме присутство-
вали одни лишь линии 0, -Та2С. По мнению авторов, различия
между обеими модификациями Та2С такие же, как и между двумя
модификациями W2C, открытыми Беккером [1]. С предположе-
нием Беккера, что переход одной из этих модификаций в другую
осуществляется скачком путем простых атомных перемещений без-
диффузионного типа, авторы не согласны; они считают, что пере-
ход этот происходит постепенно, путем поворотов отдельных групп
атомов вокруг оси с, ссылаясь на то, что возможность подобных
превращений показана в теории аллотропии, разработанной
Смитсом.
Мойокарбид тантала ТаС с решеткой типа NaCl способен, по
данным Бургерса и Базарта, растворять тантал вплоть до состава,
описываемого эмпирической формулой Tai,2C или ТаСо.вз)- Пе-
риод решетки монокарбида при растворении тантала уменьшается
с 4,445 до 4,39 кХ.
В 1936 г„ Мак-Кенна [24] изготовил монокарбид тантала путем
кристаллизации из расплавленного алюминия, нагретого до 2000°.
Состав этого карбида точно удовлетворял формуле ТаС.
Условия получения карбида тантала были исследованы
Л. П. Мольковым и А. В. Хохловой [216], которые для приготов-
ления ТаС назревали смесь танталового порошка (96,34% Та, ос-
тальное в основном, повидимому, ниобий) с сажей в печи сопро-
тивления с графитовой трубой в токе водорода. Оптимальным
режимом получения карбида тантала оказалось нагревание в про-
должение 2,5 час. при 1600°. При этом содержание связанного уг-
лерода достигало 6,34%,.
Так как по расчету вТаС должно содержаться 6,23%' связан-
ного углерода, то Мольков и Хохлова предположили, что карбид
ТаС способен растворять углерод; как справедливо указывают
Киффер и Шварцкопф, это Предположение неверно: карбид тан-
тала, полученный Мольковым и Хохловой, содержал в растворе
карбид ниобия.
Наиболее полное исследование диаграммы плавкости сплавов
системы Та — С было проведено Эллинджером [220], а исследова-
ние фазовых областей в твердом состоянии, периодов решеток фаз
в зависимости от содержания углерода, измерение теплоты образо-
вания и других физических свойств — В. И. Смирновой Б. Ф. Ор-
монтом [221, 222].
Эллинджер исследовал систему Та — С методами термического,
металлографического и рентгенографического анализов сплавов,
приготовленных спеканием брикетированных смесей тантала с уг-
лем или карбида тантала с танталом в высокочастотной вакуумной
печи. Построенная им диаграмма состояний приведена на рис. 78.
9*
132
Карбиды
Углерод по этим данным практически нерастворим в тантале1.
Фаза Та2С, дающая эвтектику с танталом, образуется цри 3400°
в результате перитектической реакции между ТаС и жидкой фазой
с содержанием углерода — 2,5%'. Вторая эвтектика образуется
между фазой ТаС, плавящейся конгруэнтно, и углеродом при со-
держании последнего около 10%. При 3400° ТаС способен раство-
рять до 1,2% Та, что уже ранее предполагалось Бургерсом и Ба-
зартом [142]. Смирнова и Ормонт, исследовавшие строение и гра-
ницы гомогенности карбидов тантала [221] с применением весьма
тонкой методики химического анализа и использованием прецизи-
онных измерений размера решетки, пришли к следующим выводам.
Содержание, углерода % (атомн.)
Рис. 78. Диаграмма состояний системы Та—С
Границы гомогенности гексагональной фазы Та2С (0-фаза) соот-
ветствуют формулам ТаС о,з8±о,2 до ТаС о.го • 0.02, т. е., как указы-
вают Смирнова и Ормонт, содержание 3,1% С вопреки данным
Эллинджера отвечает не нижнему, а верхнему пределу гомоген-
ности 0-фазы. Периоды решетки последней изменяются от
а — 3,1013 и с = 4,936? кХ на нижней границе до а = 3,1044 и
с = 4,9430 кХ на верхней границе фазы.
Карбид ТаС (т-фаза) гомогенен в пределах от ТаСо,58±о,оз до
TaCi.po- Практически Смирнова и Ормонт дошли в своей работе
до ТаСо.эь период решетки при Этом изменялся от а = 4,420в кХ
до а = 4,4564 кХ.
При изучении зависимости теплот, свободных энергий и энтро-
пий образования 0-и у-фаз те же авторы [222] оцределили, что в
1 См. также рдботу Кэ,-Тин-Суй [601].
Карбиды тантала
133
Таблица 39
Термодинамические характеристики карбидов тантала
Химический состав Теплосодержание Д/i0, ккал1Моль Энтропия S0, ккал моль, град Изменение свобод- ной энергии ДО0, ккал моль
ТпС 0,40 —15,500 + 9,72 —15,300
ТаС 1,00 —36,000 + 10,14 —35,700
пределах от ТаСолодб ТаСцоо эти величины изменяются следую-
щим образом1 (табл. 39).
Таким образом, с увеличением содержания углерода в фазах
теплота реакции образования ТаСх увеличивается, причем с при-
соединением каждой следующей 0,1 .атомной доли углерода тепло-
та реакции на 0,1 г-атома углерода несколько возрастает (т. е. за-
висимость = несколько отклоняется от линейной).
Резюмируем данные о системе тантал — углерод:
а) растворимость углерода в тантале, как и в других металлах
с объемноцентрированной кубической решеткой, если и имеется,
то ничтожна — за пределами точности выполнявшихся до сих пор
химических анализов;
б) тантал имеет два карбида: ТаС с абсолютной температурой
плавления свыше 4100° (фаза ?) и Та2С, температура плавления
которого не установлена;
в) область гомогенности монокарбида тантала простирается
по крайней мере до состава ТаС о,58, у карбида Та2С она лежит
в пределах ТаСо.5 — ТаСо.зв?
г) повидимому, карбид Та2С имеете две модификации: —
с гексагональной компактной решеткой металлических атомов и
структура которой не установлена; повидимому, она сходна со
структурой a-модификации; данных о том, какая из модификаций
Та2С является высокотемпературной, какая низкотемпературной,
нет; можно предполагать, что аллотропия Та2С аналогична алло-
тропии W2C;
д) в монокарбиде тантала ТаС металлические атомы образуют
гранецентрированную кубическую решетку; при предельном на-
сыщении этой фазы углеродом ее решетка отвечает типу NaCl;
е) данные о периодах решетки карбидов тантала разноречивы,
что лишь отчасти может быть объяснено разным содержанием уг-
лерода в однотипных образцах, изученных разными авторами.
Эти данные сведены в та бин. 40 и 41.
Повидимому, данные Смирновой и Ормонта наиболее надеж-
ны, поскольку в работе этих авторов применена весьма совершен-
1 Было изучено 6 сплавов, по составу лежащих между ТаСо.4 и ТаСо.89,
значения же констант для предельного состава были получены путем экстра
полиции
134
Карбиды
Таблица 40
Периоды решетки карбида тантала Та2С по данным различных авторов
Авторы ГоД опублико- вания Периоды, kX ^СВЯЗ, % (атомн,) Плотность <р, г/см3
а С
Бургере и Базарт [142] Смирнова и Ормонт [221] 1934 1954 3,031 1 3,104 [ 3,101 4,93 4,943 4,937 33,3 33,3 27,5 Нет данных То же 14,9
Таблица 41
Период решетки и плотность монокарбида тантала
(7-фаза) по данным различных авторов
Авторы Год опуб- ликования Период а, кХ Содержание Ссвяз, % (атоми.) Плотность, измеренная ср, г/см9
Аркель [138] 1924 4,56 Нет данных Нет данных
Беккер и Эберт [139] .... Фридрих и Зиттиг {134] . . . | 1925 4,49 То же 14,05
Шварц и Сумма [141] .... 1932 4,446 0 Нет данных
Бургере и Базарт [142] . . . 1934 4,45 50 То же
4,39 45
Мак-Кенна [24] 1936 4,445 50 14,51
Смирнова и Ормонт [221] . . 1954 1 4,456t ] 4,420 48 37 14,39 14,45
ная методика химического анализа и наблюдается наилучшее сов-
падение плотности, измеренной пикнометрически, с плотностью,
подсчитанной по данным рентгеноанализа. Старые работы Аркеля
и Беккера и Эберта вообще недостоверны, периоды фазы у лежат 1
внутри интервала, полученного Смирновой и Ормонтом, видимо,
отвечая образцам с меньшими содержаниями связанного углеро-
да, чем предполагали авторы. Труднее объяснить выходящее за
пределы ошибки опыта расхождение данных Бургерса и Ормонта
в отношении фазы р. Можно лишь предположить, что при темпе-
ратурах 2000—2500° область гомогенности фазы ₽ шире, чем при
той температуре, к которой относятся данные Ормонта и Смир-
новой, так что и в этом случае Бургере и Базарт получили карбид
с меньшим содержанием углерода, чем они считали.
Монокарбид тантала с трудом растворяется в кислотах, те-
ряет углерод под действием водорода и окисляется на воздухе
только при нагревании до 1100—1400° [122]. Цвет его золотистый
[24, 138]. Свойства карбидов тантала приведены в табл. 42.
Карбиды тантала
135
Таблица 4'2
Свойства карбидов ванадия, ниобия и тантала
Свойство Карбид
V2C VC Nb2C NbC ТадС ТаС
Содержание углеро- да, отвечающее фор- муле, % (вес.) . . . Область гомогенно- сти, % (атомн.) С . . 10,54 19,08 6,07 11,41 3,21 6,23
27—33,3 43—50 26—33 42—50 22—33 36—50
Кристаллическая структура (размеще- ние металлических атомов) [294] [294] [217] [217] [221] [221]
гексаг. г.ц.к. гексаг. Г.Ц.К. гексаг. Г.Ц.К.
Период решетки (для максимального содержания С), кХ:, а комп. 2,906 4,182 3,1191 4,4572 3,1042 4,456.
[2,94] [294] [217] [217] [221] [221]
С 4,597 4,953 4,941в (для ТаСо.98)
с: а 1,578 — 1,619 —
Плотность, г/см9: расчетная . . . . 5,75 5,48 7,85 7,82 14,9» 14,4,
эксперименталь- ная 5,36 7,86 7,56 14,86 14,За
Микротвердость, кг/мм* [139] 2094 [217] [217] 2055 [221] [221] 1547
Модуль упругости, кг/мм2 [44] 27600 [44] 34500 [44] 29100
Температура плав- ления, “С [223] . 2830 [223] 3500 ±125 3400(разх) [223] 3880 ±150
Температура кипе- ния, °C [134] [136] 4300 [220] 5500
Теплота образова- ния из металла и углерода— Д//°298, ккал, моль 28,0 ±10,0 [4] 33,6±0,8 17,0 [21] [4] 36,00
Теплопроводность, кал/см. сек • град . . [182] [610] 0,0340 [15]* 0,0530
Теплоемкость (298°К) кал/моль- град 10,17 [186] [186] 7,78
[210] [182]
136
Карбиды
Продолжение табл. 42
Свойство Карбид
V2C VC Nb2C NbC ТагС ТаС
Термический коэф- фициент линейного расширения (20—
2400°), %/г/ ад . . . Энтропия, кал!миль град . . Удельное электро- сопротивление (25°), — — — — — 8,2 -10~6 [1]
28,0 4-10,0 [182] — 19,0 + 8,0 [182] — 9,0+7,0 [182]
МКОМ см Термический коэф- фициент электросо- противления а • 10s (при 20—1170°), 156 [134] 74 [225] 30 [186]
%!?рад ...... Молярная магнит- ная восприимчивость — — +0,22 [226]
(от • 106 ) Точка перехода в сверхпроводящее со- — — — —. — +78 [195]
стояние, °К Термоэмиссионные Не сверх- проводник — 10,1—10,5 [197] —— 7,6—9,5
константы: эв . . — —— — — — 3,14 [196]
А, а! см* град* . . — — — 0,3 [196]
* По данным [350]— ДН°29?, 16 Для ТаС составляет 38,5±0.fi ккал/моль.
Карбиды хрома
Муассан [231] обнаружил, что Сг20з легко восстанавливается
и превращается в дубовой печи в карбид хрома Сг3С2, а при нагре-
вании чистого хрома в графитовом тигле (в газовой печи) обра-
зуется карбид Сг4С.
Фридрих и Зиттиг [134] расплавляли непосредственным про-
пусканием тока штабики, спрессованные из смеси 97 вес. ч. хромо-
вого порошка и 3 вес. ч. угля, получив карбидный материал, ца-
рапавший корунд.
Многочисленные работы были проведены по выделению кар-
бидов хрома и двойных карбидов хрома с другими металлами из
Карбиды хрома
137
легированных хромом сталей; так, из хромистых сталей были изо-
лированы карбиды Сг4С и Сг7Сз [228], из хромомарганцевых ста-
лей — Сг7С3 [229] и из хромоникелевых сталей — карбид Сг23С6
[230].
Кэмпбелл [122] получил карбид хрома неопределенного соста-
ва науглероживанием хрома из газовой фазы (метана) при 600—
800°. Сходным путем — разложением карбонила хрома в присут-
ствии водорода при 250—850° на поверхности железа Овен и
Веббер [232] получили твердые осадки карбидов хрома (Ну =
= 2000 кг/мм2), состоящие главным образом из Сг3С2.
Рис. 79. Диаграмма состояний системы Сг—С.
Наиболее удобным методом приготовления карбида хрома
Сг3С2 является углеродное восстановление Сг20з при 1600° в печи
сопротивления с графитовой трубой в атмосфере водорода [4].
При этом температура должна выдерживаться очень точно во из-
бежание образования низших карбидов (Сг4С и т. п.). Получае-
мый таким образом карбид содержит от 13,0 до 13,3% общего уг-
лерода (по расчету в Сг3С2 13,33% С), 0,2—0,3% свободного угле-
рода и 86,67%' хрома.
Диаграмма состояния сплавов системы Сг — С приведена на
рис. 79 [231]. В системе наверняка существуют три карбида —
Сг23С6(Сг4С), Сг7Сз и Ci3C2; все они образуются по перитектиче-
ским реакциям, т. е. имеют инконгруэнтные точки плавления.
138
Карбиды
Карбид Сг2зС6, которому часто приписывают формулу Сг4С,
устойчив при температурах ниже 1500°, карбид Сг7С3— ниже
1780°, а карбид Сг3С2 устойчив до температуры около 1900°.
Несколько уточнены точки плавления соединений хрома с уг-
леродом в работе Блума и Гранта {233]; полученные ими данные
приведены в табл. 43.
Таблица 43
Свойства карбидов хрома
Свойство Карбид
сгазСв СГ7С3 СГЗС2 СгС
Содержание углерода, % 5,33 9,0 13,33 18,76
Кристаллическая
структура Г.U.K. гексаг. ромбич- —
Период решетки, кХ:
а 10,638 13,98 2,821 —
ь [236] [237] [238] 5,52 11,96
с 4,523
с/а Плотность, г/слг3: — 0,324 — —
расчетная 6,99 —- 6,70 —
экспериментальная . . . 6,75 — 6,683
[66] [66]
Микротвердость (50 г), кг/мм* 9 (минера- — 1300 >2600
Температура плавления, логическая шкала) [190]
°C 1520 1680 1895 —
(разлагается) (разлагается) (разлагается)
Температура кипения, [233] [233] [233]
°C . • — 3800
Теплота образования из металла и углерода —ДН^д8 [66]
ккал/моль ......... 16,38 42,52 21,01 —
[210] [210] [2Ю]
Теплоемкость (298°К),
кал/моль • град 25,89 49,92 23,38 —
[182] [182] [182]*
Энтропия, кал/моль • град 25,3 t0,3 48,0 t0,3 20,42 ±0,05 —
[182] [182] [590]
* По данным [540], теплоемкость выше, она выражается формулой: Ср — 26,19 Т 4.
+ 9.48- 10~3 • Т—4,72 • 1 0 5 Т~2•
В литературе имеются также указания о существовании при
температурах выше 2000° карбида СгС, который при охлаждении
Карбиды молибдена
139
перитектически распадается на Сг3С2 и графит. Это было показано,
в частности, опытами Руффа и Фера [234], которые установили,
что в перегретом расплаве хрома растворяется значительное ко-
личество графита, который при охлаждении расплавов, содержа-
щих более 12,1% С, выделяется в свободной форме (содержание
углерода в СгС составляет 18,76%);
Температура, °C 1840 1960 2035 2140 2233 2348 2442 2570
Содержание С,% 12,42 13,33 13,75 13,96 14,03 14,96 16,00 17,00
Карбиды хрома, особенно Сг3С2, отличаются высокой стойко-
стью против действия кислот, не подвержены действию хлора до
900—1000° и действию кислорода воздуха до 1100—1400°. Убыль
свободной энергии при образовании карбидов хрома в интервале
298—1673° К составляет [210];
Реакция образования карбида ДР0, кал/моль
23/6 Сг + С= 1/6 Сг,3С6 ДР° = — 16380-1,54 7
7/27 Сг33Сй + С = 23 27 Сг;С3 ДР°=-10050-2,85 Т
3/5 Сг7С3 + С = 7/5 Сг3 С2 ДР° = -3200-0,20 Т
Полная сводка термических констант карбидов хрома дана
в монографии Елютина, Павлова и Левина [101].
В работе [591]обсуждаются вопросы спекания карбидов хрома.
Карбиды молибдена
Карбид молибдена Мо2С изготовил впервые Муассан в 1895—
1897 гг. [2]. В 1904 г. Муассан и Гофман [2] получили после рас-
плавления шихты, содержащей алюминий, уголь и Мо02, более
богатый углеродом карбид молибдена и приписали ему формулу
МоС (11,11%'С по расчету). В работе Вестпрена и Фрагмена [241]
исследовался карбид молибдена, изготовленный прокаливанием
смеси порошка металлического молибдена с углем и науглерожи-
ванием молибденовой проволоки из углеводородной среды. Вест-,
грену и Фрагмену удалось получить фазу, гомогенную в пределах
30—39%' (атомн.) [5—7,4% (вес.)], имеющую гексагональную
компактную решетку металлических атомов с периодами а =*
= 2,993—3,004 кХ (в зависимости от содержания углерода) и
с = 4,725 кХ. По их мнению, это вещество, подобно карбиду воль-
фрама W2C, является твердым раствором углерода в гипотетиче-
ской высокотемпературной гексагональной модификации металла.
Это предположение опроверг в 1930 г. Хойт [242], установивший,
что растворимость углерода в металлическом молибдене до самых
высоких температур ничтожна.
Науглероживая порошкообразный молибден из газовой среды
при 450—600°, Тутия [243] получил карбид Мо2С, а при 750—
800° — смесь Мо2С и МоС.
140
Карбиды
Оба карбида были изучены рентгенографически, причем ре-
зультаты исследования Мо2С совпали с данными Вестгрена и
Фрагмена, второй же карбид по расчетам Тутия имел структуру,
аналогичную структуре монокарбида вольфрама WC: в нем метал-
лические атомы составляли простую гексагональную решетку
с отношением осей с]а= 0,960.
В 1935 г. Сайкс, Ван ГорниТуккер [244] получили при иссле-
довании сплавов молибдена с углеродом три фазы: а-фазу — твер-
дый раствор углерода в молибдене с предельной растворимостью
при 1500—2000°, равной 0,09% С; ₽-фазу, содержащую при 1400—
2200° от 5,4 до 6%i С, и у-фазу, образующуюся при 2100° и содер-
жащую 12,3—13% С (т. е. более богатую углеродом, чем МоС).
Чистой у-фазы Сайкс не получил — в сплавах всегда присутство-
вал карбид Мо2С. Рентгеноанализ p-фазы подтвердил данные ра-
бот Вестгрена и Фрагмена [241] и Тутия [243], рентгенограмма же
Т-фазы отличалась от рентгенограммы богатого углеродом кар-
бида, приведенной в работе Тутия. Структуру у-фазы системы
МоС Сайкс не определил. Р -фаза образует с а эвтектику при
1,8% С. Карбид этот образуется при 2400° в сплавах с 5,5—10% С
по перитектической реакции. Область его гомогенности при 1400—
2200° лежит между 5,4 и 6% С.
Почти одновременно с Сайксом, Ван Горном и Туккером
в рентгеновской лаборатории завода твердых сплавов исследовала
кристаллическую структуру карбидов молибдена Е. Б. Ермолова,
которая подтверждает данные Сайкса о существовании двух кар-
бидов молибдена.
Ермолова обнаружила также ^появление новых, относительно
слабых, линий на рентгенограмме образцов, зашихтованных на
Мо2С и нагретых до высоких температур 1400° и выше.
Новые линии появляются около интенсивных линий Mq2C
с высокими значениями третьего индекса (103), (144), (104) и
(203). Эти линии хорошо индицируются в предположении, что но-
вая фаза 0-Мо2С (по обозначению Ермоловой) имеет ту же кри-
сталлическую решетку, что и а-Мо2С с тем же значением перио-
да а, но «/значительно увеличенным периодом с (4,722 кХ против
4,725 кХ у низкотемпературной модификации Мо2С). При этом
остальные линии фазы [3-Мо2С должны практически совпадать
с линиями низкотемпературной модификации Мо2С, так что на де-
баеграмме образцов с незначительным содержанием высокотемпе-
ратурной модификации они должны быть незаметны. Весьма ве-
роятно, что фаза р-Мо2С аналогична фазе f-W2C в системе W — С.
Вейсс и Андрие [126, 127]. использовали для приготовления
карбидов молибдена электролиз расплавленной смеси бората
натрия, соды, фторида лития и трехокиси молибдена:
Na2O • BaOs+2Na3COs 4-4,5 LiF-b( 1/2,8-1/3,5) МоО,.
Карбиды молибдена
141'
При температуре 780—800°, напряжении на ванне 2,5 в и силе
тока 20 а на графитовом катоде осаждаются блестящие кристал-
лы Мо2С, содержащие 5,9% С и 94,0%' Мо. Отношение МоО3: СО2
в этом случае составляло 1 : 5,5—1 : 7. Изменяя щелочность ван-
ны до МоОз: СО2 =1:21—1 : 28, Вейсс и Андрие получили карбид
МоС с 11,5%, С и 87,9%' Мо:
Na2O • ВО3 4-3 Na2CO3 4-6—6,75 LiF4-(l/7—1/8) МоО3.
Из ванн промежуточной щелочности (МоОз: СО2 = 1 : 8—1 : 12)
получаются смеси обоих карбидов (рис. 80).
Кэмпбелл [122] получил смеси карбидов молибдена неопреде-
ленного состава осаждением из смеси паров карбонила молибде-
на с водородом при 300—800° и
давлении газовой смеси 0,1 —
3 мм рт. ст. В аналогичных опы-
тах Ландера и Джермера [245],
проводившихся при низких тем-
пературах, был получен кубиче-
ский Мо2С (низкотемпературная
модификация), а при высоких —
обычный гексагональный Мо2С
или смесь обеих модификаций.
Хюттиг и Фаттингер [152] ис-
следовали условия приготовления
карбида молибдена восстановле-
нием молибденового ангидрида
сажей в вакууме и атмосфере во-
дорода с добавками к последней
Отношение ма03:С0г
Рис. 80. Содержание углерода в
карбидах молибдена, полученных
электролизом расплавленных сред
галогеноводородов и пропана. Полученные ими результаты при
ведены в табл. 44.
Таблица 44
Состав карбида молибдена, получающегося из шихты МоОа 4- С
при 950° в различных атмосферах
Атмосфера Общее со- держание углерода, % Содержание Освоб, % Содержание Ссвяз, % Полнота прохождения реакции, X
Н,+ 1,3% пропана . . 5,8 0,73 5,07 87,5
Вакуум Н2+НС1 (6:1,3) + 5,6 1,2 4,4 78,5
+ 1,3% пропана . . . НН-НВг (6:1,3) + 6,2 0,46 5,74 97,5
+ 1,3% пропана .... Hj+HJ (6 : 1,3) + 6,0 0,8 5,7 97
+ 1.3% пропана .... 5,9 0,15 5,75 98
142
Карбиды
Из этих данных ясно следует положительное влияние галоге-
нов, вводимых в газовую фазу, на состав и выход карбида, подоб-
ное влиянию галогенов на выход карбида титана (см. выше,
стр. 101), проявляющееся, однако, менее резко, в связи с большей
стойкостью МоО3 к галогенам по сравнению с ТЮ2.
Г. В. Самсонов, В. П. Латышева и А. М. Федорова [579] иссле-
довали диффузию углерода в молибден и установили (рентгено-
графически и химическим анализом), что диффузионный слой со-
стоит из карбида Мо2С, теплота активации при диффузии С в Мо
равна 33 400 ± 10 300 кал/моль, а уравнение температурного хода
диффузии:
16700
D = 2,26-106e~ т ’
Карбид молибдена Мо2С в достаточно крупных масштабах
приготовляют нагреванием смеси порошков молибдена и сажи в
атмосфере водорода при 1400—1500°. Получающийся при этом
карбид содержит 6,05—6,01 %'СОбщ и ~0,15% Ссвоб [4].
Таким образом твердо установлено существование двух карби-
дов молибдена: бедного углеродом Мо2С и с большим содержа-
нием углерода МоС.
Имеются не подтвержденные повторными исследованиями ука-
зания на существование еще двух карбидов: высокотемператур-
ной модификации Мо2С (Ермолова) и карбида, полученного
Тутия.
Карбид Мо2С гомогенен в значительном интервале концентра-
ций углерода [от 5,4 до 5,91% (вес.)]. Период его решетки а из-
меняется с увеличением содержания г углерода от 2,993 до
3,002 кХ, период с остается неизменным.
Второй карбид, существование которого можно считать дока-
занным, также является фазой переменного состава, так как ин-
терференционные линии с одними и теми же индексами на
дебаеграммах разных образцов, содержащих этот карбид, взаимно
смещены.
Недавно Новотный и Киффер [246] получили этот карбид
(МоС) закалкой расплавов Мо + С; аналогичные данные приво-
дит Давиль [247], приготовивший МоС спеканием смесей Мо + С
при 2000°.
В последней работе по исследованию карбидов молибдена Куо
и Хэгт указали [235], что при науглероживании молибдена окисью
углерода были получены две фазы — Мо2С (0) и МоС ( т ); при
соединении этих фаз обнаружен новый карбид, названный ими
Y -фазой. Эта фаза образуется при науглероживании при низких
температурах после 0-фазы; при нагревании ?'-фазы при темпе-
ратурах выше 800° в вакууме или в атмосфере СО она превраща-
ется в рфазу. При высоких температурах f-фаза устойчивее
Карбиды молибдена
143
•у'-фазы, а при низких температурах у-фаза менее устойчива, чем
остальные две фазы, и скорость превращения у' -> у очень мала.
Расположение атомов молибдена в у'-фазе (АА ВВ АА ВВ . . . )
является промежуточным между ₽-фазой (АВ АВ . . .) и у-фа-
зой (АА АА . . . ). у-фаза также может быть описана формулой
МоС, а ее элементарная ячейка идентична ячейке W2B6. Основные
рентгенографические характеристики0, 7, 7'-фаз системы Мо — С
по Куо и Хэггу следующие:
Периоды решетки, кХ 0(Мо2С) у'(МоС) т(МоС)
а 3,002 2,932 2,898
с 4,724 10,97 2,809
с/а 1,574 3,742 0,969
Число атомов Мо в элемен-
тарной ячейке..............2 4 1
Объем ячейки на атом мо-
либдена, кХ3 ...... 18,44 20,42 20,42
Ориентировочная диаграмма состояний сплавов в системе
Мо — С приведена по данным Сайкса и др. [244] па рис. 81.
Рис. 81. Участок диаграммы системы
Мо—С
Карбид молибдена М02С представляет темносерый порошок, на
который не действуют бескислородные кислоты, напротив, HNO-
и царская водка растворяют его. Хлор действует на Мо2С только
при высоких температурах, фтор — уже при комнатной темпера-
туре. При нагревании на воздухе, начиная с 500—800°, Мо2С окис-
ляется до МоОз. Убыль свободной энергии при образовании М02С
составляет: ДР = 4200—4,8 Т (при 298—1200° К) [182].
Карбид молибдена МоС изучен еще мало.
Свойства карбидов молибдена приведены в табл. 45.
144
Карбиды
Таблица 45
Свойства карбидов молибдена
Свойство
Содержание углерода (в макси-
мально насыщенной углеродом фа-
зе), % ................... . . .
Область гомогенности, % (атомн.) С
Кристаллическая структура . . .
Периоды решетки, кХ:..........
а ..............
с ... . ..............
с/а........................
Плотность, г/сл3:
расчетная ...................
экспериментальная ...........
Микротвердость (100 г), кг/мм* . .
Температура плавления, °C ... .
Теплота образования из металла и
углерода Д/^эв ' ккал/моль . . .
Энтропия S^98 • ккал/моль • град.
Удельное электросопротивление
при 20°, мком • см..............
Точка перехода к сверхпроводи-
мости, ° К......................
Карбид
М02С МоС
5,91 11,13
31,2—33,3 —
Гексагон альная
3,002 [248] 2,898 [248]
4,724 2,809
1,574 0,969
9,06 8,88
9,18 [241] 8,4 [241]
1479 [44] — 1500
2690120 (разл.) 2700- (разл.)
[224] [224]
—4,2 [182] —
' 19,8±3,0 [182] —
97,5 [134] 19,0 [134]
2,9 [248] 7,9 [197,198]
Карбиды вольфрама
Муассан получил в 1893 г. продукт, содержавший 3,05—
3,22% С. Этому веществу он приписал формулу W2C (расчетное со-
держание углерода в W2C составляет 3,16%). Позднее, в 1898 г.
Вильямс выделил из легированной стали монокарбид вольфрама
WC с 6J2% С.
После работ Муассана карбиды вольфрама получали сплавле-
нием вольфрама и углерода также Руфф и Вунш [2], Вестгрен и
Фрагмен [241], Беккер [1] и особенно Сайкс [252], исследовавший
систему вольфрам — углерод.
Руфф и Вунш опубликовали первую работу по изучению си-
стемы W — С. Они подтвердили существование карбидов WC и
W2C и высказали предположение о наличии в системе W — С
третьего химического соединения. У монокарбида вольфрама WC
Вестгрен и Фрагмен нашли простую гексагональную решетку
металлических атомов с отношением с/а'= 0,971 (а = 2,910 и
с'=<2,838 кХ).
Карбиды вольфрама
14Й
Беккер в 1928 г. обнаружил, что карбид W2C при 2300° испы-
тывает аллотропическое превращение. Модификация, устойчивая
при высоких температурах (p-W2C), частично сохраняется после
быстрого охлаждения сплава до комнатной температуры. Опреде-
лить кристаллическую структуру ему не удалось; несомненно, од-
нако, что она чрезвычайно похожа на структуру a-W2C, так как
линии на дебаеграмме (3-W2C отличаются от линий a-W2C лишь
•по интенсивности.
Анализ микроструктуры сплавов, содержащих около 4,3% С,
привел Беккера к заключению, что в системе W — С имеется
третье химическое соединение W3C2, испытывающее при охлажде-
нии сплава эвтектоидный распад на WC и W2C.
Наконец, Сайкс, использовавший полученные сплавлением об-
разцы для микроскопического, термического и рентгенографиче-
ского анализа, построил на основании всех предыдущих и своих
данных диаграмму состояния системы W—С (см. ниже, стр. 149).
Выделение карбидов вольфрама из их сплавов производил
Вильямс, получивший карбид WC при обработке • сплава
W — Fe — С соляной кислотой; Арнольд и Рид также выделили
карбид WC анодным растворением содержащей вольфрам стали
[2]. Вестгрен и Фрагмен [241] для рентгеновского исследования по-
лучили WC химической обработкой сильно науглероженного фер-
ровольфрама.
Получение карбидов вольфрама нагреванием смесей воль-
фрама с углем является наиболее распространенным и широко при-
меняющимся в промышленности методом. Реакции 2W + С = W2C
и W + С = WC проходят в зависимости от условий их проведения,
особенно атмосферы печи, как показывают опыты Скаупи и Бек-
кера [254, 255] (табл. 46).
Таблица 46-
Науглероживание вольфрама в различных условиях
Печь? атмосфера, режим Исходное вещество
W 2W+C W+C
, Печь сопротивления с графитовой тру- бой, 1400°, 1,5 часа . . - Печь с . вольфрамовым нагревателем, 1400?, 1,5 часа Печь с вольфрамовым трубчатым нагре- вателем, вакуум 10“4 мм рт. ст., 1400°, *>5 часа То же, вакуум 5 10~3ли< рт. ст., 2000°С, - * ' - * •» • • • • » •' С . • W2C W WC W, немного. w2c WC W, немного. W2C W, W2C, WC W2 C, WC, Ссвоб
Ю Т- В- Самсонов
146
Карбиды
Крайнер и Констанцкий [208] исследовали науглероживание по-
рошка вольфрама с различными содержаниями сажи в графито-
вой лодочке при 1400° в атмосфере водорода, причем установили,
что в пределах содержаний углерода в смеси от 5,21 до 6,72 %, об-
разуется только карбид вольфрама WC; лишний углерод, начиная
с содержания 6,17 %(, остается в качестве примеси к WC в форме
свободного графита. Еще раньше (в 1935 г.) процесс науглеро-
живания вольфрама в присутствии водорода был подробно иссле-
дован Г. А. Меерсоном [256], который показал, что определяющую
роль в процессе науглероживания играет наличие углеводородов,
образующихся за счет взаимодействия между сажей (а также ма-
териалом лодочки, трубы и т. д.) с водородом. Так как упругость
(концентрация) углеводородов над частицами сажи всегда выше
той, которая необходима для науглероживания вольфрама, то
обеспечивается перенос атомов углерода с частиц сажи на частицы
вольфрама; совершенно аналогично проходит процесс науглеро-
живания и в атмосфере окиси углерода, где перенос углерода че-
рез газовую фазу осуществляется за счет реакции
С + СО2 2СО.
Как показали гораздо более поздние опыты Хюттига и Фат-
тингера [152] по науглероживанию вольфрама при 1100° в вакуу-
ме, скорость науглероживания резко снижается, а введение в га-
зовую фазу водорода добавок пропана (9,5%) или пропана и га-
лоидоводородов резко ускоряет реакцию науглероживания и обе-
спечивает высокую степень полноты ее прохождения.
В последнее время науглероживание вольфрама как из твер-
дой, так и из газовой фаз, подробйо исследовалось Г. С. Крейме-
ром, Л. Д. Эфрос и Е. А. Воронковой [257], причем опыты с на-
углероживанием из твердой фазы проводились как в газовой ат-
мосфере, так и в вакууме. На всех образцах вольфрама (за исклю-
чением вакуумного науглероживания) было обнаружено, что диф-
фузионный слой состоит из двух фаз — WC и W2C, причем шири-
на слоя W2C в несколько раз больше, чем WC, что связано с мень-
шей областью гомогенности последнего. На основании результа-
тов этой работы был выяснен механизм науглероживания воль-
фрама, состоящий в том, что первой на образцах появляется фаза
WC, из которой углерод передаточной диффузией' переходит
внутрь вольфрама с образованием W2C. Теплота активации при
диффузии углерода в вольфраме установлена равной 112 000 ,±
± 3000 кал/г-атом; уравнение диффузии имеет вид:
__ 56000
£) = 2,5-104е г см^/сек.
Карбид вольфрама восстановлением вольфрамового ангидрида
впервые получен Муассаном [2]. Вольфрамовый ангидрид WOj
Карбиды вольфрама
смешивался с сажей в таком соотношении, чтобы углерода хва-
тало на восстановление ангидрида до металлического вольфрама
и на науглероживание последнего в соответствии с суммарными
уравнениями:
2WO3+7 C=W2C 4-6СО;
2 WO3+5'С =2WC+ 3 СО2;
WO3+4C=WCf3CO.
В этом случае влияние состава газовой фазы еще бол •> сущест-
венно, чем при науглероживании порошка металличесгэго воль-
фрама.
При получении WC в печи сопротивления с графитовой тру-
бой наиболее благоприятным оказался состав шихты WO3 + 3,1
молекул сажи, температура 1100° и продолжительность реакции
1 час [152]. Результаты опытов Хюттига и Фаттингера в различ-
ных атмосферах приведены в табл. 47.
Таблица 47
Влияние состава газовой атмосферы
на состав и выход карбида вольфрама
Атмосфера Содержание, % Степень полноты реакции» %
С общ Ссвоб Г '-'СВЯЗ
На + 0,5% пропана 6,0 1,85 4,15 69,2
Вакуум . 5,8 2,3 3,5 60,4
Н2 + НС1 (6: 1,3) + 0,5% пропана 6,3 0,66 5,64 92
На + НВг (6 : 1,3) + 0,5% пропана 6,2 0,45 5,75 92,5
Hi 4-HJ (6: 1,3)+0,5% пропана 6,05 0,1 5,95 98
Описан также [258] способ приготовления карбида вольфрама
непосредственным восстановлением вольфрамита углем (5 : 1)' при
1400° в продолжение 1 часа, с последующей отмывкой от приме-
сей смесью 14HNO3 + 44HF (в течение 1 часа при комнатной
температуре).
Способ наращивания карбидов вольфрама на металлической
нити из газовой фазы, разработанный Ван Аркелем [259], был ис-
пользован затем в ряде работ, в том числе в исследовании Лан-
Дера и Джермера [245], которые получили разложением пара кар-
бонила вольфрама карбид W2C, а также в исследовании Кэмп-
белла J122]. Последний приготовлял слои карбидов вольфрама из
смесей карбонила вольфрама с водородом при 300—800° и давле-
нии около 10 мм рт. ст.
Хэрд [260] получил WC с крупностью зерен 1—20 ц разложе-
нием карбонила вольфрама при 1000°.
ю*
(43
Карбиды.
82. Содержание углерода в кар-
Вейсс и Андриё [126, 127] разработали, метод получения кар-
бидов вольфрама электролизом расплавленных смесей бората нат-
рия, соды, фторида лития и вольфрамового ангидрида. При соот-
ношении WO3: СО2 в электролите, равном 3,3—6, на катоде осаж-
дается карбид W2C, а при WO3: СО2 >12 — карбид WC (рис. 82).
Диаграмма состояний сплавов системы W — С (рис. 83) была
построена Сайксом [252] и уточнена Нортоном. Максимальная
растворимость углерода в вольфраме при 2400° не превышает
0,05%. По Сайксу, вольфрам имеет два карбида: W2C, плавя-
щийся при 2750°, й WC, разлагающийся при 2600° в результате
перитектической реакции с образованием жидкой фазы и графита.
Карбид W2C при 2475° ./обра-
зует эвтектику с вольфрамом
(1,6% С) и при 2675° эвтекти-
ку с WC (4,5% С). Область го-
могенности карбида WC весь-
ма узка, область же гомоген-
ности фазы W2C при 2500° при-
мерно от 2,7 до 3,3% С.
По Беккеру [1], a-W2C при
2400° переходит в ₽- W2C — не-
стабильную модификацию, лег-
ко возвращающуюся к a -W2C
даже при механической обра-
ботке. Образование твердых
растворов W2C, W и WC, неви-
димому, не имеет места.
Рис.
бидах вольфрама, полученных элек-
1 тролизом расплавленных сред
Карбид вольфрама WC представляет собой серый тяжелый по-
рошок. Кислоты на него действуют медленно; так, например, он
в противоположность W2C не растворяется в смеси HNO3 + НС1
(1 : 4); устойчив против действия хлора до 400° и активно реаги-
рует с ним-только при 600—800°. Фтор действует на WC уже на
холоду;: реакция проходит энергично и сопровождается вспышкой.
При нагревании на воздухе окисляется, начиная с 500—800°,
до WO3.
WC образуется с поглощением энергии и является неустойчи-
вым соединением. -Эта неустойчивость проявляется, например,
в его перитектическом распаде при плавлении: 2WC W2C + С,
а также в способности легко растворяться в химически более проч-
ных кубических карбидах (титана, циркония, тантала, ниобия).
Убыль свободной энергии при образовании WC из вольфрама
и сажи выражается уравнением: A F° = —4000 + 0,4 Т (при 298—
2000° К), а теплоемкость Ср = 7,98 + 2,17 • Ю-3 Т (при 298—
3000° К). Кристаллическая структура WC была подробно исследо-.
вана Вестгреном и Фрагменом [241], по данным которых атомы
вольфрама образуют простую гексагональную решетку, а атомы
Карбиды вольфрама
149
углерода находятся в положениях 1/3, 2/3, 1/2, так что карбид
вольфрама состоит из двух простых гексагональных решеток, по-
мещенных друг в друга. Напротив, Хэгг принимает, что атомы уг-
лерода распределены в решетке равномерно, т. е. в элементарных
ячейках решетки WC, следующих друг над другом в направлении
оси С; координаты атомов углерода чередуются как 1/3, 2/3, 1/2 и
2/3, 1/3, 1/2 (структура никельарсенида).
Подробное исследование структуры WC было недавно прове-
дено Пфау и Риксом [262] на кристаллах, выращенных из распла-
вов WC — Ni и WC — Со (рис. 84). Эти исследования подтвердили
представления о структуре WC, развитые Вестгреном и Фрагме-
ном. На рис. 85 показана модель решетки WC по этим данным.
Процесс спекания карбида WC исследовался Агте и Вацеком
[263], которые установили, что оптимальными условиями спекания
являются: крупность зерен карбида 0,8—1,2 р., температура
1700—1800° и добавка к порошку перед прессованием 1—1,5%
пчелиного воска. Спеченный этим методом карбид вольфрама
имеет плотность 15,2 г/см3 (пористость ~ 2%), твердость 90,3
Удельное электросопротивление 0,278 ом мм2/м и предел проч-
ности при изгибе 82,5 кг/мм2.
Рис. 84. Кристаллы WC:
а —вид на базисную грань;
б — базисная грань|.и По од-
ной плоскости обеих призм:
в — сросшиеся кристаллы
WC; г-модель кристалла
WC
Рис. 85. Модель решетки WC (белые шарики — вольфрам
черные — углерод):
а — расположение атомов С в грани призмы (вид по оси а); б — расположение
атомов углерода в грани призмы (вид по оси Ь)
Карбиды вольфрама
151
Карбид вольфрама W2C устойчив против действия минераль-
ных кислот на холоду, при нагревании растворяется в HNO3.
Легко растворяется смесью HNO3 + HF (1:4). С хлором реаги-
рует при 400° с образованием WC16 и графита [264]. Фтор дейст-
вует на W2C на холоду. Кислородом воздуха W2C окисляется при
500° до WO3. Сплавы W2C — WC (эвтектического состава) имеют
высокую твердость и известны в технике под названием ликара
или рэлита.
Свойства карбидов вольфрама приведены в табл. 48.
Таблица 48
Свойства карбидов вольфрама
Свойство Карбид
W2C WC
Содержание углерода, % ..... Область гомогенности, % (атомн ) Кристаллическая структура . . . Периоды решетки, кХ: а С • . . са Плотность, г 1см3: расчетная . экспериментальная , Микротвердость, кг!мм3 Модуль упругости, кг/мм3 .... Предел прочности, кг/мм3: при сжатии при изгибе при разрыве . Температура плавления, °C . . . . Теплота образования из металла и углерода — ЛН°2д3, ккал/моль .... Энтропия S3S9a, кал/моль • град. Теплоемкость, (при 25°), ккал) моль, град Теплопроводность, кал!см- сек- град Термический коэффициент линей- ного расширения, %/град Удельное электросопротивление при 20°, мком. см ........... Точка перехода в Сверхпроводящее состояние, °К 3,16 29,8-33,3 гексаг. [261] 2,98 [261] 4,71 1,58 17,34 17,2 [252,261] 3000 [190] 42800 [223] 2750 [261] 1,2 • 10~6 [1] 11,4 • 10~6 [1] 81 [124] 125 (при 1925°) [124] 2,0-3,5 [266] 6,12 гексаг. [261] 2,900 [261] 2,831 0,971 15,77 15,5—15,7 [252,261] 1730 [44] 72200 [223] 52—56 [4] 35 [4] 35 [265] 2600 (разл.) [261] —8,4±3,0 [182] 9,0± 1,5 [182] 8,63 [182] 0,070 [186] 5,2 • 10“6(°сьа) [1] 7,3 . 10~6(°сь с) [1] 53 [134] 260 (при 1Пл) [134' 2,5—4,2 [197]
152
Карбиды
Карбиды марганца
Приготовление карбидов марганца может осуществляться раз-
личными способами [66]: восстановлением углем закиси-окиси
марганца, плавкой марганца в графитовом тигле, реакцией между
закисью-окисью марганца и карбидом кальция, науглерожива-
нием твердого марганца и т. п.
В системе Мп — С [231, 267] установлено наличие целой серии
карбидов: МщС, Мп23Се, Мп3С, Мп5С2 и Мп7С3; некоторые из них
аналогичны по составу и структурам соответствующим карбидам
хрома, .. ..
Наиболее изучен из них карбид Мп3С, имеющий ромбическую
решетку типа цементита с 12 атомами марганца и 4 атомами уг-
лерода в элементарной ячейке.
Плотность МпзС 6,89 г!см3, убыль свободной энергии при обра-
зовании из металла и углерода (ЗМп + С = Мп3С) составляет
при 298—1000° КД/70 = —33 000—0,26 Т, а при 1000—1193° К
Д F° = —5240 + 1,65 Т. Теплота образования из элементов обычно
принимается равной 25 + 2 ккал)моль. Мп3С известен в двух мо-
дификациях— а и Р; превращение »-*₽ происходит при 1310° К.
Теплоемкость а-Мп3С 25,3 ккал!моль, а ₽-Мп3С 38 ккал/моль,
теплота превращения а-> р около 3,57 ккал. Температура плавле-
ния 1520°.
Карбид Мп23Сб изоморфен Сг23С3, т. е. имеет кубическую гра-
нецентрированную решетку с z=4 и периодом а=10,564 кХ[268].
Мп7С3 кристаллизуется в гексагональной (тригональной) си-
стеме; элементарная ячейка имеет периоды а= 13,87 и с=4,53 кХ,
изоморфен Сг7С3. Атомы углерода в Мп7С3 образуют зигзагооб-
разные цепи, параллельные оси z.
Обзор данных по свойствам карбидов марганца и строению си-
стемы Мп — С дан в работе Изоле [269].
Карбиды железа
На рис. 86 показана диаграмма состояний сплавов в системе
Fe — С (для графита и цементита).
В этой системе известны два карбида — Fe2C и Fe3C.
Карбид Fe2C был обнаружен Хэггом [267] и затем подтвержден
Джеком. Этот карбид является фазой переменного состава, гомо-
генной в пределах 30,5—32,1%! (атомн.) С. Решетка Fe2C ромби-
ческая с ячейкой Fe20C9 и периодами: а = 9,04 кХ, b = 15,66 кХ
а с = 7,92 кХ.
Джек [270] наблюдал образование Fe2C при реакции СО с ни-
тридами железа при температуре ниже 500°; при более высоких
температурах образуется Fe3C. В жидком железе выше точки
плавления цементита растворимость углерода составляет от 25 до
Карбиды железа
153
33%' (атомн.) (при 2200°); при этом в жидкости образуются сна-
чала Fe3C, а затем Fe2C. Изменение свободной энергии при обра-
зовании Fe2C составляет [210]:
ДР° = 4930 —2,60 Г.
Структура карбида Fe3C определена Вестгреном и Фрагменом
[271] и Хендриксом [272], а в последнее время уточнялась рабо-
тами Липсона и Пича [273]. Fe3C имеет ромбическую ячейку с пе-
риодами: а = 4,5144 кХ, Ь = 5,0787 кХ, с = 6,7297 кХ [120]. Между
периодами ромбических ячеек Fe2C и Fe3C существуют простые
соотношения:
Яре2с ~ 2аре3с1
&Fe2C ~ 3^Fe3c;
СГе2С~1сГе3С.
Объем групп ячеек, содержащих равное число атомов, соот-
ветственно составляет: Fe2C (64 Fe + 32С = 96 1атомов) 934 кХ3
и Fe3C (72Fe + 24С = 96 атомов) 924 кХ3, т. е., как указывает
154
Карбиды
Гольдшмидт [120], уменьшение содержания углерода в Fe2C по
сравнению с Fe3C не вызывает существенного сжатия решетки.
Карбид Fe3C содержит 6,67%' С, плотность 7,67 г/см3, темпе-
ратура плавления 1650°. Fe3C является хрупким и твердым
(~860 HR), термодинамически неустойчив, образуется с очень
малым тепловым эффектом, составляющим при 20° от + 1,43 [274]
до — 2,5 [120] ккал!моль.
Изменение свободной энергии при образовании карбида же-
леза Fe3C в зависимости от температуры составляет [210]:
ДЕ°(298 — 463°К) = + 6200 — 5,53 Т;
ДГ°(463 —1115°К) = +6300 — 5,92 Т;
ДЕ°(1115 — 1808°К) = + 2475 — 2,43 Т;
а энтропия 5298 = 4,93 ± 1,33 ккал/моль • град.
Еще в 1933 г. В. И. Зюзин и С. С. Штейнберг [275] высказали
предположение, что при низкотемпературном (ниже 250—300°)
отпуске мартенсита закаленной стали выделяется не цементит,
а углерод или метастабильный карбид железа, превращающийся
в цементит при 250—350°. Основанием для такого предположе-
ния было отсутствие изменения магнитного насыщения низкоот-
пущенной стали при кратковременном ее нагревании до 215°,
т. е. до точки Кюри цементита. После отпуска на 300—350°
сталь проявляла нормальные магнитные свойства, т. е. ее насы-
щение при нагреве до 215° падало.
Термические и дилатометрические измерения П. А. Грузина,
Г. В. Курдюмова и Р. И. Энтина [276] подтвердили представление
о выделении при низкотемпературном отпуске метастабильной фа-
зы, которая при повышении температуры превращается в цемен-
тит. По данным А. Б. Апаева [277], этот метастабильный карбид
испытывает магнитное превращение лишь при 265°.
М. П. Арбузов и Г. В. Курдюмов [278] в 1940 г. на рентгено-
грамме образца низкоотпущенной стали при нагреве под закалку
представлявшего собой монокристалл аустенита обнаружили об-
условленные карбидной фазой интерференционные максимумы.
Эти максимумы не совпадали с рефлексами, присущими цементу.
После нагрева на достаточно высокую температуру (300—450°)
на рентгенограмме возникала нормальная диффракционная кар-
тина цементита. Сходные данные были получены в дальнейшем
И. В. Исайчевым [279]. Поскольку выделить и проанализировать
метастабильный карбид низкоотпущенной стали не удавалось, Ар-
бузов и Курдюмов приписали ему условную формулу Fex С.
Е. И. Онищик и Я. С. Уманский [280], по опубликованным экс-
периментальным данным Арбузова и Курдюмова и Исайчева,
нашли, что метастабильный карбид имеет компактную гексаго-
нальную решетку металлических атомов, т. е. является фазой
Карбиды никеля
155
внедрения, аналогичной е-фазе системы Fe — N. Сопоставив пе-
риоды решетки метастабильного карбида с периодами решетки
е-нитрида с разным содержанием азота и учтя разницу атомных
радиусов углерода и азота, Онищик и Уманский пришли к за-
ключению, что метастабильный карбид по химическому составу
очень близок к цементиту (если не совпадает с ним). Пластинча-
тые образования метастабильного карбида при соблюдении опре-
деленной ориентировки по отношению к кристаллам отпущенно-
го мартенсита очень хорошо удовлетворяют принципу «структур-
ного и размерного соответствия» Крнобеевского-Данкова. По-
этому решетки обеих фаз сопряжены между собой, что и обус-
ловливает самую возможность появления метастабильного кар-
бида (цементит может сопрягаться с a-фазой лишь при условии
сильнейшей упругой деформации, что и затрудняет его появле-
ние при низкотемпературном отпуске).
Превращение метастабильного карбида в цементит связано с
нарушением сопряженности решеток, а результатом этого нару-
шения являются коагуляция карбидной фазы и резкое изменение
механических свойств стали.
Представления Онищика и Уманского о структуре метаста-
бильного карбида низкоотпущенной стали были подтверждены
рентгенографическими и электронографическими исследованиями
Джека [281], Кэлиана и Кльюза [282] и др., назвавшими эту фазу
е-карбидом (по аналогии с е-нитридом). М. П. Арбузов [283]
установил, что карбид, выделенный электролитически из отпущен-
ной при низких температурах стали, имеет нормальную структуру
цементита. Однако это не опровергает данных о существовании
е-карбида. При растворении металлической фазы устраняются
термодинамические причины наличия метастабильного карбида и
он может бездиффузионным путем превращаться в более стабиль-
ный цементит.
Карбиды никеля [120]
В жидком никеле растворяется около 6,4%' С (атомное соот-
ношение Ni3C); карбид никеля образуется в жидкой фазе и явля-
ется неустойчивым (по данным Брайнера и Синглера [284], отно-
сительно устойчив при температурах от 300 до 1600°).
Бэр и Шмидт [285, 286] получали Ni3C науглероживанием ни-
келя при 250°; этот карбид разлагался при 380—420°. Якобсон и
Вестгрен [137] рентгеновским анализом установили, что Ni3C имеет
гексагональную плотноупакованную структуру, в отличие от дан-
ных Кольхааса и Мейера [287], которые сообщали о наличии
у Ni3C ромбической цементитной структуры. На самом деле Ni3C
имеет, повидимому, гексагональную структуру с периодом решет-
ки по Бредигу и Бергкампфу [288] а = 2,66 кХ, с/а =1,61, что
близко к значениям, установленным ранее Вестгреном и Якобсо-
156
Карбиды
ном (а = 2,646 кХ, с]а=\,&>§). Теплота образования ЬПзС со*
ставляет — 9,2 ккал/моль [66]. Изменение свободной энергии при
образовании карбида никеля из никеля и углерода ДЕ° (298—
1000° К) = + 8110—1,70 Т [210]. Ориентировочная диаграмма
состояний системы Ni—С показана на рис. 87 [120].
Карбиды кобальта1
Из приведенной на рис. 88 [289] диаграммы начальной области
системы Со — С следует, что в твердом кобальте при нормальной
температуре растворяется 0,1%', при 1000° —0,33% и при 1300° —
0,82% углерода [289], однако Хашимото [290] наблюдал раство-
Рис. 87. Диаграмма со-
стояний системы N1—С
Рис. 88. Диаграмма состоя-
ний системы Со—С
римость около 1,1% С в кобальте при эвтектической температуре
(1315)°. При 2415° в жидком кобальте (давление 30 мм рт. ст.)
растворяется около 7,4%' С [28% (атомн.)]. Эвтектика образуется
между a-твердым раствором и карбидом С03С при содержании С,
равном 2,4%.
О наличии в системе Со — С одного метастабильного карбида
Со3С впервые сообщили Шенк и Клас [291], то же было установ-
лено Руффом и Кейлигом [292]. Мейер [293] наше, что структура
Со3С аналогична структуре цементита с периодами а = 4,52,
Ь = 5,08 и с = 6,73 кХ.
Бэр и Ессен [295] сообщили о существовании второго карбида
Со2С; этот же карбид обнаружил и Хофер и Пибл [296].
Этот карбид образуется при науглероживании кобальта при
218°; он весьма неустойчив. Джек [270] считает, что решетка Со2С
. 1 Некоторые сведения о карбидах кобальта приводятся в работах
[297, 298].
Сложные карбиды
157
аналогична решетке Fe2C, однако окончательных сведений о струк-
туре Со2С нет. Изменение свободной энергии при образовании
СО2С из металла и углерода в интервале 298—1200° К состав-
ляет: 3950 ± 2,08 Т [210].
Сложные карбиды
Взаимодействие карбидов с гранецентрированной кубической
решеткой металлических атомов
В 1931 г. Агте и Альтертум [299] построили линии плавкости
для бинарных сплавов NbC — ТаС, NbC — ZrC, ТаС — ZrC и
ТаС—НЕС.
Хотя на кривых плавкости для систем ZrC —- ТаС и HfC — ТаС
были обнаружены максимумы, однако на снятых Беккером дебае-
граммах всех этих сплавов имелись ли-
нии одной только фазы, на основании
чего Агте и Альтертум утверждают,
что все четыре исследованные ими си-
стемы содержат непрерывные ряды
твердых растворов.
Беккер указывает, что период ре-
шетки твердого раствора с 80% (мол.)
ТаС и 20% ZrC равен 4,55 кХ, а у эк-
вимолярного сплава — 4,63 кХ. Эти
цифры, хорошо согласующиеся с дан-
ными Беккера для чистых карбидов
тантала и циркония, были опровергну-
ты в последующих работах.
Л. П. Мольков и И. В. Виккер
[300] получили дебаеграммы ряда
сплавов VC—TiC. На всех дебаеграм-
мах были линии одной только фазы:
сплавы TiC—VC образуют, следова-
тельно, непрерывный ряд твердых
Рис. 89. Периоды кристал-
лической решетки сложных
карбидов (по Ковальскому
и Уманскому)
растворов.
А. Е. Ковальский и Я. С. Уманский [301] исследовали рентгено-
графически сплавы ТаС — TiC, ТаС — ZrC, NbC — TiC и
NbC — ZrC. Они подтвердили данные Агте и Альтертума о неогра-
ниченной взаимной растворимости карбидов ТаС—ZrC и
NbC — ZrC и установили, что карбиды ниобия и тантала образуют
непрерывные ряды твердых растворов также с карбидом титана.
Непрерывный ряд твердых растворов с линейным изменением пе-
риода решетки образуют по Нортону и Моури [302] TiC и ZrC.
Однако процесс образования твердых растворов в этой системе
идет крайне медленно.
Периоды решетки исследованных Ковальским и Уманским
твердых растворов линейно зависят от содержания компонентов
158
Карбиды
(рис. 89). Периоды решетки сплавов с 80% (мол.) ТаС и 20%'ZrC
и с 50%' ТаС и 50% ZrC равны, по данным Уманского и Коваль-
ского, 4,49 и 4,55 кХ (вместо 4,55 и 4,63 кХ по Беккеру). ZrC и
VC по Нортону и Моури [302] почти не растворяются друг в дру-
ге. Введение в эти сплавы карбида титана [303] увеличивает об-
ласть однофазных твердых растворов.
Итак, почти все исследованные до сих пор бинарные сплавы
изоморфных тугоплавких карбидов с гранецентрированной куби-
ческой решеткой металлических атомов образуют непрерывные
ряды твердых растворов.
Взаимодействие карбидов, имеющих гранецентрированную
кубическую решетку металлических атомов, с карбидом
вольфрама
Агте и Альтертум [299] построили линии затвердевания для
систем W2C — ТаС, W2C— NbC (рис. 90). На этих кривых
Рис. 90. Линии солидус для систем W2C—ТаС и W2C—NbC
(по Агте и Альтертуму)
имеются минимумы: при 10% (мол.) ТаС и около 20% (мол.) NbC.
Эти минимумы отвечают, видимо, эвтектикам, образуемым твер-
дыми растворами W2C в ТаС и NbC с твердыми растворами ТаС
и NbC в W2C. На микрофотографиях эквимолярных сплавов
ТаС — W2C и NbC—W2C, быстро охлажденных после плавления,
можно различить две фазы, на рентгенограмме сплава с 80%' ТаС
имелись линии одной только фазы с кристаллической решеткой
карбида тантала. Таким образом, по данным Агте и Альтертума,
ТаС растворяет по крайней мере до 20% (мол.) W2C. Раствори-
мость карбидов тантала и ниобия в W2C, судя по составу эвтек-
тики, незначительна.
Анализируя особенности процесса плавления смесей W2C и
ZrC, Агте и Альтертум заключают, что карбиды эти не смешива-
ются в жидком состоянии.
Температуры плавления этих смесей следующие:
Содержание ZrC, % (мол.) 0 50 80 100
Температура плавления °К 3130 3130 3130 3805
Сложные карбиды
159
Работа Альтертума и Агте лишь в незначительной степени
освещает вопрос о взаимодействии карбида W2C с карбидами,
имеющими гранецентрированную решетку металлических ато-
мов. Остается неясным, есть ли в изученных ими системах двой-
ные карбиды с кристаллической решеткой, отличной от решеток
компонентов, определены ли сколько-нибудь точно границы вза-
имной растворимости карбидов в твердом состоянии.
Рис. 91. Микрофотография сплава с 82% W, 15% Та
и 3% С (по Ковальскому и Уманскому)
А. Е. Ковальский и Я. С. Уманский [301] установили, что ли-
той сплав, содержавший 82% W, 15%' Та и 3% С, состоял из фа-
зы с кристаллической решеткой ТаС и незначительного количества
эвтектики W2C— ТаС. Микрофотография этого сплава приведена
на рис. 91. Карбид тантала ТаС растворяет, следовательно, около
80% W2C. Сопоставляя эти данные с кривой затвердевания, по-
строенной Агте и Альтертумом, можно наметить контуры диа-
граммы плавкости ТаС — W2C (рис. 92). Очевидно, такой же вид
имеет и диаграмма NbC — W2C. Сходна с ними и диаграмма
Рис. 93. Пробная диаграмма TiC—W2C:
в —Бабич и Чапорова; б —Новотный с сотрудниками
Сложные карбиды
161
TiC — W2C, которую можно построить на основании микроско-
пических исследований Бабича и Чапоровой (рис. 93) и рентге-
нографического и термического исследований Новотного и др.
(рис. 93, б) [304].
Взаимодействие карбидов, имеющих гранецентрированную
кубическую решетку металлических атомов, с монокарбидом
вольфрама
В 1934 г. Л. П. Мольков и И. В. Виккер [300] обнаружили, что
на дебаеграммах сплавов карбида ванадия с монокарбидом воль-
фрама WC, изготовленных спеканием при 1900°, линии, отвечаю-
щие решетке WC, появлялись, лишь когда содержание карбида
вольфрама превышало 50,5% (мол.) [70%! (вес.)]; при меньших
содержаниях WC на рентгенограммах присутствовали одни лишь
линии карбида ванадия. Таким образом, по данным Молькова и
Виккер, карбид ванадия растворяет при 1900° до 50,5 %! (мол.)
монокарбида вольфрама. По тем же данным, в карбиде титана
при 2000° растворяется до 58%: (мол.) [82% (вес.)] монокарбида
вольфрама. Заметной растворимости TiC и VC в WC Мольков
и Виккер не обнаружили. Не обнаружили они в обеих системах
и каких-либо тройных фаз с кристаллической структурой, отлич-
ной от структуры спекаемых карбидов.
В 1939 г. Мак Кенна [24] описал запатентованный им метод из-
готовления сложного титановольфрамового карбида, содержащего
по 50%' (мол.) WC и TiC. Карбид изготовлялся кристаллизацией
из расплавленного никеля после четырехчасовой выдержки при
2000° и последующего вытравливания никеля смесью азотной и
соляной кислот.
Мак Кенна утверждал, что полученный им карбид является хи-
мическим соединением состава TiWC2 и дал даже его структур-
ную формулу, дающую представление о характере гипотетических
химических связей между атомами этого соединения:
с. Сх
ТГ ЧУ : ЧТ
W W
В этой формуле черта означает ионную, а точка — гомеопо-
лярную (или металлическую) связи.
Мак Кенна приводит ряд доводов в пользу своего утвержде-
ния, важнейшие из них следующие.
1. Выделенный из сплава карбид имел состав, отвечающий
формуле TiWC2 даже при повышенном содержании вольфрама, из-
Ч Г. В Самсонов
162
Карбиды
быточный вольфрам в процессе вытравливания никеля окислялся
до WO3.
2. Карбид TiWC2 обладал специфическими химическими свой-
ствами, в частности, необычайно высокой химической стойкостью.
Первый довод кажется убедительным, если не вспомнить, что
по данным Молькова растворимость WC в TiC при температурах
около 2000° близка к 50% (мол.), так что твердый раствор WC в
TiC, выкристаллизовывающийся при этих температурах из рас-
плавленного никеля, должен по составу отвечать формуле TiWC2.
Неубедителен и второй довод: эквимолярные твердые растворы
WC в TiC, изготовленные спеканием и содержащие всегда ряд
примесей, в частности, растворенные кислород и азот, также весь-
ма устойчивы по отношению к травителям, а высокая чистота
сложного карбида, полученного Мак Кенна из жидкой фазы,
должна повысить его химическую стойкость. Характерно, что Мак
Кенна, широко пользующийся в своих работах методами структур-
ного рентгеноанализа, никаких данных о рентгеноанализе химиче-
ского соединения TiWC2 не приводит. Он патентует не способ при-
готовления сложного карбида, а введение в твердый сплав откры-
того им химического соединения.
В 1940—1941 гг. взаимодействие монокарбида вольфрама с
карбидами, имеющими гранецентрированную кубическую решет-
ку, исследовали рентгенографически Уманский и Голованова (си-
стема VC— WC), Уманский и Петрусевич (WC — ZrC), Уман-
ский и Хидекель (система WC — TiC) [305], Ковальский и Уман-
ский [301] (системы WC — ТаС и WC— NbC).
Авторы изготовляли серии сплавов различного состава путем
спекания в течение 1—3 час. при температурах, близких к темпе-
ратуре перитектического разложения монокарбида вольфрама
(2600°). Сплавы после спекания быстро охлаждались, тем самым
фиксировалось состояние, отвечающее температуре спекания. Как
будет показано ниже, при этой температуре растворимость моно-
карбида вольфрама достигает максимума, с понижением темпе-
ратуры она падает.
Методом Престона или Страуманиса определялись периоды
кристаллической решетки кубической фазы сплавов и для каждой
системы строились по методу Агеева и Закса графики, выражаю-
щие зависимость периода а решетки твердого раствора от содер-
жания WC, а = /(WC). Концентрация, цри которой наклонная ли-
ния a = f(WC) переходила в прямую, параллельную оси абсцисс,
отвечала переходу от однофазных к двухфазным сплавам, т. е.
насыщению твердого раствора.
При длительном отжиге сплавов с высоким содержанием моно-
карбида вольфрама при различных температурах пересыщенный
твердый раствор распадался с выделением избыточного монокар-
бида вольфрама. Концентрацию твердого раствора после распада,
Сложные карбиды
163
т. е. границу растворимости при температуре отжига, определяли
по графику а = f (WC), измерив предварительно период решетки
этого твердого раствора.
При выполнении работ обращалось особое внимание на при-
ведение сплавов в равновесное состояние.
На рис. 94 даны графики, по которым определялись границы
растворимости монокарбида вольфрама в карбидах ниобия, тан-
тала, титана и циркония; на рис. 95 построены эти границы. На
той же диаграмме нанесена и граница растворимости монокарби-
да вольфрама в карбиде ванадия, построенная менее точным ме-
тодом фазового рентгеноанализа.
Точность построения отдельных точек кривых, выражающих
зависимость растворимости от температуры, изменялась в этих ра-
ботах от 2—3% (мол.) при температурах 1500—200001 до 7—8%;
при 2500—2600°. Источниками погрешности были неточность в из-
мерении периода решетки (величина весьма незначительная) и
неточность в определении температур спекания и отжига, играв-
шая основную роль. Максимальная растворимость, взятая безот-
носительно к температуре, определялась для каждой системы
с точностью до 2—3%| (мол.).
Применяя тот же метод Агеева и Закса, Ковальский и Уман-
ский [301] построили границы растворимости монокарбида воль-
фрама в сплавах карбидов ниобия и титана, взятых в отношени-
ях 10—90 (рис. 96, вертикальный разрез А см. концентрационный
треугольник рис. 97), 35:65 (разрез Б), 50:50 (разрез В),
65:35 (разрез Г) и 80—20 (разрез Д).
Для каждого из исследованных вертикальных разрезов системы
NbC — WC — TiC граница растворимости определялась так же,
как и для двухкомпонентных сплавов. Это было допустимо в связи
с тем, что в двухфазных сплавах твердый раствор NbC — TiC —
WC всегда находился в равновесии с практически чистым моно-
карбидом вольфрама (растворимость карбидов ниобия и титана
в WC ничтожно мала). Поэтому горизонтали на вертикальных
разрезах совпадали с линиями конод и состав твердого раствора
NbC — TiC — WC в двухфазной области не изменялся при пере-
мещении вдоль этих линий. Кривые, по которым определялась
растворимость, приведены на рис. 96.
Построенные Ковальским и Уманским изотермы растворимости
даны на концентрационном треугольнике (рис. 97).
Сходную картину получил для системы WC — ТаС Киффер
1 Для сплавов ZrC — WC эта погрешность могла достигать 3—5% (в сто-
рону преувеличения растворимости) в связи с нитрацией образцов при отпуске,
уменьшавшей периоды решетки.
11*
Сложные карбиды
165
На рис. 95 и 97 видно, что карбид вольфрама весьма значи-
тельно растворяется в карбидах с гранепентрированной кубиче-
ской решеткой металлических атомов, особенно при высоких тем-
пературах [до 60—65_%_(м-ол.) в ZrC, до 75—80% вЪСи NbC;
........” понижением температуры раствори-
85% в VC и 94 %! в TiC]1. С
мость сильно падает [до 7—
16% (мол.) в ТаС, NbC и
ZrC и до 45% в VC и TiC].
Область гомогенности твер-
дого раствора с кубической
решеткой в описанных здесь
системах тем шире, чем бли-
же атомный радиус метал-
ла, образующего карбид-рас-
творитель, к радиусу воль-
фрамового атома (табл. 49).
В большинстве случаев
различие в растворимости
WC особенно заметно при
низких температурах (7 —
15% в ТаС, NbC и ZrC вме-
сто 45—50% в VC и TiC).
Однако чрезвычайно высо-
кий атомный радиус цирко-
ния сказывается на раство-
римости WC в карбиде цир-
95. Растворимость монокарбида
Рис.
вольфрама в карбидах с кубической ре-
шеткой
Таблица 49
Атомные радиусы карбидообразующих металлов
и предельные значения растворимости карбида вольфрама
Металл Карбид „ 1 Радиус металличес- I Раствори- мость в кар- биде при 1500°, % (мол )
Атомный радиус в А для чистого металла в пересчете на коор* Авиационное число 12 кого атома в карбиде, определенный из рас- чета, что радиус углеродного атома о равен 0,77 А Максимальная раствори- мость, % (мол )
V VC 1,36 1,31 85—90 45
W WC 1,41 1,34 — —
Ti TiC 1,45 1,3/ 80-92 50
Та ТаС 1,46 1,43 75—80 7
Nb NbC 1,47 1,44 75—80 15
Zr ZrC 1,60 1,58 60—65 13
1 Количественные данные о растворимости WC в TiC, полученные Трен-
том с сотрудниками [307] и Меткафом [308], незначительно отличаются от дан-
ных Уманского и Хидекеля и различаются между собой. Вопрос о том, какие
данные наиболее надежны, неясен. Поэтому мы ограничиваемся диаграммой
Уманского и Хидекеля.
Периодрешетки, кХ Перио3petlJemf,lJi
4.34
4.32'
430
428
4.26
4.24
422,
О 10 20 30 40 50 60 70 80
Содержание МС'/.(мол)
Содержание WG % (мол.)
в
Содержание WG(k (мол)
Содержание wo,{мол )
А
Рис. S6. Зависимость периодов решетки сложных карбидов от содержа-
ния в них монокарбида вольфрама (по Ковальскому и Уманскому):
A—NtC :11С- 10:90; В—NbC : Т,С = 35 : 65; В-NIC : ГС - 50 : 50; Г — NbC : Т.С-
- 65 : 35; Д — NtC : TiC = 80:20
I
Сложные карбиды
167
кония (по сравнению с растворимостью этого карбида в ТаС и
NbC) и при высоких температурах (60—65% вместо 75—80%).
Растворимость карбида вольфрама в сплавах со сложными ти-
танониобиевыми карбидами, как видно на рис. 97, плавно снижа-
ется по мере увеличения содержания карбида ниобия. Это сниже-
ние особенно заметно при низких температурах.
На рис. 98, а сопоставлены кривые, изображающие зависи-
мость периода решетки сложных карбидов от содержания в них
карбида вольфрама. Период решетки карбида ванадия по мере
насыщения его карбидом вольфрама растет, во всех остальных
сплавах увеличение содержания WC вызывает уменьшение пе-
риода решетки. Ход кривых вполне согласуется с тем, что воль-
WG
Рис. 97. Изотермы растворимости WC в сложных титанониобиевых карбидах
(по Ковальскому и Уманскому) (а) и в сложных титанотанталовых карбидах
(по Кифферу) (б)
фрамовый атом больше ванадиевого и меньше, чем атомы ти-
тана, тантала, ниобия и циркония.
При экстраполяции всех кривых к содержанию WC, равному
100% (гипотетический монокарбид вольфрама с гранецентриро-
ванной кубической решеткой металлических атомов), период ре-
шетки делается равным 4,20—4,24 кХ.
Карбид вольфрама растворяет при 2300—2500° до 6—8%
(мол.) карбида ванадия, до 1—2% карбидов ниобия и тантала и
менее 1 % карбида титана. При насыщении карбидом ванадия пе-
риод а решетки WC уменьшается с 2,899 до 2,895 кХ, при раство-
рении карбидов ниобия и тантала увеличивается до 2,901 кХ\
в сплавах WC — TiC изменение периода решетки монокарбида
вольфрама не превышает 0,0005 кХ. Новотному с сотрудниками
[304] удалось уловить незначительные изменения периодов решет-
168
Карбиды
ки WC в сплавах с TiC, но количественных данных эти авторы не
сообщают.
С понижением температуры растворимость всех карбидов в WC
уменьшается, и при 1700—1800° практически уже отсутствует.
При изучении сплавов WC с ТаС и NbC [301] были проведены
некоторые 'наблюдения над величиной кристаллов твердого рас-
твора WC в ТаС и NbC.
Рост зерен в процессе спекания наблюдается, начиная с тем-
ператур 1500—1600°; при 1800° зерна сильно укрупняются, при-
чем размер зерен увеличивается с содержанием WC в твердом
растворе.
Рис. 98. Периоды кристаллической решетки твердых растворов WC
(а) и Мо^С (б) в карбидах с кубической .решеткой (по Ковальскому
и Уманскому)
Два однородных образца, одинаковых по составу, но спечен-
ных при разных температурах, имели зерна практически одной и
той же величины. Отсюда можно заключить, что рост зерен твер-
дого раствора происходит преимущественно за счет растворения
карбида вольфрама.
При отжиге, сопровождающемся выделением WC из пересы-
щенного твердого раствора, зерна последнего дробятся. Так, на-
пример, после двухчасового отжига эквимолекулярного .сплава ве-
личина зерен твердого раствора уменьшилась с 10—30 р до ме-
нее 1—о чем можно было судить по исчезновению точек на ли-
ниях дебаеграммы. Дробление зерен твердого раствора вызывает-
ся, очевидно, напряжениями, возникающими в них в результате
выпадения кристаллов монокарбида вольфрама. Напомним, что
Сложные карбиды
169
в металлических сплавах искажения решетки кристаллов твердого
раствора, вызванные выделением второй фазы в процессе старе-
а
в
Рис. 99. 'Микрофотографии сплавов
Та—W—С, отожженных при 2000°
(по Ковальскому и Уманскому):
а — отжиг в течение 15 мин.— середина
образца; б — то же. край образца; в—от-
жиг в течение 2 час.
ния, являются одной из причин дисперсионного твердения этих
сплавов.
Измельчение кристаллов твердого раствора в результате рас-
пада заметно и на микрофотографиях литых сплавов W — Та — С
с 82% (вес.) W, 15% Та и 3% С (рис. 99). Микрофотографии
170
Карбиды
рис. 99 характеризуют также кинетику распада пересыщенных
твердых растворов WC в карбидах с кубической решеткой: 15-ми-
нутный отжиг при 2000° не вызывает распада внутри образца, у
края образца распад заметен.
Таким образом, процесс распада имеет инкубационный период,
продолжающийся при 2000° около 15 мин. По данным рентгено-
анализа, инкубационный период при снижении температуры до
1750° возрастает до получаса, при 1600° — до часа, при 1350° рас-
пад незаметен даже после 24-часового отжига, несмотря на гро-
мадное пересыщение твердого раствора.
При отжигах, продолжительность которых лишь немного пре-
вышала инкубационный период, карбид вольфрама выделялся в
крайне дисперсной форме, о чем можно было судить по большой
ширине линий этой фазы на рентгенограммах.
Измельчение зерна твердого раствора, обусловленное его рас-
падом, наблюдали на сложном титановольфрамовом карбиде
[60% (мол.) WC и 40% TiC] В. П. Львовская и Я. С. Уманский
[309] (рис. 100).
На начальной стадии распада титановольфрамового карбида,
когда вторая фаза (WC) еще не видна на микрофотографии и
зерна твердого раствора заметно не дробились, Львовская и Уман-
ский обнаружили усиление линий рентгенограммы твердого рас-
твора. Такое усиление можно объяснить лишь тем, что высокодис-
персные выделения WC, невидимые под микроскопом, вызывают
образование внутризеренной так называемой мозаичной структу-
ры кристаллов твердого раствора. Каждый кристаллит при нали-
чии мозаичной структуры состоит из связанных между собой бло-
ков, повернутых друг относительно друга на весьма малые углы
(в несколько минут). Выявить мозаичную структуру под свето-
вым микроскопом обычно не удается.
Возникновение мозаичной структуры представляет собой, оче-
видно, начальную стадию дробления кристаллитов твердого рас-
твора, обусловленного выделением второй фазы.
Особо следует остановиться на проведенном Уманским и Хи-
декелем рентгенографическом исследовании взаимодействия моно-
карбида вольфрама с малоуглеродистым карбидом титана, содер-
жащим кислород и азота [305]. Исследовались три серии сплавов,
изготовлявшихся путем двухчасового спекания при 1600° (печь со-
противления с графитовой трубой, ток водорода). Для сравнения
в тех же условиях прокаливались образцы исходного карбида ти-
тана. Периоды решетки исследованных образцов нанесены на
график (рис. 101).
На графике видно, что период решетки исходного карбида ти-
тана после прокаливания уменьшался. Это указывало на уменьше-
ние содержания связанного углерода в карбиде, обусловленное,
повидимому, насыщением, азотом.
Сложные карбиды
17’
Периоды решетки твердых растворов карбида вольфрама
в карбиде титана, как видно на рис. 101, были больше периодов
решетки прокаленных образцов исходного карбида титана, в то
время как растворение WC в высокоуглеродистом карбиде титана
при 2500—2600° вызывает, как указывалось ниже, уменьшение пе-
Рис. 100. Микрофотографии сложного титановоль-
фрамового карбида. X 1500 (по Львовской и Уман-
скому):
а — после спекания при 23 00°; б — после спекания при
2300°» последующего отпуска при 1600° 1 час
риода решетки последнего. Разница между периодами решетки
твердого раствора WC в высокоуглсродистом и малоуглеродистом
карбидах титана уменьшалась по мере увеличения содержания
WC и при 60—70%, (вес.) WC [30—40% (мол.)] периоды решетки
твердых растворов WC в малоуглеродистом и высокоуглероди-
стом карбидах титана практически совпадали. Отсюда можно бы-
172
Карбиды
ло заключить, что растворение карбида вольфрама в малоуглеро-
дистом карбиде титана сопровождалось дополнительным науглеро-
живанием последнего. Это науглероживание должно сопровож-
даться выделением азота и кислорода, растворенных в малоугле-
родистом карбиде титана (кислород должен выделяться В соеди-
нении с углеродом в форме СО); атомы азота и кислорода долж-
ны освобождать места в кристаллической решетке для атомов уг-
лерода.
Проверить результаты рентгеноанализа методами химического
анализа не представлялось возможным, так как по мере раство-
рения WC в TiC стойкость сплавов по отношению к кислороду
резко возрастала, сплавы
при проведении анализа в
аппарате Вюрца не сго-
рали до конца и резуль-
таты анализа были совер-
шенно неудовлетворитель-
ны: данные анализа одних
и тех же образцов на
углерод отличались на
2-3%.
Дополнительное науг-
лероживание малоуглеро-
дистого карбида титана
могло идти или за счет
свободного углерода (са-
жа), или за счет углеро-
да газовой среды, или за
счет углерода, содержа-
щегося в нерастворившем-
Рис. 101. Периоды кристаллической ре-
шетки твердых растворов WC в малоугле-
родистом карбиде титана (по Уманскому и
Хидекелю)
ся монокарбиде вольфра-
ма. Для проверки этого предположения Уманский и Хидекель
спекли в вакууме при 1500° и давлении около 3»10~ 3 мм рт. ст.
шихту, содержащую 15% (вес.) малоуглеродистого карбида ти-
тана [с 13,1% (вес.) С связ при полном отсутствии свободного
углерода и азота] и 85%' (вес.) WC. При спекании происходило
обильное выделение газа (очевидно, СО), приводившее к резкому
повышению давления в вакуумном сварочном аппарате (до 0,5—
1 мм рт. ст.), несмотря на непрерывную откачку газа вакуумным
агрегатом, состоявшим из масляного и двухступенчатого диффу-
зионного насосов. Анализ снятой с этого образца дебаеграммы по-
казал, что сплав содержал насыщенный раствор WC в TiC и кар-
бид вольфрама W2C. Весь монокарбид вольфрама, не вошедший в
твердый раствор, в процессе дополнительного науглероживания
карбида титана, сопровождавшего образование твердого раство-
ра, декарбонизовался до W2C.
Сложные карбиды
173
Уманский обнаружил также, что выделение газа (и, очевидно,
дополнительное науглероживание) происходит при растворении
Монокарбида вольфрама в малоуглеродистом карбиде циркония.
Процесс протекает столь интенсивно, что выделяющиеся газы вы-
брасывают пробки из угольных патронов, в которых набита смесь
карбидов.
Дополнительное науглероживание малоуглеродистого карбида
титана при растворении в нем карбида вольфрама играет весьма
важную роль при спекании титановольфрамовых твердых сплавов.
Сложные карбиды с гранецентрированной кубической решеткой
металлических атомов, содержащие молибден и хром
В цитированной выше работе [300] Мольков и Виккер устано-
вили, что карбид ванадия растворяет при 1600° до 85%' (вес.)
Мо2С (соотношение между количеством атомов молибдена и ва-
надия, равное 3: 1); в карбиде титана при 1700° растворяется до
70% (вес.) Мо2С (Мо : Ti = 2 : 1).
Ковальский и Уманский исследовали рентгенографически ли-
тые сплавы карбида молибдена с карбидами ниобия, тантала, цир-
кония, титана и ванадия. По данным химического анализа, содер-
жание связанного углерода в этих сплавах в пересчете на карбид
молибдена составляло 35—40% (атомн.), так что по составу они
лежали на разрезах МолС — А1еС соответствующих тройных
диаграмм, где Me обозначает Та, Nb, V, Ti, Zr, а х равен прибли-
зительно 1,5.
Все сплавы содержали одну только фазу с гранецентрирован-
ной кубической решеткой металлических атомов, хотя в системе
Мо — С такая решетка не встречается. Решетка эта сохранялась
во всех пяти системах при 90 % (мол.) Мо^-С.
Период решетки этой фазы для всех систем (исключая Мо^С —
VC) уменьшался с увеличением содержания карбида молибдена
(рис. 98, б). Кривые, выражающие зависимость периода решетки
от содержания МохС при экстраполяции на 100% Mo^C, стреми-
лись к а 4,18 — 4,22 кХ.
Попытки вызвать разложение этих сплавов путем длительного
(до 10—12 час.) отжига при 1700—2000° не дали положительных
результатов; сплавы оставались однофазными, периоды решетки
твердых растворов не изменялись.
Отсюда можно заключить, что громадная растворимость кар-
бида молибдена в кубических карбидах сохраняется и при пони-
жении температуры до 1700—2000°, в отличие от растворимости
карбидов вольфрама, резко падающей с уменьшением температу-
ры. Но возможно, что распад не происходит из-за затруднений
кинетического характера.и что на самом деле растворимость МолС
в карбидах с кубической решеткой с понижением температуры
падает.
174
Карбиды
Кривые на рис. 98 хорошо иллюстрируют изложенное в гл. I
представление о склонности фаз внедрения к «концентрационной»
аллотропии. Очевидно, богатые WC или МожС сложные карбиды
с кубической решеткой можно считать особыми модификациями
этих соединений, неустойчивыми в отсутствии примесей (TiC,
ZrC, ТаС, NbC или VC). Величина 4,24 кХ характеризует период
решетки такой неустойчивой модификации монокарбида вольфра-
ма, а 4,20 кХ — карбида молибдена.
Л. П. Мольков и И.
Рис. 102. Гипотетическая диа-
грамма состояния T1C-WC
В. Виккер [300] установили, что карбид
титана растворяет при 1600° около
40% карбида хрома (Сг3С2). При этом
образуется, очевидно, дефектная ре-
шетка, так как углерода уже не хва-
тает на заполнение всех октаэдриче-
ских промежутков. По данным Трента е
сотрудниками [307], растворимость кар-
бида Сг3С2 при 1700—1800° превышает
40%, с понижением же температуры
она резко убывает.
Рюдигер [88] (рис. 102), изучавший
взаимную растворимость карбидов хро-
ма, титана и вольфрама, обнаружил,
что WC не растворяет ни TiC, ни
Cr3C2, a TiC, напротив, растворяет и
WC и Сг3С2. Микротвердость тройных
карбидных сплавов оказалась макси-
мальной (4300 кг]мм2) в области ~ 56% (вес.) TiC, 23% WC
и 21 %' Сг3С2.
Микротвердость сложных карбидов со структурой
внедрения
При выборе карбидной основы для новых твердых сплавов
весьма важно знать твердость этой основы. В связи с этим
А. Е. Ковальский и Л. Л. Петрова [44] детально изучили микро-
твердость многочисленных сложных карбидов со структурами
внедрения (для систем TiC — ТаС, TiC — ZrC, TiC — NbC, VC —
NbC, ZrC — TaC, ZrC — NbC, NbC — TaC, TiC — WC, VC — WC,
TaC — WC, NbC — WC, ZrC — Mo2C, VC — Mo2C, NbC — Mo2C,
TaC —Mo2C).
На рис. 103 приведены некоторые характерные кривые зависи-
мости микротвердости сложных карбидов от состава.
В ряде случаев (например, в сплавах TiC — ZrC, VC — ТаС,
VC — WC) микротвердость изменяется в соответствии с правилом
Курникова по кривым с четко выраженными максимумами. Сле-
дует отметить, что и в этих случаях максимальная твердость слож-
ного карбида превышает твердость более твердого карбидного
a
проценты
в
Весовые проценты
^лярные проценты
Рис. 103. Микротвердость слож-
ных карбидов ТаС—WC (я),
NbC—WC (б), TiC—WC (в),
TiC—ZrC (г), NbC—TiC (б),
VC—ТаС (е), М02С—NbC (ж)
[44J.
проценты
176
Карбиды
компонента не выше, чем на 30—35%' (системы VC — ТаС и
VC — WC), в то время как твердые растворы металлов имеют
иногда твердость, в 3—5 раз превышающую твердость компонен-
тов (например, в системе Ti — Сг). В некоторых же случаях рас-
творение любого количества менее твердого карбида вызывает
уменьшение твердости сплава (например, в системах NbC — TiC,
NbC —WC, NbC —M.o2C).
Незначительный относительный прирост твердости при образо-
вании сложных карбидов (а порой и полное отсутствие прироста и
даже падение твердости) объясняется высокой степенью исполь-
зования сил связи в фазах внедрения при пластической деформа-
ции последних. Статические искажения решетки в сложных кар-
бидах не могут значительно увеличить сопротивление пластической
деформации, не могут заметно вырасти при образовании сложных
карбидов и без того чрезвычайно значительные силы межатомного
взаимодействия.
Как видно на рис. 103, наибольшую твердость (около
3100 кг/мм2), лишь в полтора раза ниже твердости карбида бора,
имеют сплавы TiC с 25% (мол.) ZrC.
Взаимодействие карбидов с тугоплавкими металлами
и металлами железной группы
Данные в этой области весьма не полны. Изучено в основном
лишь взаимодействие карбида титана с рядом металлов, построе-
ны изотермические разрезы диаграмм Ti —W — С и Ti — Та — С,
а также отдельные области диаграмм состояния вольфрам — ме-
талл железной группы — углерод.
Изучая взаимодействие карбида титана с вольфрамом, Бабич
и Чапорова не обнаружили сколько-нибудь заметной раствори-
мости карбида титана в вольфраме, в то время как карбид титана
растворяет при 2300° примерно 30% (атомн.) W.
Новотный и др. [304], подтвердив отсутствие растворимости
карбида титана в вольфраме, установили, что при 1900° карбид
титана растворяет до 13%' (атомн.) вольфрама (см. бинарный
разрез на рис. 104).
А. Н. Зеликман [310] показал, что в соответствии с правилом
Гщртлера1 разрез Ti — WC системы Ti — W —С не является псев-
добинарным: при взаимодействии титана с монокарбидом воль-
фрама происходит предельное возможное науглероживание титана
за счет углерода, содержащегося в WC. Эти данные хорошо со-
впадают с отмеченным выше наблюдением Уманского и Хидекеля
[305] над взаимодействием малоуглеродистого карбида титана, с
* Согласно правилу Гюртлера, вытекающему из теории гетерогенных рав-
новесий, в трехкомпонентиой системе два пересекающихся между собой верти-
кальных разреза не могут являться одновременно псевдобинарными.
Постоянная решетки, кХ
IV
Рис. 104. Псевдобинар-
ный разрез TiC—W [304]
Рис. 105. Вертикальный разрез Ti—WC диаграммы
Ti—W—С [304]
Г. В.Самсонов
178
Карбиды
WC (в их опыте карбид титана насыщался почти до предела
углеродом за счет перехода WC в W2C).
Новотный и др. [304] подтвердили эту особенность диаграммы
Ti — W — С. Построенный ими разрез приведен на рис. 105.
На рис. 106 дается сводная схема равновесных реакций в систе-
ме Ti — W — С по Новотному, Партэ, Кифферу и Бенезовскому.
Растворимость молибдена в карбиде титана незначительна
[не выше 5—8%' (атомн.) при 1700—1800°]. Присутствие свобод-
ного углерода по указанной выше причине увеличивает раство-
Ti-W-ПС
Ti-ne n-w
Чяня^Лнар
Ti-W-TiC
(тройная)
W-Wp-TiC
w-w^-тх
W2C-C-TfC
W-Tic Kr-HJC W-W0-TX
(кЯаиЛнарГЛная (тройная)
£s~2S50'
WtW-fTIC
Wtc-Tx
(KtMuiii-
jsats&L-
E4~2600'
ж=иы>тк:
Tfc-c t^e-^-7x
(тройная)
--------
X*TiC
3K‘VK*tx
rV-c
(оинар-
naff)
V^600'
ж-W+WfC
•fl-7)'
VslTSD
lXtTX‘
I'pTl
w
р-тьп-а-Ъ
ft-Ti'trtfTIC
IflPfT,0-17^-77
F™1*? WfTlCHt-Ti
WCX-fTiC HV*VfC^nt
Рис. 106. Схема равновесных реакций в системе Ti—W—С [304]
римость молибдена [0,1%' свободного углерода увеличивает рас-
творимость молибдена примерно на 2% (вес.)1.
Карбид титана растворяет примерно до 5—16%' (атомн.) хро-
ма (при 1600°); при наличии 0,1%' (вес.) свободного углерода
растворимость увеличивается примерно на 1 %' (вес.) благодаря
образованию карбида хрома Сг?Сз [163, 166].
Мак Муллен и Нортон исследовали, систему Ti — Та — С [311].
На рис. 107 приведен изотермический разрез диаграммы состоя-
ния Ti — Та — С при 1820°. Как видно из этой диаграммы, куби-
ческий карбид (8-фаза) занимает обширную область, простираю-
щуюся, сужаясь от стороны Ti — С к стороне Та — С. Однофаз-
ная область гексагонального карбида (у-фаза, ТагС )весьма мала;
этот карбид может содержать в себе лишь незначительное количе-
ство титана. Очень велик трехфазный треугольник, отвечающий
Сложные карбиды
совместному равновесию обоих карбидов с металлической ₽-фазой,
сложным твердым раствором углерода, титана и тантала с объем-
ноцентрированной кубической решеткой.
Переходим к взаимодействию карбидов, являющихся фазами
внедрения, а также монокарбида вольфрама с металлами желез-
ной группы.
Эдвардс и Райн [312] исследовали смеси карбидов с металлами
группы железа после шарового размола, прессования и плавле-
ния в высокочастотной вакуумной печи с последующей гомогени-
зацией при 1250° в течение суток и закалки в воде. Растворимость
С
/а,7.(атомн.)
Рис. 107. Изотермический разрез диаграммы
состояния Т1—Та—С при 1820®
карбидов в связующих металлах определялась методами рентге-
новского анализа и изучения микроструктур.
Растворимость карбидов в металлах группы железа при 1250°
по их данным колебалась в пределах 22—0,5%' (табл. 50).
Таблица S0
Растворимость карбидов в железе, кобальте и никеле при 1250е
Металл Растворимость карбидов, X
WC TiC WC — TiC TaC NbN Mo4C v4cs CrgCg
Со 22 1 2 3 5 13 6 12
Ni 12 5 5 5 3 8 7 12
Fe 7 <0,5 0,5 0,5 ' 1 5 3 8
12*
180
Карбиды
Следует отметить, что растворимость монокарбида вольфрама
в, кобальте по Эдвардсу и Райну значительно выше, чем по дан-
ным других исследователей. Наименьшей растворимостью в желе-
зе отличается карбид титана; очевидно, растворимость твердого
раствора WC — TiC в железе почти также мала. Повидимому,
именно вследствие пониженной растворимости в железе твердые
сплавы на основе WC — TiC обладают повышенными режущими
свойствами. Как правило, растворимость велика для всех систем,
способных давать после спекания прочные, беспористые брикеты.
Растворимость карбида титана в железе в образцах, медленно
t.T
Рис. 108. Вертикальный разрез Т1С—Ni диаграммы
состояния Ti—Ni—С (по Стоверу)
охлажденных с температуры 1500°, не превышает 0,05%'
[163, 164, 165].
Диаграмму состояния псевдобинарной системы TiC — Со по-
строили Броунли и Рейн [312]. По их данным, карбид титана об-
разует с кобальтом эвтектику, плавящуюся при 1270° [91%
(атомн.) СО]. Карбид титана растворяет при этой температуре до
11 %' (атомн.) кобальта, кобальт — до 4% (атомн.) Ti + С. С по-
нижением температуры взаимная растворимость компонентов па-
дает, делаясь исчезающе малой при 800° (0,08% ).
Разрез TiC — Ni тройной системы Ti — Ni — С [314] не явля-
ется псевдобинарным: на этом разрезе имеется обширная трех-
фазная область (а-твердый раствор на основе никеля + TiC + гра-
фит), простирающаяся при 1200° от 93 до 19% (атомн.) Ni
(рис. 108). Между 93 и 96% (атомн.) Ni лежит двухфазная об-
ласть а+ графит. Здесь проявляется хорошо известная склон-
ность никеля вызывать при взаимодействии с карбидами графито-
Сложные карбиды
181
образование. Очевидно, сплавы, по составу лежащие на разрезе
TiC — Ni, не могут быть высокопрочными. Для придания проч-
ности этим сплавам необходимо добавлять какой-либо карбидооб-
разующий металл (например, хром, вольфрам и молибден), либо
вводить малоуглеродистый карбид титана, что приведет к смеще-
нию сплава с разреза TiC — Ni.
Исследованию диаграмм состояния сплавов Мо — Fe — С,
W — Fe — С, W — Со — С и W — Ni — С посвящено большое ко-
личество работ [315 и 316]. Хотя полных диаграмм состояния по
существу здесь еще нет, но ряд важных особенностей взаимодей-
стия этих компонентов установлен.
Мо,°/> (вес)
Рис. 109. Изотермический разрез диаграммы состоя-
ния Мо—Fe—С при 1200° (Такеда)
На диаграмме состояний системы Мо — С — Fe, построенной
Такеи [32], отмечен сложный железомолибденовый карбид, суще-
ствующий в довольно широком интервале концентраций. Он обра-
зуется перитектически по реакции: жидкость + Мо?С = <о и участ-
вует в распаде аустенита по реакции: 7 + со = Fe.,C 4-а (рис. 109).
Подобный же сложный карбид был обнаружен Такеда [50, 61]
в системе W — C(Fe3C) — Fe. По мнению Такеда, карбид этот ме-
тастабилен в отношении WC подобно тому, как Fe3C метастабилен
в отношении графита. Сечение Fe3C — W этой системы найдено
Такеда квазибинарным (рис. ПО). Я. С. Уманский и Н. Т. Чебо-
тарев [318] показали, что в действительности квазибинарным яв-
ляется разрез WC — Fe, а сплавы разреза Fe3C — W могут со-
держать как карбид WC, так и сложные карбиды железа и
вольфрама.
Изучая рентгенографически структуру сложного карбида желе-
за и вольфрама, Вестгрен [317] приписал ему формулу Fe3W3C.
182
Карбиды
Такеда построил также [62] ориентировочную диаграмму со-
стояний Со — С — W, использовав методы магнитного, дилато-
метрического, рентгеновского, термического и микроскопического
анализов. Он установил, что в этой системе перитектически обра-
зуется сложный немагнитный карбид ц типа Fe3W3C, являющийся
метастабильной фазой. Процессы, протекающие в системе
Со — С — W, могут описываться при быстром охлаждении мета-
стабильной диаграммой (сплошные линии на рис. 111), а при мед-
ленном охлаждении -* стабильной (пунктирные линии там же).
Метастабильной фазе соответствует стабильная фаза WC.
Рис. 110. Изотермический разрез диаграммы со-
стояния цементит—вольфрам—углерод при 1200е
(Такеда)
Отметим, что метастабильность ^-фазы, наблюденная Такеда,
видимо, вызывалась науглероживанием образцов атмосферой пе-
чи, поскольку, по данным более поздних работ, фаза эта устойчи-
ва [316].
Бабич, Гарьянов и Кислякова, изучавшие систему Со—С—W
на металлокерамических образцах металлографическими и рент-
геноструктурными методами, пришли к выводам, что тройных
фаз, лежащих по составу в треугольнике Со—WC—С, не суще-
ствует, три тройные фазы: гомогенная в широком интервале
концентраций, 7)2, гомогенная в узком интервале концентраций
и t]s, границы гомогенности которой авторы не устанавливали,
лежат в треугольнике Со—WC—W. Растворимость WC в кобаль-
те, по их данным, достигает 10%; сплавы WC с кобальтом
Сложные карбиды
183
образуют эвтектику при содержании 37% WC. Подобно Такеда,
Бабич с сотрудниками также обнаружил, что при быстром
охлаждении сплавы кристаллизуются по метастабильным рав-
новесиям с образованием -т]-фаз, а при медленном — с образо-
ванием монокарбида вольфрама и графита. Отжиг переводит ме-
тастабильно остывшие сплавы в стабильные. При средних скоро-
стях охлаждения сплавы содержат и стабильные и метастабильные
фазы. Фазы т], и т], по расположению металлических атомов ана-
логичны карбидам быстрорежущей стали. Автору указали на
наличие подобных фаз в системах Ni — С — W и Fe — С — W.
Раутала и Нортон [316] построили диаграмму состояний
W — С — Со методами металлографического и рентгеноструктур-
ного анализа. Спеченные после холодного прессования в атмосфе-
ре аргона образцы охлаждались со скоростью 300 град/мин. Были
найдены три тройные фазы тр 0 и х. На представленном на рис. 112
изотермическом разрезе этой диаграммы при 1400 видно, что
т]-фаза гомогенна в интервале 7—20% С и 38—47%' Со. Таким об-
разом, область гомогенности т]-фазы покрывает обе обнаруженные
ранее [79] фазы т и rf (т], и ?]i), являющиеся, по мнению Раутала
и Нортона, модификациями одной и той же фазы в предельном
насыщении кобальтом и вольфрамом. 0-фаза, гомогенная в весь-
ма узком интервале концентраций (2%), изображается формулой
Co3W6C2 и имеет кубическую гранецентрированную решетку с пе-
риодом 11,25 кХ. Структура 6-фазы подобна, по мнению Нортона
и Раутала, структуре ^-фазы, определенной Е. Н. Кисляковой
[85]. Периоды т)- и 0-фаз близки, отличны лишь интенсивности
диффракционных максимумов, х-фазе, гомогенность которой огра-
ничена 1 %, Раутала и Нортон приписывают гексагональную струк-
туру с периодами а = с = 7,848 кХ и формулу C03W10C4. Анало-
гичные фазы с теми же стехиометрическими формулами и струк-
турами присутствует в системах Ni — W — С и Fe — W — С.
Весьма важным отличительным признаком системы Со — W — С
является наличие узкой области сосуществования жидкой фазы с
монокарбидом вольфрама вплоть до высоких содержаний ко-
бальта.
Равновесия, приводящие к образованию тройных фаз, проте-
кают перитектически. Они приведены ниже с присущими им тем-
пературами:
х = W,C + W + жидкость, 1865—1895*;
6 = х + Wжидкость, около 1700*;
7] ». 0 4- W 4- жидкость, около 1600°.
Весьма существенным является наличие в системе Со — W — С
двух рядов превращений, зависящих от скорости охлаждения спе-
ченных сплавов. При достаточно быстром охлаждении при 1357°
происходит метастабильное превращение т + жидкость = р + WC,
соответствующее превращениям промышленных сплавов. На
Сложные' карбиды
185
рис. 113 дан вертикальный разрез метастабильной диаграммы
W — С — Со, на который ложатся промышленные твердые сплавы
А, содержащие 18%) (атомн.) Со в качестве связующего. Как вид-
но из разреза, сплавы эти, состоящие при комнатной температуре
из фаз ₽ + WC, проходят при охлаждении от температур спекания
через состояние WC + •») + жидкость, т. е. выделяют хрупкую
iq-фазу.
При достаточно медленном охлаждении превращение жид-
кость + i) = 3 + WC исчезает, уступая место превращению жид-
с
W,7o(amoMn.)
Рис. 112. Изотермический разрез диаграммы состоя-
ния W—Со—С при 1400° (по Нортону и Раутала)
кость + WC = т] + С. Медленно остывшие сплавы содержат, таким
образом, хрупкую, снижающую прочность сплава фазу а двух-
фазное поле сосуществования Р и WC, занимавшее в метастабиль-
ной диаграмме значительные области, исчезает.
Следует также отметить, что благодаря существованию слож-
ных карбидов разрезы Fe — W2C, Со — W2C и Ni — W2C (а в
диаграмме Fe — W — С также W — Fe3C) и при быстром охлаж-
дении не являются псевдобинарными. При взаимодействии с желе-
зом, кобальтом и никелем карбид вольфрама W2C разлагается
с образованием монокарбида вольфрама WC и сложной карбидной
фазы т]. Это существенно ограничивает химический состав карбида
вольфрама, применяемого для производства твердых сплавов. Если
карбидный порошок содержит связанного углерода меньше, чем
186
• Карбиды
это отвечает формуле WC, т. е. если порошок является смесью
WC и W2C, то при спекании образуется фаза связывающая часть
кобальта, и сплав становится более хрупким из-за уменьшения ко-
личества пластичной цементирующей связки. Так как избыток уг-
лерода приводит к снижению прочности и стойкости инструмен-
С*/, fatnoMH.}
Рис. 113. Вертикальный разрез диаграммы состоя-
ния W—Со—С для промышленных твердых спла-
вов, содержащих 18% Со (по Нортону и Раутала):
7 — С+ж; 2 —С + ж + WC; 3 — С 4-₽ 4-WC; 4 —WC-Ьж;
5 — р + Ж + WC; 6 —р 4- WC; 7 —ж 4- WC 4-у; 8 — ж 4-WC4-3;
S> —ж + WC + ij; 10 — 3 + i) + WC; 11 — ж 4-’x; /2 —ж + /+0;
13 — ж 4-0; 13 — ’1 + WC; 15 — ж + y +W; 16 — ж 4-0-j-W;
17 — ж -i-l + W; 18 — ,14- 0 4- WC; 19 — in 4- 0; 20 — ti 4- 04-W;
21 — ч + W; 22 — jk4-t) + W; 23 — ж + 0 4-W; 24 — 0 4-W;
25 —n;0 4-W; 26 —ж 4- W
tob из твердых сплавов, допустимое содержание углерода в кар-
биде вольфрама имеет и совершенно четкий верхний предел. Та-
ким образом, особенности диаграммы состояния W—Со — С
определяют технические условия на химический состав карбид-
ного порошка, применяющегося для изготовления твердых спла-
вов на основе WC (сплавы В К).
Сложные карбиды
187
На рис. 114 приведен вертикальный разрез WC — Со метаста-
бильной диаграммы состояния W — Со — С. Этот разрез не явля-
ется псевдобинарным, поскольку он содержит трехфазные области
р-кобальт + жидкая фаза + WC и жидкая фаза + углерод+ WC.
Однако в отличие от разреза TiC—Ni полностью закристал-
лизовавшиеся сплавы свободного углерода не содержат. Учиты-
вая графитизирующее действие никеля, проявляющееся даже при
взаимодействии со столь стойким соединением, как карбид тита-
на, следует ожидать, что на вертикальном разрезе WC—Ni трой-
ной системы W—Ni—С, как и на разрезе TiC—Ni, имеется трех-
фазная область: металлический твердый раствор + карбид + гра-
Рис. 114. Вертикальный разрез WC—Со трой-
ной диаграммы W—Со—С (по Нортону и
Раутала)
фит. Этим, видимо, объясняется то, что доброкачественные сплавы
на основе WC с никелевой связкой удается получить лишь при
некоторой нехватке углерода в карбидном порошке (по сравне-
нию со стехиометрическим составом WC). Поскольку нижний пре-
дел допустимого содержания углерода в карбиде в сплавах с ни-
келем ограничивается появлением сложного карбида *), химиче-
ский состав карбида, вводимого в сплавы с никелем, должен быть
регламентирован гораздо жестче, чем для сплавов с кобальтом.
Кроме того, так как состав карбида может изменяться при на-
греве во время спекания, для сплавов с никелем необходимо очень
тщательно подбирать и соблюдать условия спекания, в частности,
предохранительные засыпки.
В заключение рассмотрим структуру и данные о составе слож-
ных карбидных фаз tq, и т]а в системах вольфрам (молибден) —
i 88 Карбиды
—------।----------------------------------------------------
углерод — металл железной группы (структуры фаз 9 и X по
обозначению Нортона и Раутала до конца не расшифрованы).
Размещение металлических .атомов в этих фазах было опреде-
лено Вестгреном [317], исследовавшим в 1933 г. структуру двойного
карбида железа и вольфрама, выделенного из быстрорежущей
стали.
Поданным Вестгрена, химический состав карбида быстрорежу-
щей стали колеблется в пределах, отвечающих формулам Fe3W3C
и Fe4W2C.
Карбид имеет кубическую кристаллическую решетку с 96 ме-
таллическими атомами на элементарную ячейку.
Рис. 115. Размещение металлических атомов в положениях комплексов
из 48 (/) и 32 (е) эквивалентных точек решеток карбидов т] и т/ в преде-
лах '/а элементарной ячейки
Число атомов углерода в ячейке двойного карбида равно, по
Вестгрену, шестнадцати.
В карбиде Fe3W3C атомы вольфрама (48 на каждую элемен-
тарную ячейку) размещены в вершинах углов октаэдров (по 6 на
каждый октаэдр) , причем центры октаэдров образуют решетку ти-
па алмаза. На рис. 115, изображающем */4 элементарной ячейки
сложного карбида, показаны три таких октаэдра с центрами в точ-
ках О и Oi (например, октаэдры ABCDEF или AxByCyD.lEl
Октаэдры эти мы будем называть в дальнейшем основными.
Из 48 атомов железа 32 сидят в вершинах 8 тетраэдров, центры
которых также образуют решетку .алмаза, смещенную по отноше-
нию к решетке алмаза, образованной центрами основных октаэд-
ров, на 7а телесной диагонали куба.
На рис. 115 показаны два таких тетраэдра abed и avbxc\d\,
расположенных в ’/4 элементарной ячейки.
Сложные карбиды
189
На рис. 115 точки, отвечающие центрам октаэдров, обозначены
буквами О, центры тетраэдров— буквами Т.
Разметив атомы в вершинах октаэдров и тетраэдров, легко об-
наружить 16 свободных промежутков, каждый из которых нахо-
дится между парой взаимно параллельных граней двух соседних
тетраэдров (центр одного из таких промежутков обозначен на
рис. 115 буквой е). В этих промежутках находятся остальные
16 атомов железа.
При некотором избытке числа атомов железа по сравнению с
числом атомов вольфрама (т. е. при отступлении состава карбида
от формулы Fe3W3C по направлению к Fe4W2C) лишние атомы
железа размещаются статистически в вершинах октаэдров, частич-
но замещая атомы вольфрама.
Определить методами структурного анализа местоположение
атомов углерода, слабо рассеивающих рентгеновы лучи, в решет-
ке сложного карбида, построенной в основном из тяжелых интен-
сивно рассеивающих лучи металлических атомов, ни Весттрену,
ни последующим исследователям не удалось.
Задачу эту решали с учетом данных химического анализа и
геометрии кристалла. В частности, Вестгрен считал, что атомы уг-
лерода размещены между попарно-параллельными гранями сосед-
них основных октаэдров, например, между пранями AED и B\C\Fi
(рис. 115). Как видно из рисунка, промежутки эти находятся
внутри легко деформированных октаэдров (например, внутри ок-
таэдра AEDBiCFi рис. 115).
Эти деформированные октаэдры, объемы которых несколько
меньше объемов основных правильных октаэдров, мы будем на-
зывать в дальнейшем промежуточными.
Элементарная ячейка содержит 8 основных октаэдров, каждый
из которых окружен четырьмя соседними основными октаэдрами
(так же, как в решетке алмаза окружен четырьмя соседями каж-
дый атом). Поскольку каждый промежуточный октаэдр располо-
жен между парой основных, число промежуточных октаэдров рав-
но —— = 16, т. е. равно числу атомов углерода, приходящихся на
долю элементарной ячейки в соответствии с формулой Рез W3C.
М. М. Бабич, Ф. К. Гарьянов и Е. Н. Кислякова, исследуя спла-
вы W — Со — С и W— N1 — С, изготовленные металлокерамиче-
ским методом из спрессованных и затем спеченных порошков
вольфрама, карбида вольфрама и кобальта либо никеля, установи-
ли, что в каждой из этих трехкомпонентных систем имеется по два
отличающихся по содержанию углерода сложных карбида с ку-
бическими решетками, содержащими 96 металлических атомов на
элементарную ячейку. Приближенные формулы этих карбидов, по
Бабичу, Гарьянову и Кисляковой, таковы: для фазы (Кг по
*90
Карбиды
обозначению этих авторов) W3Co3C и W3Ni3C (по 16 атомов угле-
рода на элементарную ячейку) и для фазы т}г (/(i) —WeCo6C и
WeNi'gC (по 8 атомов углерода на ячейку).
Б. Н. Кислякова [85] сделала попытку определить структуры
фаз т]1 и 7]j.
Два карбида с одним и тем же расположением металлических
атомов и различным содержанием углерода были обнаружены
Я. С. Уманским совместно с Н. Т. Чеботаревым [318] в спеченных
сплавах железо-вольфрам-углерод. Оказалось, что содержание уг-
лерода в этих карбидах колеблется в пределах от 13,7 до 17%'
(атомн.) для высокоуглеродистой фазы и от 5,7 до 6,6%' (атомн.)
для малоуглеродистой фазы. Таким образом, высокоуглеродистый
карбид может содержать больше углерода, чем это следует из
формулы Fe3W3C [14,3%' (атомн.)].
Следовательно, схема размещения атомов углерода в этом
карбиде, предложенная Вестгреном, не может соответствовать
действительности.
Кристаллогеометрический анализ структуры привел авторов к
заключению, что размещение атомов углерода, предложенное
Вестгреном, противоречит принципу компактности построения ре-
шетки, который, как убедительно показал Н. В. Белов [319], в ме-
таллических кристаллах всегда реализуется.
Атомы углерода только тогда могут внедряться в центры про-
межуточных деформированных октаэдров (например, в точку О1 в
центре октаэдра AEDB^CyF-i), когда углеродом заполнены центры
основных октаэдров ABCDEF и т. д. (рис. 116). При этом оказы-
вается, что решетка, построенная из одних только металлических
атомов (96 на ячейку) без атомов углерода, в основных октаэдрах
также не компактна.
В карбиде с малым содержанием углерода атомы последнего
занимают центры основных октаэдров. Предельный состав этого
карбида должен выражаться формулой Fe6W6C (8 атомов угле-
рода на ячейку). На самом деле содержание углерода в этом
карбиде не достигает предела, т. е. 7,7% (атомн.); около 15%
центров основных октаэдров остаются незаполненными.
В высокоуглеродистом карбиде атомы углерода расположены
как в центрах основных, так и в центрах цромежуточных октаэд-
ров.
Предельное число атомов углерода в ячейке равно 24 (8 —
в центрах основных и 16 — в центрах промежуточных октаэдров),
что соответствует формуле Fe2\V2C. На самом деле и здесь наблю-
дается некоторый дефицит углерода: максимальное его содержа-
ние 17%' (атомн.), вместо 20% по формуле Fe2WaC.
Двойные карбиды вольфрама и одного из металлов железной
группы следует рассматривать как своеобразные фазы внедрения
на базе компактной решетки, построенной из сильно отличающих-
Сложные карбиды
19!'
ся по размеру атомов двух металлов переходных групп. При этом-
с атомами углерода находятся в контакте только атомы воль-
фрама, являющегося по сравнению с железом более сильным кар-
бидообразователем. Атомы вольфрама образуют каркас решетки
Рис. 116. Размещение атомов ъ решетках фаз т)' (FeGW6C) и -q
(Fe2W2C) (по Уманскому и Чеботареву)
в виде комбинации основных и промежуточных октаэдров, в цент-
ры которых внедрены атомы углерода. Атомы железа, кобальта и
никеля с атомами углерода в решетке не связаны и заполняют
192'
Карбиды
лишь свободное пространство между вольфрамовыми октаэдрами
по принципу компактной упаковки1.
Проведенное Н. Т. Чеботаревым [318] исследование структуры
сложного карбида быстрорежущей стали, содержащей, кроме же-
леза, вольфрама и углерода также хром и ванадий, показало,
что ванадий, имеющий большое сродство к углероду, растворяясь
в карбиде, замещает в решетке атомы вольфрама. Атомы хрома,
имеющего большее сродство к углероду, чем железо, и меньшее,
чем вольфрам, частично замечают в решетке атомы первого и ча-
стично атомы второго металла.
Использование карбидов в технике
В основном карбид титана используется в качестве компонента
режущих металлокерамических твердых сплавов. В этих сплавах
карбид титана применяется в форме твердых растворов с другими
карбидами, например, карбидами вольфрама, ванадия, тантала
и т. п. [4].
Большое значение приобрел карбид титана в качестве основы
жаростойких сплавов, например TiC — Со, TiC — Ni — Сг,
TiC —Ni —Al, TiC —Fe, TiC —Fe —Si, TiC —Cr, TiC —W,
TiC — Mo и многих других, используемых для изготовления дета-
лей в реактивной техникег а также модераторов (поглоти-
телей нейтронов) и защитных кожухов атомных реакторов [123].
Из карбида титана, цементированного кобальтом, в США из-
готовляют лопатки газовых турбин, работающие при температу-
рах до 1000° и числе оборотов ротора до 17 500 об/мин (рис. 117)
[321]. Часто в жаростойких сплавах используется не только карбид
титана, но сплав карбидов титана, ниобия и тантала, цементиро-
ванный никелем (65% TiC, 15%’ NbC + ТаС и 20% Ni), который
носит в США название кентаниума [322, 323, 324]. Этот сплав об-
ладает высокой прочностью, стойкостью против окисления и час-
тых резких изменений температуры до 1200°. При использовании
в качестве материала конструктивных элементов газовых турбин
температура длительной эксплуатации может достигать 1000° [4].
В Австрии заводом Планзее выпускаются жаропрочные сплавы
WZ, состоящие и? карбида титана (35—75%), цементированного
Ni — Со — Сг-связкой (65—25%), из которых приготовляют тур-
бинные лопатки, детали высокотемпературных испытательных ма-
шин и т. п. [325].
1 Хотя работа Нортона и Раутала, отрицающих существование раздельных
фаз т, и т|', выполнена позднее описанного здесь структурного исследования,
мы считаем, что на самом деле фазы эти существуют. Двухфазная область
>] + г/ узка, и потому Нортон и Раутала могли ее ие обнаружить. Измерение
интенсивностей диффракционных максимумов обеих фаз, проведенное Кисслин-
гом [86], повидимому, исключает предположение о том, что фазы т) и т)' суть
предельные концентрации одной и той же фазы.
Использование карбидов в технике
193
Жаростойкие сплавы на основе карбида титана отличаются вы-
сокой стойкостью против воздействия агрессивных химических
сред, хорошей теплопроводностью, сопротивлением тепловому уда-
ру, а также высокой горячей твердостью и прочностью (при ста-
тических, ноне ударных нагрузках).
Карбид используется также для создания химически стойких и
износоустойчивых защитных слоев на чугунах [154], которые обра-
зуются осаждением TiC из газовой фазы по реакциям:
TiCl4 + 2На’+ С = TiC + 4HCI;
TiCl4 + 2Fe 4- С = TiC + 2FeCl2.
Рис. 117. Лопатки газовых турбин из сплавов на основе карбида
титана (США)
Цементированный карбид титана применяется для изготовле-
ния тормозных дисков, особенно в самолетостроении [343]. Такие
диски имеют высокую температурную стойкость (до 1000°), в то
время как обычные тормозные материалы плохо работают уже
при 400—500°. В связи с этим, а также большей теплопровод-
ностью, диски на основе карбида титана могут эксплуатироваться
в пять раз дольше (имея при этом фрикционные свойства на 50%
выше), чем обычные тормозные диски.
Высокая твердость карбида титана иногда используется в аб-
разивных работах, связанных с полированием и шлифованием
твердых сплавов, минералов, металлов и т. п,'Значительные коли-
чества карбида титана готовятся в качестве промежуточного про-
дукта при изготовлении четыреххлористого титана, являющегося
основным сырьем для производства титана [123]. >/
В литературе имеются указания об использовании карбида ти-
тана для изготовления высокотемпературных тиглей [131, 326] и
электродов дуговых ламп [327].
13 г. В. Самсонов
194
Карбиды
Наибольшие количества карбида циркония используются, неви-
димому, в качестве промежуточного продукта (ZrCl4) для получе-
ния ковкого циркония магниетермическим восстановлением хлори-
да [328]. Указано на возможность изготовления из карбида цирко-
ния тиглей [131, 329] и электродов 330].
Как уже указывалось, сплав карбида циркония с металличе-
ским ниобием обладает высокой жаропрочностью и может исполь-
зоваться в технике, где необходима высокая температура [181].
Карбид гафния обладает высокой температурой плавления
(3900°) и высокой твердостью, в связи с чем делаются попытки
его использовать в качестве заменителя алмазов [184].
Карбид ванадия нашел себе некоторое применение при изго-
товлении твердых металлокерамических сплавов, где он исполь-
зуется в форме сложного карбида ванадия — титана [331].
Карбид ниобия также иногда используется в качестве добавок
к карбидным компонентам твердых и жаропрочных сплавов.
Карбид тантала, помимо использования в качестве компонента
некоторых металлокерамических твердых сплавов (ТаС — Ni,
TiC — ТаС — NbC — Со и т.' п.), применяется для изготовления
высокоогнеупорных тиглей [24] методом горячего прессования с
добавками железа и других металлов группы железа.
Рениевая и вольфрамовая проволоки с покрытием из карбида
тантала рекомендовались для изготовления нитей накаливания не-
которых видов электроламп [332], а трубки из карбида тантала
[333] — для элементов сопротивления высокотемпературных печей.
Карбид хрома СгзС2 входит в состав некоторых жаростойких
твердых сплавов, например, с 54,3% TiC, 5,7%' СгзС2 и 40% Ni
(сплав типа I); 42,9% TiC, 7,1% Сг3С2 и 50% Ni (сплав типа II)
[343]. Такие сплавы обладают высокой окалиностойкостью, твер-
достью, достигающей 81—85 R Аи прочностью, сохраняющейся до
сравнительно высоких температур (табл. 51).
Таблица 51
Жаростойкость твердых сплавов иа основе CrsC2
Температура °C Сопротивление разрыву, кг!мм^
сплав типа I сплав типа II
30 21 48
430 26 49
650 31 48
830 33 38
1000 26 23
Добавки молибдена к сплавам TiC — Сг3С2 — Ni еще более
повышают их горячую твердость и прочность.
Использование карбидов в технике
195
Сплавы Сг3С2 с никелем имеют высокие режущие свойства,
а также могут использоваться как жаростойкие и жаропрочные
[331, 334, 335, 336].
Кроме того, сплавы на основе карбида хрома, цементирован-
ные никелем (83% Сг3С2, 2% WC, 15% Ni), как кислотоупорные
находят все более широкое применение в химической промышлен-
ности [337]. По кислотоустойчивости они значительно превосходят
другие твердые сплавы (табл. 52).
Таблица 52
Химическая стойкость твердых сплавов и сталей
Скорость растворения, мг]день
Реагент СГ3С24- + WC +N1 WC+Co WC+TaC+ -J-TiC+Co WC+TaC+ H-Co Сталь типа 18-8
10%-ная H2SO4 .... 55 158 302 135 1650
50%-ная H2SO4 .... 31 100 120 81 7300
37%-ная НС1 190 600 650 160 Полное рас
35%-ная HNO. .... 19 250 330 110 творение 45
HNO3 4- НС1 810 2Й20 4500 1550 Полное рас
5%-иая NaOH .... 0,6 22 7 12 творение 1,0
50%-ная NaOH .... 1,0 3 3 4 2,0
5%-ная CaCl, о,з 41 24 27 I,3
1%-ная лота лимонная кис- 0,6 176 150 160 2,0
5%-ная лота молочная кис- 1,5 200 170 255 5,1
Кроме высокой химической стойкости, этот сплав обладает вы-
сокой твердостью (88 R), сопротивлением разрыву, равным
65 кг/мм2, и коэффициентом термического расширения 6,4 • 10-6.
Он используется в фармацевтической и химической промыш-
ленности для изготовления деталей центрифуг, обкладки реакто-
ров и т. п.
Карбид молибдена нашел применение в некоторых типах ме-
таллокерамических твердых режущих сплавов (4,331).
Карбид вольфрама является основным компонентом твердых
сплавов для обработки чугунов, пластмасс, цветных металлов и
сплавов, керамических материалов [4].4Кроме того, из карбида
вольфрама методом горячего прессования изготовляют тигли и де-
тали высокотемпературных печей [338], некоторые типы элек-
трических контактов и тому подобные детали различных машин.
Высокая износостойкость карбида ванадия используется для по-
крытия им деталей машин [592].
В литературе подробно описано применение карбидов в совре-
менной промышленности £339—343].
13*
ГЛАВА IV
НИТРИДЫ
Нитриды по структуре и физико-химическим свойствам явля-
ются типичными фазами внедрения, общая теория которых из-
ложена в гл. I, а представление о структурах дано в гл. III.
Физико-химическая природа нитридов
В табл. 53 приведены значения отношений /? N : RMe, опреде-
ляющие по Хэггу возможность образования простых структур
Таблица 53
Отношение /?N : RMe для нитридов переходных металлов (по Хэггу)1
Металл Металл Металл *N Металл rn
Sc 0,44 V 0,39 La—Cp 0,38-0,41
Ti 0,48 Zr 0,44 Hf 0,44 Th 0,39
V 0,53 Nb 0,49 Ta 0,49
Сг 0,56 Mo 0,51 W 0,51
Мп 0,56 Те Re 0,52 и 0,47
Fe 0,56 Ru 0,53 Os 0,53
Со 0,57 Rh 0,53 Ir 0,52
Ni 0,57 Pd 0,52 Pt 0,51 —- ——’
Радиус атома азота принят равным 0,71 А.
Как следует из этих данных, Rx : Rm? во всех случаях мень-
ше критического значения отношения Хэгга (0,59).
Атомы металла и азота связаны в нитридах по металличе-
скому типу, т. е. общцм электронным коллективом. Однако на-
ряду с металлической связью в нитридах заметное значение
имеет также ионная связь Me—N; химическая связь представ-
ляет собой результат наложения этих двух типов связи.
Наличие металлической связи в нитридах проявляется в их
относительно высокой электропроводности, впрочем гораздо
меньшей, чем для соответствующих переходных металлов, а так-
же карбидов и боридов. Нитриды способны переходить в сверх-
Физико-химическая природа нитридов
197
проводящее состояние, например нитрид ниобия становится
сверхпроводником уже при 15,6° К [134]. Отношения Видемана-
Франца для нитридов и металлов близки, термический коэффи-
циент электросопротивления положителен (см. табл. 75).
Признаки ионной связи в нитридах можно усмотреть в пер-
вую очередь в значениях их электросопротивления, которое, как
указывалось, больше сопротивления соответствующих боридов и
карбидов. Так как азот из рассматриваемых неметаллов обла-
дает наибольшим ионизационным потенциалом (8,4 для бора,
11,21 для углерода и 14,47 эв для азота), то, невидимому, ве-
роятность нахождения электронов коллектива на уровнях s—р-
электронов азота достаточно велика; таким образом, и d-элект-
роны металла пребывают известное время в s—р-состояниях
азота.
Следовательно, незаполненность d-уровней металлов не-
сколько повышается; параллельно повышается их рассеивающая
способность, что и приводит к увеличению электросопротивле-
ния. Формально этот процесс можно объяснить смещением элек-
тронного коллектива в сторону атома азота;Лочевидно, нитриды
являются промежуточными фазами на пути к чисто ионным’ и.
должны иметь ряд их признаков, правда, слабо выраженных.
Такое смещение .электронного коллектива в сторону атома азо-
та, так же как в сторону бора в боридах [345], создает энергети-
чески более устойчивую систему, нежели в карбидах, где можно
говорить о равноправной принадлежности электронов атомам
металла и углерода, т. е. о «центральном» положении элек-
тронного коллектива. Внешне это проявляется в высоких убылях
свободной энергии при образовании молекул нитридов из эле-
ментов — они превышают убыли энергии при образовании кар-
бидов вдвое, втрое и более и имеют тот же порядок, что и теп-
ловые эффекты при образовании боридов.
Впервые на наличие в нитридах элементов ионной связи ука-
зал, повидимому, Эрлих [145], использовавший результаты рабо-
ты Брегера [346]. Последний исследовал ряд препаратов систе-
мы Ti—N, полученных Ормонтом с сотрудниками [347] разложе-
нием аммиачных комплексных солей титана, в том числе мало-
устойчивый нитрид TiN иб> близкий по составу к TiNi,33
(Ti3N4), который должен был бы образоваться, если бы связь
Ti—N была чисто ионной.
По Рэндлу [348] при внедрении неметалла в переходный ме-
талл связь Me—Me ослабевает, и электроны, ее осуществляю-
щие, переходят к связи Me—X; очевидно, этот переход тем более
вероятен, чем выше ионизационный потенциал неметалла X. Эти
представления также приводят к сделанному выше выводу.
Если рассмотреть вероятность организации ионных связей в за-
198
Нитриды
висимости от электронного строения переходных элементов, то,
невидимому, эта вероятность по Рендлу будет увеличиваться с
уменьшением прочности связи между атомами металла, т. е. в
общем с уменьшением электронного дефекта d-уровня металла
при постоянном главном квантовом числе; например, в рядах
Ti—V—Сг, Zr—Nb—Мо и Hf—Та—W доля ионной связи воз-
растает. Это можно иллюстрировать данными табл. 54, в кото-
рой показаны отношения теплот образования нитридов и карби-
дов.
Юм-Розери [349], преувеличивает роль ионной связи в нитри-
дах.
Теплоты образования карбидов и нитридов
из элементов и их отношения
Таблица 54
Металл Электроны недо- строенного d-уровня Теплота образования на атом неметалла—А//298» ккал!моль ДЯйвз Л-IeN А//298 Мб С
карбид нитрид
Ti 3 d2 43,85 80,3 1,84
V 3 ds 28,0 60,0 2,15
Сг 3 d-> 10,05 29,5 2,91
Zr 4 d- 44,1 82,2 1,86
Nb 4 d* 33 6 59,0 1,76
Мо 4 d5 -4,2 16,6 75
Та 5 d3 36,0 58.1 1,62
W 5 di —8,4 17,2 ~3
Химические свойства нитридов
/ В химическом отношении нитриды довольно устойчивы про-
тив действия отдельных минеральных кислот,, быстрее растворя-
ются в их смесях, обычно с выделением аммиака. При обработ-
ке растворами или расплавами щелочей они разлагаются, а при
окислении на воздухе, по данным Кэмпбелла с сотрудниками
[122], нитриды титана и циркония устойчивы до 1100—1400°, а
нитриды ванадия, ниобия и тантала—до 500—800°. Нитриды
вольфрама и молибдена гораздо менее устойчивы в химическом
отношении и диссоциируют на металл и азот при простом нагре-
вании.
Как уже указывалось, многие нитриды являются термодина-
мически прочными соединениями; на рис. 118 показана зависи-
Методы получения нитридов
199
мость изменения свободной энергии при образовании нитридов
титана, циркония, ванадия, тантала и других металлов от тем-
пературы.
Рис. 118. Изменение свободной энергии при образовании ни-
тридов в зависимости от температуры
Методы получения нитридов
Азотированию обычно подвергается порошок металла с целью
увеличения поверхности взаимодействия по реакции:
Me (тв)4--^- N2 (газ)^ТИеН (тв).
Зависимость скорости этой реакции от времени аналогично
скорости газовой коррозии параболическая [42]. На рис. 121,
126, 129, 133 графически показана зависимость увеличения веса
азотируемого металла, отнесенного к единице поверхности, от
времени азотирования. Как следует из этих данных, скорость
200
Нитриды
образования нитридов со временем уменьшается по параболиче-
скому закону:
/ IV \2 г~
= К2*, или W Wo К V х,
где W — количество газа, поглощенного металлом;
IVо — предел растворимости газа в металле;
т — время диффузии азота в металл.
Так как образование нитридов связано с реактивной диффу-
зией азота в соответствующие металлы, то температурный ход
скорости этих реакций выражается экспоненциальным уравне-
нием:
где Q — энергия активации при диффузии азота в металл, со-
ставляющая при азотировании титана 36 300, циркония
39 200, ниобия 25 4001 и тантала 39 400 кал!моль [42].
Таким образом, реакции азотирования во всех отношениях
аналогичны газовой коррозии и при их практическом осуществ-
лении следует учитывать те же кинетические факторы, что и при
окислении компактных или порошкообразных металлов.
Реакции азотирования, как правило, удовлетворительно про-
ходят при температурах около 1200°, кроме хрома, молибдена
и вольфрама, температура азотирования которых составляет
500—1000°. Важным преимуществом непосредственного азотиро-
вания металла является возможность точного регулирования
чистоты получаемых продуктов. Использование аммиака для азо-
тирования более благоприятно, чем азота, так как атомы азо-
та, образующиеся при диссоциации аммиака, имеют высокую ре-
акционную способность, а водород восстанавливает примеси
окислов до металла, особенно в случае азотирования вольфрама
и молибдена, и предотвращает окисление за счет следов кисло-
рода в атмосфере соответствующей печи.
Азотирование окислов по общей реакции:
МеО + N3 (NH3) + С — AfeN + СО -ф Н2О + Н2
довольно широко используется при приготовлении нитридов глав-
ным образом вследствие дешевизны исходных материалов (окис-
лов металлов). Параллельно с основной реакцией образования
нитрида протекает реакция образования карбида:
МеО + С^МеС + СО,
ускоряющаяся при образовании твердых растворов карбидов с
нитридами. Примером таких равновесий A1<?N—МеС при азоти-
ровании с одновременным восстановлением окислов до карбидов
» Очевидно, заниженное значение.
Методы получения нитридов
201
углеродом является равновесие TiC—TiN, исследованное в рабо-
те А. Н. Зеликмана и Н. Н. Горовиц [158].
В качестве восстановителя можно использовать не только
углерод, но и металлы, например кальций, магний, или гидриды;
разработаны способы получения нитридов титана, циркония и
тантала по схемам [350]:
1) TiO3 (Та2О6) 4 CaH2^Ti(Ta)+H204-CaO;
2) 2Ti (Та) + N2 (2NH3) 2TiN (+ ЗН3)
или
1) ZrO2+2Mg=Zr-|-2MgO;
2) 2Zr-f-N2 (NH3) = 2ZrN(-]-H2).
Взаимодействие хлоридов или оксихлоридов металлов с ам-
миаком может быть представлено схемами:
AfeCl4+NH3- AfeN f НС1;
2ИЮС13 f NH3- Al<?N+HCl-|-H2O-]-H2.
Эти реакции проходят обычно при температурах порядка
800°. Таким способом получали нитриды титана [351], ванадия
[352], хрома и других переходных металлов [353].
Разложение аминохлоридов и других неустойчивых соедине-
ний изучено в основном для разложения аминохлоридов титана
[2, 67], например, TiCl4 • 4NH3:
TiCl4 • 4NH3- TiN-f- NH3+HC1.
При этом иногда получаются неустойчивые соединения с из-
бытком азота, легко отдаваемым при дальнейшем нагревании.
Осаждение (наращивание) из газовой фазы протекает по ре-
акции
2МеХ4 N2+H2 -> 2MeN4-2H.¥,
где X — галоид,
в условиях, приведенных в табл. 55 [122, 127].
Таблица 55
Условия осаждения нитридов из газовой фазы
Нитрид Хлорид Азотирующая смесь Температура осажде- ния нитрида, С
TIN TiCl4 3N2+h, 1100-1700
ZrN ZrCl4 3N3+H, 1100-2700
ZrN ZrCl4 N2 2800—3000
HfN HfCl4 зх3+н2 1100—2700
VN VC14 3Na+Ha 1100-1600
TaN TaCl5 Na 2400—2600
202
Нитриды
Термодинамическое исследование реакций осаждения из га-
зовой фазы подробно приведено только для нитрида титана
[153] по реакциям:
TiCl4-|- ~N2^TiN+2Cl2; (1)
TiCl4 + 2H2 -|--|-N2^TiN + 4HCl; (2)
TiCl4+2Fe+“N2^TiN ф-2FeCla. (3)
Зависимость убыли свободной энергии от температуры, при
которой протекают эти реакции, соответственно выражается
уравнениями (рис. 119):
ДР4 =96100 — 6,7 Т;
ДГ2 = 7500 — 13,45 Т;
ДЕ3 = — 51300 — 34,2 Т.
Как следует из этих данных, полнота прохождения реакций
(/) и (2) возрастает с повышением температуры осаждения; на-
200 000 600800Ш1200140016001806
Температура,
Рис. 119. Изменение свободной
энергии при азотировании по
реакциям:
z—T:Ci, + a n2 г tin + 2С2;
II — TiC!, +- 2H2i-K^2TiCTiN J-4HCI;
ZZZ-TiCl* f 2Fe+«,N2^T>N+- 2FeCi2
против, выше 1100° реакция (5) становится невыгодной. Однако
использование железа в качестве основы для осаждения нитрида
титана при низких температурах представляет большие удобства
как при получении нитрида титана, так в особенности при про-
изводстве жаростойких покрытий из TiN на железе и стали [154].
Нитриды титана
Насыщение титана азотом впервые произведено Либихом в
1831 г. Дувец и Оделль [354] приготовляли нитрид титана азоти-
рованием гидрида титана чистым азотом при 1800—1900°, а
Эрлих [145] — азотированием 99,9%-ной стружки титана также
чистым азотом в продолжение 2—3 час. при 1200° (в корундовой
трубке). При однократном азотировании получается нитрид со-
Нитриды титана
203
става TIN 0,95; после измельчения и повторного азотирования
этого продукта содержание азота возрастает до 50% (атомн.),
т. е. до TiN 1,0- Нагревая смеси TiN +Ti в вольфрамовой лодоч-
ке, Эрлих получал соединения титана с азотом с условными
формулами от TiNo.oi до TiNi.o-
Скорость азотирования титана по реакции Ti+~ N2 = TiN
изучалась в работах Гульбранзена и Эндрью [42], которые уста-
новили зависимость константы скорости реакции от температуры
Зависимость привеса при азотирова-
нии титана от времени
Рис. 120. Зависимость констан-
ты скорости реакции Ti+Vz^
от температуры
Рис. 121.
(рис. 120) и от времени азотирования при 500—900° (рис. 121).
Температура, °C
550
600
700
775
800
880
Ниже приведены константы скорости реакции
Ti + yN2 = TiN в зависимости от температуры.
~ " К. г см3 сек
5,28 • 10-15
2,97 • 10-14
2,78 • 1СГ13
1,08 • 10-12
1,46 10
3,2 • 10~12
Из этих данных теплота активации при диффузии азота в ти-
тан была установлена равной 36300 кал/моль образующегося при
диффузии нитрида.
В/ П. Ремин [355] впервые получил нитрид титана дуговой
плавкой в атмосфере азота. Впоследствии был разработан точ-
ный режим этого способа [431: расплавление Ti и его взаимодей-
ствие с TiN в компактном состоянии проводится под током в
150 а, затем силу тока увеличивают до 300 а; при обоих значе-
204
Нитриды
ниях силы тока материал выдерживают в продолжение 2—3 мин.
Недостатком этого метода является потеря азота, вызываемая
его диффузией к центру образца (например, при номинальном
содержании азота в сплаве 17% сердцевина содержит 12,6%, а
наружная оболочка 17,5% N). Ликвация азота при дуговой
плавке увеличивается с возрастанием силы тока.
Важное значение для технологии производства нитрида тита-
на в промышленном масштабе имеет восстановление двуокиси
титана углем с одновременным азотированием до нитрида тита-
на при 1100—1250°:
2TiO2 + 4С + N2 = 2TiN 4-4СО.
Содержание азота в нитриде достигает при этом 21,9% про-
тив 22,6% для TiN [356, 357]. Ремин [355] подвергал азотирова-
нию смесь двуокиси титана с активированным углем, составлен-
ную в весовом отношении 2:1 (т. е. с количеством углерода
меньшим, чем полагается по реакции TiO2 + 2С = Ti + 2СО).
Азотирование осуществлялось тщательно очищенным азотом,
аммиаком и смесью азота с водородом, причем шихту с сажей
помещали в железные, никелевые или фарфоровые лодочки.
В результате было установлено, что при трехкратном азотирова-
нии аммиаком (каждый раз в продолжение 3 час. при 1250°) со-
держание азота в полученном продукте составляет 17,61%, при
такой же обработке азотом 17,47% и при азотировании смесью
N2 + Н2 в результате 6-часовой операции (подъем температуры
до 1250° около трех часов и выдержка при 1250° также 3 часа)
содержание азота достигает 16,4%. Дополнительным азотирова-
нием не удалось увеличить содержание азота в нитриде.
При указанном методе параллельно с образованием нитрида
титана проходит также ряд дополнительных реакций, которые
могут быть выражены уравнениями (4):
TiO, + С = TiO -f- СО Ti -ф СО2;
TiO + С + N = TiN + СО;
2Ti 4- N,= 2TiN;
2TiO2 4- 4C = TiO - TiC (tb. p.) -f- 3CO;
TiO — TiC 4- N2 = 2TiN -f- CO;
TiO +2C = TiC 4 CO;
TiO4-TiC-f-TiN=TiO —TiC —TiN (tb. p.);
TiO —TiC —TiN + N2 = 3TiN + CO и т. п.
Важнейшей из этих реакций является образование карбида
титана, дающего устойчивые твердые растворы с нитридом ти-
тана.
Нитриды титана
205
При спекании металлокерамических твердых сплавов азот,
введенный в их состав в форме твердого раствора TiN-TiC, прак-
тически не выделяется из сплава, оставаясь в карбидном твердом
растворе.
При температурах до 1200° проявляется преимущественно
окисляющее действие подсасывающегося в печь воздуха; в диа-
пазоне же температур 1200—1800° преобладает азотирующее
действие [358].
Подробное изучение равновесия TiC — TiN было проведено
Зеликманом и Горовиц [158] при действии азота на карбид ти-
тана:
xTiC +у/2 N2 ZiTix [(.х — у) С, N] + уС.
Константа этой реакции: К = -pfjNj при давлении азота
0.12 ат (90 мм рт. ст.) в зависимости от температуры составляет:
при 1300° —0,14, при 1500°—0,22, при 1800° —0,36.
На основании этих данных для pN =0,12 ат выведено урав-
нение:
Отсюда следует, что насыщение азотом при данном давлении
понижается с повышением температуры. Таким образом для по-
лучения безуглеродистого нитрида титана при обычном давлении
азота в печи, равном 1 ат, необходимо производить азотирование
при температурах не выше 1000—1300°, а при более высоких
температурах для полного азотирования TiC необходимо давле-
ние азота более 1 ат.
Реакция TiN + С ^TiC + yN2 сопровождается ростом сво-
бодной энергии [153], составляющей в зависимости от темпера-
туры ДР° = 39650—20,15 Т (рис. 122, кривая I). Таким образом
при низких температурах нитрид как термодинамически прочное
соединение весьма устойчив, в то время как при высоких темпе-
ратурах, вследствие диссоциации нитрида, устойчивость послед-
него уменьшается и частично образуется карбид. Это уравнение
для ДЛ° выведено без учета образования твердых растворов
TiN — TiC; если учесть равновесие TiN — TiC, то изменение
свободной энергии выразится уравнением
1 : xTiC , /TiC
A^TiN — TiC ~ 2 RT \п р^= R Т \п X TiN + n/TiN ’
где х — молярная концентрация;
/—коэффициент активности.
Кривая II рис. 122 показывает изменение свободной энергии
с температурой при образовании твердых растворов, для
206
Нитриды
Xtic= 0,7; причем принято/tic = /™ = 1- Следовательно, по этим
данным образование твердого раствора TiN — TiC мало влияет
на взаимодействие нитрида титана с углеродом.
При практическом проведении реакций азотирования ТЮ2 в
смеси с углем следует учитывать также, как это было впервые
показано Беляковой, Комаром и Михайловым [359], что обра-
зующийся при 1100—1500° нитрид, а также карбид титана рас-
творяются в TiO, так что получаются твердые растворы TiN —
TiC — TiO; при проведении реакции при 1900° в продолжение
3 час. закись титана полностью восстанавливается и образуется
твердый раствор TiN — TiC, концентрация которого определяется
соотношениями, установленными в
S'
0
Ш 4ОО 600 800m 120014001600f80t>
Температура, ° К
Рис. 122. Изменение свободной энергии
при науглероживании нитрида титана-’
Г — по реакции TIN -Сд TiC -f- ~ N2; II—то
же, с учетом образования твердых растворов
Ti^-TiN (rT.c ~ 0,7)
работе Зеликмана и Горовиц.
При попытке непосред-
ственного азотирования TiO2
смесью N2+H2 установлено
[359], что в области темпе-
ратур от 1000 до 1500° про-
исходит образование проме-
жуточных окислов Ti, а при
1700°, повидимому, образу-
ется твердый раствор TiN в
TiO.
Исследование процесса
азотирования титана из
шихты TiO2 + С, проведенное
Г. В. Самсоновым и В. С.
Нешпором, показало, что
азотирование начинается при
1300°, но проходит при этой температуре только на 15—20%; по-
вышение температуры до 1400—1600° вызывает резкое увеличе-
ние выхода TiN — до 70—95%. При температуре 1700° и выше в
связи со сдвигом равновесия в сторону образования TiC увеличи-
вается содержание карбида титана, что хорошо согласуется с'
данными Зеликмана и Горовиц.
Наибольшее количество азота в продукте азотирования со-
держится при 1600° (21,5—22,5%).
При проведении процесса при низких температурах необхо-
димо использовать двух- и трехкратное азотирование. В работе
Самсонова и Нешпора, например, содержание связанного азота
составляло после первого азотирования 12,5%, после второго
18,5% и после третьего 20,06%'. Между азотированиями продукт
растирали для разрушения пленок нитрида титана, обволаки-
вающих частицы TiO2 и препятствующих, таким образом, их
дальнейшему восстановлению и азотированию. Крупность зерен
полученного порошка от последовательных азотирований при
1200° не меняется, составляя 2,3—2,5 р-
Нитриды титана.
207
Александер [350] предложил аналогичный способ получения
нитрида титана, с той только разницей, что восстановителем яв-
ляется не углерод, а гидрид кальция СаН2. Смесь тонкого поро-
шка TiO2 с небольшим избытком гидрида кальция помещали в
печь, и восстановление протекало в атмосфере инертного газа по
уравнению:
ТЮ2 4 СаН2 = Ti -ф Н2О ф СаО.
После этого в печь вводили азот или аммиак, образующие нит-
рид титана:
2Ti + N2- 2TiN;
2 Ti + 2NH3 = 2TiN ф ЗН2.
После отмывки продукта реакции от окиси кальция этим ме-
тодом получают весьма чистый нитрид титана.
Ормопт, Эпельбаум, Петров и Павлова [347] приготовляли
нитрид титана взаимодействием TiCU с аммиаком:
TiCl4 ф NH3 - TiN + НС1.
При температурах ниже 1400° по этому методу получается
нитрид титана, в решетке которого 15—20%' пустых титановых
узлов; аналогичные результаты получаются при разложении
аминохлоридов титана [346].
Осаждение нитрида титана из газовой фазы по реакции
2TiCl4 + N2 ф 4HS - 2TiN ф 8НС1
при 1400—1600° имеет значение главным образом для приготов-
ления покрытий из нитрида титана на металлах, например в це-
лях повышения их жаростойкости или коррозионной устойчиво-
ст. При температуре проволоки ~ 1450°, общем давлении в ре-
акционной камере 300—400 мм рт. ст., парциальном давлении
TiCl4 17 мм рт. ст. и отношении N2: Н2 = 1 : 1 получается нит-
рид титана, точно отвечающий формуле TiN [160]. Аналогичные
условия приводятся и в работе Кэмпбэлла [122].
Препараты нитридов титана, полученные в ранних работах
[195] преимущественно из четыреххлористого титана и аминохло-
ридов титана, несомненно, были сильно загрязнены. Различные
исследователи приписывали нитриду титана формулы TiN2,
Ti5N6, Ti3N4, TiN [360]; некоторые авторы считали, что титан об-
разует два нитрида разного состава.
Руфф и Айснер [356], приготовлявшие нитрид титана прока-
ливанием смеси двуокиси титана с сажей в токе азота при 1100—
1200°, указали, что состав нитрида титана отвечает формуле
TiN. Ту же формулу дают позднее Фридрих и Зиттиг [357] и
Моэрс [125], получившие в 1925 и 1931 гг. нитрид титана мето-
208
Нитриды
дом Руффа и Айснера, а также Аркель [138] и Боэр [175], синте-
зировавшие это вещество из паров четыреххлористого титана.
Все эти исследователи считают, что существует лишь один
нитрид титана.
Аркель [138] в 1924 г. установил, что TiN имеет кристалличе-
скую решетку типа NaCl, период этой решетки по Аркелю равен
4,32 кХ, по Беккеру и Эберту [139] — 4,40 кХ, по Гофману и
Шредеру 361] — 4,225 кХ, по Брегеру (1939 г.)—4,21 —
4,234 кХ (в зависимости от содержания азота) и по Давилю и
Риксу [143] — 4,23 кХ. Данные Брегера, полученные в результа-
те весьма тщательной аналитической обработки эксперименталь-
ного материала, следует признать наиболее достоверными, зна-
чения же периода, полученные Аркелем и, тем более, Беккером
и Эбертом, повидимому, ошибочны. Плотность нитрида, вычис-
ленная для найденного Беккером и Эбертом периода решетки
(4,81 г/с.м3), на 8%' ниже плотности того же образца, экспери-
ментально измеренной Фридрихом и Зиттигом (5,18 г/см2).
Образцы, которые исследовал рентгенографически Брегер,
были получены Петровым и Павловой нагреванием смеси четы-
реххлористого титана TiCl4 с аммиаком до 800° и термическим
разложением аминохлорида титана (TiCl4 • 4NH.s).
По данным химического анализа, образцы, изготовленные из
аминохлоридов при температурах 400—800°, отличались мень-
шим содержанием титана по сравнению с формулой TiN и отве-
чали эмпирической формуле TixN при х=0,85—0,95.
Чем выше температура получения образца, тем больше в нем
титана и тем выше его плотность и периоды решетки (табл. 56).
Таблица 56
Свойства нитрида титана, полученного разложением аминохлорида
Температура разложения аминохлорида, °C Период решетки, kX Удельный вес
400 4,21 4,5
1400—1600 4,234 5,1
Таким образом после прокаливания образцов при 1400—
1600° состав нитрида очень близко подходит к TiN, а плотность и
период решетки достигают максимальных значений. Нагревание
до более высоких температур вплоть до расплавления никаких
дополнительных изменений не вносит.
Сопоставление данных о химическом составе, плотности и
периодах решетки образцов нитрида, полученных при разных
температурах, позволило Ормонту и его сотрудникам установить,
что низкотемпературные нитриды с недостатком титана (иначе
Нитриды титана
209
говоря, с избытком азота) являются твердыми растворами азо-
та в нитриде, построенными по принципу вычитания.
Правильность представления о нитридах с избытком азота,
как о твердых растворах вычитания, Брегер подтвердил также
анализом интенсивностей интерференционных линий на их дебае-
граммах, проведенным методом, принятым в работах Уманско-
го о карбиде ванадия и Уманского и Хидекеля о карбиде тита-
на. Образование таких несовершенных кристаллов Брегер ставит
в связь со способом их получения (диссоциация аминохлоридов
с очень высоким содержанием азота протекает при низких тем-
пературах, очевидно, не до конца, так что часть избыточных
атомов азота остается в решетке и удаляется из нее лишь после'
нагревания до высоких температур порядка 1500°). По нашему
Рис. 123. Зависимость периода решетки TiN
от содержания азота
мнению, эти твердые растворы нельзя считать стабильными фа-
зами— даже при низких температурах они, повидимому, мета-
стабильны. Очевидно, нитриды Ti5N6 и Ti3N4 были также твер-
дыми растворами азота в нитриде, построенными по типу вычи-
тания.
Первое тщательное исследование сплавов системы Ti—N
было проведено Эрлихом [145] методом рентгенографического
анализа. При растворении азота в титане период решетки гекса-
гонального титана возрастает от а=2,949 кХ для Ti до а=2,964 кХ
Для металлической фазы (TiNo.23 — TiN 0,25 )5 соответственно с
достигает значения 4,769 кХ, а отношение с/а остается практичес-
ки неизменным (1,603—1,603). В районе от TiNo,25 До TiNo,33
Эрлихом обнаружена вторая фаза, а в области от TiN о,44 до
TiN 1,оо гомогенен нитрид титана с кубической решеткой и мак-
симальным периодом решетки 4,234 кХ (рис. 123). Современный
вид диаграммы состояний системы титан — азот, по данным
Полти, Марголина и Нильсена [43], представлен на рис. 124;
точка плавления титана принята равной 1725° (более точно —
14 Г. В. Самсонов
210
Нитриды
1660°). Всего в системе обнаружено четыре фазы: р, a, s и 3.
Перитектоидная ₽-фаза содержит (при 2020 ± 25°) около
1,4% N; образуется эта фаза при реакции между a-фазой и
жидкостью:а-фж^Р а-фаза при этой же температуре гомогенна в
пределах от 4 до 7,3% N и образуется при перитектическом пре-
вращении 3 4- ж it а при 2350 ± 25°.
Фаза е образуется по перитектоидной реакции а % 8 its при
температурах от 1000 до 1100° и гомогенна в пределах от 6,8
до 8,9% N(Ti'4N—Ti3N). Эта фаза имеет тетрагональную ячейку
с периодами: а = 4,92 кХ, с = 5,61 кХ и с/а= 1,05. 8-фаза (TiN)
t.V
ЗСОЭр
гооо
N;Mатомн.)
5 Ю /5 -20 25 30 35 40 45 50
1- - - -
ЭЮ 4-0
да
ггоо
ЮОО
1800
1725
1400
саб
] 2 3 4 Ъ & 7 9 ЮГ) h 18141'5^71810 2021222324
" N,7. (вес.) М
Рис. 124. Диаграмма состояний;систсмы Ti—N
гомогенна в пределах от 10—И до 22,6% N, что в общем совпа-
дает с данными Эрлиха.
Высший нитрид титана TiN имеет желто-бронзовый цвет, на
него не действуют минеральные кислоты. В серной кислоте нит-
рид титана гораздо устойчивее нитридов циркония и тантала
[362]. При длительной обработке TiN в концентрированной
H2SO4 при нагревании он разлагается с образованием сульфатов
титана и аммония.
Царская водка легко растворяет нитрид титана. Он разла-
гается при сплавлении со щелочами или обработке растворами
щелочей при нагревании с выделением аммиака. На воздухе он
окисляется, начиная с температур 1100—1400° [122].
В атмосфере окиси углерода TiN инертен; также инертен он
по отношению к водороду [160]. Смесью NO и NO2 нитрид титана
окисляется, но реакция эта подробно не изучена. Углекислый
газ окисляет нитрид титана:
2TiN + 4СО2 -> 2TiOa + 4СО + Na.
Нитриды титана
211
Константа скорости этой реакции выражается уравнением:
4 Др
Р т (Р — 4 Д р) ’
гдер—начальное давление СО2;
Др — изменение давления за время т реакции.
Для получения плотных образцов TiN спекание необходимо
проводить при 1700—1800° под давлением 200—300 кг/см2-, при
Рис. 125. Микроструктура спеченногр нитрида титана
более высоких температурах в графитовых прессформах нитрид
титана превращается в карбид.
Спеченные образцы весьма хрупки, внутренние напряжения,
возникающие в образцах при быстром охлаждении, значительны,
рост зерен очень велик (2,3—18 р-) -
В этом отношении нитрид титана резко отличается от нитри-
дов металлов V группы, например от нитрида тантала, зерна
которого при спекании даже при более высоких температурах
почти не укрупняются (4,2 р в порошке, 6—7 р- в спеченном об-
разце). Микроструктура спеченного TiN показана на рис. 125.
Удельный вес нитрида титана, по данным Эрлиха, в области
гомогенности меняется от 4,87о (TiNo.44) до 5,213 (TiNi.o).
Убыль свободной энергии при образовании TiN из титана и
азота составляет: Д F°=80250—22,85 Т (для 1800—2100° К), а
теплоемкость в интервале 298—1800° К Ср. =11,91+0,00094 Т —
/296 000 \ Г1С- ~
—I [167]. Описаны полупроводниковые свойства нитрид*
титана [594].
14*
212
Нитриды
Модуль упругости, определенный на пористых образцах из
нитрида титана (7 = 3,03), составляет 8060 кг/мм12, на самом де-
ле он должен быть, конечно, гораздо выше [223]. Сжимаемость
нитрида титана по Бриджмену [168] может быть выражена урав-
нениями: при 30°— ДV/Vo =3,32 • IO-7 р — 2,13- 10_ 12 р* и при
75° — ДУ/У0 = 3,51 • 10->—2,13- 10-12р2.
Термическая диссоциация TiN представляет собой реакцию
2-го порядка, константа скорости которой подчиняется уравне-
нию:
1 х
К =-----—------
т а (а—х)
где а—концентрация газа при предельном давлении ро',
х—концентрация газа при давлении р;
т — время азотирования.
При 1200° упругость диссоциации и константа скорости реак-
ции в зависимости от времени нагревания имеют численные зна-
чения, приведенные в табл. 57.
Таблица 57
Зависимость упругости и константы скорости диссоциации
TiN от времени [160]
Время, мин- Упругость диссоциации р мм рт. ст. Константа Я
5 0,218 0,19
10 0,340 0,23
20 0,431 0,23
30 0,463 0,22
40 0,439 0,22
50 0,510 0,20'
60 0,520 0,22
70 0,528 0,22
80 0,533 0,22
90 0,543 0,23
Свойства нитрида титана см. в табл. 58.
Таблица 53
Свойства нитридов титана, циркония и гафния
Свойство Нитрид
Ti gN_E Ti N.5 ZrN HfN
Содержание азота в предельно насыщенных неметаллом фазах, % . Область гомогенности, ат % Структура 8,9 20—25 Тетраг. 22,65 30—50 Г. ц. к. 13,31 Г. ц. к. 7,28 Г. ц. к.
Нитриды титана
213
Таблица 58 (продолжение)
Свойство Нитрид
TigN-S TiN-S ZrN HfN
Период решетки, кХ: а . 4,92 [43J 4,234 [ 145] 4,567 [354] 4,51 [139]
с 5,61 — — —
с/а • . 1,05 — — —
Плотность, г/см*: расчетная — 5,44 7,349 13,84
экспериментальная . , 4,77 [145] 5,21 [145] (4,56 А) 6,93-6,97 —
Микротвердость, кг/мм2: ПМТ-3 (30 г) . . . 2160+29 [362] [139, 186] 1983+18 [362]
по Кнупу (100 г) . . — 1770[186] 1510 [4] —
Температура плавле- ния, °C 2950+50 [136] 2980150 [136] —
Теплоемкость (299°К), ккал/моль. град . . . — 11,91 [167] 11,10 [366] —
Теплота образования —ЛН°298> ккал/моль . . Энтропия (298’К), кал/град ........ 80,3 ж 2,0 [368] 82,2x2,5 [192] ~97 [615]
7,2+ 0,4 [182] 9,310,5 [369] —
Теплопроводность, кал/см сек • град . . . При 100° При 200° —
Коэффициент термиче- ского расширения, %/град 0,07 [193] При 600° 0,019 [193] При 950° 0,014 [193] 9,35± 0,043[370] 0,033 [193] При 4900° 0,018 [193] При 890° 0,013 [193]
Удельное электросо- противление, мком/см: при 25°С 11,1 |371] 13,6 [136]
при —193°С 8,13 [136] 3,97 [136] —
Термический коэффи- циент электросопротивле- ния, %/град +3,0 [372] + 4,3 [136]
а . 103 (в интервале) — (—190+20) (+20+2560) —
Молярная магнитная восприимчивость m • 10е +48 (195] +60 [195] —
Точка перехода к сверхпроводимости, °К 1,2—1,6 3,2—7,8 —
Термоэмиссионные свойства: <f, эв ....... [197, 198] 2,92 [197, 198] 2,92
А., а[см* • град2 . . 1 120 I 120 1
214
Нитриды
Таблица 58 (окончание)
Свойство Нитрид
Ti3 N-s TiN-? ZrN HfN
Температуры (®С), при которых упругость дис- социации составляет: 1 мм рт. ст 2912 [367] 2603[367]
10—3 мм рт. ст. . . — 2331 [367] 2046 [367] —
Модуль упругости, кг’мм3......... 25600 [616] — —
Предел прочности при сжатии, кг/мм* .... — (для плотн. 3,03 г/см3) 129,8* 100* —
* По данным Самсонова, для TiN с у-5,03 и ZrN с 7-6,97 г1см3-
Нитрид циркония
Нитрид циркония наиболее просто получается азотированием
порошка циркония или гидрида циркония сухим азотом при
2000° [359] или аммиаком [13] при 800—900° С:
Zr (тв.) + N2 (г)^ AfeN (тв.).
на порошок циркония показана на
Рис. 126. Зависимость скорости азоти-
рования циркония от времени
Зависимость скорости реакции от времени при действии азота
рис. 126, а зависимость кон-
станты скорости реакции от
температуры — на рис. 127
[42]. Энергия активации азо-
тирования «-Zr составляет
39 200 кал/моль1. При тем-
пературах 750° и ниже цир-
коний азотируется аммиа-
ком с трудом, продукты азо-
тирования содержат метал-
лический цирконий с увели-
ченным периодом решетки
[131], что свидетельствует об
образовании твердого рас-
твора азота в цирконии. Да-
же при азотировании с помощью аммиака при 700—750° в про-
должение 12—23 час. нитрид содержит 10—11% N и имеет пе-
риод решетки 4,57—4,59 кХ.
1 Теплота активации при диффузии азота в З-Zr составляет 30 700 ккал'моль (920 —
1640® С 13 6 4 j«
Нитрид циркония
215
Фридрих и Зиттиг [357] получали нитрид циркония прокали-
ванием в атмосфере азота при 1100—2300° смеси ZrO» с сажей
в соотношении, рассчитанном на восстановление двуокиси до ме-
таллического циркония:
ZrO2 + 2С [у N3- ZrN + 2CO.
При этом получается нитрид циркония, сильно загрязненный
углеродом и содержащий значительные количества невосстано-
вившегося окисла.
Методом наращивания из газовой фазы ZrN получается на
вольфрамовой или циркониевой проволоке из смеси ZrCl4 и NH3
или N2+H2 при 2000—2400°,
а из смеси ZrCU+N^ — при
температуре нити около 3000°
[122; 125; 175; 363].
Нитриду циркония при-
писывали ранее следую-
щие формулы: Zr3N4, Zr3N2,
Zr3N8, ZrN [231], [360]. Позд-
нейшими работами установ-
лено, что цирконий имеет
один нитрид ZrN с 13,3% N,
кристаллизующийся в куби-
ческой гранецентрированной
решетке типа NaCl с перио-
дом 4,56 кХ.
По данным Ишии [365],
ZrN имеет а - и р-модифи-
кации, различающиеся стой-
костью в разбавленной хо-
лодной плавиковой кислоте.
Нитрид циркония пред-
ставляет собой желто-корич-
невый порошок с золотистым
оттенком; в компактном со-
стоянии имеет лимонно-жел-
тый цвет с металлическим
блеском.
Рис. 127. Зависимость константы ско-
рости реакции Zr + V2 Na от темпера-
туры (£' = 39 200 кал/моль)
Превращение порошка нитрида в форму компактных образ-
цов удобно производить методом кратковременного горячего
прессования при высоких температурах в графитовых или каких-
либо иных прессформах. Компактный нитрид циркония весьма
хрупок.
не растворим в азотной кислоте, в смеси азотной и соля-
ной [362] и разбавленной соляной и серной кислотах, но легко
216
Нитриды
растворяется концентрированной серной кислотой. Кислородом
воздуха он не окисляется до 1100—1400°, являясь одним из наи-
более устойчивых в этом отношении нитридов наряду с TiN.
Термодинамически ZrN является самым прочным из всех из-
вестных нитридов, по крайней мере до ~ 12006, когда убыли сво-
бодной энергии при образовании нитридов Ti и Zr становятся
почти одинаковыми. Изменение свободной энергии при образова-
нии ZrN выражается формулой Д F=—82200+22,0 Т. Измене-
ние теплосодержания для интервала температур 298—1700° К
описывается [366] уравнением
Н°т — Н°2Э» = 11,10 Т + 0,84 • IO"3 Т2+1,72- 10-5 Г~‘.
Данные об упругости диссоциации ZrN приведены в моногра-
фии Дэшмана [367].
Нитрид гафния
Данные о нитриде гафния HfN весьма ограничены. Полу-
чается он аналогично нитриду циркония, окраска его желто-
коричневая. Нитрид гафния имеет кубическую гранецентриро-
ванную решетку с периодом 4,51 кХ. Свойства нитридов титана,
циркония и гафния приведены в табл. 58.
Нитриды ванадия
Действием азота на порошок ванадия можно получать нитрид
ванадия точного состава VN [353, 354]. Для приготовления спла-
вов с более низкими содержаниями азота Хан прессовал брике-
ты из смесей VN с ванадиевым порошком, нагревая их в закры-
той кварцевой трубке 24 часа при 1000—1100° С [353]. При нагре-
вании ванадиевой проволоки в атмосфере азота образуется по-
рошок нитрида ванадия бронзового цвета [373]. Для приготов-
ления нитрида ванадия одновременным восстановлением окисла
и азотированием обычно используется V2O3, так как V2O5 очень
летуч. Однако и при использовании V2O3 получить нитрид труд-
но, так как при 1200° нитрид в присутствии углерода превра-
щается в карбид. Впервые довольно чистый нитрид получили та-
ким способом Фридрих и Зиттиг [357]. Они нагревали смесь
V2O3 + ЗС в молибденовой лодочке в трубчатой печи с фарфо-
ровой трубкой при 1200° в атмосфере азота (нитрид содержал
21,1% N вместо 21,55%, полагающихся для VN). Прокаливая
ванадий в токе азота при 1200°, они получили VN, содержащий
21,69%. N.
Нитрид ванадия приготовляли также нагреванием VOCI3 или
V2O3 в токе аммиака [4].
Эпельбаум и Ормонт [347, 374] получили нитрид ванадия раз-
ложением ванадата аммония в токе аммиака при 1000—1100°
(при более низких температурах получаются смеси VN с окисла-
Нитриды ванадия
217
ми ванадия). Позднее этот же способ с успехом был использо-
ван Ханом [353] для приготовления очень чистого нитрида вана-
дия. Эпельбаум и Ормонт [374] получали нитрид ванадия также
одновременным восстановлением и азотированием низшего окис-
ла ванадия V2O2 при 500—600* по реакции:
V2O2 + 2Ha+N2 = 2VN + 2Н2О
и установили, что эта реакция идет с выделением 16 ккал тепла.
Беккер и Эберт [139] установили, что нитрид ванадия, изго-
товленный Фридрихом и Зиттигом, имеет кристаллическую ре-
шетку типа NaCl с периодом а=4,28 кХ. Эта цифра опровергает-
ся результатами последующих работ, получивших близкие меж-
ду собой значения периода а=4,13 кХ [143] и а=4,12 кХ [376].
Вычисленная по данным Беккера и Эберта плотность нитрида
ванадия 5,46 г/см3 значительно ниже плотности, измеренной ими
же экспериментально (5,73 г/см3), что подтверждает ненадеж-
ность данных работы Беккера и Эберта.
’ Детальное рентгенографическое исследование системы V—N
было проведено Ханом [353], который установил наличие двух
нитридов ванадия V3N и VN.
Азот ничтожно мало растворим в ванадии; сплавы, содержа-
щие до 9,3%'| N(VN0.37), двухфазны— a-твердый раствор и
р -фаза.
Фаза V3N (P-фаза) гомогенна в области от VNo,37 до
VNo,43 (V3N—V2N), т. е. от 9,3 до 10,5%| азота в ванадии.
С увеличением содержания азота периоды гексагональной решет-
ки Р-фазы возрастают, как показано на рис. 124. В области от
10,5 до 16,4% N сплавы двухфазны (р+ 7), а с 16,4 до 21,5%
N(VNo,7i—VNi.o) простирается область гомогенности второй —
7-фазы, отвечающей в предельном случае формуле VN.
Период решетки этой кубической фазы также резко изменяет-
ся с повышением содержания азота (рис. 128).
Нитрид ванадия VN имеет структуру вычитания, причем в
интервале от 600 до 1200° в решетке вакантна часть узлов вана-
дия, а при температурах выше 1200° — часть узлов азота. При
низких температурах в решетке нитрида ванадия могут присут-
ствовать и атомы кислорода, т. е. соединение в общем имеет со-
став Vx (Ny O_v—_y).
Атомы азота замещаются при этом атомами кислорода, т. е.
на структуру вычитания накладывается структура замещения.
Зависимость атомного состава нитрида ванадия, содержащего
кислород, от температуры и его свойства показаны в таблицах 59
и 60 [374].
Период решетки, как следует из этих данных, имеет максимум
при соотношении Vi,o Ni.oJ этому же составу отвечает и мак-
218
Нитриды
Таблица 59
Атомный состав кислородсодержащего нитрида ванадия
при различных температурах
Температура °C Формулы
600 Vo, 9 N0 .94 °0,06
800 V0,94 ^0,94 °0 06
1000 V.,o Nfl 93 *-*0,02
1200 V] оз Nq 96 ^0,04
1300 Vj, 14 N0,93 ^0,02
Таблица 69
Зависимость состава и свойств кислородсодержащего нитрида ванадия
от температуры реакции
V2O2+2Hs+N2=2VN+2H2O
Режим процесса Химический состав % Формула Свойства
температура °C 1 время, час. 1 н V о a kX плотность удельное электро- сопротив- ление ом-мм* способ- ность к шлифовке, условные единицы
м
600 16 21,8 76,6 1,0 V0,96 N 4,113 5,12 0,0358 0,020
800 2 21,28 77,2 1,52 Vo,98 N 4,126 5,4 0,033 8 0,033
1000 2 21,1 78,4 0,5 V],oi6 N 4,13 5,83 0,0,32 0,064
1200 2 20,8 78,9 0,3 V1.14 N 4,128 5,86 0,0а26 0,066
1400 2 18,9 80,1 0,5 Vi.n N 4,12 5,78 0,0а25 0,056
симальное значение шлифспособности. Период решетки VN [376],
определенный прецизионно, составляет 4,12g кХ.
По данным Хана, удельный вес существенно зависит от содер-
жания азота в нитриде ванадия (бескислородные образцы [353]
(табл. 61).
Различие пикнометрических и расчетных значений плотности
невелико, что свидетельствует об ограниченном числе пустых
мест в решетке, во всяком случае гораздо меньшем, чем в нитри-
де титана.
Нитрид ванадия термодинамически довольно прочен; убыль
свободной энергии при образовании из металла и азота выра-
жается уравнением AF =—60000—1,73 Т 1g 74-26,38 Т (+10%,
в интервале 298—2000° К).
Нитриды ванадия
219
Таблица 61
Зависимость удельного веса нитрида ванадия
от содержания азота
Состав Удельный вес
пикнометрический расчетный
VN1>00 6,040 6,102
vn0>87 5,988 6,089
VN0,72 5,972 6,066
vn0.38 5,967 5,987
Для теплоемкости дается уравнение температурной зависи-
мости Ср =10,94+2,10 • 10~3Т—2,2 • 105 Т~2 (±1,5%, в интер-
вале 298—1611° К) [377].
Энтропия VN составляет 21,0±0,1 кал/г [378].
Рис. 128. Зависимость периодов решеток фаз
в системе V—N от содержания азота
В порошкообразной форме VN имеет серо-коричневый цвет с
фиолетовым оттенком. С повышением содержания азота цвет
его становится желто-бронзовым, а с понижением — более серым.
VN не растворим в серной и соляной кислотах, растворим в
азотной кислоте. При длительном кипячении в концентрирован-
ной серной кислоте медленно растворяется с выделением азота.
Сильные щелочи растворяют нитрид ванадия с выделением ам-
миака. При нагревании на воздухе нитрид ванадия довольно
устойчив, окисляется только с 500—800°.
Нитрид V3N гораздо менее устойчив в химическом отноше-
нии, чем VN.
Некоторые свойства нитридов ванадия приведены в табл. 62.
220
Нитриды
Таблица 62
Свойства нитридных фаз системы ванадия с азотом
Свойство Нитрид
V3N VN
Содержание азота в фазах, предельно по- глощенных металлом, % 9,3 21,5
Область гомогенности, % (атомн.) N . . 25—33 41—50
Структура » Гексаг. пл. Г. ц. к.
Периоды решетки, кХ'. а упак. 2,835 [353] 4,126 [353]
с 4,541
с/а 1,60
Плотность, г!см*: расчетная 5,987 6,102
экспериментальная 5,967 [353] 6,040 [353]
Температура плавления, °C ....... . Теплоемкость (при 298°К), ккал!моль-град — 2050—2320*
— 11,57 [377]
Теплота образования, ккал/моль .... — 60,0 ± 2,0[ 182]
Энтропия (298°К), кал/град — 21,0 10,1 [378]
Удельное электросопротивление, мком-см — 85,9 [136]
Термический коэффициент электросопро- тивления, а • 103 в интервале—190+20°, %/град + 1,4 [136]
Точка перехода к сверхпроводимости, °К — 1,5—3,2 [197]
Температуры (°C), при которых упру- гость диссоциации: 1 мм рт. ст 1242 [367]
10—5 мм рт. ст — 933 [367]
* Заимствовано из старых работ-
Нитриды ниобия
Сплавы ниобия с азотом могут получаться непосредственно
выдержкой порошка ниобия в токе азота или аммиака [379,
381]. Подобное азотирование ниобиевой стружки в продолжение
4—5 час. при 1300° позволяет получить высший нитрид ниобия
NbNli00, а при 1450°—NbNo,93 — NbNo.94- Нагреванием
этих сплавов в высоком вакууме при 1300—1400° в продолжение
3—6 час. с целью удаления части азота получают сплавы, более
бедные азотом (от NbNo.ss до NbNo.zi)- Наконец, при нагре-
вании смесей сплавов, богатых азотом, с ниобиевой стружкой
при 1450° 3 часа в атмо-сфере аргона получают сплавы, бедные
азотом (вплоть до NbNo.os)- Аналогичным путем получал спла-
вы ниобия с азотом Шенберг [380], который азотировал порошок
ниобия и гидрида ниобия при температурах 700—1000° в про-
должение от 1 часа до 2 недель.
Нитриды ниобия
221
Кинетика реакции азотирования ниобия изучалась Гульбран-
зеном и Эндрью [42]; полученная ими зависимость скорости
азотирования от времени показана на рис. 129.
Энергия активации при реактивной диффузии азота в ниобий,
рассчитанная по этим данным, составляет около 25 400 кал!моль.
Таким образом, азотирование ниобия проходит легче, чем тан-
Рис. 129. Зависимость скорости азотирования
ниобия^от времени
тала, однако значение энергии активации кажется значительно
заниженным.
При азотировании ниобиевой проволоки аммиаком в продол-
жение 1 часа при 1400—1800° [599] образуется наружный слой
из NbN и внутренний из Nb2N. Хорошо кристаллизованные осад-
ки нитрида получаются при реакции NbClg со смесью равномо-
лекулярных объемов N2 + Н2 при 1340—1350° на вольфрамовой
проволоке [600].
Сплавы ниобия с азотом можно получать также азотирова-
нием смесей Nb2Os или Nb2O3 с углем в токе азота.
Фридрих и Зиттиг [357] получали нитрид NbN путем азоти-
рования смеси Nb2O3 с углем (причем Nb2O3 приготовлялась
предварительным восстановлением Nb2Os водородом при 1100—
1200°).
Беккер и Эберт [139], исследуя рентгенографически структу-
ру нитрида, полученного Фридрихом и Зиттигом, нашли, что он
имеет кубическую кристаллическую решетку типа NaCl с перио-
дом 4,41 кХ. Измеренная ими же экспериментальная плотность
нитрида была равна 8,40 г/см3, в то время как значение плотно-
сти, вычисленное на основании данных рентгеноанализа, оказа-
лось ниже измеренного (8,25 г!см3), что ставит под сомнение
либо результаты структурного анализа, либо данные о химиче-
ском составе вещества.
В 1940 г. Уманский [382] исследовал рентгенографически
нитрид ниобия, изготовленный Бабичем трехчасовым прокалива-
222
Нитрида
нием смеси ниобия с его гидридом в платиновой печи в токе азо-
та при 1100 и 1300°
Порошок нитрида ниобия имел серый цвет у поверхности
светлее, чем в середине. Порошок, изготовленный при высокой
температуре, был темнее, чем при низкой. По данным химиче-
ского анализа (средняя проба), нитрид содержал 8,8% N
(NbN о.бб); данные анализа, однако, не очень надежны.
Рентгенографическое исследование показало, что все образ-
цы нитрида, различные по внешнему виду, имеют одну и ту же
кристаллическую решетку с одними и теми же периодами. Ме-
таллические атомы образуют компактную гексагональную ре-
шетку с измененным отношением осей с/а=1,85 и периодами
а = 3,016 ± 0,003 кХ и с = 5,580 ± 0,06 кХ.
Поскольку отношение атомных радиусов азота и ниобия, рав-
ное 0,48, значительно превышает критическое соотношение Маг-
нуса для четверной координации (0,41), атомы азота должны
располагаться в соответствии с учением Хэгга о структурах внед-
рения (см. гл. I) в октаэдрических промежутках решетки, обра-
зованной металлическими атомами (см. рис. 7).
Принимая атомный радиус ниобия равным 1,47 кХ, Уман-
ский получил для радиуса азотного атома в решетке нитрида
ниобия значение, равное 0,87 кХ, т. е. на 0,05 кХ больше, чем
ио данным Гольдшмидта.
Однако, как будет показано ниже, «эффективный» радиус
азотного атома в некоторых удовлетворяющих формуле AfeN
нитридах металлов переходных групп достигает и даже превы-
шает найденную Уманским величину.
Поскольку ни в одном нитриде металлов переходных групп с
формулой AfeN «эффективный» радиус азотного атома не превы-
шает 0,7 кХ, следует предполагать, что по химическому составу
нитриду ниобия ближе подходит формула NbN, чем Nb2N, хотя
по данным анализа этот сплав содержит лишь 8,8% N. Очевидно,
как это и указывалось, определение азота было проведено не-
точно.
Эти данные опровергают указания Беккера на то, что нитрид
ниобия имеет кубическую решетку. Повидимому, Беккер иссле-
довал не нитрид, а карбид (или карбонитрид) ниобия. Как ука-
зывалось выше, сродство ниобия к углероду чрезвычайно вели-
ко, поэтому восстановление пятиокиси ниобия сажей, пред-
шествовавшее в опытах Беккера, Фридриха и Зиттига обра-
зованию нитрида, могло привести к частичному получению кар-
бида.
Полное рентгенографическое исследование системы NbN
было проведено Брауэром и Яндером [379].
Растворимость азота в ниобии менее 4,8% (атомн.), так как
уже сплав, отвечающий формуле NbN0 05, содержит фазу
Нитриды ниобия.
223
NbN; a-твердый раствор имеет кубическую объемноцентриро-
ванную решетку с периодом, весьма мало отличающимся от пе-
риода чистого ниобия (3,2948+0,0002 кХ)', p-фаза или фаза Nb2N
гомогенна й области NbNa,4o—NbNo.so- Атомы ниобия зани-
/ 1 2 1\
мают узлы гексагональной плотнейшей упаковки/ООО и--------,
а атомы азота статистически распределены в крупных порах
„/211 2 1 3 \
решетки с координационным числом 6 1~у и у з"^) '
Периоды решетки в пределах области гомогенности изменя-
ются мало; так, период а=3,046+0,004 кХ вообще не меняется,
а значение с при уменьшении содержания азота несколько сни-
жается от 4,986±0,001 кХ ( NbNo.se) до 4,947+0,001 кХ на гра-
нице с а-фазой.
Т-фаза (NbNo.eo—NbNo.so) изоморфна 5-фазе в систе-
ме Та—N и имеет структуру типа NiAs. Атомы азота располо-
жены в центрах двух тригональных призм из атомов ниобия. По
Брауэру и Яндеру, в интервале концентраций NbNo.zs —•
NbNo.94 имеются две фазы: NbNo,75 —NbN0,79 с тетра-
гональной (деформированной NaCl) структурой и NbNo,87 —
NbNo,94 со структурой NaCl. Однако последующей работой
Шенберга [380] было показано, что наличие двух фаз следует от-
нести за счет присутствия кислорода в образцах, т. е. образова-
ния фаз системы Nb •— N — О.
8 -фаза (NbN — тс -фаза Брауэра), соответствующая формуле
NbN 0.95, имеет гексагональную решетку с антиникельарсенид-
ной конфигурацией атомов. Атомы азота расположены в центрах
октаэдров, построенных из атомов металла.
е -фаза — NbN 1,о о имеет гексагональную решетку. В ее
элементарной ячейке 4 молекулы NbN; атомы азота расположены
в центрах октаэдров, построенных из металлических атомов.
Пространственная группа— D**—(mine) с расположе-
нием атомов: 4Nbe4(f) — --z;— ~z, —— z; — — -—zcz— —
33 33 332 332 8’
2 Nb в 2 (a) 000; 00 — и 2 Nb в 2 (d) — — —; — -—Аналогичную
2 v 7 3 3 4 3 3 4 J
структуру имеют МоС (у-фаза), а также некоторые фосфиды—
TiP, p-ZrP [383].
Результаты Брауэра и Лидера недавно подтверждены; уточ-
нены области гомогенности наблюдавшихся ими нитридов нио-
бия [589].
На рис. 130 дана схема фазовых областей в системе NbN.
Брауэр и Яндер [379] обращают внимание на несоответствие
между этими представлениями о фазах системы Nb—N и данны-
ми Уманского, который, как указывалось выше, для образца
224
Нитриды
NbNo.65 получил гексагональную решетку, периоды и располо-
жение атомов которой приблизительно соответствуют S-фазе
(NbN—к -фазы Брауэра и Яндера). Это возможно только при
условии, что нитрид Уманского содержал кислород, который, внед-
ряясь в решетку ниобия вместе с атомами азота, доводил общую
картину фазы до ~ NbNo,6500,3 (т. e.~NbN~o,9s) •
Кроме того, причиной могло быть неполное азотирование, что
вызвало наличие наряду с 8-фазой металлического ниобия илн
а-фазы.
Таким образом, при взаимодействии нитрида ниобия с кисло-
родом последний внедряется в поры, не занятые азотом, т. е.
NB Ю 2D 30 40 SO 60 70 80 90 N
N, % (атомн.)
Рис. 130. ФазоваяХ'диаграмма^системы Nb—N
принимает участие в
с кислородом является, повидимому, более сильной, чем с азо-
металлической связи, причем связь ниобия
Температура. °К
Рис. 131. Теплоемкость нитрида нио-
бия NbN при низких температурах
том. Структура фаз остается
при таком внедрении неизмен-
ной, и фазовые области собст-
венно нитридных фаз расширя-
ются.
Нитрид ниобия NbN с
13,1% N в порошкообразном
виде имеет светлосерый цвет с
желтоватым оттенком. Он весь-
ма устойчив против действия
соляной, серной и азотной кис-
лот, а также царской водки,
даже при кипячении [66]. При
нагревании с NaOH или при
кипячении в растворах силь-
ных щелочей разлагается с выделением аммиака. Nb2N также
устойчив против действия кислот, при нагревании в растворах
сильных щелочей или при сплавлении с ними выделяется не ам-
миак, а азот [4].
При нагревании нитридов ниобия на воздухе до 500—800°
образуется Nb2O5.
Важным свойством нитрида ниобия NbN является его способ-
ность переходить в сверхпроводящее состояние при довольно вы-
Нитриды тантала
225
сокой температуре около 15,6° К [344]. На рис. 131 приведены
результаты исследования теплоемкости NbN при низких темпе-
ратурах [384].
Аномалия на кривой теплоемкости при 15° К показывает пе-
реход нитрида ниобия к сверхпроводимости.
Критическая величина магнитного поля, определяющая темпе-
ратуру перехода в сверхпроводящее состояние, равна 257 гс/град.
Свойства нитридов ниобия приведены в табл. 63.
Таблица 63
Свойства нитридных фаз системы ниобий — азот
Нитрид
Свойство NbN0.40- MbN„ NbNo.8O- NbN_ NbN0.95 NbN
0,50 0.90
Содержание азота, % (вес.) Область гомогенности, % 5,68—7,02 10,75—12,00 12,5 13,1
.атомн.) 28,5—33,5 44,5—47,5 —- —
[380] [380]
Структура ....... Гексагональная
Периоды решетки: 2,968
а 3,046 [380] 2,950—2,958 2,952 [380]
[380] [380]
с 4,947—4,986 2,772—2,779 5,535 11,25
с/а Плотность, г/слг®: 1,624—1,637 0,940—0,939 1,865 3,811
расчетная ...... 8,31 — -— —
экспериментальная . . . Твердость по минералоги- 8,33 [380] 8,32 [380] 8,30[ 380] 8,40 [380]
ческой шкале — >8 [4]
Температура плавления,°C — — — 2300 [ 385]
Теплоемкость (298°К), ккал/моль град (разлагается) 10,41 [386]
Теплота образования из металла и азота, ккал/моль — — —
59,0+5,0 [182] 10,510,2
Энтропия, кал]град . . . — — —
Удельное электросопро- тивление при 25°, мком • см - [182] 200 [134]
Точка перехода к сверх-
проводимости, °К Температура (°C), при ко- торой упругость диссоциа- ции составляет: 9,5 [387] 15,6(344]
1 мм рт. ст — 1946 [367]
10—’ мм рт. ст — 1491 [367]
Нитриды тантала
: Сплавы тантала с азотом в наиболее чистом виде получаются
нагреванием порошка тантала в токе азота или аммиака.
г. В. Самсонов
226
Нитриды
Хорн и Циглер приготовляли очень чистые сплавы тантала с
азотом азотированием порошка тантала азотом при 1100—
1200° [388], а Шенберг [389] — азотированием тантала и гидрида
тантала при 700—1100° в продолжение от 1 часа до 2 недель,
нагревании в вакууме при 1100°. При повторении нами этих
нагревании в вакууме при 1100°. При повторении нами этих
опытов оказалось, что для приготовления TaN при 1100° необхо-
4,000
2,000
1,000
> 1,600
»} 1,600
Д 1,200
s'
3 1 юо
J 1,060
ь. 1,060
1,040
1,020
1,ОО6
1,004
0,80 0,90, 1,0 1,1 1,2 13
~ X Ю*
цимо 5—6-часовое азотирова-
ние чистым азотом, не содер-
жащим следов кислорода.
При нагревании смеси
Та2О5-1-5С в токе азота или
аммиака получать чистый TaN
не удается; содержание нитри-
да в получаемом продукте в
лучшем случае достигает 50—
60%, остальное — карбид ТаС.
Аналогичные продукты полу-
чаются и при азотировании по-
рошка тантала азотом, содер-
жащим следы соединений угле-
рода.
Кинетика процесса азотиро-
вания тантала изучалась в ра-
боте Гульбранзена [42], кото-
рый построил графики зависи-
мости количества поглощенного
Рис. 132. Зависимость константы
скорости азотирования тантала от
температуры (Е = 39400 кал)мом>)
ции азотирования от температуры (рис. 133).
Ниже показана зависимость константы скорости реакции
Та+. Na = TaN от температуры
танталом азота от времени
(рис. 132), а также зависимо-
сти константы скорости реак-
Температура, °C
К, гем* сек
500 9,6 • 10““
600 1,78 . Ю-14
700 1,39 • 10"”
750 5,28 • 10-1*
800 1,14-10-“
850 2,94 - ЦТ1*
Определенная отсюда энергия активации при азотировании
тантала оказалась равной 39 400 кал/моль.
Чиотти исследовал условия приготовления нитрида тантала
азотированием металла аммиаком [131], однако при 800—900° и
выдержке от 5 до 18 час. содержание азота в сплаве достигало
Нитриды тантала
227
всего 6,12% и на рентгенограмме были обнаружены только сла-
бые линии, относящиеся к TaN.
При нагревании этого сплава в вакууме при 2000° он терял
часть азота, переходя в нитрид Ta2N с 3,6% N. При более дли-
тельном нагревании в вакууме на рентгенограммах появлялись
также линии тантала, что указывает на дальнейший распад нит-
рида.
Сплавы тантала с азотом могут также получаться осаждени-
ем из газовой фазы (из смеси TaClB+N2-|-H2), однако при этом
вместе с TaN на нить осаждается тантал, восстанавливаемый из
Та2Ов водородом. В связи с этим лучше проводить азотирование
Рис. 133. Зависимость скорости азотирования
тантала от времени
из смеси TaCls + N2, но при высоких температурах порядка
2500—2800°.
Систематическое изучение нитрида тантала, открытого в
1876 г. Жоли, который приписал ему формулу TaN [2]*, нача-
лось лишь в 1924 г., когда Ариель получил в результате реакции
в газовой среде препарат высокой чистоты, определил его хими-
ческий состав и кристаллическую структуру. По данным Аркеля
[138], металлические атомы в нитриде тантала образуют гексаго-
нальную компактную решетку с периодами а = 3,05 кХ и
с •= 4,95 кХ, da = 1,62. Принимая без обсуждения формулу нитри-
да, предложенную Жоли, он считал, что кристаллическая решет-
ка этого вещества аналогична решетке вурцита.
По мнению Хэгга [391], не исключена возможность, что Аркель
сшибся в определении химического состава полученного им нит-
рида: обычно гексагональная компактная решетка металлических
атомов свойственна карбидам, гидридам и нитридам, состав ко-
торых отвечает формуле Ме2Х, где Me — мегалл (например,
Та2С), и потому возможно, что в действительности полученный
* По Жоли, тантал образует, кроме TaN, второй нитрид.
15*
223 Нитриды
им нитрид тантала имел формулу Ta2N. Предложенное Аркелем
размещение атомов Хэгг также отвергает.
Подробное рентгенографическое исследование системы Та—N
проведено только в 1954 г. Шенбергом [389] и независимо от него
Брауэром и Цаппом [392]. Шенберг получал образцы сплавов
Ta-N обработкой порошка тантала азотом. Им были обнару-
жены в этой системе четыре промежуточные фазы, названные
₽-фазой (TaN^o.ns). i-фазой (TaN~o,4o—TaN~o,45), S-фазой
(TaN-o.'-o — TaNo.so) и е-фазой (TaN).
В Р-фазе атомы тантала расположены в кубической решет-
ке, очень немного отличающейся от кубической объемноцентри-
рованнэй решетки чистого тантала (а-фазы). Эта сверхструктур-
ная фаза имеет период а=3,369 кХ, период решетки Та 3,311 кХ.
7-фаза, гомогенная в пределах от TaN~Q,4o—TaN -0,45, т. е.
близка по составу к ранее обнаруживавшемуся нитриду Ta2N.
Она является классическим примером нитрида, образованного по
типу фаз внедрения с расположением атомов металла в плотно
упакованной гексагональной решетке и атомов азота в двух ок-
таэдрических порах, в центрах элементарной ячейки. Периоды
решетки изменяются в пределах,, указанных в табл. 65.
S-фаза, гомогенная в пределах от TaN^o.fO до TaN~o.°o, имеет
простую гексагональную решетку с расположением метал-
лических атомов ААА... Атомы азота расположены в одном из
центров двух тригональных призм, образуемых атомами металла.
е-фаза, соответствующая нитриду TaN, получалась Шенбер-
гом при азотировании тантала в продолжение 3 дней при 1000°
абсолютно чистым от кислорода азотом. В гексагональной эле-
ментарной ячейке TaN содержатся три молекулы. Пространствен-
ная группа TaN—D6* — Р6 mmtn с 1 Та в 1 (а) ООО, 2 Та в 2
(<*') -> ~ -- и 3 N в 3 (/) - 00; 0 - 0; -- 0.
332 332 ' 2 2 22
Брауэр и Цапп [392] получали богатые азотом сплавы систе-
мы Та—N обработкой порошка тантала чистотой 99,83% азотом
в продолжение 6 час. при 1400°. Сплавы с содержанием азота
от TaN до TaNo.so получались нагреванием TaN в вакуумной
печи при 1400°, а для приготовления сплавов с еще более низким
содержанием азота смеси Ta2N+Ta нагревались в продолжение
8 час. при 1400° в высоком вакууме. Результаты рентгеновского
анализа и определения плотностей полученных таким образом
сплавов показаны в табл. 64 [392].
Таким образом, Брауэром и Цаппом были обнаружены две
нитридные фазы: Ta2N и TaN.
При определении структуры фазы TaN получились результа-
ты, полностью совпадающие с данными Шенберга (рис. 134).
Кратчайшие расстояния между атомами тантала составляют
2,90, 2,99 и 3,33 кХ, расстояние Та—N 2,08 или 2,59 кХ. Область
Таблица 64
Результаты рентгеновских и химических анализов, а также плотность сплавов системы Та — N
Химический состав» % Условная формула Плот1.ость» г см2 Фазовый состав Периоды решетки, кХ
Та N Ta+N пикномет- рич< ская определен- ная в ре- зультате рентгенов- ского ана- лиза TaN Ta2N Ta
92,88 7,19 100,07 TaN( 00 13,80 14,3(5 TaN o=5,1808 c=2,9049 — —
92,92 7,08 100,0 Га1У,0,9з — — TaN+Ta2N — — —
94,60 5,30 99,90 TaNQ 72 14,73 — TaN+Ta2N a=5,181 c—2,905 0=3,049 c=4,922 —
95,95 4,14 100,09 TaN0 5G 15,35 — TaN+Ta,N — 0=3.036 c=4,913 —
96,39 3,72 100,11 1 aN0 50 15,46 15,86 Ta,N — 0=3,0415 c=4,9088 —
96,70 3,04 99,74 TaN0 4, 15,42 15,78 Ta,N __ 0=3,042 0=4,9J5 —
97,25 2,64 99,89 TaN0,35 15,55 — T agN 4"T a 0=3,042 c=4,905 —
99,10 0,69 99,79 TaN0 09 16,04 — T 32N -f-Та — — —
99,51 0,35 99,86 TaN0 05 16,33 ♦ - Ta2N+Ta — - 0=3,317
99,65 0,22 99,87 TaN0 03 16,50 — Ta — — 0=3,315
99,72 0,09 99,81 TaNQ 01 16,43 16,57 Ta — __ 0=3,310
99,83 0,07 Ta 16,45 16,58 Ta — 0=3,299
230
Нитриды
гомогенности этой фазы очень мала, так как сплав TaNo.gs
уже содержит низший нитрид Ta2N. Последний имеет область
гомогенности от TaNo.u до TaNo.so (вместо TaNo,4o — TaN 0.45
по Шенбергу). Атомы тантала образуют плотнейшую гексаго-
нальную упаковку с положениями ООО, 3- у •
Рис. 134. Кристаллическая структура TaN
(по Брауэру и Цаппу) [392]:
л—алемеитарвая ячейка; б —ее вертикальный
разрез по АВ
Растворимость азота в
тантале по этим данным
очень мала, так как уже
при содержании азота, со-
ответствующем формуле
TaNo.os, на рентгенограм-
мах появляются слабые
линии фазы Ta2N. р -фа-
за, обнаруженная Шен-
бергом, с достаточной
определенностью не была
установлена Цаппом.
Построенная Брауэром
и Цаппом фазовая диа-
грамма системы Та—N
показана на рис. 135.
Экспериментально уста-
новленный интенсивности
линий дебаеграмм TaN
отлично совпадают с рас-
считанными (рис. 136).
Высший нитрид танта-
ла TaN (7,19% N) пред-
ставляет собой серый по-
рошок с голубоватым от-
тенком.
В химическом отноше-
а 1
Z& ГаН
Tagjv
Рис. 135. Фазовая диаграмма системы
Та—N
нии нитриды тантала сход-
ны с металлическим тан-
талом. Как и тантал, они
активно реагируют со
смесью плавиковой и
азотной кислот, а соляная
и азотная кислоты на них
не действуют. Горячая
концентрированная серная кислота при длительном действии рас-
творяет лишь следы нитридов. При средних температурах TaN и
Ta2N более стойки против действия кислорода, чем тантал. В то
время как тантал и его гидрид окисляются до Та2О5 при кратко-
временном прокаливании на воздухе (при 570°), нитриды танта-
Нитриды тантала
23!
ла при той же температуре даже в продолжение 24 час. окис-
ляются совершенно незначительно; окисление становится замет-
ным при 800°.
Рис. 136. Экспериментально' установленные'и рассчитанные интен-
сивности линий рентгенограммы TaN
Таблица 65
Свойства нитридных фаз системы тантал—азот
Свойство Нитрид
TaN~0.05 TaN~0.40 TaN~ 0.45 TaN~0,«0 0.90 TaN
Содержание азота, % . . Область гомогенности, % 29,8-33,5 58,3—65,2 7,19
— 28,5—31 [389] 44,5—47,3 [389] —
Структура Периоды решетки, кХ: О. ц. к. Г ексагональна я 5,185 [389]
а 3,369 [389] 3,041-3,048 [389] 2,925—2,939 |389]
с — 4,907 4,918 2,876 2,883 2,908
с/а Плотность, г/см^'. — 1,614 0,983—0,981 0,561
расчетная .... • . . — 15,81 15,86 [392] 11,33 [392]
экспериментальная . • . Микротвердость ПМТ-3 —— — 15,46 [392] 13,80 [392]
[302], кг!ммг Твердость по минералоги- — — 3235 57 [362]
ческой шкале —~ — .м. > 8 [1]
Температура плавления,°C — — — 3087 д.50 [193]
232
Нитриды
Таблица 65 (окончание)
Свойство Нитрид
TaN -~0»0о TaN~ 0.40 TaN~0,45 ТаХ~0,80 TaN~0,90 TaN
Теплоемкость (298’К), ккал/моль град .... 13,10 [182]
Теплота образования ккал1моль .... — — 58,1 т2,0
Энтропия (298ОК), кал'г град [182] 12,4 ±1,5
Удельное электросопро- тивление, при 25°, мком-см Термический коэффициент электросопротивления а . 103, %/град . [182] 135 [136]
+0,03 [136]
Точка перехода к сверх- проводимости, °К 9,5 (для 1,88 [387]
Температура (°C), при ко- торых упругость диссоциа- ции составляет: 1 мм рт. ст Ta,N) [387] 1921 [367]
10-з мм рТ. ст — — — 1460[367]
Нитриды хрома
Сплавы хрома с азотом первоначально готовили азотировани-
ем порошка хрома с помощью аммиака при 800—1400° [231].
Нитрид хрома CrN получали также [394] обработкой тонкого пи-
рофорного порошка хрома (приготовленного разложением
амальгамы) при 600—900° азотом. Можно получать нитриды и не-
посредственной возгонкой амальгам хрома в азоте.
Описан ряд способов получения нитридов хрома нагреванием
СгС13 или СгО2С12 с аммиаком или с нитридами магния, лития
и т. п., однако все эти препараты вряд ли могут считаться чи-
стыми [231].
Кисслинг и Лиу [399] получали нитриды хрома обработкой
борида хрома аммиаком: при 735° образуется нитрид CrN, между
800 и 1100° — смесь CrN и Cr2N, а при 1180° — Cr2N.
Ольсон с сотрудниками [400] получали пленки нитрида хрома,
пропуская аммиак над обезгаженным в вакууме хромом
(10 “4 мм рт. ст.). Исследование пленок, полученных при
10-минутном азотировании при 950—1000°, показало, что они
состоят преимущественно из нитрида CrN; при более высоких
температурах—из смеси CrN+Cr2N и, наконец, при самых вы-
соких— из Cr2N; эти данные хорошо совпадают с данными Кис-
слинга и Лиу.
Нитриды, хрома
233
Хром в тонкодисперсном состоянии начинает поглощать азот
с 800°, причем может присоединить при этой температуре
8—12%N [395]; при повышении давления азота поглощение не-
сколько увеличивается [396].
Предельное поглощение азота порошкообразным хромом при
900° составляет 13,7%, а жидким хромом — всего около 4%. По-
нижение содержания азота в хроме с повышением температуры
связано с экзотермичностью обратимых реакций образования ни-
тридов хрома [397]. Это особенно отчетливо было показано ра-
ботой В. С. Мозгового и А. М. Самарина [398], которые устано-
вили, что содержание азота в хроме с 4,0842% (вес.) при 1600°
падает до 3,5413% при 1750° (при постоянном давлении азота
над ванной, равном 1 ат) в продолжение 40 мин.
Растворимость (область твердого раствора) азота в хроме не-
значительна. В системе Сг—N установлено наличие двух нитри-
дов — CrN и Cr2N.
Фаза Cr2N -фаза) гомогенна в узких пределах содержаний
азота (11,3—11,9%), представляя собой, повидимому, структуру
вычитания на основе Cr2N (11,87% N), т. е. типичную фазу внед-
рения с атомами азота в междуузлиях гексагональной плотно
упакованной решетки хрома.
По данным Эриксона [40], P-фаза имеет сверхструктуру с
областью гомогенности между 9,3 и 11,9% N (а не 11,3—11,9%,
как это дано в работе Бликса [402]).
Фаза CrN с 21,7% N (у -фаза) имеет кубическую решетку
типа NaCl.
Нитрид хрома CrN в порошкообразном виде имеет черный
цвет, не реагирует с водородом, сгорает в кислороде до Сг2О2,
трудно поддается действию кислот, в том числе царской водки,
диссоциирует при 1500° на хром и азот. Cr2N имеет более свет-
лый серый цвет, и также устойчив против действия кислот.
Удельная теплоемкость, удельная электропроводность и тер-
мический коэффициент электросопротивления сплавов хрома с
азотом являются линейными функциями содержания азота.
Основные свойства нитридов хрома приведены в табл. 66.
Свойства нитридов хрома
Таблица 66
| Нитрид
С В О Й СТ ВО |---------------------i ..........
Cr2N CrN
Содержание азота в предельно на-
сыщенных металлоидом фазах, % . .
Область гомогенности, % (атомн.) N
Структура ....................
11,87 .
32-33,3 [401] I
Гексаг. плотно
упакованная
21,7
Г. ц. к.
234
Нитриды
Таблица 66 (окончание)
Свойство Нитрид
CraN CrN
Периоды решетки, кХ:
а • 4,806—4,760 [401] 4,148 [401]
с • . 4,479—4,438 —-
с!а 0,928 ——
Плотность, г'см3:
расчетная . 6,51 6,18
экспериментальная — 5,8—6,1 [66]
Температура плавления, °C ... . — Диссоциируется
при 1500°
Теплота образования—ДЛ298,
ккал/моль ............ 7,6 [398] 29,5 [66]
Температуры (°C), при которых
упругость диссоциации составляет:
1 мм рт. ст — 719 [367]
10 ~3 мм рт. ст — 533 [367]
Нитриды молибдена
При пропускании аммиака при 850° над молибденом в сплав
t азотом обращается только незначительная доля металла [403].
Хэгг [404] приготовлял сплавы молибдена с азотом про-
пусканием аммиака над свежевосстановленным молибдено-
вым порошком при 400—720° в продолжение 4—24 час.
При этом получались сплавы, содержащие от 0,77 до 7,15% N.
Выше 725° эти сплавы диссоциируют. Для получения бо-
лее высоких содержаний азота (до 11,95% N) необходи-
мо длительное азотирование (до 120 час. при 400°). Шенберг
[405] получал нитриды молибдена обработкой порошка молиб-
дена азотом при 800° в продолжение нескольких часов. Макси-
мальное содержание азота составляло при этом 49,6% (атомн.).
Впервые нитриды молибдена были получены Урлаубом [2]
пропусканием аммиака над M0CI5 или МоОз; аналогичным пу-
тем, нагревая M0CI3 в токе аммиака при 340°, получали нитриды
молибдена Розенгайн и Браун [2].
Урлауб, получивший нитриды молибдена еще в 1857 г., при-
писал им формулы M05N3 и M05N4. Розенгайн и Браун дали для
нитрида молибдена формулу МозМ2.
Методами рентгеновского анализа Хэгг [404] установил нали-
чие трех промежуточных фаз в системе Мо—N: р -фазу Mo3N с
тетрагонально искаженной решеткой металлических атомов
(устойчива при температурах выше 600°), у-фазу Mo2N с гра-
нецентрированной кубической решеткой и 8 -фазу MoN с простой
Нитриды молибдена
235
гексагональной решеткой, аналогичной решетке никельарсе-
нида (атомы молибдена образуют простую гексагональную ре-
шетку) .
Область гомогенности фазы Mo2N при высоких температурах
смещается в область повышенных содержаний молибдена
(рис. 137).
Видимо, продукты, описанные Урлаубом, Розенгайном и
Брауном, представляли собой смеси нитридов молибдена.
Шенберг [404] подтвердил эти данные Хэгга и несколько по-
дробнее исследовал структуру 8-фазы (MoN).
. В элементарной ячейке MoN содержится 8 молекул: возмож-
ные положения восьми атомов молибдена:
0^:2 (в) 00 Y + 6(А)ху-^;
C*v : 2 (а) 00 гф- 6 (с) х2zz\
Z3®:2 (в) 00 y+6(A)x2x—•
6* s 2 (в) 00^-+6(Л)х2ху.
Значение параметра х колеблется около 0,5 (от 0,480 до
0,500), наиболее вероятно значение 0,489.
MoN в вакууме разла-
гается медленнее, чем WN.
Растворимость азота в мо-
либдене очень мала.
Твердый раствор азота в
молибдене хрупок; особенно
хрупким оказывается поли-
кристаллический молибден;
монокристаллы, насыщен-
ные азотом, менее хрупки.
Азот может быть удален
из твердого раствора нагре-
ванием в вакууме (10 ~3 мм
рт. ст.) при 1760°.
При нагревании на воз-
духе нитриды молибдена
окисляются до МоО3; есть
Рис. 137. Фазовая диаграмма системы
Mo—N
указания об их самопроизвольном возгорании на возду-
хе [661.
Некоторые свойства нитридов молибдена приведены в
табл. 67.
236
Нитриды
Таблица 67
Свойства нитридных фаз системы молибден—азот
Свойство Нитрид
Мо3Ы Mo2N МоЧ
Содержание азота, % . . . Область гомогенности, % 5,4 6,75 12,73
(атомн.) N >28 [405] ~ 32—33 [405] >50 [405]
Структура Периоды решетки, кХ: Г. ц. тетр. Г. и. к. Тексаг.
а ........... 4,180 [404] 4,155—4,160 [404] 5,725 [405]
с ........... 4,016 — 5,608
с/а Плотность, г/см3: 0,962 — 0,980
расчетная — — 9,18
экспериментальная . . . — 8,04 [404] 8,60 [404]
Температура плавления, °C Теплоемкость (298° К), При 600° [404] Разлагается [404] [404]
ккал/моль • град Теплота образования—dHggs, — 8,98 [408] —
ккал !м оль Температуры (°C), при кото- рых упругость диссоциации составляет: — 16.6 + 0,5 [182] —
1 мм рт. ст — 329 [367] —
10 ~3 мм рт. ст — 209 —
Нитриды вольфрама
Получить сплавы вольфрама с азотом при обработке воль-
фрама аммиаком весьма затруднительно, а по мнению ряда иссле-
дователей [403, 409], вообще невозможно. Однако Лафиттом и
Грандадармом [410] было установлено, что аммиак реагирует с
вольфрамом уже со 140°, но, начиная с 2С0°, сплав снова разла-
гается на азот и вольфрам. Азот не действует на вольфрам до
900°, а при 2500° образуется нитрид вольфрама, которому припи-
сывали формулу WN2 с 13,2% N [231, 412].
Механизм реакции между аммиаком и порошком вольфрама
изучали Митташ и Франкенбергср [413], которые установили, что
при 250—360° образуется в качестве промежуточного соединения
имид вольфрама (W3N6H6). Хэггу [404] действием аммиака на
вольфрам при 700—800° даже в продолжение 48 час. удалось по-
лучить продукты с содержанием только 1,67% N. Однако Шен-
берг [405] сообщает о приготовлении им нитридов вольфрама
с содержанием до 41,7% (атомн.) путем обработки вольфрамо-
вого порошка сухим аммиаком в продолжение нескольких ча-
сов при 800°.
Нитриды марганца
23?
Система W—N впервые исследовалась Хэггом [404], который
обнаружил a-фазу (азот практически не растворим в вольфраме,
как это было установлено в работе И. И. Жукова [395]), и р-фа-
зу, которая имеет гранецентрированную кубическую решетку и
отвечает по составу формуле W2N [33% (атомн.) N]. Эта фаза
аналогична т -фазе системы Мо—N. Кисслинг и Лиу [399] нашли
вторую модификацию фазы W2N, которая образуется при азоти-
ровании вольфрама при 825—875°, названную ими не совсем
удачно т-фазой. Эта фаза имеет также плотную кубическую
гранецентрированную решетку (с периодом от 4,130 до 4,122* кХ)
и, невидимому, идентична P-фазе. Шенберг обнаружил третью
(или четвертую?) фазу WN (8-фаза) с содержанием — 50%
(атомн.) N, имеющую гексагональную решетку. Атомы азота
расположены в центре тригональной призмы из атомов вольфра-
ма. Пространственная группа £>зй — с одним атомом азо-
та в 1 (а) ООО и другим в 1 (d) | ~ или (/) j- 5-
При 600° WN разлагается в вакууме с образованием [3-фазы:
2WN- W2Nt у Na-
Разложение WN происходит гораздо быстрее, чем MoN.
Высший нитрид вольфрама WN представляет собой коричне-
вое вещество, a W2N имеет черную окраску.
Нитриды вольфрама весьма устойчивы против действия азот-
ной кислоты, разбавленной серной кислоты и раствора соды [414].
Горячая концентрированная серная кислота разлагает нитриды
на аммиак и WO3; так же действует царская водка. При сплав-
лении с Na2CO3 образуется вольфрамат натрия и аммиак. При на-
гревании на воздухе нитриды легко окисляются до WO3.
Р -фаза (W2N) имеет кубическую гранецентрированную ре-
шетку с периодом а=4,118 кХ, содержит 3,67% N, теплота ее
образования при 298° К 17,2±3,0 ккал/моль [182], удельный
вес 12,2. Упругость диссоциации в вакууме: при 344° 1 мм рт. ст.,
при 2963 10 при 256° 10“2и при 221° 10“3л<л« рт. ст. [367].
8 -фаза (WN) имеет гексагональную решетку с периодами
а=2,893 кХ, с=2,826 кХ, с: а=0,977 (объем элементарной ячей-
ки 20,48 кХ. Пикнометрический удельный вес 12,08—12,12 [405],
а рассчитанный из периодов решетки 10,52.
Нитриды марганца
Сплавы марганца с азотом получаются непосредственным азо-
тированием марганца азотом и аммиаком при 800—1200° [395,
231, 415] или азотированием амальгам марганца в атмосфере
азота.
С повышением температуры период решетки уменьшается.
238
Нитриды
Система Мп—N была рентгенографически исследована Хэггом
[416]; соответствующая схематическая диаграмма состояний
показана на рис. 138.
Растворимость азота в я-Мп составляет всего 0,156% (пе-
риод решетки при этом растет с 8,894 до 8,897 кХ), а в Р -Мп
несколько выше (период решетки увеличивается от а—6,289 до
6,305 кХ).
Наиболее бедная азотом 8-фаза существует только при вы-
соких температурах; она содержит около 2% N и между 400
и 600° распадается на я-твердый раствор и е-фазу.
Рис. 138. Фазовая диаграмма системы Мп—N
е -фаза при низких температурах (до 500°) имеет узкую об-
ласть гомогенности (ст 6 до 6,5 % N), при высоких температурах
эта область расширяется в сторону сплавов, бедных азотом (от
3—4 до 6,5% N).
Формально е-фазу можно рассматривать как Mn4N (5,99%
N) с кубической гранецентрированной решеткой атомов Мп [ана-
логична фазе у' в системе Fe—N(Fe4N)].
$ -фаза (MriaN) имеет область гомогенности между 9,2 и
11,9% N, причем атомы марганца образуют гексагональную ре-
шетку с плотной упаковкой, а атомы азота распределены стати-
стически в межузлиях этой решетки.
При увеличении содержания азота внутри области гомогенно-
сти периоды решетки возрастают от а=2,773 кХ, с=4 520 кХ
(с/а-=1,630) до а==2,825 кХ, с=4,528 кХ (с/а=1,601).
Нитриды железа
239
Наконец, ц-фаза, содержащая минимально 13,5% N, а мак-
симально 14—15% N (что с определенностью не установлено),
имеет тетрагональную гранецентрированную решетку с периода-
ми a 5:4,20 кХ, с«*4,03 кХ (с/а^0,97), атомы азота в ней распо-
ложены неупорядоченно, «-фаза (Mn4N) ферромагнитна; при
насыщении азотом до Mn2N (или Mn5N2) теряет ферромагнитные
свойства. Теплота образования Mn4N составляет 39,9 ккал/моль.
Нитрид Mn2N (5-фаза) имеет удельный вес 6,2—6,6, пред-
ставляет собой вещество темносерого цвета, теряющее при на-
гревании до 760—850° (в аммиаке) часть азота (сдвиг к нижней
границе области гомогенности), при нагревании с водородом
образуется аммиак. Теплота образования Mn2N 57,8 ккал/моль^
Некоторые данные о сплавах Мп—N приведены в работе
Цвикера [417].
Нитриды железа
Диаграмма состояний Fe—N приведена на рис. 139 [418].
Растворимость азота в a-железе при 590° составляет 0,10%,
Рис. 139. Диаграмма состояний системы Fe—N
а при снижении температуры до 200° уменьшается до ~ 0,004%
Решетка а-железа при растворении в ней атомов азота незна-
чительно расширяется. Максимальная растворимость азота в
7-железе при 600° составляет 2,8%. При 590°. 7-фаза претер-
певает эвтектоидный распад (7 -> 7' + а) с образованием
7Z -фазы.
240
Нитриды
1' -фаза (Fe4N) имеет, как и у-фаза, гранецентрированную
кубическую решетку с узкими пределами гомогенности (от 5,3
до 5,75% N).
е-фаза, содержащая от 4,35 до 11,0% N, имеет гексагональную
плотную решетку: при 650° она претерпевает эвтектоидный рас-
пад на у-+ у'-фазы.
Для $-фазы (Fe2N),имеющей ромбическую решетку, установ-
лен только нижний предел гомогенности, составляющий 11,1%' N.
И. Е. Конторович и А. А. Совалова [419, 420, 421], а также
И. Р. Кричевский и Н. Е. Хазанова [422] подробно изучали свой-
ства нитридов железа, а также реактивную диффузию азота в
железо.
Соединение Fe2N (5-фаза) может быть приготовлено на-
греванием железного порошка (лучше всего карбонильного) в
токе аммиака при 600—700°; при нагревании нитрида в вакууме
при 440—660° он переходит в Fe4N (у' -фазу).
Нитрид Fe4N при закалке не изменяется, имеет плотность
6,57 г/см?, теплота его образования равна 2,55 ккал/моль.
Упругость диссоциации Fe4N в зависимости от температуры вы-
ражается следующими цифрами [423]:
Температура, °C 420 440 460 525
Давление азота, ат 4250 4300 5400 5600
Fe4N имеет кубическую гранецентрировалную решетку с перио-
дом а = 3,79.
е-фаза при содержании выше 7,5% N закаливается без из-
менений, а при содержании азота ниже 7,5% неустойчива. Перио-
ды гексагональной решетки е -фазы меняются от а=2,69 кХ,
с=4,36 кХ при 25% (атомн.) N (Fe3N) до а=2,77 кХ; с—4,42 кХ
при 33% (атомн.) N(Fe2N).
Наиболее изучены свойства нитрида Fe2N ($ -фаза). Его плот-
ность 6,35 г/см?, теплота образования +0,92 кал/.моль. Fe2N рас-
творяется в разбавленной соляной кислоте, разлагается хлором
и бромом, но не поддается действию иода.
Ромбическая решетка 5 -фазы имеет периоды а=2,76 кХ;
о=4,82 кХ; с=4,42 кХ.
Последними работами [17, 418, 424] установлено, что область
диаграммы состояния системы Fe—N, приписываемая ранее
одной лишь фазе е, на самом деле отвечает ряду нитридных фаз
с компактной гексагональной решеткой металлических атомов и
с различным расположением атомов азота в октаэдрических про-
межутках. Хэгг [416] и Джек [424] указывают также на сущест-
вование в узкой области концентраций (11—11,4%) фазы у с
ромбической решеткой.
Обычные методы рентгеноструктурного, анализа не позволя-
ют определить достаточно надежно размещение атомов с малым
Нитриды железа
241
ональную решетку с периодами
с~ст =4,41 кХ. На элементарную
порядковым номером в кристаллической решетке, построенной из
атомов тяжелого элемента. Поэтому наиболее полные данные о
структурах нитридов железа с компактной гексагональной решет-
кой, образованной металлическими атомами, были получены в
результате электронографического исследования 3. Г. Пинскера
и С. В. Каверина [17]. Авторы азотировали в струе аммиака при
250—600° тонкие пленки железа, полученные путем конденсации
из пара на поверхности кристалла NaCl.
Пинскер и Каверин установили кристаллогеометрически на-
личие четырех в -фаз, приписав одной из них состав Fe3N и
трем — Fe2N.
Все структуры е-фаз можно описать, приняв за основу
построенную из атомов железа компактную гексагональную ре-
шетку с периодами ат и ст.
Нитрид Fe3N имеет гекса!
а = ат /3 = 2,765 • -/з кХ и
ячейку приходится 6 атомов
железа и 2 — азота.
На рис. 140 приведена
проекция кристаллической
решетки нитрида Fe3N на
плоскость (001). Основание
элементарной ячейки обве-
дено сплошными линиями. В
пределах ячейки атомы же-
леза расположены в плос-
кости проекции и в плоско-
сти, проходящей на полови-
не высоты, один из атомов
азота (1) лежит в плоско-
сти, проходящей на '/4 высо-
ты ячейки, другой (2) на 3/4
высоты ячейки.
Структура фазы Fe2N с
большой элементарной ячейкой (будем обозначать эту фазу че-
рез е') отличается от структуры фазы Fe3N только тем, что в од-
ной из плоскостей (либо на р либо на -2 высоты ячейки) вме-
сто одного атома азота находятся 2 его атома.
Кроме нитрида Fe2N с большой элементарной ячейкой, Пинс-
кер и Каверин установили наличие двух нитридов того же со-
става с малой ячейкой (а=ат и с= ст). Первый из них (фа-
за е") имеет упорядоченное расположение атомов азота, отве-
чающее слоистой решетке Cdy2 (ом. рис. 140,6). во второй (фаза
s ) атомы азота размещены статистически.
16 Г. В. Самсонов
Рис. 140. Проекция кристаллической
решетки нитрида EeaN на плоскость
(001) (а) и элементарная ячейка
Fe. Ne' (б)
942
Нитриды
Пинскер и Каверин в своей работе не дают прямых доказа-
тельств того, что все обнаруженные ими нитриды железа с ком-
пактной гексагональной решеткой металлических атомов явля-
ются стабильными фазами. Не исключена возможность того, что
некоторые из них (например, фаза е') являются метастабиль-
ными образованиями, возникающими в качестве переходных сту-
пеней при перераспределении атомов азота.
Твердость нитридов железа колеблется в широких пределах
от 224 до 687Hn [421]. Наибольшей твердостью, повидимому,
обладает е-фаза на границе с е-+ /-полем диаграммы.
Нитриды кобальта
Дзот па кобальт практически не действует, однако при на-
гревании порошка кобальта в аммиаке при 450—500° кобальт
поглощает до 10,33% N, давая соединение приблизительной фор-
мулы С02 N— C03N2. Это же соединение получается при нагрева-
нии до 2000° смеси цианида и окиси кобальта и разложением при
нагревации до 200° амида кобальта [581]. -
При азотировании кобальта аммиаком при 250—300° полу-
чается более бедный азотом нитрид C02N. Нитриды кобальта
могут быть также получены азотированием C0F2 при 360°.
Диаграмма состояний системы Со—N исследована в ряде ра-
бот [425, 426]. Растворимость азота в кобальте при 600°, по дан-
ным рентгеновского анализа, составляет 0,63%{.
Оба нитрида имеют цвет от серого до черного, плохо подда-
ются действию слабых кислот на холоду, в концентрированной
серной кислоте растворяются медленно, а в концентрированных
соляной и азотной — быстро. При нагревании оба нитрида бы-
стро растворяются в разбавленных минеральных кислотах.
C03N имеет гексагональную плотную упаковку атомов ко-
бальта с внедренными в нее атомами азота, удельный вес Co3N
7,1. Плотность второго нитрида (C02N) составляет 6,3 г/см3.
Нитриды никеля
Азот до 1400° не действует на никель, поэтому для приготов-
ления сплавов никеля с азотом порошок металла нагревают в
токе аммиака при 450° или нагревают в токе аммиака фторид
или бромид никеля.
Кроме того, можно приготовлять сплавы никеля с азотом на-
греванием смеси цианида никеля с NiO при температурах более
2000° [231].
При 450° в никеле растворяется 0,07% N [426]; известен толь-
ко один нитрид никеля Ni3N, имеющий темный цвет, удельный
вес его 7,66. Он устойчив в едком натре, но растворяется мине-
ральными кислотами; при нагревании на воздухе до 800° его-
Сплавы нитридов
243
рает до NiO. Атомы никеля образуют в NiaN плотную гексаго-
нальную решетку, атомы азота внедрены в междуузлиях.
Сплавы нитридов •
Системы нитрид — нитрид
Образование непрерывных рядов твердых растворов установ-
лено в системах TiN — ZrN, TiN—VN, TiN — NbN, ZrN —
NbN, VN — NbN и предполагается в еще не исследованных си-
стемах HfN — ZrN, NbN — HfN. Нитрид ванадия, имеющий ма-
лый период решетки, хотя и изоморфен остальным нитридам
IV и V групп, но, кроме нитрида тантала, не образует непрерыв-
ных рядов твердых растворов с нитридами, имеющими периоды
решеток, более чем на 15% отличные от периода VN. К числу
этих нитридов относятся ZrN и HfN.
Это представление, повидимому, не совсем правильно, так
как, например, в системе NbC—VN наблюдается полная смеши-
ваемость, несмотря на то, что периоды компонентов отличаются
больше чем на 15%.. Условием полной смешиваемости является,
повидимому, установленная И. И. Корниловым неограниченная
растворимость в системе металлов [427].
При исследовании ряда двойных нитридных систем металлов
IV и V групп обнаружено, что нитриды металлов IV и V групп
неограниченно взаимно растворимы, за исключением системы
VN—ZrN (табл. 68).
Таблица 63
Фазовый состав сплавов IV и V групп
Системы Печь Температура спекания, °C Время спека- ния час- Фазовый состав
TiN —ZrN Печь сопротивле- ния графитовой тру- 2600 3 Неограниченная растворимость
ZrN — VN То же 2575—2550 4 ZrN растворяет 5% VN VN растворяет 1% ZrN
TiN —VN То же и индук- ционная печь 2125—2425 2 Неограниченная растворимость
TiN — NbN То же 2550—2575 4 То же
NbN — VN Индукционная печь 2125 2 » »
NbN —ZrN То же 2550 4 » »
Периоды решеток твердых растворов меняются в зависимости
от состава практически линейно (рис. 141).
16*
244
Нитриды
Системы TaN с кубическими нитридами металлов IV и
V групп почти не изучены, но по аналогии с системой TiC—WC
можно предполагать, что гексагональный TaN может растворять-
ся в кубических нитридах, вероятно, с широким полем раствора
на диаграмме; напротив, растворимость TiN и других ему подоб-
ных нитридов в TaN, повидимому, ограничена. В связи с'этим
уже давно сделанным предположением значительный интерес
представляют результаты исследования системы TaN—TiN, про-
веденного недавно Шенбергом [428]. Смеси тонких порошков Та
Рис. 141. Периоды решеток твердых растворов
нитридов IV и V групп
и Ti спекались в тигле из двуокиси циркония в индукционной
вакуумной печи. Лигатуры измельчались в мельнице, помеща-
лись в корундовых лодочках в фарфоровую трубку и подверга-
лись азотированию аммиаком в течение 50 час. при 900°. Рентге-
нографическое исследование сплавов TaN—TiN разных концент-
раций дало следующие результаты:
Исходный сплав
Та0,<,0 Т10,50
Та0>25 Ti0,25
Тао,)о Т1о>эо
Образовавшиеся при
азотировании фазы
Ti (Та) N + TaN
Ti (Та) N + TaN
Ti (Та) N-j-следы TaN
Таким образом, растворимость TaN в TiN выше 10% (мол.).
Нитрид (Tio,9o Та од о) N имеет кубическую решетку с перио-
дом а=4,247 кХ; [а=4,238 кХ для чистого TiN с 50 % (атомн.) N].
В патентах [429] указывается на высокую твердость сплава
Сплавы нитридов
245
TiN—TaN с содержанием 50% (мол.) каждого из компонентов.
В системе TaN—VN, исследованной аналогичным путем, были
обнаружены следующие фазы:
Исходный сплав
Tao>so Vo>r>o
Та0,25 Vo,75
Фазы, образовавшиеся
при азотировании
V (Та) N + TaN
V (Та) N,
т. е. фаза VN растворяет около 25% (мол.) TaN; при этом куби-
ческая решетка VN, имеющая период а = 4,169 кХ (VN i,oo)>при-
обретает период а = 4,291 кХ.
Системы TaN с нитридами металлов VI, VII и VIII групп
[428] исследованы подобными же методами; результаты фазово-
го анализа приведены в табл. 69.
Таблица 69
Фазы, наблюдающиеся в двойных сплавах нитрида тантала
с нитридами Сг, Мп, Fe, Со, Ni
Система Исходный сплав Фазы, образовавшиеся при азотировании
Та —Сг — N Та0,75 Сг0,25 X + TaN
Та0,60 *--го,5о X 4- следы неизвестной фазы
Та0,25 Сг0,75 Cr(Ta) N 4-следы Х-фазы
Та — Мп — N Та0,90 ^П0,10 Ta(Mn)N 0,8 4-следы TaN
1"а0,75 Мп0 25 TasMnN<
Та0,50 ^П0,50 X + TasMnN4
Та0,25 Мп0,75 X 4- нитридьГМп
Та — Fe — N Та0,«0 Fe0,20 Ta2FeN, 4- TaN
Тао,67 Fe0,33 Ta2FeN,
Та0,50 Fe0,50 Ta2FeNs 4- нитриды Fe
Та —Со — N ^а0.80 С°0,20 Ta2CoN, 4- TaN
Та0,67 *--о0,зз Ta2CoN,
Та0,50 С°0,50 TaaCoN, 4- a — Co
Та - Ni — N Та0,80 ^'0,20 Ta2NiN3 4- TaN
Та0,67 Ni0,33 Ta2NiNs
Та0,50 Ki0,50 Ta2NiNs 4- Ni
В системе Та—Сг—N обнаружена тройная фаза (фаза X в
табл. 69), рентгенограмма ее имеет сложный характер. Период
фазы CrN изменяется с а = 4,149 кХ (CrNi.oo) до а = 4,293 кХ,
последнее значение периода имеет место в точке максимальной
растворимости TaN в CrN около 25% (мол.).
В системе Та—Мп—N найдены две тройные фазы, одна из
которых изоморфна фазе X системы Та—Сг—N, а другая имеет
246
Нитриды
состав, выражаемый формулой TasMnN4. Тантал не растворяет-
ся в MnNo,61-0,63 Cq-фазе), а марганец ве-TaN.
В 8-TaN атомами марганца может быть замещено около 10%
атомов тантала, что вызывает удлинение простой гексагональной
решетки вдоль оси а и сжатие по оси с (табл. 70).
Сопоставление периодов фаз 8 — TaN
и тройной 8-фазы системы Та — Мп — N
Таблица 70
Фазы Периоды, кХ с!а
а С
е-TaN (TaN0’80_QgQ) 2,925—2,938 2,876—2,883 0,983—0,981
6-фаза в образце Та0,90 Мпо>1о ^0.84 3,057 2,819 0,922
Замещение марганца атомами тантала вызывает расширение
решетки, так как атомы марганца меньше атомов тантала.
Фаза ТазМпЫ4 имеет гексагональную решетку с периодами
а = 3,028 кХ, с = 10,49 кХ, с/а = 3,470 (V = 82,99 кХ3).
В системах Та—Fe (Со, Ni)—N (табл. 71) обнаружены
тройные фазы с гексагональными решетками.
Таблица 71
Периоды решеток и плотности тройных фаз в системах
Та —Fe(Co, Ni}— N
Фаза Периоды, кХ с!а Плотность, г[см8
а С расчетная измеренная
Ta4FeN26o 5,156 10,31 2,000 12,71 11,9
Ta2CoN2 50 5,161 10,30 1,996 12,74 12,3
Ta2NiN2>45 5,168 10,36 2,005 12,60 12,2
Система TiN—CrN изучена на образцах, полученных азоти-
рованием поверхности титано-хромовой лигатуры в атмосфере
аммиака при 950—1250° [400]. Сплавы Ti-Cr-N устойчивы про-
тив окисления и обладают высоким электросопротивлением,
весьма мало изменяющимся с повышением температуры
(рис. 142). Создание пленок сплава Ti-Cr-N используется для
производства резисторов, т. о. высокоомных полупроводниковых
сопротивлений.
Сплавы нитридов
247
0,7
Рис. 142. Зависимость измене-
ния сопротивления от темпе-
ратуры нагревания сложного
титанохромового нитрида на
воздухе в продолжение 200 час.
В системе MoN — Co3N [315] обнаружено существование
сложного нитрида, по составу соответствующего формуле
Мо0,8 Coo,2N. Подобный сложный нитрид образуется никелем.
Оба нитрида имеют решетку типа никельарсенида.
В системах Co3N—TiN и Ni3N— TiN [315] обнаружены также
сложные нитриды со структурой _ никельарсенида, описываемые
формулами Tio,7 Соо.з N и Ti
Nio,3 N.
Тройные и четверные сплавы
нитридов исследовались Шенбергом
[428], состав обнаруженных при
этом фаз приведен в табл. 72.
Фаза у в системе Та—V—Сг—N
имеет тетрагональную решетку с пе-
риодами а — 4,244 кХ, с = 4,120 кХ,
с/а = 0,971; так как этот сплав со-
держал малые количества кислоро-
да, Шенберг полагает, что фаза яв-
ляется оксинитридной.
Фаза (Та о,9 Tioi)3 MnN4, обна-
руженная в этом исследовании, име-
ет гексагональную решетку с перио-
дами а = 3,027 кХ, с =10,57 кХ,
с/а = 3,492, а фаза ТагЕео.зз
Соо.зз Ni о,зз N2.50 —также гекса-
гональную с периодами а = 5,162 кХ,
с =10,33 кХ, с/а='2,001; ее расчетная плотность равна 12,67, а
измеренная экспериментально — 12,1 г/см3.
Таблица 72
Состав фаз в тройных и четверных системах нитридов
Система
Исходный сплав
Фазы, образовавшиеся при
азотировании
Та—Ti—Мп—N Та0,зз ^0,33 Мп0,зз Ti (Ta)N + Ta3MnN4+M+r)-MnN
Та—Ti—Со—N Тао,зз Т’о.ЗЗ 4,33 Ti(Ta) N+(Ti, Ta)2 N^a-Co
Та—V-Cr-N Тао,зз V Сг v 0,33 0,33 (V, Cr, Ta)N + X-|-y
Та—V—Со—N Тао,зз ^0,33 ^о.зз V (Ta) N+TaN-j-a-Co
Та—V—Ni—N Та0,33 ^0,33 Nio,33 V (Ta) N+TaN-f-Ni
Та—Cr-Co-N Тао,зз Сго,зз Соо,зз Cr (Ta) N+a-|-a-Co
Т а—Мп—Со—N Та0,33 Мпо,зз Соо,зз Та3Мп^-|-нитриды Мп+я-Со
Та—Со—Ni—N Та0,33 Соо.зз Nio,33 Та2(Со, Ni) Ns + a-Co+Ni
Та—Fe—Со—Ni—N Та0,67 ’?со.и с°о,И Та, (Fe, Co, Ni) N,
Ni0,l 1
?48
Нитриды
Системы нитрид — карбид
Большая часть нитридов и карбидов IV и V групп образует
непрерывные ряды твердых растворов, за исключением сплавов
с TaN, имеющих гексагональную структуру, и некоторых спла-
вов с VN и VC, имеющих периоды решеток, резко отличные от
периодов решеток других карбидов и нитридов. Данные по вза-
имной растворимости нитридов и карбидов IV и V групп по Киф-
феру [430] сведены в табл. 73.
Таблица 73
Взаимная растворимость карбидов и нитридов
металлов IV и V групп
1 Tic ZrC’ HfC VC i\bC TaC
TiN A (A) (A) A A (A)
ZrN A A (A) Б Б (A)
HfN (A) (A) (A) (A) (A) (A)
VN A (B) (A) A A (A)
NbN A (A) (A) A A (A)
TaN (B) (B) <B) (A) (B) В
Примечание. А — полная взаимная растворимость, » Б —отсутствие или очень
малая растворимость. В—область твердого раствора иа стороне кубической фазы.
В скобках даются вероятные характеристики неисследованных систем.
* Карбид циркония при высоких температурах в атмосфере азота неустойчив (см.
стр. 115).
Система TiN—-TiC исследовалась методами термического1, ме-
таллографического и рентгенографического анализов [136].
Построена кривая плавления (рис. 143); установлено, что, не-
смотря на наличие максимума, сплавы TiC-TiN дают непрерыв-
ный ряд твердых растворов.
Результаты рентгенографического исследования сплавов
TiN-TiC, приготовленных нагреванием смесей TiN + TiC в про-
должение 4 час. при 2425° [354], позволяют считать, что период
решетки изменяется с составом практически по правилу Веггарда
(рис. 144). Одпофазность сплава, отвечающего эмпирической
формуле Tii0N8Cr и имеющего кристаллическую решетку типа
NaCl с периодом 4,243 кХ, близким к наиболее достоверным зна-'
чениям периода решетки нитрида титана (4,22—4,23 кХ), была
установлена раньше. Кристаллы карбонитридов титана, извле-
ченные из стали, содержащей 0,1—1 %| С и до 6% Ti, имели
желтую (почти чистый TiN с периодом решетки 4,24—4,241 кХ),
оранжевую, коричневую или серую (карбид титана с периодом,
равным 4,325 кХ) окраску и иногда промежуточные значения
периода решетки (например, 4,29 кХ). Линии на рентгенограм-
Сплавы, нитридов
249
мах карбонитридов расширены: состав этих фаз переменный
[431].
В шлаках доменных печей при плавке высокотитанистых
шихт присутствуют карбонитриды титана [359]; вследствие высо-
кой температуры плавления они сильно понижают жидкотеку-
честь шлаков.
Микротвердость сплавов TiN-TiC изменяется в зависимости
от состава по плавной кривой без экстремумов, а на кривой элек-
тросопротивление— состав имеется минимум (рис. 145). Высо-
кую твердость сплавов TiN-TiC предложено использовать на
практике [429].
В системе TiN—ZrC следует ожидать непрерывную раство-
римость, так как периоды решеток компонентов разнятс!я лишь
на 10%. ZrC при высоких
температурах активно реаги-
рует с азотом, поэтому обы-
чно получаются тройные
сплавы TiN-ZrN-ZrC.
Рис. 144. Периоды решеток твердых
растворов в системах TiN—TiC (NbC,
VC) и ZrN—TiC
Тсс, % (мол.}
Рис. 143. Линия плавкости систе-
мы TiC—TiN
Система ZrN—ZrC представляет непрерывные ряды твердых
растворов. Свободная энергия образования ZrC с повышением
температуры увеличивается, а энергия ZrN уменьшается. Поэтому
до 850—900° при азотировании смеси двуокиси циркония с сажей
получается только нитрид циркония, а при более высоких тем-
пературах — твердый раствор ZrN—ZrC, с увеличением темпе-
ратуры обогащающийся ZrC (рис. 146).
Результат исследования двойных карбонитридных систем ме-
таллов IV и V групп (табл. 74, рис. 144, 147 и 148) свидетель-
ствует о том, что при достаточно близких периодах решетки все
они образуют непрерывные ряды твердых растворов [354].
Систему TaN—ТаС впервые исследовали Агте и Моэрс [136],
установившие кривую ликвидуса (рис. 149). Рентгенографиче-
>50
Нитриды
Фазовый состав карбонитридных систем
Таблица 74
Система Печь Темпера- тура спе- кания, °C j Время 1 спекания час. Гомогенизация Фазовый состав
TiN-VC Индукцион- ная 2325—2250 2 При 2100° не- полная Непрерывная растворимость
TiN—NbC Таммапа 2550 4 При 2250° не- полная То же
ZrN-TiC 2650—2600 1-2 При 2425° не- полная » г
ZrN—VC » 2450 3 — Растворимость мала
ZrN—NbC » 2450 2* То же
VN-VC Индукцион- ная 2200 2 — Непрерывная . растворимость
VN—NbC То же 2375 2 При 2375° не- полная То же
VN—TiC 2125 2 — » »
NbN—TiC' Таммана 2550 2 При 2425° не- полная » »
NbN-VC Индукцион- ная 2260 2 — X »
NbN—NbC То же 2125 2** — » »
o/ofM0Uj
Рис. 145. Электросопротивление и мнкротвердость
сплавов в системе TiC—TiN
ское и металлографическое исследование сплава ТаС : TaN = 1:1
показало, что при обычной температуре стабильный твердый рас-
твор не образуется (рис. 150). Кэмпбелл с сотрудниками [122]
goo goo 1000 1100 1200 1300 1400 юоо 1000^1700'
Tevnepami/pa, V
Рис. 146. Свободная энергия^образования ZrN и ZrC
XH'wu/amad ропОаи хи'пршзтэа ponds и
Рис. 147. Периоды решеток
твердых растворов в системах
VN—TiC (NbC, VC)
Рнс. 149. Линия ликвидуса
системы TaN—ТаС
Рис. 148. Периоды решеток твердых
растворов в системах NbN — TiC
(NbC, VC)
>52
Нитриды
Рис. 150. Микрошлиф сплава
TaN—ТаС
готовил твердый раствор TaN—TiC совместным осаждением TaN
и ТаС из газовой фазы (TaCh, N2 и углеводороды).
Шенберг [432] азотировал карбид тантала сухим аммиаком
и науглероживал нитрид тантала метаном при температуре око-
ло 1100°. Тройных химических соединений при этом обнаружено
не было. Растворимость ТаС в TaN при обычной температуре не
смогла быть определена в связи с трудностью приготовления го-
могенных образцов, но во всяком случае она очень мала. За-
мена атомов углерода в карбиде тантала азотом вызывает уве-
личение объема ячейки <(от
21,34 кХ3 на атом Та в ячейке
ТаС до 22,57 кХ3 в ячейке
TaN).
Система Fe—N—С изучена
Бриделлем и Мишелем [433].
Сплавы готовились азотиро-
ванием карбида железа Fe3C
аммиаком при 400—500° в
продолжение 1—70 час., науг-
лероживанием нитрида железа
7' при 450° смесью Нг+СО, а
также одновременным наугле-
роживанием и азотированием
Fe2O3 при 450—550°.
Во всех случаях было обна-
ружено образование тройного
соединения Fe—N—С с гекса-
гональной решеткой. Периоды
последней составляют а = 2,749 кХ и с = 4,400 кХ. Точный хими-
ческий состав этой фазы неясен; повидимому, она имеет доволь-
но широкую область гомогенности как по содержанию азота,
так и углерода.
Использование нитридов в технике
Основными свойствами нитридов, обеспечивающими их при-
менение в технике, являются высокая температура плавления,
довольно хорошая химическая стойкость, а также некоторые
электрические свойства, как-то: способность переходить в сверх-
проводящее состояние, относительно высокая электропроводность
металлического типа и т. п. Известное значение имеет и высокая
твердость некоторых нитридов.
4 Основной областью использования нитридов в настоящее вре-
мя является, повидимому, применение их в качестве огнеупоров
с высокими точками плавления и значительной стойкостью про-
тив окисления (особенно нитридов титана, циркония, тантала,
урана и тория [435]). Так, Чиотти [131] разработал способ произ-
Использование нитридов в технике 2эЗ
водства тиглей из нитрида титана, Фостер [434] — способ изго-
товления тиглей из нитридов титана и циркония. Сплавы
MgO—TIN—Ni [4], в которых нитрид титана является связкой
между MgO и Ni (TiN образует непрерывный ряд твердых рас-
творов с MgO и растворяется в Ni), хорошо сопротивляются теп-
ловому удару; их прочность при 1090° на 30% выше, чем при
комнатной температуре. Иногда используются сплавы, в которых
Ni заменен NiO, восстанавливаемой в процессе спекания [436].
Известны антикоррозионные покрытия из нитридов [122].
Нитрид титана используют для припыливания поверхности из-
ложниц с целью получения чистой поверхности отливок.
Высокая твердость нитридов позволяет применят^ их для
правки шлифовальных кругов обкаткой кружками, например, из
литого нитрида титана [355]; покрытия из нитрида титана ис-
пользуются для повышения твердости и износостойкости деталей
из титана [597].
Нитриды титана и циркония нашли применение в качестве
проводящего элемента ториевых катодов [437], в производстве
зажигателей к выпрямителям из композиции, содержащей 25%’
TiN+75%1 ВеО [437]; сложный нитрид титана и хрома исполь-
зуется в качестве высокоомного сопротивления [400]. Особенно ши-
роко используются нитриды, в особенности нитрид ниобия: в ра-
диотехнике и автоматике известно применение его в качестве де-
тектора для радиоволн, работающего при 174° [439, 440], в кон-
струкции трубок для передачи изображений [441], а также
для сверхпроводящих болометров [442, 443]. Во всех этих случа-
ях используется способность нитрида ниобия переходить в сверх-
проводящее состояние при относительно высоких температурах
(~ 15° К). Добавлением к NbN карбида ниобия NbC удается по-
высить точку перехода к сверхпроводимости даже до 17,8°К [588].
ГЛАВА И
БОРИДЫ
Бориды переходных металлов представляют собой класс со-
единений, промежуточный между интерметаллическими соеди-
нениями типа бериллидов и фазами внедрения, классическим
примером которых являются карбиды. Бориды, а также многие
силициды имеют разнообразные и сложные структуры, что свя-
зано со способностью атомов бора (или кремния) образовывать
между собой связи [119]. Структуры боридов оказываются, таким
образом, цепными, слоистыми или каркасными.
Структуры боридов
Атомы бора в структурах боридов могут быть изолированны-
ми друг от друга или валентно связанными.
Рис. 151. Структурные элементы из атомов бора в боридах по Кисслингу[444]:
а — изолированные атомы бора (ТагВ); б—цепочки из атомов бора (ТаВ); в—двойные
цепочки из атомов бора (Та3В4); г — сетки из атомов бора (ТаВг)-
В последнем случае они образуют цепочки (простые или
сдвоенные), двухмерные слои или трехмерный каркас (рис. 151).
Это обстоятельство и положено в основу классификации струк-
турных типов боридов, предложенной Кмсслингом [444]:
1) с изолированными атомами бора,
2) с цепочками из атомов бора,
3) со сдвоенными цепочками из атомов бора,
4) с сетками из атомов бора,
5) с каркасом из атомов бора.
Структуры боридов
Й5
Структурные типы с изолированными атомами бора
а) Типы о-Мп4В (ромбическая ячейка) и Fe2B (тетрагональ-
ная ячейка). Структура образована тетраэдрами из атомов Мп.
Атомы В расположены статистически в наибольших пустотах ме-
жду тетраэдрами. По типам 8 -Мп4В и Fe2B кристаллизуются
также ₽-Та2В, у-Мо2В, i-W2B, e-Mn2B, Fe2B, Со2В, 8-NitB, Сг4В.
б) Тип ZnS — плотнейшая кубическая упаковка из атомов
Me, половина тетраэдрических пустот которой занята атомами
В. По этому типу кристаллизуются ZrB и HfB(?), а также моно-
бориды платиноидов.
Структурные типы с цепочками из атомов бора
а) Тип ТаВ — ромбическая ячейка. Структура построена из
трехгранных призм, образованных атомами Та. В центрах поло-
------
О Га
В
Рис. 152. Структурный тнп ТаВ
вины из них находятся атомы Та. Сквозь остальные призмы па-
раллельно оси z проходят зигзагообразные цепи из атомов бора
(рис. 152). По типу ТаВ построены структуры боридов: f-NbB,
T-ТаВ, С-СгВ, ?-МоВ, WB, а также, повидимому, VB.
б) Тип FeB — ромбическая ячейка, отличающаяся от ТаВ
несколько иными размерами призм и их размещением
(рис. 153). По этому типу построены С-МпВ и СоВ, а также
TiB [445].
в) Тип МоВ — тетрагональная ячейка. Структура МоВ, так
же как и структуры ТаВ и FeB, состоит из трехгранных призм из
атомов Мо, в центрах половин которых также размещаются ато-
мы Мо. Через остальные призмы проходят цепи из атомов В
256
Ёориды
(рис. 154). В отличие от структур FeB и ТаВ призмы располо-
жены слоями, причем в одном слое боковые грани призм парал-
лельны оси х, а в следующем — оси у. Поэтому цепи из атомов
В проходят параллельно осям х и у. Тип 8-МоВ имеет также
структура борида 8-WB.
____х
О * Но
@ ss S
Рис. 154. Структурный тип МоВ
О
ф-в В
Рис. 153. Структурный тип FeB
Структурные типы со сдвоенными цепочками из атомов бора
Тип Та3В4 — ромбическая ячейка. Структура состоит из сдво-
енных рядов трехгранных призм двух типов. Боковые грани
призм типа I (меньших) параллельны оси х, а боковые грани
призм типа II—оси у (рис. 155). Через призмы типа I и полови-
ну призм типа II проходят сдвоенные цепи из атомов В. Другая
половина призм типа II заполнена атомами Та. Структурный
тип Та3В4 имеют также 3-Nb3B4, т]-Сг3В4 и т]-МпзВ4.
Структурные типы с сетками из атомов бора
а) Тип А1В2— гексагональная ячейка. Структура построена
из трехгранных призм. Атомы В, находящиеся в центрах этих
призм, образуют графитоподобные сетки (Н), перпендикулярные
оси z. Слои А из атомов А1 чередуются со слоями Н из атомов В
в порядке АНАН... (рис. 156). Структурный тип А1В? имеют все
дибориды переходных металлов: TiB2, ZrB2, VB2, NbB2, TaB2,
CrB2, MoB2, а также WB2 (?), HfB2 (?) и UB2.
б) Тип e-W2Bg — гексагональная ячейка. Атомы В4 и Ви,
находящиеся между слоями АА и ВВ, расположены в центрах
тригональных призм и образуют графитоподобные сетки Н. Точ-
но под атомами Bi между слоями А и В располагаются атомы
Biv> находящиеся в центрах слегка гофрированных колец из
атомов Вщ, в результате чего возникают бесконечные, слегка
гофрированные сетки К из атомов бора. Общий порядок чередо-
вания слоев ...АНАКВНВК...
Структуры боридов
257
Таким образом, структура W2Bg отличается от структуры А1В2
только некоторым видоизменением гексагональных сеток из ато-
мов бора вследствие наличия дополнительных атомов бора в цент-
—
. X О X «•-»« ХОХ
1 oxo W-s*
х — х ——х
охо ®S4»«
X 6---Х--В®-®в--X--O X
0X0 99-В®
ХОХ в-»- OS X О X
®в- М О X о «в- В®
ХОХ во-ов ХОХ
х Атомы Me в положении хуО
О-------1---. хх ------- xyfa
з----------— v---------- хуО
®- ________ ,,---------- ху fa
х Атомы металла
ф Атомы бора
Рис. 156. Структурный тип Д1В2
Рис. 155. Структурный тип Та3В4
• в Ог/
Рис. 157. Структурный тип UBia
pax их ячеек. Структурный тип
V2B5 (?) и Сг2В5 (?).
в) Тип e-Mo2Bs — ромбоэдрическая ячейка. Структура
е-Мо2Вп отличается от e-W2Bs иным типом чередования слоев
из атомов металла... АНАК
ВНВКСНСК...; по этому ти-
пу построен только е-Мо2Вд.
Структурные типы
с каркасом из атомов бора
Тип UB4 — тетрагональ-
ная ячейка. Атомы U обра-
зуют слои с чередованием
типа ...АА... Однако в отли-
чие от А1В2 атомы U обра-
зуют как трехгранные, так и
четырехгранные призмы. В
центрах трехгранных призм
находятся отдельные атомы
В, а в каналах, проходящих через четырехгранные призмы, раз-
мещаются октаэдры из атомов В, не имеющие общих вершин.
Атомы В из квадратных сечений октаэдров и атомы В в призмах
W2Bs имеют также Ti2B5,
Г. В. Самсонов
Сводка структур боридов
Таблица 75
Металл Структурный тип
S-Mn4B Fe2B ZnS Та В FeB 5-MoB Ta3B( , A1B2 W2B5 Mo2B5 ив. CaBg UB|2
Структу pa
ромбич. тетраг. кубич. ромбич. ромбич. тетраг. ромбич. ! гексаг. гексаг. ромбич. тетраг. кубич. кубич.
Sc
V VBe
La LaB0
Ti Ti2B(?) TiB TiB2 Ti2B5 TiBl2(?).
Zr ZrB ZrBj ZrBjg
Hf HfB(?) HfBa
Ce СеВ4 CeBi;
Th ThB4 ThB6
V VB(?) VB2 V2B3(?)
Nb Nb2B(?) T-NbB B-NbjB* s-NbB2
Ta ₽-Ta2B 7-TaB B-Ta3B4 e-TaB2
Pr PrB6
Cr Cr4B Cr2B CrB Cr3B4 7-CrB2 Cr2B5(?)
Продолжение Табл. 75
Структурный тип
t-Mn4B FejB ZnS Та В FeB г-Мов Та3В4 А1В2 W2B5 Мо2В5 . UB4 СаВв ив12
Структура
ромбич. тетраг. | кубич. | ромбич. | ромбич. | тетраг. | ромбич. I гексаг. 1 гексаг. ^ромбич. тетраг. кубич. кубич.
Mo Мо2В p-MoB 5-МоВ
w W2B ₽-WB 5-WB
Nd NdB6
U ив2 UB4 ив,2
Mn Mn4B e-MtljB е-МпВ Мп,В4
Ru RuaB RuB RuB-j.
Os OsB OsB2
Co Co2B CoB
Rh Rh2B RhB RhB2
Jr JrB2 JrB2
Pd
Pt Pt2B3 1 1 1 111
Er ! ErB„ I
Yb | | ! I | I | | | | i |YbBe|
Й60
Ёориды.
образуют плоские сетки из четырех- и семигранных колец. Струк-
турный тип UB4 имеют также ThBi и СеВ4.
Тип UB12 — кубическая решетка (рис. 157). Атомы бора име-
ют пространственную координацию вокруг металлических атомов,
которые расположены в центрах трехмерных борных сеток. Каж-
дый атом бора имеет в соседстве пять борных и два металличе-
ских атома. Структуру UBj2 можно сравнить со структурой NaCl.
В положениях атомов Na находятся атомы U, в положениях
атомов С1 — архимедовы кубооктаэдры из атомов В; кубоокта-
эдр образован квадратами (100) и треугольниками (111/. По
этому типу построены также ZrBi2 и TiBi2(?).
Основные данные о структурах боридов переходных металлов
приведены в табл. 75.
Физико-химическая природа боридов
По правилу Хэгга для образования соединений типа фаз
внедрения необходимо, чтобы отношение радиусов атомов неме-
талла и металла не превышало 0,59. В этом случае образуются
соединения с простыми структурами — кубической и гексагональ-
ной. При большем значении этого отношения структура услож-
няется, хотя металлический характер соединений может еще со-
храняться.
В табл. 76 приведены значения отношений : RMe для ря-
да соединений переходных металлов с бором, причем R в при-
нят равным 0,87А, а в качестве RMe использованы значения
для 12-кратной координации, принятые Паулингом.
Таблица 76
Отношение Хэгга для боридов переходных металлов
Металл ДВ'RMe Металл rb: Металл ДВ : RMe Металл йв:
Ti 0,59 Zr 0,54 Hf 0,55 Th 0,48'
V 0,65 Nb 0,60 Ta 0,60 —
Сг 0,69 Mo 0,63 W 0,63 и 0,57
Мп 0,69 — —— Re 0,64 — —
Fe 0,69 Ru 0,65 Os 0,64 — —
Со 0,70 Rh 0,65 Jr 0,64 —
Ni 0,70 Pd 0,64 Pt 0,63 — —
Данные таблицы показывают, что металлы IV и V групп пе-
риодической системы имеют отношение RB ; RMe, близкое к кри-
тическому (0,59), за исключением ванадия, тогда как металлы
VI, VII и VIII групп имеют значительно большие отношения, т. е.
решетки этих боридов не могут иметь плотно упакованных струк-
Физико-химическая природа боридов
261
тур. Этим, повидимому, можно объяснить то, что соединения типа
МеВг, кристаллизующиеся в весьма простых гексагональных ре-
шетках, наиболее устойчивы именно в системах металлов IV и V
групп с бором, где они имеют наиболее яркие свойства химических
индивидов. Напротив, соединения Л4еВ2 металлов VI группы зна-
чительно менее устойчивы, причем существование борида WB2
вообще проблематично., Однако даже в системах металлов IV и
V групп с бором имеются соединения более сложного типа, впро-
чем, менее устойчивые, чем дибориды. То же самое можно ска-
зать и об устойчивости кубических фаз Л4еВб и Л4еВ12.
Таким образом, правило Хэгга применимо к соединениям пе-
реходных металлов с бором только в ограниченной степени.
Г. В. Самсонов и В. С. Нешпор [513] предложили для оценки
хрупкости твердых соединений использовать коэффициент А
установленной ими экспоненциальной зависимости электропро-
водности непластичных порошков от степени уплотнения:
/ А \
*=К exp-----—- .
\ и /
При этом оказывается, что показатель хрупкости боридов
близок к нитридам и меньше, чем для карбидов соответствующих
металлов. Понижение хрупкости боридов по сравнению с карби-
дами может быть связано с образованием структурных элемен-
тов из атомов бора и с соответственным ослаблением связей
Me—Me.
Распределение электронов в атоме бора описывается схемой
Is2 2s2 2р!.
Наличие единственного неспаренного 2р-электрона на внешней
орбите, обладающего тремя р3-функциями, пригодными для свя-
зи [447], повидимому, обусловливает способность атомов бора к
прочной ковалентной связи как в собственных кристаллах, так
и с атомами углерода (В4С) и кремния (B2Si и BeSi), причем в
обоих случаях образуются весьма прочные соединения. Очевид-
но, эта тенденция бора проявляется и при соединении его с пере-
ходными тугоплавкими металлами и выражается в образовании
в решетках боридов характерных цепочек и сеток, связанных,
как утверждает Кисслинг, сильной ковалентной связью. Этим,
повидимому, объясняется то, что замена одного металла в бо-
риде другим почти не изменяет элементов решетки, построенных
из атомов бора, а изменяет только расстояние между последни-
ми (табл. 77).
Из этой таблицы, а также из данных Хэгга и Кисслинга по
оценке относительной прочности связи переходных металлов с
бором [449] следует также, что прочность связи внутри данной
переходной подгруппы увеличивается с уменьшением атомного
номера элемента,
762
Бориды
Таблица 77
Расчетные расстояния между атомами
в решетках диборидов [448]
Борид Расстояние, kX
Me — Me в металле Me — Me в бориде Me — В в бориде В—В в бориде
TiBa 2,92 3,03 2,38 1,75
ZrBa 3,17 3,17 2,54 1Д53
VB, 2,63 3,00 2,31 1,73
NbB, 2,85 3,09 2,93 1,79
TaB, 2,85 . 3,09 2,41 1,79
С другой стороны, вследствие относительно низкого ионизаци-
онного потенциала бора (8,4 эв) можно было бы ожидать пере-
хода валентных электродов бора на недостроенные уровни ато-
мов переходных металлов. С наибольшей вероятностью этого
можно ожидать при взаимодействии бора с переходными метал-
лами IV и V групп, так как количество электронов на их внешних
s, р, d-уровнях меньше бив основных ковалентных связях будут
принима’ть участие все электроны. Таким образом, связующие ор-
биты дополнительных Связей останутся незаполненными и могут
играть роль акцептора электронов, а роль доноров в этом случае
предоставляется атомам бора.
Наконец, из-за наличия у атомов бора и у атомов переход-
ных металлов атомных функций, пригодных для образования
нарноэлектронных связей, возможно также наличие этих связей
между атомами бора и металла. Этого следует ожидать у борид-
ных фаз, имеющих гексагональную структуру (МеВг и МбгВз),
октаэдрическая координация атомов металла и неметалла кото-
рых характерна для фаз внедрения. Исходя из ячеистого распо-
ложения атомов бора и их тенденции к образованию весьма
сильной ковалентной связи, можно также ожидать между ато-
мами металла и бора возникновения парноэлектронной связи с
более фиксированными направлениями, что в известном смысле
приближает эти соединения к ковалентным кристаллам типа
В4С и боридов кремния.
В настоящее время еще нельзя сказать, какой вид связи в
боридах предпочтительнее. Повидимому, здесь, как и в подав-
ляющем большинстве металлических соединений, имеет место
наложение нескольких типов связи, что подтверждается физиче-
скими свойствами боридных фаз [345], особенно в сравнении с
физическими свойствами переходных металлов.
При образовании кристаллов из атомов переходных металлов
происходит обобществление как валентных, так и внутренних
электронов, что неизбежно приводит к потере электронами энер-
Физико-химическая природа боридов
263
готической индивидуальности, характеризуемой в основном глав-
ным квантовым числом недостроенного уровня. Если принять, что
число общих электронов, участвующих в организации металли-
ческой связи, тем больше, чем ниже энергетическая характери-
стика заполняемого d-уровня атома металла (N) и чем больше
электронный дефект d-уровня (п)*, то отношение \/Nn может слу-
жить качественной характеристикой способности к обобществле-
нию электронов (вероятности рассеяния потока электронов).
Сравнивая некоторые свойства боридов тугоплавких метал-
лов, связанные с состоянием в них электронов [345], можно за-
метить, что электросопротивление боридов титана, ванадия и
циркония ниже, чем для чистых металлов, а электросопротивле-
ние боридов тантала, ниобия и металлов VI—VIII групп выше
(табл. 78), причем это увеличение становится относительно бо-
лее высоким по мере заполнения недостроенного d-уровня пере-
ходного металла? Отношение Видемана-Франца имеет для бори-
дов тигана и циркония тот же порядок, что и для чистых метал-
лов, а при переходе к боридам ниобия, тантала, молибдена и
вольфрама резко возрастает, приобретая 'тот же порядок, что и
для карбидов, являющихся типичными фазами внедрения/Тер-
мический коэффициент электросопротивления боридов’ положите-
лен и имеет численные значения несколько меньшие, чем для
карбидов (при этом замечательно резкое его снижение для бори-
дов ниобия и тантала по сравнению с боридами титана, ванадия
и циркония, соответствующее значительному изменению l/Nn с
0,111—0,167 для титана, ванадия и циркония до 0,063—0,067 для
тантала и ниобия) Наконец, для систем бор — металлы пере-
ходных групп характерно наличие большого числа фаз с обла-
стями гомогенности, ограниченными в весьма узких пределах, что
является, повидимому, свидетельством перехода от строго опре-
деленных составов металлических фаз к фазам внедрения, имею-
щим широкие области гомогенности. Следует отметить, что
склонность к образованию большого числа боридных фаз усили-
вается при переходе от титана, ванадия и циркония к молибде-
ну, ниобию, вольфраму и танталу. Так, если титан, ванадий и
цирконий образуют устойчивые бориды МеВ и МеВ2, то для нио-
бия, молибдена, тантала и вольфрама установлены боридные
фазы типов Ме2В, Л4е3В4, МеВ, МеВ2, Л4е2В5. Таким образом, бо-
риды титана, ванадия и циркония обнаруживают сходство с ин-
терметаллическими фазами, а бориды ниобия, молибдена, танта-
ла и вольфрама имеют ряд признаков, свойственных фазам внед-
рения. Однако такие бориды титана и циркония, как TiB и ZrB,
имеющие кубическую решетку типа NaCl, также сходны по
структуре и по физическим свойствам с фазами внедрения.
* N — главное квантовое число, п — число электронов d-уровня.
264
Бориды
Физико-химические свойства некоторых переходных
Металл Электроны недостро- енного уровня 1 Nn Микротвердость кг/мм2 Удельное электросопротивле- ние, МКОМ, см
борнд карбид^нитрид металл борид карбид нитрид
Ti 3d2 0,167 3370 3000 2160 55,0 26,5 68,2^ 11,1
V 3d2 0,111 2080 2094 — 26,0 16,0 156 85,9
Сг 3d* 0,067 1800 1300 — 15,3 21,0 — —
Zr 4d2 0,125 2250 2836 1983 41,0 15 63,4 13,6
Nb 4d‘ 0,063 2590 2055 — 13,1 32 74,0 200
Mo 4d= 0,050 2350 1479 — 5,2 25,0 97,5 —
Hf 5d2 0,100 2830 30,0 12,0 109,0
Та 5d3 0,067 2530 1547 3236 12,41 68,0 30,0 135
W 5d‘ 0,050 2660 173Q — 5,03 21,0 53,0 —
1 Все сведения приведены для диборидов AfcBj, кроме W^Bs и Мо2В8<
2 Все сведения приведены для монокарбидов МеС, кроме М02С и сгзСа-
3 Все сведения приведены для мононитридов AleN, кроме MojN и WjN.
4 Показано [449], что из двух переходных металлов тот, кото-
рый имеет меньший атомный номер в данном «переходном перио-
де», всегда концентрируется в фазе, богатой бором; иначе го-
воря, металл тем прочнее соединяется с бором, чем меньше его
атомный номер.
, Рассматривая эти и другие физико-химические свойства бо-
ридов переходных металлов, представляется правильным опре-
делить бориды как металлические фазы, обладающие электрон-
ным коллективом, тяготеющим к атомам металла, в отличие от
фаз типа бериллидов, которым следует приписать известную сте-
пень заполнения недостроенных d-уровней в прямом смысле сло-
ва, и от карбидов, имеющих электронный коллектив, в равной
степени принадлежащий атомам металла и углерода.
Химические свойства боридов
Бориды переходных металлов являются, как правило, устой-
чивыми против действия минеральных кислот, в ряде случаев —
даже при нагревании. То же относится и к смесям кислот, при-
Химические свойства боридов
265
металлов, их боридов1, карбидов2 и нитридов3
Таблица 78
Термический коэффициент
электросопротивления
л - 103, % град.
Отношение Видемана- Франца Теплота образова- о ния-Н2ЭЯ ккал моль
, кар- ни-
борид биД |трид
I I
ме-
'.талл
бо-
рид
ни-
трид
Температура плавления
°C
металл борнД карбид нитрид
ме- I бо-
талл| рнд
карбид1 нитрид
+4,25
+2,8
+2,2
+2,19
+3,2
+3,0
172
88
280
70,04
43,85 80,3 166о1г98О
28,0 60,0 1700 2400
43,85
80,3
3250
2830
+2,5
107
>30
21,01
29,5 1800 1900,
1895
2950
2050—
2320
1500
(разл.)
+4,40
4-3,95
+2,3
+ 1,2
+ 1,2
+4,3
59
262
368
252
44,1
33,6
82,211930 3040
59,0 250013000
3175
3500
+4,71
180
50
—4,2
16,6.2622:2100
2690
2980
2300
(раз-
лаг.)
(разл.)
+4,40
+3,85
+4,82
+3,6
+0,85
+0,41
+0,22
4-0,03
162
195
225
286
20—45
3890
— — 2230 3250 ооэи
36,0 158,1 2850 3100 3880
-8,4 17,2 3377 2300 2600
8,4 17,2
2600
3090
| (разл.)
чем стойкость по отношению, например, к смеси кислот
IIC1 + HNO3 возрастает внутри каждой переходной группы с уве-
личением атомного номера (относительно тем резче, чем меньше
номер группы) [362]. Бориды легко разлагаются расплавленны-
ми щелочами, бисульфатами и карбонатами щелочных металлов,
а также перекисями свинца, натрия и т. п.
Окисление боридов кислородом воздуха начинается при тем-
пературах 600—700°, причем наиболее стойкие против окисления
бориды типа МеВ2 располагаются, как установлено Г. В. Сам-
соновым и Н. К. Голубевой [576, 577], по убывающей стойкости
в следующий ряд: TiB2, ZrB2, NbB2, TaB,, W2 B5.
Кэмпбелл с сотрудниками оценивает стойкость боридов про-
тив окисления примерно так же [122]:
Температура Температура
начала замет- начала замет-
ного окисле- ния, °C ного окисле- ния, °C
СгВ 1400—1800 NbB2 1100—1400
HfB2 1100—1700 МоВ2 1100—1400
ZrB2 1100—1700 W,B 800—1400
TiB2 1100-1700 VB2 800 -1400
ТаВ2 1100—1400
266
Бориды
Состав образующихся при этом окисных пленок не исследо-
ван, но можно полагать, что, поскольку окислы бора и металли-
ческих компонентов являются стеклообразующими, то пленки, no-
видимому, состоят из сложных стеклообразных боратно-металли-
ческих композиций тетраборной кислоты (анион В4С£) как наи-
более устойчивой из всех борных кислот при высоких темпера-
турах.
Действием азота при высоких температурах на бориды воль-
фрама и хрома образуются смеси нитридов этих металлов с
нитридом бора [399]. Бориды являются, повидимому, гораздо'бо-
лее устойчивыми в термодинамическом отношении, чем карбиды
и нитриды переходных металлов, так как при действии нитрида
бора на карбиды металлов образуются за исключением карбида
хрома соответствующие бориды [451] (табл. 79).
Таблица 79
Продукты реакции нитрида бора с карбидами
Реагирующая смесь Температура, °C Продукт реакции
TiC + BN 2400 TiB2
ZrC -f- BN 2600 ZrB2
VC+ BN 2000 VB2
NbC + BN 2250 NbB2
СГ3С2 BN 1650 Cr2N, Cr
Mo2C + BN 2300 MoB
WC + BN 2450 W2B5
Точно так же при воздействии бора на силициды переходных
металлов образуются бориды (TiB2, ZtB2, СгВ, МоВ). Углерод
практически не взаимодействует с диборидами, а также со всеми
другими боридами хрома, молибдена и вольфрама [451]. Встре-
чающиеся в литературе [452] указания на наличие тройных хи-
мических соединений Ti2BC, Ti2B2C и W2B2C являются ошибоч-
ными, так как штрихдиаграммы этих фаз легко индицируются
как смеси диборида TiB2 или борида W2Bs с соответствующими
карбидами.
При исследовании продуктов взаимодействия при горячем
прессовании смесей гидридов или карбидов металлов с бором,
углеродом или карбидом бора всегда обнаруживаются дибориды
титана, циркония, тантала, ниобия, ванадия, хрома, молибдена,
борид W2Bs, гексаборид тория и борид железа, очевидно являю-
щиеся наиболее устойчивыми при высоких температурах в при-
сутствии углерода [453].
При взаимодействии некоторых боридов с расплавленными
металлами группы железа, а также при нагревании порошкооб-
разных смесей образуются, как правило, тройные боридные фа-
Методы получения боридов 267
зы, например, Mo2NiB2, Mo2NiB4 (изоморфные бориду хрома
Сгз—В4), а также двойные бориды железа и кобальта аналогич-
ных составов [454].
Некоторые бориды, в частности борид циркония [455], устой-
чивы в расплавленных металлах и солях, в том числе алюминии,
меди, олове, магнии, фторидах, кремнии и бронзе. Расплавленное
железо и сплав инконель быстро действуют на борид циркония.
Весьма стоек в химическом отношении борид хрома — он не под-
дается действию разбавленной азотной кислоты, а также отлич-
но сопротивляется действию концентрированных азотной, соля-
ной, серной и плавиковой кислот. Хлорная кислота действует на
борид хрома медленно. Перекись натрия и смесь соды с селит-
рой (при сплавлении) легко разлагает борид хрома. Двойной
борид молибдена-никеля хорошо сопротивляется действию раз-
бавленной серной кислоты.
Основные физико-химические свойства боридов приведены в
табл. 78.
Методы получения боридов
Приготовление боридов непосредственно из металлов и бора
В основе лежит реакция: Л4е+В ~>Л4еВ, которая может осу-
ществляться в жидкой фазе, при расплавлении спрессованных
смесей порошков металла и бора [231, 458] и в твердом состоя-
нии спеканием порошков [459, 460, 461]. Сплавлением, как пра-
вило, не удается получить достаточно чистые бориды определен-
ного фазового состава, за исключением боридов хрома, которые,
вследствие их относительно низких температур плавления и хи-
мической устойчивости, были получены сплавлением хрома с бо-
ром в высокочастотной вакуумной печи [461]. Процесс образова-
ния боридов при спекании осуществляется путем реактивной диф-
фузии бора в металл с образованием в решетке последнего ха-
рактерных борных цепочек или сеток (зачастую при этом изме-
няется сама решетка). Таким путем были получены бориды цир-
кония, ниобия, тантала, хрома, молибдена и вольфрама [458,
459, 460]. Процесс проводился в кварцевой эквакуированной
трубке, помещавшейся в электропечь. • Сообщается также [462]
способ приготовления сравнительно чистых боридов путем спека-
ния смесей порошков металлов и бора в молибденовом тигле в
атмосфере аргона. Эрлих [145] готовил чистые бориды титана,
помещая смесь порошков титана и бора в вольфрамовую лодоч-
ку вакуумной печи. Температуры реакции лежат в пределах от
1300 до 2050°, хотя начало реакций, имеющих экзотермический
характер, относится к температурам 950—1250° [462].
Спекание смесей порошков металлов и бора горячим прессо-
ванием в графитовой прессформе [453, 463] дает возможность
получать бориды в компактной форме. Однако этот метод мо-
268
Бориды
жет использоваться только для тех боридов, которые при темпе-
ратурах спекания не подвергаются науглероживанию.
Металлотермическое восстановление
Для металлотермического восстановления обычно исполь-
зуется алюминий, магний, кальций или кремний:
МеО + В2О3 + Al (Mg, Са, Si) -* AfeB + Al (Mg, Ca, Si)xOy .
Оценка возможности, полноты и скорости восстановления
обычно производится по величине термичности, рассчитываемой
по Жемчужному как отношение теплового эффекта реакции к
сумме весов реагирующих веществ. Следует отметить, что уста-
новленное Жемчужным минимально требуемое значение тер-
мичности для алюминотермичеокого восстановления, равное.
550 кал/г шихты, практически действительно и для других вос-
становителей — магния, кремния, кальция и т. п.
Этим методом получали бориды хрома [463], а также бориды
вольфрама и молибдена [465]; однако они содержали значитель-
ное количество примесей, для удаления которых требуется от-
мывка или механическое разделение.
Наиболее удобным восстановителем является магний, обра-
зующий легко удаляемый окисел.
Углеродное восстановление
Углеродное восстановление, впервые предложенное Мак Кен-
на [466], экономично и позволяет получать значительные коли-
чества боридов восстановлением смесей окислов металлов и бор-
ного ангидрида углем. Однако бориды в этом случае загрязнены
карбидами или свободным углеродом. Восстановление может
осуществляться в графитовом тигле или печи сопротивления с
грдфитовой трубой при температурах около 2000°.
Целесообразнее осуществлять этот способ с использованием
значительного избытка борного ангидрида в шихте и при темпе-
ратурах, достаточных для прохождения реакции получения бо-
рида;
МеО + В2О3 + С - МеВ + СО,
но недостаточных для образования карбида бора по реакции:
2В2О3 4- 7С = В4С + 6СО.
Регулируя режим, время и температуру восстановления, мо-
жно добиться получения боридов с содержанием углерода не
выше 2% [582]. 4
Борокарбидный способ
При взаимодействии металлов, окислов, гидридов или карби-
дов переходных металлов с карбидом бора В4С, с добавкой бор-
ного ангидрида в количествах, необходимых для удаления угле-
Методы получения боридов
269
рода в целях предотвращения загрязнения им получаемого про-
дукта, образуются бориды по схеме:
Me (МеН, МеС) + В4С + В2О3- МеВ + СО.
При использовании в качестве металлосодержащего компо-
нента окислов металлов не следует вводить ангидрид, добавляют
уголь для удаления кислорода в форме СО:
МеО + В4С + С - МеВ + СО.
Борокарбидные процессы проводят [467] в печи сопротивле-
ния с графитовой трубой при температурах около 2000°. После
дополнительной обработки продукта реакции прокаливанием с
обезуглероживающими материалами и кислотной отмывки содер-
жание углерода в боридах может быть снижено до 0,05—0,07%.
Лучшие результаты получаются при осуществлении этого
процесса в вакууме [468]. Вакуумнотермический процесс по Ме-
ерсону и Самсонову обеспечивает полноту прохождения реакции
образования борида, а также позволяет избежать азотирования
и окисления полученного продукта. Меерсон и Самсонов иссле-
довали [468] условия получения боридов титана, циркония, нио-
бия, тантала и вольфрама из окислов соответствующих метал-
лов, карбида бора и сажи. Тензометрическое исследование реак-
ций образования борида титана обнаружило три стадии, соответ-
ствующие образованию промежуточных окислов:
2TiO2 + В4С + ЗС = Ti2O3 + B4C 4- 2С + СО;
Ti2O3+ В4С + 2С = 2TiO + В4С + С + СО;
2TiO + В4С + С = 2TiB2 + 2СО,
что подтвердилось также термодинамическим анализом этих
стадий [150]. Таким образом, ни углерод, ни бор карбида бора не
принимают участия в восстановлении ТЮ2 до Т120з и Ti2O3 до
ТЮ и вступают в действие только при восстановлении ТЮ до
TiB2, что, очевидно, связано с меньшей термодинамической
устойчивостью ТЮ по сравнению с ТЮ2 и Ti2O3.
При получении боридов вольфрама и ванадия, высшие оки-
слы которых (WO3 и V2O5) летучи, последние необходимо пред-
варительно восстановить до менее летучих окислов (WO2 и V2O3).
Электролиз расплавленных сред
При электролизе расплавленных смесей боратов щелочных и
щелочноземельных металлов с окислами тугоплавких металлов
в определенных условиях образуются бориды тугоплавких метал-
лов в форме хорошо кристаллизованных тонкодисперсных осад-
ков. Определяющее влияние на состав осажденного продукта
имеет соотношение компонентов расплава, так что этим спосо-
бом могут быть получены различные боридные фазы. Восстанов-
£70
Бориды
ление окисла тугоплавкого металла и борного ангидрида при
электролизе [470] осуществляется магнием, кальцием или литием,
первично выделяющимися на катоде, для чего в ванну вводят
окислы этих металлов1. В качестве флюсов используются фтори-
ды магния, кальция или лития. Температура расплава при элек-
тролизе составляет 900—1100°, в качестве анода обычно употреб-
ляют графитовый тигель, а катода — графитовый стержень.
Электролизом при условии тщательной и трудоемкой очистки ка-
тодных осадков можно получать весьма чистые боридные фазы.
Этот метод в применении к отдельным боридам описан в ряде
работ [448, 463, 469, 470, 471, 472]; в табл. 80 указаны некото-
рые особенности режимов и составов ванн для получения бори-
дов тугоплавких металлов. Следует отметить, однако, малую
экономичность этого метода.
Осаждение боридов из газовой фазы
Осаждение боридов из газовой фазы аналогично получению
карбидов и нитридов разложением галоидных соединений метал-
лов на накаленной вольфрамовой нити в присутствии углеводо-
родов или азота. Борсодержащими компонентами являются
ВВгз или ВС13, которые восстанавливаются водородом:
МеХ+ В Л^В 4-НЛЧ-НУ.
Данные об этом методе [125] были недавно уточнены Кэмп-
беллом [122, 473] и приведены в табл. 81. При осаждении обра-
зуются топкокристаллические осадки, содержание вольфрама
или молибдена в которых (за счет нити), как можно судить по
аналогии с металлическими осадками [93], не превышает 0,1 —
0,2%.
Следует отметить, что получение таким способом боридов
тантала, вольфрама, хрома и молибдена затруднительно, так как
наряду с боридом осаждается металл.
Несколько лучшие результаты получаются при осаждении
бора на предварительно наращенный на нити слой металла и
использование хлорида бора вместо его бромида. Фазовый состав
получаемого осадка во всех случаях не совсем определен, глав-
ным образом в осадке присутствуют фазы Л4еВ2. При осаждении
бсра на вольфрамовой и молибденовой нити Сабо и Тобиаш по-
лучили не бориды, а довольно чистый бор [475].
1 Г. А. Меерсои и М. П. Смирнов [472] на основании результатов иссле-
дования механизма процесса получения борида титана из расплавленных
боратно-фторндных ванн считают выделение борида титана первичным про-
цессом, происходящим при одновременном разряде ионов Ti4+ и В3+, а не
вторичным процессом восстановления TiO2 и В2О3 первично выделяющиеся
кальцием, как это показывает Андрие в своих работах. Выводы Меерсона и
Смирнова основаны на наличии на I—V-кривых при электролитическом раз-
ложении TiO2 и В2О3 в расплаве только одного скачка.
Таблица SO
Режим электролиза расплавов для получения боридов
Металл Состав ванны, молей Температура °C Состав полученного борида, % Формула борида
Me В
Ti Т1О2 + 2В2О3 + MgO (CaO) -f- + MgF2 (CaF2) 1000 68,5—69,1 30,8—31,2 Т1В2
Zr ZrO2 + 2B2O3 4“ MgO 4 (CaO, Li2O) +MgF2(CaF2, LiF) 990-1050 81,0—86,3 13,8-19,4 ZrB3
V y V2O5 + 2BaO, + MgO (CaO, Li2O) + + MgF2 (CaF3, LiF) 910—1050 69,6—70,0 29,4—30,2 VB2
Nb 1 IO NbgOg + 2B20g 4~ MgO (CaO, Li2O) 4~ 4-MgF>(CaF>, LiF) 980—1000 80,9—81,7 18,0—18,2 NbB2
Металл Состав ванны, молей
Та Та2О5 + 2В2О3 + + {MgO(CaO, Li2O)+MgF2(CaF2, LiF)} или {Na2B4O74-NaF}
Сг 1 & Cr2Os + 2B2O3 + MgO (CaO) + + MgF2(CaF2)
Мо 4-MoO3 4-2BjO3 + NaF 4 —' — MoO3 + 2BaPa + NaF о 10
W -j- WO3 + 2B2O3 • Na3O + NaF
и U3O8 + 2B3O3 + MgO (CaO, Li2O) + + MgF2 (CaF2, LiF)
Продолжение Табл. 80'
Температура °C Состав полученного борида, % Формула борида
Me в
980—990 89,1—89,4 10,3—10,7 TaB2
1000 87,4—87,6 11,8—12,1 Смесь боридов СгВ н Сг3В2
1000 93,6—94,0 88,9—89,2 5,32—5,55 9,89—10,5 Мо2В МоВ
960 93,9—94,5 5,1—5,4 WB
950—1000 — — ив^ + ив12
Бориды титана
273
Условия осаждения боридов из газовой фазы
Таблица 81
Борид По Моэрсу [125] для ВВг3 По Кэмпбеллу [122] для BCls
металлосодержа- щий компонент температура нити, °C металлосодержа- щий компонент температура нити, °C
Ti TiCl4 1100-1300 TiCl4 1000—1300
Zr ZrCl4 1700—2500 ZrCl4 1700—2500
Hf HfCl4 1900—2700 HfCl4 1900—2700
V VC1* 900—1300 VC14 900—1300
Та ТаС16 1300—1700 Та 1800—2000
Cr — Cr 1200—1600
Мо — — Mo 1800—2000
W WC16 1300-1700 w 1800—2000
Приготовить плотные образцы из порошков боридов литьем
трудно, и для этой цели, как правило, используют спекание по-
рошков. Прессование тонкого (1—3 и) порошка борида произ-
водится под удельным давлением 1—2 т/см2. Брикеты спекают в
индукционных вакуумных печах или печах сопротивления при
2000—2500° (для повышения электропроводности и прочности),
а затем через брикет, помещенный в вакууме, пропускают элек-
трический ток («сварка», аналогичная сварке вольфрама или
молибдена [476]). При этом бориды одновременно очищаются от
окисных, металлических и других примесей, которые удаляются
в вакууме [4].
Наиболее плотные образцы из боридов получаются методом
горячего прессования [453, 467, 477], причем хорошие результа-
ты дают присадки к порошкам спекаемых боридов металлов же-
лезной группы, удаляющихся при спекании через поры пресс-
формы. Этот метод добавления присадок совершенно аналоги-
чен способу, разработанному Чиотти для спекания карби-
дов [131].
Бориды титана
В системе Ti—В установлено наличие по крайней мере че-
тырех фаз: Ti2B, TiB, TiB2 и Ti2Bs; кроме того, при исследовании
взаимодействия карбида титана с карбидом бора [478] обнару-
жена еще одна фаза, близкая по составу к TiBi2.
Растворимость бора в а- и р -титане не превышает 0,05%
при 750—1300° и несколько выше 0,1% при эвтектической темпе-
ратуре 1670+25° [479].
Существование фазы Ti2B, установленной Огденом и Джеф-
фи [480] долгое время казалось спорным; в пределах TiB о,i—
TiB 0.75-0,8 полагали наличие сверхструктурной титаноподобной
18 Г- В. Самсонов
£74
Бориды
фазы [145]. Значение периодов этой фазы достигает наибольшей
величины для TiB о,о т. е. в середине области сверхструктуры.
Борид TiB с кубической решеткой типа ZnS и периодом
а — 4,24 кХ и четырьмя молекулами в элементарной ячейке
устойчив, повидимому, только при высоких температурах, распа-
даясь ниже 680° на a-Ti и диборид TiB2 [461]. Однако Эрлих
[145] считает, что существование моноборида титана возможно и
в области сравнительно низких температур, но в виде полиморф-
ной низкотемпературной разновидности, имеющей структуру ти-
па карбида вольфрама WC, близкую к структуре А1В2. [На рент-
генограммах не было получено линий, отвечающих решетке ти-
тана, что подтвердило бы распад 2TiB TiB2 + Ti]. Бревер [462]
рассматривает, однако, фазу TiB как смешанные кристаллы TiN—
TiO, образующиеся за счет примесей кислорода и азота. В пос-
леднее время существование TiB было вновь подтверждено [481].
В работе Денкера и Каспера [482] для структуры TiB найде-
на ромбическая решетка типа FeB с периодами а = 6,12 кХ,
b = 3,06 кХ, с — 4,56 кХ, что, повидимому, является ошибкой,
так как всеми другими работами для TiB была обнаружена ку-
бическая гранецентрированная решетка [453, 145, 43].
Гексагональная фаза TiB2, имеющая структуру борида алю-
миния А1В2, гомогенна приблизительно от 66,6 до 75%; (атомн.)
В [145].
Пост и Глазер [481] на основании рентгеновского исследова-
ния предположили существование гексагональной фазы Ti2Bg
(TiB2,s), устойчивой только при высоких температурах
(1700—2100°).
На рентгенограмме сплава состава TiBs.o Эрлих установил
наличие еще одной боридной фазы, более богатой бором, чем
TiB 2.5> позднее было подтверждено существование этой фазы
[478]; она, повидимому, представляет собой соединение TiBi2,
не изоморфное, однако, A1Bi2.
Ориентировочная диаграмма состояний системы Ti—В, постро-
енная на основании всех этих данных [43], показана на рис. 158.
Твердый раствор бора в a-Ti при 886±4° претерпевает перитек-
тоидный распад на ₽-Ti и TiB. Температура превращения
жрTiB составляет около 1670 ±25°, бора при этом
содержится около 3,5%. Фаза TiB образуется при перитектоид-
ном превращении: Ti2B + TiB2 3TiB, при температуре около
2060°. Соединение Ti2B, обладающее тетрагональной решеткой,
образуется при 2200±50° по перитектической реакции из жидко-
сти, содержащей около 9,9% В, и TiB2. Оно неустойчиво и при
температуре около 1800° распадается на жидкость и TiB.
Тетрагональной структуре Ti2B могут отвечать две элементар-
ные ячейки с а ~ 6,10 кХ, с = 4,53 кХ и с/а = 0,742 или а = 5,24
кХ, с = 7,602 кХ и с/а = 1,453.
Бориды циркония
275
Первая элементарная ячейка согласуется с данными Поста и
Глазера [481]: 0 = 6,11 кХ, с = 4,56 кХ и с/а = 0,747.
TiB имеет кубическую решетку с периодом а = 4,26 кХ [453],
a TiB2— гексагональную, периоды которой, ранее установлен-
ные Нортоном с сотрудниками [448] и Эрлихом [145], были под-
тверждены в излагаемой работе Полти, Марголина и Нильсе-
на [43].
Химическая устойчивость изучена только для борида TiB2.
Соляная и плавиковая кислоты на этот борид практически не
действуют, серная кислота реагирует с ним только при на-
гревании. TiB2 легко растворяется смесями НЫОз + Н2О2 и
H2SO4 + HNO3, а также разлагается расплавленными щелочами,
карбонатами и бисульфатами щелочных металлов, перекисями
свинца и натрия [471]. Он является самым устойчивым из дибо-
ридов против окисления кислородом воздуха. Более или менее
заметное окисление начинается с 900—1000°.
Свойства боридов титана приведены в табл. 82.
Бориды циркония
Растворение бора в a-Zr сопровождается увеличением пе-
риодов решетки от a = 3,229 кХ и с = 5,139 кХ до а = 3,249 и
с = 5,203 кХ, а также значительным повышением твердости,
хотя растворимость бора в a-Zr незначительна. В систе-
ме Zr—В установлено существование трех боридов: наиболее
устойчивого ZrB2, а также ZrB и ZrBi2. ZrB2, тщательно исследо-
18*
276
Бориды
Таблица 82
Свойства боридов титана
Свойство Борид
Ti2B TiB TiB2 | Ti2B5
Содержание бора, % . 10,15 18,45 31,10 36,10
Структура тетраг. г. ц. к. гексаг. гексаг.
Периоды, кХ: а 6,11 [481] 4,26 [481] 3,026 [145] 2,98 [481]
с 4,56 [481] — 3,213 [145] 13,98 [481]
с/а 0,747 [481] — 1,062 [145] 4у.7О [481[
Плотность, г/см3: расчетная • . • 5,26 4,52
экспериментальная — 5,09 [43] 4,45 [145] —
Микротвердость (30 г), кг'мм2 3370 [362]
Температура плавле- ния, °C 2200 (разла- — 2980 [43] —
Область температурной устойчивости гается) 1800—2200 600 до 1800 20 до 1700
[451] [451] 2800±30 2100 + 50
Теплота образования, —Д Hjgs ккал]моль . . [451] —70,04 [451] —105
Теплопроводность (при 200°), кал!см сек град [150] 0,0624 [483]
Удельное электросопро- тивление, мком • см: при 24° 40 [453] [448] 26,5 [225]
при —80° .... — — 20,8 [225] —
Температура перехода в сверхпроводящее состо- яние, ®к 1,26 [198]
Термический коэффи- циент электросопротивле- ния а • 10s (—80f23 ), %'град 2,2
Энтропия Д298 , кал!моль. град 5,8* 7,8* '
Модуль упругости кг/ммг — 37400 [616] —
* Рассчитано по эмпирическим формулам [1S2J.
ванный в последних работах [448, 462, 484], имеет простую гек-
сагональную решетку типа А1В2 с одной молекулой в элемен-
тарной ячейке. Эта боридная фаза плавится без разложения и
однородна в узких пределах содержаний бора.
Борид ZrB кристаллизуется в кубической системе и устой-
чив в интервале температур 800—1250°, а борид ZrBl2 изомор-
Бориды циркония
277
фен UB12 [485] (также кубическая гранецентрированная решет-
ка) и устойчив только при высоких температурах (от 1650° до
температуры плавления, равной 2680°).
На основании этих данных была сделана попытка построить
диаграмму состояний системы Zr—В [486] (рис, 159). Выделить
чистое соединение ZrBi2 затруднительно; даже при быстром
охлаждении до комнатной температуры сплав содержит 10% или
более диборида циркония.
Проведенное Г. В. Самсоновым и Н. С. Резиновой иссле-
дование системы Zr—В методами рентгеновского анализа, изу-
1500
2500
2000
t;c
3000
23.
3040
{ZrtZrBz
L-1№1.
iZnlrSf .
, ПгВ
'____№
Zrt-ZrS?
t:c
зооо
1000}
800-
ео
2Ш°ЦП0
2000
ГЯ6О~
2500
1500
1000
500
° 0 10 20 30 40 50 60 70 80 30 100
Z/* В fl. (Вес.) В
Рис. 159. Диаграмма состояний системы Zr—В
чения микроструктур и микротвердости практически полностью
подтвердило приведенную диаграмму состояний. В закаленных с
1500° образцах фаза ZrB2 была обнаружена в интервале концент-
раций 1,75—18,24% В. Твердость этой фазы практически не ме-
няется с увеличением содержания бора в сплавах (в указанных
пределах); период решетки также практически постоянен. При
увеличении содержания бора с 18,24 до 19,20% (содержание бо-
ра в ZrB2 составляет 19,21%) твердость увеличивается с 2000 до
2280—2380 кг/мм2 и периоды решетки от а — 3,098 и с = 3,530 кХ
до а = 3,120 и с = 3,533 кХ. Таким образом, фаза ZrB2 при 1500°
гомогенна в пределах по крайней мере от 18,24 до 19,21% В, т. е.
от 65,2 до 67%, (атомн.) В.
Твердость фазы a-Zr несколько возрастает при увеличения
содержания бора в a-Zr до 2,87%, после чего остается постоян-
ной и равной около 1120 кг!мм2.
Бориды
ZrB2, в некоторых источниках считающийся устойчивым про-
тив действия соляной кислоты, на самом деле в порошкообраз-
ном виде медленно разлагается ею с образованием бороводоро-
дов, что подтверждает наблюдения Ведекинда [19].
Более интенсивно протекает растворение ZrB2 в Н\т0з, цар-
ской водке и смеси H2SO4 + HNO3. При нагревании он разла-
гается серной кислотой; легко разлагается расплавленными ще-
лочами, карбонатами, бисульфатами щелочных металлов и пе-
рекисями; окисление кислородом воздуха начинается при 900—
950°. В процессе окисления при 1150° за 200 час. вес увеличи-
вается на 4 мг!см? [128]. Длительная прочность ZrB2 при растя-
жении (при 1000°) [455] составляет 11,41 кг/мм? (100 час.).
Свойства боридов циркония приведены в табл. 83.
Таблица 83
Свойства боридов циркония
Свойство Борид
ZrB ZrB2 ZrB)2
Содержание бора, % . . 10,59 19,18 58,75
Структура Периоды, кХ: Г. ц. к. Гексаг. Г. ц. к.
а . . . 4,65 [486] 3,170 [448] 7,408 [485]
с — 3,533 [448] —-
с/а ........ Плотность, г-см3'. — 1,114 [448] —
расчетная ...6,7 6,15 3,63
экспериментальная . Микротвердость (30 г), 5,7 [486] 5,82 [186] 3,70 [485]
кг/мм3 — 2250 [362] —
Твердость по , кг!мм3 69-72 [486] 87-89 [486] 92,5 [485]
Температура плавления,°C Область температурной — 3040+100 [ 486] 2680 [ 486]
устойчивости, °C Теплота образования — 800-1250 [451] 20—3040 [451] 1650—2680 [451]
—&Н°, ккал/моль Теплопроводность, 39 [483] 78 [483] 120 [483]
кал/см • сек • град . ... . Удельное электросопротив- — 0,0550 [448] 0,029 [485]
ление при 25° мком • см . . Термический коэффициент электросопротивления а 103 30—35 [486] 13—15 [ 486] 60—100 [486]
(—80 + 23°), %/град .... Коэффициент термического — +2,3 [225] + 1,62 [485]
расширения (20—1000°) . . Термоэмиссионные свой- ства: 5,5 • Ю 6 [486]
A, ajcM3 • град3 . . . — 30 [196] —
<р, эв — 4,48 [166] —
Бориды гафния
279
Таблица 83 (окончание)
Свойство Борид
ZrB ZrB, ZrBn
Предел прочности при раз- рыве, Кг/мМ2 — 39,1 (при 1000°) [455] —
Коэффициент лучеиспуска- ния (спектральная эмиссия) при X = 0,655 0,70 [196]
Энтропия (298°), кал/моль- • град Температура перехода в — 10,7* —
сверхпроводящее состоя- ние, °к. . . — 1,8'[487]
Модуль упругости, кг/мм* — 35000 [616] —
* См. сноску к табл. 8 2.
Бориды гафния
В настоящее время с достоверностью известен только дибо-
рид гафния НГВг, получающийся обычно методом осаждения
из газовой фазы (табл. 81). Имеются также отдельные указания
на существование моноборида HfB [488], а также на исключи-
тельное сходство в строении диаграммы Hf—В и Zr—В в обла-
сти от чистых металлов до диборидов [451]. В отличие от цир-
кония гафний не образует борида MeBi2. Немногочисленные све-
дения, имеющиеся в литературе о боридах гафния, приведены в
табл. 84.
Таблица 84
Свойства боридов гафния
Свойство Борид
HfB HfB,
Содержание бора, % Структура Периоды, кХ: а с с!а Плотность, г/см3: расчетная экспериментальная Температура плавления, °C Область температурной устойчивости, °C Удельное электросопротивление (20°), МКОМ -см ....... • 5 72 Г. ц. к. [488] 4,62 [488] 11,6 10,81 Гексаг. [488] 3,141 [488] 3,470 [488] 1,105 [488] 11,28 10,5 [488] 3250+ 100 [488] 20—3250 [451] 12 [488]
280
Бориды
Таблица 84 (окончание)
Свойство
Борид
HfB | ШВ2
Коэффициент термического расширения,
°/01град................................
Энтропия S°298, кал!моль • град.......
Термический коэффициент электросопро- I
тивления (+20+2630°) а 103, %/град . . 1
Температура перехода в сверхпроводи-
щее состояние, °К.......................
5,3 . 10_в [488]
14,2*
3,6 [136]
<1,26 [198]
* См- сноску к табл- 82
Бориды ванадия
Установлено существование только двух боридов ванадия:
VB и VB2, устойчивых до температур их плавления. Борид VB
впервые был получен сплавлением ванадия и бора еще Ведекин-
дом [457], затем его существование ставилось под сомнение до
недавних исследований [485, 489].
VB имеет ромбическую решетку типа СгВ с четырьмя молеку-
лами в элементарной ячейке, устойчив по отношению к раство-
рам щелочей и кислот, за исключением HF и HNOs, твердость
его по минералогической шкале равна 9.
VB2, как и все дибориды, имеет гексагональную решетку
Д1В2, нерастворим в соляной, плавиковой и серной кислотах,
легко растворим в азотной кислоте [471], быстро растворяется в
расплавах щелочей, карбонатов, бисульфатов, перекисях свинца
и натрия.
Открыт также борид V2Bs, изоморфный Ti2B5, W2Bs и
Сг2В5 [451]. Интересно, что ванадий в отличие от ниобия и тан-
тала не образует боридов типа Л1е3В, Л1е2В и Л4е3В4. Свойства
боридов ванадия приведены в табл. 85.
Таблица 85
Основные свойства боридов ванадия
Борид
Свойство
VB VB2
Содержание бора, % Структура Периоды, кХ: h i i: / : i-i • i _1. - 17,56 РоМбич- [489] 3,10 [489] 8,17 [489] 29,8 Гексаг. [448] 2,998 [448]
Бориды ниобия
281
Продолжение табл. 85
Свойство Борид
VB VB2
с 2,98 [489] 3,057 [488]
с/а Плотность, г]см3: — 1,020 [448]
расчетная 5,44 5,10
экспериментальная 1 4,61 [4]
Температура плавления, °C . . . Область температурной устойчиво- 1900(451] 2400± 50 [451]
сти, °C Микротвердость (30 г), кг /мм* . . Электросопротивление (25°), 20—1900 [451] 20—2400(451]
— 2080 [362]
МКОМ ‘ОМ ... - . Температурный коэффициент элек- 35—40 [489] 16 [453]
тросопротивления а • 103, %/град . — +2,19 [136]
Энтропия S°2!<8, кал/моль, град . . — 7,9*
Работа выхода <р, эв * См. сноску к табл. 82- — 3,88
Бориды ниобия
При рентгеновском исследовании системы Nb—В [460] в об-
ласти около 10%' (атомн.) В были обнаружены фазы р и р', при-
чем фаза р оказалась устойчивой только при комнатной темпе-
ратуре, фаза р' — при более высоких. По данным Андерсона и
Кисслинга [460], фаза Р' имеет кубическую решетку с периодом
4,21 кХ. В области от 25 до 35%; (атомн.) В они установили фа-
зу Р"9 существующую только в закаленных образцах. Бревер
[462], в известном согласии с этими данными, нашел, что в спла-
вах, содержащих от 25 до 50%', (атомн.) В, наряду с NbB2 обра-
зуются соединения неопределенного состава NbBm и NbBn бер-
толидного типа, обнаруженные по появлению на рентгенограм-
мах сплавов линий, отличных от линий чистого ниобия и его
диборида и моноборида. СоединениеNbBm при высоких темпера-
турах неустойчиво, с повышением содержания бора в сплавах
устойчивость этого соединения уменьшается.
Некоторые линии рентгенограмм этих сплавов, как сообщает
Бревер [462], соответствуют простой кубической решетке с перио-
дом а = 4,21 кХ.
Повидимому, фаза р" и NbBm соответствует соединению
Nb3B [25%' (атомн.) В] и устойчива в области сравнительно низ-
ких температур (20—1500°). Эта фаза изоморфна Та3В.
Фаза NbBn [33,3% (атомн.) В], вероятно, представляет со-
бой Nb2B — борид, несколько более устойчивый, чем Nb3B. Эта
фаза по кристаллической структуре не изоморфна Та2В.
282
Бориды
Моноборид ниобия (у-фаза по Кисслингу) NbB кристалли-
зуется в ромбической системе и изоморфен FeB, ТаВ и СгВ. Для
этой фазы обнаружена узкая область гомогенности.
8 -фаза является боридом Nb3B4, также с ромбической ре-
шеткой.
Наиболее ярко выраженными свойствами химического инди-
вида в этой системе обладает диборид NbB2, имеющий гексаго-
нальную решетку с периодами: а = 3,110 и с = 3,264 кХ в том
случае, если он находится в равновесии с Nb3B4, и а = 3,085 и
с = 3,311 кХ, когда он приготовлен нагреванием ниобия с бором
в расчете на получение NbB2 (при 1565°). Эта фаза обладает
довольно широкими пределами гомогенности, которые точно не
установлены, и устойчива при всех температурах до плавления.
Кроме NbB2, такой же высокой степенью температурной устой-
чивости обладает только борид NbB.
С точки зрения химической устойчивости изучен только ди-
борид NbB2, на который практически не действуют ни соляная,
ни азотная кислоты, ни царская водка; серная и плавиковая кис-
лоты слабо действуют при нагревании. NbB2 быстро разлагается
расплавленными щелочами и карбонатами. Окисление его на
воздухе начинается в довольно значительной степени уже при
500—600°.
Свойства боридов ниобия приведены в табл. 86.
Таблица 86
Свойства боридов ниобия
Свойство Ворид
Nb3B NbaB NbB Nb3B, NbB2
Содержание бора, % . 3,74 5,50 10,44 13,32 18,89
Структура Периоды, кХ~. Не ог ле феде- на Ромбич. [462] Ромбич. [460] Гексаг. [448]
а — — 3,298 [462] 3,305 [ 460] 3,086 [ 448]
ь — — 8,724 [ 462] 14,08 [460] —
С . . . . • — — 3,166 [4G2] 3,137 [460] 3,306 [448]
с/д Плотность, г/см3: — — —— — 1,071 [448]
расчетная — — 7,60 — 7,00
экспериментальная Температура плавле- — — — 6,60 [448]
нид, °C Область температурной — — -2000 [462] — 3000 + 50 [450]
устойчивости, “С . • . . Теплота образования, — —- — 20—3000 [451]
—Д//°г>8> ккал/моль . . — — — — 36 [483]
Бориды тантала
283
Продолжение табл. 86
Борид
Свойство I Nb3B NbaB NbB Nb3Bj NbBa
Микротвердость (30 г), кг/мм* Электросопротивление (25°), мком * см .... Температурный коэф- фициент электросопро- тивления а • 103 (—80 -f-23°C), %/град . . . 2590[362]
— 64,5 [453] — 32,0 [453]
+ 1,2 [225]
Теплопроводность, кал 'см • сек град . . . — — — — 0,0400 [225]
Температура перехода в сверхпроводящее со- стояние, °к Энтропия (298°), кал/моль, град .... 6[490] <1,27 [490]] <1,27 [490]
— — — 10,4*
* См. сноску к табл. R2.
Бориды тантала
Система Та—В изучена рентгенографически Кисслингом [458],
который обнаружил а-твердый раствор бора в тантале и четыре
боридные фазы, названные им р, 7, 8 и е.
Растворимость бора в тантале низка, но в общем выше, чем
в других переходных металлах IV, V и VI групп.
Бревер [462] в образцах, состоящих из смеси Та+ТаВ2 и за-
каленных в аргоне с температуры 1950°, обнаружил низший бо-
рид тантала ТазВ, устойчивый, повидимому, только в области
высоких температур:
P-фаза (борид Та2В) устойчива при низких температурах
(от 20 до 1800°). При этих температурах ее равновесие с а-и
7-фазами устанавливается крайне медленно и получить ее в чи-
слом виде трудно. P-фаза имеет тетрагональную структуру типа
СпА12 и изоморфна Мо2В и Ш2В.
7-фаза, соответствующая формуле ТаВ, имеет узкую область
гомогенности и устойчива только при очень низких температу-
рах. Она имеет ромбическую структуру и изоморфна СгВ (с че-
тырьмя молекулами в элементарной ячейке).
Выше 50% (атомн.) бора появляется 8-фаза состава ТазВ4,
имеющая также ромбическую решетку с двумя молекулами в эле-
ментарной ячейке. На рентгенограммах сплавов, содержащих бо-
лее 58% (атомн.) В, появляются линии «-фазы (ТаВ2), гомоген-
ной в области от 61 до 72% (атомн.) В (TaBi,78 —ТаВ 2,57) и
изоморфной другими диборидами металлов IV и V групп. Это
284
Бориды
единственная фаза системы Та—В, устойчивая в широких пре-
делах температур от 20° до точки плавления (~ 3100°).
Периоды решеток т-> 8- и s-фаз измеряли Кисслинг [458]
и Бревер [462], которые получили очень близкие значения.
В табл. 87 периоды решетки приведены по данным Кисслинга.
Таблица 87
Свойства боридов тантала
Свойство Борид
Та3Б Та2В ТаВ Та3В, ТаВа
Содержание бора, % . . . . 1,96 2,90 5,64 7,38 10,68
Структура Не оп- Тетраг. Ромбич. Ромбич. Гексаг.
Периоды решетки, кХ: редел. 3,276 3,057
а — 5,778 3,29 [458]
[458] [458] [458]
ь — 8,669 [458] 14,0 [458] —
с — 4,864 8,157 3,13 [458] 3,291
[4581 [458] [458]
с/а —— 0,843 — —— 1,078
[458] [458]
Плотность, г'см3:
расчетная — 14,28 13,69 12,62
экспериментальная .... — 14,0 11,70
[458] [458]
Температура плавления, °C . — 2040[462] 2040 [462] — 3100 + 50
Область температурной ус- тойчивости, °C 20—1780 [451] 20—3100
20—1800 20—2040
Теплота образования—ДН°ам, [451] [451] [451] [451]
ккал/моль — 1 — < — 52
[483|
Микротвердость (30 г), кг'мм2 Электросопротивление (25°), — — — 2530 [362]
— — 100 [453] — 68 [453]
Теплопроводн ость,квл/с-м-гряд Термический коэффициент — — 0,026(4]
электросопротивления а 10з +0,85
(—80+23°С), %/град — — — —
[225]
Термоэмиссионпые свойства А, а/см2 • град2 • 10 [196]
ср, Эв .......... Коэффициент лучеиспускания — — — 2,89 [196] 0,70 [196]
при Х= 0,655 р. —— — 1 —
Энтропия S°t98, кал/моль -град I _ — 13,9*
Температура перехода в сверх- ! < 1,32 <1,32 <1,32
проводящее состояние, °К . . — —
1 [490] [490] [490]
* См- сноску к табл. 82
Бориды хрома
285
По отношению к действию кислот ТаВ2 несколько устойчивее
диборида ниобия: соляная, азотная кислоты и царская водка на
него не действуют, серная кислота в смеси с соляной медленно
разлагает его только гри нагревании. Щелочами он разлагается
быстро, кислородом воздуха окисляется быстрее, начиная с более
низких температур, чем борид ниобия {450]. Борид тантала ТаВ
в термодинамическом отношении прочнее борида вольфрама
\V2B, а борид ТаВ2 и карбид ТаС прочнее борида ТаВ [462].
Бориды хрома
По данным Кисслинга [458, 461], хром с бором образует пять
боридных фаз: § (Cr2B), е(Сг3В2), ? (СгВ), у (Сг3В4) и Я (СгВ2).
Берто и Блюм [491] указывают еще одну фазу — Сг4В, а также
фазу Сг5В3, повидимому, идентичную s-фазе Кисслинга.
Борид Сг4В кристаллизуется в ромбической системе (псевдо-
гексагональиая структура) и изоморфен бориду Мп4В. Число
молекул в элементарной ячейке 4, кратчайшие расстояния
Сг—Сг 2,54 кХ и Сг — В 2,18 кХ. Сг2В [33% (атомн.) В] кри-
сталлизуется в форме тонких пластинок шестиугольной формы,
его тетрагональная решетка построена по типу Fe2B (тип СиА12).
Расстояния Сг—Сг и Сг—В соответственно составляют 2,44 и
2,21 кХ. Андерсон и Кисслинг [460] приписывают бориду Сг2В
ромбическую решетку.
СгВ и Сг3В4 имеют также ромбические решетки, СгВ2 —
гексагональную, а структура Сг3В2, если принять ее тождествен-
ной фазе Сг5В3 Берто и Блюма, — тетрагональную с четырьмя
молекулами в элементарной ячейке.
Атомы бора в Сг3В2 (Сг5В3) занимают «призматические» поры
при расположении шести ближайших атомов хрома в вершинах
тригональной призмы (как в СгВ, MnB, FeB и СоВ), а поры, со-
держащие атомы бора, находятся внутри деформированной анти-
призмы, как в боридах типа Л1е2В. Таким образом, Берто и
Блюм [491] предлагают рассматривать этот борид как комбина-
цию структур Л4еВ + 2Ме2В. Кратчайшие расстояния в этой ре-
шетке составляют: Сг—Ст 2,57 кХ\ Ст—В (призма) 2,26 кХ и
Ст—В (тетраэдр) 2,29 кХ, т. е. они значительно менее плотны,
чем решетки Сг4В и Сг2В.
Из всех этих фаз устойчивы до температур плавления только
СгВ (2000°) и СгВ2 (1900°).
Шварцкопф и Глазер [451] указывают на существование еще
одной фазы Сг2В5, изоморфной Ti2B5, V2B5, W2B5.
Борид хрома Сг3В2 очень устойчив по отношению к плави-
ковой, соляной и серной кислотам. В противоположность боль-
шинству других боридов он не поддается действию азотной кис-
лоты, а также весьма устойчив против действия растворов щело-
$86 Бориды
чей, разлагается только расплавленными щелочами; перекиси
действуют на бориды хрома гораздо медленнее, чем на бориды
других переходных металлов. С другой стороны, Андрие и Ма-
рион [492] указывают, что все бориды хрома имеют практически
одни и те же химические свойства: они противостоят действию
азотной кислоты, но легко разлагаются в расплавленных щёло-
чах, причем близость химических свойств затрудняет их разде-
ление. Бориды хрома (главным образом СгВ2) относятся к наи-
более окалиностойким соединениям [122].
При обработке в токе аммиака [451, 399] происходит разло-
жение боридов хрома с образованием нитрида хрома и нитрида
бора. При этом наиболее стойким также является СгВ2.
Основные свойства боридов хрома сведены в табл. 88.
Бориды молибдена
Система Мо—В исследована неоднократно [459, 493, 494, 495];
в ней установлены и изучены шесть боридных фаз: Мо2В, Мо3В2,
«- и р-МоВ, МоВ2 и Мо2Вб.
Рис. 160. Диаграмма состояний системы Мо—В
Ориентировочная диаграмма состояний системы Мо—В [494]
представлена на рис. 160.
Растворимость бора в молибдене мала, так как уже сплавы,
содержащие менее 1 % В, обнаруживают наличие борида Мо2В.
Мо2В имеет тетрагональную структуру и изоморфен W2B, Fe2B,
Таблица 88'
Свойства боридов хрома
Свойство Бориды
CrjB Сг2в Сг2В СгзВз= = Сг3В2(?) СгВ СгзВ| СгВз CrgBg
Содержание бора, % . . . 4,94 9.45 9,45 11,1 17,25 21,72 29,55 34.2
Структура . Ромбич. Ромбич. Тетраг. Тетраг. Ромбич. Ромбич. Гексаг. Ромбич.
Периоды решетки, кХ: [491] [458] [491] [491] [458] [458] [458] [451]
а 4,26 [491] 4,7 [458] 5,185 [401] 5,46[491] 2,969 [458] 2,984 [458] 2,969[458] —
ь 7,38 [491] 7,34 [458] — 7,858 [458] 13,02[458] [458] —
с ........... . 14,71[491] 4,29 [458] 4,31 [491] 10,64 [491] 2,932 [458] 2,954 [458] 3,066[458] —
с/а . . . Плотность, г/см3: — — 0,832 [491] 1,945 [491] — 1,032[458] —
расчетная . 6,24 — 6,53 6,12 6,11 — 5,6 —
экспериментальная .... — — —— 6,13 [491] 6,05[458] — 5,6 [458] —
Температура плавления, °C Область температурной — — — 1960150 [31] 2000+50 [451] 1900+50 [451] 2000 + 150- [451]
устойчивости, °C — 20—1625 [451] 20—1200 [451] — 20—2000 [451] 20+2000 [451] 20—1850 [451] 1400—2000 [451]
Ми кротвердость (100 г), кг]мм2 Удельное электросопро- —- + 9* 8,5* — 1800 —
тивление (25°), мком - см . . Теплота образования — — —. — 64 [453] — 21 [453] —
—Д//298, ккал!моль Энтропия — — — — — — 30 [483] —
кал!моль • град ....... — — —- 5,8* — 9,4* —
Модуль упругости, кг/мм2 — — — — — 21500 [616] —
* См- сноску к табл. Р2-
288
Бориды
С02В и Ni2B. При 2000° он перитектоидно разлагается с обра-
зованием МозВ2, плавящегося, в свою очередь, при 2060°.
Борид МоВ, гомогенный в пределах МоВ 0,95— МоВ 1.об и
имеющий тетрагональную решетку, переходит при 2000° в высоко-
температурную модификацию P-МоВ, изоморфную СгВ. Темпе-
ратура плавления МоВ 2180°. Эвтектика с 14% В имеет точку
плавления 2060°. Фаза Мо2В5, имеющая дефицит бора (19,5—
20,8%' В против 22% по формуле Мо2В5), представляет собой
дефектную структуру идеального состава Мо2В5. При 1600° она
Рис. 161. Диффузионный слой борида на молибдене
(твердофазная ванна)
переходит в другую модификацию со структурой диборида МоВ2,
плавящегося при 2100°.
В одной из последних работ по этой системе [495] значения
температур плавления фаз уточнены и составляют: для Мо2В —
инконгруэнтное плавление 2097—2142° (вместо 2060); для
Мо3В2 2221—2266° (вместо 2070°) и МоВ 2325—2374° (вместо
2180° по [494]).
При диффузии бора в молибден из твердофазной ванны в по-
верхностном слое рентгенографически удается установить нали-
чие борида Мо2В (рис. 161), энергия активации при реактивной
диффузии бора в молибден составляет 12 200 кал/г-атом по срав-
нению с 17 200 кал/г-атом для диффузии бора в вольфрам, свя-
занной с образованием W2B, что связывается с более низким
энергетическим уровнем незаполненной d-электронной полосы
молибдена, чем вольфрама [496].
При электролитическом борировании молибдена из расплав-
ленной ванны [497], состоящей из 33% НВО2 и 67%; NaF (ре-
Бориды молибдена
289
жим: катодная плотность тока 9,6 а/см2, напряжение И в, темпе-
ратура 950—1200°, время 1—2 часа), образуются два слоя —
внешний, имеющий твердость 2650 кг/мм2, и внутренний с твер-
достью 1686 кг/мм2, граничащий с чистым молибденом (твер-
дость 232 кг/мм2) (рис. 162).
Толщина внутреннего слоя мало зависит от температуры и
времени, изменяясь с ~ 8 у. при 980° до 16 у при 1100° (при на-
сыщении в продолжение 1 часа) и с 7 до 12 у. при увеличении
времени насыщения от 20 до 130 мин. (при 1050°). Напротив,
Рис. 162. Диффузионные слои боридов на молиб-
дене, образующиеся при электролитическом ?бори-
ровании из расплавленной смеси 33% НВО2 + 67%
NaF (9,6 о/с.и2, 11 в, 90 мин., 1200°), травлено элек-
тролитически смесью HF—СгН5ОН (1:5). Х500:
а —внешний слой; 0 —внутренний слой; в — молибден
внешний слой растет быстрее; толщина его при насыщении в те-
чение 1 часа при 980° составляет около 40 у.
Борид М02В не разлагается соляной кислотой, легко раство-
ряется азотной кислотой даже на холоду. Серной кислотой раз-
лагается при нагревании. Быстро разлагается расплавленными
щелочами. По отношению к кислороду воздуха неустойчив: пол-
ностью окисляется при 1000° в продолжение 16 час. М02В5 зна-
чительно более устойчив: за 100 часов увеличение веса вследст-
вие окисления на воздухе составляет только 20%'. МоВ имеет
промежуточную устойчивость против окисления: между Мо2В и
Мо2В5 [494]. Основные свойства боридов молибдена приведены в
табл. 89.
19 г. В. Самсонов
Свойства боридов молибдена
Таблица W
Свойство Борид
М02В М03В2 а-МоВ р-МоВ МеВ2 МбгВд
Содержание бора, % . 5,3 7,0 10,1 10,1 18,4 22,0
Структура Тетраг. Не опреде- Тетраг. Ромбич. Гексаг. Ромбоэдр.
[459] лена [494] [494] 3,16[494] [498] [459]
Периоды решетки, кХ:
а ; 5,543(459] __ 3,110 (494] 3,05[498] 3,011 [459]
ь __ —- —— 8,61[494] —
с • 4,735 .— 16,95 [494] 3,08 [494] 3,113[498] 20,93(459]
с/а Плотность г/см*; 0,854 3,45 [494] 1,020 [498] 6,97 [459]
расчетная 9,31 — 8,77 — 7.78 7,48
экспериментальная 9,10 [494] — 8,2—8,3 [494] — — 8,01 [494]
Температура плавления, °C Область температурной устойчивости, °C . . 2142 [495] 2240(495] 2350[495| 2100 [451] 2100[493]
20—2050 1850—2070 20—2180 2000—2180 1600—2000 20—1600
[451] [451] [4^1] [451] [451] [451]
Мнкротвердость (50 г), кг/мм2 Удельное электросопротивление (20—2000°). 2500 [453] 2350[494] 2500[494] 1200 [494] 45[494] 2350 [494] 25 [494]
40[453] — 45[494] 25 [494]
Предел прочности при разрыве, кг/мм* . . — ’— — 37,2—93,0 [455] (при 1100°)
Температура перехода в сверхпроводящее состояние, °К — 4,40[490] — — < 1,32 [490]
Теплота образования—Д/72Э8, ккал/моль . 25,5[483] 42,0[483] 16,3 (483] — 23,0(483] 50 [483]
Энтропия S°g8, кал/моль • град — — •— 12,21* —
* См. сноску к табл. 82.
Ёориды вольфрама
291
Бориды вольфрама
При рентгенографическом исследовании системы W—В пер-
воначально были обнаружены три борида — тетрагональные
W2B и WB, а также гексагональный W2B5 [459]. Позднейшими
исследованиями установлена еще высокотемпературная модифи-
кация мйноборида вольфрама p-WB [453, 481].
Борид W2B (у-фаза Кисслинга), изоморфный Мо2В, С02В и
Ni2B, устойчив от комнатной температуры до 1900°. Пределы од-
нородности фазы W2B очень узки. При действии на W2B титана,
тантала и циркония образуются более прочные бориды этих ме-
таллов. С углеродом при 1990° образуются WB и WC [462].
WB (8 -фаза) обладает более широкими пределами однород-
ности от 48 до 51% (атомн.) В (WBo,92-1.02), при 1850—
I9600 превращается в высокотемпературную p-модификацию с
ромбической решеткой (изоморфна СгВ).
W2B5 (е-фаза) устойчива до температуры плавления (2300°)
и в обычном, дефектном состоянии гомогенна в пределах от 66,7
до 68,0% (атомн.) В (WB 2,00-2.12),' идеальное содержание бо-
ра 71,4%' (атомн.).
Период решетки а в этих пределах возрастает от 2,982 до
2,984 кХ. Очевидно, эта фаза имеет дефектную структуру иде-
ального состава W2B5. По данным Бревера [462], W2B5 начинает
разлагаться уже при 1700° и полностью разлагается при 1810°.
Имеются, однако, и противоположные наблюдения. По Глазеру
[453], W2B5 плавится без разложения при 2980° и устойчив в кон-
такте с углеродом до 2000°.
Точки плавления эвтектик между этими боридами (W2B—WB
и WB—W2B5) лежат выше 2000°.
Халла и Тури [465] алюминотермическим путем получили бо-
рид химического состава WB2, рентгенограмма которого была
проиндицирована в гексагональной системе. Однако он был
сильно загрязнен окисью алюминия и другими примесями. По-
этому полученные результаты вызывают серьезные сомнения:
однако возможно, что WB2, как и М0В2, является продуктом высо-
котемпературного превращения W2B5, тем более, что, по данным
Бревера [462], W2B5 разлагается в атмосфере аргона уже при
1810°, a WB—при 2040°.
Химическая стойкость исследована только для борида WB, на
который соляная кислота не действует, серная и азотная кисло-
ты растворяют только при нагревании, царская водка (особенно
в присутствии HF) легко растворяет WB на холоду. При обработ-
ке WB аммиаком при 850—1100° образуются смеси нитридов воль-
фрама и бора [60]. Кислородом воздуха борид W2B5 начинает окис-
ляться уже при сравнительно низких температурах; окисление
идет быстрее, чем всех остальных боридов IV, V и VI групп.
Свойства боридов вольфрама приведены в табл. 90.
19*
Таблица 99
Свойства боридов вольфрама
Свойство Бориды Л
W2B a-WB 0-WB WB2 w2B5
2,86 5,56 5,56 10,55 12,81
Структура Периоды решетки, кХ: Тетраг. [459] Тетраг. [459] Ромбич. [459]. Гексаг. [465] Гексаг. [459]
а 5,564 [459] 3,115[459] 3,19 [459] 6,35 [465] 8,24 [465] 2,982 [459]
ь . . . . • — — 8,40 — —
с 4,740[459] 16,92 [459] 3,07 16,4 [465] 15,6[465] 13,87(465]
с'а Плотность, г/см3: .............. 0,852 [459] 5,45 [459] — 2,58 [465] 2,53 [465] 4,65[465]
расчетная 10,72 — 16,0 — 13,6 13,1
экспериментальная 16,0[459] — 15,3[459] — 13 [465] 11,0[465]
Температура плавления, °C 2770 ±80 [3| 2400+100 [451] — — 2300x50 (451|
Область температурной устойчивости, °C . . . 20—1900 [451] 20—2400 [451] 1950—2400 [451] 20—2300 [451]
Теплота образования—ДН298, ккал/моль . . . 20 до 28 [483] 12 до 22 [483] — — 20 до 45 [483]
Микротвердость (30 г), кг/мм3 — —— 2660[362]
Удельное электросопротивление (25°С), мксм- см —— — — ~21 [453]
Энтропия <$298, кал'моль град — — — — 28,3*
* См- сноску к табл. Р2>
Бориды железа
293
Бориды марганца
С марганцем бор образует четыре борида — 4Мп4В, Мп2В, МпВ
и Мп3В4. Мп4В (8-фаза) имеет орторомбическую решетку и
изоморфен бориду хрома Сг4В. Борид Мп2В (е-фаза) изомор-
фен Fe2B (тетрагональная решетка). МпВ (S-фаза) имеет ром-
бическую решетку с периодами: а = 2,95, 6 = 11,5 и с = 4,10 кХ,
кратчайшие расстояния Мп—В 2,1 кХ и Мп—Мп 2,3 кХ, он об-
ладает высокой способностью к намагничиванию. Борид МпзВ4
(т]-фаза) изоморфен бориду тантала Та3В4 (ромбическая решет-
ка). Рентгеновское исследование этой системы проведено Кис-
слингом [499]. По данным Андрие [469], бориды марганца легко
разлагаются не только кислотами, но даже горячей водой. При
действии соляной кислоты они разлагаются с образованием
МпС12 и Н3ВО3.
Бориды других металлов VII группы совершенно не изучены.
Бориды железа
Система Fe—В и свойства боридов железа были исследованы
в ряде работ [501—504], результаты которых в несколько идеа-
лизированном виде пред-
ставлены на рис. 163
[231].
Установлено существо-
вание двух боридов желе-
за: Fe2B и FeB.
Борид Fe2B [8,84%
В] плавится при 1389°
и обладает тетрагональ-
ной пространственно-цент-
рированной решеткой (с
четырьмя группами Fe2B
в элементарной ячейке) с
периодами: а = 5,109 и
с = 4,249 кХ-, а/с = 0,842.
Борид FeB [16,25% В]
плавится при 1540°, обла-
дает ромбической струк-
турой с четырьмя молеку-
лами FeB в элементар-
ной ячейке с периодами:
а =4,053, 6 = 5,495 и
Рис 163. Диаграмма состояний системы
Fe—В
<- = 2,946 кХ. Кисслинг [499] сообщает другие данные для пе-
риодов решетки FeB: а = 5,506, b = 2,592 и с = 4,061 кХ.
При 1135е a-FeB превращается в высокотемпературную мо-
дификацию P-FeB. Борид FeB весьма устойчив в термодинами-
ческом отношении.
294
Бориды
Участок диаграммы Fe — Fe2B недавно подробно исследован
вновь [53].
Получить бориды железа углеродным восстановлением сме-
сей В2О3 + Fe2O3 и силикотермическим методом невозможно, так
как в первом случае сплавы загрязняются углеродом (в форме
карбидов бора и железа), во втором — кремнием. Несколько
лучшие результаты дает восстановление углеродом смеси бората
кальция с железом [505]:
4СаО 5B2O3 + 10Fe +27С = 10 FeB 4- 4СаС2 + 19 СО,
а также алюминотермическое восстановление.
Бориды железа получают также электролизом расплавленной
смеси борного ангидрида, окислов железа и соответствующих
флюсов [506] при 1300—1400°. Содержание углерода и кремния
Не превышает при этом 0,2—0,5%'.
Наиболее чистые бориды железа образуются при нагревании
порошков железа и бора при 1300—1400° в инертной атмосфере
при повышенном давлении.
Бориды кобальта
Система Со—В подобна системе Fe—В и исследовалась Ке-
стером и Мюльфингером [507], а, затем, более детально,
Н. П. Чижевским и Б. А. Шмалевым [508]. Установлено наличие
двух боридов кобальта: Со2В и СоВ. Участок диаграммы состоя-
ний системы Со—В показан на рис. 164 [508].
Борид Со2В (8,41% В) плавится при 1265°. Эта фаза пара-
магнитна, точка Кюри 510°. Твердость очень высока, достигает
90 /?А. Решетка тетрагональная, типа Fe2B, с периодами:
«'=*5,016 кХ, с = 4,220 кХ, с/а = 0,893, с четырьмя молекулами
в элементарной ячейке.
Борид СоВ (15,51% В) изоморфен FeB.
Бориды никеля
Рентгеновское исследование системы Ni—В проведено Кис-
слингом [461]; при этом обнаружены пять интерметаллических
фаз: Ni3B (7), Ni2B (8), Ni3B2 (в), NiB (С) и, повидимому, Ni2B3.
На рис. 165 показана ориентировочная диаграмма состояний
участка системы Ni—В в пределах от 0 до 25% В.
Структура Ni3B, изоморфного соответствующим боридам нио-
бия и тантала, однозначно не определена.
Борид Ni2B (8,44% В), имеющий тетрагональную центриро-
ванную решетку с периодами: «=4,993 и с=4,249 кХ, с/а=0,851,
плавится при 1230°.
Борид Ni3B2, (е-фаза с 10,94% В) изоморфен Сг3В2 (те-
трагональная решетка), борид NiB ($-фаза) с ромбической
Рис. 164. Диаграмма состояний системы Со—В
Рис. 165. Диаграмма состояний системы N1—В
2S6
Бориды
структурой — изоморфен СгВ и ТаВ. Периоды решетки NiB по
данным Блюма [509] составляют: а=2,925, 6=7,396 и с=2,966 кХ.
Элементарная ячейка содержит 4 молекулы NiB, расчетная плот-
ность 7,13 г/см3. При 1050° а-модификация Ni3B2 превращается
с поглощением тепла в ₽ -форму.
Сплавы боридов
Системы борид — борид
Системы с непрерывными рядами твердых растворов
И. И, Корнилов [427] в уточненном виде сформулировал сле-
дующие известные условия изоморфизма, необходимые для обра-
зования непрерывных рядов твердых растворов между интерме-
таллическими соединениями: однотипность кристаллической ре-
шетки, атомное сходство компонентов, участвующих в образова-
нии соединений, одинаковый тип химической связи, наличие в
соединениях одного и того же элемента, одинаковый стехиомет-
рический состав соединений и образование непрерывного ряда
твердых растворов между металлами, образующими соединения.
Проведенный Р. Б. Котельниковым анализ этих, условий в при-
менении к соединениям типа фаз внедрения, показал, что необхо-
димым и достаточны^.для образования между ними непрерыв-
ных рядов твердых растворов является: изоморфность соедине-
ний, одинаковый тип химической связи и образование непрерыв-
ных рядов твердых растворов между металлами, входящими в
соединения.
Как было показано выше, структуры боридов переходных ме-
таллов весьма разнообразны и включают 5 сингоний и более 15
структурных типов, из которых основными являются типы Cu2A1
ТаВ и А1В2.
Если рассматривать только эти три главнейших типа, то мож-
но сделать вывод, что условия образования непрерывных рядов
твердых растворов соблюдаются для систем (рис. 166):
Ti2B—Та2В, CraB—Ti2B, МоаВ—Ti,B, Мо2В—Cr2B,| W2B-«.Ta2B,
W2B—Cr2B, W2B—Mo2B,^Fe2B—Mn„B, Fe2B—Cr2B, Co,В—Mn2B,
Co2B—Fe2B, Ni2B—Mn,B, Ni2B—Fe,B, NiaB—Co2B, NbB—VB,
TaB—VB, TaB—NbB, CrB—VB, MoB—VB, MoB—NbB, VB—WB,
WB—NbB, WB—TaB, WB—CrB, WB—MoB, MoB—CrB, ZrB2 —
TiB2, HfB2 — TiB„, HfBa —ZrB2, VB,—TiB2, VB,—HfB2, NbB2—
TiB2, NbB,—ZrB2, NbB2— HfB2, NbB2—VB„ TaB,—TiB,, TaB2—
ZrB2, TaB2—HfB2, TaB,—VB,, TaB2—NbB2, CrB,—TiB2, CrB2—
VB2, MoB„—TiB2, MoB2—HfB2, MoB2—VB„ MoB2—NbB„ MoB2—
CrB2.
Экспериментально установлено наличие непрерывных рядов
твердых растворов в системах Fe2B—Мп2В [449], Со2В—Мп2В
[449], Со2В—Fe2B [449], CrB—МоВ [449], ZrB2—TiB2, [510,
Сплавы боридов
297
511, 512], NbB2—TiB2 [513], ТаВ2—ZrB2 [510] и ряде других
(см. стр. 306).
Сплавы большинства систем готовили спеканием смесей
исходных порошков методом горячего прессования при высоких
температурах с последующим отжигом.
ff
Рис. 166. Возможность образо-
вания непрерывных рядов твер-
дых растворов изоморфных бо-
ридов переходных металлов (по
Котельникову):
а — бориды со структурой А'2Си
(Jj’mcm); б — бориды со структурой
ТаВ (Стет)-, в —бориды со струк-
турой А1 В2 (С^ттт)
А—вероятно образование непре-
рывного ряда твердых растворов:
Б — вероятна ограниченная раство-
римость
Система TiB2—ZrB2 была изучена Г. А. Меерсоном,
Г. В. Самсоновым и Р. Б. Котельниковым [510, 511] методами
рентгеноанализа, металлографического анализа, измерения мик-
ротвердости, электросопротивления и коррозионной устойчиво-
сти. Результаты исследования показаны на сводном графике
298
Бориды
рис. 167, из которого следует, что все свойства сплавов изменя-
ются с составом по непрерывным плавным линиям; электросо-
противление и микротвердость имеют максимумы: наибольшее
значение микротвердости 4170 кг 1мм1 при содержании в сплаве
10%, (вес.) ZrBg.
Рис. 167. Зависимость свойств системы TiB2 — ZrB2 от
состава
Борид циркония значительно более устойчив относительно
коррозии в смеси концентрированных соляной и азотной кислот,
чем борид титана.
Сплавы боридов
29Э
Глазер и Иваник [512], а также Шедлер [4] исследовали ту-
же систему методами рентгеновского анализа, при одновремен-
ном определении электропроводности и температур плавления
(рис. 168 и 169). Максимум электросопротивления соответствует
примерно 50% (вес.) TiB2 и составляет около 34 мком • см. Рент-
генографическое исследование гомогенизации твердых растворов
TiB2—ZrB2 показало, что сокращение времени гомогенизации с
ростом температуры нагревания смесей TiB2+ZrB2 подчиняется
экспоненциальному закону:
Темпера-
тура, °C
1400
1500
1900
2400
рис. 168. Кривая плавкости си-
стемы Т1В-2—ZrB»
Время гомогени-
зации. час-
15
5
2,5
0,5
Определенная из этих данных энергия активации составляет
около 42 000 кал/моль, что близко к энергии активации, обычно
наблюдаемой при взаимной диф-
фузии металлов с температурами
плавления, близкими к титану и
цирконию. Отсюда Глазер и Ива-
ник сделали вывод о том, что при
Диффузии в системе TiB2—ZrB2 перемещаются только металличе-
ские атомы, а атомы бора, находящиеся в борных сетках, оста-
ются неподвижными.
Система TiB2—NbB2 была исследована Г. В. Самсоновым и
В. С. Нешпором [617] методами микроструктурного и рентгенов-
ского анализа с измерением микротвердости, электросопротивле-
ния и стойкости образцов против окисления на воздухе. Данные
еб изменении микротвердости и ряда других характеристик
сплавов с составом приведены в табл. 91.
SOO
Бориды
Таблица 91
Зависимость свойств сплавов NbB.—Т1В3 от состава
Состав. % (мол ) Периоды решетки, кХ Микро- твердость, Предел прочности при хруп ком раз- рушении, кг/м *2 Удельная электро- провод- ность. ом~[*см~^ Средняя крупность зерен шлифа И
NbB3 TiB3 а С с/а
100 0 3,058 3,270 1,070 2250 70 . 20900 16,3
90 10 — —
80 20 — — 2382 113 — —
75 25 3,044 3,260 1,072 __ 18300 5,8
70 30 — — — 2325 115
62,5 37,5 3,046 3,251 1,069 — — 17000 6,4
60 40 — ___ 2411 79 •
50 50 3,056 3,240 0,060 . 2912 139 18000 8,0
40 60 — — — 2850 86 — —
37,5 62,5 3,053 3,250 1,070 3737 34800 11,5
30 70 — — 36С0
25 75 3,028 3,250 1,072 3737 49 35000 13,3
20 80 —— — 3560 79 —
10 90 — — — 3300 57 — —
0 100 3,0275 3,250 1,070 3367 102 71000 46,8
Максимум твердости, составляющий примерно 3700 кг/мм*-,
отвечает сплавам, содержащим 60—70% (мол.) TiB?, а макси-
мум прочности при хрупком разрушении сдвинут в сторону NbB?
и составляет около 120 кг/мм2 (табл. 91).
Изменения периодов решетки и их отношений незначительны
и выражаются графически прямыми, почти параллельными оси
составов (рис. 170).
Зависимость электропроводности от состава выражается плав-
ной линией, характерной для непрерывного ряда твердых рас-
творов с минимумом при 60% (мол.) NbB?.
Растворение борида титана в бориде ниобия сопровождает-
ся уменьшением периодов решетки твердого раствора (рис. 171).
Минимальное значение периода решетки твердого раствора
достигается при 1800° за 4 часа, при 1600° за 8 час. и при 1400°
за 18 час. выдержки, после чего вновь начинается увеличение пе-
риода. С понижением температуры нагревания минимальное зна-
чение периода решетки сдвигается в сторону больших величин.
Такой характер изменения периодов кристаллической решетки
твердого раствора, повидимому, свидетельствует о том, что при
диффузионном образовании твердого раствора изоморфных бо-
Рис. 170. Зависимость
свойств сплавов системы
NbB2—Т1В2 от состава
Рис. 171. Зависимость
периода решетки твер-
дого раствора борида
титана в бориде ниобия
от температур и времени
выдержки
302
Бориды
ридов сосуществуют два процесса, оказывающие противополож-
ное влияние на изменение размеров элементарной ячейки. Одним
из этих процессов является перемещение атомов металла и бора
с образованием твердого раствора на основе решетки борида
ниобия, приводящее к уменьшению периодов решетки. Вторым
процессом является миграция атомов бора и уход части из них
из узлов в решетке твердого раствора. Это приводит к некото-
рому увеличению углов между борными связями и увеличению
размеров кристаллической ячейки, что согласуется со взглядами
Кисслинга.
Начальная стадия гомогенизации характеризуется большим
градиентом концентрации и значительной скоростью диффузионл
ного процесса. Вследствие этого процесс диффузионного переме-
щения атомов является преобладающим и наблюдается уменьше-
ние периодов решетки твердого раствора. С течением времени,
по мере уменьшения градиента концентрации, скорость диффу-
зионного процесса уменьшается и преобладающее влияние на
изменение размеров ячейки начинает оказывать процесс мигра-
ции борных атомов, связанный с увеличением периода. При сни-
жении температуры влияние второго процесса становится более
ощутимым п минимум на кривой период решетки — время вы-
держки достигается при больших значениях периодов решетки.
Энергия активации при диффузионном образовании, твердого
раствора NbB2—TiB2 оказалась равной 26 800 кал/моль-, сопо-
ставляя эту величину для энергии активации при диффузии в
(системе TiB2—ZrB2 (42 000 кал/моль), можно заключить, что
основная роль при диффузии в решетках боридов принадлежит
металлическим атомам, т. е. диффузия в боридных системах под-
чиняется общей закономерности диффузии в металлах, что еще
раз подчеркивает металлический характер связей в кристалличе-
ских решетках боридов.
Однако предположение «неподвижности» борных атомов, сде-
ланное Глазером и Иваником [512], является, повидимому, не-
правильным, так как в процессе диффузии атомы бора, наряду с
металлическими, входят в состав атомного комплекса, совер-
шающего элементарный акт в решетках боридов [515].
Металлографическое исследование сплавов NbB2—TiB2 пока-
зало, что с повышением содержания в них NbB2 зерна измель-
чаются (рис. 172 и табл. 91). Аналогичное явление наблюдается
и во всех других случаях образования твердых растворов бори-
дов с различной прочностью связи. С повышением прочности свя-
зи в боридах их структура укрупняется, соответственно и струк-
тура сплавов боридов с разной прочностью связи исходных ком-
понентов представляет переходную картину — зерна измельча-
ются по мере обогащения сплавов боридом с менее прочной свя-
зью. Причина этого, повидимому, заключается в осложненное™
и б
в г
д е
Рис. 172. Микроструктуры сплавов системы Т1В2—NbB>. х 600; травле-
ние HNO, + Na2SiF„ [617J:
а~ I00"s NbB2; б—сплав 20%TiBa + 80% NbB2; в —сплав 30% TiB2 4- 7 0% NbBj;
’ - сплав 50% TiB2 -|-5 0%NbB4; д - сплав 90% TiBa + 104 NbBa;“e — 1 00% TiB2
304
Бориды
диффузионного перемещения атомов в решетках более прочных
боридов. Диффузионные процессы при спекании и отжиге лока-
лизуются при этом в сравнительно небольшом числе центров,
где флюктуации создают достаточную для атомных переходов
энергию. Из этих центров начинается рост кристаллитов при
спекании. Очевидно, что чем меньше таких «центров кристалли-
зации», тем зерна спеченного
борида крупнее. По мере до-
бавления к нему борида с
меньшей прочностью кристал-
лической решетки число «цент-
ров кристаллизации» увеличи-
вается, вследствие чего струк-
тура измельчается.
Система ZrB2—ТаВ2 изуча-
лась Самсоновым и Цейтиной
[511] методами рентгеновского
и металлографического анализа
с измерением микротвердости
и электросопротивления. Все
сплавы этой системы имеют
однофазную структуру. Микро-
твердость сплавов изменяется
непрерывно с изменением кон-
центрации боридов (рис. 173,
табл. 92). Также непрерывно
изменяется значение периодов
решетки и отношение с/а.
Кривая электропроводность—
состав имеет невысокий мини-
мум, приблизительно совпадаю-
щий с максимумом микротвер-
дости.
Система МоВ—СгВ, как
установлено Штейницем [516],
2гВ2,%(мол.)
Рис. 173. Зависимость свойств спла-
вов системы ТаВг—ZrB2 от состава
также дает непрерывный ряд
твердых растворов. Так, образцы из смесей МоВ : СгВ, составлен-
ные в соотношении 1 : 1 и спеченные при 1500°, обнаружили ли-
нии только структуры СгВ, откуда и было сделано заключение о
существовании фазы ^-МоВ.
Системы Fe2B—Mn2B, Со2В—Мп2В и Со8В—Fe2B исследо-
вали Хэгг и Кисслинг [449]. На рис. 174 показано изменение пе-
риода решетки а и объемов элементарной ячейки с изменением
состава этих трех систем.
Ряд взаимных боридных систем исследовали также Пост,
Глазер и Москович [132]. Исходные бориды приготовляли соеди-
Сплавы боридов
305
Таблица 92
Зависимость свойств сплавов системы ТаВ3—ZrB2
от состава
Состав, % (мол.) Периоды решетки, кХ Средняя крупность зерен шлифа, р- Микро- твердость KZjMM2 Электро- сопротив- ление МКОМ, см
ТаВ2 ZrB2 а С cja
100 0 3,053 3,266 1,070 16,0 2537 52
75 25 3,082 3,289 1,065 6,5 3374 50—68
62,5 37,5 3,089 3,300 1,068 6,6 2650 58
50 50 3,112 3,320 1,067 7,1 1965 58—60
37,5 62,5 3,116 3,353 1,080 8,2 1936
25 75 3,125 3,375 1,080 8,0 1961 48
0 100 3,172 3,486 1,100 50,6 2,131 33
нением соответствующих металлов с бором. Образцы сплавов по-
лучали горячим прессованием в атмосфере гелия. Степень взаим-
ной растворимости устанавливали рентгенографически для раз-
Рис. 174. Изменение значения периода (а) и объема ячейки
ромбической решетки (б) с изменением состава твердого
раствора (Меь Ме^ В
ных температур спекания образцов. Полученные при этом резуль-
таты приведены в табл. 93, в которой также указана разность
эффективных радиусов металлов соответствующих боридов.
Как следует из этих данных, во всех случаях, когда разница
радиусов металлических атомов при одинаковой структуре бори-
дов составляла менее 15% , образовывался непрерывный ряд
твердых растворов. При Д/?>15% (системы ZrB2—VB2, ZrB2—
СгВ2^ СгВ2—HfB2) наблюдается ограниченная растворимость
20 Г. В. Самсонов
306
Бориды
Таблица 93
Взаимная растворимость диборидов
Дибориды Приблизи- тельная температура реакции, °C Разность радиусов, % S —» °- в S л 2 О _ & 2^ Дибориды Разность радиусов, % Раствори- мость, % (мол-)
ZrB2 В ZrE TiB2 J2 в МеВ, 30001100 11 100 Л1еВ2 в TiB2 в ZrB2 ZrB, 10 100
» » HfB2 зюоцоо 2 100 HfB2 „ „ 2 100
9 VB, 2500 + 200 16 0-5 VB2 „ „ 14 10—15
9 NbB2 3000 ±100 8 100 NbB2, „ 7 100
И TaB2 3000 + 100 8 100 laBg 9 » 8 100
9 СгВг 2100 + 100 17 0-5 CrB, , 14 10-15
» 9 МоВ, 2600 + 100 14 100 MoB2 „ „ 12 100
9 9 W2B5 2700+100 13 X WB2 , . 12 X
Т1В2 В TiB ZrB2 2 в МеВ2 3000+100 10 100 ЛГеВ2 в ZrB2 в TiB, TiB2 11 100
HfB2 3000+100 8 100 HfBa » v 9 100
9 VB2 2700+100 5 100 VB, „ „ 5 100
9 NbB2 3000+100 3 100 NbB,„ » 3 100
TaB2 3000 + 100 2 100 ТаВз » » 2 100
9 CrB2 2100 г ЮО 6 100 CrB2 „ „ 5 100
» 9 MoB2 2500+100 3 100 MoB2 „ „ 3 100
9 9 W2B5 2700+100 2 X WB2 . » 2 X
СгВ2 В CrB TiB, 2 в ЛТеВ, 2100 + 100 5 100 MeB2 в TiBj в CrB2 5rB, 6 100
» 9 ZrB2 2100 t100 14 10—15 ZrBa » » 17 0—5
» 9 HfB, 2500 t 100 13 5 HfB,„ „ 15 0-5
V » VB, 2000 +100 — 100 VB2 „ , 100
9 9 NbB2 2500 + 100 8 100 NbB2„ „ 8 100
9 9 ТаВг 2500+Ю0 7 100 TaB, „ „ 8 100
9 MoB2 2000+ 100 3 100 MoB2„ „ 3 100
9 ,9 w2b5 2100+100 3 X WB2 „ „ 3 X
Примечание. X —точные пределы растворимости не установлены.
компонентов. Особенно интересные результаты дало исследова-
ние сплавов в системе Мо2В5—W2Bs. Как уже отмечалось выше,
структуры этих соединений очень сходны, отличаясь только дли-
ной оси с, т. е. степенью упорядочения по этой оси. Фаза W2B5
менее упорядочена и, как оказалось при исследовании, раство-
ряет больше Mo2Bs, чем Mo2Bs растворяет W2Bs.
Аналогичные результаты были получены и в системе TiB2—
W2B6: фаза твердого раствора в сплаве, содержащем 50% (мол.)
Сплавы боридов
307
каждого компонента, имеет структуру TiB2. Это наблюдение
особенно важно в связи с возможностью существования WB2 как
высокотемпературной фазы системы W—В.
Системы с ограниченной растворимостью в твердом состоянии
Для ограниченной растворимости в твердом состоянии или
образования сложных интерметаллических соединений необходи-
мо (но недостаточно) отсутствие изоморфизма и наличие интер-
металлических соединений между металлами, образующими сое-
динения— компоненты систем. По схемам на рис. 166 к таким
системам предположительно относятся: Сг2В—Та2В, Мо2В—Та2В,
W2B—Ti2B, Mn2B—(TiaB, Ta2B,Cr2B, Mo2B,W2B), FegB—(Ti,B,
Ta2B, Mo2B, WaB), Co2B—(Ti2B, Ta2B, Cr2B, Mo2B, W2B),
Ni2B-(Ti,B, Ta2B, Cr2B, MoaB, W2B), CrB—(NbB, TaB), MoB—TaB,
CrB—(NbBJ? TaB2, ZrB2, HfB3), VB2—TiB2, MoB2-(ZrB„ TaB2),
UB2—(TiB2, ZrB, HfB2, VB2 NbB2, TaB2, CrB2, MoB2).
Кроме того, к этому типу относятся, повидимому, системы
боридов Л1<?2В,5 с диборидами МеВг.
К системам с ограниченной растворимостью в твердом со-
стоянии относятся, например, сплавы TiB2-W2B5 и ZrB2-W2Bs,
которые, по предварительным данным, построены по эвтектиче-
скому типу, а также сплавы WB-ZrB2 и MoB-ZrB2; МоВ и WB
имеют значительную растворимость в ZrB2, особенно в присут-
ствии избыточного бора [517].
Системы с образованием ограниченных твердых растворов
и химических соединений
Экспериментально установлено образование химических со-
единений в системах Мо—Ni—В, Мо—Fe—В и Мо—Со—В, пови-
димому, по разрезам М<?2В— МеВ и Ме3В4—МеВ [454]. При до-
бавлении 5—25% (вес.) Ni к боридам молибдена Мо2В и МоВ
образуется химическое соединение Mo2NiB2 с кристаллической
структурой, отличной как от Мо3В2 [518], так и от Ni3 В2 [461].
Другое химическое соединение имеет формулу Mo2NiB4 и изо-
морфно бориду хрома Сг3В4. Жидкая фаза в системе Мо—Ni—В
появляется при температуре ниже 1300°.
Аналогичные соединения Mo2FeB2, Mo2FeB4, Мо2СоВа и
Мо2СоВ4 обнаружены в системах Мо—Fe—В и Мо—Со—В, а так-
же соединение Cr2NiB4 в системе Сг—Ni—В [583].
Системы борид — карбид
В системах боридов переходных металлов с карбидами, а
также силицидами и нитридами возможность образования непре-
рывных радов твердых растворов следует считать исключенной.
2о*
308
Бориды
Это вытекает как из специфичности структур боридов^ так и из
отсутствия непрерывных рядов твердых растворов в системах В—С
[519], В—Si [520] и В—N [521], связанного в свою очередь со зна-
чительной разницей в величинах атомных радиусов В, С, Si и N.
Рентгеновским исследованием горячепрессованных образцов
из металлов, гидридов или карбидов в смесях с бором или кар-
бидом бора установлено, что при этом всегда образуются борид-
ные фазы в смесях с карбидами [15]. Как правило, соответствую-
щие реакции идут в сторону образования диборидов как термо-
динамически наиболее устойчивых, особенно в случае Ti, Zr, Nb
и Та. В системах металлов VI группы (Сг, Mo, W) с бором и
углеродом, в зависимости от количества введенного углерода,
образуются также другие боридные фазы в смеси с карбидными.
Соответствующие данные, полученные в исследовании Глазера
[453], приведены в сводной табл. 94.
Таблица 94
Отношение боридов к углероду
Металл Л1г3В Мг8В2 МеВ Л1^зВ| ЛТй'Вд 41^2^5 MeBs Л1еВ12
Ti H н У н
Zr — — — н — У — — — Н*
V — — — н —— у** — — —
Nb H H — н н у** — — — —
Та H H н н у** — — —
Cr —— У У У У У — — г~— —
Mo — У У У,У* У У — — — —
W — У — У.У* — — У — — —
Th — — — — — — — н У —
Примечание. У — устойчив в присутствии углерода, Н — неустойчив в присут-
ствии углерода-
* Устойчив только при высоких температурах (высокотемпературная модификация).
14 Разлагается при плавлении с образованием моноборида и бора-
Аналогичные данные были получены Штейницем [516] и Гла-
зером [477], установившим факт устойчивости диборидов титана
и тантала в присутствии углерода. При попытке приготовить в
графитовых тиглях монобориды TiB и ТаВ образуются соответ-
ствующие дибориды и карбиды. При взаимодействии W2B с угле-
родом по Бреверу [462] образуются WB и WC. Нельсон [522] и
Гринхауз [478] исследовали взаимодействие карбида бора с кар-
бидом титана. При 1200° всегда образуется TiB2:
2TiC+B4C=2TiBs +ЗС,
а после израсходования всего карбида при 2000° наряду с TiB2
образуется еще одна более высокая по содержанию бора фаза
Сплавы боридов
309
TiB.r (где х~12). Эта фаза, повидимому, имеет структуру бо-
рида алюминия A1Bi2.
Система TiB2—TiC исследовалась [452] на образцах порош-
ковых сплавов, получавшихся нагреванием шихт Т1О2 + В4С + С
или TiO2 + В2О3 + С.
При рентгеновском анализе этих продуктов ошибочно было
обнаружено соединение приблизительного состава Ti2BC, пред-
ставляющее собой на самом деле твердый раствор TiB—TiC.
Системы борид — нитрид
Кисслинг и Лиу [399], обрабатывая аммиаком при высоких
температурах различные бориды хрома, железа и вольфрама, об-
наружили, что происходит разложение боридов и образуются
нитриды металлов и бора. Устойчивость исходных боридов силь-
но зависит от состава и для боридов железа и хрома увеличи-
вается с повышением содержания бора в фазе.
В системе Сг—В—N азотированию аммиаком подвергались
все бориды хрома, обнаруженные в свое время Кисслингом [399]:
8 (~ Сг2В), е (Сг3В2), $ (CrB), -q (Сг3В4) и & (СгВ2).
Фазы, полученные после 10-часового азотирования, приведены
в табл. 95 (фазы, содержащие хром, перечислены в порядке
убывания концентрации хрома, нитрид бора указан последним).
Таблица 95
Результаты азотирования боридов хрома
Темпе. ратура, • °C Исходные бориды хрома
S <~Сг2В) 8 (0*8 В 2) E(CrB) tj (Cr.Bj) 9 (CrB2)
552 Сг2В CrsB2 CrB Сг3в< CrB2
735 Cr2B+CrN+BN CrdB2 CrB Cr3B4 —
800 Cr2B4-CrN4-BN Cr3Bj+CrN CrB Cr3B4 CrB2
900 — CrN+Cr2N+BN CrB+CrN Cr8B< —
954 CrN+CfjN+BN — — — CrBj
1000 CrN+Cr,N+BN CrB+CrN 4- +BN — CrB2
1050 CiN+Cr2N+BN — CrN+CrN-f- + BN CraN4-CrjB4 —
1100 — — — CrjN+BN CrB2+CrN
1180 Cr2N4-BN Cr2N+BN Cr2N+BN Cr2N+BN Cr2N+BN
Si О
Бориды
Таким образом, в порядке возрастающей устойчивости против
действия азота фазы системы Сг—В могут быть расположены в
следующий ряд: Сг2В (735°), СгзВ2 (800°), СгВ (1000°), СгзВ*
(900—1000°) и СгВ2(—1000°); стойкость против азота возрастает
с усложнением элементов структуры из атомов бора.
О системе Fe—В—N достаточно точных данных не получено
но большей устойчивостью против действия азота, повидимому,
обладает борид железа FeB (табл. 96), в структуре которого
имеются борные цепочки, в то время как в структуре Fe2B атомы
бора изолированы друг от друга.
Таблица 96
Результаты азотирования боридов железа [339]
Температура, °C Исходные борнды железа
Fe2B FeB
352 Fe2B FeB
400 ^-фаза+BN Fe2B+C + BN (?)
448 e+BN
505 e+/ + BN -
550 . /+e + BN 7' + e + BN
602 a-Fe+f'-f-e-pBN •y' + e+a-f-Fe+BN]
702 a-Fe+BN
768 a-Fe+BN a-Fe+BN
В системе W—В—N азотированию подвергались все три бо-
рида W2B, WB и W2Bs (табл. 97).
Таблица 97
Результаты азотирования боридов вольфрама [339]
Темпера- тура, °C Исходный борид вольфрама
W2B WB W2B5
700 W2B WB WB2
750 W,B WB WB2
800 w2B WB+p+BN —
850 W,B+a-W+(v+BN) a-W+WB+ft+BN) a-W—WBj+fr+BN)
900 a-W+W2B+BN a-W+(WB) + BN a-W + (WB2) + BN
1000 a-W + (W,B) + BN a-W+BN —
1100 a-W+BN a-W+BN a-W+BN
Сплавы боридов
311'
Заметное увеличение устойчивости боридов с возрастанием
числа связей бор—бор в этой системе не обнаружено, все бориды
начинают взаимодействовать с азотом при 800—900° с образова-
нием нитридов W2N (₽-фаза Кисслинга), BN, а также кубиче-
ской нитридной f-фазы системы W—N, открытой в этой же ра-
боте Кисслингом.
Система Ti—В—N исследована Самсоновым и Петраш [370]
по разрезу TiB2—TiN, в пределах от 3 до 97% (мол.) каж-
дого компонента. Образцы сплавов получали горячим прессова-
нием с последующим отжигом. Измерение температур плавле-
ния, проведенное визуально, позволило построить кривую плав-
кости для этой системы (рис. 175). Микроскопическое исследо-
вание сплавов показало, что все сплавы до дополнительного спе-
Рис. 175. Кривая плавкости системы TiB2—TIN
кания и отжига двухфазны; после отжига двухфазные спла-
вы, содержащие 3—8% (мол.) TiB2, становятся однофазными
(рис. 176), что может быть связано с растворимостью борида в
нитриде титана.
Микротвердость белой (TiB2) и желтой (TiN) фаз практиче-
ски не зависит от состава сплавов и близка к твердости соответ-
ственно TiB2 и TiN. Такие же результаты дает и рентгеновское
исследование, малая точность которого не могла дать возмож-
ности обнаружить растворимость компонентов. Последняя выяв-
ляется на кривой электросопротивление — состав (рис. 177). Тер-
мическое расширение в системе TiB2—TiN представлено на
рис. 178.
Наиболее стоек против окисления сплав, содержащий 40—
50%' TiN (рис. 179). Вероятно, этому составу отвечает наиболее
стойкая пленка бората титана, защищающая образцы. В сплавах,
содержащих большие количества борида, образующийся при
окислении борный ангидрид вызывает пузырение пленки, а в
сплавах, богатых TiN, пленка бората не является сплошной в свя-
зи с интенсивным выделением окислов азота при окислении TIN
Рис. 176. Микрофотография сплавов системы борид титана—нит-
рид титана:
а —борид титана (отожженный); б —сплав 70% (мол.) TiBj + 30% (мол.) TiN
(отожженный); в —сплав 3% (мол.) TiBt + 97% (мол.) TiN (до отжига); г —то
же, после отжига
Использование боридов в технике
313
кислородом воздуха. Сводка свойств сплавов этой системы при-
ведена в табл. 98.
Следует отметить, что в работе обнаружены признаки рас-
творимости гексагонального TiB2 в кубическом TiN и факти-
ческое отсутствие обратной растворимости TiN в TiB2, что напо-
минает такое же явление при исследовании растворимости WC в
меньшему различию в химической прочности TiB2 и TiN, чем,
например, в системе WC—TiC, область растворимости TiB2 в
TiN здесь значительно меньше.
Использование боридов в технике
Области применения боридов в технике еще не определились,
однако такие свойства некоторых боридов, как жаростойкость,
жаропрочность, высокая твердость, химическая устойчивость и
высокие термоэмиссионные свойства, уже используются.
Одним из основных свойств, определяющих применение бо-
ридов переходных металлов, является их жаростойкость и жаро-
прочность, что позволяет использовать эти бориды или их спла-
вы для изготовления деталей реактивных двигателей, подвергаю-
щихся одновременному воздействию высокой температуры и
агрессивных в химическом отношении газов [4, 455]. Так, сплав
борида хрома СгВ с 15%' Ni в качестве цемента, приготовлен-
ный горячим прессованием, устойчив против окисления до 950°,
твердость его при повышении температуры до 1000° уменьшается
только с 88,5 до 80 RA, т. е. значительно меньше, чем для спла-
вов 87% WC + 13% Со и 94% WC + 6% Со, при тех же темпера-
турах [463].
Механические свойства некоторых металлокерамических
сплавов на основе борида хрома приведены в табл. 99.
Сплавы на основе борида хрома имеют отличное сопротивле-
ние тепловому удару и высокую стойкость против окисления на
Таблица 9S
Результаты определений свойств сплавов в системе борид титана — нитрид титана
Содержание, % (мол.) Темпера- тура плав- ления, ®С Микротвердость, кг'мм2 Период решетки*> кХ Термический коэф- фициент линейного расширения Электро- сопротив- ление МКОМ- см
белая фаза желтая фаза гексагональная ре- шетка (TiBg) кубичес- кая решет- ка (TiN) а
TiB2 TiN а . 10« ±Ла
Нр. ±ВНр. Нр. ±ДНр. а С
0 100 2980 1760 70 . 4,21 9,35 0,43 65,5
3 97 — — 1790 141 — — 4,20 — — ——
5 95 — — — 1834 131 — — 4,21 — — —
8 92 ___ — 1752 144 — —— 4,20 —
10 90 3050 — —• 1890 ПО 2,954 3,206 4,19 9,20 0,42 77,5
20 80 3100 3224 454 1872 178 2,992 3,112 4,21 7,80 0,35 48,8
30 70 3040 2734 258 1774 101 2,992 3,081 4,20 7,75 0,35 47,8
40 60 3000 3140 178 1898 73 8,970 3,200 4,20 7,70 0,35 38,5
50 50 2900 3366 211 1924 117 2,990 3,130 4,18 8,10 0,35 38,0
€0 40 2870 3615 555 1928 138 2,990 3,170 4,21 6,50 0,37 30,2
70 30 2890 3083 294 1818 127 3,000 3,150 4,19 7.35 0,30 29,4
80 20 2920 3647 326 2044 117 3,010 3,170 4,21 7,71 0,34 26,0
90 10 2910 3647 326 1988 152 2,970 3,260 7,82 0,35 25,0
92 8 — — — — 3,010 3,190 — — —
95 5 — — — —. — 3,010 3,200 — — — —
97 3 — — — 3,010 3,190 — »
100 0 2930 2987 221 — —. 3,000 3,187 — 8,21 0,38 29,3
* Значения приведены для отожженных сплавов.
Ноэффициент Линейного расширенияа-10'°
<
0 10 20 30 40 Содержание Тй Рис. 178. Коэффициент термине TiB2— го
19 18 17 18 18 14 I’3 м 12 \и * to 8 9 '° 8 Л 7. * £ 6 $Ё 5 4 3 2 1<
1000
г !
1 > wt
8ГО<
'ТОО
ПВ2 10 20 30 40 51 Содержание Рис. 179. Стойкость при окислени
1 р
30 60 76 80 00 100 К,°/о(яол) скогоУрасширения в системе TiN
N
/о
>/
> / 7
/1 ь /у
У
2 3
0 80 70 80 90 TiN TIN,%(moa.) ь сплавов TiB2—Ti и на воздухе
316
Бориды
Таблица 99
Свойства некоторых сплавов на основе борида хрома
Борид Цементирующая связка Содержание цемента, % Сопротивление разрыву, кг/яи2 Твердость ra
СгВ . Ni 15 190 87,4
СгВ Ni—Си (70-30%) 15 185 86,7
СгВ Ni—Сг (60-40%) 15 174 88,1
СгВ Со 15 123 90,5
воздухе и в кислороде; привес на единицу поверхности после
100 час. окисления при 1000° составляет 2,5—3, а при 1100°
5—13 мг/см2 [455].
Борид молибдена, цементированный никелем (или соеди-
нением МогМВг), дает сплав, обладающий хорошими режущими
свойствами, не уступающими сплавам на основе карбида воль-
фрама, при меньшем удельном весе (8—9 по сравнению с 12—15
для сплавов на основе WC) и меньшей стоимости [454].
Такие сплавы уже находят применение для обработки алюми-
ния, бронзы и им подобных материалов, где заменяют быстро-
режущую сталь и обычные твердые сплавы. Кроме того, сплавы
на основе борида молибдена с никелевой связкой вследствие кор-
розионной и абразивной стойкости могут применяться в химиче-
ской промышленности (детали центрифуг, реакторов, особенно
работающих с разбавленной серной кислотой), а также для из-
готовления прессовых устройств для прессования абразивных
материалов.
Важной областью применения этих сплавов является пайка,
обеспечивающая поддержание вакуума в 10 "6 мм рт. ст.
Высокими жаростойкими свойствами обладают сплавы бори-
да циркония с 15 % Ni [455, 523]. Эти сплавы приготовляются
спеканием порошка борида циркония в смеси с цементирующим
металлом методом горячего прессования или последовательным
прессованием и спеканием до 95%’-ной плотности.
Точные размеры изделиям придаются окончательной обработ-
кой алмазными инструментами или электроискровой обработкой.
Свойства этих сплавов можно широко варьировать добавками
цветных металлов и сплавов, особенно алюминия, бронзы, цин-
ка, меди, олова и свинца. Высокая стойкость против окисления
(привес за 100 час. окисления при 1000° всего 6 мг/см2) и сопро-
тивление тепловому удару позволяют использовать эти сплавы в
качестве материала лопаток газовых турбин, сопел высокотемпе-
ратурных горелок, систем сжигания различных видов топлива и
Использование боридов в технике
317
т. п. Хорошая стойкость против действия расплавленных метал-
лов, в том числе алюминия, меди, олова, магния, а также солей,
например фтористых, обеспечивает возможность применения этих
сплавов в качестве огнеупоров для изготовления сопел устано-
вок для распыления расплавленных металлов, чехлов термопар
металлургических печей. Сплавы на основе борида циркония об-
ладают также хорошей электропроводностью (удельное электро-
сопротивление —17 мком-см), что в сочетании с высокой изно-
соустойчивостью делает их пригодными для изготовления некоь
торых типов скользящих контактов.
Время, час.
Рис. 180. Длительная горячая прочность боролитов в сравнении
с другими жаропрочными материалами
Аналогичные сплавы выпускаются в США фирмой «Боролит
Корпорейшн» под названием боролитов [524] на основе боридов
циркония («боролит I») и хрома («боролит III»). Боролиты об-
ладают высокой горячей прочностью (рис. 180), хорошей тепло- и
электропроводностью, стойкостью против окисления и тепловых
ударов, но в отношении ударной вязкости уступают литым жа-
роупорным сплавам. Особым свойством боролитов является их
устойчивость против действия расплавленных металлов, харак-
теризующаяся цифрами, приведенными в табл. 100.
Боролиты приготовляют обычно горячим прессованием с по-
следующей алмазной шлифовкой или электроэрозионной обра-
боткой до требуемых конечных размеров и форм.
Нанесение слоев боридов на стальные, молибденовые, воль-
фрамовые элементы буровых коронок позволяет резко повысить
их твердость и износоустойчивость без существенного уменьше-
ния прочности [452].
31Й
Бориды
Таблица 100
Стойкость боролита I против действия
расплавленных металлов
Металл Темпера- тура при испыта- нии, °C Продол- житель- ность испыта- ния, час- Содержание бора и циркония в металле %
начальное конечное
в Zr в Zr
Алюминий .... 800 115 0 0 Следы Следы
Олово 400 400 0 0 0 0
Латунь 90/10 . . 1100 144 0,08 0 0,097 0
Латунь 85/15 . . 1100 116 0 0 0,037 0
Латунь 80/20 . . 1100 100 Следы 0 0 0
Свинец 400 104 0 0 0 0
Медь 1100 109 0 0 0 0
Для этих же целей используется образование боридов желе-
за — хрома — титана в наплавочных сплавах [525], которые, по-
мимо твердости, придают поверхности деталей повышенную ока-
линостойкость, и нанесение боридных слоев в ряде других случа-
ев [526].
Егер [527] указывает на возможность изготовления огнеупор-
ных тиглей и других химических и окалиностойких изделий из
боридов, особенно тантала и вольфрама. Бориды циркония и тан-
тала, обладающие высокими термоэмиссионными свойствами и
низкой работой выхода, имеют значительные перспективы приме-
нения в радиотехнике [528, 529].
В химической промышленности возможно использование са-
мих боридов и боридных покрытий на различных материалах
для повышения химической стойкости аппаратуры. Имеются так-
же сведения о применении борида никеля в качестве катализа-
тора для процессов гидрирования [530].
В этом случае используется прочность кристаллической ре-
шетки борида для создания устойчивого и длительно работаю-
щего катализатора. Недавно сообщалось об использовании бори-
дов в авиационной технике [531]; опубликованы новые данные
еб использовании боридов молибдена, циркония, хрома и титана
в составе жаропрочных и огнеупорных материалов [584, 608].
ГЛАВА VI
СИЛИЦИДЫ
Силициды тугоплавких металлов, в отличие от карбидов,
нитридов и многих боридов не являются фазами внедрения, так
как крупные атомы кремния не могут внедряться в октаэдриче-
ские или тетраэдрические поры простых металлических реше-
ток, а замещают металлические атомы с образованием, в случае
близости радиусов атомов Гме и rsi (а также небольших со-
держаний кремния), металлических структур, построенных по
типу замещения. В случае же заметных различий в величинах
радиусов атомов металлов и кремния (и высоких содержаний
последнего) образуются сложные структуры, характеризуемые
прочными ковалентными связями между атомами кремния, имею-
щего низкий ионизационный потенциал (7,39 эв) и полупровод-
никовые свойства.
Структуры силицидов
В связи с этим целесообразно классифицировать силициды на
две группы: силициды с металлическими структурами, образо-
ванными при замещении атомами кремния металлических ато-
мов без перестройки решетки металла, но с ее уплотнением, и
силициды со сложными структурами, образованными при корен-
ной перестройке решетки металла и формировании структурных
элементов из атомов кремния [618].
Силициды с металлическими структурами образуются при за-
мещении атомами кремния атомов металлов при условии
rsi ••Гме'>Ъ,М—0,85. Большинство этих силицидов — V3Si,
Cr3Si, Мп3 Si, Mo3Si, W3Si(?), Re3Si(?) построены по типу
₽-W, т. е. имеют структуру типа плотнейшей кубической упа-
ковки (рис. 181). Каждый атом металла находится в центре не-
правильного тетраэдра из атомов кремния, а каждый атом крем-
ния окружен 12 атомами металла, образующими икосаэдр. Си-
лициды Fe3Si, Co3Si и Ni3Si являются упорядоченными тверды-
ми растворами на основе кубических объемноцентрированной
(Fe3Si) и гранецентрированной (Ni3Si и Co3Si) решеток.
Фаза Bu6Si имеет решетку 0-марганца, являясь типичным
электронным соединением с неупорядоченным расположением
атомов компонентов и с электронной концентрацией 3/2.
320
Силициды
В отличие от атомов бора, более крупные атомы кремния спо-
собны к образованию изолированных групп из двух атомов, вхо-
дящих в качестве обособленного структурного элемента в решет-
ки некоторых силицидов. С учетом этих особенностей основные
структурные типы сложных силицидов могут быть классифици-
рованы следующим образом [119]:
а) с изолированными ^томами кремния;
б) с изолированными парами атомов кремния;
в) с цепочками из атомов кремния;
г) с плотнейшими слоями из атомов обоих компонентов;
д) с каркасом из атомов кремния.
Рис. 181. Структурный
тип ^-W
ф Si
Рис. 182. Структурный
тип U3Si
Структурные типы с изолированными атомами кремния
а) Тип U3Si— тетрагональная ячейка (рис. 182). Атомы U
находятся в вершинах ячейки, атомы Si — в центрах граней.
б) Тип FeSi — кубическая ячейка с 4 атомами Fe и 4 атома-
ми Si. К этому структурному типу относятся e-CrSi, е -MnSi,
e-CoSi.
в) Тип USi2 — кубическая ячейка с 1,07 атомами U и 2,14
атомами Si, причем атомы урана занимают вершины куба, а
атомы кремния и часть атомов урана статистически размещены в
центрах граней — дефектная структура типа Си3А1.
Структурные типы с изолированными парами атомов кремния
а) Тип U3Si2 — тетрагональная ячейка с 6 атомами U и 4 ато-
мами Si. Пары из атомов Si параллельны плоскости (001), а
атомы U образуют слои, чередующиеся в порядке ...АА... с обра-
зованием тригональных и тетрагональных призм. В центрах те-
трагональных призм находятся атомы U, в центрах тригональ-
ных — пары атомов кремния.
Структуры силицидов
321
б) Тип FeSi2—тетрагональная ячейка с одним атомом Fe и
двумя атомами Si — прямоугольный параллелепипед с атомами
Fe в вершинах и атомами кремния в центре кубов — половин
параллелепипеда.
Структурные типы с цепочками из атомов кремния
а) Тип Co2Si — ромбическая ячейка с 4 молекулами Co2Si.
Атомы Со и Si образуют сильно искаженную (вследствие относи-
тельно небольшого размера атомов Si) кубическую плотнейшую
упаковку. Атомы Si размещены так, что они образуют в направ-
лении оси z зигзагообразные цепи.
б) Тип MnsS’h — гексагональная ячейка с 2 молекулами
Mn3Si3. Из 10 атомов марганца 6 образуют с Si искаженные
октаэдры, а 4 атома Мп образуют октаэдры около пустых точек
•(ООО) и (00'/2). Структуру этого типа имеют также силициды
Ti5Si3, Mn5Si3 и 1 -FesSis.
Структурные типы с плотнейшими слоями из атомов
обоих компонентов
а) Тип MoSi2 —тетрагональная ячейка (рис. 183) с двумя мо-
лекулами. Атомы ЗГобразуют каркас, в пустотах которого нахо-
дятся атомы Мо. В направлении
оси z двойные плотнейшие слои
из атомов Si чередуются со слоя-
ми из атомов Мо.
Этот структурный тип имеют
также WSi2 и ReSi2.
®мо Qsi. @Ti Qst
Рис. 183. Структурный
тип MoSi2
Рис. 184. Структурный
ТИП TIS12
б) Тип ?-CrSi2 — гексагональная ячейка с 3 молекулами.
Структура построена из плотно упакованных гексагональных
слоев, атомы 1 и 3-го слоев располагаются под точками 1 и 3
соответственно (рис. 184).
21 Г. В. Самсонов
322
Силициды
Такой же структурный тип имеют VSi2, NbSi2 и TaSi2.
в) Тип TiSi2 — ромбическая ячейка (рис. 184) с 8 молекула-
ми. Атомы Ti и Si образуют слои с плотнейшей упаковкой, при-
чем каждый атом Ti в слое окружен 6 атомами Si, а каждый атом
Si — 3 атомами Ti. Слои наложены друг на друга так, что центр
атома Ti во втором слое находится над
точкой 1, в третьем — над точкой 2, в
четвертом — над точкой 3.
Структурные типы с каркасом из
атомов кремния
Структурный тип ThSi2 (рис. 185) —
тетрагональная ячейка с 4 молекулами.
Атомы Si образуют зигзагообразные
цепи, проходящие через призмы из ато-
мов Th параллельно осям х и у на раз-
ных высотах. Выступы этих цепей на-
правлены навстречу друг другу, причем
расстояние между атомами Si в высту-
пах равно расстоянию между атомами
Si в цепи, т. е. создается трехмерный
каркас из атомов Si. По этому типу
кристаллизуются LaSi2, CeSi2, PrSi2,
NdSi2, a-USi2, NbSi2 и PuSi2.
Основные данные о структурах силицидов некоторых пере-
ходных металлов приведены в табл. 101.
Физико-химическая природа силицидов
Связи между атомами кремния в молекулах силицидов имеют
ярко выраженный ковалентный характер и обусловливают воз-
никновение цепочечных, слоистых и каркасных структур силици-
дов. Однако, наряду с этим, сохраняются и прочные металличе-
ские связи между атомами металлов и атомами металлов и
кремния, о чем свидетельствует высокая электропроводность си-
лицидов и их способность переходить в сверхпроводящее состоя-
ние, не говоря уже о чисто внешних признаках — металлическом
блеске, характере излома и т. п.
В силицидах, как и в боридах, атомы кремния и металлов
имеют общий электронный коллектив, причем можно утверждать,
что он преимущественно принадлежит металлическим атомам —
происходит переход электронов от кремния к металлу. Представ-
ление об электронном строении силицидов дал Валльбаум [532].
Следует, между прочим, отметить, что первый ионизационный по-
тенциал кремния составляет всего 7,39 эв по сравнению с 8,4 эв
для бора, 11,22 эв для углерода и 14,47 эв для азота. Таким об-
Сводка структур силицидов
Таблица ЮГ
Структурный тип
Металл Ta«Si U3Si Co2Si P-W Mn5Si3 U3Si2 Zr2Si FeSi ZrSi 1 Cr3B2 FeSi2 MoSi2 CrSi2 TiSi2 ZrSi2 CaF2 ThSi2
Структура
гексаг. тетраг. ромбич. кубич- гексаг. тетраг. тетраг. ромбич. |гексаг* тетраг- тетраг. тетраг. гексаг- ромбич ромбич кубич- тетраг.
La LaSi2
Ti Ti6Si3 TiSi? TiSi2
Zr Zr3Si3 Zr2Si ZrSi ZrSi2
Hf HfSi HfSi2
Се CeSi2
Th ThSi2
V v3Si VSi2
Nb Nb<Si? a-NbjSi, NbSi2
Ta Ta4Si Ta6Si3 Ta2Si TaSi2
Pr PrSi2
Cr Cr3Si CrSl Cr3Si2 CrSi2
Mo MojSi MobSi3 I Mo3Si2 MoSi2
Продолжение табл- ЮГ
Металл Структурный тип
Ta4Si U3Si Co2Si ₽-w Mn„Si3 U3Si2 Zr2Si FeSi ZrSi СГЗВ2 FeSi2 , M0S12 1 CrSi2 TiSi2 ZrSi2 CaF2 ThSi2
Структура
гексаг. тетраг- рОмбиЧ кубич- гексаг- тетраг- тетраг. ромбич- гексаг- тетраг- тетраг- тетраг. гексак. ромбич ромбич. ^кубич • тетраг
W w5Si3 WSi,
Nd NdSi2
и U3S1 U3Si2 USi2
Мп Mn3Si Мп.,5!3 MnSi
Re Re3Si? ReSi ReSi3
Нр NpSi2.
Fe Sm Pu — Fe3Si Fe:,Sl3 FeSi — _ — FeSi3 — — SmSi2’‘ PuSi2.
Со C'o2Si Co3Sl? CoSi CoSi2
Ni NiSi - NiSi2
Физико-химическая природа силицидов
325
разом, отдача электронов кремния при его взаимодействии с пе-
реходными металлами, имеющими дефектные d-уровни, проис-
ходит еще легче, чем бора. Отношения радиусов крупных атомов
кремния (1,17А) к радиусам переходных металлов, приведенные
в табл. 102, значительно превышают хэгговское отношение 0,59 и
в ряде случаев близки к 1. Это обусловливает не внедрение, а
замещение атомов в решетках металлов атомами кремния. В со-
гласии с классическими правилами изоморфизма, замещение при-
водит к образованию металлических структур при fsi 0,84—
0,85 и содержаниях кремния 25—30% (атомн.). При более вы-
соких содержаниях кремния, а также для металлов, имею-
щих большие атомные радиусы (Sc, Y, лантаниды, Ti, Zr, Hf, Nb,
Та, ряд актинидов), замещение металлических атомов кремнием
приводит к образованию сложных структур, в которых сущест-
венную роль играют связи между атомами кремния. С уменьше-
нием отношения rsi • Тм.е стремление к образованию сложных
структур увеличивается, а с увеличением этого отношения (для
металлов с fsi s Тме > 0,84—0,85) структурные элементы из ато-
мов кремния упрощаются?/ Так, наиболее сложная каркасная
конфигурация атомов Si обнаружена только у силицидов ланта-
нидов (rsi: Гх =0,62—0,67), у тория (0,65) и урана (0,77), а
также у нептуния и плутония; слоистые элементы структуры из
атомов Si — у дисилицидов Zr, V, Сг, Nb и Та, цепочные — у Ti,
Со, Мп и Fe и структурные элементы из изолированных пар ато-
мов кремния — у железа.
Таблица 102
Отношение радиуса атома кремния к радиусам атомов
переходных металлов1
Металл Л81 tRMe Металл ^Si! RMe Металл Si Me Металл
Sc 0,72 Y 0,65 La—Lu 0,62—0,67 Ac
Ti 0,79 Zr 0,73 Hf 0,74 Th 0,65
V 0,87 Nb 0,80 Ta 0,80 Pa —
Сг 0,92 Мо 0,84 W 0,84 U 0,77
Мп 0,93 Тс — Re 0,85
Fe 0,93 Ru 0,87 Os 0,87
Со 0,94 Rh 0,87 Ir 0,86
Ni 0,95 Pd 0,86 Pt 0,84
1 Радиус атома Si принят равным 1.17А (по Паулиигу и Хиггинсу).
Силицид FesSi является сверхструктурой, получающейся при
упорядоченном распределении атомов Si в решетке a-Fe [рас-
творимость Si в a-Fe составляет около 30% (атомн.)]. То, что
326
Силициды
Fe3Si является сверхструктурной фазой, подчеркивает металличе-
ский характер связи Me—Si в силицидах со структурой ₽-\У.
Все подобные фазы должны иметь дополнительные зоны Брил-
люэна, т. е. более сильную связь электронов и соответственно
низкое электросопротивление и способность переходить в сверх-
проводящее состояние при более высоких температурах, чем бо-
лее сложные в структурном отношении фазы. Действительно, си-
лициды, как и металлы, способны переходить в сверхпроводящее
состояние, причем для структур типа ₽ -W, как правило, наблю-
даются наиболее высокие точки перехода, например V3Si имеет
точку перехода 17°, Mo3Si 1,30°, Mo3Si2 1,34°, W3Si2 2,84°,
ThSi2 3,16° К [533]. Силициды титана TisSi, TiSi, TiSi2, циркония
Zr4Si (?), Zr2Si, Zr3Si (Zr5Si3 ?),Zr4Si3 (?), Zr6Si5 (?), ZrSi,
ZrSi2, ванадия VSi2, ниобия Nb3Si2, NbSi2, тантала TaSi2, хро-
ма Cr3Si2, CrSi, CrSi2, вольфрама W.Si2 и молибдена MoSi2 име-
ют, повидимому, весьма низкие точки перехода, так как до 1,2°К
они сверхпроводниками не становятся.
Точки перехода для фаз Fe3Si, Co3Si и т. п. не установлены,
но можно предполагать, что они низки, так как при прочих рав-1
ных условиях эти металлы имеют более заполненные d-уровни,
т. е. малые значения \/Nn (где п — число электронов на d-уров-
не, N — главное квантовое число этого уровня), что должно при-
водить к образованию более узких ds-полос и высокому сопро-
тивлению таких фаз.
О металлической природе силицидов свидетельствует харак-
тер изменения термоэлектродвижущей силы термопар из силици-
дов в комбинациях с металлами, например, для пары MoSi2—Pt
в пределах от 60 до 600° Е — 5,13 + ’/2 3,76 • 10~2 Z2—V3-15,65 X
X10~6 t3, т. е. выражается аналогично Е термопары Си—Pt [534].
С повышением содержания Si в силицидных фазах связь меж-
ду металлическими атомами ослабляется и во многих дисили-
цидах (например, |3-USi2) практически отсутствует, в отличие
от изоморфных им диборидов. Например, расстояние U—U у
₽ -USi2 составляет 3,85 кХ, а у UB2 —3,18 кХ [535]. Тенденция к
исчезновению связи Me—Me и стремление к образованию соеди-
нений строго определенного состава возрастает с переходом от
элементов IV и V групп к силицидам металлов VI—VIII групп.
Недавно проведенное исследование связей в силициде молиб-
дена (MoSi2) показало [536], что атомные функции Si вступают
во взаимодействие с полосами d- и s-электронов Мо и полу-
чающееся при этом распределение заряда способствует образо-
ванию гетерополярпой связи компонентов в MoSi2.
Образующиеся при этом структуры силицидов подобны струк-
турам соединений переходных металлов с элементами четных
подгрупп периодической системы (Sn, Pb, S, Se, As, Sb, Те, Bi),
например силицид никеля NiSi имеет структуру NiAs [537]. Соеди-
Химические свойства силицидов
327
нения этого типа имеют довольно хорошую электропроводность с
минимумом, соответствующим стехиометрическому составу, они
диамагнитны^ отличаясь в этом отношении от парамагнитных фаз
внедрения.
Химические свойства 'силицидов
Следует отметить, что все силициды стойки против действия
минеральных кислот; на силициды титана и молибдена не ока-
зывают действия даже плавиковая кислота и растворы щелочей.
Расплавленными щелочами силициды легко разлагаются [538].
Стойкость против действия кислорода воздуха по Кэмпбеллу
[122] убывает для дисилицидов следующим образом:
до температур > 1700е
’ ’ } 1400-1700°
» » 1100—1400°
» » 800—1100°
» » 800—1100°
» » 800—1100°,
стоек
»
»
»
»
»
»
WSi2
CrSi2
TaSi3
NbSi2
ZrSi2
TiSi2
т. e. стойкость против окисления снижается с уменьшением по-
рядкового номера переходного металла, образующего силицид.
Стойкость карбидов и нитридов ограничивается 1100—1400°, а
WC — даже 500—800°, только бориды в этом отношении могут
быть сравнены с силицидами.
Количественное определение стойкости силицидов переходных
металлов при нагревании на воздухе в продолжение 4 час. при
1200° [539] дало результаты, приведенные в табл. 103.
Таблица 103
Изменение веса силицидов при окислении иа воздухе
Силицид Изменение веса, мг/см2 Внешний вид образца после окисления
TiSij +0,3 Стеклообразная, прочно удерживающаяся по- верхностная пленка
ZrSi2 +42 Хрупкая неплотная пленка металлического вида
ThSi2 +73 Желтоватый рыхлый поверхностный слой
VSi2 +4,9 Стеклоподобная прочно удерживающаяся поверх- ностная пленка
NbSi2 —54 Желтоватый рыхлый поверхностный слой
TaSi2 —51 Серый рыхлый поверхностный слой
CrSi2 +51 Зеленоватый пористый поверхностный слой
MoSi2 +0,3 Тонкий стеклоподобный прочно удерживающий- ся слой
MoSi2 +0,9* То же
WSi2 —17 A » »
WSi2 —23* Стеклообразная, не очень прочно удерживаю- щаяся пленка
* Температура окисления 1500°.
328
Силициды
Химически силициды менее прочны, чем бориды, нитриды и
даже карбиды переходных металлов, о чем свидетельствуют как
относительно низкие температуры их плавления, так и то, что
при врздействии на силициды элементарного бора они легко пре-
вращаются в бориды (табл. 104).
Таблица 104
Результаты реакций между силицидами металлов и бором
(присадка бора была рассчитана на образование
диборидов [451])
Фаза Температура реакции U50u), °C Преобладающая фаза в продукте реакции
TiSi3 1450 Т1Ва
ZrSi2 1650 ZrBa
CrSi2 1550 СгВ, немного CrSi2
MoSij 1750 МоВ, немного MoSia
Способы получения силицидов
Способы получения силицидов аналогичны способам получе-
ния боридов и карбидов.
Получение силицидов непосредственно из металлов и кремния
впервые описано Муассаном [231], который получал силициды
сплавлением металлов с кремнием в электродуговых печах. Поз-
же для этого использовались печи сопротивления с графитовой
трубой и индукционные печи; спекание пррводили [532] в ваку-
уме или под аргоном в корундовых тиглях. Реакции образования
силицидов экзотермичны; однако выделяющегося тепла недоста-
точно для расплавления образующихся силицидов. Спекание гид-
ридов вместо металлов облегчает взаимодействие металлов с
кремнием [540]. Силициды тантала, молибдена и вольфрама мож-
но получать спеканием металлов с очень чистым кремнием
(99,87 %[) в атмосфере аргона (>1 ат) в индукционной печи в
.силицированном танталовом тигле [462]. Хансен с сотрудниками
[541] приготовлял сплавы Ti-Si сплавлением компонентов в элек-
тродуговой печи с вольфрамовыми электродами в атмосфере ге-
лия или аргона.
Киффер [542] предложил получать плотные изделия из сили-
цидов горячим прессованием компонентов (2We+Si); этим мето-
дом Червенка [542] получил ряд силицидов молибдена и дисили-
циды переходных металлов IV, V и VI групп, Галистль [543] —
силициды вольфрама и ряд твердых растворов изоморфных си-
лицидов, а Шахнер [544] — силициды тантала. На рис. 186 по-
казана микроструктура литого и горячепрессованного силицида
молибдена.
a
Рис. 186. Микроструктура литого (а) н горячепрессован-
ного (б) силицида молибдена, травлено смесью
HF—HNO3: а — Х400; б—X 2000
(по Кифферу)
230
Силициды
Получение силицидов восстановлением окислов металлов
кремнием, карбидом кремния или взаимодействием SiO2, силика-
тов и т. п. с окислами металлов и углеродом происходит при
очень высоких температурах; например, рассчитанная равновес-
ная температура реакции TiO2 + 2SiO2 + 6С — TiSi2 + 6СО при
1 ат составляет около 1750°, снижаясь при давлении 0,1 ат до
1550—1570°. Обычно этот метод осуществляют сплавлением ших-
ты с отделением кремнекислоты и шлаков и получением продук-
тов неопределенного фазового состава. По Кроллю [549] силицид
циркония образуется при восстановлении циркона углеродом в
электродуговой печи, одновременно с карбидом циркония:
2ZrSiO4+ 9С - ZrSi2 + ZrC + 8СО.
Следует отметить, что нагреванием указанных шихт до темпе-
ратур ниже температуры полного расплавления безуглеродистых
силицидов практически получить не удается — содержание угле-
рода в силициде составляет около 50% его содержания в исход-
ной шихте (образуется, например, смесь карбидов титана и
кремния с силицидом титана).
Хенигшмид [538] предложил получать силициды алюмино-
или магниетермическим восстановлением смеси окисла металла с
кварцевой мукой с добавлением серного цвета.
Взаимодействие металлов с кремнием в расплавленной меди,
разработанное Лебо [551], основано на реакции металла или оки-
сла металла с расплавленным силицидом меди.(Си — Si)
-i-MeSi + Cu. Образующиеся при этом кристаллики силицида,
состав которых зависит от концентрации кремния в ванне, после
измельчения сплава могут быть отделены химическим путем.
Медносилицидный метод, в отличие, например, от алюмино- и
магниетермического, позволяет получать силициды любых и точ-
но определенных составов [538], а также смесей силицидов раз-
личных металлов и их твердых растворов. Этот способ подобен
способу приготовления карбидов и их твердых растворов из ни-
келевых или алюминиевых расплавов, разработанному Мак Кен-
на [24].
Приготовление силицидов осаждением из газовой фазы осу-
ществляется восстановлением галогенидов кремния (обычно
SiCh) водородом над порошком металла [122, 553—554] или на-
гретой проволокой [93, 138]. Таким способом Кэмпбелл с сотруд-
никами [122] получил ряд силицидов по реакции
Me-|-SiCl4+2H2-* AfeSi + 4НС1.
Условия осаждения приведены в табл. 105.
Методом наращивания получают также силицидные покры-
тия на металлах, например молибдене [555, 556], что повышает
стойкость изделий против окисления при относительно высоких
температурах.
Силициды титана
331
Таблица 105
Режимы получения силицидов по методу наращивания [122]
Металл Температура осаждения, °C
Ti 1000—1500
Zr 1100—1500
Nb 1100—1800
Та 1100—1800
Cr 1100—1400
Mo 1100—1800
w 1100—1800
Состав силицидов, осаждаемых из газовой фазы, не опреде-
лен. Основными фазами, повидимому, являются дисилициды как
термодинамически наиболее прочные. Для получения силицидов
можно также использовать реакцию между хлоридами металлов
и элементарным кремнием.
Силициды могут получаться электролизом из расплавленных
солевых ванн [558]. Этим способом из расплавов фторосиликата
калия или натрия и TiO2, ZrO2 или фторида хрома осаждаются
силициды титана, циркония и хрома. Додеро [4] получал дисили-
циды тантала, циркония и хрома электролизом расплавленных
смесей силикатов с окислами тугоплавких и щелочных металлов.
Силициды титана
Впервые сплав силицидов титана неопределенного состава
был получен Муассаном [231] сплавлением рутила с кремнием в
электродуговой печи. Ларсен с сотрудниками [560] получал спла-
вы титана с 0,5—10% Si спеканием смесей компонентов в ваку-
уме, а Хансен [541] — сплавлением титана с кремнием в дуговой
печи с вольфрамовым электродом в атмосфере гелия или аргона.
Дуговой плавкой сплава титана с содержанием до 4,6%' Si си-
лициды титана получались также Зютклиффом [561]. Дуговая
плавильная печь показана схематически на рис. 187. Для приго-
товления сплавов использовались иодидный титан чистотой вы-
ше 99,9% и кремний чистотой 99,89%..
Хенигшмидт [231] алюминотермическим восстановлением сме-
си SiO2 с КД4Е6 в присутствии серы получал сплав, из которого
попеременной обработкой НС1 и разбавленной КОН изолировал
хорошо образованные кристаллы силицида TiSi2. Недавно этот
метод исследован вновь [585].
Взаимодействие гидрида титана с кремнием позволяет полу-
чать силициды титана точно определенных составов [540]; выделя-
ющийся при этом водород способствует образованию силицида.
Рис. 187. Дуговая пла-
вильная печь:
7 — подвод тока; 2— водо-
охлажд емые электроды;
3 — сильфон; 4 — уплотне-
ние из в куумной резины;
5— смотровое окно; 6 — при-
способление для загрузки
образцов; 7 — электродная
муфта; 8 — струбцинки (три
через 120°); 9 — водоохла-
ждаемый бронзовый корпус
печи; 10- изоляция (фибра);
/Z — резиновое уплотнение;
12 — стол печи; /5 —водо-
охлаждаемая нижняя ч сть
корпуса (бронза); 14 — воль-
фрамовый н-конечник элек-
трода; 15—медный тигель;
16—медный блок; 77— обра-
зец сплава
Силициды тигана
ззз
Осаждением из газовой фазы [122] смесь силицидов тита-
на неопределенного фазового состава получается по схеме
Ti + SiCU + Н2 -► Ti-Si + НС1 при 1100—1500°. Леви [231] об-
ратным путем, т. е. действием паров TiCl4 на нагретый кремний,
получил небольшие количества силицида, которому приписал
формулу Ti2Si.
Электролизом расплавленной смеси K^SiFs + l/10TiO2 можно
получить TiSi2 в форме весьма тонкозернистых кристаллов [559].
Углеродным восстановлением смеси TiO2 с SiO2 дисилицид тита-
0 10 20 30 40 50 60 70 80 90
I i 11 i" 4 " I ' I ‘ > * 1
юо
t:c
2000.
•ЪгЛ
1800
1600
1400
1687° > ।
vf/ I +
W * Ж
ДД /1330°
lTifS/з !
A ••
Т/5%
TiSi '
х Термический анализ
°
• Металлографическое иссле-
дование плавленого ооразм.
-^з Ж
?ж\
ustr\№40'
о о
51%
TiSHTiSi?
1200
1410°
______<>
3 78
TiSigtSi
TiSi2b
1350'
/
/
'/ fi^5S'3
I
Jpnn'' 1 1 111___1 1 1_____b-___I-----1-----1____
0 Ю 20 30 40 50 60 70 80 90 100
Кремний,
Рис. 188. Диаграмма состояний сплавов системы Ti—Si
на не удается получить ни в вакууме, ни в графитовотрубчатой
печи до температур 1800—1900°.
Диаграмма состояний сплавов системы Ti—Si впервые по-
строена Хансеном с сотрудниками [541]. Расплавление образцов
для термического анализа производилось в графитовом тигле, из
которого в сплавы переходило около 0,2%'С. Отжиг и закалка
осуществлялись в специальной печи в атмосфере аргона. Диаг-
рамма состояний, полученная Хансеном, показана на рис. 188.
В системе имеются три химических соединения — Ti5Sia, ранее
исследованный Пьетроковским и Дувецом [562], TiSi, образую-
щееся по перитектической реакции между TigSi3 и жидкой фазой
с 43%' Si при 1760°, и TiSi2 — установленный Хенигшмидтом [538]
и структурно изученный Лавесом и Валльбаумом [563]. Эвтекти-
334
Силициды
ки имеют температуры плавления Ti—Ti5Si3 1330°, TisSi3—TiSi2
1490° и TiSi2—Si 1330°.
Растворимость кремния в а-и 8 -титане по Кригхаду [564]
менее 0,4%.
По данным Хансена [541], растворимость Si в [3 -Ti при 1330°
составляет около 3% [5%' (атомн.)]. При 860° твердый раствор
Р -Ti с 0,9% Si распадается по эвтектоидному типу па а -раствор
с 0,5%' Si и Ti5Si3; при 750° растворимость кремния в a-Ti со-
ставляет около 0,3%. В одной из более поздних работ точка эв-
тектоидного распада соответствует твердому раствору 13 -титана с
0,6% Si и несколько более низкой
температуре (850°), чем указыва-
лось Хансеном. Соответствующие
данные приведены на рис. 189.
Температура первой эвтектики
этой работой практически под-
тверждена (1320° вместо преж-
них 1330°).
Структура Ti5Si3, аналогичная
структурам Ti5Ge3 и Ti5Sn3, а так-
Рис. 190. Изменение веса при окисле-
нии образцов титанокремниевых спла-
вов (от 0 до 4,6% Si при 1000°)
Рис. 189. Участок диаграммы системы
Ti—Si [от 0 до 4% (вес.) Si]: сплошные
линии по данным Зюдклиффа; пунк-
тирные — по данным Хансена
же Afe3Si3 (где Me — Zr, Та, Мп, Fc), подробно исследова-
на [562].
Важнейшим свойством силицидов титана является их окали-
ностойкость. Добавление кремния к титану в пределах 4,6% Si
резко увеличивает его стойкость против окисления (рис. 190 и
191), а также как холодную, так и горячую твердость [561]. При
окислении на воздухе в продолжение 4 час. при 1200° увеличе-
ние веса образца силицида титана составляет всего 0,3 мг/см2—
он не уступает самому стойкому против окисления силициду мо-
Силициды титана
335
либдена (также +0,3 мг/см2). При окислении он покрывается
стеклообразной, прочно удерживающейся пленкой, состоящей, по-
видимому, из смеси силикатов титана эвтектического типа. На
TiSiz не действуют никакие минеральные кислоты, включая пла-
виковую; расплавленными щелочами он разлагается быстро.
Рис. 191. Изменение внешнего вида образцов титанокремниевых сплавов (от
0 до 4,6% Si) при окислении в продолжение 300 часов при 800° [4]
Основные физико-химические свойства силицидов приведены
в табл. 106.
Таблица 106
Свойства силицидов титана
Свойство Силицид
T15S13 TiSi TiSia
Содержание кремния, % 26,1 37,0 53,9
Структура Периоды решетки, кХ: Гексаг. [562] — Ромбич. [563]
а 7,465+0,002 [562] — 8,236 [563]
ь —- — 4,773[563]
с 5,162+0,002 [562] — 8,523 [563]
с/а . Плотность, zjcMs: 0,692 — —
расчетная — — 4,15
экспериментальная . . Микротвердость, кг/лш2: — — 4,39 [542]
(100 г) . . . • 986 [541] 1039 [541] 618—870 [541]
(50 г) — — 824 [542]
Температура плавления, °C Теплота образована 2120[541] — 1540 [541]
ДН, ккал/моль . ... . Удельное электросопро- 225 ± 60 [580] 96 ±20 [580] 56 ± 10 [580]
тивление, мком * см .... Температура перехода в — — 123 [543]
сверхпроводящее состояние, °К <1,2 [533] <1,2 [533] < 1,2 [533]
S36
Силициды
Силициды циркония
Ведекинд сплавлением ZrO2 с Si получил силицид ZrSi, а дей-
ствием избытка Si на K2Zr2F6 [231] получил сп^ав, содержащий
хорошо кристаллизованный силицид, который отмывался от из-
бытка кремния обработкой раствором КОН.
Помимо этого Ведекинд получил силицид ZrSi2 спеканием
циркония и кремния в вакуумной печи при 1000°, а Киффер с
сотрудниками [566] приготовлял силициды циркония горячим
прессованием смесей порошков Zr и Si при 2000° с после-
дующим отжигом при 1500—1800° в атмосфере очищенного во-
дорода.
Хенигшмид [550] получал силициды циркония алюминотерми-
ческим восстановлением с последующей отмывкой кристаллов по-
переменной обработкой кислотами и шлаками (см. также [585]).
В. П. Елютин и Р. Н Григораш [567] получали сплавы цирко-
ния с кремнием алюминотермическим восстановлением циркона
(ZrSiO4) с добавкой в качестве флюсов (для разжижения туго-
плавкого глиноземистого шлака) извести и плавикового шпата.
Сплавы содержали 19—30% Si, т. е. соответствовали по составу
смесям Zr3Si3 + ZrSi и ZrSi + ZrSi2. При восстановлении циркона
смесью феррокремния и углерода получались сплавы, содержа-
щие 35—65%' Si (ZrSi2 + Si) и до 0,3% С.
Кролль с сотрудниками [549] описывает получение силицида
циркония в качестве промежуточного продукта при крупном про-
мышленном производстве карбида циркония из смеси силиката
циркония и угля в электродуговой печи.
Следует отметить, что впервые этот метод был исследован
Елютиным и Григорашем [567].
Поверхностные покрытия неопределенного состава из силици-
дов циркония получили Кэмпбелл с сотрудниками [122] путем
восстановления SiCl4 водородом на цирконии при 1100—1500°.
Додеро [4] при электролизе расплава, содержащего фтороси-
ликат щелочного металла и небольшие количества ZrO2, полу-
чал ZrSi2 в форме тонкозернистых кристаллов.
Термическое и металлографическое исследование системы
Zr—Si показало наличие в этой системе следующих интерметал-
лических соединений: Zr4Si, Zr2Si, Zr3Si2, Zr4Si3, Zr6Si5 и ZrSi2
[568]. За исключением Zr3Si5, все эти соединения образуются, по-
видимому, по перитектическим реакциям, температуры которых
очень высоки. ZrSi обладает гексагональной структурой с перио-
дами решетки: а = 7,005 и с =? 12,772 кХ, с/а = 1,823. Рентгеногра-
фическое исследование других фаз не производилось вследствие
невозможности их гомогенизации даже при длительных отжигах.
Растворимость кремния в а-цирконии составляет < 0,1 %:
[0,3% (атомн.)], а в ₽-Zr<0,2% [0,6% (атомн.)].
Силициды циркония
337
Диаграмма состояний системы Zr—Si [568] показана на
рис. 192. В системе обнаружены четыре химических соединения:
Zr2Si, ZrsSia, ZrSi и ZrSi2. Открытый максимум имеет лишь сое-
динение ZrsSi3, остальные фазы образуются перитектически.
Эвтектика на циркониевой стороне лежит при содержании крем-
ния около 3% (вес.) и температуре 1630°, а на кремниевой —
при 75% (вес.) Si и 1360°. Растворимость кремния в а- и P-Zr
принята такой же, как и в работе Лундина [568].
Рис. 192. Диаграмма состояний системы Zr—Si
По данным Киффера [566] наиболее стойким против окисле-
ния на воздухе силицидом является ZrSi2, а наименее стойким —
Zr2Si.
Изменение веса при окислении ZrSi2 при 1200° в продолжение
4 час. составляет + 42 мг)см2 [539].
Вообще же стойкость силицидов циркония против окисления
гораздо ниже, чем силицидов молибдена, но выше, чем силици-.
дов хрома, и может быть сопоставлена со стойкостью силицидов
тантала. Окисленные образцы покрыты поверхностной стеклооб-
разной пленкой, но она хрупка и плохо противостоит частым и
резким сменам температур, поэтому легко отслаивается. Причи-
на этого заключается, повидимому, в том, что ZrO2 в отличие от
МоОз нелетуча, и поэтому отсутствует эффект «самозалечива-
ния» пленки, наблюдающийся при окислении силицидов молиб-
дена.
Структура Zr2Si была определена Шахнером [569] как тетра-
гональная того же типа, что и Ta2Si. Структура ZrsSU, наиболее
22 В-Г-Самсонов »
*38
Силициды
устойчивого соединения системы Zr—Si (открытый максимум),
оказалась по тем же данным 569, 570] изоморфной аналогич-
ным фазам в системах Та—Si и Ti—Si (тип D88). Zr5Si3 имеет
узкую область гомогенности, так же как и TaaSis и Ti5Si3- Гекса-
гональная структура ZrSi была установлена в работе Лундина
l568] и подтверждена данными Киффера [566]. Кристаллическую
структуру ZrSi2 исследовали Зейферт [565] и Нарай-Сабо [552]:
они определили ее, как ромбическую (тип ZrSi2) с пространствен-
ной группой Din — Стет- Однако эта структура ставится под
сомнение в работе Брауэра и Митиуса 557].
Основные свойства силицидов циркония приведены в табл. 107.
Таблица 107
Свойства силицидов циркония
Свойство Силициды
Zr2?i Zr&sij ZrSi 1 ZrSi2
Содержание кремния, % 13,33 15,58 23,52 38,09
Структура Тетраг. Гексаг. Гексаг.* Ромб.*
Периоды решетки, кХ: [569] [569] [568] [563]
а 6,56а [569] 7,870 [569] 7,005 [568] 3,72
[563]
ь — — — 14,16 [563] 3,67 [563]
с 5,361 [569] 5,517 [569] 12,772 (568]
с/а 0,81в [569] 0,7048 [569] 1,823 [568]
Плотность (расчетная), г'см3 Микротвердость, кг/мм* 5,99 5,90 5,56 4,88
(50 г) 1180—1280 1280—1390 1020—1180 830—980
[566] [566] [566] [566]
(100 г) Температура плавления, —— —• — 1030 [542]
°C 2220 [569] 2250 [569] 2150 [569] 1680—1700
Удельное электросопро- [569]
тивление, мком • см. Температура перехода в — — — 161 [543]
сверхпроводящее со- стояние, °к <1,2 [533] <1,2 [533] <1,2 [533] <1,2 [533]
* Подробные данные о структурах ZrSi и ZrSia приведены в работе [587].
Силициды гафния
Дисилицид гафния HFSi2 был изготовлен алюминотермиче-
ским восстановлением смеси HFO2 с SiO2 в присутствии серы
[585]. Его химический состав (76,1% Hf и 24,0% Si) точно отве-
чает формуле HfSi2. Дисилицид гафния имеет ромбическую
Силициды ванадия
339
структуру типа С49 с пространственной группой , с 4 моле-
кулами в элементарной ячейке с периодами: а => 3,69 ± 0,01;
b = 14,46±0,02; с = 3,64+0,01 кХ Рассчитанная отсюда плот-
ность 8,03 г/см3-, пикнометрически определенная 7,2 a/cju3. >
Микротвердость HfSi2, измеренная под нагрузкой 50 е (при
нагрузке 100 г появляются трещины отпечатков), составляет
930 кг)мм2, или в пересчете на нагрузку 100 г 865 кг/мм2.
Пост и Глазер [595] получали нагреванием смесей порошков
гафния и кремния в вакууме (88 час. при 1125°) или в атмосфе-
ре гелия (несколько минут или 1500°), силициды HfSi и HfSi2.
Силицид HfSi изоморфен ZrSi и имеет гексагональную решетку
с периодами: а =6,86; с = 12,60 кХ, a HfSi2—ромбическую ре-
шетку с периодами: а = 3,67; 6 = 14,56; с =3,64 кХ, несколько
отличающимися от установленных ранее [585].
Дисилициды титана, циркония и графния весьма хрупки,
причем хрупкость возрастает от TiSi2 к ZrSij и HfSi2 [585].
Все три дисилицида не растворимы в хлорной, серной, азот-
ной и соляной кислотах, разбавленных равным объемом воды, а
также 50%-ных растворах едкого натра и калия и расплавлен-
ном бисульфате калия (при 200—300°). Они хорошо раствори-
мы в концентрированной и разведенной (1 : 1) плавиковой кисло-
те, разлагаются сплавлением с бурой или щелочами. Дисилицид
циркония в присутствии расплавленной буры сильно разрушает
платину.
Силициды ванадия
Муассан и Холт [231] получи-
ли силицид V3Si восстановлением
V2O3 и V2O5 кремнием в присут-
ствии углерода; нагреванием V3Si
с избытком кремния можно полу-
чать второй силицид VSi2. Те же
соединения аналогичным спосо-
бом были получены Лебо [231].
Валльбаум готовил VSi2 спекани-
ем смесей порошков ванадия и
кремния в аргоне. Гибельхаузен
[231] на основе результатов тер-
мического и микроскопического
анализа построил участок диаг-
раммы состояний системы V—Si
[до 60% (вес.) Si], имеющий
эвтектический характер с откры-
тым максимумом для VSi2. На-
Рис. 193 Диаграмма состояний
системы V — Si
личие этого соединения подтверждено также работами Валльба-
ума [532] и Фогеля [550]. Кроме того, Валльбаум обнаружил си-
22*
S40
Силициды
лицид [547], имеющий структуру 0-W с периодом а '=> 4,712 ±
± 0,003 кХ.
Более полное исследование диаграммы ванадий — кремний
произведено Киффером [611] на образцах, приготовленных спе-
канием брикетов из смесей порошков V+Si. Построенная им диа-
грамма показана на рис. 193. Соединение V3Si образуется пери-
тектически при 15,5% Si; силициду V3Si3 отвечает открытый мак-
симум на диаграмме (~2150°С). Этот силицид имеет тетраго-
нальную решетку типа Ni3P с периодами: <2=9,41; с=4,74т кХ.
В системе достаточно точно установлено положение только од-
ной эвтектической точки на стороне кремния приблизительно при
5% V и температуре 1385°.
Исследование стойкости против окисления на воздухе, прове-
денное в той же работе Г611], показало, что наиболее стойки при
1250° сплавы, содержащие около 50%' Si, а при 1400° — 70%
Si. Из силицидов наиболее стоек против окисления VSia. Мине-
ральные кислоты, за исключением плавиковой, на этот силицид
не действуют. VSi2 не поддается также действию водных раство-
ров щелочей; расплавленные щелочи легко его разлагают [538].
V3Si является сверхпроводником (точка перехода 17°К). При-
меси понижают температуру перехода V3Si в сверхпроводящее
состояние; так, 1% Fe снижает точку перехода до 14,5°К, а заме-
на в V3Si Vio V на Ti, Zr, Nb, Mo, Cr, Ru или замена */ю Si на
В, C, Al, Ge снижает точки перехода от нескольких десятых гра-
дуса до 10° и более. Максимальное снижение дают В и С [533].
V5S13 по новым данным [571] имеет периоды: а=7,121;
с=4,832 кХ, с/а—0,679 (рентгеновская плотность 5,27 г/см3).
Основные свойства силицидов ванадия приведены в табл. 108.
Таблица 108
Свойства силицидов ванадия
Свойства Силицид
V3Si v6si, VSi2
Содерягание кремния % . . . 15,5 24,8 52,4
Структура Кубическая Тетрагональная Гексагональ-
Период решетки, кХ [547] [613] ная [532]
а 4,712 [547] 9,41 [613] 4,562 [532]
с — 4,74, 6,359
da ....... .. . Плотность экспериментальная, — 0,504 1,394
г [см* 5,67 [547] 4,80 [611] 4,71
Микротверлость при нагрузке 1430—1560 1350—1510 1090
100 г, кг/мм1 [6111 [611] И]
Силициды ниобия
341
Продолжение табл. 108
Свойства Силицид
V3Si V.S1, VSI3
Температура плавления, °C . 1730 2150 1670
Удельное электросопротивле- [611] [611] [611]
ние (25°) мком - см .... Температура перехода в сверх- —* —• 9,5 [4]
проводящее состояние, °К . Изменение веса при окисле- нии, мг/см* ........ 17,0 [533]
при 1250® 63 [611] —7,7 [611] +25 [611]
» 1400® — —600 [611] —12 [611]
Силициды ниобия
Валльбаум [532] спеканием смеси порошков ниобия и крем-
ния в корундовом тигле под аргоном приготовил силицид NbSi2,
обладающий относительно низкой температурой плавления.‘Ана-
логичным путем получали силициды ниобия Брауэр и Шееле
[548] при 1500—1700°. Кэмпбелл с сотрудниками [122] приготов-
ляли силициды ниобия осаждением из газовой фазы.
Система Nb—Si была исследована Наптоном [612] методами
определения температур плавления, рентгеновского и металло-
графического исследования сплавов, приготовленных сплавлени-
ем в дуговой печи под аргоном. Этой работой в системе обнару-
жены три фазы: Nb4Si, Nb5Si3 и NbSi2. Соединение Nb4Si обра-
зуется перитектически при температуре около 1950° из Nb3Si3 и
жидкой фазы (рис. 193, а). Это соединение изоморфно Ta4Si, но
имеет пространственную группу, отличную от группы РОш, ука-
занной для Ta4Si в работе Киффера с сотрудниками.
Фаза Nb5Si3 плавится конгруэнтно при 2480° и существует
в двух модификациях а (низкотемпературной) и ₽ (высокотем-
пературной) с а-> Р превращением между 1900° и 2100°. Точка
плавления NbSi2 равна 1930°, эвтектика NbSi2—Nb3Si3 плавится
при 1850° и лежит при 58%' (атомн) Si. Эвтектика Nb—Nb4Si
плавится при ~ 1880°.
Указывается на возможность небольшой растворимости крем-
ния в ниобии в связи с наблюдавшимся Наптоном увеличением
периода решетки при растворении кремния в ниобии с 3,299 до
3,308 кХ.
Последующее исследование сплавов этой системы, проведен-
ное Киффером с сотрудниками [611] на образцах, приготовлен-
ных горячим прессованием, а также спеканием предварительно
342
Силициды
спрессованных брикетов под аргоном, позволило построить диа-
грамму, показанную на рис. 193, б.
В противоположность данным Наптона, в этой работе не об-
наружено соединение Nb4Si; существование же остальных фаз
t,°c
гт
2000
1600
1200
600
Рис. 193. Диаграмма состояний системы Nb—Si:
а — по Наптому; б — по Кифферу
подтверждено. Ввиду противоречивости данных о системе Nb—Si
Самсоновым, Нешпором и Ермаковой было проведено новое ис-
следование этой системы, в результате которого подтверждена
принципиальная правильность диаграммы состояния Nb—Si по
Наптону. Установлено, что соединение Nb4Si имеет гексагональ-
ную решетку с периодами: а =* 3,59 и с = 4,46 кХ.
В образце стехиометрического состава Nb5Si3, полученном
спеканием горячим прессованием в графитовой прессформе, об-
наружены как гексагональная фаза (пространственная группа
D8& с периодами: а = 7,519 кХ; с = 5,236 кХ), так и низкотем-
пературная тетрагональная фаза (пространственная группа
а = 6,56, с = 1,86 кХ).
Исследование электропроводности сплавов системы Nb—Si
обнаружило два резких минимума электропроводности для спла-
вов состава Nb4Si и NbSij, что указывает на их дальтонидный
характер.
Установлены также фазы Nb3Si2 (тип D8&) с периодами гек-
сагональной решетки: а = 9,95; с = 5,07 кХ; с/а = 0,51 [571] и
Nb5Si3 с периодами; а = 7,52; с = 5,238 кХ; cja = 0,696 (рентге-
новская плотность 7,05 с/сл3).
Силициды ниобия не стойки против окисления; в измельчен-
ном состоянии сгорают на воздухе со вспышкой.
Силициды тантала
343
Свойства силицидов ниобия приведены в табл. 109.
Таблица 109
Свойства силицидов ниобия
Свойства — — Силицид
Kb4Si <x-NbsSl8 ₽-Nb2Sis NbSia
Содержание кремния, %
(вес.) 7 15,34 15,34 37,7
Структура Гек саго- Тетраго- Тетраго- Гексаго-
нальная нальная нальная нальная
Периоды решетки, кХ: .
а 3,59* 6,557 [611] 9,993 [613] 4,785 [532]
с 4,46 11,86 5,067 6,576
с/а 1,24 1,815 0,51 1,374
Плотность, г/смг .... 8,01* 6,56* 6,26 [611] 7,34 [548[ 5,45 [611]
Микротвердость (100 г),
кг/мм* 680—820* 700*
470— 400-
Твердость по Виккерсу, 550 [611] 600 [611] — 1050 [611]
кг/мм2 ........ 470— 550 [611] 400— 600 [611] 400— 600 [611] 600— 700 [611]
Температура плавле- *
ния, °C 1950 [612] 2400— 2400— 1950—[611)
2580* 2480 [612] 2480 [612] 2150*
Теплообразование,
ккал/моль ...... — — — 154±60 1
Удельное электросопро-
тивление, мком • см . Температура перехода — — — 6,3 [4] 24,5*
в сверхпроводящее со- стояние, °к — — — <1,2 [533]
* По данным Самсонова. Нешпора и Ермаковой.
Силициды тантала
Спекая смеси порошков Ta + Si, Валльбаум [532] получил си-
лицид тантала TaSi2, обладающий, по его данным, точкой плав-
ления, более высокой, нежели температура плавления окиси алю-
миния. Бревер [462] приготовлял силициды аналогичным спосо-
бом, нагревая смеси Ta+Si в высокочастотной индукционной пе-
чи. При этом им, кроме TaSiV были обнаружены низшие силици-
ды— TaSio.6, TaSio.4 и TaSi0г- Киффер с сотрудниками [544,
542] получал сплавы Ta-Si горячим прессованием смесей по-
рошков с последующим отжигом для гомогенизации. Горячее
прессование осуществлялось в графитовых прессформах, причем
344
Силициды
содержание углерода в образцах после спекания не превыша-
ло 0,1 %(.
Температура спекания сплавов, богатых кремнием, дости-
гала 1000°, повышаясь для сплавов с высоким содержанием тан-
тала до 1600°. Силицид TaSi2 спекался при 1500°. Продолжитель-
ность спекания изменялась в пределах от 2—3 до 8 мин.
Рис. 194. Диаграмма состояний системы Та—S1
Хенигшмид [550] получил TaSi2 алюминотермическим восста-
новлением смеси Та2О5 с SiO2 в присутствии серы; образующий-
ся при плавке королек после обработки кислотами и щелочами
давал хорошо оформленные кристаллы дисилицида.
Кэмпбелл [122] осаждал на танталовой проволоке слой сили-
цида тантала методом наращивания по схеме Та + SiCl4 + Нг -♦
-> TaSi2 + НС1 при 1100—1800°.
Ориентировочная диаграмма состояния системы Та—Si, по-
строенная по данным Киффера, Шахнера и др. [532, 462, 544,
559], показана на рис. 194.
Тантал при 1800° растворяет кремний в очень малых количе-
ствах [до 0,2 % (вес.) или 1,3% (атомн.)]. Образование твердого
раствора происходит с расширением решетки также очень ма-
лым — от 3,30 до 3,31 s кХ.
Соединение, наиболее бедное кремнием —Та<,5±о,5 Si (ана-
логично описанной Бревером [462] фазе TaSi 0.2), — плавится при
2510° и имеет гексагональную структуру. Фаза Ta2Si плавится
инконгруэнтно, имеет узкую область гомогенности и структуру
Силициды тантала
345
типа Та2В, Мо2В и соответствующих боридов марганца, железа,
кобальта и никеля. Это соединение идентично фазе TaSio4 Бре-
вера. Расстояние между атомами Та—Si меньше, чем между
Та—Та. Третьим соединением является фаза Ta3Sf3 (TaSi 0,6 Бре-
вера), плавящаяся конгруэнтно при 2500° и кристаллизующаяся
в гексагональной решетке типа Ti5Sis, TisGe3 и Ti5Sri3- Наконец,
последняя фаза (TaSi2) — гексагональная, а температура ее плав-
ления 2200°. Тантал в кремнии практически нерастворим. Четы-
ре эвтектики системы имеют температуры плавления: а-Та +
+ Та4 5 Si — 2300°, ТЭ4.5 Si — Ta2Si — 2400°, Ta5Si3 + TaSi2—
2100°,’ TaSi2 + Si— 1400°.
Силицид тантала TaSi2 при нагревании на воздухе ведет себя
аналогично NbSi2, уступая силициду ванадия VSi2 в стойкости,
хотя изменение его веса мало. Из силицидов тантала наиболее
устойчивым против окисления является TaSi2, а наименее устой-
чивым Ta4,sSi [544].
TaSi2 имеет значительную окисную пленку, а образцы, содер-
жащие 70% Та и более, покрываются тонким и плотным стекло-
образным слоем, который состоит, повидимому, из раствора
ТагОз в SiO2.
При меньшем содержании Та эвтектика TaSi2 + Si (темпера-
тура плавления — 1400°) покрывает образец пленкой, предотвра-
щающей его от дальнейшего окисления.
Из минеральных кислот на TaSi2 действует только плавико-
вая; расплавленными щелочами растворяется легко [538].
Свойства силицидов тантала приведены в табл. 110.
Таблица ПО
Свойства силицидов тантала
Свойство Силицид
Ta4,5±0,5si TajSi TagSij TaSia
Содержание кремния, %
(вес.) 3,0 7,2 8,5 23,7
Структура Гексаг. Тетраг. Гекса г. Гексаг.
Периоды решетки, кХ: [569J [569] [569] [532]
а 6,093 [569] 6,1453 [569] 7,455д[569] 4Л [532]
с 4,90э [562] 5,029 [569] 5,21s [569] 6,55! [532]
с)а ....... 1,61а [562] 0,818 [569] 0,69а [569] 1,37, [532]
Силициды хрома
По литературным данным, хром образует с кремнием ряд
силицидов: Cr3Si, Cr2Si, Cr3Si2, CrSi, Cr2Si3 CrSi2 и Cr2Si7,
346
Силициды
Продолжение табл. ПО
Свойство Силицид
Ta4.5-|-0,5sl Ta2Sl TasSI8 TaSij
Плотность, г/см3'. 13,06 9,1«
расчетная 12,8в 13,54
экспериментальная . . 12,7* [559] 12,4* [559] 11,6* [559] 8,83 [532]
Твердость по Виккерсу 1200—1500 1000—1200
(р = 40 кг), кг/мм'1 . . 1000—1200 1200—1500
[559] [559] [559] [559]
Микротвердость при 1510—1610
р — 100 г, кг/мм2 . , . 2510 [559] — 2500 [559]
[542] 2200 [559]
Температура плавления,°C Теплота образования
~2460 [559]
—Д/7, ккал/моль .... Удельное электросопро- — — 31,9 ± 12 50 ±16 [580]
тивление (25°), [580]
МКОМ 'См — — 8,5 [543]
Температура перехода в
сверхпроводящее со- стояние, °К — — — < 1,2 [533]
* Горячепрессованных образцов.
однако в действительности химическими соединениями являют-
ся только Cr3Si, CrSi, CrSi2 и, вероятно, Cr3Si2.
Муассан, Варрен и Фриллей приготовляли Cr2Si сплавлением
компонентов [231]; аналогичным путем Борэн [545] получил фа-
зу, которая, по данным Андерсена и Джетте, имеет состав Cr3Si2.
Курнаков [456—457] и Борэн [545] получали CrSi2 сплавлением
компонентов в индукционной печи, в тиглях из окиси магния. Для
предупреждения образования вязкого шлака в качестве флюса
Курнаков использовал смесь 80% СаО и 20% CaF2.
Киффер с сотрудниками [514] для исследования системы
Сг—S1 все силициды приготовил методом горячего прессования
смесей компонентов в графитовых прессформах при 1090—1330°
в продолжение 1,5—5 мин. Содержание углерода в образцах по-
сле горячего прессования не превышало 0,07%.
Муассан и другие исследователи получали силициды хрома
восстановлением Сг2О3 смесью SiO2 (SiC) и угля. Последующей
химической обработкой был выделен силицид Cr2Si; аналогично
получал Cr3Si2 Барадук-Мюллер [231]. Сплав обрабатывался
плавиковой кислотой. При взаимодействии Cr2O3 с SiO2 и С (при
больших избытках SiO2) образуется силицид CrSi2 [536].
Силициды хрома
347
Алюминотермическим восстановлением смеси Сг20з + SiO2
можно получать силицид Cr2Si [231]. Особенно широко исполь-
зовался для приготовления силицидов хрома медносилицидный
метод — восстановлением смеси Сг20з + SiO2 алюминием в при-
сутствии меди в корундовом тигле получали Cr3Si [538], сплав-
лением хрома, кремния и меди [551, 381] Cr3Si2 и очень чистый
CrSi2 [551]. Осаждение из газовой фазы использовалось только
для приготовления силицида Cr3Si2; для этого SiCl< пропускали
над порошком хрома при 1200° [551].
Додеро [231] электролизом расплавленной смеси фторосили-
катов щелочных металлов с фторидом хрома или хроматов ще-
лочных металлов получал CrSi2 в форме хорошо образованных
кристалликов.
По Кэмпбеллу [122], силициды хрома могут получаться вос-
становлением SiCU на хромовой проволоке или деталях водоро-
дом при 1100—1400°.
Фриллей [231] на основе анализа соотношения между плотно-
стями сплавов Cr-Si с 10—89% Si и концентрацией в них крем-
ния предположил существование соединений Cr3Si, Cr2Si, CrSi,
Cr2S3, CrSi2, Cr2Si7.
Курнаков [457] на основе данных термического анализа, изу-
чения микроструктуры, твердости и температурного коэффициен-
та электросопротивления установил, что растворимость кремния в
хроме составляет около 7,5%; в системе существуют соединения
Cr3Si, Cr2Si и CrSi2, а также, повидимому, Cr3Si2.
Борэн [545] провел рентгеновское исследование сплавов
Cr-Si и обнаружил четыре интерметаллических соединения: ку-
бический Cr3Si, ромбическую фазу, устойчивую только при тем-
пературах ниже 1000°, кубический CrSi и гексагональный диси-
лицид CrSi2. Хром, по его данным, растворяет до 8% кремния,
что сопровождается сжатием решетки; хром в кремнии практи-
чески не растворяется.
Шрот [514], пользуясь сплавами Cr-Si, полученными горячим
прессованием, построил ориентировочную диаграмму состояний,
подтверждающую существование фаз, найденных Борэном.
Дальнейшее исследование этой системы производилось Киффе-
ром и его сотрудниками [514] также на горячепрессованных об-
разцах методами рентгеновского и металлографического анализа
с измерением плотности, твердости, электропроводности и темпе-
ратур плавления. Построенная ими на основе всех предыдущих
и собственных данных диаграмма состояний приведена на
рис. 195 и отличается от диаграммы Курнакова [457] наличием
скрытого максимума, отвечающего Cr3Si2 (соединению, предпо-
ложительно установленному и Курниковым), а также отсутстви-
ем соединения Cr2Si. Растворимость кремния в хроме при эвтек-
тической температуре составляет около 1% [~2,5% (атомн.)]; в
348
Силициды
системе четыре соединения: Cr3Si, Cr3Si2, CrSi и CrSi2, из кото-
рых Cr3Si2 плавится инконгруэнтно, и четыре эвтектики:
а-Cr—Cr3Si (1550°), Cr3Si2—CrSi (1500°), CrSi—CrSi2 (1430°) и
CrSi2—Si (1330°). Хром в кремнии не растворяется.
Все силициды хрома очень устойчивы против действия мине-
ральных кислот, растворяются только плавиковой кислотой, а
также расплавленными щелочами [538].
При окислении силицидов хрома плотной газонепроницаемой
пленки не образуется; напротив, при нагревании хромокремние-
Рис. 195. Диаграмма состояний системы Сг—Si]
вых сплавов на воздухе они деформируются и покрываются тол-
стым и хрупким слоем окиси, мало устойчивым против колеба-
ний температуры. Явление это проявляется тем сильнее, чем
больше хрома в силициде. Отсутствие такой защитной силикат-
ной пленки объясняется тем, что Сг2О3 не растворяется в SiO2;
кроме того, в отличие, например, от WO3 и МоО3,' Сг2О3 неле-
туч, поэтому невозможно образование кварцевой пленки [514].
Основные свойства силицидов хрома приведены в табл. 111.
Силициды молибдена
Муассан [231] для получения силицидов молибдена использо-
вал сплавление компонентов (Mo+Si) в дуговой печи, установив,
что при этом образуются весьма тугоплавкие соединения. Его
опыты были повторены Вигуру [231], который получил силицид
среднего состава, отвечающего формуле Mo2Si3; однородность
его не доказана, в нем присутствовали следы силицидов железа.
Силициды молибдена
349
Таблица 11]
Свойства силицидов хрома
Сво йство Силициды
Cr3Si | Cr.Sij | CrSi ] CrSi2
Содержание кремния, % (вес.) Структура 15,22 Кубич. [583]
Периоды решетки, кХ: а 4,555 + 0,003
с • . . [583] [583]
с/а —
Плотность, г/см3' расчетная —
экспериментальная . . 6,52 [538]
Микротвердость, кг/лж» 1005 [542]
Твердость по Виккерсу, кг/мм1. 900—980
Твердость по Роквеллу [457] 37 [584]
Температура плавления, °C 1710+50
Удельное электросопро- тивление (25°), мком- см Термический коэффициент электросопротивления а • 10» [457] 45,5 [457]
6,5 [457]
Температура перехода в сверхпроводящее со- стояние, °к
26,5 Тетраг.* [571] 35,05 Кубич. [583] 51 9 Гексаг. [583]
9,16 [571] 4,65 [571] 4,620+0,002 [583] 4,422 + 0,005 [583] 6,531+0,005 [583] 1,476 [583]
0,503 [571] —
5,6 [538] 5,38 5,43 [538] 5,00 4,40 [538]
1280 [542] 1005 [542] 996—1160 [542]
1050—1200 [457] 52 [584] 950—1050 [457] 800—1100 [457]
560 + 50 [457] 1545±50 [457] 1550+20 [457]
114 [457] 143 [457] < 250 [ 457]
8,5 [457] 3,12 [457] 2,38 [457]
<1,2 [533] < 1,2 < 1,2
* Этой фазе приписывается'состав CrsSi8 с периодами решетки, близкими к'указаи
ным в таблице [5861 •
Далее этот метод был использован Темпльтоном и Даубеном
[500], а также Бревером с сотрудниками [462], которые взаимо-
действием молибдена с чистейшим кремнием в индукционной пе-
чи под аргоном получили силициды Mo3Si и MoSio,65- Чсрвенка
[542] горячим прессованием смесей Mo+Si при 1100—1600° при-
готовил силициды Mo3Si, M03S12 и MoSij.
Хенигшмид [231], Цахариазен [464] и Уатте [538] получили си-
лицид молибдена MoSij алюминотермическим восстановлением
смеси МоОз + S1O4 в присутствии серы с последующей попере-
менной обработкой сплава NaOH, НС1 и HNO3.
350
Силициды
Рис. 196. Микротвердости слоев си-
лицированного молибдена
(по Кифферу)
Дефак [450] получил тот же силицид медносилицидным методом.
Силициды молибдена могут быть получены по Кэмпбеллу
[122, 555], а также по данным Киффера и Нахтигалля [553] из
газовой фазы восстановлением SiCl4 водородом на молибденовой
проволоке при 1100—1800°. При этом молибден образует сна-
чала низший силицид, на котором наращивается высший
(рис. 196). Фитцер [554, 556],
подробно изучивший механизм
силицирования, установил, что
реакция между молибденом и
кремнием происходит с образо-
ванием дисилицида MoSi2.
Только при очень длительной
выдержке, например при тем-
пературе 1200°, образуются еще
два силицида Mo3Si2 (на грани-
це с MoSi2) и Mo3Si (между
Mo3Si2 и Мо) (рис. 197). Тол-
щина силицированного слоя
возрастает в зависимости от
времени параболически (рис.
198). Микротвердость силицид-
ного покрытия на молибдено-
вой проволоке составляет
1410 кг/мм2 (микротвердость
молибдена 371 кг/мм2). Хлори-
ды молибдена при этом спосо-
бе силицирования не образу-
ются.
В системе Мо—Si уже дав-
но было установлено наличие
соединения MoSi2 [532, 464],
рентгенографически установле-
ны также соединения Mo2Si и
MoSi0,65 [462, 500].
Систематическое исследование системы микроскопическим,
рентгеновским и термическим методами было проведено Червен-
кой [542]. Построенная им ориентировочная диаграмма Мо—Si
показана на рис. 199. Растворимость кремния в молиб-
дене составляет при 1430° 0,8% (атомн.)], а при 1200° —
0,15% [0,33%! (атомн.)] [450]. Система имеет три соединения:
Mo3Si (скрытый максимум), Mo3Si2 и MoSi2, а также три эвтек-
тики с температурами плавления 1920° для Mo3Si—Mo3Si2, 1880°
для Mo3Si2—MoSi2 и 1390° для MoSi2—Si. Последняя эвтекти-
ка соответствует ~ 5% (вес.) Si. Соединение MoSi o.ss, открытое
Бревером, очевидно идентично Mo3Si2.
Рис. 197. Диффузионное образование силицидов мо-
либдена (при 1200°) в зависимости от времени. Коэф
фициенты реактивной диффузии |S2 (с.и2)= D • 1(дин)|:
£>MoSi2 Si “ 1-5 . 10~4 см* день-, £>Моч[2 -> Мо~ 0-2Х
ХЮ-4 сн2 день-, дМо351, —* Мо ~ 0,04- 10~4 си/А.день-,
PMosSi-4.Mo ~ 0,004 1б—4 см^день
Рис. 198. Зависимость
толщины силициро-
ванного слоя на мо-
либдене от времени
силицирования из га-
зовой фазы [25% (объ-
емн.) SiCl4 и 75% (объ-
емн.) Нг]
Рис. 199. Диаграмма
состояний системы
Мо—S1
Рис. 200. Изменение внешнего вида образцов из сплавов Mo-Sl при окислении на воздухе
при 1500° 4,5 часа (по Кифферу)
Силициды молибдена
353
Молибден в кремнии практически нерастворим.
Силицид молибдена MoSi2 и его сплавы с Mo3Si2 устойчивы
против окисления не только на воздухе, но и в токе кислорода;
силициды и сплавы силицидов, содержащие более 60% (атомн.)
Мо, гораздо менее устойчивы против окисления [539] (рис. 200).
Высокая устойчивость MoSi2 и ряда других сплавов молибде-
на с кремнием объясняется образованием газонепроницаемой,
прочно удерживающейся на поверхности стеклообразной пленки,
богатой SiO2. Повреждения пленки устраняются путем образо-
вания новых порций силицида молибдена за счет летучего MoOj,
появляющегося на поверхности при окислении [555].
MoSi2 нерастворим во всех минеральных кислотах, включая
царскую водку и плавиковую кислоту [538]. Легко растворяется
смесями HNO3 + HF, быстро разлагается расплавленными щело-
чами. Частицы порошка MoSi2 имеют форму четырехгранных
призм с четырехгранными пирамидами на обоих концах.
Установлено, что фазы Me5Si3 переходных металлов, в том
числе MosSis, в идеальном виде существовать при обычных усло-
виях не могут; они стабилизируются только при условии замеще-
ния части атомов кремния в решетке углеродом, кислородом или
азотом. В соответствии с этим по данным [572] в системе Мо—Si
фаза с~ 40% (атомн.) Si с малыми примесями углерода имеет
формулу не Mo3Si2, a MosSis со структурой О88 и периодами:
а •=> 7,27, с = 4,992 кХ; с/а = 0,687 (рентгеновская плотность
8,14 г/см3).
Основные свойства силицидов в молибдене приведены в
табл. 112.
Таблица 112
Свойства силицидов молибдена
Свойство Силициды
Mo,Si MosSi, (MosSi2) MoSi2
Содержание кремния, % (вес.) Структура , . . Периоды решетки, кХ: а « с/а Плотность, г/см9: расчетная 9 Кубич. [500] 4,890 + 0,002 [500] 14,3 Г. ц. тетр. [133] 9,62 [133] 4,90 [133] 0,509 [133] 36,9 Тетраг. [532] 3,197 [532] 7,871 [532] 2,463 [562] 6,28
23 Г. В. Самсонов
354
Силициды
Продолжение табл. 12
Свойство Силициды
MOgSi Mo5Si3 (Mo3Sia) MoSij
экспериментальная . . . Микротвердость: 8,4+0,3 [500] 7,4 [542] 5,9—6,3 [542]
при нагрузке 100 г, кг/мм- 1310 [542] 1170 [542] 1260 [542]
по Виккерсу 1320—1550 1200—1320 1320—1550
Температура плавления, °C Удельное электросопротив- ление, МКОМ-С'Л'. при 22° 2050 х 50 [542] 2100+50 [542] 2030+50 [542]
— — 21,5 [411]
—80° Предел прочности при ежа- —“ 18,9 [411]
тии, кг/мм1... Температура перехода в - сверхпроводящее состоя- — —- 70,3—246 [ 542]
ние, °К ....... 1,30 [533] < 1,34 [533] 1,2 [533]
Силициды вольфрама
Муассан [231] получал твердые силициды неопределенного
состава сплавлением вольфрама и кремния в электропечи. Взаи-
модействием вольфрама с чистейшим кремнием в высокочастот-
ной печи под аргоном Бревер с сотрудниками [462] получил два
силицида: WSi2 и WSio,7- Галистль [539] приготовлял силициды
W3Si2 и WSi2 спеканием смесей порошков вольфрама и кремния
и горячим прессованием при 1100—1400° под давлением
200 кг/см2. Образование силицидов из их компонентов проходит
экзотермически. Содержание углерода в горячепрессованных об-
разцах не превышает 0,1%.
Вигуру [538] приготовлял W2Si3 восстановлением WO3 рас-
плавленным кремнием, а Дефак [450] получил дисилицид WSi2
медносилицидным методом.
Хенигшмид [231] приготовил WSi2, пользуясь алюминотерми-
ческим восстановлением.
На накаленной вольфрамовой проволоке, по И. Кэмпбеллу
[122], восстановлением SiCU водородом можно получать сили-
цидные слои, состав которых изучен Фитцером [554, 556]. Твер-
дость этих слоев приблизительно равна твердости мартенсита за-
каленной стали с 0,85% С и составляет (по Нр) 1632 кг/мм2
(твердость вольфрама около 668 кг/мм2).
В системе W—Si хорошо установлено существование силици-
да WSi2 и исследована его структура [464, 393]; кроме того, Бре-
вер [462] рентгенографически обнаружил силицид приблизитель-
Силициды вольфрама
355
1400
IV
234
5
MOO
2200
2000
1Ш
1600
t,’C
2600
31,7. (вес.)
92 15
~ю го зо 4о so 60 7й во <ю юр
Si, 7. (что мн.) Si
Рис. 201. Диаграмма состояний
системы W—Si
кого состава WSio,7- Систематическое исследование сплавов
W—Si было проведено Галистлем [539] на образцах, приготов-
ленных горячим прессованием. Диаграмма состояния, построен-
ная в этой работе на основании результатов термического, мик-
роскопического и рентгеновского анализа (а также измерений
твердости), показана
на рис. 201. Рентгено-
графически определен-
ная растворимость
кремния в вольфраме
составляет при эвтек-
тической температуре
около 0,9% (вес.) [5%
(атомн.)]. В системе
два интерметалличе-
ских соединения: W3Si
и WSi2, им отвечает от-
крытый максимум ли-
нии начала затвердева-
ния. Растворимость
вольфрама в кремнии
крайне мала. С доста-
точно высокой точно-
стью определено только
положение эвтектики
WSi2—Si с 5% W —1400+5°.
(2250°) и W3Si2—WSi2 (2060°)
ки плавления сплавов, определенные Киффером [539], лежат на
100—200° выше установленных Бревером с сотрудниками [462];
эвтектическая точка WSi2—WSio,7 была найдена ими равной
1890°, а эвтектическая точка WSio,7—W—2020°.
Вместо формулы W3Si2 по данным Аронсона [133] следует,
аналогично соответствующему силициду молибдена, принять фор-
мулу WsSi3. Структура этой фазы может быть описана простран-
ственной группой £>4°—14/mcm. WsSi3 имеет гранецентриро-
ванную тетрагональную решетку с четырьмя молекулами в эле-
ментарной ячейке и периодами а = 9,64 и с = 4,97 кХ.
Силициды вольфрама, особенно WSi2, очень устойчивы про-
тив окисления на воздухе, но менее устойчивы, чем силициды
молибдена.
Минеральные кислоты, за исключением плавиковой, на сили-
циды вольфрама не действуют. Расплавленные щелочи легко рас-
творяют WSi2. Дисилицид вольфрама имеет тетрагональную ре-
шетку типа MoSi2 [393, 500], частицы его порошка имеют
форму шестигранных призм сероголубого цвета с металличе-
ским блескам.
23*
Эвтектические точки W—W3Si2
определены приблизительно. Точ-
356
Силициды
Основные свойства силицидов вольфрама приведены в
табл. 113.
Таблица 113
Свойства силицидов вольфрама
Свойство I
I
Содержание кремния, % (вес.) . . .
Структура ......................
Периоды решетки, кХ'.
а..........................
с .......... ....
с/л........................
Плотность, г/см3'.
расчетная ......................
экспериментальная .........
Микротвердость (100 г), кг1мм'- . . .
Температура плавления, °C. . . .
Удельное электросопротивление (25 ).
мком - ом.....................
Температура перехода в сверхпрово-
дящее состояние, °К............
Теплота образования —Д/7, ккал/моль
Силицид
• WeSig (W3Si2) WSi2
8,4 1 ! 23,4 1 Тетраг. [464]
9,64 4,97 0,517 3,212 + 0,005 [464] 7,880+0,005 [464] ! 2,454[464]
10,9 [539] 770 [539] 2320 [539] i 9,88 i 9,33 [539] 1057—1090 [539] । 2165 [539]
— 33,4 [542-]
2,84 [533] 12,6 ±3,5 [580] < 1,2 [533] 26x10 [580]
Силициды марганца
Деринкель [538] получил сплавы марганца с кремнием сплав-
лением в атмосфере азота; аналогичным путем, но без защитной
атмосферы азота, приготовляли сплавы Барадук-Мюллер и
Фриллей [231]. Ими было установлено наличие соединений
Mn2Si, MnSi и MnSi2. Борэн [406] рентгеновским исследованием
установил три промежуточные фазы — Mn3Si (гексагональная
решетка, 16 атомов в элементарной ячейке), MnSi (кубическая,
аналогичная FeSi) и MnSi2 (тетрагональная). Фогель и Бедарф
Г407] на сплавах, изготовленных сплавлением под аргоном, под-
твердили существование соединения Mn3Si, способного растворять
до 1 % Мп. Между Mn3Si и MnSi вместо Mn2Si было найдено со-
единение Mn5Si3. Современный вид диаграммы состояний систе-
мы Мп—Si показан на рис. 202.
Основные свойства сплавов марганца приведены в табл. 114.
Растворимость кремния в а-Mn составляет при 900° около
10% (18% атомн.), в P-Мп при 1040° ~7% [14% (атомн.)] и в
7-Мп при 1155°— около 1,5%' [3% (атомн.)].
Силицид Mn3Si существует в двух модификациях с переходом
а при 600—700° [604]. .
Силициды железа
357
Свойства силицидов марганца
Таблица 114
Свойство Силицид
Mn3Si Mn^Sij | MnSi
Содержание кремния, % (вес.) Структура Периоды решетки, кХ: а с с!а Плотность (расчетная), г/смь Температура плавления, °C 14,55 Кубич. [406] 2,65 [406] — [406] — [406] 1080 Разлаг. [407] 23,46 Гексаг. [406] 6,898 [406] 4,802 [406] 0,696 [406] 1285 [407] 33,81 Кубич. [406] 4,548 [406] — [406] — [406] 5,88 1275 [407]
Силициды железа
Обзор многочисленных работ по исследованию сплавов Fe-Si
дан Гюртлером [390]. Фриллей [538] пытался установить состав
силицидов с помощью измерений плотности (кривой молекуляр-
ных объемов). Жуве на основе магнитных измерений обнаружил
Fe2Si и FeSi. Систематическое исследование диаграммы произ-
водилось Курнаковым и Уразовым [313] и другими. Диаграмма
состояний системы Fe—Si в ее современном виде показана на
рис. 203. Растворимость кремния в a -Fe при 1030—1195° состав-
ляет 16—18% [35%' (атомн.)], внутри a-области расположено
замкнутое т-поле; максимальное содержание кремния в y-Fe
около 2% [13%' (атомн.)] при 1160°. Коэффициент диффузии Si
в a-Fe составляет/) = 0,44е-——[574]. Установлено наличие
в системе четырех интерметаллических фаз: Fe3Si, Fe3Si2 * (vj-фа-
за), FeSi (е-фаза) и FeSi2 (С-фаза), из которых только FeSi
имеет открытый максимум на кривой начала затвердевания. Же-
лезо практически нерастворимо в кремнии.
Силицид pe3Si представляет собой упорядоченный а -твердый
раствор, кристаллизующийся по типу р-вольфрама, фаза FeSi (е)
кристаллизуется в кубической решетке с 4 группами FeSi в эле-
ментарной ячейке, структура Fe3Si2 (ц) еще не выяснена, пови-
димому, она очень сложна. Силицид FeSi2 (С) очень хрупок,
кристаллическая структура его тетрагональная с 3 атомами в
элементарной ячейке. По другим данным, С-фазе приписывают
формулу Fe2Si3 [320].
* Обнаружены новые фазовые поля а'+а" и a-Н в области 15—20% Si;
утверждается, что 1]-фаза имеет состав Fe5Si3, а не Fe3Si2 [605].
358
Силициды
Фит-дер [320] исследовал диффузию кремния в железо
[253]. При этом было установлено (рис. 204), что на границе
мы Мп—Si
Рис. 203. Диаграмма состояний си-
стемы Fe—Si
Fe—Si co стороны кремния образуется сверхструктурная фаза
Fe3Si, а со стороны железа — a-фаза. С течением времени атомы
Рис. 204. Диффузионное образование силицидов же-
леза (при 1150°) в зависимости от времени. Коэффи-
циенты реактивной диффузии |S2 (см*) = D t (дии)|:
образование a-твердого раствора аг 1,35 • 10~а см*/день;
Fe,Si —► Fe яг 5 • 10—2 см2/дснь; FeaSi -► Sis: 20 • 10—2
смЧдень
Fe из железа или a-фазы диффундируют в кремний (переда-
точным диффузионным механизмом) с образованием Fe3Si, пови-
димому, наиболее термодинамически прочного силицида в систе-
ме Fe—Si. При замене части кремния в Fe3Si алюминием легко
Силициды кабал f .та
359
образуется тройная сверхструктура Fe3 (Si, Al), ухудшающая
магнитные свойства альсифера — сплава, обладающего высокой
магнитной проницаемостью [249].
Свойства силицидов железа приведены в табл. 115.
Свойства силицидов железа
Таблица 115
Свойство Силицид
Fe3Si FesSi3 FeSi FeSig
Содержание кремния, % (вес) 14,34 23,2 33,3 50,0
Структура . Кубич. Не опреде- Кубич. Тетраг.* Тетраг. **
Периоды решетки, хХ: а . 5,64 лялось 4,489 [253] [253] 2,679 2,687
с [253] [253] 5,120 5,127
с/а [253] [253| 1,911 1,908
Плотность, г>см*: расчетная 6,09 [253] [253]
экспериментальная . . — — j — 4,75 [582|
Температура плавления, СС 1300 1195 I 1410 j 1210 (разлаг.) [320] 1
Теплота образования : [32о| (разлаг.) [320] 1320]
—ЬН, ккал/моль . . . — I 19,2 [592] , —
* В равновесии с С-фазой (73,5% (атомн-)]. ** В равновесии с т-фазой (54% (атомн-)].
Силициды кобальта [231]
Диаграмма состояний системы Со—Si, построенная на осно-
вании данных термического, микроскопического и рентгеновско-
го анализа, показана на рис. 205. Растворимость кремния в
? -Со составляет при 1020° 7,5% [15% (атомн.)]. В системе уста-
новлено существование силицидов Co3Si, Co2Si, CoSi2 и CoSis,
причем из них только соединениям Co3Si, CoSi и CoSi3 соответ-
ствует открытый максимум на кривой начала затвердевания.
Соединение Co3Si образуется при 1210° по перитектической реак-
ции Co2Si с расплавом, содержащим около 13% Si, и распадает-
ся при 1'160° снова на Co2Si и Со--твердый раствор. Co2Si имеет
ромбическую решетку (12 атомов в элементарной ячейке) [250],
CoSi имеет структуру, аналогичную FeSi (кубическая решетка с
8 атомами в элементарной ячейке), a CoSi2— структуру плави-
кового шпата.
360
Силициды
В последнее время Берто и Блюм [251] подтвердили наличие
в системе Со—Si только трех силицидов — Co2Si, CoSi и C0S12.
Дисилицид кобальта C0S12 имеет кубическую решетку типа СаБг
с параметром а = 5,365 кХ. Атомы Со находятся в положении
(ООО), атомы кремния —± (‘Д *А ’Л), расстояние Со—Si равно
2.32 кХ. Сжатие решетки при образовании CoSi2 составляет 24%
объемов исходных компонентов, достигая почти той же величины,
что и при образовании FeSh. Дисилицид кобальта проводит элек-
трический ток, обладает парамагнитными свойствами и способ-
ностью переходить в сверхпроводящее состояние '[588].
Существование силицида CoSis последними работами не под-
тверждается [239].
Рис. 205. Диаграмма состояний системы Со — Si
Свойства силицидов кобальта приведены в табл. 116.
Таблица 116
Свойства силицидов кобальта
Силицид
Свойство | Co3Si 1 C02S1" CoSi C0S12 CoSi3 (?)
Содержание кремния, % (вес.) 13,7 19,23 32,25 48,77 58,82
Структура Периоды решетки, кХ: а — Ромбич. [250] 7,095 [250] Кубич. [250] 4,438 [250] Кубич. [251] 5,365 [251] —
Силициды никеля
361
Продолжение табл. 116
Свойства । ।— — —(- Co8Si | Силицид
C02S1 1 CoSi C0S12 1 CoSig (?)
ь -,,908 [25о]
с • • 3,730 [250] — '— 1306
Температура плавления, Плотность, г/см.1: °C I 1210 ; 1231] ^(разлаг.) i 1332 [231] 1415 [231] 1277 [231]
расчетная .... . . 1 — — 4,94 [251] —
экспериментальная Теплота образования, 1 — 6,62 [251] —
ккал/моль 1 • • 1 ~ 24,0 [606] — —
Силициды никеля [231]
В системе Ni—Si разны-
ми исследователями обна-
ружено пять силицидных
фаз: NiaSi, NiSi, Ni2Si,
Ni3Si2, NiSi2 (рис. 206), из
которых только Ni2Si и
NiSi соответствуют откры-
тые максимумы на кривой
начала затвердевания.
Растворимость кремния
вначале составляет около
6,5%| [15% (атомн.)] при
1150°, кремний может рас-
творять никель при не-
большом сжатии решетки.
NiSi [240] имеет ромби-
ческую решетку с дефор-
мированной структурой
никельарсенида, NiSi2 —
структуру плавикового
шпата, a NiSi — гексаго-
нальную решетку типа
FeSi [239]. Существование
соединения Ni3Si долго
отрицалось, однако Лаш-
Рис. 206. Диаграмма состояний системы
Nl—S1
ко [261] это соединение было получено при анодном раство-
рении сплавов Ni-Si, содержащих около 7% Ni. Эта фаза имеет
гранецентрированную кубическую решетку сверхструктурного
Силициды
типа (типа Сп3Лп) с периодом 3,50 кХ. Эта сверхструктура
устойчива до температуры плавления сплава (1150°). Следова-
тельно, эта фаза возникает из жидкого состояния. Твердость
Ni3Si составляет около 400 кг/мм2 (по /7р).
При добавлении в сплав хрома образуется фаза Ni3(Si, Сг)
на основе соединения Ni3Si, сверхструктурные линии исчезают—
хром «размывает» сверхструктурную решетку.
Некоторые свойства силицидов никеля приведены в табл. 117.
Таблица 1'7
Свойства силицидов никеля
I Силицид
Свойство Ni3Si N12S1 1 Ni3Si2 NiSt NiSi2
Содержание кремния, % (вес.) 13,5 19,29 24,17 32,35 48,88
Структура Кубич. Гексаг. Не опре- Ромбич. Кубич.
[261] делена [240] [616]
Периоды решетки, кЛ: 3,797
а ....... 3,50 5,62 5,395+0,005
Ь [261] 4,898 — [240] 5,18 [240] [239]
С ....... — — >— 3,34 [240] —
с/а - 1,290 —— — —
Плотность решетки,
г/см3 ....... — — — 5,92 —
Температура плавле-
ния, °C . . . . • 1150 1290 830 1000 1025
(разл.) 1227] (разл.) 1227] (разл.)
Теплота образования, — ДН ккал/моль . . . [227] • — [227] — 20,5 [606] [227]
Сплавы силицидов
Системы силицид — силицид
Системы с непрерывными рядами твердых растворов
Системы с непрерывными рядами твердых растворов присущи
изоморфным силицидам с малыми различиями в периодах ре-
шетки: MoSi2—WSi2, Cr3Si—Mo3Si, Cr3Si—V3Si.
Сплавы системы MoSi2—WSi2 готовились горячим прессова-
нием смесей порошков исходных силицидов [539, 543, 544].
Кривая изменения веса при нагревании на воздухе имеет от-
четливый минимум при содержании 80% (вес.) WSi2 (рис. 207).
До содержаний в 40% WSi2 сплавы устойчивы против окис-
ления и на их поверхности образуется стеклоподобная, прочно
удерживающаяся па поверхности пленка. Причина резкого сни-
жения сопротивления окислению сплавов дигидридов вольфра-
ма и молибдена, содержащих около 8% WSi2, не установлена.
Сплавы силицидов
363
Система Cr3Si—Mo3Si [587] была исследована металлографи-
чески, измерялась также электропроводность (рис. 208) и стой-
кость соответствующих сплавов против окисления (рис. 209). При
Рис. 207. Кривая окисления спла-
вов MoS12 — WS12
Рис. 208. Электропроводность сплавов
в системах] Mo3Si— Cr,Si; CrSi2—TiSi2;
CrSi3—T aSi3
Рис. 209. Кривые окисления сплавов системы
CrSi2—TaSi2; CrSi2—TiSi2; Cr3Si—Mo3Si
горячем прессовании изоморфные силициды Cr3Si и Mo3Si обра-
зуют непрерывный ряд твердых растворов уже при 1300°. Кривая
электропроводности обнаруживает отчетливый минимум, анало-
гичный минимуму в металлических системах.
Стойкость сплавов Cr3Si—Mo3Si при содержании до 60%
Mo3Si остается практически постоянной, а при больших содержа-
Зб4 Силициды
ниях Mo3Si резко уменьшается. Однако и в области содержаний
до 60% (вес.) Mo3Si сплавы практически не остаются неизмен-
ными; наряду с образованием SiO2 в них проходят два процесса:
окисление хрома до Сг2О3 с соответствующим увеличением веса
и испарение МоОз с уменьшением веса. В точке, соответствую-
щей ~60% Mo3Si, между этими процессами устанавливается
равновесие. Плотная пленка на этих сплавах не образуется и
сплавы не могут считаться стойкими против окисления.
Исследование системы V3Si—MosSi [514], а также V3Si—
Cr3Si [602] проведено Шротом.
Непрерывные ряды твердых растворов обнаружены также в
системах VSi2—NbSi2, V5Si3—Nb5Si3 [575] и Fe8Si — Mn3Si [603]1
Системы с ограниченной растворимостью в твердом состоянии
Системы с ограниченной растворимостью в твердом состоянии
образуют силициды TiSi2—CrSi2, CrSi2—TaSi,, CrSi2 —MoSi
CrSi2—WSi2, ZrSi2—TiSi2-
В системе TiSi2—CrSi2 [514], исследованной металлографи-
ческим методом при одновременном определении электропровод-
ности, обнаружена ограниченная растворимость TiSi2 [до 90%
(мол.)] в CrSi2; при 1300° имеется только узкая двухфазная зо-
на: (Ti, Cr)Si2 и TiSi2. Изменение веса образцов при окислении
показано на рис. 209. По мере добавления TiSi2 к CrSi2 сплавы
становятся все более стойкими против окисления.
Разрыв растворимости в системе TaSi2—CrSi2 [514] при 1300°
простирается от 11 до 60% (мол.) TaSi2. При добавлении TaSi2
к CrSi2 сначала несколько уменьшается стойкость против окис-
ления, затем увеличивается и, начиная с 80 %* TaSi2, вновь резко
уменьшается (рис. 209). В пределах 60—80% (вес.) TaSi2 стой-
кость сплавов выше стойкости отдельных компонентов.
Системы CrSi2—WSi2 и CrSi2—MoSi2 [543, 218] имеют более
узкие двухфазные области. При 1300° MoSi2 растворяет до 41%
(мол.) CrSi2, a WSi2—до 64% (мол.) CrSi2. CrSi2 растворяет
до 31% (мол.) MoSi2 и до 16%' (мол.) WSi2.
Ограниченная растворимость обнаружена также в системах
V5Si3—Zr5Si3, VSi2— MoSi2 [575].
TiSi2—MoSi2 и TiSi2—WSi2 изучены Киффером [543, 216].
TiSi2 практически нерастворим в MoSi2, так же как и в WSi2.
При содержании TiSi2 около 40% (мол.) в сплаве с MoSi2 и при
60% (мол.) в сплаве WSi2, в сплавах дисилицидов возникают но-
вые фазы, имеющие гексагональную структуру типа CrSi2, про-
межуточную между TiSi2 и MoSi2, т. е. со слоями, промежуточ-
ными между АВАВ... и ABCDABCD..., порядок которых АВС
АВС... Эти фазы имеют очень широкие области гомогенности,
например, MoQ 6 _0>05 TiQ 4 _ 0 g5 Si2 [212].
Сплавы силицидов
365
Периоды решеток, кХ
Соединение а с с.а
Tio,5 Л\оо,6 Si2 4,644 6,490 1,39,
Tio,8 Моо,2 Sia 4,6% 6,51, 1,38,
Tio.e Moo,4 Sia 4,680 6,470 1,38s
210. Изменение объема элементарной
Рис.
ячейки при образовании сплавов в системе
ZrSi2—TiSia
Твердые растворы в этих системах образуются аналогично
системе WC—TiC; это образование связывается с вынужденным
полиморфным превращением TiSi2 [212].
Система ZrSi2—TiSi2 также изучена Киффером [199]. ZrSb.
прй 1300° может растворить до 55% (мол.) TiSi2, a TiSi2 раство-
ряет только небольшие
количества ZrSi2.
На рис. 210 показано
изменение объема эле-
ментарной ячейки с изме-
нением состава сплавов.
До 55%, (мол.) TiSi2 объ-
ем элементарной ячейки
изменяется почти линейно,
т. е. TiSi2 растворяется в
ZrSi2 с образованием од-
нородного твердого рас-
твора. В гетерогенной об-
ласти от 55 до 95% (мол.)
TiSi2 оба компонента на-
ходятся в переменной кон-
центрации и объемы их ячеек остаются постоянными. При 95%
(мол.) TiSi2 объем ячейки твердого раствора снижается до зна-
чения объема ячейки чистого TiSi2. Исследование стойкости
против окисления показало (табл. 118), что хрупкость плен-
ки на ZrSi2 несколько компенсируется добавкой весьма устойчи-
вого против окисления дисилицида титана. Склонность к отслаи-
ванию пленки при малых добавках TiSi2 к ZrSi2 сначала увели-
чивается, а начиная с 20%: (мол.) TiSi2 быстро уменьшается.
Таблица 118
Изменение веса сплавов Z rSi2—TiSi2
при 4-часовом нагревании на воздухе при 1300°
Содержание в сплаве, % (мол.) — I Изменение веса ' м г см2 1
ZrSi2 । TiSi2
100 0 + 19,3
80 20 —12,4
60 40 1 + 2,4
40 60 + 1,3
20 80 1 + 1,0
0 100 + 0,4
366
Силициды
В системе TiSi2—MoSi2—WSi2 обнаружен твердый раствор
(Ti, Мо, W) Si2 со структурой типа CrSi2. Эта фаза также имеет
широкую область гомогенности с граничными составами:
(Моо,4 — о.об Tio,6 — 0,95) Si, (Wo,4 —0,005 Tio.e —0,05) Si2 [212].
Ряд фаз с решеткой типа Me5Si3 обнаружен [573] в системах
Ti—Zr—Si, Ti—Mo—Si, Ti—W—Si (в кХ):
Фаза a c С A
(Ti0,6 Zr03) '.Sis 7,7Oo 5,305 0,689
7,3% 5,064 0,685
(Tio 6 Moo^JbSi^ 7,364 5,049 0,686
(Ti0j9 WOjli5Si3 7,386 5,I0s 0,691
(Ti0,8 Wo12)&81я 7,364 5,09s 0,692
(T>o,75 ^0,25)5813 7,36, 5,08. 0,691
Системы с полной несмешиваемостью компонентов
В настоящее время изучена система силицидов ZrSi2—VSi8.
Как и в системах ZrC—VC [470, 471, 199] и ZrN—VN [172], зна-
чительная разница атомных радиусов циркония и ванадия (боль-
ше 15%) и различие структур обусловливают несмешиваемость
соответствующих дисилицидов.
При введении VSi2 в ZrSi2 увеличивается стойкость против
окисления, как и при добавлении TiSi2 к ZrSi2 (табл. 119).
Таблица 119
Изменение веса сплавов ZrSi3 — VS1,
при 4-часовом нагревании на воздухе при 1300°
Содержание в сплаве, % (мол.)
i Изменение веса, мг!см*
ZrSig | VS12
100 । 0 4-19,3
80 20 —80,6
60 40 4-11,9
40 60 4 20,8
20 80 + 6,2
0 100 4- 0,5
Системы силицид—карбид
Тройная система Мо—Si—С была исследована [573] на об-
разцах сплавов, приготовленных горячим прессованием смесей
порошков Мо, Si и сажи с последующим 12-часовым гомогени-
зирующим отжигом при 1600° в вакууме. В системе обнаружено
тройное соединение, изоморфное фазе Mo5Si3 (структура D8&).
Это соединение имеет довольно широкую область гомогенности
с периодами решетки, изменяющимися от а = 7,27, с = 5,05 кХ и
с/а = 0,695 для границы, богатой молибденом, до а —12.1 кХ,
Системы силицид—нитрид
387
с 4,99 кХ, da = 0,687 для границы области, бедной молибденом
(рис. 211). Предполагается, что при образовании этой фазы ато-
мы углерода замещают атомы Si в положениях 6g, в то время,
как последние перемещаются в положение 4d атомов молибде-
на. Тройная фаза может быть выражена формулой
Мов [(Six , Moi—x)4 Су, 8ц_у]с,
причем значения х изменяются от 0,10 до 0,55, а у — от 0,15 до
0,40. Плотность соединения 8,0 г/смг, микротвердость 1460 кг]м.м2.
С
Л МоЗц / Mo3Si2 Mo3Si Мо
MoSi-i tMo Si Sii
• Однофазный в -Д вутфазный л - Трехфазный
Рис. 211. Изотермический разрез диаграммы Мо—Si—С
при 1600°
На тройной диаграмме Мо—-Si—С тройной фазе отвечает плав-
ный максимум.
Аналогичные фазы обнаружены в системах Сг—Si—С и
W—Si—С [571] с формулами: Cr5_x Si3-y CV4-y (а=6,97;
1.’=4,71кА') и Ws—х Si3_y Ctev (tz=7-18; с — 4.84л'Аг), а также
в системе Nb — Si—С [580].
Системы силицид—нитрид
Значительная разница в радиусах атомов азота и кремния и
в этом случае делает возможность образования непрерывных ря-
368
Силициды
дов твердых растворов AleSi—AleN маловероятной. Силициды
термодинамически менее прочны, чем нитриды.
В системах Та—Si—N и Nb—Si—N обнаружены тройные фа-
зы: Nbs-x Si3_y Nx-i-у и fTas-xSia-y Nx+y [571]. Указывается на
образование тройной фазы также в системе Zr—Si—N [580].
Системы силицид—борид
Сплавление боридов с силицидами, а также пропитка боридов
расплавленным кремнием и силицидов расплавленными борида-
ми [4] показывают возможность частичного замещения атомов
бора кремнием, в частности в сплавах Ti—Si—В [173]. Эти спла-
вы могут получаться сплавлением в тигле, покрытом изнутри бо-
ром; они очень тверды, но поддаются деформированию; раство-
ряющийся в них при сплавлении углерод выделяется при от-
жиге.
Использование силицидов в технике
Время, час.
Рис. 212. Изменение веса керметов при окислении на воз-
духе при 1000°:
I—TiC, цементированный железом: II— сплав SiC-TiSia;7 III—TiC,
цементированный никелем; IV — сплав 80% Si-4-20% ТЮ2: V — сплав
SiC-TigSi8
тив окисления до относительно высоких температур, а также на
стойкости против действия минеральных кислот и различных аг-
рессивных газов.
Кэмпбелл [122] описал метод покрытия переходных металлов
IV, V и VI групп периодической системы силицидами пропуска-
Использование силицидов в технике 369
нием над ними смеси SiCl4+H2 при 1100—1800°. Слой силицида,
нанесенный на молибденовые проволоки, сопла для реактивных
двигателей и т. п., устойчив против окисления на воздухе до
1700—1800°. Процесс силицирования молибдена и вольфрама так-
же изучался в работах [555, 556], причем было предложено ис-
пользовать молибден с силицидным покрытием в качестве на-
гревательных элементов высокотемпературных печей сопротивле-
ния, работающих в окислительной атмосфере.
При использовании силицидов для изготовления сопротивле-
ний обычно смешивают их с окислами для уменьшения электро-
проводности [614].
Силицид кобальта CoSi образует жаростойкую связку цемен-
тированных кобальтом стойких против окисления сплавов
TiC+SIC+BiC, используемых в реактивной технике [174].
' Силициды вольфрама и молибдена, так же как и их двойные
силициды с хромом или торием, могут использоваться в качестве
материала лопаток и других деталей газовых турбин [162].
Сплавы TiSi2 с SiC и особенно Ti5Si3 с SiC отличаются высо-
кой стойкостью против окисления, превышающей стойкость це-
ментированного железом и никелем карбида титана (рис. 212).
Эти сплавы могут приготовляться или спеканием TiSi2 с SiC или,
что проще, взаимодействием карбида титана с кремнием:
TiC + 3Si = SiC + TiSi2.
Сверхпроводимость VsSi и некоторых других, силицидов мо-
жет быть использована в технической физике.
24 Г. В. Самсонов
ЛИТЕРАТУРА
1. К. Becker. Hochschmelzende Hartstoffe u. ihre technische Anwen-
dung, 3-е изд., Берлин, 1937 (русский перевод во 2-м изд. ОНТИ, 1936 г.).
2. Я. С. Уманский (при участии А. Е. Ковальского). Карбиды твер-
дых сплавов, Металлургиздат, 1937.
3. Р. Schwarzkopf, R. Kieffer. Refractory Hard Metals, N.-Y.,
1953.
4. R. Kieffer, P. SchwarzKopf. Hartstoffe u. Hartmetalle,
1953.
5. О. НШ, Z. Physik. Chemie (В), II, 433, 1930.
6. A. Mott, W. Jones. Theory of Properties of Metals and Alloys,
Оксфорд, 1936.
7. С. В. В о н с о в с к и й, Я. С. Ш у р. Ферромагнетизм, ГТТИ, 1950.
8. С. В. В о н с о в с к и й. Современное учение о магнетизме, ГТТИ,
1952.
9. А. И. Бублик, Б. Я. П и н е с. ДАН СССР, 87, 1953, стр. 215.
10. I. S. Kasper. Acta metallurgica, 2, 456, 1954.
ll .Shomeker, Bergman. Journal of Amer. Chemical Soc., 72,
5793, 1950.
12. Я. Г. Д о p ф м a h, И. К. Кикоин. Физика металлов, ГТТИ,
1934.
13. В о z о г t h. Ferromagnetism, Нью-Йорк, 1953.
14. С. Д. Г е р ц р и к е н, И. Я. Д е х т я р. ЖТФ, 25, 1955. 36—44.
15. В. И. Смирнова, Б. Ф. О р м о н т. ДАН СССР, 96, 1954,
стр. 1017.
16. О. Н й g g. Nova Acta Reg. Soc. Sci, Upsalensis, IV/7, № 1, 1929.
17. 3. Г. П и н с к e p, С. В. Каверин. ДАН СССР, 96, 1954,
стр. 519.
18. С. М. Николаева, Я. С. Уманский. Известия АН СССР,
серия физическая, 20, 1956, стр. 631.
19. В. А. И вен сен. ЖТФ, 17, 1947.
20. А. X. Бреге р. ЖФХ, 13, 1939, стр. 272, 1483.
21. В. И. Смирнова, Б. Ф. Ормонт. ДАН СССР, 100, 1955, стр.
127.
22. С. Bernal. Ergebnisse der technischen Rontgenkunde, 1931
(русский перевод в сборнике «Металлофизика», т. II, ГГТИ, 1931).
23. А. X. Бреге р. ЖФХ, 15, 1941, стр. 927.
24. Р. Me Кеппа. Metal Progress, 36, 152, 1939.
25. Biggs. Phyl. Mag., 32, 131, 1916.
26. R о s e n h a 1 1. Ann. d. Physik, 24, 297, 1935.
27. Ubbelode. Proc. Roy. Soc. A, 159, 295, 1937 (перевод «Успехи
химии», 7, 1692, 1938).
28. Wi gner, H u n t i n g t о n. J. Chem. Physic., 3, 764, 1935.
29. R о s e n h a 1 1. Ann. d. Physik, 18, 1950, 1933.
30. R о h e n, Specht. Z. f. PhysiK, 62, 1, 1930.
31. Я. С. Уманский, Металловедение и термическая обработка, XX
сб. трудов Московского института стали, Металлургиздат, 1940, стр. 3.
32. Т. Т a k е i. Kinzoku no Kenkyo, 97—124; 142; 1932.
33. H. С. К у р н а к о в. Растворы и сплавы, «Основы химии» Д. И. Мен-
делеева, изд. IX ГИЗ, 1928.
34. J е n s е n. J. Iron Steel Inst., 2, 187, 1929.
Литература
371
35. S с h е i 1. Arch. Eisenhiittenwesen, 2, 10, 1929.
36. В. H. С в е ч н и к о в. ЖТФ, 4, 1934, стр. 253.
37. Т. А. Лебедев. Основные положения новой теории железоугле-
родистых сплавов, Ленинград, 1939.
38. В. И. Просвирин. Вестник металлопромышленности, 17,
1937, стр. 102.
39. W. Seith, О. Kubaschewski. Z. Elektrochem., 45, 551, 1939.
40. Т. А. Лебедев, В. М. Гутерман. Труды ЦНИИТМАШ,
1950. Машгиз.
41. Ю. М. Лахтин. Физические основы процесса азотирования, Маш-
гиз, 1948.
42. Е. G u 1 b г a n s е п, К. Andrew. J. Metals, 187, 741, 1949; 188,
568, 1950.
43. Polty, Margolin, Nilsen. Trans. Americ. Soc. Metals, 46,
312, 1954 (перевод в сб. «Титан», вып. 4, 41, ИИЛ, 1954).
44. А. Е. Ковальский, Л. А. Петрова. Сб. «Микротвердость»,
изд. АН СССР, 1951, стр. 170.
45. А. Е. Ковальский, Т. Г. Макаренко. Сб. «Микротвер-
дость», изд. АН СССР, 1951, стр. 187.
46. Pom еу, de Roux. С. г., 238, 814, 1954.
47. Г. A. At е е р с о н, Я. С. Уманский. Известия сектора физико-
химического анализа АН СССР, 22, 104, 1953.
48. Б. В. Некрасов. Курс общей химии, Госхимиздат 1948, стр.
894—905.
49. А. Дьяконов, А. М. Самарин. Изв. ОТН АН СССР, № 9,
1945, стр. 813—821.
50. S. Т а к е d a. Techn. Rept. Tohoku Imp. Univ. 9, 183, 627, 1930.
51. D. Me Pherson, M. Hansen. Z. Metallkunde, 45, 76—82, 1954.
52. A. Me Q u i 1 1 a n, Proc. Roy. Soc., 204, 309, 1950.
53. T. G i b b , H. Kruschwitz. J. Am. Chem. Soc., 72, 5365—69
1950.
54. H. Schaumann. Патент США, 2508775, 1950.
55. Metals Industry, 86, 272, 1955.
56. Г. A. M e e p с о н, Г. А. Кац, А. В. Хохлова. ЖПХ, 13,
1940, стр. 1770—1776.
57. Г. А. М е е р с о н, О. П. Колчин. Труды Минцветметзолото,
.Vs 25, Металлургиздат, 1955, стр. 195—208.
58. Р. Alexan der. Metals a. Alloys, № 2, 37, 1934.
59. Т. G i b b. J. Me S h a r r y, R. В r a g d о n. J. Am. Chem., 73,
1751—1755, 1951.
60. H. S t r a u s s. Steel, 118, 138, 160, 1946.
61. S. Takeda. Techn. Rept. Tohoku Imp. Univ. 10, 42—92, 1931.
62. S. Takeda Techn. Rept. Tohoku Imp. Univers. 15, 436—492, 1936.
63. Siewerts, Roel. Z. anorg. Chemie, 153, 304, 1926.
64. J. Belle, B. Cleland, M. M о 1 1 e t. J. Electrochem. Soc.,
101, 211—214, 1954.
65. E. Gulbransen, K. Andrew. J. Electrochem. Soc., 101,
348—353, 1954.
66. M. П. Славинский. Физико-химические свойства элементов,
Металлургиздат, 1952.
67. Б. Ф. О р м о н т. Структуры неорганических веществ, ГИТТЛ, 1950.
68. J. Fitz william, A. Kaufman, С. Squire, j. Chem.
Phys., 9, 678, 1941.
69. E. Gulbransen, K. Andrew. J. Electrochem. Soc., 101,
474, 1954.
70. H . Rentschler, D. G e n r y. Electrochem. Soc., Preprint,
№ 87—14, 155, 1945.
24*
372
Литература
71. R. Rundle, С. Shull.E.Woolen. Acta Cryst., 5, 22—26, 1952.
72. G. Miller. Zirconium, London, 333—337, 1954.
73. Zirc. and Zirconium Alloys, Cleveland, 331—336, 1953.
74. W. E s p e. Zirconium, Fiissen/Bayern, 9—11, 1953.
75. H. H a u s n e r. Powd. Metall. Bull., 6, 41—43, 1951.
76. A. Rogers. Trans. Electrochem. Soc., 88, 211, 1946.
77. H. H a u s n e r. Plansee Berichte, 1, 146—156, 1953.
78. К. Смиттел ьс, Газы в металлах, Металлургиздат, 1940.
79. Sandford and Trent. Symposium on Powder MeTallurgy,
Iron and Steel Inst., Special Report 38, 84, 1947.
80. H a a g e n, A. Siewerts. Z. anorg. Chemie, 185, 1930.
81. A. Siewerts, H. M о r i s c h. Z. anorg. Chemie, 247, 124,’1941.
82. Я- С. Уманский. ЖФХ, 14, 1940, стр. 332—339.
83. D. Gardner. Патент США, 2516863, 1950.
84. F. Horn, W. Ziegler. J. Am. Electrochem. Soc., 69, 2762—69,
1947.
85. E. H. Кислякова. ЖФХ, 17, 1943, стр. 108.
86. R. К i s s 1 i n g. Pr. Int. Symp. on Reactivity of Solids. 1952, 1065.
87. A. Siewerts, Gotto, Halberstadt. Z. anorg. Chemie,
187, 1930.
88. P. Rudiger. Metall 7, 967—9, 1953.
89. K- Andrews. J. Am. Chem. Soc., 54, 1932.
90. Pietsch, Zeh 1. Kolloid. Zs., 68, 1934.
91. M. А. Борисова. Сб. «Рентгенография в применении к исследо-
ванию материалов», Оборонгиз, 1936, стр. 299.
92. В. Р. Голик, Б. Г. Лазарев, В. И. Хоткевич. ЖЭТФ,
19, 1949, стр. 202.
93. A. Van А г k е 1. Reine Metalle, Berlin, Springer, 1939.
94. А. Б у p x a p д т. Механические и технологические свойства чистых
металлов, Металлургиздат, 1941.
95. В. А. Константинов. Сб. «Физико-химические свойства жид-
ких металлов», Оборонгиз, 1952, стр. 128—136.
96. G. Snavely, D. Vaughan. J. Am. Chem. Soc., 71, 313—314.
1949.
97. T. Dillon. Proc. Phys. Soc., 41, 1929.
98. G. Stea d. Phil. Mag., 6, 48, 1924.
99. G. Messner. F r an ken b er ger, Z. phys. Chemie, Bodenstein—
Festband, 1931.
100. Roberts. Proc. Cambridge Phil. Soc., 30, 1934.
101. В. П. Елютин, Ю. А. Павлов, Б. E. Левин. Производ-
ство ферросплавов, ч. 2, Металлургиздат, 1950.
102. Е. Rotter, Н. Lukens. Metals Technology, 13, № 6, 1946.
103. Е. Rotter, R. Huber. Phys. Rev., 68, 24, 1945.
104. И. И. Корнилов. Изв. АН СССР, ОХН, № 2, 1945, стр. J04.
105. М. М. Карнаухов, А. Н. Морозов. Изв. АН СССР, ОТН,
№ 12, 1948, стр. 1845.
106. L. Moro, I. Ch or don. С. г., 219, 507, 555, 1944.
107. Никель и его сплавы, перераб. А. Е. Волом, под редакцией
М. П. Славинского, Металлургиздат, 1932.
108. Б. В. Ерофеев, К. А. Печерская, М. С. Стаханова.
ЖОХ, 11, 1941, стр. 577.
109. R. В о n d 1 е у. Electronics, 7, 97—99, 1947.
НО. W. Е s р е. Powd. Metall. Bull. 3, 101—102, 1948.
111. R. Bond ley. Chem. Age, 58, 15—18, 1951.
112. С. P e a r s e 1 1. Materials and Methods, 30, 61—62, 1949.
113. E. Ruh. Ceramic Age, 55, 236, 1950.
Литература
373
114. Chem. Abstracts, 47, 284, 1954.
115. Chem. Abstracts, 46, 1730, 1952.
116. H. H a u s n e г, H. К a 1 i s c h, R. Angier. J. Metals, 3,
625—33, 1951.
117. Chem. Abstracts, 44, 8850, 1950.
118. E. Wiberg, R. L a c e 1. Chem. Abstr., 47, 3746, 1953.
119. Г. Б. Б о к и й. Введение в кристаллохимию, МГУ, 1954.
120. Н. Goldschmidt. J. Iron Steel Inst., 160, 345—52, 1948.
121. Я- С. Уманский. Известия сектора физико-химического ана-
лиза АН СССР, 16, 1943, стр. 127—148.
122. I. Kampbelle, С. Powell, D. Novicki, В. О о n s е г.
J. Electrochem. Soc., 96, 318—33, 1949.
123. В. H. Еременко- Карбид титана и жаростойкие сплавы на его
основе, Изд. АН УССР, 1954.
124. К. Becker. Z. Electrochemie, 34, 640—42, 1928; Z. Metallkunde,
20,437—41,1928. c
125. К. Moers. Z. anorg. Chemie, 198, 243—261, 1931.
126. L. Andrieux, P. Lebeau x. Les hautes temperatures et leurs
utilisations en Chimie, В. 1, 375—446, Paris, 1950.
127. L. A n d r i e u x, G. Weiss. Bull. Soc. Chim. France, 15, 598 —
601, 1948.
128. F. Glaser, W. I v a n i c k. J. Metals, 4, 387—90, 1952.
129. Chem. Age, 67, 469—71, 1952.
130. A. Williams. Metal Treatment, 18, 445—49, 1951.
131. P. Chiotti. J. Am. Ceram. Soc., 35, 123—30, 1952.
132. B. Post, F. G 1 as er, D, Moskowitz. Acta Metallurgica
2, 20—25, 1955.
133. В. A г о n s s о n. Acta Chemica Scandinavica 9, 1107—1110, 1955.
134. E. F r i e d e r i c h, F. S i 11 i g. Z. anorg. Chemie, 144, 169—189,
1925.
135. L. Brantley, A. Beckmann. J. Am. Chem. Soc., 52, 3956,
1930.
136. C. Agte, K. Moers. Z. anorg. Chem., 198, 236, 1931.
1'37 . B. Jacobson, A. Wes t gr en. Z. physik. Chemie, B, 20, 362,
1933
138. A. van A r ke 1. Phisyca, 4, 286, 1924.
139. R. Becker, F. Ebert. Z. Physic, 31,268, 1925.
140. L. В r a n t b y. Z. Krystallographie, 77, 505, 1931.
141. A. Schwarz, O. Summa. Z. Electrochem., 38, 743, 1932.
142. W. Burgers, I. В a s a r t. Z. anorg. Chemie, 216, 209—221, 1934.
143. W. D a w i h 1, W. R i x. Z. anorg. Chemie, 244, 191—197, 1940.
144. Г. A. M e e p с о н, Г. Л. Зверев, Б. E. О с и н о в с к а я.
ЖПХ, 13, 1940, стр. 66—75.
145. Р. Erlich. Z. anorg. Chemie, 259, 1—40, 1949.
146. Г. А. М е е р с о н. Редкие металлы, № 5, 1934.
147. Я- С. Уманский, С. С. X и д е к е л ь. ЖФХ, 15, № 9, 1941.
148. Г. А. М е е р с о н. Известия сектора Физико-химического анализа
АН СССР, 16, 1943, стр. 213.
149. Г. А. М е е р с о н, Я- М. Липкес. ЖПХ, 12, 1939, стр. 1759—
67; 14, 1941, стр. 291—301; 18, 1945, стр. 24—34, 255—258.
150. Г. В. Самсонов, ЖПХ, 28, 1955, стр. 1018—1021.
151. Г. А. М е е р с о н, О. Е. К р е й н. ЖПХ, 25, 1952, стр. 134—147.
152. G. Huttig, V. Fattinge г. Powd. Metall. Bull., 5, 30—37,
1950.
153. A. M й n s t e r, W. Ruppert. Z. Electrochem., 57, 558—564,
1953.
374
Л итература
154. A. Mflnster, W. Ruppert. Z. Electrochem., 57, 564—571,
1953.
155. I. Cadoff, I. Nielsen. J. Metals, 5, 248—252, 1953.
156. В. С. Куцев, Б. Ф. О p м о н т. ЖФХ, 29, 1955, стр. 597—601.
157. A. E. Ковальский, T. Г. Макаренко. Ж1Ф, 23, 1953,
стр. 265—66.
158. A. H. 3 e л и к м а и, Н. Н. Горовиц. ЖПХ, 23, 1950, стр.
689—695.
159. А. А. Ч е р е п н е в. Проблемы хлорирования в области редких
и рассеянных элементов. Металлургиздат, 1940.
160. F. Pollard, Р. Woodwork Trans. Faraday Soc., 46, 190,
1950.
161. В. Weber, P. Hessin ger. J. Amer. Cer. Soc., 37, 267—272,
1954.
162. P. Schwarzkopf. Can. Pat., 488351, 1948.
163. W. Engel. Metall Progress, 59, 664, 1951.
164.0. Comstock, S. Urban, H. Cohen. Titanium in Steel,
N.-Y., 1949.
165. J. Nelson, T. William, R. Womels dor p h. J. Ele-
ctrochemie Soc., 98, 465, 1951.
166. C. Me Bridge, H. Greenhouse, T. Shevlin. J. Arne-
ric. Cer. Soc., 35, 28, 1952.
167. B. Naylor. J. Amer. Chem. Soc., 68, 370—71, 1946.
168. P. Bridgman. Pr. Amer. Acad., 66, 255, 268, 1932.
169. R. Silverman n, P. Juscz, Powd. Met. Bull. 7, 25—28, 1954.
170. J. Norton, A. Mowry. Trans. AIMME, 185, 183, 1949.
171. A. E. Ковальский, Я- С. Уманский. ЖФХ, 20, 1946,
стр. 773—796.
172. Н. Novotny. Planseeberichte Pulvermetallurgie, 1, 47, 1953.
173. Немецкий патент № 349785, 1952.
174. Н. Greenhouse, R. Soops, Т. Shevlin. J. Amer.
Cer. Soc., 37, 203—206, 1954.
175. A. Van Arkel, I. В о e r. Z. anorg. Chemie, 148, 347—48, 1925.
176. C. Prescott. J. Am. Chem. Soc., 48 , 2534— 50, 1926.
177. Г. A. M e e p с о н, Г. В. С а м co н о в. ЖПХ, 25, 1952, стр. 744—
748.
178. С. Prescott, Н i п с k е. J. Am. Chem. Soc., 49, 2774, 1927.
179. Г. В. Самсонов и Н. С. Р о з и н о в а. Известия сектора фи-
зико-химического анализа АН СССР, 27, 1956, стр 126.
180. Г. А. Меер сон, Г. В. Самсонов, М. М. Борисов.
«Заводская Лаборатория», № 2, 1953, стр. 243—45.
181. W. L i d m а п, Н. Н a m i j а п. J. Am. Cer. Soc., 35, 236—240,
1952; см. также перевод в сб. «Химия и химическая технология», 4, № 4 (39),
1953.
182. О. К у б а ш е в с к и й, Э. Эванс. Термохимия в металлургии,
ИИЛ, 1954.
183. Патент США 2310964.
184. Р. Cotter, I. Kohn. J. Am. Ceramic Soc., 37, 415—420, 1954.
185. Германский патент 499069, 1928.
186. R. Kieffer F. Benesovs ky. Metall, 6, № 7/8, 171—176;
№ 9/10, 243—250, 1952.
187. A. Lomas. Mach. Lloyd Europ. Ed., 25, 103, 105—106, 1953.
188. C. G о e t z e 1. Treatise Powder Metallurgy, N.-Y., 2, 80, 1950.
189. A. K. Bobrowsky. Trans. Americ. Soc., Meeh. Eng., 11, 6, 621,
1949.
190. R. Kieffer, W. К 6 1 bl. Powd. Met. Bull., 4, 4, 1949.
191. G m e 1 1 i n s. Handbuch anorg, Chemie, Titan, 1951.
Литература
375
192. W. Kroll. Z. anorg. Chemie, 234, 42, 1937.
193. T. Vas i los, W. К i n g er y. J, Am. Cer. Soc., 37. 409—414, 1954.
494. I. G angler. J. Am. Cer. Soc., 33, 367, 1950. К-Г7
195. W. Klemm, W. Schutt. Z. anorg. Chem., 201, 24—31, 1931.
196. D. Goldwater, R. Haddad. J. Appl. Phys., 22, 70—73,
1951.
197. W. Meissner, H. Franz. Z. Physik, 65, 30, 1930.
198. W. Meissner, H. Franz, H. Wes ter ho ff. Z. Physik,
42, 349, 1941.
199. H. Novotny, R. Maschenschalk, R. Kieffer,
F. Benesovsky. Mh. Chem., 85, 241, 1954.
200. H. Novotny, R. Kieffer. Z. Metallkunde, 38, 257, 1947.
201. E. Maurer. Stahl und Eisen, 45, 1629—32, 1925.
202. Oldman n, Fischel. Z. Physik, 31, 268, 1925.
203. A. О s a w a, M. О у a. Sci. Pep. Tohoku Univ., 19, 95—108, 1930.
204. R. Vogel, W. Д1 a r t i n. Arch. Eisenht+tenwesen, 4, 487—495,
1930/31.
205. О. H a g g. Z. Physik. Chemie, B, 12, 33—56, 1933.
206. A. Westgren. Metallwirtschaft, 9, 919—23, 1930.
207. Morett, Urbain. Bull. Soc. Chim. France, 5, 1938.
208. H. Krainer, K- Konopicky. Berg.-und Htittenmann.
Mh., 92, 166—78, 1947.
209. M. А. Гуревич и Б. Ф. О р м о н т. ДАН СССР, 96, 1954,
стр. 1165.
210. F. Richardson. J. Iron and Steel Inst., 175, ч. 1, 33—51,1953.
211. E. Kin g. J. Amer. Chem. Soc., 71, 316—317, 1949.
212. H. Novotny. Pulvermetallurgie, 1 Plansee Seminar «De re me-
tallica», 296, 1953.
213. P. Me К e n n a. Ind. Eng. Chem., 28, 267—72, 1936..
214. E. Maurer, W. Dfiring, H. Pulewka. Arch. Eisen-
hiittenwesen, 13, 337—44, 1939/40.
215. Я. С. Уманский. ЖФХ, 14, 1940.
216. Л. П. М о л ь к о в, А. В. Хохлова. Редкие металлы, 4,
1935, стр. 10—23.
217. G. Brauer, Н. Renner, Н. Wernet. Z. anorg. Chem.,
277, 249—257, 1954.
218. Н. Novotny, R. Kieffer, H. Schachnef. Mh. Chem.,
83, 1243—52, 1952.
219. К. В e c k e r, H. E w es t. Z. techn. Physik, 11, 148—50, 216—20,
1930.
220. F. E 1 1 i n g e r. Trans. Am. Soc. Metals, 31, 89—102, 1943.
221. В. И. Смирнова, Б. Ф. О p м о н т. ДАН СССР, 96, 1954,
стр. 557—560.
222. В. И. С м и р н о в а, Б. Ф. О р м о н т. ДАН СССР, 100, 1955,
стр. 127—130.
223. W. Koster, W. Rauscher. Z. Metallkunde, 39, 111—120,
1948.
224. C. Agte, H. A Iter th urn. Z. techn. Phys., 11, 182—191, 1930.
225. S. Sindeband, P. Schwarzkopf. Powd. Met. Bull.,
5, 42—43, 1950.
226. K. Becker, H. E w e s t. Z. techn. Physik, 11,148, 216,1930.
227. W. Ouertler, G. Tamman. Z. anorg. Chem., 49, 93—112,
1906.
228. W. Grafts, I. Lamont. Trans. A1MME, 188, 561—74, 1950.
. 229. F. Wever, W. Koch. Archiv Eisenhflttenwensen, 21, 143—52,
1950.
376
Литература
230. 1. Brown, D. Clark. Nature, 167, 728, 1951.
231. M. Хансен. Структуры бинарных сплавов, Металлургиздат,
1941.
232. В. Owen, R. Webber. Am. Inst. Min. Met. Engrs., Techn.
Publ., № 2306, 1948.
233. D. Bloom, N. Grant. J. Metals, 188, 41—46, 1950.
234. O. Ruff, T. F о e h r. Z. anorg. Chemie, 104, 27—46, 1918.
235. K. Kuo, O. H3gg. Nature, 170, 245—246, 1952.
236. A. Westgren. Nature, 132, 480, 1933.
237. A. Westgren. Jernkontorets Ann., 119, 231, 1935.
238. K. Hellborn, A. Westgren. Swensk, Kemisk Tids., 7 141
1933.
239. K. Schubert, H. Pfisterer. Z. Metallkunde, 41, 433—41
1950.
240. K. Toman. Acta Krystallogr., 4, 462—4, 1951.
241. A. Westgren, G. P h r a g m e n. Z. anorg. Chem., 156, 27—36
1926.
242. S. Hoyt. Trans. Am. Inst. min. miner. Engrs., 89, 9—58, 1930.
243. H. T u t i у a. Sci. Pap. Inst. phys. Chem. Res., Tokio, 19 , 384— 92,
1932. >
244. W. Sykes, K. Horn, C. Tucker. Trans. Am. Inst. min.
met. Engrs., 117, 173—86, 1935.
245. I. Lander, L. G e r m e r. Am. Inst. min. met. Engrs., Techn.
Publ., № 2259, 1947.
246. H. Novotny, R. Kieffer. Z. anorg. Chemie, 267, 261—64,
1952.
247. W. D a w i h 1. Z. anorg. Chemie, 262, 212—217, 1950.
248. W. Meissner, H. Franz. Z. PhysiK, 63, 558, 1930.
249. Сб. трудов по технической физике, АН СССР, 1948, стр. 13—20.
250. Z. Physik. Chem., В 29, 231—35, 1935.
251. F. Bertaut, P. Blume. C. r., 231, 626—28, 1950.
252. W. Sy k e s. Trans. Am. Soc. Steel Treet., 18, 968—91, 1930.
253. E. Fitz er. Z. Metallkunde, 44, 462—472, 1953.
254. F. S c a u p y. Z. Electrochemie, 33, 487—91, 1927.
255. K- Becker. Z. Electrochemie, 34, 640—42, 1928; Z. Physik, 51,
481—89, 1928; Z. Metallkunde, 20, 437—441, 1928.
256. Г. A. M e e p с о h. Редкие металлы, 4, № 5, 1935, стр. 6—20.
257. Г. С. Креймер, Л. Д. Э ф р о с, Е. А. Воронкова. ЖТФ,
22, 1952, стр. 848—76.
258. A. Chretien. С. г., 234, 2608—09, 1952.
259. A. Van Arkel. Physica, 3, 76—78, 1927.
260.____D. Hurd, H. Me E n t e e, P. В r i s b i. Ind. Eng. Chem.,
44 2432 35 1952.
261. H. Ф. Л а ш к о. ДАН СССР, 81, № 4, 1951, стр. 605—607.
262. G. Р f a u, W. Rix. Z. Metallkunde, 45, 116—118, 1954.
263. С. A g t е, I. V а с е k. Hutnike Listy, 8, 249—52, 1953.
264. К. Becker, R. Н б 1 b 1 i n g. Z. angew. Chemie, 40, -512—13,
1927.
265. C. A g t e. Metallwirtschaft, 401, 1930.
266. J. Me L e n n a n, J. Allen, J. Wilhelm. Trans. Roy. Soc.,
Canada, 25, 13, 1931.
267. G. H a g g. Z. Krist, 89, 92, 1934.
268. E. О h m a n. Jernkontorets Ann., 128, 13, 1944.
269. M. I s о I e. Sci. Rep. Res. Inst. Tohokuuniv. (A), 3, 468—490, 1951.
270. K. Jack. Nature, 158, 60, 1946.
271. A. Westgren, G. P hr a gmen. J. Iron Steel Inst., II, 95,
1940.
Литература
377
272. Н. Hendricks. Z. Krist, 74, 534, 1930.
273. H. Lipson, N. Petch. J. Iron and Steel Inst., II, 95, 1940.
274. А. А. Байков. Сборник трудов АН СССР, т. II, 1948, стр. 70,
275. С. С. Штейнберг. Металловедение, т. II. Металлургиздат,
1933, стр. 246; С. Штейнберг, В. И. Зюзин, Металлург, № 8, 1936, стр. 3.
276. П. А. Грузин, Г. В. Курдюмов, Р. И. Энтин. Метал-
лург, № 8, 3, 1940.
277. А. Б. А п а е в, ЖТФ, 23, 1953, стр. 1192.
278. М. П. Арбузов и Г. В. Курдюмов. ЖТФ, 10, 1940, стр.
1098.
279. И. В. И с а й ч е в, ЖТФ, 17, 1947, стр. 835, 839.
280. Я. С. Уманский. Труды Московского института стали, вып. 28,
Металлургиздат, 1949, стр. 260.
281. К- J а с k. J. Iron and Steel Inst., 169, 26, 1951.
282. С a 1 i a n. Clews. J. Iron and Steel Inst., 170, 252, 1952.
283. M. П. Арбузов. Известия АН СССР, серия физическая, 15, 16,
1951; Вопросы физики металлов и металловедения, Киев, 1952, № 3, стр. 53.
284. Е, В г i n е г, R. S е n g 1 е t. J. de Chim. Physique et Revue ge-
nerate des Coteides, 13, 351, 1915.
285. T. Bahr. Ber. deutsch. Chem. Ges., 61, 2177, 1938; 63, 99, 1930.
286. I. Schmidt. Z. anorg. allg. Chem., 216, 85, 1933.
287. R. Kolhaus, W. Mayer. Metallwirtschaft, 17, 786, 1938.
288. G. В r e d i g, E. В e r g k a m p f. Z. physik. Chemie, Badenstein,
Anniversary Volums, 177, 1931.
289. G. Becker. Metallurgia, 9, 296, 1912.
290. U. Haschimoto. Kinzocu no Kenkyu, 9, 57, 1932.
291. R. S c h e n к, U. К 1 a s. Z. anorg. Chemie, 178, 146, 1929.
292. O. R u f f , F. К e i 1 i g. Z. anorg. Chemie, 88, 410, 1914.
293. W. Mayer. Metallwirtschaft, 17, 413, 1938.
294. N. Schonberg. Acta Chem. Scand., 8, 624—626, 1954.
295. H. Bahr, V. Jessen. Ber. deutsch. Chem. Ges., 63, 2226, 1930.
296 L. Hofer, W. P e e b 1 s. J. Am. Chem. Soc., 60, 893, 1947.
297.1. Clarke, K. Jack. Chem. and Ind., 1004—1005, 1951;
R. Juza, H. Ruff Naturwissensch., 38, 391, 1951.
'298. Metall, 9, 38, 1955.
299. C. A g t e, К. A 11 e r th u m. Z. techn. Physik, № 6, 1930.
300. Л. П. M о л ь к о в, И. В. В и к к е р. Вестник металлопромыш-
ленности, 8, 1936, стр. 75.
301 .А. Е. Ковальский, Я. С. Уманский. ЖФХ, 20 1946,
стр. 769; 20, 1946, стр. 929.
302. J. Nor ton, М о и г у. J. Metals, 1, 133, 1949.
303. J. N о г t о n, Moury. J. Metals, 3, 923, 1951.
304. Nowotny, Parthe, Kieffer, Benesowsky. Zs. f.
Metallkunde, 45, 97, 1954.
305. Я. С. Уманский, С. С. X и д e к e л ь. ЖФХ, 15, 1941,
стр. 997.
306. R. Kieffer. Powd. Metall. Bull., 6, 22, 1951.
307. Trent, Carter, Bateman. Metallurgia, 42, 111, 1950.
308. Metcalfe. J. Inst. Metals, 73 , 591, 1947.
309. В. П. Львовская, Я. С. Уманский. ЖТФ, 20, 1950,
стр. 1167.
310. А. Н. 3 е л и к м а н. Труды Минцветметзолота, № 14, 1946, стр. 240.
311. J. Me М u 1 1 i n, J. Norton. J. Metals (II Sect.), 5, 1205, 1953.
312. Edwards, Raine. Plansee Proc., 1952, стр. 232.
313. H. С. Курнаков, Г. Г. Уразов. Z. anorg. Chemie, 123,
92_______107, 1922.
314’ . S t e i n i t z. J. Metals, 5, 871, 1953.
378
Литература
315. N. Schonberg. Acta Metallurgica 2, 427, 1954.
316. R a u tai a, Norton. J. Metals, 4, 1045, 1952.
317. W e s t g r e n. Jernkontorets Ann., 1, 1, 1933.
318. Я- С. Уманский, H. T. Чеботарев. Известия АН СССР,
серия физическая, 15, 1951, стр. 24.
319. Н. В. Белов. Структура ионных кристаллов и металлических фаз,
Изд. АН СССР, 1947.
320. 1. Hayghton, М. Meeker. J. Iron Steel Inst., 121, 315—35,
1930.
321. C. Hoffmann, G. Ault, I. G a n g 1 e r. Naca Techn. Note,
№ 1836, 1949.
322. Harwood. Metal Powder Association, April, 36—50, 1952.
323. Harwood. Materials and Methods, 36, 87—91, 1952.
324. Ceramic Industry, 64, 70—72, 74, 101, 1955.
325. P f a f f i n g e r. Planseeberichte fflr Pulvermetallurgie, 3, 17—33, 1955.
326. 0. Mayer. Ber. deutsch. Chem. Ges., 11, 333—63, 1930; 4,
193—98, 1930.
327. Немецкие патенты № 231231 и 234446, 1910.
328. W. Kroll. Trans. Electrochem. Soc., 92, 187—201, 1947.
329. O. Mayer. Ber. deutsch. Chem. Ges., 11, 333—63, 1930.
330. Американский патент 789609, 1905.
331. R. Kieffer, F. К о 1 b 1. Powder Metall. Bull., 4, 17, 1949.
332. Немецкие патенты № 536749, 1930 и 437165, 1924.
333. C. A g t е, Н. А 1 t е г t h u m. Z. techn. PhysiK, 11, 182—91,
1930.
334. W. Patton. Iron Age, 168, 87, 1951.
335. Crowe. Materials and Methods, 34, 69, 1951.
336. Beuediks. Iron Age, 169, 205, 1952.
337. I. Kennedy. Materials and Methods, 36, 166—174, 1952.
338. A. Williams. Metal Treatment, 18, 445—49, 1954.
839. Г. В. Самсонов. Порошковая металлургия в машиностроении
капиталистических стран, ИТЭИ АН СССР, Москва, 1955.
340. В. В. Григорьева. Металловедение и обработка металлов,
№ 2, 1955, стр. 57—60.
341. R. Kieffer. W. Н о t о р. Pulvermetallurgie u. Sinterwerk-
stoffe, Berlin, 1943.
342. В. С. Раковский иН. Р. Айдере. Основы производства
твердых сплавов, Металлургиздат, 1951.
343. Н. Н a m i j a n, W. Lidman. J. of Metals, 5, 696—699, 1953.
344. B. Matthias. Phys. Rev., 92, 874—76, 1953; Powd. Metall. Ди11.,
6, 189, 1953.
345. Г. В, Самсонов. ДАН СССР, 93, 1953, стр. 689—692.
346. A. Ch. В г е g е г. Acta Physicochimica URSS, 10, 593, 1939.
347. Б. Ф. О р м о н т. ЖФХ, доп. том, 1947. стр. 72—73.
348. R. Rundle. Acta Krystallographica, 1, 180—187, 1948.
349. W. Hume-Rothery. Phil. Mag., 171, 44, 1154, 1953.
350. P. Alexander. Chem. Abstracts, 43, 5162, 1949.
351. A. Ch. В r e g e r. Acta Physicochimica URSS, 10, 187, 902, 1939.
352. V. A. E p p e 1 b a u m, A. Ch. В r e g e r. Acta Physicochimica URSS,
13, 595—99, 1940.
353. H. Hah n. Z. anorg. Chemie, 258, 58—68, 1949.
354. P. D u w e z, F. Odell. J. Electrochem. Soc., 97, 299—304,
1950.
355. В. П. P e м и н. Вестник металлопромышленности, 18, 1938, стр.
5763.
1 З56. О. Ruff, F. Е i s n е г. Ber. deutsch. Chem. Ges., 41, 2250—64,
908; 42, 900, 1909.
Литература
379
357. Е. Friedrich, Z. S i t t i g. Z. anorg. Chemie, 143, 293—
320, 1925.
358. A. H. Зел и км а н, С. С. Лосева, H. fl. Ц e й т и н а. Цвет-
ные металлы, 20, 1947, стр. 41—49.
359. Е. Белякова, А. Комар, В. Михайлов. Металлург,
15, 1940, стр. 5—8.
360. Omelin-Kraut. Handbuch der anorg. Chemie, 153, 304, 1926.
361. Hoffman, Schrader. Arch. Eisenhflttenwesen, 10, 65, 1936.
362. Г. В. Самсонов. ДАН СССР, 86, 1952, стр. 329—332.
363. I. Boer, I. Fast. Z. anorg. Chemie, 153, 1—8, 1926.
364. M. Mallet, I. Belle, B. Cleland. J. Electrochem. Soc.,
101, № 1, 1—5, 1955.
365. R. Ischii. Sci Pap. Inst. Phys. Chem. Res., Tokio, 41, 1—21, 1943.
366. Coughlin, King. J. Amer. Chem. Soc., 72, 2202—55, 1950.
367. С. Д э ш м а и. Научные основы вакуумной техники, НИЛ, 1950.
стр. 655—658.
368. К. SchrOter. Z. Metallkunde, 32, 425, 1940.
369. Р. Her as i m en ко. Trans. Farad. Soc., 34, 1245, 1938.
370. Г. В. Самсонов и E. В. Петра ш. Металловедение и
обработка металлов, 1, № 4, 1955.
371. Р. Clausing. Z. anorg. Chem., 208, 401—419, 1932.
372. W. Meissner, H. Franz, H. Wes ter h of f. Z. Phys.,
75, 521—30, 1952.
373. И. И. Жуков. ЖРФХО, часть химическая, 42, 1910, стр. 40.
374. В. А. Э п е л ь б а у м, Б. Ф. Ормонт, ЖФХ, 21, 1947, стр. 3—9.
375. В. А. Э п е л ь б а у м, А. X. Брегер. ЖФХ, 14, 1940, стр.
1599-1601.
376. А. X. Брегер, В. А. Эпельбаум. ЖФХ, 1940, стр. 1602—
1603.
377. Е. К i n g. J. Am. Chem. Soc., 71, 316—317, 1949.
378. C. S h о m a t e, K. Kelley. J. Am. Chem. Soc., 71, 314—315,
1949.
379. 0. Brauer, J. lander. Z. anorg. Chem., 270, 160—178, 1952.
380. N. Sch6nberg. Acta Chem. Scand., 8, 202—212, 1954.
381. A. Jove. C. r., 134, 1577—79, 1902.
382. fl. С. Уманский. ЖФХ, 14, 1940, стр. 332—339.
383. N. SchOnberg. Acta Chem. Scand., 8, 226—239, 1954.
384. G. Armstrong. J. Am. Chem., Soc., 71, 3583—3587, 1949.
385. S i d g w i c k. Chem. Elements and their Compounds, Oxford, 1950.
386. W. Krings, I. К e m p k e n s. Z. anorg. Chem., 183, 225, 1929.
387. T. H u 1 m, H. Matthias. Phys. Rev., 82, 273, 1952.
388. F. Horn u. Ziegler. J. Am. Chem. Soc., 69, 2762—69, 1947.
389. N. SchOnberg. Acta Chem. Scand., 8, 199—203, 1954.
390. W. Ou er tier. Metallographie, 1, 658—73, 1917.
391. G. H3gg. Z. physik. Chemie, 13 (B), 33, 1931.
392. 0. Brauer, K. Z a p p. Z. anorg. Chemie, 277,129—39,1954.
393. P. Ewald, C. Neumann. Strukturberichte, 1913—1928, 219,
741, 783—84, Лейпциг, 1931.
394. В. Neumann, С. К r 0 ger, H. H a e b 1 e r. Z. anorg. Chemie,
196, 65—78, 1931.
395. И. И. Жуков. Известия сектора физико-химического анализа
АН СССР, 3, № 1, 1921, стр. 14.
396. L. D u р а г е, Р. Wenger, W. Schussele. Helv. Chim.
Acte, 13, 917—29, 1930.
. 397. R. Brie, D. Criwi. Met. Techn., 7, 1940.
398. В. С. M о з г о ₽ о й, А. М- Самарин. ДАН СССР, 74, 1950,
стр. 729.
380
Литература
399. R. Kiessling, J. Liu. J. Metals, 3, 639—42, 1951.
400. E. Olson, E. L a у er, A. Mi d dl e ton, J. Electrochem. Soc.,
102, 73—76, 1955.
401. S. Eriksson. Jernkontorets Ann., 118, 630—43, 1934.
402. R. В 1 i x. Z. physik. Chemie, 3, 299—39, 1929.
403. G. Henderson, I. G a 1 1 e t 1 y. J. Soc. Chem. Ind., 27, 387—
89, 1908.
404. G. H3gg. Z. phys. Chem., В 7, 339—62, 1930.
405. N. Schonberg. Acta Chem. Scand., 8, 204—207, 1954.
406. B. Boren, Kem., Min., Geol., Al 1, 11—17, 1933.
407. R. Vogel, H. Bedarff. Arch. Eisenhflttenwesen, 7, 423—
425 1933 34.
408. R. Pease, R. Cook. J. Am. Chem. Soc., 1926.
409. A. Sieverts, E. Bergner. Ber. deutsch. Chem. Ges., 44,
2394—2402, 1911.
410. P. Laffite, P. G r a n d a d a r m. C. r., 200, 1039—41,1935.
411. F. Glaser. J. Appl. Physic., 22, 103, 1951.
412. C. S chm i t h el 1 s, H. Rooksby. J. Chem. Soc., 1882 —
1888, 1927.
413. A. Mittasch, W. Fr an ken b er ger, Z. Electrochemie,
35, 920—27, 1929.
414. A. H. Крестовников, А. С. Шахов. Физико-химиче-
ские и термодинамические свойства редких металлов, Металлургиздат, 1939.
415. С. G i у о, G. Wiare. С. г., 222,71,1946.
416. G. Н a gg. Z. physik. Chem., В, 346—70, 1929.
417. U. Zwicker. Z. Metallkunde, 42, 274, 1951.
418. V. P a r a n j p e, M. Cohen, M. В e v e r, C. F 1 о e. J. of Me-
tals, 188, 261—267, 1950.
419. И. E. Коиторович, А. А. Совалова. Известия АН СССР,
ОТН, № 11, 1949, стр. 2675.
420. И. Е. Конторович, А. А. Совалова. Труды МАТИ,
№ 4, Трансжелдориздат, 1948.
421. И. Е. Ко и то р о в и ч, А. А. С о в а л о в а. ЖТФ, 20,1950,стр. 53.
422. И. Р. Кричевский, Н. Е. Хазанова. ДАН СССР, 71,
№ 3, стр. 481 и № 4, стр. 677, 1950; ЖФХ, 19, 1945, стр. 676.
423. Р. Е m u г е t and oth. J. Am. Chem. Soc., 52, 1456, 1930.
424. K. Jack. Proc. Roy. Soc., 195, 35, 1948; 208, 400, 1951; Acta
Cryst., 5, 404, 1952.
425. R. J u s a, W. Sachse. Z. anorg. Chem., 253, 95, 1945.
426. R. J u s a, W. Sachse. Z. anorg. Chem., 251, 201, 1943.
427. И. И. Корнилов. ДАН СССР, 81, 597— 600, 1951.
428. N. Schonberg. Acta Chem. Scand., 8, 213—220, 1954.
429. Английский патент 666248, 1948.
430. R. Kieffer. Pulvermetallurgie, 1 Plansee—seminar «De re me-
tallica», 22—26 J uni Reutte, Tirol, 268—296, 1953.
431. W. H u m e R о t h er y, G. Raynor, A. Little. J. Iron
and Steel Inst., 1942.
432. N. Schonberg. Acta Chem. Scand., 8, 620—23, 1954.
433. R. В r i d e 1 1 e, A. Michel. Revue de Metallurgie, 51, 278—282,
1954.
434. L. F о c t e r. ASM Review of Metal Literature, 9, 737, 1952.
435. G. Finlay. J. Electrochem. Soc., 99, 58—60, 1952.
436. Chem. Eng., 60, 186, 1953.
437. O. Bush, R. V a n d e r g i f f, T. Hanley. J. Appl. Physics,
20, 295—96, 1949.
438. Патент США 2439290, 1948.
439. Chem. and Eng. News, 24, 3361, 1946.
Литература
381
440. Chem. Abstracts, 43, 4957, 1949.
441. Chem. Abstracts, 44, 10524, 2950.
442. N. Fuson. J. Appl. Physics, 20, 59—66, 1949.
443. R. M i 1 t о n. Chem. Revue, 39, 419—33, 1946.
444. R. К i e s s 1 i n g. Forschritte der Chem. Forschung, 3, 41, 1954.
445. B. Denker, J. Kasper. ActaCrystallographica, 7, p. 1, 77—82,
446. B. S t a 1 i n s к y, Bull. Polsk. Acad. Nauk. 3, № 5, 1954.
447. А. Г. Лесник. Сб. «Вопросы физики металлов и металловедения»,
Лаборатория металлофизики АН УССР, № 2, 1950.
448. J. Norton, Н. Blumenthal, S. Sindeband. Trans.
А1МЕ, 185, 749—51, 1949.
449. G. H a g g, R. К i e s s I i n g. f. Inst. Metals, 81, 58—60,1952.
450. J. H a m. Trans. Am. Soc. Meeh. Engn., 73, 723—32, 1951.
451. P. Schwarzkopf, F. Glaser. Z. Metallkunde, 44, 353—58,
1953.
452. «Безалмазная правка шлифовальных кругов», 53—58, Машгиз, 1951.
453. F. Glaser. J. of Metals, 4, 391—396, 1952.
454. R. S t e i n i t z. I. В i n d e r, Powder Metallurgy Bull., 6, 123—
125, 1953.
455. J. Everhart. Materials and Methods, 40, № 2, 90—92, 1954.
456. H. H. Курпаков. ДАН СССР, 26, 1940, стр. 362.
457. И. Н. Ку р н а ков. Известия сектора физико-химического анализа
АН СССР, 16, 1948, стр. 77—84.
458. R. К i е s s 1 i n g. Acta Chem. Scand., 3, 603—615, 1949.
459. R. К i e s s 1 i n g. Acta Chem. Scand., 1, 893—916, 1947.
460. L. Andersson, R. Kiessling. Acta Chem. Scand., 4, 160—
164, 1950.
461. R. К i e s s 1 i n g. Acta Chem. Scand., 3, 595—603, 1949.
462. L. Brewer, D. Sawyer, D. Templeton, C. Dauben.
J. Am. Cer. Soc., 34, 173—179, 1952.
463. S. Sindeband. J. of Metals, 185, 198—202, 1929.
464. W. Zachariasen. Z. Physik. Chem., 128, 39—48, 1927.
465. F. H a 1 1 a, W. T h u r y. Z. anorg. Chem., 249, 229, 1942.
466. P. Me К e n n a. Ind. Eng. Chem., 28, 767—72, 1936.
467. R. Kieffer, F. Benesovsky, E. Honak. Z. anorg.
Chem., 268, 191—400, 1952.
468. Г. A. M e e p с о н, Г. В. Самсонов. /КПХ, 27, 1954, стр.
1115— IT20.
469. L. A n d r i e u x. Ann. Chim. Phys., 12, 423, 1929.
470. L. A n d r i e u x, G. Weiss. Bull. Soc. Chim. France, 15,
598—601, 1948.
471. G. Weiss. Ann Chimie, 1, 446—525, 1946.
472. Г. A. M e e p с о н, M. П. Смирнов. Химия редких элементов,
№ 2, 1955, стр. 130—147.
473. J Campbell, С. Powell. Iron Age, 169,113, 1952.
474. Sidhu, Acta Crystallographica, № 5, 1954.
475. S. Naray-Szabo, C. Tobias. J. Am. Chem. Soc.,71,1882,1949.
476. A. H. 3 e л и к м а и, Г. В. Самсонов, О. Е. Крейн. Ме-
таллургия редких металлов, Металлургиздат, 1953.
477. F. Glaser. Powd. Metall. Bull., 6, 51—54, 1951.
478. H. Greenhouse, О. А с с о u n t i s, H. S i s 1 e r. J. Am.
Chem. Soc., 73, 5086—87, 1951.
479. D. Me Pearson M. Hansen. Z. Metallkunde, 45, 76—82,
1954.
480. H. Ogden, R. Jaffee. J. of Metals, 3, 335—36, 1952.
481. B. Post, F. Glaser. J. Chem. Phys., 20, 1050—51, 1952.
382
Литература
482. В. Denker, I. Kasper. Acta Crystallographica, 7, p. 1,77—80,
1954.
483. L. Brewer, H. Haraldsen. J. Electrochem. Soc., 102,
399—406, 1955.
484. R. К i e s s 1 i n g. Acta Chem. Scand., 3, 90—91, 1949.
485. B. Post, F. Glaser. J. of Metals, 4, 631—82, 1952.
486. F. Glaser. B. Post. J. of Metals. 5, 1117—18, 1953; 5,1119—
20, 1953.
487. Ziegler, Loung. Conference on Low Temperature Physics,
Oxford, 1951.
488. F. Glaser, D. Moskowitz, B. Post. J. of Metals (Sect. I),
5, 1119—1120, 1953.
489. H. Blumenthal. J. Am. Chem. Soc., 74, 2942, 1952.
490. T. H u I m, B. Matthias. Phys. Rev., 82, 273—74, 1951.
491. F. Bertaut, P. Blume. C. r., 236, 1055—56, 1953.
492. L. A n d r i e u x, A. M a r i о n. C., r., 236, 805, 1953.
493. R. S t e i n i t z . J. of Metals, 4, 148, 1952.
494. R. S t e i n i t z, I. Binder, D. M о s к о w i t z. J. of Metals,
4, 983—987, 1952.
495. P. G i 1 1 e s, В. P о 1 1 о c k. J. of Metals (II Sect.), 1537—38, 1953.
496. Г. В. Самсонов. ДАН СССР, 93, 1953, стр. 859—861.
497. W. Beck. Metal Industry, 86, 43—46, 1955.
498. F. Bertaut, P. Blume. Acta Crystall., 4, 72, 1951.
499. R. Kiessling. Acta chem Scand., 4, 146—159, 1950.
500. D. Templeton, C. D a u b e n. Acta Krystallogr., 3, 261—62,
1950.
501. H. Чижевский, А. Хердт, ЖРМ0, 1, 1915, стр. 533.
502. R. В j u r s t r 6 m. Arkiv Kemi, Miner. Geolog., Al 1, № 5, 1933.
503. G. Hagg. Z. phys. Chemie, Bll, 152, 1930.
504. Me Bridge, S p retn a к Trans. Am. Soc. Met. Prepr., 22, 1953.
505. Германский патент № 126492, 1900.
506. L. A n d r i e u x. Rev. de Metallurgie, 487, 1936.
5o7. W. Koster, W. M fl h 1 f i n g e r. Z. Metallkunde, 30, 348—50,
2938.
508. H. П. Чижевский, Б. A. Ill м ал e в. Сб. Трудов института
стали, Металлургиздат, вып. XVII, 1940, стр. 3—89.
509. Р. Blume. J. Phys. Radium, 13, 430, 1952.
510. Г. А. М е е р с о н, Г. В. С а м с о н о в, Р. Б. Котельников.
ИСФХА, 25, 1954, стр. 89-93.
511. Г. А. Меерсон, Г. В. Самсонов, Р. Б. Котельников,
Н. Я. Ц е й т и и а. Сб. трудов Минцветметзолота, № 25, Металлургиздат,
1955, стр. 209—225.
512. F. Glaser W. I v a n i с k. Powd. Metali. Bull., 6, 126—132,
1953.
513. Г. В. Самсонов, В. С. Н еш пор. ДАН СССР, 104, № 3,
1955, стр. 405—408.
514. R. Kieffer, F. Benesovsky, Н. Schroth. Z. Me-
tallkunde, 44, 437—442, 1953.
515. В. И. Архаров. ЖТФ, 24, 1954, стр. 375—378.
516. R. S t е i п i t z. Powd. Metali. Bull., 6, 54—56, 1951.
517. R. Kieffer. В сб. «Pulver metallurgie», 1-Plansee—Seminar
«De re metallica», 293, 1953.
518. F. E 1 1 i n g e r. Trans. ASM, 30, 607, 1942.
519. Г. A. M e e p с о н, Г. В. Самсонов. Известия СФХА АН
СССР, 22, 1953, стр. 92—103.
520. Г. В. С а до q о д р в, В. П. Л 6 Т Ы Щ 9 ₽ а, ДАН СССР, 105, Ks 3,
1955.
Литература
383
521. Г. А. Меер сон, Г. В. Самсонов, Н. Я. Ц е й т и н а.
Огнеупоры, № 2, 1955, стр. 72—79.
522. S. Nelson, Т. W i 11 m о г е, R. Womelsdorf. J. Electro-
chem. Soc., 98, 465—73, 1951.
523. I. Campbell. Materials and Methods, 31, 59—63, 1950.
524. Iron Age, 173, 138—39, 1954.
525. Б. M. К о н т о p о в. Руководящие указания no наплавке твердых
сплавов, Госэнергоиздат, 1953.
526. D. Hurd. An Introduction to the Chemistry of the Hydrides, № 4,
Willy a. Sons, 92, 1952.
527. G. Jaeger. Metall, 9, № 9'10, 358—366, 1955.
528. H. Д. Моргулис. УФН. Ill, № 4, 1954, стр. 534—536.
529. Вопросы радиолокационной техники, № 6, 1951.
530. N. Joseph. Ind. Eng. Chem., 44, 1006, 1952.
531. L. R i ch ar ds о n. J. Electrochem. Soc., 101, № 9, 223C, 1954.
532. H. W a 1 1 b a u m. Z. Metallkunde, 33, 378—81, 1941.
533. G. H a r d y, J. H u 1 m. Phys. Rev., 89, 884, 1953.
534. M. Arvin. J. Appl. Phy-»., 24, 498, 1953.
535. W. Zachariasen. Acta Cryctallographica, 2, 94, 1949.
536. U. D e h I i n g e r, H. Schenk. Z. Metallkunde, 46, 313—314,
1955; Akta Metallurgies, 4, 7, 1956.
537. K. Toman. Acta Crystallographica (London), 4, 462, 1951.
538. О. H 6 n i gschm i d. Karbide und Silizide, 142, 1914.
539. R. Kieffer, F. Benesovsky, E. Galiste. Z. Metall-
kunde, 43, 284—291, 1952.
540. P. Alexander. Metalls a. Alloys, 9, 179—81, 1938.
541. M. H a n s e n, H. Kessler, D. Me P h e r s о n. Am. Soc. Met.,
Preprint, № 4, 1951.
542. R. Kieffer, E. Cerwenka. Z. Metallkunde, 43, 101—105,
1952.
543. R. Kieffer, F. Benesovsky, E. Gallistl. Z. Me-
tallkunde, 43, 284—91, 1952.
544. R. Kieffer, F. Benesovsky, H. Nowotny, H.Scha-
c h n e r. Z. Metallkunde, 44, 242—246, 1953.
545. A. Boren. Arkiv. Kern. Min. Geol., All, 2, 10, 1933.
546. A. Andersen, E. Lette. Trans. Amer. Met., 24, 375, 1936.
547. H. Wallbaum. Z. Metallkunde, 31, 362, 1939.
548. W. К 1 e m m. Anorganische Chemie, B. 24, II, Wisbaden, Dietrich,
стр. 103, 1948.
549. W. Kroll, A. Schlechten, W. Carmody, L. Jerkes,
H. H e 1 m e s, H. Gilbert. Trans. Electrochem. Soc., 92, 187—201, 1947.
550. R. Vogel, H. T 6 p n e r. Arch. Eisenhiittenwesen, 13, 183—88,
1939; R. Vogel, C. Jen ts ch - U s ch i ns ky. Arch. Eisenhiittenwe-
sen, 13, 403—408, 1940.
551. P. Lebeau, J. Figueras. C. r., 136, 1329—31,1903.
552. I. Nar ay-Szabo. Z. Kryst., A97, 223, 1937.
553. R. Kieffer, E. N a c h tigal, Heraues-Festschrift, 186 —
205, Hanau, 1950.
554. E. F i t z e r. Berg.-u. Hiittenmaun. Mh., 97, 81—91, 1952.
555. E. Beidler, C. Powell, J. Campbell, L. Intern a.
J. Electrochem. Soc., 98, 21—25, 1951.
556. E. F i t z e г. В сб. Pulvermetallurgie, 1 Plansee Seminar «De re me-
tallica», 244—258, Wien, 1953.
557. G. Brauer, A. M i t i u s, Z. anorg. Chem., 249, 325, 1942.
558. L. A n d r i e u x. Rev. Metall., 49—59, 1948.
559. H. Nowotny, H. Schachner, R, Kieffer, F, Be-
nesovsky, Mh. Chem., §4, 1—12, 1953.
384
Литература
560. F. Larsen, E. S w a z у, Z. Busch, R. F e у e r. Report
of Simposium on Titanum Office of Naval Res., Washington, 105—24, 1949.
561. D. Sutcliffe. Rev. Metallurgic, 51, 524, 536, 1954.
562. P. Pietrokowsky, P. Duwez. J. Metals, 3, 772—73, 1951.
563. F. Laves, H. W a 1 1 b a u m. Z. Krist, A101, 78—93, 1939.
564. C. Craighead, O. Simmons, L. Eastwood. Trans.
AJMME, 188, 485-513, 1950.
565. H. Seyfarth. Z. Krystallogr, 67, 295, 1928.
566. R. Kieffer, F. Benesovsky, R. Maschenschalk.
Z. Metallkunde, 45, 493—497, 1951.
567. В. П. Елютин, P. H. Г p и rop ata. Производство силикоцир-
кония, Труды Московского института стали, № 12, Металлургиздат, 1939,
стр. 59—79.
568. С. Lundin, D. Me Ph er son, М. Hansen. Am. Soc. Met,
preprint, N 41, 1952.
569. H. Schachner, H. Nowotny, R. Maschenschalk,
Mh. Chem., 84, 677, 1953.
570. H. Schachner, E. Cerwenka, H. Nowotny. Mh.
Chem., 85, № 1, 1954.
571. E. Parthe, H. Schachner, H. Nowotny, Mh. Chemie,
86, 183, 1955.
572. H. Schachner, E. Cervenka, H. Nowotny, Mh.
Chemie, 85, 245, 1954.
573. H. Nowotny, E. Parthe, R. Kieffer, F. Beneso-
vsky, Mh. Chemie, 85, 255, 1954.
574. W. В a t z, H. Mead, С. В i r c h e n a 11, J. Metals, 4, 1070,
1952.
575. E. Parthe, H. Nowotny, H. Schmid, Mh. Chemie,
86, 385, 1955.
576. Г. В. Самсонов и H. К. Голубева, ЖФХ, 30, 1956,
стр. 1258 1206.
577. Г. В. С а м с о н о в. Известия сектора физико-химического анализа,
ИОНХ АН СССР, 27, 1956, стр. 97—125.
578. Г. В. Самсонов, Н. С. Р о з и н о в а. Известия сектора физико-
химического анализа, ИОНХ АН СССР, 27, 1956, стр. 126—132.
579. Г. В. Самсонов, В. П. Латышева, Физика металлов и
металловедение, 2, 1956, стр. 309—320.
580. L. Brewer, О. Krikorian. J. Electrochem Soc., 103, 38, 1956.
581. О. Schmitz-Dumont, N. Kron. Angew. Chemie, 67. 231, 1955.
582. H. Blumenthal. Powd. Metall. Bull., 7, N. 3-6, 79, 1956.
583. B. Post, E. Pipits, W. Herz. Powd. Metall Bull., 7, 3—6,
149, 1956.
584. A. Blum, W. Jvanick. Powd. Metall. Bull., 7, 3—6, 75, 1956.
585. P. Cotter, J. Kohn, B. Potter. J. Amer. Chem. Soc., 39, 11,
1956.
586. C. D a u b e n, D. T e m p 1 e t о n, C. Myers. J. Phys. Chem,, 60
443, 1956.
587. H. Schachner, N. Nowotny, Kudielka. Mh. Chemie, 85,
1140, 1954.
588. B. Matthias. Phys. Rev, 92, 874, 1953.
589. G. Brauer, J- lander, H. Rogen er. Z. Phyclk, 134. 432, 1953.
590. N. De Sorb o. J. Amer. Chem. Soc., 75, 1825, 1953.
591. H. H a m i j a n, W. Lidmann, J. Metals, 5, 695, 1953.
592. H. Sindeband. Патент США 2685544, 1954.
593. Graham. Meeh. Design., 26, 159, 1954.
594. K- S a g e 1, G. Schlamp, Nature, 174, 1154, 1954.
595. B. Post, F. Glaser. J. Chem. Phys., 22, 1264, 1954.
Литература
385
596. Н. Blumenthal, R. Silverman n, J. Metals, 7, sect. 2., 317, 1955
597. K. Bungardt, R. Rundinger, Z. Metallkunde. 47, 577, 1956.
598. E. Wohlfahrt. Acta Metallurgica, 4, 225, 1956.
599. A. Septier, M. Gauzeit, P. Baruch. C. R., 234, 105, 1952.
600. F. Pollard, G. F о w 1 e s. J. Chem. Soc., 2444, 1952.
601. Кэ-Тин-Суй. В сб. «Упругость и неупругость металлов», 273,
ИЛ, 1954.
602. Н. Nowotny, R. Maschenschalk, R. Kiefer, F. Bene-
sowsky, Mh. Chemie, 85, 241, 1954.
603. E. И. Гладышевский, П. И. Крипякевич, Ю. Б. Кузь-
ма. Физика металлов и металловедение, 2, 454, 1956.
604. К- И. Давыдов, П. В. Г е л ь д. Физика металлов и металлове-
дение, 2, 192, 1956.
605. W. Adrienne. Rev. Met., 42, 266, 1945.
606. A. Schneider, W. Meyer-J ungnik. Angew. Chem., 67,306,1955.
607. P. Grob Пег. Hutnicke Listy, 9, 273, 1954.
608. F. Glaser. Metal Progress, 67, 77, 1955.
609. G. Humphry. J. Amer. Chem. Soc., 73, 2261, 1951,
610. A. Man, R. Boyle. J. Amer. Chem. Soc., 77, 6512, 1955.
611. R. Kieffer, F. Benesowsky, H. Schmid. Z. Metallkunde, 47,
247, 1956.
612. A. Knap ton. Nature, 175, 730, 1955.
613. E. P a r t h ё, H. Nowotny, H. Schmid. Afh. Chemie, 86, 413,1955.
614. R. Kieffer, F. Benesowsky. С. К о n о p i c k y. — Ber.deutsch.
keramischen Ges., 31, 224, 1954.
615. Г. В. Самсонов. ЖФХ, 30, № 9, 1956.
616. Г. В. Самсонов., В. С. Н ешпор. Физика металлов и метал-
ловедение, 4, № 1, 1956.
617. Г. В. Самсонов, В. С. Н ешпор. ЖФХ, 29, № 5, 846—851,
1955.
618. Я. С. Уманский, Г. В. Самсонов. ЖФХ, 30, № 7, 1526—
1528, 1956.
619. S. S. S 1 d h u, Le Roy Heaton, D. Zauberis. Acta crystallo-
graphica, 9, № 7, 607—611, 1956.
25 Г. В. Самсонов
СОДЕРЖАНИЕ
Предисловие........................................................ 3
Введение........................................................... 5
Глава I. Природа металлических карбидов, нитридов, гидридов, бо-
ридов и силицидов ......................................... .... 9
Металлы переходных групп........................................... 9
Кристаллическая структура фаз внедрения........................... 18
Некоторые физические свойства фаз внедрения....................... 30
Физическая природа фаз внедрения................................... 35
Причины высокой твердости фаз внедрения ...............•. . . . 49
Глава II. Гидриды..............................................
Физико-химическая природа гидридов, их структуры...............
Гидриды титана ................................................
Гидриды циркония ..............................................
Гидрид гафния .................................................
Гидрид ванадия ................................................
Гидрид ниобия .................................................
Гидриды тантала ...............................................
Гидриды хрома, молибдена и вольфрама ..........................
Гидрид марганца ...............................................
Гидриды железа, кобальта и никеля..............................
Использование гидридов в технике...............................
Глава III. Карбиды............................................
Структуры карбидов............................................
Физико-химическая природа карбидов............................
Химические свойства карбидов..................................
Методы получения карбидов.....................................
Карбид титана.................................................
Карбид циркония ..............................................
Карбид гафния ................................................
Карбиды ванадия ..............................................
Карбиды ниобия ...............................................
Карбиды тантала ..............................................
Карбиды хрома ................................................
Карбиды молибдена ............................................
Карбиды вольфрама ............................................
Карбиды марганца..............................................
Карбиды железа................................................
Карбиды никеля ...............................................
Карбиды кобальта..............................................
Сложные карбиды...............................................
Взаимодействие карбидов с гранецентрированной кубической
решеткой металлических атомов . ........................
^Взаимодействие карбидов, имеющих гранецентрированную куби-
ческую решетку металлических атомов, с карбидом вольфрама
Взаимодействие карбидов, имеющих гранецентрированную ку-
бическую решетку металлических атомов, с монокарбидом воль-
фрама ...................................................
52
52
55
59
66
67
67
70
72
73
73
75
77
77
79
80
81
85
105
125
129
136
139
144
152
152
155
156
157
157
158
161
Содержание
387
Сложные карбиды с гранецентрированной кубической решеткой
металлических атомов, содержащие молибден и хром .... 173
Микротвердость сложных карбидов со структурой внедрения . . 174
Взаимодействие карбидов с тугоплавкими металлами н метал-
лами железной группы........................................176
Использование карбидов в технике . •.............................192
Глава IV. Нитриды............................................... 196
Физико-химическая природа нитридов.............................. 196
Химические свойства нитридов.................................... 198
Методы получения нитридов........................................199
Нитриды титана.............................................. . 202
Нитрид циркония ................................................ 214
Нитрид гафния....................................................216
Нитриды ванадия..................................................216
Нитриды ниобия...................................................220
Нитриды тантала..................................................225
Нитриды хрома .................................................. 232
Нитриды молибдена................................................234
Нитриды вольфрама .............................................. 236
Нитриды марганца.................................................237
Нитриды железа................................................. 239
Нитриды кобальта.................................................242
Нитриды никеля...................................................242
Сплавы нитридов ................................................ 243
Системы нитрид—нитрид.......................................243
Системы нитрид—карбид.......................................248
Использование нитридов в технике.................................252
Глава V. Бориды............................................... 254
Структуры боридов............................................
Физико-химическая природа боридов . . ’......................
Химические свойства боридов..................................
Методы получения боридов.....................................
Бориды титана................................................
Бориды циркония .............................................
Бориды гафния ...............................................
Бориды ванадия ..............................................
Бориды ниобия ...............................................
Бориды тантала ..............................................
Бориды хрома ................................................
Бориды молибдена ............................................
Бориды вольфрама ............................................
Бориды марганца..............................................
Бориды железа................................................
Бориды кобальта..............................................
Бориды никеля ...............................................
Сплавы боридов ..............................................
Системы борид—борид.....................................
Системы борид—карбид....................................
Системы борид—нитрид....................................
Использование боридов в технике..............................
Глава VI. Силициды..........................................
Структуры силицидов................
Физико-химическая природа силицидов
Химические свойства силицидов . . .
254
260
264
267
273
275
279
280
281
283
285
286
291
293
293
294
294
296
296
307
309
313
319
322
327
25*
388
Содержание
Способы получения силицидов..................................328
Силициды титана..............................................331
Силициды циркония .......................................... 336
Силициды гафния..............................................338
Силициды ванадия...................•.............•...........339
Силициды ниобия ............................................ 341
Силициды тантала............................................343
Силициды хрома..............................................346
Силициды молибдена..........................................348
Силициды вольфрама ......................................... 354
Силициды марганца............................................356
Силициды железа.............................................357
Силициды кобальта...........................................°'
Силициды никеля ............................................
Сплавы силицидов............................................
Системы силицид—силицид...................................v
Системы силицид—карбид..................................лоб
Системы силицид—нитрид..................................ЗбУ
Системы силицид—борид...................................368
Использование силицидов в технике............................368
Литература...................................................370
Авторы:
САМСОНОВ Григорий Валентинович.
У МАНСКИЙ Яков Семенович
Редактор Л. Н. Расторгуев
Редактор издательства О. М. Камаева
Технический редактор В. В. Михайлова
Сдано в производство 19/VII 1956 г. Подписано к печати 28/ХП 1956 г.
Бумага 6ОХ92*/1С 12, 13 бл.=24,25 и. л. Уч.-изд. л. 23,89
Т-12041 Заказ 891 Тираж 5500 Цена 13 р. 45 к.
Типография Металлургиздата. Москва, Цветной бульвар, 30
ЗАМЕЧЕННЫЕ ОПЕЧАТКИ
Стр. Строка Напечатано Должно быть По чьей вине
6 17 св. г /г <0,59 г -.г >0,59 Авт.
х Me х Me
17 6 св. (1927° С) (2927° С)
29 4 сн. - sin’ & _ sinM »
формула (3) е — t/2— X2 — /72 е ;.2
59 22 сн. Тивертс Си вс рте Корр.
79 16 сн. гл:гжс>°.59 ;г/Ий<0,о9 Авт.
223 7 сн. Лидера Лидера Род.
250 Подпись под Элсктросопротивле- Электропроводность Авт.
рис. 145 ние
316 Табл. 99
графа 4 190 86 »
185 84
174 79
123 55
319 3 сн. Bu-,Si Cu-.Si Корр.
353 10 св. силицида силиката Авт.
Г."В. Самсонов и Я- С- Уманский